 |
|
대표이사등의 확인_정정 |
정 정 신 고 (보고)
| 2025 년 09 월 08 일 |
| 1. 정정대상 공시서류 : | 증권신고서(지분증권) |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2025년 08월 18일 | 증권신고서(지분증권) | 최초 제출 |
| 2025년 09월 01일 | [기재정정]증권신고서(지분증권) | 자진 정정(빨간색) |
| 2025년 09월 08일 | [기재정정]증권신고서(지분증권) | 자진 정정(파란색) |
| 2. 정정대상 공시서류의 최초제출일 : | 2025년 08월 18일 |
| 3. 정정사항 |
| 항 목 | 정정요구ㆍ명령 관련 여부 |
정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|---|
| ※ 금번 정정 증권신고서는 자진정정에 따른 기재내용 추가/수정사항을 반영하였으며, "굵은 파란색 글씨체"를 사용하여 구분 기재하였습니다. ※ 요약정보 및 제2부 내용은 증권신고서 본문의 정정사항 또는 기존 기재사항을 추가로반영하였으며, 정오표를 별도로 기재하지 않았습니다. ※ 단순 오탈자/오기재 수정, 띄어쓰기 등 단순 수정의 경우 별도의 색깔 구분 없이 정정하였습니다. |
||||
| 제1부. 모집 또는 매출에 관한 사항 | ||||
| III. 투자위험요소 | ||||
| 1.사업위험-나. | 아니오 | 자진정정 | (주1) 정정 전 | (주1) 정정 후 |
| 2.회사위험-라. | 아니오 | 자진정정 | (주2) 정정 전 | (주2) 정정 후 |
| IV. 인수인의 의견 | ||||
| 내용 본문 | 아니오 | 자진정정 | (주3) 정정 전 | (주3) 정정 후 |
(주1) 정정 전
|
[나. 임상시험 실패에 따른 위험] 또한 식약처의 변경 허가는 저속진행군이라는 특정 타겟군을 설정하여 변경 허가 신청을 완료하고, 보완 요구를 받은 상황입니다. 식약처와의 협의를 통해 추후 예정된 식약처의 현장실사(GCP) 일정을 먼저 진행하여 해당 현장실사 및 미팅 이후 보완 요구에 대한 자료 제출을 진행하는 일정으로 계획하였으나, 보완 자료 제출 기한이 연기되면서 GCP 일정 역시 연기된 상황입니다. 반면 FDA 품목허가 신청의 경우, 국내 식약처와는 다르게 특정 타겟군을 설정하지 않고 임상 3상 결과, 유의미한 데이터를 보인 여러 바이오마커(바이오젠의 토퍼슨의 승인 근거로 인정받은 NfL 바이오마커 포함)를 기반으로 사전협의 및 품목허가 신청을 진행할 예정입니다. 단, 이는 현재 당사의 판단에 의한 것이며, 추후 임상수탁기관 및 FDA와의 사전 미팅, 품목허가 신청 전 미팅 등에서 논의한 사항 및 피드백 등을 바탕으로 품목허가 신청의 전략이 변경될 수 있습니다. 결론적으로 당사는 국내 식약처와 미국 FDA 품목허가 절차를 병행하되 각각 독립적으로 운영하고 있습니다. 즉, 국내에서는 식약처 허가 안정성과 신뢰성을 확보하고, 미국에서는 바이오마커 기반 전략으로 글로벌 진입을 준비하는 투트랙 접근을 실행하고 있습니다. 또한 당사의 계획대로 전체 루게릭병 환자를 대상으로 진행한 FDA 품목허가가 2027년 상반기에 승인이 된다면 2022년 9월 FDA 가속승인(조건부 판매허가)를 받아 2024년 확증임상 실패로 시장에서 퇴출되었던 아밀리스의 렐리브리오가 약 14개월동안 4억 301만불(한화로 약 5,506억원) 매출이 발생한 점을 기반으로 유사한 수준의 매출이 2027년 하반기부터 발생할 것으로 기대하고 있습니다. 하지만 이는 당사의 전망치이며, 이미 임상 3상의 통계적 유의성을 확보하지 못한 점, 여러 바이오마커 기반으로 품목허가를 신청했으나 일부 또는 전부 승인받지 못하거나, 일부 바이오마커 기반으로 FDA 품목허가를 승인 받더라도 전체 루게릭병 환자 대상이 아닌 크게 축소된 타겟군 대상으로 진행될 수 있는 등 뉴로나타-알 파이프라인의 실적은 불확실한 상황입니다. 이처럼 당사의 핵심 파이프라인인 뉴로나타-알의 FDA 품목허가가 불발되거나, 승인을 받더라도 당사의 기대치만큼 매출이 발생하지 못한다면 당사의 사업에 매우 중대한 악영향을 미치게 되어 계속기업가정의 불확실성이 증대될 수 있습니다.
|
(중략)
이후 2025년 7월 3일자로 식약처로부터 심사 과정 중 일부 보완자료의 제출을 요청 받았으며, 요청된 자료는 2025년 9월 1일까지 제출해 줄 것을 안내 받았습니다. 식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다. 하지만 보완 서류 제출 기한이 연장됨에 따라 식약처에서 현장실사(GCP 실사) 일정을 연기한다는 통보를 하였고, 구체적인 일정은 미정이나, 10월 또는 11월 중 진행할 것으로 예상됩니다. 당사는 현재 해당 기한 내에 문제없이 제출할 수 있도록 내부 검토는 물론 외부 전문가의 자문을 병행하며 철저히 준비하고 있습니다. 하지만 예기치 못한 문제 등의 발생으로 인해 제출기한 내 보완서류를 제출하지 못하거나, 제출하더라도 식약처에서 추가적인 보완 요구로 인해 허가 일정이 지연되거나, 심지어 보완 제출 후 식약처로부터 반려 통보를 받을 가능성을 배제할 수 없습니다.
(중략)
이후 2025년 7월 3일, 식약처는 허가 변경 심사 과정에서 일부 보완자료 제출이 필요하다는 의견을 제시했습니다. 보완자료 제출 기한은 2025년 9월 1일까지로 안내되었으나, 식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다.하지만 보완 서류 제출 기한이 연장됨에 따라 식약처에서 현장실사(GCP 실사) 일정을 연기한다는 통보를 하였고, 구체적인 일정은 미정이나, 10월 또는 11월 중 진행할 것으로 예상됩니다. 따라서 아직 승인, 반려, 추가자료 요구 등 여러 시나리오가 존재하기 때문에 확실히 승인 여부 및 시점에 대해 단정하기는 어려운 상황입니다.
(후략)
(주1) 정정 후
|
[나. 임상시험 실패에 따른 위험] 또한 식약처의 변경 허가는 저속진행군이라는 특정 타겟군을 설정하여 변경 허가 신청을 완료하고, 보완 요구를 받은 상황입니다. 식약처와의 협의를 통해 추후 예정된 식약처의 현장실사(GCP) 일정을 먼저 진행하여 해당 현장실사 및 미팅 이후 보완 요구에 대한 자료 제출을 진행하는 일정으로 계획하였으나, 보완 자료 제출 기한이 연기되면서 GCP 일정 역시 연기된 상황입니다. 반면 FDA 품목허가 신청의 경우, 국내 식약처와는 다르게 특정 타겟군을 설정하지 않고 임상 3상 결과, 유의미한 데이터를 보인 여러 바이오마커(바이오젠의 토퍼슨의 승인 근거로 인정받은 NfL 바이오마커 포함)를 기반으로 사전협의 및 품목허가 신청을 진행할 예정입니다. 단, 이는 현재 당사의 판단에 의한 것이며, 추후 임상수탁기관 및 FDA와의 사전 미팅, 품목허가 신청 전 미팅 등에서 논의한 사항 및 피드백 등을 바탕으로 품목허가 신청의 전략이 변경될 수 있습니다. 결론적으로 당사는 국내 식약처와 미국 FDA 품목허가 절차를 병행하되 각각 독립적으로 운영하고 있습니다. 즉, 국내에서는 식약처 허가 안정성과 신뢰성을 확보하고, 미국에서는 바이오마커 기반 전략으로 글로벌 진입을 준비하는 투트랙 접근을 실행하고 있습니다. 또한 당사의 계획대로 전체 루게릭병 환자를 대상으로 진행한 FDA 품목허가가 2027년 상반기에 승인이 된다면 2022년 9월 FDA 가속승인(조건부 판매허가)를 받아 2024년 확증임상 실패로 시장에서 퇴출되었던 아밀리스의 렐리브리오가 약 14개월동안 4억 301만불(한화로 약 5,506억원) 매출이 발생한 점을 기반으로 유사한 수준의 매출이 2027년 하반기부터 발생할 것으로 기대하고 있습니다. 하지만 이는 당사의 전망치이며, 이미 임상 3상의 통계적 유의성을 확보하지 못한 점, 여러 바이오마커 기반으로 품목허가를 신청했으나 일부 또는 전부 승인받지 못하거나, 일부 바이오마커 기반으로 FDA 품목허가를 승인 받더라도 전체 루게릭병 환자 대상이 아닌 크게 축소된 타겟군 대상으로 진행될 수 있는 등 뉴로나타-알 파이프라인의 실적은 불확실한 상황입니다. 이처럼 당사의 핵심 파이프라인인 뉴로나타-알의 FDA 품목허가가 불발되거나, 승인을 받더라도 당사의 기대치만큼 매출이 발생하지 못한다면 당사의 사업에 매우 중대한 악영향을 미치게 되어 계속기업가정의 불확실성이 증대될 수 있습니다.
|
(중략)
이후 2025년 7월 3일자로 식약처로부터 심사 과정 중 일부 보완자료의 제출을 요청 받았으며, 요청된 자료는 2025년 9월 1일까지 제출해 줄 것을 안내 받았습니다. 식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다. 하지만 보완 서류 제출 기한이 연장됨에 따라 식약처에서 현장실사(GCP 실사) 일정을 연기한다는 통보를 하였고, 구체적인 일정은 미정이나, 10월 또는 11월 중 진행할 것으로 예상됩니다. 이에 당사는 보완 자료 제출 전 식약처와의 대면 미팅을 9월 중으로 협의하고 있으며, 해당 대면 미팅을 진행한 후 보완 서류 제출기한인 10월 31일까지 보완 자료를 제출할 예정입니다. 당사는 현재 해당 기한 내에 문제없이 제출할 수 있도록 내부 검토는 물론 외부 전문가의 자문을 병행하며 철저히 준비하고 있습니다. 하지만 예기치 못한 문제 등의 발생으로 인해 제출기한 내 보완서류를 제출하지 못하거나, 제출하더라도 식약처에서 추가적인 보완 요구로 인해 허가 일정이 지연되거나, 심지어 보완 제출 후 식약처로부터 반려 통보를 받을 가능성을 배제할 수 없습니다.
(중략)
이후 2025년 7월 3일, 식약처는 허가 변경 심사 과정에서 일부 보완자료 제출이 필요하다는 의견을 제시했습니다. 보완자료 제출 기한은 2025년 9월 1일까지로 안내되었으나, 식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다.하지만 보완 서류 제출 기한이 연장됨에 따라 식약처에서 현장실사(GCP 실사) 일정을 연기한다는 통보를 하였고, 구체적인 일정은 미정이나, 10월 또는 11월 중 진행할 것으로 예상됩니다. 이에 당사는 보완 자료 제출 전 식약처와의 대면 미팅을 9월 중으로 협의하고 있으며, 해당 대면 미팅을 진행한 후 보완 서류 제출기한인 10월 31일까지 보완 자료를 제출할 예정입니다. 이후 2025년 12월에서 2026년 1월 중으로 식약처에서 GCP 실사 결과와 당사가 제출할 보완 자료를 검토한 후 품목허가 여부를 통보할 것으로 당사는 예상하고 있습니다. 다만, 추가적인 자료 보완 요구, 중앙 약사 심의위원회 개최 등이 발생할 경우 상기 일정에서 다소 지연될 수 있으며, 정확한 시점을 예측하기는 어렵습니다. 또한 일정대로 진행된다고 하더라도 무조건적인 품목허가 승인을 의미하지는 않으며, 이처럼 아직 승인, 반려, 추가자료 요구 등 여러 시나리오가 존재하기 때문에 확실히 승인 여부 및 시점에 대해 단정하기는 어려운 상황입니다.
(후략)
(주2) 정정 전
| [라. 재무제표 재작성 이력 존재 위험] 당사는 2023년말 감사 과정에서 2022년 연결재무제표 회계처리 오류와 관련하여, 재무제표를 재작성한바 있습니다. 또한 2023년 반기검토 당시 당사 외부감사인은 당사의 2022년말 합병후 재무제표에 대해 지적사항이 있었으며, 이를 대응하는 과정에서 2023년 반기보고서 제출이 지연된 바 있습니다. 해당 반기보고서 지연 제출과 관련하여 증권신고서 제출일 현재 상기 위반 사항에 대한 금융감독원의 조사결과에 따라 20억원 이하의 과징금 또는 3천만원 이하의 과태료가 부과될 수 있으나 현재로서는 그 조치 여부 및 수준을 정확히 예상할 수 없습니다. 당사는 공시 위반사항이 발생하지 않도록 인력 및 조직, 시스템을 구축하고 있으며, 관련 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반 시 제재 등에 대한 공시 교육을 지속적으로 실시하고 있습니다. 그럼에도 불구하고 규제기관의 제재가 내려질 경우 과징금 등 조치 규모에 따라 당사 손익에 부정적인 영향을 미칠 수 있습니다. 당사는 향후 이러한 사항이 재발하지 않도록 노력할 예정이며, 2023년부터 현재까지 지속적으로 지정감사를 받고 있는 상황이므로, 회계적 신뢰성을 유지할 수 있도록 노력하려고 합니다. 향후에도 회계처리 오류가 발생할 경우 그 심각성 정도에 따라 회계 감리 대상이 되거나, 각종 규제에 따른 처벌 대상이 될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
또한 2023년 반기검토 당시 당사 외부감사인은 당사의 2022년말 합병후 재무제표에 대해 지적사항이 있었으며, 이를 대응하는 과정에서 2023년 반기보고서 제출이 지연된 바 있습니다. 이와 관련하여 사업보고서 등의 제출의무를 위반하는 경우, 다음의 제재조치가 취해질 수 있습니다.
| 위반 사항 | 구분 | 조치사항 | 관련 근거 |
|---|---|---|---|
| 사업보고서 등 제출의무 | 금융위원회 조치 | 금융위원회는 위반자에게 이유를 제시한 후 그 사실을 공고하고 정정을 명할 수 있으며, 필요한 때에는 증권의 발행, 그 밖의 거래를 정지 또는 금지하거나대통령령으로 정하는 조치를 할 수 있음. - 대통령령으로 정하는 조치 1. 1년의 범위에서 증권의 발행 제한 2. 임원에 대한 해임권고 3. 법을 위반한 경우에는 고발 또는 수사기관에의 통보 4. 다른 법률을 위반한 경우에는 관련기관이나 수사기관에의 통보 5. 경고 또는주의 |
자본시장법 제164조 제1호 및 동법 시행령 제175조 |
| 과징금 부과 | 금융위원회는 위반자에게 직전 사업연도 중에 증권시장(다자간매매체결회사에서의 거래를 포함)에서 형성된 그 법인이 발행한 주식(그 주식과 관련된 증권예탁증권을 포함)의 일일평균거래금액의 100분의 10(10억원 미만인 경우에는 10억원, 20억원을 초과하거나 그 법인이 발행한 주식이 증권시장에서 거래되지 아니한 경우에는 20억원)을 초과하지 아니하는 범위에서 과징금을 부과할 수 있음. | 자본시장법 제429조 제3항 제2호 | |
| 형사벌 | 형사상으로는 1년 이하의 징역 또는 3천만원 이하의 벌금 등에 처해질 수 있음 | 자본시장법 제446조 제28호 |
증권신고서 제출일 현재 상기 위반 사항에 대한 금융감독원의 조사결과에 따라 20억원 이하의 과징금 또는 3천만원 이하의 과태료가 부과될 수 있으나 현재로서는 그 조치 여부 및 수준을 정확히 예상할 수 없습니다. 당사는 공시 위반사항이 발생하지 않도록 인력 및 조직, 시스템을 구축하고 있으며, 관련 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반 시 제재 등에 대한 공시 교육을 지속적으로 실시하고 있습니다. 그럼에도 불구하고 규제기관의 제재가 내려질 경우 과징금 등 조치 규모에 따라 당사 손익에 부정적인 영향을 미칠 수 있습니다.
당사는 향후 이러한 사항이 재발하지 않도록 노력할 예정이며, 2023년부터 현재까지 지속적으로 지정감사를 받고 있는 상황이므로, 회계적 신뢰성을 유지할 수 있도록 노력하려고 합니다. 향후에도 회계처리 오류가 발생할 경우 그 심각성 정도에 따라 회계 감리 대상이 되거나, 각종 규제에 따른 처벌 대상이 될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
(주2) 정정 후
| [라. 재무제표 재작성 이력 존재 위험] 당사는 2023년말 감사 과정에서 2022년 연결재무제표 회계처리 오류와 관련하여, 재무제표를 재작성한바 있습니다. 또한 2023년 반기검토 당시 당사 외부감사인은 당사의 2022년말 합병후 재무제표에 대해 지적사항이 있었으며, 이를 대응하는 과정에서 2023년 반기보고서 제출이 지연된 바 있습니다. 해당 반기보고서 지연 제출과 관련하여 증권신고서 제출일 현재 상기 위반 사항에 대한 금융감독원의 조사결과에 따라 20억원 이하의 과징금 또는 3천만원 이하의 과태료가 부과될 수 있으나 현재로서는 그 조치 여부 및 수준을 정확히 예상할 수 없습니다. 당사는 공시 위반사항이 발생하지 않도록 인력 및 조직, 시스템을 구축하고 있으며, 관련 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반 시 제재 등에 대한 공시 교육을 지속적으로 실시하고 있습니다. 그럼에도 불구하고 규제기관의 제재가 내려질 경우 과징금 등 조치 규모에 따라 당사 손익에 부정적인 영향을 미칠 수 있습니다. 당사는 향후 이러한 사항이 재발하지 않도록 노력할 예정이며, 2023년부터 현재까지 지속적으로 지정감사를 받고 있는 상황이므로, 회계적 신뢰성을 유지할 수 있도록 노력하려고 합니다. 향후에도 회계처리 오류가 발생할 경우 그 심각성 정도에 따라 회계 감리 대상이 되거나, 각종 규제에 따른 처벌 대상이 될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
또한 2023년 반기검토 당시 당사 외부감사인은 당사의 2022년말 합병후 재무제표에 대해 지적사항이 있었으며, 이를 대응하는 과정에서 2023년 반기보고서 제출이 지연된 바 있습니다. 이와 관련하여 사업보고서 등의 제출의무를 위반하는 경우, 자본시장법 등에 따라 제재조치가 취해질 수 있으며, 특히 자본시장법 제429조 제3항 제2호 등에 따라 과징금이 부과될 수 있으나, 현재로서는 그 조치 여부 및 수준을 정확히 예상할 수 없습니다. 당사는 공시 위반사항이 발생하지 않도록 인력 및 조직, 시스템을 구축하고 있으며, 관련 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반 시 제재 등에 대한 공시 교육을 지속적으로 실시하고 있습니다. 그럼에도 불구하고 규제기관의 제재가 내려질 경우 과징금 등 조치 규모에 따라 당사 손익에 부정적인 영향을 미칠 수 있습니다.
당사는 향후 이러한 사항이 재발하지 않도록 노력할 예정이며, 2023년부터 현재까지 지속적으로 지정감사를 받고 있는 상황이므로, 회계적 신뢰성을 유지할 수 있도록 노력하려고 합니다. 향후에도 회계처리 오류가 발생할 경우 그 심각성 정도에 따라 회계 감리 대상이 되거나, 각종 규제에 따른 처벌 대상이 될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
(주3) 정정 전
IV. 인수인의 의견(분석기관의 평가의견)
(중략)
6. 종합 의견
가. 대표주관회사인 엘에스증권(주) 및 공동주관회사인 한양증권(주)는 코아스템켐온(주)가 2025년 08월 18일 이사회에서 결의한 기명식 보통주 20,000,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이를 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 |
▶ 캐나다와 인도에 본사를 둔 글로벌 헬스케어 전략 컨설팅ㆍ시장조사 기업인 Towards Healthcare에 따르면, 글로벌 일반 세포치료제 시장은 2024년 약 59억 달러 규모에서 2034년 약 444억 달러 규모까지 향후 연평균 22.7%의 높은 성장률을 보일 것으로 전망하고 있습니다. 주로 자가/동종 줄기세포치료제, 조직 재생, 만성ㆍ희귀질환, 심혈관ㆍ근골격계ㆍ신경 등 다양한 영역에 활용될 것으로 전망하고 있습니다. 또한 헬스케어ㆍ바이오 등 다양한 산업군을 대상으로 한 신흥 글로벌 시장조사ㆍ전략컨설팅 전문사인 Precedence Research에 따르면 글로벌 줄기세포치료제 시장은 2024년 기준 160.2억 달러로, 2025년 181.3억 달러의 규모에서 연평균 12.95%의 성장률을 보이며 2034년 약 541.5억 달러 규모로 성장할 것으로 전망되고 있습니다. 시장 성장을 이끄는 주요 요인으로는 만성질환 및 퇴행성 질환 증가, 재생의학 기술 혁신, 정부 및 민간의 대규모 연구ㆍ임상 투자, 신약 파이프라인 확대 등이 꼽힙니다. 특히, 신경계(파킨슨병, 루게릭병 등), 심혈관계, 근골격계, 암 등 다양한 분야에서 줄기세포치료제 상용화가 확대되고 있습니다.
|
| 부정적 요인 |
▶ 2018년 이후 줄기세포치료제의 품목 허가가 줄어들고, 2023년부터 다시 일부 제품들이 승인되기 시작한 배경에는 각 규제당국의 규제가 대폭 강화된 점이 큰 영향을 미쳤습니다. 미국 식품의약국(FDA), 유럽의약품청(EMA), 그리고 일본 의약품의료기기종합기구(PMDA) 등 주요 규제기관은 줄기세포치료제에 대해 안전성과 효능을 엄격히 검증하기 위해 다양한 규제 조치를 강화하고 있습니다. ▶ 세계적인 대형 CRO업체들이 한국 제약ㆍ바이오 시장에 주목하여 임상 및 비임상시험을 비롯한 다양한 바이오컨설팅을 제공하기 위해 경쟁적으로 뛰어들 가능성을존재하는 상황입니다. 전 세계적으로 1,100개 이상의 CRO 기업이 존재하는 것으로 추산되고 있는데, 이 중 2023년에는 글로벌 CRO 상위 10개 기업에 80.8%의 시장점유율이 집중된 것으로 나타난 점을 보면 CRO 산업은 전세계적으로 볼 때 독과점 형태를 보이고 있습니다. 이 중 IQVIA, LabCorp, PPD 등은 이미 국내 시장에서도 활발히 영업망을 강화하고 있고, 합병ㆍ인수와 신사업 다각화 및 가격경쟁력 제고 등에 힘입어 앞으로도 그 영향력이 더욱 확대될 전망입니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 교환사채 채무상환자금, 뉴로나타-알의 FDA 가속승인 신청비용 및 주요 파이프라인별 연구개발비 등 운영자금으로 활용할 계획입니다. 동사는 아직 손익이 부진한 상태로서 자체 영업현금흐름 창출 능력이 낮기 때문에, 향후 계속기업으로서의 존속을 위하여 임상 진행 중인 파이프라인의 연구개발 성과가 가시화되어야 하는 상황에 처해있으며, 이는 대규모 연구개발비의 지출을 수반해야 합니다. 이를 위해 본 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 목적은 본 증권신고서 "제1부.V. 자금의 사용목적" 부분을 참고하시기 바랍니다. |
나. 대표주관회사 및 공동주관회사는 실사 과정에서 발행회사로부터 각 파이프라인별 임상 진행 경과 및 향후 계획 등에 대해 관련 자료를 제공받았으며, 본 증권신고서상 기재된 내용과 상충되지 않음을 성실하게 검토하였습니다.
다. 대표주관회사 및 공동주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다. 또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025. 09. 01. |
| 대표주관회사: 엘에스증권 주식회사 |
| 대표이사 김 원 규 |
| 공동주관회사 : 한양증권 주식회사 |
| 대표이사 김 병 철 |
(주3) 정정 후
IV. 인수인의 의견(분석기관의 평가의견)
(중략)
6. 종합 의견
가. 대표주관회사인 엘에스증권(주) 및 공동주관회사인 한양증권(주)는 코아스템켐온(주)가 2025년 08월 18일 이사회에서 결의한 기명식 보통주 20,000,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이를 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 |
▶ 캐나다와 인도에 본사를 둔 글로벌 헬스케어 전략 컨설팅ㆍ시장조사 기업인 Towards Healthcare에 따르면, 글로벌 일반 세포치료제 시장은 2024년 약 59억 달러 규모에서 2034년 약 444억 달러 규모까지 향후 연평균 22.7%의 높은 성장률을 보일 것으로 전망하고 있습니다. 주로 자가/동종 줄기세포치료제, 조직 재생, 만성ㆍ희귀질환, 심혈관ㆍ근골격계ㆍ신경 등 다양한 영역에 활용될 것으로 전망하고 있습니다. 또한 헬스케어ㆍ바이오 등 다양한 산업군을 대상으로 한 신흥 글로벌 시장조사ㆍ전략컨설팅 전문사인 Precedence Research에 따르면 글로벌 줄기세포치료제 시장은 2024년 기준 160.2억 달러로, 2025년 181.3억 달러의 규모에서 연평균 12.95%의 성장률을 보이며 2034년 약 541.5억 달러 규모로 성장할 것으로 전망되고 있습니다. 시장 성장을 이끄는 주요 요인으로는 만성질환 및 퇴행성 질환 증가, 재생의학 기술 혁신, 정부 및 민간의 대규모 연구ㆍ임상 투자, 신약 파이프라인 확대 등이 꼽힙니다. 특히, 신경계(파킨슨병, 루게릭병 등), 심혈관계, 근골격계, 암 등 다양한 분야에서 줄기세포치료제 상용화가 확대되고 있습니다.
|
| 부정적 요인 |
▶ 2018년 이후 줄기세포치료제의 품목 허가가 줄어들고, 2023년부터 다시 일부 제품들이 승인되기 시작한 배경에는 각 규제당국의 규제가 대폭 강화된 점이 큰 영향을 미쳤습니다. 미국 식품의약국(FDA), 유럽의약품청(EMA), 그리고 일본 의약품의료기기종합기구(PMDA) 등 주요 규제기관은 줄기세포치료제에 대해 안전성과 효능을 엄격히 검증하기 위해 다양한 규제 조치를 강화하고 있습니다. ▶ 세계적인 대형 CRO업체들이 한국 제약ㆍ바이오 시장에 주목하여 임상 및 비임상시험을 비롯한 다양한 바이오컨설팅을 제공하기 위해 경쟁적으로 뛰어들 가능성을존재하는 상황입니다. 전 세계적으로 1,100개 이상의 CRO 기업이 존재하는 것으로 추산되고 있는데, 이 중 2023년에는 글로벌 CRO 상위 10개 기업에 80.8%의 시장점유율이 집중된 것으로 나타난 점을 보면 CRO 산업은 전세계적으로 볼 때 독과점 형태를 보이고 있습니다. 이 중 IQVIA, LabCorp, PPD 등은 이미 국내 시장에서도 활발히 영업망을 강화하고 있고, 합병ㆍ인수와 신사업 다각화 및 가격경쟁력 제고 등에 힘입어 앞으로도 그 영향력이 더욱 확대될 전망입니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 교환사채 채무상환자금, 뉴로나타-알의 FDA 가속승인 신청비용 및 주요 파이프라인별 연구개발비 등 운영자금으로 활용할 계획입니다. 동사는 아직 손익이 부진한 상태로서 자체 영업현금흐름 창출 능력이 낮기 때문에, 향후 계속기업으로서의 존속을 위하여 임상 진행 중인 파이프라인의 연구개발 성과가 가시화되어야 하는 상황에 처해있으며, 이는 대규모 연구개발비의 지출을 수반해야 합니다. 이를 위해 본 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 목적은 본 증권신고서 "제1부.V. 자금의 사용목적" 부분을 참고하시기 바랍니다. |
나. 대표주관회사 및 공동주관회사는 실사 과정에서 발행회사로부터 각 파이프라인별 임상 진행 경과 및 향후 계획 등에 대해 관련 자료를 제공받았으며, 본 증권신고서상 기재된 내용과 상충되지 않음을 성실하게 검토하였습니다.
다. 대표주관회사 및 공동주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다. 또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025. 09. 08. |
| 대표주관회사: 엘에스증권 주식회사 |
| 대표이사 김 원 규 |
| 공동주관회사 : 한양증권 주식회사 |
| 대표이사 김 병 철 |
【 대표이사 등의 확인 】
 |
|
대표이사등의 확인_정정 |
증 권 신 고 서
| ( 지 분 증 권 ) |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2025년 08월 18일 | 증권신고서(지분증권) | 최초 제출 |
| 2025년 09월 01일 | [기재정정]증권신고서(지분증권) | 자진 정정(빨간색) |
| 2025년 09월 08일 | [기재정정]증권신고서(지분증권) | 자진 정정(파란색) |
| 금융위원회 귀중 | 2025 년 09 월 08 일 |
| 회 사 명 : |
코아스템켐온 주식회사 |
| 대 표 이 사 : |
양 길 안 |
| 본 점 소 재 지 : |
경기 성남시 분당구 판교로255번길24 |
| (전 화) 02-497-3711 | |
| (홈페이지) http://www.corestemchemon.com | |
| 작 성 책 임 자 : | (직 책) 사장 (성 명) 권 광 순 |
| (전 화) 02-497-3711 | |
| 모집 또는 매출 증권의 종류 및 수 : | 기명식 보통주 20,000,000주 | |
| 모집 또는 매출총액 : | 37,800,000,000 | 원 |
| 증권신고서 및 투자설명서 열람장소 |
| 가. 증권신고서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 투자설명서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : 코아스템켐온(주) → 경기 성남시 분당구 판교로255번길 24 엘에스증권(주) → 서울특별시 영등포구 여의나루로 60 한양증권(주) → 서울특별시 영등포구 국제금융로6길 7 SK증권(주) → 서울특별시 영등포구 국제금융로8길 31 |
【 대표이사 등의 확인 】
 |
|
대표이사등의 확인 |
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 |
[가. 국내외 경기 침체 및 불확실성 관련 위험]
[나. 임상시험 실패에 따른 위험] 또한 식약처의 변경 허가는 저속진행군이라는 특정 타겟군을 설정하여 변경 허가 신청을 완료하고, 보완 요구를 받은 상황입니다. 식약처와의 협의를 통해 추후 예정된 식약처의 현장실사(GCP) 일정을 먼저 진행하여 해당 현장실사 및 미팅 이후 보완 요구에 대한 자료 제출을 진행하는 일정으로 계획하였으나, 보완 자료 제출 기한이 연기되면서 GCP 일정 역시 연기된 상황입니다. 반면 FDA 품목허가 신청의 경우, 국내 식약처와는 다르게 특정 타겟군을 설정하지 않고 임상 3상 결과, 유의미한 데이터를 보인 여러 바이오마커(바이오젠의 토퍼슨의 승인 근거로 인정받은 NfL 바이오마커 포함)를 기반으로 사전협의 및 품목허가 신청을 진행할 예정입니다. 단, 이는 현재 당사의 판단에 의한 것이며, 추후 임상수탁기관 및 FDA와의 사전 미팅, 품목허가 신청 전 미팅 등에서 논의한 사항 및 피드백 등을 바탕으로 품목허가 신청의 전략이 변경될 수 있습니다. 결론적으로 당사는 국내 식약처와 미국 FDA 품목허가 절차를 병행하되 각각 독립적으로 운영하고 있습니다. 즉, 국내에서는 식약처 허가 안정성과 신뢰성을 확보하고, 미국에서는 바이오마커 기반 전략으로 글로벌 진입을 준비하는 투트랙 접근을 실행하고 있습니다. 또한 당사의 계획대로 전체 루게릭병 환자를 대상으로 진행한 FDA 품목허가가 2027년 상반기에 승인이 된다면 2022년 9월 FDA 가속승인(조건부 판매허가)를 받아 2024년 확증임상 실패로 시장에서 퇴출되었던 아밀리스의 렐리브리오가 약 14개월동안 4억 301만불(한화로 약 5,506억원) 매출이 발생한 점을 기반으로 유사한 수준의 매출이 2027년 하반기부터 발생할 것으로 기대하고 있습니다. 하지만 이는 당사의 전망치이며, 이미 임상 3상의 통계적 유의성을 확보하지 못한 점, 여러 바이오마커 기반으로 품목허가를 신청했으나 일부 또는 전부 승인받지 못하거나, 일부 바이오마커 기반으로 FDA 품목허가를 승인 받더라도 전체 루게릭병 환자 대상이 아닌 크게 축소된 타겟군 대상으로 진행될 수 있는 등 뉴로나타-알 파이프라인의 실적은 불확실한 상황입니다. 이처럼 당사의 핵심 파이프라인인 뉴로나타-알의 FDA 품목허가가 불발되거나, 승인을 받더라도 당사의 기대치만큼 매출이 발생하지 못한다면 당사의 사업에 매우 중대한 악영향을 미치게 되어 계속기업가정의 불확실성이 증대될 수 있습니다.
[라. 희귀의약품 시장 경쟁심화에 따른 위험] 2018년 FDA의 최종허가를 받은 미쓰비시다나베의 에다라본(제품명: 라디카바)를 제외하면 최근 7년간(2018~2025년) 미국 FDA에 루게릭병(ALS) 치료제로 조건부 허가를 신청했던 신약 11개 중 실제로 후속임상 조건부 승인을 받은 것은 아밀릭스의 렐리브리오(Relyvrio)와 바이오젠의 칼소디(Qalsody), 단 두 가지 치료제뿐입니다. 칼소디(제품명: 토퍼슨)의 경우 임상 3상 이후 2023년 조건부 승인을 받아 후속임상을 5년 이내에 진행하는 조건으로 승인되었고, 렐리브리오의 경우 임상 2상 이후 2022년 조건부 승인을 받았으며, 조건부 승인 당시 이미 임상 3상이 시작되었기 때문에 3상 결과가 통상 5년보다 빠른 3년 후 도출되어 그 결과에 따라 승인이 철회되었습니다. 나머지 도전했던 약물들은 대부분 임상 3상에서 실패하거나, 데이터 부족, 승인 거절 등의 사유로 조건부 허가에 도달하지 못하였습니다. 브레인스톰의 NurOwn 치료제는 임상 3상에서 주요 평가지표를 충족하지 못해 FDA로부터 승인을 받지 못하였으며, 아스트라제네카의 울토미리스(Ultomiris)는 임상 3상 중간 분석에서 효능 부족으로 임상 자체가 중단된 바 있습니다. 이외에도 사이토키네틱스의 릴데셈티브(Reldesemtiv), 메리케이 파마의 이부디라스트(Ibudilast), Scholar Rock의 아피테그로맙(Apitegromab), AB Science의 마시티닙(Masitinib), 호주 Isis Pharma의 CuATSM 등은 임상에서 뚜렷한 효과 증명이 실패하거나, 평가지표를 충족하지 못해 긍정적인 결과를 보여주지 못하였습니다. 즉, 확률적으로 당사의 뉴로나타-알의 FDA 승인 또는 가속승인 가능성은 18%에 불과합니다. 게다가 렐리브리오의 경우, 2024년 대규모 임상 3상(PHOENIX 시험)에서 주요 지표(ALSFRS-R)에서 위약군 대비 유의한 이점을 입증하지 못하였으며, 이로 인해 Amylyx는 2024년 4월 미국과 캐나다 시장에서 렐리브리오 마케팅 허가를 자진 철회하고, 신환자 대상 판매를 중단했습니다. ALS 환자 커뮤니티 및 규제 당국 등과의 협의를 통해 기존 치료 환자들은 의사 상담 후 무료 프로그램을 통해 계속 치료를 받을 수 있으나, 신규 환자는 더 이상 렐리브리오를 처방받을 수 없게 되었습니다. 결국 임상 3상 이후 상업화까지 성공하여 현재까지 시판되고 있는 사례는 바이오젠의 칼소디, 단 1건에 불과하여 확률은 9%에 불과한 상황입니다.
희귀의약품 영역에서는 현재 시판 중인 경쟁사의 치료제가 매우 적거나 없는 경우가 많아 경쟁 강도 자체는 비교적 낮은 편입니다. 다만 희귀질환은 유병률이 낮아 환자 수가 제한적이기 때문에 시장 규모가 작다는 근본적 한계가 있습니다. 이런 환경에서는 만약 글로벌 수준의 강력한 치료제나 경쟁사가 먼저 시판 및 상업화에 성공할 경우, 전체 시장 파이 중 상당 부분이 단일 제품이나 기업에 집중될 수 있고, 후발주자에게 추가로 시장을 확보할 여지가 거의 남지 않게 됩니다. 실제로 희귀의약품 시장에서는 '승자독식' 현상이 뚜렷하게 나타나는 경향이 있어, 경쟁 약물의 출시와 동시에 후속 개발 파이프라인의 상업적 가치가 크게 흔들릴 수 있습니다. 최근 10년간 희귀의약품 비중과 시장 규모 모두 꾸준히 증가하고 있으며, 과거 틈새 시장에 머물렀던 희귀질환 치료제가 점차 글로벌 제약산업의 중요한 축으로 자리잡고 있습니다. 이에 따라 앞으로는 대형 제약사들의 진출과 동시에 경쟁 강도 역시 한층 높아질 가능성이 매우 크므로, 시장 자체가 작고, 선점 경쟁사 등장 시 후발주자의 기회가 극도로 제한될 수 있다는 구조적 리스크가 존재합니다. 투자자 여러분께서는 이 점을 반드시 유의하시기 바랍니다.
[바. 해외 CRO업체의 공격적인 국내진출 또는 신규 기업 진입에 따른 경쟁 심화 위험]
|
| 회사위험 | [가. 합병으로 인한 시너지효과 부진 위험] 당사(코아스템(주))는 2022년 08월 16일 이사회 결의를 통해 2022년 12월 01일을 합병기일로 하여, 당사의 연결 종속회사였던 (주)켐온을 흡수합병하였습니다. 합병 후 현재 코아스템(주) 본사 사업 부문의 연구개발 성과는 가시화되지 않았으며, 켐온(주) 사업 부문의 CRO 사업 분야는 매출 감소 및 적자가 발생하고 있는 상황으로서, 합병 후 시너지 효과는 일으키지 못하고 있습니다. 이처럼 지배구조 개편만으로는 궁극적인 주주가치 제고 효과를 발생시키지 못하고 있으며, 연구개발 성과가 나지 않거나, CRO 사업의 안정적인 수익성 확보가 지속적으로 어려울 경우 당사의 재무상태는 더욱 악화될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [나. 계속기업 불확실성 증가 위험] 당사는 지속적인 영업활동의 음(-)의 현금흐름을 개선하지 못한다면 유동비율은 지속적인 감소를 할수밖에 없고,이자보상배수(비율)는 음(-)수에서 벗어날 수 없는 상황입니다. 이에 당사는 비임상 CRO 사업부의 매출 및 수익의 정상화를 위해 기존 고객에 대한 기업 관리 및 대면 미팅 확대뿐 아니라, 신규 고객 유치를 위한 관련 기업 모임 등 네트워킹에 적극 참여할 예정이며, 비임상 각 개발단계 별 전략적 대응을 강화하려고 하고 있습니다. 또한 FDA 품목허가 신청을 진행할 예정인 뉴로나타-알 파이프라인에 대해 품목허가 신청 전, 신청 후 FDA 검토 단계 등에서 사업화가 가능하다면 기술이전계약을 통해 선제적으로 사업화를 진행할 계획도 가지고 있습니다. 따라서 당사는 재무건전성 제고를 위해 본질적으로 필요한 영업이익을 발생시켜 영업활동현금흐름을 개선시키고, 이를 바탕으로 재무활동에서의 자금 의존도를 줄여서 재무구조를 개선하려고 합니다. 당사의 재무제표는 계속기업으로서 존속할 것이라는 가정을 전제로 작성되었으므로 당사의 자산과 부채가 정상적인 사업활동 과정을 통하여 회수되거나 상환될 수 있다는 가정 하에 회계처리 되었습니다. 그러나 당사는 지속적인 영업손실과 당기순손실 발생 및 음(-)의 영업현금흐름 발생, 이에 따른 결손금 누적 등 재무상태가 현저하게 악화되어 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 생길 위험이 존재합니다. 이 경우 당사는 계속기업으로서의 존속능력 불확실성에 의한 한정 의견을 받을 위험이 존재하며, 이를 해소하지 못할 경우 상장폐지 위험이 증가할 수 있습니다. 또한 당사의 재무구조가 더욱 악화될 경우, 당사의 자산과 부채를 정상적인 영업활동 과정을 통하여 장부가액으로 회수하거나 상환하지 못할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [다. 투자주의환기종목, 관리종목, 상장폐지 위험] 당사는 투자주의환기종목, 관리종목 내지 상장폐지 등의 위험을 줄이기 위해서는 자기자본의 확충 및 실적 개선이 반드시 필요한 상황입니다. 특히, 당사는 2023년에 50% 초과요건에 해당되었기 때문에 2025년 자기자본 대비 50%를 초과하는 법인세비용차감전 계속사업손실(파생상품평가손익 제외)이 발생할 경우 최근 3개년 내에 2회 이상 요건이 충족되어 관리종목으로 지정될 수 있습니다. 당사는 2025년 반기 기준으로 자기자본은 454억원이며, 96억원의 법인세비용차감전순손실(파생상품평가손익 제외)이 발생한 상태입니다. 따라서 자기자본의 확충이 일어나거나 법인세비용차감전순손실 규모가 더욱 증가하게 될 경우 50%를 초과하는 요건에 해당될 가능성이 존재합니다. 따라서 본 유상증자로 인한 자기자본 확충이 이루어져야 함은 물론, 법인세비용차감전순손실 규모가 예상보다 확대되지 않도록 관리해야 하는 상황입니다. 당사는 본 유상증자를 통해 자기자본을 확충하고자 하나, 신약개발 사업부문의 적자 발생 지속, 비임상CRO 사업의 실적 저하 추세를 고려한다면, 자기자본 확충에도 불구하고 이러한 위험성을 중장기적으로 개선해나가는 것은 어려울 수 있습니다. 특히 2025년에는 본 유상증자가 예정대로 연내에 납입되어 자기자본이 확충되고, 법인세비용차감전계속사업손실 발생 규모를 통제해야만, 관리종목 지정 위험을 피할 수 있을 것으로 예상됩니다. 투자주의환기종목 또는 관리종목으로 지정될 경우 자본시장에서의 자금 조달이 어려워지므로 유동성 위험이 증가할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [라. 재무제표 재작성 이력 존재 위험] 당사는 2023년말 감사 과정에서 2022년 연결재무제표 회계처리 오류와 관련하여, 재무제표를 재작성한바 있습니다. 또한 2023년 반기검토 당시 당사 외부감사인은 당사의 2022년말 합병후 재무제표에 대해 지적사항이 있었으며, 이를 대응하는 과정에서 2023년 반기보고서 제출이 지연된 바 있습니다. 해당 반기보고서 지연 제출과 관련하여 증권신고서 제출일 현재 상기 위반 사항에 대한 금융감독원의 조사결과에 따라 20억원 이하의 과징금 또는 3천만원 이하의 과태료가 부과될 수 있으나 현재로서는 그 조치 여부 및 수준을 정확히 예상할 수 없습니다. 당사는 공시 위반사항이 발생하지 않도록 인력 및 조직, 시스템을 구축하고 있으며, 관련 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반 시 제재 등에 대한 공시 교육을 지속적으로 실시하고 있습니다. 그럼에도 불구하고 규제기관의 제재가 내려질 경우 과징금 등 조치 규모에 따라 당사 손익에 부정적인 영향을 미칠 수 있습니다. 당사는 향후 이러한 사항이 재발하지 않도록 노력할 예정이며, 2023년부터 현재까지 지속적으로 지정감사를 받고 있는 상황이므로, 회계적 신뢰성을 유지할 수 있도록 노력하려고 합니다. 향후에도 회계처리 오류가 발생할 경우 그 심각성 정도에 따라 회계 감리 대상이 되거나, 각종 규제에 따른 처벌 대상이 될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [마. 지속적 영업손실 발생 위험] 바이오의약품사업부의 매출은 2022년 약 16억원, 2023년 약 16억원, 2024년 약 11억원, 2025년 반기 약 2억원으로 감소하는 추세이며, 영업손실은 2022년 약 139억원, 2023년 약 159억원, 2024년 139억원, 2025년 반기 60억원으로 유지되거나 늘어나고 있는 추세입니다. 이는 심평원이 제시한 보험약가는 당시 생산단가에 미치지 못하였으며, 이로 인해 재무적 지속 가능성을 훼손할 우려가 있어 당사는 부득이하게 비급여 판매를 결정한 점에서 기인합니다. 비급여 전환으로 인해 환자와 의료기관의 실구매 비용 부담이 크게 증가하였고, 이로 인해 제품의 도입과 처방이 지연되면서 실제 매출이 당초 전망치를 하회하게 되었습니다. 치료제 시장은 국가 보험제도의 특성상 예산 대비 치료 효과의 비용 효율성을 엄격히 검토하는 구조로 운영되고 있으며, 당시에도 일본 제약사 미쓰비시타나베사의 루게릭병 치료제 '라디컷'이 심평원과 약가 협의를 진행했으나 비급여 판정을 받아 현재까지 동일한 형태로 환자들에게 제공되고 있습니다. 이러한 제도적 환경은 신약 상용화 속도를 제한하는 요인으로 작용하였으며, 이는 당사의 통제 범위를 넘어선 외적 변수였습니다. 한편, 비임상 CRO 사업부의 매출은 Covid-19 사태 발생 후 약 3년간 백신 치료제 개발 시장이 활성화되며, 국내 제약/바이오 업체의 R&D 활동이 증가하며 지속적 매출 증가 추이를 보일 수 있었습니다. 다만, 2023년부터 Covid-19 사태가 종식되는 추이에 돌입하고 금리 인상에 따른 글로벌 바이오 시장의 투자 침체가 이어졌으며, 주요 고객사들의 연구개발 활동이 축소되고 프로젝트가 지연되는 등 시장 환경이 악화됨에 따라 매출의 감소세를 보이고 있습니다. 비임상CRO사업부의 매출은 2022년 약 447억원, 2023년 약 321억원, 2024년 약 276억원, 2025년 반기 약 114억원으로 감소하는 추세이며, 2022년에는 약 83억원의 영업이익이 발생하였으나, 이후 적자 전환하여 영업손실이 2023년 약 37억원, 2024년 78억원, 2025년 반기 46억원으로 증가하고 있는 추세입니다. 당사의 노력에도 불구하고 시장 환경이 개선되지 않을 경우 비임상 CRO 사업부의 실적 회복은 더딜 수 있으며, 신약 개발 사업부는 지속적으로 연구개발비용이 투입되고, 개발에 따른 성과는 단기간 내에 나오지 않기 때문에 당사 영업손실 발생은 지속될 수 있습니다. 영업손실이 지속될 경우 당사의 자금조달 환경에도 악영향을 미칠 수 있으며, 이 경우 당사의 계속기업으로서의 존속능력에 악영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [바. 유동성 저하 위험] 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 자금 경색으로 인해 중대한 유동성 위기에 봉착할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [사. 잦은 자금조달 위험] 당사는 증권시장에서의 잦은 자금 조달이 발생하고 있습니다. 주식관련채권의 발행, 자기주식의 처분, 본 유상증자를 통해 자금을 조달해오고 있는 바, 이는 영업활동에서 양(+)의 현금흐름을 창출하지 못하고 있기 때문입니다. 향후에도 당사의 실적 개선이 이루어지지 못할 경우 추가적인 자금 조달이 발생할 수 있습니다. 또한 자기주식의 처분이 발생할 경우 처분 시점의 주가가 자기주식 취득가액보다 낮을 경우 자기주식처분손실이 발생할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [아. 매출채권 회수 관련 위험] 당사 매출채권 규모는 2020년 95억원을 제외하면 약 120억원 대의 규모를 유지하고 있으나, 당사의 매출은 지속적으로 감소하고 있기 때문에 매출채권 미회수에 대한 위험성이 증대되고 있습니다. 당사의 매출액 대비 매출채권 비중은 2022년 27.57%에서 지속적으로 증가하여 2025년 반기말 54.14%까지 상승하였습니다. 반면 매출채권회전율은 2022년 4.72회에서 2023년 3.04회, 2024년 2.61회, 2025년 반기말 1.85회로 지속적으로 감소하고 있으며, 2023년 업종평균인 4.95회를 크게 하회하고 있습니다. 향후 거래상대방의 재무상태 악화, 채무불이행 등 예상치 못한 사유로 인하여 당사의 매출채권 및 계약자산의 회수가 지연될 경우, 대손상각비를 인식함에 따라 당사 영업손익에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [자. 유무형자산 관련 위험] 당사 재무제표상 건설중인자산을 인식하고 있으며, 건설중인자산의 경우, 감가상각 처리가 없으나, 향후 소기의 목적대로 운영이 개시될 때 각 유형자산으로 대체된 후 감가상각 대상이 되므로, 향후 자산화 처리된 투입 비용이 매년 비용으로 분할 인식될 예정으로 매년 고정적 비용 부담이 생기게 됩니다. 현재 오송공장은 준공 완료된 상태이나, 아직 인증 완료 및 치료제 생산 준비가 되지 않은 시점으로 2025년 반기말 기준으로는 건설중인 자산으로 인식하고 있습니다. 한편, 이러한 대규모 시설 투자 완료 후에도 당사의 실적이 개선되지 못할 경우에는 현금창출단위의 손상평가시, 유형자산의 손상차손을 인식하게 될 수도 있으며, 투입 비용 이상의 수익 창출 효과를 발생시키지 못할 수 있습니다. 당사 비임상 CRO 사업분야의 수익성이 저하되고 있고, 2025년 반기 기준 CRO 사업분야의 영업손실은 46억원입니다. 수익성이 개선되지 못할 경우, 매년말 영업권 손상평가 시점에서 평가된 회수가능액이 장부금액에 미달할 수 있으며, 이 경우 현재 인식하고 있는 영업권 장부금액 39억원의 일부 또는 전부가 손상처리될 수 있습니다. 이는 당사의 세전손실 규모를 확대시킬 수 있으며, 자기자본 대비 세전손실 50% 초과 요건 관련하여, 당사 주식의 관리종목 편입 위험 증가를 유발할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [차. 최대주주 청약 및 지분 희석 관련 위험] 증권신고서 제출일 현재 기준 최대주주는 1,000,000주에 대한 주식담보대출이 존재하며 이에 대한 반대매매가 발생한다면 최대주주의 지분율은 약 3% 가량 하락하여 7.55%로 감소하며, 특수관계인을 포함한 지분율은 8.98%로 감소하게 됩니다.또한 신주배정기준일(2025년 09월 18일 예정) 전에 반대매매가 발생할 경우, 동일하게 최대주주의 청약 참여 30% 및 특수관계인 미확정으로 미참여 가정을 한다면 증자 후 최대주주의 지분율은 5.7%, 특수관계인을 포함하면 6.58%로 하락하게 됩니다. 이처럼 근질권 설정된 1,000,000주에 대한 반대매매가 출회된다면 주가 하락은 물론이고 최대주주 등의 지분율도 크게 하락하여 당사의 경영권이 불안정한 상태가 되어 향후 경영권 분쟁 발생의 여지가 있는 등 당사에 부정적인 영향을 미칠 수 있습니다. 최대주주의 주식담보대출에 대한 반대매매가 발생하지 않으며, 당사 최대주주 본인이 배정분의 30%에 대해 청약에 참여하고 특수관계인들은 청약에 참여하지 않는 경우를 가정한다면 최대주주 등의 보통주 지분율은 본 유상증자 후 9.03% 수준까지 희석될 수 있으며, 이는 경영권을 안정적으로 유지하기에는 부족한 수준의 지분율입니다. 또한 최대주주 등이 예상치 못한 사유 등으로 인해 청약에 필요한 자금을 마련하지 못할 경우, 청약 계획에 변동이 생겨, 지분이 추가 희석될 수 있는 위험성을 배제할 수 없습니다. 또한 당사는 지속적으로 자본시장에서의 자금 조달에 의존하고 있는 만큼 향후 추가적인 유상증자, 주식관련사채 등 발행에 따라 최대주주 및 특수관계인 등의 지분율이 추가로 희석될 가능성 또한 존재하며, 또는 최대주주 및 특수관계인 등의 지분율 추가 희석을 우려하여, 자본시장에서 지분 희석이 수반될 수 있는 형태의 자금 조달을 진행하는 데에는 한계가 있을 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. [카. 특수관계인과의 거래 위험] 당사는 특수관계자와의 거래시 이사회 결의를 거쳐야 하며, 내부회계 관리 규정 등 당사 내부통제기준에 따라 거래 투명성을 확보하는 등 절차를 준수하고 있습니다. 향후에도 특수관계자와의 거래가 발생하게 될 경우 특수관계자에 대한 부당한 이익 제공 등에 해당하지 않는 범위에서 거래가 진행되도록 사전에 내부 규정에 따른 관련 절차를 준수할 예정입니다. 만일 특수관계자와의 거래 조건 등이 제3자와의 거래와 비교하여 적정성이 유지되지 않을 경우 이는 주주의 이익을 침해하는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| 기타 투자위험 |
[가. 금융감독기관의 관리감독기준 강화에 따른 위험] 당사는 2020년 6월 제1회차 전환사채 410억을 발행하였으며, 해당 전환사채 콜옵션의 만기가 도래하기 전 전체 콜옵션(40%) 164억원 중 약 108억원을 당사 뉴로나타-알 파이프라인에 대한 자신감 및 책임 경영의 측면에서 행사하기로 결정하였습니다. 해당 콜옵션 행사 금액을 조달 및 마련하기 위해 당시 제1금융권에 주식담보대출을 알아봤으나, 현실적으로 실행 가능한 곳이 없었으며 이로 인해 주요 경영진이 알고 있는 지인이 운영하고 있는 주식회사 문앤폴라리스라는 기업과 주식담보대출을 체결하게 되었습니다. 2023년 1월에도 당사의 제3회차 교환사채 10억원을 투자한 이력이 있는 문앤폴라리스는 2006년에 설립된 중소기업으로, 주요 영위사업은 응용 소프트웨어 개발 및 공급업이며, 주로 서비스 기반 프로그램 개발을 하고 있는 것으로 알려져 있습니다. 현재 계속사업자로 운영 중이나, 2019년 매출 43억원, 영업이익 33억원에서 2022년 매출 2억원, 영업손실 2억원으로 급감하는 등 현재는 주요 영위 사업을 매각 후 회사의 법인 상태만 유지되는 형태로 남아 있는 것으로 판단됩니다. 당사의 최대주주는 2022년 4월 22일, 주식회사 문앤폴라리스와 금전소비대차계약을 체결하여 100억원을 차용했습니다. 차용기간은 2024년 7월 22일까지 27개월이며, 연 이자율은 6%로 원금 상환 시 일시에 지급하기로 하였습니다. 이 채무를 담보하기 위해 최대주주(김경숙)은 자신이 보유한 코아스템㈜ 보통주 2,000,000주(액면가 500원)를 문앤폴라리스에 근질권 설정하여 제공하였습니다.
만일 담보 주식 1,000,000주에 대한 반대 매매가 실행된다면 최대주주의 지분율은 약 3% 가량 하락하여 7.55%로 감소하며, 특수관계인을 포함한 지분율은 8.98%로 감소하게 됩니다. 또한 신주배정기준일(2025년 09월 18일 예정) 전에 반대매매가 발생할 경우, 최대주주의 청약 참여 30% 및 특수관계인 미확정으로 미참여 가정을 한다면 증자 후 최대주주의 지분율은 5.7%, 특수관계인을 포함하면 6.58%로 하락하게 됩니다. 이처럼 근질권 설정된 1,000,000주에 대한 반대매매가 출회된다면 주가 하락은 물론이고 최대주주 등의 지분율도 크게 하락하여 당사의 경영권이 불안정한 상태가 되어 향후 경영권 분쟁 발생의 여지가 있는 등 당사에 부정적인 영향을 미칠 수 있습니다. 결과적으로 현재 당사의 최대주주는 문앤폴라리스에 대해 30억원의 채무를 부담하고 있으며, 이를 담보하기 위해 당사의 보통주 1,000,000주에 근질권이 설정되어 있습니다. 기존 만기 2025년 3월 31일에서 5개월 연장하여 2025년 8월 31일까지 연장되었고, 구두합의를 통해 2026년 04월 30일까지 재연장하였습니다. 약정 기한 내 채무를 상환하지 못하거나 계약상 의무를 위반하면 문앤폴라리스가 담보를 처분할 수 있어, 최대주주 지분의 강제매각(반대매매) 위험이 존재합니다. 투자자 여러분께서는 반드시 이 점 유의하시기 바랍니다.
[사. 주식매수선택권 행사에 따른 주가 하락 위험] 향후 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 20,000,000 | 500 | 1,890 | 37,800,000,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 엘에스증권 | 보통주 | 8,000,000 | 15,120,000,000 | 주관수수료: 최종모집금액의 0.5% * 50% 기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
잔액인수 |
| 공동 | 한양증권 | 보통주 | 8,000,000 | 15,120,000,000 | 주관수수료: 최종모집금액의 0.5% * 50% 기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
잔액인수 |
| 인수 | SK증권 | 보통주 | 4,000,000 | 7,560,000,000 | 기본인수수수료: 최종모집금액의 1.8% * 20% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2025년 11월 03일 ~ 2025년 11월 04일 | 2025년 11월 11일 | 2025년 11월 05일 | 2025년 11월 11일 | 2025년 09월 18일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2025년 08월 19일 | 2025년 10월 29일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 운영자금 | 12,466,836,000 |
| 채무상환자금 | 24,339,700,000 |
| 발행제비용 | 993,464,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | 주요사항보고서(유상증자결정)-2025.08.18 |
| 【기 타】 |
1) 금번 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 엘에스증권(주)이며, 공동주관회사는 한양증권(주)이며, 그 외 인수회사는 SK증권(주)입니다.
|
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 2025년 08월 18일 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6 제2항 제1호에 의거 엘에스증권(주), 한양증권(주) 및 SK증권(주)와 주주배정후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 20,000,000주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 : 원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 20,000,000 | 500 | 1,890 | 37,800,000,000 | 주주배정후실권주일반공모 |
| 주1) | 이사회 결의일 : 2025년 08월 18일 |
| 주2) | 1주의 모집가액 및 모집총액은 예정발행가액 기준입니다. |
발행가액은 「증권의 발행 및 공시 등에 관한 규정」 제5-18조 (유상증자의 발행가액 결정)에 의거, 주주배정증자시 할인율 등이 자율화 되어 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 산정할 예정입니다.
■ 예정발행가액의 산출근거
이사회결의일 직전 거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 할인율 25%를 적용하고 증자비율을 고려하여, 아래 산식에 의하여 산정된 발행가액(예정발행가액)으로 합니다. 단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.
| 기준주가 X 【 1 - 할인율(25%) 】 | ||
| ▶ 예정발행가액 | = | ---------------------------------------- |
| 1 + 【유상증자비율 X 할인율(25%)】 |
| [예정발행가액 산정표] 기산일 : 2025년 08월 14일 |
(단위 : 원, 주) |
| 일자 | 가중산술평균주가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2025/08/14 | 2,902원 | 307,451주 | 892,086,098원 |
| 2025/08/13 | 2,759원 | 223,175주 | 615,643,772원 |
| 2025/08/12 | 2,700원 | 208,880주 | 563,981,127원 |
| 2025/08/11 | 2,749원 | 148,995주 | 409,646,459원 |
| 2025/08/08 | 2,723원 | 194,600주 | 529,891,150원 |
| 2025/08/07 | 2,677원 | 143,708주 | 384,638,035원 |
| 2025/08/06 | 2,677원 | 170,698주 | 456,905,964원 |
| 2025/08/05 | 2,744원 | 337,952주 | 927,241,485원 |
| 2025/08/04 | 2,806원 | 122,467주 | 343,664,972원 |
| 2025/08/01 | 2,874원 | 221,468주 | 636,423,424원 |
| 2025/07/31 | 2,988원 | 86,301주 | 257,904,580원 |
| 2025/07/30 | 3,004원 | 97,087주 | 291,692,460원 |
| 2025/07/29 | 2,990원 | 70,541주 | 210,928,166원 |
| 2025/07/28 | 3,053원 | 170,225주 | 519,624,502원 |
| 2025/07/25 | 3,096원 | 104,012주 | 322,048,742원 |
| 2025/07/24 | 3,159원 | 133,100주 | 420,482,900원 |
| 2025/07/23 | 3,183원 | 285,613주 | 909,006,750원 |
| 2025/07/22 | 3,042원 | 1,113,994주 | 3,389,175,607원 |
| 2025/07/21 | 3,406원 | 244,151주 | 831,465,612원 |
| 2025/07/18 | 3,456원 | 228,823주 | 790,809,160원 |
| 2025/07/17 | 3,418원 | 389,462주 | 1,331,285,669원 |
| 2025/07/16 | 3,295원 | 260,348주 | 857,766,321원 |
| 2025/07/15 | 3,264원 | 536,999주 | 1,752,616,432원 |
| 1개월 가중산술평균주가 (A) | 3,042원 | 5,800,050주 | 17,644,929,387원 |
| 1주일 가중산술평균주가 (B) | 2,780원 | 1,083,101주 | 3,011,248,606원 |
| 기산일 가중산술평균주가 (C) | 2,902원 | 307,451주 | 892,086,098원 |
| A,B,C의 산술평균 (D) | 2,908원 | (A + B + C) ÷ 3 | |
| 기준주가 (E) | 2,902원 | (C와 D중 낮은 가액) | |
| 할인율 | 25.00% | - | |
| 증자비율 | 60.85% | - | |
| 예정발행가액 | 1,890원 | (기준주가 × (1-할인율)) ÷ (1 + (증자비율 × 할인율)) |
|
상기 방법에 따라 산정된 예정발행가액은 참고용이며, 구주주 청약일전 3거래일에 확정발행가액이 결정될 예정입니다.
■ 공모일정 등에 관한 사항
당사는 2025년 08월 18일 이사회를 통해 유상증자를 결의하였으며, 세부 일정은 다음과 같습니다.
| [주요일정] |
| 날짜 | 업 무 내 용 | 비고 |
|---|---|---|
| 2025-08-18(월) | 이사회결의 | - |
| 2025-08-18(월) | 신주발행 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.corestemchemon.com) |
| 2025-08-18(수) | 증권신고서 제출 | - |
| 2025-09-15(월) | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2025-09-17(수) | 권리락 | - |
| 2025-09-18(목) | 신주배정 기준일(주주확정) | - |
| 2025-09-30(화) | 신주배정 통지 | - |
| 2025-10-14(화) ~ 2025-10-20(월) |
신주인수권증서 상장 거래기간 | 5거래일 이상 거래 |
| 2025-10-21(화) | 신주인수권증서 상장 폐지 | 구주주 청약초일 5거래일 전 폐지 |
| 2025-10-29(수) | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2025-10-30(목) | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.corestemchemon.com)및 Dart전자공시시스템(http://dart.fss.or.kr) |
| 2025-11-03(월) ~ 2025-11-04(화) |
구주주 청약 및 초과청약 | - |
| 2025-11-05(수) | 일반공모 청약 공고 | 당사 인터넷 홈페이지 (http://www.corestemchemon.com) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) SK증권(주) 홈페이지(http://www.sks.co.kr) |
| 2025-11-06(목) ~ 2025-11-07(금) |
일반공모 청약 | - |
| 2025-11-11(화) | 환불 및 배정 공고 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) SK증권(주) 홈페이지(http://www.sks.co.kr) |
| 2025-11-11(화) | 주금 납입 | - |
| 2025-11-24(월) | 신주유통 개시일 | - |
| 2025-11-24(월) | 신주상장 예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
2. 공모방법
| [공모방법 : 주주배정후 실권주 일반공모] |
| 모집대상 | 주식수 | 비 고 |
|---|---|---|
| 구주주 (신주인수권증서 보유자) 청약 |
20,000,000주 (100.0%) | - 구주 1주당 신주 배정비율 : 1주당 0.71186217주 - 신주배정 기준일 : 2025년 09월 18일 - 구주주 청약일 : 2025년 11월 03일 ~ 2025년 11월 04일 (2일간) - 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권증서가 배정됨) - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 청약 가능 |
| 초과 청약 | - | - 「자본시장과 금융투자업에 관한 법률」 제165조의6의 제2항 제2호에 의거 초과청약 - 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 - 초과 청약일 : 2025년 11월 03일 ~ 2025년 11월 04일 (2일간) |
| 일반공모 청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
- | - 구주주 및 초과청약 후 발생하는 단수주 및 실권주("일반공모 배정분")에 대해 배정. - 일반공모 청약일 : 2025년 11월 06일 ~ 2025년 11월 07일 (2일간) |
| 합 계 | 20,000,000주 (100.00%) | - |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.71186217주를 곱하여 산정된 배정주식수로 하되, 1주 미만은 절사합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 주식매수선택권의 권리행사, 자기주식수의 변동으로 인하여 1주당 배정주식수가 변동될 수 있습니다. |
| 주3) |
신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. (ii) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권증서의 수량 (iii) 초과청약 한도주식수 = 신주인수권증서 청약한도 주식수 X 초과청약 비율(20%) |
| 주4) |
"고위험고수익투자신탁등"이란 다음 각 호의 어느 하나에 해당하는 투자신탁 등을 말합니다. (1) 「조세특례제한법」 제91조의15 제1항에 따른 고위험고수익채권투자신탁(이하 "고위험고수익채권투자신탁"이라 함). 다만, 해당 투자신탁 등의 최초 설정일ㆍ설립일이 속하는 분기 또는 그 다음 분기 말일 전 배정하는 경우에는 같은 법 시행령 제93조 제1항 제1호 및 같은 조 제5항에도 불구하고 배정일 직전 영업일의 고위험고수익채권의 보유비율이 같은 법 시행령 제93조 제1항 제1호 각 목의 비율 이상이어야 합니다. (2) 법률 제19328호「조세특례제한법」의 시행일 이전의 제91조의15제1항에 따른 고위험고수익투자신탁(이하 "고위험고수익투자신탁"이라 함)으로서 최초 설정일ㆍ설립일이 2023년 12월 31일 이전인 것을 말합니다. 다만, 해당 투자신탁 등의 설정일ㆍ설립일부터 배정일까지의 기간이 6개월 미만일 경우에는 대통령령 제33499호 같은 법 시행령 시행일 이전의 제93조 제3항 제1호 및 같은 조 제7항에도 불구하고 배정일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다.. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 배정일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 배정일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35이상이어야 합니다. |
| 주6) |
일반공모 청약 : "구주주" 청약(초과청약 포함) 결과 발생한 미청약주식 및 단수주는 대표주관회사, 공동주관회사 및 인수회사가 일반에게 공모하되「증권 인수업무 등에 관한 규정」 제9조 제2항 제6호에 따라 "고위험고수익투자신탁등"에 일반공모 배정분의 10%를 배정하고, "벤처기업투자신탁"에 일반공모 배정분의 25%를 배정합니다. 나머지 주식은 개인청약자 및 기관투자자에 구분없이 배정합니다. "고위험고수익투자신탁등"에 대한 일반공모 배정분 10%, "벤처기업투자신탁"에 대한 일반공모 배정분 25% 및 개인투자자 및 기관투자자에 대한 일반공모 배정분 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만 한 그룹만 청약미달이 발생할 경우 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. 일반공모에 관한 배정수량 계산시 대표주관회사, 공동주관회사 및 인수회사의 청약물량(대표주관회사, 공동주관회사 및 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미하며 대표주관회사, 공동주관회사 및 인수회사에 대하여 개별적으로 산정한 청약주식수를 말한다)에 대해서는 대표주관회사, 공동주관회사 및 인수회사의 총 청약물량(대표주관회사와 인수회사가 일반공모 방식으로 접수를 받은 청약물량의 합을 말한다)을 "일반공모 배정분" 주식수로 나눈 통합청약경쟁률에 따라 대표주관회사, 공동주관회사 및 인수회사의 각 청약자에 배정하는 방식(이하 통합배정이라 한다)으로 합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사"가 합리적으로 판단하여 배정합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정합니다. 배정결과 발생하는 잔여주식은 "대표주관회사", "공동주관회사" 및 "인수회사"가 각 인수의무비율대로 자기계산으로 잔액인수하기로 합니다. |
| 주7) | 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사, 공동주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다. |
| 주8) |
자본시장법 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2025년 03월 19일부터 2025년 05월 29일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
※ 참고 : 구주주 1주당 배정비율 산출 근거
| 구 분 | 상세 내역 |
|---|---|
| A. 보통주식 | 32,870,376 |
| B. 우선주식 | - |
| C. 발행주식총수(A+B) | 32,870,376 |
| D. 자기주식 + 자기주식신탁 | 4,775,050 |
| E. 자기주식을 제외한 발행주식총수 (C-D) | 28,095,326 |
| F. 유상증자 주식수 | 20,000,000 |
| G. 증자비율 (F/C) | 60.85% |
| H. 우리사주조합 배정 | - |
| I. 구주주배정 (F-H) | 20,000,000 |
| J. 구주주 1주당 배정비율 (I/E) | 0.71186217 |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」 제5-18조에 의거 주주배정 증자시 가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
가. 1차 발행가액: 신주배정기준일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가, 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용하고 증자비율을 고려하여, 아래의 산식에 의하여 산정된 발행가액(1차 발행가액)으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
▶ 1차 발행가액 = 기준주가 × (1-할인율) / [1 + (증자비율 × 할인율)]
나. 2차 발행가액: 구주주 청약일 전 제 3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용, 아래의 산식에 의하여 산정된 발행가액(2차 발행가액)으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
▶ 2차 발행가액 = 기준주가 × (1-할인율)
다. 확정 발행가액: 확정 발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 한다. 다만 「자본시장법」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은 가액이 구주주 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가를 기준주가로 하여 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
▶ 확정 발행가액 = MAX【MIN(1차 발행가액, 2차 발행가액), 기준주가의 60%】
* 기준주가= 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가
라. 최종 발행가액은 구주주 청약초일 전 제3거래일(2025년 10월 30일(목) 예정)에 결정되어 금융감독원 전자공시시스템에 2025년 10월 31일(금)에 공시될 예정이며, 회사의 인터넷 홈페이지(http://www.corestemchemon.com)에 공고하여 개별통지에 갈음할 예정입니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 20,000,000 | ||||||||||||||||||||||||||
| 주당 모집가액 | 예정가액 | 1,890 | |||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||
| 모집총액 | 예정가액 | 37,800,000,000 | |||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||
| 청 약 단 위 |
(1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수로 합니다. 다만, 신주배정기준일 현재 신주배정율은 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 변경될 수 있습니다(단, 1주 미만은 절사한다).
|
||||||||||||||||||||||||||
| 청약기일 | 구주주 | 개시일 | 2025년 11월 03일 | ||||||||||||||||||||||||
| 종료일 | 2025년 11월 04일 | ||||||||||||||||||||||||||
| 실권주 일반공모 | 개시일 | 2025년 11월 06일 | |||||||||||||||||||||||||
| 종료일 | 2025년 11월 07일 | ||||||||||||||||||||||||||
| 청약 증거금 |
구주주 | 청약금액의 100% | |||||||||||||||||||||||||
| 초 과 청 약 | 청약금액의 100% | ||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | ||||||||||||||||||||||||||
| 납 입 기 일 | 2025년 11월 11일 | ||||||||||||||||||||||||||
| 배당기산일(결산일) | 2025년 01월 01일 | ||||||||||||||||||||||||||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
|---|---|---|
| 신주 발행 및 배정기준일(주주확정일) 공고 |
2025년 08월 18일 | 회사 인터넷 홈페이지(http://www.corestemchemon.com) |
| 모집가액 확정의 공고 | 2025년 10월 30일 | 회사 인터넷 홈페이지(http://www.corestemchemon.com) 전자공시시스템(http://dart.fss.or.kr) |
| 실권주 일반공모 청약공고 | 2025년 11월 05일 | 회사 인터넷 홈페이지(http://www.corestemchemon.com) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) SK증권(주) 홈페이지(http://www.sks.co.kr) |
| 실권주 일반공모 배정공고 | 2025년 11월 11일 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) SK증권(주) 홈페이지(http://www.sks.co.kr) |
| 주1) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
| 주2) | 모집가액은 2025년 10월 29일을 기준으로 확정되며, 다음 영업일인 2025년 10월 30일까지 공고할 예정입니다. |
| 주3) | 청약결과 초과청약금 환불에 대한 통지는 대표주관회사, 공동주관회사 및 인수회사 홈페이지에 게시함으로써 개별통지에 갈음합니다. |
| 주4) | 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 일간 매일경제신문에 게재할 예정입니다. |
2) 청약방법
가) 구주주 청약(신주인수권증서 보유자 청약): 구주주 중 주권을 증권회사에 예탁한 주주(기존 "실질주주")는 주권을 예탁한 증권회사의 본/지점, 대표주관회사의 본/지점 및 공동주관회사의 본/지점에서 청약할 수 있습니다. 다만, 구주주 중 명의개서대행기관 특별계좌에 주식을 가지고 있는 주주(기존 "명부주주")는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 대표주관회사의 본/지점 및 공동주관회사의 본/지점에서 청약할 수 있습니다. 청약시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출하여야 합니다.
| 2019년 9월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 엘에스증권(주)의 본ㆍ지점 및 공동주관회사인 한양증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
|
「주식ㆍ사채 등의 전자등록에 관한 법률」 |
나) 신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도 주식수의 20%를 추가로 청약할 수 있습니다. 이때, 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
다) 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자는 「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약합니다. 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자의 청약 시, 각 청약처별로 다중청약은 가능하나, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구를 제외한 청약자의 한 개 청약처에 대한 복수청약은 불가능합니다. 또한 고위험고수익투자신탁등은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제18호에 따른 요건을 충족함을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다. 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제20호에 따른 요건을 충족하고, 제9조제10항에 따른 확약서 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
라) 일반청약자의 청약은 청약주식의 단위에 따라 될 수 있으며, 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 하고 청약사무 취급처는 그 차액을 납입일까지 당해 청약자에게 반환하며, 이때 받은 날부터의 이자는 지급하지 않습니다.
마) 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」 제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제 132조에 따라 투자설명서의 교부가 면제되는자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다.
바) 「자본시장법과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 의거, 2025년 08월 19일부터 2025년 10월 29일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집(매출)가액 의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항에 해당할 경우에는 공매도하거나 공매도 주문을 위탁하더라도 금번 모집(매출)에 따른 주식을 취득할 수 있으며, 세부적인 동법 시행령 제208조의4제2항의 내용은 하기와 같습니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우(매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
1) 엘에스증권(주) 본ㆍ지점 2) 한양증권(주) 본ㆍ지점 |
2025년 11월 03일~ 2025년 11월 04일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 당사 주식을 예탁하고 있는 당해 증권회사 본ㆍ지점 2) 엘에스증권(주) 본ㆍ지점 3) 한양증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
1) 엘에스증권(주) 본ㆍ지점 2) 한양증권(주) 본ㆍ지점 3) SK증권(주) 본ㆍ지점 |
2025년 11월 06일~ 2025년 11월 07일 |
|
4) 청약결과 배정방법
가) 구주주(신주인수권증서 보유자) 청약 : 신주배정기준일(2025년 09월 18일 예정) 18시 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 본 주식을 1주당 0.71186217주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 신주배정기준일 이후 신주인수권증서의 매매를 통해 신주인수권증서를 보유한 자는 보유한 신주인수권증서 수량을 한도로 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
나) 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주 및 단수주가 있는 경우, 실권주 및 단수주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율 : 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다.(단, 초과청약 주식수가 실권주 및 단수주에 미달한 경우 100% 배정)
(ⅰ) 청약한도 주식수 = 신주인수권증서 청약한도 주식수 + 초과청약한도 주식수
(ⅱ) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권증서의 수량
(ⅲ) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 × 초과청약 비율(20%)
다) 일반공모 청약:
(1) 상기 구주주 청약 및 초과청약 결과 발생한 실권주 및 단수주(이하 "일반공모 배정분"이라 한다)는 대표주관회사, 공동주관회사 및 인수회사가 일반에게 공모하되, '증권 인수업무 등에 관한 규정' 제9조 제2항 제6호에 따라 "고위험고수익투자신탁등"에 공모주식의 10%를 배정하고, 벤처기업투자신탁에 공모주식의 25%를 배정합니다. 나머지 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자 포함)에게 구분 없이 배정합니다. 각 그룹에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 어떤 그룹에 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
(2) 일반공모에 관한 배정수량 계산시 대표주관회사, 공동주관회사 및 인수회사의 "청약물량"(대표주관회사, 공동주관회사 및 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미하며, 대표주관회사, 공동주관회사 및 인수회사에 대하여 개별적으로 산정한 청약주식수를 말한다)에 대해서는 대표주관회사, 공동주관회사 및 인수회사의 총청약물량(대표주관회사, 공동주관회사 및 인수회사가 일반공모 방식으로 접수를 받은 청약물량의 합을 말한다)을 일반공모 배정분 주식수로 나눈 통합 청약경쟁률에 따라 대표주관회사, 공동주관회사 및 인수회사의 각 청약자에 배정하는 방식(이하 "통합배정"이라 한다)으로 합니다.
(3) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다.
(4) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정하며, 배정결과 발생하는 잔여주식은 대표주관회사, 공동주관회사 및 인수회사가 인수의무비율에 따라 각각 자기의 계산으로 인수합니다. 다만, 1주 미만의 단수주가 발생하는 경우 "대표주관회사"가 합리적으로 정하는 바에 따라 처리합니다.
[인수계약 내용에 따른 대표주관회사, 공동주관회사 및 인수회사의 인수의무비율]
| 구분 | 인수의무비율 | |
|---|---|---|
| 대표주관회사 | 엘에스증권 주식회사 | 40.00% |
| 공동주관회사 | 한양증권 주식회사 | 40.00% |
| 인수회사 | SK증권 주식회사 | 20.00% |
| 합 계 | 100.00% | |
(5) 단, "증권 인수업무 등에 관한 규정" 제9조 제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁, 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고, 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사, 공동주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다.
5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」 제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 당사 및 대표주관회사, 공동주관회사, 인수회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- "본 주식"에 청약하고자 하는 투자자("자본시장과 금융투자업에 관한 법률" 제9조 제5항에 규정된 전문투자자 및 "자본시장과 금융투자업에 관한 법률 시행령" 제132조에 따라 투자설명서의 교부가 면제되는 자 제외)는 청약 전 투자설명서를 교부받아야 합니다. 단, 투자설명서 수령거부의사표시는 서면, 전화, 전신, 팩스, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 가능합니다.
-전자문서의 방법으로 투자설명서를 교부받고자 하는 투자자는 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각호의 요건을 모두 충족하여야 합니다.
가) 투자설명서 교부 방법 및 일시
| 구분 | 교부방법 | 교부일시 |
|---|---|---|
| 구주주 청약자 |
1),2),3)을 병행 1) 등기우편 송부 2) 대표주관회사 및 공동주관회사의 본, 지점 교부 3) 대표주관회사 및 공동주관회사의 홈페이지나 HTS, MTS에서 교부 |
1) 우편송부 시: 구주주 청약초일인 2025년 11월 03일 전 수취 가능 2) 대표주관회사 및 공동주관회사의 본, 지점 : 청약종료일(2025년 11월 04일)까지 3) 대표주관회사 및 공동주관회사의 홈페이지 또는 HTS, MTS 교부 : 청약종료일(2025년 11월 04일)까지 |
| 일반 청약자 |
1), 2)를 병행 1) 대표주관회사, 공동주관회사 및 인수회사의 본, 지점에서 교부 2) 대표주관회사, 공동주관회사 및 인수회사의 홈페이지나 HTS, MTS 에서 교부 |
1) 대표주관회사, 공동주관회사 및 인수회사의 본, 지점 : 청약종료일 (2025년 11월 07일)까지 2) 대표주관회사, 공동주관회사 및 인수회사의 홈페이지 또는 HTS, MTS 교부: 청약종료일 (2025년 11월 07일)까지 |
※ 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
나) 확인절차
(1) 우편을 통한 투자설명서 수령 시
(가) 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
(나) HTS 또는 MTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
(2) 지점 방문을 통한 투자설명서 수령 시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
(3) 홈페이지 또는 HTS, MTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
다) 기타
(1) 금번 유상증자에서 당사는 본 증권신고서의 효력발생 이후 주주명부상 주주분들에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는 지점 방문을 통해 인쇄물을 받으실 수 있으며, 또한 동일한 내용의 투자설명서를 전자문서의 형태로 대표주관회사의 홈페이지에서 다운로드 받으실 수 있습니다. 다만, 전자문서의 형태로 교부 받으실 경우, 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각 호의 요건을 모두 충족해야만 청약이 가능합니다.
(2) 구주주 청약 시 대표주관회사 이외의 증권회사를 이용한 청약 방법
- 해당 증권회사의 청약 방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
| ※ 관련법규 「자본시장과 금융투자업에 관한 법률」 제9조 (그 밖의 용어의 정의) ⑤ 이 법에서 "전문투자자"란 금융투자상품에 관한 전문성 구비 여부, 소유자산규모 등에 비추어 투자에 따른 위험감수능력이 있는 투자자로서 다음 각 호의 어느 하나에 해당하는 자를 말한다. 다만, 전문투자자 중 대통령령으로 정하는 자가 일반투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우 금융투자업자는 정당한 사유가 있는 경우를 제외하고는 이에 동의하여야 하며, 금융투자업자가 동의한 경우에는 해당 투자자는 일반투자자로 본다. <개정 2009.2.3> 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자 제124조 (정당한 투자설명서의 사용) ① 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외한다)에게 제123조에 적합한 투자설명서(집합투자증권의 경우 투자자가 제123조에 따른 투자설명서의 교부를 별도로 요청하지 아니하는 경우에는 제2항제3호에 따른 간이투자설명서를 말한다. 이하 이 항 및 제132조에서 같다)를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 아니 된다. 이 경우 투자설명서가 제436조에 따른 전자문서의 방법에 따르는 때에는 다음 각 호의 요건을 모두 충족하는 때에 이를 교부한 것으로 본다.<개정 2013.5.28> 1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 "전자문서수신자"라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 「자본시장과 금융투자업에 관한 법률 시행령」 제11조(증권의 모집ㆍ매출) ① 법 제9조제7항 및 제9항에 따라 50인을 산출하는 경우에는 청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다. 다만, 다음 각 호의 어느 하나에 해당하는 자는 합산 대상자에서 제외한다. <개정 2009. 10. 1., 2010. 12. 7., 2013. 6. 21., 2013. 8. 27., 2016. 6. 28., 2016. 7. 28.> 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 전문투자자 나. 삭제<2016. 6. 28.> 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사ㆍ감정인ㆍ변호사ㆍ변리사ㆍ세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주[「금융회사의 지배구조에 관한 법률」 제2조제6호가목에 따른 최대주주를 말한다. 이 경 우 "금융회사"는 "법인"으로 보고, "발행주식(출자지분을 포함한다. 이하 같다)"은 "발행주식"으로 본다. 이하 같다]와 발행주식 총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본 법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열 회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는 그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자 제132조 (투자설명서의 교부가 면제되는 자) 법 제124조제1항 각 호 외의 부분 전단에서 "대통령령으로 정하는 자"란 다음 각 호의 어느 하나에 해당하는 자를 말한다. <개정 2009.7.1, 2013.6.21> 1. 제11조 제1항 제1호 다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화·전신·팩스, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. |
6) 주권유통에 관한 사항
주권유통개시(예정)일: 2025년 11월 24일(신주 상장예정) (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2025년 11월 11일부터 해당 청약사무 취급처에서 환불합니다.
8) 주금납입장소 : 신한은행 용인금융센터
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2025년 09월 18일 | 엘에스증권(주) | 00330424 |
| 한양증권(주) | 00162416 | |
1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」 제165의6조3항 및 「증권의 발행 및 공시 등에 관한 규정」 제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 9월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 엘에스증권(주) 및 공동주관회사인 한양증권(주)로 합니다.
4) 신주인수권증서 매매 등
가) 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
나) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 엘에스증권(주)의 본점 및 지점을 통해 해당 신주인수권증서에 기재되어 있는 수량만큼 청약할 수 있으며, 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
5) 당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2025년 10월 14일부터 2025년 10월 20일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2025년 10월 21일에 상장폐지될 예정입니다. 「코스닥시장 상장규정」 제16조 3(신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제44조의3 "신주인수권증서의 상장폐지기준"에 따라 신주청약 개시일 5거래일전에 상장폐지되어야 함)
6) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래 관련 사항은 다음과 같습니다.
가) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
나) 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2025년 10월 14일부터 2025년 10월 20일까지(5거래일간) 거래 | 신주배정통지일(2025년 09월 30일(예정))부터 2025년 10월 22일(신주인수권증서 상장폐지일의 익영업일)까지 거래 |
(1) 상장거래 : 2025년 10월 14일부터 2025년 10월 20일(5영업일간) 거래 가능합니다.
(2) 계좌대체거래 : 신주배정통지일인 2025년 09월 30일(예정)부터 2025년 10월 22일까지 거래 가능 합니다.
* 신주인수권증서의 계좌대체(장외거래)는 신주인수권증서 상장거래의 최종 결제일인 2025년 10월 22일까지 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다.
(3) 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다.
다) 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
(1) '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다.
(2) '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사의 본ㆍ지점 및 공동주관회사의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
1) 본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자시 이러한 점을 감안하시기 바랍니다.
2) 「자본시장과 금융투자업에 관한 법률」 제120조3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
3) 당사는 본 증권신고서를 통하여 청약 전에 투자자께서 숙지하셔야 하는 부분에 대하여 성실히 기재하고자 노력하고 있습니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 아래 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수 없으므로, 투자자는 본 증권신고서 제1부.III.투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 투자자 자신의 독자적이고도 세밀한 판단에 의해야 합니다. 따라서 본 공시서류에 기재된 사항은 투자 판단 시 참고 자료로 활용하실 것을 권고 드리며, 투자자의 투자 판단에 대한 결과는 투자자 본인에게 귀속됩니다.
4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
5) 본 증권신고서의 예정 모집가액은 확정되어 있는 것은 아니며, 청약일 3거래일 전에 확정 발행가액을 산정함으로써 확정될 예정입니다. 또한, 본 증권신고서의 발행예정금액은 추후 주당 발행가액이 확정되는 내용에 따라 변경될 수 있음을 유의하여 주시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
|---|---|---|---|
| 대표주관회사 | 엘에스증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(40.00%) |
주관수수료: 최종모집금액의 0.5% * 50% 기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
| 공동주관회사 | 한양증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(40.00%) |
주관수수료: 최종모집금액의 0.5% * 50% 기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
| 인수회사 | SK증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(20.00%) |
기본인수수수료: 최종모집금액의 1.8% * 20% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
| 주1) 최종 실권주 : 구주주청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 주2) 최종모집금액 : 최종 발행가액 X 총 발행주식수 주3) 상기 일반공모를 거친 후에도 미청약된 잔여주식에 대하여는 대표주관회사, 공동주관회사 및 인수회사가 인수계약서 상 인수의무주식수를 한도로 하여 각각 인수의무주식수만큼 자기 책임 하에 인수하기로 합니다. |
II. 증권의 주요 권리내용
당사가 금번 주주배정후 실권주 일반공모 유상증자를 통하여 발행할 증권은 기명식 보통주이며, 동 증권의 주요 권리내용은 다음과 같습니다.
1. 주식에 관한 사항
|
제5조 (회사가 발생할 주식의 총수) 회사가 발행할 주식의 총수는 일억(100,000,000)주로 한다. 제6조 (일주의 금액) 회사가 발행하는 주식 1주의 금액은 오백원(₩500)으로 한다. 제7조 (회사 설립 시에 발행하는 주식의 총수) 회사 설립 시에 발행하는 주식의 총수는 사만(40,000)주(일주의 금액 오천원 기준)로 한다. 제8조의2 (주식 등의 전자등록) 회사는 「주식·사채 등의 전자등록에 관한 법률」 제2조 제1호에 따른 주식 등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식 등을 전자 등록하여야 한다. 다만, 회사가 법령에 따른 등록 의무를 부담하지 않는 주식 등의 경우에는 그러하지 아니할 수 있다. 제9조 (주식의 종류) 1) 회사가 발행할 주식은 기명식 보통주식과 기명식 종류주식으로 한다. 2) 회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다. 제14조 (명의개서대리인) 1) 회사는 주식의 명의개서대리인을 둔다. 2) 명의개서대리인 및 그 사무취급장소와 대행업무의 범위는 이사회의 결의로 정한다. 3) 회사는 주주명부 또는그 복본을 명의개서대리인의 사무취급장소에 비치하고, 주식의 전자등록, 주주명부의 관리, 기타 주식에 관한 사무는 명의개서대리인으로 하여금 취급하게 한다. 4) 제3항의 사무취급에 관한 절차는 명의개서대리인의 증권명의개서대행 업무규정에 따른다. 제15조의2 (전자주주명부) 1) 회사는 상법 제352조의2에 따라 전자문서로 주주명부를 작성할 수 있다. 2) 회사는 전자등록기관으로부터 소유자명세를 통지 받은 경우 통지 받은 사항과 통지 연월일을 기재하여 주주명부를 작성?비치하여야 한다. 3) 회사는 5% 이상 지분을 보유한 주주(특수관계인 등을 포함한다)의 현황에 변경이 있는 등 필요한 경우에 전자등록기관에 소유자명세의 작성을 요청할 수 있다. 제16조 (주주명부의 폐쇄 및 기준일) 1) 회사는 매년 1월 1일부터 1월 15일까지 주주의 권리에 관한 주주명부의 기재사항 변경을 정지한다. 2) 회사는 매년 12월 31일 현재 주주명부에 기재되어 있는 주주를 그 결산기에 관한 정기주주총회에서 권리를 행사할 주주로 한다. 3) 회사는 임시주주총회의 소집 기타 필요한 경우 이사회의 결의로 3개월을 경과하지 아니하는 일정한 기간을 정하여 권리에 관한 주주명부의 기재변경을 정지하거나, 이사회의 결의로 3개월내로 정한 날에 주주명부에 기재되어 있는 주주를 그 권리를 행사할 주주로 할 수 있다. 이 경우 이사회는 필요하다고 인정하는 때에는 주주명부의 기재변경 정지와 기준일의 지정을 함께 할 수 있으며, 회사는 주주명부 폐쇄기간 또는 기준일의 2주간 전에 이를 공고하여야 한다. |
2. 신주인수권에 관한 사항
|
제10조 (신주인수권) 1) 회사의 주주는 신주식을 발행함에 있어 그가 소유한 주식수에 비례하여 신주를 배정받을 권리를 가진다. 2) 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우에는 이사회의 결의로 주주 이외의 자에게 신주를 배정할 수 있다. 1. 발행 주식총수의 100분의 20의 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6의 규정에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의7의 규정에 따라 우리사주조합원에게 주식을 우선 배정하는 경우 3. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 상법 제418조 제2항의 규정에 따라 기술의 도입, 재무구조 개선, 신규영업의 진출, 연구개발, 생산/판매/자본제휴 및 사업목적의 확대 등 회사의 경영상 목적을 달성하기 위하여 그 상대방에게 신주를 발행하는 경우 4. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 외국인투자촉진법에 의한 외국인 투자가, 중소기업창업지원법에 의한 중소기업창업투자회사 또는 중소기업창업투자조합 및 신기술사업금융지원에 관한 법률에 의한 신기술사업금융회사 또는 신기술사업투자조합에 배정하는 경우 5. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 주식예탁증서(DR)를 발행하는 경우 6. 상법 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 7. 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 8. 주권을 한국거래소가 개설한 유가증권시장 또는 코스닥시장에 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 3) 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우에는 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. 4) 주주의 신주인수권 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리 방법은 이사회의 결의로 정한다. |
3. 의결권에 관한 사항
|
제29조 (주주의 의결권) 주주총회에서의 주주는 자기명의로 등록된 주식 일주마다 일개의 의결권을 가진다. 제30조 (상호주에 대한 의결권 제한) 회사, 회사와 회사의 자회사 또는 회사의 자회사가 다른 회사의 발행주식총수의 10분의 1을 초과하는 주식을 가지고 있는 경우, 그 다른 회사가 가지고 있는 이 회사의 주식은 의결권이 없다. 제31조 (의결권의 불통일행사) 1) 2 이상의 의결권을 가지고 있는 주주가 의결권의 불통일 행사를 하고자 할 때에는 회일의 3일전에 회사에 대하여 서면으로 그 뜻과 이유를 통지하여야 한다. 2) 회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 그러나 주주가 주식의 신탁을 인수하였거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니하다. 제32조 (의결권의 대리행사) 주주는 대리인으로 하여금 그 의결권을 행사할 수 있으며, 이 경우 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 주주총회에 제출하여야 한다. |
4. 배당에 관한 사항
|
제11조 (신주의 배당기산일) 회사가 유상증자, 무상증자 및 신주배당에 의하여 신주를 발행하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전영업연도말에 발행된 것으로 본다. 제57조 (이익배당) 1) 이익의 배당은 금전 또는 금전 외의 재산으로 할 수 있다. 2) 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 다른 종류의 주식으로 할 수 있다. 3) 제1항의 배당은 매 결산기 말일 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. 4) 이익배당은 주주총회의 결의로 정한다. 다만 제54조 제7항에 따라 재무제표를 이사회가 승인하는 경우 이사회 결의로 이익배당을 정한다. 5) 제1항의 배당금은 지급개시일로부터 5년 이내에 지급 청구를 하지 아니한 때에는 그 청구권을 포기한 것으로 간주하고 이를 회사의 소득으로 처리한다. |
III. 투자위험요소
| [투자자 유의사항] |
|---|
| ■ 금번 당사의 유상증자에 참여하고자 하는 투자자분들께서는 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라, 특히 아래 기재된 투자위험요소를 주의 깊게 검토한 후 이를 고려하여, 최종적인 투자 판단을 해야 합니다. ■ 만일, 아래 기재한 투자위험요소가 실제로 발생하는 경우, 당사의 사업, 재무상태, 기타 영업활동에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있음을 유의하시기 바랍니다. ■ 당사는 본 공시서류를 통하여 청약 전에 투자자께서 숙지하셔야 하는 부분에 대하여 성실히 기재하고자 노력하고 있습니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 아래 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수 없으므로, 투자자는 아래 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 투자자 자신의 독자적이고도 세밀한 판단에 의해야 합니다. 따라서 본 공시서류에 기재된 사항은 투자 판단 시 참고 자료로 활용하실 것을 권고 드리며, 투자자의 투자 판단에 대한 결과는 투자자 본인에게 귀속됩니다. ■ 2009년 02월 04일 부로 시행된 「자본시장과 금융투자업에 관한 법률」제124조에 의거 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외함)에게 적합한 투자설명서를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 안됩니다. 다만, 「자본시장과 금융투자업에 관한 법률 시행령」제132조에 의거하여 투자설명서를 받기를 거부한다는 의사를 서면으로 표시한 자는 투자설명서의 교부없이 청약이 가능합니다. ■ 본 공시서류의 기재사항이 진실 또는 정확하다는 것을 정부가 인정하거나, 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자의 책임은 전적으로 투자자에게 귀속됩니다. |
| [주요 용어의 정의] |
| 용어 | 설명 |
|---|---|
| <질환 및 증상> | |
| 간질성 폐질환 (Interstitial Lung Diseases, ILD) |
폐의 간질(폐포와 폐포 사이 공간)에 염증이나 섬유화가 발생하는 질환군 |
| 근위축성측삭경화증 (ALS, 루게릭병) | 운동신경세포가 선택적으로 사멸하여 사지 마비, 구마비, 호흡근 마비 등이 진행되는 퇴행성 신경질환 |
| 다계통위축증 (MSA, Multiple System Atrophy) |
뇌의 여러 부위가 점차 퇴화해 운동·자율신경계 기능이 저하되는 퇴행성 신경질환 |
| 루푸스 (Lupus, 전신홍반루푸스) | 자가면역질환으로, 면역체계가 자신의 조직을 공격해 피부, 관절, 신장, 뇌 등을 손상시키는 만성 질환 |
| 만능줄기세포 (iPSC, Induced Pluripotent Stem Cell) |
체세포에 특정 유전자를 도입해 배아줄기세포와 유사한 분화능을 갖게 만든 인공 줄기세포 |
| 심부전 (Heart Failure) | 심장이 충분한 혈액을 몸에 공급하지 못하는 상태 |
| 시신경척수염(NMOSD, Neuromyelitis Optica Spectrum Disorder) |
시신경과 척수에 염증이 발생하여 시력 손실과 마비를 유발하는 자가면역질환 |
| 소뇌실조증 | 소뇌 손상으로 인해 균형 유지와 운동 조절이 어려워지는 질환 |
| 유전성 소뇌실조증 (Hereditary Cerebellar Ataxia) |
특정 유전자 변이에 의해 발생하는 소뇌 기능 장애 |
| 이차성 소뇌실조증 (Secondary Cerebellar Ataxia) |
외상, 종양, 감염, 대사 이상 등 후천적 원인으로 발생하는 소뇌 기능 장애 |
| 척수소뇌변성증 (Spinocerebellar Degeneration) |
척수와 소뇌의 퇴행으로 발생하는 질환군 |
| 척수손상 (Spinal Cord Injury) | 척수 손상으로 운동·감각 기능이 부분 또는 완전히 소실 |
| 탈수초화 (Demyelination) | 신경섬유의 수초(myelin)가 손상되거나 소실되는 현상 |
| 탈수초화 억제 효과 (Anti-demyelination Effect) |
수초 손실을 막거나 회복을 촉진하는 효과 |
| 특발성 간질폐렴 (Idiopathic Interstitial Pneumonia, IIP) |
원인을 알 수 없는 간질성 폐렴 |
| 특발성 폐섬유증 (IPF, Idiopathic Pulmonary Fibrosis) |
원인을 알 수 없는 진행성 폐 섬유화 질환 |
| 횡단성 척수염 (Transverse Myelitis) | 척수 특정 부위에 염증이 발생해 마비·감각 이상·배뇨배변 장애 유발 |
| 황반변성 (Age-related Macular Degeneration, AMD) |
망막 중심부(황반)가 손상되어 시력 저하가 진행되는 안과 질환 |
| <치료제 및 의약품> | |
| 뉴로나타-알 (Neuronata-R, 렌주메스트로셀) |
줄기세포를 이용한 루게릭병 치료제의 상품명 |
| 닌테다닙 (Nintedanib) | 섬유화 성장인자 수용체 억제 → IPF 진행 억제 경구 약물 |
| 벨리무맙 (Belimumab) | BLyS 단백질 억제로 루푸스 치료 세계 최초 승인 약물 |
| 바이오시밀러 (Biosimilar) | 특허 만료 바이오의약품과 유사한 품질·효능·안전성의 복제약 |
| 조직공학제제 (Tissue-engineered Product) | 세포·생체재료로 손상 조직/장기 대체·재생 의약품 |
| 스테로이드 (Steroid) | 염증 억제와 면역 조절 호르몬제 |
| 신약 후보물질 (Drug Candidate) | 의약품 개발 가능성이 높은 전임상·임상 후보 물질 |
| 신속 승인 (Accelerated Approval) | 임상 완료 전 조건부 신약 허가 제도 |
| 신약신청서 (NDA, New Drug Application) | FDA에 제출하는 신약 허가 신청 문서 |
| 시험군 (Test Group) | 실제 치료제를 투여받는 환자 그룹 |
| RNA 표적 치료제 (RNA-targeted Therapy) | RNA 조절·변형을 통한 질병 원인 차단 치료제 |
| 유효물질 (Hit Compound) | 약리 효과가 있는 것으로 선별된 초기 물질 |
| 제대 줄기세포 | 탯줄에서 채취한 줄기세포, 재생·면역조절 기능 보유 |
| 조혈모세포 이식술 | 혈액세포 생성 세포를 이식해 면역체계 재구성 |
| 줄기세포치료제 | 줄기세포 이용 조직/장기 회복 치료제 |
| 중간엽줄기세포 (MSC) | 면역 조절·재생 능력 가진 성체 줄기세포 |
| 치료제 안전성 평가 | 인체 부작용·유해성 검증 과정 |
| 피르페니돈 (Pirfenidone) | 섬유화 억제·항염증 작용으로 IPF 진행 억제 |
| 플레어 (Flare) | 질환이 일시적 악화 상태 |
| 표준치료요법 (Standard Therapy) | 의학적으로 권장되는 표준 치료방법 |
| B세포 표적 항체 | B세포를 선택적으로 억제하는 단백질 치료제 |
| T세포 표적 치료 | T세포를 선택적으로 조절하는 면역치료 |
| <검사 및 측정지표> | |
| 1차 유효성 평가변수 | 임상에서 약물 효과를 판단하는 핵심 지표 |
| 2차 유효성 평가변수 | 보조적 효과 평가 지표 |
| 95% 신뢰구간 (CI) | 실제 값이 포함될 가능성 95% 범위 |
| ALSAQ-40 | 루게릭병 환자 삶의 질 평가 설문(40문항) |
| ALSFRS-R | 루게릭병 환자 신체 기능 저하 평가 척도 |
| CAFS | 기능 점수+생존기간 결합 종합 평가 지표 |
| EQ-5D-5L | 삶의 질 5개 영역·5단계 평가 도구 |
| HHD | 근력 정량 측정 휴대 장치 |
| Joint Rank Score | 기능 점수+생존 기간 통합 비교 방법 |
| LS Mean difference | 공변량 보정 평균 차이 |
| LS 평균값 | 공변량 보정 통계 평균 |
| NfL | 신경세포 손상 시 방출되는 단백질(바이오마커) |
| p값 | 통계적 우연 확률 값 |
| SVC | 느린 호기 폐활량 |
| Time to Death | 사망까지의 기간 |
| Time to first event | 첫 부정적 사건까지의 기간 |
| <임상시험 및 연구용어> | |
| 1상 임상시험 | 초기 안전성·내약성 평가 |
| 2상 임상시험 | 유효성·안전성 평가 (2a·2b 세부) |
| 3상 임상시험 | 대규모 최종 검증 단계 |
| 4상 임상시험 (PMS) | 시판 후 장기 조사 단계 |
| ANCOVA | 공분산 분석 통계법 |
| CSR | 임상 최종 보고서 |
| IND | 임상시험계획 승인 절차 |
| MAD | 반복·점증 용량 시험 |
| Non-GLP 시험 | GLP 필수 아님, 대학·해외 CRO 활용 |
| Parallel Design | 군 간 다른 처치 유지 설계 |
| PMS | 시판 후 안전성·부작용 장기 조사 |
| SAD | 단회 용량 시험 |
| Slow Progressor | 진행이 느린 환자군 |
| 연구자 임상시험 | 연구자가 주도하는 임상시험 |
| 예측 표지자 | 반응 예측 생물지표 |
| 위약 대조군 | 치료제 대신 위약·표준치료 받는 그룹 |
| 임상시험 | 사람 대상 안전성·효과 검증 시험 |
| 전 임상시험 | 동물 대상 비임상 안전·효과 검증 |
| 관찰연구 | 장기간 추적 관찰 연구 |
| 허가 범위 조정 | 승인 적응증 변경 절차 |
| 독성평가 | 독성 정도 확인 과정 |
| 안전성 평가 | 부작용·유해성 검토 |
| 유효성 평가 | 의약품 치료 효과 검증 |
| <세포/단백질/생체물질> | |
| α-시누클레인 | 비정상 응집 시 신경세포 손상 유발 단백질 |
| anti-Aquaporin-4 항체 | NMOSD 환자에서 발견, 수분 통로 단백질 공격 |
| BDNF | 신경세포 생존·시냅스 가소성 촉진 |
| Foxp3 | 조절성 T세포 분화·기능 유지 전사인자 |
| IGF | 세포 성장·생존 촉진 인자 |
| IL-1β | 염증 반응·발열 촉진 사이토카인 |
| IL-4 | 항염증·B세포 활성화 사이토카인 |
| IL-10 | 강력한 항염증 사이토카인 |
| Macrophage | 병원체 포식·염증 조절 면역세포 |
| M1 type 대식세포 | 염증 반응에 특화 |
| M2 type 대식세포 | 조직 재생·섬유화 촉진 |
| M2 표현형 | 항염증·재생 대식세포 아형 |
| MicroRNA | 유전자 발현 조절 RNA |
| NfL | 신경손상 바이오마커 |
| Purkinje cell | 소뇌 운동 조절 핵심 신경세포 |
| TDP-43 단백질 | 비정상 축적 시 ALS 원인 단백질 |
| TGF-β1 | 염증 억제·조직 재생 조절 인자 |
| TNF-α | 염증·세포사멸 유도 인자 |
| VEGF | 혈관 형성 촉진 성장인자 |
| β-아밀로이드 | 알츠하이머 원인 단백질 |
| 골수 줄기세포 | 골수 유래 줄기세포 |
| 면역복합체 | 항체-항원 결합체 |
| 면역조절인자 | 면역 균형 조절 물질 |
| 면역체계 | 병원체·비정상세포 방어 체계 |
| 미세아교세포 | 중추신경 면역세포 |
| 병리기전 | 질병 발생·진행 과정 |
| 보체 | 병원체 제거 면역 단백질군 |
| 섬유아세포 | 결합조직 세포, 섬유화 유발 가능 |
| 세포외공간 | 세포 밖 물질 이동 영역 |
| 세포외소포체 | 단백질·RNA 전달 미세입자 |
| 성장인자 | 세포 성장·분화 단백질 |
| 아스트로사이트 | 신경세포 지원·영양 공급 교세포 |
| 염증성 단백질 | 염증 유지 유발 단백질 |
| 자가항원 | 자기 조직 항원 |
| 자가항체 | 자가항원 공격 항체 |
| 조절성 T세포 | 면역 억제·균형 유지 특수 T세포 |
| 질환동물모델 | 질환 재현 동물모델 |
| 케모카인 | 면역세포 이동 유도 단백질 |
| 호흡부전 | 폐 기능 저하 상태 |
| <기타용어> | |
| GLP | 우수실험실운영기준, 안전성 자료 신뢰성 표준 |
| GLP 인증기관 | GLP 기준 충족 인증 실험기관 |
| Non-GLP 시험 | GLP 필수 아님 연구시험 |
| Risk/Benefit 평가 | 위험성과 효과 비교 판단 과정 |
| 비임상 CRO | 전임상 연구 위탁 수행 기관 |
| 시판후안전성조사 (PMS) | 시판 후 장기 안전·효과 조사 |
| 우선심사 (Fast Track) | FDA 신속 개발·심사 지원 제도 |
| 적응증 | 약물이 사용될 수 있는 질환·증상 |
| EfficHigh 기술 | 중간엽줄기세포 성장·면역조절 인자 극대화 기술 |
| 출처) | 당사 제시 |
1. 사업위험
|
[가. 국내외 경기 침체 및 불확실성 관련 위험]
|
(1) 글로벌 경기 동향
국제통화기금(IMF)이 2025년 7월 발표한 World Economic Outlook(세계경제전망보고서)에 따르면, 2025년 세계경제성장률 전망치는 3.0%로 발표되었습니다. 이는 지난 2025년 4월의 전망치인 2025년 2.8%와 비교 시 0.2%p 상향한 수치입니다. IMF는 세계경제의 리스크가 하방 요인에 집중되어 있다고 진단하면서, 통상정책의 전개 양상이 리스크의 향방을 결정짓는 핵심 변수라고 평가하였습니다. 하방 요인으로는 실효 관세율 상승, 관세협상 결렬 등 정책 불확실성 확대가 기업 투자와 무역투자 흐름을 위축시키며 성장세를 약화 시킬 가능성을 제시하였으며, 지정학적 긴장이 공급망과 물가에 추가 압력 으로 작용할 수 있다고 평가하였습니다. 이와 함께 미국, 프랑스 등 주요국의 높은 재정적자ㆍ국가부채로 인한 시장신뢰 악화, 장기금리 상승 등은 글로벌 금융여건 위축 요인으로 작용할 수 있음을 경고하였으나, 무역협상이 성과를 낼 경우, 정책의 예측 가능성을 높이고 투자와 생산성 향상을 촉진하며 세계경제의 상방 요인으로 작용할 수 있다고 언급하였습니다. 한편, 국제통화기금은 2025년 7월 발표한 자료에서 한국의 2025년 성장률을 0.8%로 전망하여 지난 4월 전망 대비 0.2%p 하향 조정하였습니다.
| [국제통화기금(IMF)의 주요 국가별 경제성장률 전망] |
| (단위: %, %p) |
| 구분 | 2024년 | 2025년 | 2026년 | ||||
|---|---|---|---|---|---|---|---|
| '25년 4월 | '25년 7월 | 조정폭 | '25년 4월 | '25년 7월 | 조정폭 | ||
| (A) | (B) | (B-A) | (C) | (D) | (D-C) | ||
| 세계 | 3.3 | 2.8 | 3.0 | 0.2 | 3.0 | 3.1 | 0.1 |
| 선진국 | 1.8 | 1.4 | 1.5 | 0.1 | 1.5 | 1.6 | 0.1 |
| 미국 | 2.8 | 1.8 | 1.9 | 0.1 | 1.7 | 2.0 | 0.3 |
| 유로존 | 0.9 | 0.8 | 1.0 | 0.2 | 1.2 | 1.2 | 0.0 |
| 일본 | 0.2 | 0.6 | 0.7 | 0.1 | 0.6 | 0.5 | -0.1 |
| 영국 | 1.1 | 1.1 | 1.2 | 0.1 | 1.4 | 1.4 | 0.0 |
| 신흥개도국 | 4.3 | 3.7 | 4.1 | 0.4 | 3.9 | 4.0 | 0.1 |
| 중국 | 5.0 | 4.0 | 4.8 | 0.8 | 4.0 | 4.2 | 0.2 |
| 인도 | 6.5 | 6.2 | 6.4 | 0.2 | 6.3 | 6.4 | 0.1 |
| 한국 | 2.0 | 1.0 | 0.8 | -0.2 | 1.4 | 1.8 | 0.4 |
| (출처) | IMF World Economic Outlook (2025.07) |
| 주1) | 2025년, 2026년의 경제성장률은 전망치 |
한편, 2025년 6월 발표된 경제협력기구(OECD) 경제전망 자료에 따르면 OECD는 2025년 세계 경제성장률 전망치를 2024년 12월 전망치에 0.4%p 감소한 2.9%로 전망하였습니다. OECD는 2024년 미국, 중국, 신흥국 경제에서 강력한 확장이 이루어졌으나, 2025년의 경제 활동 지표는 일부 국가에서 기업과 소비자 심리가 약화됨에 따라 불확실성이 증가하였다고 평가하였습니다. 또한, 미국과 중국 간의 관세 인상과 무역 불확실성 증가는 글로벌 교역과 투자를 위축시키고 있으며, 특히 미국, 캐나다, 중국 등 주요 경제국에서 성장 둔화가 두드러질 것으로 예상했습니다. 인플레이션은 다소 완화되겠지만, 식품과 서비스 가격 상승으로 일부 국가에서는 여전히 높은 수준을 유지할 가능성이 있으며, 이에 따라 주요국 중앙은행은 신중한 통화정책을 유지할 것으로 예상하였습니다.
또한, 보호무역주의 확산과 지정학적 긴장이 주요 하방 리스크로 작용하며, 정책 측면에서는 무역장벽 완화, 재정 건전성 확보, 투자 촉진 등이 중요할 것으로 전망하였습니다. 한편, 한국의 2025년 경제 성장률은 2024년 12월 전망치였던 2.1% 대비 1.1%p 하락한 1.0%를 기록할 것으로 2025년 6월 전망하였습니다. OECD는 한국 경제 성장률 전망의 근거로 미국과의 관세 갈등 및 정치적 불확실성이 수출과 기업 투자를 위축시키고 있는 점을 언급하였으며, 하반기부터 실질임금 상승과 노동시장 개선에 따라 민간소비가 점차 회복될 것으로 전망하였습니다.
| [경제협력기구(OECD) 주요 국가별 경제성장률 전망] |
| (단위: %, %p) |
| 구 분 | 2024년 | 2025년 | 2026년 | ||||
|---|---|---|---|---|---|---|---|
| '24년 12월 | '25년 06월 | 조정폭 | '24년 12월 | '25년 06월 | 조정폭 | ||
| (A) | (B) | (B-A) | (C) | (D) | (D-C) | ||
| 세계 | 3.3 | 3.3 | 2.9 | -0.4 | 3.3 | 2.9 | -0.4 |
| G20 | 3.4 | 3.3 | 2.9 | -0.4 | 3.2 | 2.9 | -0.3 |
| 미국 | 2.8 | 2.4 | 1.6 | -0.8 | 2.1 | 1.5 | -0.6 |
| 유로존 | 0.8 | 1.3 | 1.0 | -0.3 | 1.5 | 1.2 | -0.3 |
| 일본 | 0.2 | 1.5 | 0.7 | -0.8 | 0.6 | 0.4 | -0.2 |
| 한국 | 2.1 | 2.1 | 1.0 | -1.1 | 2.1 | 2.2 | 0.1 |
| 중국 | 5.0 | 4.7 | 4.7 | 0.0 | 4.4 | 4.3 | -0.1 |
| 인도 | 6.2 | 6.9 | 6.3 | -0.6 | 6.8 | 6.4 | -0.4 |
| (출처) | OECD Economic Outlook, Report (2025.06) |
| 주1) | 2025년, 2026년의 경제성장률은 전망치 |
한편, 2025년에는 러시아-우크라이나 전쟁, 이스라엘-하마스 분쟁과 더불어 이스라엘-이란 간 충돌 등 지정학적 리스크가 복합적으로 상존하면서 글로벌 금융시장은 불안정한 양상을 보이고 있습니다. 이러한 리스크는 에너지 수급 불안, 원자재 가격 변동성을 확대시킬 수 있고, 안전자산 선호 심리를 강화시켜 달러화 강세 및 금값 상승을 유도할 수 있습니다. 또한, 글로벌 공급망 불확실성이 강화될 경우 기업 실적 및 투자심리에 부담을 주어 금융시장 내 불안정성이 확대될 가능성이 존재합니다. 투자자께서는 이 점 유의하시기 바랍니다.
(2) 국내 경기 동향
한국은행이 2025년 05월 발표한 경제전망보고서에 따르면 국내 경제성장률은 2024년 연간 2.0%를 기록하였고, 2025년 0.8% 및 2026년 1.6%로 전망하였습니다. 국내 경제는 2025년 상반기 대내외 불확실성으로 경제심리가 위축된 가운데 건설현장 사고, 기상악화, 대형산불 등 일시적 요인까지 발생하였으며, 정치적 불확실성 완화 등으로 반등하겠으나 건설경기 부진과 더딘 소비회복으로 성장세가 당초 예상을 밑돌 전망입니다. 하반기 이후에는 현재까지 진행한 금리인하와 추경의 효과와 더불어 경제심리도 회복되면서 내수가 개선될 것으로 예상하고 있습니다. 수출의 경우, 상호관세 유예, 미·중 관세협상 등으로 최근 무역긴장이 다소 완화되었으나 여전히 높은 관세율과 협상 과정의 불확실성 등으로 둔화 흐름을 나타낼 것으로 전망하였습니다. 2026년의 경우 무역전쟁의 여파로 통상환경 악화의 영향이 이어지겠으나 국내 내수를 중심으로 1.6% 성장할 것으로 전망하였습니다.
| [국내 주요 거시경제지표 전망] |
| (단위: %) |
| 구분 | 2024년 | 2025년(E) | 2026년(E) | ||||
| 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | ||
| GDP | 2.0 | 0.1 | 1.4 | 0.8 | 2.0 | 1.3 | 1.6 |
| 민간소비 | 1.1 | 0.8 | 1.4 | 1.1 | 1.8 | 1.3 | 1.6 |
| 건설투자 | -3.0 | -11.3 | -1.1 | -6.1 | 4.9 | 0.9 | 2.8 |
| 설비투자 | 1.6 | 4.9 | -1.0 | 1.8 | 1.0 | 0.9 | 1.0 |
| 지식재산생산물 투자 | 0.7 | 1.4 | 4.8 | 3.2 | 3.7 | 1.4 | 2.5 |
| 재화수출 | 6.3 | -0.1 | 0.0 | -0.1 | 0.6 | 0.8 | 0.7 |
| 재화수입 | 1.2 | 0.8 | -0.3 | 0.2 | 1.8 | 1.3 | 1.5 |
| (출처) 한국은행 경제전망보고서(2025.05) |
민간소비의 경우 심리위축 등으로 부진한 흐름을 보이고 있으나, 2025년 2분기 이후에는 정치 불확실성이 줄어들고 금융요건 완화 영향이 나타나면서 회복될 것으로 예상하였습니다. 가계소득 개선에도 국내외 불확실성 등으로 심리가 위축됨에 따라 부진한 흐름을 보였으나 2025년 5월 이후 외식, 여가 등을 중심으로 개선 조짐을 나타내고 있어 향후 민간소비는 심리가 회복되고 가계소득 개선 및 금리인하 효과가 나타나면서 점차 나아질 것으로 예상하였습니다.
건설투자는 그간 누적된 착공 위축의 여파가 지속되고 대내 불확실성 확대로 인한 분양실적 급감, 작업일수 축소안전관리 강화 등의 영향도 가세함에 따라 예상보다 크게 위축되었습니다. 2025년 하반기로 갈수록 금융여건 완화, 심리개선 및 추경으로 부진이 점차 완화되겠으나, 누적된 지방 주택미분양, 상업용 부동산의 만성적 공실 등의 하방요인으로 개선세는 더딜 것으로 전망하였습니다.
설비투자는 높은 불확실성에 따른 기업의 투자 지연 등으로 하방압력이 증대되면서 기계류를 중심으로 감소하였습니다. 2025년 중 설비투자 흐름을 살펴보면, 기계류는 반도체 기업의 첨단공정 투자가 지속되겠으나 비IT 부문의 부진이 심화되며 증가세가 당초 예상을 하회할 것으로 전망하였습니다. 운송장비의 경우, 상반기중 개소세 인하 효과 등으로 법인차 중심의 성장세를 보이다가 2025년 하반기부터는 점차 둔화될 것으로 전망하였습니다.
지식재산생산물 투자의 경우 2025년 상반기 주요 기업의 R&D 투자가 양호한 흐름을 지속하였으나, 소프트웨어 등에 대한 투자가 둔화됨에 따라 완만한 성장을 보였습니다. 향후 기업들의 기술경쟁력 강화 노력, 정부의 첨단 산업 AI 등 투자 촉진 및 연구개발 예산 본격 집행에 힘입어 성장세가 다시 확대될 것으로 예상하였습니다. 그러나 높아진 대외 불확실성을 향후 기업의 투자에 하방리스크 요인으로 작용할 것으로 전망하였습니다.
당사는 줄기세포기술을 기반으로 희귀ㆍ난치성질환에 대한 새로운 줄기세포 치료제의 개발, 생산 및 판매, 비임상실험대행 및 효력, 효능분석 용역의 제공 등을 주요 사업으로 영위하고 있으며, 고금리, 고환율, 저성장 등에 따른 글로벌 경기침체로 인해 제약ㆍ바이오 관련 산업에 대한 투자가 위축되거나 실적이 악화될 수 있습니다. 또한, 현재 금융시장의 불안요인이 완전히 해소되지 않은 상황에서, 신용 스프레드 상승 등이 당사 재무 상황에 추가적인 위험요인으로 작용할 위험이 있습니다. 이러한 거시경제의 불확실성은 국내외 경기 전반에 영향을 미칠 수 있으며, 당사가 영위하는 사업 및 실적에도 부정적인 요인으로 작용할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
|
[나. 임상시험 실패에 따른 위험] 또한 식약처의 변경 허가는 저속진행군이라는 특정 타겟군을 설정하여 변경 허가 신청을 완료하고, 보완 요구를 받은 상황입니다. 식약처와의 협의를 통해 추후 예정된 식약처의 현장실사(GCP) 일정을 먼저 진행하여 해당 현장실사 및 미팅 이후 보완 요구에 대한 자료 제출을 진행하는 일정으로 계획하였으나, 보완 자료 제출 기한이 연기되면서 GCP 일정 역시 연기된 상황입니다. 반면 FDA 품목허가 신청의 경우, 국내 식약처와는 다르게 특정 타겟군을 설정하지 않고 임상 3상 결과, 유의미한 데이터를 보인 여러 바이오마커(바이오젠의 토퍼슨의 승인 근거로 인정받은 NfL 바이오마커 포함)를 기반으로 사전협의 및 품목허가 신청을 진행할 예정입니다. 단, 이는 현재 당사의 판단에 의한 것이며, 추후 임상수탁기관 및 FDA와의 사전 미팅, 품목허가 신청 전 미팅 등에서 논의한 사항 및 피드백 등을 바탕으로 품목허가 신청의 전략이 변경될 수 있습니다. 결론적으로 당사는 국내 식약처와 미국 FDA 품목허가 절차를 병행하되 각각 독립적으로 운영하고 있습니다. 즉, 국내에서는 식약처 허가 안정성과 신뢰성을 확보하고, 미국에서는 바이오마커 기반 전략으로 글로벌 진입을 준비하는 투트랙 접근을 실행하고 있습니다. 또한 당사의 계획대로 전체 루게릭병 환자를 대상으로 진행한 FDA 품목허가가 2027년 상반기에 승인이 된다면 2022년 9월 FDA 가속승인(조건부 판매허가)를 받아 2024년 확증임상 실패로 시장에서 퇴출되었던 아밀리스의 렐리브리오가 약 14개월동안 4억 301만불(한화로 약 5,506억원) 매출이 발생한 점을 기반으로 유사한 수준의 매출이 2027년 하반기부터 발생할 것으로 기대하고 있습니다. 하지만 이는 당사의 전망치이며, 이미 임상 3상의 통계적 유의성을 확보하지 못한 점, 여러 바이오마커 기반으로 품목허가를 신청했으나 일부 또는 전부 승인받지 못하거나, 일부 바이오마커 기반으로 FDA 품목허가를 승인 받더라도 전체 루게릭병 환자 대상이 아닌 크게 축소된 타겟군 대상으로 진행될 수 있는 등 뉴로나타-알 파이프라인의 실적은 불확실한 상황입니다. 이처럼 당사의 핵심 파이프라인인 뉴로나타-알의 FDA 품목허가가 불발되거나, 승인을 받더라도 당사의 기대치만큼 매출이 발생하지 못한다면 당사의 사업에 매우 중대한 악영향을 미치게 되어 계속기업가정의 불확실성이 증대될 수 있습니다.
|
신약(New Drug)은 기존 약물에 모방이나 개량 합성에 의한 것이 아닌, 기존약물의 부작용과 현저한 기능 개선이 포함되어야 하며, 화학합성, 미생물·배양조직세포로부터 유전자재조합을 이용한 생산, 천연물 추출 등의 신물질 탐색 작업, 비임상시험, 임상시험 등을 거쳐 제조 승인을 받은 의약품 입니다. 신약개발 사업은 사업화에 성공시 통상적으로 특허권에 의해 일정기간 동안 독점권으로 보호받게 되며, 시판 승인 후 일정기간 동안 독점 판매기간을 인정받을 수도 있습니다. 대부분의 국가에서 특허 존속기간은 출원 후 20년이며, 특허의 존속기간과 관계없이 신약의 경우, 미국은 시판 승인 후 5년 이상의 시장독점권, EU는 10년의 시장독점권, 국내는 6년의 시장독점권을 보장받을 수 있습니다. 이처럼 특허권 및 독점판매권(시장독점권)을 통해 일정기간 배타적 수익을 보장받을 수 있기 때문에 글로벌 블록버스터급 신약 개발에 성공 시 막대한 수익을 창출할 수 있는 고부가가치 사업입니다.
신약 개발의 완료까지는 통상적으로 10년 이상의 긴 시간이 소요되며, 이 과정에서 임상시험을 통한 약물의 효능과 안전성을 충분히 입증해야 합니다. 약사법 시행규칙에 따르면, '임상시험(Clinical Trial/Study)'은 의약품의 안전성과 유효성을 증명하기 위하여 사람을 대상으로 해당 약물의 약동ㆍ약력ㆍ약리ㆍ임상적 효과를 확인하고 이상반응을 조사하는 시험을 의미합니다.
그러나, 신약 개발 과정은 후보물질의 유효성과 안전성을 평가하고 이에 대한 근거를 마련하기 위한 중요한 과정으로 관련 규정과 절차를 반드시 준수해야합니다. 먼저, 타겟 질환에 대해 약리적인 효과가 있을 것으로 예상되는 후보물질 탐색 및 발굴을 시작으로, 동물을 대상으로 하는 전임상 연구(preclinical study)와 사람을 대상으로 하는 임상 연구(clinical study)를 통해 후보물질의 안전성과 유효성에 대한 자료를 분석하여, 최종적으로는 규제 당국으로부터 자료의 적합성 심사를 통해 의약품 품목 허가를 받아야 합니다. 또한, 제품이 안전하고 일정한 품질 수준을 유지한 채 생산되어야 하기에 공정개발 및 검증이 동시에 성공적으로 진행되어야 합니다.
임상시험은 시판 허가 전의 3단계(1상, 2상, 3상)와 시판 후 임상시험(PMS)을 포함하여 총 4단계로 구분합니다. 이전단계의 연구에서 위험(독성) 대비 이익(유효성)이 충분하다고 판단될 때 다음 단계 임상시험의 진입을 결정하게 되며, 약사법에 따라 적합한 임상시험계획승인(IND; Investigational New Drug) 신청 자료를 마련하여 규제기관의 심사를 받게 됩니다. 규제기관은 위험 대비 이익이 허용 가능하다고 판단되면 임상시험 승인을 해주며, 개발사는 승인된 계획서와 의약품임상시험관리규정을 준수하여 임상시험을 실시하게 됩니다. 임상시험계획서에서 설정한 가설을 임상시험을 통해 입증했을 때 임상시험이 성공한 것이며, 각 임상단계에서의 부작용 발생 등 예상치 못한 결과가 발생하거나 가설을 입증하지 못하면 임상시험에 실패하게 됩니다.
한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이 과정에서는 신약의 효능이나 작용기전을 기반으로 신약개발 대상물질을 선정합니다. 유효물질(hit compound), 선도물질(lead compound)을 거쳐 신약 후보물질이 선정되면 후보물질의 안정성과 효과를 확인하기 위해 동물 모델을 대상으로 전임상시험(pre-clinical trial)을 진행합니다. 전임상시험을 통해 후보물질의 효과와 안전성을 검증하면 허가기관에 임상시험 허가신청(IND : Investigational New Drug Application)을 하는 등 일반인 또는 환자를 대상으로 하는 임상시험에 앞서 효능 및 안전성과 관련하여 임상시험 이전 단계부터 엄격한 규제에 의해 축적된 다양한 데이터를 각 국가의 규제 당국에 제출하여야 합니다.
이후 임상단계에서는 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 임상 1상은 주로 약물의 효과는 평가하지 않고 안전성에 주로 초점을 맞추기 때문에 대부분 성공률이 높습니다. 임상 2상은 인체(환자)를 대상으로 부작용 뿐 아니라 약효를 테스트하는 첫 번째 관문이기 때문에 성공률이 제일 낮을 수밖에 없습니다. 임상 3상은 임상 2상과 같이 환자를 대상으로 약효와 부작용을 보는 단계이지만, 환자 수가 훨씬 크고 약의 dose(복용량)를 결정하는 단계입니다.
| [임상시험 구분] |
| 구분 | 목적 | 내용 |
| Phase 1 (1상) |
ㆍ안전성 검토 ㆍ내약성 평가 ㆍPK/PD 정의/서술 ㆍ치료효과 추정 |
ㆍ용량-내약성 임상시험 ㆍ안전용량 범위와 부작용 확인 ㆍ체내 약물 동태 검토 ㆍ1a: SAD, 1b: MAD |
| Phase 2 (2상) |
ㆍ단기 유효성/안전성 검토 ㆍ목표 적응증에 대한 탐구 ㆍ후속 시험을 위한 용량 추정 ㆍ치료확증 시험을 위한 시험설계, 평가항목, 평가방법에 대한 근거 제공 |
ㆍ용량-반응 탐색 임상시험 ㆍ소수의 환자에서의 비교적 단기간에 걸친 초기 임상시험 ㆍ2a: 약효확인, 유효용량 검토 ㆍ2b: 약효입증, 유효용량 확인, 유효성 및 안전성의 균형 검토 |
| Phase 3 (3상) |
ㆍ안전성, 유효성 재확인 ㆍ임상적용을 위한 Risk/Benefit의 상대평가 근거제공 ㆍ용량과 반응에 대한 관계 확립 ㆍ효과에 대한 검증 |
ㆍ무작위 배정에 의한 용량-반응 임상시험 ㆍ유효성 확립을 위한 적절하고 잘 통제된 임상시험 ㆍ이환율/사망률을 위한 임상시험 ㆍ충분한 환자에서 유효성 및 안전성 확립 ㆍ대조군을 이용한 비교 임상시험 ㆍ대규모 임상시험 |
| Phase 4 (4상, PMS) |
ㆍ시판 후 안전성 조사 및 추가 임상시험 ㆍ일반 또는 특정 대상군/환경에서 Risk/Benefit에 대한 이해 ㆍ흔하지 않은 이상반응 확인 ㆍ추천되는 용량을 확인 ㆍ모든 시험 디자인이 가능 |
ㆍ장기투여시 부작용 검토 ㆍ안전성 재확립 ㆍ새로운 적응증 등 탐색 연구 ㆍ대조군을 이용한 유효성 임상시험 ㆍ이환율/사망률에 대한 임상시험 ㆍ부가적인 평가 항목에 대한 임상시험 ㆍ약물경제학적 측면의 임상시험 |
| 주1) 약물의 농도-반응 관계를 PK/PD라고 합니다. PK(Pharmacokinetics 약동학)는 약물의 흡수, 분포, 생체 내 변화 및 배설을 연구합니다. PD(Pharmacodynamics 약력학)는 생체에 대한 약물의 생리학적 및 생화학적 작용과 그 작용 기전, 즉 약물이 일으키는 생체의 반응을 주로 연구합니다. |
| 주2) SAD(단회용량상승, single ascending dose) : 단회용량을 투여한 후 안전성과 내약성을 확인합니다. |
| 주3) MAD(다중용량 상승, multiple ascending dose) : 반복 투여를 통해 더 높은 용량으로 증량해가면서 최대 내약 용량을 확인합니다. |
임상시험을 마친 후에는 식약처에 임상시험 결과를 제출하게 되는데, 이를 신약허가신청이라고 합니다. 신약허가신청 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 관리 규정을 따라야 하며, 제4상 임상시험으로 분류되는 시판후안전성조사(PMS : Post-Market Surveillance)를 통해 임상시험에서 발견하기 어려웠던 부작용에 대해서 추적 조사를 수행합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공확률이 매우 낮은, 대표적인 High Risk, High Return, Long Term Investment 사업입니다.
| [신약 개발 과정] |
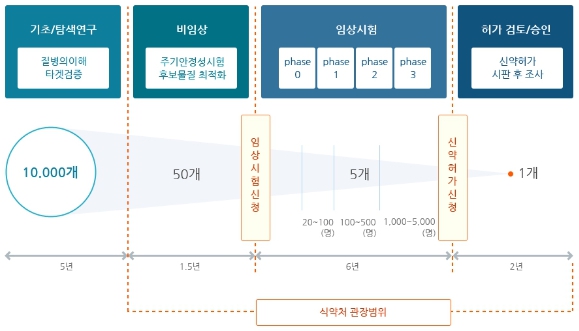 |
|
신약개발과정 |
| (출처) 의약품안전나라 의약품통합정보시스템 |
신약개발 과정에 소요되는 기간 및 비용 분석에 관하여 분석기관마다 편차는 있으나, 일반적으로 신약후보물질이 초기 연구 및 임상시험을 거쳐 출시되기까지 보통 10~15년 정도가 소요되는 것으로 알려져 있습니다. 또한 Evaluate Pharma의 World Preview 2024에 따르면 전 세계 제약 R&D 비용은 2016년 1,610억달러에서 꾸준히 상승하여 2024년 3,060억달러, 2030년에는 3,660억달러가 소요될 것으로 예상하였습니다.
| [전 세계 제약 R&D 비용 추이] |
 |
|
세계 의약품 시장 연구개발 비용 |
| (출처) World Preview 2024, Evaluate Pharma(2024.07) |
이러한 시간적, 재정적 막대한 투자에도 불구하고, 신약개발의 최종 성공률은 다소 낮은 수준입니다. IQVIA Institute(2024) 보고서에 따르면, 2010년부터 2023년까지 FDA 임상 파이프라인을 대상으로 조사된 임상의 성공률은 평균 7.6%로 나타났습니다.
| [연도별 임상 단계별 이행성공률 및 임상 성공률 추이(2010~2023, FDA)] |
 |
|
임상단계별 이행 성공율 및 임상성공율 |
| (출처) Global Trends in R&D 2024, IQVIA Institute(2024.02) |
줄기세포치료제 개발 또한 일반 신약개발과 동일하게 후보물질의 발굴에서부터 품목 허가 및 제품 출시까지 통상적으로 10년 이상의 긴 시간이 소요되며, 개발 과정에서 임상시험을 통하여 약물의 효능과 안정성을 충분히 입증하여야 하고, 임상시험 진행 중 심각한 부작용 등이 보고되는 경우에는 진행 중인 임상시험이 중단되거나 임상시험 개시승인이 철회될 수 있습니다.
당사는 2014년 세계 최초로 루게릭병 줄기세포치료제를 개발하여 한국식품의약품안전처의 승인을 받아 2015년 2월부터 상업판매를 개시하였습니다. 또한, 여타 다른 희귀ㆍ난치성 질환 등에 대한 줄기세포치료제들을 신규로 개발하고 있으며, 세포외소포체를 활용한 차세대 줄기세포치료제에 대한 기초연구 및 개발을 진행하고 있습니다. 당사의 보유 파이프라인과 그 현황은 하기와 같습니다.
| [주요 파이프라인 진행현황] |
| 구 분 | 품 목 | 적응증 |
연구 시작일 |
현재 진행단계 |
연구 중단일 |
비 고 | ||
| 단계(국가) | 승인일 | |||||||
| 바이오 |
중간엽 줄기세포 치료제 |
뉴로나타 -알® |
근위축성 측삭경화증 |
2004년 |
품목 허가(한국) 임상 3상(한국) 임상 1상(한국) |
2014년 2020년 2024년 |
- |
조건부 품목허가 MFDS, FDA 임상 3상 실시 현탁화제 변경을 위한 임상 1상 완료 |
| CE211AT15 | 루푸스 | 2012년 |
임상 1상(한국) 연구자임상(한국) |
2015년 2018년 |
- | 1상 임상시험, 연구자임상시험 종료 공동개발 |
||
| CE111BR16 | 다계통위축증 | 2013년 | 임상 1상(한국) | 2015년 | - | 1상 임상시험 종료 | ||
| CE211BR19 | 소뇌실조증 | 2016년 | 연구자임상(한국) | 2019년 | - | 연구자임상시험 종료 | ||
| CE211NS21 | 시신경 척수염 | 2021년 | 임상 1상(한국 | 2024년 | - | 1상 임상시험 승인 | ||
| 유도만능 줄기세포 치료제 |
CE223BR17 |
파킨슨, 퇴행성신경계질환 |
2017년 | 비임상 | - | - | 비임상 | |
|
세포외 소포체 |
EV231NU20 | 특발성 폐섬유증 | 2021년 | 비임상 | - | 비임상 | ||
| (출처) 당사 정기보고서 |
당사의 각 파이프라인별 상세 현황은 다음과 같습니다.
- 품 목: 뉴로나타-알®-근위축성측삭경화증
| 구 분 | 줄기세포치료제 | |||||||||||||||||||||||||||||||||||
| 적응증 |
근위축성측삭경화증(루게릭병)에서 질환의 진행속도 완화 ㆍ루게릭병은 운동신경세포만 선택적으로 사멸하는 신경계 퇴행성 질환으로 감각신경은 유지되면서 사지 마비, 구마비 및 호흡근마비가 비가역적으로 진행되어 발병 후 2~3년내 보조 호흡상태에 이르거나 사망하는 질환. |
|||||||||||||||||||||||||||||||||||
| 작용기전 |
뉴로나타-알®이 분비하는 조절성 T세포(Treg) 분화유도 전사인자(Foxp3) 및 항염증 사이토카인(TGF-β1, IL-4, IL-10)이 병소부위의 미세 면역 환경을 개선시킴. 뉴로나타-알®이 분비하는 TNF-α 및 IL-1β를 억제하여 M2 표현형을 증가시키고, 뉴로나타-알®이 분비하는 신경보호인자(VEGF, BDNF, IGF)가 운동신경세포의 사멸을 감소시킴.
|
|||||||||||||||||||||||||||||||||||
| 제품의특성 |
ㆍ시판허가 된 최초의 신경계 질환에 대한 중간엽줄기세포 치료제이며 루게릭병에서 기능개선을 통한 효능효과로 허가된 첫 번째 치료제로, 국내에서 희귀의약품 등재 및 시판허가되어 2015년 2월부터 발매 개시하였음. ㆍ루게릭병의 병소 부위인 중추신경계는 혈관-뇌장벽에 의해 분리되어 있고 정맥 주사 등의 방법으로 병소부 위에 세포가 도달하기 어렵기 때문에 해외에서 개발되고 있는 루게릭병 줄기세포치료제들이 매우 침습적 경로(척수궁 절제 수술을 통한 척수내 세포 이식)를 사용하는데 반해, 당사는 신경과에서 손쉽게 접근할 수 있는 경로인 척수강내 주사 투여 가능한 제형과 용법으로 개발하여, 용법의 침습성을 낮추어 의사의 사용이 용이함. ㆍ기존 루게릭병에 대해 개발 실패한 물질들이 병리기전 중 단일 기전만을 대상으로 한 반면 뉴로나타-알®은 중간엽줄기세포가 분비하는 다양한 인자가 병리기전에 복합적으로 작용하여 신경세포사멸을 방지함으로써 신체기능 개선 및 질환 진행 속도 완화 효과를 나타냄. ㆍ중간엽줄기세포가분비하는성장인자, 항염증인자, 면역조절인자를 극대화하도록 설계된 당사의 EfficHigh기술로 제조되어 우수한신경 보호 작용 및 항염증매개면역조절 작용을 나타냄. 뉴로나타-알®의 2상 임상시험(n=71)에서 투여 후 4개월 및 6개월에서 ALSFRS-R 점수변화량은 시험군 -1.69점(-0.42점/월), 대조군 -4.67점(-1.17점/월)으로(p=0.0002), 뉴로나타-알® 투여군에서 기능저하를 월등히 감소시켜주는 효과를 나타냄. 뉴로나타-알®은 신체 기능의 저하를 72.9% 개선시켰으며, 81%가 시험약에 반응하였음(*ALSFRS-R 점수: 루게릭병(ALS)에서 신체기능의 악화를 측정하는 지표로, 루게릭병 환자에서 1개월에 평균 약 1점씩 떨어짐). |
|||||||||||||||||||||||||||||||||||
| 진행경과 |
ㆍ치료용 조성물 특허 보유(한국, 미국), 국내 의약품 특허목록 등재(2015.01) ㆍ연구자임상시험 완료(2009.12) ㆍ1/2상 임상시험 완료(2013.05) ㆍ희귀의약품 지정(2013.12) ㆍ의약품 품목허가(2014.07) ㆍ제품 발매 및 투여 개시(2015.02) ㆍ3상 임상시험 승인(2015.04) ㆍUS FDA 희귀의약품 지정(2018.08) ㆍ3상 임상시험계획 변경승인(2019.03) ㆍEU EMA 희귀의약품 지정(2019.03) ㆍ뉴로나타-알®; 허가 변경승인(2019.05) ㆍUS FDA Pre-IND 미팅(2019.09) ㆍUS FDA IND submission (US FDA IND 신청 2020.02) ㆍUS FDA IND approved (US FDA 3상 IND 승인 2020.07) ㆍ현탁화제 변경에 대한 1상 임상시험 승인(2022.08) ㆍ현탁화제 변경에 대한 식품의약품안전처 품목허가 변경 (2024.11) ㆍ임상 3상 임상시험 TLF 수령(2024.12) |
|||||||||||||||||||||||||||||||||||
| 향후계획 |
ㆍ 현탁화제 변경에 대한 식품의약품안전처 품목허가 변경 신청 예정 ㆍ 허가 조건에 따라3상 임상시험 실시 중. 투약 완료. 결과보고서 작성 중 ㆍ 3상 임상시험의 결과를 바탕으로 신청한 품목 허가사항 변경요청의 보완자료 작성 및 대응 ㆍ 3상 임상시험의 결과를 바탕으로 신속 승인(Accelerated Approval)을 준비 중 |
|||||||||||||||||||||||||||||||||||
| 경쟁제품 |
ㆍ근위축성측삭경화증에는 합성의약품인 리루졸(판매사: 젠자임)과 에다라본(판매사: 미쓰비시다나베)가 시판 중임. ㆍ리루졸은 2-3개월의 수명 연장 효과가 있는 반면 간독성 등 약물부작용으로 사용할 수 없는 환자 비율이 제한적. ㆍ에다라본은 투여 후 6개월간의 신체기능을 평가했을 때 제한적인 효과가 있는 것으로 확인되었으나, 이 질환에서 의미있는 치료제는 아닌 것으로 보임 ㆍ뉴로나타-알®;은 규제당국에 의해 허가된 유일한 루게릭병 줄기세포치료제이며, 가장 빠르게 추격하고 있는 제품은 미국의 Brainstorm사가 개발 중인 유사 제제(자가골수유래 줄기세포)가 미국에서 3상 임상을 진행하였으나, 1차 및 2차 효능평가 변수에서 통계적으로 유의미한 결과에 도달하지 못해 실패함. |
|||||||||||||||||||||||||||||||||||
| 관련논문등 |
ㆍKim HY, Paek J, Par HK, Choi MR, Yoon HS, Kim KS, et al. Efficacy and Safety of Autologous Bone Marro w-derived Mesenchymal Stem Cell Treatment in Patients With Amyotrophic Lateral Sclerosis. J Korean Neu rol Assoc. 2009;27(2):163-169. ㆍSH Kim, Phase I Trial of Repeated Intrathecal Autologous Bone Marrow-Derived Mesenchymal Stromal Cell s in Amyotrophic Lateral Sclerosis, STEM CELLS TRANSLATIONALMEDICINE 2015;4:1?8 ㆍSH Kim, Biological markers of Mesenchymal Stromal Cells as Predictors of response to Autologous Stem Cell Transplantation in Patients with Amyotrophic Lateral Sclerosis; an Investigator?Initiated Trial and In Viv o Study, STEM CELLS 2014, ㆍSH Kim, Phase I/II trials of autologous BM derived stem cell therapy in ALS, Clinical Neurology 2016 56 Su pplement 1(S228), Embase ㆍSH Kim, A PHASE 2 STUDY FOR SAFETY AND EFFICACY EVALUATION OF TREATMENT OF AMYOTROPH IC LATERAL SCLEROSIS USING AUTOLOGOUS BONE-MARROWDERIVED STROMAL CELL; Amyotrophi c Lateral Sclerosis and Frontotemporal Degeneration, 2015; 16(Suppl. S1): 1?62 ㆍSH Kim, Immune-inflammatory modulation as a therapeutic strategy of stem cell therapy in ALS; Clinical Ev aluation Vol.44, No. 3, Dec.2016 ㆍOh Ki Wook, Repeated Intrathecal Autologous Mesenchymal Stem Cells for Amyotrophic Lateral Sclerosis; Annals of Neurology, epub, 26 July 2018. ㆍNam, Jae-Yong et al. “Efficacy and safety of Lenzumestrocel (Neuronata-R® inj.) in patients with amyotrophic lateral sclerosis (ALSUMMIT study): study protocol for a multicentre, randomized, double-blind, parallel-group, sham procedure-controlled, phase III trial.” Trials vol. 23,1 415. 18 May. 2022, doi:10.1186/s13063-022-06327-4 ㆍNam, Jae-Yong et al. “Long-term survival benefits of intrathecal autologous bone marrow-derived mesenchymal stem cells (Neuronata-R®: lenzumestrocel) treatment in ALS: Propensity-score-matched control, surveillance study.” Frontiers in aging neuroscience vol. 15 1148444. 12 Apr. 2023, doi:10.3389/fnagi.2023.1148444 |
|||||||||||||||||||||||||||||||||||
| 시장규모 |
글로벌 시장조사와 경영 컨설팅을 제공하는 세계적 리서치 기업인 IMARC GROUP에서 2025년 발표한 자료에 따르면 근위축성측삭경화증 질환의 전체 시장 규모는 2024년 약 787백만 달러 규모에서 2033년 약 1,135백만 달러까지 성장할 것으로 예측하였음.
|
|||||||||||||||||||||||||||||||||||
| 기타사항 |
뉴로나타-알주는 개발단계에서 정부의 R&D 지원을 받아 개발함
|
|||||||||||||||||||||||||||||||||||
- 품 목: CE211AT15
| 구 분 | 중간엽 줄기세포치료제 | ||
| 적응증 |
ㆍ적응증: 루푸스, 루푸스신염 ㆍ루푸스(systemic lupus erythematosus, SLE)는 만성 전신성 자가면역질환으로 정확한 발병원인을 모르며 환자의 면역체계가 이물질(외부항원)과 자기 몸의 세포나 조직의 항원과 다르다는 것을 구별하지 못하게 되어, 면역체계는 자신의 세포로부터 유래된 항원을 공격하는 항체(자가항체)를 만들고, 자가항체가 자기 항원과 결합하여 면역복합체를 형성함. 이 면역복합체는 조직 안에 축적되어 염증을 일으키고 조직 손상 및 통증을 유발하게 되며, 면역복합체가 신장, 뇌, 폐 및 신장 등 주요장기 침범 시 발생하는 합병증은 증세가 심각하며 사망률이 높아짐 ㆍ가임기 여성에게 빈발하여 경제활동을 어렵게 하고 합병증 발생 시 치명적인 수 있으나, 평생 계속해서 재발하며 완치가 어려운 만성질환임 |
||
| 작용기전 |
중간엽줄기세포는 면역세포 조절작용을 통해 자가면역질환에서 과도하게 활성화된 면역반응과 염증작용을조절함으로써 관해 유도 및 유지
|
||
| 제품의특성 |
ㆍ당사의 EfficHigh 기술로 제조된 CE211AT15은 반수체 일치 혈연의 골수유래 MSC로 면역거부반응의 위험이 없으며, 면역조절과 관련된 단백질(TGF-β1 등) 분비능이 매우 우수하여 면역세포 증식 억제 효과, 염증물질 생성 억제, T세포 및 B 세포 증식 억제, T세포 분비 cytokine 발현 억제 작용을 통해 자가면역질환에 의해 과도하게 활성화된 면역반응을 조절하고 염증반응을 억제하여 루푸스에서 관해를 유도하고 재발을 방지할 것으로 기대됨 ㆍ정맥주사 하는 제품으로 기존의 줄기세포치료제들이 시술을 동반하였던 것에 비해 투여 방법이 매우 용이함 ㆍ루푸스 신염 환자를 대상으로 안전성 및 내약성 평가를 위한 1상 임상연구 완료 ㆍ줄기세포치료제의 치료효과에 대한 개인맞춤형 효능 증진을 위한 바이오마커 발굴 및 실용화 연구 중 |
||
| 진행경과 |
ㆍ치료용 조성물 특허 출원(2013.07) ㆍ국내 1상 임상시험 승인(2015.05) ㆍ코아스템과 한림제약간 루푸스 치료제 기술이전 및 공동연구개발 계약 체결(2016.07) ㆍ임상시험용 의약품 투여 개시(2017.09) ㆍ임상 1상 임상시험 투약완료(2019.02) ㆍ임상 1상 종료(2019.07) ㆍ후속 임상 시 적절한 치료 대상 선정을 위하여 루푸스 신염 및 루푸스 혈구 감소 환자 대상으로 동종골수 유래 줄기세포 연구자 임상 승인(2018.09.27) ㆍ루푸스 신염 및 루푸스 혈구감소증 연구자주도 임상 개시(2019.09) ㆍ루푸스 신염 및 루푸스 혈구감소증 연구자주도 임상 결과보고서 최종화 승인(2022.08) |
||
| 향후계획 | 1상 임상시험 및 연구자주도 임상시험 결과 분석하여 치료 대상을 확정하여 2상 임상시험 예정이나 시기는 미정 | ||
| 경쟁제품 |
ㆍ현재 표준치료요법으로 스테로이드와 면역억제제가 사용되고 있으나 면역억제제와 스테로이드에 대한 불응성 혹은 부작용을 나타내는 환자들이 있고, 약물 사용 중단 시 악화(플레어)되거나 기존 약에 불응하게 되는 경우가 발생함 ㆍ최근 루푸스에 대한 세계 최초의 치료제로 B세포 표적 항체(belimumab)가 승인되었으나 보다 더 안전하고 효과적인 치료제 개발이 필요함 ㆍ1997년에 국내에서 불응성 루푸스 환자에게 조혈모세포 이식술이 시도되었으며 장기 추적관찰 결과 치료효과를 보인 환자 있었으나 이식편대 숙주질환 발생, 심각한 감염, 치료시술과 관련된 사망 위험성 증가(5~13%) 높은 비용 문제로 실용화가 되지 못하였음 ㆍ현재 불응성 루푸스 치료를 위해 T세포 또는 B세포를 표적으로 하는 생물학적 제제를 이용한 루푸스 임상연구가 다수 이루어지고 있으나, 시판이 가시화되고 있는 제품은 아직 없음 ㆍ루푸스에 대한 줄기세포치료 연구는 중국에서 활발히 이루어지고 있음. Nanjing Univ.의 Sun팀은 여러 환자에게 줄기세포를 투여 임상연구를 수행했으나, 선정 제외기준, 세포의 종류(제대, 골수 등) 등의 조건이 일관성 없이 실시된 연구자 임상시험으로 비교 대상이 없고, 비 혈연 동종 줄기세포를 사용하여 면역거부반응의 위험성이 있음 |
||
| 관련논문등 | ㆍSang-Cheol Bae, Safety and tolerability of bone marrow-derived mesenchymal stem cells in lupus animal models and a phase I clinical trial in human, Lupus, 2022 1-9 | ||
| 시장규모 |
2016년에 설립되어 미국 워싱턴 D.C.에 위치한 글로벌 시장조사 및 컨설팅 분야의 선도 기업인 Verified Market Research (VMR)에서 2025년 발표한 자료에 따르면 전신성 홍반성 루푸스 치료제의 글로벌 시장 규모는 2024년 약 100억 달러 수준으로 연평균성장률(CAGR) 8%를 나타내어 2032년 약 159억 달러 수준까지 성장할 것으로 예측함. 노인 인구의 증가, 만성질환 증가로치료제에 대한 수요는 꾸준히 증가하고 있음.
|
||
| 기타사항 |
CE211AT15는 정부의 R&D 지원을 받아 개발 ㆍ보건복지부 지원 보건의료연구개발사업 완료(과제명: 루푸스 줄기세포치료제 개발, 2014.08) ㆍ보건복지부 첨단의료기술개발사업 완료(루푸스 줄기세포치료제 임상1상) ㆍ미래창조과학부 원천기술 개발사업 수행 완료(과제명: 전신홍반 루푸스 줄기세포치료제의 유효성 검증을 위한 임상바이오마커 발굴 및 실용화) |
- 품 목: CE111BR16
| 구 분 | 중간엽줄기세포치료제 | ||||||||||||
| 적응증 |
ㆍ적응증: 다계통위축증 ㆍ다계통위축증(multiple system atrophy, MSA)은 병인이 명확히 규명되지 않은 복합인자 퇴행성 신경계 질환으로 발병 후 3~5년이면 단독 보행이 어려워지며, 8~10년 이내 사망에 이르는 질환으로 파킨슨병과 유사한 운동 완서, 강직, 진전 등의 증상을 보이지만 파킨슨병과는 달리 도파민 성약제에 대한 증상 호전이 없는 것이 특징임. |
||||||||||||
| 작용기전 | 중간엽줄기세포의 항염증 작용 및 신경재생 증진효과, 중간엽줄기세포의 신경보호 효과 | ||||||||||||
| 제품의특성 |
ㆍ당사의 EfficHigh 기술로 제조된 CE111BR16은 중간엽줄기세포(MSC)로 MSC가 분비하는 성장인자, 항염증인자, 면역조절인자에 의한 신경보호작용 및 항염증 매개 면역조절작용이 우수한 것을 확인하였음. ㆍ다계통위축증 모델(6-OHDA)에서 본제의 단회 경동맥 투여 시, 행동기능이 향상되었고, 도파민성 신경원 소실감소, 선조체 신경원의 소실이 감소, 선조체에서 분비되는 도파민 양 증가, 세포사멸과 관련된 caspase/microglia 활성이 감소되어 질환 치료효과를 나타냈음. ㆍ임상적으로는 병소 부위에서 세포 사멸 및 염증 반응이 감소하여 질환 진행 속도를 완화/정지시키고 신체기능(파킨슨증상)이 개선되는 효과를 나타낼 것으로 기대됨. |
||||||||||||
| 진행경과 |
ㆍ치료용 조성물 특허 출원(2013.11) ㆍ비임상시험(GLP 독성_ 완료(2015.05) ㆍ1상 임상시험 승인(2016.06) ㆍ임상시험용 의약품 투여 개시(2018.06) ㆍ1상 임상시험 1/2 단계 투약완료(2019.04) ㆍ1상 임상시험 3단계 개시(2019.08) ㆍ1상 임상시험 3단계 투약 완료 (2019.11) |
||||||||||||
| 향후계획 | 1상 임상시험 결과 분석하여 치료 대상을 확정하여 2상 임상시험 예정이나 시기는 미정 | ||||||||||||
| 경쟁제품 |
ㆍ현재 치료제나 치료방법이 전혀 없어 미충족 수요가 높으며, 치료제 개발 성공시 시장의 유일한 치료제가 될 것으로 전망 ㆍ현재까지 퇴행성 신경계질환 치료제로 개발되던 약제들(rifampicin, rasagiline, minocyclin, riluzole, growth hormone)을 이용한 임상연구가 수행되어 왔으나 모두 임상적 유용성 입증하지 못한 것으로 보고되었음 ㆍ현재 개발중인 약물은 MSA 증상 중 하나인 기립성저혈압 증상개선을 목적으로 2/3상 연구자임상시험중인 droxidopa가 있으나 이는 MSA 질환 자체의 경과를 개선치료하는 약물은 아님 |
||||||||||||
| 관련논문등 | Phil Hyu Lee, Phase Trial of Intra-arterial Administration of Autologous Bone Marrow-Derived Mesenchymal Stem Cells in Patients with Multiple System Atrophy, Hindawi, 2021 | ||||||||||||
| 시장규모 |
글로벌 시장조사와 경영 컨설팅을 제공하는 세계적 리서치 기업인 IMARC GROUP의 2025년도 최신 자료 기준으로 다계통위축증(Multiple System Atrophy, MSA) 치료제 시장 규모와 전망은 다음과 같습니다. ㆍ2024년 글로벌 7대 주요 시장(미국, EU 주요 4개국, 영국, 일본)에서 MSA 치료제 시장 규모는 약 1억3,380만 달러(USD)로 평가됨. ㆍ2035년까지 약 1억9,370만 달러까지 성장할 것으로 예상되며, 2025년부터 2035년까지 연평균성장률(CAGR)은 약 3.42%~3.74% 수준임. ㆍ시장 성장은 조기 진단 기술(고해상 MRI, PET, SPECT, 바이오마커, AI 활용 진단) 발전과 신약 개발(면역치료, 유전자 치료, 줄기세포 치료 등)의 활발한 연구 투자에 의해 견인되고 있음.
|
||||||||||||
| 기타사항 |
CE111BR16는 정부의 R&D 지원을 받아 진행함 ㆍ보건복지부 지원 보건의료연구개발사업 완료(과제명: 다계통위축증 줄기세포치료제 개발, 2015. 06) ㆍ보건복지부 첨단의료기술개발사업 수행 중(과제명: 비유전성 소뇌실조증의 줄기세포치료제 허가용 비임상 및 임상연구) |
- 품 목: CE211BR19
| 구 분 | 중간엽줄기세포치료제 | ||
| 적응증 |
ㆍ적응증: 소뇌실조증 ㆍ소뇌실조증(Cerebellar Ataxia)은 소뇌의 손상으로 근육운동이 불완전해 걷기조차 힘들 정도로 정상적인 운동이 불가능해지는 희귀질환임. 정확한 발병 원인과 발생과정에 대해서는 아직 밝혀지지 않았으나 경우에 따라서 대사성 원인에 의해 생기거나 유전자질환에 의해 생기는 경우가 많음. 현재까지 뚜렷한 치료방법이 없는 상태이며 증상을 호전시키거나 병의 진행을 늦추기 위한 약물치료가 시도되고 있으나 아직까지 실효를 거둔 치료제는 없는 상태임 |
||
| 작용기전 |
중간엽줄기세포의 항염증 효과 및 신경보호 효과를 통해 Purkinje cell의 세포사멸을 억제.
|
||
| 제품의특성 |
ㆍ퇴행성 소뇌 실조증의 경우 명확한 원인이 밝혀지지 않았으며 유전적, 환경적, 화학적, 물리적과 같은 다양한 요인이 제시되고 있음. 원인은 알 수 없지만 소뇌의 신경염증으로 인해 소뇌의 대부분을 차지하는 Purkinje cell의 사멸 및 소뇌의 실조가 일어남. ㆍ중간엽줄기세포는 다양한 항-염증인자 및 신경재생인자를 분비하며 주변 분비능을 통해 뇌신경세포들간의 상호작용을 통해 미세환경을 변화시킬 수 있음. 항-염증 효과 및 신경재생효과를 통해 소뇌실조증을 개선할 수 있을 것으로 기대함. |
||
| 진행경과 |
ㆍ비임상 GLP단회투여 독성시험 완료(2019.06) ㆍ연구자임상시험 승인(2019.10) ㆍ연구자임상시험 개시(2019.10) ㆍ연구자임상시험 마지막환자 방문 완료(2022.07) ㆍ연구자임상시험 최종화 승인(2023.02) |
||
| 향후계획 | 상업적 목적의 1상 임상시험을 진행할 예정이나 시기는 미정임 | ||
| 경쟁제품 |
ㆍ이차적인 원인에 의한 소뇌실조증의 경우 원인을 찾아 치료해주면 증상이 호전됨. 그러나 모든 원인이 치료가 가능한 것은 아님 ㆍ유전성 소뇌실조증이나 신경계퇴행성 질환에 의한 소뇌실조증은 아직 원인을 치료하거나 진행을 늦추는 방법은 없음. 전 세계적으로 많은 연구자들이 치료방법 개발 연구를 수행하고 있으나 실제 치료제로 적용할만큼 효과가 좋고 부작용이 적은 치료제는 없는 상황임 ㆍ소뇌실조증에 대한 유전자 치료도 시도되고 있으나 유효성은 아직 확인이 불가능함 ㆍ씨트렐린(Citrellin, HLB제약) : 2015년 국내 허가된 척수소뇌변성증에 의한 운동실조 개선용 치료제. 임상 4상에서 유의미한 운동실조 개선 효과 확인되어 2024년 12월 심평원에 급여 결정신청서를 접수하여 심사 중임. ㆍ기타 : 줄기세포 치료제, RNA 표적 치료제, 유전자치료제 등 혁신 신약 개발이 진행 중임 |
||
| 관련논문등 | YP Nam, DY Yoon, JW Hong, MS Kim, TY Lee, KS Kim, HW Lee ect al. Therapeutic Effects of Human Mesenchymal Stem Cells in a Mouse Model of Cerebellar Ataxia with Neuroinflammation | ||
| 시장규모 |
단순 소뇌실조증의 시장 규모를 산정하는 것은 어려움이 있으나, 더 큰 상위 개념인 운동실조증의 시장 규모는 2024년 약 8억 5,040만 달러 수준에서 연평균 성장률 약 7%로 예상되어, 2037년에는 약 27억 달러 규모까지 성장할 전망(뉴욕에 위치한 중소규모의 글로벌 시장조사 및 전략 컨설팅 전문 기업인 Research Nester의 2025년 자료) |
||
| 기타사항 |
CE211BR19은 정부의 R&D 지원을 받아 개발중임 ㆍ보건복지부 첨단의료기술개발사업 수행 완료 (과제명: 비유전성 소뇌실조증의 줄기세포치료제 허가용 비임상 및 임상연구, 2016. 10) |
- 품 목: CE211NS21
| 구 분 | 중간엽줄기세포 치료제 | ||
| 적응증 |
ㆍ적응증: 시신경척수염(Neuromyelitis Optica, NMO) ㆍ시신경척수염(Neuromyelitis Optica, NMO)은 평생 반복적으로 재발하는 중추신경계의 염증성 탈수초성 질환(inflammatory demyelinating disease of the central nervous system, IDD)의 한 종류로, 시신경염(Optic neuritis)이나 횡단성 척수염(Transverse myelitis)으로 급성 증상이 발생하는 질환임. 재발율이 매우 높고(1년에 2-3회), 심각한 장애를 남길 수 있으며, 사망률이 높은(50% 이상 7년 이내 사망) 희귀질환임. |
||
| 작용기전 |
시신경 척수염은 자가-항체인anti-Aquaporin-4가 뇌의 Astrocyte 작용하여 염증반응을 유발함. 이후 염증반응으로 인해 보체활성, 염증성 단백질 발현, 탈-수초화가 발생함. 중간엽줄기세포인 CE211NS21은 보체의 활성을 억제하며 항-염증 반응, 탈-수초화 억제 효과를 보임.
|
||
| 제품의특성 |
ㆍ당사의 EfficHigh 기술로 제조된 CE211NS21은 동종골수유래 중간엽줄기세포로서 기존 자가골수유래 중간엽줄기세포 보다 분비하는 성장인자, 항염증인자, 면역조절인자에 의한 신경보호작용 및 항염증 매개 면역조절작용이 우수 할 것으로 기대함. 더불어 환자의 수고와 부담을 최소화할 수 있음. ㆍ시신경척수염의 체내, 외 비임상시험을 통해 보체활성 억제, 세포의 보호 작용 및 희소돌기아교세포의 탈수초화 억제 효과과 미세아교세포의 항염증 작용기전을 확립하였으며 Treg cell의 분화 및 증식을 활성 작용기전을 확인하였음. 시신경척수염 질환동물모델로 활용되는 EAE(Experimental Autoimmune Encephalomyelitis) 질환동물모델에서도 CE211NS21은 척수내 항염증 및 탈수초화 억제 효과와 더불어 Clinical score의 유의적 변화를 확인하였음. |
||
| 진행경과 |
ㆍ생물학적 특성분석자료 확보 (2022.09) ㆍ비임상 유효성 평가 자료 확보 (2022.12) ㆍ비임상 약리 평가자료 확보 (2020.12) ㆍ비임상 GLP단회, 반복투여 독성시험 및 종양원성 완료(2021.10) ㆍ시신경척수염에 대한 CE211NS21임상시험 신청(2023.04) ㆍ시신경척수염에 대한 CE211NS21임상시험 승인(2024.06) ㆍ시신경척수염에 대한 CE211NS21임상시험 계획 변경 신청(2024.07) ㆍ시신경척수염에 대한 CE211NS21임상시험 계획 변경 승인(2024.07) |
||
| 향후계획 | ㆍ2026년 1분기 이후 1상 임상시험 개시 예정 | ||
| 경쟁제품 |
승인 약물 ㆍ솔리리스주(에쿨리주맙): 2019.06 FDA 승인, 2021.02 MFDS 승인 ㆍ엔스프링프리필드실린지주(사트랄리주맙):2020.08 FDA승인,2021.04 MFDS승인 ㆍ업리즈나주(이네빌리주맙): 2020.06 FDA 승인, 2021.08 MFDS 승인 |
||
| 관련논문등 | - | ||
| 시장규모 |
본사는 인도에 위치하고, ESOMAR(세계시장조사협회) 인증을 받은 글로벌 시장조사 및 컨설팅 전문 기업인 Market Research Future(MRFR)의 2025년도 자료에 따르면, 2024년 글로벌 시신경척수염 치료제 시장 규모는 약 20억 달러에서 2025년부터 2032년까지 연평균성장률(CAGR) 약 7.9%의 높은 성장률을 보이며, 2032년에는 65억 달러까지 성장할 것으로 전망됩니다. 시장성장은 NMO 유병률 증가, 혁신적 치료제 개발과 승인 확대, 정확한 진단 및 환자 인식 제고가 주요 동력입니다.
|
||
| 기타사항 | CE211NS21은 22년 범부처 재생의료사업단의 재생의료 연계기술 개발 사업의 지원 받아 2023.12.31까지 과제를 수행함 |
- 품 목: CE223BR17
| 구 분 | 유도만능줄기세포치료제 |
| 적응증 |
ㆍ적응증: 파킨슨, 퇴행성 신경계 질환 ㆍ파킨슨병(Parkinson's diseas, PD)는 아직까지 명확한 원인이 밝혀지지 않았으나, α-Synuclein 단백응집체가 신경세포의 사멸 및 기능저하를 초래하는 병적 환경에서 α-Synuclein 단백응집체는 신경세포-신경세포간 또는 신경세포-세포외공간으로의 이동이 가능해 신경세포의 손상이 뇌전체로 확대되는 병리기전을 가짐. 현재까지 뚜렷한 치료방법이 없으며 증상완화 및병의 진행을 늦추기 위한 약물치료로 실효를 거둔 치료제는 없는 상태임. |
| 작용기전 | 명확한 상관관계는 설명할 수 없는 단계이지만 substantia nigra에 dopaminergic neuron이 파괴되는데 유도만능줄기세포(iPSC)유래 신경줄기세포 및 성상세포는 미세환경 조절 및 이식으로 재생을 통한 dopaminergic neuron을 회복시킴. |
| 제품의특성 | ㆍ유도만능줄기세포는(iPSC)는 배아줄기세포와 같이 전분화능을 가진 세포로 당사는 유도만능줄기세포로부터 신경줄기세포 및 성상세포로의 분화기술을 확보하고 있음. 유도만능줄기세포는 윤리적 문제없이 치료제로 사용할 수 있는 새로운 패러다임의 세포로 지목되고 있으며 병변에 맞는 세포로 분화시켜 사용할 수 있다는 장점이 있음. |
| 진행경과 |
ㆍ유도만능줄기세포주 확립 / 뱅킹 (2022.10) ㆍ신경줄기세포 및 성상세포 분화 배양 방법 확립 (2021.07) ㆍ유도만능줄기세포 및 신경줄기세포, 성상세포 특성분석 (2022.12) |
| 향후계획 | 비임상시험을 진행 후 상업화 임상시험 진입 |
| 경쟁제품 |
ㆍ아직까지 배아줄기세포 및 유도만능줄기세포 유래 세포치료제는 임상시험을 승인받거나 의약품으로 승인받은 전례가 없으며 미래 유망한 세포치료제로서 활용가치가 높음 |
| 관련논문등 | - |
| 시장규모 | ㆍ시장조사기관 Precedence Research(캐나다 오타와 및 인도 푸네에 본사를 둔 전 세계 50개국 이상에서 맞춤형 시장 인사이트와 심층 분석 제공하는 글로벌 시장조사기관), Fact.MR(30,000개 이상 니치 마켓 데이터와 100 million 이상의 데이터 포인트 보유한 글로벌 시장조사기관 및 컨설팅 기업), Polaris Market Research(뉴욕에 위치한 중소규모의 시장규모 예측, 맞춤형 및 연간 보고서 등을 제공하는 기업) 등에 따르면, 유도만능줄기세포(iPSC) 치료제 시장은 2024년 기준 약 19억에서 21억 달러 규모로 평가되고 있음. 향후 연평균 성장률이 7%에서 10%대에 이를 정도로 빠른 속도로 성장할 것으로 전망되며, 2034년에는시장 규모가 40억에서 51억 달러까지 커질 것으로 예상됨. ㆍ성장의 주요 배경으로는 개인 맞춤형 세포치료에 대한 수요 증가, 신약개발과 독성시험 등에서 iPSC의 활용도 확대, 그리고 CRISPR, 인공지능(AI) 등 혁신기술과 iPSC 기술의 융합, 제약사의 GMP급 생산 인프라 확충 등이 있음. 특히 아시아(한국, 일본, 중국)와 북미를 중심으로 규제 환경이 개선되고 시장 확장이 빠르게 진행 중임. |
| 기타사항 | - |
- 품 목: EV231LU20 (Extracellular vesicle)
| 구 분 | 바이오 신약 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 적응증 | ㆍ적응증: 특발성폐섬유증(Idiopathic Pulmonary Fibrosis, IPF) ㆍ특발성폐섬유증(Idiopathic Pulmonary Fibrosis, IPF)은 희귀난치성 질환으로 간질성 폐질환(interstitial lung diseases, ILD)내 특발성 간질폐렴(idiopathic interstitial pneumonia, IIP)에서 가장 흔한 질환임. 폐포와 폐포 사이의 공간인 간질에 염증 및 섬유화가 발생하는 질환으로 아직까지 명확한 원인은 밝혀지지 않았으며 만성의 진행성 폐섬유증이 주된 특징임. 50세 이상의 나이에서 주로 발병하며 지역별 국가별 다양한 유병률과 발병률을 나타냄. 전세계에서 유병률과 발병률이 매년 점차 증가하고 있음. 유럽과 미국의 특발성 폐섬유증의 유병률은 인구 100,000명당 2.8~18명으로 추정되고 아시아와, 남미에서는 인구 100,000명당 0.5~4.5명으로 추정됨. 남성에게서 더 흔하게 나타나는 것으로 밝혀져 있으며 진단 시 평균연령은 65세로 알려져 있음. 특발성 폐섬유증은 폐가 딱딱하게 굳어져 가며 질환의 진행으로 인한 호흡부전 등의 문제로 결국 사망에 이르는 예후가 좋지 못한 질환임. 생존기간은 3~5년으로 매우 짧고 간질성 폐질환 (interstitial lung diseases, ILD)에서 약 20%의 상대적 발병 분포를 나타내지만 질환의 인지도 및 대중의 이해도가 낮은 질환임.2014년 개발된 피르페니돈, 닌테다닙 2가지 약물이 있고 국내에서는 급여가 적용되는 피르페니돈을 주로 사용하고 있지만 환자 대부분이 고령이라는 점을 고려하였을 때 처방이 쉽지 않음. 특히 고령의 환자 일수록 약물에 의한 부작용으로 식욕부진, 소화기계 부작용(구토, 구역), 거부감 등을 겪고 있으며 이러한 이유로 투약을 거부하거나 약물의 복용으로 인해 전신의 위약감 등이 발생하여 고령의 환자에게 처방함에 어려움이 있음. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 작용기전 |
완벽한 작용기전을 설명하기에는 어려운 단계이지만 중간엽줄기세포 유래 세포외소포체는 핵산, 지질, 단백질을 함유하고 있음. 특히 당사의 세포외소포체 치료제 내에는 항염증 및 항섬유화에 효과적인 Micro RNA가 다량 함유되어 있음.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 제품의특성 |
ㆍ당사의 세포외소포체 치료제는 타사 및 타연구에 비해 생산량이 높아 상업화 적용에 효과적이며 항섬유화 작용을 하는 MicroRNA가 다량 함유되어있음. ㆍ세포외소포체 치료제는 세포치료제에 비해 보존기간 및 안전성 등에 매우 효과적이며 치료효과는 세포치료제와 비슷하게나 우수하게 나타남. ㆍ특발성폐섬유증의 체내,체외 유효성 평가를 통해 제 2형 상피세포의 분화 및 증식을 억제 할수 있으며 섬유아세포의 분화 증식을 억제하는 효과를 확인하였음. 더불에 최근 밝혀지고 있는 Macrophage의 조절작용을 통해 M1 type을 유지하며 M2 type을 억제 하는 것을 확인하였음. Bleomycin 유발 질환동물모델에서는 폐 내 콜라겐 형성을 억제, 항 염증작용을 확인할 수 있었으며 폐, 폐포, 간질 등의 폐 내부 조직이 대조군에 비해 유의미하게 회복되는 것을 확인하였음. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 진행경과 |
ㆍ생물학적 특성분석자료 확보 (2022.12) ㆍ유효성 평가 자료 확보 (2022.12) ㆍGLP단회, 반복투여 독성시험 완료(2022.01) ㆍ비임상 시험 진행 중 (안전성약리, 분포, 면역원성, 유전독성 등 진행중) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 향후계획 |
ㆍ2025년 비임상 약리, 독성시험 완료 목표 ㆍ2026년 IND filing 임상시험신청 예정 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 관련논문 | - | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기타사항 | ㆍEV231LU20은 24년 범부처 재생의료사업단의 재생의료 연계기술 개발사업의 지원을 받아 개발 진행중임. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 경쟁제품 |
시판 중인 대표적인 치료제 ㆍPirfenidone (에스브리에트, Esbriet®): Roche가 공급하며, 2014년 FDA 승인받아 세계적으로 사용 중. ㆍ두 약물 모두 질병의 완치는 불가능하지만, 폐 섬유화 진행 속도를 30~50% 정도 늦추는 효과가 입증됨. ㆍActimmune (인터페론 감마-1b), Interferon Gamma-1b 등도 처방 사례가 있으나, 항섬유화제에 비해 제한적 사용.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 시장규모 |
ㆍ글로벌 시장조사와 경영 컨설팅을 제공하는 세계적 리서치 기업인 IMARC Group의 2025년도 자료에 따르면, 특발성폐섬유증(IPF) 치료제 글로벌 시장 규모는 2024년에 약 41억 달러 수준에서 2025년부터 2033년까지 연평균성장률(CAGR) 6.3%로 성장하여, 2033년에는 약 73억 1,580만 달러 규모에 이를 것으로 전망됨. ㆍ특발성폐섬유증은 폐에 흉터 조직이 형성되어 폐 기능이 저하되는 질환으로, 닌테다닙과 피르페니돈 같은 항섬유화 치료제가 주로 사용되고 있으며, 이들과 병용하는 산소요법이나 완화 치료가 환자 치료에 병행됨. 이 성장에는 고령화, 발병률 증가, 진단 및 치료기술 발전이 주된 원인으로 작용하고 있음. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기타사항 | - |
특히 당사의 핵심 파이프라인인 루게릭병(ALS, 근위축성 측삭경화증) 치료제인 뉴로나타-알(Neuronata-R, 렌주메스트로셀)의 의약품 품목허가 및 임상, 최근 변경 신청 관련 주요 이력과 사건을 시간 순서로 자세히 정리하면 다음과 같습니다.
먼저, 뉴로나타-알은 2014년 7월 30일 국내 식품의약품안전처(MFDS)로부터 ALS 치료제로는 최초로 조건부 품목허가를 받았습니다. 이 당시 허가는 전체 ALS 환자를 대상으로 하였으며, 조건부 허가였기에 추가 임상 및 시판 후 안전성ㆍ유효성 검증이 요구되는 상태였습니다. 이 허가는 전통적인 화학합성 약물이 아닌 환자의 자기 골수에서 유래한 줄기세포를 직접 주입하는 혁신적인 세포 치료제로서 의미가 있었습니다.
허가 직후인 2014년부터 국내에서 임상 2상이 완료되었는데, 이 연구에서는 ALS 환자의 기능 평가 척도(ALSFRS-R)를 기준으로 위약 대비 유의미한 기능 진행 억제 효과가 관찰되었습니다. 이후 400명 이상의 실제 환자들에게 처방되어 부작용 없이 사용되었으며 국내에서 장기간 시판되었습니다.
ALS 환자의 기능 평가 척도(ALSFRS-R, Amyotophic Lateral Sclerosis Functional Rating Scale-Revised)는 루게릭병(ALS) 환자들의 연수기능(말하기 , 침 및 음식 삼키기 등), 상지근력(글쓰기, 수저 사용하기, 옷입기 등), 하지 근력(걷기, 계단 오르기 등), 호흡 기능 상태에 대하여 총 12문항을 평가하는 것으로 정상인 경우 4점, 전혀 기능 수행을 하지 못할 경우 0점으로 평가하여 총 48점 만점인 평가시험입니다.
- 1단계(48~40점) : 일부 불편함 느끼나, 일상생활 대부분 자력으로 가능
- 2단계(39~30점) : 다수 부위에 불편함 느끼며, 일상생활 일부에서 타인 도움 필요
- 3단계(29~20점) : 다수 부위에 불편함 느끼며, 일상생활 대부분에서 타인 도움 필요
- 4단계(19~0점) : 침대나 휠체어 생활, 모든 부분에서 타인 도움 필요
그러나 보다 확실한 효능과 안전성 확보를 위해 미국 FDA에 임상 3상 시험계획(IND)을 2020년 7월 승인받고, 2021년 4월부터 국내를 포함한 다기관에서 임상 3상(ALSummit, NCT04745299)을 개시하였습니다. 이 3상 시험에는 총 126명의 루게릭 환자가 참여했으며, 임상 기간은 약 50개월 동안 진행되었습니다. 주요 평가지표는 기능 및 생존 통합 지표인 CAFS(Combined Assessment of Function and Survival)였습니다.
CAFS는 임상시험 등에서 기능과 생존을 동시에 평가하는 통합 지표로, ALSFRS-R 점수(ALS 환자의 신체 기능 점수)와 생존율을 결합해 치료 효과를 종합적으로 평가합니다. 즉, 환자의 기능 저하 정도와 생존 기간을 함께 고려하여 통계적으로 비교 분석하는 방법입니다. CAFS 개념은 여러 환자를 대상으로 기능 변화와 생존 기간에 대해 joint rank score(여러 임상시험 지표를 각각 따로 분석하는 대신, 두 가지 이상을 통합적으로 순위 매김하여 점수를 산출하는 통계 방법)방식으로 환자별로 순위를 매긴 후 전체의 치료 효과 차이를 산출합니다. 예를 들어, 기능 악화가 느린 동시에 생존 기간이 길다면 CAFS 점수가 높게 평가됩니다. 요약하자면, CAFS는 신체 기능과 생존 기간을 통합적으로 분석하여 치료의 효과를 평가하는 임상 지표로, 특히 희귀/난치성 질환 등에서 신약의 유효성을 판단하는 데 사용되고 있습니다.
통상 임상시험에서 p-value(p값)은 약물이 위약과 차이가 없다는 가정 하에서 우연히 이번처럼 결과가 나올 확률를 의미하며, p값이 0.05 미만이면 통계적으로 유의미하다고 판단하는 것이 일반적입니다. 물론, p값이 0.05를 넘으면 유의미하지 않아 통계적으로 효과가 없다고 판단하지만, 임상적 의미가 없다는 뜻은 아니며 임상 해석 시 p값 외에도 효과 크기, 표본 수, 연구 설계 등에 따라 달라질 수 있고, p값만으로 임상 성공 및 실패를 판단하는 것은 한계가 있습니다. 그러나 2024년 12월 18일 발표된 임상 3상 결과에서는 전체 환자군(ITT분석군: 임상시험에 등록된 모든 환자를 처음 배정된 그룹대로 분석하는 방법)을 대상으로 한 평가에서 CAFS 점수(Combined Assessment of Function and Survival: 기능 상태와 생존률을 합쳐서 평가하는 복합 평가 지표로, 흔히 루게릭병(ALS) 같은 신경 퇴행성 질환 임상에서 치료 효과를 종합적으로 판단할 때 사용) 및 생존기간 등 주요 지표 모두에서 치료군과 대조군 간에 통계적 유의성이 인정되지 않아, 해당 약물에 대한 임상 3상은 연구 약물의 임상적 유효성을 입증하지 못하였습니다.
| [투자판단 관련 주요경영사항(임상시험 결과)_2024.12.18] |
| 투자 유의사항 | - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. - 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. - 투자자는 위 사항과 수시공시 및 사업보고서 등을 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | 근위축성측삭경화증(루게릭병) 환자를 대상으로 뉴로나타-알주(자가골수유래중간엽줄기세포)의 유효성 및 안전성 평가를 위한 3상 임상시험 결과 Topline data 수령 | |
| 2. 주요내용 | 1) 임상시험명칭 | 근위축성측삭경화증(루게릭병) 환자를 대상으로 뉴로나타-알주(자가골수유래중간엽줄기세포)의 유효성 및 안전성 평가를 위한 이중눈가림, 무작위배정, 다기관, 위약대조, 평행 제3상 임상시험 |
| 2) 임상시험단계 | 제 3상 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) 및 미국 식품의약국(FDA) | |
| 4) 임상시험실시국가 | 한국 | |
| 5) 임상시험실시기관 | 한양대학교병원 외 국내 4개 병원 | |
| 6) 대상질환 | 근위축성측삭경화증(루게릭병) | |
| 7) 신청일 | 2020-02-19 | |
| 8) 승인일 | 2020-07-24 | |
| 9) 등록번호 | - CRIS 등록번호 : KCT5954 - Clinicaltrials.gov 등록번호 : NCT04745299 |
|
| 10) 임상시험 목적 | 본 임상시험은 근위축성측삭경화증(루게릭병)환자를 대상으로 뉴로나타-알주 또는 위약을 투여한 후 뉴로나타-알주 적용군이 위약 적용군에 비하여 임상적으로 우월함을 입증하기 위함이다. 1. 1차 목적 1) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 12개월 시점에서 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 (MFDS, FDA) 2) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 6개월 시점에서 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 1과 대조군의 치료적 유효성 비교 (MFDS) 2. 2차 목적 1) 투여시점으로부터 12개월 시점과 6개월 시점에 ALSFRS-R 점수, Time to first event로 평가되는 시험군 2와 대조군의 치료적 유효성 비교, 투여시점으로부터 6개월 시점에서 Joint rank score (기능 및 생존 기간에 대한 통합분석)으로 평가되는 시험군 2와 대조군의 치료적 유효성 비교, 투여 시점으로부터 12개월 시점과 6개월 시점에 SVC로 평가되는 시험군 2와 대조군의 유효성 비교 (FDA) 2) 투여시점으로부터 6개월 시점에서 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교, 투여 시점으로부터 12개월 시점과 6개월 시점에 평가되는 ALSFRS-R 점수, Time to first event로 평가되는 시험군과 대조군의 치료적 유효성 비교 (MFDS) 3. 탐색적 목적 - FDA 제출의 경우 1) 시험군 2를 대상으로 투여시점으로부터 12개월 시점의 HHD 변화량, EQ-5D-5L 변화량, ALSAQ-40 변화량, Time to death 확인 2) Main Study 이후 진행되는 시험군 2에서의 장기 유효성 및 안전성의 탐색적 확인 (폐기능검사(SVC), 근력검사(HHD), Time to first event, Time to death, EQ-5D-5L, ALSAQ-40, 이상사례, 실험실적 검사 등의 평가) 3) 시험군 2를 대상으로 싸이토카인 및/또는 기타 예측 표지자 수치에 의한 생물학적 표지자 측정을 통한 근위축성측삭경화증(루게릭병) 환자에서 뉴로나타-알주 투여시 지표로 작용할 수 있는 생물학적 표지자에 대한 평가 - MFDS 제출의 경우 1) 시험군 1과 2를 대상으로 투여 시점으로부터 6개월, 12개월 시점의 폐기능 검사(SVC) 변화량, HHD 변화량, EQ-5D-5L 변화량, ALSAQ-40 변화량, Time to death 확인 2) Main Study 이후 진행되는 시험군 1과 2의 장기 유효성 및 안전성의 탐색적 확인 (폐기능검사(SVC), 근력검사(HHD), Time to first event, Time to death, EQ-5D-5L, ALSAQ-40, 이상사례, 실험실적 검사 등의 평가) 3) 시험군 1과 2를 대상으로 싸이토카인 및/또는 기타 예측 표지자 수치에 의한 생물학적 표지자 측정을 통한 근위축성측삭경화증(루게릭병) 환자에서 뉴로나타-알주 투여시 지표로 작용할 수 있는 생물학적 표지자에 대한 평가 |
|
| 11) 임상시험 방법 | 1. 시험 대상자 수: 126명(실제 등록인원) 2. 단계 및 디자인: - Main Study: 이중눈가림, 무작위배정, 다기관, 위약대조, 평행 제3상 임상시험 - Observational Study: 다기관, 제3상 임상시험 후 관찰연구 3. 용법/용량 및 투여방법 - 시험약: 체중 1 kg당 0.1 mL (1.0x106 세포)를 뇌척수강 내로 투여 - 대조약: 체중 1 kg당 0.1 mL를 뇌척수강 내로 투여 - 병용약: 허가사항에 따라 복용(매 12시간 간격으로 50 mg씩 최소한 식사 1시간 전 또는 2시간 이후 복용) 4. 투여기간 (1) 시험약 및 대조약: - 시험군 1: 26일 간격으로 2회 시험약 투여 후, 3개월 간격으로 3회 대조약 투여/이후 26일 간격으로 2회 대조약 투여 - 시험군 2: 26일 간격으로 2회 시험약 투여 후, 3개월 간격으로 3회 시험약 투여/이후 26일 간격으로 2회 대조약 투여 (2) 대조군 : 26일 간격으로 2회 대조약 투여 후, 3개월 간격으로 3회 대조약 투여/이후 26일 간격으로 2회 시험약 투여 (3) 병용약 : 14개월(전문가의 의학적 판단에 따라 이상사례로 인해 리루졸 투여가 불가한 대상자가 아닌 경우, 모든 투여군에서 리루졸을 병용약으로 복용) 5. 추적 관찰 기간 첫 투약 후 36개월까지 6. 1차 유효성 평가변수 (1) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 12개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 (MFDS, FDA) (2) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 1과 대조군의 치료적 유효성 비교 (MFDS) 7. 2차 유효성 평가변수 (1) FDA 제출의 경우 - 12개월 시점에서의 ALSFRS-R 변화량(시험군 2와 대조군) - 12개월 시점에서의 Time to first event(시험군 2와 대조군) - 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 - 6개월 시점에서의 ALSFRS-R 변화량(시험군 2와 대조군) - 6개월 시점에서의 Time to first event(시험군 2와 대조군) - 12개월 시점에서의 SVC 변화량(시험군 2와 대조군) - 6개월 시점에서의 SVC 변화량(시험군 2와 대조군) (2) MFDS 제출의 경우 - 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 - 12개월 시점에서의 ALSFRS-R 변화량(시험군 2와 대조군) - 6개월 시점에서의 ALSFRS-R 변화량(시험군 1과 대조군) - 12개월 시점에서의 Time to first event(시험군 2와 대조군) - 6개월 시점에서의 Time to first event(시험군 1과 대조군) 8. Observational Study - FDA 제출의 경우 시험군 2와 대조군에 대해서, MFDS 제출의 경우 시험군 1과 시험군 2, 대조군에 대해서 아래와 같은 평가를 진행한다 - 36개월 시점에서의 SVC, HHD 변화량 - 36개월 시점에서의 Time to first event, Time to death - 36개월 시점의 EQ-5D-5L 및 ALSAQ-40의 변화량 9. 안전성 평가: 이상사례, 실험실적 검사(혈액학적/혈액화학적 검사, 소변검사), 신체검진 및 활력징후, 체중, 심전도/X-ray 검사 결과 |
|
| 12) 1차 지표 | - 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 12개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 (MFDS, FDA) - 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 1과 대조군의 치료적 유효성 비교 (MFDS) |
|
| 13) 임상시험기간 | 한국 식품의약품안전처(MFDS) 및 임상시험심사위원회(IRB)승인일로부터 약 50개월 | |
| 14) 목표 시험대상자 수 | 125명(실제 등록인원 126명) | |
| 3. 시험결과 | 1) 1차 지표 통계분석방법 | - 12개월 시점에서 시험군 2와 대조군간 CAFS를 이용하여 ALSFRS-R 점수와 생존기간으로 계산되는 Joint rank score 차이 및 6개월 시점에서 시험군 1과 대조군간 CAFS를 이용한 ALSFRS-R 점수와 생존기간으로 계산되는 Joint rank socre 차이를 ANCOVA를 사용해 분석함. 베이스라인 ALSFRS-R score progression rate, 베이스라인 시점 연령(25세~54세미만 vs 54세 이상), ALS type(bulbar/limb) 및 ALSFRS-R 베이스라인 점수를 공변량으로 보정함. - 각각의 가설에서 시험군과 대조군 간의 Joint rank score의 LS 평균값 차이(LS mean difference)에 대한 95% 양측 신뢰구간이 0을 포함하지 않으면 시험군의 대조군 대비 우월성을 입증한 것으로 판단함. |
| 2) 결과값 | 본 연구의 1차 유효성 평가에 대해서 평가변수는 ITT 군을 주 분석군으로 함. - 12개월 시점에서 시험군 2와 대조군간 CAFS에서 유의한 차이가 확인되지 않아, 유효성을 입증하지 못함. 시험군 2에서와 대조군에서의 CAFS Rank Score의 LS 평균값 차이 [95% CI]는 -8.75 [-19.73 ~ 2.23], 였으며 p-value = 0.118로 통계적으로 유의하지 않음. - 6개월 시점에서 시험군 1과 대조군간 CAFS에서 유의한 차이가 확인되지 않아, 유효성을 입증하지 못함. 시험군 1에서와 대조군에서의 CAFS Rank Score의 LS 평균값 차이 [95% CI]는 -3.89 [-11.87 ~ 4.08], 였으며 p-value = 0.339로 통계적으로 유의하지 않음. |
|
| 4. 사실발생(확인)일 | 2024-12-18 | |
| 5. 향후계획 | 본 공시 내용은 임상수탁기관으로부터 3상 임상시험 결과 Topline data를 전달 받은 내용이며, 2025년 상반기 중 임상시험결과보고서(CSR)를 수령한 후 임상 3상 시험 결과를 추가로 공시할 계획임. | |
| 6. 기타 투자판단과 관련한 중요사항 | ||
| - 2.주요 내용 중 7)신청일, 8)승인일은 FDA 기준입니다. - 4.상기 사실발생(확인)일은 당사가 임상수탁기관(CRO)으로부터 임상시험 결과 Topline data를 전달받은 날짜입니다. - 본 공시 내용은 당사의 IR자료, 보도자료, 학회 발표 자료 등에 사용할 예정입니다. |
||
| ※ 관련 공시 | 2020-02-19 투자판단 관련 주요경영사항(뉴로나타-알주의 미국FDA 3상 임상시험계획 신청) 2020-03-20 투자판단 관련 주요경영사항((뉴로나타-알주의 미국FDA 3상 임상시험계획 심사 보류 (Clinical Hold)) 2020-07-24 투자판단 관련 주요경영사항(줄기세포 치료제인 뉴로나타-알주의 미국 FDA 3상 임상시험계획 승인(Remove Clincal Hold)) |
|
| (출처) Dart 전자공시시스템 |
이후 2025년 4월, 당사는 임상 3상 최종보고서 및 추가 분석을 통해 전체 ALS 환자군 중 "Slow Progressor(질병 진행이 상대적으로 느린 서브그룹)"에 한해서는 기능 악화 지연 효과, 신경섬유 아교세포 수초 단백질(NfL) 등 생화학적 마커 측면에서 명확한 치료 효과가 관찰되었다는 사실을 공개했습니다. 이에 따라 당사는 기존에 허가받았던 전체 ALS 환자 대상으로부터 효능 효과군을 축소하여 "Slow Progressor (대조군의 유효성 평가 시점까지의 평균 진행속도를 기준으로 이보다 질병 진행이 느린 군, NfL 52pg/mL 미만 환자)"에 한정해 식약처에 품목허가 조건 변경을 신청하였습니다.
이후 2025년 7월 3일자로 식약처로부터 심사 과정 중 일부 보완자료의 제출을 요청 받았으며, 요청된 자료는 2025년 9월 1일까지 제출해 줄 것을 안내 받았습니다. 식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다. 하지만 보완 서류 제출 기한이 연장됨에 따라 식약처에서 현장실사(GCP 실사) 일정을 연기한다는 통보를 하였고, 구체적인 일정은 미정이나, 10월 또는 11월 중 진행할 것으로 예상됩니다. 이에 당사는 보완 자료 제출 전 식약처와의 대면 미팅을 9월 중으로 협의하고 있으며, 해당 대면 미팅을 진행한 후 보완 서류 제출기한인 10월 31일까지 보완 자료를 제출할 예정입니다. 당사는 현재 해당 기한 내에 문제없이 제출할 수 있도록 내부 검토는 물론 외부 전문가의 자문을 병행하며 철저히 준비하고 있습니다. 하지만 예기치 못한 문제 등의 발생으로 인해 제출기한 내 보완서류를 제출하지 못하거나, 제출하더라도 식약처에서 추가적인 보완 요구로 인해 허가 일정이 지연되거나, 심지어 보완 제출 후 식약처로부터 반려 통보를 받을 가능성을 배제할 수 없습니다.
| [투자판단 관련 주요경영사항(임상시험 결과)_2025.04.25] |
| 투자 유의사항 | - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. - 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. - 투자자는 위 사항과 수시공시 및 사업보고서 등을 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | 근위축성측삭경화증(루게릭병) 환자를 대상으로 뉴로나타-알주(자가골수유래중간엽줄기세포)의 유효성 및 안전성 평가를 위한 3상 임상시험결과보고서 최종본(CSR Final) 수령 | |
| 2. 주요내용 | 1) 임상시험명칭 | 근위축성측삭경화증(루게릭병) 환자를 대상으로 뉴로나타-알주(자가골수유래중간엽줄기세포)의 유효성 및 안전성 평가를 위한 이중눈가림, 무작위배정, 다기관, 위약대조, 평행 제3상 임상시험 |
| 2) 임상시험단계 | 제 3상 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) 및 미국 식품의약국(FDA) | |
| 4) 임상시험실시국가 | 한국 | |
| 5) 임상시험실시기관 | 한양대학교병원 외 국내 4개 병원 | |
| 6) 대상질환 | 근위축성측삭경화증(루게릭병) | |
| 7) 신청일 | 2020-02-19 | |
| 8) 승인일 | 2020-07-24 | |
| 9) 등록번호 | - CRIS 등록번호 : KCT5954 - Clinicaltrials.gov 등록번호 : NCT04745299 |
|
| 10) 임상시험 목적 | 본 임상시험은 근위축성측삭경화증(루게릭병)환자를 대상으로 뉴로나타-알주 또는 위약을 투여한 후 뉴로나타-알주 적용군이 위약 적용군에 비하여 임상적으로 우월함을 입증하기 위함이다. 1. 1차 목적 1) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 12개월 시점에서 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 (MFDS, FDA) 2) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 6개월 시점에서 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 1과 대조군의 치료적 유효성 비교 (MFDS) 2. 2차 목적 1) 투여시점으로부터 12개월 시점과 6개월 시점에 ALSFRS-R 점수, Time to first event로 평가되는 시험군 2와 대조군의 치료적 유효성 비교, 투여시점으로부터 6개월 시점에서 Joint rank score (기능 및 생존 기간에 대한 통합분석)으로 평가되는 시험군 2와 대조군의 치료적 유효성 비교, 투여 시점으로부터 12개월 시점과 6개월 시점에 SVC로 평가되는 시험군 2와 대조군의 유효성 비교 (FDA) 2) 투여시점으로부터 6개월 시점에서 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교, 투여 시점으로부터 12개월 시점과 6개월 시점에 평가되는 ALSFRS-R 점수, Time to first event로 평가되는 시험군과 대조군의 치료적 유효성 비교 (MFDS) 3. 탐색적 목적 - FDA 제출의 경우 1) 시험군 2를 대상으로 투여시점으로부터 12개월 시점의 HHD 변화량, EQ-5D-5L 변화량, ALSAQ-40 변화량, Time to death 확인 2) Main Study 이후 진행되는 시험군 2에서의 장기 유효성 및 안전성의 탐색적 확인 (폐기능검사(SVC), 근력검사(HHD), Time to first event, Time to death, EQ-5D-5L, ALSAQ-40, 이상사례, 실험실적 검사 등의 평가) 3) 시험군 2를 대상으로 싸이토카인 및/또는 기타 예측 표지자 수치에 의한 생물학적 표지자 측정을 통한 근위축성측삭경화증(루게릭병) 환자에서 뉴로나타-알주 투여시 지표로 작용할 수 있는 생물학적 표지자에 대한 평가 - MFDS 제출의 경우 1) 시험군 1과 2를 대상으로 투여 시점으로부터 6개월, 12개월 시점의 폐기능 검사(SVC) 변화량, HHD 변화량, EQ-5D-5L 변화량, ALSAQ-40 변화량, Time to death 확인 2) Main Study 이후 진행되는 시험군 1과 2의 장기 유효성 및 안전성의 탐색적 확인 (폐기능검사(SVC), 근력검사(HHD), Time to first event, Time to death, EQ-5D-5L, ALSAQ-40, 이상사례, 실험실적 검사 등의 평가) 3) 시험군 1과 2를 대상으로 싸이토카인 및/또는 기타 예측 표지자 수치에 의한 생물학적 표지자 측정을 통한 근위축성측삭경화증(루게릭병) 환자에서 뉴로나타-알주 투여시 지표로 작용할 수 있는 생물학적 표지자에 대한 평가 |
|
| 11) 임상시험 방법 | 1. 시험 대상자 수: 126명(실제 등록인원) 2. 단계 및 디자인: - Main Study: 이중눈가림, 무작위배정, 다기관, 위약대조, 평행 제3상 임상시험 - Observational Study: 다기관, 제3상 임상시험 후 관찰연구 3. 용법/용량 및 투여방법 - 시험약: 체중 1 kg당 0.1 mL (1.0x106 세포)를 뇌척수강 내로 투여 - 대조약: 체중 1 kg당 0.1 mL를 뇌척수강 내로 투여 - 병용약: 허가사항에 따라 복용(매 12시간 간격으로 50 mg씩 최소한 식사 1시간 전 또는 2시간 이후 복용) 4. 투여기간 (1) 시험약 및 대조약: - 시험군 1: 26일 간격으로 2회 시험약 투여 후, 3개월 간격으로 3회 대조약 투여/이후 26일 간격으로 2회 대조약 투여 - 시험군 2: 26일 간격으로 2회 시험약 투여 후, 3개월 간격으로 3회 시험약 투여/이후 26일 간격으로 2회 대조약 투여 (2) 대조군 : 26일 간격으로 2회 대조약 투여 후, 3개월 간격으로 3회 대조약 투여/이후 26일 간격으로 2회 시험약 투여 (3) 병용약 : 14개월(전문가의 의학적 판단에 따라 이상사례로 인해 리루졸 투여가 불가한 대상자가 아닌 경우, 모든 투여군에서 리루졸을 병용약으로 복용) 5. 추적 관찰 기간 첫 투약 후 36개월까지 6. 1차 유효성 평가변수 (1) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 12개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 (MFDS, FDA) (2) 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 1과 대조군의 치료적 유효성 비교 (MFDS) 7. 2차 유효성 평가변수 (1) FDA 제출의 경우 - 12개월 시점에서의 ALSFRS-R 변화량(시험군 2와 대조군) - 12개월 시점에서의 Time to first event(시험군 2와 대조군) - 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 - 6개월 시점에서의 ALSFRS-R 변화량(시험군 2와 대조군) - 6개월 시점에서의 Time to first event(시험군 2와 대조군) - 12개월 시점에서의 SVC 변화량(시험군 2와 대조군) - 6개월 시점에서의 SVC 변화량(시험군 2와 대조군) (2) MFDS 제출의 경우 - 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 - 12개월 시점에서의 ALSFRS-R 변화량(시험군 2와 대조군) - 6개월 시점에서의 ALSFRS-R 변화량(시험군 1과 대조군) - 12개월 시점에서의 Time to first event(시험군 2와 대조군) - 6개월 시점에서의 Time to first event(시험군 1과 대조군) 8. Observational Study - FDA 제출의 경우 시험군 2와 대조군에 대해서, MFDS 제출의 경우 시험군 1과 시험군 2, 대조군에 대해서 아래와 같은 평가를 진행한다 - 36개월 시점에서의 SVC, HHD 변화량 - 36개월 시점에서의 Time to first event, Time to death - 36개월 시점의 EQ-5D-5L 및 ALSAQ-40의 변화량 9. 안전성 평가: 이상사례, 실험실적 검사(혈액학적/혈액화학적 검사, 소변검사), 신체검진 및 활력징후, 체중, 심전도/X-ray 검사 결과 |
|
| 12) 1차 지표 | - 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 12개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 2와 대조군의 치료적 유효성 비교 (MFDS, FDA) - 근위축성측삭경화증(루게릭병) 환자를 대상으로 투여 시점으로부터 6개월 시점에서의 Joint rank score(기능 및 생존 기간에 대한 통합분석)로 평가되는 시험군 1과 대조군의 치료적 유효성 비교 (MFDS) |
|
| 13) 임상시험기간 | 한국 식품의약품안전처(MFDS) 및 임상시험심사위원회(IRB)승인일로부터 약 57개월 | |
| 14) 목표 시험대상자 수 | 125명(실제 등록인원 126명) | |
| 3. 시험결과 | 1) 1차 지표 통계분석방법 | - 12개월 시점에서 시험군 2와 대조군간 CAFS를 이용하여 ALSFRS-R 점수와 생존기간으로 계산되는 Joint rank score 차이 및 6개월 시점에서 시험군 1과 대조군간 CAFS를 이용한 ALSFRS-R 점수와 생존기간으로 계산되는 Joint rank socre 차이를 ANCOVA를 사용해 분석함. 베이스라인 ALSFRS-R score progression rate, 베이스라인 시점 연령(25세~54세미만 vs 54세 이상), ALS type(bulbar/limb) 및 ALSFRS-R 베이스라인 점수를 공변량으로 보정함. - 각각의 가설에서 시험군과 대조군 간의 Joint rank score의 LS 평균값 차이(LS mean difference)에 대한 95% 양측 신뢰구간이 0을 포함하지 않으면 시험군의 대조군 대비 우월성을 입증한 것으로 판단함. |
| 2) 결과값 | 1. 본 연구의 1차 유효성 평가에 대해서 평가변수는 ITT 군을 주 분석군으로 함 - 12개월 시점에서 시험군 2와 대조군간 CAFS에서 유의한 차이가 확인되지 않아, 유효성을 입증하지 못함. 시험군 2에서와 대조군에서의 CAFS Rank Score의 LS 평균값 차이 [95% CI]는 -8.75 [-19.73, 2.23], 였으며 p-value = 0.118로 통계적으로 유의하지 않음. - 6개월 시점에서 시험군 1과 대조군간 CAFS에서 유의한 차이가 확인되지 않아, 유효성을 입증하지 못함. 시험군 1에서와 대조군에서의 CAFS Rank Score의 LS 평균값 차이 [95% CI]는 -3.89 [-11.87, 4.08], 였으며 p-value = 0.339로 통계적으로 유의하지 않음. 2.본 연구에서 1차 유효성 평가에 대해서 평가변수는 Slow progressor로 정의된 분석군으로 추가 분석을 함 - 12개월 시점에서 시험군 2와 대조군간 CAFS에서 유의한 차이가 확인되어, 유효성을 입증함. 시험군 2에서와 대조군에서의 CAFS Rank Score의 LS 평균값 차이 [95% CI]는 6.86 [0.28, 13.45], 였으며 p-value = 0.041로 통계적으로 유의함 - 12개월 시점에서 시험군 1와 대조군간 CAFS에서 유의한 차이가 확인되어, 유효성을 입증함. 시험군 1에서와 대조군에서의 CAFS Rank Score의 LS 평균값 차이 [95% CI]는 7.29 [0.97, 13.60], 였으며 p-value = 0.024로 통계적으로 유의함 |
|
| 4. 사실발생(확인)일 | 2025-04-25 | |
| 5. 향후계획 | 최종 임상시험결과보고서 식약처 제출 및 정식 품목허가 절차 진행 예정 | |
| 6. 기타 투자판단과 관련한 중요사항 | ||
| (1) 2.주요 내용 중 7)신청일, 8)승인일은 FDA 기준입니다. (2) 4.상기 사실발생(확인)일은 당사가 임상수탁기관(CRO)으로부터 임상시험 결과보고서 최종본(CSR Final)을 전달받은 날짜입니다. (3) 본 연구에서 ALSFRS-R, SVC에 대해 Slow progressor로 정의된 분석군으로 추가 분석을 하였습니다. - 6개월 Slow progressor 분석군의 12개월 시점에서 시험군 1과 대조군간 ALSFRS-R score에서 유의한 차이가 확인되어, 유효성을 입증함. 시험군 1에서와 대조군에서의 ALSFRS-R의 LS 평균값 차이[95% CI]는 4.8[1.9, 7.6], 였으며 p-value = 0.001로 통계적으로 유의함 - 6개월 Slow progressor 분석군의 12개월 시점에서 시험군 2과 대조군간 ALSFRS-R score에서 유의한 차이가 확인되어, 유효성을 입증함. 시험군 2에서와 대조군에서의 ALSFRS-R의 LS 평균값 차이[95% CI]는 2.9[0.6, 5.2], 였으며 p-value = 0.012로 통계적으로 유의함 - 12개월 Slow progressor 분석군의 12개월 시점에서 시험군 2과 대조군간 ALSFRS-R score에서 유의한 차이가 확인되어, 유효성을 입증함. 시험군 2에서와 대조군에서의 ALSFRS-R의 LS 평균값 차이[95% CI]는 2.3[0.4, 4.2], 였으며 p-value = 0.017로 통계적으로 유의함 - 6개월 Slow progressor 분석군의 12개월 시점에서 시험군 1과 대조군간 SVC에서 유의한 차이가 확인되지 않아, 유효성을 입증하지 못함. 시험군 1에서와 대조군에서의 SVC의 LS 평균값 차이[95% CI]는 5.8[-5.6, 17.2], 였으며 p-value = 0.317로 통계적으로 유의하지않음 - 6개월 Slow progressor 분석군의 12개월 시점에서 시험군 2과 대조군간 SVC에서 유의한 차이가 확인되어, 유효성을 입증함. 시험군 2에서와 대조군에서의 SVC의 LS 평균값 차이[95% CI]는11.6[2.1, 21.1], 였으며 p-value = 0.017로 통계적으로 유의함 - 12개월 Slow progressor 분석군의 12개월 시점에서 시험군 2과 대조군간 SVC에서 유의한 차이가 확인되어, 유효성을 입증함. 시험군 2에서와 대조군에서의 SVC의 LS 평균값 차이[95% CI]는 9.5[0.8, 18.3], 였으며 p-value = 0.033로 통계적으로 유의함 (4) 본 공시 내용은 당사의 IR자료, 보도자료, 학회 발표 자료 등에 사용할 예정입니다. |
||
| ※ 관련 공시 | 2020-02-19 투자판단 관련 주요경영사항(뉴로나타-알주의 미국FDA 3상 임상시험계획 신청) 2020-03-20 투자판단 관련 주요경영사항((뉴로나타-알주의 미국FDA 3상 임상시험계획 심사 보류 (Clinical Hold)) 2020-07-24 투자판단 관련 주요경영사항(줄기세포 치료제인 뉴로나타-알주의 미국 FDA 3상 임상시험계획 승인(Remove Clincal Hold)) 2024-12-18 투자판단 관련 주요경영사항(임상시험 결과)(근위축성측삭경화증(루게릭병) 환자를 대상으로 뉴로나타-알주(자가골수유래중간엽줄기세포)의 유효성 및 안전성 평가를 위한 3상 임상시험 결과 Topline data 수령) |
|
| (출처) Dart 전자공시시스템 |
당사의 뉴로나타-알 치료제의 진행 현황을 요약하면 다음과 같습니다. 추후 식약처에서 요구한 보완자료 제출 후 식약처 변경 허가 신청에 대한 결과 수령 및 FDA 임상 3상 품목허가 신청 등의 일정이 예상되는 상황입니다.
| [뉴로나타-알 진행 현황] |
| 시기 | 내용 |
|---|---|
| 2014년 7월 30일 | 세계 최초 ALS 줄기세포 치료제로 식약처 조건부 품목허가 (전체 ALS 대상) |
| 2014년 ~ 2016년 | 임상 2상 완료, 실제 환자 400명 이상 처방 및 사용 |
| 2020년 7월 | 미국 FDA 임상 3상 시험계획 승인 |
| 2020년 8월 | 식약처에 FDA 승인된 프로토콜과 동일 버전으로 IND 변경 승인 |
| 2021년 4월 | 국내외 다기관 임상 3상 개시(ALSummit) |
| 2024년 10월 | 3상 임상시험 마지막 대상자 방문 종료 |
| 3상 임상시험 바이오마커 분석 | |
| 2024년 11월 | 3상 임상시험 바이오마커 분석 결과 Parexel 송부 |
| 2024년 12월 | 임상 3상 전체 환자군 대상 주요 평가지표 통계적 실패 공시 |
| 2025년 1월 ~ 3월 | 3상 임상시험 post-hoc analysis(사후비교분석) (코아스템켐온/Parexel) |
| 2025년 4월 | 저속진행 환자군에서 유의미한 효과 확인 후, 식약처에 효능효과군 축소 변경 허가 신청 |
| 2025년 7월 | 식약처, 심사 과정 중 일부 보완자료의 제출 요청 (기한: 2025년 9월 1일까지) |
| 2025년 8월 | 1차 자료 보완 제출 기한 연장 신청 및 승인(25년 10월 31일까지로 연기, GCP 실사 기간보다 보완자료 제출기한이 빠르기 때문에 GCP 실사 후 자료 제출하는 것으로 연기) |
추후 식약처에서 오송 ATMP센터에 대한 GCP 실사(의약품 제조업체의 우수 제조관리(GMP) 및 품질관리(GCP) 기준 준수 여부를 확인하기 위해 식약처가 실시하는 현장 점검)를 진행할 예정이며, 이 때 보완자료와 변경 허가 신청 등에 대해 미팅을 진행할 예정입니다. 식약처에서 변경 신청 허가에 대한 승인, 반려 또는 추가적인 보완자료 제출 요구 등 어떠한 방식으로 진행이 될지는 현재 불확실한 상황이며, 어떠한 결과가 나오더라도 시간이 다소 소요될 것으로 예상됩니다. 이와 별도로 FDA 임상 3상에 대한 품목허가 신청을 진행할 예정이며, 2025년말에 글로벌 임상수탁기관(CRO)와의 미팅을 시작으로, 2026년 1분기 내 품목허가 자료 현황 및 분석, 구성안 기획 및 작성을, 2026년 2분기 내 품목허가(BLA) 신청 전 FDA 사전 협의 미팅 진행, 생물의약품 품목허가(BLA) 신청서 작성 및 임상시험 안전성·유효성 종합보고서(ISS/ISE) 작성을, 2026년 3분기 내 품목허가(BLA) 신청서 공식 제출 및 보완자료/추가자료 제출을 진행할 예정입니다. 이는 예상 일정이며, 예상 시기 역시 임상수탁기관, FDA 등과의 협의를 통해 변경될 수 있습니다.
요약하면 뉴로나타-알은 2014년 7월, 식약처로부터 루게릭병(ALS) 줄기세포 치료제로 조건부 품목허가를 받았으며, 추가 임상시험을 통한 안전성과 유효성 검증이 필요했기 때문에 2016년까지 국내 임상 2상이 마무리되었습니다. 그러나 글로벌 상업화를 위해서는 확실한 데이터 확보가 필요했기 때문에, 당사는 2020년 2월 미국 FDA에 임상 3상 시험계획(IND)을 제출하였으며, 2020년 7월 보완 절차를 거쳐 공식적으로 3상 시험계획이 승인되었습니다. 이를 바탕으로 2021년 4월부터 국내 다기관이 참여하는 임상 3상이 본격적으로 개시되었으며, 약 3년 반에 걸쳐 진행된 임상 3상 결과는 2024년 12월 18일 발표되었습니다.
임상시험 최종보고서(CSR)에 따르면 전체 환자군(ITT 분석군)을 대상으로 한 1차 유효성 평가지표인 CAFS(기능 및 생존 통합 지표) 및 2차 유효성 평가지표인 ALSFRS-R 점수(ALS 환자의 신체 기능 점수) 등에서 치료군과 위약군 간에 통계적으로 유의한 차이가 확인되지 않았습니다. 즉, 전체 환자군을 대상으로는 약물의 임상적 유효성을 입증하지 못하였습니다. 다만, 일부 바이오마커(질병 진단, 치료 반응 예측, 예후 평가 등에 활용되는 생체 내 특정 물질(단백질, 유전자, 대사체 등)에서는 CAFS뿐만 아니라 ALSFRS-R, SVC(폐기능검사)에서도 유효성이 입증되었기에, 당사는 이를 기반으로 식약처에 전체 환자군이 아닌 특정 하위집단, 즉 질병 진행이 상대적으로 느린 환자군(Slow Progressor, NfL 52pg/mL 미만)으로 효능 효과 대상을 축소하여 식약처에 변경 허가를 신청하게 되었습니다.
이후 2025년 7월 3일, 식약처는 허가 변경 심사 과정에서 일부 보완자료 제출이 필요하다는 의견을 제시했습니다. 보완자료 제출 기한은 2025년 9월 1일까지로 안내되었으나, 식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다.하지만 보완 서류 제출 기한이 연장됨에 따라 식약처에서 현장실사(GCP 실사) 일정을 연기한다는 통보를 하였고, 구체적인 일정은 미정이나, 10월 또는 11월 중 진행할 것으로 예상됩니다.이에 당사는 보완 자료 제출 전 식약처와의 대면 미팅을 9월 중으로 협의하고 있으며, 해당 대면 미팅을 진행한 후 보완 서류 제출기한인 10월 31일까지 보완 자료를 제출할 예정입니다. 이후 2025년 12월에서 2026년 1월 중으로 식약처에서 GCP 실사 결과와 당사가 제출할 보완 자료를 검토한 후 품목허가 여부를 통보할 것으로 당사는 예상하고 있습니다. 다만, 추가적인 자료 보완 요구, 중앙 약사 심의위원회 개최 등이 발생할 경우 상기 일정에서 다소 지연될 수 있으며, 정확한 시점을 예측하기는 어렵습니다. 또한 일정대로 진행된다고 하더라도 무조건적인 품목허가 승인을 의미하지는 않으며, 이처럼 아직 승인, 반려, 추가자료 요구 등 여러 시나리오가 존재하기 때문에 확실히 승인 여부 및 시점에 대해 단정하기는 어려운 상황입니다.
한편 당사는 2025년 말 글로벌 CRO와 미팅을 진행한 뒤, 2026년 1분기에는 FDA 품목허가 자료 검토 및 작성 작업을 시작하고, 2분기에는 사전 협의(Pre-BLA meeting)를 거쳐, 3분기 중 품목허가신청(BLA)을 공식적으로 제출할 계획입니다. 이는 일부 바이오마커에서는 임상적 유효성을 보여줬기 때문에 충분히 품목허가 신청을 할 수 있다는 당사의 생각이며, 실제로 바이오젠의 토퍼슨의 경우에도 NfL(신경세포 손상 시 방출되는 단백질(바이오마커))의 감소를 기반으로 FDA 품목허가를 승인 받았기에, 당사 역시 FDA 품목허가 신청을 진행할 계획입니다.
뉴로나타-알 임상 3상의 주요 타임라인과 당사가 임상 3상 결과를 기반으로 한 FDA 품목허가 신청의 전략 및 근거 등은 다음과 같습니다.
| [뉴로나타-알 임상 3상 주요 타임라인 및 의미] |
| 1. 뉴로나타-알 3상 임상시험 임상시험용의약품 공급 | 2021년 04월 29일에서 2024년 10월 02일까지 투여 대상자에게 임상시험용의약품을 생산하여 공급하였습니다. |
| 2. 뉴로나타-알 3상 임상시험 바이오마커 분석을 위한 검체 채취 | 바이오마커 분석에 대해 투여 대상자의 뇌척수액과 말초혈액을 투여 전과 후에 3상 임상시험 프로토콜에 정해진 시점에 채취하여 보관하였습니다. |
| 3. 뉴로나타-알 3상 임상시험 바이오마커 분석 | 바이오마커 분석은 3상 임상시험의 마지막 대상자 방문이 완료된 이후 측정하는 것으로 계획하였습니다. 이에 마지막 대상자 방문이 2024년 10월 2일 완료되어 2024년 10월 07일부터 2024년 10월 20일까지 Neurofilament Light Chain (NfL), Monocyte Chemoattractant Protein-1 (MCP-1), Transforming Growth Factor-Beta1 (TGF-β1), Follistatin-like protein 1 (FSTL1), Brain-Derived Neurotrophic Factor (BDNF), Vascular Endothelial Growth Factor (VEGF)및 Fibroblast Growth Factor 2 (FGF2) 등의 바이오마커를 분석하였습니다. 분석한 결과에 대하여 3상 임상시험 CRO 기관인 Parexel Database에 2024년 11월 20일 업로드 완료하였습니다. |
| 4. 뉴로나타-알 3상 임상시험 결과 |
2024년 12월 18일 3상 임상시험 CRO 기관인 Parexel을 통해 Topline 결과를 수령하여 유효성평가 지표에서 무작위배정된대상자(ITT 분석군) 통계적 유의성을 확보하지 않은 것으로 확인하였습니다. 1차 유효성 평가지표로 생존과 기능 지표를 동시 평가하는 Joint Rank Score (JRS=CAFS)를 진행하였고, 추가적인 유효성 평가지표로 ALSFRS-R(기능지표), SVC (폐기능), HHD(근력 기능), 뇌척수액과 말초혈액 생물학적 표지자 측정(바이오마커)를 측정하는 것으로 했습니다. 이중 생물학적 표지자 측정을 하는 바이오마커 분석에서 무작위배정된대상자(ITT 분석군)에서 대조군 대비 시험군에서 NfL, MCP-1, TGF-β1, FSTL1, BDNF, VEGF, FGF2 이상 7종이 유의미한 차이를 보이는 것을 확인했습니다. SOD-1 유전변이를 가지는 근위축성측삭경화증(루게릭병, ALS) 대상으로 3상 임상시험을 진행한 Biogen 사의 토퍼슨(칼소디)에서 ALSFRS-R, SVC, HHD, CAFS 등의 유효성평가 지표에서 통계적 유의성을 확보하지 못해 실패했지만, NfL의 변화를 Surrogate marker로 인정받아 미국 FDA에 가속 승인(2023.04.25) 받은 사례가 존재합니다. 한국 식품의약품안전처(MFDS)에 2025년 08월 20일 근위축성측삭경화증(루게릭병, ALS) 대상으로 토퍼슨(칼소디)에 대해 품목허가를 승인받았습니다. 이러한 결과를 토대로 뉴로나타-알주 3상 임상시험에 대해 CAFS, HHD, SVC, ALSFRS-R 등의 유효성 평가 지표의 통계적 유의성을 확보하지 못했지만 NfL의 바이오마커에서 대조군 대비 시험군에서 뉴로나타-알주 투약 후 통계적 유의성을 확보했습니다. 또한 Biogen사의 Tofersen이 확인한 NfL 외에 MCP-1, TGF-β1, FSTL1, BDNF, VEGF, FGF2의 추가적인 6종의 바이오마커 변화를 확인하여 한국 식품의약품안전처에 품목허가 신청을 하였고, 미국 FDA에 Pre meeting 후 BLA를 신청할 예정입니다. |
| 5. 뉴로나타-알주 3상 임상시험 post-hoc analysis(사후비교분석) |
3상 임상시험 결과에서 주분석군에 무작위배정된 대상자(ITT 분석군)에서 바이오마커 지표 외에 항목은 대조군 대비 시험군에서 통계적 유의성을 확보하지 못한 것을 확인하였습니다. 바이오마커의 경우 무작위배정된 대상자(ITT 분석군)에서 대조군 대비 시험군에서 통계적 유의성을 나타내는 것을 확인하였습니다. Joint Rank Score (JRS=CAFS), ALSFRS-R(기능지표), SVC (폐기능) 등의 유효성을 나타내는 sub group을 찾기 위해 2025년 1월부터 추가 부석을 진행하였습니다. 그 결과 Slow progressor로 정의된 군에서 대조군 대비 시험군에서 Joint Rank Score (JRS=CAFS), ALSFRS-R(기능지표), SVC (폐기능) 유효성 지표가 통계적 유의성을 나타내는 것을 확인하였습니다. 또한 무작위배정된 대상자(ITT 분석군)에서 통계적 유의성을 나타내었던 바이오마커 역시 Slow progressor 군에서 동일하게 대조군 대비 시험군에서 통계적 유의성을 나타내는 것을 확인하였습니다. Post-hoc analysis 결과에 대해 임상시험 CRO 기관인 Parexel에 공유하였고, Parexel 통계팀 등에서 동일한 결과를 나오는 것을 확인하여 해당 결과를 포함하여 2025년 04월 24일 임상시험 결과 보고서를 수령하였습니다. |
이와 관련하여 통상적인 식약처 및 FDA의 품목허가 프로세스는 다음과 같습니다.
| [FDA 및 식약처 품목허가 프로세스별 소요 시간 비교] |
| 단계 | FDA | 식약처 (MFDS) |
|---|---|---|
| 자료 준비 및 사전 협의 | 3~6개월 (임상 종료 후 제출 준비) | 수개월~1년 이상 |
| 예비 심사 | 60일(자료 완비 여부 확인) | 심사 기간 내 서류 접수 후 심층 심사 진행 |
| 본 심사 및 현장 실사 | 약 10~12개월, 신속 심사 시 6개월 가능 | 6~12개월+현장 실사, 상황에 따라 변동 |
| 보완ㆍ추가 임상 요청 | 상황에 따라 보완자료 제출 가능, 추가 임상은 제한적(신속처리 추진 가능) | 추가 임상ㆍ보완자료 제출 반복, 1~3년 이상 소요 가능 |
| 전체 소요 기간 | 평균 1.5~2년 | 통상 2~5년 |
| 조건부 승인 | 부분집단 허가, 조건부 허가 가능 | 제한적, 조건부 허가보다는 보완 임상 요구가 많음 |
|
(출처) FDA Drugs Approval Process (FDA.gov), Synerg BioPharma(2025), 식약처 자료 및 연구: MFDS Drug Approval Guidelines, PMC 논문(2023~2024) |
이처럼 국내와 미국의 허가 절차는 법적ㆍ제도적으로 독립되어 있으며 상호 종속되지 않습니다. 국내에서는 2025년 4월 품목변경허가 신청을 완료했고, 하반기 실태조사(현장실사)가 예정되어 있습니다. 해당 절차는 임상시험 신뢰성과 자료 적합성을 평가하는 단계로, 이후 보완자료 제출을 거쳐 최종 허가 여부가 결정될 예정입니다. 당사는 현재 변경 허가 신청에 대한 보완 서류 제출은 10월, 식약처 현장 실사는 10월 또는 11월 중으로 진행할 것으로 예상하고 있으며, 현장 실사는 제조공정, 품질관리 시스템, 설비 및 위생관리 등을 중심으로 진행됩니다. 해당 실태조사 결과에 따라 현장 보완 또는 개선사항이 있을 경우 추가 조치가 요구될 수 있기 때문에 최종 승인 또는 반려까지의 시일이 다소 소요될 수 있으며, 정확한 시점을 예측하기가 어려운 상황입니다.
과거 뉴로나타-알 1/2상 임상시험 종료 후 조건부 품목허가까지 약 1년 정도 소요됐으며, 관련 진행 내역은 다음과 같습니다.
| [과거 뉴로나타-알 임상 1/2상 진행 내역] |
| 시기 | 내용 |
|---|---|
| 2013년 08월 | 뉴로나타-알주 1/2상 임상시험 종료 |
| 2013년 12월 | 식약처로부터 희귀의약품 지정승인 |
| 2014년 02월 | 식약처에 품목허가 신청 |
| 2014년 03월 | 식약처 심사부서(세포유전자치료제과), 1차 자료 보완 요구 |
| 2014년 05월 | 식약처 임상심사부서(임상정책과)에서 GCP 실사 |
| 2014년 06월 | 자료보완에 대한 답변자료를 제출 |
| 2014년 07월 | 조건부 품목허가 승인 |
위와 같은 과거 조건부 허가 사례를 참고하여 현재 진행되고 있는 한국 식약처 절차는 다음과 같습니다.
| [현재 뉴로나타-알 임상 3상 진행 상황 및 예상일정] |
| 시기 | 내용 |
|---|---|
| 2025년 04월 | 뉴로나타-알 품목허가 신청 |
| 2025년 07월 | 1차 자료 보완 요구(25년 09월 01일까지 제출 기한) |
| 2025년 08월 | 뉴로나타-알 GCP 실사 안내 (25.09.02~03, 25.09.11~12 실태조사) |
| 1차 자료 보완 제출 기한 연장 신청 및 승인 (25년 10월 31일까지로 연기, GCP 실사 기간보다 보완자료 제출기한이 빠르기 때문에 GCP 실사 후 자료 제출하는 것으로 연기) |
|
| 1차 자료 보완 제출 기한 연장 승인 및 제출 기한 연장으로 GCP 실사 일정 연기 통보(식약처) |
|
| 2025년 10월 | 자료보완에 대한 답변 자료 제출 (예정) |
| 2025년 11월 | GCP 실사 진행 (예정) |
| 2026년 12월 ~ 2026년 1월 |
GCP 실사 결과 및 자료보완 답변자료 검토 후 품목허가 여부 통보 (예정) |
상기와 같이 진행되고 있고, 현재 품목허가까지 남은 규제기관 일정은 보완자료 제출, GCP 실사, 제출된 보완자료 검토로 2014년 사례로 보았을 때 2025년 10월 31일 자료보완에 대한 답변 자료를 제출한다는 전제로 다음과 같이 예상합니다.
- 2025년 10월 31일, 자료보완에 대한 답변 자료 제출
- 2025년 11월, GCP 실사
- 2025년 12월 또는 2026년 01월, GCP 실사 결과 및 자료보완 답변자료 검토 후 품목허가 여부 통보
다만, 추가적인 자료 보완 요구, 중앙 약사 심의위원회 개최 등이 발생할 경우 상기 일정에서 다소 지연될 수 있으며, 정확한 시점을 예측하기는 어렵습니다. 또한 일정대로 진행된다고 하더라도 무조건적인 품목허가 승인을 의미하지는 않습니다.
미국에서는 별도의 트랙으로, 2025년 하반기 Type-C 미팅(사전미팅)을 시작으로 2026년 상반기 Pre-BLA 협의(품목허가 신청 전 협의)와 BLA 제출(품목허가 신청)을 준비하고 있습니다. 미국 전략의 핵심은 NfL(신경세포 손상 시 방출되는 단백질(바이오마커))을 포함한 다중 바이오마커 데이터를 근거로 한 가속승인(Accelerated Approval)이 목표입니다. NfL(신경섬유 아교세포 수초 단백질) 바이오마커는 신경세포 손상 시 방출되는 단백질(바이오마커)을 의미하며, 이는 2023년 FDA 조건부 승인을 받은 바이오젠의 토퍼슨 사례에서도 FDA가 NfL 감소를 승인 근거로 인정한 전례가 있기 때문에 당사의 뉴로나타-알 역시 가속승인 기대감이 존재합니다. 하지만 FDA 심사 결과, 여러 바이오마커 데이터가 승인을 허가해줄만큼 유의미하지 않는 등의 이유로 승인이 거절될 수 있으며, 바이오젠의 토퍼슨 사례를 적용하여 무조건 승인을 받을 수 있다고 확신할 수는 없는 상황입니다. 또한 첫 단계인 Type-C 미팅(사전미팅) 단계에서 FDA 측에서 부정적인 입장을 보인다면 FDA 품목허가 신청 자체를 철회할 수도 있습니다.
미국 FDA 경우 BLA 신청 전 type C meeting, Pre-BLA meeting, BLA 신청 절차로 진행됩니다.
- Type C meeting(사전미팅) : 총 105일이 소요됩니다.
1. 신청 후 21일차에 미팅 일정 및 방식(대면, 컨퍼런스 콜, 메일) 확정
2. 신청 후 75일차에 미팅 진행
3. 신청 후 105일차에 공식적인 회의록 발행
- BLA(품목허가) : Typre C meeting 결과에 대해 추가 보완 등을 진행하여 Pre-BLA meeting 진행 후 BLA 신청
1. BLA 신청 후 10개월 심사 기간이 소요
2. BLA 신청 후 GCP 실사 진행
3. BLA 신청 후 자료 보완 요구
4. 자료 보완 요구에 대한 답변자료 제출
5. GMP 실사
6. 최종 결과 통보
한국 식약처의 경우, 추가적인 보완자료 요구, 중앙 약사 심의위원회 개최 등의 사유로 추가적인 심사 기간이 발생할 수 있으며, 미국 FDA의 경우 전문가위원회 개최, 추가적인 자료보완 요구 등으로 추가적인 심사 기간이 발생할 수 있습니다. 또한 FDA 일정은 Type C meeting(사전미팅) 결과 추가적인 자료 분석 등이 필요할 경우 BLA(품목허가) 신청 자체가 지연될 수 있으며, 식약처와 FDA 심사 프로세스 정리는 다음과 같습니다.
| [MFDS(식약처) 및 FDA 심사 프로세스(예상)] |
| 구분 | MFDS(식약처) | FDA |
|---|---|---|
| Type C meeting 신청 | 해당사항 없음 | 2025년 10월 |
| Type C meeting 방식 결정 | 해당사항 없음 | 2025년 11월 |
| Type C meeting | 해당사항 없음 | 2026년 01월 |
| Type C meeting 회의록(공식) | 해당사항 없음 | 2026년 02월 |
| 품목허가 신청(FDA=BLA) | 2025년 04월 29일 | 2026년 1분기(pre 미팅 후) |
| 자료보완 요구 | 2025년 07월 02일 | 2026년 2~3분기 예상 |
| GCP 실사 | 2025년 11월 예상 | 2026년 3분기 또는 4분기 예상 |
| GMP 실사 | 해당사항 없음 | 2026년 4분기 예상 |
| 품목허가 승인 | 2025년 12월 예상 | 2027년 1분기 |
|
(주1) GMP실사의 경우, 임상시험용의약품 생산을 진행한 코아스템켐온 용인 GMP 공장에 대해 3년 주기로 정기 실사를 받아 적합판정서를 받았기에 한국 식품의약품안전처는 GMP 실사 면제 사항입니다. |
| (주2) 품목허가 승인의 경우, 추가적인 자료 보완요구, 중앙 약사 심의위원회 개최(식약처), 전문가위원회 개최(FDA) 등으로 추가적인 심사 기간 발생할 수 있습니다 |
또한 식약처의 변경 허가는 저속진행군이라는 특정 타겟군을 설정하여 변경 허가 신청을 완료하고, 보완 요구를 받은 상황입니다. 식약처와의 협의를 통해 추후 예정된 식약처의 현장실사(GCP) 일정을 먼저 진행하여 해당 현장실사 및 미팅 이후 보완 요구에 대한 자료 제출을 진행하는 일정으로 계획하였으나, 보완 자료 제출 기한이 연기되면서 GCP 일정 역시 연기된 상황입니다. 반면 FDA 품목허가 신청의 경우, 국내 식약처와는 다르게 특정 타겟군을 설정하지 않고 임상 3상 결과, 유의미한 데이터를 보인 여러 바이오마커(바이오젠의 토퍼슨의 승인 근거로 인정받은 NfL 바이오마커 포함)를 기반으로 사전협의 및 품목허가 신청을 진행할 예정입니다. 단, 이는 현재 당사의 판단에 의한 것이며, 추후 임상수탁기관 및 FDA와의 사전 미팅, 품목허가 신청 전 미팅 등에서 논의한 사항 및 피드백 등을 바탕으로 품목허가 신청의 전략이 변경될 수 있습니다.
결론적으로 당사는 국내 식약처와 미국 FDA 품목허가 절차를 병행하되 각각 독립적으로 운영하고 있습니다. 즉, 국내에서는 식약처 허가 안정성과 신뢰성을 확보하고, 미국에서는 바이오마커 기반 전략으로 글로벌 진입을 준비하는 투트랙 접근을 실행하고 있습니다. 또한 당사의 계획대로 전체 루게릭병 환자를 대상으로 진행한 FDA 품목허가가 2027년 상반기에 승인이 된다면 2022년 9월 FDA 가속승인(조건부 판매허가)를 받아 2024년 확증임상 실패로 시장에서 퇴출되었던 아밀리스의 렐리브리오가 약 14개월동안 4억 301만불(한화로 약 5,506억원) 매출이 발생한 점을 기반으로 유사한 수준의 매출이 2027년 하반기부터 발생할 것으로 기대하고 있습니다. 하지만 이는 당사의 전망치이며, 이미 임상 3상의 통계적 유의성을 확보하지 못한 점, 여러 바이오마커 기반으로 품목허가를 신청했으나 일부 또는 전부 승인받지 못하거나, 일부 바이오마커 기반으로 FDA 품목허가를 승인받더라도 전체 루게릭병 환자 대상이 아닌 크게 축소된 타겟군 대상으로 진행될 수 있는 등의 가능성으로 인해 뉴로나타-알 파이프라인의 실적은 불확실한 상황입니다. 이처럼 당사의 핵심 파이프라인인 뉴로나타-알의 FDA 품목허가가 불발되거나, 승인을 받더라도 당사의 기대치만큼 매출이 발생하지 못한다면 당사의 사업에 매우 중대한 악영향을 미치게 되어 계속기업가정의 불확실성이 증대될 수 있습니다.
또한 당사는 뉴로나타-알 파이프라인 외에도 시신경척수염(NMOSD), 다계통위축증(MSA), 소뇌실조증 등 다양한 줄기세포치료제 파이프라인을 보유하고 있고 임상 단계가 진행되고 있습니다. 하지만 제한된 개발비용과 인력 자원을 감안하여 우선순위가 높은 뉴로나타-알 중심으로 추진되고 있기 때문에 상기 다른 파이프라인들은 일시적으로 개발 속도가 조정되고 있는 상황입니다.
당사는 임상시험용의약품 제조소로 승인된 용인 제조소에서 오송 첨단바이오의약품 제조시설(ATMP 센터)로의 생산설비 이전을 2024년 5월에 최종 완료하였으며, 현재 오송 ATMP 센터에서는 식약처의 제조소 추가 승인을 위한 준비 작업이 진행 중입니다. 제조소 추가 자료 마련을 완료하여 식약처에 제조소 추가 승인 신청 및 승인을 2026년 1분기 이후로 예상하고 있습니다. 식약처 제조소 추가 승인 후 시신경척수염 치료제인 CE211NS21의 임상시험을 개시할 예정입니다. 임상시험은 서울대학교병원 신경과, 국립암센터 신경과, 경희대학교병원 신경과, 한양대학교병원 신경과에서 다기관으로 실시하는 것으로 승인되었고, 4개 기관 PI 관계자들과 일정을 공유하고 있습니다.
또한 당사는 뉴로나타-알 플랫폼 기반의 세포치료제를 활용하여 다계통위축증에 대해 연세대학교 세브란스병원에서 임상 1상을 완료하였고, 소뇌실조증에 대해서는 칠곡경북대학교병원에서 연구자 주도 임상(IIT)을 종료하였습니다. 두 질환은 모두 파킨슨증(parkinsonism)의 임상적 특징과 병태생리적 유사성을 공유하고 있으며, 특히 MSA-C 아형에서 소뇌 실조 증상이 중심적으로 나타난다는 점에서 치료 타겟의 중복 가능성이 제기되고 있습니다. 이에 따라 당사는 두 적응증을 단일 파이프라인으로 통합하여 임상 전략을 수립하는 방안을 검토 중이며, 이를 주도할 책임 연구자(PI) 선정도 병행하고 있습니다. 다만 현재는 뉴로나타-알(ALS) 적응증에 개발 역량을 집중하고 있는 상황으로, 관련 계획은 아직 구체적인 임상 일정으로 확정되지 않은 단계입니다.
당사가 기술이전을 완료한 루푸스 치료제(CS20AT04)는 초기 임상 1상 종료 후, 한양대학교병원에서 루푸스 신염 및 혈구감소증 대상자로 연구자 임상시험을 실시하였습니다. 임상 1상 및 연구자 주도 임상시험의 대상자 수가 적기 때문에 유효성 및 안전성을 입증해야 하는 임상 2상 전에 추가적인 연구자 주도 임상시험 계획하여 이를 통해 더 많은 수의 대상자에서 적절한 대상군 및 평가지표를 찾고자 하였습니다. 그러나 2019년 이후 당사의 주력 파이프라인인 뉴로나타-알의 임상 3상이 2020년 본격화됨에 따라, 내부 협의를 통해 해당 연구자 주도 임상시험은 논의를 거쳐 잠정 중단하기로 결정되었습니다. 연구자 주도 임상시험은 중단되었지만, 한양대학교병원 류마티스병원(1상 및 연구자 주도 임상시험 책임자 교수, 관계자 등), 한림제약, 당사 중앙연구소(임상팀 및 개발팀) 인원들이 매월 정기 미팅을 통해 향후 임상시험 계획에 대한 논의를 현재까지 지속해 오고 있습니다. 2025년 2월, 보건복지부의 첨단재생의료 연구 및 치료에 대한 첨단법이 시행되었고, 기존 식약처 주도의 연구자 주도 임상시험이 복지부 주관 첨단재생의료 연구 및 치료로 변경되었습니다. 향후 보건복지부 주도의 첨단재생의료 연구를 통해 적절한 대상자 및 평가지표 등의 확립을 한양대학교병원, 한림제약, 당사에서 함께 진행할 계획입니다.
따라서 당사가 뉴로나타-알주의 임상 3상 및 허가 추진에 역량을 집중하고 있기 때문에 다른 파이프라인들의 임상 진입 시기는 전략적 우선순위와 자원 배분을 고려해 조정되고 있으나, 향후 다른 파이프라인들의 임상 단계가 진행된다면 해당 파이프라인의 임상 실패, 지연, 관련 당국의 허가 또는 승인 반려 등이 발생하여 당사의 사업 현황 및 재무 현황에 부정적인 영향을 미칠 수 있습니다.
현재 식약처에서 보완자료의 제출은 2025년 10월 31일까지 연기된 상황이고, 따라서 식약처의 변경 허가 심사 결과는 발표 전이며, 이 결과에 따라 뉴로나타-알은 저속 진행 ALS 환자군 대상으로 허가 여부가 결정될 예정입니다. 하지만 결과적으로 당사의 뉴로나타-알 치료제는 임상 3상에서 전체 루게릭병 환자를 대상으로 한 시험에서 통계적으로 유의미한 효능을 입증하지 못했습니다. 따라서 임상 3상이 전체 환자군 대상에서 실패했기 때문에 원래 목표했던 전체 루게릭병 대상의 시장을 확보하기 어렵고, 이에 따른 매출 기대감도 제한될 가능성이 큽니다. 또한 효능효과군을 축소하여 진행한 변경 허가 신청이 승인된다고 해도 식약처뿐 아니라 미국 FDA에서도 유사한 허가 범위 조정 신청 및 심사가 진행될 계획이며, 각국별 허가 절차가 독립적이기 때문에 별도의 서류 제출과 심사 과정을 거쳐야 하기 때문에 이 절차가 성공할지 불확실합니다. 게다가, 식약처에서 추가 임상이나 보완 자료를 요청할 가능성이 있고, 이를 충족하기 위한 비용과 시간 부담이 늘어날 수 있습니다. 마지막으로 임상 실패와 불확실성으로 인해 당사의 주가 변동성이 커지고 당사에 대한 신뢰도가 하락하고, 투자 심리가 위축될 위험이 있으며, 새로운 경쟁 치료제가 나오거나 기존 치료법과 비교할 때 경쟁력이 약화될 위험도 존재합니다. 따라서 투자자들께서는 반드시 이 점 유의하시기 바랍니다.
| [다. 글로벌 세포치료제 및 줄기세포치료제 시장 경쟁심화에 따른 위험] 당사가 주력사업으로 영위 중인 세포치료제 시장은 2010년대 중반까지만 해도 승인 의약품이 적고 초기 단계의 시장으로 여겨졌으나, 최근 승인 의약품이 늘고 시장도 빠르게 커지면서 글로벌 제약ㆍ바이오 기업들의 참여가 증가하면서 세포치료제 시장의 경쟁이 심화되고 있습니다. 세포치료제는 주로 희귀질환이나 치료제가 없는 난치성 질환에 대한 근본적인 치료법을 제시할 수 있는 강점을 기반으로 연구개발이 활발하게 진행되고 있습니다. 따라서 특정 질병에 개발이 집중되기보다는 각 업체별로 특화된 기술을 기반으로 적응증이 전문화되어 있어 대형 제약사보다는 바이오 벤처기업이 기술개발을 주도하여 왔습니다. 현재 줄기세포치료제 시장은 상업적으로 승인된 제품의 수가 제한적이고, 각 제품이 서로 다른 적응증을 목표로 하기 때문에 동일 적응증 내에서의 경쟁 심화 위협은 상대적으로 적은 편입니다. 그러나 이는 경쟁이 없다는 의미가 아니라, 줄기세포치료제 자체가 높은 기술적 난이도와 복잡한 규제, 장기간에 걸친 임상 검증이 요구되는 분야임을 의미합니다. 현재 국내에서 허가받은 줄기세포 치료제는 총 4종에 불과하며, 지난 2011년 파미셀의 급성심근경색 치료제 '하티셀그램AMI'가 세계 첫 줄기세포치료제로 국내 승인을 받은 이후 2012년 메디포스트의 '카티스템'과 안트로젠의 크론성누공 치료제 '큐피스템'이 시판허가를 받았고, 2014년 코아스템의 루게릭병 치료제 '뉴로나타-알'이 국내 4호 줄기세포치료제로 승인을 받았습니다. 그밖에 중증 퇴행성관절염 줄기세포치료제인 네이처셀의 '조인트스템'은 2025년 8월 식약처로부터 첨단바이오의약품 품목허가 반려 처분을 통지받았습니다. 즉, 애초에 상용화 및 임상적 성공에 이르는 확률 자체가 매우 낮아 성공을 거두기 어려운 시장이라는 점을 의미합니다. 그럼에도 불구하고, 시장의 급격한 성장 가능성과 함께 국내외 대형 제약사들이 향후 줄기세포치료제 시장 진입을 모색할 것으로 예상되므로, 현재의 경쟁 구도뿐만 아니라 잠재적인 경쟁 심화와 함께 높은 기술적ㆍ상업적 리스크까지 존재합니다. 투자자 여러분께서는 반드시 이 점 유의하시기 바랍니다. |
세포치료제란 세포의 조직과 기능을 복원시키기 위하여 살아있는 자가세포, 동종세포, 또는 이종세포를 체외에서 증식ㆍ선별하거나 여타한 방법으로 세포의 생물학적 특성을 변화시키는 등의 일련의 행위를 통해 치료, 진단 및 예방의 목적으로 사용되는 의약품을 일컫는 말입니다.
세포치료제 시장은 2010년대 중반까지만 해도 승인 의약품이 적고 초기 단계의 시장으로 여겨졌습니다. 그러나 난치성 질환에 대한 미충족 수요가 존재하고 생명공학 기술의 지속적인 발전에 기인하여 세포치료제는 다른 유형 대비 월등히 높은 시장 성장률이 예상되는 반면 승인 의약품은 많지 않아 제약산업의 블루오션 시장으로 여겨져 왔습니다. 이에 따라 최근 글로벌 제약ㆍ바이오 기업들도 세포치료제 시장에서의 주도권을 잡기 위해 적극적으로 R&D 투자를 확대하고 있으며, 승인 의약품이 늘고 시장도 빠르게 커지면서 글로벌 제약ㆍ바이오 기업들의 참여가 증가하고 있어 세포치료제 시장의 경쟁이 심화되고 있습니다.
캐나다와 인도에 본사를 둔 글로벌 헬스케어 전략 컨설팅ㆍ시장조사 기업인 Towards Healthcare에 따르면, 글로벌 일반 세포치료제 시장은 2024년 약 59억 달러 규모에서 2034년 약 444억 달러 규모까지 향후 연평균 22.7%의 높은 성장률을 보일 것으로 전망하고 있습니다. 주로 자가/동종 줄기세포치료제, 조직 재생, 만성ㆍ희귀질환, 심혈관ㆍ근골격계ㆍ신경 등 다양한 영역에 활용될 것으로 전망하고 있습니다.
| [글로벌 세포치료제 시장 규모 전망] |
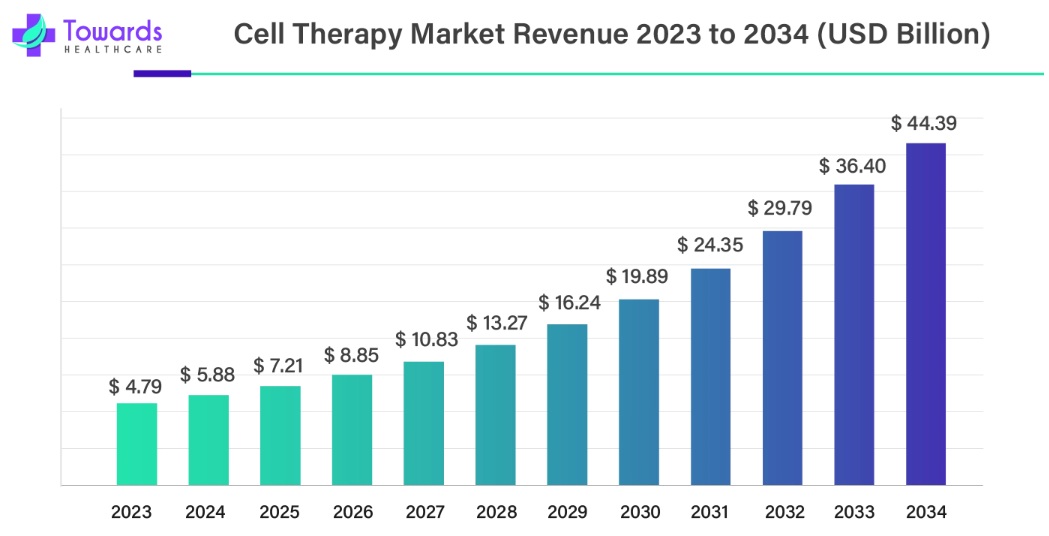 |
|
세포치료제 시장 |
| (출처) Towards Healthcare(2025.05) |
줄기세포는 모든 종류의 기능세포로 분화 가능하며 자기와 동일한 형태와 능력을 가진 세포를 만들어낼 수 있다는 특성을 활용하여, 줄기세포치료제는 주로 희귀질환이나 치료제가 없는 불치병성 질환에 대한 근본적인 치료법을 제시할 수 있는 강점을 기반으로 연구개발이 활발하게 진행되고 있습니다.
헬스케어ㆍ바이오 등 다양한 산업군을 대상으로 한 신흥 글로벌 시장조사ㆍ전략컨설팅 전문사인 Precedence Research에 따르면 글로벌 줄기세포치료제 시장은 2024년 기준 160.2억 달러로, 2025년 181.3억 달러의 규모에서 연평균 12.95%의 성장률을 보이며 2034년 약 541.5억 달러 규모로 성장할 것으로 전망되고 있습니다. 시장 성장을 이끄는 주요 요인으로는 만성질환 및 퇴행성 질환 증가, 재생의학 기술 혁신, 정부 및 민간의 대규모 연구ㆍ임상 투자, 신약 파이프라인 확대 등이 꼽힙니다. 특히, 신경계(파킨슨병, 루게릭병 등), 심혈관계, 근골격계, 암 등 다양한 분야에서 줄기세포치료제 상용화가 확대되고 있습니다.
| [글로벌 줄기세포치료제 시장 규모 전망] |
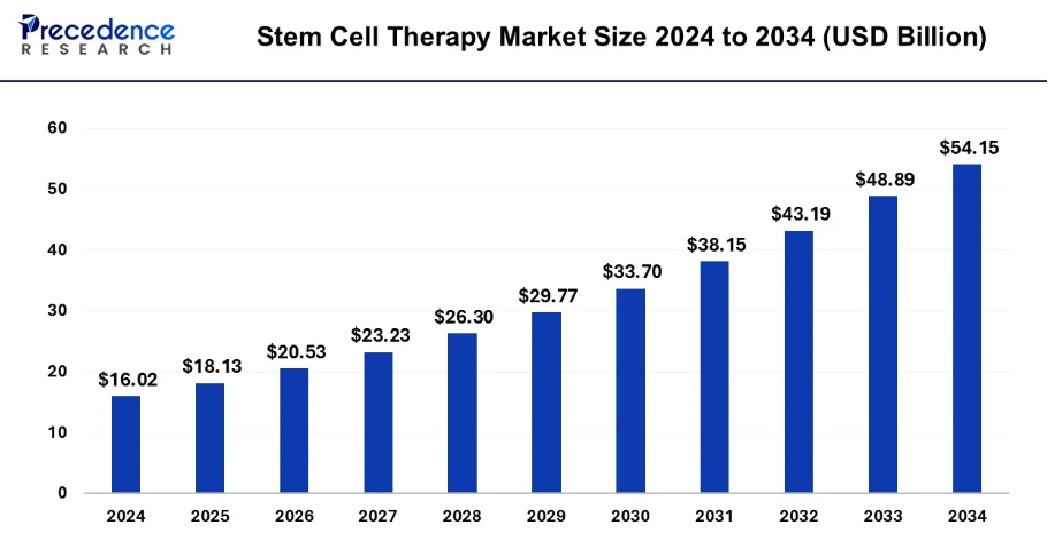 |
|
줄기세포치료제 시장 |
| (출처) Precedence Research(2025.05) |
현재 국내에서 허가받은 줄기세포 치료제는 총 4종으로, 지난 2011년 파미셀의 급성심근경색 치료제 '하티셀그램AMI'가 세계 첫 줄기세포치료제로 국내 승인을 받은 이후 2012년 메디포스트의 '카티스템'과 안트로젠의 크론성누공 치료제 '큐피스템'이 시판허가를 받았고, 2014년 코아스템의 루게릭병 치료제 '뉴로나타-알'이 국내 4호 줄기세포치료제로 승인을 받았습니다. 그밖에 중증 퇴행성관절염 줄기세포치료제인 네이처셀의 '조인트스템'은 2025년 8월 식약처로부터 첨단바이오의약품 품목허가 반려 처분을 통지받았습니다.
| [국내 품목허가된 줄기세포치료제 비교] |
| 구분 | 뉴로나타-알주 | 큐피스템 | 카티스템 | 하티셀그램-AMI |
|---|---|---|---|---|
| 제조사 | 코아스템 | 안트로젠 | 메디포스트 | 파미셀 |
| 허가년월 | 2014.07 | 2012.01 | 2012.01 | 2011.07 |
| 원재료 세포 | 자가 골수 줄기세포 |
자가 지방 줄기세포 |
동종 제대혈 줄기세포 |
자가 골수 줄기세포 |
| 적응증 | 루게릭병 | 크론성 누공 | 무릎연골결손 | 급성심근경색 |
| 2024년 매출 | 11.2억원 | 5.1억원 | 202.2억원 | 9.7억원 |
| 희귀의약품 여부 | O | O | X | X |
| (출처) 각사 사업보고서(2024.12), 약학정보원 홈페이지 |
2018년 이후 줄기세포치료제의 품목 허가가 줄어들고, 2023년부터 다시 일부 제품들이 승인되기 시작한 배경에는 각 규제당국의 규제가 대폭 강화된 점이 큰 영향을 미쳤습니다. 미국 식품의약국(FDA), 유럽의약품청(EMA), 그리고 일본 의약품의료기기종합기구(PMDA) 등 주요 규제기관은 줄기세포치료제에 대해 안전성과 효능을 엄격히 검증하기 위해 다양한 규제 조치를 강화했습니다.
먼저, FDA는 2020년 발표한 최소 조작 및 동종 사용(homologous use) 가이드라인에서 표적 조직의 기본 기능과 일치하는 효능만 저규제(면제)로 인정하며, 이를 벗어나면 전수 임상, 독성, 종양화 위험성 검증을 의무화하였습니다. 또한 줄기세포치료제가 인체 내에서 최소한의 가공만을 거친 경우와 그렇지 않은 경우를 명확히 구분하여, 가공이 많거나 세포 기능을 변경하는 경우에는 신약 수준의 임상시험과 제조관리기준(GMP)을 요구하고 있습니다.
유럽 EMA 역시 첨단 치료제(ATMP)로서 줄기세포치료제를 분류해 높은 수준의 제조 및 임상 기준을 부과하고 있습니다. EMA는 혁신 치료제에 한해 신속심사(PRIME) 제도를 운영하지만, 임상 근거가 부족하거나 제조 공정이 불확실한 제품에 대해서는 승인을 보류하거나 철회하는 사례가 늘어나고 있습니다.
일본 PMDA는 조건부ㆍ기한부 승인 제도를 운영하며 초기 안전성이 확보된 경우 시장에 진입시킨 후 추가 임상 결과를 제출받아 허가 확정 여부를 결정합니다. 하지만 추가 자료 제출이 미흡하거나 효과가 불충분할 경우 승인 철회 사례도 증가하고 있습니다. 또한, 일본은 임상 시험이나 공식 승인 없이 개인이나 의료기관이 진행하는 줄기세포 치료 시술을 금지하는 등 환자 보호를 강화하고 있습니다.
이처럼 전 세계적으로 규제당국은 줄기세포치료제가 임상적 효능과 안전성을 명확히 증명할 때까지 엄격한 임상 데이터와 제조 표준, 장기 추적 조사 등을 요구하고 있으며, 불법적이거나 비승인 치료 시술에 대해서는 강력하게 단속하고 있습니다. 이러한 규제 강화로 인해 2018년부터 2022년까지는 줄기세포치료제 신규 허가가 주춤한 규제 보수기를 겪게 되었습니다. 하지만 2023년 이후에는 대규모 임상 시험에서 성공을 거두고, 제조 공정이 고도화된 일부 면역세포치료제 및 첨단 줄기세포치료제가 점차 승인을 받는 사례가 발생하고 있는 추세입니다. 아울러 중국, 일본 등 아시아 국가들도 관련 규제체계 개선과 지원 정책 강화로 신제품 허가를 활성화하고 있습니다.
| [글로벌 줄기세포치료제 품목허가 현황] |
| 업체명 | 제품명 | 주원료 세포구분 | 대상질환 | 허가연월 | 허가국가 |
|---|---|---|---|---|---|
| 파미셀 | 하티셀그램-AMI |
자가골수유래 중간엽줄기세포 |
급성심근경색 환자에서 좌심실구혈률 개선 |
2011.07 | 한국 |
| 메디포스트 | 카티스템 |
동종제대혈유래 중간엽줄기세포 |
골관절염 환자의 무릎연골 결손 치료 |
2012.01 | 한국 |
| 안트로젠 | 큐피스템 |
자가지방유래 중간엽줄기세포 |
크론성 누공 | 2012.01 | 한국 |
| Osiris Therapeutics (JCR Pharmaceuticals) |
Prochymal (Temcell) |
동종골수유래 중간엽줄기세포 |
GvHD (이식편대숙주질환) |
2012.05 2012.06 |
캐나다 뉴질랜드 |
| 테루모 | 하트시트 |
자가골격근유래 줄기세포 |
중증심부전 | 2015.09 | 일본(조건부승인) |
| 코아스템켐온 | 뉴로나타-알 |
자가골수유래 중간엽줄기세포 |
근위축성측삭경화증 (루게릭병) |
2014.07 | 한국 |
| Chiesi | Holoclar | 자가각막유래 줄기세포 |
화상에 의한 눈 질환 | 2015.02 | 유럽 |
| Stempeutics Research | Stempeucel | 동종골수유래 중간엽줄기세포 |
중증하지허혈, 무릎 골관절염, |
2016.05 2020.08 |
인도 |
| Takeda Pharma | Alofisel |
동종지방유래 줄기세포 |
크론성 누공 |
2018.03 2021.09 |
유럽 일본 |
| Nipro | Stemirac |
자가골수유래 중간엽줄기세포 |
척수손상환자 | 2018.12 | 일본 |
| Gamida Cell Ltd. | OMISIRGE |
동종제대혈유래 조혈전구세포 |
골수절제 조절요법 후 제대혈 이식이 예정된 혈액암 환자 |
2023.04 | 미국 |
| Mesoblast, Inc. | Ryoncil | 동종골수유래 중간엽기질세포 | 스테로이드-불응 이식편대숙주병(SR-aGVHD) | 2024.12 | 미국 |
| (출처) 대한민국 식약처(MFDS), 미국 식약처(FDA), 유럽 식약처(EMA), 인도 식약처(DCGI) 및 일본 식약처(PMDA) |
현재 줄기세포치료제 시장은 상업적으로 승인된 제품의 수가 제한적이고, 각 제품이 서로 다른 적응증을 목표로 하기 때문에 동일 적응증 내에서의 경쟁 심화 위협은 상대적으로 적은 편입니다. 그러나 이는 경쟁이 없다는 의미가 아니라, 줄기세포치료제 자체가 높은 기술적 난이도와 복잡한 규제, 장기간에 걸친 임상 검증이 요구되는 분야임을 의미합니다. 즉, 애초에 상용화 및 임상적 성공에 이르는 확률 자체가 매우 낮아 성공을 거두기 어려운 시장이라는 점을 의미합니다. 그럼에도 불구하고, 시장의 급격한 성장 가능성과 함께 국내외 대형 제약사들이 향후 줄기세포치료제 시장 진입을 모색할 것으로 예상되므로, 현재의 경쟁 구도뿐만 아니라 잠재적인 경쟁 심화와 함께 높은 기술적ㆍ상업적 리스크까지 존재합니다. 투자자 여러분께서는 반드시 이 점 유의하시기 바랍니다.
|
[라. 희귀의약품 시장 경쟁심화에 따른 위험] 게다가 렐리브리오의 경우, 2024년 대규모 임상 3상(PHOENIX 시험)에서 주요 지표(ALSFRS-R)에서 위약군 대비 유의한 이점을 입증하지 못하였으며, 이로 인해 Amylyx는 2024년 4월 미국과 캐나다 시장에서 렐리브리오 마케팅 허가를 자진 철회하고, 신환자 대상 판매를 중단했습니다. ALS 환자 커뮤니티 및 규제 당국 등과의 협의를 통해 기존 치료 환자들은 의사 상담 후 무료 프로그램을 통해 계속 치료를 받을 수 있으나, 신규 환자는 더 이상 렐리브리오를 처방받을 수 없게 되었습니다. 결국 임상 3상 이후 상업화까지 성공하여 현재까지 시판되고 있는 사례는 바이오젠의 칼소디, 단 1건에 불과하여 확률은 9%에 불과한 상황입니다.
희귀의약품 영역에서는 현재 시판 중인 경쟁사의 치료제가 매우 적거나 없는 경우가 많아 경쟁 강도 자체는 비교적 낮은 편입니다. 다만 희귀질환은 유병률이 낮아 환자 수가 제한적이기 때문에 시장 규모가 작다는 근본적 한계가 있습니다. 이런 환경에서는 만약 글로벌 수준의 강력한 치료제나 경쟁사가 먼저 시판 및 상업화에 성공할 경우, 전체 시장 파이 중 상당 부분이 단일 제품이나 기업에 집중될 수 있고, 후발주자에게 추가로 시장을 확보할 여지가 거의 남지 않게 됩니다. 실제로 희귀의약품 시장에서는 '승자독식' 현상이 뚜렷하게 나타나는 경향이 있어, 경쟁 약물의 출시와 동시에 후속 개발 파이프라인의 상업적 가치가 크게 흔들릴 수 있습니다. 최근 10년간 희귀의약품 비중과 시장 규모 모두 꾸준히 증가하고 있으며, 과거 틈새 시장에 머물렀던 희귀질환 치료제가 점차 글로벌 제약산업의 중요한 축으로 자리잡고 있습니다. 이에 따라 앞으로는 대형 제약사들의 진출과 동시에 경쟁 강도 역시 한층 높아질 가능성이 매우 크므로, 시장 자체가 작고, 선점 경쟁사 등장 시 후발주자의 기회가 극도로 제한될 수 있다는 구조적 리스크가 존재합니다. 투자자 여러분께서는 이 점을 반드시 유의하시기 바랍니다. |
희귀질환은 소수의 환자들이 앓는 질환으로 시장의 크기가 작아 제약기업의 치료제 개발 동기가 약한 분야입니다. 그러나 개별 희귀질환의 환자 수는 적을지라도 희귀질환의 종류는 매우 다양합니다. 세계보건기구(WHO)에 의하면 희귀질환은 전 세계적으로 약 6천여 종, 약 3천만 명이 겪고 있는 것으로 보고되고 있으며, 질환 종류 및 발병대상도 확대되고 있습니다. 희귀의약품은 이런 희귀질환으로 중증 또는 생명을 위협하는 질환의 예방 및 치료를 목적으로 하는 의약품으로 희귀질환에 대한 정의는 국가별로 상이합니다.
희귀의약품은 치료제 개발에 투입되는 비용에 비해 유병률이 낮아 시장성이 제한적이라는 이유로 글로벌 제약회사들이 개발을 소홀히 하였던 분야로 주요 바이오 벤처들 위주로 제품 개발이 진행되었습니다. 그러나 2024년 미국 식품의약국(FDA) 승인 신약 50건 중 26건이 희귀의약품 지정을 받는 등 최근 희귀의약품 비중이 증가하고 있고, 제품 매출도 계속해서 성장하며 틈새 시장에서 주류로 전환되는 추세입니다.
여기에 선진국에서는 희귀의약품의 개발과 안정적인 공급을 독려하기 위하여 정부차원에서 법률 제정, 연구개발비 지원, 독점권 허용 및 각종 인센티브 부여 등의 지원을 실시하고 있어 상대적으로 낮은 승인장벽, 특허 독점기간과 개발비용에 대한 세제혜택 등에서 유리한 점이 존재하므로 빅파마들의 희귀의약품 시장 진출은 점차 증가할 것으로 보입니다.
하지만 지난 10년간 희귀의약품(Orphan Drug) 지정 및 승인 건수는 미국과 유럽을 중심으로 급증했으나, 실제로 상업화까지 이르는 확률은 매우 낮은 편 입니다. 1981년 창간된 미국의 대표적인 보건의료 정책 전문 학술지인 Health Affairs에 따르면, 약 10년간 희귀의약품 지정을 받은 후보물질(신물질, NME) 중 실제로 FDA 시판 승인을 받은 비율은 11~25% 내외, 유럽(EMA)에서는 6~10%에 불과합니다. 또한, 희귀의약품(특히 암 외 non-oncology)은 임상1상 진입 후 최종 FDA 승인을 받는 확률이 13~25% 수준으로, 전체 신약 평균(약 10%)에 비해 다소 높지만, 실제 상업적 성공률로 환산하면 오히려 6~11%대에 머물렀습니다. 한편 2010~2022년 FDA 지정 기준으로, 약 35%의 약물이 지정 후 2년 내, 69%가 5년 내, 92%가 10년 내에 시판승인을 받긴 했지만, 지정된 전체 후보물질 대비 실제 시장 진입(non-expired, on-market) 비중은 15~20% 수준에 머무르는 것으로 집계됩니다. 더불어, 매년 지정받은 희귀의약품의 다수(60~70%)는 임상실패, 개발 포기, 허가 심사 실패, 혹은 시장 진입 후 단기 퇴출 등으로 상업적으로 성과를 내지 못했습니다.
| [최초 및 후속 희귀의약품 승인, 승인 연도] |
 |
|
희귀의약품 승인 |
| (출처) Health Affairs(2024.02) |
헬스케어ㆍ바이오 등 다양한 산업군을 대상으로 한 신흥 글로벌 시장조사ㆍ전략컨설팅 전문사인 Precedence Research, 캐나다와 인도에 본사를 둔 글로벌 헬스케어 전략 컨설팅ㆍ시장조사 기업인 Towards Healthcare 및 인도 기반의 2013년에 설립된 글로벌 제약ㆍ바이오 시장조사 및 컨설팅 기업인 Roots Analysis 등 여러 시장조사기관에 따르면, 글로벌 희귀의약품 시장 규모는 2025년 2,165억 ~ 2,370억 달러에서 2030년 3,940억 ~ 4,440억 달러로 연평균 10 ~ 12%의 높은 성장률을 보일 것으로 전망되며, 2030년에는 전체 전문의약품 시장의 약 20%를 차지할 정도로 비중이 커질 전망입니다. 그러나 희귀의약품은 환자 수 부족으로 인한 임상 지연과 고비용 치료 모델에 대한 거부감, 세포치료제의 짧은 유통기한으로 인한 콜드체인 물류 능력이 요구되는 등 바이오 벤처에서 직접 개발하기에는 다양한 성장 제약 요인이 존재합니다.
| [글로벌 희귀의약품 시장 규모 전망] |
 |
|
희귀의약품 시장 |
| (출처) Precedence Research(2025.05) |
희귀질환을 정의하는 기준은 국가별로 다르며, 각 나라에서는 희귀의약품 개발을 촉진시키기 위한 여러 인센티브를 제도적으로 보장하고 있습니다. 희귀의약품에 대한 개발 촉진 제도는 1983년 미국이 희귀의약품법(The Orphan Drug Act)을 제정하면서 시작되었으며, 규제기관이 개발단계에서부터 희귀의약품으로 지정하여 개발 단계에서 보조금 및 세제 혜택을 지원하고, 시판 후 시장 독점권을 부여하는 방식입니다. 미국 FDA 기준 일반 신약은 독점권을 5년까지 부여받게 되는 반면 희귀의약품 지정(Orphan Drug Designation, 이하 ODD)을 받게 되면 독점권을 7년까지 부여받을 수 있습니다. 최근 미국에서는 희귀병 환자, 특히 소아 환자의 치료 접근성을 보장하기 위한 초당적 법안인 RARE(Retaining Access and Restoring Exclusivity)법이 2024년 2월 미국 연방 하원에 공식 발의되어 희귀의약품 개발을 위한 인센티브는 더욱 강화될 전망입니다. 한국은 2016년 12월 30일부터 희귀질환관리법을 시행하여 희귀의약품 인센티브에 대한 법적 근거를 마련하였습니다. 주요 국가별 희귀질환(rare disease) 지정 기준과 희귀의약품(orphan drug) 개발 촉진 제도는 아래와 같이 비교할 수 있습니다.
| [미국, EU, 일본, 한국의 희귀질환 지정 기준 및 희귀의약품 개발 촉진 제도] |
| 구분 | 정의 및 법률 | 희귀질환 지정 기준 | 지정 시점 | 요건 | 시장 독점 혜택 | 지원 혜택 |
|---|---|---|---|---|---|---|
| 미국 | Orphan Drug Act(1983), Rare Diseases Act | 환자 수 20만 명 미만 |
연구개발 초기 (임상 전~임상 전과정) |
생명 위협/만성 질병, 대체 치료 없을 것 | 시판허가일로부터 7년 독점권 부여 |
ㆍR&D 비용에 대한 세제혜택 최대 50% 제공 ㆍ임상 개발을 위한 보조금 및 프로토콜 설계 자문 ㆍ심사신청 수수료 면제 가능 ㆍ희귀의약품을 위한 우선심사제도 신설(2022) |
| EU | Regulation(EC) No 141/2000 | 유병률 1만 명당 5명 미만 |
R&D 초기 (임상 전~임상 전과정) |
생명 위협/만성 질병, 치료옵션 부족 | 시판허가일로부터 10년 독점권 부여 |
ㆍ5년 뒤 재평가 후 독점기간 설정(수익성 등) ㆍ국가별로 세제혜택 상이함 ㆍ심사신청 수수료 면제 가능 ㆍ우선심사제도 있음 |
| 일본 | Pharmaceutical Affairs Law | 환자 수 5만 명 미만 |
R&D 단계 (임상 초기 중심) |
대체 치료 어려움, 난치성 및 희귀성 질환 |
시판허가일로부터 최대 10년 독점권 부여 |
ㆍ세제혜택 제공 ㆍ심사신청 수수료 30% 면제 ㆍ우선심사제도 있음 |
| 한국 | 희귀의약품 지정 규정, 국가 희귀질환 조례 | 환자 수 2만 명 미만 |
시판 허가 단계 | 대체 치료제 미존재 또는 치료효과 우월해야 함 | 시판허가일로부터 4년 독점권 부여 |
ㆍ품목허가 유효기간 10년 (기타 5년) ㆍ우선심사제도 적용가능 ㆍ수수료 감면 |
| (출처) (미국) 희귀질환법(Rare Disease Act of 2002), (유럽) Communication From the Commission to the European Parliament, The Council. The European Economic and Social Committee and the Committee of the Regions on Rare Disease: Europe's Challenges, (일본) 난병환자에 대한 의료 등에 관한 법률, (한국) 희귀질환관리법 |
주요 공통점으로는 희귀질환 지정 기준이 인구수(유병률) 중심이고, 생명에 위협적이며 만성질환인 경우, 미충족 치료 수요가 존재하는 경우에 충족됩니다. 미국, EU, 일본은 R&D 단계부터 희귀의약품 지정이 가능하고 연구비, 세금, 심사 인센티브가 매우 다양하게 제공되는 한편, 한국은 시판 허가 전후 단계에서 지정되며, R&D, 세금, 심사 인센티브가 점진 확대 중이나 비교적 제한적입니다.
당사가 최근 임상 3상 결과에 따른 식약처에 변경 허가 신청을 완료한 뉴로나타-알 치료제의 경우 루게릭병에 대한 줄기세포치료제로, 2013년 12월 국내 희귀의약품 지정에 이어, 2018년 8월 미국 FDA 희귀의약품 지정, 2019년 3월 EU EMA 희귀의약품 지정이 완료되었습니다. 글로벌 시장조사와 경영 컨설팅을 제공하는 세계적 리서치 기업인 IMARC GROUP에서 2025년 발표한 자료에 따르면, 근위축성측삭경화증 질환(루게릭병)의 전체 시장 규모는 2024년 약 7.9억 달러 규모에서 2033년 약 11.4억 달러까지 성장할 것으로 예측하였습니다. 북미 시장이 전체 시장의 약 56.2%를 점유하며 선도할 것으로 전망되며, 성장 요인은 신약 및 유전자ㆍ세포 치료제 개발, 임상연구 확대, 고령화, 환자와 시장 인식 증가 등의 이유가 주로 거론되고 있습니다.
| [글로벌 루게릭병(ALS) 시장 규모 전망] |
 |
|
als 시장 규모 |
| (출처) IMARC GROUP(2025.03) |
이와 관련하여 글로벌 루게릭병 치료제의 경쟁 현황을 살펴보면 다음과 같습니다.
1. 뉴로나타-알(Neuronata-R, 성분명: 렌주메스트로셀(Lenzumestrocel), 코아스템켐온)
당사가 개발한 자기유래 골수 유래 중간엽 줄기세포 치료제입니다. 환자 본인의 골수에서 줄기세포를 추출 및 배양한 뒤 척수강 내에 투여하여 신경 염증 조절 및 신경세포 보호 효과를 노립니다. 2014년 식약처로부터 세계 최초 루게릭병(ALS) 세포치료제로 조건부 허가를 받았고, 이후 2상 임상과 400명 이상의 상업적 투여가 이루어졌습니다. 2024년 대규모 글로벌 임상 3상에서는 전체 환자군에서 주요 평가지표 유의성을 획득하지 못해 실패로 결론났으나, 질병 진행이 느린 환자군(subgroup)에는 유의한 효과가 확인되어 현재 이들 환자군으로 효능 범위를 축소해 식약처에 변경허가 신청을 완료하였고, 미국 FDA에 변경 허가(가속승인 포함)를 추진 중입니다. 현재 식약처에서 보완자료 제출을 요구하였고 당사는 2025년 9월 1일까지 해당 자료를 제출할 예정이었으나,식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다.
2. 렐리브리오(Relyvrio, 성분명: AMX0035, Amylyx)
Amylyx Pharmaceuticals가 개발한 경구 복합제(소듐 페닐부티레이트+타우루르소디올)로, 신경세포 미토콘드리아 안정과 세포 보호 효과를 기반으로 합니다. 2022년 FDA 조건부 신속승인을 받으며 기대를 모았으나, 2024년 대규모 임상 3상(PHOENIX 시험)에서 주요 지표(ALSFRS-R)에서 위약군 대비 유의한 이점을 입증하지 못했습니다. 이로 인해 Amylyx는 2024년 4월 미국과 캐나다 시장에서 렐리브리오 마케팅 허가를 자진 철회하고, 신환자 대상 판매를 중단했습니다. ALS 환자 커뮤니티 및 규제 당국 등과의 협의를 통해 기존 치료 환자들은 의사 상담 후 무료 프로그램을 통해 계속 치료를 받을 수 있으나, 신규 환자는 더 이상 렐리브리오를 처방받을 수 없게 되었습니다. 요약하면, 렐리브리오는 신경세포 사멸 경로를 조절하는 두 가지 분자인 sodium phenylbutyrate와 taurursodiol를 병용하는 경구용 복합약제로, 초기 2상 임상(CENTAUR 시험)에서는 기능 저하 감소와 생존기간 연장 가능성을 보였으나, 3상에서 효과가 확인되지 못해 상업적 지속이 어려워진 상황입니다.
3. 칼소디(Qalsody, 성분명: 토퍼슨(Tofersen), Biogen)
Biogen이 개발한 유전자 치료 기반(ASO) 주사제로, SOD1 돌연변이형 루게릭병(ALS) 환자를 표적합니다. 항센스 올리고뉴클레오타이드(antisense oligonucleotide, ASO)로서 SOD1 mRNA에 결합해 변이된 SOD1 단백질 생산을 감소시켜 신경세포 손상을 줄이는 작용 기전을 이용하여 발현되며, 2023년 FDA로부터 SOD1 변이 확진 환자용 신약으로 허가를 받아, 세계 최초 유전자 맞춤형 루게릭병(ALS) 치료제로 평가받고 있습니다. 시장 규모가 극히 제한적이고, 유전자 진단 후 처방되는 환자가 많지 않아 매출 규모도 아직 초기 단계입니다. 2024년 매출은 약 2,000만 달러(약 270억 원) 수준입니다. 2025년 3월, 캐나다 보건부가 조건부 시판 허가를 발급하며 SOD1-ALS 치료제로 첫 승인하였으며, 2024년 5월 유럽연합에서 예외적 상황 판매 허가 획득하였으며, EMA와 유럽 다수 국가에서 접근성이 확대 중 입니다. 또한, 2025년 7월, 영국 의약품건강관리제품규제청(MHRA)에서 최초 SOD1-ALS 치료제로 허가하였습니다. 초기 3상 VALOR 임상시험(108명 대상, 28주)의 1차 평가변수(ALSFRS-R, 기능 점수)에서는 통계적 유의성 미달성하였으나, 바이오마커(혈장 신경섬유경화단백질 NfL)의 유의미한 감소 및 일부 2차 평가변수에서 긍정적 결과 관찰이 되어 장기 공개 확장 연구(52주 이상)에서 조기 투여 환자 그룹에서 기능 유지, 생존 연장 추세가 확인되었습니다.
4. 리루텍(Rilutek, 성분명: 리루졸(Riluzole), 사노피)
사노피가 오리지널 개발한 최초의 루게릭병(ALS) 치료제(증상완화제)로, 1995 ~ 1996년 미국/유럽 승인된 뒤 전세계적으로 사용되어 온 표준치료제(증상완화제)입니다. 주된 작용 기전은 신경 세포 간 신호 전달에 관여하는 글루타메이트의 과잉 방출을 억제함으로써 신경 세포 손상을 완화하는 것입니다. 이를 통해 ALS 환자의 생존 기간을 연장하고 인공호흡기 사용 시점을 지연시키는 효과가 입증되었습니다. 신경 전달 억제(글루타메이트 독성 완화)를 통해 질병 진행을 늦추고, 사망 시점이나 생존기간을 2~3개월 연장시키는 유의미한 임상 효과가 입증되어 있습니다. 복용 형태는 전통적인 정제 외에도, 최근에는 삼키기 어려운 환자를 위한 구강 필름(oral film)과 액상 제형도 FDA 승인을 받아 제공되어 환자의 복약 편의성을 높이고 있습니다. 시장에는 다양한 제네릭 제품이 출시되어 있으며, 단일 브랜드 매출은 줄고 있지만 여전히 표준 치료로 널리 활용되고 있습니다. 2024년 매출은 사노피 및 전 세계 제네릭 포함 약 4,100만 달러(약 550억 원) 규모로 파악됩니다.
5. 라디카바(Radicava, 성분명: 에다라본(Edaravone), 미쓰비시다나베)
일본 미쓰비시다나베가 개발한 루게릭병(ALS) 및 뇌졸중 치료제(증상완화제)입니다.2017년 미국 FDA에서 정맥주사(IV) 제형이 처음 승인되었으며, 2022년에는 환자의 편의성을 높인 경구용 제형(Radicava ORS)도 FDA 승인을 받아 현재 두 가지 형태로사용되고 있습니다. 항산화제로 작용하여 신경손상과 진행을 지연시키는 효과가 주요 임상에서 검증돼 일본, 한국, 미국 등에서 허가 및 상업화되었고, 미국에서는 주사제(Radicava) 및 경구제(Radicava ORS) 형태 모두 유통 중입니다.
활성산소를 제거하여 신경세포 손상을 줄이고 TDP-43 단백질 이상 국소화를 완화함으로써 신경계질환 진행을 늦추는 다면적 보호작용을 기대할 수 있으며, 24주 임상 3상 시험에서 신체 기능 악화 속도를 약 33% 낮추는 효과가 입증되었고, 장기 확장 연구에서는 2년 이상 치료 시 질병 진행 및 사망률 감소 효과도 관찰되었습니다.정맥주사형과 경구형 모두 장기간 사용 시 특별한 심각 부작용 없이 안전한 것으로 보고되었으며, 주요 부작용은 ALS 증상과 연관된 근력 약화, 호흡 곤란, 변비 등이 있습니다. 라디카바는 표준치료 대비 빠른 진행형 환자군에서는 임상적 유의미함이 다소 제한적이지만 전체 루게릭병(ALS) 치료 선택지가 적다는 점에서 널리 병용 처방되고 있습니다. 또한 일본 및 중국 등 아시아에서는 뇌졸중 적응증 매출 비중도 높습니다. 2024년 매출은 약 2억9,300만 달러(약 4,000억 원)로, 루게릭병(ALS)관련 치료제 중 매출 규모가 가장 크며, 일본 및 미국 비중이 높은 편입니다.
따라서 루게릭병(ALS) 치료제 시장은 오랫동안 리루텍 및 라디카바 등 기존 '완화제' 위주였으며, 단순 수명 연장 및 질병 진행 속도 지연 등의 증상완화에 초점을 두었으나, 수명 연장 효과는 10개월 미만으로 파악됩니다. 이에 줄기세포 기반(뉴로나타-알), 유전자 맞춤형(칼소디), 신약 조합제(렐리브리오) 등 다양한 혁신 약물이 등장했습니다. 그러나 렐리브리오의 경우, 미국 등에서 조건부 허가 후 3상 실패로 시장에서 철수하는 수순을 밟고 있으며, 당사의 뉴로나타-알 역시 임상 3상에서 통계적 유의성 확보에 실패하여, 효능 효과군을 저속 진행군으로 축소하여 식약처에 변경 허가 신청을 완료한 상태입니다. 또한, 칼소디는 전자 맞춤형 SOD1 변이 환자에만 한정 승인된 상태이며, 이는 전체 루게릭병 환자의 대략 2% 수준에 불과합니다. 이처럼 임상 및 시장 진입 장벽과 제한적 효과, 엄격한 환자군 선정(특히 칼소디) 등으로 현재도 미충족 의료수요가 상당하며, 이로 인해 새로운 작용 기전 신약 개발에 대한 기대감이 여전히 높은 상태입니다. 하지만 이러한 기대감과 루게릭병(ASL) 치료제의 현재 상황이 당사의 뉴로나타-알의 시판 승인 및 상업화의 성공을 보장하는 것은 아니며, 미충족 치료 수요가 높은 상황이더라도 당사의 뉴로나타-알의 가속승인 또는 승인은 불확실한 상황이며, 승인이 되어 시판되더라도 상업화에 문제가 생길 수 있는 등 뉴로나타-알의 성공을 보장하지는 않습니다.
2018년 FDA의 최종허가를 받은 미쓰비시다나베의 에다라본(제품명: 라디카바)를 제외하면 최근 7년간(2018~2025년) 미국 FDA에 루게릭병(ALS) 치료제로 조건부 허가를 신청했던 신약 11개 중 실제로 후속임상 조건부 승인을 받은 것은 아밀릭스의 렐리브리오(Relyvrio)와 바이오젠의 칼소디(Qalsody), 단 두 가지 치료제뿐입니다. 칼소디(제품명: 토퍼슨)의 경우 임상 3상 이후 2023년 조건부 승인을 받아 후속임상을 5년 이내에 진행하는 조건으로 승인되었고, 렐리브리오의 경우 임상 2상 이후 2022년 조건부 승인을 받았으며, 조건부 승인 당시 이미 임상 3상이 시작되었기 때문에 3상 결과가 통상 5년보다 빠른 3년 후 도출되어 그 결과에 따라 승인이 철회되었습니다. 나머지 도전했던 약물들은 대부분 임상 3상에서 실패하거나, 데이터 부족, 승인 거절 등의 사유로 조건부 허가에 도달하지 못하였습니다. 브레인스톰의 NurOwn 치료제는 임상 3상에서 주요 평가지표를 충족하지 못해 FDA로부터 승인을 받지 못하였으며, 아스트라제네카의 울토미리스(Ultomiris)는 임상 3상 중간 분석에서 효능 부족으로 임상 자체가 중단된 바 있습니다. 이외에도 사이토키네틱스의 릴데셈티브(Reldesemtiv), 메리케이 파마의 이부디라스트(Ibudilast), Scholar Rock의 아피테그로맙(Apitegromab), AB Science의 마시티닙(Masitinib), 호주 Isis Pharma의 CuATSM 등은 임상에서 뚜렷한 효과 증명이 실패하거나, 평가지표를 충족하지 못해 긍정적인 결과를 보여주지 못하였습니다. 즉, 확률적으로 당사의 뉴로나타-알의 FDA 승인 또는 가속승인 가능성은 18%에 불과합니다.
게다가 렐리브리오의 경우, 2024년 대규모 임상 3상(PHOENIX 시험)에서 주요 지표(ALSFRS-R)에서 위약군 대비 유의한 이점을 입증하지 못하였으며, 이로 인해 Amylyx는 2024년 4월 미국과 캐나다 시장에서 렐리브리오 마케팅 허가를 자진 철회하고, 신환자 대상 판매를 중단했습니다. ALS 환자 커뮤니티 및 규제 당국 등과의 협의를 통해 기존 치료 환자들은 의사 상담 후 무료 프로그램을 통해 계속 치료를 받을 수 있으나, 신규 환자는 더 이상 렐리브리오를 처방받을 수 없게 되었습니다. 결국 임상 3상 이후 상업화까지 성공하여 현재까지 시판되고 있는 사례는 바이오젠의 칼소디, 단 1건에 불과하여 확률은 9%에 불과한 상황입니다.
물론 상업화 성공사례 1건만을 감안하면 기대확률이 9%라는 점은 직관적인 관점에서 맞다고 판단됩니다. 하지만 당사가 FDA 조건부 승인이 이루어진다면 이후 후속임상 완료 전에 뉴로나타-알의 Licensing out 계획 및 가능성이 존재하며, 당사의 FDA 조건부 승인 신청의 주요 전략이 현재 기준으로 상업화까지 성공한 유일한 사례인 바이오젠의 칼소디처럼 해당 바이오마커(NfL)를 포함한 여러 바이오마커의 유효성에 근거한 품목허가 신청입니다. 그러나 위의 여러 사례들을 고려하면 루게릭병 치료제가 임상 3상 단계에서 통계적 유의성을 확보하거나 최소한의 가능성을 보여줘, 조건부 승인 또는 정식 승인 받는 것이 얼마나 어렵고 확률적으로 낮은 일인지는 부인할 수 없습니다.
이처럼 루게릭병 치료제가 FDA 허가 또는 조건부 허가를 획득할 확률은 18% 남짓, 허가 획득 후 시판 및 상업화에 성공할 확률은 9% 남짓 수준으로 임상 3상에서 유의미한 결과를 내고 승인을 받는 경우가 극히 드물며, 설령 FDA 허가 또는 조건부 허가를 받더라도 상업적 성공이 보장되지 않는 상황입니다. 당사의 뉴로나알-알 역시 FDA 허가 또는 조건부 허가 실패, 승인을 받더라도 상업화에 실패할 가능성 등의 이유로 인해 막대한 연구개발비 투자와 장기간 임상시험 규모에 비해 최종적으로 실질적인 수익을 내지 못하거나, 손실을 입을 가능성을 배제할 수 없습니다.
또한 현재 라이센스아웃(License-out) 계약이 되어 있고, 임상1상이 종료된 개발 중인 루푸스 치료제 또한 희귀의약품에 해당합니다. 실제로 루푸스 희귀의약품 후보물질 중에서 시판 승인 및 상업적으로 가시화된 제품은 미국, 유럽 기준 Benlysta(벨리무맙)와 Saphnelo(아니프로루맙) 정도로 압축됩니다. 그 외 Abetimus, Baricitinib, Epratuzumab, Dapirolizumab 등 다양한 후보물질이 희귀의약품 지정을 받았지만 개발 또는 허가가 중도에 좌절되었습니다.
위 두 약물은 모두 FDA와 EMA 승인까지 받은 유일한 표적 생물학적제(항체 치료제)로, 실제 임상 현장과 적응증(중등도~중증 SLE, 피부/신장 침범형 등)에서 상당 부분 경쟁 구도를 이루고 있습니다. 벨리무맙은 B세포 활성화 인자(BLyS, BAFF) 억제제, 아니프로루맙은 1형 인터페론 수용체(IFNAR1) 억제제로 작용 기전이 다르지만, 전체 환자 풀, 실제 사용 단계에서는 상당수 적응증과 환자군이 겹치는 상황입니다. 최근 실제 처방 데이터 연구에서도 벨리무맙과 아니프로루맙은 52주 SLE 임상 반응(예: SRI-4)에서 임상적으로 유의한 차이 없음(비슷한 효과) 혹은 벨리무맙이 약간 우세하나, 중요한 차이는 없음이라는 결과들이 일관되게 보고되고 있습니다. 즉, 의사및 환자 선택에 따라 하나를 대신해 쓸 수 있는 관계이며, 환자 맞춤형 선택이나 일부 합병증(피부, 신장 등) 치료에서만 세부 차이가 존재한다고 볼 수 있습니다. 따라서 당사의 루푸스 치료제가 병용, 서브타깃이 아닌 단독 1차 치료제/표적치료제로 허가되거나 효과적으로 상업화될 경우, 벨리무맙과 아니프로루맙(그리고 그 계열 파이프라인)이 바로 직/간접 경쟁 제품이 될 가능성이 매우 높은 편 입니다. 결국, 당사가 기술이전 완료한 루푸스 치료제가 임상 2상 및 3상에서 안전성 또는 유효성을 입증하지 못할 가능성, 임상 3상까지 잘 끝마치더라도 식약처, FDA 등 규제 기관의 허가 승인을 받지 못할 가능성, 품목 허가를 받더라도 상업화에 문제가 생길 가능성, 상업화를 진행하더라도 기대만큼의 수요가 발생하지 않아 매출이 적을 가능성 등 현재 확정된 사항은 없고 미래의 결과를 보장할 수 없으며, 오히려 시간과 자금이 많이 소요될 가능성이 큰 상황입니다.
희귀의약품 영역에서는 현재 시판 중인 경쟁사의 치료제가 매우 적거나 없는 경우가 많아 경쟁 강도 자체는 비교적 낮은 편입니다. 다만 희귀질환은 유병률이 낮아 환자 수가 제한적이기 때문에 시장 규모가 작다는 근본적 한계가 있습니다. 이런 환경에서는 만약 글로벌 수준의 강력한 치료제나 경쟁사가 먼저 시판 및 상업화에 성공할 경우, 전체 시장 파이 중 상당 부분이 단일 제품이나 기업에 집중될 수 있고, 후발주자에게 추가로 시장을 확보할 여지가 거의 남지 않게 됩니다. 실제로 희귀의약품 시장에서는 '승자독식' 현상이 뚜렷하게 나타나는 경향이 있어, 경쟁 약물의 출시와 동시에 후속 개발 파이프라인의 상업적 가치가 크게 흔들릴 수 있습니다.
최근 10년간 희귀의약품 비중과 시장 규모 모두 꾸준히 증가하고 있으며, 과거 틈새 시장에 머물렀던 희귀질환 치료제가 점차 글로벌 제약산업의 중요한 축으로 자리잡고 있습니다. 이에 따라 앞으로는 대형 제약사들의 진출과 동시에 경쟁 강도 역시 한층 높아질 가능성이 매우 크므로, 시장 자체가 작고, 선점 경쟁사 등장 시 후발주자의 기회가 극도로 제한될 수 있다는 구조적 리스크가 존재합니다. 투자자 여러분께서는 이 점을 반드시 유의하시기 바랍니다.
| [마. 높은 가격과 줄기세포치료제에 대한 인식 부족으로 인한 수요 부진 위험] 당사가 집중하고 있는 줄기세포치료제 역시 바이오 의약품의 일종 및 첨단바이오의약품의 일종으로 제품이 상용화되어 있으나 실제 시술횟수가 상대적으로 적어 아직 본격적으로 대중화되지는 못하고 있습니다. 비록 첨단바이오재생법의 시행으로 줄기세포치료제의 임상 연구ㆍ시판 문턱이 낮아졌으나, 국내에서는 여전히 고비용ㆍ보험 미적용ㆍ효과 불신 등이 혼재해 진정한 대중화는 아직 어려운 상황입니다. 따라서 기존 의약품에 비해 환자 처방 후 제품 생산이 가능하고, 대량생산이 어려우며, 보관 기간이 짧고, 제조원가 부담으로 인한 높은 판매가격으로 가격 경쟁력 측면에서 열위에 있기 때문에 여전히 본격적인 대중화에 어려움을 겪고 있습니다. 또한 환자들의 줄기세포치료제에 대한 인식수준이나 이해도가 낮아 적극적인 치료가 권장되기 어려운 점 역시 줄기세포치료제를 이용한 치료 확대를 지연시키는 요인입니다. 따라서 상기 요인들은 당사 제품 수요에 부정적인 영향을 미칠 수 있으며 이로 인해 당사의 매출과 수익성에 부정적 요인으로 작용할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
바이오의약품은 국가별로 그 정의가 상이한 측면이 있지만, 한국의 경우 사람이나 다른 생물체에서 유래된 것을 원료 또는 재료로 하여 제조한 의약품을 총칭하며 '생물의약품'으로 불리기도 합니다. 바이오의약품은 '생물학적제제 등의 품목허가ㆍ심사 규정' 제2조에 따르면 보건위생상 특별한 주의가 필요한 의약품으로, 생물학적제제, 유전자재조합의약품, 세포배양의약품, 세포치료제, 유전자치료제, 기타 식품의약품안전처장이 인정하는 제제 등이 그 범주에 포함됩니다. 그 중 당사의 사업 영역에 해당하는 세포치료제는 살아있는 세포를 체외에서 배양, 증식하거나 선별하는 등 물리적, 화학적 생물학적 방법으로 조작하여 제조하는 의약품으로, 체세포치료제와 줄기세포치료제가 이에 속합니다.
바이오의약품이 지니는 가장 큰 가치는 희귀ㆍ난치성 질환에 효과가 뛰어나다는 점입니다. 바이오의약품은 기존 치료법으로 충족되지 않은 퇴행성ㆍ난치성 질환 치료제 또는 환자 맞춤형 표적치료제로 사용됩니다. 기존의 합성의약품이 대다수의 사람에게 일관적 효과를 기대하며 다수의 환자군을 타겟으로 한다면, 바이오의약품은 유전공학 및 항체 기술을 바탕으로 특정 환자군을 표적 치료하는 데 효과적입니다. 게다가 생체유래물질을 이용하기 때문에 독성이 낮고, 합성의약품보다 부작용이 적다는 장점을 가지고 있습니다.
그러나 바이오의약품은 복잡한 고분자 구조를 가지고 있고, 생물체를 이용하여 복잡한 제조공정을 거쳐야 하기 때문에 주변 환경 변화에 매우 민감합니다. 원료, 공정, 설비의 변화가 의약품 자체를 변화시킬 만큼 제조공정의 난이도가 매우 높아, 합성의약품 대비 제조가 까다롭습니다. 뿐만 아니라 배양 기술 및 제조 환경, 방법에 따라 전혀 다른 물질이 나올 수 있어 복제약(바이오시밀러) 제조도 쉽지 않습니다. 그렇기 때문에 바이오의약품은 합성의약품 대비 가격이 높게 형성되어 있습니다.
| [합성의약품과 바이오의약품 비교] |
| 구분 | 합성의약품 | 바이오의약품 |
|---|---|---|
| 원료 | 합성화합물질 | 생물체 유래물질(세포, 조직, 유전물질 등) |
| 구조 | 물리화학적 특성이 명확한 저분자 구조 | 정확한 특성 분석이 불가능하고, 활성과 구조가 일정하지 않음 |
| 안정성 | 대부분 온도ㆍ빛 등 환경에 안정적 | 온도ㆍ빛ㆍpH 등 외부 환경에 민감, 미생물 오염에 취약 |
| 대부분 36개월 | (세포치료제 사례) 대부분 3일 이내 (유전자치료제 사례) 영하 135℃에서 24개월 |
|
| 제조공정 | 간단한 화확적 합성으로 대량생산 | 복잡한 제조과정의 맞춤형 소량 생산 |
| 원료, 공정, 설비변화가 품질에 영향이 비교적 적음 (제조공정의 변이성이 매우 낮음) |
원료, 공정, 설비의 변화가 의약품 자체를 변화 (제조공정의 변이성이 매우 높음) |
|
| 상대적으로 복제가 쉽고 낮은 제조비용 | 복제가 불가능하고 높은 제조비용 | |
| 치료효과 | 비교적 명확한 약리기전, 대다수 사람에게 일관적 효과 기대 |
(세포치료제) 약리기전이 불확실 (유전자치료제) 복합적인 기전 환자에 따른 맞춤형 치료 가능 |
| 대부분 질병의 증상개선에 그침 | 질병의 근본적인 원인치료 가능 | |
| 안전성 | 약물 특이적이거나 약물 대사와 관련된 이상반응 | 생물체 유래물로 고유독성은 낮으나 면역 거부반응, 종양발생 등의 이상반응이 있음. 특히 장기 안전성 결과는 매우 부족 |
| 비임상시험 | 동물 시험을 통하여 약물의 독성 및 효과를 예측 가능 | 동물 시험으로 인체 결과를 예측하는 데 한계가 있음 |
| 투약방법 | 대부분 경구ㆍ주사 등 일반적 투여경로 | 대부분 주사 또는 주입, 이식 등 시술을 동반한 투여 |
| (출처) 바이오의약품 산업동향 보고서, 한국바이오의약품협회(2024.12) |
또한 2025년 2월 시행된 첨단바이오재생법에 따르면 첨단바이오의약품은 '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률' 제2조 제5호에서 정의하고 있으며, 세포치료제, 유전자치료제, 조직공학제제, 첨단바이오융복합제제, 그 밖에 세포나 조직 또는 유전물질을 함유하는 의약품입니다. 첨단바이오재생법은 첨단재생의료(줄기세포치료 포함) 및 첨단바이오의약품의 임상연구와 현장 적용을 크게 확대한 것이 핵심입니다. 중대한 난치질환 및 희귀질환만 가능했던 이전과 달리, 해당 제한이 폐지되었으며, 첨단재생의료 치료 역시 불가하였으나 심의를 전제로 중대ㆍ희귀ㆍ난치 질환의 환자 대상으로 가능해졌습니다. 또한 임상 연구 참여 범위가 넓어졌고 치료 실제 적용까지 절차가 간소화되었으며, 치료제 안전성과 유효성에 대한 사전 심사, 국가 임상지원, 치료비용 공개 등 환자보호장치가 추가되었습니다.
당사가 집중하고 있는 줄기세포치료제 역시 바이오 의약품의 일종 및 첨단바이오의약품의 일종으로 제품이 상용화되어 있으나 실제 시술횟수가 상대적으로 적어 아직 본격적으로 대중화되지는 못하고 있습니다. 비록 첨단바이오재생법의 시행으로 줄기세포치료제의 임상 연구ㆍ시판 문턱이 낮아졌으나, 국내에서는 여전히 고비용ㆍ보험 미적용ㆍ효과 불신 등이 혼재해 진정한 대중화는 아직 어려운 상황입니다. 따라서 기존 의약품에 비해 환자 처방 후 제품 생산이 가능하고, 대량생산이 어려우며, 보관 기간이 짧고, 제조원가 부담으로 인한 높은 판매가격으로 가격 경쟁력 측면에서 열위에 있기 때문에 여전히 본격적인 대중화에 어려움을 겪고 있습니다. 언론 보도 및 업계에 따르면 개원가(병원)에서는 한 무릎 기준 연골치료용 골수줄기세포 시술이 450~700만 원, 기존 허가 받은 줄기세포 치료제(예: 카티스템, 카티라이프 등)는 양측 1회 기준 약 2,000만 원(2병 기준)까지 형성되어 있으며, 이로 인해 국내에서는 보험 비적용, 정부 지원 한계 등으로 인해 연간 1만~3만명이 해외로 원정 치료를 떠나는 실정입니다. 또한 환자들의 줄기세포치료제에 대한 인식수준이나 이해도가 낮아 적극적인 치료가 권장되기 어려운 점 역시 줄기세포치료제를 이용한 치료 확대를 지연시키는 요인입니다. 줄기세포치료제의 임상적 효과와 장기적인 안전성이 충분히 입증되지 않았으며, 학계 부정(논문조작 등), 성급한 상업화 및 윤리적 논란 등으로 인해 부정적인 이미지를 심화시켰다는 점이 대표적인 사례입니다.
따라서 상기 요인들은 당사 제품 수요에 부정적인 영향을 미칠 수 있으며 이로 인해 당사의 매출과 수익성에 부정적 요인으로 작용할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
|
[바. 해외 CRO업체의 공격적인 국내진출 또는 신규 기업 진입에 따른 경쟁 심화 위험] |
제약ㆍ바이오 시장의 성장으로 인하여 국내에서 다양한 신약 및 의약품에 대한 연구개발이 증가하고 있습니다. 국내 제약ㆍ바이오 기업들 대부분은 글로벌 제약사에 기술수출을 하는 것이 목표이다 보니, 외국계 CRO를 선호하는 경향이 점점 더 뚜렷해지고 있습니다. 실제로 국내에서 기술수출이 이루어지는 신약 후보물질 다수는 임상 1상 또는 2a상 종료 이후 해외로 이전되며, 이후 후속 임상 단계는 대부분 외국계 CRO가 수행하게 되는 실정입니다. 국내 CRO 기업들도 일부 효능ㆍ독성 실험에서는 경쟁력을 보유하고 있으나, 기술적 경험, 글로벌 신뢰도, 규제ㆍ인허가 지원 및 시장 네트워크 등 여러 중요한 분야에서 외국계 CRO 업체에 밀리고 있는 추세입니다.
특히, 외국자본 CRO는 중ㆍ대형 글로벌 빅파마와의 오랜 파트너십, 대형ㆍ다국적 임상 및 신약개발을 대행할 수 있는 조직ㆍ인프라ㆍ자본ㆍ데이터 역량 측면에서 내국자본 CRO 대비 우위를 띠고 있습니다. 복잡하고 규모가 큰 임상 시험에서는 외국자본 CRO의 고객기반 흡수력이 두드러지며, 사실상 점유율 확대가 가속화되고 있습니다.
국가임상시험지원재단 임상시험 산업실태 조사(2024)에 따르면, 국내 CRO 산업의 매출규모는 2020년 6,722억원에서 2023년 9,801억원으로 증가하였으며, 국내자본 CRO의 매출규모는 2020년 4,024억원에서 2023년 5,463억원 연평균 10.7%으로 증가하는 데 그친 반면, 외국자본 CRO의 매출규모는 2020년 2,698억원에서 2023년 4,338억원으로 연평균 17.1% 증가하여 외국자본 CRO의 성장세가 국내자본 CRO 대비 높게 나타나며 매출규모 차이가 좁혀지고 있습니다. 이는 국내자본 CRO의 최대 강점이던 커뮤니케이션 및 신속성, 대관업무 효율 등도 점차 글로벌 사업자들의 국내 경험 축적, 조직 기반 확장, 우수 인력 흡수 등에 따라 그 우위가 약화된 점에 기인합니다.
| [국내 CRO 매출규모 및 추이 (단위 : 백만원)] |
 |
|
국내 cro 매출규모 및 추이 |
| (출처) 국가임상시험지원재단, 2024년 임상시험 산업실태 조사(2024.07) |
국내 비임상 CRO 시장은 주로 안전성 평가를 하는 민간회사 2개사(당사, 바이오톡스텍)와 정부 산하기관 1개사(KIT)가 과점형태를 띄고 있으며, 유효성 평가를 주업으로 하는 HLB바이오스텝, 엔딕(구. KPC), 디티앤씨알오 및 외국계 CRO업체들로 나눠져 있습니다. 안전성 평가를 위해서는 식품의약품안전처 GLP 인증기관으로 식품의약품안전처에 보고서를 접수할 수 있는 자격을 갖추어야 합니다. 식품의약품안전처의 최근 공고일인 2025년 6월 30일 기준, 국내 우수실험실운영(GLP) 기준을 충족하여 인증을 받은 기관은 총 28개 입니다.
국내의 경우 1986년 보건복지부에서 '의약품안전성시험관리기준' 을 고시함으로써 의약품 등의 안전성 평가시험에 대한 GLP 적용을 규제하기 시작했습니다. 이후 산업화학물질 및 농약 등 산업 각 분야의 신물질에 대해 GLP 적용이 확대 실시되고 있으며, 각 영역마다 주관 정부기관이 해당 GLP 규정을 제정하여 관리하고 있습니다. 즉, 의약품, 화장품, 식품, 화학물질 등 허가 관련하여 해당 정부기관에 제출되는 자료는 GLP 인증기관에서 적합하게 수행된 자료만 인정하도록 법제화되어 있습니다.
효능시험의 경우 허가기관의 GLP 인증이 필요 없는 Non-GLP 시험으로 수행하는 바, 대학교 연구소, 해외 CRO 기관 등에 주로 시험을 의뢰하여 경쟁상황 파악에 어려움이 있습니다. 또한 임상 및 비임상 CRO 서비스를 같이 병행하는 기업들이 많으며, 안전성 평가 역시 연구소 및 연구센터 등이 적지 않기에 정확한 국내 비임상 CRO 시장 규모를 산정하는 것에 어려움이 있습니다. 다만, 업계에 따르면 국내 비임상 CRO 시장은 약 3,000억 ~ 4,000억 규모로 추산되며, 유효성 평가보다 독성 평가 등 관련 항목이 많은 안전성 평가 비중이 더 클 것으로 추정되고 있습니다.
CRO산업은 특성상 초기투자비용이 높고, 높은 수준의 시험기자재, 숙련된 연구원 등 연구기반 인프라 구축까지 많은 시간과 자원의 소요가 필요하며, 실험경험의 유무가 계약과 관련한 중요한 요소가 되는 만큼 진입장벽이 높은 산업적 특성을 가지고 있습니다. 하지만 최근 대형 글로벌 CRO의 국내 진출, 합병ㆍ제휴 움직임, 정부 및 기업의 글로벌 인허가 영향력, 대형 의뢰 고객의 외자 선호 등으로 인해 점유율이 지속적으로 잠식되고 있습니다. 특히 국내 CRO들은 해외 선진업체와 비교해 해외 인허가 경험, R&Dㆍ투자 규모, 글로벌 네트워크, 데이터 신뢰성ㆍ투명성 측면에서 구조적 한계를 갖고 있어, 국내외 경쟁이 격화되는 본격적인 변화기에 지속적으로 밀려날 위험이 적지 않습니다.
즉, 세계적인 대형 CRO업체들이 한국 제약ㆍ바이오 시장에 주목하여 임상 및 비임상시험을 비롯한 다양한 바이오컨설팅을 제공하기 위해 경쟁적으로 뛰어들 가능성을존재하는 상황입니다. 전 세계적으로 1,100개 이상의 CRO 기업이 존재하는 것으로 추산되고 있는데, 이 중 2023년에는 글로벌 CRO 상위 10개 기업에 80.8%의 시장점유율이 집중된 것으로 나타난 점을 보면 CRO 산업은 전세계적으로 볼 때 독과점 형태를 보이고 있습니다. 이 중 IQVIA, LabCorp, PPD 등은 이미 국내 시장에서도 활발히 영업망을 강화하고 있고, 합병ㆍ인수와 신사업 다각화 및 가격경쟁력 제고 등에 힘입어 앞으로도 그 영향력이 더욱 확대될 전망입니다.
| [글로벌 상위 CRO 업체 시장 점유율(2023년)] |
| 순위 | 업체 | 2023년 매출(억 달러) | 시장점유율(%) |
|---|---|---|---|
| 1 | IQVIA | 149.8 | 18.3 |
| 2 | LabCorp | 121.6 | 14.8 |
| 3 | PPD (Thermo Fisher 산하) | 99.9 | 12.2 |
| 4 | ICON | 81.2 | 9.9 |
| 5 | WuXi AppTec | 56.4 | 6.9 |
| 6 | Syneos Health | 54.3 | 6.6 |
| 7 | Charles River Laboratories | 41.3 | 5.0 |
| 8 | Fortrea | 31.0 | 3.8 |
| 9 | Medpace | 18.9 | 2.3 |
| 10 | Parexel | 8.4 | 1.0 |
| 기타 | 기타(중소ㆍ지역 CRO 포함) | 157.3 | 19.2 |
| (출처) Pharma Boardroom(2024.09) |
이러한 시장 상황에서 중소 국내 CRO 업체들은 자본력, 글로벌 경험, 첨단 기술력, 조직관리, 데이터 표준화 및 국제 인증 등 여러 방면에서 구조적 열위에 놓일 수밖에 없으며, 단기적으로는 매출 증가세 유지가 어렵고, 중장기적으로는 영업기반 위축, 인력 유출, 수익성 약화 등 경영환경 악화가 현실화될 위험이 높아지고 있습니다. 더욱이, 세계적으로 크고 수많은 대형 CRO업체들은 한국 제약ㆍ바이오 시장에 공격적으로 국내 임상 및 비임상시험, 바이오컨설팅 시장 등에 진출할 가능성이 높으며, 인수ㆍ합병 또는 제휴 등을 통해 국내 CRO업체들에 대한 위협은 갈수록 커질 수 있습니다. 따라서 당사의 미래 경영실적과 시장 점유율에 중대한 부정적 영향을 줄 수 있음을 투자자 여러분께서는 반드시 유의하시기 바랍니다.
| [사. 임상시험 관련 정보 및 데이터 유출에 따른 피소 위험] 당사는 다양한 임상관련 업무의 일체 혹은 일부를 의뢰자에게 위탁받은 연구용역 위탁업체로서 임상 관련 데이터를 산출, 관리하기 때문에 의뢰자의 개발 프로젝트에 대한 비밀정보 접근이 쉽습니다. 임상 관련 데이터는 신약개발 성공 유무에 있어 매우 중대한 사업정보이기 때문에 고객사로부터 획득한 비밀정보의 유지와 데이터 보안의 중요성이 더욱 커지고 있습니다. 이러한 거래상대방의 비밀정보가 외부로 누설될 경우, 당사는 고객사로부터 손해배상청구 소송 등에 노출될 수 있으며, 나아가 시장의 신뢰성 하락으로 당사의 사업 지속성에 부정적인 영향을 미칠 수 있으니 투자자들께서는 이 점 유의하시기 바랍니다. |
제약ㆍ바이오산업의 신약 개발은 장기간 투자와 고위험을 수반하나 글로벌 블록버스터급 신약 개발 성공 시 막대한 고부가가치 창출이 가능한 산업입니다. 시장에서 성공한 블록버스터 신약은 해당 기업에 보통 10년 이상의 안정적인 고부가가치 수익 기반을 제공하게 됩니다. 또한 한 개의 신약이 개발되기까지는 여러 개발 단계를 거치게 되며, 과학기술정보통신부의 'BIOTECHNOLOGY IN KOREA 2024'에 따르면 임상1상 착수 후 품목허가를 받는 비율은 지난 10년 간 평균 7.9%로 조사되었습니다. 이에 따라 제약/바이오 업체 간 정보 및 기술 경쟁이 점차 심화되고 있으며 비밀정보 유지와 데이터 보안은 개발성공을 위해 필수적이고 중요한 부분입니다.
당사는 비임상시험 수행 및 그 결과분석 등에 요구되는 다양한 업무의 일체 혹은 일부를 의뢰자에게 위탁받은 연구용역 위탁업체로서 고객사 관련 데이터를 산출, 관리하기 때문에 의뢰자의 개발 프로젝트에 대한 정보에 접근할 수 있습니다. 이러한 거래상대방의 중요 정보가 외부로 누설 또는 유출될 경우, 거래상대방으로부터 손해배상소송 등에 노출될 수 있으며, 나아가 시장의 신뢰성 하락으로 당사의 평판에 악영향을 끼쳐 사업 지속성에 부정적인 영향을 미칠 수 있습니다.
이에 당사는 중요정보 유출에 대한 방지책을 마련하고 있습니다. 먼저 수주된 용역별로 개별적으로 시험 책임자를 지정하며, 개별 시험에 참여하는 연구자들은 해당 연구자료를 임의로 외부반출하지 못하도록 파일을 암호화하고 있습니다. 외부반출 파일자료의 복호화는 특정 인원에게만 부여되며, 필요시마다 승인을 받아야 하고, 매달 전산정보센터에서 복호화 기록 자료를 의무적으로 경영지원본부와 연구소장 등에게 보고하도록 하고 있습니다. 또한 신입 직원 교육 시 회사의 업종의 특수성에 대한 설명과 고객 비밀준수 교육에 대하여 중요하게 진행하고 있으며, 수시로 해당부서장이 인지 재교육을 실시하고 있습니다.
또한 당사는 임직원들에게 정보보안 교육을 주기적으로 수행하고 IT 담당 팀에서 지속적으로 정보유출에 관한 모니터링을 하는 등 비밀 정보 유출을 방지하기 위해 최선을 다하고 있습니다. 그럼에도 불구하고 당사의 임직원이 고의 또는 과실로 고객에 대한 비밀정보 유출이 발생할 경우 당사는 손해배상 소송에 노출될 수 있으며, 나아가 시장의 신뢰성 하락으로 영업 전반에 부정적인 영향을 받을 수 있으니 투자자들께서는 이 점 유의하시기 바랍니다.
| [아. 기술이전계약 해지 및 기술이전계약 파트너사 관련 위험] 계약금은 계약 직후 수령하는 것으로, 계약조건에 따라 반환의무가 존재하는 경우가 있습니다. 마일스톤의 경우 추가개발 진행상황에 따라 수취하게 되는 금액이며, 로열티는 최종 허가 이후 해당 제품이 매출을 발생시킬 경우 받게 되는 수수료입니다. 다만 당사는 기술이전 계약을 체결하고 현재 개발중인 루푸스 치료제(CE211AT15 품목)에 대하여 계약금 및 임상 1상 종료에 따른 마일스톤을 수취하였으며, 라이센스아웃 계약이 종료되더라도 반환의무가 발생되는 금액은 없습니다. 하지만 향후 당사가 추가적인 기술이전을 통해 신약개발을 진행하게 되면 계약 상대방이 추가개발에 실패하거나 원활한 진행이 되지 않는 경우, 반환의무가 있는 계약금이나 마일스톤 등은 기술이전을 완료했더라도 지급의무가 발생할 수 있습니다. 또한 기술을 이전받은 파트너사는 라이센스아웃을 시행한 회사에서 별도의 관리감독을 할 수 없는 경우가 다수이므로 파트너사의 임상수행 능력, 내부사정 및 예상치 못한 원인으로 인하여 임상진행이 중단될 가능성도 존재합니다. 따라서 이러한 경우에는 당사의 수익성이 악화되거나 사업에 부정적 영향을 줄 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
높은 비용과 낮은 임상 성공률, 그리고 오랜시간이 소요되는 신약개발 사업의 특성상 다수의 제약ㆍ바이오 기업에서는 기술이전을 활발히 진행하고 있습니다. 기술이전이란 개발된 기술을 계약 파트너에게 이전하여 해당기술의 독점실시권을 허락하는 것으로, 통상 기술을 이전할 때는 계약 파트너가 해당 기술을 활용하여 제품을 개발하고 판매할 수 있는 권리도 함께 이전하게 됩니다. 이 과정에서 기술을 이전한 기업은 계약 조건에 따라 계약체결 직후 선수금을, 이후 개발 단계의 달성 시점에 따라 중도금을 지급받게 됩니다. 그리고 완제 의약품의 시장 출시 후 판매대금의 일정비율까지 로열티의 명목으로 지급받는 경우가 일반적입니다. 따라서 기술이전 계약 이후에 이루어지는 임상 개발, 품목 허가 및 판매 등의 업무는 기술을 이전받는 회사의 역량에 의해 좌우된다고 할 수 있습니다.
라이센스 거래는 제약기업 간 전략적 제휴의 대표적인 형태 중 하나로 최근들어 건수는 소폭 감소하고 있으나 거래 규모는 확대되고 있습니다. 양질의 기술을 보유했으나 자금력과 경험 부족 등으로 높은 임상비용을 감당하기 어려운 회사나, 최종 임상 성공여부의 리스크 부담을 경감하고자 하는 회사에서는 라이센스 아웃(기술이전)을 통해 각종 기술료를 받음으로써 회사 재무구조 개선에 활용하고 있습니다. 라이센스 아웃은 Upfront fee(초기계약금), Milestone(개발단계별 기술료), Running Royalty(매출의 일정 비중을 로열티로 지급) 등으로 구성되어 있으며, 단계별로 수익이 발생하게 됩니다. 반대로 라이센스 인을 하는 기업은 오랜 기간이 소요되는 연구 단계를 거치지 않고 양질의 기술을 신속하게 확보함으로써 보다 효율적인 신약개발을 진행할 수 있다는 장점이 있습니다. 이처럼 라이센스 거래는 다양한 파이프라인의 보유 목적 외에도 파이프라인 독점을 위한 수단으로도 활용되고 있습니다.
당사의 사업은 기술이전을 통한 계약금 및 로열티, 마일스톤 등의 기술이전 매출을 주요 수익원 중 하나로 인식하고 있습니다. 따라서 추진했거나 추진 예정인 기술이전 계약의 성공적인 이행에 따른 수익 인식은 당사의 수익성에 큰 영향을 미칠 것으로 판단됩니다. 기술이전 계약이 성공적으로 체결되지 못하여 체결이 지연 혹은 취소될 경우 그 액수와 규모에 따라 당사의 수익성에 부정적 영향을 미칠 가능성이 존재합니다.
일반적으로 기술이전이 이루어질 경우, 추가개발은 라이센스인(License-in)을 한 기업에서 진행하며 계약에 따라 별도로 추가개발을 진행할 수도 있습니다. 라이센스인을 한 기업에서는 추가개발 상황 및 임상시험 결과에 따라 마일스톤 및 로열티를 지급하게 되는데 이러한 수익구조는 다음과 같이 정리할 수 있습니다.
| [라이센스 계약의 수익구조] |
| 구분 | 내용 | |
|---|---|---|
| 총계약금액 | 계약금 | 계약 체결 직후 또는 일정기간 내에 받게 되는 금액 |
| 마일스톤 | 전임상, 임상, 허가신청, 허가완료 등 개발 단계별로 성공시 받게 되는 금액 | |
| 로열티 | 기술 이전으로 생산된 제품의 매출에 따라 받게 되는 금액 (통상 매출액 대비 비율로 책정) |
|
| (출처) 금융감독원 보도자료, 제약ㆍ바이오 기업의 공시실태 및 투자자 보호방안(2018.08)) |
계약금은 계약 직후 수령하는 것으로, 계약조건에 따라 반환의무가 존재하는 경우가 있습니다. 마일스톤의 경우 추가개발 진행상황에 따라 수취하게 되는 금액이며, 로열티는 최종 허가 이후 해당 제품이 매출을 발생시킬 경우 받게 되는 수수료입니다. 다만 당사는 기술이전 계약을 체결하고 현재 개발중인 루푸스 치료제(CE211AT15 품목)에 대하여 계약금 및 임상 1상 종료에 따른 마일스톤을 수취하였으며, 라이센스아웃 계약이 종료되더라도 반환의무가 발생되는 금액은 없습니다.
해당 루푸스 치료제(CS20AT04)는 초기 임상 1상 종료 후, 한양대학교병원에서 루푸스 신염 및 혈구감소증 대상자로 연구자 임상시험을 실시하였습니다. 임상 1상 및 연구자 주도 임상시험의 대상자 수가 적기 때문에 유효성 및 안전성을 입증해야 하는 임상 2상 전에 추가적인 연구자 주도 임상시험 계획하여 이를 통해 더 많은 수의 대상자에서 적절한 대상군 및 평가지표를 찾고자 하였습니다. 그러나 2019년 이후 당사의 주력 파이프라인인 뉴로나타-알의 임상 3상이 2020년 본격화됨에 따라, 내부 협의를 통해 해당 연구자 주도 임상시험은 논의를 거쳐 잠정 중단하기로 결정되었습니다. 연구자 주도 임상시험은 중단되었지만, 한양대학교병원 류마티스병원(1상 및 연구자 주도 임상시험 책임자 교수, 관계자 등), 한림제약, 당사 중앙연구소(임상팀 및 개발팀) 인원들이 매월 정기 미팅을 통해 향후 임상시험 계획에 대한 논의를 현재까지 지속해 오고 있습니다. 2025년 2월, 보건복지부의 첨단재생의료 연구 및 치료에 대한 첨단법이 시행되었고, 기존 식약처 주도의 연구자 주도 임상시험이 복지부 주관 첨단재생의료 연구 및 치료로 변경되었습니다. 향후 보건복지부 주도의 첨단재생의료 연구를 통해 적절한 대상자 및 평가지표 등의 확립을 한양대학교병원, 한림제약, 당사에서 함께 진행할 계획입니다.
| [라이센스아웃 계약 총괄표] |
(주1) 전신성 홍반성 루푸스 및 루푸스 신염 세포치료제
|
| (출처) Dart전자공시시스템 |
하지만 향후 당사가 추가적인 기술이전을 통해 신약개발을 진행하게 되면 계약 상대방이 추가개발에 실패하거나 원활한 진행이 되지 않는 경우, 반환의무가 있는 계약금이나 마일스톤 등은 기술이전을 완료했더라도 지급의무가 발생할 수 있습니다. 또한 기술을 이전받은 파트너사는 라이센스아웃을 시행한 회사에서 별도의 관리감독을 할 수 없는 경우가 다수이므로 파트너사의 임상수행 능력, 내부사정 및 예상치 못한 원인으로 인하여 임상진행이 중단될 가능성도 존재합니다. 따라서 이러한 경우에는 당사의 수익성이 악화되거나 사업에 부정적 영향을 줄 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [자. 핵심연구인력 등 인력 유출 위험] 연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 가장 중요한 요소입니다. 이는 제약 산업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 또한, 주요 연구 인력의 유출이 있을 경우 해당 연구 개발과제가 지연되거나 개발전략을 수정해야 할 가능성이 존재하며, 개발비 부담 등으로 당사의 경쟁력 및 성장 가능성이 악화될 수 있습니다. 당사의 총 연구인력 규모는 지속적으로 감소하고 있으며, 특히 2023년에 바이오의약품 사업부 부문 중 석사급 인력에서 기존 인원 대비 절반 수준의 인력 유출이 발생하였으며, 이는 이직이 잦은 제약/바이오 업계 특성을 감안하더라도 매우 큰 수치라고 볼 수 있습니다. 이에 당사가 추정한 바로는 FDA 임상 3상 IND 승인이라는 가치 있는 경험을 가진 해당 인력들에 대한 수요가 많기에 헤드헌팅을 통해 이직한 경우가 많은 것으로 판단하고 있습니다. 또한 당사는 특허를 통해 핵심기술에 대한 권리보호 전략을 시행하고 있으나, 핵심 연구 인력의 유출은 당사가 축척해온 기술관련 노하우 등의 기술유출 위험을 내포하고 있습니다. 특히 당사 핵심 연구인력의 유출은 당사의 사업계획 및 주요 임상 진행 계획에 차질을 발생시킬 수 있습니다. 하지만 각 팀의 중추적인 팀장급 핵심인력들은 유지되고 있으며, 적절한 내부통제를 준수하여 당사의 핵심 기술이나 핵심 문서 등에 대한 유출 사례는 발생하지 않은 것으로 파악되고 있습니다. 따라서 각 파이프라인별 임상의 연속성 및 지속성에는 큰 문제가 없다고 판단되지만, 당사가 미처 파악하지 못한 기술 유출 등의 사례가 존재하거나, 추후 기술 유출 등이 발생한다면 당사 사업의 매우 중대한 악영향을 미칠 수 있습니다. 당사 및 당사는 지식과 경험이 풍부한 인력이 사업의 핵심 경쟁력이라는 사실을 인지하고 우수한 인력을 지속적으로 채용하고 적극적인 훈련과 교육을 통해 우수한 인재를 양성하고자 노력하고 있습니다. 또한 기존 인력에 대해서는 사업경쟁력을 바탕으로 한 자긍심 고취, 스톡옵션 부여 및 급여 인상 등 처우 개선을 위해 노력하고 있습니다. 하지만 당사 및 당사의 이러한 노력에도 불구하고 우수한 전문인력의 국내외 경쟁사 또는 정부출연 연구기관으로의 유출 등의 사유로 인해 우수한 전문인력을 유지하거나 확보하는 데 어려움이 발생하는 경우 사업경쟁력이 약화될 수 있으며, 이로 인하여 재무상태 및 영업실적에 부정적인 영향이 있을 수 있으니 투자자들께서는 이 점 유의하시기 바랍니다. |
연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 가장 중요한 요소입니다. 이는 제약 산업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 또한, 주요 연구 인력의 유출이 있을 경우 해당 연구 개발과제가 지연되거나 개발전략을 수정해야 할 가능성이 존재하며, 개발비 부담 등으로 당사의 경쟁력 및 성장 가능성이 악화될 수 있습니다.
당사의 중앙연구소는 줄기세포를 기반한 치료제를 개발하기 위하여 신규기반 기술 구축, 안전성과 유효성 관련 비임상연구, 생산성 향상 기술 개발 등을 수행하고 있습니다. 특히 희귀질환 및 난치성 질환의 경우 전문의의 요청에 따라 치료제 개발 니즈와 가능성을 검토해야 하기 때문에, 각 연구인력들은 초기 단계부터 목표 질환에 대표성 있는 의료진과 긴밀한 협력관계를 유지하며 장기간에 걸쳐 공동 연구개발을 진행하는 체계로 연구개발을 수행하고 있습니다.
| [연구개발 조직 개요(바이오의약품 사업부)] |
| 구분 | 주요 내용 |
|---|---|
| 조직명 | 코아스템켐온(주) 중앙연구소 |
| 조직형태 | 기업부설연구소 |
| 운영현황 |
설립 : 2005년 3월 10일(최초 인증일) - 신규 기능강화 물질 탐색 - 신규 제형/ 제제 개발 - 신규 타겟 발굴 - 신규 질환 맞춤형 동물모델 확립 및 평가 - 치료제 작용기전 연구 - 바이오마커 발굴 |
| (출처) 당사 제시 |
비임상CRO사업부의 자체 R&D는 연구소장 총괄로 모든 센터가 관여하지만, 인허가 자료에 필요한 안전성, 효력시험등은 모두 운영책임자 책임을 전제로 운영되고 있습니다. 또한, 모든 시험의 신뢰성을 부여하기 위해서 QAU가 별도의 부서로 존재하고 있습니다.
| [연구개발 조직 개요(비임상 CRO 사업부)] |
| 구분 | 주요 내용 |
|---|---|
| 조직명 | 코아스템켐온(주) 비임상연구소 |
| 조직형태 | 기업부설연구소 |
| 운영현황 |
설립 : 2001년 1월 18일(최초 인증일) - 안전성/유효성 평가 시험방법 개발 |
| (출처) 당사 제시 |
본 증권신고서 제출일 현재 당사는 박사급 14명, 석사급 74명, 기타 109명 등 총 197명의 연구인력을 보유하고 있으며, 그 현황은 다음과 같습니다.
| [당사 연구개발인력 현황] |
| 구 분 | 인 원 | ||||
| 박사 | 석사 | 기타 | 합 계 | ||
| 바이오의약품사업부 | 중앙연구소 | 4 | 14 | 5 | 23 |
| 비임상CRO사업부 | 비임상연구소 | 10 | 60 | 104 | 174 |
| 합계 | 14 | 74 | 109 | 197 | |
| (출처) 당사 정기보고서 |
과거 3개년부터 2025년 반기말까지 당사 연구인력의 유출입 현황은 다음과 같습니다.
| 연도 | 구분 | 박사 | 석사 | 기타 | 합계 |
| 기존인원(바이오의약품) | 1 | 12 | 6 | 19 | |
| 2022년 (바이오의약품 사업부) |
유입 | 1 | 6 | 6 | 13 |
| 유출 | 0 | 4 | 1 | 5 | |
| 총원 | 2 | 14 | 11 | 27 | |
| 평균 근속년수 | 1년 9개월 | 1년 6개월 | 1년 7개월 | 1년 7개월 | |
| 2022년 (비임상CRO사업부) |
유입 | 0 | 0 | 1 | 1 |
| 유출 | 0 | 7 | 6 | 13 | |
| 총원 | 9 | 40 | 97 | 146 | |
| 평균 근속년수 | 7년 9개월 | 7년 1개월 | 6년 5개월 | 6년 7개월 | |
| 2022년 합계 | 유입 | 1 | 6 | 7 | 14 |
| 유출 | 0 | 11 | 7 | 18 | |
| 총원 | 11 | 54 | 108 | 173 | |
| 평균 근속년수 | 6년 8개월 | 5년 7개월 | 6년 | 5년 9개월 | |
| 2023년 (바이오의약품 사업부) |
유입 | 0 | 4 | 2 | 6 |
| 유출 | 1 | 6 | 4 | 11 | |
| 총원 | 1 | 12 | 9 | 22 | |
| 평균 근속년수 | 4년 | 3년 4개월 | 2년 6개월 | 3년 1개월 | |
| 2023년 (비임상CRO사업부) |
유입 | 3 | 19 | 16 | 38 |
| 유출 | 0 | 2 | 4 | 6 | |
| 총원 | 12 | 57 | 109 | 178 | |
| 평균 근속년수 | 6년 8개월 | 5년 9개월 | 6년 6개월 | 6년 4개월 | |
| 2023년 합계 | 유입 | 3 | 23 | 18 | 44 |
| 유출 | 1 | 8 | 8 | 17 | |
| 총원 | 13 | 69 | 118 | 200 | |
| 평균 근속년수 | 6년 6개월 | 5년 4개월 | 6년 3개월 | 6년 | |
| 2024년 (바이오의약품 사업부) |
유입 | 1 | 10 | 0 | 11 |
| 유출 | 0 | 4 | 3 | 7 | |
| 총원 | 2 | 18 | 6 | 26 | |
| 평균 근속년수 | 3년 1개월 | 1년 9개월 | 4년 2개월 | 2년 5개월 | |
| 2024년 (비임상CRO사업부) |
유입 | 3 | 15 | 17 | 35 |
| 유출 | 0 | 4 | 10 | 14 | |
| 총원 | 15 | 68 | 116 | 199 | |
| 평균 근속년수 | 7년 3개월 | 6년 | 7년 1개월 | 년 개월 | |
| 2024년 합계 | 유입 | 4 | 25 | 17 | 46 |
| 유출 | 0 | 8 | 13 | 21 | |
| 총원 | 17 | 86 | 122 | 225 | |
| 평균 근속년수 | 6년 8개월 | 5년 2개월 | 6년 9개월 | 6년 2개월 | |
| 2025년 반기 (바이오의약품 사업부) |
유입 | 2 | 0 | 0 | 2 |
| 유출 | 0 | 4 | 1 | 5 | |
| 총원 | 4 | 14 | 5 | 23 | |
| 평균 근속년수 | 3년 8개월 | 1년 9개월 | 4년 8개월 | 2년 9개월 | |
| 2025년 반기 (비임상CRO사업부) |
유입 | 0 | 0 | 0 | 0 |
| 유출 | 5 | 8 | 12 | 25 | |
| 총원 | 10 | 60 | 104 | 174 | |
| 평균 근속년수 | 7년 7개월 | 6년 5개월 | 7년 7개월 | 7년 3개월 | |
| 2025년 반기합계 | 유입 | 2 | 0 | 0 | 2 |
| 유출 | 5 | 12 | 13 | 30 | |
| 총원 | 14 | 74 | 109 | 197 | |
| 평균 근속년수 | 6년 6개월 | 5년 6개월 | 7년 5개월 | 6년 8개월 | |
| (출처) 당사 제시 |
| 주) 유입/유츨 현황에는 재직 중 학위를 취득한 인원이 포함되어 있습니다. |
총 연구인력 규모는 지속적으로 감소하고 있으며, 특히 2023년에 바이오의약품 사업부 부문 중 석사급 인력에서 기존 인원 대비 절반 수준의 인력 유출이 발생하였으며, 이는 이직이 잦은 제약/바이오 업계 특성을 감안하더라도 매우 큰 수치라고 볼 수 있습니다. 이에 당사가 추정한 바로는 FDA 임상 3상 IND 승인이라는 가치 있는 경험을 가진 해당 인력들에 대한 수요가 많기에 헤드헌팅을 통해 이직한 경우가 많은 것으로 판단하고 있습니다. 또한 당사는 특허를 통해 핵심기술에 대한 권리보호 전략을 시행하고 있으나, 핵심 연구 인력의 유출은 당사가 축척해온 기술관련 노하우 등의 기술유출 위험을 내포하고 있습니다. 특히 당사 핵심 연구인력의 유출은 당사의 사업계획 및 주요 임상 진행 계획에 차질을 발생시킬 수 있습니다. 하지만 각 팀의 중추적인 팀장급 핵심인력들은 유지되고 있으며, 적절한 내부통제를 준수하여 당사의 핵심 기술이나 핵심 문서 등에 대한 유출 사례는 발생하지 않은 것으로 파악되고 있습니다. 따라서 각 파이프라인별 임상의 연속성 및 지속성에는 큰 문제가 없다고 판단되지만, 당사가 미처 파악하지 못한 기술 유출 등의 사례가 존재하거나, 추후 기술 유출 등이 발생한다면 당사 사업의 매우 중대한 악영향을 미칠 수 있습니다.
증권신고서 작성 기준일 현재 당사가 개발 완료하였거나 개발 중인 신약(개량신약, 복제약(시밀러)등 포함)의 세부 내용은 다음과 같습니다.
| [연구개발 완료 실적] |
| 구 분 | 품 목 | 적 응 증 | 개발완료일 | 현재 현황 | 비 고 | |
|---|---|---|---|---|---|---|
| 바이오 | 세포치료제 | 뉴로나타-알® | 근위축성 측삭경화증 | 2014년 | 한국 판매중 | 변경허가 신청 |
| (출처) 당사 제시 |
| [연구개발 진행 총괄표] |
| 구 분 | 품 목 | 적응증 |
연구 시작일 |
현재 진행단계 |
연구 중단일 |
비 고 | ||
| 단계(국가) | 승인일 | |||||||
| 바이오 |
중간엽 줄기세포 치료제 |
뉴로나타 -알® |
근위축성 측삭경화증 |
2004년 |
품목 허가(한국) 임상 3상(한국) 임상 1상(한국) |
2014년 2020년 2024년 |
- |
조건부 품목허가 MFDS, FDA 임상 3상 실시 현탁화제 변경을 위한 임상 1상 완료 |
| CE211AT15 | 루푸스 | 2012년 |
임상 1상(한국) 연구자임상(한국) |
2015년 2018년 |
- | 1상 임상시험, 연구자임상시험 종료 공동개발 |
||
| CE111BR16 | 다계통위축증 | 2013년 | 임상 1상(한국) | 2015년 | - | 1상 임상시험 종료 | ||
| CE211BR19 | 소뇌실조증 | 2016년 | 연구자임상(한국) | 2019년 | - | 연구자임상시험 종료 | ||
| CE211NS21 | 시신경 척수염 | 2021년 | 임상 1상(한국 | 2024년 | - | 1상 임상시험 승인 | ||
| 유도만능 줄기세포 치료제 |
CE223BR17 |
파킨슨, 퇴행성신경계질환 |
2017년 | 비임상 | - | - | 비임상 | |
|
세포외 소포체 |
EV231NU20 | 특발성 폐섬유증 | 2021년 | 비임상 | - | - | 비임상 | |
| (출처) 당사 정기보고서 |
당사는 2003년 창립 이후 현재까지 줄기세포 기반의 희귀난치병 치료제를 개발해 오면서 루게릭병 줄기세포 치료제의 국내 판매 승인 및 FDA 임상3상 승인 등의 성과를 이루었고, 국내 줄기세포관련 바이오 기업 중 가장 앞선 성취를 달성하였습니다. 이러한 당사의 선도적인 지위는 관련 분야의 핵심 연구인력이 유입되는 계기가 되었습니다. 또한, 당사는 판매 승인된 줄기세포 치료제의 자가 생산을 위하여 자가GMP를 운영하고 있으며 COVID-19 팬데믹 이전까지 연간 약 150LOT의 생산량을 달성하였는데, 이러한 자가GMP 운영 환경은 생산분야 임직원의 배양/생산/품질관리 등의 분야에 대한 노하우를 습득할 수 있는 이점으로 판단됩니다. 더불어 당사는 2014년, 2019년 2차례에 걸쳐 전 임직원을 대상으로 스톡옵션을 발행하고, 2021년 직원들의 평균 연봉을 약 28% 인상하는 등 핵심 인력의 채용 및 유지를 위한 처우 수준 향상에 노력하고 있습니다.
또한 당사가 영위 중인 비임상 시험이란 사람에 대해 수행하는 임상시험 실시 전에 동물을 사용하여 안전성과 부작용을 예측하기 위해 수행되는 일련의 시험을 의미합니다. 제약산업에서 비임상 CRO의 사업 영역은 합성의약품, 바이오의약품, 바이오시밀러, 세포치료제, 유전자치료제, 건강기능식품 등 인간의 건강과 안전에 관련된 신물질에 대하여 세포 및 동물 등을 이용해 효능과 인체유해성을 평가하는 연구개발 서비스사업을 포괄하며, 크게 나누어 안전성 평가, 유효성평가, 안전성 약리, 약물분석의 4개의 영역으로 나눌 수 있습니다.
안전성 평가는 신물질에 대한 독성 발현 및 부작용을 평가하는 것으로서 일반독성시험, 특수 독성시험 등이 해당됩니다. 유효성 평가는 신물질에 대한 약리학적 효과를 평가하는 것으로 스크리닝 시험, 약효약리 시험 등이 해당됩니다. 안전성 약리 시험은 약물개발 단계에서 치료용량 또는 그 이상의 용량에 노출되었을 때에 나타날 수 있는 바람직하지 않은 약리학적 효과를 평가하는 시험으로 심혈관계, 중추신경계, 호흡기계 영향에 대한 시험입니다. 약물 분석의 경우 체내에서 약물동태 및 독성동태의 특성을 연구하는 것으로서 약물동태, 독성동태, 약동력학시험이 해당됩니다.
| [당사의 사업영역 구분] |
| 주요 사업 | 내용 | 세부사업 |
|---|---|---|
| 안전성 평가 | 신물질에 대한 독성 발현 및 부작용 평가 | 인체독성시험/환경독성시험/첨단대체독성시험 |
| 안전성(일반) 약리 평가 | 약물개발 단계에서의 치료용량 또는 그 이상 노출시 바람직하지 않은 생리학적 효과를 평가 |
중추신경계시험/심혈관계시험/호흡기계시험/ 추가시험 및 추적시험/일반약리시험 |
| 유효성(약리) 평가 | 신물질에 대한 약리학적 효과를 평가 | 효능평가시험수행 및 개발/기전시험(MOA) 질환모델 동물제작, 판매/동반진단 |
| 병리 및 분석 평가 | 체내에서의 약물동태 및 독성동태의 특성 연구 | 조직병리 및 임상병리/ 흡수, 분포, 대사, 배설시험/조제물 분석/생분해성시험 |
| (출처) 당사 제시 |
비임상시험에는 고도의 기술력과 노하우가 필요하며 담당인력의 기술육성을 위해서는 많은 시간과 비용이 소요됩니다. 따라서 비임상 CRO가 글로벌 수준의 경쟁력을 갖추기 위해 전문 인력의 안정적인 공급이 필요합니다. 그러나 어렵게 육성된 비임상 CRO의 우수인력이 바이오ㆍ제약회사의 개발 담당자로 유출되고 있습니다. 바이오ㆍ제약회사의 입장에서는 개발업무를 위해 숙련된 경험자를 활용할 수 있어 도움이 되겠지만, 비임상 CRO 사업에 있어서 숙련된 인력의 유출은 큰 어려움으로 작용하고 있습니다.
당사는 기 확보하고 있는 경험이 많은 핵심 멤버를 유지하기 위해 노력하고 있을 뿐 아니라, 전방산업인 바이오 산업에 종사하고 있는 연구인력들을 적극적으로 채용하여 적극적인 훈련과 교육을 통해 우수한 인재를 양성하고자 노력하고 있습니다. 이렇게 구성된 CRO 사업에 특화된 우수한 인력은 매출 수주를 위한 영업 일선에도 전략적으로 배치하여 비임상 CRO 업체로서의 연구수행과 컨설팅, 기술마케팅을 동시에 실시하는 등 사업에서 중요한 역할을 수행하도록 하고 있습니다.
당사의 핵심 연구인력의 현황은 다음과 같습니다.
| [핵심연구인력 상세] |
| 구분 | 성명 | 소속(직위) | 최종학위 | 주요경력 | 주요프로젝트 |
|---|---|---|---|---|---|
| 1 | 김경숙 | 연구소 상임고문 |
박사 (한양대 의학) |
진단검사의학과 전문의 한양대 의생명과학연구원 연구부교수 한양대 정신건강연구소 연구조교수 오송첨단의료복합단지 신약개발 지원센터 자문위원 카톨릭의대 산부인과학교실 연구전임의 양평길병원 진단검사의학과 과장 |
루게릭병 줄기세포치료제 개발 골관절염 줄기세포치료제 개발 루푸스 줄기세포 치료제 개발 다계통위축증 줄기세포치료제 개발 임상용 줄기세포 배양액 개발 대량 세포배양시스템 개발 |
| 2 | 송시환 | 비임상CRO 사업부 사장 |
박사 (서울대 수의학) |
한국화학연구소 선임연구원 ㈜켐온 대표이사 |
KIT의 GLP 시스템구축 관련 동물실험책임자 및 시험책임자 보건복지부과제: 천연물을 이용한 알레르기 관절염 치료제의 산업부과제: 경구용 내성 진균감염 치료제 개발 연구책임자 식약처과제: 천초근을 이용한 발암성시험 연구책임자 과학기술부과제: 현장활용 가능 독성스크리닝 시스템구축 및 식약처과제: 천연물의 NTP 독성시험 과제 책임자 |
| 3 | 이령아 | 연구개발 혁신본부 본부장 |
박사 (이화여대 의학) |
이화여대 의학과 박사 서울대학교 외과 전임의 및 임상의학연구소 연구 전임의 Thomas Jefferson University, Kimmel cancer center 연수 원자력병원 외과 과장 이화여자대학교 의과대학 교수 이화여자대학교 의과대학 외과학교실 주임교수 이대목동병원 대장암 센터장 |
본인 요청에 의한 미기재 |
| 4 | 이태용 | 중앙연구소 연구소장 |
박사 (충북대 응용약학) |
코아스템 세포치료제 QC 팀장 코아스템 세포치료제 제조관리 팀장 코아스템 세포치료제 QC/QA 팀장 코아스템 세포치료 공정혁신 팀장 코아스템 중앙연구소 연구소장 |
루게릭병 줄기세포치료제 개발 골관절염 줄기세포치료제 개발 루푸스 줄기세포치료제 개발 다계통위축증 줄기세포치료제 개발 임상용 줄기세포 배양액 개발 대량 세포배양시스템 개발 |
| 5 | 김문순 | 비임상연구소장 | 석사 (충북대 약학) |
한국생명공학연구원 연구원 ㈜켐온 약리약효시험책임자 ㈜켐온 비임상연구소 신뢰성보증업무책임자 GLP본부장/운영책임자 |
본인 요청에 의한 미기재 |
| 6 | 이용상 | 헬스케어본부 본부장 |
박사 (서울대 농생명공학) |
식품의약품안전처 서울청 / 유해물질분석과 / 과장 ㈜인바이오 / 생명과학연구소 / 연구소장 / CTO Tunas Sawa Erma(Indonesia) / 연구책임자 / GM ㈜LG화학 / 생명과학 정밀화학 제형개발 파트장 한국화학연구원 / 스크리닝연구부 코아스템켐온 춘천연구소 연구소장 |
본인 요청에 의한 미기재 |
| (출처) 당사 정기보고서 |
일반적으로 업계 연구 인력들의 특성이 학계나 국가 연구원 등에서 근무하는 것을 선호하고 있으며, 개인적인 학업 증진을 위한 해외유학 등의 사유로 핵심연구 인력의 이탈이 발생할 수 있습니다. 이에 대한 대안으로 당사는 주식매수선택권 부여와 차별화된 대우 및 보상(특별 인센티브), 급여성/비급여성 복리후생 강화, 신약을 포함한 다양한 프로젝트 추진 환경 및 기회 제공 등을 시행 중입니다. (주1)
| (주1) | 당사 주식매수선택권 부여 내역은 본 증권신고서 "제1부.III.투자위험요소-3.기타위험-사." 부분을 참고하여 주시기 바랍니다. |
또한 당사는 연구개발 인력의 중요성을 인지하고 인력 유치도 물론 기존 인력의 양성을 위한 기업차원의 활동을 영위하고 있습니다. 성과 관리제도를 통한 연봉제 운영, 기숙사 제공, 사내 카페운영, 석, 박사 학위 취득지원 및 논문 및 특허관련 성과 보상,해외 학회 및 심포지움 참여 지원 및 전임직원 해외여행 팀워크 교육 기회 부여 등 다양한 방면으로 노력하고 있습니다.
| [인력 확보 활동] |
| 구분 | 내용 |
|---|---|
| 해당 과학기술 분야 전문기관과 공동연구 |
해외 및 국내 대학 및 산학협력단과의 공동연구를 통한 인재 확보 - 미국 Brown Univ. 생명공학과와 기술 개발 및 자문 계약을 통한 해외 전문가 영입 및 전문성을 보유한 인력양성 및 유치 - 서울대학교 의생명연구원, 한양대학교 의대, 충북대학교 약대, 경북대 의대와 보건복지부, 및 범부처 과제 공동연구를 통한 실무경험을 갖춘 인력 양성 - 충북대학교, 한양대학교 등 산학협력단과의 민간수탁과제를 활용한 인력 유치 |
| 석박사급 연구개발 전문 인력 채용 |
가족기업 또는 공동 연구개발 계약 체결을 통한 맞춤형 커리큘럼 운영, 석박사급 인력 채용 - 충북대학교 약학대학 프로젝트랩 과제 참여(맞춤형 인재 육성), 공동 연구 개발(자가면역질환치료제), 공동 연구개발 참여 인력 채용을 통한 연구 연속성 보장 - 한양대학교·서울과학기술대학교, 세명대 가족기업 계약 체결을 통한 우수 인력 유치 채널 확보 |
| 신규인재 Pool 확보 및 병역특례 제도 |
- 사람인, 브릭 등 수시 공개채용, 코스닥 상장기업 채용박람회 및 코리아 잡페어를 활용한 우수 인력 유치. - 병역특례제도를 활용한 전문 인력 채용, 확보. |
| (출처) 당사 제시 |
그러나 이와 같은 당사의 노력에도 불구하고 핵심인력의 국내외 경쟁사 또는 정부출연 연구기관 등으로의 유출 및 이탈 가능성을 배제할 수는 없는 상황입니다. 특히 타경쟁사의 당사 우수인력의 스카우트는 당사가 사업을 영위함에 있어 큰 문제가 될 수 있습니다. 또한, 핵심인력 이탈과 함께 당사의 주요 기술이 유출될 경우, 당사의 경쟁력이 악화될 수 있으며, 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [차. 지적재산권 분쟁 관련 위험] 당사는 기술 동향 및 비즈니스 상황을 종합적으로 고려하여 특허의 출원, 공개, 심사 타이밍을 결정함으로써 독자 기술이 쉽게 공개되지 않도록 보호하는 한편 일부 핵심 기술은 영업비밀로 보호하고 있습니다. 당사의 이 같은 노력에도 불구하고 현재 출원 중인 또는 출원 예정인 특허가 최종적으로 등록이 되지 않을 수 있으며, 등록된 특허가 제품 출시 전에 만료, 표기, 소멸될 수 있습니다. 국가별로 현행 특허관련 법률이 개정되어 특허 보호 범위나 기간이 축소될 수도 있습니다. 또한, 경쟁 업체가 당사 보유 특허 기술과 유사한 기술을 발견하여 당사의 특허권을 침해하거나 당사 보유 특허 기술과 유사한 기술을 이미 보유하여 당사가 이를 침해했다고 주장하는 경우, 소송 등의 분쟁이 발생할 수 있습니다. 당사가 영위하고 있는 줄기세포치료제 개발사업은 각 개발사들이 보유한 특화된 기술 및 제품화 능력에 의하여 성패가 결정되는 기술지향형 산업입니다. 현재 당사의 핵심기술 및 활용기술과 관련한 소송이나 분쟁은 발생한 내역이 없으며 기술보호를 위해 국내 뿐만 아니라 해외에서도 특허 등록을 진행하고 있으나, 향후 당사가 보유한 지적재산권을 적절히 보호하지 못하거나 당사가 사용하는 기술과 관련한 지적재산권 관련 분쟁이 발생하는 경우 당사의 경쟁력은 약화될 수 있으며, 이는 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 반드시 이 점 유의하시기 바랍니다. |
제약 산업은 특허의 확보가 사업의 핵심 성공 요인으로, 특허를 확보하지 못할 경우 원천적으로 사업이 불가능하거나 특허 소유자로부터 기술이전을 받아야 합니다. 특허가 가장 중요한 경쟁요소이기 때문에 특허기간을 최대한 보호하기 위한 다양한 전략 및 정책을 도입하고 있으며, 제약사를 비롯하여 개발사들 역시 제품화 이후 특허 보호기간을 연장하기 위한 전략으로 공정 특허, 제법 특허 등의 방법을 활용하고 있습니다.
당사는 증권신고서 제출일 현재 기준 국내 21건, 해외 30건의 특허권을 출원하였으며, 이 중 국내등록은 국내 16건, 해외 7건의 특허가 등록되었습니다.
| [국내 특허 현황] |
| 번호 | 발명의 명칭 | 출원일 | 등록일 | 존속기한 |
| 1 | 중간엽 줄기세포 배양 배지 및 이를 이용한 중간엽줄기세포의 배양 방법 | 2006-04-24 | 2009-07-13 | 2026-04-24 |
| 2 | 중간엽 줄기세포를 포함하는 운동신경원질환 치료용 조성물및 치료방법 | 2006-11-28 | 2009-02-27 | 2026-11-28 |
| 3 | 연골줄기세포를 유효성분으로 포함하는 골질환 치료용 또는 항염증용 약제학적 조성물 | 2010-01-15 | 2012-06-14 | 2030-01-15 |
| 4 | 중간엽 기질세포 배양용 항산화 조성물 및 이의 용도 | 2012-02-29 | 2014-06-16 | 2032-02-29 |
| 5 | 인간 골수 유래 중간엽 줄기세포를 유효성분으로 포함하는 자가면역질환의 예방 또는 치료용 약제학적 조성물 | 2016-02-26 | 2020-02-28 | 2034-07-30 |
| 6 | 동결보존효과가 개선된 줄기세포 동결보존용 조성물 및 이를 이용한 방법 | 2017-03-28 | 2019-02-26 | 2037-03-28 |
| 7 | 자가면역질환 치료에 대한 유효성 예측용 바이오마커, 진단키트 및 치료용 용도 | 2018-06-15 | 2020-02-03 | 2038-06-15 |
| 8 | 단백질 키나아제 C 활성화제로 처리된 줄기세포 또는 그 배양물을 포함하는 자가면역질환 예방 또는 치료용 약학적 조성물 | 2018-11-09 | 2020-11-11 | 2038-11-09 |
| 9 | 중간엽줄기세포의 증식 및 이동 능력 예측용 바이오마커 및 이의 용도 | 2018-11-09 | 2020-08-04 | 2038-11-09 |
| 10 | 중간엽줄기세포의 전신홍반루푸스 치료효과 예측용 바이오마커 조성물 | 2019-10-02 | 2021-04-14 | 2039-10-02 |
| 11 | 중간엽줄기세포의 신장섬유화 치료효과 예측용 바이오마커 조성물 | 2019-10-02 | 2021-04-14 | 2039-10-02 |
| 12 | 나권형 세포 배양용기 및 이를 이용한 세포 배양시스템 | 2020-08-20 | 2023-01-02 | 2040-08-20 |
| 13 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 세포를 다량 확보하는 분화방법 | 2019-10-16 | 2021-08-26 | 2039-10-16 |
| 14 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 희소돌기아교세포를 다량 확보하는 분화방법 | 2020-12-17 | 2024-03-20 | 2040-12-17 |
| 15 | 삼차원 뇌 오가노이드 유래 신경 줄기세포 및 그의 용도 | 2021-08-24 | 2022-11-14 | 2039-10-16 |
| 16 | 삼차원 시상하부 오가노이드로부터 유래된 신경줄기세포를 포함하는 노인성 질환 예방 및 치료용 약학 조성물 및 그의 용도 | 2022-05-20 | - | - |
| 17 | 커큐민 및 진세노사이드를 포함하는 약학 조성물 및 이의 제형 | 2023-02-10 | - | - |
| 18 | 인간 만능 줄기세포로부터 3D 오가노이드를 이용하여 미세교세포를 다량 확보하는 미세교세포의 분화방법 | 2023-11-16 | 2024-03-28 | 2040-12-16 |
| 19 | 인게놀-3-안젤레이트로 처리된 줄기세포를 포함하는 자가면역질환 치료용 약학적 조성물 | 2023-12-01 | - | - |
| 20 | 중간엽 줄기세포 유래 세포외 소포체 및 이의 용도 | 2024-06-27 | - | - |
| 21 | 줄기세포 및 인공 뇌척수액을 포함하는 약제학적 제제 | 2024-12-24 | - | - |
| (출처) 당사 제시 |
| [해외 특허 현황] |
| 번호 | 발명의 명칭 | PCT출원일 | 출원국 | 국내출원일 | 국내등록일 | 존속기한 |
| 1 | 중간엽 줄기세포를 포함하는 운동신경원질환 치료용 조성물 및 치료 방법 | 2006-11-28 | 미국(US) | 2008-11-24 | 2012-10-02 | 2029-06-05 |
| 2 | 자가면역질환 치료에 대한 유효성 예측용 바이오마커, 진단키트 및 치료용 용도 | 2019-06-13 | 유럽(EP) | 2020-12-14 | - | - |
| 3 | 일본(JP) | 2020-12-14 | 2023-02-24 | 2039-06-13 | ||
| 4 | 중간엽줄기세포의 증식 및 이동 능력 예측용 바이오마커 및 이의 용도 | 2019-11-06 | 유럽(EP) | 2021-05-07 | - | - |
| 5 | 일본(JP) | 2021-05-10 | 2022-12-07 | 2039-11-06 | ||
| 6 | 단백질 키나아제 C 활성화제로 처리된 줄기세포 또는 그 배양물을 포함하는 자가면역질환 예방 또는 치료용 약학적 조성물 | 2019-11-06 | 유럽(EP) | 2021-05-07 | - | - |
| 7 | 일본(JP) | 2021-05-10 | 2023-05-10 | 2039-11-06 | ||
| 8 | 미국(US) | 2021-05-07 | - | - | ||
| 9 | 중간엽줄기세포의 전신홍반루푸스 치료효과 예측용 바이오마커 조성물 | 2020-09-29 | 유럽(EP) | 2022-04-29 | - | - |
| 10 | 중간엽줄기세포의 신장섬유화 치료효과 예측용 바이오마커 조성물 | 2020-09-29 | 유럽(EP) | 2022-04-07 | - | - |
| 11 | 미국(US) | 2022-03-31 | - | - | ||
| 12 | 중간엽 줄기세포를 포함하는 퇴행성 신경계 질환의 치료용 조성물 | 2021-01-08 | 미국(US) | 2022-07-07 | - | - |
| 13 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 세포를 다량 확보하는 분화방법 | 2020-01-13 | 미국(US) | 2022-07-12 | - | - |
| 14 | 일본(JP) | 2022-07-11 | 2024-11-12 | 2040-01-13 | ||
| 15 | 유럽(EP) | 2022-08-12 | - | - | ||
| 16 | 인간 만능 줄기세포로부터 3D 오가노이드를 이용하여 미세교세포를 다량 확보하는 미세교세포의 분화방법 | 2020-12-17 | 미국(US) | 2022-06-16 | - | - |
| 17 | 일본(JP) | 2022-06-09 | 2024-08-07 | 2024-12-17 | ||
| 18 | 유럽(EP) | 2022-07-08 | - | - | ||
| 19 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 희소돌기아교세포를 다량 확보하는 분화방법 | 2020-12-17 | 일본(JP) | 2022-06-09 | 2024-07-11 | 2040-12-17 |
| 20 | 유럽(EP) | 2022-07-08 | - | - | ||
| 21 | 나권형 세포 배양용기 및 이를 이용한 세포 배양시스템 | 2021-08-23 | 미국(US) | 2024-02-22 | - | - |
| 22 | 커큐민 및 진세노사이드를 포함하는 약학 조성물 및 이의 제형 | 2023-02-10 | 미국(US) | 2024-08-08 | - | - |
| 23 | 유럽(EP) | 2024-09-09 | - | - | ||
| 24 | 삼차원 시상하부 오가노이드로부터 유래된 신경줄기세포를 포함하는 노인성 질환 예방 및 치료용 약학 조성물 및 그의 용도 | 2023-05-19 | 미국(US) | 2024-11-19 | - | - |
| 25 | 일본(JP) | 2024-11-15 | - | - | ||
| 26 | 유럽(EP) | 2024-12-05 | - | - | ||
| 27 | 중국(CN) | 2024-11-20 | - | - | ||
| 28 | 호주(AU) | 2024-12-02 | - | - | ||
| 29 | 캐나다(CA) | 2024-11-19 | - | - | ||
| 30 | 중간엽 줄기세포 유래 세포외 소포체 및 이의 용도 | 2024-06-27 | PCT | 2024-06-27 | - | - |
| (출처) 당사 제시 |
당사는 기술 동향 및 비즈니스 상황을 종합적으로 고려하여 특허의 출원, 공개, 심사 타이밍을 결정함으로써 독자 기술이 쉽게 공개되지 않도록 보호하는 한편 일부 핵심 기술은 영업비밀로 보호하고 있습니다. 당사의 이 같은 노력에도 불구하고 현재 출원 중인 또는 출원 예정인 특허가 최종적으로 등록이 되지 않을 수 있으며, 등록된 특허가 제품 출시 전에 만료, 표기, 소멸될 수 있습니다. 국가별로 현행 특허관련 법률이 개정되어 특허 보호 범위나 기간이 축소될 수도 있습니다. 또한, 경쟁 업체가 당사 보유 특허 기술과 유사한 기술을 발견하여 당사의 특허권을 침해하거나 당사 보유 특허 기술과 유사한 기술을 이미 보유하여 당사가 이를 침해했다고 주장하는 경우, 소송 등의 분쟁이 발생할 수 있습니다.
당사가 영위하고 있는 줄기세포치료제 개발사업은 각 개발사들이 보유한 특화된 기술 및 제품화 능력에 의하여 성패가 결정되는 기술지향형 산업입니다. 현재 당사의 핵심기술 및 활용기술과 관련한 소송이나 분쟁은 발생한 내역이 없으며 기술보호를 위해 국내 뿐만 아니라 해외에서도 특허 등록을 진행하고 있으나, 향후 당사가 보유한 지적재산권을 적절히 보호하지 못하거나 당사가 사용하는 기술과 관련한 지적재산권 관련 분쟁이 발생하는 경우 당사의 경쟁력은 약화될 수 있으며, 이는 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 반드시 이 점 유의하시기 바랍니다.
|
[카. 전방산업인 제약ㆍ바이오 산업에 대한 정부 정책 및 규제 변화에 따른 위험] |
제약산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업으로, 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 제약 및 신약개발 사업과 관련된 국내 법률 중 당사의 사업과 밀접하게 연관된 법률로는 식품의약품안전처 및 보건복지부 소관의 '약사법'이 대표적이며, 그 외 보건복지부 소관의 「국민건강보험법」, 「생명윤리 및 안전에 관한 법률」, 「제약산업 육성 및 지원에 관한 특별법」, 「희귀질환관리법」, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」과 식품의약품안전처 소관의 「실험동물에 관한 법률」 등이 있습니다.
특히, 「약사법」 하위 시행령/시행규칙 중 의약품 등의 안전에 관한 규칙, 의약품 등의 제조업 및 수입자의 시설기준령 시행규칙, 생물학적 제제 등의 제조ㆍ판매관리 규칙, 동물용 의약품등 취급규칙 등과 이의 하위 규정을 준수해야 합니다. 이에 따라, 신약 후보물질의 발굴에서부터 동물을 대상으로 하는 비임상시험, 인체를 대상으로 하는 임상시험, 품목허가에 이르기까지 임상 승인에 관한 규정, 의약품의 약리 및 독성, 안정성 시험 기준, 임상시험 실시기관 지정에 관한 규정, 품목허가ㆍ심사 등의 규정 등을 반드시 준수하여 진행해야 합니다. 또한 제조 및 판매 단계에서도 제조소 시설 기준, 제조 및 품질관리 규정, 포장 및 공급에 관한 규정, 표시 등에 관한 규정을 준수해야 하며, 사후에도 정기적으로 규제기관으로부터 제품 생산 공정 및 품질관리 전반에 대한 실사 및 관리, 감독을 받게 됩니다. 이러한 규제 및 검증을 통해 제약산업의 선진화 정책을 시현할 수 있지만, 각종 규제 및 절차, 검증 강화로 인한 부담이 높아지는 경우, 당사의 사업에 부정적인 영향을 미칠 수 있습니다.
| [제약ㆍ바이오산업과 관련된 주요법령 및 규제] |
| 국가 | 법규 | 주요내용 |
|---|---|---|
| 대한 민국 |
약사법 |
- 의약품의 제조, 수입, 특허권의 등재, 판매, 취급 등에 관한 전반적인 규제 - 관련 내용을 위반하는 경우 행정처분(허가 취소 등) 또는 형사처벌(징역 또는 벌금형) 부과 |
| 국민건강보험법 | - 국민의 질병, 부상에 대한 예방, 진단, 치료, 출산 및 건강증진에 대한 보험급여를 실시 | |
| 생명윤리 및 안전에 관한 법률 | - 인간과 인체유래물 등을 연구하거나 취급할 때 인간의 존엄과 가치를 침해하거나 인체에 위해를 끼치는 것을 방지하도록 규정 | |
| 제약산업 육성 및 지원에 관한 특별법 | - 제약산업 발전기반 조성 및 경쟁력 강화 촉진을 위해 5년 마다 지원 종합계획을 수립하도록 규정 | |
| 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 | - 첨단재생의료의 안전성 확보, 기술 혁신, 실용화에 필요한 사항 규정 - 첨단바이오의약품의 품질, 안전성, 유효성 확보, 제품화 지원에 필요한 사항 규정 |
|
| 생물학적 제제 등의 제조ㆍ 판매관리 규칙 |
- 생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품, 유전자재조합의약품, 세포배양의약품, 세포 치료제, 유전자 치료제 및 이와 유사한 제제의 제조 및 판매 관리 규제 | |
| 식품ㆍ의약품분야 시험ㆍ검사 등에 관한 법률 |
- 식품ㆍ의약품분야의 시험ㆍ검사 및 시험ㆍ검사기관의 관리 등에 관한 사항을 규정 | |
| 산업기술의 유출방지 및 보호에 관한 법률 |
- 산업기술의 부정한 유출 및 침해 방지 및 보호 규정 | |
| 특허법 | - 공동출원, 통상실시권, 특허권 침해 등에 관하여 규정 | |
| 실용신안법 | - 특허법에서 규율하지 않는 실용적인 고안을 보호, 장려 | |
| 부정경쟁방지 및 영업비밀보호에 관한 법률 | - 고객사의 영업비밀을 부정하게 사용하거나 공개하는 행위 규제 | |
| 하도급거래 공정화에 관한 법률 |
- 위탁받은 사업을 재위탁하는 경우 관한 규제 |
또한, 국내는 단일보험자(국민건강보험공단)에 의한 전국민 건강보험제도를 운영하고 있는 상황으로, 건강보험의 지속가능성 제고와 적정수준의 국민의료비 유지, 불법 리베이트 차단 등의 목표 하에 약가에 대해 정책적 개입이 이루어지고 있습니다. 국내의 약가 사후관리제도는 대내외 보건의료 환경변화에 의하여 수 차례 변화되어, 현재는 실거래가 조사에 의한 약가 인하, 사용량-약가 연동 협상, 급여범위 확대 시 약가인하, 제네릭의약품 등재 시 오리지널의약품의 약가 인하 등의 제도가 운영되고 있습니다. 약가는 산업 정책과 보건의료 정책이 상충하여 변동성이 상존해 있는 상황으로, 현재 제네릭 약가 차등제가 시행 예정되어 있는 상황입니다. 이러한 점진적인 약가 인하 정책은 제약산업에서 간과할 수 없는 중요 요인이며, 당사의 사업에도 부정적인 영향을 미칠 수 있습니다.
| [약가 인하 정책 추이] |
|
시기 |
인하제도 |
내용 |
|
2000년 ~ 2009년 |
실거래가약가인하 (표본조사) |
표본조사(전국 80개 요양기관)를 통해 의약품 청구 실태 조사 후 약가인하 |
| 2002년 ~ 2012년 |
약가 재평가 |
최초 상한금액 산정이후 3년마다 7개국 조정 평균가를 |
| 2007년 ~ 2014년 |
기등재 목록정비 |
2007년 선별등재제도로 전환하면서 기존약재의 경우 20% |
| 2012년 |
일괄 약가인하 |
상한금액대비 53.55%수준까지 일괄 약가인하 |
| 2016년 ~ |
실거래가약가인하 (전수조사) |
유통정보센터 유통정보를 근거로 가중평가가격 까지 약가 인하 |
|
현행 |
특허만료 약가인하 |
개별약제 특허만료시 1년간 70%, 1년 후 53.55%로 약가인하 |
|
현행 |
사전 약가인하 |
개별약제 급여기준 확대 이전에 협의를 통하여 약가인하 |
|
현행 |
사용량 약가연동 |
개별약제 약가와 사용량을 연계하여 등재 후 사용량이 일정 % 증가할 때 약가 인하 |
| (출처) 식약처, 건강보험심사평가원, 보건복지부 등 |
당사는 내부에 담당 인력과 외부 전문가들을 통하여 국내 및 해외 제약 산업 정책 및 규제 환경을 지속적으로 모니터링하고 있으며, 각국의 규제 당국과의 소통을 통해 정책 및 규제 환경의 변화에 효과적으로 대비하기 위해 최선의 노력을 다하고 있습니다. 당사는 사업관련 법규 개정 및 제정시 당사의 석/박사급 전문 인력이 검토하고 외부 법무법인의 법률 자문을 통해 현행 법률에 대응하고 있습니다. 당사가 자문을 받고 있는 법무법인은 제약,바이오,헬스케어 등 분야에 특화된 법률 서비스를 제공하고 있으며, 약사법 및 사업제안, 임상시험, 라이센스, 공동사업 수행 등 자문을 제공하고 있습니다. 그럼에도 불구하고 국내를 포함한 주요 국가에서의 제약 산업 관련 정책이 비우호적 분위기로 전환되거나 규제가 강화되는 경우, 당사의 사업에 부정적인 영향을 미칠 수 있습니다.
한편, 국내를 비롯한 미국, 유럽 등 글로벌 선진국에서는 제약·바이오 산업을 국민의 건강을 증진하고 일자리와 고부가가치를 창출하는 핵심 기간산업이자 미래 신성장 동력 산업으로 인지하고, 제약ㆍ바이오 산업에 대한 우호적 정책을 펼치고 있는 상황입니다.
국내 정부의 경우, 한-미 FTA 발효, 약가제도 개편 등 제약산업의 환경 악화로 2012년 제약산업 육성대책 마련 필요성이 제기되었으며, 제약산업 발전기반 조성 및 국제 경쟁력 강화를 촉진하기 위하여, 2012년 '제약산업 육성 및 지원에 관한 특별법'을 시행하였습니다. 이에 따라 2013년부터 5년 단위의 제약산업육성ㆍ지원 종합계획과 1년 단위의 제약산업육성ㆍ지원 시행계획을 수립ㆍ시행하여 세부 과제를 추진하고 있습니다. 또한 국내 정부는 2019년 5월, 바이오헬스 분야 기술개발, 인허가, 생산, 시장출시 등 전주기에 걸쳐 단계별 지원내용을 담고 있는 '바이오헬스 산업 혁신전략'을 발표하였습니다. 이러한 정부 방침에 지방자치단체들도 바이오 산업을 지역 역점산업으로 육성하기 위해 노력하고 있습니다.
또한 정부는 2023년 3월에 바이오헬스 글로벌 중심국가 도약을 위한 제 3차 제약·바이오산업 육성ㆍ지원 5개년 종합계획을 발표하였으며, 주요 골자는 블록버스터급 혁신 신약 2개, 수출 2배 달성 등 글로벌 6대 제약 강국 도약으로 민관 연구개발 투자 지속 확대와 차세대 유명 신기술 발굴 및 지원을 강화하며, 개방형 혁신 데이터 체제와, AIㆍ빅데이터를 활용한 신약개발 분야 R&D를 집중 지원하기로 결정하였습니다. 국가에서 이번 제 3차 제약바이오산업 육성ㆍ지원 종합계획을 통해 5년 후 달성하고자 하는 목표는 다음과 같습니다.
| [제3차 제약바이오산업 육성ㆍ지원 5개년 종합계획] |
 |
|
2023-2027 제약 바이오산업 육성지원 정부 종합계획 |
| (출처) 보건복지부 |
이에 더불어, 최근에는 재생의료 임상연구실시 및 첨단바이오의약품 패스트트랙을 골자로 하는 「첨단재생의료법(첨단재생의료 및 첨단바이오의약품의 안전ㆍ지원에 관한 법률)」이 국회 본회의를 통과하여 2020년 8월부터 시행된 후 몇 차례 개정을 거쳐 현재는 2025년 2월 21일 개정법이 시행되고 있습니다. 첨단바이오의약품은 세포치료제, 유전자체료제, 조직공학제 등 살아있는 세포ㆍ조직 또는 유전자를 원료로 제조한 의약품을 의미합니다. 첨단재생의료법은 첨단재생의료의 안전성 확보 체계 및 기술 혁신ㆍ실용화 방안을 마련하고, 약사법, 생명윤리법 등에 산재한 바이오의약품 관련 규제를 일원화하며, 신속허가제도 도입 및 안전관리체계를 구축하는 것이 핵심입니다. 본 법을 통해 재생의료 임상연구가 가능해져 의료기술의 기술경쟁력을 제고하여 희귀ㆍ난치 질환자에게 새로운 치료 기회를 제공할 수 있을 뿐만 아니라, 품목허가 검증 체계를 첨단바이오의약품 특성에 맞게 재편하여 맞춤형 심사, 우선 심사, 조건부 허가 등의 혜택이 가능할 것으로 기대됩니다.
| [개정 첨단재생바이오법 주요 내용] |
 |
|
개정 첨생법 주요내용 |
| (출처) 보건복지부 |
상기 언급된 제약 및 신약개발 산업에 대한 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에도 불구하고, 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 또한 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않을 경우, 규제 완화의 범위가 축소될 수 있습니다. 이러한 정부의 우호적인 정책 및 규제 완화의 변동 가능성은 당사의 사업에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
2. 회사위험
| [가. 합병으로 인한 시너지효과 부진 위험] 당사(코아스템(주))는 2022년 08월 16일 이사회 결의를 통해 2022년 12월 01일을 합병기일로 하여, 당사의 연결 종속회사였던 (주)켐온을 흡수합병하였습니다. 합병 후 현재 코아스템(주) 본사 사업 부문의 연구개발 성과는 가시화되지 않았으며, 켐온(주) 사업 부문의 CRO 사업 분야는 매출 감소 및 적자가 발생하고 있는 상황으로서, 합병 후 시너지 효과는 일으키지 못하고 있습니다. 이처럼 지배구조 개편만으로는 궁극적인 주주가치 제고 효과를 발생시키지 못하고 있으며, 연구개발 성과가 나지 않거나, CRO 사업의 안정적인 수익성 확보가 지속적으로 어려울 경우 당사의 재무상태는 더욱 악화될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사(코아스템(주))는 2022년 08월 16일 이사회 결의를 통해 2022년 12월 01일을 합병기일로 하여, 당사의 연결 종속회사였던 (주)켐온을 흡수합병하였습니다.
합병과 관련된 주요 내용은 다음과 같습니다.
| [주요사항보고서] - 회사합병 결정(2022.09.15) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
가. 상기 '10. 합병일정' 중 '종료보고 총회'는 합병종료보고 이사회 결의 공고 절차로 갈음합니다. 라. 코아스템(주)가 (주)켐온을 흡수합병함에 있어 피합병회사인 (주)켐온의 주주에게 합병비율에 따른 합병신주의 교부와 단주 지급금 외 별도의 합병교부금 지급은 없습니다. 마. 상기 '8.합병상대회사'인 (주)켐온의 최근 사업연도 재무내용은 2021년말 개별재무제표 기준입니다. 바. 상기 '10. 합병일정'은 제출일 현재 예상 일정으로, 관계법령상의 인허가 승인 자. 주식매수청구권을 행사한 이후에는 회사의 승낙이 없는 한 주식매수청구를 취소하거나 철회할 수 없습니다. 차. 합병계약서 상의 계약 변경 및 해제 조건
※ 관련공시 - 해당사항 없음 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (출처) | DART(전자공시시스템) - 주요사항보고서(2022.09.15) |
당사는 합병을 통해 합병 이후 매출 포트폴리오의 확대로 매출 안정성이 증가할 것으로 기대하였으며, 합병당사회사 모두 바이오 관련 사업을 영위하는 만큼 사업 부문의 일괄 체계를 구축해 불필요한 자원낭비를 줄이고 인적/물적 자원을 효율적으로 활용해 일원화된 관리체계로 경영효율성의 향상을 기대하였습니다. 이와 더불어, 시설/인력/R&D 등의 중복투자 해소를 통한 고정비 감소 효과도 기대하였습니다. 이에, 안정적인 수익창출 능력을 바탕으로 연구개발 및 마케팅, 고객 서비스 역량 강화로 시장점유율을 확대해 궁극적으로 합병당사회사의 재무구조 및 수익성 개선을 달성할 계획이었으며, 향후 주주 환원 측면에서도 긍정적인 결과를 만들어내어 궁극적으로 주주가치를 제고해 나갈 수 있을 것으로 판단하였습니다.
다만, 합병 후 현재 코아스템(주) 본사 사업 부문의 연구개발 성과는 가시화되지 않았으며, 켐온(주) 사업 부문의 CRO 사업 분야는 매출 감소 및 적자가 발생하고 있는 상황으로서, 합병 후 시너지 효과는 일으키지 못하고 있습니다. 이처럼 지배구조 개편만으로는 궁극적인 주주가치 제고 효과를 발생시키지 못하고 있으며, 연구개발 성과가 나지 않거나, CRO 사업의 안정적인 수익성 확보가 지속적으로 어려울 경우 당사의 재무상태는 더욱 악화될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [나. 계속기업 불확실성 증가 위험] 당사는 지속적인 영업활동의 음(-)의 현금흐름을 개선하지 못한다면 유동비율은 지속적인 감소를 할수밖에 없고,이자보상배수(비율)는 음(-)수에서 벗어날 수 없는 상황입니다. 이에 당사는 비임상 CRO 사업부의 매출 및 수익의 정상화를 위해 기존 고객에 대한 기업 관리 및 대면 미팅 확대뿐 아니라, 신규 고객 유치를 위한 관련 기업 모임 등 네트워킹에 적극 참여할 예정이며, 비임상 각 개발단계 별 전략적 대응을 강화하려고 하고 있습니다. 또한 FDA 품목허가 신청을 진행할 예정인 뉴로나타-알 파이프라인에 대해 품목허가 신청 전, 신청 후 FDA 검토 단계 등에서 사업화가 가능하다면 기술이전계약을 통해 선제적으로 사업화를 진행할 계획도 가지고 있습니다. 따라서 당사는 재무건전성 제고를 위해 본질적으로 필요한 영업이익을 발생시켜 영업활동현금흐름을 개선시키고, 이를 바탕으로 재무활동에서의 자금 의존도를 줄여서 재무구조를 개선하려고 합니다. 당사의 재무제표는 계속기업으로서 존속할 것이라는 가정을 전제로 작성되었으므로 당사의 자산과 부채가 정상적인 사업활동 과정을 통하여 회수되거나 상환될 수 있다는 가정 하에 회계처리 되었습니다. 그러나 당사는 지속적인 영업손실과 당기순손실 발생 및 음(-)의 영업현금흐름 발생, 이에 따른 결손금 누적 등 재무상태가 현저하게 악화되어 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 생길 위험이 존재합니다. 이 경우 당사는 계속기업으로서의 존속능력 불확실성에 의한 한정 의견을 받을 위험이 존재하며, 이를 해소하지 못할 경우 상장폐지 위험이 증가할 수 있습니다. 또한 당사의 재무구조가 더욱 악화될 경우, 당사의 자산과 부채를 정상적인 영업활동 과정을 통하여 장부가액으로 회수하거나 상환하지 못할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [주요 재무사항 총괄표] |
| (단위 : 천원, %) |
| 구 분 | 2025년 반기 | 2024년 반기 | 2024년 | 2023년 | 2022년 | 비 고 | ||
|---|---|---|---|---|---|---|---|---|
| 외부감사인 | 안진회계법인 | 안진회계법인 | 안진회계법인 | 인덕회계법인 | 다산회계법인 | - | ||
| 감사(검토)의견 | 적정 | 적정 | 적정 | 적정 | 적정 | - | ||
| (계속기업 불확실성 관련 주석기재) | 없음 | 없음 | 없음 | 없음 | 없음 | - | ||
| 내부회계관리제도에 대한 의견 | 특이사항 없음 | 특이사항 없음 | 특이사항 없음 | 특이사항 없음 | 특이사항 없음 | - | ||
| 1. 자산총계 | 114,159,761 | 96,062,267 | 117,457,187 | 78,591,324 | 77,054,042 | - | ||
| 유동자산 | 13,894,935 | 16,985,834 | 15,783,513 | 10,721,294 | 15,206,490 | - | ||
| 비유동자산 | 100,264,825 | 79,076,433 | 101,673,674 | 67,870,030 | 61,847,551 | - | ||
| 2. 부채총계 | 68,785,264 | 76,670,707 | 68,863,831 | 58,990,694 | 38,419,865 | - | ||
| 유동부채 | 45,550,902 | 54,945,149 | 41,931,973 | 41,591,587 | 27,871,596 | - | ||
| 비유동부채 | 23,234,363 | 21,725,558 | 26,931,858 | 17,399,107 | 10,548,269 | - | ||
| 3. 자본총계 | 45,374,496 | 19,391,560 | 48,593,356 | 19,600,630 | 38,634,176 | - | ||
| 지배기업지분 | 45,374,496 | 19,391,560 | 48,593,356 | 19,600,630 | 38,634,176 | - | ||
| 자본금 | 16,435,188 | 16,435,188 | 16,435,188 | 16,435,188 | 16,435,188 | - | ||
| 주식발행초과금 | 212,364,193 | 212,364,193 | 212,364,193 | 212,364,193 | 212,364,193 | |||
| 자기주식처분이익 | 29,330,130 | 17,976,685 | 29,886,948 | 0 | 0 | - | ||
| 기타자본 | (121,415,555) | (134,481,539) | (128,403,555) | (141,980,135) | (141,976,562) | - | ||
| 기타포괄손익누계액 | 11,796,610 | (538,054) | 11,753,619 | (622,209) | (968,165) | - | ||
| 이익잉여금 | (103,136,070) | (92,364,914) | (93,443,038) | (66,596,408) | (47,220,478) | - | ||
| 비지배지분 | 0 | 0 | 0 | 0 | 0 | - | ||
| 4. 부채비율(%) | 151.6% | 395.4% | 141.7% | 301.0% | 99.4% | 부채총계 ÷ 자본총계 | ||
| 5. 유동비율(%) | 30.5% | 30.9% | 37.6% | 25.8% | 54.6% | 유동자산 ÷ 유동부채 | ||
| 6. 자본잠식률(%) | N/A | N/A | N/A | N/A | N/A | (자본금-지배기업지분) ÷ 자본금 | ||
| 7. 총차입금 | 53,640,264 | 60,922,394 | 53,875,952 | 44,234,023 | 21,135,166 | 유동성 차입금 + 비유동성 차입금 | ||
| 유동성 차입금 | 38,095,152 | 46,293,620 | 34,932,123 | 33,809,428 | 14,628,376 | - | ||
| 단기차입금 | 11,000,000 | 3,000,000 | 8,400,000 | 3,000,000 | 3,000,000 | - | ||
| 유동성장기차입금 | 11,095,540 | 4,260,000 | 7,762,100 | 4,260,000 | 0 | - | ||
| 전환사채 | 0 | 0 | 0 | 0 | 8,491,333 | - | ||
| 유동파생상품부채 | 5,010,847 | 23,138,652 | 7,049,784 | 11,463,472 | 2,699,198 | 전환권 및 조기상환권 | ||
| 유동리스부채 | 324,333 | 496,377 | 450,189 | 690,231 | 437,845 | |||
| 교환사채 | 10,664,433 | 15,398,591 | 11,270,050 | 14,395,725 | 0 | |||
| 비유동성 차입금 | 15,545,111 | 14,628,774 | 18,943,829 | 10,424,595 | 6,506,790 | - | ||
| 장기차입금 | 15,138,460 | 14,404,400 | 18,471,900 | 10,194,000 | 6,234,645 | - | ||
| 비유동리스부채 | 406,651 | 224,374 | 471,929 | 230,595 | 272,145 | - | ||
| - 총차입금 의존도(%) | 47.0% | 63.4% | 45.9% | 56.3% | 27.4% | 총차입금 ÷ 자산총계 | ||
| - 유동성 차입금 비중(%) | 71.0% | 76.0% | 64.8% | 76.4% | 69.2% | 유동성 차입금 ÷ 총차입금 | ||
| 8. 영업활동 현금흐름 | (7,793,050) | (10,083,378) | (21,118,190) | (15,696,516) | (8,272,929) | - | ||
| - 영업활동현금흐름 총부채 비율(%) | N/A | N/A | N/A | N/A | N/A | (연환산)영업활동현금흐름 ÷ 부채총계 | ||
| 9. 투자활동 현금흐름 | 2,064,787 | (15,652,552) | (24,652,717) | (9,298,003) | 55,461,664 | - | ||
| 10. 재무활동 현금흐름 | 5,623,269 | 24,774,721 | 44,738,173 | 25,139,165 | (50,993,787) | - | ||
| 11. 현금 및 현금성자산 | 1,149,221 | 1,330,308 | 1,280,250 | 2,250,165 | 2,100,850 | - | ||
| 12. 순차입금 | 52,491,042 | 59,592,085 | 52,595,702 | 41,983,858 | 19,034,317 | 총차입금 - 현금 및 현금성자산 | ||
| - 순차입금 의존도(%) | 46.0% | 62.0% | 44.8% | 53.4% | 24.7% | 순차입금 ÷ 자산총계 | ||
| 13. 매출액 | 11,610,426 | 15,538,404 | 28,762,460 | 33,657,156 | 45,877,628 | - | ||
| 14. 매출원가 | 12,529,896 | 15,139,326 | 29,880,329 | 30,164,466 | 30,633,240 | - | ||
| 15. 매출총이익 | (919,470) | 399,079 | (1,117,869) | 3,492,690 | 15,244,389 | - | ||
| - 매출총이익률(%) | -7.3% | 2.6% | -3.7% | 11.6% | 49.8% | 매출총이익 ÷ 매출액 | ||
| 16. 판매비와관리비 | 9,730,832 | 8,938,685 | 20,901,376 | 23,168,323 | 21,596,808 | - | ||
| 17. 영업이익 | (10,650,302) | (8,539,607) | (22,019,245) | (19,675,633) | (6,352,419) | - | ||
| - 영업이익률(%) | -91.7% | -55.0% | -76.6% | -58.5% | -13.8% | 영업이익 ÷ 매출액 | ||
| 18. 기타수익 | 1,225,640 | 206,687 | 348,808 | 387,147 | 400,097 | - | ||
| 19. 기타비용 | 375,085 | 33,808 | 34,425 | 344,198 | 126,996 | - | ||
| 20. 금융수익 | 1,846,304 | 6,789,687 | 21,721,232 | 7,916,534 | 16,869,698 | - | ||
| 파생상품부채평가이익 | 1,716,963 | 6,410,366 | 19,252,744 | 7,370,672 | 14,574,303 | - | ||
| 21. 금융비용 | 1,624,760 | 23,812,669 | 31,319,855 | 5,959,980 | 7,383,622 | - | ||
| |
이자비용 | 948,512 | 2,174,373 | 4,487,672 | 3,758,995 | 5,463,292 | - | |
| - 이자보상배수(배) | N/A | N/A | N/A | N/A | N/A | 영업이익 ÷ 이자비용 | ||
| 파생상품부채평가손실 | 277,413 | 21,284,324 | 26,419,827 | 0 | 0 | - | ||
| 22. 법인세비용차감전계속사업이익 | (9,578,203) | (25,389,710) | (31,303,485) | (17,676,130) | 3,406,757 | - | ||
| |
- 자기자본 대비 비중 | -21.1% | -130.9% | -64.4% | -90.2% | 8.8% | 법인세비용차감전계속사업이익 ÷ 자기자본 | |
| - 자기자본 대비 비중 (파생상품부채평가손익 제외) |
-24.3% | -54.2% | -49.7% | - | - | 2024년 관리종목 요건 판단시 예외 적용 해당 | ||
| - 50% 초과 해당 여부 | - | - | - | 50% 초과 | - | 2024년 관리종목 요건 판단시 예외 적용 해당 | ||
| 23. 법인세비용 | 66,493 | 79,168 | (5,051,072) | (4,496) | 2,704,493 | - | ||
| 24. 당기순이익 | (9,644,696) | (25,468,878) | (26,252,413) | (17,671,635) | 702,264 | - | ||
| - 당기순이익률(%) | -83.1% | -163.9% | -91.3% | -52.5% | 1.5% | 당기순이익 ÷ 매출액 | ||
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
당사는 지속적인 영업 적자 발생에 따라 2025년 반기말 기준 약 1,031억원의 결손금이 누적되어 있고, 영업활동에서 지속적인 음(-)의 현금흐름이 발생하는 상황이 개선되지 않고 있음에 따라 재무활동에서의 자금 조달에 의존하고 있으며, 유동비율은 30.5%까지 하락하고 순차입금의존도가 46%에 이르는 등 유동성이 악화된 모습을 보이고 있습니다. 특히, 유동비율의 경우 2022년 54.6%에서 2023년 25.8%, 2024년 37.6%, 2025년 반기말 30.5%로 지속적으로 감소하고 있습니다.
또한 당사는 2016년 이후 지속적인 영업손실이 발생하여 당사의 이자보상배수(비율)은 음(-)의 수치를 보이고 있습니다. 이처럼 지속적인 영업활동의 음(-)의 현금흐름을 개선하지 못한다면 유동비율은 지속적인 감소를 할수밖에 없고,이자보상배수(비율)는 음(-)수에서 벗어날 수 없는 상황입니다. 이에 당사는 비임상 CRO 사업부의 매출 및 수익의 정상화를 위해 기존 고객에 대한 기업 관리 및 대면 미팅 확대뿐 아니라, 신규 고객 유치를 위한 관련 기업 모임 등 네트워킹에 적극 참여할 예정이며, 비임상 각 개발단계 별 전략적 대응을 강화하려고 하고 있습니다. 또한 FDA 품목허가 신청을 진행할 예정인 뉴로나타-알 파이프라인에 대해 품목허가 신청 전, 신청 후 FDA 검토 단계 등에서 사업화가 가능하다면 기술이전계약을 통해 선제적으로 사업화를 진행할 계획도 가지고 있습니다. 따라서 당사는 재무건전성 제고를 위해 본질적으로 필요한 영업이익을 발생시켜 영업활동현금흐름을 개선시키고, 이를 바탕으로 재무활동에서의 자금 의존도를 줄여서 재무구조를 개선하려고 합니다.
당사의 재무제표는 계속기업으로서 존속할 것이라는 가정을 전제로 작성되었으므로 당사의 자산과 부채가 정상적인 사업활동 과정을 통하여 회수되거나 상환될 수 있다는 가정 하에 회계처리 되었습니다. 그러나 당사는 지속적인 영업손실과 당기순손실 발생 및 음(-)의 영업현금흐름 발생, 이에 따른 결손금 누적 등 재무상태가 현저하게 악화되어 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 생길 위험이 존재합니다. 이 경우 당사는 계속기업으로서의 존속능력 불확실성에 의한 한정 의견을 받을 위험이 존재하며, 이를 해소하지 못할 경우 상장폐지 위험이 증가할 수 있습니다. 또한 당사의 재무구조가 더욱 악화될 경우, 당사의 자산과 부채를 정상적인 영업활동 과정을 통하여 장부가액으로 회수하거나 상환하지 못할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [다. 투자주의환기종목, 관리종목, 상장폐지 위험] 당사는 투자주의환기종목, 관리종목 내지 상장폐지 등의 위험을 줄이기 위해서는 자기자본의 확충 및 실적 개선이 반드시 필요한 상황입니다. 특히, 당사는 2023년에 50% 초과요건에 해당되었기 때문에 2025년 자기자본 대비 50%를 초과하는 법인세비용차감전 계속사업손실(파생상품평가손익 제외)이 발생할 경우 최근 3개년 내에 2회 이상 요건이 충족되어 관리종목으로 지정될 수 있습니다. 당사는 2025년 반기 기준으로 자기자본은 454억원이며, 96억원의 법인세비용차감전순손실(파생상품평가손익 제외)이 발생한 상태입니다. 따라서 자기자본의 확충이 일어나거나 법인세비용차감전순손실 규모가 더욱 증가하게 될 경우 50%를 초과하는 요건에 해당될 가능성이 존재합니다. 따라서 본 유상증자로 인한 자기자본 확충이 이루어져야 함은 물론, 법인세비용차감전순손실 규모가 예상보다 확대되지 않도록 관리해야 하는 상황입니다. 당사는 본 유상증자를 통해 자기자본을 확충하고자 하나, 신약개발 사업부문의 적자 발생 지속, 비임상CRO 사업의 실적 저하 추세를 고려한다면, 자기자본 확충에도 불구하고 이러한 위험성을 중장기적으로 개선해나가는 것은 어려울 수 있습니다. 특히 2025년에는 본 유상증자가 예정대로 연내에 납입되어 자기자본이 확충되고, 법인세비용차감전계속사업손실 발생 규모를 통제해야만, 관리종목 지정 위험을 피할 수 있을 것으로 예상됩니다. 투자주의환기종목 또는 관리종목으로 지정될 경우 자본시장에서의 자금 조달이 어려워지므로 유동성 위험이 증가할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 코스닥시장에 상장된 법인으로서, 코스닥시장상장규정상 투자주의환기종목, 관리종목, 상장폐지 등과 관련된 각각의 지정 요건을 적용받고 있습니다. 투자자 여러분들께서는 각각의 요건별로 당사의 지정 가능성을 염두에 두고 투자 판단에 임해야 합니다.
1. 투자주의환기종목
| [코스닥시장 상장규정 제52조(투자주의 환기종목)] |
|
제52조(투자주의 환기종목) 1. 정기지정: 보통주식 상장법인의 영업·재무·경영 등에 관한 계량적·비계량적 변수 등을 고려하여 세칙으로 정하는 기업부실위험 선정기준에 해당하는 경우 2. 수시지정: 보통주식 상장법인이 다음 각 목의 어느 하나에 해당하는 경우 가. 외부감사법 제8조에 따른 내부회계관리제도의 운영실태에 대한 감사인의 검토·감사 결과 중요한 취약점이 발견되거나 중요한 범위제한이 있는 경우 또는 검토·감사의견이 표명되지 않은 경우 나. 제17조제1항을 위반하여 이 규정에 따른 의무보유 대상 주식등을 사실상 매각한 경우. 다만, 최대주주 변경을 수반하는 경우로 한정한다. 다. 제3자 배정 방식의 유상증자로 해당 보통주식 상장법인의 신주를 취득한 자에게 해당 취득일부터 6개월 이내에 선급금 지급, 금전의 가지급, 금전 대여, 증권(법 제4조제2항 각 호의 증권, 어음, 양도성 예금증서를 말한다)의 대여, 출자(타법인이 발행한 주식등 또는 출자증권의 취득을 말한다) 등을 한 사실이 공시 등을 통해 확인된 경우 라. 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정인 경우 마. 최대주주 변경으로 제51조제1항에 따른 의무보유가 적용되는지 여부가 확인되지 않은 경우 바. 제51조제1항에 따른 의무보유 대상자가 해당 의무보유를 이행하지 않은 경우 사. 최근 5개 사업연도에 각각 영업손실이 발생한 경우. 다만, 세칙으로 정하는 기술성장기업에는 이 목을 적용하지 않는다. 아. 최근 반기 말 현재 자본잠식률이 100분의 50 이상인 경우 자. 최근 반기 말 현재 자기자본이 10억원 미만인 경우 차. 최근 반기의 개별재무제표 또는 연결재무제표에 대한 감사인의 검토의견 또는 감사의견이 부적정, 의견거절이거나 감사범위 제한에 따른 한정인 경우 ② 거래소는 보통주식 상장법인을 투자주의 환기종목으로 지정하거나 해제하는 경우 지체 없이 공시매체에 공표하여야 한다. ③ 투자주의 환기종목 지정 사유의 적용방법과 지정 및 해제 시기, 그 밖에 필요한 사항은 세칙으로 정한다. |
| (출처) | KRX 법무포털 |
| [코스닥시장 상장규정시행세칙 제48조(투자주의 환기종목의 지정 및 해제 등)] |
| 제48조(투자주의 환기종목의 지정 및 해제 등) ① 규정 제52조제1항제1호에 따른 기업부실위험 선정기준은 별표 8에서 정하는 기준(이하 “기업부실위험 선정기준”이라 한다)을 말한다. ② 기업부실위험 선정기준은 다음 각 호에 따라 적용한다. 1. 12월 결산법인의 사업보고서 법정 제출기한까지 제출된 최근 사업연도의 감사보고서상 재무정보와 공시사항 등을 기준으로 판단할 것. 다만, 제52조제1항 각 호의 어느 하나에 해당하는 사유가 발생하여 법정 제출기한까지 사업보고서를 제출하지 못하는 경우에는 기업부실위험 선정 기준 해당 여부를 판단하는 기준일과 투자주의 환기종목 지정 및 해제 시기를 달리 정할 수 있다. 2. 지정일 전일 현재 규정 제54조의 형식적 상장폐지사유(규정 제54조제1항제5호의 주식분산 미달, 규정 제54조제1항제8호의 주식양도 제한, 규정 제54조제1항제11호의 지배구조 미달 사유는 제외한다)가 발생하였거나, 규정 제56조제1항 각 호의 어느 하나에 해당하는 사실이 확인된 보통주식 상장법인에 대하여는 적용하지 않을 것 <개정 2025. 7. 9.> ③ 규정 제52조제1항제2호에 따른 수시지정 사유는 다음 각 호에 따라 적용한다. 1. 규정 제52조제1항제2호가목, 라목, 사목부터 차목까지의 사유: 공시규정 제6조제1항제2호마목(1)에 따라 신고된 검토·감사보고서를 기준으로 적용할 것. 이 경우 해당 신고에 대한 정정신고가 있는 때에는 정정하여 신고된 내용을 기준으로 신고일의 다음 날에 투자주의 환기종목으로 지정하거나 해제한다. 2. 규정 제52조제1항제2호사목부터 자목까지의 사유: 보통주식 상장법인이 지주회사로 전환하기 위하여 분할하였으나 지주회사 전환이 완료되지 않은 경우에는 분할기일이 속하는 사업연도와 그 다음 사업연도에는 적용하지 않을 것 3. 규정 제52조제1항제2호사목의 사유: 다음 각 목에 따라 적용할 것 가. 규정 제3조제7항제2호에도 불구하고 규정 제3조제7항제1호의 법인을 제외한 경우에는 개별재무제표를 기준으로 할 것 나. 보통주식 상장법인의 결산기 변경 등으로 사업연도가 6개월 미만인 경우 해당 사업연도에는 적용하지 않을 것 ④ 규정 제52조제1항제2호사목 단서에서 “세칙으로 정하는 기술성장기업”이란 우량기업부로 소속부가 변경지정되지 않은 기술성장기업을 말한다. ⑤ 규정 제52조제3항에 따른 투자주의 환기종목의 지정 및 해제 시기는 별표 9에서 정한다. ⑥ 제1항부터 제5항까지의 규정 외에 투자주의 환기종목의 지정과 해제 및 그 밖에 필요한 사항은 거래소가 따로 정한다. [전문개정 2022.12.9] |
| (출처) | KRX 법무포털 |
| [코스닥시장 상장규정시행세칙 별표 8(기업부실위험 선정기준)] |
|
기업부실위험 선정기준 (세칙 제48조 관련) 1. 거래소는 기업부실에 유의한 영향을 미치는 아래의 기업부실위험 선정 변수, 변수별 기준치 및 변수별 가중치에 따라 코스닥시장 상장법인(기업인수목적회사를 제외한다. 이하 이 표에서 같다)의 부실 정도를 측정한다.
주1) 기준치는 변수별로 부실징후에 유의한 영향을 미치는지 여부를 판단하는 기준을 말하고,기준치의 변수값은 기준치를 충족하는 경우 1, 미충족하는 경우 0으로 한다. 다만, 기준치가 없는 변수의 경우에는 변수 측정치를 변수값으로 하되, 변수 측정치가 아래의 상한 또는 하한을 벗어나는 경우에는 해당 상한 또는 하한을 변수값으로 본다.
주2) 감사의견이 적정이나, 감사보고서상 계속기업존속 불확실성이 특기사항으로 기재된 경우를 포함한다. 2. 거래소는 코스닥시장 상장법인에 대하여 변수별로 측정된 부실 정도에 따라 아래의 방법으로 부실 징후 종합 측정치를 산출하고, 종합 측정치가 종합 임계치주1)를 초과하는지 여부 등을 감안하여 투자주의 환기종목으로 지정한다. < 부실 징후 종합 측정치 산출 방법주2) > 주1) 종합 임계치는 0.7로 한다. 3. 거래소는 지정결과 및 기준치에 해당하는 기업부실위험 선정변수 등을 투자주의 환기종목으로 지정된 코스닥시장 상장법인에 통지한다. |
| (출처) | KRX 법무포털 |
(1) 정기지정
거래소는 보통주식 상장법인의 영업·재무·경영 등에 관한 계량적·비계량적 변수 등을 고려하여 코스닥시장 상장규정 시행세칙 [별표8]에서 정하는 기업부실위험 선정기준에 해당하는 경우 해당 주식을 투자주의 환기종목으로 지정합니다.
거래소는 기업부실에 유의한 영향을 미치는 기업부실위험 선정 변수, 변수별 기준치 및 변수별 가중치에 따라 코스닥시장 상장법인의 부실 정도를 측정합니다. 이어, 거래소는 코스닥시장 상장법인에 대하여 변수별로 측정된 부실 정도에 따라 아래의 방법으로 부실 징후 종합 측정치를 산출하고, 종합 측정치가 종합 임계치(주1)를 초과하는지 여부 등을 감안하여 투자주의 환기종목으로 지정합니다.
< 부실 징후 종합 측정치 산출 방법(주2) >
부실점수(z) = ∑(변수별 변수값 × 변수별 가중치) - 4.494
부실 징후 종합 측정치 = ez ÷ (1 + ez)
| (주1) | 종합 임계치는 0.7로 한다. |
| (주2) | e는 자연상수(자연로그의 밑값)를 말한다. |
기업부실위험 선정기준은 최근 사업연도의 감사보고서상 재무정보와 공시사항 등을 기준으로 판단하며, 현재 당사 현황을 검토하면 다음과 같습니다.
| [기업부실위험 선정기준 변수에 대한 당사 현황 검토] |
| (단위 : 백만원, %) |
| 구분 | 변수 | 기준치 (주1) |
가중치 | 당사 현황 (2025년 반기말) |
당사 현황 (2024년말) |
비 고 |
|---|---|---|---|---|---|---|
| 재무변수 | ①단기차입금 의존도 | - | 0.569 | 33.21% | 29.70% | K-IFRS 별도기준 |
| ②총자산대비영업현금흐름비율 | - | -2.332 | -6.69% | -17.72% | K-IFRS 별도기준 | |
| ③법인세차감전계속사업이익 | 손실 발생 | 1.078 | 해당 (-95억원) |
해당 (-310억원) |
K-IFRS 별도기준 | |
| 해당 (-96억원) |
해당 (-313억원) |
K-IFRS 연결기준 | ||||
| ④이자보상배율 | 1 미만 | 0.426 | 해당 (영업적자) |
해당 (영업적자) |
K-IFRS 별도기준 | |
| ⑤자본잠식 | 30% 이상 | 0.940 | - (없음) |
- (없음) |
K-IFRS 별도기준 | |
| - (없음) |
- (없음) |
K-IFRS 연결기준 | ||||
| ⑥매출액 규모 | 50억원 미만 | 0.415 | - (116억원) |
- (288억원) |
K-IFRS 별도기준 | |
| ⑦총자산회전율 | - | -0.211 | 10.12% | 24.45% | K-IFRS 별도기준 | |
| 질적변수 | ⑧최대주주 변경(횟수) | 3년간 2회 이상 | 0.282 | - | - | 최근일 기준 |
| ⑨대표이사 변경(횟수) | 3년간 3회 이상 | 0.577 | 1회 (2022.12.02) |
1회 (2022.12.02) |
최근일 기준 | |
| ⑩제3자배정 방식의 유상증자(횟수) | 3년간 2회 이상 | 0.093 | - | - | - | |
| ⑪제3자배정 방식의 전환사채, 신주인수권부사채, 교환사채 발행(횟수) | 3년간 2회 이상 | 0.511 | 해당 (3회) |
해당 3회 |
- | |
| ⑫불성실공시(횟수) | 3년간 2회 이상 | 0.327 | - | - | - | |
| ⑬최대주주등 지분율 | 25% 미만 | 0.751 | 해당 12.02% |
해당 12.02% |
- | |
| ⑭감사보고서 상 계속기업존속 불확실성 사유 발생 | 불확실성 발생 | 0.737 | - | - | - |
| (주1) |
기준치는 변수별로 부실징후에 유의한 영향을 미치는지 여부를 판단하는 기준을 말하고,기준치의 변수값은 기준치를 충족하는 경우 1, 미충족하는 경우 0으로 합니다. 다만, 기준치가 없는 변수의 경우에는 변수 측정치를 변수값으로 하되, 변수 측정치가 아래의 상한 또는 하한을 벗어나는 경우에는 해당 상한 또는 하한을 변수값으로 봅니다.
|
당사는 아직 한국거래소의 투자주의환기종목 정기지정 사유에는 해당된 바 없습니다. 다만, 재무변수 및 질적변수 중 부실징후 기준치에 해당되는 요인이 많습니다. 이는 당사의 재무상태 및 경영상황이 투자주의환기종목 정기지정 사유에 해당될 수 있을 만큼 부실한 요소를 두루 갖추고 있다는 점을 의미합니다.
(2) 수시지정
거래소는 보통주식 상장법인에 대하여 상기 코스닥시장 상장규정 제52조 제1항 제2호 가목 내지 차목에 해당될 경우 해당 주식을 투자주의 환기종목으로 수시 지정합니다. 이와 관련하여 현재 당사 현황을 검토하면 다음과 같습니다.
| [수시지정 요건에 대한 당사 현황 검토] |
| 구 분 | 내 용 | 당사 현황 (2025년 반기말) |
당사 현황 (2024년말) |
비 고 |
|---|---|---|---|---|
| ①내부회계관리제도 | 외부감사법 제8조에 따른 내부회계관리제도의 운영실태에 대한 감사인의 검토·감사 결과 중요한 취약점이 발견되거나 중요한 범위제한이 있는 경우 또는 검토·감사의견이 표명되지 않은 경우 | - | - | - |
| ②코스닥시장상장규정 제17조제1항 위반 | 이 규정에 따른 의무보유 대상 주식등을 사실상 매각한 경우. 다만, 최대주주 변경을 수반하는 경우로 한정한다. | - | - | - |
| ③제3자배정 신주 취득자와의 단기 금전거래 등 | 제3자 배정 방식의 유상증자로 해당 보통주식 상장법인의 신주를 취득한 자에게 해당 취득일부터 6개월 이내에 선급금 지급, 금전의 가지급, 금전 대여, 증권(법 제4조제2항 각 호의 증권, 어음, 양도성 예금증서를 말한다)의 대여, 출자(타법인이 발행한 주식등 또는 출자증권의 취득을 말한다) 등을 한 사실이 공시 등을 통해 확인된 경우 | - | - | - |
| ④감사의견 | 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정인 경우 | - | - | - |
| ⑤최대주주 변경 관련 | 최대주주 변경으로 제51조제1항에 따른 의무보유가 적용되는지 여부가 확인되지 않은 경우 | - | - | - |
| 제51조제1항에 따른 의무보유 대상자가 해당 의무보유를 이행하지 않은 경우 | - | - | - | |
| ⑥영업손실 | 최근 5개 사업연도에 각각 영업손실이 발생한 경우. 다만, 세칙으로 정하는 기술성장기업에는 이 목을 적용하지 않는다. | 미적용 | 미적용 | 기술성장기업에 해당되어 미적용 |
| ⑦자본잠식률 | 최근 반기 말 현재 자본잠식률이 100분의 50 이상인 경우 | - | - | - |
| ⑧자기자본 | 최근 반기 말 현재 자기자본이 10억원 미만인 경우 | - | - | - |
| ⑨검토/감사의견 | 최근 반기의 개별재무제표 또는 연결재무제표에 대한 감사인의 검토의견 또는 감사의견이 부적정, 의견거절이거나 감사범위 제한에 따른 한정인 경우 | - | - | - |
당사는 상기 수시 지정 요건 중 현재 해당사항은 없습니다. 최근 5개 사업연도에 각각 영업손실이 발생하기는 했으나, 당사(합병 전 코아스템(주) 본사)는 2015년 기술특례상장을 통해 코스닥시장에 상장된 기술성장기업에 해당하므로, 해당 요건은 적용받지 않고 있습니다.
2. 관리종목
| [코스닥시장 관리종목 지정요건 및 해당여부 검토] |
| 구 분 | 관리종목 지정(코스닥 상장규정 제53조) | 관리종목지정유예 | 관리종목 지정요건 적용여부 |
회사현황 | ||
|---|---|---|---|---|---|---|
| 해당여부 | 유예기간 | 사업연도 | 금액(백만원) / 비율(%) / 내용 | |||
| (1) 매출액 미달 | 최근 사업연도 100억원 미만 (지주회사는 연결기준) - 이익미실현기업 또는 기술성장기업은 상장후 5년간 미적용 - 기술성장기업 중 최근 사업연도 말「제약산업 육성 및 지원에 관한 특별법」에 따른 혁신제약기업이 세칙으로 정한 요건을 충족하는 경우에 해당하는 제약·바이오기업은 최근 사업연도 미적용 - 최근 사업연도의 일평균 시가총액이 600억원 이상인 기업의 경우, 최근 사업연도 미적용 |
미해당 | 2025년 6월말 |
2025년 6월말 이후 적용 | 2024년 | 매출액 : 288억원 (K-IFRS 별도기준) |
| 2025년 반기 | 매출액 : 116억원 (K-IFRS 별도기준) |
|||||
| (2) 법인세비용차감전 계속사업손실 |
최근 3사업연도중 2사업연도에 각각 10억원 이상이면서 해당 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 (다만, 상장일부터 상장일이 속한 사업연도의 말일까지의 기간이 3개월 미만인 경우에는 상장일이 속하는 사업연도와 그 이후 5개 사업연도로 한다) - 기술성장기업은 상장후 3년간 미적용(다만, 상장일부터 상장일이 속한 사업연도의 말일까지의 기간이 3개월 미만인 경우에는 상장일이 속하는 사업연도와 그 이후 3개 사업연도로 한다) |
- | - | 최근 3사업연도중 2사업연도에 각각 10억원 이상이면서 해당 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 | 2023년 (50% 초과 해당) |
세전손실 : -177억원 자기자본 : 196억원 (자기자본 대비 90.2%) |
| 2024년 (50% 초과 미해당) |
(파생상품평가손익 제외) 조정 후 세전손실 : -241억원 자기자본 : 486억원 (자기자본 대비 49.7%) |
|||||
| 2025년 반기 | 세전손실 : -96억원 자기자본 : 454억원 (자기자본 대비 24.3%) |
|||||
| (3) 자본잠식 등 | 최근 사업연도말 현재 자본잠식률이 100분의 50 이상인 경우 | - | - | 최근 사업연도말 자본잠식률이 100분의 50 이상일 경우 해당 |
2024년말 | 자본금 : 164억원 지배주주지분 : 486억원 자본잠식률 : - |
| 2025년 반기말 | 자본금 : 164억원 지배주주지분 : 454억원 자본잠식률 : - |
|||||
| (4)자기자본 미달 | 최근 사업연도말 현재 자기자본이 10억원 미만인 경우 | - | - | 최근 사업연도말 자기자본이 10억원 미만일 경우 해당 | 2024년말 | 지배주주지분 : 486억원 |
| 2025년 반기말 | 지배주주지분 : 454억원 | |||||
| (5) 시가총액 미달 | 보통주 시가총액 300억원미만 30일간 지속 - 천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
- | - | 현재 미해당 | 현재 기준 | 현재 충족 |
| (6) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 | - | - | 현재 미해당 | 현재 기준 | 현재 특이사항 없음 |
| (7) 지배구조 미달 | 최근 사업연도 사업보고서상 A)사외이사의 수가 「상법」 제542조의8의 규정에서 정하는 수에 미달하는 경우 B) 「상법」 제542조의11의 규정에서 정하는 감사위원회를 구성하지 않거나 감사위원회의 구성요건을 충족하지 못하는 경우 *「상법」 제542조의8에 의거 자산총액 1,000억원 미만의 코스닥 상장 벤처기업은 사외이사 선임 의무 면제 **「상법」 제542조의11에 의거 자산총액 2조원 미만의 상장회사는 감사위원회 설치 의무 면제 |
- | - | 현재 미해당 | 2025년 반기말 | 사외이사 선임 의무 면제 (자산총액 : 1,142억원) |
| (8) 거래량 미달 | 분기월평균거래량이 유동주식수의 1%에 미달 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다. - 신규상장법인(신규상장일이 속하는 분기에 한정) - 분기의 월평균거래량 1만주 이상(액면가액 5,000원 기준) - 「코스닥시장 업무규정」(이하 “업무규정”이라 한다) 제12조의3제1항에 따른 유동성공급계약이 체결된 경우 - 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. |
- | - | 현재 미해당 | 2024년말 | 소액주주 - 지분율 63.4% - 32,263명 |
| (9) 주식분산 미달 | 소액주주 200인미만 or 소액주주지분 20%미만 - 300인이상의 소액주주가 유동주식수의 10%이상으로서 100만주이상을 소유, 해외증권시장에 상장된 경우는 적용배제 |
- | - | 현재 미해당 | 2024년말 | 소액주주 - 지분율 63.4% - 32,263명 |
| (10) 회생절차 개시신청 | "채무자 회생 및 파산에 관한 법률" 제34조에 의한 회생 절차개시 신청이 있는 경우 | - | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| (11) 파산신청 | 코스닥시장 상장법인에 대하여 "채무자 회생 및 파산에 관한 법률" 제294조에 의한 파산신청이 있는 경우 | - | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| (12) 기타 | - 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 - 변경·추가상장이 유예된 기간 중에「증권의 발행 및 공시 등에 관한 규정」에 따른 재무관리기준을 위반한 경우 |
- | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| (출처) | 각 사업연도 (연결)감사보고서, 반기(연결)검토보고서, 정기보고서 |
| (주1) | 상기 도표 중 (1)매출액 미달 요건 관련하여, 별도재무제표를 기준으로 합니다. 그 외 요건은 연결재무제표를 기준으로 합니다. 현재 혁신형제약기업에 해당되어, 매출액 미달 요건은 2025년 6월말까지 적용받지 않습니다. |
| (주2) | (2)법인세비용차감전계속사업손실 요건 관련하여, 자기자본은 비지배지분을 제외하지 않은 금액 기준을 적용합니다. (3)자본잠식 등, (4)자기자본 미달 요건 관련하여, 자기자본은 비지배지분을 제외한 지배기업지분금액 기준을 적용합니다. |
당사는 기술성장특례 요건을 통해 코스닥시장에 2015년 상장하였기 때문에, 코스닥시장 상장규정상 관리종목 지정 요건 중 재무 관련 사항 일부(매출액 요건, 법인세비용차감전 세전손실 요건)를 일정기간 동안 유예받아 왔습니다. 단, 법인세비용차감전 세전손실 요건은 상장 3년 후 유예기간이 종료되었으며, 2018년부터 해당 요건을 적용받고 있습니다. 한편, 매출액 관련 요건은 상장 후 5년간 유예되고나서, 유예기간이 종료되었으나, 혁신형제약기업에 대한 특례 요건을 적용받아 2025년 6월말까지 요건 적용을 유예받고 있습니다.(주1)
| (주1) | 당사는 코스닥시장 상장규정 제53조 제1항 제1호 나목 및 동규정 시행세칙 제49조 제2항에 따라 '25.02.27자로 기술특례상장 제약바이오 연구개발 우수기업 매출액 특례 요건을 충족하였습니다. |
각 요건별로 당사 현황 및 발생 가능성을 살펴보면 다음과 같습니다.
(1) 매출액 미달 관련 요건
| [매출액 현황] | |
| (K-IFRS 별도기준) | (단위 : 천원) |
| 구 분 | 2025년 반기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 매출액 | 11,610,426 | 28,762,460 | 33,657,156 | 4,650,379 |
| (출처) | 각 사업연도 감사보고서, 반기보고서 |
매출액 미달 관련하여, 당사는 혁신형제약기업 특례를 적용받아 2025년 6월말까지 요건을 적용받지 않고 있습니다. 다만 유예기간이 종료되더라도, 당사 매출은 현재 연 100억원을 상회하고 있는 상태이므로, 급격한 매출 하락이 발생하지 않는 한 단기간 내에 매출액 미달 요건에 의해 관리종목 지정될 가능성은 높지 않을 것으로 예상하고 있습니다.
(2) 자기자본 50% 초과 법인세비용차감전 계속사업손실 관련 요건
| [법인세비용차감전순손익 및 자기자본 현황] | |
| (K-IFRS 연결기준) | (단위 : 천원, %) |
| 구 분 | 2025년 반기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 법인세비용차감전순손익 | (9,578,203) | (31,303,485) | (17,676,130) | 3,406,757 |
| (파생상품평가손익 제외) 조정 후 법인세비용차감전 순손익 |
(11,017,753) | (24,136,402) | (17,676,130) | 3,406,757 |
| 자기자본 | 45,374,496 | 48,593,356 | 19,600,630 | 38,634,176 |
| (조정 후)법인세비용차감전순손익 / 자기자본 | -24.28% | -49.67% | -90.18% | 8.82% |
| 50% 초과여부 | 미해당 | 미해당 | 해당 | 미해당 |
| (출처) | 각 사업연도 연결감사보고서, 반기보고서 |
| (주1) | 자기자본은 비지배지분을 제외하지 않은 금액 기준입니다. |
| (주2) | 2022년과 2023년에는 파생상품평가손익을 제외하지 않은 세전손익 기준입니다. 2024년에는 파생상품평가손익을 제외한 세전손익 기준입니다. |
당사는 2023년 자기자본 대비 50%를 초과하는 법인세비용차감전 계속사업손실이 발생하였습니다. 2024년에는 파생상품평가손익을 제외한 법인세비용차감전 계속사업손실이 자기자본 대비 49.67% 규모로서, 50%를 초과하지 않았습니다.
당사는 2023년에 50% 초과요건에 해당되었기 때문에 2025년 자기자본 대비 50%를 초과하는 법인세비용차감전 계속사업손실(파생상품평가손익 제외)이 발생할 경우 최근 3개년 내에 2회 이상 요건이 충족되어 관리종목으로 지정될 수 있습니다.
당사는 2025년 반기 기준으로 자기자본은 454억원이며, 96억원의 법인세비용차감전순손실(파생상품평가손익 제외)이 발생한 상태입니다. 따라서 자기자본의 확충이 일어나거나 법인세비용차감전순손실 규모가 더욱 증가하게 될 경우 50%를 초과하는 요건에 해당될 가능성이 존재합니다. 따라서 본 유상증자로 인한 자기자본 확충이 이루어져야 함은 물론, 법인세비용차감전순손실 규모가 예상보다 확대되지 않도록 관리해야 하는 상황입니다.
관리종목으로 지정될 경우 일정 기간 내에 해당 사유를 해소하지 못할 경우 상장폐지까지 이어질 수 있으므로 투자자 여러분들께서는 반드시 당사의 재무 추이에 대해 실시간 모니터링하셔야 합니다.
(3) 자본잠식률 50% 이상, 자기자본 10억원 미달 관련 요건
| [자기자본 및 자본잠식률 현황] | |
| (K-IFRS 연결기준) | (단위 : 천원, %) |
| 구 분 | 2025년 반기말 | 2024년말 | 2023년말 | 2022년말 | |
|---|---|---|---|---|---|
| 지배기업소유주지분 | 45,374,496 | 48,593,356 | 19,600,630 | 38,634,176 | |
| 자본금 | 16,435,188 | 16,435,188 | 16,435,188 | 16,435,188 | |
| 주식발행초과금 | 212,364,193 | 212,364,193 | 212,364,193 | 212,364,193 | |
| 자기주식처분이익 | 29,330,130 | 29,886,948 | 0 | 0 | |
| 기타자본 | (121,415,555) | (128,403,555) | (141,980,135) | (141,976,562) | |
| 기타포괄손익누계액 | 11,796,610 | 11,753,619 | (622,209) | (968,165) | |
| 결손금 | (103,136,070) | (93,443,038) | (66,596,408) | (47,220,478) | |
| 비지배지분 | 0 | 0 | 0 | 0 | |
| 자본총계 | 45,374,496 | 48,593,356 | 19,600,630 | 38,634,176 | |
| 자본잠식률 | - | - | - | - | |
| (출처) | 각 사업연도 (연결)감사보고서, 반기보고서 |
| (주1) | 자본잠식률 : (자본금 - 지배기업소유주지분) ÷ 자본금 |
| (주2) | 자본잠식률 및 자기자본 요건 관련하여, 자기자본은 지배기업소유주지분을 기준으로 적용합니다. |
당사는 2025년 반기말 기준 자본잠식 상태는 아닙니다. 다만, 당사의 적자 발생이 지속될 경우 당사의 자기자본 규모는 지속적으로 축소될 수 있고 향후 자본잠식 위험성이 생길 수 있습니다.
관리종목으로 지정될 경우 일정 기간 내에 해당 사유를 해소하지 못할 경우 상장폐지까지 이어질 수 있으므로 투자자 여러분들께서는 반드시 당사의 재무 추이에 대해 실시간 모니터링하셔야 합니다.
(4) 시가총액 미달 관련 요건
당사 보통주의 시가총액이 300억원 미만인 상태로 30일간 지속될 경우 관리종목으로 지정될 수 있습니다. 단, 현재 당사의 시가총액 수준을 고려할 경우 단기간 내에 시가총액이 300억원 미만인 상태에 진입할 가능성은 낮을 것으로 예상하고 있습니다.
(5) 정기보고서 미제출 관련 요건
| [기타 경영사항(자율공시) - 2023.08.14] - 반기보고서 미제출에 관한 건 |
|
기타 경영사항(자율공시)
|
||||||||||||
| (출처) | 거래소 공시사항(https://kind.krx.co.kr) |
당사는 자본시장과 금융투자업에 관한 법률 제160조에 의거하여, 반기보고서를 해당 기간 경과 후 45일 이내에 금융위원회와 거래소에 제출하여야 합니다. 다만, 2023년 반기 당시, 당사의 외부감사인은 당사의 2023년도 반기말 재무제표 및 연결재무제표에 대한 검토를 수행하는 과정에서 물리적 시간 부족으로 검토절차가 완료되지 않아 반기보고서 제출이 지체되었습니다. 이는 2022년 합병 후 2023년 변경된 지정감사인을 대응하는 과정에서, 일시적으로 당사 회계/재무 인력의 외부감사인 대응 과정에 예상보다 많은 시간이 지출되었기 때문입니다. 그 결과 당사는 반기 연결재무제표 및 재무제표에 대한 반기보고서 및 감사인의 검토보고서를 법정 제출기한인 2023년 8월 14일까지 제출하지 못하였습니다.
| [관리종목 지정 - 2023.08.14] |
|
관리종목 지정
|
|||||||||||||||
| (출처) | 거래소 공시사항(https://kind.krx.co.kr) |
반기보고서 법정기한 내 미제출에 따라 당사 주식은 2023년 08월 14일부로 관련 한국거래소 상장규정에 따라 관리종목으로 지정되었습니다.
다만, 2023년 08월 22일 법정기한 이후, 당사는 반기보고서를 제출 완료하였으며, 이에 따라 다음과 같이 당사 주식은 관리종목에서 해제되었습니다.
| [관리종목 해제 - 2023.08.22] |
|
관리종목 해제
|
| (출처) | 거래소 공시사항(https://kind.krx.co.kr) |
이는 당사의 일시적인 회계 대응 지연에 따른 상황이었으나, 주식이 관리종목으로 지정된 이력이 있음에 따라, 당사의 기발행 채권의 기한이익 상실에 해당될 수 있는 경우에 해당될 수 있었습니다. 이에 2023년 08월 31일 당사는 제2회 사모 교환사채 중 기한이익 상실을 선언한 일부 채권자(권면금액 27억원)의 채권을 다음과 같이 조기상환하게 되었습니다.
| [교환사채(해외교환사채포함) 발행후 만기전 사채 취득(2023.08.31)] |
|
교환사채(해외교환사채 포함) 발행후 만기전 사채 취득
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (출처) | 거래소 공시사항(https://kind.krx.co.kr) |
당사는 이후, 정기보고서의 제출기한을 엄수하고 있으며, 동일한 사유로 인해 관리종목에 지정된 이력은 없습니다. 다만, 해당 이력은 당사의 평판 및 신뢰성 등에 악영향을 미친 것으로 생각되며, 향후 재발하지 않도록 회계/재무 담당 인력의 대응 능력 향상에 더욱 노력해오고 있습니다.
만일 향후 당사가 정기보고서 제출기한을 지키지 못할 경우 관리종목으로 지정될 수 있으므로 투자자 여러분들께서는 당사의 정기보고서 제출기한 여부에 대해 실시간 모니터링하셔야 합니다.
(6) 지배구조 미달 관련 요건
당사는 현재 지배구조 관련하여 관리종목 지정 요건에 해당되지 않습니다. 향후에도 동 요건에 해당되지 않도록 관리해나갈 예정입니다.
(7) 거래량 미달, 주식분산 미달 관련 요건
당사는 현재 거래량 미달 및 주식분산 미달 관련하여 관리종목 지정 요건에 해당되지 않습니다.
(8) 회생절차, 파산신청, 그 외 기타 요건
당사는 현재 회생절차, 파산신청 등의 사유가 발생하지 않았으므로, 현재까지는 관리종목 지정 요건에 해당되지 않습니다. 다만, 당사는 현재 지속적인 손실 발생으로 인해 재무상태가 악화된 상태이므로, 반드시 유동성을 확보하면서 동시에 재무 상태를 개선해나가야 하는 과제를 안고 있습니다. 당사의 재무 개선이 이루어지지 않을 경우 당사의 채무 지급이 연체될 수 있으며, 끝내 이를 해결하지 못한다면, 이는 당사의 회생절차 신청, 파산신청 등으로 이어질 수도 있습니다. 따라서 투자자 여러분들께서는 반드시 당사의 재무 추이에 대해 실시간 모니터링하셔야 합니다.
3. 상장적격성실질심사 / 상장폐지
| [코스닥시장상장규정 제54조(형식적상장폐지)] |
|---|
|
제54조(형식적 상장폐지) 1. 감사인 의견 미달: 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 부적정, 의견거절이거나 감사범위 제한에 따른 한정인 경우. 다만, 해당 감사의견이 계속기업으로서의 존속능력에 대한 불확실성에 의한 부적정 또는 의견거절인 경우에는 사업보고서 법정 제출기한의 다음 날부터 10일 이내에 해당 사유 해소에 관하여 세칙으로 정하는 감사인의 확인서(해당 감사보고서를 작성한 감사인이 작성한 것으로 한정한다)를 제출하여 거래소가 인정하는 때에는 그 제출일이 속하는 반기를 기준으로 다음 각 목의 어느 하나에 해당하는 경우로 한다. 가. 반기 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 부적정, 의견거절이거나 감사범위 제한에 따른 한정인 경우 나. 반기보고서 법정 제출기한의 다음 날부터 10일 이내에 반기 감사보고서를 제출하지 않은 경우. 이 경우 종속회사가 있는 법인은 연결재무제표에 대한 감사보고서를 포함한다. 1의2. 2년 연속 감사인 의견 미달 등: 제1호에 따른 감사인 의견 미달 사유를 해소하지 못한 상태에서 다음 각 목의 어느 하나에 해당하는 경우 <신설 2025. 7. 9.> 가. 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 부적정, 의견거절 또는 감사범위 제한에 따른 한정인 경우 <신설 2025. 7. 9.> 나. 최근 사업연도의 사업보고서를 법정 제출기한의 다음 날부터 10일 이내에 제출하지 않은 경우 <신설 2025. 7. 9.> 2. 최종부도 또는 은행거래 정지: 발행한 어음 또는 수표가 주거래은행에 의하여 최종부도로 결정되거나 거래은행에 의하여 거래가 정지되는 경우 3. 해산 등: 피흡수 합병 또는 파산선고 등으로 법률에 따른 해산 사유가 발생한 경우 또는 주식의 포괄적 교환 등으로 다른 법인의 완전자회사가 되는 경우 4. 거래량 미달: 거래량 미달로 제53조제1항제8호에 따라 관리종목으로 지정된 상태에서 다음 분기에도 연속하여 해당 규정에 따른 거래량 미달 상태가 계속되는 경우 5. 주식분산 미달: 주식분산 미달로 제53조제1항제9호에 따라 관리종목으로 지정된 보통주식 상장법인이 1년 이내에 해당 규정에 따른 주식분산 미달을 해소하지 않는 경우 6. 자본전액잠식: 최근 사업연도 말 현재 자본전액잠식 상태인 경우. 다만, 사업보고서의 법정 제출기한까지 자본전액잠식이 해소되었음을 증명하는 재무제표 및 이에 대한 감사인(정기재무제표에 대한 감사보고서를 작성한 감사인과 동일한 감사인으로 한정한다)의 감사보고서(감사의견이 적정인 경우로 한정한다)를 제출하는 경우는 제외한다. 7. 정기보고서 미제출: 다음 각 목의 어느 하나에 해당하는 경우 가. 사업보고서, 반기보고서 또는 분기보고서 미제출로 제53조제1항제6호에 따라 관리종목으로 지정된 상태에서 공시규정 제19조제1항에 따른 사업보고서, 반기보고서 또는 분기보고서를 법정 제출기한까지 제출하지 않은 경우 나. 최근 2년 동안 3회 이상 공시규정 제19조제1항에 따른 사업보고서, 반기보고서 또는 분기보고서를 법정 제출기한까지 제출하지 않은 경우 다. 사업보고서 미제출로 제53조제1항제6호에 따라 관리종목으로 지정된 상태에서 해당 사업보고서를 법정 제출기한의 다음 날부터 10일 이내에 제출하지 않은 경우 8. 주식의 양도제한: 주식의 양도가 제한되는 경우. 다만, 법령 또는 정관 등에 따라 주식양도가 제한되는 경우로서 그 제한이 코스닥시장의 매매거래를 해치지 않는다고 거래소가 인정하는 경우는 제외한다. 9. 이전상장: 유가증권시장에 상장하기 위하여 상장폐지를 신청하는 경우 10. 우회상장기준 위반: 우회상장과 관련하여 다음 각 목의 어느 하나에 해당하는 경우. 다만, 해당 기업결합을 취소하는 결의·결정이 있고, 그 이행이 확인된 경우는 제외한다. 가. 제35조의 우회상장 심사요건을 충족하지 못하고 합병, 주식의 포괄적 교환, 중요한 영업양수, 중요한 자산양수, 주식의 발행 등 우회상장을 완료하는 경우 나. 제36조 또는 제37조의 우회상장에 따른 의무보유를 이행하지 않고 우회상장을 완료하는 경우 11. 지배구조 미달: 다음 각 목의 어느 하나의 사유에 해당하는 경우. 다만, 해당 사유가 주주총회의 정족수 미달로 발생한 경우는 제외한다. 가. 제53조제1항제7호가목에 따라 관리종목으로 지정된 보통주식 상장법인이 다음 사업연도에도 해당 규정에서 정하는 상태에 해당되는 경우 나. 제53조제1항제7호나목에 따라 관리종목으로 지정된 보통주식 상장법인이 다음 사업연도에도 해당 규정에서 정하는 상태에 해당되는 경우 12. 시가총액 미달: 시가총액 미달로 제53조제1항제5호에 따라 관리종목으로 지정된 후 90일(해당 종목의 매매거래일을 기준으로 한다. 이하 이 호에서 같다) 동안 해당 보통주식의 시가총액이 다음 각 목의 어느 하나라도 충족하지 못하는 경우. 이 경우 제53조제1항제5호 단서를 준용한다. 가. 300억원 이상인 상태가 10일 이상 계속될 것 <개정 2025. 7. 9.> 나. 300억원 이상인 일수가 30일 이상일 것 <개정 2025. 7. 9.> ② 제1항제1호 각 목 외의 부분 단서에 따른 반기에 대하여는 반기보고서에 감사인의 감사의견이 포함되어야 한다. <개정 2022. 12. 7.> ③ 거래소는 제1항의 형식적 상장폐지 사유가 발생한 경우 다음 각 호의 사항을 해당 법인에 서면으로 통지하여야 한다. 다만, 제55조제1항에 따라 이의신청이 허용되는 상장폐지 사유가 아닌 경우에는 그러하지 아니하다. 1. 상장폐지의 사유 및 근거 2. 상장폐지에 대하여 이의신청을 할 수 있다는 뜻 3. 그 밖에 거래소가 상장폐지 및 이의신청과 관련하여 필요하다고 인정하는 사항 ④ 거래소는 보통주식 상장법인의 형식적 상장폐지 등과 관련된 향후 세부절차를 시장안내 사항으로 공시하여야 한다. ⑤ 제1항부터 제4항까지의 규정 외에 형식적 상장폐지 사유의 적용 방법과 그 밖에 필요한 사항은 세칙으로 정한다. |
| (출처) | KRX 법무포털 |
| [코스닥시장상장규정 제56조(상장적격성 실질심사에 따른 상장폐지)] |
|---|
|
제56조(상장적격성 실질심사에 따른 상장폐지) 1. 회생절차개시신청으로 제53조제1항제10호에 따라 관리종목으로 지정된 상태에서 법원의 회생절차개시신청 기각, 회생절차개시결정 취소, 회생계획 불인가, 회생절차폐지의 결정 등이 있는 경우. 다만, 간이회생절차의 경우 「채무자 회생 및 파산에 관한 법률」 제293조의5제2항제2호가목의 회생절차개시결정이 있거나 같은 조 제4항에 따라 회생절차가 속행되는 경우는 제외한다. 2. 상장 또는 상장적격성 실질심사와 관련하여 제출한 서류에 투자자 보호를 위하여 중요한 사항이 거짓으로 기재되거나 누락된 사실이 발견되는 경우 3. 형식적 상장폐지 또는 상장적격성 실질심사를 회피하기 위하여 증자, 분할 또는 사업부 매각 등을 한 것으로 인정되는 경우 4. 상당한 규모의 횡령·배임 혐의가 공시 등을 통해 확인되는 경우 5. 외부감사법 제5조제3항을 중대하게 위반한 사실 등이 확인된 경우 6. 주된 영업이 정지된 경우 7. 제54조제1항제6호 단서에 따른 감사보고서를 제출하여 같은 호 본문의 자본전액잠식에 따른 형식적 상장폐지 사유를 해소한 경우. 다만, 회생절차개시결정 법인에 대하여는 이 목을 적용하지 않는다. 8. 매출채권 이외의 채권에서 상당한 규모의 손상차손 발생이 공시 등을 통해 확인되는 경우 9. 관리종목(제53조제1항제7호부터 제9호까지의 규정에 따라 관리종목으로 지정된 경우는 제외한다)이나 투자주의 환기종목으로 지정된 보통주식 상장법인이 다음 각 목의 어느 하나에 해당하는 경우 가. 경영권 변동사실이 공시 등을 통해 확인되는 경우. 다만, 경영정상화를 위한 유상증자, 출자전환 등에 따라 신주를 발행하여 경영권 변동이 발생한 경우는 제외한다. 나. 제3자 배정 방식의 유상증자로 신주를 취득한 자에게 해당 신주의 취득일부터 6개월 이내에 선급금 지급, 금전의 가지급, 금전 대여, 증권(법 제4조제2항 각 호의 증권, 어음 또는 양도성 예금증서를 말한다)의 대여, 출자(타법인이 발행한 주식등 또는 출자증권의 취득을 말한다)에 관한 결정 등을 한 사실이 공시 등을 통해 확인되는 경우 10. 보통주식 상장법인이 「상법」 제530조의2에 따른 분할 또는 분할합병을 하는 경우로서 다음 각 목의 어느 하나에 해당하는 경우 가. 분할 또는 분할합병 이후 존속될 법인이 해당 분할 또는 분할합병 결의일 현재 존속될 예정인 영업부문에 대하여 다음의 요건 중 어느 하나라도 충족하지 못하는 경우. 다만, 지주회사 전환을 위한 분할 등 거래소가 필요하다고 인정하는 경우는 제외한다. 나. 보통주식 상장법인이 주권비상장법인 또는 코넥스시장 상장법인과 합병(「상법」 제527조의3에 따른 소규모 합병은 제외한다)한 이후 3년 이내에 분할을 위한 이사회 결의를 하는 경우로서 존속될 법인의 주된 영업이 합병 당시 주권비상장법인 또는 코넥스시장 상장법인의 영업부문이었던 경우. 다만, 합병 당시 합병에 따른 우회상장 심사를 받은 경우는 제외한다. 11. 이익미실현기업이 제53조제1항제1호가목 또는 같은 항 제2호가목에 따라 매출액 미달 또는 법인세비용차감전계속사업손실 발생으로 인한 관리종목 지정이 면제되는 기간 중에 상당한 규모의 매출액 감소가 공시 등을 통해 확인되는 경우 12. 공시규정에 따라 벌점을 부과 받는 경우로서 해당 벌점을 포함하여 최근 1년 이내의 누계벌점이 15점 이상이 되는 경우 13. 제54조제1항제1호의 감사인 의견 미달로 형식적 상장폐지 사유가 발생한 보통주식 상장법인이 제55조제1항의 이의신청 등으로 해당 감사보고서상 감사의견이 변경되거나 차기 감사보고서상 감사의견이 적정이 되어 해당 상장폐지 사유를 해소한 경우. 이 경우 제55조의2제2항에 따라 상장폐지 사유가 해소된 것으로 보는 경우를 포함한다. 14. 제52조제1항제2호라목에 따라 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정으로 투자주의 환기종목으로 지정된 보통주식 상장법인이 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정인 경우 15. 매출액 미달로 제53조제1항제1호에 따라 관리종목으로 지정된 상태에서 최근 사업연도에도 매출액이 100억원 미만인 경우. 다만, 제53조제1항제1호다목에 해당하는 경우에는 이 호를 적용하지 않는다. 16. 법인세비용차감전계속사업손실이 발생하여 제53조제1항제2호에 따라 관리종목으로 지정된 상태에서 최근 사업연도에도 최근 사업연도 말 자기자본의 100분의 50을 초과하고 10억원 이상인 법인세비용차감전계속사업손실이 발생한 경우. 이 경우 법인세비용차감전계속사업손실에서 세칙으로 정하는 금액은 제외한다. 17. 자본잠식으로 제53조제1항제3호에 따라 관리종목으로 지정된 상태에서 최근 사업연도 말 현재 자본잠식률이 100분의 50 이상인 경우 18. 자기자본 미달로 제53조제1항제4호에 따라 관리종목으로 지정된 상태에서 최근 사업연도 말 현재 자기자본이 10억원 미만인 경우 19. 제1호부터 제18호까지의 상장적격성 실질심사 사유와 제54조의 형식적 상장폐지 사유에 준하는 경우로서 거래소가 투자자 보호를 위하여 상장을 폐지할 필요가 있다고 인정하는 경우 ② 상장적격성 실질심사 사유의 적용 방법과 그 밖에 필요한 사항은 세칙으로 정한다. [전문개정 2025. 7. 9.] |
| (출처) | KRX 법무포털 |
당사는 현재 법인세비용차감전계속사업손실 요건 관련하여 관리종목 지정 위험성이 존재하므로, 만일 향후 관리종목으로 지정될 경우 이를 기한 내에 해소하지 못한다면, 상장적격성 실질심사까지 이어질 가능성이 존재합니다. 아직 관리종목으로 지정된 상황은 아니지만 투자자 여러분들께서는 당사의 재무적 상황이 열악한 수준인 점에 대해 반드시 유념해주시기 바랍니다.
이처럼 당사는 투자주의환기종목, 관리종목 내지 상장폐지 등의 위험을 줄이기 위해서는 자기자본의 확충 및 실적 개선이 반드시 필요한 상황입니다. 당사는 본 유상증자를 통해 자기자본을 확충하고자 하나, 신약개발 사업부문의 적자 발생 지속, 비임상CRO 사업의 실적 저하 추세를 고려한다면, 자기자본 확충에도 불구하고 이러한 위험성을 중장기적으로 개선해나가는 것은 어려울 수 있습니다. 특히 2025년에는 본 유상증자가 예정대로 연내에 납입되어 자기자본이 확충되고, 법인세비용차감전계속사업손실 발생 규모를 통제해야만, 관리종목 지정 위험을 피할 수 있을 것으로 예상됩니다. 투자주의환기종목 또는 관리종목으로 지정될 경우 자본시장에서의 자금 조달이 어려워지므로 유동성 위험이 증가할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [라. 재무제표 재작성 이력 존재 위험] 당사는 2023년말 감사 과정에서 2022년 연결재무제표 회계처리 오류와 관련하여, 재무제표를 재작성한바 있습니다. 또한 2023년 반기검토 당시 당사 외부감사인은 당사의 2022년말 합병후 재무제표에 대해 지적사항이 있었으며, 이를 대응하는 과정에서 2023년 반기보고서 제출이 지연된 바 있습니다. 해당 반기보고서 지연 제출과 관련하여 증권신고서 제출일 현재 상기 위반 사항에 대한 금융감독원의 조사결과에 따라 20억원 이하의 과징금 또는 3천만원 이하의 과태료가 부과될 수 있으나 현재로서는 그 조치 여부 및 수준을 정확히 예상할 수 없습니다. 당사는 공시 위반사항이 발생하지 않도록 인력 및 조직, 시스템을 구축하고 있으며, 관련 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반 시 제재 등에 대한 공시 교육을 지속적으로 실시하고 있습니다. 그럼에도 불구하고 규제기관의 제재가 내려질 경우 과징금 등 조치 규모에 따라 당사 손익에 부정적인 영향을 미칠 수 있습니다. 당사는 향후 이러한 사항이 재발하지 않도록 노력할 예정이며, 2023년부터 현재까지 지속적으로 지정감사를 받고 있는 상황이므로, 회계적 신뢰성을 유지할 수 있도록 노력하려고 합니다. 향후에도 회계처리 오류가 발생할 경우 그 심각성 정도에 따라 회계 감리 대상이 되거나, 각종 규제에 따른 처벌 대상이 될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 2023년말 감사 과정에서 다음과 같이 2022년 연결재무제표 회계처리 오류와 관련하여, 재무제표를 재작성한바 있습니다.
| [연결감사보고서(2024.03.21)] - 감사보고서상 강조사항 일부 내용 발췌 |
|
강조사항 - 전기 비교표시 재무제표의 수정 연결재무제표에 대한 주석 39에 기술하고 있는 바와 같이, 매출액 수익인식기준, 기타포괄손익-공정가치측정금융자산 분류와 측정, 자기주식 계정재분류 등의 회계처리 오류와 관련하여 연결회사의 2022년 12월 31일로 종료되는 보고기간의 연결재무제표를 재작성하였습니다. - 연결회사의 전기 연결재무제표 재작성 내용과 관련한 사실관계가 적절한지 확인 - 연결회사의 기존 회계정책 및 재작성시 적용한 회계정책과 관련 세부자료를 검토하여 재작성의 근거가 기준서에 부합하는 지 검토 |
| (출처) | 2023년말 연결감사보고서 |
당사는 상기 회계오류 수정으로 인하여 2022년 12월 31일로 종료되는 보고기간의 자산 1,560,004천원 감소, 부채 1,266,895천원 증가, 자본 2,826,899천원 감소 및 당기순이익 298,644천원이 감소하였습니다.
이와 관련된 보다 상세한 내용은 다음과 같습니다.
| [연결감사보고서(2024.03.21)] - 주석사항 일부 내용 발췌 |
|
39. 재무제표 재작성 연결회사는 당기 중 매출액 수익인식기준, 기타포괄손익-공정가치측정금융자산 분류와 측정, 자기주식 계정재분류 등의 오류가 발견되었으며, 동 사항으로 인한 연결재무제표에 미치는 영향이 중요하다고 판단하여 비교표시된 전년도 연결재무제표에 수정사항을 반영하여 재작성하였습니다. (아래의 '이전 보고금액'은 당사의 최초 공시가 이루어졌던 2023년 3월 20일자 감사보고서에 첨부된 연결재무제표에 따른 보고금액입니다.)
(2-2) 전기 연결포괄손익계산서
(2-4) 전기말 현금흐름표
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (출처) | 2023년말 연결감사보고서 |
또한 2023년 반기검토 당시 당사 외부감사인은 당사의 2022년말 합병후 재무제표에 대해 지적사항이 있었으며, 이를 대응하는 과정에서 2023년 반기보고서 제출이 지연된 바 있습니다. 이와 관련하여 사업보고서 등의 제출의무를 위반하는 경우, 자본시장법 등에 따라 제재조치가 취해질 수 있으며, 특히 자본시장법 제429조 제3항 제2호 등에 따라 과징금이 부과될 수 있으나, 현재로서는 그 조치 여부 및 수준을 정확히 예상할 수 없습니다. 당사는 공시 위반사항이 발생하지 않도록 인력 및 조직, 시스템을 구축하고 있으며, 관련 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반 시 제재 등에 대한 공시 교육을 지속적으로 실시하고 있습니다. 그럼에도 불구하고 규제기관의 제재가 내려질 경우 과징금 등 조치 규모에 따라 당사 손익에 부정적인 영향을 미칠 수 있습니다.
당사는 향후 이러한 사항이 재발하지 않도록 노력할 예정이며, 2023년부터 현재까지 지속적으로 지정감사를 받고 있는 상황이므로, 회계적 신뢰성을 유지할 수 있도록 노력하려고 합니다. 향후에도 회계처리 오류가 발생할 경우 그 심각성 정도에 따라 회계 감리 대상이 되거나, 각종 규제에 따른 처벌 대상이 될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [마. 지속적 영업손실 발생 위험] 바이오의약품사업부의 매출은 2022년 약 16억원, 2023년 약 16억원, 2024년 약 11억원, 2025년 반기 약 2억원으로 감소하는 추세이며, 영업손실은 2022년 약 139억원, 2023년 약 159억원, 2024년 139억원, 2025년 반기 60억원으로 유지되거나 늘어나고 있는 추세입니다. 이는 심평원이 제시한 보험약가는 당시 생산단가에 미치지 못하였으며, 이로 인해 재무적 지속 가능성을 훼손할 우려가 있어 당사는 부득이하게 비급여 판매를 결정한 점에서 기인합니다. 비급여 전환으로 인해 환자와 의료기관의 실구매 비용 부담이 크게 증가하였고, 이로 인해 제품의 도입과 처방이 지연되면서 실제 매출이 당초 전망치를 하회하게 되었습니다. 치료제 시장은 국가 보험제도의 특성상 예산 대비 치료 효과의 비용 효율성을 엄격히 검토하는 구조로 운영되고 있으며, 당시에도 일본 제약사 미쓰비시타나베사의 루게릭병 치료제 '라디컷'이 심평원과 약가 협의를 진행했으나 비급여 판정을 받아 현재까지 동일한 형태로 환자들에게 제공되고 있습니다. 이러한 제도적 환경은 신약 상용화 속도를 제한하는 요인으로 작용하였으며, 이는 당사의 통제 범위를 넘어선 외적 변수였습니다. 한편, 비임상 CRO 사업부의 매출은 Covid-19 사태 발생 후 약 3년간 백신 치료제 개발 시장이 활성화되며, 국내 제약/바이오 업체의 R&D 활동이 증가하며 지속적 매출 증가 추이를 보일 수 있었습니다. 다만, 2023년부터 Covid-19 사태가 종식되는 추이에 돌입하고 금리 인상에 따른 글로벌 바이오 시장의 투자 침체가 이어졌으며, 주요 고객사들의 연구개발 활동이 축소되고 프로젝트가 지연되는 등 시장 환경이 악화됨에 따라 매출의 감소세를 보이고 있습니다. 비임상CRO사업부의 매출은 2022년 약 447억원, 2023년 약 321억원, 2024년 약 276억원, 2025년 반기 약 114억원으로 감소하는 추세이며, 2022년에는 약 83억원의 영업이익이 발생하였으나, 이후 적자 전환하여 영업손실이 2023년 약 37억원, 2024년 78억원, 2025년 반기 46억원으로 증가하고 있는 추세입니다. 당사의 노력에도 불구하고 시장 환경이 개선되지 않을 경우 비임상 CRO 사업부의 실적 회복은 더딜 수 있으며, 신약 개발 사업부는 지속적으로 연구개발비용이 투입되고, 개발에 따른 성과는 단기간 내에 나오지 않기 때문에 당사 영업손실 발생은 지속될 수 있습니다. 영업손실이 지속될 경우 당사의 자금조달 환경에도 악영향을 미칠 수 있으며, 이 경우 당사의 계속기업으로서의 존속능력에 악영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사의 바이오의약품사업부는 Covid-19 사태 발생 후 외국인의 입국 제한으로 인한 수요 감소, 미국 아밀릭스사의 렐리브리오 출시 등으로 인해 지속적으로 매출이 감소하고 있습니다. 바이오의약품사업부의 매출은 2022년 약 16억원, 2023년 약 16억원, 2024년 약 11억원, 2025년 반기 약 2억원으로 감소하는 추세이며, 영업손실은 2022년 약 139억원, 2023년 약 159억원, 2024년 139억원, 2025년 반기 60억원으로 유지되거나 늘어나고 있는 추세입니다.
| [바이오의약품사업부 매출 및 영업이익 추이] |
| (단위 : 백만원) |
| 구분 | 2025년 반기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 매출액 | 188 | 1,121 | 1,605 | 1,642 |
| 영업이익 | (6,004) | (13,887) | (15,909) | (13,934) |
| 당기순이익 | (4,393) | (19,306) | (13,535) | (4,617) |
| (출처) | 당사 제시 |
IPO 당시에는 건강보험심사평가원과의 협의를 통해 일정 수준의 보험약가가 책정되고, 이를 기반으로 상급종합병원 중심의 처방 확대가 이루어질 것으로 가정하였습니다. 그러나 실제 협상 과정에서 심평원은 해당 약물이 고가이며, 출시 초기에는 대체 약물이 없어 수요가 많을 것으로 예상되는 상황에서 단일 약물에 과도한 예산을 배정하기 어렵다고 판단하였으며, 심평원이 제시한 보험약가는 당시 생산단가에 미치지 못하였습니다. 이는 재무적 지속 가능성을 훼손할 우려가 있어 당사는 부득이하게 비급여 판매를 결정하게 되었습니다.
비급여 전환으로 인해 환자와 의료기관의 실구매 비용 부담이 크게 증가하였고, 이로 인해 제품의 도입과 처방이 지연되면서 실제 매출이 당초 전망치를 하회하게 되었습니다. 치료제 시장은 국가 보험제도의 특성상 예산 대비 치료 효과의 비용 효율성을 엄격히 검토하는 구조로 운영되고 있으며, 당시에도 일본 제약사 미쓰비시타나베사의 루게릭병 치료제 '라디컷'이 심평원과 약가 협의를 진행했으나 비급여 판정을 받아 현재까지 동일한 형태로 환자들에게 제공되고 있습니다. 이러한 제도적 환경은 신약 상용화 속도를 제한하는 요인으로 작용하였으며, 이는 당사의 통제 범위를 넘어선 외적 변수였습니다.
| [IPO 당시 대표주관회사의 추정 내역 및 실제 내역] |
| (단위: 백만원, %) |
| 과 목 | 2015 (E) | 2015년 실제 | 괴리율 | 2016 (E) | 2016년 실제 | 괴리율 | 2017 (E) | 2017년 실제 | 괴리율 | 2018 (E) | 2018년 실제 | 괴리율 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 22,496 | 18,571 | -17.4% | 32,496 | 17,953 | -44.8% | 46,924 | 18,094 | -61.4% | 70,971 | 22,317 | -68.6% |
| 매출원가 | 14,736 | 12,499 | -15.2% | 19,708 | 12,740 | -35.4% | 27,419 | 14,628 | -46.7% | 34,827 | 18,063 | -48.1% |
| 매출총이익 | 7,760 | 6,072 | -21.8% | 12,788 | 5,213 | -59.2% | 19,505 | 3,467 | -82.2% | 36,144 | 4,253 | -88.2% |
| 판매관리비 | 6,861 | 4,704 | -31.4% | 7,775 | 6,837 | -12.1% | 9,231 | 8,537 | -7.5% | 11,014 | 8,113 | -26.3% |
| 영업이익 | 900 | 1,368 | 52.0% | 5,013 | (1,624) | -132.4% | 10,274 | (5,071) | -149.4% | 25,130 | (4,021) | -116.0% |
| 법인세비용차감전순이익 | 2,353 | 704 | -70.1% | 6,299 | (1,264) | -120.1% | 11,837 | (5,715) | -148.3% | 27,636 | (2,989) | -110.8% |
| 당기순이익 | 1,774 | 277 | -84.4% | 4,820 | (1,218) | -125.3% | 9,109 | (4,755) | -152.2% | 21,401 | (3,082) | -114.4% |
| (출처) Dart전자공시시스템 |
이와 같은 배경에서 IPO 당시의 실적 추정치는 해당 시점의 제도와 시장 여건을 기반으로 한 가정이었으나, 이후 약가 협상 결렬이라는 중대한 환경 변화로 인해 실적 괴리가 불가피하게 발생하였습니다. 당사는 향후 제도 변화 가능성을 보다 보수적으로 반영하고, 관계 기관과의 협력을 강화하여 환자 접근성과 재무 건전성의 균형을 유지할 수 있는 전략을 지속적으로 마련해 나갈 계획입니다.
| [증권신고서(지분증권)(2015.06.16)] - 인수인의의견 일부 내용 발췌 |
|
(전략) (나) 미래 추정순이익 기준 주당 평가가액 산출
그러나 상기 주당 평가가액은 대표주관회사의 주관적인 판단요소(유사회사 선정, 가치평가방법의 선정 및 적용방법, 유사회사의 기준주가 선정 등)들이 반영되어 있으며, 경기 변동의 위험, 동사의 영업 및 재무에 관한 위험, 동사가 속한 산업의 위험 등이 반영되지 않은 상대적 평가가액으로서, 향후 동사가 코스닥시장에서 거래될 때의 미래가치를 반영한 적정주가라고는 볼 수 없습니다.
(나) 매출원가
주) 상기 매출원가는 별도 기준입니다.
1) 급여 / 주식기준보상 / 퇴직급여 2) 복리후생비 / 여비교통비 / 세금과공과 / 기타 등 광고선전비 등은 경영 활동의 증가에 따라 비용이 증가하는 특성을 감안하여 2014년 매출액 대비 비용 비율로 향후 매출액에 비례하여 발생하는 것으로 추정하였습니다. 6) 경상연구개발비
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (출처) | Dart전자공시시스템, [발행조건확정]증권신고서(지분증권), 2015.06.16 |
한편, 비임상 CRO 사업부의 매출은 Covid-19 사태 발생 후 약 3년간 백신 치료제 개발 시장이 활성화되며, 국내 제약/바이오 업체의 R&D 활동이 증가하며 지속적 매출 증가 추이를 보일 수 있었습니다. 다만, 2023년부터 Covid-19 사태가 종식되는 추이에 돌입하고 금리 인상에 따른 글로벌 바이오 시장의 투자 침체가 이어졌으며, 주요 고객사들의 연구개발 활동이 축소되고 프로젝트가 지연되는 등 시장 환경이 악화됨에 따라 매출의 감소세를 보이고 있습니다. 비임상CRO사업부의 매출은 2022년 약 447억원, 2023년 약 321억원, 2024년 약 276억원, 2025년 반기 약 114억원으로 감소하는 추세이며, 2022년에는 약 83억원의 영업이익이 발생하였으나, 이후 적자 전환하여 영업손실이 2023년 약 37억원, 2024년 78억원, 2025년 반기 46억원으로 증가하고 있는 추세입니다.
| [비임상CRO사업부 매출 및 영업이익 추이] |
| (단위 : 백만원) |
| 구분 | 2025년 반기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 매출액 | 11,363 | 27,642 | 32,052 | 44,651 |
| 영업이익 | (4,646) | (7,828) | (3,668) | 8,304 |
| 당기순이익 | (5,138) | (6,670) | (4,038) | 7,231 |
| (출처) | 당사 제시 |
비임상 CRO 사업부의 2023년 1월 1일부터 ~ 2025년 6월 30일까지의 고객사별 매출 비중은 아래와 같습니다. 상위 10개 기업 외에 기타 396개 기업을 고객사로 두고 있으며, 매출액 기준 상위 10개 고객사의 총 계약금액은 총 약 118.6억원으로 전체 계약금액 대비 16.8% 입니다. 또한 상위 1개 기업에 대한 전체 계약금액 대비 비율은 2.9%로 채 3%가 안되는 수준으로 특정 거래처에 의존하고 있지 않으나, 향후 외자 CRO의 국내 침투 가속화, 신규 기업 진입에 따른 경쟁 심화 등으로 인해 특정 고객사에 대한 비임상 CRO 사업부의 매출이 편중될 가능성은 존재하기 때문에 주기적으로 모니터링을 할 필요가 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-1.사업위험-바." 부분에 해외 CRO업체의 공격적인 국내진출 또는 신규 기업 진입에 따른 경쟁 심화 위험 관련하여 상세내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
| [비임상CRO사업부 매출비중 내역] |
| (단위 : 원, %) |
| 순위 | 고객사 | 계약금액(원) | 전체 계약금액 대비 비율(%) |
|---|---|---|---|
| 1 | S사 | 2,028,950,000원 | 2.88% |
| 2 | A사 | 1,480,160,000원 | 2.10% |
| 3 | I사 | 1,299,100,000원 | 1.84% |
| 4 | E사 | 1,141,800,000원 | 1.62% |
| 5 | T사 | 1,080,640,000원 | 1.53% |
| 6 | H사 | 1,076,130,000원 | 1.53% |
| 7 | A사 | 1,040,000,000원 | 1.48% |
| 8 | N사 | 955,900,000원 | 1.36% |
| 9 | Y사 | 887,326,000원 | 1.26% |
| 10 | K사 | 865,040,000원 | 1.23% |
| 합계 | 11,855,046,000원 | 16.83% | |
| (출처) | 당사 제시 |
당사는 비임상 CRO 사업부의 실적 회복을 위해 주요고객과의 협력 기반을 강화하고자 노력하고 있습니다. 자사 주관 심포지움을 상/하반기에 개최하여 멘토링 서비스를 강화하고 있고, 우수 협력기업 관리 차원에서 대면 주요 고객들과 대면 미팅 횟수를 늘리고 있으며, 신규 고객 유치를 위하여, 주요 학회에 정기적으로 참여하여 영업 네트워크 확대에 노력하고 있습니다. 또한 유효, 선도, 후보, 비임상, 임상 개발 단계에 따른 전략적 대응을 위해 다양한 프로젝트별 담당자를 배정하고 있고 신규 서비스 제안에 적극적 대응 가능하도록 인력을 투입하고 있습니다.
다만 당사의 노력에도 불구하고 시장 환경이 개선되지 않을 경우 비임상 CRO 사업부의 실적 회복은 더딜 수 있으며, 신약 개발 사업부는 지속적으로 연구개발비용이 투입되고, 개발에 따른 성과는 단기간 내에 나오지 않기 때문에 당사 영업손실 발생은 지속될 수 있습니다. 영업손실이 지속될 경우 당사의 자금조달 환경에도 악영향을 미칠 수 있으며, 이 경우 당사의 계속기업으로서의 존속능력에 악영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [바. 유동성 저하 위험] 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 자금 경색으로 인해 중대한 유동성 위기에 봉착할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [현금흐름 내역] |
| (단위 : 천원) |
| 구 분 | 2025년 반기 | 2024년 반기 | 2024년 | 2023년 | 2022년 | |||
|---|---|---|---|---|---|---|---|---|
| 영업활동으로 인한 현금흐름 | (7,793,050) | (10,083,378) | (21,118,190) | (15,696,516) | (8,272,929) | |||
| 영업으로부터 창출된 현금흐름 | (7,112,027) | (10,155,134) | (20,531,332) | (14,403,715) | (8,571,235) | |||
| 당기순손익 | (9,644,696) | (25,468,878) | (26,252,413) | (17,671,635) | 702,264 | |||
| 조정 | 2,915,962 | 19,826,923 | 12,717,519 | 7,550,561 | 1,680,578 | |||
| 퇴직급여 | 1,152,558 | 1,006,999 | 2,060,522 | 1,658,982 | 1,663,368 | |||
| 투자자산상각비 | - | 6,234 | 11,428 | 10,906 | 10,905 | |||
| 유형자산상각비 | 1,678,337 | 1,904,945 | 3,731,299 | 3,859,296 | 3,580,942 | |||
| 무형자산상각비 | 60,022 | 53,766 | 115,371 | 222,081 | 297,030 | |||
| 사용권자산상각비 | 421,572 | 449,627 | 921,668 | 794,579 | 701,605 | |||
| 이자비용 | 906,365 | 2,134,492 | 6,235,315 | 3,663,329 | 5,407,400 | |||
| 대손상각비(환입) | 526,843 | (478,885) | (190,817) | 1,453,764 | 1,261,958 | |||
| 기타의대손상각비 | 0 | 0 | 0 | 37,053 | 0 | |||
| 법인세비용(수익) | 66,493 | 79,168 | (5,051,072) | (4,496) | 2,704,493 | |||
| 이자비용(리스부채) | 42,147 | 39,880 | 85,996 | 95,666 | 55,892 | |||
| 외화환산손실 | 10,106 | 0 | 0 | 2,269 | 0 | |||
| 유형자산처분손실 | 0 | 954 | 955 | 244,334 | 5,275 | |||
| 유형자산폐기손실 | 1 | 0 | 0 | 0 | 0 | |||
| 무형자산처분손실 | 347,601 | 0 | 0 | 0 | 0 | |||
| 장기종업원급여 | 0 | 107,536 | 0 | 418,961 | 5,310 | |||
| 당기손익-공정가치측정금융자산평가손실 | 4,350 | 1,655 | 1,655 | 300,000 | 10,455 | |||
| 파생상품평가손실 | 277,413 | 21,284,324 | 26,419,827 | 0 | ||||
| 계약손실충당부채전입(환입)액 | 6,161 | (325,718) | (313,541) | 812,393 | 99,314 | |||
| 사채상환손실 | 384,379 | 352,305 | 410,596 | 1,896,362 | 1,617,860 | |||
| 이자수익 | (48,407) | (35,257) | (76,333) | (188,140) | (1,033,776) | |||
| 배당금수익 | (57,762) | (76,786) | (139,008) | (137,672) | 0 | |||
| 외화환산이익 | 0 | (10,065) | (14,680) | (8) | 0 | |||
| 유형자산처분이익 | 0 | (902) | (902) | 0 | 0 | |||
| 투자자산처분이익 | (1,122,472) | 0 | 0 | 0 | 0 | |||
| 당기손익-공정가치측정금융자산평가이익 | 0 | (33,387) | (2,924) | (3,101) | (417) | |||
| 당기손익-공정가치측정금융자산처분이익 | (19,838) | (84,536) | (135,667) | (215,325) | (169,730) | |||
| 사채상환이익 | 0 | (139,060) | (2,098,245) | 0 | 0 | |||
| 파생상품평가이익 | (1,716,963) | (6,410,366) | (19,252,744) | (7,370,672) | (14,574,303) | |||
| 리스해지이익 | (2,137) | 0 | (1,180) | 0 | 0 | |||
| 리스변경이익 | (807) | 0 | 0 | 0 | 0 | |||
| 잡이익 | 0 | 0 | 0 | 0 | 36,997 | |||
| 순운전자본의 변동 | (383,293) | (4,513,180) | (6,996,438) | (4,282,642) | (10,954,077) | |||
| 매출채권의 증감 | 1,765,224 | 130,020 | (892,923) | 200,743 | (2,995,391) | |||
| 계약자산의 증감 | (1,894,479) | (2,518,375) | (2,112,667) | 2,713,002 | (3,651,516) | |||
| 미수금의 증감 | 243,124 | (410,050) | (405,558) | 92,149 | (38,482) | |||
| 선급금의 증감 | (21,004) | (183,046) | 31,103 | 40,967 | (77,658) | |||
| 선급비용의 증감 | 183,101 | 264,249 | 3,539 | 16,424 | (73,282) | |||
| 재고자산의 증감 | 383,290 | 80,154 | 84,506 | 52,330 | (199,117) | |||
| 매입채무의 증감 | (118,583) | (112,639) | (52,996) | 62,446 | (497,374) | |||
| 미지급금의 증감 | 150,645 | 63,434 | 203,199 | (1,206,818) | (488,012) | |||
| 미지급비용의 증감 | (118,048) | (334,511) | (2,159,852) | (205,665) | 634,849 | |||
| 계약부채의 증감 | 716,424 | (1,047,806) | (1,499,802) | (2,800,479) | (2,040,546) | |||
| 정부보조금의 사용 | 0 | 0 | 0 | (919,479) | (540,772) | |||
| 임차보증금의 증감 | 0 | 0 | 0 | 0 | 0 | |||
| 선수수익의 증감 | (39,041) | (50,637) | (50,637) | 0 | 0 | |||
| 예수금의 증감 | (154,155) | (4,268) | 12,534 | (118,856) | 233,696 | |||
| 부가세예수금의 증감 | 0 | 0 | 0 | (544,718) | 113,362 | |||
| 선수금의 증감 | (4,807) | 0 | 88,999 | (5,100) | 42,702 | |||
| 장기종업원급여의 지급 | (103,375) | (94,000) | 457,514 | (28,100) | (8,000) | |||
| 확정급여채무의 증감 | 0 | 0 | (1,231,173) | (152,673) | 25,614 | |||
| 사외적립자산의 증감 | 1,160,633 | 261,245 | 527,776 | (1,478,815) | (1,394,151) | |||
| 퇴직금의 지급 | (2,532,242) | (556,950) | 0 | 0 | 0 | |||
| 이자의 수취 | 59,270 | 82,329 | 157,375 | 301,583 | 1,134,522 | |||
| 이자의 지급 | (769,223) | (58,216) | (771,209) | (322,065) | (263,186) | |||
| 법인세의 환급(납부) | 28,929 | 47,643 | 26,976 | (1,272,319) | (573,030) | |||
| 투자활동으로 인한 현금흐름 | 2,064,787 | (15,652,552) | (24,652,717) | (9,298,003) | 55,461,664 | |||
| 투자활동으로 인한 현금유입액 | 10,324,181 | 17,509,304 | 30,093,675 | 31,811,447 | 189,093,973 | |||
| 단기금융상품의 감소 | 0 | 0 | 0 | 12,000,000 | 144,016,337 | |||
| 당기손익-공정가치측정금융자산의 처분 | 7,428,225 | 17,447,269 | 28,970,602 | 19,756,732 | 41,692,542 | |||
| 기타포괄손익-공정가치측정금융자산의 처분 | 0 | 0 | 1,000,000 | 0 | 3,138,294 | |||
| 장기대여금의 감소 | 0 | 0 | 29,038 | 0 | 0 | |||
| 투자부동산의 처분 | 1,240,000 | 0 | 0 | 0 | 0 | |||
| 유형자산의 처분 | 0 | 9,000 | 9,000 | 1,500 | 0 | |||
| 무형자산의 처분 | 1,418,182 | 0 | 0 | 0 | 0 | |||
| 보증금의 감소 | 237,774 | 53,035 | 85,035 | 53,216 | 246,800 | |||
| 투자활동으로 인한 현금유출액 | (8,259,394) | (33,161,855) | (54,746,392) | (41,109,450) | (133,632,309) | |||
| 단기금융상품의 증가 | 0 | 0 | (1,000,000) | (12,000,000) | (95,266,303) | |||
| 당기손익-공정가치측정금융자산의 취득 | (6,854,434) | (21,548,951) | (30,598,472) | (19,503,261) | (24,955,160) | |||
| 장기금융상품의 증가 | (1,800) | (1,800) | (3,600) | (300) | (3,089,267) | |||
| 장기대여금의 증가 | 0 | 0 | 0 | (108,963) | 0 | |||
| 유형자산의 취득 | (1,343,142) | (11,223,050) | (22,705,511) | (9,173,671) | (9,077,820) | |||
| 무형자산의 취득 | 0 | (331,240) | (332,170) | (97,722) | (836,785) | |||
| 보증금의 증가 | (30,018) | (56,814) | (106,639) | (225,534) | (406,973) | |||
| 임대보증금의 감소 | (30,000) | 0 | 0 | 0 | 0 | |||
| 재무활동으로 인한 현금흐름 | 5,623,269 | 24,774,721 | 44,738,173 | 25,139,165 | (50,993,787) | |||
| 재무활동으로 인한 현금유입액 | 10,470,000 | 29,760,200 | 61,516,500 | 48,208,921 | 3,059,417 | |||
| 정부보조금의 수령 | 0 | 19,800 | 0 | 970,116 | 540,772 | |||
| 교환사채의 발행 | 0 | 21,000,000 | 21,000,000 | 32,311,450 | 0 | |||
| 단기차입금의 차입 | 4,100,000 | 4,530,000 | 14,730,000 | 6,708,000 | 0 | |||
| 장기차입금의 차입 및 상환 | 0 | 4,210,400 | 11,780,000 | 8,219,355 | 1,974,645 | |||
| 자기주식의 감소 | 6,370,000 | 0 | 14,006,500 | 0 | 0 | |||
| 주식매수선택권의 행사 | 0 | 0 | 0 | 0 | 544,000 | |||
| 재무활동으로 인한 현금유출액 | (4,846,731) | (4,965,679) | (16,778,327) | (23,069,756) | (54,053,204) | |||
| 리스부채의 상환 | (370,568) | (435,679) | (1,015,442) | (785,073) | (776,281) | |||
| 전환사채의 상환 | 0 | 0 | 0 | (12,873,110) | (25,658,740) | |||
| 전환사채의 전환 | 0 | 0 | 0 | 0 | (15) | |||
| 교환사채의 상환 | (2,976,163) | 0 | (6,432,884) | (2,700,000) | 0 | |||
| 단기차입금의 상환 | (1,500,000) | (4,530,000) | (9,330,000) | (6,708,000) | 0 | |||
| 자기주식의 취득 | 0 | 0 | 0 | (3,572) | (27,618,168) | |||
| 현금및현금성자산의순증가(감소) | (104,995) | (961,209) | (1,032,733) | 144,646 | (3,805,052) | |||
| 기초현금및현금성자산 | 1,280,250 | 2,250,165 | 2,250,165 | 2,100,850 | 5,905,902 | |||
| 현금및현금성자산의 환율변동효과 | (26,034) | 41,352 | 62,818 | 4,669 | 0 | |||
| 기말현금및현금성자산 | 1,149,221 | 1,330,308 | 1,280,250 | 2,250,165 | 2,100,850 | |||
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
당사는 2022년 7억원의 당기순이익이 발생하였으나, 이 중 감가상각비, 이자비용, 주가 변동에 따른 주식관련사채 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 순운전자본 조정 효과를 반영한 결과 총 83억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품의 증가/감소, 당기손익-공정가치측정금융자산의 취분/처득 등 현금 유출입이 발생했으며, 총 555억원의 양(+)의 투자활동으로 인한 현금흐름이 발생하였습니다. 재무활동 부문에서는 전환사채의 조기상환, 합병 과정에서의 주식매수청구권 행사에 따른 자기주식 취득 등에 따라 510억원의 음(-)의 재무활동으로 인한 현금흐름이 발생하였습니다.
2023년에는 177억원의 당기순손실이 발생하였으며, 이 중 감가상각비, 이자비용, 주가 변동에 따른 주식관련사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 순운전자본 조정 효과를 반영한 결과 총 157억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 유형자산의 취득 227억원 등 현금 유출이 크게 발생함에 따라, 총 247억원의 음(-)의 투자활동으로 인한 현금흐름이 발생하였습니다. 재무활동 부문에서는 교환사채의 발행 및 일부 상환에 따른 146억원의 현금 유입이 발생하였고, 장기차입금 82억원의 순차입이 발생하여 총 251억원의 양(+)의 재무활동으로 인한 현금흐름이 발생하였습니다.
2024년에는 263억원의 당기순손실이 발생하였으며, 이 중 감가상각비, 이자비용, 주가 변동에 따른 주식관련사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 순운전자본 조정 효과를 반영한 결과 총 211억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 유형자산의 취득 등 현금 유출입이 발생했으며, 총 93억원의 음(-)의 투자활동으로 인한 현금흐름이 발생하였습니다. 재무활동 부문에서는 교환사채의 발행 및 일부 상환에 따른 146억원의 현금 유입이 발생하였고, 장/단기차입금 172억원의 순차입 발생, 자기주식의 처분에 따른 140억원의 현금 유입 등이 발생하여 총 447억원의 양(+)의 재무활동으로 인한 현금흐름이 발생하였습니다.
2025년 상반기에는 96억원의 당기순손실이 발생하였으며, 이 중 감가상각비, 이자비용, 주가 변동에 따른 주식관련사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 순운전자본 조정 효과를 반영한 결과 총 101억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 유형자산의 취득 등 현금 유출이 발생했으나, 공정가치측정금융자산의 처분, 투자부동산의 처분, 무형자산의 처분 등 현금 유입이 더 크게 발생했으며, 총 21억원의 양(+)의 투자활동으로 인한 현금흐름이 발생하였습니다. 재무활동 부문에서는 자기주식의 감소 및 단기차입금의 차입에 따른 105억원의 현금 유입이 발생하였고, 단기차입금 의 상환, 교환사채의 상환 등에 따른 48억원의 현금 유출 등이 발생하여 총 56억원의 양(+)의 재무활동으로 인한 현금흐름이 발생하였습니다.
그 결과 2025년 반기말 기준 당사는 11.5억원의 현금및현금성자산을 보유하고 있습니다.
이처럼 당사는 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있습니다. 사업을 영위하는 과정에서, 투자활동현금흐름은 매년 유출입의 변동이 있으며, 영업활동에서 현금흐름창출능력을 보유하지 못하여, 영업 및 투자에 필요한 자금은 주로 주식관련사채 발행, 장단기차입금 발생, 자기주식의 처분 등 재무활동에서 창출하고 있는 상태입니다. 당사의 신약 개발사업 부문에서는 후보물질발굴부터 임상 진행, 품목허가까지 대규모의 자금이 소요되는 사업을 영위하고 있는 반면에, 라이센스 아웃, 임상성공 및 상품화 성공 등이 이루어지지 않을 경우 영업활동에서 현금흐름을 창출해내기는 어려운 구조를 가지고 있으며, 비임상 CRO 사업 부문에서도 영업활동 현금흐름을 창출해내지 못할 경우, 재무 활동을 통한 외부 자금 조달 의존도가 매우 높은 상황입니다.
당사의 재무안정성과 관련된 주요 지표는 다음과 같습니다.
| [주요 재무안정성 지표 추이] |
| (단위 : 천원, %) |
| 구 분 | 2025년 반기 | 2024년 반기 | 2024년 | 2023년 | 2022년 | 비 고 | ||
|---|---|---|---|---|---|---|---|---|
| 1. 자산총계 | 114,159,761 | 96,062,267 | 117,457,187 | 78,591,324 | 77,054,042 | - | ||
| 유동자산 | 13,894,935 | 16,985,834 | 15,783,513 | 10,721,294 | 15,206,490 | - | ||
| 비유동자산 | 100,264,825 | 79,076,433 | 101,673,674 | 67,870,030 | 61,847,551 | - | ||
| 2. 부채총계 | 68,785,264 | 76,670,707 | 68,863,831 | 58,990,694 | 38,419,865 | - | ||
| 유동부채 | 45,550,902 | 54,945,149 | 41,931,973 | 41,591,587 | 27,871,596 | - | ||
| 비유동부채 | 23,234,363 | 21,725,558 | 26,931,858 | 17,399,107 | 10,548,269 | - | ||
| 3. 자본총계 | 45,374,496 | 19,391,560 | 48,593,356 | 19,600,630 | 38,634,176 | - | ||
| 지배기업지분 | 45,374,496 | 19,391,560 | 48,593,356 | 19,600,630 | 38,634,176 | - | ||
| 자본금 | 16,435,188 | 16,435,188 | 16,435,188 | 16,435,188 | 16,435,188 | - | ||
| 주식발행초과금 | 212,364,193 | 212,364,193 | 212,364,193 | 212,364,193 | 212,364,193 | |||
| 자기주식처분이익 | 29,330,130 | 17,976,685 | 29,886,948 | 0 | 0 | - | ||
| 기타자본 | (121,415,555) | (134,481,539) | (128,403,555) | (141,980,135) | (141,976,562) | - | ||
| 기타포괄손익누계액 | 11,796,610 | (538,054) | 11,753,619 | (622,209) | (968,165) | - | ||
| 이익잉여금 | (103,136,070) | (92,364,914) | (93,443,038) | (66,596,408) | (47,220,478) | - | ||
| 비지배지분 | 0 | 0 | 0 | 0 | 0 | - | ||
| 4. 부채비율(%) | 151.6% | 395.4% | 141.7% | 301.0% | 99.4% | 부채총계 ÷ 자본총계 | ||
| 5. 유동비율(%) | 30.5% | 30.9% | 37.6% | 25.8% | 54.6% | 유동자산 ÷ 유동부채 | ||
| 6. 자본잠식률(%) | N/A | N/A | N/A | N/A | N/A | (자본금-지배기업지분) ÷ 자본금 | ||
| 7. 총차입금 | 53,640,264 | 60,922,394 | 53,875,952 | 44,234,023 | 21,135,166 | 유동성 차입금 + 비유동성 차입금 | ||
| 유동성 차입금 | 38,095,152 | 46,293,620 | 34,932,123 | 33,809,428 | 14,628,376 | - | ||
| 단기차입금 | 11,000,000 | 3,000,000 | 8,400,000 | 3,000,000 | 3,000,000 | - | ||
| 유동성장기차입금 | 11,095,540 | 4,260,000 | 7,762,100 | 4,260,000 | 0 | - | ||
| 전환사채 | 0 | 0 | 0 | 0 | 8,491,333 | - | ||
| 유동파생상품부채 | 5,010,847 | 23,138,652 | 7,049,784 | 11,463,472 | 2,699,198 | 전환권 및 조기상환권 | ||
| 유동리스부채 | 324,333 | 496,377 | 450,189 | 690,231 | 437,845 | |||
| 교환사채 | 10,664,433 | 15,398,591 | 11,270,050 | 14,395,725 | 0 | |||
| 비유동성 차입금 | 15,545,111 | 14,628,774 | 18,943,829 | 10,424,595 | 6,506,790 | - | ||
| 장기차입금 | 15,138,460 | 14,404,400 | 18,471,900 | 10,194,000 | 6,234,645 | - | ||
| 비유동리스부채 | 406,651 | 224,374 | 471,929 | 230,595 | 272,145 | - | ||
| - 총차입금 의존도(%) | 47.0% | 63.4% | 45.9% | 56.3% | 27.4% | 총차입금 ÷ 자산총계 | ||
| - 유동성 차입금 비중(%) | 71.0% | 76.0% | 64.8% | 76.4% | 69.2% | 유동성 차입금 ÷ 총차입금 | ||
| 8. 영업활동 현금흐름 | (7,793,050) | (10,083,378) | (21,118,190) | (15,696,516) | (8,272,929) | - | ||
| - 영업활동현금흐름 총부채 비율(%) | N/A | N/A | N/A | N/A | N/A | (연환산)영업활동현금흐름 ÷ 부채총계 | ||
| 9. 투자활동 현금흐름 | 2,064,787 | (15,652,552) | (24,652,717) | (9,298,003) | 55,461,664 | - | ||
| 10. 재무활동 현금흐름 | 5,623,269 | 24,774,721 | 44,738,173 | 25,139,165 | (50,993,787) | - | ||
| 11. 현금 및 현금성자산 | 1,149,221 | 1,330,308 | 1,280,250 | 2,250,165 | 2,100,850 | - | ||
| 12. 순차입금 | 52,491,042 | 59,592,085 | 52,595,702 | 41,983,858 | 19,034,317 | 총차입금 - 현금 및 현금성자산 | ||
| - 순차입금 의존도(%) | 46.0% | 62.0% | 44.8% | 53.4% | 24.7% | 순차입금 ÷ 자산총계 | ||
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
2025년 반기말 현재 당사 유동비율은 30.5%, 부채비율은 151.6%이며, 현금 및 현금성자산은 11.5억원을 보유하고 있으며 총차입금 잔액은 536.4억원, 현금 및 현금성자산을 차감한 순차입금 잔액은 524.9억원으로, 자산총계 대비 순차입금 의존도는 46%입니다. 총차입금 536.4억원은 유동성차입금 380.9억원 및 비유동성차입금 155.5억원으로 구성되어 있습니다.
당사 차입금의 상세 내역은 다음과 같습니다.
| [단기차입금 내역] |
| (단위 : 천원) |
| 구 분 | 차입처 | 연이자율 | 2025년 반기말 |
|---|---|---|---|
| 일반대출 | 신한은행 | 3.47% | 3,000,000 |
| 일반대출 | 신한은행 | 4.56% | 4,000,000 |
| 일반대출 | 신한은행 | 5.94% | 4,000,000 |
| 합 계 | 11,000,000 | ||
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
| [단기차입금 내역] |
| (단위 : 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 2025년 반기말 |
|---|---|---|---|---|
| 일반대출 | 신한은행 | 2025-10-30 | 3.92% | 1,400,000 |
| 일반대출 | 신한은행 | 2026-01-27 | 4.16% | 2,860,000 |
| 일반대출 | 신한은행 | 2025-08-03 | 4.36% | 1,974,000 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.57% | 250,000 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.68% | 250,000 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.23% | 333,370 |
| 시설대출 | 산업은행 | 2025-12-26 | 2.90% | 296,250 |
| 시설대출 | 산업은행 | 2026-01-26 | 2.74% | 138,750 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.19% | 135,780 |
| 시설대출 | 산업은행 | 2025-12-26 | 2.97% | 215,160 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.19% | 47,540 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.57% | 250,000 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.68% | 250,000 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.23% | 333,330 |
| 시설대출 | 산업은행 | 2026-03-26 | 2.90% | 296,250 |
| 시설대출 | 산업은행 | 2026-04-24 | 2.74% | 138,750 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.19% | 135,770 |
| 시설대출 | 산업은행 | 2026-03-26 | 2.97% | 215,160 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.19% | 47,460 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.57% | 250,000 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.68% | 250,000 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.23% | 333,330 |
| 시설대출 | 산업은행 | 2026-06-26 | 2.90% | 296,250 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.19% | 135,770 |
| 시설대출 | 산업은행 | 2026-06-26 | 2.97% | 215,160 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.19% | 47,460 |
| 합 계 | 11,095,540 | |||
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
| [장기차입금 내역] |
| (단위 : 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 2025년 반기말 |
|---|---|---|---|---|
| 일반대출 | 신한은행 | 2025-08-03 | 4.36% | 1,974,000 |
| 일반대출 | 신한은행 | 2025-10-30 | 3.92% | 1,400,000 |
| 일반대출 | 신한은행 | 2026-01-27 | 4.16% | 2,860,000 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.57% | 3,000,000 |
| 시설대출 | 산업은행 | 2028-09-26 | 2.90% | 3,555,000 |
| 시설대출 | 산업은행 | 2028-10-24 | 2.74% | 1,665,000 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.19% | 1,629,250 |
| 시설대출 | 산업은행 | 2028-09-26 | 2.97% | 2,581,150 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.68% | 3,000,000 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.19% | 569,600 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.23% | 4,000,000 |
| 소 계 | 26,234,000 | |||
| 유동성대체액 | (11,095,540) | |||
| 합 계 : 비유동성잔액 | 15,138,460 | |||
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
| [주식관련사채 내역] |
| (단위 : 천원) |
| 구 분 | 2025년 반기말 |
|---|---|
| 교환사채 | 17,439,700 |
| 교환권조정 | (7,485,333) |
| 상환할증금 | 710,066 |
| 합 계 | 10,664,433 |
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
| 구 분 | 발행일 | 만기일 | 2025년 반기말 |
|---|---|---|---|
| 제2회 이권부 무보증 사모 교환사채 | 2023-01-19 | 2027-01-19 | 1,078,730 |
| 제3회 이권부 무보증 사모 교환사채 | 2023-01-26 | 2027-01-26 | 2,039,579 |
| 제4회 이권부 무보증 사모 교환사채 | 2024-03-26 | 2028-03-24 | 7,546,124 |
| 합 계 | 10,664,433 |
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
| [리스부채 내역] |
| (단위 : 천원) |
| 구 분 | 2025년 반기말 |
|---|---|
| 유동리스부채 | 324,333 |
| 비유동리스부채 | 406,651 |
| 합계 | 730,984 |
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
2025년 반기 중 리스의 총 현금유출액 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구분 | 당반기 |
|---|---|
| 리스부채에 대한 이자비용 | 42,147 |
| 리스부채에서 발생한 현금유출 | 370,568 |
| 단기리스료 및 소액자산리스료 | 121,374 |
| 합 계 | 534,089 |
| (출처) | 각 사업연도 (연결)감사보고서 및 정기보고서 |
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 당사의 차입금 상환 부담 규모가 증가하고, 재무안정성은 저하된 상태입니다. 이에 당사는 유동성 관리가 필수적인 상황으로서, 향후 1년간 자금수지 계획을 다음과 같이 수립하고, 유동성 관리에 노력하고 있습니다.
| [당사 향후 1년간 자금수지계획] |
| (단위 : 백만원) |
| 구분 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | ||
|---|---|---|---|---|---|---|
| 영업 현금흐름 |
(a)수입 | CRO 매출채권 회수 | 7,073 | 7,073 | 9,000 | 9,000 |
| 의약품 매출채권 회수 | 73 | 0 | 0 | 0 | ||
| 계 | 7,146 | 7,073 | 9,000 | 9,000 | ||
| (b)지출 | 인건비 지급 | 3,564 | 3,564 | 3,564 | 3,564 | |
| 운영경비 지급 | 5,220 | 5,220 | 5,220 | 5,220 | ||
| 퇴직금 지급 | 0 | 0 | 0 | 0 | ||
| 계 | 8,784 | 8,784 | 8,784 | 8,784 | ||
| 영업수지(=(a)-(b)) | (1,638) | (1,711) | 216 | 216 | ||
| 투자 현금흐름 |
(c)수입 | 비영업자산의 매각 | 0 | 0 | 0 | 0 |
| 계 | 0 | 0 | 0 | 0 | ||
| (d)지출 | Paraxel 잔금 | 0 | 0 | 370 | 0 | |
| 오송ATMP 기계설비 잔금 | 180 | 200 | 0 | 0 | ||
| 계 | 180 | 200 | 370 | 0 | ||
| 투자수지(=(c)-(d)) | (180) | (200) | (370) | 0 | ||
| 재무 현금흐름 |
(e)수입 | 은행 대출 | 7,000 | 0 | 0 | 0 |
| 자기주식 매각 | 2,300 | 0 | 0 | 0 | ||
| 보증금 | 100 | 0 | 0 | 0 | ||
| 유상증자 | 0 | 36,807 | 0 | 0 | ||
| 계 | 9,400 | 36,807 | 0 | 0 | ||
| (f)지출 | 2차 교환사채 상환 | 1,500 | 0 | 0 | 0 | |
| 3차 교환사채 상환 | 0 | 0 | 3,000 | 0 | ||
| 4차 교환사채 상환 | 0 | 0 | 13,000 | 0 | ||
| 은행 대출금 상환 | 0 | 1,700 | 1,700 | 1,700 | ||
| 계 | 1,500 | 1,700 | 17,700 | 1,700 | ||
| 재무수지(=(e)-(f)) | 7,900 | 35,107 | (17,700) | (1,700) | ||
| 기초 자금 | 1,149 | 7,231 | 40,427 | 22,573 | ||
| 기말 자금 | 7,231 | 40,427 | 22,573 | 21,089 | ||
| (출처) | 당사 제시 |
| (주1) | 재무현금흐름 (e)수입 중 유상증자는 발행제비용을 제외한 예정발행가액 기준입니다. |
| (주2) | 상기 자금수지 계획은 당사가 현재 계획 중인 현금흐름을 예상하여 반영한 것이므로, 실제 현금흐름 발생과는 차이가 생길 수 밖에 없습니다. |
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 자금 경색으로 인해 중대한 유동성 위기에 봉착할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [사. 잦은 자금조달 위험] 당사는 증권시장에서의 잦은 자금 조달이 발생하고 있습니다. 주식관련채권의 발행, 자기주식의 처분, 본 유상증자를 통해 자금을 조달해오고 있는 바, 이는 영업활동에서 양(+)의 현금흐름을 창출하지 못하고 있기 때문입니다. 향후에도 당사의 실적 개선이 이루어지지 못할 경우 추가적인 자금 조달이 발생할 수 있습니다. 또한 자기주식의 처분이 발생할 경우 처분 시점의 주가가 자기주식 취득가액보다 낮을 경우 자기주식처분손실이 발생할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 2020년 06월 제1회차 전환사채 발행을 시작으로 하여, 2022년 12월 합병 종료 후 그 과정에서 발생한 주식매수청구권에 따라 보유하게 된 자기주식의 일부를 기초자산으로 하여 제2회차, 제3회차, 제4회차 교환사채를 발행하여 증권시장에서 잦은 자금 조달이 발생하고 있습니다.
합병 과정에서 취득하게 된 당사 자기주식 내역은 다음과 같습니다.
| [합병 당시 주식매수청구권 행사에 따른 자기주식 취득 내용] |
|
Ⅲ. 주식매수청구권 행사
(1) 주식매수 예정가격의 산정방법
(2) 산출내역
(1) 주식매수 예정가격의 산정방법
2. 주식매수 청구내역 가. 존속회사 코아스템(주)의 보통주 매수 청구내역
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (출처) | 증권발행실적보고서(합병등) - 2022.12.02 |
| (주1) | 합병기일을 기준으로 피합병회사가 보유하고 있는 각각의 자기주식(소멸회사 주주들의 주식매수청구권 행사 또는 단주 처리로 인해 소멸회사가 자기주식으로 취득하거나 또는 취득예정인 소멸회사의 주식을 포함함)에 대해서도 존속회사의 합병신주를 배정합니다. |
| (주2) | 코아스템(주)가 합병 전 보유하고 있던 (주)켐온 주식 33,844,507주에 대한 합병신주, 코아스템(주)가 주주 중 일부의 주식매수청구권 행사로 인하여 취득한 자기주식 1,076,642주(가격조정신청 주식수 250주 포함)에 배정될 합병신주 및 (주)켐온이 주주 중 일부의 주식매수청구권 행사로 인하여 취득한 자기주식 5,245,078주(가격조정신청 주식수 1,777주 포함)에 배정될 합병신주까지 총 11,460,416주의 자기주식을 합병 종료 후 취득하게 되었습니다. |
당사는 2022년 4분기 합병 종료 후 자기주식 11,460,416주를 취득하게 되었습니다. 합병 과정에서 주식매수청구권에 의해 취득한 자기주식은「자본시장과 금융투자업에 관한 법률」제165조의5 제4항과 동법 시행령 제176조의7 제4항의 규정에 따라 당해 주식을 매수한 날로부터 5년 이내에 처분해야 하는 점도 있고, 당사의 운영자금 및 시설자금 등을 조달하기 위해 당사가 취득하게 된 자기주식을 기초로 교환사채를 세번에 걸쳐 발행하게 되었습니다. 또한 잔여 자기주식에 대해서도 장내외 매도를 통해 일부 처분해오고 있습니다.
당사가 발행한 주식관련채권의 내역은 다음과 같습니다.
| [주식관련채권 발행 내역] |
| (단위 : 원, 주, %) |
| 구 분 | 1회차 | 2회차 | 3회차 | 4회차 | |
|---|---|---|---|---|---|
| 종류 | 전환사채 | 교환사채 | 교환사채 | 교환사채 | |
| 발행일 | 2020-06-26 | 2023-01-19 | 2023-01-26 | 2024-03-24 | |
| 만기일 | 2024-06-26 | 2027-01-19 | 2027-01-26 | 2028-03-24 | |
| 발행금액 | 발행시점 | 41,000,000,000 | 21,500,000,000 | 10,811,450,000 | 21,000,000,000 |
| 자금사용목적 | 운영자금 | 25,000,000,000 | 10,688,550,000 | 10,811,450,000 | 10,000,000,000 |
| 시설자금 | 16,000,000,000 | 0 | 0 | 11,000,000,000 | |
| 채무상환자금 | 0 | 10,811,450,000 | 0 | 0 | |
| 표면이자율 | 0.00% | 0.00% | 0.00% | 0.00% | |
| 만기이자율 | 0.00% | 1.00% | 1.00% | 1.00% | |
| 전환(교환)가액 | 발행시점 | 18,672 | 8,870 | 8,870 | 11,200 |
| Refixing 한도 | 85% | - | - | - | |
| 전환(교환) 가능수량 | 발행시점 | 2,195,801 | 2,423,900 | 1,218,878 | 1,875,000 |
| 전환(교환)청구기간 | 시작일 | 2021-06-26 | 2023-02-19 | 2023-02-19 | 2024-04-26 |
| 종료일 | 2024-05-26 | 2026-12-19 | 2026-12-26 | 2028-02-24 | |
| Put Option | 시작일 | 2021-12-26 | 2024-07-19 | 2024-07-26 | 2026-03-26 |
| 주기 | 3개월 | 3개월 | 3개월 | 3개월 | |
| 조기상환수익률 | 0.00% | 1.00% | 1.00% | 1.00% | |
| Call Option | 시작일 | 2021-06-26 | - | - | - |
| 주기 | 1개월 | - | - | - | |
| 행사한도 | 40% | - | - | - | |
| 조기상환수익률 | 2.00% | - | - | - | |
| 발행대상자 | 기관투자자 등 | 기관투자자 등 | 임직원 등 | 기관투자자 등 | |
| 미상환잔액 | 현재시점 | 0 | 0 | 2,939,700,000 | 13,000,000,000 |
| 전환(교환)가액 | 현재시점 | - | - | 8,870 | 11,200 |
| 전환(교환) 가능수량 | 현재시점 | 0 | 0 | 331,420 | 1,160,714 |
| (출처) | DART(전자공시시스템) |
| (주1) | 현재시점 : 본 공시서류 제출일 전일 기준입니다. |
현재 제1회차 전환사채 및 제2회차 교환사채의 미상환잔액은 존재하지 않으며, 제3회차 교환사채 및 제4회차 교환사채가 총 159억원(권면금액) 잔존하고 있습니다. 각각의 교환가액은 8,870원, 11,200원으로 현재 당사의 주가가 교환가액을 크게 하회하고 있기 때문에 단기간 내 교환 가능성은 매우 낮은 상황이며, 조기상환 가능성이 높은 상황입니다. 따라서 본 유상증자 대금 중 약 160억원을 교환사채의 상환용도로 사용할 예정입니다.
한편, 증권시장에서 자금을 조달할 경우 자금조달 목적과 실제 사용목적이 상이할 경우 계약상 위반사항이 발생하거나 또는 금융감독당국의 제재를 받을 수 있기 때문에 자금조달 목적대로 자금이 사용되었는지 여부는 투자 판단에 중요한 사항입니다.
당사가 발행한 주식관련채권의 실제 자금사용내역은 다음과 같습니다.
| [주식관련채권 자금사용 내역] |
| (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 총 납입금액 | 주요사항보고서의 | 실제 자금사용 | 차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|---|
| 자금사용 계획 | 내역 | |||||||
| 사용용도 | 조달금액 | 내용 | 금액 | |||||
| 전환사채 | 1 | 2020-06-26 | 41,000 | 시설자금 | 16,000 | 시설자금 및 운영자금 | 81 | 계획에 따른 사용 및 조기상환 |
| 운영자금 | 25,000 | 운영자금 | 40,919 | 계획에 따른 사용 및 조기상환 | ||||
| 교환사채 | 2 | 2023-01-19 | 21,500 | 채무상환자금 | 10,811 | 1회차 전환사채 조기상환 | 10,811 | 채권자와 합의에 따른 조기상환 |
| 운영자금 | 10,689 | 운영자금 | 10,689 | - | ||||
| 교환사채 | 3 | 2023-01-26 | 10,811 | 운영자금 | 10,811 | 운영자금 | 8,111 | - |
| 2회차 교환사채 조기상환 | 2,700 | 기한이익 상실에 따른 조기상환 | ||||||
| 교환사채 | 4 | 2024-03-26 | 21,000 | 운영자금 | 10,000 | 운영자금 | 12,400 | 한도대출 원리금 상환 |
| 임상연구개발비 및 운영자금 사용 | ||||||||
| 생산설비구매 | 11,000 | 생산설비 구매 | 8,600 | - | ||||
| (출처) | 당사 정기보고서 |
당사는 시설자금, 운영자금, 채무상환자금 등 목적으로 주식관련채권 발행 후, 기존 계획대로 자금을 집행해왔으나, 발행 시점에 예상치 못한 조기상환 대응 및 시설자금 투입 규모 및 시기 등이 변동된 바는 있습니다.
2023년 이후 발행한 제1회차, 제2회차 및 제3회차 교환사채 자금의 사용내역 및 세부 사용내역은 다음과 같습니다.
| [교환사채 자금 사용내역] |
| (단위 : 천원) |
| 항목 | 연구개발비 | 시설 투자 | 운영 경비 | 사채 조기 상환 | 합계 |
| 제2회 교환사채 | 0 | 0 | 10,688,550 | 10,811,450 | 21,500,000 |
| 제3회 교환사채 | 0 | 0 | 8,111,450 | 2,700,000 | 10,811,450 |
| 제4회 교환사채 | 4,657,949 | 8,600,000 | 7,742,051 | 0 | 21,000,000 |
| 합계 | 4,657,949 | 8,600,000 | 26,542,051 | 13,511,450 | 53,311,450 |
| (출처) | 당사 제시 |
| [교환사채 자금 세부 사용내역] |
| (단위 : 천원) |
| 항목 | 임상연구개발비 | 운영자금 | 생산설비구매 | 사채 조기 상환 | 합계 | ||||||||
| 인건비 | 임상비용 | 위탁연구 | 기타 | 인건비 | 시설유지비 | 기타 | GMP사용기기 | 지원설비 | 컴퓨터시스템 및 컨설팅 | 기타 | |||
| 제2회 교환사채 | 0 | 0 | 0 | 0 | 6,639,375 | 2,443,695 | 1,605,480 | 0 | 0 | 0 | 0 | 10,811,450 | 21,500,000 |
| 제3회 교환사채 | 0 | 0 | 0 | 0 | 4,743,813 | 1,833,157 | 1,534,480 | 0 | 0 | 0 | 0 | 2,700,000 | 10,811,450 |
| 제4회 교환사채 | 789,873 | 2,940,787 | 862,780 | 64,509 | 5,611,888 | 1,128,312 | 1,001,851 | 4,093,255 | 1,897,500 | 2,112,045 | 497,200 | 0 | 21,000,000 |
| 합계 | 789,873 | 2,940,787 | 862,780 | 64,509 | 16,995,076 | 5,405,164 | 4,141,811 | 4,093,255 | 1,897,500 | 2,112,045 | 497,200 | 13,511,450 | 53,311,450 |
| (출처) | 당사 제시 |
먼저 제2회차 교환사채 215억원의 경우, 해당금액의 절반 수준인 약 108억원은 조기상환대금으로 사용하였으며, 나머지 약 107억원은 인건비 약 66억원, 가스비 및 전기료 등을 포함한 시설유지비 약 24억원, 기타비용 약 16억원 등으로 사용하였습니다. 제3회차 교환사채 약 108억원의 경우, 조기상환대금 27억원, 인건비 약 47억원, 시설유지비 약 18억원 및 기타비용 약 15억원 등으로 사용하였습니다. 제4회차 교환사채 210억원의 경우, 뉴로나타-알 임상 3상을 위한 임상연구개발비로 약 47억원을 사용하였으며, 이는 인건비 약 8억원, 임상비용 약 29억원, 위탁연구비용 약 9억원 등을 포함합니다. 또한 지난 제2회차 및 제3회차 교환사채처럼 인건비, 시설유지비, 기타 등의 운영자금 항목으로 총 약 77억원을 사용하였으며, 오송ATMP 센터 생산설비 구매비용으로 86억원을 사용하였습니다. 해당비용은 GMP사용기기(생산 및 시험기기, 미생물신속검출기 장비, 유세포분석기장비 등을 포함) 구매 비용 약 41억원, 지원설비(발전기, 보일러, 무정전전원장치, 고압증기멸균기, 청정증기제조기 등을 포함) 구매 비용 약 19억원, 컴퓨터시스템 및 컨설팅 비용(자동제어, 환경모니터링시스템, 의약품품질시스템 컨설팅, Validation 컨설팅 등을 포함) 약 21억원 및 기타비용(건축물 설계비용, 공사감리비용, 비품비용 등을 포함) 약 5억원의 세부 내역들을 포함한 비용입니다.
한편 상기 주식관련채권 발행 이외에도, 당사는 자기주식 잔여 보유수량 일부를 처분하여 유동성을 확보해오고 있습니다. 상기 교환사채를 제외한 당사의 자기주식 처분 현황은 다음과 같습니다.
| [자기주식 장내외 처분 내역] |
| (단위 : 원, 주) |
| 일자 | 처분수량 | 처분단가 | 처분금액 |
|---|---|---|---|
| 2024-07-16 | 300,000 | 11,970 | 3,591,000,000 |
| 2024-08-30 | 300,000 | 10,815 | 3,244,500,000 |
| 2024-10-14 | 200,000 | 12,930 | 2,586,000,000 |
| 2024-11-20 | 200,000 | 12,020 | 2,404,000,000 |
| 2024-11-27 | 200,000 | 10,905 | 2,181,000,000 |
| 2025-03-27 | 500,000 | 3,426 | 1,713,000,000 |
| 2025-04-17 | 500,000 | 3,158 | 1,579,000,000 |
| 2025-05-08 | 500,000 | 3,233 | 1,616,500,000 |
| 2025-06-02 | 500,000 | 2,923 | 1,461,500,000 |
| 2025-07-22 | 800,000 | 2,957 | 2,365,600,000 |
| (출처) | DART(전자공시시스템) |
| (주1) | 교환사채 발행에 따른 자기주식 처분은 제외되어 있습니다. |
2025년 올해 당사는 자사주를 3월부터 7월까지 총 5회에 걸쳐 280만주 가량 처분하였으며, 총 처분금액은 약 87억원입니다. 2025년 4월부터 7월까지 당사는 해당 자사주 처분대금으로 인건비 약 5억원, 재료비 등 기타 연구개발비 약 9.6억원, 임상비용 약 4억원, 오송ATMP센터 운용비 및 장비/설비 비용 총 약 13.5억원, 비임상 CRO 설비 및 장비 총 약 2.8억원, 제2회차 교환사채 조기상환대금 15억원, 제3회차 교환사채 조기상환대금 약 29.8억원 및 기타 일반운영경비 약 7.4억원으로 총 87.4억원을 사용하였으며, 상세 사용내역은 다음과 같습니다.
| [2025년 자기주식 처분대금 상세 사용내역] |
| (단위 : 원) |
| 분류 | 25년 4월 | 25년 5월 | 25년 6월 | 25년 7월 | 합계 |
| 경상연구개발비(인건비) | 129,711,770 | 130,850,631 | 125,164,451 | 121,961,578 | 507,688,430 |
| 경상연구개발비(재료비 외) | 223,125,726 | 179,699,564 | 481,708,139 | 77,919,877 | 962,453,306 |
| 임상 비용 | 0 | 338,931,822 | 73,565,353 | 0 | 412,497,175 |
| 오송ATMP센터 운영비 | 173,923,010 | 180,404,569 | 148,701,751 | 171,050,209 | 674,079,539 |
| 오송ATMP센터 장비/설비 | 420,718,879 | 55,650,000 | 203,160,000 | 0 | 679,528,879 |
| 비임상CRO 설비 | 9,000,000 | 0 | 0 | 0 | 9,000,000 |
| 비임상CRO 장비 | 43,390,000 | 45,850,000 | 149,640,000 | 34,750,000 | 273,630,000 |
| 제2회 및 제3회차 교환사채 조기상환 | 2,976,132,660 | 0 | 0 | 1,500,000,000 | 4,476,132,660 |
| 일반 운영경비 | 196,940,791 | 189,522,891 | 168,950,800 | 185,175,529 | 740,590,011 |
| 합계 | 4,172,942,836 | 1,120,909,477 | 1,350,890,494 | 2,090,857,193 | 8,735,600,000 |
| (출처) | 당사 제시 |
현재 당사는 자기주식 4,775,050주를 보유하고 있으며, 이 중 3,282,902주는 직접 보유하고 있고, 1,492,148주는 교환사채 발행에 따른 것으로 예탁결제원에 예탁되어 있습니다. 현재 교환사채 미상환잔액이 존재하지만 주가와 교환가액의 괴리율이 상당하고, 본 유상증자 대금 중 일부를 교환사채 상환대금으로 사용할 예정이므로, 예탁되어 있는 자기주식은 채권의 상환 직후 당사에 환입될 가능성이 높습니다.
향후 당사에 추가적인 유동성이 필요할 경우, 당사가 보유하고 있는 자기주식 4,775,050주의 장내외 처분 또는 교환사채의 추가 발행에 따른 처분 등이 발생할 수 있으며, 이는 시장에 물량으로 출회되어 당사 주가에 악영향을 미칠 수 있습니다.
이처럼 당사는 증권시장에서의 잦은 자금 조달이 발생하고 있습니다. 주식관련채권의 발행, 자기주식의 처분, 본 유상증자를 통해 자금을 조달해오고 있는 바, 이는 영업활동에서 양(+)의 현금흐름을 창출하지 못하고 있기 때문입니다. 향후에도 당사의 실적 개선이 이루어지지 못할 경우 추가적인 자금 조달이 발생할 수 있습니다. 또한 자기주식의 처분이 발생할 경우 처분 시점의 주가가 자기주식 취득가액보다 낮을 경우 자기주식처분손실이 발생할 수도 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [아. 매출채권 회수 관련 위험] 당사 매출채권 규모는 2020년 95억원을 제외하면 약 120억원 대의 규모를 유지하고 있으나, 당사의 매출은 지속적으로 감소하고 있기 때문에 매출채권 미회수에 대한 위험성이 증대되고 있습니다. 당사의 매출액 대비 매출채권 비중은 2022년 27.57%에서 지속적으로 증가하여 2025년 반기말 54.14%까지 상승하였습니다. 반면 매출채권회전율은 2022년 4.72회에서 2023년 3.04회, 2024년 2.61회, 2025년 반기말 1.85회로 지속적으로 감소하고 있으며, 2023년 업종평균인 4.95회를 크게 하회하고 있습니다. 향후 거래상대방의 재무상태 악화, 채무불이행 등 예상치 못한 사유로 인하여 당사의 매출채권 및 계약자산의 회수가 지연될 경우, 대손상각비를 인식함에 따라 당사 영업손익에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [매출채권 및 계약자산 현황] |
| (단위 : 천원, %) |
| 구 분 | 2025년 반기말 | 2024년말 | 2023년말 | 2022년말 | 2021년말 | ||
|---|---|---|---|---|---|---|---|
| 매출채권 및 계약자산 | 9,310,609 | 9,708,198 | 6,550,131 | 10,937,547 | 6,248,614 | ||
| 채권총액 | 12,571,008 | 12,483,116 | 9,515,865 | 12,648,590 | 6,808,615 | ||
| 대손충당금 | (3,260,399) | (2,774,918) | (2,965,734) | (1,711,043) | (560,001) | ||
| 매출채권 | 2,506,112 | 4,564,875 | 3,333,724 | 5,025,096 | 3,393,258 | ||
| 채권총액 | 5,339,045 | 7,145,631 | 6,291,048 | 6,710,771 | 3,739,907 | ||
| 대손충당금 | (2,832,933) | (2,580,756) | (2,957,324) | (1,685,675) | (346,649) | ||
| 계약자산 | 6,804,497 | 5,143,322 | 3,216,407 | 5,912,451 | 2,855,356 | ||
| 채권총액 | 7,231,963 | 5,337,485 | 3,224,817 | 5,937,819 | 3,068,708 | ||
| 대손충당금 | (427,466) | (194,162) | (8,410) | (25,368) | (213,352) | ||
| 매출액 | 11,610,426 | 28,762,460 | 33,657,156 | 45,877,628 | 30,240,039 | ||
| 회전율 | 185.4% | 261.5% | 303.7% | 471.6% | |||
| 대손상각비(환입) | 526,843 | (190,817) | 1,453,764 | 1,261,958 | |||
| (주1) | 회전율은 매출채권 및 계약자산의 채권총액 기준으로 산출하였습니다.(매출액 ÷ 연평균 채권총액) 2025년 반기 회전율은 연환산 매출액 기준으로 산출하였습니다.(상반기 매출액 × 2) |
| (출처) | 각 사업연도 (연결)감사보고서, (연결)반기검토보고서 |
당사는 2025년 반기말 기준 매출채권 25억원, 계약자산 68억원을 인식하고 있습니다. 계약자산은 당사가 진행중인 용역에 대해 당기 현재 미청구한 금액에 대한 자산입니다. 계약자산은 당사가 청구서를 발행할 때 매출채권으로 대체됩니다.
| [매출채권 및 계약자산 관련 회계처리기준] | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
금융자산(채무상품)의 기대신용손실당기손익-공정가치측정금융자산을 제외한 상각후원가측정금융자산 및 기타포괄손익-공정가치측정채무상품은 매 보고기간 말에 기대신용손실을 평가하고 있습니다. 손실충당금의 측정방식은 신용위험의 유의적인 증가 여부에 따라 결정됩니다. 금융자산의 최초 인식 후 신용위험의 유의적인 증가 여부에 따라 아래 표와 같이 3단계로구분하여 12개월 기대신용손실이나 전체기간 기대신용손실에 해당하는 금액으로 손실충당금을 인식합니다.
(주1) 보고기간 말 신용위험이 낮은 경우에는 신용위험이 유의적으로 증가하지 않은 것으로 간주할 수 있습니다.최초 인식 시점에 신용이 손상된 금융자산에 대하여 최초 인식 후 전체기간 기대신용손실의 누적변동분만을 손실충당금으로 계상합니다.한편, 매출채권, 계약자산, 리스채권 등에 대해서는 전체기간 기대신용손실에 해당하는 금액으로 손실충당금을 측정하는 간편법을 적용하고 있습니다. 기대신용손실은 일정 범위의 발생 가능한 결과를 확률가중한 값으로, 화폐의 시간가치를 반영하고, 보고기간 말에 과거사건, 현재 상황과 미래 경제적 상황에 대한 예측에 대한 과도한 원가나 노력 없이 이용할 수 있는 정보를 반영해 측정합니다 연결회사는 기대신용손실 모형이 적용되는 다음의 금융자산을 보유하고 있습니다. · 재화 및 용역의 제공에 따른 매출채권 · 용역 제공에 따른 계약자산 · 당기손익-공정가치로 측정하는 채무상품 · 상각후원가로 측정하는 기타 금융자산 현금성자산도 손상 규정의 적용대상에 포함되나 식별된 기대신용손실은 유의적이지 않습니다. (가) 매출채권과 계약자산 연결회사는 매출채권과 계약자산에 대해 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용합니다. 기대신용손실을 측정하기 위해 매출채권과 계약자산은 신용위험 특성과 연체일을 기준으로 구분하였습니다. 미청구용역에 연결따른 계약자산은 동일 유형의 계약에서 발생한 매출채권과 유사한 위험속성을 가지므로 연결회사는 매출채권의 손실율이 계약자산의 손실율에 대한 합리적인 추정치로 판단하였습니다. 기대신용손실율은 보고기간말 기준으로부터 각 36개월 동안의 매출과 관련된 지불 정보와 관련 확인된 신용손실 정보를 근거로 산출하였습니다. 과거 손실 정보는 고객의 채무 이행능력에 영향을 미칠 거시경제적 현재 및 미래전망정보를 반영하여 조정합니다. 연결회사는 매출이 발생하는 국가의 GDP 및 실업률이 가장 목적적합한 요소로 판단하고 과거 손실 정보를 이러한 요소의 예상 변동에 근거하여 조정합니다.
|
|||||||||||
| (출처) | 2024년 (연결)감사보고서 |
매출채권과 계약자산의 경우 회수 불가능 금액을 추정하여 대손충당금을 인식하고 있으며, 이는 대손상각비로 인식되어 영업손익에 영향을 미치고 있습니다. 2022년에는 대손상각비 12.6억원, 2023년에는 14.5억원을 인식하였으며, 2024년에는 대손충당금환입 1.9억원이 발생하였습니다.
당사 매출채권 규모는 2020년 95억원을 제외하면 약 120억원 대의 규모를 유지하고 있으나, 당사의 매출은 지속적으로 감소하고 있기 때문에 매출채권 미회수에 대한 위험성이 증대되고 있습니다. 당사의 매출액 대비 매출채권 비중은 2022년 27.57%에서 지속적으로 증가하여 2025년 반기말 54.14%까지 상승하였습니다. 반면 매출채권회전율은 2022년 4.72회에서 2023년 3.04회, 2024년 2.61회, 2025년 반기말 1.85회로 지속적으로 감소하고 있으며, 2023년 업종평균인 4.95회를 크게 하회하고 있습니다. 당사의 최근 3개년 및 2025년 반기말 매출채권 관련 지표는 다음과 같습니다.
| [매출채권 관련 지표(연결기준)] |
| (단위: 천원) |
| 구분 | 2025년 반기말 | 2024년말 | 2023년말 | 2022년말 | 업종 평균(주1) |
|---|---|---|---|---|---|
| 매출액 | 11,610,426 | 28,762,460 | 33,657,156 | 45,877,628 | - |
| 매출채권 | 12,571,008 | 12,483,116 | 9,515,865 | 12,648,590 | - |
| 매출액 대비 매출채권 비중 |
54.14% | 43.40% | 28.27% | 27.57% | - |
| 매출채권 회전율 | 1.85회 | 2.61회 | 3.04회 | 4.72회 | 4.95회 |
| 매출채권 회수기일 | 196.91일 | 139.59일 | 120.18일 | 77.4일 | 73.74일 |
| (출처) 당사 정기보고서 | |
| (주1) | 업종 평균은 한국은행에서 2024년 10월 발간한 "2023 기업경영분석"의 (C.21) 의료용 물질 및 의약품 (중소기업) 업종 기준입니다. |
| (주2) | 매출채권 회전율: 매출액/평균 매출채권 |
| (주3) | 2025년 반기 회전율은 연환산 매출액 기준으로 산출하였습니다.(상반기 매출액 × 2) |
만일 향후 거래상대방의 재무상태 악화, 채무불이행 등 예상치 못한 사유로 인하여 당사의 매출채권 및 계약자산의 회수가 지연될 경우, 대손상각비를 인식함에 따라 당사 영업손익에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [자. 유무형자산 관련 위험] 당사 재무제표상 건설중인자산을 인식하고 있으며, 건설중인자산의 경우, 감가상각 처리가 없으나, 향후 소기의 목적대로 운영이 개시될 때 각 유형자산으로 대체된 후 감가상각 대상이 되므로, 향후 자산화 처리된 투입 비용이 매년 비용으로 분할 인식될 예정으로 매년 고정적 비용 부담이 생기게 됩니다. 현재 오송공장은 준공 완료된 상태이나, 아직 인증 완료 및 치료제 생산 준비가 되지 않은 시점으로 2025년 반기말 기준으로는 건설중인 자산으로 인식하고 있습니다. 한편, 이러한 대규모 시설 투자 완료 후에도 당사의 실적이 개선되지 못할 경우에는 현금창출단위의 손상평가시, 유형자산의 손상차손을 인식하게 될 수도 있으며, 투입 비용 이상의 수익 창출 효과를 발생시키지 못할 수 있습니다. 당사 비임상 CRO 사업분야의 수익성이 저하되고 있고, 2025년 반기 기준 CRO 사업분야의 영업손실은 46억원입니다. 수익성이 개선되지 못할 경우, 매년말 영업권 손상평가 시점에서 평가된 회수가능액이 장부금액에 미달할 수 있으며, 이 경우 현재 인식하고 있는 영업권 장부금액 39억원의 일부 또는 전부가 손상처리될 수 있습니다. 이는 당사의 세전손실 규모를 확대시킬 수 있으며, 자기자본 대비 세전손실 50% 초과 요건 관련하여, 당사 주식의 관리종목 편입 위험 증가를 유발할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [유형자산 현황] |
| (단위 : 천원, %) |
| 구 분 | 2025년 반기말 | 2024년말 | 2023년말 | 2022년말 | ||
|---|---|---|---|---|---|---|
| 유형자산 | 89,956,168 | 89,038,858 | 54,750,079 | 49,373,698 | ||
| 토지 | 24,774,222 | 24,774,222 | 11,339,089 | 11,307,496 | ||
| 취득원가 | 24,774,222 | 24,774,222 | 11,339,089 | 11,307,496 | ||
| 상각누계액 | 0 | 0 | 0 | 0 | ||
| 건물 | 21,641,076 | 21,967,809 | 22,621,275 | 23,337,755 | ||
| 취득원가 | 26,506,693 | 26,506,693 | 26,506,693 | 26,707,764 | ||
| 상각누계액 | (4,865,617) | (4,538,884) | (3,885,418) | (3,370,009) | ||
| 구축물 | 545,384 | 567,918 | 613,240 | 658,563 | ||
| 취득원가 | 872,043 | 872,043 | 872,043 | 872,043 | ||
| 상각누계액 | (326,659) | (304,125) | (258,802) | (213,480) | ||
| 기계장치 | 38,932 | 47,794 | 33,105 | 51,323 | ||
| 취득원가 | 499,276 | 499,276 | 460,780 | 495,280 | ||
| 상각누계액 | (460,344) | (451,482) | (427,675) | (443,957) | ||
| 차량운반구 | 4,658 | 6,054 | 8,847 | 14,243 | ||
| 취득원가 | 53,494 | 53,494 | 53,494 | 53,494 | ||
| 상각누계액 | (48,836) | (47,440) | (44,646) | (39,251) | ||
| 공구와기구 | 24,878 | 31,517 | 22,066 | 29,672 | ||
| 취득원가 | 355,646 | 355,646 | 333,166 | 346,543 | ||
| 상각누계액 | (330,768) | (324,129) | (311,100) | (316,871) | ||
| 비품 | 474,514 | 579,857 | 695,870 | 738,641 | ||
| 취득원가 | 1,884,556 | 1,873,965 | 1,757,776 | 1,690,367 | ||
| 상각누계액 | (1,410,042) | (1,294,108) | (1,061,906) | (951,726) | ||
| 시설장치 | 1,722,366 | 1,888,439 | 2,141,144 | 2,240,256 | ||
| 취득원가 | 5,592,696 | 5,563,696 | 5,401,696 | 5,063,573 | ||
| 상각누계액 | (3,870,330) | (3,675,257) | (3,260,552) | (2,823,317) | ||
| 연구및시험기기 | 7,211,169 | 7,723,796 | 8,952,505 | 10,422,250 | ||
| 취득원가 | 23,822,679 | 23,335,309 | 22,248,833 | 21,491,958 | ||
| 상각누계액 | (16,611,510) | (15,611,513) | (13,296,328) | (11,069,708) | ||
| 건설중인자산 | 33,518,969 | 31,451,453 | 8,322,938 | 573,500 | ||
| 취득원가 | 33,518,969 | 31,451,453 | 8,322,938 | 573,500 | ||
| 자산총계 | 114,159,761 | 117,457,187 | 78,591,324 | 77,054,042 | ||
| 유형자산/자산총계 | 78.80% | 75.80% | 69.70% | 64.10% | ||
| 유형자산상각비 | 1,678,337 | 3,731,299 | 3,859,296 | 3,580,942 | ||
| 유형자산처분이익 | 0 | (902) | 0 | 0 | ||
| 유형자산처분손실 | 0 | 955 | 244,334 | 5,275 | ||
| 유형자산폐기손실 | 1 | 0 | 0 | 0 | ||
| (출처) | 각 사업연도 (연결)감사보고서, (연결)반기검토보고서 |
당사는 2025년 반기말 기준 유형자산 899.6억원을 인식하고 있으며, 이는 자산총계 대비 78.8%의 비중을 차지하고 있습니다. 유형자산과 관련되어, 매년 감가상각비가 고정적 성격으로 발생하고 있으며, 처분손익이 발생하고 있습니다. 또한 현금흐름창출단위의 손상평가시 회수가능액이 장부금액보다 낮게 평가될 경우 손상차손을 인식할 수 있습니다.
| [유형자산 회계처리 기준] | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
유형자산은 원가에서 감가상각누계액과 손상차손누계액을 차감하여 표시됩니다. 역사적 원가는 자산의 취득에 직접적으로 관련된 지출을 포함합니다.
유형자산의 감가상각방법과 잔존가치 및 경제적 내용연수는 매 회계연도 말에 재검토되고 필요한 경우 추정의 변경으로 회계처리 됩니다. |
| (출처) | 각 사업연도 (연결)감사보고서, (연결)반기검토보고서 |
당사는 2024년에 유형자산 중 토지를 재평가하는 회계정책을 최초로 적용하면서 유형자산의 장부금액은 재평가일의 공정가치로 인식하였습니다. 2024년말 기준 당사가 보유하고 있는 토지의 공정가치는 당사와 관계없는 독립적 평가법인인 리얼티뱅크감정평가법인이 수행한 평가에 근거하여 결정되었습니다. 토지의 공정가치는 측정대상 토지의 표준지공시지가와 인근지역 내 유사한 토지의 최근 거래가격을 반영하는 시장접근법에 기초하여 결정하였으며, 당기 중 가치평가기법의 변경은 없습니다. 2024년말 기준 재평가에 따른 토지의 장부금액과 원가모형으로 평가되었을 경우 장부금액은 다음과 같습니다.
| [재평가모형 및 원가모형에 따른 장부금액] |
| (단위 : 천원) |
| 구 분 | 재평가모형 | 원가모형 |
|---|---|---|
| 토지 | 23,661,804 | 10,226,671 |
| (출처) | 2024년 (연결)감사보고서 |
상기 토지 재평가로 인해 2024년에 인식한 재평가이익은 13,435,133천원(법인세효과 차감 전)입니다. 당사는 토지 재평가이익을 기타포괄손익으로 인식함에 따라 2024년말 자본총계가 증가한 효과가 발생했으며, 만일 재평가이익을 인식하지 않았다면 2024년말 기준 당사 자본총계 대비 법인세비용차감전순손실 비중은 50%를 초과하는 수준입니다. 2024년에 토지 재평가가 이루어지지 않았다면 당사는 코스닥시장 관리종목에 지정됐을 가능성이 매우 높습니다. 투자자 여러분들께서는 당사 자본규모 대비 법인세비용차감전순손실 발생 비중이 크게 발생하고 있는 점을 유의하여 주시기 바랍니다.
한편, 당사는 2023년 3월 아래와 같이 오송 생명과학단지에 안정적인 치료제 생산을 위한 자가 공장 확보 목적으로 아래와 같이 공장 신축 투자를 결정하였습니다.
| [신규 시설투자 등(2023.03.06) - 거래소 공시] |
|
신규 시설투자 등
|
|||||||||||||||||||||||||||||||||||||||
| (출처) | 거래소 공시사항(https://kind.krx.co.kr) |
이와 관련해, 당사 재무제표상 건설중인자산을 인식하고 있으며, 건설중인자산의 경우, 감가상각 처리가 없으나, 향후 소기의 목적대로 운영이 개시될 때 각 유형자산으로 대체된 후 감가상각 대상이 되므로, 향후 자산화 처리된 투입 비용이 매년 비용으로 분할 인식될 예정으로 매년 고정적 비용 부담이 생기게 됩니다. 현재 오송공장은 준공 완료된 상태이나, 아직 인증 완료 및 치료제 생산 준비가 되지 않은 시점으로 2025년 반기말 기준으로는 건설중인 자산으로 인식하고 있습니다.
한편, 이러한 대규모 시설 투자 완료 후에도 당사의 실적이 개선되지 못할 경우에는 현금창출단위의 손상평가시, 유형자산의 손상차손을 인식하게 될 수도 있으며, 투입 비용 이상의 수익 창출 효과를 발생시키지 못할 수 있습니다.
| [무형자산 현황] |
| (단위 : 천원, %) |
| 구 분 | 2025년 반기말 | 2024년말 | 2023년말 | 2022년말 | ||
|---|---|---|---|---|---|---|
| 무형자산 | 4,381,523 | 6,207,328 | 5,990,529 | 6,114,888 | ||
| 특허권 | 297,861 | 318,376 | 24,192 | 38,716 | ||
| 취득원가 | 863,146 | 863,147 | 533,147 | 532,088 | ||
| 상각누계액 | (565,285) | (544,771) | (508,955) | (493,372) | ||
| 상표권 | 0 | 0 | 96 | 3,702 | ||
| 취득원가 | 0 | 15,312 | 15,312 | 15,312 | ||
| 상각누계액 | 0 | (15,312) | (15,217) | (11,611) | ||
| 산업재산권 | 0 | 0 | 0 | 1,059 | ||
| 취득원가 | 0 | 0 | 0 | 1,059 | ||
| 상각누계액 | 0 | 0 | 0 | 0 | ||
| 회원권 | 0 | 1,765,783 | 1,765,783 | 1,765,783 | ||
| 취득원가 | 0 | 1,765,783 | 1,765,783 | 1,765,783 | ||
| 상각누계액 | 0 | 0 | 0 | 0 | ||
| 소프트웨어 | 133,906 | 173,413 | 250,702 | 234,605 | ||
| 취득원가 | 1,005,199 | 1,005,199 | 1,003,029 | 905,307 | ||
| 상각누계액 | (871,293) | (831,786) | (752,327) | (670,702) | ||
| 고객가치 | 0 | 0 | 0 | 121,267 | ||
| 취득원가 | 0 | 121,267 | 121,267 | 121,267 | ||
| 상각누계액 | 0 | (121,267) | (121,267) | 0 | ||
| 영업권 | 3,949,756 | 3,949,756 | 3,949,756 | 3,949,756 | ||
| 취득원가 | 3,949,756 | 3,949,756 | 3,949,756 | 3,949,756 | ||
| 상각누계액 | 0 | 0 | 0 | 0 | ||
| 자산총계 | 114,159,761 | 117,457,187 | 78,591,324 | 77,054,042 | ||
| 무형자산/자산총계 | 3.84% | 5.28% | 7.62% | 7.94% | ||
| 무형자산상각비 | 60,022 | 115,371 | 222,081 | 297,030 | ||
| 무형자산처분이익 | 0 | 0 | 0 | 0 | ||
| 무형자산처분손실 | 347,601 | 0 | 0 | 0 | ||
| (출처) | 각 사업연도 (연결)감사보고서, (연결)반기검토보고서 |
당사는 2025년 반기말 기준 무형자산 44억원을 인식하고 있으며, 이는 자산총계 대비 3.8%의 비중을 차지하고 있습니다. 무형자산과 관련되어, 매년 감가상각비가 고정적 성격으로 발생하고 있으며, 처분이 일어날 경우 처분손익을 인식할 수 있습니다. 또한 현금흐름창출단위의 손상평가시 회수가능액이 장부금액보다 낮게 평가될 경우 손상차손을 인식할 수 있습니다.
당사는 2013년 (주)켐온 지분 취득 이후 인식한 영업권 39억원(장부가액)이 존재하고 있으며, 이후 매년 영업권에 대한 손상 평가를 수행하여 현금창출단위의 회수가능액과 순자산 장부금액을 비교하여 손상 인식 여부를 판단하고 있습니다.
최근 2024년말 손상검사 평가는 삼덕회계법인에서 수행하였으며, 해당 검사 결과의 주요 내용은 다음과 같습니다.
| [비임상 CRO 사업부 - CGU(영업권포함) 손상검사 결과] |
| 구 분 | 내 용 | 비 고 |
|---|---|---|
| 사용가치(A) | 70,714 | |
| 순공정가치(B) | N/A | (주1) |
| 회수가능액(C=max(A,B)) | 70,714 | |
| 비교대상 장부가액(D) | 61,428 | (주2) |
| 장부가액을 초과하는 회수가능액(E=C-D) | 9,286 | |
| 영업권 손상검사 결과 | 손상 없음 |
| (주1) | 평가대상 개별 CGU 수준의 순공정가치는 산출하기가 어려우나, 다만 평가기준일 현재 평가대상회사 전체(비임상실험대행 CGU 및 세포치료제 CGU 합계수준) 순공정가치는 2024년 12월 28일 종가 기준 시가총액 127,537백만원입니다.(Source: KRX 한국거래소) |
| (주2) | 손상검사 대상 영업권(3,950백만원)이 포함된 비임상실험대행 CGU의 영업용 순자산 장부금액입니다. |
| (출처) | 손상검사 보고서(삼덕회계법인) |
2024년말 손상검사 당시, DCF 법을 통해 현금창출단위의 사용가치를 추정하였으며, 추정 결과 회수가능액이 비교대상 장부가액을 초과하는 것으로 평가됨에 따라 아직 별도의 손상금액을 인식하지 않은 상태입니다.(주1)
| (주1) | 현금창출단위(영업권 포함) 사용가치 산정 시 현금흐름할인법(DCF)에 따른 공정가치 평가방법을 적용하였으며, 이는 기업의 영업활동으로부터 발생하는 잉여현금흐름을 기업이 필요한 자금을 동원하는데 소요되는 기회비용인 가중평균자본비용(WACC)으로 할인하여 기업의 영업가치를 구하는 방식입니다. |
다만, 현금창출단위의 사용가치를 추정하는 데 있어, 당사로부터 제공받은 자료를 토대로 시장 상황 등을 고려한 수많은 가정이 포함되므로 이는 객관적이지 못할 한계성을 가지고 있습니다. 사용가치 추정 당시 가정한 주요 내용은 다음과 같습니다.
| [사용가치 평가시 주요 가정] |
| 항 목 | 주요 가정 | |
|---|---|---|
| 평가대상 CGU | 비임상실험대행 현금창출단위(영업권 포함) | |
| 평가기준일 | 2024년 12월 31일 | |
| 추정기간 | 2025년 1월 1일~2029년 12월 31일(5년간) | |
| 현금흐름에 대한 가정 | 현금흐름은 기중에 발생하는 것으로 가정함 | |
| 법인세율 | 2024년말 대한민국의 세율 적용(2억원까지는 9.9%, 2억~200억원은 20.9%) | |
| 할인율 | 평가기준일 현재, 가중평균자본비용(WACC)는 13.625% | |
| 영구성장률 | 평가대상 CGU가 영위하는 산업의 성장률은 매년 10% 이상으로 예측되나 불확실성을 고려하여 추정기간 이후의 영구성장률은 0.0%로 가정함 | |
| 민감도 분석 | 할인율과 영구성장률 각각 1.00%p를 가감한 값으로 증감분석을 수행함 | |
| 경제지표 | 현금흐름 추정시 적용한 물가상승률 및 임금상승률은 EIU 제시값을 사용함 | |
| 순공정가치 | 평가대상 CGU 단독 순공정가치는 산정하기 어려우므로 고려하지 아니함 | |
| 매출액 | 실험용역매출 | 회사제시 평가대상 CGU 사업계획상 매출액을 기초로 과거 사업계획 실적 달성률을 적용하여 추정함. 2024년에는 실적률 88.9%를 적용하고 이후 매년간 1%p씩 달성률이 상승하는 것으로 가정함 |
| 기타매출 | 과거 4개년간(2021년~2024년) 기타매출 실적의 평균치가 이후 일정하게 발생하는 것으로 가정함. | |
| 매출원가 | 원부재료비 | 원재료비 : 평가대상 CGU의 최근 과거 4개년(2021년~2024년) 매출액 대비 원재료비 비율의 평균값으로 추정 부재료비 : 평가대상 CGU의 최근 과거 4개년(2021년~2024년) 매출액 대비 부재료비 비율의 평균값으로 추정 |
| 노무비 | 급여 - 인원 : 평가대상 CGU의 사업계획상 향후 5개년간(2025년~2029년) 인력운영계획 반영함 - 2024년 인당 평균 급여(잡급 포함) 실적을 기초로 2025년 이후 인당 평균급여가 추정기간 동안 EIU 제공 명목임금상승률에 따라 상승함을 가정하여 사업계획상 연도별 인원계획 인원수를 고려하여 추정 퇴직급여 - 평가대상 CGU의 최근 과거 4개년간(2021년~2024년) 급여 대비 퇴직급여 비율이 추정기간 동안 유지됨을 가정 |
|
| 제조경비 | - 인건비성 경비 : 평가대상 CGU의 최근 과거 4개년(2021년~2024년) 급여 대비 인건비성 비율의 평균값으로 추정 - 매출액 변동비 : 평가대상 CGU의 최근 과거 4개년(2021년~2024년) 매출액 대비 변동비성 비율의 평균값으로 추정 - 고정비성 경비 : 2024년 고정비 발생 실적이 추정기간 동안 EIU 제공 소비자물가상승률에 따라 상승함을 가정 - 감가상각비 1) 평가기준일 현재 재무상태표상 유무형자산(사용권자산 포함)이 대상회사의 내용연수 및 상각방법을 고려하여 추정기간 동안 유무형자산 상각비 추정하여 반영함 2) 평가대상 기간동안 발생할 것으로 예상되는 CAPEX 자산에 대한 감가상각비도 추정하여 연도별로 반영함 3) 사용권자산의 경우 평가대상 CGU의 최근 과거 5개년간(2020년~2024년) 사용권자산 감가상각비 발생 실적이 2025년 이후 동일한 금액으로 발생할 것으로 가정함 |
|
| 타계정대체 | 용역원가 중 경상연구개발비 등 매출원가 외 타계정으로 대체되는 항목으로 최근 과거 4개년(2021년~2024년) 타계정대체 금액 대비 용역원가 합계 비율의 평균값으로 추정함 | |
| 판매비와관리비 | 인건비 | 급여 - 인원 : 평가대상 CGU의 사업계획상 향후 5개년간(2025년~2029년) 인력운영계획 반영함 - 2024년 연간 누적 인원별 평균 급여(잡급 포함)가 2025년 이후 EIU 예측 임금인상률에 따라 상승할 것으로 가정함 퇴직급여 - 평가대상 CGU의 최근 과거 4개년간(2021년~2024년) 급여 대비 퇴직급여 비율이 추정기간 동안 유지됨을 가정 |
| 인건비성 경비 | 평가대상 CGU의 최근 과거 4개년간(2021년~2024년) 급여 대비 인건비성 비율의 평균값으로 추정 | |
| 매출액 변동비 | 평가대상 CGU의 최근 과거 4개년간(2021년~2024년) 매출액 대비 변동비성 비율의 평균값으로 추정 | |
| 경상연구개발비 | 평가대상 CGU의 향후 추정기간 동안 예측된 타계정대체 금액이 경상연구개발비로 대체됨을 가정 국고보조금의 경우 평가대상 CGU의 최근 과거 6개년(2019년~2024년) 실제 발생한 국고보조금 금액의 평균값으로 가정 |
|
| 기타 고정비성 경비 | 2024년 고정비 발생 실적이 추정기간 동안 EIU 제공 소비자물가상승률에 따라 상승함을 가정 다만, 2023년 비경상적으로 거액이 발생한 대손상각비 및 손실충당부채 전입액은 2023년말 현재 최대 설정액으로 판단하여 이후 추정치에 포함하지 아니함 |
|
| 유무형 상각비 | 평가기준일 현재 재무상태표상 유무형자산이 대상회사의 내용연수 및 상각방법을 고려하여 추정기간동안 유무형자산 상각비 추정하여 반영함 평가대상 기간 동안 발생할 것으로 예상되는 CAPEX 자산에 대한 감가상각비도 추정하여 연도별로 반영함 사용권자산의 경우 평가대상 CGU의 최근 과거 5개년간(2020년~2024년) 사용권자산 감가상각비 발생 실적이 2025년 이후 동일한 금액으로 발생할 것으로 가정함 |
|
| 법인세 | 법인세비용 | 추정 영업이익에 2024년말 개정 법인세 세율(2억원까지는 9.9%, 2억원 초과 20.9%, 200억원 초과 23.1%) 적용하여 산출 |
| 자본적지출 | 자본적지출 | 평가기간 동안은 평가대상회사 제시 자본적지출로 추정하였으며, 평가대상기간 이후에는 감가상각비만큼 재투자됨을 가정 |
| 순운전자본 | 순운전자본 | 매출채권(계약자산 포함) : 매출액에 연동되며, 2024년 회전기일이 추정기간 동안 유지됨을 가정 재고자산 : 재료비와 연동되며, 2024년 회전기일이 추정기간 동안 유지됨을 가정 기타영업자산 : 선급금, 선급비용, 미수금 등으로 운전자산과 연동되는 추세를 나타냄. 최근 과거 4개년(2021년~2024년) 기타 영업자산 대비 운전자산 비율의 평균값으로 추정 매입채무 : 재료비와 연동되며, 2024년 회전기일이 추정기간 동안 유지됨을 가정 계약부채 : 매출액에 연동되며, 2024년 회전기일이 추정기간 동안 유지됨을 가정 미지급비용 : 제조경비와 연동되며, 2024년 회전기일이 추정기간 동안 유지됨을 가정 기타영업부채 : 예수금, 부가세예수금, 선수수익 등으로 운전부채와 연동되는 추세를 나타냄. 최근 과거 4개년(2021년~2024년) 기타영업부채 대비 운전부채 비율의 평균값으로 추정 |
| (출처) | 손상검사 보고서(삼덕회계법인) |
상기 손상검사 평가 결과와 관련하여 수행시 사용된 자료 및 적용된 가정에는 한계점이 존재합니다. 회계법인의 의견과 결론은 당사 주요 임직원과의 인터뷰와 당사에서 제공한 정보를 토대로 합니다. 회계법인은 본 업무 관련하여 당사가 제시한 자료에 대하여 어떠한 검증절차나 감사절차를 수행하지 아니하였습니다. 또한 회계법인은 평가기준일 현재 당사 시장 및 경제와 관련된 향후 전망에 대해 당사 및 당사가 제시한 가정에 근거하여 가치 검토를 수행하였으며, 이러한 가정들은 현재로서는 합리적이라고 판단되나, 그 특성상 완전히 실현되거나 예측된대로 정확히 구현되지 않을 수 있습니다. 따라서 손상검사 평가시 사용된 재무 추정치의 실현 가능성에 관한 어떠한 확신도 제공되지 않으며, 실제치와 추정치의 차이는 매우 중대할 수 있습니다.
| [비임상CRO사업부 매출 및 영업이익 추이] |
| (단위 : 백만원) |
| 구분 | 2025년 반기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 매출액 | 11,363 | 27,642 | 32,052 | 44,651 |
| 영업이익 | (4,646) | (7,828) | (3,668) | 8,304 |
| (출처) | 당사 제시 |
현재 당사 비임상 CRO 사업분야의 수익성이 저하되고 있고, 2025년 반기 기준 CRO 사업분야의 영업손실은 46억원입니다. 수익성이 개선되지 못할 경우, 매년말 영업권 손상평가 시점에서 평가된 회수가능액이 장부금액에 미달할 수 있으며, 이 경우 현재 인식하고 있는 영업권 장부금액 39억원의 일부 또는 전부가 손상처리될 수 있습니다. 이는 당사의 세전손실 규모를 확대시킬 수 있으며, 자기자본 대비 세전손실 50% 초과 요건 관련하여, 당사 주식의 관리종목 편입 위험 증가를 유발할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [차. 최대주주 청약 및 지분 희석 관련 위험] 증권신고서 제출일 현재 기준 최대주주는 1,000,000주에 대한 주식담보대출이 존재하며 이에 대한 반대매매가 발생한다면 최대주주의 지분율은 약 3% 가량 하락하여 7.55%로 감소하며, 특수관계인을 포함한 지분율은 8.98%로 감소하게 됩니다.또한 신주배정기준일(2025년 09월 18일 예정) 전에 반대매매가 발생할 경우, 동일하게 최대주주의 청약 참여 30% 및 특수관계인 미확정으로 미참여 가정을 한다면 증자 후 최대주주의 지분율은 5.7%, 특수관계인을 포함하면 6.58%로 하락하게 됩니다. 이처럼 근질권 설정된 1,000,000주에 대한 반대매매가 출회된다면 주가 하락은 물론이고 최대주주 등의 지분율도 크게 하락하여 당사의 경영권이 불안정한 상태가 되어 향후 경영권 분쟁 발생의 여지가 있는 등 당사에 부정적인 영향을 미칠 수 있습니다. 최대주주의 주식담보대출에 대한 반대매매가 발생하지 않으며, 당사 최대주주 본인이 배정분의 30%에 대해 청약에 참여하고 특수관계인들은 청약에 참여하지 않는 경우를 가정한다면 최대주주 등의 보통주 지분율은 본 유상증자 후 9.03% 수준까지 희석될 수 있으며, 이는 경영권을 안정적으로 유지하기에는 부족한 수준의 지분율입니다. 또한 최대주주 등이 예상치 못한 사유 등으로 인해 청약에 필요한 자금을 마련하지 못할 경우, 청약 계획에 변동이 생겨, 지분이 추가 희석될 수 있는 위험성을 배제할 수 없습니다. 또한 당사는 지속적으로 자본시장에서의 자금 조달에 의존하고 있는 만큼 향후 추가적인 유상증자, 주식관련사채 등 발행에 따라 최대주주 및 특수관계인 등의 지분율이 추가로 희석될 가능성 또한 존재하며, 또는 최대주주 및 특수관계인 등의 지분율 추가 희석을 우려하여, 자본시장에서 지분 희석이 수반될 수 있는 형태의 자금 조달을 진행하는 데에는 한계가 있을 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [주주 현황] | |
| (증권신고서 제출전일 기준) | (단위 : 주, %) |
| 성 명 | 관 계 | 보통주식수 | 지분율 |
|---|---|---|---|
| 김경숙 | 최대주주 | 3,483,320 | 10.60% |
| 양길안 | 임원 | 5,116 | 0.02% |
| 홍순복 | 최대주주의 특수관계인 | 6,000 | 0.02% |
| 홍정식 | 최대주주의 특수관계인 | 30,700 | 0.09% |
| 김병철 | 최대주주의 특수관계인 | 34,200 | 0.10% |
| 권광순 | 임원 | 47,200 | 0.14% |
| 이태용 | 임원 | 20,000 | 0.06% |
| 김종일 | 임원 | 3,500 | 0.01% |
| 송시환 | 임원 | 291,981 | 0.89% |
| 홍정욱 | 최대주주의 특수관계인 | 10,000 | 0.03% |
| 홍정인 | 최대주주의 특수관계인 | 10,000 | 0.03% |
| 김혜연 | 최대주주의 특수관계인 | 4,978 | 0.02% |
| 김우곤 | 최대주주의 특수관계인 | 4,000 | 0.01% |
| 계 | 3,950,995 | 12.02% | |
| 자기주식수 | 4,775,050 | 14.53% | |
| 발행주식총수 | 32,870,376 | 100.00% | |
| (주1) | 자기주식수 4,775,050주는 직접보유분 3,282,902주 및 교환사채예탁분 1,492,148주를 합한 주식수입니다. |
| (주2) | 상기 도표는 기발행 보통주식수 기준이며, 최대주주 및 특수관계인 등의 교환사채권 및 주식매수선택권 개별 보유분은 포함되어 있지 않습니다. |
당사의 최대주주 김경숙은 현재 보통주 3,483,320주(지분율 10.60%)를 보유하고 있으며, 특수관계인 등 합산시 보통주 3,950,995주(지분율 12.02%)를 보유하고 있습니다.
한편, 당사가 발행한 교환사채권 미상환잔액 및 주식매수선택권을 고려한 최대주주 등의 주식 등 보유 현황 및 지분율은 다음과 같습니다.
| [최대주주 등의 주식등 보유 현황] | |
| (증권신고서 제출전일 기준) | (단위 : 주, %) |
| 성 명 | 관계 | 보유주식등의 내역 | ||||
|---|---|---|---|---|---|---|
| 보통주 | 교환사채권 | 주식매수선택권 | 합 계 | |||
| 주식등의 수 | 주식 등 지분율 | |||||
| 김경숙 | 최대주주 | 3,483,320 | - | - | 3,483,320 | 10.06% |
| 양길안 | 임원 | 5,116 | - | 150,000 | 155,116 | 0.45% |
| 홍순복 | 최대주주의 특수관계인 | 6,000 | - | - | 6,000 | 0.02% |
| 홍정식 | 최대주주의 특수관계인 | 30,700 | - | - | 30,700 | 0.09% |
| 김병철 | 최대주주의 특수관계인 | 34,200 | - | - | 34,200 | 0.10% |
| 권광순 | 임원 | 47,200 | 226,606 | 30,000 | 303,806 | 0.88% |
| 이태용 | 임원 | 20,000 | 96,392 | 30,000 | 146,392 | 0.42% |
| 김종일 | 임원 | 3,500 | - | 6,500 | 10,000 | 0.03% |
| 송시환 | 임원 | 291,981 | - | - | 291,981 | 0.84% |
| 홍정욱 | 최대주주의 특수관계인 | 10,000 | - | - | 10,000 | 0.03% |
| 홍정인 | 최대주주의 특수관계인 | 10,000 | - | - | 10,000 | 0.03% |
| 김혜연 | 최대주주의 특수관계인 | 4,978 | - | - | 4,978 | 0.01% |
| 김우곤 | 최대주주의 특수관계인 | 4,000 | - | - | 4,000 | 0.01% |
| 최대주주 등 계 | 3,950,995 | 322,998 | 216,500 | 4,490,493 | 12.97% | |
| 자기주식수 | 4,775,050 | 0 | 0 | 4,775,050 | 13.79% | |
| 주식등의 총수 | 32,870,376 | 1,492,148 | 255,670 | 34,618,194 | 100.00% | |
| (주1) | 자기주식수 4,775,050주는 직접보유분 3,282,902주 및 교환사채예탁분 1,492,148주를 합한 주식수입니다. |
| (주2) | 교환사채권(미상환잔액) 교환가능주식 총수는 1,492,148주이며, 주식매수선택권 잔여주식 총수는 255,670주입니다. |
| (주3) | 상기 지분율은 교환사채권 및 주식매수선택권이 모두 보통주로 전환되었을 때를 고려한 주식등 지분율입니다. |
당사 임원 일부는 보통주 외에도 교환사채권 및 주식매수선택권을 위와 같이 보유하고 있으며, 교환사채권 및 주식매수선택권이 모두 보통주로 전환되었을 때를 가정하면, 최대주주 등은 현재 12.97%의 주식 등 지분을 보유하고 있습니다.
다만 본 유상증자 대금으로 교환사채 미상환잔액을 상환할 예정이며, 당사 주가 추이상 주식매수선택권의 단기적 행사 가능성은 현재 낮은 상황입니다. 이에, 교환사채권 및 주식매수선택권을 제외하고, 보통주를 기준으로 하여 최대주주 등의 예상 배정주식수와, 청약참여율에 따른 지분율 변동을 예측한 결과는 다음과 같습니다.
| [최대주주 등 예상 배정주식수] |
| (단위 : 주, 원, %) |
| 성 명 | 관 계 | 보통주식수 | 지분율 | 배정주식수 | 배정금액 |
|---|---|---|---|---|---|
| 김경숙 | 최대주주 | 3,483,320 | 10.60% | 2,479,643 | 4,686,525,270 |
| 양길안 | 임원 | 5,116 | 0.02% | 3,641 | 6,881,490 |
| 홍순복 | 최대주주의 특수관계인 | 6,000 | 0.02% | 4,271 | 8,072,190 |
| 홍정식 | 최대주주의 특수관계인 | 30,700 | 0.09% | 21,854 | 41,304,060 |
| 김병철 | 최대주주의 특수관계인 | 34,200 | 0.10% | 24,345 | 46,012,050 |
| 권광순 | 임원 | 47,200 | 0.14% | 33,599 | 63,502,110 |
| 이태용 | 임원 | 20,000 | 0.06% | 14,237 | 26,907,930 |
| 김종일 | 임원 | 3,500 | 0.01% | 2,491 | 4,707,990 |
| 송시환 | 임원 | 291,981 | 0.89% | 207,850 | 392,836,500 |
| 홍정욱 | 최대주주의 특수관계인 | 10,000 | 0.03% | 7,118 | 13,453,020 |
| 홍정인 | 최대주주의 특수관계인 | 10,000 | 0.03% | 7,118 | 13,453,020 |
| 김혜연 | 최대주주의 특수관계인 | 4,978 | 0.02% | 3,543 | 6,696,270 |
| 김우곤 | 최대주주의 특수관계인 | 4,000 | 0.01% | 2,847 | 5,380,830 |
| 계 | 3,950,995 | 12.02% | 2,812,563 | 5,315,744,070 | |
| 자기주식수 | 4,775,050 | 14.53% | 0 | 0 | |
| 발행주식총수 | 32,870,376 | 100.00% | 20,000,000 | 37,800,000,000 | |
| (주1) | 신주배정비율은 보통주 1주당 0.71186217주입니다. |
| (주2) | 배정금액은 예정발행가액 기준입니다. |
| (주3) | 자기주식에는 신주가 배정되지 않습니다. |
당사 최대주주 및 특수관계인 등은 본 유상증자시 총 2,812,563주의 신주를 배정받을 예정이며, 예정발행가액 기준 총 배정금액은 약 53억원에 해당됩니다. 만일 최대주주 및 특수관계인 등이 자금 사정 등에 의해 금번 유상증자 청약시 배정분의 전량을 미참여하게 될 경우를 가정한다면 배정받게 될 2,812,563주(신주 발행주식수의 14.06%)가 실권 위험에 노출될 수 있습니다.
다만 예정발행가액 기준 당사 최대주주 김경숙 본인은 신주 배정분의 30% 정도 청약에 참여할 계획을 가지고 있으며, 이외 임원 및 특수관계인들은 본인의 자금 사정 등을 고려하여 일부 가능한 범위 내에서 청약에 참여할 계획을 가지고 있습니다.
당사 최대주주 및 특수관계인 등의 본 유상증자 청약 참여 여부는 향후 청약재원 마련에 실패하는 등 예상치 못한 상황에 따라 변동될 수는 있으나, 현재 기준 계획상으로는, 최대주주는 보통주 및 신주인수권증서의 매각 등을 통해 청약재원을 조달할 계획을 가지고 있으며, 임원 및 특수관계인들은 보유 중인 자기자금 내지 미청약분에 대한 신주인수권증서 매각대금 등을 활용하여 개인적으로 가능한 범위 내에서 최대한 청약에 참여할 계획을 가지고 있습니다.
최대주주가 신주 배정분의 30%를 청약하고, 그 외 특수관계인들은 청약에 참여하지 않는다고 가정할 경우, 보통주 지분율 변동 시뮬레이션 결과는 다음과 같습니다.
| [최대주주 등 지분율 변동 시뮬레이션] | |
| (증권신고서 제출일 전일 기준) | (단위: 주, %) |
| 성 명 | 관 계 | 현재 | 배정주식수 | 배정금액 | 청약주식수 | 청약금액 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|---|---|
| 보통주식수 | 지분율 | 보통주식수 | 지분율 | ||||||
| 김경숙 | 최대주주 | 3,483,320 | 10.60% | 2,479,643 | 4,686,525,270 | 743,892 | 1,405,955,880 | 4,227,212 | 8.00% |
| 양길안 | 임원 | 5,116 | 0.02% | 3,641 | 6,881,490 | 0 | 0 | 5,116 | 0.01% |
| 홍순복 | 최대주주의 특수관계인 | 6,000 | 0.02% | 4,271 | 8,072,190 | 0 | 0 | 6,000 | 0.01% |
| 홍정식 | 최대주주의 특수관계인 | 30,700 | 0.09% | 21,854 | 41,304,060 | 0 | 0 | 30,700 | 0.06% |
| 김병철 | 최대주주의 특수관계인 | 34,200 | 0.10% | 24,345 | 46,012,050 | 0 | 0 | 34,200 | 0.06% |
| 권광순 | 임원 | 47,200 | 0.14% | 33,599 | 63,502,110 | 0 | 0 | 47,200 | 0.09% |
| 이태용 | 임원 | 20,000 | 0.06% | 14,237 | 26,907,930 | 0 | 0 | 20,000 | 0.04% |
| 김종일 | 임원 | 3,500 | 0.01% | 2,491 | 4,707,990 | 0 | 0 | 3,500 | 0.01% |
| 송시환 | 임원 | 291,981 | 0.89% | 207,850 | 392,836,500 | 0 | 0 | 291,981 | 0.55% |
| 홍정욱 | 최대주주의 특수관계인 | 10,000 | 0.03% | 7,118 | 13,453,020 | 0 | 0 | 10,000 | 0.02% |
| 홍정인 | 최대주주의 특수관계인 | 10,000 | 0.03% | 7,118 | 13,453,020 | 0 | 0 | 10,000 | 0.02% |
| 김혜연 | 최대주주의 특수관계인 | 4,978 | 0.02% | 3,543 | 6,696,270 | 0 | 0 | 4,978 | 0.01% |
| 김우곤 | 최대주주의 특수관계인 | 4,000 | 0.01% | 2,847 | 5,380,830 | 0 | 0 | 4,000 | 0.01% |
| 최대주주 등 계 | 3,950,995 | 12.02% | 2,812,563 | 5,315,744,070 | 743,892 | 1,405,955,880 | 4,694,887 | 8.88% | |
| 자기주식수 | 4,775,050 | 14.53% | 0 | 0 | 0 | 0 | 4,775,050 | 9.03% | |
| 발행주식총수 | 32,870,376 | 100.00% | 20,000,000 | 37,800,000,000 | - | - | 52,870,376 | 100.00% | |
| (주1) | 신주배정비율은 보통주 1주당 0.71186217주입니다. |
| (주2) | 배정금액 및 청약금액은 예정발행가액 기준입니다. |
| (주3) | 자기주식에는 신주가 배정되지 않습니다. |
| (주4) | 교환사채권 행사 또는 주식매수선택권 행사로 인한 지분 변동은 고려하지 않은 수치입니다. |
| (주5) | 최대주주가 배정분의 30%를 청약한 것으로 가정하고, 그 외 특수관계인들의 청약참여율은 보수적으로 0%로 가정하였습니다. |
당사 최대주주가 배정분의 30%를 청약하고 특수관계인들의 청약은 없는 것으로 가정했을 때, 유상증자 완료 후 최대주주의 보통주 지분율은 현재 10.60%에서 8.88%로 감소할 수 있고, 최대주주 및 특수관계인 합산 보통주 지분율은 현재 14.53%에서 9.03%로 감소할 수 있습니다.(주1)
| (주1) | 잔존하고 있는 교환사채권 또는 주식매수선택권이 향후에 만일 행사될 경우에는 최대주주 등의 보통주 지분율은 추가로 변동될 수 있습니다. |
한편 증권신고서 제출일 현재 기준 최대주주는 1,000,000주에 대한 주식담보대출이 존재하며 이에 대한 반대매매가 발생한다면 최대주주의 지분율은 약 3% 가량 하락하여 7.55%로 감소하며, 특수관계인을 포함한 지분율은 8.98%로 감소하게 됩니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-3.기타위험-나." 부분에 최대주주의 주식담보대출 관련 반대매매 관련 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
| [주식담보대출 일백만주에 대한 반대매매 가정한 주주 현황] | |
| (단위 : 주, %) | |
| 성 명 | 관 계 | 보통주식수 | 지분율 | 반대매매 가정 후 보통주식수 |
지분율 |
|---|---|---|---|---|---|
| 김경숙 | 최대주주 | 3,483,320 | 10.60% | 2,483,320 | 7.55% |
| 양길안 | 임원 | 5,116 | 0.02% | 5,116 | 0.02% |
| 홍순복 | 최대주주의 특수관계인 | 6,000 | 0.02% | 6,000 | 0.02% |
| 홍정식 | 최대주주의 특수관계인 | 30,700 | 0.09% | 30,700 | 0.09% |
| 김병철 | 최대주주의 특수관계인 | 34,200 | 0.10% | 34,200 | 0.10% |
| 권광순 | 임원 | 47,200 | 0.14% | 47,200 | 0.14% |
| 이태용 | 임원 | 20,000 | 0.06% | 20,000 | 0.06% |
| 김종일 | 임원 | 3,500 | 0.01% | 3,500 | 0.01% |
| 송시환 | 임원 | 291,981 | 0.89% | 291,981 | 0.89% |
| 홍정욱 | 최대주주의 특수관계인 | 10,000 | 0.03% | 10,000 | 0.03% |
| 홍정인 | 최대주주의 특수관계인 | 10,000 | 0.03% | 10,000 | 0.03% |
| 김혜연 | 최대주주의 특수관계인 | 4,978 | 0.02% | 4,978 | 0.02% |
| 김우곤 | 최대주주의 특수관계인 | 4,000 | 0.01% | 4,000 | 0.01% |
| 최대주주 등 계 | 3,950,995 | 12.02% | 2,950,995 | 8.98% | |
| 자기주식수 | 4,775,050 | 14.53% | 4,775,050 | 14.53% | |
| 발행주식총수 | 32,870,376 | 100.00% | 32,870,376 | 100.00% | |
| (주1) | 자기주식수 4,775,050주는 직접보유분 3,282,902주 및 교환사채예탁분 1,492,148주를 합한 주식수입니다. |
| (주2) | 상기 도표는 기발행 보통주식수 기준이며, 최대주주 및 특수관계인 등의 교환사채권 및 주식매수선택권 개별 보유분은 포함되어 있지 않습니다. |
또한 신주배정기준일(2025년 09월 18일 예정) 전에 반대매매가 발생할 경우, 동일하게 최대주주의 청약 참여 30% 및 특수관계인 미확정으로 미참여 가정을 한다면 증자 후 최대주주의 지분율은 5.7%, 특수관계인을 포함하면 6.58%로 하락하게 됩니다. 이처럼 근질권 설정된 1백만주에 대한 반대매매가 출회된다면 주가 하락은 물론이고 최대주주 등의 지분율도 크게 하락하여 당사의 경영권이 불안정한 상태가 되어 향후 경영권 분쟁 발생의 여지가 있는 등 당사에 부정적인 영향을 미칠 수 있습니다.
| [주식담보대출 일백만주에 대한 반대매매 가정한 최대주주 등 지분율 변동 시뮬레이션] | |
| (증권신고서 제출일 전일 기준) | (단위: 주, %) |
| 성 명 | 관 계 | 현재 | 배정주식수 | 배정금액 | 청약주식수 | 청약금액 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|---|---|
| 보통주식수 | 지분율 | 보통주식수 | 지분율 | ||||||
| 김경숙 | 최대주주 | 2,483,320 | 7.55% | 1,767,781 | 3,341,106,090 | 530,334 | 1,002,331,260 | 3,013,654 | 5.70% |
| 양길안 | 임원 | 5,116 | 0.02% | 3,641 | 6,881,490 | 0 | 0 | 5,116 | 0.01% |
| 홍순복 | 최대주주의 특수관계인 | 6,000 | 0.02% | 4,271 | 8,072,190 | 0 | 0 | 6,000 | 0.01% |
| 홍정식 | 최대주주의 특수관계인 | 30,700 | 0.09% | 21,854 | 41,304,060 | 0 | 0 | 30,700 | 0.06% |
| 김병철 | 최대주주의 특수관계인 | 34,200 | 0.10% | 24,345 | 46,012,050 | 0 | 0 | 34,200 | 0.06% |
| 권광순 | 임원 | 47,200 | 0.14% | 33,599 | 63,502,110 | 0 | 0 | 47,200 | 0.09% |
| 이태용 | 임원 | 20,000 | 0.06% | 14,237 | 26,907,930 | 0 | 0 | 20,000 | 0.04% |
| 김종일 | 임원 | 3,500 | 0.01% | 2,491 | 4,707,990 | 0 | 0 | 3,500 | 0.01% |
| 송시환 | 임원 | 291,981 | 0.89% | 207,850 | 392,836,500 | 0 | 0 | 291,981 | 0.55% |
| 홍정욱 | 최대주주의 특수관계인 | 10,000 | 0.03% | 7,118 | 13,453,020 | 0 | 0 | 10,000 | 0.02% |
| 홍정인 | 최대주주의 특수관계인 | 10,000 | 0.03% | 7,118 | 13,453,020 | 0 | 0 | 10,000 | 0.02% |
| 김혜연 | 최대주주의 특수관계인 | 4,978 | 0.02% | 3,543 | 6,696,270 | 0 | 0 | 4,978 | 0.01% |
| 김우곤 | 최대주주의 특수관계인 | 4,000 | 0.01% | 2,847 | 5,380,830 | 0 | 0 | 4,000 | 0.01% |
| 최대주주 등 계 | 2,950,995 | 8.98% | 2,100,695 | 3,970,313,550 | 530,334 | 1,002,331,260 | 3,481,329 | 6.58% | |
| 자기주식수 | 4,775,050 | 14.53% | 0 | 0 | 0 | 0 | 4,775,050 | 9.03% | |
| 발행주식총수 | 32,870,376 | 100.00% | 20,000,000 | 37,800,000,000 | - | - | 52,870,376 | 100.00% | |
| (주1) | 신주배정비율은 보통주 1주당 0.71186217주입니다. |
| (주2) | 배정금액 및 청약금액은 예정발행가액 기준입니다. |
| (주3) | 자기주식에는 신주가 배정되지 않습니다. |
| (주4) | 교환사채권 행사 또는 주식매수선택권 행사로 인한 지분 변동은 고려하지 않은 수치입니다. |
| (주5) | 최대주주가 배정분의 30%를 청약한 것으로 가정하고, 그 외 특수관계인들의 청약참여율은 보수적으로 0%로 가정하였습니다. |
최대주주의 주식담보대출에 대한 반대매매가 발생하지 않으며, 당사 최대주주 본인이 배정분의 30%에 대해 청약에 참여하고 특수관계인들은 청약에 참여하지 않는 경우를 가정한다면 최대주주 등의 보통주 지분율은 본 유상증자 후 9.03% 수준까지 희석될 수 있으며, 이는 경영권을 안정적으로 유지하기에는 부족한 수준의 지분율입니다. 또한 최대주주 등이 예상치 못한 사유 등으로 인해 청약에 필요한 자금을 마련하지 못할 경우, 청약 계획에 변동이 생겨, 지분이 추가 희석될 수 있는 위험성을 배제할 수 없습니다. 또한 당사는 지속적으로 자본시장에서의 자금 조달에 의존하고 있는 만큼 향후 추가적인 유상증자, 주식관련사채 등 발행에 따라 최대주주 및 특수관계인 등의 지분율이 추가로 희석될 가능성 또한 존재하며, 또는 최대주주 및 특수관계인 등의 지분율 추가 희석을 우려하여, 자본시장에서 지분 희석이 수반될 수 있는 형태의 자금 조달을 진행하는 데에는 한계가 있을 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [카. 특수관계인과의 거래 위험] 당사는 특수관계자와의 거래시 이사회 결의를 거쳐야 하며, 내부회계 관리 규정 등 당사 내부통제기준에 따라 거래 투명성을 확보하는 등 절차를 준수하고 있습니다. 향후에도 특수관계자와의 거래가 발생하게 될 경우 특수관계자에 대한 부당한 이익 제공 등에 해당하지 않는 범위에서 거래가 진행되도록 사전에 내부 규정에 따른 관련 절차를 준수할 예정입니다. 만일 특수관계자와의 거래 조건 등이 제3자와의 거래와 비교하여 적정성이 유지되지 않을 경우 이는 주주의 이익을 침해하는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [특수관계자 현황] |
| (K-IFRS 연결기준) |
| 구 분 | 2025년 반기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 기타특수관계자 | 주요 경영진 | 주요 경영진 | 주요 경영진 | 주요 경영진 |
| (출처) | 각 사업연도 (연결)감사보고서 |
최근 3개년간 당사와 직접적인 거래 관계가 존재한 특수관계자는 주요 경영진에 해당하며, 거래 내역은 다음과 같습니다.
| [특수관계자 등에 대한 거래 내역] | |
| (K-IFRS 연결기준) | (단위: 천원) |
| 구 분 | 계정과목 | 2021년말 | 증 가 | 감 소 | 2022년말 | 증 가 | 감 소 | 2023년말 | 증 가 | 감 소 | 2024년말 | 증 가 | 감 소 | 2025년 반기말 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 주요 경영진 | 전환사채 | 0 | 6,700,000 | 0 | 6,700,000 | 0 | (6,700,000) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 교환사채 | 0 | 0 | 0 | 0 | 6,700,000 | 0 | 6,700,000 | 0 | (3,350,000) | 3,350,000 | 0 | (1,910,000) | 1,440,000 | |
| 합 계 | 0 | 6,700,000 | 0 | 6,700,000 | 6,700,000 | (6,700,000) | 6,700,000 | 0 | (3,350,000) | 3,350,000 | 0 | (1,910,000) | 1,440,000 | |
| (출처) | 각 사업연도 (연결)감사보고서 |
2022년 중 당사의 기타 특수관계자에 해당하는 주요 경영진 1명이 당사가 발행했던 제1회차 전환사채 67억원(권면금액)을 전환사채 콜옵션 행사를 통해 취득하였습니다. 이어, 2023년 중에는 당사가 기관투자자들로부터 제2회차 교환사채 215억원을 투자받은 직후 동일한 조건으로 제3회차 교환사채를 당사 임직원 등을 대상으로 발행하였으며, 이 때 제1회차 전환사채 67억원을 보유하고 있던 주요 경영진 1명은 전환사채를 전액 조기상환받고, 동일한 금액만큼 제3회차 교환사채 67억원을 취득하였습니다.(주1)
| (주1) | 당사의 주식관련채권 발행내역은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-사" 부분을 참고하여 주시기 바랍니다. |
이후 해당 주요 경영진 1명은 2024년 중 제3회차 교환사채 취득분의 50%인 33.5억원(권면금액)을 처분 완료하였으며, 2025년 중에는 잔여분 33.5억원 중 40%인 13.4억원(권면금액)을 조기상환받았으며, 현재 제3회차 교환사채 20.1억원을 보유하고 있습니다. 해당 교환사채는 본 유상증자 완료 후 조기상환될 예정입니다.
한편, 당사의 모든 주요 경영진에 대한 최근 3개년간 보상내역은 다음과 같습니다.
| [주요 경영진에 대한 보상내역] | |
| (K-IFRS 연결기준) | (단위: 천원) |
| 구 분 | 2025년 반기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 단기종업원급여 | 253,150 | 1,250,040 | 1,254,360 | 1,051,700 |
| 퇴직급여 | 61,523 | 312,500 | 769,415 | 855,995 |
| 장기종업원급여 | - | 11,000 | 11,835 | 0 |
| 합 계 | 314,673 | 1,573,540 | 2,035,610 | 1,907,695 |
| (출처) | 각 사업연도 (연결)감사보고서 |
당사는 특수관계자와의 거래시 이사회 결의를 거쳐야 하며, 내부회계 관리 규정 등 당사 내부통제기준에 따라 거래 투명성을 확보하는 등 절차를 준수하고 있습니다. 향후에도 특수관계자와의 거래가 발생하게 될 경우 특수관계자에 대한 부당한 이익 제공 등에 해당하지 않는 범위에서 거래가 진행되도록 사전에 내부 규정에 따른 관련 절차를 준수할 예정입니다. 만일 특수관계자와의 거래 조건 등이 제3자와의 거래와 비교하여 적정성이 유지되지 않을 경우 이는 주주의 이익을 침해하는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
3. 기타위험
| [가. 금융감독기관의 관리감독기준 강화에 따른 위험] 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 투자주의환기종목 지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. 또한 2024년 2월 27일, 금융감독원은 기업공개(IPO), 유상증자 주관 업무 관련하여 16개 증권사와 간담회를 갖고 주관 업무 관련 불공정거래 및 위규 행위에 대해 엄정하게 대응하겠다고 밝혔습니다. 주주권익 훼손 우려가 있는 유상증자에 대해서는 증권신고서가 주주와의 공식적 소통 창구가 될 수 있도록 심사 절차 및 기준을 정비하고 이를 공개하였습니다. 특히, △ 주주 가치 희석화, △ 일반주주 권익 훼손 우려, △ 주관사의 의무 소홀 등 7개 사유 중 하나에 해당하는 경우 '중점심사 유상증자' 대상으로 선정해 유상증자의 당위성, 의사결정 과정, 이사회 논의 내용, 주주 소통계획 등 기재 사항을 집중심사한다고 밝혔습니다. 이처럼 당사가 중점심사 대상 기준에 부합하여 본 공모 유상증자가 진행될 경우, 중점 심사항목 위주로 1주일 이내 집중심사를 진행하고 최소 1회 이상의 대면협의를 진행하게 됩니다. 이에 따라 기존 예상보다 일정이 빨라지거나 지연될 수 있으며, 중점심사 유상증자에 해당된 사유가 충실히 기재 및 설명이 되지 않을 경우 예상보다 일정이 지연될 가능성이 커질 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다. |
최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 투자주의환기종목 지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다. (주1)
| (주1) | (본 증권신고서 "제1부.III.투자위험요소-2.회사위험 - 다" 부분을 참고하여 주시기 바랍니다). |
특히, "코스닥시장 상장규정 제28조(관리종목), 코스닥시장 상장규정 제38조(상장의 폐지) 및 코스닥시장 상장규정 제38조의2(실질심사위원회의 심사 등"에 유의하시기 바랍니다. 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법무포털(http://rule.krx.co.kr)" 등을 참고하시기 바랍니다.
또한 2025년 2월 27일, 금융감독원은 기업공개(IPO), 유상증자 주관 업무 관련하여 16개 증권사와 간담회를 갖고 주관 업무 관련 불공정거래 및 위규 행위에 대해 엄정하게 대응하겠다고 밝혔습니다. 주주권익 훼손 우려가 있는 유상증자에 대해서는 증권신고서가 주주와의 공식적 소통 창구가 될 수 있도록 심사 절차 및 기준을 정비하고 이를 공개하였습니다. 특히, △ 주주 가치 희석화, △ 일반주주 권익 훼손 우려, △ 주관사의 의무 소홀 등 7개 사유 중 하나에 해당하는 경우 '중점심사 유상증자' 대상으로 선정해 유상증자의 당위성, 의사결정 과정, 이사회 논의 내용, 주주 소통계획 등 기재 사항을 집중심사한다고 밝혔습니다.
| [유상증자 증권신고서 심사 방향 및 개선 방안] |
 |
|
유상증자 증권신고서 심사 방향 |
 |
|
붙임2) 유상증자 심사개선 방안 |
| (출처) IPO/유상증자 증권신고서 심사 관련 주관사 간담회, 금융감독원(2025.02) |
증권신고서 제출일 현재 당사는 중점심사 대상에 지정됐는지 그 여부를 알 수 없으나, 중점심사 대상 선정을 가정한 주요 심사항목에 대한 내용은 다음과 같습니다.
(공통) 당사의 본 공모 유상증자 추진 목적은 제3회차 교환사채 잔액 약 29억원, 제4회차 교환사채 잔액 약 130억원, 시설자금 일부 약 84억원, 총 243억원에 대한 채무상환과 뉴로나타-알 파이프라인에 대한 미국 FDA 가속승인 신청 관련 비용 약 56억원, 연구개발 및 인건비 등의 운영경비 약 69억원을 합하여 총 342억원(발행제비용 약 9억원 제외 기준)을 조달하는 데 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-Ⅴ.자금사용목적." 부분에 본 공모 유상증자 자금조달 상세 목적 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
반복되는 자금조달로 인해 주주들의 희석화 우려 및 앞으로의 회사 발전 방향 등 시장에서 야기되는 문제들에 대해 당사는 증권신고서 제출 전일에 주주서한을 홈페이지에 게시하여 금번 공모 유상증자와 관련된 주요 일정, 세부 사항, 목적 및 필요성을 투명하게 제공하였습니다. 또한, 이를 본 유상증자 투자설명서 발송 시 주주 서한 형태의 안내문을 통해 개별적으로 고지할 예정입니다.
또한 더 면밀하고 상세한 기업실사를 위해 단순히 대표주관사에게만 기업실사를 의존하지 않고 공동주관사를 같이 선임하여 단일 회사에 의존하지 않고 2개의 증권회사에서 기업 실사를 진행하였습니다. 게다가 이사회에서도 단순히 본 유상증자에 정량적 조건에 따른 결의만 진행한 게 아니라, 유상증자의 당위성 및 주주소통 절차 등 주주 보호를 위해 정성적 기준으로 본 유상증자에 대한 목적 및 필요성 등을 논의하였으며, 이러한 조치를 통해 당사는 유상증자 절차의 투명성을 확보하고, 주주의 신뢰를 제고하는 데 최선을 다하기 위해 노력하고 있습니다.
| [이사회의사록_발췌] |
 |
|
이사회의사록_발췌 |
| (출처) 당사 제시 |
(증자비율, 할인율 등) 본 공모 유상증자의 증자비율은 60.85%이며, 할인율은 25%입니다. 최근 4개년 공모 유상증자 증자비율 및 할인율 추이를 살펴보면 본 공모처럼 주주배정 후 실권주 일반공모의 경우, 2021년 증자비율 42%, 할인율 22%, 2022년 증자비율 36%, 할인율 22%, 2023년 증자비율 41%, 할인율 23%, 2024년 증자비율 47%, 할인율 24% 입니다. 이는 본 공모 유상증자의 증자비율은 최근 4개년 데이터에 비해 다소 높은 편이며, 할인율은 유사한 수준으로 판단됩니다.
| [최근 4개년 공모 유상증자 증자비율 및 할인율] |
| 구분 | 2021년 | 2022년 | 2023년 | 2024년 | ||||
|---|---|---|---|---|---|---|---|---|
| 증자비율 | 할인율 | 증자비율 | 할인율 | 증자비율 | 할인율 | 증자비율 | 할인율 | |
| 일반공모 | 107.89% | 12.22% | 39.26% | 30.00% | 18.98% | 15.00% | 59.34% | 26.25% |
| 주주배정 | 1.79% | 45.00% | 33.30% | 16.67% | 127.09% | 20.83% | 45.32% | 17.50% |
| 주주우선공모 | 118.27% | 27.50% | 69.26% | 28.50% | 76.95% | 28.75% | 92.26% | 27.50% |
| 주주배정 후 실권주 일반공모 | 42.11% | 21.99% | 36.17% | 22.08% | 40.85% | 23.09% | 47.13% | 23.94% |
| 평균 | 52.43% | 60.85% | 38.69% | 37.93% | 51.50% | 22.97% | 50.96% | 24.12% |
| (출처) Dart 전자공시시스템 |
| 주) 최초 증권신고서 제출일 기준으로 해당 사업연도 산정 |
(신사업투자 등) 당사는 경영의 효율성을 제고하고 사업간 시너지 효과를 창출하며 사업의 안정성 및 경쟁력을 강화하고 핵심역량 결합을 통해 새로운 성장 동력을 확보하기 위해, 당사의 연결 종속회사였던 비임상CRO 전문기업인 (주)켐온을 2022년 08월 16일 이사회 결의를 통해 2022년 12월 01일을 합병기일로 하여 흡수합병하였습니다.
합병을 통해 사업 역량을 공유함으로서 사업적 시너지 효과를 기대하고, 전문인력의 효율적인 활용 및 분배가 가능하며, 인적 교류 및 전문인력 육성을 통해 인력의 활용도를 높이는 기대 효과와 보유하고 있는 자산에 대해 보다 효율적인 운용을 가능하게하는 효율적 자산의 재배치를 기대하였으나, (주)켐온을 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, 꾸준한 매출은 발생하나 (주)켐온 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 (주)켐온과의 흡수합병 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
(경영권 분쟁발생) 당사는 현재까지 경영권 관련 분쟁이 발생한 적이 없으나, 증권신고서 제출일 전일 기준 현재 최대주주의 지분율 10.6%, 특수관계인 포함시 12.02%로 다소 낮은 편이며, 최대주주 등이 청약에 100% 참여하지 못할 경우 지분율은 더욱 희석될 예정입니다. 이와 관련하여 추후 경영권 분쟁이 발생할 수도 있는 점, 투자자께서는 유의하시기 바랍니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-차." 부분에 지분율 희석에 따른 경영권 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
(한계기업 등) 당사는 매출이 부진한 가운데, 지속적으로 줄기세포치료제의 발굴과 보유 파이프라인의 적응증 증가를 위하여 다양한 비임상 및 임상시험을 준비하고 있으며 이에 따라 관련비용의 지출이 꾸준히 발생하여 2022년 영업손실 63.5억원, 2023년 영업손실 196.8억원, 2024년 영업손실 220.2억원, 2025년 반기 영업손실 106.5억원이 발생하였습니다. 또한 영업 외적 측면에서도, 금융비용 등의 발생 영향으로 인해 2022년 당기순이익 7억원, 2023년 당기순손실 176.7억원, 2024년 당기순손실 262.5억원, 2025년 반기순손실 96.4억원이 발생하는 등 지속적인 적자 구조를 면하지 못하고 있습니다. 따라서 당사의 파이프라인에서 임상 성공을 통한 기술이전, 상업화 성공 등의 성과를 이루어내지 못한다면 당사의 적자 구조를 개선하는 것은 불가능할 수 있으며, 자본력이 지속적으로 감소하여 지속적인 연구개발비용 등의 지출이 필요한 당사의 영업활동을 영위하는데 상당한 제약이 생길 수 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-나. 및 2.회사위험-마." 부분에 매출 부진 및 지속적 손실 발생 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이에 따라 당사는 지속적인 영업손실과 당기순손실 발생 및 부의 영업현금흐름 발생, 이에 따른 결손금 누적과 재무상태 악화로 인하여 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 존재하는 상황입니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-나." 부분에 계속기업 가정의 불확실성 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
또한 당사가 상장적격성 실질심사 대상이 될 가능성도 존재하며, 코스닥시장에서의 주식 거래는 장기간 정지될 수 있고, 실질심사 과정에서 상장폐지까지 이어질 위험성이 존재합니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-다." 부분에 관리종목 및 환기종목 지정 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이외에도 당사는 현금흐름 악화에 따른 유동성 위험, 유무형자산 관련 위험, 매출채권 관련 위험 등이 상존하는 상황이오니, 투자자 여러분께서는 이 점 유의하시기 바랍니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-바., 2.회사위험-아. 및 2.회사위험-자." 부분에 현금흐름 악화 위험, 우발채무 등의 위험 및 개발비 등의 손상차손 인식 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
(IPO 실적 과다 추정 등) 당사는 2015년 코스닥시장 IPO 당시 줄기세포기술을 기반으로 희귀ㆍ난치성질환에 대한 새로운 줄기세포 치료제를 개발, 생산 및 판매를 영위하는 기업으로서 다양한 줄기세포치료제 파이프라인 연구개발을 진행해 왔습니다.그러나, IPO 당시에는 건강보험심사평가원과의 협의를 통해 일정 수준의 보험약가가 책정되고, 이를 기반으로 상급종합병원 중심의 처방 확대가 이루어질 것으로 가정하였으나 실제 협상 과정에서 심평원은 해당 약물이 고가이며, 출시 초기에는 대체 약물이 없어 수요가 많을 것으로 예상되는 상황에서 단일 약물에 과도한 예산을 배정하기 어렵다고 판단하였습니다. 심평원이 제시한 보험약가는 당시 생산단가에 미치지 못하였습니다. 이는 재무적 지속 가능성을 훼손할 우려가 있어 당사는 부득이하게 비급여 판매를 결정하게 되었습니다. 비급여 전환으로 인해 환자와 의료기관의 실구매 비용 부담이 크게 증가하였고, 이로 인해 제품의 도입과 처방이 지연되면서 실제 매출이 당초 전망치를 하회하게 되었습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-.마" 부분에 매출 지연 사유 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이처럼 당사가 중점심사 대상 기준에 부합하여 본 공모 유상증자가 진행될 경우, 중점 심사항목 위주로 1주일 이내 집중심사를 진행하고 최소 1회 이상의 대면협의를 진행하게 됩니다. 이에 따라 기존 예상보다 일정이 빨라지거나 지연될 수 있으며, 중점심사 유상증자에 해당된 사유가 충실히 기재 및 설명이 되지 않을 경우 예상보다 일정이 지연될 가능성이 커질 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
|
[나. 최대주주의 주식담보대출 반대매매 위험] 당사는 2020년 6월 제1회차 전환사채 410억을 발행하였으며, 해당 전환사채 콜옵션의 만기가 도래하기 전 전체 콜옵션(40%) 164억원 중 약 108억원을 당사 뉴로나타-알 파이프라인에 대한 자신감 및 책임 경영의 측면에서 행사하기로 결정하였습니다. 해당 콜옵션 행사 금액을 조달 및 마련하기 위해 당시 제1금융권에 주식담보대출을 알아봤으나, 현실적으로 실행 가능한 곳이 없었으며 이로 인해 주요 경영진이 알고 있는 지인이 운영하고 있는 주식회사 문앤폴라리스라는 기업과 주식담보대출을 체결하게 되었습니다. 2023년 1월에도 당사의 제3회차 교환사채 10억원을 투자한 이력이 있는 문앤폴라리스는 2006년에 설립된 중소기업으로, 주요 영위사업은 응용 소프트웨어 개발 및 공급업이며, 주로 서비스 기반 프로그램 개발을 하고 있는 것으로 알려져 있습니다. 현재 계속사업자로 운영 중이나, 2019년 매출 43억원, 영업이익 33억원에서 2022년 매출 2억원, 영업손실 2억원으로 급감하는 등 현재는 주요 영위 사업을 매각 후 회사의 법인 상태만 유지되는 형태로 남아 있는 것으로 판단됩니다. 당사의 최대주주는 2022년 4월 22일, 주식회사 문앤폴라리스와 금전소비대차계약을 체결하여 100억원을 차용했습니다. 차용기간은 2024년 7월 22일까지 27개월이며, 연 이자율은 6%로 원금 상환 시 일시에 지급하기로 하였습니다. 이 채무를 담보하기 위해 최대주주(김경숙)은 자신이 보유한 코아스템㈜ 보통주 2,000,000주(액면가 500원)를 문앤폴라리스에 근질권 설정하여 제공하였습니다.
만일 담보 주식 1,000,000주에 대한 반대 매매가 실행된다면 최대주주의 지분율은 약 3% 가량 하락하여 7.55%로 감소하며, 특수관계인을 포함한 지분율은 8.98%로 감소하게 됩니다. 또한 신주배정기준일(2025년 09월 18일 예정) 전에 반대매매가 발생할 경우, 최대주주의 청약 참여 30% 및 특수관계인 미확정으로 미참여 가정을 한다면 증자 후 최대주주의 지분율은 5.7%, 특수관계인을 포함하면 6.58%로 하락하게 됩니다. 이처럼 근질권 설정된 1,000,000주에 대한 반대매매가 출회된다면 주가 하락은 물론이고 최대주주 등의 지분율도 크게 하락하여 당사의 경영권이 불안정한 상태가 되어 향후 경영권 분쟁 발생의 여지가 있는 등 당사에 부정적인 영향을 미칠 수 있습니다. 결과적으로 현재 당사의 최대주주는 문앤폴라리스에 대해 30억원의 채무를 부담하고 있으며, 이를 담보하기 위해 당사의 보통주 1,000,000주에 근질권이 설정되어 있습니다. 기존 만기 2025년 3월 31일에서 5개월 연장하여 2025년 8월 31일까지 연장되었고, 구두합의를 통해 2026년 04월 30일까지 재연장하였습니다. 약정 기한 내 채무를 상환하지 못하거나 계약상 의무를 위반하면 문앤폴라리스가 담보를 처분할 수 있어, 최대주주 지분의 강제매각(반대매매) 위험이 존재합니다. 투자자 여러분께서는 반드시 이 점 유의하시기 바랍니다. |
당사는 2020년 6월 제1회차 전환사채 410억을 발행하였으며, 해당 전환사채 콜옵션의 만기가 도래하기 전 전체 콜옵션(40%) 164억원 중 약 108억원을 당사 뉴로나타-알 파이프라인에 대한 자신감 및 책임 경영의 측면에서 행사하기로 결정하였습니다. 해당 콜옵션 행사 금액을 조달 및 마련하기 위해 당시 제1금융권에 주식담보대출을 알아봤으나, 현실적으로 실행 가능한 곳이 없었으며 이로 인해 주요 경영진이 알고 있는 지인이 운영하고 있는 주식회사 문앤폴라리스라는 기업과 주식담보대출을 체결하게 되었습니다. 2023년 1월에도 당사의 제3회차 교환사채 10억원을 투자한 이력이 있는 문앤폴라리스는 2006년에 설립된 중소기업으로, 주요 영위사업은 응용 소프트웨어 개발 및 공급업이며, 주로 서비스 기반 프로그램 개발을 하고 있는 것으로 알려져 있습니다. 현재 계속사업자로 운영 중이나, 2019년 매출 43억원, 영업이익 33억원에서 2022년 매출 2억원, 영업손실 2억원으로 급감하는 등 현재는 주요 영위 사업을 매각 후 회사의 법인 상태만 유지되는 형태로 남아 있는 것으로 판단됩니다.
당사의 최대주주는 2022년 4월 22일, 주식회사 문앤폴라리스와 금전소비대차계약을 체결하여 100억원을 차용했습니다. 차용기간은 2024년 7월 22일까지 27개월이며, 연 이자율은 6%로 원금 상환 시 일시에 지급하기로 하였습니다. 이 채무를 담보하기 위해 최대주주(김경숙)은 자신이 보유한 코아스템㈜ 보통주 2,000,000주(액면가 500원)를 문앤폴라리스에 근질권 설정하여 제공했고, 이에 대한 (근)질권설정계약서, 질권설정승낙서, 질권 설정 승낙 신청서, 양도증서, 처분승낙서 등 부대 서류를 모두 작성·교부하였습니다. 주식은 미래에셋증권에 예탁되었고, 코아스템의 주주명부에도 질권설정 내용이 기재되었습니다. 계약서에는 부도, 압류, 청산, 채무불이행 등의 사유 발생 시 기한의 이익이 상실되어 문앤폴라리스가 즉시 전액 상환을 요구하고 담보를 처분할 수 있는 조항이 포함되어 있습니다.
이후 2024년 7월 16일~18일 사이 양측은 계약 변경 합의서를 체결하였습니다. 당사의 최대주주는 원금 100억 원 중 50억원을 상환했고, 남은 50억원에 대해 만기를 2025년 3월 31일까지 9개월 연장하기로 합의했습니다. 담보 주식도 기존 코아스템㈜ 2,000,000주에서 코아스템켐온㈜ 1,000,000주로 변경되었습니다. 아울러 기존(2022년자) 근질권설정계약과 모든 부대계약(승낙서, 신청서, 양도증서, 처분승낙서 등)은 모두 무효화하고, 변경된 조건에 맞춰 새로 작성·체결했습니다. 이와 함께 상계 관련 조문(만기 시 담보주식을 상계 처리할 수 있는 권리)은 삭제되었습니다. 해당 청구권은 형성권(권리자의 일방적 의사표시로 법률관계의 변동을 일으키는 권리로, 상대방의 동의 없이도 효력이 발생하는 권리)으로 채무자인 최대주주에 의해 행사된다면 채권자인 문앤폴라리스는 해당 권리를 청구한 시점 이후의 주가 하락에 따른 손실이 발생할 수 있기에 채권자인 문앤폴라리스의 요구에 의해 삭제되었습니다. 새 질권설정계약서에서 채권최고액은 100억 원으로 설정되었으며, 문앤폴라리스는 여전히 기한이익 상실 시 해당 주식을 처분할 수 있는 권한을 가졌습니다.
이후 제3회차 교환사채 약 29억원이 조기상환됨에 따라, 주식담보대출 남은 원금 50억원 중 20억원을 상환하였으며 남은 원금 30억에 대해서는 기존 만기 2025년 8월 31일에서 2026년 04월 30일로 연장되었습니다. 문앤폴라리스 대표의 개인적인 사정으로 인해 계약서는 작성 전이며, 해당 기간 연장에 대해서는 구두 합의를 완료하였습니다. 2025년 9월 중 계약서를 작성하고 체결할 예정이며, 당사의 주가 하락폭이 깊기 때문에 근질권이 설정된 당사의 보통주 1,000,000주에 대한 담보 수량 변화는 없습니다. 그러나 구두 합의를 진행했다고 하더라도 서면 계약서 작성 및 체결 전이기 때문에 채권자 문앤폴라리스에 의해 반대매매가 출회될 가능성을 배제할 수 없습니다.
만일 담보 주식 1,000,000주에 대한 반대 매매가 실행된다면 최대주주의 지분율은 약 3% 가량 하락하여 7.55%로 감소하며, 특수관계인을 포함한 지분율은 8.98%로 감소하게 됩니다. 또한 신주배정기준일(2025년 09월 18일 예정) 전에 반대매매가 발생할 경우, 최대주주의 청약 참여 30% 및 특수관계인 미확정으로 미참여 가정을 한다면 증자 후 최대주주의 지분율은 5.7%, 특수관계인을 포함하면 6.58%로 하락하게 됩니다. 이처럼 근질권 설정된 1,000,000주에 대한 반대매매가 출회된다면 주가 하락은 물론이고 최대주주 등의 지분율도 크게 하락하여 당사의 경영권이 불안정한 상태가 되어 향후 경영권 분쟁 발생의 여지가 있는 등 당사에 부정적인 영향을 미칠 수 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-차." 부분에 최대주주의 주식담보대출 관련 반대매매에 따른 시뮬레이션에 대한 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
결과적으로 현재 당사의 최대주주는 문앤폴라리스에 대해 30억원의 채무를 부담하고 있으며, 이를 담보하기 위해 당사의 보통주 1,000,000주에 근질권이 설정되어 있습니다. 기존 만기 2025년 3월 31일에서 5개월 연장하여 2025년 8월 31일까지 연장되었고, 구두합의를 통해 2026년 04월 30일까지 재연장하였습니다. 약정 기한 내 채무를 상환하지 못하거나 계약상 의무를 위반하면 문앤폴라리스가 담보를 처분할 수 있어, 최대주주 지분의 강제매각(반대매매) 위험이 존재합니다. 또한 투자자 여러분께서는 반드시 이 점 유의하시기 바랍니다.
| [다. 인수인의 실권주 인수분 물량 출회에 따른 주가하락 위험] 실권주를 인수한 대표주관회사, 공동주관회사 또는 인수회사가 수익 확정을 위해 인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 각 사에서 인수한 실권주를 일정 기간 보유하더라도, 동 인수물량이 잠재 매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사, 공동주관회사 및 인수회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 18.0% ~ 25.0%를 추가수수료로 지급하게 되며, 이를 고려시 대표주관회사, 공동주관회사 및 인수회사의 실권주 매입단가는 청약자들보다 18.0% ~ 25.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 금번 유상증자를 주주배정후 실권주 일반공모 방식으로 진행하고 있으며, 구주주 청약 및 일반공모 청약 이후 발생한 최종 실권주는 대표주관회사인 엘에스증권(주), 공동주관회사인 한양증권(주) 및 인수회사인 SK증권(주)에서 각자의 인수비율에 따라 자기계산으로 인수하게 됩니다.
| [대표주관회사, 공동주관회사 및 인수회사의 인수조건] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
|---|---|---|---|
| 대표주관회사 | 엘에스증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(40.00%) |
주관수수료: 최종모집금액의 0.5% * 50% 기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
| 공동주관회사 | 한양증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(40.00%) |
주관수수료: 최종모집금액의 0.5% * 50% 기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
| 인수회사 | SK증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(20.00%) |
기본인수수수료: 최종모집금액의 1.8% * 20% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 50억원 이하일 경우 18%, 50억원 초과 100억원 이하일 경우 20%, 100억원 초과할 경우 25% |
만일 구주주 청약 및 일반공모 청약 이후 최종 실권주가 발생할 경우에는 대표주관회사인 엘에스증권(주), 공동주관회사인 한양증권(주) 및 인수회사인 SK증권(주)에서 각자의 인수비율에 따라 자기계산으로 인수하게 되며, 당사는 각 증권사에게 인수의무비율에 따른 잔액인수금액의 18.0% ~ 25.0%를 실권수수료로 지급하게 됩니다.
따라서 실권주를 인수한 대표주관회사, 공동주관회사 또는 인수회사가 수익 확정을 위해 인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 각 사에서 인수한 실권주를 일정 기간 보유하더라도, 동 인수물량이 잠재 매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사, 공동주관회사 및 인수회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 18.0% ~ 25.0%를 추가수수료로 지급하게 되며, 이를 고려시 대표주관회사, 공동주관회사 및 인수회사의 실권주 매입단가는 청약자들보다 18.0% ~ 25.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [라. 유상증자 신주발행에 따른 물량 출회 및 주가 희석화 위험] 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 확정발행가액보다 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 존재합니다. 또한 본 유상증자의 발행예정주식수 20,000,000주는 당사 발행주식총수 32,870,376주의 60.85%에 해당하는 규모로, 보호예수되지 않아 일시적 물량 출회로 인한 주가 하락 위험이 존재합니다. 또한 유상증자 후 주식매수선택권 255,670주는 현재 당사 발행주식총수 32,870,376주의 0.78%에 해당하는 규모로, 이 역시 행사가능 시기가 도래하면, 시장에 출회될 수 있습니다. 이처럼 주가희석화 및 물량수급의 불균형에 따른 주가하락의 가능성이 존재하므로 투자자의 손실을 초래할 위험이 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 금번 유상증자를 주주배정후 실권주 일반공모 방식으로 진행하고 있습니다. 금번 유상증자에 따른 모집가액은 '증권의 발행 및 공시 등에 관한 규정' 제5-18조에 의거 주주배정 증자 시 가격 산정절차 폐지 및 가격 산정의 자율화에 따라 발행가액을 자유롭게 산정할 수 있으나, '(舊) 유가증권의 발행 및 공시 등에 관한 규정' 제57조를 적용하여 산정합니다.(주1)
| (주1) | 본 증권신고서 "제1부.I.모집 또는 매출에 관한 일반사항-3.공모가격 결정방법" 부분을 참고하여 주시기 바랍니다. |
| [출회가능 주식수] |
| (단위 : 주, %) |
| 구 분 | 주식수 | 현재 주식수 대비 |
유상증자 후 주식수 대비 |
주식매수선택권 행사 후 주식수 대비 |
|
|---|---|---|---|---|---|
| 모집예정주식수 | 20,000,000 | 60.85% | 37.83% | 37.65% | |
| 주식매수선택권 | 255,670 | 0.78% | 0.48% | 0.48% | |
| 소계 | 20,255,670 | 61.62% | 38.31% | 38.13% | |
| 발행주식총수 | 현재 | 32,870,376 | 100.00% | 62.17% | 61.87% |
| 유상증자 후 | 52,870,376 | - | 100.00% | 99.52% | |
| 주식매수선택권 행사 후 | 53,126,046 | - | - | 100.00% | |
| (주1) | 본 유상증자 완료시, 주식매수선택권 계약서에 따라 이사회의 결의로 행사 가격이 조정될 수 있으나 이는 의무사항이 아닙니다. 기존에 발행한 제2회차/제3회차/제4회차 교환사채 발행시에도 행사가격 조정을 하지 않았으며, 유상증자시에도 행사가격 조정은 고려하지 않고 있습니다. 주식매수선택권 관련하여 상세한 내용은, 본 증권신고서 "제1부.III.투자위험요소-3.기타위험-사" 부분을 참고하여 주시기 바랍니다. 한편, 상기 수치는 유상증자 예정발행가액을 기준으로 산출하였습니다. |
그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 확정발행가액보다 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 존재합니다. 또한 본 유상증자의 발행예정주식수 20,000,000주는 당사 발행주식총수 32,870,376주의 60.85%에 해당하는 규모로, 보호예수되지 않아 일시적 물량 출회로 인한 주가 하락 위험이 존재합니다. 또한 유상증자 후 주식매수선택권 255,670주는 현재 당사 발행주식총수 32,870,376주의 0.78%에 해당하는 규모로, 이 역시 행사가능 시기가 도래하면, 시장에 출회될 수 있습니다. 이처럼 주가희석화 및 물량수급의 불균형에 따른 주가하락의 가능성이 존재하므로 투자자의 손실을 초래할 위험이 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [마. 환금성 제약 및 원금 손실 가능성에 대한 위험] 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다. 또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장 전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 코스닥시장 상장법인으로서 이번 유상증자로 발행되는 신주는 코스닥시장에상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다.
그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다. 또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장 전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [바. 주가하락에 따른 발행금액 감소 위험] 확정발행가액이 당초 계획 대비 하락할 경우에는 당사가 계획했던 공모자금 조달 규모가 감소하게 되어, 자금운용계획의 변동이 불가피하며, 당사 영업활동에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
금번 유상증자의 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 결정됩니다. 다만 '자본시장과 금융투자업에 관한 법률' 제165조의6 및 '증권의 발행 및 공시 등에 관한 규정' 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. (단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
따라서 확정발행가액이 당초 계획 대비 하락할 경우에는 당사가 계획했던 공모자금 조달 규모가 감소하게 되어, 자금운용계획의 변동이 불가피하며, 당사 영업활동에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[사. 주식매수선택권 행사에 따른 주가 하락 위험] 향후 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
본 증권신고서 "제1부.III.투자위험요소-2.회사위험-차." 부분에 기재된 바와 같이 당사는 현재 임직원 등에 부여한 주식매수선택권 255,670주가 잔존하고 있습니다. 향후 당사 주식수에 변동이 생길 수 있는 기발행된 잠재주식은 주식매수선택권에 해당됩니다.
| [주식매수선택권 내역] | |
| (증권신고서 제출일 전일 기준) | (단위 : 원, %) |
| 구 분 | 부여일 | 의무복무기간 | 행사가능기간 | 현재 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|
| 보유수량 | 행사가격 | 조정 후 행사가능수량 | 조정 후 행사가격 | ||||
| 1 | 2019-03-29 | 2년 | 행사시작일로부터 5년('21.3.29~'26.3.28) | 255,670 | 13,600 | 255,670 | 13,600 |
| 계 | 255,670 | 13,600 | 255,670 | 13,600 | |||
| (출처) | 공시자료 및 당사제시자료 |
| 주1) | 본 유상증자 완료시, 주식매수선택권 계약서에 따라 이사회의 결의로 행사 가격이 조정될 수 있으나 이는 의무사항이 아닙니다. 기존에 발행한 제2회차/제3회차/제4회차 교환사채 발행시에도 행사가격 조정을 하지 않았으며, 유상증자시에도 행사가격 조정은 고려하지 않고 있습니다. |
본 유상증자 완료 후에도 주식매수선택권의 행사가액은 조정되지 않을 예정이며, 총 행사가능수량은 255,670주로 동일합니다. 하지만 향후 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [아. 유상증자 일정 관련 위험 및 철회 가능성 관련 위험] 본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경되거나 관계기관과의 업무 진행과정에서 본 증권신고서상의 예상 일정에 차질을 가져올 수 있습니다. 또한 금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사, 공동주관회사 및 인수회사의 잔액인수 방식으로 진행되며, 인수계약서에 의거하여, 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생할 경우에는 당사 혹은 대표주관회사 등의 판단에 따라 유상증자가 철회될 수 있습니다. 만일 유상증자 진행이 철회될 경우, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있고 이는 보상받지 못할 수 있습니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
「자본시장과 금융투자업에 관한 법률」 제120조 3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 본 공시서류를 참조하시기 바랍니다.
본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경되거나 관계기관과의 업무 진행과정에서 본 증권신고서상의 예상 일정에 차질을 가져올 수 있습니다.
또한 금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사, 공동주관회사 및 인수회사의 잔액인수 방식으로 진행되며, 인수계약서에 의거하여, 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생할 경우에는 당사 혹은 대표주관회사 등의 판단에 따라 유상증자가 철회될 수 있습니다. 만일 유상증자 진행이 철회될 경우, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있고 이는 보상받지 못할 수 있습니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [자. 분석정보의 한계 및 투자판단 관련 위험] 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있습니다. 본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단하시기 바랍니다. |
당사의 주식가치는 금번 유상증자 실시에 따른 전 과정에서 다양한 영향을 받아 하락할 수 있습니다.
본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 본 주식을 청약하고자 하는 투자자께서는 투자결정을 하기 전에 본 공시서류의 상기 투자위험요소 뿐만 아니라 다른 부분 또한 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없습니다. 따라서 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단할 필요가 있습니다.
당사는 상기에 기술된 투자위험요소 외에도 불안정한 경제상황 등에 의하여 직·간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 실제 결과는 현재시점에서의 평가와는 상당히 다를 수 있는 점을 유의하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생할 경우, 당사의 사업환경과 재무상태, 기타 운영결과에 부정적인 영향을 미칠 수 있습니다. 이에 따른 주가 하락으로 투자자께서는 금번 공모 과정에서 취득하게 되는 주식의 투자금액의 일부 또는 전부를 잃을 수 있습니다.
또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 최초에 예측했던 것과 다를 수 있는 점을 유의하시기 바랍니다.
| [차. 집단 소송 제기 위험] 공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [카. 차입공매도 유상증자 참여 제한 관련 위험] 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률과 시행령」이 개정되어 2021년 4월 6일부터 시행됨에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막 날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자 참여를 제한하되, 예외적인 경우에만 증자 참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 상기 사항을 위반 시 과징금 등의 제재 조치를 받을 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
주권상장법인이 유상증자 계획을 공시한 이후 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우 증자참여를 허용하고 있습니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 이와 관련 유상증자 참여가 제한되는 공매도 시점과 증자참여가 허용되는 예외사유를 시행령에서 정하도록 위임하고 있습니다.
시행령에 따르면, 유상증자 계획이 공시된 다음 날부터, 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지 공매도 한 경우 증자참여가 제한됩니다 (「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제1항)
다만, 다음의 경우 공매도를 통해 발행가격에 부당한 영향을 미쳤다고 보지 않아 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제2항「금융투자업규정」제6-34조)
ⅰ) 마지막 공매도 이후 발행가격 산정 기산일까지 공매도 주문 수량 이상을 증권시장 정규거래시간에 매수(체결일 기준)
ⅱ) 금융위원회가 정하는 기준을 충족한 독립된 거래단위를 운영하는 법인 내에서 공매도를 하지 않은 거래단위가 증자참여
ⅲ) 시장조성 또는 유동성공급을 위한 거래과정에서 공매도
상기 공매도제도 개선 관련 자본시장법 시행령 시행에 따라, 당사의 주식을 해당 기간 동안 공매도하는 투자자께서는 금번 유상증자 참여가 제한될 수 있음을 유의하시기 바랍니다. 해당 법령과 관련된 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법무포털(http://rule.krx.co.kr)" 등을 참고하시기 바랍니다.
| [타. 기타 투자자 유의사항] 당사의 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우, 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 공시서류에 기재된 정보에만 의존하여 투자 판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 유의하시어 투자에 임하시기 바랍니다. |
(1) 금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분들께서는 이 점을 유의하여 주시기 바랍니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
(3) 본 공시서류의 공시심사 과정에서 기재사항은 청약일 이전에 변경될 수 있고, 일부 내용은 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 공시서류상의 일정에 차질을 가져올 수 있습니다. 또한 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다.
(4) 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
(5) 당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점을 유의하여 투자에 임하시기 바랍니다.
(6) 만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다.
(7) 본건 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
(8) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있으니 투자의사를 결정하시는 데 참조하시기 바랍니다.
이와 같이, 본 건 유상증자를 통해 취득한 당사의 주식 가치는 하락할 수 있으며, 본본 공시서류에서 제시된 투자위험요소 및 기타 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 다시 한번 유의하여 주시기 바랍니다.
| ※ 상기 제반사항을 고려하시어 투자자 제위의 현명한 판단을 바랍니다. 투자자는 본건 공모주식에의 투자 여부를 결정함에 있어서 필요한 경우 스스로 별도의 독립된 자문을 받아야 하며, 이에 따른 투자의 결과에 대하여는 투자자가 책임을 부담합니다. |
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 「금융투자회사의 기업실사 모범규준」에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 엘에스증권(주) 및 공동주관회사인 한양증권(주)입니다. 발행회사인 코아스템켐온(주)는 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 금융투자업자(분석기관) | |
|---|---|---|
| 회 사 명 | 고 유 번 호 | |
| 대표주관회사 | 엘에스증권(주) | 00330424 |
| 공동주관회사 | 한양증권(주) | 00162416 |
2. 분석의 개요
대표주관회사인 엘에스증권(주) 및 공동주관회사인 한양증권(주)는「자본시장과 금융투자업에 관한 법률」 제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한 「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 지분증권, 채무증권 증권신고서를 대상으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사 및 공동주관회사가 기업실사 과정을 통해 발행회사부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
| 「금융투자회사의 기업실사 모범규준」 |
|---|
| 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 '리스크관리위원회 등')의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요 내용
| 일자 | 실사내용 |
|---|---|
| 2025-07-21 |
* 발행회사 방문 - 자금조달 목적 등 발행회사 의견 청취 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 주요 사항 및 일정 체크 - 유상증자 상세 일정 등 업무 협의 |
| 2025-07-22 ~ 2025-08-03 |
* 발행회사 및 해당 산업 조사 - 회사 정관 등 기본자료 수령 - 공시 및 뉴스 내용 등을 통한 발행회사 및 산업 이해 - 경영진 평판 리스크 검토 - 관련 Q&A 등 * 유상증자 리스크검토 - 발행시장 상황, 자금조달규모 적정성공모가액 희망 할인율 검토 |
| 2025-08-04 ~ 2025-08-14 |
* 발행회사 방문 및 보고서 작성 * Due-diligence checklist에 따라 투자위험요소 실사 1) 사업위험관련 실사 - 영위중인 사업 등에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 - 최대주주의 지분율 및 경영권 안정성 검토 - 주요 계정과목별 재무수치 변동요인 검토 - 원장 및 각종 명세서 등 검토 - 주요 계약관련 계약서 및 등의 확인 - 각 부서 주요 담당자 인터뷰 * 주요 경영진 면담 - 경영진 평판 리스크 검토 - 자금 사용 목적 등에 관한 청취 |
| 2025-08-15 ~ 2025-08-18 |
* 실시간 실사자료 요청 및 확인/검토 * 증권신고서 작성에 대한 조언 * 이사회의사록 검토/인수계약서 작성 및 검토 |
| 2025-08-19 ~ 2025-09-01 |
* 증권신고서 보완 및 정정관련 조언 * 실사 추가 자료 요청 |
4. 기업실사 참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 엘에스증권(주) | 기업금융2팀 | 안종섭 | 팀장 | 기업실사 총괄 | 2025년 07월 21일 ~ 2025년 09월 01일 |
기업금융업무 등 13년 |
| 엘에스증권(주) | 기업금융2팀 | 문재준 | 선임매니저 | 실사책임 및 검토 | 2025년 07월 21일 ~ 2025년 09월 01일 |
기업금융업무 등 9년 |
| 엘에스증권(주) | 기업금융2팀 | 유한종 | 선임매니저 | 기업실사 및 서류작성 등 | 2025년 07월 21일 ~ 2025년 09월 01일 |
기업금융업무 등 5년 |
[공동주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 한양증권(주) | 기업금융부 | 정경훈 | 부장 | 기업실사 총괄 | 2025년 07월 21일 ~ 2025년 09월 01일 |
기업금융업무 등 13년 |
| 한양증권(주) | 기업금융부 | 장창환 | 과장 | 실사책임 및 검토 | 2025년 07월 21일 ~ 2025년 09월 01일 |
기업금융업무 등 7년 |
| 한양증권(주) | 기업금융부 | 윤상호 | 대리 | 기업실사 및 서류작성 등 | 2025년 07월 21일 ~ 2025년 09월 01일 |
기업금융업무 등 4년 |
[발행회사]
| 소속 | 부서 | 성명 | 직책 | 담당업무 |
|---|---|---|---|---|
| 코아스템켐온(주) | - | 권광순 | CFO | 발행업무 총괄 |
| 코아스템켐온(주) | 경영지원팀 | 박상성 | 팀장 | 실사대응 및 서류작성 |
| 코아스템켐온(주) | 기획실 | 양승범 | 부장 | 실사대응 및 서류작성 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 엘에스증권(주) 및 공동주관회사인 한양증권(주)는 코아스템켐온(주)가 2025년 08월 18일 이사회에서 결의한 기명식 보통주 20,000,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이를 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 |
▶ 캐나다와 인도에 본사를 둔 글로벌 헬스케어 전략 컨설팅ㆍ시장조사 기업인 Towards Healthcare에 따르면, 글로벌 일반 세포치료제 시장은 2024년 약 59억 달러 규모에서 2034년 약 444억 달러 규모까지 향후 연평균 22.7%의 높은 성장률을 보일 것으로 전망하고 있습니다. 주로 자가/동종 줄기세포치료제, 조직 재생, 만성ㆍ희귀질환, 심혈관ㆍ근골격계ㆍ신경 등 다양한 영역에 활용될 것으로 전망하고 있습니다. 또한 헬스케어ㆍ바이오 등 다양한 산업군을 대상으로 한 신흥 글로벌 시장조사ㆍ전략컨설팅 전문사인 Precedence Research에 따르면 글로벌 줄기세포치료제 시장은 2024년 기준 160.2억 달러로, 2025년 181.3억 달러의 규모에서 연평균 12.95%의 성장률을 보이며 2034년 약 541.5억 달러 규모로 성장할 것으로 전망되고 있습니다. 시장 성장을 이끄는 주요 요인으로는 만성질환 및 퇴행성 질환 증가, 재생의학 기술 혁신, 정부 및 민간의 대규모 연구ㆍ임상 투자, 신약 파이프라인 확대 등이 꼽힙니다. 특히, 신경계(파킨슨병, 루게릭병 등), 심혈관계, 근골격계, 암 등 다양한 분야에서 줄기세포치료제 상용화가 확대되고 있습니다.
|
| 부정적 요인 |
▶ 2018년 이후 줄기세포치료제의 품목 허가가 줄어들고, 2023년부터 다시 일부 제품들이 승인되기 시작한 배경에는 각 규제당국의 규제가 대폭 강화된 점이 큰 영향을 미쳤습니다. 미국 식품의약국(FDA), 유럽의약품청(EMA), 그리고 일본 의약품의료기기종합기구(PMDA) 등 주요 규제기관은 줄기세포치료제에 대해 안전성과 효능을 엄격히 검증하기 위해 다양한 규제 조치를 강화하고 있습니다. ▶ 세계적인 대형 CRO업체들이 한국 제약ㆍ바이오 시장에 주목하여 임상 및 비임상시험을 비롯한 다양한 바이오컨설팅을 제공하기 위해 경쟁적으로 뛰어들 가능성을존재하는 상황입니다. 전 세계적으로 1,100개 이상의 CRO 기업이 존재하는 것으로 추산되고 있는데, 이 중 2023년에는 글로벌 CRO 상위 10개 기업에 80.8%의 시장점유율이 집중된 것으로 나타난 점을 보면 CRO 산업은 전세계적으로 볼 때 독과점 형태를 보이고 있습니다. 이 중 IQVIA, LabCorp, PPD 등은 이미 국내 시장에서도 활발히 영업망을 강화하고 있고, 합병ㆍ인수와 신사업 다각화 및 가격경쟁력 제고 등에 힘입어 앞으로도 그 영향력이 더욱 확대될 전망입니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 교환사채 채무상환자금, 뉴로나타-알의 FDA 가속승인 신청비용 및 주요 파이프라인별 연구개발비 등 운영자금으로 활용할 계획입니다. 동사는 아직 손익이 부진한 상태로서 자체 영업현금흐름 창출 능력이 낮기 때문에, 향후 계속기업으로서의 존속을 위하여 임상 진행 중인 파이프라인의 연구개발 성과가 가시화되어야 하는 상황에 처해있으며, 이는 대규모 연구개발비의 지출을 수반해야 합니다. 이를 위해 본 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 목적은 본 증권신고서 "제1부.V. 자금의 사용목적" 부분을 참고하시기 바랍니다. |
나. 대표주관회사 및 공동주관회사는 실사 과정에서 발행회사로부터 각 파이프라인별 임상 진행 경과 및 향후 계획 등에 대해 관련 자료를 제공받았으며, 본 증권신고서상 기재된 내용과 상충되지 않음을 성실하게 검토하였습니다.
다. 대표주관회사 및 공동주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다. 또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025. 09. 08. |
| 대표주관회사: 엘에스증권 주식회사 |
| 대표이사 김 원 규 |
| 공동주관회사 : 한양증권 주식회사 |
| 대표이사 김 병 철 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
|
(단위 : 원) |
|
구 분 |
금 액 |
|---|---|
|
모집 또는 매출총액(1) |
37,800,000,000 |
|
발행제비용(2) |
993,464,000 |
|
순 수 입 금 [ (1)-(2) ] |
36,806,536,000 |
| 주1) | 상기 금액은 예정발행가액을 기준으로 산정하였습니다. |
| 주2) | 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) | 발행제비용은 공모금액 및 실권규모, 유관기관과의 협의, 상장신청일 전일 당사 주가추이 등에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 발행제비용은 공모금액에서 지급될 예정이나, 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 연구개발비로 지출할 예정입니다. |
나. 발행제비용의 내역
|
(단위 : 원) |
|
구 분 |
금 액 |
계산근거 |
|---|---|---|
|
발행분담금 |
6,804,000 |
모집총액의 0.018% (10원 미만 절사) |
|
주관수수료 |
189,000,000 | 모집총액의 0.5% |
|
인수수수료 |
680,400,000 |
모집총액의 1.8% |
|
상장수수료 |
9,260,000 | 590만원 + 500억원 초과금액[추가상장분 시가총액]의 10억원당 7만원 |
|
등록세 |
40,000,000 |
증자 자본금의 0.4% |
|
교육세 |
8,000,000 |
등록세의 20% |
|
기타비용 |
60,000,000 |
구주주 청약서, 투자설명서 인쇄 및 발송비 등 |
|
합 계 |
993,464,000 |
- |
| 주1) | 상기 금액은 예정발행가액을 기준으로 산정하였습니다. |
| 주2) | 발행제비용은 공모금액 및 실권규모, 유관기관과의 협의, 상장신청일 전일 당사 주가추이 등에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 발행제비용은 공모금액에서 지급될 예정이나, 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 연구개발비로 지출할 예정입니다. |
| 주3) | 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
| (기준일 : | 2025년 08월 31일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 12,467 | 24,340 | - | - | 36,807 |
| (주1) | 상기 자금은 예상되는 발행제비용을 제외한 순수입금 기준입니다. |
나. 공모자금 세부 사용목적
| [유상증자 자금사용의 우선순위] |
| (단위 : 백만원) |
| 우선순위 | 구분 | 자금용도 | 25년 3분기 | 25년 4분기 | 26년 1분기 | 26년 2분기 | 26년 3분기 | 26년 4분기 | 27년 이후 | 합계 |
| 1 | 채무상환자금 | 3EB, 4EB 및 시설자금대출 상환 | 0 | 14,528 | 4,606 | 1,667 | 0 | 0 | 3,538 | 24,340 |
| 2 | 운영자금 | FDA 임상 3상 품목허가 신청비용 | 0 | 213 | 238 | 4,865 | 243 | 0 | 0 | 5,559 |
| 3 | 운영경비 | 0 | 1,587 | 1,824 | 1,344 | 1,344 | 808 | 0 | 6,908 | |
| 합계 | 0 | 16,329 | 6,668 | 7,876 | 1,588 | 808 | 3,538 | 36,807 | ||
| (출처) | 당사 제시 |
| (주1) | 상기 자금은 예정발행가액 기준으로 산정되었습니다. |
| (주2) | 상기 자금은 예상되는 발행제비용을 제외한 순수입금 기준입니다. |
| (주3) | 25년 3분기 또는 4분기 내에 FDA 품목허가 신청비용 또는 운영경비에 대한 선제적인 조달이 필요할 경우, 실시간 당사의 유동성을 고려하여 사모사채 또는 대출 등을 진행하여 자금을 조달할 예정이며, 이는 본 유상증자 납입 자금으로 상환을 할 계획입니다. 단, 실행 여부는 확정되지 않았습니다. |
1) 교환사채 조기상환자금 및 산업은행 시설대출 상환자금
먼저 당사가 발행한 주식관련채권의 내역은 다음과 같습니다.
| [주식관련채권 발행 내역] | |
| (증권신고서 제출 전일 기준) | (단위 : 원, 주, %) |
| 구 분 | 1회차 | 2회차 | 3회차 | 4회차 | |
|---|---|---|---|---|---|
| 종류 | 전환사채 | 교환사채 | 교환사채 | 교환사채 | |
| 발행일 | 2020-06-26 | 2023-01-19 | 2023-01-26 | 2024-03-24 | |
| 만기일 | 2024-06-26 | 2027-01-19 | 2027-01-26 | 2028-03-24 | |
| 발행금액 | 발행시점 | 41,000,000,000 | 21,500,000,000 | 10,811,450,000 | 21,000,000,000 |
| 자금사용목적 | 운영자금 | 25,000,000,000 | 10,688,550,000 | 10,811,450,000 | 10,000,000,000 |
| 시설자금 | 16,000,000,000 | 0 | 0 | 11,000,000,000 | |
| 채무상환자금 | 0 | 10,811,450,000 | 0 | 0 | |
| 표면이자율 | 0.00% | 0.00% | 0.00% | 0.00% | |
| 만기이자율 | 0.00% | 1.00% | 1.00% | 1.00% | |
| 전환(교환)가액 | 발행시점 | 18,672 | 8,870 | 8,870 | 11,200 |
| Refixing 한도 | 85% | - | - | - | |
| 전환(교환) 가능수량 | 발행시점 | 2,195,801 | 2,423,900 | 1,218,878 | 1,875,000 |
| 전환(교환)청구기간 | 시작일 | 2021-06-26 | 2023-02-19 | 2023-02-19 | 2024-04-26 |
| 종료일 | 2024-05-26 | 2026-12-19 | 2026-12-26 | 2028-02-24 | |
| Put Option | 시작일 | 2021-12-26 | 2024-07-19 | 2024-07-26 | 2026-03-26 |
| 주기 | 3개월 | 3개월 | 3개월 | 3개월 | |
| 조기상환수익률 | 0.00% | 1.00% | 1.00% | 1.00% | |
| Call Option | 시작일 | 2021-06-26 | - | - | - |
| 주기 | 1개월 | - | - | - | |
| 행사한도 | 40% | - | - | - | |
| 조기상환수익률 | 2.00% | - | - | - | |
| 발행대상자 | 기관투자자 등 | 기관투자자 등 | 임직원 등 | 기관투자자 등 | |
| 미상환잔액 | 현재시점 | 0 | 0 | 2,939,700,000 | 13,000,000,000 |
| 전환(교환)가액 | 현재시점 | - | - | 8,870 | 11,200 |
| 전환(교환) 가능수량 | 현재시점 | 0 | 0 | 331,420 | 1,160,714 |
| (출처) | DART(전자공시시스템) |
| (주1) | 현재시점 : 본 공시서류 제출일 전일 기준입니다. |
현재 제1회차 전환사채 및 제2회차 교환사채의 미상환잔액은 존재하지 않으며, 제3회차 교환사채 및 제4회차 교환사채가 총 15,940백만원(권면금액) 잔존하고 있습니다. 각각의 교환가액은 8,870원, 11,200원으로 현재 당사의 주가가 교환가액을 크게 하회하고 있기 때문에 단기간 내 교환 가능성은 매우 낮은 상황이며, 조기상환 가능성이 높은 상황입니다. 따라서 본 유상증자 대금 중 약 15,940백만원을 교환사채의 상환용도로 사용할 예정입니다.
다음은 오송 신축 공장에 대한 당사의 시설자금대출은 다음과 같습니다.
| [시설자금대출 중 단기차입금] | |
| (증권신고서 제출 전일 기준) | (단위 : 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 잔액 |
|---|---|---|---|---|
| 시설대출 | 산업은행 | 2025-12-26 | 3.57% | 250,000 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.68% | 250,000 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.23% | 333,370 |
| 시설대출 | 산업은행 | 2025-12-26 | 2.90% | 296,250 |
| 시설대출 | 산업은행 | 2026-01-26 | 2.74% | 138,750 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.19% | 135,780 |
| 시설대출 | 산업은행 | 2025-12-26 | 2.97% | 215,160 |
| 시설대출 | 산업은행 | 2025-12-26 | 3.19% | 47,540 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.57% | 250,000 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.68% | 250,000 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.23% | 333,330 |
| 시설대출 | 산업은행 | 2026-03-26 | 2.90% | 296,250 |
| 시설대출 | 산업은행 | 2026-04-24 | 2.74% | 138,750 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.19% | 135,770 |
| 시설대출 | 산업은행 | 2026-03-26 | 2.97% | 215,160 |
| 시설대출 | 산업은행 | 2026-03-26 | 3.19% | 47,460 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.57% | 250,000 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.68% | 250,000 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.23% | 333,330 |
| 시설대출 | 산업은행 | 2026-06-26 | 2.90% | 296,250 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.19% | 135,770 |
| 시설대출 | 산업은행 | 2026-06-26 | 2.97% | 215,160 |
| 시설대출 | 산업은행 | 2026-06-26 | 3.19% | 47,460 |
| 합 계 | 4,861,540 | |||
| (출처) | 당사 제시 |
| [시설자금대출 중 장기차입금] | |
| (증권신고서 제출 전일 기준) | (단위 : 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 잔액 |
|---|---|---|---|---|
| 시설대출 | 산업은행 | 2028-09-26 | 3.57% | 3,000,000 |
| 시설대출 | 산업은행 | 2028-09-26 | 2.90% | 3,555,000 |
| 시설대출 | 산업은행 | 2028-10-24 | 2.74% | 1,665,000 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.19% | 1,629,250 |
| 시설대출 | 산업은행 | 2028-09-26 | 2.97% | 2,581,150 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.68% | 3,000,000 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.19% | 569,600 |
| 시설대출 | 산업은행 | 2028-09-26 | 3.23% | 4,000,000 |
| 소 계 | 20,000,000 | |||
| 유동성대체액 | -4,861,540 | |||
| 합 계 : 비유동성잔액 | 15,138,460 | |||
| (출처) | 당사 제시 |
오송 신축 공장에 대한 시설자금대출 중 유동성대체된 단기차입금은 약 48.6억원이며, 이를 제외한 장기차입금은 약 151.4억원으로 총 200억원입니다.
위의 제3회차 교환사채, 제4회차 교환사채 및 오송 신축 공장 시설자금대출의 상환 예상 일정은 다음과 같습니다.
| [채무상환자금 일정] | |
| (단위 : 천원) | |
| 구분 | 상환 일정 | 합계 | |||||||||||
| 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 2027년 3분기 | 2027년 4분기 | 2028년 1분기 | 2028년 2분기 | 2028년 3분기 | ||
| 시설자금대출 | 1,528,100 | 1,666,720 | 1,666,720 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3,538,460 | 8,400,000 |
| 제3회차 교환사채 | 0 | 2,939,700 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2,939,700 |
| 제4회차 교환사채 | 13,000,000 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 13,000,000 |
| 합계 | 13,700,000 | 3,639,700 | 700,000 | 700,000 | 700,000 | 700,000 | 700,000 | 700,000 | 700,000 | 700,000 | 700,000 | 700,000 | 24,339,700 |
| (출처) | 당사 제시 |
| (주1) | 제3회차 교환사채 및 제4회차 교환사채 상환의 경우, 사채권자와의 합의에 의한 조기상환 실행으로 부채비율 개선이 목적입니다. |
당사는 오송 ATMP센터 시설자금대출 총액 200억원에 대하여 농업금융채권 약 20억원, 중소기업은행채권조건부자본증권 약 18억원, 총 기타포괄손익-공정가치측정금융상품 약 38억원을 담보로 제공하였으며, 시설자금대출 상환 시필요하다고 판단되면 해당 담보를 활용할 계획을 가지고 있으므로 이를 제외한 시설자금대출 잔액은 약 78억원입니다. 또한 남은 시설자금대출 116억원(위의 금융상품 제외 시, 약 78억원)의 상환 재원은 2026년 CRO 시장의 정상화를 가정한 비임상 CRO 사업부에서 발생하는 이익잉여금으로 분할상환하는 것을 최우선적으로 고려하고 있으며, 다음으로 뉴로나타-알의 FDA 품목허가 진행 상황에 따라 승인 여부까지 기다리지 않고 선제적인 사업화 전략인 기술이전(License Out) 계약을 통한 자금 유입의 가능성이 존재합니다. 마지막으로 당사의 예상과 다르게 2026년 CRO 시장의 정상화가 이루어지지 않아, 비임상 CRO 사업부에서 이익잉여금이 발생하지 않거나, 뉴로나타-알의 FDA 품목허가 진행 상황이 우호적이지 않아 기술이전(License Out) 계약이 여의치 않을 경우, 오송 ATMP센터 또는 비임상 CRO 사업부문의 매각을 통한 재원 마련을 고려할 계획입니다.
2) 운영자금(FDA 임상 3상 품목허가 신청 비용)
당사의 뉴로나타-알의 FDA 임상 3상 품목허가 신청 비용의 세부 내역은 다음과 같으며, 원화 환산 기준으로 총 약 55.6억원이 소요될 예정입니다. 각 단계별 비용은 임상수탁기관의 견적서를 기초로 작성되었으며 실제 실행단계에서 변경될 수 있는 예상치이며, 예상 시기 역시 임상수탁기관, FDA 등과의 협의를 통해 변경될 수 있습니다.
| [FDA 임상 3상 품목허가 신청 비용 세부 내역] | |
| (단위 : 달러, 천원) | |
| 항목 | 예상금액($) | 원화 환산(\) | 예상 시기 |
| FDA C-type Meeting (FDA 사전미팅) | 153,270 | 213,050 | 2025년 말 |
| Project Kick off (품목허가 신청 프로젝트 착수회의) | 16,000 | 22,240 | 2026년 1분기 |
| Gap Analysis (허가자료 현황 및 미비점(갭) 분석) | 60,000 | 83,400 | |
| Storyboarding (허가자료(신청/제출 문서) 구성안 기획 및 작성) |
95,000 | 132,050 | |
| Pre-BLA Meeting (품목허가(BLA) 신청 전 FDA 사전 협의 미팅) |
150,000 | 208,500 | 2026년 2분기 |
| BLA Preparation (Include ISS/ISE authoring) (생물의약품 품목허가(BLA) 신청서 작성 및 임상시험 안전성·유효성 종합보고서(ISS/ISE) 작성) |
3,200,000 | 4,448,000 | |
| Post-BLA filing Strategic support (품목허가 신청(BLA 제출) 후 추가 질의/요구 대응 전략 지원) |
150,000 | 208,500 | |
| BLA Original Submission Publishing (생물의약품 품목허가(BLA) 신청서 원본 공식 제출) |
160,000 | 222,400 | 2026년 3분기 |
| On-going BLA Publishing (품목허가 신청서 보완자료/추가자료 지속 제출) |
15,000 | 20,850 | |
| 합계 | 3,999,270 | 5,558,990 | - |
| (출처) | 당사 제시 |
| (주1) | 원달러환율 1,390원을 기준으로 작성하였습니다. |
| (주2) | 각 단계별 비용은 임상수탁기관의 견적서를 기초로 예상금액 밴드의 최대치로 작성되었으며 실제 실행단계에서 변경될 수 있습니다. |
| (주3) | BLA Preparation(품목허가 신청) 단계의 금액 산정 세부 내역은 임상수탁기관에 요청하였으며, 해당 내역 및 산정기준 등을 확인 중에 있습니다. |
1. FDA C-type Meeting (FDA 사전미팅)
품목허가를 준비하는 과정에서 FDA와의 C형 미팅을 진행합니다. 이 회의에서는 3상 임상 결과, 개발 전략, 허가에 필요한 핵심 자료 등에 대해 FDA와 심도 있게 논의하며, 앞으로 제출해야 할 자료의 범위와 승인을 위한 구체적인 방향성을 조율하게 됩니다. 실질적으로 허가 가능성, 자료 보완 사항, 임상이나 서류상의 쟁점 등을 사전에 확인할 수 있는 절차입니다.
2. Project Kick off (품목허가 신청 프로젝트 착수회의)
본격적인 허가 신청 업무의 시작을 알리는 단계입니다. 이 회의에서는 세부 일정과 주요 마일스톤, 담당자별 역할 등을 정의하고, 전체 추진 계획을 전사적으로 공유합니다. 프로젝트 추진의 기반을 마련하는 공식적인 착수 절차입니다.
3. Gap Analysis (허가자료 현황 및 미비점(갭) 분석)
현재 보유한 자료와 FDA 공식 가이드라인 및 요구사항을 비교해, 부족하거나 보완이 필요한 부분을 도출합니다. 이를 통해 추가 임상, 데이터 보강, 해석자료 마련 등 필수적으로 준비해야 할 항목을 구체적으로 설계하는 단계입니다.
4. Storyboarding(허가자료(신청/제출 문서) 구성안 기획 및 작성)
허가 신청을 위해 제출할 모든 문서의 전체 구조와 흐름을 기획합니다. 임상 요약, 안전성 및 유효성 데이터, 개발 경과 등 각종 보고서가 효과적으로 내용을 전달할 수 있도록 스토리라인, 목차, 데이터 배열 방식 등을 사전에 설계하고 작성방향을 정하는 단계입니다.
5. Pre-BLA Meeting(품목허가(BLA) 신청 전 FDA 사전 협의 미팅)
신청서 제출 직전, FDA와 한 번 더 공식 협의 미팅을 진행하며, 이 과정에서 자료의 완성도, 보완 필요성, 제출 형식 등의 세부사항을 최종 점검하고, 허가 성공 가능성을높이기 위해 남아있는 쟁점에 대해 추가적인 조율을 거칩니다.
6. BLA Preparation (Include ISS/ISE authoring) (생물의약품 품목허가(BLA) 신청서 작성 및 임상시험 안전성·유효성 종합보고서(ISS/ISE) 작성)
BLA 신청서 및 방대한 임상시험 관련 데이터, 안전성·유효성 종합보고서 등 주요 허가 자료를 공식 양식에 맞추어 체계적으로 작성하는 단계입니다.
7. Post-BLA filing Strategic support(품목허가 신청(BLA 제출) 후 추가 질의/요구 대응 전략 지원)
BLA 제출 후에는 FDA로부터 추가 질의나 자료 보완 요청이 발생할 수 있습니다. 이에 대비해 전문팀이 신속하게 응답하고 필요한 데이터를 재정리하거나 보충 자료를 제출하는 등, 전 과정을 전략적으로 지원하는 단계입니다.
8. BLA Original Submission Publishing(생물의약품 품목허가(BLA) 신청서 원본 공식 제출)
작성된 BLA 신청서를 공식적으로 FDA에 제출하는 단계입니다. 관련 부속자료와 증빙문서를 첨부하여 요건에 맞게 제출하며, 형식과 내용의 적정성을 마지막까지 점검하게 됩니다.
9. On-going BLA Publishing(품목허가 신청서 보완자료/추가자료 지속 제출)
심사 기간 중 FDA가 추가 자료를 요청할 경우 이에 적기에 대응하며, 필요에 따라 자발적으로 추가 자료도 제출합니다. 전 심사 프로세스에서 자료의 완결성과 신뢰성을 유지하기 위한 절차입니다.
3) 운영자금(운영경비)
기타 운영경비의 경우, 오송 ATMP센터 설비 잔금 약 3.5억원, 뉴로나타-알주 임상 3상 CRO 분석 잔금 3.7억원, 오송 ATMP센터 운영비 총 약 21.5억원 및 경상연구개발비 총 약 40.3억원으로 총 69.1억원의 자금을 사용할 예정입니다.
| [운영경비 세부 내역] | |
| (단위 : 천원) | |
| 항목 | 세부항목 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 합계 |
| 오송ATMP센터 설비 잔금 | GxP(LIMS, EDMS, LMS) 솔루션 | 163,260 | 108,840 | - | - | - | 272,100 |
| 바이알 충전기 | 79,800 | - | - | - | - | 79,800 | |
| 뉴로나타-알주 임상3상 분석 잔금 | 임상수탁기관(Parexel) | - | 370,854 | - | - | - | 370,854 |
| 오송ATMP센터 운영비 | 인건비 | 332,358 | 332,358 | 332,358 | 332,358 | - | 1,329,432 |
| 가스비 | 51,525 | 51,525 | 51,525 | 51,525 | - | 206,100 | |
| 전기료 | 153,000 | 153,000 | 153,000 | 153,000 | - | 612,000 | |
| 경상연구개발비 | 인건비 | 378,594 | 378,594 | 378,594 | 378,594 | 378,594 | 1,892,970 |
| 위탁연구비 및 컨설팅비 | 120,000 | 120,000 | 120,000 | 120,000 | 120,000 | 600,000 | |
| 재료비 외 기타비용 | 308,918 | 308,918 | 308,918 | 308,918 | 308,918 | 1,544,590 | |
| 합계 | 1,587,455 | 1,824,089 | 1,344,395 | 1,344,395 | 807,512 | 6,907,846 | |
| (출처) | 당사 제시 |
| (주1) | 뉴로나타-알주 품목변경허가 및 GMP이전으로 인해 2026년 상반기까지 치료제 생산을 중단하며 이에 따라 치료제 매출 역시 2026년 하반기부터 발생할 예정입니다. |
구체적으로 살펴보면, 오송ATMP센터 설비 잔금 약 3.5억원에는 GxP통합솔루션 구축 비용(LIMS - 실험실정보 관리솔루션, EDMS - 전자문서관리 통합솔루션, LMS - 학습관리 솔루션) 약 2.7억원, 소량의 액체, 분말 등을 담는 작은 병이나 용기인 바이알에 자동으로 채우는 장치인 바이알 충전기 약 0.8억원이 들어가 있습니다. 오송ATMP센터 운영비 약 21.5억원에는 식약처 실사를 위한 운영이 필요하기 때문에 해당 인건비 약 13억원, 가스비 2억원 및 전기료 약 6억원이 포함되어 있으며, 경상연구개발비 약 40.3억원에는 당사 연구소 인건비 약 19억원, 위탁연구비와 컨설팅비 6억원 및 각종 소모성 실험 재료 비용 약 15억원 등이 포함되어 있습니다.
당사는 상기 내용과 같이, 채무상환자금, FDA 임상 3상 품목허가 신청비 및 기타 운영경비로 당사 공모자금을 집행할 계획입니다. 다만, 이는 현 시점에서 당사의 주요 파이프라인별 임상 단계, 향후 계획 등을 고려하여 수립한 예산에 따른 것이므로 향후 당사의 파이프라인별 실시간 점검, 연구개발 성공 가능성 점검, 대내외적 자금조달 환경 또는 영업환경 등의 변화 등 향후 당사 영업활동 과정에서 세부 집행 계획은 변동될 수 있습니다.
다. 유상증자 진행 배경
당사는 최근 루게릭병 치료제 '뉴로나타-알' 임상 3상 주요 결과에서 아쉽게도 통계적 유의성을 충족하지 못했습니다. 이 결과로 인해 주가가 급격히 하락하며 시장 신뢰가 위축되었고, 기존과 같은 사모 방식의 자금 조달이 어려워진 상황입니다. 게다가 기존 교환사채의 조기상환 시점이 임박하여, 단기 유동성 부담이 크게 증가하고 있습니다. 이러한 상황은 당사의 연구개발 지속성과 경영 안정성 모두에 부정적 영향을 줄 수 있습니다.
그러나 당사는 효능효과군을 저속진행군으로 축소한 임상 탑라인 결과에서 통계적 유의성을 확인하였으며, 이를 바탕으로 2025년 4월에 식약처에 변경 허가 신청을 하였습니다. 현재 식약처에서 보완자료 제출을 요구하였고 당사는 2025년 9월 1일까지 해당 자료를 제출할 예정이었으나, 식약처의 오송 ATMP 센터에 대한 현장실사(GCP)도 예정되어 있기에 먼저 현장실사를 진행하면서 식약처와의 미팅을 진행한 후 보완자료를 제출하기 위한 일정 협의를 하여 2025년 10월 31일까지 연기되었습니다. 이와 별개로 당사는 식약처의 조건부 허가 여부와 상관없이, 미국 FDA에 품목허가를 신청하고 추후 글로벌 시장에 진출하겠다는 계획을 가지고 있습니다. 이를 실현하기 위해서는 글로벌 CRO 기업과의 사전미팅을 시작으로 FDA 품목허가(BLA) 준비/진행/대응 등의 일련의 과정을 진행해야하는 상황입니다.
이에 당사는 자사주를 활용하여 자금을 조달하는 기존 방식을 모색하였으나, 2024년 12월 임상 3상에서 통계적 유의성을 보이지 못해 주가가 급락하여, 추가적인 사모 자금조달의 어려움을 느끼게 되었습니다. 이에 불가피하게 본 공모 유상증자를 진행하게 되었고, 곧바로 주주서한을 당사 홈페이지에 게재하고 최근 주주총회에서도 본 공모 유상증자의 배경과 필요성, 뉴로나타-알을 비롯한 주요 파이프라인 진행 현황 및 향후 계획 등에서 대해서 최대한 소통을 하기 위해 노력할 예정입니다.
라. 주주 권익 보호를 위한 사항
당사는 금번 유상증자와 관련하여 주주와의 소통을 강화하고자 유상증자 결의일 익영업일인 8월 19일에 주주간담회 개최 안내문을 당사 홈페이지에 공지하고 8월 27일 오전 10시에 주주간담회를 개최하였습니다. 본 간담회에는 대표이사와 주요 경영진이 참석하여 이번 유상증자의 배경과 목적, 기대효과를 비롯해 당사의 중장기 사업전략과 경영목표를 상세히 설명드렸습니다. 아울러, 경영진과 주주 간 자유로운 질의응답 시간을 통해 주주들의 의견을 경청하고 회사의 입장을 적극적으로 공유함으로써 충분하고 투명한 정보 전달이 이루어지도록 노력하였습니다.
당사는 주주의 정보 접근성을 높이고 소통을 활성화하여 주주 권익을 보호하기 위해, 대표이사가 유상증자의 배경과 자금 사용 목적을 상세히 설명한 주주 안내문과 서한을 당사 홈페이지에 게재하였습니다. 또한 유상증자의 핵심 내용을 이해하기 쉽게 정리한 PT 자료를 함께 제공하고 있으며, 주주 문의를 반영한 Q&A와 관련 정보를 상시 업데이트하고 있습니다. 아울러, 주주 전담 상담 인원 2명을 배치하여 주주들의 문의에 신속하고 적극적으로 대응하고 있으며, 앞으로도 유상증자 관련 사항은 물론 당사가 추진 중인 전반적인 사업 정보를 제공하여 주주들의 권리 행사가 원활히 이루어질 수 있도록 지속적으로 지원할 계획입니다. 아울러, 주주 대응 과정에서 미흡한 부분이 발견될 경우 즉시 내부 전담 인력과 협의하여 대응 전략을 보완하고, 주주들에게 적절하고 신속한 안내가 이루어질 수 있도록 만전을 기하고 있습니다.
8월 27일까지 당사에 접수된 주주 문의와 주주간담회에서 나온 주요 질의내용은 자금의 사용목적, 예정발행가액, 유상증자 참여절차, 주가변동에 대한 우려 등입니다. 이에 대한 당사의 답변은 아래 Q&A를 참고해 주시기 바랍니다.
| 주요 문의 내용 및 당사 답변 | |
|---|---|
| Q1 | 유상증자 자금의 사용목적은 무엇인가요? |
| A1 |
이번 유상증자는 총 378억원 규모로 추진하고 있습니다. 유상증자를 통해 확보한 자금은 약 125억 원을 뉴로나타-알 FDA 품목허가 및 차기 파이프라인 연구개발 등 운영자금으로, 약 243억 원을 기존 교환사채 및 시설자금대출 상환에 사용할 예정입니다. 운영자금은 국내외 허가 및 BLA 신청, 글로벌 CRO 컨설팅 등 상용화 절차를 신속히 추진하는 데 투입하며, 채무 상환은 재무구조 개선과 향후 발생할 이자비용 절감을 통해 경영 안정성과 장기적인 주주가치 제고를 도모할 계획입니다. |
| Q2 | 유상증자의 참여 대상이 되기 위해서는 언제까지 주식을 보유해야하나요? |
| A2 |
신규로 발행할 주식을 배정받는 주주의 기준일은 9월 18일(목)로 예정되어 있습니다. 증권결제일이 T+2(매매일로부터 2영업일 후 결제)임을 감안하여, 기준일 2영업일 전인 9월 16일(화)까지 주식을 매수하셔야 유상증자 청약 자격이 부여됩니다. |
| Q3 | 자사주 처분 대금 사용용도? |
| A3 |
자사주는 최근에도 반복적으로 처분되어 현금화되었으며, 2024년 7월부터 2025년 4월까지 170만 주 이상을 매각하여 총 약 150억 원 이상의 자금을 확보했습니다. 자사주 처분 대금은 주로 아래와 같은 사항에 사용되었습니다. - 채무 조기상환(전환사채, 교환사채 관련) - 운영자금 확보 - 임상 연구개발비, 생산설비 투자 |
| Q4 | 주주들과 상의 없이 증자 진행해서 왜 희석시키는가? |
| A4 |
당사는 올해 상반기 비임상 사업부의 매출 증대를 기대하며, 상반기에는 자사주를 활용하여 자금 운영의 유동성을 확보하고 주주가치를 제고하는 것이 바람직하다고 판단하였습니다. 그러나 반기보고서를 작성하는 과정에서, 연말 기준 당초 계획했던 매출 목표를 달성하기 어려울 것으로 판단되었습니다. 정관 및 관련법령에 따라 적법한 통지 절차를 거쳐 소집된 이사회에서 현재 상황과 리스크 요인들을 모두 상세히 보고하였고, 이사회 또한 이러한 필요성에 동의하여 증자 진행을 하였습니다. 당사의 결정은 주주가치 보호와 회사의 안정적인 사업 운영을 위한 불가피한 조치였음을 양해 부탁드립니다. 또한 회사는 현재 약 477만 주의 자사주를 보유하고 있으나, 이 중 약 149만 주는 교환사채 발행에 따라 예탁결제원에 묶여 있고, 잔여 자사주 또한 장내외 처분 시 시장에 직접적인 매도 물량으로 출회되어 주가 하락을 초래할 수 있는 구조입니다. 반면 유상증자는 운영자금·채무상환자금 등을 안정적으로 확보하는 방식으로, 자사주 처분 시 발생할 수 있는 대규모 매도충격이나 자사주 처분손실(법차손) 위험을 회피할 수 있습니다. 즉, 단순히 자사주를 매각하는 방식은 단기 유동성 확보에는 기여할 수 있으나, 구조적으로 대규모 자금이 필요한 채무상환 및 지속적 연구개발비 충당에는 충분하지 않습니다. 따라서 중장기적 자본확충과 재무구조 개선을 위해 주가 희석을 감수하고 유상증자를 선택한 것입니다. |
| Q5 | 자금사용목적 보면 당장 급한 돈이 아닌 것 같은데 진행이유? |
| A5 |
재무구조 안정화 시급성: 회사는 지속적인 영업손실과 음(-)의 영업현금흐름으로 결손금이 누적되어 있으며, 이로 인해 계속기업 존속 불확실성이 제기되는 상황입니다. 2025년 내에 자기자본 확충이 이루어져야 관리종목 지정 위험을 피할 수 있습니다.
임상 및 허가 일정 대응: 오송 ATMP센터 운영비, 뉴로나타-알주 임상 3상 CRO 분석 잔금, FDA BLA 자료 제출 등 즉각적 연구개발비 집행 수요가 존재합니다. 즉, 시기를 늦출 경우 관리종목 지정, 부채상환 불이행, 연구개발 지연이라는 3중 리스크가 동시에 발생할 수 있어 자금조달이 불가피한 상황입니다. |
| Q6 | 주주총회 당시 유상증자 계획을 미리 알리지 않은 이유는? |
| A6 | 유상증자 계획과 관련하여 앞서 말씀드리지 못한 부분에 대해서 당사는 깊은 유감을 표합니다. 하지만 앞서 희석과 관련하여 답변을 드린 것처럼 연내 자금 확충을 위한 시기를 고려하였을 때 모든 분들께 충분한 설명을 드릴 수 있는 시간이 부족했다는 점 부디 너그러이 이해 부탁드립니다. |
| Q7 | 유증 미달하게 되면 주관사 인수하는가? |
| A7 | 주관사 잔액 전액 인수 조건이 포함된 계약입니다. |
| Q8 | 경영진 참여 계획? |
| A8 | 앞서 신고서 상에 신고한 사항에 대해 추가 변경가능성이 있으며, 현재시점에서는 최대주주에게 배정되는 신주인수권의 30% 정도 참여 계획을 가지고 있습니다. |
| Q9 | 1차 보완을 준비 중으로 알고 있다. 추가 보완이 있을 수 있는가? 그러면 연장되는 기간이 1차보완 기간과 동일한가? 1차 보완을 제출한 이후의 진행은 어떻게 되는가? |
| A9 | 우선 1차 보완을 제출하고 난 이후에는 2차 보완이 있을 수 있습니다. 다만 기간에 대해서는 1차와는 다릅니다. 2차 보완의 경우는 일주일 이내에 답변을 완료 해야하며 기한을 준수하지 못한 경우에는 식약처로부터 의견 거절을 받을 수 있는 경우가 존재합니다. 2차 보완 이후에는 외부자문위원회를 통해 의약품심의를 받을 수 있습니다. 1차 보완을 완료하고 나면 1차에 답변에 대한 추가 자료 제출은 불가하며 이후 현장 미팅 진행 시 1차 보완에 대한 내용은 검토 중인 관계로 미팅의 안건으로 진행 할 수 없습니다. |
| Q10 | 9월 1일 보완에 대한 사항은? 유상증자 이전에 결과가 확인이 가능하다면 증자 참여가 원활하게 될 수 있지 않을까?뉴로나타-알주의 식약처 품목변경허가 승인 시점? |
| A10 | 9월 1일에 1차 보완 제출 시점을 통보받은 이후, 저희는 해당 기간 내 제출을 위해 자료를 준비해왔으며 기한내 제출이 가능합니다. 질문 주신 것처럼 유상증자 이전에 긍정적인 결과를 도출해 모든 분들께 전달할 수 있다면 증자 성공 가능성은 더욱 높아질 것입니다. 다만, 회사 내부적으로도 유의미한 결과가 나올 수 있다고 판단하고 있으나, 결과는 어느 누구도 확정할 수 없는 상황입니다. 예를 들어 성공 가능성을 70% 이상으로 본다고 하더라도, 만약 좋지 않은 결과가 유상증자 이전에 나오게 된다면 그 파급효과는 회사에게 있어 더 큰 부정적 결과를 초래할 수 있습니다. 따라서 이러한 리스크를 최소화하기 위해 식약처로부터 전체적 검토 기간을 늘려 결과 발표 시점을 유상증자 완료 이후로 조정하려는 계획입니다. 이에 따라 유상증자 완료된 후 시점에 승인에 관한 답변을 받을 수 있을 것이라 판단합니다. |
| Q11 | 유상증자 기간 내 자사주 활용 계획은 어떻게 되는가? |
| A11 | 유상증자 공시 이후에는 보유하고 있는 자사주는 움직일 수 없게 되어 있습니다. 유상증자가 끝난 이후에 대한 계획의 경우는 차후 공시 사항으로 연결되어 있어 직접적인 답변을 드리기는 어렵습니다. 다만 주주가치를 제고하는 방향에 있어서는 내부적으로 검토를 하겠습니다. |
| Q12 |
식약처 및 FDA 바이오 마커 분석이 원래 부터 계획되어 있는 것인가? 진행속도가 느리다라고 불리는 Slow Progressor라는 군이 어떻게 정의하는가? |
| A12 |
대부분 모든 분들께서 아시는 사항으로 저희는 FDA와 MFDS(한국식약처)로부터 임상계획승인을 동시에 받았습니다. MFDS의 경우 계획 단계 있어 통계 분석 부분을 사전에 검토하지 않는 절차로 운영되고 있으며, FDA는 DB Lock 전에 통계분석 계획서를 사전 승인하는 제도가 있어 통계 분석 방법에 대한 계획서를 제출하고 승인을 받아야 합니다. 이는 사후적으로 데이터를 조작할 가능성을 차단하기 위한 것입니다. 따라서 저희는 이러한 절차에 따라 사전에 승인을 받았으며, 이에 따라 사후 분석과는 무관합니다. 바이오마커는 계획된 분석으로 주분석군인 ITT 분석군, 즉 무작위 배정되었던 그룹에서 확보된 것입니다. 이는 앞서 말씀드린 토퍼센과 동일한 결과이며, 이 결과만으로도 MFDS와 FDA와 충분히 논의가 가능하다고 판단했습니다. 다만, 국내의 경우 토퍼센이 8월 20일 MFDS로부터 승인을 받기 전까지는 Surrogate Marker로 인정된 사례가 없었기 때문에, Subgroup을 통해 유의성 있는 그룹을 찾아 함께 포함시키기로 하였습니다. 이에 따라 1월부터 3월까지 Subgroup 유의성에 대한 분석을 진행하여 의미 있는 결과를 도출했고, 이를 기사화하였습니다. 또한 통계 분석 방법과 Subgroup 관련된 내용 및 절차는 CRO 업체와 공유해 CRO 업체가 직접 검토를 진행하여 해당 내용에 문제가 없다는 판단을 확인하였습니다. 그 결과, 바이오마커 분석 및 Subgroup에 관한 ALSFRS-R score, CAFS, SVC 등 관련 유의미한 결과를 CRO에서 최종 분석하여, 해당 결과를 최종 임상시험결과 보고서에 포함되었습니다. Slow Progressor에 대한 post-hoc analysis 결과를 확인 후 전체 임상시험 대상자에서 Slow progressor를 판별할 수 있는 인자를 확인하였습니다. 분석 방법으로 통계 프로그램인 Decision Tree를 사용하였으며, 이를 통해 투여 전 baseline 시점에의 NfL 기준 수치를 확인할 수 있었습니다. 따라서 이번 변경 허가 신청에서도 환자를 구분할 수 있는 해당 수치에 관한 내용을 포함하여 제출했습니다. |
| Q13 | 조건부허가라고 하는 것은 추후 추가 임상을 요구하는 것인지? |
| A13 | FDA의 경우 Accelerated Approval을 받게 된다면 추가 임상(3B)를 진행해야하는 가이드라인에 따라 임상을 진행해야 합니다. 이는 토퍼센도 적용 되어 동일하게 진행하였습니다. 한국 식약처의 경우는 허가를 내주거나 혹은 또다른 조건 내용으로 저희에게 필요한 사항을 요구 할 수 있다고 판단합니다. |
| Q14 | 내년도 단기 계획은 어떻게 되는가? 오송 ATMP 운영은 어떻게 되는가? |
| A14 | 국내 CDMO의 경우는 대형사(삼성바이오로직스, 셀트리온 등)는 항체치료제 혹은 단백질 바이오의약품을 중심으로 대규모 위탁생산에 집중하고 있습니다. 다만, 세포/유전자 치료제 분야의 경우는 생산 공정 복잡성과 특수정으로 인하여 중견 및 중소 기업의 시장 진입 기회가 충분하다고 판단하고 있습니다. CDMO 사업 진행을 위해서는 설비, 품질,연구 기술 전문성 및 규제 대응 필수인데 이러한 요건은 저희가 충분히 보유하고 있다고 판단하며 식약처로부터 생산 허가 획득을 받을 즉각적으로 사업화를 진행할 수 있습니다. 이를 위해서 사전에 시장 Pool를 구축하고 있습니다. |
| (출처) 당사 제시 |
또한 더 면밀하고 상세한 기업실사를 위해 단순히 대표주관사에게만 기업실사를 의존하지 않고 공동주관사를 같이 선임하여 단일 회사에 의존하지 않고 2개의 증권회사에서 기업 실사를 진행하였습니다. 게다가 이사회에서도 단순히 본 유상증자에 정량적 조건에 따른 결의만 진행한 게 아니라, 유상증자의 당위성 및 주주소통 절차 등 주주 보호를 위해 정성적 기준으로 본 유상증자에 대한 목적 및 필요성 등을 논의하였으며, 이러한 조치를 통해 당사는 유상증자 절차의 투명성을 확보하고, 주주의 신뢰를 제고하는 데 최선을 다하기 위해 노력하고 있습니다.
| [이사회의사록_발췌] |
 |
|
이사회의사록_발췌 |
| (출처) 당사 제시 |
당사는 유상증자와 관련된 주요 일정, 세부 사항, 목적 및 필요성을 전자공시시스템(DART) 및 회사 홈페이지를 통해 투명하게 제공할 예정입니다. 또한, 유상증자 투자설명서 발송 시 주주 서한 형태의 안내문을 통해 개별적으로 안내해드릴 계획입니다.
아울러, 유상증자의 목적과 중요성에 대한 주주 여러분의 이해를 돕기 위해 2025년 8월 27일에 개최될 예정인 주주간담회에서 배경 및 필요성을 상세하고 명확하게 설명드렸습니다.
| [유상증자 주요 Q&A 내용에 대한 홈페이지 공지] |
 |
|
q&a 홈피 공지 |
| (출처) 당사 제시 |
또한, 주주 여러분과의 실시간 소통을 강화하기 위해 주주의 문의에 대하여 IR팀에서 신속히 응대하고, 주요 질의사항에 대한 답변을 정리하여 FAQ 형태로 홈페이지에 게시함으로써 소액 주주를 포함한 모든 주주의 정보 접근성을 높이고자 합니다.
당사는 상기와 같이 주주 및 시장과의 적극적인 소통을 통해 회사의 경영 전략 및 본 유상증자의 배경과 필요성을 명확히 전달하는 한편, 본 유상증자와 관련 후속 정보를 지속적으로 제공해 나가겠습니다.
3. 자금의 운용계획
공모자금 입금 후 실제 투자집행 시기까지의 자금보유 기간에는 국내 제 1금융권 및 증권사 등 안정성이 높은 금융기관의 상품에 예치할 계획이며, 자금의 사용시기가 도래하여 단기간 내에 자금의 사용이 예상되는 경우에는 당사의 단기금융상품 계좌 등에 일시 예치하여 운용할 예정입니다.
한편, 예기치 못한 비용의 증가 또는 발생이 있을 수 있으며, 당사는 필요 시 추가로 소요되는 자금은 자체자금 또는 외부 차입/투자유치 등 재무활동을 통해 조달할 예정입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
해당사항 없습니다.
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
1. 연결대상 종속회사 개황(연결재무제표를 작성하는 주권상장법인이 사업보고서, 분기ㆍ반기보고서를 제출하는 경우에 한함)
연결대상 종속회사 현황(요약)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | 0 | 0 | 0 | 0 | 0 |
| 비상장 | 2 | 0 | 0 | 2 | 0 |
| 합계 | 2 | 0 | 0 | 2 | 0 |
1-1. 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
2. 회사의 법적, 상업적 명칭
당 회사는 '코아스템켐온 주식회사'라 표기 합니다. 또한 영문으로는 'CORESTEMCHEMON Inc.(약호 "CORESTEMCHEMON")'이라 표기 합니다.
3. 설립일자 및 존속 기간
당 회사는 2003년 12월 30일에 설립되었으며, 계속사업기업으로 존속기간이 정해져 있지 않습니다.
4. 본사의 주소, 전화번호 및 홈페이지
- 주소 : 경기 성남시 분당구 판교로255번길 24
- 전화번호 : 02-497-3711
- 홈페이지 : http://www.corestemchemon.com
5. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
 |
|
중소기업확인서 |
 |
|
벤처기업확인서 |
6. 주요 사업의 내용 및 향후 추진하려는 신규사업
공시서류의 'Ⅱ.사업의 내용'을 참조하시기 바랍니다.
7. 신용평가에 관한 사항
작성기준일 현재 해당사항이 없습니다.
8. 회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 코스닥시장 상장 | 2015년 06월 26일 | 기술성장기업의 코스닥시장 상장 |
2. 회사의 연혁
1. 회사의 본점 소재지 및 그 변경
해당 사항 없습니다.
2. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2023년 03월 31일 | 정기주총 | 감사 윤준섭 | - | 감사 임헌정 |
| 2024년 03월 30일 | - | - | - | 사외이사 홍권희 |
| 2025년 03월 28일 | 정기주총 | 감사 윤준섭 | 사내이사 양길안 사내이사 김경숙 사내이사 송시환 사내이사 권광순 사외이사 한상배 사외이사 박건우 |
- |
주) 비상근감사 윤준섭을 상근감사로 신규 선임하였습니다.
3. 최대주주의 변동
해당 사항 없습니다.
4. 상호의 변경
해당 사항 없습니다.
5. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행중인 경우 그 내용과 결과
해당 사항 없습니다.
6. 회사가 합병등을 한 경우 그 내용
해당 사항 없습니다.
7. 회사의 업종 또는 주된 사업의 변화
- 세포치료제 개발 및 제조/생산
- 비임상 CRO 대행
8. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
| 일자 | 내용 |
| 2023.04 | 미국 법인 Corestemchemon US Inc. 설립 |
| 2024.10 | 뉴로나타-알주(성분명: Lenzumestrocel) 임상 3상 종료 |
| 2025.04 | 뉴로나타-알주(성분명: Lenzumestrocel) 품목허가 변경 신청(한국 식품의약품안전처) |
3. 자본금 변동사항
자본금 변동추이
| (단위 : 원, 주 ) |
| 종류 | 구분 | 23기 (2025년 반기말) |
22기 (2024년말) |
21기 (2023년말) |
|---|---|---|---|---|
| 보통주 | 발행주식총수 | 32,870,376 | 32,870,376 | 32,870,376 |
| 액면금액 | 500 | 500 | 500 | |
| 자본금 | 16,435,188,000 | 16,435,188,000 | 16,435,188,000 | |
| 우선주 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 기타 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 합계 | 자본금 | 16,435,188,000 | 16,435,188,000 | 16,435,188,000 |
4. 주식의 총수 등
1. 주식의 총수 현황
| (증권신고서 제출일 전일 기준) | (단위 : 주, %) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 94,000,000 | 6,000,000 | 100,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 33,870,376 | 3,838,340 | 37,708,716 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | 1,000,000 | 3,838,340 | 4,838,340 | - | |
| 1. 감자 | 1,000,000 | - | 1,000,000 | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | 3,838,340 | 3,838,340 | 보통주 전환 | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 32,870,376 | - | 32,870,376 | - | |
| Ⅴ. 자기주식수 | 4,775,050 | - | 4,775,050 | 합병으로 인한 기타취득 (교환사채 위탁수량 포함) |
|
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 28,095,326 | - | 28,095,326 | - | |
| Ⅶ. 자기주식 보유비율 | 14.5 | - | 14.5 | - | |
주) 자기주식수에는 제2회차, 제3회차, 제4회차 교환사채 교환대상으로 한국예탁결제원에 예치한 수량이 포함되어 있습니다.
2. 자기주식 취득 및 처분 현황
| (증권신고서 제출일 전일 기준) | (단위 : 주) |
| 취득방법 | 주식의 종류 | 기초수량 | 변동 수량 | 기말수량 | 비고 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 취득(+) | 처분(-) | 소각(-) | |||||||
| 배당 가능 이익 범위 이내 취득 |
직접 취득 |
장내 직접 취득 |
- | - | - | - | - | - | - |
| - | - | - | - | - | - | - | |||
| 장외 직접 취득 |
- | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 공개매수 | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 소계(a) | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 신탁 계약에 의한 취득 |
수탁자 보유물량 | - | - | - | - | - | - | - | |
| - | - | - | - | - | - | - | |||
| 현물보유물량 | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 소계(b) | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 기타 취득(c) | 보통주 | 5,585,677 | - | 2,302,775 | - | 3,282,902 | 자기주식 처분 및 교환사채 교환대상으로 위탁 |
||
| - | - | - | - | - | - | - | |||
| 총 계(a+b+c) | 보통주 | 5,585,677 | - | 2,302,775 | - | 3,282,902 | 자기주식 처분 및 교환사채 교환대상으로 위탁 |
||
| - | - | - | - | - | - | - | |||
주) 자기주식 처분수량에는 제2회차, 제3회차, 제4회차 교환사채 발행에 따라 한국예탁결제원에 교환 대상으로 예치한 주식수량이 포함되어 있습니다.
5. 정관에 관한 사항
1. 정관 변경 이력
해당 사항 없습니다.
2. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| 1 | 원료의약품 및 완제의약품의 연구개발, 생산, 판매 공급업 | 영위 |
| 2 | 원료의약품 및 완제의약품의 수입, 유통 및 판매 공급업 | 미영위 |
| 3 | 의료용 기기, 측정, 시험기기, 과학기기, 의약외품, 시약 등의 연구개발, 제조, 수입, 유통, 판매 및 임대 사업 |
미영위 |
| 4 | 제대혈, 면역세포, 줄기세포 등의 인체조직 보존, 증식 및 기타 엔지니어링 관련 사업 |
영위 |
| 5 | 세포치료제 연구 개발, 제조 및 판매 사업 | 영위 |
| 6 | 국내외 세포치료 재활 센터 및 의료기관 등의 운영지원 및 운영 사업 |
미영위 |
| 7 | 세포치료제 수탁 생산 사업 | 미영위 |
| 8 | 유전자치료제 연구 개발, 제조 및 판매 사업 | 미영위 |
| 9 | 유전자 은행 및 유전자 검사 사업 | 영위 |
| 10 | 임상연구, 임상분석, 시험 수탁 대행 사업 | 미영위 |
| 11 | 임상약리학적 검사 사업 및 진단검사 중개 사업 | 미영위 |
| 12 | 바이오 연구개발 컨설팅 및 교육 사업 | 영위 |
| 13 | 비임상 및 임상실험 대행업 | 영위 |
| 14 | 신약개발 및 연구 대행업 | 영위 |
| 15 | 신약개발 자문 및 알선업 | 영위 |
| 16 | 화장품의 연구 개발, 제조 및 판매 사업 | 미영위 |
| 17 | 부동산 및 그 부대시설의 임대 사업 | 미영위 |
| 18 | 의약학 및 의료기기 연구개발업 | 영위 |
| 19 | 의료용 물질 및 의약품 제조업 | 영위 |
| 20 | 보건업 및 수의업 | 미영위 |
| 21 | 응용소프트웨어 개발 및 공급업 | 영위 |
| 22 | 정보기술 및 컴퓨터 운영관련 서비스업 | 미영위 |
| 23 | 연구시설임대업 | 미영위 |
| 24 | 교육서비스업 | 영위 |
| 25 | 사회복지서비스업 | 미영위 |
| 26 | 위 각 호의 사업관련 해외사업 및 수출입업 | 영위 |
| 27 | 위 각 호의 사업에 관련한 일체의 부대 사업 | 영위 |
II. 사업의 내용
1. 사업의 개요
| 분류 | 주요 사업 | 주요 사업 내용 |
|---|---|---|
| 바이오의약품사업부 | 세포치료제 | 세포치료제 의약품 제조 및 판매 |
| 비임상CRO사업부 | 비임상CRO | 비임상실험대행 및 효력, 효능분석 용역 제공 |
당사는 줄기세포기술을 기반으로 희귀ㆍ난치성질환에 대한 새로운 줄기세포 치료제를 개발, 생산 및 판매를 영위하고 있으며, 줄기세포치료제의 상용화에 성공하여 2015년 2월 부터 환자에게 투약을 개시하였습니다. 또한, 희귀ㆍ난치성 질환 등에 대한 줄기세포치료제들을 신규로 개발하고 있으며, 2세대(차세대) 줄기세포치료제에 대한 기초연구와 공정자동화기술의 연구 및 개발을 진행하고 있습니다.
당사는 2022년 12월 2일에 국내 Top 3 비임상 CRO기관 중의 하나인 종속회사 (주)켐온을 흡수합병하여 성장성과 안정성을 겸비한 사업구조를 보유하고 있습니다. 비임상 CRO는 신약개발의 경우, 사람을 대상으로 하는 임상시험 전 단계인 전임상(비임상) 단계에서 독성(안전성)과 약효(유효성)를 동물실험을 통하여 사전 검증하는 시험을 담당하는 기관으로서, 켐온사업부의 신속하고 높은 수준의 R&D 서비스는 당사의 제품개발 속도 증대에 기여하는등 당사의 다양한 사업 모델의 실현에 중요한 인프라이자 당사의 안정적 수익구조에 기여하고 있습니다.
당사는 목표 질환별로 Key Opinion Leader(KOL)가 이끄는 임상센터와의 긴밀한 협력을 바탕으로 한 유기적인 산학중개연구를 통해 희귀 난치성 질환에 대해 의미 있는치료 효과를 보여주는 세포치료제를 개발하여, 희귀의약품으로서 가급적 빠른 기간 내에 상용화 하는 것을 목표로 하고 있습니다. 희귀의약품으로서 빠른 기간 내에 해당 질환에 대한 실제 효과를 입증한 후에, 해외 라이센스-아웃 추진과 적응증 확대를통한 수익 증대를 추구하며 향후 2세대 줄기세포치료제를 주도하여 세계적인 바이오의약품 상용화 선도기업으로 도약하고자 합니다.
2. 주요 제품 및 서비스
당사의 주요 제품과 서비스별 매출액 및 총매출액에서 차지하는 비율은 다음과 같습니다.
| (기준일: | 2025년 06월 30일) | (단위: 백만원,%) |
| 분류 | 사업부문 | 매출유형 | 품목 | 용도 | 매출액 | 매출액비율 |
|---|---|---|---|---|---|---|
| 바이오의약품사업부 | 세포치료제의약품부문 | 제품 | 뉴로나타-알주 | 루게릭병 치료제 | 188 | 1.62 |
| 비임상CRO사업부 | 비임상실험대행용역부문 | 용역 | R&D서비스 | 유효성 및 독성실험 | 11,423 | 98.38 |
| 합계 | 11,610 | 100.00 | ||||
2014년 7월 30일 식약처로부터 의약품 품목허가를 받은 뉴로나타-알주는 신경계 질환에 대해서 최초로 시판허가된 줄기세포치료제이며, 루게릭병에서 기능개선을 통한 효능효과로 허가된 첫번째 치료제로서, 2015년 2월말부터 제품 발매가 되었습니다.
| [뉴로나타-알주 일반정보] |
| 주성분 | 자가골수유래중간엽줄기세포 |
| 의약품 분류 | 전문의약품 (희귀의약품) (분류번호 439: 기타의 조직세포와 치료 및 진단) |
| 품목허가 | 2014년 7월 |
| 포장단위 | 4㎖/프리필드시린지 x 자사포장단위 |
| 저장방법 및 사용(유효)기간 |
기밀용기, 냉장보관(2~8℃), 제조시로부터 48시간 |
3. 원재료 및 생산설비
1. 주요 원재료의 가격 변동추이
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 천원) |
| 주요 원재료 | 구분 | 제23기 반기말 (2025년) |
제22기 (2024년) |
제21기 (2023년) |
|---|---|---|---|---|
| 배지 | 국내 | 38 | 38 | 38 |
| Trypsin-EDTA | 국내 | 71 | 71 | 69 |
| HBSS | 국내 | 294 | 294 | 285 |
| DPBS | 국내 | 293 | 280 | 280 |
| Beagle Dog | 국내 | 1,700 | 2,600 | 2,600 |
| 수입 | 3,100 | 3,100 | 3,300 | |
| Rabbit | 국내 | 175 | 175 | 165 |
| 수입 | 200 | 200 | 200 | |
| Guinea Pig | 국내 | 67 | 67 | 61.5 |
| 수입 | - | - | - | |
| Rat | 국내 | 15 | 15 | 14.5 |
| 수입 | 45.6 | 45.6 | 45.6 | |
| Mouse | 국내 | 5.8 | 5.8 | 5.6 |
| 수입 | 63 | 63 | 78.8 | |
| Fish | 국내 | 1.5 | 1.5 | 1.5 |
| 수입 | - | - | - |
주1) 배지는 내수구매로 전환하였으며, 원재료 제조사가 해외업체라도 국내대리점을 통해 원화결제로 구매한 경우에는 '내수'로 분류하였습니다.
주2) 연구개발용 시료 및 도구 등은 대부분 장기간 동안 지속적인 반복 구매를 하게 되는데, 국내 대리점을 통해 수입되는 품목이 많아 해외 제조사의 제조원가 상승에 따른 가격 인상 정책 또는 환율 변동에 따라 가격이 변동하게 되며, 구입시마다 거래처와의 협의를 통해 가격을 결정하게 됩니다.
주3) 각 동물별로 주령, 체중,암/수 성별에 따라서 비용은 달라집니다.
2. 기타 주요 매입처 및 공급의 안정성에 관한 사항
당사의 주요 원재료의 매입처 중 당사와 특수 관계가 있는 매입처는 없습니다. 주요 원재료에 대한 매입처는 공시 대상기간 동안 지속적으로 거래를 해왔으며 현재까지 공급과 관련한 문제가 발생한 사례는 없습니다. 다만 주요 원재료의 가격 변동이 환율 변동, 가격 인상 정책에 따라 상승할 수 있어 주요 원재료에 대한 공급업체 다각화를(2개 업체 선정) 진행하였습니다. 따라서 향후 공급의 안정성 측면에서 우려할 사항은 없다고 판단됩니다.
3. 생산설비 현황
(1) 생산설비 현황
| 기준일 : 2025년 06월 30일 ) | (단위 : 천원) |
| 구분 | 기초 장부금액 | 취득 | 처분 | 감가상각 | 대체 | 기타 | 2025년 |
| 토지 | 24,774,222 | - | - | - | - | - | 24,774,222 |
| 건물 | 21,967,808 | - | - | (326,733) | - | 21,641,075 | |
| 구축물 | 567,918 | - | - | (22,534) | - | 545,384 | |
| 기계장치 | 47,794 | - | - | (8,861) | - | 38,933 | |
| 차량운반구 | 6,054 | - | - | (1,397) | - | 4,657 | |
| 공구와기구 | 31,517 | - | - | (6,640) | - | 24,877 | |
| 비품 | 571,768 | 12,244 | - | (115,562) | - | 468,450 | |
| 시설장치 | 1,888,439 | 19,000 | - | (195,073) | 10,000 | 1,722,366 | |
| 연구및시험기기 | 7,723,796 | 486,970 | - | (999,997) | 400 | 7,211,169 | |
| 건설중인자산 | 31,451,453 | 2,077,916 | - | - | (10,400) | - | 33,518,969 |
| 합계 | 89,030,769 | 2,596,130 | - | (1,676,797) | - | - | 89,950,102 |
(2) 생산능력 및 가동률
① 바이오의약품사업부
현재 뉴로나타-알주를 양산 생산하고 있는 용인GMP제조소의 생산능력은 연간 500Lot 이며 가동률은 아래 표와 같습니다.
| (기준일 : 2025년 06월 30일 |
| 구 분 | 제23기 반기말 | 제22기 | 제21기 |
|---|---|---|---|
| 연평균 가동률 | 1.4% | 16.8% | 31.8% |
주) 연평균 가동율 감소 요인은 뉴로나타-알주 품목허가 변경 신청에 따라 치료제 제조를 중단하였기 때문입니다. 용인GMP는 더 이상 사용하지 않으며, 식품의약품안전처에서 품목변경 허가 신청 및 오송ATMP센터 GMP인증이 승인될 경우 오송ATMP센터에서 치료제 제조를 진행할 예정입니다.
② 비임상CRO사업부
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 백만원) |
| 사업부분 | 품목 | 제23기 반기말 | 제22기 | 제21기 |
|---|---|---|---|---|
| 비임상 시험 | 안전성/유효성/기타/생체시료분석 | 50,000 (11,423) |
50,000 (28,762) |
50,000 (32,052) |
주) 비임상CRO사업부는 연구용역을 수주 받아 투입원가에 따라 매출을 산정하고 있습니다. 이에 따라 현재 인력 및 시설 기준으로 연간 최대 매출을 500억원으로 가정하고 기준일까지 발생한 매출을 가동율로 판단하여 기재하였습니다.
(3) 지적재산권 관련 사항
지적재산관 관련 사항은 상세표를 참고해주시기 바랍니다.
4. 매출 및 수주상황
1. 매출실적
| 연결 기준(2025년 06월 30일) | (단위: 백만원) |
| 사업부문 | 매출유형 | 품 목 | 제23기 반기말 |
제22기 | 제21기 | |
|---|---|---|---|---|---|---|
| (2025년) | (2024년) | (2023년) | ||||
| 세포 치료제 |
제품 | 줄기세포치료제 | 내수 | 188 | 1,094 | 1,605 |
| 수출 | - | 27 | ||||
| 소계 | 188 | 1,121 | 1,605 | |||
| 비임상 CRO |
용역 | R&D서비스 (비임상실험대행 등) |
내수 | 11,363 | 27,642 | 31,841 |
| 수출 | - | - | 211 | |||
| 소계 | 11,363 | 27,642 | 32,052 | |||
| 합 계 | 내수 | 11,610 | 28,736 | 33,446 | ||
| 수출 | - | 27 | 211 | |||
| 소계 | 11,610 | 28,763 | 33,657 | |||
2. 수주상황
| 2025년 06월 30일 기준 | (단위 : 백만원 ) |
| 품목 | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
|---|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
| 안전성평가 | - | - | 2,322 | 66,080 | 1,821 | 45,831 | 501 | 20,249 |
| 합 계 | 2,322 | 66,080 | 1,821 | 45,831 | 501 | 20,249 | ||
주1) 비임상CRO사업부의 연구용역 계약에 의거하여 실험기간 동안 투입한 발생 원가 범위 내에서 매출을 인식(납품)하고 있습니다.
주2) 바이오의약품사업부의 줄기세포 치료제 뉴로나타-알주는 자가골수유래 중간엽줄기세포로서, 병원에서 전문의의 처방에 의해, 환자로부터 채취한 줄기세포를 일정기간 배양하여 치료제를 생산하며, 통상 출고 후 당일내(최대 48시간 이내) 해당 환자에게 투여를 하게 됩니다. 이와 같은 환자 맞춤형 치료제의 특성상 장기 매출계약 등과 같은 수주 확보에는 해당하지 않아 본 수주상황에는 표기하지 않았습니다.
3. 판매방법
(1)바이오의약품사업부
당사가 개발한 줄기세포치료제 뉴로나타-알주는 당사 및 판매사를 통하여 국내 시장에 공급하고 있습니다. 자가골수유래 줄기세포치료제의 특성상 병원에서 환자에게 처방이 내려지면, 그에 따라 생산 주문을 접수하고, 제조를 시작하여 치료제를 출고하며, 판매사는 당사로부터 치료제를 인수받아 의약품 도매업체를 통해 병원에 납품을 합니다.
(2) 비임상CRO사업부
2000년 창업 당시는 비임상시험 대행 뿐 아니라 신약개발을 목표로 합성신약과 천연물신약을 연구개발한 경험을 갖고 있습니다. 이후 비임상 CRO 사업에 전념할 수 있도록 구조를 조정하고 현재는 본 비임상 CRO 사업에만 집중하고 있습니다. 그러나 신약의 연구개발 사업에서 얻어진 Know-How를 바탕으로 고객들에게 비임상 시험과 관련한 지식 뿐 아니라 신약개발의 초기단계에서 일어나는 여러 가지 문제에 대해서 설명해주고 향후 이루어질 비임상 및 임상시험 전략을 수립까지 병행하며 시험 수주를 진행 하고 있습니다.
4. 판매전략
(1) 바이오의약품사업부
① 줄기세포치료제(뉴로나타-알주)
당사는 줄기세포치료제 개발 시 개발 초기단계부터 해당 질환에 대한 국내 오피니언 리더 그룹과 함께 연구를 진행하여, 해당 질환의 특성에 맞는 제형 및 투여경로가 선정되도록 함으로써, 향후 임상에서 적용이 편리하고 효능효과가 최대화될 수 있도록 하는 한편, 연구자에게 임상연구 결과를 논문으로 발표할 수 있도록 하고 있습니다.
- 국내 판매전략: 의료계 저변 확대
ㆍ 학술영업 및 개별 의료진 접촉
- 해외 판매전략
ㆍ 임상 결과 논문 게재
ㆍ 해외 학술영업 적극 추진
ㆍ 해외 컨퍼런스를 통한 홍보
ㆍ 해외 비영리 협회 및 환우 단체 마케팅
ㆍ Agent 협업(중국, 미국, 러시아, 일본)
② 기술이전 모델
루푸스 치료제 및 관절염/연골결손 치료제는 개발 초기부터 제약사로 License-Out을 하는 기술이전 모델을 추진하고 있습니다. 또한 뉴로나타-알®의 국내허가를 바탕으로 해외 License-Out을 추진하고 있습니다. 당사는 기술이전 대상 탐색을 위하여 아래의 활동을 하고 있습니다.
ㆍ 전시회 및 비즈니스 파트너링 행사 참여
ㆍ 국/내외 제약사 접촉
ㆍ 국/내외 Agent를 통한 국/내외 제약사들에 연락
회사는 2016년 7월 26일자로 한림제약(주)과 루푸스 및 루푸스 신염 치료제에 대한 기술이전 및 공동연구개발에 관한 계약을 체결하였으며 향후에도 제품의 판매경로는기술이전의 내용에 따라 다양할 수 있을 것으로 예상됩니다.
(2) 비임상CRO사업부
비임상 시험의 특성상 신물질 개발을 위한 연구개발의 단계에서의 경험은 안전성평가를 수행 하는데 있어서 장점으로 작용합니다. 때문에 전방산업인 신약연구개발 분야에서의 경력을 가지고 있는 인력을 확보하는 것은 경쟁사 대비 유리한 위치를 확보하는 것을 의미합니다. 회사는 기 확보하고 있는 경험이 많은 핵심 멤버 뿐 아니라 전방산업 분야에서의 연구인력들을 적극적으로 채용하고 적극적인 훈련과 교육을 통한 육성을 통하여 우수한 인재를 양성하고 있습니다. 그 결과 우수한 연구시험 결과물은 국내 최초로 천연물의약품의 US FDA에서 임상 2, 3상을 각각 승인받은 신약후보물질의 비임상 시험을 모두 수행하였고, 또한 바이오의약품으로는 국내 최초 FDA 임상 3상 승인을 받은 신약후보물질에 대해서도 비임상 시험 부분을 담당했습니다. 시험평가 대상 물질에 대한 사항은 물론이고 연구개발 단계에서부터의 시험에 대한 컨설팅 능력을 갖추고 있습니다. CRO 사업의 특화된 우수한 인력은 매출 수주를 위한 영업 일선에도 전략적으로 배치되어 비임상 CRO 업체로서의 연구수행과 컨설팅을 동시에 실시하는 적극적인 기술마케팅을 실시하고 있습니다.
5. 주요 매출처
(1) 바이오의약품사업부
뉴로나타-알주 치료제의 공급은 국내 유수의 종합병원을 대상으로 하고 있습니다.
(2) 비임상CRO사업부
당사가 영위하는 업종은 계약에 의한 연구개발시험 대행업으로 계약당사자와 계약에서 비밀이나 비공개사항으로 규정하고 해당 연구개발용역의 비밀공개로 인한 손실을 초래할 가능성이 높음으로 공개하지는 못하나 매출비중에서 국내 제약사의 비중이 다수를 차지하고 있습니다.
5. 위험관리 및 파생거래
1. 시장위험과 위험 관리
시장위험에 대한 노출이 중요하지 않아서 기재를 생략합니다.
2. 파생상품 및 풋백옵션 등 거래현황
당사는 공시서류작성기준일 현재 해당사항이 없습니다.
6. 주요계약 및 연구개발활동
1. 경영상의 주요 계약
(1). 라이센스아웃(License-out) 계약
공시서류 작성기준일 현재 당사가 체결 중인 라이센스아웃(License-out) 계약 현황은 다음과 같습니다.
[라이센스아웃 계약 총괄표]
| 품 목 | 계약상대방 | 대상지역 | 계약체결일 | 계약종료일 | 총계약금액(백만원) | 수취금액(백만원) | 진행단계 |
| CS20AT04(주1) | 한림제약 주식회사 | 대한민국 | 2016.7.26 | 라이센스기간(주2) | 13,000 | 3,000 | 임상1상 종료 |
(주1) 전신성 홍반성 루푸스 및 루푸스 신염 세포치료제
(주2) 라이센스기간은 상기품목 관련 코아스템이 출원한 특허 중 가장 늦게 출원한 특허의 존속기한 또는 제품출시일로 부터 15년 중 늦게 도래하는 날까지의 기간
| 1.계약상대방 | 한림제약 주식회사(대한민국) |
| 2.계약내용 | 루푸스 및 루푸스신염 치료제의 공동연구개발, 기술이전 및 사업화 |
| 3.대상지역 | 국내 |
| 4.계약기간 |
계약체결일: 2016.07.26 계약종료일: 상기품목관련 코아스템이 출원한 특허 중 가장 늦게 출원한 특허의 존속기한또는 제품출시일로 부터 15년 중 늦게 도래하는 날까지의 기간 |
| 5.총계약금액 | 13,000백만원, 로열티 별도 |
| 6.수취금액 |
<반환의무 없는 금액> 계약금: 1,500백만원 (2016.8.26 수취) 해당사항 없음 |
| 7.계약조건 |
계약금(Upfront Payment): 1,500백만원 - 수취조건: 계약 체결시
마일스톤(Milestione): 11,500백만원 - 수취조건:각 임상단계 성공, 품목허가, 판매 승인
로열티(Royalty): 매출액의 7% - 수취조건: 매출 발생시 |
| 8.회계처리방법 | 계약금 및 마일스톤 수취액 3,000백만원은 기술수익 인식 |
| 9.대상기술 | 전신성 홍반성 루푸스 및 루푸스 신염의 치료, 개선 등의 효과를 얻고자 하는 세포치료제 |
| 10.개발진행경과 | -치료용 조성물 특허 출원(2013.07) -국내 1상 임상시험 승인(2015.05) -코아스템과 한림제약간 루푸스치료제 기술이전 및 공동연구개발 계약체결(2016.07) -임상시험용 의약품 투여 개시(2017.09) -임상 1상 임상시험 투약완료(2019.02) -임상 1상 종료(2019.07) -후속임상시 적절한 치료 대상 선정을 위하여 루푸스 신염 및 루푸스 혈구감소 환자 대상으로 동종골수유래 줄기세포 연구자 임상 승인(2018.09.27) -루푸스 신염 및 루푸스 혈구감소증 연구자주도 임상 개시(2019.09) |
| 11.기타사항 | - |
(2) 기타 계약(MOU 등)
| 계약상대방 | 계약의 목적 및 내용 | 계약체결시기 및 계약 기간 |
계약금액 |
| 태국나레수안대학교 | GLP 컨설팅 MOU 체결 | 2017년 08월 03일 | - |
| 파미노젠 | 신약후보물질 발굴 서비스 및 비임상시험의 MOU 체결 | 2017년 09월 07일 | - |
| LSK글로벌PS | 신약공동연구개발 역량 강화를 위한 MOU체결 | 2017년 11월08일 | - |
| 건양대병원 | 의료기기 중개임상시험지원센터와 의료기기 중계, 임상시험 활성화를 위한 MOU 체결, |
2018년 04월 13일 | - |
| 태국 NPRCT-CU | 업무ㆍ기술 협력 MOU 체결 | 2018년 07월 19일 | - |
| 한국화학융합시험연구원 | GLP 시험 기술 및 노하우 무상 이전 업무에 대한 MOU 체결 | 2019년 04월 16일 | - |
| 연세대학교 심혈관제품유효성평가센터 |
산학 협력을 위한 MOU 체결 | 2019년 08월 05일 | - |
| 태국 출랄롱코른대학교 국립영장류연구센터 |
업무ㆍ기술 협력 MOU 체결 | 2019년 10월 01일 | - |
| (주)에스피메드 | 비임상ADME, 신약 개발 컨설팅 등을 기반으로 IND 승인을 위한 정보 교류 및 기술협력 MOU 체결 |
2019년 12월 30일 | - |
| 인제대학교 산학협력단 | 업무역량강화 및 증진을 위해, 상호 사업 분야의 협력 | 2020년 01월 17일 | - |
| 아이알아이파마(주) | 고품질 4D 혈관-뇌 장벽(BBB) 생체조직칩 제품 기술 개발을 위함 |
2020년 03월 30일 | - |
| 한국폴리텍대학 | 산업기술개발과 기술교육 등에 관한 상호협력 | 2020년 09월 09일 | - |
| (주)넥셀 | 연구 협력 MOU 체결 | 2020년 11월 04일 | - |
| 충북대학교 | 3차원 세포배양기술 등 동물대체시험법 관련 업무협의 | 2021년 02월 01일 | - |
| (주)제이맥켐 | 협력연구, 인력교류를 통하여 의약품연구개발 | 2021년 03월 17일 | - |
| (주)메디팁 | 의약품 개발분야의 발전을 위한 연구/교육 컨설팅 협력 | 2021년 04월 27일 | - |
| 대구경북첨단의료산업진흥재단(DGMIF) 실험동물센터 |
상호 협력을 위한 MOU 체결 | 2021년 06월 01일 | - |
| 에스엠엘메디트리 | 양사의 기술 융합을 통해 관련 사업분야의 성공적 추진 | 2021년 08월 06일 | - |
| 재미한인수의사회 (Korean Veterinary Society of America, KVSA) |
전략적 상호 발전을 위한 MOU 체결 | 2021년 11월 03일 | - |
| 아주대학교 | 융합복합의료제품 연구개발지원 등을 위한 학술,연구 상호교류 활성화 촉진 |
2021년 11월 11일 | - |
| ㈜씨앤에이아이 | AI기반 Digital Pathology 연구개발의 효율적인 추진을 위함 | 2021년 11월 25일 | - |
| 건국대학교 산학협력단 및 건국대학교 기술지주㈜ |
산학협력체계 구축을 MOU 체결 | 2021년 11월 29일 | - |
| 충북대 산학협력단 | 조직 칩에서 uptake clearance, 분포계수를 예측하기 위한 플랫폼 개발 |
2021년 12월 13일 | - |
| (주)드림씨아이에스 | Early phase의 후보물질 개발, 신약개발 전주기 등에 관한 협력체계 구축 |
2022년 05월 10일 | - |
| 호서대학교 (임상병리학과) | 바이오화학산업을 이끌어 갈 GLP전문인력 발굴 및 양성을 위함 | 2022년 06월 01일 | - |
| (주)젬크로 | 유전자변형 질환무델마우스를 이용한 비임상시험에 관한 협력체계 구축 |
2022년 06월 28일 | - |
| Naresuan University | GLP전문인력의 트레이닝 및 교류를 통한 비임상시험 서비스 발전 |
2022년 08월 31일 | - |
| 분당서울대병원 재생의학센터 | 연구중심병원육성 R&D 사업 연구 개발협력 | 2022년 12월 20일 | - |
| 대전대학교 천안한방병원 웰니스 임상연구센터 |
상호 업무협력 - 설치류 및 영장류를 이용한 비임상시험 | 2023년 03월 07일 | - |
| 중소기업벤처부, 인천광역시, 연세대학교 및 바이오 관련 기업 |
업무 협약 - 의약바이오 분야 혁신 창업기업 발굴, 육성 | 2023년 03월 22일 | - |
| Biocytogen-KNTSC | 상호 업무협력 | 2023년 03월 24일 | - |
| 신구대학교 산학협력단 | 산학협력협정 | 2023년 04월 03일 | - |
| 센트럴바이오 | 상호 업무협력 - 화학물질, 의약품 등 비임상시험 | 2023년 04월 05일 | - |
| 대전대학교 천안한방병원 웰니스 임상연구센터 |
상호협력 협약 | 2023년 04월 06일 | - |
| 전북대학교병원 폐질환 유효성평가센터 |
업무 협약 - 폐질환(감염병) 진단마커, 의료기기 및 치료제 개발을 위한 유효성평가 |
2023년 04월 12일 | - |
| 서울아산병원 항암유효성평가지원센터 |
상호간의 교류와 협력을 위함 | 2023년 05월 02일 | - |
| ㈜멥스젠 | ORGAN-ON-A-CHIP 및 의약품 전달 시스템 개발의 상호교류 및 협력 |
2023년 05월 11일 | - |
| 덕성여자대학교 | 산학협력협정 | 2023.07.11 | - |
| 경북대학교 메디바이오 핵심소재 산업혁신기반구축 사업단 |
업무 협약 | 2023.08.26 | - |
| 다우케미칼 | 향후 시험수주를 위한 Master Service Agreement (MSA) 체결 | 2023.09.04 | - |
| 주식회사 뉴로벤티 | 상호 업무협력 | 2023.09.05 | - |
| 디엑스앤브이엑스㈜ | 바이오마커 발굴 및 동반진단 서비스를 포함한 업무의 상호협력에 관한 협약 |
2023.10.16 | |
| 이미타사이언스㈜ | ORGAN-ON-A-CHIP 및 의약품 전달 시스템 개발의 상호교류 및 협력을 포함한 상호간 협력체계 구축 |
2023.10.30 | |
| 신데카바이오 | AI 신약개발의 비임상서비스 지원을 위한 전략적 파트너 업무협약 |
2023.12.13 | |
| 주식회사 시파코리아 | 안전성약리시험 서비스를 포함한 업무의 상호협력 | 2024. 01.18 | |
| ㈜ 바오밥에이바이오 | AI를 활용한 신약개발 및 cryoEM 서비스를 포함한 업무의 상호협력에 관한 협약 |
2024.02.01 | |
| 충북대학교 산학협력단 | 글로벌 지역혁신 선도연구센터사업과 관련해 업무 협조및 정보교류 |
2024.02.23 | |
| (주)압타머사이언스 | 바이오의약품 분석 서비스를 포함한 업무의 상호협력에 관한 협약 |
2024.10.10 | |
| (주)바이오스페로 | Organ and Organoid-on-Chip 및 의약품 평가 시스템을 포함한 업무의 상호 협력 |
2024.11.06 | |
| (주)레드진 | 세포기반 배양 인공혈액 상업화 및 사업확대를 포함한 업무의 상호협력에 관한 협약 |
2024.11.26 | |
| (주)에이티지라이프텍 |
바이오마커 발굴 및 분석 서비스를 포함한 업무의 상호협력에 관한 협약 |
2025.07.15 |
2. 연구개발활동
(1) 바이오의약품사업부
① 개발활동의 개요
당사의 중앙연구소는 줄기세포를 기반한 치료제를 개발하기 위하여 신규기반 기술 구축, 안전성과 유효성 관련 비임상연구, 생산성 향상 기술 개발 등을 수행하고 있습니다.
② 연구개발 담당조직
- 연구개발 조직 개요
| 구분 | 주요 내용 |
|---|---|
| 조직명 | 코아스템켐온(주) 중앙연구소 |
| 조직형태 | 기업부설연구소 |
| 운영현황 |
설립 : 2005년 3월 10일(최초 인증일) - 신규 기능강화 물질 탐색 - 신규 제형/ 제제 개발 - 신규 타겟 발굴 - 신규 질환 맞춤형 동물모델 확립 및 평가 - 치료제 작용기전 연구 - 바이오마커 발굴 |
신약 개발은 많은 인력을 유지하면서 많은 시간과 자금이 소요되기 때문에 특히 희귀질환 및 난치성 질환의 경우, 전문의의 요청에 따라 치료제 개발 니즈와 가능성을 검토하는 것은, 개발 대상후보(candidate)를 찾고 초기 개발 형태(제형, 투여부위 및 방법, 임상시험 디자인)를 결정하기 위하여 R&D 회사들이 부담해야 하는 비용을 절감시켜 주는 좋은 전략입니다. 당사는 초기 단계부터 목표 질환에 대표성 있는 의료진과 긴밀한 협력관계를 유지하며 장기간에 걸쳐 공동 연구개발을 진행하는 체계로 연구개발을 수행하고 있습니다.
(2) 비임상CRO 사업부
① 연구개발 활동 개요
CRO(Contract Research Organization, 계약연구기관) 사업이란 의약품, 식품, 화학물질, 화장품 등 신물질을 탐색하고 개발하는 모든 과정에서 요구되는 광범위한 연구개발 용역을 제공하고 그 대가를 수익의 기반으로 하는 연구개발서비스 사업으로 정의됩니다. 이러한 서비스는 단순용역을 넘어 신물질개발 파트너로서의 역할이 강조되고 있습니다.
당사는 CRO 전문기관으로서, 의약품(합성신약, 세포치료제, 유전자치료제 등), 화학물질 및 농약 등 인간의 건강과 안전에 관계되는 인허가가 필요한 물질들에 대하여 칩, 세포, 장기, 실험동물 등을 이용하여 연구개발 서비스를 제공하는 비임상시험(Non-Clinical Research)전문 바이오 기술기업입니다.
② 연구개발 조직
비임상CRO사업부의 자체 R&D는 연구소장 총괄로 모든 센터가 관여하지만, 인허가 자료에 필요한 안전성, 효력시험등은 모두 운영책임자 책임을 전제로 운영되고 있습니다. 또한, 모든 시험의 신뢰성을 부여하기 위해서 QAU가 별도의 부서로 존재하고 있습니다.
| 구분 | 주요 내용 |
|---|---|
| 조직명 | 코아스템켐온(주) 비임상연구소 |
| 조직형태 | 기업부설연구소 |
| 운영현황 |
설립 : 2001년 1월 18일(최초 인증일) - 안전성/유효성 평가 시험방법 개발 |
(3) 연구개발인력 현황
| 구분 | 조직명 | 박사 | 석사 | 기타 | 합계 |
| 바이오의약품사업부 | 중앙연구소 | 4 | 14 | 5 | 23 |
| 비임상CRO사업부 | 비임상연구소 | 10 | 60 | 104 | 174 |
(4) 핵심연구인력 현황
| 구분 | 성명 | 소속(직위) | 최종학위 | 주요경력 | 주요프로젝트 |
|---|---|---|---|---|---|
| 1 | 김경숙 | 연구소 상임고문 |
박사 (한양대 의학) |
진단검사의학과 전문의 한양대 의생명과학연구원 연구부교수 한양대 정신건강연구소 연구조교수 오송첨단의료복합단지 신약개발 지원센터 자문위원 카톨릭의대 산부인과학교실 연구전임의 양평길병원 진단검사의학과 과장 |
루게릭병 줄기세포치료제 개발 골관절염 줄기세포치료제 개발 루푸스 줄기세포 치료제 개발 다계통위축증 줄기세포치료제 개발 임상용 줄기세포 배양액 개발 대량 세포배양시스템 개발 |
| 2 | 송시환 | 비임상CRO 사업부 사장 |
박사 (서울대 수의학) |
한국화학연구소 선임연구원 ㈜켐온 대표이사 |
KIT의 GLP 시스템구축 관련 동물실험책임자 및 시험책임자 보건복지부과제: 천연물을 이용한 알레르기 관절염 치료제의 산업부과제: 경구용 내성 진균감염 치료제 개발 연구책임자 식약처과제: 천초근을 이용한 발암성시험 연구책임자 과학기술부과제: 현장활용 가능 독성스크리닝 시스템구축 및 식약처과제: 천연물의 NTP 독성시험 과제 책임자 |
| 3 | 이령아 | 연구개발 혁신본부 본부장 |
박사 (이화여대 의학) |
이화여대 의학과 박사 서울대학교 외과 전임의 및 임상의학연구소 연구 전임의 Thomas Jefferson University, Kimmel cancer center 연수 원자력병원 외과 과장 이화여자대학교 의과대학 교수 이화여자대학교 의과대학 외과학교실 주임교수 이대목동병원 대장암 센터장 |
본인 요청에 의한 미기재 |
| 4 | 이태용 | 중앙연구소 연구소장 |
박사 (충북대 응용약학) |
코아스템 세포치료제 QC 팀장 코아스템 세포치료제 제조관리 팀장 코아스템 세포치료제 QC/QA 팀장 코아스템 세포치료 공정혁신 팀장 코아스템 중앙연구소 연구소장 |
루게릭병 줄기세포치료제 개발 골관절염 줄기세포치료제 개발 루푸스 줄기세포치료제 개발 다계통위축증 줄기세포치료제 개발 임상용 줄기세포 배양액 개발 대량 세포배양시스템 개발 |
| 5 | 김문순 | 비임상연구소장 | 석사 (충북대 약학) |
한국생명공학연구원 연구원 ㈜켐온 약리약효시험책임자 ㈜켐온 비임상연구소 신뢰성보증업무책임자 GLP본부장/운영책임자 |
본인 요청에 의한 미기재 |
| 6 | 이용상 | 헬스케어본부 본부장 |
박사 (서울대 농생명공학) |
식품의약품안전처 서울청 / 유해물질분석과 / 과장 ㈜인바이오 / 생명과학연구소 / 연구소장 / CTO Tunas Sawa Erma(Indonesia) / 연구책임자 / GM ㈜LG화학 / 생명과학 정밀화학 제형개발 파트장 한국화학연구원 / 스크리닝연구부 코아스템켐온 춘천연구소 연구소장 |
본인 요청에 의한 미기재 |
3. 연구개발 비용
별도재무제표기준
| ( 기준일 : 2025년 06월 30일 ) | (단위: 천원,%) |
| 구 분 | 제23기 (2025년 반기말) |
제22기 (2024년) |
제21기 (2023년) |
제20기 (2022년) |
비 고 | |
|---|---|---|---|---|---|---|
|
비용의 성격별 분류 |
원재료비 | 2,313,516 | 3,998,436 | 3,504,694 | 3,659,142 | - |
| 인건비 | 706,629 | 2,072,125 | 1,547,674 | 1,430,184 | - | |
| 감가상각비 | 134,113 | 505,319 | 546,164 | 544,353 | - | |
| 위탁용역비 | 1,161,303 | 3,335,446 | 4,012,783 | 4,324,706 | - | |
| 기타 | 575,739 | 2,754,247 | 3,920,085 | 857,451 | - | |
| 연구개발비용 합계 | 4,891,300 | 12,665,573 | 13,531,400 | 10,815,836 | - | |
| (정부보조금) | (148,074) | (630,091) | (767,969) | (550,932) | - | |
| 보조금 차감 후 금액 | 4,743,226 | 12,035,482 | 12,763,431 | 10,264,904 | - | |
|
회계처리 내역 |
판매비와 관리비 | 4,743,226 | 12,035,482 | 12,763,431 | 10,264,904 | - |
| 회계처리금액 계 | 4,743,226 | 12,035,482 | 12,763,431 | 10,264,904 | - | |
|
연구개발비 / 매출액 비율 [연구개발비용합계÷당기매출액×100] |
40.85 | 44.04 | 39.00 | 204 | - | |
주) 연결회사 코아스템바이오주식회사 및 Corestemchemon US Inc. 는 연구개발활동을 하지 않기에 연결 기준 연구개발비는 별도로 표기하지 않았습니다.
4. 연구개발 실적
(1) 바이오의약품사업부
① 연구개발 진행 현황 및 항후계획
공시서류 작성기준일 현재 당사 연구개발 진행 중인 신약[개량신약, 복제약(시밀러) 등 포함]의 현황은 다음과 같습니다.
| [연구개발 진행 총괄표] |
| 구 분 | 품 목 | 적응증 |
연구 시작일 |
현재 진행단계 |
연구 중단일 |
비 고 | ||
| 단계(국가) | 승인일 | |||||||
| 바이오 |
중간엽 줄기세포 치료제 |
뉴로나타 -알® |
근위축성 측삭경화증 |
2004년 |
품목 허가(한국) 임상 3상(한국) 임상 1상(한국) |
2014년 2020년 2024년 |
- |
조건부 품목허가 MFDS, FDA 임상 3상 실시 현탁화제 변경을 위한 임상 1상 완료 |
| CE211AT15 | 루푸스 | 2012년 |
임상 1상(한국) 연구자임상(한국) |
2015년 2018년 |
- | 1상 임상시험, 연구자임상시험 종료 공동개발 |
||
| CE111BR16 | 다계통위축증 | 2013년 | 임상 1상(한국) | 2015년 | - | 1상 임상시험 종료 | ||
| CE211BR19 | 소뇌실조증 | 2016년 | 연구자임상(한국) | 2019년 | - | 연구자임상시험 종료 | ||
| CE211NS21 | 시신경 척수염 | 2021년 | 임상 1상(한국 | 2024년 | - | 1상 임상시험 승인 | ||
| 유도만능 줄기세포 치료제 |
CE223BR17 |
파킨슨, 퇴행성신경계질환 |
2017년 | 비임상 | - | - | 비임상 | |
|
세포외 소포체 |
EV231NU20 | 특발성 폐섬유증 | 2021년 | 비임상 | - | 비임상 | ||
- 품 목: 뉴로나타-알®-근위축성측삭경화증
| 구 분 | 줄기세포치료제 | |||||||||||||||||||||||||||||||||||
| 적응증 |
근위축성측삭경화증(루게릭병)에서 질환의 진행속도 완화 - 루게릭병은 운동신경세포만 선택적으로 사멸하는 신경계퇴행성질환으로 감각신경은 유지되면서 사지 마비, 구마비 및 호흡근마비가 비가역적으로 진행되어 발 병 후2~3년내 보조호흡 상태에 이르거나 사망하는 질환. |
|||||||||||||||||||||||||||||||||||
| 작용기전 |
뉴로나타-알®®;이 분비하는 조절성 T세포(Treg) 분화유도 전사인자(Foxp3) 및 항염증 사이토카인(TGF-β1, IL-4, IL-10)이 병소부위의 미세 면역 환경을 개선시킴. 뉴로나타-알®®;이 분비하는 TNF-α 및 IL-1β를 억제하여 M2 표현형을 증가시키고, 뉴로나타-알®®이 분비하는 신경보호인자(VEGF, BDNF, IGF)가 운동신경세포의 사멸을 감소시킴.
|
|||||||||||||||||||||||||||||||||||
| 제품의 특성 |
- 시판 허가 된 최초의 신경계 질환에 대한 중간엽줄기세포 치료제이며 루게릭병에서 기능개선을 통한 효능효과로 허가된 첫 번째 치료제로, 국내에서 희귀의약품 등재 및 시판 허가되어 2015년 2월부터 발매 개시하였음. - 루게릭병의 병소 부위인 중추신경계는 혈관-뇌장벽에 의해 분리되어 있고 정맥 주사 등의 방법으로 병소 부 위에 세포가 도달하기 어렵기 때문에 해외에서 개발되고 있는 루게릭병 줄기세포치료제들이 매우 침습적 경로(척수궁 절제 수술을 통한 척수내 세포 이식)를 사용하는데 반해, 당사는 신경과에서 손쉽게 접근할 수 있는 경로인 척수강내 주사 투여 가능한 제형과 용법으로 개발하여, 용법의 침습성을 낮추어 의사의 사용이 용이함. - 기존 루게릭병에 대해 개발 실패한 물질들이 병리기전 중 단일 기전만을 대상으로 한 반면 뉴로나타-알®®은 중간엽줄기세포가 분비하는 다양한 인자가 병리기전에 복합적으로 작용하여 신경세포사멸을 방지함으로써 신체기능 개선 및 질환 진행 속도 완화 효과를 나타냄. - 중간엽줄기세포가 분비하는 성장인자, 항염증 인자, 면역조절인자를 극대화하도록 설계된 당사의EfficHigh기술로제조되어우수한신경보호작용및항염증매개면역조절작용을나타냄. 뉴로나타-알®®의2상임상시험(n=71)에서 투여 후4개월및6개월에서ALSFRS-R 점수 변화량은 시험군-1.69점(-0.42점/월), 대조군-4.67점(-1.17점/월)으로(p=0.0002), 뉴로나타-알® 투여군에서 기능 저하를 월등히 감소시켜주는 효과를 나타냄. 뉴로나타-알®®은 신체 기능의 저하를72.9% 개선시켰으며, 81%가 시험약에 반응하였음(*ALSFRS-R 점수: 루게릭병(ALS)에서 신체 기능의 악화를 측정하는 지표로, 루게릭병 환자에서1개월에평균약1점씩떨어짐). |
|||||||||||||||||||||||||||||||||||
| 진행경과 |
- 치료용 조성물 특허 보유(한국, 미국), 국내 의약품 특허목록 등재(2015.01) - 연구자임상시험 완료(2009.12) - 1/2상 임상시험 완료(2013.05) - 희귀의약품 지정(2013.12) - 의약품 품목허가(2014.07) - 제품 발매 및 투여 개시(2015.02) - 3상 임상시험 승인(2015.04) - US FDA 희귀의약품 지정(2018.08) - 3상 임상시험계획 변경승인(2019.03) - EU EMA 희귀의약품 지정(2019.03) - 뉴로나타-알®®; 허가 변경승인(2019.05) - US FDA Pre-IND 미팅(2019.09) - US FDA IND submission (US FDA IND 신청 2020.02) ㆍUS FDA IND approved (US FDA 3상 IND 승인 2020.07) ㆍ한국 식약처 3상 임상시험계획 변경승인(2020.08) ㆍUS FDA 긴급임상 승인(20.12) ㆍ국내 3상 임상시험 개시(21.01) - 현탁화제 변경에 대한 1상 임상시험 승인(2022.08) - 현탁화제 변경에 대한 식품의약품안전처 품목허가 변경 (2024.11) - 임상 3상 임상시험 TLF 수령(2024.12) - 임상3상CSR 수령(2025.04) - 뉴로나타-알®주 식약처 품목 허가사항 변경 신청(2025.054) |
|||||||||||||||||||||||||||||||||||
| 향후계획 |
- 현탁화제 변경에 대한 식품의약품안전처 품목허가 변경 신청 예정 - 허가 조건에 따라3상 임상시험 실시 중. 투약 완료. 결과보고서 작성 중 - 3상 임상시험의 결과를 바탕으로 신청한 품목 허가사항 변경요청의 보완자료 작성 및 대응 - 3상 임상시험의 결과를 바탕으로 신속 승인(Accelerated Approval)을 준비 중 |
|||||||||||||||||||||||||||||||||||
| 경쟁제품 |
- 근위축성측삭경화증에는 합성의약품인 리루졸(판매사: 젠자임)과 에다라본(판매사: 미쓰비시다나베)가 시판 중임. - 리루졸은 2-3개월의 수명 연장 효과가 있는 반면 간독성 등 약물부작용으로 사용할 수 없는 환자 비율이 제한적. - 에다라본은 투여 후 6개월간의 신체기능을 평가했을 때 제한적인 효과가 있는 것으로 확인되었으나, 이 질환에서 의미있는 치료제는 아닌 것으로 보임 - 뉴로나타-알®®;은 규제당국에 의해 허가된 유일한 루게릭병 줄기세포치료제이며, 가장 빠르게 추격하고 있는 제품은 미국의 Brainstorm사가 개발 중인 유사 제제(자가골수유래 줄기세포)가 미국에서 3상 임상을 진행하였으나, 1차 및 2차 효능평가 변수에서 통계적으로 유의미한 결과에 도달하지 못해 실패함. |
|||||||||||||||||||||||||||||||||||
| 관련 논문 등 |
- Kim HY, Paek J, Par HK, Choi MR, Yoon HS, Kim KS, et al. Efficacy and Safety of Autologous Bone Marro w-derived Mesenchymal Stem Cell Treatment in Patients With Amyotrophic Lateral Sclerosis. J Korean Neu rol Assoc. 2009;27(2):163-169. - SH Kim, Phase I Trial of Repeated Intrathecal Autologous Bone Marrow-Derived Mesenchymal Stromal Cell s in Amyotrophic Lateral Sclerosis, STEM CELLS TRANSLATIONALMEDICINE 2015;4:1?8 - SH Kim, Biological markers of Mesenchymal Stromal Cells as Predictors of response to Autologous Stem Cell Transplantation in Patients with Amyotrophic Lateral Sclerosis; an Investigator? Initiated Trial and In Viv o Study, STEM CELLS 2014, - SH Kim, Phase I/II trials of autologous BM derived stem cell therapy in ALS, Clinical Neurology 2016 56 Su pplement 1(S228), Embase - SH Kim, A PHASE 2 STUDY FOR SAFETY AND EFFICACY EVALUATION OF TREATMENT OF AMYOTROPH IC LATERAL SCLEROSIS USING AUTOLOGOUS BONE-MARROWDERIVED STROMAL CELL; Amyotrophi c Lateral Sclerosis and Frontotemporal Degeneration, 2015; 16(Suppl. S1): 1?62 - SH Kim, Immune-inflammatory modulation as a therapeutic strategy of stem cell therapy in ALS; Clinical Ev aluation Vol.44, No. 3, Dec.2016 - Oh Ki Wook, Repeated Intrathecal Autologous Mesenchymal Stem Cells for Amyotrophic Lateral Sclerosis; Annals of Neurology, epub, 26 July 2018. - Nam, Jae-Yong et al. “Efficacy and safety of Lenzumestrocel (Neuronata-R® inj.) in patients with amyotrophic lateral sclerosis (ALSUMMIT study): study protocol for a multicentre, randomized, double-blind, parallel-group, sham procedure-controlled, phase III trial.” Trials vol. 23,1 415. 18 May. 2022, doi:10.1186/s13063-022-06327-4 - Nam, Jae-Yong et al. “Long-term survival benefits of intrathecal autologous bone marrow-derived mesenchymal stem cells (Neuronata-R&®reg;: : lenzumestrocel) treatment in ALS: Propensity-score-matched control, surveillance study.” Frontiers in aging neuroscience vol. 15 1148444. 12 Apr. 2023, doi:10.3389/fnagi.2023.1148444 |
|||||||||||||||||||||||||||||||||||
| 시장규모 |
Globaldata에서 2018년 발표한 자료에 따르면 근위축성측삭경화증 질환의 전체 시장 규모는
|
|||||||||||||||||||||||||||||||||||
| 기타사항 |
뉴로나타-알주는 개발단계에서 정부의 R&D 지원을 받아 개발함
|
|||||||||||||||||||||||||||||||||||
- 품 목: CE211AT15
| 구 분 | 중간엽 줄기세포치료제 | ||
| 적응증 |
- 적응증: 루푸스, 루푸스신염 - 루푸스(systemic lupus erythematosus, SLE)는 만성 전신성 자가면역질환으로 정확한 발병원인을 모르며 환자의 면역체계가 이물질(외부항원)과 자기 몸의 세포나 조직의 항원과 다르다는 것을 구별하지 못하게 되어, 면역체계는 자신의 세포로부터 유래된 항원을 공격하는 항체(자가항체)를 만들고, 자가항체가 자기 항원과 결합하여 면역복합체를 형성함. 이 면역복합체는 조직 안에 축적되어 염증을 일으키고 조직 손상 및 통증을 유발하게 되며, 면역복합체가 신장, 뇌, 폐 및 신장 등 주요장기 침범 시 발생하는 합병증은 증세가 심각하며 사망률이 높아짐 - 가임기 여성에게 빈발하여 경제활동을 어렵게 하고 합병증 발생 시 치명적인 수 있으나, 평생 계속해서 재발하며 완치가 어려운 만성질환임 |
||
| 작용기전 |
중간엽줄기세포는 면역세포 조절작용을 통해 자가면역질환에서 과도하게 활성화된 면역반응과 염증작용을 조절함으로써 관해 유도 및 유지
|
||
| 제품의특성 |
- 당사의 EfficHigh 기술로 제조된 CE211AT15은 반수체 일치 혈연의 골수유래 MSC로 면역거부반응의 위험이 없으며, 면역조절과 관련된 단백질(TGF-β1 등) 분비능이 매우 우수하여 면역세포 증식 억제 효과, 염증물질 생성 억제, T세포 및 B 세포 증식 억제, T세포 분비 cytokine 발현 억제 작용을 통해 자가면역질환에 의해 과도하게 활성화된 면역반응을 조절하고 염증반응을 억제하여 루푸스에서 관해를 유도하고 재발을 방지할 것으로 기대됨 - 정맥주사 하는 제품으로 기존의 줄기세포치료제들이 시술을 동반하였던 것에 비해 투여 방법이 매우 용이함 - 루푸스 신염 환자를 대상으로 안전성 및 내약성 평가를 위한 1상 임상연구 완료 - 줄기세포치료제의 치료효과에 대한 개인맞춤형 효능 증진을 위한 바이오마커 발굴 및 실용화 연구 중 |
||
| 진행경과 |
- 치료용 조성물 특허 출원(2013.07) - 국내 1상 임상시험 승인(2015.05) - 코아스템과 한림제약간 루푸스 치료제 기술이전 및 공동연구개발 계약 체결(2016.07) - 임상시험용 의약품 투여 개시(2017.09) - 임상 1상 임상시험 투약완료(2019.02) - 임상 1상 종료(2019.07) - 후속 임상 시 적절한 치료 대상 선정을 위하여 루푸스 신염 및 루푸스 혈구 감소 환자 대상으로 동종골수 유래 줄기세포 연구자 임상 승인(2018.09.27) - 루푸스 신염 및 루푸스 혈구감소증 연구자주도 임상 개시(2019.09) - 루푸스 및 루푸스신염 환자들을 대상으로 치료목적사용 2020년까지 총 8차례 진행 - 루푸스 신염 및 루푸스 혈구감소증 연구자주도 임상 결과보고서 최종화 승인(2022.08) |
||
| 향후계획 | 1상 임상시험 및 연구자주도 임상시험 결과 분석하여 치료 대상을 확정하여 2상 임상시험 예정 | ||
| 경쟁제품 |
- 현재 표준치료요법으로 스테로이드와 면역억제제가 사용되고 있으나 면역억제제와 스테로이드에 대한 불응성 혹은 부작용을 나타내는 환자들이 있고, 약물 사용 중단 시 악화(플레어)되거나 기존 약에 불응하게 되는 경우가 발생함 - 최근 루푸스에 대한 세계 최초의 치료제로 B세포 표적 항체(belimumab)가 승인되었으나 보다 더 안전하고 효과적인 치료제 개발이 필요함 - 1997년에 국내에서 불응성 루푸스 환자에게 조혈모세포 이식술이 시도되었으며 장기 추적관찰 결과 치료효과를 보인 환자 있었으나 이식편대 숙주질환 발생, 심각한 감염, 치료시술과 관련된 사망 위험성 증가(5~13%) 높은 비용 문제로 실용화가 되지 못하였음 - 현재 불응성 루푸스 치료를 위해 T세포 또는 B세포를 표적으로 하는 생물학적 제제를 이용한 루푸스 임상연구가 다수 이루어지고 있으나, 시판이 가시화되고 있는 제품은 아직 없음 - 루푸스에 대한 줄기세포치료 연구는 중국에서 활발히 이루어지고 있음. Nanjing Univ.의 Sun팀은 여러 환자에게 줄기세포를 투여 임상연구를 수행했으나, 선정 제외기준, 세포의 종류(제대, 골수 등) 등의 조건이 일관성 없이 실시된 연구자 임상시험으로 비교 대상이 없고, 비 혈연 동종 줄기세포를 사용하여 면역거부반응의 위험성이 있음 |
||
| 관련 논문 등 | ㆍSang-Cheol Bae, Safety and tolerability of bone marrow-derived mesenchymal stem cells in lupus animal models and a phase I clinical trial in human, Lupus, 2022 1-9 | ||
| 시장규모 |
2022년전루푸스치료제글로벌시장규모는약2.5억달러수준으로연평균성장률(CAGR) 7.5%를나타냄. 노인 인구의 증가, 만성 질환증가로 치료제에 대한 수요는 꾸준히 증가하고 있음.
|
||
| 기타사항 |
CE211AT15는 정부의 R&D 지원을 받아 개발 - 보건복지부 지원 보건의료연구개발사업 완료(과제명: 루푸스 줄기세포치료제 개발, 2014.08) - 보건복지부 첨단의료기술개발사업 완료(루푸스 줄기세포치료제 임상1상) - 미래창조과학부원천기술개발사업수행완료(과제명: 전신홍반루푸스줄기세포치료제의유효성검증을위한 임상바이오마커발굴및실용화) |
- 품 목: CE111BR16
| 구 분 | 중간엽줄기세포치료제 |
| 적응증 |
- 적응증: 다계통위축증 - 다계통위축증(multiple system atrophy, MSA)은 병인이 명확히 규명되지 않은 복합인자 퇴행성 신경계질환으로 발병 후3~5년이면단독보행이어려워지며, 8~10년이내사망에이르는질환으로파킨슨병과유사한운동완서, 강직, 진전 등의 증상을 보이지만 파킨슨병과는 달리 도파민성 약제에 대한 증상 호전이 없는것이 특징임. |
| 작용기전 | 중간엽줄기세포의 항염증 작용 및 신경재생 증진효과, 중간엽줄기세포의 신경보호 효과 |
| 제품의특성 |
- 당사의 EfficHigh 기술로 제조된 CE111BR16은 중간엽줄기세포(MSC)로 MSC가 분비하는 성장인자, 항염증인자, 면역조절인자에 의한 신경보호작용 및 항염증 매개 면역조절작용이 우수한 것을 확인하였음. - 다계통위축증 모델(6-OHDA)에서 본제의 단회 경동맥 투여 시, 행동기능이 향상되었고, 도파민성 신경원 소실감소, 선조체 신경원의 소실이 감소, 선조체에서 분비되는 도파민 양 증가, 세포사멸과 관련된 caspase/microglia 활성이 감소되어 질환 치료효과를 나타냈음. - 임상적으로는 병소부위에서 세포사멸 및 염증반응이 감소하여 질환 진행속도를 완화/정지시키고 신체 기능(파킨슨 증상)이개선되는 효과를 나타낼 것으로 기대됨. |
| 진행경과 |
- 치료용 조성물 특허 출원(2013.11) - 비임상시험(GLP 독성_ 완료(2015.05) - 1상 임상시험 승인(2016.06) - 임상시험용 의약품 투여 개시(2018.06) ㆍ1상 임상시험 종료 후 안정성 평가를 위한 장기 연장연구 진행 중(2018.11) - 1상 임상시험 1/2 단계 투약완료(2019.04) - 1상 임상시험 3단계 개시(2019.08) - 1상 임상시험 3단계 투약 완료 (2019.11) ㆍ1상 임상시험 3단계 종료(2019.12) ㆍ결과보고서 최종화 승인(2020.09) |
| 향후계획 | 1상 임상시험 결과 분석하여 치료 대상을 확정하여 2상 임상시험 예정 |
| 경쟁제품 |
- 현재 치료제나 치료방법이 전혀 없어 unmet needs가 매우 높은 질환이며, 치료제 개발 성공 시 시장의 유 일한 치료제가 될 것으로 전망 - 현재까지 퇴행성 신경계질환 치료제로 개발되던 약제들(rifampicin, rasagiline, minocyclin, riluzole, growth hormone)을 이용한 임상연구가 수행되어 왔으나 모두 임상적 유용성 입증하지 못한 것으로 보고되었음 - 현재 개발중인 약물은 MSA 증상 중 하나인 기립성 저혈압 증상개선을 목적으로 2/3상 연구자 임상시험 중 인 droxidopa가 있으나 이는 MSA 질환 자체의 경과를 개선 치료하는 약물은 아님 |
| 관련 논문등 | Phil Hyu Lee, Phase Trial of Intra-arterial Administration of Autologous Bone Marrow-Derived Mesenchymal Stem Cells in Patients with Multiple System Atrophy, Hindawi, 2021 |
| 시장규모 | 다계통위축증은 희귀 난치성 질환으로 글로벌 시장규모를 추산하기 어려움. 주요 7개국시장중심으로 2019년약 1900억원의약물시장이형성돼있으며, 연간 4%씩성장해 2032년약 3200억원수준으로성장할것으로예측됨 |
| 기타사항 |
CE111BR16는 정부의 R&D 지원을 받아 진행함 - 보건복지부 지원 보건의료연구개발사업 완료(과제명: 다계통위축증 줄기세포치료제 개발, 2015. 06) - 보건복지부 첨단의료기술개발사업 수행 중(과제명: 비유전성 소뇌실조증의 줄기세포치료제 허가용 비임 상 및 임상연구) |
- 품 목: CE211BR19
| 구 분 | 중간엽줄기세포치료제 | ||
| 적응증 |
- 적응증: 소뇌실조증 - 소뇌실조증(Cerebellar Ataxia)은소뇌의 손상으로 근육 운동이 불완전해 걷기조차 힘들 정도로 정상적인 운동이 불가능해지는 희귀질환임. 정확한 발병원인과 발생과정에 대해서는 아직 밝혀지지 않았으나 경우에 따라서 대사성 원인에 의해 생기거나 유전자질환에 의해 생기는 경우가 많음. 현재까지뚜렷한치료방법이없는상태이며증상을호전시키거나병의진행을늦추기위한약물치료가시도되고있으나아직까지실효를거둔치료제는없는상태임 |
||
| 작용기전 |
중간엽줄기세포의 항염증 효과 및 신경보호 효과를 통해 Purkinje cell의 세포사멸을 억제.
|
||
| 제품의특성 |
- 퇴행성 소뇌 실조증의 경우 명확한 원인이 밝혀지지 않았으며 유전적, 환경적, 화학적, 물리적과 같은 다양한 요인이 제시되고 있음. 원인은 알 수 없지만 소뇌의 신경염증으로 인해 소뇌의 대부분을 차지하는 Purkinje cell의 사멸 및 소뇌의 실조가 일어남. - 중간엽줄기세포는 다양한 항-염증 인자 및 신경 재생인자를 분비하며 주변 분비능을 통해 뇌 신경세포들 간의 상호 작용을 통해 미세환경을 변화시킬 수 있음. 항-염증 효과 및 신경재생효과를 통해 소뇌실조증을 개선할 수 있을 것으로 기대함. |
||
| 진행경과 |
- 비임상 GLP단회투여 독성시험 완료(2019.06) - 연구자임상시험 승인(2019.10) - 연구자임상시험 개시(2019.10) - 연구자임상시험 마지막환자 방문 완료(2022.07) - 연구자임상시험 최종화 승인(2023.02) |
||
| 향후 계획 | 상업적 목적의 1상 임상시험을 진행할 예정임 | ||
| 경쟁제품 |
- 이차적인 원인에 의한 소뇌실조증의 경우 원인을 찾아 치료해주면 증상이 호전됨. 그러나 모든 원인이 치 료가 가능한 것은 아님 - 유전성 소뇌실조증이나 신경계퇴행성 질환에 의한 소뇌실조증은 아직 원인을 치료하거나 진행을 늦추는 방법 은 없음. 전 세계적으로 많은 연구자들이 치료방법 개발 연구를 수행하고 있으나 실제 치료제로 적용할 만큼 효과가 좋고 부작용이 적은 치료제는 없는 상황임 - 소뇌실조증에 대한 유전자 치료도 시도되고 있으나 유효성은 아직 확인이 불가능함
|
||
| 관련 논문 등 | YP Nam, DY Yoon, JW Hong, MS Kim, TY Lee, KS Kim, HW Lee ect al. Therapeutic Effects of Human Mesenchymal Stem Cells in a Mouse Model of Cerebellar Ataxia with Neuroinflammation | ||
| 시장규모 | - | ||
| 기타사항 |
CE211BR19은 정부의 R&D 지원을 받아 개발중임 - 보건복지부 첨단의료기술개발사업 수행 완료 (과제명: 비유전성 소뇌실조증의 줄기세포치료제 허가용 비임 상 및 임상연구, 2016. 10) |
- 품 목: CE211NS21
| 구 분 | 중간엽줄기세포 치료제 | ||||||||||||||||||||||||||||||||||||||
| 적응증 |
- 적응증: 시신경척수염(Neuromyelitis Optica, NMO) - 시신경척수염(Neuromyelitis Optica, NMO)은 평생 반복적으로 재발하는 중추신경계의 염증성 탈수초성 질환(inflammatory demyelinating disease of the central nervous system, IDD)의 한 종류로, 시신경염(Optic neuritis)이나 횡단성 척수염(Transverse myelitis)으로 급성 증상이 발생하는 질환임. 재발율이 매우 높고(1년에 2-3회), 심각한 장애를 남길 수 있으며, 사망률이 높은(50% 이상 7년 이내 사망) 희귀질환임. |
||||||||||||||||||||||||||||||||||||||
| 작용기전 |
시신경 척수염은 자가-항체인anti-Aquaporin-4가 뇌의 Astrocyte 작용하여 염증반응을 유발함. 이후 염증반응으로 인해 보체 활성, 염증성 단백질 발현, 탈-수초화가 발생함. 중간엽줄기세포인 CE211NS21은 보체의 활성을 억제하며 항-염증 반응, 탈-수초화 억제 효과를 보임.
|
||||||||||||||||||||||||||||||||||||||
| 제품의특성 |
- 당사의 EfficHigh 기술로 제조된 CE211NS21은 동종골수유래 중간엽줄기세포로서 기존 자가골수유래 중간엽줄기세포 보다 분비하는 성장인자, 항염증인자, 면역조절인자에 의한 신경보호작용 및 항염증 매개 면역조절작용이 우수 할 것으로 기대함. 더불어 환자의 수고와 부담을 최소화할 수 있음. - 시신경척수염의 체내, 외 비임상시험을 통해 보체활성 억제, 세포의 보호 작용 및 희소돌기아교세포의 탈수초화 억제 효과과 미세아교세포의 항염증 작용기전을 확립하였으며 Treg cell의 분화 및 증식을 활성 작용기전을 확인하였음. 시신경척수염 질환동물모델로 활용되는 EAE(Experimental Autoimmune Encephalomyelitis) 질환동물모델에서도 CE211NS21은 척수내 항염증 및 탈수초화 억제 효과와 더불어 Clinical score의 유의적 변화를 확인하였음. |
||||||||||||||||||||||||||||||||||||||
| 진행경과 |
- 생물학적 특성분석자료 확보 (2022.09) - 비임상 유효성 평가 자료 확보 (2022.12) - 비임상 약리 평가자료 확보 (2020.12) - 비임상 GLP단회, 반복투여 독성시험 및 종양원성 완료(2021.10) - 시신경척수염에 대한 CE211NS21임상시험 신청(2023.04) - 시신경척수염에 대한 CE211NS21임상시험 승인(2024.06) - 시신경척수염에 대한 CE211NS21임상시험 계획 변경 신청(2024.07) - 시신경척수염에 대한 CE211NS21임상시험 계획 변경 승인(2024.07) |
||||||||||||||||||||||||||||||||||||||
| 향후계획 | 2025년 하전반기 1상 임상시험 개시 예정 | ||||||||||||||||||||||||||||||||||||||
| 경쟁제품 |
승인 약물 - 솔리리스주(에쿨리주맙): 2019.06 FDA 승인, 2021.02 MFDS 승인 - 엔스프링프리필드실린지주(사트랄리주맙):2020.08 FDA승인,2021.04 MFD승인 - 업리즈나주(이네빌리주맙): 2020.06 FDA 승인, 2021.08 MFDS 승인 상업화 임상시험 진행 약물
|
||||||||||||||||||||||||||||||||||||||
| 관련 논문 등 | - | ||||||||||||||||||||||||||||||||||||||
| 시장규모 | 희귀난치성 질환으로 아직까지 정확한 글로벌 시장규모를 추산하기 어려움. 국내 시신경척수염 유병률은 2010년 0.75명/100,000명에서 2016년 2.56/100,000명으로 18.5% 상승하였으며 시신경척수염 진단 방법이 점차 개발됨에 따라 유병률, 발병율은 향후 지속적으로 증가할 것으로 예상됨. 이에 따라 시장규모도 점차 확대될것으로 판단됨. | ||||||||||||||||||||||||||||||||||||||
| 기타사항 |
- CE211NS21은 정부의R&D 지원을 받아 진행함 - CE211NS21은 22년 범부처 재생의료사업단의 재생의료 연계기술 개발 사업의 지원을 받아 2023.12.31까지 비임상과제를 수행함 - 25년 범부처재생의료사업단의 재생의료 허가용 임상시험 사업의 지원을 받아2027.12.31까지 임상과제를 수행중 |
- 품 목: CE223BR17
| 구 분 | 유도만능줄기세포 및 배아줄기세포 유래 세포치료제 |
| 적응증 |
- 적응증: 파킨슨, 퇴행성 신경계 질환 - 파킨슨병(Parkinson’s diseas, PD)는 아직까지 명확한 원인이 밝혀지지 않았으나 α-Synuclein 단백응집체가 신경세포의 사멸 및 기능저하를 초래하는 병적환경에서 α-Synuclein 단백응집체는 신경세포-신경세포간 또는 신경세포-세포외 공간으로의 이동이 가능해 신경세포의 손상이 뇌전체로 확대되는 병리기전을 가짐. 현재까지 뚜렷한 치료방법이 없으며 증상완화 및 병의진행을 늦추기 위한 약물치료로 실효를 거둔치료제는 없는 상태임. |
| 작용기전 | 명확한 상관관계는 설명할 수 없는 단계이지만 substantia nigra에 dopaminergic neuron이 파괴되는데 유도만능줄기세포(iPSC) 및 배아줄기세포(ESC)유래 신경줄기세포 및 성상세포는 미세환경 조절 및 이식으로 재생을 통한 dopaminergic neuron을 회복시킴. |
| 제품의특성 | - 유도만능줄기세포는(iPSC) 및는 배아줄기세포는와 같이 전분화능을 가진 세포로 당사는 유도만능줄기세포 또는 배아줄기세포로로부터 신경줄기세포 및 성상세포로의 분화기술을 확보하고 있음. 유도만능줄기세포 및 배아줄기세포는는 윤리적 문제없이 치료제로 사용할 수 있는 모든 유형의 세포로 분화할 수 있는 새로운 패러다임의차세대 세포로 주목받고 있으며 병변 특이적인 세포로 분화가 가능하다는 이점과 함께 치료제로서의 활용에 있어 새로운 패러다임을 제시하고 있음. 세포로 지목되고 있으며 병변에 맞는 세포로 분화시켜 사용할 수 있다는 장점이 있음. |
| 진행경과 |
- 유도만능줄기세포주 확립 / 뱅킹 (2022.10) - 신경줄기세포 및 성상세포 분화 배양 방법 확립 (2021.07) - 유도만능줄기세포 및 신경줄기세포, 성상세포 특성분석 (2022.12) - 상업화 가능한 배아줄기세포주 확보(2025.07) |
| 향후계획 | 비임상시험을 진행 후 상업화 임상시험 진입 |
| 경쟁제품 | ㆍ아직까지 배아줄기세포 및 유도만능줄기세포 유래 세포치료제는 임상시험을 승인받거나 의약품으로 승인 받은 전례가 없으며 미래 유망한 세포치료제로서 활용가치가 높음 |
| 관련 논문등 | - |
| 시장규모 | - |
| 기타사항 | - |
- 품 목: EV231LU20 (Extracellular vesicle)
| 구 분 | 바이오 신약 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 적응증 | - 적응증: 특발성폐섬유증(Idiopathic Pulmonary Fibrosis, IPF) ㆍ특발성폐섬유증(Idiopathic Pulmonary Fibrosis, IPF)은 희귀난치성 질환으로 간질성 폐질환(interstitial lung diseases, ILD)내 특발성 간질폐렴(idiopathic interstitial pneumonia, IIP)에서 가장 흔한 질환임. 폐포와 폐포 사이의 공간인 간질에 염증 및 섬유화가 발생하는 질환으로 아직까지 명확한 원인은 밝혀지지 않았으며 만성의 진행성 폐섬유증이 주된 특징임. 50세 이상의 나이에서 주로 발병하며 지역별 국가별 다양한 유병률과 발병률을 나타냄. 전세계에서 유병률과 발병률이 매년 점차 증가하고 있음. 유럽과 미국의 특발성 폐섬유증의 유병률은 인구 100,000명당 2.8~18명으로 추정되고 아시아와, 남미에서는 인구 100,000명당 0.5~4.5명으로 추정됨. 남성에게서 더 흔하게 나타나는 것으로 밝혀져 있으며 진단 시 평균연령은 65세로 알려져 있음. 특발성 폐섬유증은 폐가 딱딱하게 굳어져 가며 질환의 진행으로 인한 호흡부전 등의 문제로 결국 사망에 이르는 예후가 좋지 못한 질환임. 생존기간은 3~5년으로 매우 짧고 간질성 폐질환 (interstitial lung diseases, ILD)에서 약 20%의 상대적 발병 분포를 나타내지만 질환의 인지도 및 대중의 이해도가 낮은 질환임.2014년 개발된 피르페니돈, 닌테다닙 2가지 약물이 있고 국내에서는 급여가 적용되는 피르페니돈을 주로 사용하고 있지만 환자 대부분이 고령이라는 점을 고려하였을 때 처방이 쉽지 않음. 특히 고령의 환자 일수록 약물에 의한 부작용으로 식욕부진, 소화기계 부작용(구토, 구역), 거부감 등을 겪고 있으며 이러한 이유로 투약을 거부하거나 약물의 복용으로 인해 전신의 위약감 등이 발생하여 고령의 환자에게 처방함에 어려움이 있음. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 작용기전 |
완벽한 작용기전을 설명하기에는 어려운 단계이지만 중간엽줄기세포 유래 세포외소포체는 핵산, 지질, 단백질을 함유하고 있음. 특히 당사의 세포외소포체 치료제 내에는 항염증 및 항섬유화에 효과적인 Micro RNA가 다량 함유되어 있음.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 제품의특성 |
- 당사의 세포외소포체 치료제는 타사 및 타연구에 비해 생산량이 높아 상업화 적용에 효과적이며 항섬유화 작용을 하는 MicroRNA가 다량 함유되어 있음. - 세포외소포체 치료제는 세포치료제에 비해 보존기간 및 안전성 등에 매우 효과적이며 치료효과는 세포치료제와 비슷하거게나 우수하게 나타남. - 특발성폐섬유증의 체내, 체외 유효성 평가를 통해 제 2형 상피세포의 분화 및 증식을 억제 할 수 있으며 섬유아세포의 분화 증식을 억제하는 효과를 확인하였음. 더불어에 최근 밝혀지고 있는 Macrophage의 조절작용을 통해 M1 type을 유지하며 M2 type을 억제 하는 것을 확인하였음. Bleomycin 유발 질환동물모델에서는 폐 내 콜라겐 형성을 억제, 항 염증작용을 확인할 수 있었으며 폐, 폐포, 간질 등의 폐 내부 조직이 대조군에 비해 유의미하게 회복되는 것을 확인하였음. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 진행경과 |
- 생물학적 특성분석자료 확보 (2022.12) - 유효성 평가 자료 확보 (2022.12) - GLP단회, 반복투여 독성시험 완료(2022.01) - 비임상 시험 진행 중 (안전성 약리, 분포, 면역원성, 유전독성 등 진행중) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 향후계획 |
- 2025년 비임상 약리, 독성시험 완료. - 2026년IND filing 임상시험신청. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 관련논문 | - | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기타사항 | - EV231LU20은 24년 범부처 재생의료사업단의 재생의료 연계기술 개발사업의 지원을 받아 개발 진행중임. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 경쟁제품 |
상업화 임상시험 진행 약물
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 시장규모 |
세포외소포체(EVs, Exosome) 치료제 시장규모 현황은2017년 약9,100만달러에서 연평균23.8%으로 가파르게 성장하여2024년에는2억6,400만달러규모로 성장할것으로 예측되며 이미 미국은 인프라 및 정부 정책에 의한 진단 및 치료제 개발로 많은 점유율을 차지하고 있음. Cancer에 진단 및 운반체로서의 세포외소포체(EVs, Exosome)의 활용도가 점점 높아지는 추세임. (Markets and Markets, 2019, Global Exosome Therapeutic Market? Industry Trends and Forecast to 2026) 아직까지 질환 치료제로서 허가 받은 세포외소포체(EVs, Exosome) 치료제는 없으며 세포치료제 대비 효과 및 투여 방법, 운송 등의 용이성을 따져본다면 향후 더 큰 성장을 보일 신산업으로 분류할 수 있음.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기타사항 | - |
② 연구개발 완료 실적
공시서류 작성기준일 현재 개발이 완료된 줄기세포치료제의 현황은 다음과 같습니다
| 품 목 | 개발완료일 | 비 고 | |
| 세포치료제 | 근위축성 측삭경화증 | 한국 판매중 | - |
③ 기타연구개발 실적
국가 등 연구과제 수행을 위한 계획은 다음과 같습니다.
| (단위 : 천원) |
| 제공처 | 과제명 | 수행기간 | 수령액 | |
|
당기 (2025년 |
전기 (2024년) |
|||
|
과학기술정보통신부 ㆍ보건복지부 |
중간엽줄기세포 유래 세포외 소포체(EV231LU20)를 이용한 특발성 폐섬유증 치료제 개발 |
2025.01.01~2027.12.31 | 300,000 | 200,000 |
| 보건복지부 | 시신경척수염 치료를 위한 CE211NS21 (Allo BM-MSC) 치료제 1상 임상시험 완료 및 2상 임상시험 승인 | 2025.04.01~2027.12.31 | 700,000 | - |
| 합계 | 1,000,000 | 200,000 | ||
(2) 비임상CRO사업부
① 연구개발 완료 실적
| 과제명 | 결과/기대효과 | 상품화여부 |
| infusion pump를 이용한 정맥내 투여법 | 기존 Bolus 시장과 별도로 infusion 투여 신약 수주 |
수주 (USFDA 임상 1상 승인) |
| 스테레오탁식을 이용한 뇌내투여법 | 세포치료제 등 뇌내 직접투여 시험 가능 | 수주(총 4건) |
| C-Arm를 이용한 척수조직내 등 투여법 | 척수조직, 신경내 투여 시험가능 | 수주(총 3건) |
| 관절강내 투여 시험법 | 줄기세포, HA등 시험수주 가능 | 수주(다수) |
| in vivo Comet 시험법 | 유전독성중 위양성 판정 가능 | 수주(다수) |
| in vitro hERG 시험법 | 안전성약리중 심혈관계 미치는 영향시험 수주 가능 |
수주(다수) |
| Beagle Dog을 이용한 Telemetry | 안전성약리중 심혈관계 미치는 영향시험 수주 가능 |
수주(다수) |
| 요도괄약근내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 항문괄약근내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 망막하내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 결막하내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 내경동맥내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 간문맥내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 방광배뇨근 내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 방광내막 내 투여법 | 줄기세포 치료제 수주 가능 | 수주 |
| 폐암치료제의 폐암 효능 시험법 | 폐암치료제 효능시장 공략 | 수주 |
| 비만예방 효능 시험법 | 비만치료제 및 항비만제의 효능시장 공략 | 수주(다수) |
| 치매치료제 효과측정 시험법 | 치매제의 효능시장 공략 | 수주(다수) |
|
고지방식 급여를 통한 항비만 효능 시험법 |
항비만 효능시장 공략 | 수주(다수) |
| MS/MS를 이용한 TK분석법 개발 | 비임상시험 확대 및 임상 기반기술 확보 | 수주(다수) |
| 동물실험 대체법 | 화장품 비임상시험의 신규 시장 개척 | 수주 |
| SHR을 이용한 혈압강하 효능 시험법 | 고혈압 치료제 및 예방제의 효능시장 공략 | 수주 |
| 만성 간장애에 대한 기능개선효과 | 간기능개선제 효능시장 공략 | 수주 |
|
NC/Nga Mice를 이용한 아토피성 효능시험법 |
아토피 치료제 효능시장 공략 | 수주(다수) |
| HT-1080의 Xenograft 모델 확립시험 | 항암제 효능시장 공략 | 수주(다수) |
| 물벼룩급성독성 | 화학물질, 농약 독성 시장 공략 | 수주(다수) |
| 담수조류 성장저해시험 | 화학물질, 농약 독성 시장 공략 | 수주(다수 |
| 인공피부 이용한 확인시험 | 화장품 대체법 시장 공략 | 수주 |
| 인공각막 이용한 확인시험 | 화장품 대체법 시장 공략 | 수주 |
| ELISA 법을 이용한 국소림프절시험 | 화장품 대체법 시장 공략 | 수주(다수) |
| 어류 급성 독성 | 화학물질, 농약 독성 시장 공략 | 수주(다수) |
| 인공피부 이용한 자극시험 | 화학물질 대체법 시험 공략 | 수주(다수) |
| 인공각막 이용한 자극시험 | 화학물질 대체법 시험 공략 | 수주(다수) |
| 마우스 림포마 시험 | 화학물질의 유전독성 평가 가능, OECD TG 490 기준 충족, In Vitro 시험으로 동물 대체 가능 |
수주 |
| 3T3 NRU 광독성시험 |
광독성 평가 가능, OECD TG 432 기준 충족, In Vitro 시험으로 동물 대체 가능 |
수주(다수) |
| 동물용의약품 GLP 독성시험 |
동물용 의약품의 체내 독성 평가 가능, 허가 자료 활용 가능 |
수주(다수) |
| 동물용의료기기 GLP 독성시험 |
동물용 의료기기의 안전성 평가 가능, GLP 인증을 통한 글러벌 시장 진출 공략 |
수주(다수) |
| 인혈청 이용한 중화항체형성 확인 시험을 위한 GCLP 기관과 업무 협약 |
백신 및 바이오의약품의 면역원성 평가 가능, GCLP 기준 충족을 통한 글로벌 규제 대응 가능 |
수주(다수) |
| 생체외 포유류 세포 소핵시험 |
화학물질의 유전독성 평가 가능, OECD TG 487 기준 충족, 동물실험 대체 가능 |
수주(다수) |
|
자극성과 피부감작성 시험 - 유세포분석을 이용한 국소림프절시험법 |
의료기기의 피부 감작성 평가 가능, ISO 10993-10 및 OECD TG 442B 기준 충족, 유세포 분석을 이용하여 보다 정확한 면역반응 평가 가능 |
수주(다수) |
|
자극성과 피부감작성 시험 - ELISA 법을 이용한 국소림프절 시험법 |
의료기기의 피부 감작성 평가 가능, ISO 10993-10 및 OECD TG 442B 기준 충족 (의료기기 허가를 위한 안전성 평가자료로 활용 가능) |
수주(다수) |
| 전신독성시험 - 아만성(아급성)시험 |
반복 노출 시 장기 독성 평가 가능, ISO 10993-11 기준 충족 (의료기기 허가를 위한 안전성 평가자료로 활용 가능) |
수주(다수) |
| 이식시험 - 피하조직 내 이식 시험 |
이식형 의료기기의 생체적합성 평가 가능, ISO 10993-6 기준 충족 (의료기기 허가를 위한 안전성 평가자료로 활용 가능) |
수주(다수) |
| 유세포분석을 이용한 국소림프절시험법 (LLNA:BrdU-FCM) |
화장품 원료 및 기능성 성분의 피부 감작성 평가 가능 | 수주(다수) |
| 설치류의 심전도 및 근전도의 평가시험 | 심혈관계 및 신경·근육계 영향 평가 가능 | 수주 |
| Pig-a 유전자 돌연변이시험 | 체내 유전독성 평가 가능, in vivo 유전독성 시험 대체 가능 | 수주 |
| 혈액적합성시험 (체외시험) |
의료기기의 혈액적합성 평가 가능, ISO 10993-4 기준 충족 (의료기기 허가를 위한 안전성 평가자료로 활용 가능)
|
수주(다수) |
|
자극성과 피부 감작성 시험 - 안자극성 시험 |
안구 점막과 접촉하는 의료기기의 자극 반응 평가 가능, ISO 10993-23 충족 (의료기기 허가를 위한 안전성 평가자료로 활용 가능)
|
수주(다수) |
|
자극성과 피부 감작성 시험 - 구강점막자극성 시험 |
구강 내 점막 접촉 의료기기의 자극 반응 평가 가능, ISO 10993-10 충족 (의료기기 허가를 위한 안전성 평가자료로 활용 가능)
|
수주(다수) |
|
전신독성시험 - 엔도톡신 매개성 발열성 |
의료기기의 내독소(엔도톡신) 오염 여부 및 발열 반응 평가 가능, ISO 10993-11 & USP 기준 충족 (의료기기 허가를 위한 안전성 평가자료로 활용 가능)
|
수주(다수) |
|
물리화학적 성질 시험분야 - n-옥탄올/물 분배계수시험: 용기진탕법 |
화학물질의 친수성·소수성 평가, OECD TG 107, (화학물질의 물리화학적 특성평가 및 화평법 등록 활용 가능) |
수주(다수) |
|
물리화학적 성질 시험분야 - n-옥탄올/물 분배계수시험: 고속액체크로마토그래피법 |
화학물질의 친수성·소수성 평가, OECD TG 117 및 (화학물질의 물리화학적 특성평가 및 화평법 등록 활용 가능) |
수주(다수) |
|
분해성 및 농축성 시험분야 - 미생물분해시험(이분해성): 압력계를 이용한 산소소모량측정시험 |
화학물질의 생분해성 평가 가능, OECD TG 301F 및 (화학물질의 물리화학적 특성평가 및 화평법 등록 활용 가능) |
수주(다수) |
|
건강영향 시험분야 - 병합생식/발달독성 선별시험 및 반복투여독성시험 |
1. 화학물질의 생식·발달독성 평가 가능, 2. 반복 노출에 따른 장기독성 평가 가능, |
수주(다수) |
| 면역표현형검사 시험 |
면역세포 분석을 통해, 세포치료제 및 백신의 작용기전 및 면역세포 반응 정량 평가 가능 (CD3, CD4, CD8a, CD45R, CD161a 등) |
수주(진행 및 예정) |
주) 연구개발활동은 GLP 추가 인증을 위한 실험프로젝트, 대체시험법 개발을 위한 실험프로젝트, 국가등 국책연구과제 수행을 위한 실험프로젝트로 구성되어 있습니다. 환경독성 GLP등 인증을 위한 연구는 완료되었으며 대체시험법 개발은 향후에도 지속적으로 진행될 예정입니다.
② 기타연구개발 실적
국가 등 연구과제 수행을 위한 계획은 다음과 같습니다.
| (단위 : 천원) |
| 제공처 | 과제명 | 수행기간 | 수령액 | |
|
당기 (2025년 |
전기 (2024년) |
|||
| 식품의약품안전처 | 축수산용 동물용의약품 안전성 재평가 연구 | 2022-02-01~2026-11-30 | 221,000 | 353,000 |
| 농촌진흥청 | 새싹대마 활용 고부가 식의약 원료 개발 연구 | 2022-04-01~2026-12-31 | 40,000 | 50,000 |
| 한국보건산업진흥원 | 독성평가용 오가노이드 플랫폼 개발을 위한 검증 연구 | 2023-04-01~2025-12-31 | 94,000 | 94,000 |
| 한국보건산업진흥원 | 이대목동병원 유로진(UroGyn) 유효성 평가센터 | 2023-07-01~2027-12-31 | 267,000 | 247,000 |
| - |
다중 오믹스 및 오가노이드 기반 유전자치료제 효력 평가 시스템 구축 |
2022-07-01~2030-12-31 | 90,787 | 90,787 |
| 한국산업기술기획평가원 | 펩타이드-HLA 다량체 기반 교모세포종 혁신 치료제 개발 | 2024-07-01~2026-12-31 | 135,860 | 195,000 |
| 한국산업기술기획평가원 |
미세생리시스템 기반 의약품 독성평가를 위한 AI 소프트웨어 및 검증 플랫폼 개발 |
2024-07-01~2028-12-31 | 40,000 | 20,000 |
| 한국산업기술기획평가원 | 신개념 백신 접종 장비를 이용한 LNP를 사용하지 않는 mRNA 백신의 국산화 | 2022-08-01~2025-06-30 | 38,667 | 77,333 |
| 농림축산식품부 | 동물용의약품등 독성시험지침 및 GLP 규정의 국제조화를 위한 조사 연구 | 2025-01-06~2025-11-15 | 90,000 | - |
| 합계 | 1,017,314 | 1,127,120 | ||
7. 기타 참고사항
회사의 현황은 아래 상세표를 참고해주시기 바랍니다.
| 상세 현황은 '상세표-7.회사의 현황' 참조 |
III. 재무에 관한 사항
1. 요약재무정보
1-1. 연결 요약재무제표
| 코아스템켐온 주식회사 및 그 종속기업 | (단위: 백만원) |
| 구 분 | 제 23기 | 제 22기 | 제 21 기 |
| (2025년 반기말) | (2024년 12월말) | (2023년 12월말) | |
| 자산 | |||
| [유동자산] | 13,895 | 15,783 | 10,721 |
| 현금및현금성자산 | 1,149 | 1,280 | 2,250 |
| 단기금융상품 | 1,000 | 1,000 | - |
| 당기손익-공정가치측정금융자산 | 1,663 | 2,221 | 456 |
| 매출채권 | 2,506 | 4,565 | 3,334 |
| 계약자산 | 6,805 | 5,143 | 3,216 |
| 기타유동금융자산 | 145 | 372 | 117 |
| 기타유동자산 | 477 | 640 | 674 |
| 당기법인세자산 | 17 | 46 | 73 |
| 재고자산 | 133 | 516 | 601 |
| [비유동자산] | 100,265 | 101,674 | 67,870 |
| 기타포괄손익-공정가치측정금융자산 | 3,803 | 3,736 | 4,502 |
| 투자부동산 | - | 118 | 129 |
| 유형자산 | 89,956 | 89,039 | 54,750 |
| 무형자산 | 4,381 | 6,207 | 5,991 |
| 사용권자산 | 811 | 1,048 | 972 |
| 기타비유동금융자산 | 1,314 | 1,526 | 1,526 |
| 자산 총계 | 114,160 | 117,457 | 78,591 |
| 부채 | |||
| [유동부채] | 45,551 | 41,932 | 41,592 |
| 단기차입금 | 11,000 | 8,400 | 3,000 |
| 유동성장기차입금 | 11,096 | 7,762 | 4,260 |
| 매입채무 | 249 | 368 | 421 |
| 기타유동금융부채 | 2,580 | 2,530 | 2,257 |
| 계약손실충당부채 | 674 | 668 | - |
| 파생상품부채 | 5,011 | - | 11,463 |
| 계약부채 | 3,740 | 7,050 | 4,523 |
| 유동성리스부채 | 324 | 3,023 | 690 |
| 교환사채 | 10,664 | 450 | 14,396 |
| 기타유동부채 | 213 | 11,270 | 582 |
| 당기법인세부채 | - | 411 | - |
| [비유동부채] | 23,234 | 26,932 | 17,399 |
| 장기차입금 | 15,138 | 18,472 | 10,194 |
| 비유동리스부채 | 407 | 472 | 231 |
| 계약손실충당부채 | - | - | 981 |
| 기타비유동금융부채 | - | 30 | 30 |
| 기타비유동부채 | 1,055 | 1,158 | 700 |
| 순확정급여부채 | 6,556 | 6,722 | 4,705 |
| 이연법인세부채 | 78 | 78 | 558 |
| 부채 총계 | 68,785 | 68,864 | 58,991 |
| 자본 | |||
| [지배기업의 소유지분] | 45,374 | 48,593 | 19,601 |
| 자본금 | 16,435 | 16,435 | 16,435 |
| 주식발행초과금 | 212,364 | 212,364 | 212,364 |
| 자기주식처분이익 | 29,330 | 29,887 | - |
| 기타자본 | (121,416) | (128,404) | (141,980) |
| 기타포괄손익누계액 | 11,797 | 11,754 | (622) |
| 결손금 | (103,136) | (93,443) | (66,596) |
| [비지배지분] | - | - | - |
| 자본총계 | 45,374 | 48,593 | 19,601 |
| 구 분 | 제 23기 반기 | 제 22 기 | 제 21 기 |
| (2025.01.01~2025.06.30) | (2024.01.01~2024.12.31) | (2023.01.01~2023.12.31) | |
| 매출액 | 11,610 | 28,762 | 33,657 |
| 영업이익(손실) | (10,650) | (22,018) | (19,676) |
| 연결당기순이익(손실) | (9,645) | (17,672) | (17,672) |
| · 지배기업 소유주 | (9,645) | (17,672) | (17,672) |
| · 비지배지분 | - | - | - |
| 총포괄이익(손실) | (9,650) | (19,030) | (19,030) |
| · 지배기업 소유주 | (9,650) | (19,030) | (19,030) |
| · 비지배지분 | - | - | - |
| 주당순이익(손실) | |||
| · 기본주당이익(손실)(원) | (372) | (825) | (825) |
| · 희석주당이익(손실)(원) | (372) | (837) | (837) |
| 연결에 포함된 회사의 수 | 2개사 | 2개사 | 2개사 |
1-2. 요약재무제표
| 코아스템켐온 주식회사 | (단위: 백만원) |
| 구 분 | 제 23 기 반기 | 제 22 기 | 제 21 기 |
| (2025년 반기말) | (2024년 12월말) | (2023년 12월말) | |
| 자산 | |||
| [유동자산] | 13,794 | 15,348 | 10,080 |
| 현금및현금성자산 | 877 | 862 | 1,610 |
| 단기금융자산 | 1,000 | 1,000 | - |
| 당기손익-공정가치측정금융자산 | 1,663 | 2,221 | 456 |
| 매출채권 | 2,506 | 4,565 | 3,334 |
| 계약자산 | 6,804 | 5,143 | 3,216 |
| 기타유동금융자산 | 317 | 372 | 118 |
| 기타유동자산 | 477 | 622 | 672 |
| 당기법인세자산 | 17 | 46 | 73 |
| 재고자산 | 133 | 516 | 600 |
| [비유동자산] | 100,899 | 102,279 | 68,477 |
| 종속기업투자 | 642 | 642 | 642 |
| 기타포괄손익-공정가치측정금융자산 | 3,803 | 3,736 | 4,502 |
| 투자부동산 | - | 118 | 129 |
| 유형자산 | 89,950 | 89,030 | 54,744 |
| 무형자산 | 4,382 | 6,207 | 5,991 |
| 사용권자산 | 810 | 1,048 | 972 |
| 기타비유동금융자산 | 1,312 | 1,498 | 1,497 |
| 자산 총계 | 114,693 | 117,627 | 78,557 |
| 부채 | |||
| [유동부채] | 45,573 | 41,900 | 41,600 |
| 단기차입금 | 11,000 | 8,400 | 3,000 |
| 유동성장기차입금 | 11,096 | 7,762 | 4,260 |
| 매입채무 | 249 | 368 | 421 |
| 기타유동금융부채 | 2,606 | 2,510 | 2,279 |
| 계약손실충당부채 | 674 | 668 | - |
| 전환사채 | - | - | - |
| 파생상품부채 | 5,011 | 7,050 | 11,463 |
| 계약부채 | 3,740 | 3,023 | 4,523 |
| 유동성리스부채 | 324 | 450 | 690 |
| 교환사채 | 10,664 | 11,270 | 14,396 |
| 기타유동부채 | 209 | 399 | 568 |
| 당기법인세부채 | - | - | - |
| [비유동부채] | 23,156 | 26,681 | 17,119 |
| 장기차입금 | 15,138 | 18,472 | 10,194 |
| 비유동리스부채 | 407 | 472 | 231 |
| 계약손실충당부채 | - | - | 981 |
| 기타비유동금융부채 | - | 30 | 30 |
| 기타비유동부채 | 1,055 | 1,158 | 700 |
| 순확정급여부채 | 6,556 | 6,549 | 4,563 |
| 이연법인세부채 | - | - | 420 |
| 부채 총계 | 68,729 | 68,581 | 58,720 |
| 자본 | |||
| 자본금 | 16,435 | 16,435 | 16,435 |
| 주식발행초과금 | 212,364 | 212,364 | 212,364 |
| 자기주식처분이익 | 29,330 | 29,886 | - |
| 기타자본 | (110,552) | (117,540) | (131,117) |
| 기타포괄손익누계액 | 11,906 | 11,840 | (476) |
| 결손금 | (113,519) | (103,939) | (77,369) |
| 자본 총계 | 45,964 | 49,046 | 19,838 |
| 구 분 | 제 23 기 반기 | 제 22기 | 제 21기 |
| (2025.01.01~2025.06.30) | (2024.01.01~2024.12.31) | (2023.01.01~2023.12.31) | |
| 매출액 | 11,610 | 28,762 | 33,657 |
| 영업이익(손실) | (10,537) | (21,705) | (19,578) |
| 당기순이익(손실) | (9,531) | (25,976) | (17,573) |
| 총포괄이익(손실) | (9,513) | (14,255) | (18,936) |
| 주당순이익(손실) | |||
| ㆍ기본주당이익(손실)(원) | (367) | (1,112) | (821) |
| ㆍ기본주당이익(손실)(원) | (367) | (1,112) | (834) |
2. 연결재무제표
2-1. 연결 재무상태표
|
연결 재무상태표 |
|
제 23 기 반기말 2025.06.30 현재 |
|
제 22 기말 2024.12.31 현재 |
|
(단위 : 원) |
|
제 23 기 반기말 |
제 22 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
13,894,935,376 |
15,783,512,957 |
|
현금및현금성자산 |
1,149,221,457 |
1,280,249,566 |
|
단기금융상품 |
1,000,000,000 |
1,000,000,000 |
|
당기손익-공정가치측정금융자산 |
1,662,918,007 |
2,221,221,195 |
|
매출채권 |
2,506,112,366 |
4,564,875,358 |
|
계약자산 |
6,804,496,670 |
5,143,322,146 |
|
기타유동금융자산 |
144,927,269 |
371,762,825 |
|
기타유동자산 |
477,228,733 |
639,832,146 |
|
당기법인세자산 |
17,428,640 |
46,357,420 |
|
재고자산 |
132,602,234 |
515,892,301 |
|
비유동자산 |
100,264,825,257 |
101,673,674,252 |
|
기타포괄손익-공정가치측정금융자산 |
3,802,608,000 |
3,735,764,000 |
|
투자부동산 |
0 |
117,527,802 |
|
유형자산 |
89,956,166,537 |
89,038,857,797 |
|
무형자산 |
4,381,522,801 |
6,207,327,756 |
|
사용권자산 |
810,617,860 |
1,048,070,834 |
|
기타비유동금융자산 |
1,313,910,059 |
1,526,126,063 |
|
자산총계 |
114,159,760,633 |
117,457,187,209 |
|
부채 |
||
|
유동부채 |
45,550,901,564 |
41,931,972,850 |
|
단기차입금 |
11,000,000,000 |
8,400,000,000 |
|
유동성장기차입금 |
11,095,540,000 |
7,762,100,000 |
|
매입채무 |
248,997,750 |
367,580,940 |
|
기타유동금융부채 |
2,579,872,275 |
2,529,563,888 |
|
계약손실충당부채 |
673,974,030 |
667,813,456 |
|
파생상품부채 |
5,010,846,582 |
7,049,784,185 |
|
계약부채 |
3,739,753,416 |
3,023,329,792 |
|
유동성리스부채 |
324,332,786 |
450,188,784 |
|
교환사채 |
10,664,433,093 |
11,270,050,308 |
|
기타유동부채 |
213,151,632 |
411,561,497 |
|
비유동부채 |
23,234,362,571 |
26,931,858,295 |
|
장기차입금 |
15,138,460,000 |
18,471,900,000 |
|
비유동리스부채 |
406,651,459 |
471,928,773 |
|
기타비유동금융부채 |
0 |
30,000,000 |
|
기타비유동부채 |
1,054,508,613 |
1,157,883,612 |
|
순확정급여부채 |
6,556,342,961 |
6,721,746,372 |
|
이연법인세부채 |
78,399,538 |
78,399,538 |
|
부채총계 |
68,785,264,135 |
68,863,831,145 |
|
자본 |
||
|
지배기업의 소유주에게 귀속되는 자본 |
45,374,496,498 |
48,593,356,064 |
|
자본금 |
16,435,188,000 |
16,435,188,000 |
|
주식발행초과금 |
212,364,193,443 |
212,364,193,443 |
|
자기주식처분이익 |
29,330,129,864 |
29,886,947,864 |
|
기타자본 |
(121,415,554,641) |
(128,403,554,641) |
|
기타포괄손익누계액 |
11,796,610,272 |
11,753,619,092 |
|
이익잉여금(결손금) |
(103,136,070,440) |
(93,443,037,694) |
|
비지배지분 |
0 |
0 |
|
자본총계 |
45,374,496,498 |
48,593,356,064 |
|
자본과부채총계 |
114,159,760,633 |
117,457,187,209 |
2-2. 연결 포괄손익계산서
|
연결 포괄손익계산서 |
|
제 23 기 반기 2025.01.01 부터 2025.06.30 까지 |
|
제 22 기 반기 2024.01.01 부터 2024.06.30 까지 |
|
(단위 : 원) |
|
제 23 기 반기 |
제 22 기 반기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출액 |
5,492,570,158 |
11,610,425,825 |
7,144,382,483 |
15,538,404,222 |
|
매출원가 |
5,093,307,177 |
12,529,895,693 |
7,547,546,521 |
15,139,325,670 |
|
매출총이익(손실) |
399,262,981 |
(919,469,868) |
(403,164,038) |
399,078,552 |
|
판매비와관리비 |
7,186,472,581 |
9,730,831,784 |
5,691,435,016 |
8,938,685,261 |
|
영업이익(손실) |
(6,787,209,600) |
(10,650,301,652) |
(6,094,599,054) |
(8,539,606,709) |
|
기타수익 |
57,988,876 |
1,225,639,559 |
103,708,899 |
206,686,793 |
|
기타비용 |
150,049,989 |
375,085,194 |
32,774,459 |
33,807,601 |
|
금융수익 |
235,909,156 |
1,846,303,814 |
5,402,905,658 |
6,789,686,902 |
|
금융비용 |
1,148,676,706 |
1,624,759,606 |
13,616,159,636 |
23,812,669,476 |
|
법인세비용차감전순이익(손실) |
(7,792,038,263) |
(9,578,203,079) |
(14,236,918,592) |
(25,389,710,091) |
|
법인세비용(수익) |
66,493,119 |
66,493,119 |
79,168,340 |
79,168,340 |
|
당기순이익(손실) |
(7,858,531,382) |
(9,644,696,198) |
(14,316,086,932) |
(25,468,878,431) |
|
지배기업의 소유주에게 귀속되는 당기순이익(손실) |
(7,858,531,382) |
(9,644,696,198) |
(14,316,086,932) |
(25,468,878,431) |
|
비지배지분에 귀속되는 당기순이익(손실) |
0 |
0 |
0 |
0 |
|
기타포괄손익 |
(70,085,052) |
(5,345,368) |
(207,186,325) |
(215,472,609) |
|
당기손익으로 재분류될 수 있는 항목(세후기타포괄손익) |
(22,364,504) |
(23,852,820) |
15,374,222 |
40,060,938 |
|
해외사업장환산외환차이 |
(22,364,504) |
(23,852,820) |
15,374,222 |
40,060,938 |
|
당기손익으로 재분류되지 않는 항목 |
(47,720,548) |
18,507,452 |
(222,560,547) |
(255,533,547) |
|
확정급여제도의재측정요소 |
(48,336,548) |
(48,336,548) |
(299,627,547) |
(299,627,547) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
616,000 |
66,844,000 |
77,067,000 |
44,094,000 |
|
총포괄손익 |
(7,928,616,434) |
(9,650,041,566) |
(14,523,273,257) |
(25,684,351,040) |
|
지배기업 소유주 순이익(손실) |
(7,928,616,434) |
(9,650,041,566) |
(14,523,273,257) |
(25,684,351,040) |
|
비지배지분 순이익(손실) |
0 |
0 |
0 |
0 |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(295) |
(372) |
(622) |
(1,144) |
|
희석주당이익(손실) (단위 : 원) |
(295) |
(372) |
(622) |
(1,144) |
2-3. 연결 자본변동표
|
연결 자본변동표 |
|
제 23 기 반기 2025.01.01 부터 2025.06.30 까지 |
|
제 22 기 반기 2024.01.01 부터 2024.06.30 까지 |
|
(단위 : 원) |
|
자본 |
||||||||
|---|---|---|---|---|---|---|---|---|
|
지배기업의 소유주에게 귀속되는 지분 |
비지배지분 |
자본 합계 |
||||||
|
자본금 |
자본잉여금 |
기타자본 |
기타포괄손익 |
이익잉여금 |
지배기업의 소유주에게 귀속되는 지분 합계 |
|||
|
2024.01.01 (기초자본) |
16,435,188,000 |
212,364,193,443 |
(141,980,134,537) |
(622,208,969) |
(66,596,408,151) |
19,600,629,786 |
0 |
19,600,629,786 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(25,468,878,431) |
(25,468,878,431) |
0 |
(25,468,878,431) |
|
기타포괄손익 |
0 |
0 |
0 |
84,154,938 |
(299,627,547) |
(215,472,609) |
0 |
(215,472,609) |
|
순확정급여제도의 재측정요소 |
0 |
0 |
0 |
0 |
(299,627,547) |
(299,627,547) |
0 |
(299,627,547) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
0 |
0 |
0 |
44,094,000 |
0 |
44,094,000 |
0 |
44,094,000 |
|
해외사업환산손익 |
0 |
0 |
0 |
40,060,938 |
0 |
40,060,938 |
0 |
40,060,938 |
|
소유주와의 거래 |
0 |
17,976,685,460 |
7,498,595,690 |
0 |
0 |
25,475,281,150 |
0 |
25,475,281,150 |
|
교환사채의 교환 |
0 |
17,976,685,460 |
7,498,595,690 |
0 |
0 |
25,475,281,150 |
0 |
25,475,281,150 |
|
자기주식의 처분 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2024.06.30 (기말자본) |
16,435,188,000 |
230,340,878,903 |
(134,481,538,847) |
(538,054,031) |
(92,364,914,129) |
19,391,559,896 |
0 |
19,391,559,896 |
|
2025.01.01 (기초자본) |
16,435,188,000 |
242,251,141,307 |
(128,403,554,641) |
11,753,619,092 |
(93,443,037,694) |
48,593,356,064 |
0 |
48,593,356,064 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(9,644,696,198) |
(9,644,696,198) |
0 |
(9,644,696,198) |
|
기타포괄손익 |
0 |
0 |
0 |
42,991,180 |
(48,336,548) |
(5,345,368) |
0 |
(5,345,368) |
|
순확정급여제도의 재측정요소 |
0 |
0 |
0 |
0 |
(48,336,548) |
(48,336,548) |
0 |
(48,336,548) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
0 |
0 |
0 |
66,844,000 |
0 |
66,844,000 |
0 |
66,844,000 |
|
해외사업환산손익 |
0 |
0 |
0 |
(23,852,820) |
0 |
(23,852,820) |
0 |
(23,852,820) |
|
소유주와의 거래 |
0 |
(556,818,000) |
6,988,000,000 |
0 |
0 |
6,431,182,000 |
0 |
6,431,182,000 |
|
교환사채의 교환 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
자기주식의 처분 |
0 |
(556,818,000) |
6,988,000,000 |
0 |
0 |
6,431,182,000 |
0 |
6,431,182,000 |
|
2025.06.30 (기말자본) |
16,435,188,000 |
241,694,323,307 |
(121,415,554,641) |
11,796,610,272 |
(103,136,070,440) |
45,374,496,498 |
0 |
45,374,496,498 |
2-4. 연결 현금흐름표
|
연결 현금흐름표 |
|
제 23 기 반기 2025.01.01 부터 2025.06.30 까지 |
|
제 22 기 반기 2024.01.01 부터 2024.06.30 까지 |
|
(단위 : 원) |
|
제 23 기 반기 |
제 22 기 반기 |
|
|---|---|---|
|
영업활동현금흐름 |
(7,793,050,242) |
(10,083,378,157) |
|
영업으로부터 창출된 현금흐름 |
(7,112,026,594) |
(10,155,134,339) |
|
이자의 수취 |
59,270,373 |
82,329,051 |
|
이자의 지급 |
(769,222,801) |
(58,216,079) |
|
법인세의 환급(납부) |
28,928,780 |
47,643,210 |
|
투자활동현금흐름 |
2,064,786,844 |
(15,652,551,533) |
|
당기손익-공정가치측정금융자산의 취득 |
(6,854,433,831) |
(21,548,950,876) |
|
당기손익-공정가치측정금융자산의 처분 |
7,428,225,463 |
17,447,268,769 |
|
장기금융상품의 증가 |
(1,800,000) |
(1,800,000) |
|
투자자산의 처분 |
1,240,000,000 |
0 |
|
유형자산의 취득 |
(1,343,142,379) |
(11,223,050,269) |
|
유형자산의 처분 |
0 |
9,000,000 |
|
무형자산의 취득 |
0 |
(331,240,000) |
|
무형자산의 처분 |
1,418,181,818 |
0 |
|
보증금의 증가 |
(30,017,734) |
(56,814,050) |
|
보증금의 감소 |
237,773,507 |
53,034,893 |
|
임대보증금의 감소 |
(30,000,000) |
0 |
|
재무활동현금흐름 |
5,623,268,845 |
24,774,720,601 |
|
교환사채의 발행 |
0 |
21,000,000,000 |
|
교환사채의 상환 |
(2,976,162,660) |
0 |
|
단기차입금의 차입 |
4,100,000,000 |
4,530,000,000 |
|
단기차입금의 상환 |
(1,500,000,000) |
(4,530,000,000) |
|
장기차입금의 차입 |
0 |
4,210,400,000 |
|
리스부채의 상환 |
(370,568,495) |
(435,679,399) |
|
자기주식의 처분 |
6,370,000,000 |
0 |
|
현금및현금성자산의 순증가(감소) |
(104,994,553) |
(961,209,089) |
|
기초현금및현금성자산 |
1,280,249,566 |
2,250,164,965 |
|
현금및현금성자산에 대한 환율변동효과 |
(26,033,556) |
41,352,368 |
|
기말현금및현금성자산 |
1,149,221,457 |
1,330,308,244 |
3. 연결재무제표 주석
| 제 23 기 2분기 2025년 04월 01일부터 2025년 06월 30일까지 |
| 제 23 기 반기 2025년 01월 01일부터 2025년 06월 30일까지 |
| 제 22 기 2분기 2024년 04월 01일부터 2024년 06월 30일까지 |
| 제 22 기 반기 2024년 01월 01일부터 2024년 06월 30일까지 |
| 코아스템 주식회사와 그 종속기업 |
1. 일반 사항
이 연결재무제표는 한국채택국제회계기준에 따라 작성되었으며, 기업회계기준서 제 1110호 '연결재무제표'에 의한 지배기업인 코아스템켐온 주식회사(이하 "지배기업")와 그 종속기업(이하 "연결대상 종속기업")의 일반적인 사항은 다음과 같습니다.
가. 지배기업의 개요
지배기업은 줄기세포 등 세포치료제를 활용한 난치성질환치료제의 개발 및 공급을 목적으로 2003년 12월 29일에 설립되었습니다. 지배기업은 경기도 성남시 분당구에본사를 두고 있으며, 2015년 6월 26일에 코스닥시장에 주식을 상장하였습니다. 2022년 12월 1일을 합병기일로 하여 주식회사 켐온을 흡수합병하였으며, 비임상실험대행, 신약개발 및 연구대행 등의 사업이 추가 되었습니다.
지배기업의 설립시 자본금은 200백만원이었으며, 설립 후 수차의 유상증자를 실시하여 당반기말 현재 납입자본금은 16,435백만원이며, 최대주주는 김경숙 이사로 보유주식은 3,483,320주(지분율 10.60%)입니다.
나. 연결대상 종속기업의 현황
(1) 연결재무제표 작성대상에 포함된 연결대상 종속기업의 현황은 다음과 같습니다.
| 종속기업명 | 지분율(%) | 영업소재지 | 주요영업활동 | 결산월 | |
|---|---|---|---|---|---|
| 당반기말 | 전기말 | ||||
| 코아스템바이오 주식회사 | 100 | 100 | 경기도 용인시 | 의약품 판매업 | 12월 |
| Corestemchemon US Inc. | 100 | 100 | 미국 | 마케팅 | 12월 |
(2) 연결대상 종속기업의 요약 재무정보는 다음과 같습니다.
1) 요약 재무상태표
| (당반기말) | (단위: 천원) |
| 종속기업명 | 유동자산 | 비유동자산 | 유동부채 | 비유동부채 | 자본 |
|---|---|---|---|---|---|
| 코아스템바이오 주식회사 | 56,379 | 764 | 980,263 | - | (923,120) |
| Corestemchemon US Inc. | 244,860 | 6,793 | 4,289 | - | 247,364 |
| (전기말) | (단위: 천원) |
| 종속기업명 | 유동자산 | 비유동자산 | 유동부채 | 비유동부채 | 자본 |
|---|---|---|---|---|---|
| 코아스템바이오 주식회사 | 58,708 | 29,434 | 818,213 | 172,341 | (902,412) |
| Corestemchemon US Inc. | 376,899 | 7,102 | 6,322 | - | 377,678 |
2) 요약 포괄손익계산서
| (당반기) | (단위: 천원) |
| 종속기업명 | 매출 | 순이익 | 기타포괄손익 | 총포괄손익 |
|---|---|---|---|---|
| 코아스템바이오 주식회사 | - | (20,708) | - | (20,708) |
| Corestemchemon US Inc. | - | (106,461) | (23,853) | (130,314) |
| (전반기) | (단위: 천원) |
| 종속기업명 | 매출 | 순이익 | 기타포괄손익 | 총포괄손익 |
|---|---|---|---|---|
| 코아스템바이오 주식회사 | 240,000 | (33,546) | - | (33,546) |
| Corestemchemon US Inc. | - | (155,295) | 40,061 | (115,234) |
3) 요약 현금흐름표
| (당반기) | (단위: 천원) |
| 종속기업명 | 영업활동으로 인한 현금흐름 |
투자활동으로 인한 현금흐름 |
재무활동으로 인한 현금흐름 |
|---|---|---|---|
| 코아스템바이오 주식회사 | (31,074) | - | - |
| Corestemchemon US Inc. | (89,561) | (1,571) | - |
| (전반기) | (단위: 천원) |
| 종속기업명 | 영업활동으로 인한 현금흐름 |
투자활동으로 인한 현금흐름 |
재무활동으로 인한 현금흐름 |
|---|---|---|---|
| 코아스템바이오 주식회사 | (1,304) | - | - |
| Corestemchemon US Inc. | (173,039) | (2,658) | - |
(3) 누적 비지배지분의 변동
당반기와 전기 중 연결대상 종속기업의 손익 및 자본 중 비지배지분에 배분된 순손익및 누적비지배지분은 없습니다.
다. 연결대상범위의 변동
당반기 중 연결재무제표의 작성대상에서 변동된 연결대상 종속기업의 현황은 없습니다.
2. 재무제표 작성기준 및 중요한 회계정책
지배기업과 지배기업의 종속기업(이하 "연결실체")의 반기연결재무제표는 한국채택국제회계기준에 따라 작성되는 요약중간재무제표입니다. 동 요약중간재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석에는 직전 연차보고기간말 후 발생한 연결실체의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다. 동 요약중간재무제표에 대한 이해를 위해서는 한국채택국제회계기준에 따라 작성된 2024년 12월 31일자로 종료하는 회계연도에 대한 연차연결재무제표를 함께 이용하여야 합니다.
중간재무제표의 작성에 적용된 중요한 회계정책은 아래에서 설명하는 기준서나 해석서의 도입과 관련된 영향을 제외하고는 2024년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다.
1) 당반기부터 새로 도입된 기준서 및 해석서와 그로 인한 회계정책 변경의 내용은 다음과 같습니다.
- 기업회계기준서 제1021호 ‘환율변동효과’와 기업회계기준서 제1101호 ‘한국채택국제회계기준의 최초채택’ 개정 - 교환가능성 결여
동 개정사항은 회계목적상 다른 통화와 교환이 가능하다고 보는 상황에 대해 정의하고, 다른 통화와의 교환가능성 평가, 교환가능성이 결여된 경우 사용할 현물환율 추정 및 공시 요구사항을 명확히 합니다.
다른 통화와 교환이 가능하지 않다면 측정일에 현물환율을 추정해야 하며, 관측 가능한 환율을 조정 없이 사용하거나 다른 추정기법을 사용하도록 하고 있습니다.
2) 제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
(1) 기업회계기준서 제1109호 '금융상품'과 제1107호 '금융상품: 공시'(개정) - 금융상품 분류와 측정
동 개정사항은 전자지급시스템을 사용하여 금융부채를 결제할 때의 금융부채의 결제일 전 이행과 관련된 조건, 계약상 현금흐름이 기본대여계약과 일관되는지 평가할 때 고려해야 할 이자 및 우발사건 특성, 비소구 특성을 가진 금융자산, 계약상 연계된 금융상품의 특성을 명확히 합니다. 그리고 기타포괄손익-공정가치로 지정된 지분상품에 대한 투자와 계약상 현금흐름의 시기나 금액을 변경할 수 있는 계약조건에 대한 추가적인 공시 요구사항을 포함합니다.
(2) 기업회계기준서 제1109호 '금융상품' - 리스부채의 제거 회계처리 및 거래가격의 정의
동 개정사항은 리스부채 제거시 발생하는 차손익을 당기손익으로 인식해야 함을 명확히 하였습니다. 또한 거래가격의 정의를 기업회계기준서 제1115호와 일관되도록 개정하였습니다.
(3) 기업회계기준서 제1110호 '연결재무제표' - 사실상의 대리인 결정
동 개정사항은 사실상 대리인의 판단과 관련한 기준서 제1110호의 표현을 개정하여 기준서 문단 간의 불일치를 해소하였습니다.
(4) 기업회계기준서 제1101호 '한국채택국제회계기준의 최초채택' - 위험회피회계 적용
동 개정사항은 위험회피회계의 적용조건을 기업회계기준서 제1109호 '금융상품'의 구체적인 문단을 참조하도록 명시하고 관련 용어를 일치시켰습니다.
(5) 기업회계기준서 제1107호 '금융상품: 공시' - 제거 손익
동 개정사항은 공정가치 측정과 관련하여 기업회계기준서 제1113호 '공정가치'를 참조하도록 하고 관련 용어를 일치시켰습니다.
(6) 기업회계기준서 제1007호 - 원가법
동 개정으로 '원가법'이라는 용어를 삭제하고 이를 '원가'로 대체하였습니다.
상기 개정사항은 2026년 1월 1일 이후 최초로 시작되는 회계연도부터 전진적용하며 조기적용이 허용됩니다.
당사는 동 개정사항이 재무제표에 미치는 영향이 중요하지 않을 것으로 판단하고 있습니다.
3. 중요한 회계추정 및 가정
재무제표 작성에는 미래에 대한 가정 및 추정이 요구되며 경영진은 연결회사의 회계정책을 적용하기 위해 판단이 요구됩니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에 비추어 합리적으로 예측가능한 미래의 사건을 고려하여 이루어집니다. 회계추정의 결과가 실제 결과와 동일한 경우는 드물 것이므로 중요한 조정을 유발할 수 있는 유의적인 위험을 내포하고 있습니다.
다음 회계연도에 자산 및 부채 장부금액의 조정에 영향을 미칠 수 있는 경영진 판단과 유의적 위험에 대한 추정 및 가정은 다음과 같습니다. 일부 항목에 대한 유의적인 판단 및 추정에 대한 추가적인 정보는 개별 주석에 포함되어 있습니다.
(1) 영업권이 배부된 현금창출단위의 손상검사
영업권의 손상 여부를 검토하기 위한 현금창출단위의 회수가능액은 사용가치의 계산에 기초하여 결정됩니다(주석 14 참조).
(2) 법인세
연결회사의 과세소득에 대한 법인세는 대한민국의 세법 및 과세당국의 결정을 적용하여 산정되므로 최종 세효과를 산정하는 데에는 불확실성이 존재합니다(주석 22 참조).
연결회사는 특정 기간동안 과세소득의 일정 금액을 투자, 임금증가 등에 사용하지 않았을 때 세법에서 정하는 방법에 따라 산정된 법인세를 추가로 부담합니다. 따라서, 해당 기간의 당기법인세와 이연법인세를 측정할 때 이에 따른 세효과를 반영하여야 하고, 이로 인해 연결회사가 부담할 법인세는 각 연도의 투자, 임금증가 등의 수준에 따라 달라지므로 최종 세효과를 산정하는데에는 불확실성이 존재합니다.
(3) 금융상품의 공정가치
활성시장에서 거래되지 않는 금융상품의 공정가치는 원칙적으로 평가기법을 사용하여 결정됩니다. 연결회사는 보고기간말 현재 중요한 시장상황에 기초하여 다양한 평가기법의 선택 및 가정에 대한 판단을 하고 있습니다(주석 5 참조).
(4) 금융자산의 손상
금융자산의 손실충당금은 부도위험 및 기대손실률 등에 대한 가정에 기초하여 측정됩니다. 연결회사는 이러한 가정의 설정 및 손상모델에 사용되는 투입변수의 선정에 있어서 연결회사의 과거 경험, 현재 시장 상황, 재무보고일 기준의 미래전망정보 등을 고려하여 판단합니다(주석 4.1.2 참조).
(5) 순확정급여부채
순확정급여부채의 현재가치는 보험수리적방식에 의해 결정되는 다양한 요소들 특히 할인율의 변동에 영향을 받습니다(주석 18 참조).
(6) 수익인식
용역수익금액은 회수가능성이 매우 높은 발생원가의 범위 내에서만 인식하고 있습니다.
(7) 리스
리스기간을 산정할 때에 경영진은 연장선택권을 행사하거나 종료선택권을 행사하지 않을 경제적 유인이 생기게 하는 관련되는 사실 및 상황을 모두 고려합니다. 연장선택권의 대상 기간(또는 종료선택권의 대상 기간)은 리스이용자가 연장선택권을 행사할 것(또는 행사하지 않을 것)이 상당히 확실한 경우에만 리스기간에 포함됩니다.(주석 15 참조).
4. 재무위험관리
4.1 재무위험관리요소
연결회사는 여러 활동으로 인하여 시장위험(환위험, 이자율위험 및 가격위험), 신용위험 및 유동성위험과 같은 다양한 재무위험에 노출되어 있습니다. 연결회사의 전반적인 위험관리정책은 금융시장의 예측불가능성에 초점을 맞추고 있으며 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화하는데 중점을 두고 있습니다.
위험관리는 이사회에서 승인한 정책에 따라 이루어지고 있습니다. 이사회는 신용 위험 및 유동성을 초과하는 투자와 같은 특정 분야에 관한 문서화된 정책뿐 아니라, 전반적인 위험관리에 대한 문서화된 정책을 검토, 승인합니다.
4.1.1 시장위험
(1) 외환위험
당반기말과 전기말 현재 다른 모든 변수가 일정하고 각 외화에 대한 기능통화의 환율이 10%변동시 세전이익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분(*) | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 10% 상승시 | 10% 하락시 | 10% 상승시 | 10% 하락시 | |
| 미국 달러/원 | 12,727 | (12,727) | 15,401 | (15,401) |
(*) 상기 민감도 분석은 당반기말과 전기말 현재 연결실체의 기능통화인 원화 이외의 외화로 표시된 화폐성 자산ㆍ부채를 대상으로 하였습니다.
(2) 가격위험
(가) 가격위험
연결회사는 재무상태표상 기타포괄손익-공정가치 측정 금융자산 또는 당기손익-공정가치 측정 금융자산으로 분류되는 연결실체 보유 지분증권의 가격위험에 노출돼 있습니다.
연결회사는 지분증권에 대한 투자로 인한 가격위험을 관리하기 위해 포트폴리오를 분산투자하고 있으며 포트폴리오의 분산투자는 연결회사가 정한 한도에 따라 이루어집니다.
연결회사가 보유하고 있는 상장 신종자본증권은 대부분 공개시장에서 거래되고 있으며, 공정가치로 평가하고 있습니다.
(나) 민감도 분석
당반기말과 전기말 현재 다른 모든 변수가 일정하고 공정가치 가격 10% 변동 시 회사의 자본에 미치는 영향은 아래 표와 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 10% 상승시 | 10% 하락시 | 10% 상승시 | 10% 하락시 | |
| 당기손익 | 166,292 | (166,292) | 222,122 | (222,122) |
| 기타포괄손익 | 380,261 | (380,261) | 373,576 | (373,576) |
당기손익-공정가치 측정 지분증권의 손익은 당기손익에 영향을 미치고 기타포괄손익-공정가치 측정 지분증권의 손익은 자본에 영향을 미칩니다.
(다) 당기손익 및 기타포괄손익
연결회사의 투자 금융상품이 당기손익 및 기타포괄손익에 미치는 영향은 주석 5에서설명하고 있습니다.
(3) 이자율 위험
변동금리부 금융상품의 이자율 변동위험은 시장금리 변동으로 인한 재무상태표 항목의 가치변동(공정가치) 위험과 투자 및 재무활동으로부터 발생하는 이자수익, 비용의현금흐름이 변동될 위험으로 정의할 수 있습니다. 이러한 연결회사의 이자율 변동위험은 주로 변동금리부 차입금에서 비롯되며, 주기적인 금리동향 모니터링 및 대응방안 수립을 통해 이자율 위험을 관리하고 있습니다.
연결회사의 차입금과 채권은 상각후원가로 측정됩니다. 차입금 중 이자율이 주기적으로 재설정되는 계약의 경우에는 관련하여 시장이자율 변동위험에 노출되어 있습니다.
당반기말과 전기말 현재 연결회사의 이자율 위험에 노출된 차입금은 다음과 같습니다.
| (단위: 천원) |
| 지 수 | 당반기말 | 전기말 | ||
| 금액 | 비율 | 금액 | 비율 | |
| 변동금리 차입금 - 만기일 |
||||
| 1년 미만 | 22,095,540 | 59% | 16,162,100 | 47% |
| 1-5년 | 15,138,460 | 41% | 18,471,900 | 53% |
| 합 계 | 37,234,000 | 100% | 34,634,000 | 100% |
만기별 분석은 아래 유동성 관련 주석사항에 포함되어 있습니다. 위의 차입금 비율은 전체 차입금 중 변동금리에 노출된 해당 차입금의 비율을 나타냅니다.
당반기말과 전기말 현재 다른 모든 변수가 일정하고 이자율의 1% 변동시 연결회사의 법인세차감전순이익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 1% 상승 | 1% 하락 | 1% 상승 | 1% 하락 | |
| 법인세차감전 순이익 | (372,340) | 372,340 | (346,340) | 346,340 |
4.1.2 신용위험
신용위험은 기업 및 개인 고객에 대한 신용거래 및 채권뿐 아니라 현금성자산, 채무상품의 계약 현금흐름, 유리한 파생상품 및 예치금 등에서도 발생합니다.
금융자산의 장부가액은 연결회사의 신용위험에 대한 최대노출정도를 나타내고 있다고 판단되며, 당반기말과 전기말 현재 연결회사의 신용위험에 대한 최대노출정도는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 현금및현금성자산 | 1,149,221 | 1,280,250 |
| 단기금융자산 | 1,000,000 | 1,000,000 |
| 당기손익-공정가치측정금융자산 | 1,662,918 | 2,221,221 |
| 기타포괄손익-공정가치측정금융자산 | 3,802,608 | 3,735,764 |
| 매출채권 | 2,506,112 | 4,564,875 |
| 기타유동금융자산 | 144,927 | 371,763 |
| 기타비유동금융자산 | 1,313,910 | 1,526,126 |
| 합 계 | 11,579,696 | 14,699,999 |
(1) 위험관리
신용위험은 연결회사의 통상적인 거래 및 투자활동에서 발생하며 고객 또는 거래상대방이 계약조건상 의무사항을 지키지 못하였을 때 발생합니다. 이러한 신용위험을 관리하기 위하여 연결회사는 주기적으로 고객과 거래상대방의 재무상태와 과거 경험및 기타요소들을 고려하여 재무신용도를 평가하고 있으며 고객과 거래상대방 각각에대한 신용한도를 설정하고 있습니다. 신용위험은 현금및현금성자산, 각종 예금 등과 같은 금융기관과의 거래에서도 발생할 수 있습니다. 이러한 위험을 줄이기 위해, 연결회사는 신용도가 높은 금융기관들에 대해서만 거래를 하고 있습니다.
(2) 금융자산의 손상
연결회사는 기대신용손실 모형이 적용되는 다음의 금융자산을 보유하고 있습니다.
· 재화 및 용역의 제공에 따른 매출채권
· 용역 제공에 따른 계약자산
· 당기손익-공정가치로 측정하는 채무상품
· 상각후원가로 측정하는 기타 금융자산
현금성자산도 손상 규정의 적용대상에 포함되나 식별된 기대신용손실은 유의적이지 않습니다.
(가) 매출채권과 계약자산
연결회사는 매출채권과 계약자산에 대해 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용합니다.
기대신용손실을 측정하기 위해 매출채권과 계약자산은 신용위험 특성과 연체일을 기준으로 구분하였습니다. 미청구용역에 연결따른 계약자산은 동일 유형의 계약에서 발생한 매출채권과 유사한 위험속성을 가지므로 연결회사는 매출채권의 손실율이 계약자산의 손실율에 대한 합리적인 추정치로 판단하였습니다.
기대신용손실율은 당반기말과 전기말 기준으로부터 각 36개월 동안의 매출과 관련된지불 정보와 관련 확인된 신용손실 정보를 근거로 산출하였습니다. 과거 손실 정보는고객의 채무 이행능력에 영향을 미칠 거시경제적 현재 및 미래전망정보를 반영하여 조정합니다. 연결회사는 매출이 발생하는 국가의 GDP 및 실업률이 가장 목적적합한요소로 판단하고 과거 손실 정보를 이러한 요소의 예상 변동에 근거하여 조정합니다.
당반기말과 전기말의 매출채권과 계약자산에 대한 손실충당금은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 정상 | 30일 초과 연체 |
90일 초과 연체 |
180일 초과 연체 |
1년 초과 연체 |
개별인식 | 계 |
| 기대 손실률 | 3% | 16% | 30% | 60% | 100% | 100% | |
| 총 장부금액 - 매출채권 | 1,284,793 | 726,686 | 249,450 | 1,200,639 | 1,229,963 | 647,514 | 5,339,045 |
| 총 장부금액 - 계약자산 | 7,231,963 | - | - | - | - | - | 7,231,963 |
| 손실충당금 | 471,704 | 118,811 | 74,614 | 717,793 | 1,229,963 | 647,514 | 3,260,399 |
| (전기말) | (단위: 천원) |
| 구 분 | 정상 | 30일 초과 연체 |
90일 초과 연체 |
180일 초과 연체 |
1년 초과 연체 |
개별인식 | 계 |
| 기대 손실률 | 2% | 11% | 18% | 57% | 100% | 100% | |
| 총 장부금액 - 매출채권 | 2,678,109 | 1,447,019 | 417,515 | 708,542 | 820,138 | 1,074,308 | 7,145,631 |
| 총 장부금액 - 계약자산 | 5,337,485 | - | - | - | - | - | 5,337,485 |
| 손실충당금 | 248,091 | 152,795 | 76,329 | 403,257 | 820,138 | 1,074,308 | 2,774,918 |
당반기와 전반기 중 매출채권과 계약자산의 손실충당금 변동내역은 다음과 같습니다
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 매출채권 | 계약자산 | 매출채권 | 계약자산 | |
| 기초금액 | 2,580,755 | 194,162 | 2,957,324 | 8,410 |
| 대손상각비(환입) | 293,539 | 233,304 | (493,679) | 14,794 |
| 제각 | (41,361) | - | - | - |
| 기말금액 | 2,832,933 | 427,466 | 2,463,645 | 23,204 |
(나) 당기손익-공정가치 측정 금융자산
연결회사는 당기손익-공정가치 측정 금융자산에 대한 신용위험에도 노출되어 있습니다. 당반기말 현재 연결회사의 관련 최대노출금액은 해당 장부금액입니다 (당반기말: 1,662,918천원, 전기말: 2,221,221천원).
4.1.3 유동성 위험
연결회사는 매 6개월 및 1년 단위로 자금수지계획을 수립함으로써 영업활동, 투자활동, 재무활동에서의 자금수지를 미리 예측하고 있으며, 이를 통해 필요한 유동성 규모를 사전에 확보하고 유지하여 향후에 발생할 수 있는 유동성 리스크를 사전에 관리하고 있습니다. 또한, 신중한 유동성 위험 관리는 충분한 현금성자산 및 단기금융상품의 유지, 적절히 약정된 신용한도금액으로부터의 자금 여력 등을 포함하고 있습니다.
(1) 만기분석
유동성 위험 분석에서는 연결회사의 다음의 금융부채를 계약상 만기별로 구분하였습니다.
(가) 모든 비파생 금융부채
(나) 순액 및 총액 결제 파생상품 중 계약상 만기가 현금흐름의 시기를 이해하기 위해 필요한 경우
유동성 위험 분석에 포함된 금액은 계약상의 할인되지 않은 현금흐름입니다. 금융보증계약 이외의 12개월 이내 만기가 도래하는 금액은 현재가치 할인의 효과가 중요하지 않으므로 장부금액과 동일합니다. 금융보증계약은 즉시 지급을 요구받을 수 있으므로 계약금액 총액이 6개월 미만 구분에 포함되어 있습니다. 이자율스왑의 경우 보고기간말 현재의 선도이자율을 적용하여 미래 현금흐름을 추정하였습니다.
당반기말과 전기말 현재 금융부채의 계약상 만기는 다음과 같습니다. 아래 표에 표시된 현금흐름은 현재가치 할인을 하지 아니한 금액입니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 3개월미만 | 3개월이상 1년 미만 |
1년이상 | 합 계 |
|---|---|---|---|---|
| 매입채무 | 248,998 | - | - | 248,998 |
| 미지급금 | 1,291,244 | - | - | 1,291,244 |
| 미지급비용 | 1,288,628 | - | - | 1,288,628 |
| 차입금 | 2,320,531 | 20,793,353 | 16,230,813 | 39,344,697 |
| 리스부채 | 113,726 | 237,440 | 497,687 | 848,853 |
| 교환사채 | 18,149,766 | - | - | 18,149,766 |
| 합 계 | 23,412,893 | 21,030,793 | 16,728,500 | 61,172,186 |
| (전기말) | (단위: 천원) |
| 구분 | 3개월미만 | 3개월이상 1년 미만 |
1년이상 | 합계 |
|---|---|---|---|---|
| 매입채무 | 367,581 | - | - | 367,581 |
| 미지급금 | 1,130,485 | - | - | 1,130,485 |
| 미지급비용 | 1,399,078 | - | - | 1,399,078 |
| 차입금 | 3,192,366 | 12,565,891 | 22,144,353 | 37,902,610 |
| 리스부채 | 222,467 | 295,096 | 563,685 | 1,081,248 |
| 교환사채 | 21,178,372 | - | - | 21,178,372 |
| 임대보증금 | - | - | 30,000 | 30,000 |
| 합 계 | 27,490,349 | 12,860,987 | 22,738,038 | 63,089,374 |
4.2 자본위험관리
연결회사의 자본관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보유하고 자본비용을 절감하기 위해 최적 자본구조를 유지하는 것입니다.
연결회사는 자본조달비율에 기초하여 자본을 관리하고 있으며, 자본조달비율은 순부채를 총자본으로 나누어 산출하고 있습니다. 순부채는 총차입금에서 현금및현금성자산을차감한 금액이며, 총자본은 연결재무상태표의 자본에 순부채를 가산한 금액입니다. 당반기말과 전기말 현재 연결회사의 자본조달비율은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 총차입금 | 47,898,433 | 45,904,050 |
| 차감: 현금및현금성자산 | (1,149,221) | (1,280,250) |
| 순부채 | 46,749,212 | 44,623,800 |
| 자본총계 | 45,374,496 | 48,593,356 |
| 총자본 | 92,123,708 | 93,217,156 |
| 자본조달비율 | 50.7% | 47.9% |
5. 범주별 금융상품
(1) 당반기말과 전기말 현재 연결회사의 범주별 금융자산의 내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정금융자산 |
당기손익-공정가치 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합계 |
|---|---|---|---|---|
| 현금및현금성자산 | 1,149,221 | - | - | 1,149,221 |
| 단기금융자산 | 1,000,000 | - | 1,000,000 | |
| 당기손익-공정가치측정금융자산 | - | 1,662,918 | - | 1,662,918 |
| 기타포괄손익-공정가치측정금융자산 | - | - | 3,802,608 | 3,802,608 |
| 매출채권 | 2,506,112 | - | - | 2,506,112 |
| 기타유동금융자산 | 144,927 | - | - | 144,927 |
| 기타비유동금융자산 | 1,313,910 | - | - | 1,313,910 |
| 합 계 | 6,114,170 | 1,662,918 | 3,802,608 | 11,579,696 |
| (전기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정금융자산 |
당기손익-공정가치 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합계 |
|---|---|---|---|---|
| 현금및현금성자산 | 1,280,250 | - | - | 1,280,250 |
| 단기금융자산 | 1,000,000 | 1,000,000 | ||
| 당기손익-공정가치측정금융자산 | - | 2,221,221 | - | 2,221,221 |
| 기타포괄손익-공정가치측정금융자산 | - | - | 3,735,764 | 3,735,764 |
| 매출채권 | 4,564,875 | - | - | 4,564,875 |
| 기타유동금융자산 | 371,763 | - | - | 371,763 |
| 기타비유동금융자산 | 1,526,126 | - | - | 1,526,126 |
| 합 계 | 8,743,014 | 2,221,221 | 3,735,764 | 14,699,999 |
(2) 당반기말과 전기말 현재 연결회사의 범주별 금융부채의 내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치 측정금융부채 |
기타금융부채 | 합 계 |
|---|---|---|---|---|
| 단기차입금 | 11,000,000 | - | - | 11,000,000 |
| 유동성장기차입금 | 11,095,540 | - | 11,095,540 | |
| 매입채무 | 248,998 | - | - | 248,998 |
| 기타유동금융부채 | 2,579,872 | - | - | 2,579,872 |
| 유동리스부채 | - | - | 324,333 | 324,333 |
| 기타비유동금융부채 | - | - | - | - |
| 비유동리스부채 | - | - | 406,651 | 406,651 |
| 장기차입금 | 15,138,460 | - | - | 15,138,460 |
| 교환사채 | 10,664,433 | - | - | 10,664,433 |
| 파생상품부채 | - | 5,010,847 | - | 5,010,847 |
| 합 계 | 50,727,303 | 5,010,847 | 730,984 | 56,469,134 |
| (전기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치 측정금융부채 |
기타금융부채 | 합 계 |
|---|---|---|---|---|
| 단기차입금 | 8,400,000 | - | - | 8,400,000 |
| 유동성장기차입금 | 7,762,100 | - | 7,762,100 | |
| 매입채무 | 367,581 | - | - | 367,581 |
| 기타유동금융부채 | 2,529,564 | - | - | 2,529,564 |
| 유동리스부채 | - | - | 450,189 | 450,189 |
| 기타비유동금융부채 | 30,000 | - | - | 30,000 |
| 비유동리스부채 | - | - | 471,929 | 471,929 |
| 장기차입금 | 18,471,900 | - | - | 18,471,900 |
| 교환사채 | 11,270,050 | - | - | 11,270,050 |
| 파생상품부채 | - | 7,049,784 | - | 7,049,784 |
| 합 계 | 48,831,195 | 7,049,784 | 922,118 | 56,803,097 |
(3) 당반기와 전반기의 연결회사의 금융상품 범주별 금융손익은 내역은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 상각후원가 측정 금융자산 |
당기손익-공정가치측정금융자산 | 기타포괄손익-공정가치측정금융자산 | 상각후원가 측정 금융부채 |
당기손익-공정가치측정금융부채 | 기타금융부채 | 합 계 |
|---|---|---|---|---|---|---|---|
| 이자수익(비용) | 48,407 | - | - | (906,365) | - | (42,147) | (900,105) |
| 배당금수익 | - | - | 57,762 | - | - | - | 57,762 |
| 외환차익 | 3,333 | - | - | - | - | - | 3,333 |
| 외화환산이익(손실) | (10,106) | - | - | - | - | - | (10,106) |
| 당기손익-공정가치측정금융자산평가이익(손실) | - | (4,350) | - | - | - | - | (4,350) |
| 당기손익-공정가치측정금융자산처분이익 | - | 19,838 | - | - | - | - | 19,838 |
| 파생상품평가이익 | - | - | - | - | 1,439,550 | - | 1,439,550 |
| 사채상환이익(손실) | - | - | - | (384,378) | - | - | (384,378) |
| 합 계 | 41,634 | 15,488 | 57,762 | (1,290,743) | 1,439,550 | (42,147) | 221,544 |
| (전반기) | (단위: 천원) |
| 구 분 | 상각후원가 측정 금융자산 |
당기손익-공정가치측정금융자산 | 기타포괄손익-공정가치측정금융자산 | 상각후원가 측정 금융부채 |
당기손익-공정가치측정금융부채 | 기타금융부채 | 합 계 |
|---|---|---|---|---|---|---|---|
| 이자수익(비용) | 35,257 | - | - | (2,134,492) | - | (39,880) | (2,139,115) |
| 배당금수익 | - | - | 76,786 | - | - | - | 76,786 |
| 외환차익(차손) | 230 | - | - | (12) | - | - | 218 |
| 외화환산이익 | 10,065 | - | - | - | - | - | 10,065 |
| 당기손익-공정가치측정금융자산평가이익 | - | 31,732 | - | - | - | - | 31,732 |
| 당기손익-공정가치측정금융자산처분이익 | - | 84,536 | - | - | - | - | 84,536 |
| 파생상품평가이익(손실) | - | - | - | - | (14,873,958) | - | (14,873,958) |
| 사채상환이익(손실) | - | - | - | (213,245) | - | - | (213,245) |
| 합 계 | 45,552 | 116,268 | 76,786 | (2,347,749) | (14,873,958) | (39,880) | (17,022,981) |
(4) 공정가치
1) 금융상품의 범주별 분류 및 공정가치
공정가치로 측정되거나 공정가치로 공시되는 금융상품을 공정가치 서열체계에 따라 구분하기 위하여 정의된 수준들은 다음과 같습니다.
ㆍLevel 1 : 동일한 자산이나 부채에 대한 활성시장의(조정되지 않은) 공시가격
ㆍLevel 2 : 직접적 또는 간접적으로 관측가능한, 자산이나 부채에 대한 투입변수
단, Level 1에 포함된 공시가격은 제외함
ㆍLevel 3 : 관측가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입변수
(관측가능하지 않은 투입변수)
금융상품의 공정가치를 측정하는 데에 사용되는 평가기법에는 다음이 포함됩니다.
- 유사한 상품의 공시시장가격 또는 딜러가격
- 현금흐름의 할인기법 등의 기타 기법 사용
당반기말과 전기말 현재 공정가치로 측정된 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | Level 1 | Level 2 | Level 3 | 합계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익-공정가치측정금융자산 | - | 1,662,918 | - | 1,662,918 |
| 기타포괄손익-공정가치측정금융자산 | 3,802,608 | - | - | 3,802,608 |
| 금융자산 계 | 3,802,608 | 1,662,918 | - | 5,465,526 |
| 금융부채 | ||||
| 파생상품부채 | - | - | 5,010,847 | 5,010,847 |
| (전기말) | (단위: 천원) |
| 구 분 | Level 1 | Level 2 | Level 3 | 합계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익-공정가치측정금융자산 | - | 2,221,221 | - | 2,221,221 |
| 기타포괄손익금융자산 | 3,735,764 | - | - | 3,735,764 |
| 금융자산 계 | 3,735,764 | 2,221,221 | - | 5,956,985 |
| 금융부채 | ||||
| 파생상품부채 | - | - | 7,049,784 | 7,049,784 |
2) 가치평가기법 및 투입 변수
| (단위: 천원) |
| 구분 | 수준 | 가치평가기법 | 투입변수 | 공정가치 | 수준 3 투입변수 범위 | |||
|---|---|---|---|---|---|---|---|---|
| 당기말 | 전기말 | 투입변수 | 당기말 | 전기말 | ||||
| 파생상품부채 | ||||||||
| 교환사채 | 3 | 이항모형 | 주가의 변동성 | 5,010,847 | 7,049,784 | 변동성 | 89.6% | 89.2% |
6. 현금및현금성자산 등
(1) 당반기말과 전기말 현재 현금및현금성자산 등의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 현금및현금성자산 | ||
| 보통예금 | 1,149,221 | 1,280,250 |
| 단기금융자산 | ||
| 정기예금(*) | 1,000,000 | 1,000,000 |
| 합 계 | 2,149,221 | 2,280,250 |
(*) 당반기말 현재 연결회사는 차입금과 관련하여 상기 정기예금을 담보로 제공하고 있습니다(주석34참고).
(2) 당반기말과 전기말 현재 사용이 제한된 예금은 다음과 같습니다.
| (단위: 천원) |
| 금융기관 | 계정과목 | 당반기말 | 전기말 | 설정기관 | 비고 |
|---|---|---|---|---|---|
| 미래에셋투자증권 | 현금및현금성자산 | 61,255 | 12,140 | 산업은행 | 특정차입금에 대한 질권설정 |
| 산업은행 | 단기금융자산 | 1,000,000 | 1,000,000 | 산업은행 | 특정차입금에 대한 질권설정 |
| 합계 | 1,061,255 | 1,012,140 |
7. 공정가치측정금융자산
7.1 당기손익-공정가치측정금융자산
(1) 당반기말과 전기말 현재 당기손익-공정가치측정금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 휴믹(*) | - | - | - | - |
| MMF | 1,662,918 | - | 2,221,221 | - |
| 합 계 | 1,662,918 | - | 2,221,221 | - |
(*) 2023년 중 공간사용계약의 대가로 받을 임대료의 출자전환으로 취득하였으며, 손상징후가 발생함에 따라 전액 평가손실을 인식 하였습니다.
7.2 기타포괄손익-공정가치측정금융자산
(1) 당반기말과 전기말 현재 기타포괄손익-공정가치측정금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 비유동항목 : | ||
| 상장 | ||
| 농업금융채권 | 1,969,010 | 1,946,114 |
| 중소기업은행채권조건부자본증권 | 1,833,598 | 1,789,650 |
| 합 계 | 3,802,608 | 3,735,764 |
위 금융상품을 처분하는 경우 관련 기타포괄손익누계액은 이익잉여금으로 재분류되며 당기손익으로 재분류되지 않습니다.
(2) 당반기말 현재 연결회사는 차입금과 관련하여 상기 기타포괄손익-공정가치측정금융자산을 담보로 제공하고 있습니다(주석34 참조).
8. 매출채권
(1) 당반기말과 전기말 현재 매출채권과 계약자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | |
| 매출채권(*) | 5,339,045 | (2,832,933) | 2,506,112 | 7,145,631 | (2,580,756) | 4,564,875 |
| 계약자산 | 7,231,963 | (427,466) | 6,804,497 | 5,337,485 | (194,162) | 5,143,323 |
| 합 계 | 12,571,008 | (3,260,399) | 9,310,609 | 12,483,116 | (2,774,918) | 9,708,198 |
(*) 당반기 중 매출채권 제각으로 인해 손실충당금 41,361천원이 감소하였습니다.
(2) 손상
매출채권, 기타 상각후원가 금융자산의 손상 및 연결회사의 신용위험 관련 사항은 주석 4.1.2를 참고하시기 바랍니다.
9. 기타금융자산
당반기말과 전기말 현재 기타금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타유동금융자산 | ||
| 미수수익 | 34,398 | 18,770 |
| 미수금 | 110,529 | 352,992 |
| 소 계 | 144,927 | 371,762 |
| 기타비유동금융자산 | ||
| 장기금융상품 | 5,700 | 3,900 |
| 보증금 | 1,259,896 | 1,496,178 |
| 현재가치할인차금 | (33,425) | (62,536) |
| 장기대여금 | 81,739 | 88,584 |
| 소 계 | 1,313,910 | 1,526,126 |
| 합 계 | 1,458,837 | 1,897,888 |
10. 기타유동자산
당반기말과 전기말 현재 기타유동자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 선급금 | 256,886 | 236,388 |
| 선급비용 | 220,343 | 403,444 |
| 합 계 | 477,229 | 639,832 |
11. 재고자산
당반기말과 전기말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 평가전금액 | 평가충당금 | 재무상태표가액 | 평가전금액 | 평가충당금 | 재무상태표가액 | |
| 원재료 | 65,596 | - | 65,596 | 184,010 | - | 184,010 |
| 부재료 | 59,124 | - | 59,124 | 93,423 | - | 93,423 |
| 저장품 | 7,882 | - | 7,882 | 6,614 | - | 6,614 |
| 재공품 | - | - | - | 231,845 | - | 231,845 |
| 합 계 | 132,602 | - | 132,602 | 515,892 | - | 515,892 |
당반기에 비용으로 인식되어 제조원가에 포함된 재고자산의 원가는 1,710,402천원 (전반기: 2,671,122천원) 입니다.
12. 투자부동산
(1) 당반기말과 전기말 현재 투자부동산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 회사명 | 당반기말 장부금액 |
전기말 장부금액 |
|---|---|---|
| 토지(*) | - | 117,527 |
| 건물(*) | - | 1 |
| 합 계 | - | 117,528 |
(*) 당반기에 투자부동산(토지 및 건물)을 처분하였으며, 처분이익 1,122,472천원이 발생 하였습니다.
(2) 당반기 및 전반기 중 투자부동산의 주요 변동은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기 초 | 117,528 | 128,956 |
| 감가상각비(*) | - | (6,234) |
| 처분 | (117,528) | - |
| 기 말 | - | 122,722 |
(*) 투자부동산의 감가상각비는 판매비와관리비에 포함되어 있습니다.
(3) 당반기 중 투자부동산에서 발생한 임대수익은 2,129천원(전반기 18,000천원)입니다.
(4) 전기말 투자부동산의 공정가치는 608,000천원이며, 공정가치 평가는 독립된 평가인에 의해 수행됩니다.
13. 유형자산
(1) 당반기말과 전기말 현재 유형자산 장부금액의 구성내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 토지 | 24,774,222 | - | 24,774,222 |
| 건물 | 26,506,693 | (4,865,617) | 21,641,076 |
| 구축물 | 872,043 | (326,659) | 545,384 |
| 기계장치 | 499,276 | (460,344) | 38,932 |
| 차량운반구 | 53,494 | (48,836) | 4,658 |
| 공구와기구 | 355,646 | (330,768) | 24,878 |
| 비품 | 1,884,556 | (1,410,042) | 474,514 |
| 시설장치 | 5,592,696 | (3,870,330) | 1,722,366 |
| 연구및시험기기 | 23,822,679 | (16,611,510) | 7,211,169 |
| 건설중인자산 | 33,518,969 | - | 33,518,969 |
| 합 계 | 117,880,274 | (27,924,106) | 89,956,168 |
| (전기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 토지 | 24,774,222 | - | 24,774,222 |
| 건물 | 26,506,693 | (4,538,884) | 21,967,809 |
| 구축물 | 872,043 | (304,125) | 567,918 |
| 기계장치 | 499,276 | (451,482) | 47,794 |
| 차량운반구 | 53,494 | (47,440) | 6,054 |
| 공구와기구 | 355,646 | (324,129) | 31,517 |
| 비품 | 1,873,965 | (1,294,108) | 579,857 |
| 시설장치 | 5,563,696 | (3,675,257) | 1,888,439 |
| 연구및시험기기 | 23,335,309 | (15,611,513) | 7,723,796 |
| 건설중인자산 | 31,451,453 | - | 31,451,453 |
| 합 계 | 115,285,797 | (26,246,938) | 89,038,859 |
(2) 당반기와 전반기 중 유형자산의 변동은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 기초 장부금액 |
취득 | 처분 | 감가상각 | 대체 | 환율변동 차이 |
기말 장부금액 |
|---|---|---|---|---|---|---|---|
| 토지 | 24,774,222 | - | - | - | - | - | 24,774,222 |
| 건물 | 21,967,808 | - | - | (326,733) | - | - | 21,641,075 |
| 구축물 | 567,918 | - | - | (22,534) | - | - | 545,384 |
| 기계장치 | 47,794 | - | - | (8,861) | - | - | 38,932 |
| 차량운반구 | 6,054 | - | - | (1,397) | - | - | 4,657 |
| 공구와기구 | 31,517 | - | - | (6,640) | - | - | 24,877 |
| 비품 | 579,857 | 12,244 | (1) | (117,103) | - | (483) | 474,514 |
| 시설장치 | 1,888,439 | 19,000 | - | (195,073) | 10,000 | - | 1,722,366 |
| 연구및시험기기 | 7,723,795 | 486,970 | - | (999,996) | 400 | - | 7,211,169 |
| 건설중인자산 | 31,451,453 | 2,077,916 | - | - | (10,400) | - | 33,518,969 |
| 합 계 | 89,038,857 | 2,596,130 | (1) | (1,678,337) | - | (483) | 89,956,167 |
| (전반기) | (단위: 천원) |
| 구 분 | 기초 장부금액 |
취득 | 처분 | 감가상각 | 대체 | 환율변동 차이 |
기말 장부금액 |
|---|---|---|---|---|---|---|---|
| 토지 | 11,339,089 | - | - | - | - | - | 11,339,089 |
| 건물 | 22,621,274 | - | - | (326,733) | - | - | 22,294,541 |
| 구축물 | 613,241 | - | - | (22,661) | - | - | 590,580 |
| 기계장치 | 33,106 | 35,297 | - | (14,688) | - | - | 53,715 |
| 차량운반구 | 8,847 | - | - | (1,397) | - | - | 7,449 |
| 공구와기구 | 22,066 | 22,480 | - | (6,390) | - | - | 38,157 |
| 비품 | 695,870 | 37,596 | (954) | (116,325) | - | 379 | 616,566 |
| 시설장치 | 2,141,144 | 42,000 | - | (211,655) | - | - | 1,971,489 |
| 실험기기 | 8,952,505 | 446,062 | (8,098) | (1,205,097) | 187,273 | - | 8,372,645 |
| 건설중인자산 | 8,322,938 | 12,420,408 | - | - | (187,273) | - | 20,556,073 |
| 합 계 | 54,750,080 | 13,003,843 | (9,052) | (1,904,946) | - | 379 | 65,840,304 |
(3) 당반기와 전반기 중 감가상각비의 계정별 배부현황은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 매출원가 | 1,586,007 | 1,652,077 |
| 경상연구개발비 | 71,400 | 243,228 |
| 판매비와관리비 | 20,930 | 9,640 |
| 합 계 | 1,678,337 | 1,904,945 |
(4) 당반기 중 적격자산인 유형자산에 대해 자본화된 차입원가는 1,215,087천원이며, 자본화가능차입원가를 산정하기 위해 사용된 자본화차입이자율은 11.26%입니다.
(5) 당반기말 현재 연결회사는 차입금과 관련하여 토지와 건물을 담보로 제공하고 있습니다(주석34 참조). 연결회사는 상기 건물에 대하여 KB손해보험에 화재보험을 가입하고 있으며, 동 화재보험과 관련하여 신한은행은 3,200,000천원의 질권을 설정하고 있습니다.
14. 무형자산
(1) 당반기말과 전기말 현재 무형자산 장부금액의 구성내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 특허권 | 863,146 | (565,285) | 297,861 |
| 회원권 | - | - | - |
| 소프트웨어 | 1,005,199 | (871,293) | 133,906 |
| 영업권 | 3,949,756 | - | 3,949,756 |
| 합 계 | 5,818,101 | (1,436,578) | 4,381,523 |
| (전기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 특허권 | 863,147 | (544,771) | 318,376 |
| 상표권 | 15,312 | (15,312) | - |
| 회원권 | 1,765,783 | - | 1,765,783 |
| 소프트웨어 | 1,005,199 | (831,786) | 173,413 |
| 고객가치 | 121,267 | (121,267) | - |
| 영업권 | 3,949,756 | - | 3,949,756 |
| 합 계 | 7,720,464 | (1,513,136) | 6,207,328 |
(2) 당반기와 전반기 중 무형자산의 변동은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 기 초 장부금액 |
취 득 | 감가상각 | 처 분 | 대체 | 기 말 장부금액 |
|---|---|---|---|---|---|---|
| 특허권 | 318,376 | - | (20,515) | - | - | 297,861 |
| 회원권 | 1,765,783 | - | - | (1,765,783) | - | - |
| 소프트웨어 | 173,413 | - | (39,507) | - | - | 133,906 |
| 영업권 | 3,949,756 | - | - | - | - | 3,949,756 |
| 합 계 | 6,207,328 | - | (60,022) | (1,765,783) | - | 4,381,523 |
| (전반기) | (단위: 천원) |
| 구 분 | 기 초 장부금액 |
취 득 | 감가상각 | 처 분 | 대체 | 기 말 장부금액 |
|---|---|---|---|---|---|---|
| 특허권 | 24,192 | 330,000 | (13,939) | - | - | 340,253 |
| 상표권 | 96 | - | (96) | - | - | - |
| 회원권 | 1,765,783 | - | - | - | - | 1,765,783 |
| 소프트웨어 | 250,703 | 1,240 | (39,731) | - | - | 212,212 |
| 영업권 | 3,949,756 | - | - | - | - | 3,949,756 |
| 합 계 | 5,990,530 | 331,240 | (53,766) | - | - | 6,268,004 |
(3) 당반기와 전반기에 인식한 무형자산상각비의 계정별 배부현황은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 매출원가 | 8,996 | 17,993 |
| 경상연구개발비 | 16,500 | 8,250 |
| 판매비와관리비 | 34,526 | 27,523 |
| 합 계 | 60,022 | 53,766 |
(4) 당반기와 전반기에 발생한 경상연구개발비는 각각 4,743,226천원 및 5,187,918천원입니다.
(5) 영업권이 배분된 현금창출단위 손상검사
연결회사는 주석2에서 설명하는 바와 같이 매 보고기간말 영업권이 배분된 현금창출단위에 대하여 손상평가를 수행하고 있습니다. 회수가능액은 사용가치 혹은 처분부대원가를 뺀 공정가치인 순공정가치의 계산에 근거하여 결정되었습니다.
연결회사는 2022년 중 종속기업인 주식회사 켐온의 흡수합병으로 승계한 영업권이 배분된 현금창출단위인 비임상실험대행 부문에 대해 전기말에 손상평가를 수행하였으며 사용가치에 근거한 회수가능가액이 장부금액을 초과하였습니다.
회수가능액의 추정에 사용된 주요 가정은 아래와 같습니다. 주요 가정치는 해당 산업의 미래 추세에 대한 경영진의 평가를 반영하고 있으며, 내ㆍ외부의 역사적 자료에 기초하고 있습니다.
| 구분 | 비임상실험대행 |
|---|---|
| 영구성장률 | 0.0% |
| 세후할인율 | 13.63% |
15. 사용권자산 및 리스부채
(1) 당반기와 전반기 중 사용권자산의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||||
|---|---|---|---|---|---|---|
| 건 물 | 차량운반구 | 합 계 | 건 물 | 차량운반구 | 합 계 | |
| 기초 순장부가액 | 646,540 | 401,529 | 1,048,069 | 701,702 | 270,417 | 972,119 |
| 취득 | 180,638 | 35,839 | 216,477 | 89,416 | 174,430 | 263,846 |
| 처분 | (184) | (32,174) | (32,358) | - | - | - |
| 감가상각비 | (337,854) | (83,718) | (421,572) | (364,327) | (85,300) | (449,627) |
| 기말 순장부가액 | 489,140 | 321,476 | 810,616 | 426,791 | 359,547 | 786,338 |
(2) 당반기와 전반기 중 리스사용권 및 리스부채와 관련하여 당기손익으로 인식된 금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 사용권자산의 감가상각비 | 421,572 | 449,627 |
| 리스부채에 대한 이자비용 | 42,147 | 39,880 |
| 단기리스료 및 소액자산리스료 | 121,374 | 36,013 |
(3) 당반기말과 전기말 현재 리스부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동리스부채 | 324,333 | 450,189 |
| 비유동리스부채 | 406,651 | 471,929 |
| 합계 | 730,984 | 922,118 |
(4) 당반기와 전반기 중 리스부채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초 | 922,118 | 920,825 |
| 증가 | 256,883 | 235,605 |
| 감소 | (35,301) | - |
| 지급 | (412,716) | (435,679) |
| 기말 | 730,984 | 720,751 |
(5) 당반기와 전반기 중 리스의 총 현금유출액 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 |
|---|---|---|
| 리스부채에 대한 이자비용 | 42,147 | 39,880 |
| 리스부채에서 발생한 현금유출 | 370,568 | 395,799 |
| 단기리스료 및 소액자산리스료 | 121,374 | 36,013 |
| 합 계 | 534,089 | 471,692 |
16. 기타금융부채
당반기말과 전기말 현재 기타금융부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타유동금융부채 | ||
| 미지급금 | 1,291,244 | 1,130,486 |
| 미지급비용 | 1,288,628 | 1,399,078 |
| 합 계 | 2,579,872 | 2,529,564 |
| 기타비유동금융부채 | ||
| 임대보증금 | - | 30,000 |
| 합 계 | - | 30,000 |
17. 기타부채
당반기말과 전기말 현재 기타부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타유동부채 | ||
| 예수금 | 185,201 | 339,762 |
| 선수금 | 27,951 | 32,758 |
| 선수수익 | - | 39,041 |
| 합 계 | 213,152 | 411,561 |
| 기타비유동부채 | ||
| 장기급여부채 | 1,028,709 | 1,132,084 |
| 복구충당부채 | 25,800 | 25,800 |
| 합 계 | 1,054,509 | 1,157,884 |
18. 순확정급여부채
(1) 당반기말과 전기말 현재 순확정급여부채의 산정내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기금에 적립되지 않은 확정급여채무의 현재가치 | 11,220,197 | 12,479,682 |
| 사외적립자산의 공정가치 | (4,663,854) | (5,757,936) |
| 재무상태표상의 순확정급여부채 | 6,556,343 | 6,721,746 |
(2) 당반기말과 전반기말 중 확정급여채무의 변동 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초 확정급여채무의 현재가치 | 12,479,682 | 10,808,606 |
| 당기 근무원가 | 1,086,080 | 978,823 |
| 이자원가 | 199,190 | 187,573 |
| 재측정요소: | ||
| - 인구통계적가정의 변동에 의한 보험수리적 손익 | - | 40,828 |
| - 재무적가정의 변동에 의한 보험수리적 손익 | 3,887 | 101,922 |
| - 가정과 실제의 차이에 의한 보험수리적 손익 | (16,400) | 185,041 |
| 제도에서의 지급액: | ||
| - 급여의 지급 | (2,532,242) | (556,950) |
| 보고기간말 금액 | 11,220,197 | 11,745,843 |
(3) 당반기와 전반기의 사외적립자산의 공정가치 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초금액 | 5,757,936 | 6,103,493 |
| 사외적립자산의 이자수익 | 132,711 | 159,397 |
| 재측정요소: | ||
| - 사외적립자산의 수익(이자수익에 포함된 금액 제외) | (66,161) | (51,005) |
| 사외적립자산 납입액 | 1,180,739 | 313,144 |
| 제도에서의 지급액: | ||
| - 급여의 지급 | (2,341,371) | (574,388) |
| 기말금액 | 4,663,854 | 5,950,641 |
(4) 당반기말과 전기말 현재 사외적립자산의 공정가치에 포함된 주요 유형별 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 정기예금 | 4,663,854 | 5,757,936 |
(5) 당반기와 전반기 중 포괄손익계산서에 반영된 금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 당기근무원가 | 1,086,080 | 978,823 |
| 이자원가 | 199,189 | 187,573 |
| 사외적립자산의 이자수익 | (132,711) | (159,397) |
| 당기손익에 인식한 퇴직급여 | 1,152,558 | 1,006,999 |
(6) 당반기와 전반기 중 인식한 퇴직급여 배부액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 판매비와관리비 | 292,664 | 201,995 |
| 경상연구개발비 | 166,316 | 65,162 |
| 매출원가 | 696,067 | 739,842 |
| 합 계 | 1,155,047 | 1,006,999 |
(7) 당반기말과 전기말 현재 주요 보험수리적 가정은 다음과 같습니다.
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 할인율 | 4.46% | 4.54% |
| 미래임금상승률 | 4.00% | 4.00% |
19. 차입금
(1) 당반기말과 전기말의 단기차입금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 차입처 | 연이자율 | 당반기말 | 전기말 |
|---|---|---|---|---|
| 일반대출 | 신한은행(*) | 3.47% | 3,000,000 | 3,000,000 |
| 일반대출 | 신한은행(*) | 4.56% | 4,000,000 | 1,400,000 |
| 일반대출 | 신한은행(*) | 5.94% | 4,000,000 | 4,000,000 |
| 합 계 | 11,000,000 | 8,400,000 | ||
(*) 차입금에 대해서 연결회사의 금융상품과 유형자산이 담보로 설정되어 있습니다(주석34 참조).
(2) 당반기말과 전기말의 유동성장기차입금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 당반기말 | 전기말 |
|---|---|---|---|---|---|
| 일반대출 | 신한은행(*) | 2025-10-30 | 3.92% | 1,400,000 | 1,400,000 |
| 일반대출 | 신한은행(*) | 2026-01-27 | 4.16% | 2,860,000 | 2,860,000 |
| 일반대출 | 신한은행(*) | 2025-08-03 | 4.36% | 1,974,000 | 1,974,000 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.57% | 250,000 | 250,000 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.68% | 250,000 | 250,000 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.23% | 333,370 | 333,370 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 2.90% | 296,250 | 296,250 |
| 시설대출 | 산업은행(*) | 2026-01-26 | 2.74% | 138,750 | - |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.19% | 135,780 | 135,780 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 2.97% | 215,160 | 215,160 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.19% | 47,540 | 47,540 |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.57% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.68% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.23% | 333,330 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 2.90% | 296,250 | - |
| 시설대출 | 산업은행(*) | 2026-04-24 | 2.74% | 138,750 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.19% | 135,770 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 2.97% | 215,160 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.19% | 47,460 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.57% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.68% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.23% | 333,330 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 2.90% | 296,250 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.19% | 135,770 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 2.97% | 215,160 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.19% | 47,460 | - |
| 합 계 | 11,095,540 | 7,762,100 | |||
(*) 차입금에 대해서 연결회사의 금융상품과 유형자산이 담보로 설정되어 있습니다(주석34 참조).
(3) 당반기말과 전기말의 장기차입금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 당반기말 | 전기말 |
|---|---|---|---|---|---|
| 일반대출 | 신한은행(*) | 2025-08-03 | 4.36% | 1,974,000 | 1,974,000 |
| 일반대출 | 신한은행(*) | 2025-10-30 | 3.92% | 1,400,000 | 1,400,000 |
| 일반대출 | 신한은행(*) | 2026-01-27 | 4.16% | 2,860,000 | 2,860,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.57% | 3,000,000 | 3,000,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 2.90% | 3,555,000 | 3,555,000 |
| 시설대출 | 산업은행(*) | 2028-10-24 | 2.74% | 1,665,000 | 1,665,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.19% | 1,629,250 | 1,629,250 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 2.97% | 2,581,150 | 2,581,150 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.68% | 3,000,000 | 3,000,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.19% | 569,600 | 569,600 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.23% | 4,000,000 | 4,000,000 |
| 소 계 | 26,234,000 | 26,234,000 | |||
| 유동성대체액 | (11,095,540) | (7,762,100) | |||
| 합 계 : 비유동성잔액 | 15,138,460 | 18,471,900 | |||
(*) 상기 차입금에 대하여 연결회사의 금융상품과 토지, 건물이 담보로 설정되어 있습니다(주석34 참조).
20. 계약손실충당부채
(1) 당반기말과 전기말의 현재 충당부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 계약손실충당부채 | 673,974 | 667,813 |
(2) 당반기와 전반기 중 계약손실충당부채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 |
|---|---|---|
| 기초 | 667,813 | 981,354 |
| 전입액 | 6,161 | - |
| 환입액 | - | (325,718) |
| 기말금액 | 673,974 | 655,636 |
21. 교환사채
(1) 당반기말과 전기말 교환사채의 구성 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 교환사채 | 17,439,700 | 20,349,700 |
| 교환권조정 | (7,485,333) | (9,908,322) |
| 상환할증금 | 710,066 | 828,672 |
| 합 계 | 10,664,433 | 11,270,050 |
| (단위: 천원) |
| 구 분 | 발행일 | 만기일 | 당반기말 | 전기말 |
|---|---|---|---|---|
| 제2회 이권부 무보증 사모 교환사채 | 2023-01-19 | 2027-01-19 | 1,078,730 | 951,235 |
| 제3회 이권부 무보증 사모 교환사채 | 2023-01-26 | 2027-01-26 | 2,039,579 | 3,541,026 |
| 제4회 이권부 무보증 사모 교환사채 | 2024-03-26 | 2028-03-24 | 7,546,124 | 6,777,789 |
| 합 계 | 10,664,433 | 11,270,050 |
(2) 교환사채 발행내역
회사가 발행한 교환사채의 내역은 다음과 같습니다.
| 구 분 | 제2회 무기명식 이권부 무보증 사모 교환사채 |
제3회 무기명식 이권부 무보증 사모 교환사채 |
제4회 무기명식 이권부 무보증 사모 교환사채 |
|---|---|---|---|
| 발 행 일 | 2023-01-19 | 2023-01-26 | 2024-03-26 |
| 만 기 일 | 2027-01-19 | 2027-01-26 | 2028-03-24 |
| 액면금액 | 1,500,000,000원 | 2,939,700,000원 | 13,000,000,000원 |
| 발행가액 | 21,500,000,000원 | 10,811,450,000원 | 21,000,000,000원 |
| 액면이자율 | 액면이자 연0.0% | 액면이자 연0.0% | 액면이자 연 0.0% |
| 보장수익률 | 사채 만기일까지 연 1.0%(3개월 단위 복리계산) | 사채 만기일까지 연 1.0%(3개월 단위 복리계산) | 사채 만기일까지 연 1.0%(3개월 단위 복리계산) |
| 상환방법 | 전환되지 않거나 조기상환되지 않을 경우 만기일에 액면가액의 104.0758%를 일시 상환 | 전환되지 않거나 조기상환되지 않을 경우 만기일에 액면가액의 104.0758%를 일시 상환 | 전환되지 않거나 조기상환되지 않을 경우 만기일에 액면가액의 104.0701%를 일시 상환 |
| 교환대상주식 | 코아스템켐온㈜ 기명식 보통주(자기주식) | 코아스템켐온㈜ 기명식 보통주(자기주식) | 코아스템켐온㈜ 기명식 보통주(자기주식) |
| 교환시 발행할 주식수 | 169,109주 | 331,420주 | 1,160,714주 |
| 교환가격 | 8,870원(단, 시가를 하회하는 발행가액으로 유상증자를 하는 경우 등 기타 사채발행계약서에 정한 기준에 따라 전환가격은 조정될 수 있음) | 8,870원(단, 시가를 하회하는 발행가액으로 유상증자를 하는 경우 등 기타 사채발행계약서에 정한 기준에 따라 전환가격은 조정될 수 있음) | 11,200원(단, 시가를 하회하는 발행가액으로 유상증자를 하는 경우 등 기타 사채발행계약서에 정한 기준에 따라 교환가격은 조정될 수 있음) |
| 사채권자의 조기상환청구권 | 발행일로부터 18개월이 되는 날로부터 가능 | 발행일로부터 18개월이 되는 날로부터 가능 | 발행일로부터 24개월이 되는 날로부터 가능 |
| 교환청구기간 | 2023-02-19 ~ 2026-12-19 | 2023-02-19 ~ 2026-12-26 | 2024-04-26 ~ 2028-02-24 |
| 발행회사(또는 발행회사가 지정하는 자)의 매도청구권 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 |
연결회사가 발행한 교환사채는 보유자의 선택에 의해 주식으로 교환될 수 있는 교환사채로, 발행할 주식수는 교환사채의 교환가격의 조정 약정에 해당될 경우 변동될 수 있습니다. 따라서 지분교환권을 부채로 분류하고 파생상품으로 처리하고 있습니다.
(3) 교환사채의 당반기와 전반기 중 증감내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 2회차 | 3회차 | 4회차 | |||
|---|---|---|---|---|---|---|
| 당반기 | 전반기 | 당반기 | 전반기 | 당반기 | 전반기 | |
| 기초 | 1,500,000 | 18,800,000 | 5,849,700 | 10,811,450 | 13,000,000 | - |
| 발행 | - | - | - | - | - | 21,000,000 |
| 상환 및 교환(*) | - | (16,190,000) | (2,910,000) | (74,700) | - | (3,500,000) |
| 기말 | 1,500,000 | 2,610,000 | 2,939,700 | 10,736,750 | 13,000,000 | 17,500,000 |
(*) 당반기 중 3회차가 조기상환 되었으며, 전반기 중 모두 교환청구에 의하여 자기주식으로 교환(2회차 1,825,219주, 3회차 8,420주, 4회차 312,496주)되었습니다.
(4) 교환사채의 발행일 및 당반기말 현재 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 제2회차 | 제3회차 | 제4회차 | |||
|---|---|---|---|---|---|---|
| 발행일 | 당반기말 | 발행일 | 당반기말 | 발행일 | 당반기말 | |
| 발행가액 | 21,500,000 | 1,500,000 | 10,811,450 | 2,939,700 | 21,000,000 | 13,000,000 |
| 교환사채의 부채요소 | 8,501,737 | 1,078,730 | 3,938,196 | 2,039,579 | 9,245,625 | 7,546,124 |
| 조기상환청구권(파생상품부채) | 6,757,835 | 305,659 | 3,416,516 | 605,514 | 5,096,250 | 3,821,100 |
| 지분교환권(파생상품부채) | 6,240,428 | - | 3,456,738 | - | 6,658,125 | 278,574 |
교환사채 발행으로 수령한 순수취액은 주계약인 부채요소와 내재파생상품인 지분교환권으로 구분 계상되었습니다. 교환사채에 내재된 지분교환권은 자본요소에 해당하지 않으므로 교환사채 전체를 금융부채로 분류하였으며, 지분교환권이 내재파생상품의 분리조건을 모두 충족하므로 주계약에서 분리하여 별도의 파생상품으로 회계처리 하였습니다.
당반기 중 제2회 교환사채와 관련하여 파생상품평가이익 161,203천원(조기상환청구권 136,845천원 및 지분교환권 24,358천원)이 발생하였습니다.
당반기 중 제3회 교환사채와 관련하여 파생상품평가이익 627,182천원(조기상환청구권 534,193천원 및 지분교환권 92,989천원)이 발생하였습니다.
당반기 중 제4회 교환사채와 관련하여 파생상품평가이익 651,166천원(조기상환청구권 (-)80,090천원 및 지분교환권 731,256천원)이 발생하였습니다.
(5) 발행자의 주가 변동에 따라 행사가격이 조정되는 조건으로 인해 부채로 분류된 각금융부채의 장부금액 및 관련 손익은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 제2회차 | 제3회차 | 제4회차 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 발행일 | 당반기말 | 전기말 | 발행일 | 당반기말 | 전기말 | 발행일 | 당반기말 | 전기말 | |
| 지분교환권(파생상품부채) | 6,240,428 | - | 24,358 | 3,456,738 | - | 92,989 | 6,658,125 | 278,574 | 1,009,829 |
| 조기상환청구권(파생상품부채) | 6,757,835 | 305,659 | 442,504 | 3,416,516 | 605,514 | 1,739,094 | 5,096,250 | 3,821,100 | 3,741,010 |
| 합 계 | 12,998,263 | 305,659 | 466,862 | 6,873,254 | 605,514 | 1,832,083 | 11,754,375 | 4,099,674 | 4,750,839 |
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 법인세비용 차감전계속사업이익(손실) | (9,578,203) | (25,389,710) |
| 평가이익(손실) | 1,439,550 | (14,873,958) |
| 평가손익 제외 법인세비용차감전계속사업이익(손실) | (11,017,753) | (10,515,752) |
22. 법인세비용 및 이연법인세
법인세비용은 법인세부담액에서 전기 법인세와 관련되어 당반기에 인식한 조정사항,일시적 차이의 발생과 소멸로 인한 이연법인세변동액 및 당기손익 이외로 인식되는 항목과 관련된 법인세비용 등을 조정하여 산출하였습니다.
당반기 및 전반기의 평균유효세율은 법인세비용차감전손실이 발생하여 유효세율을 산정하지 아니하였습니다.
23. 자본금과 자본잉여금
(1) 당반기말과 전기말 현재 자본금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 보통주 : | ||
| 발행할 주식의 총수 | 100,000,000주 | 100,000,000주 |
| 1주당 액면금액 | 500원 | 500원 |
| 발행한 주식의 수 | 32,870,376주 | 32,870,376주 |
| 자본금 | 16,435,188 | 16,435,188 |
(2) 당반기말과 전기말의 자본잉여금의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 자본잉여금 | ||
| 주식발행초과금 | 212,364,193 | 212,364,193 |
| 자기주식처분이익(*) | 29,330,130 | 29,886,948 |
| 합계 | 241,694,323 | 242,251,141 |
(*) 당반기 중 자기주식 200만주를 처분하였습니다.
(3) 당반기말과 전반기 중 자본금 및 주식발행초과금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 일자 | 주식수(주) | 자본금 | 주식발행초과금 |
|---|---|---|---|---|
| 전기초 | 2024-01-01 | 32,870,376 | 16,435,188 | 212,364,193 |
| 전반기말 | 2024-06-30 | 32,870,376 | 16,435,188 | 212,364,193 |
| 당기초 | 2025-01-01 | 32,870,376 | 16,435,188 | 212,364,193 |
| 당반기말 | 2025-06-30 | 32,870,376 | 16,435,188 | 212,364,193 |
24. 기타자본
(1) 당반기말과 전기말 현재 기타자본의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타자본잉여금 | (102,670,306) | (102,670,306) |
| 자기주식(*) | (19,479,761) | (26,467,761) |
| 주식매수선택권 | 734,512 | 734,512 |
| 합 계 | (121,415,555) | (128,403,555) |
(*) 자기주식 중 일부는 교환사채의 교환대상 주식으로 한국예탁결제원에 신탁되어 있습니다.
(2) 당반기와 전반기 중 주식매수선택권의 변동내역은 없습니다.
(3) 주식기준보상
가. 연결회사는 주주총회 결의에 의거 당사의 임직원에게 주식선택권을 부여하였는 바, 주요사항은 다음과 같습니다.
- 주식선택권으로 발행할 주식의 종류 : 기명식 보통주식
- 부여방법 : 보통주 신주발행
- 부여일 : 2019년 3월 29일
- 가득조건 및 행사가능시점 : 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 2년 경과시점부터 5년 이내에 행사 가능
- 행사가격 : 13,600원
나. 당반기와 전반기의 주식선택권의 수량 변동은 다음과 같습니다.
| (단위: 주) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초 잔여주 | 255,670 | 255,670 |
| 부여 | - | - |
| 행사 | - | - |
| 소멸 | - | - |
| 기말 잔여주 | 255,670 | 255,670 |
25. 기타포괄손익누계액
(1) 당반기말과 전기말의 기타포괄손익누계액의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 재평가잉여금 | 12,105,055 | 12,105,055 |
| 기타포괄손익-공정가치측정금융자산평가손실 | (349,884) | (416,728) |
| 해외사업환산이익 | 41,439 | 65,292 |
| 합 계 | 11,796,610 | 11,753,619 |
(2) 당반기와 전반기의 기타포괄손익누계액의 증감 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 기타포괄손익-공정가치측정금융자산평가손익 | |
|---|---|---|
| 당반기 | 전반기 | |
| 기초 | 11,753,619 | (622,209) |
| 기타포괄손익-공정가치측정금융자산평가이익 | 66,844 | 44,094 |
| 해외사업환산이익 | (23,853) | 40,061 |
| 기말 | 11,796,610 | (538,054) |
26. 결손금
(1) 당반기말과 전기말 현재 결손금의 세부내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 미처리결손금 | (103,136,070) | (93,443,038) |
(2) 당반기와 전반기의 결손금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초금액 | (93,443,038) | (66,596,408) |
| 반기순손실 | (9,644,696) | (25,468,878) |
| 확정급여제도의 재측정요소 | (48,336) | (299,628) |
| 반기말금액 | (103,136,070) | (92,364,914) |
27. 고객과의 계약에서 생기는 수익 및 관련 계약자산과 계약부채
(1) 당반기와 전반기의 수익인식 시기에 따라 구분한 매출 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 고객과의 계약에서 생기는 수익 | 11,610,426 | 15,538,404 |
(2) 당반기와 전반기의 고객과의 계약에서 생기는 수익 구분 내역은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 제품매출 | 연구용역매출 | 기타매출 | 합계 |
|---|---|---|---|---|
| 한 시점에 인식 | 187,620 | - | 59,337 | 246,957 |
| 기간에 걸쳐 인식 | - | 11,363,469 | - | 11,363,469 |
| 합 계 | 187,620 | 11,363,469 | 59,337 | 11,610,426 |
| (전반기) | (단위: 천원) |
| 구 분 | 제품매출 | 연구용역매출 | 기타매출 | 합계 |
|---|---|---|---|---|
| 한 시점에 인식 | 625,400 | - | 79,824 | 705,224 |
| 기간에 걸쳐 인식 | - | 14,833,180 | - | 14,833,180 |
| 합 계 | 625,400 | 14,833,180 | 79,824 | 15,538,404 |
(3) 당반기말과 전기말 현재 고객과의 계약에서 생기는 계약자산과 계약부채는 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 계약자산 | 6,804,497 | 5,143,322 |
| 계약부채 | 3,739,753 | 3,023,330 |
계약자산은 연결회사가 진행중인 용역에 대해 당기 현재 미청구한 금액에 대한 자산입니다. 계약자산은 연결회사가 청구서를 발행할 때 매출채권으로 대체됩니다. 계약부채는 기간에 걸쳐 이행하는 고객과의 계약에서 고객으로부터 선수취한 금액에 대한 부채입니다. 전기 계약부채로 계상된 선수금 중 2,186,921천원(전반기 : 2,817,145천원)이 당반기에 수익으로 인식 되었습니다.
28. 판매비와 관리비
당반기와 전반기 중 판매비와 관리비 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 1,121,128 | 1,987,967 | 1,229,435 | 2,309,179 |
| 퇴직급여 | 205,946 | 292,663 | 70,590 | 201,995 |
| 복리후생비 | 86,109 | 156,004 | 50,669 | 107,552 |
| 여비교통비 | 21,306 | 52,294 | 85,608 | 156,635 |
| 통신비 | 9,106 | 17,333 | 6,723 | 10,951 |
| 세금과공과 | 3,538 | 7,461 | 7,694 | 11,786 |
| 감가상각비 | 13,813 | 20,930 | 8,013 | 15,874 |
| 감가상각비(사용권자산) | 114,740 | 214,333 | 110,245 | 217,380 |
| 무형자산상각비 | 21,583 | 34,526 | 13,739 | 27,523 |
| 계약손실충당전입액 | 574,563 | 6,161 | 858,820 | - |
| 지급임차료 | 68,483 | 87,292 | 27,485 | 58,277 |
| 수선비 | 494 | 494 | 35 | 35 |
| 보험료 | 89,239 | 153,016 | 88,859 | 148,864 |
| 차량유지비 | 17,429 | 40,388 | 23,288 | 45,047 |
| 운반비 | 155 | 672 | 168 | 313 |
| 교육훈련비 | 6,763 | 9,388 | 2,160 | 6,557 |
| 도서인쇄비 | 11 | 11 | 151 | 1,889 |
| 사무용품비 | 4,298 | 5,591 | 4,270 | 7,717 |
| 소모품비 | 101,978 | 110,135 | - | - |
| 지급수수료 | 337,419 | 797,816 | 257,872 | 600,495 |
| 경상연구개발비 | 2,690,227 | 4,743,226 | 2,428,906 | 5,187,918 |
| 광고선전비 | 61,974 | 69,199 | 28,432 | 58,829 |
| 대손상각비(환입) | 1,445,751 | 526,843 | 284,560 | (478,885) |
| 기타 | 190,420 | 397,089 | 103,713 | 242,754 |
| 합 계 | 7,186,473 | 9,730,832 | 5,691,435 | 8,938,685 |
29. 비용의 성격별 분류
당반기와 전반기 중 비용의 성격별 분류 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 재고자산의 변동 | 117,876 | 383,290 | 20,526 | 80,154 |
| 원/부재료 사용(매입)액 | 624,510 | 1,681,471 | 1,068,468 | 1,999,697 |
| 종업원급여 | 4,206,396 | 8,981,943 | 6,189,188 | 12,159,493 |
| 퇴직급여 | 542,514 | 1,155,047 | 510,363 | 1,006,999 |
| 복리후생비 | 390,534 | 841,581 | 439,931 | 939,314 |
| 유형자산감가상각비 | 831,356 | 1,678,337 | 956,239 | 1,904,945 |
| 투자부동산감가상각비 | - | - | 3,117 | 6,234 |
| 사용권자산감가상각비 | 190,200 | 421,572 | 228,386 | 449,627 |
| 무형자산상각비 | 29,832 | 60,022 | 30,985 | 53,766 |
| 지급수수료 | 816,956 | 1,859,933 | 832,141 | 1,685,427 |
| 지급임차료 | 83,979 | 121,374 | 44,127 | 91,135 |
| 수선비 | 26,563 | 54,239 | 70,445 | 138,556 |
| 보험료 | 325,363 | 603,869 | 461,850 | 800,159 |
| 차량유지비 | 34,777 | 77,258 | 43,233 | 87,933 |
| 수도광열비 | 195,171 | 528,720 | 133,784 | 413,054 |
| 소모품비 | 401,819 | 695,554 | 401,786 | 796,217 |
| 여비교통비 | 34,652 | 82,029 | 96,224 | 186,894 |
| 전력비 | 361,161 | 719,220 | 299,517 | 608,589 |
| 광고선전비 | 61,974 | 69,199 | 28,432 | 58,829 |
| 위탁연구비 | 845,660 | 1,161,303 | 314,897 | 701,301 |
| 대손상각비(환입) | 1,445,751 | 526,843 | 284,560 | (478,885) |
| 기타 | 712,736 | 557,923 | 780,783 | 388,573 |
| 매출원가 및 판매비와관리비의 합계 | 12,279,780 | 22,260,727 | 13,238,982 | 24,078,011 |
30. 기타수익과 기타비용
(1) 당반기와 전반기 중 기타수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 잡이익 | 55,934 | 59,055 | 57,311 | 112,990 |
| 임대료수익 | 2,055 | 41,170 | 46,398 | 92,795 |
| 유형자산처분이익 | - | - | - | 902 |
| 투자부동산처분이익 | - | 1,122,472 | - | - |
| 리스해지이익 | - | 2,137 | - | - |
| 리스변경이익 | - | 806 | - | - |
| 합 계 | 57,989 | 1,225,640 | 103,709 | 206,687 |
(2) 당반기와 전반기 중 기타비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 유형자산처분손실 | - | - | 1 | 954 |
| 유형자산폐기손실 | 1 | 1 | - | - |
| 무형자산처분손실 | 122,678 | 347,601 | - | - |
| 기부금 | 3,000 | 3,000 | 32,742 | 32,742 |
| 잡손실 | 24,371 | 24,483 | 32 | 112 |
| 합 계 | 150,050 | 375,085 | 32,775 | 33,808 |
31. 금융수익과 금융비용
(1) 당반기와 전반기 중 금융수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | (6,756) | 48,407 | 17,342 | 35,257 |
| 배당금수익 | 28,882 | 57,762 | 38,329 | 76,786 |
| 외환차익 | 291 | 3,334 | - | 230 |
| 외화환산이익 | (583) | - | 4,739 | 10,065 |
| 당기손익-공정가치측정금융자산평가이익 | (3) | - | 32,626 | 33,387 |
| 당기손익-공정가치측정금융자산처분이익 | 5,748 | 19,838 | 77,765 | 84,536 |
| 사채상환이익 | - | - | (665,423) | 139,060 |
| 파생상품부채평가이익 | 208,330 | 1,716,963 | 5,897,528 | 6,410,366 |
| 합 계 | 235,909 | 1,846,304 | 5,402,906 | 6,789,687 |
(2) 당반기와 전반기 중 금융비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용(*) | 478,382 | 948,512 | 1,061,226 | 2,174,373 |
| 외환차손 | - | - | - | 12 |
| 외화환산손실 | 9,820 | 10,106 | - | - |
| 당기손익-공정가치측정금융자산평가손실 | (1,317) | 4,350 | - | 1,655 |
| 사채상환손실 | 384,379 | 384,379 | 352,305 | 352,305 |
| 파생상품부채평가손실 | 277,413 | 277,413 | 12,202,628 | 21,284,324 |
| 합 계 | 1,148,677 | 1,624,760 | 13,616,159 | 23,812,669 |
(*) 당반기 중 적격자산인 유형자산에 대해 자본화된 차입원가는 1,215,087천원(전반기 : 405,492천원)이 차감되어 있습니다.
32. 주당순손익
(1) 당반기와 전반기의 기본주당순손실의 산정내역은 다음과 같습니다.
| (단위: 원, 주) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 반기순손실 | (7,858,531,382) | (9,644,696,198) | (14,316,086,932) | (25,468,878,431) |
| 가중평균유통보통주식수(*) | 26,603,018 | 25,955,547 | 23,015,902 | 22,269,816 |
| 주당순손실 | (295) | (372) | (622) | (1,144) |
(*) 당반기와 전반기의 가중평균유통보통주식수의 산정내역은 다음과 같습니다.
| (당반기) |
| (3개월) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2025-04-01 | 25,795,326 | 91 | 2,347,374,666 |
| 자기주식 처분 | 2025-04-21 | 500,000 | 71 | 35,500,000 |
| 자기주식 처분 | 2025-05-12 | 500,000 | 50 | 25,000,000 |
| 자기주식 처분 | 2025-06-05 | 500,000 | 26 | 13,000,000 |
| 합 계 | 2,420,874,666 | |||
| 일 수 | 91 | |||
| 가중평균유통보통주식수 | 26,603,018 | |||
| (누적) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2025-01-01 | 25,295,326 | 181 | 4,578,454,006 |
| 자기주식 처분 | 2025-03-31 | 500,000 | 92 | 46,000,000 |
| 자기주식 처분 | 2025-04-21 | 500,000 | 71 | 35,500,000 |
| 자기주식 처분 | 2025-05-12 | 500,000 | 50 | 25,000,000 |
| 자기주식 처분 | 2025-06-05 | 500,000 | 26 | 13,000,000 |
| 합 계 | 4,697,954,006 | |||
| 일 수 | 181 | |||
| 가중평균유통보통주식수 | 25,955,547 | |||
| (전반기) |
| (3개월) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2024-04-01 | 21,971,073 | 91 | 1,999,367,643 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-01 | 248,025 | 91 | 22,570,275 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-02 | 62,005 | 90 | 5,580,450 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-09 | 11,273 | 83 | 935,659 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-17 | 119,501 | 75 | 8,962,575 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-18 | 546,784 | 74 | 40,462,016 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-19 | 11,273 | 73 | 822,929 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-22 | 90,191 | 70 | 6,313,370 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-23 | 11,273 | 69 | 777,837 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-30 | 5,636 | 62 | 349,432 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-02 | 5,636 | 60 | 338,160 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-03 | 5,636 | 59 | 332,524 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-07 | 5,636 | 55 | 309,980 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-09 | 5,636 | 53 | 298,708 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-10 | 5,636 | 52 | 293,072 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-20 | 5,636 | 42 | 236,712 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-29 | 5,636 | 33 | 185,988 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-07 | 5,636 | 24 | 135,264 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-07 | 133,927 | 24 | 3,214,248 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-14 | 4,210 | 17 | 71,570 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-17 | 178,569 | 14 | 2,499,966 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-19 | 4,210 | 12 | 50,520 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-28 | 112,739 | 3 | 338,217 |
| 합 계 | 2,094,447,115 | |||
| 일 수 | 91 | |||
| 가중평균유통보통주식수 | 23,015,902 | |||
| (누적) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2024-01-01 | 21,409,642 | 182 | 3,896,554,844 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-02-20 | 78,917 | 132 | 10,417,044 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-12 | 63,132 | 111 | 7,007,652 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-13 | 93,572 | 110 | 10,292,920 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-14 | 99,772 | 109 | 10,875,148 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-18 | 89,627 | 105 | 9,410,835 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-22 | 56,369 | 101 | 5,693,269 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-25 | 56,369 | 98 | 5,524,162 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-26 | 6,764 | 97 | 656,108 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-28 | 5,636 | 95 | 535,420 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-29 | 11,273 | 94 | 1,059,662 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-01 | 248,025 | 91 | 22,570,275 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-02 | 62,005 | 90 | 5,580,450 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-09 | 11,273 | 83 | 935,659 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-17 | 119,501 | 75 | 8,962,575 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-18 | 546,784 | 74 | 40,462,016 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-19 | 11,273 | 73 | 822,929 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-22 | 90,191 | 70 | 6,313,370 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-23 | 11,273 | 69 | 777,837 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-30 | 5,636 | 62 | 349,432 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-02 | 5,636 | 60 | 338,160 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-03 | 5,636 | 59 | 332,524 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-07 | 5,636 | 55 | 309,980 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-09 | 5,636 | 53 | 298,708 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-10 | 5,636 | 52 | 293,072 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-20 | 5,636 | 42 | 236,712 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-29 | 5,636 | 33 | 185,988 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-07 | 5,636 | 24 | 135,264 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-07 | 133,927 | 24 | 3,214,248 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-14 | 4,210 | 17 | 71,570 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-17 | 178,569 | 14 | 2,499,966 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-19 | 4,210 | 12 | 50,520 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-28 | 112,739 | 3 | 338,217 |
| 합 계 | 4,053,106,536 | |||
| 일 수 | 182 | |||
| 가중평균유통보통주식수 | 22,269,816 | |||
(2) 당반기 및 전반기 모두 희석효과가 없어 희석주당순손실은 기본주당순손실과 동일합니다.
희석주당이익은 모든 희석성 잠재적보통주가 보통주로 전환된다고 가정하여 조정한 가중평균유통보통주식수를 적용하여 산정하고 있습니다. 당반기 중 연결회사가 보유하고 있는 희석성 잠재적보통주로는 교환사채 및 주식매수선택권이 있으나, 이로 인한 희석화는 발생하지 아니하였습니다.
33. 현금흐름표
(1) 당반기와 전반기의 영업으로부터 창출된 현금흐름은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 반기순손실 | (9,644,696) | (25,468,878) |
| 조정 : | ||
| 퇴직급여 | 1,152,558 | 1,006,999 |
| 투자부동산상각비 | - | 6,234 |
| 유형자산상각비 | 1,678,337 | 1,904,945 |
| 무형자산상각비 | 60,022 | 53,766 |
| 사용권자산상각비 | 421,572 | 449,627 |
| 이자비용 | 906,365 | 2,134,492 |
| 이자비용(리스부채) | 42,147 | 39,880 |
| 외화환산손실 | 10,106 | - |
| 대손상각비(환입) | 526,843 | (478,885) |
| 법인세비용 | 66,493 | 79,168 |
| 유형자산처분손실 | - | 954 |
| 유형자산폐기손실 | 1 | - |
| 무형자산처분손실 | 347,601 | - |
| 장기종업원급여 | - | 107,536 |
| 당기손익-공정가치측정금융자산평가손실 | 4,350 | 1,655 |
| 파생상품부채평가손실 | 277,413 | 21,284,324 |
| 손실충당부채전입(환입) | 6,161 | (325,718) |
| 사채상환손실 | 384,379 | 352,305 |
| 유형자산처분이익 | - | (902) |
| 이자수익 | (48,407) | (35,257) |
| 배당금수익 | (57,762) | (76,786) |
| 외화환산이익 | - | (10,065) |
| 사채상환이익 | - | (139,060) |
| 당기손익인식-공정가치측정 금융자산평가이익 |
- | (33,387) |
| 당기손익인식-공정가치측정 금융자산처분이익 |
(19,838) | (84,536) |
| 투자부동산처분이익 | (1,122,472) | - |
| 파생상품평가이익 | (1,716,963) | (6,410,366) |
| 리스해지이익 | (2,137) | - |
| 리스변경이익 | (807) | - |
| 소 계 | 2,915,962 | 19,826,923 |
| 순운전자본의 변동 : | ||
| 매출채권의 증감 | 1,765,224 | 130,020 |
| 계약자산의 증감 | (1,894,479) | (2,518,375) |
| 미수금의 증감 | 243,124 | (410,050) |
| 선급금의 증감 | (21,004) | (183,046) |
| 선급비용의 증감 | 183,101 | 264,249 |
| 재고자산의 증감 | 383,290 | 80,154 |
| 매입채무의 증감 | (118,583) | (112,639) |
| 미지급금의 증감 | 150,645 | 63,434 |
| 미지급비용의 증감 | (118,048) | (334,511) |
| 계약부채의 증감 | 716,424 | (1,047,806) |
| 예수금의 증감 | (154,155) | (4,268) |
| 선수금의 증감 | (4,807) | - |
| 선수수익의 증감 | (39,041) | (50,637) |
| 장기종업원급여의 지급 | (103,375) | (94,000) |
| 퇴직금의 지급 | (2,532,242) | (556,950) |
| 사외적립자산의 증감 | 1,160,633 | 261,245 |
| 소 계 | (383,293) | (4,513,180) |
| 합 계 | (7,112,027) | (10,155,135) |
(2) 당반기와 전반기의 현금의 유입ㆍ유출이 없는 거래 중 중요한 사항은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 유형자산의 취득으로 인한 미지급금 | 37,900 | 1,683,090 |
| 건설중인자산의 본계정 대체 | 10,400 | 187,273 |
| 건설중인자산의 차입원가자본화 | 1,215,087 | 405,492 |
| 사용권자산의 취득 | 216,477 | 263,846 |
| 장기차입금의 유동성대체 | 3,333,440 | - |
| 교환사채의 교환 | - | 25,475,281 |
| 계약손실충당부채 유동성대체 | - | 981,354 |
(3) 당반기와 전반기의 재무활동으로 인한 부채의 변동은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 내역 | 기초 | 재무활동으로 인한 현금흐름 | 기타(*) | 기말 | |
|---|---|---|---|---|---|
| 증가 | 감소 | ||||
| 단기차입금 | 8,400,000 | 4,100,000 | (1,500,000) | - | 11,000,000 |
| 유동성장기차입금 | 7,762,100 | - | - | 3,333,440 | 11,095,540 |
| 장기차입금 | 18,471,900 | - | - | (3,333,440) | 15,138,460 |
| 리스부채 | 922,118 | - | (370,568) | 179,434 | 730,984 |
| 교환사채 | 11,270,050 | - | (2,910,000) | 2,304,383 | 10,664,433 |
(*) 유동성대체, 교환사채 상각, 리스부채 상각 등이 포함되어 있습니다.
| (전반기) | (단위: 천원) |
| 내역 | 기초 | 재무활동으로 인한 현금흐름 | 기타(*) | 기말 | |
|---|---|---|---|---|---|
| 증가 | 감소 | ||||
| 단기차입금 | 3,000,000 | 4,530,000 | (4,530,000) | - | 3,000,000 |
| 유동성장기차입금 | 4,260,000 | - | - | - | 4,260,000 |
| 장기차입금 | 10,194,000 | 4,210,400 | - | - | 14,404,400 |
| 리스부채 | 920,825 | - | (435,679) | 235,605 | 720,751 |
| 교환사채 | 14,395,725 | 21,000,000 | - | (19,997,134) | 15,398,591 |
(*) 교환사채 상각 및 교환, 리스부채 상각 등이 포함되어 있습니다.
34. 약정사항 및 우발사항
(1) 당반기말 현재 금융기관과 맺고 있는 주요한 차입약정 등은 다음과 같습니다.
| (단위: 천원) |
| 금융기관 | 약정내용 | 한도금액 | 실행금액 |
|---|---|---|---|
| 신한은행 | 신용대출 | 4,500,000 | 4,000,000 |
| 신한은행 | 담보대출 | 13,234,000 | 13,234,000 |
| 산업은행 | 담보대출 | 20,000,000 | 20,000,000 |
| 합 계 | 37,734,000 | 37,234,000 |
(2) 당반기말과 전기말 현재 차입금과 관련하여 제공한 담보는 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 담보제공자산 | 장부가액 | 담보한도액 | 차입금액 | 담보권자 |
|---|---|---|---|---|
| 토지 | 21,414,974 | 21,912,000 | 13,234,000 | 신한은행 |
| 건물 | 19,827,570 | |||
| 토지 | 2,246,830 | 24,000,000 | 20,000,000 | 산업은행(*) |
| 건설중인자산 | 28,196,900 | |||
| 기타포괄손익-공정가치측정금융자산 | 3,802,608 | |||
| 합 계 | 75,488,882 | 45,912,000 | 33,234,000 |
(*) 상기 자산이외에 산업은행 차입금과 관련하여 현금및현금성자산 61,255천원 및 단기금융상품 1,000,000천원이 질권설정되어 있습니다(주석6 참조).
| (전기말) | (단위: 천원) |
| 담보제공자산 | 장부가액 | 담보한도액 | 차입금액 | 담보권자 |
|---|---|---|---|---|
| 토지 | 21,414,974 | 21,912,000 | 13,234,000 | 신한은행 |
| 건물 | 20,127,706 | |||
| 토지 | 2,246,830 | 24,000,000 | 20,000,000 | 산업은행(*) |
| 건설중인자산 | 29,607,414 | |||
| 기타포괄손익-공정가치측정금융자산 | 3,735,764 | |||
| 합 계 | 77,132,688 | 45,912,000 | 33,234,000 |
(*) 상기 자산이외에 산업은행 차입금과 관련하여 현금및현금성자산 12,140천원 및 단기금융상품 1,000,000천원이 질권설정되어 있습니다(주석6 참조).
(3) 당반기말과 전기말 현재 연결회사가 타인으로부터 제공받은 담보 및 보증의 내역은 다음과 같습니다.
| (단위: 천원) |
| 보증제공자 | 내역 | 보증한도액 | |
|---|---|---|---|
| 당반기말 | 전기말 | ||
| 서울보증보험 | 이행(계약)보증 외 | 3,336,180 | 1,825,427 |
(4) 당반기말 현재 연결회사가 피고로서 계류 중인 소송은 없습니다.
35. 특수관계자 거래
(1) 당반기말과 전기말 현재 특수관계자의 내역은 다음과 같습니다.
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타특수관계자 | 주요 경영진 | 주요 경영진 |
(2) 당반기와 전반기 중 특수관계자 등에 대한 차입거래내역은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 회사명 | 계정과목 | 기 초 | 증 가 | 감 소 | 기 말 |
|---|---|---|---|---|---|
| 기타특수관계자 | |||||
| - 주요 경영진 | 교환사채(*) | 3,350,000 | - | (1,910,000) | 1,440,000 |
(*) 당반기 중 특수관계자가 보유한 교환사채의 조기상환으로 인한 사채상환손실은 252,290천원 입니다.
| (전반기) | (단위: 천원) |
| 회사명 | 계정과목 | 기 초 | 증 가 | 감 소 | 기 말 |
|---|---|---|---|---|---|
| 기타특수관계자 | |||||
| - 주요 경영진 | 교환사채 | 6,700,000 | - | - | 6,700,000 |
(3) 주요 경영진에 대한 보상
연결회사가 당반기와 전반기 중 회사경영의 계획,운영,통제에 대한 중요한 권한과 책임을 가진 주요 경영진(등기임원)에 대하여 지급한 총 보상금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 단기종업원급여 | 253,150 | 625,000 |
| 퇴직급여 | 61,523 | 156,250 |
| 장기종업원급여 | - | 11,000 |
| 합 계 | 314,673 | 792,250 |
36. 부문별 정보
(1) 부문에 대한 일반정보
연결회사가 한국채택기업회계기준 제1108호(영업부문)에 의거하여 구분한 영업부문의 주요 현황은 다음과 같습니다.
| 부문 | 주요 사업의 내용 |
|---|---|
| 세포치료제 부문 | 세포치료제 의약품 제조 및 판매 |
| 비임상실험대행 부문 | 비임상실험대행 및 효력, 효능분석 용역 제공 |
영업부문은 최고영업의사결정자에게 보고되는 내부 보고자료와 동일한 방법으로 보고되고 있습니다. 최고 영업의사결정자는 영업부문에 배부될 자원과 영업부문의 성과를 평가하는데 책임이 있으며, 전략적 의사결정을 수행하는 이사회를 최고의사결정자로 보고 있습니다.
(2) 부문의 손익 및 자산
당반기와 전반기의 보고부문별 손익은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 세포치료제 의약품부문 |
비임상실험 대행용역부문 |
보고부문 합계 |
조정 | 합 계 |
| 수익 | 187,620 | 11,422,806 | 11,610,426 | - | 11,610,426 |
| 외부거래 | 187,620 | 11,422,806 | 11,610,426 | - | 11,610,426 |
| 내부거래 | - | - | - | - | - |
| 비용 | 6,191,621 | 16,069,106 | 22,260,727 | - | 22,260,727 |
| 외부거래 | 6,191,621 | 16,069,106 | 22,260,727 | - | 22,260,727 |
| 내부거래 | - | - | - | - | - |
| 영업이익 | (6,004,001) | (4,646,301) | (10,650,302) | - | (10,650,302) |
| 감가상각비 | 318,639 | 1,781,270 | 2,099,909 | - | 2,099,909 |
| 무형자산상각비 | 11,037 | 48,985 | 60,022 | - | 60,022 |
| (전반기) | (단위: 천원) |
| 구 분 | 세포치료제 의약품부문 |
비임상실험 대행용역부문 |
보고부문 합계 |
조정 | 합 계 |
| 수익 | 865,400 | 14,913,004 | 15,778,404 | (240,000) | 15,538,404 |
| 외부거래 | 625,400 | 14,913,004 | 15,538,404 | - | 15,538,404 |
| 내부거래 | 240,000 | - | 240,000 | (240,000) | - |
| 비용 | 6,858,376 | 17,460,235 | 24,318,611 | (240,600) | 24,078,011 |
| 외부거래 | 6,617,776 | 17,460,235 | 24,078,011 | - | 24,078,011 |
| 내부거래 | 240,600 | - | 240,600 | (240,600) | - |
| 영업이익 | (5,992,976) | (2,547,231) | (8,540,207) | 600 | (8,539,607) |
| 감가상각비 | 585,394 | 1,775,412 | 2,360,806 | - | 2,360,806 |
| 무형자산상각비 | 13,031 | 40,735 | 53,766 | - | 53,766 |
(3) 부문의 총자산 및 총부채
당반기말과 전기말 현재 보고부문별 자산총액과 부채총액의 내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 세포치료제 의약품부문 |
비임상실험 대행용역부문 |
조 정 | 합 계 |
|---|---|---|---|---|
| 총자산 | 44,542,284 | 70,459,935 | (842,458) | 114,159,761 |
| 총부채 | 40,912,492 | 28,800,762 | (927,990) | 68,785,264 |
| (전기말) | (단위: 천원) |
| 구 분 | 세포치료제 의약품부문 |
비임상실험 대행용역부문 |
조 정 | 합 계 |
|---|---|---|---|---|
| 총자산 | 46,103,985 | 71,995,533 | (642,332) | 117,457,186 |
| 총부채 | 44,930,361 | 24,647,644 | (714,174) | 68,863,831 |
(4) 지역별 정보
당반기 및 전반기의 지역별 매출액은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 국내 | 국외 | 연결조정 | 연결후 금액 |
|---|---|---|---|---|
| 총부문수익 | 11,610,426 | - | - | 11,610,426 |
| 부문간수익 | - | - | - | - |
| 외부고객으로부터수익 | 11,610,426 | - | - | 11,610,426 |
| (전반기) | (단위: 천원) |
| 구 분 | 국내 | 국외 | 연결조정 | 연결후 금액 |
|---|---|---|---|---|
| 총부문수익 | 15,778,404 | - | (240,000) | 15,538,404 |
| 부문간수익 | 240,000 | - | (240,000) | - |
| 외부고객으로부터수익 | 15,538,404 | - | - | 15,538,404 |
(5) 수익의 상세내역
당반기와 전반기의 수익의 상세내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 |
|---|---|---|
| 제품매출 | 187,620 | 625,400 |
| 연구용역매출 | 11,363,469 | 14,833,180 |
| 기타매출 | 59,337 | 79,824 |
| 합 계 | 11,610,426 | 15,538,404 |
(6) 외부고객으로부터의 수익에 대한 연결회사의 고객별 정보
| (단위: 천원) |
| 구분(*) | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 매출액 | 비율 | 매출액 | 비율 | |
| 주요고객 A고객그룹 | 1,019,104 | 8.78% | - | 0.00% |
| 주요고객 B고객그룹 | 2,102,825 | 18.11% | 3,510,778 | 22.59% |
| 주요고객 C고객그룹 | 5,982,704 | 51.53% | 7,386,523 | 47.54% |
| 기타고객 | 2,505,792 | 21.58% | 4,641,103 | 29.87% |
| 합 계 | 11,610,425 | 100.00% | 15,538,404 | 100.00% |
(*) A고객그룹은 당반기 매출액이 10억 이상, B인 고객그룹은 당반기 매출액의 5~10억 미만, C고객그룹은 1~5억미만, 기타고객은 1억미만의 그룹에 해당합니다.
(7) 당반기 및 전반기 중 연결회사의 자가골수유래줄기세포치료제(제품명: 뉴로나타-알주)의 국내 판매권을 가진 A사에 각각 187,620천원(매출액 총액의 1.62%) 및 625,400천원(매출액 총액의 4.02%)의 제품매출액이 발생하였습니다.
37. 보고기간 후 사건
(1) 보고기간 말 이후, 제2회 무기명 이권부 무보증 사모 교환사채에 대한 조기상환청구권 행사로 인하여 다음과 같이 교환사채가 상환되었습니다.
| (단위: 원/주) |
| 상환청구일 | 구분 | 조기상환청구액 | 대상주식수 |
|---|---|---|---|
| 2025-07-21 | 제2회차 | 1,500,000,000 | 169,109 |
(2) 보고기간 말 이후 다음과 같이 자기주식을 처분하였습니다.
| (단위: 원/주) |
| 처분일 | 처분수량 | 1주당 처분가액 | 처분가액 총액 |
|---|---|---|---|
| 2025-07-22 | 800,000 | 2,957 | 2,365,600,000 |
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 23 기 반기말 2025.06.30 현재 |
|
제 22 기말 2024.12.31 현재 |
|
(단위 : 원) |
|
제 23 기 반기말 |
제 22 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
13,794,484,520 |
15,348,566,350 |
|
현금및현금성자산 |
876,733,159 |
862,364,483 |
|
단기금융상품 |
1,000,000,000 |
1,000,000,000 |
|
당기손익-공정가치측정금융자산 |
1,662,918,007 |
2,221,221,195 |
|
매출채권 |
2,506,112,366 |
4,564,875,358 |
|
계약자산 |
6,804,496,670 |
5,143,322,146 |
|
기타유동금융자산 |
316,967,771 |
372,422,825 |
|
기타유동자산 |
477,228,733 |
622,116,882 |
|
당기법인세자산 |
17,425,580 |
46,351,160 |
|
재고자산 |
132,602,234 |
515,892,301 |
|
비유동자산 |
100,898,939,228 |
102,278,809,548 |
|
종속기업투자 |
641,670,500 |
641,670,500 |
|
기타포괄손익-공정가치측정금융자산 |
3,802,608,000 |
3,735,764,000 |
|
투자부동산 |
0 |
117,527,802 |
|
유형자산 |
89,950,102,048 |
89,030,769,593 |
|
무형자산 |
4,381,522,801 |
6,207,327,756 |
|
사용권자산 |
810,617,860 |
1,048,070,834 |
|
기타비유동금융자산 |
1,312,418,019 |
1,497,679,063 |
|
자산총계 |
114,693,423,748 |
117,627,375,898 |
|
부채 |
||
|
유동부채 |
45,572,738,859 |
41,900,012,372 |
|
단기차입금 |
11,000,000,000 |
8,400,000,000 |
|
유동성장기차입금 |
11,095,540,000 |
7,762,100,000 |
|
매입채무 |
248,997,750 |
367,580,940 |
|
기타유동금융부채 |
2,606,011,275 |
2,510,188,888 |
|
계약손실충당부채 |
673,974,030 |
667,813,456 |
|
파생상품부채 |
5,010,846,582 |
7,049,784,185 |
|
계약부채 |
3,739,753,416 |
3,023,329,792 |
|
유동성리스부채 |
324,332,786 |
450,188,784 |
|
교환사채 |
10,664,433,093 |
11,270,050,308 |
|
기타유동부채 |
208,849,927 |
398,976,019 |
|
비유동부채 |
23,155,963,033 |
26,681,117,757 |
|
장기차입금 |
15,138,460,000 |
18,471,900,000 |
|
비유동리스부채 |
406,651,459 |
471,928,773 |
|
기타비유동금융부채 |
0 |
30,000,000 |
|
기타비유동부채 |
1,054,508,613 |
1,157,883,612 |
|
순확정급여부채 |
6,556,342,961 |
6,549,405,372 |
|
부채총계 |
68,728,701,892 |
68,581,130,129 |
|
자본 |
||
|
자본금 |
16,435,188,000 |
16,435,188,000 |
|
주식발행초과금 |
212,364,193,443 |
212,364,193,443 |
|
자기주식처분이익 |
29,330,129,864 |
29,886,947,864 |
|
기타자본 |
(110,552,265,570) |
(117,540,265,570) |
|
기타포괄손익누계액 |
11,906,382,664 |
11,839,538,664 |
|
이익잉여금(결손금) |
(113,518,906,545) |
(103,939,356,632) |
|
자본총계 |
45,964,721,856 |
49,046,245,769 |
|
자본과부채총계 |
114,693,423,748 |
117,627,375,898 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 23 기 반기 2025.01.01 부터 2025.06.30 까지 |
|
제 22 기 반기 2024.01.01 부터 2024.06.30 까지 |
|
(단위 : 원) |
|
제 23 기 반기 |
제 22 기 반기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출액 |
5,492,570,158 |
11,610,425,825 |
7,144,382,483 |
15,538,404,222 |
|
매출원가 |
5,093,307,177 |
12,529,895,693 |
7,547,546,521 |
15,139,325,670 |
|
매출총이익(손실) |
399,262,981 |
(919,469,868) |
(403,164,038) |
399,078,552 |
|
판매비와관리비 |
7,141,391,107 |
9,617,332,649 |
5,622,713,146 |
8,784,394,951 |
|
영업이익(손실) |
(6,742,128,126) |
(10,536,802,517) |
(6,025,877,184) |
(8,385,316,399) |
|
기타수익 |
57,988,876 |
1,225,638,559 |
104,007,395 |
207,283,787 |
|
기타비용 |
150,048,989 |
375,084,194 |
12,531,959 |
13,558,881 |
|
금융수익 |
235,901,499 |
1,846,287,512 |
5,402,895,578 |
6,789,666,797 |
|
금융비용 |
1,148,676,706 |
1,624,759,606 |
13,616,159,636 |
23,812,669,476 |
|
법인세비용차감전순이익(손실) |
(7,746,963,446) |
(9,464,720,246) |
(14,147,665,806) |
(25,214,594,172) |
|
법인세비용(수익) |
66,493,119 |
66,493,119 |
79,168,340 |
79,168,340 |
|
당기순이익(손실) |
(7,813,456,565) |
(9,531,213,365) |
(14,226,834,146) |
(25,293,762,512) |
|
기타포괄이익(손실) |
(47,720,548) |
18,507,452 |
(222,560,547) |
(255,533,547) |
|
당기손익으로 재분류되지 않는 항목 |
(47,720,548) |
18,507,452 |
(222,560,547) |
(255,533,547) |
|
순확정급여제도의 재측정요소 |
(48,336,548) |
(48,336,548) |
(299,627,547) |
(299,627,547) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
616,000 |
66,844,000 |
77,067,000 |
44,094,000 |
|
총포괄손익 |
(7,861,177,113) |
(9,512,705,913) |
(14,449,394,693) |
(25,549,296,059) |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(294) |
(367) |
(618) |
(1,136) |
|
희석주당이익(손실) (단위 : 원) |
(294) |
(367) |
(618) |
(1,136) |
4-3. 자본변동표
|
자본변동표 |
|
제 23 기 반기 2025.01.01 부터 2025.06.30 까지 |
|
제 22 기 반기 2024.01.01 부터 2024.06.30 까지 |
|
(단위 : 원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본 |
기타포괄손익 |
이익잉여금 |
자본 합계 |
|
|
2024.01.01 (기초자본) |
16,435,188,000 |
212,364,193,443 |
(131,116,845,466) |
(475,699,000) |
(77,368,947,207) |
19,837,889,770 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(25,293,762,512) |
(25,293,762,512) |
|
기타포괄손익 |
0 |
0 |
0 |
44,094,000 |
(299,627,547) |
(255,533,547) |
|
순확정급여제도의 재측정요소 |
0 |
0 |
0 |
0 |
(299,627,547) |
(299,627,547) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
0 |
0 |
0 |
44,094,000 |
0 |
44,094,000 |
|
소유주와의 거래 |
0 |
17,976,685,460 |
7,498,595,690 |
0 |
0 |
25,475,281,150 |
|
교환사채의 교환 |
0 |
17,976,685,460 |
7,498,595,690 |
0 |
0 |
25,475,281,150 |
|
자기주식의 처분 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2024.06.30 (기말자본) |
16,435,188,000 |
230,340,878,903 |
(123,618,249,776) |
(431,605,000) |
(102,962,337,266) |
19,763,874,861 |
|
2025.01.01 (기초자본) |
16,435,188,000 |
242,251,141,307 |
(117,540,265,570) |
11,839,538,664 |
(103,939,356,632) |
49,046,245,769 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(9,531,213,365) |
(9,531,213,365) |
|
기타포괄손익 |
0 |
0 |
0 |
66,844,000 |
(48,336,548) |
18,507,452 |
|
순확정급여제도의 재측정요소 |
0 |
0 |
0 |
0 |
(48,336,548) |
(48,336,548) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
0 |
0 |
0 |
66,844,000 |
0 |
66,844,000 |
|
소유주와의 거래 |
0 |
(556,818,000) |
6,988,000,000 |
0 |
0 |
6,431,182,000 |
|
교환사채의 교환 |
0 |
0 |
0 |
0 |
0 |
0 |
|
자기주식의 처분 |
0 |
(556,818,000) |
6,988,000,000 |
0 |
0 |
6,431,182,000 |
|
2025.06.30 (기말자본) |
16,435,188,000 |
241,694,323,307 |
(110,552,265,570) |
11,906,382,664 |
(113,518,906,545) |
45,964,721,856 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 23 기 반기 2025.01.01 부터 2025.06.30 까지 |
|
제 22 기 반기 2024.01.01 부터 2024.06.30 까지 |
|
(단위 : 원) |
|
제 23 기 반기 |
제 22 기 반기 |
|
|---|---|---|
|
영업활동현금흐름 |
(7,672,415,784) |
(9,909,034,589) |
|
영업으로부터 창출된 현금흐름 |
(6,991,372,634) |
(9,980,761,216) |
|
이자의 수취 |
59,254,071 |
82,308,946 |
|
이자의 지급 |
(769,222,801) |
(58,216,079) |
|
법인세납부(환급) |
28,925,580 |
47,633,760 |
|
투자활동현금흐름 |
2,066,357,578 |
(15,649,893,720) |
|
당기손익-공정가치측정금융자산의 취득 |
(6,854,433,831) |
(21,548,950,876) |
|
당기손익-공정가치측정금융자산의 처분 |
7,428,225,463 |
17,447,268,769 |
|
장기금융상품의 증가 |
(1,800,000) |
(1,800,000) |
|
투자자산의 처분 |
1,240,000,000 |
0 |
|
유형자산의 취득 |
(1,343,142,379) |
(11,220,392,456) |
|
유형자산의 처분 |
0 |
9,000,000 |
|
무형자산의 취득 |
0 |
(331,240,000) |
|
무형자산의 처분 |
1,418,181,818 |
0 |
|
보증금의 증가 |
(28,447,000) |
(56,814,050) |
|
보증금의 감소 |
237,773,507 |
53,034,893 |
|
임대보증금의 감소 |
(30,000,000) |
0 |
|
재무활동현금흐름 |
5,623,268,845 |
24,774,720,601 |
|
교환사채의 발행 |
0 |
21,000,000,000 |
|
교환사채의 상환 |
(2,976,162,660) |
0 |
|
단기차입금의 차입 |
4,100,000,000 |
4,530,000,000 |
|
단기차입금의 상환 |
(1,500,000,000) |
(4,530,000,000) |
|
리스부채의 상환 |
(370,568,495) |
(435,679,399) |
|
장기차입금의 차입 |
0 |
4,210,400,000 |
|
자기주식의 처분 |
6,370,000,000 |
0 |
|
현금및현금성자산의 순증가(감소) |
17,210,639 |
(784,207,708) |
|
기초현금및현금성자산 |
862,364,483 |
1,610,034,625 |
|
현금및현금성자산에 대한 환율변동효과 |
(2,841,963) |
1,803,465 |
|
기말현금및현금성자산 |
876,733,159 |
827,630,382 |
5. 재무제표 주석
| 제 23 기 2분기 2025년 04월 01일부터 2025년 06월 30일까지 |
| 제 23 기 반기 2025년 01월 01일부터 2025년 06월 30일까지 |
| 제 22 기 2분기 2024년 04월 01일부터 2024년 06월 30일까지 |
| 제 22 기 반기 2024년 01월 01일부터 2024년 06월 30일까지 |
| 코아스템켐온 주식회사 |
1. 회사의 개요
코아스템켐온 주식회사(이하 "회사")는 줄기세포 등 세포치료제를 활용한 난치성질환치료제의 개발 및 공급을 목적으로 2003년 12월 29일에 설립되었습니다. 회사는 경기도 성남시 분당구에 본사를 두고 있으며, 2015년 6월 26일에 코스닥시장에 주식을상장하였습니다. 2022년 12월 1일을 합병기일로 하여 주식회사 켐온을 흡수합병하였으며, 비임상실험대행, 신약개발 및 연구대행 등의 사업이 추가 되었습니다.
회사의 설립시 자본금은 200백만원이었으며, 설립 후 수차의 유상증자를 실시하여 당기말 현재 납입자본금은 16,435백만원이며, 최대주주는 김경숙 이사로 보유주식은 3,483,320주(지분율 10.60%)입니다.
2. 재무제표 작성기준 및 중요한 회계정책
회사의 반기재무제표는 한국채택국제회계기준에 따라 작성되는 요약중간재무제표입니다. 동 재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표입니다. 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석에는 직전 연차보고기간말 후 발생한 회사의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다. 동 요약중간재무제표에 대한 이해를 위해서는 한국채택국제회계기준에 따라 작성된 2024년 12월 31일자로 종료하는 회계연도에 대한 연차별도재무제표를 함께 이용하여야 합니다.
중간재무제표의 작성에 적용된 중요한 회계정책은 아래에서 설명하는 기준서나 해석서의 도입과 관련된 영향을 제외하고는 2024년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다.
1) 당반기부터 새로 도입된 기준서 및 해석서와 그로 인한 회계정책 변경의 내용은 다음과 같습니다.
-기업회계기준서 제1021호 '환율변동효과'와 제1101호 '한국채택국제회계기준의 최초채택'(개정) - 교환가능성 결여
동 개정사항은 회계목적상 다른 통화와 교환이 가능하다고 보는 상황에 대해 정의하고, 다른 통화와의 교환가능성 평가, 교환가능성이 결여된 경우 사용할 현물환율 추정 및 공시 요구사항을 명확히 합니다.
다른 통화와 교환이 가능하지 않다면 측정일에 현물환율을 추정해야 하며, 관측 가능한 환율을 조정 없이 사용하거나 다른 추정기법을 사용하도록 하고 있습니다.
2) 제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
(1) 기업회계기준서 제1109호 '금융상품'과 제1107호 '금융상품: 공시'(개정) - 금융상품 분류와 측정
동 개정사항은 전자지급시스템을 사용하여 금융부채를 결제할 때의 금융부채의 결제일 전 이행과 관련된 조건, 계약상 현금흐름이 기본대여계약과 일관되는지 평가할 때 고려해야 할 이자 및 우발사건 특성, 비소구 특성을 가진 금융자산, 계약상 연계된 금융상품의 특성을 명확히 합니다. 그리고 기타포괄손익-공정가치로 지정된 지분상품에 대한 투자와 계약상 현금흐름의 시기나 금액을 변경할 수 있는 계약조건에 대한 추가적인 공시 요구사항을 포함합니다.
(2) 기업회계기준서 제1109호 '금융상품' - 리스부채의 제거 회계처리 및 거래가격의 정의
동 개정사항은 리스부채 제거시 발생하는 차손익을 당기손익으로 인식해야 함을 명확히 하였습니다. 또한 거래가격의 정의를 기업회계기준서 제1115호와 일관되도록 개정하였습니다.
(3) 기업회계기준서 제1110호 '연결재무제표' - 사실상의 대리인 결정
동 개정사항은 사실상 대리인의 판단과 관련한 기준서 제1110호의 표현을 개정하여 기준서 문단 간의 불일치를 해소하였습니다.
(4) 기업회계기준서 제1101호 '한국채택국제회계기준의 최초채택' - 위험회피회계 적용
동 개정사항은 위험회피회계의 적용조건을 기업회계기준서 제1109호 '금융상품'의 구체적인 문단을 참조하도록 명시하고 관련 용어를 일치시켰습니다.
(5) 기업회계기준서 제1107호 '금융상품: 공시' - 제거 손익
동 개정사항은 공정가치 측정과 관련하여 기업회계기준서 제1113호 '공정가치'를 참조하도록 하고 관련 용어를 일치시켰습니다.
(6) 기업회계기준서 제1007호 - 원가법
동 개정으로 '원가법'이라는 용어를 삭제하고 이를 '원가'로 대체하였습니다.
상기 개정사항은 2026년 1월 1일 이후 최초로 시작되는 회계연도부터 전진적용하며 조기적용이 허용됩니다.
당사는 동 개정사항이 재무제표에 미치는 영향이 중요하지 않을 것으로 판단하고 있습니다.
3. 중요한 회계추정 및 가정
재무제표 작성에는 미래에 대한 가정 및 추정이 요구되며 경영진은 회사의 회계정책을 적용하기 위해 판단이 요구됩니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에 비추어 합리적으로 예측가능한 미래의 사건을 고려하여 이루어집니다. 회계추정의 결과가 실제 결과와 동일한 경우는 드물 것이므로 중요한 조정을 유발할 수 있는 유의적인 위험을 내포하고 있습니다.
다음 회계연도에 자산 및 부채 장부금액의 조정에 영향을 미칠 수 있는 경영진 판단과 유의적 위험에 대한 추정 및 가정은 다음과 같습니다. 일부 항목에 대한 유의적인 판단 및 추정에 대한 추가적인 정보는 개별 주석에 포함되어 있습니다.
(1) 영업권이 배부된 현금창출단위의 손상검사
영업권의 손상 여부를 검토하기 위한 현금창출단위의 회수가능액은 사용가치의 계산에 기초하여 결정됩니다(주석 15 참조).
(2) 법인세
회사의 과세소득에 대한 법인세는 대한민국의 세법 및 과세당국의 결정을 적용하여 산정되므로 최종 세효과를 산정하는 데에는 불확실성이 존재합니다(주석 23 참조).
회사는 특정 기간동안 과세소득의 일정 금액을 투자, 임금증가 등에 사용하지 않았을 때 세법에서 정하는 방법에 따라 산정된 법인세를 추가로 부담합니다. 따라서, 해당 기간의 당기법인세와 이연법인세를 측정할 때 이에 따른 세효과를 반영하여야 하고, 이로 인해 회사가 부담할 법인세는 각 연도의 투자, 임금증가 등의 수준에 따라 달라지므로 최종 세효과를 산정하는데에는 불확실성이 존재합니다.
(3) 금융상품의 공정가치
활성시장에서 거래되지 않는 금융상품의 공정가치는 원칙적으로 평가기법을 사용하여 결정됩니다. 회사는 보고기간말 현재 중요한 시장상황에 기초하여 다양한 평가기법의 선택 및 가정에 대한 판단을 하고 있습니다(주석 5 참조).
(4) 금융자산의 손상
금융자산의 손실충당금은 부도위험 및 기대손실률 등에 대한 가정에 기초하여 측정됩니다. 회사는 이러한 가정의 설정 및 손상모델에 사용되는 투입변수의 선정에 있어서 회사의 과거 경험, 현재 시장 상황, 재무보고일 기준의 미래전망정보 등을 고려하여 판단합니다(주석 4.1.2 참조).
(5) 순확정급여부채
순확정급여부채의 현재가치는 보험수리적방식에 의해 결정되는 다양한 요소들 특히 할인율의 변동에 영향을 받습니다(주석 19 참조).
(6) 수익인식
용역수익금액은 회수가능성이 매우 높은 발생원가의 범위 내에서만 인식하고 있습니다.
(7) 리스
리스기간을 산정할 때에 경영진은 연장선택권을 행사하거나 종료선택권을 행사하지 않을 경제적 유인이 생기게 하는 관련되는 사실 및 상황을 모두 고려합니다. 연장선택권의 대상 기간(또는 종료선택권의 대상 기간)은 리스이용자가 연장선택권을 행사할 것(또는 행사하지 않을 것)이 상당히 확실한 경우에만 리스기간에 포함됩니다. (주석 16 참조).
4. 재무위험관리
4.1 재무위험관리요소
회사는 여러 활동으로 인하여 시장위험(환위험, 이자율위험 및 가격위험), 신용위험 및 유동성위험과 같은 다양한 재무위험에 노출되어 있습니다. 회사의 전반적인 위험관리정책은 금융시장의 예측불가능성에 초점을 맞추고 있으며 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화하는데 중점을 두고 있습니다.
위험관리는 이사회에서 승인한 정책에 따라 이루어지고 있습니다. 이사회는 신용 위험 및 유동성을 초과하는 투자와 같은 특정 분야에 관한 문서화된 정책뿐 아니라, 전반적인 위험관리에 대한 문서화된 정책을 검토, 승인합니다.
4.1.1 시장위험
(1) 외환위험
당반기말과 전기말 현재 다른 모든 변수가 일정하고 각 외화에 대한 기능통화의 환율이 10%변동시 세전이익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분(*) | 당반기말 | 전기말 | ||
| 10% 상승시 | 10% 하락시 | 10% 상승시 | 10% 하락시 | |
| 미국 달러/원 | 12,727 | (12,727) | 15,401 | (15,401) |
(*) 상기 민감도 분석은 당반기말과 전기말 현재 회사의 기능통화인 원화 이외의 외화로 표시된 화폐성 자산ㆍ부채를 대상으로 하였습니다.
(2) 가격위험
(가) 가격위험
회사는 재무상태표상 기타포괄손익-공정가치 측정 금융자산 또는 당기손익-공정가치 측정 금융자산으로 분류되는 회사 보유 지분증권의 가격위험에 노출되어 있습니다. 회사는 지분증권에 대한 투자로 인한 가격위험을 관리하기 위해 포트폴리오를 분산투자하고 있으며 포트폴리오의 분산투자는 회사가 정한 한도에 따라 이루어집니다.
(나) 민감도 분석
당반기말과 전기말 현재 다른 모든 변수가 일정하고 공정가치 가격 10% 변동 시 회사의 자본에 미치는 영향은 아래 표와 같습니다.
| (단위: 천원) |
| 가격 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 10% 상승시 | 10% 하락시 | 10% 상승시 | 10% 하락시 | |
| 당기손익 | 166,292 | (166,292) | 222,122 | (222,122) |
| 기타포괄손익 | 380,261 | (380,261) | 373,576 | (373,576) |
당기손익-공정가치 측정 지분증권의 손익은 당기손익에 영향을 미치고 기타포괄손익-공정가치 측정 지분증권의 손익은 자본에 영향을 미칩니다.
(다) 당기손익 및 기타포괄손익
회사의 투자 금융상품이 당기손익 및 기타포괄손익에 미치는 영향은 주석 7에서 설명하고 있습니다.
(3) 이자율 위험
변동금리부 금융상품의 이자율 변동위험은 시장금리 변동으로 인한 재무상태표 항목의 가치변동(공정가치) 위험과 투자 및 재무활동으로부터 발생하는 이자수익, 비용의현금흐름이 변동될 위험으로 정의할 수 있습니다. 이러한 회사의 이자율 변동위험은 주로 예금(당기손익인식금융자산의 편입자산 중 채무증권 포함) 및 변동금리부 차입금에서 비롯되며, 회사는 이자율 변동으로 인한 불확실성과 금융비용의 최소화를 위한 정책을 수립 및 운용하고 있습니다.
회사의 차입금과 채권은 상각후원가로 측정됩니다. 차입금 중 이자율이 주기적으로 재설정되는 계약의 경우에는 관련하여 시장이자율 변동위험에 노출되어 있습니다.
당반기말과 전기말 현재 회사의 이자율위험에 노출된 차입금은 다음과 같습니다.
| (단위: 천원) |
| 지 수 | 당반기말 | 전기말 | ||
| 금액 | 비율 | 금액 | 비율 | |
| 변동금리 차입금 - 만기일 |
||||
| 1년 미만 | 22,095,540 | 59% | 16,162,100 | 47% |
| 1-5년 | 15,138,460 | 41% | 18,471,900 | 53% |
| 합 계 | 37,234,000 | 100% | 34,634,000 | 100% |
만기별 분석은 아래 유동성 관련 주석사항에 포함되어 있습니다. 위의 차입금 비율은 전체 차입금 중 변동금리에 노출된 해당 차입금의 비율을 나타냅니다.
당반기말과 전기말 현재 다른 모든 변수가 일정하고 이자율의 1% 변동시 회사의 법인세차감전순이익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 1% 상승 | 1% 하락 | 1% 상승 | 1% 하락 | |
| 법인세차감전순이익 | (372,340) | 372,340 | (346,340) | 346,340 |
4.1.2 신용위험
신용위험은 기업 및 개인 고객에 대한 신용거래 및 채권뿐 아니라 현금성자산, 채무상품의 계약 현금흐름, 유리한 파생상품 및 예치금 등에서도 발생합니다.
금융자산의 장부가액은 회사의 신용위험에 대한 최대노출정도를 나타내고 있다고 판단되며, 당반기말과 전기말 현재 회사의 신용위험에 대한 최대노출정도는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
| 현금성자산 | 876,733 | 862,364 |
| 단기금융상품 | 1,000,000 | 1,000,000 |
| 당기손익-공정가치측정금융자산 | 1,662,918 | 2,221,221 |
| 기타포괄손익-공정가치측정금융자산 | 3,802,608 | 3,735,764 |
| 매출채권 | 2,506,112 | 4,564,875 |
| 기타유동금융자산 | 316,968 | 372,423 |
| 기타비유동금융자산 | 1,312,418 | 1,497,679 |
| 합 계 | 11,477,757 | 14,254,326 |
(1) 위험관리
신용위험은 회사의 통상적인 거래 및 투자활동에서 발생하며 고객 또는 거래상대방이 계약조건상 의무사항을 지키지 못하였을 때 발생합니다. 이러한 신용위험을 관리하기 위하여 회사는 주기적으로 고객과 거래상대방의 재무상태와 과거 경험 및 기타요소들을 고려하여 재무신용도를 평가하고 있으며 고객과 거래상대방 각각에 대한 신용한도를 설정하고 있습니다. 신용위험은 현금및현금성자산, 각종 예금 등과 같은 금융기관과의 거래에서도 발생할 수 있습니다. 이러한 위험을 줄이기 위해, 회사는 신용도가 높은 금융기관들에 대해서만 거래를 하고 있습니다.
(2) 금융자산의 손상
회사는 기대신용손실 모형이 적용되는 다음의 금융자산을 보유하고 있습니다.
· 재화 및 용역의 제공에 따른 매출채권
· 용역 제공에 따른 계약자산
· 당기손익-공정가치로 측정하는 채무상품
· 상각후원가로 측정하는 기타 금융자산
현금성자산도 손상 규정의 적용대상에 포함되나 식별된 기대신용손실은 유의적이지 않습니다.
(가) 매출채권과 계약자산
회사는 매출채권과 계약자산에 대해 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용합니다.
기대신용손실을 측정하기 위해 매출채권과 계약자산은 신용위험 특성과 연체일을 기준으로 구분하였습니다. 미청구용역에 따른 계약자산은 동일 유형의 계약에서 발생한 매출채권과 유사한 위험속성을 가지므로 회사는 매출채권의 손실율이 계약자산의 손실율에 대한 합리적인 추정치로 판단하였습니다.
기대신용손실율은 보고기간말 기준으로부터 각 36개월 동안의 매출과 관련된 지불 정보와 관련 확인된 신용손실 정보를 근거로 산출하였습니다. 과거 손실 정보는 고객의 채무 이행능력에 영향을 미칠 거시경제적 현재 및 미래전망정보를 반영하여 조정합니다. 회사는 매출이 발생하는 국가의 GDP 및 실업률이 가장 목적적합한 요소로 판단하고 과거 손실 정보를 이러한 요소의 예상 변동에 근거하여 조정합니다.
당반기말과 전기말의 매출채권과 계약자산에 대한 손실충당금은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 정상 | 30일 초과 연체 |
90일 초과 연체 |
180일 초과 연체 |
1년 초과 연체 |
개별인식 | 계 |
| 기대 손실률 | 3% | 16% | 30% | 60% | 100% | 100% | |
| 총 장부금액 - 매출채권 | 1,284,793 | 726,686 | 249,450 | 1,200,639 | 1,229,963 | 647,514 | 5,339,045 |
| 총 장부금액 - 계약자산 | 7,231,963 | - | - | - | - | - | 7,231,963 |
| 손실충당금 | 471,704 | 118,811 | 74,614 | 717,793 | 1,229,963 | 647,514 | 3,260,399 |
| (전기말) | (단위: 천원) |
| 구 분 | 정상 | 30일 초과 연체 |
90일 초과 연체 |
180일 초과 연체 |
1년 초과 연체 |
개별인식 | 계 |
| 기대 손실률 | 2% | 11% | 18% | 57% | 100% | 100% | |
| 총 장부금액 - 매출채권 | 2,678,109 | 1,447,019 | 417,515 | 708,542 | 820,138 | 1,074,308 | 7,145,631 |
| 총 장부금액 - 계약자산 | 5,337,485 | - | - | - | - | - | 5,337,485 |
| 손실충당금 | 248,091 | 152,795 | 76,329 | 403,257 | 820,138 | 1,074,308 | 2,774,918 |
당반기와 전반기 중 매출채권과 계약자산의 대손충당금 변동내역은 다음과 같습니다
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 매출채권 | 계약자산 | 매출채권 | 계약자산 | |
| 기초금액 | 2,580,755 | 194,162 | 2,957,324 | 8,410 |
| 대손상각비(환입) | 293,539 | 233,304 | (493,679) | 14,794 |
| 제각 | (41,361) | - | - | - |
| 기말금액 | 2,832,933 | 427,466 | 2,463,645 | 23,204 |
(나) 상각후원가 측정 기타수취채권
상각후원가로 측정하는 기타 금융자산에는 관계사대여금, 임직원대여금, 기타 미수금 등이 포함됩니다.
상각후원가로 측정되는 기타 금융자산에 대한 손실충당금의 변동 내역은 다음과 같습니다.
| (단위: 천원) |
|
관계사 대여금 |
당반기 | 전반기 |
|---|---|---|
|
기초 손실충당금 |
600,000 | 600,000 |
|
당기손익에 인식된 손실충당금의 증가 |
- | - |
|
기말 손실충당금 |
600,000 | 600,000 |
리스채권 이외의 상각후원가로 측정하는 기타 금융자산은 모두 신용위험이 낮은 것으로 판단되며, 따라서 손실충당금은 12개월 기대신용손실로 인식하였습니다. 경영진은 적어도 한 개 이상의 주요 신용평가기관에서 투자 등급인 신용등급을 받은 상장 회사채의 경우 '신용위험이 낮은' 것으로 간주합니다. 그 외 금융상품은 채무불이행 위험이 낮고 단기간 내에 계약상 현금흐름을 지급할 수 있는 발행자의 충분한 능력이 있는 경우 신용위험이 낮은 것으로 간주합니다. 리스채권은 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용합니다.
(다) 당기손익-공정가치 측정 금융자산
회사는 당기손익-공정가치 측정 금융자산에 대한 신용위험에도 노출되어 있습니다. 당반기 현재 회사의 관련 최대노출금액은 해당 장부금액입니다(당반기: 1,662,918천원, 전기: 2,221,221천원).
4.1.3 유동성 위험
회사는 매 6개월 및 1년 단위로 자금수지계획을 수립함으로써 영업활동, 투자활동, 재무활동에서의 자금수지를 미리 예측하고 있으며, 이를 통해 필요한 유동성 규모를 사전에 확보하고 유지하여 향후에 발생할 수 있는 유동성 리스크를 사전에 관리하고 있습니다. 또한, 신중한 유동성 위험 관리는 충분한 현금성자산 및 단기금융상품의 유지, 적절히 약정된 신용한도금액으로부터의 자금 여력 등을 포함하고 있습니다.
(1) 만기분석
유동성 위험 분석에서는 회사의 다음의 금융부채를 계약상 만기별로 구분하였습니다.
(가) 모든 비파생 금융부채
(나) 순액 및 총액 결제 파생상품 중 계약상 만기가 현금흐름의 시기를 이해하기 위해 필요한 경우
유동성 위험 분석에 포함된 금액은 계약상의 할인되지 않은 현금흐름입니다. 금융보증계약 이외의 12개월 이내 만기가 도래하는 금액은 현재가치 할인의 효과가 중요하지 않으므로 장부금액과 동일합니다. 금융보증계약은 즉시 지급을 요구받을 수 있으므로 계약금액 총액이 6개월 미만 구분에 포함되어 있습니다. 이자율스왑의 경우 보고기간말 현재의 선도이자율을 적용하여 미래 현금흐름을 추정하였습니다.
당반기말과 전기말 현재 금융부채의 계약상 만기는 다음과 같습니다. 아래 표에 표시된 현금흐름은 현재가치 할인을 하지 아니한 금액입니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 3개월미만 | 3개월이상 1년 미만 |
1년이상 | 합 계 |
|---|---|---|---|---|
| 매입채무 | 248,998 | - | - | 248,998 |
| 미지급금 | 1,319,351 | - | - | 1,319,351 |
| 미지급비용 | 1,286,660 | - | - | 1,286,660 |
| 차입금 | 2,320,531 | 20,793,353 | 16,230,813 | 39,344,697 |
| 리스부채 | 113,726 | 237,440 | 497,687 | 848,853 |
| 교환사채 | 18,149,766 | - | - | 18,149,766 |
| 합 계 | 23,439,032 | 21,030,793 | 16,728,500 | 61,198,325 |
| (전기말) | (단위: 천원) |
| 구분 | 3개월미만 | 3개월이상 1년 미만 |
1년이상 | 합계 |
|---|---|---|---|---|
| 매입채무 | 367,581 | - | - | 367,581 |
| 미지급금 | 1,126,719 | - | - | 1,126,719 |
| 미지급비용 | 1,383,470 | - | - | 1,383,470 |
| 차입금 | 3,192,366 | 12,565,891 | 22,144,353 | 37,902,610 |
| 리스부채 | 222,467 | 295,096 | 563,685 | 1,081,248 |
| 교환사채 | 21,178,372 | - | - | 21,178,372 |
| 임대보증금 | - | - | 30,000 | 30,000 |
| 합 계 | 27,470,975 | 12,860,987 | 22,738,038 | 63,070,000 |
4.2 자본위험관리
회사의 자본관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보유하고 자본비용을 절감하기 위해 최적 자본구조를 유지하는 것입니다.
회사는 자본조달비율에 기초하여 자본을 관리하고 있으며, 자본조달비율은 순부채를총자본으로 나누어 산출하고 있습니다. 순부채는 총차입금에서 현금및현금성자산을차감한 금액이며, 총자본은 재무상태표의 자본에 순부채를 가산한 금액입니다. 당반기말 및 전기말 현재 회사의 자본조달비율은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
| 총차입금 | 47,898,433 | 45,904,050 |
| 차감: 현금및현금성자산 | (876,733) | (862,364) |
| 순부채 | 47,021,700 | 45,041,686 |
| 자본총계 | 45,964,722 | 49,046,246 |
| 총자본 | 92,986,422 | 94,087,932 |
| 자본조달비율 | 50.6% | 47.9% |
5. 범주별 금융상품
(1) 당반기말과 전기말 현재 회사의 범주별 금융자산의 내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정금융자산 |
당기손익-공정가치 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합 계 |
|---|---|---|---|---|
| 현금및현금성자산 | 876,733 | - | - | 876,733 |
| 단기금융자산 | 1,000,000 | - | - | 1,000,000 |
| 당기손익-공정가치측정금융자산 | - | 1,662,918 | - | 1,662,918 |
| 기타포괄손익-공정가치측정금융자산 | - | - | 3,802,608 | 3,802,608 |
| 매출채권 | 2,506,112 | - | - | 2,506,112 |
| 기타유동금융자산 | 316,968 | - | - | 316,968 |
| 기타비유동금융자산 | 1,312,418 | - | - | 1,312,418 |
| 합 계 | 6,012,231 | 1,662,918 | 3,802,608 | 11,477,757 |
| (전기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정금융자산 |
당기손익-공정가치 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합 계 |
|---|---|---|---|---|
| 현금및현금성자산 | 862,364 | - | - | 862,364 |
| 단기금융자산 | 1,000,000 | - | - | 1,000,000 |
| 당기손익-공정가치측정금융자산 | - | 2,221,221 | - | 2,221,221 |
| 기타포괄손익-공정가치측정금융자산 | - | - | 3,735,764 | 3,735,764 |
| 매출채권 | 4,564,875 | - | - | 4,564,875 |
| 기타유동금융자산 | 372,423 | - | - | 372,423 |
| 기타비유동금융자산 | 1,497,679 | - | - | 1,497,679 |
| 합 계 | 8,297,341 | 2,221,221 | 3,735,764 | 14,254,326 |
(2) 당반기말과 전기말 현재 회사의 범주별 금융부채의 내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치 측정금융부채 |
기타금융부채 | 합 계 |
|---|---|---|---|---|
| 단기차입금 | 11,000,000 | - | - | 11,000,000 |
| 유동성장기차입금 | 11,095,540 | - | - | 11,095,540 |
| 매입채무 | 248,998 | - | - | 248,998 |
| 기타유동금융부채 | 2,606,011 | - | - | 2,606,011 |
| 유동리스부채 | - | - | 324,333 | 324,333 |
| 비유동리스부채 | - | - | 406,651 | 406,651 |
| 장기차입금 | 15,138,460 | - | - | 15,138,460 |
| 교환사채 | 10,664,433 | - | - | 10,664,433 |
| 파생상품부채 | - | 5,010,847 | - | 5,010,847 |
| 합 계 | 50,753,442 | 5,010,847 | 730,984 | 56,495,273 |
| (전기말) | (단위: 천원) |
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치측정금융부채 | 기타금융부채 | 합 계 |
|---|---|---|---|---|
| 단기차입금 | 8,400,000 | - | - | 8,400,000 |
| 유동성장기차입금 | 7,762,100 | - | - | 7,762,100 |
| 매입채무 | 367,581 | - | - | 367,581 |
| 기타유동금융부채 | 2,510,189 | - | - | 2,510,189 |
| 유동리스부채 | - | - | 450,189 | 450,189 |
| 기타비유동금융부채 | 30,000 | - | - | 30,000 |
| 비유동리스부채 | - | - | 471,929 | 471,929 |
| 장기차입금 | 18,471,900 | - | - | 18,471,900 |
| 교환사채 | 11,270,050 | - | - | 11,270,050 |
| 파생상품부채 | - | 7,049,784 | - | 7,049,784 |
| 합 계 | 48,811,820 | 7,049,784 | 922,118 | 56,783,722 |
(3) 당반기와 전반기의 회사의 금융상품 범주별 금융손익은 내역은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 상각후원가측정금융자산 | 당기손익-공정가치측정금융자산 | 기타포괄손익 인식금융자산 |
상각후원가측정금융부채 | 당기손익-공정가치측정금융부채 | 기타금융부채 | 합 계 |
|---|---|---|---|---|---|---|---|
| 이자수익(비용) | 48,391 | - | - | (906,365) | - | (42,147) | (900,121) |
| 외환차익(차손) | 3,333 | - | - | - | - | - | 3,333 |
| 배당금수익 | - | - | 57,762 | - | - | - | 57,762 |
| 외화환산이익(손실) | (10,106) | - | - | - | - | - | (10,106) |
| 당기손익-공정가치측정금융자산평가이익(손실) | - | (4,350) | - | - | - | - | (4,350) |
| 당기손익-공정가치측정금융자산처분이익(손실) | - | 19,838 | - | - | - | - | 19,838 |
| 파생상품평가이익(손실) | - | - | - | - | 1,439,550 | - | 1,439,550 |
| 사채상환이익(손실) | - | - | - | (384,379) | - | - | (384,379) |
| 합 계 | 41,618 | 15,488 | 57,762 | (1,290,744) | 1,439,550 | (42,147) | 221,527 |
| (전반기) | (단위: 천원) |
| 구 분 | 상각후원가측정금융자산 | 당기손익-공정가치측정금융자산 | 기타포괄손익 인식금융자산 |
상각후원가측정금융부채 | 당기손익-공정가치측정금융부채 | 기타금융부채 | 합 계 |
|---|---|---|---|---|---|---|---|
| 이자수익(비용) | 35,237 | - | - | (2,134,492) | - | - | (2,099,255) |
| 외환차익(차손) | 230 | - | - | (12) | - | - | 218 |
| 배당금수익 | - | - | 76,786 | - | - | - | 76,786 |
| 외화환산이익(손실) | 10,065 | - | - | - | - | - | 10,065 |
| 당기손익-공정가치측정금융자산평가이익(손실) | - | 31,732 | - | - | - | - | 31,732 |
| 당기손익-공정가치측정금융자산처분이익(손실) | - | 84,536 | - | - | - | - | 84,536 |
| 파생상품평가이익(손실) | - | - | - | - | (14,873,958) | - | (14,873,958) |
| 사채상환이익(손실) | - | - | - | (213,245) | - | - | (213,245) |
| 합 계 | 45,532 | 116,268 | 76,786 | (2,347,749) | (14,873,958) | - | (16,983,121) |
(4) 공정가치
1) 금융상품의 범주별 분류 및 공정가치
공정가치로 측정되거나 공정가치로 공시되는 금융상품을 공정가치 서열체계에 따라 구분하기 위하여 정의된 수준들은 다음과 같습니다.
ㆍLevel 1 : 동일한 자산이나 부채에 대한 활성시장의(조정되지 않은) 공시가격
ㆍLevel 2 : 직접적 또는 간접적으로 관측가능한, 자산이나 부채에 대한 투입변수
단, Level 1에 포함된 공시가격은 제외함
ㆍLevel 3 : 관측가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입변수
(관측가능하지 않은 투입변수)
금융상품의 공정가치를 측정하는 데에 사용되는 평가기법에는 다음이 포함됩니다.
- 유사한 상품의 공시시장가격 또는 딜러가격
- 현금흐름의 할인기법 등의 기타 기법 사용
당반기말과 전기말 현재 공정가치로 측정된 금융상품의 공정가치 및 공정가치 서열체계구분은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | Level 1 | Level 2 | Level 3 | 합계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익-공정가치측정금융자산 | - | 1,662,918 | - | 1,662,918 |
| 기타포괄손익-공정가치측정금융자산 | 3,802,608 | - | - | 3,802,608 |
| 합 계 | 3,802,608 | 1,662,918 | - | 5,465,526 |
| 금융부채 | ||||
| 파생상품부채 | - | - | 5,010,847 | 5,010,847 |
| (전기말) | (단위: 천원) |
| 구 분 | Level 1 | Level 2 | Level 3 | 합계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익-공정가치측정금융자산 | - | 2,221,221 | - | 2,221,221 |
| 기타포괄손익-공정가치측정금융자산 | 3,735,764 | - | - | 3,735,764 |
| 합 계 | 3,735,764 | 2,221,221 | - | 5,956,985 |
| 금융부채 | ||||
| 파생상품부채 | - | - | 7,049,784 | 7,049,784 |
2) 가치평가기법 및 투입 변수
| (단위: 천원) |
| 구분 | 수준 | 가치평가기법 | 투입변수 | 공정가치 | 수준 3 투입변수 범위 | |||
|---|---|---|---|---|---|---|---|---|
| 당반기말 | 전기말 | 투입변수 | 당반기말 | 전기말 | ||||
| 파생상품부채 | ||||||||
| 교환사채 | 3 | 이항모형 | 주가의 변동성 | 5,010,847 | 7,049,784 | 변동성 | 89.6% | 89.2% |
6. 현금및현금성자산 등
(1) 당반기말과 전기말 현재 현금및현금성자산 등의 구성내역은 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 현금및현금성자산 | ||
| 보통예금(*) | 876,733 | 862,364 |
| 단기금융자산 | ||
| 정기예금(*) | 1,000,000 | 1,000,000 |
| 소 계 | 1,876,733 | 1,862,364 |
(*) 당반기말 현재 회사는 차입금과 관련하여 상기 보통예금과 정기예금을 담보로 제공하고 있습니다(주석35참고).
(2) 당반기말과 전기말 현재 사용이 제한된 예금은 다음과 같습니다.
| (단위: 천원) |
| 금융기관 | 계정과목 | 당반기말 | 전기말 | 설정기관 | 비고 |
|---|---|---|---|---|---|
| 미래에셋투자증권 | 현금및현금성자산 | 61,255 | 12,140 | 산업은행 | 특정차입금에 대한 질권설정 |
| 산업은행 | 단기금융자산 | 1,000,000 | 1,000,000 | 산업은행 | 특정차입금에 대한 질권설정 |
| 합 계 | 1,061,255 | 1,012,140 |
7. 공정가치측정금융자산
7.1 당기손익-공정가치측정금융자산
(1) 당반기말과 전기말 현재 당기손익-공정가치측정금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 휴믹(*) | - | - | - | - |
| MMF | 1,662,918 | - | 2,221,221 | - |
| 합 계 | 1,662,918 | - | 2,221,221 | - |
(*) 2023년 중 공간사용계약의 대가로 받을 임대료의 출자전환으로 취득하였으며, 손상징후가 발생함에 따라 전액 평가손실을 인식 하였습니다.
7.2 기타포괄손익-공정가치측정금융자산
(1) 기타포괄손익-공정가치 측정금융상품
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 비유동항목 : | ||
| 상장 | ||
| 농업금융채권 | 1,969,010 | 1,946,114 |
| 중소기업은행채권조건부자본증권 | 1,833,598 | 1,789,650 |
| 합 계 | 3,802,608 | 3,735,764 |
위 금융상품을 처분하는 경우 관련 기타포괄손익누계액은 이익잉여금으로 재분류되며 당기손익으로 재분류되지 않습니다.
(2) 당반기말과 전기말 현재 회사는 차입금과 관련하여 상기 기타포괄손익-공정가치측정금융자산을 담보로 제공하고 있습니다(주석35참조).
8. 매출채권
(1) 당반기말과 전기말 현재 매출채권과 계약자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | |
| 매출채권(*) | 5,339,045 | (2,832,933) | 2,506,112 | 7,145,631 | (2,580,756) | 4,564,875 |
| 계약자산 | 7,231,963 | (427,466) | 6,804,497 | 5,337,485 | (194,162) | 5,143,323 |
| 합 계 | 12,571,008 | (3,260,399) | 9,310,609 | 12,483,116 | (2,774,918) | 9,708,198 |
(*) 당반기 중 매출채권 제각으로 인해 손실충당금 41,361천원이 감소하였습니다.
(2) 손상
매출채권, 기타 상각후원가 금융자산의 손상 및 회사의 신용위험 관련 사항은 주석 4.1.2를 참고하시기 바랍니다.
9. 기타금융자산
(1) 당반기말과 전기말 현재 기타금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타유동금융자산 | ||
| 미수수익 | 34,398 | 18,770 |
| 미수금 | 282,570 | 353,653 |
| 단기대여금 | 600,000 | 600,000 |
| 손실충당금(단기대여금) | (600,000) | (600,000) |
| 소 계 | 316,968 | 372,423 |
| 기타비유동금융자산 | ||
| 장기금융상품 | 5,700 | 3,900 |
| 보증금 | 1,258,404 | 1,467,731 |
| 현재가치할인차금 | (33,425) | (62,536) |
| 장기대여금 | 81,739 | 88,584 |
| 소 계 | 1,312,418 | 1,497,679 |
| 합 계 | 1,629,386 | 1,870,102 |
(2) 당반기와 전반기 중 단기대여금의 손실충당금 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초 | 600,000 | 600,000 |
| 기타의 대손상각비 | - | - |
| 기말 | 600,000 | 600,000 |
당반기말과 전기말 현재 종속기업 코아스템바이오(주)에 대한 대여금에 대하여 손실충당금을 설정하고 있습니다.
10. 기타유동자산
당반기말과 전기말 현재 기타유동자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 선급금 | 256,886 | 218,673 |
| 선급비용 | 220,343 | 403,444 |
| 합 계 | 477,229 | 622,117 |
11. 재고자산
당반기말과 전기말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 평가전금액 | 평가충당금 | 재무상태표가액 | 평가전금액 | 평가충당금 | 재무상태표가액 | |
| 원재료 | 65,597 | - | 65,597 | 184,010 | - | 184,010 |
| 부재료 | 59,123 | - | 59,123 | 93,423 | - | 93,423 |
| 저장품 | 7,882 | - | 7,882 | 6,614 | - | 6,614 |
| 재공품 | - | - | - | 231,845 | - | 231,845 |
| 합 계 | 132,602 | - | 132,602 | 515,892 | - | 515,892 |
당반기에 비용으로 인식되어 제조원가에 포함된 재고자산의 원가는 1,710,402천원 (전반기: 2,671,122천원) 입니다.
12. 종속기업투자
(1) 당반기 현재 회사의 종속기업의 현황은 다음과 같습니다
| 종속기업명 | 지분율(%) | 영업소재지 | 주요영업활동 |
|---|---|---|---|
| 코아스템바이오(주) | 100 | 경기도 용인시 | 의약품판매업 |
| CORESTEMCHEMON US INC. | 100 | 미국 | 마케팅 |
(2) 당반기말과 전기말 현재 종속기업투자 현황은 다음과 같습니다.
| (단위: 천원) |
| 회사명 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 지분율(%) | 장부금액 | 지분율(%) | 장부금액 | |
| 코아스템바이오(주)(*) | 100 | - | 100 | - |
| CORESTEMCHEMON US INC. | 100 | 641,671 | 100 | 641,671 |
(*) 2012년 폐업으로 장부가액 전액이 감액된 코아스템마케팅을 의약품판매업 영위를 위하여 2017년에 코아스템바이오로 사명을 변경하고 신규 사업자등록을 하였습니다.
- 재무상태
| (단위: 천원) |
| 구분 | 코아스템바이오(주) | CORESTEMCHEMON US INC. | ||
|---|---|---|---|---|
| 당반기말 | 전기말 | 당반기말 | 전기말 | |
| 자산 | 57,142 | 88,142 | 251,653 | 384,000 |
| 부채 | 980,262 | 990,554 | 4,289 | 6,322 |
| 자본 | (923,120) | (902,412) | 247,364 | 377,678 |
- 손익현황
| (단위: 천원) |
| 구분 | 코아스템바이오(주) | CORESTEMCHEMON US INC. | ||
|---|---|---|---|---|
| 당반기 | 전반기 | 당반기 | 전반기 | |
| 매출 | - | 240,000 | - | - |
| 반기순손실 | (20,708) | (33,546) | (106,461) | (155,295) |
| 총포괄손실 | (20,708) | (33,546) | (130,314) | (115,234) |
13. 투자부동산
(1) 당반기말과 전기말 현재 투자부동산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 회사명 | 당반기말 | 전기말 |
|---|---|---|
| 장부금액 | 장부금액 | |
| 토지(*) | - | 117,527 |
| 건물(*) | - | 1 |
| 합 계 | - | 117,528 |
(*) 당반기에 투자부동산(토지 및 건물)을 처분하였으며, 처분이익 1,122,472천원이 발생 하였습니다.
(2) 당반기 및 전반기 중 투자부동산의 주요 변동은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기 초 | 117,528 | 128,956 |
| 감가상각비(*) | - | (6,234) |
| 처분 | (117,528) | - |
| 기 말 | - | 122,722 |
(*) 투자부동산의 감가상각비는 판매비와관리비에 포함되어 있습니다.
(3) 당반기 중 투자부동산에서 발생한 임대수익은 2,129천원(전반기 18,000천원)입니다.
(4) 전기말 투자부동산의 공정가치는 608,000천원이며, 공정가치 평가는 독립된 평가인에 의해 수행됩니다.
14. 유형자산
(1) 당반기말과 전기말 현재 유형자산 장부금액의 구성내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 토지 | 24,774,222 | - | 24,774,222 |
| 건물 | 26,506,693 | (4,865,618) | 21,641,075 |
| 구축물 | 872,043 | (326,659) | 545,384 |
| 기계장치 | 499,276 | (460,344) | 38,932 |
| 차량운반구 | 53,494 | (48,837) | 4,657 |
| 공구와기구 | 355,646 | (330,768) | 24,878 |
| 비품 | 1,873,632 | (1,405,182) | 468,450 |
| 시설장치 | 5,592,696 | (3,870,330) | 1,722,366 |
| 연구및시험기기 | 23,822,679 | (16,611,510) | 7,211,169 |
| 건설중인자산 | 33,518,969 | - | 33,518,969 |
| 합 계 | 117,869,350 | (27,919,248) | 89,950,102 |
| (전기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 토지 | 24,774,222 | - | 24,774,222 |
| 건물 | 26,506,693 | (4,538,885) | 21,967,808 |
| 구축물 | 872,043 | (304,125) | 567,918 |
| 기계장치 | 499,276 | (451,482) | 47,794 |
| 차량운반구 | 53,494 | (47,440) | 6,054 |
| 공구와기구 | 355,646 | (324,129) | 31,517 |
| 비품 | 1,861,388 | (1,289,620) | 571,768 |
| 시설장치 | 5,563,696 | (3,675,257) | 1,888,439 |
| 연구및시험기기 | 23,335,309 | (15,611,513) | 7,723,796 |
| 건설중인자산 | 31,451,453 | - | 31,451,453 |
| 합 계 | 115,273,220 | (26,242,451) | 89,030,769 |
(2) 당반기와 전반기 중 유형자산의 변동은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 기초 장부금액 |
취득 | 처분 | 감가상각 | 대체 | 기말 장부금액 |
|---|---|---|---|---|---|---|
| 토지 | 24,774,222 | - | - | - | - | 24,774,222 |
| 건물 | 21,967,808 | - | - | (326,733) | - | 21,641,075 |
| 구축물 | 567,918 | - | - | (22,534) | - | 545,384 |
| 기계장치 | 47,794 | - | - | (8,861) | - | 38,933 |
| 차량운반구 | 6,054 | - | - | (1,397) | - | 4,657 |
| 공구와기구 | 31,517 | - | - | (6,640) | - | 24,877 |
| 비품 | 571,768 | 12,244 | - | (115,562) | - | 468,450 |
| 시설장치 | 1,888,439 | 19,000 | - | (195,073) | 10,000 | 1,722,366 |
| 연구및시험기기 | 7,723,796 | 486,970 | - | (999,997) | 400 | 7,211,169 |
| 건설중인자산 | 31,451,453 | 2,077,916 | - | - | (10,400) | 33,518,969 |
| 합 계 | 89,030,769 | 2,596,130 | - | (1,676,797) | - | 89,950,102 |
| (전반기) | (단위: 천원) |
| 구 분 | 기초 장부금액 |
취득 | 처분 | 감가상각 | 대체 | 기말 장부금액 |
|---|---|---|---|---|---|---|
| 토지 | 11,339,089 | - | - | - | - | 11,339,089 |
| 건물 | 22,621,274 | - | - | (326,733) | - | 22,294,541 |
| 구축물 | 613,241 | - | - | (22,661) | - | 590,580 |
| 기계장치 | 33,106 | 35,297 | - | (14,688) | - | 53,715 |
| 차량운반구 | 8,847 | - | - | (1,397) | - | 7,450 |
| 공구와기구 | 22,066 | 22,480 | - | (6,389) | - | 38,157 |
| 비품 | 689,693 | 34,888 | (954) | (115,550) | - | 608,077 |
| 시설장치 | 2,141,144 | 42,000 | - | (211,655) | - | 1,971,489 |
| 연구및시험기기 | 8,952,505 | 446,062 | (8,098) | (1,205,097) | 187,273 | 8,372,645 |
| 건설중인자산 | 8,322,938 | 12,420,408 | - | - | (187,273) | 20,556,073 |
| 합 계 | 54,743,903 | 13,001,135 | (9,052) | (1,904,170) | - | 65,831,816 |
(3) 당반기와 전반기 중 감가상각비의 계정별 배부현황은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
| 매출원가 | 1,586,007 | 1,652,077 |
| 경상연구개발비 | 71,400 | 243,228 |
| 판매비와관리비 | 19,390 | 8,865 |
| 합 계 | 1,676,797 | 1,904,170 |
(4) 당반기 중 적격자산인 유형자산에 대해 자본화된 차입원가는 1,215,087천원(전반기 : 405,492천원)이며, 자본화가능차입원가를 산정하기 위해 사용된 자본화차입이자율은 11.26% 입니다.
(5) 당반기말 현재 회사는 차입금과 관련하여 토지와 건물을 담보로 제공하고 있습니다(주석35 참조). 회사는 상기 건물에 대하여 KB손해보험에 화재보험을 가입하고 있으며, 동 화재보험과 관련하여 신한은행은 3,200,000천원의 질권을 설정하고 있습니다.
15. 무형자산
(1) 당반기말과 전기말 현재 무형자산 장부금액의 구성내역은 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 특허권 | 863,146 | (565,285) | 297,861 |
| 회원권 | - | - | - |
| 소프트웨어 | 1,005,199 | (871,293) | 133,906 |
| 영업권 | 3,949,756 | - | 3,949,756 |
| 합 계 | 5,818,101 | (1,436,578) | 4,381,523 |
| (전기말) | (단위: 천원) |
| 구 분 | 취득원가 | 감가상각 및 손상차손누계액 |
장부금액 |
|---|---|---|---|
| 특허권 | 863,147 | (544,771) | 318,376 |
| 상표권 | 15,312 | (15,312) | - |
| 회원권 | 1,765,783 | - | 1,765,783 |
| 소프트웨어 | 1,005,199 | (831,786) | 173,413 |
| 고객가치 | 121,267 | (121,267) | - |
| 영업권 | 3,949,756 | - | 3,949,756 |
| 합 계 | 7,720,464 | (1,513,136) | 6,207,328 |
(2) 당반기와 전반기 중 무형자산의 변동은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 구 분 | 기 초 장부금액 |
취 득 | 감가상각 | 처분 | 기 말 장부금액 |
|---|---|---|---|---|---|
| 특허권 | 318,376 | - | (20,515) | - | 297,861 |
| 회원권 | 1,765,783 | - | - | (1,765,783) | - |
| 소프트웨어 | 173,413 | - | (39,507) | - | 133,906 |
| 영업권 | 3,949,756 | - | - | - | 3,949,756 |
| 합 계 | 6,207,328 | - | (60,022) | (1,765,783) | 4,381,523 |
| (전반기) | (단위: 천원) |
| 구 분 | 기 초 장부금액 |
취 득 | 감가상각 | 처분 | 기 말 장부금액 |
|---|---|---|---|---|---|
| 특허권 | 24,192 | 330,000 | (13,939) | - | 340,253 |
| 상표권 | 96 | - | (96) | - | - |
| 회원권 | 1,765,783 | - | - | - | 1,765,783 |
| 소프트웨어 | 250,703 | 1,240 | (39,731) | - | 212,212 |
| 영업권 | 3,949,756 | - | - | - | 3,949,756 |
| 합 계 | 5,990,530 | 331,240 | (53,766) | - | 6,268,004 |
(3) 당반기와 전반기에 인식한 무형자산상각비의 계정별 배부현황은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 매출원가 | 8,996 | 17,993 |
| 경상연구개발비 | 16,500 | 8,250 |
| 판매비와관리비 | 34,526 | 27,523 |
| 합 계 | 60,022 | 53,766 |
(4) 당반기와 전반기에 발생한 경상연구개발비는 각각 4,743,226천원 및 5,187,918천원입니다.
(5) 영업권이 배분된 현금창출단위 손상검사
회사는 주석2에서 설명하는 바와 같이 매 보고기간말 영업권이 배분된 현금창출단위에 대하여 손상평가를 수행하고 있습니다. 회수가능액은 사용가치 혹은 처분부대원가를 뺀 공정가치인 순공정가치의 계산에 근거하여 결정되었습니다.
회사는 2022년 중 종속기업인 주식회사 켐온의 흡수합병으로 승계한 영업권이 배분된 현금창출단위인 비임상실험대행 부문에 대해 전기말에 손상평가를 수행하였으며 사용가치에 근거한 회수가능가액이 장부금액을 초과하였습니다.
회수가능액의 추정에 사용된 주요 가정은 아래와 같습니다. 주요 가정치는 해당 산업의 미래 추세에 대한 경영진의 평가를 반영하고 있으며, 내ㆍ외부의 역사적 자료에 기초하고 있습니다.
| 구 분 | 비임상실험대행 |
|---|---|
| 영구성장률 | 0.0% |
| 세후할인율 | 13.63% |
16. 사용권자산 및 리스부채
(1) 당반기와 전반기 중 사용권자산의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||||
|---|---|---|---|---|---|---|
| 건 물 | 차량운반구 | 합 계 | 건 물 | 차량운반구 | 합 계 | |
| 기초 순장부가액 | 646,540 | 401,529 | 1,048,069 | 701,702 | 270,417 | 972,119 |
| 취득 | 180,638 | 35,839 | 216,477 | 89,416 | 174,430 | 263,846 |
| 처분 | (184) | (32,174) | (32,358) | - | - | - |
| 감가상각비 | (337,854) | (83,718) | (421,572) | (364,327) | (85,300) | (449,627) |
| 기말 순장부가액 | 489,140 | 321,476 | 810,616 | 426,791 | 359,547 | 786,338 |
(2) 당반기와 전반기의 사용권자산 및 리스부채와 관련하여 당기손익으로 인식된 금액은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 |
|---|---|---|
| 사용권자산의 감가상각비 | 421,572 | 449,627 |
| 리스부채에 대한 이자비용 | 42,147 | 39,880 |
| 단기리스료 및 소액자산리스료 | 121,374 | 36,013 |
(3) 당반기말과 전기말의 리스부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동리스부채 | 324,333 | 450,189 |
| 비유동리스부채 | 406,651 | 471,929 |
| 합 계 | 730,984 | 922,118 |
(4) 당반기와 전반기 중 리스부채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초 | 922,118 | 920,825 |
| 증가 | 256,883 | 235,605 |
| 감소 | (35,301) | - |
| 지급 | (412,716) | (435,679) |
| 기말 | 730,984 | 720,751 |
(5) 당반기와 전반기 중 리스의 총 현금유출액 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 |
|---|---|---|
| 리스부채에 대한 이자비용 | 42,147 | 39,880 |
| 리스부채에서 발생한 현금유출 | 370,568 | 395,799 |
| 단기리스료 및 소액자산리스료 | 121,374 | 36,013 |
| 합 계 | 534,089 | 471,692 |
17. 기타금융부채
당반기말과 전기말 현재 기타금융부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타유동금융부채 | ||
| 미지급금 | 1,319,351 | 1,126,719 |
| 미지급비용 | 1,286,660 | 1,383,470 |
| 합 계 | 2,606,011 | 2,510,189 |
| 기타비유동금융부채 | ||
| 임대보증금 | - | 30,000 |
| 합 계 | - | 30,000 |
18. 기타부채
당반기말과 전기말 현재 기타부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타유동부채 | ||
| 예수금 | 180,899 | 327,177 |
| 선수금 | 27,951 | 32,758 |
| 선수수익 | - | 39,041 |
| 합 계 | 208,850 | 398,976 |
| 기타비유동부채 | ||
| 장기급여부채 | 1,028,709 | 1,132,084 |
| 복구충당부채 | 25,800 | 25,800 |
| 합 계 | 1,054,509 | 1,157,884 |
19. 순확정급여부채
(1) 당반기말과 전기말 현재 순확정급여부채의 산정내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기금에 적립되지 않은 확정급여채무의 현재가치 | 11,220,197 | 12,307,342 |
| 사외적립자산의 공정가치 | (4,663,854) | (5,757,936) |
| 재무상태표상의 순확정급여부채 | 6,556,343 | 6,549,406 |
(2) 당반기와 전반기 중 확정급여채무의 변동 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초 확정급여채무의 현재가치 | 12,307,342 | 10,666,218 |
| 당기 근무원가 | 1,086,080 | 962,753 |
| 이자원가 | 199,189 | 187,573 |
| 재측정요소: | ||
| - 인구통계적가정의 변동에 의한 보험수리적 손익 | - | 40,828 |
| - 재무적가정의 변동에 의한 보험수리적 손익 | 3,887 | 101,922 |
| - 가정과 실제의 차이에 의한 보험수리적 손익 | (16,400) | 185,041 |
| 제도에서의 지급액: | ||
| - 급여의 지급 | (2,532,242) | (556,950) |
| 기타: | ||
| - 관계사 전입(전출)으로 인한 영향 | 172,341 | - |
| 보고기간말 금액 | 11,220,197 | 11,587,385 |
(3) 당반기와 전반기의 사외적립자산의 공정가치 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초금액 | 5,757,936 | 6,103,493 |
| 사외적립자산의 이자수익 | 132,711 | 159,396 |
| 재측정요소: | ||
| - 사외적립자산의 수익(이자수익에 포함된 금액 제외) | (66,161) | (51,005) |
| 사외적립자산 납입액 | 1,180,738 | 313,144 |
| 제도에서의 지급액: | ||
| - 급여의 지급 | (2,341,370) | (574,388) |
| 기말금액 | 4,663,854 | 5,950,640 |
(4) 당반기말과 전기말 현재 사외적립자산의 공정가치에 포함된 주요 유형별 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 정기예금 | 4,663,854 | 5,757,937 |
(5) 당반기와 전반기 중 포괄손익계산서에 반영된 금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 당기근무원가 | 1,086,080 | 962,753 |
| 이자원가 | 199,189 | 187,573 |
| 사외적립자산의 이자수익 | (132,711) | (159,396) |
| 당기손익에 인식한 퇴직급여 | 1,152,558 | 990,930 |
(6) 당반기와 전반기 중 인식한 퇴직급여 배부액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 판매비와관리비 | 292,664 | 185,926 |
| 경상연구개발비 | 166,316 | 65,162 |
| 매출원가 | 696,067 | 739,842 |
| 합 계 | 1,155,047 | 990,930 |
(7) 당반기말과 전기말 현재 주요 보험수리적 가정은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 할인율 | 4.46% | 4.54% |
| 미래임금상승률 | 4.00% | 4.00% |
20. 차입금
(1) 당반기말과 전기말의 단기차입금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 차입처 | 연이자율 | 당반기말 | 전기말 |
|---|---|---|---|---|
| 일반대출 | 신한은행(*) | 3.47% | 3,000,000 | 3,000,000 |
| 일반대출 | 신한은행(*) | 4.56% | 4,000,000 | 1,400,000 |
| 일반대출 | 신한은행(*) | 5.94% | 4,000,000 | 4,000,000 |
| 합 계 | 11,000,000 | 8,400,000 | ||
(*) 차입금에 대해서 회사의 금융상품과 유형자산이 담보로 설정되어 있습니다(주석35 참조).
(2) 당반기말과 전기말의 유동성장기차입금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 당반기말 | 전기말 |
|---|---|---|---|---|---|
| 일반대출 | 신한은행(*) | 2025-10-30 | 3.92% | 1,400,000 | 1,400,000 |
| 일반대출 | 신한은행(*) | 2026-01-27 | 4.16% | 2,860,000 | 2,860,000 |
| 일반대출 | 신한은행(*) | 2025-08-03 | 4.36% | 1,974,000 | 1,974,000 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.57% | 250,000 | 250,000 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.68% | 250,000 | 250,000 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.23% | 333,370 | 333,370 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 2.90% | 296,250 | 296,250 |
| 시설대출 | 산업은행(*) | 2026-01-26 | 2.74% | 138,750 | - |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.19% | 135,780 | 135,780 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 2.97% | 215,160 | 215,160 |
| 시설대출 | 산업은행(*) | 2025-12-26 | 3.19% | 47,540 | 47,540 |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.57% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.68% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.23% | 333,330 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 2.90% | 296,250 | - |
| 시설대출 | 산업은행(*) | 2026-04-24 | 2.74% | 138,750 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.19% | 135,770 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 2.97% | 215,160 | - |
| 시설대출 | 산업은행(*) | 2026-03-26 | 3.19% | 47,460 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.57% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.68% | 250,000 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.23% | 333,330 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 2.90% | 296,250 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.19% | 135,770 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 2.97% | 215,160 | - |
| 시설대출 | 산업은행(*) | 2026-06-26 | 3.19% | 47,460 | - |
| 합 계 | 11,095,540 | 7,762,100 | |||
(*) 차입금에 대해서 회사의 금융상품과 유형자산이 담보로 설정되어 있습니다(주석35 참조).
(3) 당반기말과 전기말의 장기차입금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 차입처 | 만기일자 | 연이자율 | 당반기말 | 전기말 |
|---|---|---|---|---|---|
| 일반대출 | 신한은행(*) | 2025-08-03 | 4.36% | 1,974,000 | 1,974,000 |
| 일반대출 | 신한은행(*) | 2025-10-30 | 3.92% | 1,400,000 | 1,400,000 |
| 일반대출 | 신한은행(*) | 2026-01-27 | 4.16% | 2,860,000 | 2,860,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.57% | 3,000,000 | 3,000,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 2.90% | 3,555,000 | 3,555,000 |
| 시설대출 | 산업은행(*) | 2028-10-24 | 2.74% | 1,665,000 | 1,665,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.19% | 1,629,250 | 1,629,250 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 2.97% | 2,581,150 | 2,581,150 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.68% | 3,000,000 | 3,000,000 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.19% | 569,600 | 569,600 |
| 시설대출 | 산업은행(*) | 2028-09-26 | 3.23% | 4,000,000 | 4,000,000 |
| 소 계 | 26,234,000 | 26,234,000 | |||
| 유동성대체액 | (11,095,540) | (7,762,100) | |||
| 합 계 : 비유동성잔액 | 15,138,460 | 18,471,900 | |||
(*) 차입금에 대하여 당사의 금융상품과 토지, 건물이 담보로 설정되어 있습니다(주석35 참조).
21. 계약손실충당부채
(1) 당반기말과 전기말의 현재 충당부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 계약손실충당부채 | 673,974 | 667,813 |
(2) 당반기와 전반기 중 계약손실충당부채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 |
|---|---|---|
| 기초 | 667,813 | 981,354 |
| 전입액 | 6,161 | - |
| 환입액 | - | (325,718) |
| 기말금액 | 673,974 | 655,636 |
22. 교환사채
(1) 당반기말과 전기말 교환사채의 구성 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 교환사채 | 17,439,700 | 20,349,700 |
| 교환권조정 | (7,485,333) | (9,908,322) |
| 상환할증금 | 710,066 | 828,672 |
| 합 계 | 10,664,433 | 11,270,050 |
| (단위: 천원) |
| 구 분 | 발행일 | 만기일 | 당반기말 | 전기말 |
|---|---|---|---|---|
| 제2회 이권부 무보증 사모 교환사채 | 2023-01-19 | 2027-01-19 | 1,078,730 | 951,235 |
| 제3회 이권부 무보증 사모 교환사채 | 2023-01-26 | 2027-01-26 | 2,039,579 | 3,541,026 |
| 제4회 이권부 무보증 사모 교환사채 | 2024-03-26 | 2028-03-24 | 7,546,124 | 6,777,789 |
| 합 계 | 10,664,433 | 11,270,050 |
(2) 교환사채 발행내역
회사가 발행한 교환사채의 내역은 다음과 같습니다.
| 구 분 | 제2회 무기명식 이권부 무보증 사모 교환사채 |
제3회 무기명식 이권부 무보증 사모 교환사채 |
제4회 무기명식 이권부 무보증 사모 교환사채 |
|---|---|---|---|
| 발 행 일 | 2023-01-19 | 2023-01-26 | 2024-03-26 |
| 만 기 일 | 2027-01-19 | 2027-01-26 | 2028-03-24 |
| 액면금액 | 1,500,000,000원 | 2,939,700,000원 | 13,000,000,000원 |
| 발행가액 | 21,500,000,000원 | 10,811,450,000원 | 21,000,000,000원 |
| 액면이자율 | 액면이자 연0.0% | 액면이자 연0.0% | 액면이자 연 0.0% |
| 보장수익률 | 사채 만기일까지 연 1.0%(3개월 단위 복리계산) | 사채 만기일까지 연 1.0%(3개월 단위 복리계산) | 사채 만기일까지 연 1.0%(3개월 단위 복리계산) |
| 상환방법 | 전환되지 않거나 조기상환되지 않을 경우 만기일에 액면가액의 104.0758%를 일시 상환 | 전환되지 않거나 조기상환되지 않을 경우 만기일에 액면가액의 104.0758%를 일시 상환 | 전환되지 않거나 조기상환되지 않을 경우 만기일에 액면가액의 104.0701%를 일시 상환 |
| 교환대상주식 | 코아스템켐온㈜ 기명식 보통주(자기주식) | 코아스템켐온㈜ 기명식 보통주(자기주식) | 코아스템켐온㈜ 기명식 보통주(자기주식) |
| 교환시 발행할 주식수 | 169,109주 | 331,420주 | 1,160,714주 |
| 교환가격 | 8,870원(단, 시가를 하회하는 발행가액으로 유상증자를 하는 경우 등 기타 사채발행계약서에 정한 기준에 따라 전환가격은 조정될 수 있음) | 8,870원(단, 시가를 하회하는 발행가액으로 유상증자를 하는 경우 등 기타 사채발행계약서에 정한 기준에 따라 전환가격은 조정될 수 있음) | 11,200원(단, 시가를 하회하는 발행가액으로 유상증자를 하는 경우 등 기타 사채발행계약서에 정한 기준에 따라 교환가격은 조정될 수 있음) |
| 사채권자의 조기상환청구권 | 발행일로부터 18개월이 되는 날로부터 가능 | 발행일로부터 18개월이 되는 날로부터 가능 | 발행일로부터 24개월이 되는 날로부터 가능 |
| 교환청구기간 | 2023-02-19 ~ 2026-12-19 | 2023-02-19 ~ 2026-12-26 | 2024-04-26 ~ 2028-02-24 |
| 발행회사(또는 발행회사가 지정하는 자)의 매도청구권 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 |
회사가 발행한 교환사채는 보유자의 선택에 의해 주식으로 교환될 수 있는 교환사채로, 발행할 주식수는 교환사채의 교환가격의 조정 약정에 해당될 경우 변동될 수 있습니다. 따라서 지분교환권을 부채로 분류하고 파생상품으로 처리하고 있습니다.
(3) 교환사채의 당반기와 전반기 중 증감내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 2회차 | 3회차 | 4회차 | |||
|---|---|---|---|---|---|---|
| 당반기 | 전반기 | 당반기 | 전반기 | 당반기 | 전반기 | |
| 기초 | 1,500,000 | 18,800,000 | 5,849,700 | 10,811,450 | 13,000,000 | - |
| 발행 | - | - | - | - | - | 21,000,000 |
| 상환 및 교환(*) | - | (16,190,000) | (2,910,000) | (74,700) | - | (3,500,000) |
| 기말 | 1,500,000 | 2,610,000 | 2,939,700 | 10,736,750 | 13,000,000 | 17,500,000 |
(*) 당반기 중 3회차가 조기상환 되었으며, 전반기 중 모두 교환청구에 의하여 자기주식으로 교환(2회차 1,825,219주, 3회차 8,420주, 4회차 312,496주)되었습니다.
(4) 교환사채의 발행일 및 당반기말 현재 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 제2회차 | 제3회차 | 제4회차 | |||
|---|---|---|---|---|---|---|
| 발행일 | 당반기말 | 발행일 | 당반기말 | 발행일 | 당반기말 | |
| 발행가액 | 21,500,000 | 1,500,000 | 10,811,450 | 2,939,700 | 21,000,000 | 13,000,000 |
| 교환사채의 부채요소 | 8,501,737 | 1,078,730 | 3,938,196 | 2,039,579 | 9,245,625 | 7,546,124 |
| 조기상환청구권(파생상품부채) | 6,757,835 | 305,659 | 3,416,516 | 605,514 | 5,096,250 | 3,821,100 |
| 지분교환권(파생상품부채) | 6,240,428 | - | 3,456,738 | - | 6,658,125 | 278,574 |
교환사채 발행으로 수령한 순수취액은 주계약인 부채요소와 내재파생상품인 지분교환권으로 구분 계상되었습니다. 교환사채에 내재된 지분교환권은 자본요소에 해당하지 않으므로 교환사채 전체를 금융부채로 분류하였으며, 지분교환권이 내재파생상품의 분리조건을 모두 충족하므로 주계약에서 분리하여 별도의 파생상품으로 회계처리 하였습니다.
당반기 중 제2회 교환사채와 관련하여 파생상품평가이익 161,203천원(조기상환청구권 136,845천원 및 지분교환권 24,358천원)이 발생하였습니다.
당반기 중 제3회 교환사채와 관련하여 파생상품평가이익 627,182천원(조기상환청구권 534,193천원 및 지분교환권 92,989천원)이 발생하였습니다.
당반기 중 제4회 교환사채와 관련하여 파생상품평가이익 651,166천원(조기상환청구권 (-)80,090천원 및 지분교환권 731,256천원)이 발생하였습니다.
(5) 발행자의 주가 변동에 따라 행사가격이 조정되는 조건으로 인해 부채로 분류된 각금융부채의 장부금액 및 관련 손익은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 제2회차 | 제3회차 | 제4회차 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 발행일 | 당반기말 | 전기말 | 발행일 | 당반기말 | 전기말 | 발행일 | 당반기말 | 전기말 | |
| 지분교환권(파생상품부채) | 6,240,428 | - | 24,358 | 3,456,738 | - | 92,989 | 6,658,125 | 278,574 | 1,009,829 |
| 조기상환청구권(파생상품부채) | 6,757,835 | 305,659 | 442,504 | 3,416,516 | 605,514 | 1,739,094 | 5,096,250 | 3,821,100 | 3,741,010 |
| 합 계 | 12,998,263 | 305,659 | 466,862 | 6,873,254 | 605,514 | 1,832,083 | 11,754,375 | 4,099,674 | 4,750,839 |
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 법인세비용 차감전계속사업이익(손실) | (9,464,720) | (25,214,594) |
| 평가이익(손실) | 1,439,550 | (14,873,958) |
| 평가손익 제외 법인세비용차감전계속사업이익(손실) | (10,904,270) | (10,340,636) |
23. 법인세비용 및 이연법인세
법인세비용은 법인세부담액에서 전기 법인세와 관련되어 당반기에 인식한 조정사항,일시적 차이의 발생과 소멸로 인한 이연법인세변동액 및 당기손익 이외로 인식되는 항목과 관련된 법인세비용 등을 조정하여 산출하였습니다.
당반기 및 전반기의 평균유효세율은 법인세비용차감전손실이 발생하여 유효세율을 산정하지 아니하였습니다.
24. 자본금과 자본잉여금
(1) 당반기말과 전기말 현재 자본금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 보통주 : | ||
| 발행할 주식의 총수 | 100,000,000주 | 100,000,000주 |
| 1주당 액면금액 | 500원 | 500원 |
| 발행한 주식의 수 | 32,870,376주 | 32,870,376주 |
| 자본금 | 16,435,188 | 16,435,188 |
(2) 당반기말과 전기말의 자본잉여금의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 자본잉여금 | ||
| 주식발행초과금 | 212,364,193 | 212,364,193 |
| 자기주식처분이익(*) | 29,330,130 | 29,886,948 |
| 합계 | 241,694,323 | 242,251,141 |
(*) 당반기 중 자기주식 200만주를 처분하였습니다.
(3) 당반기 및 전반기 중 자본금 및 주식발행초과금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 일자 | 주식수(주) | 자본금 | 주식발행초과금 |
|---|---|---|---|---|
| 전기초 | 2024-01-01 | 32,870,376 | 16,435,188 | 212,364,193 |
| 전반기말 | 2024-06-30 | 32,870,376 | 16,435,188 | 212,364,193 |
| 당기초 | 2025-01-01 | 32,870,376 | 16,435,188 | 212,364,193 |
| 당반기말 | 2025-06-30 | 32,870,376 | 16,435,188 | 212,364,193 |
25. 기타자본
(1) 당반기말과 전기말 현재 기타자본의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타자본잉여금 | (91,807,017) | (91,807,017) |
| 자기주식(*) | (19,479,761) | (26,467,761) |
| 주식매수선택권 | 734,512 | 734,512 |
| 합 계 | (110,552,266) | (117,540,266) |
(*) 자기주식 중 일부는 교환사채의 교환대상 주식으로 한국예탁결제원에 신탁되어 있습니다.
(2) 당반기와 전반기 중 주식매수선택권의 변동내역은 없습니다.
(3) 주식기준보상
가. 회사는 주주총회 결의에 의거 당사의 임직원에게 주식선택권을 부여하였는 바, 주요사항은 다음과 같습니다.
- 주식선택권으로 발행할 주식의 종류 : 기명식 보통주식
- 부여방법 : 보통주 신주발행
- 부여일 : 2019년 3월 29일
- 가득조건 및 행사가능시점 : 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 2년 경과시점부터 5년 이내에 행사 가능
- 행사가격 : 13,600원
나. 당반기와 전반기의 주식선택권의 수량 변동은 다음과 같습니다.
| (단위: 주) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초 잔여주 | 255,670 | 255,670 |
| 부여 | - | - |
| 행사 | - | - |
| 소멸 | - | - |
| 기말 잔여주 | 255,670 | 255,670 |
26. 기타포괄손익누계액
(1) 당반기말과 전기말의 기타포괄손익누계액의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타포괄손익-공정가치측정금융자산평가손실 | (198,672) | (265,516) |
| 재평가잉여금 | 12,105,055 | 12,105,055 |
| 합 계 | 11,906,383 | 11,839,539 |
(2) 당반기와 전반기의 기타포괄손익누계액의 증감 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 기타포괄손익-공정가치측정금융자산평가손익 | |
|---|---|---|
| 당반기 | 전반기 | |
| 기초 | 11,839,539 | (475,699) |
| 기타포괄손익-공정가치측정금융자산평가이익 | 66,844 | 44,094 |
| 기말 | 11,906,383 | (431,605) |
27. 결손금
(1) 당반기말과 전기말 현재 결손금의 세부내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 미처리결손금 | (113,518,907) | (103,939,357) |
(2) 당반기와 전반기의 결손금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기초금액 | (103,939,357) | (77,368,947) |
| 반기순손실 | (9,531,213) | (25,293,763) |
| 확정급여제도의 재측정요소 | (48,337) | (299,627) |
| 반기말금액 | (113,518,907) | (102,962,337) |
28. 고객과의 계약에서 생기는 수익 및 관련 계약자산과 계약부채
(1) 당반기와 전반기의 수익인식 시기에 따라 구분한 매출 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 고객과의 계약에서 생기는 수익 | 11,610,426 | 15,538,404 |
(2) 당반기와 전반기의 고객과의 계약에서 생기는 수익 구분 내역은 다음과 같습니다.
| (당반기) | (단위 : 천원) |
| 구 분 | 제품매출 | 연구용역매출 | 기타매출 | 합계 |
|---|---|---|---|---|
| 한 시점에 인식 | 187,620 | - | 59,337 | 246,957 |
| 기간에 걸쳐 인식 | - | 11,363,469 | - | 11,363,469 |
| 합 계 | 187,620 | 11,363,469 | 59,337 | 11,610,426 |
| (전반기) | (단위 : 천원) |
| 구 분 | 제품매출 | 연구용역매출 | 기타매출 | 합계 |
|---|---|---|---|---|
| 한 시점에 인식 | 625,400 | - | 79,824 | 705,224 |
| 기간에 걸쳐 인식 | - | 14,833,180 | - | 14,833,180 |
| 합 계 | 625,400 | 14,833,180 | 79,824 | 15,538,404 |
(3) 당반기말과 전기말 현재 고객과의 계약에서 생기는 계약자산과 계약부채는 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 계약자산 | 6,804,497 | 5,143,322 |
| 계약부채 | 3,739,753 | 3,023,330 |
계약자산은 회사가 진행중인 용역에 대해 당기 현재 미청구한 금액에 대한 자산입니다. 계약자산은 회사가 청구서를 발행할 때 매출채권으로 대체됩니다. 계약부채는 기간에 걸쳐 이행하는 고객과의 계약에서 고객으로부터 선수취한 금액에 대한 부채입니다. 전기 계약부채로 계상된 선수금 중 2,186,921천원(전반기 : 2,817,145천원)이 당반기에 수익으로 인식 되었습니다.
29. 판매비와 관리비
당반기와 전반기 중 판매비와 관리비 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 1,081,060 | 1,906,072 | 1,090,645 | 2,026,725 |
| 퇴직급여 | 205,947 | 292,663 | 67,082 | 185,925 |
| 복리후생비 | 85,773 | 154,523 | 40,113 | 87,068 |
| 여비교통비 | 21,292 | 46,204 | 77,656 | 139,335 |
| 통신비 | 8,883 | 16,519 | 6,056 | 9,769 |
| 세금과공과 | 3,538 | 7,461 | 7,694 | 11,786 |
| 감가상각비 | 13,427 | 19,390 | 7,621 | 15,098 |
| 감가상각비(사용권자산) | 114,740 | 214,333 | 110,245 | 217,380 |
| 무형자산상각비 | 21,582 | 34,526 | 13,739 | 27,523 |
| 계약손실충당전입액 | 574,562 | 6,161 | 858,820 | - |
| 지급임차료 | 68,484 | 87,292 | 17,240 | 37,358 |
| 수선비 | 494 | 494 | 35 | 35 |
| 보험료 | 89,239 | 152,928 | 87,772 | 147,072 |
| 차량유지비 | 17,428 | 39,342 | 19,070 | 37,140 |
| 운반비 | 155 | 672 | 168 | 313 |
| 교육훈련비 | 6,693 | 9,203 | 1,364 | 5,761 |
| 도서인쇄비 | 11 | 11 | 151 | 1,889 |
| 사무용품비 | 3,589 | 4,880 | 4,040 | 6,158 |
| 소모품비 | 101,977 | 110,135 | - | - |
| 지급수수료 | 334,141 | 779,144 | 256,490 | 597,093 |
| 경상연구개발비 | 2,690,227 | 4,743,226 | 2,428,906 | 5,187,918 |
| 광고선전비 | 61,974 | 69,199 | 148,432 | 298,829 |
| 대손상각비 | 1,445,751 | 526,843 | 284,560 | (478,885) |
| 기타 | 190,424 | 396,112 | 94,814 | 223,105 |
| 합계 | 7,141,391 | 9,617,333 | 5,622,713 | 8,784,395 |
30. 비용의 성격별 분류
당반기와 전반기 중 비용의 성격별 분류 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 재고자산의 변동 | 117,876 | 383,290 | 20,526 | 80,154 |
| 원/부재료 사용(매입)액 | 624,510 | 1,681,471 | 1,068,468 | 1,999,697 |
| 종업원급여 | 4,166,328 | 8,900,048 | 6,051,349 | 11,877,040 |
| 퇴직급여 | 542,514 | 1,155,047 | 506,856 | 990,929 |
| 복리후생비 | 390,198 | 840,100 | 429,435 | 918,830 |
| 유형자산감가상각비 | 830,970 | 1,676,797 | 955,851 | 1,904,170 |
| 투자부동산감가상각비 | - | - | 3,117 | 6,234 |
| 사용권자산감가상각비 | 190,200 | 421,572 | 228,386 | 449,627 |
| 무형자산상각비 | 29,832 | 60,022 | 30,985 | 53,766 |
| 지급수수료 | 813,677 | 1,841,261 | 831,072 | 1,682,026 |
| 지급임차료 | 83,979 | 121,374 | 33,582 | 70,216 |
| 수선비 | 26,563 | 54,239 | 70,445 | 138,556 |
| 보험료 | 325,364 | 603,781 | 460,762 | 798,366 |
| 차량유지비 | 34,776 | 76,211 | 39,018 | 80,026 |
| 수도광열비 | 195,171 | 528,720 | 133,784 | 413,054 |
| 소모품비 | 401,819 | 695,554 | 401,786 | 796,217 |
| 여비교통비 | 34,638 | 75,938 | 88,328 | 169,594 |
| 전력비 | 361,161 | 719,220 | 299,517 | 608,589 |
| 광고선전비 | 61,974 | 69,199 | 148,432 | 298,829 |
| 위탁연구비 | 845,660 | 1,161,303 | 314,897 | 701,301 |
| 대손상각비(환입) | 1,445,751 | 526,843 | 284,560 | (478,885) |
| 기타 | 711,737 | 555,238 | 769,104 | 365,385 |
| 매출원가 및 판매비와관리비의 합계 | 12,234,698 | 22,147,228 | 13,170,260 | 23,923,721 |
31. 기타수익과 기타비용
(1) 당반기와 전반기 중 기타수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 잡이익 | 55,934 | 59,054 | 57,310 | 112,987 |
| 임대료수익 | 2,055 | 41,170 | 46,697 | 93,395 |
| 유형자산처분이익 | - | - | - | 902 |
| 투자부동산처분이익 | - | 1,122,472 | - | - |
| 리스해지이익 | - | 2,137 | - | - |
| 리스변경이익 | - | 806 | - | - |
| 합 계 | 57,989 | 1,225,639 | 104,007 | 207,284 |
(2) 당반기와 전반기 중 기타비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 유형자산처분손실 | - | - | 1 | 954 |
| 무형자산처분손실 | 122,678 | 347,601 | - | - |
| 기부금 | 3,000 | 3,000 | 12,500 | 12,500 |
| 잡손실 | 24,371 | 24,483 | 31 | 105 |
| 합 계 | 150,049 | 375,084 | 12,532 | 13,559 |
32. 금융수익과 금융비용
(1) 당반기와 전반기 중 금융수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | (6,763) | 48,391 | 17,333 | 35,237 |
| 배당금수익 | 28,882 | 57,762 | 38,329 | 76,786 |
| 외환차익 | 290 | 3,333 | - | 230 |
| 외화환산이익 | (583) | - | 4,739 | 10,065 |
| 당기손익-공정가치측정금융자산평가이익 | (3) | - | 32,626 | 33,387 |
| 당기손익-공정가치측정금융자산처분이익 | 5,748 | 19,838 | 77,765 | 84,536 |
| 사채상환이익 | - | - | (665,424) | 139,060 |
| 파생상품부채평가이익 | 208,330 | 1,716,963 | 5,897,528 | 6,410,366 |
| 합 계 | 235,901 | 1,846,287 | 5,402,896 | 6,789,667 |
(2) 당반기와 전반기 중 금융비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용(*) | 478,382 | 948,512 | 1,061,226 | 2,174,372 |
| 외환차손 | - | - | - | 12 |
| 외화환산손실 | 9,820 | 10,106 | - | - |
| 당기손익-공정가치측정금융자산평가손실 | (1,317) | 4,350 | - | 1,655 |
| 사채상환손실 | 384,379 | 384,379 | 352,305 | 352,305 |
| 파생상품부채평가손실 | 277,413 | 277,413 | 12,202,628 | 21,284,324 |
| 합 계 | 1,148,677 | 1,624,760 | 13,616,159 | 23,812,668 |
(*) 당반기 중 적격자산인 유형자산에 대해 자본화된 차입원가 1,215,087천원(전반기 : 405,492천원)이 차감되어 있습니다.
33. 주당순손익
(1) 당반기와 전반기의 기본주당순손실의 산정내역은 다음과 같습니다.
| (단위: 원, 주) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 반기순손실 | (7,813,456,565) | (9,531,213,365) | (14,226,834,146) | (25,293,762,512) |
| 가중평균유통보통주식수(*) | 26,603,018 | 25,955,547 | 23,015,902 | 22,269,816 |
| 주당순손실 | (294) | (367) | (618) | (1,136) |
(*) 당반기와 전반기의 가중평균유통보통주식수의 산정내역은 다음과 같습니다.
| (당반기) |
| (3개월) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2025-04-01 | 25,795,326 | 91 | 2,347,374,666 |
| 자기주식 처분 | 2025-04-21 | 500,000 | 71 | 35,500,000 |
| 자기주식 처분 | 2025-05-12 | 500,000 | 50 | 25,000,000 |
| 자기주식 처분 | 2025-06-05 | 500,000 | 26 | 13,000,000 |
| 합 계 | 2,420,874,666 | |||
| 일 수 | 91 | |||
| 가중평균유통보통주식수 | 26,603,018 | |||
| (누적) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2025-01-01 | 25,295,326 | 181 | 4,578,454,006 |
| 자기주식 처분 | 2025-03-31 | 500,000 | 92 | 46,000,000 |
| 자기주식 처분 | 2025-04-21 | 500,000 | 71 | 35,500,000 |
| 자기주식 처분 | 2025-05-12 | 500,000 | 50 | 25,000,000 |
| 자기주식 처분 | 2025-06-05 | 500,000 | 26 | 13,000,000 |
| 합 계 | 4,697,954,006 | |||
| 일 수 | 181 | |||
| 가중평균유통보통주식수 | 25,955,547 | |||
| (전반기) |
| (3개월) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2024-04-01 | 21,971,073 | 91 | 1,999,367,643 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-01 | 248,025 | 91 | 22,570,275 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-02 | 62,005 | 90 | 5,580,450 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-09 | 11,273 | 83 | 935,659 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-17 | 119,501 | 75 | 8,962,575 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-18 | 546,784 | 74 | 40,462,016 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-19 | 11,273 | 73 | 822,929 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-22 | 90,191 | 70 | 6,313,370 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-23 | 11,273 | 69 | 777,837 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-30 | 5,636 | 62 | 349,432 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-02 | 5,636 | 60 | 338,160 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-03 | 5,636 | 59 | 332,524 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-07 | 5,636 | 55 | 309,980 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-09 | 5,636 | 53 | 298,708 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-10 | 5,636 | 52 | 293,072 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-20 | 5,636 | 42 | 236,712 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-29 | 5,636 | 33 | 185,988 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-07 | 5,636 | 24 | 135,264 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-07 | 133,927 | 24 | 3,214,248 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-14 | 4,210 | 17 | 71,570 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-17 | 178,569 | 14 | 2,499,966 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-19 | 4,210 | 12 | 50,520 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-28 | 112,739 | 3 | 338,217 |
| 합 계 | 2,094,447,115 | |||
| 일 수 | 91 | |||
| 가중평균유통보통주식수 | 23,015,902 | |||
| (누적) | (단위: 주) |
| 구 분 | 일 자 | 주식수 | 가중치 | 적 수 |
|---|---|---|---|---|
| 기초 | 2024-01-01 | 21,409,642 | 182 | 3,896,554,844 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-02-20 | 78,917 | 132 | 10,417,044 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-12 | 63,132 | 111 | 7,007,652 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-13 | 93,572 | 110 | 10,292,920 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-14 | 99,772 | 109 | 10,875,148 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-18 | 89,627 | 105 | 9,410,835 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-22 | 56,369 | 101 | 5,693,269 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-25 | 56,369 | 98 | 5,524,162 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-26 | 6,764 | 97 | 656,108 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-28 | 5,636 | 95 | 535,420 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-03-29 | 11,273 | 94 | 1,059,662 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-01 | 248,025 | 91 | 22,570,275 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-02 | 62,005 | 90 | 5,580,450 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-09 | 11,273 | 83 | 935,659 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-17 | 119,501 | 75 | 8,962,575 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-18 | 546,784 | 74 | 40,462,016 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-19 | 11,273 | 73 | 822,929 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-22 | 90,191 | 70 | 6,313,370 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-23 | 11,273 | 69 | 777,837 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-04-30 | 5,636 | 62 | 349,432 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-02 | 5,636 | 60 | 338,160 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-03 | 5,636 | 59 | 332,524 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-07 | 5,636 | 55 | 309,980 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-09 | 5,636 | 53 | 298,708 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-10 | 5,636 | 52 | 293,072 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-20 | 5,636 | 42 | 236,712 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-05-29 | 5,636 | 33 | 185,988 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-07 | 5,636 | 24 | 135,264 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-07 | 133,927 | 24 | 3,214,248 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-14 | 4,210 | 17 | 71,570 |
| 자기주식의 처분(4회차 EB교환청구) | 2024-06-17 | 178,569 | 14 | 2,499,966 |
| 자기주식의 처분(3회차 EB교환청구) | 2024-06-19 | 4,210 | 12 | 50,520 |
| 자기주식의 처분(2회차 EB교환청구) | 2024-06-28 | 112,739 | 3 | 338,217 |
| 합 계 | 4,053,106,536 | |||
| 일 수 | 182 | |||
| 가중평균유통보통주식수 | 22,269,816 | |||
(2) 당반기 및 전반기 모두 희석효과가 없어 희석주당순손실은 기본주당순손실과 동일합니다.
희석주당이익은 모든 희석성 잠재적보통주가 보통주로 전환된다고 가정하여 조정한 가중평균유통보통주식수를 적용하여 산정하고 있습니다. 당반기 중 회사가 보유하고 있는 희석성 잠재적보통주로는 교환사채 및 주식매수선택권이 있으나, 이로 인한 희석화는 발생하지 아니하였습니다.
34. 현금흐름표
(1) 당반기와 전반기의 영업으로부터 창출된 현금흐름은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 반기순손실 | (9,531,213) | (25,293,763) |
| 조정 : | ||
| 퇴직급여 | 1,152,558 | 990,929 |
| 투자부동산상각비 | - | 6,234 |
| 유형자산상각비 | 1,676,797 | 1,904,170 |
| 무형자산상각비 | 60,022 | 53,766 |
| 사용권자산상각비 | 421,572 | 449,627 |
| 이자비용 | 906,365 | 2,134,492 |
| 이자비용(리스부채) | 42,147 | 39,880 |
| 외화환산손실 | 10,106 | - |
| 대손상각비(환입) | 526,843 | (478,885) |
| 법인세비용 | 66,493 | 79,168 |
| 유형자산처분손실 | - | 954 |
| 무형자산처분손실 | 347,601 | - |
| 장기종업원급여 | - | 107,536 |
| 당기손익-공정가치측정금융자산평가손실 | 4,350 | 1,655 |
| 당기손익-공정가치측정금융자산처분손실 | - | - |
| 파생상품부채평가손실 | 277,413 | 21,284,324 |
| 손실충당부채전입(환입) | 6,161 | (325,718) |
| 사채상환손실 | 384,379 | 352,305 |
| 유형자산처분이익 | - | (902) |
| 이자수익 | (48,391) | (35,237) |
| 배당금수익 | (57,762) | (76,786) |
| 외화환산이익 | - | (10,065) |
| 사채상환이익 | - | (139,060) |
| 당기손익인식-공정가치측정금융자산평가이익 | - | (33,387) |
| 당기손익인식-공정가치측정금융자산처분이익 | (19,838) | (84,536) |
| 투자부동산처분이익 | (1,122,472) | - |
| 파생상품평가이익 | (1,716,963) | (6,410,366) |
| 리스해지이익 | (2,137) | - |
| 리스변경이익 | (806) | - |
| 소 계 | 2,914,438 | 19,810,098 |
| 순운전자본의 변동 : | ||
| 매출채권의 증감 | 1,765,224 | 130,020 |
| 계약자산의 증감 | (1,894,479) | (2,518,375) |
| 미수금의 증감 | 243,424 | (410,050) |
| 선급금의 증감 | (38,213) | (165,617) |
| 선급비용의 증감 | 183,101 | 264,249 |
| 재고자산의 증감 | 383,290 | 80,154 |
| 매입채무의 증감 | (118,583) | (112,639) |
| 미지급금의 증감 | 154,732 | 63,478 |
| 미지급비용의 증감 | (104,408) | (336,609) |
| 계약부채의 증감 | 716,424 | (1,047,807) |
| 예수금의 증감 | (146,278) | (3,560) |
| 선수금의 증감 | (4,807) | - |
| 선수수익의 증감 | (39,041) | (50,637) |
| 장기종업원급여의 지급 | (103,375) | (94,000) |
| 퇴직금의 지급 | (2,532,242) | (556,950) |
| 사외적립자산의 증감 | 1,160,633 | 261,245 |
| 소 계 | (374,598) | (4,497,098) |
| 합 계 | (6,991,373) | (9,980,763) |
(2) 당반기와 전반기의 현금의 유입ㆍ유출이 없는 거래 중 중요한 사항은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 유형자산의 취득으로 인한 미지급금 | 37,900 | 1,683,090 |
| 건설중인자산의 본계정 대체 | 10,400 | 187,273 |
| 건설중인자산의 차입원가자본화 | 1,215,087 | 405,492 |
| 사용권자산의 취득 | 216,477 | 263,846 |
| 장기차입금의 유동성대체 | 3,333,440 | - |
| 계약손실충당부채 유동성대체 | - | 981,354 |
| 교환사채의 교환 | - | 25,475,281 |
(3) 당반기와 전반기의 재무활동으로 인한 부채의 변동은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 내역 | 기초 | 재무활동으로 인한 현금흐름 | 기타(*) | 기말 | |
|---|---|---|---|---|---|
| 증가 | 감소 | ||||
| 단기차입금 | 8,400,000 | 4,100,000 | (1,500,000) | - | 11,000,000 |
| 유동성장기차입금 | 7,762,100 | - | - | 3,333,440 | 11,095,540 |
| 장기차입금 | 18,471,900 | - | - | (3,333,440) | 15,138,460 |
| 리스부채 | 922,118 | - | (370,568) | 179,434 | 730,984 |
| 교환사채 | 11,270,050 | - | (2,910,000) | 2,304,383 | 10,664,433 |
(*) 유동성대체, 교환사채 상각, 리스부채 상각 등이 포함되어 있습니다.
| (전반기) | (단위: 천원) |
| 내역 | 기초 | 재무활동으로 인한 현금흐름 | 기타(*) | 기말 | |
|---|---|---|---|---|---|
| 증가 | 감소 | ||||
| 단기차입금 | 3,000,000 | 4,530,000 | (4,530,000) | - | 3,000,000 |
| 유동성장기차입금 | 4,260,000 | - | - | - | 4,260,000 |
| 장기차입금 | 10,194,000 | 4,210,400 | - | - | 14,404,400 |
| 리스부채 | 920,825 | - | (435,679) | 235,605 | 720,751 |
| 교환사채 | 14,395,725 | 21,000,000 | - | (19,997,134) | 15,398,591 |
(*) 교환사채 상각 및 교환, 리스부채 상각 등이 포함되어 있습니다.
35. 약정사항 및 우발사항
(1) 당반기말 현재 금융기관과 맺고 있는 주요한 차입약정 등은 다음과 같습니다.
| (단위: 천원) |
| 금융기관 | 약정내용 | 한도금액 | 실행금액 |
|---|---|---|---|
| 신한은행 | 신용대출 | 4,500,000 | 4,000,000 |
| 신한은행 | 담보대출 | 13,234,000 | 13,234,000 |
| 산업은행 | 담보대출 | 20,000,000 | 20,000,000 |
| 합 계 | 37,734,000 | 37,234,000 |
(2) 당반기말과 전기말 현재 차입금과 관련하여 제공한 담보는 다음과 같습니다.
| (당반기말) | (단위: 천원) |
| 담보제공자산 | 장부가액 | 담보한도액 | 차입금액 | 담보권자 |
|---|---|---|---|---|
| 토지 | 21,414,974 | 21,912,000 | 13,234,000 | 신한은행 |
| 건물 | 19,827,570 | |||
| 토지 | 2,246,830 | 24,000,000 | 20,000,000 | 산업은행(*) |
| 건설중인자산 | 28,196,900 | |||
| 기타포괄손익-공정가치측정금융자산 | 3,802,608 | |||
| 합 계 | 75,488,882 | 45,912,000 | 33,234,000 |
(*) 상기 자산이외에 산업은행 차입금과 관련하여 현금및현금성자산 61,255천원 및 단기금융상품 1,000,000천원이 질권설정되어 있습니다(주석6 참조).
| (전기말) | (단위: 천원) |
| 담보제공자산 | 장부가액 | 담보한도액 | 차입금액 | 담보권자 |
|---|---|---|---|---|
| 토지 | 21,414,974 | 21,912,000 | 13,234,000 | 신한은행 |
| 건물 | 20,127,706 | |||
| 토지 | 2,246,830 | 24,000,000 | 20,000,000 | 산업은행(*) |
| 건설중인자산 | 29,607,414 | |||
| 기타포괄손익-공정가치측정금융자산 | 3,735,764 | |||
| 합 계 | 77,132,688 | 45,912,000 | 33,234,000 |
(*) 상기 자산이외에 산업은행 차입금과 관련하여 현금및현금성자산 12,140천원 및 단기금융상품 1,000,000천원이 질권설정되어 있습니다(주석6 참조).
(3) 당반기말과 전기말 현재 회사가 타인으로부터 제공받은 담보 및 보증의 내역은 다음과 같습니다.
| (단위: 천원) |
| 보증제공자 | 내역 | 보증한도액 | |
|---|---|---|---|
| 당반기말 | 전기말 | ||
| 서울보증보험 | 이행(계약)보증 외 | 3,336,180 | 1,825,427 |
(4) 당반기말 현재 회사가 피고로서 계류 중인 소송은 없습니다.
36. 특수관계자 거래
(1) 당반기말과 전기말 현재 특수관계자의 내역은 다음과 같습니다.
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 종속기업 | 코아스템바이오 주식회사 | 코아스템바이오 주식회사 |
| CORESTEMCHEMON US INC. | CORESTEMCHEMON US INC. | |
| 기타특수관계자 | 주요 경영진 | 주요 경영진 |
(2) 당반기말과 전기말 현재 특수관계자에 대한 채권ㆍ채무 내역은 다음과 같습니다.
| (단위: 천원) |
| 회사명 | 기타유동금융자산 | 기타유동금융부채 | 교환사채 | |||
|---|---|---|---|---|---|---|
| 당반기말 | 전기말 | 당반기말 | 전기말 | 당반기말 | 전기말 | |
| 종속기업 | ||||||
| - 코아스템바이오(*) | 772,341 | 600,660 | 28,447 | - | - | - |
| 기타특수관계자 | ||||||
| - 주요 경영진 | - | - | - | - | 1,440,000 | 3,350,000 |
(*) 회사와 코아스템바이오 간의 대여 및 차입 거래에 대하여는 연 4.6%의 이자율을적용하고 있습니다. 당반기말 현재 코아스템바이오에 대한 대여금에 대하여 전액 손실충당금을 설정하고 있습니다.
(3) 당반기와 전반기 중 특수관계자와의 매출ㆍ매입 등 거래 내역은 다음과 같습니다
| (단위: 천원) |
| 회사명 | 매입 | 임대료수익 | ||
|---|---|---|---|---|
| 당반기 | 전반기 | 당반기 | 전반기 | |
| 종속기업 | ||||
| 코아스템바이오 주식회사 | - | 240,000 | - | 600 |
(4) 당반기와 전반기 중 특수관계자 등에 대한 차입거래내역은 다음과 같습니다.
| (당반기) | (단위: 천원) |
| 회사명 | 계정과목 | 기 초 | 증 가 | 감 소 | 기 말 |
|---|---|---|---|---|---|
| 기타특수관계자 | |||||
| - 주요 경영진 | 교환사채(*) | 3,350,000 | - | (1,910,000) | 1,440,000 |
(*) 당반기 중 특수관계자가 보유한 교환사채의 조기상환으로 인한 사채상환손실은 252,290천원입니다.
| (전반기) | (단위: 천원) |
| 회사명 | 계정과목 | 기 초 | 증 가 | 감 소 | 기 말 |
|---|---|---|---|---|---|
| 기타특수관계자 | |||||
| - 주요 경영진 | 교환사채 | 6,700,000 | - | - | 6,700,000 |
(5) 주요 경영진에 대한 보상
회사가 당반기와 전반기 중 회사경영의 계획,운영,통제에 대한 중요한 권한과 책임을 가진 주요 경영진(등기임원)에 대하여 지급한 총 보상금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 단기종업원급여 | 253,150 | 625,000 |
| 퇴직급여 | 61,523 | 156,250 |
| 장기종업원급여 | - | 11,000 |
| 합 계 | 314,673 | 792,250 |
37. 보고기간 후 사건
(1) 보고기간 말 이후, 제2회 무기명 이권부 무보증 사모 교환사채에 대한 조기상환청구권 행사로 인하여 다음과 같이 교환사채가 상환되었습니다.
| (단위: 원/주) |
| 상환청구일 | 구분 | 조기상환청구액 | 대상주식수 |
|---|---|---|---|
| 2025-07-21 | 제2회차 | 1,500,000,000 | 169,109 |
(2) 보고기간 말 이후 다음과 같이 자기주식을 처분하였습니다.
| (단위: 원/주) |
| 처분일 | 처분수량 | 1주당 처분가액 | 처분가액 총액 |
|---|---|---|---|
| 2025-07-22 | 800,000 | 2,957 | 2,365,600,000 |
6. 배당에 관한 사항
1. 회사의 배당정책에 관한 사항
당사는 정관에 의거 배당 가능 이익이 발생할 경우 배당 가능 이익 범위 내에서 이사회 및 주주총회 결의를 통해 이익 배당을 진행할 수 있습니다. 다만, 당기말의 이익 수준을 예상하는 것은 불확실하기에 현시점에서 배당0에 관한 정책을 확정하긴 어렵습니다. 배당에 관한 기본적인 사항은 아래와 같이 당사 정관에서 규정하고 있습니다.
2. 배당관련 예측가능성 제공에 관한 사항
가. 정관상 배당절차 개선방안 이행 가부
| 구분 | 현황 및 계획 |
| 정관상 배당액 결정 기관 | 주주총회 |
| 정관상 배당기준일을 배당액 결정 이후로 정할 수 있는지 여부 | 해당 없음 |
| 배당절차 개선방안 이행 관련 향후 계획 | 보고서 작성일 기준 계획 없음 |
나. 배당액 확정일 및 배당기준일 지정 현황
| 구분 | 결산월 | 배당여부 | 배당액 확정일 |
배당기준일 | 배당 예측가능성 제공여부 |
비고 |
|---|---|---|---|---|---|---|
| - | - | X | - | - | X | - |
| - | - | X | - | - | X | - |
| - | - | X | - | - | X | - |
3. 기타 참고사항(배당 관련 정관의 내용 등)
| 제 12 조 (신주의 배당기산일) 이 회사가 유상증자, 무상증자 및 주식배당에 의하여 신주를 배당하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업년도의 직전영업년도 말에 발행된 것으로 본다. 제 57 조(이익금의 처분) 이 회사의 매사업년도의 처분전이익잉여금을 다음과 같이 처분한다. 1. 이익준비금 2. 기타의 법정적립금 3. 배당금 4. 임의적립금 5. 기타의 이익잉여금처분액 제 58 조(이익배당) ① 이익의 배당은 금전 또는 금전 외의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 종류 주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. ③ 제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익 배당은 주주총회의 결의로 정한다. ⑤ 제 1항의 배당금은 지급 개시일로 부터 5년 이내에 지급 청구를 하지 아니한 때에는 그 청구권을 포기한 것으로 간주하고 이를 회사의 소득으로 처리한다. |
4. 주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제23기 반기말 | 제22기 | 제21기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | -9,645 | -26,252 | -17,672 | |
| (별도)당기순이익(백만원) | -9,531 | -25,976 | -17,573 | |
| (연결)주당순이익(원) | -372 | -1,124 | -825 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
증자(감자)현황
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2022년 03월 08일 | 주식매수선택권행사 | 보통주 | 40,000 | 500 | 13,600 | - |
| 2022년 08월 25일 | 전환권행사 | 보통주 | 23,194 | 500 | 15,872 | - |
| 2022년 12월 02일 | - | 보통주 | 16,938,243 | 500 | - | - |
주) 2022년 12월 2일 종속회사 켐온과의 합병으로 인해 당사가 보유하고 있던 켐온의 지분이 합병회사 지분으로 변경되어 증자가 되었고, 주식매수청구권 행사를 통한 자기주식 취득 및 증자가 이루어졌습니다.
| [채무증권의 발행 등과 관련된 사항] |
채무증권 발행실적
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - |
기업어음증권 미상환 잔액
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
단기사채 미상환 잔액
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
회사채 미상환 잔액
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
신종자본증권 미상환 잔액
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
조건부자본증권 미상환 잔액
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
사모자금의 사용내역
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 교환사채 | 2 | 2023년 01월 19일 | 채무상환자금 | 10,811 | 1회차 전환사채 조기상환 | 10,811 | 채권자와 합의에 따른 조기상환 |
| 교환사채 | 2 | 2023년 01월 19일 | 운영자금 | 10,689 | 운영자금 사용 | 10,689 | - |
| 교환사채 | 3 | 2023년 01월 26일 | 운영자금 | 10,811 | 운영자금 사용 | 8,111 | - |
| 교환사채 | 3 | 2023년 01월 26일 | - | - | 2회차 교환사채 조기상환 | 2,700 | 기한이익 상실에 따른 조기상환 |
| 교환사채 | 4 | 2024년 03월 26일 | 임상연구개발비 | 10,000 | 운영자금 사용 | 10,000 | 한도대출 원리금 상환, 임상연구개발비 및 운영자금 사용 |
| 교환사채 | 4 | 2024년 03월 26일 | 생산설비구매 | 11,000 | 운영자금 사용 | 2,400 | 임상연구개발비 및 운영자금 사용 |
| 교환사채 | 4 | - | - | - | 생산설비 구매 | 8,600 | - |
주) 제2회차, 제3회차, 제4회차 교환사채 발행으로 조달한 사모자금은 전액 소진하였습니다.
8. 기타 재무에 관한 사항
1. 재무제표 재작성 등 유의사항
해당사항 없습니다.
2. 대손충당금의 설정현황(연결기준)
매출채권 채권 총액의 경우, 기존에 매출채권과 계약자산으로 인식했었습니다.
아래는 매출채권과 계약자산을 채권총액으로 계산한 내역입니다.
(1) 최근 3사업연도의 계정과목별 대손충당금 설정내역
| (단위:천원) |
| 구 분 | 계정과목 | 채권총액 | 대손충당금 | 대손충당금 설정률 |
| 제23기 반기말 | 매출채권 | 5,339,045 | 2,832,933 | 53.06% |
| 제22기 | 매출채권 | 7,145,631 | 2,580,755 | 36.12% |
| 제21기 | 매출채권 | 9,515,865 | 2,965,734 | 31.17% |
(2) 연결실체의 대손충당금 변동내역
당기말 현재 대손충당금의 변동내역은 다음과 같습니다.
| (단위:천원) |
| 구 분 | 제23기 반기말 |
제22기 | 제21기 | 비 고 |
| 기초금액 | 2,580,755 | 2,965,734 | 1,711,044 | - |
| 대손상각비 (매출채권 제각) |
252,178 | -384,979 | 1,254,690 | - |
| 기말금액 | 2,832,933 | 2,580,755 | 2,965,734 | - |
(3) 매출채권관련 대손충당금 설정방침
금융자산의 손상 발생에 대한 객관적인 증거가 있는지는 매 보고기간말에 평가하고 , 그 결과 손상되었다는 객관적인 증거가 있으며, 손상사건이 신뢰성 있게 추정할 수 있는 금융자산의 추정 미래현금흐름에 영향을 미친 경우에는 손상차손을 인식하고 있습니다.
금융자산의 손상되었다는 객관적인 증거에는 금융자산의 발행자나 지급의무자의 유의적인 재무적 어려움, 이자지급이나 원금상환이 장기간 연체, 재무적 어려움으로 당해 금융자산에 대한 활성시장의 소멸 등이 포함됩니다.
(4) 연결실체의 당기말 현재 경과기간별 매출채권잔액 현황
| (단위:천원) |
| 구 분 | 6월 이하 | 6월 초과 1년 이하 |
1년 초과 3년 이하 |
3년 초과 | 계 | |
|---|---|---|---|---|---|---|
| 금 액 |
매출채권 (일반) |
2,011,479 | 1,450,089 | 1,877,477 | - | 5,339,045ㄴ |
| 매출채권 (특관자) |
- | - | - | - | - | |
| 계약자산 | 7,231,963 | - | - | - | 7,231,963 | |
| 계 | 9,243,442 | 1,450,089 | 1,877,477 | - | 12,571,008 | |
| 구성비율 | 73.53% | 11.54% | 14.93% | - | 100.00% | |
3. 재고자산의 현황
(1) 연결실체의 재고자산 사업부문별 보유현황은 다음과 같습니다.
| (단위:천원) |
| 사업부문 | 계정과목 | 제23기 반기말 | 제22기 | 제21기 |
|---|---|---|---|---|
| 바이오의약품사업부 | 원재료 | 65,597 | 184,010 | 348,411 |
| 부재료 | 48,926 | 93,423 | 108,051 | |
| 재공품 | - | 231,844 | 121,650 | |
| 소계 | 114,523 | 509,277 | 578,112 | |
| 비임상CRO사업부 | 원부재료 | 10,198 | 7,139 | 12,503 |
| 연구용소모품 | 7,882 | 29,810 | 9,783 | |
| 소계 | 18,080 | 36,949 | 22,286 | |
| 합 계 | 132,602 | 546,226 | 600,398 | |
| 총자산대비 재고자산 구성비율(%) | 0.12% | 0.47 | 0.76 | |
| 재고자산회전율(회수) | 87.6 | 52.7 | 56.1 | |
주) 담보로 제공된 재고자산은 없습니다.
(2) 재고자산의 실사등
재고자산의 원가는 총평균법에 의하여 결정하고 있으며 취득원가는 매입원가, 전환원가 및 재고자산을 이용가능한 상태로 준비하는데 필요한 기타원가를 포함하고 있습니다.
재고자산의 판매에 따른 수익을 인식하는 기간에 재고자산의 장부금액을 매출원가로인식하고 있습니다. 재고자산은 취득원가와 순실현가능가치 중 낮은 금액으로 측정하고 있습니다.
재고자산을 순실현가능가치로 감액한 평가손실과 모든 감모손실은 감액이나 감모가 발생한 기간에 비용으로 인식하고 있으며, 재고자산의 순실현가능가치의 상승으로 인한 재고자산평가손실의 환입은 환입이 발생한 기간의 비용으로 인식된 재고자산의매출원가에서 차감하고 있습니다.
외부감사기관 입회하의 재고자산실사는 매해 사업연도말 한번이며, 그 외 각 분기별 재고자산실사는 회사 자체적으로 실시합니다.
4. 수주계약 현황
(1) 당사는 수익을 회수가능성이 매우 높은 발생원가의 범위 내에서만 인식하고 있습니다. 발생한 누적계약원가를 매출액으로 인식하고 계약종료시 인식한 매출액과 계약금액의 차이를 일시에 수익으로 인식하며, 미청구공사금액(손상차손누계액 구분표시), 공사미수금(대손충당금 구분표시)등을 기재하고 있습니다.
| (단위 : 백만원) |
| 회사명 | 품목 | 발주처 | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 총액 | 손상차손 누계액 |
총액 | 대손 충당금 |
|||||||
| - | 연구수탁용역 | - | - | - | 66,079 | - | 7,232 | -427 | 5,339 | -2,833 |
| 합 계 | - | 7,232 | -427 | 5,339 | -2,833 | |||||
주) 기재대상 계약은 K-IFRS 및 일반기업회계기준에 따라 진행률, 미청구공사금액 등을 재무제표 주석에 공시하는 계약에 한하여 개별재무제표 기준으로 기재하였습니다. 개별과 연결 각각 기재하는 것이 원칙이나, 종속회사 코아스템바이오(주) 및 Corestemchemon US Inc. 는 진행율이 적용되는 매출이 없어 동일한 내역이기 때문에 개별 하나로 작성하였습니다.
(2) 당사가 영위하는 업종은 계약에 의한 연구개발시험 대행업으로 계약당사자와 계약에서 비밀이나 비공개사항으로 규정하고 해당 연구개발용역의 비밀공개로 인한 손실을 초래할 가능성이 높음으로 공개하지 않았으며 해당 보고기간의 내역을 총액으로 기재하고 있으며 본 사실관련하여 매 정기 사업보고시 감사에게 보고하고 있습니다.
5. 공정가치
(1) 공정가치와 장부금액
연결회사의 금융자산과 부채의 장부금액과 공정가치는 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당 반기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| [금융자산] | ||||
| 현금및현금성자산 | 1,149,221 | 1,149,221 | 1,280,250 | 1,280,250 |
| 단기금융상품 | 1,000,000 | 1,000,000 | 1,000,000 | 1,000,000 |
| 당기손익-공정가치측정금융자산 | 1,662,918 | 1,662,918 | 2,221,221 | 2,221,221 |
| 기타포괄손익금융자산(비유동) | 3,802,608 | 3,802,608 | 3,735,764 | 3,735,764 |
| 매출채권(*) | 2,506,112 | 2,506,112 | 4,564,875 | 4,564,875 |
| 기타유동금융자산 | 144,927 | 144,927 | 5,143,322 | 5,143,322 |
| 기타비유동금융자산 | 1,313,910 | 1,313,910 | 371,763 | 371,763 |
| 합 계 | 11,579,696 | 11,579,696 | 18,317,195 | 18,317,195 |
| [금융부채] | ||||
| 단기차입금 | 11,000,000 | 11,000,000 | 8,400,000 | 8,400,000 |
| 유동성장기차입금 | 11,095,540 | 11,095,540 | 7,762,100 | 7,762,100 |
| 매입채무(*) | 248,998 | 248,998 | 367,581 | 367,581 |
| 기타유동금융부채 | 2,579,872 | 2,579,872 | 2,529,564 | 2,529,564 |
| 유동리스부채 | 324,333 | 324,333 | 450,189 | 450,189 |
| 기타비유동금융부채 | - | - | 30,000 | 30,000 |
| 비유동리스부채 | 406,651 | 406,651 | 471,929 | 471,929 |
| 장기차입금 | 15,138,460 | 15,138,460 | 18,471,900 | 18,471,900 |
| 교환사채 | 10,664,433 | 10,664,433 | 11,270,050 | 11,270,050 |
| 파생상품부채 | 5,010,847 | 5,010,847 | 7,049,784 | 7,049,784 |
| 합 계 | 56,469,134 | 56,469,134 | 56,803,097 | 56,803,097 |
(2) 공정가치 측정
공정가치로 측정되거나 공정가치로 공시되는 금융상품을 공정가치 서열체계에 따라 구분하기 위하여 정의된 수준들은 다음과 같습니다.
ㆍLevel 1 : 동일한 자산이나 부채에 대한 활성시장의(조정되지 않은) 공시가격
ㆍLevel 2 : 직접적 또는 간접적으로 관측가능한, 자산이나 부채에 대한 투입변수
단, Level 1에 포함된 공시가격은 제외함
ㆍLevel 3 : 관측가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입변수
(관측가능하지 않은 투입변수)
금융상품의 공정가치를 측정하는 데에 사용되는 평가기법에는 다음이 포함됩니다.
- 유사한 상품의 공시시장가격 또는 딜러가격
- 현금흐름의 할인기법 등의 기타 기법 사용
보고기간종료일 현재 공정가치로 측정된 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
- 당 반기말
| (단위:천원) |
| 구 분 | Level 1 | Level 2 | Level 3 | 합계 |
|---|---|---|---|---|
| [금융자산] | ||||
| 당기손익-공정가치측정금융자산(유동) | - | 1,662,918 | - | 1,662,918 |
| 기타포괄손익-공정가치측정금융자산 | 3,802,608 | - | - | 3,802,608 |
| 금융자산 계 | 3,802,608 | 1,662,918 | - | 5,465,526 |
| [금융부채] | ||||
| 파생상품부채 | - | - | 5,010,847 | 5,010,847 |
- 전기말
| (단위:천원) |
| 구 분 | Level 1 | Level 2 | Level 3 | 합계 |
|---|---|---|---|---|
| [금융자산] | ||||
| 당기손익-공정가치측정금융자산(유동) | - | 2,221,221 | - | 2,221,221 |
| 기타포괄손익-공정가치측정금융자산 | 3,735,764 | - | - | 3,735,764 |
| 금융자산 계 | 3,735,764 | 2,221,221 | - | 5,956,985 |
| [금융부채] | ||||
| 파생상품부채 | - | - | 7,049,784 | 7,049,784 |
(3) 가치평가기법 및 투입 변수
| (단위: 천원) |
| 구분 | 수준 | 가치평가기법 | 투입변수 | 공정가치 | 수준 3 투입변수 범위 | |||
|---|---|---|---|---|---|---|---|---|
| 당 반기말 | 전기말 | 투입변수 | 당 반기말 | 전기말 | ||||
| 파생상품부채 | ||||||||
| 교환사채 | 3 | 이항모형 | 주가의 변동성 | 5,010,847 | 7,049,784 | 변동성 | 89.6% | 89.22% |
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
1. 회계감사인의 명칭 및 감사의견
| 사업연도 | 구분 | 감사인 | 감사의견 | 의견변형사유 | 계속기업 관련 중요한 불확실성 |
강조사항 | 핵심감사사항 |
|---|---|---|---|---|---|---|---|
| 제23기 반기말 (당기) |
감사보고서 | 안진회계법인 | - | - | - | - | - |
| 연결감사 보고서 |
안진회계법인 | - | - | - | - | - | |
| 제22기 (전기) |
감사보고서 | 안진회계법인 | 적정의견 | - | - | - | [교환사채 공정가치 평가] -교환사채 및 파생상품 공정가치 평가와 관련된 회사의 내부통제 이해 - 회사가 활용한 경영진측 전문가의 적격성 및 독립성 확인 - 교환사채 및 파생상품 공정가치 평가에 적용한 평가방법론 검토 - 평가방법론에 이용된 입력변수의 데이터원천 및 산출기법 검토 |
| 연결감사 보고서 |
안진회계법인 | 적정의견 | - | - | - | 상동 | |
| 제21기 (전전기) |
감사보고서 | 인덕회계법인 | 적정의견 | - | - | - |
[기간에 걸친 수익인식] - 주요 계약사항에 대한 확인 - 보고기간별 누적계약원가와 총계약원가의 주요 구성항목의 변동에 대한 질문 및 분석적 검토 |
| 연결감사 보고서 |
인덕회계법인 | 적정의견 | - | - | - | 상동 |
2. 감사용역 체결현황
| (단위 : 백만원, 시간) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제23기(당기) | 안진회계법인 | 반기재무제표 및 반기연결재무제표 검토, 재무제표 및 연결재무제표 감사 내부회계관리제도 감사 |
230 | 1,918 | - | 292 |
| 제22기(전기) | 안진회계법인 | 반기재무제표 및 반기연결재무제표 검토, 재무제표 및 연결재무제표 감사 내부회계관리제도 검토 |
168 | 1,200 | 168 | 1617 |
| 제21기(전기) | 인덕회계법인 | 반기재무제표 및 반기연결재무제표 검토, 재무제표 및 연결재무제표 감사 |
170 | 1,440 | 170 | 1,440 |
3. 회계감사인과의 비감사용역 계약체결 현황은 다음의 표에 따라 기재한다.
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제22기(당기) | - | - | - | - | - |
| 제21기(전기) | - | - | - | - | - |
| 제20기(전전기) | - | - | - | - | - |
4. 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 내부감사기구가 회계감사인과 논의한 결과를 다음의 표에 따라 기재한다.
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2024년 02월 14일 | 회사측: 감사,재무담당이사 등 2인, 감사인측: 업무수행이사 등 2인 |
대면회의 | 감사결과 및 기타보고사항 논의 |
| 2 | 2024년 12월 17일 | 회사측: 감사,재무담당이사 등 2인, 감사인측: 업무수행이사 등 2인 |
서면보고 | 외부감사 계획 보고 |
| 3 | 2025년 03월 20일 | 회사측: 감사,재무담당이사 등 2인, 감사인측: 업무수행이사 등 2인 |
서면보고 | 외부감사 결과 보고 |
5. 주요 감사 내용
당기 감사 종료 후 사업보고서에 기재할 예정입니다.
6. 종속회사 감사의견
공시대상기간 중 회계감사인으로부터 적정의견 이외의 감사의견을 받은 회사는 없습니다.
2. 내부통제에 관한 사항
1. 경영진의 내부회계 관리제도 효과성 평가 결과
| 사업연도 | 구분 | 운영실태 보고서 보고일자 |
평가 결론 | 중요한 취약점 |
시정조치 계획 등 |
|---|---|---|---|---|---|
| 제23기 (당기) |
내부회계 관리제도 |
- | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제22기 (전기) |
내부회계 관리제도 |
2025.02.07 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
2025.02.07 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - | |
| 제21기 (전전기) |
내부회계 관리제도 |
2024.02.05 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
2024.02.05 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
2. 감사(위원회)의 내부회계관리제도 효과성 평가 결과
| 사업연도 | 구분 | 평가보고서 보고일자 |
평가 결론 | 중요한 취약점 |
시정조치 계획 등 |
|---|---|---|---|---|---|
| 제23기 (당기) |
내부회계 관리제도 |
- | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제22기 (전기) |
내부회계 관리제도 |
2025년 02월 21일 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
2025년 02월 21일 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - | |
| 제21기 (전전기) |
내부회계 관리제도 |
2024년 02월 05일 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
2024년 02월 05일 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
3. 감사인의 내부회계관리제도 감사의견(검토결론)
| 사업연도 | 구분 | 감사인 | 유형 (감사/검토) |
감사의견 또는 검토결론 |
지적사항 | 회사의 대응조치 |
|---|---|---|---|---|---|---|
| 제23기 (당기) |
내부회계 관리제도 |
안진회계법인 | 감사 | - | - | - |
| 연결내부회계 관리제도 |
안진회계법인 | 감사 | - | - | - | |
| 제22기 (전기) |
내부회계 관리제도 |
안진회계법인 | 검토 | 적정의견 | - | - |
| 연결내부회계 관리제도 |
안진회계법인 | 검토 | 적정의견 | - | - | |
| 제21기 (전전기) |
내부회계 관리제도 |
인덕회계법인 | 검토 | 적정의견 | - | - |
| 연결내부회계 관리제도 |
인덕회계법인 | 검토 | 적정의견 | - | - |
4. 내부회계관리·운영조직 인력 및 공인회계사 보유현황
| 소속기관 또는 부서 |
총 원 | 내부회계담당인력의 공인회계사 자격증 보유비율 |
내부회계담당 인력의 평균경력월수 |
||
|---|---|---|---|---|---|
| 내부회계 담당인력수(A) |
공인회계사자격증 소지자수(B) |
비율 (B/A*100) |
|||
| 감사 | 1 | 1 | 0 | 0 | 66 |
| 이사회 | 7 | 1 | 1 | 100 | 86 |
| 회계처리부서 | 2 | 2 | 0 | 0 | 58 |
| 전산운영부서 | 6 | 1 | 0 | 0 | 180 |
| 자금운영부서 | 2 | 2 | 0 | 0 | 50 |
| 경영지원팀 | 6 | 3 | 0 | 0 | 86 |
5. 회계담당자의 경력 및 교육실적
| 직책 (직위) |
성명 | 회계담당자 등록여부 |
경력 (단위:년, 개월) |
교육실적 (단위:시간) |
||
|---|---|---|---|---|---|---|
| 근무연수 | 회계관련경력 | 당기 | 누적 | |||
| 사장 | 권광순 | 미등록 | 6년 8개월 | 29년 | - | - |
| 부장 | 박상성 | 미등록 | 5년 5개월 | 4년 | - | - |
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
1. 사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 7 | 3 | 2 | - | - |
당사의 이사회는 법령 또는 정관에 정하여진 사항, 주주총회로부터위임 받은 사항, 회사 경영의 기본 방침 및 업무 집행에 관한 중요 사항을 의결하며 이사 및 경영진의 직무 집행을 감독하고 있습니다. 공시서류작성기준일 현재 당사의 이사회는 7명의 이사(사내이사 4명, 사외이사 3명)로 구성되어 있으며, 이사회 내 별도의 위원회는 구성되어 있지 않습니다. 이사의 주요 이력 및 인적사항은 본 보고서 「Ⅷ. 임원 및 직원 등에 관한 사항」을 참조하시기 바랍니다.
| 회차 | 개최일자 | 의 안 내 용 | 가결 여부 |
사내이사 | 사내이사 | 사내이사 | 사내이사 | 사외이사 | 사외이사 | 사외이사 | |||||||
| 양길안 (출석률: 100%) |
김경숙 (출석률: 100%) |
송시환 (출석률: 100%) |
권광순 (출석률: 100%) |
한상배 (출석률: 67%) |
장양수 (출석률: 67%) |
박건우 (출석률: 67%) |
|||||||||||
| 참석 여부 |
찬반 여부 |
참석 여부 |
찬반 여부 |
참석 여부 |
찬반 여부 |
참석 여부 |
찬반 여부 |
참석 여부 |
찬반 여부 |
참석 여부 |
찬반 여부 |
참석 여부 |
찬반 여부 |
||||
| 1 | 2025-02-21 | 1. 정기주주총회 소집 결의의 건 2. 전자투표제도 도입의 건 |
가결 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 |
| 3 | 2025-03-26 | 1. 자기주식 처분의 건 | 가결 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 불참 | - | 불참 | - | 불참 | - |
| 4 | 2025-03-28 | 1. 임시의장 선임의 건 2. 대표이사 선임의 건 |
가결 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 불참 | - | 불참 | - | 불참 | - |
| 5 | 2025-05-07 | 1. 자기주식 처분의 건 | 가결 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 참석 | 찬성 | 불참 | - | 불참 | - | 불참 | - |
3. 이사회 내의 위원회 구성현황과 그 활동내역
공시서류작성기준일 현재 당사의 이사회 내에는 위원회가 구성되어 있지 않습니다.
4. 이사의 독립성
공시서류작성기준일 현재 당사의 이사회는 사내이사 4인과 사외이사 3인으로 구성되어 있으며, 회사 경영의 중요한 의사결정과 업무집행은 이사회의 심의 및 결정을 통하여 이루어지고 있습니다. 사외이사 선임 시 사외이사자격요건 확인서 등을 통하여 검증하고 있으며 현재 선임된 모든 사외이사가 자격요건을 만족하고 있습니다. 또한 당사는 대주주 등의 독단적인 경영과 이로 인한 소액주주의 이익 침해가 발생하지 않도록 이사회 운영규정을 제정하여 성실히 준수하고 있습니다.
5. 사외이사의 전문성
당사는 사외이사가 이사회에서 전문적인 직무수행이 가능하도록 보조하고 있습니다.사외이사를 지원하기 위한 별도의 지원조직은 없지만 이사회 전에 해당 안건 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고, 기타 사내 주요 현안에 대해서도 수시로 정보를 제공하고 있습니다.
6. 사외이사 교육 미실시 내역
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | 해당 분야에 대한 전문성을 충분히 갖추고 있으며, 각 사안에 대해 사전에 자료를 제공하여 충분히 파악할 수 있도록 조치 |
2. 감사제도에 관한 사항
1. 감사위원회의 설치 여부
당사는 공시서류작성기준일 현재 감사위원회를 별도로 설치하고 있지 않으며, 주주총회 결의로 선임된 상근 감사 1명이 감사 업무를 수행하고 있습니다.
2. 감사의 인적사항
| 성명 | 주요 경력 | 최대주주등과의 이해관계 |
결격요건 여부 |
| 윤준섭 | 명인제약 사장/공장장 (주)퍼슨 제조관리 임원 (주)켐온 비상근 감사 |
이해관계 없음 | 결격요건 없음 |
3. 감사의 독립성
감사는 회계와 업무를 감사하며 이사회 및 타 부서로부터 독립된 위치에서 업무를 수행하고 있습니다. 또한 당사는 감사의 감사업무에 필요한 경영정보접근을 위하여 당사 정관에 다음과 같은 조항을 두고 있습니다.
|
제50조 (감사의 직무) 1) 감사는 회사의 회계와 업무를 감사한다. 2) 감사는 회의의 목적사항과 소집의 이유를 기재한 서면을 이사회에 제출하여 임시주주총회의 소집을 청구할 수 있다. 3) 감사는 그 직무를 수행하기 위하여 필요한 때에는 자회사에 대하여 영업의 보고를 요구할 수 있다. 이 경우 자회사가 지체 없이 보고를 하지 아니할 때 또는 그 보고의 내용을 확인할 필요가 있는 때에는 자회사의 업무와 재산상태를 조사할 수 있다. 4) 감사는 필요하면 회의의 목적사항과 소집이유를 적은 서면을 이사(소집권자가 있는 경우에는 소집권자)에게 제출하여 이사회 소집을 청구할 수 있다. 5) 4항의 청구를 하였는데도 이사가 지체없이 이사회를 소집하지 아니하면 그 청구한 감사가 이사회를 소집할 수 있다. 6) 감사에 대해서는 정관 제39조 제4항의 규정을 준용한다. 7) 감사는 회사의 비용으로 전문가의 도움을 구할 수 있다. |
4. 감사의 주요 활동내역
| 회차 | 개최일자 | 의 안 내 용 | 가결 여부 |
감사 윤준섭 |
| 참석 여부 | ||||
| 1 | 2025-02-21 | 1. 정기주주총회 소집 결의의 건 2. 전자투표제도 도입의 건 |
가결 | 참석 |
| 2 | 2025-03-26 | 1. 자기주식 처분의 건 | 가결 | 불참 |
| 3 | 2025-03-28 | 1. 임시의장 선임의 건 2. 대표이사 선임의 건 |
가결 | 불참 |
| 4 | 2025-05-07 | 1. 자기주식 처분의 건 | 가결 | 불참 |
5. 감사 교육 미실시 내역
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | 해당 분야에 대한 전문성을 충분히 갖추고 있으며, 각 사안에 대해 사전에 자료를 제공하여 충분히 파악할 수 있도록 조치 |
6. 감사 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 재무회계팀 | 5 | 부장 1명(5) 과장 1명(9) 대리 2명(4) 주임 1명(2) |
내부회계관리제도 운영실태 자료 등 |
| 경영지원팀 | 1 | 과장 1명(9) | 감사 관련 자료 제공 |
7. 준법지원인 등 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| - | - | - | - |
주) 당사는 보고서 작성일 기준 자산총액 5천억원 이하이며, 관련 법령에 따른 설치 의무가 없어 준법지원인 등 지원조직을 별도로 두고 있지 않습니다.
3. 주주총회 등에 관한 사항
1. 투표제도 현황
| (기준일 : | 2025년 06월 30일 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 도입 |
| 실시여부 | 미실시 | 미실시 | 실시 |
2. 소수주주권의 행사여부
당사는 공시대상기간 중 소수주주권이 행사된 사실이 없습니다.
3. 경영권 경쟁 여부
당사는 공시대상기간 중 경영권과 관련하여 경쟁이 발생한 사실이 없습니다.
4. 의결권 현황
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 32,870,376 | - |
| - | - | - | |
| 의결권없는 주식수(B) | 보통주 | 5,575,050 | 자기주식 (교환사채 위탁수량 포함) |
| - | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | - | - | - |
| - | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
- | - | - |
| - | - | - | |
| 의결권이 부활된 주식수(E) | - | - | - |
| - | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 29,295,326 | - |
| - | - | - |
5. 주식 사무
회사 정관상의 신주인수권의 내용과 결산일, 정기주주총회의 시기, 주주명부 폐쇄 시기, 주권의 종류, 명의개서대리인의 명칭과 전화번호, 주주의 특전, 공고방법 등은 다음과 같습니다.
| 정관상 신주인수권의 내용 |
제10조 (신주인수권) 1) 회사의 주주는 신주식을 발행함에 있어 그가 소유한 주식수에 비례하여 신주를 배정받을 권리를 가진다. 2) 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우에는 이사회의 결의로 주주 이외의 자에게 신주를 배정할 수 있다. 1. 발행 주식총수의 100분의 20의 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6의 규정에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의7의 규정에 따라 우리사주조합원에게 주식을 우선 배정하는 경우 3. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 상법 제418조 제2항의 규정에 따라 기술의 도입, 재무구조 개선, 신규영업의 진출, 연구개발, 생산/판매/자본제휴 및 사업목적의 확대 등 회사의 경영상 목적을 달성하기 위하여 그 상대방에게 신주를 발행하는 경우 4. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 외국인투자촉진법에 의한 외국인 투자가, 중소기업창업지원법에 의한 중소기업창업투자회사 또는 중소기업창업투자조합 및 신기술사업금융지원에 관한 법률에 의한 신기술사업금융회사 또는 신기술사업투자조합에 배정하는 경우 5. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 주식예탁증서(DR)를 발행하는 경우 6. 상법 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 7. 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 8. 주권을 한국거래소가 개설한 유가증권시장 또는 코스닥시장에 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 3) 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우에는 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. 4) 주주의 신주인수권 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리 방법은 이사회의 결의로 정한다. 제11조 (신주의 배당기산일) 회사가 유상증자, 무상증자 및 신주배당에 의하여 신주를 발행하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전영업연도말에 발행된 것으로 본다. |
||
| 결 산 일 | 12월 31일 | 정기주주총회 | 매 사업연도 종료 후 3개월 이내 |
| 주권의 종류 |
제9조 (주식의 종류) 1) 회사가 발행할 주식은 기명식 보통주식과 기명식 종류주식으로 한다. 2) 회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다. |
||
| 명의개서대리인 | 한국예탁결제원(051-519-1500) | ||
| 주주의 특전 | 해당사항 없음 | ||
| 공고방법 | 제4조 (공고방법) 회사의 공고는 회사의 인터넷 홈페이지(www.corestemchemon.com)에 한다. 다만, 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행하는 매일경제신문(합병 또는 개칭이 있는 경우 그 승계신문)에 게재한다. |
||
6. 주주총회 의결사항
| 주총일자 | 안건 | 결의내용 | 비고 |
| 제20기 정기주주총회 (2023.03.26) |
제20기(2022.1.1~2022.12.31) 재무제표(별도 및 연결) 승인의 건 |
원안대로 승인 | - |
| 감사 신규 선임 승인의 건 | 원안대로 승인 | 감사 윤준섭 | |
| 이사 보수한도 승인의 건 | 원안대로 승인 | 30억원 | |
| 감사 보수한도 승인의 건 | 원안대로 승인 | 1억원 | |
| 제21기 정기주주총회 (2024.03.29) |
제21기(2023.1.1~2023.12.31) 재무제표(별도 및 연결) 승인의 건 |
원안대로 승인 | - |
| 이사 보수한도 승인의 건 | 원안대로 승인 | 30억원 | |
| 감사 보수한도 승인의 건 | 원안대로 승인 | 1억원 | |
| 제22기 정기주주총회 (2025.03.28) |
제22기(2024.1.1~2024.12.31) 재무제표(별도 및 연결) 승인의 건 |
원안대로 승인 | - |
| 이사 선임의 건 - 사내이사 양길안 재선임 - 사내이사 김경숙 재선임 - 사내이사 송시환 재선임 - 사내이사 권광순 재선임 - 사외이사 한상배 재선임 - 사외이사 박건우 재선임 |
원안대로 승인 | - | |
| 상근감사 선임의 건 - 비상근감사 윤준섭을 상근감사로 신규 선임 |
원안대로 승인 | - | |
| 이사 보수한도 승인의 건 | 원안대로 승인 | 30억원 | |
| 감사 보수한도 승인의 건 | 원안대로 승인 | 1억원 |
VI. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (증권신고서 제출일 전일 기준) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 김경숙 | 최대주주 | 보통주 | 3,483,320 | 10.60 | 3,483,320 | 10.60 | - |
| 양길안 | 임원 | 보통주 | 5,116 | 0.02 | 5,116 | 0.02 | - |
| 홍순복 | 최대주주의 특수관계인 |
보통주 | 6,000 | 0.02 | 6,000 | 0.02 | - |
| 홍정식 | 최대주주의 특수관계인 |
보통주 | 30,700 | 0.09 | 30,700 | 0.09 | - |
| 김병철 | 최대주주의 특수관계인 |
보통주 | 34,200 | 0.10 | 34,200 | 0.10 | - |
| 권광순 | 임원 | 보통주 | 47,200 | 0.14 | 47,200 | 0.14 | - |
| 이태용 | 임원 | 보통주 | 20,000 | 0.06 | 20,000 | 0.06 | - |
| 김종일 | 임원 | 보통주 | 3,500 | 0.01 | 3,500 | 0.01 | - |
| 송시환 | 임원 | 보통주 | 291,981 | 0.89 | 291,981 | 0.89 | - |
| 홍정욱 | 최대주주의 특수관계인 |
보통주 | 10,000 | 0.03 | 10,000 | 0.03 | - |
| 홍정인 | 최대주주의 특수관계인 |
보통주 | 10,000 | 0.03 | 10,000 | 0.03 | - |
| 김혜연 | 최대주주의 특수관계인 |
보통주 | 4,000 | 0.01 | 4,978 | 0.02 | 장내매수 |
| 김우곤 | 최대주주의 특수관계인 |
보통주 | 4,000 | 0.01 | 4,000 | 0.01 | - |
| 계 | 보통주 | 3,950,017 | 12.02 | 3,950,995 | 12.02 | - | |
| - | - | - | - | - | - | ||
2. 최대주주의 주요경력 및 개요
| 성명 | 직위 | 주요경력(최근 5년간) |
| 김경숙 | 연구소 상임고문 (상근/등기) |
한양대 의학과 학사/석사/박사(1984~2002) 한양대학교 류마티스관절염임상연구센터 연구교수(2018~2021) 중앙약사심의위원회 위원(2018~2022) 산업표준심의회 생명공학 기술심의회 위원(2019~2022) |
3. 주식의 분포
1. 주식 소유현황
| (증권신고서 제출일 전일 기준) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 김경숙 | 3,483,320 | 10.60 | 최대주주 |
| - | - | - | - | |
| 우리사주조합 | - | - | - | |
2. 소액주주 현황
소액주주현황
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 32,263 | 32,369 | 99.97 | 20,930,237 | 32,870,376 | 63.67 | - |
4. 주가 및 주식거래실적(코스닥)
| 일자 | 종가 | 대비 | 등락률 | 시가 | 고가 | 저가 | 거래량 | 거래대금 |
| 2025/06/30 | 2,635 | -70 | -2.59 | 2,685 | 2,745 | 2,620 | 76,788 | 203,894,745 |
| 2025/06/27 | 2,705 | 25 | 0.93 | 2,710 | 2,745 | 2,655 | 36,965 | 99,305,675 |
| 2025/06/26 | 2,680 | -40 | -1.47 | 2,785 | 2,785 | 2,665 | 43,463 | 116,970,875 |
| 2025/06/25 | 2,720 | -10 | -0.37 | 2,740 | 2,800 | 2,670 | 80,924 | 220,020,055 |
| 2025/06/24 | 2,730 | 55 | 2.06 | 2,710 | 2,770 | 2,685 | 104,443 | 284,113,120 |
| 2025/06/23 | 2,675 | -150 | -5.31 | 2,805 | 2,825 | 2,635 | 415,319 | 1,104,685,935 |
| 2025/06/20 | 2,825 | 45 | 1.62 | 2,770 | 2,830 | 2,745 | 50,232 | 140,304,410 |
| 2025/06/19 | 2,780 | -10 | -0.36 | 2,780 | 2,810 | 2,740 | 33,976 | 93,707,545 |
| 2025/06/18 | 2,790 | -20 | -0.71 | 2,855 | 2,855 | 2,765 | 108,250 | 302,265,720 |
| 2025/06/17 | 2,810 | 110 | 4.07 | 2,725 | 2,815 | 2,650 | 94,482 | 259,826,695 |
| 2025/06/16 | 2,700 | -85 | -3.05 | 2,810 | 2,810 | 2,620 | 102,448 | 279,596,298 |
| 2025/06/13 | 2,785 | -185 | -6.23 | 2,995 | 2,995 | 2,785 | 366,093 | 1,038,168,335 |
| 2025/06/12 | 2,970 | -35 | -1.16 | 3,005 | 3,005 | 2,890 | 156,929 | 460,991,695 |
| 2025/06/11 | 3,005 | -5 | -0.17 | 3,000 | 3,080 | 2,990 | 37,913 | 113,998,985 |
| 2025/06/10 | 3,010 | 25 | 0.84 | 2,990 | 3,080 | 2,930 | 70,721 | 211,718,900 |
| 2025/06/09 | 2,985 | -105 | -3.40 | 3,080 | 3,100 | 2,945 | 90,644 | 271,744,820 |
| 2025/06/05 | 3,090 | -25 | -0.80 | 3,095 | 3,155 | 3,035 | 76,889 | 237,287,025 |
| 2025/06/04 | 3,115 | 5 | 0.16 | 3,110 | 3,175 | 3,055 | 70,141 | 217,648,565 |
| 2025/06/02 | 3,110 | -10 | -0.32 | 3,200 | 3,200 | 3,035 | 571,551 | 1,681,585,000 |
| 2025/05/30 | 3,120 | -25 | -0.79 | 3,160 | 3,260 | 3,065 | 98,441 | 310,046,915 |
| 2025/05/29 | 3,145 | 65 | 2.11 | 3,050 | 3,205 | 3,045 | 67,985 | 214,501,050 |
| 2025/05/28 | 3,080 | 150 | 5.12 | 2,960 | 3,175 | 2,870 | 166,301 | 500,525,235 |
| 2025/05/27 | 2,930 | 0 | 0.00 | 2,965 | 3,015 | 2,890 | 236,996 | 696,867,450 |
| 2025/05/26 | 2,930 | -100 | -3.30 | 3,025 | 3,050 | 2,830 | 357,493 | 1,036,213,222 |
| 2025/05/23 | 3,030 | -80 | -2.57 | 3,080 | 3,105 | 3,010 | 54,206 | 164,732,689 |
| 2025/05/22 | 3,110 | 10 | 0.32 | 3,100 | 3,120 | 3,015 | 51,705 | 158,053,571 |
| 2025/05/21 | 3,100 | 15 | 0.49 | 3,095 | 3,180 | 3,090 | 45,046 | 140,842,705 |
| 2025/05/20 | 3,085 | -35 | -1.12 | 3,135 | 3,390 | 3,075 | 50,601 | 157,178,965 |
| 2025/05/19 | 3,120 | -75 | -2.35 | 3,150 | 3,250 | 3,080 | 66,043 | 206,432,200 |
| 2025/05/16 | 3,195 | -65 | -1.99 | 3,260 | 3,265 | 3,175 | 90,235 | 289,251,344 |
| 2025/05/15 | 3,260 | -10 | -0.31 | 3,275 | 3,300 | 3,215 | 46,258 | 150,873,075 |
| 2025/05/14 | 3,270 | 10 | 0.31 | 3,300 | 3,340 | 3,200 | 63,544 | 207,783,160 |
| 2025/05/13 | 3,260 | -65 | -1.95 | 3,295 | 3,350 | 3,215 | 88,470 | 290,104,635 |
| 2025/05/12 | 3,325 | -40 | -1.19 | 3,370 | 3,370 | 3,090 | 73,846 | 241,795,545 |
| 2025/05/09 | 3,365 | -55 | -1.61 | 3,465 | 3,465 | 3,335 | 132,696 | 447,222,070 |
| 2025/05/08 | 3,420 | -20 | -0.58 | 3,475 | 3,500 | 3,400 | 556,469 | 1,810,549,984 |
| 2025/05/07 | 3,440 | -140 | -3.91 | 3,600 | 3,620 | 3,415 | 153,328 | 535,518,655 |
| 2025/05/02 | 3,580 | -25 | -0.69 | 3,550 | 3,625 | 3,525 | 86,501 | 308,473,515 |
| 2025/04/30 | 3,605 | 75 | 2.12 | 3,540 | 3,695 | 3,525 | 245,598 | 884,690,945 |
| 2025/04/29 | 3,530 | 150 | 4.44 | 3,440 | 3,535 | 3,360 | 172,290 | 592,830,206 |
| 2025/04/28 | 3,380 | -180 | -5.06 | 3,560 | 3,565 | 3,340 | 407,249 | 1,387,728,364 |
| 2025/04/25 | 3,560 | 135 | 3.94 | 3,450 | 4,310 | 3,435 | 5,097,178 | 20,042,554,082 |
| 2025/04/24 | 3,425 | 20 | 0.59 | 3,455 | 3,550 | 3,400 | 143,948 | 500,007,072 |
| 2025/04/23 | 3,405 | -10 | -0.29 | 3,415 | 3,420 | 3,315 | 76,324 | 258,181,493 |
| 2025/04/22 | 3,415 | 185 | 5.73 | 3,200 | 3,460 | 3,195 | 195,606 | 660,533,586 |
| 2025/04/21 | 3,230 | -170 | -5.00 | 3,405 | 3,405 | 3,200 | 148,706 | 483,624,307 |
| 2025/04/18 | 3,400 | 40 | 1.19 | 3,380 | 3,405 | 3,320 | 78,268 | 263,451,703 |
| 2025/04/17 | 3,360 | -55 | -1.61 | 3,390 | 3,455 | 3,310 | 566,447 | 1,802,147,044 |
| 2025/04/16 | 3,415 | 40 | 1.19 | 3,420 | 3,475 | 3,350 | 51,878 | 176,664,548 |
| 2025/04/15 | 3,375 | -115 | -3.30 | 3,430 | 3,475 | 3,340 | 65,237 | 220,912,209 |
| 2025/04/14 | 3,490 | -10 | -0.29 | 3,445 | 3,535 | 3,310 | 137,406 | 476,449,160 |
| 2025/04/11 | 3,500 | 470 | 15.51 | 3,100 | 3,575 | 3,100 | 532,465 | 1,806,682,128 |
| 2025/04/10 | 3,030 | 245 | 8.80 | 2,855 | 3,065 | 2,855 | 110,043 | 326,584,552 |
| 2025/04/09 | 2,785 | -130 | -4.46 | 2,895 | 2,945 | 2,770 | 73,343 | 206,552,464 |
| 2025/04/08 | 2,915 | 120 | 4.29 | 2,860 | 2,940 | 2,805 | 120,502 | 345,719,905 |
| 2025/04/07 | 2,795 | -360 | -11.41 | 3,110 | 3,115 | 2,765 | 436,889 | 1,254,287,965 |
| 2025/04/04 | 3,155 | 5 | 0.16 | 3,140 | 3,175 | 3,010 | 229,179 | 705,489,871 |
| 2025/04/03 | 3,150 | -25 | -0.79 | 3,235 | 3,235 | 3,145 | 65,834 | 208,383,140 |
| 2025/04/02 | 3,175 | -60 | -1.85 | 3,325 | 3,330 | 3,150 | 74,307 | 237,188,214 |
| 2025/04/01 | 3,235 | 70 | 2.21 | 3,165 | 3,340 | 3,165 | 102,194 | 333,214,385 |
| 2025/03/31 | 3,165 | -295 | -8.53 | 3,405 | 3,445 | 3,135 | 219,377 | 713,101,380 |
| 2025/03/28 | 3,460 | -50 | -1.42 | 3,555 | 3,575 | 3,440 | 108,506 | 379,549,660 |
| 2025/03/27 | 3,510 | -135 | -3.70 | 3,610 | 3,735 | 3,450 | 770,839 | 2,669,851,335 |
| 2025/03/26 | 3,645 | -45 | -1.22 | 3,680 | 3,750 | 3,605 | 189,510 | 696,763,310 |
| 2025/03/25 | 3,690 | 225 | 6.49 | 3,465 | 3,980 | 3,400 | 1,195,451 | 4,536,145,644 |
| 2025/03/24 | 3,465 | 50 | 1.46 | 3,420 | 3,585 | 3,300 | 94,869 | 330,172,000 |
| 2025/03/21 | 3,415 | 35 | 1.04 | 3,395 | 3,620 | 3,385 | 166,231 | 579,592,896 |
| 2025/03/20 | 3,380 | -95 | -2.73 | 3,475 | 3,535 | 3,370 | 164,233 | 565,400,575 |
| 2025/03/19 | 3,475 | -20 | -0.57 | 3,495 | 3,560 | 3,440 | 83,435 | 289,878,775 |
| 2025/03/18 | 3,495 | -70 | -1.96 | 3,560 | 3,615 | 3,485 | 134,062 | 472,285,663 |
| 2025/03/17 | 3,565 | -65 | -1.79 | 3,570 | 3,660 | 3,480 | 122,669 | 437,972,965 |
| 2025/03/14 | 3,630 | -90 | -2.42 | 3,720 | 3,810 | 3,505 | 233,091 | 844,137,378 |
| 2025/03/13 | 3,720 | -60 | -1.59 | 3,745 | 3,910 | 3,705 | 221,997 | 841,136,608 |
| 2025/03/12 | 3,780 | 110 | 3.00 | 3,670 | 3,865 | 3,600 | 173,733 | 654,181,606 |
| 2025/03/11 | 3,670 | 175 | 5.01 | 3,485 | 3,720 | 3,390 | 125,536 | 451,761,342 |
| 2025/03/10 | 3,495 | -125 | -3.45 | 3,590 | 3,620 | 3,480 | 114,227 | 403,478,230 |
| 2025/03/07 | 3,620 | -30 | -0.82 | 3,700 | 3,700 | 3,615 | 68,094 | 248,589,896 |
| 2025/03/06 | 3,650 | -60 | -1.62 | 3,710 | 3,815 | 3,600 | 116,940 | 434,552,575 |
| 2025/03/05 | 3,710 | 140 | 3.92 | 3,540 | 3,800 | 3,540 | 169,638 | 620,579,038 |
| 2025/03/04 | 3,570 | -20 | -0.56 | 3,570 | 3,605 | 3,470 | 83,042 | 292,717,740 |
| 2025/02/28 | 3,590 | -130 | -3.49 | 3,720 | 3,740 | 3,590 | 163,512 | 595,286,750 |
| 2025/02/27 | 3,720 | -45 | -1.20 | 3,840 | 3,890 | 3,695 | 118,329 | 445,768,515 |
| 2025/02/26 | 3,765 | 115 | 3.15 | 3,690 | 3,880 | 3,650 | 187,254 | 711,495,135 |
| 2025/02/25 | 3,650 | -80 | -2.14 | 3,745 | 3,765 | 3,630 | 132,946 | 486,609,045 |
| 2025/02/24 | 3,730 | -65 | -1.71 | 3,740 | 3,770 | 3,665 | 130,838 | 485,648,370 |
| 2025/02/21 | 3,795 | -180 | -4.53 | 3,950 | 3,950 | 3,735 | 464,142 | 1,764,423,755 |
| 2025/02/20 | 3,975 | 335 | 9.20 | 3,655 | 4,180 | 3,650 | 1,602,263 | 6,350,307,145 |
| 2025/02/19 | 3,640 | 125 | 3.56 | 3,515 | 3,770 | 3,515 | 256,915 | 938,789,790 |
| 2025/02/18 | 3,515 | 30 | 0.86 | 3,485 | 3,550 | 3,415 | 82,006 | 284,901,230 |
| 2025/02/17 | 3,485 | 80 | 2.35 | 3,405 | 3,540 | 3,360 | 113,743 | 393,989,030 |
| 2025/02/14 | 3,405 | -115 | -3.27 | 3,580 | 3,580 | 3,350 | 185,966 | 634,305,375 |
| 2025/02/13 | 3,520 | -50 | -1.40 | 3,625 | 3,720 | 3,520 | 140,951 | 504,165,105 |
| 2025/02/12 | 3,570 | -100 | -2.72 | 3,740 | 3,840 | 3,550 | 228,772 | 836,620,380 |
| 2025/02/11 | 3,670 | -90 | -2.39 | 3,750 | 3,770 | 3,530 | 326,946 | 1,191,497,375 |
| 2025/02/10 | 3,760 | 610 | 19.37 | 3,125 | 3,830 | 3,075 | 1,284,016 | 4,614,124,345 |
| 2025/02/07 | 3,150 | -60 | -1.87 | 3,245 | 3,295 | 3,140 | 137,154 | 437,405,490 |
| 2025/02/06 | 3,210 | -130 | -3.89 | 3,310 | 3,390 | 3,210 | 145,316 | 473,511,885 |
| 2025/02/05 | 3,340 | 90 | 2.77 | 3,255 | 3,425 | 3,235 | 199,545 | 663,510,985 |
| 2025/02/04 | 3,250 | 45 | 1.40 | 3,210 | 3,400 | 3,210 | 220,018 | 725,364,950 |
| 2025/02/03 | 3,205 | -180 | -5.32 | 3,385 | 3,385 | 3,115 | 489,769 | 1,565,420,875 |
| 2025/01/31 | 3,385 | -200 | -5.58 | 3,585 | 3,605 | 3,365 | 323,615 | 1,105,853,990 |
| 2025/01/24 | 3,585 | -20 | -0.55 | 3,550 | 3,655 | 3,525 | 213,083 | 766,919,815 |
| 2025/01/23 | 3,605 | -130 | -3.48 | 3,770 | 3,770 | 3,600 | 368,301 | 1,346,397,965 |
| 2025/01/22 | 3,735 | 15 | 0.40 | 3,750 | 3,785 | 3,710 | 143,136 | 534,164,235 |
| 2025/01/21 | 3,720 | -65 | -1.72 | 3,740 | 3,870 | 3,720 | 179,989 | 677,220,555 |
| 2025/01/20 | 3,785 | 80 | 2.16 | 3,720 | 3,880 | 3,680 | 306,959 | 1,165,507,690 |
| 2025/01/17 | 3,705 | 20 | 0.54 | 3,700 | 3,740 | 3,625 | 267,719 | 982,014,515 |
| 2025/01/16 | 3,685 | -30 | -0.81 | 3,725 | 3,775 | 3,600 | 392,141 | 1,443,896,175 |
| 2025/01/15 | 3,715 | -115 | -3.00 | 3,835 | 3,860 | 3,690 | 474,698 | 1,780,147,155 |
| 2025/01/14 | 3,830 | -90 | -2.30 | 3,970 | 3,970 | 3,750 | 501,085 | 1,912,895,605 |
| 2025/01/13 | 3,920 | -85 | -2.12 | 3,975 | 4,070 | 3,885 | 323,400 | 1,276,407,040 |
| 2025/01/10 | 4,005 | -115 | -2.79 | 4,120 | 4,180 | 3,990 | 382,494 | 1,543,390,640 |
| 2025/01/09 | 4,120 | -75 | -1.79 | 4,230 | 4,240 | 4,070 | 347,112 | 1,428,385,985 |
| 2025/01/08 | 4,195 | 140 | 3.45 | 4,055 | 4,450 | 4,000 | 1,476,695 | 6,317,324,355 |
| 2025/01/07 | 4,055 | -130 | -3.11 | 4,200 | 4,220 | 4,030 | 629,548 | 2,570,712,630 |
| 2025/01/06 | 4,185 | 20 | 0.48 | 4,185 | 4,265 | 4,140 | 457,773 | 1,922,317,685 |
| 2025/01/03 | 4,165 | 20 | 0.48 | 4,150 | 4,230 | 4,035 | 593,274 | 2,457,262,670 |
| 2025/01/02 | 4,145 | 265 | 6.83 | 3,935 | 4,145 | 3,885 | 642,274 | 2,556,868,405 |
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
1. 임원 현황
| (증권신고서 제출일 전일 기준) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 양길안 | 남 | 1956년 04월 | 대표이사 | 사내이사 | 상근 | 회사 총괄 | 명인제약 대표이사 코아스템바이오(주) 대표이사 코아스템(주) 회장 |
5,116 | - | 임원 | 2018.07 ~ 현재 |
2028년 03월 28일 |
| 김경숙 | 여 | 1965년 04월 | 상임고문 | 사내이사 | 상근 | 연구소 상임고문 |
한양대 의학과 박사 한양대학교 류마티스관절염 임상연구센터 연구교수 중앙약사심의위원회 위원 산업표준심의회 생명공학 기술심의회 위원 |
3,483,320 | - | 본인 | 2003.12 ~ 현재 |
2028년 03월 28일 |
| 권광순 | 남 | 1972년 01월 | 사장 | 사내이사 | 상근 | 바이오의약품 사업부 사장 |
성균관대 경영학과 학사 Duke University(MBA) 삼일회계법인 감사/재무자문본부 한영회계법인 재무자문본부 |
47,200 | - | 임원 | 2018.04 ~ 현재 |
2028년 03월 28일 |
| 김종일 | 남 | 1961년 04월 | 상무이사 | 미등기 | 상근 | 생산본부장 |
한밭대 기계과 대한적십자사 팀장 (주)유바이오로직스 이사 |
3,500 | - | 임원 | 2013.03 ~현재 |
- |
| 이태용 | 남 | 1982년 10월 | 이사 | 미등기 | 상근 | 중앙연구소 연구소장 |
김천대 임상병리과 학사 한양대 의생명공학과 석사 충북대 응용약학 박사 |
20,000 | - | 임원 | 2006.01~현재 | - |
| 한상배 | 남 | 1969년 05월 | 사외이사 | 사외이사 | 비상근 | 사외이사 |
충북대 약학과 학사/석사 KAIST 생물과학과 박사 미국 NIH Postdoctoral fellow 한국생명공학연구원 선임연구원 |
- | - | 타인 | 2022.03 ~ 현재 |
2028년 03월 28일 |
| 박건우 | 남 | 1962년 01월 | 사외이사 | 사외이사 | 비상근 | 사외이사 | 고려대학교 의학박사 고려대학교 안암병원 신경과 과장 고려대학교 안암병원 기획실장 고려대학교 의과대학 교육정책실장 대한치매학회 이사장, 대한신경과학회 부이사장 고려대학교의료원 사회공헌사업본부장 국가치매관리위원회 부위원장 |
950 | - | 타인 | 2023년 12월 ~ 현재 |
2028년 03월 28일 |
| 송시환 | 남 | 1961년 08월 | 사장 | 사내이사 | 상근 | 비임상CRO 사업부 사장 |
서울대학교 수의학과 박사 한국화학연구소 선임연구원 |
291,981 | - | 임원 | 2000년 08월 ~ 현재 |
2028년 03월 28일 |
| 장양수 | 남 | 1957년 12월 | 사외이사 | 사외이사 | 비상근 | 사외이사 |
연세대학교 의과대학 의학박사 연세대학교 의과대학 내과학교실 주임교수 세브란스병원 내과부장 연세대학교 총동문회 공공분야 상임이사 연세대학교 의과대학장 겸 의학전문대학원장 연세대학교 전기전자공학과 겸직교수 연세대학교 총동문회 보건복지분야 상임이사 연세대학교 의과대학 심혈관제품 |
- | - | 타인 | 2023년 12월 ~ 현재 |
2025년 12월 02일 |
| 길기현 | 남 | 1968년 06월 | 상무이사 | 미등기 | 상근 | 사업본부장 | (주)켐온 GLP 본부장 비임상연구소장 |
21,023 | - | 임원 | 2000년 8월 ~ 현재 |
- |
| 김문순 | 여 | 1971년 07월 | 이사 | 미등기 | 상근 | 비임상연구소장 |
충북대학교 약학과 석사 한국생명공학연구원 연구원 (주)켐온 신뢰성본부장 |
1,735 | - | 임원 | 2000년4월 ~ 현재 |
- |
| 유지성 | 남 | 1969년 12월 | 이사 | 미등기 | 상근 | 환경독성본부 본부장 |
성균관대학교 약학과 박사 환경부 국립환경과학원 위해성평가과 연구원(조사연구원) 환경부 국립환경과학원 위해성평가연구과(연구사) 환경부 화학물질안전원 교육훈련혁신팀(과장) |
- | - | 임원 | 2022년 10월 ~ 현재 |
- |
| 윤준섭 | 남 | 1949년 04월 | 감사 | 감사 | 상근 | 상근 감사 | 명인제약 사장/공장장 (주)퍼슨 제조관리 임원 (주)켐온 비상근 감사 |
- | - | 타인 | 2023년 03월 ~ 현재 |
2028년 03월 28일 |
| 이용상 | 남 | 1975년 04월 | 이사 | 미등기 | 상근 | 헬스케어본부 본부장 |
식품의약품안전처 서울청 / 유해물질분석과 / 과장 ㈜인바이오 / 생명과학연구소 / 연구소장 / CTO Tunas Sawa Erma(Indonesia) / 연구책임자 / GM ㈜LG화학 / 생명과학 정밀화학 제형개발 파트장 한국화학연구원 / 스크리닝연구부 코아스템켐온 춘천연구소장 |
- | - | 타인 | 2024년 03월 ~ 현재 |
- |
| 이령아 | 여 | 1967년 04월 | 본부장 | 미등기 | 상근 | 연구개발 혁신본부 본부장 |
이화여대 의학과 박사 서울대학교 외과 전임의 및 임상의학연구소 연구 전임의 Thomas Jefferson University, Kimmel cancer center 연수 원자력병원 외과 과장 이화여자대학교 의과대학 교수 이화여자대학교 의과대학 외과학교실 주임교수 이대목동병원 대장암 센터장 |
- | - | 타인 | 2024.10 ~ 현재 |
- |
2. 직원 등 현황
2-1. 직원 등 현황
| (증권신고서 제출일 전일 기준) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 바이오의약품사업부 | 남 | 24 | - | 4 | 4 | 28 | 4.6 | 669 | 24 | - | - | - | - |
| 바이오의약품사업부 | 여 | 37 | - | 2 | 1 | 39 | 3.8 | 862 | 22 | - | |||
| 비임상CRO사업부 | 남 | 110 | - | 4 | - | 114 | 6.3 | 3,072 | 27 | - | |||
| 비임상CRO사업부 | 여 | 134 | - | 11 | - | 145 | 6.1 | 3,225 | 22 | - | |||
| 합 계 | 306 | - | 20 | 5 | 326 | 5.8 | 7,828 | 24 | - | ||||
2-2. 육아지원제도 사용 현황
| (단위: 명,%) |
| 구분 | 당 반기(제23기) | 전기(제22기) | 전전기(제21기) |
| 육아휴직 사용자수(남) | 5 | 3 | |
| 육아휴직 사용자수(여) | 5 | 12 | 4 |
| 육아휴직 사용자수(전체) | 10 | 15 | 4 |
| 육아휴직 사용률(남) | 0 | 60 | 0 |
| 육아휴직 사용률(여) | 100 | 200 | 50 |
| 육아휴직 사용율(전체) | 100 | 136 | 33 |
| 육아휴직 복귀 후 12개월 이상 근속자(남) |
1 | - | - |
| 육아휴직 복귀 후 12개월 이상 근속자(여) |
4 | 4 | 4 |
| 육아휴직 복귀 후 12개월 이상 근속자(전체) |
5 | 4 | 4 |
| 육아기 단축근무제 사용자 수 | 5 | 2 | 1 |
| 배우자 출산휴가 사용자 수 | 0 | 4 | 0 |
2-3. 유연근무제도 사용 현황
| 구분 | 당 반기(제23기) | 전기(제22기) | 전전기(제21기) |
| 유연근무제 활용 여부 |
- | - | - |
| 시차출퇴근제 사용자 수 |
- | - | - |
| 선택근무제 사용자 수 |
- | - | - |
| 원격근무제 (재택근무 포함) 사용자 수 |
- | - | - |
2. 미등기임원 보수 현황
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 천원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 7 | 301,550 | 43,079 | - |
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
1. 주주총회 승인금액
| (단위 : 천원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 7 | 3,000,000 | - |
| 감사 | 1 | 100,000 | - |
2. 보수지급금액
2-1. 이사ㆍ감사 전체
| (단위 : 천원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 8 | 257,897 | 32,237 | - |
2-2. 유형별
| (단위 : 천원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
4 | 250,000 | 62,500 | - |
| 사외이사 (감사위원회 위원 제외) |
3 | 1,645 | 548 | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 6,252 | 6,252 | - |
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 천원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
2. 산정기준 및 방법
| (단위 : 천원 ) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 천원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
2. 산정기준 및 방법
| (단위 : 천원) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
<주식매수선택권의 부여 및 행사현황>
<표1>
| (단위 : 천원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
2 | - | - |
| 사외이사 (감사위원회 위원 제외) |
- | - | - |
| 감사위원회 위원 또는 감사 | - | - | - |
| 업무집행지시자 등 | - | - | - |
| 계 | 2 | - | - |
<표2>
| (증권신고서 제출일 전일 기준) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 000외 53명 |
직원 | 2019년 03월 29일 | 신주교부 | 보통주 | 54,865 | 0 | 0 | 4,750 | 23,445 | 26,670 | 2021.03.29 ~2026.03.28 |
13,600 | X | - |
| 000외 1명 |
등기임원 | 2019년 03월 29일 | 신주교부 | 보통주 | 180,000 | 0 | 0 | 40,000 | 0 | 140,000 | 2021.03.29 ~2026.03.28 |
13,600 | X | - |
| 000외 1명 |
미등기임원 | 2019년 03월 29일 | 신주교부 | 보통주 | 60,000 | 0 | 0 | 23,500 | 0 | 36,500 | 2021.03.29 ~2026.03.28 |
13,600 | X | - |
| 000 | 계열회사 직원 | 2019년 03월 29일 | 신주교부 | 보통주 | 2,500 | 0 | 0 | 0 | 0 | 2,500 | 2021.03.29 ~2026.03.28 |
13,600 | X | - |
| 000 | 계열회사 임원 | 2019년 03월 29일 | 신주교부 | 보통주 | 10,000 | 0 | 0 | 0 | 0 | 10,000 | 2021.03.29 ~2026.03.28 |
13,600 | X | - |
※ 증권신고서 제출일 전일 기준 현재 종가 : 2,890 원
VIII. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (증권신고서 제출일 전일 기준) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| - | - | - | - |
| 상세 현황은 '상세표-2.계열회사 현황(상세)' 참조 |
IX. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여등
공시서류작성기준일 현재 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
공시서류작성기준일 현재 해당사항이 없습니다.
3. 대주주와의 영업거래
공시서류작성기준일 현재 해당사항이 없습니다.
4. 대주주에 대한 주식기준보상 거래
공시서류작성기준일 현재 해당사항이 없습니다.
5. 대주주 이외의 이해관계자와의 거래
(1) 특수관계자 내역
| (기준일: 2025년 06월 30일) |
| 특수관계자 명 | 특수관계 구분 |
| 코아스템바이오(주) | 종속회사 |
| Corestemchemon US Inc. | 종속회사 |
(2) 매입 및 매출 거래
| (단위:천원) |
|
성명 (법인명) |
관계 | 구분 | 2025년 | 2024년 | 2023년 | |||
| 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | |||
| 코아스템 바이오(주) |
종속 회사 |
매출거래 | - | - | 1,200 | 임대료 | 1,200 | 임대료 |
| 매입거래 | - | - | 440,000 | 서비스용역 | 480,000 | 서비스용역 | ||
| Corestemchemon US Inc. |
종속 회사 |
매출거래 | - | - | - | - | - | - |
| 매입거래 | - | - | - | - | - | - | ||
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
해당 사항 없습니다.
2. 우발부채 등에 관한 사항
1. 중요한 소송사건
작성기준일 현재 해당사항이 없습니다.
2. 견질 또는 담보용 어음ㆍ수표 현황
| (기준일 : 2025년 06월 30일) | (단위 : 매, 백만원) |
| 제 출 처 | 매 수 | 금 액 | 비 고 |
|---|---|---|---|
| 은 행 | - | - | - |
| 금융기관(은행제외) | - | - | - |
| 법 인 | - | - | - |
| 기타(개인) | - | - | - |
3. 채무보증 현황
| (기준일 : 2025-06-30 ) | (단위 : 원) |
| 거래처 | 시작일 | 종료일 | 보증한도금액 | 내 역 |
| (주)티스템 | 2022-12-12 | 2025-12-11 | 17,600,000 | 부동산가압류 |
| 충청북도 청주시 | 2023-03-03 | 2025-08-31 | 172,395,080 | 건축공사 안전관리예치금 보증 |
| 한국환경공단 | 2023-12-14 | 2027-09-30 | 73,838,000 | 2023년 동물대체시험 GLP 시험기관 지원사업 |
| (주)셀라퓨틱스바이오 | 2024-07-24 | 2027-07-23 | 4,200,000 | 부동산가압류 |
| 삼양화학공업(주) | 2024-07-10 | 2026-01-29 | 3,729,000 | 화학물질 유해성평가(방제제)를 위한 비임상시험 |
| 충청에너지서비스(주) | 2024-08-15 | 2026-08-14 | 38,519,350 | 도시가스 공급계약 |
| (재)춘천바이오산업진흥원 | 2024-10-24 | 2025-10-23 | 34,000,000 | 헴프 유래 유효성분(칸나다디올)의 비임상시험 독성평가 용역 |
| (주)삼천리 | 2024-12-01 | 2025-11-30 | 181,800,000 | 도시가스 공급계약 |
| (주)삼천리 | 2024-12-01 | 2025-11-30 | 219,000,000 | 도시가스 공급계약 |
| (재)춘천바이오산업진흥원 | 2024-11-14 | 2025-12-22 | 178,693,200 | 헴프 유래 유효성분(칸나다디올)의 비임상시험 독성평가 용역 |
| 경상국립대학교산학협력단 | 2024-12-16 | 2025-12-15 | 438,240 | GLP 연구기관 급성 경구투여 독성시험 |
| 건국대학교 산학협력단 | 2024-12-23 | 2025-08-31 | 9,017,313 | 전임상 연구개발을 위한 설치류를 이용한 뇌실내 단회 투여 독성시험 용역 |
| 대한민국정부대구지방조달청 | 2025-01-06 | 2026-11-15 | 18,000,000 | (연구용역)동물용의약품등 독성시험지침 및 GLP 규정의 국제 조화를 위한 조사 연구 |
| 안국약품(주) | 2025-01-06 | 2025-09-30 | 88,550,000 | 2제 복합제 4주 주 반복독성시험(6 point,동시분석 기준) |
| 농림축산검역본부 | 2025-01-17 | 2026-01-14 | 75,408,430 | (연구용역)동물용의약품등 독성시험지침 및 GLP 규정의 국제 조화를 위한 조사 연구 |
| 아주대학교의료원 | 2025-03-31 | 2025-12-31 | 219,164,000 | 액상플라즈마 원료의약품 등록을 위한 GLP 독성 시험 |
| 아주대학교의료원 | 2025-03-27 | 2025-12-31 | 54,791,000 | 액상플라즈마 원료의약품 등록을 위한 GLP 독성 시험 |
| 대한민국정부인천지방조달청 | 2025-05-02 | 2026-03-28 | 28,676,050 | 2025년 화학물질 유해성시험자료 생산(2) |
| 대한민국정부인천지방조달청 | 2025-05-02 | 2026-03-28 | 28,768,550 | 2025년 화학물질 유해성시험자료 생산(1) |
| 대한민국정부인천지방조달청 | 2025-05-02 | 2026-03-28 | 29,244,400 | 2025년 화학물질 유해성시험자료 생산(3) |
| 한국환경공단 | 2025-05-09 | 2026-05-27 | 580,136,980 | 2025년 화학물질 유해성시험자료 생산(3) |
| 한국환경공단 | 2025-05-09 | 2026-05-27 | 569,836,770 | 2025년 화학물질 유해성시험자료 생산(2) |
| 한국환경공단 | 2025-05-09 | 2026-05-27 | 571,674,880 | 2025년 화학물질 유해성시험자료 생산(1) |
| 경기도 용인시 처인구 | 2021-09-02 | 2031-09-01 | 2,532,930 | 용인 처인구 양지면 양지리 120-28번지(12세대) |
| 경기도 용인시 처인구 | 2021-09-02 | 2026-09-01 | 3,166,160 | 용인 처인구 양지면 양지리 120-28번지(12세대) |
| 리퓨어헬스케어 주식회사 | 2022-09-26 | 2025-09-25 | 133,000,000 | 소유권이전등기청구권및채권가압류 |
| 합계 | 3,336,180,333 | - | ||
3. 제재 등과 관련된 사항
해당 사항 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
1. 매출액 미달에 대한 관리종목 지정유예 현황
(최근 사업연도 매출액 30억원 미만)
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|
| 사업연도 | 매출금액 | 해당여부 | 사유 | 종료시점 | |
| 2024 | 28,762,459,937 | 미해당 | 해당 | 혁신형제약기업 | 2025년 06월 30일 |
2. 계속사업손실에 대한 관리종목 지정유예 현황
(자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속 사업손실 발생)
| (기준일 : | 2025년 06월 30일 | ) | (단위 : 원, %) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | ||||
|---|---|---|---|---|---|---|
| 사업연도 | 법인세 차감전 계속사업손익(A) |
자기자본금액 (B) |
비율(A/B) | 해당 여부 |
종료 시점 |
|
| 2022년 | 3,406,757,177 | 38,634,176,444 | 8.8 | 미해당 | 미해당 | - |
| 2023년 | -17,676,130,498 | 19,600,629,786 | -90.2 | |||
| 2024년 | -24,136,402,072 | 48,593,356,064 | -49.6 | |||
주) 법인세차감전계속사업손익(A) 2024년 수치는 '코스닥시장상장규정 시행세칙 제49조, 제61조'에 따라 리픽싱조건부 금융상품 관련 평가손실 금액이 차감된 수치입니다.
3. 교환사채 조기상환 청구
제2회 무기명 이권부 무보증 사모 교환사채에 대한 조기상환청구권 행사로 인하여 다음과 같이 교환사채가 상환되었습니다.
| (단위: 원/주) |
| 상환청구일 | 구분 | 조기상환청구액 | 대상주식수 |
|---|---|---|---|
| 2025-07-21 | 제2회차 | 1,500,000,000 | 169,109 |
4. 자기주식 처분
보고기간 말 이후 다음과 같이 자기주식을 처분하였습니다.
| (단위: 원/주) |
| 처분일 | 처분수량 | 1주당 처분가액 | 처분가액 총액 |
|---|---|---|---|
| 2025-07-22 | 800,000 | 2,957 | 2,365,600,000 |
XI. 상세표
1. 연결대상 종속회사 현황(상세)
| (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| 코아스템 바이오(주) |
2009년 4월20일 |
경기도 용인시 처인구 영문로 2-27(유방동) |
의약품 판매 | 56 | 해당 종속회사에 대한 100% 의결권 있는 주식을 보유함에 따라 해당 종속회사에 대한 힘이 있고, 해당 종속회사에 관여함에 따라 변동이익에 노출되거나 변동이익에 대한 권리가 있으며, 투자회사의 이익금액에 영향을 미치기 위하여 종속회사에 대한 힘을 사용할 수 있으므로 연결회사는 해당종속회사에 대한 지배력을 가지고 있음 |
미해당 |
| Corestemchemon US Inc. |
2023년 4월 28일 |
1952 Gallows Road, Suite 110, Vienna, VA, 22182 USA |
마케팅 및 시장조사 |
245 | 해당 종속회사에 대한 100% 의결권 있는 주식을 보유함에 따라 해당 종속회사에 대한 힘이 있고, 해당 종속회사에 관여함에 따라 변동이익에 노출되거나 변동이익에 대한 권리가 있으며, 투자회사의 이익금액에 영향을 미치기 위하여 종속회사에 대한 힘을 사용할 수 있으므로 연결회사는 해당종속회사에 대한 지배력을 가지고 있음 |
미해당 |
2. 계열회사 현황(상세)
| (증권신고서 제출일 전일 기준) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | - | - | - |
| - | - |
3. 타법인출자 현황(상세)
해당사항 없습니다.
4. 산업현황 및 보유기술(상세)
1. 바이오의약품사업부
(1)제약산업으로서 줄기세포치료제 산업의 특징
첨단바이오의약품은 세포치료제, 유전자치료제, 조직공학제제, 첨단바이오 융복합제제, 그 밖에 세포나 조직 또는 유전물질을 등을 함유하는 의약품으로 구분됩니다.
| [첨단바이오의약품의 분류] |
| 구 분 | 설 명 | 예 시 |
| 세포치료제 | 세포를 체외에서 배양ㆍ증식하거나 선별하는 등 물리적, 화학적 또는 생물학적 방법으로 조작하여 제조한 의약품 (단순분리, 세척, 냉동, 해동 등만을 하는 경우는 제외) |
체세포치료제 줄기세포치료제 |
| 유전자치료제 | 유전물질의 발현에 영향을 주기 위하여 투여하는 것으로서 유전물질을 함유한 의약품 또는 유전물질이 변형ㆍ도입된 세포를 함유한 의약품 |
Car-T |
| 조직공학제제 | 조직의 재생, 복원 또는 대체 등을 목적으로 사람 또는 동물의 살아 있는 세포나 조직에 공학기술을 적용하여 제조한 의약품 | - |
| 첨단바이오융복합제제 | 세포치료제, 유전자치료제, 조직공학제제와 「의료기기법」 제2조제1항에 따른 의료기기가 물리적ㆍ화학적으로 결합(융합, 복합, 조합 등을 포함한다)하여 이루어진 의약품 | - |
| (출처: 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률) |
바이오의약품 전체로 확대하면 바이오시밀러 및 바이오베터는 우리나라에 도전의 기회를 넘어 글로벌 시장을 선도하고 있으며, 특히 줄기세포치료제는 글로벌 시장을 선도할 수 있는 경쟁력이 마련되어 가고 있습니다. 첨단바이오의약품인 세포치료제는 기존 바이오신약 및 바이오시밀러 또는 바이오베터와는 완전히 다른 새로운 약으로서, 현재 국내외 규제기관에서 첨단바이오의약품으로 분류하여 심사하고 있으며, 시장에서 매우 초기에 속하지만 가능성 면에서는 잠재력이 매우 큰 분야라고 할 수 있습니다. 특히 질병 치료의 패러다임이 개인 맞춤형 치료로 전환되는 추세와 함께 미래 난치성 질환의 치료를 위한 핵심 의약품이 될 것으로 예상됩니다.
세포치료제는 살아있는 세포를 체외에서 배양ㆍ증식, 선별하는 등 물리적, 화학적, 생물학적 방법으로 조작하여 제조하는 의약품을 말하며, 면역세포치료제, 조직세포치료제, 줄기세포치료제 등이 있습니다. 기존의 제제가 단일 또는 특정 기전을 타깃으로 하기 때문에, 다양한 원인에 의해 발병하고 병리기전이 복합적으로 결합되어 있는 퇴행성질환이나 면역질환에 좋은 효과를 보이지 못하고 있는 반면, 세포치료제는 질환에 복합적으로 작용하는 기전을 가지고 있어 난치성 질환에 대한 차세대 치료제로서 기대를 받고 있습니다.
줄기세포(stem cell)는 조직분화 과정에서 볼 수 있는 미분화 세포로 인체를 구성하는 다양한 조직으로 분화 가능한 세포를 말합니다. 그 밖에도 체내에서 병소 부위로 이동하는 성질(homing effect), 다양한 인자 분비능(paracrine effect)을 가지고 있어 손상된 신체 부위의 재생 또는 다양하고 복잡한 발병기전을 가진 질환의 치료에 적합하여 현재 치료제가 없는 난치성 질환의 치료에 대한 가능성이 높은 새로운 대안으로서 각광을 받고 있습니다. 다양한 종류의 줄기세포 중 성체줄기세포는 골수, 말초혈액, 신경, 근육, 지방, 간, 피부, 제대혈 등에서 쉽게 얻을 수 있어 윤리적 문제가 없으며, 면역거부반응이나 종양 형성 위험성이 적은 장점을 갖고 있습니다. 이와 같은 이유로 현재 임상에서 사용하는 줄기세포 중 가장 많은 부분이 성체줄기세포이며, 당분간 성체줄기세포 기반의 줄기세포치료제가 시장에서 주력이 될 것으로 예상됩니다.
| [줄기세포 분류 및 장단점] |
| 분화능 |
분리 세포 |
확립방식 | 장점 | 단점 |
|
만능성 줄기 세포 |
배아 줄기 세포 |
배반포기 배아 |
ㆍ확립이 비교적 수월 ㆍ미국 임상 허용 |
ㆍ윤리문제(배아 사용) ㆍ면역거부반응 ㆍ암 유발 가능성 |
| 체세포 핵이식 |
ㆍ대량생산 가능 ㆍ면역거부반응 없음 |
ㆍ윤리문제(난자 사용) ㆍ암 유발 ㆍ인간복제 가능성 |
||
|
유도만능 줄기세포 (체세포 역분화) |
ㆍ윤리적 문제 극복 ㆍ면역거부반응 없음 ㆍ환자 맞춤형 가능 |
ㆍ암 유발 가능성 ㆍ외래 유전자 도입의 |
||
|
다능성 줄기 세포 |
성체 줄기 세포 |
골수, 태반, 제대혈 등에서 직접 분리 |
ㆍ배아, 난자 사용의 ㆍ면역거부반응 가능성 |
ㆍ대량 생산 어려움 ㆍ자가가 아닐 경우 면역 ㆍ다양한 장기 세포로 |
| (출처: 생명공학정책연구센터 2013) |
■ 과학기반, 연구집약적: 줄기세포치료제 산업은 기초과학연구의 결과가 산업적 성과와 긴밀하게 연계되는 과학기반 산업이라는 점과 연구집약적인 특성은 일반적인 제약산업과 유사합니다. 한국바이오협회 바이오경제연구센터에 따르면, 2024년 기준 전 세계적으로 1,975건의 재생의료(첨단바이오의약품) 임상이 이루어지고 있으며 그 중107건(5%)이 3상 진행 중에 있으며, 2024년 현재 총34개의 재생의약품이 FDA 허가되었습니다. 국내에서는 2020.8.28.부터 첨단재생바이오법 시행에 따라,자진취하한 1개 품목을 제외한 기허가된 세포치료제 전체 품목(13개)이 2021년에 첨단바이오의약품으로서 재허가를 받았으며, 유전자치료제로는2021년도에 총 3품목이 첨단바이오의약품으로 신규 허가되었으며, 2023년도에1품목이 추가로 허가되었습니다. 코로나19에도 불구하고 2020년 재생의료 (첨단바이오의약품)산업은 큰 폭으로 성장하였으며, iPSC, 유전자 편집, 동종이계 세포 면역치료 등의 분야에서 성과가 이루어지고 있습니다. 또한, 미국, 유럽 등 선진국 규제기관에서는 첨단바이오의약품의 신속한 인허가 절차를 지원하는 패스트트랙제도를 활성화하여 기업의 연구개발을 지원하고 있으며, 첨단바이오의약품의 개발과 생산을 지원하기 위한 위탁개발생산기업(CDMO)들도 대폭 투자를 확대하고 있습니다. (2023년 의약품 허가보고서)
■ 개발 리스크와 고부가가치: 줄기세포치료제는 현재 치료제가 없는 난치성 질환에 대한 미충족수요(unmet medical needs)를 해결할 새로운 치료 대안으로서 대두되고 있습니다. 따라서 시장에서 다른 치료제와의 경쟁이 없거나 매우 적을 것으로 예상되어 일반적인 신약에 비해 개발 리스크는 낮은 특징이 있습니다.
■ 정부지원정책: 줄기세포분야는 여러 동향분석ㆍ예측 전문기관에서 향후 경제적ㆍ기술적 파급효과가 큰 미래유망기술로 내다보고 있으며, 각국 정부에서도 차세대 성장동력으로 선정하여 R&D 지원이 활발하게 이루어지고 있습니다. 대한민국은 정부가 줄기세포 지원정책을 가장 적극적으로 수행하고 있는 국가입니다. 'Pharma Korea 2020 비전기획단'에서 발표한 한국 제약산업의 비전과 로드맵에 관한 자료에서 줄기세포 분야는 시장성 측면에서 우선순위가 높고 기술적 접근이 유망한 분야로서 한국 제약산업의 미래를 주도할 혁신제품 과제 중의 하나로 선정되었습니다.
줄기세포에 대한 중요성 인식과 정책적 지원은 2006년부터 과학기술부(현 교육부) 주관으로 범정부 차원에서 수립된 '줄기세포연구 종합추진계획'의 연장선상에 있으며 관계부처(과학기술정보통신부, 교육부, 농림축산식품부, 산업통상자원부, 보건복지부, 식품의약품안전처)는 종합추진계획에 따라 줄기세포연구의 연차별 시행 계획을 수립하고 이를 시행하고 있습니다. 정부는 우리나라의 줄기세포ㆍ재생의료 기술 수준이 세계 상위 7~8위권으로 세계 수준과의 격차가 크지 않아, 정부의 투자가 효율적으로 뒷받침될 경우 세계 최상위권의 경쟁력을 확보할 것으로 전망하며, 줄기세포 분야에 대하여 다양한 방식으로 지원을 하고 있습니다.
최근 정부는 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 및 하위 법령 규정을 마련하여 국가 책임에 따라 절박한 희귀난치 질환자에 새로운 치료기회를 제공함과 동시에 빠르게 성장하고 있는 재생의료 시장에서 줄기세포등을 활용한 첨단재생의료와 첨단바이오의약품에 대한 전주기 안전관리체계 및 기술발전의 토대를 마련하는 등 적극적인 노력을 하고 있으며, 2024년 2월 1일 세포치료, 유전자치료등 첨단재생의료의 치료기회를 확대하는 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’ 개정안이 국회 본회의를 통과함으로써 줄기세포를 포함한 첨단재생 산업전반에 걸쳐 도약할 것으로 기대하고 있습니다.
■ 산업ㆍ조직적 특성: 현재 줄기세포치료제는 대부분 바이오벤처기업들에 의해 개발 및 상용화가 진행되고 있으며, 글로벌 주요 제약사들은 여전히 직접적인 시장 진입보다는 기술도입이나 전략적 제휴를 통해 간접적으로 접근하고 있는 상황입니다. 이는 기존의 항체의약품이나 화학합성의약품과는 달리, 살아있는 세포를 기반으로 한 제품의 개발 및 제조 경험이 부족하고, 줄기세포치료제의 핵심 경쟁력인 제조공정 기술, 환자 맞춤형 생산 체계, 그리고 세포 운송·보관 등 공급망 관리에 대한 노하우가 부족하기 때문입니다. 이러한 역량은 단순한 자본력만으로 확보하기 어려운 기술 기반 요소이기 때문에, 줄기세포치료제 분야에서는 다른 바이오의약품 시장과는 달리 주요 제약사들이 단기간 내에 직접 시장에 진입하기 어려운 구조로 분석됩니다.
최근에는 일부 상업화에 성공한 줄기세포치료제 기업들을 중심으로 글로벌 공동연구, 기술이전, 전략적 투자 및 인수합병(M&A)이 점차 확대되고 있으며, 이를 통해 주요 글로벌 제약사들이 간접적으로 시장 참여를 확대해 나가고 있는 흐름이 관찰되고 있습니다. 특히 미국, 유럽, 일본 등 주요 시장에서는 세포치료제에 대한 규제 체계가 점차 정비되고 있으며, 세포외소포체(Exosome) 기반 치료제와 같은 차세대 세포유래 제품에 대한 투자도 증가하고 있습니다.
줄기세포치료제 산업은 여전히 표준화된 생산 플랫폼, 품질관리 기준, 공급망 인프라 등 산업적 기반이 완전히 구축되지 않은 초기 단계에 머물러 있으며, 이에 따라 개발부터 생산, 품질관리, 환자 전달까지 전주기적 요소기술을 통합적으로 확보하고 있는 기업만이 성공적인 제품화를 기대할 수 있는 상황입니다.
당사는 연구개발 초기단계에서부터 대량 배양, 세포 분화, 품질관리, 동결보존, 물류 및 투약에 이르기까지 줄기세포치료제 상업화에 필요한 모든 핵심 기술을 내재화하고 있으며, 이를 바탕으로 글로벌 수준의 경쟁력을 갖춘 세포치료제 개발 기업으로 도약하고 있습니다.
■ 엄격한 규제: 우리나라, 미국과 유럽 등 주요국가에서 줄기세포치료제는 의약품으로 구분되어 식약처의 신약허가 절차에 따라 품목허가를 받고, 허가 후 관리를 받게 됩니다. 또한 시판 시 허가-특허 연계에 따른 후발주자 판매금지, 생명윤리법에 따른 규제도 함께 적용 받아야 하는 특수성이 있으며 보험 약가를 받기 위해서는 경제성평가 및 보험급여등재신청 절차를 진행해야 합니다. 따라서 다른 산업분야에 비해 연구(기초연구, 비임상시험 및 임상시험)에 소요되는 개발기간(약 8~10년)을 준수해야 하는 제약조건이 많은 반면, 최초 개발 성공시에는 진입장벽이 높아 제품의 독점적 지위를 누릴 수 있습니다.
(2) 시장 규모 및 전망
줄기세포치료제를 포함하는 재생의료 분야는 전세계에서 매우 활발히 연구되고 있는 분야입니다. 2024년4분기 Alliance for Regenerative Medicine (ARM) 자료에 따르면 전 세계 세포유전자치료제 개발기업은 2,396개사로 꾸준히 증가하는 추세입니다. 이중 45.6%인1092개사가 북미 지역에 소재하고 있으며 아시아태평양 지역748개사, 유럽 481개사, 기타 지역75개사 순으로 위치해 있음을 알 수 있습니다.
 |
|
세포유전자 치료제 개발사 현황 (developers by headquarter region and therapeutic approach) |
| 출처: ARM, Developer Data - 2024. Q4 |
재생의료진흥재단에서 발간한 ‘재생의료분야 글로벌 시장 동향’ 보고서에 따르면, 글로벌 재생의료 시장은 2015년 약 1조2752억원에서 2020년 약 10조3986억원으로 연간 54.1% 성장했습니다. 세포조직공학치료제의 경우, 2015년 약 6711억원에서 2020년 약 7조7397억원으로 연간 65.6% 성장한 것으로 나타났으며, 오는 2025년까지는 연 평균 24.5%로 약 23조1792억원, 오는 2030년까지는 연평균 11.2%로 약 39조4113억원까지 성장이 예상되고 있습니다.
 |
|
글로벌 재생의료치료제 시장규모 |
| 출처: 재생의료재단 |
5. 특허 기술 상세 현황
| 국내 | ||||
| 번호 | 발명의 명칭 | 출원일 | 등록일 | 존속기한 |
| 1 | 중간엽 줄기세포 배양 배지 및 이를 이용한 중간엽줄기세포의 배양 방법 | 2006-04-24 | 2009-07-13 | 2026-04-24 |
| 2 | 중간엽 줄기세포를 포함하는 운동신경원질환 치료용 조성물및 치료방법 | 2006-11-28 | 2009-02-27 | 2026-11-28 |
| 3 | 연골줄기세포를 유효성분으로 포함하는 골질환 치료용 또는 항염증용 약제학적 조성물 | 2010-01-15 | 2012-06-14 | 2030-01-15 |
| 4 | 중간엽 기질세포 배양용 항산화 조성물 및 이의 용도 | 2012-02-29 | 2014-06-16 | 2032-02-29 |
| 5 | 인간 골수 유래 중간엽 줄기세포를 유효성분으로 포함하는 자가면역질환의 예방 또는 치료용 약제학적 조성물 | 2016-02-26 | 2020-02-28 | 2034-07-30 |
| 6 | 동결보존효과가 개선된 줄기세포 동결보존용 조성물 및 이를 이용한 방법 | 2017-03-28 | 2019-02-26 | 2037-03-28 |
| 7 | 자가면역질환 치료에 대한 유효성 예측용 바이오마커, 진단키트 및 치료용 용도 | 2018-06-15 | 2020-02-03 | 2038-06-15 |
| 8 | 단백질 키나아제 C 활성화제로 처리된 줄기세포 또는 그 배양물을 포함하는 자가면역질환 예방 또는 치료용 약학적 조성물 | 2018-11-09 | 2020-11-11 | 2038-11-09 |
| 9 | 중간엽줄기세포의 증식 및 이동 능력 예측용 바이오마커 및 이의 용도 | 2018-11-09 | 2020-08-04 | 2038-11-09 |
| 10 | 중간엽줄기세포의 전신홍반루푸스 치료효과 예측용 바이오마커 조성물 | 2019-10-02 | 2021-04-14 | 2039-10-02 |
| 11 | 중간엽줄기세포의 신장섬유화 치료효과 예측용 바이오마커 조성물 | 2019-10-02 | 2021-04-14 | 2039-10-02 |
| 12 | 나권형 세포 배양용기 및 이를 이용한 세포 배양시스템 | 2020-08-20 | 2023-01-02 | 2040-08-20 |
| 13 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 세포를 다량 확보하는 분화방법 | 2019-10-16 | 2021-08-26 | 2039-10-16 |
| 14 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 희소돌기아교세포를 다량 확보하는 분화방법 | 2020-12-17 | 2024-03-20 | 2040-12-17 |
| 15 | 삼차원 뇌 오가노이드 유래 신경 줄기세포 및 그의 용도 | 2021-08-24 | 2022-11-14 | 2039-10-16 |
| 16 | 삼차원 시상하부 오가노이드로부터 유래된 신경줄기세포를 포함하는 노인성 질환 예방 및 치료용 약학 조성물 및 그의 용도 | 2022-05-20 | - | - |
| 17 | 커큐민 및 진세노사이드를 포함하는 약학 조성물 및 이의 제형 | 2023-02-10 | - | - |
| 18 | 인간 만능 줄기세포로부터 3D 오가노이드를 이용하여 미세교세포를 다량 확보하는 미세교세포의 분화방법 | 2023-11-16 | 2024-03-28 | 2040-12-16 |
| 19 | 인게놀-3-안젤레이트로 처리된 줄기세포를 포함하는 자가면역질환 치료용 약학적 조성물 | 2023-12-01 | - | - |
| 20 | 중간엽 줄기세포 유래 세포외 소포체 및 이의 용도 | 2024-06-27 | - | - |
| 21 | 줄기세포 및 인공 뇌척수액을 포함하는 약제학적 제제 | 2024-12-24 | - | - |
| 해외 | ||||||
| 번호 | 발명의 명칭 | PCT출원일 | 출원국 | 국내출원일 | 국내등록일 | 존속기한 |
| 1 | 중간엽 줄기세포를 포함하는 운동신경원질환 치료용 조성물 및 치료 방법 | 2006-11-28 | 미국(US) | 2008-11-24 | 2012-10-02 | 2029-06-05 |
| 2 | 자가면역질환 치료에 대한 유효성 예측용 바이오마커, 진단키트 및 치료용 용도 | 2019-06-13 | 유럽(EP) | 2020-12-14 | - | - |
| 3 | 일본(JP) | 2020-12-14 | 2023-02-24 | 2039-06-13 | ||
| 4 | 중간엽줄기세포의 증식 및 이동 능력 예측용 바이오마커 및 이의 용도 | 2019-11-06 | 유럽(EP) | 2021-05-07 | - | - |
| 5 | 일본(JP) | 2021-05-10 | 2022-12-07 | 2039-11-06 | ||
| 6 | 단백질 키나아제 C 활성화제로 처리된 줄기세포 또는 그 배양물을 포함하는 자가면역질환 예방 또는 치료용 약학적 조성물 | 2019-11-06 | 유럽(EP) | 2021-05-07 | - | - |
| 7 | 일본(JP) | 2021-05-10 | 2023-05-10 | 2039-11-06 | ||
| 8 | 미국(US) | 2021-05-07 | - | - | ||
| 9 | 중간엽줄기세포의 전신홍반루푸스 치료효과 예측용 바이오마커 조성물 | 2020-09-29 | 유럽(EP) | 2022-04-29 | - | - |
| 10 | 중간엽줄기세포의 신장섬유화 치료효과 예측용 바이오마커 조성물 | 2020-09-29 | 유럽(EP) | 2022-04-07 | - | - |
| 11 | 미국(US) | 2022-03-31 | - | - | ||
| 12 | 중간엽 줄기세포를 포함하는 퇴행성 신경계 질환의 치료용 조성물 | 2021-01-08 | 미국(US) | 2022-07-07 | - | - |
| 13 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 세포를 다량 확보하는 분화방법 | 2020-01-13 | 미국(US) | 2022-07-12 | - | - |
| 14 | 일본(JP) | 2022-07-11 | 2024-11-12 | 2040-01-13 | ||
| 15 | 유럽(EP) | 2022-08-12 | - | - | ||
| 16 | 인간 만능 줄기세포로부터 3D 오가노이드를 이용하여 미세교세포를 다량 확보하는 미세교세포의 분화방법 | 2020-12-17 | 미국(US) | 2022-06-16 | - | - |
| 17 | 일본(JP) | 2022-06-09 | 2024-08-07 | 2024-12-17 | ||
| 18 | 유럽(EP) | 2022-07-08 | - | - | ||
| 19 | 인간 만능 줄기세포로부터 제작된 3D 오가노이드를 해체하여 희소돌기아교세포를 다량 확보하는 분화방법 | 2020-12-17 | 일본(JP) | 2022-06-09 | 2024-07-11 | 2040-12-17 |
| 20 | 유럽(EP) | 2022-07-08 | - | - | ||
| 21 | 나권형 세포 배양용기 및 이를 이용한 세포 배양시스템 | 2021-08-23 | 미국(US) | 2024-02-22 | - | - |
| 22 | 커큐민 및 진세노사이드를 포함하는 약학 조성물 및 이의 제형 | 2023-02-10 | 미국(US) | 2024-08-08 | - | - |
| 23 | 유럽(EP) | 2024-09-09 | - | - | ||
| 24 | 삼차원 시상하부 오가노이드로부터 유래된 신경줄기세포를 포함하는 노인성 질환 예방 및 치료용 약학 조성물 및 그의 용도 | 2023-05-19 | 미국(US) | 2024-11-19 | - | - |
| 25 | 일본(JP) | 2024-11-15 | - | - | ||
| 26 | 유럽(EP) | 2024-12-05 | - | - | ||
| 27 | 중국(CN) | 2024-11-20 | - | - | ||
| 28 | 호주(AU) | 2024-12-02 | - | - | ||
| 29 | 캐나다(CA) | 2024-11-19 | - | - | ||
| 30 | 중간엽 줄기세포 유래 세포외 소포체 및 이의 용도 | 2024-06-27 | PCT | 2024-06-27 | - | - |
6. 핵심 연구인력(상세)
| 구분 | 성명 | 소속(직위) | 최종학위 | 주요경력 | 주요프로젝트 |
|---|---|---|---|---|---|
| 1 | 김경숙 | 연구소 상임고문 |
박사 (한양대 의학) |
진단검사의학과 전문의 한양대 의생명과학연구원 연구부교수 한양대 정신건강연구소 연구조교수 오송첨단의료복합단지 신약개발 지원센터 자문위원 카톨릭의대 산부인과학교실 연구전임의 양평길병원 진단검사의학과 과장 |
루게릭병 줄기세포치료제 개발 골관절염 줄기세포치료제 개발 루푸스 줄기세포 치료제 개발 다계통위축증 줄기세포치료제 개발 임상용 줄기세포 배양액 개발 대량 세포배양시스템 개발 |
| 2 | 송시환 | 비임상CRO 사업부 사장 |
박사 (서울대 수의학) |
한국화학연구소 선임연구원 ㈜켐온 대표이사 |
KIT의 GLP 시스템구축 관련 동물실험책임자 및 시험책임자 보건복지부과제: 천연물을 이용한 알레르기 관절염 치료제의 산업부과제: 경구용 내성 진균감염 치료제 개발 연구책임자 식약처과제: 천초근을 이용한 발암성시험 연구책임자 과학기술부과제: 현장활용 가능 독성스크리닝 시스템구축 및 식약처과제: 천연물의 NTP 독성시험 과제 책임자 |
| 3 | 이령아 | 연구개발 혁신본부 본부장 |
박사 (이화여대 의학) |
이화여대 의학과 박사 서울대학교 외과 전임의 및 임상의학연구소 연구 전임의 Thomas Jefferson University, Kimmel cancer center 연수 원자력병원 외과 과장 이화여자대학교 의과대학 교수 이화여자대학교 의과대학 외과학교실 주임교수 이대목동병원 대장암 센터장 |
본인 요청에 의한 미기재 |
| 4 | 이태용 | 중앙연구소 연구소장 |
박사 (충북대 응용약학) |
코아스템 세포치료제 QC 팀장 코아스템 세포치료제 제조관리 팀장 코아스템 세포치료제 QC/QA 팀장 코아스템 세포치료 공정혁신 팀장 코아스템 중앙연구소 연구소장 |
루게릭병 줄기세포치료제 개발 골관절염 줄기세포치료제 개발 루푸스 줄기세포치료제 개발 다계통위축증 줄기세포치료제 개발 임상용 줄기세포 배양액 개발 대량 세포배양시스템 개발 |
| 5 | 김문순 | 비임상연구소장 | 석사 (충북대 약학) |
한국생명공학연구원 연구원 ㈜켐온 약리약효시험책임자 ㈜켐온 비임상연구소 신뢰성보증업무책임자 GLP본부장/운영책임자 |
본인 요청에 의한 미기재 |
| 6 | 이용상 | 헬스케어본부 본부장 |
박사 (서울대 농생명공학) |
식품의약품안전처 서울청 / 유해물질분석과 / 과장 ㈜인바이오 / 생명과학연구소 / 연구소장 / CTO Tunas Sawa Erma(Indonesia) / 연구책임자 / GM ㈜LG화학 / 생명과학 정밀화학 제형개발 파트장 한국화학연구원 / 스크리닝연구부 코아스템켐온 춘천연구소 연구소장 |
본인 요청에 의한 미기재 |
7. 회사의 현황
1. 바이오의약품사업부
(1) 영업개황 및 사업부문의 구분
(가) 영업개황
당사는 줄기세포치료제의 개발, 제조 및 공급 등의 사업 영위를 목적으로2003년 12월 30일에 설립되었습니다. 또한 2015년 6월 26일자로 코스닥시장에 상장되어 매매가 개시되었습니다.
당사의 바이오의약품사업부는 줄기세포기술을 기반으로 희귀ㆍ난치성질환에 대한 새로운 줄기세포 치료제를 개발, 생산 및 판매를 영위하고 있습니다. 당사는 전세계에서5번째로 줄기세포치료제의 상용화에 성공하여 2015년 2월말부터 환자에게 투약을 개시하였습니다. 또한 희귀ㆍ난치성 질환 등에 대한 줄기세포치료제들을 신규로 개발하고 있습니다. 또한2세대(차세대) 줄기세포치료제에 대한 기초연구와 공정자동화기술의 연구 및 개발을 진행하고 있습니다.
(나) 공시대상 사업부문의 구분
당사는 줄기세포치료제의 개발, 제조 및 판매를 영위하고 있습니다.
| 사업부문 | 품 목 | 구체적용도 | 주요상표 등 |
| 줄기세포치료제 | 루게릭병치료제 등 | 희귀난치성 질환 치료제 | 뉴로나타-알주 |
(2) 시장점유율
현재 정확한 시장규모 및 시장점유율을 알 수 있는 신뢰성 있는 객관적인 자료를 확보하기 어려운 상황이어서 기재를 생략합니다.
(3) 시장의 특성
(가) 줄기세포치료제 시장
현재 품목허가를 받은 줄기세포치료제는 모두 성체줄기세포 기술에 기반하고 있습니다. 향후 배아줄기세포 또는 역분화줄기세포 기반의2세대 줄기세포치료제 기술로 발전하겠지만 비임상 및 임상시험 단계를 거쳐 안전성과 유효성 등을 확인하는 개발기간을 고려한다면, 앞으로 최소5~10년간은 현재와 같이 성체줄기세포 중심의 줄기세포치료제가 시장을 주도할 것으로 예상됩니다.
| [전 세계 줄기세포치료제 품목허가 현황] |
| 업체명 | 제품명 | 주원료 세포구분 | 대상질환 | 허가연월 | 허가국가 |
| 파미셀 | 하티셀그램-AMI |
자가골수유래 중간엽줄기세포 |
급성심근경색 환자에서 좌심실구혈률 개선 |
2011.07 | 한국 |
| 메디포스트 | 카티스템 |
동종제대혈유래 중간엽줄기세포 |
골관절염 환자의 무릎연골 결손 치료 |
2012.01 | 한국 |
| 안트로젠 | 큐피스템 |
자가지방유래 중간엽줄기세포 |
크론성 누공 | 2012.01 | 한국 |
| Osiris Therapeutics (JCR Pharmaceuticals) |
Prochymal (Temcell) |
동종골수유래 중간엽줄기세포 |
GvHD (이식편대숙주질환) |
2012.05 2012.06 |
캐나다 뉴질랜드 |
| 테루모 | 하트시트 |
자가골격근유래 줄기세포 |
중증심부전 | 2015.09 | 일본(조건부승인) |
| 코아스템켐온 | 뉴로나타-알 |
자가골수유래 중간엽줄기세포 |
근위축성측삭경화증 (루게릭병) |
2014.07 | 한국 |
| Chiesi | Holoclar | 자가각막유래 줄기세포 |
화상에 의한 눈 질환 | 2015.02 | 유럽 |
| Stempeutics Research | Stempeucel | 동종골수유래 중간엽줄기세포 |
중증하지허혈, 무릎 골관절염, |
2016.05 2020.08 |
인도 |
| Takeda Pharma | Alofisel |
동종지방유래 줄기세포 |
크론성 누공 |
2018.03 2021.09 |
유럽 일본 |
| Nipro | Stemirac |
자가골수유래 중간엽줄기세포 |
척수손상환자 | 2018.12 | 일본 |
| Gamida Cell Ltd. | OMISIRGE |
동종제대혈유래 조혈전구세포 |
골수절제 조절요법 후 제대혈 이식이 예정된 혈액암 환자 |
2023.04 | 미국 |
| Mesoblast, Inc. | Ryoncil | 동종골수유래 중간엽기질세포 | 스테로이드-불응 이식편대숙주병(SR-aGVHD) | 2024.12 | 미국 |
| (출처: 대한민국 식약처(MFDS), 미국 식약처(FDA), 유럽 식약처(EMA), 인도 식약처(DCGI) 및 일본 식약처(PMDA)) |
제약산업을 둘러싼 규제환경에도 불구하고 제약산업은 타 산업에 비해 경기변동에 비탄력적인 모습을 보이고 있어 꾸준한 성장이 기대됩니다. 의약품의 가격이 수급에 절대적으로 의존하고 있지 않아, 경쟁구조가 산업위험에 미치는 영향이 크지 않고, 국민보건과 관련된 산업으로 기본적인 국가의 정책적 지원을 받는 점 등이 긍정적 요인으로 작용하고 있습니다. 또한 고령화 사회, 건강에 대한 관심 증대로 인하여 지속적인 성장 요인을 갖고 있다고 할 수 있습니다.
특히 희귀 난치성 질환의 경우 기존에 질환을 치료할 수 있는 의약품이나 대체 치료제가 거의 없는 형편이기 때문에 치료제가 출시되어 실제 치료가 시작되면 그 수요는 외부의 경기변동에 의한 영향을 별로 받지 않을 것으로 예상됩니다.
줄기세포치료제는 정부의 육성의지 재개, 해외 대비 허가 규정의 조기 세팅 및 국내 대형병원들의 특성화센터 중심 환자 적용 경험 등 이머징(emerging) 바이오의약 분야 중 성장 토대가 상대적으로 견고하게 다져지고 있는 분야입니다. 국내에서 총10여개 내외의 전문 기업들이 다양한 난치성 질환에 대한 임상시험을 수행 중이며, 향후 임상적용 사례의 증가와 함께 보수적 처방 패턴을 탈피하여 처방률의 증가가 예상됩니다. 현재의 난치 질환의 공통적 양상은 단일 작용기전 만으로는 해법이 어려운 경우가 대부분이며 조직 구조적 수복을 요하는 경우가 많아 줄기세포가 갖는 다양한 성장인자 분비능 및 증식능을 통한 접근법이 타당성을 갖습니다. 여기에 국내의 질 높은 병원 인프라와 연계된 해외 환자유치, 메디컬 투어리즘(medical tourism)을 구현할 수 있는 적정 분야라는 점을 최대한 활용한다면 우리나라가 시장을 선도할 잠재력이 있는 분야라고 판단됩니다.
(나) 희귀의약품 시장
현재 WHO의 국제질병분류(International Classification of Diseases 11th Revision, ICD-11)에 등록되어 있는 희귀질환은 5,500여종이며, 특정 증상이 보고된 사례들까지 합하면8,000여종에 이르는 희귀질환이 존재하는 것으로 추정되고 있습니다. 전 세계 약 4억명의 환자들이 희귀질환을 앓고 있는 것으로 추정되며 미국에서만 총 2천5백만명이 희귀질환으로 투병 중에 있습니다. 또 매년 250개의 새로운 희귀질환이 등장하고 있는 것으로 보고되고 있습니다. 전 세계 많은 국가들이 희귀의약품 개발과 관련한 여러가지 인센티브들 즉, 조건부 승인, 신속한 허가, 높은 수준의 보험급여 및 독점기간 보장 등을 제공하고 있기 때문에 이를 활용하고 다수의 희귀질환에 작용하는 신약이 출시될 경우 블록버스터급 약물 개발도 가능할 것으로 예상됩니다. 한국혁신의약품컨소시엄에서 분석한 자료에 의하면, 희귀의약품은 비희귀의약품보다 승인 성공확률은 약 3배 정도 높고 임상개발 비용은 대략 절반 정도 낮은 것으로 파악되어 제약회사 입장에서 리스크를 줄일 수 있는 것으로 파악됩니다. 또한, 지난 5년간 FDA의 희귀의약품 지정률은 50%를 상회하였으며, 특히 2023년 승인 신약의 60%는 희귀의약품으로 지정 받았을 정도로 희귀의약품에 대한 관심은 여전히 높습니다. 글로벌 제약·바이오 시장분석 전문기관 Evaluate가 지난해 발표한‘2024 희귀의약품 보고서(Orphan Drug Report 2024; Orphan Drugs are Losing Their Sparkle)’에 따르면 전세계 희귀의약품 시장규모는 2028년에는 약 2,700억 달러에 이를 것으로 전망되고 있습니다. 또한, Precedence Research에 따르면 글로벌 희귀의약품 시장 규모는 2024년에 1,930억 달러로 추산되며, 2034년에는 약 6,000억 달러에 도달할 것으로 예상되어 2024년에서 2034년까지 연평균 성장률 12.20%로 확대될 것으로 전망되고 있습니다.
 |
|
희귀의약품과 비희귀의약품 성공확률 및 임상 개발 비용 비교 |
 |
|
희귀의약품 시장 성장률 |
(4) 신규사업 등의 내용 및 전망
(가) iPSC-derived NSC/Astrocyte
현재 파킨슨병 치료제 시장은 글로벌데이터에 따르면, 세계의 파킨슨병 치료제 시장 규모는 2024년 55억 6,000만 달러로 추정되고, 2029년에는 66억 3,000만 달러에 이를 것으로 예측되며, 예측 기간 중(2024-2029년) CAGR은 3.58%에서 성장할 전망입니다. 이에 반해 현재 치료 옵션은 초기 증상, 진행 단계 환자에서 발생하는 운동 변동 통제에 효과적이지 않기 때문에 효능과 전달 시스템을 개선하고, 질병을 수정하는 이익을 제공하는 약품에 대한 미충족 요구가 크다고 할 수 있습니다. 당사는 iPSC-derived Neural Stem cell과 Astocyte cell line을 이용하여 파킨슨병 치료제 개발을 진행하고 있으며 전임상 시험에서 효과를 확인한 후 추가 효력 및 독성 시험을 병행하고 있습니다. 전임상 자료가 확보되는 시점에 맞춰 임상 1/2상을 계획하고 있습니다.
(나) NMO
시신경 척수염 (Neuromyelitis Optica, NMO)은 평생 재발하는 중추신경계 자가면역성 질환으로 높은 재발율과 사망률을 보이는 희귀질환 중 하나입니다. 시신경 척수염 치료제로 승인된 기존 약물을 포함하여 현재 개발 중인 치료제는 재발 예방에 초점을 맞춘 약물이라 할 수 있으며, 신경 회복 및 장애 회복에 초점을 맞춘 치료제는 전무하다고 할 수 있습니다.
시신경 척수염의 발병 원인(자가 항체에 의한 중추신경계 내의 면역 활성화)을 고려 시 Multiple targeting을 통한 면역 반응 조절이 필요하며, 이는 다양한 성장 인자 및 cytokine을 분비하고 면역 활성도를 제어할 수 있는 줄기세포 치료제가 대안이 될 수 있습니다.
당사는 여러 연구에서 확인된 중간엽줄기세포의 수초 재생 효과에 착안하여 시신경 척수염 질환에 줄기세포 치료제 개발에 착수하였습니다. 현재 다양한 전임상 시험에서 면역 반응 조절 및 신경세포 보호, 항염증, 수초화 보호작용 등의 효과를 확인하였으며 분포시험, 단회 및 반복투여 독성시험, 종양원성시험, 면역독성시험을 통한 안전성을 확인하였습니다. 당사는 선행 연구 및 제조 경험을 바탕으로 중증 재발 항아쿠아포린4 항체 양성 시신경척수염 범주질환 환자에서 동종골수유래 중간엽줄기세포의 안전성 및 내약성을 평가하기 위한 제 1상 임상시험을2024.06.05자로 식약처 승인을 받아 같은 해 임상시험 개시 미팅을 완료하였으며 오송 ATMP (Advanced Therapy Medicinal Products, ATMP) 가동 시점인 내년 1분기 임상 개시를 계획하고 있습니다.
(다) IPF
특발성 폐섬유화증 (Idiopathic Pulmonary Fibrosis)은 아직 밝혀지지 않은 원인에 의한 폐손상 후 상처 치유과정의 이상으로 섬유화가 지속적으로 과도하게 일어나는 질환으로, 폐이식 외에는 생존할 수 있는 치료법이 없어 효과적인 치료법의 개발이 시급합니다. 현재 특발성 폐섬유화증 치료를 위해 항섬유화 효과가 있는 퍼페니돈(pirfenidone)과 닌테다닙(nintedanib)이라는 약제를 사용하나, 이들 약제는 질병의 진행 속도를 지연하는 효과가 있는 것으로 입증되었고 아직까지 이 질병을 완치할 수 있는 약물은 없습니다. 당사는 중간엽줄기세포에서 유래된 세포외소포체 (Extracelluar Vesicles)를 이용하여 특발성 폐섬유화증 치료제 개발을 진행 중이며 전임상 자료가 확보되는 시점에 맞춰 임상 1/2상을 계획하고 있습니다.
(5) 보유기술 및 핵심 파이프라인
(가) 기반 기술
당사는 난치성 질환에 대한 줄기세포치료제의 연구개발 및 상용화와 관련된 아래의 4가지 핵심기술들을 기반으로 난치성 질환에 대한 줄기세포치료제의 연구개발 및 상용화를 진행하고 있고, 관련하여 세포 외 소포체 용도 등 4건의 특허 출원과 배양 및 분화 기술에 대한 특허 3건, 바이오 마커 특허 4건, 세포동결, 보존 기술 특허 4건 등을 포함하여 국내외 26건의 지적 재산권을 보유하고 있습니다.
ㆍ세포치료제 개발 기술
ㆍ세포치료제 공정 기술
ㆍ역가 및 안정성 최적화를 위한 원료 기술
ㆍ전임상 평가기술
(나) 핵심 파이프라인
| 바이오의약품사업부 줄기세포치료제 파이프라인 |
| 제품명 | 대상질환 및 치료제의 특징 | 개발현황 |
| 뉴로나타-알 |
루게릭병(근위축성측삭경화증, ALS) - 루게릭병 환자 신체 기능 개선을 입증한 최초의 치료제 - 신경계 질환에서 세계 최초 줄기세포치료제 |
의약품 품목허가(2014.7) 처방개시(2015.1) 3상 임상승인(2015.4) 미국FDA 희귀의약품지정 승인 (2018. 08) 유럽 EMA 희귀의약품지정(2019.03) 미국FDA 3상 임상시험계획 승인(2020.07) 현탁화제 변경 1상 임상시험승인(2022.08) 국내 3상 대상자 등록 완료 (2023.07) 임상 3상 IDMC 임상 지속 권고 (2024.01) 현탁화제 변경 IDMC 현탁화제로 변경 권고(2024.02) 임상 3상 관찰 종료 (2024.10) 국내 제조판매품목 첨가제(현탁화제) 변경 허가(2024.11) 국내 품목변경허가 신청서 제출(2025.04) |
| CE111BR16 |
다계통위축증(MSA) - MSA 줄기세포치료 임상연구 수행 - 기존 치료제 없는 질환 |
임상승인(2016.6) 임상 1상 개시(2018.6) |
| CE211BR19 |
소뇌실조증(CA) - 기존 치료제 없는 질환 - 줄기세포를 이용한 소뇌실조증 치료제 중 |
연구자임상시험 승인(2019.10) 연구자임상 개시, 진행 중(2019.10) 연구자임상 환자 방문 완료(2022.07) 연구자임상 결과보고서 최종화 승인(2023.02) |
| CE211AT15 |
전신홍반루푸스(SLE) 줄기세포를 이용한 루푸스 치료제 중 |
임상승인(2015.5) 임상 1상 종료(2019.08) 연구자 임상시험 종료(2021.11) 연구자 임상시험 결과보고서 최종화 승인(2022.08) |
| CE223BR17 |
파킨슨 병(PD) 역분화줄기세포에서 유래된 NSC/Astrocyte를 이용, |
비임상 시험 |
| CE211NS21 |
시신경척수염(NMO) 동종골수유래 중간엽줄기세포 치료제를 활용한 |
비임상 시험 임상 1상 신청(2023.12) 임상1상 승인(2024.06) |
| EV231NU20 |
특발성 폐섬유증(IPF) 세포외소포 (EV)를 이용, 섬유증 치료에 비임상 연구 수행 |
비임상 시험 |
2. 비임상CRO사업부
(1) 영업개황 및 사업부문의 구분
(가) 영업개황
코아스템켐온㈜ 비임상CRO 사업부는 경기도 용인시 처인구 양지면에 위치한 연구소를 기반으로 신약 개발 및 관련 산업 분야에 필수적인 비임상시험 및 연구 서비스를 제공합니다. 주요 서비스는 독성시험, 유효성 평가, 약물·독성동태학, 환경영향평가, 분석평가 등이며, 고객 맞춤형 시험 수행을 통해 신약 및 기타 의약품의 국내외 인허가에 필요한 핵심 자료를 제공합니다.
2000년 비임상 사업을 시작한 이후, 코아스템켐온㈜ 비임상CRO 사업부는 50건 이상의 국내외 신약 허가 및 해외 임상시험에 필요한 자료를 성공적으로 제공하며 신뢰받는 시험기관으로 자리매김했습니다. 국내 최초 민간 비임상시험기관으로서 GLP(Good Laboratory Practice) 기준을 충족하는 첨단 시험시설과 숙련된 연구 인력을 보유하고 있으며, 표준작업지침서(SOP)에 따라 모든 시험을 철저히 수행하고 있습니다.
비임상시험 서비스는 단순한 자료 제공에 그치지 않고, 초기 독성 스크리닝부터 완제품 개발에 이르기까지 전 주기에 걸친 컨설팅과 지원을 포함합니다. 합성물질, 천연물, 바이오의약품 등 다양한 원료에 대한 유효성 및 독성시험 경험을 바탕으로, Cytochrome P450 등 종간 차이에 따른 임상시험의 잠재적 문제에도 적극 대응할 수 있는 역량을 갖추고 있습니다. 또한, 합성의약품(small molecules)과 바이오의약품(biologics)의 특성을 고려한 맞춤형 독성시험 설계가 가능합니다.
의약품뿐만 아니라 식품, 화장품, 의료기기, 농약 등 다양한 화학물질 및 바이오의약품의 안전성과 유효성 평가도 수행하며, 시험동물뿐만 아니라 유전자, 세포, 장기, 식물 등 다양한 시험계를 활용한 정밀 분석을 제공합니다. 이는 국민 건강과 생명을 지키는 기반 인프라로서, 사회적 공익성과 산업적 필요성을 동시에 충족하는 역할을 수행하고 있습니다.
특히 글로벌 경쟁력 강화를 위해 영장류를 활용한 독성시험, 고난이도 유효성 및 약물동태학 평가 등 고기술 기반 시험 역량을 확보하였으며, 화학물질 등록 및 위해성 평가와 관련한 국내외 법률(예: 화학물질 등록 및 평가 등에 관한 법률, 화평법)에 따른 위해성 평가 자료 생산 체계도 구축했습니다. 이러한 역량은 국내 신약 허가는 물론 미국, 유럽 등 주요 해외 규제기관에 제출되는 임상시험 허가 자료로도 활용되고 있습니다.
코아스템켐온㈜ 비임상CRO 사업부는 대규모 제조설비 없이 연구소, 시험시설, 장비를 기반으로 전문 연구대행 서비스를 제공하며, 제약기업들이 연구개발 과정에서 인력, 장비, 비용 부담을 줄이고 핵심 역량에 집중할 수 있도록 지원합니다. 이러한 비임상시험 외주 수요는 지속 증가하고 있으며, 이는 글로벌 바이오 산업의 일반적인 추세입니다.
이러한 시장 환경 속에서 코아스템켐온㈜ 비임상CRO 사업부는 연구개발의 효율성과 품질을 동시에 제공하는 신뢰받는 파트너로 자리매김하고 있으며, 앞으로도 지속적인 기술 고도화와 글로벌 네트워크 확장을 통해 바이오 산업의 성장 동력으로서 핵심 역할을 수행할 것입니다.
(나) 공시대상 사업부문의 구분
|
주요사업 (당국의 인허가가 필요한 모든 물질) |
세부사업 |
| 안전성(독성, 부작용) 평가 | In vitro/vivo 독성시험 / 환경독성시험 / 첨단대체독성시험 / 의료기기 |
| 안전성 약리 평가 | 중추신경계시험 / 심혈관계시험 / 호흡기계시험 / 추적시험 / 일반약리시험 |
| 효능(유효성, 약효) 평가 | 효능평가시험수행 및 개발 / 기전시험(MOA) / 질환모델동물 / 동반진단 / 의료기기 |
| 병리 및 분석 평가 | 조직병리 및 임상병리 / 흡수, 분포, 대사, 배설시험 /조제물 분석 / 생분해성시험 |
(2) 임상수탁기관(CRO, Contract Research Organization) 산업 개요
임상수탁기관(CRO)은 제약, 생명공학, 의료기기 산업 분야에서 계약을 통해 연구개발(R&D) 서비스를 제공하는 전문 회사로, 본질적으로 의뢰자가 외부에 아웃소싱하는 신약 개발 파트너 역할을 수행합니다. ICH에 따르면, CRO는 “의뢰자와 계약을 맺어 의뢰자의 임상시험 관련 의무 및 기능 중 하나 이상을 수행하는 개인 또는 조직”으로 정의됩니다. CRO 산업은 1980년대 초 제약사들이 내부 연구 역량의 한계를 경험하면서 본격적으로 발전하기 시작했습니다. 당시 대부분의 제약사는 연구개발 활동을 사내에서 직접 수행했으나, 급증하는 R&D 수요를 자체적으로 감당하기 어려워지면서 외부 지원이 필요해졌고, 이러한 배경 속에서 최초의 CRO들이 등장했습니다. 1980년대 후반에는 미국 식품의약국(FDA) 등 주요 규제 기관이 외부 위탁 모델을 공식 인정하여 의뢰자가 CRO에 임상시험 의무를 이전할 수 있도록 허용하는 규정을 마련했습니다. 이후 신약 개발 비용과 복잡성이 증가함에 따라 제약 및 생명공학 산업에서는 연구개발 업무를 CRO에 아웃소싱하는 경향이 지속적으로 확대되었고, 이에 따라 CRO 산업은 빠르게 성장했습니다. 2022년 기준 글로벌 임상 서비스 계약 지출은 약 500억 달러에 달합니다. 현재 CRO는 신약의 초기 발견 단계부터 비임상 시험, 임상시험 계획 및 운영, 데이터 관리 및 통계 분석, 규제 대응 및 허가 준비 등 신약 개발 전 과정에 걸쳐 포괄적인 서비스를 제공하며, 이러한 통합 서비스는 의뢰자가 신약 개발에 따른 비용과 리스크를 절감하고, 개발 속도를 가속화하는 데 크게 기여하고 있습니다.
(3) 비임상 CRO 서비스 개요
비임상 CRO는 신약 개발 초기 단계에서 후보물질 발굴부터 안전성 평가까지 전문적이고 통합된 연구개발 서비스를 제공합니다. 의뢰자는 후보물질 최적화, ADME(흡수·분포·대사·배설) 분석, 약리작용 검증, 급성·반복투여·생식·유전·발암성 독성시험, 약동학(PK) 평가 등 다양한 시험을 비임상 CRO에 위탁해 후보물질의 유효성과 안전성을 사전에 평가하고 임상 진입에 필요한 자료를 확보할 수 있습니다.
많은 비임상 CRO는 화합물, 생물학적 제제, 바이오시밀러, 세포·유전자 치료제 등 다양한 제형과 기술 플랫폼에 특화된 시험 역량을 갖추고 있으며, GLP(Good Laboratory Practice) 기준에 따라 독성시험을 수행하고 글로벌 규제 요건에 맞는 시험 설계와 문서화도 지원합니다. 의뢰자는 특정 분야에 특화된 비임상 CRO를 개별 활용하거나, 전체 비임상 프로그램을 통합 운영하는 비임상 CRO와 전략적 파트너십을 맺기도 합니다. 예를 들어, 한 기관이 동물모델 기반 독성시험을 수행하는 동안 다른 기관이 약물 대사 및 잔류물 분석을 담당하는 협업 사례가 일반적입니다. 주요 서비스에는 후보물질 스크리닝, 기초 약리시험, ADME 및 약동학 분석, 급성·만성 독성시험, 유전독성·생식독성·발암성 시험, 면역독성 평가, 생체분포 및 조직 축적 시험, 안전약리학 평가, 시험물질 분석, 비임상 연구 보고서 작성 및 규제 문서화 지원 등이 포함됩니다. 비임상 CRO는 신속하고 정확한 비임상 데이터 확보로 의뢰자의 개발 리스크를 줄이고 효율성을 높이는 데 중요한 역할을 합니다. 또한, 특수 질병 모델, 인간화 마우스 모델, 제브라피쉬 스크리닝 플랫폼 등 첨단 기술과 모델을 활용해 맞춤형 시험을 진행합니다. 최근에는 환자 암세포에서 유래한 3차원 세포 배양체인 환자 유래 오가노이드(PDO)와 환자 유래 이종이식 모델 등 다양한 In Vivo 및 In Vitro 모델을 활용하며, 이는 바이오 제약사, 정부, 학계, 의료기기 회사 등에서 질병 연구와 치료법 개발에 적극 활용되고 있습니다. 비임상 CRO는 FDA 등 규제 기관의 요구를 충족하며, 인체와 유사한 해부학적·생리학적 환경을 가진 살아있는 동물 모델로 후보물질의 안전성과 효능을 평가합니다. 생물분석, DMPK 연구, 화학 분석, 안전성 약리학 시험 등 신약 개발 전반에 걸친 서비스를 제공하며, 임상 진입 전 연구개발의 핵심 파트너로 자리매김하고 있습니다.
(4) 비임상 CRO 활용의 주요 이점
제약 및 생명공학 회사들은 연구개발 프로젝트를 CRO에 아웃소싱하는 경우가 점점 늘어나고 있습니다. CRO와의 파트너십이 제공하는 주요 이점은 속도와 효율성, 비용 효율성, 전문 지식, 유연성과 집중력입니다. 우선, 자격을 갖춘 CRO는 확립된 프로세스와 숙련된 인력, 준비된 인프라를 통해 연구를 신속하게 본격 운영할 수 있어 연구 시작과 실행 일정을 가속화할 수 있습니다. 둘째, 아웃소싱은 고정비용을 변동비용으로 전환하여 전체 연구개발(R&D) 비용을 절감할 수 있으며, 활용도가 낮은 대규모 영구 팀 유지 비용을 줄이고 필요 시에만 서비스 비용을 지불함으로써 자본 지출을 감소시킵니다. 셋째, CRO는 다양한 의뢰자와의 연구 경험을 바탕으로 폭넓은 전문성을 축적하고, 생물통계학, 약동학, 데이터 과학, 규제 업무 전문가 등을 통해 내부에서 확보하기 어려운 전문 역량을 제공합니다. 마지막으로, 아웃소싱은 프로젝트 요구에 따라 CRO 리소스를 신속히 확장하거나 축소할 수 있는 운영 유연성을 제공하며, 의뢰자는 핵심 역량에 집중하고 운영 업무는 CRO에 위임함으로써 효율성을 극대화할 수 있습니다.
(5) 비임상 CRO 산업 분석 및 시장 동향
비임상 CRO 서비스는 신약 개발자의 연구 운영 역량을 크게 향상시키는 속도, 비용 효율성, 전문 지식, 유연성의 강력한 조합을 제공합니다. 산업 분석에 따르면 연구개발(R&D)을 비임상 CRO 서비스에 아웃소싱하는 것은 자본 수요를 줄이고 개발 일정을 단축하여 비용 효율성을 높이는 효과가 있습니다. 비임상 CRO 서비스에 따른 물질의 안전성을 입증하는 데이터를 제공하면, 의뢰자는 이를 바탕으로 임상시험계획(IND)을 제출하여 임상시험 단계로 진입할 수 있습니다. 오늘날 제약 연구개발 환경에서 비임상 CRO 서비스는 없어서는 안 될 연구개발 파트너로 자리 잡았으며, 새로운 치료법을 환자에게 전달하기까지 필요한 운영 역량과 전문 지식을 제공합니다. 적절한 비임상 CRO 서비스를 선정하고 견고한 파트너십을 유지함으로써 제약 기업은 연구개발 프로그램을 가속화하고 환자에게 신속히 새로운 치료법을 제공할 수 있습니다. 비임상 CRO 서비스는 신약 개발 여정의 촉매제 역할을 하며, 적합한 파트너는 팀의 연장선처럼 과학적 계획을 실질적인 성과로 전환합니다. 명확한 기대치 설정, 원활한 소통, 품질에 대한 공동의 약속을 바탕으로 의뢰자와 비임상 CRO 서비스 간 협력은 연구 성공의 강력한 동력이 될 수 있습니다.
시장 규모와 성장 전망을 살펴보면, 비임상 CRO 서비스 시장은 최근 몇 년 동안 크게 성장하여 2024년 약 57억 달러, 2025년 약 62억 6천만 달러에 이를 것으로 예상되며, 연평균 성장률(CAGR) 9.9%를 기록할 전망입니다. 과거 성장의 주요 원인으로는 신속한 약물 개발, 비용 절감 전략, 핵심 역량 집중, 규제 준수 강화, 임상 시험의 세계화 등이 있으며, 앞으로는 맞춤형 의학의 확대, 희귀질환 및 희귀 의약품에 대한 집중, 바이오의약품 아웃소싱 증가, 바이오마커 연구 중요성 증대, RWE(real-world evidence) 생성 수요 증가 등이 성장을 견인할 것으로 보입니다. 또한 인공지능(AI) 기술 통합, 종양학 연구 확대, 오믹스(omics) 기술 발전, 고도화된 시험관 내 및 생체 내 모델 개발, 중개 연구 협력 강화 등도 주요 동향으로 나타날 전망입니다.
시장 세분화 측면에서 비임상 CRO 서비스 시장은 서비스별, 유형별, 동물 모델별, 모델 시스템별, 그리고 최종 사용자별로 구분됩니다. 서비스별로는 생물분석 및 DMPK 연구, 독성시험, 화합물 관리, 화학, 안전성 약리학, 기타 서비스로 나뉩니다. 생물분석 및 DMPK 연구는 약동학 연구, 약력학 연구, 약물 대사 연구로 세분화되며, 독성 시험은 급성, 만성, 생식 독성 시험 등으로 구분됩니다. 화합물 관리는 시료 관리, 재고 관리, 제형 서비스로, 화학 분야는 의약화학, 분석화학, 합성화학으로 세분화됩니다. 안전성 약리학은 심혈관, 중추신경계, 호흡기 안전성 연구로 구분되고, 기타 서비스에는 규제 컨설팅, 프로젝트 관리, 데이터 관리 서비스가 포함됩니다. 유형별로는 환자 유래 오가노이드(PDO) 모델과 환자 유래 이종이식 모델이 있으며, 동물 모델별로는 소동물 및 대동물 모델로 나누어집니다. 모델 시스템별로는 생체 내(In Vivo)와 시험관 내(In Vitro) 시스템으로 구분됩니다. 최종 사용자별로는 바이오제약회사, 정부 및 학술 기관, 의료기기 회사, 기타 최종 사용자로 분류됩니다.
이처럼 비임상 CRO 서비스 산업은 신약 개발 과정에서 핵심적인 역할을 수행하며, 빠르게 성장하는 시장과 다양한 세분화를 바탕으로 앞으로도 제약 및 생명과학 분야의 혁신을 지원하는 중추적 파트너로 자리매김할 것입니다.
 |
|
글로벌 비임상cro 시장규모 및 전망 |
출처: https://www.thebusinessresearchcompany.com/report/preclinical-cro-global-market-report
(6) 비임상 시험 수요와 아웃소싱의 증가
비임상 시험 수요 증가는 비임상 CRO 시장 성장의 중요한 원동력입니다. 비임상 시험은 임상시험에 앞서 약물이나 치료법의 안전성과 유효성을 평가하기 위한 모든 연구를 포함하며, 신약 개발에서 핵심적인 역할을 수행합니다. 최근 규제 기관의 안전성과 효능에 대한 요구가 강화되면서 비임상 시험의 중요성은 더욱 커지고 있습니다. 연구의 복잡성이 증가하고 전문 기술 확보가 어려워지면서, 비임상 연구를 전문 CRO에 아웃소싱하는 사례가 늘어나고 있으며, 이를 통해 기업은 필요한 전문성을 확보하고 핵심 비즈니스에 집중할 수 있게 되었습니다.
비임상 CRO의 최신 트렌드로는 다음과 같은 사항들이 있습니다. 첫째, 글로벌 확장과 아웃소싱의 확대입니다. 비임상 CRO는 전 세계적으로 운영 범위를 넓히고 있으며, 기업들은 비용 효율적인 솔루션을 찾기 위해 아시아 태평양 지역으로 비임상 업무를 확대하는 추세입니다. 둘째, 인공지능(AI), 고처리량 스크리닝, 고급 분석 기술 등 혁신적인 기술 도입으로 연구의 효율성과 효과를 높이고 경쟁 우위를 확보하고 있습니다. 셋째, 면역 항암학, 유전자 치료, 정밀 의학 등 전문 치료 분야에 대한 집중도가 높아지고 있습니다. 넷째, 전략적 제휴 및 합병이 활발히 이루어져 서비스 역량을 강화하고 지리적 범위를 확대함으로써 비임상부터 임상시험까지 엔드 투 엔드(end-to-end) 솔루션 제공을 목표로 하고 있습니다.
비임상 CRO의 주요 사용 사례로는 약물 안전성 및 효능 검사, 다양한 치료 분야 지원, 초기 연구 및 개념 증명, 그리고 규정 준수 및 제출 지원 등이 있습니다. 특히 종양학, 신경학, 심장학 등 다양한 치료 분야에서 서비스를 제공하며, 암 치료제와 같은 전문 분야에 대한 수요가 꾸준히 증가하고 있습니다. 또한 새로운 치료법의 잠재적 효능과 대상 집단을 결정하는 개념 증명 연구 역시 신약 개발에서 중요한 역할을 합니다. 아울러 비임상 CRO는 FDA, EMA 등 주요 규제 당국의 요구 사항을 충족하며 성공적인 약물 승인 과정을 지원합니다.
비임상 CRO 시장은 신약 개발 초기 단계에서 중요한 역할을 수행하며, 신약 개발 투자 증가, 아웃소싱 확산, 만성 질환 유병률 증가 등의 요인으로 지속해서 성장할 전망입니다. 북미와 아시아 태평양 지역은 각각 첨단 의료 인프라와 비용 효율성 덕분에 시장에서 핵심적인 역할을 할 것으로 기대되며, 기술 발전과 전략적 제휴, 합병이 시장 경쟁 환경을 형성하고 있습니다.
 |
|
신약 개발 단계 |
출처: https://www.tracercro.com/early-phase-clinical-trials/
(7) 신규사업 등의 내용 및 전망
코아스템켐온㈜ 비임상 CRO 사업부는 국내외 제약 및 바이오 기업과의 협력을 통해 안전하고 효과적인 의약품 개발을 지원하고 있으며, 핵심 사업으로는 안전성 및 유효성 평가 서비스를 제공하고 있습니다. 이러한 핵심 역량을 바탕으로 글로벌 제약사 및 바이오 기업들의 신약 개발을 뒷받침하고 있으며, 최근에는 글로벌 빅파마들의 변화하는 요구와 시장 동향을 반영하여 기존 비임상 서비스 외에도 다양한 부가 서비스를 제공하고자 하는 전략을 수립하고 있습니다.
기업의 빠른 성과 창출과 다양한 서비스 제공을 위해 비임상 CRO 사업부는 여러 방면에서 비임상 서비스를 확장하고 있습니다. 먼저, 신약 후보물질의 선별 및 초기 개발 과정에서 기술적 우위성을 입증할 수 있도록 Hit/Lead 발견 및 초기 후보물질에 대한 Panel 서비스를 확대하고 있습니다. 또한, 임상 중단의 주요 원인인 부작용을 줄이기 위해 심독성 등 비임상 지원 서비스를 강화하여 보다 정교한 안전성 평가와 대응이 가능하도록 하고 있습니다.
차세대 바이오 의약품의 개발을 지원하기 위해 비임상 서비스 범위를 확장하고 있으며, 질환별 이너서클 시스템을 구축하여 각 질환에 특화된 연구 및 개발 전략을 적용함으로써 시험의 전문성을 강화하고 있습니다. 이와 함께, 지속형 약물전달시스템(DDS) 기반 플랫폼 기술 지원, 제네릭 의약품 개발, 제형 변경에 따른 부작용 대응 등 신약과 개량신약 개발 전반에 걸친 서비스를 확대하고 있습니다.
첨단 기술을 활용한 Organoid, Organ-on-a-Chip 기반 대체시험 서비스도 적극 도입하고 있습니다. 이를 통해 안전성 약리, 유전독성 및 유효성 검증에 있어 최신 기법을 활용하고 있으며, 동물실험에 사용하는 동물 수를 줄이는 동시에 빅데이터 기반 신약개발 및 AI 적용을 통해 부가가치를 높이고 있습니다.
글로벌 경쟁력 강화를 위한 전략의 일환으로, 미국에 위치한 Corestemchemon US를 통해 해외 수주를 확대하고 있으며, 글로벌 네트워크를 지속적으로 확장하고 있습니다. 또한, 바이오의약품 연구개발에 필수적인 고품질 게잡이 원숭이 공급 시스템을 구축함으로써 국내 연구환경의 자립성과 효율성을 높이고 있습니다.
이와 더불어, 각국의 규제 요건에 부합하는 신약 개발을 돕기 위해 인허가 컨설팅 서비스도 확대하고 있으며, 제약사들이 글로벌 시장에서 성공적으로 제품을 출시할 수 있도록 전방위적 지원을 제공하고 있습니다.
비임상 CRO 사업부는 코로나19 팬데믹 기간 동안 일시적으로 감소한 수주에 대응하여, 지속적인 서비스 다각화와 혁신을 추진하고 있습니다. 이를 통해 글로벌 R&D 전략의 핵심 거점으로 자리매김하고 있으며, 차별화된 기술력과 전문성을 기반으로 비임상 CRO 시장에서의 입지를 강화해 나가고 있습니다. 다양한 신규 서비스를 통해 고객 맞춤형 솔루션을 제공함으로써 향후 비임상 CRO 사업의 성장을 더욱 가속화할 것으로 기대됩니다.
앞으로도 코아스템켐온㈜ 비임상 CRO 사업부는 제약 및 바이오 산업의 변화를 선도하는 핵심 파트너로서의 역할을 지속적으로 강화하며, 글로벌 시장에서의 경쟁력을 더욱 높여 나갈 것입니다.
(가) 평가서비스 컨설팅 사업
비임상 시험은 신약 개발에서 중요한 단계로, 비임상CRO 사업부는 이 분야에서의 깊은 노하우와 비임상 전문가 풀을 바탕으로 신약 개발을 위한 컨설팅 서비스를 제공합니다. 과거에는 기밀 유지를 위해 개발하려는 화합물에 대한 정보를 공개하지 않고, 국책 과제 일정에 맞추어 불필요한 시험을 진행하는 경우가 많았습니다. 이로 인해 연구 비용이 낭비되고 신약 개발 일정이 지연되는 문제가 발생했었습니다. 이를 해결하기 위해, 비임상CRO 사업부는 그동안의 경험을 토대로 연구와 시험을 신속하게 진행하고, R&D 기업과의 원활한 소통을 통해 신약 개발이 임상 단계에 진입할 때 실패하지 않도록 철저하게 지원하는 역할을 수행하고 있습니다.
또한, 비임상CRO 사업부는 동남아시아 국가들이 GLP 시스템 구축을 원하는 경우에 대해서도 전문적인 컨설팅 서비스를 제공하고 있습니다. 이를 통해 동남아시아 시장으로의 진출과 매출 확대를 목표로 하고 있으며, GLP 시스템 구축을 비롯한 다양한 컨설팅 서비스를 통해 글로벌 시장에서의 입지를 강화해 나가고 있습니다. 한국에서는 컨설팅 서비스가 무료로 제공되는 경향이 있었지만, 비임상CRO 사업부는 이제 컨설팅의 가치를 정당히 평가하고, 이를 중개 수수료가 아닌 실질적인 매출로 연결될 수 있는 시스템을 구축하고 있습니다.
2018년에 설립된 컨설팅 센터는 신약 개발 컨설팅뿐만 아니라 GLP 시스템 구축, 실험동물 사육 시스템 구축 등 다양한 서비스를 제공하고 있으며, 연구개발서비스협회에 가입하여 기업의 가치를 높이는 활동도 활발히 진행하고 있습니다. 이를 통해 GLP에 대한 교육 및 컨설팅을 제공하며 추가적인 매출도 발생하고 있습니다. 앞으로는 인재와 시스템을 지속적으로 확충하여 컨설팅 센터를 강화하고, 더욱 많은 기업들이 신뢰할 수 있는 파트너로 자리매김할 수 있도록 지원할 것입니다.
이러한 컨설팅 사업을 통해 비임상CRO 사업부는 신약 개발 파트너로서의 입지를 더욱 확고히 다지며, 연구와 개발의 효율성을 높이고 성공적인 임상 진입을 위한 든든한 지원을 계속해서 제공할 것입니다.
(나) 실험동물 모델 제작 및 판매
① 사업 배경
비임상CRO 사업부는 실험동물 모델 제작 및 판매를 위한 전략을 수립하고, 기존 국책 과제와의 협업을 통해 질환 모델 개발에 성공했습니다. 이로 인해, 개발된 질환 모델은 비임상CRO 사업부에서 활용하고 보급할 수 있는 시스템을 구축하였으며, 향후에도 지속적으로 새로운 동물 모델을 개발할 계획입니다.
현재 국내 실험동물 관리에 대한 문제와 나고야의정서 발효로 인한 해외 생명자원 이용에 대한 경제적 손실 및 동물 자원 확보 경쟁 심화가 중요한 이슈로 떠오르고 있습니다. 많은 국내 연구에서 실험동물은 개별 연구에만 사용되고 공유되지 않아, 고부가가치 연구 자원이 방치되는 경우가 많습니다. 또한, 나고야의정서 발효로 실험동물 사용에 대한 규제가 강화되고, 비용이 증가할 것으로 예상되는 상황에서 국내 실험동물 개발의 필요성이 더욱 커지고 있습니다.
이러한 상황을 해결하기 위해, 비임상CRO 사업부는 실험동물 모델 제작 및 공급을 통한 국내 실험동물 자원의 효율적 활용을 목표로 하고 있습니다. 특히, 국내 실험동물 시설의 국제 인증을 받는 것이 필수적인 상황에서, 많은 시설들이 미국실험동물관리평가인증협회(AAALAC)의 인증을 받고 있으나, 인증에 따른 로열티와 기타 비용이 해외로 유출되는 문제를 인식하고 있습니다. 이에 따라 정부는 국가 R&D 기반 자원 확보를 위한 제도적 장치를 마련하고 있으며, 비임상CRO 사업부는 이와 연계하여 국가 기관에서 상용화가 어려운 대량의 모델 동물을 선정, 생산, 공급하는 역할을 맡고 있습니다.
비임상CRO 사업부는 정부 주도 R&D 사업과 협력하여, 식품의약품안전처 인허가에 필요한 비임상 유효성 및 안전성 시험자료에 적합한 다양한 질환 모델동물을 제공하며, 이를 통해 국가 수준의 연구개발에 기여하고자 합니다. 실험동물 모델 제작 및 판매 사업을 통해 국내 실험동물 자원의 효율적인 활용을 촉진하고, 글로벌 경쟁력을 확보할 수 있는 기반을 마련하고 있습니다.
② 서비스 개요
비임상CRO 사업부는 실험동물 모델 제작 및 판매 서비스를 두 가지 주요 방향으로 발전시키고 있습니다. 첫 번째 방향은 수술이나 약물을 이용한 질환 모델을 대량으로 제작하여 공급하는 사업입니다. 과거에는 비만 유도 동물, 치매 유발 동물 등 일부 질환 모델을 간헐적으로 제공했으나, 새로 구축된 동물실을 활용하여 대량 생산 및 공급 서비스를 본격적으로 확대할 계획입니다. 이를 통해 연구자들이 필요한 실험동물을 보다 효율적이고 지속적으로 확보할 수 있도록 지원할 예정입니다.
두 번째 방향은 기존 국책 과제를 수행하는 기관과의 협업을 통해 새로운 표준화된 동물을 공급하는 서비스입니다. 단순히 표준화된 동물을 개발하는 것에 그치지 않고, 물리적으로 수행이 어려운 연구 분야에 대한 연구자들의 요구를 충족시키기 위해 대량 모델동물 생산 시스템을 구축할 계획입니다. 또한, 질병검사 데이터를 활용하여 맞춤형 모델동물을 제작하고, 이를 연구자들에게 공급하는 서비스를 제공함으로써 보다 고도화된 연구 환경을 지원하고자 합니다.
특히, 현재 해외에서 의존하고 있는 유전자 변형 동물은 가격이 높고 연구에 필요한 실험동물을 충분히 확보하기 어려운 상황입니다. 이에 비임상CRO 사업부는 보다 경제적이고 효율적인 모델동물 공급을 통해 연구자들의 요구를 충족시키고, 연구의 한계를 극복할 수 있도록 노력하고 있습니다. 이를 통해 연구 개발에 필요한 실험동물을 안정적으로 공급하며, 실험동물 모델 제작 및 판매 분야에서의 경쟁력을 강화해 나갈 것입니다.
③ 실험동물 사용 현황
농림축산검역본부가 지난 7월 2일 발표한 「2024년도 동물실험윤리위원회 운영실적 및 실태조사 결과 보고서」에 따르면, 지난 한 해 동안 국내 실험기관에서 의약품, 화학물질, 식품, 교육 등의 목적으로 수행된 동물실험에 사용된 동물의 수는 총 459만 2,958마리로 나타났습니다. 이는 2015년 실태조사 발표 당시 250만 마리였던 것과 비교할 때, 10년 사이 200만 마리 이상 증가한 수치로, 동물실험에 대한 의존도가 지속적으로 증가하고 있음을 보여줍니다.
실험동물 수는 지난 10년 동안 꾸준히 증가해 왔으며, 특히 2020년부터는 3년 연속으로 최대치를 경신하였습니다. 2022년에는 약 499만 5,600마리에 달해 역대 최대치를 기록하였고, 2023년과 2024년에도 460만 마리 수준을 유지하고 있습니다. 동물종별로는 설치류가 가장 많이 사용되어 406만 7,518마리였으며, 이 중 실험용 생쥐(마우스)가 374만 4,411마리로 전체의 81.5%를 차지하였습니다. 그 외에도 어류 26만 5,177마리, 조류 13만 9,034마리, 개·고양이 등 기타 포유류 8만 4,795마리, 토끼 2만 7,605마리, 원숭이류 3,961마리, 양서류 3,944마리, 파충류 924마리가 실험에 이용되었습니다.
이들 동물 중 가장 높은 수준의 고통 등급에 해당하는 ‘E등급’ 실험에 사용된 동물은 236만 4,100마리로, 전체의 51.5%를 차지하였습니다. 여기에 ‘D등급’(고통, 억압, 스트레스 동반) 실험에 동원된 131만 5,849마리를 포함하면, 전체 실험동물의 80% 이상이 심각한 고통을 겪은 것으로 나타났습니다. 이는 미국이나 유럽연합에서 D·E등급 동물실험 비율이 10~20% 수준인 것과 비교할 때, 우리나라는 상대적으로 고통이 큰 실험에 많이 의존하고 있는 것으로 분석됩니다.
 |
|
실험동물 사용량 |
출처 : 농림축산검역본부
(다) PDX 사업을 통한 맞춤형 진단시장 진출
① 사업 배경
환자 파생 이종 이식편(PDX) 모델 시장은 생의학 연구 및 제약 개발 분야에서 중요한 역할을 하고 있으며, 특히 암 연구에서 그 가치는 더욱 부각되고 있습니다. PDX 모델은 인간 종양을 면역 저하 마우스에 이식하여 연구자들이 임상 환경에서 실제 환자의 종양을 실험할 수 있게 해줍니다. 이는 전통적인 세포주 모델보다 인간 종양의 거동을 더 정확히 재현할 수 있어, 암 치료 연구와 신약 개발에서 점차 중요한 도구로 자리잡고 있습니다. 미국 국립보건원(NIH)의 보고서에 따르면 암은 여전히 전 세계에서 사망의 주요 원인으로, 2020년에는 1천만 명 이상의 사망자를 초래했으며, 이러한 상황에서 PDX 모델과 같은 효과적인 연구 도구에 대한 필요성이 더욱 강조됩니다.
최근 몇 년 간 PDX 모델 시장은 생명공학의 발전과 암 연구에 대한 투자가 증가함에 따라 빠르게 성장하고 있습니다. 2021년 Global PDX Models 시장 규모는 약 3억 5천만 달러였으며, 2030년까지 8억 달러 이상에 도달할 것으로 예상되며, 예측 기간 동안 연평균 성장률(CAGR)은 약 12%로 예상됩니다. 이는 암 발병률 증가와 개인화된 의약 접근법에 대한 수요 증가에 기인하고 있으며, 다중 요법을 동시에 테스트하고 치료 조합의 효능을 평가하는 등의 장점으로 인해 PDX 모델에 대한 수요가 높아지고 있습니다.
PDX 모델의 중요한 특성 중 하나는 종양 미세환경을 재현할 수 있습니다는 점입니다. 종양과 그 주변 기질 간의 상호작용은 암의 진행과 치료 반응에 중요한 영향을 미칩니다. PDX 모델은 이러한 종양 미세환경을 보다 실제적으로 재현하여, 연구자들이 다양한 치료법이 실제 환자 환경에서 어떻게 작용할 수 있는지에 대한 중요한 통찰을 제공하며, 약물 개발과정의 효율성을 높이는 데 기여하고 있습니다.
비임상CRO 사업부는 PDX 모델을 활용한 맞춤형 암 치료 솔루션을 제공하고자 합니다. 암은 다양한 유형과 유전자 변이, 암의 위치에 따라 치료법이 달라지기 때문에, 기존의 항암효능검사 기술만으로는 환자에게 최적의 치료제를 찾는 데 한계가 있습니다. 이에 따라, 비임상CRO 사업부는 실제 암 환자의 조직을 활용한 시험계 제작 및 평가 검사 시스템을 구축하여, 환자 맞춤형 항암제 선택을 지원하는 동반진단 시스템을 개발하고 있습니다. 이러한 시스템을 통해 신약 개발 과정에서의 실패율을 낮추고, 각 환자에게 가장 적합한 항암제를 찾을 수 있는 모델을 제공하는 것이 목표입니다.
따라서, 비임상CRO 사업부는 PDX 모델을 기반으로 한 맞춤형 진단 시장에 적극적으로 진출하고 있으며, 이를 통해 암 치료의 개인화 및 신약 개발의 성공률을 높이는 데 기여하고 있습니다.
② 서비스 개요
비임상 CRO 사업부는 "환자 맞춤형 동물 모델(PDX, Patient-Derived Xenograft)"을 활용하여 암 면역 치료 및 항암제 개발에 중요한 역할을 하는 맞춤형 진단 시장에 진출하고 있습니다. PDX 모델은 환자 유래 암세포를 면역 결핍 동물에 이식하여 만들어지며, 암 환자의 유전적, 생리적, 환경적 특성을 최대한 반영하여 실험 환경을 구성합니다. 이를 통해 연구자들은 환자 개개인의 암 특성에 맞춘 항암제의 효과를 평가하고, 보다 개인화된 치료 방법을 개발할 수 있습니다.
비임상 CRO 사업부는 이러한 맞춤형 동물 모델을 구축하기 위한 유전자 분석 시스템을 보유하고 있으며, 유전자 및 세포 치료제의 비임상 시험을 적극적으로 진행하고 있습니다. 현재 주로 폐암과 대장암에 중점을 두고 연구를 진행 중이며, 이들 암은 한국인에게 많이 발생하는 주요 암으로, 개인 맞춤형 항암제 선정 및 효과 평가에 중요한 모델이 됩니다. 이를 바탕으로 암 환자 유래 맞춤형 이종이식 동물 모델을 개발하고 있으며, 이를 통해 보다 정교한 맞춤형 항암 치료법을 찾고 있습니다.
비임상 CRO 사업부는 이러한 PDX 모델을 활용하여 신속하게 치료 범위를 확대하고 있으며, 이를 통해 암 면역 치료와 항암제 개발의 성공률을 높이는 것을 목표로 하고 있습니다. 또한, 적절한 협력업체와의 협업 방안을 적극적으로 검토하여, 맞춤형 진단 시장에서의 입지를 강화하고 있습니다. 이를 통해, 환자 맞춤형 치료법을 개발하고, 암 치료의 개인화 및 신약 개발의 효율성을 높이기 위한 중요한 기반을 마련하고 있습니다.
③ 시장 현황
환자 파생 이종 이식/PDX 모델 시장은 최근 몇 년 동안 빠르게 성장하고 있으며, 2022년에는 약 15억 달러 규모로 평가되었습니다. 이 시장은 2030년까지 38억 달러에 이를 것으로 예상되며, 연평균 성장률(CAGR)은 약 12.0%에 이를 것으로 보입니다. PDX 모델은 암의 생물학적 행동을 실제 환경에서 시뮬레이션할 수 있는 중요한 도구로, 암 연구 및 약물 개발에 필수적인 역할을 하고 있습니다.
PDX 모델은 인간 종양을 면역 결핍 동물에 이식하여 환자 특유의 암 생물학을 유지하면서, 치료 반응을 정확하게 예측할 수 있는 환경을 제공합니다. 이는 전통적인 세포주 모델과 비교할 때 유전적 이질성과 복잡성을 그대로 유지함으로써, 보다 실제적인 암 연구를 가능하게 만듭니다. 제약 및 생명 공학 회사들은 PDX 모델을 활용하여 새로운 약물 후보를 선별하고, 개별 환자에게 맞춤형 치료를 개발하는 데 집중하고 있습니다.
시장 성장은 암 유병률 증가, 생명 공학 기술 발전, 개인화된 암 치료에 대한 수요 증가에 의해 더욱 가속화되고 있습니다. 2020년에는 전 세계적으로 1,900만 건 이상의 새로운 암 사례가 발생했으며, 이에 따라 더 효과적인 암 연구 모델에 대한 필요성이 급증하고 있습니다. PDX 모델은 암 약물 발견 과정에서 중요한 역할을 하며, 고급 바이오마커 기술과의 통합을 통해 연구자들이 더 나은 예측 가능성으로 약물의 효능을 테스트할 수 있게 도와줍니다.
PDX 모델은 제약, 생명 공학, 학술 연구 분야에서 광범위하게 활용되며, 특히 제약 회사들이 종양학 약물의 효능을 테스트하고 개발 프로세스를 가속화하는 데 중요한 도구로 사용됩니다. 또한, 계약 연구 기관(CROs)은 제약 회사에 아웃소싱 서비스를 제공하여 약물 개발 과정을 촉진하고 있습니다. 이러한 추세는 PDX 모델의 시장 성장과 맞춤형 진단 시장으로의 진출을 더욱 강화하고 있으며, 암 치료의 개인화 및 신약 개발에 중요한 기여를 하고 있습니다.
(라) Organoid 및 Organ-on-a-Chip 플랫폼 기술을 통한 비임상시험 대체시험 서비스 시장 진출
① 사업 배경
앞서 언급한 신규 사업 중 하나인 오가노이드(Organoid) 및 오간 온 어 칩(Organ-on-a-Chip)을 이용한 대체시험 서비스에 대해 보다 구체적으로 설명하고자 합니다. 생명공학 및 제약 산업이 빠르게 발전함에 따라, 신약 개발의 효율성과 안전성을 동시에 확보하기 위한 다양한 기술적 접근이 시도되고 있습니다. 기존 동물모델 기반의 비임상시험은 인간 생리와의 차이, 윤리적 이슈, 높은 비용과 긴 소요 시간 등 여러 한계를 지니고 있어, 대체 기술의 필요성이 지속적으로 제기되어 왔습니다. 이러한 배경 속에서 인간의 생리·병리 환경을 정밀하게 모사할 수 있는 플랫폼 기술인 오가노이드 및 오간 온 어 칩 기술이 주목받고 있으며, 이는 비임상시험의 패러다임을 획기적으로 전환할 수 있는 핵심 기술로 부상하고 있습니다.
코아스템켐온㈜ 비임상CRO 사업부는 이미 보유하고 있는 줄기세포치료제 기술을 바탕으로, 오가노이드 및 오간 온 어 칩 기반의 대체 독성시험 서비스를 비임상시험 영역에 적극적으로 적용하고 있습니다. 이를 통해 비임상시험 초기 단계에서의 독성 예측 정확도를 높이고, 선도적인 입지를 구축함과 동시에 해당 시장으로의 본격적인 진출을 모색하고 있습니다.
② 서비스 개요
오가노이드는 줄기세포 또는 조직 유래 세포를 3차원적으로 배양해 실제 장기의 구조와 기능을 모사한 ‘미니 장기’로, 질병 모델링이나 약물 반응 분석에 폭넓게 활용되고 있습니다. 오간 온 어 칩은 미세유체공학 기반 기술을 이용하여 다양한 세포군을 미세 채널 내에서 배양함으로써, 조직 간 상호작용, 혈류, 물질 교환 등을 정밀하게 재현할 수 있는 플랫폼으로, 간, 폐, 신장 등 주요 장기의 생리학적 특성을 반영한 시험 환경을 제공합니다. 이 두 기술은 기존 2D 세포배양 방식이나 동물 모델 대비 뛰어난 예측 가능성과 인간 친화적 데이터를 제공한다는 점에서, 글로벌 제약사 및 연구기관들의 높은 관심을 받고 있습니다.
비임상시험은 신약 개발에 있어 안전성과 유효성을 사전에 검증하는 필수적 단계입니다. 그러나 동물모델 기반 시험은 윤리적 부담과 인간 적용성의 한계로 인해 대체 기술의 필요성이 더욱 부각되고 있으며, 미국 FDA와 유럽 EMA 등 주요 규제기관들도 비동물 기반 시험법에 대한 수용 가능성을 점차 확대하고 있습니다. 특히 유럽연합은 “3R 원칙(Replacement, Reduction, Refinement)”에 입각해 동물시험을 줄이는 방향으로 정책을 추진하고 있으며, 이는 오가노이드 및 오간 온 어 칩 기술 상용화의 흐름을 가속화하고 있습니다.
③ 시장 현황
시장 진출 전략 측면에서 비임상시험 서비스 시장은 CRO 중심으로 형성되어 있으며, 기술력을 기반으로 한 플랫폼 시험 서비스를 제공하는 기업들이 빠르게 성장하고 있습니다. 코아스템켐온㈜ 비임상CRO 사업부는 초기 전략으로 간, 폐, 신장 등 특정 장기에 특화된 모델을 개발하여 맞춤형 약물 테스트 플랫폼을 제공할 계획이며, 이후에는 다양한 장기 모델을 통합한 멀티 organ 시스템 개발, 질환 특이적 모델을 통한 정밀의학 연구 지원, AI 기반 분석 서비스와의 연계를 통해 서비스 범위를 확장하고자 합니다. 또한, 고객 맞춤형 플랫폼 설계, 정량적 시험 결과 리포트 제공, 시험 설계 단계부터의 컨설팅 등 전주기적 서비스를 통해 고객 만족도를 극대화할 방침입니다.
해당 기술을 확보하고 사업화하기 위해서는 고품질 세포 소스의 안정적 확보, 3D 배양 및 미세유체 기술의 고도화, 정량적 데이터 분석 시스템 구축이 필요합니다. 아울러 GMP 수준의 생산시설 구축, 기술 인증 및 국제 규제기관 대응 역량 강화, 글로벌 네트워크 확대 등도 함께 고려되어야 합니다. 코아스템켐온㈜ 비임상CRO 사업부는 국내 바이오기업으로서 정부의 바이오헬스 산업 육성 정책과 R&D 지원 사업을 적극적으로 활용해 이러한 기반을 탄탄히 다지고 있습니다.
오가노이드 및 오간 온 어 칩 기술은 신약 개발 및 질병 연구의 패러다임을 바꾸는 차세대 플랫폼으로서, 기술적 잠재력과 시장 수요 모두에서 지속적인 성장세를 보이고 있습니다. 인간 친화적이고 정밀한 생리 환경 구현을 통해 기존 시험의 한계를 극복하는 동시에, 윤리적·경제적 측면에서도 우수한 대안을 제공하는 이 기술은 향후 바이오 산업의 핵심 경쟁력이 될 것으로 전망됩니다.
코아스템켐온㈜ 비임상CRO 사업부는 지난 7년간 해당 기술의 내재화 및 시험 서비스 고도화를 위해 지속적으로 노력해왔으며, 한국화학연구원, 국가독성평가연구소, 생명공학연구원으로부터 장, 신장, 간 오가노이드 관련 기술을 도입하였습니다. 또한 Organ-on-a-Chip 장비 개발 전문 기업인 맵스젠 등과의 연구개발 협약을 통해 플랫폼 기술 개발 및 신약개발 관련 서비스를 확대하고 있습니다. 이러한 협력과 기술 투자를 바탕으로, 코아스템켐온㈜ 비임상CRO 사업부는 글로벌 비임상시험 시장에서 차별화된 경쟁력을 확보하고, 미래 성장을 위한 핵심 동력을 지속적으로 강화해 나갈 것입니다.
【 전문가의 확인 】
1. 전문가의 확인
해당 사항 없습니다.
2. 전문가와의 이해관계
해당 사항 없습니다.