 |
|
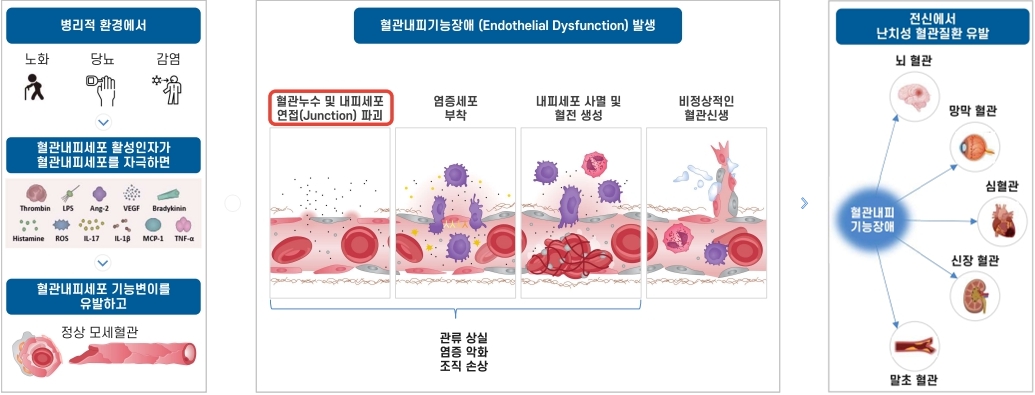
혈관내피기능장애 |
정 정 신 고 (보고)
| 2025년 06월 09일 |
| 1. 정정대상 공시서류 : | 증권신고서(지분증권) |
| 2. 정정대상 공시서류의 최초제출일 : | 2025년 05월 22일 |
| 3. 정정사항 |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
| 2025년 05월 22일 | 증권신고서(지분증권) | 최초 제줄 |
| 2025년 06월 09일 | [기재정정]증권신고서(지분증권) | 기재 정정(파란색) |
| 항 목 | 정정요구ㆍ명령 관련 여부 |
정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|---|
| ※금번 정정사항은 공시서류 기재사항 보완에 따른 정정으로서, 정정사항 확인의 편의를 위해 정정사항은 '굵은 파란색'을 사용하여 기재하였습니다. ※요약정보는 본문의 정정사항을 반영하였으며, 정오표를 별도로 기재하지 않았습니다. ※단순 오타인 경우 별도의 색깔 표시 없이 정정하였습니다. |
||||
| 제1부 모집 또는 매출에 관한 사항 | ||||
| III. 투자위험요소 | ||||
| 1. 사업위험 | ||||
| 가. 국내외 거시경기 침체 및 불확실성이 미치는 위험 | 아니오 | 기재정정 | (주1) 정정 전 | (주1) 정정 후 |
| 다. 파이프라인별 치료제 시장 경쟁 심화에 따른 위험 | 아니오 | 기재정정 | (주2) 정정 전 | (주2) 정정 후 |
| 라. 신규사업(원료의약품 수입, 도소매업) 영위에 따른 위험 | 아니오 | 기재정정 | (주3) 정정 전 | (주3) 정정 후 |
| 마. 정부 정책 및 규제 변화에 따른 위험 | 아니오 | 기재정정 | (주4) 정정 전 | (주4) 정정 후 |
| 바. 신약 개발의 불확실성에 따른 위험 | 아니오 | 기재정정 | (주5) 정정 전 | (주5) 정정 후 |
| 사. 기술이전 및 공동개발 관련 위험 | 아니오 | 기재정정 | (주6) 정정 전 | (주6) 정정 후 |
| 차. 신규 플랫폼 기술 및 항체 신약 개발 관련 특화 위험 | 아니오 | 기재정정 | (주7) 정정 전 | (주7) 정정 후 |
| 2. 회사위험 | ||||
| 가. 관리종목 지정 및 상장폐지 관련 위험 | 아니오 | 기재정정 | (주8) 정정 전 | (주8) 정정 후 |
| 나. 최대주주 지분희석 및 경영권 관련 위험 | 아니오 | 기재정정 | (주9) 정정 전 | (주9) 정정 후 |
| 다. 매출부진 및 지속적 손실 발생 위험 | 아니오 | 기재정정 | (주10) 정정 전 | (주10) 정정 후 |
| 라. 재무안정성 관련 위험 | 아니오 | 기재정정 | (주11) 정정 전 | (주11) 정정 후 |
| 마. 현금흐름 관련 유동성 위험 | 아니오 | 기재정정 | (주12) 정정 전 | (주12) 정정 후 |
| 자. 신규상장 당시 추정 경영실적과 현재 실적의 높은 괴리율 위험 | 아니오 | 기재정정 | - | (주13) 정정 후 |
| 3. 기타위험 | ||||
| 가. 중점심사 유상증자 선정 가능성 및 증권신고서 정정에 따른 일정 지연 관련 위험 | 아니오 | 기재정정 | (주14) 정정 전 | (주14) 정정 후 |
| IV. 인수인의 의견(분석기관의 평가의견) | 아니오 | 기재정정 | (주15) 정정 전 | (주15) 정정 후 |
| V. 자금의 사용목적 | 아니오 | 기재정정 | (주16) 정정 전 | (주16) 정정 후 |
| 제2부 발행인에 관한 사항 | ||||
| III. 재무에 관한 사항 | ||||
| 4. 재무제표 | 아니오 | 기재정정 | (주17) 정정 전 | (주17) 정정 후 |
| X. 그 밖에 투자자 보호를 위하여 필요한 사항 | ||||
| 4. 작성기준일 이후 발생한 주요사항 등 기타사항 | 아니오 | 기재정정 | (주18) 정정 전 | (주18) 정정 후 |
(주1) 정정 전
|
가. 국내외 거시경기 침체 및 불확실성이 미치는 위험 국내외 거시경제 환경의 불확실성이 증대되고 성장세가 둔화될 경우, 이는 당사의 사업 전반에 걸쳐 부정적인 영향을 미칠 수 있습니다. 특히, 당사와 같은 신약 연구개발 회사는 임상시험 환자모집에 대한 수요 감소, 글로벌 빅파마 회사들의 자금경색 등 예기치 못한 상황으로 임상시험이 연기되거나 중단될 위험이 존재하며 이에 따라 당사가 계획하고 있는 기술이전 등의 일정에도 부정적인 영향을 미칠 수 있습니다. 따라서 투자자께서는 국내외 경기 동향, 주요국의 정책 변화, 지정학적 리스크, 국내 정치 상황 등 거시경제 환경 변화가 당사의 사업 및 재무 상태에 미칠 수 있는 잠재적 위험을 충분히 고려하여 투자 결정을 내리시기 바랍니다. |
1) 국내 경기 동향
먼저 국내 경기의 경우, 한국은행이 2025년 02월 발표한 경제전망보고서에 따르면 국내 경제성장률은 2024년 연간 2.0%를 기록하였고, 2025년 1.5% 및 2026년 연간 1.8%로 전망하였습니다. 국내 경제는 국내 정치 및 미국 관세 정책으로 인한 무역 환경 불확실성과 글로벌 무역 갈등의 전개 양상이 가장 큰 불확실성 요인임을 감안할 필요가 있으며, 글로벌 긴축기조 장기화, 부동산 PF 구조조정 영향 확대, 글로벌 자산가격 조정 등 향후 전망경로 상에는 주요국 성장 및 물가흐름과 통화정책 운용, IT경기 확장 속도, 국제유가 및 환율 움직임 등과 관련한 불확실성이 높은상황으로 전망하였습니다.
| [국내 주요 거시경제지표 전망] |
| (단위 : %) |
| 구분 | 2023년 | 2024년(E) | 2025년(E) | ||||
| 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | ||
| GDP | 1.4 | 2.8 | 1.3 | 2.0 | 0.8 | 2.2 | 1.5 |
| 민간소비 | 1.8 | 1.0 | 1.3 | 1.1 | 1.0 | 1.7 | 1.4 |
| 건설투자 | 1.5 | 0.4 | -5.5 | 2.7 | -6.7 | 1.1 | -2.8 |
| 설비투자 | 1.1 | -1.8 | 5.3 | 1.8 | 5.7 | -0.2 | 2.6 |
| 지식재산생산물 투자 | 1.7 | 1.5 | -0.1 | 0.7 | -2.5 | 4.9 | 3.7 |
| 재화수출 | 2.9 | 8.4 | 4.3 | 6.3 | 0.7 | 1.2 | 0.9 |
| 재화수입 | -0.3 | -1.3 | 3.6 | 1.2 | 2.0 | 0.2 | 1.1 |
| 출처) 한국은행 경제전망보고서(2025.02) |
민간소비의 경우, 당분간 심리위축 등으로 부진한 흐름을 보이고 있으나, 2025년 2분기 이후에는 정치 불확실성이 줄어들고 금융요건 완화 영향이 나타나면서 회복될 것으로 예상하였습니다. 설비 투자는 2025년 반도체 장비 투자를 중심으로 완만한 성장세를 나타낼 전망이라고 발표했습니다. 또한 향후에도 주요 대기업의 AI 및 첨단 공정과 생산라인 고도화 관련투자가 이어질 전망이나, 주요국 무역정책 불확실성 및 환율에 따른 수입 자본재 가격 상승 등은 리스크로 잠재해있는 것으로 전망하였습니다. 건설투자는 그간의 수주, 착공 위축의 영향으로 부진할 것으로 전망하였습니다. 수주 및 정부 SOC 예산이 감소한 점, 부동산PF 등의 구조조정의 영향으로 감소세가 지속될 전망이나, 향후에는 선행지표 개선 및 금융여건 완화에 따라 낮은 수준에서 점차 회복세를 보일 것으로 전망하였습니다. 또한 상반기 중 재정 집행, 대단지 아파트 마감 공사 집중 등의 영향에 따른 일시적 공사 물량 증가 등이 상방 압력으로 작용하고 있어, 건설 투자는 2025년 2.8% 감소를 전망하나, 2026년에는 2.5% 증가할 것으로 예상하였습니다.
(중략)
(주1) 정정 후
|
가. 국내외 거시경기 침체 및 불확실성이 미치는 위험 국내외 거시경제 환경의 불확실성이 증대되고 성장세가 둔화될 경우, 이는 당사의 사업 전반에 걸쳐 부정적인 영향을 미칠 수 있습니다. 특히, 당사와 같은 신약 연구개발 회사는 임상시험 환자모집에 대한 수요 감소, 글로벌 빅파마 회사들의 자금경색 등 예기치 못한 상황으로 임상시험이 연기되거나 중단될 위험이 존재하며 이에 따라 당사가 계획하고 있는 기술이전 등의 일정에도 부정적인 영향을 미칠 수 있습니다. 따라서 투자자께서는 국내외 경기 동향, 주요국의 정책 변화, 지정학적 리스크, 국내 정치 상황 등 거시경제 환경 변화가 당사의 사업 및 재무 상태에 미칠 수 있는 잠재적 위험을 충분히 고려하여 투자 결정을 내리시기 바랍니다. |
1) 국내 경기 동향
먼저 국내 경기의 경우, 한국은행이 2025년 05월 발표한 경제전망보고서에 따르면 국내 경제성장률은 2024년 연간 2.0%를 기록하였고, 2025년 0.8% 및 2026년 연간 1.6%로 전망하였습니다. 국내 경제는 2025년 상반기 대내외 불확실성으로 경제심리가 위축된 가운데 건설현장 사고, 기상악화, 대형산불 등 일시적 요인까지 발생하였으며, 정치 불확실성 완화 등으로 반등하겠으나 건설경기 부진과 더딘 소비회복으로 성장세가 당초 예상을 밑돌 전망입니다. 하반기 이후에는 현재까지 진행한 금리인하와 추경의 효과와 더불어 경제심리도 회복되면서 내수가 개선될 것으로 예상하고 있습니다.
수출의 경우, 상호관세 유예, 미·중 관세협상등으로 최근 무역긴장이 다소 완화되었으나 여전히 높은 관세율과 협상 과정의 불확실성 등으로 둔화 흐름을 나타낼 것으로 전망하였습니다.
2026년의 경우 무역전쟁의 여파로 통상환경 악화의 영향이 이어지겠으나 국내 내수를 중심으로 1.6% 성장할 것으로 전망하였습니다.
| [국내 주요 거시경제지표 전망] |
| (단위 : %) |
| 구분 | 2024년 | 2025년(E) | 2026년(E) | ||||
| 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | ||
| GDP | 2.0 | 0.1 | 1.4 | 0.8 | 2.0 | 1.3 | 1.6 |
| 민간소비 | 1.1 | 0.8 | 1.4 | 1.1 | 1.8 | 1.3 | 1.6 |
| 건설투자 | -3.0 | -11.3 | -1.1 | -6.1 | 4.9 | 0.9 | 2.8 |
| 설비투자 | 1.6 | 4.9 | -1.0 | 1.8 | 1.0 | 0.9 | 1.0 |
| 지식재산생산물 투자 | 0.7 | 1.4 | 4.8 | 3.2 | 3.7 | 1.4 | 2.5 |
| 재화수출 | 6.3 | -0.1 | 0.0 | -0.1 | 0.6 | 0.8 | 0.7 |
| 재화수입 | 1.2 | 0.8 | -0.3 | 0.2 | 1.8 | 1.3 | 1.5 |
| 출처) 한국은행 경제전망보고서(2025.05) |
민간소비의 경우, 당분간 심리위축 등으로 부진한 흐름을 보이고 있으나, 2025년 2분기 이후에는 정치 불확실성이 줄어들고 금융요건 완화 영향이 나타나면서 회복될 것으로 예상하였습니다. 가계소득 개선에도 국내외 불확실성 등으로 심리가 위축됨에 따라 부진한 흐름을 보였으나 2025년 5월 이후 외식, 여가 등을 중심으로 개선 조짐을 나타내고 있어 향후 민간소비는 심리가 회복되고 가계소득 개선 및 금리인하 효과가 나타나면서 점차 나아질 것으로 예상하였습니다.
건설투자는 그간 누적된 착공 위축의 여파가 지속되고 대내 불확실성 확대로 인한 분양실적 급감, 작업일수 축소안전관리 강화 등 영향도 가세함에 따라 예상보다 크게 위축되었습니다. 2025년 하반기로 갈수록 금융여건 완화, 심리개선 및 추경으로 부진이 점차 완화되겠으나, 누적된 지방 주택미분양, 상업용 부동산의 만성적 공실 등의 하방요인으로 개선세는 더딜 것으로 전망하였습니다.
설비투자는 높은 불확실성에 따른 기업의 투자 지연 등으로 하방압력이 증대되면서 기계류를 중심으로 감소하였습니다. 2025년 중 설비투자 흐름을 살펴보면, 기계류는 반도체 기업의 첨단공정 투자가 지속되겠으나 비IT 부문의 부진이 심화되며 증가세가 당초 예상을 하회할 것으로 전망하였습니다. 운송장비의 경우, 상반기중 개소세 인하 효과 등으로 법인차 중심의 성장세를 보이다가 2025년 하반기부터는 점차 둔화될 것으로 전망하였습니다.
지식재산생산물 투자의 경우 2025년 상반기 주요 기업의 R&D 투자가 양호한 흐름을 지속하였으나, 소프트웨어 등에 대한 투자가 둔화됨에 따라 완만한 성장을 보였습니다. 향후 기업들의 기술경쟁력 강화 노력, 정부의 첨단산업AI 등 투자 촉진 및 연구개발 예산 본격 집행에 힘입어 성장세가 다시 확대될 것으로 예상하였습니다. 그러나 높아진 대외 불확실성을 향후 기업의 투자에 하방리스크 요인으로 전망하였습니다.
(중략)
(주2) 정정 전
| 다. 파이프라인별 치료제 시장 경쟁 심화에 따른 위험 당사가 주력으로 연구개발하고 있는 혈관내피기능장애 관련 질환 치료제 시장은 전 세계적인 인구 고령화, 당뇨병 등 만성질환 환자 수 증가, 삶의 질 향상에 대한 관심 증대 등으로 인해 지속적인 성장이 예상되는 분야입니다. 그러나 한편으로는 글로벌 제약사 및 다수의 바이오 기업들이 혁신 신약 개발을 위해 치열하게 경쟁하고 있으며, 각국 정부의 약가 규제 강화, 새로운 치료 기술 및 플랫폼의 등장 등으로 인해 산업 성장성이 예상에 미치지 못하거나 시장 환경이 급변할 가능성도 존재합니다. 당사가 주력하는 혈관 질환 및 염증성 질환 분야에서도 새로운 병태생리 기전이 규명되고 혁신적인 치료 기술들이 지속적으로 연구개발되고 있습니다. 만약 당사가 현재 개발 중인 파이프라인보다 현저하게 우수한 새로운 치료법이나 기술이 등장하여 기존 치료 패러다임을 바꿀 경우, 당사 파이프라인의 시장 가치가 급격히 하락하거나 개발 자체가 무의미해질 수 있습니다. 당사는 최신 연구 동향 및 기술 발전을 지속적으로 모니터링하고 연구개발 전략에 반영하여 미래 시장 변화에 대응하고자 노력하고 있으나, 기술 변화의 속도와 방향을 예측하는 것은 매우 어려우며, 당사가 이러한 변화에 신속하고 효과적으로 대응하지 못할 경우, 개발 중인 파이프라인이 기술적 진부화에 직면하여 투자 가치를 상실할 위험이 있습니다. 투자자께서는 제약·바이오 산업의 빠른 기술 변화 속도와 이로 인한 당사 파이프라인의 경쟁력 약화 가능성에 유의하시기 바랍니다. |
당사가 주력으로 연구개발하고 있는 혈관내피기능장애 관련 질환 치료제 시장은 전 세계적인 인구 고령화, 당뇨병 등 만성질환 환자 수 증가, 삶의 질 향상에 대한 관심 증대 등으로 인해 지속적인 성장이 예상되는 분야입니다. 그러나 한편으로는 글로벌 제약사 및 다수의 바이오 기업들이 혁신 신약 개발을 위해 치열하게 경쟁하고 있으며, 각국 정부의 약가 규제 강화, 새로운 치료 기술 및 플랫폼의 등장 등으로 인해 산업 성장성이 예상에 미치지 못하거나 시장 환경이 급변할 가능성도 존재합니다.
혈관내피세포는 혈관의 가장 안쪽을 구성하는 단일 세포층으로 혈관의 구조적 장벽 역할뿐만 아니라 혈관의 항상성 유지, 혈액 응고 조절, 염증 반응 조절 등 다양한 생리적 기능에 중요한 역할을 합니다. 이러한 혈관내피세포의 기능장애는 노화나 당뇨병, 고혈압, 고지혈증, 비만 등 다양한 대사성 질환 및 만성 염증성 질환의 발병 및 진행과 밀접하게 연관되어 있으며, 당뇨병성 황반부종, 당뇨병성 신증, 궤양성 대장염, 습성 황반변성 등 다양한 난치성 질환의 핵심적인 병태생리 기전 중 하나로 인식되고 있습니다.
| [혈관내피기능장애 발생 구조도] |
|
| 출처) 당사 제시 |
당뇨병성 황반부종 치료제 시장의 경우, 국제 당뇨병 연맹의 2021년 보고서에 따르면 전 세계 당뇨병 유병 인구는 2021년 약 5억 3,700만 명에서 2045년 약 7억 8,300만 명으로 증가할 전망이며, 이 중 상당수가 당뇨병성 황반부종으로 진행될 가능성이 있습니다. 당뇨병성 황반부종과 습성 황반변성 등 망막질환 치료로는 항혈관내피세포성장인자 주사제(Anti-VEGF)가 표준 치료법으로 사용되고 있으며, 최근에는 이중 특이항체나 투여 간격을 연장시킨 제형들이 개발되어 사용되고 있으나, 여전히 반복적인 안구 내 주사에 대한 부담감과 일부 환자에서의 제한적인 반응으로 인해 새로운 치료 표적 발굴 및 투여 편의성 개선 노력이 지속되고 있습니다.
시장조사기관인 글로벌데이터의 2023년 11월 보고서(Global Data Drug Forecast and Market Analysis(2022))는 미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본 등 주요 7개국 당뇨병성 황반부종 및 습성 황반변성 치료제 시장이 2021년 약 128억 달러에서 2031년 약 339억 달러로 연평균 10.3% 성장할 것으로 예측했습니다.
| [습성 황반변성 및 당뇨병성 황반부종 치료제 시장 추이] |
|
| 출처) Global Data Drug Forecast and Market Analysis(2022) |
퇴행성 뇌질환 중 가장 높은 발생 비율을 보이는 알츠하이머병은 시장조사기관인 글로벌데이터의 2024년 보고서(Global Data Market Analysis and Sales Forecast 2024)에 따르면 연평균 약 22.3% 성장하여 2033년 약 245억 달러에 이를 것으로 전망됩니다. 뇌 속에서 생성되는 단백질 덩어리인 아밀로이드 베타가 과도하게 축적될 경우 신경 독으로 작용해 뇌의 인지 기능을 떨어뜨리고 알츠하이머병으로까지 발전하게 된다는 아밀로이드 베타 가설에 의해 최근 아밀로이드 베타를 타깃하는 항체 치료제들이 시장에 등장했지만, 두통, 구역감부터 뇌 부종, 혼돈 등의 증상이 나타나는 ARIA 부작용(Amyloid-reated Imaging Abnormality)에 대한 우려, 고비용 등으로 제한적으로 사용되고 있으며, 여전히 1996년에 발매된 경구용 치매 치료제 도네페질이 가장 널리 사용 중입니다. 여전히 신규 치료제에 대한 미충족 수요가 높은 질환입니다. 따라서 알츠하이머병에 대해 기존 치료제와 다른 새로운 기전, 투여 방식으로 접근하는 치료제에 대한 미충족 수요가 매우 높은 실정입니다.
당뇨병성 신증 치료제 시장 또한 성장세가 예상됩니다. 미국 질병통제예방센터의 2023년 보고서에 따르면 미국 성인 당뇨병 환자의 약 37%가 만성 신장 질환을 동반하고 있으며, 시장조사기관인 프레시던스 리서치의 2024년 3월 보고서는 글로벌 당뇨병성 신증 치료제 시장이 2023년 약 35억 달러에서 2033년 약 65억 달러로 연평균 6.4% 성장할 것으로 전망했습니다. 레닌-안지오텐신-알도스테론 시스템 차단제, SGLT-2 억제제, 비스테로이드성 미네랄코르티코이드 수용체 길항제 등이 사용되고 있으나, 여전히 많은 환자들이 말기 신질환으로 진행하고 있어, 보다 효과적인 신장 보호 및 기능 개선 치료제 개발이 시급한 실정입니다.
궤양성 대장염 치료제 시장은 시장조사기관인 포춘 비즈니스 인사이트의 2024년 1월 보고서에 따르면 2023년 약 75억 달러에서 2032년 약 108억 달러로 연평균 4.1% 성장할 것으로 보입니다. 다양한 계열의 치료제가 존재함에도 불구하고, 기존 치료에 불응하거나 반응이 소실되는 환자들이 많아 새로운 작용 기전을 가진 치료제, 특히 안전성과 복용 편의성이 개선된 경구용 치료제에 대한 수요가 높습니다.
상기 시장 전망은 시장조사기관의 분석 자료를 바탕으로 하였으나, 실제 시장 성장세는 예상과 다를 수 있습니다. 신규 경쟁 약물의 예상보다 빠른 출시, 기존 치료제의 특허 만료에 따른 바이오시밀러 또는 제네릭 경쟁 심화, 각국 정부의 급격한 약가 인하 정책 시행, 새로운 치료 패러다임의 등장 등 예기치 못한 변수로 인해 목표 시장의 성장성이 둔화되거나 역성장할 경우, 당사가 개발 중인 파이프라인의 상업적 가치가 하락하고 연구개발 성과가 기대에 미치지 못하여 당사의 수익성 및 성장성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 목표 시장의 성장 전망이 다양한 외부 요인에 의해 변동될 수 있으며, 이는 당사의 사업 성과에 직접적인 영향을 줄 수 있음을 유의하시기 바랍니다.
당사가 개발 중인 치료제 시장은 다수의 글로벌 제약사 및 바이오 기업들이 경쟁하고 있는 분야입니다. 예를 들어, 당뇨병성 황반부종 및 습성 황반변성 치료제 시장에서는 리제네론과 바이엘의 '아일리아', 제넨텍과 노바티스의 '루센티스', 로슈의 '바비스모' 등 항혈관내피성장인자 계열 약물들이 치열하게 경쟁하고 있으며, 바이오시밀러 출시 및 새로운 기전의 신약 개발이 활발합니다.
알츠하이머병 시장에서는 아세틸콜린 분해 효소 억제 기전의 아리셉트, 아밀로이드 베타 단백질을 타깃하는 레켐비, 키순라 등이 시판 중이며, 이 외에도 타우 단백질을 타깃하는 항체 등 다양한 기전의 신약 후보물질들이 개발되고 있습니다.
당뇨병성 신증 시장에서는 아스트라제네카, 베링거인겔하임과 릴리, 얀센, 바이엘 등이 안지오텐신 전환 효소 억제제, 안지오텐신 수용체 차단제, SGLT-2 억제제, 비스테로이드성 미네랄코르티코이드 수용체 길항제 등으로 경쟁하고 있습니다.
궤양성 대장염 시장에서는 애브비, 얀센, 다케다, 화이자, 비엠에스 등이 종양괴사인자 알파 억제제, 인테그린 저해제, 인터루킨 억제제, 야누스키나제 억제제 등 다양한 기전의 치료제로 경쟁 중입니다.
이러한 경쟁사들은 대부분 당사보다 월등한 자금력, 연구개발 인프라, 글로벌 마케팅 및 영업 네트워크, 풍부한 신약 개발 경험을 보유하고 있을 가능성이 높습니다. 경쟁사들이 당사보다 먼저 혁신적인 신약을 개발하여 시장을 선점하거나, 유사한 기전의 치료제를 더 낮은 가격으로 공급할 경우, 당사 제품의 시장 경쟁력이 약화될 수 있습니다.
또한, 기술 발전 속에서 당사의 파이프라인이 경쟁 우위를 유지하지 못할 경우, 기술이전 협상에서 불리하거나 상업화 이후 시장에서 도태될 위험이 있습니다. 당사는 혈관내피세포 기능 회복이라는 차별화된 작용 기전과 SOLVADYS®, EAGLES® 플랫폼 기술을 바탕으로 경쟁 우위를 확보하고자 하나, 치열한 경쟁 환경은 당사의 성장성과 수익성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 당사가 직면한 치열한 경쟁 환경과 경쟁사들의 우위 요소가 당사의 시장 진입 및 점유율 확보에 미칠 수 있는 부정적 영향을 충분히 고려하시기 바랍니다.
제약ㆍ바이오 기술은 매우 빠르게 발전하며 치료 패러다임 또한 빠르게 변화하고 있습니다. 당사가 주력하는 혈관 질환 및 염증성 질환 분야에서도 새로운 병태생리 기전이 규명되고 혁신적인 치료 기술들이 지속적으로 연구개발되고 있습니다. 만약 당사가 현재 개발 중인 파이프라인보다 현저하게 우수한 새로운 치료법이나 기술이 등장하여 기존 치료 패러다임을 바꿀 경우, 당사 파이프라인의 시장 가치가 급격히 하락하거나 개발 자체가 무의미해질 수 있습니다. 당사는 최신 연구 동향 및 기술 발전을 지속적으로 모니터링하고 연구개발 전략에 반영하여 미래 시장 변화에 대응하고자 노력하고 있으나, 기술 변화의 속도와 방향을 예측하는 것은 매우 어려우며, 당사가 이러한 변화에 신속하고 효과적으로 대응하지 못할 경우, 개발 중인 파이프라인이 기술적 진부화에 직면하여 투자 가치를 상실할 위험이 있습니다. 투자자께서는 제약·바이오 산업의 빠른 기술 변화 속도와 이로 인한 당사 파이프라인의 경쟁력 약화 가능성에 유의하시기 바랍니다.
(주2) 정정 후
| 다. 파이프라인별 치료제 시장 경쟁 심화에 따른 위험 당사가 주력으로 연구개발하고 있는 혈관내피기능장애 관련 질환 치료제 시장은 전 세계적인 인구 고령화, 당뇨병 등 만성질환 환자 수 증가, 삶의 질 향상에 대한 관심 증대 등으로 인해 지속적인 성장이 예상되는 분야입니다. 그러나 한편으로는 글로벌 제약사 및 다수의 바이오 기업들이 혁신 신약 개발을 위해 치열하게 경쟁하고 있으며, 각국 정부의 약가 규제 강화, 새로운 치료 기술 및 플랫폼의 등장 등으로 인해 산업 성장성이 예상에 미치지 못하거나 시장 환경이 급변할 가능성도 존재합니다. 당사가 주력하는 혈관 질환 및 염증성 질환 분야에서도 새로운 병태생리 기전이 규명되고 혁신적인 치료 기술들이 지속적으로 연구개발되고 있습니다. 만약 당사가 현재 개발 중인 파이프라인보다 현저하게 우수한 새로운 치료법이나 기술이 등장하여 기존 치료 패러다임을 바꿀 경우, 당사 파이프라인의 시장 가치가 급격히 하락하거나 개발 자체가 무의미해질 수 있습니다. 당사는 최신 연구 동향 및 기술 발전을 지속적으로 모니터링하고 연구개발 전략에 반영하여 미래 시장 변화에 대응하고자 노력하고 있으나, 기술 변화의 속도와 방향을 예측하는 것은 매우 어려우며, 당사가 이러한 변화에 신속하고 효과적으로 대응하지 못할 경우, 개발 중인 파이프라인이 기술적 진부화에 직면하여 투자 가치를 상실할 위험이 있습니다. 투자자께서는 제약·바이오 산업의 빠른 기술 변화 속도와 이로 인한 당사 파이프라인의 경쟁력 약화 가능성에 유의하시기 바랍니다. |
당사가 주력으로 연구개발하고 있는 혈관내피기능장애 관련 질환 치료제 시장은 전 세계적인 인구 고령화, 당뇨병 등 만성질환 환자 수 증가, 삶의 질 향상에 대한 관심 증대 등으로 인해 지속적인 성장이 예상되는 분야입니다. 그러나 한편으로는 글로벌 제약사 및 다수의 바이오 기업들이 혁신 신약 개발을 위해 치열하게 경쟁하고 있으며, 각국 정부의 약가 규제 강화, 새로운 치료 기술 및 플랫폼의 등장 등으로 인해 산업 성장성이 예상에 미치지 못하거나 시장 환경이 급변할 가능성도 존재합니다.
혈관내피세포는 혈관의 가장 안쪽을 구성하는 단일 세포층으로 혈관의 구조적 장벽 역할뿐만 아니라 혈관의 항상성 유지, 혈액 응고 조절, 염증 반응 조절 등 다양한 생리적 기능에 중요한 역할을 합니다. 이러한 혈관내피세포의 기능장애는 노화나 당뇨병, 고혈압, 고지혈증, 비만 등 다양한 대사성 질환 및 만성 염증성 질환의 발병 및 진행과 밀접하게 연관되어 있으며, 당뇨병성 황반부종, 당뇨병성 신증, 궤양성 대장염, 습성 황반변성 등 다양한 난치성 질환의 핵심적인 병태생리 기전 중 하나로 인식되고 있습니다.
| [혈관내피기능장애 발생 구조도] |
|
| 출처) 당사 제시 |
당뇨병성 황반부종 치료제 시장의 경우, 국제 당뇨병 연맹의 2021년 보고서에 따르면 전 세계 당뇨병 유병 인구는 2021년 약 5억 3,700만 명에서 2045년 약 7억 8,300만 명으로 증가할 전망이며, 이 중 상당수가 당뇨병성 황반부종으로 진행될 가능성이 있습니다. 당뇨병성 황반부종과 습성 황반변성 등 망막질환 치료로는 항혈관내피세포성장인자 주사제(Anti-VEGF)가 표준 치료법으로 사용되고 있으며, 최근에는 이중 특이항체나 투여 간격을 연장시킨 제형들이 개발되어 사용되고 있으나, 여전히 반복적인 안구 내 주사에 대한 부담감과 일부 환자에서의 제한적인 반응으로 인해 새로운 치료 표적 발굴 및 투여 편의성 개선 노력이 지속되고 있습니다.
시장조사기관인 글로벌데이터의 2023년 11월 보고서(Global Data Drug Forecast and Market Analysis(2022))는 미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본 등 주요 7개국 당뇨병성 황반부종 및 습성 황반변성 치료제 시장이 2021년 약 128억 달러에서 2031년 약 339억 달러로 연평균 10.3% 성장할 것으로 예측했습니다.
| [습성 황반변성 및 당뇨병성 황반부종 치료제 시장 추이] |
|
| 출처) Global Data Drug Forecast and Market Analysis(2022) |
퇴행성 뇌질환 중 가장 높은 발생 비율을 보이는 알츠하이머병은 시장조사기관인 글로벌데이터의 2024년 보고서(Global Data Market Analysis and Sales Forecast 2024)에 따르면 연평균 약 22.3% 성장하여 2033년 약 245억 달러에 이를 것으로 전망됩니다. 뇌 속에서 생성되는 단백질 덩어리인 아밀로이드 베타가 과도하게 축적될 경우 신경 독으로 작용해 뇌의 인지 기능을 떨어뜨리고 알츠하이머병으로까지 발전하게 된다는 아밀로이드 베타 가설에 의해 최근 아밀로이드 베타를 타깃하는 항체 치료제들이 시장에 등장했지만, 두통, 구역감부터 뇌 부종, 혼돈 등의 증상이 나타나는 ARIA 부작용(Amyloid-reated Imaging Abnormality)에 대한 우려, 고비용 등으로 제한적으로 사용되고 있으며, 여전히 1996년에 발매된 경구용 치매 치료제 도네페질이 가장 널리 사용 중입니다. 여전히 신규 치료제에 대한 미충족 수요가 높은 질환입니다. 따라서 알츠하이머병에 대해 기존 치료제와 다른 새로운 기전, 투여 방식으로 접근하는 치료제에 대한 미충족 수요가 매우 높은 실정입니다.
당뇨병성 신증 치료제 시장 또한 성장세가 예상됩니다. 미국 질병통제예방센터의 2023년 보고서에 따르면 미국 성인 당뇨병 환자의 약 37%가 만성 신장 질환을 동반하고 있으며, 시장조사기관인 프레시던스 리서치의 2024년 3월 보고서는 글로벌 당뇨병성 신증 치료제 시장이 2023년 약 35억 달러에서 2033년 약 65억 달러로 연평균 6.4% 성장할 것으로 전망했습니다. 레닌-안지오텐신-알도스테론 시스템 차단제, SGLT-2 억제제, 비스테로이드성 미네랄코르티코이드 수용체 길항제 등이 사용되고 있으나, 여전히 많은 환자들이 말기 신질환으로 진행하고 있어, 보다 효과적인 신장 보호 및 기능 개선 치료제 개발이 시급한 실정입니다.
궤양성 대장염 치료제 시장은 시장조사기관인 포춘 비즈니스 인사이트의 2024년 1월 보고서에 따르면 2023년 약 75억 달러에서 2032년 약 108억 달러로 연평균 4.1% 성장할 것으로 보입니다. 다양한 계열의 치료제가 존재함에도 불구하고, 기존 치료에 불응하거나 반응이 소실되는 환자들이 많아 새로운 작용 기전을 가진 치료제, 특히 안전성과 복용 편의성이 개선된 경구용 치료제에 대한 수요가 높습니다.
상기 시장 전망은 시장조사기관의 분석 자료를 바탕으로 하였으나, 실제 시장 성장세는 예상과 다를 수 있습니다. 신규 경쟁 약물의 예상보다 빠른 출시, 기존 치료제의 특허 만료에 따른 바이오시밀러 또는 제네릭 경쟁 심화, 각국 정부의 급격한 약가 인하 정책 시행, 새로운 치료 패러다임의 등장 등 예기치 못한 변수로 인해 목표 시장의 성장성이 둔화되거나 역성장할 경우, 당사가 개발 중인 파이프라인의 상업적 가치가 하락하고 연구개발 성과가 기대에 미치지 못하여 당사의 수익성 및 성장성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 목표 시장의 성장 전망이 다양한 외부 요인에 의해 변동될 수 있으며, 이는 당사의 사업 성과에 직접적인 영향을 줄 수 있음을 유의하시기 바랍니다.
당사가 개발 중인 치료제 시장은 다수의 글로벌 제약사 및 바이오 기업들이 경쟁하고 있는 분야입니다. 예를 들어, 당뇨병성 황반부종 및 습성 황반변성 치료제 시장에서는 리제네론과 바이엘의 '아일리아', 로슈와 노바티스의 '루센티스', 로슈의 '바비스모' 등 항혈관내피성장인자 계열 약물들이 치열하게 경쟁하고 있으며, 바이오시밀러 출시 및 새로운 기전의 신약 개발이 활발합니다.
| [당뇨병성 황반부종 및 습성 황반변성 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU06(성분명 : 리바스테랏) | 아일리아(Eylea/Eylea HD) | 루센티스(Lucentis) | 바비스모(Vabysmo) | ||
| 적응증 | 당뇨병성 황반부종, 습성 황반변성 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 | ||
| 작용 기전 | 혈관내피기능장애 차단 | VEGF 억제 | VEGF 억제 | VEGF 및 Ang-2 이중억제 | ||
| 특징 | 경구용 망막질환 치료제로 개발 중 | 유리체강 내 주사제 | 유리체강 내 주사제 | 유리체강 내 주사제 | ||
| 개발단계 | 임상2a상 완료, 임상2b상 준비 중 | 시판 중 | 시판 중 | 시판 중 | ||
| 개발회사명 | 큐라클 | 리제네론 | 바이엘 | 노바티스 | 로슈 | 로슈 |
| 소재지 | 대한민국 | 미국 | 독일 | 스위스 | 스위스 | 스위스 |
| 요약재무정보(FY2024 기준) | ||||||
| 제품 매출액 | 0 | 13,386,525 | 1,675,986 | 6,486,651 | ||
| 전체 매출액 | 1,633 | 19,510,708 | 73,129,009 | 69,125,495 | 101,555,376 | 101,555,376 |
| 영업이익 | (12,635) | 5,482,424 | (11,141) | 19,980,547 | 22,523,655 | 22,523,655 |
| 당기순이익 | (14,886) | 6,062,030 | (4,004,318) | 16,401,798 | 15,422,584 | 15,422,584 |
| 자산총계 | 59,288 | 51,873,864 | 173,933,627 | 140,465,555 | 17,089,573 | 17,089,573 |
| 부채총계 | 29,335 | 11,547,888 | 123,652,137 | 79,845,256 | 110,192,494 | 110,192,494 |
| 자본총계 | 29,953 | 40,325,976 | 50,281,489 | 60,620,299 | 60,704,917 | 60,704,917 |
| 출처) 각 사 2024 Annual Report | |
| 주) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
알츠하이머병 시장에서는 아세틸콜린 분해 효소 억제 기전의 에자이의 '아리셉트', 아밀로이드 베타 단백질을 타깃하는 에자이와 바이오젠의 '레켐비', 일라이 릴리의 '키순라' 등이 시판 중이며, 이 외에도 타우 단백질을 타깃하는 항체 등 다양한 기전의 신약 후보물질들이 개발되고 있습니다.
| [알츠하이머병 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU71 | 아리셉트(Aricept) | 레켐비(Leqembi) | 키순라(Kisunla) | |
| 적응증 | 퇴행성 뇌질환(알츠하이머병) | 알츠하이머병 | 알츠하이머병 | 알츠하이머병 | |
| 작용 기전 | 혈관내피기능장애 차단 | 아세틸콜린에스터레이스 억제제 | 아밀로이드 베타 항체 | 아밀로이드 베타 항체 | |
| 특징 | BBB Stabilize를 통한 BBB Dysfunction 및 Neuroinflammation 개선하는 경구용 치료제 |
경구용 치료제 | 정맥 주사 | 정맥 주사 | |
| 개발단계 | 전임상 | 시판 중 | 시판 중 | 시판 중 | |
| 개발회사명 | 큐라클 | 에자이 | 에자이 | 바이오젠 | 일라이 릴리 |
| 소재지 | 대한민국 | 일본 | 일본 | 미국 | 미국 |
| 요약재무정보(FY2024 기준) | |||||
| 제품 매출액 | 0 | 241,507 | 426,246 | 알 수 없음 | |
| 전체 매출액 | 1,633 | 7,595,449 | 7,595,449 | 13,292,751 | 61,325,636 |
| 영업이익 | (12,635) | 523,214 | 523,214 | 3,048,325 | 23,828,565 |
| 당기순이익 | (14,886) | 462,414 | 462,414 | 2,242,316 | 14,418,285 |
| 자산총계 | 59,288 | 13,341,078 | 13,341,078 | 38,534,128 | 107,170,336 |
| 부채총계 | 29,335 | 5,008,907 | 5,008,907 | 15,569,688 | 47,530,782 |
| 자본총계 | 29,953 | 8,332,171 | 8,332,171 | 22,964,441 | 59,639,554 |
| 출처) 각 사 2024 Annual Report | |
| 주1) 키순라의 FY2024 매출액은 정기보고서에 기재되어 있지 않아 확인할 수 없습니다. |
|
| 주2) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
당뇨병성 신증 시장에서는 MSD의 '코자'와 '바소텍', 아스트라제네카의 '포시가', 바이엘의 '케렌디아' 등이 안지오텐신 전환 효소 억제제, 안지오텐신 수용체 차단제, SGLT-2 억제제, 비스테로이드성 미네랄코르티코이드 수용체 길항제 등으로 경쟁하고 있습니다.
| [당뇨병성 신증 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU01 | 코자(Cozaar) | 바소텍(Vasotec) | 포시가(Farxiga/Forxiga) | 케렌디아(Kerendia) |
| 적응증 | 당뇨병성 신증 | 고혈압, 심부전, 당뇨병성 신증 등 | 고혈압, 심부전 등 | 제2형 당뇨병, 심부전, 만성 신장병 | 제2형 당뇨병 동반 만성 신장병 |
| 작용 기전 | Nrf2 활성화, TGF-β 신호 조절 |
안지오텐신 II 수용체 차단제 (ARB) | 안지오텐신 전환 효소 억제제 (ACEI) | SGLT2 억제제 | 비스테로이드성 무기질코르티코이드 수용체 길항제 |
| 특징 | 신장기능 유지 및 개선 효과 기대 | 광범위하게 사용되는 고혈압 및 신장보호 약물 | 광범위하게 사용되는 고혈압 및 신장보호 약물 | 혈당강하 외 심장 및 신장 보호 효과 입증 | 심장 및 신장 보호 효과, 염증 및 섬유화 억제 |
| 개발단계 | 임상2b상 진행 중 | 시판 중 | 시판 중 | 시판 중 | 시판 중 |
| 개발회사명 | 큐라클 | MSD | MSD | 아스트라제네카 | 바이엘 |
| 소재지 | 대한민국 | 미국 | 미국 | 영국 | 스위스 |
| 요약재무정보(FY2024 기준) | |||||
| 제품 매출액 | 0 | 알 수 없음 | 알 수 없음 | 10,601,615 | 726,489 |
| 전체 매출액 | 1,633 | 88,153,998 | 88,153,998 | 74,285,487 | 73,129,009 |
| 영업이익 | (12,635) | 27,388,077 | 27,388,077 | 13,742,121 | (11,141) |
| 당기순이익 | (14,886) | 23,537,315 | 23,537,315 | 9,672,926 | (4,004,318) |
| 자산총계 | 59,288 | 160,880,223 | 160,880,223 | 142,923,283 | 173,933,627 |
| 부채총계 | 29,335 | 97,174,369 | 97,174,369 | 86,774,703 | 123,652,137 |
| 자본총계 | 29,953 | 63,705,854 | 63,705,854 | 56,148,580 | 50,281,489 |
| 출처) 각 사 2024 Annual Report | |
| 주1) 바소텍과 코자의 FY2024 매출액은 각 사 정기보고서에 기재되어 있지 않아 확인할 수 없습니다. | |
| 주2) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
궤양성 대장염 시장에서는 애브비의 '휴미라', 얀센의 '스텔라라', 다케다의 '엔티비오', 화이자의 '젤잔즈' 등이 종양괴사인자 알파 억제제, 인테그린 저해제, 인터루킨 억제제, 야누스키나제 억제제 등 다양한 기전의 치료제로 경쟁 중입니다.
| [궤양성 대장염 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU104 | 휴미라(Humira) | 젤잔즈(Xeljanz) | 엔티비오(Entyvio) | 스텔라라(Stelara) |
| 적응증 | 궤양성 대장염 | 궤양성 대장염, 류마티스 관절염, 건선 크론 등 | 궤양성 대장염, 류마티스 관절염 등 | 궤양성 대장염, 크론병 | 궤양성 대장염, 크론병, 건선 등 |
| 작용 기전 | 혈관내피기능장애 차단 | TNF-알파(종양괴사인자-알파) 억제제 | JAK(야누스키나제) 억제제 | 인테그린 수용체(α4β7 인테그린) 억제제 |
인터루킨-12(IL-12), 인터루킨-23(IL-23) 억제제 |
| 특징 | 경구용 자가면역질환 치료제 | 다양한 자가면역 질환에 폭넓게 사용 | 경구용 자가면역질환 치료제 | 장 선택적 작용으로 전신 부작용 위험 낮음 | 이중 작용 기전, 다양한 면역 매개 질환에 효과적 |
| 개발단계 | 임상1상 완료 | 시판 중 | 시판 중 | 시판 중 | 시판 중 |
| 개발회사명 | 큐라클 | 애브비 | 화이자 | 다케다 | 얀센(J&J) |
| 소재지 | 대한민국 | 미국 | 미국 | 일본 | 미국 |
| 요약재무정보 | FY2024 | FY2023 | FY2024 | ||
| 제품 매출액 | 0 | 12,354,583 | 1,604,598 | 7,706,100 | 14,233,942 |
| 전체 매출액 | 1,633 | 77,391,649 | 87,410,773 | 41,025,065 | 122,022,290 |
| 영업이익 | (12,635) | (2,046,962) | 27,783,731 | 2,060,027 | 28,902,004 |
| 당기순이익 | (14,886) | (31,597) | 11,075,576 | 1,387,435 | 19,323,871 |
| 자산총계 | 59,288 | 185,684,182 | 293,163,425 | 145,373,775 | 247,426,875 |
| 부채총계 | 29,335 | 181,062,719 | 171,586,246 | 75,384,754 | 149,213,913 |
| 자본총계 | 29,953 | 4,621,463 | 121,577,179 | 69,989,021 | 98,212,962 |
| 출처) 각 사 2024 Annual Report | |
| 주1) 다케다의 경우 2024 Annual Report가 아직 발간되지 않아 요약재무정보를 FY2023 기준으로 작성하였습니다. | |
| 주2) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
이러한 경쟁사들은 대부분 당사보다 월등한 자금력, 연구개발 인프라, 글로벌 마케팅 및 영업 네트워크, 풍부한 신약 개발 경험을 보유하고 있을 가능성이 높습니다. 경쟁사들이 당사보다 먼저 혁신적인 신약을 개발하여 시장을 선점하거나, 유사한 기전의 치료제를 더 낮은 가격으로 공급할 경우, 당사 제품의 시장 경쟁력이 약화될 수 있습니다.
또한, 기술 발전 속에서 당사의 파이프라인이 경쟁 우위를 유지하지 못할 경우, 기술이전 협상에서 불리하거나 상업화 이후 시장에서 도태될 위험이 있습니다. 당사는 혈관내피세포 기능 회복이라는 차별화된 작용 기전과 SOLVADYS®, EAGLES® 플랫폼 기술을 바탕으로 경쟁 우위를 확보하고자 하나, 치열한 경쟁 환경은 당사의 성장성과 수익성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 당사가 직면한 치열한 경쟁 환경과 경쟁사들의 우위 요소가 당사의 시장 진입 및 점유율 확보에 미칠 수 있는 부정적 영향을 충분히 고려하시기 바랍니다.
제약ㆍ바이오 기술은 매우 빠르게 발전하며 치료 패러다임 또한 빠르게 변화하고 있습니다. 당사가 주력하는 혈관 질환 및 염증성 질환 분야에서도 새로운 병태생리 기전이 규명되고 혁신적인 치료 기술들이 지속적으로 연구개발되고 있습니다. 만약 당사가 현재 개발 중인 파이프라인보다 현저하게 우수한 새로운 치료법이나 기술이 등장하여 기존 치료 패러다임을 바꿀 경우, 당사 파이프라인의 시장 가치가 급격히 하락하거나 개발 자체가 무의미해질 수 있습니다. 당사는 최신 연구 동향 및 기술 발전을 지속적으로 모니터링하고 연구개발 전략에 반영하여 미래 시장 변화에 대응하고자 노력하고 있으나, 기술 변화의 속도와 방향을 예측하는 것은 매우 어려우며, 당사가 이러한 변화에 신속하고 효과적으로 대응하지 못할 경우, 개발 중인 파이프라인이 기술적 진부화에 직면하여 투자 가치를 상실할 위험이 있습니다. 투자자께서는 제약·바이오 산업의 빠른 기술 변화 속도와 이로 인한 당사 파이프라인의 경쟁력 약화 가능성에 유의하시기 바랍니다.
(주3) 정정 전
| 라. 신규사업(원료의약품품 수입, 도소매업) 영위에 따른 위험 당사는 기존 신약 연구개발 사업 외에 사업 다각화 및 새로운 성장 동력 확보의 일환으로 원료의약품의 수입 및 도소매업을 신규 사업으로 추진하고 있습니다. 이는 당사의 사업 영역을 확장하고 잠재적인 수익원을 창출할 수 있는 기회가 될 수 있으나, 동시에 다양한 내재적 위험 요소를 안고 있습니다. 당사가 신규 사업자로 진입할 경우, 이미 안정적인 공급망, 폭넓은 고객 네트워크, 가격 경쟁력을 확보하고 있는 기존 국내외 대형 공급업체 및 다수의 중소 유통업체들과의 힘겨운 경쟁에 직면할 가능성이 높습니다. 글로벌 원료의약품 시장은 대형 다국적 제약사들의 자체 생산 비중이 높고, 중국, 인도 등 특정 국가에 생산이 집중되어 있어, 당사가 가격 경쟁력을 확보하고 안정적인 고품질 공급처를 발굴하는 데 상당한 어려움을 겪을 수 있습니다. 시장 점유율 확보를 위한 초기 단계에서의 출혈 경쟁은 수익성 악화로 이어질 수 있으며, 향후 신규 경쟁자의 추가 진입이나 대체 원료의 등장 등 예측 불가능한 시장 환경 변화에 따라 경쟁 강도는 더욱 심화될 수 있습니다. 당사는 이러한 신규 사업 관련 위험을 최소화하고 성공적인 시장 안착을 위해 철저한 시장 조사, 면밀한 사업 타당성 분석, 관련 분야 전문가 영입 또는 외부 전문기관의 자문 활용, 체계적인 내부 통제 시스템 구축, 안정적이고 다변화된 공급망 확보 노력, 관련 법규 준수 강화 등 다각적인 노력을 기울일 예정입니다. 그럼에도 불구하고, 신규 사업 진출에는 본질적인 불확실성과 다양한 위험이 상존하므로, 투자자께서는 신규 사업의 성공 가능성, 예상 수익성, 기존 핵심 사업에 미칠 수 있는 영향 등을 종합적으로 고려하여 신중하게 투자 결정을 내리시기 바랍니다. |
당사는 기존 신약 연구개발 사업 외에 사업 다각화 및 새로운 성장 동력 확보의 일환으로 원료의약품의 수입 및 도소매업을 신규 사업으로 추진하고 있습니다. 이는 당사의 사업 영역을 확장하고 잠재적인 수익원을 창출할 수 있는 기회가 될 수 있으나, 동시에 다양한 내재적 위험 요소를 안고 있습니다.
우선, 경쟁 환경 및 시장 진입의 어려움이 예상됩니다. 국내 원료의약품 시장은 이미 다수의 업체가 치열하게 경쟁하고 있는 상황이며, 2022년 기준 300개가 넘는 원료의약품 업체 중 약 74%가 연 생산액 50억 미만의 영세업체일 정도로 경쟁 강도가 높고 산업 구조가 영세합니다. 더욱이 국내 원료의약품 자급도는 2022년 기준 11.9%로 매우 낮아 수입 의존도가 절대적이며, 중국 및 인도산 원료의약품 수입 비중이 70%를 상회하는 등 특정 국가에 대한 의존도가 매우 높은 실정입니다.
이러한 시장 환경에서 당사가 신규 사업자로 진입할 경우, 이미 안정적인 공급망, 폭넓은 고객 네트워크, 가격 경쟁력을 확보하고 있는 기존 국내외 대형 공급업체 및 다수의 중소 유통업체들과의 힘겨운 경쟁에 직면할 가능성이 높습니다. 글로벌 원료의약품 시장은 대형 다국적 제약사들의 자체 생산 비중이 높고, 중국, 인도 등 특정 국가에 생산이 집중되어 있어, 당사가 가격 경쟁력을 확보하고 안정적인 고품질 공급처를 발굴하는 데 상당한 어려움을 겪을 수 있습니다. 시장 점유율 확보를 위한 초기 단계에서의 출혈 경쟁은 수익성 악화로 이어질 수 있으며, 향후 신규 경쟁자의 추가 진입이나 대체 원료의 등장 등 예측 불가능한 시장 환경 변화에 따라 경쟁 강도는 더욱 심화될 수 있습니다.
또한 운영 및 관리상의 다양한 위험에 노출될 수 있습니다. 원료의약품의 수입, 품질관리, 보관, 유통, 도소매업은 당사의 기존 주력 사업인 신약 연구개발과는 사업의 성격, 요구되는 전문 지식, 규제 환경, 운영 노하우 등 여러 측면에서 상이합니다. 해당 분야에서의 사업 경험 부족은 사업 초기 시장 분석의 오류, 비효율적인 공급망 관리, 관련 법규 위반 등의 시행착오로 이어져 사업 안정성 확보를 지연시키고 불필요한 비용 증가를 초래할 수 있습니다. 특히, 수입 원료의약품은 식품의약품안전처의 엄격한 수입요건 및 품질 기준을 충족해야 하므로, 공급처 실사부터 수입 시 품질 검사, 보관 및 유통 과정에서의 품질 유지에 이르기까지 전 과정에 걸쳐 철저하고 체계적인 관리가 요구됩니다.
만약 품질 문제가 발생할 경우, 이는 제품 회수, 막대한 손해배상 책임, 기업 이미지 실추는 물론, 해당 원료를 사용하는 완제의약품의 안전성 및 유효성에도 심각한 영향을 미칠 수 있습니다. 또한, 약사법, 의약품 등의 안전에 관한 규칙 등 관련 법규의 빈번한 변경에 대한 신속하고 정확한 대응이 미흡할 경우, 예기치 않은 행정처분이나 법적 제재를 받을 위험도 상존합니다.
글로벌 원료의약품 공급망은 중국, 인도 등 특정 국가에 대한 의존도가 높아, 해당 국가의 정책 변화, 지정학적 리스크, 팬데믹과 같은 예기치 못한 사태 발생 시 원료 수급에 심각한 차질이 발생하여 생산 중단, 납기 지연, 원가 급등 등으로 이어질 수 있으며, 이는 당사 사업의 연속성과 수익성에 직접적인 타격을 줄 수 있습니다. 더불어, 원료의약품 수입 거래는 주로 외화로 이루어지므로 환율 변동 위험에 직접적으로 노출됩니다. 환율 상승 시 수입 원가가 상승하여 수익성이 악화될 수 있으며, 환율 변동성의 확대는 안정적인 사업 운영 계획 수립에 부담으로 작용할 것입니다.
재무적 위험 또한 고려해야 합니다. 신규 사업 추진에는 사무실 및 창고 임차, 초기 재고 매입을 위한 자금, 전문 인력 채용 및 교육 비용 등 상당한 규모의 초기 투자 비용과 지속적인 운영 자금이 소요됩니다. 당사의 자금 조달 계획이 원활하게 진행되지 않거나 예상보다 많은 비용이 투입될 경우, 이는 당사의 재무 구조에 부담으로 작용할 수 있습니다. 또한, 신규 사업이 시장에 성공적으로 안착하여 안정적인 수익을 창출하고 초기 투자금을 회수하기까지는 상당한 시간이 소요될 수 있으며, 치열한 시장 경쟁, 높은 수입 의존도에 따른 원가 변동성, 예상치 못한 시장 환경 변화 등으로 인해 신규 사업의 수익성이 기대에 미치지 못하거나 손실이 발생하여 투자 회수가 지연되거나 불가능해질 위험도 존재합니다.
마지막으로, 기존 신약 연구개발 사업과의 연관성 및 자원 배분 문제가 발생할 수 있습니다. 원료의약품 수입 및 도소매 사업이 당사의 주력 사업인 혁신 신약 연구개발과 직접적인 시너지 효과를 창출하지 못하거나 그 효과가 미미할 수 있습니다. 오히려 한정된 경영 자원이 신규 사업에 분산됨으로써, 핵심 사업인 신약 연구개발의 추진 동력이 약화되거나 기존 연구개발 프로젝트의 진행 속도가 늦춰지는 등 부정적인 영향을 미칠 가능성도 배제할 수 없습니다.
당사는 이러한 신규 사업 관련 위험을 최소화하고 성공적인 시장 안착을 위해 철저한 시장 조사, 면밀한 사업 타당성 분석, 관련 분야 전문가 영입 또는 외부 전문기관의 자문 활용, 체계적인 내부 통제 시스템 구축, 안정적이고 다변화된 공급망 확보 노력, 관련 법규 준수 강화 등 다각적인 노력을 기울일 예정입니다. 그럼에도 불구하고, 신규 사업 진출에는 본질적인 불확실성과 다양한 위험이 상존하므로, 투자자께서는 신규 사업의 성공 가능성, 예상 수익성, 기존 핵심 사업에 미칠 수 있는 영향 등을 종합적으로 고려하여 신중하게 투자 결정을 내리시기 바랍니다.
(주3) 정정 후
|
라. 신규사업(원료의약품 수입, 도소매업) 영위에 따른 위험 또한, 신약 연구개발과 상이한 사업 특성으로 인해 운영 및 관리상의 위험에 노출될 수 있습니다. 사업 경험 부족은 초기 시행착오로 이어질 수 있으며, 엄격한 품질 기준 미충족 시 제품 회수, 손해배상 등의 막대한 손실이 발생할 수 있습니다. 관련 법규 미준수에 따른 행정처분 및 법적 제재의 위험도 상존합니다. 신규 사업 추진에 따른 재무적 위험도 고려해야 합니다. 초기 투자 및 운영 자금 소요로 인해 재무 구조에 부담이 될 수 있으며, 시장 안착 지연 및 수익성 악화 시 투자금 회수가 어려워질 수 있습니다. 마지막으로, 한정된 경영 자원이 신규 사업에 분산될 경우, 핵심 사업인 신약 연구개발의 추진 동력이 약화될 수 있는 위험 역시 존재합니다. 당사는 신규 사업 관련 위험 최소화를 위해 다각적인 노력을 기울일 예정입니다. 그럼에도 불구하고, 신규 사업 진출에는 본질적인 불확실성과 다양한 위험이 상존하므로, 투자자께서는 신규 사업의 성공 가능성, 예상 수익성, 기존 핵심 사업에 미칠 수 있는 영향 등을 종합적으로 고려하여 신중하게 투자 결정을 내리시기 바랍니다. |
당사는 기존 신약 연구개발 사업 외에 사업 다각화 및 새로운 성장 동력 확보의 일환으로 원료의약품의 수입 및 도소매업을 신규 사업으로 추진하고 있습니다. 이는 당사의 사업 영역을 확장하고 잠재적인 수익원을 창출할 수 있는 기회가 될 수 있으나, 동시에 다양한 내재적 위험 요소를 안고 있습니다.
우선, 경쟁 환경 및 시장 진입의 어려움이 예상됩니다. 국내 원료의약품 시장은 이미 다수의 업체가 치열하게 경쟁하고 있는 상황이며, 2022년 기준 300개가 넘는 원료의약품 업체 중 약 74%가 연 생산액 50억 미만의 영세업체일 정도로 경쟁 강도가 높고 산업 구조가 영세합니다. 더욱이 국내 원료의약품 자급도는 2022년 기준 11.9%로 매우 낮아 수입 의존도가 절대적이며, 중국 및 인도산 원료의약품 수입 비중이 70%를 상회하는 등 특정 국가에 대한 의존도가 매우 높은 실정입니다.
이러한 시장 환경에서 당사가 신규 사업자로 진입할 경우, 이미 안정적인 공급망, 폭넓은 고객 네트워크, 가격 경쟁력을 확보하고 있는 기존 국내외 대형 공급업체 및 다수의 중소 유통업체들과의 힘겨운 경쟁에 직면할 가능성이 높습니다. 글로벌 원료의약품 시장은 대형 다국적 제약사들의 자체 생산 비중이 높고, 중국, 인도 등 특정 국가에 생산이 집중되어 있어, 당사가 가격 경쟁력을 확보하고 안정적인 고품질 공급처를 발굴하는 데 상당한 어려움을 겪을 수 있습니다. 시장 점유율 확보를 위한 초기 단계에서의 출혈 경쟁은 수익성 악화로 이어질 수 있으며, 향후 신규 경쟁자의 추가 진입이나 대체 원료의 등장 등 예측 불가능한 시장 환경 변화에 따라 경쟁 강도는 더욱 심화될 수 있습니다.
또한 운영 및 관리상의 다양한 위험에 노출될 수 있습니다. 원료의약품의 수입, 품질관리, 보관, 유통, 도소매업은 당사의 기존 주력 사업인 신약 연구개발과는 사업의 성격, 요구되는 전문 지식, 규제 환경, 운영 노하우 등 여러 측면에서 상이합니다. 해당 분야에서의 사업 경험 부족은 사업 초기 시장 분석의 오류, 비효율적인 공급망 관리, 관련 법규 위반 등의 시행착오로 이어져 사업 안정성 확보를 지연시키고 불필요한 비용 증가를 초래할 수 있습니다. 특히, 수입 원료의약품은 식품의약품안전처의 엄격한 수입요건 및 품질 기준을 충족해야 하므로, 공급처 실사부터 수입 시 품질 검사, 보관 및 유통 과정에서의 품질 유지에 이르기까지 전 과정에 걸쳐 철저하고 체계적인 관리가 요구됩니다.
만약 품질 문제가 발생할 경우, 이는 제품 회수, 막대한 손해배상 책임, 기업 이미지 실추는 물론, 해당 원료를 사용하는 완제의약품의 안전성 및 유효성에도 심각한 영향을 미칠 수 있습니다. 또한, 약사법, 의약품 등의 안전에 관한 규칙 등 관련 법규의 빈번한 변경에 대한 신속하고 정확한 대응이 미흡할 경우, 예기치 않은 행정처분이나 법적 제재를 받을 위험도 상존합니다.
글로벌 원료의약품 공급망은 중국, 인도 등 특정 국가에 대한 의존도가 높아, 해당 국가의 정책 변화, 지정학적 리스크, 팬데믹과 같은 예기치 못한 사태 발생 시 원료 수급에 심각한 차질이 발생하여 생산 중단, 납기 지연, 원가 급등 등으로 이어질 수 있으며, 이는 당사 사업의 연속성과 수익성에 직접적인 타격을 줄 수 있습니다. 더불어, 원료의약품 수입 거래는 주로 외화로 이루어지므로 환율 변동 위험에 직접적으로 노출됩니다. 환율 상승 시 수입 원가가 상승하여 수익성이 악화될 수 있으며, 환율 변동성의 확대는 안정적인 사업 운영 계획 수립에 부담으로 작용할 것입니다.
재무적 위험 또한 고려해야 합니다. 신규 사업 추진에는 사무실 및 창고 임차, 초기 재고 매입을 위한 자금, 전문 인력 채용 및 교육 비용 등 상당한 규모의 초기 투자 비용과 지속적인 운영 자금이 소요됩니다. 당사의 자금 조달 계획이 원활하게 진행되지 않거나 예상보다 많은 비용이 투입될 경우, 이는 당사의 재무 구조에 부담으로 작용할 수 있습니다. 또한, 신규 사업이 시장에 성공적으로 안착하여 안정적인 수익을 창출하고 초기 투자금을 회수하기까지는 상당한 시간이 소요될 수 있으며, 치열한 시장 경쟁, 높은 수입 의존도에 따른 원가 변동성, 예상치 못한 시장 환경 변화 등으로 인해 신규 사업의 수익성이 기대에 미치지 못하거나 손실이 발생하여 투자 회수가 지연되거나 불가능해질 위험도 존재합니다.
마지막으로, 기존 신약 연구개발 사업과의 연관성 및 자원 배분 문제가 발생할 수 있습니다. 원료의약품 수입 및 도소매 사업이 당사의 주력 사업인 혁신 신약 연구개발과 직접적인 시너지 효과를 창출하지 못하거나 그 효과가 미미할 수 있습니다. 오히려 한정된 경영 자원이 신규 사업에 분산됨으로써, 핵심 사업인 신약 연구개발의 추진 동력이 약화되거나 기존 연구개발 프로젝트의 진행 속도가 늦춰지는 등 부정적인 영향을 미칠 가능성도 배제할 수 없습니다.
상기한 위험 요인에도 불구하고, 당사는 원료의약품 신사업이 기존에 영위하고 있는 신약 연구개발 사업과 높은 연관성을 보유하고 있어 시너지 창출이 가능하다고 판단하고 있습니다.
당사는 이미 원료의약품의 자체 품질 검증 및 연구개발이 가능한 연구시설과 전문 연구 인력을 확보하고 있으며, 이는 원료의약품의 품질 관리 및 공정 효율화에 기여할 수 있는 기반입니다. 또한, 당사 임직원의 국내외 제약 산업 네트워크를 사업 개발에 활용할 계획입니다. 특히, 피합병법인인 대성팜텍의 안과 질환 관련 원료의약품 포트폴리오는 당사가 보유한 망막질환 신약 파이프라인(CU06, MT-103 등)과 직접적으로 연계되어, 향후 신약 개발과 원료 공급의 수직적 통합을 통해 사업 경쟁력을 강화할 수 있을 것으로 예상하고 있습니다.
이러한 잠재적 시너지를 극대화하고 사업 초기 리스크를 관리하여 안정적인 사업 기반을 구축하기 위해, 당사는 다음과 같은 계획을 추진하고자 합니다.
먼저 신규 사업 추진에 필요한 자본금 5억 원은 금번 유상증자를 통해 조달할 계획이며, 그 외 본 사업과 관련하여 계획된 자금조달은 없습니다.
사업의 제도적 기반과 안정성을 확보하기 위해 2025년 3분기 내 원료의약품 도매업 및 수입업 허가를 취득하고, 2025년 4분기까지 기존 주요 매입처 및 매출처와의 거래 기간을 확대하여 중장기적 수익 기반을 공고히 할 예정입니다. 이와 동시에 2026년 01월 28일 대성팜텍의 흡수합병을 완료하여 사업 시너지를 극대화할 계획이며, 사업 확장을 위해 2026년 2분기까지 주요 원료의약품에 대한 DMF(Drug Master File) 등록을 순차적으로 진행하고, 안정적인 수급 구조를 위한 매입처 다변화를 추진할 것입니다.
성공적인 사업 수행을 위한 조직 역량 강화를 위하여 2025년 04월 원료의약품 사업본부를 신설하고 글로벌 제약사에서 경험을 갖춘 전문가를 사업본부장으로 영입했습니다. 2026년에는 대성팜텍 합병을 통해 확보되는 인력과 더불어 원료의약품 수입, 유통, 판매 및 개발 경험을 보유한 실무 인력을 추가 채용하여 사업의 안정적인 정착을 도모하겠습니다.
당사는 이러한 신규 사업 관련 위험을 최소화하고 성공적인 시장 안착을 위해 철저한 시장 조사, 면밀한 사업 타당성 분석, 관련 분야 전문가 영입 또는 외부 전문기관의 자문 활용, 체계적인 내부 통제 시스템 구축, 안정적이고 다변화된 공급망 확보 노력, 관련 법규 준수 강화 등 다각적인 노력을 기울일 예정입니다. 그럼에도 불구하고, 신규 사업 진출에는 본질적인 불확실성과 다양한 위험이 상존하므로, 투자자께서는 신규 사업의 성공 가능성, 예상 수익성, 기존 핵심 사업에 미칠 수 있는 영향 등을 종합적으로 고려하여 신중하게 투자 결정을 내리시기 바랍니다.
(주4) 정정 전
| 마. 정부 정책 및 규제 변화에 따른 위험 제약ㆍ바이오 산업은 인간의 생명과 건강에 직접적인 영향을 미치기 때문에 연구개발, 임상시험, 인허가, 제조, 유통, 판매, 약가, 광고 등 사업 전반에 걸쳐 각국 정부의 엄격하고 포괄적인 규제를 받습니다. 이러한 정부 정책 및 규제는 수시로 변경될 수 있으며, 그 변화의 내용과 방향에 따라 당사의 사업 활동, 수익성 및 성장성에 중대한 영향을 미칠 수 있습니다. 또한, 의약품 제조 및 품질관리 기준, 임상시험 관리 기준, 비임상시험 관리 기준, 의약품 유통 관리 기준 등 신약 개발 및 생산, 유통 전반에 걸친 규제 기준이 강화될 수 있습니다. 이러한 기준을 충족하기 위해서는 지속적인 설비 투자 및 품질 관리 시스템 개선이 필요하며, 이를 준수하지 못할 경우 제조 허가 취소, 제품 회수 등의 제재를 받을 수 있습니다. 또한, 환경·안전·보건 관련 규제 강화는 생산 비용 증가 요인으로 작용할 수 있으며, 개인정보보호 규제는 임상시험 데이터 및 환자 정보 관리에 대한 부담을 가중시킬 수 있습니다. 공정거래 관련 법규 위반 시 과징금 부과 등 불이익을 받을 수도 있습니다. 당사는 이러한 정부 정책 및 규제 환경 변화에 대한 면밀한 모니터링과 법규 준수를 위한 내부 통제 시스템 강화를 통해 관련 위험을 최소화하고자 노력하고 있습니다. 그러나 예측 불가능하거나 급격한 정책 및 규제 변화는 당사의 사업 계획, 연구개발 활동, 수익성 및 재무 상태에 부정적인 영향을 미칠 수 있으므로, 투자자께서는 이 점에 각별히 유의하시고, 다양한 규제 환경 변화가 당사의 사업 전반에 미칠 수 있는 잠재적 위험을 인지하시기 바랍니다. |
제약ㆍ바이오 산업은 인간의 생명과 건강에 직접적인 영향을 미치기 때문에 연구개발, 임상시험, 인허가, 제조, 유통, 판매, 약가, 광고 등 사업 전반에 걸쳐 각국 정부의 엄격하고 포괄적인 규제를 받습니다. 이러한 정부 정책 및 규제는 수시로 변경될 수 있으며, 그 변화의 내용과 방향에 따라 당사의 사업 활동, 수익성 및 성장성에 중대한 영향을 미칠 수 있습니다.
(1) 신약 개발 및 허가 관련 규제 변화 위험
신약을 개발하여 시장에 출시하기 위해서는 각 국가의 규제 당국으로부터 임상시험계획 승인 및 품목허가를 받아야 합니다. 이러한 허가 과정은 신약의 안전성과 유효성을 과학적으로 입증해야 하므로 매우 엄격하며, 제출해야 하는 자료의 범위가 방대하고 심사 기간도 장기간 소요될 수 있습니다.
최근 글로벌 규제 당국은 신약의 안전성과 유효성 검증 기준을 강화하는 추세입니다. 임상시험 설계의 적절성, 임상 데이터의 품질 및 신뢰성, 통계적 유의성 확보, 장기 안전성 데이터 확보 등에 대한 요구 수준이 지속적으로 높아지고 있습니다. 예를 들어, 특정 질환에 대한 임상시험 평가지표가 기존의 대리 평가지표에서 임상적으로 더욱 의미 있는 직접적인 평가지표로 변경되거나, 비교 약물 선정 기준이 강화되어 기존 표준 치료제보다 우월성을 입증해야 하는 경우가 발생할 수 있습니다. 또한, 특정 환자군에 대한 추가적인 분석이나 별도의 임상시험이 요구될 수도 있습니다. 최근에는 실제 임상 환경에서의 약효를 반영하는 실사용데이터 및 실사용증거의 활용이 신약 허가 및 시판 후 안전관리 등에서 중요성이 커지고 있으나, 아직 명확한 가이드라인이 정립되지 않은 부분도 많아 규제적 불확실성이 존재합니다.
당사가 현재 진행 중이거나 향후 진행할 임상시험이 이러한 규제 당국의 강화된 기준을 충족하지 못하거나, 임상시험 과정에서 예상치 못한 중대한 이상반응이 발생할 경우, 임상시험이 지연, 중단되거나 실패할 수 있으며, 이는 최종적으로 품목허가를 받지 못하는 결과로 이어질 수 있습니다. 예를 들어, 당사의 CU06 당뇨병성 황반부종 임상 2a상에서 전체 환자군 대상 1차 평가지표 미충족 후 미국 식품의약국과 Type C 미팅을 통해 임상 2b상 디자인을 논의한 바와 같이, 규제기관과의 지속적인 소통과 협의가 중요하나, 그 과정에서 예상치 못한 요구사항이 발생할 수 있습니다.
또한, 각국 규제 당국의 심사 기준, 절차, 가이드라인 등은 예고 없이 변경될 수 있습니다. 이러한 규제 환경의 변화는 당사에게 추가적인 임상시험 수행, 보완 자료 제출, 허가 전략 수정 등을 요구할 수 있으며, 이는 신약 개발 비용의 증가, 개발 일정의 지연, 나아가서는 특정 파이프라인의 개발 포기로 이어질 수 있습니다. 예를 들어, 특정 성분이나 제형에 대한 새로운 안전성 규제가 도입되거나, 희귀의약품 지정 기준이 변경되는 등의 상황이 발생할 수 있습니다. 특히, 당사가 개발 중인 혁신 신약의 경우, 유사한 선례가 없어 규제 당국의 심사 과정에서 더 많은 불확실성에 직면할 수 있습니다. 투자자께서는 이러한 신약 개발 및 허가 과정의 규제 관련 위험이 당사의 파이프라인 개발 일정 및 성공 가능성에 중대한 영향을 미칠 수 있음을 충분히 인지하시고 투자에 유의하시기 바랍니다.
(2) 약가 규제 정책 변화 위험
신약이 규제 당국의 시판 허가를 받더라도, 해당 국가의 건강보험 시스템에 등재되고 적절한 약가를 인정받아야 성공적인 시장 진입 및 매출 창출이 가능합니다. 그러나 대부분의 국가에서 정부는 건강보험 재정의 지속가능성 확보, 의약품 접근성 강화, 의료비 통제 등을 목적으로 약가에 대한 직·간접적인 규제를 시행하고 있으며, 이러한 약가 규제 정책은 신약 개발 기업의 수익성에 직접적인 영향을 미칩니다.
우리나라의 경우, 국민건강보험법에 따라 신약이 건강보험 급여 대상이 되기 위해서는 건강보험심사평가원의 약제급여 적정성 평가를 거쳐 국민건강보험공단과의 약가 협상을 통해 상한금액이 결정됩니다. 이 과정에서 신약의 임상적 유용성, 비용효과성, 대체 가능성, 보험 재정에 미치는 영향 등이 종합적으로 고려되므로, 당사가 개발한 신약이 기대만큼의 약가를 인정받지 못하거나 급여 등재 자체가 지연 또는 거부될 수 있습니다. 또한, 약가 등재 이후에도 사용량-약가 연동제, 실거래가 조사에 따른 약가 인하, 제네릭 등재에 따른 오리지널 약가 인하 등 다양한 사후 관리 제도를 통해 지속적으로 약가가 인하될 위험이 있습니다.
미국 의약품 시장은 전통적으로 자유로운 시장 경쟁을 통해 약가가 형성되어 왔으나, 최근에는 높은 약가에 대한 사회적 비판이 거세지면서 정부 차원의 약가 통제 움직임이 눈에 띄게 강화되고 있습니다. 이러한 변화의 대표적인 예로, 2022년에 발효된 인플레이션 감축법을 들 수 있습니다. 이 법안은 공공의료보험인 메디케어가 특정 고비용 의약품에 대해 제약사와 직접 약가를 협상할 수 있는 권한을 부여함으로써, 향후 미국 시장에서 신약의 가격 결정 방식과 제약 기업의 수익성에 중대한 변화를 가져올 것으로 예상됩니다.
여기에 더해, 2025년 5월 12일 트럼프 행정부에서는 '최혜국 대우' 원칙, 즉 다른 선진국들이 지불하는 가장 낮은 의약품 가격을 기준으로 미국 내 약가를 책정하려는 정책에 기반한 약가 모델의 재도입 포함한 약가인하 정책을 시행하였으며, 이와 함께 의약품 수입 확대, 복잡한 리베이트 시스템 개혁 등 추가적인 약가 인하 정책들을 적극적으로 모색하고 있는 상황입니다. 이 경우, 미국 시장에 새롭게 진출하는 신약들은 가격 책정 단계에서부터 상당한 인하 압박에 직면하게 될 것이며, 이는 당사와 같이 혁신 신약을 개발하는 기업들의 기대 수익률을 현저히 낮출 수 있는 직접적인 위험 요인입니다. 뿐만 아니라, 미국 각 주 정부 차원에서도 자체적으로 약가 투명성을 강화하고 리베이트를 규제하려는 다양한 정책들이 꾸준히 추진되고 있어, 전반적인 약가 인하 압력은 앞으로 더욱 거세질 것으로 전망됩니다.
유럽의 경우, 각 국가별로 상이한 약가 결정 및 상환 시스템을 운영하고 있으나, 대부분 참조가격제, 경제성 평가, 정부와의 직접 협상 등을 통해 약가를 통제하고 있습니다. 일본 또한 중앙사회보험의료협의회를 통해 약가를 결정하며, 정기적인 약가 재산정 제도를 운영하여 시장 실거래가를 반영한 약가 인하를 시행하고 있습니다.
이처럼 국내외적으로 강화되는 약가 규제 정책은 당사가 개발한 신약의 예상 시장 가치 및 수익성을 하락시켜, 연구개발 투자 비용의 회수를 어렵게 만들고 장기적으로는 혁신 신약 개발에 대한 동기를 저해할 수 있습니다. 투자자께서는 이러한 약가 규제 정책 변화가 당사 수익성에 미칠 수 있는 부정적 영향을 충분히 고려하시고, 당사 파이프라인의 상업화 성공 시 예상되는 수익 규모가 이러한 규제 환경에 따라 변동될 수 있음을 인지하시기 바랍니다.
(3) 정부 연구개발 지원 정책 변화 위험
정부는 제약·바이오 산업을 국가 핵심 전략 산업으로 인식하고, 신약 개발 및 산업 육성을 위해 다양한 연구개발 지원 정책을 운영하고 있습니다. 당사 또한 이러한 정부 연구개발 과제 참여를 통해 연구개발 자금의 일부를 지원받거나 정책적 혜택을 받고 있습니다. 예를 들어, 당사의 항체 신약 후보물질 MT-101과 MT-103은 국가신약개발사업단의 지원 과제로 선정된 바 있습니다.
그러나 정부의 재정 상황, 경제 정책 방향, 산업 육성 우선순위의 변화 등에 따라 제약·바이오 산업에 대한 연구개발 지원 규모가 축소되거나, 지원 대상 및 조건이 변경되거나, 특정 기술 분야에 대한 지원이 중단될 수 있습니다. 정부의 연구개발 지원이 감소하거나 중단될 경우, 당사는 연구개발 자금 확보에 어려움을 겪을 수 있으며, 이는 현재 진행 중인 연구개발 과제의 지연 또는 축소, 신규 연구개발 투자 위축 등으로 이어질 수 있습니다. 투자자께서는 정부 지원 정책의 변동 가능성 및 이에 따른 당사 연구개발 활동의 영향과 자금 조달 계획의 변동 가능성을 고려하시기 바랍니다.
(4) 기타 규제 환경 변화 위험
상기 언급된 사항 외에도, 의약품 제조 및 품질관리 기준, 임상시험 관리 기준, 비임상시험 관리 기준, 의약품 유통 관리 기준 등 신약 개발 및 생산, 유통 전반에 걸친 규제 기준이 강화될 수 있습니다. 이러한 기준을 충족하기 위해서는 지속적인 설비 투자 및 품질 관리 시스템 개선이 필요하며, 이를 준수하지 못할 경우 제조 허가 취소, 제품 회수 등의 제재를 받을 수 있습니다. 또한, 환경·안전·보건 관련 규제 강화는 생산 비용 증가 요인으로 작용할 수 있으며, 개인정보보호 규제는 임상시험 데이터 및 환자 정보 관리에 대한 부담을 가중시킬 수 있습니다. 공정거래 관련 법규 위반 시 과징금 부과 등 불이익을 받을 수도 있습니다.
당사는 이러한 정부 정책 및 규제 환경 변화에 대한 면밀한 모니터링과 법규 준수를 위한 내부 통제 시스템 강화를 통해 관련 위험을 최소화하고자 노력하고 있습니다. 그러나 예측 불가능하거나 급격한 정책 및 규제 변화는 당사의 사업 계획, 연구개발 활동, 수익성 및 재무 상태에 부정적인 영향을 미칠 수 있으므로, 투자자께서는 이 점에 각별히 유의하시고, 다양한 규제 환경 변화가 당사의 사업 전반에 미칠 수 있는 잠재적 위험을 인지하시기 바랍니다.
(주4) 정정 후
|
마. 정부 정책 및 규제 변화에 따른 위험 또한, 신약의 시판 허가 이후에도 각국의 약가 규제 정책은 수익성에 직접적인 영향을 미칩니다. 우리나라는 물론, 미국 인플레이션 감축법(IRA) 시행 및 최혜국 대우 원칙 기반 정책 도입, 유럽 각국의 참조가격제 등 주요 시장에서 약가 인하 압력이 거세지고 있습니다. 이로 인해 당사가 개발한 신약이 기대만큼의 약가를 인정받지 못하거나 지속적으로 약가가 인하될 경우, 막대한 연구개발 투자 비용의 회수가 어려워질 수 있습니다. 더불어, 당사는 정부의 연구개발 과제 참여를 통해 자금의 일부를 지원받고 있으나, 정부의 산업 육성 정책 및 재정 상황 변화에 따라 지원 규모가 축소되거나 중단될 수 있습니다. 이러한 정부 지원 정책의 변동은 당사의 연구개발 자금 확보 계획에 차질을 빚게 하여, 진행 중인 연구개발 과제의 지연 또는 신규 투자 위축으로 이어질 수 있습니다. 상기 언급된 사항 외에도, 의약품 제조 및 품질관리 기준, 임상시험 관리 기준 등 신약 개발, 생산, 유통 전반에 걸친 규제 기준이 강화될 수 있습니다. 이러한 기준을 충족하기 위해서는 지속적인 설비 투자 및 품질 관리 시스템 개선이 필요하며, 이를 준수하지 못할 경우 제조 허가 취소, 제품 회수 등의 제재를 받을 수 있습니다. 또한, 환경·안전·보건, 개인정보보호, 공정거래 관련 규제 강화 역시 비용 증가나 사업 활동 제약의 요인으로 작용할 수 있습니다. 당사는 이러한 정부 정책 및 규제 환경 변화에 대한 면밀한 모니터링과 법규 준수를 위한 내부 통제 시스템 강화를 통해 관련 위험을 최소화하고자 노력하고 있습니다. 그러나 예측 불가능하거나 급격한 정책 및 규제 변화는 당사의 사업 계획, 연구개발 활동, 수익성 및 재무 상태에 부정적인 영향을 미칠 수 있으므로, 투자자께서는 이 점에 각별히 유의하시고, 다양한 규제 환경 변화가 당사의 사업 전반에 미칠 수 있는 잠재적 위험을 인지하시기 바랍니다. |
제약ㆍ바이오 산업은 인간의 생명과 건강에 직접적인 영향을 미치기 때문에 연구개발, 임상시험, 인허가, 제조, 유통, 판매, 약가, 광고 등 사업 전반에 걸쳐 각국 정부의 엄격하고 포괄적인 규제를 받습니다. 이러한 정부 정책 및 규제는 수시로 변경될 수 있으며, 그 변화의 내용과 방향에 따라 당사의 사업 활동, 수익성 및 성장성에 중대한 영향을 미칠 수 있습니다.
(1) 신약 개발 및 허가 관련 규제 변화 위험
신약을 개발하여 시장에 출시하기 위해서는 각 국가의 규제 당국으로부터 임상시험계획 승인 및 품목허가를 받아야 합니다. 이러한 허가 과정은 신약의 안전성과 유효성을 과학적으로 입증해야 하므로 매우 엄격하며, 제출해야 하는 자료의 범위가 방대하고 심사 기간도 장기간 소요될 수 있습니다.
최근 글로벌 규제 당국은 신약의 안전성과 유효성 검증 기준을 강화하는 추세입니다. 임상시험 설계의 적절성, 임상 데이터의 품질 및 신뢰성, 통계적 유의성 확보, 장기 안전성 데이터 확보 등에 대한 요구 수준이 지속적으로 높아지고 있습니다. 예를 들어, 특정 질환에 대한 임상시험 평가지표가 기존의 대리 평가지표에서 임상적으로 더욱 의미 있는 직접적인 평가지표로 변경되거나, 비교 약물 선정 기준이 강화되어 기존 표준 치료제보다 우월성을 입증해야 하는 경우가 발생할 수 있습니다. 또한, 특정 환자군에 대한 추가적인 분석이나 별도의 임상시험이 요구될 수도 있습니다. 최근에는 실제 임상 환경에서의 약효를 반영하는 실사용데이터 및 실사용증거의 활용이 신약 허가 및 시판 후 안전관리 등에서 중요성이 커지고 있으나, 아직 명확한 가이드라인이 정립되지 않은 부분도 많아 규제적 불확실성이 존재합니다.
당사가 현재 진행 중이거나 향후 진행할 임상시험이 이러한 규제 당국의 강화된 기준을 충족하지 못하거나, 임상시험 과정에서 예상치 못한 중대한 이상반응이 발생할 경우, 임상시험이 지연, 중단되거나 실패할 수 있으며, 이는 최종적으로 품목허가를 받지 못하는 결과로 이어질 수 있습니다.
이처럼 강화되는 규제 기준과 높아지는 불확실성에 효과적으로 대응하고 개발 성공 가능성을 높이기 위해, 신약 개발사는 규제기관과의 효과적인 소통을 통해 개발 전략을 수립하고 규제적 불확실성을 줄여나가야 합니다. 미국 식품의약국(FDA)은 이러한 목적을 위해 개발사와 공식적으로 논의할 수 있는 다양한 미팅 유형을 제공하고 있으며, 이를 통해 개발사는 신약 개발 전략, 임상시험 설계, 규제 요건 등에 대한 FDA의 공식적인 의견과 지침을 확보할 수 있습니다. 주요 미팅 유형과 그 내용은 다음과 같습니다.
| [미국 식품의약국(FDA) 미팅 유형] |
| 구분 | Type A 미팅 | Type B 미팅 | Type C 미팅 |
|---|---|---|---|
| 요청 주체 | 개발사 (스폰서) | 개발사 (스폰서) | 개발사 (스폰서) |
| 정의/목적 | 지체된 개발 진행, 중대한 안전성 문제 해결 | 개발 주요 시점(Pre-IND, EOP, Pre-NDA/BLA 등) 논의 | Type A/B 외 기타 개발 및 검토 관련 모든 사항 논의 |
| 긴급성 | 매우 높음 (Critical Path) | 높음 (Milestone) | 상대적으로 낮음 (필요시) |
| 미팅의 의의 | 중대한 장애물 신속 해결 및 개발 정상화 | 개발 방향 설정, 규제 불확실성 해소, 성공적 허가 기반 마련 | 다양한 개발 이슈에 대한 유연한 자문 및 선제적 문제 해결 |
| 주요 예시 | 임상 보류 해제, 분쟁 해결, SPA 관련 논의 | Pre-IND, EOP1, EOP2/Pre-Phase 3, Pre-NDA/BLA 미팅 | 과학적 이슈, CMC, 시험 디자인 세부사항, 라벨링, 비임상 결과 등 |
| FDA 통보 | 14일 이내 | 21일 이내 | 21일 이내 |
| 미팅 개최 | 요청 접수 후 30일 이내 | 요청 접수 후 60일 이내 (EOP의 경우 70일 이내) | 요청 접수 후 75일 이내 |
| 미팅 개최 난이도 | 매우 어려움 (엄격한 기준 충족 필요) | 중간 (주요 단계별 필요성 입증) | 상대적으로 수월 (유연한 요청 가능, 명확한 목적 제시 시) |
|
출처) 미국 식품의약국(FDA) Guidance for Industry: Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products |
당사는 규제적 불확실성에 대응하고 개발 전략의 명확성을 확보하기 위해 규제기관과 소통하고 있습니다. CU06 임상 2a상에서 1차 평가지표 미충족 후, 향후 개발 방향에 대한 FDA의 견해를 확인하고자 미국 식품 의약국(FDA)와 Type C 미팅을 진행하여 임상 2b상 개발 전략의 주요 고려사항들을 논의하였습니다. 특히 '위약 대비 우월성 입증 임상' 프로토콜 진행 가능, 임상 2b상과 임상 3상의 투약 기간, 1차 및 2차 주요 평가지표로 황반중심두께(CST)가 아닌 최대교정시력(BCVA) 활용, 규제 준수를 위한 연구 개발 계획 등을 논의하였습니다.
그러나 이러한 규제기관과의 소통이 반드시 개발의 순항을 담보하는 것은 아니며, 협의 과정에서 예상치 못한 변수가 발생하거나 기존 논의된 사항이 변경될 가능성도 상존합니다. 따라서 투자자께서는 특정 미팅에서의 논의 내용이나 규제기관의 잠정적인 피드백이 곧 향후 임상시험의 성공이나 최종 허가를 보장하는 것은 아니라는 점을 충분히 인지하시고, 신중한 판단을 하시기 바랍니다.
또한, 각국 규제 당국의 심사 기준, 절차, 가이드라인 등은 예고 없이 변경될 수 있습니다. 이러한 규제 환경의 변화는 당사에게 추가적인 임상시험 수행, 보완 자료 제출, 허가 전략 수정 등을 요구할 수 있으며, 이는 신약 개발 비용의 증가, 개발 일정의 지연, 나아가서는 특정 파이프라인의 개발 포기로 이어질 수 있습니다. 예를 들어, 특정 성분이나 제형에 대한 새로운 안전성 규제가 도입되거나, 희귀의약품 지정 기준이 변경되는 등의 상황이 발생할 수 있습니다. 특히, 당사가 개발 중인 혁신 신약의 경우, 유사한 선례가 없어 규제 당국의 심사 과정에서 더 많은 불확실성에 직면할 수 있습니다. 모든 신약 개발 과정에는 다양한 변수와 불확실성이 내재되어 있으므로, 투자자께서는 이러한 신약 개발 및 허가 과정의 규제 관련 위험이 당사의 파이프라인 개발 일정 및 성공 가능성에 중대한 영향을 미칠 수 있음을 충분히 인지하시고 투자에 유의하시기 바랍니다.
(2) 약가 규제 정책 변화 위험
신약이 규제 당국의 시판 허가를 받더라도, 해당 국가의 건강보험 시스템에 등재되고 적절한 약가를 인정받아야 성공적인 시장 진입 및 매출 창출이 가능합니다. 그러나 대부분의 국가에서 정부는 건강보험 재정의 지속가능성 확보, 의약품 접근성 강화, 의료비 통제 등을 목적으로 약가에 대한 직·간접적인 규제를 시행하고 있으며, 이러한 약가 규제 정책은 신약 개발 기업의 수익성에 직접적인 영향을 미칩니다.
우리나라의 경우, 국민건강보험법에 따라 신약이 건강보험 급여 대상이 되기 위해서는 건강보험심사평가원의 약제급여 적정성 평가를 거쳐 국민건강보험공단과의 약가 협상을 통해 상한금액이 결정됩니다. 이 과정에서 신약의 임상적 유용성, 비용효과성, 대체 가능성, 보험 재정에 미치는 영향 등이 종합적으로 고려되므로, 당사가 개발한 신약이 기대만큼의 약가를 인정받지 못하거나 급여 등재 자체가 지연 또는 거부될 수 있습니다. 또한, 약가 등재 이후에도 사용량-약가 연동제, 실거래가 조사에 따른 약가 인하, 제네릭 등재에 따른 오리지널 약가 인하 등 다양한 사후 관리 제도를 통해 지속적으로 약가가 인하될 위험이 있습니다.
미국 의약품 시장은 전통적으로 자유로운 시장 경쟁을 통해 약가가 형성되어 왔으나, 최근에는 높은 약가에 대한 사회적 비판이 거세지면서 정부 차원의 약가 통제 움직임이 눈에 띄게 강화되고 있습니다. 이러한 변화의 대표적인 예로, 2022년에 발효된 인플레이션 감축법을 들 수 있습니다. 이 법안은 공공의료보험인 메디케어가 특정 고비용 의약품에 대해 제약사와 직접 약가를 협상할 수 있는 권한을 부여함으로써, 향후 미국 시장에서 신약의 가격 결정 방식과 제약 기업의 수익성에 중대한 변화를 가져올 것으로 예상됩니다.
여기에 더해, 2025년 5월 12일 트럼프 행정부에서는 '최혜국 대우' 원칙, 즉 다른 선진국들이 지불하는 가장 낮은 의약품 가격을 기준으로 미국 내 약가를 책정하려는 정책에 기반한 약가 모델의 재도입 포함한 약가인하 정책을 시행하였으며, 이와 함께 의약품 수입 확대, 복잡한 리베이트 시스템 개혁 등 추가적인 약가 인하 정책들을 적극적으로 모색하고 있는 상황입니다. 이 경우, 미국 시장에 새롭게 진출하는 신약들은 가격 책정 단계에서부터 상당한 인하 압박에 직면하게 될 것이며, 이는 당사와 같이 혁신 신약을 개발하는 기업들의 기대 수익률을 현저히 낮출 수 있는 직접적인 위험 요인입니다. 뿐만 아니라, 미국 각 주 정부 차원에서도 자체적으로 약가 투명성을 강화하고 리베이트를 규제하려는 다양한 정책들이 꾸준히 추진되고 있어, 전반적인 약가 인하 압력은 앞으로 더욱 거세질 것으로 전망됩니다.
유럽의 경우, 각 국가별로 상이한 약가 결정 및 상환 시스템을 운영하고 있으나, 대부분 참조가격제, 경제성 평가, 정부와의 직접 협상 등을 통해 약가를 통제하고 있습니다. 일본 또한 중앙사회보험의료협의회를 통해 약가를 결정하며, 정기적인 약가 재산정 제도를 운영하여 시장 실거래가를 반영한 약가 인하를 시행하고 있습니다.
이처럼 국내외적으로 강화되는 약가 규제 정책은 당사가 개발한 신약의 예상 시장 가치 및 수익성을 하락시켜, 연구개발 투자 비용의 회수를 어렵게 만들고 장기적으로는 혁신 신약 개발에 대한 동기를 저해할 수 있습니다. 투자자께서는 이러한 약가 규제 정책 변화가 당사 수익성에 미칠 수 있는 부정적 영향을 충분히 고려하시고, 당사 파이프라인의 상업화 성공 시 예상되는 수익 규모가 이러한 규제 환경에 따라 변동될 수 있음을 인지하시기 바랍니다.
(3) 정부 연구개발 지원 정책 변화 위험
정부는 제약·바이오 산업을 국가 핵심 전략 산업으로 인식하고, 신약 개발 및 산업 육성을 위해 다양한 연구개발 지원 정책을 운영하고 있습니다. 당사 또한 이러한 정부 연구개발 과제 참여를 통해 연구개발 자금의 일부를 지원받거나 정책적 혜택을 받고 있습니다. 예를 들어, 당사의 항체 신약 후보물질 MT-101과 MT-103은 국가신약개발사업단의 지원 과제로 선정된 바 있습니다.
그러나 정부의 재정 상황, 경제 정책 방향, 산업 육성 우선순위의 변화 등에 따라 제약·바이오 산업에 대한 연구개발 지원 규모가 축소되거나, 지원 대상 및 조건이 변경되거나, 특정 기술 분야에 대한 지원이 중단될 수 있습니다. 정부의 연구개발 지원이 감소하거나 중단될 경우, 당사는 연구개발 자금 확보에 어려움을 겪을 수 있으며, 이는 현재 진행 중인 연구개발 과제의 지연 또는 축소, 신규 연구개발 투자 위축 등으로 이어질 수 있습니다. 투자자께서는 정부 지원 정책의 변동 가능성 및 이에 따른 당사 연구개발 활동의 영향과 자금 조달 계획의 변동 가능성을 고려하시기 바랍니다.
(4) 기타 규제 환경 변화 위험
상기 언급된 사항 외에도, 의약품 제조 및 품질관리 기준, 임상시험 관리 기준, 비임상시험 관리 기준, 의약품 유통 관리 기준 등 신약 개발 및 생산, 유통 전반에 걸친 규제 기준이 강화될 수 있습니다. 이러한 기준을 충족하기 위해서는 지속적인 설비 투자 및 품질 관리 시스템 개선이 필요하며, 이를 준수하지 못할 경우 제조 허가 취소, 제품 회수 등의 제재를 받을 수 있습니다. 또한, 환경·안전·보건 관련 규제 강화는 생산 비용 증가 요인으로 작용할 수 있으며, 개인정보보호 규제는 임상시험 데이터 및 환자 정보 관리에 대한 부담을 가중시킬 수 있습니다. 공정거래 관련 법규 위반 시 과징금 부과 등 불이익을 받을 수도 있습니다.
당사는 이러한 정부 정책 및 규제 환경 변화에 대한 면밀한 모니터링과 법규 준수를 위한 내부 통제 시스템 강화를 통해 관련 위험을 최소화하고자 노력하고 있습니다. 그러나 예측 불가능하거나 급격한 정책 및 규제 변화는 당사의 사업 계획, 연구개발 활동, 수익성 및 재무 상태에 부정적인 영향을 미칠 수 있으므로, 투자자께서는 이 점에 각별히 유의하시고, 다양한 규제 환경 변화가 당사의 사업 전반에 미칠 수 있는 잠재적 위험을 인지하시기 바랍니다.
(주5) 정정 전
| 바. 신약 개발의 불확실성에 따른 위험 신약 개발은 본질적으로 매우 높은 불확실성을 내포하는 과정으로, 기초 연구 및 후보물질 발굴, 전임상시험, 임상 1상, 2상, 3상 시험, 허가 신청 및 심사, 시판 후 조사 등 여러 단계를 거치며 각 단계마다 실패할 위험이 매우 높습니다. 미국바이오협회와 인포마 파마 인텔리전스의 2021년 02월 보고서 "Clinical Development Success Rates and Contributing Factors 2011-2020"에 따르면, 임상 1상에 진입한 신약 후보물질이 최종적으로 미국 식품의약국의 시판 허가를 받을 확률은 평균 7.9%에 불과했으며, 특히 임상 2상 단계에서의 성공률은 28.9%로 가장 낮았습니다. 당사가 개발 중인 파이프라인 역시 이러한 통계적 실패율에서 자유로울 수 없습니다. 각 임상시험에서 1차 평가지표를 충족하지 못하거나, 통계적으로 유의미한 치료 효과를 입증하지 못하거나, 심각한 안전성 문제가 발생할 경우, 해당 파이프라인의 개발이 중단되거나 다음 단계 임상으로의 진입이 불가능해질 수 있으며, 이는 당사의 파이프라인 가치 하락, 주가 하락 등 심각한 부정적 결과를 초래할 수 있습니다. 또한, 임상시험 과정에서 환자 모집 지연, 임상시험수탁기관과의 문제, 임상시험용 의약품 생산 차질 등 다양한 변수로 인해 개발 일정이 지연되고 비용이 증가할 위험이 상존합니다. 임상시험에서 긍정적인 결과를 얻더라도 규제 당국의 품목허가를 받지 못하면 신약을 출시할 수 없으며, 허가를 받더라도 시장 경쟁, 낮은 시장 수용성, 불리한 약가 등으로 상업적 성공을 거두지 못할 위험도 존재합니다. 당사는 이러한 신약 개발의 높은 불확실성을 최소화하기 위해 노력하고 있으나, 본질적인 위험 요소는 완전히 제거하기 어렵습니다. 투자자께서는 신약 개발 과정의 본질적인 불확실성과 높은 실패 가능성을 충분히 인지하시고, 각 파이프라인의 진행 상황 및 결과에 따라 당사의 기업가치가 크게 변동될 수 있으며, 투자 원금 손실의 가능성도 있음을 유의하시기 바랍니다. |
신약 개발은 본질적으로 매우 높은 불확실성을 내포하는 과정으로, 기초 연구 및 후보물질 발굴, 전임상시험, 임상 1상, 2상, 3상 시험, 허가 신청 및 심사, 시판 후 조사 등 여러 단계를 거치며 각 단계마다 실패할 위험이 매우 높습니다. 미국바이오협회와 인포마 파마 인텔리전스의 2021년 02월 보고서 "Clinical Development Success Rates and Contributing Factors 2011-2020"에 따르면, 임상 1상에 진입한 신약 후보물질이 최종적으로 미국 식품의약국의 시판 허가를 받을 확률은 평균 7.9%에 불과했으며, 특히 임상 2상 단계에서의 성공률은 28.9%로 가장 낮았습니다. 당사가 개발 중인 파이프라인 역시 이러한 통계적 실패율에서 자유로울 수 없습니다.
| [신약 개발 단계 및 단계별 성공률] |
|
| 출처) 미국바이오협회, "Clinical Development Success Rates and Contributing Factors 2011-2020, 2021.02 |
당사의 주요 파이프라인인 CU06의 경우, 당뇨병성 황반부종 환자를 대상으로 미국 임상 2a상을 완료하고, 2024년 02월 05일 탑라인 결과를 발표하였으며 2024년 04월 04일 임상시험결과보고서(CSR)를 수령했습니다. 보고서에 따르면 1차 평가지표인 기저치(베이스라인) 대비 12주차 황반중심두께(CST) 변화는 전체 환자군에서 통계적으로 유의미한 변화가 관찰되지 않았으나, 베이스라인 황반중심두께 값이 모든 시험군에서 추가적인 악화 없이 안정화되었음을 확인했습니다. 2차 평가지표 중 하나인 최대교정시력(BCVA) 변화와 관련하여, 베이스라인 최대교정시력이 69글자 이하인 하위그룹의 경우 12주차에 300mg 투여군에서 5.8-6.1글자의 시력 개선(최소자승법 평균값 기준)을 보였으며, 안전성 및 내약성은 양호했습니다.
당사는 이번 임상 2a상 결과를 바탕으로 후속 임상 2b상을 진행할 예정이나, 1차 평가지표인 황반중심두께 변화에서 통계적 유의성을 확보하지 못한 점은 후속 임상 2b상 진행 및 기술이전 협상에 상당한 어려움을 야기할 수 있습니다. 1차 평가지표에서 명확한 효능을 입증하지 못함에 따라 후속 임상 2b상의 주요 평가지표 설정, 대상 환자군 선정, 적정 용량 결정 등 임상 디자인 수립에 있어 과학적 근거가 부족해질 수 있으며, 이는 규제기관과의 임상 디자인 협의 과정을 더욱 복잡하게 만들고 임상시험계획 승인 지연의 원인이 될 수 있습니다.
또한, 황반중심두께는 당뇨병성 황반부종에서 질병의 중증도를 나타내는 객관적이고 중요한 지표이므로, 이 지표에서 통계적으로 유의미한 개선 효과를 보이지 못한 것은 약물의 잠재적 효능에 대한 의구심을 증폭시켜 향후 임상 2b상의 성공 가능성을 낮추는 요인으로 작용할 수 있습니다. 비록 특정 하위그룹에서 긍정적인 시력 개선 효과가 관찰되었다고는 하나, 이것이 전체 환자군에서의 치료 효과를 담보하는 것은 아니기 때문입니다.
이러한 임상 2a상 1차 평가지표 미충족은 신약 후보물질의 가치 평가에 부정적인 영향을 미쳐, 후속 임상 개발에 필요한 자금 조달이나 글로벌 제약사와의 기술이전 협상 시 당사를 불리한 위치에 놓이게 할 수 있습니다. 잠재적 투자자나 파트너사는 약물의 효능에 대해 더욱 엄격한 기준을 적용하거나 더 많은 검증 데이터를 요구할 수 있으며, 투자 조건이나 기술이전 조건을 보수적으로 설정할 가능성이 높습니다.
뿐만 아니라, 임상 2a상 결과에 따라 후속 임상 2b상의 디자인을 변경하거나 약물의 효능을 보다 명확히 입증하기 위한 추가적인 탐색적 연구 또는 소규모 임상시험이 필요할 경우, 전체적인 신약 개발 기간이 연장되고 연구개발 비용의 추가적인 증가를 초래할 수 있습니다. 마지막으로, 임상 2a상은 신약 개발 초기 단계의 임상시험이지만, 1차 평가지표 미충족 이력은 향후 품목허가 신청 시 규제 당국의 심사 과정에서 약물의 유효성에 대한 추가적인 소명 자료를 요구받거나 더 엄격한 심사 기준이 적용될 수 있는 잠재적 위험 요인이 될 수 있습니다.
한편, 당사는 2021년 10월 프랑스 떼아 오픈이노베이션과 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06와 관련하여 아시아(한국, 중국, 일본, 인도 등 일부 국가 제외)를 제외한 전 세계 지역에서의 개발 및 상업화 권리를 이전하는 계약을 체결하였으나, 2024년 07월 12일 권리반환이 확정되었습니다. 계약 해지 사유는 떼아 오픈이노베이션의 내부 개발 전략 변경으로, 당사는 CU06에 대한 모든 권리를 반환받았습니다. 이에 따라 당사는 CU06의 당뇨병성 황반부종 및 습성 황반변성 적응증에 대한 향후 개발 및 상업화 전략을 재수립해야 하며, 기존에 기대했던 마일스톤 및 로열티 수익 확보는 불가능하게 되었습니다. 이는 당사의 향후 수익성 및 현금흐름에 부정적인 영향을 미칠 수 있습니다.
당뇨병성 신증 치료제로 개발 중인 CU01은 현재 임상2b상을 진행 중으로 별도의 개발 경로를 따르고 있으며, 반려동물 만성신장질환 치료제로 개발 중인 CP01-R01은 임상3상을 진행하고 있습니다. 그 외 알츠하이머병 치료제인 CU71을 비롯해 맵틱스와 공동 연구개발 중인 항체치료제 MT 시리즈 등은 아직 초기 연구개발 단계로 불확실성이 매우 높습니다.
| [당사 파이프라인 현황] |
|
||
|
| 출처) 당사 제시 |
각 임상시험에서 1차 평가지표를 충족하지 못하거나, 통계적으로 유의미한 치료 효과를 입증하지 못하거나, 심각한 안전성 문제가 발생할 경우, 해당 파이프라인의 개발이 중단되거나 다음 단계 임상으로의 진입이 불가능해질 수 있으며, 이는 당사의 파이프라인 가치 하락, 주가 하락 등 심각한 부정적 결과를 초래할 수 있습니다. 또한, 임상시험 과정에서 환자 모집 지연, 임상시험수탁기관과의 문제, 임상시험용 의약품 생산 차질 등 다양한 변수로 인해 개발 일정이 지연되고 비용이 증가할 위험이 상존합니다. 임상시험에서 긍정적인 결과를 얻더라도 규제 당국의 품목허가를 받지 못하면 신약을 출시할 수 없으며, 허가를 받더라도 시장 경쟁, 낮은 시장 수용성, 불리한 약가 등으로 상업적 성공을 거두지 못할 위험도 존재합니다.
당사는 이러한 신약 개발의 높은 불확실성을 최소화하기 위해 노력하고 있으나, 본질적인 위험 요소는 완전히 제거하기 어렵습니다. 투자자께서는 신약 개발 과정의 본질적인 불확실성과 높은 실패 가능성을 충분히 인지하시고, 각 파이프라인의 진행 상황 및 결과에 따라 당사의 기업가치가 크게 변동될 수 있으며, 투자 원금 손실의 가능성도 있음을 유의하시기 바랍니다
(주5) 정정 후
|
바. 신약 개발의 불확실성에 따른 위험 또한, CU06의 글로벌 개발을 위해 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 기술이전 계약이 2024년 7월 파트너사의 내부 개발 전략 변경을 사유로 해지되었으며 당사는 반환된 CU06의 경쟁력을 재점검하고 향후 개발 계획을 수립하였습니다. 더불어 기업공개(IPO) 당시 계획했던 주요 파이프라인의 임상시험 및 기술이전 일정이 전반적으로 지연되고 있습니다. CU06은 파트너사와의 협력 및 규제 대응 과정에서, CU01(당뇨병성 신증 치료제)은 규제기관의 권고 및 대규모 임상 필요성에 따른 개발 전략 수정으로 인해 당초 예상보다 사업화 성과 달성이 지체되고 있습니다. 이와 같은 개발 일정 지연은 추가적인 비용 발생으로 이어질 수 있으며, 향후 계획 역시 추가적인 변수로 인해 지연될 가능성이 있습니다. 상기 서술된 바와 같이 각 임상시험에서 1차 평가지표를 충족하지 못하거나, 통계적으로 유의미한 치료 효과를 입증하지 못하거나, 심각한 안전성 문제가 발생할 경우, 해당 파이프라인의 개발이 중단될 수 있습니다. 이는 당사의 파이프라인 가치 하락, 주가 하락 등 심각한 부정적 결과를 초래할 수 있습니다. 또한, 임상시험 과정에서 환자 모집 지연, 임상시험수탁기관과의 문제, 임상시험용 의약품 생산 차질 등 다양한 변수로 인해 개발 일정이 지연되고 비용이 증가할 위험이 상존합니다. 긍정적인 임상 결과를 얻더라도 규제 당국의 품목허가를 받지 못하면 신약을 출시할 수 없으며, 허가를 받더라도 시장 경쟁, 낮은 시장 수용성, 불리한 약가 등으로 상업적 성공을 거두지 못할 위험도 존재합니다. |
신약 개발은 본질적으로 매우 높은 불확실성을 내포하는 과정으로, 기초 연구 및 후보물질 발굴, 전임상시험, 임상 1상, 2상, 3상 시험, 허가 신청 및 심사, 시판 후 조사 등 여러 단계를 거치며 각 단계마다 실패할 위험이 매우 높습니다. 미국바이오협회와 인포마 파마 인텔리전스의 2021년 02월 보고서 "Clinical Development Success Rates and Contributing Factors 2011-2020"에 따르면, 임상 1상에 진입한 신약 후보물질이 최종적으로 미국 식품의약국의 시판 허가를 받을 확률은 평균 7.9%에 불과했으며, 특히 임상 2상 단계에서의 성공률은 28.9%로 가장 낮았습니다. 당사가 개발 중인 파이프라인 역시 이러한 통계적 실패율에서 자유로울 수 없습니다.
| [신약 개발 단계 및 단계별 성공률] |
|
| 출처) 미국바이오협회, "Clinical Development Success Rates and Contributing Factors 2011-2020, 2021.02 |
당사의 주요 파이프라인인 CU06의 경우, 당뇨병성 황반부종 환자를 대상으로 미국 임상 2a상을 완료하고, 2024년 02월 05일 탑라인 결과를 발표하였으며 2024년 04월 04일 임상시험결과보고서(CSR)를 수령했습니다. 보고서에 따르면 1차 평가지표인 기저치(베이스라인) 대비 12주차 황반중심두께(Central Subfield Thickness, CST) 변화는 전체 환자군에서 통계적으로 유의미한 변화가 관찰되지 않았으나, 베이스라인 황반중심두께 값이 모든 시험군에서 추가적인 악화 없이 안정화되었음을 확인했습니다. 2차 평가지표 중 하나인 최대교정시력(Best Corrected Visual Acuity, BCVA) 변화와 관련하여, 베이스라인 최대교정시력이 69글자 이하인 하위그룹의 경우 12주차에 300mg 투여군에서 5.8-6.1글자의 시력 개선(최소자승법 평균값 기준)을 보였으며, 안전성 및 내약성은 양호했습니다.
당뇨병성 황반부종(Diabetic Macular Edema)은 당뇨병으로 인해 망막 중심부인 황반에 혈관이 누수되어 부종이 발생하여 시력이 저하되는 질환으로, 해당 질환 치료의 궁극적인 목적은 단순한 해부학적 개선을 넘어 환자의 최대교정시력을 유지하거나 개선하는 것입니다. 이는 미국 FDA를 포함한 글로벌 규제기관이 당뇨병성 황반부종 치료제 허가 시 가장 중요한 평가 기준으로 삼는 항목이기도 합니다.
당뇨병성 황반부종 치료제의 품목허가를 위한 임상3상 단계에서는 반드시 최대교정시력을 1차 평가지표로 설정해야 하지만, 임상 2상과 같은 초기 단계에서는 약물의 치료기전과 효능 등을 탐색하기 위해 다양한 지표가 우선적으로 적용될 수 있습니다. 특히 비임상(동물실험) 단계에서는 동물을 대상으로 시력 지표를 직접 평가하기 어려운 한계가 있어 동물실험에서 확인된 해부학적 변화(황반중심두께, 섬유화 등)를 1차 평가지표로 설정하여 임상시험 설계를 진행하게 됩니다.
CU06 또한 이러한 배경 하에 지난 당뇨병성 황반부종 임상2a상에서 1차 평가지표로 황반중심두께를, 2차 평가지표로 최대교정시력을 설정하여 탐색적 분석을 수행했습니다.
임상 2a상은 일반적으로 약물의 안전성을 확인하고 초기 유효성을 탐색하는 단계로, CU06의 해당 임상시험에서 1차 평가지표를 충족하지 못한 점은 향후 개발 과정에서의 불확실성을 높이는 요인으로 작용할 수 있습니다. 당사는 해당 임상에서 황반중심두께(CST)의 안정적 유지 및 최대교정시력(BCVA)의 일부 개선 추세 등 긍정적인 경향을 관찰하였으나, 임상 결과 해석에는 한계가 있으며, 후속 임상을 통해 치료제로서의 효능과 안전성을 확인해야 합니다. 투자자께서는 1차 평가지표 미충족이라는 객관적 결과와 이것이 후속 임상 및 최종 허가 가능성에 미칠 수 있는 잠재적 영향을 신중하게 고려하실 필요가 있으며, 현재까지의 결과는 추가적인 검증이 요구되는 초기 단계의 소견임을 유의하시기 바랍니다.
당사는 이번 임상 2a상 결과를 바탕으로 후속 임상 2b상을 진행할 예정이나, 1차 평가지표인 황반중심두께 변화에서 통계적 유의성을 확보하지 못한 점은 후속 임상 2b상 진행 및 기술이전 협상에 상당한 어려움을 야기할 수 있습니다.
황반중심두께는 당뇨병성 황반부종에서 질병의 중증도를 나타내는 객관적이고 중요한 지표이므로, 이 지표에서 통계적으로 유의미한 개선 효과를 보이지 못한 것은 약물의 잠재적 효능에 대한 의구심을 증폭시켜 향후 임상 2b상의 성공 가능성을 낮추는 요인으로 작용할 수 있습니다. 비록 특정 하위그룹에서 긍정적인 시력 개선 효과가 관찰되었다고는 하나, 이것이 전체 환자군에서의 치료 효과를 담보하는 것은 아니기 때문입니다.
CU06의 임상2a상 결과 1차 평가지표에서 명확한 효능을 입증하지 못함에 따라 후속 임상 2b상의 주요 평가지표 설정, 대상 환자군 선정, 적정 용량 결정 등 임상 디자인 수립에 있어 과학적 근거가 부족해질 수 있으며, 이는 규제기관과의 임상 디자인 협의 과정을 더욱 복잡하게 만들고 임상시험계획 승인 지연의 원인이 될 수 있습니다. 뿐만 아니라, 임상 2a상 결과에 따라 후속 임상 2b상의 디자인을 변경하거나 약물의 효능을 보다 명확히 입증하기 위한 추가적인 탐색적 연구 또는 소규모 임상시험이 필요할 경우, 전체적인 신약 개발 기간이 연장되고 연구개발 비용의 추가적인 증가를 초래할 수 있습니다.
또한 신약 후보물질의 가치 평가에 부정적인 영향을 미쳐, 후속 임상 개발에 필요한 자금 조달이나 글로벌 제약사와의 기술이전 협상 시 당사를 불리한 위치에 놓이게 할 수 있습니다. 잠재적 투자자나 파트너사는 약물의 효능에 대해 더욱 엄격한 기준을 적용하거나 더 많은 검증 데이터를 요구할 수 있으며, 투자 조건이나 기술이전 조건을 보수적으로 설정할 가능성이 높습니다.
마지막으로, 임상 2a상은 신약 개발 초기 단계의 임상시험이지만, 1차 평가지표 미충족 이력은 향후 품목허가 신청 시 규제 당국의 심사 과정에서 약물의 유효성에 대한 추가적인 소명 자료를 요구받거나 더 엄격한 심사 기준이 적용될 수 있는 잠재적 위험 요인이 될 수 있습니다.
이에 따라 당사는 CU06의 개발 전략, 특히 임상 2b상 및 3상, 허가 단계에 이르는 전반적인 계획에 대해 FDA의 검토를 받고자 2025년 2월 Type C 미팅을 진행했습니다. 이는 막대한 자원과 시간이 소요되는 후속 임상에 본격적으로 돌입하기 전, FDA와 협의를 통해 향후 개발의 불확실성을 줄이고 성공 가능성을 높이기 위한 목적이었습니다. 특히 계열 내 최초 신약(First-in-Class)과 같이 기존에 승인된 유사한 약물이 없는 경우, FDA의 의견을 미리 확인하는 것이 중요합니다. 글로벌 제약사들 또한 신약 개발의 성공 가능성을 높이기 위해 Type C 미팅을 적극 활용하고 있습니다.
미국 FDA와의 미팅은 신약 개발 과정에서 개발사가 FDA와 공식적으로 논의하는 사전 협의 절차 중 하나입니다. 이를 통해 개발사는 신약 개발 전략 수립 과정에서 FDA의 피드백을 받고 임상시험 설계, 데이터 제출 전략 등 다양한 사항에 대한 과학적, 규제적 조언을 구할 수 있습니다. 특히 CU06과 같이 계열 내 최초 신약이거나 당뇨병성 황반부종 적응증으로 후기 임상에 진입하는 세계 최초의 경구용 약물인 경우, 개발 방향 설정에 있어 규제기관의 의견을 사전에 확인하는 것이 중요합니다.
주요 미팅 유형과 그 내용은 다음과 같습니다.
| [미국 식품의약국(FDA) 미팅 유형] |
| 구분 | Type A 미팅 | Type B 미팅 | Type C 미팅 |
|---|---|---|---|
| 요청 주체 | 개발사 (스폰서) | 개발사 (스폰서) | 개발사 (스폰서) |
| 정의/목적 | 지체된 개발 진행, 중대한 안전성 문제 해결 | 개발 주요 시점(Pre-IND, EOP, Pre-NDA/BLA 등) 논의 | Type A/B 외 기타 개발 및 검토 관련 모든 사항 논의 |
| 긴급성 | 매우 높음 (Critical Path) | 높음 (Milestone) | 상대적으로 낮음 (필요시) |
| 미팅의 의의 | 중대한 장애물 신속 해결 및 개발 정상화 | 개발 방향 설정, 규제 불확실성 해소, 성공적 허가 기반 마련 | 다양한 개발 이슈에 대한 유연한 자문 및 선제적 문제 해결 |
| 주요 예시 | 임상 보류 해제, 분쟁 해결, SPA 관련 논의 | Pre-IND, EOP1, EOP2/Pre-Phase 3, Pre-NDA/BLA 미팅 | 과학적 이슈, CMC, 시험 디자인 세부사항, 라벨링, 비임상 결과 등 |
| FDA 통보 | 14일 이내 | 21일 이내 | 21일 이내 |
| 미팅 개최 | 요청 접수 후 30일 이내 | 요청 접수 후 60일 이내 (EOP의 경우 70일 이내) | 요청 접수 후 75일 이내 |
| 미팅 개최 난이도 | 매우 어려움 (엄격한 기준 충족 필요) | 중간 (주요 단계별 필요성 입증) | 상대적으로 수월 (유연한 요청 가능, 명확한 목적 제시 시) |
|
출처) 미국 식품의약국(FDA) Guidance for Industry: Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products |
당사는 FDA와 미팅에서 CU06 후속 임상 디자인으로 '위약 대비 우월성 입증 임상(vs. Placebo)'을 제안했으며, FDA는 이러한 디자인 방향에 동의했습니다. 또한, 임상2b상의 투약 기간은 '6개월(24주 투약) + 1개월(4주 안전성 추적 관찰)'로, 임상3상은 '1년(52주 투약)'으로 제안하여 FDA의 동의를 얻었습니다. 이것이 통상적인 Anti-VEGF 주사제 임상 기간(임상2b상 약 1년, 임상3상 약 2년) 대비 짧아 개발 기간 단축 및 비용 절감 효과를 기대하고 있습니다.
FDA는 CU06의 후속 임상(임상2b상 및 임상3상)에서 1차 및 2차 주요 평가지표로 '최대교정시력'을 활용할 것을 권고했으며, 임상 2a상의 1차 평가지표였던 '황반중심두께'에 대해서는 별도의 언급이 없었습니다. 이에 따라 임상2b상에서 최대교정시력을 1차 평가지표, 2차 평가지표로 활용하여 효능을 평가할 계획입니다.
FDA는 CU06 약물에 대한 이해를 높이기 위한 질문과 함께 총 9개의 추가 연구 계획을 제시할 것을 요청했습니다. 이 중 4개는 이미 완료되었거나 진행 중이며, 나머지 연구들은 비임상(In vitro, In vivo) 수준으로 임상3상 종료 후 허가 신청(NDA) 전까지 제출하면 되는 사항이므로 현재 개발 일정에는 영향을 미치지 않을 것으로 예상하고 있습니다.
당사는 이번 FDA와의 Type C 미팅을 통해 CU06의 개발 전략이 임상 2b상뿐 아니라 임상 3상 단계까지 구체적으로 확립되었으며, 이는 향후 글로벌 제약사와의 기술이전 논의 시 CU06의 임상 성공 및 허가 가능성에 대한 신뢰도를 높일 수 있을 것으로 기대하고 있습니다.
그러나 FDA와의 협의를 통해 개발 전략이 명확해진 점은 긍정적일 수 있으나, 기술이전의 성사 여부 및 조건은 잠재적 파트너사의 자체적인 실사 결과, 임상 2b상의 실제 데이터, 시장 상황 등 다양한 요인에 의해 결정되므로 Type C 미팅 결과만으로 기술이전의 성공을 낙관하기는 어렵습니다. 또한 투자자께서는 Type C 미팅이 FDA의 공식적인 조언을 받는 과정일 뿐, 그 결과가 향후 후속 임상의 임상시험계획승인이나 최종 품목허가를 보장하지 않는다는 점을 유의하셔야 합니다. FDA의 권고는 개발 방향을 제시할 뿐이며,계열 내 최초 신약 및 새로운 투여 경로 약물 개발은 본질적으로 높은 불확실성과 위험을 수반하는 점을 유의하시기 바랍니다.
한편, 2021년 10월 프랑스 떼아 오픈이노베이션과 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06와 관련하여 아시아(한국, 중국, 일본, 인도 등 일부 국가 제외)를 제외한 전 세계 지역에서의 개발 및 상업화 권리를 이전하는 계약을 체결하였으나, 2024년 07월 12일 권리반환이 확정되었습니다. 계약 해지 사유는 떼아 오픈이노베이션의 내부 개발 전략 변경으로, CU06에 대한 모든 권리를 반환받았습니다. 이에 따라 CU06의 당뇨병성 황반부종 및 습성 황반변성 적응증에 대한 향후 개발 및 상업화 전략을 재수립해야 하며, 기존에 기대했던 마일스톤 및 로열티 수익 확보는 불가능하게 되었습니다. 이는 당사의 향후 수익성 및 현금흐름에 부정적인 영향을 미칠 수 있습니다.
이에 당사는 반환된 CU06의 경쟁력을 재점검하고 향후 개발 계획을 수립하고자, 현재 상용화된 경쟁 제품 및 개발 중인 파이프라인과 그 특성을 비교하였습니다.
| [CU06의 경쟁 약물 비교] |
| 제품명 | CU06 | 아일리아 | 루센티스 | 바비스모 | RZ402 | Danegaptide | Tonabersat | IBE-814 IVT | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 적응증 | 당뇨병성 황반부종, 습성 황반변성 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 |
당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 |
당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 |
당뇨병성 황반부종 | 당뇨 망막병증 | 당뇨병성 황반부종 | 당뇨병성 황반부종 | ||
| 작용 기전 | 혈관내피기능장애 차단 | VEGF 억제 | VEGF 억제 | VEGF 및 Ang-2 이중억제 | Plasma kallikrein inhibitor | 갭 접합 단백질 Alpha 1 활성제 | Connexin43 반채널 억제제 | 항염증 스테로이드(Dexamethasone) | ||
| 투여경로 | 경구 투여 | 안구 주사제 | 안구 주사제 | d안구 주사제 | 경구 투여 | 경구 투여 | 경구 투여 | 안구 내 임플란트 | ||
| 개발 단계 | 임상2a상 완료, 임상2b상 준비 중 | 시판 중 | 시판 중 | 시판 중 | 당뇨병성 황반부종 임상2a상 완료 | 당뇨 망막병증 임상 1b/2a상 진행 중 | 당뇨병성 황반부종 임상2상 진행 중 | 당뇨병성 황반부종 임상 2b상 완료 | ||
| 시장성 | 높음 | 높음 | 높음 | 높음 | 높음 | 높음 | 높음 | 낮음 | ||
| 특징 | - 임상2a상에서 황반중심두께 유지 및 시력개선 효과와 안전성을 입증 | - 항체 치료제로서 다양한 망막질환에 사용 중 - 반복 치료시 내성 발생 |
- 항체 치료제로서 다양한 망막질환에 사용 중 - 반복 치료시 내성 발생 |
- 망막질환 치료제 내 최초의 이중항체 치료제 - 반복 치료시 내성 발생 |
- 임상2a상 황반중심두께 개선 확인 | - 심근경색 적응증으로 개발 중단 이력 | - 편두통 적응증으로 개발 중단 이력 | - 상용화된 기존 스테로이드 치료제 존재 | ||
| 개발회사명 | 큐라클 | 리제네론 | 바이엘 | 노바티스 | 로슈 | 로슈 | 레졸루트 | 브레이 | 인플램엑스 | 리플테라퓨틱스 |
| 소재지 | 대한민국 | 미국 | 독일 | 스위스 | 스위스 | 스위스 | 미국 | 덴마크 | 미국 | 미국 |
| 출처) 당사 제시 |
당사가 개발 중인 CU06의 주요 적응증인 망막질환 시장(당뇨병성 황반부종, 습성 황반변성 등)은 다수의 글로벌 제약사 및 바이오 기업들이 경쟁하고 있는 분야입니다. 현재 대표적인 망막질환 치료제로는 안구에 직접 약물을 주사하는 형태의 안구내 주사제가 주로 사용되고 있으며, 리제네론과 바이엘의 '아일리아', 노바티스와 로슈의 '루센티스', 로슈의 '바비스모' 등이 대표적인 예입니다.
이들 약물은 공통적으로 혈관내피세포 성장인자(VEGF, Vascular Endothelial Growth Factor)를 억제함으로써 병적 혈관 생성과 혈관 누출을 차단하는 작용 기전을 기반으로 하며, 현재까지도 표준 치료제로 사용되고 있습니다. 그러나 VEGF 단독 억제 방식은 일부 환자군에서 반응이 제한적이거나, 장기적인 반복 치료 시 치료 효과가 점차 감소하는 한계가 보고되고 있습니다. 또한 유리체강 내 반복 주사는 안내염, 안구 내 염증, 망막박리 등의 시술 관련 부작용 위험을 수반하며, 1~2개월 간격으로 반복 투여해야 하는 일정 역시 환자와 보호자에게 상당한 부담으로 작용하고 있습니다.
비침습적이고 환자 순응도를 높일 수 있는 경구용 치료제에 대한 개발 시도가 활발히 이루어져 왔으나, 현재까지 망막질환에 대해 허가를 받은 경구용 치료제는 존재하지 않습니다. 로슈, 베링거인겔하임, 센쥬 등 글로벌 주요 제약사들도 경구용 치료제 개발을 다수 시도했으나, 최대교정시력과 같은 유효성 지표를 입증하지 못하거나 안전성 이슈로 인해 임상에 실패한 사례가 이어졌습니다.
현재 글로벌 기준에서 임상 단계에 진입하여 활발히 개발되고 있는 경구용 망막질환 치료제 후보물질은 극히 제한적이며, 대표적으로 당사의 CU06, 레졸루트의 'RZ402', 브레이의 'Danegaptide', 인플램엑스의 'Tonabersat' 등이 있습니다. 이들 중 일부는 당뇨병성 황반부종을 적응증으로, 일부는 당뇨 망막병증을 목표로 개발되고 있으며, 모두 기존의 항-VEGF 치료제를 대체하거나 병용 가능한 경구 치료제로서의 가능성을 입증하기 위해 임상개발을 진행 중입니다. 레졸루트의 RZ402는 동일한 작용기전의 약물이 안구내 주사제 형태로 망막질환 치료제로 개발된 이력이 2번 있지만 개발이 중단됐으며, 임상2a상에서 황반중심두께는 개선하는 결과를 보였지만, 최대교정시력은 변화를 보이지 않은 것으로 알려져 있습니다. 브레이의 Danegaptide와 인플램엑스의 Tonabersat은 각각 심근경색, 편두통 치료제로 임상2상을 진행했지만 개발이 중단되고 현재 망막 질환으로 적응증을 변경하여 개발하고 있습니다.
IBE-814 IVT는 스테로이드 계열 항염증 약물인 덱사메타손 기반의 안구 내 주사형 임플란트로, 임상 2b상을 완료한 상태입니다. 주성분인 덱사메타손은 기존 시장에서 장기간 사용되어 임상 데이터가 축적된 물질이며, 애브비(AbbVie)의 오저덱스(Ozurdex)와 같은 유사 기전의 상용화된 제품이 존재하여 상대적으로 개발 위험이 낮습니다. 그러나 기존 치료제 대비 목표 시장의 규모가 제한적일 수 있으며, 장기 투여 시 백내장 등 부작용 발생 가능성이 존재하는 한계가 있습니다. 이는 빠른 상업화가 가능하나 상대적으로 낮은 기대수익을 특징으로 합니다.
반면 CU06은 혈관내피기능장애를 표적하는 계열 내 최초(First-in-Class) 신약 후보물질입니다. 선행 약물이 없어 개발 과정의 불확실성 및 위험은 상대적으로 높으나, 신규 작용기전과 경구용 제형이라는 특징을 바탕으로 기존 Anti-VEGF 주사제의 제형 및 내성 이슈로 인해 미충족 수요가 존재하기 때문에 더 큰 규모의 시장을 목표할 수 있습니다.
상기 권리반환에도 불구하고, 당사는 CU06이 임상 2a상에서 핵심 유효성 지표인 최대교정시력(BCVA)의 개선 효과를 입증하였으며, 상기 기재한 경쟁 약물과의 비교표를 통해 확인할 수 있는 특징 등을 통해서 후속 기술이전 가능성이 높은 파이프라인으로 내부적으로 평가하고 있으며 임상 2b상을 진행하고자 합니다. 그럼에도 불구하고 투자자께서는 CU06의 임상 2a상 1차 평가지표인 황반중심두께 변화 미충족 등 객관적인 사실을 면밀히 검토하여 투자를 결정하시기 바랍니다.
당뇨병성 신증 치료제로 개발 중인 CU01은 현재 임상2b상을 진행 중으로 별도의 개발 경로를 따르고 있으며, 반려동물 만성신장질환 치료제로 개발 중인 CP01-R01은 임상3상을 진행하고 있습니다. 그 외 알츠하이머병 치료제인 CU71을 비롯해 맵틱스와 공동 연구개발 중인 항체치료제 MT 시리즈 등은 아직 초기 연구개발 단계로 불확실성이 매우 높습니다.
| [당사 파이프라인 현황] |
|
||
|
| 출처) 당사 제시 |
당사의 파이프라인별 진행 예정인 임상 개요는 다음과 같습니다.
| [CU06 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 주요 목적 - 당뇨병성 황반부종(DME) 환자를 대상으로 최적의 용량을 도출하여 향후 3상 시험 설계에 반영 부차적 목적 - 24주 후 CU06의 안전성과 유효성 평가 (위약과 비교) - CU06 및 대사체의 혈중 약물동태(PK) 평가 - 혈중 바이오마커(TNF-α, IL-6 등)에 대한 CU06-1004의 영향 분석 |
| 임상시험 대상국가 | 미국 내 20개 기관에서 환자 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 이번 임상시험은 미국 내 20개 의료기관에서 시행되는 무작위배정, 이중눈가림, 위약대조 방식의 다기관 임상 2b상 시험으로, 중심성 당뇨병성 황반부종(Center-Involved Diabetic Macular Edema, DME) 환자를 대상으로 CU06-1004의 유효성과 안전성을 평가하기 위해 설계되었습니다. 총 135명의 환자를 1:1:1 비율로 세 군(200mg, 300mg, 위약)으로 무작위 배정하여, 매일 식사 직후 경구로 24주간 약물을 투여받게 됩니다. - 주 평가 지표는 24주 시점에서의 ETDRS 문자표 기준 최고교정시력(BCVA) 변화량이며, 이외에도 망막 두께, 망막 내/하부 액체량, 혈관 밀도 및 혈류량, 염증성 바이오마커(TNF-α, IL-6) 등의 변화를 포함한 다양한 이차 평가지표들을 통해 약물의 치료 효과를 종합적으로 분석합니다. - 약동학적 특성은 혈중 약물 농도 측정을 통해 파악되며, 안전성은 이상반응 발생률, 생체징후 변화, 심전도 및 혈액검사 등 다양한 지표를 통해 평가됩니다. 주요 유효성 분석은 MMRM(Mixed Model for Repeated Measures)을 이용하며, 300mg과 200mg 용량을 위약과 순차적으로 비교하여 통계적 유의성을 검증합니다. |
| 기대효과 | - 본 임상을 통해 CU06-1004가 당뇨병성 황반부종 환자에서 유의미한 시력 개선 및 망막 구조 개선 효과를 나타낼 경우, 기존 항VEGF 주사제 중심의 치료법에 대한 대안으로 자리매김할 수 있을 것으로 기대됩니다. 특히 CU06-1004는 경구 투약이라는 비침습적 제형을 통해, 반복적인 안구 주사로 인한 환자 부담과 내원 횟수를 줄일 수 있는 잠재력을 보유하고 있습니다. - 또한, 다양한 시각적 기능 및 구조적 개선 외에도 염증 조절과 혈관 안정화 등의 기전을 입증함으로써, 기존 치료제 대비 차별화된 약물 프로파일을 확보할 수 있습니다. 이번 임상에서 도출되는 최적 용량과 유효성·안전성 데이터는 향후 3상 시험 설계의 근거가 되며, 글로벌 라이선싱 및 상업화를 위한 핵심 기반 자료로 활용될 수 있습니다. 이를 통해 CU06-1004는 DME 치료 분야에서 새로운 경구 치료제로서의 가능성을 입증할 수 있을 것으로 기대됩니다. |
| 출처) 당사 제시 |
| [CU71 임상1상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 이번 임상시험의 목적은 건강한 성인을 대상으로 CU71의 안전성, 내약성, 그리고 약동학적 특성을 평가하는 것입니다. 본 임상시험을 통해 단회 및 반복 투여 시 CU71의 체내 흡수, 분포, 대사 및 배출 특성을 확인하고, 인체 내에서의 안전성과 복용 가능 용량을 도출하여 향후 알츠하이머병 환자를 대상으로 한 임상 2상 진입을 준비하고자 합니다. |
| 임상시험 대상국가 | CU71의 이번 임상 1상 시험은 미국에서 진행될 예정입니다. 미국 식품의약국(FDA)의 승인을 받은 후, 미국 내 전문 임상시험기관에서 국제 임상시험 기준(GCP)을 준수하여 단일기관 방식으로 수행됩니다. |
| 임상시험 수행방법 | - 임상시험은 건강한 성인을 대상으로 진행되며, 무작위배정, 이중눈가림, 위약대조 방식으로 설계되었습니다. 시험대상자는 단회 또는 7일간 반복하여 CU71을 경구로 투약받게 되며, 용량은 단계적으로 증량되며, 각 단계에서의 안전성과 약동학 데이터를 기반으로 다음 단계로의 진입 여부가 결정될 예정입니다. - 시험 기간 동안 피험자들은 반복적인 혈액 및 소변 채취를 통해 약물의 혈중 농도 및 약동학적 지표를 측정받으며, 동시에 이상반응, 심전도 변화, 활력징후, 임상병리 검사 등을 통해 전반적인 안전성을 평가받게 됩니다. 특히 반복 투여 시 체내 약물 축적 여부를 확인하여 장기간 복용에 대한 위험성도 함께 평가하게 됩니다. |
| 기대효과 | - 이번 임상시험을 통해 CU71이 건강한 성인에서 전신적으로 안전하고 예측 가능한 약동학적 특성을 보인다는 것이 입증된다면, 알츠하이머병 환자를 대상으로 한 후속 임상(2상) 진행이 가능해질 것으로 기대됩니다. 특히 CU71은 경구로 복용 가능한 치료제이기 때문에 기존 주사제 기반 치료에 비해 환자의 복약 편의성 및 치료 접근성을 크게 향상시킬 수 있을 것으로 보입니다. - 아울러 본 임상 1상을 통해 확보되는 안전성 및 약동학 데이터는 적절한 초기 용량 설정에 중요한 근거가 되며, 후속 개발과 글로벌 파트너십 논의에도 긍정적인 영향을 줄 수 있을 것으로 예상됩니다. CU71은 기존 치료제의 한계를 극복할 수 있는 새로운 치료 옵션으로 자리매김할 가능성을 가진 후보물질로, 이번 임상을 통해 그 가능성을 한 단계 더 검증하는 계기가 될 것입니다. |
| 출처) 당사 제시 |
| [CU01 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | - 본 임상시험은 알부민뇨를 동반한 제2형 당뇨병성 신증 환자를 대상으로, 당사의 신약 후보물질인 CU01을 24주간 투여하여 유효성과 안전성을 평가하고, 동시에 적절한 투여 용량을 탐색하기 위해 설계되었습니다. - 당뇨병성 신증은 진행 시 투석 등 중증 합병증으로 이어질 수 있음에도 불구하고 현재까지 뚜렷한 치료제가 없는 영역으로, 이번 임상시험은 CU01의 치료 가능성을 과학적이고 객관적인 방식으로 입증하고자 하는 데 목적이 있습니다. |
| 임상시험 대상국가 | 대한민국 내 24개 기관에서 환자 240명 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 본 임상시험은 알부민뇨가 동반된 제2형 당뇨병성 신증 환자를 대상으로 실시됩니다. 시험대상자에게는 당사의 임상시험용 의약품인 CU01을 1일 2회 또는 1일 3회, 1회 120mg씩 경구 투여하며, 총 24주간 투여 후 유효성과 안전성을 평가하게 됩니다. = 또한, 이번 임상은 다양한 환자 환경에서의 치료 효과를 평가하고자 하는 탐색적 임상시험의 성격을 가지며, 다기관, 무작위배정, 이중눈가림, 위약 대조, 평행설계 방식으로 설계되었습니다. |
| 기대효과 | - 당뇨병성 신증은 제2형 당뇨병 환자에서 흔히 발생하는 만성 합병증으로, 진행 시 신기능 저하 및 말기신부전으로 이어질 수 있음에도 불구하고 현재까지 신장 기능을 유지하거나 개선하는 치료제는 부재한 상황입니다. - 이번 임상시험은 CU01이 당뇨병성 신증 환자에서 알부민뇨(단백뇨)의 개선 효과와 추정 사구체 여과율(eGFR) 등을 유의하게 개선할 수 있는지를 확인하는 것으로, 기존 RAS 차단제(ACEi, ARB) 중심 등의 치료 전략에서 벗어나, 새로운 기전의 치료 옵션 가능성을 제시할 수 있습니다. - 또한, CU01이 충분한 안전성과 유효성을 입증할 경우, 질병의 조기 개입을 통해 신장 기능의 악화를 지연시키고, 말기 환자들의 투석 의존도를 낮추는 임상적 가치가 클 것으로 기대됩니다. |
| 출처) 당사 제시 |
| [CP01-R01 임상3상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 반려견 CKD(만성 신장질환) 치료제 개발 (혈관내피기능장애 억제제 First-in-class 신약 후보물질) |
| 임상시험 대상국가 | 대한민국 내 32개 기관에서 환견 60두 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | 이번 임상 3상 시험은 반려견을 대상으로 혈관 내피 기능장애 억제제를 이용한 만성 신장질환(Chronic Kidney Disease, CKD) 치료제 후보물질 CP01-R01의 유효성과 안전성을 평가하기 위한 무작위배정·위약대조 방식으로 설계되었습니다. 시험에는 IRIS 기준 2~3단계의 CKD가 진단된 반려견이 포함되며, 대상은 생후 6개월 이상의 개체로 제한됩니다. 선별 기준에는 혈청 크레아티닌 수치와 SDMA 수치를 기반으로 한 IRIS 단계 확인 외에도, 요 비중은 1.035 이하, 단백뇨/크레아티닌 비율(UPCR)은 0.2 초과, 수축기 혈압은 170mmHg 이하라는 조건이 포함됩니다. 시험은 총 12주간 진행되며, 첫 1주간의 스크리닝 기간을 거쳐 0주차에 무작위 배정을 실시한 후 투약을 시작합니다. 투약군은 위약군과 시험약 투여군으로 나뉘며, 각 그룹에는 각각 20마리, 40마리의 반려견이 배정됩니다. 체중 10kg당 1개의 튜브 제형을 사용해 식사 후 15분 이내에 경구 투여하는 방식으로, 위약군에는 위약이, 시험군에는 CP01-R01이 동일한 방식으로 1일 1회, 12주간 반복 투여됩니다. 치료기간 동안에는 0주차, 4주차, 8주차, 12주차에 걸쳐 임상 증상, 체중, 혈압, 혈액 및 혈청 생화학 지표, 전해질, 소변검사 등이 정기적으로 평가되며, 1차 평가 지표로는 크레아티닌 및 SDMA 수치를 포함한 IRIS 지표 개선 여부가 설정되어 있고, 2차 평가 지표로는 전반적인 임상 증상(안전성 포함), 요 비중 및 UPCR의 변화가 포함됩니다. |
| 기대효과 | 본 시험은 CP01-R01이 만성 신장질환 진행을 효과적으로 억제할 수 있는지를 검증하기 위한 핵심 단계에 해당하며, 향후 반려동물 대상 신장질환 치료제 시장에서의 경쟁력 확보와 글로벌 라이선싱 기회를 염두에 두고 진행 중입니다. |
| 출처) 당사 제시 |
각 임상시험에서 1차 평가지표를 충족하지 못하거나, 통계적으로 유의미한 치료 효과를 입증하지 못하거나, 심각한 안전성 문제가 발생할 경우, 해당 파이프라인의 개발이 중단되거나 다음 단계 임상으로의 진입이 불가능해질 수 있으며, 이는 당사의 파이프라인 가치 하락, 주가 하락 등 심각한 부정적 결과를 초래할 수 있습니다. 또한, 임상시험 과정에서 환자 모집 지연, 임상시험수탁기관과의 문제, 임상시험용 의약품 생산 차질 등 다양한 변수로 인해 개발 일정이 지연되고 비용이 증가할 위험이 상존합니다. 임상시험에서 긍정적인 결과를 얻더라도 규제 당국의 품목허가를 받지 못하면 신약을 출시할 수 없으며, 허가를 받더라도 시장 경쟁, 낮은 시장 수용성, 불리한 약가 등으로 상업적 성공을 거두지 못할 위험도 존재합니다.
한편, 당사는 현재 기업공개(IPO) 당시 계획했던 임상시험 및 기술이전 일정이 현재 전반적으로 지연되고 있습니다. 이에 따라 주요 파이프라인의 가시적인 사업화 성과 달성 또한 당초 예상보다 지체되고 있는 상황입니다.
다음은 기업공개 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정입니다.
| [IPO 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정] |
| 주요 파이프라인 |
적응증 | 구분 단계 |
지역 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 상반기 | 하반기(E) | 상반기 | 하반기 | 상반기 | 하반기 | 상반기 | 하반기 | ||||
| CU06 | 당뇨 황반부종 |
임상 단계 |
미주 및 유럽 |
- 임상 1상 진입 (미국) |
- 임상 1상 종료 (미국) |
- 임상 2상 진입 (미국) |
- | - | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - | - | - | - | - | - | - | - 임상 3상 진입 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- | - | - 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (한국) |
|||
| CU01 | 당뇨병성 신증 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 2상 진입 (미국) |
- | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - 임상 2a 종료 (한국) |
- 임상 2b/3상 진입 (한국) |
- | - | - | - 임상 2b/3상 종료 (한국) |
- NDA 제출 (한국) |
- Launch (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미국/유럽) |
- 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
|||
| CU03 | 습성 황반변성 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 1/2a 진입 (미국) |
- | - | - | - 임상 1/2a 종료 (미국) |
| 아시아 | - | - 임상 2a 종료 (한국) |
- 임상 2b/3 진입 (한국) |
- | - | - | - | - 임상 2b/3 종료 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - | - | - 마일스톤 수령 (아시아) |
|||
|
주1) 원/달러 환율은 2021년 6월 8일 기준 최근 1개년(2021년 5월 10일 ~ 2021년 6월 8일) 서울외국환중개 매매기준율 평균인 1,120.87원/USD을 적용하였습니다. 주2) 동사 보유 파이프라인 중 임상 1상 단계 이상의 파이프라인만을 대상으로 매출을 추정하였으며, 전임상 단계의 CU02, CU04, CU05, CU06-MI, CU06-ALI 파이프라인의 경우 매출 추정시 제외하였습니다. |
CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 7월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
이와 같이 모든 적응증을 포괄하는 기술이전 구조는 일부 글로벌 제약사들이 선호하는 방식으로, 현재 관련 파트너링 논의가 보다 진전된 상태입니다. 또한, CU06은 망막질환 적응증의 임상 2a상을 통해 개념입증(Proof of Concept)을 이미 확보하여 개발 단계가 이전보다 진척된 만큼, 당사는 2021년 10월 당시의 계약보다 개선된 조건과 규모의 기술이전 계약 달성을 목표로 하고 있습니다. 다만, 당사가 추진하는 기술이전 계약은 현재 파트너링을 논의하는 초기 단계로 구체적인 계약 조건이나 상대방이 확정된 것은 아니므로, 기술이전의 성공 여부 및 시기 등은 불확실할 수 있다는 점을 투자자께서는 유의하시기 바랍니다.
CU01(당뇨병성 신증 치료제)의 경우 당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
CU03(습성 황반변성 치료제)의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
당사는 신약 개발의 높은 불확실성을 최소화하기 위해 노력하고 있으나, 본질적인 위험 요소는 완전히 제거하기 어렵습니다. 투자자께서는 신약 개발 과정의 본질적인 불확실성과 높은 실패 가능성을 충분히 인지하시고, 각 파이프라인의 진행 상황 및 결과에 따라 당사의 기업가치가 크게 변동될 수 있으며, 투자 원금 손실의 가능성도 있음을 유의하시기 바랍니다.
(주6) 정정 전
|
사. 기술이전 및 공동개발 관련 위험 당사는 계약 조건의 면밀한 검토와 파트너사와의 긴밀한 협력을 통해 이러한 위험을 최소화하고자 하나, 기술이전 및 공동개발과 관련된 불확실성은 여전히 존재하며, 이는 당사의 경영 성과 및 재무 상태에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 기술이전 및 공동개발 계약에 따른 수익 실현의 불확실성과 파트너사의 개발 역량 및 전략 변화에 따른 위험이 당사의 재무적 성과 및 파이프라인 가치에 직접적인 영향을 줄 수 있음을 충분히 고려하시기 바랍니다. |
당사는 자체적인 신약 개발 역량 강화와 더불어 연구개발 성과의 조기 사업화 및 투자 재원 확보, 글로벌 시장 진출 등을 위해 기술이전 및 공동개발을 중요한 사업 전략으로 추진하고 있습니다.
2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06 기술이전 계약은 2024년 07월 12일부로 파트너사의 내부 개발 전략 변경에 따라 해지되었으며, 당사는 해당 물질에 대한 모든 권리를 반환받았습니다. 이 계약 해지로 인해 당사는 해당 파이프라인에 대한 새로운 개발 및 사업화 전략을 모색해야 하는 상황이며, 기존 계약을 통해 기대했던 마일스톤 및 로열티 수익은 확보할 수 없게 되었습니다. 당사는 이미 수령한 계약금 및 연구개발 비용에 대한 반환 의무는 없으며, 권리 반환 후에도 CU06의 임상 2b상 등 후속 개발계획은 진행할 예정입니다.
한편, 당사는 2024년 07월 항체 치료제 개발기업 맵틱스와 난치성 혈관질환에 대한 단일 및 다중 항체 치료제 공동 연구개발 계약을 체결하여 8개의 항체 파이프라인(MT 시리즈)을 확보하는 등 지속적으로 외부 협력을 통한 파이프라인 확장을 추진하고 있습니다.
이러한 기술이전 및 공동개발 계약은 다음과 같은 다양한 내재적 위험을 수반합니다. 기술이전의 경우, 파트너사가 자체적인 경영 판단, 전략 수정, 자금 조달의 어려움, 예상치 못한 임상 결과, 규제 환경 변화 등의 이유로 해당 파이프라인의 개발을 중단하거나 지연시킬 수 있습니다. 이 경우 당사는 계약상 예정된 마일스톤 수익을 수령하지 못하거나 수령 시기가 지연될 수 있으며, 최종적으로 상업화에 실패하여 로열티 수익을 얻지 못할 가능성이 있습니다. 마일스톤은 특정 개발 단계의 성공적인 달성을 조건으로 지급되므로, 해당 단계에 도달하지 못하면 수령할 수 없습니다. 신약 개발의 낮은 성공률을 고려할 때, 모든 마일스톤이 계획대로 수취될 것이라고 보장할 수 없습니다. 또한, 상업화에 성공하더라도 실제 매출 규모, 시장 경쟁 상황, 약가 수준 등에 따라 로열티 수익 규모가 기대에 미치지 못할 수 있습니다. 계약 조건에 따라 중도 해지될 위험도 존재하며, 이 경우 권리 회수 및 새로운 파트너 물색에 어려움을 겪을 수 있습니다. 계약 내용 해석 차이 등으로 파트너사와의 분쟁 발생 가능성도 배제할 수 없습니다.
공동개발의 경우, 파트너사와의 연구 방향, 개발 우선순위, 비용 분담, 지적재산권 귀속 등에 대한 의견 차이로 의사결정이 지연되거나 프로젝트 진행에 차질이 발생할 수 있습니다. 예상보다 개발 비용이 증가하거나 특정 파트너사가 자금 조달에 어려움을 겪을 경우 프로젝트 진행에 부담이 될 수 있으며, 공동 소유 지적재산권의 활용 또한 복잡한 협의 과정을 거쳐야 할 수 있습니다. 파트너사의 경영 전략 변경이나 인수합병 등도 공동개발 계약의 지속성에 영향을 미칠 수 있습니다.
당사는 계약 조건의 면밀한 검토와 파트너사와의 긴밀한 협력을 통해 이러한 위험을 최소화하고자 하나, 기술이전 및 공동개발과 관련된 불확실성은 여전히 존재하며, 이는 당사의 경영 성과 및 재무 상태에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 기술이전 및 공동개발 계약에 따른 수익 실현의 불확실성과 파트너사의 개발 역량 및 전략 변화에 따른 위험이 당사의 재무적 성과 및 파이프라인 가치에 직접적인 영향을 줄 수 있음을 충분히 고려하시기 바랍니다.
(주6) 정정 후
|
사. 기술이전 및 공동개발 관련 위험 당사의 핵심 파이프라인인 CU06의 글로벌 기술이전 계약이 해지됨에 따라, 향후 사업화 전략의 불확실성이 증대되었으며 기대수익 확보가 불가능하게 되었습니다. 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 CU06 기술이전 계약은 2024년 7월, 파트너사의 내부 개발 전략 변경에 따라 해지되었습니다. 이로 인해 당사는 해당 계약을 통해 기대했던 마일스톤 및 로열티 수익을 확보할 수 없게 되었으며, 새로운 글로벌 파트너사를 찾아야 하는 과제에 직면했습니다. 현재 당사는 CU06 및 관련 파이프라인 전체의 글로벌 권리를 하나의 패키지로 기술이전하는 새로운 전략을 추진하고 있으나, 이는 초기 논의 단계로 계약의 성사 여부, 시기, 조건 등 모든 측면에서 불확실성이 매우 높은 상황입니다. 또한, 기업공개(IPO) 당시 계획했던 주요 파이프라인의 임상시험 및 기술이전 일정이 전반적으로 지연되고 있습니다. CU06의 경우 파트너사와의 협력 및 규제 대응 과정에서, CU01(당뇨병성 신증 치료제)은 대규모 임상 필요성에 따른 개발 전략 수정 및 규제기관의 권고 등으로 인해 당초 계획보다 사업화 일정이 지연되었습니다. 이러한 일정 지연은 가시적인 사업화 성과 도출을 지체시키고 추가적인 비용 발생으로 이어질 수 있으며, 향후 계획 역시 다양한 변수로 인해 추가적으로 지연될 가능성이 존재합니다. 기술이전 및 공동개발 계약은 파트너사의 전략 변화, 개발 중단, 계약 해지 등 본질적인 불확실성과 파트너 의존성에 따른 위험을 내포하고 있습니다. 기술이전 계약의 파트너사는 자체적인 경영 판단, 자금 조달의 어려움, 예상치 못한 임상 결과 등을 이유로 개발을 중단하거나 지연시킬 수 있으며, 이 경우 당사는 마일스톤 및 로열티 수익을 수령하지 못할 수 있습니다. 공동개발 역시 파트너사와의 연구 방향, 비용 분담 등에 대한 의견 차이로 프로젝트 진행에 차질이 발생할 수 있습니다. 당사가 최근 맵틱스와 신규 공동개발 계약을 체결하는 등 외부 협력을 지속하고 있으나, 이러한 파트너 의존적 사업 구조의 본질적인 위험은 여전히 존재합니다. 당사는 계약 조건의 면밀한 검토와 파트너사와의 긴밀한 협력을 통해 이러한 위험을 최소화하고자 하나, 기술이전 및 공동개발과 관련된 불확실성은 여전히 존재하며, 이는 당사의 경영 성과 및 재무 상태에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 기술이전 및 공동개발 계약에 따른 수익 실현의 불확실성과 파트너사의 개발 역량 및 전략 변화에 따른 위험이 당사의 재무적 성과 및 파이프라인 가치에 직접적인 영향을 줄 수 있음을 충분히 고려하시기 바랍니다. |
당사는 자체적인 신약 개발 역량 강화와 더불어 연구개발 성과의 조기 사업화 및 투자 재원 확보, 글로벌 시장 진출 등을 위해 기술이전 및 공동개발을 중요한 사업 전략으로 추진하고 있습니다.
2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06 기술이전 계약은 2024년 07월 12일부로 파트너사의 내부 개발 전략 변경에 따라 해지되었으며, 당사는 해당 물질에 대한 모든 권리를 반환받았습니다. 이 계약 해지로 인해 당사는 해당 파이프라인에 대한 새로운 개발 및 사업화 전략을 모색해야 하는 상황이며, 기존 계약을 통해 기대했던 마일스톤 및 로열티 수익은 확보할 수 없게 되었습니다. 당사는 이미 수령한 계약금 및 연구개발 비용에 대한 반환 의무는 없으며, 권리 반환 후에도 CU06의 임상 2b상 등 후속 개발계획은 진행할 예정입니다.
당사는 현재 기업공개(IPO) 당시 계획했던 임상시험 및 기술이전 일정이 현재 전반적으로 지연되고 있습니다. 이에 따라 주요 파이프라인의 가시적인 사업화 성과 달성 또한 당초 예상보다 지체되고 있는 상황입니다.
다음은 기업공개 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정입니다.
| [IPO 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정] |
| 주요 파이프라인 |
적응증 | 구분 단계 |
지역 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 상반기 | 하반기(E) | 상반기 | 하반기 | 상반기 | 하반기 | 상반기 | 하반기 | ||||
| CU06 | 당뇨 황반부종 |
임상 단계 |
미주 및 유럽 |
- 임상 1상 진입 (미국) |
- 임상 1상 종료 (미국) |
- 임상 2상 진입 (미국) |
- | - | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - | - | - | - | - | - | - | - 임상 3상 진입 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- | - | - 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (한국) |
|||
| CU01 | 당뇨병성 신증 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 2상 진입 (미국) |
- | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - 임상 2a 종료 (한국) |
- 임상 2b/3상 진입 (한국) |
- | - | - | - 임상 2b/3상 종료 (한국) |
- NDA 제출 (한국) |
- Launch (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미국/유럽) |
- 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
|||
| CU03 | 습성 황반변성 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 1/2a 진입 (미국) |
- | - | - | - 임상 1/2a 종료 (미국) |
| 아시아 | - | - 임상 2a 종료 (한국) |
- 임상 2b/3 진입 (한국) |
- | - | - | - | - 임상 2b/3 종료 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - | - | - 마일스톤 수령 (아시아) |
|||
|
주1) 원/달러 환율은 2021년 6월 8일 기준 최근 1개년(2021년 5월 10일 ~ 2021년 6월 8일) 서울외국환중개 매매기준율 평균인 1,120.87원/USD을 적용하였습니다. 주2) 동사 보유 파이프라인 중 임상 1상 단계 이상의 파이프라인만을 대상으로 매출을 추정하였으며, 전임상 단계의 CU02, CU04, CU05, CU06-MI, CU06-ALI 파이프라인의 경우 매출 추정시 제외하였습니다. |
CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 7월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
이와 같이 모든 적응증을 포괄하는 기술이전 구조는 일부 글로벌 제약사들이 선호하는 방식으로, 현재 관련 파트너링 논의가 보다 진전된 상태입니다. 또한, CU06은 망막질환 적응증의 임상 2a상을 통해 개념입증(Proof of Concept)을 이미 확보하여 개발 단계가 이전보다 진척된 만큼, 당사는 2021년 10월 당시의 계약보다 개선된 조건과 규모의 기술이전 계약 달성을 목표로 하고 있습니다. 다만, 당사가 추진하는 기술이전 계약은 현재 파트너링을 논의하는 초기 단계로 구체적인 계약 조건이나 상대방이 확정된 것은 아니므로, 기술이전의 성공 여부 및 시기 등은 불확실할 수 있다는 점을 투자자께서는 유의하시기 바랍니다.
CU01(당뇨병성 신증 치료제)의 경우 당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
CU03(습성 황반변성 치료제)의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
한편, 당사는 2024년 07월 항체 치료제 개발기업 맵틱스와 난치성 혈관질환에 대한 단일 및 다중 항체 치료제 공동 연구개발 계약을 체결하여 8개의 항체 파이프라인(MT 시리즈)을 확보하는 등 지속적으로 외부 협력을 통한 파이프라인 확장을 추진하고 있습니다.
이러한 기술이전 및 공동개발 계약은 다음과 같은 다양한 내재적 위험을 수반합니다. 기술이전의 경우, 파트너사가 자체적인 경영 판단, 전략 수정, 자금 조달의 어려움, 예상치 못한 임상 결과, 규제 환경 변화 등의 이유로 해당 파이프라인의 개발을 중단하거나 지연시킬 수 있습니다. 이 경우 당사는 계약상 예정된 마일스톤 수익을 수령하지 못하거나 수령 시기가 지연될 수 있으며, 최종적으로 상업화에 실패하여 로열티 수익을 얻지 못할 가능성이 있습니다. 마일스톤은 특정 개발 단계의 성공적인 달성을 조건으로 지급되므로, 해당 단계에 도달하지 못하면 수령할 수 없습니다. 신약 개발의 낮은 성공률을 고려할 때, 모든 마일스톤이 계획대로 수취될 것이라고 보장할 수 없습니다. 또한, 상업화에 성공하더라도 실제 매출 규모, 시장 경쟁 상황, 약가 수준 등에 따라 로열티 수익 규모가 기대에 미치지 못할 수 있습니다. 계약 조건에 따라 중도 해지될 위험도 존재하며, 이 경우 권리 회수 및 새로운 파트너 물색에 어려움을 겪을 수 있습니다. 계약 내용 해석 차이 등으로 파트너사와의 분쟁 발생 가능성도 배제할 수 없습니다.
공동개발의 경우, 파트너사와의 연구 방향, 개발 우선순위, 비용 분담, 지적재산권 귀속 등에 대한 의견 차이로 의사결정이 지연되거나 프로젝트 진행에 차질이 발생할 수 있습니다. 예상보다 개발 비용이 증가하거나 특정 파트너사가 자금 조달에 어려움을 겪을 경우 프로젝트 진행에 부담이 될 수 있으며, 공동 소유 지적재산권의 활용 또한 복잡한 협의 과정을 거쳐야 할 수 있습니다. 파트너사의 경영 전략 변경이나 인수합병 등도 공동개발 계약의 지속성에 영향을 미칠 수 있습니다.
당사는 계약 조건의 면밀한 검토와 파트너사와의 긴밀한 협력을 통해 이러한 위험을 최소화하고자 하나, 기술이전 및 공동개발과 관련된 불확실성은 여전히 존재하며, 이는 당사의 경영 성과 및 재무 상태에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 기술이전 및 공동개발 계약에 따른 수익 실현의 불확실성과 파트너사의 개발 역량 및 전략 변화에 따른 위험이 당사의 재무적 성과 및 파이프라인 가치에 직접적인 영향을 줄 수 있음을 충분히 고려하시기 바랍니다.
(주7) 정정 전
| 차. 신규 플랫폼 기술 및 항체 신약 개발 관련 특화 위험 당사는 저분자 화합물 신약 개발 플랫폼인 SOLVADYS® 외에도, 2024년 07월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 인간 항체 라이브러리 기반의 항체 발굴 플랫폼 EAGLES® 및 이를 활용한 다수의 항체 신약 파이프라인을 확보하였습니다. 이는 당사의 연구개발 약물 형태를 확장하고 파이프라인을 다각화하는 긍정적인 측면이 있으나, 동시에 다음과 같은 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화된 위험에 노출될 수 있습니다. 이러한 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화 위험은 당사의 연구개발 전략 및 향후 성장성에 중요한 영향을 미칠 수 있습니다. 당사는 맵틱스와의 긴밀한 협력을 통해 EAGLES® 플랫폼 기술의 잠재력을 극대화하고, 항체 개발 전문 인력 확보 및 육성, 경쟁 기술 동향 분석을 통한 차별화 전략 수립, 효율적인 생산 파트너십 구축 등을 통해 이러한 위험에 대응하고자 합니다. 그러나 항체 신약 개발의 높은 난이도와 불확실성, 그리고 신규 플랫폼 기술의 검증 필요성을 고려할 때, 투자자께서는 관련 위험이 당사의 기술적 성공 가능성 및 시장 경쟁력에 미칠 수 있는 영향을 충분히 인지하시고, 당사의 기술력과 시장 경쟁력 확보 여부를 신중하게 판단하시기 바랍니다. |
당사는 저분자 화합물 신약 개발 플랫폼인 SOLVADYS® 외에도, 2024년 07월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 인간 항체 라이브러리 기반의 항체 발굴 플랫폼 EAGLES® 및 이를 활용한 다수의 항체 신약 파이프라인을 확보하였습니다. 이는 당사의 연구개발 약물 형태를 확장하고 파이프라인을 다각화하는 긍정적인 측면이 있으나, 동시에 다음과 같은 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화된 위험에 노출될 수 있습니다.
첫째, 신규 플랫폼 기술 검증의 불확실성입니다. EAGLES®와 같은 새로운 항체 발굴 플랫폼 기술이 실제 신약 개발 과정에서 기대만큼의 효율성, 생산성, 또는 성공률을 보이지 못할 수 있습니다. 플랫폼 기술의 유효성은 다수의 성공적인 후보물질 도출 및 임상 개발 성공 사례를 통해 입증되는데, 아직 초기 단계인 만큼 그 잠재력을 완전히 평가하기에는 시간이 필요합니다.
둘째, 항체 신약 개발의 고유한 기술적 난이도 및 높은 실패율입니다. 항체 의약품은 저분자 화합물 의약품과는 다른 특성을 가지며, 개발 과정에서 세포주 개발 및 안정적인 항체 생산 세포주 확립, 대규모 배양 및 정제 공정 개발, 면역원성 평가 및 최소화 전략, 약동학적 특성 및 약력학적 특성 최적화 등 다양한 기술적 허들이 존재합니다. 이러한 과정에서의 실패는 시간과 비용의 막대한 손실로 이어질 수 있습니다.
셋째, 항체 신약 시장의 치열한 경쟁 환경입니다. 이미 많은 글로벌 대형 제약사 및 바이오 기업들이 항체 신약 개발에 막대한 투자를 하고 있으며, 특정 질환 타겟에 대해서는 다수의 경쟁 항체들이 개발 중이거나 시판되어 있습니다. 또한, 항체-약물 접합체, 이중특이항체, 삼중특이항체, 키메라 항원 수용체 T세포와 같은 세포 치료제 등 차세대 항체 기반 기술 경쟁이 매우 치열하여, 당사의 항체 파이프라인이 경쟁 우위를 확보하고 시장에 성공적으로 진입하기 위해서는 혁신성과 차별성을 입증해야 합니다.
넷째, 항체 의약품 생산 시설 확보 및 높은 생산 비용입니다. 항체 의약품은 일반적으로 미생물 또는 동물 세포 배양을 통해 생산되므로, 복잡한 생산 공정과 대규모 설비 투자가 필요합니다. 당사가 자체 생산 시설을 보유하지 않을 경우, 위탁생산기관 또는 위탁개발생산기관에 생산을 위탁해야 하며, 이 경우 위탁 생산 비용이 높고 안정적인 생산 파트너 확보가 중요합니다. 생산 수율 문제나 품질 관리 실패는 막대한 비용 손실과 개발 지연을 초래할 수 있습니다.
이러한 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화 위험은 당사의 연구개발 전략 및 향후 성장성에 중요한 영향을 미칠 수 있습니다. 당사는 맵틱스와의 긴밀한 협력을 통해 EAGLES® 플랫폼 기술의 잠재력을 극대화하고, 항체 개발 전문 인력 확보 및 육성, 경쟁 기술 동향 분석을 통한 차별화 전략 수립, 효율적인 생산 파트너십 구축 등을 통해 이러한 위험에 대응하고자 합니다. 그러나 항체 신약 개발의 높은 난이도와 불확실성, 그리고 신규 플랫폼 기술의 검증 필요성을 고려할 때, 투자자께서는 관련 위험이 당사의 기술적 성공 가능성 및 시장 경쟁력에 미칠 수 있는 영향을 충분히 인지하시고, 당사의 기술력과 시장 경쟁력 확보 여부를 신중하게 판단하시기 바랍니다.
(주7) 정정 후
| 차. 신규 플랫폼 기술 및 항체 신약 개발 관련 특화 위험 당사는 저분자 화합물 신약 개발 플랫폼인 SOLVADYS® 외에도, 2024년 07월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 인간 항체 라이브러리 기반의 항체 발굴 플랫폼 EAGLES® 및 이를 활용한 다수의 항체 신약 파이프라인을 확보하였습니다. 이는 당사의 연구개발 약물 형태를 확장하고 파이프라인을 다각화하는 긍정적인 측면이 있으나, 동시에 다음과 같은 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화된 위험에 노출될 수 있습니다. 이러한 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화 위험은 당사의 연구개발 전략 및 향후 성장성에 중요한 영향을 미칠 수 있습니다. 당사는 맵틱스와의 긴밀한 협력을 통해 EAGLES® 플랫폼 기술의 잠재력을 극대화하고, 항체 개발 전문 인력 확보 및 육성, 경쟁 기술 동향 분석을 통한 차별화 전략 수립, 효율적인 생산 파트너십 구축 등을 통해 이러한 위험에 대응하고자 합니다. 그러나 항체 신약 개발의 높은 난이도와 불확실성, 그리고 신규 플랫폼 기술의 검증 필요성을 고려할 때, 투자자께서는 관련 위험이 당사의 기술적 성공 가능성 및 시장 경쟁력에 미칠 수 있는 영향을 충분히 인지하시고, 당사의 기술력과 시장 경쟁력 확보 여부를 신중하게 판단하시기 바랍니다. |
당사는 저분자 화합물 신약 개발 플랫폼인 SOLVADYS® 외에도, 2024년 07월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 인간 항체 라이브러리 기반의 항체 발굴 플랫폼 EAGLES® 및 이를 활용한 다수의 항체 신약 파이프라인을 확보하였습니다.
SOLVADYS® 플랫폼
해당 플랫폼은 혈관내피기능장애를 저해하는 효과적인 저분자화합물을 발굴할 수 있는 기술로, 스크리닝부터 기전 및 약효 검증을 종합적으로 수행할 수 있는 5가지 세부 기술로 구성된 당사의 독자적인 신약 개발 플랫폼 기술입니다.
당사는 SOLVADYS® 플랫폼을 활용하여 배양된 사람 혈관내피세포에서 혈관내피기능장애의 세부항목을 순차적으로 스크리닝하여 강력한 혈관내피세포 보호 효과를 보유한 저분자 물질 CU06, CU71 등을 발굴하였습니다. CU06은 망막 질환인 당뇨병성 황반부종, 습성 황반변성 치료제로 개발 중이고, CU71은 퇴행성 뇌질환 치료제로 현재 알츠하이머병을 적응증으로 비임상 시험을 진행 중입니다.
EAGLES®(Exceptional Antibody Generation by Library Engineering and Screening)
해당 플랫폼은 항체 전문기업 맵틱스의 독자적인 항체 발굴 플랫폼입니다. 당사는 맵틱스와 2024년 7월 항체 공동 연구개발 계약을 체결하고, 항체 파이프라인 8종 등에 대한 연구개발을 함께 진행 중입니다. 양사는 공동 연구개발하는 파이프라인에 대한 연구개발 비용을 각 2분의 1씩 부담하며, 향후 기술이전 등 사업화 수익이 발생하는 경우 2분의 1씩 분배하게 됩니다.
맵틱스는 EAGLES® 플랫폼을 통해 Tie2 활성화 항체 및 다양한 파이프라인을 구축해 난치성 혈관질환 신약을 개발하는 기업입니다. 현재까지 EAGLES® 플랫폼을 통해 발굴한 항체 파이프라인은 MT-101, 103, 201, 202 등 총 8종입니다.
| 구분 | MT-101 | MT-102 | MT-103 | MT-104 | MT-105 | MT-201 | MT-202 | MT-40X |
|---|---|---|---|---|---|---|---|---|
| 계약상대방 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 |
| 계약내용 | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) |
| 계약체결일 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 |
| 계약종료일 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 |
| 총 계약금액 | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) |
| 지급금액 | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) |
| 계약목적 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 |
| 적응증 | 급성 신손상, 만성신부전 | 습성 황반변성, 당뇨병성 황반부종, 당뇨 망막병증 | 중증하지허혈 | 고형암 | 염증성 장질환 | 염증성 혈전질환 | 급성 허혈성 뇌졸증 | 고형암 |
| 개발 진행경과 | 전임상 진행 중 | 전임상 진행 중 | 전임상 진행 중 | 후보물질 도출단계 | 선도물질 도출단계 | 후보물질 도출단계 | 후보물질 도출단계 | 유효물질 도출단계 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 대상 물질에 대한 연구개발비용과 수익금은 약정비율로 부담 및 배분합니다. |
| 주2) 양사 합의 의해 계약 규모는 미공개 처리하였습니다. |
이는 당사의 연구개발 약물 형태를 확장하고 파이프라인을 다각화하는 긍정적인 측면이 있으나, 동시에 다음과 같은 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화된 위험에 노출될 수 있습니다.
첫째, 신규 플랫폼 기술 검증의 불확실성입니다. EAGLES®와 같은 새로운 항체 발굴 플랫폼 기술이 실제 신약 개발 과정에서 기대만큼의 효율성, 생산성, 또는 성공률을 보이지 못할 수 있습니다. 플랫폼 기술의 유효성은 다수의 성공적인 후보물질 도출 및 임상 개발 성공 사례를 통해 입증되는데, 아직 초기 단계인 만큼 그 잠재력을 완전히 평가하기에는 시간이 필요합니다.
둘째, 항체 신약 개발의 고유한 기술적 난이도 및 높은 실패율입니다. 항체 의약품은 저분자 화합물 의약품과는 다른 특성을 가지며, 개발 과정에서 세포주 개발 및 안정적인 항체 생산 세포주 확립, 대규모 배양 및 정제 공정 개발, 면역원성 평가 및 최소화 전략, 약동학적 특성 및 약력학적 특성 최적화 등 다양한 기술적 허들이 존재합니다. 이러한 과정에서의 실패는 시간과 비용의 막대한 손실로 이어질 수 있습니다.
셋째, 항체 신약 시장의 치열한 경쟁 환경입니다. 이미 많은 글로벌 대형 제약사 및 바이오 기업들이 항체 신약 개발에 막대한 투자를 하고 있으며, 특정 질환 타겟에 대해서는 다수의 경쟁 항체들이 개발 중이거나 시판되어 있습니다. 또한, 항체-약물 접합체, 이중특이항체, 삼중특이항체, 키메라 항원 수용체 T세포와 같은 세포 치료제 등 차세대 항체 기반 기술 경쟁이 매우 치열하여, 당사의 항체 파이프라인이 경쟁 우위를 확보하고 시장에 성공적으로 진입하기 위해서는 혁신성과 차별성을 입증해야 합니다.
넷째, 항체 의약품 생산 시설 확보 및 높은 생산 비용입니다. 항체 의약품은 일반적으로 미생물 또는 동물 세포 배양을 통해 생산되므로, 복잡한 생산 공정과 대규모 설비 투자가 필요합니다. 당사가 자체 생산 시설을 보유하지 않을 경우, 위탁생산기관 또는 위탁개발생산기관에 생산을 위탁해야 하며, 이 경우 위탁 생산 비용이 높고 안정적인 생산 파트너 확보가 중요합니다. 생산 수율 문제나 품질 관리 실패는 막대한 비용 손실과 개발 지연을 초래할 수 있습니다.
이러한 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화 위험은 당사의 연구개발 전략 및 향후 성장성에 중요한 영향을 미칠 수 있습니다. 당사는 맵틱스와의 긴밀한 협력을 통해 EAGLES® 플랫폼 기술의 잠재력을 극대화하고, 항체 개발 전문 인력 확보 및 육성, 경쟁 기술 동향 분석을 통한 차별화 전략 수립, 효율적인 생산 파트너십 구축 등을 통해 이러한 위험에 대응하고자 합니다. 그러나 항체 신약 개발의 높은 난이도와 불확실성, 그리고 신규 플랫폼 기술의 검증 필요성을 고려할 때, 투자자께서는 관련 위험이 당사의 기술적 성공 가능성 및 시장 경쟁력에 미칠 수 있는 영향을 충분히 인지하시고, 당사의 기술력과 시장 경쟁력 확보 여부를 신중하게 판단하시기 바랍니다.
(주8) 정정 전
| 가. 관리종목 지정 및 상장폐지 관련 위험 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 당사는 매출액 및 법인세비용차감전계속사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 향후 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있으며, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다. 당사는 증권신고서 제출일 전일 기준 코스닥시장 상장규정 상 관리종목 지정 및 상장폐지요건에 해당하는 경우는 없습니다. 하지만 당사는 최근 3개년동안 매출 성장이 둔화되고 있으며 수익성도 악화되는 추세입니다. 이와 같은 추세가 향후 지속될 경우 당사는 관리종목 지정 사유뿐만 아니라 형식적 상장폐지 사유에 해당될 수 있습니다. 추가적으로, 최근 한국증시 발전 및 부실기업 퇴출을 위해 금융감독원, 한국거래소 등에서 상장폐지제도 개선 움직임이 진행되고 있습니다. 이에 따라 향후 상장폐지 요건이 현재보다 강화될 예정이며 향후 적자 상태가 지속될 경우 관리종목 및 상장폐지 요건을 충족시킬 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
(중략)
(주8) 정정 후
| 가. 관리종목 지정 및 상장폐지 관련 위험 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 당사는 매출액 및 법인세비용차감전계속사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 향후 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있으며, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다. 당사는 기술성장특례 요건을 통해 코스닥시장에 2021년 07월 상장하였으며, 관리종목 지정 요건 중 재무 관련 사항 중 매출액 요건은 2025년까지 유예, 법인세비용차감전 세전손실 요건은 2024년부터 유예기간이 종료된 상태입니다. 당사는 증권신고서 제출일 전일 기준 코스닥시장 상장규정 상 관리종목 지정 및 상장폐지요건에 해당하는 경우는 없습니다. 하지만 당사는 최근 3개년동안 매출 성장이 둔화되고 있으며 수익성도 악화되는 추세입니다. 이와 같은 추세가 향후 지속될 경우 당사는 관리종목 지정 사유뿐만 아니라 형식적 상장폐지 사유에 해당될 수 있습니다. 추가적으로, 최근 한국증시 발전 및 부실기업 퇴출을 위해 금융위원회, 금융감독원, 한국거래소 등에서 상장폐지제도 개선 움직임이 진행되고 있습니다. 이에 따라 향후 상장폐지 요건이 현재보다 강화될 예정이며 향후 적자 상태가 지속될 경우 관리종목 및 상장폐지 요건을 충족시킬 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
(중략)
(주9) 정정 전
| 나. 최대주주 지분희석 및 경영권 관련 위험 증권신고서 제출 전일 기준 당사 최대주주는 권영근 의장으로 1,809,047주(지분율 12.91%) 보유하고 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.4996732494로 신주인수권증서를 교부받게 됩니다. 이에 따라 최대주주인 권영근 의장은 903,932주를 배정받게 됩니다. 금번 유상증자에서 권영근 의장은 약 30% 내외 참여를 계획 중입니다. 만약 권영근 의장이 전액 미참여할 경우 지분율은 현재 12.91%에서 8.61%까지 감소할 수 있으며, 권영근 의장이 최대 약 30% 내외 참여할 경우 권영근 의장님의 지분율은 현재 12.91%에서 9.90%까지 감소할 수 있습니다. 당사의 특수관계인들은 증권신고서 제출 전일 기준 주식교부 방식의 주식매수선택권총 374,000주를 보유하고 있으며, 이를 행사하더라도 신주 교부 방식이 아닌 자기주식 교부 방식이기 때문에 당사의 총 발생주식수 자체는 변동이 없습니다. 따라서, 당사의 주식선택권 행사에 따른 지분희석은 없을 것으로 판단됩니다. |
증권신고서 제출 전일 기준 당사 최대주주는 권영근 의장으로 1,809,047주(지분율 12.91%) 보유하고 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 보유 중인 주식 1주당 0.4996732494주의 신주인수권증서를 교부받게 됩니다. 이에 따라 최대주주인 권영근 의장은 903,932주를 배정받게 됩니다. 금번 유상증자에서 최대주주는 배정분의 약 30% 내외 참여를 계획 중입니다. 만약 최대주주가 전액 미참여할 경우 지분율은 현재 12.91%에서 8.61%까지 감소할 수 있으며, 최대주주가 배정분의 약 30% 내외 참여할 경우 유상증자 후 지분율은 현재 12.91%에서 9.90%까지 감소할 수 있습니다.
| [최대주주 및 특수관계인 청약율에 따른 지분변동 가정] |
| 성명 | 공시서류 제출일 현재 | 증자 후 (최대주주 청약 미참여) |
증자 후 (최대주주 약 30% 청약 참여 가정) |
||||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 배정주식수 | 주식수 | 지분율 | 주식수 | 지분율 | |
| 권영근 의장님 | 1,809,047주 | 12.91% | 903,932주 | 1,809,047주 | 8.61% | 2,080,226주 | 9.90% |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 최대주주 권영근 의장이 배정분의 약 30% 참여에 따른 청약 참여주식수는 271,179주입니다. |
| 주2) 증자 전 발행주식 총수 : 14,009,155주 → 증자 후 발행주식 총수 : 21,009,155주 |
당사는 증권신고서 제출 전일 현재 미발행 주식수(보통주)는 총 2,568,608주가 존재하며, 그 내역은 미전환 제1회 전환사채 19,000백만원의 전환가능주식입니다.
| [기발행 전환사채 내역] | |||
| (기준일 : | 증권신고서 제출 전일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2023.06.28 | 2028.06.28 | 20,000,000,000 | 보통주 | 2024.06.28 ~ 2028.05.28 |
100 | 7,397 | 19,000,000,000 | 2,568,608 | - |
| 출처) 당사 정기보고서 및 당사 제시 |
제1회 전환사채의 전환가능기간은 2024년 06월 28일부터 2028년 05월 28일까지입니다. 상기 기발행된 전환사채의 전환권이 행사되어 당사 보통주로 전환될 경우, 최대주주를 포함한 기존 주주의 지분율이 희석될 위험이 있습니다. 기발행 전환사채가 보통주로 전환될 경우 총발행주식수(보통주) 14,009,155주의 약 18.34%(금번 유상증자 7,000,000주 포함 12.23%)에 해당합니다.
| [전환사채 전환권 행사 및 유상증자 납입에 따른 지분율 변동 가정] |
| 성명 | 현재 | 전환사채 전환권 행사 후 (권리 행사 100% 가정) |
전환사채 전환권 행사 & 증자 후 (최대주주 미참여 가정) |
||||
| 주식수 | 지분율 | 배정주식수 | 주식수 | 지분율 | 주식수 | 지분율 | |
| 권영근 의장님 | 1,809,047주 | 12.91% | 903,932주 | 1,809,047주 | 10.91% | 1,809,047주 | 7.67% |
| 주1) 최대주주 및 특수관계인은 유상증자 배정주식수 미참여를 가정하였습니다. |
| 주2) 전환사채의 전환권 100% 행사(전환가액 7,397원)를 가정하였습니다. |
| [주식매수선택권 부여 내역] | |
| (기준일 : 증권신고서 제출 전일) | (단위: 주) |
| 부여 회차 |
부여일 | 만기일 | 주식의 종류 |
부여방법 | 잔여 부여수량 |
행사가격 | 부여일 공정가치 |
|---|---|---|---|---|---|---|---|
| 3-1회차 | 2019.06.30 | 2026.07.13 | 보통주 | 주식교부 | 20,000 | 3,384 | 4,782 |
| 4회차 | 2020.03.31 | 2027.04.01 | 보통주 | 주식교부 | 10,000 | 6,200 | 4,793 |
| 5-1회차 | 2021.01.05 | 2028.01.05 | 보통주 | 주식교부 | 20,000 | 7,750 | 11,061 |
| 5-2회차 | 2021.01.05 | 2028.01.05 | 보통주 | 주식교부 | 10,000 | 10,720 | 10,669 |
| 6-1회차 | 2021.03.29 | 2028.03.29 | 보통주 | 주식교부 | 10,000 | 8,500 | 10,700 |
| 6-2회차 | 2021.03.29 | 2028.03.29 | 보통주 | 주식교부 | 4,000 | 10,720 | 10,376 |
| 7회차 | 2022.03.30 | 2029.03.29 | 보통주 | 주식교부 | 135,000 | 21,500 | 18,999 |
| 8회차 | 2022.11.16 | 2029.11.15 | 보통주 | 주식교부 | 45,000 | 12,700 | 9,985 |
| 9회차 | 2023.03.30 | 2030.03.29 | 보통주 | 주식교부 | 30,000 | 11,100 | 7,646 |
| 합계 | 374,000 | - | - | ||||
| 출처) 당사 정기 보고서 및 당사 제시 |
| 주) 주식수 및 행사가격은 2020년 12월 12일 100% 무상증자를 실시함에 따라 주식선택권 부여수량, 행사가격 및 부여일 공정가치가 조정되었습니다. |
당사의 특수관계인들은 증권신고서 제출 전일 기준 주식교부 방식의 주식매수선택권총 374,000주를 보유하고 있으며, 이를 행사하더라도 신주 교부 방식이 아닌 자기주식 교부 방식이기 때문에 당사의 총 발생주식수 자체는 변동이 없습니다. 따라서, 당사의 주식선택권 행사에 따른 지분희석은 없을 것으로 판단됩니다.
상기한 바와 같이 증권신고서 제출 전일 기준 당사의 최대주주 권영근 의장님은 약 12.91%의 지분율을 확보하고 있으며, 금번 주주배정 후 실권주 일반공모에 권영근 의장님은 약 30% 내외 참여할 계획입니다. 보유 지분 및 미청약분 증서 매각 대금 및 보유 자금을 활용하여 청약 자금을 마련할 예정이며, 증서 청약률은 매각 당시 주가 흐름과 시장 상황에 따라 변동될 수 있습니다. 만약 시장 상황 악화로 인하여 당사의 주가가 하락한다면 증서 매각대금은 감소하여 청약률이 낮아질 수 있습니다. 이 경우 청약률 하락으로 인해 지분 희석이 심화될 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. 또한 당사 발행주식총수의 5% 이상 지분율을 보유한 주주는 최대주주 이외에 없고 소액주주들에게 지분율이 분산되어 있어 최대주주의 변경 등 가능성은 제한적일 것으로 판단하고 있습니다. 그럼에도 불구하고 향후 적대적 M&A 및 외부의 경영권 취득 시도 등의 위험에 노출될 수 있으며, 최대주주 변경가능성 등에 의한 경영권의 안정성 저하 및 당사의 신뢰도 하락을 유발할 수 있는 등 당사의 장기적인 발전을 저해하는 요소로 작용할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주9) 정정 후
| 나. 최대주주 지분희석 및 경영권 관련 위험 증권신고서 제출 전일 기준 당사 최대주주는 권영근 의장으로 1,809,047주(지분율 12.91%) 보유하고 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.4996732494로 신주인수권증서를 교부받게 됩니다. 이에 따라 최대주주인 권영근 의장은 903,932주를 배정받게 됩니다. 금번 유상증자에서 권영근 의장은 약 30% 내외 참여를 계획 중이나 최대주주 외 특수관계인들의 지분율은 0.84%(보유 주식수 118,000주, 배정주식수 58,959주)이며 청약 참여 여부는 현재 미정입니다. 만약 특수관계인 청약 미참여 가정 및 최대주주가 전액 미참여할 경우 지분율은 현재 13.76%에서 9.17%까지 감소할 수 있으며, 특수관계인 청약 미참여 가정 및 최대주주가 배정분의 약 30% 내외 참여할 경우 유상증자 후 지분율은 현재 13.76%에서 10.46%까지 감소할 수 있습니다. 당사의 특수관계인들은 증권신고서 제출 전일 기준 주식교부 방식의 주식매수선택권총 374,000주를 보유하고 있으며, 이를 행사하더라도 신주 교부 방식이 아닌 자기주식 교부 방식이기 때문에 당사의 총 발생주식수 자체는 변동이 없습니다. 따라서, 당사의 주식선택권 행사에 따른 지분희석은 없을 것으로 판단됩니다. |
증권신고서 제출 전일 기준 당사 최대주주는 권영근 의장으로 1,809,047주(지분율 12.91%) 보유하고 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 보유 중인 주식 1주당 0.4996732494주의 신주인수권증서를 교부받게 됩니다. 이에 따라 최대주주인 권영근 의장은 903,932주를 배정받게 됩니다. 금번 유상증자에서 최대주주는 배정분의 약 30% 내외 참여를 계획 중이나 최대주주 외 특수관계인들의 지분율은 0.84%(보유 주식수 118,000주, 배정주식수 58,959주)이며 청약 참여 여부는 현재 미정입니다. 만약 특수관계인 청약 미참여 가정 및 최대주주가 전액 미참여할 경우 지분율은 현재 13.76%에서 9.17%까지 감소할 수 있으며, 특수관계인 청약 미참여 가정 및 최대주주가 배정분의 약 30% 내외 참여할 경우 유상증자 후 지분율은 현재 13.76%에서 10.46%까지 감소할 수 있습니다.
| [최대주주 및 특수관계인 청약율에 따른 지분변동 가정] |
| 성명 | 공시서류 제출 전일 현재 | 증자 후 (최대주주 및 특수관계인 청약 미참여) |
증자 후 (최대주주 약 30% 청약 참여 및 특수관계인 미참여 가정) |
||||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 배정주식수 | 주식수 | 지분율 | 주식수 | 지분율 | |
| 권영근 의장 | 1,809,047주 | 12.91% | 903,932주 | 1,809,047주 | 8.61% | 2,080,226주 | 9.90% |
| 특수관계인 | 118,000주 | 0.84% | 58,959주 | 118,000주 | 0.56% | 118,000주 | 0.56% |
| 합계 | 1,927,047주 | 13.76% | 962,893주 | 1,927,047주 | 9.17% | 2,198,226주 | 10.46% |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 최대주주 권영근 의장이 배정분의 약 30% 참여에 따른 청약 참여주식수는 271,179주입니다. |
| 주2) 증자 전 발행주식 총수 : 14,009,155주 → 증자 후 발행주식 총수 : 21,009,155주 |
당사는 증권신고서 제출 전일 현재 미발행 주식수(보통주)는 2025년 05월 28일자로 미전환 제1회 전환사채 14,800백만원을 상환함에 따라 총 567,797주가 존재하며, 그 내역은 미전환 제1회 전환사채 4,200백만원의 전환가능주식입니다.
| [기발행 전환사채 내역] | |||
| (기준일 : | 증권신고서 제출 전일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2023.06.28 | 2028.06.28 | 20,000,000,000 | 보통주 | 2024.06.28 ~ 2028.05.28 |
100 | 7,397 | 4,200,000,000 | 567,797 | - |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 2025년 05월 28일자로 미전환 제1회 전환사채 14,800백만원을 상환함에 따라 증권신고서 제출 전일 기준 미상환사채는 4,200백만원입니다. |
제1회 전환사채의 전환가능기간은 2024년 06월 28일부터 2028년 05월 28일까지입니다. 상기 기발행된 전환사채의 전환권이 행사되어 당사 보통주로 전환될 경우, 최대주주를 포함한 기존 주주의 지분율이 희석될 위험이 있습니다. 기발행 전환사채가 보통주로 전환될 경우 총발행주식수(보통주) 14,009,155주의 약 4.05%(금번 유상증자 7,000,000주 포함 2.70%)에 해당합니다.
| [전환사채 전환권 행사 및 유상증자 납입에 따른 지분율 변동 가정] |
| 성명 | 현재 | 전환사채 전환권 행사 후 (권리 행사 100% 가정) |
전환사채 전환권 행사 & 증자 후 (최대주주 미참여 가정) |
||||
| 주식수 | 지분율 | 배정주식수 | 주식수 | 지분율 | 주식수 | 지분율 | |
| 권영근 의장 | 1,809,047주 | 12.91% | 903,932주 | 1,809,047주 | 12.41% | 1,809,047주 | 8.38% |
| 특수관계인 | 118,000 | 0.84% | 58,959주 | 118,000 | 0.81% | 118,000 | 0.55% |
| 주1) 최대주주 및 특수관계인은 유상증자 배정주식수 미참여를 가정하였습니다. |
| 주2) 전환사채의 전환권 100% 행사(전환가액 7,397원)를 가정하였습니다. |
| [주식매수선택권 부여 내역] | |
| (기준일 : 증권신고서 제출 전일) | (단위: 주) |
| 부여 회차 |
부여일 | 만기일 | 주식의 종류 |
부여방법 | 잔여 부여수량 |
행사가격 | 부여일 공정가치 |
|---|---|---|---|---|---|---|---|
| 3-1회차 | 2019.06.30 | 2026.07.13 | 보통주 | 주식교부 | 20,000 | 3,384 | 4,782 |
| 4회차 | 2020.03.31 | 2027.04.01 | 보통주 | 주식교부 | 10,000 | 6,200 | 4,793 |
| 5-1회차 | 2021.01.05 | 2028.01.05 | 보통주 | 주식교부 | 20,000 | 7,750 | 11,061 |
| 5-2회차 | 2021.01.05 | 2028.01.05 | 보통주 | 주식교부 | 10,000 | 10,720 | 10,669 |
| 6-1회차 | 2021.03.29 | 2028.03.29 | 보통주 | 주식교부 | 10,000 | 8,500 | 10,700 |
| 6-2회차 | 2021.03.29 | 2028.03.29 | 보통주 | 주식교부 | 4,000 | 10,720 | 10,376 |
| 7회차 | 2022.03.30 | 2029.03.29 | 보통주 | 주식교부 | 135,000 | 21,500 | 18,999 |
| 8회차 | 2022.11.16 | 2029.11.15 | 보통주 | 주식교부 | 45,000 | 12,700 | 9,985 |
| 9회차 | 2023.03.30 | 2030.03.29 | 보통주 | 주식교부 | 30,000 | 11,100 | 7,646 |
| 합계 | 374,000 | - | - | ||||
| 출처) 당사 정기 보고서 및 당사 제시 |
| 주) 주식수 및 행사가격은 2020년 12월 12일 100% 무상증자를 실시함에 따라 주식선택권 부여수량, 행사가격 및 부여일 공정가치가 조정되었습니다. |
당사의 특수관계인들은 증권신고서 제출 전일 기준 주식교부 방식의 주식매수선택권총 374,000주를 보유하고 있으며, 이를 행사하더라도 신주 교부 방식이 아닌 자기주식 교부 방식이기 때문에 당사의 총 발생주식수 자체는 변동이 없습니다. 따라서, 당사의 주식선택권 행사에 따른 지분희석은 없을 것으로 판단됩니다.
상기한 바와 같이 증권신고서 제출 전일 기준 당사의 최대주주 권영근 의장은 약 12.91%의 지분율을 확보하고 있으며, 금번 주주배정 후 실권주 일반공모에 권영근 의장은 약 30% 내외 참여할 계획입니다. 보유 지분 및 미청약분 증서 매각 대금 및 보유 자금을 활용하여 청약 자금을 마련할 예정이며, 증서 청약률은 매각 당시 주가 흐름과 시장 상황에 따라 변동될 수 있습니다. 만약 시장 상황 악화로 인하여 당사의 주가가 하락한다면 증서 매각대금은 감소하여 청약률이 낮아질 수 있습니다. 이 경우 청약률 하락으로 인해 지분 희석이 심화될 수 있습니다. 또한 최대주주가 예상치 못한 사유 등으로 인해 청약에 필요한 자금을 마련하지 못할 경우, 청약 계획에 변동이 생겨, 지분이 추가 희석될 수 있는 위험성을 배제할 수 없으니 투자자께서는 이 점 유의하시기 바랍니다.
다만, 당사 발행주식총수의 5% 이상 지분율을 보유한 주주는 최대주주 이외에 없고 소액주주들에게 지분율이 분산되어 있어 최대주주의 변경 등 가능성은 제한적일 것으로 판단하고 있습니다. 그럼에도 불구하고 향후 적대적 M&A 및 외부의 경영권 취득 시도 등의 위험에 노출될 수 있으며, 최대주주 변경가능성 등에 의한 경영권의 안정성 저하 및 당사의 신뢰도 하락을 유발할 수 있는 등 당사의 장기적인 발전을 저해하는 요소로 작용할 수 있습니다. 또한 당사가 향후 추가적인 유상증자, 주식관련사채 등의 발행에 따라 최대주주의 지분율이 추가로 희석될 가능성 또한 존재하며, 또는 최대주주의 지분율 추가 희석을 우려하여, 자본시장에서 자금 조달을 진행하는데 어려움이 생길 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주10) 정정 전
|
다. 매출부진 및 지속적 손실 발생 위험 당사는 2016년 05월 설립, 2021년 07월 기술특례로 코스닥 시장 상장한 바이오 벤처 기업으로, 혈관내피기능장애(Endothelial Dysfunction)을 정상화하여 다양한 난치성 질환의 근본 원인을 개선하는 치료제를 연구 및 개발하고 있습니다. 현재까지 당사의 주된 수익원은 개발 중인 신약 후보물질의 기술이전 계약에 따른 계약금(Upfront payment) 및 개발 단계별 성과보수(Milestone payment) 등으로 구성됩니다. 이는 일반적인 제조기업이나 이미 상용화된 제품을 보유한 제약사와는 다른 수익 구조로, 신약 개발의 성공 여부 및 기술이전 계약 체결 및 유지 여부에 따라 매출 발생이 간헐적이거나 변동성이 매우 클 수 있습니다. 이러한 사업 모델은 당사의 재무적 특성에 직접적인 영향을 미칩니다. 기술이전 계약은 성공 시 상당한 규모의 수익을 가져다줄 수 있지만, 계약 체결 자체가 빈번하지 않고 각 개발 단계의 성공에 따라 마일스톤이 지급되므로 수익 흐름이 연속적이지 못하고 예측 또한 어렵습니다. 이는 안정적인 현금흐름 확보를 어렵게 만들며, 대규모 연구개발 투자가 지속되는 상황에서 재무적 부담을 가중시키는 요인으로 작용합니다. 당사의 수익 창출 능력이 아직까지는 특정 기술이전 계약에 크게 의존하고 있으며, 이러한 계약의 변동이 발생할 경우 재무 상태에 즉각적이고 심각한 영향을 미칠 수 있음을 시사합니다. 또한, 매출 발생 여부와 관계없이 연구개발비 등 고정적인 비용 지출 규모가 커 수익성을 확보하지 못하고 손실이 누적되는 구조가 고착화될 위험이 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
(중략)
한편, 당사의 별도기준 판매비와관리비는 2022년 15,565백만원, 2023년 20,803백만원, 2024년 14,267백만원, 2025년 1분기 3,649백만원으로, 위탁연구개발비가 2025년 1분기 기준 전체 판매비와관리비 중 48.5%로 가장 큰 비중을 차지하고 있습니다. 다만, 2024년 위탁연구개발비는 전년대비 6,378백만원이 감소하였는데, 이는 2024년 05월 CU06의 기술이전 계약해지 및 권리반환에 따른 감소는 아니며 CU06의 미국 임상2a상 결과 보고서 수령 이후 임상2b상 IND 신청을 준비하는 과정에서 추가 비용이 아직 발생하지 않은 점이 기인합니다. 최근 3개년 및 2025년 1분기 판매비와관리비 추이 및 파이프라인별 경상연구개발비(연구인력 인건비, 위탁연구개발비, 기타 공통비 등)은 다음과 같습니다.
| [최근 3개년 및 2025년 1분기 판매비와관리비 추이] |
| (단위: 백만원, %) |
| 구분 | 2025년 1분기 | 2024년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|---|
| 급여 | 1,060 | 1,077 | 4,376 | 4,086 | 3,825 |
| 위탁용역연구비 | 1,769 | 1,153 | 5,500 | 11,877 | 6,914 |
| 위탁용역연구비 비중 | 48.5% | 32.4% | 38.5% | 57.1% | 44.4% |
| 지급수수료 | 304 | 3 | 1,388 | 841 | 1,219 |
| 감가상각비 | 120 | 127 | 522 | 511 | 332 |
| 기타 | 396 | 1,195 | 2,482 | 3,487 | 3,275 |
| 합계 | 3,649 | 3,556 | 14,267 | 20,803 | 15,565 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주) 급여는 종업원 급여, 퇴직급여, 복리후생비를 합한 금액입니다. |
| [파이프라인별 경상연구개발비 추이] |
| (단위: 백만원, %) |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| CU01 | 235 | 1,530 | 1,587 | 511 |
| CU02 | 0 | 0 | 0 | 23 |
| CU03 | 0 | 4 | 267 | 634 |
| CU04 | 0 | 0 | 275 | 217 |
| CU05 | 0 | 0 | 5 | 136 |
| CU06 | 645 | 3,630 | 10,094 | 5,890 |
| CU71 | 964 | 673 | 88 | 0 |
| CP01-R01 | 7 | 69 | 40 | 0 |
| 기타 공통비 | 842 | 6,300 | 3,693 | 3,964 |
| 합계 | 2,693 | 9,507 | 16,049 | 11,375 |
| 출처) 당사 정기보고서 |
| 주) 파이프라인별 경상연구개발비로 연구인력 인건비, 위탁연구개발비, 기타 공통비 등의 비용이 합한 금액입니다. |
상기 기재한 바와 같이, 당사의 주요 수익원은 기술이전 계약에 의존하고 있어, 각 계약의 조건 및 유지 여부가 전체 매출에 결정적인 영향을 미칩니다. 특히, CU06 기술이전 계약 해지는 당사의 최근 매출 부진에 직접적인 원인이 되었습니다. 2021년 10월 떼아 오픈이노베이션과 체결했던 CU06의 아시아 제외 글로벌 판권 기술이전 계약은 과거 당사 매출의 중요 부분을 차지했습니다. 그러나 해당 계약이 2024년 05월 16일부로 계약 상대방의 일방적인 통보에 의해 2024년 07월 12일부로 최종 계약 해지됨에 따라, 2024년 매출액은 전년 대비 84.1% 급감한 1,633백만원을 기록하였습니다. 기 수령한 계약금 및 연구개발비 보전금에 대한 반환 의무는 없으나, 향후 해당 파이프라인으로부터 기대되었던 마일스톤 수익이 소멸되었을 뿐만 아니라, 기존에 계약 상대방이 부담하던 CU06의 연구개발 비용까지 당사가 직접 부담하게 되는 결과를 초래했습니다. 이는 당사의 재무 부담 가중으로 이어질 수 있으며, 최근 3년간 당사 매출의 대부분이 CU06 관련 마일스톤 수익이었다는 점을 고려하였을 때, 단일 계약의 해지가 전체 매출에 미치는 부정적인 영향이 크다는 점을 투자자께서는 유의하시기 바랍니다.
한편, 당사는 2025년 03월 06일자로 원료의약품(API) 개발 및 유통 전문기업인 주식회사 대성팜텍을 흡수합병하기로 결정하였으며, 합병 기일은 2026년 01월 28일로 지정되어 흡수합병을 진행할 계획입니다. (주)대성팜텍의 주력 제품군은 안과 치료제 관련 원료의약품 및 중간체로, 이는 당사가 개발 중인 망막질환 경구용 치료제 CU06 및 망막질환 이중항체 MT-103과 밀접한 연관이 있기 때문에 금번 합병을 통해 신약 개발과 원료의약품 사업 간의 시너지를 기대하고 있습니다. 당사의 (주)대성팜텍 흡수합병 관련 공시 내용은 다음과 같습니다.
| [주요사항보고서(회사합병결정) - 2025.03.06] - 2025.05.09(정정) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
회사합병 결정
가. 본 합병은 『상법』 제527조의3의 소규모합병으로 추진하는 바, 존속회사인 (주)큐라클의 주주총회 승인은 이사회 승인으로 갈음합니다. 다만, 상법 527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 합병 반대의사 통지 접수기간 시작일로부터 2주간 내에 서면으로 합병에 반대하는 의사를 통지하는 때에는 소규모합병으로 본 합병을 진행할 수 없습니다. 또한 소멸회사인 (주)대성팜텍은 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다.
다. 존속회사인 (주)큐라클의 경우 소규모합병에 대한 반대의사 접수(접수기간 : 2025년 3월 21일 ~ 2025년 4월 3일)를 위한 주주확정기준일은 2025년 3월 21일입니다. 라. 상법 제526조의 합병종료보고총회는 2026년 1월 29일 존속회사인 (주)큐라클의 이사회결의 개최와 공고 절차로 갈음할 예정입니다. ※ 관련공시 【합병관련 주요사항 상세기재】 1. 합병의 개요 가. 합병에 관한 기본사항
주) 상기 합병 일정은 본 보고서 제출일 현재 기준 예상 일정이며, 관계기간과의 협의 - 증권신고서 제출여부
나. 합병가액 및 그 산출근거
<외부기관 합병가액 산정 개요> - 산정 개요: (주)큐라클과 (주)대성팜텍 간의 합병을 실시함에 있어 동 주요사항보고서상 합병가액의 산정에 대하여, 외부기관은 합병당사회사의 합의에 기초하여 아래의 관련 규정을 적용하여 (주)큐라클과 (주)대성팜텍의 1주당 합병가액을 산정하였으며, 이를 기초로 합병비율의 적정성을 검토하였습니다.
이촌회계법인은 주권상장법인 (주)큐라클과 주권비상장법인인 (주)대성팜텍이 합병을 함에 있어 합병당사회사 간 합병비율의 적정성에 대해 검토하였습니다. 외부평가에 대한 자세한 사항은 첨부서류 '외부평가기관의 평가의견서'를 참고하시기 바랍니다.
- 평가 결과 : 적정한 것으로 판단됩니다(자세한 사항은 '외부평가기관의 평가의견서'를 참고하시기 바랍니다).
라. 주식매수청구권에 관한 사항
② 채무보증
해당사항 없습니다. 가. 경영방침 및 임원구성 2. 합병 상대방회사에 관한 사항 가. 회사의 개요
나. 사업의 내용
라. 외부감사인의 감사의견
사. 임원 및 직원 등에 관한 사항 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 출처) 전자공시시스템(DART) |
2025년 1분기 기준 매출액은 1,108백만원, 영업이익 34백만원을 기록하였으며, 이를 통해 당사의 재무건전성을 강화하고 안정적인 수익 기반을 마련할 수 있을 것으로 보입니다. 피합병회사 (주)대성팜텍의 2025년 1분기 요약 재무 정보는 다음과 같습니다.
| [피합병회사 (주)대성팜텍의 2025년 1분기 요약 재무 정보] |
| (단위: 백만원) |
| 구분 | 2025년 1분기 |
|---|---|
| 자산총계 | 1,733 |
| 부채총계 | 1,499 |
| 자본총계 | 234 |
| 매출액 | 1,108 |
| 영업이익 | 34 |
| 영업이익률 | 3.04% |
| 당기순이익 | 34 |
| 당기순이익률 | 3.04% |
| 출처) 당사 제시 |
| 주) (주)대성팜텍의 경우 2025년 01월 17일 설립되어, 상기 재무 정보는 2025년 1분기 매출만 기재하였으니 투자자께서는 이 점 유의하시기 바랍니다. |
상기 기재한 바와 같이, 당사의 매출은 기술이전 계약 성사 여부 및 조건, 임상시험의 성공적 진행에 따른 마일스톤 수취 등에 따라 큰 폭으로 변동될 수 있으며, 신약 개발 과정의 내재적 불확실성으로 인해 지속적인 손실이 발생할 가능성이 높습니다. 이는 당사 주가에 부정적인 영향을 미칠 수 있으며, 투자 원금 손실의 위험도 수반합니다. 향후 사업 계획, 매출 및 이익 전망 등은 국내외 경기 변동, 규제 환경 변화, 경쟁 상황, 임상시험 결과, 기술이전 계약 조건 등 다양한 내외부 요인에 의해 실제 결과와 중대하게 달라질 수 있습니다.
또한, 당사가 계획 중인 연구개발 활동을 지속하고 상업화를 달성하기 위해서는 상당한 규모의 자금이 지속적으로 필요합니다. 향후 필요한 자금 규모의 조달이 이루어지지 않거나, 자금 납입 시기가 지연되어 임상 일정이 늦어지게 된다면 후속 임상 일정이 전반적으로 지연될 경우 당사의 사업 추진 및 재무 상태에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주10) 정정 후
|
다. 매출부진 및 지속적 손실 발생 위험 당사는 2016년 05월 설립, 2021년 07월 기술특례로 코스닥 시장 상장한 바이오 벤처 기업으로, 혈관내피기능장애(Endothelial Dysfunction)을 정상화하여 다양한 난치성 질환의 근본 원인을 개선하는 치료제를 연구 및 개발하고 있습니다. 현재까지 당사의 주된 수익원은 개발 중인 신약 후보물질의 기술이전 계약에 따른 계약금(Upfront payment) 및 개발 단계별 성과보수(Milestone payment) 등으로 구성됩니다. 이는 일반적인 제조기업이나 이미 상용화된 제품을 보유한 제약사와는 다른 수익 구조로, 신약 개발의 성공 여부 및 기술이전 계약 체결 및 유지 여부에 따라 매출 발생이 간헐적이거나 변동성이 매우 클 수 있습니다. 이러한 사업 모델은 당사의 재무적 특성에 직접적인 영향을 미칩니다. 기술이전 계약은 성공 시 상당한 규모의 수익을 가져다줄 수 있지만, 계약 체결 자체가 빈번하지 않고 각 개발 단계의 성공에 따라 마일스톤이 지급되므로 수익 흐름이 연속적이지 못하고 예측 또한 어렵습니다. 이는 안정적인 현금흐름 확보를 어렵게 만들며, 대규모 연구개발 투자가 지속되는 상황에서 재무적 부담을 가중시키는 요인으로 작용합니다. 당사의 수익 창출 능력이 아직까지는 특정 기술이전 계약에 크게 의존하고 있으며, 이러한 계약의 변동이 발생할 경우 재무 상태에 즉각적이고 심각한 영향을 미칠 수 있음을 시사합니다. 또한, 매출 발생 여부와 관계없이 연구개발비 등 고정적인 비용 지출 규모가 커 수익성을 확보하지 못하고 손실이 누적되는 구조가 고착화될 위험이 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
(중략)
CU06의 진행 예정인 임상 개요는 다음과 같습니다.
| [CU06 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 주요 목적 - 당뇨병성 황반부종(DME) 환자를 대상으로 최적의 용량을 도출하여 향후 3상 시험 설계에 반영 부차적 목적 - 24주 후 CU06의 안전성과 유효성 평가 (위약과 비교) - CU06 및 대사체의 혈중 약물동태(PK) 평가 - 혈중 바이오마커(TNF-α, IL-6 등)에 대한 CU06-1004의 영향 분석 |
| 임상시험 대상국가 | 미국 내 20개 기관에서 환자 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 이번 임상시험은 미국 내 20개 의료기관에서 시행되는 무작위배정, 이중눈가림, 위약대조 방식의 다기관 임상 2b상 시험으로, 중심성 당뇨병성 황반부종(Center-Involved Diabetic Macular Edema, DME) 환자를 대상으로 CU06-1004의 유효성과 안전성을 평가하기 위해 설계되었습니다. 총 135명의 환자를 1:1:1 비율로 세 군(200mg, 300mg, 위약)으로 무작위 배정하여, 매일 식사 직후 경구로 24주간 약물을 투여받게 됩니다. - 주 평가 지표는 24주 시점에서의 ETDRS 문자표 기준 최고교정시력(BCVA) 변화량이며, 이외에도 망막 두께, 망막 내/하부 액체량, 혈관 밀도 및 혈류량, 염증성 바이오마커(TNF-α, IL-6) 등의 변화를 포함한 다양한 이차 평가지표들을 통해 약물의 치료 효과를 종합적으로 분석합니다. - 약동학적 특성은 혈중 약물 농도 측정을 통해 파악되며, 안전성은 이상반응 발생률, 생체징후 변화, 심전도 및 혈액검사 등 다양한 지표를 통해 평가됩니다. 주요 유효성 분석은 MMRM(Mixed Model for Repeated Measures)을 이용하며, 300mg과 200mg 용량을 위약과 순차적으로 비교하여 통계적 유의성을 검증합니다. |
| 기대효과 | - 본 임상을 통해 CU06-1004가 당뇨병성 황반부종 환자에서 유의미한 시력 개선 및 망막 구조 개선 효과를 나타낼 경우, 기존 항VEGF 주사제 중심의 치료법에 대한 대안으로 자리매김할 수 있을 것으로 기대됩니다. 특히 CU06-1004는 경구 투약이라는 비침습적 제형을 통해, 반복적인 안구 주사로 인한 환자 부담과 내원 횟수를 줄일 수 있는 잠재력을 보유하고 있습니다. - 또한, 다양한 시각적 기능 및 구조적 개선 외에도 염증 조절과 혈관 안정화 등의 기전을 입증함으로써, 기존 치료제 대비 차별화된 약물 프로파일을 확보할 수 있습니다. 이번 임상에서 도출되는 최적 용량과 유효성·안전성 데이터는 향후 3상 시험 설계의 근거가 되며, 글로벌 라이선싱 및 상업화를 위한 핵심 기반 자료로 활용될 수 있습니다. 이를 통해 CU06-1004는 DME 치료 분야에서 새로운 경구 치료제로서의 가능성을 입증할 수 있을 것으로 기대됩니다. |
| 출처) 당사 제시 |
한편, 당사가 2021년 07월 22일 코스닥시장에 신규상장 당시 증권신고서 상의 6개년(2019년 ~ 2024년) 추정 경영실적 세부내역은 다음과 같습니다.
| [상장 당시 공시한 추정 손익계산서] |
| (단위: 백만원) |
| 구분 | 2019년 | 2020년 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) |
|---|---|---|---|---|---|---|
| 매출액 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 매출원가 | 0 | 0 | 0 | 0 | 0 | 0 |
| 매출총이익 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 판매관리비 | 5,734 | 7,853 | 17,225 | 19,160 | 28,309 | 34,494 |
| 영업이익(손실) | (5,734 | (7,853) | (17,225) | (3,032) | 2,837 | 35,824 |
| 영업외수익 | 166 | 160 | 165 | 264 | 234 | 366 |
| 영업외비용 | 8,421 | 20,917 | 19 | 17 | 14 | 12 |
| 법인세비용차감전순이익(손실) | (13,989 | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 법인세비용 | 0 | 0 | 0 | 0 | 0 | 0 |
| 당기순이익(손실) | (13,989) | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 출처) 당사 정기보고서 |
하지만, 상기 추정손익과 달리 최근 3개년(2022년 ~ 2024년) 매출 등의 실적은 아래와 같이 큰 차이를 보이고 있습니다.
| [추정손익과 현재 손익 비교] | |
| (K-IFRS, 연결) | (단위: 백만원) |
| 구분 | 2024년 | 2023년 | 2022년 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | |
| 매출액 | 70,318 | 1,633 | (68,685) | 31,146 | 10,294 | (20,852) | 16,128 | 3,583 | (12,545) |
| 영업이익(손실) | 35,824 | (12,635) | (48,459) | 2,837 | (10,508) | (13,345) | (3,032) | (10,508) | (7,476) |
| 당기순이익(손실) | 36,177 | (14,886) | (51,063) | 3,057 | (11,586) | (14,643) | (2,784) | (11,586) | (8,802) |
| 출처) 당사 정기보고서 및 증권신고서 |
상기와 같이 당사는 매출액이 예측치 대비 괴리액이 2022년 12,545백만원, 2023년 20,852백만원, 2024년에는 68,685백만원 하회하고 있으며, 영업손실 또한 예측치 대비 크게 상이한 모습을 보이고 있습니다. 이처럼 당사는 상장 당시 매출 및 수익성 추정치와 현재 실적 간 차이가 큰 편에 속합니다. 상장 당시 주요 파이프라인별 추정 실적과 실제 매출액을 파이프라인별로 상세히 살펴보면 다음과 같습니다.
| [주요 파이프라인별 세부 추정 매출액과 현재 매출액 비교] |
| (단위: 백만원) |
| 구분 | 추정 매출 추정치 | 실제 매출 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 주요 파이프라인 | 기술료 구분 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) | 2021년 | 2022년 | 2023년 | 2024년 |
| CU06 | Upfront | 0 | 8,227 | 0 | 3,835 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 10,970 | 13,712 | 0 | 3,583 | 10,294 | 1,633 | |
| CU01 | Upfront | 0 | 2,688 | 5,767 | 0 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 14,409 | 13,644 | 0 | 0 | 0 | 0 | |
| CU03 | Upfront | 0 | 5,213 | 0 | 11,184 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 0 | 27,944 | 0 | 0 | 0 | 0 | |
| Total | Upfront | 0 | 16,128 | 5,767 | 15,019 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 25,379 | 55,300 | 0 | 3,583 | 10,294 | 1,633 | |
| 합계 | 0 | 16,128 | 31,146 | 70,318 | 6,255 | 3,583 | 10,294 | 1,633 | |
| 출처) 당사 정기보고서 및 증권신고서 |
2021년부터 2024년까지 당사의 주요 파이프라인별 추정 실적과 실제 매출액간 차이가 발생한 사유는 아래와 같습니다.
① CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)
당사의 주요 파이프라인 CU06은 2021년 10월 떼아 오픈이노베이션에 기술 수출을 통해 당뇨병성 황반부종 및 습성 황반변성에 대한 아시아를 제외한 전세계 지역에 대한 판권을 이전하였습니다. 이에 따른 계약금(Upfront) 6백만불을 수취하였으며, 당시 환율을 적용하여 2021년 6,255백만원을 매출액으로 인식하였습니다. 이후 원가투입법기준 진행률에 따라 기간에 걸쳐 수익을 인식하였으며, 임상2상 시험, 비임상 시험 및 CMC(Chemistry, Manufacturing and Controls)에 필요한 외주 용역 비용의 보상을 받을 뿐만 아니라, 이 과정을 수행하는데 소요되는 임상연구비용 및 제반비용 등을 수익으로 인식함에 따라 2022년, 2023년 각각 3,583백만원, 10,294백만원의 매출액을 기록하였습니다.
CU06의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 07월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
② CU01(당뇨병성 신증 치료제)
당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
③ CU03(습성 황반변성 치료제)
CU03의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
한편, 당사의 별도기준 판매비와관리비는 2022년 15,565백만원, 2023년 20,803백만원, 2024년 14,267백만원, 2025년 1분기 3,649백만원으로, 위탁연구개발비가 2025년 1분기 기준 전체 판매비와관리비 중 48.5%로 가장 큰 비중을 차지하고 있습니다. 다만, 2024년 위탁연구개발비는 전년대비 6,378백만원이 감소하였는데, 이는 2024년 05월 CU06의 기술이전 계약해지 및 권리반환에 따른 감소는 아니며 CU06의 미국 임상2a상 결과 보고서 수령 이후 임상2b상 IND 신청을 준비하는 과정에서 추가 비용이 아직 발생하지 않은 점이 기인합니다. 최근 3개년 및 2025년 1분기 판매비와관리비 추이 및 파이프라인별 경상연구개발비(연구인력 인건비, 위탁연구개발비, 기타 공통비 등)은 다음과 같습니다.
| [최근 3개년 및 2025년 1분기 판매비와관리비 추이] |
| (단위: 백만원, %) |
| 구분 | 2025년 1분기 | 2024년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|---|
| 급여 | 1,060 | 1,077 | 4,376 | 4,086 | 3,825 |
| 위탁용역연구비 | 1,769 | 1,153 | 5,500 | 11,877 | 6,914 |
| 위탁용역연구비 비중 | 48.5% | 32.4% | 38.5% | 57.1% | 44.4% |
| 지급수수료 | 304 | 3 | 1,388 | 841 | 1,219 |
| 감가상각비 | 120 | 127 | 522 | 511 | 332 |
| 기타 | 396 | 1,195 | 2,482 | 3,487 | 3,275 |
| 합계 | 3,649 | 3,556 | 14,267 | 20,803 | 15,565 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주) 급여는 종업원 급여, 퇴직급여, 복리후생비를 합한 금액입니다. |
| [파이프라인별 경상연구개발비 추이] |
| (단위: 백만원, %) |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| CU01 | 235 | 1,530 | 1,587 | 511 |
| CU02 | 0 | 0 | 0 | 23 |
| CU03 | 0 | 4 | 267 | 634 |
| CU04 | 0 | 0 | 275 | 217 |
| CU05 | 0 | 0 | 5 | 136 |
| CU06 | 645 | 3,630 | 10,094 | 5,890 |
| CU71 | 964 | 673 | 88 | 0 |
| CP01-R01 | 7 | 69 | 40 | 0 |
| 기타 공통비 | 842 | 6,300 | 3,693 | 3,964 |
| 합계 | 2,693 | 9,507 | 16,049 | 11,375 |
| 출처) 당사 정기보고서 |
| 주) 파이프라인별 경상연구개발비로 연구인력 인건비, 위탁연구개발비, 기타 공통비 등의 비용이 합한 금액입니다. |
상기 기재한 바와 같이, 당사의 주요 수익원은 기술이전 계약에 의존하고 있어, 각 계약의 조건 및 유지 여부가 전체 매출에 결정적인 영향을 미칩니다. 특히, CU06 기술이전 계약 해지는 당사의 최근 매출 부진에 직접적인 원인이 되었습니다. 2021년 10월 떼아 오픈이노베이션과 체결했던 CU06의 아시아 제외 글로벌 판권 기술이전 계약은 과거 당사 매출의 중요 부분을 차지했습니다. 그러나 해당 계약이 2024년 05월 16일부로 계약 상대방의 일방적인 통보에 의해 2024년 07월 12일부로 최종 계약 해지됨에 따라, 2024년 매출액은 전년 대비 84.1% 급감한 1,633백만원을 기록하였습니다. 기 수령한 계약금 및 연구개발비 보전금에 대한 반환 의무는 없으나, 향후 해당 파이프라인으로부터 기대되었던 마일스톤 수익이 소멸되었을 뿐만 아니라, 기존에 계약 상대방이 부담하던 CU06의 연구개발 비용까지 당사가 직접 부담하게 되는 결과를 초래했습니다. 이는 당사의 재무 부담 가중으로 이어질 수 있으며, 최근 3년간 당사 매출의 대부분이 CU06 관련 마일스톤 수익이었다는 점을 고려하였을 때, 단일 계약의 해지가 전체 매출에 미치는 부정적인 영향이 크다는 점을 투자자께서는 유의하시기 바랍니다.
한편, 당사는 2025년 03월 06일자로 원료의약품(API) 개발 및 유통 전문기업인 주식회사 대성팜텍을 흡수합병하기로 결정하였으며, 합병 기일은 2026년 01월 28일로 지정되어 흡수합병을 진행할 계획입니다. (주)대성팜텍의 주력 제품군은 안과 치료제 관련 원료의약품 및 중간체로, 이는 당사가 개발 중인 망막질환 경구용 치료제 CU06 및 망막질환 이중항체 MT-103과 밀접한 연관이 있기 때문에 금번 합병을 통해 신약 개발과 원료의약품 사업 간의 시너지를 기대하고 있습니다. 당사의 (주)대성팜텍 흡수합병 관련 공시 내용은 다음과 같습니다.
| [주요사항보고서(회사합병결정) - 2025.03.06] - 2025.05.09(정정) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
회사합병 결정
가. 본 합병은 『상법』 제527조의3의 소규모합병으로 추진하는 바, 존속회사인 (주)큐라클의 주주총회 승인은 이사회 승인으로 갈음합니다. 다만, 상법 527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 합병 반대의사 통지 접수기간 시작일로부터 2주간 내에 서면으로 합병에 반대하는 의사를 통지하는 때에는 소규모합병으로 본 합병을 진행할 수 없습니다. 또한 소멸회사인 (주)대성팜텍은 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다.
다. 존속회사인 (주)큐라클의 경우 소규모합병에 대한 반대의사 접수(접수기간 : 2025년 3월 21일 ~ 2025년 4월 3일)를 위한 주주확정기준일은 2025년 3월 21일입니다. 라. 상법 제526조의 합병종료보고총회는 2026년 1월 29일 존속회사인 (주)큐라클의 이사회결의 개최와 공고 절차로 갈음할 예정입니다. ※ 관련공시 【합병관련 주요사항 상세기재】 1. 합병의 개요 가. 합병에 관한 기본사항
주) 상기 합병 일정은 본 보고서 제출일 현재 기준 예상 일정이며, 관계기간과의 협의 - 증권신고서 제출여부
나. 합병가액 및 그 산출근거
<외부기관 합병가액 산정 개요> - 산정 개요: (주)큐라클과 (주)대성팜텍 간의 합병을 실시함에 있어 동 주요사항보고서상 합병가액의 산정에 대하여, 외부기관은 합병당사회사의 합의에 기초하여 아래의 관련 규정을 적용하여 (주)큐라클과 (주)대성팜텍의 1주당 합병가액을 산정하였으며, 이를 기초로 합병비율의 적정성을 검토하였습니다.
이촌회계법인은 주권상장법인 (주)큐라클과 주권비상장법인인 (주)대성팜텍이 합병을 함에 있어 합병당사회사 간 합병비율의 적정성에 대해 검토하였습니다. 외부평가에 대한 자세한 사항은 첨부서류 '외부평가기관의 평가의견서'를 참고하시기 바랍니다.
- 평가 결과 : 적정한 것으로 판단됩니다(자세한 사항은 '외부평가기관의 평가의견서'를 참고하시기 바랍니다).
라. 주식매수청구권에 관한 사항
② 채무보증
해당사항 없습니다. 가. 경영방침 및 임원구성 2. 합병 상대방회사에 관한 사항 가. 회사의 개요
나. 사업의 내용
라. 외부감사인의 감사의견
사. 임원 및 직원 등에 관한 사항 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 출처) 전자공시시스템(DART) |
당사는 2025년 03월 06일 이사회 결의를 통해, (주)대성팜텍을 소멸회사로 하고 당사를 존속회사로 하는 흡수합병을 추진하기로 결정하였습니다. 본 합병은 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제6항 및 「상법」 제527조의3에 따른 소규모합병 절차에 따라 진행되며, 주주총회 승인을 갈음하여 이사회 승인만으로 효력을 발생합니다.
합병가액은 자본시장법령 및 관련 규정에 따라 외부평가기관인 대주회계법인이 수익가치 방식을 기준으로 산출하였으며, 별도로 이촌회계법인이 합병가액의 공정성 및 적정성에 대한 검토를 수행하였습니다. 이 과정에서 합병 대상인 대성팜텍의 과거 실적, 향후 성장률(향후 5년간 연평균 약 10%), 업종의 시장환경 등을 반영하여 수익가치를 추정하였으며, 이를 바탕으로 합병비율은 1:15.5139384로 결정되었습니다(대성팜텍 보통주 1주당 당사 보통주 15.5139384주를 교부).
해당 합병비율 및 거래조건은 외부평가와 법적 기준을 모두 충족하고 있으며, 이사회는 이를 바탕으로 본 합병이 당사와 주주의 이익에 부합하고, 회사의 성장 기반을 강화하며, 장기적인 가치 창출에 기여할 수 있을 것으로 판단하였습니다. 특히 당사와 대성팜텍 간의 사업 연관성과 R&D 및 유통 역량의 결합을 통해, 원료의약품 사업부문에서의 안정적인 수익 확보와 신약 개발과의 시너지 확대가 가능하다는 점에서 전략적 타당성도 충분하다고 평가하였습니다.
본 합병안은 이사회 전원의 찬성으로 의결되었으며, 반대 의견은 없었습니다. 아울러 본 합병은 소규모합병에 해당하므로, 합병 반대주주에 대한 주식매수청구권은 발생하지 않습니다.
또한, 당사의 최대주주를 포함한 주요 주주 및 피합병회사인 (주)대성팜텍의 주주들 간에는 과거 동업 이력이나 공동 투자 이력이 없으며, 「자본시장과 금융투자업에 관한 법률」 및 「상법」상 규정에 따른 특수관계인에도 해당하지 않습니다. 따라서 본 합병은 이해관계에 기반한 거래가 아닌, 사업적 필요성과 전략적 판단에 따라 추진되었습니다.
2025년 1분기 기준 매출액은 1,108백만원, 영업이익 34백만원을 기록하였으며, 이를 통해 당사의 재무건전성을 강화하고 안정적인 수익 기반을 마련할 수 있을 것으로 보입니다. 피합병회사 (주)대성팜텍의 2025년 1분기 요약 재무 정보는 다음과 같습니다.
| [피합병회사 (주)대성팜텍의 2025년 1분기 요약 재무 정보] |
| (단위: 백만원) |
| 구분 | 2025년 1분기 |
|---|---|
| 자산총계 | 1,733 |
| 부채총계 | 1,499 |
| 자본총계 | 234 |
| 매출액 | 1,108 |
| 영업이익 | 34 |
| 영업이익률 | 3.04% |
| 당기순이익 | 34 |
| 당기순이익률 | 3.04% |
| 출처) 당사 제시 |
| 주) (주)대성팜텍의 경우 2025년 01월 17일 설립되어, 상기 재무 정보는 2025년 1분기 매출만 기재하였으니 투자자께서는 이 점 유의하시기 바랍니다. |
상기 기재한 바와 같이, 당사의 매출은 기술이전 계약 성사 여부 및 조건, 임상시험의 성공적 진행에 따른 마일스톤 수취 등에 따라 큰 폭으로 변동될 수 있으며, 신약 개발 과정의 내재적 불확실성으로 인해 지속적인 손실이 발생할 가능성이 높습니다. 이는 당사 주가에 부정적인 영향을 미칠 수 있으며, 투자 원금 손실의 위험도 수반합니다. 향후 사업 계획, 매출 및 이익 전망 등은 국내외 경기 변동, 규제 환경 변화, 경쟁 상황, 임상시험 결과, 기술이전 계약 조건 등 다양한 내외부 요인에 의해 실제 결과와 중대하게 달라질 수 있습니다.
또한, 당사가 계획 중인 연구개발 활동을 지속하고 상업화를 달성하기 위해서는 상당한 규모의 자금이 지속적으로 필요합니다. 향후 필요한 자금 규모의 조달이 이루어지지 않거나, 자금 납입 시기가 지연되어 임상 일정이 늦어지게 된다면 후속 임상 일정이 전반적으로 지연될 경우 당사의 사업 추진 및 재무 상태에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주11) 정정 전
| 라. 재무안정성 관련 위험 당사의 부채비율은 별도기준으로 2022년말 20.55%, 2023년말 66.69%, 2024년말 97.94%, 2025년 1분기 100.93%로 나타났습니다. 2022년의 경우 3,583백만원의 매출액과 11,406백만원의 당기순손실을 기록하였으나 2021년 07월 기업공개를 통해 조달한 48,110백만원의 자본 확충 영향으로 자본총계 46,171백만원을 기록한 반면, 부채의 경우 은행차입금 8,000백만원 등으로 부채총계 9,487백만원을 기록하며 낮은 수준의 부채비율 20.55%을 기록하였습니다. 다만, 2023년 06월 20,000백만원 규모의 제1회 전환사채를 발행하며 부채비율이 크게 증가하여 66.69%를 기록하였습니다. 2024년의 경우 14,886백만원의 당기순손실이 발생함에 따라 자본총계가 전년 대비 28% 감소함에 따라 부채비율은 97.94%까지 증가하였습니다. 2025년 1분기 기준 4,126백만원의 당기순손실이 발생하며 자본총계가 감소하였으며, 이에 부채비율은 110.10%까지 증가하였습니다. 한편, 당사의 차입금의 규모를 살펴보면 2022년은 은행차입금 8,000백만원으로 차입금의존도는 14.64%로 매우 낮은 편이었으나, 2023년의 경우 주요 파이프라인의 연구개발 관련 비용 등을 충당하기 위해 06월 28월 20,000백만원 규모의 제1회 전환사채를 발행하며 차입금의존도가 37.00%까지 증가하였습니다. 2024년의 경우, 떼아 오픈이노베이션과 2021년 10월 체결한 당뇨병성 황반부종 및 습성 환반병성 치료제 CU06에 대한 기술이전 계약에 대한 해지 및 권리반환 통보로 인해 계약자산 감소 등 자산총계가 감소하며 차입금의존도는 47.88%까지 증가하였습니다. 2025년 1분기는 사채권자의 전환청구 700백만원이 발생하며 1CB 잔액은 19,300백만원으로 소폭 감소하였지만 자산총계 감소 폭이 더 큼에 따라 차입금의존도는 48.89%를 기록하였습니다. 이후 2025년 04월 22일 300백만원이 추가 전환되어 증권신고서 제출 전일 기준, 1CB 잔액은 19,000백만원입니다. 당사의 경우 단기차입금 비중이 낮아 단기적으로 수익성이 급격히 악화되거나, 지정학적 리스크 및 트럼프 정부의 극단적인 정책 변경 등의 글로벌 금융시장의 급격한 변화가 발생하여 금융기관으로부터 차입금의 상환 요구가 발생하거나 계획대로 만기연장이 이루어지지 않을 경우 당사의 유동성 위기가 발생할 가능성은 낮은 편이지만, 당사의 예상과는 달리 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등과 더불어 예상치 못한 사유로 수익성 개선 시기가 지연되거나, 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 지속적으로 이자보상배율이 1배를 하회할 수 있습니다. 향후 지속적으로 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사 2025년 1분기 보고서 재무제표를 살펴보면 총자산 55,835백만원 및 유동자산 29,097백만원, 총 차입금 27,300백만원, 차입금 의존도 48.89%, 부채비율 110.10%, 유동비율 100.93%를 나타내고 있습니다.
또한 당사가 속한 업종인 한국은행 2023년 기업경영분석 상 C21(의료용 물질 및 의약품) 기준 업종평균 수치를 살펴보면, 부채비율 52.81%, 유동비율 196.90%, 차입금의존도 16.77%입니다. 업종평균 수치를 당사 2025년 1분기 기준 재무 수치와 비교시 유동비율를 제외한 부채비율 및 차입금의존도가 상회하고 있습니다. 다음은 최근 3개년 및 2025년 1분기 요약 재무 현황입니다.
| [요약 재무 현황] | |
| (단위: 백만원, %) | |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 업종평균 |
|---|---|---|---|---|---|
| 자산총계 | 55,835 | 59,288 | 69,782 | 55,657 | - |
| 유동자산 | 29,097 | 32,417 | 44,473 | 33,407 | - |
| 비유동자산 | 26,739 | 26,871 | 25,309 | 22,251 | - |
| 부채총계 | 29,260 | 29,335 | 27,919 | 9,487 | - |
| 유동부채 | 28,828 | 20,986 | 10,197 | 1,371 | - |
| 비유동부채 | 432 | 8,349 | 17,722 | 8,116 | - |
| 자본총계 | 26,575 | 29,953 | 41,863 | 46,171 | - |
| 자본금 | 6,984 | 6,937 | 6,928 | 6,923 | - |
| 부채비율 | 110.10% | 97.94% | 66.69% | 20.55% | 52.81% |
| 유동비율 | 100.93% | 154.47% | 436.16% | 2,437.23% | 196.90% |
| 총 차입금 | 27,300 | 28,000 | 28,000 | 8,000 | - |
| 단기차입금 | 19,300 | 20,000 | 8,000 | 0 | - |
| 장기차입금 | 8,000 | 8,000 | 20,000 | 8,000 | - |
| 현금성자산 | 27,246 | 30,346 | 40,841 | 28,511 | - |
| 차입금의존도 | 48.89% | 47.23% | 40.12% | 14.37% | 16.77% |
| 출처) 당사 정기보고서 및 한국은행 기업경영분석(2023) |
| 주1) 업종평균은 한국은행 2023년 기업경영분석 C21(의료용 물질 및 의약품) 기준으로 작성하였습니다. |
| 주2) 현금성자산은 현금및현금성자산과 단기금융상품을 합한 금액입니다. |
당사의 부채비율은 별도기준으로 2022년말 20.55%, 2023년말 66.69%, 2024년말 97.94%, 2025년 1분기 100.93%로 나타났습니다. 2022년의 경우 3,583백만원의 매출액과 11,406백만원의 당기순손실을 기록하였으나 2021년 07월 기업공개를 통해 조달한 48,110백만원의 자본 확충 영향으로 자본총계 46,171백만원을 기록한 반면, 부채의 경우 은행차입금 8,000백만원 등으로 부채총계 9,487백만원을 기록하며 낮은 수준의 부채비율 20.55%을 기록하였습니다.
다만, 2023년 06월 20,000백만원 규모의 제1회 전환사채를 발행하며 부채비율이 크게 증가하여 66.69%를 기록하였습니다. 2024년의 경우 14,886백만원의 당기순손실이 발생함에 따라 자본총계가 전년 대비 28% 감소함에 따라 부채비율은 97.94%까지 증가하였습니다.
2025년 1분기 기준 4,126백만원의 당기순손실이 발생하며 자본총계가 감소하였으며, 이에 부채비율은 110.10%까지 증가하였습니다.
한편, 당사의 차입금의 규모를 살펴보면 2022년은 은행차입금 8,000백만원으로 차입금의존도는 14.64%로 매우 낮은 편이었으나, 2023년의 경우 주요 파이프라인의 연구개발 관련 비용 등을 충당하기 위해 06월 28월 20,000백만원 규모의 제1회 전환사채를 발행하며 차입금의존도가 37.00%까지 증가하였습니다. 2024년의 경우, 떼아 오픈이노베이션과 2021년 10월 체결한 당뇨병성 황반부종 및 습성 환반병성 치료제 CU06에 대한 기술이전 계약에 대한 해지 및 권리반환 통보로 인해 계약자산 감소 등 자산총계가 감소하며 차입금의존도는 47.88%까지 증가하였습니다.
2025년 1분기는 사채권자의 전환청구 700백만원이 발생하며 1CB 잔액은 19,300백만원으로 소폭 감소하였지만 자산총계 감소 폭이 더 큼에 따라 차입금의존도는 48.89%를 기록하였습니다. 이후 2025년 04월 22일 300백만원이 추가 전환되어 증권신고서 제출 전일 기준, 1CB 잔액은 19,000백만원입니다. 당사가 현재까지 발행한 전환사채의 상세 내역은 다음과 같습니다.
| [전환사채 발행 개요] |
| 구분 | 제1회 무기명식 이권부 무보증 사모 전환사채 |
|---|---|
| 액면가액 | 20,000백만원 |
| 현재 잔액 | 19,000백만원 |
| 이자지급조건 | 표면금리 0% |
| 만기보장수익률 | 3% |
| 발행일 | 2023.06.28 |
| 만기일 | 2028.06.28 |
| 전환비율 | 100% |
| 전환시 발행할 주식 | 기명식 보통주식 |
| 전환가액 | 주당 7,397원 |
| 전환가능주식수 | 2,568,608주 |
| 전환청구기간 | 2024.06.28~2028.05.28 |
| 투자자의 조기상환청구권 (Put Option) |
2025년 06월 28일 및 이후 매 3개월에 해당되는 날에 사채의 전자등록금액의전부 또는 일부에 대하여 만기 전 조기상환 청구 가능 |
| 발행자의 매도청구권 (Call Option) |
2024년 06월 28일부터 전환사채의 일부(최대 20%)에 대하여 발행회사 또는 발행회사가 지정하는 제3자에게 매도하도록 청구 가능. |
| 출처) 당사 제시 및 정기보고서 |
| 주) 증권신고서 제출 전일 기준입니다. |
당사의 2025년 1분기 기준 총 차입금 내역은 다음과 같습니다.
| [총 차입금 상세 내역] | |
| (K-IFRS, 별도) | (단위 : 백만원) |
| 구 분 | 차입처 | 차입 목적 | 차입일 | 만기일 | 이자율 (표면이자율/만기이자율) |
2025년 1분기 |
|---|---|---|---|---|---|---|
| 은행차입금 | 하나은행 | 시설자금대출 | 2021.12.29 | 2026.01.29 | CD(3M) + 1.64% | 8,000 |
| 1CB | 하나증권(주) 외 | 오픈 이노베이션, 혁신신약 임상연구 등 연구개발비 투자 | 2023.08.04 | 2028.08.04 | 0%/3% | 19,300 |
| 합계 | 27,300 | |||||
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 전환사채의 경우 투자자의 이해를 돕기 위해 전자등록총액으로 작성하였습니다. |
| 주2) 1CB 잔액의 경우, 2025년 04월 22일 300백만원이 추가 전환되며 증권신고서 제출 전일 기준 1CB 잔액은 19,000백만원입니다. |
한편, 이자보상배율의 경우 영업활동을 통해 벌어들인 이익으로 차입금에 대한 이자비용을 감내할 수 있는지를 확인할 수 있는 지표로서 활용됩니다. 당사의 이자보상배율 관련 현황은 다음과 같습니다.
| [이자보상배율 현황] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 비고 |
|---|---|---|---|---|---|
| 영업수익 | 0 | 1,633 | 10,294 | 3,583 | - |
| 영업비용 | 3,649 | 14,267 | 20,803 | 15,565 | - |
| 영업비용율 | - | 8.74% | 2.02% | 4.34% | 영업비용 ÷ 영업수익 |
| 영업이익(손실) | (3,649) | (12,635) | (10,508) | (11,982) | - |
| 영업이익률 | - | -7.73% | -1.02% | -3.34% | 영업이익(손실) ÷ 영업수익 |
| 자산총계 | 55,835 | 59,288 | 69,782 | 55,657 | - |
| 이자비용 | 653 | 2,455 | 1,347 | 300 | - |
| 이자보상배율(배) | (5.58) | (5.15) | (7.80) | (39.95) | 영업이익(손실) ÷ 이자비용 |
| 이자비용 부담률 | - | 150.36% | 13.09% | 8.37% | 이자비용 ÷ 영업수익 |
| 차입금 총계 | 27,300 | 28,000 | 28,000 | 8,000 | - |
| 차입금 평균이자율 | 2.39% | 8.77% | 4.81% | 3.75% | 이자비용 ÷ 차입금 총계 |
| 차입금 의존도 | 48.89% | 47.23% | 40.12% | 14.37% | 차입금 총계 ÷ 자산총계 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 차입금 총계는 기발행 전환사채의 미상환잔액(권면금액기준) 및 은행 차입금의 합입니다. |
| 주2) 1CB 잔액의 경우, 2025년 04월 22일 300백만원이 추가 전환되며 증권신고서 제출 전일 기준 1CB 잔액은 19,000백만원입니다. |
당사의 영업수익은 프랑스 안과 전문회사 떼아 오픈이노베이션으로부터의 마일스톤 유입에 따른 것으로, 2021년 10월 CU06 기술이전에 성공하며 계약금(Upfront) 6,300백만원을 수취하여 매출로 인식되었으며, 진행률에 따라 수익을 추가로 인식하며 2022년 영업수익은 3,583백만원을 기록하였습니다.
2023년에는 기술이전 계약에 따라, CU06의 임상2상 시험, 비임상시험 및 CMC(Chemistry, Manufacturing and Controls)에 필요한 외주 용역 비용의 보상을 받을 뿐만 아니라, 이 과정을 수행하는 데 소요되는 동사의 전문 인력의 인건비 및 간접 비용 등 서비스 비용도 떼아 오픈이노베이션으로부터 지급받았으며, 이를 모두 수익으로 인식하며 10,294백만원의 영업수익을 기록하였습니다.
다만, 2024년 05월 떼아 오픈이노베이션으로부터 경구용 망막 질환 치료제인 CU06의 기술이전 계약해지 및 권리반환 통보를 받았으며 마일스톤 유입이 제한됨에 따라 매출이 급감하며 1,633백만원을 기록하였습니다.
당사는 신약 연구 및 개발하는 바이오벤처기업으로 신약개발로 인한 임상 비용 및 연구인력 인건비 등의 비중이 큰 편으로, 영업손실은 2022년 11,932백만원, 2023년 10,508백만원, 2024년 12,635백만원, 2025년 1분기 3,649백만원이 발생하였으며, 이자비용의 경우 2022년 300백만원, 2023년 1,347백만원, 2024년 2,455백만원, 2025년 1분기 663백만원이 발생하였습니다. 당사의 이자보상배율은 지속적으로 1배 미만을 기록하고 있으며, 영업을 통해 손실이 지속적으로 발생하고 있어 이자비용을 충당하지 못하는 상황입니다. 특히 2023년 20,000백만원 규모의 1CB 발행으로 이자비용 부담이 커졌습니다. 이는 당사의 채무상환능력이 취약하다는 것을 나타내며, 미미한 매출 수준으로 인해 영업 적자가 심화되고 있음에 기인합니다.
당사의 경우 단기차입금 비중이 낮아 단기적으로 수익성이 급격히 악화되거나, 지정학적 리스크 및 트럼프 정부의 극단적인 정책 변경 등의 글로벌 금융시장의 급격한 변화가 발생하여 금융기관으로부터 차입금의 상환 요구가 발생하거나 계획대로 만기연장이 이루어지지 않을 경우 당사의 유동성 위기가 발생할 가능성은 낮은 편이지만,당사의 예상과는 달리 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등과 더불어 예상치 못한 사유로 수익성 개선 시기가 지연되거나, 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 지속적으로 이자보상배율이 1배를 하회할 수 있습니다. 향후 지속적으로 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주11) 정정 후
| 라. 재무안정성 관련 위험 당사의 부채비율은 별도기준으로 2022년말 20.55%, 2023년말 66.69%, 2024년말 97.94%, 2025년 1분기 100.93%로 나타났습니다. 2022년의 경우 3,583백만원의 매출액과 11,406백만원의 당기순손실을 기록하였으나 2021년 07월 기업공개를 통해 조달한 48,110백만원의 자본 확충 영향으로 자본총계 46,171백만원을 기록한 반면, 부채의 경우 은행차입금 8,000백만원 등으로 부채총계 9,487백만원을 기록하며 낮은 수준의 부채비율 20.55%을 기록하였습니다. 다만, 2023년 06월 20,000백만원 규모의 제1회 전환사채를 발행하며 부채비율이 크게 증가하여 66.69%를 기록하였습니다. 2024년의 경우 14,886백만원의 당기순손실이 발생함에 따라 자본총계가 전년 대비 28% 감소함에 따라 부채비율은 97.94%까지 증가하였습니다. 2025년 1분기 기준 4,126백만원의 당기순손실이 발생하며 자본총계가 감소하였으며, 이에 부채비율은 110.10%까지 증가하였습니다. 한편, 당사의 차입금의 규모를 살펴보면 2022년은 은행차입금 8,000백만원으로 차입금의존도는 14.64%로 매우 낮은 편이었으나, 2023년의 경우 주요 파이프라인의 연구개발 관련 비용 등을 충당하기 위해 06월 28월 20,000백만원 규모의 제1회 전환사채를 발행하며 차입금의존도가 37.00%까지 증가하였습니다. 2024년의 경우, 떼아 오픈이노베이션과 2021년 10월 체결한 당뇨병성 황반부종 및 습성 환반병성 치료제 CU06에 대한 기술이전 계약에 대한 해지 및 권리반환 통보로 인해 계약자산 감소 등 자산총계가 감소하며 차입금의존도는 47.88%까지 증가하였습니다. 2025년 1분기는 사채권자의 전환청구 700백만원이 발생하며 1CB 잔액은 19,300백만원으로 소폭 감소하였지만 자산총계 감소 폭이 더 큼에 따라 차입금의존도는 48.89%를 기록하였습니다. 이후 2025년 04월 22일 300백만원이 추가 전환되었으며,2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준, 1CB 잔액은 4,200백만원입니다. 당사의 경우 단기차입금 비중이 낮아 단기적으로 수익성이 급격히 악화되거나, 지정학적 리스크 및 트럼프 정부의 극단적인 정책 변경 등의 글로벌 금융시장의 급격한 변화가 발생하여 금융기관으로부터 차입금의 상환 요구가 발생하거나 계획대로 만기연장이 이루어지지 않을 경우 당사의 유동성 위기가 발생할 가능성은 낮은 편이지만, 당사의 예상과는 달리 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등과 더불어 예상치 못한 사유로 수익성 개선 시기가 지연되거나, 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 지속적으로 이자보상배율이 1배를 하회할 수 있습니다. 향후 지속적으로 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. 한편, 기발행 1CB의 경우 사채권자의 전환청구 1,000백만원과 당사가 14,800백만원을 사채권자에게 상환하며 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원까지 감소하였으며, 이에 이자비용 및 부채비율 감소 등의 재무구조가 개선되었습니다. 다만, 14,800백만원 상환 등과 같은 대규모 현금유출은 당사의 현금유동성을 고려하였을 때 유동성 악화로 이어질 수 있으며, 당사가 계획했던 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등 수익성 개선 시기가 지연되거나, 금번 진행하는 유상증자의 중점심사 대상에 지정되었기 때문에 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사 2025년 1분기 보고서 재무제표를 살펴보면 총자산 55,835백만원 및 유동자산 29,097백만원, 총 차입금 27,300백만원, 차입금 의존도 48.89%, 부채비율 110.10%, 유동비율 100.93%를 나타내고 있습니다.
또한 당사가 속한 업종인 한국은행 2023년 기업경영분석 상 C21(의료용 물질 및 의약품) 기준 업종평균 수치를 살펴보면, 부채비율 52.81%, 유동비율 196.90%, 차입금의존도 16.77%입니다. 업종평균 수치를 당사 2025년 1분기 기준 재무 수치와 비교시 유동비율를 제외한 부채비율 및 차입금의존도가 상회하고 있습니다. 다음은 최근 3개년 및 2025년 1분기 요약 재무 현황입니다.
| [요약 재무 현황] | |
| (단위: 백만원, %) | |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 업종평균 |
|---|---|---|---|---|---|
| 자산총계 | 55,835 | 59,288 | 69,782 | 55,657 | - |
| 유동자산 | 29,097 | 32,417 | 44,473 | 33,407 | - |
| 비유동자산 | 26,739 | 26,871 | 25,309 | 22,251 | - |
| 부채총계 | 29,260 | 29,335 | 27,919 | 9,487 | - |
| 유동부채 | 28,828 | 20,986 | 10,197 | 1,371 | - |
| 비유동부채 | 432 | 8,349 | 17,722 | 8,116 | - |
| 자본총계 | 26,575 | 29,953 | 41,863 | 46,171 | - |
| 자본금 | 6,984 | 6,937 | 6,928 | 6,923 | - |
| 부채비율 | 110.10% | 97.94% | 66.69% | 20.55% | 52.81% |
| 유동비율 | 100.93% | 154.47% | 436.16% | 2,437.23% | 196.90% |
| 총 차입금 | 27,300 | 28,000 | 28,000 | 8,000 | - |
| 단기차입금 | 19,300 | 20,000 | 8,000 | 0 | - |
| 장기차입금 | 8,000 | 8,000 | 20,000 | 8,000 | - |
| 현금성자산 | 27,246 | 30,346 | 40,841 | 28,511 | - |
| 차입금의존도 | 48.89% | 47.23% | 40.12% | 14.37% | 16.77% |
| 출처) 당사 정기보고서 및 한국은행 기업경영분석(2023) |
| 주1) 업종평균은 한국은행 2023년 기업경영분석 C21(의료용 물질 및 의약품) 기준으로 작성하였습니다. |
| 주2) 현금성자산은 현금및현금성자산과 단기금융상품을 합한 금액입니다. |
당사의 부채비율은 별도기준으로 2022년말 20.55%, 2023년말 66.69%, 2024년말 97.94%, 2025년 1분기 100.93%로 나타났습니다. 2022년의 경우 3,583백만원의 매출액과 11,406백만원의 당기순손실을 기록하였으나 2021년 07월 기업공개를 통해 조달한 48,110백만원의 자본 확충 영향으로 자본총계 46,171백만원을 기록한 반면, 부채의 경우 은행차입금 8,000백만원 등으로 부채총계 9,487백만원을 기록하며 낮은 수준의 부채비율 20.55%을 기록하였습니다.
다만, 2023년 06월 20,000백만원 규모의 제1회 전환사채를 발행하며 부채비율이 크게 증가하여 66.69%를 기록하였습니다. 2024년의 경우 14,886백만원의 당기순손실이 발생함에 따라 자본총계가 전년 대비 28% 감소함에 따라 부채비율은 97.94%까지 증가하였습니다.
2025년 1분기 기준 4,126백만원의 당기순손실이 발생하며 자본총계가 감소하였으며, 이에 부채비율은 110.10%까지 증가하였습니다.
한편, 당사의 차입금의 규모를 살펴보면 2022년은 은행차입금 8,000백만원으로 차입금의존도는 14.64%로 매우 낮은 편이었으나, 2023년의 경우 주요 파이프라인의 연구개발 관련 비용 등을 충당하기 위해 06월 28월 20,000백만원 규모의 제1회 전환사채를 발행하며 차입금의존도가 37.00%까지 증가하였습니다. 2024년의 경우, 떼아 오픈이노베이션과 2021년 10월 체결한 당뇨병성 황반부종 및 습성 환반병성 치료제 CU06에 대한 기술이전 계약에 대한 해지 및 권리반환 통보로 인해 계약자산 감소 등 자산총계가 감소하며 차입금의존도는 47.88%까지 증가하였습니다.
2025년 1분기는 사채권자의 전환청구 700백만원이 발생하며 1CB 잔액은 19,300백만원으로 소폭 감소하였지만 자산총계 감소 폭이 더 큼에 따라 차입금의존도는 48.89%를 기록하였습니다. 이후 2025년 04월 22일 300백만원이 추가 전환되었으며,2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준, 1CB 잔액은 4,200백만원입니다. 당사가 현재까지 발행한 전환사채의 상세 내역은 다음과 같습니다.
| [전환사채 발행 개요] |
| 구분 | 제1회 무기명식 이권부 무보증 사모 전환사채 |
|---|---|
| 액면가액 | 20,000백만원 |
| 현재 잔액 | 4,200백만원 |
| 이자지급조건 | 표면금리 0% |
| 만기보장수익률 | 3% |
| 발행일 | 2023.06.28 |
| 만기일 | 2028.06.28 |
| 전환비율 | 100% |
| 전환시 발행할 주식 | 기명식 보통주식 |
| 전환가액 | 주당 7,397원 |
| 전환가능주식수 | 567,797주 |
| 전환청구기간 | 2024.06.28~2028.05.28 |
| 투자자의 조기상환청구권 (Put Option) |
2025년 06월 28일 및 이후 매 3개월에 해당되는 날에 사채의 전자등록금액의전부 또는 일부에 대하여 만기 전 조기상환 청구 가능 |
| 발행자의 매도청구권 (Call Option) |
2024년 06월 28일부터 전환사채의 일부(최대 20%)에 대하여 발행회사 또는 발행회사가 지정하는 제3자에게 매도하도록 청구 가능. |
| 출처) 당사 제시 및 정기보고서 |
| 주) 증권신고서 제출 전일 기준입니다. |
당사의 2025년 1분기 기준 총 차입금 내역은 다음과 같습니다.
| [총 차입금 상세 내역] | |
| (K-IFRS, 별도) | (단위 : 백만원) |
| 구 분 | 차입처 | 차입 목적 | 차입일 | 만기일 | 이자율 (표면이자율/만기이자율) |
2025년 1분기 |
|---|---|---|---|---|---|---|
| 은행차입금 | 하나은행 | 시설자금대출 | 2021.12.29 | 2026.01.29 | CD(3M) + 1.64% | 8,000 |
| 1CB | 하나증권(주) 외 | 오픈 이노베이션, 혁신신약 임상연구 등 연구개발비 투자 | 2023.08.04 | 2028.08.04 | 0%/3% | 19,300 |
| 합계 | 27,300 | |||||
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 전환사채의 경우 투자자의 이해를 돕기 위해 전자등록총액으로 작성하였습니다. |
| 주2) 1CB 잔액의 경우, 2025년 04월 22일 300백만원이 추가 전환되었으며, 2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원입니다. |
한편, 이자보상배율의 경우 영업활동을 통해 벌어들인 이익으로 차입금에 대한 이자비용을 감내할 수 있는지를 확인할 수 있는 지표로서 활용됩니다. 당사의 이자보상배율 관련 현황은 다음과 같습니다.
| [이자보상배율 현황] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 비고 |
|---|---|---|---|---|---|
| 영업수익 | 0 | 1,633 | 10,294 | 3,583 | - |
| 영업비용 | 3,649 | 14,267 | 20,803 | 15,565 | - |
| 영업비용율 | - | 8.74% | 2.02% | 4.34% | 영업비용 ÷ 영업수익 |
| 영업이익(손실) | (3,649) | (12,635) | (10,508) | (11,982) | - |
| 영업이익률 | - | -7.73% | -1.02% | -3.34% | 영업이익(손실) ÷ 영업수익 |
| 자산총계 | 55,835 | 59,288 | 69,782 | 55,657 | - |
| 이자비용 | 653 | 2,455 | 1,347 | 300 | - |
| 이자보상배율(배) | (5.58) | (5.15) | (7.80) | (39.95) | 영업이익(손실) ÷ 이자비용 |
| 이자비용 부담률 | - | 150.36% | 13.09% | 8.37% | 이자비용 ÷ 영업수익 |
| 차입금 총계 | 27,300 | 28,000 | 28,000 | 8,000 | - |
| 차입금 평균이자율 | 2.39% | 8.77% | 4.81% | 3.75% | 이자비용 ÷ 차입금 총계 |
| 차입금 의존도 | 48.89% | 47.23% | 40.12% | 14.37% | 차입금 총계 ÷ 자산총계 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 차입금 총계는 기발행 전환사채의 미상환잔액(권면금액기준) 및 은행 차입금의 합입니다. |
| 주2) 1CB 잔액의 경우, 2025년 04월 22일 300백만원이 추가 전환되었으며, 2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원입니다. |
당사의 영업수익은 프랑스 안과 전문회사 떼아 오픈이노베이션으로부터의 마일스톤 유입에 따른 것으로, 2021년 10월 CU06 기술이전에 성공하며 계약금(Upfront) 6,300백만원을 수취하여 매출로 인식되었으며, 진행률에 따라 수익을 추가로 인식하며 2022년 영업수익은 3,583백만원을 기록하였습니다.
2023년에는 기술이전 계약에 따라, CU06의 임상2상 시험, 비임상시험 및 CMC(Chemistry, Manufacturing and Controls)에 필요한 외주 용역 비용의 보상을 받을 뿐만 아니라, 이 과정을 수행하는 데 소요되는 동사의 전문 인력의 인건비 및 간접 비용 등 서비스 비용도 떼아 오픈이노베이션으로부터 지급받았으며, 이를 모두 수익으로 인식하며 10,294백만원의 영업수익을 기록하였습니다.
다만, 2024년 05월 떼아 오픈이노베이션으로부터 경구용 망막 질환 치료제인 CU06의 기술이전 계약해지 및 권리반환 통보를 받았으며 마일스톤 유입이 제한됨에 따라 매출이 급감하며 1,633백만원을 기록하였습니다.
당사는 신약 연구 및 개발하는 바이오벤처기업으로 신약개발로 인한 임상 비용 및 연구인력 인건비 등의 비중이 큰 편으로, 영업손실은 2022년 11,932백만원, 2023년 10,508백만원, 2024년 12,635백만원, 2025년 1분기 3,649백만원이 발생하였으며, 이자비용의 경우 2022년 300백만원, 2023년 1,347백만원, 2024년 2,455백만원, 2025년 1분기 663백만원이 발생하였습니다. 당사의 이자보상배율은 지속적으로 1배 미만을 기록하고 있으며, 영업을 통해 손실이 지속적으로 발생하고 있어 이자비용을 충당하지 못하는 상황입니다. 특히 2023년 20,000백만원 규모의 1CB 발행으로 이자비용 부담이 커졌습니다. 이는 당사의 채무상환능력이 취약하다는 것을 나타내며, 미미한 매출 수준으로 인해 영업 적자가 심화되고 있음에 기인합니다.
당사의 경우 단기차입금 비중이 낮아 단기적으로 수익성이 급격히 악화되거나, 지정학적 리스크 및 트럼프 정부의 극단적인 정책 변경 등의 글로벌 금융시장의 급격한 변화가 발생하여 금융기관으로부터 차입금의 상환 요구가 발생하거나 계획대로 만기연장이 이루어지지 않을 경우 당사의 유동성 위기가 발생할 가능성은 낮은 편이지만,당사의 예상과는 달리 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등과 더불어 예상치 못한 사유로 수익성 개선 시기가 지연되거나, 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 지속적으로 이자보상배율이 1배를 하회할 수 있습니다. 향후 지속적으로 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다.
한편, 기발행 1CB의 경우 사채권자의 전환청구 1,000백만원과 당사가 14,800백만원을 사채권자에게 상환하며 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원까지 감소하였으며, 이에 이자비용 및 부채비율 감소 등의 재무구조가 개선되었습니다. 다만, 14,800백만원 상환 등과 같은 대규모 현금유출은 당사의 현금유동성을 고려하였을 때 유동성 악화로 이어질 수 있으며, 당사가 계획했던 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등 수익성 개선 시기가 지연되거나, 금번 진행하는 유상증자의 중점심사 대상에 지정되었기 때문에 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주12) 정정 전
| 마. 현금흐름 관련 유동성 위험 당사는 2022년 별도기준 11,237백만원의 음(-)의 영업활동현금흐름, 8,436백만원의 양(+)의 투자활동현금흐름, 662백만원의 양(+)의 재무활동현금흐름이 발생하였습니다. 2023년은 별도기준 9,393백만원의 음(-)의 영업활동현금흐름, 6,036백만원의 음(-)의 투자활동현금흐름,19,804백만원의 양(+)의 재무활동현금흐름이 발생하였습니다. 2024년은 별도기준 9,508백만원의 음(-)의 영업활동현금흐름, 29백만원의 음(-)의 투자활동현금흐름, 59백만원의 양(+)의 재무활동현금흐름이 발생하였습니다. 2025년 1분기 4,126백만원의 당기순손실이 발생하였으며, 이자수취 701백만원 등의 영향으로 3,058백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,365백만원의 영향으로 1,342백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 리스부채 상환 15백만원이 발생하며 15백만원의 음(-)의 현금흐름이 발생하였습니다. 한편, 당사의 유동비율은 2021년 07월 기업상장을 통한 자금을 조달하며 현금성자산 28,511백만원(현금및현금성자산 8,511백만원 + 단기금융상품 20,000백만원)을 보유하고, 기타 금융부채 1,259백만원 외 보유 차입금이 존재하지 않아 2022년 유동비율은 2,437.23%를 기록하였으며, 2023년에는 장기차입금 8,000백만원, 기타 금융부채 2,060백만원의 영향으로 유동부채가 증가하며 유동비율은 436.16%를 기록하였습니다. 2024년에는 기발행 제1회 전환사채의 만기일이 1년 이내로 다가오며 유동부채로 재분류 됨에 따라 유동부채가 전년대비 106% 증가하였으며, 이에 유동비율은 154.47%를 기록하였습니다. 2025년 1분기에는 비유동 장기차입금으로 분류되어있던 장기차입금이 유동 장기차입금으로 재분류됨에 따라 유동부채가 전년대비 37% 증가하였으며, 이에 유동비율은 100.93%를 기록하였습니다. 이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속 능력에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 최근 3년 및 2025년 1분기 지속적인 당기순손실 발생 등의 영향으로 음(-)의 영업활동현금흐름을 보이고 있으며, 당사가 보유하고 있는 현금을 단기금융상품 취득 및 처분 등으로 운용하면서 지속적으로 변동하고 있는 상황으로 음(-)과 양(+)의 투자활동현금흐름을 보이고 있습니다. 재무활동현금흐름의 경우, 2023년 06월 전환사채 발행 등으로 양(+)의 재무활동현금흐름을 기록했습니다. 당사의 최근 3개년 및 2025년 1분기 요약 현금흐름 추이는 다음과 같습니다.
| [주요 현금흐름 추이] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구 분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 1. 영업활동현금흐름 | (3,058) | (9,508) | (9,393) | (11,237) |
| 영업활동으로부터 창출된 현금흐름 | (3,554) | (10,106) | (9,583) | (11,407) |
| 이자수취(영업) | 701 | 1,044 | 665 | 447 |
| 법인세납부(환급) | (97) | (43) | (41) | 13 |
| 이자지급(영업) | (108) | (404) | (434) | (290) |
| 2. 투자활동현금흐름 | 1,342 | (29) | (6,036) | 8,436 |
| 투자활동으로 인한 현금유입액 | 26,365 | 50,547 | 59,164 | 57,351 |
| 단기금융상품의 감소 | 26,365 | 50,540 | 49,000 | 25,000 |
| 장기금융상품의 감소 | 0 | 0 | 0 | 31 |
| 기타투자자산의 감소 | 0 | 0 | 10,139 | 32,029 |
| 보증금의 감소 | 0 | 6 | 14 | 259 |
| 유형자산의 처분 | 0 | 0 | 12 | 32 |
| 투자활동으로 인한 현금유출액 | (25,022) | (50,576) | (65,200) | (48,915) |
| 장단기금융상품의 증가 | (25,000) | (48,905) | (57,000) | (20,000) |
| 기타투자자산의 증가 | 0 | 0 | (7,000) | (25,300) |
| 장기선급금의 감소(증가) | (21) | 35 | 71 | (48) |
| 유형자산의 취득 | (1) | (248) | (120) | (3,411) |
| 무형자산의 취득 | 0 | (70) | (9) | (135) |
| 보증금의 증가 | 0 | 0 | 0 | (21) |
| 3. 재무활동현금흐름 | (15) | 59 | 19,804 | 662 |
| 재무활동으로 인한 현금유입액 | 0 | 115 | 19,853 | 736 |
| 전환사채의 증가 | 0 | 0 | 19,797 | 0 |
| 주식선택권의 행사 | 0 | 115 | 56 | 736 |
| 재무활동으로 인한 현금유출액 | (15) | (55) | (49) | (74) |
| 리스부채의 상환 | (15) | (55) | (49) | (74) |
| 현금및현금성자산에 대한 환율변동효과 | (5) | 619 | (45) | 209 |
| 현금및현금성자산의순증가(감소) | (1,731) | (9,478) | 4,375 | (1,931) |
| 기초현금및현금성자산 | 3,982 | 12,841 | 8,511 | 10,442 |
| 기말현금및현금성자산 | 2,246 | 3,982 | 12,841 | 8,511 |
| 출처) 당사 정기보고서 |
당사는 2022년 별도기준 11,407백만원의 당기순이익이 발생하며 11,237백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 경우 금융상품 성격의 단기금융상품(정기예금 등), 기타투자자산(MMF 투자상품 등) 등을 처분하며 8,436백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 주식선택권 행사 736백만원 등이 발생하며 662백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라 2022년말 기준 8,511백만원의 현금및현금성자산을 보유하게 되었습니다.
2023년은 별도기준 11,586백만원의 당기순손실이 발생하였으며 9,393백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 경우 금융상품 성격의 단기금융상품 및 기타투자산의 순취득 4,861백만원이 발생하며 6,036백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 제1회 전환사채 20,000백만원 발행 등으로 19,804백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라 2023년말 기준 12,840백만원의 현금및현금성자산을 보유하게 되었습니다.
2024년은 별도기준 14,886백만원의 당기순손실이 발생하였으며, 이자수취 1,044백만원 등의 영향으로 9,508백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,635백만원에도 유형자산 취득 248백만원 및 무형자산 취득 70백만원 등이 발생하며 29백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 주식선택권 행사 115백만원 및 리스부채 상환 55백만원 등의 영향으로 59백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라, 2024년말 기준 3,982백만원의 현금및현금성자산을 보유하게 되었습니다.
2025년 1분기 4,126백만원의 당기순손실이 발생하였으며, 이자수취 701백만원 등의 영향으로 3,058백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,365백만원의 영향으로 1,342백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 리스부채 상환 15백만원이 발생하며 15백만원의 음(-)의 현금흐름이 발생하였습니다. 이에 따라, 2025년 1분기 기준 2,246백만원의 현금및현금성자산을 보유하게 되었습니다.
한편, 당사의 유동비율은 최근 3개년 감소하는 추세입니다. 2022년에는 2021년 07월 기업상장을 통한 자금을 조달하며 현금성자산 28,511백만원(현금및현금성자산 8,511백만원 + 단기금융상품 20,000백만원)을 보유하고, 기타 금융부채 1,259백만원 외 보유 차입금이 존재하지 않아 유동비율은 2,437.23%를 기록하였습니다. 2023년에는 장기차입금 8,000백만원, 기타 금융부채 2,060백만원의 영향으로 유동부채가 증가하며 유동비율은 436.16%를 기록하였습니다. 2024년에는 기발행 제1회 전환사채의 만기일이 1년 이내로 다가오며 유동부채로 재분류 됨에 따라 유동부채가 전년대비 106% 증가하였으며, 이에 유동비율은 154.47%를 기록하였습니다.
2025년 1분기에는 비유동 장기차입금으로 분류되어있던 장기차입금이 유동 장기차입금으로 재분류됨에 따라 유동부채가 전년대비 37% 증가하였으며, 이에 유동비율은 100.93%를 기록하였습니다.
| [당사의 최근 3개년 및 2025년 1분기 유동성 관련 비율] |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 비고 |
|---|---|---|---|---|---|
| 유동비율 | 100.93% | 154.47% | 436.16% | 2,437.23% | 유동자산÷유동부채 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 2025년 03월 05일자로 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍을 흡수합병하기로 결정하였으며, 합병기일 2026년 01월 28일로 주요사항보고서(회사합병결정)를 공시하였습니다. 당사는 대성팜텍을 흡수합병함에 따라, 매출 안정화를 도모하고 있으며 연구개발 인프라 통합을 통한 비용 절감 효과도 기대할 수 있을 것으로 판단됩니다. 또한, 2024년 실적 악화의 주요 원인이 떼아 오픈이노베이션과의 기술이전 계약 중단에 따른 마일스톤 수익 감소와 연구개발비 지출에 있지만, 단기적으로 대성팜텍 합병을 통한 매출 안정성을 확보하고 중장기적으로 보유 파이프라인들의 기술이전 계약 성사 여부가 당사의 성장 동력으로 작용할 것으로 판단됩니다. 현 시점에서 당사가 계획 중인 주요 연구개발비 등을 충당하기에는 그 규모가 부족할 것으로 생각되며, 영업수지상 음(-)의 현금흐름이 발생할 것으로 예상하고 있습니다. 이에 본 유상증자 등의 재무활동을 통해 당사 운영자금 등을 조달하고자 합니다. 단, 재무활동을 통해서도 목표 자금을 조달하지 못한다면 당사에 유동성 위기가 생길 수 있고, 영업활동을 영위해나가는데 상당한 제약이 생길 수 있습니다.
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속 능력에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
(주12) 정정 후
| 마. 현금흐름 관련 유동성 위험 당사는 2022년 별도기준 11,237백만원의 음(-)의 영업활동현금흐름, 8,436백만원의 양(+)의 투자활동현금흐름, 662백만원의 양(+)의 재무활동현금흐름이 발생하였습니다. 2023년은 별도기준 9,393백만원의 음(-)의 영업활동현금흐름, 6,036백만원의 음(-)의 투자활동현금흐름,19,804백만원의 양(+)의 재무활동현금흐름이 발생하였습니다. 2024년은 별도기준 9,508백만원의 음(-)의 영업활동현금흐름, 29백만원의 음(-)의 투자활동현금흐름, 59백만원의 양(+)의 재무활동현금흐름이 발생하였습니다. 2025년 1분기 4,126백만원의 당기순손실이 발생하였으며, 이자수취 701백만원 등의 영향으로 3,058백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,365백만원의 영향으로 1,342백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 리스부채 상환 15백만원이 발생하며 15백만원의 음(-)의 현금흐름이 발생하였습니다. 한편, 당사의 유동비율은 2021년 07월 기업상장을 통한 자금을 조달하며 현금성자산 28,511백만원(현금및현금성자산 8,511백만원 + 단기금융상품 20,000백만원)을 보유하고, 기타 금융부채 1,259백만원 외 보유 차입금이 존재하지 않아 2022년 유동비율은 2,437.23%를 기록하였으며, 2023년에는 장기차입금 8,000백만원, 기타 금융부채 2,060백만원의 영향으로 유동부채가 증가하며 유동비율은 436.16%를 기록하였습니다. 2024년에는 기발행 제1회 전환사채의 만기일이 1년 이내로 다가오며 유동부채로 재분류 됨에 따라 유동부채가 전년대비 106% 증가하였으며, 이에 유동비율은 154.47%를 기록하였습니다. 2025년 1분기에는 비유동 장기차입금으로 분류되어있던 장기차입금이 유동 장기차입금으로 재분류됨에 따라 유동부채가 전년대비 37% 증가하였으며, 이에 유동비율은 100.93%를 기록하였습니다. 금번 유상증자 대금 납입 이후 1년(2025년 3분기 ~ 2026년 2분기)간의 예상현금흐름은 실질적으로, 해당 기간 동안 Cash-In이 될 항목은 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금 27,995백만원(예정발행가액 기준, 발행제비용 제외)과 보유하고 있는 현금성 자산에 의한 이자수익과 영업활동으로 인한 매출 등 밖에 없습니다. 이와 반대로 당사의 매출이 본격적으로 성장궤도에 올라 수익성이 확보되기 전까지는 사업특성상 연구개발자금 및 인건비, 지급수수료 등 운영경비 자금이 지속적으로 유출될 것으로 예상하고 있습니다. 당사 계획과 달리 IPO 이후 증권신고서 제출 전일 기준 CU06 외에 기술이전 계약은 없었으며, CU06 또한 2024년 05월 16일부로 기술이전 계약해지 및 권리반환으로 인해 향후 마일스톤 유입에 따른 매출 성장세가 정체되는 모습이 예상됩니다. 이러한 추세가 지속될 경우 재무적 부담이 가중될 가능성이 있습니다. 다만, 당사는 합병기일 2026년 01월 28일로 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍을 흡수합병하기로 결정하였으며, 대성팜텍은 2025년 1분기 기준 매출액은 1,108백만원, 영업이익 34백만원을 기록하였으며, 단순 연환산 시 매출액 4,432백만원, 영업이익 136백만원이 예상됩니다. 이를 통해 당사의 재무건전성을 강화하고 안정적인 수익 기반을 마련할 수 있을 것으로 보입니다. 특히, 금번 유상증자를 통한 자금이 납입된 이후 매출 성장세가 회복되지 않을 시 유동성 리스크를 완화하기 위해 비용 효율성을 극대화하고, 판관비 및 연구개발비 등 운영비를 축소하는 한편, 인건비 조정 및 추가 자금 조달 방안을 검토할 예정이며, 향후 추가적인 자본시장을 활용한 자금조달을 시행해야할 가능성이 있고, 이 경우 기존 주주들의 지분 희석 리스크가 발생할 수 있습니다. 당사는 유동성 리스크를 면밀히 모니터링하며, 재무 건전성을 유지하고 유동성 위기를 사전에 방지하기 위해 최선의 노력을 기울일 계획입니다.이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속 능력에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 최근 3년 및 2025년 1분기 지속적인 당기순손실 발생 등의 영향으로 음(-)의 영업활동현금흐름을 보이고 있으며, 당사가 보유하고 있는 현금을 단기금융상품 취득 및 처분 등으로 운용하면서 지속적으로 변동하고 있는 상황으로 음(-)과 양(+)의 투자활동현금흐름을 보이고 있습니다. 재무활동현금흐름의 경우, 2023년 06월 전환사채 발행 등으로 양(+)의 재무활동현금흐름을 기록했습니다. 당사의 최근 3개년 및 2025년 1분기 요약 현금흐름 추이는 다음과 같습니다.
| [주요 현금흐름 추이] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구 분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 1. 영업활동현금흐름 | (3,058) | (9,508) | (9,393) | (11,237) |
| 영업활동으로부터 창출된 현금흐름 | (3,554) | (10,106) | (9,583) | (11,407) |
| 이자수취(영업) | 701 | 1,044 | 665 | 447 |
| 법인세납부(환급) | (97) | (43) | (41) | 13 |
| 이자지급(영업) | (108) | (404) | (434) | (290) |
| 2. 투자활동현금흐름 | 1,342 | (29) | (6,036) | 8,436 |
| 투자활동으로 인한 현금유입액 | 26,365 | 50,547 | 59,164 | 57,351 |
| 단기금융상품의 감소 | 26,365 | 50,540 | 49,000 | 25,000 |
| 장기금융상품의 감소 | 0 | 0 | 0 | 31 |
| 기타투자자산의 감소 | 0 | 0 | 10,139 | 32,029 |
| 보증금의 감소 | 0 | 6 | 14 | 259 |
| 유형자산의 처분 | 0 | 0 | 12 | 32 |
| 투자활동으로 인한 현금유출액 | (25,022) | (50,576) | (65,200) | (48,915) |
| 장단기금융상품의 증가 | (25,000) | (48,905) | (57,000) | (20,000) |
| 기타투자자산의 증가 | 0 | 0 | (7,000) | (25,300) |
| 장기선급금의 감소(증가) | (21) | 35 | 71 | (48) |
| 유형자산의 취득 | (1) | (248) | (120) | (3,411) |
| 무형자산의 취득 | 0 | (70) | (9) | (135) |
| 보증금의 증가 | 0 | 0 | 0 | (21) |
| 3. 재무활동현금흐름 | (15) | 59 | 19,804 | 662 |
| 재무활동으로 인한 현금유입액 | 0 | 115 | 19,853 | 736 |
| 전환사채의 증가 | 0 | 0 | 19,797 | 0 |
| 주식선택권의 행사 | 0 | 115 | 56 | 736 |
| 재무활동으로 인한 현금유출액 | (15) | (55) | (49) | (74) |
| 리스부채의 상환 | (15) | (55) | (49) | (74) |
| 현금및현금성자산에 대한 환율변동효과 | (5) | 619 | (45) | 209 |
| 현금및현금성자산의순증가(감소) | (1,731) | (9,478) | 4,375 | (1,931) |
| 기초현금및현금성자산 | 3,982 | 12,841 | 8,511 | 10,442 |
| 기말현금및현금성자산 | 2,246 | 3,982 | 12,841 | 8,511 |
| 출처) 당사 정기보고서 |
당사는 2022년 별도기준 11,407백만원의 당기순손실이 발생하며 11,237백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 경우 금융상품 성격의 단기금융상품(정기예금 등), 기타투자자산(MMF 투자상품 등) 등을 처분하며 8,436백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 주식선택권 행사 736백만원 등이 발생하며 662백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라 2022년말 기준 8,511백만원의 현금및현금성자산을 보유하게 되었습니다.
2023년은 별도기준 11,586백만원의 당기순손실이 발생하였으며 9,393백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 경우 금융상품 성격의 단기금융상품 및 기타투자산의 순취득 4,861백만원이 발생하며 6,036백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 제1회 전환사채 20,000백만원 발행 등으로 19,804백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라 2023년말 기준 12,840백만원의 현금및현금성자산을 보유하게 되었습니다.
2024년은 별도기준 14,886백만원의 당기순손실이 발생하였으며, 이자수취 1,044백만원 등의 영향으로 9,508백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,635백만원에도 유형자산 취득 248백만원 및 무형자산 취득 70백만원 등이 발생하며 29백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 주식선택권 행사 115백만원 및 리스부채 상환 55백만원 등의 영향으로 59백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라, 2024년말 기준 3,982백만원의 현금및현금성자산을 보유하게 되었습니다.
2025년 1분기 4,126백만원의 당기순손실이 발생하였으며, 이자수취 701백만원 등의 영향으로 3,058백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,365백만원의 영향으로 1,342백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 리스부채 상환 15백만원이 발생하며 15백만원의 음(-)의 현금흐름이 발생하였습니다. 이에 따라, 2025년 1분기 기준 2,246백만원의 현금및현금성자산을 보유하게 되었습니다.
한편, 당사의 유동비율은 최근 3개년 감소하는 추세입니다. 2022년에는 2021년 07월 기업상장을 통한 자금을 조달하며 현금성자산 28,511백만원(현금및현금성자산 8,511백만원 + 단기금융상품 20,000백만원)을 보유하고, 기타 금융부채 1,259백만원 외 보유 차입금이 존재하지 않아 유동비율은 2,437.23%를 기록하였습니다. 2023년에는 장기차입금 8,000백만원, 기타 금융부채 2,060백만원의 영향으로 유동부채가 증가하며 유동비율은 436.16%를 기록하였습니다. 2024년에는 기발행 제1회 전환사채의 만기일이 1년 이내로 다가오며 유동부채로 재분류 됨에 따라 유동부채가 전년대비 106% 증가하였으며, 이에 유동비율은 154.47%를 기록하였습니다.
2025년 1분기에는 비유동 장기차입금으로 분류되어있던 장기차입금이 유동 장기차입금으로 재분류됨에 따라 유동부채가 전년대비 37% 증가하였으며, 이에 유동비율은 100.93%를 기록하였습니다.
| [당사의 최근 3개년 및 2025년 1분기 유동성 관련 비율] |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 비고 |
|---|---|---|---|---|---|
| 유동비율 | 100.93% | 154.47% | 436.16% | 2,437.23% | 유동자산÷유동부채 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 2025년 03월 05일자로 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍을 흡수합병하기로 결정하였으며, 합병기일 2026년 01월 28일로 주요사항보고서(회사합병결정)를 공시하였습니다. 당사는 대성팜텍을 흡수합병함에 따라, 매출 안정화를 도모하고 있으며 연구개발 인프라 통합을 통한 비용 절감 효과도 기대할 수 있을 것으로 판단됩니다. 또한, 2024년 실적 악화의 주요 원인이 떼아 오픈이노베이션과의 기술이전 계약 중단에 따른 마일스톤 수익 감소와 연구개발비 지출에 있지만, 단기적으로 대성팜텍 합병을 통한 매출 안정성을 확보하고 중장기적으로 보유 파이프라인들의 기술이전 계약 성사 여부가 당사의 성장 동력으로 작용할 것으로 판단됩니다.
현 시점에서 당사가 계획 중인 주요 연구개발비 등을 충당하기에는 그 규모가 부족할 것으로 생각되며, 영업 수지상 음(-)의 현금흐름이 발생할 것으로 예상하고 있습니다. 이에 본 유상증자 등의 재무활동을 통해 당사 운영자금 등을 조달하고자 합니다. 단, 재무활동을 통해서도 목표 자금을 조달하지 못한다면 당사에 유동성 위기가 생길 수 있고, 영업활동을 영위해나가는데 상당한 제약이 생길 수 있습니다.
| [하단의 자금수지계획에 따른 유의사항] |
| 하단의 내용은 증권신고서 제출일 현재 기준 당사 자금수지계획을 참고 목적으로 기재한 것으로써, 이는 미래에 대한 당사의 주관적 판단이 개입되었을 수 있고, 향후 실제 이행 결과와는 상이할 수 있습니다. 투자자 여러분들께서는 하단의 계획은 당사의 전망과 예상, 주관적 판단 등에 따른 것임을 반드시 유의하여 주시기 바랍니다. |
금번 유상증자 대금 납입 이후 1년(2025년 3분기 ~ 2026년 2분기)간의 예상현금흐름표는 다음과 같습니다. 실질적으로, 해당 기간 동안 Cash-In이 될 항목은 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금 27,995백만원(예정발행가액 기준, 발행제비용 제외)과 보유하고 있는 현금성 자산에 의한 이자수익과 영업활동으로 인한 매출 등 밖에 없습니다. 이와 반대로 당사의 매출이 본격적으로 성장궤도에 올라 수익성이 확보되기 전까지는 사업특성상 연구개발자금 및 인건비, 지급수수료 등 운영경비 자금이 지속적으로 유출될 것으로 예상하고 있습니다.
당사의 주요 파이프라인 중 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06에 대해 2021년 10월 27일 떼아 이노베이션과 기술이전 계약을 체결하며 계약금(Upfront) 6백만불(6,255백만원)을 수취하여 매출액으로 부분 인식하였습니다. 다만, 2024년 05월 16일자로 떼아 오픈이노베이션으로부터 기술이전 계약해지 및 권리반환 통보를 받았으며, 2024년 07월 12일 최종 기술이전 계약이 해지되었습니다. 계약이 종료되더라도 당사가 떼아 오픈이노베이션으로부터 이미 수령한 계약금과 연구개발 비용은 반환의무가 발생하지 않지만 향후 마일스톤 유입이 제한되었습니다.
당사 계획과 달리 IPO 이후 증권신고서 제출 전일 기준 CU06 외에 기술이전 계약은 없었으며, CU06 또한 2024년 05월 16일부로 기술이전 계약해지 및 권리반환으로 인해 향후 마일스톤 유입에 따른 매출 성장세가 정체되는 모습이 예상됩니다. 이러한 추세가 지속될 경우 재무적 부담이 가중될 가능성이 있습니다. 다만, 당사는 합병기일 2026년 01월 28일로 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍을 흡수합병하기로 결정하였으며, 대성팜텍은 2025년 1분기 기준 매출액은 1,108백만원, 영업이익 34백만원을 기록하였으며, 단순 연환산 시 매출액 4,432백만원, 영업이익 136백만원이 예상됩니다. 이를 통해 당사의 재무건전성을 강화하고 안정적인 수익 기반을 마련할 수 있을 것으로 보입니다.
특히, 금번 유상증자를 통한 자금이 납입된 이후 매출 성장세가 회복되지 않을 시 유동성 리스크를 완화하기 위해 비용 효율성을 극대화하고, 판관비 및 연구개발비 등 운영비를 축소하는 한편, 인건비 조정 및 추가 자금 조달 방안을 검토할 예정이며, 향후 추가적인 자본시장을 활용한 자금조달을 시행해야할 가능성이 있고, 이 경우 기존 주주들의 지분 희석 리스크가 발생할 수 있습니다. 당사는 유동성 리스크를 면밀히 모니터링하며, 재무 건전성을 유지하고 유동성 위기를 사전에 방지하기 위해 최선의 노력을 기울일 계획입니다.
| [당사의 유상증자 대금 납입 이후 1년간의 자금수지 예상] |
| (단위: 백만원) |
| 구분 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | ||
|---|---|---|---|---|---|---|
| 영업현금흐름 | 수입(A) | 매출대금 | 75 | 225 | 1,667 | 2,500 |
| 기타 | - | - | - | - | ||
| 소계 | 75 | 225 | 1,667 | 2,500 | ||
| 지출(B) | 원재료 구입/외주가공비 | 73 | 218 | 1,500 | 2,250 | |
| 급여 | 1,170 | 1,170 | 1,239 | 1,244 | ||
| 판매관리비 | 569 | 546 | 559 | 559 | ||
| 경상연구비 | 3,700 | 6,152 | 3,108 | 1,255 | ||
| 기타 | 200 | 600 | ||||
| 소계 | 5,712 | 8,686 | 6,406 | 5,308 | ||
| 영업수지(= A - B ) | (5,637) | (8,461) | (4,739) | (2,808) | ||
| 투자현금흐름 | 수입(C) | 자산매각 | - | - | - | - |
| 기타 | - | - | - | - | ||
| 소계 | - | - | - | - | ||
| 지출(D) | 연구개발투자 | - | - | - | - | |
| 해외법인 투자 | - | - | - | - | ||
| 기타 | - | - | - | - | ||
| 소계 | - | - | - | - | ||
| 투자수지(= C - D ) | - | - | - | - | ||
| 재무현금흐름 | 수입(E) | 유상증자 | 27,995 | - | - | - |
| 기타 | - | - | - | - | ||
| 소계 | 27,995 | - | - | - | ||
| 지출(F) | 차입금 상환 | - | - | - | - | |
| 이자비용 | 122 | 122 | 122 | 122 | ||
| CB, BW 상환 | - | - | - | - | ||
| 기타 | - | - | - | - | ||
| 소계 | 122 | 122 | 122 | 122 | ||
| 재무수지(= E - F ) | 27,873 | (122) | (122) | (122) | ||
| 기초 자금 | 11,895 | 34,131 | 25,548 | 20,687 | ||
| 기말 자금 | 34,131 | 25,548 | 20,687 | 17,757 | ||
| 출처) 당사 제시 |
| 주1) 상기 예상현금흐름표는 증권신고서 제출 전일 기준으로 예상된 현금흐름표이므로, 향후 변동될 가능성이 있으므로 참고하여 주시기 바랍니다.(유상증자 예상 대금 27,995백만원(예정발행가액 기준, 발행제비용 제외) 가정) |
| 주2) 보유 파이프라인의 L/O는 발생하지 않는 것으로 가정하였습니다. |
| 주3) 신규 사업(원료의약품 수입 및 도소매업) 관련 실적은 최대한 보수적으로 산정하였습니다. |
영업현금흐름 중 2025년 3분기부터 4분기까지 발생하는 매출대금 300백만원은 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 신규 사업 진출을 계획 중인 원료의약품 유통사업 관련 매출입니다. 이는 당사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
또한, 2026년 1분기부터는 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍 흡수합병을 통한 매출이 발생할 것을 반영하여 2026년 1분기, 2분기 각각 1,667백만원, 2,500백만원의 매출대금을 예상하고 있습니다. 다만, 당사의 계획과 달리 신규 사업 매출대금 300백만원 및 흡수합병을 통한 매출대금 4,167백만원이 발생하지 않는다면 추가적인 자금조달이 필요할 수 있으며, 추가적인 자금조달을 못할 경우에는 재무적인 불확실성에 크게 노출될 수 있음을 의미합니다.
이처럼 당사가 제시한 향후 1년간의 매출대금 4,167백만원은 신규 사업(원료의약품 유통사업 진출) 및 흡수합병(읜료의약품(API) 개발 및 유통)을 통해 발생할 매출을 보수적으로 가정하여 산정된 수치이며, 실제 결과치와 상이할 가능성이 있습니다. 따라서 당사의 재무적 불확실성은 지속적으로 존재하는 상황이니 투자자께서는 이 점 유의하시기 바랍니다.
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속 능력에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
(주13) 정정 후
| 자. 신규상장 당시 추정 경영실적과 현재 실적의 높은 괴리율 위험 당사는 2021년 07월 22일에 기술성장기업으로 코스닥시장에 신규상장 하였으나, 상장 당시 추정손익과 달리 최근 3개년(2022년 ~ 2024년) 매출 등의 실적은 큰 차이를 보이고 있습니다. 당사는 상장 당시에 제시한 주요 파이프라인별 추정 손익과 실제 경영성과 간 괴리를 보이고 있습니다. 이는 당사의 사업계획 중 일부가 지연되거나 중단되었음을 의미하며, 이로 인해 향후 3개년(2025년 ~ 2027년)의 실적 역시 당사의 계획 대비 부진할 가능성이 존재합니다. 투자자께서는 당사의 2025년 사업계획 및 손익 역시 추정치와 높은 괴리를 보일 수 있음에 유의하시고 투자에 임하시기 바랍니다. |
당사는 2021년 07월 22일에 기술성장기업으로 코스닥시장에 신규상장 하였으며, 상장공모를 위한 증권신고서 상의 6개년(2019년 ~ 2024년) 추정 경영실적 세부내역은 다음과 같습니다.
| [상장 당시 공시한 추정 손익계산서] |
| (단위: 백만원) |
| 구분 | 2019년 | 2020년 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) |
|---|---|---|---|---|---|---|
| 매출액 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 매출원가 | 0 | 0 | 0 | 0 | 0 | 0 |
| 매출총이익 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 판매관리비 | 5,734 | 7,853 | 17,225 | 19,160 | 28,309 | 34,494 |
| 영업이익(손실) | (5,734 | (7,853) | (17,225) | (3,032) | 2,837 | 35,824 |
| 영업외수익 | 166 | 160 | 165 | 264 | 234 | 366 |
| 영업외비용 | 8,421 | 20,917 | 19 | 17 | 14 | 12 |
| 법인세비용차감전순이익(손실) | (13,989 | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 법인세비용 | 0 | 0 | 0 | 0 | 0 | 0 |
| 당기순이익(손실) | (13,989) | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 출처) 당사 정기보고서 |
하지만, 상기 추정손익과 달리 최근 3개년(2022년 ~ 2024년) 매출 등의 실적은 아래와 같이 큰 차이를 보이고 있습니다.
| [추정손익과 현재 손익 비교] | |
| (K-IFRS, 연결) | (단위: 백만원) |
| 구분 | 2024년 | 2023년 | 2022년 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | |
| 매출액 | 70,318 | 1,633 | (68,685) | 31,146 | 10,294 | (20,852) | 16,128 | 3,583 | (12,545) |
| 영업이익(손실) | 35,824 | (12,635) | (48,459) | 2,837 | (10,508) | (13,345) | (3,032) | (10,508) | (7,476) |
| 당기순이익(손실) | 36,177 | (14,886) | (51,063) | 3,057 | (11,586) | (14,643) | (2,784) | (11,586) | (8,802) |
| 출처) 당사 정기보고서 및 증권신고서 |
상기와 같이 당사는 매출액이 예측치 대비 괴리액이 2022년 12,545백만원, 2023년 20,852백만원, 2024년에는 68,685백만원 하회하고 있으며, 영업손실 또한 예측치 대비 크게 상이한 모습을 보이고 있습니다. 이처럼 당사는 상장 당시 매출 및 수익성 추정치와 현재 실적 간 차이가 큰 편에 속합니다. 상장 당시 주요 파이프라인별 추정 실적과 실제 매출액을 파이프라인별로 상세히 살펴보면 다음과 같습니다.
| [주요 파이프라인별 세부 추정 매출액과 현재 매출액 비교] |
| (단위: 백만원) |
| 구분 | 추정 매출 추정치 | 실제 매출 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 주요 파이프라인 | 기술료 구분 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) | 2021년 | 2022년 | 2023년 | 2024년 |
| CU06-RE (=CU06) |
Upfront | 0 | 8,227 | 0 | 3,835 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 10,970 | 13,712 | 0 | 3,583 | 10,294 | 1,633 | |
| CU01 | Upfront | 0 | 2,688 | 5,767 | 0 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 14,409 | 13,644 | 0 | 0 | 0 | 0 | |
| CU03 | Upfront | 0 | 5,213 | 0 | 11,184 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 0 | 27,944 | 0 | 0 | 0 | 0 | |
| Total | Upfront | 0 | 16,128 | 5,767 | 15,019 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 25,379 | 55,300 | 0 | 3,583 | 10,294 | 1,633 | |
| 합계 | 0 | 16,128 | 31,146 | 70,318 | 6,255 | 3,583 | 10,294 | 1,633 | |
| 출처) 당사 정기보고서 및 증권신고서 |
2021년부터 2024년까지 당사의 주요 파이프라인별 추정 실적과 실제 매출액간 차이가 발생한 사유는 아래와 같습니다.
① CU06-RE(당뇨병성 황반부종 및 습성 황반변성 치료제)
당사의 주요 파이프라인 CU06-RE(=CU06)은 2021년 10월 떼아 오픈이노베이션에 기술 수출을 통해 당뇨병성 황반부종 및 습성 황반변성에 대한 아시아를 제외한 전세계 지역에 대한 판권을 이전하였습니다. 이에 따른 계약금(Upfront) 6백만불을 수취하였으며, 당시 환율을 적용하여 2021년 6,255백만원을 매출액으로 인식하였습니다. 이후 원가투입법기준 진행률에 따라 기간에 걸쳐 수익을 인식하였으며, 임상2상 시험, 비임상 시험 및 CMC(Chemistry, Manufacturing and Controls)에 필요한 외주 용역 비용의 보상을 받을 뿐만 아니라, 이 과정을 수행하는데 소요되는 임상연구비용 및 제반비용 등을 수익으로 인식함에 따라 2022년, 2023년 각각 3,583백만원, 10,294백만원의 매출액을 기록하였습니다.
CU06의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 07월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
② CU01(당뇨병성 신증 치료제)
당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
③ CU03(습성 황반변성 치료제)
CU03의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
당사의 매출 성장성 및 수익성 개선 방안 관련한 상세 계획은 'III. 투자위험요소 - 2. 회사위험 - 다. 매출부진 및 지속적 손실 발생 위험'을 참고하시기 바랍니다.
상기한 바와 같이, 당사는 상장 당시에 제시한 주요 파이프라인별 추정 손익과 실제 경영성과 간 괴리를 보이고 있습니다. 이는 당사의 사업계획 중 일부가 지연되거나 중단되었음을 의미하며, 이로 인해 향후 3개년(2025년 ~ 2027년)의 실적 역시 당사의 계획 대비 부진할 가능성이 존재합니다. 투자자께서는 당사의 2025년 사업계획 및 손익 역시 추정치와 높은 괴리를 보일 수 있음에 유의하시고 투자에 임하시기 바랍니다.
(주14) 정정 전
| 가. 중점심사 유상증자 선정 가능성 및 증권신고서 정정에 따른 일정 지연 관련 위험 2025년 02월 27일 금융감독원은 IPO(기업공개) 및 유상증자 주관업무와 관련해 16개 증권사와 간담회를 하고 유상증자 증권신고서 중점심사 방향을 공개했습니다. 앞으로 일반주주 권익 훼손 우려 등 7개 사유에 해당하면 '중점심사 유상증자'로 선정하고, 심사 항목별로 집중심사하기로 했습니다. 금융감독원은 '주식가치 희석화 우려', '일반주주 권익훼손 우려', '재무위험 과다', '주관사의 주의의무 소홀' 등 대분류와 7가지 소분류에 따라 중점심사 유상증자 항목을 선정하였습니다. 당사는 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등의 부재로 금융감독원으로부터 중점심사 대상으로 지정되었으며, 항목은 한계기업에 해당합니다. 당사는 증권신고서 제출 전일 기준 중점심사 대상의 주요 심사항목에 대한 내용을 상세히 기재하였으며, 금번 주주배정 후 실권주 일반공모 유상증자의 당위성 설명 및 과정 중 주주권익보호활동을 적극적으로 진행할 예정입니다. 이처럼 중점심사 대상에 지정된 경우 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
「자본시장과 금융투자업에 관한 법률」제120조 3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 참조하시기 바랍니다.
한편, 2025년 02월 27일 금융감독원은 IPO(기업공개) 및 유상증자 주관업무와 관련해 16개 증권사와 간담회를 하고 유상증자 증권신고서 중점심사 방향을 공개했습니다. 앞으로 일반주주 권익 훼손 우려 등 7개 사유에 해당하면 '중점심사 유상증자'로 선정하고, 심사 항목별로 집중심사하기로 했습니다. 금융감독원은 '주식가치 희석화 우려', '일반주주 권익훼손 우려', '재무위험 과다', '주관사의 주의의무 소홀' 등 대분류와 7가지 소분류에 따라 중점심사 유상증자 항목을 선정하였습니다. 중점심사 유상증자 선정기준 상세 항목 및 중점심사 유상증자 해당시 심사절차는 아래와 같습니다.
| [중점심사 유상증자 선정기준] |
| 대분류 | 소분류 | 선정기준 |
|---|---|---|
| 주식가치 희석화 우려 | ① 증자비율 | 증자규모 및 증자비율 등 고려 |
| ② 할인율 | 증자규모 및 할인율 등 고려 | |
| 일반주주 권익훼손 우려 | ③ 신사업투자 등 | 자금사용목적의 타법인출자 또는 신규사업 연관성 고려 |
| ④ 경영권 분쟁발생 | 경영권 분쟁 소송이 진행되었거나 진행중 | |
| 재무위험 과다 | ⑤ 한계기업 등 | 최근 3년 연속 재무실적 부실 또는 재무구조 악화 등 |
| 주관사의 주의의무 소흘 | ⑥ IPO 실적 과다 추정 | IPO 후 실적 괴리율 등 고려 |
| ⑦ Due Diligence 소흘 | 다수의 정정요구를 받은 주관사의 인수·주선 참여 |
| 출처) 금융감독원 보도자료 |
| 주1) 주식 관련 사채(CB, BW 등) 발행 포함 |
| 주2) ③, ④ 외 정성적 중점심사 유상증자 기준을 탄력적으로 운용 예정 |
| 주3) 규모, 비율 등 계량기준은 비공개 운영 |
| [중점심사 유상증자 심사절차] | ||
|
||
| 출처) 금융감독원 보도자료 |
중점심사 유상증자에 해당하는 경우 공통 심사항목으로 1) 유상증자의 당위성 및 의사결정 과정, 2) 이사회 논의 내용, 3) 주주 소통절차, 4) 기업실사 내용 등 기재사항을 집중심사할 예정입니다. 특히, 현행 IPO 심사절차를 준용해 제출 1주일 내 집중심사를 진행하고, 최소 1회 이상 대면협의를 할 계획입니다. 이와 함께 중점심사 유상증자 대상으로 지정된 사유와 해당 이슈가 발생하게 된 경위와 향후 대응 방안 등을 심사할 예정입니다.
| [중점심사 지정사유별 심사항목] |
| 중점심사 지정사유 | 심사항목 |
|---|---|
| ① 공통 심사항목 | 유상증자 당위성 및 의사결정과정, 동 사항들의 이사회 논의 여부 및 그 논의내용, 소액주주 등의 이해 고려여부 및 주주 보호 방안 관련 개선계획, 기업실사 합리적 수행여부 등 |
| ② 증자비율, 할인율 | 증자비율, 할인율 적정성에 대한 검토여부 및 검토내용, 이에 대한 이사회 논의여부 및 그 내용 등 |
| ③ 신사업투자 등 | 신규사업 진출위험, 기존 사업에 미치는 영향, 타법인 인수시 가격 적정성 검토여부 및 주요 검토내용 등 |
| ④ 경영권 분쟁발생 | 경영권 분쟁 상황에서 유상증자 추진 배경 및 목적, 관련 법률적 위험 등 |
| ⑤ 한계기업 등 | 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등 |
| ⑥ IPO실적 과다 추정 | 상장시 자금사용 계획과 달리 자금이 추가로 필요하게 된 경위, 괴리율 발생원인 및 회사의 대응방안 등 |
| 출처) 금융감독원 보도자료 |
증권신고서 제출일 현재 유상증자 중점심사 지정사유별 심사항목에 관한 당사의 검토내역은 아래와 같습니다.
① 공통 심사항목
가) 주주배정 후 실권주 일반공모 유상증자 당위성
당사가 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 자금을 조달하고자 하는 주요 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 후속 파이프라인 연구개발 투자 및 지속 가능한 성장 기반 마련
당사는 핵심 파이프라인 외에도 MT-101(급성 신손상 및 만성 신부전), MT-103(습성 황반변성 등 안과질환 이중항체), CP01-R01(반려동물 만성신장질환 치료제) 등 유망한 후속 및 신규 파이프라인 포트폴리오를 보유하고 있습니다. 이러한 파이프라인들의 비임상 및 초기 임상 연구개발을 가속화하고, 혁신적인 신약 포트폴리오를 지속적으로 확장하기 위해서는 선제적이고 적극적인 연구개발 투자가 필수적입니다. 이는 단기적인 성과뿐만 아니라 중장기적인 기업 성장의 발판을 마련하는 데 중요한 역할을 할 것입니다.
3) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
4) 연구개발 역량 강화 및 안정적인 운영자금 확보를 통한 경영 효율화
신약 개발은 고도의 전문성을 갖춘 연구인력과 첨단 연구시설 및 장비가 필수적인 분야입니다. 우수한 연구인력을 지속적으로 확보하고 유지하며, 최적의 연구 환경을 조성하기 위해서는 안정적인 운영자금 확보가 선행되어야 합니다. 금번 유상증자를 통해 조달되는 자금은 핵심 연구인력에 대한 투자, 연구 인프라의 효율적 운영 및 관리, 그리고 전반적인 경영활동의 안정성을 제고하는 데 사용될 것입니다. 이는 당사가 예측 불가능한 외부 환경 변화에 유연하게 대응하고, 장기적인 비전을 가지고 연구개발에 매진할 수 있는 재정적 토대를 마련해 줄 것입니다.
5) 제약·바이오 산업 환경 변화에 대한 능동적 대응 및 경쟁 우위 확보
글로벌 제약·바이오 시장은 기술 발전 속도가 매우 빠르고 경쟁이 치열한 분야입니다. 이러한 환경 속에서 경쟁 우위를 확보하고 지속적으로 성장하기 위해서는 혁신적인 기술력과 함께 신속한 의사결정, 그리고 이를 뒷받침할 수 있는 충분한 자금력이 중요합니다. 당사는 금번 자금 조달을 통해 빠르게 변화하는 시장 환경과 기술 트렌드에 능동적으로 대응하고, 핵심 기술 및 파이프라인의 경쟁력을 강화하여 글로벌 시장에서 입지를 다져나갈 계획입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
6) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
나) 주주 권익 보호를 위한 회사정책
당사는 금번 유상증자를 추진함에 있어 주주님들의 이익을 최우선으로 고려하며, 유상증자 이후에도 지속적인 주주가치 제고를 위해 다음과 같은 정책을 추진하고 주주님들과의 소통을 강화하고자 합니다.
1) 투명하고 공정한 정보 제공 강화
당사는 유상증자의 진행 과정, 조달 자금의 구체적인 사용 계획 및 집행 내역, 주요 경영 활동, 임상시험의 진행 상황 및 결과 등 주주 및 투자자분들의 의사결정에 중대한 영향을 미칠 수 있는 모든 정보를 관련 법규 및 규정을 철저히 준수하여 금융감독원 전자공시시스템(DART) 및 당사 홈페이지를 통해 신속, 정확, 충분하게 공시하겠습니다. 특히, 분ㆍ반기ㆍ사업보고서 및 정기적인 IR 자료를 통해 조달 자금의 사용 현황을 상세히 안내하고, 자금 집행의 투명성을 확보하여 주주님들의 신뢰를 높이는 데 주력할 것입니다. 또한, 예측 정보나 미래 전망에 대해서는 합리적인 근거를 제시하고 발생 가능한 위험 요인에 대해서도 충분히 설명하여 투자자 보호에 만전을 기하겠습니다.
2) 적극적이고 다각적인 IR 활동을 통한 소통 활성화
당사는 주주님들과의 열린 소통을 경영의 중요한 가치로 여기고 있습니다. 이를 위해 국내외 기관투자자, 애널리스트, 언론뿐만 아니라 개인 주주님들을 포함한 모든 시장 참여자들과의 소통 채널을 확대하고 다각화할 계획입니다.
- 정기 및 비정기 기업설명회(IR) 및 주주간담회 개최: 연간 경영실적 발표회 외에도, 주요 경영 현안 발생 시 또는 시장의 관심이 높을 경우, 온/오프라인 기업설명회를 수시로 개최할 예정입니다. 특히, 당사는 금번 유상증자의 배경 및 회사의 향후 성장 전략을 주주님들께 상세히 설명드리고 의견을 경청하기 위해 2025년 05월 29일에 주주간담회를 개최할 예정입니다. 간담회의 구체적인 시간 및 장소, 참여 방법 등은 추후 당사 홈페이지 공지 및 별도 안내를 통해 신속히 알려드리겠습니다. 이를 통해 당사의 경영 전략, 연구개발 진행 상황, 향후 비전 등을 상세히 설명하고 질의응답 시간을 통해 주주님들의 궁금증을 해소하겠습니다.
- 소그룹 미팅 및 컨퍼런스 참여: 국내외 주요 투자 컨퍼런스에 적극적으로 참여하고, 기관투자자 및 애널리스트들을 대상으로 한 미팅을 정기적으로 진행하여 심도 있는 정보를 제공하고 상호 이해도를 높이겠습니다.
- 주주서한 및 온라인 소통 강화: 금번 유상증자와 관련하여 2025년 05월 16일 주주서한을 통해 회사의 입장을 전달드린 바와 같이, 앞으로도 중요한 경영 사항 발생 시 주주서한, 회사 홈페이지 공지, FAQ 게시, 이메일 문의 답변 등을 통해 주주님들과 적극적으로 소통하겠습니다. 특히 소액주주님들의 정보 접근성을 높이기 위해 노력하겠습니다.
- 주주총회의 내실 있는 운영: 정기 및 임시 주주총회를 단순한 의결 절차를 넘어, 주주님들과 경영진이 회사의 발전 방향에 대해 심도 있게 논의하고 의견을 교환하는 소통의 장으로 만들어가겠습니다.
| [주주서한] |
|
|
|
| 출처) 당사 홈페이지 |
3) 기업가치 제고를 통한 실질적인 주주 이익 환원
당사는 금번 유상증자를 통해 확보된 자금을 바탕으로 핵심 파이프라인의 연구개발을 성공적으로 완수하고, 기술이전 및 상업화를 통해 실질적인 기업 성장을 이루어내는 데 모든 역량을 집중할 것입니다.
- 핵심 사업의 성공적 추진: CU06, CU71 등 주요 파이프라인의 임상적 가치를 입증하고, 글로벌 기술이전 또는 자체 상업화를 통해 기업가치를 극대화하겠습니다.
- 신성장 동력 확보: 원료의약품 유통사업 등 신규 사업의 안정적인 시장 진입과 성장을 도모하고, 지속적인 연구개발을 통해 미래 성장 가능성이 높은 신규 파이프라인을 확보하겠습니다.
- 합리적인 주주환원 정책 수립 검토: 회사의 지속적인 성장과 이익 실현이 안정적인 궤도에 오르면, 재무 상태, 향후 투자 계획, 시장 상황 등을 종합적으로 고려하여 배당, 자사주 매입/소각 등 주주가치를 제고할 수 있는 다양한 방안을 적극적으로 검토하고, 관련 정책 수립 시 투명하게 공시하고 시행할 수 있도록 노력하겠습니다.
4) 이사회 중심의 투명하고 책임 있는 경영체제 확립
당사는 이사회의 독립성과 전문성을 강화하고, 경영진에 대한 효과적인 감독 기능을 수행함으로써 투명하고 책임 있는 경영체제를 구축하겠습니다. 이사회는 주주의 이익을 최우선으로 고려하여 의사결정을 하며, 모든 경영활동은 관련 법규와 정관을 준수하여 이루어질 것입니다. 또한, 내부회계관리제도의 효과적인 운영과 내부통제시스템 강화를 통해 경영의 투명성과 신뢰성을 지속적으로 높여나가겠습니다.
당사는 상기 언급된 주주 권익 보호 방안들을 성실히 이행하고, 끊임없는 혁신과 성장을 통해 주주님들의 기대에 부응할 수 있도록 최선을 다할 것을 약속드립니다.
② 증자비율 및 할인율
당사는 금번 주주배정 후 실권주 일반공모 유상증자를 통해 파이프라인별 임상연구비용 및 신규사업을 위한 자본금 확충 등 회사의 지속적인 성장을 위한 운영자금을 확충하고 재무적인 안정성을 확보하고자 합니다. 이를 통해 주주가치를 극대화하고, 장기적으로 경쟁력을 갖춘 기업으로 도약할 수 있도록 최선을 다 할 것입니다.
증자비율은 기업의 필요 자금 규모와 주주가치 보호의 균형을 고려하여 다양한 비율로 결정되어야 하며, 증자비율이 과도하게 높을 경우 시장에서 재무 상태에 대한 부정적인 신호로 해석될 가능성이 있고 기존 주주들의 주주가치가 훼손될수 있어 적정한 수준에서 결정하는 것이 중요합니다. 할인율의 경우 「증권의 발행 및 공시 등에 관한 규정」에 의거 주주배정 유상증자의 경우 40% 이내에서 결정할 수 있으며, 기존주주들의 지분 희석 정도를 감안하여 적정 할인율에 대한 결정이 필요합니다.
이에, 기존 주주의 권익을 보호하면서도 장기적인 기업가치 상승을 기대할 수 있는 조건을 결정하기 위해 당사의 이사회는 과거 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 토대로 금번 유상증자의 증자비율과 할인율 적정성 검토 및 논의를 진행하였습니다. 당사가 이사회 논의에서 참고한 유사업종 유상증자 사례는 다음과 같습니다.
| [최근(2023년~2025년) 발행규모 250억원~350억원 규모 유상증자 사례] |
| (단위: 억원, 원, %) |
| 회사명 | 납입일 | 발행금액(억원) | 발행가(원) | 할인율 | 증자비율 |
|---|---|---|---|---|---|
| 젠큐릭스 | 2023.04.20 | 254 | 3,925 | 25% | 92.65% |
| 엘앤케이바이오 | 2023.07.13 | 260 | 3,980 | 25% | 48.67% |
| 클리노믹스 | 2023.08.10 | 276 | 3,540 | 25% | 55.71% |
| 뉴인텍 | 2023.08.17 | 261 | 1,255 | 25% | 69.09% |
| 원익피앤이 | 2023.11.18 | 283 | 5,660 | 25% | 11.78% |
| 유니슨 | 2024.05.03 | 305 | 727 | 25% | 33.24% |
| SG | 2024.06.27 | 318 | 1,061 | 25% | 49.04% |
| 엑시콘 | 2024.07.19 | 333 | 15,130 | 25% | 21.38% |
| 평균 | 25% | 47.69% | |||
| 출처) Dart 전자공시시스템, 당사 제시 |
2023년 이후 당사와 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 분석한 결과, 평균 증자비율은 47.69%, 평균 할인율은 25% 수준으로 파악됩니다. 증자비율의 경우, 자금의 사용목적과 회사의 필요 자금 규모에 따라 21.38% ~ 92.65%까지 다양한 비율로 결정된 반면, 할인율은 대부분 25%를 설정하였습니다.
당사는 이러한 사례를 기반으로 이사회에서 논의를 진행하였고, 본 발행조건이 기존 주주들의 권익 침해를 최소화하고, 주주가치를 제고할 수 있는 적정한 조건이라고 판단하여 금번 유상증자의 할인율 25%, 증자비율 49.97%로 발행 조건을 결정하였습니다.
③ 신사업투자 등
당사는 2025년 03월 06일자로 원료의약품(API) 개발 및 유통 전문기업인 주식회사 대성팜텍을 흡수합병하기로 결정하였으며, 합병 기일은 2026년 01월 28일로 지정되어 흡수합병을 진행할 계획입니다. 대성팜텍과 합병을 계기로 당사 또한 원료의약품 수입, 도소매업을 신규사업으로 진행하기로 결정하였습니다. 신규사업은 신규 법인을 설립하거나, 타법인증권취득이 아니라 기존 법인인 당사에서 진행할 예정이며, 이를 위하여 금번 유상증자 자금 중 5억원이 자본금 확충의 목적으로 소요될 예정입니다.
신규 사업과 관련한 위험은 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 1. 사업위험 - 라. 신규사업(원료의약품품 수입, 도소매업) 영위에 따른 위험'을 참고하여 주시기 바랍니다.
그 외 세부 자금사용 계획에 대해서는 '제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적'을 참고하여 주시기 바랍니다.
④ 경영권 분쟁발생
증권신고서 제출 전일 기준 당사의 최대주주 권영근 의장은 약 12.91%의 지분율을 확보하고 있으며, 금번 주주배정 후 실권주 일반공모에 최대주주인 권영근 의장은 배정주식수의 약 30%을 참여할 계획입니다. 당사 발행주식총수의 5% 이상 지분율을 보유한 주주는 최대주주 이외에 없고 소액주주들에게 지분율이 분산되어 있어 최대주주의 변경 및 경영권 분쟁발생 가능성은 제한적일 것으로 판단하고 있습니다. 최대주주 지분율 약화에 따른 경영권 변동 및 분쟁 관련 위험은 '제1부 모집 또는 매출에 관한 사항 중 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 2. 회사위험 - 나. 최대주주 변경 및 지분희석 등 경영권 관련 위험'을 참고하여 주시기 바랍니다.
⑤ 한계기업 등
당사는 임상 및 연구개발비용으로 인해 지속적인 영업적자 및 당기순손실이 발생하고 결손금이 누적되고 있어 자본총계가 감소하는 추세이고 부채비율은 급격하게 상승하고 있습니다. 이처럼 당사는 성장성, 수익성, 안정성, 활동성, 유동성 등 전반적인 재무지표가 악화되는 추세를 보이고 있습니다.
2024년 말 감사보고서상 외부감사인의 감사 결과 계속기업 관련 중요한 불확실성은 없는 상황이지만 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06 기술이전 계약이 2024년 07월 12일부로 파트너사의 내부 개발 전략 변경에 따라 해지되었으며, 당사는 해당 물질에 대한 모든 권리를 반환받으면서 2024년부터 당사의 전반적인 재무지표가 악화되고 있습니다.
당사의 재무 관련 위험은 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 2. 회사위험 - 라. 재무안정성 관련 위험'을 참고하여 주시기 바랍니다.
⑥ IPO실적 과다 추정
당사는 2021년 07월 22일 코스닥시장에 기술특례상장 하였으며, 증권신고서를 통해 2024년 매출액 예측치를 70,318백만원로 추정하였으나, 실적치는 1,633백만원으로 약 97.68%의 괴리율이 발생하였습니다.
본 증권신고서 '제2부-X. 그 밖에 투자자 보호를 위하여 필요한 사항-4. 작성기준일 이후 발생한 주요사항 등 기타사항-1. 상장기업의 재무사항 비교표'에 IPO 당시 추정 실적과 실제 실적의 괴리 발생 원인과 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다.
상기 서술한 내용을 종합해 보면, 당사는 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등의 부재로 금융감독원으로부터 중점심사 대상으로 지정되었으며, 항목은 한계기업에 해당합니다. 당사는 증권신고서 제출 전일 기준 중점심사 대상의 주요 심사항목에 대한 내용을 상세히 기재하였으며, 금번 주주배정 후 실권주 일반공모 유상증자의 당위성 설명 및 과정 중 주주권익보호활동을 적극적으로 진행할 예정입니다. 이처럼 중점심사 대상에 지정된 경우 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주14) 정정 후
| 가. 중점심사 유상증자 선정 가능성 및 증권신고서 정정에 따른 일정 지연 관련 위험 2025년 02월 27일 금융감독원은 IPO(기업공개) 및 유상증자 주관업무와 관련해 16개 증권사와 간담회를 하고 유상증자 증권신고서 중점심사 방향을 공개했습니다. 앞으로 일반주주 권익 훼손 우려 등 7개 사유에 해당하면 '중점심사 유상증자'로 선정하고, 심사 항목별로 집중심사하기로 했습니다. 금융감독원은 '주식가치 희석화 우려', '일반주주 권익훼손 우려', '재무위험 과다', '주관사의 주의의무 소홀' 등 대분류와 7가지 소분류에 따라 중점심사 유상증자 항목을 선정하였습니다. 당사는 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등의 부재로 금융감독원으로부터 중점심사 대상으로 지정되었으며, 항목은 한계기업에 해당합니다. 당사는 증권신고서 제출 전일 기준 중점심사 대상의 주요 심사항목에 대한 내용을 상세히 기재하였으며, 금번 주주배정 후 실권주 일반공모 유상증자의 당위성 설명 및 과정 중 주주권익보호활동을 적극적으로 진행할 예정입니다. 이처럼 중점심사 대상에 지정된 경우 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
「자본시장과 금융투자업에 관한 법률」제120조 3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 참조하시기 바랍니다.
한편, 2025년 02월 27일 금융감독원은 IPO(기업공개) 및 유상증자 주관업무와 관련해 16개 증권사와 간담회를 하고 유상증자 증권신고서 중점심사 방향을 공개했습니다. 앞으로 일반주주 권익 훼손 우려 등 7개 사유에 해당하면 '중점심사 유상증자'로 선정하고, 심사 항목별로 집중심사하기로 했습니다. 금융감독원은 '주식가치 희석화 우려', '일반주주 권익훼손 우려', '재무위험 과다', '주관사의 주의의무 소홀' 등 대분류와 7가지 소분류에 따라 중점심사 유상증자 항목을 선정하였습니다. 중점심사 유상증자 선정기준 상세 항목 및 중점심사 유상증자 해당시 심사절차는 아래와 같습니다.
| [중점심사 유상증자 선정기준] |
| 대분류 | 소분류 | 선정기준 |
|---|---|---|
| 주식가치 희석화 우려 | ① 증자비율 | 증자규모 및 증자비율 등 고려 |
| ② 할인율 | 증자규모 및 할인율 등 고려 | |
| 일반주주 권익훼손 우려 | ③ 신사업투자 등 | 자금사용목적의 타법인출자 또는 신규사업 연관성 고려 |
| ④ 경영권 분쟁발생 | 경영권 분쟁 소송이 진행되었거나 진행중 | |
| 재무위험 과다 | ⑤ 한계기업 등 | 최근 3년 연속 재무실적 부실 또는 재무구조 악화 등 |
| 주관사의 주의의무 소흘 | ⑥ IPO 실적 과다 추정 | IPO 후 실적 괴리율 등 고려 |
| ⑦ Due Diligence 소흘 | 다수의 정정요구를 받은 주관사의 인수·주선 참여 |
| 출처) 금융감독원 보도자료 |
| 주1) 주식 관련 사채(CB, BW 등) 발행 포함 |
| 주2) ③, ④ 외 정성적 중점심사 유상증자 기준을 탄력적으로 운용 예정 |
| 주3) 규모, 비율 등 계량기준은 비공개 운영 |
| [중점심사 유상증자 심사절차] | ||
|
||
| 출처) 금융감독원 보도자료 |
중점심사 유상증자에 해당하는 경우 공통 심사항목으로 1) 유상증자의 당위성 및 의사결정 과정, 2) 이사회 논의 내용, 3) 주주 소통절차, 4) 기업실사 내용 등 기재사항을 집중심사할 예정입니다. 특히, 현행 IPO 심사절차를 준용해 제출 1주일 내 집중심사를 진행하고, 최소 1회 이상 대면협의를 할 계획입니다. 이와 함께 중점심사 유상증자 대상으로 지정된 사유와 해당 이슈가 발생하게 된 경위와 향후 대응 방안 등을 심사할 예정입니다.
| [중점심사 지정사유별 심사항목] |
| 중점심사 지정사유 | 심사항목 |
|---|---|
| ① 공통 심사항목 | 유상증자 당위성 및 의사결정과정, 동 사항들의 이사회 논의 여부 및 그 논의내용, 소액주주 등의 이해 고려여부 및 주주 보호 방안 관련 개선계획, 기업실사 합리적 수행여부 등 |
| ② 증자비율, 할인율 | 증자비율, 할인율 적정성에 대한 검토여부 및 검토내용, 이에 대한 이사회 논의여부 및 그 내용 등 |
| ③ 신사업투자 등 | 신규사업 진출위험, 기존 사업에 미치는 영향, 타법인 인수시 가격 적정성 검토여부 및 주요 검토내용 등 |
| ④ 경영권 분쟁발생 | 경영권 분쟁 상황에서 유상증자 추진 배경 및 목적, 관련 법률적 위험 등 |
| ⑤ 한계기업 등 | 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등 |
| ⑥ IPO실적 과다 추정 | 상장시 자금사용 계획과 달리 자금이 추가로 필요하게 된 경위, 괴리율 발생원인 및 회사의 대응방안 등 |
| 출처) 금융감독원 보도자료 |
증권신고서 제출일 현재 유상증자 중점심사 지정사유별 심사항목에 관한 당사의 검토내역은 아래와 같습니다.
① 공통 심사항목
가) 주주배정 후 실권주 일반공모 유상증자 당위성
당사의 이사회는 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 추진하기에 앞서, 당사의 현재 재무 상태, 보유 현금 수준 및 단기적인 자금 운용 계획, 임상개발을 진행 중인 파이프라인의 사업성 및 예상되는 비용 규모, 그리고 예정된 전환사채 등의 차입금 상환 스케줄 등을 면밀히 검토하였습니다. 또한, 이를 바탕으로 자금 조달의 필요성과 시기의 적정성은 물론, 조달 자금의 규모와 사용 계획이 당사의 핵심 파이프라인 개발 및 신사업 진출 등 중장기 사업 전략에 부합하는지 다각적으로 분석하고 심도 있는 논의를 거쳤습니다.
그 결과, 현재의 내부 유보 자금 및 영업 현금흐름만으로는 예정된 임상 개발과 미래 성장 동력 확보를 위한 투자를 동시에 진행하기에 부족하며, 안정적인 재무구조를 유지하면서 기업가치를 극대화하기 위해서는 외부 자금 조달이 필수적이라는 결론에 이르렀습니다. 이에 당사 이사회는 본 유상증자가 회사의 핵심 경쟁력을 강화하고 지속 가능한 성장의 발판을 마련하기 위한 최적의 방안이라고 판단하였으며, 이사회가 검토한 금번 유상증자를 통해 자금을 조달하고자 하는 구체적인 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
3) 연구개발 역량 강화 및 안정적인 운영자금 확보를 통한 경영 효율화
신약 개발은 고도의 전문성을 갖춘 연구인력과 첨단 연구시설 및 장비가 필수적인 분야입니다. 우수한 연구인력을 지속적으로 확보하고 유지하며, 최적의 연구 환경을 조성하기 위해서는 안정적인 운영자금 확보가 선행되어야 합니다. 금번 유상증자를 통해 조달되는 자금은 핵심 연구인력에 대한 투자, 연구 인프라의 효율적 운영 및 관리, 그리고 전반적인 경영활동의 안정성을 제고하는 데 사용될 것입니다. 이는 당사가 예측 불가능한 외부 환경 변화에 유연하게 대응하고, 장기적인 비전을 가지고 연구개발에 매진할 수 있는 재정적 토대를 마련해 줄 것입니다.
4) 제약·바이오 산업 환경 변화에 대한 능동적 대응 및 경쟁 우위 확보
글로벌 제약·바이오 시장은 기술 발전 속도가 매우 빠르고 경쟁이 치열한 분야입니다. 이러한 환경 속에서 경쟁 우위를 확보하고 지속적으로 성장하기 위해서는 혁신적인 기술력과 함께 신속한 의사결정, 그리고 이를 뒷받침할 수 있는 충분한 자금력이 중요합니다. 당사는 금번 자금 조달을 통해 빠르게 변화하는 시장 환경과 기술 트렌드에 능동적으로 대응하고, 핵심 기술 및 파이프라인의 경쟁력을 강화하여 글로벌 시장에서 입지를 다져나갈 계획입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
5) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
나) 주주 권익 보호를 위한 회사정책
당사는 금번 유상증자를 추진함에 있어 주주님들의 이익을 최우선으로 고려하며, 유상증자 이후에도 지속적인 주주가치 제고를 위해 이사회에서 논의한 바와 같이 다음과 같은 정책을 추진하고 주주님들과의 소통을 강화하고자 합니다.
| [이사회의사록 발췌] |
|
| 출처) 2025년 05월 22일 당사 이사회의사록 |
1) 투명하고 공정한 정보 제공 강화
당사는 유상증자의 진행 과정, 조달 자금의 구체적인 사용 계획 및 집행 내역, 주요 경영 활동, 임상시험의 진행 상황 및 결과 등 주주 및 투자자분들의 의사결정에 중대한 영향을 미칠 수 있는 모든 정보를 관련 법규 및 규정을 철저히 준수하여 금융감독원 전자공시시스템(DART) 및 당사 홈페이지를 통해 신속, 정확, 충분하게 공시하겠습니다. 특히, 분ㆍ반기ㆍ사업보고서 및 정기적인 IR 자료를 통해 조달 자금의 사용 현황을 상세히 안내하고, 자금 집행의 투명성을 확보하여 주주님들의 신뢰를 높이는 데 주력할 것입니다. 또한, 예측 정보나 미래 전망에 대해서는 합리적인 근거를 제시하고 발생 가능한 위험 요인에 대해서도 충분히 설명하여 투자자 보호에 만전을 기하겠습니다.
2) 적극적이고 다각적인 IR 활동을 통한 소통 활성화
당사는 주주님들과의 열린 소통을 경영의 중요한 가치로 여기고 있습니다. 이를 위해 국내외 기관투자자, 애널리스트, 언론뿐만 아니라 개인 주주님들을 포함한 모든 시장 참여자들과의 소통 채널을 확대하고 다각화할 계획입니다.
- 정기 및 비정기 기업설명회(IR) 및 주주간담회 개최: 연간 경영실적 발표회 외에도, 주요 경영 현안 발생 시 또는 시장의 관심이 높을 경우, 온/오프라인 기업설명회를 수시로 개최할 예정입니다. 특히, 당사는 금번 유상증자의 배경 및 회사의 향후 성장 전략을 주주님들께 상세히 설명드리고 의견을 경청하기 위해 2025년 05월 29일에 주주간담회를 개최할 예정입니다. 간담회의 구체적인 시간 및 장소, 참여 방법 등은 추후 당사 홈페이지 공지 및 별도 안내를 통해 신속히 알려드리겠습니다. 이를 통해 당사의 경영 전략, 연구개발 진행 상황, 향후 비전 등을 상세히 설명하고 질의응답 시간을 통해 주주님들의 궁금증을 해소하겠습니다.
- 소그룹 미팅 및 컨퍼런스 참여: 국내외 주요 투자 컨퍼런스에 적극적으로 참여하고, 기관투자자 및 애널리스트들을 대상으로 한 미팅을 정기적으로 진행하여 심도 있는 정보를 제공하고 상호 이해도를 높이겠습니다.
- 주주서한 및 온라인 소통 강화: 금번 유상증자와 관련하여 2025년 05월 16일 주주서한을 통해 회사의 입장을 전달드린 바와 같이, 앞으로도 중요한 경영 사항 발생 시 주주서한, 회사 홈페이지 공지, FAQ 게시, 이메일 문의 답변 등을 통해 주주님들과 적극적으로 소통하겠습니다. 특히 소액주주님들의 정보 접근성을 높이기 위해 노력하겠습니다.
- 주주총회의 내실 있는 운영: 정기 및 임시 주주총회를 단순한 의결 절차를 넘어, 주주님들과 경영진이 회사의 발전 방향에 대해 심도 있게 논의하고 의견을 교환하는 소통의 장으로 만들어가겠습니다.
| [주주서한] |
|
|
|
| 출처) 당사 홈페이지 |
당사는 금번 유상증자와 관련하여 주주와의 소통 강화를 위해 다양한 활동을 진행하고 있습니다. 당사는 1차 정정증권신고서 제출 전일인 2025년 06월 08일 기준으로 주주들과의 소통을 적극적으로 진행하였습니다. 구체적으로는 2025년 05월 29일 주주간담회를 개최하여 유상증자의 목적과 필요성을 상세히 설명하고 아래와 같은 Q&A를 진행하였으며, 참석하지 않은 주주분들도 내용을 확인할 수 있도록 당사 홈페이지에 Q&A를 게시하였습니다.
| [주주간담회 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 유상증자 자금의 사용 목적은 무엇인가요? A. 금번 유상증자를 통해 조달 예정인 약 286억 원은 △CU06 미국 당뇨병성 황반부종 임상 2b상 △CU71 미국 알츠하이머병 임상 1상 등 주요 파이프라인의 연구개발(R&D) 진척 △공통 소모품 구매 및 장비 유지보수 △원료의약품 유통사업 진출을 위한 자본금 확충 등에 사용될 계획입니다. |
| 2 | Q. 신규로 발행하는 주식의 형태는 무엇인가요? A. 큐라클㈜ 기명식 보통주로 발행됩니다. |
| 3 | Q. 주주배정 후 실권주 일반공모 방식의 유상증자 방식은 무엇인가요? A. 일정 기준일을 기준으로 주주명부에 등재된 기존 주주들께 신주를 우선 배정하며, 주주 청약 이후 발생한 실권주에 대해 일반 투자자를 대상으로 공모 청약을 진행하는 방식입니다. |
| 4 | Q. 유상증자의 참여 대상이 되기 위해서는 언제까지 주식을 보유해야 하나요? A. 신규로 발행할 주식을 배정받는 주주의 기준일(신주배정기준일)은 6월 26일로 예정되어 있으며, 증권결제일(T+2일)을 감안하여 2 영업일 전인 6월 24일까지 주식을 매수하시면 대상이 됩니다. |
| 5 | Q. 기존 주주에게는 어떠한 비율로 신주가 배정되는 건가요? A. 기존 주주의 개인별 청약 한도는 신주배정기준일인 6 월 26 일 현재 주주명부에 기재된 소유주식 1 주당 신주배정비율인 0.4996732494주를 곱하여 산정된 배정주식수 로 하되 , 1 주 미만의 단수주는 절사합니다. |
| 6 | Q. 신주의 발행가액은 어떻게 결정되나요? A. 최근 주가와 거래량을 기간 별로 가중산술평균하여 이를 반영한 기준주가가 결정되고 , 기준주가에 할인율과 증자비율을 반영하여 발행가액이 결정됩니다. 현재 공시된 예정 발행가액은 잠정적인 금액이며, 1 차 발행가액은 6월 23일 확정, 확정 발행가액은 7월 30일 산정되어 7월 31일에 공고될 예정입니다. 구체적인 발행가액 산정방식 및 세부내용은 전자공시시스템에 공시된 증권신고서를 참고해주시기 바랍니다. |
| 7 | Q. 청약에 참여하려면 어떻게 해야 하나요? A. 주주분들께서 현재 이용하고 계신 증권사의 HTS, MTS 를 통해 청약이 가능 합니다. 보유하고 계신 증권사 주식 계좌 내, 유상 청약 신청 메뉴를 통해 청약을 신청하실 수 있습니다. |
| 8 | Q. 신주인수권은 무엇인가요? A. 신주인수권은 유상증자 시 기존 주주가 보유하고 있던 주식 수에 비례하여 우선적으로 주식을 배정 받을 수 있는 권리를 말하며, 신주인수권은 정해진 기간 동안 시장에서 매매가 가능합니다(신주인수권증서 상장 및 거래기간 7월 15일-21일 예정). 기존 주주 분께서 유상증자에 참여하고 싶은 경우 신주인수권증서를 매도하지 않고 보유해야만 청약이 가능하며, 기존 주주가 아닌 분들은 유상증자에 참여하고자 하시는 경우 신주인수권증서를 매수하시면 됩니다. |
| 9 | Q. 신주인수권증서를 매매하는 방법과 매매가 가능한 기간은 어떻게 되나요? A. 신주인수권증서 매매는 HTS, MTS 등 온라인, 전화, 지점 내방 등을 통해 가능하며, 보유 수량의 일부 매도도 가능합니다. 자세한 사항은 이용 중이신 증권사 고객센터를 통해 안내 받으실 수 있습니다. 장내 신주인수권증서 매매는 정해진 5 영업일(7월 15일-21일 예정)동안 가능하며, 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. 장외 신주인수권증서 매매는 신주인수권증서 상장거래의 결제일인 7월 23(예정)일까지, 거래의 세부 요건은 계좌를 보유하고 계신 증권사를 통해 확인해주시기 바랍니다. |
| 10 | Q. 유상증자 청약 후에 취소가 가능한가요? A. 구주주 청약일(8월 4일-5일 예정) 또는 일반공모 청약일(8월 7일-8일 예정) 각 청약 기간 내에서만 취소가 가능합니다. |
| 11 | Q. 주주가 아닌 경우에도 청약에 참여할 수 있나요? A. 신주인수권증서 상장 및 거래기간(7월 15일-21일 예정)에 해당 증서를 매수하여 구주주 청약일(8월 4일-5일 예정)에 청약할 수 있으며, 구주주 청약 미달로 실권주가 발생할 경우 일반공모 청약을 통해서도 참여가 가능합니다. |
| 12 | Q. 신주는 언제부터 매매할 수 있게 되나요? A. 현재 예정된 일정을 기준으로 7월 15일 신주가 상장될 예정이며, 매매가 개시될 예정입니다. 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. |
| 13 | Q. 초과청약을 120% 까지 할 수 있는 초과청약제도는 무엇인가요? A. 유상증자 초과청약제도는 신주인수권증서 청약자가 보유분보다 초과로 청약할 수 있고, 추후 실권주가 발생하는 경우 초과청약분을 추가로 배정받는 제도입니다. 주주 별로 배정되는 신주 수량의 최대 20% 까지 추가로 청약이 가능하며, 초과청약분이 실권주 발생 수량에 미달할 경우 청약분 100% 에 대해 신주를 배정받고, 초과청약분이 실권주 발생 수량을 초과할 경우 청약 주식 수에 비례하게 신주를 배정받게 됩니다. |
| 14 | Q. 행사 가능한 신주 인수 권리 수량을 초과하여 청약하려면 어떻게 해야 하나요? A. 추가 청약은 1) 배정 수량의 20% 내에서 초과 청약을 신청하는 방법과 2) 신주인수권 매매기간(7월 15일-21일 예정)동안 신주인수권증서를 매수하여 청약을 신청하는 방법 2가지가 있습니다. |
| 15 | Q. 초과 청약을 하였는데 초과분 전부를 배정 받지 못할 경우에 환불은 언제되나요? A. 구주주 청약과 일반공모 청약이 완료된 후 주금납입일(8월 12일 예정)에 청약 계좌로 환급됩니다. |
| 출처) 당사 제시 |
또한 주주와 유선 의견청취 및 소통 약 28회, 이메일 문의 12건에 대한 답변 등을 통하여 주주들의 의견을 수렴하고, 유상증자의 목적과 필요성을 상세히 설명히였습니다.
| [이메일 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 원료의약품 유통사업 자본금 5억원 사용 목적은? A. 당사는 신규 성장 동력 확보 및 사업 포트폴리오 다각화의 일환으로 원료의약품 유통사업 진출을 결정했으며, 유상증자를 통해 조달하는 금액 중 5억원은 원료의약품 유통사업을 위한 자본금 확충에 사용(약사법 내 의약품 도매상 자본금 요건)될 예정입니다. |
| 2 | Q. 1회차 전환사채(CB) 진행 상황은? A. 전환사채 만기 전 유보 현금을 사용해 당사에서 일부 채권(148억원)을 취득했으며, 향후 소각 또는 재매각 예정입니다. |
| 3 | Q. CU06 당뇨병성 황반부종 임상2b상을 진행하는 동안 기술이전이 가능한지? A. 임상 진행 중에도 기술이전이 가능하며, 임상시험과 사업화 활동을 병행해서 진행할 계획입니다. |
| 4 | Q. CU06 임상2b상 소요기간은 어느 정도로 예상하는지? A. 미국 FDA와 논의된 임상 디자인 상 약 2년 정도 소요될 것으로 예상하고 있으며, 경구제로만 임상을 진행하게 될 경우 앞선 임상2a상 등의 사례로 미루어 볼 때 주사제 임상보다 환자 모집이 수월할 것으로 예상하고 있습니다. |
| 5 | Q. CU01 임상2b상 결과는 언제 나오는지? A. 현재 환자 투여가 약 90% 정도 완료되었으며, 올해 4분기 중 임상이 종료되고 결과를 확인할 수 있을 것으로 예상하고 있습니다. |
| 6 | Q. MT-101, MT-103에 대한 기술이전을 진행 중인 파트너사들의 관심도가 높은지? A. MT-101, MT-103이 기반으로 하는 Tie2 활성화 항체는 글로벌 제약사 등이 최근 주목하고 있는 신규 타깃으로 많은 회사들의 관심을 받고 있습니다. 바이오 Europe, 바이오 USA 등 파트너링 미팅에서 MT-101과 MT-103이 전임상 시험에서 보인 우수한 데이터를 바탕으로 활발한 파트너링 활동을 진행 중입니다. |
| 출처) 당사 제시 |
이러한 노력은 주주들과의 신뢰를 공고히 하고, 당사의 유상증자 진행 과정에서 주주 의견을 실질적으로 반영하는 데 중점을 두고 있습니다. 특히 소액주주와 기관 투자자를 포함한 다양한 주체들과의 적극적인 소통은, 유상증자와 관련한 의사결정의 투명성을 높이고, 주주와의 협력을 강화하는 중요한 기반이 되고 있기에 당사는 주주들이 당사의 경영전략과 유상증자의 목적을 보다 명확하게 이해할 수 있도록 적극적으로 소통하고 있습니다.
3) 기업가치 제고를 통한 실질적인 주주 이익 환원
당사는 금번 유상증자를 통해 확보된 자금을 바탕으로 핵심 파이프라인의 연구개발을 성공적으로 완수하고, 기술이전 및 상업화를 통해 실질적인 기업 성장을 이루어내는 데 모든 역량을 집중할 것입니다.
- 핵심 사업의 성공적 추진: CU06, CU71 등 주요 파이프라인의 임상적 가치를 입증하고, 글로벌 기술이전 또는 자체 상업화를 통해 기업가치를 극대화하겠습니다.
- 신성장 동력 확보: 원료의약품 유통사업 등 신규 사업의 안정적인 시장 진입과 성장을 도모하고, 지속적인 연구개발을 통해 미래 성장 가능성이 높은 신규 파이프라인을 확보하겠습니다.
- 합리적인 주주환원 정책 수립 검토: 회사의 지속적인 성장과 이익 실현이 안정적인 궤도에 오르면, 재무 상태, 향후 투자 계획, 시장 상황 등을 종합적으로 고려하여 배당, 자사주 매입/소각 등 주주가치를 제고할 수 있는 다양한 방안을 적극적으로 검토하고, 관련 정책 수립 시 투명하게 공시하고 시행할 수 있도록 노력하겠습니다.
4) 이사회 중심의 투명하고 책임 있는 경영체제 확립
당사는 이사회의 독립성과 전문성을 강화하고, 경영진에 대한 효과적인 감독 기능을 수행함으로써 투명하고 책임 있는 경영체제를 구축하겠습니다. 이사회는 주주의 이익을 최우선으로 고려하여 의사결정을 하며, 모든 경영활동은 관련 법규와 정관을 준수하여 이루어질 것입니다. 또한, 내부회계관리제도의 효과적인 운영과 내부통제시스템 강화를 통해 경영의 투명성과 신뢰성을 지속적으로 높여나가겠습니다.
당사는 상기 언급된 주주 권익 보호 방안들을 성실히 이행하고, 끊임없는 혁신과 성장을 통해 주주님들의 기대에 부응할 수 있도록 최선을 다할 것을 약속드립니다.
② 증자비율 및 할인율
당사는 금번 주주배정 후 실권주 일반공모 유상증자를 통해 파이프라인별 임상연구비용 및 신규사업을 위한 자본금 확충 등 회사의 지속적인 성장을 위한 운영자금을 확충하고 재무적인 안정성을 확보하고자 합니다. 이를 통해 주주가치를 극대화하고, 장기적으로 경쟁력을 갖춘 기업으로 도약할 수 있도록 최선을 다 할 것입니다.
증자비율은 기업의 필요 자금 규모와 주주가치 보호의 균형을 고려하여 다양한 비율로 결정되어야 하며, 증자비율이 과도하게 높을 경우 시장에서 재무 상태에 대한 부정적인 신호로 해석될 가능성이 있고 기존 주주들의 주주가치가 훼손될수 있어 적정한 수준에서 결정하는 것이 중요합니다. 할인율의 경우 「증권의 발행 및 공시 등에 관한 규정」에 의거 주주배정 유상증자의 경우 40% 이내에서 결정할 수 있으며, 기존주주들의 지분 희석 정도를 감안하여 적정 할인율에 대한 결정이 필요합니다.
이에, 기존 주주의 권익을 보호하면서도 장기적인 기업가치 상승을 기대할 수 있는 조건을 결정하기 위해 당사의 이사회는 과거 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 토대로 금번 유상증자의 증자비율과 할인율 적정성 검토 및 논의를 진행하였습니다. 당사가 이사회 논의에서 참고한 유사업종 유상증자 사례는 다음과 같습니다.
| [최근(2023년~2025년) 발행규모 250억원~350억원 규모 유상증자 사례] |
| (단위: 억원, 원, %) |
| 회사명 | 납입일 | 발행금액(억원) | 발행가(원) | 할인율 | 증자비율 |
|---|---|---|---|---|---|
| 젠큐릭스 | 2023.04.20 | 254 | 3,925 | 25% | 92.65% |
| 엘앤케이바이오 | 2023.07.13 | 260 | 3,980 | 25% | 48.67% |
| 클리노믹스 | 2023.08.10 | 276 | 3,540 | 25% | 55.71% |
| 뉴인텍 | 2023.08.17 | 261 | 1,255 | 25% | 69.09% |
| 원익피앤이 | 2023.11.18 | 283 | 5,660 | 25% | 11.78% |
| 유니슨 | 2024.05.03 | 305 | 727 | 25% | 33.24% |
| SG | 2024.06.27 | 318 | 1,061 | 25% | 49.04% |
| 엑시콘 | 2024.07.19 | 333 | 15,130 | 25% | 21.38% |
| 평균 | 25% | 47.69% | |||
| 출처) Dart 전자공시시스템, 당사 제시 |
2023년 이후 당사와 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 분석한 결과, 평균 증자비율은 47.69%, 평균 할인율은 25% 수준으로 파악됩니다. 증자비율의 경우, 자금의 사용목적과 회사의 필요 자금 규모에 따라 21.38% ~ 92.65%까지 다양한 비율로 결정된 반면, 할인율은 대부분 25%를 설정하였습니다.
당사는 이러한 사례를 기반으로 이사회에서 논의를 진행하였고, 본 발행조건이 기존 주주들의 권익 침해를 최소화하고, 주주가치를 제고할 수 있는 적정한 조건이라고 판단하여 금번 유상증자의 할인율 25%, 증자비율 49.97%로 발행 조건을 결정하였습니다.
③ 신사업투자 등
당사는 2025년 03월 06일자로 원료의약품(API) 개발 및 유통 전문기업인 주식회사 대성팜텍을 흡수합병하기로 결정하였으며, 합병 기일은 2026년 01월 28일로 지정되어 흡수합병을 진행할 계획입니다. 대성팜텍과 합병을 계기로 당사 또한 원료의약품 수입, 도소매업을 신규사업으로 진행하기로 결정하였습니다. 신규사업은 신규 법인을 설립하거나, 타법인증권취득이 아니라 기존 법인인 당사에서 진행할 예정이며, 이를 위하여 금번 유상증자 자금 중 5억원이 자본금 확충의 목적으로 소요될 예정입니다.
신규 사업과 관련한 위험은 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 1. 사업위험 - 라. 신규사업(원료의약품 수입, 도소매업) 영위에 따른 위험'을 참고하여 주시기 바랍니다.
그 외 세부 자금사용 계획에 대해서는 '제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적'을 참고하여 주시기 바랍니다.
④ 경영권 분쟁발생
증권신고서 제출 전일 기준 당사의 최대주주 권영근 의장은 약 12.91%의 지분율을 확보하고 있으며, 금번 주주배정 후 실권주 일반공모에 최대주주인 권영근 의장은 배정주식수의 약 30%을 참여할 계획입니다. 당사 발행주식총수의 5% 이상 지분율을 보유한 주주는 최대주주 이외에 없고 소액주주들에게 지분율이 분산되어 있어 최대주주의 변경 및 경영권 분쟁발생 가능성은 제한적일 것으로 판단하고 있습니다. 최대주주 지분율 약화에 따른 경영권 변동 및 분쟁 관련 위험은 '제1부 모집 또는 매출에 관한 사항 중 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 2. 회사위험 - 나. 최대주주 변경 및 지분희석 등 경영권 관련 위험'을 참고하여 주시기 바랍니다.
⑤ 한계기업 등
당사는 임상 및 연구개발비용으로 인해 지속적인 영업적자 및 당기순손실이 발생하고 결손금이 누적되고 있어 자본총계가 감소하는 추세이고 부채비율은 급격하게 상승하고 있습니다. 이처럼 당사는 성장성, 수익성, 안정성, 활동성, 유동성 등 전반적인 재무지표가 악화되는 추세를 보이고 있습니다.
2024년 말 감사보고서상 외부감사인의 감사 결과 계속기업 관련 중요한 불확실성은 없는 상황이지만 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06 기술이전 계약이 2024년 07월 12일부로 파트너사의 내부 개발 전략 변경에 따라 해지되었으며, 당사는 해당 물질에 대한 모든 권리를 반환받으면서 2024년부터 당사의 전반적인 재무지표가 악화되고 있습니다.
당사의 재무 관련 위험은 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 2. 회사위험 - 라. 재무안정성 관련 위험'을 참고하여 주시기 바랍니다.
⑥ IPO실적 과다 추정
당사는 2021년 07월 22일 코스닥시장에 기술특례상장 하였으며, 증권신고서를 통해 2024년 매출액 예측치를 70,318백만원로 추정하였으나, 실적치는 1,633백만원으로 약 97.68%의 괴리율이 발생하였습니다.
본 증권신고서 '제2부-X. 그 밖에 투자자 보호를 위하여 필요한 사항-4. 작성기준일 이후 발생한 주요사항 등 기타사항-1. 상장기업의 재무사항 비교표'에 IPO 당시 추정 실적과 실제 실적의 괴리 발생 원인과 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다.
상기 서술한 내용을 종합해 보면, 당사는 과거 IPO 실적을 과다 추정한 점 및 재무지표 악화 경위와 이에 따른 위험 및 극복 방안 등에 대한 설명이 미흡한 점을 사유로 금융감독원으로부터 중점심사 대상으로 지정되었습니다. 이에 당사는 증권신고서 제출 전일 기준 중점심사 대상의 주요 심사항목에 대한 내용을 상세히 기재하였으며, 금번 주주배정 후 실권주 일반공모 유상증자의 당위성을 설명하고 주주권익 보호 활동을 적극적으로 이행할 것입니다. 다만, 중점심사 대상으로 지정됨에 따라 증권신고서 심사 과정이 엄격하게 진행될 수 있으며, 이 과정에서 금융감독원으로부터 정정요구가 발생할 경우 유상증자 일정이 지연되는 등 절차 진행에 제약이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(주15) 정정 전
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 「금융투자회사의 기업실사 모범규준」을 참조하여 작성된 대표주관회사인 한양증권(주)의 내부규정에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 한양증권(주)입니다. 발행회사인 (주)큐라클은 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 회 사 명 | 고 유 번 호 |
|---|---|---|
| 대표주관회사 | 한양증권(주) | 00162416 |
2. 분석의 개요
대표주관회사인 한양증권(주)는「자본시장과 금융투자업에 관한 법률」제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한 「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 2012년 2월 1일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사인 한양증권(주)가 기업실사과정을 통해 발행회사인 (주)큐라클로부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 주주배정후 실권주 일반공모 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
| 「금융투자회사의 기업실사 모범규준」 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 ‘리스크관리위원회 등’)의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요내용
| 일자 | 기업 실사 내용 |
|---|---|
| 2025년 04월 04일 |
* 발행회사 방문 - 자금조달 목적 등 발행회사 의견 청취 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 주요 사항 및 일정 체크 - 유상증자 상세 일정 등 업무 협의 |
| 2025년 04월 07일~ 04월 14일 |
* 발행회사 및 해당 산업 조사 - 회사 정관 등 기본자료 수령 - 공시 및 뉴스 내용 등을 통한 발행회사 및 산업 이해 - 경영진 평판 리스크 검토 - 관련 Q&A 등 * 유상증자 리스크검토 - 발행시장 상황, 자금조달규모 적정성공모가액 희망 할인율 검토 |
| 2025년 04월 15일 ~ 04월 28일 |
* 발행회사 방문 및 보고서 작성 * Due-diligence checklist에 따라 투자위험요소 실사 1) 사업위험관련 실사 - 영위중인 사업 등에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 - 최대주주의 지분율 및 경영권 안정성 검토 - 주요 계정과목별 재무수치 변동요인 검토 - 원장 및 각종 명세서 등 검토 - 주요 계약관련 계약서 및 등의 확인 - 각 부서 주요 담당자 인터뷰 * 주요 경영진 면담 - 경영진 평판 리스크 검토 - 자금 사용 목적 등에 관한 청취 |
| 2025년 04월 29일 ~ 05월 21일 |
* 실시간 실사자료 요청 및 확인/검토 * 증권신고서 작성에 대한 조언 * 이사회의사록 검토/인수계약서 작성 및 검토 |
4. 실사참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
| 한양증권(주) | 기업금융부 | 유문성 | 상무 | 증자업무 총괄 | 2025년 04월 04일 ~ 2025년 05월 21일 | 기업금융업무 21년 |
| 한양증권(주) | 기업금융부 | 안병종 | 상무 | 기업실사 | 2025년 04월 04일 ~ 2025년 05월 21일 | 기업금융업무 25년 |
| 한양증권(주) | 기업금융부 | 정경훈 | 부장 | 기업실사 책임 | 2025년 04월 04일 ~ 2025년 05월 21일 | 기업금융업무 13년 |
| 한양증권(주) | 기업금융부 | 장창환 | 대리 | 기업실사 실무 | 2025년 04월 04일 ~ 2025년 05월 21일 | 기업금융업무 7년 |
| 한양증권(주) | 기업금융부 | 윤상호 | 대리 | 기업실사 실무 | 2025년 04월 04일 ~ 2025년 05월 21일 | 기업금융업무 4년 |
[발행회사]
| 소속 | 부서 | 성명 | 직위 | 담당업무 |
|---|---|---|---|---|
| (주)큐라클 | 사장 | 유재현 | CEO | 발행 및 실사 책임 |
| 전략기획실 | 최재진 | 상무이사 | 발행 및 실사 책임 | |
| 경영관리본부 | 황용 | 이사 | 실사자료 작성 및 제공 | |
| 전략기획실 | 배지훈 | 차장 | 실사자료 작성 및 제공 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 한양증권(주)는 (주)큐라클이 2025년 05월 16일 및 2025년 05월 22일 이사회에서 결의한 기명식 보통주 7,000,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적요인 | ▶ 동사가 주력하는 난치성 혈관질환 치료제 시장은 미충족 의료 수요가 높아 지속적인 성장이 전망됩니다. ▶ 동사는 기존 치료제의 한계를 극복할 수 있는 혁신 신약 후보물질을 개발 중이며, 특히 CU06 임상2a상에서 긍정적 가능성을 확인하였습니다. ▶동사는 혈관내피세포 기능장애에 기반한 난치성 혈관질환 및 만성 염증성 질환 치료제를 연구개발하고 있으며, 이는 신규 파이프라인 확장 및 기술 경쟁력 강화에 기여할 것입니다. |
| 부정적요인 |
▶ 신약 개발은 성공 확률이 매우 낮고 장기간 막대한 비용이 소요되는 본질적인 위험을 내포하고 있습니다.
▶ 임상시험 결과가 기대에 미치지 못하거나 규제 당국의 허가 기준을 충족하지 못할 경우, 상업화 지연 또는 실패 가능성이 존재합니다. ▶ 현재까지 안정적인 매출 부재로 연구개발 투자에 따른 영업손실이 지속되고 있으며, 향후 자금 조달의 불확실성은 재무 안정성을 저해할 수 있습니다.
|
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 운영자금으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 동사가 제출한 자료와 당사가 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 용역을 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다 하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025년 05월 22일 |
| 대표주관회사 : 한양증권 주식회사 |
| 대표이사 임 재 택 |
(주15) 정정 후
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 「금융투자회사의 기업실사 모범규준」을 참조하여 작성된 대표주관회사인 한양증권(주)의 내부규정에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 한양증권(주)입니다. 발행회사인 (주)큐라클은 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 회 사 명 | 고 유 번 호 |
|---|---|---|
| 대표주관회사 | 한양증권(주) | 00162416 |
2. 분석의 개요
대표주관회사인 한양증권(주)는「자본시장과 금융투자업에 관한 법률」제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한 「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 2012년 2월 1일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사인 한양증권(주)가 기업실사과정을 통해 발행회사인 (주)큐라클로부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 주주배정후 실권주 일반공모 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
| 「금융투자회사의 기업실사 모범규준」 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 ‘리스크관리위원회 등’)의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요내용
| 일자 | 기업 실사 내용 |
|---|---|
| 2025년 04월 04일 |
* 발행회사 방문 - 자금조달 목적 등 발행회사 의견 청취 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 주요 사항 및 일정 체크 - 유상증자 상세 일정 등 업무 협의 |
| 2025년 04월 07일~ 04월 14일 |
* 발행회사 및 해당 산업 조사 - 회사 정관 등 기본자료 수령 - 공시 및 뉴스 내용 등을 통한 발행회사 및 산업 이해 - 경영진 평판 리스크 검토 - 관련 Q&A 등 * 유상증자 리스크검토 - 발행시장 상황, 자금조달규모 적정성공모가액 희망 할인율 검토 |
| 2025년 04월 15일 ~ 04월 28일 |
* 발행회사 방문 및 보고서 작성 * Due-diligence checklist에 따라 투자위험요소 실사 1) 사업위험관련 실사 - 영위중인 사업 등에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 - 최대주주의 지분율 및 경영권 안정성 검토 - 주요 계정과목별 재무수치 변동요인 검토 - 원장 및 각종 명세서 등 검토 - 주요 계약관련 계약서 및 등의 확인 - 각 부서 주요 담당자 인터뷰 * 주요 경영진 면담 - 경영진 평판 리스크 검토 - 자금 사용 목적 등에 관한 청취 |
| 2025년 04월 29일 ~ 05월 21일 |
* 실시간 실사자료 요청 및 확인/검토 * 증권신고서 작성에 대한 조언 * 이사회의사록 검토/인수계약서 작성 및 검토 |
| 2025년 05월 22일 ~ 06월 08일 | - 실사보고서 작성 - 증권신고서 작성 가이드 및 주가자료 작성 |
4. 실사참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
| 한양증권(주) | 기업금융부 | 유문성 | 상무 | 증자업무 총괄 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 21년 |
| 한양증권(주) | 기업금융부 | 안병종 | 상무 | 기업실사 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 25년 |
| 한양증권(주) | 기업금융부 | 정경훈 | 부장 | 기업실사 책임 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 13년 |
| 한양증권(주) | 기업금융부 | 장창환 | 대리 | 기업실사 실무 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 7년 |
| 한양증권(주) | 기업금융부 | 윤상호 | 대리 | 기업실사 실무 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 4년 |
[발행회사]
| 소속 | 부서 | 성명 | 직위 | 담당업무 |
|---|---|---|---|---|
| (주)큐라클 | 사장 | 유재현 | CEO | 발행 및 실사 책임 |
| 전략기획실 | 최재진 | 상무이사 | 발행 및 실사 책임 | |
| 경영관리본부 | 황용 | 이사 | 실사자료 작성 및 제공 | |
| 전략기획실 | 배지훈 | 차장 | 실사자료 작성 및 제공 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 한양증권(주)는 (주)큐라클이 2025년 05월 16일 및 2025년 05월 22일 이사회에서 결의한 기명식 보통주 7,000,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적요인 |
▶ 동사가 주력하는 난치성 혈관질환 치료제 시장은 미충족 의료 수요가 높아 지속적인 성장이 전망됩니다. |
| 부정적요인 |
▶ 신약 개발은 성공 확률이 매우 낮고 장기간 막대한 비용이 소요되는 본질적인 위험을 내포하고 있습니다.
▶ 임상시험 결과가 기대에 미치지 못하거나 규제 당국의 허가 기준을 충족하지 못할 경우, 상업화 지연 또는 실패 가능성이 존재합니다. ▶ 현재까지 안정적인 매출 부재로 연구개발 투자에 따른 영업손실이 지속되고 있으며, 향후 자금 조달의 불확실성은 재무 안정성을 저해할 수 있습니다.
|
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 운영자금으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 동사가 제출한 자료와 당사가 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 용역을 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다 하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025년 06월 09일 |
| 대표주관회사 : 한양증권 주식회사 |
| 대표이사 임 재 택 |
(주16) 정정 전
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
| (단위 : 원) |
| 구 분 | 금 액 |
|---|---|
| 모집 또는 매출총액(1) | 28,595,000,000 |
| 발행제비용(2) | 600,000,000 |
| 순 수 입 금 [ (1)-(2) ] | 27,995,000,000 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 3) 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. |
나. 발행제비용의 내역
| (단위 : 원) |
| 구 분 | 금 액 | 계산근거 |
|---|---|---|
| 발행분담금 | 5,147,100 | 모집총액의 0.018% (10원 미만 절사) |
| 인수수수료 | 514,710,000 | 모집총액의 1.80% |
| 상장수수료 | 4,460,000 | 430만원 + 300억원 초과금액의 10억원당 8만원 |
| 등록세 | 14,000,000 | 증자 자본금의 0.4% |
| 교육세 | 2,800,000 | 등록세의 20% |
| 기타비용 | 59,202,900 | 구주주 청약서, 투자설명서 인쇄 및 발송비 등 |
| 합 계 | 600,000,000 | - |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가, 유관기관 정책 등에 따라 변동될 수 있습니다. |
| 주3) 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사는 금번 유상증자를 통해 조달한 자금을 다음과 같이 사용할 예정입니다.
| (기준일 : | 2025년 05월 21일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 27,995 | - | - | 600 | 28,595 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액이며, 향후 발행가액 확정 시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) 발행제비용은 공모금액 및 실권규모, 유관기관과의 협의 등에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 발행제비용은 공모금액에서 지급될 예정이나, 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 운영자금(연구개발비)으로 지출할 예정입니다. |
나. 공모자금 세부 사용목적
당사가 금번 공모 유상증자를 통해 조달한 순수입금 약 27,995백만원은 CU06 미국 당뇨병성 황반부종 임상 2b상, CU71 미국 알츠하이머병 임상 1상 등 주요 파이프라인의 연구개발(R&D) 진척, 전체 임상시험 및 연구개발 활동에 필요한 공통 소모품 구매 및 장비 유지보수, 그리고 원료의약품 유통사업 진출을 위한 자본금 확충 등에 사용될 계획입니다.
신약 연구개발은 장기간이 소요되며 대규모 투자가 수반되는 분야입니다. 각 임상시험 단계마다 성공 가능성이 낮으며, 예상치 못한 결과나 부작용 발생, 규제기관의 승인 지연 또는 실패 등 다양한 변수로 인해 개발이 중단될 수 있습니다. 특정 파이프라인의 임상시험이 실패할 경우, 해당 파이프라인에 투입된 연구개발 비용은 회수되지 않을 수 있으며, 이는 당사의 재무 상태 및 향후 사업 계획에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이러한 신약 개발의 본질적인 위험을 충분히 인지하시고 투자 결정을 내리시기 바랍니다.
금번 유상증자 자금 사용내역 우선순위는 아래와 같습니다.
| [금번 유상증자 자금 사용내역 우선순위] |
| (단위: 백만원) |
| 구분 | 세부내역 | 내용 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 금액 | 우선순위 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 운영자금 | R&D CU06 | 미국 임상2b상 운영, 비임상, 약물 개발 및 생산 | 1,555 | 3,602 | 1,130 | 585 | 1,580 | 2,090 | 2,200 | 2,200 | 14,942 | 1 |
| 운영자금 | R&D CU71 | 미국 임상1상 운영, 비임상, 약물 개발 및 생산 | 550 | 1,602 | 1,090 | 420 | 1,360 | 1,650 | 920 | 2,700 | 10,292 | 2 |
| 운영자금 | R&D CU01 | 국내 임상2b상 운영, 임상3상 약물 생산 | 550 | 550 | 350 | 0 | 100 | 350 | 0 | 0 | 1,900 | 3 |
| 기타자금 | 원료의약품 사업진출 | 원료의약품 유통사업 자본금 확충 | 0 | 500 | 0 | 0 | 0 | 0 | 0 | 0 | 500 | 4 |
| 운영자금 | R&D 기타 | 연구개발 공통 소모품 구매 및 연구 장비 유지보수 | 45 | 78 | 238 | 0 | 0 | 0 | 0 | 0 | 361 | 5 |
| 합계 | 2,700 | 6,332 | 2,808 | 1,005 | 3,040 | 4,090 | 3,120 | 4,900 | 27,995 | - | ||
| 주1) 상기 발행제비용은 공모자금에 포함되어 있지 아니합니다. (별도 모집총액에서 차감 또는 자체자금 사용) |
| 주2) 상기 자금 사용 계획은 현재 당사의 사업 전략 및 시장 상황을 고려하여 수립된 예측치이며, 향후 연구개발 진행 상황, 임상시험 결과, 시장 환경 변화, 규제기관과의 협의 내용 등에 따라 실제 집행 금액, 시기 및 세부 항목이 변경될 수 있습니다. 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(1) R&D CU06 (미국 임상2b상 운영, 비임상, 약물 개발 및 생산 등)
CU06은 당사의 핵심 파이프라인으로, 당뇨병성 황반부종 및 습성 황반변성 치료제로 개발 중입니다. 최근 미국 FDA와의 Type C 미팅을 통해 위약(Placebo) 대조 임상 2b상 진행에 대한 긍정적인 가이드라인을 확보하여, 기존의 표준치료제(Anti-VEGF) 직접 비교 임상 외에 개발 경로의 유연성을 확보하였습니다. 특히 경구 투여 방식의 편의성과 함께, 자체 개발한 신규 제형을 통해 기존 제형 대비 생체 흡수율을 약 2배 개선하여 임상 성공 가능성을 높이고자 합니다.
금번 조달 자금 중 14,942백만원은 CU06의 미국 임상 2b상 시험의 성공적인 수행 및 가치 극대화에 사용될 예정입니다. 주요 사용처는 임상2b상 시험 임상시험계획승인신청(IND) 비용, 개시 준비비용 및 운영비용 그리고 임상약물 개발 및 생산 비용, 비임상 연구 비용 등입니다. 임상시험을 진행하면서 기술이전 가치를 높이기 위한 자체 임상 데이터를 확보하고자 합니다.
| [CU06 주요 자금 사용 계획 (25년 3분기 ~ 27년 2분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 합계 |
|---|---|---|---|---|---|---|---|---|---|
| 임상2b상 시험 IND 비용 | 0 | 200 | 100 | 0 | 0 | 0 | 0 | 0 | 300 |
| 임상2b상 시험 개시 준비비용 | 0 | 1,800 | 900 | 0 | 0 | 0 | 0 | 0 | 2,700 |
| 임상2b상 시험 운영비용 | 0 | 0 | 0 | 500 | 1,500 | 2,000 | 2,200 | 2,200 | 8,400 |
| 임상약물 개발 및 생산 | 1,102 | 1,340 | 100 | 55 | 50 | 60 | 0 | 0 | 2,707 |
| 비임상 연구 | 453 | 262 | 30 | 30 | 30 | 30 | 0 | 0 | 835 |
| 합계 | 1,555 | 3,602 | 1,130 | 585 | 1,580 | 2,090 | 2,200 | 2,200 | 14,942 |
| 출처) 당사 제시 |
| [CU06 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 주요 목적 - 당뇨병성 황반부종(DME) 환자를 대상으로 최적의 CU06-1004("CU06-1004"="CU06") 용량을 도출하여 향후 3상 시험 설계에 반영 부차적 목적 - 24주 후 CU06-1004의 안전성과 유효성 평가 (위약과 비교) - CU06-1004 및 대사체의 혈중 약물동태(PK) 평가 - 혈중 바이오마커(TNF-α, IL-6 등)에 대한 CU06-1004의 영향 분석 |
| 임상시험 대상국가 | 미국 내 20개 기관에서 환자 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 이번 임상시험은 미국 내 20개 의료기관에서 시행되는 무작위배정, 이중눈가림, 위약대조 방식의 다기관 임상 2b상 시험으로, 중심성 당뇨병성 황반부종(Center-Involved Diabetic Macular Edema, DME) 환자를 대상으로 CU06-1004의 유효성과 안전성을 평가하기 위해 설계되었습니다. 총 135명의 환자를 1:1:1 비율로 세 군(200mg, 300mg, 위약)으로 무작위 배정하여, 매일 식사 직후 경구로 24주간 약물을 투여받게 됩니다. - 주 평가 지표는 24주 시점에서의 ETDRS 문자표 기준 최고교정시력(BCVA) 변화량이며, 이외에도 망막 두께, 망막 내/하부 액체량, 혈관 밀도 및 혈류량, 염증성 바이오마커(TNF-α, IL-6) 등의 변화를 포함한 다양한 이차 평가지표들을 통해 약물의 치료 효과를 종합적으로 분석합니다. - 약동학적 특성은 혈중 약물 농도 측정을 통해 파악되며, 안전성은 이상반응 발생률, 생체징후 변화, 심전도 및 혈액검사 등 다양한 지표를 통해 평가됩니다. 주요 유효성 분석은 MMRM(Mixed Model for Repeated Measures)을 이용하며, 300mg과 200mg 용량을 위약과 순차적으로 비교하여 통계적 유의성을 검증합니다. |
| 기대효과 | 본 임상을 통해 CU06-1004가 당뇨병성 황반부종 환자에서 유의미한 시력 개선 및 망막 구조 개선 효과를 나타낼 경우, 기존 항VEGF 주사제 중심의 치료법에 대한 대안으로 자리매김할 수 있을 것으로 기대됩니다. 특히 CU06-1004는 경구 투약이라는 비침습적 제형을 통해, 반복적인 안구 주사로 인한 환자 부담과 내원 횟수를 줄일 수 있는 잠재력을 보유하고 있습니다. 또한, 다양한 시각적 기능 및 구조적 개선 외에도 염증 조절과 혈관 안정화 등의 기전을 입증함으로써, 기존 치료제 대비 차별화된 약물 프로파일을 확보할 수 있습니다. 이번 임상에서 도출되는 최적 용량과 유효성·안전성 데이터는 향후 3상 시험 설계의 근거가 되며, 글로벌 라이선싱 및 상업화를 위한 핵심 기반 자료로 활용될 수 있습니다. 이를 통해 CU06-1004는 DME 치료 분야에서 새로운 경구 치료제로서의 가능성을 입증할 수 있을 것으로 기대됩니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(2) R&D CU71 (미국 임상1상 운영, 비임상, 약물 개발 및 생산 등)
CU71은 알츠하이머병, 혈관성 치매 등 퇴행성 뇌질환 치료를 목표로 하는 First-in-Class 신약 후보물질입니다. 혈액뇌관문(BBB) 기능 조절을 통해 뇌 내 환경을 개선하는 새로운 기전을 가지며, 전임상 연구에서 기존 알츠하이머병 치료제 대비 우수한 인지 기능 개선 효과 및 바이오마커 변화를 확인하였습니다.
금번 조달 자금 중 10,292백만원은 CU71의 미국 임상 1상 진입, 그리고 후속 개발 준비를 위해 사용될 예정입니다. 올해 추가 비임상 연구를 완료하고 2025년 하반기 중 미국 FDA와 Pre-IND 미팅을 진행하여, 2026년 상반기 임상 1상 진입을 목표하고 있습니다. 주요 사용처는 비임상 연구 비용, 임상약물 개발 및 생산 비용, 임상 1상 시험 수행을 위한 임상시험신청(IND), 개시 준비 및 운영비용 등입니다.
| [CU71 주요 자금 사용 계획 (25년 3분기 ~ 27년 2분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 합계 |
|---|---|---|---|---|---|---|---|---|---|
| 비임상 연구 | 500 | 1,022 | 990 | 370 | 510 | 100 | 240 | 150 | 3,882 |
| 임상1상 시험 IND 비용 | 0 | 0 | 0 | 0 | 300 | 0 | 0 | 0 | 300 |
| 임상1상 시험 개시 준비비용 | 0 | 0 | 0 | 0 | 500 | 1,500 | 0 | 0 | 2,000 |
| 임상1상 시험 운영비용 | 0 | 0 | 0 | 0 | 0 | 0 | 630 | 2,500 | 3,130 |
| 임상약물 개발 및 생산 | 50 | 580 | 100 | 50 | 50 | 50 | 50 | 50 | 980 |
| 합계 | 550 | 1,602 | 1,090 | 420 | 1,360 | 1,650 | 920 | 2,700 | 10,292 |
| 출처) 당사 제시 |
| [CU71 임상1상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 이번 임상시험의 목적은 건강한 성인을 대상으로 CU71의 안전성, 내약성, 그리고 약동학적 특성을 평가하는 것입니다. 본 임상시험을 통해 단회 및 반복 투여 시 CU71의 체내 흡수, 분포, 대사 및 배출 특성을 확인하고, 인체 내에서의 안전성과 복용 가능 용량을 도출하여 향후 알츠하이머병 환자를 대상으로 한 임상 2상 진입을 준비하고자 합니다. |
| 임상시험 대상국가 | CU71의 이번 임상 1상 시험은 미국에서 진행될 예정입니다. 미국 식품의약국(FDA)의 승인을 받은 후, 미국 내 전문 임상시험기관에서 국제 임상시험 기준(GCP)을 준수하여 단일기관 방식으로 수행됩니다. |
| 임상시험 수행방법 | 임상시험은 건강한 성인을 대상으로 진행되며, 무작위배정, 이중눈가림, 위약대조 방식으로 설계되었습니다. 시험대상자는 단회 또는 7일간 반복하여 CU71을 경구로 투약받게 되며, 용량은 단계적으로 증량되며, 각 단계에서의 안전성과 약동학 데이터를 기반으로 다음 단계로의 진입 여부가 결정될 예정입니다. 시험 기간 동안 피험자들은 반복적인 혈액 및 소변 채취를 통해 약물의 혈중 농도 및 약동학적 지표를 측정받으며, 동시에 이상반응, 심전도 변화, 활력징후, 임상병리 검사 등을 통해 전반적인 안전성을 평가받게 됩니다. 특히 반복 투여 시 체내 약물 축적 여부를 확인하여 장기간 복용에 대한 위험성도 함께 평가하게 됩니다. |
| 기대효과 | 이번 임상시험을 통해 CU71이 건강한 성인에서 전신적으로 안전하고 예측 가능한 약동학적 특성을 보인다는 것이 입증된다면, 알츠하이머병 환자를 대상으로 한 후속 임상(2상) 진행이 가능해질 것으로 기대됩니다. 특히 CU71은 경구로 복용 가능한 치료제이기 때문에 기존 주사제 기반 치료에 비해 환자의 복약 편의성 및 치료 접근성을 크게 향상시킬 수 있을 것으로 보입니다. 아울러 본 임상 1상을 통해 확보되는 안전성 및 약동학 데이터는 적절한 초기 용량 설정에 중요한 근거가 되며, 후속 개발과 글로벌 파트너십 논의에도 긍정적인 영향을 줄 수 있을 것으로 예상됩니다. CU71은 기존 치료제의 한계를 극복할 수 있는 새로운 치료 옵션으로 자리매김할 가능성을 가진 후보물질로, 이번 임상을 통해 그 가능성을 한 단계 더 검증하는 계기가 될 것입니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(3) R&D CU01 (국내 임상2b상 운영, 임상3상 약물 생산 등)
CU01은 당뇨병성 신증 치료제로 개발 중이며, 현재 국내에서 임상 2b상 대상자 투약이 약 90% 완료되어 올해 하반기 임상 종료를 목표로 하고 있습니다.
조달 자금 중 1,900백만원은 CU01의 국내 임상 2b상 운영비용, 데이터 분석 및 보고 그리고 임상3상 시험 준비를 위한 원료의약품 구매 및 완제의약품 제조 활동에 투입될 예정입니다.
| [CU01 주요 자금 사용 계획 (25년 3분기 ~ 26년 4분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 합계 |
|---|---|---|---|---|---|---|---|
| 임상2b상 운영비용 | 500 | 500 | 300 | 0 | 0 | 0 | 1,300 |
| 임상3상 시험 원료의약품 구매 및 완제의약품 제조 | 0 | 0 | 0 | 0 | 100 | 350 | 450 |
| 데이터 분석 및 보고 | 50 | 50 | 50 | 0 | 0 | 0 | 150 |
| 합계 | 550 | 550 | 350 | 0 | 100 | 350 | 1,900 |
| 출처) 당사 제시 |
| [CU01 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 |
본 임상시험은 알부민뇨를 동반한 제2형 당뇨병성 신증 환자를 대상으로, 당사의 신약 후보물질인 CU01-1001("CU01-1001"="CU01")을 24주간 투여하여 유효성과 안전성을 평가하고, 동시에 적절한 투여 용량을 탐색하기 위해 설계되었습니다. 당뇨병성 신증은 진행 시 투석 등 중증 합병증으로 이어질 수 있음에도 불구하고 현재까지 뚜렷한 치료제가 없는 영역으로, 이번 임상시험은 CU01-1001의 치료 가능성을 과학적이고 객관적인 방식으로 입증하고자 하는 데 목적이 있습니다. |
| 임상시험 대상국가 | 해당 임상시험은 대한민국 내에서만 진행되는 국내 임상시험으로 총 24개 의료기관에서 다기관 임상 형식으로 진행 중이며, 국내 환자 240명을 대상으로 모집 및 투약이 진행됩니다. |
| 임상시험 수행방법 |
본 임상시험은 알부민뇨가 동반된 제2형 당뇨병성 신증 환자를 대상으로 실시됩니다. 시험대상자에게는 당사의 임상시험용 의약품인 CU01-1001을 1일 2회 또는 1일 3회, 1회 120mg씩 경구 투여하며, 총 24주간 투여 후 유효성과 안전성을 평가하게 됩니다. 또한, 이번 임상은 다양한 환자 환경에서의 치료 효과를 평가하고자 하는 탐색적 임상시험의 성격을 가지며, 다기관, 무작위배정, 이중눈가림, 위약 대조, 평행설계 방식으로 설계되었습니다. |
| 기대효과 |
당뇨병성 신증은 제2형 당뇨병 환자에서 흔히 발생하는 만성 합병증으로, 진행 시 신기능 저하 및 말기신부전으로 이어질 수 있음에도 불구하고 현재까지 신장 기능을 유지하거나 개선하는 치료제는 부재한 상황입니다. 이번 임상시험은 CU01-1001이 당뇨병성 신증 환자에서 알부민뇨(단백뇨)의 개선 효과와 추정 사구체 여과율(eGFR) 등을 유의하게 개선할 수 있는지를 확인하는 것으로, 기존 RAS 차단제(ACEi, ARB) 중심 등의 치료 전략에서 벗어나, 새로운 기전의 치료 옵션 가능성을 제시할 수 있습니다. 또한, CU01-1001이 충분한 안전성과 유효성을 입증할 경우, 질병의 조기 개입을 통해 신장 기능의 악화를 지연시키고, 말기 환자들의 투석 의존도를 낮추는 임상적 가치가 클 것으로 기대됩니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(4) 운영자금 - 원료의약품 사업진출 (원료의약품 유통사업 자본금 확충)
당사는 신규 성장 동력 확보 및 사업 포트폴리오 다각화의 일환으로 원료의약품 유통사업 진출을 계획하고 있습니다. 이를 위해 「약사법」제38조제1항 및 관련 동법 시행규칙 제31조의2제2항에서 정하는 의약품 도매상의 자본금 요건(5억원 이상)을 충족시키고자 합니다.
조달 자금 중 500백만원은 원료의약품 유통사업을 위해 자본금 확충에 사용될 예정입니다. 이는 2025년 4분기에 집행될 계획이며, 안정적인 사업 개시를 위한 기반을 마련하는 데 기여할 것입니다.
(5) R&D 기타 (임상시험 공통 소모품 구매 및 연구 장비 유지보수)
당사는 개별 파이프라인 연구개발 활동 외에도, 다수의 임상시험 및 연구개발 과제를 원활하게 수행하기 위한 공통적인 지원 비용이 발생합니다. 이러한 비용은 특정 파이프라인에 직접 배부하기 어려운 연구 인프라 유지 및 공통 연구 활동 지원에 필수적입니다.
조달 자금 중 361백만원은 다양한 파이프라인의 비임상 및 초기 연구 단계에서 공통적으로 사용되는 고순도 시약, 실험용 세포주, 배지, 각종 실험기자재(튜브, 플레이트, 필터 등) 및 기타 연구용 소모품의 구매에 사용될 예정입니다.
또한, HPLC, 질량분석기, 분리분석기, 세포배양기 등 고가의 정밀 연구 장비에 대한 정기적인 유지보수 계약, 부품 교체, 교정 서비스, 소프트웨어 업데이트 등에도 자금이 투입되어 장비의 성능을 최적으로 유지하고 신뢰성 있는 연구 결과를 도출하는 데 기여할 것입니다.
이와 함께 연구소 실험실 운영에 필요한 유틸리티 비용, 폐기물 처리, 실험실 안전 관리 등 공통 시설 유지 관리에 필요한 경비와 연구 데이터의 체계적인 관리, 백업, 보안을 위한 시스템 운영 비용 및 전문 소프트웨어 라이선스 구매 및 갱신 비용으로도 사용될 계획입니다.
| [R&D 기타 주요 자금 사용 계획 (25년 3분기 ~ 26년 1분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 합계 |
|---|---|---|---|---|
| 연구용 공통 소모품/시약 구매 | 20 | 30 | 100 | 150 |
| 연구 장비 유지보수/관리 | 15 | 28 | 88 | 131 |
| 공통 연구 시설 관리비 | 5 | 10 | 30 | 45 |
| 연구 데이터 관리/라이선스 비용 등 | 5 | 10 | 20 | 35 |
| 합계 | 45 | 78 | 238 | 361 |
| 출처) 당사 제시 |
상기 자금 사용 계획의 연도별/분기별 배분은 예상되는 연구개발 일정 및 각 과제의 진행 상황에 따라 실제 집행 과정에서 변동될 수 있으며, 중요한 변경 사항 발생 시 관련 규정에 따라 정기보고서에 공시할 예정입니다.
다. 자금이 계획대로 조달되지 않을 경우의 대응 방안
금번 주주배정 후 실권주 일반공모의 경우 확정발행가액 결정에 따라 최종 조달자금의 변동될 수 있습니다. 자금 사용계획에 대한 우선순위는 상기 기재한 바와 같으며, 금번 주주배정 후 실권주 일반공모를 진행하는 동안 주가 하락에 의하여 유입되는 자금이 감소할 경우 당사의 대응 방안은 다음과 같습니다.
가) 임상시험 비용 계획 조정
당사는 효율적인 자금 운용과 연구개발 활동의 최적화를 위해 임상시험 비용을 세밀하게 조정할 예정입니다. 금번 공모자금이 당사 예상 대비 줄어들 경우, 당사는 진행 중인 임상 연구 프로젝트 및 연구 과제에 대한 우선 순위를 재평가하여, 자문비용 및 데이터 사용 비용, 외부 전문가 활용 비용을 절감할 방안을 모색할 예정입니다. 이를 위해, 당사는 내부의 R&D 인력을 적극 활용하여 연구 개발 활동을 수행함으로써 외주 비용을 최소화하고, 동시에 내부 역량을 강화해 나갈 계획입니다. 이러한 전략적 조정을 통해, 당사는 제한된 자금을 가장 중요한 연구개발 활동에 효과적으로 할당하고, 장기적으로 회사의 핵심 가치와 성장 잠재력을 높일 수 있을 것으로 기대합니다
라. 유상증자 진행 배경
당사가 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 자금을 조달하고자 하는 주요 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 후속 파이프라인 연구개발 투자 및 지속 가능한 성장 기반 마련
당사는 핵심 파이프라인 외에도 MT-101(급성 신손상 및 만성 신부전), MT-103(습성 황반변성 등 안과질환 이중항체), CP01-R01(반려동물 만성신장질환 치료제) 등 유망한 후속 및 신규 파이프라인 포트폴리오를 보유하고 있습니다. 이러한 파이프라인들의 비임상 및 초기 임상 연구개발을 가속화하고, 혁신적인 신약 포트폴리오를 지속적으로 확장하기 위해서는 선제적이고 적극적인 연구개발 투자가 필수적입니다. 이는 단기적인 성과뿐만 아니라 중장기적인 기업 성장의 발판을 마련하는 데 중요한 역할을 할 것입니다.
3) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
4) 연구개발 역량 강화 및 안정적인 운영자금 확보를 통한 경영 효율화
신약 개발은 고도의 전문성을 갖춘 연구인력과 첨단 연구시설 및 장비가 필수적인 분야입니다. 우수한 연구인력을 지속적으로 확보하고 유지하며, 최적의 연구 환경을 조성하기 위해서는 안정적인 운영자금 확보가 선행되어야 합니다. 금번 유상증자를 통해 조달되는 자금은 핵심 연구인력에 대한 투자, 연구 인프라의 효율적 운영 및 관리, 그리고 전반적인 경영활동의 안정성을 제고하는 데 사용될 것입니다. 이는 당사가 예측 불가능한 외부 환경 변화에 유연하게 대응하고, 장기적인 비전을 가지고 연구개발에 매진할 수 있는 재정적 토대를 마련해 줄 것입니다.
5) 제약ㆍ바이오 산업 환경 변화에 대한 능동적 대응 및 경쟁 우위 확보
글로벌 제약ㆍ바이오 시장은 기술 발전 속도가 매우 빠르고 경쟁이 치열한 분야입니다. 이러한 환경 속에서 경쟁 우위를 확보하고 지속적으로 성장하기 위해서는 혁신적인 기술력과 함께 신속한 의사결정, 그리고 이를 뒷받침할 수 있는 충분한 자금력이 중요합니다. 당사는 금번 자금 조달을 통해 빠르게 변화하는 시장 환경과 기술 트렌드에 능동적으로 대응하고, 핵심 기술 및 파이프라인의 경쟁력을 강화하여 글로벌 시장에서 입지를 다져나갈 계획입니다.
6) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
마. 주주 권익 보호를 위한 사항
당사는 금번 유상증자를 추진함에 있어 주주님들의 이익을 최우선으로 고려하며, 유상증자 이후에도 지속적인 주주가치 제고를 위해 다음과 같은 정책을 추진하고 주주님들과의 소통을 강화하고자 합니다.
1) 투명하고 공정한 정보 제공 강화
당사는 유상증자의 진행 과정, 조달 자금의 구체적인 사용 계획 및 집행 내역, 주요 경영 활동, 임상시험의 진행 상황 및 결과 등 주주 및 투자자분들의 의사결정에 중대한 영향을 미칠 수 있는 모든 정보를 관련 법규 및 규정을 철저히 준수하여 금융감독원 전자공시시스템(DART) 및 당사 홈페이지를 통해 신속, 정확, 충분하게 공시하겠습니다. 특히, 분기별 사업보고서 및 정기적인 IR 자료를 통해 조달 자금의 사용 현황을 상세히 안내하고, 자금 집행의 투명성을 확보하여 주주님들의 신뢰를 높이는 데 주력할 것입니다. 또한, 예측 정보나 미래 전망에 대해서는 합리적인 근거를 제시하고 발생 가능한 위험 요인에 대해서도 충분히 설명하여 투자자 보호에 만전을 기하겠습니다.
2) 적극적이고 다각적인 IR 활동을 통한 소통 활성화
당사는 주주님들과의 열린 소통을 경영의 중요한 가치로 여기고 있습니다. 이를 위해 국내외 기관투자자, 애널리스트, 언론뿐만 아니라 개인 주주님들을 포함한 모든 시장 참여자들과의 소통 채널을 확대하고 다각화할 계획입니다.
- 정기 및 비정기 기업설명회(IR) 및 주주간담회 개최: 연간 경영실적 발표회 외에도, 주요 경영 현안 발생 시 또는 시장의 관심이 높을 경우, 온/오프라인 기업설명회를 수시로 개최할 예정입니다. 특히, 당사는 금번 유상증자의 배경 및 회사의 향후 성장 전략을 주주님들께 상세히 설명드리고 의견을 경청하기 위해 2025년 05월 29일에 주주간담회를 개최할 예정입니다. 간담회의 구체적인 시간 및 장소, 참여 방법 등은 추후 당사 홈페이지 공지 및 별도 안내를 통해 신속히 알려드리겠습니다. 이를 통해 당사의 경영 전략, 연구개발 진행 상황, 향후 비전 등을 상세히 설명하고 질의응답 시간을 통해 주주님들의 궁금증을 해소하겠습니다.
- 소그룹 미팅 및 컨퍼런스 참여: 국내외 주요 투자 컨퍼런스에 적극적으로 참여하고, 기관투자자 및 애널리스트들을 대상으로 한 미팅을 정기적으로 진행하여 심도 있는 정보를 제공하고 상호 이해도를 높이겠습니다.
- 주주서한 및 온라인 소통 강화: 금번 유상증자와 관련하여 2025년 05월 16일 주주서한을 통해 회사의 입장을 전달드린 바와 같이, 앞으로도 중요한 경영 사항 발생 시 주주서한, 회사 홈페이지 공지, FAQ 게시, 이메일 문의 답변 등을 통해 주주님들과 적극적으로 소통하겠습니다. 특히 소액주주님들의 정보 접근성을 높이기 위해 노력하겠습니다.
- 주주총회의 내실 있는 운영: 정기 및 임시 주주총회를 단순한 의결 절차를 넘어, 주주님들과 경영진이 회사의 발전 방향에 대해 심도 있게 논의하고 의견을 교환하는 소통의 장으로 만들어가겠습니다.
| [주주서한] |
|
|
|
| 출처) 당사 홈페이지 |
3) 기업가치 제고를 통한 실질적인 주주 이익 환원
당사는 금번 유상증자를 통해 확보된 자금을 바탕으로 핵심 파이프라인의 연구개발을 성공적으로 완수하고, 기술이전 및 상업화를 통해 실질적인 기업 성장을 이루어내는 데 모든 역량을 집중할 것입니다.
- 핵심 사업의 성공적 추진: CU06, CU71 등 주요 파이프라인의 임상적 가치를 입증하고, 글로벌 기술이전 또는 자체 상업화를 통해 기업가치를 극대화하겠습니다.
- 신성장 동력 확보: 원료의약품 유통사업 등 신규 사업의 안정적인 시장 진입과 성장을 도모하고, 지속적인 연구개발을 통해 미래 성장 가능성이 높은 신규 파이프라인을 확보하겠습니다.
- 합리적인 주주환원 정책 수립 검토: 회사의 지속적인 성장과 이익 실현이 안정적인 궤도에 오르면, 재무 상태, 향후 투자 계획, 시장 상황 등을 종합적으로 고려하여 배당, 자사주 매입/소각 등 주주가치를 제고할 수 있는 다양한 방안을 적극적으로 검토하고, 관련 정책 수립 시 투명하게 공시하고 시행할 수 있도록 노력하겠습니다.
4) 이사회 중심의 투명하고 책임 있는 경영체제 확립
당사는 이사회의 독립성과 전문성을 강화하고, 경영진에 대한 효과적인 감독 기능을 수행함으로써 투명하고 책임 있는 경영체제를 구축하겠습니다. 이사회는 주주의 이익을 최우선으로 고려하여 의사결정을 하며, 모든 경영활동은 관련 법규와 정관을 준수하여 이루어질 것입니다. 또한, 내부회계관리제도의 효과적인 운영과 내부통제시스템 강화를 통해 경영의 투명성과 신뢰성을 지속적으로 높여나가겠습니다.
당사는 상기 언급된 주주 권익 보호 방안들을 성실히 이행하고, 끊임없는 혁신과 성장을 통해 주주님들의 기대에 부응할 수 있도록 최선을 다할 것을 약속드립니다.
3. 자금의 운용계획
금번 유상증자를 통해 조달되는 자금은 상기 "2. 자금의 사용목적"에 기재된 계획에 따라 집행될 예정입니다. 다만, 각 자금 사용 항목의 실제 집행 시기와 조달 시기 간에 일시적인 차이가 발생하여 미사용 자금이 발생할 수 있습니다.
이러한 미사용 자금에 대해서는 자금의 안정성과 환금성을 고려하여 운용할 계획입니다. 구체적으로, 자금 사용 시점까지의 기간, 시장 금리 수준, 금융기관의 안정성 등을 종합적으로 검토하여 국내 제1금융기관 및 기타 신용도가 높은 우량 금융기관의 수시입출금식예금(MMDA), 정기예금, 국공채, 기타 이에 준하는 안정성이 높은 단기 금융상품 등에 예치하여 운용할 예정입니다.
당사는 미사용 자금의 운용을 통해 발생하는 이자수익 등은 당사의 영업 외 수익으로 인식하고, 향후 사업 운영에 필요한 자금으로 활용할 계획입니다. 미사용 자금의 구체적인 운용 내역 및 현황은 향후 분기별 정기보고서 등을 통해 투명하게 공시하여 주주 및 투자자 여러분께서 확인할 수 있도록 하겠습니다. 당사는 조달된 자금이 본래의 목적에 따라 효율적으로 사용될 수 있도록 관리 및 감독을 시행할 것입니다.
(주16) 정정 후
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
| (단위 : 원) |
| 구 분 | 금 액 |
|---|---|
| 모집 또는 매출총액(1) | 28,595,000,000 |
| 발행제비용(2) | 600,000,000 |
| 순 수 입 금 [ (1)-(2) ] | 27,995,000,000 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 3) 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. |
나. 발행제비용의 내역
| (단위 : 원) |
| 구 분 | 금 액 | 계산근거 |
|---|---|---|
| 발행분담금 | 5,147,100 | 모집총액의 0.018% (10원 미만 절사) |
| 인수수수료 | 514,710,000 | 모집총액의 1.80% |
| 상장수수료 | 4,460,000 | 430만원 + 300억원 초과금액의 10억원당 8만원 |
| 등록세 | 14,000,000 | 증자 자본금의 0.4% |
| 교육세 | 2,800,000 | 등록세의 20% |
| 기타비용 | 59,202,900 | 구주주 청약서, 투자설명서 인쇄 및 발송비 등 |
| 합 계 | 600,000,000 | - |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가, 유관기관 정책 등에 따라 변동될 수 있습니다. |
| 주3) 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사는 금번 유상증자를 통해 조달한 자금을 다음과 같이 사용할 예정입니다.
| (기준일 : | 2025년 05월 21일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 27,995 | - | - | 600 | 28,595 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액이며, 향후 발행가액 확정 시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) 발행제비용은 공모금액 및 실권규모, 유관기관과의 협의 등에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 발행제비용은 공모금액에서 지급될 예정이나, 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 운영자금(연구개발비)으로 지출할 예정입니다. |
나. 공모자금 세부 사용목적
당사가 금번 공모 유상증자를 통해 조달한 순수입금 약 27,995백만원은 CU06 미국 당뇨병성 황반부종 임상 2b상, CU71 미국 알츠하이머병 임상 1상 등 주요 파이프라인의 연구개발(R&D) 진척, 전체 임상시험 및 연구개발 활동에 필요한 공통 소모품 구매 및 장비 유지보수, 그리고 원료의약품 유통사업 진출을 위한 자본금 확충 등에 사용될 계획입니다.
신약 연구개발은 장기간이 소요되며 대규모 투자가 수반되는 분야입니다. 각 임상시험 단계마다 성공 가능성이 낮으며, 예상치 못한 결과나 부작용 발생, 규제기관의 승인 지연 또는 실패 등 다양한 변수로 인해 개발이 중단될 수 있습니다. 특정 파이프라인의 임상시험이 실패할 경우, 해당 파이프라인에 투입된 연구개발 비용은 회수되지 않을 수 있으며, 이는 당사의 재무 상태 및 향후 사업 계획에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이러한 신약 개발의 본질적인 위험을 충분히 인지하시고 투자 결정을 내리시기 바랍니다.
금번 유상증자 자금 사용내역 우선순위는 아래와 같습니다.
| [금번 유상증자 자금 사용내역 우선순위] |
| (단위: 백만원) |
| 구분 | 세부내역 | 내용 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 금액 | 우선순위 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 운영자금 | R&D CU06 | 미국 임상2b상 운영, 비임상, 약물 개발 및 생산 | 1,555 | 3,602 | 1,130 | 585 | 1,580 | 2,090 | 2,200 | 2,200 | 14,942 | 1 |
| 운영자금 | R&D CU71 | 미국 임상1상 운영, 비임상, 약물 개발 및 생산 | 550 | 1,602 | 1,090 | 420 | 1,360 | 1,650 | 920 | 2,700 | 10,292 | 2 |
| 운영자금 | R&D CU01 | 국내 임상2b상 운영, 임상3상 약물 생산 | 550 | 550 | 350 | 0 | 100 | 350 | 0 | 0 | 1,900 | 3 |
| 기타자금 | 원료의약품 사업진출 | 원료의약품 유통사업 자본금 확충 | 0 | 500 | 0 | 0 | 0 | 0 | 0 | 0 | 500 | 4 |
| 운영자금 | R&D 기타 | 연구개발 공통 소모품 구매 및 연구 장비 유지보수 | 45 | 78 | 238 | 0 | 0 | 0 | 0 | 0 | 361 | 5 |
| 합계 | 2,700 | 6,332 | 2,808 | 1,005 | 3,040 | 4,090 | 3,120 | 4,900 | 27,995 | - | ||
| 주1) 상기 발행제비용은 공모자금에 포함되어 있지 아니합니다. (별도 모집총액에서 차감 또는 자체자금 사용) |
| 주2) 상기 자금 사용 계획은 현재 당사의 사업 전략 및 시장 상황을 고려하여 수립된 예측치이며, 향후 연구개발 진행 상황, 임상시험 결과, 시장 환경 변화, 규제기관과의 협의 내용 등에 따라 실제 집행 금액, 시기 및 세부 항목이 변경될 수 있습니다. 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
| 주3) 당사가 2021년 07월 기업공개 당시 추정한 임상비용은 파이프라인별로 파트너사와의 기술이전계약 체결을 통해 임상 개발 비용의 상당 부분을 파트너사가 부담하는 구조를 전제로 비용을 추정하였습니다. 하지만 다수의 잠재적 파트너사와 기술이전 협의가 최종 계약에 이르지 못했을 뿐만 아니라, 주요 파이프라인 중 하나인 CU06의 권리가 반환되며 기존 파트너사와의 기술이전 계약이 해지됨에 따라 당사가 관련 비용을 직접 부담하는 방식으로 사업 계획이 변경되었습니다. 아울러 코로나19 팬데믹 이후의 전반적인 인건비 상승 및 달러 환율 상승과 같은 외부 환경 변화 역시 임상시험 수행에 필요한 예산을 증가시키는 요인으로 작용하였으며, 이러한 복합적인 원인으로 인해 현재의 임상비용 계획은 당초 추정치와 차이가 발생하게 되었습니다. 투자자께서는 이 점 유의하셔서 투자를 결정하시기 바랍니다. |
(1) R&D CU06 (미국 임상2b상 운영, 비임상, 약물 개발 및 생산 등)
CU06은 당사의 핵심 파이프라인으로, 당뇨병성 황반부종 및 습성 황반변성 치료제로 개발 중입니다. 최근 미국 FDA와의 Type C 미팅을 통해 위약(Placebo) 대조 임상 2b상 진행에 대한 긍정적인 가이드라인을 확보하여, 기존의 표준치료제(Anti-VEGF) 직접 비교 임상 외에 개발 경로의 유연성을 확보하였습니다. 특히 경구 투여 방식의 편의성과 함께, 자체 개발한 신규 제형을 통해 기존 제형 대비 생체 흡수율을 약 2배 개선하여 임상 성공 가능성을 높이고자 합니다.
미국 식품의약국(FDA)은 개발사와 공식적으로 논의할 수 있는 다양한 미팅 유형을 제공하고 있으며, 이를 통해 개발사는 신약 개발 전략, 임상시험 설계, 규제 요건 등에 대한 FDA의 공식적인 의견과 지침을 확보할 수 있습니다. 주요 미팅 유형과 그 내용은 다음과 같습니다.
| [미국 식품의약국(FDA) 미팅 유형] |
| 구분 | Type A 미팅 | Type B 미팅 | Type C 미팅 |
|---|---|---|---|
| 요청 주체 | 개발사 (스폰서) | 개발사 (스폰서) | 개발사 (스폰서) |
| 정의/목적 | 지체된 개발 진행, 중대한 안전성 문제 해결 | 개발 주요 시점(Pre-IND, EOP, Pre-NDA/BLA 등) 논의 | Type A/B 외 기타 개발 및 검토 관련 모든 사항 논의 |
| 긴급성 | 매우 높음 (Critical Path) | 높음 (Milestone) | 상대적으로 낮음 (필요시) |
| 미팅의 의의 | 중대한 장애물 신속 해결 및 개발 정상화 | 개발 방향 설정, 규제 불확실성 해소, 성공적 허가 기반 마련 | 다양한 개발 이슈에 대한 유연한 자문 및 선제적 문제 해결 |
| 주요 예시 | 임상 보류 해제, 분쟁 해결, SPA 관련 논의 | Pre-IND, EOP1, EOP2/Pre-Phase 3, Pre-NDA/BLA 미팅 | 과학적 이슈, CMC, 시험 디자인 세부사항, 라벨링, 비임상 결과 등 |
| FDA 통보 | 14일 이내 | 21일 이내 | 21일 이내 |
| 미팅 개최 | 요청 접수 후 30일 이내 | 요청 접수 후 60일 이내 (EOP의 경우 70일 이내) | 요청 접수 후 75일 이내 |
| 미팅 개최 난이도 | 매우 어려움 (엄격한 기준 충족 필요) | 중간 (주요 단계별 필요성 입증) | 상대적으로 수월 (유연한 요청 가능, 명확한 목적 제시 시) |
|
출처) 미국 식품의약국(FDA) Guidance for Industry: Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products |
당사는 CU06 임상 2a상에서 1차 평가지표 미충족 후, 향후 개발 방향에 대한 FDA의 견해를 확인하고자 미국 식품 의약국(FDA)와 Type C 미팅을 진행하여 임상 2b상 개발 전략의 주요 고려사항들을 논의하였습니다. 특히 '위약 대비 우월성 입증 임상' 프로토콜 진행 가능, 임상 2b상과 임상 3상의 투약 기간, 1차 및 2차 주요 평가지표로 황반중심두께(CST)가 아닌 최대교정시력(BCVA) 활용, 규제 준수를 위한 연구 개발 계획 등을 논의하였습니다.
금번 조달 자금 중 14,942백만원은 CU06의 미국 임상 2b상 시험의 성공적인 수행 및 가치 극대화에 사용될 예정입니다. 주요 사용처는 임상2b상 시험 임상시험계획승인신청(IND) 비용, 개시 준비비용 및 운영비용 그리고 임상약물 개발 및 생산 비용, 비임상 연구 비용 등입니다. 임상시험을 진행하면서 기술이전 가치를 높이기 위한 자체 임상 데이터를 확보하고자 합니다.
| [CU06 주요 자금 사용 계획 (25년 3분기 ~ 27년 2분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 합계 |
|---|---|---|---|---|---|---|---|---|---|
| 임상2b상 시험 IND 비용 | 0 | 200 | 100 | 0 | 0 | 0 | 0 | 0 | 300 |
| 임상2b상 시험 개시 준비비용 | 0 | 1,800 | 900 | 0 | 0 | 0 | 0 | 0 | 2,700 |
| 임상2b상 시험 운영비용 | 0 | 0 | 0 | 500 | 1,500 | 2,000 | 2,200 | 2,200 | 8,400 |
| 임상약물 개발 및 생산 | 1,102 | 1,340 | 100 | 55 | 50 | 60 | 0 | 0 | 2,707 |
| 비임상 연구 | 453 | 262 | 30 | 30 | 30 | 30 | 0 | 0 | 835 |
| 합계 | 1,555 | 3,602 | 1,130 | 585 | 1,580 | 2,090 | 2,200 | 2,200 | 14,942 |
| 출처) 당사 제시 |
| [CU06 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 주요 목적 - 당뇨병성 황반부종(DME) 환자를 대상으로 최적의 CU06-1004("CU06-1004"="CU06") 용량을 도출하여 향후 3상 시험 설계에 반영 부차적 목적 - 24주 후 CU06-1004의 안전성과 유효성 평가 (위약과 비교) - CU06-1004 및 대사체의 혈중 약물동태(PK) 평가 - 혈중 바이오마커(TNF-α, IL-6 등)에 대한 CU06-1004의 영향 분석 |
| 임상시험 대상국가 | 미국 내 20개 기관에서 환자 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 이번 임상시험은 미국 내 20개 의료기관에서 시행되는 무작위배정, 이중눈가림, 위약대조 방식의 다기관 임상 2b상 시험으로, 중심성 당뇨병성 황반부종(Center-Involved Diabetic Macular Edema, DME) 환자를 대상으로 CU06-1004의 유효성과 안전성을 평가하기 위해 설계되었습니다. 총 135명의 환자를 1:1:1 비율로 세 군(200mg, 300mg, 위약)으로 무작위 배정하여, 매일 식사 직후 경구로 24주간 약물을 투여받게 됩니다. - 주 평가 지표는 24주 시점에서의 ETDRS 문자표 기준 최고교정시력(BCVA) 변화량이며, 이외에도 망막 두께, 망막 내/하부 액체량, 혈관 밀도 및 혈류량, 염증성 바이오마커(TNF-α, IL-6) 등의 변화를 포함한 다양한 이차 평가지표들을 통해 약물의 치료 효과를 종합적으로 분석합니다. - 약동학적 특성은 혈중 약물 농도 측정을 통해 파악되며, 안전성은 이상반응 발생률, 생체징후 변화, 심전도 및 혈액검사 등 다양한 지표를 통해 평가됩니다. 주요 유효성 분석은 MMRM(Mixed Model for Repeated Measures)을 이용하며, 300mg과 200mg 용량을 위약과 순차적으로 비교하여 통계적 유의성을 검증합니다. |
| 기대효과 | 본 임상을 통해 CU06-1004가 당뇨병성 황반부종 환자에서 유의미한 시력 개선 및 망막 구조 개선 효과를 나타낼 경우, 기존 항VEGF 주사제 중심의 치료법에 대한 대안으로 자리매김할 수 있을 것으로 기대됩니다. 특히 CU06-1004는 경구 투약이라는 비침습적 제형을 통해, 반복적인 안구 주사로 인한 환자 부담과 내원 횟수를 줄일 수 있는 잠재력을 보유하고 있습니다. 또한, 다양한 시각적 기능 및 구조적 개선 외에도 염증 조절과 혈관 안정화 등의 기전을 입증함으로써, 기존 치료제 대비 차별화된 약물 프로파일을 확보할 수 있습니다. 이번 임상에서 도출되는 최적 용량과 유효성·안전성 데이터는 향후 3상 시험 설계의 근거가 되며, 글로벌 라이선싱 및 상업화를 위한 핵심 기반 자료로 활용될 수 있습니다. 이를 통해 CU06-1004는 DME 치료 분야에서 새로운 경구 치료제로서의 가능성을 입증할 수 있을 것으로 기대됩니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(2) R&D CU71 (미국 임상1상 운영, 비임상, 약물 개발 및 생산 등)
CU71은 알츠하이머병, 혈관성 치매 등 퇴행성 뇌질환 치료를 목표로 하는 First-in-Class 신약 후보물질입니다. 혈액뇌관문(BBB) 기능 조절을 통해 뇌 내 환경을 개선하는 새로운 기전을 가지며, 전임상 연구에서 기존 알츠하이머병 치료제 대비 우수한 인지 기능 개선 효과 및 바이오마커 변화를 확인하였습니다.
금번 조달 자금 중 10,292백만원은 CU71의 미국 임상 1상 진입, 그리고 후속 개발 준비를 위해 사용될 예정입니다. 올해 추가 비임상 연구를 완료하고 2025년 하반기 중 미국 FDA와 Pre-IND 미팅을 진행하여, 2026년 상반기 임상 1상 진입을 목표하고 있습니다. 주요 사용처는 비임상 연구 비용, 임상약물 개발 및 생산 비용, 임상 1상 시험 수행을 위한 임상시험신청(IND), 개시 준비 및 운영비용 등입니다.
| [CU71 주요 자금 사용 계획 (25년 3분기 ~ 27년 2분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 합계 |
|---|---|---|---|---|---|---|---|---|---|
| 비임상 연구 | 500 | 1,022 | 990 | 370 | 510 | 100 | 240 | 150 | 3,882 |
| 임상1상 시험 IND 비용 | 0 | 0 | 0 | 0 | 300 | 0 | 0 | 0 | 300 |
| 임상1상 시험 개시 준비비용 | 0 | 0 | 0 | 0 | 500 | 1,500 | 0 | 0 | 2,000 |
| 임상1상 시험 운영비용 | 0 | 0 | 0 | 0 | 0 | 0 | 630 | 2,500 | 3,130 |
| 임상약물 개발 및 생산 | 50 | 580 | 100 | 50 | 50 | 50 | 50 | 50 | 980 |
| 합계 | 550 | 1,602 | 1,090 | 420 | 1,360 | 1,650 | 920 | 2,700 | 10,292 |
| 출처) 당사 제시 |
| [CU71 임상1상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 이번 임상시험의 목적은 건강한 성인을 대상으로 CU71의 안전성, 내약성, 그리고 약동학적 특성을 평가하는 것입니다. 본 임상시험을 통해 단회 및 반복 투여 시 CU71의 체내 흡수, 분포, 대사 및 배출 특성을 확인하고, 인체 내에서의 안전성과 복용 가능 용량을 도출하여 향후 알츠하이머병 환자를 대상으로 한 임상 2상 진입을 준비하고자 합니다. |
| 임상시험 대상국가 | CU71의 이번 임상 1상 시험은 미국에서 진행될 예정입니다. 미국 식품의약국(FDA)의 승인을 받은 후, 미국 내 전문 임상시험기관에서 국제 임상시험 기준(GCP)을 준수하여 단일기관 방식으로 수행됩니다. |
| 임상시험 수행방법 | 임상시험은 건강한 성인을 대상으로 진행되며, 무작위배정, 이중눈가림, 위약대조 방식으로 설계되었습니다. 시험대상자는 단회 또는 7일간 반복하여 CU71을 경구로 투약받게 되며, 용량은 단계적으로 증량되며, 각 단계에서의 안전성과 약동학 데이터를 기반으로 다음 단계로의 진입 여부가 결정될 예정입니다. 시험 기간 동안 피험자들은 반복적인 혈액 및 소변 채취를 통해 약물의 혈중 농도 및 약동학적 지표를 측정받으며, 동시에 이상반응, 심전도 변화, 활력징후, 임상병리 검사 등을 통해 전반적인 안전성을 평가받게 됩니다. 특히 반복 투여 시 체내 약물 축적 여부를 확인하여 장기간 복용에 대한 위험성도 함께 평가하게 됩니다. |
| 기대효과 | 이번 임상시험을 통해 CU71이 건강한 성인에서 전신적으로 안전하고 예측 가능한 약동학적 특성을 보인다는 것이 입증된다면, 알츠하이머병 환자를 대상으로 한 후속 임상(2상) 진행이 가능해질 것으로 기대됩니다. 특히 CU71은 경구로 복용 가능한 치료제이기 때문에 기존 주사제 기반 치료에 비해 환자의 복약 편의성 및 치료 접근성을 크게 향상시킬 수 있을 것으로 보입니다. 아울러 본 임상 1상을 통해 확보되는 안전성 및 약동학 데이터는 적절한 초기 용량 설정에 중요한 근거가 되며, 후속 개발과 글로벌 파트너십 논의에도 긍정적인 영향을 줄 수 있을 것으로 예상됩니다. CU71은 기존 치료제의 한계를 극복할 수 있는 새로운 치료 옵션으로 자리매김할 가능성을 가진 후보물질로, 이번 임상을 통해 그 가능성을 한 단계 더 검증하는 계기가 될 것입니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(3) R&D CU01 (국내 임상2b상 운영, 임상3상 약물 생산 등)
CU01은 당뇨병성 신증 치료제로 개발 중이며, 현재 국내에서 임상 2b상 대상자 투약이 약 90% 완료되어 올해 하반기 임상 종료를 목표로 하고 있습니다.
조달 자금 중 1,900백만원은 CU01의 국내 임상 2b상 운영비용, 데이터 분석 및 보고 그리고 임상3상 시험 준비를 위한 원료의약품 구매 및 완제의약품 제조 활동에 투입될 예정입니다.
| [CU01 주요 자금 사용 계획 (25년 3분기 ~ 26년 4분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 합계 |
|---|---|---|---|---|---|---|---|
| 임상2b상 운영비용 | 500 | 500 | 300 | 0 | 0 | 0 | 1,300 |
| 임상3상 시험 원료의약품 구매 및 완제의약품 제조 | 0 | 0 | 0 | 0 | 100 | 350 | 450 |
| 데이터 분석 및 보고 | 50 | 50 | 50 | 0 | 0 | 0 | 150 |
| 합계 | 550 | 550 | 350 | 0 | 100 | 350 | 1,900 |
| 출처) 당사 제시 |
| [CU01 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 |
본 임상시험은 알부민뇨를 동반한 제2형 당뇨병성 신증 환자를 대상으로, 당사의 신약 후보물질인 CU01-1001("CU01-1001"="CU01")을 24주간 투여하여 유효성과 안전성을 평가하고, 동시에 적절한 투여 용량을 탐색하기 위해 설계되었습니다. 당뇨병성 신증은 진행 시 투석 등 중증 합병증으로 이어질 수 있음에도 불구하고 현재까지 뚜렷한 치료제가 없는 영역으로, 이번 임상시험은 CU01-1001의 치료 가능성을 과학적이고 객관적인 방식으로 입증하고자 하는 데 목적이 있습니다. |
| 임상시험 대상국가 | 해당 임상시험은 대한민국 내에서만 진행되는 국내 임상시험으로 총 24개 의료기관에서 다기관 임상 형식으로 진행 중이며, 국내 환자 240명을 대상으로 모집 및 투약이 진행됩니다. |
| 임상시험 수행방법 |
본 임상시험은 알부민뇨가 동반된 제2형 당뇨병성 신증 환자를 대상으로 실시됩니다. 시험대상자에게는 당사의 임상시험용 의약품인 CU01-1001을 1일 2회 또는 1일 3회, 1회 120mg씩 경구 투여하며, 총 24주간 투여 후 유효성과 안전성을 평가하게 됩니다. 또한, 이번 임상은 다양한 환자 환경에서의 치료 효과를 평가하고자 하는 탐색적 임상시험의 성격을 가지며, 다기관, 무작위배정, 이중눈가림, 위약 대조, 평행설계 방식으로 설계되었습니다. |
| 기대효과 |
당뇨병성 신증은 제2형 당뇨병 환자에서 흔히 발생하는 만성 합병증으로, 진행 시 신기능 저하 및 말기신부전으로 이어질 수 있음에도 불구하고 현재까지 신장 기능을 유지하거나 개선하는 치료제는 부재한 상황입니다. 이번 임상시험은 CU01-1001이 당뇨병성 신증 환자에서 알부민뇨(단백뇨)의 개선 효과와 추정 사구체 여과율(eGFR) 등을 유의하게 개선할 수 있는지를 확인하는 것으로, 기존 RAS 차단제(ACEi, ARB) 중심 등의 치료 전략에서 벗어나, 새로운 기전의 치료 옵션 가능성을 제시할 수 있습니다. 또한, CU01-1001이 충분한 안전성과 유효성을 입증할 경우, 질병의 조기 개입을 통해 신장 기능의 악화를 지연시키고, 말기 환자들의 투석 의존도를 낮추는 임상적 가치가 클 것으로 기대됩니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(4) 운영자금 - 원료의약품 사업진출 (원료의약품 유통사업 자본금 확충)
당사는 신규 성장 동력 확보 및 사업 포트폴리오 다각화의 일환으로 원료의약품 유통사업 진출을 계획하고 있습니다. 이를 위해 「약사법」제38조제1항 및 관련 동법 시행규칙 제31조의2제2항에서 정하는 의약품 도매상의 자본금 요건(5억원 이상)을 충족시키고자 합니다.
조달 자금 중 500백만원은 원료의약품 유통사업을 위해 자본금 확충에 사용될 예정입니다. 이는 2025년 4분기에 집행될 계획이며, 안정적인 사업 개시를 위한 기반을 마련하는 데 기여할 것입니다.
(5) R&D 기타 (임상시험 공통 소모품 구매 및 연구 장비 유지보수)
당사는 개별 파이프라인 연구개발 활동 외에도, 다수의 임상시험 및 연구개발 과제를 원활하게 수행하기 위한 공통적인 지원 비용이 발생합니다. 이러한 비용은 특정 파이프라인에 직접 배부하기 어려운 연구 인프라 유지 및 공통 연구 활동 지원에 필수적입니다.
조달 자금 중 361백만원은 다양한 파이프라인의 비임상 및 초기 연구 단계에서 공통적으로 사용되는 고순도 시약, 실험용 세포주, 배지, 각종 실험기자재(튜브, 플레이트, 필터 등) 및 기타 연구용 소모품의 구매에 사용될 예정입니다.
또한, HPLC, 질량분석기, 분리분석기, 세포배양기 등 고가의 정밀 연구 장비에 대한 정기적인 유지보수 계약, 부품 교체, 교정 서비스, 소프트웨어 업데이트 등에도 자금이 투입되어 장비의 성능을 최적으로 유지하고 신뢰성 있는 연구 결과를 도출하는 데 기여할 것입니다.
이와 함께 연구소 실험실 운영에 필요한 유틸리티 비용, 폐기물 처리, 실험실 안전 관리 등 공통 시설 유지 관리에 필요한 경비와 연구 데이터의 체계적인 관리, 백업, 보안을 위한 시스템 운영 비용 및 전문 소프트웨어 라이선스 구매 및 갱신 비용으로도 사용될 계획입니다.
| [R&D 기타 주요 자금 사용 계획 (25년 3분기 ~ 26년 1분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 합계 |
|---|---|---|---|---|
| 연구용 공통 소모품/시약 구매 | 20 | 30 | 100 | 150 |
| 연구 장비 유지보수/관리 | 15 | 28 | 88 | 131 |
| 공통 연구 시설 관리비 | 5 | 10 | 30 | 45 |
| 연구 데이터 관리/라이선스 비용 등 | 5 | 10 | 20 | 35 |
| 합계 | 45 | 78 | 238 | 361 |
| 출처) 당사 제시 |
상기 자금 사용 계획의 연도별/분기별 배분은 예상되는 연구개발 일정 및 각 과제의 진행 상황에 따라 실제 집행 과정에서 변동될 수 있으며, 중요한 변경 사항 발생 시 관련 규정에 따라 정기보고서에 공시할 예정입니다.
다. 자금이 계획대로 조달되지 않을 경우의 대응 방안
금번 주주배정 후 실권주 일반공모의 경우 확정발행가액 결정에 따라 최종 조달자금의 변동될 수 있습니다. 자금 사용계획에 대한 우선순위는 상기 기재한 바와 같으며, 금번 주주배정 후 실권주 일반공모를 진행하는 동안 주가 하락에 의하여 유입되는 자금이 감소할 경우 당사의 대응 방안은 다음과 같습니다.
가) 임상시험 비용 계획 조정
당사는 효율적인 자금 운용과 연구개발 활동의 최적화를 위해 임상시험 비용을 세밀하게 조정할 예정입니다. 금번 공모자금이 당사 예상 대비 줄어들 경우, 당사는 진행 중인 임상 연구 프로젝트 및 연구 과제에 대한 우선 순위를 재평가하여, 자문비용 및 데이터 사용 비용, 외부 전문가 활용 비용을 절감할 방안을 모색할 예정입니다. 이를 위해, 당사는 내부의 R&D 인력을 적극 활용하여 연구 개발 활동을 수행함으로써 외주 비용을 최소화하고, 동시에 내부 역량을 강화해 나갈 계획입니다. 이러한 전략적 조정을 통해, 당사는 제한된 자금을 가장 중요한 연구개발 활동에 효과적으로 할당하고, 장기적으로 회사의 핵심 가치와 성장 잠재력을 높일 수 있을 것으로 기대합니다
라. 유상증자 진행 배경
당사의 이사회는 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 추진하기에 앞서, 당사의 현재 재무 상태, 보유 현금 수준 및 단기적인 자금 운용 계획, 임상개발을 진행 중인 파이프라인의 사업성 및 예상되는 비용 규모, 그리고 예정된 전환사채 등의 차입금 상환 스케줄 등을 면밀히 검토하였습니다. 또한, 이를 바탕으로 자금 조달의 필요성과 시기의 적정성은 물론, 조달 자금의 규모와 사용 계획이 당사의 핵심 파이프라인 개발 및 신사업 진출 등 중장기 사업 전략에 부합하는지 다각적으로 분석하고 심도 있는 논의를 거쳤습니다.
그 결과, 현재의 내부 유보 자금 및 영업 현금흐름만으로는 예정된 임상 개발과 미래 성장 동력 확보를 위한 투자를 동시에 진행하기에 부족하며, 안정적인 재무구조를 유지하면서 기업가치를 극대화하기 위해서는 외부 자금 조달이 필수적이라는 결론에 이르렀습니다. 이에 당사 이사회는 본 유상증자가 회사의 핵심 경쟁력을 강화하고 지속 가능한 성장의 발판을 마련하기 위한 최적의 방안이라고 판단하였으며, 이사회가 검토한 금번 유상증자를 통해 자금을 조달하고자 하는 구체적인 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
3) 제약·바이오 산업 환경 변화에 대한 능동적 대응 및 경쟁 우위 확보
글로벌 제약·바이오 시장은 기술 발전 속도가 매우 빠르고 경쟁이 치열한 분야입니다. 이러한 환경 속에서 경쟁 우위를 확보하고 지속적으로 성장하기 위해서는 혁신적인 기술력과 함께 신속한 의사결정, 그리고 이를 뒷받침할 수 있는 충분한 자금력이 중요합니다. 당사는 금번 자금 조달을 통해 빠르게 변화하는 시장 환경과 기술 트렌드에 능동적으로 대응하고, 핵심 기술 및 파이프라인의 경쟁력을 강화하여 글로벌 시장에서 입지를 다져나갈 계획입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
4) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
마. 주주 권익 보호를 위한 사항
당사는 금번 유상증자를 추진함에 있어 주주님들의 이익을 최우선으로 고려하며, 유상증자 이후에도 지속적인 주주가치 제고를 위해 이사회에서 논의한 바와 같이 다음과 같은 정책을 추진하고 주주님들과의 소통을 강화하고자 합니다.
| [이사회의사록 발췌] |
|
| 출처) 2025년 05월 22일 당사 이사회의사록 |
1) 투명하고 공정한 정보 제공 강화
당사는 유상증자의 진행 과정, 조달 자금의 구체적인 사용 계획 및 집행 내역, 주요 경영 활동, 임상시험의 진행 상황 및 결과 등 주주 및 투자자분들의 의사결정에 중대한 영향을 미칠 수 있는 모든 정보를 관련 법규 및 규정을 철저히 준수하여 금융감독원 전자공시시스템(DART) 및 당사 홈페이지를 통해 신속, 정확, 충분하게 공시하겠습니다. 특히, 분기별 사업보고서 및 정기적인 IR 자료를 통해 조달 자금의 사용 현황을 상세히 안내하고, 자금 집행의 투명성을 확보하여 주주님들의 신뢰를 높이는 데 주력할 것입니다. 또한, 예측 정보나 미래 전망에 대해서는 합리적인 근거를 제시하고 발생 가능한 위험 요인에 대해서도 충분히 설명하여 투자자 보호에 만전을 기하겠습니다.
2) 적극적이고 다각적인 IR 활동을 통한 소통 활성화
당사는 주주님들과의 열린 소통을 경영의 중요한 가치로 여기고 있습니다. 이를 위해 국내외 기관투자자, 애널리스트, 언론뿐만 아니라 개인 주주님들을 포함한 모든 시장 참여자들과의 소통 채널을 확대하고 다각화할 계획입니다.
- 정기 및 비정기 기업설명회(IR) 및 주주간담회 개최: 연간 경영실적 발표회 외에도, 주요 경영 현안 발생 시 또는 시장의 관심이 높을 경우, 온/오프라인 기업설명회를 수시로 개최할 예정입니다. 특히, 당사는 금번 유상증자의 배경 및 회사의 향후 성장 전략을 주주님들께 상세히 설명드리고 의견을 경청하기 위해 2025년 05월 29일에 주주간담회를 개최할 예정입니다. 간담회의 구체적인 시간 및 장소, 참여 방법 등은 추후 당사 홈페이지 공지 및 별도 안내를 통해 신속히 알려드리겠습니다. 이를 통해 당사의 경영 전략, 연구개발 진행 상황, 향후 비전 등을 상세히 설명하고 질의응답 시간을 통해 주주님들의 궁금증을 해소하겠습니다.
- 소그룹 미팅 및 컨퍼런스 참여: 국내외 주요 투자 컨퍼런스에 적극적으로 참여하고, 기관투자자 및 애널리스트들을 대상으로 한 미팅을 정기적으로 진행하여 심도 있는 정보를 제공하고 상호 이해도를 높이겠습니다.
- 주주서한 및 온라인 소통 강화: 금번 유상증자와 관련하여 2025년 05월 16일 주주서한을 통해 회사의 입장을 전달드린 바와 같이, 앞으로도 중요한 경영 사항 발생 시 주주서한, 회사 홈페이지 공지, FAQ 게시, 이메일 문의 답변 등을 통해 주주님들과 적극적으로 소통하겠습니다. 특히 소액주주님들의 정보 접근성을 높이기 위해 노력하겠습니다.
- 주주총회의 내실 있는 운영: 정기 및 임시 주주총회를 단순한 의결 절차를 넘어, 주주님들과 경영진이 회사의 발전 방향에 대해 심도 있게 논의하고 의견을 교환하는 소통의 장으로 만들어가겠습니다.
| [주주서한] |
|
|
|
| 출처) 당사 홈페이지 |
당사는 금번 유상증자와 관련하여 주주와의 소통 강화를 위해 다양한 활동을 진행하고 있습니다. 당사는 1차 정정증권신고서 제출 전일인 2025년 06월 08일 기준으로 주주들과의 소통을 적극적으로 진행하였습니다. 구체적으로는 2025년 05월 29일 주주간담회를 개최하여 유상증자의 목적과 필요성을 상세히 설명하고 아래와 같은 Q&A를 진행하였으며, 참석하지 않은 주주분들도 내용을 확인할 수 있도록 당사 홈페이지에 Q&A를 게시하였습니다.
| [주주간담회 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 유상증자 자금의 사용 목적은 무엇인가요? A. 금번 유상증자를 통해 조달 예정인 약 286억 원은 △CU06 미국 당뇨병성 황반부종 임상 2b상 △CU71 미국 알츠하이머병 임상 1상 등 주요 파이프라인의 연구개발(R&D) 진척 △공통 소모품 구매 및 장비 유지보수 △원료의약품 유통사업 진출을 위한 자본금 확충 등에 사용될 계획입니다. |
| 2 | Q. 신규로 발행하는 주식의 형태는 무엇인가요? A. 큐라클㈜ 기명식 보통주로 발행됩니다. |
| 3 | Q. 주주배정 후 실권주 일반공모 방식의 유상증자 방식은 무엇인가요? A. 일정 기준일을 기준으로 주주명부에 등재된 기존 주주들께 신주를 우선 배정하며, 주주 청약 이후 발생한 실권주에 대해 일반 투자자를 대상으로 공모 청약을 진행하는 방식입니다. |
| 4 | Q. 유상증자의 참여 대상이 되기 위해서는 언제까지 주식을 보유해야 하나요? A. 신규로 발행할 주식을 배정받는 주주의 기준일(신주배정기준일)은 6월 26일로 예정되어 있으며, 증권결제일(T+2일)을 감안하여 2 영업일 전인 6월 24일까지 주식을 매수하시면 대상이 됩니다. |
| 5 | Q. 기존 주주에게는 어떠한 비율로 신주가 배정되는 건가요? A. 기존 주주의 개인별 청약 한도는 신주배정기준일인 6 월 26 일 현재 주주명부에 기재된 소유주식 1 주당 신주배정비율인 0.4996732494주를 곱하여 산정된 배정주식수 로 하되 , 1 주 미만의 단수주는 절사합니다. |
| 6 | Q. 신주의 발행가액은 어떻게 결정되나요? A. 최근 주가와 거래량을 기간 별로 가중산술평균하여 이를 반영한 기준주가가 결정되고 , 기준주가에 할인율과 증자비율을 반영하여 발행가액이 결정됩니다. 현재 공시된 예정 발행가액은 잠정적인 금액이며, 1 차 발행가액은 6월 23일 확정, 확정 발행가액은 7월 30일 산정되어 7월 31일에 공고될 예정입니다. 구체적인 발행가액 산정방식 및 세부내용은 전자공시시스템에 공시된 증권신고서를 참고해주시기 바랍니다. |
| 7 | Q. 청약에 참여하려면 어떻게 해야 하나요? A. 주주분들께서 현재 이용하고 계신 증권사의 HTS, MTS 를 통해 청약이 가능 합니다. 보유하고 계신 증권사 주식 계좌 내, 유상 청약 신청 메뉴를 통해 청약을 신청하실 수 있습니다. |
| 8 | Q. 신주인수권은 무엇인가요? A. 신주인수권은 유상증자 시 기존 주주가 보유하고 있던 주식 수에 비례하여 우선적으로 주식을 배정 받을 수 있는 권리를 말하며, 신주인수권은 정해진 기간 동안 시장에서 매매가 가능합니다(신주인수권증서 상장 및 거래기간 7월 15일-21일 예정). 기존 주주 분께서 유상증자에 참여하고 싶은 경우 신주인수권증서를 매도하지 않고 보유해야만 청약이 가능하며, 기존 주주가 아닌 분들은 유상증자에 참여하고자 하시는 경우 신주인수권증서를 매수하시면 됩니다. |
| 9 | Q. 신주인수권증서를 매매하는 방법과 매매가 가능한 기간은 어떻게 되나요? A. 신주인수권증서 매매는 HTS, MTS 등 온라인, 전화, 지점 내방 등을 통해 가능하며, 보유 수량의 일부 매도도 가능합니다. 자세한 사항은 이용 중이신 증권사 고객센터를 통해 안내 받으실 수 있습니다. 장내 신주인수권증서 매매는 정해진 5 영업일(7월 15일-21일 예정)동안 가능하며, 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. 장외 신주인수권증서 매매는 신주인수권증서 상장거래의 결제일인 7월 23(예정)일까지, 거래의 세부 요건은 계좌를 보유하고 계신 증권사를 통해 확인해주시기 바랍니다. |
| 10 | Q. 유상증자 청약 후에 취소가 가능한가요? A. 구주주 청약일(8월 4일-5일 예정) 또는 일반공모 청약일(8월 7일-8일 예정) 각 청약 기간 내에서만 취소가 가능합니다. |
| 11 | Q. 주주가 아닌 경우에도 청약에 참여할 수 있나요? A. 신주인수권증서 상장 및 거래기간(7월 15일-21일 예정)에 해당 증서를 매수하여 구주주 청약일(8월 4일-5일 예정)에 청약할 수 있으며, 구주주 청약 미달로 실권주가 발생할 경우 일반공모 청약을 통해서도 참여가 가능합니다. |
| 12 | Q. 신주는 언제부터 매매할 수 있게 되나요? A. 현재 예정된 일정을 기준으로 7월 15일 신주가 상장될 예정이며, 매매가 개시될 예정입니다. 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. |
| 13 | Q. 초과청약을 120% 까지 할 수 있는 초과청약제도는 무엇인가요? A. 유상증자 초과청약제도는 신주인수권증서 청약자가 보유분보다 초과로 청약할 수 있고, 추후 실권주가 발생하는 경우 초과청약분을 추가로 배정받는 제도입니다. 주주 별로 배정되는 신주 수량의 최대 20% 까지 추가로 청약이 가능하며, 초과청약분이 실권주 발생 수량에 미달할 경우 청약분 100% 에 대해 신주를 배정받고, 초과청약분이 실권주 발생 수량을 초과할 경우 청약 주식 수에 비례하게 신주를 배정받게 됩니다. |
| 14 | Q. 행사 가능한 신주 인수 권리 수량을 초과하여 청약하려면 어떻게 해야 하나요? A. 추가 청약은 1) 배정 수량의 20% 내에서 초과 청약을 신청하는 방법과 2) 신주인수권 매매기간(7월 15일-21일 예정)동안 신주인수권증서를 매수하여 청약을 신청하는 방법 2가지가 있습니다. |
| 15 | Q. 초과 청약을 하였는데 초과분 전부를 배정 받지 못할 경우에 환불은 언제되나요? A. 구주주 청약과 일반공모 청약이 완료된 후 주금납입일(8월 12일 예정)에 청약 계좌로 환급됩니다. |
| 출처) 당사 제시 |
또한 주주와 유선 의견청취 및 소통 약 28회, 이메일 문의 12건에 대한 답변 등을 통하여 주주들의 의견을 수렴하고, 유상증자의 목적과 필요성을 상세히 설명히였습니다.
| [이메일 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 원료의약품 유통사업 자본금 5억원 사용 목적은? A. 당사는 신규 성장 동력 확보 및 사업 포트폴리오 다각화의 일환으로 원료의약품 유통사업 진출을 결정했으며, 유상증자를 통해 조달하는 금액 중 5억원은 원료의약품 유통사업을 위한 자본금 확충에 사용(약사법 내 의약품 도매상 자본금 요건)될 예정입니다. |
| 2 | Q. 1회차 전환사채(CB) 진행 상황은? A. 전환사채 만기 전 유보 현금을 사용해 당사에서 일부 채권(148억원)을 취득했으며, 향후 소각 또는 재매각 예정입니다. |
| 3 | Q. CU06 당뇨병성 황반부종 임상2b상을 진행하는 동안 기술이전이 가능한지? A. 임상 진행 중에도 기술이전이 가능하며, 임상시험과 사업화 활동을 병행해서 진행할 계획입니다. |
| 4 | Q. CU06 임상2b상 소요기간은 어느 정도로 예상하는지? A. 미국 FDA와 논의된 임상 디자인 상 약 2년 정도 소요될 것으로 예상하고 있으며, 경구제로만 임상을 진행하게 될 경우 앞선 임상2a상 등의 사례로 미루어 볼 때 주사제 임상보다 환자 모집이 수월할 것으로 예상하고 있습니다. |
| 5 | Q. CU01 임상2b상 결과는 언제 나오는지? A. 현재 환자 투여가 약 90% 정도 완료되었으며, 올해 4분기 중 임상이 종료되고 결과를 확인할 수 있을 것으로 예상하고 있습니다. |
| 6 | Q. MT-101, MT-103에 대한 기술이전을 진행 중인 파트너사들의 관심도가 높은지? A. MT-101, MT-103이 기반으로 하는 Tie2 활성화 항체는 글로벌 제약사 등이 최근 주목하고 있는 신규 타깃으로 많은 회사들의 관심을 받고 있습니다. 바이오 Europe, 바이오 USA 등 파트너링 미팅에서 MT-101과 MT-103이 전임상 시험에서 보인 우수한 데이터를 바탕으로 활발한 파트너링 활동을 진행 중입니다. |
| 출처) 당사 제시 |
이러한 노력은 주주들과의 신뢰를 공고히 하고, 당사의 유상증자 진행 과정에서 주주 의견을 실질적으로 반영하는 데 중점을 두고 있습니다. 특히 소액주주와 기관 투자자를 포함한 다양한 주체들과의 적극적인 소통은, 유상증자와 관련한 의사결정의 투명성을 높이고, 주주와의 협력을 강화하는 중요한 기반이 되고 있기에 당사는 주주들이 당사의 경영전략과 유상증자의 목적을 보다 명확하게 이해할 수 있도록 적극적으로 소통하고 있습니다.
3) 기업가치 제고를 통한 실질적인 주주 이익 환원
당사는 금번 유상증자를 통해 확보된 자금을 바탕으로 핵심 파이프라인의 연구개발을 성공적으로 완수하고, 기술이전 및 상업화를 통해 실질적인 기업 성장을 이루어내는 데 모든 역량을 집중할 것입니다.
- 핵심 사업의 성공적 추진: CU06, CU71 등 주요 파이프라인의 임상적 가치를 입증하고, 글로벌 기술이전 또는 자체 상업화를 통해 기업가치를 극대화하겠습니다.
- 신성장 동력 확보: 원료의약품 유통사업 등 신규 사업의 안정적인 시장 진입과 성장을 도모하고, 지속적인 연구개발을 통해 미래 성장 가능성이 높은 신규 파이프라인을 확보하겠습니다.
- 합리적인 주주환원 정책 수립 검토: 회사의 지속적인 성장과 이익 실현이 안정적인 궤도에 오르면, 재무 상태, 향후 투자 계획, 시장 상황 등을 종합적으로 고려하여 배당, 자사주 매입/소각 등 주주가치를 제고할 수 있는 다양한 방안을 적극적으로 검토하고, 관련 정책 수립 시 투명하게 공시하고 시행할 수 있도록 노력하겠습니다.
4) 이사회 중심의 투명하고 책임 있는 경영체제 확립
당사는 이사회의 독립성과 전문성을 강화하고, 경영진에 대한 효과적인 감독 기능을 수행함으로써 투명하고 책임 있는 경영체제를 구축하겠습니다. 이사회는 주주의 이익을 최우선으로 고려하여 의사결정을 하며, 모든 경영활동은 관련 법규와 정관을 준수하여 이루어질 것입니다. 또한, 내부회계관리제도의 효과적인 운영과 내부통제시스템 강화를 통해 경영의 투명성과 신뢰성을 지속적으로 높여나가겠습니다.
당사는 상기 언급된 주주 권익 보호 방안들을 성실히 이행하고, 끊임없는 혁신과 성장을 통해 주주님들의 기대에 부응할 수 있도록 최선을 다할 것을 약속드립니다.
3. 자금의 운용계획
금번 유상증자를 통해 조달되는 자금은 상기 "2. 자금의 사용목적"에 기재된 계획에 따라 집행될 예정입니다. 다만, 각 자금 사용 항목의 실제 집행 시기와 조달 시기 간에 일시적인 차이가 발생하여 미사용 자금이 발생할 수 있습니다.
이러한 미사용 자금에 대해서는 자금의 안정성과 환금성을 고려하여 운용할 계획입니다. 구체적으로, 자금 사용 시점까지의 기간, 시장 금리 수준, 금융기관의 안정성 등을 종합적으로 검토하여 국내 제1금융기관 및 기타 신용도가 높은 우량 금융기관의 수시입출금식예금(MMDA), 정기예금, 국공채, 기타 이에 준하는 안정성이 높은 단기 금융상품 등에 예치하여 운용할 예정입니다.
당사는 미사용 자금의 운용을 통해 발생하는 이자수익 등은 당사의 영업 외 수익으로 인식하고, 향후 사업 운영에 필요한 자금으로 활용할 계획입니다. 미사용 자금의 구체적인 운용 내역 및 현황은 향후 분기별 정기보고서 등을 통해 투명하게 공시하여 주주 및 투자자 여러분께서 확인할 수 있도록 하겠습니다. 당사는 조달된 자금이 본래의 목적에 따라 효율적으로 사용될 수 있도록 관리 및 감독을 시행할 것입니다.
(주17) 정정 전
4. 재무제표
4-1. 재무상태표
| 재무상태표 |
| 제 10 기 1분기말 2025.03.31 현재 |
| 제 9 기말 2024.12.31 현재 |
| (단위 : 원) |
| 제 10 기 1분기말 | 제 9 기말 | |
|---|---|---|
| 자산 | ||
| 유동자산 | 29,096,642,468 | 32,417,332,819 |
| 현금및현금성자산 | 2,245,700,283 | 3,981,677,368 |
| 단기금융상품 | 25,000,000,000 | 26,364,517,855 |
| 매출채권 | 1,097,888,625 | 1,100,791,922 |
| 기타유동금융자산 | 87,968,229 | 583,293,306 |
| 기타유동자산 | 665,085,331 | 387,052,368 |
| 비유동자산 | 26,738,522,443 | 26,871,034,427 |
| 유형자산 | 22,867,651,276 | 22,986,597,277 |
| 무형자산 | 396,614,732 | 392,076,247 |
| 사용권자산 | 77,610,430 | 92,396,044 |
| 기타비유동투자자산 | 2,619,454,180 | 2,619,454,180 |
| 기타비유동금융자산 | 7,544,104 | 7,473,478 |
| 기타비유동자산 | 267,493,318 | 270,882,798 |
| 파생상품금융자산 | 502,154,403 | 502,154,403 |
| 자산총계 | 55,835,164,911 | 59,288,367,246 |
| 부채 | ||
| 유동부채 | 28,827,583,494 | 20,986,484,411 |
| 유동성 장기 차입금 | 8,000,000,000 | |
| 유동성전환사채 | 12,412,800,572 | 12,298,573,033 |
| 유동 리스부채 | 53,794,591 | 58,977,320 |
| 기타 유동부채 | 321,950 | 52,276,460 |
| 기타유동금융부채 | 651,023,896 | 587,390,774 |
| 유동 파생상품 금융부채 | 7,709,642,485 | 7,989,266,824 |
| 비유동부채 | 432,229,361 | 8,348,547,341 |
| 금융기관 차입금(사채 제외) | 8,000,000,000 | |
| 순확정급여부채 | 142,653,380 | 49,120,682 |
| 비유동 리스부채 | 29,165,481 | 39,016,159 |
| 이연법인세부채 | 260,410,500 | 260,410,500 |
| 부채총계 | 29,259,812,855 | 29,335,031,752 |
| 자본 | ||
| 자본금 | 6,984,299,500 | 6,936,984,000 |
| 보통주자본금 | 6,984,299,500 | 6,936,984,000 |
| 자본잉여금 | 102,420,346,156 | 101,554,153,832 |
| 주식발행초과금 | 102,420,346,156 | 101,554,153,832 |
| 기타포괄손익누계액 | 2,369,998,588 | 2,369,998,588 |
| 유형자산, 재평가잉여금 | 2,369,998,588 | 2,369,998,588 |
| 기타자본구성요소 | 10,175,034,779 | 10,340,353,179 |
| 주식선택권 | 4,826,449,201 | 4,797,777,451 |
| 전환권대가 | 5,348,585,578 | 5,542,575,728 |
| 이익잉여금(결손금) | (95,374,326,967) | (91,248,154,105) |
| 미처분이익잉여금(미처리결손금) | (95,374,326,967) | (91,248,154,105) |
| 자본총계 | 26,575,352,056 | 29,953,335,494 |
| 자본과부채총계 | 55,835,164,911 | 59,288,367,246 |
4-2. 포괄손익계산서
| 포괄손익계산서 |
| 제 10 기 1분기 2025.01.01 부터 2025.03.31 까지 |
| 제 9 기 1분기 2024.01.01 부터 2024.03.31 까지 |
| (단위 : 원) |
| 제 10 기 1분기 | 제 9 기 1분기 | |||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 영업수익 | 499,870,993 | 499,870,993 | ||
| 영업비용 | 3,648,605,528 | 3,648,605,528 | 3,555,569,687 | 3,555,569,687 |
| 영업이익(손실) | (3,648,605,528) | (3,648,605,528) | (3,055,698,694) | (3,055,698,694) |
| 기타수익 | 243,572 | 243,572 | 13,553,453 | 13,553,453 |
| 기타비용 | 32,000 | 32,000 | 6,049,730 | 6,049,730 |
| 금융수익 | 217,878,003 | 217,878,003 | 754,889,408 | 754,889,408 |
| 금융비용 | 692,387,464 | 692,387,464 | 602,056,878 | 602,056,878 |
| 법인세비용차감전순이익(손실) | (4,122,903,417) | (4,122,903,417) | (2,895,362,441) | (2,895,362,441) |
| 법인세비용(수익) | ||||
| 당기순이익(손실) | (4,122,903,417) | (4,122,903,417) | (2,895,362,441) | (2,895,362,441) |
| 기타포괄손익 | (3,269,445) | (3,269,445) | (1,906,718) | (1,906,718) |
| 당기손익으로 재분류되지 않는항목(세후기타포괄손익) | (3,269,445) | (3,269,445) | (1,906,718) | (1,906,718) |
| 확정급여제도의 재측정손익(세후기타포괄손익) | (3,269,445) | (3,269,445) | (1,906,718) | (1,906,718) |
| 총포괄손익 | (4,126,172,862) | (4,126,172,862) | (2,897,269,159) | (2,897,269,159) |
| 주당이익 | ||||
| 기본주당이익(손실) (단위 : 원) | (296.0) | (296.0) | (209.0) | (209.0) |
| 희석주당이익(손실) (단위 : 원) | (296.0) | (296.0) | (209.0) | (209.0) |
(주17) 정정 후
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 10 기 1분기말 2025.03.31 현재 |
|
제 9 기말 2024.12.31 현재 |
| 제 8 기말 2023.12.31 현재 |
|
(단위 : 원) |
|
제 10 기 1분기말 |
제 9 기말 |
제 8 기말 | |
|---|---|---|---|
|
자산 |
|||
|
유동자산 |
29,096,642,468 |
32,417,332,819 |
44,473,449,606 |
|
현금및현금성자산 |
2,245,700,283 |
3,981,677,368 |
12,840,748,751 |
|
단기금융상품 |
25,000,000,000 |
26,364,517,855 |
28,000,000,000 |
|
매출채권 |
1,097,888,625 |
1,100,791,922 |
|
|
기타유동금융자산 |
87,968,229 |
583,293,306 |
460,629,916 |
|
기타유동자산 |
665,085,331 |
387,052,368 |
318,019,514 |
| 계약자산 | 2,854,051,425 | ||
|
비유동자산 |
26,738,522,443 |
26,871,034,427 |
25,308,683,368 |
|
유형자산 |
22,867,651,276 |
22,986,597,277 |
20,630,535,705 |
|
무형자산 |
396,614,732 |
392,076,247 |
327,065,331 |
|
사용권자산 |
77,610,430 |
92,396,044 |
195,473,566 |
|
기타비유동투자자산 |
2,619,454,180 |
2,619,454,180 |
1,300,864,000 |
|
기타비유동금융자산 |
7,544,104 |
7,473,478 |
25,892,914 |
|
기타비유동자산 |
267,493,318 |
270,882,798 |
1,076,484,889 |
| 순확정급여자산 | 86,074,563 | ||
|
파생상품금융자산 |
502,154,403 |
502,154,403 |
1,666,292,400 |
|
자산총계 |
55,835,164,911 |
59,288,367,246 |
69,782,132,974 |
|
부채 |
|||
|
유동부채 |
28,827,583,494 |
20,986,484,411 |
10,196,545,273 |
|
유동성 장기 차입금 |
8,000,000,000 |
8,000,000,000 | |
|
유동성전환사채 |
12,412,800,572 |
12,298,573,033 |
|
|
유동 리스부채 |
53,794,591 |
58,977,320 |
99,494,358 |
|
기타 유동부채 |
321,950 |
52,276,460 |
37,008,540 |
|
기타유동금융부채 |
651,023,896 |
587,390,774 |
2,060,042,375 |
|
유동 파생상품 금융부채 |
7,709,642,485 |
7,989,266,824 |
|
|
비유동부채 |
432,229,361 |
8,348,547,341 |
17,722,411,376 |
|
금융기관 차입금(사채 제외) |
8,000,000,000 |
||
| 전환사채, 총액 | 10247185104 | ||
|
순확정급여부채 |
142,653,380 |
49,120,682 |
|
|
비유동 리스부채 |
29,165,481 |
39,016,159 |
97,993,479 |
| 비유동 파생상품 금융부채 | 7,377,232,793 | ||
|
이연법인세부채 |
260,410,500 |
260,410,500 |
|
|
부채총계 |
29,259,812,855 |
29,335,031,752 |
27,918,956,649 |
|
자본 |
|||
|
자본금 |
6,984,299,500 |
6,936,984,000 |
6,927,671,000 |
|
보통주자본금 |
6,984,299,500 |
6,936,984,000 |
6,927,671,000 |
|
자본잉여금 |
102,420,346,156 |
101,554,153,832 |
101,359,651,614 |
|
주식발행초과금 |
102,420,346,156 |
101,554,153,832 |
101,359,651,614 |
|
기타포괄손익누계액 |
2,369,998,588 |
2,369,998,588 |
|
|
유형자산, 재평가잉여금 |
2,369,998,588 |
2,369,998,588 |
|
|
기타자본구성요소 |
10,175,034,779 |
10,340,353,179 |
9,786,645,273 |
|
주식선택권 |
4,826,449,201 |
4,797,777,451 |
4,244,069,545 |
|
전환권대가 |
5,348,585,578 |
5,542,575,728 |
5,542,575,728 |
|
이익잉여금(결손금) |
(95,374,326,967) |
(91,248,154,105) |
(76,210,791,562) |
|
미처분이익잉여금(미처리결손금) |
(95,374,326,967) |
(91,248,154,105) |
(76,210,791,562) |
|
자본총계 |
26,575,352,056 |
29,953,335,494 |
41,863,176,325 |
|
자본과부채총계 |
55,835,164,911 |
59,288,367,246 |
69,782,132,974 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 10 기 1분기 2025.01.01 부터 2025.03.31 까지 |
|
제 9 기 1분기 2024.01.01 부터 2024.03.31 까지 |
| 제 9 기 2024.01.01 부터 2024.12.31 까지 |
| 제 8 기 2023.01.01 부터 2023.12.31 까지 |
|
(단위 : 원) |
|
제 10 기 1분기 |
제 9 기 1분기 |
제 9 기 | 제 8 기 | |||
|---|---|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|||
|
영업수익 |
499,870,993 |
499,870,993 |
1,632,550,301 | 10,294,390,768 | ||
|
영업비용 |
3,648,605,528 |
3,648,605,528 |
3,555,569,687 |
3,555,569,687 |
14,267,238,281 | 20,802,500,996 |
|
영업이익(손실) |
(3,648,605,528) |
(3,648,605,528) |
(3,055,698,694) |
(3,055,698,694) |
(12,634,687,980) | (10,508,110,228) |
|
기타수익 |
243,572 |
243,572 |
13,553,453 |
13,553,453 |
41,938,259 | 24,039,652 |
|
기타비용 |
32,000 |
32,000 |
6,049,730 |
6,049,730 |
160,320,340 | 2,703,508 |
|
금융수익 |
217,878,003 |
217,878,003 |
754,889,408 |
754,889,408 |
2,237,578,553 | 1,700,749,330 |
|
금융비용 |
692,387,464 |
692,387,464 |
602,056,878 |
602,056,878 |
4,370,981,642 | 2,799,744,399 |
|
법인세비용차감전순이익(손실) |
(4,122,903,417) |
(4,122,903,417) |
(2,895,362,441) |
(2,895,362,441) |
(14,886,473,150) | (11,585,769,153) |
|
법인세비용(수익) |
||||||
|
당기순이익(손실) |
(4,122,903,417) |
(4,122,903,417) |
(2,895,362,441) |
(2,895,362,441) |
(14,886,473,150) | (11,585,769,153) |
|
기타포괄손익 |
(3,269,445) |
(3,269,445) |
(1,906,718) |
(1,906,718) |
2,219,109,195 | (12,185,457) |
|
당기손익으로 재분류되지 않는항목(세후기타포괄손익) |
(3,269,445) |
(3,269,445) |
(1,906,718) |
(1,906,718) |
||
|
확정급여제도의 재측정손익(세후기타포괄손익) |
(3,269,445) |
(3,269,445) |
(1,906,718) |
(1,906,718) |
(150,889,393) | (12,185,457) |
| 유형자산재평가이익 | 2,369,998,588 | |||||
|
총포괄손익 |
(4,126,172,862) |
(4,126,172,862) |
(2,897,269,159) |
(2,897,269,159) |
(12,667,363,955) | (11,597,954,610) |
|
주당이익 |
||||||
|
기본주당이익(손실) (단위 : 원) |
(296.0) |
(296.0) |
(209.0) |
(209.0) |
(1,074) | (836) |
|
희석주당이익(손실) (단위 : 원) |
(296.0) |
(296.0) |
(209.0) |
(209.0) |
(1,074) | (836) |
(주18) 정정 전
4. 작성기준일 이후 발생한 주요사항 등 기타사항
1. 상장기업의 재무사항 비교표
| (기준 재무제표 : | 개별 | ) | (상장일 : | 2021년 07월 22일 | , 인수인 : | 삼성증권 | ) | (단위 : 백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 예측치 달성 여부 |
괴리율 |
|---|---|---|---|---|---|
| 2022년 | 매출액 | 16,128 | 3,583 | 미달성 | 77.78 |
| 영업이익 | -3,032 | -11,982 | 미달성 | 295.18 | |
| 당기순이익 | -2,784 | -11,406 | 미달성 | 309.70 | |
| 2023년 | 매출액 | 31,146 | 10,294 | 미달성 | 66.95 |
| 영업이익 | 2,837 | -10,508 | 미달성 | 470.39 | |
| 당기순이익 | 3,057 | -11,586 | 미달성 | 479.00 | |
| 2024년 | 매출액 | 70,318 | 1,633 | 미달성 | 97.68 |
| 영업이익 | 35,824 | -12,635 | 미달성 | 135.27 | |
| 당기순이익 | 36,177 | -14,886 | 미달성 | 141.15 |
(주1) 당사는 기술성장기업으로 2021년 07월 22일 코스닥 시장에 상장하였습니다.
(주2) 매출액 요건의 경우, 신규상장일이 속하는 사업연도를 포함하는 연속하는 5개 사업연도(상장일부터 상장일이 속한 사엽연도의 말일까지의 기간이 3월미만인 경우 에는 그 다음 사업연도)까지 지정 유예되며, 2026년 말 재무제표부터 대상이 됩니다.
(주3) 기술성장기업의 경우에는 영업손실과 관련한 관리종목규정을 적용받지 않습니다.
(주4) 법인세비용차감전계속사업손실 요건은 신규상장일이 속하는 사업연도를 포함 한 연속하는 3개 사업연도 동안 해당 요건을 적용받지 않게 됩니다. 2024년& 2025년 말 재무제표부터 해당 요건을 적용받게 될 예정입니다.
(주5) 당사의 2024년 법인세차감전계속사업손실은 14,886,473,150원이며, 2023년 법인세차감전계속사업손실은 11,585,769,153원입니다.
(주6) 괴리율에 대한 분석
[매출액]
당사는 2021년 07월 22일 코스닥시장에 기술특례상장 하였으며, 증권신고서를 통해 2024년 매출액 예측치를 70,318백만원로 추정하였으나, 실적치는 1,633백만원으로 약
97.68%의 괴리율이 발생하였습니다.
상장 시 매출액을 추정한 근거로는 1) CU06 당뇨병성 황반부종 적응증 임상3상 진입으로 2024년 마일스톤 수령액 13,712백만원 2) CU06 아시아 Upfront 3,835백만원 3) CU01 당뇨병성 신증에 대해 기술이전 및 마일스톤 수령액 13,644백만원입니다 4) CU03 에 대해 기술이전 및 마일스톤 수령액 39,128백만원 입니다.
추정근거 대비 실제 실적의 괴리 발생 원인은 아래와 같습니다.
1) CU06
CU06은 상장 이후인 2021년 10월 아시아를 제외한 글로벌 판권을 '떼아 오픈이노베이션'으로 기술이전 하였고, 계약금(Upfront payment) 및 당사의 임상2a상 수행에 따른 연구비/용역비 등을 떼아 오픈이노베이션에서 보전 받아 영업수익으로 인식하였으나, 2024년 5월 16일자로 계약해지 및 권리반환 통보를 받음으로써 이후 예상 수익은 인식하지 못하게 되었습니다. 단, 당사가 떼아 오픈이노베이션으로부터 이미 수령한 계약금 및 연구개발비 보전금액에 대한 반환의무는 없습니다. 괴리가 발생한 예상수익은 아시아를 제외한 지역의 임상2상 성공 마일스톤과, 임상2상 성공 후 예상되었던 아시아 지역에 대한 기술이전 계약금입니다.
당사는 CU06이 세계 최초로 시력 개선 효과를 입증한 경구용 약물이며, 임상2a상에서 보인 시력 개선 효과가 항체 치료제인 루센티스가 임상2상에서 나타낸 효과와 비슷한 양상을 보이는 점을 고려하여, FDA 미팅, 메커니즘 규명 및 임상2b상 IND 준비 등의 후속 개발 활동을 활발히 진행하고 있습니다. 이에 더불어 글로벌 판권에 대한 기술이전도 추진 중입니다.
2) CU01
당뇨병성 신증은 기존에 별다른 치료제가 없던 상황이었으나, 2021년 7월 미국 FDA 허가를 받은 바이엘의 케렌디아를 비롯해 SGLT-2 억제제 등 여러 치료제들이 시장에 출시되었습니다. 의약품 규제기관이 새롭게 등장한 치료제들의 연구개발 프로토콜을 바탕으로 당뇨병성 신증 치료제의 허가 기준을 마련함으로써, 상장 당시에 계획했던 CU01의 임상 범위를 넘어 감당하기 어려운 임상 규모를 필요로 하게 되어 불가피하게 개발 계획의 변경이 발생하였습니다. 예를 들어, SGLT-2 억제제인 Dapagliflozin 및 Empagliflozin의 경우 각각 4,304명 및 6,609명의 환자를 대상으로 38개월간 임상연구를 수행하였고, 바이엘의 케렌디아 경우에도 5,734명의 환자를 대상으로 32개월간 연구를 진행하였습니다.
CU01 개발 계획 변경 이후, 당사는 현재 국내에서 당뇨병성 신증 환자 240명을 대상으로 임상2b상을 진행하고 있습니다. 최근 일본 제약사가 진행한 대규모 임상연구에서 Nrf2 activator 기전의 약물이 신장 기능을 유지할 수 있는 것으로 밝혀짐에 따라, 같은 기전을 포함하고 있는 CU01의 신장기능 유지 효과에 대한 기대를 가지고 있는 파트너사들에게, 임상2b상 결과가 나오는 대로 기술이전을 통한 수익 인식을 목표로 하고 있습니다.
3) CU03
CU03은 2019년 12월 식품의약품안전처 임상2a상 IND 승인 이후 2022년 1월 임상시험결과보고서(CSR)를 수령하였고, 비임상 시험(26주 반복투여 독성시험)을 완료했습니다. 임상2a상 결과를 확보하고 아시아 지역에서 임상2b/3상에 진입함으로써, 계약금과 마일스톤을 통한 수익 창출을 목표로 하였으나, 상장 이후 개발전략 변경을 통해 임상2a상 결과만으로 국내 기술이전을 추진 중입니다.
당사는 상장 이후 오픈 이노베이션의 일환으로 항체 치료제 개발 전문기업인 맵틱스와 2024년 7월에 공동 연구개발 계약을 체결하였고, 이를 통해 확보한 파이프라인들과 기존 파이프라인, 새로 개발하는 파이프라인을 아울러 전략적 우선순위를 재설정하였습니다. 특히, CU03과 개발영역이 겹치는 망막질환에 기존 주력 파이프라인인 CU06과 더불어 혁신적 항체 치료제인 M-T103 파이프라인이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03은 임상2a상의 결과만으로 국내 기술이전을 추진하고, 대신 훨씬 경쟁력이 높은 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
당사는 상장 이후 전략적인 핵심 파이프라인 개편에 따라, 퇴행성 뇌질환 치료제 CU71처럼 의학적 차별화 가능성과 상업적 경쟁력을 동시에 갖춘 파이프라인들을 우선 개발순위 파이프라인으로 선정하여 개발을 진행중이며, 오픈 이노베이션을 통해 혁신적인 신규 파이프라인을 지속적으로 발굴하여 추가적인 성장 모멘텀과 영업수익을 기대하고 있습니다
또한, 큐라클의 연구 및 네트워크 역량과 관련이 깊은 신사업으로의 진출을 통한 수익 인식도 추진하고 있습니다.
[영업이익(손실)]
당사는 증권신고서상 영업이익을 35,824백만원 추정하였으나 실적은 영업손실 12,635백만 원으로 괴리율은 135.27%입니다.
괴리발생 원인은 상기와 같이 매출액에 있어 예측치 대비 68,685백만원의 실적괴리에 따라 발생하였습니다.
(중략)
(주18) 정정 후
4. 작성기준일 이후 발생한 주요사항 등 기타사항
1. 상장기업의 재무사항 비교표
| (기준 재무제표 : | 개별 | ) | (상장일 : | 2021년 07월 22일 | , 인수인 : | 삼성증권 | ) | (단위 : 백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 예측치 달성 여부 |
괴리율 |
|---|---|---|---|---|---|
| 2022년 | 매출액 | 16,128 | 3,583 | 미달성 | 77.78 |
| 영업이익 | -3,032 | -11,982 | 미달성 | 295.18 | |
| 당기순이익 | -2,784 | -11,406 | 미달성 | 309.70 | |
| 2023년 | 매출액 | 31,146 | 10,294 | 미달성 | 66.95 |
| 영업이익 | 2,837 | -10,508 | 미달성 | 470.39 | |
| 당기순이익 | 3,057 | -11,586 | 미달성 | 479.00 | |
| 2024년 | 매출액 | 70,318 | 1,633 | 미달성 | 97.68 |
| 영업이익 | 35,824 | -12,635 | 미달성 | 135.27 | |
| 당기순이익 | 36,177 | -14,886 | 미달성 | 141.15 |
(주1) 당사는 기술성장기업으로 2021년 07월 22일 코스닥 시장에 상장하였습니다.
(주2) 매출액 요건의 경우, 신규상장일이 속하는 사업연도를 포함하는 연속하는 5개 사업연도(상장일부터 상장일이 속한 사엽연도의 말일까지의 기간이 3월미만인 경우 에는 그 다음 사업연도)까지 지정 유예되며, 2026년 말 재무제표부터 대상이 됩니다.
(주3) 기술성장기업의 경우에는 영업손실과 관련한 관리종목규정을 적용받지 않습니다.
(주4) 법인세비용차감전계속사업손실 요건은 신규상장일이 속하는 사업연도를 포함 한 연속하는 3개 사업연도 동안 해당 요건을 적용받지 않게 됩니다. 2024년& 2025년 말 재무제표부터 해당 요건을 적용받게 될 예정입니다.
(주5) 당사의 2024년 법인세차감전계속사업손실은 14,886,473,150원이며, 2023년 법인세차감전계속사업손실은 11,585,769,153원입니다.
(주6) 괴리율에 대한 분석
당사는 현재 기업공개(IPO) 당시 계획했던 임상시험 및 기술이전 일정이 현재 전반적으로 지연되고 있습니다. 이에 따라 주요 파이프라인의 가시적인 사업화 성과 달성 또한 당초 예상보다 지체되고 있는 상황입니다.
다음은 기업공개 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정입니다.
| [IPO 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정] |
| 주요 파이프라인 |
적응증 | 구분 단계 |
지역 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 상반기 | 하반기(E) | 상반기 | 하반기 | 상반기 | 하반기 | 상반기 | 하반기 | ||||
| CU06 | 당뇨 황반부종 |
임상 단계 |
미주 및 유럽 |
- 임상 1상 진입 (미국) |
- 임상 1상 종료 (미국) |
- 임상 2상 진입 (미국) |
- | - | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - | - | - | - | - | - | - | - 임상 3상 진입 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- | - | - 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (한국) |
|||
| CU01 | 당뇨병성 신증 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 2상 진입 (미국) |
- | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - 임상 2a 종료 (한국) |
- 임상 2b/3상 진입 (한국) |
- | - | - | - 임상 2b/3상 종료 (한국) |
- NDA 제출 (한국) |
- Launch (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미국/유럽) |
- 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
|||
| CU03 | 습성 황반변성 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 1/2a 진입 (미국) |
- | - | - | - 임상 1/2a 종료 (미국) |
| 아시아 | - | - 임상 2a 종료 (한국) |
- 임상 2b/3 진입 (한국) |
- | - | - | - | - 임상 2b/3 종료 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - | - | - 마일스톤 수령 (아시아) |
|||
|
주1) 원/달러 환율은 2021년 6월 8일 기준 최근 1개년(2021년 5월 10일 ~ 2021년 6월 8일) 서울외국환중개 매매기준율 평균인 1,120.87원/USD을 적용하였습니다. 주2) 동사 보유 파이프라인 중 임상 1상 단계 이상의 파이프라인만을 대상으로 매출을 추정하였으며, 전임상 단계의 CU02, CU04, CU05, CU06-MI, CU06-ALI 파이프라인의 경우 매출 추정시 제외하였습니다. |
당사의 이사회는 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 추진하기에 앞서, 당사의 현재 재무 상태, 보유 현금 수준 및 단기적인 자금 운용 계획, 임상개발을 진행 중인 파이프라인의 사업성 및 예상되는 비용 규모, 그리고 예정된 전환사채 등의 차입금 상환 스케줄 등을 면밀히 검토하였습니다. 또한, 이를 바탕으로 자금 조달의 필요성과 시기의 적정성은 물론, 조달 자금의 규모와 사용 계획이 당사의 핵심 파이프라인 개발 및 신사업 진출 등 중장기 사업 전략에 부합하는지 다각적으로 분석하고 심도 있는 논의를 거쳤습니다.
그 결과, 현재의 내부 유보 자금 및 영업 현금흐름만으로는 예정된 임상 개발과 미래 성장 동력 확보를 위한 투자를 동시에 진행하기에 부족하며, 안정적인 재무구조를 유지하면서 기업가치를 극대화하기 위해서는 외부 자금 조달이 필수적이라는 결론에 이르렀습니다. 이에 당사 이사회는 본 유상증자가 회사의 핵심 경쟁력을 강화하고 지속 가능한 성장의 발판을 마련하기 위한 최적의 방안이라고 판단하였으며, 이사회가 검토한 금번 유상증자를 통해 자금을 조달하고자 하는 구체적인 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
3) 제약·바이오 산업 환경 변화에 대한 능동적 대응 및 경쟁 우위 확보
글로벌 제약·바이오 시장은 기술 발전 속도가 매우 빠르고 경쟁이 치열한 분야입니다. 이러한 환경 속에서 경쟁 우위를 확보하고 지속적으로 성장하기 위해서는 혁신적인 기술력과 함께 신속한 의사결정, 그리고 이를 뒷받침할 수 있는 충분한 자금력이 중요합니다. 당사는 금번 자금 조달을 통해 빠르게 변화하는 시장 환경과 기술 트렌드에 능동적으로 대응하고, 핵심 기술 및 파이프라인의 경쟁력을 강화하여 글로벌 시장에서 입지를 다져나갈 계획입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
5) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
항목별 괴리발생 원인은 다음과 같습니다.
[매출액]
당사는 2021년 07월 22일 코스닥시장에 기술특례상장 하였으며, 증권신고서를 통해 2024년 매출액 예측치를 70,318백만원로 추정하였으나, 실적치는 1,633백만원으로 약
97.68%의 괴리율이 발생하였습니다.
상장 시 매출액을 추정한 근거로는 1) CU06 당뇨병성 황반부종 적응증 임상3상 진입으로 2024년 마일스톤 수령액 13,712백만원 2) CU06 아시아 Upfront 3,835백만원 3) CU01 당뇨병성 신증에 대해 기술이전 및 마일스톤 수령액 13,644백만원입니다 4) CU03 에 대해 기술이전 및 마일스톤 수령액 39,128백만원 입니다.
추정근거 대비 실제 실적의 괴리 발생 원인은 아래와 같습니다.
1) CU06
CU06은 상장 이후인 2021년 10월 아시아를 제외한 글로벌 판권을 '떼아 오픈이노베이션'으로 기술이전 하였고, 계약금(Upfront payment) 및 당사의 임상2a상 수행에 따른 연구비/용역비 등을 떼아 오픈이노베이션에서 보전 받아 영업수익으로 인식하였으나, 2024년 5월 16일자로 계약해지 및 권리반환 통보를 받음으로써 이후 예상 수익은 인식하지 못하게 되었습니다. 단, 당사가 떼아 오픈이노베이션으로부터 이미 수령한 계약금 및 연구개발비 보전금액에 대한 반환의무는 없습니다. 괴리가 발생한 예상수익은 아시아를 제외한 지역의 임상2상 성공 마일스톤과, 임상2상 성공 후 예상되었던 아시아 지역에 대한 기술이전 계약금입니다.
당사는 CU06이 세계 최초로 시력 개선 효과를 입증한 경구용 약물이며, 임상2a상에서 보인 시력 개선 효과가 항체 치료제인 루센티스가 임상2상에서 나타낸 효과와 비슷한 양상을 보이는 점을 고려하여, FDA 미팅, 메커니즘 규명 및 임상2b상 IND 준비 등의 후속 개발 활동을 활발히 진행하고 있습니다. 이에 더불어 글로벌 판권에 대한 기술이전도 추진 중입니다.
2) CU01
당뇨병성 신증은 기존에 별다른 치료제가 없던 상황이었으나, 2021년 7월 미국 FDA 허가를 받은 바이엘의 케렌디아를 비롯해 SGLT-2 억제제 등 여러 치료제들이 시장에 출시되었습니다. 의약품 규제기관이 새롭게 등장한 치료제들의 연구개발 프로토콜을 바탕으로 당뇨병성 신증 치료제의 허가 기준을 마련함으로써, 상장 당시에 계획했던 CU01의 임상 범위를 넘어 감당하기 어려운 임상 규모를 필요로 하게 되어 불가피하게 개발 계획의 변경이 발생하였습니다. 예를 들어, SGLT-2 억제제인 Dapagliflozin 및 Empagliflozin의 경우 각각 4,304명 및 6,609명의 환자를 대상으로 38개월간 임상연구를 수행하였고, 바이엘의 케렌디아 경우에도 5,734명의 환자를 대상으로 32개월간 연구를 진행하였습니다.
CU01 개발 계획 변경 이후, 당사는 현재 국내에서 당뇨병성 신증 환자 240명을 대상으로 임상2b상을 진행하고 있습니다. 최근 일본 제약사가 진행한 대규모 임상연구에서 Nrf2 activator 기전의 약물이 신장 기능을 유지할 수 있는 것으로 밝혀짐에 따라, 같은 기전을 포함하고 있는 CU01의 신장기능 유지 효과에 대한 기대를 가지고 있는 파트너사들에게, 임상2b상 결과가 나오는 대로 기술이전을 통한 수익 인식을 목표로 하고 있습니다.
3) CU03
CU03은 2019년 12월 식품의약품안전처 임상2a상 IND 승인 이후 2022년 1월 임상시험결과보고서(CSR)를 수령하였고, 비임상 시험(26주 반복투여 독성시험)을 완료했습니다. 임상2a상 결과를 확보하고 아시아 지역에서 임상2b/3상에 진입함으로써, 계약금과 마일스톤을 통한 수익 창출을 목표로 하였으나, 상장 이후 개발전략 변경을 통해 임상2a상 결과만으로 국내 기술이전을 추진 중입니다.
당사는 상장 이후 오픈 이노베이션의 일환으로 항체 치료제 개발 전문기업인 맵틱스와 2024년 7월에 공동 연구개발 계약을 체결하였고, 이를 통해 확보한 파이프라인들과 기존 파이프라인, 새로 개발하는 파이프라인을 아울러 전략적 우선순위를 재설정하였습니다. 특히, CU03과 개발영역이 겹치는 망막질환에 기존 주력 파이프라인인 CU06과 더불어 혁신적 항체 치료제인 M-T103 파이프라인이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03은 임상2a상의 결과만으로 국내 기술이전을 추진하고, 대신 훨씬 경쟁력이 높은 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
당사는 상장 이후 전략적인 핵심 파이프라인 개편에 따라, 퇴행성 뇌질환 치료제 CU71처럼 의학적 차별화 가능성과 상업적 경쟁력을 동시에 갖춘 파이프라인들을 우선 개발순위 파이프라인으로 선정하여 개발을 진행중이며, 오픈 이노베이션을 통해 혁신적인 신규 파이프라인을 지속적으로 발굴하여 추가적인 성장 모멘텀과 영업수익을 기대하고 있습니다
또한, 큐라클의 연구 및 네트워크 역량과 관련이 깊은 신사업으로의 진출을 통한 수익 인식도 추진하고 있습니다.
[영업이익(손실)]
당사는 증권신고서상 영업이익을 35,824백만원 추정하였으나 실적은 영업손실 12,635백만 원으로 괴리율은 135.27%입니다.
괴리발생 원인은 상기와 같이 매출액에 있어 예측치 대비 68,685백만원의 실적괴리에 따라 발생하였습니다.
(중략)
【 대표이사 등의 확인 】
 |
|
대표이사확인등서명_250609 |
증 권 신 고 서
| ( 지 분 증 권 ) |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2025년 05월 22일 | 증권신고서(지분증권) | 최초 제줄 |
| 2025년 06월 09일 | [기재정정]증권신고서(지분증권) | 기재 정정(파란색) |
| 금융위원회 귀중 | 2025년 05월 22일 |
| 회 사 명 : |
주식회사 큐라클 |
| 대 표 이 사 : |
유재현 |
| 본 점 소 재 지 : |
서울특별시 서초구 효령로 23-1 (방배동) |
| (전 화) 02-3487-0077 |
|
| (홈페이지) http://www.curacle.com |
|
| 작 성 책 임 자 : | (직 책) 이사 (성 명) 황용 |
| (전 화) 070-4193-4067 |
|
| 모집 또는 매출 증권의 종류 및 수 : | 기명식 보통주 7,000,000주 | |
| 모집 또는 매출총액 : | 28,595,000,000 | 원 |
| 증권신고서 및 투자설명서 열람장소 |
| 가. 증권신고서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 투자설명서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : (주)큐라클 → 서울특별시 서초구 효령로 23-1 (방배동) 한양증권(주) → 서울특별시 영등포구 국제금융로6길 7 삼성증권(주) → 서울특별시 서초구 서초대로74길 11 |
【 대표이사 등의 확인 】
 |
|
대표이사등의확인서_250522 |
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 |
가. 국내외 거시경기 침체 및 불확실성이 미치는 위험 라. 신규사업(원료의약품 수입, 도소매업) 영위에 따른 위험 또한, 신약 연구개발과 상이한 사업 특성으로 인해 운영 및 관리상의 위험에 노출될 수 있습니다. 사업 경험 부족은 초기 시행착오로 이어질 수 있으며, 엄격한 품질 기준 미충족 시 제품 회수, 손해배상 등의 막대한 손실이 발생할 수 있습니다. 관련 법규 미준수에 따른 행정처분 및 법적 제재의 위험도 상존합니다. 신규 사업 추진에 따른 재무적 위험도 고려해야 합니다. 초기 투자 및 운영 자금 소요로 인해 재무 구조에 부담이 될 수 있으며, 시장 안착 지연 및 수익성 악화 시 투자금 회수가 어려워질 수 있습니다. 마지막으로, 한정된 경영 자원이 신규 사업에 분산될 경우, 핵심 사업인 신약 연구개발의 추진 동력이 약화될 수 있는 위험 역시 존재합니다. 당사는 신규 사업 관련 위험 최소화를 위해 다각적인 노력을 기울일 예정입니다. 그럼에도 불구하고, 신규 사업 진출에는 본질적인 불확실성과 다양한 위험이 상존하므로, 투자자께서는 신규 사업의 성공 가능성, 예상 수익성, 기존 핵심 사업에 미칠 수 있는 영향 등을 종합적으로 고려하여 신중하게 투자 결정을 내리시기 바랍니다.
또한, 신약의 시판 허가 이후에도 각국의 약가 규제 정책은 수익성에 직접적인 영향을 미칩니다. 우리나라는 물론, 미국 인플레이션 감축법(IRA) 시행 및 최혜국 대우 원칙 기반 정책 도입, 유럽 각국의 참조가격제 등 주요 시장에서 약가 인하 압력이 거세지고 있습니다. 이로 인해 당사가 개발한 신약이 기대만큼의 약가를 인정받지 못하거나 지속적으로 약가가 인하될 경우, 막대한 연구개발 투자 비용의 회수가 어려워질 수 있습니다. 더불어, 당사는 정부의 연구개발 과제 참여를 통해 자금의 일부를 지원받고 있으나, 정부의 산업 육성 정책 및 재정 상황 변화에 따라 지원 규모가 축소되거나 중단될 수 있습니다. 이러한 정부 지원 정책의 변동은 당사의 연구개발 자금 확보 계획에 차질을 빚게 하여, 진행 중인 연구개발 과제의 지연 또는 신규 투자 위축으로 이어질 수 있습니다. 상기 언급된 사항 외에도, 의약품 제조 및 품질관리 기준, 임상시험 관리 기준 등 신약 개발, 생산, 유통 전반에 걸친 규제 기준이 강화될 수 있습니다. 이러한 기준을 충족하기 위해서는 지속적인 설비 투자 및 품질 관리 시스템 개선이 필요하며, 이를 준수하지 못할 경우 제조 허가 취소, 제품 회수 등의 제재를 받을 수 있습니다. 또한, 환경·안전·보건, 개인정보보호, 공정거래 관련 규제 강화 역시 비용 증가나 사업 활동 제약의 요인으로 작용할 수 있습니다. 바. 신약 개발의 불확실성에 따른 위험 또한, CU06의 글로벌 개발을 위해 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 기술이전 계약이 2024년 7월 파트너사의 내부 개발 전략 변경을 사유로 해지되었으며 당사는 반환된 CU06의 경쟁력을 재점검하고 향후 개발 계획을 수립하였습니다. 더불어 기업공개(IPO) 당시 계획했던 주요 파이프라인의 임상시험 및 기술이전 일정이 전반적으로 지연되고 있습니다. CU06은 파트너사와의 협력 및 규제 대응 과정에서, CU01(당뇨병성 신증 치료제)은 규제기관의 권고 및 대규모 임상 필요성에 따른 개발 전략 수정으로 인해 당초 예상보다 사업화 성과 달성이 지체되고 있습니다. 이와 같은 개발 일정 지연은 추가적인 비용 발생으로 이어질 수 있으며, 향후 계획 역시 추가적인 변수로 인해 지연될 가능성이 있습니다. 상기 서술된 바와 같이 각 임상시험에서 1차 평가지표를 충족하지 못하거나, 통계적으로 유의미한 치료 효과를 입증하지 못하거나, 심각한 안전성 문제가 발생할 경우, 해당 파이프라인의 개발이 중단될 수 있습니다. 이는 당사의 파이프라인 가치 하락, 주가 하락 등 심각한 부정적 결과를 초래할 수 있습니다. 또한, 임상시험 과정에서 환자 모집 지연, 임상시험수탁기관과의 문제, 임상시험용 의약품 생산 차질 등 다양한 변수로 인해 개발 일정이 지연되고 비용이 증가할 위험이 상존합니다. 긍정적인 임상 결과를 얻더라도 규제 당국의 품목허가를 받지 못하면 신약을 출시할 수 없으며, 허가를 받더라도 시장 경쟁, 낮은 시장 수용성, 불리한 약가 등으로 상업적 성공을 거두지 못할 위험도 존재합니다.
당사의 핵심 파이프라인인 CU06의 글로벌 기술이전 계약이 해지됨에 따라, 향후 사업화 전략의 불확실성이 증대되었으며 기대수익 확보가 불가능하게 되었습니다. 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 CU06 기술이전 계약은 2024년 7월, 파트너사의 내부 개발 전략 변경에 따라 해지되었습니다. 이로 인해 당사는 해당 계약을 통해 기대했던 마일스톤 및 로열티 수익을 확보할 수 없게 되었으며, 새로운 글로벌 파트너사를 찾아야 하는 과제에 직면했습니다. 현재 당사는 CU06 및 관련 파이프라인 전체의 글로벌 권리를 하나의 패키지로 기술이전하는 새로운 전략을 추진하고 있으나, 이는 초기 논의 단계로 계약의 성사 여부, 시기, 조건 등 모든 측면에서 불확실성이 매우 높은 상황입니다. 또한, 기업공개(IPO) 당시 계획했던 주요 파이프라인의 임상시험 및 기술이전 일정이 전반적으로 지연되고 있습니다. CU06의 경우 파트너사와의 협력 및 규제 대응 과정에서, CU01(당뇨병성 신증 치료제)은 대규모 임상 필요성에 따른 개발 전략 수정 및 규제기관의 권고 등으로 인해 당초 계획보다 사업화 일정이 지연되었습니다. 이러한 일정 지연은 가시적인 사업화 성과 도출을 지체시키고 추가적인 비용 발생으로 이어질 수 있으며, 향후 계획 역시 다양한 변수로 인해 추가적으로 지연될 가능성이 존재합니다. 기술이전 및 공동개발 계약은 파트너사의 전략 변화, 개발 중단, 계약 해지 등 본질적인 불확실성과 파트너 의존성에 따른 위험을 내포하고 있습니다. 기술이전 계약의 파트너사는 자체적인 경영 판단, 자금 조달의 어려움, 예상치 못한 임상 결과 등을 이유로 개발을 중단하거나 지연시킬 수 있으며, 이 경우 당사는 마일스톤 및 로열티 수익을 수령하지 못할 수 있습니다. 공동개발 역시 파트너사와의 연구 방향, 비용 분담 등에 대한 의견 차이로 프로젝트 진행에 차질이 발생할 수 있습니다. 당사가 최근 맵틱스와 신규 공동개발 계약을 체결하는 등 외부 협력을 지속하고 있으나, 이러한 파트너 의존적 사업 구조의 본질적인 위험은 여전히 존재합니다. 당사는 계약 조건의 면밀한 검토와 파트너사와의 긴밀한 협력을 통해 이러한 위험을 최소화하고자 하나, 기술이전 및 공동개발과 관련된 불확실성은 여전히 존재하며, 이는 당사의 경영 성과 및 재무 상태에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 기술이전 및 공동개발 계약에 따른 수익 실현의 불확실성과 파트너사의 개발 역량 및 전략 변화에 따른 위험이 당사의 재무적 성과 및 파이프라인 가치에 직접적인 영향을 줄 수 있음을 충분히 고려하시기 바랍니다. |
| 회사위험 |
가. 관리종목 지정 및 상장폐지 관련 위험 다. 매출부진 및 지속적 손실 발생 위험 당사는 2016년 05월 설립, 2021년 07월 기술특례로 코스닥 시장 상장한 바이오 벤처 기업으로, 혈관내피기능장애(Endothelial Dysfunction)을 정상화하여 다양한 난치성 질환의 근본 원인을 개선하는 치료제를 연구 및 개발하고 있습니다. 현재까지 당사의 주된 수익원은 개발 중인 신약 후보물질의 기술이전 계약에 따른 계약금(Upfront payment) 및 개발 단계별 성과보수(Milestone payment) 등으로 구성됩니다. 이는 일반적인 제조기업이나 이미 상용화된 제품을 보유한 제약사와는 다른 수익 구조로, 신약 개발의 성공 여부 및 기술이전 계약 체결 및 유지 여부에 따라 매출 발생이 간헐적이거나 변동성이 매우 클 수 있습니다. 이러한 사업 모델은 당사의 재무적 특성에 직접적인 영향을 미칩니다. 기술이전 계약은 성공 시 상당한 규모의 수익을 가져다줄 수 있지만, 계약 체결 자체가 빈번하지 않고 각 개발 단계의 성공에 따라 마일스톤이 지급되므로 수익 흐름이 연속적이지 못하고 예측 또한 어렵습니다. 이는 안정적인 현금흐름 확보를 어렵게 만들며, 대규모 연구개발 투자가 지속되는 상황에서 재무적 부담을 가중시키는 요인으로 작용합니다. 당사의 수익 창출 능력이 아직까지는 특정 기술이전 계약에 크게 의존하고 있으며, 이러한 계약의 변동이 발생할 경우 재무 상태에 즉각적이고 심각한 영향을 미칠 수 있음을 시사합니다. 또한, 매출 발생 여부와 관계없이 연구개발비 등 고정적인 비용 지출 규모가 커 수익성을 확보하지 못하고 손실이 누적되는 구조가 고착화될 위험이 있으니 투자자께서는 이 점 유의하시기 바랍니다.
|
| 기타 투자위험 | 가. 중점심사 유상증자 선정 가능성 및 증권신고서 정정에 따른 일정 지연 관련 위험 2025년 02월 27일 금융감독원은 IPO(기업공개) 및 유상증자 주관업무와 관련해 16개 증권사와 간담회를 하고 유상증자 증권신고서 중점심사 방향을 공개했습니다. 앞으로 일반주주 권익 훼손 우려 등 7개 사유에 해당하면 '중점심사 유상증자'로 선정하고, 심사 항목별로 집중심사하기로 했습니다. 금융감독원은 '주식가치 희석화 우려', '일반주주 권익훼손 우려', '재무위험 과다', '주관사의 주의의무 소홀' 등 대분류와 7가지 소분류에 따라 중점심사 유상증자 항목을 선정하였습니다. 당사는 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등의 부재로 금융감독원으로부터 중점심사 대상으로 지정되었으며, 항목은 한계기업에 해당합니다. 당사는 증권신고서 제출 전일 기준 중점심사 대상의 주요 심사항목에 대한 내용을 상세히 기재하였으며, 금번 주주배정 후 실권주 일반공모 유상증자의 당위성 설명 및 과정 중 주주권익보호활동을 적극적으로 진행할 예정입니다. 이처럼 중점심사 대상에 지정된 경우 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. 나. 신주 물량 출회에 따른 주가하락 위험 금번 주주배정 유상증자의 발행예정주식수 7,000,000주는 발행주식총수(보통주 14,009,155주) 21,009,155주 대비 49.97%에 해당합니다. 신주 추가 상장 시점에 대규모 물량의 일시 출회에 따른 주가 희석화 우려로, 투자자가 경제적 손실을 입을 가능성이 있는것으로 판단됩니다. 또한, 금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 모집예정주식 7,000,000주가 향후 코스닥 시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다. 다. 환금성 제한 및 원금 손실 가능성에 대한 위험 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있습니다. 투자자분들은 투자시 이점 유의하시기 바랍니다. 라. 경영환경변화 등에 따른 위험 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 증권신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분이 독자적으로 결정해야 함을 유의하시기 바랍니다. 마. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 하락할 경우 당사가 계획했던 자금운용계획 등에 차질이 빚어질 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있습니다. 바. 집단 소송이 제기될 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있음을 유의하시기 바랍니다. 사. 유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. 아. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다. 자. 기타 투자자 유의사항 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 7,000,000 | 500 | 4,085 | 28,595,000,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 한양증권 | 보통주 | 4,900,000 | 20,016,500,000 | - 인수수수료: 모집총액의 1.8% 中 70% - 실권수수료: 잔액인수금액의 18.0% |
잔액인수 |
| 인수 | 삼성증권 | 보통주 | 2,100,000 | 8,578,500,000 | - 인수수수료: 모집총액의 1.8% 中 30% - 실권수수료: 잔액인수금액의 18.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2025년 08월 04일 ~ 2025년 08월 05일 | 2025년 08월 12일 | 2025년 08월 06일 | 2025년 08월 12일 | 2025년 06월 26일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2025년 05월 17일 | 2025년 07월 30일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 운영자금 | 27,995,000,000 |
| 발행제비용 | 600,000,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | [정정] 주요사항보고서(유상증자결정)-2025.05.22 |
| 【기 타】 |
1) 금번 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 한양증권(주)이며, 그 외 인수회사는 삼성증권(주)입니다.
|
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6 제2항 제1호에 의거 한양증권(주) 및 삼성증권(주)와 주주배정후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 7,000,000주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 : 원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 7,000,000 | 500 | 4,085 | 28,595,000,000 | 주주배정후 실권주 일반공모 |
| 주1) | 최초 이사회 결의일 : 2025년 05월 16일 |
| 주2) | 1주의 모집가액 및 모집총액은 예정발행가액 기준으로 한 예정금액이며, 확정되지 않은 금액입니다. |
발행가액은 「증권의 발행 및 공시 등에 관한 규정」 제5-18조 (유상증자의 발행가액 결정)에 의거, 주주배정 증자시 할인율 등이 자율화 되어 발행가격을 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 산정할 예정입니다.
■ 예정발행가액의 산출근거
이사회결의일 전일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 최근일 가중산술평균주가를 산술평균하여 산정한 가액과 최근일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 할인율 25%를 적용하고 증자비율을 고려하여, 아래 산식에 의하여 산정된 발행가액(예정발행가액)으로 합니다. 단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.
| ▶ 예정발행가액 |
= | 기준주가 ×【 1 - 할인율(25%)】 |
| ------------------------------------------------ | ||
| 1 + 【증자비율 × 할인율(25%)】 |
상기 방법에 따라 산정된 예정발행가액은 참고용이며, 최종발행가액은 구주주 청약일 3거래일 전에 결정될 예정입니다.
| [ 예정발행가액 산정표] | |
| (단위 : 원, 주) | |
| 일자 | 가중산술평균주가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2025-05-15 | 6,127 | 82,095 | 502,993,020 |
| 2025-05-14 | 6,205 | 40,083 | 248,706,495 |
| 2025-05-13 | 6,260 | 79,373 | 496,907,680 |
| 2025-05-12 | 6,400 | 79,868 | 511,139,635 |
| 2025-05-09 | 6,647 | 80,990 | 538,361,175 |
| 2025-05-08 | 6,688 | 50,990 | 340,999,570 |
| 2025-05-07 | 6,663 | 43,628 | 290,685,890 |
| 2025-05-02 | 6,797 | 28,644 | 194,691,240 |
| 2025-04-30 | 6,784 | 52,635 | 357,061,900 |
| 2025-04-29 | 6,869 | 61,529 | 422,613,380 |
| 2025-04-28 | 6,828 | 52,577 | 359,017,530 |
| 2025-04-25 | 6,884 | 33,340 | 229,501,235 |
| 2025-04-24 | 6,738 | 93,508 | 630,023,115 |
| 2025-04-23 | 6,780 | 65,829 | 446,336,630 |
| 2025-04-22 | 6,861 | 115,688 | 793,695,745 |
| 2025-04-21 | 7,211 | 338,811 | 2,443,075,280 |
| 2025-04-18 | 6,967 | 39,150 | 272,768,085 |
| 2025-04-17 | 7,011 | 106,129 | 744,068,085 |
| 2025-04-16 | 6,846 | 116,798 | 799,587,555 |
| 1개월 가중산술평균주가 (A) | 6,802 | 1,561,665 | 10,622,233,245 |
| 1주일 가중산술평균주가 (B) | 6,341 | 362,409 | 2,298,108,005 |
| 최근일 가중산술평균주가 (C) | 6,127 | 82,095 | 502,993,020 |
| A,B,C의 산술평균 (D) | 6,423 | (A+B+C)/3 | |
| 기준주가 (E) | 6,127 | (C와 D중 낮은가액) | |
| 할인율 (F) | 25% | - | |
| 증자비율 (G) | 49.97% | - | |
| 예정발행가액 | 4,085 | 기준주가 × (1-할인율) / 1 + (유상증자비율 × 할인율 ) (단, 호가 단위 미만은 호가 단위로 절상하기로 하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.) |
|
■ 공모일정 등에 관한 사항
| [주요일정] |
| 날 짜 | 내 용 | 비 고 |
|---|---|---|
| 2025년 05월 16일 | 최초 이사회결의 | - |
| 2025년 05월 16일 | 신주발행 및 기준일 공고 | 회사 인터넷 홈페이지 (www.curacle.com) |
| 2025년 05월 22일 | 증권신고서 제출 | - |
| 2025년 06월 23일 | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2025년 06월 25일 | 권리락 | - |
| 2025년 06월 26일 | 신주배정기준일 | - |
| 2025년 07월 08일 | 신주배정통지 | - |
| 2025년 07월 15일 ~ 2025년 07월 21일 |
신주인수권증서 상장 및 거래기간 | 5거래일 간 거래 |
| 2025년 07월 22일 | 신주인수권증서 상장폐지 | 구주주 청약초일 5거래일 이전에 폐지 |
| 2025년 07월 30일 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 산정 |
| 2025년 07월 31일 | 확정 발행가액 공고 | 회사 인터넷 홈페이지 (www.curacle.com) DART 전자공시시스템 (dart.fss.or.kr) |
| 2025년 08월 04일 ~ 2025년 08월 05일 |
구주주 청약 및 초과청약 | - |
| 2025년 08월 06일 | 일반공모 청약 공고 | 회사 인터넷 홈페이지 (www.curacle.com) 한양증권(주) 홈페이지 (www.hygood.co.kr) 삼성증권(주) 홈페이지 (www.samsungpop.com) |
| 2025년 08월 07일 ~ 2025년 08월 08일 |
일반공모 청약 | - |
| 2025년 08월 12일 | 환불 및 배정 공고 | 한양증권(주) 홈페이지 (www.hygood.co.kr) 삼성증권(주) 홈페이지 (www.samsungpop.com) |
| 2025년 08월 12일 | 주금 납입 / 환불 | - |
| 2025년 08월 26일 | 신주상장 예정일 | - |
| 주1) 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) 2019년 09월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주상장과 동시에 신주가 유통될 예정입니다. |
| 주3) 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
2. 공모방법
[공모방법 : 주주배정후 실권주 일반공모]
| 모집대상 | 주식수 | 비 고 |
|---|---|---|
| 구주주 청약 (신주인수권증서 보유자 청약) |
7,000,000주(100%) | ▶ 구주주 청약일 : 2025년 08월 04일 ~ 08월 05일 ▶ 구주 1주당 신주 배정비율 : 1주당 0.4996732494주 ▶ 신주배정기준일 : 2025년 06월 26일 ▶ 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권증서가 배정됨) ▶ 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 청약 가능 |
| 초과 청약 | - | ▶ 「자본시장과 금융투자업에 관한 법률」 제165조의6의제2항제2호에 의거 초과청약 ▶ 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 (단, 1주 미만은 절사함) ▶ 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 ▶ 구주주 청약일에 초과청약 접수 |
| 일반공모 청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
- | ▶ 구주주 청약 후 발생하는 단수주 및 실권주 배정 ▶ 일반공모 청약일 : 2025년 08월 07일 ~ 08월 08일 |
| 합계 | 7,000,000주(100%) |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.4996732494를 곱하여 산정된 배정주식수로 하되, 1주 미만은 절사합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 주식매수선택권의 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동으로 인하여 1주당 배정주식수가 변동될 수 있습니다. |
| 주3) |
신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20%)을 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. (ii) 신주인수권증서청약 한도주식수 = 보유한 신주인수권증서의 수량 (iii) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율(20%) (1주 미만 절사) |
| 주4) |
"고위험고수익투자신탁등"이란 다음 각 호의 어느 하나에 해당하는 투자신탁 등을 말합니다. (1) 「조세특례제한법」 제91조의15 제1항에 따른 고위험고수익채권투자신탁(이하 "고위험고수익채권투자신탁"이라 함). 다만, 해당 투자신탁 등의 최초 설정일ㆍ설립일이 속하는 분기 또는 그 다음 분기 말일 전 배정하는 경우에는 같은 법 시행령 제93조 제1항 제1호 및 같은 조 제5항에도 불구하고 배정일 직전 영업일의 고위험고수익채권의 보유비율이 같은 법 시행령 제93조 제1항 제1호 각 목의 비율 이상이어야 합니다. (2) 법률 제19328호「조세특례제한법」의 시행일 이전의 제91조의15제1항에 따른 고위험고수익투자신탁(이하 "고위험고수익투자신탁"이라 함)으로서 최초 설정일ㆍ설립일이 2023년 12월 31일 이전인 것을 말합니다. 다만, 해당 투자신탁 등의 설정일ㆍ설립일부터 배정일까지의 기간이 6개월 미만일 경우에는 대통령령 제33499호 같은 법 시행령 시행일 이전의 제93조 제3항 제1호 및 같은 조 제7항에도 불구하고 배정일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 배정일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 배정일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35이상이어야 합니다. |
| 주6) |
일반공모 청약 : "구주주" 청약(초과청약 포함) 결과 발생한 미청약주식 및 단수주는 대표주관회사가 일반에게 공모하되「증권 인수업무 등에 관한 규정」 제9조 제2항 제6호에 따라 "고위험고수익투자신탁등"에 일반공모 배정분의 10%를 배정하고, "벤처기업투자신탁"에 일반공모 배정분의 25%를 배정합니다. 나머지 주식은 개인청약자 및 기관투자자에 구분없이 배정합니다. "고위험고수익투자신탁등"에 대한 일반공모 배정분 10%, "벤처기업투자신탁"에 대한 일반공모 배정분 25% 및 개인투자자 및 기관투자자에 대한 일반공모 배정분 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만 한 그룹만 청약미달이 발생할 경우 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정합니다. 배정결과 발생하는 잔여주식은 대표주관회사와 인수회사가 각 인수의무비율대로 자기계산으로 잔액인수하기로 합니다. |
| 주7) | 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다. |
| 주8) |
「자본시장과 금융투자업에 관한 법률」 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2025년 05월 23일부터 2025년 07월 30일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 「금융투자업규정」 제6-30조제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
※ 참고 : 구주주 1주당 배정비율 산출 근거
| 구 분 | 상세 내역 |
|---|---|
| A. 보통주식 | 14,009,155 |
| B. 우선주식 | - |
| C. 발행주식총수(A+B) | 14,009,155 |
| D. 자기주식 + 자기주식신탁 | - |
| E. 자기주식을 제외한 발행주식총수 (C-D) | 14,009,155 |
| F. 유상증자 주식수 | 7,000,000 |
| G. 증자비율 (F/C) | 49.97% |
| H. 우리사주조합 배정 | - |
| I. 구주주배정 (F-H) | 7,000,000 |
| J. 구주주 1주당 배정비율 (I/E) | 0.4996732494 |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」 제5-18조에서 주주배정 증자시 가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
(1) 1차 발행가액 : 신주배정기준일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와, 1주일 가중산술평균주가 및 최근일 가중산술평균주가를 산술평균하여 산정한 가액과 최근일 가중산술평균주가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용하고 증자비율을 고려하여, 아래의 산식에 의하여 산정된 발행가액(1차 발행가액)으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
| 기준주가 ×【 1 - 할인율(25%)】 | ||
| ▶ 1차 발행가액 | = | ------------------------------------- |
| 1 + 【증자비율 × 할인율(25%)】 |
(2) 2차 발행가액 : 구주주 청약일 전 제3거래일을 기산일로 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 최근일 가중산술평균주가를 산술평균하여 산정한 가액과 최근일 가중산술평균주가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용, 아래의 산식에 의하여 산정된 발행가액(2차 발행가액)으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
| ▶ 2차 발행가액 = 기준주가 ×【1 - 할인율(25%)】 |
(3) 확정 발행가액 : 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 합니다. 다만, 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액중 낮은 가액이 구주주 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가를 기준주가로 하여 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
| ▶ 확정 발행가액 = MAX【MIN(1차 발행가액, 2차 발행가액), 기준주가의 60%】 * 기준주가= 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가 |
(4) 최종 발행가액은 구주주 청약 초일 전 제3거래일에 결정되어 금융감독원 전자공시시스템에 공시될 예정이며, 회사의 인터넷 홈페이지(www.curacle.com)에 공고하여 개별통지에 갈음할 예정입니다.
(5) 당사는 금번 주주배정 후 실권주 일반공모 유상증자를 통해 파이프라인별 임상연구비용 및 신규사업을 위한 자본금 확충 등 회사의 지속적인 성장을 위한 운영자금을 확충하고 재무적인 안정성을 확보하고자 합니다. 이를 통해 주주가치를 극대화하고, 장기적으로 경쟁력을 갖춘 기업으로 도약할 수 있도록 최선을 다 할 것입니다.
증자비율은 기업의 필요 자금 규모와 주주가치 보호의 균형을 고려하여 다양한 비율로 결정되어야 하며, 증자비율이 과도하게 높을 경우 시장에서 재무 상태에 대한 부정적인 신호로 해석될 가능성이 있고 기존 주주들의 주주가치가 훼손될수 있어 적정한 수준에서 결정하는 것이 중요합니다. 할인율의 경우 「증권의 발행 및 공시 등에 관한 규정」에 의거 주주배정 유상증자의 경우 40% 이내에서 결정할 수 있으며, 기존주주들의 지분 희석 정도를 감안하여 적정 할인율에 대한 결정이 필요합니다.
이에, 기존 주주의 권익을 보호하면서도 장기적인 기업가치 상승을 기대할 수 있는 조건을 결정하기 위해 당사의 이사회는 과거 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 토대로 금번 유상증자의 증자비율과 할인율 적정성 검토 및 논의를 진행하였습니다. 당사가 이사회 논의에서 참고한 유사업종 유상증자 사례는 다음과 같습니다.
| [최근(2023년~2025년) 발행규모 250억원~350억원 규모 유상증자 사례] |
| (단위: 억원, 원, %) |
| 회사명 | 납입일 | 발행금액(억원) | 발행가(원) | 할인율 | 증자비율 |
|---|---|---|---|---|---|
| 젠큐릭스 | 2023.04.20 | 254 | 3,925 | 25% | 92.65% |
| 엘앤케이바이오 | 2023.07.13 | 260 | 3,980 | 25% | 48.67% |
| 클리노믹스 | 2023.08.10 | 276 | 3,540 | 25% | 55.71% |
| 뉴인텍 | 2023.08.17 | 261 | 1,255 | 25% | 69.09% |
| 원익피앤이 | 2023.11.18 | 283 | 5,660 | 25% | 11.78% |
| 유니슨 | 2024.05.03 | 305 | 727 | 25% | 33.24% |
| SG | 2024.06.27 | 318 | 1,061 | 25% | 49.04% |
| 엑시콘 | 2024.07.19 | 333 | 15,130 | 25% | 21.38% |
| 평균 | 25% | 47.69% | |||
| 출처) Dart 전자공시시스템, 당사 제시 |
2023년 이후 당사와 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 분석한 결과, 평균 증자비율은 47.69%, 평균 할인율은 25% 수준으로 파악됩니다. 증자비율의 경우, 자금의 사용목적과 회사의 필요 자금 규모에 따라 21.38% ~ 92.65%까지 다양한 비율로 결정된 반면, 할인율은 대부분 25%를 설정하였습니다.
당사는 이러한 사례를 기반으로 이사회에서 논의를 진행하였고, 본 발행조건이 기존 주주들의 권익 침해를 최소화하고, 주주가치를 제고할 수 있는 적정한 조건이라고 판단하여 금번 유상증자의 할인율 25%, 증자비율 49.97%로 발행 조건을 결정하였습니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 7,000,000 | |||||||||||||||||||||||||||||||||||
| 주당 모집가액 | 예정가액 | 4085 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 모집총액 | 예정가액 | 28,595,000,000 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수(1주 미만은 절사)와 초과청약 가능 주식수(보유하고 있는 신주인수권증서 1주당 0.2주를 곱하여 산정된 수, 단 1주 미만은 절사)로 합니다. 다만, 신주배정기준일 현재 신주배정비율은 자기주식의 변동, 주식관련사채의 행사, 주식매수선택권의 행사 등으로 인하여 변경될 수 있습니다.(단, 1주 미만은 절사한다).
|
|||||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 및 초과청약 |
개시일 | 2025년 08월 04일 | |||||||||||||||||||||||||||||||||
| 종료일 | 2025년 08월 05일 | |||||||||||||||||||||||||||||||||||
| 실권주 일반공모 | 개시일 | 2025년 08월 07일 | ||||||||||||||||||||||||||||||||||
| 종료일 | 2025년 08월 08일 | |||||||||||||||||||||||||||||||||||
| 청약 증거금 | 구주주 | 청약금액의 100% | ||||||||||||||||||||||||||||||||||
| 초과청약 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 납입기일 | 2025년 08월 12일 | |||||||||||||||||||||||||||||||||||
| 배당기산일(결산일) | 2025년 01월 01일 | |||||||||||||||||||||||||||||||||||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
(1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
|---|---|---|
| 신주발행(신주배정기준일)의 공고 | 2025년 05월 16일 | 회사 인터넷 홈페이지 (www.curacle.com) |
| 모집 또는 매출가액 확정의 공고 | 2025년 07월 30일 | 회사 인터넷 홈페이지 (www.curacle.com) DART 전자공시시스템 (dart.fss.or.kr) |
| 실권주 일반공모 청약공고 | 2025년 08월 06일 | 회사 인터넷 홈페이지 (www.curacle.com) 한양증권(주) 홈페이지 (www.hygood.co.kr) 삼성증권(주) 홈페이지 (www.samsungpop.com) |
| 실권주 일반공모 배정 및 환불 공고 | 2025년 08월 12일 | 한양증권(주) 홈페이지 (www.hygood.co.kr) 삼성증권(주) 홈페이지 (www.samsungpop.com) |
| 주1) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
| 주2) | 모집가액은 2025년 07월 30일을 기준으로 확정되며, 다음 영업일인 2025년 07월 31일까지 공고할 예정입니다. |
| 주3) | 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 홈페이지에 게시함으로써 개별통지에 갈음합니다. |
| 주4) | 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행한 일간신문 한국경제에 게재할 예정입니다. |
(2) 청약방법
1) 구주주 중 주권을 증권회사에 예탁한 실질주주는 주권을 예탁한 증권회사의 본ㆍ지점 및 대표주관회사인 한양증권(주)의 본ㆍ지점에서 청약할 수 있습니다. 다만, 구주주 중 주식을 증권회사 계좌에 보유하지 않은 특별계좌부 등재 주주(기존 명부주주)의 경우는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 한양증권(주)의 본ㆍ지점에서 청약할 수 있습니다. 청약시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출해야 합니다.
| 2019년 09월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한양증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
| 「주식ㆍ사채 등의 전자등록에 관한 법률」 |
|---|
| 제29조(특별계좌의 개설 및 관리) ① 발행인이 제25조부터 제27조까지의 규정에 따라 이미 주권등이 발행된 주식등을 전자등록하는 경우 제25조제1항에 따른 신규 전자등록의 신청을 하기 전에 제27조제1항제2호에 따른 통지를 하지 아니하거나 주권등을 제출하지 아니한 주식등의 소유자 또는 질권자를 위하여 명의개서대행회사, 그 밖에 대통령령으로 정하는 기관(이하 이 조에서 "명의개서대행회사등"이라 한다)에 기준일의 직전 영업일을 기준으로 주주명부등에 기재된 주식등의 소유자 또는 질권자를 명의자로 하는 전자등록계좌(이하 "특별계좌"라 한다)를 개설하여야 한다. ② 제1항에 따라 특별계좌가 개설되는 때에 제22조제2항 또는 제23조제2항에 따라 작성되는 전자등록계좌부(이하 이 조에서 "특별계좌부"라 한다)에 전자등록된 주식등에 대해서는 제30조부터 제32조까지의 규정에 따른 전자등록을 할 수 없다. 다만, 다음 각 호의 어느 하나에 해당하는 경우에는 그러하지 아니하다. 1. 해당 특별계좌의 명의자가 아닌 자가 주식등이 특별계좌부에 전자등록되기 전에 이미 주식등의 소유자 또는 질권자가 된 경우에 그 자가 발행인에게 그 주식등에 관한 권리가 표시된 주권등을 제출(주권등을 제출할 수 없는 경우에는 해당 주권등에 대한 제권판결의 정본·등본을 제출하는 것을 말한다. 이하 제2호 및 제3호에서 같다)하고 그 주식등을 제30조에따라 자기 명의의 전자등록계좌로 계좌간 대체의 전자등록을 하려는 경우(해당 주식등에 질권이 설정된 경우에는 다음 각 목의 어느 하나에 해당하는 경우로 한정한다) 가. 해당 주식등에 설정된 질권이 말소된 경우 나. 해당 주식등의 질권자가 그 주식등을 특별계좌 외의 소유자 명의의 다른 전자등록계좌로 이전하는 것에 동의한 경우 2. 해당 특별계좌의 명의자인 소유자가 발행인에게 전자등록된 주식등에 관한 권리가 표시된 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 다른 전자등록계좌로 이전하려는 경우(해당 주식등에 질권이 설정된 경우에는 제1호 각 목의 어느 하나에 해당하는 경우로 한정한다) 3. 해당 특별계좌의 명의자인 질권자가 발행인에게 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 전자등록계좌로 이전하려는 경우 4. 그 밖에 특별계좌에 전자등록된 주식등의 권리자의 이익을 해칠 우려가 없는 경우로서 대통령령으로 정하는 경우 ③ 누구든지 주식등을 특별계좌로 이전하기 위하여 제30조에 따른 계좌간 대체의 전자등록을 신청할 수 없다. 다만, 제1항에 따라 특별계좌를 개설한 발행인이 대통령령으로 정하는 사유에 따라 신청을 한 경우에는 그러하지 아니하다. ④ 명의개서대행회사등이 발행인을 대행하여 제1항에 따라 특별계좌를 개설하는 경우에는 「금융실명거래 및 비밀보장에 관한 법률」 제3조에도 불구하고 특별계좌부에 소유자 또는질권자로 전자등록될 자의 실지명의를 확인하지 아니할 수 있다. |
2) 신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도주식수의 20%를 추가로 청약할 수 있습니다. 이때 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
3) 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자는 「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약합니다. 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자의 청약 시, 각 청약처별로 다중청약은 가능하나, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구를 제외한 청약자의 한 개 청약처에 대한 복수청약은 불가능합니다. 또한 고위험고수익투자신탁등은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제18호에 따른 요건을 충족함을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다. 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제20호에 따른 요건을 충족하고, 제9조제10항에 따른 확약서 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
4) 1인당 청약한도를 초과하는 청약은 초과되는 부분에 대하여는 청약이 없는 것으로 하고, 청약사무 취급처는 그 차액을 납입일까지 당해 청약자에게 반환하며, 받은 날부터의 이자는 지급하지 않습니다.
5) 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」 제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제 132조에 따라 투자설명서의 교부가 면제되는자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다.
6) 「자본시장과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 따라 2025년 05월 17일부터 2025년 07월 30일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장 업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
(3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
한양증권(주) 본ㆍ지점 | 2025년 08월 04일 ~ 2025년 08월 05일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 주식을 예탁하고 있는 해당 증권회사 본ㆍ지점 2) 한양증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
1)한양증권(주) 본ㆍ지점 2)삼성증권(주) 본ㆍ지점 |
2025년 08월 07일 ~ 2025년 08월 08일 |
|
단, 금번 신주발행은 주주배정 후 실권주 일반공모 방식으로 진행되며, 이는 기존 주주에게 우선적으로 청약기회를 부여하는 방식으로, 구주주에게 신주를 우선적으로 배정한 후 이에 대한 미청약주식이 발생한 경우에는 이를 일반투자자를 대상으로 공모하는 방식입니다. 따라서 실권주가 발생할 경우 일반투자자에게 청약 기회가 제공될 수 있으며, 만약 구주주 청약에서 실권주가 발생하지 않을 경우에는 일반투자자에게 청약기회가 제공되지 않을 수 있습니다.
(4) 청약결과 배정방법
1) 구주주 청약 : 신주배정기준일 18시 현재 주주명부에 등재된 주주에게 본 주식을 1주당 0.4996732494주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 자기주식의 변동, 주식관련사채의 행사, 주식매수선택권의 행사 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
2) 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주가 있는 경우,실권주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율 : 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다.(단, 초과청약 주식수가 실권주에 미달한 경우 100% 배정)
(i) 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수
(ii) 신주인수권증서청약 한도주식수 = 보유한 신주인수권 증서의 수량
(iii) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율(20%)
3) 일반공모 청약
① 상기 구주주 청약 및 초과청약 결과 발생한 실권주 및 단수주는 대표주관회사와 인수회사가 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」제9조제2항제6호에 따라 고위험고수익투자신탁등에 공모주식의 10%를 배정하고, 벤처기업투자신탁에 공모주식의 25%를 배정합니다. 나머지 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자)에게 구분 없이 배정합니다. 고위험고수익투자신탁등에 대한 공모주식의 10%, 벤처기업투자신탁에 대한 공모주식의 25%와 개인투자자 및 기관투자자에 대한 공모주식의 65%에 대한 청약경쟁률과 배정에 있어서는 별도로 산출 및 배정합니다. 다만, 어느 한 그룹에서 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
② 일반공모에 관한 배정수량 계산시 대표주관회사와 인수회사의 "청약물량"(대표주관회사와 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미하며, 대표주관회사와 인수회사에 대하여 개별적으로 산정한 청약주식수를 말한다)에 대해서는 대표주관회사와 인수회사의 총청약물량(대표주관회사와 인수회사가 일반공모 방식으로 접수를 받은 청약물량의 합을 말한다)을 일반공모 배정분 주식수로 나눈 통합 청약경쟁률에 따라 대표주관회사와 인수회사의 각 청약자에 배정하는 방식(이하 "통합배정"이라 한다)으로 합니다.
③ 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다.
④ 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정하며, 배정결과 발생하는 잔여주식은 대표주관회사가와 인수회사가 인수의무비율에 따라 각각 자기의 계산으로 인수합니다.
[인수계약 내용에 따른 대표주관회사 및 인수회사의 인수의무비율]
| 구분 | 인수의무비율 | |
|---|---|---|
| 대표주관회사 | 한양증권(주) | 70.00% |
| 인수회사 | 삼성증권(주) | 30.00% |
| 합 계 | 100.00% | |
⑤ 단, 「증권 인수업무 등에 관한 규정」 제9조제2항제7호에 의거 일반청약자에 대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니하고 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다.
(5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」 제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 (주)큐라클 및 대표주관회사, 인수회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- 금번 유상증자에 청약하고자 하는 투자자께서는 (「자본시장과 금융투자업에 관한법률」 제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 따라 투자설명서의 교부가 면제되는 자 제외) 청약하시기 전 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
- 투자설명서 수령거부 의사 표시는 서면, 전화ㆍ전신ㆍ모사전송, 전자우편 및 이와비슷한 전자통신으로만 하여야 합니다.
1) 투자설명서 교부 방법 및 일시
| 구분 | 교부방법 | 교부일시 |
|---|---|---|
|
구주주 청약자 |
1), 2), 3)을 병행 | - |
| 1) 우편 송부 | 구주주(신주인수권증서) 청약 초일 전까지 | |
| 2) 한양증권(주)의 본ㆍ지점에서 교부 | 구주주(신주인수권증서) 청약 종료일까지 | |
| 3) 한양증권(주)의 HTS, MTS에서 교부 | ||
|
일반 청약자 |
1), 2)를 병행 | - |
| 1) 한양증권(주) 및 삼성증권(주)의 본ㆍ지점에서 교부 | 일반공모 청약 종료일까지 | |
| 2) 한양증권(주) 및 삼성증권(주)의 홈페이지나 HTS, MTS에서 교부 |
| 주) | 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다. |
2) 확인절차
① 우편을 통한 투자설명서 수령시(구주주 청약의 경우)
- 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
- HTS 및 MTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
- 주주배정 유상증자 경우 유선청약이 가능합니다. 유선상으로 신분확인을 하신 후, 투자설명서 교부 확인을 해주시고 청약을 진행하여 주시기 바랍니다.
② 지점 방문을 통한 투자설명서 수령시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
③ 홈페이지 또는 HTS, MTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
3) 기타
① 금번 유상증자의 경우, 본 증권신고서의 효력발생 이후 주주명부 상 주주분들에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는 지점방문을 통해 인쇄물을 받으실 수 있습니다. 다만, 전자문서의 형태로 교부받으실 경우 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각호의 요건을 모두 충족해야만 청약이 가능합니다.
② 구주주 청약시 한양증권(주) 이외의 증권회사를 이용할 경우 해당 증권회사의 청약방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부 의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
|
「자본시장과 금융투자업에 관한 법률」 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 전문투자자 나. 삭제 <2016. 6. 28.> 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사ㆍ감정인ㆍ변호사ㆍ변리사ㆍ세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주[「금융회사의 지배구조에 관한 법률」 제2조제6호가목에 따른 최대주주를 말한다. 이 경우 "금융회사"는 "법인"으로 보고, "발행주식(출자지분을 포함한다.이하 같다)"은 "발행주식"으로 본다. 이하 같다]와 발행주식 총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자
|
(6) 주권유통에 관한 사항
주권유통개시(예정)일: 2025년 08월 26일 (2019년 09월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
(7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2025년 08월 12일부터 해당 청약사무 취급처에서 환불합니다.
(8) 주금납입장소 : 우리은행 판교벤처밸리지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2025년 06월 26일 | 한양증권(주) | 00162416 |
(1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」 제165조의6제3항 및 「증권의 발행 및 공시 등에 관한 규정」제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
(2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 09월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
(3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 한양증권(주)로 합니다.
(4) 신주인수권증서 매매 등
1) 금번 유상증자시 신주인수권증서는 전자증권제도 시행 이후에 발행되고 상장될 예정으로 실물은 발행 되지 않고 전자증권으로 등록발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
2) 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량(초과청약이 있는 경우 초과청약 가능수량이 합산된 수량)만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(5) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 한양증권(주)의 본점 및 지점을 통해 해당 신주인수권증서에 기재되어 있는 수량(초과청약이 있는 경우 초과청약 가능수량이 합산된 수량)만큼 청약할 수 있으며 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(6) 신주인수권증서의 상장
당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2025년 07월 15일부터 2025년 07월 21일까지 5거래일간으로 예정하고 있으며, 동 기간중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2025년 07월 22일에 상장폐지될 예정입니다.(「코스닥시장 상장규정」 제83조에 근거하여 5거래일 이상 상장되어야 하며, 동 규정 제85조에 따라 신주청약개시일 5거래일 전에 상장폐지되어야 함)
(7) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래관련 사항은 다음과 같습니다.
1) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
2) 실질주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 기존 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의계좌대체를 청구합니다. 위탁자계좌를 통하여신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2025년 07월 15일부터 2025년 07월 21일까지(5거래일간) 거래 | 2025년 07월 08일(예정)부터 2025년 07월 23일까지 거래 |
| 주1) | 상장거래 : 2025년 07월 15일부터 2025년 07월 21일까지(5거래일간) 거래 가능합니다. |
| 주2) | 계좌대체거래 : 2025년 07월 08일(예정)부터 2025년 07월 23일까지 거래 가능 합니다. * 신주인수권증서 상장거래의 결제일인 2025년 07월 23일까지 계좌대체(장외거래) 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다. |
| 주3) | 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다. |
3) 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
① '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다.
② '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
(1) 본 증권신고서는 공시심사 과정에서 일부 내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자 시 이러한 점을 감안하시기 바랍니다.
(2) 「자본시장과 금융투자업에 관한 법률」 제120조제3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
(3) 본 증권신고서에 기재된 내용은 신고서 제출일 현재까지 발생된 것으로 본 신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익상황에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다. 따라서, 주주 및 투자자가 투자의사를 결정함에 있어 유의하여야 할 사항이 본 증권신고서상에 누락되어 있지 않습니다.
(4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
(5) 본 증권신고서의 예정 모집가액은 확정되어 있는 것은 아니며, 청약일 3거래일 전에 확정 발행가액을 산정함으로써 확정될 예정입니다. 또한, 본 증권신고서의 발행예정금액은 추후 주당 발행가액이 확정되는 내용에 따라 변경될 수 있음을 유의하여 주시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
|---|---|---|---|
| 대표 | 한양증권(주) | 인수주식의 종류: 기명식 보통주 인수주식의 수: 최종 실권주 X 인수비율(70%) |
인수수수료 : 모집총액의 1.8% 中 70% 실권수수료 : 잔액인수금액의 18.0% |
| 인수 | 삼성증권(주) | 인수주식의 종류: 기명식 보통주 인수주식의 수: 최종 실권주 X 인수비율(30%) |
인수수수료 : 모집총액의 1.8% 中 30% 실권수수료 : 잔액인수금액의 18.0% |
| 주1) | 최종 실권주 : 구주주 청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 |
| 주2) | 모집총액 : 최종발행가액 X 총 발행주식수 |
| 주3) | 상기 일반공모를 거친 후에도 미청약된 잔여주식에 대하여는 대표주관회사 및 인수회사가 자기계산으로 잔액인수하기로 합니다. |
II. 증권의 주요 권리내용
당사가 금번 주주배정 후 실권주 일반공모 유상증자를 통하여 발행할 증권은 기명식 보통주이며, 동 증권의 주요 권리내용은 다음과 같습니다.
1. 액면금액
제7조【 1주의 금액 】
주식 1주의 금액은 500원으로 한다.
2. 주식의 발행 및 배정에 관한 사항
제5조【 발행예정주식총수 】
회사가 발행할 주식의 총수는 100,000,000주로 한다.
제8조【 주식 등의 전자등록 】
「주식, 사채 등의 전자등록에 관한 법률」제2조 제1호에 따른 주식 등 을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식 등을 전자등 록 하여야 한다.
제9조【 주식의 종류 】
회사가 발행할 주식은 기명식 보통주식과 기명식 종류주식으로 한다.
회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다.
보통주식과 종류주식의 수는 본 정관 제5조의 범위 내로 발행하며, 그 중 의결권이 제한 또는 배제된 종류주식은 신발행주식수를 포함하여 발행할 주식 총수의 4분의 1 범위를 초과하지 못한다.
제10조【 신주인수권 】
1. 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다.
2. 회사는 제1항의 규정에도 불구하고 다음 각호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다.
1) 발행주식총수의 100분의 30을 초과하지 않은 범위 내에서 「자본시장과 금융 투자업에 관한 법률」제165조의 6에 따른 일반 공모증자방식으로 신주를 발행하는 경우
2) 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 신주를 우선 배정하는 경우
3) 「상법」 제524조의 3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우
4) 「근로복지기본법」제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우
5) 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 주식예탁증서(DR) 발행에 따라 신주를 발행하는 경우
6) 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 회사가 경영상 필요로 외국인 투자를 위하여 신주를 우선 배정하는 경우
7) 발행주식총수의 100분의 20을 초과하지 않은 범위 내에서 기술신용보증기금법에 관한 법률에 의한 신기술사업금융회사와 신기술투자조합, 중소기업 창업지원법에 의한 중소기업창업투자회사와 중소기업창업투자조합 및 법인세법 규정에 의한 기관 투자자에게 배정하는 경우
8) 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 기술도입, 연구개발, 생산, 판매, 자본제휴를 위하여 그 제휴 회사에게 신주를 배정하는 경우
9) 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 경영상 목적을 위하여 국내외 금융기관, 국내법인 또는 국내외 개인에게 신주를 배정하는 경우
10) 발행주식총수의 100분의 50을 초과하지 않는 범위 내에서 주권을 코스닥시장에 상장하기 위하여 신주를 모집하거나 인수인에게 인수하는 경우
3. 제2항 각호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다.
4. 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다.
3. 배당에 관한 사항
제57조【 이익금의 처분 】
회사는 매사업년도의 처분전 이익잉여금을 다음과 같이 처분한다.
이익준비금
기타의 법정준비금
배당금
임의적립금
기타의 이익잉여금처분액
제58조【 이익배당 】
이익배당은 금전 또는 금전 외의 재산으로 할 수 있다.
이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다
제1항의 배당은 제16조 제1항에서 정한 기준일 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다.
이익배당은 주주총회의 결의로 정한다.
제59조【 분기배당 】
회사는 이사회의 결의로 사업년도 개시일부터 3월, 6월 및 9월의 말일 (이하 “분기배당 기준일”이라 한다.)의 주주에게「자본시장과 금융투자업 에 관한 법률」제165조의 12에 따라 분기배당은 금전으로 한다.
제1항의 이사회 결의는 분기배당 기준일 이후 45일 내에 하여야 한다.
분기배당은 직전결산기의 대차대조표상의 순자산액에서 다음 각호의 금액 을 공제한 액을 한도로 한다.
1) 직전결산기의 자본금의 액
2) 직전결산기까지 적립된 자본준비금과 이익준비금의 합계액
3) 직전결산기의 정기주주총회에서 이익배당하기로 정한 금액
4) 직전결산기까지 정관의 규정 또는 주주총회의 결의에 의하여 특정목 적을 위해 적립한 임의준비금
5)「상법시행령」제19조에서 정한 미실현이익
6) 분기배당에 따라 결산기에 적림하여야 할 이익준비금의 합계액
7) 당해 영업년도 중에 분기배당이 있었던 경우 그 금액의 합계액
4. 의결권에 관한 사항
제29조【 주주의 의결권 】
주주의 의결권은 1주마다 1개로 한다.
제30조【 상호주에 대한 의결권 제한 】
회사, 회사와 회사의 자회사 또는 회사의 자회사가 다른 회사의 발행주식총수의 10분의 1을 초과하는 주식을 가지고 있는 경우, 그 다른 회사가 가지고 있는 이 회사의 주식은 의결권이 없다.
제31조【 의결권의 불통일행사 】
2 이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3일 전에 회사에 대하여 서면 또는 전자문서로 그 뜻과 이유를 통지하여야 한다.
회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 그러나 주주가 신탁을 인수하였거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니한다.
제32조【 의결권의 대리행사 】
주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있으며, 이 경우 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다.
III. 투자위험요소
| 용어 | 해설 |
|---|---|
| 혈관내피세포 | 혈관의 가장 안쪽 벽을 이루는 세포입니다. 혈관 건강 유지에 매우 중요한 역할을 하며, 이 세포의 기능이 망가지면 다양한 혈관 질환이 발생할 수 있습니다. |
| 플랫폼 기술 | 신약을 개발하는 데 있어 바탕이 되는 핵심 기반 기술입니다. 특정 질환군에 적용 가능한 여러 신약 후보물질을 효율적으로 찾아내거나 개발하는 데 사용됩니다. (예: SOLVADYS®, EAGLES®, mRNA 백신 플랫폼, 항체-약물 접합체(ADC) 플랫폼 등) |
| 당뇨병성 황반부종 | 당뇨병의 합병증 중 하나로, 눈의 황반(시력에서 가장 중요한 중심 부분)이 붓는 질환입니다. 심하면 시력 저하를 유발할 수 있습니다. |
| 당뇨병성 신증 | 역시 당뇨병의 합병증으로, 신장(콩팥)의 기능이 점차 손상되는 질환입니다. |
| 습성 황반변성 | 노화 등으로 인해 황반 부위에 비정상적인 혈관이 자라나 출혈이나 부종을 일으키고, 이로 인해 시력이 빠르게 나빠지는 질환입니다. |
| 궤양성 대장염 | 대장에 원인 불명의 염증이나 궤양(움푹 파이는 상처)이 생기는 만성적인 염증성 장 질환입니다. |
| 항혈관내피성장인자 (Anti-VEGF) | 눈 등에서 비정상적으로 새로운 혈관이 자라나는 것을 억제하는 약물입니다. 주로 황반변성, 당뇨병성 황반부종 등 안과 질환 치료에 많이 사용됩니다. |
| SGLT-2 억제제 | 신장에서 포도당 재흡수를 억제하여 혈당을 낮추는 작용을 하는 당뇨병 치료제의 한 종류입니다. |
| 레닌-안지오텐신-알도스테론 시스템 (RAAS) 차단제 | 혈압을 올리는 호르몬 시스템을 차단하여 혈압을 낮추는 고혈압 치료제 등에 사용됩니다. |
| 비스테로이드성 미네랄코르티코이드 수용체 길항제 (nsMRA) | 특정 호르몬 수용체에 작용하여 염증이나 섬유화 등을 억제하는 효과를 나타내는 약물 계열입니다. |
| 종양괴사인자 알파 (TNF-α) 억제제 | 우리 몸에서 염증 반응을 일으키는 주요 물질 중 하나인 TNF-α의 작용을 막아 염증을 줄이는 약물입니다. 주로 류마티스 관절염 등 자가면역질환 치료에 사용됩니다. |
| 야누스키나제 (JAK) 억제제 | 세포 내에서 염증 신호를 전달하는 JAK라는 효소의 활동을 억제하여 염증 반응을 줄이는 약물 계열입니다. |
| 항체 의약품 | 우리 몸의 면역 시스템이 만드는 항체의 원리를 이용하여, 특정 질병의 원인 물질에만 정확히 결합하여 치료 효과를 내도록 개발된 단백질 기반 의약품입니다. |
| 저분자 화합물 | 분자량이 상대적으로 작은 화학적으로 합성된 물질입니다. 많은 전통적인 알약 형태의 의약품이 여기에 해당합니다. |
| 임상시험수탁기관 (CRO) | 제약회사의 의뢰를 받아 임상시험의 설계, 수행, 데이터 분석 등 전문적인 업무를 대행해주는 전문 서비스 기관입니다. |
| 위탁생산기관 (CMO) / 위탁개발생산기관 (CDMO) | 의약품의 생산(CMO) 또는 개발부터 생산까지(CDMO)의 과정을 전문적으로 위탁받아 수행하는 기관입니다. |
| 원료의약품 (API) | 완제품 의약품을 만드는 데 사용되는 핵심 주성분 물질입니다. |
| 실사용데이터 (RWD) / 실사용증거 (RWE) | 실제 병원 진료 환경에서 얻어지는 환자들의 건강 관련 데이터(RWD)와 이를 분석하여 얻은 의학적 결론(RWE)을 말합니다. 신약의 실제 효과와 안전성을 평가하는 데 활용됩니다. |
| 표준작업절차 (SOP) | 특정 업무나 실험 등을 일관되고 정확하게 수행하기 위해 상세하게 규정해 놓은 공식적인 작업 절차 및 방법 설명서입니다. |
1. 사업위험
당사는 혈관내피세포 기능장애에 기반한 난치성 혈관질환 및 만성 염증성 질환 치료제를 연구개발하는 바이오 기업입니다. 신약개발 플랫폼 기술인 SOLVADYS®와 EAGLES®를 바탕으로 다양한 파이프라인을 개발 중이며, 주요 파이프라인으로는 경구용 당뇨병성 황반부종 및 습성 황반변성 치료제로 개발 중인 CU06, 알츠하이머병 및 혈관성 자폐 등 퇴행성 뇌질환 치료제로 개발 중인 CU71, 당뇨병성 신증 치료제로 개발 중인 CU01 등이 있습니다. 또한, 항체 치료제 분야에서는 급성 신손상 및 만성 신부전 치료를 목표로 하는 MT-101과 습성 황반변성, 당뇨병성 황반부종 및 당뇨 망막병증 등 안과 질환 치료를 목표로 하는 MT-103 등을 핵심 파이프라인으로 개발하고 있습니다.
| [당사 파이프라인 현황] |
|
||
|
| 출처) 당사 제시 |
제약·바이오 산업은 국민의 건강과 생명에 직접적인 영향을 미치는 산업으로, 신약의 연구개발부터 임상시험, 인허가, 제조, 판매, 약가 등 전 과정에 걸쳐 각국 정부의 엄격한 규제를 받습니다. 또한, 신약 개발은 일반적으로 10년 이상의 장기간과 막대한 비용이 소요되며, 모든 단계에서 실패의 위험이 높아 최종 상업화 성공률이 낮은 특성을 가지고 있습니다. 따라서 제약·바이오 기업에 대한 투자는 높은 위험을 수반합니다. 투자자께서는 본 증권신고서에 기재된 모든 투자위험요소를 충분히 숙지하신 후 신중하게 투자 결정을 내리시기 바랍니다.
|
가. 국내외 거시경기 침체 및 불확실성이 미치는 위험 국내외 거시경제 환경의 불확실성이 증대되고 성장세가 둔화될 경우, 이는 당사의 사업 전반에 걸쳐 부정적인 영향을 미칠 수 있습니다. 특히, 당사와 같은 신약 연구개발 회사는 임상시험 환자모집에 대한 수요 감소, 글로벌 빅파마 회사들의 자금경색 등 예기치 못한 상황으로 임상시험이 연기되거나 중단될 위험이 존재하며 이에 따라 당사가 계획하고 있는 기술이전 등의 일정에도 부정적인 영향을 미칠 수 있습니다. 따라서 투자자께서는 국내외 경기 동향, 주요국의 정책 변화, 지정학적 리스크, 국내 정치 상황 등 거시경제 환경 변화가 당사의 사업 및 재무 상태에 미칠 수 있는 잠재적 위험을 충분히 고려하여 투자 결정을 내리시기 바랍니다. |
1) 국내 경기 동향
먼저 국내 경기의 경우, 한국은행이 2025년 05월 발표한 경제전망보고서에 따르면 국내 경제성장률은 2024년 연간 2.0%를 기록하였고, 2025년 0.8% 및 2026년 연간 1.6%로 전망하였습니다. 국내 경제는 2025년 상반기 대내외 불확실성으로 경제심리가 위축된 가운데 건설현장 사고, 기상악화, 대형산불 등 일시적 요인까지 발생하였으며, 정치 불확실성 완화 등으로 반등하겠으나 건설경기 부진과 더딘 소비회복으로 성장세가 당초 예상을 밑돌 전망입니다. 하반기 이후에는 현재까지 진행한 금리인하와 추경의 효과와 더불어 경제심리도 회복되면서 내수가 개선될 것으로 예상하고 있습니다.
수출의 경우, 상호관세 유예, 미·중 관세협상등으로 최근 무역긴장이 다소 완화되었으나 여전히 높은 관세율과 협상 과정의 불확실성 등으로 둔화 흐름을 나타낼 것으로 전망하였습니다.
2026년의 경우 무역전쟁의 여파로 통상환경 악화의 영향이 이어지겠으나 국내 내수를 중심으로 1.6% 성장할 것으로 전망하였습니다.
| [국내 주요 거시경제지표 전망] |
| (단위 : %) |
| 구분 | 2024년 | 2025년(E) | 2026년(E) | ||||
| 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | ||
| GDP | 2.0 | 0.1 | 1.4 | 0.8 | 2.0 | 1.3 | 1.6 |
| 민간소비 | 1.1 | 0.8 | 1.4 | 1.1 | 1.8 | 1.3 | 1.6 |
| 건설투자 | -3.0 | -11.3 | -1.1 | -6.1 | 4.9 | 0.9 | 2.8 |
| 설비투자 | 1.6 | 4.9 | -1.0 | 1.8 | 1.0 | 0.9 | 1.0 |
| 지식재산생산물 투자 | 0.7 | 1.4 | 4.8 | 3.2 | 3.7 | 1.4 | 2.5 |
| 재화수출 | 6.3 | -0.1 | 0.0 | -0.1 | 0.6 | 0.8 | 0.7 |
| 재화수입 | 1.2 | 0.8 | -0.3 | 0.2 | 1.8 | 1.3 | 1.5 |
| 출처) 한국은행 경제전망보고서(2025.05) |
민간소비의 경우, 당분간 심리위축 등으로 부진한 흐름을 보이고 있으나, 2025년 2분기 이후에는 정치 불확실성이 줄어들고 금융요건 완화 영향이 나타나면서 회복될 것으로 예상하였습니다. 가계소득 개선에도 국내외 불확실성 등으로 심리가 위축됨에 따라 부진한 흐름을 보였으나 2025년 5월 이후 외식, 여가 등을 중심으로 개선 조짐을 나타내고 있어 향후 민간소비는 심리가 회복되고 가계소득 개선 및 금리인하 효과가 나타나면서 점차 나아질 것으로 예상하였습니다.
건설투자는 그간 누적된 착공 위축의 여파가 지속되고 대내 불확실성 확대로 인한 분양실적 급감, 작업일수 축소안전관리 강화 등 영향도 가세함에 따라 예상보다 크게 위축되었습니다. 2025년 하반기로 갈수록 금융여건 완화, 심리개선 및 추경으로 부진이 점차 완화되겠으나, 누적된 지방 주택미분양, 상업용 부동산의 만성적 공실 등의 하방요인으로 개선세는 더딜 것으로 전망하였습니다.
설비투자는 높은 불확실성에 따른 기업의 투자 지연 등으로 하방압력이 증대되면서 기계류를 중심으로 감소하였습니다. 2025년 중 설비투자 흐름을 살펴보면, 기계류는 반도체 기업의 첨단공정 투자가 지속되겠으나 비IT 부문의 부진이 심화되며 증가세가 당초 예상을 하회할 것으로 전망하였습니다. 운송장비의 경우, 상반기중 개소세 인하 효과 등으로 법인차 중심의 성장세를 보이다가 2025년 하반기부터는 점차 둔화될 것으로 전망하였습니다.
지식재산생산물 투자의 경우 2025년 상반기 주요 기업의 R&D 투자가 양호한 흐름을 지속하였으나, 소프트웨어 등에 대한 투자가 둔화됨에 따라 완만한 성장을 보였습니다. 향후 기업들의 기술경쟁력 강화 노력, 정부의 첨단산업AI 등 투자 촉진 및 연구개발 예산 본격 집행에 힘입어 성장세가 다시 확대될 것으로 예상하였습니다. 그러나 높아진 대외 불확실성을 향후 기업의 투자에 하방리스크 요인으로 전망하였습니다.
2) 글로벌 경기 동향
2025년 04월에 발표된 국제통화기금의 세계 경제성장률 전망은 아래와 같습니다.
| [국제통화기금 세계 경제성장률 전망치] |
| (단위 : %, %p) |
| 구분 | 2024년 | 2025년(E) | 2026년(E) | ||||
|---|---|---|---|---|---|---|---|
| 25년 01월 전망치(A) |
25년 04월 전망치(B) |
조정폭 (B-A) |
25년 01월 전망치(C) |
25년 04월 전망치(D) |
조정폭 (D-C) |
||
| 세계 | 3.2 | 3.3 | 2.8 | (0.5) | 3.3 | 3.0 | (0.3) |
| 선진국 | 1.7 | 1.9 | 1.4 | (0.5) | 1.8 | 1.5 | (0.3) |
| 미국 | 2.8 | 2.7 | 1.8 | (0.9) | 2.1 | 1.7 | (0.4) |
| 유로존 | 0.8 | 1.0 | 0.8 | (0.2) | 1.4 | 1.2 | (0.2) |
| 일본 | -0.2 | 1.1 | 0.6 | (0.5) | 0.8 | 0.6 | (0.2) |
| 영국 | 0.9 | 1.6 | 1.1 | (0.5) | 1.5 | 1.4 | (0.1) |
| 캐나다 | 1.3 | 2.0 | 1.4 | (0.6) | 2.0 | 1.6 | (0.4) |
| 한국 | 2.2 | 2.0 | 1.0 | (1.0) | 2.1 | 1.4 | (0.7) |
| 신흥국 | 4.2 | 4.2 | 3.7 | (0.5) | 4.3 | 3.9 | (0.4) |
| 중국 | 4.8 | 4.6 | 4.0 | (0.6) | 4.5 | 4.0 | (0.5) |
| 인도 | 6.5 | 6.5 | 6.2 | (0.3) | 6.5 | 6.3 | (0.2) |
| 출처: IMF, World Economic Outlook(2025.04) |
2025년 04월 IMF의 세계 경제성장률 전망치는 2025년 01월 세계경제전망 (WEO)에 비해 대폭 하향 조정되었는데, 이는 미국 수입 물품에 대한 각국의 실효 관세율이 한 세기 만에 최고치를 기록하고 있고 향후 예측이 매우 어려운 환경을 반영한 것입니다. 특히 미국과 중국의 관세 전쟁으로 인해 무역 긴장 고조와 금융 시장 조정 속에서 하방 위험 심화가 전망에 지배적입니다. 정책 입장의 차이와 급격한 변화 또는 심리 악화는 세계 금융 여건을 더욱 긴축시킬 수 있습니다. 무역 전쟁 심화와 무역 정책 불확실성 고조는 단기 및 장기 성장 전망을 더욱 저해할 수 있습니다. 국제 협력을 축소하는 것은 더욱 회복력 있는 세계 경제로의 진전을 저해할 수 있습니다.
국가별로 살펴보면, 미국의 경우 2025년 경제성장률은 1.8%로 2024년 대비 1.0%p 하락할 것으로 전망되며, 이는 2025년 01월 WEO 업데이트 당시의 전망치보다 0.9%p 낮은 수준입니다. 이러한 하향 조정은 정책 불확실성 확대, 무역 긴장, 그리고 예상보다 둔화된 소비 증가로 인한 수요 약세 전망에 기인합니다. 또한 관세 조치는 2026년 성장률에도 부담 요인으로 작용할 것으로 보이며, 2026년 성장률은 민간 소비의 완만한 증가 속에 1.7%로 예상됩니다.
유로 지역의 성장률은 2025년에 소폭 하락하여 0.8%로 예상되며, 2026년에는 소폭 반등하여 1.2%에 이를 것으로 전망됩니다. 불확실성 증가와 관세 영향이 2025년 성장 둔화의 주요 요인이며, 2026년에는 독일의 재정 규칙 개정에 따른 재정 확대와 실질임금 상승에 기반한 소비 증가가 완만한 반등을 뒷받침할 것으로 보입니다. 지역 내에서는 스페인이 다른 국가들의 둔화 흐름과 대조되는 성장 모멘텀을 보이고 있으며, 2025년 스페인의 성장률 전망은 2.5%로 상향 조정(2025년 01월 WEO 대비 0.2%p 증가)되었습니다. 이는 2024년 예상보다 양호했던 실적에 따른 이월 효과와 홍수 이후의 복구 활동을 반영한 것입니다. 한국의 경우 2025년 경제성장률에 대해 2025년 01월 전망치 대비 1.0%p 하락한 1.0%를 전망하여 IMF가 분류한 선진국 중 가장 낙폭이 크게 나타났습니다.
2024년의 뚜렷한 둔화 이후, 신흥 및 개발도상 아시아의 성장률은 2025년 4.5%, 2026년 4.6%로 추가 하락할 것으로 전망됩니다. 동남아시아국가연합(ASEAN)을 중심으로 2025년 04월 도입된 관세 조치의 영향을 크게 받은 것으로 분석됩니다.
중국의 경우, 2025년 GDP 성장률 전망치는 01월 WEO 업데이트 당시의 4.6%에서 4.0%로 하향 조정되었습니다. 이는 최근 시행된 관세의 영향을 반영한 것으로, 2024년 4분기의 예상보다 강한 성장 및 예산 내 재정 확대 효과를 상쇄한 것으로 분석됩니다. 2026년 성장률 전망 또한 4.5%에서 4.0%로 하향 조정되었으며, 이는 장기화된 무역정책 불확실성과 현재 시행 중인 관세의 영향을 반영한 것입니다.
인도의 경우, 비교적 안정적인 성장세가 유지될 것으로 보이며, 2025년 성장률은 6.2%로 전망됩니다. 이는 특히 농촌 지역의 민간 소비 증가에 힘입은 것으로 평가됩니다. 다만, 이는 2025년 01월 WEO 대비 0.3%p 하향 조정된 수치로, 무역 긴장 고조 및 전 세계적인 불확실성 확대가 그 원인입니다.
이처럼 국내외 거시경제 환경의 불확실성이 증대되고 성장세가 둔화될 경우, 이는 당사의 사업 전반에 걸쳐 부정적인 영향을 미칠 수 있습니다. 특히, 당사와 같은 신약 연구개발 회사는 임상시험 환자모집에 대한 수요 감소, 글로벌 빅파마 회사들의 자금경색 등 예기치 못한 상황으로 임상시험이 연기되거나 중단될 위험이 존재하며 이에 따라 당사가 계획하고 있는 기술이전 등의 일정에도 부정적인 영향을 미칠 수 있습니다. 따라서 투자자께서는 국내외 경기 동향, 주요국의 정책 변화, 지정학적 리스크, 국내 정치 상황 등 거시경제 환경 변화가 당사의 사업 및 재무 상태에 미칠 수 있는 잠재적 위험을 충분히 고려하여 투자 결정을 내리시기 바랍니다.
| 나. 글로벌 의약품 시장 성장 관련 위험 글로벌 의약품 시장은 인구 고령화 심화, 자가면역질환 증가 등으로 인해 관련 수요가 지속적으로 증가하고 있으며, 연구개발 비중 또한 상승할 것으로 전망되고 있습니다. 국내 제약 시장의 경우에도 복제약 판매에 치중했던 과거와는 달리 최근 기술 역량 향상 및 투자 확대에 힘입어 신약 개발 분야에서도 적지 않은 성과를 거두고 있습니다. 일반의약품 뿐만 아니라 바이오의약품에도 투자와 인력이 집중되고 있으며, 이를 주도하는 제약사들이 국내 제약 산업의 성장을 견인하고 있습니다. 한국제약바이오협회에서 글로벌 시장조사 기관, 보건복지부, 식품의약품안전처 등으로부터 관련 정보를 취합, 가공하여 발간한 '2024 제약산업 DATABOOK'에 따르면, 2023년 글로벌 의약품 시장 규모는 전년 대비 3.6% 증가한 1조 4,924만 달러를 기록하며 역대 최대치를 경신하였습니다. 세계 의약품 시장은 2022년에 소폭 성장이 둔화하였으나, 2023년에 성장률이 반등하며 현재까지 꾸준한 성장세를 보이고 있습니다. 혁신신약의 약가 개선, 노인 의료비 증가, 공공의료 인프라 개선에 따른 환자 수 증가, 디지털헬스 및 원격의료의 성장과 신제품 출시 등으로 인해 국내 제약산업의 지속적인 성장이 전망되고 있습니다. 상기한 바와 같이, 2021년 국내외 의약품 시장은 9%가 넘는 높은 성장률을 보였으며, 고령화 심화, COVID-19 지속 등이 의약품 시장 확대에 크게 기여하였습니다. 이 외에도 원격의료의 활성화, CMO시장의 다각화 등을 통해 의약품 시장이 지속적인 성장세를 보일 것으로 전망됩니다. 그러나 지난 3년간 의약품 시장의 큰 폭의 성장세는 COVID-19라는 변수가 크게 작용했기에, 2025년 이후부터는 COVID-19 확산 이전의 패턴으로 돌아가 성장률이 다시 낮아질 가능성을 배제할 수 없습니다. 이 외에도 보험사들의 가격 인하 압박, 매출 상위제품에 대한 바이오시밀러 또는 제네릭화, 평균 R&D 비용 상승 등은 의약품 시장 성장의 저해요인으로 작용할 수 있습니다. 상기한 요인들로 인해 국내외 의약품 시장에 대한 전망이 악화될 경우, 당사의 매출 및 수익성에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
의약품은 일반적으로 화학합성의약품(저분자의약품이라고도 함)과 바이오의약품으로 나눌 수 있으며, 합성의약품은 화학합성에 의해 제조하는 의약품으로서 일반적으로 복용하는 고혈압약, 진통제 등이 합성의약품에 속하고 있습니다. 바이오의약품은 생물공학기술을 이용하여 사람이나 다른 생물체에서 유래된 것(단백질)을 원료 및 재료로 해서 만든 의약품으로서 백신, 인슐린, 항체 의약품 등이 있습니다. 바이오의약품은 합성의약품에 비하여 크기가 크고 복잡한 고분자 구조를 가지고 있으며, 생물체를 이용하여 복잡한 제조공정을 거쳐야 되므로 변화에 민감합니다. 이러한 특징으로 합성의약품은 합성 물질의 합성 비율만 알면 쉽게 제조가 가능한 반면 바이오의약품의 경우 배양 기술과 환경, 방법에 따라 최종 생성물에서 차이가 발생할 수 있기 때문에 기술적으로 복잡하고 제조과정에서 고도의 기술력이 필요로 하여 상대적으로 부작용이 적고 안정성이 높습니다.
| [합성의약품과 바이오의약품 차이점] |
| 구분 | 합성의약품 | 바이오의약품 |
| 원료 | 합성화학물질 | 생물체 유래물질(세포, 조직, 유전물질 등) |
| 원료의 고려사항 |
품질(시험분석으로 확인 가능) | 시험분석으로 확인 가능한 품질 외에 공여(기증)자의 동의 등 윤리성, 감염질환 확인 등 안전성 확보 필요 |
| 구조 | 물리화학적 특성이 명확한 저분자 구조 | 정확한 특성 분석이 불가능하고, 활성과 구조가 일정하지 않음 |
| 제품의 안정성 |
대부분 온도·빛 등 환경에 안정적 | 온도·빛·pH 등 외부 환경에 민감, 미생물 오염에 취약 |
| 대부분 36개월 | (세포치료제 사례) 대부분 3일 이내 (유전자치료제 사례) 영하 135℃에서 24개월 |
|
| 제조 | 간단한 화학적 합성으로 대량생산 | 복잡한 제조과정의 맞춤형 소량 생산 |
| 원료, 공정, 설비변화가 품질에 영향이 비교적 적음 (제조공정의 변이성이 매우 낮음) |
원료, 공정, 설비의 변화가 의약품 자체를 변화 (제조공정의 변이성이 매우 높음) |
|
| 상대적으로 복제가 쉽고 낮은 제조비용 | 복제가 불가능하고 높은 제조비용 | |
| 치료효과 | 비교적 명확한 약리기전, 대다수 사람에게 일관적 효과 기대 |
(세포치료제)약리기전이 불확실 (유전자치료제)복합적인 기전 환자에 따른 맞춤형 치료 가능 |
| 대부분 질병의 증상개선에 그침 | 질병의 근본적인 원인치료 가능 | |
| 안전성 | 약물 특이적이거나 약물 대사와 관련된 이상반응 | 생물체 유래물로 고유독성은 낮으나 면역 거부 반응, 종양발생 등의 이상반응이 있음. 특히 장기 안전성 결과는 매우 부족 |
| 비임상 시험 |
동물 시험을 통하여 약물의 독성 및 효과를 예측 가능 | 동물 시험으로 인체결과를 예측하는데 한계 |
| 투약방법 | 대부분 경구·주사 등 일반적 투여경로 | 대부분 주사 또는 주입, 이식 등 시술을 동반한 투여 |
| 출처) 식품의약품안전처(첨단바이오의약품법안 검토 보고서, 의안정보시스템, 2017.11) |
한편, 바이오의약품은 성분에 따라 생물학적 제제, 단백질의약품, 항체의약품(당사 주요 개발분야), 세포치료제 및 유전자치료제 등으로 구분하고 있습니다. 또한, 바이오의약품은 합성의약품처럼 체내에서 발생되는 대사산물이 없어 독성이 낮고 작용기전이 명확하여 희귀·난치성 및 만성 질환의 치료 효과가 뛰어나기 때문에 주로 기존 치료법에 대한 미충족 수요가 높은 퇴행성, 난치성 질환 치료제 또는 환자 맞춤형 표적치료제로 사용되고 있습니다.
| [바이오의약품 분류] |
| 분 류 | 정 의 |
| 생물학적 제제 | 생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품으로서 물리적 ·화학적 시험만으로는 그 역가와 안전성을 평가할 수 없는 백신·혈장분획제제 및 항독소 등 |
| 유전자재조합 의약품 |
유전자조작기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품 항체의약품, 펩타이드 또는 단백질의약품, 세포배양의약품 등을 포함(세포배양의약품이란 세포배양기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품) |
| 재생의약품 (세포치료제) |
살아있는 자가·동종·이종세포를 체외에서 배양·증식하거나 선별하는 등 물리적·화학적·생물학적 방법으로 조작하여 제조하는 의약품 다만, 의료기관에서 자가 또는 동종세포를 당해 수술이나 처치과정에서 안정성 문제가 없는 최소한의 조작만을 하는 경우는 제외(생물학적 특성이 유지되는 범위에서 단순분리, 세척, 냉동, 해동 등) |
| 재생의약품 (유전자치료제) |
질병치료 등을 목적으로 인체에 투입하는 유전물질 또는 유전물질을 포함하고 있는 의약품 |
| 동등생물의약품 (바이오시밀러) | 이미 제조판매 또는 수입품목 허가를 받은 품목과 품질 및 비임상, 임상적 비교동등성이 입증된 의약품 |
| 개량생물의약품 (바이오베터) | 이미 허가된 바이오의약품에 비해 안전성, 유효성 또는 유용성이 개선되었거나 의약기술에 있어 진보성이 있는 의약품 |
| 출처) 식품의약품안전처 생물학적제재 등의 품목허가심사 규정 고시 재구성 |
글로벌 의약품 시장은 인구 고령화 심화, 자가면역질환 증가 등으로 인해 관련 수요가 지속적으로 증가하고 있으며, 연구개발 비중 또한 상승할 것으로 전망되고 있습니다. 국내 제약 시장의 경우에도 복제약 판매에 치중했던 과거와는 달리 최근 기술 역량 향상 및 투자 확대에 힘입어 신약 개발 분야에서도 적지 않은 성과를 거두고 있습니다. 일반의약품 뿐만 아니라 바이오의약품에도 투자와 인력이 집중되고 있으며, 이를 주도하는 제약사들이 국내 제약 산업의 성장을 견인하고 있습니다.
한국제약바이오협회에서 글로벌 시장조사 기관, 보건복지부, 식품의약품안전처 등으로부터 관련 정보를 취합, 가공하여 발간한 '2024 제약산업 DATABOOK'에 따르면, 2023년 글로벌 의약품 시장 규모는 전년 대비 3.6% 증가한 1조 4,924만 달러를 기록하며 역대 최대치를 경신하였습니다. 세계 의약품 시장은 2022년에 소폭 성장이 둔화하였으나, 2023년에 성장률이 반등하며 현재까지 꾸준한 성장세를 보이고 있습니다. 한국제약바이오협회에서 발표한 최근 4년간 글로벌 의약품 시장 규모 추이는 다음과 같습니다.
| [글로벌 의약품 시장 규모 추이] |
| (단위: 십억 달러, %) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 |
| 전체 시장 | 1,251.7 | 1,415.1 | 1,441.0 | 1,492.4 |
| 성장률 | 2.10% | 13.05% | 1.83% | 3.57% |
| 북미 | 407.3 | 441.9 | 475.8 | 492.8 |
| 아프리카, 아시아, 오세아니아, 중동 | 418.2 | 473.9 | 461.4 | 479.5 |
| 유럽 | 359.8 | 415.8 | 427.9 | 448.1 |
| 남미 | 66.4 | 83.5 | 75.9 | 72.0 |
| 출처) 2024 제약산업 DATABOOK, 한국제약바이오협회(2024.12) |
글로벌 의약품 시장이 2022년에 성장폭이 둔화하였으나, 2021년에 13.1%라는 큰 성장세를 보일 수 있었던 주요한 이유는 COVID-19의 확산입니다. COVID-19의 확산이 제약/바이오 기업들의 신약 임상 스케줄에 차질을 준 측면도 존재하나, 오히려 환자 대상의 가상 임상, 원격을 통한 임상 모니터링, 빅데이터와 AI 기술 도입 등 신약 임상시험의 디지털화가 촉진되었습니다. 또한, COVID-19 확산 초기에는 의료기관 방문 감소로 인한 처방의약품 매출 감소가 예상되었으나 오히려 COVID-19 백신 매출 가세로 인해 백신 관련 매출액이 급증하였습니다.
한국보건산업진흥원의 '2024 글로벌 보건산업 시장규모'에 따르면, 글로벌 의약품 시장은 2023년부터 2029년까지 5.2% 수준의 연평균 성장률을 보이며 2029년 약 2조 184억 달러에 이를 것으로 전망하고 있습니다. 글로벌 시장의 성장은 주로 바이오 의약품, 특히 백신 부문에서 기인할 것으로 예상됩니다. 코로나19의 지속, 분산형 임상시험의 증가, 세포 및 유전자 치료제 제조 증대, 의약품 공급망의 디지털화 등이 향후 의약품 시장의 성장에 중요한 역할을 할 것으로 예상됩니다. 2029년까지의 시장 전망은 다음과 같습니다.
| [글로벌 의약품 시장 전망] |
|
| 출처) 2024 글로벌 보건산업 시장규모, 한국보건산업진흥원(2024.04) |
한국제약바이오협회에 따르면 2023년 국내 의약품 시장 규모(생산금액+수입금액-수출금액)은 전년 대비 5.3% 증가한 31조 4,513억원을 기록하며, 국내 의약품 시장은 역대 최대치를 달성하였습니다. 국내 의약품 시장 규모는 꾸준한 증가세를 보이고 있으며, 특히 2021년의 경우 최근 5년간의 연평균 성장률을 크게 상회하는 9.6%의 성장률을 보였는데, 이는 2020년 이후 COVID-19 백신 치료제 보급 정책에 따라 국내 생산량이 크게 증가하였기 때문입니다. 또한, 타이레놀 등의 일부 진통제와 감기약의 판매량이 증가한 것도 높은 성장세에 기여하였습니다. 최근 5년간 국내 의약품 시장 규모 추이는 다음과 같습니다.
| [국내 의약품 시장 규모 추이] |
| (단위: 억원) |
| 구분 | 2019년 | 2020년 | 2021년 | 2022년 | 2023년 |
|---|---|---|---|---|---|
| 생산 | 223,132 | 245,662 | 254,906 | 289,503 | 306,303 |
| 수출 | 60,581 | 99,648 | 113,642 | 104,561 | 98,851 |
| 수입 | 80,549 | 85,708 | 112,668 | 113,653 | 107,061 |
| 무역수지 | -19,968 | 13,940 | 974 | -9,092 | -8,210 |
| 시장규모 | 243,100 | 231,722 | 253,932 | 298,595 | 314,513 |
| 출처) 2024 제약산업 DATABOOK, 한국제약바이오협회(2024.12) |
정부는 국내 의약품산업을 국가 전략산업으로 육성하기 위해 핵심기술에 선제적으로 투자하고, 글로벌 수준의 규제 합리화 및 전후방 생태계 조성으로 활력을 제고하기 위해 노력하고 있습니다. 특히 보건복지부에서 운영 및 관리하는 혁신형 제약기업 인증 및 육성 지원을 통해 의약품산업의 구조적 선진화 및 글로벌 진출 역량을 강화하려는 정책도 지속적으로 추진하고 있습니다. 또한, 국내 고령인구 및 만성질환의 지속적인 증가세 역시 의약품 산업 확대에 많은 영향을 끼치고 있습니다.
통계청이 2024년 09월에 발표한 '2024 고령자 통계'에 의하면, 2024년 65세 이상 고령 인구는 약 994만 명으로, 전체 인구의 19.2%를 차지하고 있습니다. UN 기준에 따르면 65세 이상 인구가 총 인구 중 차지하는 비중이 14% 이상일 경우 고령사회로 정의하고 있으므로 우리나라는 이미 고령사회에 진입한 상태이며, 향후에도 계속 증가하여 2025년에는 20%, 2036년에는 30%, 2050년에는 40%를 넘어설 것으로 전망됩니다. 과학기술의 발전으로 인간의 기대 수명이 연장되었으며, 기대 수명의 연장은 다시 의약품 등에 대한 수요를 증가시키고 있습니다. 우리나라의 경우 초고령사회로의 진행 속도가 세계에서 가장 빠른 수준인 만큼, 국내 의약품 및 제약산업의 중요성이 더욱 확대될 것으로 예상됩니다.
이 외에도 혁신신약의 약가 개선, 노인 의료비 증가, 공공의료 인프라 개선에 따른 환자 수 증가, 디지털헬스 및 원격의료의 성장과 신제품 출시 등으로 인해 국내 제약산업의 지속적인 성장이 전망되고 있습니다. 상기한 바와 같이, 2021년 국내외 의약품 시장은 9%가 넘는 높은 성장률을 보였으며, 고령화 심화, COVID-19 지속 등이 의약품 시장 확대에 크게 기여하였습니다. 이 외에도 원격의료의 활성화, CMO시장의 다각화 등을 통해 의약품 시장이 지속적인 성장세를 보일 것으로 전망됩니다. 그러나 지난 3년간 의약품 시장의 큰 폭의 성장세는 COVID-19라는 변수가 크게 작용했기에, 2025년 이후부터는 COVID-19 확산 이전의 패턴으로 돌아가 성장률이 다시 낮아질 가능성을 배제할 수 없습니다. 이 외에도 보험사들의 가격 인하 압박, 매출 상위제품에 대한 바이오시밀러 또는 제네릭화, 평균 R&D 비용 상승 등은 의약품 시장 성장의 저해요인으로 작용할 수 있습니다. 상기한 요인들로 인해 국내외 의약품 시장에 대한 전망이 악화될 경우, 당사의 매출 및 수익성에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 다. 파이프라인별 치료제 시장 경쟁 심화에 따른 위험 당사가 주력으로 연구개발하고 있는 혈관내피기능장애 관련 질환 치료제 시장은 전 세계적인 인구 고령화, 당뇨병 등 만성질환 환자 수 증가, 삶의 질 향상에 대한 관심 증대 등으로 인해 지속적인 성장이 예상되는 분야입니다. 그러나 한편으로는 글로벌 제약사 및 다수의 바이오 기업들이 혁신 신약 개발을 위해 치열하게 경쟁하고 있으며, 각국 정부의 약가 규제 강화, 새로운 치료 기술 및 플랫폼의 등장 등으로 인해 산업 성장성이 예상에 미치지 못하거나 시장 환경이 급변할 가능성도 존재합니다. 당사가 주력하는 혈관 질환 및 염증성 질환 분야에서도 새로운 병태생리 기전이 규명되고 혁신적인 치료 기술들이 지속적으로 연구개발되고 있습니다. 만약 당사가 현재 개발 중인 파이프라인보다 현저하게 우수한 새로운 치료법이나 기술이 등장하여 기존 치료 패러다임을 바꿀 경우, 당사 파이프라인의 시장 가치가 급격히 하락하거나 개발 자체가 무의미해질 수 있습니다. 당사는 최신 연구 동향 및 기술 발전을 지속적으로 모니터링하고 연구개발 전략에 반영하여 미래 시장 변화에 대응하고자 노력하고 있으나, 기술 변화의 속도와 방향을 예측하는 것은 매우 어려우며, 당사가 이러한 변화에 신속하고 효과적으로 대응하지 못할 경우, 개발 중인 파이프라인이 기술적 진부화에 직면하여 투자 가치를 상실할 위험이 있습니다. 투자자께서는 제약·바이오 산업의 빠른 기술 변화 속도와 이로 인한 당사 파이프라인의 경쟁력 약화 가능성에 유의하시기 바랍니다. |
당사가 주력으로 연구개발하고 있는 혈관내피기능장애 관련 질환 치료제 시장은 전 세계적인 인구 고령화, 당뇨병 등 만성질환 환자 수 증가, 삶의 질 향상에 대한 관심 증대 등으로 인해 지속적인 성장이 예상되는 분야입니다. 그러나 한편으로는 글로벌 제약사 및 다수의 바이오 기업들이 혁신 신약 개발을 위해 치열하게 경쟁하고 있으며, 각국 정부의 약가 규제 강화, 새로운 치료 기술 및 플랫폼의 등장 등으로 인해 산업 성장성이 예상에 미치지 못하거나 시장 환경이 급변할 가능성도 존재합니다.
혈관내피세포는 혈관의 가장 안쪽을 구성하는 단일 세포층으로 혈관의 구조적 장벽 역할뿐만 아니라 혈관의 항상성 유지, 혈액 응고 조절, 염증 반응 조절 등 다양한 생리적 기능에 중요한 역할을 합니다. 이러한 혈관내피세포의 기능장애는 노화나 당뇨병, 고혈압, 고지혈증, 비만 등 다양한 대사성 질환 및 만성 염증성 질환의 발병 및 진행과 밀접하게 연관되어 있으며, 당뇨병성 황반부종, 당뇨병성 신증, 궤양성 대장염, 습성 황반변성 등 다양한 난치성 질환의 핵심적인 병태생리 기전 중 하나로 인식되고 있습니다.
| [혈관내피기능장애 발생 구조도] |
|
| 출처) 당사 제시 |
당뇨병성 황반부종 치료제 시장의 경우, 국제 당뇨병 연맹의 2021년 보고서에 따르면 전 세계 당뇨병 유병 인구는 2021년 약 5억 3,700만 명에서 2045년 약 7억 8,300만 명으로 증가할 전망이며, 이 중 상당수가 당뇨병성 황반부종으로 진행될 가능성이 있습니다. 당뇨병성 황반부종과 습성 황반변성 등 망막질환 치료로는 항혈관내피세포성장인자 주사제(Anti-VEGF)가 표준 치료법으로 사용되고 있으며, 최근에는 이중 특이항체나 투여 간격을 연장시킨 제형들이 개발되어 사용되고 있으나, 여전히 반복적인 안구 내 주사에 대한 부담감과 일부 환자에서의 제한적인 반응으로 인해 새로운 치료 표적 발굴 및 투여 편의성 개선 노력이 지속되고 있습니다.
시장조사기관인 글로벌데이터의 2023년 11월 보고서(Global Data Drug Forecast and Market Analysis(2022))는 미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본 등 주요 7개국 당뇨병성 황반부종 및 습성 황반변성 치료제 시장이 2021년 약 128억 달러에서 2031년 약 339억 달러로 연평균 10.3% 성장할 것으로 예측했습니다.
| [습성 황반변성 및 당뇨병성 황반부종 치료제 시장 추이] |
|
| 출처) Global Data Drug Forecast and Market Analysis(2022) |
퇴행성 뇌질환 중 가장 높은 발생 비율을 보이는 알츠하이머병은 시장조사기관인 글로벌데이터의 2024년 보고서(Global Data Market Analysis and Sales Forecast 2024)에 따르면 연평균 약 22.3% 성장하여 2033년 약 245억 달러에 이를 것으로 전망됩니다. 뇌 속에서 생성되는 단백질 덩어리인 아밀로이드 베타가 과도하게 축적될 경우 신경 독으로 작용해 뇌의 인지 기능을 떨어뜨리고 알츠하이머병으로까지 발전하게 된다는 아밀로이드 베타 가설에 의해 최근 아밀로이드 베타를 타깃하는 항체 치료제들이 시장에 등장했지만, 두통, 구역감부터 뇌 부종, 혼돈 등의 증상이 나타나는 ARIA 부작용(Amyloid-reated Imaging Abnormality)에 대한 우려, 고비용 등으로 제한적으로 사용되고 있으며, 여전히 1996년에 발매된 경구용 치매 치료제 도네페질이 가장 널리 사용 중입니다. 여전히 신규 치료제에 대한 미충족 수요가 높은 질환입니다. 따라서 알츠하이머병에 대해 기존 치료제와 다른 새로운 기전, 투여 방식으로 접근하는 치료제에 대한 미충족 수요가 매우 높은 실정입니다.
당뇨병성 신증 치료제 시장 또한 성장세가 예상됩니다. 미국 질병통제예방센터의 2023년 보고서에 따르면 미국 성인 당뇨병 환자의 약 37%가 만성 신장 질환을 동반하고 있으며, 시장조사기관인 프레시던스 리서치의 2024년 3월 보고서는 글로벌 당뇨병성 신증 치료제 시장이 2023년 약 35억 달러에서 2033년 약 65억 달러로 연평균 6.4% 성장할 것으로 전망했습니다. 레닌-안지오텐신-알도스테론 시스템 차단제, SGLT-2 억제제, 비스테로이드성 미네랄코르티코이드 수용체 길항제 등이 사용되고 있으나, 여전히 많은 환자들이 말기 신질환으로 진행하고 있어, 보다 효과적인 신장 보호 및 기능 개선 치료제 개발이 시급한 실정입니다.
궤양성 대장염 치료제 시장은 시장조사기관인 포춘 비즈니스 인사이트의 2024년 1월 보고서에 따르면 2023년 약 75억 달러에서 2032년 약 108억 달러로 연평균 4.1% 성장할 것으로 보입니다. 다양한 계열의 치료제가 존재함에도 불구하고, 기존 치료에 불응하거나 반응이 소실되는 환자들이 많아 새로운 작용 기전을 가진 치료제, 특히 안전성과 복용 편의성이 개선된 경구용 치료제에 대한 수요가 높습니다.
상기 시장 전망은 시장조사기관의 분석 자료를 바탕으로 하였으나, 실제 시장 성장세는 예상과 다를 수 있습니다. 신규 경쟁 약물의 예상보다 빠른 출시, 기존 치료제의 특허 만료에 따른 바이오시밀러 또는 제네릭 경쟁 심화, 각국 정부의 급격한 약가 인하 정책 시행, 새로운 치료 패러다임의 등장 등 예기치 못한 변수로 인해 목표 시장의 성장성이 둔화되거나 역성장할 경우, 당사가 개발 중인 파이프라인의 상업적 가치가 하락하고 연구개발 성과가 기대에 미치지 못하여 당사의 수익성 및 성장성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 목표 시장의 성장 전망이 다양한 외부 요인에 의해 변동될 수 있으며, 이는 당사의 사업 성과에 직접적인 영향을 줄 수 있음을 유의하시기 바랍니다.
당사가 개발 중인 치료제 시장은 다수의 글로벌 제약사 및 바이오 기업들이 경쟁하고 있는 분야입니다. 예를 들어, 당뇨병성 황반부종 및 습성 황반변성 치료제 시장에서는 리제네론과 바이엘의 '아일리아', 로슈와 노바티스의 '루센티스', 로슈의 '바비스모' 등 항혈관내피성장인자 계열 약물들이 치열하게 경쟁하고 있으며, 바이오시밀러 출시 및 새로운 기전의 신약 개발이 활발합니다.
| [당뇨병성 황반부종 및 습성 황반변성 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU06(성분명 : 리바스테랏) | 아일리아(Eylea/Eylea HD) | 루센티스(Lucentis) | 바비스모(Vabysmo) | ||
| 적응증 | 당뇨병성 황반부종, 습성 황반변성 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 | ||
| 작용 기전 | 혈관내피기능장애 차단 | VEGF 억제 | VEGF 억제 | VEGF 및 Ang-2 이중억제 | ||
| 특징 | 경구용 망막질환 치료제로 개발 중 | 유리체강 내 주사제 | 유리체강 내 주사제 | 유리체강 내 주사제 | ||
| 개발단계 | 임상2a상 완료, 임상2b상 준비 중 | 시판 중 | 시판 중 | 시판 중 | ||
| 개발회사명 | 큐라클 | 리제네론 | 바이엘 | 노바티스 | 로슈 | 로슈 |
| 소재지 | 대한민국 | 미국 | 독일 | 스위스 | 스위스 | 스위스 |
| 요약재무정보(FY2024 기준) | ||||||
| 제품 매출액 | 0 | 13,386,525 | 1,675,986 | 6,486,651 | ||
| 전체 매출액 | 1,633 | 19,510,708 | 73,129,009 | 69,125,495 | 101,555,376 | 101,555,376 |
| 영업이익 | (12,635) | 5,482,424 | (11,141) | 19,980,547 | 22,523,655 | 22,523,655 |
| 당기순이익 | (14,886) | 6,062,030 | (4,004,318) | 16,401,798 | 15,422,584 | 15,422,584 |
| 자산총계 | 59,288 | 51,873,864 | 173,933,627 | 140,465,555 | 17,089,573 | 17,089,573 |
| 부채총계 | 29,335 | 11,547,888 | 123,652,137 | 79,845,256 | 110,192,494 | 110,192,494 |
| 자본총계 | 29,953 | 40,325,976 | 50,281,489 | 60,620,299 | 60,704,917 | 60,704,917 |
| 출처) 각 사 2024 Annual Report | |
| 주) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
알츠하이머병 시장에서는 아세틸콜린 분해 효소 억제 기전의 에자이의 '아리셉트', 아밀로이드 베타 단백질을 타깃하는 에자이와 바이오젠의 '레켐비', 일라이 릴리의 '키순라' 등이 시판 중이며, 이 외에도 타우 단백질을 타깃하는 항체 등 다양한 기전의 신약 후보물질들이 개발되고 있습니다.
| [알츠하이머병 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU71 | 아리셉트(Aricept) | 레켐비(Leqembi) | 키순라(Kisunla) | |
| 적응증 | 퇴행성 뇌질환(알츠하이머병) | 알츠하이머병 | 알츠하이머병 | 알츠하이머병 | |
| 작용 기전 | 혈관내피기능장애 차단 | 아세틸콜린에스터레이스 억제제 | 아밀로이드 베타 항체 | 아밀로이드 베타 항체 | |
| 특징 | BBB Stabilize를 통한 BBB Dysfunction 및 Neuroinflammation 개선하는 경구용 치료제 |
경구용 치료제 | 정맥 주사 | 정맥 주사 | |
| 개발단계 | 전임상 | 시판 중 | 시판 중 | 시판 중 | |
| 개발회사명 | 큐라클 | 에자이 | 에자이 | 바이오젠 | 일라이 릴리 |
| 소재지 | 대한민국 | 일본 | 일본 | 미국 | 미국 |
| 요약재무정보(FY2024 기준) | |||||
| 제품 매출액 | 0 | 241,507 | 426,246 | 알 수 없음 | |
| 전체 매출액 | 1,633 | 7,595,449 | 7,595,449 | 13,292,751 | 61,325,636 |
| 영업이익 | (12,635) | 523,214 | 523,214 | 3,048,325 | 23,828,565 |
| 당기순이익 | (14,886) | 462,414 | 462,414 | 2,242,316 | 14,418,285 |
| 자산총계 | 59,288 | 13,341,078 | 13,341,078 | 38,534,128 | 107,170,336 |
| 부채총계 | 29,335 | 5,008,907 | 5,008,907 | 15,569,688 | 47,530,782 |
| 자본총계 | 29,953 | 8,332,171 | 8,332,171 | 22,964,441 | 59,639,554 |
| 출처) 각 사 2024 Annual Report | |
| 주1) 키순라의 FY2024 매출액은 정기보고서에 기재되어 있지 않아 확인할 수 없습니다. |
|
| 주2) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
당뇨병성 신증 시장에서는 MSD의 '코자'와 '바소텍', 아스트라제네카의 '포시가', 바이엘의 '케렌디아' 등이 안지오텐신 전환 효소 억제제, 안지오텐신 수용체 차단제, SGLT-2 억제제, 비스테로이드성 미네랄코르티코이드 수용체 길항제 등으로 경쟁하고 있습니다.
| [당뇨병성 신증 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU01 | 코자(Cozaar) | 바소텍(Vasotec) | 포시가(Farxiga/Forxiga) | 케렌디아(Kerendia) |
| 적응증 | 당뇨병성 신증 | 고혈압, 심부전, 당뇨병성 신증 등 | 고혈압, 심부전 등 | 제2형 당뇨병, 심부전, 만성 신장병 | 제2형 당뇨병 동반 만성 신장병 |
| 작용 기전 | Nrf2 활성화, TGF-β 신호 조절 |
안지오텐신 II 수용체 차단제 (ARB) | 안지오텐신 전환 효소 억제제 (ACEI) | SGLT2 억제제 | 비스테로이드성 무기질코르티코이드 수용체 길항제 |
| 특징 | 신장기능 유지 및 개선 효과 기대 | 광범위하게 사용되는 고혈압 및 신장보호 약물 | 광범위하게 사용되는 고혈압 및 신장보호 약물 | 혈당강하 외 심장 및 신장 보호 효과 입증 | 심장 및 신장 보호 효과, 염증 및 섬유화 억제 |
| 개발단계 | 임상2b상 진행 중 | 시판 중 | 시판 중 | 시판 중 | 시판 중 |
| 개발회사명 | 큐라클 | MSD | MSD | 아스트라제네카 | 바이엘 |
| 소재지 | 대한민국 | 미국 | 미국 | 영국 | 스위스 |
| 요약재무정보(FY2024 기준) | |||||
| 제품 매출액 | 0 | 알 수 없음 | 알 수 없음 | 10,601,615 | 726,489 |
| 전체 매출액 | 1,633 | 88,153,998 | 88,153,998 | 74,285,487 | 73,129,009 |
| 영업이익 | (12,635) | 27,388,077 | 27,388,077 | 13,742,121 | (11,141) |
| 당기순이익 | (14,886) | 23,537,315 | 23,537,315 | 9,672,926 | (4,004,318) |
| 자산총계 | 59,288 | 160,880,223 | 160,880,223 | 142,923,283 | 173,933,627 |
| 부채총계 | 29,335 | 97,174,369 | 97,174,369 | 86,774,703 | 123,652,137 |
| 자본총계 | 29,953 | 63,705,854 | 63,705,854 | 56,148,580 | 50,281,489 |
| 출처) 각 사 2024 Annual Report | |
| 주1) 바소텍과 코자의 FY2024 매출액은 각 사 정기보고서에 기재되어 있지 않아 확인할 수 없습니다. | |
| 주2) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
궤양성 대장염 시장에서는 애브비의 '휴미라', 얀센의 '스텔라라', 다케다의 '엔티비오', 화이자의 '젤잔즈' 등이 종양괴사인자 알파 억제제, 인테그린 저해제, 인터루킨 억제제, 야누스키나제 억제제 등 다양한 기전의 치료제로 경쟁 중입니다.
| [궤양성 대장염 치료제 시장 경쟁 현황] |
| (단위: 백만원) |
| 제품명 | CU104 | 휴미라(Humira) | 젤잔즈(Xeljanz) | 엔티비오(Entyvio) | 스텔라라(Stelara) |
| 적응증 | 궤양성 대장염 | 궤양성 대장염, 류마티스 관절염, 건선 크론 등 | 궤양성 대장염, 류마티스 관절염 등 | 궤양성 대장염, 크론병 | 궤양성 대장염, 크론병, 건선 등 |
| 작용 기전 | 혈관내피기능장애 차단 | TNF-알파(종양괴사인자-알파) 억제제 | JAK(야누스키나제) 억제제 | 인테그린 수용체(α4β7 인테그린) 억제제 |
인터루킨-12(IL-12), 인터루킨-23(IL-23) 억제제 |
| 특징 | 경구용 자가면역질환 치료제 | 다양한 자가면역 질환에 폭넓게 사용 | 경구용 자가면역질환 치료제 | 장 선택적 작용으로 전신 부작용 위험 낮음 | 이중 작용 기전, 다양한 면역 매개 질환에 효과적 |
| 개발단계 | 임상1상 완료 | 시판 중 | 시판 중 | 시판 중 | 시판 중 |
| 개발회사명 | 큐라클 | 애브비 | 화이자 | 다케다 | 얀센(J&J) |
| 소재지 | 대한민국 | 미국 | 미국 | 일본 | 미국 |
| 요약재무정보 | FY2024 | FY2023 | FY2024 | ||
| 제품 매출액 | 0 | 12,354,583 | 1,604,598 | 7,706,100 | 14,233,942 |
| 전체 매출액 | 1,633 | 77,391,649 | 87,410,773 | 41,025,065 | 122,022,290 |
| 영업이익 | (12,635) | (2,046,962) | 27,783,731 | 2,060,027 | 28,902,004 |
| 당기순이익 | (14,886) | (31,597) | 11,075,576 | 1,387,435 | 19,323,871 |
| 자산총계 | 59,288 | 185,684,182 | 293,163,425 | 145,373,775 | 247,426,875 |
| 부채총계 | 29,335 | 181,062,719 | 171,586,246 | 75,384,754 | 149,213,913 |
| 자본총계 | 29,953 | 4,621,463 | 121,577,179 | 69,989,021 | 98,212,962 |
| 출처) 각 사 2024 Annual Report | |
| 주1) 다케다의 경우 2024 Annual Report가 아직 발간되지 않아 요약재무정보를 FY2023 기준으로 작성하였습니다. | |
| 주2) 각 환율은 증권신고서 제출 전일 매매기준율을 적용하여 산정하였습니다. | |
| 1 USD = | 1,373.8원 |
| 1 EUR = | 1,569.09원 |
| 1 CHF = | 1,678.74원 |
| 1 JPY = | 9.6218원 |
이러한 경쟁사들은 대부분 당사보다 월등한 자금력, 연구개발 인프라, 글로벌 마케팅 및 영업 네트워크, 풍부한 신약 개발 경험을 보유하고 있을 가능성이 높습니다. 경쟁사들이 당사보다 먼저 혁신적인 신약을 개발하여 시장을 선점하거나, 유사한 기전의 치료제를 더 낮은 가격으로 공급할 경우, 당사 제품의 시장 경쟁력이 약화될 수 있습니다.
또한, 기술 발전 속에서 당사의 파이프라인이 경쟁 우위를 유지하지 못할 경우, 기술이전 협상에서 불리하거나 상업화 이후 시장에서 도태될 위험이 있습니다. 당사는 혈관내피세포 기능 회복이라는 차별화된 작용 기전과 SOLVADYS®, EAGLES® 플랫폼 기술을 바탕으로 경쟁 우위를 확보하고자 하나, 치열한 경쟁 환경은 당사의 성장성과 수익성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 당사가 직면한 치열한 경쟁 환경과 경쟁사들의 우위 요소가 당사의 시장 진입 및 점유율 확보에 미칠 수 있는 부정적 영향을 충분히 고려하시기 바랍니다.
제약ㆍ바이오 기술은 매우 빠르게 발전하며 치료 패러다임 또한 빠르게 변화하고 있습니다. 당사가 주력하는 혈관 질환 및 염증성 질환 분야에서도 새로운 병태생리 기전이 규명되고 혁신적인 치료 기술들이 지속적으로 연구개발되고 있습니다. 만약 당사가 현재 개발 중인 파이프라인보다 현저하게 우수한 새로운 치료법이나 기술이 등장하여 기존 치료 패러다임을 바꿀 경우, 당사 파이프라인의 시장 가치가 급격히 하락하거나 개발 자체가 무의미해질 수 있습니다. 당사는 최신 연구 동향 및 기술 발전을 지속적으로 모니터링하고 연구개발 전략에 반영하여 미래 시장 변화에 대응하고자 노력하고 있으나, 기술 변화의 속도와 방향을 예측하는 것은 매우 어려우며, 당사가 이러한 변화에 신속하고 효과적으로 대응하지 못할 경우, 개발 중인 파이프라인이 기술적 진부화에 직면하여 투자 가치를 상실할 위험이 있습니다. 투자자께서는 제약·바이오 산업의 빠른 기술 변화 속도와 이로 인한 당사 파이프라인의 경쟁력 약화 가능성에 유의하시기 바랍니다.
|
라. 신규사업(원료의약품 수입, 도소매업) 영위에 따른 위험 또한, 신약 연구개발과 상이한 사업 특성으로 인해 운영 및 관리상의 위험에 노출될 수 있습니다. 사업 경험 부족은 초기 시행착오로 이어질 수 있으며, 엄격한 품질 기준 미충족 시 제품 회수, 손해배상 등의 막대한 손실이 발생할 수 있습니다. 관련 법규 미준수에 따른 행정처분 및 법적 제재의 위험도 상존합니다. 신규 사업 추진에 따른 재무적 위험도 고려해야 합니다. 초기 투자 및 운영 자금 소요로 인해 재무 구조에 부담이 될 수 있으며, 시장 안착 지연 및 수익성 악화 시 투자금 회수가 어려워질 수 있습니다. 마지막으로, 한정된 경영 자원이 신규 사업에 분산될 경우, 핵심 사업인 신약 연구개발의 추진 동력이 약화될 수 있는 위험 역시 존재합니다. 당사는 신규 사업 관련 위험 최소화를 위해 다각적인 노력을 기울일 예정입니다. 그럼에도 불구하고, 신규 사업 진출에는 본질적인 불확실성과 다양한 위험이 상존하므로, 투자자께서는 신규 사업의 성공 가능성, 예상 수익성, 기존 핵심 사업에 미칠 수 있는 영향 등을 종합적으로 고려하여 신중하게 투자 결정을 내리시기 바랍니다. |
당사는 기존 신약 연구개발 사업 외에 사업 다각화 및 새로운 성장 동력 확보의 일환으로 원료의약품의 수입 및 도소매업을 신규 사업으로 추진하고 있습니다. 이는 당사의 사업 영역을 확장하고 잠재적인 수익원을 창출할 수 있는 기회가 될 수 있으나, 동시에 다양한 내재적 위험 요소를 안고 있습니다.
우선, 경쟁 환경 및 시장 진입의 어려움이 예상됩니다. 국내 원료의약품 시장은 이미 다수의 업체가 치열하게 경쟁하고 있는 상황이며, 2022년 기준 300개가 넘는 원료의약품 업체 중 약 74%가 연 생산액 50억 미만의 영세업체일 정도로 경쟁 강도가 높고 산업 구조가 영세합니다. 더욱이 국내 원료의약품 자급도는 2022년 기준 11.9%로 매우 낮아 수입 의존도가 절대적이며, 중국 및 인도산 원료의약품 수입 비중이 70%를 상회하는 등 특정 국가에 대한 의존도가 매우 높은 실정입니다.
이러한 시장 환경에서 당사가 신규 사업자로 진입할 경우, 이미 안정적인 공급망, 폭넓은 고객 네트워크, 가격 경쟁력을 확보하고 있는 기존 국내외 대형 공급업체 및 다수의 중소 유통업체들과의 힘겨운 경쟁에 직면할 가능성이 높습니다. 글로벌 원료의약품 시장은 대형 다국적 제약사들의 자체 생산 비중이 높고, 중국, 인도 등 특정 국가에 생산이 집중되어 있어, 당사가 가격 경쟁력을 확보하고 안정적인 고품질 공급처를 발굴하는 데 상당한 어려움을 겪을 수 있습니다. 시장 점유율 확보를 위한 초기 단계에서의 출혈 경쟁은 수익성 악화로 이어질 수 있으며, 향후 신규 경쟁자의 추가 진입이나 대체 원료의 등장 등 예측 불가능한 시장 환경 변화에 따라 경쟁 강도는 더욱 심화될 수 있습니다.
또한 운영 및 관리상의 다양한 위험에 노출될 수 있습니다. 원료의약품의 수입, 품질관리, 보관, 유통, 도소매업은 당사의 기존 주력 사업인 신약 연구개발과는 사업의 성격, 요구되는 전문 지식, 규제 환경, 운영 노하우 등 여러 측면에서 상이합니다. 해당 분야에서의 사업 경험 부족은 사업 초기 시장 분석의 오류, 비효율적인 공급망 관리, 관련 법규 위반 등의 시행착오로 이어져 사업 안정성 확보를 지연시키고 불필요한 비용 증가를 초래할 수 있습니다. 특히, 수입 원료의약품은 식품의약품안전처의 엄격한 수입요건 및 품질 기준을 충족해야 하므로, 공급처 실사부터 수입 시 품질 검사, 보관 및 유통 과정에서의 품질 유지에 이르기까지 전 과정에 걸쳐 철저하고 체계적인 관리가 요구됩니다.
만약 품질 문제가 발생할 경우, 이는 제품 회수, 막대한 손해배상 책임, 기업 이미지 실추는 물론, 해당 원료를 사용하는 완제의약품의 안전성 및 유효성에도 심각한 영향을 미칠 수 있습니다. 또한, 약사법, 의약품 등의 안전에 관한 규칙 등 관련 법규의 빈번한 변경에 대한 신속하고 정확한 대응이 미흡할 경우, 예기치 않은 행정처분이나 법적 제재를 받을 위험도 상존합니다.
글로벌 원료의약품 공급망은 중국, 인도 등 특정 국가에 대한 의존도가 높아, 해당 국가의 정책 변화, 지정학적 리스크, 팬데믹과 같은 예기치 못한 사태 발생 시 원료 수급에 심각한 차질이 발생하여 생산 중단, 납기 지연, 원가 급등 등으로 이어질 수 있으며, 이는 당사 사업의 연속성과 수익성에 직접적인 타격을 줄 수 있습니다. 더불어, 원료의약품 수입 거래는 주로 외화로 이루어지므로 환율 변동 위험에 직접적으로 노출됩니다. 환율 상승 시 수입 원가가 상승하여 수익성이 악화될 수 있으며, 환율 변동성의 확대는 안정적인 사업 운영 계획 수립에 부담으로 작용할 것입니다.
재무적 위험 또한 고려해야 합니다. 신규 사업 추진에는 사무실 및 창고 임차, 초기 재고 매입을 위한 자금, 전문 인력 채용 및 교육 비용 등 상당한 규모의 초기 투자 비용과 지속적인 운영 자금이 소요됩니다. 당사의 자금 조달 계획이 원활하게 진행되지 않거나 예상보다 많은 비용이 투입될 경우, 이는 당사의 재무 구조에 부담으로 작용할 수 있습니다. 또한, 신규 사업이 시장에 성공적으로 안착하여 안정적인 수익을 창출하고 초기 투자금을 회수하기까지는 상당한 시간이 소요될 수 있으며, 치열한 시장 경쟁, 높은 수입 의존도에 따른 원가 변동성, 예상치 못한 시장 환경 변화 등으로 인해 신규 사업의 수익성이 기대에 미치지 못하거나 손실이 발생하여 투자 회수가 지연되거나 불가능해질 위험도 존재합니다.
마지막으로, 기존 신약 연구개발 사업과의 연관성 및 자원 배분 문제가 발생할 수 있습니다. 원료의약품 수입 및 도소매 사업이 당사의 주력 사업인 혁신 신약 연구개발과 직접적인 시너지 효과를 창출하지 못하거나 그 효과가 미미할 수 있습니다. 오히려 한정된 경영 자원이 신규 사업에 분산됨으로써, 핵심 사업인 신약 연구개발의 추진 동력이 약화되거나 기존 연구개발 프로젝트의 진행 속도가 늦춰지는 등 부정적인 영향을 미칠 가능성도 배제할 수 없습니다.
상기한 위험 요인에도 불구하고, 당사는 원료의약품 신사업이 기존에 영위하고 있는 신약 연구개발 사업과 높은 연관성을 보유하고 있어 시너지 창출이 가능하다고 판단하고 있습니다.
당사는 이미 원료의약품의 자체 품질 검증 및 연구개발이 가능한 연구시설과 전문 연구 인력을 확보하고 있으며, 이는 원료의약품의 품질 관리 및 공정 효율화에 기여할 수 있는 기반입니다. 또한, 당사 임직원의 국내외 제약 산업 네트워크를 사업 개발에 활용할 계획입니다. 특히, 피합병법인인 대성팜텍의 안과 질환 관련 원료의약품 포트폴리오는 당사가 보유한 망막질환 신약 파이프라인(CU06, MT-103 등)과 직접적으로 연계되어, 향후 신약 개발과 원료 공급의 수직적 통합을 통해 사업 경쟁력을 강화할 수 있을 것으로 예상하고 있습니다.
이러한 잠재적 시너지를 극대화하고 사업 초기 리스크를 관리하여 안정적인 사업 기반을 구축하기 위해, 당사는 다음과 같은 계획을 추진하고자 합니다.
먼저 신규 사업 추진에 필요한 자본금 5억 원은 금번 유상증자를 통해 조달할 계획이며, 그 외 본 사업과 관련하여 계획된 자금조달은 없습니다.
사업의 제도적 기반과 안정성을 확보하기 위해 2025년 3분기 내 원료의약품 도매업 및 수입업 허가를 취득하고, 2025년 4분기까지 기존 주요 매입처 및 매출처와의 거래 기간을 확대하여 중장기적 수익 기반을 공고히 할 예정입니다. 이와 동시에 2026년 1월 28일 대성팜텍의 흡수합병을 완료하여 사업 시너지를 극대화할 계획이며, 사업 확장을 위해 2026년 2분기까지 주요 원료의약품에 대한 DMF(Drug Master File) 등록을 순차적으로 진행하고, 안정적인 수급 구조를 위한 매입처 다변화를 추진할 것입니다.
성공적인 사업 수행을 위한 조직 역량 강화를 위하여 2025년 4월 원료의약품 사업본부를 신설하고 글로벌 제약사에서 경험을 갖춘 전문가를 사업본부장으로 영입했습니다. 2026년에는 대성팜텍 합병을 통해 확보되는 인력과 더불어 원료의약품 수입, 유통, 판매 및 개발 경험을 보유한 실무 인력을 추가 채용하여 사업의 안정적인 정착을 도모하겠습니다.
당사는 이러한 신규 사업 관련 위험을 최소화하고 성공적인 시장 안착을 위해 철저한 시장 조사, 면밀한 사업 타당성 분석, 관련 분야 전문가 영입 또는 외부 전문기관의 자문 활용, 체계적인 내부 통제 시스템 구축, 안정적이고 다변화된 공급망 확보 노력, 관련 법규 준수 강화 등 다각적인 노력을 기울일 예정입니다. 그럼에도 불구하고, 신규 사업 진출에는 본질적인 불확실성과 다양한 위험이 상존하므로, 투자자께서는 신규 사업의 성공 가능성, 예상 수익성, 기존 핵심 사업에 미칠 수 있는 영향 등을 종합적으로 고려하여 신중하게 투자 결정을 내리시기 바랍니다.
|
마. 정부 정책 및 규제 변화에 따른 위험 또한, 신약의 시판 허가 이후에도 각국의 약가 규제 정책은 수익성에 직접적인 영향을 미칩니다. 우리나라는 물론, 미국 인플레이션 감축법(IRA) 시행 및 최혜국 대우 원칙 기반 정책 도입, 유럽 각국의 참조가격제 등 주요 시장에서 약가 인하 압력이 거세지고 있습니다. 이로 인해 당사가 개발한 신약이 기대만큼의 약가를 인정받지 못하거나 지속적으로 약가가 인하될 경우, 막대한 연구개발 투자 비용의 회수가 어려워질 수 있습니다. 더불어, 당사는 정부의 연구개발 과제 참여를 통해 자금의 일부를 지원받고 있으나, 정부의 산업 육성 정책 및 재정 상황 변화에 따라 지원 규모가 축소되거나 중단될 수 있습니다. 이러한 정부 지원 정책의 변동은 당사의 연구개발 자금 확보 계획에 차질을 빚게 하여, 진행 중인 연구개발 과제의 지연 또는 신규 투자 위축으로 이어질 수 있습니다. 상기 언급된 사항 외에도, 의약품 제조 및 품질관리 기준, 임상시험 관리 기준 등 신약 개발, 생산, 유통 전반에 걸친 규제 기준이 강화될 수 있습니다. 이러한 기준을 충족하기 위해서는 지속적인 설비 투자 및 품질 관리 시스템 개선이 필요하며, 이를 준수하지 못할 경우 제조 허가 취소, 제품 회수 등의 제재를 받을 수 있습니다. 또한, 환경·안전·보건, 개인정보보호, 공정거래 관련 규제 강화 역시 비용 증가나 사업 활동 제약의 요인으로 작용할 수 있습니다. 당사는 이러한 정부 정책 및 규제 환경 변화에 대한 면밀한 모니터링과 법규 준수를 위한 내부 통제 시스템 강화를 통해 관련 위험을 최소화하고자 노력하고 있습니다. 그러나 예측 불가능하거나 급격한 정책 및 규제 변화는 당사의 사업 계획, 연구개발 활동, 수익성 및 재무 상태에 부정적인 영향을 미칠 수 있으므로, 투자자께서는 이 점에 각별히 유의하시고, 다양한 규제 환경 변화가 당사의 사업 전반에 미칠 수 있는 잠재적 위험을 인지하시기 바랍니다. |
제약ㆍ바이오 산업은 인간의 생명과 건강에 직접적인 영향을 미치기 때문에 연구개발, 임상시험, 인허가, 제조, 유통, 판매, 약가, 광고 등 사업 전반에 걸쳐 각국 정부의 엄격하고 포괄적인 규제를 받습니다. 이러한 정부 정책 및 규제는 수시로 변경될 수 있으며, 그 변화의 내용과 방향에 따라 당사의 사업 활동, 수익성 및 성장성에 중대한 영향을 미칠 수 있습니다.
(1) 신약 개발 및 허가 관련 규제 변화 위험
신약을 개발하여 시장에 출시하기 위해서는 각 국가의 규제 당국으로부터 임상시험계획 승인 및 품목허가를 받아야 합니다. 이러한 허가 과정은 신약의 안전성과 유효성을 과학적으로 입증해야 하므로 매우 엄격하며, 제출해야 하는 자료의 범위가 방대하고 심사 기간도 장기간 소요될 수 있습니다.
최근 글로벌 규제 당국은 신약의 안전성과 유효성 검증 기준을 강화하는 추세입니다. 임상시험 설계의 적절성, 임상 데이터의 품질 및 신뢰성, 통계적 유의성 확보, 장기 안전성 데이터 확보 등에 대한 요구 수준이 지속적으로 높아지고 있습니다. 예를 들어, 특정 질환에 대한 임상시험 평가지표가 기존의 대리 평가지표에서 임상적으로 더욱 의미 있는 직접적인 평가지표로 변경되거나, 비교 약물 선정 기준이 강화되어 기존 표준 치료제보다 우월성을 입증해야 하는 경우가 발생할 수 있습니다. 또한, 특정 환자군에 대한 추가적인 분석이나 별도의 임상시험이 요구될 수도 있습니다. 최근에는 실제 임상 환경에서의 약효를 반영하는 실사용데이터 및 실사용증거의 활용이 신약 허가 및 시판 후 안전관리 등에서 중요성이 커지고 있으나, 아직 명확한 가이드라인이 정립되지 않은 부분도 많아 규제적 불확실성이 존재합니다.
당사가 현재 진행 중이거나 향후 진행할 임상시험이 이러한 규제 당국의 강화된 기준을 충족하지 못하거나, 임상시험 과정에서 예상치 못한 중대한 이상반응이 발생할 경우, 임상시험이 지연, 중단되거나 실패할 수 있으며, 이는 최종적으로 품목허가를 받지 못하는 결과로 이어질 수 있습니다.
이처럼 강화되는 규제 기준과 높아지는 불확실성에 효과적으로 대응하고 개발 성공 가능성을 높이기 위해, 신약 개발사는 규제기관과의 효과적인 소통을 통해 개발 전략을 수립하고 규제적 불확실성을 줄여나가야 합니다. 미국 식품의약국(FDA)은 이러한 목적을 위해 개발사와 공식적으로 논의할 수 있는 다양한 미팅 유형을 제공하고 있으며, 이를 통해 개발사는 신약 개발 전략, 임상시험 설계, 규제 요건 등에 대한 FDA의 공식적인 의견과 지침을 확보할 수 있습니다. 주요 미팅 유형과 그 내용은 다음과 같습니다.
| [미국 식품의약국(FDA) 미팅 유형] |
| 구분 | Type A 미팅 | Type B 미팅 | Type C 미팅 |
|---|---|---|---|
| 요청 주체 | 개발사 (스폰서) | 개발사 (스폰서) | 개발사 (스폰서) |
| 정의/목적 | 지체된 개발 진행, 중대한 안전성 문제 해결 | 개발 주요 시점(Pre-IND, EOP, Pre-NDA/BLA 등) 논의 | Type A/B 외 기타 개발 및 검토 관련 모든 사항 논의 |
| 긴급성 | 매우 높음 (Critical Path) | 높음 (Milestone) | 상대적으로 낮음 (필요시) |
| 미팅의 의의 | 중대한 장애물 신속 해결 및 개발 정상화 | 개발 방향 설정, 규제 불확실성 해소, 성공적 허가 기반 마련 | 다양한 개발 이슈에 대한 유연한 자문 및 선제적 문제 해결 |
| 주요 예시 | 임상 보류 해제, 분쟁 해결, SPA 관련 논의 | Pre-IND, EOP1, EOP2/Pre-Phase 3, Pre-NDA/BLA 미팅 | 과학적 이슈, CMC, 시험 디자인 세부사항, 라벨링, 비임상 결과 등 |
| FDA 통보 | 14일 이내 | 21일 이내 | 21일 이내 |
| 미팅 개최 | 요청 접수 후 30일 이내 | 요청 접수 후 60일 이내 (EOP의 경우 70일 이내) | 요청 접수 후 75일 이내 |
| 미팅 개최 난이도 | 매우 어려움 (엄격한 기준 충족 필요) | 중간 (주요 단계별 필요성 입증) | 상대적으로 수월 (유연한 요청 가능, 명확한 목적 제시 시) |
|
출처) 미국 식품의약국(FDA) Guidance for Industry: Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products |
당사는 규제적 불확실성에 대응하고 개발 전략의 명확성을 확보하기 위해 규제기관과 소통하고 있습니다. CU06 임상 2a상에서 1차 평가지표 미충족 후, 향후 개발 방향에 대한 FDA의 견해를 확인하고자 미국 식품 의약국(FDA)와 Type C 미팅을 진행하여 임상 2b상 개발 전략의 주요 고려사항들을 논의하였습니다. 특히 '위약 대비 우월성 입증 임상' 프로토콜 진행 가능, 임상 2b상과 임상 3상의 투약 기간, 1차 및 2차 주요 평가지표로 황반중심두께(CST)가 아닌 최대교정시력(BCVA) 활용, 규제 준수를 위한 연구 개발 계획 등을 논의하였습니다.
그러나 이러한 규제기관과의 소통이 반드시 개발의 순항을 담보하는 것은 아니며, 협의 과정에서 예상치 못한 변수가 발생하거나 기존 논의된 사항이 변경될 가능성도 상존합니다. 따라서 투자자께서는 특정 미팅에서의 논의 내용이나 규제기관의 잠정적인 피드백이 곧 향후 임상시험의 성공이나 최종 허가를 보장하는 것은 아니라는 점을 충분히 인지하시고, 신중한 판단을 하시기 바랍니다.
또한, 각국 규제 당국의 심사 기준, 절차, 가이드라인 등은 예고 없이 변경될 수 있습니다. 이러한 규제 환경의 변화는 당사에게 추가적인 임상시험 수행, 보완 자료 제출, 허가 전략 수정 등을 요구할 수 있으며, 이는 신약 개발 비용의 증가, 개발 일정의 지연, 나아가서는 특정 파이프라인의 개발 포기로 이어질 수 있습니다. 예를 들어, 특정 성분이나 제형에 대한 새로운 안전성 규제가 도입되거나, 희귀의약품 지정 기준이 변경되는 등의 상황이 발생할 수 있습니다. 특히, 당사가 개발 중인 혁신 신약의 경우, 유사한 선례가 없어 규제 당국의 심사 과정에서 더 많은 불확실성에 직면할 수 있습니다. 모든 신약 개발 과정에는 다양한 변수와 불확실성이 내재되어 있으므로, 투자자께서는 이러한 신약 개발 및 허가 과정의 규제 관련 위험이 당사의 파이프라인 개발 일정 및 성공 가능성에 중대한 영향을 미칠 수 있음을 충분히 인지하시고 투자에 유의하시기 바랍니다.
(2) 약가 규제 정책 변화 위험
신약이 규제 당국의 시판 허가를 받더라도, 해당 국가의 건강보험 시스템에 등재되고 적절한 약가를 인정받아야 성공적인 시장 진입 및 매출 창출이 가능합니다. 그러나 대부분의 국가에서 정부는 건강보험 재정의 지속가능성 확보, 의약품 접근성 강화, 의료비 통제 등을 목적으로 약가에 대한 직·간접적인 규제를 시행하고 있으며, 이러한 약가 규제 정책은 신약 개발 기업의 수익성에 직접적인 영향을 미칩니다.
우리나라의 경우, 국민건강보험법에 따라 신약이 건강보험 급여 대상이 되기 위해서는 건강보험심사평가원의 약제급여 적정성 평가를 거쳐 국민건강보험공단과의 약가 협상을 통해 상한금액이 결정됩니다. 이 과정에서 신약의 임상적 유용성, 비용효과성, 대체 가능성, 보험 재정에 미치는 영향 등이 종합적으로 고려되므로, 당사가 개발한 신약이 기대만큼의 약가를 인정받지 못하거나 급여 등재 자체가 지연 또는 거부될 수 있습니다. 또한, 약가 등재 이후에도 사용량-약가 연동제, 실거래가 조사에 따른 약가 인하, 제네릭 등재에 따른 오리지널 약가 인하 등 다양한 사후 관리 제도를 통해 지속적으로 약가가 인하될 위험이 있습니다.
미국 의약품 시장은 전통적으로 자유로운 시장 경쟁을 통해 약가가 형성되어 왔으나, 최근에는 높은 약가에 대한 사회적 비판이 거세지면서 정부 차원의 약가 통제 움직임이 눈에 띄게 강화되고 있습니다. 이러한 변화의 대표적인 예로, 2022년에 발효된 인플레이션 감축법을 들 수 있습니다. 이 법안은 공공의료보험인 메디케어가 특정 고비용 의약품에 대해 제약사와 직접 약가를 협상할 수 있는 권한을 부여함으로써, 향후 미국 시장에서 신약의 가격 결정 방식과 제약 기업의 수익성에 중대한 변화를 가져올 것으로 예상됩니다.
여기에 더해, 2025년 5월 12일 트럼프 행정부에서는 '최혜국 대우' 원칙, 즉 다른 선진국들이 지불하는 가장 낮은 의약품 가격을 기준으로 미국 내 약가를 책정하려는 정책에 기반한 약가 모델의 재도입 포함한 약가인하 정책을 시행하였으며, 이와 함께 의약품 수입 확대, 복잡한 리베이트 시스템 개혁 등 추가적인 약가 인하 정책들을 적극적으로 모색하고 있는 상황입니다. 이 경우, 미국 시장에 새롭게 진출하는 신약들은 가격 책정 단계에서부터 상당한 인하 압박에 직면하게 될 것이며, 이는 당사와 같이 혁신 신약을 개발하는 기업들의 기대 수익률을 현저히 낮출 수 있는 직접적인 위험 요인입니다. 뿐만 아니라, 미국 각 주 정부 차원에서도 자체적으로 약가 투명성을 강화하고 리베이트를 규제하려는 다양한 정책들이 꾸준히 추진되고 있어, 전반적인 약가 인하 압력은 앞으로 더욱 거세질 것으로 전망됩니다.
유럽의 경우, 각 국가별로 상이한 약가 결정 및 상환 시스템을 운영하고 있으나, 대부분 참조가격제, 경제성 평가, 정부와의 직접 협상 등을 통해 약가를 통제하고 있습니다. 일본 또한 중앙사회보험의료협의회를 통해 약가를 결정하며, 정기적인 약가 재산정 제도를 운영하여 시장 실거래가를 반영한 약가 인하를 시행하고 있습니다.
이처럼 국내외적으로 강화되는 약가 규제 정책은 당사가 개발한 신약의 예상 시장 가치 및 수익성을 하락시켜, 연구개발 투자 비용의 회수를 어렵게 만들고 장기적으로는 혁신 신약 개발에 대한 동기를 저해할 수 있습니다. 투자자께서는 이러한 약가 규제 정책 변화가 당사 수익성에 미칠 수 있는 부정적 영향을 충분히 고려하시고, 당사 파이프라인의 상업화 성공 시 예상되는 수익 규모가 이러한 규제 환경에 따라 변동될 수 있음을 인지하시기 바랍니다.
(3) 정부 연구개발 지원 정책 변화 위험
정부는 제약·바이오 산업을 국가 핵심 전략 산업으로 인식하고, 신약 개발 및 산업 육성을 위해 다양한 연구개발 지원 정책을 운영하고 있습니다. 당사 또한 이러한 정부 연구개발 과제 참여를 통해 연구개발 자금의 일부를 지원받거나 정책적 혜택을 받고 있습니다. 예를 들어, 당사의 항체 신약 후보물질 MT-101과 MT-103은 국가신약개발사업단의 지원 과제로 선정된 바 있습니다.
그러나 정부의 재정 상황, 경제 정책 방향, 산업 육성 우선순위의 변화 등에 따라 제약·바이오 산업에 대한 연구개발 지원 규모가 축소되거나, 지원 대상 및 조건이 변경되거나, 특정 기술 분야에 대한 지원이 중단될 수 있습니다. 정부의 연구개발 지원이 감소하거나 중단될 경우, 당사는 연구개발 자금 확보에 어려움을 겪을 수 있으며, 이는 현재 진행 중인 연구개발 과제의 지연 또는 축소, 신규 연구개발 투자 위축 등으로 이어질 수 있습니다. 투자자께서는 정부 지원 정책의 변동 가능성 및 이에 따른 당사 연구개발 활동의 영향과 자금 조달 계획의 변동 가능성을 고려하시기 바랍니다.
(4) 기타 규제 환경 변화 위험
상기 언급된 사항 외에도, 의약품 제조 및 품질관리 기준, 임상시험 관리 기준, 비임상시험 관리 기준, 의약품 유통 관리 기준 등 신약 개발 및 생산, 유통 전반에 걸친 규제 기준이 강화될 수 있습니다. 이러한 기준을 충족하기 위해서는 지속적인 설비 투자 및 품질 관리 시스템 개선이 필요하며, 이를 준수하지 못할 경우 제조 허가 취소, 제품 회수 등의 제재를 받을 수 있습니다. 또한, 환경·안전·보건 관련 규제 강화는 생산 비용 증가 요인으로 작용할 수 있으며, 개인정보보호 규제는 임상시험 데이터 및 환자 정보 관리에 대한 부담을 가중시킬 수 있습니다. 공정거래 관련 법규 위반 시 과징금 부과 등 불이익을 받을 수도 있습니다.
당사는 이러한 정부 정책 및 규제 환경 변화에 대한 면밀한 모니터링과 법규 준수를 위한 내부 통제 시스템 강화를 통해 관련 위험을 최소화하고자 노력하고 있습니다. 그러나 예측 불가능하거나 급격한 정책 및 규제 변화는 당사의 사업 계획, 연구개발 활동, 수익성 및 재무 상태에 부정적인 영향을 미칠 수 있으므로, 투자자께서는 이 점에 각별히 유의하시고, 다양한 규제 환경 변화가 당사의 사업 전반에 미칠 수 있는 잠재적 위험을 인지하시기 바랍니다.
|
바. 신약 개발의 불확실성에 따른 위험 또한, CU06의 글로벌 개발을 위해 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 기술이전 계약이 2024년 7월 파트너사의 내부 개발 전략 변경을 사유로 해지되었으며 당사는 반환된 CU06의 경쟁력을 재점검하고 향후 개발 계획을 수립하였습니다. 더불어 기업공개(IPO) 당시 계획했던 주요 파이프라인의 임상시험 및 기술이전 일정이 전반적으로 지연되고 있습니다. CU06은 파트너사와의 협력 및 규제 대응 과정에서, CU01(당뇨병성 신증 치료제)은 규제기관의 권고 및 대규모 임상 필요성에 따른 개발 전략 수정으로 인해 당초 예상보다 사업화 성과 달성이 지체되고 있습니다. 이와 같은 개발 일정 지연은 추가적인 비용 발생으로 이어질 수 있으며, 향후 계획 역시 추가적인 변수로 인해 지연될 가능성이 있습니다. 상기 서술된 바와 같이 각 임상시험에서 1차 평가지표를 충족하지 못하거나, 통계적으로 유의미한 치료 효과를 입증하지 못하거나, 심각한 안전성 문제가 발생할 경우, 해당 파이프라인의 개발이 중단될 수 있습니다. 이는 당사의 파이프라인 가치 하락, 주가 하락 등 심각한 부정적 결과를 초래할 수 있습니다. 또한, 임상시험 과정에서 환자 모집 지연, 임상시험수탁기관과의 문제, 임상시험용 의약품 생산 차질 등 다양한 변수로 인해 개발 일정이 지연되고 비용이 증가할 위험이 상존합니다. 긍정적인 임상 결과를 얻더라도 규제 당국의 품목허가를 받지 못하면 신약을 출시할 수 없으며, 허가를 받더라도 시장 경쟁, 낮은 시장 수용성, 불리한 약가 등으로 상업적 성공을 거두지 못할 위험도 존재합니다. |
신약 개발은 본질적으로 매우 높은 불확실성을 내포하는 과정으로, 기초 연구 및 후보물질 발굴, 전임상시험, 임상 1상, 2상, 3상 시험, 허가 신청 및 심사, 시판 후 조사 등 여러 단계를 거치며 각 단계마다 실패할 위험이 매우 높습니다. 미국바이오협회와 인포마 파마 인텔리전스의 2021년 02월 보고서 "Clinical Development Success Rates and Contributing Factors 2011-2020"에 따르면, 임상 1상에 진입한 신약 후보물질이 최종적으로 미국 식품의약국의 시판 허가를 받을 확률은 평균 7.9%에 불과했으며, 특히 임상 2상 단계에서의 성공률은 28.9%로 가장 낮았습니다. 당사가 개발 중인 파이프라인 역시 이러한 통계적 실패율에서 자유로울 수 없습니다.
| [신약 개발 단계 및 단계별 성공률] |
|
| 출처) 미국바이오협회, "Clinical Development Success Rates and Contributing Factors 2011-2020, 2021.02 |
당사의 주요 파이프라인인 CU06의 경우, 당뇨병성 황반부종 환자를 대상으로 미국 임상 2a상을 완료하고, 2024년 02월 05일 탑라인 결과를 발표하였으며 2024년 04월 04일 임상시험결과보고서(CSR)를 수령했습니다. 보고서에 따르면 1차 평가지표인 기저치(베이스라인) 대비 12주차 황반중심두께(Central Subfield Thickness, CST) 변화는 전체 환자군에서 통계적으로 유의미한 변화가 관찰되지 않았으나, 베이스라인 황반중심두께 값이 모든 시험군에서 추가적인 악화 없이 안정화되었음을 확인했습니다. 2차 평가지표 중 하나인 최대교정시력(Best Corrected Visual Acuity, BCVA) 변화와 관련하여, 베이스라인 최대교정시력이 69글자 이하인 하위그룹의 경우 12주차에 300mg 투여군에서 5.8-6.1글자의 시력 개선(최소자승법 평균값 기준)을 보였으며, 안전성 및 내약성은 양호했습니다.
당뇨병성 황반부종(Diabetic Macular Edema)은 당뇨병으로 인해 망막 중심부인 황반에 혈관이 누수되어 부종이 발생하여 시력이 저하되는 질환으로, 해당 질환 치료의 궁극적인 목적은 단순한 해부학적 개선을 넘어 환자의 최대교정시력을 유지하거나 개선하는 것입니다. 이는 미국 FDA를 포함한 글로벌 규제기관이 당뇨병성 황반부종 치료제 허가 시 가장 중요한 평가 기준으로 삼는 항목이기도 합니다.
당뇨병성 황반부종 치료제의 품목허가를 위한 임상3상 단계에서는 반드시 최대교정시력을 1차 평가지표로 설정해야 하지만, 임상 2상과 같은 초기 단계에서는 약물의 치료기전과 효능 등을 탐색하기 위해 다양한 지표가 우선적으로 적용될 수 있습니다. 특히 비임상(동물실험) 단계에서는 동물을 대상으로 시력 지표를 직접 평가하기 어려운 한계가 있어 동물실험에서 확인된 해부학적 변화(황반중심두께, 섬유화 등)를 1차 평가지표로 설정하여 임상시험 설계를 진행하게 됩니다.
CU06 또한 이러한 배경 하에 지난 당뇨병성 황반부종 임상2a상에서 1차 평가지표로 황반중심두께를, 2차 평가지표로 최대교정시력을 설정하여 탐색적 분석을 수행했습니다.
임상 2a상은 일반적으로 약물의 안전성을 확인하고 초기 유효성을 탐색하는 단계로, CU06의 해당 임상시험에서 1차 평가지표를 충족하지 못한 점은 향후 개발 과정에서의 불확실성을 높이는 요인으로 작용할 수 있습니다. 당사는 해당 임상에서 황반중심두께(CST)의 안정적 유지 및 최대교정시력(BCVA)의 일부 개선 추세 등 긍정적인 경향을 관찰하였으나, 임상 결과 해석에는 한계가 있으며, 후속 임상을 통해 치료제로서의 효능과 안전성을 확인해야 합니다. 투자자께서는 1차 평가지표 미충족이라는 객관적 결과와 이것이 후속 임상 및 최종 허가 가능성에 미칠 수 있는 잠재적 영향을 신중하게 고려하실 필요가 있으며, 현재까지의 결과는 추가적인 검증이 요구되는 초기 단계의 소견임을 유의하시기 바랍니다.
당사는 이번 임상 2a상 결과를 바탕으로 후속 임상 2b상을 진행할 예정이나, 1차 평가지표인 황반중심두께 변화에서 통계적 유의성을 확보하지 못한 점은 후속 임상 2b상 진행 및 기술이전 협상에 상당한 어려움을 야기할 수 있습니다.
황반중심두께는 당뇨병성 황반부종에서 질병의 중증도를 나타내는 객관적이고 중요한 지표이므로, 이 지표에서 통계적으로 유의미한 개선 효과를 보이지 못한 것은 약물의 잠재적 효능에 대한 의구심을 증폭시켜 향후 임상 2b상의 성공 가능성을 낮추는 요인으로 작용할 수 있습니다. 비록 특정 하위그룹에서 긍정적인 시력 개선 효과가 관찰되었다고는 하나, 이것이 전체 환자군에서의 치료 효과를 담보하는 것은 아니기 때문입니다.
CU06의 임상2a상 결과 1차 평가지표에서 명확한 효능을 입증하지 못함에 따라 후속 임상 2b상의 주요 평가지표 설정, 대상 환자군 선정, 적정 용량 결정 등 임상 디자인 수립에 있어 과학적 근거가 부족해질 수 있으며, 이는 규제기관과의 임상 디자인 협의 과정을 더욱 복잡하게 만들고 임상시험계획 승인 지연의 원인이 될 수 있습니다. 뿐만 아니라, 임상 2a상 결과에 따라 후속 임상 2b상의 디자인을 변경하거나 약물의 효능을 보다 명확히 입증하기 위한 추가적인 탐색적 연구 또는 소규모 임상시험이 필요할 경우, 전체적인 신약 개발 기간이 연장되고 연구개발 비용의 추가적인 증가를 초래할 수 있습니다.
또한 신약 후보물질의 가치 평가에 부정적인 영향을 미쳐, 후속 임상 개발에 필요한 자금 조달이나 글로벌 제약사와의 기술이전 협상 시 당사를 불리한 위치에 놓이게 할 수 있습니다. 잠재적 투자자나 파트너사는 약물의 효능에 대해 더욱 엄격한 기준을 적용하거나 더 많은 검증 데이터를 요구할 수 있으며, 투자 조건이나 기술이전 조건을 보수적으로 설정할 가능성이 높습니다.
마지막으로, 임상 2a상은 신약 개발 초기 단계의 임상시험이지만, 1차 평가지표 미충족 이력은 향후 품목허가 신청 시 규제 당국의 심사 과정에서 약물의 유효성에 대한 추가적인 소명 자료를 요구받거나 더 엄격한 심사 기준이 적용될 수 있는 잠재적 위험 요인이 될 수 있습니다.
이에 따라 당사는 CU06의 개발 전략, 특히 임상 2b상 및 3상, 허가 단계에 이르는 전반적인 계획에 대해 FDA의 검토를 받고자 2025년 2월 Type C 미팅을 진행했습니다. 이는 막대한 자원과 시간이 소요되는 후속 임상에 본격적으로 돌입하기 전, FDA와 협의를 통해 향후 개발의 불확실성을 줄이고 성공 가능성을 높이기 위한 목적이었습니다. 특히 계열 내 최초 신약(First-in-Class)과 같이 기존에 승인된 유사한 약물이 없는 경우, FDA의 의견을 미리 확인하는 것이 중요합니다. 글로벌 제약사들 또한 신약 개발의 성공 가능성을 높이기 위해 Type C 미팅을 적극 활용하고 있습니다.
미국 FDA와의 미팅은 신약 개발 과정에서 개발사가 FDA와 공식적으로 논의하는 사전 협의 절차 중 하나입니다. 이를 통해 개발사는 신약 개발 전략 수립 과정에서 FDA의 피드백을 받고 임상시험 설계, 데이터 제출 전략 등 다양한 사항에 대한 과학적, 규제적 조언을 구할 수 있습니다. 특히 CU06과 같이 계열 내 최초 신약이거나 당뇨병성 황반부종 적응증으로 후기 임상에 진입하는 세계 최초의 경구용 약물인 경우, 개발 방향 설정에 있어 규제기관의 의견을 사전에 확인하는 것이 중요합니다.
주요 미팅 유형과 그 내용은 다음과 같습니다.
| [미국 식품의약국(FDA) 미팅 유형] |
| 구분 | Type A 미팅 | Type B 미팅 | Type C 미팅 |
|---|---|---|---|
| 요청 주체 | 개발사 (스폰서) | 개발사 (스폰서) | 개발사 (스폰서) |
| 정의/목적 | 지체된 개발 진행, 중대한 안전성 문제 해결 | 개발 주요 시점(Pre-IND, EOP, Pre-NDA/BLA 등) 논의 | Type A/B 외 기타 개발 및 검토 관련 모든 사항 논의 |
| 긴급성 | 매우 높음 (Critical Path) | 높음 (Milestone) | 상대적으로 낮음 (필요시) |
| 미팅의 의의 | 중대한 장애물 신속 해결 및 개발 정상화 | 개발 방향 설정, 규제 불확실성 해소, 성공적 허가 기반 마련 | 다양한 개발 이슈에 대한 유연한 자문 및 선제적 문제 해결 |
| 주요 예시 | 임상 보류 해제, 분쟁 해결, SPA 관련 논의 | Pre-IND, EOP1, EOP2/Pre-Phase 3, Pre-NDA/BLA 미팅 | 과학적 이슈, CMC, 시험 디자인 세부사항, 라벨링, 비임상 결과 등 |
| FDA 통보 | 14일 이내 | 21일 이내 | 21일 이내 |
| 미팅 개최 | 요청 접수 후 30일 이내 | 요청 접수 후 60일 이내 (EOP의 경우 70일 이내) | 요청 접수 후 75일 이내 |
| 미팅 개최 난이도 | 매우 어려움 (엄격한 기준 충족 필요) | 중간 (주요 단계별 필요성 입증) | 상대적으로 수월 (유연한 요청 가능, 명확한 목적 제시 시) |
|
출처) 미국 식품의약국(FDA) Guidance for Industry: Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products |
당사는 FDA와 미팅에서 CU06 후속 임상 디자인으로 '위약 대비 우월성 입증 임상(vs. Placebo)'을 제안했으며, FDA는 이러한 디자인 방향에 동의했습니다. 또한, 임상2b상의 투약 기간은 '6개월(24주 투약) + 1개월(4주 안전성 추적 관찰)'로, 임상3상은 '1년(52주 투약)'으로 제안하여 FDA의 동의를 얻었습니다. 이것이 통상적인 Anti-VEGF 주사제 임상 기간(임상2b상 약 1년, 임상3상 약 2년) 대비 짧아 개발 기간 단축 및 비용 절감 효과를 기대하고 있습니다.
FDA는 CU06의 후속 임상(임상2b상 및 임상3상)에서 1차 및 2차 주요 평가지표로 '최대교정시력'을 활용할 것을 권고했으며, 임상 2a상의 1차 평가지표였던 '황반중심두께'에 대해서는 별도의 언급이 없었습니다. 이에 따라 임상2b상에서 최대교정시력을 1차 평가지표, 2차 평가지표로 활용하여 효능을 평가할 계획입니다.
FDA는 CU06 약물에 대한 이해를 높이기 위한 질문과 함께 총 9개의 추가 연구 계획을 제시할 것을 요청했습니다. 이 중 4개는 이미 완료되었거나 진행 중이며, 나머지 연구들은 비임상(In vitro, In vivo) 수준으로 임상3상 종료 후 허가 신청(NDA) 전까지 제출하면 되는 사항이므로 현재 개발 일정에는 영향을 미치지 않을 것으로 예상하고 있습니다.
당사는 이번 FDA와의 Type C 미팅을 통해 CU06의 개발 전략이 임상 2b상뿐 아니라 임상 3상 단계까지 구체적으로 확립되었으며, 이는 향후 글로벌 제약사와의 기술이전 논의 시 CU06의 임상 성공 및 허가 가능성에 대한 신뢰도를 높일 수 있을 것으로 기대하고 있습니다.
그러나 FDA와의 협의를 통해 개발 전략이 명확해진 점은 긍정적일 수 있으나, 기술이전의 성사 여부 및 조건은 잠재적 파트너사의 자체적인 실사 결과, 임상 2b상의 실제 데이터, 시장 상황 등 다양한 요인에 의해 결정되므로 Type C 미팅 결과만으로 기술이전의 성공을 낙관하기는 어렵습니다. 또한 투자자께서는 Type C 미팅이 FDA의 공식적인 조언을 받는 과정일 뿐, 그 결과가 향후 후속 임상의 임상시험계획승인이나 최종 품목허가를 보장하지 않는다는 점을 유의하셔야 합니다. FDA의 권고는 개발 방향을 제시할 뿐이며,계열 내 최초 신약 및 새로운 투여 경로 약물 개발은 본질적으로 높은 불확실성과 위험을 수반하는 점을 유의하시기 바랍니다.
한편, 2021년 10월 프랑스 떼아 오픈이노베이션과 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06와 관련하여 아시아(한국, 중국, 일본, 인도 등 일부 국가 제외)를 제외한 전 세계 지역에서의 개발 및 상업화 권리를 이전하는 계약을 체결하였으나, 2024년 07월 12일 권리반환이 확정되었습니다. 계약 해지 사유는 떼아 오픈이노베이션의 내부 개발 전략 변경으로, CU06에 대한 모든 권리를 반환받았습니다. 이에 따라 CU06의 당뇨병성 황반부종 및 습성 황반변성 적응증에 대한 향후 개발 및 상업화 전략을 재수립해야 하며, 기존에 기대했던 마일스톤 및 로열티 수익 확보는 불가능하게 되었습니다. 이는 당사의 향후 수익성 및 현금흐름에 부정적인 영향을 미칠 수 있습니다.
이에 당사는 반환된 CU06의 경쟁력을 재점검하고 향후 개발 계획을 수립하고자, 현재 상용화된 경쟁 제품 및 개발 중인 파이프라인과 그 특성을 비교하였습니다.
| [CU06의 경쟁 약물 비교] |
| 제품명 | CU06 | 아일리아 | 루센티스 | 바비스모 | RZ402 | Danegaptide | Tonabersat | IBE-814 IVT | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 적응증 | 당뇨병성 황반부종, 습성 황반변성 | 당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 |
당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 |
당뇨병성 황반부종, 습성 황반변성, 망막정맥폐쇄 등 |
당뇨병성 황반부종 | 당뇨 망막병증 | 당뇨병성 황반부종 | 당뇨병성 황반부종 | ||
| 작용 기전 | 혈관내피기능장애 차단 | VEGF 억제 | VEGF 억제 | VEGF 및 Ang-2 이중억제 | Plasma kallikrein inhibitor | 갭 접합 단백질 Alpha 1 활성제 | Connexin43 반채널 억제제 | 항염증 스테로이드(Dexamethasone) | ||
| 투여경로 | 경구 투여 | 안구 주사제 | 안구 주사제 | d안구 주사제 | 경구 투여 | 경구 투여 | 경구 투여 | 안구 내 임플란트 | ||
| 개발 단계 | 임상2a상 완료, 임상2b상 준비 중 | 시판 중 | 시판 중 | 시판 중 | 당뇨병성 황반부종 임상2a상 완료 | 당뇨 망막병증 임상 1b/2a상 진행 중 | 당뇨병성 황반부종 임상2상 진행 중 | 당뇨병성 황반부종 임상 2b상 완료 | ||
| 시장성 | 높음 | 높음 | 높음 | 높음 | 높음 | 높음 | 높음 | 낮음 | ||
| 특징 | - 임상2a상에서 황반중심두께 유지 및 시력개선 효과와 안전성을 입증 | - 항체 치료제로서 다양한 망막질환에 사용 중 - 반복 치료시 내성 발생 |
- 항체 치료제로서 다양한 망막질환에 사용 중 - 반복 치료시 내성 발생 |
- 망막질환 치료제 내 최초의 이중항체 치료제 - 반복 치료시 내성 발생 |
- 임상2a상 황반중심두께 개선 확인 | - 심근경색 적응증으로 개발 중단 이력 | - 편두통 적응증으로 개발 중단 이력 | - 상용화된 기존 스테로이드 치료제 존재 | ||
| 개발회사명 | 큐라클 | 리제네론 | 바이엘 | 노바티스 | 로슈 | 로슈 | 레졸루트 | 브레이 | 인플램엑스 | 리플테라퓨틱스 |
| 소재지 | 대한민국 | 미국 | 독일 | 스위스 | 스위스 | 스위스 | 미국 | 덴마크 | 미국 | 미국 |
| 출처) 당사 제시 |
당사가 개발 중인 CU06의 주요 적응증인 망막질환 시장(당뇨병성 황반부종, 습성 황반변성 등)은 다수의 글로벌 제약사 및 바이오 기업들이 경쟁하고 있는 분야입니다. 현재 대표적인 망막질환 치료제로는 안구에 직접 약물을 주사하는 형태의 안구내 주사제가 주로 사용되고 있으며, 리제네론과 바이엘의 '아일리아', 노바티스와 로슈의 '루센티스', 로슈의 '바비스모' 등이 대표적인 예입니다.
이들 약물은 공통적으로 혈관내피세포 성장인자(VEGF, Vascular Endothelial Growth Factor)를 억제함으로써 병적 혈관 생성과 혈관 누출을 차단하는 작용 기전을 기반으로 하며, 현재까지도 표준 치료제로 사용되고 있습니다. 그러나 VEGF 단독 억제 방식은 일부 환자군에서 반응이 제한적이거나, 장기적인 반복 치료 시 치료 효과가 점차 감소하는 한계가 보고되고 있습니다. 또한 유리체강 내 반복 주사는 안내염, 안구 내 염증, 망막박리 등의 시술 관련 부작용 위험을 수반하며, 1~2개월 간격으로 반복 투여해야 하는 일정 역시 환자와 보호자에게 상당한 부담으로 작용하고 있습니다.
비침습적이고 환자 순응도를 높일 수 있는 경구용 치료제에 대한 개발 시도가 활발히 이루어져 왔으나, 현재까지 망막질환에 대해 허가를 받은 경구용 치료제는 존재하지 않습니다. 로슈, 베링거인겔하임, 센쥬 등 글로벌 주요 제약사들도 경구용 치료제 개발을 다수 시도했으나, 최대교정시력과 같은 유효성 지표를 입증하지 못하거나 안전성 이슈로 인해 임상에 실패한 사례가 이어졌습니다.
현재 글로벌 기준에서 임상 단계에 진입하여 활발히 개발되고 있는 경구용 망막질환 치료제 후보물질은 극히 제한적이며, 대표적으로 당사의 CU06, 레졸루트의 'RZ402', 브레이의 'Danegaptide', 인플램엑스의 'Tonabersat' 등이 있습니다. 이들 중 일부는 당뇨병성 황반부종을 적응증으로, 일부는 당뇨 망막병증을 목표로 개발되고 있으며, 모두 기존의 항-VEGF 치료제를 대체하거나 병용 가능한 경구 치료제로서의 가능성을 입증하기 위해 임상개발을 진행 중입니다. 레졸루트의 RZ402는 동일한 작용기전의 약물이 안구내 주사제 형태로 망막질환 치료제로 개발된 이력이 2번 있지만 개발이 중단됐으며, 임상2a상에서 황반중심두께는 개선하는 결과를 보였지만, 최대교정시력은 변화를 보이지 않은 것으로 알려져 있습니다. 브레이의 Danegaptide와 인플램엑스의 Tonabersat은 각각 심근경색, 편두통 치료제로 임상2상을 진행했지만 개발이 중단되고 현재 망막 질환으로 적응증을 변경하여 개발하고 있습니다.
IBE-814 IVT는 스테로이드 계열 항염증 약물인 덱사메타손 기반의 안구 내 주사형 임플란트로, 임상 2b상을 완료한 상태입니다. 주성분인 덱사메타손은 기존 시장에서 장기간 사용되어 임상 데이터가 축적된 물질이며, 애브비(AbbVie)의 오저덱스(Ozurdex)와 같은 유사 기전의 상용화된 제품이 존재하여 상대적으로 개발 위험이 낮습니다. 그러나 기존 치료제 대비 목표 시장의 규모가 제한적일 수 있으며, 장기 투여 시 백내장 등 부작용 발생 가능성이 존재하는 한계가 있습니다. 이는 빠른 상업화가 가능하나 상대적으로 낮은 기대수익을 특징으로 합니다.
반면 CU06은 혈관내피기능장애를 표적하는 계열 내 최초(First-in-Class) 신약 후보물질입니다. 선행 약물이 없어 개발 과정의 불확실성 및 위험은 상대적으로 높으나, 신규 작용기전과 경구용 제형이라는 특징을 바탕으로 기존 Anti-VEGF 주사제의 제형 및 내성 이슈로 인해 미충족 수요가 존재하기 때문에 더 큰 규모의 시장을 목표할 수 있습니다.
상기 권리반환에도 불구하고, 당사는 CU06이 임상 2a상에서 핵심 유효성 지표인 최대교정시력(BCVA)의 개선 효과를 입증하였으며, 상기 기재한 경쟁 약물과의 비교표를 통해 확인할 수 있는 특징 등을 통해서 후속 기술이전 가능성이 높은 파이프라인으로 내부적으로 평가하고 있으며 임상 2b상을 진행하고자 합니다. 그럼에도 불구하고 투자자께서는 CU06의 임상 2a상 1차 평가지표인 황반중심두께 변화 미충족 등 객관적인 사실을 면밀히 검토하여 투자를 결정하시기 바랍니다.
당뇨병성 신증 치료제로 개발 중인 CU01은 현재 임상2b상을 진행 중으로 별도의 개발 경로를 따르고 있으며, 반려동물 만성신장질환 치료제로 개발 중인 CP01-R01은 임상3상을 진행하고 있습니다. 그 외 알츠하이머병 치료제인 CU71을 비롯해 맵틱스와 공동 연구개발 중인 항체치료제 MT 시리즈 등은 아직 초기 연구개발 단계로 불확실성이 매우 높습니다.
| [당사 파이프라인 현황] |
|
||
|
| 출처) 당사 제시 |
당사의 파이프라인별 진행 예정인 임상 개요는 다음과 같습니다.
| [CU06 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 주요 목적 - 당뇨병성 황반부종(DME) 환자를 대상으로 최적의 용량을 도출하여 향후 3상 시험 설계에 반영 부차적 목적 - 24주 후 CU06의 안전성과 유효성 평가 (위약과 비교) - CU06 및 대사체의 혈중 약물동태(PK) 평가 - 혈중 바이오마커(TNF-α, IL-6 등)에 대한 CU06-1004의 영향 분석 |
| 임상시험 대상국가 | 미국 내 20개 기관에서 환자 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 이번 임상시험은 미국 내 20개 의료기관에서 시행되는 무작위배정, 이중눈가림, 위약대조 방식의 다기관 임상 2b상 시험으로, 중심성 당뇨병성 황반부종(Center-Involved Diabetic Macular Edema, DME) 환자를 대상으로 CU06-1004의 유효성과 안전성을 평가하기 위해 설계되었습니다. 총 135명의 환자를 1:1:1 비율로 세 군(200mg, 300mg, 위약)으로 무작위 배정하여, 매일 식사 직후 경구로 24주간 약물을 투여받게 됩니다. - 주 평가 지표는 24주 시점에서의 ETDRS 문자표 기준 최고교정시력(BCVA) 변화량이며, 이외에도 망막 두께, 망막 내/하부 액체량, 혈관 밀도 및 혈류량, 염증성 바이오마커(TNF-α, IL-6) 등의 변화를 포함한 다양한 이차 평가지표들을 통해 약물의 치료 효과를 종합적으로 분석합니다. - 약동학적 특성은 혈중 약물 농도 측정을 통해 파악되며, 안전성은 이상반응 발생률, 생체징후 변화, 심전도 및 혈액검사 등 다양한 지표를 통해 평가됩니다. 주요 유효성 분석은 MMRM(Mixed Model for Repeated Measures)을 이용하며, 300mg과 200mg 용량을 위약과 순차적으로 비교하여 통계적 유의성을 검증합니다. |
| 기대효과 | - 본 임상을 통해 CU06-1004가 당뇨병성 황반부종 환자에서 유의미한 시력 개선 및 망막 구조 개선 효과를 나타낼 경우, 기존 항VEGF 주사제 중심의 치료법에 대한 대안으로 자리매김할 수 있을 것으로 기대됩니다. 특히 CU06-1004는 경구 투약이라는 비침습적 제형을 통해, 반복적인 안구 주사로 인한 환자 부담과 내원 횟수를 줄일 수 있는 잠재력을 보유하고 있습니다. - 또한, 다양한 시각적 기능 및 구조적 개선 외에도 염증 조절과 혈관 안정화 등의 기전을 입증함으로써, 기존 치료제 대비 차별화된 약물 프로파일을 확보할 수 있습니다. 이번 임상에서 도출되는 최적 용량과 유효성·안전성 데이터는 향후 3상 시험 설계의 근거가 되며, 글로벌 라이선싱 및 상업화를 위한 핵심 기반 자료로 활용될 수 있습니다. 이를 통해 CU06-1004는 DME 치료 분야에서 새로운 경구 치료제로서의 가능성을 입증할 수 있을 것으로 기대됩니다. |
| 출처) 당사 제시 |
| [CU71 임상1상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 이번 임상시험의 목적은 건강한 성인을 대상으로 CU71의 안전성, 내약성, 그리고 약동학적 특성을 평가하는 것입니다. 본 임상시험을 통해 단회 및 반복 투여 시 CU71의 체내 흡수, 분포, 대사 및 배출 특성을 확인하고, 인체 내에서의 안전성과 복용 가능 용량을 도출하여 향후 알츠하이머병 환자를 대상으로 한 임상 2상 진입을 준비하고자 합니다. |
| 임상시험 대상국가 | CU71의 이번 임상 1상 시험은 미국에서 진행될 예정입니다. 미국 식품의약국(FDA)의 승인을 받은 후, 미국 내 전문 임상시험기관에서 국제 임상시험 기준(GCP)을 준수하여 단일기관 방식으로 수행됩니다. |
| 임상시험 수행방법 | - 임상시험은 건강한 성인을 대상으로 진행되며, 무작위배정, 이중눈가림, 위약대조 방식으로 설계되었습니다. 시험대상자는 단회 또는 7일간 반복하여 CU71을 경구로 투약받게 되며, 용량은 단계적으로 증량되며, 각 단계에서의 안전성과 약동학 데이터를 기반으로 다음 단계로의 진입 여부가 결정될 예정입니다. - 시험 기간 동안 피험자들은 반복적인 혈액 및 소변 채취를 통해 약물의 혈중 농도 및 약동학적 지표를 측정받으며, 동시에 이상반응, 심전도 변화, 활력징후, 임상병리 검사 등을 통해 전반적인 안전성을 평가받게 됩니다. 특히 반복 투여 시 체내 약물 축적 여부를 확인하여 장기간 복용에 대한 위험성도 함께 평가하게 됩니다. |
| 기대효과 | - 이번 임상시험을 통해 CU71이 건강한 성인에서 전신적으로 안전하고 예측 가능한 약동학적 특성을 보인다는 것이 입증된다면, 알츠하이머병 환자를 대상으로 한 후속 임상(2상) 진행이 가능해질 것으로 기대됩니다. 특히 CU71은 경구로 복용 가능한 치료제이기 때문에 기존 주사제 기반 치료에 비해 환자의 복약 편의성 및 치료 접근성을 크게 향상시킬 수 있을 것으로 보입니다. - 아울러 본 임상 1상을 통해 확보되는 안전성 및 약동학 데이터는 적절한 초기 용량 설정에 중요한 근거가 되며, 후속 개발과 글로벌 파트너십 논의에도 긍정적인 영향을 줄 수 있을 것으로 예상됩니다. CU71은 기존 치료제의 한계를 극복할 수 있는 새로운 치료 옵션으로 자리매김할 가능성을 가진 후보물질로, 이번 임상을 통해 그 가능성을 한 단계 더 검증하는 계기가 될 것입니다. |
| 출처) 당사 제시 |
| [CU01 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | - 본 임상시험은 알부민뇨를 동반한 제2형 당뇨병성 신증 환자를 대상으로, 당사의 신약 후보물질인 CU01을 24주간 투여하여 유효성과 안전성을 평가하고, 동시에 적절한 투여 용량을 탐색하기 위해 설계되었습니다. - 당뇨병성 신증은 진행 시 투석 등 중증 합병증으로 이어질 수 있음에도 불구하고 현재까지 뚜렷한 치료제가 없는 영역으로, 이번 임상시험은 CU01의 치료 가능성을 과학적이고 객관적인 방식으로 입증하고자 하는 데 목적이 있습니다. |
| 임상시험 대상국가 | 대한민국 내 24개 기관에서 환자 240명 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 본 임상시험은 알부민뇨가 동반된 제2형 당뇨병성 신증 환자를 대상으로 실시됩니다. 시험대상자에게는 당사의 임상시험용 의약품인 CU01을 1일 2회 또는 1일 3회, 1회 120mg씩 경구 투여하며, 총 24주간 투여 후 유효성과 안전성을 평가하게 됩니다. = 또한, 이번 임상은 다양한 환자 환경에서의 치료 효과를 평가하고자 하는 탐색적 임상시험의 성격을 가지며, 다기관, 무작위배정, 이중눈가림, 위약 대조, 평행설계 방식으로 설계되었습니다. |
| 기대효과 | - 당뇨병성 신증은 제2형 당뇨병 환자에서 흔히 발생하는 만성 합병증으로, 진행 시 신기능 저하 및 말기신부전으로 이어질 수 있음에도 불구하고 현재까지 신장 기능을 유지하거나 개선하는 치료제는 부재한 상황입니다. - 이번 임상시험은 CU01이 당뇨병성 신증 환자에서 알부민뇨(단백뇨)의 개선 효과와 추정 사구체 여과율(eGFR) 등을 유의하게 개선할 수 있는지를 확인하는 것으로, 기존 RAS 차단제(ACEi, ARB) 중심 등의 치료 전략에서 벗어나, 새로운 기전의 치료 옵션 가능성을 제시할 수 있습니다. - 또한, CU01이 충분한 안전성과 유효성을 입증할 경우, 질병의 조기 개입을 통해 신장 기능의 악화를 지연시키고, 말기 환자들의 투석 의존도를 낮추는 임상적 가치가 클 것으로 기대됩니다. |
| 출처) 당사 제시 |
| [CP01-R01 임상3상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 반려견 CKD(만성 신장질환) 치료제 개발 (혈관내피기능장애 억제제 First-in-class 신약 후보물질) |
| 임상시험 대상국가 | 대한민국 내 32개 기관에서 환견 60두 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | 이번 임상 3상 시험은 반려견을 대상으로 혈관 내피 기능장애 억제제를 이용한 만성 신장질환(Chronic Kidney Disease, CKD) 치료제 후보물질 CP01-R01의 유효성과 안전성을 평가하기 위한 무작위배정·위약대조 방식으로 설계되었습니다. 시험에는 IRIS 기준 2~3단계의 CKD가 진단된 반려견이 포함되며, 대상은 생후 6개월 이상의 개체로 제한됩니다. 선별 기준에는 혈청 크레아티닌 수치와 SDMA 수치를 기반으로 한 IRIS 단계 확인 외에도, 요 비중은 1.035 이하, 단백뇨/크레아티닌 비율(UPCR)은 0.2 초과, 수축기 혈압은 170mmHg 이하라는 조건이 포함됩니다. 시험은 총 12주간 진행되며, 첫 1주간의 스크리닝 기간을 거쳐 0주차에 무작위 배정을 실시한 후 투약을 시작합니다. 투약군은 위약군과 시험약 투여군으로 나뉘며, 각 그룹에는 각각 20마리, 40마리의 반려견이 배정됩니다. 체중 10kg당 1개의 튜브 제형을 사용해 식사 후 15분 이내에 경구 투여하는 방식으로, 위약군에는 위약이, 시험군에는 CP01-R01이 동일한 방식으로 1일 1회, 12주간 반복 투여됩니다. 치료기간 동안에는 0주차, 4주차, 8주차, 12주차에 걸쳐 임상 증상, 체중, 혈압, 혈액 및 혈청 생화학 지표, 전해질, 소변검사 등이 정기적으로 평가되며, 1차 평가 지표로는 크레아티닌 및 SDMA 수치를 포함한 IRIS 지표 개선 여부가 설정되어 있고, 2차 평가 지표로는 전반적인 임상 증상(안전성 포함), 요 비중 및 UPCR의 변화가 포함됩니다. |
| 기대효과 | 본 시험은 CP01-R01이 만성 신장질환 진행을 효과적으로 억제할 수 있는지를 검증하기 위한 핵심 단계에 해당하며, 향후 반려동물 대상 신장질환 치료제 시장에서의 경쟁력 확보와 글로벌 라이선싱 기회를 염두에 두고 진행 중입니다. |
| 출처) 당사 제시 |
각 임상시험에서 1차 평가지표를 충족하지 못하거나, 통계적으로 유의미한 치료 효과를 입증하지 못하거나, 심각한 안전성 문제가 발생할 경우, 해당 파이프라인의 개발이 중단되거나 다음 단계 임상으로의 진입이 불가능해질 수 있으며, 이는 당사의 파이프라인 가치 하락, 주가 하락 등 심각한 부정적 결과를 초래할 수 있습니다. 또한, 임상시험 과정에서 환자 모집 지연, 임상시험수탁기관과의 문제, 임상시험용 의약품 생산 차질 등 다양한 변수로 인해 개발 일정이 지연되고 비용이 증가할 위험이 상존합니다. 임상시험에서 긍정적인 결과를 얻더라도 규제 당국의 품목허가를 받지 못하면 신약을 출시할 수 없으며, 허가를 받더라도 시장 경쟁, 낮은 시장 수용성, 불리한 약가 등으로 상업적 성공을 거두지 못할 위험도 존재합니다.
한편, 당사는 현재 기업공개(IPO) 당시 계획했던 임상시험 및 기술이전 일정이 현재 전반적으로 지연되고 있습니다. 이에 따라 주요 파이프라인의 가시적인 사업화 성과 달성 또한 당초 예상보다 지체되고 있는 상황입니다.
다음은 기업공개 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정입니다.
| [IPO 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정] |
| 주요 파이프라인 |
적응증 | 구분 단계 |
지역 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 상반기 | 하반기(E) | 상반기 | 하반기 | 상반기 | 하반기 | 상반기 | 하반기 | ||||
| CU06 | 당뇨 황반부종 |
임상 단계 |
미주 및 유럽 |
- 임상 1상 진입 (미국) |
- 임상 1상 종료 (미국) |
- 임상 2상 진입 (미국) |
- | - | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - | - | - | - | - | - | - | - 임상 3상 진입 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- | - | - 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (한국) |
|||
| CU01 | 당뇨병성 신증 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 2상 진입 (미국) |
- | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - 임상 2a 종료 (한국) |
- 임상 2b/3상 진입 (한국) |
- | - | - | - 임상 2b/3상 종료 (한국) |
- NDA 제출 (한국) |
- Launch (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미국/유럽) |
- 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
|||
| CU03 | 습성 황반변성 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 1/2a 진입 (미국) |
- | - | - | - 임상 1/2a 종료 (미국) |
| 아시아 | - | - 임상 2a 종료 (한국) |
- 임상 2b/3 진입 (한국) |
- | - | - | - | - 임상 2b/3 종료 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - | - | - 마일스톤 수령 (아시아) |
|||
|
주1) 원/달러 환율은 2021년 6월 8일 기준 최근 1개년(2021년 5월 10일 ~ 2021년 6월 8일) 서울외국환중개 매매기준율 평균인 1,120.87원/USD을 적용하였습니다. 주2) 동사 보유 파이프라인 중 임상 1상 단계 이상의 파이프라인만을 대상으로 매출을 추정하였으며, 전임상 단계의 CU02, CU04, CU05, CU06-MI, CU06-ALI 파이프라인의 경우 매출 추정시 제외하였습니다. |
CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 7월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
이와 같이 모든 적응증을 포괄하는 기술이전 구조는 일부 글로벌 제약사들이 선호하는 방식으로, 현재 관련 파트너링 논의가 보다 진전된 상태입니다. 또한, CU06은 망막질환 적응증의 임상 2a상을 통해 개념입증(Proof of Concept)을 이미 확보하여 개발 단계가 이전보다 진척된 만큼, 당사는 2021년 10월 당시의 계약보다 개선된 조건과 규모의 기술이전 계약 달성을 목표로 하고 있습니다. 다만, 당사가 추진하는 기술이전 계약은 현재 파트너링을 논의하는 초기 단계로 구체적인 계약 조건이나 상대방이 확정된 것은 아니므로, 기술이전의 성공 여부 및 시기 등은 불확실할 수 있다는 점을 투자자께서는 유의하시기 바랍니다.
CU01(당뇨병성 신증 치료제)의 경우 당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
CU03(습성 황반변성 치료제)의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
당사는 신약 개발의 높은 불확실성을 최소화하기 위해 노력하고 있으나, 본질적인 위험 요소는 완전히 제거하기 어렵습니다. 투자자께서는 신약 개발 과정의 본질적인 불확실성과 높은 실패 가능성을 충분히 인지하시고, 각 파이프라인의 진행 상황 및 결과에 따라 당사의 기업가치가 크게 변동될 수 있으며, 투자 원금 손실의 가능성도 있음을 유의하시기 바랍니다.
|
사. 기술이전 및 공동개발 관련 위험 당사의 핵심 파이프라인인 CU06의 글로벌 기술이전 계약이 해지됨에 따라, 향후 사업화 전략의 불확실성이 증대되었으며 기대수익 확보가 불가능하게 되었습니다. 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 CU06 기술이전 계약은 2024년 7월, 파트너사의 내부 개발 전략 변경에 따라 해지되었습니다. 이로 인해 당사는 해당 계약을 통해 기대했던 마일스톤 및 로열티 수익을 확보할 수 없게 되었으며, 새로운 글로벌 파트너사를 찾아야 하는 과제에 직면했습니다. 현재 당사는 CU06 및 관련 파이프라인 전체의 글로벌 권리를 하나의 패키지로 기술이전하는 새로운 전략을 추진하고 있으나, 이는 초기 논의 단계로 계약의 성사 여부, 시기, 조건 등 모든 측면에서 불확실성이 매우 높은 상황입니다. 또한, 기업공개(IPO) 당시 계획했던 주요 파이프라인의 임상시험 및 기술이전 일정이 전반적으로 지연되고 있습니다. CU06의 경우 파트너사와의 협력 및 규제 대응 과정에서, CU01(당뇨병성 신증 치료제)은 대규모 임상 필요성에 따른 개발 전략 수정 및 규제기관의 권고 등으로 인해 당초 계획보다 사업화 일정이 지연되었습니다. 이러한 일정 지연은 가시적인 사업화 성과 도출을 지체시키고 추가적인 비용 발생으로 이어질 수 있으며, 향후 계획 역시 다양한 변수로 인해 추가적으로 지연될 가능성이 존재합니다. 기술이전 및 공동개발 계약은 파트너사의 전략 변화, 개발 중단, 계약 해지 등 본질적인 불확실성과 파트너 의존성에 따른 위험을 내포하고 있습니다. 기술이전 계약의 파트너사는 자체적인 경영 판단, 자금 조달의 어려움, 예상치 못한 임상 결과 등을 이유로 개발을 중단하거나 지연시킬 수 있으며, 이 경우 당사는 마일스톤 및 로열티 수익을 수령하지 못할 수 있습니다. 공동개발 역시 파트너사와의 연구 방향, 비용 분담 등에 대한 의견 차이로 프로젝트 진행에 차질이 발생할 수 있습니다. 당사가 최근 맵틱스와 신규 공동개발 계약을 체결하는 등 외부 협력을 지속하고 있으나, 이러한 파트너 의존적 사업 구조의 본질적인 위험은 여전히 존재합니다. 당사는 계약 조건의 면밀한 검토와 파트너사와의 긴밀한 협력을 통해 이러한 위험을 최소화하고자 하나, 기술이전 및 공동개발과 관련된 불확실성은 여전히 존재하며, 이는 당사의 경영 성과 및 재무 상태에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 기술이전 및 공동개발 계약에 따른 수익 실현의 불확실성과 파트너사의 개발 역량 및 전략 변화에 따른 위험이 당사의 재무적 성과 및 파이프라인 가치에 직접적인 영향을 줄 수 있음을 충분히 고려하시기 바랍니다. |
당사는 자체적인 신약 개발 역량 강화와 더불어 연구개발 성과의 조기 사업화 및 투자 재원 확보, 글로벌 시장 진출 등을 위해 기술이전 및 공동개발을 중요한 사업 전략으로 추진하고 있습니다.
2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06 기술이전 계약은 2024년 07월 12일부로 파트너사의 내부 개발 전략 변경에 따라 해지되었으며, 당사는 해당 물질에 대한 모든 권리를 반환받았습니다. 이 계약 해지로 인해 당사는 해당 파이프라인에 대한 새로운 개발 및 사업화 전략을 모색해야 하는 상황이며, 기존 계약을 통해 기대했던 마일스톤 및 로열티 수익은 확보할 수 없게 되었습니다. 당사는 이미 수령한 계약금 및 연구개발 비용에 대한 반환 의무는 없으며, 권리 반환 후에도 CU06의 임상 2b상 등 후속 개발계획은 진행할 예정입니다.
당사는 현재 기업공개(IPO) 당시 계획했던 임상시험 및 기술이전 일정이 현재 전반적으로 지연되고 있습니다. 이에 따라 주요 파이프라인의 가시적인 사업화 성과 달성 또한 당초 예상보다 지체되고 있는 상황입니다.
다음은 기업공개 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정입니다.
| [IPO 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정] |
| 주요 파이프라인 |
적응증 | 구분 단계 |
지역 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 상반기 | 하반기(E) | 상반기 | 하반기 | 상반기 | 하반기 | 상반기 | 하반기 | ||||
| CU06 | 당뇨 황반부종 |
임상 단계 |
미주 및 유럽 |
- 임상 1상 진입 (미국) |
- 임상 1상 종료 (미국) |
- 임상 2상 진입 (미국) |
- | - | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - | - | - | - | - | - | - | - 임상 3상 진입 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- | - | - 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (한국) |
|||
| CU01 | 당뇨병성 신증 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 2상 진입 (미국) |
- | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - 임상 2a 종료 (한국) |
- 임상 2b/3상 진입 (한국) |
- | - | - | - 임상 2b/3상 종료 (한국) |
- NDA 제출 (한국) |
- Launch (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미국/유럽) |
- 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
|||
| CU03 | 습성 황반변성 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 1/2a 진입 (미국) |
- | - | - | - 임상 1/2a 종료 (미국) |
| 아시아 | - | - 임상 2a 종료 (한국) |
- 임상 2b/3 진입 (한국) |
- | - | - | - | - 임상 2b/3 종료 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - | - | - 마일스톤 수령 (아시아) |
|||
|
주1) 원/달러 환율은 2021년 6월 8일 기준 최근 1개년(2021년 5월 10일 ~ 2021년 6월 8일) 서울외국환중개 매매기준율 평균인 1,120.87원/USD을 적용하였습니다. 주2) 동사 보유 파이프라인 중 임상 1상 단계 이상의 파이프라인만을 대상으로 매출을 추정하였으며, 전임상 단계의 CU02, CU04, CU05, CU06-MI, CU06-ALI 파이프라인의 경우 매출 추정시 제외하였습니다. |
CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 7월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
이와 같이 모든 적응증을 포괄하는 기술이전 구조는 일부 글로벌 제약사들이 선호하는 방식으로, 현재 관련 파트너링 논의가 보다 진전된 상태입니다. 또한, CU06은 망막질환 적응증의 임상 2a상을 통해 개념입증(Proof of Concept)을 이미 확보하여 개발 단계가 이전보다 진척된 만큼, 당사는 2021년 10월 당시의 계약보다 개선된 조건과 규모의 기술이전 계약 달성을 목표로 하고 있습니다. 다만, 당사가 추진하는 기술이전 계약은 현재 파트너링을 논의하는 초기 단계로 구체적인 계약 조건이나 상대방이 확정된 것은 아니므로, 기술이전의 성공 여부 및 시기 등은 불확실할 수 있다는 점을 투자자께서는 유의하시기 바랍니다.
CU01(당뇨병성 신증 치료제)의 경우 당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
CU03(습성 황반변성 치료제)의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
한편, 당사는 2024년 07월 항체 치료제 개발기업 맵틱스와 난치성 혈관질환에 대한 단일 및 다중 항체 치료제 공동 연구개발 계약을 체결하여 8개의 항체 파이프라인(MT 시리즈)을 확보하는 등 지속적으로 외부 협력을 통한 파이프라인 확장을 추진하고 있습니다.
이러한 기술이전 및 공동개발 계약은 다음과 같은 다양한 내재적 위험을 수반합니다. 기술이전의 경우, 파트너사가 자체적인 경영 판단, 전략 수정, 자금 조달의 어려움, 예상치 못한 임상 결과, 규제 환경 변화 등의 이유로 해당 파이프라인의 개발을 중단하거나 지연시킬 수 있습니다. 이 경우 당사는 계약상 예정된 마일스톤 수익을 수령하지 못하거나 수령 시기가 지연될 수 있으며, 최종적으로 상업화에 실패하여 로열티 수익을 얻지 못할 가능성이 있습니다. 마일스톤은 특정 개발 단계의 성공적인 달성을 조건으로 지급되므로, 해당 단계에 도달하지 못하면 수령할 수 없습니다. 신약 개발의 낮은 성공률을 고려할 때, 모든 마일스톤이 계획대로 수취될 것이라고 보장할 수 없습니다. 또한, 상업화에 성공하더라도 실제 매출 규모, 시장 경쟁 상황, 약가 수준 등에 따라 로열티 수익 규모가 기대에 미치지 못할 수 있습니다. 계약 조건에 따라 중도 해지될 위험도 존재하며, 이 경우 권리 회수 및 새로운 파트너 물색에 어려움을 겪을 수 있습니다. 계약 내용 해석 차이 등으로 파트너사와의 분쟁 발생 가능성도 배제할 수 없습니다.
공동개발의 경우, 파트너사와의 연구 방향, 개발 우선순위, 비용 분담, 지적재산권 귀속 등에 대한 의견 차이로 의사결정이 지연되거나 프로젝트 진행에 차질이 발생할 수 있습니다. 예상보다 개발 비용이 증가하거나 특정 파트너사가 자금 조달에 어려움을 겪을 경우 프로젝트 진행에 부담이 될 수 있으며, 공동 소유 지적재산권의 활용 또한 복잡한 협의 과정을 거쳐야 할 수 있습니다. 파트너사의 경영 전략 변경이나 인수합병 등도 공동개발 계약의 지속성에 영향을 미칠 수 있습니다.
당사는 계약 조건의 면밀한 검토와 파트너사와의 긴밀한 협력을 통해 이러한 위험을 최소화하고자 하나, 기술이전 및 공동개발과 관련된 불확실성은 여전히 존재하며, 이는 당사의 경영 성과 및 재무 상태에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 기술이전 및 공동개발 계약에 따른 수익 실현의 불확실성과 파트너사의 개발 역량 및 전략 변화에 따른 위험이 당사의 재무적 성과 및 파이프라인 가치에 직접적인 영향을 줄 수 있음을 충분히 고려하시기 바랍니다.
| 아. 핵심 인력 및 핵심기술 노하우 유출위험 당사는 난치성 혈관질환에 대한 혁신적인 신약을 연구개발하는 바이오 벤처기업으로, 당사가 영위하고 있는 사업은 신규 후보물질 발굴, 원활한 전임상시험 및 임상시험 수행 등을 위한 구체적인 노하우를 보유한 전문인력 등에 대한 인적자원에 의존도가 높습니다. 당사는 우수한 연구인력을 유치하기 위해 지속적으로 인력을 충원 중에 있으며, 해당 인력의 이탈 방지를 위해 9차례의 주식매수선택권을 부여하는 등 우수 인력 유치 및 장기 근속에 대한 동기 부여를 마련해왔습니다. 그럼에도 불구하고, 핵심 연구인력의 예기치 못한 이탈이나 신규 우수 인력 확보의 지연 및 실패는 당사의 연구개발 연속성, 기술 경쟁력, 나아가 장기적인 성장 잠재력에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이러한 인력 관련 위험이 당사의 지속적인 연구개발 역량 및 기업가치에 미칠 수 있는 중대한 영향을 충분히 고려하시기 바랍니다. |
신약 연구개발은 고도의 전문 지식과 오랜 경험을 가진 핵심 연구인력의 역량에 크게 의존하는 지식 집약적 산업입니다.
증권신고서 제출일 현재 당사의 연구개발 조직도는 아래와 같습니다.
| [연구개발 조직 현황] |
 |
|
연구개발 조직 현황 |
| 출처) 당사 제시 |
증권신고서 제출 전일 기준 연구개발인력은 15명으로 구성되어 있습니다. 해당 인력들은 대부분 당사의 연구개발 분야와 긴밀하게 연관된 전공과 경력을 보유하고 있으며, 오랜 기간 바이오 의약품 개발 및 사업화 경험을 지니고 있습니다.
| [연구개발 조직의 주요 업무] |
| 부서명 | 인원수 | 주요업무 및 협력기관 | |
|---|---|---|---|
| CAIT | Central Research Center |
1 | - DS 공정개발 및 생산: 대웅바이오(EU GMP), 유한화학(cGMP) - DP 생산: Patheon(cGMP, USA), 동국제약(KGMP), 제뉴원사이언스(KGMP) - 동물의약품 생산: 이엘티사이언스(KVGMP) - 제형연구: Patheon(USA), Ardena(Belgium), Hovione(Portugal), Jiuzhou(China), Bora Pharmaceutical(Taiwan), 원광대 약학대학 - 지식재산권 관리: 원 국제특허법률사무소, 특허법인 한얼 - 약동력학 시험 및 분석연구: HLB바이오스탭, 큐베스트바이오, 엔딕, 켐온 - 대외 인증 및 관리(연구부분): Brand Insititute, 이노비즈협회 - 후보물질 분석연구 및 MV시험: Koptri, 파마엔텍, 비바젠, 경기바이오센터 - VDR 관리: LegalTech, ShareVault |
| New Drug Research Center |
8 | - 신규 합성의약품 개발에 대한 제반 업무 진행 : 과제 수립, 화합물 설계, 화합물 합성 및 물질의 물리화학적 성질 평가 - 진행 과제 : CU06, CU71 - Vascular dysfunction을 normalization 시킴으로써 각종 혈관 질환에 대한 약물 개발 (DME, 퇴행성 뇌질환, UC 등) - 그 외 항암제, 자가면역질환 등에 대한 치료제 개발 연구 |
|
| Bio Research Center |
6 | - 혈관질환 관련 전임상 후보물질 도출 - 신약 후보물질의 약리 및 약효평가: 연세대학교, 일본의과대학, 나손사이언스, 등 - 작용기전 연구: Eurofins, Macrogen, Promega, 이바이오젠, Indigo 등 |
|
| 합계 | 15 | - | |
| 출처) 당사 정기보고서 |
| [주요 연구개발 인력 현황] |
| 직위 | 성명 | 담당업무 | 주요경력 | 주요연구실적 |
|---|---|---|---|---|
| 이사회의장 | 권영근 | 종합기술원 총괄 |
- State University of New York at Buffalo 생화학 박사 - 한국혈관학회 회장(전) - 한국과학기술한림원 정회원(현) - (주)큐라클 이사회의장('20.04~현재) |
- 신규 혈관 누출 차단제 개발 (기술이전) AMIGO2와 3-포스포이노시티드-의존 키나아제1의결합억제용 데코이 펨타이드 개발 (기술이전) - 허혈성 심혈관질환을 대상으로 한 DKK2 단백질치료제 개발(기술이전) - 국제학술지 SCI 논문 225편, 특허 출원/등록 25건 |
| 사외이사 | 최동훈 |
임상개발 및 중개 연구자문 |
- 연세대학교 의학 박사 - 용인세브란스병원 병원장('19.03~‘22.07) - 연세의료원 심장혈관병원 심장내과 교수(’22.08~현재) - (주)큐라클 사외이사('21.01~현재) |
- 대한 심장학회 학술이사/기초과학연구회 회장 - 한국생체재료학회 분과전문이사 - 한국심장학회 학술이사 - 대한심혈관중재학회 혈관중재시술연구회 회장 - 식품의약품안전청 중앙약사심의위원회 전문위원 - 한국지질동맥화학회 기획위원장 - 대한심장학회 연구이사 - 보건복지부 신의료기술평가위원회 위원 - 식품의약품안전평가원 의약품 심사자문단 - 국제학술지 SCI 논문 478편, 특허 출원/등록 31건 |
| 기타비상무이사 | 추연성 | 해외사업개발 자문 |
- 미국 Univ Illinois at Chicago 약학 박사 - LG생명과학 부사장 및 고문('00~'17) - ㈜TSD라이프사이언스 ㈜진메디신, ㈜스탠다임 고문('18~'22) - (주)스탠다임 대표이사('23~현재) - (주)큐라클 기타비상무이사('20.03~현재) |
- LG생명과학 합성신약(신규 퀴놀론계항균제) 한국 최초 美 FDA 승인 획득 - LG생명과학 바이오의약품(인간성장호르몬) 한국 최초 유럽 EMEA / 美 FDA 승인 획득 - LG생명과학 신약/신제품 (신규 당뇨병치료제, 골관절염치료제, 진통소염제) 출시 - 美 훽스트메리엔루셀 신규 항구토제 美 FDA 승인 획득 |
| 기타비상무이사 | 김영명 | 연구개발자문 |
- 미국 Utah 주립대학교, 이학박사(생화학) - 강원대 우수연구센터장 ('01~ '09) |
- 황반 및 당뇨성 망막질환 치료제 개발 - 임신중독증 진단용 miRNA 발굴 - 암혈관신생치료제 개발 - 암혈관 정상화 치료전략 개발 - 혈관기능 복원용 치료전략 개발 - 국제학술지 SCI 논문 200편 |
| 상무이사/본부장 | 이원일 |
전임상 후보물질 및 합성 공정개발 |
- 서울대학교, 약학박사 - C&C 신약연구소 책임연구원('01~'15) - 젬백스앤카엘 연구개발본부 이사('15~'16) - 제일약품 신약연구부 책임연구원('16~'17) - 대원제약 신약연구부 이사('17~'22) |
- 제2형 당뇨병, 고지혈증 치료제 및 항암제 개발 - 소염진통제, 제2형 당뇨병 치료제의 신규염/공결정을 이용한 개량신약 개발 - GnRH 길항제의 process development 및 임상시험을 위한 API 합성 - 역류성식도염 치료제, 진통제, 항암제 개발 - 펩타이드 백신 및 약물 개발 - 유방암 치료제 개발 - 통풍 치료제 개발 - 아토피 피부염 치료제 개발 - COPD치료제 개발(PDE4 inhibitor) - 당뇨병 치료제 개발(SGLT2 inhibitor) |
| 이사/본부장 | 표정인 | DS/DP 생산 및 품질관리, 조제물 및 생체시료 분석 연구 | - 연세대학교, 이학박사(의약화학) - 한국과학기술연구원(KIST) 연구원('03-06~'14.12) - 삼육대학교 특임교수/비전임('11.09~'14.07) - iNtRON Biotechnology 신약연구 팀장('15.01~'17.07) |
- CMC 총괄: 국내 2a상(2건), 2b상(1건), 미국 1상(1건), 2a상(1건) - 파키슨병 치료제 개발: Pyrazolopyrimidine - Calcium channel blocker 개발: Oxo & thioxoquinaxoline carboxamides - 천연물 유래의 생리활성물질 개발: Xanthorrhizol, Vitamin D3 전합성 - 약물전달 기술개발: nanoparticle(polymeric, liposome), BNCT modulator(Nucleoside, Inositol, Folic acid complex) - Generic drug 개발: 항히스타민제, 과민성 방광증상 치료제, 당뇨병 치료제(DPP-4) - 발효균주를 이용한 빈혈 치료제 개발: eHeme - 산업용 소재개발(효소촉매 고정화 및 반응): 생체 고분자, Carbohydrate - 특허출원 국내외 77건 |
| 출처) 당사 정기보고서 |
제약·바이오 산업 내에서는 우수한 연구인력에 대한 수요가 매우 높아, 경쟁사로의 이직이나 매력적인 조건을 제시하는 해외 기업으로의 이동, 또는 개인적인 창업 등으로 인해 핵심 연구인력이 유출될 가능성이 상존합니다. 핵심 연구인력의 이탈은 현재 진행 중인 연구개발 프로젝트의 연속성을 저해하고, 중요한 기술적 노하우의 손실을 야기하며, 대체 인력 확보 및 교육에 따른 시간과 비용을 추가적으로 발생시켜 신약 개발 일정에 심각한 차질을 초래할 수 있습니다. 특히, 특정 파이프라인이나 핵심 기술에 대한 의존도가 높은 인력이 이탈할 경우 그 부정적인 영향은 더욱 클 수 있습니다.
또한, 신규 파이프라인의 도입, 연구 분야의 확장, 임상시험의 규모 확대 등을 위해서는 지속적으로 우수한 연구인력을 확보해야 합니다. 그러나 국내외적으로 신약 개발 경험이 풍부한 임상 개발 전문가, 규제과학 전문가, 약물감시 전문가, 통계 전문가 등의 공급은 제한적인 반면, 다수의 바이오 기업들이 이러한 인력 확보를 위해 경쟁하고 있어 채용이 쉽지 않은 상황입니다. 당사가 신규 사업 추진이나 연구개발 역량 강화에 필요한 우수 인력을 적시에 충분히 확보하지 못할 경우, 연구개발 계획의 지연 또는 축소, 외부 컨설팅 의존도 증가에 따른 비용 상승 등의 어려움을 겪을 수 있습니다.
더불어, 우수 인력 확보 및 유지를 위한 경쟁이 심화됨에 따라 업계 전반의 인건비 수준이 지속적으로 상승하는 추세입니다. 이는 당사의 연구개발 비용 및 전반적인 운영 비용 증가로 이어져 수익성에 부담을 줄 수 있으며, 특히 아직 안정적인 매출원이 없는 개발 단계 기업에게는 재무적 압박을 가중시킬 수 있습니다.
당사는 핵심 연구인력의 장기근속을 유도하고 우수 인재를 적극적으로 유치하기 위해, 경쟁력 있는 급여 및 성과 기반 인센티브 제도 운영, 주식매수선택권 부여, 도전적이고 자율적인 연구 환경 조성, 국내외 학회 및 교육 프로그램 참여 지원, 수평적이고 개방적인 조직 문화 구축 등 다각적인 노력을 기울이고 있습니다. 또한 당사는 인력의 이탈 방지를 위해 9차례의 주식매수선택권을 부여하는 등 우수 인력 유치 및 장기 근속에 대한 동기 부여를 마련해왔습니다.
| [주식매수선택권 부여 내역] |
| (단위: 주) |
| 부여 회차 |
부여일 | 만기일 | 주식의 종류 |
잔여 부여수량 |
행사가격 | 부여일 공정가치 |
|---|---|---|---|---|---|---|
| 3-1회차 | 2019.06.30 | 2026.07.13 | 보통주 | 20,000 | 3,384 | 4,782 |
| 4회차 | 2020.03.31 | 2027.04.01 | 보통주 | 10,000 | 6,200 | 4,793 |
| 5-1회차 | 2021.01.05 | 2028.01.05 | 보통주 | 20,000 | 7,750 | 11,061 |
| 5-2회차 | 2021.01.05 | 2028.01.05 | 보통주 | 10,000 | 10,720 | 10,669 |
| 6-1회차 | 2021.03.29 | 2028.03.29 | 보통주 | 10,000 | 8,500 | 10,700 |
| 6-2회차 | 2021.03.29 | 2028.03.29 | 보통주 | 4,000 | 10,720 | 10,376 |
| 7회차 | 2022.03.30 | 2029.03.29 | 보통주 | 135,000 | 21,500 | 18,999 |
| 8회차 | 2022.11.16 | 2029.11.15 | 보통주 | 45,000 | 12,700 | 9,985 |
| 9회차 | 2023.03.30 | 2030.03.29 | 보통주 | 30,000 | 11,100 | 7,646 |
| 합계 | 374,000 | - | - | |||
| 주) 주식수 및 행사가격은 2020년 12월 12일 100% 무상증자를 실시함에 따라 주식선택권 부여수량, 행사가격 및 부여일 공정가치가 조정되었습니다. |
그럼에도 불구하고, 핵심 연구인력의 예기치 못한 이탈이나 신규 우수 인력 확보의 지연 및 실패는 당사의 연구개발 연속성, 기술 경쟁력, 나아가 장기적인 성장 잠재력에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이러한 인력 관련 위험이 당사의 지속적인 연구개발 역량 및 기업가치에 미칠 수 있는 중대한 영향을 충분히 고려하시기 바랍니다.
| 자. 지적재산권 관련 위험 신약 개발 산업에서 특허권, 상표권, 영업비밀 등 지적재산권은 기술적 우위를 바탕으로 시장에서의 독점적 또는 배타적 지위를 확보하고, 막대한 투자 비용을 회수하며 지속적인 수익을 창출하는 데 있어 가장 핵심적인 요소 중 하나입니다. 따라서 강력하고 광범위한 지적재산권 포트폴리오를 구축하고 이를 효과적으로 관리 및 방어하는 것은 바이오 기업의 생존과 성장에 필수적입니다. 당사는 이러한 지적재산권 관련 위험을 최소화하기 위해 전담 부서 운영, 외부 전문가와의 협력, 체계적인 특허 포트폴리오 관리, 내부 정보 보안 강화 등 다각적인 노력을 기울이고 있으나, 본질적인 불확실성과 위험은 상존하며, 이러한 위험이 현실화될 경우 당사의 사업 경쟁력, 수익성 및 기업가치에 중대한 부정적 영향을 미칠 수 있습니다. 투자자께서는 지적재산권 확보 및 유지의 어려움, 특허 분쟁 가능성, 기술 유출 위험 등이 당사의 사업에 미칠 수 있는 중대한 영향을 충분히 고려하시고, 당사의 특허 포트폴리오가 충분한 시장 보호를 제공하는지 여부를 신중히 판단하시기 바랍니다. |
신약 개발 산업에서 특허권, 상표권, 영업비밀 등 지적재산권은 기술적 우위를 바탕으로 시장에서의 독점적 또는 배타적 지위를 확보하고, 막대한 투자 비용을 회수하며 지속적인 수익을 창출하는 데 있어 가장 핵심적인 요소 중 하나입니다. 따라서 강력하고 광범위한 지적재산권 포트폴리오를 구축하고 이를 효과적으로 관리 및 방어하는 것은 바이오 기업의 생존과 성장에 필수적입니다.
당사는 핵심 플랫폼 기술인 SOLVADYS® 및 EAGLES®와 더불어 주요 파이프라인 후보물질, 이들 물질의 제조방법, 특정 질환에 대한 치료 용도 등에 대해 한국, 미국, 유럽, 일본, 중국 등 주요 시장을 포함한 다수의 국가에 특허를 출원하여 등록을 받았거나 심사가 진행 중에 있습니다. 현재 당사의 지적재산권 현황은 다음과 같습니다.
| [파이프라인별 지적재산권 현황] |
| CU06 | CU01 |
CU03 (전용실시권) |
CU05 | CU-71 | |||||
|---|---|---|---|---|---|---|---|---|---|
| 등록 | 출원 | 등록 | 출원 | 등록 | 출원 | 등록 | 출원 | 등록 | 출원 |
| 25 | 16 | 9 | 17 | (4) | 2(4) | 2 | 0 | 0 | 1 |
| 출처) 당사 정기보고서 및 당사 제시 |
| [지적재산권 상세내역] |
| 번호 | 구분 | 내용 | 출원인 | 권리자 | 출원 | 등록 | 적용 | 출원국 | 비고 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 특허권 | 신규 혈관누출 차단제 | 연세대 산학협력단 외 1곳 | (주)큐라클 | 2012.04.26 | 2014.11.18 | CU06 |
미국 | 특허 양수도 |
| 2 | 2010.10.29 | 2015.02.27 | 일본 | ||||||
| 3 | 2010.10.29 | 2016.05.04 | 유럽 | ||||||
| 4 | 2010.10.29 | 2015.02.18 | 중국 | ||||||
| 5 | 2010.10.29 | - | PCT | ||||||
| 6 | 특허권 | 신규 혈관누출 차단제 | 연세대 산학협력단 | ㈜큐라클 | 2011.12.29 | 2014.01.10 | 한국 | 특허 양수도 | |
| 7 | 2012.12.28 | 2016.05.31 | 미국 | ||||||
| 8 | 2012.12.28 | - | PCT | ||||||
| 9 | 특허권 | 면역항암 보조제 | 연세대 산학협력단,㈜큐라클 | 연세대 산학협력단,㈜큐라클 | 2020.04.23 | 2022.09.20 | 한국 | 공동 출원 | |
| 10 | 2020.04.23 | - | PCT | ||||||
| 11 | 2021.09.15 | - | 미국 | ||||||
| 12 | 2021.09.07 | - | 유럽 | ||||||
| 13 | 2021.10.28 | 2023.06.14 | 일본 | ||||||
| 14 | 2021.09.27 | 2024.12.10 | 중국 | ||||||
| 15 | 특허권 | 지방간 질환의 예방 또는 치료를 위한 약학적 조성물 | 연세대 산학협력단,㈜큐라클 | 연세대 산학협력단,㈜큐라클 | 2020.07.03 | 2024.08.05 | 한국 | 공동 출원 | |
| 16 | 2021.06.24 | - | PCT | ||||||
| 17 | 특허권 | 신규 혈관누출 차단제의 고수율 제조방법 | ㈜큐라클 | ㈜큐라클 | 2019.12.13 | 2020.06.12 | 한국 | 단독 출원 | |
| 18 | 2020.07.28 | - | PCT | ||||||
| 19 | 2020.11.24 | 2022.09.27 | 미국 | ||||||
| 20 | 2020.11.25 | - | 인도 | ||||||
| 21 | 2020.12.01 | 2023.06.07 | 유럽 | ||||||
| 22 | 2020.12.01 | 2022.08.02 | 일본 | ||||||
| 23 | 2020.12.10 | 2022.08.05 | 중국 | ||||||
| 24 | 특허권 | 혈관 누출 차단제 화합물의 신규 결정형 | ㈜큐라클 | ㈜큐라클 | 2020.05.04 | 2021.02.26 | 한국 | 단독 출원 | |
| 25 | 2020.10.05 | - | PCT | ||||||
| 26 | 2021.04.22 | - | 아르헨티나 | ||||||
| 27 | 2021.07.07 | 2024.10.01 | 미국 | ||||||
| 28 | 2021.07.07 | 2024.12.18 | 유럽 | ||||||
| 29 | 2021.07.05 | - | 인도 | ||||||
| 30 | 2021.07.23 | - | 중국 | ||||||
| 31 | 2021.07.20 | 2023.02.03 | 일본 | ||||||
| 32 | 2021.10.11 | - | 브라질 | ||||||
| 33 | 2021.10.06 | 2023.01.03 | 캐나다 | ||||||
| 34 | 2021.10.29 | 2023.12.07 | 러시아 | ||||||
| 35 | 2021.10.05 | 2022.12.08 | 호주 | ||||||
| 36 | 2021.11.12 | 2024.10.24 | 멕시코 | ||||||
| 37 | 2021.11.15 | 2024.04.16 | 사우디아라비아 | ||||||
| 38 | 2022.04.24 | - | 이스라엘 | ||||||
| 39 | 특허권 | CU06-1004 화합물을 활성 성분으로 함유하는 오일 액상 제제 | ㈜큐라클 | - | 2024.02.02 | - | 한국 | 단독출원 | |
| 40 | 특허권 | 인터루킨-2 면역항암제를 위한 병용제제 | ㈜큐라클 | - | 2023.08.18 | 2024.11.26 | 한국 | 단독출원 | |
| 41 | - | 2023.08.22 | - | PCT | |||||
| 42 | 특허권 | 디메틸푸마레이트를 유효성분으로 포함 하는 신섬유증의 예방 또는 치료용 | 경북대 산학 협력단 외 1곳 | ㈜큐라클 | 2013.02.13 | 2014.03.24 | CU01 | 한국 | 특허 양수도 |
| 43 | 2013.02.20 | - | PCT | ||||||
| 44 | 2013.02.20 | 2017.08.08 | 미국 | ||||||
| 45 | 특허권 | 디메틸푸마르산염을 함유한 장용성정제 조성물 | ㈜큐라클 | ㈜큐라클 | 2020.05.21 | 2020.12.24 | CU01 | 한국 | 단독 출원 |
| 46 | 2020.05.21 | - | PCT | ||||||
| 47 | 2021.09.20 | - | 미국 | ||||||
| 48 | 2024.02.14 | - | |||||||
| 49 | 2021.09.27 | - | 유럽 | ||||||
| 50 | 2021.09.28 | 2023.02.09 | 일본 | ||||||
| 51 | 2021.09.27 | - | 중국 | ||||||
| 52 | 2021.09.22 | - | 인도 | ||||||
| 53 | 2021.10.01 | 2022.08.09 | 캐나다 | ||||||
| 54 | 2021.09.16 | 2022.10.04 | 브라질 | ||||||
| 55 | 2021.10.11 | 2022.10.07 | 멕시코 | ||||||
| 56 | 2021.11.29 | - | 사우디아라비아 | ||||||
| 57 | 2021.10.20 | - | 필리핀 | ||||||
| 58 | 2021.09.23 | - | 태국 | ||||||
| 59 | 2021.09.10 | - | 베트남 | ||||||
| 60 | 2021.12.07 | 2022.10.20 | 호주 | ||||||
| 61 | 2021.12.23 | - | 인도네시아 | ||||||
| 62 | 2021.12.29 | 2023.01.28 | 러시아 | ||||||
| 63 | 특허권 | 모노메틸푸마레이트를 유효성분으로 포함하는 장기 섬유증의 예방 또 는 치료용 약학적 조성물 |
㈜큐라클 | ㈜큐라클 | 2020.11.27 | - | 한국 | 단독 출원 | |
| 64 | 2021.08.25 | - | PCT | ||||||
| 65 | 특허권 | 특정 약동학적 매개변수를 나타내는 디메틸푸마 레이트 를 유효성분으로 함유한 약학적 조성물 | ㈜큐라클 | - | 2021.03.25 | - | 한국 | 단독 출원 | |
| 66 | 2021.03.24 | - | PCT | ||||||
| 67 | 2022.08.10 | - | 미국 | ||||||
| 68 | 특허권 | 천연 혼합 추출물을 유효성분으로 함유 하는 당뇨합병증 및 혈관부종 예방 또는 치료용 약학적 조성물 | 한국한의학 연구원 | 한국한의학 연구원 | 2015.05.21 | 2016.10.27 | CU03 | 한국 | 전용 실시권 |
| 69 | 2015.05.21 | - | PCT | ||||||
| 70 | 2015.05.21 | 2021.12.07 | 미국 | ||||||
| 71 | 2015.05.21 | 2021.01.13 | 유럽 | ||||||
| 72 | 2015.05.21 | - | 중국 | ||||||
| 73 | 2021.05.19 | - | 중국 | ||||||
| 74 | 2023.04.10 | - | 중국 | ||||||
| 75 | 2016.08.26 | 2021.03.24 | 한국 | ||||||
| 76 | 계지 및 목단피 혼합추 출물을 유효성분으로 함유한 정제 및 이의 특정 투여요량에 의한 치료를 위한 조성물 | ㈜큐라클 | - | 2022.12.29 | - | 한국 | 단독 출원 | ||
| 77 | 2022.12.30 | - | PCT | ||||||
| 78 | 특허권 | AMIGO2와 3-포스포이 노시티드- 의존 키나아 제1의 결합 억제용 데코 이펩타이드 | ㈜큐라클 | ㈜큐라클 | 2015.06.29 | 2017.09.21 | CU05 | 한국 | 특허 양수도 |
| 79 | 2016.06.28 | 2018.11.13 | 미국 | ||||||
| 80 | 특허권 | 혈관내피 기능장애 치료제 | ㈜큐라클 | - | 2024.07.05 | - | CU-71 | 한국 | 단독출원 |
| 81 | 상표 특허 | Solvadys | ㈜큐라클 | ㈜큐라클 | 2019.11.04 | 2021.02.08 | CU06 | 한국 | 단독 출원 |
| 82 | 솔바디스 | 2019.11.04 | 2021.02.01 | 한국 | |||||
| 83 | Healvasc | 2019.11.04 | 2021.02.08 | 한국 | |||||
| 84 | 힐바스크 | 2019.11.04 | 2021.02.08 | 한국 | |||||
| 85 | Vesaegis | 2019.11.04 | 2021.02.01 | 한국 | |||||
| 86 | 베세지스 | 2019.11.04 | 2021.02.08 | 한국 | |||||
| 87 | Dnitier | 2022.01.27 | 2023.07.10 | CU01 | 한국 | ||||
| 88 | 디니티어 | 2022.01.27 | 2023.07.10 | 한국 | |||||
| 89 | Qunef | 2022.01.27 | 2023.07.10 | 한국 | |||||
| 90 | 큐네프 | 2022.01.27 | 2023.07.10 | 한국 | |||||
| 91 | CURACLE | 2019.09.11 | 2020.10.21 | 기타 | 한국 | ||||
| 92 | THE CURACLE | 2019.09.11 | 2020.10.21 | 한국 | |||||
| 93 | 큐라클 | 2019.09.11 | 2020.10.21 | 한국 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사가 보유하거나 출원 중인 지적재산권과 관련하여 다음과 같은 다양한 위험에 노출될 수 있습니다.
첫째, 특허 확보 실패 및 권리 범위 축소 위험입니다. 당사가 심혈을 기울여 출원한 특허라 할지라도 각국 특허청의 엄격한 심사 과정에서 등록이 거절될 수 있으며, 등록이 되더라도 최초 출원 시 의도했던 것보다 권리 범위가 축소되어 경쟁사의 유사 기술 개발을 효과적으로 방어하지 못할 수 있습니다. 특히, 신규 타겟이나 작용 기전에 기반한 혁신 신약의 경우, 관련 기술 분야의 특허 심사 기준이 명확하지 않거나 선행 기술과의 경계가 모호하여 특허 확보에 어려움을 겪을 수 있습니다. 특허청의 심사관은 출원된 발명이 기존에 공개된 기술과 비교하여 신규성이 있고, 해당 기술 분야의 통상의 기술자가 용이하게 발명할 수 없는 수준의 진보성을 가져야 특허로 인정합니다. 이 과정에서 심사관의 주관적인 판단이 개입될 여지가 있으며, 당사가 제출한 자료가 충분하지 않거나 경쟁사의 이의제기 등이 있을 경우 특허 등록이 지연되거나 거절될 수 있습니다.
둘째, 특허 무효화 또는 회피 설계 위험입니다. 당사가 보유한 등록 특허에 대해 경쟁사 등 제3자가 특허의 유효성에 이의를 제기하며 무효 심판을 청구할 수 있고, 이로 인해 특허가 무효화될 경우 해당 기술에 대한 독점적 권리를 상실하게 됩니다. 또한, 경쟁사들이 당사의 특허 권리 범위를 분석하여 이를 교묘하게 회피하는 새로운 기술이나 물질을 개발할 경우, 당사의 특허가 실질적인 시장 독점력을 발휘하지 못할 수도 있습니다.
셋째, 특허 침해 소송 위험입니다. 당사가 개발 중이거나 상업화한 제품 또는 기술이 의도치 않게 제3자의 유효한 특허권을 침해했다는 이유로 특허 침해 소송에 휘말릴 수 있으며, 반대로 제3자가 당사의 특허권을 무단으로 침해할 경우에도 이를 방어하기 위한 법적 조치에 상당한 비용과 시간이 소요될 수 있습니다. 특허 소송은 그 결과에 따라 막대한 손해배상, 판매 금지 등 사업에 치명적인 영향을 미칠 수 있습니다.
넷째, 특허권의 지역적 한계 및 존속기간 만료 위험입니다. 특허권은 속지주의 원칙에 따라 특허가 등록된 해당 국가 내에서만 효력이 발생하므로, 글로벌 시장 진출을 위해서는 목표하는 모든 국가에서 개별적으로 특허를 확보해야 하는 부담이 있습니다. 또한, 특허권은 일반적으로 출원일로부터 일정기간의 존속기간이 정해져 있어, 기간 만료 후에는 제네릭 또는 바이오시밀러 의약품의 시장 진입으로 인해 경쟁이 심화되고 수익성이 악화될 수 있습니다.
다섯째, 영업비밀 유출 위험입니다. 특허로 공개되지 않은 당사의 핵심 연구 데이터, 제조 공정 노하우, 사업 전략 등은 영업비밀로서 보호될 수 있으나, 내부자 또는 외부의 불법적인 수단에 의해 유출될 경우 당사의 기술 경쟁력이 심각하게 훼손될 수 있습니다.
당사는 이러한 지적재산권 관련 위험을 최소화하기 위해 전담 부서 운영, 외부 전문가와의 협력, 체계적인 특허 포트폴리오 관리, 내부 정보 보안 강화 등 다각적인 노력을 기울이고 있으나, 본질적인 불확실성과 위험은 상존하며, 이러한 위험이 현실화될 경우 당사의 사업 경쟁력, 수익성 및 기업가치에 중대한 부정적 영향을 미칠 수 있습니다. 투자자께서는 지적재산권 확보 및 유지의 어려움, 특허 분쟁 가능성, 기술 유출 위험 등이 당사의 사업에 미칠 수 있는 중대한 영향을 충분히 고려하시고, 당사의 특허 포트폴리오가 충분한 시장 보호를 제공하는지 여부를 신중히 판단하시기 바랍니다.
| 차. 신규 플랫폼 기술 및 항체 신약 개발 관련 특화 위험 당사는 저분자 화합물 신약 개발 플랫폼인 SOLVADYS® 외에도, 2024년 07월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 인간 항체 라이브러리 기반의 항체 발굴 플랫폼 EAGLES® 및 이를 활용한 다수의 항체 신약 파이프라인을 확보하였습니다. 이는 당사의 연구개발 약물 형태를 확장하고 파이프라인을 다각화하는 긍정적인 측면이 있으나, 동시에 다음과 같은 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화된 위험에 노출될 수 있습니다. 이러한 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화 위험은 당사의 연구개발 전략 및 향후 성장성에 중요한 영향을 미칠 수 있습니다. 당사는 맵틱스와의 긴밀한 협력을 통해 EAGLES® 플랫폼 기술의 잠재력을 극대화하고, 항체 개발 전문 인력 확보 및 육성, 경쟁 기술 동향 분석을 통한 차별화 전략 수립, 효율적인 생산 파트너십 구축 등을 통해 이러한 위험에 대응하고자 합니다. 그러나 항체 신약 개발의 높은 난이도와 불확실성, 그리고 신규 플랫폼 기술의 검증 필요성을 고려할 때, 투자자께서는 관련 위험이 당사의 기술적 성공 가능성 및 시장 경쟁력에 미칠 수 있는 영향을 충분히 인지하시고, 당사의 기술력과 시장 경쟁력 확보 여부를 신중하게 판단하시기 바랍니다. |
당사는 저분자 화합물 신약 개발 플랫폼인 SOLVADYS® 외에도, 2024년 07월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 인간 항체 라이브러리 기반의 항체 발굴 플랫폼 EAGLES® 및 이를 활용한 다수의 항체 신약 파이프라인을 확보하였습니다.
SOLVADYS® 플랫폼
해당 플랫폼은 혈관내피기능장애를 저해하는 효과적인 저분자화합물을 발굴할 수 있는 기술로, 스크리닝부터 기전 및 약효 검증을 종합적으로 수행할 수 있는 5가지 세부 기술로 구성된 당사의 독자적인 신약 개발 플랫폼 기술입니다.
당사는 SOLVADYS® 플랫폼을 활용하여 배양된 사람 혈관내피세포에서 혈관내피기능장애의 세부항목을 순차적으로 스크리닝하여 강력한 혈관내피세포 보호 효과를 보유한 저분자 물질 CU06, CU71 등을 발굴하였습니다. CU06은 망막 질환인 당뇨병성 황반부종, 습성 황반변성 치료제로 개발 중이고, CU71은 퇴행성 뇌질환 치료제로 현재 알츠하이머병을 적응증으로 비임상 시험을 진행 중입니다.
EAGLES®(Exceptional Antibody Generation by Library Engineering and Screening)
해당 플랫폼은 항체 전문기업 맵틱스의 독자적인 항체 발굴 플랫폼입니다. 당사는 맵틱스와 2024년 7월 항체 공동 연구개발 계약을 체결하고, 항체 파이프라인 8종 등에 대한 연구개발을 함께 진행 중입니다. 양사는 공동 연구개발하는 파이프라인에 대한 연구개발 비용을 각 2분의 1씩 부담하며, 향후 기술이전 등 사업화 수익이 발생하는 경우 2분의 1씩 분배하게 됩니다.
맵틱스는 EAGLES® 플랫폼을 통해 Tie2 활성화 항체 및 다양한 파이프라인을 구축해 난치성 혈관질환 신약을 개발하는 기업입니다. 현재까지 EAGLES® 플랫폼을 통해 발굴한 항체 파이프라인은 MT-101, 103, 201, 202 등 총 8종입니다.
| 구분 | MT-101 | MT-102 | MT-103 | MT-104 | MT-105 | MT-201 | MT-202 | MT-40X |
|---|---|---|---|---|---|---|---|---|
| 계약상대방 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 |
| 계약내용 | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) |
| 계약체결일 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 |
| 계약종료일 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 |
| 총 계약금액 | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) |
| 지급금액 | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) |
| 계약목적 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 |
| 적응증 | 급성 신손상, 만성신부전 | 습성 황반변성, 당뇨병성 황반부종, 당뇨 망막병증 | 중증하지허혈 | 고형암 | 염증성 장질환 | 염증성 혈전질환 | 급성 허혈성 뇌졸증 | 고형암 |
| 개발 진행경과 | 전임상 진행 중 | 전임상 진행 중 | 전임상 진행 중 | 후보물질 도출단계 | 선도물질 도출단계 | 후보물질 도출단계 | 후보물질 도출단계 | 유효물질 도출단계 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 대상 물질에 대한 연구개발비용과 수익금은 약정비율로 부담 및 배분합니다. |
| 주2) 양사 합의 의해 계약 규모는 미공개 처리하였습니다. |
이는 당사의 연구개발 약물 형태를 확장하고 파이프라인을 다각화하는 긍정적인 측면이 있으나, 동시에 다음과 같은 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화된 위험에 노출될 수 있습니다.
첫째, 신규 플랫폼 기술 검증의 불확실성입니다. EAGLES®와 같은 새로운 항체 발굴 플랫폼 기술이 실제 신약 개발 과정에서 기대만큼의 효율성, 생산성, 또는 성공률을 보이지 못할 수 있습니다. 플랫폼 기술의 유효성은 다수의 성공적인 후보물질 도출 및 임상 개발 성공 사례를 통해 입증되는데, 아직 초기 단계인 만큼 그 잠재력을 완전히 평가하기에는 시간이 필요합니다.
둘째, 항체 신약 개발의 고유한 기술적 난이도 및 높은 실패율입니다. 항체 의약품은 저분자 화합물 의약품과는 다른 특성을 가지며, 개발 과정에서 세포주 개발 및 안정적인 항체 생산 세포주 확립, 대규모 배양 및 정제 공정 개발, 면역원성 평가 및 최소화 전략, 약동학적 특성 및 약력학적 특성 최적화 등 다양한 기술적 허들이 존재합니다. 이러한 과정에서의 실패는 시간과 비용의 막대한 손실로 이어질 수 있습니다.
셋째, 항체 신약 시장의 치열한 경쟁 환경입니다. 이미 많은 글로벌 대형 제약사 및 바이오 기업들이 항체 신약 개발에 막대한 투자를 하고 있으며, 특정 질환 타겟에 대해서는 다수의 경쟁 항체들이 개발 중이거나 시판되어 있습니다. 또한, 항체-약물 접합체, 이중특이항체, 삼중특이항체, 키메라 항원 수용체 T세포와 같은 세포 치료제 등 차세대 항체 기반 기술 경쟁이 매우 치열하여, 당사의 항체 파이프라인이 경쟁 우위를 확보하고 시장에 성공적으로 진입하기 위해서는 혁신성과 차별성을 입증해야 합니다.
넷째, 항체 의약품 생산 시설 확보 및 높은 생산 비용입니다. 항체 의약품은 일반적으로 미생물 또는 동물 세포 배양을 통해 생산되므로, 복잡한 생산 공정과 대규모 설비 투자가 필요합니다. 당사가 자체 생산 시설을 보유하지 않을 경우, 위탁생산기관 또는 위탁개발생산기관에 생산을 위탁해야 하며, 이 경우 위탁 생산 비용이 높고 안정적인 생산 파트너 확보가 중요합니다. 생산 수율 문제나 품질 관리 실패는 막대한 비용 손실과 개발 지연을 초래할 수 있습니다.
이러한 신규 플랫폼 기술 및 항체 신약 개발과 관련된 특화 위험은 당사의 연구개발 전략 및 향후 성장성에 중요한 영향을 미칠 수 있습니다. 당사는 맵틱스와의 긴밀한 협력을 통해 EAGLES® 플랫폼 기술의 잠재력을 극대화하고, 항체 개발 전문 인력 확보 및 육성, 경쟁 기술 동향 분석을 통한 차별화 전략 수립, 효율적인 생산 파트너십 구축 등을 통해 이러한 위험에 대응하고자 합니다. 그러나 항체 신약 개발의 높은 난이도와 불확실성, 그리고 신규 플랫폼 기술의 검증 필요성을 고려할 때, 투자자께서는 관련 위험이 당사의 기술적 성공 가능성 및 시장 경쟁력에 미칠 수 있는 영향을 충분히 인지하시고, 당사의 기술력과 시장 경쟁력 확보 여부를 신중하게 판단하시기 바랍니다.
2. 회사위험
| 【투자자 유의사항】 |
|---|
| ○ 회사위험에는 당사의 주요 재무적 위험요소들이 기재되어 있습니다. 투자자 여러분들의 이해 편의를 위하여, 당사의 최근 3개년간 주요 재무사항 총괄표를 아래와 같이 요약 기재하였으니, 투자 판단에 참고하시기 바랍니다. ○ 본 증권신고서에 기재된 2022년, 2023년, 2024년 재무정보는 외부감사인의 감사를 받은 재무제표를 사용하였습니다. 투자자께서는 참고하여 투자에 임하시기 바랍니다. ○ 본 증권신고서에 기재된 2024년 1분기, 2025년 1분기 재무정보는 외부감사인의 감사를 받지 않은 재무제표를 사용하였으니 투자자께서는 참고하여 투자에 임하시기 바랍니다. ○ 투자자께서는 투자위험요소 각 항목을 꼼꼼하게 확인하시고 투자에 임하시길 바랍니다. |
| [주요재무사항 총괄표] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구 분 | 2025년 1분기 | 2024년 1분기 | 2024년 | 2023년 | 2022년 | 비 고 | |
|---|---|---|---|---|---|---|---|
| 외부감사인 | 삼정회계법인 | 삼정회계법인 | 삼정회계법인 | 삼정회계법인 | 삼정회계법인 | - | |
| 감사의견 | - | - | 적정 | 적정 | 적정 | - | |
| (계속기업 불확실성 관련 의견표명) | - | - | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 | - | |
| 1. 자산총계 | 55,835 | 66,279 | 59,288 | 69,782 | 55,657 | - | |
| 유동자산 | 29,097 | 41,205 | 32,417 | 44,473 | 33,407 | - | |
| 비유동자산 | 26,739 | 25,075 | 26,871 | 25,309 | 22,251 | - | |
| 2. 부채총계 | 29,260 | 26,912 | 29,335 | 27,919 | 9,487 | - | |
| 유동부채 | 28,828 | 8,729 | 20,986 | 10,197 | 1,371 | - | |
| 비유동부채 | 432 | 18,183 | 8,349 | 17,722 | 8,116 | - | |
| 3. 자본총계 | 26,575 | 39,367 | 29,953 | 41,863 | 46,171 | - | |
| 자본금 | 6,984 | 6,928 | 6,937 | 6,928 | 6,923 | - | |
| 자본잉여금 | 102,420 | 101,360 | 101,554 | 101,360 | 101,263 | ||
| 기타포괄손익누계액 | 2,370 | 0 | 2,370 | 0 | 0 | - | |
| 기타자본구성요소 | 10,175 | 10,188 | 10,340 | 9,787 | 2,597 | ||
| 이익잉여금(결손금) | (95,374) | (79,108) | (91,248) | (76,211) | (64,613) | - | |
| 4. 부채비율(%) | 110.10% | 68.36% | 97.94% | 66.69% | 20.55% | 부채총계 ÷ 자본총계 | |
| 5. 유동비율(%) | 100.93% | 472.03% | 154.47% | 436.16% | 2,437.23% | 유동자산 ÷ 유동부채 | |
| 6. 총차입금 | 27,300 | 28,000 | 28,000 | 28,000 | 8,000 | 유동성 차입금 + 비유동성 차입금 | |
| 유동성 차입금 | 27,300 | 8,000 | 20,000 | 8,000 | 0 | - | |
| 비유동성 차입금 | 0 | 20,000 | 8,000 | 20,000 | 8,000 | - | |
| - 총차입금 의존도(%) | 48.89% | 42.25% | 47.23% | 40.12% | 14.37% | 총차입금 ÷ 자산총계 | |
| - 유동성 차입금 비중(%) | 100.00% | 28.57% | 71.43% | 28.57% | 0.00% | 유동성 차입금 ÷ 총차입금 | |
| 7. 영업활동 현금흐름 | (3,058) | (9,508) | (9,508) | (9,393) | (11,237) | - | |
| - 영업활동현금흐름 총부채 비율(%) | -10.45% | -35.33% | -32.41% | -33.64% | -118.45% | 영업활동현금흐름 ÷ 부채총계 | |
| 8. 투자활동 현금흐름 | (25,022) | (50,576) | (50,576) | (65,200) | (48,915) | - | |
| 9. 재무활동 현금흐름 | (15) | 59 | 59 | 19,804 | 662 | - | |
| 10. 현금성자산 | 27,246 | 39,811 | 10,290 | 35,442 | 28,511 | 현금및현금성자산 + 단기금융상품 | |
| 11. 순차입금 | 54 | (11811) | (2346) | (12841) | (20511) | 총차입금 - 현금 및 현금성자산 | |
| - 순차입금 의존도(%) | 0.10% | -17.82% | -3.96% | -18.40% | -36.85% | 순차입금 ÷ 자산총계 | |
| 12. 영업수익 | 0 | 500 | 1,633 | 10,294 | 3,583 | - | |
| 13. 영업비용 | 3,649 | 3,556 | 14,267 | 20,803 | 15,565 | - | |
| - 영업비용율(%) | -% | 711.30% | 873.92% | 202.08% | 434.43% | 매출원가 ÷ 매출액 | |
| 14. 영업이익(손실) | (3,649) | (3,056) | (12,635) | (10,508) | (11,982) | - | |
| - 영업이익률(%) | -% | -611.30% | -773.92% | -102.08% | -334.43% | 영업이익 ÷ 매출액 | |
| 15. 기타수익 | 0 | 14 | 42 | 24 | 34 | - | |
| 16. 기타비용 | 0 | 6 | 160 | 3 | 85 | - | |
| 17. 금융수익 | 218 | 755 | 2,238 | 1,701 | 1,098 | - | |
| 18. 금융비용 | 692 | 602 | 4,371 | 2,800 | 471 | - | |
| 이자비용 | 653 | 586 | 2,455 | 1,347 | 300 | - | |
| - 이자보상배수(배) | (5.58) | (5.21) | (5.15) | (7.80) | (39.95) | 영업이익 ÷ 이자비용 | |
| 20. 법인세비용차감전계속사업이익(손실) | (4,123) | (2,895) | (14,886) | (11,586) | (11,406) | - | |
| 21. 당기순이익(손실) | (4,126) | (2,897) | (14,886) | (11,586) | (11,406) | - | |
| - 당기순이익률(%) | -% | -579.60% | -911.85% | -112.54% | -318.34% | 당기순이익 ÷ 매출액 | |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주) 차입금 총계는 기발행 전환사채의 미상환잔액(권면금액기준) 및 은행 차입금의 합입니다. |
| 가. 관리종목 지정 및 상장폐지 관련 위험 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 당사는 매출액 및 법인세비용차감전계속사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 향후 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있으며, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다. 당사는 기술성장특례 요건을 통해 코스닥시장에 2021년 07월 상장하였으며, 관리종목 지정 요건 중 재무 관련 사항 중 매출액 요건은 2025년까지 유예, 법인세비용차감전 세전손실 요건은 2024년부터 유예기간이 종료된 상태입니다. 당사는 증권신고서 제출일 전일 기준 코스닥시장 상장규정 상 관리종목 지정 및 상장폐지요건에 해당하는 경우는 없습니다. 하지만 당사는 최근 3개년동안 매출 성장이 둔화되고 있으며 수익성도 악화되는 추세입니다. 이와 같은 추세가 향후 지속될 경우 당사는 관리종목 지정 사유뿐만 아니라 형식적 상장폐지 사유에 해당될 수 있습니다. 추가적으로, 최근 한국증시 발전 및 부실기업 퇴출을 위해 금융위원회, 금융감독원, 한국거래소 등에서 상장폐지제도 개선 움직임이 진행되고 있습니다. 이에 따라 향후 상장폐지 요건이 현재보다 강화될 예정이며 향후 적자 상태가 지속될 경우 관리종목 및 상장폐지 요건을 충족시킬 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 당사는 매출액 및 법인세비용차감전계속사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 향후 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있으며, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다.
당사는 기술성장특례 요건을 통해 코스닥시장에 2021년 07월 상장하였으며, 하기 규정에 따라 관리종목 지정 요건 중 재무 관련 사항 중 매출액 요건은 2025년까지 유예, 법인세비용차감전 세전손실 요건은 2024년부터 유예기간이 종료된 상태입니다. 주요 요건별로, 관리종목 지정 가능성을 살펴보면 다음과 같습니다.
| [코스닥시장 관리종목 지정요건 및 해당여부 검토] |
| 구 분 | 관리종목 지정(코스닥 상장규정 제53조) | 관리종목지정유예 | 관리종목 지정요건 적용여부 |
회사현황 | ||
|---|---|---|---|---|---|---|
| 해당여부 | 유예기간 | 사업연도 | 금액(백만원) / 비율(%) / 내용 | |||
| (1) 매출액 미달 | 최근 사업연도 30억원 미만 (지주회사는 연결기준) - 이익미실현기업 또는 기술성장기업은 상장후 5년간 미적용 - 기술성장기업 중 A), B), C) 중 어느 하나에 해당하는 제약·바이오기업은 최근 사업연도 미적용 A) 최근 사업연도 말「제약산업 육성 및 지원에 관한 특별법」에 따른 혁신제약기업이 세칙으로 정한 요건을 충족하는 경우 B) 최근 사업연도의 일평균 시가총액 4,000억 이상이며, 그 금액이 현재의 자본금을 초과하는 기업이 세칙으로 정하는 요건을 충족하는 경우 C) 최근 3사엽언도의 매출액 합계 90억 이상이며, 최근 사업연도의 직전 사업연도의 매출액이 30억 이상인 경우 |
해당 후 종료 |
2025년까지 유예 |
2026년부터 최근 사업연도 매출액 30억원 미만시 해당 |
2024년 | 1,633백만원 |
| (2) 법인세비용차감전 계속사업손실 |
최근 3사업연도중 2사업연도에 각각 10억원 이상이면서 해당 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 (다만, 상장일부터 상장일이 속한 사업연도의 말일까지의 기간이 3개월 미만인 경우에는 상장일이 속하는 사업연도와 그 이후 5개 사업연도로 한다) - 기술성장기업은 상장후 3년간 미적용(다만, 상장일부터 상장일이 속한 사업연도의 말일까지의 기간이 3개월 미만인 경우에는 상장일이 속하는 사업연도와 그 이후 3개 사업연도로 한다) |
해당 후 종료 |
2021년부터 3사업연도 적용 |
2024년부터 3사업연도 중 2사업연도에 법인세비용차감전계속사업손실이 각 사업연도말 자기자본의 50% 초과시 해당 |
2022년 2023년 2024년 |
11,405백만원 손실 / 24.7% 11,586백만원 손실 / 27.7% 14,886백만원 손실 / 49.7% |
| (3) 자본잠식 등 | 최근 사업연도말 현재 자본잠식률이 100분의 50 이상인 경우 | - | - | 최근 사업연도말 자본잠식률이 100분의 50 이상일 경우 해당 |
2024년말 | 자본금 : 6,937백만원 자본총계 : 29,953백만원 자본잠식률 : - |
| (4)자기자본 미달 | 최근 사업연도말 현재 자기자본이 10억원 미만인 경우 | - | - | 최근 사업연도말 자기자본이 10억원 미만일 경우 해당 | 2024년말 | 자본총계 : 29,953백만원 |
| (5) 시가총액 미달 | 보통주 시가총액 40억원미만 30일간 지속 - 천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
- | - | 현재 미해당 | 현재 기준 | 현재 충족 |
| (6) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 | - | - | 현재 미해당 | 현재 기준 | 현재 특이사항 없음 |
| (7) 지배구조 미달 | 최근 사업연도 사업보고서상 A)사외이사의 수가 「상법」 제542조의8의 규정에서 정하는 수에 미달하는 경우 B) 「상법」 제542조의11의 규정에서 정하는 감사위원회를 구성하지 않거나 감사위원회의 구성요건을 충족하지 못하는 경우 *「상법」 제542조의8에 의거 자산총액 1,000억원 미만의 코스닥 상장 벤처기업은 사외이사 선임 의무 면제 **「상법」 제542조의11에 의거 자산총액 2조원 미만의 상장회사는 감사위원회 설치 의무 면제 |
- | - | 현재 미해당 | 2024년말 | 사외이사 선임 의무 면제 (자산총액 : 59,288백만원) |
| (8) 거래량 미달 | 분기월평균거래량이 유동주식수의 1%에 미달. 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다. - 신규상장법인(신규상장일이 속하는 분기에 한정) - 분기의 월평균거래량 1만주 이상(액면가액 5,000원 기준) - 「코스닥시장 업무규정」(이하 “업무규정”이라 한다) 제12조의3제1항에 따른 유동성공급계약이 체결된 경우 - 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. |
- | - | 현재 미해당 | 2024년말 | 소액주주 지분율 73.22% 30,242명 |
| (9) 주식분산 미달 | 소액주주 200인미만 or 소액주주지분 20%미만 - 300인이상의 소액주주가 유동주식수의 10%이상으로서 100만주이상을 소유, 해외증권시장에 상장된 경우는 적용배제 |
- | - | 현재 미해당 | 2024년말 | 소액주주 지분율 73.22% 30,242명 |
| (10) 회생절차 개시신청 | "채무자 회생 및 파산에 관한 법률" 제34조에 의한 회생 절차개시 신청이 있는 경우 | - | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| (11) 파산신청 | 코스닥시장 상장법인에 대하여 "채무자 회생 및 파산에 관한 법률" 제294조에 의한 파산신청이 있는 경우 | - | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| (12) 기타 | - 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 - 변경·추가상장이 유예된 기간 중에「증권의 발행 및 공시 등에 관한 규정」에 따른 재무관리기준을 위반한 경우 |
- | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| 출처) 당사 사업보고서 |
| 주) 2022년~2024년 별도 재무제표 기준입니다.(연결 종속회사 없음) |
① 매출액 미달 여부 검토
| [관리종목 지정 관련 주요 재무사항 검토] | |
| (별도기준) | (단위 : 백만원) |
| 구분 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|
| 매출액 (별도) | 1,633 | 10,294 | 3,583 |
| 출처) 당사 제시 |
「코스닥시장 상장규정」 제53조제1항제1호에 따라 최근 사업연도의 매출액이 30억 미만일 경우 관리종목으로 지정되게 됩니다. 당사의 2024년 매출액은 약 16억원으로 30억원을 초과하지 못하며 관리종목 지정 요건에 해당됩니다. 당사는 2021년 07월 기술특례로 코스닥 시장에 상장한 이후 2025년까지 유예됩니다. 따라서, 당사는 2024년 매출액 약 16억원임에도 불구하고 관리종목으로 지정되지 않았으며, 2025년까지 관리종목지정 유예입니다. 2026년부터는 매출액 요건인 30억원 이상 달성해야만, 관리종목에 지정되지 않습니다.
당사는 2025년 03월 06일자로 원료의약품(API) 개발 및 유통 전문기업인 주식회사 대성팜텍을 흡수합병하기로 결정하였으며, 합병 기일은 2026년 01월 28일로 지정되어 흡수합병을 진행할 예정입니다. (주)대성팜텍의 경우, 2025년 1분기 기준 매출액은 11.1억원, 영업이익 0.34억원을 기록하였습니다. 그럼에도 불구하고, 전방산업 악화, 대내외적 요인 등 매출 부진으로 30억원의 매출을 달성하지 못한다면 2026년 관리종목으로 지정될 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
한편, 2025년 01월 21일 금융위원회와 금융감독원, 한국거래소, 금융투자협회, 자본시장연구원은 'IPO 및 상장폐지 제도 개선 방안'을 발표하면서 시가총액 및 매출 관련 상장폐지 요건을 강화하였으며, 상장폐지 절차 또한 효율적으로 개정하였습니다. 시가총액 요건은 2026년 150억원, 2027년 200억원, 2028년 300억원으로 높아집니다. 매출 요건의 경우 시가총액 대비 적응 기간이 더 필요하다는 점에서 시행일을 1년씩 늦췄습니다. 상장 유지를 위한 매출 요건은 2027년 50억원, 2028년 75억원, 2029년 100억원으로 강화되었습니다. 대신 성장 잠재력은 높지만 매출이 낮은 기업을 고려, 코스닥 상장기업 기준 최소 시가총액 600억원을 충족하면 매출 요건을 면제하는 완충 장치도 도입됩니다. 증권신고서 제출 전일 기준, 당사의 시가총액 600억원 이상으로 해당 사항은 없을 것으로 판단됩니다.
다만, 향후 전방산업인 원료의약품 시장의 성장 둔화 지속 및 당사의 시장 점유율 감소 등의 이유로 현재 수준보다 매출이 큰 폭으로 감소되어 매출액(별도 기준) 30억원을 유지하지 못하거나 시가총액이 600억원 미만으로 떨어질 경우 금융당국의 상장폐지 요건 강화 정책에 의해 2027년 이후 상장폐지 사유에 해당될 수 있습니다. 이에 투자자 여러분께서는 당사의 매출 성장 정체 및 제도 변화에 따른 상장폐지 위험성을 충분히 고려해 주시기 바랍니다.
② 법인세비용차감전계속사업손실 발생 여부 검토
| [관리종목 지정 관련 주요 재무사항 검토] | |
| (별도 기준) | (단위 : 백만원, %) |
| 구분 | 2027년 | 2026년 | 2025년 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|---|---|
| 법인세비용차감전순손실 (별도) |
12,626 | 12,626 | 12,626 | 14,886 | 11,586 | 11406 |
| 자기자본 (별도) | 10,953 | 23,579 | 36,205 | 29,953 | 41,863 | 46,171 |
| 법인세비용차감전순손실/자기자본 (별도) | 115.3% | 53.5% | 34.9% | 49.7% | 27.7% | 24.7% |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 유상증자 납입 후 법인세비용차감전계속사업손실률 시뮬레이션은 2024년 재무제표에서 금번 유상증자 납입금(예정발행가액 기준)을 자본총계에 단순 합산한 수치이며 향후 예상되는 결손금은 2022년, 2023년, 2024년 평균 당기순손실로 가정하였습니다. |
| 주2) 향후 예상되는 법인세비용차감전순손실은 2022년, 2023년, 2024년 평균치를 가정하였습니다. |
| 주3) 2021년 07월 기술성장특례에 따라 2023년을 끝으로 관리종목지정 유예는 종료되었습니다. |
「코스닥시장 상장규정」 제53조제1항제2호에 따라 최근 3사업연도 중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근 사업연도에 법인세비용차감전계속사업손실이 있는 경우 관리종목으로 지정되게 됩니다.
당사는 2024년말 기준 법인세비용차감전계속사업손실률 49.7%로 관리종목지정 요건에 해당되지 않지만, 50%에 매우 근접해 있기 때문에 추가 자본 확충이 없다면 2025년부터 50%를 초과할 가능성이 매우 높습니다. 그렇기 때문에 금번 공모 유상증자를 통해 자본을 확충한다면 법인세비용차감전계속산업손실에 따른 관리종목지정 리스크는 일부 해소될 것으로 예상됩니다.
다만, 사업성 및 재무구조 등이 개선되지 않고 당사의 향후 법인세차감전순손실이 2022년, 2023년, 2024년 평균 수준으로 지속되어 2026년, 2027년 법인세비용차감전계속사업손실률이 50%이상을 기록한다면 최근 3사업연도 중 2회 이상에 해당되어 관리종목으로 지정될 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
③ 자본잠식 여부 검토
| [자본잠식 여부 검토] | |
| (단위 : 백만원) | |
| 구분 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|
| 자기자본 | 29,953 | 41,863 | 46,171 |
| 자본금 | 6,397 | 6,928 | 6,923 |
| 자본잠식률 | 미해당 | 미해당 | 미해당 |
| 출처) 당사 정기보고서 및 당사 제시 |
코스닥시장 상장규정 제53조 1항 4호에 따라 최근 사업연도 말을 기준으로 자본잠식률 50%이상인 경우 관리종목으로 지정됩니다. 당사는 2024년말 현재 자본금 6,397백만원, 자기자본 29,953백만원으로 자본잠식 상태에 이르지는 않았으며, 본 유상증자 후에는 자본금 대비 자기자본 확대가 다시 한번 이루어지므로 2025년 중 자본잠식에 의한 관리종목 지정 위험은 대응 가능할 것으로 판단하고 있습니다. 단, 대규모 손실 발생시에는 자기자본이 크게 감액될 수 있으므로 자본잠식 여부에 대해서도 투자자 여러분들께서는 당사 재무 추이에 대해 실시간 주시해주셔야 합니다.
④ 시가총액 미달여부 검토
| [최근 2년간 시가총액 추이] | |
| (단위 : 역원, %) | |
| 구분 | 일자 | 금액 |
|---|---|---|
| 시가총액(최고) | 2024.04.08 | 2,826 |
| 시가총액(최저) | 2025.05.19 | 610 |
| 출처: 한국거래소 정보데이터 시스템 |
또한, 최근 3년간의 당사의 시가총액은 최고 2,826억원(주가 20,400원)에서 최저 610억원(주가 4,355원)까지 변동하였으며, 공시서류 제출일 현재 약 610~2,826억원 수준을 기록하고 있습니다. 이처럼 상장 당시 업황 호조에 따른 기대와 달리 업황 성장 둔화, 기술 수요 변동성, 글로벌 반도체 수급 불균형 등으로 매출 성장성이 정체되고 수익성 또한 악화되면서 당사의 시가총액은 지속적으로 하락하고 있습니다.
「코스닥시장 상장규정」제53조제1항제5호에 따라 보통주 시가총액 40억원 미만 30일간 지속되는 경우 관리종목으로 지정됩니다.
증권신고서 제출일 전일 기준 최근 3개년 동안 당사의 시가총액은 최고 2,826억원, 최저 710억원으로 시가총액 40억원 미만을 기록한 바가 없어 관리종목 지정요건에 해당하지 않습니다.
⑤ 정기보고서 미제출 여부 검토
「코스닥시장 상장규정」제53조제1항제6호에 따라 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 관리종목으로 지정됩니다.
당사는 2023년 사업보고서, 2024년 1분기보고서, 2024년 반기보고서, 2024년 3분기보고서, 2024년 사업보고서, 2025년 1분기보고서를 법정제출기한 내에 제출한 바 관리종목 지정요건에 해당하지 않습니다.
⑥ 지배구조 미달 여부 검토
「코스닥시장 상장규정」제53조제1항제7호에 따라 최근 사업연도 사업보고서상 A)사외이사의 수가 법에서 정하는 수에 미달 B) 법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 관리종목으로 지정됩니다.
당사는 벤처기업에 해당하며 「상법 시행령」 제34조제1항1호에 따라 자산총액이 1천억원 미만으로 「상법」 제542조의8제1항에 따라 이사 총수의 4분의 1 이상을 사외이사로 할 의무가 없으나, 당사는 2명의 사내이사 및 1명의 사외이사를 두고 있어 향후 자산총액이 1천억원을 초과하더라도 해당 법규를 준수하고 있습니다.
또한, 당사는 「상법」 제542조의11제1항 감사위원회 설치 규정 적용 대상인 자산총액 2조원 이상의 기업에 해당하지 않습니다.
⑦ 거래량 미달 여부 검토
「코스닥시장 상장규정」 제53조제1항제8호에 따라 분기월평균거래량이 유동주식수의 1%에 미달하는 경우 관리종목으로 지정됩니다.
| [관리종목 지정 관련 주요 거래량 검토] | |
| (단위 : 주, %) | |
| 구분 | 2025년 1분기 |
|---|---|
| 월평균 거래량 | 156,927 |
| 분기말 유동주식수 | 14,009,155 |
| 비율 (주1) | 1.12% |
| 출처) 한국거래소 정보데이터시스템, Dart 전자공시시스템 |
| 주) 비율 = 분기월평균거래량 / 유동주식수 |
당사는 2025년 1분기 월평균거래량이 156,927주로 유동주식수의 1.12%에 해당하며 월간 거래량 1만주, 소액주주 300인 이상이 20% 이상 지분 보유하고 있으므로 거래량 미달에 의한 관리종목 지정요건에 해당하지 않습니다.
⑧ 주식분산 미달 여부 검토
「코스닥시장 상장규정」제53조제1항제9호에 따라 최근 사업연도말 소액주주가 200인 미만이거나 소액주주지분이 20% 미만일 경우 관리종목으로 지정됩니다.
당사의 최근사업연도말(2024년) 소액주주수는 30,242인, 소액주주지분율은 73.22%로 주식분산 미달에 의한 관리종목 지정요건에 해당하지 않습니다.
⑨ 상장폐지 요건 강화
한편, 2025년 01월 21일 금융위원회와 금융감독원, 한국거래소, 금융투자협회, 자본시장연구원은 'IPO 및 상장폐지 제도 개선 방안'을 발표하면서 시가총액 및 매출 관련 상장폐지 요건을 강화하였으며, 상장폐지 절차 또한 효율적으로 개정하였습니다. 기업가치 기반 투자를 활성화하고 부실 기업 퇴출을 유도해 국내 주식 시장의 질적 성장을 도모하겠다는게 제도 개선안의 목표입니다.
현행 제도의 문제점으로는 기업 회생기회 부여, 투자자 보호에 초점을 둔 제도운영으로 저성과 기업의 적절한 퇴출이 지연되고 있다는 평가 등이 거론되고 있으며, 상장회사의 수 증가율은 높지만, 이에 비해 주가의 상승률은 높지 않아 주요국 대비 '상장기업수 대비 시가총액' 수치 또한 저조한 수준을 보이고 있다고 지적하였습니다.
이러한 문제를 해결하기 위한 방안으로 저성과기업의 적시 적절한 퇴출을 통한 증시 전반의 밸류업에 기여하기 위해, 상장폐지 요건은 강화하고 그 절차는 효율화 할 수 있는 세부적인 개선안이 논의되었습니다.
금융당국은 상장폐지 정량적 요건인 시가총액과 매출 기준을 실효성 있는 수준으로 강화하기로 했습니다. 연착륙을 위해 최종 목표치까지 3단계, 3년에 걸쳐 상장 유지 기준을 단계적으로 상향하기로 했습니다.
시가총액 요건은 2026년 150억원, 2027년 200억원, 2028년 300억원으로 높아집니다. 매출 요건의 경우 시가총액 대비 적응 기간이 더 필요하다는 점에서 시행일을 1년씩 늦췄습니다. 상장 유지를 위한 매출 요건은 2027년 50억원, 2028년 75억원, 2029년 100억원으로 강화되었습니다. 대신 성장 잠재력은 높지만 매출이 낮은 기업을 고려, 코스닥 상장기업 기준 최소 시가총액 600억원을 충족하면 매출 요건을 면제하는 완충 장치도 도입됩니다.
| [상장폐지 제도 개선 방안: 시총/매출 요건 강화] | ||
|
||
| 출처: 금융위원회, 데일리팜 |
최근 3년간 별도기준 매출액은 2022년 35.8억원, 2023년 102.9억원, 2024년 16.3억원으로 2028년부터 적용되는 매출요건 75억원을 하회하고 있습니다. 하지만, 당사의 최근 시가총액은 600억원 이상으로 2028년부터 적용되는 최소 시가총액 요건인 600억원을 상회하고 있지만, 향후 당사의 매출 성장성이 둔화되어 매출이 악화되고 현재 시가총액 수준을 유지 및 지속적으로 하락하여 상장폐지 요건에 해당될 경우 즉시 상장폐지 될 수 있습니다. 투자자들께서는 투자 판단 시 최근 상장폐지 요건 강화에 따른 상장폐지 위험에 대해서 충분히 인지하시길 바랍니다.
이 외에도 상장폐지의 비재무적 요건 강화 방안으로는 '감사의견 미달요건'기준의 강화를 발표했습니다. 현행 '감사의견 미달요건'의 경우 이의신청이 허용되는 형식적 상장폐지 사유로서, 이의신청시 개선기간을 부여하였습니다. 따라서 다음 혹은 다다음 사업연도 감사의견이 나올 때 까지 개선기간을 부여하는 등 다소 완화적으로 요건을 적용하였습니다.
이러한 '감사의견 미달요건'의 개선사항으로, 감사의견 미달사유 발생 이후 다음 사업연도 감사의견 미달시 즉시 상장폐지 절차를 진행하게 되었습니다. 즉, 감사의견 2회 연속 미달을 '이의신청 불가 형식적 사유'로 규정하게 되었습니다. 상기 개선사항은 2025년 07월 01일부터 시행 예정입니다.
이렇듯 금융 관계기관의 국내증시 상장폐지 제도에 대한 개선방안 논의가 진행되었고, 현행 제도에서 단계적으로 유가증권시장 및 코스닥시장의 상장폐지 요건이 엄격하게 작용될 전망입니다. 이에 따라 현행 기준으로 당사는 재무적, 비재무적 상장폐지 요건에 해당되는 바 없지만, 당사가 이후 영업실적의 악화나 재무구조의 급격한 변화 등에 의해 강화된 상장폐지 요건에 해당되게 된다면 상장폐지 사유에 해당될 위험이 있으니, 투자자께서는 이 점 유의하시기 바랍니다.
당사는 증권신고서 제출일 전일 기준 「코스닥시장 상장규정」 상 관리종목 지정 및 상장폐지요건에 해당하는 경우는 없습니다. 하지만 당사는 2024년부터 매출 성장이 둔화되고 있으며 수익성도 악화되는 추세입니다. 이와 같은 추세가 향후 지속될 경우 당사는 관리종목 지정 사유뿐만 아니라 형식적 상장폐지 사유에 해당될 수 있습니다. 추가적으로, 최근 한국증시 발전 및 부실기업 퇴출을 위해 금융감독원, 한국거래소 등에서 상장폐지제도 개선 움직임이 진행되고 있습니다. 이에 따라 향후 상장폐지 요건이 현재보다 강화될 예정이며 향후 적자 상태가 지속될 경우 관리종목 및 상장폐지 요건을 충족시킬 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 나. 최대주주 지분희석 및 경영권 관련 위험 증권신고서 제출 전일 기준 당사 최대주주는 권영근 의장으로 1,809,047주(지분율 12.91%) 보유하고 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.4996732494로 신주인수권증서를 교부받게 됩니다. 이에 따라 최대주주인 권영근 의장은 903,932주를 배정받게 됩니다. 금번 유상증자에서 권영근 의장은 약 30% 내외 참여를 계획 중이나 최대주주 외 특수관계인들의 지분율은 0.84%(보유 주식수 118,000주, 배정주식수 58,959주)이며 청약 참여 여부는 현재 미정입니다. 만약 특수관계인 청약 미참여 가정 및 최대주주가 전액 미참여할 경우 지분율은 현재 13.76%에서 9.17%까지 감소할 수 있으며, 특수관계인 청약 미참여 가정 및 최대주주가 배정분의 약 30% 내외 참여할 경우 유상증자 후 지분율은 현재 13.76%에서 10.46%까지 감소할 수 있습니다. 당사의 특수관계인들은 증권신고서 제출 전일 기준 주식교부 방식의 주식매수선택권총 374,000주를 보유하고 있으며, 이를 행사하더라도 신주 교부 방식이 아닌 자기주식 교부 방식이기 때문에 당사의 총 발생주식수 자체는 변동이 없습니다. 따라서, 당사의 주식선택권 행사에 따른 지분희석은 없을 것으로 판단됩니다. |
증권신고서 제출 전일 기준 당사 최대주주는 권영근 의장으로 1,809,047주(지분율 12.91%) 보유하고 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 보유 중인 주식 1주당 0.4996732494주의 신주인수권증서를 교부받게 됩니다. 이에 따라 최대주주인 권영근 의장은 903,932주를 배정받게 됩니다. 금번 유상증자에서 최대주주는 배정분의 약 30% 내외 참여를 계획 중이나 최대주주 외 특수관계인들의 지분율은 0.84%(보유 주식수 118,000주, 배정주식수 58,959주)이며 청약 참여 여부는 현재 미정입니다. 만약 특수관계인 청약 미참여 가정 및 최대주주가 전액 미참여할 경우 지분율은 현재 13.76%에서 9.17%까지 감소할 수 있으며, 특수관계인 청약 미참여 가정 및 최대주주가 배정분의 약 30% 내외 참여할 경우 유상증자 후 지분율은 현재 13.76%에서 10.46%까지 감소할 수 있습니다.
| [최대주주 및 특수관계인 청약율에 따른 지분변동 가정] |
| 성명 | 공시서류 제출 전일 현재 | 증자 후 (최대주주 및 특수관계인 청약 미참여) |
증자 후 (최대주주 약 30% 청약 참여 및 특수관계인 미참여 가정) |
||||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 배정주식수 | 주식수 | 지분율 | 주식수 | 지분율 | |
| 권영근 의장 | 1,809,047주 | 12.91% | 903,932주 | 1,809,047주 | 8.61% | 2,080,226주 | 9.90% |
| 특수관계인 | 118,000주 | 0.84% | 58,959주 | 118,000주 | 0.56% | 118,000주 | 0.56% |
| 합계 | 1,927,047주 | 13.76% | 962,893주 | 1,927,047주 | 9.17% | 2,198,226주 | 10.46% |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 최대주주 권영근 의장이 배정분의 약 30% 참여에 따른 청약 참여주식수는 271,179주입니다. |
| 주2) 증자 전 발행주식 총수 : 14,009,155주 → 증자 후 발행주식 총수 : 21,009,155주 |
당사는 증권신고서 제출 전일 현재 미발행 주식수(보통주)는 2025년 05월 28일자로 미전환 제1회 전환사채 14,800백만원을 상환함에 따라 총 567,797주가 존재하며, 그 내역은 미전환 제1회 전환사채 4,200백만원의 전환가능주식입니다.
| [기발행 전환사채 내역] | |||
| (기준일 : | 증권신고서 제출 전일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2023.06.28 | 2028.06.28 | 20,000,000,000 | 보통주 | 2024.06.28 ~ 2028.05.28 |
100 | 7,397 | 4,200,000,000 | 567,797 | - |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 2025년 05월 28일자로 미전환 제1회 전환사채 14,800백만원을 상환함에 따라 증권신고서 제출 전일 기준 미상환사채는 4,200백만원입니다. |
제1회 전환사채의 전환가능기간은 2024년 06월 28일부터 2028년 05월 28일까지입니다. 상기 기발행된 전환사채의 전환권이 행사되어 당사 보통주로 전환될 경우, 최대주주를 포함한 기존 주주의 지분율이 희석될 위험이 있습니다. 기발행 전환사채가 보통주로 전환될 경우 총발행주식수(보통주) 14,009,155주의 약 4.05%(금번 유상증자 7,000,000주 포함 2.70%)에 해당합니다.
| [전환사채 전환권 행사 및 유상증자 납입에 따른 지분율 변동 가정] |
| 성명 | 현재 | 전환사채 전환권 행사 후 (권리 행사 100% 가정) |
전환사채 전환권 행사 & 증자 후 (최대주주 미참여 가정) |
||||
| 주식수 | 지분율 | 배정주식수 | 주식수 | 지분율 | 주식수 | 지분율 | |
| 권영근 의장 | 1,809,047주 | 12.91% | 903,932주 | 1,809,047주 | 12.41% | 1,809,047주 | 8.38% |
| 특수관계인 | 118,000 | 0.84% | 58,959주 | 118,000 | 0.81% | 118,000 | 0.55% |
| 주1) 최대주주 및 특수관계인은 유상증자 배정주식수 미참여를 가정하였습니다. |
| 주2) 전환사채의 전환권 100% 행사(전환가액 7,397원)를 가정하였습니다. |
| [주식매수선택권 부여 내역] | |
| (기준일 : 증권신고서 제출 전일) | (단위: 주) |
| 부여 회차 |
부여일 | 만기일 | 주식의 종류 |
부여방법 | 잔여 부여수량 |
행사가격 | 부여일 공정가치 |
|---|---|---|---|---|---|---|---|
| 3-1회차 | 2019.06.30 | 2026.07.13 | 보통주 | 주식교부 | 20,000 | 3,384 | 4,782 |
| 4회차 | 2020.03.31 | 2027.04.01 | 보통주 | 주식교부 | 10,000 | 6,200 | 4,793 |
| 5-1회차 | 2021.01.05 | 2028.01.05 | 보통주 | 주식교부 | 20,000 | 7,750 | 11,061 |
| 5-2회차 | 2021.01.05 | 2028.01.05 | 보통주 | 주식교부 | 10,000 | 10,720 | 10,669 |
| 6-1회차 | 2021.03.29 | 2028.03.29 | 보통주 | 주식교부 | 10,000 | 8,500 | 10,700 |
| 6-2회차 | 2021.03.29 | 2028.03.29 | 보통주 | 주식교부 | 4,000 | 10,720 | 10,376 |
| 7회차 | 2022.03.30 | 2029.03.29 | 보통주 | 주식교부 | 135,000 | 21,500 | 18,999 |
| 8회차 | 2022.11.16 | 2029.11.15 | 보통주 | 주식교부 | 45,000 | 12,700 | 9,985 |
| 9회차 | 2023.03.30 | 2030.03.29 | 보통주 | 주식교부 | 30,000 | 11,100 | 7,646 |
| 합계 | 374,000 | - | - | ||||
| 출처) 당사 정기 보고서 및 당사 제시 |
| 주) 주식수 및 행사가격은 2020년 12월 12일 100% 무상증자를 실시함에 따라 주식선택권 부여수량, 행사가격 및 부여일 공정가치가 조정되었습니다. |
당사의 특수관계인들은 증권신고서 제출 전일 기준 주식교부 방식의 주식매수선택권총 374,000주를 보유하고 있으며, 이를 행사하더라도 신주 교부 방식이 아닌 자기주식 교부 방식이기 때문에 당사의 총 발생주식수 자체는 변동이 없습니다. 따라서, 당사의 주식선택권 행사에 따른 지분희석은 없을 것으로 판단됩니다.
상기한 바와 같이 증권신고서 제출 전일 기준 당사의 최대주주 권영근 의장은 약 12.91%의 지분율을 확보하고 있으며, 금번 주주배정 후 실권주 일반공모에 권영근 의장은 약 30% 내외 참여할 계획입니다. 보유 지분 및 미청약분 증서 매각 대금 및 보유 자금을 활용하여 청약 자금을 마련할 예정이며, 증서 청약률은 매각 당시 주가 흐름과 시장 상황에 따라 변동될 수 있습니다. 만약 시장 상황 악화로 인하여 당사의 주가가 하락한다면 증서 매각대금은 감소하여 청약률이 낮아질 수 있습니다. 이 경우 청약률 하락으로 인해 지분 희석이 심화될 수 있습니다. 또한 최대주주가 예상치 못한 사유 등으로 인해 청약에 필요한 자금을 마련하지 못할 경우, 청약 계획에 변동이 생겨, 지분이 추가 희석될 수 있는 위험성을 배제할 수 없으니 투자자께서는 이 점 유의하시기 바랍니다.
다만, 당사 발행주식총수의 5% 이상 지분율을 보유한 주주는 최대주주 이외에 없고 소액주주들에게 지분율이 분산되어 있어 최대주주의 변경 등 가능성은 제한적일 것으로 판단하고 있습니다. 그럼에도 불구하고 향후 적대적 M&A 및 외부의 경영권 취득 시도 등의 위험에 노출될 수 있으며, 최대주주 변경가능성 등에 의한 경영권의 안정성 저하 및 당사의 신뢰도 하락을 유발할 수 있는 등 당사의 장기적인 발전을 저해하는 요소로 작용할 수 있습니다. 또한 당사가 향후 추가적인 유상증자, 주식관련사채 등의 발행에 따라 최대주주의 지분율이 추가로 희석될 가능성 또한 존재하며, 또는 최대주주의 지분율 추가 희석을 우려하여, 자본시장에서 자금 조달을 진행하는데 어려움이 생길 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
|
다. 매출부진 및 지속적 손실 발생 위험 당사는 2016년 05월 설립, 2021년 07월 기술특례로 코스닥 시장 상장한 바이오 벤처 기업으로, 혈관내피기능장애(Endothelial Dysfunction)을 정상화하여 다양한 난치성 질환의 근본 원인을 개선하는 치료제를 연구 및 개발하고 있습니다. 현재까지 당사의 주된 수익원은 개발 중인 신약 후보물질의 기술이전 계약에 따른 계약금(Upfront payment) 및 개발 단계별 성과보수(Milestone payment) 등으로 구성됩니다. 이는 일반적인 제조기업이나 이미 상용화된 제품을 보유한 제약사와는 다른 수익 구조로, 신약 개발의 성공 여부 및 기술이전 계약 체결 및 유지 여부에 따라 매출 발생이 간헐적이거나 변동성이 매우 클 수 있습니다. 이러한 사업 모델은 당사의 재무적 특성에 직접적인 영향을 미칩니다. 기술이전 계약은 성공 시 상당한 규모의 수익을 가져다줄 수 있지만, 계약 체결 자체가 빈번하지 않고 각 개발 단계의 성공에 따라 마일스톤이 지급되므로 수익 흐름이 연속적이지 못하고 예측 또한 어렵습니다. 이는 안정적인 현금흐름 확보를 어렵게 만들며, 대규모 연구개발 투자가 지속되는 상황에서 재무적 부담을 가중시키는 요인으로 작용합니다. 당사의 수익 창출 능력이 아직까지는 특정 기술이전 계약에 크게 의존하고 있으며, 이러한 계약의 변동이 발생할 경우 재무 상태에 즉각적이고 심각한 영향을 미칠 수 있음을 시사합니다. 또한, 매출 발생 여부와 관계없이 연구개발비 등 고정적인 비용 지출 규모가 커 수익성을 확보하지 못하고 손실이 누적되는 구조가 고착화될 위험이 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2016년 05월 설립, 2021년 07월 기술특례로 코스닥 시장 상장한 바이오 벤처 기업으로, 혈관내피기능장애(Endothelial Dysfunction)을 정상화하여 다양한 난치성 질환의 근본 원인을 개선하는 치료제를 연구 및 개발하고 있습니다. 현재까지 당사의 주된 수익원은 개발 중인 신약 후보물질의 기술이전 계약에 따른 계약금(Upfront payment) 및 개발 단계별 성과보수(Milestone payment) 등으로 구성됩니다. 이는 일반적인 제조기업이나 이미 상용화된 제품을 보유한 제약사와는 다른 수익 구조로, 신약 개발의 성공 여부 및 기술이전 계약 체결 및 유지 여부에 따라 매출 발생이 간헐적이거나 변동성이 매우 클 수 있습니다.
이러한 사업 모델은 당사의 재무적 특성에 직접적인 영향을 미칩니다. 기술이전 계약은 성공 시 상당한 규모의 수익을 가져다줄 수 있지만, 계약 체결 자체가 빈번하지 않고 각 개발 단계의 성공에 따라 마일스톤이 지급되므로 수익 흐름이 연속적이지 못하고 예측 또한 어렵습니다. 이는 안정적인 현금흐름 확보를 어렵게 만들며, 대규모 연구개발 투자가 지속되는 상황에서 재무적 부담을 가중시키는 요인으로 작용합니다.
당사의 최근 3개년 및 2025년 1분기 손익계산서 및 매출 유형별 현황은 다음과 같습니다.
| [최근 3개년 및 2025년 1분기 손익계산서] |
| (단위: 백만원, %) |
| 구 분 | 2025년 1분기 | 2024년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|---|
| 영업수익 | 0 | 500 | 1,633 | 10,294 | 3,583 |
| 영업비용 | 3,649 | 3,556 | 14,267 | 20,803 | 15,565 |
| 영업이익(손실) | (3,649) | (3,056) | (12,635) | (10,508) | (11,982) |
| 기타수익 | 0 | 14 | 42 | 24 | 34 |
| 기타손실 | 0 | 6 | 160 | 3 | 85 |
| 금융수익 | 218 | 755 | 2,238 | 1,701 | 1,098 |
| 금융원가 | 692 | 602 | 4,371 | 2,800 | 471 |
| 법인세비용차감전순이익(손실) | (4,126) | (2,895) | (14,886) | (11,586) | (11,406) |
| 당기순이익(손실) | (4,126) | (2,897) | (14,886) | (11,586) | (11,406) |
| 출처) 당사 정기보고서 |
| [최근 3개년 및 2025년 1분기 매출 유형별 현황] |
| (단위: 백만원, %) |
| 매출유형 | 품목 | 2025년 1분기 | 2024년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|---|---|
| 용역매출 | CU06 | 0 | 500 | 1,633 | 10,294 | 3,583 |
| 출처) 당사 정기보고서 |
당사의 2022년부터 2024년까지의 수익성은 기술이전 계약에 따른 마일스톤 유입 등으로 일시적 수익에 의존하는 경향이 있습니다. 2022년은 떼아 오픈이노베이션으로부터 CU06 관련 일부 마일스톤 수익이 반영되며 3,588백만원을 기록하였으나, 연구개발비 지출로 인해 영업손실 및 당기순손실을 기록하였습니다.
2023년은 임상2a상 결과 등 기술이전 마일스톤 유입이 증가하며 매출이 전년 대비 218% 증가한 10,294백만원을 기록하였으나, 연구개발비 및 운영비 부담으로 인해 영업손실과 당기순손실 규모는 전년과 비슷한 수준을 유지하였습니다.
2024년에는 떼아 오픈이노베이션과 체결했던 CU06의 기술이전 계약이 중단됨에 따라 마일스톤 수익이 발생하지 않아 매출이 1,633백만원으로 급감하였으며, 영업손실 및 당기순손실의 적자 폭 또한 더욱 확대되었습니다.
이는 당사의 수익 창출 능력이 아직까지는 특정 기술이전 계약에 크게 의존하고 있으며, 이러한 계약의 변동이 발생할 경우 재무 상태에 즉각적이고 심각한 영향을 미칠 수 있음을 시사합니다. 또한, 매출 발생 여부와 관계없이 연구개발비 등 고정적인 비용 지출 규모가 커 수익성을 확보하지 못하고 손실이 누적되는 구조가 고착화될 위험이 있으니 투자자께서는 이 점 유의하시기 바랍니다.
당사의 주요 파이프라인 중 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06에 대해 2021년 10월 27일 떼아 이노베이션과 기술이전 계약을 체결하며 계약금(Upfront) 6백만불(6,255백만원)을 수취하여 매출액으로 부분 인식하였습니다. 다만, 2024년 05월 16일자로 떼아 오픈이노베이션으로부터 기술이전 계약해지 및 권리반환 통보를 받았으며, 2024년 07월 12일 최종 기술이전 계약이 해지되었습니다. 계약이 종료되더라도 당사가 떼아 오픈이노베이션으로부터 이미 수령한 계약금과 연구개발 비용은 반환의무가 발생하지 않지만 향후 마일스톤 유입이 제한됨에 따라 2024년말 기준 매출액은 전년 대비 84% 급감한 1,633백만원을 기록하였습니다. CU06에 대한 라이선스아웃 계약 현황은 다음과 같습니다.
| [라이선스아웃 계약 현황] |
| 품목 | 계약 상대방 | 대상 지역 | 계약 체결일 | 계약 종료 통보일 | 계약 금액 | 수취금액 | 진행 단계 |
|---|---|---|---|---|---|---|---|
| CU06 |
Thea Open Innovation (떼아 오픈이노베이션) |
아시아 제외 전세계 | 2021.10.27 | 2024.07.12 | US$163,500,000 | US$6,000,000 | 미국 임상2a상 결과보고서 수령 |
| 출처) 당사 정기보고서 |
(1) 품목: CU06
| 계약상대방 | Thea Open Innovation (떼아 오픈이노베이션, 프랑스) |
| 계약내용 | 떼아오픈이노베이션이 CU06에 대한 독점권 권리를 갖고 임상시험, 허가, 상업화를 진행 |
| 대상지역 | 아시아를 제외한 전세계 지역 |
| 계약기간 | 계약체결일 : 2021.10.27 |
| 총계약금액 | US$163,500,000, 로열티는 매출액의 8% 별도 수취 |
| 수취금액 | 반환 의무가 없는 계약금(Upfront) : US$6,000,000 (2021.11.10) |
| 계약조건 |
계약금(Upfront): US$6,000,000 경상기술료(Royalty) : 매출액의 8% |
| 회계처리방법 | 계약금은 2021년~2022년 동안 분할하여 수익 인식 |
| 대상기술 | 당뇨병성 황반부종 및 습성 황반변성 치료제 |
| 개발진행경과 |
2022.06 미국 임상1상 완료 (당뇨병성 황반부종/습성 황반변성) 2022.08 미국 임상2a상 IND 신청 (당뇨병성 황반부종) 2022.09 미국 임상2a상 IND 승인 (당뇨병성 황반부종) 2023.06 미국 임상2a상 대상자 등록 완료(당뇨병성 황반부종) 2023.08 한국 임상1b상 IND 신청 (당뇨병성 황반부종) |
| 기타사항 |
□ 상기 마일스톤은 임상 성공시, 적응증 및 지역에 따른 허가시, 매출에 따른 목표 달성시 수령 하며, 계약금과 각 단계별로 수령하는 마일스톤과 로열티는 반환 의무가 없음. □ 당사는 FDA 1상까지의 비용을 부담하며, 2상 진입시부터는 떼아오픈이노베이션에서 비용을 부담합니다. 기존 계약에 추가하여 비임상 비용도 떼아오픈이노베이션에서 부담함 |
| 출처) 당사 정기보고서 |
CU06의 진행 예정인 임상 개요는 다음과 같습니다.
| [CU06 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 주요 목적 - 당뇨병성 황반부종(DME) 환자를 대상으로 최적의 용량을 도출하여 향후 3상 시험 설계에 반영 부차적 목적 - 24주 후 CU06의 안전성과 유효성 평가 (위약과 비교) - CU06 및 대사체의 혈중 약물동태(PK) 평가 - 혈중 바이오마커(TNF-α, IL-6 등)에 대한 CU06-1004의 영향 분석 |
| 임상시험 대상국가 | 미국 내 20개 기관에서 환자 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 이번 임상시험은 미국 내 20개 의료기관에서 시행되는 무작위배정, 이중눈가림, 위약대조 방식의 다기관 임상 2b상 시험으로, 중심성 당뇨병성 황반부종(Center-Involved Diabetic Macular Edema, DME) 환자를 대상으로 CU06-1004의 유효성과 안전성을 평가하기 위해 설계되었습니다. 총 135명의 환자를 1:1:1 비율로 세 군(200mg, 300mg, 위약)으로 무작위 배정하여, 매일 식사 직후 경구로 24주간 약물을 투여받게 됩니다. - 주 평가 지표는 24주 시점에서의 ETDRS 문자표 기준 최고교정시력(BCVA) 변화량이며, 이외에도 망막 두께, 망막 내/하부 액체량, 혈관 밀도 및 혈류량, 염증성 바이오마커(TNF-α, IL-6) 등의 변화를 포함한 다양한 이차 평가지표들을 통해 약물의 치료 효과를 종합적으로 분석합니다. - 약동학적 특성은 혈중 약물 농도 측정을 통해 파악되며, 안전성은 이상반응 발생률, 생체징후 변화, 심전도 및 혈액검사 등 다양한 지표를 통해 평가됩니다. 주요 유효성 분석은 MMRM(Mixed Model for Repeated Measures)을 이용하며, 300mg과 200mg 용량을 위약과 순차적으로 비교하여 통계적 유의성을 검증합니다. |
| 기대효과 | - 본 임상을 통해 CU06-1004가 당뇨병성 황반부종 환자에서 유의미한 시력 개선 및 망막 구조 개선 효과를 나타낼 경우, 기존 항VEGF 주사제 중심의 치료법에 대한 대안으로 자리매김할 수 있을 것으로 기대됩니다. 특히 CU06-1004는 경구 투약이라는 비침습적 제형을 통해, 반복적인 안구 주사로 인한 환자 부담과 내원 횟수를 줄일 수 있는 잠재력을 보유하고 있습니다. - 또한, 다양한 시각적 기능 및 구조적 개선 외에도 염증 조절과 혈관 안정화 등의 기전을 입증함으로써, 기존 치료제 대비 차별화된 약물 프로파일을 확보할 수 있습니다. 이번 임상에서 도출되는 최적 용량과 유효성·안전성 데이터는 향후 3상 시험 설계의 근거가 되며, 글로벌 라이선싱 및 상업화를 위한 핵심 기반 자료로 활용될 수 있습니다. 이를 통해 CU06-1004는 DME 치료 분야에서 새로운 경구 치료제로서의 가능성을 입증할 수 있을 것으로 기대됩니다. |
| 출처) 당사 제시 |
한편, 당사가 2021년 07월 22일 코스닥시장에 신규상장 당시 증권신고서 상의 6개년(2019년 ~ 2024년) 추정 경영실적 세부내역은 다음과 같습니다.
| [상장 당시 공시한 추정 손익계산서] |
| (단위: 백만원) |
| 구분 | 2019년 | 2020년 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) |
|---|---|---|---|---|---|---|
| 매출액 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 매출원가 | 0 | 0 | 0 | 0 | 0 | 0 |
| 매출총이익 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 판매관리비 | 5,734 | 7,853 | 17,225 | 19,160 | 28,309 | 34,494 |
| 영업이익(손실) | (5,734 | (7,853) | (17,225) | (3,032) | 2,837 | 35,824 |
| 영업외수익 | 166 | 160 | 165 | 264 | 234 | 366 |
| 영업외비용 | 8,421 | 20,917 | 19 | 17 | 14 | 12 |
| 법인세비용차감전순이익(손실) | (13,989 | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 법인세비용 | 0 | 0 | 0 | 0 | 0 | 0 |
| 당기순이익(손실) | (13,989) | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 출처) 당사 정기보고서 |
하지만, 상기 추정손익과 달리 최근 3개년(2022년 ~ 2024년) 매출 등의 실적은 아래와 같이 큰 차이를 보이고 있습니다.
| [추정손익과 현재 손익 비교] | |
| (K-IFRS, 연결) | (단위: 백만원) |
| 구분 | 2024년 | 2023년 | 2022년 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | |
| 매출액 | 70,318 | 1,633 | (68,685) | 31,146 | 10,294 | (20,852) | 16,128 | 3,583 | (12,545) |
| 영업이익(손실) | 35,824 | (12,635) | (48,459) | 2,837 | (10,508) | (13,345) | (3,032) | (10,508) | (7,476) |
| 당기순이익(손실) | 36,177 | (14,886) | (51,063) | 3,057 | (11,586) | (14,643) | (2,784) | (11,586) | (8,802) |
| 출처) 당사 정기보고서 및 증권신고서 |
상기와 같이 당사는 매출액이 예측치 대비 괴리액이 2022년 12,545백만원, 2023년 20,852백만원, 2024년에는 68,685백만원 하회하고 있으며, 영업손실 또한 예측치 대비 크게 상이한 모습을 보이고 있습니다. 이처럼 당사는 상장 당시 매출 및 수익성 추정치와 현재 실적 간 차이가 큰 편에 속합니다. 상장 당시 주요 파이프라인별 추정 실적과 실제 매출액을 파이프라인별로 상세히 살펴보면 다음과 같습니다.
| [주요 파이프라인별 세부 추정 매출액과 현재 매출액 비교] |
| (단위: 백만원) |
| 구분 | 추정 매출 추정치 | 실제 매출 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 주요 파이프라인 | 기술료 구분 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) | 2021년 | 2022년 | 2023년 | 2024년 |
| CU06 | Upfront | 0 | 8,227 | 0 | 3,835 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 10,970 | 13,712 | 0 | 3,583 | 10,294 | 1,633 | |
| CU01 | Upfront | 0 | 2,688 | 5,767 | 0 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 14,409 | 13,644 | 0 | 0 | 0 | 0 | |
| CU03 | Upfront | 0 | 5,213 | 0 | 11,184 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 0 | 27,944 | 0 | 0 | 0 | 0 | |
| Total | Upfront | 0 | 16,128 | 5,767 | 15,019 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 25,379 | 55,300 | 0 | 3,583 | 10,294 | 1,633 | |
| 합계 | 0 | 16,128 | 31,146 | 70,318 | 6,255 | 3,583 | 10,294 | 1,633 | |
| 출처) 당사 정기보고서 및 증권신고서 |
2021년부터 2024년까지 당사의 주요 파이프라인별 추정 실적과 실제 매출액간 차이가 발생한 사유는 아래와 같습니다.
① CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)
당사의 주요 파이프라인 CU06은 2021년 10월 떼아 오픈이노베이션에 기술 수출을 통해 당뇨병성 황반부종 및 습성 황반변성에 대한 아시아를 제외한 전세계 지역에 대한 판권을 이전하였습니다. 이에 따른 계약금(Upfront) 6백만불을 수취하였으며, 당시 환율을 적용하여 2021년 6,255백만원을 매출액으로 인식하였습니다. 이후 원가투입법기준 진행률에 따라 기간에 걸쳐 수익을 인식하였으며, 임상2상 시험, 비임상 시험 및 CMC(Chemistry, Manufacturing and Controls)에 필요한 외주 용역 비용의 보상을 받을 뿐만 아니라, 이 과정을 수행하는데 소요되는 임상연구비용 및 제반비용 등을 수익으로 인식함에 따라 2022년, 2023년 각각 3,583백만원, 10,294백만원의 매출액을 기록하였습니다.
CU06의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 07월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
② CU01(당뇨병성 신증 치료제)
당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
③ CU03(습성 황반변성 치료제)
CU03의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
한편, 당사의 별도기준 판매비와관리비는 2022년 15,565백만원, 2023년 20,803백만원, 2024년 14,267백만원, 2025년 1분기 3,649백만원으로, 위탁연구개발비가 2025년 1분기 기준 전체 판매비와관리비 중 48.5%로 가장 큰 비중을 차지하고 있습니다. 다만, 2024년 위탁연구개발비는 전년대비 6,378백만원이 감소하였는데, 이는 2024년 05월 CU06의 기술이전 계약해지 및 권리반환에 따른 감소는 아니며 CU06의 미국 임상2a상 결과 보고서 수령 이후 임상2b상 IND 신청을 준비하는 과정에서 추가 비용이 아직 발생하지 않은 점이 기인합니다. 최근 3개년 및 2025년 1분기 판매비와관리비 추이 및 파이프라인별 경상연구개발비(연구인력 인건비, 위탁연구개발비, 기타 공통비 등)은 다음과 같습니다.
| [최근 3개년 및 2025년 1분기 판매비와관리비 추이] |
| (단위: 백만원, %) |
| 구분 | 2025년 1분기 | 2024년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|---|
| 급여 | 1,060 | 1,077 | 4,376 | 4,086 | 3,825 |
| 위탁용역연구비 | 1,769 | 1,153 | 5,500 | 11,877 | 6,914 |
| 위탁용역연구비 비중 | 48.5% | 32.4% | 38.5% | 57.1% | 44.4% |
| 지급수수료 | 304 | 3 | 1,388 | 841 | 1,219 |
| 감가상각비 | 120 | 127 | 522 | 511 | 332 |
| 기타 | 396 | 1,195 | 2,482 | 3,487 | 3,275 |
| 합계 | 3,649 | 3,556 | 14,267 | 20,803 | 15,565 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주) 급여는 종업원 급여, 퇴직급여, 복리후생비를 합한 금액입니다. |
| [파이프라인별 경상연구개발비 추이] |
| (단위: 백만원, %) |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| CU01 | 235 | 1,530 | 1,587 | 511 |
| CU02 | 0 | 0 | 0 | 23 |
| CU03 | 0 | 4 | 267 | 634 |
| CU04 | 0 | 0 | 275 | 217 |
| CU05 | 0 | 0 | 5 | 136 |
| CU06 | 645 | 3,630 | 10,094 | 5,890 |
| CU71 | 964 | 673 | 88 | 0 |
| CP01-R01 | 7 | 69 | 40 | 0 |
| 기타 공통비 | 842 | 6,300 | 3,693 | 3,964 |
| 합계 | 2,693 | 9,507 | 16,049 | 11,375 |
| 출처) 당사 정기보고서 |
| 주) 파이프라인별 경상연구개발비로 연구인력 인건비, 위탁연구개발비, 기타 공통비 등의 비용이 합한 금액입니다. |
상기 기재한 바와 같이, 당사의 주요 수익원은 기술이전 계약에 의존하고 있어, 각 계약의 조건 및 유지 여부가 전체 매출에 결정적인 영향을 미칩니다. 특히, CU06 기술이전 계약 해지는 당사의 최근 매출 부진에 직접적인 원인이 되었습니다. 2021년 10월 떼아 오픈이노베이션과 체결했던 CU06의 아시아 제외 글로벌 판권 기술이전 계약은 과거 당사 매출의 중요 부분을 차지했습니다. 그러나 해당 계약이 2024년 05월 16일부로 계약 상대방의 일방적인 통보에 의해 2024년 07월 12일부로 최종 계약 해지됨에 따라, 2024년 매출액은 전년 대비 84.1% 급감한 1,633백만원을 기록하였습니다. 기 수령한 계약금 및 연구개발비 보전금에 대한 반환 의무는 없으나, 향후 해당 파이프라인으로부터 기대되었던 마일스톤 수익이 소멸되었을 뿐만 아니라, 기존에 계약 상대방이 부담하던 CU06의 연구개발 비용까지 당사가 직접 부담하게 되는 결과를 초래했습니다. 이는 당사의 재무 부담 가중으로 이어질 수 있으며, 최근 3년간 당사 매출의 대부분이 CU06 관련 마일스톤 수익이었다는 점을 고려하였을 때, 단일 계약의 해지가 전체 매출에 미치는 부정적인 영향이 크다는 점을 투자자께서는 유의하시기 바랍니다.
한편, 당사는 2025년 03월 06일자로 원료의약품(API) 개발 및 유통 전문기업인 주식회사 대성팜텍을 흡수합병하기로 결정하였으며, 합병 기일은 2026년 01월 28일로 지정되어 흡수합병을 진행할 계획입니다. (주)대성팜텍의 주력 제품군은 안과 치료제 관련 원료의약품 및 중간체로, 이는 당사가 개발 중인 망막질환 경구용 치료제 CU06 및 망막질환 이중항체 MT-103과 밀접한 연관이 있기 때문에 금번 합병을 통해 신약 개발과 원료의약품 사업 간의 시너지를 기대하고 있습니다. 당사의 (주)대성팜텍 흡수합병 관련 공시 내용은 다음과 같습니다.
| [주요사항보고서(회사합병결정) - 2025.03.06] - 2025.05.09(정정) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
회사합병 결정
가. 본 합병은 『상법』 제527조의3의 소규모합병으로 추진하는 바, 존속회사인 (주)큐라클의 주주총회 승인은 이사회 승인으로 갈음합니다. 다만, 상법 527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 합병 반대의사 통지 접수기간 시작일로부터 2주간 내에 서면으로 합병에 반대하는 의사를 통지하는 때에는 소규모합병으로 본 합병을 진행할 수 없습니다. 또한 소멸회사인 (주)대성팜텍은 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다.
다. 존속회사인 (주)큐라클의 경우 소규모합병에 대한 반대의사 접수(접수기간 : 2025년 3월 21일 ~ 2025년 4월 3일)를 위한 주주확정기준일은 2025년 3월 21일입니다. 라. 상법 제526조의 합병종료보고총회는 2026년 1월 29일 존속회사인 (주)큐라클의 이사회결의 개최와 공고 절차로 갈음할 예정입니다. ※ 관련공시 【합병관련 주요사항 상세기재】 1. 합병의 개요 가. 합병에 관한 기본사항
주) 상기 합병 일정은 본 보고서 제출일 현재 기준 예상 일정이며, 관계기간과의 협의 - 증권신고서 제출여부
나. 합병가액 및 그 산출근거
<외부기관 합병가액 산정 개요> - 산정 개요: (주)큐라클과 (주)대성팜텍 간의 합병을 실시함에 있어 동 주요사항보고서상 합병가액의 산정에 대하여, 외부기관은 합병당사회사의 합의에 기초하여 아래의 관련 규정을 적용하여 (주)큐라클과 (주)대성팜텍의 1주당 합병가액을 산정하였으며, 이를 기초로 합병비율의 적정성을 검토하였습니다.
이촌회계법인은 주권상장법인 (주)큐라클과 주권비상장법인인 (주)대성팜텍이 합병을 함에 있어 합병당사회사 간 합병비율의 적정성에 대해 검토하였습니다. 외부평가에 대한 자세한 사항은 첨부서류 '외부평가기관의 평가의견서'를 참고하시기 바랍니다.
- 평가 결과 : 적정한 것으로 판단됩니다(자세한 사항은 '외부평가기관의 평가의견서'를 참고하시기 바랍니다).
라. 주식매수청구권에 관한 사항
② 채무보증
해당사항 없습니다. 가. 경영방침 및 임원구성 2. 합병 상대방회사에 관한 사항 가. 회사의 개요
나. 사업의 내용
라. 외부감사인의 감사의견
사. 임원 및 직원 등에 관한 사항 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 출처) 전자공시시스템(DART) |
당사는 2025년 03월 06일 이사회 결의를 통해, (주)대성팜텍을 소멸회사로 하고 당사를 존속회사로 하는 흡수합병을 추진하기로 결정하였습니다. 본 합병은 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제6항 및 「상법」 제527조의3에 따른 소규모합병 절차에 따라 진행되며, 주주총회 승인을 갈음하여 이사회 승인만으로 효력을 발생합니다.
합병가액은 자본시장법령 및 관련 규정에 따라 외부평가기관인 대주회계법인이 수익가치 방식을 기준으로 산출하였으며, 별도로 이촌회계법인이 합병가액의 공정성 및 적정성에 대한 검토를 수행하였습니다. 이 과정에서 합병 대상인 대성팜텍의 과거 실적, 향후 성장률(향후 5년간 연평균 약 10%), 업종의 시장환경 등을 반영하여 수익가치를 추정하였으며, 이를 바탕으로 합병비율은 1:15.5139384로 결정되었습니다(대성팜텍 보통주 1주당 당사 보통주 15.5139384주를 교부).
해당 합병비율 및 거래조건은 외부평가와 법적 기준을 모두 충족하고 있으며, 이사회는 이를 바탕으로 본 합병이 당사와 주주의 이익에 부합하고, 회사의 성장 기반을 강화하며, 장기적인 가치 창출에 기여할 수 있을 것으로 판단하였습니다. 특히 당사와 대성팜텍 간의 사업 연관성과 R&D 및 유통 역량의 결합을 통해, 원료의약품 사업부문에서의 안정적인 수익 확보와 신약 개발과의 시너지 확대가 가능하다는 점에서 전략적 타당성도 충분하다고 평가하였습니다.
본 합병안은 이사회 전원의 찬성으로 의결되었으며, 반대 의견은 없었습니다. 아울러 본 합병은 소규모합병에 해당하므로, 합병 반대주주에 대한 주식매수청구권은 발생하지 않습니다.
또한, 당사의 최대주주를 포함한 주요 주주 및 피합병회사인 (주)대성팜텍의 주주들 간에는 과거 동업 이력이나 공동 투자 이력이 없으며, 「자본시장과 금융투자업에 관한 법률」 및 「상법」상 규정에 따른 특수관계인에도 해당하지 않습니다. 따라서 본 합병은 이해관계에 기반한 거래가 아닌, 사업적 필요성과 전략적 판단에 따라 추진되었습니다.
2025년 1분기 기준 매출액은 1,108백만원, 영업이익 34백만원을 기록하였으며, 이를 통해 당사의 재무건전성을 강화하고 안정적인 수익 기반을 마련할 수 있을 것으로 보입니다. 피합병회사 (주)대성팜텍의 2025년 1분기 요약 재무 정보는 다음과 같습니다.
| [피합병회사 (주)대성팜텍의 2025년 1분기 요약 재무 정보] |
| (단위: 백만원) |
| 구분 | 2025년 1분기 |
|---|---|
| 자산총계 | 1,733 |
| 부채총계 | 1,499 |
| 자본총계 | 234 |
| 매출액 | 1,108 |
| 영업이익 | 34 |
| 영업이익률 | 3.04% |
| 당기순이익 | 34 |
| 당기순이익률 | 3.04% |
| 출처) 당사 제시 |
| 주) (주)대성팜텍의 경우 2025년 01월 17일 설립되어, 상기 재무 정보는 2025년 1분기 매출만 기재하였으니 투자자께서는 이 점 유의하시기 바랍니다. |
상기 기재한 바와 같이, 당사의 매출은 기술이전 계약 성사 여부 및 조건, 임상시험의 성공적 진행에 따른 마일스톤 수취 등에 따라 큰 폭으로 변동될 수 있으며, 신약 개발 과정의 내재적 불확실성으로 인해 지속적인 손실이 발생할 가능성이 높습니다. 이는 당사 주가에 부정적인 영향을 미칠 수 있으며, 투자 원금 손실의 위험도 수반합니다. 향후 사업 계획, 매출 및 이익 전망 등은 국내외 경기 변동, 규제 환경 변화, 경쟁 상황, 임상시험 결과, 기술이전 계약 조건 등 다양한 내외부 요인에 의해 실제 결과와 중대하게 달라질 수 있습니다.
또한, 당사가 계획 중인 연구개발 활동을 지속하고 상업화를 달성하기 위해서는 상당한 규모의 자금이 지속적으로 필요합니다. 향후 필요한 자금 규모의 조달이 이루어지지 않거나, 자금 납입 시기가 지연되어 임상 일정이 늦어지게 된다면 후속 임상 일정이 전반적으로 지연될 경우 당사의 사업 추진 및 재무 상태에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 라. 재무안정성 관련 위험 당사의 부채비율은 별도기준으로 2022년말 20.55%, 2023년말 66.69%, 2024년말 97.94%, 2025년 1분기 100.93%로 나타났습니다. 2022년의 경우 3,583백만원의 매출액과 11,406백만원의 당기순손실을 기록하였으나 2021년 07월 기업공개를 통해 조달한 48,110백만원의 자본 확충 영향으로 자본총계 46,171백만원을 기록한 반면, 부채의 경우 은행차입금 8,000백만원 등으로 부채총계 9,487백만원을 기록하며 낮은 수준의 부채비율 20.55%을 기록하였습니다. 다만, 2023년 06월 20,000백만원 규모의 제1회 전환사채를 발행하며 부채비율이 크게 증가하여 66.69%를 기록하였습니다. 2024년의 경우 14,886백만원의 당기순손실이 발생함에 따라 자본총계가 전년 대비 28% 감소함에 따라 부채비율은 97.94%까지 증가하였습니다. 2025년 1분기 기준 4,126백만원의 당기순손실이 발생하며 자본총계가 감소하였으며, 이에 부채비율은 110.10%까지 증가하였습니다. 한편, 당사의 차입금의 규모를 살펴보면 2022년은 은행차입금 8,000백만원으로 차입금의존도는 14.64%로 매우 낮은 편이었으나, 2023년의 경우 주요 파이프라인의 연구개발 관련 비용 등을 충당하기 위해 06월 28월 20,000백만원 규모의 제1회 전환사채를 발행하며 차입금의존도가 37.00%까지 증가하였습니다. 2024년의 경우, 떼아 오픈이노베이션과 2021년 10월 체결한 당뇨병성 황반부종 및 습성 환반병성 치료제 CU06에 대한 기술이전 계약에 대한 해지 및 권리반환 통보로 인해 계약자산 감소 등 자산총계가 감소하며 차입금의존도는 47.88%까지 증가하였습니다. 2025년 1분기는 사채권자의 전환청구 700백만원이 발생하며 1CB 잔액은 19,300백만원으로 소폭 감소하였지만 자산총계 감소 폭이 더 큼에 따라 차입금의존도는 48.89%를 기록하였습니다. 이후 2025년 04월 22일 300백만원이 추가 전환되었으며,2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준, 1CB 잔액은 4,200백만원입니다. 당사의 경우 단기차입금 비중이 낮아 단기적으로 수익성이 급격히 악화되거나, 지정학적 리스크 및 트럼프 정부의 극단적인 정책 변경 등의 글로벌 금융시장의 급격한 변화가 발생하여 금융기관으로부터 차입금의 상환 요구가 발생하거나 계획대로 만기연장이 이루어지지 않을 경우 당사의 유동성 위기가 발생할 가능성은 낮은 편이지만, 당사의 예상과는 달리 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등과 더불어 예상치 못한 사유로 수익성 개선 시기가 지연되거나, 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 지속적으로 이자보상배율이 1배를 하회할 수 있습니다. 향후 지속적으로 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. 한편, 기발행 1CB의 경우 사채권자의 전환청구 1,000백만원과 당사가 14,800백만원을 사채권자에게 상환하며 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원까지 감소하였으며, 이에 이자비용 및 부채비율 감소 등의 재무구조가 개선되었습니다. 다만, 14,800백만원 상환 등과 같은 대규모 현금유출은 당사의 현금유동성을 고려하였을 때 유동성 악화로 이어질 수 있으며, 당사가 계획했던 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등 수익성 개선 시기가 지연되거나, 금번 진행하는 유상증자의 중점심사 대상에 지정되었기 때문에 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사 2025년 1분기 보고서 재무제표를 살펴보면 총자산 55,835백만원 및 유동자산 29,097백만원, 총 차입금 27,300백만원, 차입금 의존도 48.89%, 부채비율 110.10%, 유동비율 100.93%를 나타내고 있습니다.
또한 당사가 속한 업종인 한국은행 2023년 기업경영분석 상 C21(의료용 물질 및 의약품) 기준 업종평균 수치를 살펴보면, 부채비율 52.81%, 유동비율 196.90%, 차입금의존도 16.77%입니다. 업종평균 수치를 당사 2025년 1분기 기준 재무 수치와 비교시 유동비율를 제외한 부채비율 및 차입금의존도가 상회하고 있습니다. 다음은 최근 3개년 및 2025년 1분기 요약 재무 현황입니다.
| [요약 재무 현황] | |
| (단위: 백만원, %) | |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 업종평균 |
|---|---|---|---|---|---|
| 자산총계 | 55,835 | 59,288 | 69,782 | 55,657 | - |
| 유동자산 | 29,097 | 32,417 | 44,473 | 33,407 | - |
| 비유동자산 | 26,739 | 26,871 | 25,309 | 22,251 | - |
| 부채총계 | 29,260 | 29,335 | 27,919 | 9,487 | - |
| 유동부채 | 28,828 | 20,986 | 10,197 | 1,371 | - |
| 비유동부채 | 432 | 8,349 | 17,722 | 8,116 | - |
| 자본총계 | 26,575 | 29,953 | 41,863 | 46,171 | - |
| 자본금 | 6,984 | 6,937 | 6,928 | 6,923 | - |
| 부채비율 | 110.10% | 97.94% | 66.69% | 20.55% | 52.81% |
| 유동비율 | 100.93% | 154.47% | 436.16% | 2,437.23% | 196.90% |
| 총 차입금 | 27,300 | 28,000 | 28,000 | 8,000 | - |
| 단기차입금 | 19,300 | 20,000 | 8,000 | 0 | - |
| 장기차입금 | 8,000 | 8,000 | 20,000 | 8,000 | - |
| 현금성자산 | 27,246 | 30,346 | 40,841 | 28,511 | - |
| 차입금의존도 | 48.89% | 47.23% | 40.12% | 14.37% | 16.77% |
| 출처) 당사 정기보고서 및 한국은행 기업경영분석(2023) |
| 주1) 업종평균은 한국은행 2023년 기업경영분석 C21(의료용 물질 및 의약품) 기준으로 작성하였습니다. |
| 주2) 현금성자산은 현금및현금성자산과 단기금융상품을 합한 금액입니다. |
당사의 부채비율은 별도기준으로 2022년말 20.55%, 2023년말 66.69%, 2024년말 97.94%, 2025년 1분기 100.93%로 나타났습니다. 2022년의 경우 3,583백만원의 매출액과 11,406백만원의 당기순손실을 기록하였으나 2021년 07월 기업공개를 통해 조달한 48,110백만원의 자본 확충 영향으로 자본총계 46,171백만원을 기록한 반면, 부채의 경우 은행차입금 8,000백만원 등으로 부채총계 9,487백만원을 기록하며 낮은 수준의 부채비율 20.55%을 기록하였습니다.
다만, 2023년 06월 20,000백만원 규모의 제1회 전환사채를 발행하며 부채비율이 크게 증가하여 66.69%를 기록하였습니다. 2024년의 경우 14,886백만원의 당기순손실이 발생함에 따라 자본총계가 전년 대비 28% 감소함에 따라 부채비율은 97.94%까지 증가하였습니다.
2025년 1분기 기준 4,126백만원의 당기순손실이 발생하며 자본총계가 감소하였으며, 이에 부채비율은 110.10%까지 증가하였습니다.
한편, 당사의 차입금의 규모를 살펴보면 2022년은 은행차입금 8,000백만원으로 차입금의존도는 14.64%로 매우 낮은 편이었으나, 2023년의 경우 주요 파이프라인의 연구개발 관련 비용 등을 충당하기 위해 06월 28월 20,000백만원 규모의 제1회 전환사채를 발행하며 차입금의존도가 37.00%까지 증가하였습니다. 2024년의 경우, 떼아 오픈이노베이션과 2021년 10월 체결한 당뇨병성 황반부종 및 습성 환반병성 치료제 CU06에 대한 기술이전 계약에 대한 해지 및 권리반환 통보로 인해 계약자산 감소 등 자산총계가 감소하며 차입금의존도는 47.88%까지 증가하였습니다.
2025년 1분기는 사채권자의 전환청구 700백만원이 발생하며 1CB 잔액은 19,300백만원으로 소폭 감소하였지만 자산총계 감소 폭이 더 큼에 따라 차입금의존도는 48.89%를 기록하였습니다. 이후 2025년 04월 22일 300백만원이 추가 전환되었으며,2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준, 1CB 잔액은 4,200백만원입니다. 당사가 현재까지 발행한 전환사채의 상세 내역은 다음과 같습니다.
| [전환사채 발행 개요] |
| 구분 | 제1회 무기명식 이권부 무보증 사모 전환사채 |
|---|---|
| 액면가액 | 20,000백만원 |
| 현재 잔액 | 4,200백만원 |
| 이자지급조건 | 표면금리 0% |
| 만기보장수익률 | 3% |
| 발행일 | 2023.06.28 |
| 만기일 | 2028.06.28 |
| 전환비율 | 100% |
| 전환시 발행할 주식 | 기명식 보통주식 |
| 전환가액 | 주당 7,397원 |
| 전환가능주식수 | 567,797주 |
| 전환청구기간 | 2024.06.28~2028.05.28 |
| 투자자의 조기상환청구권 (Put Option) |
2025년 06월 28일 및 이후 매 3개월에 해당되는 날에 사채의 전자등록금액의전부 또는 일부에 대하여 만기 전 조기상환 청구 가능 |
| 발행자의 매도청구권 (Call Option) |
2024년 06월 28일부터 전환사채의 일부(최대 20%)에 대하여 발행회사 또는 발행회사가 지정하는 제3자에게 매도하도록 청구 가능. |
| 출처) 당사 제시 및 정기보고서 |
| 주) 증권신고서 제출 전일 기준입니다. |
당사의 2025년 1분기 기준 총 차입금 내역은 다음과 같습니다.
| [총 차입금 상세 내역] | |
| (K-IFRS, 별도) | (단위 : 백만원) |
| 구 분 | 차입처 | 차입 목적 | 차입일 | 만기일 | 이자율 (표면이자율/만기이자율) |
2025년 1분기 |
|---|---|---|---|---|---|---|
| 은행차입금 | 하나은행 | 시설자금대출 | 2021.12.29 | 2026.01.29 | CD(3M) + 1.64% | 8,000 |
| 1CB | 하나증권(주) 외 | 오픈 이노베이션, 혁신신약 임상연구 등 연구개발비 투자 | 2023.08.04 | 2028.08.04 | 0%/3% | 19,300 |
| 합계 | 27,300 | |||||
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 전환사채의 경우 투자자의 이해를 돕기 위해 전자등록총액으로 작성하였습니다. |
| 주2) 1CB 잔액의 경우, 2025년 04월 22일 300백만원이 추가 전환되었으며, 2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원입니다. |
한편, 이자보상배율의 경우 영업활동을 통해 벌어들인 이익으로 차입금에 대한 이자비용을 감내할 수 있는지를 확인할 수 있는 지표로서 활용됩니다. 당사의 이자보상배율 관련 현황은 다음과 같습니다.
| [이자보상배율 현황] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 비고 |
|---|---|---|---|---|---|
| 영업수익 | 0 | 1,633 | 10,294 | 3,583 | - |
| 영업비용 | 3,649 | 14,267 | 20,803 | 15,565 | - |
| 영업비용율 | - | 8.74% | 2.02% | 4.34% | 영업비용 ÷ 영업수익 |
| 영업이익(손실) | (3,649) | (12,635) | (10,508) | (11,982) | - |
| 영업이익률 | - | -7.73% | -1.02% | -3.34% | 영업이익(손실) ÷ 영업수익 |
| 자산총계 | 55,835 | 59,288 | 69,782 | 55,657 | - |
| 이자비용 | 653 | 2,455 | 1,347 | 300 | - |
| 이자보상배율(배) | (5.58) | (5.15) | (7.80) | (39.95) | 영업이익(손실) ÷ 이자비용 |
| 이자비용 부담률 | - | 150.36% | 13.09% | 8.37% | 이자비용 ÷ 영업수익 |
| 차입금 총계 | 27,300 | 28,000 | 28,000 | 8,000 | - |
| 차입금 평균이자율 | 2.39% | 8.77% | 4.81% | 3.75% | 이자비용 ÷ 차입금 총계 |
| 차입금 의존도 | 48.89% | 47.23% | 40.12% | 14.37% | 차입금 총계 ÷ 자산총계 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 차입금 총계는 기발행 전환사채의 미상환잔액(권면금액기준) 및 은행 차입금의 합입니다. |
| 주2) 1CB 잔액의 경우, 2025년 04월 22일 300백만원이 추가 전환되었으며, 2025년 05월 28일 14,800백만원을 추가 상환함에 따라 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원입니다. |
당사의 영업수익은 프랑스 안과 전문회사 떼아 오픈이노베이션으로부터의 마일스톤 유입에 따른 것으로, 2021년 10월 CU06 기술이전에 성공하며 계약금(Upfront) 6,300백만원을 수취하여 매출로 인식되었으며, 진행률에 따라 수익을 추가로 인식하며 2022년 영업수익은 3,583백만원을 기록하였습니다.
2023년에는 기술이전 계약에 따라, CU06의 임상2상 시험, 비임상시험 및 CMC(Chemistry, Manufacturing and Controls)에 필요한 외주 용역 비용의 보상을 받을 뿐만 아니라, 이 과정을 수행하는 데 소요되는 동사의 전문 인력의 인건비 및 간접 비용 등 서비스 비용도 떼아 오픈이노베이션으로부터 지급받았으며, 이를 모두 수익으로 인식하며 10,294백만원의 영업수익을 기록하였습니다.
다만, 2024년 05월 떼아 오픈이노베이션으로부터 경구용 망막 질환 치료제인 CU06의 기술이전 계약해지 및 권리반환 통보를 받았으며 마일스톤 유입이 제한됨에 따라 매출이 급감하며 1,633백만원을 기록하였습니다.
당사는 신약 연구 및 개발하는 바이오벤처기업으로 신약개발로 인한 임상 비용 및 연구인력 인건비 등의 비중이 큰 편으로, 영업손실은 2022년 11,932백만원, 2023년 10,508백만원, 2024년 12,635백만원, 2025년 1분기 3,649백만원이 발생하였으며, 이자비용의 경우 2022년 300백만원, 2023년 1,347백만원, 2024년 2,455백만원, 2025년 1분기 663백만원이 발생하였습니다. 당사의 이자보상배율은 지속적으로 1배 미만을 기록하고 있으며, 영업을 통해 손실이 지속적으로 발생하고 있어 이자비용을 충당하지 못하는 상황입니다. 특히 2023년 20,000백만원 규모의 1CB 발행으로 이자비용 부담이 커졌습니다. 이는 당사의 채무상환능력이 취약하다는 것을 나타내며, 미미한 매출 수준으로 인해 영업 적자가 심화되고 있음에 기인합니다.
당사의 경우 단기차입금 비중이 낮아 단기적으로 수익성이 급격히 악화되거나, 지정학적 리스크 및 트럼프 정부의 극단적인 정책 변경 등의 글로벌 금융시장의 급격한 변화가 발생하여 금융기관으로부터 차입금의 상환 요구가 발생하거나 계획대로 만기연장이 이루어지지 않을 경우 당사의 유동성 위기가 발생할 가능성은 낮은 편이지만,당사의 예상과는 달리 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등과 더불어 예상치 못한 사유로 수익성 개선 시기가 지연되거나, 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 지속적으로 이자보상배율이 1배를 하회할 수 있습니다. 향후 지속적으로 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다.
한편, 기발행 1CB의 경우 사채권자의 전환청구 1,000백만원과 당사가 14,800백만원을 사채권자에게 상환하며 증권신고서 제출 전일 기준 1CB 잔액은 4,200백만원까지 감소하였으며, 이에 이자비용 및 부채비율 감소 등의 재무구조가 개선되었습니다. 다만, 14,800백만원 상환 등과 같은 대규모 현금유출은 당사의 현금유동성을 고려하였을 때 유동성 악화로 이어질 수 있으며, 당사가 계획했던 보유 파이프라인별 임상 진행 단계에 따른 기술이전 계약 및 로열티 수취 시기 지연 등 수익성 개선 시기가 지연되거나, 금번 진행하는 유상증자의 중점심사 대상에 지정되었기 때문에 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
|
마. 현금흐름 관련 유동성 위험 이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속 능력에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 최근 3년 및 2025년 1분기 지속적인 당기순손실 발생 등의 영향으로 음(-)의 영업활동현금흐름을 보이고 있으며, 당사가 보유하고 있는 현금을 단기금융상품 취득 및 처분 등으로 운용하면서 지속적으로 변동하고 있는 상황으로 음(-)과 양(+)의 투자활동현금흐름을 보이고 있습니다. 재무활동현금흐름의 경우, 2023년 06월 전환사채 발행 등으로 양(+)의 재무활동현금흐름을 기록했습니다. 당사의 최근 3개년 및 2025년 1분기 요약 현금흐름 추이는 다음과 같습니다.
| [주요 현금흐름 추이] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구 분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 1. 영업활동현금흐름 | (3,058) | (9,508) | (9,393) | (11,237) |
| 영업활동으로부터 창출된 현금흐름 | (3,554) | (10,106) | (9,583) | (11,407) |
| 이자수취(영업) | 701 | 1,044 | 665 | 447 |
| 법인세납부(환급) | (97) | (43) | (41) | 13 |
| 이자지급(영업) | (108) | (404) | (434) | (290) |
| 2. 투자활동현금흐름 | 1,342 | (29) | (6,036) | 8,436 |
| 투자활동으로 인한 현금유입액 | 26,365 | 50,547 | 59,164 | 57,351 |
| 단기금융상품의 감소 | 26,365 | 50,540 | 49,000 | 25,000 |
| 장기금융상품의 감소 | 0 | 0 | 0 | 31 |
| 기타투자자산의 감소 | 0 | 0 | 10,139 | 32,029 |
| 보증금의 감소 | 0 | 6 | 14 | 259 |
| 유형자산의 처분 | 0 | 0 | 12 | 32 |
| 투자활동으로 인한 현금유출액 | (25,022) | (50,576) | (65,200) | (48,915) |
| 장단기금융상품의 증가 | (25,000) | (48,905) | (57,000) | (20,000) |
| 기타투자자산의 증가 | 0 | 0 | (7,000) | (25,300) |
| 장기선급금의 감소(증가) | (21) | 35 | 71 | (48) |
| 유형자산의 취득 | (1) | (248) | (120) | (3,411) |
| 무형자산의 취득 | 0 | (70) | (9) | (135) |
| 보증금의 증가 | 0 | 0 | 0 | (21) |
| 3. 재무활동현금흐름 | (15) | 59 | 19,804 | 662 |
| 재무활동으로 인한 현금유입액 | 0 | 115 | 19,853 | 736 |
| 전환사채의 증가 | 0 | 0 | 19,797 | 0 |
| 주식선택권의 행사 | 0 | 115 | 56 | 736 |
| 재무활동으로 인한 현금유출액 | (15) | (55) | (49) | (74) |
| 리스부채의 상환 | (15) | (55) | (49) | (74) |
| 현금및현금성자산에 대한 환율변동효과 | (5) | 619 | (45) | 209 |
| 현금및현금성자산의순증가(감소) | (1,731) | (9,478) | 4,375 | (1,931) |
| 기초현금및현금성자산 | 3,982 | 12,841 | 8,511 | 10,442 |
| 기말현금및현금성자산 | 2,246 | 3,982 | 12,841 | 8,511 |
| 출처) 당사 정기보고서 |
당사는 2022년 별도기준 11,407백만원의 당기순손실이 발생하며 11,237백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 경우 금융상품 성격의 단기금융상품(정기예금 등), 기타투자자산(MMF 투자상품 등) 등을 처분하며 8,436백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 주식선택권 행사 736백만원 등이 발생하며 662백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라 2022년말 기준 8,511백만원의 현금및현금성자산을 보유하게 되었습니다.
2023년은 별도기준 11,586백만원의 당기순손실이 발생하였으며 9,393백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 경우 금융상품 성격의 단기금융상품 및 기타투자산의 순취득 4,861백만원이 발생하며 6,036백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 제1회 전환사채 20,000백만원 발행 등으로 19,804백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라 2023년말 기준 12,840백만원의 현금및현금성자산을 보유하게 되었습니다.
2024년은 별도기준 14,886백만원의 당기순손실이 발생하였으며, 이자수취 1,044백만원 등의 영향으로 9,508백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,635백만원에도 유형자산 취득 248백만원 및 무형자산 취득 70백만원 등이 발생하며 29백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 주식선택권 행사 115백만원 및 리스부채 상환 55백만원 등의 영향으로 59백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 따라, 2024년말 기준 3,982백만원의 현금및현금성자산을 보유하게 되었습니다.
2025년 1분기 4,126백만원의 당기순손실이 발생하였으며, 이자수취 701백만원 등의 영향으로 3,058백만원의 음(-)의 영업활동현금흐름을 보였습니다. 투자활동현금흐름의 금융상품 성격의 단기금융상품 및 기타투자산의 순처분 1,365백만원의 영향으로 1,342백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 리스부채 상환 15백만원이 발생하며 15백만원의 음(-)의 현금흐름이 발생하였습니다. 이에 따라, 2025년 1분기 기준 2,246백만원의 현금및현금성자산을 보유하게 되었습니다.
한편, 당사의 유동비율은 최근 3개년 감소하는 추세입니다. 2022년에는 2021년 07월 기업상장을 통한 자금을 조달하며 현금성자산 28,511백만원(현금및현금성자산 8,511백만원 + 단기금융상품 20,000백만원)을 보유하고, 기타 금융부채 1,259백만원 외 보유 차입금이 존재하지 않아 유동비율은 2,437.23%를 기록하였습니다. 2023년에는 장기차입금 8,000백만원, 기타 금융부채 2,060백만원의 영향으로 유동부채가 증가하며 유동비율은 436.16%를 기록하였습니다. 2024년에는 기발행 제1회 전환사채의 만기일이 1년 이내로 다가오며 유동부채로 재분류 됨에 따라 유동부채가 전년대비 106% 증가하였으며, 이에 유동비율은 154.47%를 기록하였습니다.
2025년 1분기에는 비유동 장기차입금으로 분류되어있던 장기차입금이 유동 장기차입금으로 재분류됨에 따라 유동부채가 전년대비 37% 증가하였으며, 이에 유동비율은 100.93%를 기록하였습니다.
| [당사의 최근 3개년 및 2025년 1분기 유동성 관련 비율] |
| 구분 | 2025년 1분기 | 2024년 | 2023년 | 2022년 | 비고 |
|---|---|---|---|---|---|
| 유동비율 | 100.93% | 154.47% | 436.16% | 2,437.23% | 유동자산÷유동부채 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 2025년 03월 05일자로 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍을 흡수합병하기로 결정하였으며, 합병기일 2026년 01월 28일로 주요사항보고서(회사합병결정)를 공시하였습니다. 당사는 대성팜텍을 흡수합병함에 따라, 매출 안정화를 도모하고 있으며 연구개발 인프라 통합을 통한 비용 절감 효과도 기대할 수 있을 것으로 판단됩니다. 또한, 2024년 실적 악화의 주요 원인이 떼아 오픈이노베이션과의 기술이전 계약 중단에 따른 마일스톤 수익 감소와 연구개발비 지출에 있지만, 단기적으로 대성팜텍 합병을 통한 매출 안정성을 확보하고 중장기적으로 보유 파이프라인들의 기술이전 계약 성사 여부가 당사의 성장 동력으로 작용할 것으로 판단됩니다.
현 시점에서 당사가 계획 중인 주요 연구개발비 등을 충당하기에는 그 규모가 부족할 것으로 생각되며, 영업수지상 음(-)의 현금흐름이 발생할 것으로 예상하고 있습니다. 이에 본 유상증자 등의 재무활동을 통해 당사 운영자금 등을 조달하고자 합니다. 단, 재무활동을 통해서도 목표 자금을 조달하지 못한다면 당사에 유동성 위기가 생길 수 있고, 영업활동을 영위해나가는데 상당한 제약이 생길 수 있습니다.
| [하단의 자금수지계획에 따른 유의사항] |
| 하단의 내용은 증권신고서 제출일 현재 기준 당사 자금수지계획을 참고 목적으로 기재한 것으로써, 이는 미래에 대한 당사의 주관적 판단이 개입되었을 수 있고, 향후 실제 이행 결과와는 상이할 수 있습니다. 투자자 여러분들께서는 하단의 계획은 당사의 전망과 예상, 주관적 판단 등에 따른 것임을 반드시 유의하여 주시기 바랍니다. |
금번 유상증자 대금 납입 이후 1년(2025년 3분기 ~ 2026년 2분기)간의 예상현금흐름표는 다음과 같습니다. 실질적으로, 해당 기간 동안 Cash-In이 될 항목은 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금 27,995백만원(예정발행가액 기준, 발행제비용 제외)과 보유하고 있는 현금성 자산에 의한 이자수익과 영업활동으로 인한 매출 등 밖에 없습니다. 이와 반대로 당사의 매출이 본격적으로 성장궤도에 올라 수익성이 확보되기 전까지는 사업특성상 연구개발자금 및 인건비, 지급수수료 등 운영경비 자금이 지속적으로 유출될 것으로 예상하고 있습니다.
당사의 주요 파이프라인 중 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06에 대해 2021년 10월 27일 떼아 이노베이션과 기술이전 계약을 체결하며 계약금(Upfront) 6백만불(6,255백만원)을 수취하여 매출액으로 부분 인식하였습니다. 다만, 2024년 05월 16일자로 떼아 오픈이노베이션으로부터 기술이전 계약해지 및 권리반환 통보를 받았으며, 2024년 07월 12일 최종 기술이전 계약이 해지되었습니다. 계약이 종료되더라도 당사가 떼아 오픈이노베이션으로부터 이미 수령한 계약금과 연구개발 비용은 반환의무가 발생하지 않지만 향후 마일스톤 유입이 제한되었습니다.
당사 계획과 달리 IPO 이후 증권신고서 제출 전일 기준 CU06 외에 기술이전 계약은 없었으며, CU06 또한 2024년 05월 16일부로 기술이전 계약해지 및 권리반환으로 인해 향후 마일스톤 유입에 따른 매출 성장세가 정체되는 모습이 예상됩니다. 이러한 추세가 지속될 경우 재무적 부담이 가중될 가능성이 있습니다. 다만, 당사는 합병기일 2026년 01월 28일로 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍을 흡수합병하기로 결정하였으며, 대성팜텍은 2025년 1분기 기준 매출액은 1,108백만원, 영업이익 34백만원을 기록하였으며, 단순 연환산 시 매출액 4,432백만원, 영업이익 136백만원이 예상됩니다. 이를 통해 당사의 재무건전성을 강화하고 안정적인 수익 기반을 마련할 수 있을 것으로 보입니다.
특히, 금번 유상증자를 통한 자금이 납입된 이후 매출 성장세가 회복되지 않을 시 유동성 리스크를 완화하기 위해 비용 효율성을 극대화하고, 판관비 및 연구개발비 등 운영비를 축소하는 한편, 인건비 조정 및 추가 자금 조달 방안을 검토할 예정이며, 향후 추가적인 자본시장을 활용한 자금조달을 시행해야할 가능성이 있고, 이 경우 기존 주주들의 지분 희석 리스크가 발생할 수 있습니다. 당사는 유동성 리스크를 면밀히 모니터링하며, 재무 건전성을 유지하고 유동성 위기를 사전에 방지하기 위해 최선의 노력을 기울일 계획입니다.
| [당사의 유상증자 대금 납입 이후 1년간의 자금수지 예상] |
| (단위: 백만원) |
| 구분 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | ||
|---|---|---|---|---|---|---|
| 영업현금흐름 | 수입(A) | 매출대금 | 75 | 225 | 1,667 | 2,500 |
| 기타 | - | - | - | - | ||
| 소계 | 75 | 225 | 1,667 | 2,500 | ||
| 지출(B) | 원재료 구입/외주가공비 | 73 | 218 | 1,500 | 2,250 | |
| 급여 | 1,170 | 1,170 | 1,239 | 1,244 | ||
| 판매관리비 | 569 | 546 | 559 | 559 | ||
| 경상연구비 | 3,700 | 6,152 | 3,108 | 1,255 | ||
| 기타 | 200 | 600 | ||||
| 소계 | 5,712 | 8,686 | 6,406 | 5,308 | ||
| 영업수지(= A - B ) | (5,637) | (8,461) | (4,739) | (2,808) | ||
| 투자현금흐름 | 수입(C) | 자산매각 | - | - | - | - |
| 기타 | - | - | - | - | ||
| 소계 | - | - | - | - | ||
| 지출(D) | 연구개발투자 | - | - | - | - | |
| 해외법인 투자 | - | - | - | - | ||
| 기타 | - | - | - | - | ||
| 소계 | - | - | - | - | ||
| 투자수지(= C - D ) | - | - | - | - | ||
| 재무현금흐름 | 수입(E) | 유상증자 | 27,995 | - | - | - |
| 기타 | - | - | - | - | ||
| 소계 | 27,995 | - | - | - | ||
| 지출(F) | 차입금 상환 | - | - | - | - | |
| 이자비용 | 122 | 122 | 122 | 122 | ||
| CB, BW 상환 | - | - | - | - | ||
| 기타 | - | - | - | - | ||
| 소계 | 122 | 122 | 122 | 122 | ||
| 재무수지(= E - F ) | 27,873 | (122) | (122) | (122) | ||
| 기초 자금 | 11,895 | 34,131 | 25,548 | 20,687 | ||
| 기말 자금 | 34,131 | 25,548 | 20,687 | 17,757 | ||
| 출처) 당사 제시 |
| 주1) 상기 예상현금흐름표는 증권신고서 제출 전일 기준으로 예상된 현금흐름표이므로, 향후 변동될 가능성이 있으므로 참고하여 주시기 바랍니다.(유상증자 예상 대금 27,995백만원(예정발행가액 기준, 발행제비용 제외) 가정) |
| 주2) 보유 파이프라인의 L/O는 발생하지 않는 것으로 가정하였습니다. |
| 주3) 신규 사업(원료의약품 수입 및 도소매업) 관련 실적은 최대한 보수적으로 산정하였습니다. |
영업현금흐름 중 2025년 3분기부터 4분기까지 발생하는 매출대금 300백만원은 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 신규 사업 진출을 계획 중인 원료의약품 유통사업 관련 매출입니다. 이는 당사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
또한, 2026년 1분기부터는 원료의약품(API) 개발 및 유통 전문기업인 (주)대성팜텍 흡수합병을 통한 매출이 발생할 것을 반영하여 2026년 1분기, 2분기 각각 1,667백만원, 2,500백만원의 매출대금을 예상하고 있습니다. 다만, 당사의 계획과 달리 신규 사업 매출대금 300백만원 및 흡수합병을 통한 매출대금 4,167백만원이 발생하지 않는다면 추가적인 자금조달이 필요할 수 있으며, 추가적인 자금조달을 못할 경우에는 재무적인 불확실성에 크게 노출될 수 있음을 의미합니다.
이처럼 당사가 제시한 향후 1년간의 매출대금 4,167백만원은 신규 사업(원료의약품 유통사업 진출) 및 흡수합병(읜료의약품(API) 개발 및 유통)을 통해 발생할 매출을 보수적으로 가정하여 산정된 수치이며, 실제 결과치와 상이할 가능성이 있습니다. 따라서 당사의 재무적 불확실성은 지속적으로 존재하는 상황이니 투자자께서는 이 점 유의하시기 바랍니다.
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속 능력에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 바. 기술도입계약 및 공동연구개발 계약에 따른 손익규모 변동 위험 당사는 난치성 혈관내피기능장애 관련 질환의 First-in-Class 치료제를 개발하는 회사로, 사내외 연구역량을 활용하여 신약 후보물질 발굴부터 임상시험을 진행하고 특정 임상시험 단계에서 기술이전을 하여 수익을 창출하고자 합니다. 당사는 CU06(혈관내피기능장애), CU01(당뇨병성 신증), CU05(폐암) 파이프라인에 대한 특허기술 양도 계약, CU03(습성 황반변성) 파이프라인에 대한 전용실시권 계약을 통해 기술을 도입한 바 있습니다. 또한, 당사는 광주과학기술원, 경북대학교, 한국과학기술원과 CU02(NASH/비만) 파이프라인에 대한 공동연구개발 계약을 체결한 사실이 있습니다. 당사는 계약 조건에 따라 선급 계약금, 마일스톤 기술료, 경상기술료 및 성공기술료를 계약상대방에게 지급할 의무가 발생할 수 있으며 이와 같은 수익 배분의무는 당사의 수익성 및 재무성과에 부정적인 영향을 줄 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 난치성 혈관내피기능장애 관련 질환의 First-in-Class 치료제를 개발하는 회사로, 사내외 연구역량을 활용하여 신약 후보물질 발굴부터 임상시험을 진행하고 특정 임상시험 단계에서 기술이전을 하여 수익을 창출하고자 합니다. 당사는 CU06(혈관내피기능장애), CU01(당뇨병성 신증), CU05(폐암) 파이프라인에 대한 특허기술 양도 계약, CU03(습성 황반변성) 파이프라인에 대한 기술실시 계약 체결을 통해 기술을 도입한 바 있습니다.
| [파이프라인별 기술도입 계약 현황] |
| 품 목 | 계약 상대방 (국적) |
대상지역 | 계약체결일 | 계약종료일 | 계약의 목적 및 내용 | 총계약금액 | 지급금액 | 비고 |
|---|---|---|---|---|---|---|---|---|
| CU06 | 연세대학교 산학협력단(한국) |
전세계 | 2019.04.12 | 2030.10.29 | 특허기술 양도 | 주1) | 주1) | 경상기술료 별도 |
| CU01 | 경북대학교 산학협력단, 경북대학교병원(한국) |
전세계 | 2017.02.01 | 2033.02.13 | 특허기술 양도 | 주1) | 주1) | 경상기술료 별도 |
| CU03 | 한국한의학연구원(한국) | 전세계 | 2017.03.21 |
특허권 만료일 (2035.05.21) 또는 제품출시후 10년 중 더 늦은 기간 |
특허기술 실시계약 (전용실시권) |
주1) | 주1) | 경상기술료 별도 |
| CU05 | 연세대학교 산학협력단(한국) |
전세계 | 2017.02.03 | 2035.06.29 | 특허기술 양도 | 주1) | 주1) | 경상기술료 별도 |
| 출처) 당사 정기보고서 |
| 주1) 계약 세부 내용의 경우 영업기밀에 해당하므로 기재하지 않았습니다. |
상기 기술도입 계약에 대한 품목별 주요 사항은 아래와 같습니다.
| [특허기술양도 및 특허기술 실시계약 주요 사항] |
| 구분 | CU06 | CU01 | CU03 | CU05 |
|---|---|---|---|---|
| 계약상대방 | 연세대 산학협력단 | 경북대 산학협력단, 경북대학교병원 |
한국한의학연구원 | 연세대 산학협력단 |
| 계약내용 | 특허 양수도 계약에 따라 큐라클이 신약후보물질 CU06-1004 물질특허권리를 양도 받고 임상시험, 허가, 생산, 상업화를 진행 | 특허 양수도 계약에 따라 CU01 용도 특허권리를 양도 받고 임상시험, 허가, 생산, 상업화를 진행 | 특허 전용실시권 계약에 따라 독점권 물질 특허 권리를 양도 받고 임상시험, 허가, 생산, 상업화를 진행 | 특허 양수도 계약에 따라 용도 특허권리를 양도 받고 비임상 후보물질 도출연구 진행 |
| 대상지역 | 전세계 | 전세계 | 전세계 | 전세계 |
| 계약체결일 | 2019.04.12 | 2017.02.01 | 2017.03.21 | 2017.02.03 |
| 계약종료일 | 2030.10.29 | 2033.02.13 |
특허권 만료일 (2035.05.21) 또는 제품출시후 10년 중 더 늦은 기간 |
2035.06.29 |
| 총 계약금액 | 주1) | 주1) | 주1) | 주1) |
| 지급금액 | 주1) | 주1) | 주1) | 주1) |
| 계약조건 | 매출 발생에 대한 로열티 수취 | 매출 발생에 대한 로열티 수취 | 매출 발생에 대한 로열티 수취 | 매출 발생에 대한 로열티 수취 |
| 회계처리방법 | 기술료는 향후 발생 시 인식 | 기술료는 향후 발생 시 인식 | 기술료는 향후 발생 시 인식 | 기술료는 향후 발생 시 인식 |
| 대상기술 | 신규 혈관누출 차단제, 당뇨병성 황반부종 치료제 | 만성 신장 질환 포함 당뇨병성 신증 치료제 | 습성 황반변성 치료제 및 당뇨망막병증 치료제 | 항암제(췌장암, 대장암, 삼중음성유방암 등) |
| 개발 진행경과 | 당뇨병성 황반부종 임상2a상 완료 (미국) | 임상2b상 진행 중(한국) | 임상2a상 완료(한국) | 후보물질 최적화 중 |
| 출처) 당사 정기보고서 |
| 주1) 양사 합의 의해 계약 규모는 미공개 처리하였습니다. |
당사는 특허 양수도 계약 및 특허 전용실시권 계약에 따라 특허 권리를 양도 받고 임상시험, 허가, 생산, 상업화를 진행합니다. CU06 파이프라인의 경우 선급기술료가 존재하지 않아 기술도입처로 지급된 금액은 없지만, 향후 개발성공금(마일스톤 기술료)과 순매출액의 일정부분을 경상기술료로 지급해야 합니다. 또한, 당사는 CU01, CU05 및 CU03 파이프라인에 대해 계약 체결 후 계약상대방에게 선급기술료를 지급한 사실이 있으며 향후 각 계약에 따라 경상기술료를 지급하게 될 경우가 발생할 수 있습니다.
한편, 당사는 NASH/비만 파이프라인인 CU02 파이프라인과 관련하여 광주과학기술원, 경북대학교, 한국과학기술연구원과 공동연구개발 계약을 체결한 바 있습니다. 하지만, 신약 개발 및 경쟁 상황과 규제 기준을 고려하였을 때 글로벌 경쟁력을 갖추기가 쉽지않다고 판단하여 2024년 03월 05일자로 계약을 종료하였으며, 기술이전 반환하였습니다. CU02 파이프라인 관련 자세한 내용은 다음과 같습니다.
| [공동연구개발 계약 주요 사항] |
| 구분 | CU02 |
|---|---|
| 계약상대방 | 광주과학기술원, 경북대학교, 한국과학기술연구원 |
| 계약내용 | 공동 연구개발 계약에 따라 CU02의 후보물질 도출연구 공동 진행 |
| 대상지역 | 전세계 |
| 계약체결일 | 2017.08.25 |
| 계약종료일 | 2024.03.05 |
| 총 계약금액 | 주1) |
| 지급금액 | 주1) |
| 계약조건 | 매출 발생에 대한 로열티 수취 |
| 회계처리방법 | 기술료는 향후 발생 시 인식 |
| 대상기술 | 비알콜성 지방간염 치료제 |
| 개발 진행경과 | 기술이전 반환 |
| 출처) 당사 정기보고서 |
| 주1) 양사 합의 의해 계약 규모는 미공개 처리하였습니다. |
당사는 2022년에 설립된 항체치료제 개발기업 주식회사 맵틱스와 2023년 06월 업무협약(MOU) 및 2024년 07월 공동 연구개발 계약을 체결하였으며, 현재 항체 파이프라인 8개를 확보한 상태입니다. 당사와 맵틱스는 Tie2 활성화 항체 기반인 MT-101(급성 신송한, 만성 신부전) 및 이중항체 MT-103(당뇨병성 황반부종, 당뇨 망막병증, 습성 황반변성) 등에 대한 공동 연구 및 개발 협업을 진행 중에 있습니다. 상장 당시 7개에 그쳤던 파이프라인이 현재 맵틱스와 공동연구개발 중인 8개의 파이프라인 포함 총 15개까지 파이프라인이 대폭 확대되었습니다. 당사와 맵틱스가 공동연구개발 중인 파이프라인 및 계약 주요 사항은 다음과 같습니다.
| [당사-주식회사 맵틱스의 공동연구개발 계약 주요 사항] |
| 구분 | MT-101 | MT-102 | MT-103 | MT-104 | MT-105 | MT-201 | MT-202 | MT-40X |
|---|---|---|---|---|---|---|---|---|
| 계약상대방 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 | 주식회사 맵틱스 |
| 계약내용 | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) | 주1) |
| 계약체결일 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 | 2024.07.01 |
| 계약종료일 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 | 공동연구개발이 종료되는 날 |
| 총 계약금액 | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) |
| 지급금액 | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) | 주2) |
| 계약목적 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 | 공동연구개발 |
| 적응증 | 급성 신손상, 만성신부전 | 습성 황반변성, 당뇨병성 황반부종, 당뇨 망막병증 | 중증하지허혈 | 고형암 | 염증성 장질환 | 염증성 혈전질환 | 급성 허혈성 뇌졸증 | 고형암 |
| 개발 진행경과 | 전임상 진행 중 | 전임상 진행 중 | 전임상 진행 중 | 후보물질 도출단계 | 선도물질 도출단계 | 후보물질 도출단계 | 후보물질 도출단계 | 유효물질 도출단계 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 대상 물질에 대한 연구개발비용과 수익금은 약정비율로 부담 및 배분합니다. |
| 주2) 양사 합의 의해 계약 규모는 미공개 처리하였습니다. |
향후 당사가 외부로부터 추가적인 기술도입계약 또는 공동연구개발 계약을 체결하는 경우, 계약상대방에게 계약체결에 따른 선급기술료 및 개발 단계에 따른 마일스톤 기술료 등을 지급해야 하므로 상당 규모의 자금이 추가로 소요될 수 있습니다. 기술도입계약 이후에도 후속 임상시험 진행을 위해서 추가적인 자금이 소요되며 제품 개발이 완료되더라도 해당 계약에 따라 매출의 일정부분을 계약상대방에게 경상기술료로 지급하여야 합니다. 또한, 파이프라인 도입 이후 신약 개발에 실패하는 경우 계약 조건에 따라 이미 계약상대방에게 지급한 자금에 대해서 반환 받지 못할 수 있으며, 당사가 임상 개발에 사용한 자금을 회수하지 못할 가능성이 존재합니다. 이처럼 기술도입 계약 조건에 따라 당사의 수익성 및 재무성과에 부정적인 영향을 줄 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 사. 분쟁에 따른 우발채무 등에 관한 위험 당사는 증권신고서 제출일 현재 당사의 영업에 중대한 영향을 미치는 소송 등의 분쟁 사항은 없습니다. 하지만 향후 당사 기술과 관련 특허권 분쟁, 핵심인력 유출입이 발생하거나, 임직원 및 관련자가 당사에 중대한 손해를 입히는 경우 등과 관련된 다양한 종류의 분쟁 또는 소송이 발생할 수 있습니다. 당사는 법률위반으로 인한 리스크를 회피하고자 주요 시점마다 회사의 영업활동에 관련된 법률검토 및 자문을 받고 있으며 담당 임직원에 대한 법률적 내부통제에 힘쓰고 있습니다. 다만 소송이나 분쟁, 예상치 못한 법률적 리스크가 발생할 경우 당사의 영업 및 재무구조에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이점 유의하시고 투자에 임하시길 바랍니다. |
당사는 증권신고서 제출일 현재 당사의 영업에 중대한 영향을 미치는 소송 등의 분쟁 사항은 없습니다. 하지만 향후 당사 기술과 관련 특허권 분쟁, 핵심인력 유출입이 발생하거나, 임직원 및 관련자가 당사에 중대한 손해를 입히는 경우 등과 관련된 다양한 종류의 분쟁 또는 소송이 발생할 수 있습니다.
당사는 법률위반으로 인한 리스크를 회피하고자 주요 시점마다 회사의 영업활동에 관련된 법률검토 및 자문을 받고 있으며 담당 임직원에 대한 법률적 내부통제에 힘쓰고 있습니다. 다만 소송이나 분쟁, 예상치 못한 법률적 리스크가 발생할 경우 당사의 영업 및 재무구조에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이점 유의하시고 투자에 임하시길 바랍니다.
| 아. 내부회계관리제도 및 내부통제 관련 위험 당사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 검토한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 코스닥 상장법인으로「주식회사 등의 외부감사에 관한 법률」(이하 '외감법')에 따라 신뢰할 수 있는 회계정보의 작성과 공시를 위해 내부회계관리규정 및 내부회계관리제도를 갖추고 있어야 합니다. 또한, 외부감사인은 당사의 내부회계관리제도 운영실태를 검토를 진행하여야 하며, 해당 결과는 감사보고서에 표명하도록 되어 있습니다. 최근 사업연도 기준 당사 외부감사인의 내부회계관리제도 검토 의견은 아래와 같습니다.
| [내부회계관리제도 검토의견] |
| 사업연도 | 감사인 | 감사의견 및 검토 의견 | 지적사항 |
|---|---|---|---|
| 제9기 (2024년) |
삼정회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 '내부회계관리제도 평가 및 보고 모범규준'제4장 '중소기업에 대한 적용'에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제8기 (2023년) |
삼정회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 '내부회계관리제도 평가 및 보고 모범규준'제4장 '중소기업에 대한 적용'에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제7기 (2022년) |
삼정회계법인 | 경영자의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영자의운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 '중소기업에 대한 적용'의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 출처) 당사 정기보고서 |
당사는 재무활동 건전성 및 타당성을 검토하고 내부회계관리제도 운영실태를 평가하며, 현 내부회계관리제도를 철저히 운영하여 외부감사인의 내부회계관리제도에 대한 의견을 받고 있습니다.
다만, 내부회계관리를 철저히 운영함에도 불구하고 회계처리 위반, 혹은 관련 임직원의 배임 및 횡령 등 발생으로 내부회계관리가 적절하게 운영되지 않을 경우 과태료 등의 법적 제재가 부과될 수 있습니다. 과태료 부과 시 법정최고금액에 과태료 예정금액 산정표에 따른 비율을 적용하여 예정금액을 산정하고, 가증, 감경하여 최종 과태료부과금액을 결정하고 있습니다.
특히, 이사 등 내부회계관리제도 운영 관련자가 회계정보를 내부회계관리제도에 의하지 아니하고 위조, 변조, 훼손 또는 파기한 사실이 확인되는 경우, 5년 이하의 징역 또는 5천만원 이하의 벌금이 부과될 수 있습니다.
또한, 코스닥시장 상장규정에 따라 내부회계관리제도 비적정 시 투자주의환기종목에 지정될 수 있으며(「코스닥시장 상장규정」제52조), 2년 연속 내부회계관리제도 비적정 의견을 받는 경우 상장적격성 실질심사에 따른 상장폐지 요건에 해당할 수 있습니다(「코스닥시장 상장규정」제56조).
종합적으로 당사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 검토한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 자. 신규상장 당시 추정 경영실적과 현재 실적의 높은 괴리율 위험 당사는 2021년 07월 22일에 기술성장기업으로 코스닥시장에 신규상장 하였으나, 상장 당시 추정손익과 달리 최근 3개년(2022년 ~ 2024년) 매출 등의 실적은 큰 차이를 보이고 있습니다. 당사는 상장 당시에 제시한 주요 파이프라인별 추정 손익과 실제 경영성과 간 괴리를 보이고 있습니다. 이는 당사의 사업계획 중 일부가 지연되거나 중단되었음을 의미하며, 이로 인해 향후 3개년(2025년 ~ 2027년)의 실적 역시 당사의 계획 대비 부진할 가능성이 존재합니다. 투자자께서는 당사의 2025년 사업계획 및 손익 역시 추정치와 높은 괴리를 보일 수 있음에 유의하시고 투자에 임하시기 바랍니다. |
당사는 2021년 07월 22일에 기술성장기업으로 코스닥시장에 신규상장 하였으며, 상장공모를 위한 증권신고서 상의 6개년(2019년 ~ 2024년) 추정 경영실적 세부내역은 다음과 같습니다.
| [상장 당시 공시한 추정 손익계산서] |
| (단위: 백만원) |
| 구분 | 2019년 | 2020년 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) |
|---|---|---|---|---|---|---|
| 매출액 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 매출원가 | 0 | 0 | 0 | 0 | 0 | 0 |
| 매출총이익 | 0 | 0 | 0 | 16,128 | 31,146 | 70,318 |
| 판매관리비 | 5,734 | 7,853 | 17,225 | 19,160 | 28,309 | 34,494 |
| 영업이익(손실) | (5,734 | (7,853) | (17,225) | (3,032) | 2,837 | 35,824 |
| 영업외수익 | 166 | 160 | 165 | 264 | 234 | 366 |
| 영업외비용 | 8,421 | 20,917 | 19 | 17 | 14 | 12 |
| 법인세비용차감전순이익(손실) | (13,989 | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 법인세비용 | 0 | 0 | 0 | 0 | 0 | 0 |
| 당기순이익(손실) | (13,989) | (28,610) | (17,079) | (2,784) | 3,057 | 36,177 |
| 출처) 당사 정기보고서 |
하지만, 상기 추정손익과 달리 최근 3개년(2022년 ~ 2024년) 매출 등의 실적은 아래와 같이 큰 차이를 보이고 있습니다.
| [추정손익과 현재 손익 비교] | |
| (K-IFRS, 연결) | (단위: 백만원) |
| 구분 | 2024년 | 2023년 | 2022년 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | 예측 | 실적 | 괴리액 | |
| 매출액 | 70,318 | 1,633 | (68,685) | 31,146 | 10,294 | (20,852) | 16,128 | 3,583 | (12,545) |
| 영업이익(손실) | 35,824 | (12,635) | (48,459) | 2,837 | (10,508) | (13,345) | (3,032) | (10,508) | (7,476) |
| 당기순이익(손실) | 36,177 | (14,886) | (51,063) | 3,057 | (11,586) | (14,643) | (2,784) | (11,586) | (8,802) |
| 출처) 당사 정기보고서 및 증권신고서 |
상기와 같이 당사는 매출액이 예측치 대비 괴리액이 2022년 12,545백만원, 2023년 20,852백만원, 2024년에는 68,685백만원 하회하고 있으며, 영업손실 또한 예측치 대비 크게 상이한 모습을 보이고 있습니다. 이처럼 당사는 상장 당시 매출 및 수익성 추정치와 현재 실적 간 차이가 큰 편에 속합니다. 상장 당시 주요 파이프라인별 추정 실적과 실제 매출액을 파이프라인별로 상세히 살펴보면 다음과 같습니다.
| [주요 파이프라인별 세부 추정 매출액과 현재 매출액 비교] |
| (단위: 백만원) |
| 구분 | 추정 매출 추정치 | 실제 매출 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 주요 파이프라인 | 기술료 구분 | 2021년(E) | 2022년(E) | 2023년(E) | 2024년(E) | 2021년 | 2022년 | 2023년 | 2024년 |
| CU06-RE (=CU06) |
Upfront | 0 | 8,227 | 0 | 3,835 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 10,970 | 13,712 | 0 | 3,583 | 10,294 | 1,633 | |
| CU01 | Upfront | 0 | 2,688 | 5,767 | 0 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 14,409 | 13,644 | 0 | 0 | 0 | 0 | |
| CU03 | Upfront | 0 | 5,213 | 0 | 11,184 | 0 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 0 | 27,944 | 0 | 0 | 0 | 0 | |
| Total | Upfront | 0 | 16,128 | 5,767 | 15,019 | 6,255 | 0 | 0 | 0 |
| Milestone | 0 | 0 | 25,379 | 55,300 | 0 | 3,583 | 10,294 | 1,633 | |
| 합계 | 0 | 16,128 | 31,146 | 70,318 | 6,255 | 3,583 | 10,294 | 1,633 | |
| 출처) 당사 정기보고서 및 증권신고서 |
2021년부터 2024년까지 당사의 주요 파이프라인별 추정 실적과 실제 매출액간 차이가 발생한 사유는 아래와 같습니다.
① CU06-RE(당뇨병성 황반부종 및 습성 황반변성 치료제)
당사의 주요 파이프라인 CU06-RE(=CU06)은 2021년 10월 떼아 오픈이노베이션에 기술 수출을 통해 당뇨병성 황반부종 및 습성 황반변성에 대한 아시아를 제외한 전세계 지역에 대한 판권을 이전하였습니다. 이에 따른 계약금(Upfront) 6백만불을 수취하였으며, 당시 환율을 적용하여 2021년 6,255백만원을 매출액으로 인식하였습니다. 이후 원가투입법기준 진행률에 따라 기간에 걸쳐 수익을 인식하였으며, 임상2상 시험, 비임상 시험 및 CMC(Chemistry, Manufacturing and Controls)에 필요한 외주 용역 비용의 보상을 받을 뿐만 아니라, 이 과정을 수행하는데 소요되는 임상연구비용 및 제반비용 등을 수익으로 인식함에 따라 2022년, 2023년 각각 3,583백만원, 10,294백만원의 매출액을 기록하였습니다.
CU06의 경우 상용화 시점을 앞당기고자 글로벌 파트너사인 떼아 오픈이노베이션과 협력하여 개발을 진행해왔습니다. 그러나 개발 과정에서 1) 임상 결과의 종합적 분석, 2) 인허가 전략 수립, 3) 글로벌 규제 대응 등 복합적인 절차가 추가로 요구되면서 당초 계획했던 상업화 일정이 조정되었습니다. 이로 인해 기술이전 마일스톤 수익 또한 예정된 시점에 인식되지 못하여, 기존 IPO 당시 제시했던 예상 매출 실적과 차이가 발생하게 되었습니다.
그동안 다수의 글로벌 제약사와 아시아 지역 판권에 대한 기술이전 협의를 진행하였으나, 계약 조건에 대한 이견으로 최종 계약에 이르지는 못했습니다. 이후 2024년 07월, 떼아 오픈이노베이션으로부터 글로벌 판권 전체를 반환받게 됨에 따라, 당사는 모든 권리를 통합적으로 확보하게 되었습니다. 이를 계기로 사업 전략을 수정하여, 이제는 CU06의 모든 적응증을 포함한 글로벌 판권 전체를 하나의 패키지로 기술이전하는 방안을 추진하며 보다 유리한 조건의 계약 체결을 위해 협의를 진행하고 있습니다. 기존의 단일 적응증 기술이전 전략에서 나아가, CU06(당뇨병성 황반부종 및 습성 황반변성 치료제)뿐만 아니라 적응증 확장 파이프라인인 CU104(궤양성 대장염) 및 CU106(면역항암제 병용요법)까지 동일한 핵심 작용기전을 가진 물질을 복수의 적응증으로 개발하고 있는 파이프라인들을 하나로 묶어 일괄로 기술이전하는 방식을 적극적으로 추진하고 있습니다.
② CU01(당뇨병성 신증 치료제)
당사는 IPO 당시 CU01의 글로벌 임상을 계획했으나, 최근 글로벌 시장에 출시된 당뇨병성 신증 치료제들의 대규모 임상 데이터를 분석한 후 보다 효율적인 방향으로 개발 전략을 수정했습니다. 실제로 바이엘의 케렌디아는 약 5,700명, SGLT-2 억제제 계열 약물들은 최대 6,600명의 환자를 대상으로 장기간 임상을 진행한 바 있습니다. 이러한 선행 사례는 CU01의 글로벌 허가 역시 수천 명 단위의 대규모 임상과 상당한 시간 및 비용이 요구됨을 시사하였고, 당사는 이를 고려하여 국내 임상에 우선 집중하는 것이 더 합리적이라고 판단했습니다.
CU01의 국내 임상의 경우 당뇨병성 신증에 대한 기존 임상 전례가 없었기 때문에 식품의약품안전처에서 임상 계획 변경을 권고로 기업공개 당시 계획했던 일정보다 지연되었습니다. 식품의약품안전처의 권고에 따라 당사는 당초 계획과 달리 CU01의 임상2b상과 임상3상의 분리 진행을 결정하였으며 2022년 07월 임상2b상 임상시험계획(IND)을 승인받고 2023년 02월 최초 환자를 등록하였습니다.
현재 국내 24개 주요 대학병원에서 약 240명의 환자를 대상으로 임상 2b상을 진행하고 있습니다. 2024년 의료계 집단행동의 여파로 임상시험기관의 환자 모집이 일시적으로 지연되는 어려움이 있었으나, 2025년 4월 모든 환자 모집을 완료하였습니다. 2025년 4분기 임상 종료가 예상되며, 확보된 데이터를 기반으로 기술이전 및 사업화 논의를 본격화할 계획입니다.
③ CU03(습성 황반변성 치료제)
CU03의 경우 약물의 특성 상 안구내 주사제와 병용투여 요법으로 개발 중인 약물로 단독으로 쓰이는 약물 대비 제한된 시장성을 가지며, 기존 주력 파이프라인인 CU06과 개발영역이 겹치고, 2024년 7월 항체 치료제 개발 전문기업인 맵틱스와의 공동 연구개발 계약을 통해 체결한 MT-103(습성 황반변성 및 당뇨병성 황반부종)이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03 대비 경쟁력이 높은 CU06과 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
| 파이프라인명 | CU03 | CU06 | MT-103 |
|---|---|---|---|
| 적응증 | 습성 황반변성 | 습성 황반변성, 당뇨병성 황반부종 | 습성 황반변성, 당뇨병성 황반부종 |
| 의약품 분류 | 천연물 신약 | 화학합성 신약 | 항체 신약 |
| 투여 경로 | 경구제 | 경구제 | 안구내 주사제 |
| 시장성 | 작음(안구내 주사제와 병용투여) | 높음(단독 투여 및 병용 투여 가능성) | 높음 |
| 글로벌 기술이전 가능성 | 낮음(천연물 신약의 특성상) | 높음 | 높음 |
| 출처) 당사 제시 |
최근 기존 망막질환 치료에 쓰이던 빌베리건조엑스(Bilberry Dried Extract)의 당뇨병성 망막병증에 대한 치료 효과의 근거 부족으로 해당 성분을 사용한 제품이 건강보험 급여 대상에서 제외되고, CU03과 유사한 천연물 기반 신약 후보물질인 안지오랩의 AL101-AMD가 국내 임상 3상 승인을 받는 등 시장에 긍정적인 변화가 나타나고 있습니다. 당사는 이러한 우호적인 시장 환경을 적극 활용하여 이미 확보한 CU03의 임상2a상 결과를 바탕으로 국내 기술이전을 추진하고 있습니다.
당사의 매출 성장성 및 수익성 개선 방안 관련한 상세 계획은 'III. 투자위험요소 - 2. 회사위험 - 다. 매출부진 및 지속적 손실 발생 위험'을 참고하시기 바랍니다.
상기한 바와 같이, 당사는 상장 당시에 제시한 주요 파이프라인별 추정 손익과 실제 경영성과 간 괴리를 보이고 있습니다. 이는 당사의 사업계획 중 일부가 지연되거나 중단되었음을 의미하며, 이로 인해 향후 3개년(2025년 ~ 2027년)의 실적 역시 당사의 계획 대비 부진할 가능성이 존재합니다. 투자자께서는 당사의 2025년 사업계획 및 손익 역시 추정치와 높은 괴리를 보일 수 있음에 유의하시고 투자에 임하시기 바랍니다.
3. 기타위험
| 가. 중점심사 유상증자 선정 가능성 및 증권신고서 정정에 따른 일정 지연 관련 위험 2025년 02월 27일 금융감독원은 IPO(기업공개) 및 유상증자 주관업무와 관련해 16개 증권사와 간담회를 하고 유상증자 증권신고서 중점심사 방향을 공개했습니다. 앞으로 일반주주 권익 훼손 우려 등 7개 사유에 해당하면 '중점심사 유상증자'로 선정하고, 심사 항목별로 집중심사하기로 했습니다. 금융감독원은 '주식가치 희석화 우려', '일반주주 권익훼손 우려', '재무위험 과다', '주관사의 주의의무 소홀' 등 대분류와 7가지 소분류에 따라 중점심사 유상증자 항목을 선정하였습니다. 당사는 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등의 부재로 금융감독원으로부터 중점심사 대상으로 지정되었으며, 항목은 한계기업에 해당합니다. 당사는 증권신고서 제출 전일 기준 중점심사 대상의 주요 심사항목에 대한 내용을 상세히 기재하였으며, 금번 주주배정 후 실권주 일반공모 유상증자의 당위성 설명 및 과정 중 주주권익보호활동을 적극적으로 진행할 예정입니다. 이처럼 중점심사 대상에 지정된 경우 예상보다 일정이 지연되어 유상증자 진행에 다소 제약사항이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
「자본시장과 금융투자업에 관한 법률」제120조 3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 참조하시기 바랍니다.
한편, 2025년 02월 27일 금융감독원은 IPO(기업공개) 및 유상증자 주관업무와 관련해 16개 증권사와 간담회를 하고 유상증자 증권신고서 중점심사 방향을 공개했습니다. 앞으로 일반주주 권익 훼손 우려 등 7개 사유에 해당하면 '중점심사 유상증자'로 선정하고, 심사 항목별로 집중심사하기로 했습니다. 금융감독원은 '주식가치 희석화 우려', '일반주주 권익훼손 우려', '재무위험 과다', '주관사의 주의의무 소홀' 등 대분류와 7가지 소분류에 따라 중점심사 유상증자 항목을 선정하였습니다. 중점심사 유상증자 선정기준 상세 항목 및 중점심사 유상증자 해당시 심사절차는 아래와 같습니다.
| [중점심사 유상증자 선정기준] |
| 대분류 | 소분류 | 선정기준 |
|---|---|---|
| 주식가치 희석화 우려 | ① 증자비율 | 증자규모 및 증자비율 등 고려 |
| ② 할인율 | 증자규모 및 할인율 등 고려 | |
| 일반주주 권익훼손 우려 | ③ 신사업투자 등 | 자금사용목적의 타법인출자 또는 신규사업 연관성 고려 |
| ④ 경영권 분쟁발생 | 경영권 분쟁 소송이 진행되었거나 진행중 | |
| 재무위험 과다 | ⑤ 한계기업 등 | 최근 3년 연속 재무실적 부실 또는 재무구조 악화 등 |
| 주관사의 주의의무 소흘 | ⑥ IPO 실적 과다 추정 | IPO 후 실적 괴리율 등 고려 |
| ⑦ Due Diligence 소흘 | 다수의 정정요구를 받은 주관사의 인수·주선 참여 |
| 출처) 금융감독원 보도자료 |
| 주1) 주식 관련 사채(CB, BW 등) 발행 포함 |
| 주2) ③, ④ 외 정성적 중점심사 유상증자 기준을 탄력적으로 운용 예정 |
| 주3) 규모, 비율 등 계량기준은 비공개 운영 |
| [중점심사 유상증자 심사절차] | ||
|
||
| 출처) 금융감독원 보도자료 |
중점심사 유상증자에 해당하는 경우 공통 심사항목으로 1) 유상증자의 당위성 및 의사결정 과정, 2) 이사회 논의 내용, 3) 주주 소통절차, 4) 기업실사 내용 등 기재사항을 집중심사할 예정입니다. 특히, 현행 IPO 심사절차를 준용해 제출 1주일 내 집중심사를 진행하고, 최소 1회 이상 대면협의를 할 계획입니다. 이와 함께 중점심사 유상증자 대상으로 지정된 사유와 해당 이슈가 발생하게 된 경위와 향후 대응 방안 등을 심사할 예정입니다.
| [중점심사 지정사유별 심사항목] |
| 중점심사 지정사유 | 심사항목 |
|---|---|
| ① 공통 심사항목 | 유상증자 당위성 및 의사결정과정, 동 사항들의 이사회 논의 여부 및 그 논의내용, 소액주주 등의 이해 고려여부 및 주주 보호 방안 관련 개선계획, 기업실사 합리적 수행여부 등 |
| ② 증자비율, 할인율 | 증자비율, 할인율 적정성에 대한 검토여부 및 검토내용, 이에 대한 이사회 논의여부 및 그 내용 등 |
| ③ 신사업투자 등 | 신규사업 진출위험, 기존 사업에 미치는 영향, 타법인 인수시 가격 적정성 검토여부 및 주요 검토내용 등 |
| ④ 경영권 분쟁발생 | 경영권 분쟁 상황에서 유상증자 추진 배경 및 목적, 관련 법률적 위험 등 |
| ⑤ 한계기업 등 | 재무지표 악화 경위, 이로 인해 발생할 수 있는 위험 및 이를 극복하기 위한 회사의 대응방안 등 |
| ⑥ IPO실적 과다 추정 | 상장시 자금사용 계획과 달리 자금이 추가로 필요하게 된 경위, 괴리율 발생원인 및 회사의 대응방안 등 |
| 출처) 금융감독원 보도자료 |
증권신고서 제출일 현재 유상증자 중점심사 지정사유별 심사항목에 관한 당사의 검토내역은 아래와 같습니다.
① 공통 심사항목
가) 주주배정 후 실권주 일반공모 유상증자 당위성
당사의 이사회는 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 추진하기에 앞서, 당사의 현재 재무 상태, 보유 현금 수준 및 단기적인 자금 운용 계획, 임상개발을 진행 중인 파이프라인의 사업성 및 예상되는 비용 규모, 그리고 예정된 전환사채 등의 차입금 상환 스케줄 등을 면밀히 검토하였습니다. 또한, 이를 바탕으로 자금 조달의 필요성과 시기의 적정성은 물론, 조달 자금의 규모와 사용 계획이 당사의 핵심 파이프라인 개발 및 신사업 진출 등 중장기 사업 전략에 부합하는지 다각적으로 분석하고 심도 있는 논의를 거쳤습니다.
그 결과, 현재의 내부 유보 자금 및 영업 현금흐름만으로는 예정된 임상 개발과 미래 성장 동력 확보를 위한 투자를 동시에 진행하기에 부족하며, 안정적인 재무구조를 유지하면서 기업가치를 극대화하기 위해서는 외부 자금 조달이 필수적이라는 결론에 이르렀습니다. 이에 당사 이사회는 본 유상증자가 회사의 핵심 경쟁력을 강화하고 지속 가능한 성장의 발판을 마련하기 위한 최적의 방안이라고 판단하였으며, 이사회가 검토한 금번 유상증자를 통해 자금을 조달하고자 하는 구체적인 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
3) 연구개발 역량 강화 및 안정적인 운영자금 확보를 통한 경영 효율화
신약 개발은 고도의 전문성을 갖춘 연구인력과 첨단 연구시설 및 장비가 필수적인 분야입니다. 우수한 연구인력을 지속적으로 확보하고 유지하며, 최적의 연구 환경을 조성하기 위해서는 안정적인 운영자금 확보가 선행되어야 합니다. 금번 유상증자를 통해 조달되는 자금은 핵심 연구인력에 대한 투자, 연구 인프라의 효율적 운영 및 관리, 그리고 전반적인 경영활동의 안정성을 제고하는 데 사용될 것입니다. 이는 당사가 예측 불가능한 외부 환경 변화에 유연하게 대응하고, 장기적인 비전을 가지고 연구개발에 매진할 수 있는 재정적 토대를 마련해 줄 것입니다.
4) 제약·바이오 산업 환경 변화에 대한 능동적 대응 및 경쟁 우위 확보
글로벌 제약·바이오 시장은 기술 발전 속도가 매우 빠르고 경쟁이 치열한 분야입니다. 이러한 환경 속에서 경쟁 우위를 확보하고 지속적으로 성장하기 위해서는 혁신적인 기술력과 함께 신속한 의사결정, 그리고 이를 뒷받침할 수 있는 충분한 자금력이 중요합니다. 당사는 금번 자금 조달을 통해 빠르게 변화하는 시장 환경과 기술 트렌드에 능동적으로 대응하고, 핵심 기술 및 파이프라인의 경쟁력을 강화하여 글로벌 시장에서 입지를 다져나갈 계획입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
5) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
나) 주주 권익 보호를 위한 회사정책
당사는 금번 유상증자를 추진함에 있어 주주님들의 이익을 최우선으로 고려하며, 유상증자 이후에도 지속적인 주주가치 제고를 위해 이사회에서 논의한 바와 같이 다음과 같은 정책을 추진하고 주주님들과의 소통을 강화하고자 합니다.
| [이사회의사록 발췌] |
|
| 출처) 2025년 05월 22일 당사 이사회의사록 |
1) 투명하고 공정한 정보 제공 강화
당사는 유상증자의 진행 과정, 조달 자금의 구체적인 사용 계획 및 집행 내역, 주요 경영 활동, 임상시험의 진행 상황 및 결과 등 주주 및 투자자분들의 의사결정에 중대한 영향을 미칠 수 있는 모든 정보를 관련 법규 및 규정을 철저히 준수하여 금융감독원 전자공시시스템(DART) 및 당사 홈페이지를 통해 신속, 정확, 충분하게 공시하겠습니다. 특히, 분ㆍ반기ㆍ사업보고서 및 정기적인 IR 자료를 통해 조달 자금의 사용 현황을 상세히 안내하고, 자금 집행의 투명성을 확보하여 주주님들의 신뢰를 높이는 데 주력할 것입니다. 또한, 예측 정보나 미래 전망에 대해서는 합리적인 근거를 제시하고 발생 가능한 위험 요인에 대해서도 충분히 설명하여 투자자 보호에 만전을 기하겠습니다.
2) 적극적이고 다각적인 IR 활동을 통한 소통 활성화
당사는 주주님들과의 열린 소통을 경영의 중요한 가치로 여기고 있습니다. 이를 위해 국내외 기관투자자, 애널리스트, 언론뿐만 아니라 개인 주주님들을 포함한 모든 시장 참여자들과의 소통 채널을 확대하고 다각화할 계획입니다.
- 정기 및 비정기 기업설명회(IR) 및 주주간담회 개최: 연간 경영실적 발표회 외에도, 주요 경영 현안 발생 시 또는 시장의 관심이 높을 경우, 온/오프라인 기업설명회를 수시로 개최할 예정입니다. 특히, 당사는 금번 유상증자의 배경 및 회사의 향후 성장 전략을 주주님들께 상세히 설명드리고 의견을 경청하기 위해 2025년 05월 29일에 주주간담회를 개최할 예정입니다. 간담회의 구체적인 시간 및 장소, 참여 방법 등은 추후 당사 홈페이지 공지 및 별도 안내를 통해 신속히 알려드리겠습니다. 이를 통해 당사의 경영 전략, 연구개발 진행 상황, 향후 비전 등을 상세히 설명하고 질의응답 시간을 통해 주주님들의 궁금증을 해소하겠습니다.
- 소그룹 미팅 및 컨퍼런스 참여: 국내외 주요 투자 컨퍼런스에 적극적으로 참여하고, 기관투자자 및 애널리스트들을 대상으로 한 미팅을 정기적으로 진행하여 심도 있는 정보를 제공하고 상호 이해도를 높이겠습니다.
- 주주서한 및 온라인 소통 강화: 금번 유상증자와 관련하여 2025년 05월 16일 주주서한을 통해 회사의 입장을 전달드린 바와 같이, 앞으로도 중요한 경영 사항 발생 시 주주서한, 회사 홈페이지 공지, FAQ 게시, 이메일 문의 답변 등을 통해 주주님들과 적극적으로 소통하겠습니다. 특히 소액주주님들의 정보 접근성을 높이기 위해 노력하겠습니다.
- 주주총회의 내실 있는 운영: 정기 및 임시 주주총회를 단순한 의결 절차를 넘어, 주주님들과 경영진이 회사의 발전 방향에 대해 심도 있게 논의하고 의견을 교환하는 소통의 장으로 만들어가겠습니다.
| [주주서한] |
|
|
|
| 출처) 당사 홈페이지 |
당사는 금번 유상증자와 관련하여 주주와의 소통 강화를 위해 다양한 활동을 진행하고 있습니다. 당사는 1차 정정증권신고서 제출 전일인 2025년 06월 08일 기준으로 주주들과의 소통을 적극적으로 진행하였습니다. 구체적으로는 2025년 05월 29일 주주간담회를 개최하여 유상증자의 목적과 필요성을 상세히 설명하고 아래와 같은 Q&A를 진행하였으며, 참석하지 않은 주주분들도 내용을 확인할 수 있도록 당사 홈페이지에 Q&A를 게시하였습니다.
| [주주간담회 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 유상증자 자금의 사용 목적은 무엇인가요? A. 금번 유상증자를 통해 조달 예정인 약 286억 원은 △CU06 미국 당뇨병성 황반부종 임상 2b상 △CU71 미국 알츠하이머병 임상 1상 등 주요 파이프라인의 연구개발(R&D) 진척 △공통 소모품 구매 및 장비 유지보수 △원료의약품 유통사업 진출을 위한 자본금 확충 등에 사용될 계획입니다. |
| 2 | Q. 신규로 발행하는 주식의 형태는 무엇인가요? A. 큐라클㈜ 기명식 보통주로 발행됩니다. |
| 3 | Q. 주주배정 후 실권주 일반공모 방식의 유상증자 방식은 무엇인가요? A. 일정 기준일을 기준으로 주주명부에 등재된 기존 주주들께 신주를 우선 배정하며, 주주 청약 이후 발생한 실권주에 대해 일반 투자자를 대상으로 공모 청약을 진행하는 방식입니다. |
| 4 | Q. 유상증자의 참여 대상이 되기 위해서는 언제까지 주식을 보유해야 하나요? A. 신규로 발행할 주식을 배정받는 주주의 기준일(신주배정기준일)은 6월 26일로 예정되어 있으며, 증권결제일(T+2일)을 감안하여 2 영업일 전인 6월 24일까지 주식을 매수하시면 대상이 됩니다. |
| 5 | Q. 기존 주주에게는 어떠한 비율로 신주가 배정되는 건가요? A. 기존 주주의 개인별 청약 한도는 신주배정기준일인 6 월 26 일 현재 주주명부에 기재된 소유주식 1 주당 신주배정비율인 0.4996732494주를 곱하여 산정된 배정주식수 로 하되 , 1 주 미만의 단수주는 절사합니다. |
| 6 | Q. 신주의 발행가액은 어떻게 결정되나요? A. 최근 주가와 거래량을 기간 별로 가중산술평균하여 이를 반영한 기준주가가 결정되고 , 기준주가에 할인율과 증자비율을 반영하여 발행가액이 결정됩니다. 현재 공시된 예정 발행가액은 잠정적인 금액이며, 1 차 발행가액은 6월 23일 확정, 확정 발행가액은 7월 30일 산정되어 7월 31일에 공고될 예정입니다. 구체적인 발행가액 산정방식 및 세부내용은 전자공시시스템에 공시된 증권신고서를 참고해주시기 바랍니다. |
| 7 | Q. 청약에 참여하려면 어떻게 해야 하나요? A. 주주분들께서 현재 이용하고 계신 증권사의 HTS, MTS 를 통해 청약이 가능 합니다. 보유하고 계신 증권사 주식 계좌 내, 유상 청약 신청 메뉴를 통해 청약을 신청하실 수 있습니다. |
| 8 | Q. 신주인수권은 무엇인가요? A. 신주인수권은 유상증자 시 기존 주주가 보유하고 있던 주식 수에 비례하여 우선적으로 주식을 배정 받을 수 있는 권리를 말하며, 신주인수권은 정해진 기간 동안 시장에서 매매가 가능합니다(신주인수권증서 상장 및 거래기간 7월 15일-21일 예정). 기존 주주 분께서 유상증자에 참여하고 싶은 경우 신주인수권증서를 매도하지 않고 보유해야만 청약이 가능하며, 기존 주주가 아닌 분들은 유상증자에 참여하고자 하시는 경우 신주인수권증서를 매수하시면 됩니다. |
| 9 | Q. 신주인수권증서를 매매하는 방법과 매매가 가능한 기간은 어떻게 되나요? A. 신주인수권증서 매매는 HTS, MTS 등 온라인, 전화, 지점 내방 등을 통해 가능하며, 보유 수량의 일부 매도도 가능합니다. 자세한 사항은 이용 중이신 증권사 고객센터를 통해 안내 받으실 수 있습니다. 장내 신주인수권증서 매매는 정해진 5 영업일(7월 15일-21일 예정)동안 가능하며, 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. 장외 신주인수권증서 매매는 신주인수권증서 상장거래의 결제일인 7월 23(예정)일까지, 거래의 세부 요건은 계좌를 보유하고 계신 증권사를 통해 확인해주시기 바랍니다. |
| 10 | Q. 유상증자 청약 후에 취소가 가능한가요? A. 구주주 청약일(8월 4일-5일 예정) 또는 일반공모 청약일(8월 7일-8일 예정) 각 청약 기간 내에서만 취소가 가능합니다. |
| 11 | Q. 주주가 아닌 경우에도 청약에 참여할 수 있나요? A. 신주인수권증서 상장 및 거래기간(7월 15일-21일 예정)에 해당 증서를 매수하여 구주주 청약일(8월 4일-5일 예정)에 청약할 수 있으며, 구주주 청약 미달로 실권주가 발생할 경우 일반공모 청약을 통해서도 참여가 가능합니다. |
| 12 | Q. 신주는 언제부터 매매할 수 있게 되나요? A. 현재 예정된 일정을 기준으로 7월 15일 신주가 상장될 예정이며, 매매가 개시될 예정입니다. 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. |
| 13 | Q. 초과청약을 120% 까지 할 수 있는 초과청약제도는 무엇인가요? A. 유상증자 초과청약제도는 신주인수권증서 청약자가 보유분보다 초과로 청약할 수 있고, 추후 실권주가 발생하는 경우 초과청약분을 추가로 배정받는 제도입니다. 주주 별로 배정되는 신주 수량의 최대 20% 까지 추가로 청약이 가능하며, 초과청약분이 실권주 발생 수량에 미달할 경우 청약분 100% 에 대해 신주를 배정받고, 초과청약분이 실권주 발생 수량을 초과할 경우 청약 주식 수에 비례하게 신주를 배정받게 됩니다. |
| 14 | Q. 행사 가능한 신주 인수 권리 수량을 초과하여 청약하려면 어떻게 해야 하나요? A. 추가 청약은 1) 배정 수량의 20% 내에서 초과 청약을 신청하는 방법과 2) 신주인수권 매매기간(7월 15일-21일 예정)동안 신주인수권증서를 매수하여 청약을 신청하는 방법 2가지가 있습니다. |
| 15 | Q. 초과 청약을 하였는데 초과분 전부를 배정 받지 못할 경우에 환불은 언제되나요? A. 구주주 청약과 일반공모 청약이 완료된 후 주금납입일(8월 12일 예정)에 청약 계좌로 환급됩니다. |
| 출처) 당사 제시 |
또한 주주와 유선 의견청취 및 소통 약 28회, 이메일 문의 12건에 대한 답변 등을 통하여 주주들의 의견을 수렴하고, 유상증자의 목적과 필요성을 상세히 설명히였습니다.
| [이메일 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 원료의약품 유통사업 자본금 5억원 사용 목적은? A. 당사는 신규 성장 동력 확보 및 사업 포트폴리오 다각화의 일환으로 원료의약품 유통사업 진출을 결정했으며, 유상증자를 통해 조달하는 금액 중 5억원은 원료의약품 유통사업을 위한 자본금 확충에 사용(약사법 내 의약품 도매상 자본금 요건)될 예정입니다. |
| 2 | Q. 1회차 전환사채(CB) 진행 상황은? A. 전환사채 만기 전 유보 현금을 사용해 당사에서 일부 채권(148억원)을 취득했으며, 향후 소각 또는 재매각 예정입니다. |
| 3 | Q. CU06 당뇨병성 황반부종 임상2b상을 진행하는 동안 기술이전이 가능한지? A. 임상 진행 중에도 기술이전이 가능하며, 임상시험과 사업화 활동을 병행해서 진행할 계획입니다. |
| 4 | Q. CU06 임상2b상 소요기간은 어느 정도로 예상하는지? A. 미국 FDA와 논의된 임상 디자인 상 약 2년 정도 소요될 것으로 예상하고 있으며, 경구제로만 임상을 진행하게 될 경우 앞선 임상2a상 등의 사례로 미루어 볼 때 주사제 임상보다 환자 모집이 수월할 것으로 예상하고 있습니다. |
| 5 | Q. CU01 임상2b상 결과는 언제 나오는지? A. 현재 환자 투여가 약 90% 정도 완료되었으며, 올해 4분기 중 임상이 종료되고 결과를 확인할 수 있을 것으로 예상하고 있습니다. |
| 6 | Q. MT-101, MT-103에 대한 기술이전을 진행 중인 파트너사들의 관심도가 높은지? A. MT-101, MT-103이 기반으로 하는 Tie2 활성화 항체는 글로벌 제약사 등이 최근 주목하고 있는 신규 타깃으로 많은 회사들의 관심을 받고 있습니다. 바이오 Europe, 바이오 USA 등 파트너링 미팅에서 MT-101과 MT-103이 전임상 시험에서 보인 우수한 데이터를 바탕으로 활발한 파트너링 활동을 진행 중입니다. |
| 출처) 당사 제시 |
이러한 노력은 주주들과의 신뢰를 공고히 하고, 당사의 유상증자 진행 과정에서 주주 의견을 실질적으로 반영하는 데 중점을 두고 있습니다. 특히 소액주주와 기관 투자자를 포함한 다양한 주체들과의 적극적인 소통은, 유상증자와 관련한 의사결정의 투명성을 높이고, 주주와의 협력을 강화하는 중요한 기반이 되고 있기에 당사는 주주들이 당사의 경영전략과 유상증자의 목적을 보다 명확하게 이해할 수 있도록 적극적으로 소통하고 있습니다.
3) 기업가치 제고를 통한 실질적인 주주 이익 환원
당사는 금번 유상증자를 통해 확보된 자금을 바탕으로 핵심 파이프라인의 연구개발을 성공적으로 완수하고, 기술이전 및 상업화를 통해 실질적인 기업 성장을 이루어내는 데 모든 역량을 집중할 것입니다.
- 핵심 사업의 성공적 추진: CU06, CU71 등 주요 파이프라인의 임상적 가치를 입증하고, 글로벌 기술이전 또는 자체 상업화를 통해 기업가치를 극대화하겠습니다.
- 신성장 동력 확보: 원료의약품 유통사업 등 신규 사업의 안정적인 시장 진입과 성장을 도모하고, 지속적인 연구개발을 통해 미래 성장 가능성이 높은 신규 파이프라인을 확보하겠습니다.
- 합리적인 주주환원 정책 수립 검토: 회사의 지속적인 성장과 이익 실현이 안정적인 궤도에 오르면, 재무 상태, 향후 투자 계획, 시장 상황 등을 종합적으로 고려하여 배당, 자사주 매입/소각 등 주주가치를 제고할 수 있는 다양한 방안을 적극적으로 검토하고, 관련 정책 수립 시 투명하게 공시하고 시행할 수 있도록 노력하겠습니다.
4) 이사회 중심의 투명하고 책임 있는 경영체제 확립
당사는 이사회의 독립성과 전문성을 강화하고, 경영진에 대한 효과적인 감독 기능을 수행함으로써 투명하고 책임 있는 경영체제를 구축하겠습니다. 이사회는 주주의 이익을 최우선으로 고려하여 의사결정을 하며, 모든 경영활동은 관련 법규와 정관을 준수하여 이루어질 것입니다. 또한, 내부회계관리제도의 효과적인 운영과 내부통제시스템 강화를 통해 경영의 투명성과 신뢰성을 지속적으로 높여나가겠습니다.
당사는 상기 언급된 주주 권익 보호 방안들을 성실히 이행하고, 끊임없는 혁신과 성장을 통해 주주님들의 기대에 부응할 수 있도록 최선을 다할 것을 약속드립니다.
② 증자비율 및 할인율
당사는 금번 주주배정 후 실권주 일반공모 유상증자를 통해 파이프라인별 임상연구비용 및 신규사업을 위한 자본금 확충 등 회사의 지속적인 성장을 위한 운영자금을 확충하고 재무적인 안정성을 확보하고자 합니다. 이를 통해 주주가치를 극대화하고, 장기적으로 경쟁력을 갖춘 기업으로 도약할 수 있도록 최선을 다 할 것입니다.
증자비율은 기업의 필요 자금 규모와 주주가치 보호의 균형을 고려하여 다양한 비율로 결정되어야 하며, 증자비율이 과도하게 높을 경우 시장에서 재무 상태에 대한 부정적인 신호로 해석될 가능성이 있고 기존 주주들의 주주가치가 훼손될수 있어 적정한 수준에서 결정하는 것이 중요합니다. 할인율의 경우 「증권의 발행 및 공시 등에 관한 규정」에 의거 주주배정 유상증자의 경우 40% 이내에서 결정할 수 있으며, 기존주주들의 지분 희석 정도를 감안하여 적정 할인율에 대한 결정이 필요합니다.
이에, 기존 주주의 권익을 보호하면서도 장기적인 기업가치 상승을 기대할 수 있는 조건을 결정하기 위해 당사의 이사회는 과거 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 토대로 금번 유상증자의 증자비율과 할인율 적정성 검토 및 논의를 진행하였습니다. 당사가 이사회 논의에서 참고한 유사업종 유상증자 사례는 다음과 같습니다.
| [최근(2023년~2025년) 발행규모 250억원~350억원 규모 유상증자 사례] |
| (단위: 억원, 원, %) |
| 회사명 | 납입일 | 발행금액(억원) | 발행가(원) | 할인율 | 증자비율 |
|---|---|---|---|---|---|
| 젠큐릭스 | 2023.04.20 | 254 | 3,925 | 25% | 92.65% |
| 엘앤케이바이오 | 2023.07.13 | 260 | 3,980 | 25% | 48.67% |
| 클리노믹스 | 2023.08.10 | 276 | 3,540 | 25% | 55.71% |
| 뉴인텍 | 2023.08.17 | 261 | 1,255 | 25% | 69.09% |
| 원익피앤이 | 2023.11.18 | 283 | 5,660 | 25% | 11.78% |
| 유니슨 | 2024.05.03 | 305 | 727 | 25% | 33.24% |
| SG | 2024.06.27 | 318 | 1,061 | 25% | 49.04% |
| 엑시콘 | 2024.07.19 | 333 | 15,130 | 25% | 21.38% |
| 평균 | 25% | 47.69% | |||
| 출처) Dart 전자공시시스템, 당사 제시 |
2023년 이후 당사와 유사 규모의 주주배정 후 실권주 일반공모 유상증자 사례를 분석한 결과, 평균 증자비율은 47.69%, 평균 할인율은 25% 수준으로 파악됩니다. 증자비율의 경우, 자금의 사용목적과 회사의 필요 자금 규모에 따라 21.38% ~ 92.65%까지 다양한 비율로 결정된 반면, 할인율은 대부분 25%를 설정하였습니다.
당사는 이러한 사례를 기반으로 이사회에서 논의를 진행하였고, 본 발행조건이 기존 주주들의 권익 침해를 최소화하고, 주주가치를 제고할 수 있는 적정한 조건이라고 판단하여 금번 유상증자의 할인율 25%, 증자비율 49.97%로 발행 조건을 결정하였습니다.
③ 신사업투자 등
당사는 2025년 03월 06일자로 원료의약품(API) 개발 및 유통 전문기업인 주식회사 대성팜텍을 흡수합병하기로 결정하였으며, 합병 기일은 2026년 01월 28일로 지정되어 흡수합병을 진행할 계획입니다. 대성팜텍과 합병을 계기로 당사 또한 원료의약품 수입, 도소매업을 신규사업으로 진행하기로 결정하였습니다. 신규사업은 신규 법인을 설립하거나, 타법인증권취득이 아니라 기존 법인인 당사에서 진행할 예정이며, 이를 위하여 금번 유상증자 자금 중 5억원이 자본금 확충의 목적으로 소요될 예정입니다.
신규 사업과 관련한 위험은 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 1. 사업위험 - 라. 신규사업(원료의약품 수입, 도소매업) 영위에 따른 위험'을 참고하여 주시기 바랍니다.
그 외 세부 자금사용 계획에 대해서는 '제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적'을 참고하여 주시기 바랍니다.
④ 경영권 분쟁발생
증권신고서 제출 전일 기준 당사의 최대주주 권영근 의장은 약 12.91%의 지분율을 확보하고 있으며, 금번 주주배정 후 실권주 일반공모에 최대주주인 권영근 의장은 배정주식수의 약 30%을 참여할 계획입니다. 당사 발행주식총수의 5% 이상 지분율을 보유한 주주는 최대주주 이외에 없고 소액주주들에게 지분율이 분산되어 있어 최대주주의 변경 및 경영권 분쟁발생 가능성은 제한적일 것으로 판단하고 있습니다. 최대주주 지분율 약화에 따른 경영권 변동 및 분쟁 관련 위험은 '제1부 모집 또는 매출에 관한 사항 중 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 2. 회사위험 - 나. 최대주주 변경 및 지분희석 등 경영권 관련 위험'을 참고하여 주시기 바랍니다.
⑤ 한계기업 등
당사는 임상 및 연구개발비용으로 인해 지속적인 영업적자 및 당기순손실이 발생하고 결손금이 누적되고 있어 자본총계가 감소하는 추세이고 부채비율은 급격하게 상승하고 있습니다. 이처럼 당사는 성장성, 수익성, 안정성, 활동성, 유동성 등 전반적인 재무지표가 악화되는 추세를 보이고 있습니다.
2024년 말 감사보고서상 외부감사인의 감사 결과 계속기업 관련 중요한 불확실성은 없는 상황이지만 2021년 10월 프랑스 떼아 오픈이노베이션과 체결했던 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06 기술이전 계약이 2024년 07월 12일부로 파트너사의 내부 개발 전략 변경에 따라 해지되었으며, 당사는 해당 물질에 대한 모든 권리를 반환받으면서 2024년부터 당사의 전반적인 재무지표가 악화되고 있습니다.
당사의 재무 관련 위험은 '제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 2. 회사위험 - 라. 재무안정성 관련 위험'을 참고하여 주시기 바랍니다.
⑥ IPO실적 과다 추정
당사는 2021년 07월 22일 코스닥시장에 기술특례상장 하였으며, 증권신고서를 통해 2024년 매출액 예측치를 70,318백만원로 추정하였으나, 실적치는 1,633백만원으로 약 97.68%의 괴리율이 발생하였습니다.
본 증권신고서 '제2부-X. 그 밖에 투자자 보호를 위하여 필요한 사항-4. 작성기준일 이후 발생한 주요사항 등 기타사항-1. 상장기업의 재무사항 비교표'에 IPO 당시 추정 실적과 실제 실적의 괴리 발생 원인과 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다.
상기 서술한 내용을 종합해 보면, 당사는 과거 IPO 실적을 과다 추정한 점 및 재무지표 악화 경위와 이에 따른 위험 및 극복 방안 등에 대한 설명이 미흡한 점을 사유로 금융감독원으로부터 중점심사 대상으로 지정되었습니다. 이에 당사는 증권신고서 제출 전일 기준 중점심사 대상의 주요 심사항목에 대한 내용을 상세히 기재하였으며, 금번 주주배정 후 실권주 일반공모 유상증자의 당위성을 설명하고 주주권익 보호 활동을 적극적으로 이행할 것입니다. 다만, 중점심사 대상으로 지정됨에 따라 증권신고서 심사 과정이 엄격하게 진행될 수 있으며, 이 과정에서 금융감독원으로부터 정정요구가 발생할 경우 유상증자 일정이 지연되는 등 절차 진행에 제약이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 나. 신주 물량 출회에 따른 주가하락 위험 금번 주주배정 유상증자의 발행예정주식수 7,000,000주는 발행주식총수(보통주 14,009,155주) 21,009,155주 대비 49.97%에 해당합니다. 신주 추가 상장 시점에 대규모 물량의 일시 출회에 따른 주가 희석화 우려로, 투자자가 경제적 손실을 입을 가능성이 있는것으로 판단됩니다. 또한, 금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 모집예정주식 7,000,000주가 향후 코스닥 시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다. |
금번 주주배정 유상증자의 발행예정주식수 7,000,000주는 발행주식총수(보통주 14,009,155주) 21,009,155주 대비 49.97%에 해당합니다. 신주 추가 상장 시점에 대규모 물량의 일시 출회에 따른 주가 희석화 우려로, 투자자가 경제적 손실을 입을 가능성이 있는것으로 판단됩니다.
| [주주배정증자 유상증자 개요] |
| 구 분 | 내 용 |
|---|---|
| 모집예정주식 종류 | 기명식 보통주 |
| 모집예정 주식수 | 7,000,000주 |
| 기발행 주식수(보통주) | 14,009,155주 |
| 증자비율 | 49.97% |
금번 유상증자에 따른 모집가액은 (구) 「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 산출할 예정입니다. 그러나 주식 시장의 특성상 주가 변동성으로 인해, 신주 추가 상장 후 거래시점의 주가가 1주당 모집가액보다 낮아져, 투자자에게 금전적 손실을 끼칠 가능성을 배제할 수 없습니다.
또한 금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 주권의 상장일은 2025년 08월 26일로 예정되어 있습니다. 금번 유상증자에 따라 향후 유가증권시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다. 「자본시장과 금융투자업에 관한 법률」 제165조의6의 ②조 2항에 의거 초과청약을 실시하며 초과청약비율은 배정신주 1주당 0.2주로서 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약이 가능합니다.
구주주 초과청약을 실시한 후 그 결과로 나온 미청약주식 및 단수주는 본 유상증자의 대표주관회사인 한양증권(주) 및 인수회사인 삼성증권(주)에서 일반에게 공모하되, 개인투자자 및 기관투자자(집합투자업자 포함)에게 구분없이 배정합니다. 최종적으로 일반공모 청약을 완료한 주식 수의 합계가 모집하여야 할 주식수에 미달하는 경우 미달된 잔여주식은 대표주관회사 및 인수회사가 자기계산으로 실권주식 전량을 인수할 수 있습니다.
따라서 실권주를 인수한 대표주관회사 및 인수회사가 잔액인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 인수한 실권주를 일정 기간 보유하더라도 동 인수물량이 잠재매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사 및 인수회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 18.0%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관회사 및 인수회사의 실권주 매입단가는 일반청약자들보다 18.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다. 또한, 금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 모집예정주식 7,000,000주가 향후 코스닥 시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다.
| 다. 환금성 제한 및 원금 손실 가능성에 대한 위험 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있습니다. 투자자분들은 투자시 이점 유의하시기 바랍니다. |
당사는 코스닥 시장 상장법인으로서 이번 유상증자로 발행되는 신주는 코스닥 시장에 상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다. 그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다.
본 유상증자의 자세한 일정은 본 신고서의 '제1부 모집 또는 매출에 관한 사항 - I. 모집 또는 매출에 관한 일반사항' 중 '1. 공모의 개요'를 참고하시기 바랍니다.
또한 신주가 코스닥 시장에 추가 상장될 때까지 당사의 주가가 유상증자로 발행되는 신주의 발행가액 수준으로 유지되지 않을 수 있으며, 당사의 내적인 요인 또는 시장전체의 환경 변화 등에 의해 주가가 급락할 경우, 투자원금에 대한 손실이 발생할 수 있습니다.
당사의 금번 발행되는 주식에 대해서는 전량 보호예수되지 않으므로 상장 후 즉시 물량 출회가 가능하여 주가 하락에 따른 환금성 위험 및 주가희석화에 노출될 수 있으니, 이점 투자에 유의하시기 바랍니다.
| 라. 경영환경변화 등에 따른 위험 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 증권신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분이 독자적으로 결정해야 함을 유의하시기 바랍니다. |
당사의 주가는 국내외 주식시장 환경 변화와 같은 외부적 요인에 영향을 받아 변동할 가능성이 존재하며, 당사의 외부적인 경영환경 변화에 따라 당사 실적이 악화될 가능성이 높아질 경우 당사의 주가에 부정적인 영향을 미칠 수 있습니다.
본 건 공모 주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 하며, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소 및 본 신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해서 투자하셔야 합니다.
만일 상기 투자위험요소에 기재한 내용 중 부정적인 요소가 현실화될 경우 당사 및 종속회사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액에 손실이 발생할 수도 있음을 유의하시기 바랍니다.
| 마. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 하락할 경우 당사가 계획했던 자금운용계획 등에 차질이 빚어질 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있습니다. |
금번 유상증자의 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 결정됩니다. 다만 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. (단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
일반공모 후 미청약분에 대해서는 그 전부를 대표주관사가 자기 계산으로 인수하므로 청약 미달에 따른 위험은 없으나, 주가 하락으로 발행가액이 크게 하락할 경우 회사가 계획했던 자금운용계획에 차질이 빚어질 수 있습니다. 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있으니 투자자 여러분께서는 이 점 유의하시기 바랍니다.
| 바. 집단 소송이 제기될 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있음을 유의하시기 바랍니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
증권신고서 및 투자설명서에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있음을 유의하시기 바랍니다.
| 사. 유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. |
금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분께서는 이 점 유의하시기 바랍니다.
이 증권신고서의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있으며, 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점 유의하여 투자에 임하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
| 아. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다. |
금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사 및 인수회사의 잔액인수 방식으로 진행됩니다. 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다.
유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다.
또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 유상증자가 철회될 경우 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다.
| 자. 기타 투자자 유의사항 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다. |
(1) 금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있습니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
(3) 본 공시서류의 공시심사 과정에서 기재사항은 청약일 이전에 변경될 수 있고, 일부 내용은 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다.
(4) 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
(5) 당사는 상기한 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 그 실제 결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자께서는 이 점을 유의하여 투자에 임하시기 바랍니다.
(6) 만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다.
(7) 본건 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있습니다.
(8) 금융감독원 전자공시 홈페이지(https://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있으니 투자의사를 결정하시는 데 참조하시기 바랍니다.
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 「금융투자회사의 기업실사 모범규준」을 참조하여 작성된 대표주관회사인 한양증권(주)의 내부규정에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 한양증권(주)입니다. 발행회사인 (주)큐라클은 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 회 사 명 | 고 유 번 호 |
|---|---|---|
| 대표주관회사 | 한양증권(주) | 00162416 |
2. 분석의 개요
대표주관회사인 한양증권(주)는「자본시장과 금융투자업에 관한 법률」제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한 「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 2012년 2월 1일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사인 한양증권(주)가 기업실사과정을 통해 발행회사인 (주)큐라클로부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 주주배정후 실권주 일반공모 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
| 「금융투자회사의 기업실사 모범규준」 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 ‘리스크관리위원회 등’)의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요내용
| 일자 | 기업 실사 내용 |
|---|---|
| 2025년 04월 04일 |
* 발행회사 방문 - 자금조달 목적 등 발행회사 의견 청취 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 주요 사항 및 일정 체크 - 유상증자 상세 일정 등 업무 협의 |
| 2025년 04월 07일~ 04월 14일 |
* 발행회사 및 해당 산업 조사 - 회사 정관 등 기본자료 수령 - 공시 및 뉴스 내용 등을 통한 발행회사 및 산업 이해 - 경영진 평판 리스크 검토 - 관련 Q&A 등 * 유상증자 리스크검토 - 발행시장 상황, 자금조달규모 적정성공모가액 희망 할인율 검토 |
| 2025년 04월 15일 ~ 04월 28일 |
* 발행회사 방문 및 보고서 작성 * Due-diligence checklist에 따라 투자위험요소 실사 1) 사업위험관련 실사 - 영위중인 사업 등에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 - 최대주주의 지분율 및 경영권 안정성 검토 - 주요 계정과목별 재무수치 변동요인 검토 - 원장 및 각종 명세서 등 검토 - 주요 계약관련 계약서 및 등의 확인 - 각 부서 주요 담당자 인터뷰 * 주요 경영진 면담 - 경영진 평판 리스크 검토 - 자금 사용 목적 등에 관한 청취 |
| 2025년 04월 29일 ~ 05월 21일 |
* 실시간 실사자료 요청 및 확인/검토 * 증권신고서 작성에 대한 조언 * 이사회의사록 검토/인수계약서 작성 및 검토 |
| 2025년 05월 22일 ~ 06월 08일 | - 실사보고서 작성 - 증권신고서 작성 가이드 및 주가자료 작성 |
4. 실사참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
| 한양증권(주) | 기업금융부 | 유문성 | 상무 | 증자업무 총괄 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 21년 |
| 한양증권(주) | 기업금융부 | 안병종 | 상무 | 기업실사 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 25년 |
| 한양증권(주) | 기업금융부 | 정경훈 | 부장 | 기업실사 책임 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 13년 |
| 한양증권(주) | 기업금융부 | 장창환 | 대리 | 기업실사 실무 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 7년 |
| 한양증권(주) | 기업금융부 | 윤상호 | 대리 | 기업실사 실무 | 2025년 04월 04일 ~ 2025년 06월 08일 |
기업금융업무 4년 |
[발행회사]
| 소속 | 부서 | 성명 | 직위 | 담당업무 |
|---|---|---|---|---|
| (주)큐라클 | 사장 | 유재현 | CEO | 발행 및 실사 책임 |
| 전략기획실 | 최재진 | 상무이사 | 발행 및 실사 책임 | |
| 경영관리본부 | 황용 | 이사 | 실사자료 작성 및 제공 | |
| 전략기획실 | 배지훈 | 차장 | 실사자료 작성 및 제공 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 한양증권(주)는 (주)큐라클이 2025년 05월 16일 및 2025년 05월 22일 이사회에서 결의한 기명식 보통주 7,000,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적요인 |
▶ 동사가 주력하는 난치성 혈관질환 치료제 시장은 미충족 의료 수요가 높아 지속적인 성장이 전망됩니다. |
| 부정적요인 |
▶ 신약 개발은 성공 확률이 매우 낮고 장기간 막대한 비용이 소요되는 본질적인 위험을 내포하고 있습니다.
▶ 임상시험 결과가 기대에 미치지 못하거나 규제 당국의 허가 기준을 충족하지 못할 경우, 상업화 지연 또는 실패 가능성이 존재합니다. ▶ 현재까지 안정적인 매출 부재로 연구개발 투자에 따른 영업손실이 지속되고 있으며, 향후 자금 조달의 불확실성은 재무 안정성을 저해할 수 있습니다.
|
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 운영자금으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 동사가 제출한 자료와 당사가 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 용역을 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다 하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025년 06월 09일 |
| 대표주관회사 : 한양증권 주식회사 |
| 대표이사 임 재 택 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
| (단위 : 원) |
| 구 분 | 금 액 |
|---|---|
| 모집 또는 매출총액(1) | 28,595,000,000 |
| 발행제비용(2) | 600,000,000 |
| 순 수 입 금 [ (1)-(2) ] | 27,995,000,000 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 3) 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. |
나. 발행제비용의 내역
| (단위 : 원) |
| 구 분 | 금 액 | 계산근거 |
|---|---|---|
| 발행분담금 | 5,147,100 | 모집총액의 0.018% (10원 미만 절사) |
| 인수수수료 | 514,710,000 | 모집총액의 1.80% |
| 상장수수료 | 4,460,000 | 430만원 + 300억원 초과금액의 10억원당 8만원 |
| 등록세 | 14,000,000 | 증자 자본금의 0.4% |
| 교육세 | 2,800,000 | 등록세의 20% |
| 기타비용 | 59,202,900 | 구주주 청약서, 투자설명서 인쇄 및 발송비 등 |
| 합 계 | 600,000,000 | - |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가, 유관기관 정책 등에 따라 변동될 수 있습니다. |
| 주3) 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사는 금번 유상증자를 통해 조달한 자금을 다음과 같이 사용할 예정입니다.
| (기준일 : | 2025년 05월 21일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 27,995 | - | - | 600 | 28,595 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액이며, 향후 발행가액 확정 시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) 발행제비용은 공모금액 및 실권규모, 유관기관과의 협의 등에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 발행제비용은 공모금액에서 지급될 예정이나, 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 운영자금(연구개발비)으로 지출할 예정입니다. |
나. 공모자금 세부 사용목적
당사가 금번 공모 유상증자를 통해 조달한 순수입금 약 27,995백만원은 CU06 미국 당뇨병성 황반부종 임상 2b상, CU71 미국 알츠하이머병 임상 1상 등 주요 파이프라인의 연구개발(R&D) 진척, 전체 임상시험 및 연구개발 활동에 필요한 공통 소모품 구매 및 장비 유지보수, 그리고 원료의약품 유통사업 진출을 위한 자본금 확충 등에 사용될 계획입니다.
신약 연구개발은 장기간이 소요되며 대규모 투자가 수반되는 분야입니다. 각 임상시험 단계마다 성공 가능성이 낮으며, 예상치 못한 결과나 부작용 발생, 규제기관의 승인 지연 또는 실패 등 다양한 변수로 인해 개발이 중단될 수 있습니다. 특정 파이프라인의 임상시험이 실패할 경우, 해당 파이프라인에 투입된 연구개발 비용은 회수되지 않을 수 있으며, 이는 당사의 재무 상태 및 향후 사업 계획에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이러한 신약 개발의 본질적인 위험을 충분히 인지하시고 투자 결정을 내리시기 바랍니다.
금번 유상증자 자금 사용내역 우선순위는 아래와 같습니다.
| [금번 유상증자 자금 사용내역 우선순위] |
| (단위: 백만원) |
| 구분 | 세부내역 | 내용 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 금액 | 우선순위 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 운영자금 | R&D CU06 | 미국 임상2b상 운영, 비임상, 약물 개발 및 생산 | 1,555 | 3,602 | 1,130 | 585 | 1,580 | 2,090 | 2,200 | 2,200 | 14,942 | 1 |
| 운영자금 | R&D CU71 | 미국 임상1상 운영, 비임상, 약물 개발 및 생산 | 550 | 1,602 | 1,090 | 420 | 1,360 | 1,650 | 920 | 2,700 | 10,292 | 2 |
| 운영자금 | R&D CU01 | 국내 임상2b상 운영, 임상3상 약물 생산 | 550 | 550 | 350 | 0 | 100 | 350 | 0 | 0 | 1,900 | 3 |
| 기타자금 | 원료의약품 사업진출 | 원료의약품 유통사업 자본금 확충 | 0 | 500 | 0 | 0 | 0 | 0 | 0 | 0 | 500 | 4 |
| 운영자금 | R&D 기타 | 연구개발 공통 소모품 구매 및 연구 장비 유지보수 | 45 | 78 | 238 | 0 | 0 | 0 | 0 | 0 | 361 | 5 |
| 합계 | 2,700 | 6,332 | 2,808 | 1,005 | 3,040 | 4,090 | 3,120 | 4,900 | 27,995 | - | ||
| 주1) 상기 발행제비용은 공모자금에 포함되어 있지 아니합니다. (별도 모집총액에서 차감 또는 자체자금 사용) |
| 주2) 상기 자금 사용 계획은 현재 당사의 사업 전략 및 시장 상황을 고려하여 수립된 예측치이며, 향후 연구개발 진행 상황, 임상시험 결과, 시장 환경 변화, 규제기관과의 협의 내용 등에 따라 실제 집행 금액, 시기 및 세부 항목이 변경될 수 있습니다. 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
| 주3) 당사가 2021년 07월 기업공개 당시 추정한 임상비용은 파이프라인별로 파트너사와의 기술이전계약 체결을 통해 임상 개발 비용의 상당 부분을 파트너사가 부담하는 구조를 전제로 비용을 추정하였습니다. 하지만 다수의 잠재적 파트너사와 기술이전 협의가 최종 계약에 이르지 못했을 뿐만 아니라, 주요 파이프라인 중 하나인 CU06의 권리가 반환되며 기존 파트너사와의 기술이전 계약이 해지됨에 따라 당사가 관련 비용을 직접 부담하는 방식으로 사업 계획이 변경되었습니다. 아울러 코로나19 팬데믹 이후의 전반적인 인건비 상승 및 달러 환율 상승과 같은 외부 환경 변화 역시 임상시험 수행에 필요한 예산을 증가시키는 요인으로 작용하였으며, 이러한 복합적인 원인으로 인해 현재의 임상비용 계획은 당초 추정치와 차이가 발생하게 되었습니다. 투자자께서는 이 점 유의하셔서 투자를 결정하시기 바랍니다. |
(1) R&D CU06 (미국 임상2b상 운영, 비임상, 약물 개발 및 생산 등)
CU06은 당사의 핵심 파이프라인으로, 당뇨병성 황반부종 및 습성 황반변성 치료제로 개발 중입니다. 최근 미국 FDA와의 Type C 미팅을 통해 위약(Placebo) 대조 임상 2b상 진행에 대한 긍정적인 가이드라인을 확보하여, 기존의 표준치료제(Anti-VEGF) 직접 비교 임상 외에 개발 경로의 유연성을 확보하였습니다. 특히 경구 투여 방식의 편의성과 함께, 자체 개발한 신규 제형을 통해 기존 제형 대비 생체 흡수율을 약 2배 개선하여 임상 성공 가능성을 높이고자 합니다.
미국 식품의약국(FDA)은 개발사와 공식적으로 논의할 수 있는 다양한 미팅 유형을 제공하고 있으며, 이를 통해 개발사는 신약 개발 전략, 임상시험 설계, 규제 요건 등에 대한 FDA의 공식적인 의견과 지침을 확보할 수 있습니다. 주요 미팅 유형과 그 내용은 다음과 같습니다.
| [미국 식품의약국(FDA) 미팅 유형] |
| 구분 | Type A 미팅 | Type B 미팅 | Type C 미팅 |
|---|---|---|---|
| 요청 주체 | 개발사 (스폰서) | 개발사 (스폰서) | 개발사 (스폰서) |
| 정의/목적 | 지체된 개발 진행, 중대한 안전성 문제 해결 | 개발 주요 시점(Pre-IND, EOP, Pre-NDA/BLA 등) 논의 | Type A/B 외 기타 개발 및 검토 관련 모든 사항 논의 |
| 긴급성 | 매우 높음 (Critical Path) | 높음 (Milestone) | 상대적으로 낮음 (필요시) |
| 미팅의 의의 | 중대한 장애물 신속 해결 및 개발 정상화 | 개발 방향 설정, 규제 불확실성 해소, 성공적 허가 기반 마련 | 다양한 개발 이슈에 대한 유연한 자문 및 선제적 문제 해결 |
| 주요 예시 | 임상 보류 해제, 분쟁 해결, SPA 관련 논의 | Pre-IND, EOP1, EOP2/Pre-Phase 3, Pre-NDA/BLA 미팅 | 과학적 이슈, CMC, 시험 디자인 세부사항, 라벨링, 비임상 결과 등 |
| FDA 통보 | 14일 이내 | 21일 이내 | 21일 이내 |
| 미팅 개최 | 요청 접수 후 30일 이내 | 요청 접수 후 60일 이내 (EOP의 경우 70일 이내) | 요청 접수 후 75일 이내 |
| 미팅 개최 난이도 | 매우 어려움 (엄격한 기준 충족 필요) | 중간 (주요 단계별 필요성 입증) | 상대적으로 수월 (유연한 요청 가능, 명확한 목적 제시 시) |
|
출처) 미국 식품의약국(FDA) Guidance for Industry: Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products |
당사는 CU06 임상 2a상에서 1차 평가지표 미충족 후, 향후 개발 방향에 대한 FDA의 견해를 확인하고자 미국 식품 의약국(FDA)와 Type C 미팅을 진행하여 임상 2b상 개발 전략의 주요 고려사항들을 논의하였습니다. 특히 '위약 대비 우월성 입증 임상' 프로토콜 진행 가능, 임상 2b상과 임상 3상의 투약 기간, 1차 및 2차 주요 평가지표로 황반중심두께(CST)가 아닌 최대교정시력(BCVA) 활용, 규제 준수를 위한 연구 개발 계획 등을 논의하였습니다.
금번 조달 자금 중 14,942백만원은 CU06의 미국 임상 2b상 시험의 성공적인 수행 및 가치 극대화에 사용될 예정입니다. 주요 사용처는 임상2b상 시험 임상시험계획승인신청(IND) 비용, 개시 준비비용 및 운영비용 그리고 임상약물 개발 및 생산 비용, 비임상 연구 비용 등입니다. 임상시험을 진행하면서 기술이전 가치를 높이기 위한 자체 임상 데이터를 확보하고자 합니다.
| [CU06 주요 자금 사용 계획 (25년 3분기 ~ 27년 2분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 합계 |
|---|---|---|---|---|---|---|---|---|---|
| 임상2b상 시험 IND 비용 | 0 | 200 | 100 | 0 | 0 | 0 | 0 | 0 | 300 |
| 임상2b상 시험 개시 준비비용 | 0 | 1,800 | 900 | 0 | 0 | 0 | 0 | 0 | 2,700 |
| 임상2b상 시험 운영비용 | 0 | 0 | 0 | 500 | 1,500 | 2,000 | 2,200 | 2,200 | 8,400 |
| 임상약물 개발 및 생산 | 1,102 | 1,340 | 100 | 55 | 50 | 60 | 0 | 0 | 2,707 |
| 비임상 연구 | 453 | 262 | 30 | 30 | 30 | 30 | 0 | 0 | 835 |
| 합계 | 1,555 | 3,602 | 1,130 | 585 | 1,580 | 2,090 | 2,200 | 2,200 | 14,942 |
| 출처) 당사 제시 |
| [CU06 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 주요 목적 - 당뇨병성 황반부종(DME) 환자를 대상으로 최적의 CU06-1004("CU06-1004"="CU06") 용량을 도출하여 향후 3상 시험 설계에 반영 부차적 목적 - 24주 후 CU06-1004의 안전성과 유효성 평가 (위약과 비교) - CU06-1004 및 대사체의 혈중 약물동태(PK) 평가 - 혈중 바이오마커(TNF-α, IL-6 등)에 대한 CU06-1004의 영향 분석 |
| 임상시험 대상국가 | 미국 내 20개 기관에서 환자 모집 및 시험 수행 예정 |
| 임상시험 수행방법 | - 이번 임상시험은 미국 내 20개 의료기관에서 시행되는 무작위배정, 이중눈가림, 위약대조 방식의 다기관 임상 2b상 시험으로, 중심성 당뇨병성 황반부종(Center-Involved Diabetic Macular Edema, DME) 환자를 대상으로 CU06-1004의 유효성과 안전성을 평가하기 위해 설계되었습니다. 총 135명의 환자를 1:1:1 비율로 세 군(200mg, 300mg, 위약)으로 무작위 배정하여, 매일 식사 직후 경구로 24주간 약물을 투여받게 됩니다. - 주 평가 지표는 24주 시점에서의 ETDRS 문자표 기준 최고교정시력(BCVA) 변화량이며, 이외에도 망막 두께, 망막 내/하부 액체량, 혈관 밀도 및 혈류량, 염증성 바이오마커(TNF-α, IL-6) 등의 변화를 포함한 다양한 이차 평가지표들을 통해 약물의 치료 효과를 종합적으로 분석합니다. - 약동학적 특성은 혈중 약물 농도 측정을 통해 파악되며, 안전성은 이상반응 발생률, 생체징후 변화, 심전도 및 혈액검사 등 다양한 지표를 통해 평가됩니다. 주요 유효성 분석은 MMRM(Mixed Model for Repeated Measures)을 이용하며, 300mg과 200mg 용량을 위약과 순차적으로 비교하여 통계적 유의성을 검증합니다. |
| 기대효과 | 본 임상을 통해 CU06-1004가 당뇨병성 황반부종 환자에서 유의미한 시력 개선 및 망막 구조 개선 효과를 나타낼 경우, 기존 항VEGF 주사제 중심의 치료법에 대한 대안으로 자리매김할 수 있을 것으로 기대됩니다. 특히 CU06-1004는 경구 투약이라는 비침습적 제형을 통해, 반복적인 안구 주사로 인한 환자 부담과 내원 횟수를 줄일 수 있는 잠재력을 보유하고 있습니다. 또한, 다양한 시각적 기능 및 구조적 개선 외에도 염증 조절과 혈관 안정화 등의 기전을 입증함으로써, 기존 치료제 대비 차별화된 약물 프로파일을 확보할 수 있습니다. 이번 임상에서 도출되는 최적 용량과 유효성·안전성 데이터는 향후 3상 시험 설계의 근거가 되며, 글로벌 라이선싱 및 상업화를 위한 핵심 기반 자료로 활용될 수 있습니다. 이를 통해 CU06-1004는 DME 치료 분야에서 새로운 경구 치료제로서의 가능성을 입증할 수 있을 것으로 기대됩니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(2) R&D CU71 (미국 임상1상 운영, 비임상, 약물 개발 및 생산 등)
CU71은 알츠하이머병, 혈관성 치매 등 퇴행성 뇌질환 치료를 목표로 하는 First-in-Class 신약 후보물질입니다. 혈액뇌관문(BBB) 기능 조절을 통해 뇌 내 환경을 개선하는 새로운 기전을 가지며, 전임상 연구에서 기존 알츠하이머병 치료제 대비 우수한 인지 기능 개선 효과 및 바이오마커 변화를 확인하였습니다.
금번 조달 자금 중 10,292백만원은 CU71의 미국 임상 1상 진입, 그리고 후속 개발 준비를 위해 사용될 예정입니다. 올해 추가 비임상 연구를 완료하고 2025년 하반기 중 미국 FDA와 Pre-IND 미팅을 진행하여, 2026년 상반기 임상 1상 진입을 목표하고 있습니다. 주요 사용처는 비임상 연구 비용, 임상약물 개발 및 생산 비용, 임상 1상 시험 수행을 위한 임상시험신청(IND), 개시 준비 및 운영비용 등입니다.
| [CU71 주요 자금 사용 계획 (25년 3분기 ~ 27년 2분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 2027년 1분기 | 2027년 2분기 | 합계 |
|---|---|---|---|---|---|---|---|---|---|
| 비임상 연구 | 500 | 1,022 | 990 | 370 | 510 | 100 | 240 | 150 | 3,882 |
| 임상1상 시험 IND 비용 | 0 | 0 | 0 | 0 | 300 | 0 | 0 | 0 | 300 |
| 임상1상 시험 개시 준비비용 | 0 | 0 | 0 | 0 | 500 | 1,500 | 0 | 0 | 2,000 |
| 임상1상 시험 운영비용 | 0 | 0 | 0 | 0 | 0 | 0 | 630 | 2,500 | 3,130 |
| 임상약물 개발 및 생산 | 50 | 580 | 100 | 50 | 50 | 50 | 50 | 50 | 980 |
| 합계 | 550 | 1,602 | 1,090 | 420 | 1,360 | 1,650 | 920 | 2,700 | 10,292 |
| 출처) 당사 제시 |
| [CU71 임상1상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | 이번 임상시험의 목적은 건강한 성인을 대상으로 CU71의 안전성, 내약성, 그리고 약동학적 특성을 평가하는 것입니다. 본 임상시험을 통해 단회 및 반복 투여 시 CU71의 체내 흡수, 분포, 대사 및 배출 특성을 확인하고, 인체 내에서의 안전성과 복용 가능 용량을 도출하여 향후 알츠하이머병 환자를 대상으로 한 임상 2상 진입을 준비하고자 합니다. |
| 임상시험 대상국가 | CU71의 이번 임상 1상 시험은 미국에서 진행될 예정입니다. 미국 식품의약국(FDA)의 승인을 받은 후, 미국 내 전문 임상시험기관에서 국제 임상시험 기준(GCP)을 준수하여 단일기관 방식으로 수행됩니다. |
| 임상시험 수행방법 | 임상시험은 건강한 성인을 대상으로 진행되며, 무작위배정, 이중눈가림, 위약대조 방식으로 설계되었습니다. 시험대상자는 단회 또는 7일간 반복하여 CU71을 경구로 투약받게 되며, 용량은 단계적으로 증량되며, 각 단계에서의 안전성과 약동학 데이터를 기반으로 다음 단계로의 진입 여부가 결정될 예정입니다. 시험 기간 동안 피험자들은 반복적인 혈액 및 소변 채취를 통해 약물의 혈중 농도 및 약동학적 지표를 측정받으며, 동시에 이상반응, 심전도 변화, 활력징후, 임상병리 검사 등을 통해 전반적인 안전성을 평가받게 됩니다. 특히 반복 투여 시 체내 약물 축적 여부를 확인하여 장기간 복용에 대한 위험성도 함께 평가하게 됩니다. |
| 기대효과 | 이번 임상시험을 통해 CU71이 건강한 성인에서 전신적으로 안전하고 예측 가능한 약동학적 특성을 보인다는 것이 입증된다면, 알츠하이머병 환자를 대상으로 한 후속 임상(2상) 진행이 가능해질 것으로 기대됩니다. 특히 CU71은 경구로 복용 가능한 치료제이기 때문에 기존 주사제 기반 치료에 비해 환자의 복약 편의성 및 치료 접근성을 크게 향상시킬 수 있을 것으로 보입니다. 아울러 본 임상 1상을 통해 확보되는 안전성 및 약동학 데이터는 적절한 초기 용량 설정에 중요한 근거가 되며, 후속 개발과 글로벌 파트너십 논의에도 긍정적인 영향을 줄 수 있을 것으로 예상됩니다. CU71은 기존 치료제의 한계를 극복할 수 있는 새로운 치료 옵션으로 자리매김할 가능성을 가진 후보물질로, 이번 임상을 통해 그 가능성을 한 단계 더 검증하는 계기가 될 것입니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(3) R&D CU01 (국내 임상2b상 운영, 임상3상 약물 생산 등)
CU01은 당뇨병성 신증 치료제로 개발 중이며, 현재 국내에서 임상 2b상 대상자 투약이 약 90% 완료되어 올해 하반기 임상 종료를 목표로 하고 있습니다.
조달 자금 중 1,900백만원은 CU01의 국내 임상 2b상 운영비용, 데이터 분석 및 보고 그리고 임상3상 시험 준비를 위한 원료의약품 구매 및 완제의약품 제조 활동에 투입될 예정입니다.
| [CU01 주요 자금 사용 계획 (25년 3분기 ~ 26년 4분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 2026년 2분기 | 2026년 3분기 | 2026년 4분기 | 합계 |
|---|---|---|---|---|---|---|---|
| 임상2b상 운영비용 | 500 | 500 | 300 | 0 | 0 | 0 | 1,300 |
| 임상3상 시험 원료의약품 구매 및 완제의약품 제조 | 0 | 0 | 0 | 0 | 100 | 350 | 450 |
| 데이터 분석 및 보고 | 50 | 50 | 50 | 0 | 0 | 0 | 150 |
| 합계 | 550 | 550 | 350 | 0 | 100 | 350 | 1,900 |
| 출처) 당사 제시 |
| [CU01 임상2b상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 |
본 임상시험은 알부민뇨를 동반한 제2형 당뇨병성 신증 환자를 대상으로, 당사의 신약 후보물질인 CU01-1001("CU01-1001"="CU01")을 24주간 투여하여 유효성과 안전성을 평가하고, 동시에 적절한 투여 용량을 탐색하기 위해 설계되었습니다. 당뇨병성 신증은 진행 시 투석 등 중증 합병증으로 이어질 수 있음에도 불구하고 현재까지 뚜렷한 치료제가 없는 영역으로, 이번 임상시험은 CU01-1001의 치료 가능성을 과학적이고 객관적인 방식으로 입증하고자 하는 데 목적이 있습니다. |
| 임상시험 대상국가 | 해당 임상시험은 대한민국 내에서만 진행되는 국내 임상시험으로 총 24개 의료기관에서 다기관 임상 형식으로 진행 중이며, 국내 환자 240명을 대상으로 모집 및 투약이 진행됩니다. |
| 임상시험 수행방법 |
본 임상시험은 알부민뇨가 동반된 제2형 당뇨병성 신증 환자를 대상으로 실시됩니다. 시험대상자에게는 당사의 임상시험용 의약품인 CU01-1001을 1일 2회 또는 1일 3회, 1회 120mg씩 경구 투여하며, 총 24주간 투여 후 유효성과 안전성을 평가하게 됩니다. 또한, 이번 임상은 다양한 환자 환경에서의 치료 효과를 평가하고자 하는 탐색적 임상시험의 성격을 가지며, 다기관, 무작위배정, 이중눈가림, 위약 대조, 평행설계 방식으로 설계되었습니다. |
| 기대효과 |
당뇨병성 신증은 제2형 당뇨병 환자에서 흔히 발생하는 만성 합병증으로, 진행 시 신기능 저하 및 말기신부전으로 이어질 수 있음에도 불구하고 현재까지 신장 기능을 유지하거나 개선하는 치료제는 부재한 상황입니다. 이번 임상시험은 CU01-1001이 당뇨병성 신증 환자에서 알부민뇨(단백뇨)의 개선 효과와 추정 사구체 여과율(eGFR) 등을 유의하게 개선할 수 있는지를 확인하는 것으로, 기존 RAS 차단제(ACEi, ARB) 중심 등의 치료 전략에서 벗어나, 새로운 기전의 치료 옵션 가능성을 제시할 수 있습니다. 또한, CU01-1001이 충분한 안전성과 유효성을 입증할 경우, 질병의 조기 개입을 통해 신장 기능의 악화를 지연시키고, 말기 환자들의 투석 의존도를 낮추는 임상적 가치가 클 것으로 기대됩니다. |
| 출처) 당사 제시 |
| 주) 본 임상시험계획은 확정이 아니며, 변경될 수 있습니다. |
(4) 운영자금 - 원료의약품 사업진출 (원료의약품 유통사업 자본금 확충)
당사는 신규 성장 동력 확보 및 사업 포트폴리오 다각화의 일환으로 원료의약품 유통사업 진출을 계획하고 있습니다. 이를 위해 「약사법」제38조제1항 및 관련 동법 시행규칙 제31조의2제2항에서 정하는 의약품 도매상의 자본금 요건(5억원 이상)을 충족시키고자 합니다.
조달 자금 중 500백만원은 원료의약품 유통사업을 위해 자본금 확충에 사용될 예정입니다. 이는 2025년 4분기에 집행될 계획이며, 안정적인 사업 개시를 위한 기반을 마련하는 데 기여할 것입니다.
(5) R&D 기타 (임상시험 공통 소모품 구매 및 연구 장비 유지보수)
당사는 개별 파이프라인 연구개발 활동 외에도, 다수의 임상시험 및 연구개발 과제를 원활하게 수행하기 위한 공통적인 지원 비용이 발생합니다. 이러한 비용은 특정 파이프라인에 직접 배부하기 어려운 연구 인프라 유지 및 공통 연구 활동 지원에 필수적입니다.
조달 자금 중 361백만원은 다양한 파이프라인의 비임상 및 초기 연구 단계에서 공통적으로 사용되는 고순도 시약, 실험용 세포주, 배지, 각종 실험기자재(튜브, 플레이트, 필터 등) 및 기타 연구용 소모품의 구매에 사용될 예정입니다.
또한, HPLC, 질량분석기, 분리분석기, 세포배양기 등 고가의 정밀 연구 장비에 대한 정기적인 유지보수 계약, 부품 교체, 교정 서비스, 소프트웨어 업데이트 등에도 자금이 투입되어 장비의 성능을 최적으로 유지하고 신뢰성 있는 연구 결과를 도출하는 데 기여할 것입니다.
이와 함께 연구소 실험실 운영에 필요한 유틸리티 비용, 폐기물 처리, 실험실 안전 관리 등 공통 시설 유지 관리에 필요한 경비와 연구 데이터의 체계적인 관리, 백업, 보안을 위한 시스템 운영 비용 및 전문 소프트웨어 라이선스 구매 및 갱신 비용으로도 사용될 계획입니다.
| [R&D 기타 주요 자금 사용 계획 (25년 3분기 ~ 26년 1분기)] |
| (단위: 백만원) |
| 세부 사용처 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | 합계 |
|---|---|---|---|---|
| 연구용 공통 소모품/시약 구매 | 20 | 30 | 100 | 150 |
| 연구 장비 유지보수/관리 | 15 | 28 | 88 | 131 |
| 공통 연구 시설 관리비 | 5 | 10 | 30 | 45 |
| 연구 데이터 관리/라이선스 비용 등 | 5 | 10 | 20 | 35 |
| 합계 | 45 | 78 | 238 | 361 |
| 출처) 당사 제시 |
상기 자금 사용 계획의 연도별/분기별 배분은 예상되는 연구개발 일정 및 각 과제의 진행 상황에 따라 실제 집행 과정에서 변동될 수 있으며, 중요한 변경 사항 발생 시 관련 규정에 따라 정기보고서에 공시할 예정입니다.
다. 자금이 계획대로 조달되지 않을 경우의 대응 방안
금번 주주배정 후 실권주 일반공모의 경우 확정발행가액 결정에 따라 최종 조달자금의 변동될 수 있습니다. 자금 사용계획에 대한 우선순위는 상기 기재한 바와 같으며, 금번 주주배정 후 실권주 일반공모를 진행하는 동안 주가 하락에 의하여 유입되는 자금이 감소할 경우 당사의 대응 방안은 다음과 같습니다.
가) 임상시험 비용 계획 조정
당사는 효율적인 자금 운용과 연구개발 활동의 최적화를 위해 임상시험 비용을 세밀하게 조정할 예정입니다. 금번 공모자금이 당사 예상 대비 줄어들 경우, 당사는 진행 중인 임상 연구 프로젝트 및 연구 과제에 대한 우선 순위를 재평가하여, 자문비용 및 데이터 사용 비용, 외부 전문가 활용 비용을 절감할 방안을 모색할 예정입니다. 이를 위해, 당사는 내부의 R&D 인력을 적극 활용하여 연구 개발 활동을 수행함으로써 외주 비용을 최소화하고, 동시에 내부 역량을 강화해 나갈 계획입니다. 이러한 전략적 조정을 통해, 당사는 제한된 자금을 가장 중요한 연구개발 활동에 효과적으로 할당하고, 장기적으로 회사의 핵심 가치와 성장 잠재력을 높일 수 있을 것으로 기대합니다
라. 유상증자 진행 배경
당사의 이사회는 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 추진하기에 앞서, 당사의 현재 재무 상태, 보유 현금 수준 및 단기적인 자금 운용 계획, 임상개발을 진행 중인 파이프라인의 사업성 및 예상되는 비용 규모, 그리고 예정된 전환사채 등의 차입금 상환 스케줄 등을 면밀히 검토하였습니다. 또한, 이를 바탕으로 자금 조달의 필요성과 시기의 적정성은 물론, 조달 자금의 규모와 사용 계획이 당사의 핵심 파이프라인 개발 및 신사업 진출 등 중장기 사업 전략에 부합하는지 다각적으로 분석하고 심도 있는 논의를 거쳤습니다.
그 결과, 현재의 내부 유보 자금 및 영업 현금흐름만으로는 예정된 임상 개발과 미래 성장 동력 확보를 위한 투자를 동시에 진행하기에 부족하며, 안정적인 재무구조를 유지하면서 기업가치를 극대화하기 위해서는 외부 자금 조달이 필수적이라는 결론에 이르렀습니다. 이에 당사 이사회는 본 유상증자가 회사의 핵심 경쟁력을 강화하고 지속 가능한 성장의 발판을 마련하기 위한 최적의 방안이라고 판단하였으며, 이사회가 검토한 금번 유상증자를 통해 자금을 조달하고자 하는 구체적인 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
3) 제약·바이오 산업 환경 변화에 대한 능동적 대응 및 경쟁 우위 확보
글로벌 제약·바이오 시장은 기술 발전 속도가 매우 빠르고 경쟁이 치열한 분야입니다. 이러한 환경 속에서 경쟁 우위를 확보하고 지속적으로 성장하기 위해서는 혁신적인 기술력과 함께 신속한 의사결정, 그리고 이를 뒷받침할 수 있는 충분한 자금력이 중요합니다. 당사는 금번 자금 조달을 통해 빠르게 변화하는 시장 환경과 기술 트렌드에 능동적으로 대응하고, 핵심 기술 및 파이프라인의 경쟁력을 강화하여 글로벌 시장에서 입지를 다져나갈 계획입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
4) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
마. 주주 권익 보호를 위한 사항
당사는 금번 유상증자를 추진함에 있어 주주님들의 이익을 최우선으로 고려하며, 유상증자 이후에도 지속적인 주주가치 제고를 위해 이사회에서 논의한 바와 같이 다음과 같은 정책을 추진하고 주주님들과의 소통을 강화하고자 합니다.
| [이사회의사록 발췌] |
|
| 출처) 2025년 05월 22일 당사 이사회의사록 |
1) 투명하고 공정한 정보 제공 강화
당사는 유상증자의 진행 과정, 조달 자금의 구체적인 사용 계획 및 집행 내역, 주요 경영 활동, 임상시험의 진행 상황 및 결과 등 주주 및 투자자분들의 의사결정에 중대한 영향을 미칠 수 있는 모든 정보를 관련 법규 및 규정을 철저히 준수하여 금융감독원 전자공시시스템(DART) 및 당사 홈페이지를 통해 신속, 정확, 충분하게 공시하겠습니다. 특히, 분기별 사업보고서 및 정기적인 IR 자료를 통해 조달 자금의 사용 현황을 상세히 안내하고, 자금 집행의 투명성을 확보하여 주주님들의 신뢰를 높이는 데 주력할 것입니다. 또한, 예측 정보나 미래 전망에 대해서는 합리적인 근거를 제시하고 발생 가능한 위험 요인에 대해서도 충분히 설명하여 투자자 보호에 만전을 기하겠습니다.
2) 적극적이고 다각적인 IR 활동을 통한 소통 활성화
당사는 주주님들과의 열린 소통을 경영의 중요한 가치로 여기고 있습니다. 이를 위해 국내외 기관투자자, 애널리스트, 언론뿐만 아니라 개인 주주님들을 포함한 모든 시장 참여자들과의 소통 채널을 확대하고 다각화할 계획입니다.
- 정기 및 비정기 기업설명회(IR) 및 주주간담회 개최: 연간 경영실적 발표회 외에도, 주요 경영 현안 발생 시 또는 시장의 관심이 높을 경우, 온/오프라인 기업설명회를 수시로 개최할 예정입니다. 특히, 당사는 금번 유상증자의 배경 및 회사의 향후 성장 전략을 주주님들께 상세히 설명드리고 의견을 경청하기 위해 2025년 05월 29일에 주주간담회를 개최할 예정입니다. 간담회의 구체적인 시간 및 장소, 참여 방법 등은 추후 당사 홈페이지 공지 및 별도 안내를 통해 신속히 알려드리겠습니다. 이를 통해 당사의 경영 전략, 연구개발 진행 상황, 향후 비전 등을 상세히 설명하고 질의응답 시간을 통해 주주님들의 궁금증을 해소하겠습니다.
- 소그룹 미팅 및 컨퍼런스 참여: 국내외 주요 투자 컨퍼런스에 적극적으로 참여하고, 기관투자자 및 애널리스트들을 대상으로 한 미팅을 정기적으로 진행하여 심도 있는 정보를 제공하고 상호 이해도를 높이겠습니다.
- 주주서한 및 온라인 소통 강화: 금번 유상증자와 관련하여 2025년 05월 16일 주주서한을 통해 회사의 입장을 전달드린 바와 같이, 앞으로도 중요한 경영 사항 발생 시 주주서한, 회사 홈페이지 공지, FAQ 게시, 이메일 문의 답변 등을 통해 주주님들과 적극적으로 소통하겠습니다. 특히 소액주주님들의 정보 접근성을 높이기 위해 노력하겠습니다.
- 주주총회의 내실 있는 운영: 정기 및 임시 주주총회를 단순한 의결 절차를 넘어, 주주님들과 경영진이 회사의 발전 방향에 대해 심도 있게 논의하고 의견을 교환하는 소통의 장으로 만들어가겠습니다.
| [주주서한] |
|
|
|
| 출처) 당사 홈페이지 |
당사는 금번 유상증자와 관련하여 주주와의 소통 강화를 위해 다양한 활동을 진행하고 있습니다. 당사는 1차 정정증권신고서 제출 전일인 2025년 06월 08일 기준으로 주주들과의 소통을 적극적으로 진행하였습니다. 구체적으로는 2025년 05월 29일 주주간담회를 개최하여 유상증자의 목적과 필요성을 상세히 설명하고 아래와 같은 Q&A를 진행하였으며, 참석하지 않은 주주분들도 내용을 확인할 수 있도록 당사 홈페이지에 Q&A를 게시하였습니다.
| [주주간담회 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 유상증자 자금의 사용 목적은 무엇인가요? A. 금번 유상증자를 통해 조달 예정인 약 286억 원은 △CU06 미국 당뇨병성 황반부종 임상 2b상 △CU71 미국 알츠하이머병 임상 1상 등 주요 파이프라인의 연구개발(R&D) 진척 △공통 소모품 구매 및 장비 유지보수 △원료의약품 유통사업 진출을 위한 자본금 확충 등에 사용될 계획입니다. |
| 2 | Q. 신규로 발행하는 주식의 형태는 무엇인가요? A. 큐라클㈜ 기명식 보통주로 발행됩니다. |
| 3 | Q. 주주배정 후 실권주 일반공모 방식의 유상증자 방식은 무엇인가요? A. 일정 기준일을 기준으로 주주명부에 등재된 기존 주주들께 신주를 우선 배정하며, 주주 청약 이후 발생한 실권주에 대해 일반 투자자를 대상으로 공모 청약을 진행하는 방식입니다. |
| 4 | Q. 유상증자의 참여 대상이 되기 위해서는 언제까지 주식을 보유해야 하나요? A. 신규로 발행할 주식을 배정받는 주주의 기준일(신주배정기준일)은 6월 26일로 예정되어 있으며, 증권결제일(T+2일)을 감안하여 2 영업일 전인 6월 24일까지 주식을 매수하시면 대상이 됩니다. |
| 5 | Q. 기존 주주에게는 어떠한 비율로 신주가 배정되는 건가요? A. 기존 주주의 개인별 청약 한도는 신주배정기준일인 6 월 26 일 현재 주주명부에 기재된 소유주식 1 주당 신주배정비율인 0.4996732494주를 곱하여 산정된 배정주식수 로 하되 , 1 주 미만의 단수주는 절사합니다. |
| 6 | Q. 신주의 발행가액은 어떻게 결정되나요? A. 최근 주가와 거래량을 기간 별로 가중산술평균하여 이를 반영한 기준주가가 결정되고 , 기준주가에 할인율과 증자비율을 반영하여 발행가액이 결정됩니다. 현재 공시된 예정 발행가액은 잠정적인 금액이며, 1 차 발행가액은 6월 23일 확정, 확정 발행가액은 7월 30일 산정되어 7월 31일에 공고될 예정입니다. 구체적인 발행가액 산정방식 및 세부내용은 전자공시시스템에 공시된 증권신고서를 참고해주시기 바랍니다. |
| 7 | Q. 청약에 참여하려면 어떻게 해야 하나요? A. 주주분들께서 현재 이용하고 계신 증권사의 HTS, MTS 를 통해 청약이 가능 합니다. 보유하고 계신 증권사 주식 계좌 내, 유상 청약 신청 메뉴를 통해 청약을 신청하실 수 있습니다. |
| 8 | Q. 신주인수권은 무엇인가요? A. 신주인수권은 유상증자 시 기존 주주가 보유하고 있던 주식 수에 비례하여 우선적으로 주식을 배정 받을 수 있는 권리를 말하며, 신주인수권은 정해진 기간 동안 시장에서 매매가 가능합니다(신주인수권증서 상장 및 거래기간 7월 15일-21일 예정). 기존 주주 분께서 유상증자에 참여하고 싶은 경우 신주인수권증서를 매도하지 않고 보유해야만 청약이 가능하며, 기존 주주가 아닌 분들은 유상증자에 참여하고자 하시는 경우 신주인수권증서를 매수하시면 됩니다. |
| 9 | Q. 신주인수권증서를 매매하는 방법과 매매가 가능한 기간은 어떻게 되나요? A. 신주인수권증서 매매는 HTS, MTS 등 온라인, 전화, 지점 내방 등을 통해 가능하며, 보유 수량의 일부 매도도 가능합니다. 자세한 사항은 이용 중이신 증권사 고객센터를 통해 안내 받으실 수 있습니다. 장내 신주인수권증서 매매는 정해진 5 영업일(7월 15일-21일 예정)동안 가능하며, 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. 장외 신주인수권증서 매매는 신주인수권증서 상장거래의 결제일인 7월 23(예정)일까지, 거래의 세부 요건은 계좌를 보유하고 계신 증권사를 통해 확인해주시기 바랍니다. |
| 10 | Q. 유상증자 청약 후에 취소가 가능한가요? A. 구주주 청약일(8월 4일-5일 예정) 또는 일반공모 청약일(8월 7일-8일 예정) 각 청약 기간 내에서만 취소가 가능합니다. |
| 11 | Q. 주주가 아닌 경우에도 청약에 참여할 수 있나요? A. 신주인수권증서 상장 및 거래기간(7월 15일-21일 예정)에 해당 증서를 매수하여 구주주 청약일(8월 4일-5일 예정)에 청약할 수 있으며, 구주주 청약 미달로 실권주가 발생할 경우 일반공모 청약을 통해서도 참여가 가능합니다. |
| 12 | Q. 신주는 언제부터 매매할 수 있게 되나요? A. 현재 예정된 일정을 기준으로 7월 15일 신주가 상장될 예정이며, 매매가 개시될 예정입니다. 일정이 변동될 경우 전자공시시스템 및 당사 홈페이지를 통해 안내할 예정이오니 참고 부탁드립니다. |
| 13 | Q. 초과청약을 120% 까지 할 수 있는 초과청약제도는 무엇인가요? A. 유상증자 초과청약제도는 신주인수권증서 청약자가 보유분보다 초과로 청약할 수 있고, 추후 실권주가 발생하는 경우 초과청약분을 추가로 배정받는 제도입니다. 주주 별로 배정되는 신주 수량의 최대 20% 까지 추가로 청약이 가능하며, 초과청약분이 실권주 발생 수량에 미달할 경우 청약분 100% 에 대해 신주를 배정받고, 초과청약분이 실권주 발생 수량을 초과할 경우 청약 주식 수에 비례하게 신주를 배정받게 됩니다. |
| 14 | Q. 행사 가능한 신주 인수 권리 수량을 초과하여 청약하려면 어떻게 해야 하나요? A. 추가 청약은 1) 배정 수량의 20% 내에서 초과 청약을 신청하는 방법과 2) 신주인수권 매매기간(7월 15일-21일 예정)동안 신주인수권증서를 매수하여 청약을 신청하는 방법 2가지가 있습니다. |
| 15 | Q. 초과 청약을 하였는데 초과분 전부를 배정 받지 못할 경우에 환불은 언제되나요? A. 구주주 청약과 일반공모 청약이 완료된 후 주금납입일(8월 12일 예정)에 청약 계좌로 환급됩니다. |
| 출처) 당사 제시 |
또한 주주와 유선 의견청취 및 소통 약 28회, 이메일 문의 12건에 대한 답변 등을 통하여 주주들의 의견을 수렴하고, 유상증자의 목적과 필요성을 상세히 설명히였습니다.
| [이메일 주요 Q&A 내용] |
| 구분 | 내용 |
| 1 | Q. 원료의약품 유통사업 자본금 5억원 사용 목적은? A. 당사는 신규 성장 동력 확보 및 사업 포트폴리오 다각화의 일환으로 원료의약품 유통사업 진출을 결정했으며, 유상증자를 통해 조달하는 금액 중 5억원은 원료의약품 유통사업을 위한 자본금 확충에 사용(약사법 내 의약품 도매상 자본금 요건)될 예정입니다. |
| 2 | Q. 1회차 전환사채(CB) 진행 상황은? A. 전환사채 만기 전 유보 현금을 사용해 당사에서 일부 채권(148억원)을 취득했으며, 향후 소각 또는 재매각 예정입니다. |
| 3 | Q. CU06 당뇨병성 황반부종 임상2b상을 진행하는 동안 기술이전이 가능한지? A. 임상 진행 중에도 기술이전이 가능하며, 임상시험과 사업화 활동을 병행해서 진행할 계획입니다. |
| 4 | Q. CU06 임상2b상 소요기간은 어느 정도로 예상하는지? A. 미국 FDA와 논의된 임상 디자인 상 약 2년 정도 소요될 것으로 예상하고 있으며, 경구제로만 임상을 진행하게 될 경우 앞선 임상2a상 등의 사례로 미루어 볼 때 주사제 임상보다 환자 모집이 수월할 것으로 예상하고 있습니다. |
| 5 | Q. CU01 임상2b상 결과는 언제 나오는지? A. 현재 환자 투여가 약 90% 정도 완료되었으며, 올해 4분기 중 임상이 종료되고 결과를 확인할 수 있을 것으로 예상하고 있습니다. |
| 6 | Q. MT-101, MT-103에 대한 기술이전을 진행 중인 파트너사들의 관심도가 높은지? A. MT-101, MT-103이 기반으로 하는 Tie2 활성화 항체는 글로벌 제약사 등이 최근 주목하고 있는 신규 타깃으로 많은 회사들의 관심을 받고 있습니다. 바이오 Europe, 바이오 USA 등 파트너링 미팅에서 MT-101과 MT-103이 전임상 시험에서 보인 우수한 데이터를 바탕으로 활발한 파트너링 활동을 진행 중입니다. |
| 출처) 당사 제시 |
이러한 노력은 주주들과의 신뢰를 공고히 하고, 당사의 유상증자 진행 과정에서 주주 의견을 실질적으로 반영하는 데 중점을 두고 있습니다. 특히 소액주주와 기관 투자자를 포함한 다양한 주체들과의 적극적인 소통은, 유상증자와 관련한 의사결정의 투명성을 높이고, 주주와의 협력을 강화하는 중요한 기반이 되고 있기에 당사는 주주들이 당사의 경영전략과 유상증자의 목적을 보다 명확하게 이해할 수 있도록 적극적으로 소통하고 있습니다.
3) 기업가치 제고를 통한 실질적인 주주 이익 환원
당사는 금번 유상증자를 통해 확보된 자금을 바탕으로 핵심 파이프라인의 연구개발을 성공적으로 완수하고, 기술이전 및 상업화를 통해 실질적인 기업 성장을 이루어내는 데 모든 역량을 집중할 것입니다.
- 핵심 사업의 성공적 추진: CU06, CU71 등 주요 파이프라인의 임상적 가치를 입증하고, 글로벌 기술이전 또는 자체 상업화를 통해 기업가치를 극대화하겠습니다.
- 신성장 동력 확보: 원료의약품 유통사업 등 신규 사업의 안정적인 시장 진입과 성장을 도모하고, 지속적인 연구개발을 통해 미래 성장 가능성이 높은 신규 파이프라인을 확보하겠습니다.
- 합리적인 주주환원 정책 수립 검토: 회사의 지속적인 성장과 이익 실현이 안정적인 궤도에 오르면, 재무 상태, 향후 투자 계획, 시장 상황 등을 종합적으로 고려하여 배당, 자사주 매입/소각 등 주주가치를 제고할 수 있는 다양한 방안을 적극적으로 검토하고, 관련 정책 수립 시 투명하게 공시하고 시행할 수 있도록 노력하겠습니다.
4) 이사회 중심의 투명하고 책임 있는 경영체제 확립
당사는 이사회의 독립성과 전문성을 강화하고, 경영진에 대한 효과적인 감독 기능을 수행함으로써 투명하고 책임 있는 경영체제를 구축하겠습니다. 이사회는 주주의 이익을 최우선으로 고려하여 의사결정을 하며, 모든 경영활동은 관련 법규와 정관을 준수하여 이루어질 것입니다. 또한, 내부회계관리제도의 효과적인 운영과 내부통제시스템 강화를 통해 경영의 투명성과 신뢰성을 지속적으로 높여나가겠습니다.
당사는 상기 언급된 주주 권익 보호 방안들을 성실히 이행하고, 끊임없는 혁신과 성장을 통해 주주님들의 기대에 부응할 수 있도록 최선을 다할 것을 약속드립니다.
3. 자금의 운용계획
금번 유상증자를 통해 조달되는 자금은 상기 "2. 자금의 사용목적"에 기재된 계획에 따라 집행될 예정입니다. 다만, 각 자금 사용 항목의 실제 집행 시기와 조달 시기 간에 일시적인 차이가 발생하여 미사용 자금이 발생할 수 있습니다.
이러한 미사용 자금에 대해서는 자금의 안정성과 환금성을 고려하여 운용할 계획입니다. 구체적으로, 자금 사용 시점까지의 기간, 시장 금리 수준, 금융기관의 안정성 등을 종합적으로 검토하여 국내 제1금융기관 및 기타 신용도가 높은 우량 금융기관의 수시입출금식예금(MMDA), 정기예금, 국공채, 기타 이에 준하는 안정성이 높은 단기 금융상품 등에 예치하여 운용할 예정입니다.
당사는 미사용 자금의 운용을 통해 발생하는 이자수익 등은 당사의 영업 외 수익으로 인식하고, 향후 사업 운영에 필요한 자금으로 활용할 계획입니다. 미사용 자금의 구체적인 운용 내역 및 현황은 향후 분기별 정기보고서 등을 통해 투명하게 공시하여 주주 및 투자자 여러분께서 확인할 수 있도록 하겠습니다. 당사는 조달된 자금이 본래의 목적에 따라 효율적으로 사용될 수 있도록 관리 및 감독을 시행할 것입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
해당사항 없음
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
1. 연결대상 종속회사 개황 (연결재무제표를 작성하는 주권상장법인이 사업보고서, 분기ㆍ반기보고서를 제출하는 경우에 한함)
가. 연결대상 종속회사 현황(요약)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 |
- |
- |
- |
- |
- |
| 비상장 |
- |
- |
- |
- |
- |
| 합계 |
- |
- |
- |
- |
- |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(삭제)' 참조 |
1-1. 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- |
- |
|
- |
- |
|
| 연결 제외 |
- |
- |
|
- |
- |
2. 회사의 법적ㆍ상업적 명칭
당사의 명칭은 "주식회사 큐라클"이며, 영문명은 "curacle co.,ltd."입니다.
3. 설립일자
당사의 설립일은 2016년 05월 12일 입니다.
4. 본사의 주소, 전화번호, 홈페이지 주소
|
구분 |
내용 |
|
본사 주소 |
서울특별시 서초구 효령로 23-1 |
|
전화번호 |
02-3487-0077 |
|
홈페이지 |
www.curacle.com |
5. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
[큐라클] 벤처기업확인서 (22.11.01~25.10.31)
[큐라클] 벤처기업확인서 (22.11.01~25.10.31).pdf
[큐라클] 중소기업 확인서(중기업) (25.04.01~26.03.31)
[큐라클] 중소기업 확인서(중기업) (25.04.01~26.03.31).pdf
6. 대한민국에 대리인이 있는 경우에는 이름(대표자), 주소 및 연락처
보고서 작성기준일 현재 해당사항이 없습니다.
7. 주요 사업의 내용 및 향후 추진하려는 신규사업에 관한 간략한 설명
당사는 고령화에 따른 난치성 혈관 및 대사성질환의 혁신적인 치료제 연구/개발업을 주력사업으로 영위하고 있습니다. 기타 자세한 사항은 「Ⅱ. 사업의 내용」을 참조하시기 바랍니다.
8. 당사의 정관에 기재된 목적 사업은 다음과 같습니다.
|
사업목적 |
비고 |
|
의약품, 의약외품 개발, 제조, 판매업 의료기기, 기자재 개발, 제조, 판매업 건강식품, 건강기능 및 보조식품 개발, 제조, 판매업 식품 및 화장품 개발, 제조, 판매업 농축산약품, 화공약품 개발, 제조, 판매업 화장품 및 화장품 원료, 신변잡화 개발, 제조, 판매업 의료기기, 미용기기, 미용제품, 의료장비, 헬스용품 개발, 제조, 판매업 위 각호와 관련된 도소매, 유통, 임가공, 서비스업 위 각호와 관련된 무역(수출입) 및 무역중개업 부동산임대 및 전대업 동물 의약품/의약외품 개발 제조, 판매업 위 각호와 관련된 부대사업 일체 |
- |
9. 신용평가에 관한 사항
보고서 작성기준일 현재 해당사항이 없습니다.
10. 회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 코스닥시장 상장 | 2021년 07월 22일 | 기술성장기업의 코스닥시장 상장 |
2. 회사의 연혁
1. 회사의 본점소재지 및 그 변경
|
일자 |
본점소재지 |
|
2016.05.12 |
서울시 강남구 밤고개로1길 10, 912호 (수서동, 현대벤처빌) |
|
2016.11.18 |
경기도 성남시 분당구 판교로 253, 비동 801호 (삼평동, 판교이노밸리) |
|
2018.10.10 |
경기도 성남시 분당구 판교로 255번길 9-22, 512호 (삼평동, 우림더블유시티) |
|
2019.09.27 |
경기도 성남시 수정구 창업로 54, 608, 609, 610, 611호 (시흥동, 엘에이치 판교 제2테크노밸리 기업성장센터) |
|
2022.04.15 |
서울특별시 서초구 효령로 23-1(방배동, 큐라클빌딩) |
2. 경영진 및 감사의 중요한 변동
|
변동일자 |
주총종류 |
선임 |
임기만료 또는 해임 |
|
|
신규 |
재선임 |
|||
|
2019.03.22 |
정기주총 |
사내이사 김영명 |
사내이사 권영근 감사 김활년 |
사내이사 이인규 |
|
2019.07.24 |
임시주총 |
사내이사 김명화 |
- |
- |
|
2019.07.24 |
- |
사내이사 김명화 대표이사 취임 |
- |
- |
|
2019.12.24 |
- |
기타비상무이사 김영명 기타비상무이사 권영근 |
- |
- |
|
2020.03.30 |
정기주총 |
사외이사 추연성 |
- |
- |
|
2021.01.05 |
임시주총 |
사외이사 최동훈 |
- |
- |
|
2021.03.29 |
정기주총 |
기타비상무이사 추연성 감사 고민석 |
- |
사외이사 추연성 감사 김활년 |
|
2021.09.30 |
- |
- |
- |
대표이사 김명화 |
|
2021.11.26 |
임시주총 |
사내이사 유재현 |
- |
대표이사 박광락 |
|
2021.11.26 |
- |
사내이사 유재현 대표이사 취임 사외이사 조상헌 |
- |
- |
|
2022.03.30 |
정기주총 |
- |
기타비상무이사 김영명 기타비상무이사 권영근 |
- |
|
2022.07.22 |
임시주총 |
감사 서규영 |
- |
감사 고민석 |
| 2024.03.27 | 정기주총 | 사내이사 권영근 | 사내이사 유재현 대표이사 기타비상무이사 추연성 사외이사 최동훈 사외이사 조상헌 |
기타비상무이사 권영근 |
| 2025.03.31 | 정기주총 | 감사 송경호 | 기타비상무이사 김영명 | 감사 서규영 |
3. 최대주주의 변동
보고서 작성기준일 현재 해당사항이 없습니다.
4. 상호의 변경
보고서 작성기준일 현재 해당사항이 없습니다.
5. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행 중인 경우 그 내용과 결과
보고서 작성기준일 현재 해당사항이 없습니다.
6. 회사가 합병 등을 한 경우 그 내용
2025년 03월 06일 공시된 주요사항보고서(회사합병결정)를 참고하시길 바랍니다.
7. 회사의 업종 또는 주된 사업의 변화
보고서 작성기준일 현재 해당사항이 없습니다.
8. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
|
일자 |
주요 연혁 |
|---|---|
|
2019.01 |
신약연구소 이전 (대전시 한국화학연구원) |
|
2019.04 |
CU06 (혈관내피기능장애): 기술도입계약 체결 (연세대학교) |
|
2019.05 |
CU01 (당뇨병성 신증): 임상 2a상 IND 식약처 승인 |
|
2019.06 |
Covance(UK)와 연구협약 체결 (CU06 global GLP 시험 관련) |
|
액면분할(5,000원 →500원)후 빌행주식총수 4,848,980주 |
|
|
2019.08 |
IPO 대표주관사 계약 체결 (삼성증권) |
|
2019.10 |
본사이전 (경기도 판교제2테크노밸리 기업성장센터) |
|
Patheon (cGMP, USA)와 협약 체결 |
|
|
2019.10 |
3차 유상증자(3자배정): 561,291주 / 증자 후 자본금 2,705백만원 |
|
2019.12 |
CU03 (습성 황반변성): 임상 2a상 IND 식약처 승인 |
|
2020.01 |
중앙연구소 설립 (판교제2테크노밸리 기업성장센터) |
|
2020.03 |
유한화학(cGMP)과 계약 체결 (미국 임상용 DS생산 관련) |
|
2020.04 |
중소벤처기업부 연구기반활용사업(연구집중형) 선정 |
|
CU06 보건복지부 제약사업 전주기 글로벌 진출 강화 지원사업 과제 선정 |
|
|
2020.06 |
LS Pharma 와의 연구협약 체결(제제연구) |
|
2020.08 |
CU01 (당뇨병성 신증): 임상2a상 시험대상자 모집 완료 |
|
CU03(습성 황반변성) 임상2a상 내약성 평가완료. 추가환자 60명 모집 |
|
|
2020.10 |
전자증권제도 도입 |
| CU06 (혈관내피기능장애): 미국 임상용 DP 생산완료 (cGMP) | |
|
4차 유상증자 : 149,213주 / 증자 후 자본금 2,780백만원 |
|
|
2020.11 |
연세대학교 연구협약 체결 및 산학협력 바이오랩 개설 |
|
이노비즈 인증 (중소벤처기업부 인증번호 : 200605-01197) |
|
|
스톡옵션 행사 : 98,500주 / 증자 후 자본금 2,829백만원 |
|
|
2020.12 |
연세대 세브란스병원과 신약 연구개발 및 학술활동 연구협약 체결 |
|
2차 무상증자 : 5,657,984주 / 증자 후 자본금 5,658백만원 |
|
|
2021.01 |
CU06 : 임상1상 미국 IND 신청 |
|
고려대 약학대학 및 약과학연구소와의 혁신 신약개발 연구협약 체결 |
|
|
2021.03 |
CU06: 임상 1상 미국 IND 승인 |
|
CU01: 임상2a상 국내 완료 |
|
| 기술특례상장을 위한 기술성 평가 통과 (등급:AA. A) | |
| 2021.07 | 코스닥시장 상장 |
| 2021.09 | CU01 (당뇨병성 신증): 임상3상 국내 IND 신청 |
| 2021.10 | CU06 (당뇨병성 황반부종 및 습성 황반변성): 기술이전 계약 체결 |
| 2021.11 | 유재현 단독 대표이사 취임 |
| 2022.01 | 바이오연구소 설립 |
| 2022.04 | 본사이전 (서울 서초구 효령로 23-1 큐라클빌딩) |
| 2022.06 | CU06 임상1상 결과 보고서 확보 |
| 2022.07 | CU01(당뇨병성 신증): 임상2b상 IND 승인 |
| 2022.09 | CU06 (당뇨병성 황반부종): 임상2a상 미국 IND 승인 |
| 2022.11 | 연구개발유형 벤처기업 인증 획득 |
| 2022.12 | 산업통상자원부 첨단기술제품 확인인증 획득 |
|
2023.04 |
서울대학교 약학대학 임상약학 연구실과 학술교류 및 공동연구 수행을 위한 업무협약(MOU) 체결 |
|
2023.05 |
CU104(궤양성 대장염): 임상2상 미국 IND 제출 |
|
2023.06 |
항체치료제 개발기업 맵틱스와 글로벌 신약 공동 연구개발 및 사업화를 위한 업무협약(MOU) 체결 |
|
2023.06 |
CU104(궤양성 대장염): 임상2상 미국 IND 승인 |
|
2023.06 |
CU06 (당뇨병성 황반부종): 미국 임상2a상 시험대상자 모집 완료 |
|
2023.06 |
반려동물신약개발사업단과 동물용 의약품 신약개발을 위한 업무협약(MOU) 체결 |
|
2023.07 |
인공지능 기반 신약발굴 기업 스탠다임과 글로벌 신약 공동 연구개발 및 사업화를 위한 업무협약(MOU) 체결 |
|
2023.07 |
CU104(궤양성 대장염): 임상2상 유럽 IND 제출 |
| 2023.08 | 궤양성 대장염 및 면역 항암 병용 치료 후보물질 국내 임상1b상 신청 |
| 2023.09 | 반려동물신약개발사업단과 반려동물 신부전 치료제 공동개발 기술계약 체결 |
| 2023.12 | CU104 (궤양성 대장염): 임상 2상 유럽 IND 승인 |
| 2024.02 | CU06 미국 임상2a상 Topline 결과 발표 (당뇨병성 황반부종) |
| 2024.03 |
큐라클 종합기술원(CAIT) 설립 |
| 2024.03 |
CU104 (궤양성 대장염): 임상 2상 한국 IND 신청 |
| 2024.04 | CU06 미국 임상2a상 결과 보고서 수령 |
| 2024.05 | CU06 미국 임상1상 결과 ARVO 2024(미국 시과학안과학회)에서 포스터 발표 |
| 2024.05 | CU06 (당뇨병성 황반부종 및 습성 황반변성): 계약해지 및 권리반환 통보 |
| 2024.07 | CU06 미국 임상2a상 결과 ASRS 2024(미국 망막학회)에서 구연 발표 |
| 2024.07 | 항체치료제 개발기업 맵틱스와 항체 치료제 공동 연구개발 계약 체결 |
| 2024.09 | CU06 미국 임상2a상 결과 EURETINA 2024(유럽 망막학회)에서 e-포스터 발표 |
| 2024.10 | 안전성평가연구소와 반려동물 난치질환 치료제 개발 위한 MOU 체결 |
| 2024.12 | CU104(궤양성 대장염) : 임상2상 한국 IND 신청 자진취하 |
| 2024.12 | CU06 미국 임상2a상 결과 ARC 2024(제4회 아시아망막학회) 및 한국망막학회 총회 학술대회에서 구연 발표 |
| 2025.01 | CP01-R01(반려동물 만성신장질환) 임상3상시험 계획 승인 |
| 2025.02 |
CU06 미국 식품의약국(FDA) Type C 미팅 진행 |
| 2025.03 | 원료의약품 기업 대성팜텍 흡수합병 결정 |
3. 자본금 변동사항
당사는 기업공시서식 작성기준에 따른 소규모기업에 해당하여 '자본금 변동사항' 을 기재하지 아니합니다.
4. 주식의 총수 등
1. 주식의 총수 현황
| (기준일 : | 증권신고서 제출 전일 | ) | (단위 : 주, %) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 100,000,000 | - | 100,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 14,009,155 | - | 14,009,155 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | - | - | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | - | - | - | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 14,009,155 | - | 14,009,155 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 14,009,155 | - | 14,009,155 | - | |
| Ⅶ. 자기주식 보유비율 | - | - | - | - | |
5. 정관에 관한 사항
1. 정관의 최근 개정일
당사 정관의 최근 개정일은 2024년 03월 27일 입니다.
2. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2019.06.27 | 제04기 임시주주총회(1차) | - 회사가 발행할 주식의 총수 - 일주의 금액 |
액면분할에 따른 정관 변경 |
| 2019.09.26 | 제04기 임시주주총회(2차) | - 주식등의 전자등록 - 주식의 종류 - 신주인수권 - 주식의 명의개서 및 재발행 - 전환사채의 발행 - 신주인수권부사채의 발행 - 이익참가부사채의 발행 - 교환사채의 발행 - 소집통지 - 소집지 - 의장의 질서유지권 - 주주의 의결권 - 상호주에 대한 의결권 제한 - 의결권의 불통일 행사 - 이사의 수 - 이사의 선임 - 이사회의 구성과 소집 - 감사의 수 - 감사의 선임 - 감사의 직무 - 외부감사인의 선임 - 이익배당 - 분기배당 |
전자증권제도 도입 및 코스닥상장을 위한 정관 변경 |
| 2021.03.29 | 제05기 정기주주총회 | - 주식의 종류 - 주식의 전환에 관한 종류주식 - 신주인수권 - 주식매수선택권 - 신주의 배당기산일 - 명의개서대리인 - 주주명부 - 주주명부의 폐쇄 및 기준일 - 전환사채의 발행 - 신주인수권부사채의 발행 - 사채 및 신주인수권증권에 표시하여야 할 권리의 전자등록 - 소집시기 - 이사의 수 - 감사의 선임 - 이익배당 - 분기배당 |
상법 개정에 따른 변경 |
| 2022.03.30 | 제06기 정기주주총회 | - 본점의 소재지 - 기준일 - 시행일 |
본점 이전에 따른 변경 |
| 2024.03.27 | 제08기 정기주주총회 | - 발행예정 주식 총수 - 신주인수권 - 주주의 작성, 비치 - 전환사채의 발행 - 신주인수권부 사채의 발행 - 이익참가부사채의 발행 - 교환사채의 발행 - 소집통지 및 공고 - 의결권의 대리행사 |
한국거래소 표준 정관 준용 |
3. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
|
1 |
의약품, 의약외품 개발, 제조, 판매업 |
영위 |
|
2 |
의료기기, 기자재 개발, 제조, 판매업 |
미영위 |
|
3 |
건강식품, 건강기능 및 보조식품 개발, 제조, 판매업 |
미영위 |
|
4 |
식품 및 화장품 개발, 제조, 판매업 |
미영위 |
|
5 |
농축산약품, 화공약품 개발, 제조, 판매업 |
미영위 |
|
6 |
화장품 및 화장품 원료, 신변잡화 개발, 제조, 판매업 |
미영위 |
|
7 |
의료기기, 미용기기, 미용제품, 의료장비, 헬스용품 개발, 제조, 판매업 |
미영위 |
|
8 |
위 각호와 관련된 도소매, 유통, 임가공, 서비스업 |
미영위 |
|
9 |
위 각호와 관련된 무역(수출입) 및 무역중개업 |
미영위 |
|
10 |
부동산임대 및 전대업 |
미영위 |
|
11 |
동물 의약품/의약외품 개발 제조, 판매업 |
영위 |
|
12 |
위 각호와 관련된 부대사업 일체 |
미영위 |
II. 사업의 내용
1. 사업의 개요
당사는 '혈관내피기능장애(Endothelial Dysfunction)'를 정상화하여 다양한 난치성 질환의 근본 원인을 개선하는 혁신적인 치료제를 연구·개발하는 바이오 벤처 기업입니다. 당사는 화학 합성 신약(Small Molecule)을 발굴하는 독자적인 신약개발 플랫폼 솔바디스(SOLVADYS®)와 오픈 이노베이션을 통해 확보한 생물학적 제제(Biologics) 발굴 플랫폼 이글스(EAGLES®)를 바탕으로, 의학적으로 차별화된 치료 접근법을 제시하며 상용화 및 확장 가능성이 높은 파이프라인을 구축하여 연구/개발을 진행하고 있습니다.
당사가 개발 중인 파이프라인은 모두 First-in-Class 신약이며 CU06, CU71, CU01, MT-101, MT-103 등 핵심 파이프라인을 비롯해 여러 파이프라인들의 연구/개발을 활발히 진행 중입니다.
 |
|
솔바디스 플랫폼 및 이글스 플랫폼 |
당사는 혈관내피기능장애 차단제(Endothelial Dysfunction Blocker, ED Blocker) 개발에 특화된 신개념 플랫폼 기술 솔바디스(SOLVADYS®)를 활용하여 혈관 정상화 및 염증 차단을 특징으로 하는 ED Blocker 물질, CU06-1004(이하 ‘CU06-1004’ = ’CU06’)를 발굴해 개발 중에 있습니다. 당뇨병성 황반부종 및 습성 황반변성 등 망막 질환 치료제로 개발중인 CU06은 2022년 6월 건강한 성인을 대상으로 한 미국 임상1상을 완료했으며, 2024년 4월 당뇨병성 황반부종 환자를 대상으로 한 미국 임상2a상을 완료했습니다. CU06은 개념증명(PoC, Proof of Concept)을 확인하는 임상2a상에서 환자를 대상으로 효능과 안전성을 확인했습니다. 특히 미국 FDA(식품의약국)가 망막 질환 치료제 허가 시 가장 중요하게 평가하는 시력개선 지표(BCVA, Best Corrected Visual Acuity)에서 경구용 치료제 중 세계 최초로 임상적으로 의미 있는 효과를 확인했습니다. 임상2a상 결과는 미국, 유럽 및 아시아 망막학회(ASRS, EURETINA, ARC) 등에서 발표되며 주목을 받았고, 당사는 임상2a상 결과를 토대로 후속 임상을 준비 중입니다. CU71은 솔바디스 플랫폼과 SPAR(Structure-Phenotypic Activity Relationship) 개념 확립을 통해 발굴한 차세대 혈관내피기능장애 차단제입니다. 알츠하이머, 혈관성 치매 등 퇴행성 뇌질환을 적응증으로 개발 중인 CU71은 BBB Dysfunction 및 Neuro Inflammation을 개선하는 First-in-Class 경구용 약물로 2024년 7월 물질특허를 출원했으며, 알츠하이머병 동물모델 전임상 시험에서 Donepezil 대비 우수한 인지기능 개선 효과를 확인했습니다. 대표적인 당뇨 합병증 중 하나인 당뇨병성 신증 치료제로 개발중인 CU01은 2022년 7월 국내 임상2b상을 승인받아 환자 240명을 대상으로 임상을 진행 중입니다. 이외에도, 2024년 3월 큐라클 종합기술원(CAIT, Curacle Advanced Institute of Technology) 설립 이후 차세대 혈관내피기능장애 후보물질들을 연이어 발굴해 나가고 있습니다. 또한 항체 전문기업 맵틱스와 2023년 6월 업무협약(MOU) 및 2024년 7월 공동 연구개발 계약을 체결하여 항체 파이프라인 8개를 확보했습니다. 당사와 맵틱스는 Tie2 활성화 항체 기반인 MT-101(급성 신손상· 만성 신부전) 및 이중항체 MT-103(당뇨병성 황반부종· 당뇨 망막병증· 습성 황반변성) 등에 대한 공동 연구/개발 협업을 활발히 이어나가고 있습니다. MT-101 및 MT-103은 2025년 3월 국내 및 PCT 특허를 출원했습니다.
 |
|
파이프라인_핵심 |
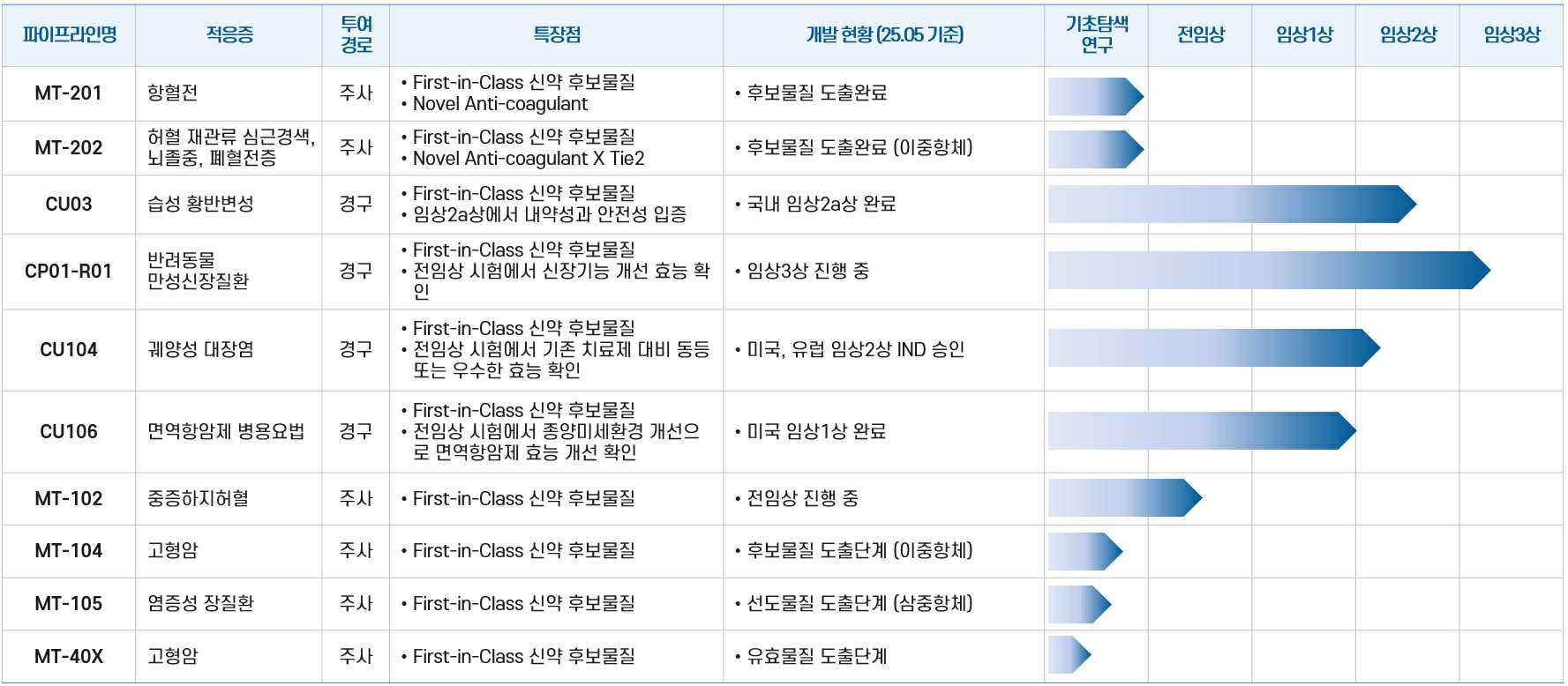 |
|
파이프라인_이머징 |
(주1) 자세한 내역은 회사 홈페이지 참조를 부탁드립니다.
(http://curacle.com/kor/pipeline/overview.html)
2. 주요 제품 및 서비스
1. 주요 제품 등의 현황
당사는 혈관내피기능장애 차단제 개발의 혁신 플랫폼 기술인 SOLVADYS® 플랫폼 기술을 이용한 First-in-Class 신약후보물질을 개발하고 파트너사와의 공동연구 또는 기술이전을 사업화 모델로 하고 있어 제품 판매에 대한 매출은 존재하지 않습니다. 다만, 라이선스 계약에 따른 초기 기술료(Upfront), 개별 단계별마일스톤(Milestone), 판매액에 대한 로열 티와 임상연구비용 및 제반비용 등을 수익으로 인식하고 있습니다. 당사는 2021년 10월 떼아 오픈이노베이션에 기술이전한 CU06에 대하여 계약금(Upfront) 및 연구개발비 보전금액을 수령했으며, 2024년 5월 16일자로 계약해지 및 권리반환 통보를 받았지만 기수령한 계약금 및 연구개발비 보전금액에 대한 반환의무는 없습니다.
| (단위: 백만원) |
|
품목 |
매출액 (비율) |
제품설명 |
|
CU06 |
- |
□ 망막질환(당뇨병성 황반부종, 습성 황반변성) 치료제로 개발 중인 세계 최초 혈관내피기능장애 차단제 |
| CU71 | - |
□ 차세대 혈관내피기능장애 차단제 신규 물질로 2024년 7월 물질특허 출원 □ BBB Dysfunction 및 Neuro Inflammation을 개선하는 First-in-Class 경구용 약물로 퇴행성 뇌질환(알츠하이머 등) 치료제로 개발할 계획이며 현재 전임상 진행 중 |
|
CU01 |
- |
□ Nrf2 활성 및 TGF-β/Smad3 억제를 통해 당뇨병성 신증을 치료할 수 있는 새로운 작용 기전의 First-in-Class 혁신신약임 |
| MT-101 | - |
□ Tie2 신호전달 경로를 활성화시켜 혈관을 구조적/기능적으로 정상화 및 안정화시키는 기전을 가진 First-in-Class 항체 신약으로 전임상 진행 중 □ 급성 신손상 및 만성 신부전 적응증으로 개발중이며, 충남대학교병원에서 진행한 동물모델 실험 등에서 신장혈관 손상을 개선하는 효과를 입증함 □ 2023년 국가신약개발사업 과제로 선정됨 |
| MT-103 | - |
□ Tie2 활성화 항체와 VEGF 항체를 결합한 이중 항체로 망막 질환(습성 황반변성, 당뇨병성 황 반부종, 당뇨 망막병증) 치료제로 개발중인 First-in-Class 신약임 □ 서울아산병원에서 진행한 동물모델 실험에서 기존 치료제인 아일리아 대비 우수한 효능을 확 인하였으며, 현재 전임상 진행 중 □ 2024년 국가신약개발사업 과제로 선정됨 |
|
CU03 |
- |
□ 경구용 습성 황반변성 치료제이며 글로벌 최초의 천연물 신약으로서 높은 인체 안전성이 특징□ 안구내 주사제와의 병용으로 주사투여의 횟수 감소와 동시에 습성 황반변성 치료 효과의 시너지를 기대할 수 있음 |
2. 주요 제품 등의 가격변동추이 및 가격변동원인
당사의 사업구조는 신약후보물질을 개발하여 기술이전을 사업화 모델로 하고 있습니다. 신약의 기술이전은 거래구조와 조건에 따라 크게 변동하므로 주요 제품 등의 가격변동 추이를 기재하기 어렵습니다.
3. 원재료 및 생산설비
1. 원재료 매입에 관한 사항
당사의 주요 영업활동은 신약연구개발로서 제품 제조를 위한 별도의 원재료에 대한 매입은 없습니다.
2. 생산설비에 관한 사항
당사의 주요 영업활동은 신약연구개발로서 제품 제조를 위한 별도의 생산 및 생산 설비에 관하여는 해당사항이 없습니다. 비임상 및 임상약 생산은 위탁생산전문업체(CMO, Contract and Manufacturing Organization)가 업무를 수행하고 있습니다.
4. 매출 및 수주상황
1. 매출실적
당사는 혈관내피기능장애 차단제 개발의 혁신 플랫폼 기술인 SOLVADYS® 플랫폼 기술을 이용한 First-in-Class 신약후보물질을 개발하고 파트너사와의 공동연구 또는 기술이전을 사업화 모델로 하고 있어 제품 판매에 대한 매출은 존재하지 않습니다. 다만, 라이선스 계약에 따른 초기 기술료(Upfront), 개별 단계별마일스톤(Milestone), 판매액에 대한 로열 티와 임상연구비용 및 제반비용 등을 수익으로 인식하고 있습니다. 당사는 2021년 10월 떼아 오픈이노베이션에 기술이전한 CU06에 대하여 계약금(Upfront) 및 연구개발비 보전금액을 수령했으며, 2024년 5월 16일자로 계약해지 및 권리반환 통보를 받았지만 기수령한 계약금 및 연구개발비 보전금액에 대한 반환의무는 없습니다.
| (단위: 백만원) |
| 매출유형 | 품목 | 제10기 1분기 | 제9기 | 제8기 |
|---|---|---|---|---|
|
용역매출 |
CU06 |
- | 1,633 |
10,294 |
|
합 계 |
- | 1,633 |
10,294 |
|
2. 판매경로 및 판매방법
가. 판매조직
당사는 신약후보물질을 개발하여 기술이전을 목표로 하고 있으며 이를 위한 조직으로 사업개발본부를 운영하고 있습니다. 미국 및 북미시장은 BIO USA 및 각 북미학회 지회 Conference 참가 및 Business meeting을 통하여 다수의 글로벌 제약사 및 사업기회가 있는 회사들과 라이선스 아웃에 대한 접촉을 하고 있으며, 아시아 및 유럽은 Bio China, Bio Japan, Bio Europe 등의 Conference 참가를 활발히 진행하고 있습니다. 또한, 국내 Major 제약회사들과 지속적으로 접촉하는 등 다방면으로 사업기회를 찾고 있습니다.
나. 판매전략
당사는 신약개발을 전문으로하는 바이오벤처 기업이며, 비즈니스 모델은 SOLVADYS® 플랫폼과 EAGLES®플랫폼, 오픈 이노베이션 등을 통해 확보한 차세대 난치성 질환 치료제 개발과 더불어 글로벌 제약사와의 전략적 기술제휴를 통한 기술료 매출 및 수익 창출입니다.
글로벌 제약사와의 라이선스 아웃 추진은 해외 컨퍼런스, 파트너사와의 네트워크를 통해 상호 정보교환으로 착수되며 기본적인 프로세스는 '파트너링 미팅 → NCD 자료공개 → CDA 체결 → 지속적인 정보공유 → MTA 계약 → Term sheet 작성 → Due diligence → 라이선스 계약' 단계로 구성되어 있습니다. 당사는 이미 라이선스 대상 기술 및 파이프라인에 대하 여 다수의 글로벌 제약사와 CDA 계약을 체결하고 '지속적인 정보공유' 단계로 파트너사의 Unmet needs에 대해 지속적으로 연구결과를 업데이트하며 소통하고 있습니다.
3. 수주상황
당사의 주요 영업활동은 신약연구개발로서 수주 산업이 아니므로 해당사항이 없습니다.
5. 위험관리 및 파생거래
1. 시장위험과 위험관리
당사는 금리위험, 가격위험, 환위험 등 다양한 시장위험에 노출되어 있습니다. 이러한 위험 요소들을 관리하기 위하여 각각의 위험요인에 대해 면밀하게 모니터링하고 대응하는 위험관리 정책을 운용하고 있으며, 이에 대한 자세한 사항은「III. 재무에 관한 사항 → 5. 재무제표 주석」을 참조하시기 바랍니다.
2. 파생상품 및 풋백옵션 등 거래현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
6. 주요계약 및 연구개발활동
1. 경영상의 주요계약
가. 라이선스 아웃(License out) 계약
보고서 작성기준일 현재 당사가 체결 중인 주요 라이선스 아웃 계약은 해당사항 없습니다.
당사는 2021년 10월 27일 Thea Open Innovation과 체결한 당뇨병성 황반부종 및 습성 황반변성 치료제 CU06에 대한 기술이전 계약에 대해 2024년 5월 16일자로 계약해지 및 권리반환 통보를 받았으며, Thea Open Innovation로부터 수령한 계약금(Upfront payment) 및 연구개발비 보전금액에 대한 반환의무는 없습니다.
|
품목 |
계약 상대방 |
대상 지역 |
계약 체결일 |
계약 종료 통보일 |
계약 종료일 |
계약금액 |
수취금액 |
진행 단계 |
|
CU06 |
Thea Open Innovation (떼아오픈이노베이션) |
아시아제외 전세계 |
2021.10.27 |
2024.05.16 |
2024.07.12 |
US$163,500,000 |
US$6,000,000 |
미국 임상2a상 결과보고서 수령 |
■ 품목: CU06
|
계약상대방 |
Thea Open Innovation (떼아오픈이노베이션, 프랑스) |
|
계약내용 |
떼아오픈이노베이션이 CU06에 대한 독점권 권리를 갖고 임상시험, 허가, 상업화를 진행 |
|
대상지역 |
아시아를 제외한 전세계 지역 |
|
계약기간 |
계약체결일 : 2021.10.27 |
|
총계약금액 |
US$163,500,000, 로열티는 매출액의 8% 별도 수취 |
|
수취금액 |
반환 의무가 없는 계약금(Upfront) : US$6,000,000 (2021.11.10) |
|
계약조건 |
계약금(Upfront): US$6,000,000 마일스톤(Milestone) : US$157,500,000 경상기술료(Royalty) : 매출액의 8% |
|
회계처리방법 |
계약금은 2021년~2022년 동안 분할하여 수익 인식 |
|
대상기술 |
당뇨병성 황반부종 및 습성 황반변성 치료제 |
|
개발진행경과 |
2022.06 미국 임상1상 완료 (당뇨병성 황반부종/습성 황반변성) 2022.08 미국 임상2a상 IND 신청 (당뇨병성 황반부종) 2022.09 미국 임상2a상 IND 승인 (당뇨병성 황반부종) 2023.06 미국 임상2a상 대상자 등록 완료(당뇨병성 황반부종) 2024.02 미국 임상2a상 Topline 결과 발표 (당뇨병성 황반부종) |
|
기타사항 |
□ 상기 마일스톤은 임상 성공시, 적응증 및 지역에 따른 허가시, 매출에 따른 목표 달성시 수령 하며, 계약금과 각 단계별로 수령하는 마일스톤과 로열티는 반환 의무가 없음. □ 당사는 FDA 1상까지의 비용을 부담하며, 2상 진입시부터는 떼아오픈이노베이션에서 비용을 부담합니다. 기존 계약에 추가하여 비임상 비용도 떼아오픈이노베이션에서 부담함 |
나. 라이선스 인(License in) 계약
|
품목 |
계약상대방(국적) |
대상지역 |
계약체결일 |
계약종료일 |
계약의 목적 및 내용 |
총계약금액 |
지급금액 |
진행단계 |
비고 |
|
CU06 |
연세대학교 산학협력단(한국) |
전세계 |
2019.04.12 |
2030.10.29 |
특허기술 양도 |
주1) |
주1) |
미국 임상2a상 결과보고서 수령 |
경상기술료 별도 |
|
CU01 |
경북대학교 산학협력단, 경북대학교병원(한국) |
전세계 |
2017.02.01 |
2033.02.13 |
특허기술 양도 |
주1) |
주1) |
임상 2b상(한국) 진행중 |
경상기술료 별도 |
|
CU03 |
한국한의학연구원(한국) |
전세계 |
2017.03.21 |
특허권 만료일 (2035.05.21) 또는 제품출시후 10년 중 더 늦은 기간 |
특허기술 실시계약 (전용실시권) |
주1) |
주1) |
임상 2a상(한국) 완료 |
경상기술료 별도 |
|
CU05 |
연세대학교 산학협력단(한국) |
전세계 |
2017.02.03 |
2035.06.29 |
특허기술 양도 |
주1) |
주1) |
후보물질 최적화 진행중 |
경상기술료 별도 |
|
합계 |
- |
- |
- |
- |
|||||
(주1) 계약 세부 내용의 경우 영업기밀에 해당하므로 기재하지 않았습니다. 자료: (주)큐라클
■ 품목 : CU06
|
계약상대방 |
연세대학교 산학협력단 |
|
계약내용 |
특허 양수도 계약에 따라 큐라클이 신약후보물질 CU06-1004 물질특허권리를 양도 받고 임상시험, 허가, 생산, 상업화를 진행 |
|
대상지역 |
전세계 |
|
계약기간 |
계약체결일 (2019.04.12) ~ 2030.10.29 |
|
총 계약금액 |
양사 합의에 의해 계약 규모 미공개 |
|
지급금액 |
양사 합의에 의해 계약 규모 미공개 |
|
계약조건 |
매출 발생에 대한 로열티 수취 |
|
회계처리방법 |
기술료는 향후 발생 시 인식 |
|
대상기술 |
신규 혈관누출 차단제, 당뇨병성 황반부종 치료제 |
|
개발 진행경과 |
당뇨병성 황반부종 임상2a상 완료 (미국) |
|
기타사항 |
- |
자료: ㈜큐라클
■ 품목 : CU01
|
계약상대방 |
경북대학교 산학협력단, 경북대학교병원 |
|
계약내용 |
특허 양수도 계약에 따라 CU01 용도 특허권리를 양도 받고 임상시험, 허가, 생산, 상업화를 진행 |
|
대상지역 |
전세계 |
|
계약기간 |
계약체결일 (2017.02.01) ~ 2033.02.13 |
|
총 계약금액 |
양사 합의에 의해 계약 규모 미공개 |
|
지급금액 |
양사 합의에 의해 계약 규모 미공개 |
|
계약조건 |
매출 발생에 대한 로열티 수취 |
|
회계처리방법 |
기술료는 향후 발생 시 인식 |
|
대상기술 |
만성 신장 질환 포함 당뇨병성 신증 치료제 |
|
개발 진행경과 |
임상2b상 진행 중(한국) |
|
기타사항 |
- |
자료: ㈜큐라클
■ 품목 : CU03
|
계약상대방 |
한국한의학연구원 |
|
계약내용 |
특허 전용실시권 계약에 따라 독점권 물질 특허 권리를 양도 받고 임상시험, 허가, 생산, 상업화를 진행 |
|
대상지역 |
전세계 |
|
계약기간 |
계약체결일 (2017.03.21) ~ 특허권 만료일(2035.05.21) 또는 제품출시후 10년 중 더 늦은 기간 |
|
총 계약금액 |
양사 합의에 의해 계약 규모 미공개 |
|
지급금액 |
양사 합의에 의해 계약 규모 미공개 |
|
계약조건 |
매출 발생에 대한 로열티 수취 |
|
회계처리방법 |
기술료는 향후 발생 시 인식 |
|
대상기술 |
습성 황반변성 치료제 및 당뇨망막병증 치료제 |
|
개발 진행경과 |
임상2a상 완료(한국) |
|
기타사항 |
- |
자료: ㈜큐라클
■ 품목 : CU05
|
계약상대방 |
연세대학교 산학협력단 |
|
계약내용 |
특허 양수도 계약에 따라 용도 특허권리를 양도 받고 비임상 후보물질 도출연구 진행 |
|
대상지역 |
전세계 |
|
계약기간 |
계약체결일 (2017.02.03) ~ 2035.06.29 |
|
총 계약금액 |
양사 합의에 의해 계약 규모 미공개 |
|
지급금액 |
양사 합의에 의해 계약 규모 미공개 |
|
계약조건 |
매출 발생에 대한 로열티 수취 |
|
회계처리방법 |
기술료는 향후 발생 시 인식 |
|
대상기술 |
항암제(췌장암, 대장암, 삼중음성유방암 등) |
|
개발 진행경과 |
후보물질 최적화 중 |
|
기타사항 |
- |
자료: ㈜큐라클
다. 공동연구개발 계약
|
품목 |
계약 상대방 |
계약체결일 |
계약종료일 |
계약의 목적 및 내용 |
계약금액 |
지급방법 |
진행경과 |
비고 |
|
CU02 |
광주과학기술원(한국), 경북대학교(한국), 한국과학기술원(한국) |
2017.08.25 |
2024.03.05 |
공동연구개발 |
(주1) |
(주1) |
기술이전 반환 |
(주2) |
| MT-101 | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 전임상 진행 중 | - |
| MT-102 | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 전임상 진행 중 | - |
| MT-103 | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 전임상 진행 중 | - |
| MT-104 | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 후보물질 도출단계 |
- |
| MT-105 | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 선도물질 도출단계 |
- |
| MT-201 | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 후보물질 도출완료 |
- |
| MT-202 | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 후보물질 도출완료 |
- |
| MT-40X | 주식회사 맵틱스(한국) | 2024.07.01 | 공동연구개발이 종료되는 날 | 공동연구개발 | (주1) | (주1) | 유효물질 도출단계 |
- |
(주1) 계약 세부 내용의 경우 영업기밀에 해당하므로 기재하지 않았습니다.자료: ㈜큐라클
(주2) 최근 신약 개발 및 경쟁 상황과 규제 기준을 고려하였을 때 글로벌 경쟁력을 갖추기가 쉽지 않다고 판단하여 2024년 03월 05일로 계약 종료되었습니다.
■ 품목 : CU02
|
계약상대방 |
광주과학기술원, 경북대학교, 한국과학기술연구원 |
|
계약내용 |
공동 연구개발 계약에 따라 CU02의 후보물질 도출연구 공동 진행 |
|
대상지역 |
전세계 |
|
계약기간 |
계약체결일 (2017.08.25)~ 2024.03.05 |
|
총 계약금액 |
양사 합의에 의해 계약 규모 미공개 |
|
지급금액 |
양사 합의에 의해 계약 규모 미공개 |
|
계약조건 |
매출 발생에 대한 로열티 수취 |
|
회계처리방법 |
기술료는 향후 발생 시 인식 |
|
대상기술 |
비알콜성 지방간염 치료제 |
|
개발 진행경과 |
기술이전 반환 |
|
기타사항 |
- |
자료: ㈜큐라클
2. 연구개발 활동
가. 연구개발 활동의 개요
당사는 플랫폼 기술을 기반으로 모세혈관 기능장애에 기인하는 난치성 혈관질환 치료제를 연구 및 개발하는 바이오 벤처기업으로 고령화에 따른 난치성 혈관 및 대사성질환의 혁신적인 치료제 개발을 목표로 하고 있습니다.
나. 연구개발 담당 조직
(1) 연구개발 조직 구성
보고서 작성기준일 현재 당사는 박사급 10명, 석사급 7명 등 총 22명의 연구인력을 보유하고 있으며 각 조직별 주요 역할은 아래와 같습니다.
|
조직 |
역할 |
|
신약연구본부 |
- 전임상 후보물질 개발, 합성 공정 개발 - 공정 지표 물질 및 방사성 표지 물질 (Stable isotope) 합성 |
|
임상개발본부 |
- 임상시험 전략 수립 및 임상개발 수행 - 임상 인허가 관리 |
|
연구개발본부 |
- 임상 DS/DP개발 및 생산, GLP 시험 관리, 지식재산권 관리 - 대사체 분석 연구, 후보물질 분석 연구 및 MV 시험 |
|
바이오연구본부 |
- 기전 및 in vitro/ in vivo 효능 시험 |
(2) 연구개발 인력 구성
|
구분 |
박사 |
석사 |
학사 |
합계 |
|
신약연구본부 |
6 |
2 |
0 |
8 |
|
임상개발본부 |
0 |
2 |
2 |
4 |
|
연구개발본부 |
1 |
1 |
1 |
3 |
|
바이오연구본부 |
3 |
2 |
1 |
6 |
|
계 |
10 |
7 |
4 |
21 |
(3) 주요 연구개발 인력
|
직위 |
성명 |
담당업무 |
주요경력 |
주요 연구실적 |
| 이사회의장 |
권영근 |
종합기술원 총괄 |
- State University of New York at Buffalo 생화학 박사 - 한국혈관학회 회장(전) - 한국과학기술한림원 정회원(현) - (주)큐라클 이사회의장('20.04~현재) |
- 신규 혈관 누출 차단제 개발 (기술이전) AMIGO2와 3-포스포이노시티드-의존 키나아제1의 |
|
사외이사 |
최동훈 |
임상개발 및 중개 연구 자문 |
- 연세대학교 의학 박사 - 용인세브란스병원 병원장('19.03~‘22.07) - 연세의료원 심장혈관병원 심장내과 교수(’22.08~현재) - (주)큐라클 사외이사('21.01~현재) |
- 대한 심장학회 학술이사/기초과학연구회 회장 |
|
기타 |
추연성 |
해외사업 |
- 미국 Univ Illinois at Chicago 약학 박사 - LG생명과학 부사장 및 고문('00~'17) - ㈜TSD라이프사이언스 ㈜진메디신, ㈜스탠다임 고문('18~'22) - (주)스탠다임 대표이사('23~현재) - (주)큐라클 기타비상무이사('20.03~현재) |
- LG생명과학 합성신약(신규 퀴놀론계항균제) 한국 최초 美 FDA 승인 획득 - LG생명과학 바이오의약품(인간성장호르몬) 한국 최초 유럽 EMEA / 美 FDA 승인 획득 - LG생명과학 신약/신제품 (신규 당뇨병치료제, 골관절염치료제, 진통소염제) 출시 - 美 훽스트메리엔루셀 신규 항구토제 美 FDA 승인 획득 |
|
기타 |
김영명 |
연구개발자문 |
- 미국 Utah 주립대학교, 이학박사(생화학) - 강원대 우수연구센터장 ('01~ '09) |
- 황반 및 당뇨성 망막질환 치료제 개발 |
|
상무이사 |
이원일 |
전임상 후보물질 및 |
-서울대학교, 약학박사 - C&C 신약연구소 책임연구원('01~'15) - 젬백스앤카엘 연구개발본부 이사('15~'16) - 제일약품 신약연구부 책임연구원('16~'17) - 대원제약 신약연구부 이사('17~'22) |
- 제2형 당뇨병, 고지혈증 치료제 및 항암제 개발 - 소염진통제, 제2형 당뇨병 치료제의 신규염/공결정을 이용한 개량신약 개발 - GnRH 길항제의 process development 및 임상시험을 위한 API 합성 - 역류성식도염 치료제, 진통제, 항암제 개발 - 펩타이드 백신 및 약물 개발 - 유방암 치료제 개발 - 통풍 치료제 개발 - 아토피 피부염 치료제 개발 - COPD치료제 개발(PDE4 inhibitor) - 당뇨병 치료제 개발(SGLT2 inhibitor) |
|
이사 |
김판경 |
임상 개발, |
- 경북대학교, 의학 석사 - LG 생명과학 Clinical study leader ('10.08~'14.05) |
- 국내신약 제미글로 임상개발 및 품목허가 - 글로벌신약 롤론티스 임상개발 - 다수의 신약, 개량신약 임상개발 및 품목허가 - 글로벌 라이센싱 아웃 2건 |
| 이사 /본부장 |
표정인 | DS/DP 생산 및 품질관리, 조제물 및 생체시료 분석 연구 | - 연세대학교, 이학박사(의약화학) - 한국과학기술연구원(KIST) 연구원('03-06~'14.12) - 삼육대학교 특임교수/비전임('11.09~'14.07) - iNtRON Biotechnology 신약연구 팀장('15.01~'17.07) |
- CMC 총괄: 국내 2a상(2건), 2b상(1건), 미국 1상(1건), 2a상(1건) - 파키슨병 치료제 개발: Pyrazolopyrimidine - Calcium channel blocker 개발: Oxo & thioxoquinaxoline carboxamides - 천연물 유래의 생리활성물질 개발: Xanthorrhizol, Vitamin D3 전합성 - 약물전달 기술개발: nanoparticle(polymeric, liposome), BNCT modulator(Nucleoside, Inositol, Folic acid complex) - Generic drug 개발: 항히스타민제, 과민성 방광증상 치료제, 당뇨병 치료제(DPP-4) - 발효균주를 이용한 빈혈 치료제 개발: eHeme - 산업용 소재개발(효소촉매 고정화 및 반응): 생체 고분자, Carbohydrate - 특허출원 국내외 77건 |
다. 연구개발 비용
당사는 연구 및 임상개발 등에 소요되는 모든 비용을 당기 비용으로 회계처리하고 있습니다.
[연구개발비 현황]
| (단위 : 백만원) |
|
구분 |
2025년 |
2024년 |
2023년 |
|
|
연구개발비용 총계 |
2,694 | 9,641 | 16,048 | |
|
회계처리내역 |
회계처리금액 |
2,694 | 9,641 | 16,048 |
|
정부보조금 |
- | - | - | |
|
연구개발비용 합계 |
2,694 | 9,641 | 16,048 | |
|
연구개발비/매출액 비율 |
- | 590.5% | 155.9% | |
라. 연구개발 실적
(1) 연구개발 진행현황 및 향후계획
[연구개발 진행 총괄표]
| 구분 | 품목 | 적응증 | 현재 진행단계 (국가) | 비고 |
| 화학합성 | CU06 | 당뇨병성 황반부종 | 임상2a상 결과보고서 수령 (미국)(*) | - |
| 화학합성 | CU06 | 습성 황반변성 | 임상1상 완료 (미국) | - |
| 화학합성 | CU104 | 궤양성 대장염 | 글로벌 임상2상 미국, 유럽 IND 승인 | CU06 적응증 확장 프로젝트 |
| 화학합성 | CU106 | 면역항암제 병용요법 | 임상1상 완료 (미국) | CU06 적응증 확장 프로젝트 |
| 화학합성 | CU01 | 당뇨병성 신증 | 임상2b상 진행중 (한국) | 2022.07 (임상2b상 IND 승인) |
| 생물학적 제제 | MT-101 |
급성 신손상·만성 신부전 |
전임상 진행 중 | 맵틱스 공동 연구개발 |
| 생물학적 제제 | MT-103 | 습성 황반변성·당뇨병성 황반부종·당뇨 망막병증 | 전임상 진행 중 | 맵틱스 공동 연구개발 |
| 천연물 | CU03 | 습성 황반변성 | 임상2a상 완료 (한국) | - |
| 화학합성 | CU71 | 퇴행성 뇌질환 | 전임상 진행 중 | BBB Stabilizer |
| 화학합성 | CP01-R01 | 반려동물 만성 신장질환 | 임상3상 진행 중(한국) | CU06 반려동물 의약품 |
| 생물학적 제제 | MT-102 | 중증하지허혈 | 전임상 진행 중 | 맵틱스 공동 연구개발 |
| 생물학적 제제 | MT-104 | 고형암 | 후보물질 도출단계 | 맵틱스 공동 연구개발 |
| 생물학적 제제 | MT-105 | 염증성 장질환 | 선도물질 도출단계 | 맵틱스 공동 연구개발 |
| 생물학적 제제 | MT-201 | 항혈전 | 후보물질 도출완료 | 맵틱스 공동 연구개발 |
| 생물학적 제제 | MT-202 | 허혈 재관류 심근경색, 뇌졸중, 폐혈전증 | 후보물질 도출완료 | 맵틱스 공동 연구개발 |
| 생물학적 제제 | MT-40X | 고형암 | 유효물질 도출단계 | 맵틱스 공동 연구개발 |
■ 품목 : CU06
|
구분 |
화학합성 신약(경구용) |
|
적응증 |
당뇨병성 황반부종·습성 황반변성 |
|
작용기전 |
- 혈관내피기능장애로 인해 손상되거나 비정상적인 혈관을 정상화해 시신경세포 보호 효과를 나타내고 이를 통해 시력을 개선 - 혈관내피세포의 actin 구조 변형을 통해 내피세포 연접을 안정화 - 혈관내피세포 NF-kB 염증신호체계 차단 - 혈관내피세포의 생존율 향진 및 보호 효과 |
|
제품의 특성 |
- 혈관내피기능장애 차단제로 혈관내피세포의 Actin 구조 변형을 통해 내피세포 연접을 정상화함 -혈관내피세포 NF-kB 염증신호체계 차단 -혈관내피세포의 생존율 향진 및 보호 효과 - 12주 투여 후 황반중심두께(CST) 값의 변화가 없어 부종을 악화시키기 않고 유지하는 것을 확인했으며, 사후 분석(Post-hoc analysis)에서 두께 변화, 망막하액, 삼출물 정도 등을 정성적으로 확인한 결과 용량의존적으로 해부학적 개선이 있었음을 관찰함 - 안구내 주사 형태의 기존 치료제와 달리 경구용 치료제로서 환자의 투약 편의성 및 복약 순응도를 증가시킬 수 있음 |
|
진행경과 |
- 2021.01 미국 FDA 임상1상 IND 신청 - 2021.02 미국 FDA 임상1상 IND 승인 - 2021.03 임상시험 개시 후, 7월에 첫 투여 실시함 - 2022.03 마지막시험대상자의 마지막 방문 완료 - 2022.08 미국 FDA 임상2a상 IND 신청 - 2022.09 미국 FDA 임상2a상 IND 승인 - 2023.06 미국 임상2a상 대상자 등록 완료 - 2023.11 미국 임상2a상 마지막 대상자의 최종방문 완료 - 2024.05 미국 시과학안과학회(ARVO)에서 임상1상 결과 포스터 발표 - 2024.07 미국 망막학회(ASRS)에서 임상2a상 결과 구연 발표 - 2024.09 유럽 망막학회(EURETINA)에서 임상2a상 결과 포스터 발표 - 2024.11 신규제형 2차 개발 완료 - 2024.12 제4회 아시아망막학회(Asia Retina Congress, ARC) 및 한국망막학회 총회 학술대회(ARC)에서 임상2a상 구연 발표 - 2025.01 당뇨 마우스 모델 실험에서 시신경 보호 메커니즘 규명 - 2025.02 미국 식품의약국(FDA) Type C 미팅 진행 |
|
향후계획 |
- 임상2a상, Type C 미팅 결과를 바탕으로 후기 임상 진입 예정 - 글로벌 기술이전 추진 |
|
경쟁제품 |
- 안구내 주사제(Anti-VEGF) : 아일리아, 바비스모, 루센티스 등 - 망막 혈관질환인 당뇨병성 황반부종과 습성 황반변성은 시력저하 및 실명에 도달할 수 있는 매우 심각한 질환이지만, Anti-VEGF 주사제를 활용한 치료법 외에 다른 치료대안이 없어 CU06과 같은 비침습적인 투여 경로에 대한 미충족 의료수요가 높음 |
|
관련논문 등 |
Sac-1004, a novel vascular leakage blocker, enhances endothelial barrier through the cAMP/Rac/cortactin pathway. Biochem Biophys Res Commun. 435(3): 420-427 (2013)를 통한 기전규명 등 다수 적응증 확장 논문/학회 발표 진행 |
|
글로벌 시장규모 |
2021년 128억 달러에서 2031년 339억 달러(CAGR 10.3%)로 성장 전망(출처 : 글로벌데이터 기준 : 선진국 7개국) |
| 기타사항 | - |
■ 품목 : CU-71
| 구분 | 화학합성 신약(경구용) |
| 적응증 | 퇴행성 뇌질환 |
| 작용기전 |
- 혈관내피세포의 actin 구조 변형을 통해 내피세포 연접을 안정화 - 혈관내피세포 NF-kB 염증신호체계 차단 - 혈관내피세포의 생존율 향진 및 보호 효과 |
| 제품의 특징 |
- 혈관내피세포의 Actin 구조 변형을 통해 내피세포 연접을 안정화 - 혈관내피세포 NF-kB 염증신호체계 차단 - 혈관내피세포의 생존율 향진 및 보호 효과 - CU71은 알츠하이머의 발병 요인이자 악화 요인으로 최근 대두되는 BBB Dysfunction과 Neuro Inflammation을 개선하는 차세대 경구용 약물로 시장에서 새로운 치료 패러다임을 가져올 것으로 기대함 - 알츠하이머 동물모델에서 가장 널리 사용되고 있는 치료제(Donepezil) 대비 인지기능을 통계적으로 유의미하게 개선하는 효능 확인 - 아밀로이드 베타, 신경교 세포 등 알츠하이머와 관련된 주요 바이오마커에서도 우수한 결과 확인 |
| 진행경과 | - 2024년 07월 물질특허 출원 - 2025년 01월 용도특허 출원 |
| 글로벌 시장규모 | - 알츠하이머 시장 2033년 약 245억 달러(한화 35조 원) |
| 향후계획 |
- 기술이전 추진 |
■ 품목 : CU01
|
구분 |
화학합성 신약(경구용) |
|
적응증 |
당뇨병성 신증 |
|
작용기전 |
- Nrf2 활성(Nuclear factor erythroid-2-related factor 2, 항산화 유전자의 유도발 현에 영향을 주는 대표적인 전사인자)과 TGF-β(전환성장인자 베타, Transforming growth factor-beta)/Smad3(전환성장인자의 수용체에 작용하는 단백질) 억제 기 전의 First-in-Class 약제로 항산화 및 섬유화 억제 작용을 갖고 있어 신섬유증 및 신섬유증을 수반하는 만성신장질환 환자의 예방 및 치료 |
|
제품의 특성 |
[당뇨병성 신증의 근본적인 치료] - 당뇨병성 신증은 혈역학적 요인과 당뇨 및 고혈압 등과 관련된 대사성 요인에 의하여 발생하며, 여기에는 각종 세포내 신호전달 경로와 TGF-β 등의 여러 사이토카인이 작용함. - CU01은 디메틸푸마레이트(DMF)의 Nrf2 활성 및 TGF-β/Smad3 억제를 통한 신 장 섬유화를 치료할 수 있는 새로운 작용 기전의 First-in-Class 혁신 신약임. - 미국 Biogen 사의 블록버스터 의약품(다발성 경화증 치료제 Tecfidera, 2019 Peak Sales;제네릭 출시 이전 4,433 Million US$ / 2021 Sales 486.5 Million US$)의 주성분 디메틸푸마레이트를 Drug Repositioning 방법을 이용하여 당뇨병성 신증 치료제로 개발하였음. |
|
진행경과 |
- 2019.05 식품의약품안전처 임상2a상 IND 승인 - 2019.09 첫 환자 투여 - 2020.08 안전성자료모니터링위원회(DSMB)에서 안전성 중간분석 회의 결과, CU01의 안전성 이슈가 없으므로 임상시험 지속 권고 받음. - 2021.03 국내에서 진행한 임상 2a 상 임상시험결과보고서(CSR) 발행됨 - 알부민뇨가 나타나는 제2형 당뇨병성 신증 (Diabetic Nephropathy) 환자 39명을 대상으로 CU01-1001 또는 위약을 12주간 투여한 결과 CU01-1001 투여군에서 ACR 개선에 효과 확인. - 신기능 개선에 주요 지표가 되는 사구체 여과율 (estimated Glomerular Filtration Rate)의 통계적으로 유의한 증가를 관찰함 - 2022.07 식품의약품안전처 임상 2b상 IND 승인 - 2023.02 임상 2b상 대상자 등록 진행 |
|
향후계획 |
- 후기 임상 진입 전략 수립 및 기술이전 추진 |
|
경쟁제품 |
- 현재 당뇨병성 신증 치료제는 고혈압 및 당뇨병 치료제가 주로 사용되고 있으며, 섬유화 진행을 억제하는 경쟁 약물은 없음. - Non-steroidal MRA(Mineralocorticoid Receptor Antagonist) : Kerendia(Finerenone) 등 - RAS(Renin-angiotensin-aldosterone system) Inhibitor : Cozaar(Losartan Potassium), Micardis(Telmisartan) 등 - SGLT-2 Inhibitor : Jardiance(Empagliflozin) 등 |
|
관련논문 등 |
Dimethylfumarate Attenuates Renal Fibrosis via NF-E2-Related Factor 2- Mediated Inhibition of Transforming Growth Factor-β/Smad3 Signaling, PLoS One 2012, 7(10):e45870를 통한 기전규명 등 다수 논문/학회 발표 진행 |
|
글로벌 시장규모 |
만성신부전 글로벌시장 2024년 약 5조원 규모 전망 (출처: Evaluate Pharma Database) |
|
기타사항 |
현재 임상2b상이 진행 중이며, 2025년 임상이 종료될 것으로 예상됨 |
■ 품목 : MT-101
| 구분 | 생물학적 제제(주사제) |
| 적응증 | 급성 신손상 · 만성 신부전 |
| 작용기전 | - Tie2 신호전달 경로 활성화시켜 혈관을 구조적/기능적으로 정상화 및 안정화 |
| 제품의 특징 | - Tie2 활성화 항체 중 맵틱스 항체의 Tie2 활성도 및 효과가 가장 우수(맵틱스 내부 비교실험 결과) - 충남대학교병원 신장내과에서 진행한 급성 신손상, 만성신부전 동물모델 효능평가에서 유의적인 효능 검증 |
| 진행경과 |
- 2023.04 2023년도 제1차 국가신약개발사업 과제 선정 - 현재 전임상 진행 중 |
| 향후계획 | - 맵틱스와 공동 연구개발을 통해 임상 진입 전략 수립 및 기술이전 추진 |
| 글로벌 시장규모 | 만성 신부전 2033년 시장 규모 135억 달러(CAGR 19.6%)로 성장 전망(출처 : 글로벌데이터) |
■ 품목 : MT-103
| 구분 | 생물학적 제제(주사제) |
| 적응증 | 당뇨병성 황반부종·당뇨 망막병증·습성 황반변성 |
| 작용기전 | - Tie2(Tunica Interna Endothelial cell kinase 2) 신호전달 경로 활성화 & VEGF 억제 & Ang-2(Angiopoietin-2) 억제하는 삼중 기능을 가진 이중 항체 |
| 제품의 특징 |
- 기존 안구내 주사제(Anti-VEGF)제에 불응하는 환자에게 새로운 기전의 치료제 필요성 대두 - 이중 항체치료제인 Faricimab은 Tie2 활성화를 저해하는 Ang-2(Angiopoietin-2)를 억제하지만, Tie2 자체를 활성화시키는 효능은 한계가 있음. Tie2를 활성화하려면 Ang-1(Angiopoietin-1)이 필요한데, Ang-1이 적거나 낮게 발현되는 환자의 경우 Faricimab의 약효를 볼 수 없는 가능성이 있음 - MT-103은 Tie2 활성화 항체를 포함하고 있어 직접 Tie2를 활성화시키기 때문에, Ang-1이 결핍되거나 Faricimab 등에 불응하는 환자들에게 좋은 효과를 보일 것으로 기대 - 서울아산병원 연구팀에서 수행한 습성 황반변성 모사 동물모델 기반 효능평가 시험에서 기존 치료제인 Aflibercept 대비 우수한 효능 확인 |
| 진행경과 |
- 2024.04 2024년도 제1차 국가신약개발사업 과제 선정 - 현재 전임상 진행 중 |
| 향후계획 | - 맵틱스와 공동 연구개발을 통해 임상 진입 전략 수립 및 기술이전 추진 |
| 경쟁제품 |
- 안구내 주사제(Anti-VEGF) : 아일리아, 바비스모, 루센티스 등 - Anti-VEGF의 불응 비율이 40%에 달하고, 장기적으로 사용할 경우 효과가 감소하기 때문에 새로운 기전을 가진 혁신적인 신약의 필요성 대두 |
| 글로벌 시장규모 | 2021년 128억 달러에서 2031년 339억 달러(CAGR 10.3%)로 성장 전망(출처 : 글로벌데이터 기준 : 선진국 7개국) |
■ 품목 : CU03
|
구분 |
천연물 신약(경구용) |
|
적응증 |
습성 황반변성 |
|
작용기전 |
항산화, 항염증, 항신생혈관 및 항투과성 |
|
제품의 특성 |
- 경구용 천연물 신약으로 안전하고 효과적인 천연 약재인 계지와 목단피가 주성분 - 경구투여로 기존 안구내 주사제가 갖는 부작용을 줄이고, 황반변성 치료에 큰 효과를 나타낼 수 있는 것이 동물실험에서 확인됨. - 기존 anti-VEGF 주사제와 병용 사용하여 치료 효율을 높일 수 있는 장점이 있음 |
|
진행경과 |
[임상2a시험 진행] - 2019.12 식품의약품안전처 IND 승인 - 2020.09 내약성 평가완료 - 마지막 대상자의 마지막 방문 완료 - 2022.01 국내에서 진행한 임상 2a상 임상시험결과보고서(CSR) 발행됨 - 비임상시험(26주 반복투여 독성시험) 완료 |
|
향후계획 |
- 후기 임상 진입 전략수립 및 기술이전 추진 |
|
경쟁제품 |
- 현재 시장에 출시되어 있는 경구용 황반변성 치료제 없음. - 레이저 치료 (국/격자/범안저광응고술) 또는 스테로이드 안구내 주사 및 - 대표적인 제품은 anti-VEGF 주사제인 Lucentis(ranibizumab), Avastin(bevacizumab), Eylea (aflibercept) 등이 90%의 시장 점유율을 차지하고 있으며, 연평균 6%의 증가가 예상됨 |
|
관련논문 등 |
Extract of Moutan radicis cortex and Cinnamomi ramulus ameliorates laser- induced choroidal neovascularization in Brown-Norway rats, Phytomedicine, 심 사中를 통해 CNV 동물모델 효능을 논문/학회 발표함 |
|
글로벌 시장규모 |
2017년 63억 달러에서 2025년 88억 달러(CAGR: 3.8%)로 성장예측 |
|
기타사항 |
- |
(2) 계획 중인 후속 프로젝트
당사는 보고서 작성기준일 현재 임상연구 중인 프로젝트와 함께 계획중인 후속 프로젝트는 아래와 같습니다. 다만 당사의 사업 전략에 따라 연구 개발 계획의 변동이 발생할 수 있습니다.
[계획 중인 후속 프로젝트 총괄표]
| 구분 | 품목 | 적응증 | 현재 진행단계 | 비고 | |
| 화학합성 | 신약 | CP01-R01 | 반려동물 신부전 | 임상3상 준비 | 공동연구 |
| 생물학적 제제 | 신약 | MT-201 | 항혈전 | 후보물질 도출완료 | 공동연구 |
| 생물학적 제제 | 신약 | MT-202 | 허혈 재관류 심근경색, 뇌졸중, 폐혈전증 | 후보물질 도출완료 | 공동연구 |
| 생물학적 제제 | 신약 | MT-40X | 고형암 | 후보물질 도출 | 공동연구 |
(3) 보유 기술에 대한 연구실적(논문 및 학회 발표)
- CU06 핵심기술에 대한 논문 17편 및 학회 발표 25건(주저자: 연세대 권영근 교수)
- CU01 핵심기술에 대한 논문 4편 및 학회 발표 2건(주저자: 경북대 의대 이인규 교수)
- CU03 핵심기술에 대한 논문 1편 및 학회 발표 1건 (주저자: 한국한의학연구원 김진숙 박사)
- CU05 핵심기술에 대한 논문 2편 및 학회 발표 5건 (주저자: 연세대 권영근 교수)
[논문 발표 목록]
| 구분 | 논문제목 | 게재정보 | 비고 |
|---|---|---|---|
| CU06 | CU06-1004 alleviates oxidative stress and inflammation on folic acid-induced acute kidney injury in mice | J Pharmacol Sci(2024) | 급성신장손상모델에서 효과규명 |
| CU06-1004 as a promising strategy to improve anti-cancer drug efficacy by preventing vascular leaky syndrome | Front Pharmacol(2023) | 면역활성화제 IL-2에 혈관누출증후군 부작용을 억제하는 효과규명 | |
| Efficacy of CU06-1004 via regulation of inflammation and endothelial permeability in LPS-induced acute lung injury | J Inflamm (2023) | 급성 폐손상 모델에서 효과규명 | |
| CU06-1004 alleviates vascular hyperpermeability in a murine model of hereditary angioedema by protecting the endothelium | Allergy (2023) | 유전성 혈관부종 모델에서 효과규명 | |
| Long-term administration of CU06-1004 ameliorates cerebrovascular aging and BBB injury in aging mouse model | Fluids Barriers CNS. 1;20(1):9 (2023) | 노화 모델에서 효과규명 | |
| Oral administration of CU06-1004 attenuates vascular permeability and stabilizes neovascularization in retinal vascular diseases | Eur J Pharmacol. 15; 939:175427 (2023) | 망막혈관질환 모델에서 효과규명 | |
| CU06-1004 modulates the adenosine monophosphate (AMP)-associated protein kinase (AMPK) signaling pathway and inhibits lipogenesis in 3T3-L1 adipocytes and high-fat diet-induced obese mice | Life Sci. 1; 296:120440 (2022) | 비만모델에서 효과 규명 | |
| CU06-1004 enhances vascular integrity and improves cardiac remodeling by suppressing edema and inflammation in myocardial ischemia-reperfusion injury | Exp Mol Med. 54(1):23-34 (2022) | 심근경색 모델에서 효과 규명 | |
| CU06-1004-inducedvascular normalization improves immunotherapy by modulating tumor microenviroment via cytotoxic T cell. | Front. Immunol. 11; 620166 (2021) | 종양 미세환경 개선 효과 규명 | |
| The endothelial dysfunction blocker CU06-1004 ameliorates choline-deficient L-amino acid diet-induced non-alcoholic steatohepatitis in mice | PLoS One. 15(12):e0243497(2020) | 비알코올성 지방간 모델에서 효과 규명 | |
| CU06-1004 Alleviates Experimental Colitis by Modulating Colonic Vessel Dysfunction | Front Pharmacol. 15;11:571266(2020) | 대장염 모델에서 효과 규명 | |
| CU06-1004 (endothelial dysfunction blocker) ameliorates astrocyte end-feet swelling by stabilizing endothelial cell junctions in cerebral ischemia/reperfusion injury | J Mol Med (Berl). | 뇌졸중 모델에서 효과 및 기전 규명 | |
| Sac-1004, a vascular leakage blocker, reduces cerebral ischemia-reperfusion injury by suppressing blood-brain barrier disruption and inflammation | J Neuroinflammation. | 뇌졸중 모델에서 효과 규명 | |
| Sac-1004, a Pseudo-Sugar Derivative of Cholesterol, Restores Erectile Function through Reconstruction of Nonleaky and Functional Cavernous Angiogenesis in the Streptozotocin Induced Diabetic Mouse | J Urol. 195(6): 1936-46 (2016) | 당뇨 마우스에서 발기기능 효과 규명 | |
| Direct endothelial junction restoration results in significant tumor vascular normalization and metastasis inhibition in mice | Oncotarget. 5(9): 2761-77 (2014) | 종양 혈관 정상화 효과 규명 | |
| Combined effect of vascular-leakage-blocker Sac-1004 and antiangiogenic drug sunitinib on tumor angiogenesis | Biochem Biophys Res Commun. 450(4): 1320-6 (2014) | 항암제와의 병용투여 효과 규명 | |
| Sac-1004, a novel vascular leakage blocker, enhances endothelial barrier through the cAMP/Rac/cortactin pathway. | Biochem Biophys Res Commun. 435(3): 420-427 (2013) | 기전 규명 | |
| CU01 | Dimethylfumarate Attenuates Renal Fibrosis via NF-E2-Related Factor 2-Mediated Inhibition of Transforming Growth Factor-β/Smad3 Signaling | PLoS One 2012, | Renal fibrosis 감소효능 |
| Dimethylfumarate suppresses adipogenic differentiation in 3T3-L1 preadipocytes through inhibition of STAT3 activity | PLoS One 2013, 18;8(4):e61411 | Adipocytes 분화 억제 효능 | |
| Activation of Nrf2 by dimethyl fumarate improves vascular calcification | Vascul Pharmacol. | Vascular calcification 억제 효능 | |
| Dimethylfumarate attenuates restenosis after acute vascular injury by cell-specific and Nrf2-dependent mechanisms | Redox Biol 2014 | Vascular restenosis 감소효능 | |
| CU03 | Extract of Moutan radicis cortex and Cinnamomi ramulus ameliorates laser-induced choroidal neovascularization in Brown-Norway rats | Phytomedicine,심사中 | CNV 동물모델 효능 |
| CU05 | A novel small molecule, CU05-1189, targeting the pleckstrin homology domain of PDK1 suppresses VEGF-mediated angiogenesis and tumor growth by blocking the Akt signaling pathway | Front Pharmacol(2023) | 항암모델에서 효과 규명 |
| AMIGO2, a novel membrane anchor of PDK1, controls cell survival and angiogenesis via Akt activation | J Cell Biol. 211(3): 619-37 (2015) | 기전 규명 |
마. 연구개발 완료 실적
당사는 보고서 작성기준일 현재 연구개발 완료 실적이 없습니다.
바. 연구활동 및 판매 중단 현황
당사는 보고서 작성기준일 현재 연구활동 및 판매 중단 현황이 없습니다.
사. 기타 연구개발 실적
[당사 국책과제 현황]
(단위: 백만원)
|
기술구분 |
사업명 (시행부처) |
과제명 |
사업기간 |
총 지원금 (당사 부담금) |
참여 형태 |
현황 |
|
- |
- |
- |
- |
- |
- |
- |
7. 기타 참고사항
1. 지적재산권 보유 현황
당사는 파이프라인의 시장 진입장벽을 확보하기 위하여 특허권 보유전략 및 관리체계를 확립하였고, 핵심특허의 지역적 실효성 평가를 통해 플랫폼 및 파이프라인에 대한 다양한 특허 출원 및 등록으로 광범위한 지적재산권을 확보하고 있습니다. 현재 당사의 지적재산권 현황은 다음과 같습니다.
|
특허 (전용실시권) |
등록 |
38 (4) |
상표권 |
등록 |
13 |
|
출원 |
35 (4) |
출원 |
- |
|
CU06 |
CU01 |
CU03 (전용실시권) |
CU05 |
CU-71 | |||||
|---|---|---|---|---|---|---|---|---|---|
|
등록 |
출원 |
등록 |
출원 |
등록 |
출원 |
등록 |
출원 |
등록 | 출원 |
| 26 | 15 | 10 | 16 | (4) | 2(4) | 2 | 0 | 0 | 2 |
| 번호 | 구분 | 내용 | 출원인 | 권리자 | 출원 | 등록 | 적용 | 출원국 | 비고 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 특허권 | 신규 혈관누출 차단제 | 연세대 산학협력단 외 1곳 | (주)큐라클 | 2012.04.26 | 2014.11.18 | CU06 |
미국 | 특허 양수도 |
| 2 | 2010.10.29 | 2015.02.27 | 일본 | ||||||
| 3 | 2010.10.29 | 2016.05.04 | 유럽 | ||||||
| 4 | 2010.10.29 | 2015.02.18 | 중국 | ||||||
| 5 | 2010.10.29 | - | PCT | ||||||
| 6 | 특허권 | 신규 혈관누출 차단제 | 연세대 산학협력단 | ㈜큐라클 | 2011.12.29 | 2014.01.10 | 한국 | 특허 양수도 | |
| 7 | 2012.12.28 | 2016.05.31 | 미국 | ||||||
| 8 | 2012.12.28 | - | PCT | ||||||
| 9 | 특허권 | 면역항암 보조제 | 연세대 산학협력단,㈜큐라클 | 연세대 산학협력단,㈜큐라클 | 2020.04.23 | 2022.09.20 | 한국 | 공동 출원 | |
| 10 | 2020.04.23 | - | PCT | ||||||
| 11 | 2021.09.15 | - | 미국 | ||||||
| 12 | 2021.09.07 | - | 유럽 | ||||||
| 13 | 2021.10.28 | 2023.06.14 | 일본 | ||||||
| 14 | 2021.09.27 | 2024.12.10 | 중국 | ||||||
| 15 | 특허권 | 지방간 질환의 예방 또는 치료를 위한 약학적 조성물 | 연세대 산학협력단,㈜큐라클 | 연세대 산학협력단,㈜큐라클 | 2020.07.03 | 2024.08.05 | 한국 | 공동 출원 | |
| 16 | 2021.06.24 | - | PCT | ||||||
| 17 | 특허권 | 신규 혈관누출 차단제의 고수율 제조방법 | ㈜큐라클 | ㈜큐라클 | 2019.12.13 | 2020.06.12 | 한국 | 단독 출원 | |
| 18 | 2020.07.28 | - | PCT | ||||||
| 19 | 2020.11.24 | 2022.09.27 | 미국 | ||||||
| 20 | 2020.11.25 | - | 인도 | ||||||
| 21 | 2020.12.01 | 2023.06.07 | 유럽 | ||||||
| 22 | 2020.12.01 | 2022.08.02 | 일본 | ||||||
| 23 | 2020.12.10 | 2022.08.05 | 중국 | ||||||
| 24 | 특허권 | 혈관 누출 차단제 화합물의 신규 결정형 | ㈜큐라클 | ㈜큐라클 | 2020.05.04 | 2021.02.26 | 한국 | 단독 출원 | |
| 25 | 2020.10.05 | - | PCT | ||||||
| 26 | 2021.04.22 | - | 아르헨티나 | ||||||
| 27 | 2021.07.07 | 2024.10.01 | 미국 | ||||||
| 28 | 2021.07.07 | 2024.12.18 | 유럽 | ||||||
| 29 | 2021.07.05 | - | 인도 | ||||||
| 30 | 2021.07.23 | 2025.01.14 | 중국 | ||||||
| 31 | 2021.07.20 | 2023.02.03 | 일본 | ||||||
| 32 | 2021.10.11 | - | 브라질 | ||||||
| 33 | 2021.10.06 | 2023.01.03 | 캐나다 | ||||||
| 34 | 2021.10.29 | 2023.12.07 | 러시아 | ||||||
| 35 | 2021.10.05 | 2022.12.08 | 호주 | ||||||
| 36 | 2021.11.12 | 2024.10.24 | 멕시코 | ||||||
| 37 | 2021.11.15 | 2024.04.16 | 사우디아라비아 | ||||||
| 38 | 2022.04.24 | - | 이스라엘 | ||||||
| 39 | 특허권 |
CU06-1004 화합물을 활성 성분으로 함유하는 오일 액상 제제 |
㈜큐라클 | - | 2024.02.02 | - | 한국 | 단독출원 | |
| 40 | 특허권 | 인터루킨-2 면역항암제를 위한 병용제제 | ㈜큐라클 | - | 2023.08.18 | 2024.11.26 | 한국 | 단독출원 | |
| 41 | - | 2023.08.22 | - | PCT | |||||
| 42 | 특허권 | 디메틸푸마레이트를 유효성분으로 포함 하는 신섬유증의 예방 또는 치료용 | 경북대 산학 협력단 외 1곳 | ㈜큐라클 | 2013.02.13 | 2014.03.24 | CU01 | 한국 | 특허 양수도 |
| 43 | 2013.02.20 | - | PCT | ||||||
| 44 | 2013.02.20 | 2017.08.08 | 미국 | ||||||
| 45 | 특허권 | 디메틸푸마르산염을 함유한 장용성정제 조성물 | ㈜큐라클 | ㈜큐라클 | 2020.05.21 | 2020.12.24 | CU01 | 한국 | 단독 출원 |
| 46 | 2020.05.21 | - | PCT | ||||||
| 47 | 2021.09.20 | - | 미국 | ||||||
| 48 | 2024.02.14 | - | |||||||
| 49 | 2021.09.27 | - | 유럽 | ||||||
| 50 | 2021.09.28 | 2023.02.09 | 일본 | ||||||
| 51 | 2021.09.27 | - | 중국 | ||||||
| 52 | 2021.09.22 | 2025.01.17 | 인도 | ||||||
| 53 | 2021.10.01 | 2022.08.09 | 캐나다 | ||||||
| 54 | 2021.09.16 | 2022.10.04 | 브라질 | ||||||
| 55 | 2021.10.11 | 2022.10.07 | 멕시코 | ||||||
| 56 | 2021.11.29 | - | 사우디아라비아 | ||||||
| 57 | 2021.10.20 | - | 필리핀 | ||||||
| 58 | 2021.09.23 | - | 태국 | ||||||
| 59 | 2021.09.10 | - | 베트남 | ||||||
| 60 | 2021.12.07 | 2022.10.20 | 호주 | ||||||
| 61 | 2021.12.23 | - | 인도네시아 | ||||||
| 62 | 2021.12.29 | 2023.01.28 | 러시아 | ||||||
| 63 | 특허권 | 모노메틸푸마레이트를 유효성분으로 포함하는 장기 섬유증의 예방 또 는 치료용 약학적 조성물 |
㈜큐라클 | ㈜큐라클 | 2020.11.27 | - | 한국 | 단독 출원 | |
| 64 | 2021.08.25 | - | PCT | ||||||
| 65 | 특허권 | 특정 약동학적 매개변수를 나타내는 디메틸푸마 레이트 를 유효성분으로 함유한 약학적 조성물 | ㈜큐라클 | - | 2021.03.25 | - | 한국 | 단독 출원 | |
| 66 | 2021.03.24 | - | PCT | ||||||
| 67 | 2022.08.10 | - | 미국 | ||||||
| 68 | 특허권 | 천연 혼합 추출물을 유효성분으로 함유 하는 당뇨합병증 및 혈관부종 예방 또는 치료용 약학적 조성물 | 한국한의학 연구원 | 한국한의학 연구원 | 2015.05.21 | 2016.10.27 | CU03 | 한국 | 전용 실시권 |
| 69 | 2015.05.21 | - | PCT | ||||||
| 70 | 2015.05.21 | 2021.12.07 | 미국 | ||||||
| 71 | 2015.05.21 | 2021.01.13 | 유럽 | ||||||
| 72 | 2015.05.21 | - | 중국 | ||||||
| 73 | 2021.05.19 | - | 중국 | ||||||
| 74 | 2023.04.10 | - | 중국 | ||||||
| 75 | 2016.08.26 | 2021.03.24 | 한국 | ||||||
| 76 | 계지 및 목단피 혼합추 출물을 유효성분으로 함유한 정제 및 이의 특정 투여요량에 의한 치료를 위한 조성물 | ㈜큐라클 | - | 2022.12.29 | - | 한국 | 단독 출원 | ||
| 77 | 2022.12.30 | - | PCT | ||||||
| 78 | 특허권 | AMIGO2와 3-포스포이 노시티드- 의존 키나아 제1의 결합 억제용 데코 이펩타이드 | ㈜큐라클 | ㈜큐라클 | 2015.06.29 | 2017.09.21 | CU05 | 한국 | 특허 양수도 |
| 79 | 2016.06.28 | 2018.11.13 | 미국 | ||||||
| 80 | 특허권 | 혈관내피 기능장애 치료제 | ㈜큐라클 | - | 2024.07.05 | - | CU-71 | 한국 | 단독출원 |
| 81 | 특허권 | 알츠하이머병 예방 또는 치료용 조성물 | ㈜큐라클 | - | 2025.01.10 | - |
CU-71 |
한국 |
단독출원 |
| 82 | 상표 특허 | Solvadys | ㈜큐라클 | ㈜큐라클 | 2019.11.04 | 2021.02.08 | CU06 | 한국 | 단독 출원 |
| 83 | 솔바디스 | 2019.11.04 | 2021.02.01 | 한국 | |||||
| 84 | Healvasc | 2019.11.04 | 2021.02.08 | 한국 | |||||
| 85 | 힐바스크 | 2019.11.04 | 2021.02.08 | 한국 | |||||
| 86 | Vesaegis | 2019.11.04 | 2021.02.01 | 한국 | |||||
| 87 | 베세지스 | 2019.11.04 | 2021.02.08 | 한국 | |||||
| 88 | Dnitier | 2022.01.27 | 2023.07.10 | CU01 | 한국 | ||||
| 89 | 디니티어 | 2022.01.27 | 2023.07.10 | 한국 | |||||
| 90 | Qunef | 2022.01.27 | 2023.07.10 | 한국 | |||||
| 91 | 큐네프 | 2022.01.27 | 2023.07.10 | 한국 | |||||
| 92 | CURACLE | 2019.09.11 | 2020.10.21 | 기타 | 한국 | ||||
| 93 | THE CURACLE | 2019.09.11 | 2020.10.21 | 한국 | |||||
| 94 | 큐라클 | 2019.09.11 | 2020.10.21 | 한국 |
2. 영업에 영향을 미치는 법률 또는 제규정
의약품의 제품 개발에서 의약품이 판매되기 위해서는 신약후보물질의 발굴에서부터 동물을 대상으로 하는 비임상시험, 인체를 대상으로 하는 임상 1상부터 3상 시험, 신약 판매 허가라는 각 단계를 모두 거쳐야 합니다. 모든 단계에서 한국을 포함한 각 국가는 엄격히 허가 및 규제기관을 통해 통제되고 있으며, 본 사업과 밀접하게 연관된 국내외 규제는 『약사법』, 의약품 등의 안전에 관한 규칙』, 생명윤리 및 안전에 관한 법률』, 국민건강보험법』, 『독점규제 및 공정거래에 관한 법률』,『The Food, Drug and Cosmetic Act, the Code of Federal Regulations』 등의 법령과 미국(FDA), 유럽 (EMEA) 및 일본 (PMDA) 등의 선진국의 규제가 매우 엄격합니다. 이에 당사는 연구개발 초기단계부터 관련국에 규격에 맞게 모든 자료를 준비하고 있고 해외 컨설턴트와 지속적으로 협업하여 진행하고 있습니다.
3. 산업의 특성
가. 산업의 특성
제약산업(Pharmaceutical Industry)은 「약사법」제2조제4호와 「제약산업 육성 및 지원에 관한 특별법」제2조에는 의약품을 연구개발ㆍ제조ㆍ가공ㆍ보관 및 유통하는 것과 관련된 산업으로 정의되어 있습니다. 전 세계적으로 고령화로 인한 뇌/심혈관 질환, 난치성 및 만성 질환 환자 규모는 증가하여 제약산업은 꾸준히 성장하고 있습니다. 제약산업은 인간의 생명과 보건에 관련된 제품을 개발하고 생산하는 첨단산업으로서 우수한 의약품 개발과 접근성 제고를 통해 질병으로 인한 사회적 비용 감소 등 국민 건강증진 및 건강권 확보와 직결된 산업입니다.
나. 의약품의 분류
의약품은 제조방식에 따라 화학합성으로 제조되는 합성의약품, 천연물로부터 약효를 가진주성분을 함유하는 천연물의약품, 생물학적 제제로서 재조합 단백질, 백신, 혈액제제를 포함하는 생물학적 반응을 이용하여 제조하는 바이오의약품으로 분류되며, 「약사법」제2조 제10항에 따라 일반의약품(Over the Counter Drug, OTC)과 전문의약품(Ethical the Counter Drug, ETC)으로 구분됩니다.
| [의약품의 분류] |
| 의약품 구분 | 내용 | |
|---|---|---|
| 제조방식 | 합성의약품 | 실험실에서 유기화학에 기반하여 합성에 의해 인위적으로 만들어진 저분자 화합물 의약품 |
| 천연물의약품 | 약용식물 등 이미 존재하는 천연물로부터 약효를 가진 성분만을 분리 정제하여 만든 의약품 | |
| 바이오의약품 | 생물체(미생물, 동식물 세포 등)를 활용하여 바이오기술을 응용하여 만들어진 의약품 | |
| 의사 처방유무 | 전문 의약품 | 일반의약품이 아닌 의약품을 말하는 것으로, 약리작용 또는 적응증으로 볼 때, 의사의 전문적인 진단과 지시·감독에 따라 사용되어야 하는 의약품 (Ethical the Counter Drug, ETC) |
| 일반 의약품 | 의약품의 제형과 약리작용상 인체에 미치는 부작용이 비교적 적거나, 오용·남용의 우려가 적고 의사나 치과의사의 처방 없이 사용하더라도 안전성 및 유효성을 기대할 수 있는 의약품(Over the Counter Drug, OTC) | |
당사는 난치성 혈관질환의 First-in-Class 혁신신약으로 합성의약품(CU06, CU71, CU01)과 바이오의약품(MT-101, MT-103) 및 천연물의약품(CU03)의 연구 개발을 진행하고 있으며, 해당 파이프라인들은 약리작용 또는 적응증으로 볼 때, 의사의 전문적인 진단과 지시/감독에 따라 사용하는 전문의약품(ETC)으로 분류됩니다.
다. 산업의 특성
당사가 추진 중인 사업은 제약 및 바이오산업에 속해 있으며, 동 산업의 특성은 다음과 같습니다.
- 각 국가별 식품의약국의 규정 준수 필요
신약은 기존 약물의 유효성 혹은 안전성 측면에서 현저한 개선이 포함되어야 하며, 신물질 탐색 작업, 비임상 시험, 임상시험, 허가 신청 (NDA) 등을 거쳐 제조 승인 및 시판허가를 받은 의약품을 말합니다. 한 개의 신약이 나오기 위해서는 여러 단계를 수행해야 합니다. 첫 번째로 신약 후보물질을 도출하기 위한 탐색 과정에서 신약의 효능이나 작용기전을 기반으로 신약개발 대상 품질을 선정합니다. 유효물질, 선도물질을 거쳐 신약 후보물질이 선정되면 후보물질의 안전성과 효과를 확인하기 위해 동물 모델을 대상으로 비임상시험을 진행합니다. 비임상시험을 통해 후보물질의 효과와 안전성이 검증되면 식약처에 임상시험 허가신청 (IND)을 하고, 사람을 대상으로 약물의 효과 및 부작용을 확인하는 임상시험 (Clinical Trial)을 수행합니다. 임상시험을 완료한 후에는 식약처에 임상시험 결과를 제출하게 되는데, 이를 신약 허가신청(NDA) 이라고 합니다. 신약 허가 신청이 정상적으로 이루어지면, 제4상 임상시험으로 분류되는 시판 후 안전성 조사(PMS)를 통해 임상시험에서 발견하기 어려웠던 부작용에 대해서 추적 조사를 수행합니다. 이처럼 새로운 의약품이 개발되어 소비자에게 전달되기까지는 높은 비용과 노력이 필요하며, 시판으로 이어질 확률은 10,000분의 1 정도로 낮은 편입니다. 이렇게 성공 가능성이 낮지만, 성공했을 경우 특허법, 각 국가별 약사법 등으로 독점적 시장 보호가 가능하고 막대한 경제적 가치를 창출할 수 있기 때문에 글로벌 시장에 도전하는 신약개발은 여전히 매력적인 사업입니다.
- 다양한 정책에 따른 높은 진입장벽 존재
신약개발 산업은 높은 기술력과 천문학적인 개발비용, 국가별 허가 당국의 시판 승인 등 진입장벽이 상당히 높은 편입니다. 또한 특허법, 의약품 특허존속기간 연장제도, 희귀의약품 지정제도, 의약품 자료 독점권 제도 등 신약 개발사에 혜택을 주는 다양한 보호 제도가 있어 제네릭사의 시장 진입을 제한하고 있습니다.
- 국내 의약품 시장의 글로벌 성장성
글로벌 제약산업 시장 조사기관인 IQVIA가 발표한 리포트에 따르면 2021년 글로벌 제약산업 시장 규모는 1조 4,003억 달러를 형성하고 있으며 이후 연평균 4.1%로 성장하여 2025년에는 1조 6,420억 달러에 달할 것으로 예상됩니다. 대한민국의 제약산업 시장 규모는 2021년 179억 달러에서 글로벌 성장보다 빠른 연평균 5.8%의 성장을 통해 2025년에는 224억 달러를 형성할 것으로 예상됩니다.
2021년 기준으로 대한민국의 제약산업 시장 규모는 글로벌 전체 시장 규모의 1.27%를 차지하고 있으며 국내 제약기업과 바이오벤처가 다국적기업과의 기술 제휴 또는 라이선스 아웃 등을 통해 글로벌 파트너사와 임상 개발을 진행하여 경험과 노하우를 습득하면서 고도화되고 있어 향후 글로벌 성장성 대비 높은 성장성을 보이며 시장이 확대될 것으로 보입니다.
- 고부가가치 산업
제약산업은 다른 어떤 산업보다도 기술과 자본이 집약된 '고부가가치 지식산업'으로, 개발된 의약품의 제조원가 자체는 매우 낮지만, 장기적인 R&D 투자를 통한 신약개발 여부가 성패를 좌우하는 특성을 가집니다. 글로벌 신약개발 시 평균 1조 원에서 2조 원에 이르는 개발비용과 10~15년의 개발기간이 소요되며, 더욱이 신약개발 성공확률은 5,000분의 1에 불과한 것으로 알려져 있습니다. 후보물질 발굴 단계에서 5,000~10,000개의 화합물이 R&D 파이프라인으로 들어간 이후 전임상단계에서 약 250여 개의 연구를 거쳐 임상단계에서 2~5개가량만 남게 되며, 이중 1개만이 최종 판매허가를 받고 상용화됩니다.
신약 하나를 개발하기 위해서는 장기간에 걸친 R&D 과정에서 막대한 자본과 인력의 지속적인 투입이 수반되지만 성공을 확신할 수 없습니다. 그러나, 이른바 '죽음의 계곡'을 넘어 신약 개발에 성공하게 되면, 확실한 시장 우위를 점하며 그동안의 R&D에 투자한 것 이상의 많은 이익을 회수할 수 있습니다. 다국적 제약사 화이자에서 출시한 '비아그라(성분 실데나필)'는 임상 실패 이후 신약 재창출 과정을 통해 큰 성공을 거둔 사례입니다. 실데나필은 협심증 치료를 목표로 개발된 약물이었지만, 임상 실패 이후 발기부전 치료제로 재탄생했습니다. '20세기 최고의 발명품'으로 불리는 비아그라는 1998년 5월 출시 이후 단 3개월 만에 4억 달러(약 4,700억 원) 규모, 지난 20년 간 연간 평균 18억 달러(약 2조 1,300억 원) 규모의 매출을 기록하여 대표적인 블록버스터급 의약품으로 알려져 있습니다. 같은 회사에서 출시한 고지혈증 치료제 '리피토’는 2010년 무려 127억 달러의 매출을 기록하였는데, 이는 '자동차 100만 대 수출' 수익보다도 높은 수준입니다.
- 주력 기술제품의 산업의 연혁
당뇨병은 췌장에서 분비되는 인슐린이 부족하거나 우리 몸에서 제대로 작용하지 못하여 혈액 속의 혈당이 에너지로 이용되지 않고 혈액 속에 축적되어 고혈당 증상과 이로 인한 합병증을 나타내는 질환입니다. 2017년에는 전세계적으로 당뇨 환자가 4억 5천 1백만 명(18세~99세) 발병했고 2045년경에는 6억 9천 3백만 명으로 증가할 것으로 예상되고 있으며, 당뇨 의약품 시장 또한 폭발적으로 증가하여 2026년경에는 950 ~ 1020억 달러(107 ~ 115조원)에 이를 것으로 추정되고 있습니다. 이와 같이 당뇨병 환자의 증가와 함께 고령인구 증가로 당뇨합병증 시장 또한 높은 성장성이 예상되어 글로벌제약사들이 치료제 개발을 위해 많은 투자를 진행하고 있습니다.
합병증은 크게 혈관 합병증과 신경 합병증으로 나눌 수 있으며, 혈관 합병증은 다시 대혈관 손상과 미세혈관 손상으로 나눌 수 있습니다. 대혈관이 손상되면 협심증, 동맥경화, 심근경색, 뇌졸중이 발병하고 미세혈관이 손상되면 망막병증, 신장병, 신경병, 족부궤양 등의 다양한 합병증이 나타날 수 있습니다. 그리고 신경 합병증은 말초신경장애와 자율신경장애로 나누어 집니다.
혈관 합병증의 원인은 아직까지 확실히 밝혀져 있지 않으나 대혈관 손상의 경우 고혈합, 고지혈증이 동반되면서 복합적인 원인에 의해 발생하는 것으로 알려져 있습니다. 또한 제2형 당뇨병 환자에서는 비만과 관상동맥질환 등이 위험인자로 작용함으로써 고혈당의 치료와 더불어 이들 질환의 치료가 동시에 이루어져야 합병증의 진행을 막을 수 있습니다.
미세혈관 합병증 중 하나인 당뇨병성 신증은 당뇨환자의 주요 사망요인으로 아주 서서히 진행되기 때문에 초기에는 검사로도 식별이 어려우며 환자에 따라 다르나 대개 15년 정도 지난 후에 단백뇨 증상이 나타나게 됩니다. 처음에는 단백뇨로 인해 부종이 발생하고 더욱 진행이 되면 노폐물이 신장에서 배설되지 않음으로써 만성 신부전증으로 결국 요독증에 빠지게 됩니다. 당뇨병성 신증 치료제 중 신장 섬유화를 치료하는 전문치료제는 없으며, 질환의 원인이 될 수 있는 혈당과 혈압을 관리하는 치료제가 처방되고 있습니다. 60세 이상 당뇨병 환자 중 75%가 당뇨병성 신증 환자임을 고려할 때 전문치료제의 개발이 절실하다고 하겠습니다.
또한 미세혈관 합병증 하나인 당뇨병성 황반부종도 당뇨병 환자에서 20년 유병 기간 후 약 30~50%정도 발생하는데, 25세 이후의 시력상실 질병 중 가장 많은 원인이 되고 있습니다. 그러나 모든 환자가 시력이 상실되는 것이 아니라 적극적으로 혈당을 조절하고 자주 검사하여 조기에 발견하면 예방할 수 있으며 그 진행속도 또한 늦출 수 있습니다. 최근에는 치료를 위해 혈관내피성장인자(VEGF) 저해제인 아일리아 혹은 루센티스를 안구내에 주사(intravitreal injection)하여 치료제가 사용되고 있습니다. 다만, 2019년도 Scientific reports 에 의하면 이 약물에 불응성을 나타내는 환자가 41% 정도이고 약가는 각각 1,940달러/vial, 1,575달러/vial 로 상당히 고가여서 환자 및 국가 보험 재정에 부담을 주고 있어 높은 효능, 경제성, 투여방식 편의성 등의 측면을 개선할 수 있는 신약 개발이 필요한 상황입니다.
황반변성은 시력에 중요한 역할을 담당하는 망막중심부 신경조직인 황반이 노화, 염증 등으로 기능이 떨어지는 질환을 말하며 국내 65세 이상의 노인인구에서 실명을 일으키는 주요 원인으로 알려져 있습니다. 2017년 황반변성 환자는 70억 세계 인구의 약 8.3%인 5천800만명 이상으로 추정되고 있으며 2020년에는 환자수가 약 2억 명, 2040년경에는 약 3억명에 육박할 것으로 예측되고 있습니다. 당뇨병성 황반부종도 동일하게 혈관 내피성장인자(VEGF) 저해제인 아일리아나 루센티스가 치료제로 사용되고 있으며 노령인구의 중가의 함께 황반변성 치료제 시장도 크게 성장할 것으로 예상됩니다.
라. 산업의 전망
- 글로벌 제약시장 전망
글로벌 전문의약품(ETC) 시장은 지속적으로 성장해왔습니다. 전세계 전문의약품 매출액은 2020년 9,040억 달러(약 1,073조 원)에서 연평균 7.4%씩 성장해 2026년에는 1조 3,903억 달러(약 1,650조 원) 규모가 될 전망입니다. 이는 지난 2012∼2019년 처방의약품 매출액 연평균 성장률이 2.7%에 그친 것과 비교할 때 매우 빠른 성장세를 볼 수 있습니다.
 |
|
전세계 전문의약품의 매출액(2012-2026) |
자료: EvaluatePharma, World Preview 2020, outlook to 2026
생명공학정책 연구센터, 글로벌 제약산업 2020년 프리뷰 및 2026년 전망
인구증가 및 고령화, 만성질환 증가, 규제장벽 완화, 맞춤형 치료제, 희귀병 치료제 등의 성장 요인(Market Drivers)에 따라 미국 FDA에서 최근 10년간(2014~2023년) 승인된 화학합성신약은 456건으로 이는 과거 10년(2010~2019년) 289건에 비해 약 58% 증가되었습니다. 미국 FDA의 산업 친화적(industry-friendly) 입장은 유지 될 것으로 전망되며, 미국 FDA가 채택한 입장은 전세계 제약시장에 대한 투자심리를 결정하는 데 중요한 역할을 합니다
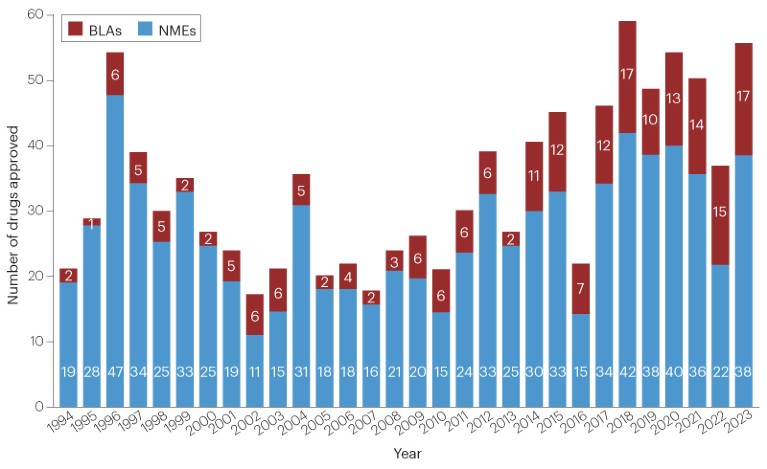 |
|
30 years of novel fda approvals |
자료: FDA CDER, New Drug Therapy Approval 2023, 2024.01
또한, 전세계적으로 신약 개발 기간 단축을 통한 효율성 제고를 위해 플랫폼 기술 도입이 늘어나고 있습니다. 전통적인 신약 탐색 과정에서 통상 약물 후보물질을 찾을 때까지 소요되는 시간과 비용을 플랫폼 기술을 활용함으로써 절감하려는 시도가 이루어지고 있습니다. 당사 또한 신개념 SOLVADYS® 플랫폼 기술을 이용하여 유효물질을 효율적으로 발굴하기 위한 초기 단계 연구개발을 적극적으로 진행하고 있으며 이 플랫폼을 통하여 신약개발기간을 효율적으로 단축시키고 실패를 줄일 수 있을 것으로 기대 하고 있습니다.
마. 경기변동의 특성
- 라이프사이클
일반적으로 의약품은 관련된 특허의 존속기간(선출원 후 20년)이 만료될 때까지 독점적인 판매가 가능하며, 또한 국가별로 자료 및 시장독점권(Data & Market Exclusivity) 제도에 의하여 미국인 경우 신약 승인 후 5년간의 자료독점권을 그리고 유럽의 경우 자료독점권 8년에 시장독점권 2년을 추가로 부여하고, 희귀의약품으로 지정된 경우 미국은 7년 , 유럽은 11년간의 시장 독점권을 주는 것을 허용하는 등 다양한 제도를 통하여 독점적 판매권을 보장받을 수 있습니다.
당사는 신개념 SOLVADYS® 플랫폼 기술을 이용하여 난치성 혈관질환의 First-in-Class 혁신신약을 개발하고 있으며 각 파이프라인별로 물질, 용도(적응증/용법 용량). 조성물(제제, 병용투여), 결정형 및 제법 등 연구단계별 다양한 특허를 출원, 등록하는 evergreening 전략을 사용하여 특허의 존속기간을 연장하고 있습니다. 또한 특허존속기간 연장제도 (최장 5년 추가)로 대부분 제품이 2045년까지 특허보호를 받을 수 있어 제품 판매 후 13 ~ 17년간 시장 진입장벽이 존재할 것으로 예상합니다.
- 경기변동 및 계절성
일반적으로 의약품은 크게 전문의약품(ETC)과 일반의약품(OTC)으로 분류됩니다. 전문의약품은 의사의 진단과 처방을 통해 약 복용이 엄격히 관리되어야 하는 의약품을 의미하며, 일반의약품은 안전성과 유효성이 충분히 인정되어 약사나 소비자가 임의로 선택할 수 있는 의약품을 의미합니다. 당사가 개발중인 파이프라인은 모두 전문의약품 분야에 속하며, 의학적 미충족 수요가 큰 영역이라 경기 변동에 거의 영향을 받지 않습니다.
삶의 질 향상과 수명연장에 대한 요구가 높아지고 있고 GDP 수준 향상과 전세계적으로 고령화 사회가 확산됨에 따라 만성질환과 치매 같은 문제가 사회적 이슈로 대두되고 있어 이러한 추세로 인해 의약품 산업은 지속적이고 안정적인 증가가 예상됩니다. 한편, 의약품 산업의 특성상 국가별 의료 정책이나 약가 정책에 따라 변동성이 있을 수 있으나 당사가 개발중인 First-in-Class 혁신 신약의 경우 약가 결정에 이점이 있어 상대적으로 높고 안정적인 수익을 창출할 것으로 기대됩니다.
앞서 설명한 바와 같이 당사가 개발중인 파이프라인은 모두 전문의약품 분야에 속하며, 당뇨합병증은 만성 질환이고 같은 유전적 또는 생활 환경 요인에 따라 발생되는 질환으로 날씨와 기후에 의한 계절적 요인에는 거의 영향을 받지 않습니다. 이와는 달리 일반의약품의 경우 소비자 선택으로 경기변동이나 기후에 의한 계절적 영향이 다소 있는 편입니다. 또한 인플루엔자나 전염성 질환 관련 의약품의 경우 계절, 환경적 요인에 따라 영향을 받을 수 있습니다.
- 대체재 현황
당사에서 개발하고 있는 신약은 전문의약품(ETC)이며 의사의 진단과 처방에 의해서만 약을 구입할 수 있도록 제도적으로 엄격히 관리보호되고 있으며, 모든 단계에서 한국을 포함한 각 국가는 엄격히 허가 및 규제기관을 통해 통제되고 있으며 각 국가에서 설정한 기준에 의해 허가절차를 거쳐 승인을 받아야만 출시할 수 있습니다. 동일한 목표시장에 대해 경쟁제품이 있을 수 있으나 경쟁제품 상호 간에 제품의 약효와 안전성이 완전히 일치하는 신약은 존재할 수 없습니다.
연구단계별 다양한 특허를 출원, 등록하는 evergreening 전략을 사용하여 특허의 존속기간을 연장하고 있습니다. 다만, 특허기간이 만료된 이후에는 다수의 복제약(제네릭/바이오시밀러)이 출시되어 오리지널 의약품이 경쟁력을 잃고 대체될 수 있겠으나, 특허 만료 이후에도 오리지널 제품에 대한 수요가 일정 부분 지속적으로 존재하는 현상이 있습니다
4. 회사 경쟁상의 특징
가. 망막질환 치료제
글로벌 시장 조사 전문기관인 Global Market Insights 2016에 따르면 당뇨병성 황반부종 및 습성 황반변성 치료제는 anti-VEGF 주사제인 Eylea, Lucentis, Avastin 등이 90%의 시장 점유율을 차지하고 있으며, 연평균 6%의 증가가 예상됩니다.
| [시판되고 있는 anti-VEGF 안구내 주사제] |
|
제품명 |
제약사 |
매출 | 가격 | 비고 |
|
Lucentis (ranibizumab) |
Novartis |
글로벌 매출 약 3조 8000억원 (2023년) |
824,513~941,098원 | 시장에 주사제외에 경구제가 존재하지 않고, Endothelial dysfunction을 차단 하는 약물 역시 존재하지 않기에, First-in-class & Oral agent로 시장 진입 가능 |
|
Avastin (bevacizumab) |
Roche |
글로벌 매출 약 6조 3000억원 (2020년) |
330,387~346,320원 | |
|
Eylea (aflibercept) |
Regeneron/Bayer |
글로벌 매출 약 12조원 (2023년) |
751,493~851,788원 | |
| Vabysmo (faricimab) |
Roche | 글로벌 매출 약 6조 2000억원 (2024년) |
751,493원 |
자료: ㈜큐라클
하지만, anti-VEGF 안구내 주사제는 모두 병증이 많이 진행된 후에 처방되어 진단 초기 경증의 환자에게는 투약의 제한이 있습니다. 당뇨환자 중 당뇨병성 황반부종 진단 후 첫해에 치료(anti-VEGF 항체, Laser치료, corticosteroid 및 병용 치료 등)를 받고 있는 환자는 40% 미만으로 60% 환자가 약물투여를 제대로 받지 못하는 것으로 알려져 있습니다. 이에 진단받은 후 많은 환자는 병의 진행을 악화시키고 있다고 볼 수 있어 환자에게 복용편의성이 높은 적절한 경구치료제가 개발된다면 환자의 삶의 질을향상시킬 뿐만 아니라 엄청난 시장을 확보할 것으로 기대하고 있습니다.
CU06은 anti-VEGF 주사제와 비교하여 당뇨병성 황반부종 및 습성 황반변성과 같은 다양한원인 인자에 기인되는 혈관 손상 및 누수를 치료할 수 있는 최적의 치료제입니다. 또한 경구 투여에 의한 복용편의성으로 만성질환인 당뇨병성 황반부종 및 습성 황반변성 치료제로 개발된다면 글로벌 시장에서 충분히 경쟁력이 있습니다.
현재 세계적 제약기업 및 신약벤처들이 아래 다양한 타깃의 당뇨병성 황반부종 치료제 개발에 집중하고 있습니다.
| ▶ 안구내 주사제: | VEGF 외에 Tissue-protective receptor, Corticosteroid, c-Raf kinase, Plasma kallikrein, PIGF, pan RGD integrin 타깃 |
| ▶ 점안제: | Bradykinin receptor B1, Plasma kallikrein 타깃 |
| ▶ 경구제: | Steroid ethisterone, C-Kit, Plasma kallikrein 타깃 |
대표적인 혈관내피세포 타겟 치료제는 anti-VEGF 중화 항체로 주로 항암 및 망막 혈관질환 치료제로 사용되고 있습니다. 망막 혈관질환 치료제의 경우, 전세계 시장규모가 년간 150억 달러를 상회함에도 불구하고 안구내 주사의 불편함과 2019년도 Scientific reports 에 의하면 41%의 불응 환자로 인하여 치료의 한계가 있어 대체 치료제가 절실하게 필요한 상황입니다 (자료: Scientific reports, 9(1), 10952)
나. 당뇨병성 신증 치료제
현재 당뇨병성 신증 치료제는 비스테로이드성 미네랄코르티코이드 수용체 길항제(MRA), 안지오텐신전환효소억제제(angiotensin converting enzyme inhibitor), 안지오텐신II 수용체 차단제(angiotensin II receptor blocker) 등 고혈압 치료제 그리고 SGLT-2 억제제와 같은 당뇨병 치료제가 주로 사용되고 있습니다.
| [시판되고 있는 당뇨병성 신증 치료제] |
| 제품명 (성분명) |
제약사 |
가격 |
비고 |
| Cozaar (Losartan Potassium) | MSD | 476~912원 | 혈압약 |
|
Micardis (Telmisartan) |
Boehringer Ingelheim | 414~550원 | 혈압약 |
| Jardiance (Empagliflozin) | Boehringer Ingelheim | 301~798원 | 당뇨약 |
| Kerendia (Finerenone) | Bayer | 1,670원 | 당뇨병성 신증을 주 적응증으로 가진 치료제 |
자료: ㈜큐라클
만성 신섬유증 치료제로 섬유화 진행을 억제하는 시장에 나온 경쟁 약물은 없습니다. CU01은 Nrf2 활성과 TGF-β/Smad3 억제 기전의 First-in-Class 약제로 항산화 및 섬유화 억제 작용을 갖고 있어 신섬유증 및 신섬유증을 수반하는 만성신장질환 환자의 예방 및 치료에 사용될 수 있고 발 빠른 국내 출시를 목표로 후기임상을 준비하고 있습니다.
당사의 CU01은 물질특허가 없는 블록버스터 의약품이며 약물의 안전성이 확보된 Tecfidera의 주성분인 DMF를 신약재창출 방법으로 재평가하여 Nrf2 활성제 및 TGF-β/Smad3 억제 기전으로 당뇨병성 신증 모델에서 우수한 효능을 보였고, 당사가 국내에서 진행한 임상 2a상 시험에서 유효성, 안전성 및 내약성을 확보하였습니다.
다. 습성 황반변성 치료제
글로벌 시장 조사 전문기관인 Global Market Insights 2016에 따르면 습성 황반변성치료제 시장도 anti-VEGF 제제가 90%를 차지하고 있으며, 연평균 6%의 증가가 예상됩니다.
경구제로는 growth factor 저해제, kinase 저해제, 활성산소를 제거하는 항산화제, DNA lygase 등의 저분자 물질로 주로 단일 타깃을 저해하는 물질이 개발되고 있고 현재 시장에 나온 제품은 없습니다.
천연물 신약인 CU03는 만성 난치성 질환의 다양한 병인에 의하여 발병되는 습성 황반변성의 경구용 치료제로 환자에게 복용 편의성 및 안전성을 제공하여 장기적 투여가 가능하고 기존의 주사제와 차별성이 있습니다. 당사는 천연물의 multi-component and multi-target (다중 성분과 다중 타깃)의 작용 원리로 다양한 인자가 원인이 되는 만성질환의 치료제 CU03를 개발하고 특허의 특허연장 전략으로 천연물 중 성분함량, 임상시험에 의한 용량, 추가 적응증 확보 등을 기반으로 특허를 출원하여 특허권리 확보 및 권리기간 연장을 할 계획입니다. 새로운 개념의 경구용 혈관내피기능장애 치료제는 전 세계적으로 당사가 유일하고 신약개발의 특성상 글로벌 제약사가 단기간 내에 진입하기는 어려울 것으로 봅니다.
5. 용어해설
당사가 영위하는 사업의 내용을 이해하기 위하여 개념 정리가 필요한 용어에 대한 해설은 다음과 같습니다.
| [주요 용어 정리] |
|
용어 |
해설 |
|
당뇨합병증 |
당뇨병이 발생하여 췌장에서 분비되는 인슐린이 부족하거나 우리 몸에서 제대로 작용하지 못하여 혈액 속의 혈당이 에너지로 이용되지 않고 혈액 속에 축적되어 고혈당증상과 이로 인한 합병증을 나타내는 질환입니다. |
|
당뇨병성 신증 |
미세혈관에 발생하는 당뇨 합병증으로 신장이 손상되어 단백뇨와 부종, 고혈압이 동반되고 노폐물이 신장에서 배설되지 않음으로써 만성신부전으로 진행되는 질환입니다. |
|
당뇨병성 황반부종 |
당뇨병으로 인하여 안구의 모세혈관의 파괴로 인하여 시각 세포가 손상되어 시력상실을 일으키는 질환입니다. |
| 당뇨망막병증 (DR; Diabetic Retionopathy) |
당뇨병에 의한 발생하며 고혈당으로 인하여 일어나는 말초 순환장애로 인하여 망막에 발생하는 합병증입니다. |
| 망막색소상피 박리 (PED; Pigment epithelial Detachment) |
망막의 10개층 중에 가장 아래층을 구성하는 1개 층으로 유일하게 색소를 지니고 있어 망막색소상피로 불리며, 망막색소상피가 그 아래의 맥락막으로부터 떨어지는 현상을 망막색소상피 박리라고 합니다. |
| 맥락망신생혈관 (CNV; Choroidal Neovascularization) |
망상색소상피 박리로 생긴 공간에서 신생혈관이 자라나 맥락막신생혈관이 되며 우리 눈의 망막중에서 특히 중요한 황분부에 삼출물, 출혈 등을 일으켜서 중심시력에 영향을 주는 현상을 황반변성이라고 합니다. |
| 습성 황반변성 (wet AMD; wet Age-related macular degeneration) |
삼출성-연령관련 황반 변성, 시력에 매우 중요한 역할을 하는 황반에 나이가 들면서 드루젠(drusen), 망막 색소상피 위축(retinal pigment epithelial atrophy), 맥락막 신생혈관(choroidal neovascularization) 등 변화가 생겨 시력상실을 초래하는 질환입니다. |
|
퇴행성뇌질환 (Neurodegenerative disease) |
퇴행성 뇌질환은 뇌의 신경세포가 점차적으로 손상되어 뇌 기능이 감소하는 질환을 말합니다. 대표적으로 알츠하이머병, 파킨슨병 등이 있으며, 인지, 운동 및 기억 기능에 영향을 미칩니다. |
|
생체 이용률 (Bioavailability) |
투여된 약물이 변화되지 않은 형태로 전신 순환혈에 도달하는 정도이며 주로 경구투여 시의 흡수정도를 의미하며, 약물의 화학적 형태, 제형, 투여경로, 위장관내 안정도, 초회통과효과 등에 영향을 받습니다. |
|
신약후보물질 |
질병과 관련된 단백질(약물 타겟)의 기능을 조절하는 물질을 찾은 후 동물, 독성, 약물 체내동태 등을 평가하여 임상 개발 가치가 있는 물질로 선정하는 일련의 과정을 의미합니다. |
|
신약허가신청 (NDA; new drug application) |
합성의약품에 대한 신약승인 신청서를 의미합니다. 바이오의약품의 경우는 BLA(Biologic License Application)라고 합니다. |
|
임상시험 |
임상시험용 의약품의 안전성과 유효성을 증명할 목적으로 해당 약물의 약동 · 약력 · 약리 · 임상적 효과를 확인하고 이상반응을 조사하기 위하여 사람을 대상으로 실시하는 시험 또는 연구를 총칭하는 것이며, 임상1상, 임상2상 (임상2a 와 임상2b를 구분하여 진행할 수도 있음), 임상3상 크게 3단계로 구분하여 운영되고 있습니다. |
|
임상1상 |
건강한 사람을 대상으로 약물을 안전하게 부여할 수 있는 용량과 인체 내 약물흡수 정도 등을 평가합니다. 앞서 수행된 전임상 단계에서 독성시험 등 전임상시험 결과가 유효한 경우, 시험약을 최초로 사람에 적용하는 단계입니다. 건강한 지원자 또는 약물군에 따른 적응환자를 대상으로 부작용 및 약물의 체내동태 등 안전성 확인에 중점을 두고 있습니다. |
|
임상2상 |
소규모 환자들을 대상으로 약물의 약효와 부작용을 평가하고, 유효성을 검증하는 단계입니다. 단기투약에 따른 흔한 부작용, 약물동태 및 예상적응증에 대한 효능 효과에 대한 탐색을 위해 실시하는 것으로 대상질환 중 조건에 부합되는 환자를 대상으로 합니다. 임상3상 시험에 진입하기 위해 적응증과 최적용법 용량을 결정하는 단계입니다. |
|
임상2a상 (Pilot study) |
약효확인, 작용시간 및 유효용량 검토하는 단계로 효과의 증거를 찾는 것이 목적입니다. 반드시 허가기관이 인정하는 변수를 사용하지 않아도 되며, 설계측면에서 여러 디자인 사용이 가능하고, 피험자 수도 통계적 검정력에 의해 결정하지만 디자인에 따라 현실적 이유를 반영하여 결정됩니다. |
|
임상2b상 (Pivotal study) |
약효 입증, 용량-반응양상 검토, 최적의 용량 및 용법 결정하는 단계로 임상3상과 함께 허가의 핵심이 되는 단계입니다. 허가기관에서 인정하는 검증된 변수만을 사용해야 하고, 임상시험 디자인은 주로 평행군 시험으로 설계되며, 환자 수는 통계적 검정을 통해 결정됩니다. |
|
임상3상 |
신약의 유효성이 어느 정도 확립된 후에 대규모(최소 수백 명에서 수천 명) 환자들의 자료를 식약처에 제출하여 승인을 받아야 판매가 가능합니다. |
|
임상4상(PMS) (시판 후 안전성, 유효성 조사) |
신약이 시판 사용된 후 장기간의 효능과 안전성에 관한 사항을 평가하기 위한 시험으로, 시판 전 제한적인 임상시험에서 파악할 수 없었던 부작용이나 예상하지 못하였던 새로운 적응증을 발견하기 위한 약물역학적인 연구가 실시되는데 이것을 시판 후 조사(Post Market Surveillance)라고 합니다. |
|
유효성 |
의약품 등이 그 적응증에 대해서 효능 및 효과를 갖는 것 또는 그 정도를 의미합니다. |
|
안전성 |
의약품의 독성을 판단하는 것으로 그 사용용량과 투여방식에 있어 인체에 유해하지 않다는 것 또는 그 정도를 의미합니다. |
|
의약품 자료 독점권 |
데이터 독점권은 신약을 처음 개발한 혁신적인 회사를 보호하는 제도로 제네릭 또는 바이오시밀러를 개발하는 회사가 일정기간 동안 원개발사의 안전성, 유효성 자료 즉, 임상자료를 인용하지 못하도록 하는 제도입니다. 이럴 경우 후속개발자가 원개발사의 데이터 인용없이 의약품 허가를 받기 위해서는 임상을 수행해야 하기 때문에 경제적, 시간적 부담이 따르게 됩니다. 따라서 이 제도는 의약품 원개발사에게 유리한 제도입니다. |
|
작용기전 (MOA; Mode of Action) |
의약품이 효능을 나타내는 원리 및 치료 효능과 화학적 작용의 과정을 의미합니다. |
|
전임상시험 |
새로 개발한 신약후보물질을 사람에게 사용하기 전에 동물에게 사용하여 부작용이나 독성, 효과 등을 알아보는 시험입니다. 약물이 체내에 어떻게 흡수되어 분포되고 배설되는가를 연구하는 체내동태 연구와 약효약리 연구가 수행됩니다. 그 후 동물실험을 통해 시험약이 지니는 부작용 및 독성을 검색하는 안전성 평가를 진행하는 단계입니다. |
|
제형 |
약품을 인체에 투여하는 사용 목적이나 용도에 맞게 적절한 형태로 만든 물질을 의미합니다. (예: 정제, 캡슐제, 액제, 크림제, 주사제) |
|
적응증 |
어떠한 약제나 수술 등에 의하여 치료효과가 기대되는 질병이나 증상을 의미합니다. 의약품의 적응증은 회사가 어떤 약을 허가 받기 위해 여러 효능시험과 성적서와 관련 논문, 안전성 자료 등을 종합하여 식품의약품 안전처에 제출하면 승인된 부분에 한해서 적응증으로 사용할 수 있습니다. |
| 최종당화산물 (AGEs;advanced glycation end products) |
당화(Glycation)는 우리 몸, 피부 등에 있는 단백질(콜라겐, 엘라스틴), 핵산(DNA), 지질 등에 당(포도당glucose, 과당fructose)이 효소작용 없이( 비효소반응) 공유 결합하여 단백질(콜라겐, 엘라스틴), 핵산(nucleotides), 지질의 물성이 변하는 현상을 말하며 이때 생성되는 당화산물(AGE, advanced glycation end product) 은 축적되어 노화 및 질병(당뇨합병증, 동맥경화)의 유발 과정에 깊이 관여한다는 것이 알려져있습니다. |
|
체내동태 (Pharmacokinetics, PK) |
생체 내 투여된 약물은 흡수되어 작용부위에 도달해 약효를 발현하고 생체 내에 분포합니다. 그리고 간 등에서 분해(대사)되고 뇨중으로 배설되어 생체로부터 소실됩니다. 이러한 약물의 생체 내 이행과 변화의 과정을 약물의 체내동태라고 합니다. |
|
합성의약품 신약 |
화학적 합성에 의하여 생산되는 의약품으로 바이오의약품과 비교 시 QC 관리가 용이하고 생산단가가 저렴한 것이 특징입니다. |
| 혈액-뇌 장벽 (BBB; Blood-Brain Barrier) |
뇌-혈관장벽은 뇌와 혈액을 보다 격리시키는 혈관 장벽으로 높은 선택적 투과성을 갖고 있어 뇌를 포함한 중추신경계의 조절기능을 세균 등과 같은 혈액으로 운반될 수 있는 병원체와 혈액 내의 잠재적인 위험 물질로부터 격리시키는 역할을 합니다. 또한, 생체항상성을 조절하고 뇌기능에 필수적인 물질들을 선택적으로 뇌속으로 전달하는 기능을 합니다. |
|
혈관 투여(IV) (Intravenous Injection) |
치료제를 정맥주사를 통해 주입하는 방법을 의미합니다. |
| ALI (acute lung injury) |
급성폐손상을 의미합니다. |
| Amigo2-PDK1 | Amigo2의 세포질 도메인과 PDK-1의 PH 도메인과의 결합을 의미합니다. |
| Ang-2 (Angiopoietin-2) |
신생혈관의 혈관성장인자를 의미합니다. |
| ARDS (Acute respiratory distress syndrome) |
급성호흡곤란증후군을 의미합니다. |
|
CDA |
기밀 공개 계약을 의미하며 독점정보를 보호하고 당사자들이 일정기간 동안 정보를 기말로 유지하도록 구속하는 법적 계약입니다. |
|
CRO: 임상시험수탁기관 |
제약회사가 신약개발에 드는 비용을 절감하기 위해 임상시험 연구를 아웃소싱하는 기관으로 임상시험수탁기관은 신약개발 단계에서 제약사의 의뢰를 받아 임상시험 진행의 설계, 컨설팅, 모니터링, 데이터 관리, 허가 대행 등의 업무를 대행해 주는 기관을 말합니다. |
|
CMO: 위탁제조기관 (Contract Manufacturing Organization ) |
위탁 받은 제품을 생산해 주는 기업으로 바이오, 제약부문에서 주로 사용되는 용어입니다. 의약품 대량생산시설을 갖추고 있지 않거나 생산역량이 부족할 때 경영효율화를 위하여 바이오·제약 기업은 CMO를 활용함으로써 공장 건설에 필요한 초기투자 비용을 아끼고 생산원가를 낮출 수 있습니다. |
| CNV (Choroidal Neovascularization) |
안구내 맥락막 신생혈관을 의미합니다. |
| cGMP (Current Good Manufacturing Practice) |
강화된 의약품 제조 및 품질관리기준으로 미국 FDA가 인정하는 의약품 품질관리 기준입니다. |
|
Drug Repositioning (신약재창출) |
기존에 나와 있는 약물이 다른 질환에 쓰일 수 있게 하는 것으로, ‘약물 재창출’이라고 합니다. 이는 이미 출시된 약의 새로운 기전을 찾아 새로운 증상에 대해 쓰일 수 있도록 개발을 진행하는 전략입니다. |
| DMF (Dimethyl Fumarate) |
푸마린산에 메틸에스터기가 붙은 물질을 의미합니다. |
|
FDA |
미국의 식품의약국이며 미국 내에서 생산되는 식품·의약품·화장품 뿐만 아니라 수입품과 일부 수출품의 효능과 안전성을 주로 관리하고 있습니다. 또한 FDA는 전세계적으로 가장 엄격하고 신중한 시판승인 결정을 내리는 것으로 유명하기 때문에 세계적으로 공신력을 인정받고 있습니다. 참고로 한국 식약처는 MFDS, 중국 식약처는 CFDA 라고 합니다. |
|
EMA |
유럽연합(EU)을 통해 설립된 유럽식약청이며, 유럽연합(EU) 소속 국가들의 의약품관련 규제를 맞추고 관리·감독하는 기관입니다. 의약품 시판승인과 관련하여 미국의 FDA와 비슷한 수준의 엄격한 기준을 가지고 있으며 그 공신력 또한 인정받고 있습니다. |
|
First-in-Class 신약 (혁신 신약) |
기존에 치료제가 없는 질병을 고치는 신약이거나 특정 질환에 사용되는 약품이 있지만 기존의 약물과 비교 시 효능, 독성 면이 개선된 약물을 의미합니다. 질병을 일으키는 단백질을 밝혀내고 이를 치유하는 최적의 물질을 찾아 동물실험을 하는 전임상, 안전성과 약효를 검증하는 임상 1·2·3상 단계를 거쳐 각국의 식약처에서 의약품으로 승인받은 신약을 의미합니다. |
|
GLP: 우수 실험실 관리기준 |
의약품, 화장품 등의 안전성 평가를 위해 실시하는 각종 독성 시험의 신뢰성을 보증하기 위한 기준으로 '비임상시험 관리 기준’ 또는 '우수 실험실 운영기준' 이라고도 합니다. 식약처로부터 적격성을 승인 받아야 GLP기관의 자격이 부여됩니다. |
|
GCP: 임상시험 실시 기준 |
인체를 대상으로 하는 시험의 안전성 및 유효성 검증 절차를 규정하는 기준으로 시험결과에 대한 신뢰성 뿐만 아니라 시험 대상자의 인권보호 등 임상시험이 윤리적인 배려 하에 과학적으로 시행되도록 국가가 정한 기준을 말합니다. |
|
GMP: 우수의약품 제조관리기준 |
의약품의 안정성과 유효성을 확보하기 위해 준수해야 하는 우수 의약품의 제조 관리 기준, 우리나라의 KGMP, 미국의 cGMP(Current Good Manufacturing Practice)와 유럽 EU GMP(또는 who GMP) 등 국가별 GMP규정을 두고 운영하고 있으며, 식약처의 실사 및 정기적 관리보고를 통해 적격성을 승인받아야 자격이 부여 됩니다. |
|
IVT 주사 (Intravitreal Injection) |
안구 내 약물 전달을 위해 유리체 내에 약물을 직접 주사하는 방법을 의미합니다. |
| I/R injury (ischemia-reperfusion injury) |
허혈/재관류 손상. 막힌 혈관을 재관류할 때 허혈조직으로의 혈류 회복과 산소화로 더 많은 조직 손상을 초래하는 현상입니다. |
| IBD (Inflammatory bowel disease) |
만성염증성 장염을 의미합니다. 발병의 원인은 불명확하며 궤양성대장염과 크론병이 있습니다. |
|
IND 신청: 임상시험계획 승인 신청 (IND; Investigational New Drug application) |
인체를 대상으로 한 안전성·유효성 자료 수집을 목적으로 해당 의약품을 사용하여 임상시험을 실시하고자 하는 자가 식약처에 승인을 신청하는 과정으로 신약개발의 경우 반드시 허가당국의 승인이 있어야 진행할 수 있습니다. |
|
MTA |
물질이전계약을 의미하며 수신자가 자신의 연구목적으로 사용하려는 경우 두 조직간이 유형연구자료 혹은 물질을 이전하기 위해 체결하는 계약입니다. |
|
MFDS (한국 식품의약품안전처, |
식품과 의약품에 관해 임상실험이나 안전검증 등을 하여 국민들의 건강에 유익하거나 유해한 식품, 의약품을 분류, 고시, 단속하는 등의 업무를 수행합니다. |
| NASH (Non-alcoholic steatohepatitis) |
비알콜성지방간염을 의미합니다. |
| Nrf2 (Nuclear factor erythroid 2-related factor 2) |
다양한 항산화 유전자들을 증가시킴으로써 세포 방어 기전에 중요한 역할을 담당하는 물질입니다. |
|
NCD 자료공개 |
기밀이 아닌 데이터의 자료공개를 의미합니다. |
|
NDA |
비공개 계약을 의미합니다. |
| SGLT2 (Sodium glucose co-transporter 2) |
나트륨 / 포도당 공동 수송체 2를 의미하며, 신세뇨관에서 포도당이 재흡수되어 혈류 내로 들어가는데 이용됩니다. |
| TGF-β (전환성장인자 베타, Transforming growth factor-beta) |
상피세포와 조혈세포의 성장, 이동, 분화 및 사멸 등을 조절하여 세포의 성장과 고사를 통한 생물의 항상성 유지에 기본이 되는 세포 성장인자이며, 당뇨 병성 신증에서 TGF-β에 의해 활성화되어 혈관간세포가 콜라겐을 형성하는데 중요한 역할을 하는 것으로 알려져 있습니다. |
| TNF-α (tumor necrosis factor alpha) |
염증반응에 포함되고 급성기 반응의 구성원인 사이토카인입니다. TNF-α는 주로 활성화된 대식세포에 의해 분비되는데, 보조 T 세포, 자연살해세포, 그리고 손상된 뉴런 등의 다양한 세포에서도 분비됩니다. |
| TPH1 (Tryptophan Hydroxylase 1) |
혈관수축작용을 하는 물질인 세로토닌을 합성하는데 관여하는 효소입니다. |
| VEGF (vascular endothelial) |
혈관내피세포에 특이적으로 작용하여 세포 증식이나 혈관신생을 촉진하는 당단백입니다. |
III. 재무에 관한 사항
1. 요약재무정보
당사는 기업공시서식 작성기준에 따른 소규모기업에 해당하여 '요약재무정보'를 기재하지 아니합니다. 다음의 재무제표 본문을 참고하시기 바랍니다.
2. 연결재무제표
해당사항 없음
3. 연결재무제표 주석
해당사항 없음
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 10 기 1분기말 2025.03.31 현재 |
|
제 9 기말 2024.12.31 현재 |
| 제 8 기말 2023.12.31 현재 |
|
(단위 : 원) |
|
제 10 기 1분기말 |
제 9 기말 |
제 8 기말 | |
|---|---|---|---|
|
자산 |
|||
|
유동자산 |
29,096,642,468 |
32,417,332,819 |
44,473,449,606 |
|
현금및현금성자산 |
2,245,700,283 |
3,981,677,368 |
12,840,748,751 |
|
단기금융상품 |
25,000,000,000 |
26,364,517,855 |
28,000,000,000 |
|
매출채권 |
1,097,888,625 |
1,100,791,922 |
|
|
기타유동금융자산 |
87,968,229 |
583,293,306 |
460,629,916 |
|
기타유동자산 |
665,085,331 |
387,052,368 |
318,019,514 |
| 계약자산 | 2,854,051,425 | ||
|
비유동자산 |
26,738,522,443 |
26,871,034,427 |
25,308,683,368 |
|
유형자산 |
22,867,651,276 |
22,986,597,277 |
20,630,535,705 |
|
무형자산 |
396,614,732 |
392,076,247 |
327,065,331 |
|
사용권자산 |
77,610,430 |
92,396,044 |
195,473,566 |
|
기타비유동투자자산 |
2,619,454,180 |
2,619,454,180 |
1,300,864,000 |
|
기타비유동금융자산 |
7,544,104 |
7,473,478 |
25,892,914 |
|
기타비유동자산 |
267,493,318 |
270,882,798 |
1,076,484,889 |
| 순확정급여자산 | 86,074,563 | ||
|
파생상품금융자산 |
502,154,403 |
502,154,403 |
1,666,292,400 |
|
자산총계 |
55,835,164,911 |
59,288,367,246 |
69,782,132,974 |
|
부채 |
|||
|
유동부채 |
28,827,583,494 |
20,986,484,411 |
10,196,545,273 |
|
유동성 장기 차입금 |
8,000,000,000 |
8,000,000,000 | |
|
유동성전환사채 |
12,412,800,572 |
12,298,573,033 |
|
|
유동 리스부채 |
53,794,591 |
58,977,320 |
99,494,358 |
|
기타 유동부채 |
321,950 |
52,276,460 |
37,008,540 |
|
기타유동금융부채 |
651,023,896 |
587,390,774 |
2,060,042,375 |
|
유동 파생상품 금융부채 |
7,709,642,485 |
7,989,266,824 |
|
|
비유동부채 |
432,229,361 |
8,348,547,341 |
17,722,411,376 |
|
금융기관 차입금(사채 제외) |
8,000,000,000 |
||
| 전환사채, 총액 | 10247185104 | ||
|
순확정급여부채 |
142,653,380 |
49,120,682 |
|
|
비유동 리스부채 |
29,165,481 |
39,016,159 |
97,993,479 |
| 비유동 파생상품 금융부채 | 7,377,232,793 | ||
|
이연법인세부채 |
260,410,500 |
260,410,500 |
|
|
부채총계 |
29,259,812,855 |
29,335,031,752 |
27918956649 |
|
자본 |
|||
|
자본금 |
6,984,299,500 |
6,936,984,000 |
6,927,671,000 |
|
보통주자본금 |
6,984,299,500 |
6,936,984,000 |
6,927,671,000 |
|
자본잉여금 |
102,420,346,156 |
101,554,153,832 |
101,359,651,614 |
|
주식발행초과금 |
102,420,346,156 |
101,554,153,832 |
101,359,651,614 |
|
기타포괄손익누계액 |
2,369,998,588 |
2,369,998,588 |
|
|
유형자산, 재평가잉여금 |
2,369,998,588 |
2,369,998,588 |
|
|
기타자본구성요소 |
10,175,034,779 |
10,340,353,179 |
9,786,645,273 |
|
주식선택권 |
4,826,449,201 |
4,797,777,451 |
4,244,069,545 |
|
전환권대가 |
5,348,585,578 |
5,542,575,728 |
5,542,575,728 |
|
이익잉여금(결손금) |
(95,374,326,967) |
(91,248,154,105) |
(76,210,791,562) |
|
미처분이익잉여금(미처리결손금) |
(95,374,326,967) |
(91,248,154,105) |
(76,210,791,562) |
|
자본총계 |
26,575,352,056 |
29,953,335,494 |
41,863,176,325 |
|
자본과부채총계 |
55,835,164,911 |
59,288,367,246 |
69,782,132,974 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 10 기 1분기 2025.01.01 부터 2025.03.31 까지 |
|
제 9 기 1분기 2024.01.01 부터 2024.03.31 까지 |
| 제 9 기 2024.01.01 부터 2024.12.31 까지 |
| 제 8 기 2023.01.01 부터 2023.12.31 까지 |
|
(단위 : 원) |
|
제 10 기 1분기 |
제 9 기 1분기 |
제 9 기 | 제 8 기 | |||
|---|---|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|||
|
영업수익 |
499,870,993 |
499,870,993 |
1,632,550,301 | 10,294,390,768 | ||
|
영업비용 |
3,648,605,528 |
3,648,605,528 |
3,555,569,687 |
3,555,569,687 |
14,267,238,281 | 20,802,500,996 |
|
영업이익(손실) |
(3,648,605,528) |
(3,648,605,528) |
(3,055,698,694) |
(3,055,698,694) |
(12,634,687,980) | (10,508,110,228) |
|
기타수익 |
243,572 |
243,572 |
13,553,453 |
13,553,453 |
41,938,259 | 24,039,652 |
|
기타비용 |
32,000 |
32,000 |
6,049,730 |
6,049,730 |
160,320,340 | 2,703,508 |
|
금융수익 |
217,878,003 |
217,878,003 |
754,889,408 |
754,889,408 |
2,237,578,553 | 1,700,749,330 |
|
금융비용 |
692,387,464 |
692,387,464 |
602,056,878 |
602,056,878 |
4,370,981,642 | 2,799,744,399 |
|
법인세비용차감전순이익(손실) |
(4,122,903,417) |
(4,122,903,417) |
(2,895,362,441) |
(2,895,362,441) |
(14,886,473,150) | (11,585,769,153) |
|
법인세비용(수익) |
||||||
|
당기순이익(손실) |
(4,122,903,417) |
(4,122,903,417) |
(2,895,362,441) |
(2,895,362,441) |
(14,886,473,150) | (11,585,769,153) |
|
기타포괄손익 |
(3,269,445) |
(3,269,445) |
(1,906,718) |
(1,906,718) |
2,219,109,195 | (12,185,457) |
|
당기손익으로 재분류되지 않는항목(세후기타포괄손익) |
(3,269,445) |
(3,269,445) |
(1,906,718) |
(1,906,718) |
||
|
확정급여제도의 재측정손익(세후기타포괄손익) |
(3,269,445) |
(3,269,445) |
(1,906,718) |
(1,906,718) |
(150,889,393) | (12,185,457) |
| 유형자산재평가이익 | 2,369,998,588 | |||||
|
총포괄손익 |
(4,126,172,862) |
(4,126,172,862) |
(2,897,269,159) |
(2,897,269,159) |
(12,667,363,955) | (11,597,954,610) |
|
주당이익 |
||||||
|
기본주당이익(손실) (단위 : 원) |
(296.0) |
(296.0) |
(209.0) |
(209.0) |
(1,074) | (836) |
|
희석주당이익(손실) (단위 : 원) |
(296.0) |
(296.0) |
(209.0) |
(209.0) |
(1,074) | (836) |
4-3. 자본변동표
|
자본변동표 |
|
제 10 기 1분기 2025.01.01 부터 2025.03.31 까지 |
|
제 9 기 1분기 2024.01.01 부터 2024.03.31 까지 |
|
(단위 : 원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본구성요소 |
기타포괄손익누계액 |
이익잉여금 |
자본 합계 |
|
|
2024.01.01 (기초자본) |
6,927,671,000 |
101,359,651,614 |
9,786,645,273 |
(76,210,791,562) |
41,863,176,325 |
|
|
당기순이익(손실) |
(2,895,362,441) |
(2,895,362,441) |
||||
|
확정급여제도의재측정요소 |
(1,906,718) |
(1,906,718) |
||||
|
주식선택권 부여 |
401,108,879 |
401,108,879 |
||||
|
전환사채의 감소 |
||||||
|
2024.03.31 (기말자본) |
6,927,671,000 |
101,359,651,614 |
10,187,754,152 |
(79,108,060,721) |
39,367,016,045 |
|
|
2025.01.01 (기초자본) |
6,936,984,000 |
101,554,153,832 |
10,340,353,179 |
2,369,998,588 |
(91,248,154,105) |
29,953,335,494 |
|
당기순이익(손실) |
(4,122,903,417) |
(4,122,903,417) |
||||
|
확정급여제도의재측정요소 |
(3,269,445) |
(3,269,445) |
||||
|
주식선택권 부여 |
28,671,750 |
28,671,750 |
||||
|
전환사채의 감소 |
(47,315,500) |
(866,192,324) |
193,990,150 |
(719,517,674) |
||
|
2025.03.31 (기말자본) |
6,984,299,500 |
102,420,346,156 |
10,175,034,779 |
2,369,998,588 |
(95,374,326,967) |
26,575,352,056 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 10 기 1분기 2025.01.01 부터 2025.03.31 까지 |
|
제 9 기 1분기 2024.01.01 부터 2024.03.31 까지 |
|
(단위 : 원) |
|
제 10 기 1분기 |
제 9 기 1분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(3,058,156,043) |
(1,303,290,880) |
|
영업활동으로부터 창출된 현금흐름 |
(3,554,369,041) |
(1,808,103,643) |
|
이자수취 |
701,318,706 |
613,624,774 |
|
이자지급 |
(97,105,268) |
(108,812,011) |
|
법인세환급(납부) |
(108,000,440) |
|
|
투자활동현금흐름 |
1,342,147,732 |
4,445,262,075 |
|
투자활동으로부터의 현금유입 |
26,364,517,855 |
28,006,381,895 |
|
임차보증금의 감소 |
6,381,895 |
|
|
단기금융상품의 처분 |
26,364,517,855 |
28,000,000,000 |
|
투자활동으로부터의 현금유출 |
(25,022,370,123) |
(23,561,119,820) |
|
단기금융상품의 취득 |
25,000,000,000 |
23,538,081,820 |
|
유형자산의 취득 |
1,078,182 |
23,038,000 |
|
장기선급금의 감소(증가) |
21,291,941 |
|
|
재무활동현금흐름 |
(15,033,407) |
(13,416,310) |
|
재무활동으로 인한 현금유입액 |
||
|
재무활동으로 인한 현금유출액 |
(15,033,407) |
(13,416,310) |
|
리스부채의 지급 |
(15,033,407) |
(13,416,310) |
|
현금및현금성자산의순증가(감소) |
(1,731,041,718) |
3,128,554,885 |
|
현금및현금성자산에 대한 환율변동효과 |
(4,935,367) |
196,788,190 |
|
기초현금및현금성자산 |
3,981,677,368 |
12,840,748,751 |
|
기말현금및현금성자산 |
2,245,700,283 |
16,166,091,826 |
5. 재무제표 주석
주석
| 제 10 기 1분기 : 2025년 03월 31일 현재 |
| 제 9 기 1분기 : 2024년 03월 31일 현재 |
| 주식회사 큐라클 |
1. 일반사항
주식회사 큐라클(이하 "당사"라고 함)은 2016년 5월 12일 설립되어, 의학 및 약학 연구개발업을 주요 사업으로 영위하고 있으며, 2021년 7월 22일자로 코스닥시장에 주식을 상장한 공개법인입니다. 당사의 본점은 서울특별시 서초구 효령로 23-1(방배동, 큐라클빌딩)에 소재하고 있으며, 대표이사는 유재현입니다.
당분기말 현재 당사의 주요 주주 현황은 다음과 같습니다.
| 주주명 | 보통주 | |
|---|---|---|
| 주식수(주) | 지분율(%) | |
| 권영근 | 1,809,047 | 12.95% |
| 김태윤 | 470,880 | 3.37% |
| 박광락 | 421,800 | 3.02% |
| 장덕수 | 228,572 | 1.64% |
| 이인규 | 222,550 | 1.59% |
| 유요선 | 237,414 | 1.70% |
| 넥시드-어니스트 제1호투자조합 | 152,716 | 1.09% |
| 스마트혁신산업단지제1호투자조합 | 151,420 | 1.08% |
| 기타 | 10,274,200 | 73.55% |
| 합계 | 13,968,599 | 100.00% |
2. 중요한 회계정책
당사의 분기재무제표는 한국채택국제회계기준(이하 "기업회계기준")에 따라 작성되는 요약중간재무제표입니다. 동 재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석은 직전 연차보고기간말 후 발생한 회사의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다.
분기재무제표는 매 보고기간말에 공정가치로 측정되는 금융자산 및 금융부채를 제외하고는 역사적 원가에 기초하여 작성하였습니다.
기업회계기준은 중간재무제표 작성시 중요한 회계추정의 사용을 허용하고 있으며, 회계정책을 적용함에 있어 경영진의 판단을 요구하고 있습니다. 보다 복잡하고 높은 수준의 판단이 필요한 부분이나 중요한 가정 및 추정이 필요한 부분은 주석 3에서 설명하고 있습니다.
2025년 1월 1일부터 시행되는 회계기준이 있으나, 그 기준들은 당사의 재무제표에 중요한 영향을 미치지 않으며, 이를 제외하고는 중간재무제표의 작성에 적용된 중요한 회계정책은 2024년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시채택한 회계정책과 동일합니다.
3. 중요한 회계추정 및 가정
중간재무제표 작성에는 미래에 대한 가정 및 추정이 요구되며 경영진은 당사의 회계정책을 적용하기 위해 판단이 요구됩니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에 비추어 합리적으로 예측가능한 미래의 사건을 고려하여 이루어집니다. 회계추정의 결과가 실제 결과와 동일한 경우는 드물 것이므로 중요한 조정을 유발할 수 있는 유의적인 위험을 내포하고 있습니다.
분기재무제표 작성을 위한 당사의 회계정책 적용과 추정 금액에 대한 경영진의 판단은 2024년 12월 31일로 종료하는 회계연도의 연차재무제표와 동일한 회계정책과 추정의 근거를 사용하였습니다.
4. 원가기준 투입법 적용 계약
(1) 당분기 및 전기의 계약잔액 및 영업수익 등의 내역은 다음과 같습니다.
① 당분기
해당사항 없음
② 전기
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구분 |
기초 계약잔액 |
증감액 | 영업수익 |
기말 계약잔액(*) |
| CU06 임상시험 | - | 1,129,384 | 1,129,384 | - |
| CU06 비임상시험 | - | 503,166 | 503,166 | - |
| 합계 | - | 1,632,550 | 1,632,550 | - |
(*) 임상 2상 및 비임상 시험 용역 제공 수행의무를 통해 수행의무 결과를 합리적으로측정할 수 없는 상황에서 투입되는 원가만큼 회수가 가능할 것으로 예상하고 있기 때문에, 계약잔액이 존재하지 않습니다.
(2) 당분기말과 전기말 현재 진행중인 용역과 관련된 누적원가 등의 내역은 다음과 같습니다.
① 당분기말
해당사항 없음
② 전기말
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구분 | 누적원가 | 누적손익 | 계약자산 | 계약부채 |
| CU06 임상시험 | 8,955,666 | 131,227 | - | - |
| CU06 비임상시험 | 6,653,511 | - | - | - |
| 합계 | 15,609,177 | 131,227 | - | - |
(3) 당분기 및 전기의 계약수익금액이 전기 매출액의 5% 이상인 수행의무별 정보는 다음과 같습니다.
ⓛ 당분기
해당사항 없음
② 전기
| (단위: 천원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 수행의무 | 계약일 | 이행종료시점 | 진행률 | 계약수익 | 계약자산 | 계약부채 |
| CU06 임상 및 비임상시험 |
임상 2상 시험 | 2021-10 | 2024년 5월(*) | - | 1,129,384 | - | - |
| 비임상 시험 | 2023-03 | 2024년 5월(*) | - | 503,166 | - | - | |
| 합계 | 1,632,550 | - | - | ||||
(*) 당사가 Thea Open Innovation과 2021년 10월 27일자에 체결한 당뇨병선 황반부종 및 습성 황반변성 치료제 CU06에 대한 기술이전 계약에 대해 2024년 5월 16일자로 계약해지 및 권리반환 통보를 받았습니다.
5. 금융상품 공정가치
5.1 금융상품 종류별 공정가치
당분기말과 전기말 현재 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
| (단위: 천원) | ||||
| 구분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산 | ||||
| 현금및현금성자산(*) | 2,245,700 | 2,245,700 | 3,981,677 | 3,981,677 |
| 매출채권(*) | 1,097,889 | 1,097,889 | 1,100,792 | 1,100,792 |
| 단기금융상품(*) | 25,000,000 | 25,000,000 | 26,364,519 | 26,364,519 |
| 기타포괄손익공정가치측정금융자산 | 2,619,454 | 2,619,454 | 2,619,454 | 2,619,454 |
| 기타금융자산(*) | 95,512 | 95,512 | 590,766 | 590,766 |
| 파생상품금융자산 | 502,154 | 502,154 | 502,154 | 502,154 |
| 합계 | 31,560,709 | 31,560,709 | 35,159,362 | 35,159,362 |
| 금융부채 | ||||
| 전환사채(*) | 12,412,801 | 12,412,801 | 12,298,573 | 12,298,573 |
| 기타금융부채(*) | 651,024 | 651,024 | 587,391 | 587,391 |
| 리스부채(*) | 82,960 | 82,960 | 97,993 | 97,993 |
| 유동성장기차입금(*) | 8,000,000 | 8,000,000 | - | - |
| 장기차입금(*) |
- | - | 8,000,000 | 8,000,000 |
| 파생상품금융부채 | 7,709,642 | 7,709,642 | 7,989,267 | 7,989,267 |
| 합계 | 28,856,427 | 28,856,427 | 28,973,224 | 28,973,224 |
(*) 상각후원가로 측정되는 금융자산 및 금융부채로서 장부금액은 공정가치의 합리적인 근사치입니다.
5.2 공정가치 서열체계
공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
- 수준 1: 측정일에 동일한 자산이나 부채에 대한 접근가능한 활성시장의 조정되지 않은 공시가격
- 수준 2: 수준 1의 공시가격 이외에 자산이나 부채에 대해 직접적으로 또는 간접적으로 관측가능한 투입변수
- 수준 3: 자산이나 부채에 대한 관측가능하지 않은 투입변수
① 당분기말
| (단위: 천원) | ||||
| 구분 | 수준 1 | 수준 2 | 수준 3 | 합계 |
| 금융자산 | ||||
| 기타포괄손익공정가치측정금융자산 | - | - | 2,619,454 | 2,619,454 |
| 파생상품금융자산 | - | - | 502,154 | 502,154 |
| 금융부채 | ||||
| 파생상품금융부채 | - | - | 7,709,642 | 7,709,642 |
② 전기말
| (단위: 천원) | ||||
| 구분 | 수준 1 | 수준 2 | 수준 3 | 합계 |
| 금융자산 | ||||
| 기타포괄손익공정가치측정금융자산 | - | - | 2,619,454 | 2,619,454 |
| 파생상품금융자산 | - | - | 502,154 | 502,154 |
| 금융부채 | ||||
| 파생상품금융부채 | - | - | 7,989,267 | 7,989,267 |
5.3 공정가치 측정치의 서열체계 수준 간 이동
당사는 공정가치 서열체계의 수준 간 이동을 보고기간말에 인식하며 각 공정가치 서열체계의 수준 간 이동 내역은 없습니다.
5.4 공정가치 측정치의 수준 3의 변동 내역
당분기 및 전기 중 공정가치 측정치의 수준 3의 변동 내역은 다음과 같습니다.
① 당분기말
| (단위: 천원) | |||
| 구분 | 기타포괄손익 공정가치측정금융자산 |
파생상품금융자산 | 파생상품금융부채 |
| 기초금액 | 2,619,454 | 502,154 | 7,989,267 |
| 취득 | - | - | - |
| 전환 | - | - | (279,625) |
| 평가 | - | - | - |
| 기말금액 | 2,619,454 | 502,154 | 7,709,642 |
② 전기말
| (단위: 천원) | |||
| 구분 | 기타포괄손익 공정가치측정금융자산 |
파생상품금융자산 | 파생상품금융부채 |
| 기초금액 | 1,300,864 | 1,666,292 | 7,377,233 |
| 취득 | 1,318,590 | - | - |
| 평가 | - | (1,164,138) | 612,034 |
| 기말금액 | 2,619,454 | 502,154 | 7,989,267 |
5.5 가치평가기법 및 투입변수
(1) 당분기말과 전기말 현재 당사의 재무상태표에서 공정가치로 측정되는 자산, 부채중 공정가치 서열체계 수준 2로 분류된 항목은 없습니다.
(2) 당분기말과 전기말 현재 당사의 재무상태표에서 공정가치로 측정되는 자산, 부채중 공정가치 서열체계 수준 3으로 분류된 항목의 가치평가기법과 투입변수는 다음과같습니다.
① 당분기말
| (단위: 천원) | |||||
| 구분 | 공정가치 | 수준 | 가치평가기법 | 투입변수 | 투입변수 범위 |
| 기타포괄손익공정가치측정금융자산 | |||||
| 비상장주식 | 2,619,454 | 3 | 원가접근법 | - | - |
| 당기손익공정가치측정금융자산 | |||||
| 파생상품금융자산 | 502,154 | 3 | 이항모형 | 할인율 | 2.60% ~ 2.86% |
| 주가변동성 | 82.49% | ||||
| 당기손익공정가치측정금융자산 | |||||
| 파생상품금융부채 | 7,709,642 | 3 | 이항모형 | 할인율 | 2.60% ~ 2.86% |
| 주가변동성 | 82.49% | ||||
② 전기말
| (단위: 천원) | |||||
| 구분 | 공정가치 | 수준 | 가치평가기법 | 투입변수 | 투입변수 범위 |
| 기타포괄손익공정가치측정금융자산 | |||||
| 비상장주식 | 2,619,454 | 3 | 원가접근법 | - | - |
| 당기손익공정가치측정금융자산 | |||||
| 파생상품금융자산 | 502,154 | 3 | 이항모형 | 할인율 | 2.60% ~ 2.86% |
| 주가변동성 | 82.49% | ||||
| 당기손익공정가치측정금융자산 | |||||
| 파생상품금융부채 | 7,989,267 | 3 | 이항모형 | 할인율 | 2.60% ~ 2.86% |
| 주가변동성 | 82.49% | ||||
5.6 수준 3으로 분류된 공정가치 측정치의 가치평가과정
당사는 재무보고 목적의 공정가치 측정을 담당하는 담당자가 있으며, 이러한 공정가치 측정치는 수준 3으로 분류되는 공정가치 측정치를 포함하고 있습니다. 공정가치 측정 담당자는 당사의 재무담당이사와 감사에 직접 보고하며 매기 보고일정에 맞추어 공정가치 평가과정 및 그 결과에 대해 재무담당이사 및 감사와 협의합니다.
6. 범주별 금융상품
(1) 당분기말과 전기말 현재 금융자산 내역은 다음과 같습니다.
| (단위: 천원) | ||||
| 구분 | 당분기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 상각후원가측정금융자산 | ||||
| 현금및현금성자산 | 2,245,700 | - | 3,981,677 | - |
| 매출채권 | 1,097,889 | - | 1,100,792 | - |
| 단기금융상품 | 25,000,000 | - | 26,364,518 | - |
| 기타금융자산 | 87,968 | 7,544 | 583,293 | 7,473 |
| 소계 | 28,431,557 | 7,544 | 32,030,280 | 7,473 |
| 당기손익공정가치측정금융자산 | ||||
| 파생상품금융자산 | - | 502,154 | - | 502,154 |
| 기타포괄손익공정가치측정금융자산 | ||||
| 기타투자자산 | - | 2,619,454 | - | 2,619,454 |
| 합계 | 28,431,557 | 3,129,152 | 32,030,280 | 3,129,081 |
(2) 당분기말과 전기말 현재 금융부채 내역은 다음과 같습니다.
| (단위: 천원) | ||||
| 구분 | 당분기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 상각후원가측정금융부채 | ||||
| 차입금 | 8,000,000 | - | - | 8,000,000 |
| 전환사채 | 12,412,801 | - | 12,298,573 | - |
| 리스부채 | 53,795 | 29,165 | 58,977 | 39,016 |
| 기타금융부채 | 651,024 | - | 587,391 | - |
| 소계 | 21,117,620 | 29,165 | 12,944,941 | 8,039,016 |
| 당기손익공정가치측정금융부채 | ||||
| 파생상품금융부채 | 7,709,642 | - | 7,989,267 | - |
| 합계 | 28,827,262 | 29,165 | 20,934,208 | 8,039,016 |
(3) 당분기 및 전분기의 금융상품 범주별 순손익 정보는 다음과 같습니다.
| (단위: 천원) | ||
| 구분 | 당분기 | 전분기 |
| 상각후원가측정금융자산 | ||
| 이자수익 | 215,245 | 275,359 |
| 외환차익 | - | 175,467 |
| 외화환산이익 | - | 303,988 |
| 외화환산손실 | (7,839) | - |
| 상각후원가측정 금융부채 | ||
| 이자비용 | (653,427) | (586,281) |
| 외환차손 | (24,577) | (14,328) |
| 외화환산손실 | (6,544) | (1,448) |
| 외환차익 | 2,633 | 75 |
7. 현금및현금성자산 및 단기금융상품
(1) 당분기말과 전기말 현재 현금및현금성자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||
| 구분 | 당분기말 | 전기말 |
| 보통예금 | 2,245,700 | 3,981,677 |
(2) 당분기말과 전기말 현재 단기금융상품의 내역은 다음과 같습니다.
| (단위: 천원) | ||
| 구분 | 당분기말 | 전기말 |
| 정기예적금 | 25,000,000 | 26,364,518 |
8. 기타투자자산
당분기말과 전기말 현재 당사의 기타투자자산 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기말 | 전기말 |
| 기타포괄손익공정가치측정금융자산 | 2,619,454 | 2,619,454 |
9. 매출채권 및 계약자산
(1) 당분기말과 전기말 현재 매출채권 및 계약자산 내역은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당분기말 | 전기말 | ||
| 매출채권 | 계약자산 | 매출채권 | 계약자산 | |
| 총 장부금액 | 1,216,482 | - | 1,219,385 | - |
| 손실충당금 | (118,593) | - | (118,593) | - |
| 순 장부금액 | 1,097,889 | - | 1,100,792 | - |
(2) 당분기 및 전분기의 매출채권과 계약자산의 손실충당금 변동내역은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당분기 | 전분기 | ||
| 매출채권 | 계약자산 | 매출채권 | 계약자산 | |
| 기초금액 | 118,593 | - | - | - |
| 대손상각비(환입) | - | - | - | - |
| 제각 | - | - | - | - |
| 기타변동 | - | - | - | - |
| 기말금액 | 118,593 | - | - | - |
10. 유형자산
(1) 당분기 및 전분기의 유형자산 변동 내역은 다음과 같습니다.
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 당분기 | 기초 | 취득 | 처분 | 감가상각비 | 기말 |
| 토지 | 19,010,040 | - | - | - | 19,010,040 |
| 건물 | 2,912,282 | - | - | (19,546) | 2,892,736 |
| 기계장치 | 927,426 | - | - | (87,168) | 840,258 |
| (정부보조금) | (1,650) | - | - | 455 | (1,195) |
| 비품 | 138,499 | 1,078 | - | (13,765) | 125,812 |
| 합계 | 22,986,597 | 1,078 | - | (120,024) | 22,867,651 |
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 전분기 | 기초 | 취득 | 처분 | 감가상각비 | 기말 |
| 토지 | 16,379,631 | - | - | - | 16,379,631 |
| 건물 | 2,988,824 | - | - | (17,905) | 2,970,919 |
| 기계장치 | 1,076,219 | 23,038 | - | (95,197) | 1,004,060 |
| (정부보조금) | (4,055) | - | - | 882 | (3,173) |
| 비품 | 189,252 | - | - | (15,055) | 174,197 |
| 리스개량자산 | 665 | - | (665) | - | - |
| 합계 | 20,630,536 | 23,038 | (665) | (127,275) | 20,525,634 |
(2) 당분기말 현재 유형자산 담보제공내역은 다음과 같습니다.
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 담보설정금액 | 관련 계정과목 | 관련 차입금 | 담보권자 |
| 토지 | 19,010,040 | 9,600,000 | 차입금 (주석13) |
8,000,000 | 하나은행 |
| 건물 | 2,892,736 | ||||
(3) 유형자산 재평가 모형
가. 당사는 토지의 인식시점 이후의 측정과 관련하여 재평가모형을 선택적용 하였습니다. 토지의 공정가치를 결정하기 위해 회사는 공인된 독립적인 감정평가법인에 평가를 의뢰하였으며, 재평가내역은 다음과 같습니다.
| 구분 | 내역 |
|---|---|
| 재평가자산 | 토지 |
| 재평가기준일 | 2024년 12월 31일 |
| 공정가치 결정방법 | 감정평가에 관한 규칙 제 14조에 따라 주된 방법인 공시지가기준법에 의한 시산가액 산출 후 다른 감정평가방식에 속한 거래사례비교법에 의한 시산가액과 비교하여 합리성을 검토함 |
나. 재평가된 유형자산이 원가모형으로 평가되었을 경우의 장부금액 및 재평가모형과의 차이내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 토지 | |
| 당분기말 | 전기말 | |
| 원가 | 16,379,631 | 16,379,631 |
| 원가모형 순장부금액 | 16,379,631 | 16,379,631 |
| 재평가모형 순장부금액 | 19,010,040 | 19,010,040 |
| 재평가잉여금 | 2,630,409 | 2,630,409 |
다. 재평가로 인한 기타포괄손익누계액의 변동내역은 다음과 같습니다.
| (단위: 천원) | |||
|---|---|---|---|
| 구분 | 기초 | 증감 | 기말 |
| 재평가차액 | 2,630,409 | - | 2,630,409 |
| 법인세효과 | 260,410 | - | 260,410 |
| 기타포괄손익 인식액 | 2,369,999 | - | 2,369,999 |
11. 무형자산
당분기 및 전분기의 무형자산 변동 내역은 다음과 같습니다.
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 당분기 | 기초 | 취득 | 상각비 | 대체(*) | 기말 |
| 특허권 | 285,485 | - | (13,646) | 22,096 | 293,935 |
| 전용실시권 | 19,536 | - | (1,456) | - | 18,080 |
| 소프트웨어 | 17,059 | - | (1,995) | - | 15,064 |
| 상표권 | 1,996 | - | (461) | - | 1,535 |
| 회원권 | 68,000 | - | - | - | 68,000 |
| 합계 | 392,076 | - | (17,558) | 22,096 | 396,614 |
(*) 장기선급금에서 대체된 금액입니다.
| (단위: 천원) | |||||
| 전분기 | 기초 | 취득 | 상각비 | 대체 | 기말 |
| 특허권 | 141,057 | - | (8,615) | - | 132,442 |
| 전용실시권 | 88,020 | - | (10,463) | - | 77,557 |
| 소프트웨어 | 26,149 | - | (2,767) | - | 23,382 |
| 상표권 | 3,839 | - | (461) | - | 3,378 |
| 회원권 | 68,000 | - | - | - | 68,000 |
| 합계 | 327,065 | - | (22,306) | - | 304,759 |
12. 리스
당사가 리스이용자인 경우의 리스에 대한 정보는 다음과 같습니다.
(1) 당분기 및 전분기의 사용권자산 변동 내역은 다음과 같습니다.
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 당분기 | 기초 | 취득 | 처분 | 감가상각비 | 기말 |
| 차량운반구 | 92,396 | - | - | (14,786) | 77,610 |
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 전분기 | 기초 | 취득 | 처분 | 감가상각비 | 기말 |
| 차량운반구 | 195,474 | - | (43,540) | (15,181) | 136,753 |
(2) 재무상태표에 인식된 금액
당분기말 및 전기말 현재 리스와 관련해 재무상태표에인식된 금액은 다음과 같습니다.
| (단위: 천원) | ||
| 구분 | 당분기말 | 전기말 |
| 사용권자산 | ||
| 차량운반구 | 77,610 | 92,396 |
| (단위: 천원) | ||
| 구분 | 당분기말 | 전기말 |
| 리스부채 | ||
| 유동 | 53,795 | 58,977 |
| 비유동 | 29,165 | 39,016 |
| 합계 | 82,960 | 97,993 |
당분기 및 전분기 중 증가된 사용권자산은 없습니다.
(3) 포괄손익계산서에 인식된 금액
당분기 및 전분기 중 리스와 관련해서 포괄손익계산서에 인식된 금액은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 사용권자산의 감가상각비 | ||
| 차량운반구 | 14,786 | 15,181 |
| 합계 | 14,786 | 15,181 |
| 리스부채에 대한 이자비용 | 1,206 | 1,972 |
| 단기리스가 아닌 소액자산리스료 | 4,101 | 3,193 |
당분기 및 전분기 중 선급리스료를 포함한 리스의 총 현금유출은 각각 20,340천원 및 16,609천원입니다.
13. 차입금
(1) 당분기말과 전기말 현재 당사의 차입금의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기말 | 전기말 |
| 유동항목 | ||
| 유동성장기차입금 | 8,000,000 | - |
| 비유동항목 | ||
| 장기차입금 | - | 8,000,000 |
상기 차입금과 관련하여 유형자산이 담보로 제공되어 있습니다(주석10 참조).
(2) 당분기말과 전기말 현재 차입금의 상세내역은 다음과 같습니다.
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 차입처 | 만기일 | 연이자율 | 당분기말 | 전기말 |
| 장기차입금 | |||||
| 원화대출 | 하나은행 | 2026-01-29 | CD(3M) + 1.42% | 8,000,000 | 8,000,000 |
| 차감: 유동성장기차입금 | (8,000,000) | - | |||
| 차감 후 잔액 | - | 8,000,000 | |||
(3) 당분기말 현재 차입금의 상환일정은 다음과 같습니다.
| (단위: 천원) | |
|---|---|
| 상환연도 | 상환금액 |
| 1년 이내 | 8,000,000 |
14. 전환사채
(1) 당분기말과 전기말 현재 전환사채의 내역은 다음과 같습니다.
| (단위 : 천원) | ||||||
|---|---|---|---|---|---|---|
| 종 류 | 발행일 | 만기일 | 액면이자율 | 보장수익률 | 당분기말 | 전기말 |
| 제1회차 무기명식 무보증 사모 전환사채 |
2023-06-28 | 2028-06-28 | 0.0% | 3.0% | 19,300,000 | 20,000,000 |
| 사채상환할증금 | 3,110,852 | 3,223,680 | ||||
| 전환권조정 | (9,998,051) | (10,925,107) | ||||
| 가감 계 | 12,412,801 | 12,298,573 | ||||
(2) 당분기말 현재 발행된 전환사채의 발행조건은 다음과 같습니다.
| 구분 | 내역 |
|---|---|
| 종류 | 제1회차 무기명식 무보증 사모 전환사채 |
| 사채의 권면총액(*1) | 19,300,000천원 |
| 사채의 발행가액 | 사채권면금액의 100% |
| 발행일 | 2023년 06월 28일 |
| 만기일 | 2028년 06월 28일 |
| 표면이자율 | 연 0.0% |
| 만기보장수익률 | 연 3.0% |
| 이자지급조건 및 기한 | 표면이자율이 0%로 별도의 이자지급기일 없음 |
| 원금상환방법 | 만기까지 보유하고 있는 "본 사채"의 전자등록금액에 대하여는 만기일에 전자등록금액의 116.1184%에 해당하는 금액을 일시 상환함 |
| 전환가격의 조정 | 시가를 하회하는 가격으로 주식 등을 발행하는 경우, 전환가격을 조정함 |
| 옵션에 관한 사항 | 1. 조기상환청구권(Put Option)에 관한 사항 발행일로부터 24개월이 되는 날 및 이후 매3개월에 해당되는 날에 원금의 전부 또는 일부를 조기상환 할 것을 청구할 수 있다. 2. 매도청구권(Call Option)에 관한 사항 발행일로부터 12개월이 되는 날로부터 24개월이 되는날까지 매3개월이 되는 날마다 전환사채 액면금액의 20%인 40억원까지 발행회사 또는 발행회사가 지정하는 제3자에게 매도하도록 청구할 수 있다. |
| 전환조건 | (1) 전환가격(*2) : 7,397 원 |
| (2) 전환청구기간 : 2024년 6월 28일부터 2028년 6월 28일까지 | |
| (3) 전환비율 : 100% | |
| (4) 전환대상 유가증권 : 주식회사 큐라클 기명식 보통주 |
(*1) 최초 발행금액은 20,000,000천원이었으나, 당기 중 전환권 행사로 700,000천원은 보통주로 전환되었습니다.
(*2) 전기 중 행사(전환)가액이 조정되었으며, 조정 후 행사(전환)가액입니다.
(3) 당분기말과 전기말 현재 전환사채 발행과 관련하여 인식한 파생상품 내역은 다음과 같습니다.
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 파생상품자산 | - | 502,154 | - | 502,154 |
| 파생상품부채 | 7,709,642 | - | 7,989,267 | - |
당사는 전환사채 발행과 관련하여 약정된 매도청구권(발행자의 콜옵션)과 조기상환청구권(사채권자의 풋옵션)을 해당 전환사채의 최초 발행시점에 별도의 파생상품으로 보아 각각 파생상품자산 및 파생상품부채로 인식하였습니다.
(4) 당사가 발행한 전환사채에 시가하락에 따른 전환가액 조정약정이 존재하지만, 금융감독원 질의회신 '회제이-00094'에 의거하여 전환권대가를 자본으로 인식하였으며, 동 회계처리는 '주식회사 등의 외부감사에 관한 법률' 제 13조 제1항 제 1호의 한국채택국제회계기준에 한하여 효력이 있습니다.
15. 퇴직급여
(1) 당분기 및 전분기의 포괄손익계산서에 반영된 금액은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 당기근무원가 | 100,194 | 68,974 |
| 순이자원가(수익) | (9,930) | (8,102) |
| 종업원급여에 포함된 총 비용 | 90,264 | 60,872 |
(2) 당분기말 및 전기말 현재 순확정급여부채(자산) 금액의 산정내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기말 | 전기말 |
| 확정급여채무의 현재가치 | 1,202,197 | 1,102,004 |
| 사외적립자산의 공정가치 | (1,059,544) | (1,052,883) |
| 재무상태표상 순확정급여부채(자산)(*) | 142,653 | 49,121 |
(*) 확정급여채무를 초과하는 사외적립자산의 장부금액은 순확정급여자산으로 분류하였습니다.
16. 기타자산 및 기타부채
당분기말 및 전기말 현재 기타자산 및 기타부채 내역은 아래와 같습니다.
| (단위: 천원) | ||||
| 구분 | 당분기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 기타자산 | ||||
| 선급금 | - | 230,048 | 180 | 230,853 |
| 선급비용 | 208,623 | 37,445 | 118,846 | 40,030 |
| 당기법인세자산 | 268,530 | - | 160,529 | - |
| 부가세대급금 | 187,932 | - | 107,497 | - |
| 합계 | 665,085 | 267,493 | 387,052 | 270,883 |
| 기타부채 | ||||
| 예수금 | 322 | - | 52,276 | - |
17. 법인세비용 및 이연법인세
법인세비용은 당기법인세비용에서 과거기간 당기법인세에 대하여 당기에 인식한 조정사항, 일시적차이의 발생과 소멸로 인한 이연법인세비용(수익) 및 당기손익 이외로인식되는 항목과 관련된 법인세비용을 조정하여 산출하였습니다. 당분기 및 전분기는 법인세비용이 존재하지 않습니다.
18. 자본금과 자본잉여금
(1) 당사가 발행할 주식의 총수는 50,000,000주이고, 발행한 주식수는 보통주식 13,968,599주(전기말: 13,873,968주)이며 1주당 액면금액은 500원입니다.
(2) 당분기 및 전기 중 자본금 및 자본잉여금의 변동은 다음과 같습니다.
| (단위: 주, 천원) | |||
|---|---|---|---|
| 구분 | 주식수 | 자본금 | 주식발행초과금 |
| 전분기초 | 13,855,342 | 6,927,671 | 101,359,652 |
| 2024-05-20 주식선택권 행사 | 18,626 | 9,313 | 194,502 |
| 전기말 | 13,873,968 | 6,936,984 | 101,554,154 |
| 당분기초 | 13,873,968 | 6,936,984 | 101,554,154 |
| 2025-02-24 전환권 행사 | 67,594 | 33,797 | 618,666 |
| 2025-02-25 전환권 행사 | 27,037 | 13,519 | 247,526 |
| 당분기말 | 13,968,599 | 6,984,300 | 102,420,346 |
19. 기타자본구성요소 및 기타포괄손익누계액
(1) 당분기말과 전기말 현재 기타자본구성요소의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기말 | 전기말 |
| 주식선택권 | 4,826,449 | 4,797,777 |
| 전환권대가 | 5,348,586 | 5,542,576 |
| 합계 | 10,175,035 | 10,340,353 |
(2) 당분기말과 전기말 현재 기타포괄손익누계액의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기말 | 전기말 |
| 재평가잉여금 | 2,369,999 | 2,369,999 |
20. 결손금
당분기말과 전기말 현재 결손금의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기말 | 전기말 |
| 미처리결손금 | (95,374,327) | (91,248,154) |
21. 주식기준보상
(1) 당사는 주주총회 결의에 의거하여 당사의 임직원에게 주식선택권을 부여하였으며, 당분기말 현재 그 주요 내용은 다음과 같습니다.
| (단위: 주, 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 부여방법 | 잔여 부여수량(*) |
가득기간 | 만기일 | 행사가격(*) | 부여일 공정가치(*) |
| 3-1차 - 2019년 6월 30일 부여 | 주식교부형 | 20,000 | 2.0년 | 2026-07-13 | 3,384 | 4,782 |
| 4차 - 2020년 3월 31일 부여 | 주식교부형 | 10,000 | 2.0년 | 2027-04-01 | 6,200 | 4,793 |
| 5-1차 - 2021년 1월 5일 부여 | 주식교부형 | 20,000 | 2.0년 | 2028-01-05 | 7,750 | 11,061 |
| 5-2차 - 2021년 1월 5일 부여 | 주식교부형 | 10,000 | 2.0년 | 2028-01-05 | 10,720 | 10,669 |
| 6-1차 - 2021년 3월 29일 부여 | 주식교부형 | 100,000 | 2.0년 | 2028-03-29 | 8,500 | 10,700 |
| 6-2차 - 2021년 3월 29일 부여 | 주식교부형 | 4,000 | 2.0년 | 2028-03-29 | 10,720 | 10,376 |
| 7차 - 2022년 3월 30일 부여 | 주식교부형 | 135,000 | 2.0년 | 2029-03-29 | 21,500 | 18,999 |
| 8차 - 2022년 11월 16일 부여 | 주식교부형 | 45,000 | 2.0년 | 2029-11-15 | 12,700 | 9,985 |
| 9차 - 2023년 3월 30일 부여 | 주식교부형 | 30,000 | 2.0년 | 2030-03-29 | 11,100 | 7,646 |
(*) 당사는 2020년 12월 12일 100% 무상증자를 실시함에 따라 주식선택권 부여수량, 행사가격 및 부여일 공정가치를 조정하였습니다.
종업원 주식선택권은 행사시점에 당사의 주식으로 전환되며, 종업원이 주식선택권을부여받을 때 지급하였거나 지급할 금액은 없습니다. 주식선택권은 배당에 대한 권리나 의결권을 가지지 않으며, 가득일로부터 만기일까지의 기간 동안 행사될 수 있습니다.
(2) 당분기와 전기 중 주식선택권의 변동은 다음과 같습니다.
| (단위: 주) | ||
|---|---|---|
| 구분 | 당분기 | 전기 |
| 기초 잔여주식 | 374,000 | 392,626 |
| 기중 부여수량 | - | - |
| 기중 권리상실분 | - | - |
| 기중 행사분 | - | (18,626) |
| 기말 잔여주식 | 374,000 | 374,000 |
당분기말 현재 유효한 주식선택권의 가중평균 잔여만기는 3.58년이며, 가중평균 행사가격은 13,614원입니다.
(3) 당사는 부여된 주식선택권의 보상원가를 이항모형을 이용한 공정가치접근법을 적용하여 산정했으며, 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| 구분 | 3-1차 | 4차 | 5-1차 | 5-2차 | 6-1차 | 6-2차 | 7차 | 8차 | 9차 |
|---|---|---|---|---|---|---|---|---|---|
| 주식선택권 공정가치 | 4,782원 | 4,793원 | 11,061원 | 10,669원 | 10,700원 | 10,376원 | 18,999원 | 9,985원 | 7,646원 |
| 주가 | 7,172원 | 7,514원 | 13,218원 | 13,218원 | 13,218원 | 13,218원 | 24,200원 | 12,900원 | 10,620원 |
| 무위험이자율 | 1.54% | 1.22% | 1.50% | 1.50% | 1.73% | 1.73% | 2.90% | 3.84% | 3.26% |
| 연환산 예상주가변동성 | 43.82% | 61.79% | 91.25% | 91.25% | 85.88% | 85.88% | 86.26% | 85.15% | 77.26% |
(4) 당분기 및 전분기 비용으로 인식된 주식기준보상은 각각 28,672천원 및 401,109천원이며, 전액 주식결제형 주식기준보상과 관련된 비용입니다.
22. 영업수익
(1) 수익의 구성
전기 중 당사의 영업수익은 프랑스 소재 기업인 Thea Open Innovation과 체결한 기술이전계약에서 발생하였습니다.
(2) 당분기 및 전분기의 영업수익 인식 시기에 대한 구분은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 기간에 걸쳐 이행 | - | 499,871 |
(3) 당분기 및 전기 중 당사가 고객과의 계약과 관련하여 인식한 자산, 부채는 다음과 같습니다.
① 당분기
해당사항 없음
② 전기
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 증가 | 감소 | 기말 |
| 계약자산 | 2,854,051 | 1,645,100 | 4,499,151 | - |
(4) 당분기 및 전분기 중 영업수익의 10%이상을 차지하는 주요 고객은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| Thea Open Innovation | - | 499,871 |
23. 영업비용
당분기 및 전분기의 영업비용 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 종업원 급여 | 916,371 | 962,499 |
| 퇴직급여 | 90,263 | 60,873 |
| 복리후생비 | 53,013 | 53,511 |
| 주식보상비용 | 28,672 | 401,109 |
| 여비교통비 | 28,856 | 79,395 |
| 접대비 | 22,899 | 32,855 |
| 세금과공과 | 70,717 | 68,473 |
| 감가상각비 | 120,024 | 127,275 |
| 사용권자산상각비 | 14,786 | 15,181 |
| 지급임차료 | 4,101 | 3,193 |
| 보험료 | 5,793 | 5,722 |
| 차량유지비 | 4,465 | 3,336 |
| 소모품비 | 86,871 | 193,389 |
| 지급수수료 | 304,420 | 262,045 |
| 광고선전비 | 29,311 | 33,282 |
| 건물관리비 | 29,529 | 27,126 |
| 무형자산상각비 | 17,558 | 22,307 |
| 위탁용역연구비 | 1,768,609 | 1,153,144 |
| 전력비 | 20,639 | 19,331 |
| 기타 | 31,709 | 31,524 |
| 합계 | 3,648,606 | 3,555,570 |
24. 기타수익 및 기타비용
당분기 및 전분기의 기타수익 및 기타비용 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 기타수익 | ||
| 잡이익 | 244 | 13,553 |
| 기타비용 | ||
| 유형자산처분손실 | - | 6,032 |
| 잡손실 | 32 | 18 |
| 합계 | 32 | 6,050 |
25. 금융수익 및 금융비용
당분기 및 전분기의 금융수익 및 금융비용 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 금융수익 | ||
| 이자수익 | 215,245 | 275,359 |
| 외화환산이익 | - | 303,988 |
| 외환차익 | 2,633 | 175,542 |
| 합계 | 217,878 | 754,889 |
| 금융비용 | ||
| 이자비용 | 653,427 | 586,282 |
| 외화환산손실 | 14,383 | 1,448 |
| 외환차손 | 24,577 | 14,327 |
| 합계 | 692,387 | 602,057 |
26. 주당순손실
기본주당순손실은 당사의 보통주당기순손실을 해당 기간의 가중평균유통보통주식수로 나누어 산정하였습니다.
(1) 보통주당기순손실
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 분기순손실 | (4,122,903) | (2,895,362) |
| 가중평균유통보통주식수(*) | 13,911,520 | 13,855,342 |
| 기본주당순손실 | (296) | (209) |
(*) 당분기 및 전분기 중 가중평균유통보통주식수의 산정내역은 다음과 같습니다.
① 당분기
| (단위: 주) | ||||
|---|---|---|---|---|
| 구분 | 기준일 | 유통보통주식수 | 누적 | |
| 가중치(일) | 가중평균 유통보통주식수 |
|||
| 당분기초 | 2025-01-01 | 13,873,968 | 90/90 | 13,873,968 |
| 2025-02-24 전환권 행사 | 2025-02-24 | 67,594 | 36/90 | 27,038 |
| 2025-02-25 전환권 행사 | 2025-02-25 | 27,037 | 35/90 | 10,514 |
| 합계 | 13,968,599 | 13,911,520 | ||
② 전분기
| (단위: 주) | ||||
|---|---|---|---|---|
| 구분 | 기준일 | 유통보통주식수 | 누적 | |
| 가중치(일) | 가중평균 유통보통주식수 |
|||
| 전분기초 | 2024-01-01 | 13,855,342 | 91/91 | 13,855,342 |
| 합계 | 13,855,342 | 13,855,342 | ||
(2) 희석주당순손실
당분기 및 전분기 손실발생으로 인하여 희석효과가 없습니다. 따라서 희석주당손익은 기본주당손익과 동일합니다. 잠재적으로 미래의 기본주당이익을 희석할 수 있는 항목은 다음과 같습니다.
| (단위: 주) | ||
|---|---|---|
| 구분 | 당분기말 | 전기말 |
| 주식선택권 | 374,000 | 374,000 |
| 전환사채 | 2,609,167 | 2,703,798 |
27. 현금흐름표
(1) 보고기간 중 영업활동으로부터 창출된 현금흐름은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 분기순손실 | (4,122,903) | (2,895,362) |
| 조정 | 723,868 | 639,711 |
| 감가상각비 | 120,024 | 127,275 |
| 사용권자산상각비 | 14,786 | 15,181 |
| 무형자산상각비 | 17,558 | 22,307 |
| 퇴직급여 | 90,263 | 60,873 |
| 이자비용 | 653,427 | 586,281 |
| 주식보상비용 | 28,672 | 401,109 |
| 유형자산처분손실 | - | 6,032 |
| 이자수익 | (215,245) | (275,359) |
| 외화환산이익 | - | (303,988) |
| 영업활동으로 인한 자산 부채의 변동 | (155,334) | 125,587 |
| 매출채권 | - | 2,641,045 |
| 미수금 | 9,180 | (193) |
| 계약자산 | - | (512,421) |
| 선급금 | 180 | 134 |
| 선급비용 | (89,777) | (88,522) |
| 부가세대급금 | (80,435) | - |
| 장기선급금 | - | (14,334) |
| 장기선급비용 | 2,585 | - |
| 당기법인세자산 | - | (91,509) |
| 예수금 | (51,955) | (10,732) |
| 미지급금 | 283,025 | (943,382) |
| 미지급비용 | (228,137) | (474,152) |
| 퇴직금의 지급 | - | (242,305) |
| 사외적립자산 | - | (138,042) |
| 영업활동으로부터 창출된 현금흐름 | (3,554,369) | (2,130,064) |
(2) 현금의 유출ㆍ입이 없는 거래 중 중요한 사항은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 전환권 행사로 인한 자본 대체 | 2,587 | - |
| 장기선급금의 무형자산 대체 | 22,096 | - |
| 사외적립자산의 대체 | - | 62,636 |
| 장기차입금의 유동성 대체 | 8,000,000 | - |
(3) 재무활동에서 생기는 자산 및 부채의 조정내용은 다음과 같습니다.
| (단위: 천원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구분 | 재무활동으로 인한 부채 | 재무활동으로 인한 자산 |
합계 | |||||
| 전환사채 | 파생상품 금융부채 |
유동성 장기차입금 |
장기차입금 | 리스부채 | 소계 | 파생상품 금융자산 |
||
| 당기초 순부채(자산) | 12,298,573 | 7,989,267 | - | 8,000,000 | 97,993 | 28,385,833 | (502,154) | 27,883,679 |
| 재무활동현금흐름 | - | - | - | - | (15,033) | (15,033) | - | (15,033) |
| 전환권 행사 | (442,480) | (279,625) | - | - | - | (722,105) | - | (722,105) |
| 기타변동 | 556,707 | - | 8,000,000 | (8,000,000) | - | 556,707 | - | 556,707 |
| 당분기말 순부채(자산) | 12,412,800 | 7,709,642 | 8,000,000 | - | 82,960 | 28,205,402 | (502,154) | 27,703,248 |
28. 우발부채와 약정사항
(1) 당분기말 현재 당사는 도시가스 사용료 납부와 관련하여 지급보증보험(부보금액: 4,200천원)을 가입하고 있습니다.
(2) 당분기말 현재 금융기관과 체결한 약정한도는 다음과 같습니다.
| (단위: 천원) | ||
| 구분 | 금융기관 | 약정한도 |
| 시설대출 | 하나은행 | 8,000,000 |
(3) 보고기한 종료일 현재 당사가 "원고"로 계류중인 국제중재 건은 1건이며, 현재로서 국제중재 건의 전망을 예측할 수 없습니다.
29. 연구개발관련 약정사항
(1) 당분기말 현재 당사가 타기관과 공동연구를 진행 중인 계약은 다음과 같습니다.
| 계약상대방 | 계약체결일 | 계약목적 | 대상물질 | 계약내용 |
| (주)맵틱스 | 2024-07-01 | 공동연구개발 | MT-101, MT-102, MT-103, MT-104, MT-105, MT-201, MT-202, MT-40X |
대상 물질에 대한 연구개발비용과 수익금은 약정비율로 부담 및 배분 |
(2) 당분기말 현재 당사가 진행중인 연구개발 현황 및 각 파이프라인별 개발 진행단계는 다음과 같습니다.
| 구분 | 품 목 | 적응증 | 연구시작일 | 현재 진행단계 | ||
|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | |||||
| 화학합성 | 신약 개발 | CU01 | 당뇨병성 신증 | 2016년 | 임상 2b상(한국) | 2022년 7월 |
| CU03 | 습성 황반변성 | 2016년 | 임상 2a상(한국) 종료 | 2019년 12월 | ||
| CU06 | 혈관손상과 관련된 다양한 질환 | 2017년 | 임상 2a상(미국) | 2022년 9월 | ||
| CU71 | 차세대 혈관내피기능장애차단제 | 2023년 | 유효물질 탐색 중 | - | ||
| CP01-R01 | 반려동물 만성신장질환 | 2023년 | 임상 3상(한국) (*1) | 2025년 1월 | ||
(*1) 농림축산검역본부의 승인을 받아 수행하는 반려동물임상시험 입니다.
(3) 보고기간 중 파이프라인별로 발생한 경상연구개발비 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| CU01 | 234,652 | 481,944 |
| CU03 | 108 | 89 |
| CU06 | 645,470 | 833,932 |
| CU07 | 964,172 | 43,601 |
| CP01-R01 | 6,892 | - |
| 기타공통비 | 841,805 | 903,346 |
| 합계 | 2,693,099 | 2,262,912 |
30. 특수관계자거래
(1) 당분기 및 전분기 중 특수관계자에 대한 수익 및 비용 거래 내역은 없습니다.
(2) 당분기말 및 전분기말 현재 특수관계자에 대한 채무 금액은 없습니다.
(3) 당분기 및 전분기 중 특수관계자에 대한 자금거래 내역은 없습니다.
(4) 주요 경영진에 대한 보상
주요 경영진은 등기 및 비등기임원에 해당하며, 종업원 용역의 대가로서 주요 경영진에게 지급됐거나 지급될 보상금액은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당분기 | 전분기 |
| 급여 및 기타 단기종업원 급여 | 480,574 | 509,481 |
| 퇴직 급여 | 54,050 | 26,038 |
| 주식기준보상 | 28,672 | 401,109 |
| 합 계 | 563,296 | 936,628 |
(5) 지급보증 및 담보제공 내역
당사가 특수관계자로부터 제공받거나 특수관계자에게 제공한 지급보증 및 담보제공 내역은 없습니다.
31. 보고기한 후 사건
당사는 (주)대성팜텍을 2025년 5월 14일에 흡수합병하기로 결정하였으나 양사 합의에 의해 합병기일을 2026년 1월 28일로 변경하였습니다.
6. 배당에 관한 사항
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2019.10.26 | 유상증자(제3자배정) | 우선주 | 258,065 | 500 | 15,500 | - |
| 2019.10.30 | 유상증자(제3자배정) | 우선주 | 109,678 | 500 | 15,500 | - |
| 2019.11.30 | 유상증자(제3자배정) | 우선주 | 129,032 | 500 | 15,500 | - |
| 2019.12.13 | 유상증자(제3자배정) | 우선주 | 64,516 | 500 | 15,500 | - |
| 2020.10.31 | 유상증자(제3자배정) | 보통주 | 149,213 | 500 | 26,800 | - |
| 2020.11.02 | 주식매수선택권행사 | 보통주 | 2,500 | 500 | 2,820 | - |
| 2020.11.02 | 주식매수선택권행사 | 보통주 | 96,000 | 500 | 500 | - |
| 2020.11.16 | 전환권행사 | 보통주 | 40,000 | 500 | - | 전환상환우선주 보통주전환 |
| 2020.12.01 | 전환권행사 | 보통주 | 40,000 | 500 | - | 전환상환우선주 보통주전환 |
| 2020.12.12 | 무상증자 | 보통주 | 3,872,993 | 500 | - | 1주당 1주 배정 |
| 2020.12.12 | 무상증자 | 우선주 | 1,784,991 | 500 | - | 1주당 1주 배정 |
| 2020.12.23 | 전환권행사 | 보통주 | 365,432 | 500 | - | 전환상환우선주 보통주전환 |
| 2020.12.24 | 전환권행사 | 보통주 | 1,229,474 | 500 | - | 전환상환우선주 보통주전환 |
| 2020.12.28 | 전환권행사 | 보통주 | 803,432 | 500 | - | 전환상환우선주 보통주전환 |
| 2020.12.29 | 전환권행사 | 보통주 | 548,148 | 500 | - | 전환상환우선주 보통주전환 |
| 2020.12.30 | 전환권행사 | 보통주 | 258,064 | 500 | - | 전환상환우선주 보통주전환 |
| 2021.01.07 | 전환권행사 | 보통주 | 365,432 | 500 | - | 전환상환우선주 보통주전환 |
| 2021.07.19 | 유상증자(일반공모) | 보통주 | 2,040,000 | 500 | 25,000 | 신규상장 |
| 2021.09.02 | 주식매수선택권행사 | 보통주 | 53,000 | 500 | 500 | - |
| 2021.09.02 | 주식매수선택권행사 | 보통주 | 154,000 | 500 | 3,384 | - |
| 2021.09.02 | 주식매수선택권행사 | 보통주 | 20,000 | 500 | 1,410 | - |
| 2021.12.06 | 주식매수선택권행사 | 보통주 | 11,000 | 500 | 500 | - |
| 2021.12.06 | 주식매수선택권행사 | 보통주 | 43,500 | 500 | 3,384 | - |
| 2021.12.06 | 주식매수선택권행사 | 보통주 | 50,000 | 500 | 500 | - |
| 2022.04.11 | 주식매수선택권행사 | 보통주 | 30,500 | 500 | 3,384 | - |
| 2022.04.11 | 주식매수선택권행사 | 보통주 | 68,000 | 500 | 6,200 | - |
| 2022.06.17 | 주식매수선택권행사 | 보통주 | 4,000 | 500 | 6,200 | - |
| 2022.11.30 | 주식매수선택권행사 | 보통주 | 56,000 | 500 | 3,384 | - |
| 2023.01.13 | 주식매수선택권행사 | 보통주 | 2,000 | 500 | 6,200 | - |
| 2023.06.14 | 주식매수선택권행사 | 보통주 | 7,374 | 500 | 6,200 | - |
| 2024.05.20 | 주식매수선택권행사 | 보통주 | 18,626 | 500 | 6,200 | - |
| 2025.02.24 | 전환권행사 | 보통주 | 67,594 | 500 | 7,397 | 전환사채 보통주전환 |
| 2025.02.25 | 전환권행사 | 보통주 | 27,037 | 500 | 7,397 | 전환사채 보통주전환 |
미상환 전환사채 발행현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 | 1회차 | 2023.06.28 | 2028.06.28 | 20,000,000,000 | 보통주 | 24.06.28~28.05.28 | 100 | 7,397 | 19,300,000,000 | 2,609,165 | 주1 |
| 합 계 | - | - | - | 20,000,000,000 | - | - | 100 | 7,397 | 19,300,000,000 | 2,609,165 | - |
주1) Put Option에 관한 사항: 본 사채의 사채권자는 본 사채의 발행일로부터 24개월이 되는 2025년 06월 28일 및 이후 매 3개월에 해당되는 날(이하"조기상환일"이라 한다.)에 조기상환청구 전자등록금액의 원금에 해당하는 금액의 전부 또는 일부를 조기상환율에 따라 조기상환을 청구할 수 있다. 단, 조기상환지급일이 영업일이 아닌 경우에는 그 다음 영업일에 상환하고 조기상환지급일 이후의 이자는 계산하지 아니한다.
- 2025.02.24 보통주전환 67,594주 (권면금액: 500,000,000원)
- 2025.02.25 보통주전환 27,037주 (권면금액: 200,000,000원)
| [채무증권의 발행 등과 관련된 사항] |
채무증권 발행실적
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
|
주식회사 큐라클 |
회사채 | 사모 | 2023년 06월 28일 |
20,000,000,000 |
표면:0% 만기:3% |
- |
2028년 06월 28일 |
N |
NH투자증권 |
| 합 계 | - | - | - | 20,000,000,000 | - | - | - | - | - |
주1) 2023.06.28 제 1회차 무기명식 이권부 무보증 사모 전환사채
기업어음증권 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
| 사모 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
| 합계 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
단기사채 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 |
- |
- |
- |
- |
- |
- |
- |
- |
| 사모 |
- |
- |
- |
- |
- |
- |
- |
- |
|
| 합계 |
- |
- |
- |
- |
- |
- |
- |
- |
|
회사채 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 |
- |
- |
- |
- |
- |
- |
- |
- |
| 사모 | - | - |
- |
19,300,000,000 |
- |
- |
- |
19,300,000,000 | |
| 합계 | - | - |
- |
19,300,000,000 |
- |
- |
- |
19,300,000,000 | |
신종자본증권 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 |
- |
- |
- |
- |
- |
- |
- |
- |
| 사모 |
- |
- |
- |
- |
- |
- |
- |
- |
|
| 합계 |
- |
- |
- |
- |
- |
- |
- |
- |
|
조건부자본증권 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
| 사모 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
| 합계 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
1. 공모자금의 사용내역
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 코스닥시장 상장 | - | 2021.07.16 | 시설자금 | 11,082 | 시설자금 | 11,082 | (주1) |
| 코스닥시장 상장 | - | 2021.07.16 | 연구개발자금 | 37,028 | 연구개발자금 | 37,028 | - |
(주1) 증권신고서 제출 당시 기재한 자금사용 계획에 따라 유형자산 취득(수수료 및 세금등 부대비용 포함)을 위해 동 자금을 사용하였습니다.
2. 사모자금의 사용내역
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 유상증자 | 1회 | 2018.07.14 | 운영자금 |
1,000 |
운영 및 연구개발자금 |
1,000 |
- |
| 유상증자 | 2회 | 2018.07.18 | 운영자금 | 1,000 | 운영 및 연구개발자금 | 1,000 | - |
| 유상증자 | 3회 | 2018.08.29 | 운영자금 |
1,030 |
운영 및 연구개발자금 |
1,030 |
- |
| 유상증자 | 4회 | 2018.09.21 | 운영자금 |
2,000 |
운영 및 연구개발자금 |
2,000 |
- |
| 유상증자 | 5회 | 2018.10.06 | 운영자금 |
3,500 |
운영 및 연구개발자금 |
3,500 |
- |
| 유상증자 | 6회 | 2018.10.27 | 운영자금 |
1,000 |
운영 및 연구개발자금 |
1,000 |
- |
| 유상증자 | 7회 | 2018.11.30 | 운영자금 |
1,500 |
운영 및 연구개발자금 |
1,500 |
- |
| 유상증자 | 8회 | 2019.10.26 | 운영자금 |
4,000 |
운영 및 연구개발자금 |
4,000 |
- |
| 유상증자 | 9회 | 2019.10.30 | 운영자금 |
1,700 |
운영 및 연구개발자금 |
1,700 |
- |
| 유상증자 | 10회 | 2019.11.30 | 운영자금 |
2,000 |
운영 및 연구개발자금 |
2,000 |
- |
| 유상증자 | 11회 | 2019.12.13 | 운영자금 |
1,000 |
운영 및 연구개발자금 |
1,000 |
- |
| 유상증자 | 12회 | 2020.10.31 | 운영자금 |
3,999 |
운영 및 연구개발자금 |
3,999 |
- |
| 유상증자 | 13회 | 2020.11.02 | 운영자금 | 55 | 운영 및 연구개발자금 | 55 | - |
| 전환사채 | 1회 | 2023.06.28 | 운영자금 | 20,000 | 오픈 이노베이션, 혁신신약 임상연구 등 연구개발비 투자 | 4,665 | - |
3. 미사용자금의 운용내역
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 정기예금 (하나은행) | 3,000 | 2025년 02월 ~ 2025년 05월 | 2개월 |
| 예ㆍ적금 | 정기예금 (우리은행) | 4,000 | 2025년 02월 ~ 2025년 05월 | 2개월 |
| 예ㆍ적금 | 정기예금 (NH증권) | 8,000 | 2025년 02월 ~ 2025년 05월 | 2개월 |
| 예ㆍ적금 | 보통예금 (우리은행) | 256 | - | - |
| 예ㆍ적금 | 보통예금 (하나은행) | 42 | - | - |
| 예ㆍ적금 | 보통예금 (기업은행) | 37 | - | - |
| 계 | 15,335 | - | ||
8. 기타 재무에 관한 사항
해당사항 없음.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
2. 내부통제에 관한 사항
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
2. 감사제도에 관한 사항
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
3. 주주총회 등에 관한 사항
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
VI. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 증권신고서 제출 전일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 권영근 | 최대주주 | 보통주 | 1,809,047 | 13.04 | 1,809,047 | 12.91 | - |
| 김영명 | 등기임원 | 보통주 | 40,000 | 0.29 | 40,000 | 0.29 | - |
| 곽현정 | 미등기임원 | 보통주 | 50,000 | 0.36 | 50,000 | 0.36 | - |
| 표정인 | 미등기임원 | 보통주 | 10,000 | 0.07 | 10,000 | 0.07 | - |
| 황용 | 미등기임원 | 보통주 | 18,000 | 0.13 | 18,000 | 0.13 | - |
| 계 | 보통주 | 1,927,047 | 13.89 | 1,927,047 | 13.76 | - | |
| 우선주 | - | - | - | - | - | ||
주1) 기초 발행주식 총수는 13,873,968주 입니다.
주2) 기말 발행주식 총수는 13,968,599주 입니다.
2. 최대주주의 주요경력 및 개요
| 명 칭 | 직 책 | 학력 및 경력 |
|---|---|---|
| 권영근 | 이사회의장 |
State University of New York at Buffalo 생화학 박사 연세대 생명시스템대학 학장(전) 한국혈관학회 회장(전) 한국과학기술한림원 정회원(현) (주)큐라클 이사회의장('20.04~현재) |
3. 최대주주의 최대주주(법인 또는 단체)의 개요
당사는 설립이후 현재까지 최대주주 변동내역이 없습니다.
4. 주식 소유현황
| (기준일 : | 증권신고서 제출 전일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 권영근 | 1,809,047 | 12.91 | - |
| - | - | - | - | |
| 우리사주조합 | - | - | - | |
소액주주현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 29,184 | 29,192 | 99.97 | 10,274,200 | 13,968,599 | 73.55 | - |
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
1. 임원 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 유재현 | 남 | 1972.08 | 대표이사 | 사내이사 | 상근 | 총괄 |
서울대학교 제약학과 졸업 얀센북아시아 Specialty 사업부 총괄전무(전) 중국얀센 마케팅부 이사(전) 얀센아시아태평양 전략마케팅(전) ㈜큐라클 대표이사(현) |
- | - | - | 3년 5개월 | 2027.03.26 |
| 권영근 | 남 | 1964.04 | 이사회 의장 |
사내이사 | 상근 | 종합기술원 총괄 |
State University of New York at Buffalo 생화학 박사 한국혈관학회 회장(전) 한국과학기술한림원 정회원(현) (주)큐라클 이사회의장('20.04~현재) |
1,809,047 | - | 본인 | 8년 11개월 | 2027.03.26 |
| 김영명 | 남 | 1956.05 | 기타 비상무 이사 |
기타비상무이사 | 비상근 | 기타 비상무 이사 |
미국 Utah 주립대학교 생화학 박사 강원대학교 의과대학 명예교수/석좌교수('21.09~현재) |
40,000 | - | - | 6년 1개월 | 2028.03.30 |
| 추연성 | 남 | 1956.03 | 기타 비상무 이사 |
사외이사 | 비상근 | 기타 비상무 이사 |
미국 Univ Illinois at Chicago 약학 박사 LG생명과학 부사장 및 고문('00~'17) ㈜TSD라이프사이언스 ㈜진메디신, ㈜스탠다임 고문('18~'22) (주)스탠다임 대표이사('23~현재) (주)큐라클 기타비상무이사('20.03~현재) |
- | - | - | 5년 1개월 | 2027.03.28 |
| 최동훈 | 남 | 1963.06 | 사외 이사 |
사외이사 | 비상근 | 사외 이사 |
연세대학교 의학 박사 용인세브란스병원 병원장('19.03~‘22.07) 연세의료원 심장혈관병원 심장내과 교수(’22.08~현재) (주)큐라클 사외이사('21.01~현재) |
- | - | - | 4년 3개월 | 2027.03.26 |
| 조상헌 | 남 | 1959.12 | 사외 이사 |
사외이사 | 비상근 | 사외 이사 |
서울대학교 내과학 박사 서울대학교 내과학교실 교수('92~현재) 서울대학교병원 알레르기내과 전문의('93~현재) (주)큐라클 사외이사('21.11~현재) |
- | - | - | 3년 5개월 | 2027.03.26 |
| 송경호 | 남 | 1970.10 | 감사 | 감사 | 비상근 | 감사 |
서울대학교 사법학과 학사 서울북부지방법원 부장판사(‘21.02.~’23.02) 서울서부지방법원 부장판사(‘23.02.~’25.02) 법무법인(유한) 평산 대표변호사 ('25.02~현재) (주)큐라클 감사('25.03~현재) |
- | - | - | - | 2028.03.30 |
| 김정한 | 남 | 1974.04 | 상무 이사 |
미등기 | 상근 | 사업 개발 총괄 |
University of california,Berkeley, Marketing&Global business MBA 동화약품 BD, Global&ETC Marketing 총괄임원 ('12.12~'20.09) (주)큐라클 사업개발본부 본부장('21.04~현재) |
- | - | - | 4년 | - |
| 최재진 | 남 | 1969.02 | 상무 이사 |
미등기 | 상근 | 전략 기획 총괄 |
서강대학교 마케팅 석사 한독 Commercial Excellence 부서장 ('15.05~19.05) 아이큐비아코리아 Strategic Consultant ('20.12~21.12) (주)큐라클 상무이사 ('21.12~현재) |
- | - | - | 3년 4개월 | - |
| 이원일 | 남 | 1975.09 | 상무 이사 |
미등기 | 상근 | 신약&바이오 연구소 총괄 |
서울대학교 약학박사 C&C신약연구소 신약연구 책임연구원('01.01~'15.01) 젬백스앤카엘 연구개발 이사('15.02~'16.07) 제일약품 신약연구 책임연구원('16.08~'17.06) (주)대원제약 신약연구 이사('17.06~'22.07) (주)큐라클 신약연구본부 상무('22.08~현재) |
- | - | - | 2년 8개월 | - |
| 노응진 | 남 | 1974.09 | 상무 이사 |
미등기 | 상근 | 원료의약품 사업본부 총괄 |
서강대학교 경영학 석사 한국얀센 뉴로사이언스 영업 팀장('06~'11) 한국얀센 면역사업부, 항암제사업부 영업 본부장('12~'15) 한국얀센 피부면역사업부 영업마케팅 총괄 상무이사('16~'23) (주)큐라클 원료의약품사업본부 상무('25.03~현재) |
- | - | - | 1개월 | - |
| 곽현정 | 여 | 1971.01 | 이사 | 미등기 | 상근 | 전임상 후보물질 발굴 |
충남대학교 화학과 이학박사 (주)큐라클 전락기획실 이사('22.05~23.12) (주)큐라클 신약연구소 이사('24.01~현재) |
50,000 | - | - | 8년 1개월 | - |
| 표정인 | 남 | 1977.11 | 이사 | 미등기 | 상근 | 중앙 연구소 총괄 |
연세대학교 이학박사(의약화학) 한국과학기술연구원(KIST) 연구원('03.06~'14.12) 삼육대학교 특임교수/비전임('11.09~'14.07) iNtRON Biotechnology 신약연구 팀장('15.01~'17.07) (주)큐라클 연구개발본부 수석연구원('17.08~'20.11) (주)큐라클 연구개발본부 이사('20.12~현재) |
10,000 | - | - | 7년 8개월 | - |
| 황용 | 남 | 1971.08 | 이사 | 미등기 | 상근 | 경영 관리 총괄 |
서해대학교 경영학 학사 (주)네온테크 경영지원총괄('06.11~'19.06) (주)큐라클 경영관리본부 이사('19.07~현재) |
18,000 | - | - | 5년 9개월 | - |
| 김판경 | 여 | 1980.03 | 이사 | 미등기 | 상근 | 임상 개발 총괄 |
경북대학교 의학 석사 한미약품 임상팀장('14.05~'17.04) 현대약품 임상팀장('17.04~'19.03) 유영제약 임상팀장('20.06~'22.05) (주)큐라클 임상개발본부 이사('22.05~현재) |
- | - | - | 2년 11개월 | - |
2. 직원 등 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
|
연구/관리 |
남 |
19 |
- |
- |
- |
19 |
3.4 | 460 | 24 |
- |
- |
- |
- |
|
연구/관리 |
여 |
14 |
- |
- |
- |
14 |
3.7 | 261 | 19 |
- |
|||
| 합 계 |
33 |
- |
- |
- |
33 |
3.5 | 721 | 22 |
- |
||||
3. 미등기임원 보수 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 8 | 265 | 33 | - |
주1) 인원수는 보고서 작성기준일 현재 재직중인 미등기임원의 수입니다.
주2) 연간급여 총액은 2025년 1월 1일부터 보고서 작성기준일까지의 누계금액입니다.
주3) 1인 평균 급여액은 급여 총액을 인원수로 나누어 산출하였습니다.
2. 임원의 보수 등
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
VIII. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
|
- |
- |
- |
- |
| ※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조 |
2. 타법인출자 현황(요약)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | - | - | - | - | - | - |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | - | - | - | - | - | - |
| 계 | - | - | - | - | - | - | - |
| ※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조 |
IX. 대주주 등과의 거래내용
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
2025년 03월 06일 회사합병 결정에 대한 내용이 공시되었습니다.
2. 우발부채 등에 관한 사항
1. 견질 또는 담보용 어음ㆍ수표 현황
| (기준일 : 2025.03.31) | (단위 : 매, 백만원) |
| 제 출 처 | 매 수 | 금 액 | 비 고 |
|---|---|---|---|
| 은 행 |
- |
- |
- |
| 금융기관(은행제외) |
- |
- |
- |
| 법 인 |
- |
- |
- |
| 기타(개인) |
- |
- |
- |
3. 제재 등과 관련된 사항
1. 제재현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
2. 한국거래소 등으로부터 받은 제재
투자판단 관련 주요경영사항(당뇨병성 황반부종 및 습성 황반변성 치료제 CU06 기술이전(License-Out, L/O) 권리 반환 의향 통보) 공시불이행 및 공시 번복으로 불성실공시법인으로 지정되었습니다.
- 부과벌점: 5.0점
- 공시위반제재금: 20,000,000원
- 사유발생일: 2024.05.16
- 불성실공시법인 지정일: 2024.07.15
3. 단기매매차익 발생 및 반환에 관한 사항
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
1. 상장기업의 재무사항 비교표
| (기준 재무제표 : | 개별 | ) | (상장일 : | 2021년 07월 22일 | , 인수인 : | 삼성증권 | ) | (단위 : 백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 예측치 달성 여부 |
괴리율 |
|---|---|---|---|---|---|
| 2022년 | 매출액 | 16,128 | 3,583 | 미달성 | 77.78 |
| 영업이익 | -3,032 | -11,982 | 미달성 | 295.18 | |
| 당기순이익 | -2,784 | -11,406 | 미달성 | 309.70 | |
| 2023년 | 매출액 | 31,146 | 10,294 | 미달성 | 66.95 |
| 영업이익 | 2,837 | -10,508 | 미달성 | 470.39 | |
| 당기순이익 | 3,057 | -11,586 | 미달성 | 479.00 | |
| 2024년 | 매출액 | 70,318 | 1,633 | 미달성 | 97.68 |
| 영업이익 | 35,824 | -12,635 | 미달성 | 135.27 | |
| 당기순이익 | 36,177 | -14,886 | 미달성 | 141.15 |
(주1) 당사는 기술성장기업으로 2021년 07월 22일 코스닥 시장에 상장하였습니다.
(주2) 매출액 요건의 경우, 신규상장일이 속하는 사업연도를 포함하는 연속하는 5개 사업연도(상장일부터 상장일이 속한 사엽연도의 말일까지의 기간이 3월미만인 경우 에는 그 다음 사업연도)까지 지정 유예되며, 2026년 말 재무제표부터 대상이 됩니다.
(주3) 기술성장기업의 경우에는 영업손실과 관련한 관리종목규정을 적용받지 않습니다.
(주4) 법인세비용차감전계속사업손실 요건은 신규상장일이 속하는 사업연도를 포함 한 연속하는 3개 사업연도 동안 해당 요건을 적용받지 않게 됩니다. 2024년& 2025년 말 재무제표부터 해당 요건을 적용받게 될 예정입니다.
(주5) 당사의 2024년 법인세차감전계속사업손실은 14,886,473,150원이며, 2023년 법인세차감전계속사업손실은 11,585,769,153원입니다.
(주6) 괴리율에 대한 분석
당사는 현재 기업공개(IPO) 당시 계획했던 임상시험 및 기술이전 일정이 현재 전반적으로 지연되고 있습니다. 이에 따라 주요 파이프라인의 가시적인 사업화 성과 달성 또한 당초 예상보다 지체되고 있는 상황입니다.
다음은 기업공개 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정입니다.
| [IPO 당시 추정한 주요 파이프라인 임상시험 및 기술이전 일정] |
| 주요 파이프라인 |
적응증 | 구분 단계 |
지역 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 상반기 | 하반기(E) | 상반기 | 하반기 | 상반기 | 하반기 | 상반기 | 하반기 | ||||
| CU06 | 당뇨 황반부종 |
임상 단계 |
미주 및 유럽 |
- 임상 1상 진입 (미국) |
- 임상 1상 종료 (미국) |
- 임상 2상 진입 (미국) |
- | - | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - | - | - | - | - | - | - | - 임상 3상 진입 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- | - | - 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (한국) |
|||
| CU01 | 당뇨병성 신증 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 2상 진입 (미국) |
- | - 임상 2상 종료 (미국) |
- 임상 3상 진입 (미국) |
- |
| 아시아 | - 임상 2a 종료 (한국) |
- 임상 2b/3상 진입 (한국) |
- | - | - | - 임상 2b/3상 종료 (한국) |
- NDA 제출 (한국) |
- Launch (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미국/유럽) |
- 마일스톤 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
- | ||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
- 마일스톤 수령 (아시아) |
|||
| CU03 | 습성 황반변성 |
임상 단계 |
미주 및 유럽 |
- | - | - | - 임상 1/2a 진입 (미국) |
- | - | - | - 임상 1/2a 종료 (미국) |
| 아시아 | - | - 임상 2a 종료 (한국) |
- 임상 2b/3 진입 (한국) |
- | - | - | - | - 임상 2b/3 종료 (한국) |
|||
| 기술 이전 |
미주 및 유럽 |
- | - | - | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (미주/유럽) |
- 마일스톤 수령 (미주/유럽) |
||
| 아시아 | - | - | - | - 기술이전 계약 체결 및 계약금 수령 (아시아) |
- | - | - | - 마일스톤 수령 (아시아) |
|||
|
주1) 원/달러 환율은 2021년 6월 8일 기준 최근 1개년(2021년 5월 10일 ~ 2021년 6월 8일) 서울외국환중개 매매기준율 평균인 1,120.87원/USD을 적용하였습니다. 주2) 동사 보유 파이프라인 중 임상 1상 단계 이상의 파이프라인만을 대상으로 매출을 추정하였으며, 전임상 단계의 CU02, CU04, CU05, CU06-MI, CU06-ALI 파이프라인의 경우 매출 추정시 제외하였습니다. |
당사의 이사회는 금번 주주배정 후 실권주 일반공모 방식의 유상증자를 추진하기에 앞서, 당사의 현재 재무 상태, 보유 현금 수준 및 단기적인 자금 운용 계획, 임상개발을 진행 중인 파이프라인의 사업성 및 예상되는 비용 규모, 그리고 예정된 전환사채 등의 차입금 상환 스케줄 등을 면밀히 검토하였습니다. 또한, 이를 바탕으로 자금 조달의 필요성과 시기의 적정성은 물론, 조달 자금의 규모와 사용 계획이 당사의 핵심 파이프라인 개발 및 신사업 진출 등 중장기 사업 전략에 부합하는지 다각적으로 분석하고 심도 있는 논의를 거쳤습니다.
그 결과, 현재의 내부 유보 자금 및 영업 현금흐름만으로는 예정된 임상 개발과 미래 성장 동력 확보를 위한 투자를 동시에 진행하기에 부족하며, 안정적인 재무구조를 유지하면서 기업가치를 극대화하기 위해서는 외부 자금 조달이 필수적이라는 결론에 이르렀습니다. 이에 당사 이사회는 본 유상증자가 회사의 핵심 경쟁력을 강화하고 지속 가능한 성장의 발판을 마련하기 위한 최적의 방안이라고 판단하였으며, 이사회가 검토한 금번 유상증자를 통해 자금을 조달하고자 하는 구체적인 배경은 다음과 같습니다.
1) 핵심 파이프라인의 임상 개발 가속화 및 기업가치 극대화 전략 실행
당사는 현재 혈관내피기능장애 관련 난치성 질환 분야에서 혁신적인 신약 후보물질들을 개발하고 있으며, 이 중 CU06(당뇨병성 황반부종 및 습성 황반변성 치료제), CU71(퇴행성 뇌질환 치료제), CU01(당뇨병성 신증 치료제) 등 핵심 파이프라인들이 중요한 임상 개발 단계에 진입하였거나 앞두고 있습니다. 특히, CU06의 경우 미국 FDA와의 Type C 미팅을 통해 임상 2b상 개발 전략의 타당성을 확인하였으며, 생체 흡수율이 개선된 신규 제형 개발로 임상 성공 가능성을 한층 높였습니다. 이러한 핵심 파이프라인의 임상시험은 대규모 자금이 소요되나, 자체 임상 데이터 확보를 통해 신약의 가치를 최대한 높이고, 향후 글로벌 기술이전 시 유리한 협상 위치를 확보하며 파트너사 선택의 폭을 넓히기 위한 필수적인 과정입니다. 금번 조달 자금은 이러한 핵심 파이프라인들의 임상시험을 계획대로 신속하게 진행하고, 조기에 의미 있는 결과를 도출하여 기업가치를 극대화하는 데 사용될 것입니다.
2) 신규 사업(원료의약품 유통) 진출을 통한 사업 안정성 및 성장성 강화
당사는 기존 신약 연구개발 사업의 리스크를 분산하고 안정적인 수익 기반을 확보하기 위해 원료의약품 유통사업으로의 신규 진출을 계획하고 있습니다. 이는 회사의 사업 포트폴리오를 다각화하고, 연구개발 투자에 필요한 현금 흐름을 보완하며, 장기적으로 사업 안정성을 높이는 데 기여할 것입니다. 금번 조달 자금의 일부는 이러한 신규 사업 진출에 필요한 법적 자본금 요건 충족 및 초기 운영자금으로 활용될 예정입니다.
3) 실권주 일반공모를 통한 투자자 참여 기회 확대
당사는 주주배정 후 실권주 일반공모 방식을 채택함으로써 기존 주주의 권리를 보호하는 동시에 신규 투자자들에게도 투자 기회를 제공하고자 합니다. 이를 통해 기존 주주들의 지분희석화를 최소화함과 동시에 실권주 일반공모를 통해 다양한 투자자층을 확보하고 기업의 지속 가능한 성장을 위한 기반을 마련할 것입니다.
상기한 바와 같이, 당사는 금번 유상증자를 통해 조달되는 자금을 핵심 사업의 경쟁력 강화, 미래 성장 동력 확보, 사업 다각화 및 경영 안정성 제고라는 명확한 목표 하에 투명하고 효율적으로 사용할 계획입니다. 이를 통해 기업가치를 지속적으로 증대시키고, 궁극적으로 주주님들의 이익을 극대화하는 데 최선의 노력을 다할 것입니다.
항목별 괴리발생 원인은 다음과 같습니다.
[매출액]
당사는 2021년 07월 22일 코스닥시장에 기술특례상장 하였으며, 증권신고서를 통해 2024년 매출액 예측치를 70,318백만원로 추정하였으나, 실적치는 1,633백만원으로 약
97.68%의 괴리율이 발생하였습니다.
상장 시 매출액을 추정한 근거로는 1) CU06 당뇨병성 황반부종 적응증 임상3상 진입으로 2024년 마일스톤 수령액 13,712백만원 2) CU06 아시아 Upfront 3,835백만원 3) CU01 당뇨병성 신증에 대해 기술이전 및 마일스톤 수령액 13,644백만원입니다 4) CU03 에 대해 기술이전 및 마일스톤 수령액 39,128백만원 입니다.
추정근거 대비 실제 실적의 괴리 발생 원인은 아래와 같습니다.
1) CU06
CU06은 상장 이후인 2021년 10월 아시아를 제외한 글로벌 판권을 '떼아 오픈이노베이션'으로 기술이전 하였고, 계약금(Upfront payment) 및 당사의 임상2a상 수행에 따른 연구비/용역비 등을 떼아 오픈이노베이션에서 보전 받아 영업수익으로 인식하였으나, 2024년 5월 16일자로 계약해지 및 권리반환 통보를 받음으로써 이후 예상 수익은 인식하지 못하게 되었습니다. 단, 당사가 떼아 오픈이노베이션으로부터 이미 수령한 계약금 및 연구개발비 보전금액에 대한 반환의무는 없습니다. 괴리가 발생한 예상수익은 아시아를 제외한 지역의 임상2상 성공 마일스톤과, 임상2상 성공 후 예상되었던 아시아 지역에 대한 기술이전 계약금입니다.
당사는 CU06이 세계 최초로 시력 개선 효과를 입증한 경구용 약물이며, 임상2a상에서 보인 시력 개선 효과가 항체 치료제인 루센티스가 임상2상에서 나타낸 효과와 비슷한 양상을 보이는 점을 고려하여, FDA 미팅, 메커니즘 규명 및 임상2b상 IND 준비 등의 후속 개발 활동을 활발히 진행하고 있습니다. 이에 더불어 글로벌 판권에 대한 기술이전도 추진 중입니다.
2) CU01
당뇨병성 신증은 기존에 별다른 치료제가 없던 상황이었으나, 2021년 7월 미국 FDA 허가를 받은 바이엘의 케렌디아를 비롯해 SGLT-2 억제제 등 여러 치료제들이 시장에 출시되었습니다. 의약품 규제기관이 새롭게 등장한 치료제들의 연구개발 프로토콜을 바탕으로 당뇨병성 신증 치료제의 허가 기준을 마련함으로써, 상장 당시에 계획했던 CU01의 임상 범위를 넘어 감당하기 어려운 임상 규모를 필요로 하게 되어 불가피하게 개발 계획의 변경이 발생하였습니다. 예를 들어, SGLT-2 억제제인 Dapagliflozin 및 Empagliflozin의 경우 각각 4,304명 및 6,609명의 환자를 대상으로 38개월간 임상연구를 수행하였고, 바이엘의 케렌디아 경우에도 5,734명의 환자를 대상으로 32개월간 연구를 진행하였습니다.
CU01 개발 계획 변경 이후, 당사는 현재 국내에서 당뇨병성 신증 환자 240명을 대상으로 임상2b상을 진행하고 있습니다. 최근 일본 제약사가 진행한 대규모 임상연구에서 Nrf2 activator 기전의 약물이 신장 기능을 유지할 수 있는 것으로 밝혀짐에 따라, 같은 기전을 포함하고 있는 CU01의 신장기능 유지 효과에 대한 기대를 가지고 있는 파트너사들에게, 임상2b상 결과가 나오는 대로 기술이전을 통한 수익 인식을 목표로 하고 있습니다.
3) CU03
CU03은 2019년 12월 식품의약품안전처 임상2a상 IND 승인 이후 2022년 1월 임상시험결과보고서(CSR)를 수령하였고, 비임상 시험(26주 반복투여 독성시험)을 완료했습니다. 임상2a상 결과를 확보하고 아시아 지역에서 임상2b/3상에 진입함으로써, 계약금과 마일스톤을 통한 수익 창출을 목표로 하였으나, 상장 이후 개발전략 변경을 통해 임상2a상 결과만으로 국내 기술이전을 추진 중입니다.
당사는 상장 이후 오픈 이노베이션의 일환으로 항체 치료제 개발 전문기업인 맵틱스와 2024년 7월에 공동 연구개발 계약을 체결하였고, 이를 통해 확보한 파이프라인들과 기존 파이프라인, 새로 개발하는 파이프라인을 아울러 전략적 우선순위를 재설정하였습니다. 특히, CU03과 개발영역이 겹치는 망막질환에 기존 주력 파이프라인인 CU06과 더불어 혁신적 항체 치료제인 M-T103 파이프라인이 추가로 우선 개발 파이프라인에 선정됨에 따라, CU03은 임상2a상의 결과만으로 국내 기술이전을 추진하고, 대신 훨씬 경쟁력이 높은 MT-103 개발에 주력하며 글로벌 기술이전을 추진하고 있습니다.
당사는 상장 이후 전략적인 핵심 파이프라인 개편에 따라, 퇴행성 뇌질환 치료제 CU71처럼 의학적 차별화 가능성과 상업적 경쟁력을 동시에 갖춘 파이프라인들을 우선 개발순위 파이프라인으로 선정하여 개발을 진행중이며, 오픈 이노베이션을 통해 혁신적인 신규 파이프라인을 지속적으로 발굴하여 추가적인 성장 모멘텀과 영업수익을 기대하고 있습니다
또한, 큐라클의 연구 및 네트워크 역량과 관련이 깊은 신사업으로의 진출을 통한 수익 인식도 추진하고 있습니다.
[영업이익(손실)]
당사는 증권신고서상 영업이익을 35,824백만원 추정하였으나 실적은 영업손실 12,635백만 원으로 괴리율은 135.27%입니다.
괴리발생 원인은 상기와 같이 매출액에 있어 예측치 대비 68,685백만원의 실적괴리에 따라 발생하였습니다.
2. 중소기업기준검토표
기업공시서식 작성기준에 따라 본 항목을 기재하지 않습니다. 관련 내용은 2025년 03월 21일에 제출된 사업보고서를 참조하시기를 바랍니다.
3. 매출액 미달에 대한 관리종목 지정유예 현황
(최근 사업연도 매출액 30억원 미만)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|
| 사업연도 | 매출금액 | 해당여부 | 사유 | 종료시점 | |
| 2024 | 1,633 | 해당 | 해당 | 코스닥시장상장규정(제53조 1항 1호 나목) 요건을 충족하는 제약,바이오기업 | 2025년 12월 31일 |
주1) 당사는 기술성장기업으로 2021년 07월 22일 코스닥 시장에 상장하였습니다.
주2) 매출액 요건의 경우, 신규상장일이 속하는 사업연도를 포함하는 연속하는 5개 사업연도 (상장 일부터 상장일이 속한 사엽연도의 말일까지의 기간이 3월미만인 경우에는 그 다음 사 업연도)까지 지정 유예되며, 당사는 2026년부터 대상이 됩니다.
5. 계속사업손실에 대한 관리종목 지정유예 현황
(자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속 사업손실 발생)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원, %) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | ||||
|---|---|---|---|---|---|---|
| 사업연도 | 법인세 차감전 계속사업손익(A) |
자기자본금액 (B) |
비율(A/B) | 해당 여부 |
종료 시점 |
|
| 2024년 | -14,886 | 29,953 | -49.69 | 미해당 | 미해당 | 2023년 12월 31일 |
| 2023년 | -11,586 | 41,863 | -28 | |||
| 2022년 | -11,406 | 46,171 | -25 | |||
주1) 법인세비용차감전계속사업손실 요건은 신규상장일이 속하는 사업연도를 포함 한 연속 하는 3개 사업연도 동안 해당 요건을 적용받지 않게 됩니다. 2024년부터 해당 요건을 적용 받게 될 예정입니다.
XI. 상세표
1. 연결대상 종속회사 현황(상세)
| (단위 : 원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
|
- |
- |
- |
- |
- |
- |
- |
|
- |
- |
- |
- |
- |
- |
- |
|
- |
- |
- |
- |
- |
- |
- |
2. 계열회사 현황(상세)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 |
- |
- |
- |
|
- |
- |
||
| 비상장 |
- |
- |
- |
|
- |
- |
3. 타법인출자 현황(상세)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - | - | - | ||||
(주1) 당사는 소규모기업에 해당하므로 타법인 출자현황을 기재하지 아니하고 있습니다.
【 전문가의 확인 】
1. 전문가의 확인
보고서 작성기준일 현재 해당사항이 없습니다.
2. 전문가와의 이해관계
보고서 작성기준일 현재 해당사항이 없습니다.