 |
|
pbp_대표이사등의확인ㆍ서명_20250530 - signed_f |
분 기 보 고 서
(제 10 기)
| 사업연도 | 2024년 07월 01일 | 부터 |
| 2025년 03월 31일 | 까지 |
| 금융위원회 | |
| 한국거래소 귀중 | 2025년 5월 30일 |
| 제출대상법인 유형 : | 주권상장법인 |
| 면제사유발생 : | 해당사항 없음 |
| 회 사 명 : | 프레스티지바이오파마 (Prestige Biopharma Limited) |
| 대 표 이 사 : | 박소연 |
| 본 점 소 재 지 : | 21 Biopolis Road, #04-24 Nucleos South Building Biopolis, Singapore 138567 |
| (전 화) +65-6924-6535 | |
| (홈페이지) http://www.prestigebiopharma.com | |
| 작 성 책 임 자 : | (직 책) 이사 (성 명) Michael Jinwoo Kim |
| (전 화) 070-4131-9977 |
【 대표이사 등의 확인 】
 |
|
pbp_대표이사등의확인ㆍ서명_20250530 - signed_f |
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 현황
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | 1 | - | - | 1 | 1 |
| 비상장 | 3 | - | - | 3 | 1 |
| 합계 | 4 | - | - | 4 | 2 |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조 |
1-1. 연결대상회사의 변동내용
당사는 본 분기보고서 작성기준일 현재 연결대상회사의 변동내역이 없습니다.
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
나. 회사의 법적 ·상업적 명칭
당사의 명칭은 'Prestige Biopharma Limited'로, 한글로는 "프레스티지바이오파마"로 표기 합니다. 싱가포르에 소재한 기업으로서 영문 명칭이 싱가포르에 등록된 정식명칭입니다.
다. 설립일자
당사는 2015년 7월 13일에 설립되었습니다.
라. 본사의 주소, 전화번호, 홈페이지 주소
본사의 주소:
21 Biopolis Road, #04-24 Nucleos South Building, Biopolis, Singapore 138567
전화번호: +65-6924-6535
홈페이지: http://www.prestigebiopharma.com
마. 회사사업 영위의 근거가 되는 법률
당사는 싱가포르법에 따라 설립된 회사입니다.
바. 중소기업 해당 여부
당사는 싱가포르법에 따라 설립된 외국기업으로 해당사항 없으나, 한국의 '중소기업기본법' 및 '중견기업 성장촉진 및 경쟁력 강화에 관한 특별법'을 준용하여 판단 시 국내 중소기업에 해당하지 않습니다.
| 중소기업 해당 여부 | 미해당 | |
| 벤처기업 해당 여부 | 미해당 | |
| 중견기업 해당 여부 | 해당 | |
사. 대한민국에 대리인이 있는 경우에는 이름(대표자), 주소 및 연락처
당사는 본 분기보고서 작성 기준일 현재 해당사항이 없습니다. 당사는 현재 한국에 사무소를 설치하였으며 한국사무소의 공시담당자를 통하여 공시를 이행하고 있습니다.
아. 주요 사업의 내용 및 향후 추진하려는 신규사업
당사는 원약사 특허가 만료 예정인 항체의약품 중 시장성이 높고 임상적 효능과 안전성이 장기간 입증된 제품을 선별해 바이오시밀러 제품의 개발을 진행하고 있습니다. 특히 당사는 다양한 플랫폼 기술을 기반으로 바이오시밀러 경쟁력의 핵심인 원가경쟁력 향상에 주력하고 있습니다.
당사는 바이오시밀러 외에도 미래 성장동력이 될 희귀의약품을 포함한 미충족 수요(Unmet Needs) 항체의약품 신약 개발을 함께 진행하고 있으며, 고도의 차별화된 기술력을 바탕으로 끊임없는 변화와 시도를 통해 바이오시밀러부터 항체 신약에 이르기까지 우수한 품질의 항체의약품을 개발하고 있습니다.
종속회사 프레스티지바이오로직스 주식회사는 Easy to modify/Adapt 시스템을 도입하여 고객 Needs에 맞는 제조환경을 제공하는 CDEMO(Contract Development, Engineering & Manufacturing Organization) 사업을 영위하고 있으며, 동 사업으로 국내외 제약회사의 첨단 바이오의약품을 위탁 생산하며, 의약품개발 과정에 참여하여 개발단계별 맞춤형 서비스를 제공함으로써 다양한 형태의 고객과 협력체계를 구축하고 있습니다.
당사의 사업에 대한 상세 내용은 'Ⅱ. 사업의 내용'을 참고하시기 바랍니다.
자. 신용평가에 관한 사항
당사는 본 분기보고서 작성 기준일 현재 해당사항이 없습니다.
차. '상법' 제290조에 따른 변태설립사항
당사는 본 분기보고서 작성 기준일 현재 해당사항이 없습니다.
카. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 유가증권시장 상장 | 2021.02.05 | 해당사항 없음 |
2. 회사의 연혁
가. 회사의 본점소재지 및 그 변경
| 이전일 | 소재지 | 비고 |
|---|---|---|
|
2015.07.13 |
15 Tech Park Crescent, Singapore (638117) |
설립 |
|
2017.07.04 |
2 Science Park Drive #4-13/14 Ascent Singapore (118222) |
이전 |
| 2021.07.26 | 21 Biopolis Road, #04-24 Nucleos South Building, Biopolis, Singapore (138567) |
이전 |
나. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2022.09.28 | 정기주총 | - | 이사 이의경 이사 전경희 이사 Lee Kok Fatt 이사 오승주 |
- |
| 2023.09.26 | 정기주총 | 이사 및 감사위원 Ong Kang Lin 이사 및 감사위원 방규호 |
- | - |
| 2024.09.27 | 정기주총 | 이사 Tan Yong Chuang 이사 Tan Ting Yong |
대표이사 박소연 이사 Michael Jinwoo Kim |
- |
다. 최대주주의 변동
당사는 공시대상기간 중 최대주주의 변동사항은 없습니다.
라. 상호의 변경
당사는 공시대상기간 중 상호의 변경은 없습니다.
마. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행 중인 경우 그 내용과 결과
당사는 본 분기보고서 작성기준일 현재 해당사항이 없습니다.
바. 합병, 기업분할, 영업양수도, 감자 등 경영활동과 관련된 중요한 사실의 발생
최근 3사업연도 내 합병, 분할, 자산양수도, 영업양수도에 관한 사항은 다음과 같습니다.
- 프레스티지바이오로직스㈜ 사업결합
당사는 그룹 지배구조 형성 및 그룹사간 시너지 효과를 증대시키기 위하여 2022년 8월 26일 이사회 결의에 의거 2022년 9월 5일 프레스티지바이오로직스㈜을 제3자배정 유상증자 참여의 방법으로 지분을 취득하였습니다. 당사는 기업회계기준서 제 1103호 '사업결합'에 따라 취득법을 적용하여 연결회계 처리하였으므로 취득한 자산과 부채는 공정가치로 측정되었습니다.
- 프레스티지바이오로직스㈜ 지분 추가취득
당사는 그룹 지배력 유지 및 재무건정성을 확보하고 그룹의 성장동력을 강화하기 위하여 2024년 9월 12일 이사회 결의에 의거 2024년 9월 프레스티지바이오로직스㈜을 제3자배정 유상증자 참여의 방법으로 지분을 추가취득하였습니다. 2024년 9월 프레스티지바이오로직스㈜의 제3자배정 유상증자 참여로 추가 취득한 15,916,168주를 합한 총 31,122,728주를 보유하고 있으며, 이에 따라 지분율이 24.7%에서 40.2%로 증가하였습니다.
사. 회사의 업종 또는 주된 사업의 변화
당사는 공시대상기간 중 주된 사업의 변동사항은 없습니다.
아. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
공시대상기간의 경영활동과 관련된 중요한 사항의 발생내용은 아래와 같습니다.
| 일자 |
연 혁 |
|---|---|
| 2022 | 휴미라 바이오시밀러(PBP1502) 스페인 의약품위생제품청(AEMPS)으로부터 1상 임상시험계획 승인 |
| 췌장암 항체신약(PBP1510) 일본서 특허 취득 | |
| 췌장암 항체신약(PBP1510) 스페인 의약품위생제품청(AEMPS)으로부터 1/2a상 임상시험계획 승인 | |
| 허셉틴 바이오시밀러(HD201) 제조시설 EU-GMP 인증 획득 | |
| 허셉틴 바이오시밀러(HD201) 임상시험 제3상 최종 결과 보고 | |
| 췌장암 항체신약(PBP1510) WHO 국제일반명(INN, International Nonpropietary Names), 'Ulenistamab'으로 등록 | |
| 허셉틴 바이오시밀러(HD201) EMA 품목허가 재심사 신청 | |
| 미국 베네비라사와 코로나 치료 의약품 위탁생산을 위한 포괄계약 체결 | |
| 췌장암 항체신약(PBP1510) 미국 식품의약국(FDA)으로부터 1/2a상 임상시험계획 승인 | |
| 인타스제약과 아바스틴 바이오시밀러(HD204) 유럽, 미국, 캐나다, 브라질, 멕시코, 중동 및 북아프리카(MENA), 동남아 일부 국가, CIS 일부 국가 등에서의 판매를 위한 라이선스 계약 체결 | |
| 췌장암 항체신약(PBP1510) 싱가포르서 특허 취득 | |
| 췌장암 항체신약(PBP1510) 말레이시아에서 특허 취득 | |
| 허셉틴 바이오시밀러(HD201) 유럽 의약품청(EMA) 품목허가심사 신청 자진 철회 | |
| 췌장암 항체신약(PBP1510) 인도네시아에서 특허 취득 | |
| 2023 | 난치성고형암 항체신약(PBP1710) 한국 특허 취득 |
| 난치성고형암 항체신약(PBP1710) 남아프리카 특허 취득 | |
| 휴미라 바이오시밀러(PBP1502) 헝가리 임상1상 승인 | |
| 췌장암 항체신약(PBP1510) 미 FDA Fast-Track 지정 | |
| 췌장암 항체신약(PBP1510) 캐나다에서 특허 취득 | |
| 췌장암 항체신약(PBP1510) 호주 임상시험심사위원회로부터 1/2a상 임상시험계획 승인 | |
| 췌장암 항체신약(PBP1510) 싱가포르 보건과학청(Health Sciences Authority. HSA)으로부터 1/2a상 임상시험계획 승인 | |
| 허셉틴 바이오시밀러(HD201) 유럽 의약품청(EMA) 품목허가심사 신청 | |
| 2024 | 아바스틴 바이오시밀러(HD204) 일본 특허 취득 |
| 휴미라 바이오시밀러(PBP1502) 일본 특허 취득 | |
| 췌장암 항체신약(PBP1510) 인도, 이스라엘에서 특허 취득 | |
| 점막점착성-PLGA 나노입자 (IDC222) 한국서 특허취득 | |
| 허셉틴 바이오시밀러(HD201 Tuznue) 유럽연합 집행위원회(EC)로부터 품목허가 최종 획득 | |
| 췌장암 항체신약(PBP1510) 뉴질랜드에서 특허 취득 | |
| 난치성고형암 항체신약(PBP1710) 러시아, 중국 특허 취득 | |
| 2025 | 췌장암 항체신약(PBP1510) 멕시코 특허 취득 |
| 난치성고형암 항체신약(PBP1710) 일본 특허 취득 |
3. 자본금 변동사항
가. 자본금 변동추이
| (단위 : 천원, 주) |
| 종류 | 구분 | 당분기 (2025년 3월말) |
전기 (2024년 6월말) |
전전기 (2023년 6월말) |
|---|---|---|---|---|
| 보통주 | 발행주식총수 | 12,019,231 | 12,019,231 | 12,019,231 |
| 액면금액 | - | - | - | |
| 자본금 | 589,604,508 | 589,604,508 | 589,604,508 | |
| 우선주 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 기타 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 합계 | 자본금 | 589,604,508 | 589,604,508 | 589,604,508 |
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주, %) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | - | - | - | 주1 | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 12,019,231 | - | 12,019,231 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | - | - | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | - | - | - | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 12,019,231 | - | 12,019,231 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 12,019,231 | - | 12,019,231 | - | |
| Ⅶ. 자기주식 보유비율 | - | - | - | - | |
주1) 싱가포르법상 발행할 주식의 총수에 대한 개념은 존재하지 않습니다.
주2) 2021.02.05 당사는 대한민국 유가증권시장에 증권예탁증권(DR)을 신규상장하였습니다. 상장 증권예탁증권 총수는 60,096,155 DR이며, 발행주식 총수는 주입니다( 5DR = 보통주 1주). 상기 주식수는 원주를 기준으로 작성되었습니다.
나. 자기주식 취득 및 처분 현황
당사는 본 분기보고서 작성기준일 현재 해당사항이 없습니다.
다. 종류주식 발행현황
당사는 본 분기보고서 작성기준일 현재 해당사항이 없습니다.
5. 정관에 관한 사항
가. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2020년 04월 22일 | -주주 결의 (2020.04.22) -이사회 결의 (2020.04.22) |
1) 3, 10, 11, 41조: 주식의 발행, 소각, 배정 관련 내용 수정 2) 8, 8A-E, 32조: 주식의 양도, 우선주 관련 내용 수정 3) 73, 73A-D, 75, 79조: 이사회 관련 내용 수정 4) 93-95, 99조: 이사회 결의 관련 내용 수정 5) 45, 45A, 46, 49A조: 주주총회 결의 관련 내용 수정 6) 122, 123조: 배당 관련 내용 수정 7) 131조: 이익 자본전입 관련 내용 수정 8) 81A-C, 145조: 임원배상책임 관련 내용 수정 9) 103조: 감사위원회 관련 내용 수정 10) 117조: 서류의 인증 및 열람 관련 내용 수정 |
- Private Company(비공개회사)에서 Public Company(유한책임공개회사)로 변경되면서 관련사항 반영 - 한국 유가증권시장 상장 요건에 부합하도록 정관 개정 |
| 2020년 05월 21일 | -주주 결의 (2020.05.21) -이사회 결의 (2020.05.21) |
1) 45, 73, 93, 95, 99조: 일부 투자자에게 배정되었던 우선주 관련 내용 수정 2) 8조: 우선주 관련 일반사항 수정 3) 44, 47, 51, 66, 121, 122, 130조: 한국 유가증권시장 상장 요건 관련 내용 수정 4) 8A-E, 11A, 41-43, 59B-C, 73A-D조, 51조 일부: 삭제 |
- 회사의 모든 우선주가 보통주로 변경되면서 기존의 우선주 관련 조항 수정 - 한국예탁결제원의 유가증권시장 상장 관련 요건 반영 |
| 2020년 10월 27일 | -주주 결의 (2020.10.27) -이사회 결의 (2020.10.27) |
1) 2조: '최대주주', '주요 자회사', '특수관계인'에 대한 정의 수정 2) 45A조: 용어 일부 변경 ('stocks'를 'shares'로 변경) 3) 48조: 추가 문구 삽입 ('Auditors'에서 'Auditors and Audit Committee members'로 변경) 4) 49A조: 특별결의 관련 조항 수정(49A(b)조) 및 신설(49A(c)조) 5) 100조: 이사회의 위원회 관련 조항 일부 내용 추가 6) 103조: 감사위원회 관련 내용 수정 7) 135조: 감사 임명 관련 일부 내용 추가 |
- 한국 유가증권시장 상장 관련 규정 내용을 반영 |
나. 사업목적
당사는 싱가포르 회사법을 근거로 싱가포르에 설립지 및 본점을 둔 외국법인으로서 정관 상 사업목적을 기재하지 않습니다.
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| - | - | 영위 |
II. 사업의 내용
1. 사업의 개요
당사는 바이오시밀러와 항체 신약 개발에 집중해 온 항체의약품 개발 전문 제약회사로서, 2021년 2월 5일자로 한국에 유가증권시장에 상장되었으며, 종속기업 CDMO전문기업 프레스티스바이오로직스(주)와 R&D 전문기업 프레스티스바이오파마(주)를 운영함으로써 연구, 개발 및 생산을 통합한 원스톱 솔루션을 제공하는 제약 그룹입니다.
가. 사업부문
[투즈뉴(Tuznue-허셉틴 바이오시밀러)]
당사의 파이프라인 중 개발이 가장 앞선 허셉틴 바이오시밀러(HD201)는 2019년 4월 유럽의약품청(EMA)에 품목허가신청서(MAA)를 제출한 이후, COVID-19로 인한장기간 심사가 지연되어 2022년 5월, EMA의 인체의약품위원회(CHMP)는 당사가 제출한 MAA에 대해 당사와 통계적 분석방법에 대한 견해 차이를 보이며 '부정적 의견(Negative Opinion)'을 제시하였습니다. 이에 당사는 심사관과 동등성 평가기준에 이견이 있었던 일부 분석시험에 대한 부정적 의견을 해소하기 위해 해당 분석법에 대한 추가 밸리데이션(Validation) 진행 후 자료를 보완하여 2023년 7월 유럽 EMA에 품목허가신청을 다시 제출하였으며, 2024년 7월 유럽 의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 품목허가 승인 권고(Positive Opinion)를 취득하였고, 2024년 9월 유럽연합 집행위원회(EC)로부터 품목허가를 최종 획득함으로써 HD201 품목명 투즈뉴(Tuznue)로 등록하였습니다. 현재는 유럽 시장 출시를 준비하고 있으며, 동시에 미국 FDA 승인을 위한 절차를 체계적으로 진행하고 있습니다.
[HD204-아바스틴 바이오시밀러]
현재 글로벌 임상 3상을 진행 중인 당사의 아바스틴 바이오시밀러(HD204)는 임상시험에서 품목허가 신청에 필요한 데이터를 확보하는대로 미국 FDA와 유럽 EMA에 품목허가를 신청할 계획입니다. 현재 HD204의 글로벌 임상3상은 전세계 17개 국가에서 진행하고 있습니다.
[PBP1502-휴미라 바이오시밀러]
당사의 휴미라 바이오시밀러(PBP1502)는 2022년 1월 스페인에서 '1상' 임상시험계획을 승인 받아 임상 1상이 진행 중입니다. 바이오시밀러는 이미 효능이 검증된 원약과의 동등성 입증에 포커스를 두기 때문에 임상 2상 시험의 생략이 가능하며, 당사는 임상 1상에서 초기 데이터를 통해 안전성을 확인한 후 개도국을 중심으로 빠른 상업화를 이루기 위한 전략을 진행할 예정입니다.
[기타 바이오시밀러 파이프라인]
이 밖에도 당사는 지난 사업연도에 새로운 바이오시밀러 파이프라인을 추가하며, 바이오시밀러 제품군 확대에도 노력하고 있습니다. 추가된 새로운 바이오시밀러 파이프라인의 상세사항은 다음 장, '2. 주요 제품 및 서비스 - 가. 주요 제품 현황'을 참고해 주시기 바랍니다.
나. 항체신약 사업부문
[PBP1510 - Ulenistamab]
췌장암 항체신약 PBP1510은 2022년 2월 스페인에서 임상 1/2a상에 대한 임상계획을 승인 받았으며, 2022년 6월에는 미국 FDA에서도 임상 1/2a상에 대한 임상계획을 승인 받아 현재 유럽과 미국에서 임상 1/2a상을 진행하고 있습니다. 또한, 2023년 9월에 싱가포르에서도 임상계획을 승인받아 현재 임상1상을 진행중에 있습니다.
2022년 4월 WHO가 발간한 'Recommended INN List'에 공개된 바와 같이 PBP1510은 'ulenistamab'이라는 성분명으로 국제 일반명(INN, International Nonpropietary Names)이 등록되었으며, 따라서 향후 PBP1510 Anti-PAUF 항체신약의 성분명은
'ulenistamab'으로 표기될 예정입니다.
PBP1510은 췌장암 대부분에서 발견되는 췌관선암 과발현 인자(PAUF, Pancreatic Adenocarcinoma Up-regulated Factor)를 중화하는 항체신약으로 PAUF에 기인한 다양한 암 진행 및 전이 메커니즘을 차단합니다. PAUF는 또한 종양미세환경(TME, Tumor Microenvironment)을 변화시켜 생체의 면역체계를 억제함과 동시에 면역을 교란시켜 암세포의 성장을 촉진하는데, PBP1510은 이러한 PAUF의 역할을 원천 차단해 암세포가 생체의 면역체계와 기존 항암제에 대해 더욱 민감하게 반응하도록 만들어 줍니다. 이러한 특성을 통해 기존 항암제와 상승적인 효과를 발휘할 것으로 기대하고 있습니다.
2020년 유럽 의약품청(EMA), 미국 식품의약국(FDA), 한국 식품의약품안전처(MFDS)로부터 희귀의약품으로 지정된 바 있는 PBP1510은 지난해 캐나다, 중국에 이어 올해 2024년 1월 인도, 5월 이스라엘, 7월 뉴질랜드에서도 특허를 획득하였습니다.이로써 PBP1510은 현재까지 한국, 미국, 호주, 대만, 러시아, 남아프리카공화국, 일본, 싱가포르, 말레이시아, 인도네시아, 캐나다, 이스라엘, 중국, 인도, 뉴질랜드, 멕시코를 포함하는 세계 주요 16개국에서 특허를 취득했으며, 유럽 등 8개의 국가에서도 특허 심사가 진행 중입니다.
[PBP1710 - Anti-CTHRC1]
당사가 개발 중인 두 번째 항체신약, PBP1710은 췌장암, 유방암 등 다양한 고형암 유래 암세포에서 과발현되는 CTHRC1 (Collagen Triple Helix Repeat Containing-1)을 표적으로 하고 있습니다. CTHRC1은 암의 증식이나 전이, 그리고 유착과 같은 암세포의 특징들을 증강시켜 암세포를 더욱 공격적으로 만든다고 보고되고 있습니다. PBP1710은 이러한 CTHRC1을 중화하는 항체신약으로 CTHRC1에 기인한 다양한 암의진행 및 전이 메커니즘을 차단합니다. 2023년 1월 한국, 4월 남아프리카공화국 11월 인도네시아에서 특허를 취득하였으며, 2024년에는 러시아와 중국에도 등재되었습니다. 2025년 1월 기준으로 일본에서도 특허를 획득했으며, 현재 유럽을 포함한 15개국에서 특허 심사가 진행 중입니다.
[기타 항체신약 파이프라인]
이 밖에도 당사는 희귀질환 등 미충족 수요가 높은 질환에 대한 혁신 신약을 개발하기 위해 새로운 타겟을 발굴하여 항체신약 파이프라인을 확장하고 있습니다. 아래 파이프라인을 비롯해서 종양미세환경 조절인자이자 면역관문억제제로 작용하는 이중 항체, 면역세포 활성화를 유도하여 항종양 효과를 증강시키는 신개념 융합 항체 등 항체 엔지니어링 기술을 적용한 다양한 항체 신약의 타겟을 검증하고 최종 후보물질을 도출하기 위한 연구개발을 수행 중입니다.
다. 백신 사업부문
2021년 백신사업으로의 진출을 결정한 후, 당사는 종속회사인 프레스티지바이오로직스와의 협력을 통해 백신 위탁생산사업을 진행해 오고 있으며, 호주의 백신개발사 박신(Vaxine)을 비롯한 글로벌 백신 개발사들과 백신의 공동 개발 등을 논의하는 등 관련 연구인력 및 시설 투자를 계획하고 있습니다.
라. CDEMO 사업부문
당사의 종속회사인 프레스티지바이오로직스㈜는 국내외 제약회사의 첨단 바이오의약품을 위탁 생산하며,의약품개발 과정에 참여하여 개발단계별 맞춤형 서비스를 제공함으로써 다양한 형태의고객과 협력체계를 구축하고 있습니다. 또한, Easy to modify/Adapt 시스템을 도입하여 고객 Needs에 맞는 제조 환경을 제공하는 CDEMO (Contract Development, Engineering & Manufacturing Organization) 사업을 영위하고 있습니다.
2. 주요 제품 및 서비스
가. 주요 제품 현황
당사가 현재까지 구축한 파이프라인은 바이오시밀러와 항체신약으로 구성되어 있습니다.
| No. | 구분 | 파이프 라인 |
주요 적응증 |
개발현황 | 오리지널 특허 만료 (유럽/미국) |
|---|---|---|---|---|---|
| 1 | 허셉틴 바이오시밀러 |
Tuznue |
유방암, 전이성 |
-글로벌 임상3상 개시: 2018년 1분기 -유럽 의약품청(EMA) 품목허가 신청 완료: 2019년 2분기 -캐나다 식약청 품목허가 신청 사전미팅: 2020년 1분기 -Bridging Study 완료: 2020년 1분기 |
만료/만료 |
| 2 | 아바스틴 바이오시밀러 |
HD204 |
유방암, 폐암, |
-임상1상 개시: 2018년 3분기 -임상1상 완료: 2019년 2분기 -글로벌 임상3상 개시: 2019년 2분기 |
만료/만료 |
| 3 | 휴미라 바이오시밀러 |
PBP1502 |
류마티스관절염, 건선 등 |
-전임상 완료 -스페인 1상 임상시험계획 승인: 2022년 1분기 -스페인 임상1상 진행 중 |
만료/만료 |
| 4 | 췌장암 항체신약 |
PBP1510 |
췌장암, 난소암 |
-Chemical Abstracts Service (CAS) 등록: 2020년 2분기 |
해당사항 없음 |
| 5 | 프롤리아 바이오시밀러 |
PBP1601 |
골소실, |
- 마스터세포은행(Master Cell Bank) 및 제조용세포은행(Working Cell Bank) 완료 - 전임상 진행 중 |
만료/2025 |
| 6 | 아일리아 바이오시밀러 |
PBP1602 |
황반부종, |
- 마스터세포은행(Master Cell Bank) 및 제조용세포은행(Working Cell Bank) 완료 - 전임상 진행 중 |
2024/만료 |
| 7 | 솔리리스 바이오시밀러 |
PBP1603 |
비정형 용혈성 |
- 세포주 개발 | 만료/2027 |
| 8 | 고형암 항체신약 |
PBP1710 |
난치성 고형암 |
- 연구용세포은행(Research Cell Bank) 생성 완료 - 마스터세포은행(Master Cell Bank) 및 제조용세포은행(Working Cell Bank) 완료 - 전임상 진행 중 |
해당사항 없음 |
| 9 | 옵디보 바이오시밀러 |
PBP2101 | 흑색종, 요로상피세포암 |
- 세포주 개발 | 2026/2027 |
| 10 | 키트루다 바이오시밀러 |
PBP2102 | 흑색종, 비소세포폐암, 요로상피암 | - 세포주 개발 | 2028/2036 |
| 주1) 프롤리아 유럽 특허 만료일은 2022년 06월 25일이지만, 프랑스, 이탈리아, 스페인, 영국은 예외적으로 2025년이 만료 예정일입니다. 주2) 오리지널 특허 만료일은 각 오리지널 제품 개발사 공시자료 및 홈페이지 등을 참고하여 작성하였습니다. |
나. 주요 제품 매출
| (단위: USD) |
| 매출유형 | 품목 |
당분기 |
전기 |
전전기 (제8기) |
|---|---|---|---|---|
| 라이센스 아웃 (License-out) |
바이오시밀러 HD201(주1) | 1,758,000 |
- |
- |
| 바이오시밀러 HD204 | - |
- |
- |
|
| CDMO(주2) |
- | 4,300,957 |
- |
- |
| 기타 | - | 218,050 | 517,114 | 122,410 |
| 합계 | 6,277,007 | 517,114 | 122,410 | |
(주1) 투즈뉴(Tuznue)의 유럽연합 집행위원회(EC)로부터 품목허가를 최종 획득함에 따라 라이선스 아웃계약에 따른 마일스톤(Milestone)에 대하여 인식한 매출입니다.
(주2) 당사의 종속회사인 프레스티지바이오로직스㈜의 당분기에 인식한 개발용역,CPO 및 분석용역 관련 매출 입니다.
다. 주요 제품 등의 가격변동추이
당사는 본 분기보고서 작성기준일 시판 진행 중인 제품이 없어 해당사항이 없습니다
3. 원재료 및 생산설비
당사는 바이오 항체의약품의 연구개발업을 전문적으로 영위하고 있으며, 파이프라인및 백신에 대한 생산은 당사의 종속회사(CDMO)를 통하여 글로벌 공급을 위한 대규모 생산을 진행할 예정입니다.
가. 주요 원재료 매입 현황
| (단위: USD) |
| 사업부문 | 매입유형 | 품목 | 매입액 | 비율 | 비고 (매입처) |
|---|---|---|---|---|---|
| CMO | 원재료 | Power CHO 등 | 3,460,099 | 47.43% | (주1) |
| 부재료 | BPC SUB 등 | 3,834,644 | 52.57% | (주2) | |
| 합 계 | 7,294,744 | 100.00% | - | ||
(주1) 싸토리우스코리아바이오텍, 써모피셔사이언티픽솔루션스, GE HEALTHCARE등
(주2) 비엔브이테크놀러지, 써모피셔사이언티픽솔루션스, 삼전순약공업 등
나. 원재료 가격 변동추이 및 가격변동 원인
당사의 종속회사인 프레스티지바이오로직스㈜의 의약품 제조에 사용되는 원재료 등은 사업의 특성상 매입처에서 주문생산 방식으로 조달하고 있으며, 계약 당사자 간의상호 협의를 통해 가격을 조정하고 있어 가격변동추이는 별도로 산정하지 않았습니다. 주요 매입처의 경우 경쟁상황 및 상호 계약내용에 따라 기재하지 않습니다.
다. 생산능력 및 생산실적
| (단위 : 배치/%) |
| 제품 품목명 | 구분 | 2025년도 3월말 (제10기 3분기) |
2024년도 6월말 (제9기) |
| 실효생산능력 | 36 | 48 | |
| HD201 | 생산실적 | - | - |
| HD204 | 생산실적 | - | 10 |
| PBP1502 | 생산실적 | 1 | - |
| 그외 | 생산실적 | 12 | 13 |
| 가동률(%) | 36.1 | 47.9 | |
* 당사의 종속회사인 프레스티지바이오로직스㈜의 실효생산능력입니다.
라. 생산설비에 관한 사항
(1) 생산설비 현황
| (단위: USD) |
| 구분 | 기초 | 취득 | 처분 | 감가상각 | 기타 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | 7,652,235 | - | - | - | (461,987) |
7,190,248 |
| 건물 | 47,114,278 | - | - | (937,984) |
(2,801,972) |
43,374,322 |
| 기계장치 | 18,370,720 | 6,430 | - | (1,821,001) |
(383,705) |
16,172,444 |
| 시설장치 | 22,269,811 | - | - | (2,011,321) |
(1,253,467) |
19,005,023 |
| 차량운반구 | 186,790 | 36,583 | (9,331) | (49,698) |
(10,261) |
154,083 |
| 집기비품 | 7,641,886 | 192,601 | - | (2,051,647) |
(275,787) |
5,507,053 |
| 사용권자산 | 55,675 | - | - | (35,971) |
(1,733) |
17,971 |
| 건설중인자산 | 65,589,484 | 1,453,168 | (47,509) |
- | (2,962,870) |
64,032,273 |
| 국고보조금 (건설 중인 자산) |
(83,656) | - | - | - | 5,051 | (78,605) |
| 합계 | 168,797,223 | 1,688,782 | (56,840) |
(6,907,622) |
(8,146,731) |
155,374,812 |
*당사의 종속회사인 프레스티지바이오로직스㈜의 한국채택국제회계기준에 따른 연결기준의 생산설비 현황입니다.
4. 매출 및 수주상황
가. 매출실적
| (단위: USD) |
|
매출유형 |
품 목 |
당분기 |
전기 |
전전기 (제8기) |
||||
|---|---|---|---|---|---|---|---|---|
|
수량 |
금액 |
수량 |
금액 |
수량 |
금액 |
|||
| 라이선스아웃 (License-out) |
바이오 |
수 출 |
- |
1,758,000 |
- |
- |
- |
- |
|
내 수 |
- |
- |
- |
- |
- |
- |
||
|
소 계 |
- |
1,758,000 |
- |
- |
- |
- |
||
| 기타 | CDMO등 |
수 출 |
- | 127,400 |
- |
- |
- |
- |
|
내 수 |
- |
4,391,607 |
- |
517,114 |
- |
122,410 | ||
|
소 계 |
- |
4,519,007 |
- |
517,114 |
- |
122,410 | ||
|
합 계 |
수 출 |
- |
1,885,400 |
- |
- |
- |
- |
|
|
내 수 |
- |
4,391,607 |
- |
517,114 |
- |
122,410 | ||
|
소 계 |
- |
6,277,007 |
- |
517,114 |
- |
122,410 | ||
나. 판매경로 및 판매방법
[프레스티지바이오파마]
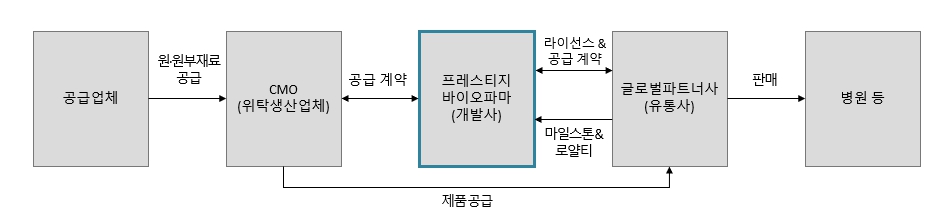
당사는 원료의약품 및 완제의약품 CMO업체가 원자재 매입부터 생산, 보관, 최종 포장, 그리고 글로벌 파트너사의 물류창고 배송까지 담당하고 있으며, 글로벌 파트너사는 물류창고에서 최종 포장된 제품을 보관하고 판매국의 판매처에 이르기까지의 물류활동을 수행할 예정입니다.
제품 개발사인 당사는 직접 마케팅 및 판매에 나서지 않는 대신 유통 네트워크와 판매 노하우를 이미 갖춘 글로벌 제약기업과의 제휴 관계를 통하여 시장에서 시너지를 내려는 사업전략을 구사하고 있습니다. 계약조건 및 시장 동향에 따라 파트너사별 판매방법 및 조건이 모두 상이하며, 계약금 및 마일스톤 방식의 기술료와 더불어 향후 제품 상업화에 따른 로열티/수익 배분(Profit Sharing)을 받게 됩니다.
| [바이오시밀러 라이선스 아웃 비즈니스 모델] |
|
구분 |
계약금 Up-front |
단계별 마일스톤 (Milestone Payment) |
판매 수익배분 Profit Sharing |
|
|---|---|---|---|---|
|
상업판매 개시 전 Development Milestone |
상업판매 개시 후 Sales Milestone |
|||
|
지급조건 |
계약 완료 시 일시불로 |
계약 조건에 따라 |
계약 조건에 따른 |
상업판매 개시 후 매출액에 대하여 계약된 |
| * 계약마다 주요조건은 상이할 수 있습니다. |
[프레스티지바이오로직스]
현재 글로벌 수주를 위한 영업조직과 싱가폴, 호주, 벨기에에 거점을 둔 모회사인 프레스티지바이오파마와의 협업을 통하여 주요 거점의 글로벌 제약사와 지속적인 미팅을 진행하고 있습니다. 해당 미팅에서 당사의 생산설비 현황 및 CDEMO서비스 정보를 지속적으로 잠재적 파트너사에게 제공하고 있습니다.
또한, 고객사와의 계약에 의거하여 생산된 제품을 고객사가 지정한 운송업체 또는 창고를 통하여 고객사에 판매/수출할 예정이며 대리점 등 별도의 판매경로를 이용하고 있지 않습니다.
다. 판매전략
[프레스티지바이오파마]
당사는 임상시험 진행 중 또는 허가 절차 진행 중에 이루어지는 라이선스아웃(License-out) 계약을 통하여 세계 제약시장에서 확실한 영업력과 유통 역량이 검증된 글로벌 제약사와 파트너십을 맺고 이들이 보유하고 있는 현지 시장에 대한 전문성 및 자원을 활용하여 해외 유통 및 판매를 진행할 예정입니다.
 |
|
판매 프로세스 |
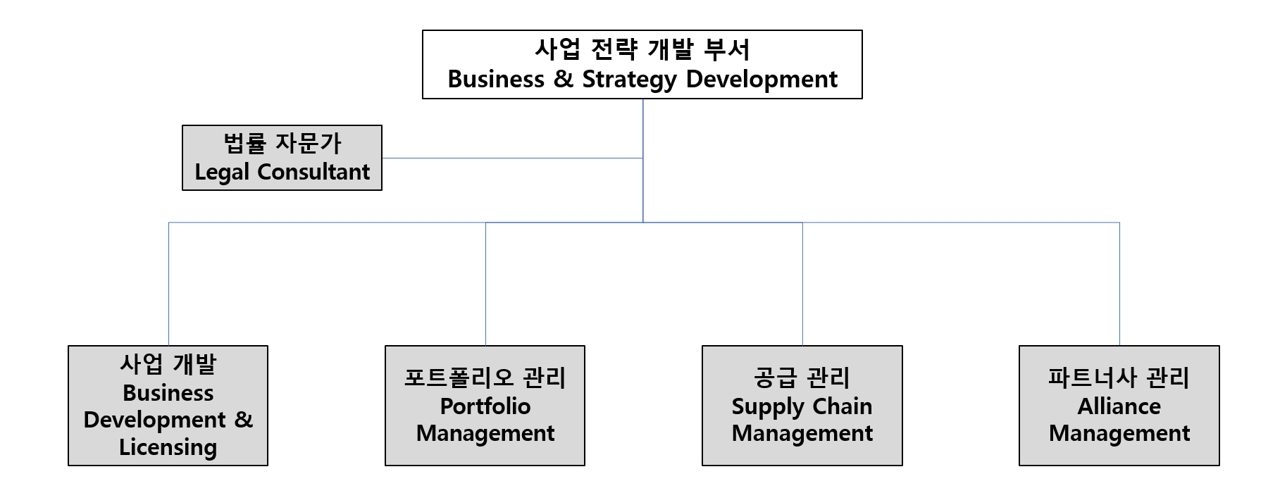
당사는 영업의 효율성을 위하여 위탁생산업체를 담당하는 전략 개발팀과 유통사를 담당하는 사업개발팀을 하나의 사업전략 개발 부서에서 전담 관리하고 있습니다. 이와 함께 구매 및 IT팀과의 협업을 통해 팀뿐만 아니라 팀원들간 다양한 능력을 상호보완할 수 있게 하여 시너지 효과를 가져오고 있습니다. 당사의 사업 전략 개발 부서의 조직도 및 조직별 주요 역할은 다음과 같습니다.
 |
|
사업전략개발부서 조직도 |
|
조 직 명 |
업 무 내 용 |
|---|---|
|
사업전략개발 부서 (Business Strategy Development) |
사업에 관련된 전반적인 운영을 담당하며, 매주 전체 미팅을 주선합니다. 주간 미팅을 통해 다양한 의견을 수렴하고 끊임없이 교류를 이루며, 개인이 아닌 팀 간의 협력 관계 형성에 중요한 역할을 합니다. |
|
법률 자문가 (Legal Consultant) |
라이선스 및 공급 계약서뿐만 아니라, 본 계약 체결에 앞서 이루어져야 하는 기업 간의 비밀유지 계약서 (Confidential Disclosure Agreement, CDA)까지 사업과 관련된 전반적인 법률적 자문을 수행하고 있습니다. 이후 계약의 수정 또는 변경이 이루어지는 경우를 대비하여, 지속적으로 파트너사와의 계약 관계를 관리하고 있습니다. |
|
사업 개발 팀 (Business Development & Licensing) |
사업개발 전략을 구상하며 라이선스 계약과 관련한 시장조사, 대상자 선정, 계약 체결 등을 수행하고 있습니다. 이와 더불어, 계약이 체결된 후 파트너사와의 지속적인 네트워크를 담당하여 파트너 간의 소통 및 신뢰를 위해 핵심적인 역할을 합니다. |
|
포트폴리오 관리 팀 (Portfolio Management) |
최적의 사업 포트폴리오를 구성하기 위해 시장 동향에 대한 정보 수집 및 분석을 바탕으로 향후 시장 수요의 특성과 성장성 및 유망성을 예측하는 업무를 수행합니다. 바이오시밀러 및 항체신약, 백신 등 제품군별 신규 파이프라인을 검토하고 기존 파이프라인을 정비하는 역할을 하고 있습니다. |
|
공급 관리 팀 (Supply Chain Management) |
CMO와의 계약 체결부터 제품의 출고까지의 전 과정을 영업과 생산 사이에서 조율하고 관리 감독하고 있습니다. 그뿐만 아니라 당사 제품이 GMP 규격에 맞게 생산되고 있는지 정기적으로 모니터링하여 제품의 품질 및 생산 비용을 직접적으로 관리하거나 통제하기도 합니다. 필요에 따라 기술이전 계약이 체결된 파트너사에게 기술이전을 지원하는 팀이기도 합니다. |
|
파트너사 관리 팀 (Alliance Management) |
파트너사와의 계약에 있어 필수 단계인 기술 실사(Technical Due Diligence) 준비부터 계약 체결 후의 파트너십 관리를 담당하고 있습니다. 계약지역의 시장 동향을 상시 파악하고, 파트너사의 경영상황 및 재무 실적 등을 정기적으로 모니터링하여 계약상 변경이 요구되는 경우 신속히 대응하고 있습니다. |
[프레스티지바이오로직스]
프레스티지바이오로직스(주)는 홈페이지 등을 통하여 당사의 생산설비 및 서비스에 대한 정보를 제공하고 있으며, 관계회사인 프레스티지바이오파마와 함께 해외 전시 및 컨퍼런스 참가 등을 통하여 기존 및 잠재고객을 대상으로 당사의 최신장비, 시설확장, 우수한 인재 등의 정보를 업데이트 하여 제공하고 있습니다.
라. 수주상황
본 분기보고서 작성기준일 현재 당사의 수주현황은 다음과 같습니다.
| (단위 : USD) |
| 품목 | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
|---|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
| 스푸트니크 라이트 COVID-19 백신 |
2021년 4분기 |
(주1) | (주1) | 136,320,000 | - | - | (주1) | 136,320,000 |
| M01/M02 위탁생산 |
2024년 1분기 |
(주1) | (주1) | 6,818,380 | - | 4,505,030 | - | 2,313,350 |
| 바이오 의약품 위탁생산 (주2) |
2025년 1분기 |
- | - | 2,688,380 | - | - | - | 2,688,380 |
| 합 계 | - | 145,826,760 | - | 4,505,030 | - | 141,321,730 | ||
(주1) 계약 세부내용의 경우 양사간 협약한 기밀에 해당되므로 내용을 기재하지 않았습니다.
(주2) 고객사 요청으로 인해 해당 품목은 비공개 하고 있습니다.
5. 위험관리 및 파생거래
가. 시장위험과 위험관리
(1) 환위험
당사는 다양한 통화로 거래함에 따라 환율변동위험에 노출되어 있습니다. 환율변동위험에 노출되는 주요 통화로는 EUR, KRW, SGD 등이 있습니다. 당사 환율 관리의 기본 전략은 지속적인 모니터링을 통해 환율 영향으로 인한 손익 변동성을 축소하는 것입니다.
보고기간 종료일 현재 외환위험에 노출되어 있는 금융자산ㆍ금융부채의 내역은 다음과 같습니다.
|
(단위: USD) |
|
구 분 |
당분기말 |
||||||
|---|---|---|---|---|---|---|---|
| SGD | EUR | KRW | GBP | HKD | USD |
합계 |
|
| 금융자산 | 962,601 | 520,999 | 130,995 | 1,851 | - | - | 1,616,446 |
| 금융부채 | 1,723,151 | 2,132,275 | 42,891 | - | 7,268 | - | 3,905,585 |
| 순금융자산(부채) | (760,550) | (1,611,276) | 88,104 | 1,851 | (7,268) | - | (2,289,139) |
주1) K-IFRS 연결재무재표 기준으로 작성하였습니다.
|
(단위: USD) |
|
구 분 |
전기말 |
|||||||
|---|---|---|---|---|---|---|---|---|
| SGD | EUR | KRW | GBP | MYR | HKD | USD |
합계 |
|
| 금융자산 | 1,184,950 | 328,438 | 137,878 | - | - | - | - | 1,651,266 |
| 금융부채 | 1,427,042 | 1,827,077 | 619,942 | 7,661 | 27,007 | 7,241 | - | 3,915,970 |
| 순금융자산(부채) | (242,092) | (1,498,639) | (482,064) | (7,661) | (27,007) | (7,241) | - | (2,264,704) |
주1) K-IFRS 연결재무재표 기준으로 작성하였습니다.
보고기간 종료일 현재 다른 모든 변수가 일정하고 각 외화에 대한 기능통화의 환율이10% 변동시 법인세비용차감전순손익에 미치는 영향은 다음과 같습니다.
|
(단위: USD) |
|
구 분 |
세후 이익에 대한 영향 |
자본에 대한 영향 |
||
| 당기 | 전기 | 당기 | 전기 | |
| 10% 환율 상승시 | (228,915) | (174,451) | (228,915) | (174,451) |
| 10% 환율 하락시 | 228,915 | 174,451 | 228,915 | 174,451 |
(2) 이자율위험
이자율위험은 미래의 시장이자율 변동에 따라 예금 또는 차입금 등에서 발생하는 이자수익 및 이자비용이 변동될 위험으로서 이는 주로 변동금리부 조건의 예금과 차입금에서 발생하고 있습니다. 당사의 이자율위험관리의 목표는 이자율변동으로 인한 불확실성과 순이자비용의 최소화를 추구함으로써 기업의 가치를 극대화하는데 있습니다.
보고기간 종료일 현재 다른 모든 변수가 일정하고 변동이자부 차입금의 이자율이 0.5% 변동 시 세후이익에 미치는 영향은 다음과 같습니다.
|
(단위: USD) |
| 이자율 |
당분기 |
전기 | ||
|---|---|---|---|---|
|
세후 이익에 |
자본에 |
세후 이익에 |
자본에 |
|
|
0.5% 상승시 |
(354,514) | (354,514) | (190,554) | 190,554 |
|
0.5% 하락시 |
354,514 | 354,514 | 190,554 | 190,554 |
나. 신용위험
당사는 금융상품의 당사자 중 일방이 의무를 이행하지 않아 상대방에게 재무손실을 입힐 신용위험에 노출되어 있습니다. 신용위험은 주로 현금및현금성자산, 당기손익-공정가치측정금융자산 등으로부터 발생하고 있습니다. 당사는 금융기관에 현금및현금성자산을 예치하고 있으며, 신용등급이 우수한 금융기관과 거래하고 있으므로 금융기관으로부터의 신용위험은 제한적입니다.
(1) 보고기간 종료일 현재 신용위험에 대한 최대 노출 정도는 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 현금및현금성자산 | 97,956,034 | 157,956,551 |
| 단기금융상품 | 38,000,000 | - |
| 매출채권 | 2,925,054 | 281,886 |
| 기타금융자산 | 9,474,221 | 6,753,026 |
| 기타비유동금융자산 | 460,952 | 396,994 |
| 합 계 | 148,816,261 | 165,388,457 |
| 주1) K-IFRS 연결재무재표 기준으로 작성하였습니다. |
(2) 금융자산의 손상
당사는 기대신용손실 모형이 적용되는 다음의 금융자산을 보유하고 있습니다.
·상각후원가로 측정하는 기타 금융자산
현금성자산도 손상 규정의 적용대상에 포함되나 식별된 기대신용손실은 유의적이지 않습니다.
당분기 중 금융자산 손실충당금 변동내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 대여금 | 미수이자 | 합계 | |||
|---|---|---|---|---|---|---|
| 당분기 | 전기 | 당분기 | 전기 | 당분기 | 전기 | |
| 기초 | 3,017,399 | 3,017,399 | 1,325,569 | 1,325,569 | 4,342,968 | 4,342,968 |
| 당기손익으로 인식된 손실충당금의 증가 | - | - | - | - | - | - |
| 기말 | 3,017,399 | 3,017,399 | 1,325,569 | 1,325,569 | 4,342,968 | 4,342,968 |
대여금은 만기가 미경과한 금융자산이나, 부도위험 및 기대손실 등에 대한 가정에 기초하여 손실충당금을 측정하였습니다.
기대신용손실을 측정하기 위하여 당사는 다음의 단계 중 해당 금융자산이 포함되는 단계를 결정합니다.
ㆍ 1단계: 최초 인식 시점에 신용손실이 없었으며, 최초 인식 이후 신용위험의 유의적인 증가가 없는 금융자산이 포함됨. 이러한 자산에 대해서는 12개월 기대신용손실을 인식함
ㆍ 2단계: 최초 인식 시점에 신용손실이 없었으나, 최초 인식 이후 신용위험이 유의적으로 증가한 금융자산이 포함됨. 이러한 자산에 대해서는 전체기간 기대신용손실을 인식하며 이자수익은 여전히 해당 자산 총장부금액에 대해 계산됨
ㆍ 3단계: 보고기간 종료일 현재 손상의 객관적인 증거가 있는 금융자산이 포함됨. 이러한 자산에 대해서는 전체기간 기대신용손실을 인식하며 이자수익은 순장부금액(총장부금액에서 손실충당금 차감 순액)에 대해 계산됨
기대신용손실은 금융상품의 기대존속기간에 걸친 신용손실의 확률가중추정치입니다. 신용손실은 계약에 따라 지급받기로 한 모든 계약상 현금흐름과 부도위험 및 기대손실 등을 고려한 수취할 것으로 예상하는 모든 계약상 현금흐름의 차이를 최초 유효이자율로 할인한 금액입니다.
당사는 특수관계자로부터의 대여금에 대한 기대신용손실을 측정하기 위하여 최초 인식 시점 이후 신용위험이 유의적으로 증가하였는지를 평가하였습니다. 당사는 신용이 손상된 금융자산을 결정하기 위하여 다음과 같은 정보를 활용합니다.
ㆍ 차입자의 유의적인 재무적 어려움, 채무불이행이나 연체 같은 계약 위반
ㆍ 차입자의 재무적 어려움에 관련된 경제적이나 계약상 이유로 당초 차입조건의
불가피한 완화
ㆍ 차입자의 파산 가능성이 높아지거나 그 밖의 재무구조조정 가능성이 높아짐
추정미래현금흐름을 최초 유효이자율로 할인한 현재가치가 해당 금융자산의 장부금액에 미달하는 경우 손상차손으로 당기손익에 인식하며, 회수가능금액이 증가하여 추정미래현금흐름의 현재가치가 장부금액을 초과하는 경우 손상차손은 환입됩니다.
다. 유동성위험
유동성위험은 당사가 유동성 부족으로 인해 금융부채에 대한 지급 의무를 이행 못하거나, 정상적인 영업을 위한 자금조달이 불가능한 경우 발생할 수 있습니다. 당사는 3개월 및 연간자금수지계획을 수립함으로써 영업활동, 투자활동, 재무활동에서의 자금수지를 미리 예측하고 있으며, 이를 통해 필요 유동성 규모를 사전에 확보하고 유지하여 향후에 발생할 수 있는 유동성위험을 사전에 관리하고 있습니다.
유동성 위험 분석 내역은 다음과 같습니다.
| (단위: USD) |
| 당분기말 | 장부금액 |
1년 미만 |
1년 ~ 2년 |
2년 ~ 5년 |
5년 초과 |
|---|---|---|---|---|---|
| 매입채무 및 기타채무 | 15,075,004 | 15,075,004 | - | - | - |
| 차입금 및 이자비용 | 99,834,123 | 75,749,855 | - | 24,084,267 | - |
| 리스부채 | 1,573,109 | 977,548 | 344,384 | 196,958 | 54,218 |
| 기타금융부채 | 3,772,109 | 3,772,109 | - | - | - |
| 유동파생상품부채 | 10,407,444 | 10,407,444 | - | - | - |
| 합 계 | 130,661,790 | 105,981,961 | 344,384 | 24,281,226 | 54,218 |
| 주1) K-IFRS 연결재무재표 기준으로 작성하였습니다. |
| (단위: USD) |
| 전기말 | 장부금액 |
1년 미만 |
1년 ~ 2년 |
2년 ~ 5년 |
5년 초과 |
|---|---|---|---|---|---|
| 매입채무 및 기타채무 | 18,399,100 | 18,399,100 | - | - | - |
| 차입금 및 이자비용 | 63,412,232 | 19,778,425 | 46,189,959 | 25,245,648 | 1,819,952 |
| 리스부채 | 1,133,636 | 686,308 | 446,949 | 2,310 | - |
| 기타금융부채 | 4,841,920 | 4,841,920 | - | - | - |
| 유동파생상품부채 | 11,113,830 | - | - | - | - |
| 합 계 | 98,900,718 | 43,705,753 | 46,636,908 | 25,247,958 | 1,819,952 |
| 주1) K-IFRS 연결재무재표 기준으로 작성하였습니다. |
라. 자본관리위험
당사의 자본 관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본 비용을 절감하기 위해 최적의 자본 구조를 유지하는 것입니다.
당사는 자본조달비율에 기초하여 자본을 관리하고 있습니다. 자본조달비율은 순부채를 총자본으로 나누어 산출하고 있습니다. 순부채는 총차입금(연결재무상태표의장단기차입금 및 장단기리스부채 포함)에서 현금및현금성자산을 차감한 금액이며 총자본은 연결재무상태표의 "자본"에 순부채를 가산한 금액입니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 단기차입금 | 38,000,000 | - |
| 유동성장기차입금 | 8,818,705 | 7,839,910 |
| 장기차입금 | 24,084,267 | 28,971,651 |
| 전환사채 | 28,931,152 | 26,600,671 |
| 유동성리스부채 | 855,549 | 684,427 |
| 비유동리스부채 | 585,636 | 449,209 |
| 총차입금 | 101,275,309 | 64,545,868 |
| 차감: 현금및현금성자산 | 97,956,034 | (157,956,551) |
| 순부채(A) | 3,319,275 | (93,410,683) |
| 자본총계 | 368,958,940 | 371,078,210 |
| 총자본(B) | 372,278,215 | 277,667,527 |
| 자본조달비율(A/B) |
0.89% |
- |
마. 파생상품 및 풋백옵션 등 거래 현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
6. 주요계약 및 연구개발활동
가. 경영상의 주요계약
(1) 라이선스아웃 (License-out) 계약
| 품목 | 계약 상대방 | 대상 지역 | 계약 체결일 | 계약 종료일 | 계약금액 | 수취금액 | 진행 단계 |
|---|---|---|---|---|---|---|---|
| HD201 Tuznue |
Cipla Gulf FZ LLC | 남아시아(일부), 중동 및 북아프리카(일부) |
2018.12.04 | 국가별, 제품 출시로부터 5년 |
주1) | 주1) | 유럽연합 집행위원회 (EC) 품목허가 최종승인 |
| Cipla Gulf FZ LLC | 중동 및 북아프리카(일부) 추가 계약 |
2020.02.01 | 국가별, 제품 출시로부터 5년 |
주1) | 주1) | ||
| PHARMAPARK LLC | 러시아 | 2019.04.20 | 제품 출시로부터 10년 | 주1) | 주1) | ||
| Tabuk Pharmaceutical Manufacturing Company |
중동 및 북아프리카(일부) |
2021.01.14 | 국가별, 제품 출시로부터 10년 |
주1) | 주1) | ||
| Dr. Reddy's Laboratories Ltd |
남미 및 동남아시아(일부) |
2021.12.09 | 국가별, 제품 출시로부터 5년 |
주1) | 주1) | ||
| HD204 아바스틴 바이오 시밀러 |
㈜휴온스 | 한국 | 2019.08.27 | 한국식약처 품목허가 승인으로부터 10년 |
USD 1,250,000 |
주1) | 글로벌 임상 3상 진행 중 |
| PHARMAPARK LLC | 러시아 | 2021.03.11 | 제품 출시로부터 10년 | 주1) | 주1) | ||
| Intas Pharmaceuticals Limited |
미국 및 캐나다, 유럽, 중동, 북아프리카, 남미(일부), 동남아시아(일부), CIS 국가(일부) |
2022.07.26 | 특정국가제품 출시로부터 5년 |
주1) | 주1) | ||
| PBP1502 휴미라 바이오 시밀러 |
㈜휴온스 | 한국 | 2019.08.27 | 한국식약처 품목허가 승인으로부터 10년 | USD 1,250,000 |
주1) | 유럽 임상1상 진행 중 |
| 주1) 계약 세부내용의 경우 양사간 협약한 기밀에 해당되므로 내용을 기재하지 않았습니다. |
(가) 파이프라인: Tuznue
|
(1) 계약상대방 |
Cipla Gulf FZ LLC (인도) [이하 "Cipla"] |
|
(2) 계약내용 |
Cipla는 대상지역 내에서 Tuznue에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 공급을 진행 |
|
(3) 대상지역 |
남아시아 및 중동, 북아프리카 국가 8개국 |
|
(4) 계약기간 |
계약체결일: 2018.12.04 추가계약일: 2020.02.01(대상지역 추가) 계약종료일: 국가별 제품 출시로부터 5년 |
|
(5) 총 계약금액 |
계약금 등으로 구성되어 있으며 계약 규모 미공개 |
|
(6) 수취금액 |
계약금(Upfront Payment): 수취, 양사 합의에 의해 금액 미공개 |
|
(7) 계약조건 |
계약금: 계약 체결시 수취, 구체적인 계약조건은 양사 합의에 의해 미공개 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
- 유럽연합 집행위원회(EC)로부터 품목허가 획득 - 대상지역에 대한 시판허가신청은 Cipla가 진행 |
|
(1) 계약상대방 |
PHARMAPARK LLC (러시아) [이하 "PHARMAPARK"] |
|
(2) 계약내용 |
[1] PHARMAPARK는 대상지역 내에서 Tuznue에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 생산 및 공급을 진행 [2] 대상 지역 내에서 제품(Tuznue)의 등록, 생산 및 상업화를 목적으로 당사가 소유하고 있는 제품과 관련된 기존의 기술 및 노하우를 계약상대방에게 전수하고 지적 재산권 사용 권한을 부여 |
|
(3) 대상지역 |
러시아 |
|
(4) 계약기간 |
계약체결일: 2019.04.20 계약종료일: 제품 출시로부터 10년 |
|
(5) 총 계약금액 |
계약금 및 마일스톤, 로열티로 구성되어 있으며 계약 규모 미공개 |
|
(6) 수취금액 |
계약금(Upfront Payment): 수취 |
|
(7) 계약조건 |
- 계약금: 계약 체결시 수취 - 마일스톤: 인허가 및 판매 매출 관련 각 단계별 수취 - 로열티: 매출 발생 시 매출 총이익의 일정 비율 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
- 유럽연합 집행위원회(EC)로부터 품목허가 획득 - 대상지역에 대한 시판허가신청은 PHARMAPARK가 진행 |
|
(1) 계약상대방 |
Tabuk Pharmaceutical Manufacturing Company (사우디아라비아) [이하 "Tabuk"] |
|
(2) 계약내용 |
Tabuk은 대상지역 내에서 Tuznue에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 공급을 진행 |
|
(3) 대상지역 |
중동 및 북아프리카 9개국 |
|
(4) 계약기간 |
계약체결일: 2021.01.14 계약종료일: 국가별 제품 출시로부터 10년 |
|
(5) 총 계약금액 |
계약금 및 마일스톤, 로열티로 구성되어 있으며 계약 규모 미공개 |
|
(6) 수취금액 |
계약금(Upfront Payment): 수취, 양사 합의에 의해 금액 미공개 |
|
(7) 계약조건 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
- 유럽연합 집행위원회(EC)로부터 품목허가 획득 - 대상지역에 대한 시판허가신청은 Tabuk이 진행 |
|
(1) 계약상대방 |
Dr. Reddy's Laboratories Ltd. (인도) [이하 "Dr. Reddy's"] |
|
(2) 계약내용 |
Dr. Reddy's는 대상지역 내에서 Tuznue에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 공급을 진행 |
|
(3) 대상지역 |
남미 및 동남아시아 8개국 |
|
(4) 계약기간 |
계약체결일: 2021.12.09 계약종료일: 국가별 제품 출시로부터 5년 |
|
(5) 총 계약금액 |
계약금 및 마일스톤, 로열티로 구성되어 있으며, 계약 규모 미공개 |
|
(6) 수취금액 |
계약금(Upfront Payment): 수취, 양사 합의에 의해 금액 미공개 |
|
(7) 계약조건 |
계약금: 계약 체결시 수취 마일스톤: 인허가 및 판매 매출 관련 각 단계별 수취 로열티: 매출 발생 시 매출 총이익의 일정 비율 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
- 유럽연합 집행위원회(EC)로부터 품목허가 획득 - 대상지역에 대한 시판허가신청은 Dr. Reddy's가 진행 |
(나) 파이프라인: HD204 아바스틴 바이오시밀러
|
(1) 계약상대방 |
㈜휴온스 [이하 "휴온스"] |
|
(2) 계약내용 |
[1] 휴온스는 대상지역 내에서 HD204에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 생산 및 공급을 진행 [2] 대상 지역 내에서 제품(HD204)의 등록, 생산 및 상업화를 목적으로 당사가 소유하고 있는 제품과 관련된 기존의 기술 및 노하우를 계약상대방에게 전수하고 지적 재산권 사용 권한을 부여 |
|
(3) 대상지역 |
한국 |
|
(4) 계약기간 |
계약체결일: 2019.08.27 계약종료일: 한국 식약처 품목허가 승인으로부터 10년 |
|
(5) 총 계약금액 |
총 계약금액은 1,250,000 USD로 계약금 및 마일스톤, 로열티로 구성됨 |
|
(6) 수취금액 |
계약금(Upfront Payment): 수취, 양사 합의에 의해 계약 규모 미공개 |
|
(7) 계약조건 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
글로벌 임상 3상 진행 중 |
|
(1) 계약상대방 |
PHARMAPARK LLC (러시아) [이하 "PHARMAPARK"] |
|
(2) 계약내용 |
PHARMAPARK는 대상지역 내에서 HD204에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 생산 및 공급을 진행 |
|
(3) 대상지역 |
러시아 |
|
(4) 계약기간 |
계약체결일: 2021.03.11 계약종료일: 제품 출시로부터 10년 |
|
(5) 총 계약금액 |
계약금 및 로열티로 구성되어 있으며 계약 규모 미공개 |
|
(6) 수취금액 |
계약금(Upfront Payment): 수취, 양사 합의에 의해 계약 규모 미공개 |
|
(7) 계약조건 |
계약금: 계약 체결시 수취 로열티: 매출 발생 시 매출 총이익의 일정 비율 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
글로벌 임상 3상 진행 중 |
|
(1) 계약상대방 |
Intas Pharmaceuticals Limited [이하 "Intas"] |
|
(2) 계약내용 |
Intas는 대상지역 내에서 HD204에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 생산 및 공급을 진행. Intas Pharmaceuticals Limited는 자회사인 Accord Healthcare와 협업하여 계약 이행 가능. |
|
(3) 대상지역 |
미국 및 캐나다, 유럽, 중동, 북아프리카, 남미, 동남아시아, CIS 82개국 |
|
(4) 계약기간 |
계약체결일: 2022.07.26 계약종료일: 특정국가 제품 출시로부터 5년 |
|
(5) 총 계약금액 |
마일스톤 및 로열티로 구성되어 있으며 계약 규모 미공개 |
|
(6) 수취금액 |
N/A |
|
(7) 계약조건 |
마일스톤: 인허가 및 판매 매출 관련 각 단계별 수취 로열티: 매출 발생 시 매출 총이익의 일정 비율 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
글로벌 임상 3상 진행 중 |
(다) 파이프라인: PBP1502 휴미라 바이오시밀러
|
(1) 계약상대방 |
㈜휴온스 [이하 "휴온스"] |
|
(2) 계약내용 |
[1] 휴온스는 대상지역 내에서 PBP1502에 대한 독점적 라이선스 실시권을 부여 받아 제품의 마케팅, 판매, 제품 생산 및 공급을 진행 [2] 대상 지역 내에서 제품(PBP1502)의 등록, 생산 및 상업화를 목적으로 당사가 소유하고 있는 제품과 관련된 기존의 기술 및 노하우를 계약상대방에게 전수하고 지적 재산권 사용 권한을 부여 |
|
(3) 대상지역 |
한국 |
|
(4) 계약기간 |
계약체결일: 2019.08.27 계약종료일: 한국 식약처 품목허가 승인으로부터 10년 |
|
(5) 총 계약금액 |
총 계약금액은 1,250,000 USD로 계약금 및 마일스톤, 로열티로 구성되어 있음. |
|
(6) 수취금액 |
계약금(Upfront Payment): 수취, 양사 합의에 의해 계약 규모 미공개 |
|
(7) 계약조건 |
계약금: 계약 체결시 수취 마일스톤: 인허가 관련 각 단계별 수취 로열티: 매출 발생 시 매출 총이익의 일정 비율 |
|
(8) 회계처리방법 |
- 수취된 대금(계약금 및 마일스톤)은 품목허가 또는 특정제품매출 달성 하는 시점에 수익 인식 예정 - 대상지역 내에서 제품 상용화 이후 매출이 발생하면 받는 로열티는 수취 시 인식 예정 |
|
(9) 개발진행경과 |
유럽 임상 1상 진행 중 |
(2) 라이선스인 (License-in) 계약
(가) 파이프라인: PBP1510 췌장암 항체신약
|
(1) 계약상대방 |
동아대학교 산학협력단 및 동아대학교 고상석 교수 |
|
(2) 계약내용 |
PAUF 유전자를 표적으로 하는 췌장암 및 난소암 치료용 항체의 개발, 임상, 글로벌 상용화 권리를 위한 기술도입 계약으로, 체결된 계약조건에 따라 당사는 글로벌 상용화 권리와 지적재산권 소유권(공동)을 확보 |
|
(3) 대상지역 |
전 세계 |
|
(4) 계약기간 |
계약체결일: 2017.11.30 |
|
(5) 총 계약금액 |
계약금, 마일스톤 및 로열티로 구성되어 있으며, 계약 규모 미공개 |
|
(6) 지급 금액 |
<환수 불가능 금액> 계약금(Upfront Payment): 지급 마일스톤 (Milestone): 일부 지급 |
|
(7) 계약조건 |
계약금: 계약 체결시 지급 |
|
(8) 개발진행경과 |
스페인, 미국 임상 1/2a상 진행 중 (스페인 2022년 1분기 1/2a상 임상계획 승인, 미국 2022년 2분기 1/2a상 임상계획 승인) 싱가포르 임상 1상 진행 중(2023년 3분기 임상1상 임상계획 승인) |
(3) 개발 및 제조관련 계약
| 구분 | 계약 상대방 | 계약 체결일 |
계약 종료일 | 계약 목적 및 주요 내용 | 계약 금액 |
| 위탁개발생산계약 (Contract Development & Manufacturing Agreement) |
프레스티지바이오로직스 주식회사 | 2023.08.15 | 임상시험용 제품의 개발 및 생산 | 프레스티지바이오로직스와의 Master Service Agreement (MSA) |
주1) |
| 위탁생산계약 (Contract Manufacturing Agreement) |
프레스티지바이오로직스 주식회사 | 2024.12.05 | 원료의약품 생산계약 | 프레스티지바이오로직스와의 트라스투주맙(HD201) 원료의약품 생산계약 |
주1) |
| 주1) 계약 세부내용의 경우 양사 간 협약한 기밀에 해당되므로 내용을 기재하지 않았습니다. 주2) 바이오시밀러 산업에서 생산기술과 설비가 중요한 부분을 차지하는 만큼, 당사는 프레스티지바이오로직스 주식회사에 제조 우선권을 부여함으로써 안정적인 제품 생산을 지원받고 있습니다. |
(4) 기타 계약
본 분기보고서 작성기준일 현재 당사가 체결중인 주요 기타 계약은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 계약 상대방(주1) | 계약 체결일 |
계약 종료일 |
계약 목적 및 주요 내용 | 계약 금액 |
|---|---|---|---|---|---|
| 연구설비매매 계약 |
양도인: 프레스티지바이로직스 주식회사 양수인: 프레스티지바이오파마아이디씨 주식회사 |
2022.10.06 | - | 연구설비 자산양수도 | 792 |
| 주1) 프레스티지바이오파마코리아 주식회사는 프레스티지바이오파마아이디씨 주식회사로 회사명이 변경되었습니다. |
나. 연구개발활동
[프레스티지바이오파마]
(1) 연구개발활동의 개요
당사는 자체 R&D 연구소를 보유하고 있으며, 바이오시밀러와 바이오신약 연구 및 개발과 세포주 개발 및 평가, 바이오의약품 분석개발 및 검증, 바이오의약품의 구조분석을 수행하고 있으며, 당사의 파이프라인은 다음과 같습니다.
|
구분 |
주성분명 |
적응증 |
오리지널(제약사) |
파이프 |
개발 단계 |
|---|---|---|---|---|---|
|
바이오시밀러 |
트라스트주맙 (Trastuzumab) |
유방암,전이성 위암 등 |
허셉틴(로슈) |
HD201 |
2024년 9월 유럽연합 집행위원회(EC) 품목허가 획득 |
|
바이오시밀러 |
베바시주맙 (Bevacizumab) |
유방암, 폐암,위암,대장암,난소암 등 |
아바스틴(로슈) |
HD204 |
글로벌 임상 3상 진행 중 |
|
바이오시밀러 |
아달리무맙 (Adalimumab) |
류마티스관절염,건선 등 |
휴미라(애브비) |
PBP1502 |
임상 1상 진행 중 |
|
항체신약 |
Anti-PAUF |
췌장암, 난소암 |
First in Class |
PBP1510 |
임상 1/2a상 진행 중 |
|
바이오시밀러 |
데노수맙 (Denosumab) |
골소실, 골다공증 등 |
프롤리아(암젠) |
PBP1601 |
전임상 진행 중 (마스터세포은행 및 제조용세포은행 생성 완료) |
|
바이오시밀러 |
애플리버셉트 (Aflibercept) |
황반부종, 망막병증, 전이성 대장암 등 |
아일리아(리제네론) |
PBP1602 |
전임상 진행 중 (마스터세포은행 및 제조용세포은행 생성 완료) |
|
바이오시밀러 |
에쿨리주맙 (Eculizumab) |
비정형,용혈성 요독 증후군 |
솔리리스(알렉시온) |
PBP1603 |
세포주 개발 |
|
항체신약 |
Anti-CTHRC1 |
난치성 고형암 |
First in Class |
PBP1710 |
전임상 진행 중 (마스터세포은행 및 제조용세포은행 생성 완료) |
| 바이오시밀러 | 니볼루맙 (Nivolumab) |
흑색종,요로상피세포암 | 옵디보(BMS) | PBP2101 | 세포주 개발 |
| 바이오시밀러 | 펨브롤리주맙 (Pembrolizumab) |
흑색종, 비소세포폐암, 요로상피암 | 키트루다(머크) | PBP2102 | 세포주 개발 |
(2) 연구개발 담당조직
(가) 연구개발 조직 개요
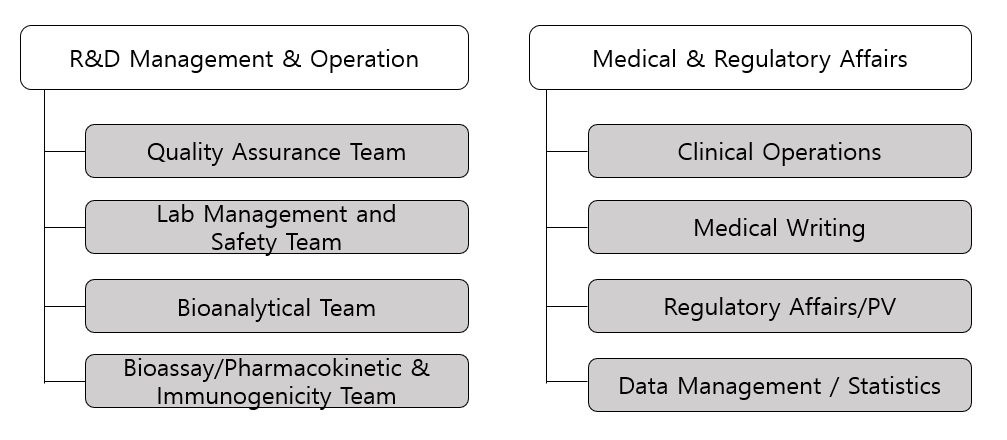
당사의 R&D 연구소는 싱가포르의 바이오 연구개발(R&D) 산업단지 '바이오폴리스'에 위치하고 있으며, 총 9개 팀으로 구성되어 있습니다.
당사의 연구개발 조직의 구성 및 각 조직별 업무내용은 다음과 같습니다.
| 팀 | 주요 업무 | |
|---|---|---|
| Quality Assurance Team | 현재 연구개발 진행 중인 제품에 효과적인 점검 및 관리 시스템을 적용하여 제품의 품질을 보증하는 업무를 수행 | |
| Lab Management and Safety Team | 시험 데이터를 안전하게 보호하고 안전한 연구 환경을 유지하기 위해 전반적인 실험실 관리업무 수행 | |
|
Bioanalytical Team |
연구개발 진행 중인 바이오시밀러나 항체 의약품의 구조 및 성분을 분석하는 팀으로, Mass, 서열 분석, SE-HPLC, RP-HPLC, Glycan과 monosaccharide 등의 당분석, isomerization, sialylation 확인 및 UV, Fluorescence, CD, FT-IR, DSC, CE-SDS, DLS, CEX-HPLC, clEF 등의 실험을 진행 |
|
|
Bioassay/Pharmacokinetic & |
[Bioassay] |
|
| Medical & Regulatory Affairs |
Clinical Operations | CRO 및 vendor 선정 및 관리, 임상시험연구진(PI) 선정 및 관리, Risk assessment 등 임상시험 전반 GCP적 관리 감독하고 임상시험 현장관리, 임상시험데이터 모니터링, Trial Master File (TMF) 관리 |
| Medical Writing | 임상시험 계획 및 protocol 작성, 임상 데이터 분석 및 통계학적 분석, 관련 논문 작성 등을 수행 | |
| Regulatory Affairs/PV | FDA, EMA, 식약처 등 글로벌 규제기관 대응 업무 및 약사감시(Pharmacovigilance) 업무 제품의 허가 등록을 위해 진행하는 시험을 관리 감독하며 각 국가의 의약품 규제기관에서 제출하도록 요구되는 기술 문서(dossier) 작성 |
|
| Data Management/ Statistics | 임상시험데이터 플랫폼 구축, 실시간 데이터 입력 지원 및 데이터 관리 (EDC, eTMF) | |
 |
|
연구개발 조직도 |
(나) 연구개발 인력 현황
본 분기보고서 작성기준일 현재 박사급 6명과 석사급 8명을 포함하여 총 49명의 연구개발 인원을 보유하고 있으며, 전체 인력(67명) 중 약 73%를 차지합니다.
| (단위: 명) |
| 구 분 | 인 원 | ||||
|---|---|---|---|---|---|
| 박 사 | 석 사 | 기 타 | 합 계 | ||
| Management and Operation | 1 | - | - | 1 | |
| Quality Assurance Team | - | 2 | 9 | 11 | |
| Lab Management and Safety Team | - | 1 | 1 | 2 | |
| Bioanalytical Team | 1 | 1 | 3 | 5 | |
| Bioassay Team/Pharmacokinetic & Immunogenicity Team | 1 | 2 | 5 | 8 | |
| Clinical Development |
Clinical Operations | - | - | 8 | 8 |
| Data Management / IT | - | 1 | 3 | 4 | |
| Regulatory & Medical Affairs |
Regulatory Affairs / PV | 3 | 1 | 6 | 10 |
| 합 계 | 6 | 8 | 35 | 49 | |
(다) 핵심 연구인력
당사의 핵심 연구 인력 현황은 아래와 같습니다.
| 직위 |
성명 |
담당 |
주 요 경 력 |
주요연구실적 |
|---|---|---|---|---|
|
CEO |
박소연 |
경영 및 개발 |
('81.03~'85.02) 이화여자대학교 약학 학사 ('85.08~'87.08) 이화여자대학교 의학 화학 석사 ('91.08~'95.12) Univ. of Missouri-Columbia, ('95.12~'96.09) KIST 대사독성연구실, Postdoc ('96.10~'99.10) 미국 MIT 화학과 독성학분과 ('99.11~'04.02) 바이오메드랩 연구소장/ ('04.03~'09.03) 한국 안전성평가연구소 ('04.03~'09.03) 한국과학기술대학원 겸임 교수 ('06.11~'09.03) KIT-ISIS바이오신약개발 ('09.04~'15.06) Qion Pte. Ltd. (싱가포르) CSO ('12.01~'18.11) 싱가포르 국립과학기술연구소 ('15.09~'19.10) 프레스티지바이오로직스(한국) 연구소장 ('15.07~현재) Prestige Biopharma Limited |
[논문] TROIKA-1: A double-blind, randomized, parallel group, study aimed to demonstrate the equivalent pharmacokinetic profile of HD201, a potential biosimilar candidate to trastuzumab, versus EU-Herceptin® and US-Herceptin® in healthy male subjects. Pharmacology Research & Perspectives, July 26, 2021 [논문] Assessment of quality and clinical similarity (pharmacokinetic and safety) of HD204, a biosimilar of bevacizumab. Journal of Clinical Oncology, May 25, 2020 [논문] HD204: Analytical biocomparability and clinical trial I progression of bevacizumab. Journal of Clinical Oncology, May 26, 2019 [논문] HD201: Analytical biocomparability and clinical trial progression of trastuzumab. Journal of Clinical Oncology, May 26, 2019 [논문] A Randomized Phase I Study Comparing the Pharmacokinetics of HD201, a Trastuzumab Biosimilar, With European Union-sourced Herceptin, Clinical Therapeutics Volume 40, Issue 3, March 2018, Pages 396-405.e4 [논문] The establishment of a porcine rheumatoid arthritis model: Collagen induced arthritis minipig model, Journal of Pharmacological SciencesVolume 132, Issue 1, September 2016, Pages 41-47 [논문] Establishment of normal reference of radiological morphology of renal artery in mini-pigs by renal angiography, pISSN 2466-1384 eISSN 2466-1392, August 2, 2016 |
|
Project |
Jamie |
연구 |
('10~'13) George Mason University 생물학 학사 ('13.08~'17.05) Virginia Commonwealth ('17.08~'19.12) WALGREENS, 약사 ('20.03~현재) Prestige Biopharma Limited, |
- |
|
Project |
Litha |
연구 |
('02.08~'05.05) Bangalore University Affiliated ('06.08~'08.06) Bangalore University Affiliated ('08.09~'10.02) Bioscan Medical Laboratory, ('10.07~'12.07) Qion Pte. Ltd., Study Director ('12.11~'14.05) Bioscan Medical Laboratory, ('15.05~현재) Prestige Biopharma Limited, |
[논문] TROIKA-1: A double-blind, randomized, parallel group, study aimed to demonstrate the equivalent pharmacokinetic profile of HD201, a potential biosimilar candidate to trastuzumab, versus EU-Herceptin® and US-Herceptin® in healthy male subjects. Pharmacology Research & Perspectives, July 26, 2021 [논문] Final analysis of the phase 3 randomized clinical trial comparing HD201 vs. referent trastuzumab in patients with ERBB2?positive breast cancer treated in the neoadjuvant setting. BMC Cancer 23, 112 (2023). |
| Research Scientist |
Neil O'Connor |
연구 개발 |
('04~'08) University College Dublin 화학 학사 ('10~'14) University College Dublin 미생물학/화학 박사 ('15.11~'21.06) Janssen Biologics (존슨앤존슨) 선임 연구원 ('21.09~현재) Prestige Biopharma Limited 책임 연구원 |
[논문] (2014). Novel fluorinated lipopeptides from Bacillus sp. CS93 via precursor-directed biosynthe-sis. Amino Acids, 46, 2745-2752. [논문] (2018). Biodegradation of pentafluorosulfanyl-substituted aminophenol in Pseudomonas spp.. Biodegradation, 29(3), 259 -270. [논문] (2014). Microbial biotransformation of aryl sulfanylpentafluorides. Environmental Science and Pollution Research, 21(1), 753-758. [논문] (2013). A convenient chemical-microbial method for developing fluorinated pharmaceuticals. Organic & Biomolecular Chemistry, 11, 1135-42. |
| Research Scientist |
Paramita Batabyal |
연구 개발 |
('11~'15) Dr. D Y Patil Biotechnology and ('16.07~'18.05) Institute of Chemical ('19.11~'23) Institute of Chemical ('24.01~현재) Prestige Biopharma Limited 연구원 |
[논문] Molecular Docking:Virtual Screening of Phytoconstituent for Drug Discovery. International Journal of Basic and Applied Biology, September 2017 [논문] Xanthine Oxidase: A Versatile Enzyme as a Future Therapeutic Target for Prevention of Inflammation Mediated Disorders. International Journal of Biotech and Biomedical Sciences, October 2017 |
| R&MA Head |
Sumita |
연구 |
('01.02~'06.06) ITS Dental College 치의학 학사 ('16.01~'18.04) Ruby Hall clinic, ('18.04~'19.08) Springer Nature, ('19.12~'20.01) Nuffield Dental Holdings ('20.02~현재) Prestige Biopharma Limited, |
- |
| CMC & BA Manager |
Rusha Chakraborty |
품질 관리 및 바이오 분석 |
('07~'11) National Institute of Technology, Biotechnology 학사 ('11~'16) National University of Singapore, 분자 생물물리학 및 구조 생물학 박사 ('16~'18) National University of Singapore, Postdoc ('18.05~'21.03) Syngene International Limited, 수석연구원 ('21.04~현재) Prestige Biopharma Limited, CMC Manager |
[논문] Structural basis of oligomerization of N-terminal domain of spider Aciniform silk protein International Journal of Molecular Sciences, 2020 [논문] The molten globule state of Maltose-Binding protein: structural and thermodynamic characterization by EPR Spectroscopy and Isothermal Titration Calorimetry Applied Magnetic Resonance, 2020 [논문] Untangling spider silk protein assembly and role of N-terminal domain in silk formation ANZMAG, 2015 |
(3) 연구개발비용
당사의 최근 3년간 연구개발비용은 다음과 같습니다.
|
(단위: USD) |
| 구분 |
당기 (제10기) |
전기 (제9기) |
전전기 (제8기) |
|
|---|---|---|---|---|
| 비용의 성격별 분류 |
원재료비 | 2,448,590 | 7,234,972 | 18,367,729 |
| 인건비 | 5,352,850 | 6,521,689 | 5,358,458 | |
| 감가상각비 | 2,079,950 | 2,697,094 | 2,796,122 | |
| 위탁용역비 | 1,449,931 | 5,184,653 | 17,017,103 | |
| 기타 | 2,857,081 | 1,844,259 | 240,211 | |
| 연구개발비용 합계 | 14,188,403 | 23,482,667 | 43,779,623 | |
| (정부보조 ) | - | - | - | |
| 보조 차감 후 액 | 14,188,403 | 23,482,667 | 43,779,623 | |
| 회계처리 내역 | 판매비와 관리비 | 12,380,795 | 17,571,290 | 30,921,880 |
| 제조경비 | - | - | - | |
| 개발비(무형자산) | 1,807,608 | 5,911,377 | 12,857,743 | |
| 회계처리 액 계 | 14,188,403 | 23,482,667 | 43,779,623 | |
| 연구개발비 / 매출액 비율 [연구개발비용 합계÷당기매출액×100] |
226.04% | 주1) | 주1) | |
주1) 해당 회계연도에는 매출이 존재하지 아니하여 해당 비율을 산정하지 아니합니다.
(4) 연구개발실적
(가) 연구개발 진행 현황 및 향후계획
당사는 안정적인 사업활동에 필요한 역량 구축을 우선 과제로 채택하고 있습니다. 바이오신약의 경우 개발에 성공하는 경우 많은 수익을 창출할 수 있으나 실패하는 경우 회사의 존립을 위협할 수 있을 정도로 위험성이 높습니다. 이에 당사는 리스크가 높은 바이오신약의 개발보다는 리스크가 낮은 바이오시밀러 개발에 우선적으로 사업역량을 집중함으로써, 개발 위험을 낮추고 바이오신약 개발에 필요한 기술과 경험을 축적할 수 있었습니다.
당사 바이오시밀러 및 항체신약 파이프라인의 상세 연구개발 진행 현황은 아래 표와 같습니다.
| 구분 | 주성분명 | 품목 | 적응증 | 연구 시작일 |
현재 진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|---|
| 단계(국가) | 완료일 | |||||||
| 바이오의약품 | 항체 신약 |
Anti-PAUF |
PBP1510 |
췌장암,난소암 |
2015년 |
전임상 |
2020년 2020년 2020년 2020년 2023년 진행중 |
라이선스인 주2) |
|
Anti-CTHRC1 |
PBP1710 |
난치성 고형암 |
2017년 |
전임상(마스터세포은행및제조용세포은행 생성 완료) | 진행중 | 자체개발 | ||
| 바이오 시밀러 |
트라스투주맙 (Trastuzumab) |
HD201 |
유방암, 전이성 위암 등 |
2015년 |
임상 1상(영국) |
2014년 2019년 2019년 2020년 2021년 2021년 2022년 2022년 2022년 2023년 2024년 2024년 |
자산양수/ 라이선스아웃 |
|
|
베바시주맙 (Bevacizumab) |
HD204 |
유방암,폐암,위암, |
2015년 |
임상 1상(뉴질랜드) |
2019년 진행중 |
자산양수/ 라이선스아웃 |
||
|
아달리무맙 (Adalimumab) |
PBP1502 |
류마티스 |
2015년 |
전임상 |
2020년 진행중 |
자체개발/ 라이선스아웃 |
||
|
데노수맙 (Denosumab) |
PBP1601 |
골소실, |
2016년 |
전임상(마스터세포은행및제조용세포은행 생성 완료) |
진행중 | 자체개발 | ||
|
애플리버셉트 (Aflibercept) |
PBP1602 |
황반부종, 망막병증, 전이성 대장암 등 |
2016년 |
전임상(마스터세포은행및제조용세포은행 생성 완료) | 진행중 | 자체개발 | ||
|
에쿨리주맙 (Eculizumab) |
PBP1603 |
비정형, 용혈성 |
2016년 |
세포주 개발 |
진행중 | 자체개발 | ||
| 니볼루맙 (Nivolumab) |
PBP2101 | 흑색종, 요로상피 세포암 |
2021년 |
세포주 개발 |
진행중 | 자체개발 | ||
| 펨브롤리주맙 (Pembrolizu-mab) |
PBP2102 | 흑색종, 비소세포 폐암, 요로상피암 |
2021년 |
세포주 개발 |
진행중 | 자체개발 | ||
| 주1) 2015년 6월 한화케미칼로부터 허셉틴과 아바스틴 바이오시밀러를 자산 양수도 조건으로 인수하였으며, 인수 당시 허셉틴 바이오시밀러(HD201)와 아바스틴 바이오시밀러(HD204)는 각각 임상 1상 일부와 비임상을 완료한 수준으로 개발 초기 단계였습니다. 인수 이후 당사의 지속적인 개발을 통해 현재 허셉텐 바이오시밀러(HD201)는 유럽연합 집행위원회(EC)로부터 품목허가를 최종승인 받았으며, 아바스틴 바이오시밀러(HD204)의 경우 글로벌 임상 3상 진행 중에 있습니다. 주2) 2017년 11월 동아대학교 산학협력단 및 동아대학교 고상석 교수와 PAUF 유전자를 표적으로 하는 췌장암 및 난소암 치료용 항체의 개발, 임상, 글로벌 상용화 권리를 위한 기술도입을 체결하였습니다. |
당사의 파이프라인 중 개발이 가장 앞선 허셉틴 바이오시밀러(HD201)는 2019년 4월 유럽의약품청(EMA)에 품목허가신청서(MAA)를 제출한 이후, COVID-19로 인한장기간 심사가 지연되어 2022년 5월, EMA의 인체의약품위원회(CHMP)는 당사가 제출한 MAA에 대해 당사와 통계적 분석방법에 대한 견해 차이를 보이며 '부정적 의견(Negative Opinion)'을 제시하였습니다. 이에 당사는 심사관과 동등성 평가기준에 이견이 있었던 일부 분석시험에 대한 부정적 의견을 해소하기 위해 해당 분석법에 대한 추가 밸리데이션(Validation) 진행 후 자료를 보완하여 2023년 7월 유럽 EMA에 품목허가신청을 다시 제출하였으며, 2024년 7월 유럽 의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 품목허가 승인 권고(Positive Opinion)를 취득하였고, 2024년 9월 유럽연합 집행위원회(EC)로부터 품목허가를 최종 획득함으로써 HD201 품목명 투즈뉴(Tuznue)로 등록하였습니다.
현재 글로벌 임상 3상 단계에 있는 HD204(아바스틴 바이오시밀러)는 임상 3상 시험을 마친 후 유럽과 미국 동시에 품목허가 신청서를 제출할 예정입니다.
또한 HD201 및 HD204의 개발과정에서 축적한 플랫폼 기술을 활용하여 개발한 PBP1502(휴미라 바이오시밀러)는 2022년 1분기 스페인, 2024년 1월 호주에서 1상 임상계획을 승인받아 현재 임상 1상을 진행하고 있습니다.
췌장암 항체신약인 PBP1510은 췌장암 대부분에서 발견되는 PAUF (Pancreatic Adenocarcinoma Up-regulated Factor)를 중화하는 항체신약으로 PAUF에 기인한 다양한 암 진행 및 전이 메커니즘을 차단합니다. PBP1510은 2022년 2월, 스페인에서 임상 1/2a상에 대한 임상계획을 승인 받았으며, 2022년 6월에는 미국 FDA에서도 임상 1/2a상에 대한 임상계획을 승인 받아 현재 유럽과 미국에서 임상시험을 진행 중이며, 유럽 의약품청(EMA) 및 미국 식품의약국(FDA)에 신약판매허가 신청을 목표로 개발 중에 있습니다. 2020년에는 FDA와 EMA, 한국 식약처로부터 '희귀의약품' 지정을 승인받아 신속허가, 세금 감면 등 다양한 혜택을 받을 수 있게 되었습니다.
당사의 두번째 항체신약 파이프라인인 PBP1710 또한 본격적인 개발에 착수하였으며, 특발성 폐섬유증을 적응증으로 하여 희귀의약품 지정 승인을 받기 위해 노력하고 있습니다. PBP1710은 췌장암, 대장암 등 다양한 종류의 암세포에서 과발현되는 CTHRC1 (Collagen Triple Helix Repeat Containing-1)을 중화하는 항체신약으로 CTHRC1에 기인한 암 진행 및 전이 메커니즘을 차단해, 성공적으로 개발이 완료될 경우 다양한 난치성 고형암종에 적용이 가능할 것으로 예상하고 있습니다.
향후 당사는 새로운 치료표적물질인 PAUF, CTHRC1을 기반으로 한 이중항체 개발 등 다양한 새로운 항체신약개발은 물론 지속적인 연구개발을 통한 새로운 치료표적물질 발굴에도 매진할 계획입니다. 당사는 항체개발 전문 제약사로서 바이오시밀러 및 항체신약 파이프라인의 적절한 조합으로 기업의 안정성을 추구함과 동시에 성장 가능성을 확보함으로써 글로벌 바이오제약사로 발돋움하기 위해 노력하고 있습니다.
투즈뉴(Tuznue)
| ①구분 | 바이오시밀러 |
| ②적응증 | 유방암, 전이성 위암 등 |
| ③성분명 | 트라스투주맙 (trastuzumab) |
| ④작용기전 | 트라스투주맙은 HER2를 표적하는 단일클론 항체치료제이며, HER2 수용체가 과발현되어 있는 암세포에 효과적으로 작용하고 주로 유방암 치료제로 사용됩니다. 이들은 HER2 수용체와 결합하여 과발현된 HER2 신호전달경로를 차단함으로써 암의 성장, 발달을 억제하며, 또한 항체가 갖는 불변 부위에 의해 일어나는 보체의존 세포독성 (ADCC; antibody-dependent cell-mediated cytotoxicity)에 의해 암세포의 사멸 효과를 얻을 수 있습니다. |
| ⑤제품의 특성 |
총 502명의 HER2 양성 유방암 환자를 대상으로 전 세계 13개국에서 진행된 임상 3상 시험 결과, 유방 및 액와부(겨드랑이) 림프절 종양이 완전히 소실된 환자의 비율(병리학적 완전관해율)과 유방조직 내 종양이 완전히 소실된 환자의 비율(유방조직 완전관해율) 평가에서 기존 표적치료제인 허셉틴과 각각 0.5%, 1.7% 이내의 반응 차이를 확인하였고 글로벌 임상 3상을 통해 안전성 및 원약과의 비교동등성 99.5% 입증하였습니다. |
| ⑥진행경과 |
- 글로벌 임상 3상 개시: 2018년 1분기 - 유럽 EMA 품목허가 신청 완료: 2019년 2분기 - 캐나다 식약청 허가 신청 사전미팅: 2020년 1분기 - Bridging Study 완료: 2020년1분기 - 글로벌 임상 3상 최종 결과보고서(CSR) 완료: 2022년 1분기 - 유럽 EMA 품목허가 심사의견에 대한 재심 신청: 2022년 2분기 |
| ⑦향후 계획 | - 미국 FDA 품목허가 신청: 2026년 |
| ⑧경쟁제품 | Ogivri, Ontruzant, Herzuma, Kanjinti 등 |
| ⑨관련논문 등 | * 임상 3상 중간 결과 JAMA Oncology에 발표-2022 [학술지 게재] Efficacy ofHD201 vsReferent Trastuzumab inPatients WithERBB2-Positive Breast Cancer Treated in the Neoadjuvant Setting A Multicenter Phase 3 Randomized Clinical Trial. JAMA Oncology,March 3, 2022 * 미국 식품의약국(FDA) 가교시험 결과 발표-2021 [학술지 게재] TROIKA-1: A double-blind, randomized, parallel group, study aimed to demonstrate the equivalent pharmacokinetic profile of HD201, a potential biosimilar candidate to trastuzumab, versus EU-Herceptin® and US-Herceptin® in healthy male subjects. Pharmacology Research & Perspectives, July 26, 2021 * 유럽 종양학회 정기 학술대회(ESMO)-2020: 임상 연구결과 발표 [학회 발표] A phase III trial to compare the efficacy, safety, pharmacokinetics and immunogenicity of HD201 to trastuzumab in HER2+ early breast cancer patients (TROIKA) [학회 발표] A double-blind, randomized, parallel group study to demonstrate the equivalent pharmacokinetic properties of a single intravenous dose HD201, a trastuzumab biosimilar candidate, versus EU trastuzumab and US trastuzumab * 미국 임상종양학회(ASCO)-2020: 임상 연구결과 발표 [학회 발표] Establishing analytical and clinical similarity between HD201 and herceptin * 임상 1상 관련 연구결과 발표-2018 [학술지 게재] A Randomized Phase I Study Comparing the Pharmacokinetics of HD201, a Trastuzumab Biosimilar, With European Union-sourced Herceptin, Clinical TherapeuticsVolume 40, Issue 3, March 2018, Pages 396-405.e4 등 다수 논문/학회 발표 진행 |
| ⑩시장규모 | - 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 1.81 billion (출처: GlobalData) - 바이오시밀러 글로벌 시장규모: 2026년까지 $ 5.7 billion으로 성장 예상 (출처: GlobalData) |
| ⑪기타사항 | [라이선스아웃 (License-out) 계약]: - Cipla Gulf FZ LLC와 남아시아(일부), 중동 및 북아프리카(일부)판권에 대한 라이선스아웃 계약 체결 (2018년 12월) - Cipla Gulf FZ LLC와 중동 및 북아프리카(일부) 판권에 대한 추가 라이선스아웃 계약 체결 (2020년 02월) - PHARMAPARK LLC와 러시아 판권에 대한 라이선스아웃 계약 체결 (2019년 04월) - Tabuk Pharmaceutical Manufacturing Company와 중동 및 북아프리카 (일부) 판권에 대한 라이선스아웃 계약 체결 (2021년 01월) - Dr. Reddy's Laboratories Ltd와 남미 및 동남아(일부) 판권에 대한 라이선스아웃 계약 체결 (2021년 12월) [라이선스 계약]: 2015년 07월 체결된 라이선스 계약을 토대로 프레스티지바이오로직스는 HD201 개발 과정 중 제조와 관련된 공정 개발 및 품질 관련 분야를 담당. [자산양수도 계약]: 2015년 06월 한화케미칼로부터 허셉틴 바이오시밀러를 자산 양수도 조건으로 인수. 인수 당시 해당 파이프라인의 개발 단계는 임상 1상 일부를 완료한 수준으로 개발 초기 단계였음. [물질이전 계약]: Imagion Biosystems, Inc이 진행하고 있는 의료기기개발 프로젝트를 위해 HD201을 연구 개발 목적으로 공급하기 위한 물질이전계약을 체결(2020년 09월) |
아바스틴 바이오시밀러 (HD204)
| ①구분 | 바이오시밀러 |
| ②적응증 | 전이성 직결장암, 전이성 유방암, 비소세포폐암, 진행성 또는 전이성 신세포암, 교모세포종, 상피성 난소암, 난관암 또는 원발성 복막암, 자궁경부암 |
| ③성분명 | 베바시주맙 (Bevacizumab) |
| ④작용기전 | 베바시주맙은 수용성 VEGF에 결합하여 VEGF가 VEGFR과 상호작용하는 것을 억제하는 인간화 단일클론 항체입니다.VEGF에 대한 항체의 결합은 VEGF가 그것의 수용체와 결합하는 것을 방해하여 VEGF에 의한 생물학적 활성 억제를 유도합니다. VEGFR은 정상 조직 혈관에 비해 종양의 맥관구조(Vasculature) 내피(Endothelium)에 과발현 되어있기 때문에 베바시주맙은VEGF와 결합함으로써 종양의 VEGFR 활성을 억제하여 새로운 혈관형성 활성을 억제합니다. 혈관 형성을 억제되면 종양 세포에 대한 산소와 영양분 공급이 어려워지고, 노폐물이 축적되어 종양 세포가 생존하기 어려운 환경이 조성되어 종양 성장을 억제합니다. |
| ⑤제품의 특성 | 호주에서 진행된 임상 1상 결과, 약동학(PK) 측면 및 안전성 모두에서 US-Avastin 및 EU-Avastin과의 우수한 동등성이 입증되었음 |
| ⑥진행경과 |
- 임상 1상 개시: 2018년 3분기 - 임상 1상 완료: 2019년 2분기 - 글로벌 임상3상 개시: 2019년 2분기 |
| ⑦향후 계획 | - 영국 MHRA 신청: 2025년 하반기 (예정) |
| ⑧경쟁제품 | Mvasi, Zirabev, Krabeva 등 |
| ⑨관련논문 등 | *논문-2021: A Randomized Phase I study comparing the Pharmacokinetics of a bevacizumab (HD204) biosimilar to European Union- and United States of America-sourced bevacizumab, PLOS ONE, 2021. *미국 임상종양학회(ASCO)-2020: 임상 연구결과 발표 [학회 발표] Assessment of quality and clinical similarity (pharmacokinetic and safety) of HD204, a biosimilar of bevacizumab |
| ⑩시장규모 | - 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 1.75 billion (출처: GlobalData) - 바이오시밀러 글로벌 시장규모: 2026년까지 $ 8.47 billion으로 성장 예상 (출처: GlobalData) |
| ⑪기타사항 | [라이선스아웃 (License-out) 계약]: - ㈜휴온스와 한국 판권에 대한 라이선스아웃 계약 체결 (2019년 08월) - PHARMAPARK LLC와 러시아 판권에 대한 라이선스아웃 계약 체결(2021년 03월) - Intas Pharmaceutical Limited와 미국 및 캐나다, 유럽, 중동, 북아프리카, 남미, 동남아시아, CIS 일부 국가의 판권에 대한 라이선스아웃 계약 체결 (2022년 7월) [라이선스계약]: 2015년 07월 체결된 라이선스 계약을 토대로 프레스티지바이오로직스는 HD204 개발 과정 중 제조와 관련된 공정 개발 및 품질 관련분야를 담당. [자산양수도계약]: 2015년 06월 한화케미칼로부터 아바스틴 바이오시밀러를 자산 양수도 조건으로 인수. 인수 당시 해당 파이프라인의 개발 단계는 비임상을 완료한 수준으로 개발 초기 단계였음. |
휴미라 바이오시밀러 (PBP1502)
| ①구분 | 바이오시밀러 |
| ②적응증 | 류마티스 관절염, 건선성 관절염, 축성 척추관절염, 성인 크론병(18세 이상), 건선, 궤양성 대장염, 베체트 장염, 화농성 한선염, 소아 포도막염, 소아 크론별, 소아 특발성 관절염, 소아 판상 건선 치료 |
| ③성분명 | 아달리무맙 (Adalimumab) |
| ④작용기전 | 아달리무맙은 면역반응을 유발하는 사이토카인인 TNF-α의 수용성 형태에 결합하는 항체 치료제입니다. TNF-α에 대한 생물학적 반응은 구조적으로 다르나 유사한 두 가지 TNF 수용체인 TNF-R1와 TNF-R2를 통해 일어나는데, 이러한 높은 친화성 수용체는 세포 표면에서 삼중체(Trimer)로 미리 형성됩니다. 대부분의 세포는 일반적으로 세포 표면에 TNF-R1을 발현하나, TNF-R2는 조혈모세포와 내피세포에 주로 발현됩니다. 아달리무맙은 주로 그들의 변이 부위(Variable region)에 있는 상보성결정부위(CDR; Complementary determining region)를 통하여 국소적 염증 조직 부위로부터 방출되는sTNF-α와 결합하여, 이들이 수용체에 결합하지 못하도록 격리함으로써 시그널을 중화합니다. 또 다른 변이 부위에 의한 기능은 면역 세포 표면에 존재하는mTNF-α에 결합하여 역신호전달과정(Reverse signaling)을 유발하는 것입니다. |
| ⑤제품의 특성 |
전임상을 통해 물리화학적 특성, 생체 내 및 생체 외 생물학적 활성 및 기능 분석, 약동학 및 약력학적(pharmacokinetics/pharmacodynamic) 특성 분석, 동물에 대한 안전성 및 독성 등에 대한 분석을 진행하여 오리지널 의약품과의 유사성을 검증함. 또한 우수한 항체 발현량을 확보하여 높은 생산성 확인 |
| ⑥진행경과 |
- 전임상 완료 - 스페인 1상 임상계획 승인: 2022년 1분기 - 임상 1상 진행 중 |
| ⑦향후 계획 |
- 영국 품목허가 신청: 2026년 (예정) |
| ⑧경쟁제품 | Amgevita, Imraldi, Hulio 등 |
| ⑨관련논문 등 | N/A |
| ⑩시장규모 | - 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 14.49 billion (출처: GlobalData) - 바이오시밀러 글로벌 시장규모: 2026년까지 $ 10.40 billion으로 성장 예상 (출처: GlobalData) |
| ⑪기타사항 | [라이선스아웃 (License-out) 계약]: ㈜휴온스와 한국 판권에 대한 라이선스아웃 계약 체결 (2019년 08월) |
프롤리아 바이오시밀러 (PBP1601)
| ①구분 | 바이오시밀러 |
| ②적응증 | 골소실, 골다공증 등 |
| ③성분명 | 데노수맙 (Denosumab) |
| ④작용기전 | 공개불가 |
| ⑤제품의 특성 | 오리지널 의약품과의 과학적인 유사성을 확인 |
| ⑥진행경과 | - 전임상: 마스터세포은행 및 제조용세포은행 생성 완료 |
| ⑦향후 계획 |
- 글로벌 임상 (1상 및 3상): 2025년 ~ 2027년 (예정) - 유럽 EMA 및 미국 FDA 품목허가 신청: 2027년 (예정) |
| ⑧경쟁제품 | N/A |
| ⑨관련논문 등 | N/A |
| ⑩시장규모 | 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 6.69 billion (출처: GlobalData) |
| ⑪기타사항 | N/A |
아일리아 바이오시밀러 (PBP1602)
| ①구분 | 바이오시밀러 |
| ②적응증 |
황반부종, 망막병증, 전이성 대장암 등 |
| ③성분명 | 애플리버셉트 (Aflibercept) |
| ④작용기전 | 공개불가 |
| ⑤제품의 특성 | 오리지널 의약품과의 과학적인 유사성을 확인 |
| ⑥진행경과 | - 전임상: 마스터세포은행 및 제조용세포은행 생성 완료 |
| ⑦향후 계획 |
- 글로벌 임상 (1상 및 3상): 2025년 ~ 2027년 (예정) - 유럽 EMA 및 미국 FDA 품목허가 신청: 2028년 (예정) |
| ⑧경쟁제품 | N/A |
| ⑨관련논문 등 | N/A |
| ⑩시장규모 | 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 9.88 billion (출처: GlobalData) |
| ⑪기타사항 | N/A |
솔리리스 바이오시밀러 (PBP1603)
| ①구분 | 바이오시밀러 |
| ②적응증 | 비정형 용혈성 요독 증후군 |
| ③성분명 | 에쿨리주맙 (Eculizumab) |
| ④작용기전 | 공개불가 |
| ⑤제품의 특성 | 오리지널 의약품과의 과학적인 유사성을 확인 |
| ⑥진행경과 | - 세포주개발 진행 중 |
| ⑦향후 계획 | 미정 |
| ⑧경쟁제품 | N/A |
| ⑨관련논문 등 | N/A |
| ⑩시장규모 | 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 6.11 billion (출처: GlobalData) |
| ⑪기타사항 | N/A |
옵디보 바이오시밀러 (PBP2101)
| ①구분 | 바이오시밀러 |
| ②적응증 | 흑색종, 요로상피세포암 |
| ③성분명 | 니볼루맙(Nivolumab) |
| ④작용기전 | 공개불가 |
| ⑤제품의 특성 | 오리지널 의약품과의 과학적인 유사성을 확인 |
| ⑥진행경과 | - 세포주개발 진행 중 |
| ⑦향후 계획 |
- 전임상: 2024년 ~ 2025년 (예정) - 글로벌 임상 (1상 및 3상): 2025년 ~ 2027년 (예정) - 유럽 EMA 및 미국 FDA 품목허가 신청: 2028년 (예정) |
| ⑧경쟁제품 | N/A |
| ⑨관련논문 등 | N/A |
| ⑩시장규모 | 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 10.01 billion (출처: GlobalData) |
| ⑪기타사항 | N/A |
키트루다 바이오시밀러 (PBP2102)
| ①구분 | 바이오시밀러 |
| ②적응증 | 흑색종, 비소세포폐암, 요로상피암 |
| ③성분명 | 펨브롤리주맙(Pembrolizumab) |
| ④작용기전 | 공개불가 |
| ⑤제품의 특성 | 오리지널 의약품과의 과학적인 유사성을 확인 |
| ⑥진행경과 | - 세포주개발 진행 중 |
| ⑦향후 계획 |
- 전임상: 2025년 ~ 2026년 (예정) - 글로벌 임상 (1상 및 3상): 2026년 ~ 2028년 (예정) - 유럽 EMA 및 미국 FDA 품목허가 신청: 2028년 (예정) |
| ⑧경쟁제품 | N/A |
| ⑨관련논문 등 | N/A |
| ⑩시장규모 | 오리지널 의약품 글로벌 시장규모: 2023년 기준 $ 25.01 billion (출처: GlobalData) |
| ⑪기타사항 | N/A |
췌장암 항체신약 (PBP1510)
| ①구분 | 항체신약 |
| ②적응증 | 췌장암, 난소암 |
| ③작용기전 | 인체 내에 존재하는 췌장암 전이인자 PAUF를 중화시켜 자가분비 및 주변분비 신호 전달을 감소 |
| ④제품의 특성 |
췌장암 치료 항체신약으로서의 성공 가능성을 인정받아 미국 FDA, 한국 MFDS, 유럽 EMA로부터 희귀의약품 지정을 승인받음. PBP1510은 희귀의약품으로 지정됨에 따라 임상 비용 지원, 신약 시판 승인을 위한 시험 계획 자문, 그리고 시장 독점 등 다양한 혜택의 기회를 얻을 수 있음 |
| ⑤진행경과 |
- Chemical Abstracts Service (CAS) 등록: 2020년 2분기 - WHO 국제일반명(INN) 신청: 2020년 2분기 - 희귀의약품지정 미국FDA 승인: 2020년 2분기 - 희귀의약품지정 한국MFDS 승인: 2020년 3분기 - 희귀의약품지정 유럽EMA 승인: 2020년 4분기 - 스페인 1/2a상 임상계획 승인: 2022년 1분기 - WHO 국제일반명(INN) 'Ulenistamab'으로 등록: 2022년 2분기 - 미국 1/2a상 임상계획 승인: 2022년 2분기 - 미국 패스트트랙 품목 지정: 2023년 1분기 - 유럽과 미국에서 임상 1/2a상 진행 중 - 싱가포르 1/2a상 임상계획 승인: 2023년 3분기 |
| ⑥향후 계획 |
- 글로벌 임상 2상 개시: 2026년 (예정) - 유럽EMA 및 미국FDA 품목허가 신청: 2027년 (예정) |
| ⑦경쟁제품 | 신약으로 해당사항 없음 |
| ⑧관련논문 등 | * 유럽 종양학회(ESMO) 표적항암요법 학회(TAT)-2022: 전임상 연구결과 발표 [학회 발표] Targeting pancreatic adenocarcinoma upregulated factor (PAUF) to treat pancreatic cancer (PC): In vivo efficacy and safety of PBP1510, a first in class monoclonal antibody (mAb) * 난소암의 치료제로서의 효과에 관한 연구 [학술지 게재] PAUF as a Target for Treatment for High PAUF-Expressing Ovarian Cancer, May 6, 2022 |
| ⑨시장규모 | 신약으로 해당사항 없음 |
| ⑩기타사항 | [라이선스인 계약]: 2017년 11월 동아대학교 산학협력단 및 동아대학교 고상석 교수와 PAUF 유전자를 표적으로 하는 췌장암 및 난소암 치료용 항체의 개발, 임상, 글로벌 상용화 권리를 위한 기술도입을 체결. |
고형암 항체신약 (PBP1710)
| ①구분 | 항체신약 |
| ②적응증 | 공개불가 |
| ③작용기전 | 공개불가 |
| ④제품의 특성 |
특발성 폐섬유증을 적응증으로 개발 진행 중에 있으며, 적용할 수 있는 암종의 범위가 넓음. 또한 다른 암 치료법과 함께 사용될 수도 있고 단독으로도 사용될 수 있기 때문에, 단독 사용으로 인한 빠른 내성이나 적용증의 한계를 해결하여 치료 효능의 극대화 가능. |
| ⑤진행경과 | - 전임상: 마스터세포은행 및 제조용세포은행 생성 완료 |
| ⑥향후 계획 |
- 전임상: 2024년 ~ 2025년 (예정) - 글로벌 임상 (1/2a상 및 2상): 2025년 ~ 2027년 (예정) - 유럽 EMA 및 미국 FDA 품목허가 신청: 2028년 (예정) |
| ⑦경쟁제품 | 신약으로 해당사항 없음 |
| ⑧관련논문 등 | [특허] 신규 CTHRC1에 특이적 항체 및 이의 용도 |
| ⑨시장규모 | 신약으로 해당사항 없음 |
| ⑩기타사항 | N/A |
(나) 연구개발 완료 실적
당사는 본 분기보고서 작성기준일 현재 개발이 완료된 제품은 없습니다.
(다) 연구개발활동 및 판매 중단 현황
당사는 본 분기보고서 작성기준일 현재 해당사항이 없습니다.
[프레스티지바이오로직스]
(1) 연구개발활동의 개요
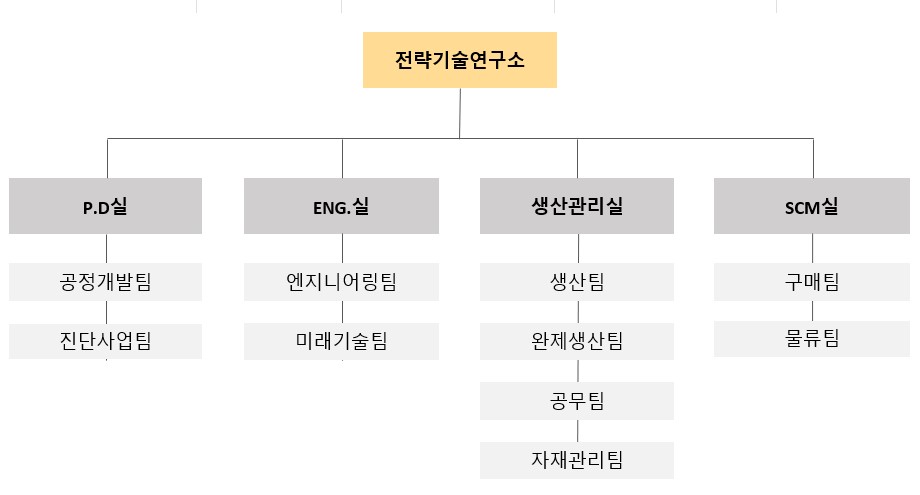
당사는 연구개발 담당조직으로 전략기술연구소 내 공정개발팀,엔지니어링팀이 있으며, 고객사의 가격 경쟁력 향상(원가절감, 생산량 증가 등) 및 Regulatory Documentation을 위한 QbD, DoE 바탕의 공정개발 연구부터 Scale-up, Tech Transfer, Engineering까지 전반에 걸친 개발을 담당하고 있습니다.
(2) 연구개발 담당조직
(가)연구개발 조직개요
 |
|
전략기술연구소 조직도 |
(나) 연구개발 인력현황
보고서 제출일 기준 당사는 박사급 1명, 석사급 10명 등 연구전담인력 103명을 보유하고 있으며, 그 현황은 다음과 같습니다.
|
부서명 |
인원구성 |
업무내용 |
| 공정개발팀 | 28명 | - 품질고도화 기반 항체의약품 생산 공정 개발 및 기존 공정의 최적화 연구 - 항체의약품 생산을 위한 배양 및 정제공정, 시험법 개발 및 기술이전 - 비임상 제조연구 및 DS, DP 안정성 시험 - 생산성 및 수율 향상, 공정시간 단축, 원가절감 구현을 위한 공정 개발 - 바이오시밀러 제품의 생물학적 비교동등성 평가 및 제품 물질 특성 규명 |
| 엔지니어링팀 | 9명 | - 고객 맞춤형 제조 스위트 (Customized Manufacturing Suite) 개발 - 고객 맞춤형 제조 스위트 (Customized Manufacturing Suite) 개발 - 엔지니어링 프로젝트 수행 및 관리 (제조소 신규 및 증설 등) - 신규 제조소 구축을 위한 개념 및 기본설계 - 제품별, 규모별 맞춤형 공정설계 수행 및 엔지니어링 서포트 - 공정개발과 연계한 최적화 엔지니어링 - 엔지니어링 프로젝트 수행 및 관리 (제조소 신규 및 증설 등) - 신규 제조소 구축을 위한 개념 및 기본설계 - 제품별, 규모별 맞춤형 공정설계 수행 및 엔지니어링 서포트 - 공정개발과 연계한 최적화 엔지니어링 |
| 배양팀 | 29명 | - 엄격한 GMP 규정에 기반한 의약품 생산 - 규정을 준수하여 제조 기록 관리 - 규정에 따라 제조시설 관리 및 생산 장비 관리 - 규정에 따라 GMP 문서 관리 및 작성 - 고객 맞춤형 배양 일정 및 생산량 관리 - 고객 맞춤형 배양 공정 설계 및 검토 - 고객 맞춤형 배양 Data 관리 및 제공 - Engineering Batch를 통한 배양 Scale-up 공정 최적환 및 안정성 향상 - 다양한 변수에 대한 배양 모니터링 및 공정 제어를 통한 제품 품질 유지 |
| 정제팀 | 29명 | - 고객사 제품 생산 - 자사 제품 생산 - 제조소 관리 (Plant1, Plant 4) - 항체의약품 생산을 위한 정제 공정 기술이전 (PD → DSP) |
| 완제생산팀 | 8명 | - 임상 샘플 포장 - 제조소 구축위한 Study 및 Qualification/PQ - 작업준비 과정 세척 및 고압멸균/훈증 - Grade A/B 구역 훈증 및 청소/소독 관리 - GMP 문서 제.개정(SOP 및 MBR) - GMP 문서 작성 검토 및 관리(기록서, 점검일지,교육 카드등) - 생산라인 관리 및 1차포장(바이알 세병,여과,멸균,충전,씰링) - 생산라인 관리 및 2차포장(이물검사,라벨링,카톤,일련번호 인쇄) - SAP BOM 등록 및 생산실적등록 - Grade C/D 구역 청소/소독 관리 - 충전 및 포장라인 설비관리 |
|
소계 |
103명 |
[연구개발 인력 현황]
|
구 분 |
박사 |
석사 |
기타 |
합계 |
| 공정개발팀 | 1 | 6 | 21 | 28 |
| 엔지니어링팀 | 1 | 1 | 7 | 9 |
| 배양팀 | - | 3 | 26 | 29 |
| 정제팀 | - | 3 | 26 | 29 |
| 완제생산팀 | - | - | 8 | 8 |
| 합 계 | 2 | 13 | 88 | 103 |
(다) 핵심 연구인력
| 성명 | 직위 | 담당 업무 |
주요경력 | 주요 연구실적 |
|---|---|---|---|---|
| 박주양 | 연구 소장 |
연구소 총괄 |
(19.10 ~ 현재) 프레스티지바이오로직스 전략 기술연구소 총괄 소장 (99.03 ~ 19.08) 한양대학교(서울) 공과대학 토목공학과(환경공학) 교수 (98.08 ~ 99.03) 한국환경정책·평가연구원(책임연구원) (94.12 ~ 98.05) Texas A&M 대 토목공학과 (환경전공), 공학박사 (92.08 ~ 94.02) Texas A&M 대 토목공학과 (환경전공), 공학석사 (81.10 ~ 87.04) 국제종합건설 (대리) (78.03 ~ 82.02) 서울대학교 토목공학과 학사 |
(17.03~20.02) 폐수의 적극적인 에너지 및 질소회수를 위한 다기능 미생물 연료전지 개발 (17.02~18.01) 프레스티지바이오로직스 스마트 팩토리 건설 및 Scale-up 공정개발 (15.09~16.08) 수중 인 제거 및 회수를 위한 영가철 충전 수처리 시스템 개발 (13.12~16.11) 고염도 산업폐수와 유기폐수를 활용한 수소에너지 화수용 미생물 역전기투석 전기분해 장치 기술 개발 (13.10~18.06) 해수담수화 플랜트 부산물 자원화 기술 개발 (12.10~15.09) 원자력 발전소 열수송계통의 ETA 폐수처리를 위한 에너지 회수형 기술개발 (12.03~13.02) Trichloroethylene (TCE)으로 오염된 토양 및 지하수 정화를 위한 전기화학적 Permeable Reactive Barrier (bipolar electro-PRB)기술 개발 이외에 다수의 연구실적과 논문들(해외저명학술지(SCI)에 총74편(2018년기준IF)과 국내 전문학술지에 총55편) |
| 윤지용 | 실장 | P.D실 총괄 |
(22.07~현재) 프레스티지바이오로직스 공정개발실 실장 (21.08~22.07) 프레스티지바이오로직스 백신생산팀 팀장 (20.12~21.07) 프레스티지바이오로직스 공정개발팀 책임 (20.03~21.08) 에이프로젠바이오로직스 정제공정팀 파트장 (15.05 ~20.02) 종근당 바이오생산팀 차장 (07.05 ~15.05) 한화케미칼 중앙연구소 수석연구원 (06.05~07.05) Bristol-Myers Squibb 공정 inspector (98.08~20.09) 경희대학교 화학공학과 석사 (92.03~98.03) 경희대학교 화학공학과 학사 |
(22.07~현재) PBP1510, PBP1502, HD201 항체의약품 공정개발 (21.08~22.07) COVID 19 vaccine 생산 공정개발/생산(시제품완료) (20.12~21.07) PBP1502/PBP1510 신약 항체 정제공정개발 (20.03~21.08) 항체의약품 (레미케이드 BS) 정제 생산 (15.05 ~20.02) 바이오의약품(NESF BS) 생산/CTD 작성, MFDS PMDA 품목 허가참여 (07.05 ~15.05) 항체의약품 (HD201), Non Protein 정제공정 개발 (특허출원), 이중항체 신약 정제공정개발, 특성분석 (06.05~07.05) Abatacept (Orencia) Celltrion CMO공장 PV Batch 참여 (00.09 ~06.04) 재조합의약품 (Growth Hormone) 배양 및 정제공정개발 (98.08~20.09) Clostridium Acetobutylicum B18을 이용한 부탄올 발효 및 추출 |
(3) 연구개발실적
(가) 연구개발 진행 현황 및 향후계획
프레스티지바이오로직스㈜는 파이프라인별 공정개발 및 배지개발을 통해 의약품 생산성 향상, 원가 절감 등 연구개발을 진행할 예정입니다.
| 연구과제 | 연구기관 | 연구시작일 | 현재진행단계 | 비고 |
| HD201 New Process - Media development | 연구소(내부) | 2019.01 | 완료 | (주1) |
| HD201 New Process- Feasibility study | 연구소(내부) | 2021.04 | 완료 | - |
| HD201 New Process - Purification process development (Chromatography process improvement) |
연구소(내부) | 2020.06 | 완료 | - |
| HD204 New Process - Media development | 연구소(내부) | 2019.06 | 완료 | (주1) |
| PBP1502 - Purification process development | 연구소(내부) | 2020.06 | 완료 | - |
|
PBP1502 - Cell culture process development |
연구소(내부) |
2020.12 |
완료 |
- |
|
PBP1510 - Cell culture process development |
연구소(내부) |
2020.03 |
완료 |
- |
|
PBP1510 - Purification process development |
연구소(내부) |
2020.03 |
완료 |
- |
| COVID-19 Vaccine Tech Transfer and Scale-up | 연구소(내부) | 2021.04 | 완료 | - |
|
M01 Project - Process Fit and Transfer |
연구소(내부) | 2023.11 | 완료 | - |
|
M02 Project - Process Fit and Transfer |
연구소(내부) | 2023.12 | 완료 | - |
| PBP1601 Cell culture, Purification process development |
연구소(내부) | 2024.11 | 진행 중 | - |
|
PBP1710 Scale down study and Non-clinical Production |
연구소(내부) | 2025.01 | 진행 중 | - |
주1) HD201/HD204 New process media 개발은 세포배양배지 전문 기업과 공동 개발진행 중입니다.
각각의 연구개발 과제에 대한 현재까지의 진행현황과 계획은 다음과 같습니다.
(1) HD201 New Process - Media development
|
1. 개발과제 |
HD201 New Process - Media development |
|
2. 진행현황 |
세포 배양 공정에서 항체의 생산량을 2배 이상 증대시키기 위하여 신규세포 배양액 선정 및 배양 공정 시스템 개선 연구를 통해 파일럿 스케일에서 기존 공정 대비 200% 이상 증대된 생산성을 확보하였음. 뿐만 아니라 기존 임상 1/3상, PV 배치에서 생산된 제품과의 품질 동등성도 확보되었음. 세포 배양 공정 변수의 정당성을 확보하기 위하여 QbD 기반 공정 연구를 2020년부터 세포 배양 배지 공동개발사와 진행하였으며2021년 1월 완료함. |
|
3. 향후계획 |
신규 배양 배지를 사용하는 배양 공정의 기술이전 예정 |
(2) HD201 New Process - Purification process development
|
1. 개발과제 |
HD201 New Process - Purification process development |
|
2. 진행현황 |
기존 HD201 정제 공정인 Non-Protein A 정제 공정 기술은 현재에도Protein A를 사용하지 않으면서도 높은 수율 및 불순물 제거 능력을 보이는 공정이라고 할 수 있음. 기존 정제 기술을 보완하기 위하여 신규 양이온 교환 크로마토그래피 공정 개선 연구를 진행하였음. 기존 공정 대비 공정 시간, 크로마토그래피 장비 간소화, 원부자재 비용 감소, 정제 수율 향상 효과가 발생할 것으로 예상함. |
|
3. 향후계획 |
HD201 신규 정제 공정의 기술이전 예정 |
(3) HD204 New Process - Media development
|
1. 개발과제 |
HD204 New Process - Media development |
|
2. 진행현황 |
현재 공정으로 글로벌 임상3상 진행. 신규 배양 공정 개발을 통하여 기존 공정 대비200% 이상의 생산성을 담보할 수 있는 배양 공정 확립 중. |
|
3. 향후계획 |
현재 공정으로 Process validation 통하여 유럽 시장 진출을 위한 제품 허가 등록 심사 절차 진행 예정이며, 이후 New Process로 배양 기술이전 예정 |
(4) PBP1502 - Cell culture process development
|
1. 개발과제 |
PBP1502 - Cell culture process development |
|
2. 진행현황 |
글로벌 임상 1상 진행. 확립된 공정은 임상 시료 생산을 위한 기술이전을 완료함. |
|
3. 향후계획 |
GMP 임상 시료 생산 예정 |
(5) PBP1510 - Cell culture process development
|
1. 개발과제 |
PBP1510 - Cell culture process development |
|
2. 진행현황 |
2022년 3분기 배양공정 기술이전 완료. 글로벌 임상 1상/2a상 진행중. |
|
3. 향후계획 |
GMP 임상 시료 생산 예정 |
(6) PBP1502 - Purification process development
|
1. 개발과제 |
PBP1502 - Purification process development |
|
2. 진행현황 |
PBP1502 세포 배양 공정 확립은 완료되었으며 선행 파이프라인과 마찬가지로 Protein A 레진을 사용하지 않는 Non-Protein A 공정을 개발 완료함. 확립된 공정은 2022년 1분기 임상 시료 생산을 위한 기술이전을 완료함. 정제 공정 개선을 통한 수율 및 순도를 향상시킴. |
|
3. 향후계획 |
개선된 정제공정을 생산에 도입 예정 |
(7) PBP1510 - Purification process development
|
1. 개발과제 |
PBP1510 - Purification process development |
|
2. 진행현황 |
선행 파이프라인과 마찬가지로 Protein A 레진을 사용하지 않는 Non-Protein A 공정을 개발 완료함. 확립된 공정은 2022년 3분기 임상 시료 생산을 위한 기술이전을 완료함. |
|
3. 향후계획 |
GMP 임상 시료 생산 예정 |
(8) M01 Project - Process Fit and Transfer
| 1. 개발과제 | M01 Project - Process Fit and Transfer |
| 2. 진행현황 | 고객사 Project 인 M01 Project의 GMP생산을 위해 배양, 정제 Process Fit과 Tech transfer를 위한 Feasibility Study 및 Satellite run을 고객사와 함께 진행하였음.2024년 ENG, GMP 생산을 위한 기술이전 완료함. |
| 3. 향후계획 | ENG, GMP 임상 시료 생산 |
(9) M02 Project - Process Fit and Transfer
| 1. 개발과제 | M02 Project - Process Fit and Transfer |
| 2. 진행현황 | 고객사 Project 인 M02 Project의 GMP생산을 위해 배양, 정제 Process Fit과 Tech transfer를 위한 Feasibility Study를 고객사와 함께 진행함. 2024년 ENG, GMP 생산을 위한 기술이전 진행 중. |
| 3. 향후계획 | ENG, GMP 임상 시료 생산 |
(10) PBP1601 - Cell culture, Purification process development
| 1. 개발과제 | PBP1601 - Cell culture, Purification process development |
| 2. 진행현황 |
세포 배양 공정 개발을 위한 Media screening과 Culture condition selection, 공정 조건 최적화와 회수 공정 개발을 진행 예정임. 정제 공정 개발을 위한 Resin screening과 정제 공정 확립을 위한 정제 공정 조건 연구 진행 예정임. |
| 3. 향후계획 | 임상 시료 생산 |
(11) PBP1710 - Scale down study and Non-clinical Production
| 1. 개발과제 | PBP1710 - Scale down study and Non-clinical Production |
| 2. 진행현황 |
비임상시료 생산을 위한 Scale down study를 진행하여 배양 공정에서는 Seed culture부터 Main culture까지 Process feasibility를 확인하고 정제 공정 파라미터를 확립하는 공정개발 진행함. Non-clinical 생산일정에 따라 Pilot 생산시설에서 비임상시료 생산을 완료함. |
| 3. 향후계획 | 비임상 시료에 대한 안정성 시험 예정 |
(나) 연구개발 완료 실적
|
연구과제명 |
주관부서 |
연구기간 |
관련제품 |
비고 |
|
HD201 배양 배지 최적화 |
공정개발팀 |
2017.03~2018.09 |
HD201 |
완료 |
|
PBP1502 배양 공정 확립 |
공정개발팀 |
2020.06~2021.02 |
PBP1502 |
완료 |
|
PBP1502 정제 공정 개발 |
공정개발팀 |
2020.06~2022.02 |
PBP1502 |
완료 |
|
PBP1510 배양 공정 확립 |
공정개발팀 |
2020.03~2020.08 |
PBP1510 |
완료 |
|
PBP1510 정제 공정 확립 |
공정개발팀 |
2020.03~2022.08 |
PBP1510 |
완료 |
| M01 공정 적합성 및 기술이전 | 공정개발팀 | 2023.11~2024.05 | M01 | 완료 |
| M02 공정 적합성 및 기술이전 | 공정개발팀 | 2023.12~2024.09 | M02 | 완료 |
각각의 완료된 연구개발 과제에 대한 결과 및 기대효과 등은 다음과 같습니다.
(1) HD201 배양 배지 최적화
|
①연구과제 |
HD201 배양 배지 최적화 (공동연구) |
|
②연구기관 |
프레스티지바이오로직스, KBio Health 신약개발지원센터 |
|
③연구결과 |
세포 배양 배지 첨가물 단일화 (기존 13종 원료를 단일화) |
|
④기대효과 |
원료 비용 절감 및 생산 공정 효율성 증대 |
|
⑤상용화 여부 |
상용화 제품 공정에 적용 |
(2) PBP1502 배양 공정 확립
|
①연구과제 |
PBP1502 배양 공정 확립 |
|
②연구기관 |
프레스티지바이오로직스 |
|
③연구결과 |
PBP1502 배양 및 회수 공정 확립 |
|
④기대효과 |
제조공정 기술이전을 통한 GMP 시료 생산 가능 |
|
⑤상용화 여부 |
예정 |
(3) PBP1502 정제 공정 개발
|
①연구과제 |
PBP1502 정제 공정 개발 |
|
②연구기관 |
프레스티지바이오로직스 |
|
③연구결과 |
PBP1502 Non Protein A 정제 공정 개발 |
|
④기대효과 |
제조공정 기술이전을 통한 GMP 시료 생산 가능 |
|
⑤상용화 여부 |
예정 |
(4) PBP1510 배양 공정 확립
|
①연구과제 |
PBP1510 배양 공정 확립 |
|
②연구기관 |
프레스티지바이오로직스 |
|
③연구결과 |
PBP1510 배양 및 회수 공정 확립 |
|
④기대효과 |
높은 생산성이 확보된 제조 공정 확립 및 기술이전을 통한 GMP 시료 생산 가능. PBP1510 항체는 췌장암을 적응증으로 하는 단일클론 항체 의약품으로써, EMA 및 FDA 희귀 의약품으로 지정된 항체 신약임. 배양 및 정제 제조공정 기술이전을 통한 GMP 시료 생산하여 임상 시료 생산을 완료하였으며 국내외 임상 시험 진행이 예정되어 있음. |
|
⑤상용화 여부 |
예정 |
(5) PBP1510 정제 공정 확립
|
①연구과제 |
PBP1510 정제 공정 확립 |
|
②연구기관 |
프레스티지바이오로직스 |
|
③연구결과 |
Non-Protein A 정제 공정 확립 |
|
④기대효과 |
PBP1510 항체는 췌장암을 적응증으로 하는 단일클론 항체 의약품으로써, EMA 및 FDA 희귀 의약품으로 지정된 항체 신약임. 배양 및 정제 제조공정 기술이전을 통한 GMP 시료 생산하여 임상 시료 생산을 완료하였으며 국내외 임상 시험 진행이 예정되어 있음. 선행 파이프라인을 통해 구축된 정제 공정 기술을 보완하여 PBP1510 제품에 적용하였으며 높은 정제 수율과 불순물 제거가 가능한 공정을 확립하였음. 향후 추가 공정 개선 작업을 통해 공정 간소화 및 전체 공정 일수 단축효과를 기대함 |
|
⑤상용화 여부 |
예정 |
(6) M01 공정 적합성 및 기술이전
| ①연구과제 | M01 공정 적합성 및 기술이전 |
| ②연구기관 | 프레스티지바이오로직스 |
| ③연구결과 | M01 공정 적합성 확인 및 기술이전 완료 |
| ④기대효과 | M01 Project 제품의 GMP생산을 위해 배양, 정제 Process Fit과 Tech transfer를 위한 Feasibility Study 및 Satellite run을 고객사와 협력하여 진행함. 해당 제품의 계획된 생산일정에 따라 ENG, GMP 생산을 완료함. |
| ⑤상용화 여부 | 해당사항 없음 |
(7) M02 공정 적합성 및 기술이전
| ①연구과제 | M02 공정 적합성 및 기술이전 |
| ②연구기관 | 프레스티지바이오로직스 |
| ③연구결과 | M02 공정 적합성 확인 및 기술이전 완료 |
| ④기대효과 | M02 Project 제품의 GMP생산을 위해 배양, 정제 Process Fit과 Tech transfer를 위한 Feasibility Study 및 Satellite run을 고객사와 협력하여 진행함. 해당 제품의 계획된 생산일정에 따라 ENG, GMP 생산을 완료함. |
| ⑤상용화 여부 | 해당사항 없음 |
(다) 정부과제실적
| (단위: 천원) |
|
연구과제 |
주관부서 |
연구기간 |
정부출연금 |
관련제품 |
비고 |
|
첨단의료복합단지 기반기술구축사업 (주1) |
한국보건 산업진흥원 |
2017.09 ~ 2019.06 |
연간 187,000 (총 374,000) |
HD201 |
완료 |
|
충청북도가치창출사업 (주2) |
한국보건 산업진흥원 |
2018.01 ~2018.12 |
150,000 |
HD201 |
완료 |
|
2019충청북도 바이오의약시제품제작 지원사업 (주3) |
충청북도 |
2019.08.01 ~2019.10.31 |
21,000 |
PBP1502 |
완료 |
|
주1) 연구과제명: 항체의약품 정제공정 개선 및 불순물 제거 검증 주2) 연구개발과제명: 세포 배양공정 최적화를 통한 항체 의약품의 생산성 및 품질향상에 관한 연구 주3) 과제명: 항 TNF-alpha 항체 의약품의 GMP임상시료 생산 |
7. 기타 참고사항
가. 영업에 영향을 미치는 법률 또는 제규정
당사의 사업과 관련된 주요법령 및 규제는 다음과 같습니다.
[프레스티지바이오로직스]
|
법규 |
주요내용 |
|
약사법 |
- 의약품의 제조, 수입, 특허권의 등재, 판매, 취급 등에 관한 전반적인 규제 - 관련 내용을 위반하는 경우 행정처분(허가 취소 등) 또는 형사처벌(징역 또는 벌금형) 부과 |
|
화학물질관리법 |
- 약사법 상의 의약품 및 의약외품으로 규제를 받지 않는 화학물질에 대한 등록, 평가, 관리 규제 |
|
식품ㆍ의약품분야 시험ㆍ검사 등에 관한 법률 |
- 식품ㆍ의약품분야의 시험ㆍ검사 및 시험ㆍ검사기관의 관리 등에 관한 사항을 규정 |
|
엔지니어링산업 진흥법 |
- 과학기술의 지식을 응용하여 수행하는 사업이나 시설물에 관한 활동(엔지니어링 활동) 규제 - 엔지니어링사업의 신고, 비밀누설 금지 등 규정 |
|
산업기술의 유출방지 및 보호에 관한 법률 |
- 산업기술의 부정한 유출 및 침해 방지 및 보호 규정 |
|
특허법 |
- 공동출원, 통상실시권, 특허권 침해 등에 관하여 규정 |
|
실용신안법 |
- 특허법에서 규율하지 않는 실용적인 고안을 보호, 장려 |
|
대ㆍ중소기업 상생협력 촉진에 관한 법률 |
- 위탁거래에 관하여 규제. - 타인의 기술자료 절취, 비밀유지 위반, 대기업의 사업조정 등에 관한 벌칙 규정 있음. |
|
독점규제 및 공정거래에 관한 법률 |
- 계열사에 대한 규제 및 전 사업 영역에서의 불공정 거래행위, 부당한 공동행위 규제 |
|
부정경쟁방지 및 영업비밀보호에 관한 법률 |
- 고객사의 영업비밀을 부정하게 사용하거나 공개하는 행위 규제 |
|
하도급거래 공정화에 관한 법률 |
- 위탁받은 사업을 재위탁하는 경우 관한 규제 |
|
생물학적 제제 등의 제조ㆍ판매관리 규칙 |
- 생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품, 유전자재조합의약품, 세포배양의약품, 세포 치료제, 유전자 치료제 및 이와 유사한 제제의 제조 및 판매 관리 규제 |
|
ICH 가이드라인(국제의약품규제조화위원회) |
- 의약품 허가, 관리 규정의 통일 표준화를 위한 가이드라인. - 미국, 유럽, 일본, 싱가포르, 터키, 대만 등 가입 |
|
Federal Food, Drug and Cosmetic Act |
- 미국 의약품 관련 법 |
|
Guidance for Industry, Process Validation: |
- 의약품의 품질관리 등에 관한 FDA 규정 |
|
DIRECTIVE 2001/83/EC OF THE EUROPEAN |
- 유럽 의약품 관련 법 * Regulation (EC) No 1394/2007(첨단의약품 규정) * Commission Regulation (EC) No 668/2009(첨단의약품 규정) * Regulation (EC) No 141/2000(희귀의약품 규정) |
|
Directive 2003/94/EC OF THE EUROPEAN |
- 의약품의 품질관리 등에 관한 EMA(유럽의약품청) 규정 |
나. 사업과 관련된 중요한 지적재산권 보유현황
[프레스티지바이오파마]
| 번호 | 구분 | 내용 | 권리자 | 출원일 | 등록일 | 적용제품 | 출원국 |
|---|---|---|---|---|---|---|---|
| 1 | 특허권 | 항체의 정제 방법 | 당사 | 2014.05.26 | 2018.07.11 | HD201 | EP (BG, CH, DE, DK, ES, FI, FR, GB, GR, IE, IS, IT, LI, NL, NO, PT, SE, TR) |
| 당사 | 2014.06.05 | 2017.02.17 | HD201 | JP | |||
| 당사 | 2014.06.12 | 2017.06.20 | HD201 | US | |||
| 당사 | 2014.06.10 | 2018.01.02 | HD201 | CN | |||
| 2 | 특허권 | 항체의 당함량 조절을 통한 항체의 제조방법 |
당사 | 2016.09.29 | 2018.08.24 | HD201 | JP |
| 당사 | 2016.09.29 | 2020.10.20 | HD201 | US | |||
| 당사 | 2016.11.07 | 2021.05.07 | HD201 | CN | |||
| 당사 | 2016.10.31 | 2021.09.01 | HD201 | EP (BG, CH, DE, DK, ES, FI, FR, GB, GR, IE, IS, IT, LI, NL, NO, PT, SE, TR) | |||
| 3 | 특허권 | 항체의 정제방법 | 당사 | 2015.12.22 | 2020.07.29 | HD204 | EP (BG, CH, DE, DK, ES, FI, FR, GB, GR, IE, IS, IT, LI, NL, NO, PT, SE, TR) |
| 당사 | 2015.12.05 | 2018.08.21 | HD204 | US | |||
| 4 | 특허권 | 베바시주맙 정제의 최적화된 방법 | 당사 | 2020.02.21 | 2020.09.01 | HD204 | KR |
| 2022.08.17 | - | HD204 | CN | ||||
| 2022.09.12 | - | HD204 | EP | ||||
| 2022.08.19 | 2024.02.28 | HD204 | JP | ||||
| 2022.08.17 | - | HD204 | US | ||||
| 5 | 특허권 | 항체 발현용 바이시스트로닉 발현벡터 및 이를 이용한 항체의 생산방법 | 당사 | 2016.04.05 | 2018.05.25 | HD204 | JP |
| 당사 | 2016.04.07 | - | HD204 | CN | |||
| 당사 | 2016.04.07 | 2021.06.29 | HD204 | US | |||
| 당사 | 2020.02.11 | - | HD204 | EP | |||
| 6 | 특허권 | 아달리무맙의 Non-Protein A 정제방법 |
당사 | 2020.02.21 | 2020.09.04 | PBP1502 | KR |
| 당사 | 2022.08.17 | - | PBP1502 | CN | |||
| 당사 | 2022.09.12 | - | PBP1502 | EP | |||
| 당사 | 2022.08.19 | 2024.02.01 | PBP1502 | JP | |||
| 당사 | 2022.08.17 | - | PBP1502 | US | |||
| 7 | 특허권 | PAUF 단백질에 특이적으로 결합하는 항체 및 이의 용도 | 당사& 동아대학교산학협력단 |
2017.07.28 | 2018.05.03 | PBP1510 | KR |
| 2018.07.26 | 2020.09.01 | PBP1510 | TW | ||||
| 2019.04.26 | 2020.10.01 | PBP1510 | AU | ||||
| 2019.04.30 | 2020.10.28 | PBP1510 | RU | ||||
| 2020.02.19 | 2021.05.26 | PBP1510 | ZA | ||||
| 2019.05.02 | 2021.06.29 | PBP1510 | US | ||||
| 2019.10.07 | 2022.01.31 | PBP1510 | JP | ||||
| 2020.01.17 | 2022.08.25 | PBP1510 | MY | ||||
| 2019.04.22 | 2022.09.28 | PBP1510 | SG | ||||
| 2018.07.26 | - | PBP1510 | AR | ||||
| 2019.04.25 | - | PBP1510 | EP | ||||
| 2019.05.12 | 2024.05.02 | PBP1510 | IL | ||||
| 2019.05.16 | 2023.05.23 | PBP1510 | CA | ||||
| 2019.05.24 | 2023.11.24 | PBP1510 | CN | ||||
| 2019.05.24 | - | PBP1510 | BR | ||||
| 2019.07.01 | 2024.01.23 | PBP1510 | IN | ||||
| 2020.01.10 | 2024.07.30 | PBP1510 | NZ | ||||
| 2020.01.22 | - | PBP1510 | TH | ||||
| 2020.01.23 | - | PBP1510 | PH | ||||
| 2020.01.27 | 2024.12.16 | PBP1510 | MX | ||||
| 2020.01.27 | - | PBP1510 | TR | ||||
| 2020.02.10 | 2022.09.27 | PBP1510 | ID | ||||
| 2020.02.13 | - | PBP1510 | VN | ||||
| 2020.08.31 | - | PBP1510 | HK | ||||
| 9 | 특허권 | 신규 CTHRC1에 특이적 항체 및 이의 용도 | 당사 | 2021.12.10 | - | PBP1710 | CA |
| 2021.12.12 | - | PBP1710 | IL | ||||
| 2021.12.12 | - | PBP1710 | SG | ||||
| 2021.12.13 | - | PBP1710 | MX | ||||
| 2021.12.13 | - | PBP1710 | MY | ||||
| 2021.12.13 | - | PBP1710 | PH | ||||
| 2021.12.13 | - | PBP1710 | TH | ||||
| 2021.12.13 | - | PBP1710 | TR | ||||
| 2021.12.15 | - | PBP1710 | BR | ||||
| 2021.12.17 | 2024.11.11 | PBP1710 | RU | ||||
| 2021.12.22 | - | PBP1710 | AU | ||||
| 2021.12.22 | - | PBP1710 | NZ | ||||
| 2022.01.04 | - | PBP1710 | ID | ||||
| 2022.01.07 | - | PBP1710 | IN | ||||
| 2022.01.07 | - | PBP1710 | VN | ||||
| 2022.01.10 | 2023.04.26 | PBP1710 | ZA | ||||
| 당사& 프레스티지바이오파마아이디씨 |
2020.06.15 | 2023.01.09 | PBP1710 | KR | |||
| 2021.12.13 | 2025.01.08 | PBP1710 | JP | ||||
| 2021.12.13 | - | PBP1710 | US | ||||
| 2021.12.16 | - | PBP1710 | EP | ||||
| 2022.01.26 | 2024.11.12 | PBP1710 | CN | ||||
| 10 | 특허권 | 점막점착성-PLGA 나노입자 | 당사& 프레스티지바이오파마아이디씨 |
2022.07.26 | 2024.02.15 | IDC222 | KR |
| 주1) BR: 브라질, CN: 중국, BG: 불가리아, CH: 스위스, DE: 독일, DK: 덴마크, ES: 스페인, FI: 핀란드, FR: 프랑스, GB: 영국, GR: 그리스, IE: 아일랜드, IS: 아이슬란드, IT: 이탈리아, LI: 리히텐슈타인, NL: 네덜란드, NO: 노르웨이, PT: 포르투갈, SE: 스웨덴, TR: 터키, JP: 일본, US: 미국, KR: 한국, AR: 아르헨티나, AU: 호주, BR: 브라질, CA: 캐나다, HK: 홍콩, ID: 인도네시아, IL: 이스라엘, IN: 인도, MX: 멕시코, MY: 말레이시아, NZ: 뉴질랜드, PH: 필리핀, RU: 러시아, SG: 싱가포르, TH: 태국, TW: 대만, VN: 베트남. ZA:남아프리카공화국 |
| 주2) EP: EPO(European Patent Office, 유럽특허청)에 따른 특허 |
| 주3) EP Validation: EPO 심사를 통과해 유럽특허를 받으면 유럽 각국에서 따로 심사 받을필요 없이 각국에서 유효한 특허를 획득할 수 있지만, 그 효력 발생을 위해서는 특허권자가 특허를 등록·유지하고자 하는 국가들을 선택하여 국가별로 특허 유효화(validation) 절차를 밟아야 하는 경우가 발생합니다. |
[프레스티지바이오로직스]
| 구분 | 내용 | 출원일 | 등록일 | 만료일 | 적용제품 | 출원국가 |
|---|---|---|---|---|---|---|
| 특허권 | 항체의 정제방법 (10-2012-0146672 / 출원인 PBL) |
2012.12.14 | 2015.02.26 | 2035.02.26 | HD201 | KR |
| 특허권 | 항체 발현용 바이시스트로닉 발현벡터 및 이를 이용한 항체의 생산 방법 (10-2012-0057027 / 출원인 PBL) |
2012.05.29 | 2014.06.18 | 2034.06.18 | HD201 | KR |
| 특허권 | 항체의 당 함량 조절을 통한 항체의 제조 방법 (10-2014-0039307 / 출원인 PBL) |
2014.04.02 | 2016.09.21 | 2036.09.21 | HD201 | KR |
| 특허권 | 항체의 정제방법 (10-2013-0064803 / 출원인 PBL) |
2013.06.05 | 2015.11.11 | 2035.11.11 | HD204 | KR |
| 특허권 | 항체 발현용 바이시스트로닉 발현벡터 및 이를 이용한 항체의 생산 방법 (10-2014-0134777 / 출원인 PBL) |
2014.10.07 | 2017.03.16 | 2037.03.16 | HD204 | KR |
| 특허권 | 항체 집단의 제조방법 (10-2021-0134891 / 출원인 PBL) |
2021.10.12 | 2024.07.02 | 2041.10.12 | PBP1502 | KR |
| 특허권 | 항체 의약품 제조를 위한 배양 및 정제 공정의 하이브리드 시스템 (10-2020-0035260 / 출원인 PBL) |
2020.03.23 | 2022.02.28 | 2040.03.23 | 의약품 제조공정 |
KR |
| 특허권 | 항체 의약품 제조를 위한 배양 및 정제 공정의 하이브리드 시스템 (2022-555666 / 출원인 PBL) |
2022.09.13 | 2024.02.28 | 2041.03.08 | 의약품 제조공정 |
JP |
| 특허권 | 항체 의약품 제조 공정을 위한 제균 필터 시스템 및 그 작동 방법 (10-2020-0035263 / 출원인 PBL) |
2020.03.23 | 2022.03.31 | 2040.03.23 | 의약품 제조공정 |
KR |
| 특허권 | 항체 의약품 제조 공정을 위한 제균 필터 시스템 및 그 작동 방법 (2022-555667 / 출원인 PBL) |
2022.09.13 | 2024.04.24 | 2041.03.08 | 의약품 제조공정 |
JP |
| 특허권 | 항체 의약품 제조 공정을 위한 하이브리드 무균 연결 시스템 및 무균 연결 방법 (10-2020-0035265 / 출원인 PBL) |
2020.03.23 | 2022.03.31 | 2040.03.23 | 의약품 제조공정 |
KR |
| 특허권 | 항체 의약품 제조 공정을 위한 하이브리드 무균 연결 시스템 및 무균 연결 방법 (2022-555669 / 출원인 PBL) |
2022.09.13 | 2024.03.08 | 2041.03.08 | 의약품 제조공정 |
JP |
| 특허권 | 항체 의약품 제조 공정을 위한 버퍼 조제 및 이송 시스템 (10-2020-0035279 / 출원인 PBL) |
2020.03.23 | 2022.06.10 | 2040.03.23 | 의약품 제조공정 |
KR |
| 특허권 | 항체 의약품 제조 공정을 위한 버퍼 조제 및 이송 시스템 (2022-555670 / 출원인 PBL) |
2022.09.13 | 2024.05.15 | 2041.03.08 | 의약품 제조공정 |
JP |
| 상표권 | ALITA (제40류) (40-2020-0049337 / 출원인 PBL) |
2020.03.25 | 2021.07.30 | 2031.07.30 | - | KR |
| 상표권 | ALITA (제37류) (40-2020-0049338 / 출원인 PBL) |
2020.03.25 | 2021.07.30 | 2031.07.30 | - | KR |
| 상표권 | ALITA (제35류) (40-2020-0049341 / 출원인 PBL) |
2020.03.27 | 2021.06.25 | 2031.06.25 | - | KR |
| 상표권 | ALITA (제01류) (40-2020-0049342 / 출원인 PBL) |
2020.03.28 | 2021.04.09 | 2031.04.09 | - | KR |
| 상표권 | ALITA (제09류) (40-2020-0049343 / 출원인 PBL) |
2020.03.29 | 2021.04.23 | 2031.04.23 | - | KR |
| 상표권 | ALITA (제07류) (40-2020-0049344 / 출원인 PBL) |
2020.03.30 | 2021.06.25 | 2031.06.25 | - | KR |
| 상표권 | ALITA (제40류, 제37류) (1560862 / 출원인 PBL) |
2020.09.24 | 2021.04.07 | 2031.04.07 | - | EP |
| 상표권 | ALITA (제40류, 제37류) (1560862 / 출원인 PBL) |
2020.09.24 | 2022.01.25 | 2032.01.25 | - | US |
| 상표권 | ALITA (제40류, 제37류) (1560862 / 출원인 PBL) |
2020.09.24 | 2022.02.18 | 2032.02.18 | - | SG |
| 상표권 | ALITA (제40류, 제37류) (3640279 / 출원인 PBL) |
2021.05.12 | 2021.09.17 | 2031.09.17 | - | GB |
| 상표권 | Alita Smart Bio Factory (제40류) (40-2020-0049346 / 출원인 PBL) |
2020.03.31 | 2021.07.30 | 2031.07.30 | - | KR |
| 상표권 | Alita Smart Bio Factory (제37류) (40-2020-0049347 / 출원인 PBL) |
2020.04.01 | 2021.07.30 | 2031.07.30 | - | KR |
| 상표권 | Alita Smart Bio Factory (제40류, 제37류) (1560918 / 출원인 PBL) |
2020.09.24 | 2021.04.07 | 2031.04.07 | - | EP |
| 상표권 | Alita Smart Bio Factory (제40류, 제37류) (1560918 / 출원인 PBL) |
2020.09.24 | 2022.01.25 | 2032.01.25 | - | US |
| 상표권 | Alita Smart Bio Factory (제40류, 제37류) (1560918 / 출원인 PBL) |
2020.09.24 | 2021.11.25 | 2031.11.25 | - | SG |
| 상표권 | Alita Smart Bio Factory (제40류, 제37류) (3640310 / 출원인 PBL) |
2021.05.12 | 2021.09.17 | 2031.09.17 | - | GB |
| 상표권 | CDEMO (제01류) (40-2021-0240664 / 출원인 PBL) |
2021.11.26 | 2023.09.27 | 2033.09.27 | - | KR |
| 상표권 | CDEMO (제01류) (40-2021-0240666 / 출원인 PBL) |
2021.11.26 | 2023.09.27 | 2033.09.27 | - | KR |
| 상표권 | CDEMO (제01류) (40-2021-0240669 / 출원인 PBL) |
2021.11.26 | 2023.09.27 | 2033.09.27 | - | KR |
| 상표권 | CDEMO (제01류) (40-2021-0240677 / 출원인 PBL) |
2021.11.26 | 2023.09.27 | 2033.09.27 | - | KR |
| 상표권 | CDEMO (제01류, 제05류, 제40류, 제42류) (1675607 / 출원인 PBL) |
2022.05.17 | 2022.12.21 | 2032.12.21 | - | EP |
| 상표권 | CDEMO (제01류, 제05류, 제40류, 제42류) (1675607 / 출원인 PBL) |
2022.05.17 | 2023.11.07 | 2033.11.07 | - | US |
| 상표권 | CDEMO (제01류, 제05류, 제40류, 제42류) (1675607 / 출원인 PBL) |
2022.05.17 | 2022.10.25 | 2032.10.25 | - | GB |
| 상표권 | CDEMO (제01류, 제05류, 제40류, 제42류) (1675607 / 출원인 PBL) |
2022.05.17 | 2024.10.03 | 2032.10.03 | - | SG |
다. 시장여건 및 영업 개황
[프레스티지바이오파마]
(1) 산업의 특성 및 전망
당사가 사업을 영위하고 있는 분야인 바이오산업은 세계경제의 중심인 미국을 비롯하여 많은 선진국에서 중점적으로 육성하고 있는 '미래 성장 산업’입니다. COVID-19 대유행은 전세계 제약 시장에 지속적으로 영향을 미치고 있으며 2020년부터 2027년까지 순 누적 제약 시장이 5,000억 달러 증가할 것으로 예상되며, 특히 팬데믹 이후 백신을 신속하게 개발하고 공급해야 하는 필요성으로 인하여 글로벌 바이오산업의 규모가 크게 증가하였습니다.
2023년은 COVID-19에 대한 백신 수요 및 지출 감소와 전반적인 경제 위축을 직면하고 있으나 COVID-19 팬데믹에 의해 중단되었던 공급망도 정상적으로 회복되었으며 막중한 영향을 받았던 임상 시험 활동이 점차 증가하고 있는 추세입니다. 이와 더불어 유럽은 COVID-19 팬데믹을 통해 드러난 의약품 수급 불균형 문제를 해결하기 위하여 의약품 가격 및 접근성 확대를 도모하기 위한 일반의약품 법규 개정안을 제안하였으며, 보다 적극적으로 대응하고 있는 면모를 보였습니다.
시장조사기관인 Precedence Research에 따르면, 글로벌 바이오의약품 시장은 2022년 3,590억 3,000만 달러로 추정되었으며 2032년에는 1조 4,211억 7,000만 달러를 넘어 2023년부터 2032년까지 연평균 14.8% 성장할 것으로 전망되고 있습니다.
 |
|
글로벌 바이오의약품 시장 |
[출처: Precedence Research, Biopharmaceuticals Market Size to Surpass US $1,421.17 Bn by 2032]
세계인구의 고령화가 가속되는 상황 속에서 희귀 신경 질환, 알츠하이머병, 암 및 당뇨병과 같은 이전에는 치료할 수 없었던 만성질환 및 신종질병의 유병률이 증가함에 따라 바이오의약품에 대한 수요가 증가할 것이며 바이오의약품 시장의 성장을 촉진할 것으로 예상됩니다. 또한, 전 세계적으로 진행되고 있는 인구 고령화와 평균 수명 증가로 인하여 만성 질환을 가진 환자의 수가 증가하여 의약품의 수요가 점차적으로 증가할 것으로 전망하고 있습니다.
Precedence Research의 보고서에 따르면 단클론항체 부문은 2022년 37%로 가장 큰 매출 점유율을 차지했으며 2023년부터 2032년까지 연평균 7.2%에 달하는 성장세가 예상되었습니다.
바이오산업을 분야별로 살펴보면, 산업 내에서 큰 비중을 차지하고 있으며 당사의 주력사업 부문이기도 한 '바이오시밀러' 산업은 2032년까지 성장이 가속화될 것으로 기대되고 있습니다.
 |
|
바이오시밀러 산업 규모 및 전망 (2020-2029) |
[출처: IQVIA]
시장조사 전문기관인 IQVIA에 따르면, 향후 기존 주요 오리지널 바이오의약품의 특허기간이 2030년에 만료됨에 따라 오리지널 바이오의약품과 효과와 안정성은 동등하면서도 가격 측면에서 경쟁력을 보유한 바이오시밀러 시장 수요와 규모가 지속적으로 확대될 것으로 예측되며 각국 정부의 정책의 변화 등이 반영되어 바이오시밀러 연구 및 개발에 우호적인 시장환경으로 재편되고 있습니다.
IQVIA의 'Biosimilars to continue rapid growth over the next decade’에 따르면 지난 2015년부터 2020년까지 연평균 약 78% 성장하여 2020년 179억달러에 달했습니다. 이후에도 바이오시밀러 시장 가치는 2030년까지 연평균 15%로 지속적으로 성장하여 10년 이내에 약 750억 달러에 이를 것으로 전망하고 있습니다.
IQVIA에 따르면 2015년 1분기부터 2022년 3분기까지 출시된 바이오시밀러의 시장 침투율을 보면 전체 시장의 약 24% 차지할 것이며 2023년에 휴미라, 스텔라라, 엔브렐와 같은 약물들이 출시된다면 추가적으로 약 13%가 추가될 것으로 예상되고 있습니다. 현재 FDA 승인된 바이오시밀러 약 30개 수준에서 10개가 2023년 중으로 추가될 것으로 밝혀졌습니다.
 |
|
바이오시밀러 시장 침투율 추이 |
[출처: IQVIA, 현대차증권]
당사가 2021년 새롭게 진출한 백신 위탁생산사업이 포함된 글로벌 바이오의약품 CDMO 시장의 성장 전망을 살펴보면 아래와 같습니다. 글로벌 바이오의약품CDMO 시장은 2020년 미화 113.8억 달러에서 2026년 미화 203.1억 달러로 연평균 10.1%의 성장이 예상되고 있습니다. 특별히 단기적으로는 COVID-19 사태의 여파로 인해 백신 관련 제조 및 전반적인 바이오의약품 시장 확대, 신약 개발, 항암 치료제 CDMO 시장의 급성장이 예상되고 있습니다.
이상에서 살펴본 바와 같이 바이오산업은 미래 성장성 및 시장 수요가 매우 높은 산업으로 분류되고 있으며, 특별히 당사가 2021년 새롭게 진출한 백신사업은 한국 정부에서 '제2의 반도체 산업’으로 육성하고 있는 분야로 그 시장성 및 성장가능성이 높다고 볼 수 있습니다.
 |
|
Bio CDMO 시장 규모 |
[출처: Froster & Sullivan, Global Biologics Contract Development and Manufacturing Organizations Growth Opportunities. 2021. 06]
(2) 한국내외 시장여건
(가) 한국내 시장
삼정 KPMG 경제연구원의 2023년 국내 주요산업 전망 보고서에 따르면 한국의 제약바이오산업은 COVID-19 회복세로 인한 COVID-19 백신 수요 감소와 러시아-우크라이나 지정학적 갈등으로 의료 지출 감소와 공급망 리스크가 확대됨에 따라 전년대비 성장세가 둔화되었으나 블록버스터 신약 특허가 만료되면서 K-바이오시밀러 경쟁이 본격화될 것이며 바이오시밀러 수요가 지속적으로 증가될 것으로 예측되었습니다. 또한 EU 바이오시밀러의 오리지널 의약품 대체 처방의 공식화 등 주요국의 우호적인 바이오시밀러 정책과 한국 보건복지부의 한국 제약바이오협회에서 제약산업 육성·지원 위원회를 개최 및 「바이오헬스 글로벌 중심국가 도약을 위한 제3차 제약바이오산업 육성·지원 종합계획 (2023~2027년)」을 발표하여 국내 기업들의 시장 확대에 유리한 환경이 조성되고 있습니다.
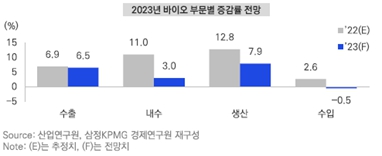 |
|
2023년 국내 바이오 부문별 증감률 전망 |
[출처: 삼정KPMG 경제연구원, 2023년 국내 주요산업 전망 보고서]
당사의 주력사업인 바이오시밀러 산업은 COVID-19 팬데믹과 같은 글로벌 시장경제 악재에도 미국과 유럽 등에서 국산 바이오시밀러가 강세이며 2022년 기준 국산 2개 품목이 유럽 점유율 1위를 차지하였으며, 미국 FDA 허가 39개 중 국내 9개 품목으로 점유율 2위를 차지하여 글로벌 바이오시밀러 시장에서 크게 두각을 보이고 있습니다.
국가신약개발사업단의 '2023 국내 신약개발 파이프라인 조사 결과’에 의하면 2022년의 국내 제약바이오 기업의 파이프라인은 전년대비 24% 증가한 1833개로, 이 중에는 바이오신약이 44.1%, 합성신약이 40.3%를 차지하고 있습니다. 국내 제약 바이오기업의 R&D 투자율 역시 8.6%에서 10.7%로 증가해 선진국형 R&D 투자양상을 보이고 있으며, 활발하고 다양한 기업간의 라이센싱 인-아웃이 이루어지고 있는 것으로 조사되었습니다.
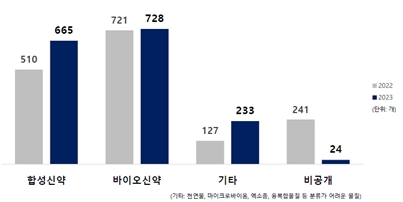 |
|
국내 제약바이오 기업 파이프라인 현황 (2022-2023) |
[출처: 국가신약개발사업단, 2023 국내 신약개발 파이프라인 조사 결과]
파이프라인을 질환별로 분류해 보면, '암’이 38.1%로 선두를 차지했으며 중추신경계질환 (11.3%), 감염질환 (8.3%) 순이며 단계별로 후보물질 (51.5%), 비임상 (25.3%), 임상 1상 (9.4%) 순으로 차지하였습니다.
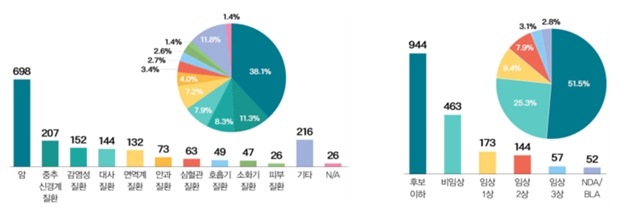 |
|
국내 파이프라인 현황 - 질환별, 연구단계별 |
[출처: 국가신약개발사업단, 2023 국내 신약개발 파이프라인 조사 결과]
(나) 해외 시장
글로벌 제약시장에서 바이오의약품이 차지하는 비중은 지속적으로 늘고 있으며, Precedence Research의 'Biopharmaceuticals Market Size to Surpass US$1,421.17 Bn by 2032’에 따르면, 글로벌 바이오의약 시장은 2023년에 3,735억 달러로 확대되었으며 전반적으로 성장하고 있는 바이오의약품 시장에서 북미는 2021년 기준 세계 제약시장의 약 45%로 독점적인 우세를 차지하였으며 세계 생산량의 22%를 차지하였습니다. 그리고 유럽과 아시아-태평양 지역 시장이 그 뒤를 이었습니다.
IQVIA의 'Biosimilar in the United States 2023-2027’에 따르면 미국 의약품의 시장 규모를 바이오의약품과 케미컬의약품을 구분지어 성장률을 비교해보았을 때, 아래와 같이 미국과 유럽에서의 바이오의약품의 연평균 성장률은 12.5%에 이르는 반면 케미컬의약품에 속하는 저분자 화합물 시장은 그 성장속도가 1.3%에 그치는 것을 확인할 수 있습니다. 이는 곧 바이오시밀러 시장의 성장성을 기대할 수 있는 중요한 지표입니다.
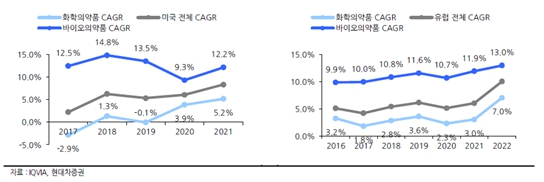 |
|
미국과 유럽의 의약품 전체 시장과 바이오/케미컬 의약품 연간성장률 비교 |
[출처: IQVIA, 현대차증권]
세계에서 가장 큰 규모의 의약품 시장을 보유한 북미는 국제 연구 개발 협력 증진, 제조 역량 강화, 기술 채택 증가, 연방 투자 확대 및 위기관리와 같은 적극적인 방책으로 인하여 바이오의약품 시장에서 독점적인 우세를 차지하고 있습니다. 미국 식품의약국 (FDA)는 2023년에 42개의 바이오시밀러을 승인하였으며 글로벌 제약 기업 간 활발한 협업이 이루어지고 있습니다. 이는 유럽의약품청 (EMA)에서 허가된 21개의 바이오시밀러보다 비교적 더 높은 수치임을 확인할 수 있으며 2023년부터 미국 의료보험 재정에 있어 경상의료비 지출의 상당 부분을 절감할 수 있을 것으로 판단되며 시장 또한 그만큼 성장 여지가 큼을 전망할 수 있습니다.
이와 더불어, 세계 인구의 약 60%가 거주하는 아시아-태평양 지역은 다양한 만성 질환 유병률 증가, 의료 지출 증가, 주요 CMO 보유 및 정교한 의료 인프라 개발을 위한정부 투자가 활발하게 이어지고 있으므로 글로벌 바이오의약품 시장 성장에 크게 기여할 것으로 기대되고 있습니다.
Evaluate Pharma의 'WORLD PREVIEW 2022 Outlook to 2028’에 따르면, 글로벌 처방의약품 시장은 2021년부터 2028년까지 연평균 6%의 지속적인 성장세가 기대되고 있습니다. 현재 미국과 유럽에서 임상 1/2a상을 진행하고 있는 당사의 췌장암항체신약 PBP1510 (Anti PUAF) 역시 2020년 유럽의약품청 (EMA) 및 미국 식품의약국 (FDA), 한국 식품의약품안전처로부터 '희귀의약품’으로 지정된 바 있으며, 2023년 3월에 미국 식품의약국 (FDA) 패스트트랙 품목으로 선정되었습니다. 향후 시장 진출 시 글로벌 처방의약품 시장의 희귀의약품 부문에서 중요한 위치를 차지할 수있을 것으로 기대하고 있습니다.
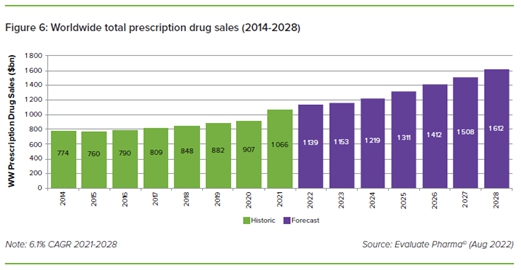 |
|
글로벌 처방의약품 시장 규모 및 전망 (2014-2028) |
[출처: Evaluate Pharma (Aug 2022), 'WORLD PREVIEW 2022 Outlook to 2028']
(3) 경쟁력 요소
(가) 특허 기술 및 가격 경쟁력
당사는 특허 기술 및 대체원료를 기반으로 고정비(Fixed Cost)와 변동비(Variable Cost)의 측면에서 뛰어난 경쟁력을 확보하고 있습니다. 먼저 당사가 보유하고 있는 특허 기술 중 '항체 정제방법 (Non-Protein A Purification)' 및 '항체 발현용 바이시스트로닉 발현벡터 및 이를 이용한 항체의 생산 방법'을 활용해 항체의약품의 생산원가를 절감할 수 있습니다. 두번째로, 종속회사인 프레스티지바이오로직스가 보유한 최첨단 생산시설 및 특허기술 ALITA Smart BioFactory의 싱글유즈시스템(Single-Use System)은 교차오염의 위험을 줄이고 효율성과 생산성을 높일 수 있게 합니다. 세번째로, 당사는 대체원재료 개발을 통해 생산성과 가격경쟁력을 높일 수 있으며 외부 요인으로 인해 바이오의약품의 원부자재 조달이 힘들어지더라도 안정적으로 생산설비 및 관련 원부자재를 확보할 수 있습니다. 이처럼 당사는 모든 생산 프로세스가 종속회사인 프레스티지바이오로직스 등을 통해 내재화되어 있고 외주에 의존하지 않기 때문에 원가경쟁력을 확보할 수 있게 됩니다.
(나) 시장 진입 경쟁력 및 마케팅 역량
당사는 싱가포르 본사를 기반으로 광범위한 아시아 태평양 네트워크를 구축해 글로벌 시장 진출에 박차를 가하고 있습니다. 먼저 싱가포르에 위치한 본사 및 R&D센터에서는 항체신약 및 바이오시밀러 연구 개발 총괄, 임상시험 관리, 국제 인허가 등 규제 등록, 해외 사업 개발 및 라이선스 계약 등을 담당하고 있습니다. 또한 호주, 벨기에 법인을 통해 글로벌 임상 및 국제 인허가, 해외 사업이 원활하게 이루어질 수 있도록 뒷받침하고 있습니다.
이에 더해, 개발이 앞선 파이프라인에 대해 다수의 글로벌 제약사들과 파트너십 계약을 체결해 미주, 유렵, 아시아태평양, 아프리카 등 전세계 유통망을 확보하고 판로를 개척해나가고 있습니다. 글로벌 제약사들의 전문성과 경험을 활용해 지역 및 국가별 진입 장벽을 낮추고 시장 특성에 맞춰 공략할 수 있도록 전략적 협력을 도모하고 있습니다.
[프레스티지바이오로직스]
(1) 산업의 특성
(가) 산업의 동향
바이오의약품은 사람이나 다른 생물체에서 유래하는 세포, 단백질, 유전자 등을 원료로 하여 제조한 의약품으로서 보건위생상 특별한 주의가 필요한 의약품을 말하며, 성분에 따라 생물학적제제, 단백질의약품, 항체의약품, 세포치료제 및 유전자치료제 등으로 구분하고 있습니다.
바이오의약품은 합성의약품과 비교하여 약의 체내 분해시 발생하는 대사 산물이 없어 독성이 낮고, 질환의 발병기전과 관련된 체내 단백질에 선택적으로 작용한다는 장점을 가지고 있습니다. 다만 살아있는 세포에서 만들어지는 큰 단백질로 이루어져 있기 때문에 일반적으로 크기가 훨씬 작은 저분자 화합물(small molecule)로 구성되는 합성의약품보다 200~1,000배 가량 크고 구조적으로 복잡하여 제조 및 보관 조건에 민감하다는 특성을 가지고 있습니다. 치료상 장점과 생산 및 보관의 까다로움으로 인하여 합성의약품에 비하여 바이오의약품 분야가 상대적으로 많은 시간과 자금이 소요되며, 높은 진입 장벽을 가지고 있어 더 높은 시장가격을 인정받고 있습니다.
|
구 분 |
합성의약품 |
바이오의약품 |
|
원료 |
합성화학물질 |
생물체 유래물질 (세포, 조직, 유전물질 등) |
|
원료의 고려사항 |
품질(시험분석으로 확인가능) |
시험분석으로 확인 가능한 품질 외에 공여(기증)자의 동의 등의 윤리성, 감염 질환 확인 등의 안정성 확보 필요 |
|
구조 |
물리화학적 특성이 명확한 저분자 구조 |
정확한 특성 분석이 불가능하고, 활성과 구조가 일정하지 않음 |
|
제품의 |
대부분 온도·빛 등 환경에 안정적 |
온도·빛·pH 등 외부환경에 민감하며 미생물 오염에 취약 |
|
대부분 36개월 |
(세포 치료제 사례) 대부분 3일이내 (유전자 치료제 사례) 영하 135도에서 24개월 |
|
|
제조 |
간단한 화학적 합성으로 대량생산 |
복잡한 제조과정의 맞춤형 소량생산 |
|
원료, 공정, 설비변화가 품질에 미치는 영향이 비교적 적음(제조공정의 변이성이 매우 낮음) |
원료, 공정, 설비의 변화가 의약품 자체를 변화시킴(제조공정에 따른 변이성 매우 높음) |
|
|
상대적으로 복제가 쉽고 낮은 제조비용 |
유사 복제만 가능하고 높은 제조비용 |
|
|
치료효과 |
비교적 명확한 약리기전, 불특정 다수에 일관적 효과 기대 |
세포 치료제: 약리기전이 불확실 유전자 치료제: 복합적인 기전 환자에 따른 맞춤형 치료 가능 |
|
대부분 질병의 증상개선에 그침 |
질병의 근본적인 원인치료 가능 |
|
|
투약방법 |
대부분 경구·주사 등 일반적 투여경로 |
대부분 주사 또는 주입투여하나, 이식 등 시술을 통하여 투여하기도 함 |
(자료:바이오의약품 산업동향보고서(2020.12),한국바이오의약품협회,회사 일부수정)
합성의약품은 다른 제조과정을 통해서도 성분과 구조가 원약과 동일한 복제약의 제조가 가능한 반면, 바이오의약품은 일반적으로 합성의약품에 비해 크기가 크고 복잡한 고분자 구조를 가지고 있으며, 생물체를 이용하여 복잡한 제조공정을 거쳐야 되므로 배양기술과 환경, 방법에 따라 단백질의 변형, 단백질의 당화수준이 달라져 원약과 비교하여 성분과 구조가 동일하지 않은 물질이 만들어지기 때문에 생물학적 동등성을 갖으면서 구조적으로 유사한 복제가 쉽지 않습니다.
바이오의약품 산업의 가치사슬(Value Chain)은 연구개발, 생산, 운송과 유통 그리고 판매라는 다양한 단계로 구분되고 각 단계는 매우 복잡하고 동시에 대규모 투자를 필요로 하므로 몇몇 소수의 다국적 거대 제약 기업을 제외하고 전 기능을 단독으로 수행하기 어렵습니다. 바이오의약품의 생산을 위해서는 대규모 투자가 필요할 뿐만 아니라, 플랜트 및 엔지니어링 설계, 건설, 밸리데이션, 안정화 등에 최소 3년 이상의 시간이 필요합니다. 또한, 동물세포를 이용하는 세포 배양, 정제, 충전 등 생산 전 과정에서 GMP(Good Manufacturing Practice)에 부합하는 높은 수준의 품질관리 역량이 필수적으로 요구됩니다.
이에 따라, 바이오의약품은 합성의약품과 달리 생산공정이 복잡하여 전문적인 CMO의 필요성이 더욱 커지고 있습니다. CMO는 산업 초기에 제약사들이 내부 제조 시설(in-house manufacturing)만으로 시장 수요를 충족시킬 수 없을 때, 추가적인 제조 역량을 제공하던 것에서 출발하여, 생산공정 기준 및 시험법 개발확인, 제품제형 개발지원, 해외등록서류 개발 등을 포함하여 업무범위가 확장되었습니다.
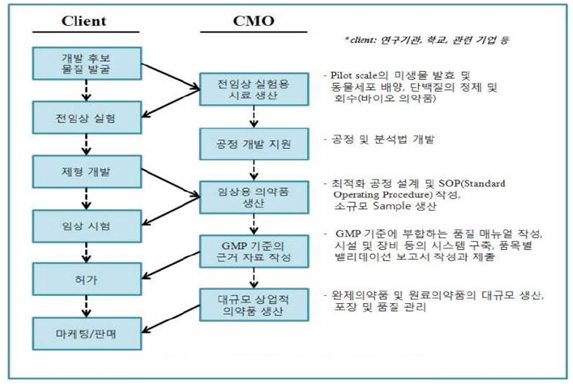 |
|
(자료 :글로벌의약품 생산거점 인프라구축 방안연구, 식품의약품안전평가원) |
한편, 제약사들은 개발중인 의약품의 등록을 위하여 전용 제조 시설을 설치하였지만 임상 3상 단계에서 실패하는 사례를 종종 볼 수 있습니다. 이 경우, 특정 의약품을 위하여 설치한 제조 시설을 더 이상 필요하지 않게 되는 투자 위험이 있으며, 투자위험을 줄이기 위해 아웃소싱 제조에 대한 수요가 지속적으로 증가하고 있습니다. 이에 연구개발의 위험성 극복 및 제한된 자원의 효율적인 활용을 위하여 대기업 뿐만 아니라 중소기업도 개방형 혁신(Open Innovation)전략을 추구하게 되면서, 신약개발 사업모델이 신약개발에서 생산 및 영업까지 모든 단계를 수행하는 완전통합형(FIPCO, Fully Integrated Pharma Co.)에서 신약개발의 가치사슬(Value Chain)별로 전문·세분화되어 수행하면서 가상적으로 통합하여 수행하는 가상통합형(VIPCO, Virtually Integrated Pharma Co.) 모델로 진화하고 있습니다. (세계의약품 산업 및 국내산업경쟁력 현황, 한국수출입은행 해외경제연구소, 2017.08)
이러한 추세로 인하여 과거에는 대형 제약사가 대형 CMO와 계약을 맺는 시장이 주를 이루었으나 최근에는 중견 제약사, 바이오제약사, virtual 제약사 등과 계약을 맺는 중ㆍ소규모 또는 신흥 CMO가 새로운 기회를 얻는 등 산업 생태계의 변화가 나타나고 있으며, 산업 초기 전임상 물질, 임상 물질, 상업화에 위탁 생산만 담당하던 CMO 시장에서도 단순 생산 이상의 업무범위를 갖는 차별화된 CMO가 나타나고 있습니다.
특히, 바이오시밀러 생산의 경우 대규모 생산시설 및 수율이 중요한 이슈이며, 일반적인 제품 생산보다 훨씬 다양한 노하우와 기술이 존재하고, 이를 활용한 생산 공정 기술 확립이 바이오시밀러 생산에서 매우 중요한 역할을 차지합니다. 바이오시밀러에 대한 관심과 수요가 증가함에 따라 대규모 생산시설과 고난도의 생산기술을 필요로 하는 CMO 시장도 함께 성장하고 있으며, CMO 산업 내에서도 경쟁력을 확보하기 위해 다양한 방면으로 연구 및 개발이 진행되고 있습니다. 이에, 배양 배지 선정, 공정개발, 세포주 개발, Scale up, 기술이전, 시험 분석법 개발 등의 실제 개발 업무에도 참여하는 CDO(Contract Development Organization)로서의 역할이 결합된 CDMO(Contract Development Manufacturing Organization)사업이 부상하고 있습니다.
(나) 산업의 특성
바이오의약품 위탁생산사업(Contract Manufacturing Organization)은 실험용 시료생산에서부터 공정개발지원, 임상 및 완제의약품 생산에 이르기까지의 전문적인 서비스를 제공하는 사업으로 제약산업의 세계화와 산업 자체의 급속한 성장, 기업 규모 증대 및 여러 사회·정책적 변화 등으로 활성화되고 있습니다.
바이오의약품은 생물체를 이용하여 복잡한 제조공정을 거쳐야 하고, 인간의 생명과 보건에 관련된 제품을 생산하는 국민의 건강과 직결된 산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 판매 등 전 과정이 국가에 의해 엄격히 규제되는 산업입니다. 화학(Chemical) 제품은 대규모 생산이 용이하고 품질의 균일성, 약효발현 등이 장점으로 의약품산업의 성장을 이끌어왔으나, 의약품산업이 고도화됨에 따라 화학적 합성을 통한 신물질 개발의 한계가 도래하고 있습니다. 반면, 바이오의약품의 경우 생산 노하우(Know-how) 및 시설의 Validation 등까지 수년간의 시간과 막대한 시설투자가 선행되어야 하고 호르몬, 항체, 백신 및 생체기능성 단백질을 살아있는 미생물/동물숙주세포에서 대량생산, 추출하여 의약품으로 개발하는 첨단 생명공학 기술이 요구되며, 각 국의 GMP시설 운영 및 품질관리 능력이 필요한 고부가가치 산업입니다.
GMP 규정은 의약품 개발 및 상업화에 이르기까지 준수해야하는 규정으로 임상시험에 사용하는 의약품부터 GMP기준에 맞게 제조하고 각국의 임상시험계획승인 신청시 GMP 기준에 맞게 제조되었음을 증명하는 자료를 제출해야 합니다. 각 현지의 GMP 기준에 대한 경험 및 능력을 갖추기 위해 많은 시간이 필요하므로 이미 가격경쟁위주의 범용화가 진행된 합성의약품 분야보다는 상대적으로 바이오의약품 CMO산업은 기술 및 진입장벽은 높은 편이라 할 수 있습니다.
당사는 제1공장 준공 후 7개월만인 2019년 1월, 주요 생산장비 및 생산지원설비의 설치·운전 적격성 평가부터 우수의약품 제조관리기준(GMP, Good Manufacturing Practice) 인증 획득을 위한 공정 밸리데이션 (PV) 배치 생산을 한번의 실패없이 성공하였고, GMP실사를 완료하여 2019년 4월 식품의약품안전처로부터 의약품제조 및 품질관리기준 (KGMP) 적합판정을 받았습니다. 또한 2021년 11월, EU-GMP 실사를 완료하여 2022년 2월 스페인의약품 위생제품청(AEMPS)로부터 바이오의약품 제조 및 품질관리기준(EU-GMP) 적합성 승인을 받았습니다.
(2) 산업의 성장성
(가) 시장의 성장요인
① 세계 의약품 시장에서 바이오의약품 비중의 증가
합성의약품은 합성신약의 성공빈도가 낮아져 R&D 투자효율성이 낮아지고 있는 반면, 바이오의약품은 합성의약품 대비 독성이 낮아 부작용이 적고, 표적 단백질 혹은 장기에 직접적인 효능을 발휘하여 우수한 효과가 있으며, 생명공학기술 발전 등으로 성공확률이 높아 바이오의약품 시장이 급성장하고 있습니다. 전체 의약품에서 바이오의약품이 차지하는 비중은 2014년 24%에서 2021년 38%로 증가하였으며, 2028년 41%로 증가할 것으로 전망됩니다. 또한, 글로벌 매출 상위 100대 의약품 중 바이오의약품 매출 비중은 2028년에 100대 의약품 매출액의 60% 차지할 것으로 추정됩니다. 바이오의약품 시장의 성장과 함께 바이오의약품 위탁제조 및 연구개발시장의 성장도 함께 이루어질 것으로 예상합니다.
(자료: Evaluate Pharma World Preview 2022, Outlook to 2028, Evaluate Pharma, 2022.10.08.)
② 바이오의약품 개발사들의 비용효율 및 투자리스크 관리
적절한 생산설비를 보유하지 못한 제약기업이 새로운 바이오의약품 출시를 준비중이라면 허가 받기 2~4년 전부터 큰 위험 부담을 감수해야 합니다. 신약이 100% 허가를 받을 수 있는 것이 불확실한 상황에서 공장 건설에 수년이 걸리고 대규모 투자자금이 소요됩니다. 따라서, 위탁생산업체(CMO)에 위탁생산을 함으로써, 공장 건설에필요한 높은 초기 투자 비용이 소요되지 않고, 시간을 절약하고 위험부담을 낮출 수 있습니다. 생명공학의 발전으로 바이오신약 개발증가와 리스크 관리 측면에서의 CMO의 수요도 함께 증가될 것으로 예상됩니다.
③ 공급안정화 및 경쟁력향상을 위한 대형제약기업의 아웃소싱 증가
의약품의 경우 생산지를 변경하려면 추가적인 허가절차가 필요하여 긴 시간이 소요되는데, CMO를 포함하여 복수의 공장에 대해 사전에 허가작업을 진행해 놓으면 수요 급증이나 천재지변 등으로 인한 제품 부족에 대응할 수 있습니다. 또한, 생산지 등을 변경할 경우 허가절차 등에 추가 시간이 소요되어 의약품 허가전쟁에 불리한 점으로 작용될 수 있기 때문에 생산역량을 갖춘 대형제약기업의 경우에도 아웃소싱을 적극 활용하고 있습니다. 또한 최근 미국ㆍ유럽에서 의약품 생산중단 리스크를 줄이기 위해 듀얼소싱(Dual Sourcing)수요가 증가하여, 자체적인 생산에 아웃소싱 CMO를 추가하거나, 두 군데 이상의 CMO 업체에 위탁생산을 맡기는 경우도 발생하고 있습니다.
④ 의약품 개발 전단계에 대한 아웃소싱의 수요 증가
바이오 제약기업들이 효율적인 연구개발(R&D)을 위해 학계 및 임상대행기업과의 제휴가 증가하고 있으며, 연구 및 생산시설이 없거나 부족한 중소규모의 기업들 뿐만 아니라 대기업들도 리스크를 낮추기 위해 아웃소싱 서비스에 대한 수요가 증가하고 있습니다. 이에 글로벌 CRO 산업과 함께 이루어지는 의약품 상업화를 위한 세포주 및 공정개발 등을 포함하는 개발업무에 대한 아웃소싱 시장도 성장할 것으로 예상하고 있습니다.
⑤ 특허만료로 인한 바이오시밀러 시장 확대
바이오시밀러 시장은 바이오신약에 비해 상대적으로 개발비용 및 개발기간을 절감할수 있고, 제품가격이 바이오신약보다 저렴하여 세계 각국의 의료비 재정부담을 축소하고 의약품에 대한 환자의 접근성 개선하여 도입이 적극적으로 장려되고 있습니다. 최근 항체 블록버스터 의약품의 특허가 만료되며, 바이오시밀러 시장이 확대되었습니다. 2032년까지 연 매출 10억 달러가 넘는 55개의 블록버스터급 바이오 의약품의 특허 만료가 예정되어 있으며, 해당 바이오시밀러의 최대 예상 매출은 2,700억 달러에 달할 것으로 추정됩니다. (Mackinsey, 2022.08) 블록버스터 신약 물질인 키트루다(Keytruda), 옵디보(Opdivo), 스텔라라(Stelara) 등의 특허 만료가 예정되어 있는 점은 CMO 업체들에 긍정적인 요소로 작용할 것입니다.
⑥ 규제 등 정책적 측면
FDA 등에서 제시하는 의약품 제조 및 품질관리기준의 강화로 인해 바이오의약품을 연구 ·개발하는 제약사들이 관련 기준을 충족하는 생산시설을 자체적으로 갖추기는 어렵게 된 반면, 지적재산권 보호 강화 정책에 따라 충분한 기술이전을 통하여 위탁생산의약품의 품질에 대한 신뢰성이 담보될 수 있게 되었습니다. 또한, FDA 등의 의약품 규제기관에서는 의약품의 안정적인 공급을 확보할 수 있도록 복수의 생산라인을 운영하도록 권고하고 있습니다. 이로 인하여 자체적으로 복수의 생산라인이 없는 회사들이 CMO를 이용하는 경우가 많아지고 있습니다.
(나) 시장규모 및 전망
글로벌 바이오의약품 시장 현황 및 전망은 조사기관과 발표 시점에 따라 차이가 있으나, 아이큐비아(IQVIA, 글로벌 컨설팅 시장조사업체)의 의약품 매출자료 기반, 전 세계 바이오의약품 시장 규모는 2021년 기준 4,339억 달러이며, 전체의약품 대비 38%를 차지하고 있습니다. 최근 5년(2017~2021년)간 연평균 12.6%로 성장하였습니다.
'Evaluate Pharma(2022)'보고서에 따르면, 2028년 전체의약품 대비 바이오의약품 비중은 41%로 증가할 것으로 전망하고 있습니다.
바이오의약품 산업동향보고서(한국바이오의약품협회, 2022)에 따르면, 2021년 글로벌 매출 상위 10위 의약품 중 바이오의약품은 7품목이고, 상위 2위는 휴미라(Humira,Abbvie)로 207억 달러를 기록하였으며, 키트루다(Keytruda, Merck & Co.)는 4위로 172억달러, 옵디보(Opdivo, Bristol Myers Squibb)는 9위로 약 76억달러를 기록하였습니다(Nature Reviews, 2022).
한편, 당사의 주제품으로 생산을 예정하고 있는 바이오시밀러 시장의 경우, 2021년 156억 7,000만 달러에서 2022년 191억 달러 규모로 연평균 21.8% 성장하였고, 이후 연평균 22% 성장하여 2026년에는 423억 달러에 이를 것으로 전망됩니다(ResearchandMarkets, 2023.02). 또한, 2021년 기준 글로벌 의약품 R&D 투자는 2,380억
달러로 추정하고 향후 7년(2021~2028년)간 연평균 2.6% 증가하여 2028년에는 2,850억 달러에 이를 것으로 전망하고 있습니다.
바이오의약품의 시장규모 및 R&D투자의 증가는 개발사들의 비용효율 및 투자리스크 관리, 공급안정화 및 성장경쟁력 집중전략 등으로 인해 연구개발 및 제조의 아웃소싱 수요의 증가로 이어지고 있으며, Frost & Sullivan에 따르면 글로벌 바이오의약품 CDMO 시장이 2020년 114억 달러(약 14조원) 규모에서 매년 10.1%씩 성장하여 2026년 203억 달러 규모(약 25조원)로 확대될 것으로 전망하고 있습니다.
(3) 경기변동의 특성
(가) 경기변동 및 계절성
바이오의약품 산업은 생명 및 건강과 직접적인 연관이 있는 의약품을 연구ㆍ제조하는 산업으로 경기변동과 계절적요인에 따른 민감도가 비교적 낮아 타 산업에 비하여 비탄력적인 특성을 가집니다.
(나) 대체시장의 현황
의약품은 각 국가별 기준에 의거한 허가절차를 거쳐 승인을 받아야만 시판할 수 있고, 전문 의약품의 경우 의사의 처방전에 의해서만 약을 구입할 수 있도록 제도적으로 보호되어 있으므로 타 산업과 비교하여 대체시장의 형성이 쉽지 않은 특성을 지니고 있습니다.
다만, 바이오의약품 위탁서비스산업의 측면에서는 자체적으로 생산설비 및 개발역량을 확보하여 제조 및 연구개발을 진행하는 개발사가 될 수도 있지만, 대규모 생산시설 구축 및 전문 인력확보에 어려움이 있거나, 비용 효율 및 연구개발 집중 등을 원인으로 중ㆍ소형 제약사 뿐만 아니라 대형제약사에서도 아웃소싱 수요가 증가하는 추세입니다.
(다) 라이프사이클
[바이오의약품의 성장주기]
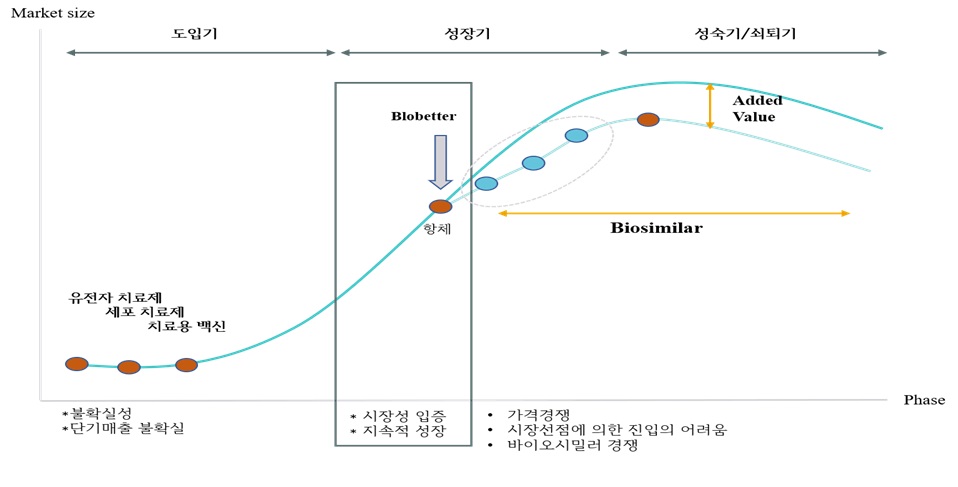 |
|
(자료: 생명공학연구센터, 한국투자증권리서치센터) |
바이오의약품 시장의 라이프사이클은 오리지널 의약품의 특허보호로 인해 타 산업에비하여 주기가 길고 안정적입니다. 오리지널 의약품의 특허 만료 이후, 바이오시밀러가 개발되어 시장에 진입하게 되면서, 의약품 가격의 하락과 수요의 증가로 처방받는 환자수가 증가하게 되며, 이로 인하여 지속적으로 성장하는 흐름을 보여주고 있습니다. 바이오의약품 위탁서비스사업의 라이프사이클 또한 제품별로 5년~10년의 라이선스 및 공급계약을 체결하고, 기술이전 및 제조소 변경에 긴 시간과 비용이 소요되기 때문에 주기가 긴 편이며, 안정적인 라이프사이클을 유지하고 있습니다.
(4) 경쟁상황
한국바이오협회의 글로벌 주요 바이오의약품 CDMO 최근동향 자료에 따르면 2020년 기준 100개 이상의 바이오의약품 CDMO 기업이 있으며, Lonza, Samsung Biologics, Catalent, Boehringer Ingelheim, Thermo Fisher 등 상위 5개사가 전체 시장의 59.4%를 점유하고 있습니다.
현재 자체설비를 가지고 있는 개발사 및 위탁제조사들이 성장하는 바이오의약품 수요에 대응하기 위해 인수합병 및 공장증설 등을 추진하여 생산능력확보에 많은 노력을 기울이고 있어 세계적인 생산규모는 더욱 커질 것으로 예상됩니다.
Bioplan Internal data(2019)에 따르면 전세계적으로 운영되고 있는 바이오의약품 제조시설은 1,813개로 추정됩니다. 연구개발과 초기 임상시험 시료를 제조하는 500L이하의 소규모 생산시설은 751개로 40% 이상을 차지하고 있으며 상업용 제품을 생산하는 10,000L이상의 대규모 생산 시설은 292개로 약 16%를 차지하고 있습니다. 또한, 전체 바이오의약품 제조시설 중에서 497개의 제조시설이 CMO 시설로 운영되고 있으며, 전체 제조시설 중에서 약 27%를 차지하고 있습니다. 일반적으로 전체 제조 시설 중에서 약 3분의 1이 상업용 제품을 생산하고 있는 것으로 추정됩니다.
한편, 규모에 따라서 CMO를 small, mid-sized, large로 구분할 수 있습니다.
- Small CMOs : 물질의 개발, 전임상 단계, 이른 단계의 임상용 시료를 생산하기 위하여 위탁하고 있습니다.
- Mid-sized CMOs : 2,000-12,000L 규모의 생산 Capacity를 보유하고 있는 CMOs를 통칭하며, 연간 30~150백만 달러의 매출이 발생하고 있습니다.
- Large CMOs : Stainless steel 방식 기반의 10,000L 이상의 배양기를 보유하고 있으며, 일반적으로 연간 150백만 달러 이상의 매출이 발생하고 있습니다.
(5) 자원조달의 특성
바이오의약품 CMO 사업의 경우 고객사 제품의 전체공정에 대한 기술을 이전받아 생산되어야 하고 각 제품별로 해당지역을 관할하는 규제당국의 허가를 받아야 합니다. 이에 제품별로 지정된 원부재료를 사용하여야 하며, 해당 원부재료의 구매비용 및 일정운영비를 더하여 환급받고, 경우에 따라 특정 설비 및 기계장치가 필요한 경우, 해당 장치의 설치 및 구매비용도 고객사로부터 환급 또는 지원받아 위탁생산하는 경우도 있습니다. 일반적으로는 각 현지의 CMO가 직접 고객사가 지정하는 원재료의 판매를 담당하는 현지업체와 접촉하여 계약하며, CMO는 현지업체와 대량 및 장기계약을 통해 안정적으로 원재료를 조달 받는 구조입니다.
(6) 관련 법령 또는 정부규제
바이오의약품은 각국의 규제기간으로부터 품목별로 제조허가를 별도로 받아야 하며,품목허가 시(시판허가 시) 제조소 현장실사를 통해 각 규제당국의 GMP 규정에 맞는 검증을 거쳐 제조허가를 승인 받을 수 있습니다.
GMP(Good Manufacturing Practice)는 우수한 의약품을 제조하기 위하여 공장에서 원료의 구입부터 제조, 출하 등에 이르는 모든 과정에 필요한 관리기준을 규정한 것입니다. 미국 FDA가 1963년 GMP를 제정ㆍ공표하면서 WHO(세계보건기구)와 각국에서 GMP를 도입하기 시작했고, 한국에도 1977년에 처음 도입되어 1995년의 의무화되었습니다.
|
국가/국제기구 GMP |
|
|
cGMP |
미국 식품의약청(FDA)가 만든 가장 높은 수준의 GMP |
|
EU GMP |
유럽의약품청(EMA)에서 정한 가이드라인 |
|
KGMP |
한국 식품의약품안전처(MFDS)의 우수의약품제조 및 품질관리기준 |
|
WHO GMP |
WHO 주관 입찰을 통해 수출하는 백신, 생물학 제제 제조관리 기준 |
|
PIC/S GMP |
의약품 상호실사협력기구의 GMP 가이드라인이며 회원국간 의약품 실사정보를 공유해 의약품 허가 등록시 필요한 GMP 실사를 면제 또는 간소화할 수 있음 |
(자료: 한미약품 홈페이지, 회사재구성)
당사는 2019년 4월 식품의약품안전처로부터 의약품 제조 및 품질관리기준 적합판정을 획득(KGMP) 하였으며, 3년 주기로 바이오의약품 전문수탁 제조업체 제조 및 품질관리기준 실시상황 평가를 진행하여 GMP에 대한 관리감독을 받을 예정입니다. 또한 유럽 및 미국을 포함한 글로벌 판매를 위하여 각국의 의약품 품질관리 기관(EMA, FDA 등)으로부터 GMP(EU GMP, cGMP 등)를 획득하여야 합니다. 당사는 2018년 11월 유럽에서의 임상 의약품 사용 승인을 위한 GMP 실사 제도인 EU QP (Qualified Person) 실사를 성공적으로 마쳤습니다.
허가절차의 하나로 2020년 1월 27일부터 EU GMP 실사를 진행하였으며, 2021년 11월 9일부터 12일까지 EU GMP 실사를 진행하여 2022년 2월 17일 스페인의약품 위생제품청(AEMPS)로부터 바이오의약품 제조 및 품질관리기준(EU GMP) 적합성 승인을 받았습니다.
III. 재무에 관한 사항
1. 요약재무정보
아래 제공되는 원화표시 재무정보 중 재무상태표의 자산과 부채는 해당 보고기간말의 마감환율로 기재하였고, 포괄손익계산서의 수익과 비용, 현금흐름표의 현금흐름은 해당 보고기간의 평균 환율을 적용하여 환산하였습니다.
[환율 정보]
| 구 분 | 제10기 3분기 | 제9기 | 제8기 |
| 기말환율 | 1,466.50 | 1,389.20 | 1,312.80 |
| 평균환율 | 1,401.87 | 1,332.54 | 1,322.12 |
| 최고환율 | 1,474.10 | 1,395.30 | 1,436.60 |
| 최저환율 | 1,306.90 | 1,261.60 | 1,219.30 |
출처: 서울외국환중개 공시 매매기준율
|
원화정보이용시 유의사항 |
|
제공되는 원화표시 재무정보는 외화표시 재무정보의 참고자료로서 환율적용에 따라 다른결과를 나타낼 수 있으니 이용시 유의하시기 바랍니다. |
가. 요약 연결재무정보
당사의 제10기 3분기, 제9기, 제8기 연결재무제표는 한국채택국제회계 기준(K-IFRS)에 따른 외부감사(검토)를 받은 연결재무제표입니다.
|
(단위: USD) |
| 계 정 과 목 | 제10기 3분기 | 제9기 | 제8기 |
|---|---|---|---|
| 2025년 3월말 | 2024년 6월말 | 2023년 6월말 | |
| [유동자산] | 165,543,656 | 180,212,721 | 237,260,528 |
| 현금및현금성자산 | 97,956,034 | 157,956,551 | 95,233,052 |
| 단기금융상품 | 38,000,000 | - | 120,265,517 |
| 매출채권 | 2,925,054 | 281,886 | 101,098 |
| 기타유동금융자산 | 9,474,221 | 6,753,026 | 14,096,518 |
| 기타유동자산 | 1,757,522 | 2,190,018 | 2,120,995 |
| 재고자산 | 15,430,825 | 13,031,240 | 5,443,348 |
| [비유동자산] | 375,854,691 | 332,111,252 | 327,639,079 |
| 유형자산 | 234,549,677 | 235,432,205 | 236,470,269 |
| 무형자산 | 140,844,062 | 96,282,053 | 90,578,361 |
| 기타비유동금융자산 | 460,952 | 396,994 | 590,449 |
| 자산총계 | 541,398,347 | 512,323,973 | 564,899,607 |
| [유동부채] | 120,322,131 | 104,993,756 | 102,748,364 |
| [비유동부채] | 52,117,276 | 36,252,007 | 46,067,456 |
| 부채총계 | 172,439,407 | 141,245,763 | 148,815,820 |
| [지배기업소유지분] | 301,950,504 | 316,072,148 | 343,167,697 |
| 자본금 | 525,727,248 | 525,727,248 | 525,727,248 |
| 자본잉여금 | (23,420,258) | 5,661,828 | 5,549,900 |
| 기타자본 | 8,178,733 | 7,569,120 | 7,328,992 |
| 기타포괄손익누계액 | (18,494,076) | (10,679,407) | (7,937,431) |
| 결손금 | (190,041,143) | (212,206,641) | (187,501,012) |
| [비지배지분] | 67,008,436 | 55,006,062 | 72,916,090 |
| 자본총계 | 368,958,940 | 371,078,210 | 416,083,787 |
| 구 분 | 2024년 7월 01일 ~ | 2023년 07월 01일 ~ | 2022년 07월 01일 ~ |
| 2025년 3월 31일 | 2024년 06월 30일 | 2023년 06월 30일 | |
| 영업수익 | 6,277,007 | 517,114 | 122,410 |
| 영업손실 | (37,832,689) | (47,115,233) | (52,622,071) |
| 법인세비용차감전순이익(손실) | 9,449,343 | (41,041,418) | (1,584,945) |
| 당기순이익(손실) | 9,462,557 | (41,348,110) | (2,162,259) |
| 지배기업소유지분 | 22,165,498 | (24,705,629) | 13,288,723 |
| 비지배지분 | (12,702,941) | (16,642,481) | (15,450,982) |
| 기본주당이익(손실) | 1.84 | (2.06) | 1.11 |
| 희석주당이익(손실) | 1.84 | (2.06) | 1.11 |
| 연결에 포함된 회사수 | 5 | 5 | 5 |
[원화 기준]
| (단위: 천원) |
| 계 정 과 목 | 제10기 3분기 | 제9기 | 제8기 |
|---|---|---|---|
| 2025년 3월말 | 2024년 6월말 | 2023년 6월말 | |
| [유동자산] | 242,769,772 | 250,351,512 | 311,475,621 |
| 현금및현금성자산 | 143,652,524 | 219,433,241 | 125,021,951 |
| 단기금융상품 | 55,727,000 | - | 157,884,571 |
| 매출채권 | 4,289,592 | 391,596 | 132,721 |
| 기타유동금융자산 | 13,893,945 | 9,381,304 | 18,505,909 |
| 기타유동자산 | 2,577,406 | 3,042,373 | 2,784,442 |
| 재고자산 | 22,629,305 | 18,102,999 | 7,146,027 |
| [비유동자산] | 551,190,904 | 461,368,951 | 430,124,583 |
| 기타비유동금융자산 | 675,986 | 551,504 | 775,141 |
| 유형자산 | 343,967,101 | 327,062,419 | 310,438,169 |
| 무형자산 | 206,547,817 | 133,755,028 | 118,911,272 |
| 자산총계 | 793,960,676 | 711,720,463 | 741,600,204 |
| [유동부채] | 176,452,405 | 145,857,326 | 134,888,052 |
| [비유동부채] | 76,429,985 | 50,361,288 | 60,477,356 |
| 부채총계 | 252,882,390 | 196,218,614 | 195,365,408 |
| [지배기업소유지분] | 463,486,810 | 452,484,097 | 459,232,568 |
| 자본금 | 589,604,508 | 589,604,508 | 589,604,508 |
| 자본잉여금 | (32,335,432) | 6,468,795 | 6,319,646 |
| 기타자본 | 9,941,456 | 9,086,857 | 8,821,038 |
| 기타포괄손익누계액 | 120,792,887 | 102,913,691 | 77,155,891 |
| 결손금 | (224,516,608) | (255,589,755) | (222,668,516) |
| [비지배지분] | 77,591,475 | 63,017,753 | 87,002,228 |
| 자본총계 | 541,078,286 | 515,501,850 | 546,234,796 |
| 구 분 | 2024년 07월 01일 ~ | 2023년 07월 01일 ~ | 2022년 07월 01일 ~ |
| 2025년 03월 31일 | 2024년 06월 30일 | 2023년 06월 30일 | |
| 영업수익 | 8,799,548 | 689,075 | 161,841 |
| 영업손실 | (53,036,512) | (62,782,933) | (69,572,693) |
| 법인세비용차감전순이익(손실) | 13,246,750 | (54,689,331) | (2,095,487) |
| 당기순이익(손실) | 13,265,275 | (55,098,010) | (2,858,766) |
| 지배기업소유지분 | 31,073,147 | (32,921,239) | 17,569,287 |
| 비지배지분 | (17,807,872) | (22,176,772) | (20,428,052) |
| 기본주당이익(손실) | 2,585 | (2,739) | 1,462 |
| 희석주당이익(손실) | 2,585 | (2,739) | 1,462 |
| 연결에 포함된 회사수 | 5 | 5 | 5 |
나. 요약 재무정보
당사의 제10기 3분기, 제9기, 제8기 재무제표는 한국채택국제회계 기준(K-IFRS)에 따른 외부감사(검토)를 받은 재무제표입니다.
|
(단위: USD) |
| 계 정 과 목 | 제10기 3분기 | 제9기 | 제8기 |
|---|---|---|---|
| 2025년 3월말 | 2024년 6월말 | 2023년 6월말 | |
| [유동자산] | 134,758,369 | 145,143,744 | 161,632,219 |
| 현금및현금성자산 | 80,140,035 | 132,697,494 | 52,442,595 |
| 단기금융상품 | 38,000,000 | - | 104,000,000 |
| 매출채권 | 126,000 | - | - |
| 기타유동금융자산 | 1,479,452 | 5,742,181 | 3,835,915 |
| 기타유동자산 | 14,793,181 | 6,569,110 | 1,206,088 |
| 재고자산 | 219,701 | 134,959 | 147,621 |
| [비유동자산] | 377,162,638 | 264,994,049 | 259,143,916 |
| 종속기업투자주식 | 254,073,508 | 136,141,828 | 136,141,828 |
| 기타비유동금융자산 | 5,898,918 | 56,569,937 | 55,462,462 |
| 유형자산 | 1,727,249 | 1,212,877 | 3,119,636 |
| 무형자산 | 115,462,963 | 71,069,407 | 64,419,990 |
| 자산총계 | 511,921,007 | 410,137,793 | 420,776,135 |
| [유동부채] | 60,799,228 | 25,135,269 | 26,817,857 |
| [비유동부채] | 2,015,221 | 1,022,500 | 1,591,068 |
| 부채총계 | 62,814,449 | 26,157,769 | 28,408,925 |
| [자본금] | 525,727,248 | 525,727,248 | 525,727,248 |
| [자본잉여금] | 5,549,900 | 5,549,900 | 5,549,900 |
| [기타자본] | 8,178,733 | 7,569,120 | 7,328,992 |
| [결손금] | (90,349,323) | (154,866,244) | (146,238,930) |
| 자본총계 | 449,106,558 | 383,980,024 | 392,367,210 |
| 종속ㆍ관계ㆍ공동기업 투자주식의 평가방법 |
원가법 | 원가법 | 원가법 |
| 구분 | 2024년 07월 01일 ~ | 2023년 07월 01일 ~ | 2022년 07월 01일 ~ |
| 2025년 03월 31일 | 2024년 06월 30일 | 2023년 06월 30일 | |
| 영업수익 | 1,512,000 | - | - |
| 영업손실 | (6,592,203) | (20,390,880) | (15,653,952) |
| 법인세비용차감전순손실 | 64,526,261 | (8,290,550) | 22,121,814 |
| 당기순이익(손실) | 64,516,921 | (8,627,314) | 21,519,439 |
| 기본주당이익(손실) | 5.37 | (0.72) | 1.79 |
| 희석주당손실 | 5.37 | (0.72) | 1.79 |
[원화 기준]
| (단위: 천원) |
| 계 정 과 목 | 제10기 3분기 | 제9기 | 제8기 |
|---|---|---|---|
| 2025년 3월말 | 2024년 6월말 | 2023년 6월말 | |
| [유동자산] | 197,623,148 | 201,633,689 | 212,190,777 |
| 현금및현금성자산 | 117,525,361 | 184,343,359 | 68,846,639 |
| 단기금융상품 | 55,727,000 | - | 136,531,200 |
| 매출채권 | 184,779 | - | - |
| 기타유동금융자산 | 2,169,616 | 7,977,038 | 5,035,789 |
| 기타유동자산 | 21,694,200 | 9,125,808 | 1,583,352 |
| 재고자산 | 322,192 | 187,485 | 193,797 |
| [비유동자산] | 553,109,009 | 368,129,733 | 340,204,133 |
| 종속기업투자주식 | 372,598,799 | 189,128,227 | 178,726,992 |
| 기타비유동금융자산 | 8,650,763 | 78,586,956 | 72,811,120 |
| 유형자산 | 2,533,011 | 1,684,929 | 4,095,458 |
| 무형자산 | 169,326,435 | 98,729,620 | 84,570,563 |
| 자산총계 | 750,732,157 | 569,763,422 | 552,394,910 |
| [유동부채] | 89,162,068 | 34,917,916 | 35,206,483 |
| [비유동부채] | 2,955,322 | 1,420,457 | 2,088,754 |
| 부채총계 | 92,117,389 | 36,338,373 | 37,295,237 |
| [자본금] | 589,604,508 | 589,604,508 | 589,604,508 |
| [자본잉여금] | 6,319,646 | 6,319,646 | 6,319,646 |
| [기타자본] | 9,941,456 | 9,086,857 | 8,766,877 |
| [기타포괄손익누계액] | 145,976,031 | 112,085,247 | 82,583,610 |
| [결손금] | (93,226,874) | (183,671,210) | (172,174,969) |
| 자본총계 | 658,614,767 | 533,425,049 | 515,099,673 |
| 종속ㆍ관계ㆍ공동기업 투자주식의 평가방법 |
원가법 | 원가법 | 원가법 |
| 구분 | 2024년 07월 01일 ~ | 2023년 07월 01일 ~ | 2022년 07월 01일 ~ |
| 2025년 03월 31일 | 2024년 06월 30일 | 2023년 03월 31일 | |
| 영업수익 | 2,119,627 | - | - |
| 영업손실 | (9,241,412) | (27,171,663) | (20,696,403) |
| 법인세비용차감전순이익(손실) | 90,457,430 | (11,047,489) | 29,247,693 |
| 당기순이익(손실) | 90,444,336 | (11,496,241) | 28,451,281 |
| 기본주당이익(손실) | 7,525 | (956) | 2,367 |
| 희석주당이익(손실) | 7,525 | (956) | 2,367 |
2. 연결재무제표
2-1. 연결 재무상태표
|
연결 재무상태표 |
|
제 10 기 3분기말 2025.03.31 현재 |
|
제 9 기말 2024.06.30 현재 |
|
(단위 : USD) |
|
제 10 기 3분기말 |
제 9 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
165,543,656 |
180,212,721 |
|
현금및현금성자산 (주4,5,6) |
97,956,034 |
157,956,551 |
|
단기금융상품 (주4,5,6,23) |
38,000,000 |
0 |
|
매출채권 (주4,5) |
2,925,054 |
281,886 |
|
기타유동금융자산 (주4,5,7,21) |
9,474,221 |
6,753,026 |
|
기타유동자산 (주8,21) |
1,757,522 |
2,190,018 |
|
유동재고자산 (주9) |
15,430,825 |
13,031,240 |
|
비유동자산 |
375,854,691 |
332,111,252 |
|
유형자산 (주10,11,22) |
234,549,677 |
235,432,205 |
|
무형자산 (주12,22) |
140,844,062 |
96,282,053 |
|
기타비유동금융자산 (주4,5,7,21) |
460,952 |
396,994 |
|
자산총계 |
541,398,347 |
512,323,973 |
|
부채 |
||
|
유동부채 |
120,322,131 |
104,993,756 |
|
매입채무 (주4,5,21) |
3,352,111 |
1,642,667 |
|
미지급금 (주4,5,21) |
11,722,893 |
16,756,433 |
|
차입금 (주4,5,13,23) |
75,749,857 |
34,440,581 |
|
유동성리스부채 (주4,5,11) |
855,549 |
684,427 |
|
기타유동금융부채 (주4,5,14) |
14,179,553 |
15,955,750 |
|
기타 유동부채 (주15,21) |
14,462,168 |
35,513,898 |
|
비유동부채 |
52,117,276 |
36,252,007 |
|
비유동 리스부채 (주4,5,11) |
585,636 |
449,209 |
|
기타 비유동 부채 (주15,21) |
21,887,309 |
1,248,529 |
|
장기차입금(사채 포함), 총액 (주4,5,13,23) |
24,084,267 |
28,971,651 |
|
이연법인세부채 |
5,560,064 |
5,582,618 |
|
부채총계 |
172,439,407 |
141,245,763 |
|
자본 |
||
|
지배기업의 소유주에게 귀속되는 자본 |
301,950,504 |
316,072,148 |
|
자본금 (주1,16) |
525,727,248 |
525,727,248 |
|
자본잉여금 |
(23,420,258) |
5,661,828 |
|
기타자본 (주17) |
8,178,733 |
7,569,120 |
|
기타포괄손익누계액 |
(18,494,076) |
(10,679,407) |
|
이익잉여금(결손금) |
(190,041,143) |
(212,206,641) |
|
비지배지분 |
67,008,436 |
55,006,062 |
|
자본총계 |
368,958,940 |
371,078,210 |
|
자본과부채총계 |
541,398,347 |
512,323,973 |
2-2. 연결 포괄손익계산서
|
연결 포괄손익계산서 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : USD) |
|
제 10 기 3분기 |
제 9 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
영업수익 (주18) |
2,382,493 |
6,277,007 |
483,794 |
625,868 |
|
영업비용 (주21) |
13,329,406 |
44,109,696 |
13,167,603 |
40,805,713 |
|
영업손익 |
(10,946,913) |
(37,832,689) |
(12,683,809) |
(40,179,845) |
|
기타수익 (주5,19) |
42,637,080 |
42,977,211 |
255,566 |
380,773 |
|
기타비용 (주5,19) |
24,906 |
41,865 |
15,446 |
92,744 |
|
금융수익 (주5,21) |
(6,492,822) |
9,815,254 |
4,350,544 |
15,522,770 |
|
금융비용 (주5,21) |
(7,780,245) |
5,468,568 |
1,870,068 |
7,289,819 |
|
법인세비용차감전순이익(손실) |
32,952,684 |
9,449,343 |
(9,963,213) |
(31,658,865) |
|
법인세비용(수익) (주20) |
(1,054) |
(13,214) |
109,289 |
190,552 |
|
당기순이익(손실) |
32,953,738 |
9,462,557 |
(10,072,502) |
(31,849,417) |
|
당기순이익(손실)의 귀속 |
||||
|
지배기업의 소유주에게 귀속되는 당기순이익(손실) |
35,996,328 |
22,165,498 |
(1,089,273) |
(17,905,704) |
|
비지배지분에 귀속되는 당기순이익(손실) |
(3,042,590) |
(12,702,941) |
(8,983,229) |
(13,943,713) |
|
기타포괄손익 |
153,698 |
(12,222,441) |
(3,995,282) |
(1,975,521) |
|
후속적으로 당기손익으로 재분류되는 포괄손익 |
||||
|
해외사업장환산외환차이 |
153,698 |
(12,222,441) |
(3,995,282) |
(1,975,521) |
|
총포괄손익 |
33,107,436 |
(2,759,884) |
(14,067,784) |
(33,824,938) |
|
총 포괄손익의 귀속 |
||||
|
포괄손익, 지배기업의 소유주에게 귀속되는 지분 |
36,096,264 |
14,350,829 |
(3,230,903) |
(19,000,790) |
|
포괄손익, 비지배지분 |
(2,988,828) |
(17,110,713) |
(10,836,881) |
(14,824,148) |
|
주당이익(손실) |
||||
|
기본주당이익(손실) (단위 : USD) |
2.99 |
1.84 |
(0.09) |
(1.49) |
|
희석주당이익(손실) (단위 : USD) |
2.99 |
1.84 |
(0.09) |
(1.49) |
2-3. 연결 자본변동표
|
연결 자본변동표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : USD) |
|
자본 |
||||||||
|---|---|---|---|---|---|---|---|---|
|
지배기업의 소유주에게 귀속되는 지분 |
비지배지분 |
자본 합계 |
||||||
|
자본금 |
자본잉여금 |
기타자본 |
기타포괄손익누계액 |
이익잉여금 |
지배기업의 소유주에게 귀속되는 지분 합계 |
|||
|
2023.07.01 (기초자본) |
525,727,248 |
5,549,900 |
7,328,992 |
(7,937,431) |
(187,501,012) |
343,167,697 |
72,916,090 |
416,083,787 |
|
총포괄손익 |
||||||||
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(17,905,704) |
(17,905,704) |
(13,943,713) |
(31,849,417) |
|
해외사업환산이익(손실) |
0 |
0 |
0 |
(1,095,086) |
0 |
(1,095,086) |
(880,435) |
(1,975,521) |
|
주식기준보상 (주17) |
0 |
0 |
53,385 |
0 |
0 |
53,385 |
(42,108) |
11,277 |
|
지분변동효과 |
0 |
112,208 |
0 |
0 |
0 |
112,208 |
869,420 |
981,628 |
|
2024.03.31 (기말자본) |
525,727,248 |
5,662,108 |
7,382,377 |
(9,032,517) |
(205,406,716) |
324,332,500 |
58,919,254 |
383,251,754 |
|
2024.07.01 (기초자본) |
525,727,248 |
5,661,828 |
7,569,120 |
(10,679,407) |
(212,206,641) |
316,072,148 |
55,006,062 |
371,078,210 |
|
총포괄손익 |
||||||||
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
22,165,498 |
22,165,498 |
(12,702,941) |
9,462,557 |
|
해외사업환산이익(손실) |
0 |
0 |
0 |
(7,814,669) |
0 |
(7,814,669) |
(4,407,772) |
(12,222,441) |
|
주식기준보상 (주17) |
0 |
0 |
609,613 |
0 |
0 |
609,613 |
0 |
609,613 |
|
지분변동효과 |
0 |
(29,082,086) |
0 |
0 |
0 |
(29,082,086) |
29,113,087 |
31,001 |
|
2025.03.31 (기말자본) |
525,727,248 |
(23,420,258) |
8,178,733 |
(18,494,076) |
(190,041,143) |
301,950,504 |
67,008,436 |
368,958,940 |
2-4. 연결 현금흐름표
|
연결 현금흐름표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : USD) |
|
제 10 기 3분기 |
제 9 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(34,091,842) |
(26,216,590) |
|
영업에서 창출된 현금흐름 |
(33,530,741) |
(29,671,775) |
|
이자의 수취 |
4,995,391 |
7,108,857 |
|
이자지급 |
(5,592,008) |
(3,515,882) |
|
법인세의 납부 |
35,516 |
(137,790) |
|
투자활동현금흐름 |
(63,198,829) |
87,676,137 |
|
단기금융상품의 증가 |
(38,000,000) |
0 |
|
단기금융상품의 감소 |
0 |
103,755,504 |
|
보증금의 증가 |
(48,092) |
(142,821) |
|
보증금의 감소 |
227,619 |
122,466 |
|
유형자산의 취득 (주10) |
(23,151,307) |
(11,185,384) |
|
유형자산의 처분 (주10) |
52,073 |
38,895 |
|
무형자산의 취득 (주12) |
(1,172,942) |
(4,926,390) |
|
정부보조금의 수취 |
7,128 |
87,655 |
|
자본화된 이자의 지급 |
(1,113,308) |
(73,788) |
|
재무활동현금흐름 |
37,296,514 |
(727,540) |
|
차입금의 차입 (주13) |
38,000,000 |
0 |
|
차입금의 상환 (주13) |
0 |
(625,540) |
|
리스부채의 원금상환 (주11) |
(703,486) |
(1,095,836) |
|
주식선택권행사로 인한 현금유입 |
0 |
993,836 |
|
환율변동으로 인한 현금의 변동 |
(6,360) |
(810,558) |
|
현금및현금성자산의 증가(감소) |
(60,000,517) |
59,921,449 |
|
기초현금및현금성자산 (주6) |
157,956,551 |
95,233,052 |
|
기말현금및현금성자산 (주6) |
97,956,034 |
155,154,501 |
[원화기준]
|
연결 재무상태표 |
|
제 10 기 3분기말 2025.03.31 현재 |
|
제 9 기말 2024.06.30 현재 |
|
(단위 : 천원) |
| 과 목 |
제 10 기 3분기말 |
제 9 기말 |
|---|---|---|
|
자산 |
||
|
유동자산 |
242,769,772 | 250,351,512 |
|
현금및현금성자산 |
143,652,524 | 219,433,241 |
|
단기금융상품 |
55,727,000 | - |
|
매출채권 |
4,289,592 | 391,596 |
|
기타유동금융자산 |
13,893,945 | 9,381,304 |
|
기타유동자산 |
2,577,406 | 3,042,373 |
|
재고자산 |
22,629,305 | 18,102,999 |
|
비유동자산 |
551,190,904 | 461,368,951 |
|
유형자산 |
343,967,101 | 327,062,419 |
|
무형자산 |
206,547,817 | 133,755,028 |
|
기타비유동금융자산 |
675,986 | 551,504 |
|
자산총계 |
793,960,676 | 711,720,463 |
|
부채 |
||
|
유동부채 |
176,452,405 | 145,857,326 |
|
매입채무 |
4,915,871 | 2,281,993 |
|
미지급금 |
17,191,623 | 23,278,036 |
|
차입금 |
111,087,165 | 47,844,855 |
|
유동리스부채 |
1,254,663 | 950,806 |
|
유동파생상품부채 |
15,262,517 | 15,439,333 |
| 기타유동금융부채 | 5,531,798 | 6,726,395 |
|
기타 유동부채 |
21,208,769 | 49,335,907 |
|
비유동부채 |
76,429,985 | 50,361,288 |
|
비유동 리스부채 |
858,835 | 624,041 |
|
기타 비유동 부채 |
32,097,739 | 1,734,456 |
|
장기차입금 |
35,319,578 | 40,247,418 |
|
이연법인세부채 |
8,153,834 | 7,755,373 |
|
부채총계 |
252,882,390 | 196,218,614 |
|
자본 |
||
|
지배기업의 소유주에게 귀속되는 자본 |
463,486,810 | 452,484,097 |
|
자본금 |
589,604,508 | 589,604,508 |
|
자본잉여금 |
(32,335,432) | 6,468,795 |
|
기타자본 |
9,941,456 | 9,086,857 |
|
기타포괄손익누계액 |
120,792,887 | 102,913,691 |
|
이익잉여금(결손금) |
(224,516,608) | (255,589,755) |
|
비지배지분 |
77,591,475 | 63,017,753 |
|
자본총계 |
541,078,286 | 515,501,850 |
|
자본과부채총계 |
793,960,676 | 711,720,463 |
|
연결 포괄손익계산서 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : 천원) |
| 과 목 |
제 10 기 3분기 |
제 9 기 3분기 |
||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
영업수익 |
3,432,479 | 8,799,548 | 639,215 | 826,165 |
|
영업비용 |
19,417,434 | 61,836,059 | 17,496,882 | 53,864,765 |
|
영업손익 |
(15,984,955) | (53,036,512) | (16,857,667) | (53,038,601) |
|
기타수익 |
59,779,725 | 60,248,463 | 337,877 | 502,632 |
|
기타비용 |
35,318 | 58,689 | 20,712 | 122,425 |
|
금융수익 |
(8,714,612) | 13,759,710 | 5,789,437 | 20,490,522 |
|
금융비용 |
(10,592,100) | 7,666,221 | 2,491,146 | 9,622,780 |
|
법인세비용차감전순이익(손실) |
45,636,940 | 13,246,750 | (13,242,211) | (41,790,652) |
|
법인세비용(수익) |
(1,766) | (18,524) | 144,604 | 251,534 |
|
당기순이익(손실) |
45,638,706 | 13,265,275 | (13,386,815) | (42,042,186) |
|
당기순이익(손실)의 귀속 |
||||
|
지배기업의 소유주에게 귀속되는 당기순이익(손실) |
50,133,552 | 31,073,147 | (1,507,998) | (23,636,066) |
|
비지배지분에 귀속되는 당기순이익(손실) |
(4,494,846) | (17,807,872) | (11,878,817) | (18,406,119) |
|
기타포괄손익 |
1,742,575 | 11,415,198 | 17,226,835 | 10,714,348 |
|
해외사업환산손익 |
1,742,575 | 11,415,198 | 17,226,835 | 10,714,348 |
|
총포괄손익 |
47,381,281 | 24,680,473 | 3,840,021 | (31,327,837) |
|
총 포괄손익의 귀속 |
||||
|
포괄손익, 지배기업의 소유주에게 귀속되는 지분 |
51,781,670 | 48,952,343 | 18,159,474 | (11,735,948) |
|
포괄손익, 비지배지분 |
(4,400,388) | (24,271,870) | (14,319,453) | (19,591,889) |
|
주당이익(손실) |
||||
|
기본주당이익(손실) (단위 : 원) |
4,171 | 2,585 | (125) | (1,967) |
|
희석주당이익(손실) (단위 : 원) |
4,171 | 2,585 | (125) | (1,967) |
|
연결 자본변동표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : 천원) |
| 구 분 | 자본 | |||||||
|---|---|---|---|---|---|---|---|---|
| 지배기업의 소유주에게 귀속되는 지분 | 비지배지분 | 자본 합계 | ||||||
| 자본금 | 자본잉여금 | 기타자본 | 기타포괄손익누계액 | 이익잉여금 | 지배기업의 소유주에게 귀속되는 지분 합계 | |||
|
2023.07.01 (기초자본) |
589,604,508 | 6,319,646 | 8,821,038 | 77,155,891 | (222,668,516) | 459,232,568 | 87,002,228 | 546,234,796 |
|
당기순이익(손실) |
- | - | - | - | (23,636,066) | (23,636,066) | (18,406,119) | (42,042,186) |
|
해외사업환산손익(손실) |
- | - | - | 11,900,118 | - | 11,900,118 | (1,185,770) | 10,714,348 |
|
주식기준보상 |
- | - | 16,309 | - | - | 16,309 | (55,584) | (39,275) |
| 지분변동효과 | - | 148,118 | - | - | - | 148,118 | 1,147,660 | 1,295,778 |
|
2024.03.31 (기말자본) |
589,604,508 | 6,467,764 | 8,837,347 | 89,056,009 | (246,304,582) | 447,661,047 | 68,502,415 | 516,163,462 |
|
2024.07.01 (기초자본) |
589,604,508 | 6,468,795 | 9,086,857 | 102,913,691 | (255,589,755) | 452,484,097 | 63,017,753 | 515,501,850 |
|
당기순이익(손실) |
- | - | - | - |
31,073,147 | 31,073,147 | (17,807,872) | 13,265,275 |
|
해외사업환산이익(손실) |
- | - | - | 17,879,196 | - |
17,879,196 | (6,463,998) | 11,415,198 |
|
주식기준보상 |
- | - | 854,598 | - |
- |
854,598 | - | 854,598 |
|
지분변동효과 |
- | (38,804,227) | - | - |
- |
(38,804,227) | 38,845,592 | 41,365 |
|
2025.03.31 (기말자본) |
589,604,508 | (32,335,432) | 9,941,456 | 120,792,887 | (224,516,608) | 463,486,810 | 77,591,475 | 541,078,286 |
|
연결 현금흐름표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : 천원) |
| 구 분 |
제 10 기 3분기 |
제 9 기 3분기 |
|---|---|---|
|
영업활동현금흐름 |
(47,792,331) | (34,606,685) |
|
영업에서 창출된 현금흐름 |
(47,005,740) | (39,167,633) |
|
이자의 수취 |
7,002,889 | 9,383,904 |
|
이자지급 |
(7,839,268) | (4,641,070) |
|
법인세의 납부 |
49,789 | (181,887) |
|
투자활동현금흐름 |
(88,596,542) | 115,735,132 |
|
단기금융상품의 증가 |
(53,271,060) | - |
|
단기금융상품의 감소 |
- | 136,960,378 |
|
보증금의 증가 |
(67,419) | (188,528) |
|
보증금의 감소 |
319,092 | 161,659 |
|
유형자산의 취득 |
(32,455,123) | (14,765,042) |
|
유형자산의 처분 |
73,000 | 51,342 |
|
무형자산의 취득 |
(1,644,313) | (6,502,982) |
|
정부보조금의 수취 |
9,993 | 115,707 |
|
자본화된 이자의 지급 |
(1,560,713) | (97,402) |
|
재무활동현금흐름 |
52,284,864 | (960,373) |
|
차입금의 차입 |
53,271,060 | - |
|
차입금의 상환 |
- | (825,732) |
|
리스부채의 상환 |
(986,196) | (1,446,536) |
|
주식선택권행사 |
- | 1,311,895 |
|
환율변동으로 인한 현금의 변동 |
8,323,292 | 3,772,058 |
|
현금및현금성자산의 증가(감소) |
(75,780,717) | 83,940,131 |
|
기초현금및현금성자산 |
219,433,241 | 125,021,951 |
|
기말현금및현금성자산 |
143,652,524 | 208,962,082 |
3. 연결재무제표 주석
| 당분기 2025년 03월 31일 현재 |
| 전 기 2024년 06월 30일 현재 |
| Prestige BioPharma Limited와 그 종속기업 |
1. 일반 사항
Prestige BioPharma Limited(이하 "회사" 또는 "지배회사")와 종속기업(이하 지배회사와 종속기업을 모두 합하여 "연결회사")은 항암치료제의 연구, 개발, 위탁개발생산및 판매업 등을 주된 사업목적으로 하고 있습니다. 회사는 2015년 7월 13일 설립되었으며, 본사는 싱가포르에 소재하고 있습니다. 회사는 2021년 2월 5일 한국증권거래소가 개설한 유가증권시장에 상장하였으며, 보고기간말 현재 자본금은 USD 525,727,248입니다.
보고기간말 현재 회사의 주요 보통주 주주 구성내역은 다음과 같습니다.
| 주주명 | 주식수 | 증권예탁증권수(주1) | 지분율 |
|---|---|---|---|
| Mayson Partners Pte. Ltd. | 2,602,074 | 13,010,372 | 21.7% |
| Octava Fund Limited | 2,177,787 | 10,888,935 | 18.1% |
| 박소연 | 1,851,256 | 9,256,281 | 15.4% |
| Michael Jinwoo, Kim | 1,795,720 | 8,978,600 | 14.9% |
| 기타 | 3,592,394 | 17,961,967 | 29.9% |
| 합 계 | 12,019,231 | 60,096,155 | 100.0% |
(주1) 증권예탁증권(Depositary Receipts)의 원주 교환비율은 5 DR(Depositary
Receipts, 이하 DR)당 1주입니다.
1.1 종속기업 현황
보고기간말 현재 회사의 연결대상 종속기업 현황은 다음과 같습니다.
| 종속기업 | 소재지 |
당분기말 지분율 |
전기말 지분율 |
결산월 | 업종 |
|---|---|---|---|---|---|
| Prestige BioPharma Australia Pty. Ltd. | 호주 | 100% | 100% | 6월 | 항체의약품의 임상개발 |
| Prestige BioPharma Belgium BVBA(주1) | 벨기에 | 100% | 100% | 6월 | 항체의약품의 인허가 |
| 프레스티지바이오파마아이디씨㈜(주2) | 한국 | 100% | 100% | 6월 | 생명공학 연구 및 개발업 |
| 프레스티지바이오로직스㈜(주2),(주3) | 한국 | 40.20% | 24.88% | 6월 | 항체의약품의 생산, 위탁개발생산 |
(주1) 전체 지분의 1%는 회사의 주요 경영진이 회사를 대신하여 보유하고 있어 회사의 실질 지분율을 100%로 판단 하였습니다.
(주2) 회사는 당분기 중 종속회사인 프레스티지바이오파마아이디씨㈜에 USD 38,000,000, 프레스티지바이오로직스㈜에 USD 67,335,432을 유상증자하였습니다.
(주3) 회사는 기존에 보유하고 있었던 프레스티지바이오로직스㈜ 주식 15,206,560주와 2024년 9월 프레스티지바이오로직스㈜의 제3자배정 유상증자 참여로 추가 취득한 15,916,168주를 합한 총 31,122,728주를 보유하고 있습니다. 이에 따라, 회사의 프레스티지바이오로직스㈜에 대한 지분율은 40.20%이며, 기타주주로부터 의결권을위임받아 실질 지배력을 보유함에 따라 회사의 종속기업으로 판단하였습니다.
1.2 종속기업의 요약 재무정보
1) 당분기
| (단위: USD) |
| 종속기업 | 자산 | 부채 | 매출액 | 분기순손실 | 분기포괄손익 |
| Prestige BioPharma Australia Pty. Ltd. | 18,358 | 4,644,550 | - | (228,521) | 47,258 |
| Prestige BioPharma Belgium BVBA | 3,536 | 907,321 | - | (320,480) | (327,140) |
| 프레스티지바이오파마아이디씨㈜ | 87,401,753 | 23,297,950 | - | (9,016,215) | (13,081,711) |
| 프레스티지바이오로직스㈜ | 189,012,962 | 98,054,615 | 4,880,053 | (19,893,149) | (28,319,213) |
2) 전분기
| (단위: USD) |
| 종속기업 | 자산 | 부채 | 매출액 | 분기순손실 | 분기포괄손실 |
|
Prestige BioPharma Australia Pty. Ltd. |
989 | 4,549,417 | - | (309,407) | (236,141) |
|
Prestige BioPharma Belgium BVBA |
1,828 | 575,671 | - | (23,419) | (18,152) |
|
프레스티지바이오파마아이디씨㈜ |
67,295,932 | 24,467,777 | - | (6,898,993) | (7,782,670) |
|
프레스티지바이오로직스㈜ |
220,804,559 | 163,715,715 | 1,748,633 | (18,469,320) | (19,639,697) |
2. 중요한 회계정책
2.1 회계정책의 변경과 공시
연결회사의 2025년 03월 31일로 종료하는 9개월 보고기간에 대한 분기연결재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차연결재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 이 분기연결재무제표는 보고기간 종료일인 2025년 03월 31일 현재 유효한 한국채택국제회계기준에 따라 작성되었습니다. 분기연결재무제표를 작성하기 위하여 채택한 중요한 회계정책은 별도의 언급이 없는 한 전기 연차연결재무제표 작성시 채택한 회계정책과 동일하게 적용되었습니다.
2.1.1 연결회사가 채택한 제ㆍ개정 기준서 및 해석서
연결회사는 2024년 7월 1일로 개시하는 회계기간부터 다음의 제ㆍ개정 기준서 및 해석서를 신규로 적용하였습니다.
(1) 기업회계기준서 제1001호 '재무제표 표시' (개정) - 부채의 유동/비유동 분류
동 개정사항은 유동부채와 비유동부채의 분류는 보고기간말에 존재하는 기업의 권리에 근거한다는 점을 명확히 하고 기업이 부채의 결제를 연기할 수 있는 권리를 행사할지 여부에 대한 기대와는 무관하다는 점을 강조합니다. 그리고 보고기간말에 차입약정을 준수하고 있다면 해당 권리가 존재한다고 설명하고 결제는 현금, 지분상품, 그 밖의 자산 또는 용역을 거래상대방에게 이전하는 것으로 그 정의를 명확히 합니 다. 해당 기준서의 개정이 연결재무제표에 미치는 중요한 영향은 없습니다.
(2) 기업회계기준서 제1116호 '리스' (개정) - 판매후리스에서 생기는 부채
동 개정사항은 판매후리스 거래의 후속측정에 대해 규정합니다. 판매후리스 사용권자산 및 리스부채에도 일반적인 리스 후속측정 방식을 적용하되, 판매자-리스이용자가 보유하는 사용권에 대해서는 관련 손익을 인식하지 않는 방식으로 리스부채를 인식하고 '(수정)리스료'를 산정합니다. 해당 기준서의 개정이 연결재무제표에 미치는 중요한 영향은 없습니다.
(3) 기업회계기준서 제1007호 '현금흐름표' 및 제1107호 '금융상품:공시' (개정) - 공급자금융약정
동 개정사항은 재무제표 이용자가 기업의 부채와 현금흐름에 미치는 영향을 평가할 수 있도록 재무활동에서 생기는 부채의 변동에 공급자금융약정 정보를 구분하여 공시하고 공급자금융약정으로 발생하는 유동성 위험을 공시하도록 규정하고 있습니다.개정내용을 최초로 적용하는 회계연도 내 표시하는 중간보고기간에는 경과규정에 따라 해당 내용을 공시할 필요가 없습니다. 해당 기준서의 개정이 연결재무제표에 미치는 중요한 영향은 없습니다.
2.1.2 공표되었으나 아직 시행되지 않은 제ㆍ개정 기준서 및 해석서
당분기말 현재 제정ㆍ공표되었으나 아직 시행일이 도래하지 않아 적용하지 아니한 한국채택국제회계기준의 내역은 다음과 같습니다.
(1) 기업회계기준서 제1021호 '환율변동효과'와 제1101호 '한국채택국제회계기준의 최초채택' (개정) - 교환가능성 결여
동 개정사항은 한 통화를 다른 통화로 교환 가능한지 여부를 평가하고 교환 가능하지않은 경우 사용할 현물환율을 결정할 때 일관된 접근 방식을 적용하고 관련 정보를 공시하도록 요구합니다. 동 개정사항은 2025년 1월 1일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다. 연결회사는 동 개정으로 인한 연결재무제표의 영향을 검토 중에 있습니다.
2.2 재무제표 작성기준
분기연결재무제표의 작성에 적용된 유의적 회계정책과 계산방법은 주석 2.1.1에서 설명하는 제ㆍ개정 기준서의 적용으로 인한 변경 및 아래 문단에서 설명하는 사항을 제외하고는 전기 연결재무제표 작성에 적용된 회계정책이나 계산방법과 동일합니다.
2.2.1 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전손익에 적용하여 계산합니다.
2.2.2 유형자산
연결회사의 유형자산은 원가에서 감가상각누계액과 손상차손누계액을 차감하여 표시됩니다. 역사적 원가는 자산의 취득에 직접적으로 관련된 지출을 포함합니다.
토지를 제외한 자산은 취득원가에서 잔존가치를 제외하고, 다음의 추정 경제적 내용연수에 걸쳐 정액법으로 상각됩니다.
| 구 분 | 추정 내용연수 |
|---|---|
| 건물 | 40년 |
| 기계장치 | 10년 |
| 시설장치 | 10년 |
| 연구설비 | 3~5년 |
| 차량운반구 | 5년 |
| 공구와기구 | 5년 |
| 집기비품 | 3~5년 |
| 임차개량자산 | 2~3년 |
| 사용권자산 | 2~6년 |
유형자산의 감가상각방법과 잔존가치 및 경제적 내용연수는 매 회계연도 말에 재검토되고 필요한 경우 추정의 변경으로 조정됩니다.
2.2.3 무형자산
1) 무형자산 상각
연결회사의 무형자산은 역사적 원가로 최초 인식되고, 원가에서 상각누계액과 손상차손누계액을 차감한 금액으로 표시됩니다.
내부적으로 창출한 개발비는 기술적 실현가능성, 미래경제적효익 등을 포함한 자산 인식요건이 충족된 시점 이후에 발생한 지출금액의 합계입니다.
연결회사는 내부적으로 창출한 개발비를 제외한 무형자산을 사용가능한 시점부터 잔존가치를 영('0')으로 하여 아래의 내용연수 동안 정액법으로 상각하고 있습니다. 다만, 회원권에 대해서는 이를 이용할 수 있을 것으로 기대되는 기간에 제한이 없으므로 당해 무형자산의 내용연수가 비한정인 것으로 평가하고 상각하지 아니하고 있습니다.
연결회사는 무형자산을 아래의 추정 내용연수 동안 상각하고 있습니다.
| 구 분 | 추정 내용연수 |
|---|---|
| 지적재산권 | 17년 |
| 산업재산권 | 5년 |
| 소프트웨어 | 5년 |
| 회원권 | 비한정 |
2) 영업권
사업결합과 관련하여 이전대가, 피취득자에 대한 비지배지분의 금액 및 단계적으로 이루어지는 사업결합의 경우 연결회사가 이전에 보유하고 있던 피취득자에 대한 지분의 취득일의 공정가치의 합계 금액이 취득일의 식별가능한 취득 자산과 인수 부채의 순액을 초과하는 경우 그 초과 금액을 영업권으로 인식하고 있습니다.
3) 사업결합으로 인한 취득
사업결합으로 취득하는 영업권과 분리하여 인식하는 무형자산의 취득원가는 취득일의 공정가치로 측정하고 있습니다.
4) 무형자산 손상
연결회사는 자산손상을 시사하는 징후의 존재 여부를 검토하며, 그러한 징후가 있는 경우에는 당해 자산의 회수가능액을 추정하고 있습니다. 연결회사는 회수가능액을 개별 자산별로 추정하나, 개별 자산의 회수가능액을 추정할 수 없는 자산의 경우에는그 자산이 속하는 현금창출단위별로 회수가능액을 추정하고 있습니다. 자산이나 현금창출단위의 회수가능액이 장부금액에 미달하는 경우 연결회사는 자산의 장부금액을 감소시키며 이러한 장부금액의 감소를 손상차손으로 즉시 당기손실로 인식하고 있습니다.
3. 중요한 회계추정 및 가정
연결재무제표 작성에는 미래에 대한 가정 및 추정이 요구되며 경영진은 연결회사의 회계정책을 적용하기 위해 판단이 요구됩니다. 추정 및 가정은 지속적으로 평가되며,과거 경험과 현재의 상황에 비추어 합리적으로 예측가능한 미래의 사건을 고려하여 이루어집니다. 회계추정의 결과가 실제 결과와 동일한 경우는 드물 것이므로 중요한 조정을 유발할 수 있는 유의적인 위험을 내포하고 있습니다.
분기 연결재무제표 작성시 사용된 중요한 회계추정 및 가정은 주석 2.2.1에서 설명하는 법인세비용을 결정하는데 사용된 추정의 방법을 제외하고는 전기 연결재무제표 작성시 적용된 회계추정 및 가정과 동일합니다.
4. 금융상품 공정가치
4.1 금융상품 종류별 공정가치
보고기간말 현재 연결회사의 금융상품 종류별 공정가치는 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 상각후원가 측정 금융자산 | ||||
| 현금및현금성자산 | 97,956,034 | 97,956,034 | 157,956,551 | 157,956,551 |
| 단기금융상품 | 38,000,000 | 38,000,000 | - | - |
| 매출채권 | 2,925,054 | 2,925,054 | 281,886 | 281,886 |
| 기타유동금융자산 | 2,172,126 | 2,172,126 | 2,201,540 | 2,201,540 |
| 기타비유동금융자산 | 460,952 | 460,952 | 396,994 | 396,994 |
| 소 계 | 141,514,166 | 141,514,166 | 160,836,971 | 160,836,971 |
| 당기손익공정가치 측정 금융자산 | 7,302,095 | 7,302,095 | 4,551,486 | 4,551,486 |
| 금융자산 합계 | 148,816,261 | 148,816,261 | 165,388,457 | 165,388,457 |
| 상각후원가 측정 금융부채 | ||||
| 매입채무 | 3,352,111 | 3,352,111 | 1,642,667 | 1,642,667 |
| 미지급금 | 11,722,893 | 11,722,893 | 16,756,433 | 16,756,433 |
| 리스부채 | 1,441,185 | 1,441,185 | 1,133,636 | 1,133,636 |
| 단기차입금 | 38,000,000 | 38,000,000 | - | - |
| 유동성장기차입금 | 8,818,705 | 8,818,705 | 7,839,910 | 7,839,910 |
| 유동성전환사채 | 28,931,152 | 28,931,152 | 26,600,671 | 26,600,671 |
| 장기차입금 | 24,084,267 | 24,084,267 | 28,971,651 | 28,971,651 |
| 기타유동금융부채 | 3,772,109 | 3,772,109 | 4,841,920 | 4,841,920 |
| 소 계 | 120,122,422 | 120,122,422 | 87,786,888 | 87,786,888 |
| 당기손익공정가치 측정 금융부채 | 10,407,444 | 10,407,444 | 11,113,830 | 11,113,830 |
| 금융부채 합계 | 130,529,866 | 130,529,866 | 98,900,718 | 98,900,718 |
4.2 금융상품 공정가치 서열 체계
공정가치로 측정되거나 공정가치가 공시되는 항목은 공정가치 서열체계에 따라 구분하며, 정의된 수준들은 다음과 같습니다.
- 동일한 자산이나 부채에 대한 활성시장의(조정되지 않은) 공시가격(수준 1)
- 직접적으로(예: 가격) 또는 간접적으로(예: 가격에서 도출되어) 관측 가능한, 자산 이나 부채에 대한 투입 변수를 이용하여 산정한 공정가치. 단, 수준 1에 포함된 공 시가격은 제외함(수준 2)
- 관측 가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입 변수(관측 가 능하지 않은 투입 변수)를 이용하여 산정한 공정가치(수준 3)
보고기간말 현재 공정가치로 측정되거나 공정가치가 공시되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
(1) 당분기말
| (단위: USD) |
| 구 분 | 수준 1 | 수준 2 | 수준 3 | 합 계 |
|---|---|---|---|---|
| 공정가치 측정되는 금융자산(파생상품자산): | ||||
| 당기손익공정가치 측정 금융자산 | - | - | 7,302,095 | 7,302,095 |
| 공정가치 측정되는 금융부채(파생상품부채): | ||||
| 당기손익공정가치 측정 금융부채 | - | - | 10,407,444 | 10,407,444 |
(2) 전기말
| (단위: USD) |
| 구 분 | 수준 1 | 수준 2 | 수준 3 | 합 계 |
|---|---|---|---|---|
| 공정가치 측정되는 금융자산(파생상품자산): | ||||
| 당기손익공정가치 측정 금융자산 | - | - | 4,551,486 | 4,551,486 |
| 공정가치 측정되는 금융부채(파생상품부채): | ||||
| 당기손익공정가치 측정 금융부채 | - | - | 11,113,830 | 11,113,830 |
4.3 반복적인 측정치의 수준 3의 변동 내역
(1) 당분기
| (단위: USD) |
| 구 분 | 파생상품자산(주1) | 파생상품부채(주1) |
|---|---|---|
| 기초금액 | 4,551,486 | 11,113,830 |
| 당기손익인식액 | 3,168,802 | (37,091) |
| 기타조정 | (418,193) | (669,295) |
| 기말금액 | 7,302,095 | 10,407,444 |
| 미실현손익(주2) | 3,168,802 | 37,091 |
(주1) 2023년 3월 프레스티지바이오로직스㈜는 전환사채를 발행하였으며, 조기상환권과 행사가격 조정 조건이 있는 전환권을 파생상품자산 및 파생상품부채로 인식하였습니다(주석 13 참조).
(주2) 금융자산과 금융부채와 관련하여 당분기 중 파생상품평가이익 USD 3,205,893을 금융수익으로 반영하였습니다.
(2) 전분기
| (단위: USD) |
| 구 분 | 파생상품자산(주1) | 파생상품부채(주1) |
|---|---|---|
| 기초금액 | 11,835,380 | 23,756,728 |
| 당기손익인식액 | (1,337,955) | (4,600,637) |
| 기타조정 | (212,023) | (388,211) |
| 기말금액 | 10,285,402 | 18,767,880 |
| 미실현손익(주2) | (1,337,955) | 4,600,637 |
(주1) 2023년 3월 프레스티지바이오로직스㈜는 전환사채를 발행하였으며, 조기상환권과 행사가격 조정 조건이 있는 전환권을 파생상품자산 및 파생상품부채로 인식하였습니다(주석 13 참조).
(주2) 금융자산과 금융부채와 관련하여 전분기 중 각각 파생상품평가이익 USD 4,600,637와 파생상품평가손실 USD 1,337,955을 금융수익과 금융비용으로 반영하였습니다.
4.4 가치평가기법 및 투입 변수
연결회사는 공정가치 서열체계에서 수준 3으로 분류되는 금융상품의 공정가치에 대하여 다음의 가치평가기법과 투입 변수를 사용하고 있으며, 당분기 중 연결회사의 금융자산과 금융부채의 공정가치에 영향을 미치는 사업환경 및 경제적인 환경의 유의적인 변동은 없습니다.
| (단위: USD) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 투입변수 | 투입변수범위 |
|---|---|---|---|---|---|
| 파생상품자산 | 7,302,095 | 3 | 이항모형 | 기초자산 가격변동성 | 60.45% |
| 무위험이자율 | 2.63% | ||||
| 위험수익률 | 13.78% | ||||
| 파생상품부채 | 10,407,444 | 3 | 이항모형 | 기초자산 가격변동성 | 60.45% |
| 무위험이자율 | 2.63% | ||||
| 위험수익률 | 13.78% |
4.5 수준 3으로 분류된 반복적인 공정가치 측정치의 민감도 분석
금융상품의 민감도 분석은 통계적 기법을 이용한 관측 불가능한 투입변수의 변동에 따른 금융상품의 가치 변동에 기초하여 유리한 변동과 불리한 변동으로 구분하여 이루어집니다. 그리고 공정가치가 두 개 이상의 투입변수에 영향을 받는 경우에는 가장유리하거나 또는 가장 불리한 금액을 바탕으로 산출됩니다. 민감도 분석대상으로 수준3으로 분류되는 금융상품 중 해당 공정가치 변동이 당기손익으로 인식되는 파생상품자산과 파생상품부채 투입변수의 변동에 따른 손익효과에 대한 민감도 분석 결과는 아래와 같습니다.
| (단위: USD) |
| 금융상품 | 구 분 | 법인세비용차감전순손익에 미치는 영향 | ||
|---|---|---|---|---|
| 가정의 변동폭 | 가정의 증가 | 가정의 감소 | ||
| 파생상품자산 | 기초자산가격 | 1.0% | 254,909 | (254,909) |
| 기초자산가격변동성 | 1.0% | 122,916 | (123,050) | |
| 파생상품부채 | 기초자산가격 | 1.0% | (254,909) | 254,909 |
| 기초자산가격변동성 | 1.0% | (122,916) | 123,050 | |
5. 범주별 금융상품
5.1 금융상품 범주별 장부금액
(1) 보고기간말 현재 연결회사의 범주별 금융자산은 아래와 같이 구성되어 있습니다.
| (단위: USD) |
| 금융자산 | 당분기말 | 전기말 |
|---|---|---|
| 상각후원가 측정 금융자산 | ||
| 현금및현금성자산 | 97,956,034 | 157,956,551 |
| 단기금융상품 | 38,000,000 | - |
| 매출채권 | 2,925,054 | 281,886 |
| 기타유동금융자산 | 2,172,126 | 2,201,540 |
| 기타비유동금융자산 | 460,952 | 396,994 |
| 소 계 | 141,514,166 | 160,836,971 |
| 당기손익공정가치 측정 금융자산 | 7,302,095 | 4,551,486 |
| 합 계 | 148,816,261 | 165,388,457 |
(2) 보고기간말 현재 연결회사의 범주별 금융부채는 아래와 같이 구성되어 있습니다.
| (단위: USD) |
| 금융부채 | 당분기말 | 전기말 |
|---|---|---|
| 상각후원가 측정 금융부채 | ||
| 매입채무 | 3,352,111 | 1,642,667 |
| 미지급금 | 11,722,893 | 16,756,433 |
| 리스부채 | 1,441,185 | 1,133,636 |
| 단기차입금 | 38,000,000 | - |
| 유동성장기차입금 | 8,818,705 | 7,839,910 |
| 유동성전환사채 | 28,931,152 | 26,600,671 |
| 장기차입금 | 24,084,267 | 28,971,651 |
| 기타유동금융부채 | 3,772,109 | 4,841,920 |
| 소 계 | 120,122,422 | 87,786,888 |
| 당기손익공정가치 측정 금융부채 | 10,407,444 | 11,113,830 |
| 합 계 | 130,529,866 | 98,900,718 |
5.2 금융상품 범주별 순손익
당분기와 전분기 중 연결회사의 금융상품 범주별 순손익은 아래와 같이 구성되어 있습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 상각후원가 측정 금융자산 | ||
| 이자수익 | 5,226,375 | 10,583,398 |
| 외환이익(손실) | (552,369) | 20,070 |
| 기타의대손상각비환입 | - | 25,000 |
| 파생상품자산 | ||
| 파생상품평가이익(손실) | 3,168,802 | (1,337,955) |
| 상각후원가 측정 금융부채 | ||
| 외환이익(손실) | 557,449 | (1,745,771) |
| 이자비용 | (4,090,662) | (3,897,045) |
| 파생상품부채 | ||
| 파생상품평가이익(손실) | 37,091 | 4,600,637 |
6. 현금및현금성자산 및 단기금융상품
보고기간말 현재 연결회사의 현금및현금성자산 및 단기금융상품의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 현금및현금성자산 | ||
| 보통예금(주1) | 21,466,063 | 25,410,119 |
| 정기예금(주1) | 76,489,971 | 132,546,432 |
| 소 계 | 97,956,034 | 157,956,551 |
| 단기금융상품(주2) | 38,000,000 | - |
| 합 계 | 135,956,034 | 157,956,551 |
(주1) 보고기간말 현재 사용이 제한되어 있는 예금은 없습니다.
(주2) 보고기간말 현재 연결회사는 단기금융상품을 차입금에 대한 담보로 제공하고 있습니다(주석 23 참조).
7. 기타금융자산
보고기간말 현재 연결회사의 기타금융자산의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 대여금(주1) | 3,017,399 | 3,017,399 |
| 미수수익(주1) | 2,505,524 | 2,629,438 |
| 미수금 | 908,200 | 563,272 |
| 보증금 | 544,923 | 731,393 |
| 당기손익공정가치 측정 금융자산 | 7,302,095 | 4,551,486 |
| 차감: 손실충당금(주1) | (4,342,968) | (4,342,968) |
| 합 계 | 9,935,173 | 7,150,020 |
| 차감: 비유동항목 | (460,952) | (396,994) |
| 유동항목 | 9,474,221 | 6,753,026 |
(주1) 대여금 및 미수수익에는 특수관계자에 대한 거래가 포함되어 있습니다(주석 21참조).
8. 기타자산
보고기간말 현재 연결회사의 기타자산의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 선급금 | 164,607 | 222,729 |
| 선급비용 | 891,496 | 931,732 |
| 선납세금 | 103,915 | 78,040 |
| 부가세대급금 | 597,504 | 957,517 |
| 합 계 | 1,757,522 | 2,190,018 |
| 차감 : 비유동항목 | - | - |
| 유동항목 | 1,757,522 | 2,190,018 |
9. 재고자산
보고기간말 현재 연결회사의 재고자산의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 제품 | 17,189,037 | 18,619,794 |
| 재공품 | 592,708 | 571,378 |
| 원재료 | 15,574,178 | 13,683,435 |
| 저장품 | 219,701 | 134,959 |
| 소 계 | 33,575,624 | 33,009,566 |
| 평가손실충당금(주1) | (18,144,799) | (19,978,326) |
| 합 계 | 15,430,825 | 13,031,240 |
(주1) 당분기 연결회사의 재고자산 순실현가능가치 평가에 따른 재고자산평가충당금환입은 USD 1,833,527이며, 전분기 재고자산평가손실 인식액은 없습니다.
10. 유형자산
(1) 유형자산의 내역
보고기간말 현재 연결회사의 유형자산의 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 토지(주1) | 18,948,491 | - | 18,948,491 | 19,942,746 | - | 19,942,746 |
| 건물 | 93,694,744 | (5,218,813) | 88,475,931 | 55,767,311 | (3,942,627) | 51,824,684 |
| 기계장치 | 23,635,006 | (7,535,689) | 16,099,317 | 24,468,803 | (6,178,609) | 18,290,194 |
| 시설장치 | 29,628,995 | (6,769,773) | 22,859,222 | 26,719,116 | (4,988,721) | 21,730,395 |
| 연구설비 | 10,087,213 | (6,590,611) | 3,496,602 | 10,265,464 | (5,895,797) | 4,369,667 |
| 차량운반구 | 497,087 | (279,049) | 218,038 | 437,736 | (245,310) | 192,426 |
| 공구와기구 | 65,240 | (42,243) | 22,997 | 69,432 | (34,542) | 34,890 |
| 집기비품 | 16,589,237 | (10,373,367) | 6,215,870 | 16,894,030 | (8,958,743) | 7,935,287 |
| 임차개량자산 | 1,707,628 | (1,599,553) | 108,075 | 1,605,906 | (1,544,620) | 61,286 |
| 사용권자산 | 5,850,575 | (4,291,670) | 1,558,905 | 5,255,960 | (4,251,316) | 1,004,644 |
| 건설중인자산(주2) | 76,546,229 | - | 76,546,229 | 110,045,986 | - | 110,045,986 |
| 합 계 | 277,250,445 | (42,700,768) | 234,549,677 | 271,472,490 | (36,040,285) | 235,432,205 |
(주1) 당분기말 현재 장부금액에 포함된 USD 8,284,084(전기말: USD 8,816,352)는 연결회사가 부산 IDC R&D센터 부지로 사용할 목적에서 한국토지주택공사로부터 매입한 토지이며, 해당 토지는 매매계약일(2021년 8월 20일)로부터 5년이 되는 날까지 제3자로의 매각이 제한됩니다.
(주2) 건설중인자산은 취득 중인 항체부문 관련 기계장치 등으로 구성되어 있습니다.
(2) 유형자산의 변동
당분기와 전분기 중 연결회사의 유형자산의 변동 내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 기초 | 취득 | 처분 | 대체(주1) | 감가상각 | 환율차이 | 분기말 |
|---|---|---|---|---|---|---|---|
| 토지 | 19,942,746 | - | - | - | - | (994,255) | 18,948,491 |
| 건물 | 51,824,684 | 5,114,689 | - | 37,824,802 | (1,567,293) | (4,720,951) | 88,475,931 |
| 기계장치 | 18,290,194 | 6,430 | - | 673,759 | (1,813,603) | (1,057,463) | 16,099,317 |
| 시설장치 | 21,730,395 | 2,780 | - | 4,768,112 | (2,182,221) | (1,459,844) | 22,859,222 |
| 연구설비 | 4,369,667 | 71,669 | - | 475,344 | (1,194,753) | (225,325) | 3,496,602 |
| 차량운반구 | 192,426 | 102,879 | (9,330) | - | (54,548) | (13,389) | 218,038 |
| 공구와기구 | 34,890 | - | - | - | (10,250) | (1,643) | 22,997 |
| 집기비품 | 7,935,287 | 803,631 | - | 99,123 | (2,202,698) | (419,473) | 6,215,870 |
| 임차개량자산 | 61,286 | 114,447 | - | - | (67,658) | - | 108,075 |
| 사용권자산 | 1,004,644 | 1,268,212 | - | - | (708,721) | (5,230) | 1,558,905 |
| 건설중인자산 | 110,045,986 | 14,053,032 | (47,509) | (42,027,604) | - | (5,477,676) | 76,546,229 |
| 합 계 | 235,432,205 | 21,537,769 | (56,839) | 1,813,536 | (9,801,745) | (14,375,249) | 234,549,677 |
(주1) 해당 금액에는 건설중인자산의 본계정대체, 건설이자비용 자본화 금액이 포함되어 있습니다.
2) 전분기
| (단위: USD) |
| 구 분 | 기초 | 취득 | 처분 | 대체(주1) | 감가상각 | 환율차이 | 분기말 |
|---|---|---|---|---|---|---|---|
| 토지 | 20,236,871 | - | - | - | - | (337,277) | 19,899,594 |
| 건물 | 55,540,933 | 22,485 | - | - | (1,091,197) | (1,001,211) | 53,471,010 |
| 기계장치 | 10,607,197 | 437,908 | - | 9,964,281 | (1,471,388) | (389,400) | 19,148,598 |
| 시설장치 | 5,205,704 | 456,085 | - | 19,235,765 | (1,439,795) | (471,589) | 22,986,170 |
| 연구설비 | 5,365,110 | 506,588 | - | - | (1,318,908) | (84,118) | 4,468,672 |
| 차량운반구 | 281,006 | 13,622 | (11,535) | - | (63,957) | (4,449) | 214,687 |
| 공구와기구 | 51,139 | - | - | - | (10,913) | (815) | 39,411 |
| 집기비품 | 7,953,202 | 1,107,250 | - | 1,506,568 | (2,144,674) | (167,962) | 8,254,384 |
| 임차개량자산 | 329,545 | - | - | - | (211,858) | (11) | 117,676 |
| 사용권자산 | 2,055,236 | 301,906 | - | - | (1,007,946) | (4,636) | 1,344,560 |
| 건설중인자산 | 128,844,326 | 8,543,278 | (52,176) | (29,655,574) | - | (2,210,274) | 105,469,580 |
| 합 계 | 236,470,269 | 11,389,122 | (63,711) | 1,051,040 | (8,760,636) | (4,671,742) | 235,414,342 |
(주1) 해당 금액에는 건설중인자산의 본계정대체, 건설이자비용 자본화 금액 및 장기선급금의 건설중인자산으로의 대체가 포함되어 있습니다.
11. 리스
(1) 사용권자산의 내역
보고기간말 현재 연결회사의 사용권자산의 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 건물 | 5,441,237 | (4,189,568) | 1,251,669 | 5,110,211 | (4,126,571) | 983,640 |
| 차량운반구 | 403,736 | (99,959) | 303,777 | 140,147 | (123,443) | 16,704 |
| 기타설비 | 5,602 | (2,143) | 3,459 | 5,602 | (1,302) | 4,300 |
| 합 계 | 5,850,575 | (4,291,670) | 1,558,905 | 5,255,960 | (4,251,316) | 1,004,644 |
(2) 사용권자산의 변동
당분기와 전분기 중 연결회사의 사용권자산 변동내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 건 물 | 차량운반구 | 기타설비 | 합 계 |
|---|---|---|---|---|
| 기초 | 983,640 | 16,704 | 4,300 | 1,004,644 |
| 취득 및 증가 | 961,497 | 306,715 | - | 1,268,212 |
| 환율차이 | (4,180) | (1,050) | - | (5,230) |
| 감가상각 | (689,288) | (18,592) | (841) | (708,721) |
| 분기말 | 1,251,669 | 303,777 | 3,459 | 1,558,905 |
2) 전분기
| (단위: USD) |
| 구 분 | 건 물 | 차량운반구 | 기타설비 | 합 계 |
|---|---|---|---|---|
| 기초 | 2,002,157 | 47,663 | 5,416 | 2,055,236 |
| 취득 및 증가 | 301,906 | - | - | 301,906 |
| 환율차이 | (4,457) | (179) | - | (4,636) |
| 감가상각 | (984,067) | (23,042) | (837) | (1,007,946) |
| 분기말 | 1,315,539 | 24,442 | 4,579 | 1,344,560 |
(3) 리스부채의 변동
당분기와 전분기 중 연결회사의 리스부채의 변동내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | 1,133,636 | 2,291,077 |
| 리스자산의 취득 | 1,004,506 | 292,867 |
| 리스부채의 원리금 지급 | (703,486) | (1,169,891) |
| 이자비용 | 2,352 | 84,462 |
| 환율변동효과 | 4,177 | 5,183 |
| 분기말 | 1,441,185 | 1,503,698 |
(4) 당분기와 전분기 중 리스와 관련해서 포괄손익계산서에 인식된 금액은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 사용권자산의 감가상각비(영업비용에 포함) | 708,721 | 1,007,946 |
| 리스부채에 대한 이자비용(주1) | 73,960 | 84,462 |
| 단기리스료(영업비용에 포함) | 16,641 | 41,289 |
| 단기리스가 아닌 소액자산 리스료(영업비용에 포함) | 73,652 | 66,055 |
(주1) 리스부채에 대한 이자비용 중 당분기와 전분기에 각각 USD 71,607와 USD 73,788이 무형자산(개발비)으로 자본화되었습니다(주석 12 참조).
(5) 리스의 총 현금유출은 각각 당분기 USD 793,779와 전분기 USD 1,277,235입니다.
12. 무형자산
(1) 무형자산의 내역
보고기간말 현재 연결회사의 무형자산의 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | |||
|---|---|---|---|---|
| 취득원가 | 상각누계액 | 손상누계액 | 장부금액 | |
| 영업권 | 19,160,421 | - | (11,397,184) | 7,763,237 |
| 개발비(주1) | 124,080,331 | - | (13,903,934) | 110,176,397 |
| 지적재산권(주1) | 21,384,857 | (477,413) | (4,352,296) | 16,555,148 |
| 산업재산권 | 5,530,291 | (17,253) | (268,946) | 5,244,092 |
| 소프트웨어 | 859,502 | (405,705) | - | 453,797 |
| 회원권 | 451,290 | - | - | 451,290 |
| 건설중인자산 | 200,101 | - | - | 200,101 |
| 합 계 | 171,666,793 | (900,371) | (29,922,360) | 140,844,062 |
| (단위: USD) |
| 구 분 | 전기말 | |||
|---|---|---|---|---|
| 취득원가 | 상각누계액 | 손상누계액 | 장부금액 | |
| 영업권 | 19,160,421 | - | (11,397,184) | 7,763,237 |
| 개발비(주1) | 122,272,723 | - | (56,304,355) | 65,968,368 |
| 지적재산권(주1) | 20,860,971 | (488,720) | (3,912,632) | 16,459,619 |
| 산업재산권 | 5,472,398 | (7,227) | (268,946) | 5,196,225 |
| 소프트웨어 | 684,005 | (333,631) | - | 350,374 |
| 회원권 | 480,286 | - | - | 480,286 |
| 건설중인자산 | 63,944 | - | - | 63,944 |
| 합 계 | 168,994,748 | (829,578) | (71,883,117) | 96,282,053 |
(주1) 연결회사는 내부적으로 창출한 무형자산의 경우, 임상 1상의 개시가 승인되면 기술적 실현가능성, 미래경제적효익 등을 포함한 자산 인식요건이 충족된 시점 이후 발생한 지출을 무형자산으로 인식하고 있습니다. 제3자로부터 지적재산권의 취득 등의계약을 체결하면서 지급한 계약금 등의 지출에 대하여 무형자산의 정의 및 인식기준을 충족하는 경우 무형자산으로 인식하고 있습니다.
연결회사는 2019년 4월 29일 유럽 의약품청인 EMA(European Medicines Agency 이하, EMA)에 HD201 품목허가 신청서류를 제출하였습니다. 이후 2022년 5월 19일 연결회사는 EMA의 인체의약품위원회인 Committee for Medicinal Products for Human Use(CHMP)로부터 품목허가에 대한 부정적 의견을 받았습니다. 연결회사는 EMA로부터 수령한 품목허가에 대한 부정적 의견 및 품목허가 재심사 신청 철회를 근거로, 과거기간에 HD201 관련한 무형자산 전액에 대해 손상차손을 인식하였습니다. 2024년 7월 25일, EMA CHMP로부터 공식적으로 HD201 파이프라인(유방암 및 전이성 위암치료제)의 승인을 권고하는 긍정적 의견을 획득하였으며, 2024년 9월 20일 유럽연합진행위원회로부터 품목명 투즈뉴(Tuznue)로 최종 판매허가를 취득함에 따라 당분기에 손상차손 금액 중 USD 42,400,421을 환입하였습니다. 회사는 투즈뉴(Tuznue)의 글로벌 상업화를 위해 유럽 시장 외에도, 영국(MHRA), 스위스(Swissmedic), 호주(TGA), 캐나다(HCA) 그리고 한국(MFDS)에서 마케팅 허가를 신청할 계획입니다.
HD204는 보고기간말 현재 임상시험 3상이 진행 중에 있으며, PBP1502는 보고기간말 현재 임상시험 1상이 진행 중에 있습니다.
(2) 무형자산의 변동
당분기와 전분기 중 연결회사의 무형자산 변동 내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 기초 | 취득(주1) | 대체 | 감가상각 | 손상차손환입(주2) | 환율차이 | 분기말 |
|---|---|---|---|---|---|---|---|
| 영업권 | 7,763,237 | - | - | - | - | - | 7,763,237 |
| 개발비 | 65,968,368 | 1,807,608 | - | - | 42,400,421 | - | 110,176,397 |
| 지적재산권 | 16,459,619 | 127,500 | - | (19,061) | - | (12,910) | 16,555,148 |
| 산업재산권 | 5,196,225 | 61,857 | 592 | (10,958) | - | (3,624) | 5,244,092 |
| 소프트웨어 | 350,374 | 152,222 | 74,846 | (96,588) | - | (27,057) | 453,797 |
| 회원권 | 480,286 | - | - | - | - | (28,996) | 451,290 |
| 건설중인자산 | 63,944 | 145,371 | 1,283 | - | - | (10,497) | 200,101 |
| 합 계 | 96,282,053 | 2,294,558 | 76,721 | (126,607) | 42,400,421 | (83,084) | 140,844,062 |
(주1) 취득 금액에는 자본화된 차입원가 및 인건비가 포함되어 있습니다.
(주2) 당분기 중 HD201 개발비에 설정된 무형자산손상차손 USD 42,400,421을 환입하였습니다.
2) 전분기
| (단위: USD) |
| 구 분 | 기초 | 취득(주1) | 대체 | 감가상각 | 환율차이 | 분기말 |
|---|---|---|---|---|---|---|
| 영업권 | 7,763,237 | - | - | - | - | 7,763,237 |
| 개발비 | 60,056,991 | 4,886,703 | - | - | (415,313) | 64,528,381 |
| 지적재산권 | 16,434,834 | 62,914 | - | (20,294) | (4,961) | 16,472,493 |
| 산업재산권 | 5,053,978 | 98,800 | 2,441 | (3,111) | (249) | 5,151,859 |
| 소프트웨어 | 419,338 | 9,524 | - | (93,205) | (6,802) | 328,855 |
| 회원권 | 776,812 | - | - | - | (15,631) | 761,181 |
| 건설중인자산 | 73,171 | 63,438 | (2,441) | - | (2,663) | 131,505 |
| 합 계 | 90,578,361 | 5,121,379 | - | (116,610) | (445,619) | 95,137,511 |
(주1) 취득 금액에는 자본화된 차입원가 및 인건비가 포함되어 있습니다.
(3) 보고기간말 현재 주요 개발 프로젝트별 자산화된 내부창출 개발비 금액 및 잔여상각기간은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 프로젝트 | 단계 | 자산화한 연구개발비 금액(누계액) | 연구 개발비 |
잔여 상각기간 |
|||
|---|---|---|---|---|---|---|---|---|
| 임상 1상 | 임상 3상 | 손상차손 | 합 계 | |||||
| 바이오시밀러 | HD201 | 개발완료 | 524,369 | 55,779,986 | (13,903,934) | 42,400,421 | 156,683 | - |
| 바이오시밀러 | HD204 | 개발 중 | 11,789,722 | 53,586,339 | - | 65,376,061 | - | - |
| 바이오시밀러 | PBP1502 | 개발 중 | 2,399,915 | - | - | 2,399,915 | - | - |
| 합 계 | 14,714,006 | 109,366,325 | (13,903,934) | 110,176,397 | 156,683 | - | ||
상기 프로젝트는 허셉틴, 아바스틴 및 휴미라의 바이오시밀러 개발 프로젝트입니다. 품목명 투즈뉴인 허셉틴 바이오시밀러(HD201)는 암 치료제로 당분기 중 개발이 완료되었습니다. 아바스틴의 바이오시밀러(HD204)는 암 치료제, 휴미라의 바이오시밀러
(PBP1502)는 류마티스 관절염 등의 치료제로 개발 중에 있습니다. 이들은 보고기간 말 현재 개발 중인 프로젝트이며, 상각이 개시되지 않았습니다.
(4) 당분기와 전분기 중 적격 자산인 무형자산에 대해 자본화된 차입원가는 각각 당분기 USD 1,113,308이며, 전분기 USD 73,788입니다.
(5) 개발비의 손상
회사는 과거기간에 HD201 관련 개발비에 손상차손을 인식하였으나, 당분기에 유럽연합진행위원회로부터 최종 판매허가를 취득함에 따라 과거 인식하였던 손상차손 금액 중 USD 42,400,421을 환입하였습니다.
회수가능액은 미래현금흐름을 근거로 계산한 사용가치에 기초하여 결정하였으며, 미래현금흐름은 회사의 과거 경험과 향후 10년간의 사업계획 등을 근거로 추정하였습니다.
당분기말 현재 추정기간동안 사용가치 계산에 사용된 주된 가정은 다음과 같습니다.
이러한 가정을 통한 검토 결과, 사용가치가 장부금액을 USD 42,400,421 초과하여 무형자산손상차손환입을 인식하였습니다.
| 구 분 | 주요 가정치 |
|---|---|
| 매출성장률 | -7.59%~72.00% |
| 할인율 | 13.89% |
한편, 회사의 회수가능액은 사용된 회사의 주요 가정치에 대한 가정에 따라 변동되 며, 가정치 변동에 따른 효과는 다음과 같습니다.
| (단위: USD) |
| 구 분 | 할인율의 변동 | |
|---|---|---|
| 0.5% 증가 | 0.5% 감소 | |
| 회수가능액(사용가치) | 48,487,599 | 50,393,598 |
HD204 및 PBP1502 관련 개발비에 대해 인식된 손상은 없으며, 주요 가정에 대한 민감도 분석은 다음과 같습니다.
| (단위: USD) |
| 주요 가정 | 투입변수 민감도 |
CGU사용가치의 장부금액 초과분 (CGU사용가치 - CGU장부금액) |
||
|---|---|---|---|---|
| HD204 | PBP1502 | 합계 | ||
| 예상 제품 판매 수량 | 10% 감소 | 18,979,049 | 33,330,221 | 52,309,270 |
| 할인율(주1) | 1% 증가 | 24,838,419 | 35,729,525 | 60,567,944 |
| 예상 제품 판매 승인 시점 | 1년 연기 | 6,856,306 | 25,562,963 | 32,419,269 |
(주1) 당분기말 미래 현금흐름추정의 할인에 사용된 세후할인율은 14.25%입니다.
다른 투입변수가 동일할 경우 무형자산 손상이 발생하게 되는 투입변수의 조정 수준은 다음과 같습니다.
| 주요 가정 | 손상이 발생하게 되는 가정의 변동 |
|---|---|
| HD204 예상 제품 판매 수량 | 24.47% 감소시 |
| HD204 할인율 | 20.94%로 변동시 |
13. 차입금
(1) 차입금 내역
보고기간말 현재 연결회사의 차입금 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 차입처 | 만기 | 이자율 | 당분기말 | 전기말 |
|---|---|---|---|---|---|
| 단기차입금(주1),(주2) | Woori Bank Singapore Br. |
2025.07.21~2025.11.25 | 4.50%~5.85% | 38,000,000 | - |
| 장기차입금 | 한국산업은행 | 2024.12.29~ 2029.06.30 |
4.80%~ 5.40% |
32,902,972 | 36,811,561 |
| 전환사채 | Octava Fund Ltd. | 2026.03.20 | 0.0% | 28,931,152 | 26,600,671 |
| 합 계 | 99,834,124 | 63,412,232 | |||
| 차감: 유동성항목 | (75,749,857) | (34,440,581) | |||
| 순 액 | 24,084,267 | 28,971,651 | |||
(주1) 보고기간말 현재 연결회사의 단기차입금에 대하여 단기금융상품이 담보로 제공되어 있습니다(주석 23 참조).
(주2) 단기차입금에 대한 당분기 이자비용 USD 1,041,701의 금액이 무형자산(개발비)으로 자본화되었습니다(주석 12 참조).
(2) 장기차입금 상환계획
| (단위: USD) |
| 구 분 | 1년이내 | 2년이내 | 3년이내 | 3년 이후 | 합 계 |
|---|---|---|---|---|---|
| 장기차입금 | 8,818,705 | 7,410,686 | 7,410,686 | 9,262,895 | 32,902,972 |
(3) 전환사채
보고기간말 현재 전환사채 내역은 다음과 같습니다.
| 구 분 | 내 역 |
|---|---|
| 액면가액 | USD 35,031,528(KRW 455억원) |
| 발행가액 | USD 35,031,528(KRW 455억원) |
| 액면이자율 | 0% |
| 상환보장수익률 | 연복리 4.12% |
| 만기 | 2026년 3월 20일 |
| 행사가격 조정내역 | 발행일로부터 매 3개월 경과한 날마다 조정하며 하향조정 한도는 최초 전환가격의 70%, 상향조정 한도는 최초 전환가격임 |
| 조기상환권(주1) | 발행일부터 원금의 일부 또는 전부 상환가능 |
| 전환권(주1) | 발행일로부터 1년 후 주당 USD 2.72(KRW 3,534원)으로 전환가능 |
(주1) 조기상환권과 행사가격 조정 조건이 있는 전환권을 파생상품자산 및 파생상품부채로 인식하였으며, 당분기에 파생상품평가이익 USD 3,205,893을 금융수익으로 반영하였습니다(주석 5 참조).
(4) 행사가격 조정 조건이 있는 금융부채
보고기간말 현재 행사가격 조정 조건이 있는 금융부채의 장부금액은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 전환사채 | 10,407,444 | 11,113,830 |
한편, 행사가격 조정 조건이 있는 금융부채 평가손익을 제외한 법인세비용차감전 순손익의 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| I. 법인세비용차감전순이익(손실) | 9,449,343 | (31,658,865) |
| II. 평가이익(손실) | 3,205,893 | 3,262,682 |
| III. 평가손익 제외 법인세비용차감전순이익(손실) |
6,243,450 | (34,921,547) |
(5) 현재가치할인차금
보고기간말 현재 전환사채의 현재가치할인차금 내역은 다음과 같으며, 유효이자율은19.97%입니다.
| (단위: USD) |
| 구 분 | 기초 | 취득 | 이자비용 | 기말 |
|---|---|---|---|---|
| 현재가치할인차금 | 10,597,975 | - | (4,576,268) | 6,021,707 |
14. 기타금융부채
보고기간말 현재 연결회사의 기타금융부채의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 미지급비용 | 3,731,336 | 4,300,690 |
| 예수금 | 40,773 | 541,230 |
| 당기손익 공정가치 측정 금융부채 | 10,407,444 | 11,113,830 |
| 합 계 | 14,179,553 | 15,955,750 |
| 차감: 비유동항목 | - | - |
| 유동항목 | 14,179,553 | 15,955,750 |
15. 기타부채
보고기간말 현재 연결회사의 기타부채의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 선수수익(주1) | 2,031,483 | 22,540,447 |
| 선수금(주2) | 13,742,044 | 13,045,568 |
| 기타부채(주3) | 408,010 | 1,176,000 |
| 이연수익 | 20,167,940 | |
| 부가세예수금 | - | 412 |
| 합 계 | 36,349,477 | 36,762,427 |
| 차감: 비유동항목 | (21,887,309) | (1,248,529) |
| 유동항목 | 14,462,168 | 35,513,898 |
(주1) 선수수익은 고객과의 계약과 관련한 계약부채 USD 1,363,689이 포함되어 있습니다(주석 18 참조).
(주2) 2021년 8월 연결회사는 고객과 COVID-19 백신 공급 계약을 체결하기 위한 선수금으로 고객으로부터 USD 13,632,000를 수령하였습니다. 2021년 11월 연결회사는 고객과 COVID-19 백신 제품 공급 계약을 체결하였습니다.
(주3) 전기말 기타부채 USD 1,176,000은 고객과의 계약에 따라 수령한 HD201 관련 계약의 계약금(Upfront fee) 및 마일스톤 대가(Milestone fee)로 당분기 중 수익으로 인식하였습니다.
16. 자본금
보고기간말 현재 연결회사의 자본금의 구성 내역은 다음과 같습니다.
| (단위: 주, USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 발행주식수 | 12,019,231 | 12,019,231 |
| 자본금 | 525,727,248 | 525,727,248 |
당분기와 전분기 중 자본금 변동은 발생하지 않았습니다.
17. 주식기준보상
(1) 지배회사는 2021 사업년도 주주총회 결의에 의거해서 지배회사의 임직원 등에게 주식선택권을 부여했으며, 그 주요 내용은 다음과 같습니다.
| ㆍ | 주식선택권으로 발행한 주식의 종류 : 기명식 보통주식 | |
| ㆍ | 부여방법 : 보통주 신주발행 | |
| ㆍ | 가득조건 : | |
| - | IPO 후 1년 경과 시점에 2년 이상 재직한 임직원의 경우 : 회사의 IPO 후 1년 경과시 전체부여주식의 30%, IPO 후 3년 경과 시 35%, IPO 후 5년 경과 시 35% 가득 됨 | |
| - | IPO 후 1년 경과 시점에 2년 미만 재직한 임직원의 경우 : 재직기간이 2년이 되는 시점 및 회사의 IPO 후 1년 경과 시점 중 늦은 시점에 전체 부여주식의 30%, 최초 가득일로부터 2년 경과 시 35%, 최초 가득일로부터 4년 경과 시 35% 가득 됨 | |
| - | 특정 인원의 경우 : 약정된 기술된 임상시험 진행 등 마일스톤 달성에 따라 가득됨 | |
(2) 주식선택권의 수량과 가중평균 행사가격의 변동은 다음과 같습니다.
| (단위: 주, USD) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 주식매수선택권 수량 | 가중평균행사 가격 |
주식매수선택권 수량 | 가중평균행사 가격 |
|
| 기초 잔여주 | 106,562 | 90 | 128,044 | 90 |
| 소멸 | - | - | (16,808) | 90 |
| 기말 잔여주 (주1) | 106,562 | 90 | 111,236 | 90 |
(주1) 외부 컨설턴트에 부여된 주식선택권 22,778주가 포함되어 있습니다,
보고기간말 현재 유효한 주식선택권의 가중평균 잔여만기는 5.6년, 행사 가격은 한주당 USD 90이며, 행사 가능한 주식선택권은 40,368주 입니다.
상기의 수량 및 행사가격은 지배회사의 주식 1주 기준이며, 지배회사의 주식 1주는 현재 유가증권시장에서 유통되고 있는 예탁증서 5DR에 해당합니다.
(3) 지배회사는 부여한 주식선택권에 대하여 부여일의 공정가치로 측정하며, 이로 인하여 증가하는 총 자본은 가득기간에 걸쳐 주식기준보상비용으로 인식됩니다.
(4) 지배회사는 2021 사업년도 중 부여된 주식선택권의 보상원가를 블랙-숄즈모형을이용한 공정가치접근법을 적용하여 산정했으며, 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| 구 분 | 2021 사업년도 |
|---|---|
| 부여된 주식선택권의 공정가치 | USD 91.38 |
| 부여일의 주식가치 | USD 115.29 |
| 주가변동성(주1) | 92% |
| 주식선택권의 계약상 만기(주2) | 10년 |
| 무위험수익률 | 0.66% |
(주1) 상장되어 있는 회사의 대용기업의 변동성을 사용하였습니다.
(주2) 주식선택권의 공정가치 측정 시에는 주식선택권 양도 제한 및 고용 중단 등의 영향으로 인한 종업원의 조기행사효과를 고려한 기대만기(5.6년~7.9년)를 적용하였습니다.
(5) 당분기와 전분기 중 인식한 주식기준보상 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 자본화된 개발비 | - | 158,656 |
| 주식기준보상비용(주1) | 609,613 | (105,271) |
| 합 계 | 609,613 | 53,385 |
(주1) 외부 컨설턴트에 부여된 주식선택권과 관련한 주식기준보상비용으로 USD 274,910(전분기 USD 220,080) 금액이 포함되어 있습니다.
(6) 종속회사 주식보상비용
보고기간말 현재 프레스티지바이오로직스㈜의 주식보상비용 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 |
|---|---|
| 공정가치 접근법 | 이항모형 |
| 기초잔여수 | 510,000 주 |
| 소멸 | - |
| 기말잔여수 | 510,000 주 |
| 행사가능주식수 | 510,000 주 |
| 가중평균행사가격 | 3.96 |
| 주식보상비용 | - |
| 지배기업 소유지분 | 40.20% |
18. 고객과의 계약에서 생기는 수익 및 관련 계약부채
(1) 고객과의 계약에서 생기는 수익
연결회사는 수익과 관련해 포괄손익계산서에 다음 금액을 인식하였습니다.
| (단위 : USD) |
|
구 분 |
당분기 |
전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 고객과의 계약에서 생기는 수익 | 2,382,493 | 6,277,007 | 483,794 | 625,868 |
(2) 고객과의 계약과 관련된 부채
연결회사가 인식하고 있는 고객과의 계약과 관련한 계약부채는 아래와 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기타유동부채 | ||
| 선수금 | 213,490 | 50,700 |
| 선수수익 | 147,689 | 245,739 |
| 기타비유동부채 | ||
| 장기선수수익 | 1,216,000 | 586,000 |
연결회사의 계약부채는 계약체결 시점에 고객에게 청구 및 수령한 계약금(Upfront fee)과 일정요건 달성시점에 고객에게 청구 및 수령한 마일스톤 대가(Milestone fee) 중 수익인식 시점이 차기 이후로 이연된 금액입니다. 추후기간 장기선수수익은 수익으로 인식될 것으로 예상하고 있습니다.
19. 유의적인 손익정보
당분기와 전분기 중 분기순이익은 성격, 크기, 빈도에 있어 비경상적인 다음 항목을 포함하고 있습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 기타대손상각비환입 | - | - | - | 25,000 |
| 파생상품평가이익(주1) | (7,982,040) | 3,205,893 | 32,348 | 4,600,637 |
| 파생상품평가손실(주1) | (8,916,790) | - | (1,143,599) | 1,337,955 |
| 무형자산손상차손환입(주2) | 42,400,421 | 42,400,421 | - | - |
(주1) 프레스티지바이오로직스㈜가 발행한 전환사채의 조기상환권에 대한 파생상품평가이익과 행사가격 조정 조건이 있는 전환권에 대한 파생상품평가손실입니다.
(주2) 연결회사는 당분기 중 HD201 개발비에 설정된 무형자산손상차손 USD 42,400,421을 환입하였습니다.
20. 법인세비용
법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균 연간유효법인세율의 추정에 기초하여 인식하였습니다. 당분기 및 전분기 종료하는 회계연도의 예상평균 연간법인세율은 0%입니다.
21. 특수관계자 거래
(1) 특수관계자 현황
연결회사의 주요 특수관계자 및 주요 경영진 등은 다음과 같습니다.
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 주요 주주 | Mayson Partners Pte. Ltd. Octava Fund Limited |
Mayson Partners Pte. Ltd. Octava Fund Limited |
| 주요 경영진 | 박소연 Michael Jinwoo, Kim |
박소연 Michael Jinwoo, Kim |
| 기타 특수관계자 |
Qion Pte. Ltd. | Qion Pte. Ltd. |
(2) 보고기간말 현재 연결회사의 특수관계자에 대한 주요 채권ㆍ채무 내역은 다음과 같습니다.
1) 당분기말
| (단위: USD) |
| 구 분 | 특수관계자명 | 채권 등 | 채무 등 | |||
|---|---|---|---|---|---|---|
| 대여금 | 미수수익 | 파생상품금융자산 | 전환사채 | 파생상품금융부채 | ||
| 기타 특수관계자 |
Octava Fund Limited | - | - | 7,302,095 | 28,931,152 | 10,407,444 |
| Qion Pte. Ltd.(주1) | - | - | - | - | - | |
| 합 계 | - | - | 7,302,095 | 28,931,152 | 10,407,444 | |
2) 전기말
| (단위: USD) |
| 구 분 | 특수관계자명 | 채권 등 | 채무 등 | |||
| 대여금 | 미수수익 | 파생상품금융자산 | 전환사채 | 파생상품금융부채 | ||
| 기타 특수관계자 |
Octava Fund Limited | - | - | 4,551,486 | 26,600,671 | 11,113,830 |
| Qion Pte. Ltd.(주1) | - | - | - | - | - | |
| 합 계 | - | - | 4,551,486 | 26,600,671 | 11,113,830 | |
(주1) 보고기간말 현재 특수관계자 대여금 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 특수관계자명 | 통화 | 만기일 | 연이자율 | 당분기말 | 전기말 |
|---|---|---|---|---|---|---|
| 기타 특수관계자 |
Qion Pte. Ltd. (*1) |
USD | 2026.6.16 ~ 2028.11.18 | 18.00% | 2,824,871 | 2,824,871 |
| SGD | 2028.7.10 ~ 2029. 1.28 | 18.00% | 192,528 | 192,528 | ||
| 합 계 | 3,017,399 | 3,017,399 | ||||
| 차감: 손실충당금 | (3,017,399) | (3,017,399) | ||||
| 대여금(순액) | - | - | ||||
(*1) 연결회사는 과거 사업연도에 Qion Pte. Ltd.의 대여금 USD 3,017,399와 미수수익 USD 1,325,569은 전액을 손실충당금으로 인식하였습니다.
(3) 당분기와 전분기 중 특수관계자와의 주요 거래내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 특수관계자명 | 수익 | 비용 |
|---|---|---|---|
| 이자수익 | 이자비용 | ||
| 기타특수관계자 | Octava Fund Limited | - | 2,749,004 |
2) 전분기
| (단위: USD) |
| 구 분 | 특수관계자명 | 수익 | 비용 |
|---|---|---|---|
| 이자수익 | 이자비용 | ||
| 기타특수관계자 | Octava Fund Limited | - | 3,624,521 |
(4) 연결회사는 당분기와 전분기 중 특수관계자와의 자금 거래내역은 없습니다.
(5) 지배회사의 운영에 대한 권한과 책임을 가진 이사회 구성원이 주요 경영진에 해당하며, 당분기와 전분기 중 주요 경영진에 대한 보상내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급여 | 845,826 | 745,597 |
| 주식기준보상비용 | 25,485 | (508,971) |
| 퇴직급여 | 19,780 | 18,076 |
| 합 계 | 891,091 | 254,702 |
(6) 지급보증
보고기간말 현재 연결회사의 차입금에 대해 특수관계자로부터 제공받고 있는 지급보증은 없습니다.
22. 영업부문
(1) 연결회사의 영업부문은 2개로 구성되어 있으며 그 내용은 다음과 같습니다.
| 구 분 | 내 용 |
|---|---|
| 바이오제약부문 | 바이오시밀러 및 항체 신약 개발을 위해 연구개발 중심의 조직 구조를 갖추고 있으며, 전임상부터 임상시험까지 신약 개발의 전 과정을 수행하고 있습니다. |
| CDMO부문 | 바이오의약품 위탁개발생산(CDMO, Contract Development and Manufacturing Organization) 부문으로 고객사의 바이오의약품에 대한 공정개발, 기술이전, 생산 등 통합적 솔루션을 제공하고 있습니다. |
(2) 영업부문별 정보는 다음과 같습니다.
1) 영업부문의 당기손익정보는 다음과 같습니다.
① 당분기
| (단위: USD) |
| 구 분 | 바이오제약부문 | CDMO부문 | 조정(주1) | 합 계 |
|---|---|---|---|---|
| 매출액 | 1,512,000 | 4,880,053 | (115,046) | 6,277,007 |
| 내부거래 | - | 115,046 | (115,046) | - |
| 외부거래 | 1,512,000 | 4,765,007 | - | 6,277,007 |
| 영업손실 | (16,646,754) | (21,023,423) | (162,512) | (37,832,689) |
| 분기순이익(손실) | 54,951,705 | (19,893,149) | (25,595,999) | 9,462,557 |
| 감가상각비와 상각비 | 2,893,157 | 6,989,832 | 45,363 | 9,928,352 |
| 이자수익 | 6,515,815 | 337,534 | (1,626,974) | 5,226,375 |
| 이자비용 | 392,137 | 4,973,431 | (1,274,906) | 4,090,662 |
| 법인세비용(수익) | 9,340 | - | (22,554) | (13,214) |
| 손상차손(환입) | (42,400,421) | - | - | (42,400,421) |
(주1) 연결회사는 내부거래 제거액을 조정으로 표시하고 있습니다.
② 전분기
| (단위: USD) |
| 구 분 | 바이오제약부문 | CDMO부문 | 조정(주1) | 합 계 |
|---|---|---|---|---|
| 매출액 | - | 1,748,633 | (1,122,765) | 625,868 |
| 내부거래 | - | 1,122,765 | (1,122,765) | - |
| 외부거래 | - | 625,868 | - | 625,868 |
| 영업손실 | (25,060,762) | (23,946,115) | 8,827,032 | (40,179,845) |
| 분기순이익(손실) | (15,308,640) | (18,469,320) | 1,928,543 | (31,849,417) |
| 감가상각비와 상각비 | 2,745,758 | 6,049,429 | 85,546 | 8,880,733 |
| 이자수익 | 9,886,911 | 913,256 | (216,769) | 10,583,398 |
| 이자비용 | 225,609 | 6,409,250 | (2,737,814) | 3,897,045 |
| 법인세비용(수익) | 213,106 | - | (22,554) | 190,552 |
| 손상차손(환입) | - | - | - | - |
(주1) 연결회사는 내부거래 제거액을 조정으로 표시하고 있습니다.
2) 부문별 정보 중 부문자산 및 부문부채에 관한 사항은 최고영업의사결정권자에게 정기적으로 보고되지 않으므로 별도 공시하지 아니합니다.
3) 회사 전체 수익의 10% 이상을 차지하는 외부고객으로부터의 수익금액 정보는 다음과 같습니다.
① 당분기
| (단위: USD) |
| 구 분 | 금액 | 영업부문 |
|---|---|---|
| A사 | 4,426,140 | CDMO부문 |
| B사 | 1,400,000 | 바이오제약부문 |
| 합 계 | 5,826,140 |
② 전분기
| (단위: USD) |
| 구 분 | 금액 | 영업부문 |
|---|---|---|
| A사 | 412,931 | CDMO부문 |
| B사 | 72,385 | CDMO부문 |
| C사 | 71,468 | CDMO부문 |
| 합 계 | 556,784 |
4) 영업부문의 수익 내역은 다음과 같습니다.
① 당분기
| (단위: USD) |
| 구 분 | 바이오제약부문 | CDMO부문 | 합 계 |
|---|---|---|---|
| 주요 제품/용역 구분 | |||
| 바이오시밀러 HD201 | 1,512,000 | 246,033 | 1,758,033 |
| CDMO | - | 4,300,924 | 4,300,924 |
| 기타 | - | 218,050 | 218,050 |
| 합 계 | 1,512,000 | 4,765,007 | 6,277,007 |
| 수익 인식시기 | |||
| 한 시점에 인식 | 1,512,000 | 4,546,957 | 6,058,957 |
| 기간에 걸쳐 인식 | - | 218,050 | 218,050 |
| 합 계 | 1,512,000 | 4,765,007 | 6,277,007 |
② 전분기
| (단위: USD) |
| 구 분 | 바이오제약부문 | CDMO부문 | 합 계 |
|---|---|---|---|
| 주요 제품/용역 구분 | |||
| 바이오시밀러 HD201 | - | - | - |
| CDMO | - | 625,868 | 625,868 |
| 기타 | - | - | |
| 합 계 | - | 625,868 | 625,868 |
| 수익 인식시기 | |||
| 한 시점에 인식 | - | 625,868 | 625,868 |
| 기간에 걸쳐 인식 | - | - | - |
| 합 계 | - | 625,868 | 625,868 |
(3) 지역별 부문정보는 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전기 | ||
|---|---|---|---|---|
| 매출 | 비유동자산(주1) | 매출 | 비유동자산(주1) | |
| 본사(싱가포르) | 1,512,000 | 117,190,212 | - | 72,282,284 |
| 본사 외 외국소재 | ||||
| 한국 | 4,765,007 | 252,356,842 | 517,114 | 253,586,941 |
| 기타 | - | 5,846,685 | - | 5,845,033 |
| 소 계 | 4,765,007 | 258,203,527 | 517,114 | 259,431,974 |
| 합 계 | 6,277,007 | 375,393,739 | 517,114 | 331,714,258 |
(주1) 금융상품 및 이연법인세자산, 순확정급여자산을 포함하지 않은 금액입니다.
23. 약정사항
(1) 연결회사는 보고기간말 현재 Pharmapark LLC, Dr. Reddy's Laboratories Ltd. Tabuk Pharmaceutical Manufacturing Company 등의 고객과 라이선스 및 제품 공급 계약을 체결하고 있습니다. 해당 계약과 관련하여 과거기간 중 고객으로부터 계약금(Upfront fee) 및 요건을 달성한 마일스톤 대가(Milestone fee)를 청구 및 일부 수령하였습니다. 수익인식이 차기 이후로 이연된 금액은 계약부채로 인식하였습니다.
(2) 2021년 11월 연결회사는 Stelis Pte. Ltd. 및 Enso Healthcare DMCC와 COVID-19 백신 제품을 공급하는 위탁생산 계약을 체결하였으며, 계약금은 USD 13,632,000입니다.
(3) 연결회사는 2024년 7월 25일, EMA CHMP로부터 공식적으로 HD201 파이프라인(유방암 및 전이성 위암 치료제)의 승인을 권고하는 긍정적 의견을 획득하였으며, 2024년 9월 20일 유럽연합진행위원회로부터 품목명 투즈뉴(Tuznue)로 최종 판매허가를 취득하였습니다. 연결회사는 투즈뉴(Tuznue)의 글로벌 상업화를 위해 유럽 시장 외에도, 영국(MHRA), 스위스(Swissmedic), 호주(TGA), 캐나다(HCA), 그리고 한국(MFDS)에서 마케팅 허가를 신청할 계획입니다.
(4) 보고기간말 현재 종속기업은 설비투자와 관련하여 취득 약정을 체결하고 있으며, 그 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 취득약정액 | 청구액 | 미청구액 |
|---|---|---|---|
| 프레스티지바이오로직스㈜ | 23,093,496 | 14,568,204 | 8,525,292 |
| 프레스티지바이오파마아이디씨㈜ | 67,634,497 | 65,212,163 | 2,422,334 |
| 합 계 | 90,727,993 | 79,780,367 | 10,947,626 |
(5) 보고기간말 현재 프레스티지바이오로직스㈜가 금융기관과 체결하고 있는 약정사항의 내역은 다음과 같습니다.
| (단위: USD) |
| 금융기관명 | 내용 | 관련 차입금 | 한도액 | 실행금액 | 미실행금액 |
|---|---|---|---|---|---|
| 한국산업은행 | 시설자금대출 | 장기차입금 | 32,902,972 | 32,902,972 | - |
(6) 보고기간말 현재 종속기업이 타인으로부터 제공받은 보증내역은 다음과 같습니다.
| (단위: USD) |
| 제공받은 자 | 제공한 자 | 보증처 | 보증내용 | 보증금액 |
|---|---|---|---|---|
| 프레스티지 바이오로직스㈜ |
서울보증보험 | 청주시 흥덕구청, 충청에너지서비스㈜ |
인허가 보증보험, 도시가스 공급계약 |
287,247 |
| 소 계 | 287,247 | |||
| 프레스티지 바이오파마아이디씨㈜ |
서울보증보험 | 부산진해 경제자유구역청 |
건축공사 안전관리예치보증 |
479,284 |
| 하나은행 | 산업통상자원부 | 이행보증 | 15,721,023 | |
| 하나은행 | 부산광역시 | 이행보증 | 6,737,581 | |
| 소 계 | 22,937,888 | |||
| 합 계 | 23,225,135 | |||
(7) 보고기간말 현재 차입금 등과 관련하여 담보로 제공된 연결회사의 자산은 다음과 같습니다.
| (단위: USD) |
| 제공처 | 차입처/보증처 | 담보제공자산 | 차입금액 | 보증금액 | 비고 |
|---|---|---|---|---|---|
| Prestige BioPharma Limited |
Woori Bank Singapore Br. |
단기금융상품 | 38,000,000 | 38,000,000 | 차입금 |
| 프레스티지 바이오로직스㈜ |
한국산업은행 | 토지 및 건물, 시설장치, 기계장치 |
32,902,972 | 45,325,548 | 차입금 |
| 프레스티지 바이오파마아이디씨㈜ |
하나은행 | 토지 | 20,416,913 | - | 이행보증 |
(8) 보고기간말 현재 연결실체가 원고 또는 피고인 소송사건은 다음과 같습니다.
| (단위: USD) |
| 원고 | 피고 | 사건내용 | 소송가액 |
| 주식회사 신성이엔지 | 프레스티지바이오로직스(주) | 공사대금 소송 | 5,179,090 |
상기 소송사건 이외에 프레스티지바이오로직스(주)는 Alvotech hf.과 HD204에 대한 위탁생산 용역대금 USD 1,062,110 청구 관련한 분쟁이 존재합니다. 연결실체는 보고기간말 현재 소송과 분쟁의 결과를 신뢰성 있게 추정할 수 없어 관련부채를 계상하지 아니하였습니다.
(9) 주요 보험 가입현황
보고기간말 현재 연결회사의 건물과 기계장치 등은 DB손해보험㈜의 부보금액 USD 181,072,670의 재산종합보험 및 USD 6,564,530의 기계위험보장보험에 가입되어있습니다. 동 보험에 대한 보험금 수령권은 한국산업은행 청주지점에 USD 68,502,713의 질권이 설정되어 있습니다.
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 10 기 3분기말 2025.03.31 현재 |
|
제 9 기말 2024.06.30 현재 |
|
(단위 : USD) |
|
제 10 기 3분기말 |
제 9 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
134,758,369 |
145,143,744 |
|
현금및현금성자산 (주4,5,6) |
80,140,035 |
132,697,494 |
|
단기금융상품 (주4,5,6,23) |
38,000,000 |
0 |
|
매출채권 (주4,5) |
126,000 |
0 |
|
기타유동금융자산 (주4,5,7,22) |
1,479,452 |
5,742,181 |
|
기타유동자산 (주8,22) |
14,793,181 |
6,569,110 |
|
유동재고자산 (주9) |
219,701 |
134,959 |
|
비유동자산 |
377,162,638 |
264,994,049 |
|
종속기업투자주식 (주10) |
254,073,508 |
136,141,828 |
|
유형자산 (주11,12) |
1,727,249 |
1,212,877 |
|
무형자산 (주13) |
115,462,963 |
71,069,407 |
|
기타비유동금융자산 (주4,5,7,22) |
5,898,918 |
56,569,937 |
|
자산총계 |
511,921,007 |
410,137,793 |
|
부채 |
||
|
유동부채 |
60,799,228 |
25,135,269 |
|
미지급금 (주4,5,22) |
5,542,415 |
6,090,708 |
|
단기차입금 (주4,5,14,23) |
38,000,000 |
0 |
|
유동성리스부채 (주4,5,12) |
809,476 |
568,568 |
|
기타유동금융부채 (주4,5,15) |
2,634,686 |
3,667,993 |
|
기타 유동부채 (주16,22) |
13,812,651 |
14,808,000 |
|
비유동부채 |
2,015,221 |
1,022,500 |
|
비유동 리스부채 (주4,5,12) |
571,862 |
436,500 |
|
기타 비유동 부채 (주16,19,22) |
1,443,359 |
586,000 |
|
부채총계 |
62,814,449 |
26,157,769 |
|
자본 |
||
|
자본금 (주1,17) |
525,727,248 |
525,727,248 |
|
자본잉여금 |
5,549,900 |
5,549,900 |
|
기타자본 (주18) |
8,178,733 |
7,569,120 |
|
이익잉여금(결손금) |
(90,349,323) |
(154,866,244) |
|
자본총계 |
449,106,558 |
383,980,024 |
|
자본과부채총계 |
511,921,007 |
410,137,793 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : USD) |
|
제 10 기 3분기 |
제 9 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
수익(매출액) (주19) |
0 |
1,512,000 |
0 |
0 |
|
영업비용 (주22) |
2,652,363 |
8,104,203 |
2,012,237 |
17,217,751 |
|
영업손익 |
(2,652,363) |
(6,592,203) |
(2,012,237) |
(17,217,751) |
|
기타수익 (주5,20) |
42,421,189 |
65,529,214 |
35,917 |
71,190 |
|
기타비용 (주5,20) |
0 |
0 |
0 |
0 |
|
금융수익 (주5,22) |
1,403,584 |
6,276,951 |
2,790,241 |
9,614,319 |
|
금융비용 (주5) |
(22,463) |
687,701 |
(56,269) |
331,473 |
|
법인세비용차감전순이익(손실) |
41,194,873 |
64,526,261 |
870,190 |
(7,863,715) |
|
법인세비용(수익) (주21) |
6,464 |
9,340 |
116,807 |
213,106 |
|
당기순이익(손실) |
41,188,409 |
64,516,921 |
753,383 |
(8,076,821) |
|
기타포괄손익 |
0 |
0 |
0 |
0 |
|
총포괄손익 |
41,188,409 |
64,516,921 |
753,383 |
(8,076,821) |
|
주당이익(손실) |
||||
|
기본주당이익(손실) (단위 : USD) |
3.43 |
5.37 |
0.06 |
(0.67) |
|
희석주당이익(손실) (단위 : USD) |
3.43 |
5.37 |
0.06 |
(0.67) |
4-3. 자본변동표
|
자본변동표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : USD) |
|
자본 |
|||||
|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본 |
이익잉여금 |
자본 합계 |
|
|
2023.07.01 (기초자본) |
525,727,248 |
5,549,900 |
7,328,992 |
(146,238,930) |
392,367,210 |
|
당기순이익(손실) |
0 |
0 |
0 |
(8,076,821) |
(8,076,821) |
|
주식기준보상거래에 따른 증가(감소) (주18) |
0 |
0 |
53,385 |
0 |
53,385 |
|
2024.03.31 (기말자본) |
525,727,248 |
5,549,900 |
7,382,377 |
(154,315,751) |
384,343,774 |
|
2024.07.01 (기초자본) |
525,727,248 |
5,549,900 |
7,569,120 |
(154,866,244) |
383,980,024 |
|
당기순이익(손실) |
0 |
0 |
0 |
64,516,921 |
64,516,921 |
|
주식기준보상거래에 따른 증가(감소) (주18) |
0 |
0 |
609,613 |
0 |
609,613 |
|
2025.03.31 (기말자본) |
525,727,248 |
5,549,900 |
8,178,733 |
(90,349,323) |
449,106,558 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : USD) |
|
제 10 기 3분기 |
제 9 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(9,521,393) |
(14,112,736) |
|
영업에서 창출된 현금흐름 |
(15,421,444) |
(19,723,617) |
|
이자의 수취 |
5,900,051 |
5,753,062 |
|
이자지급 |
0 |
(4,391) |
|
법인세의 납부 |
0 |
(137,790) |
|
투자활동현금흐름 |
(80,363,945) |
81,351,408 |
|
단기금융상품의 감소 |
0 |
87,500,000 |
|
단기금융상품의 증가 |
(38,000,000) |
0 |
|
보증금의 증가 |
(23,015) |
(87,448) |
|
보증금의 감소 |
0 |
35,949 |
|
종속기업투자주식취득 (주22) |
(105,335,432) |
0 |
|
유형자산의 취득 (주11) |
(167,322) |
(34,016) |
|
유형자산의 처분 |
124 |
0 |
|
무형자산의 취득 (주13) |
(879,827) |
(4,768,544) |
|
대여금의 감소 |
65,477,567 |
801,980 |
|
대여금의 증가 (주22) |
(322,732) |
(2,022,725) |
|
자본화된 이자의 지급 (주12) |
(1,113,308) |
(73,788) |
|
재무활동현금흐름 |
37,386,203 |
(867,909) |
|
단기차입금의 차입 (주14) |
38,000,000 |
0 |
|
리스부채의 원금상환 (주12) |
(613,797) |
(867,909) |
|
환율변동으로 인한 현금의 변동 |
(58,324) |
0 |
|
현금및현금성자산의 증가(감소) |
(52,557,459) |
66,370,763 |
|
기초현금및현금성자산 (주6) |
132,697,494 |
52,442,595 |
|
기말현금및현금성자산 (주6) |
80,140,035 |
118,813,358 |
[원화기준]
|
재무상태표 |
|
제 10 기 3분기말 2025.03.31 현재 |
|
제 9 기말 2024.06.30 현재 |
|
(단위 : 천원) |
|
제 10 기 3분기말 |
제 9 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
197,623,148 | 201,633,689 |
|
현금및현금성자산 |
117,525,361 | 184,343,359 |
|
단기금융상품 |
55,727,000 | - |
|
매출채권 |
184,779 | - |
|
기타유동금융자산 |
2,169,616 | 7,977,038 |
|
기타유동자산 |
21,694,200 | 9,125,808 |
|
재고자산 |
322,192 | 187,485 |
|
비유동자산 |
553,109,009 | 368,129,733 |
|
종속기업투자주식 |
372,598,799 | 189,128,227 |
|
유형자산 |
2,533,011 | 1,684,929 |
|
무형자산 |
169,326,435 | 98,729,620 |
|
기타비유동금융자산 |
8,650,763 | 78,586,956 |
|
자산총계 |
750,732,157 | 569,763,422 |
|
부채 |
||
|
유동부채 |
89,162,068 | 34,917,916 |
|
미지급금 |
8,127,952 | 8,461,212 |
|
단기차입금 |
55,727,000 | - |
|
유동성리스부채 |
1,187,097 | 789,855 |
|
기타유동금융부채 |
3,863,767 | 5,095,576 |
|
기타 유동부채 |
20,256,253 | 20,571,274 |
|
비유동부채 |
2,955,322 | 1,420,457 |
|
비유동 리스부채 |
838,636 | 606,386 |
|
기타 비유동 부채 |
2,116,686 | 814,071 |
|
부채총계 |
92,117,389 | 36,338,373 |
|
자본 |
||
|
자본금 |
589,604,508 | 589,604,508 |
|
자본잉여금 |
6,319,646 | 6,319,646 |
|
기타자본 |
9,941,456 | 9,086,857 |
|
이익잉여금(결손금) |
(93,226,874) | (183,671,210) |
|
자본총계 |
658,614,767 | 533,425,049 |
|
자본과부채총계 |
750,732,157 | 569,763,422 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : 천원) |
|
제 10 기 3분기 |
제 9 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
수익(매출액) |
35,925 | 2,119,627 | - | - |
|
영업비용 |
3,847,804 | 11,361,039 | 2,719,620 | 22,727,948 |
|
영업손익 |
(3,811,879) | (9,241,412) | (2,719,620) | (22,727,948) |
|
기타수익 |
60,018,039 | 91,863,439 | 47,559 | 93,973 |
|
금융수익 |
2,083,434 | 8,799,469 | 3,711,658 | 12,691,190 |
|
금융비용 |
(14,617) | 964,067 | (72,660) | 437,554 |
|
법인세비용차감전순이익(손실) |
58,304,210 | 90,457,430 | 1,112,257 | (10,380,340) |
|
법인세비용(수익) |
9,130 | 13,093 | 154,590 | 281,306 |
|
당기순이익(손실) |
58,295,080 | 90,444,336 | 957,666 | (10,661,646) |
|
기타포괄손익 |
684,715 | 33,890,784 | 22,077,164 | 13,125,698 |
|
총포괄손익 |
58,979,795 | 124,335,120 | 23,034,831 | 2,464,052 |
|
주당이익(손실) |
||||
|
기본주당이익(손실) (단위 : 원) |
4,850 | 7,525 | 80 | (887) |
|
희석주당이익(손실) (단위 : 원) |
4,850 | 7,525 | 80 | (887) |
4-3. 자본변동표
|
자본변동표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : 천원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본 |
기타포괄손익 누계액 | 이익잉여금 |
자본 합계 |
|
|
2023.07.01 (기초자본) |
589,604,508 | 6,319,646 | 8,766,877 | 82,583,610 | (172,174,969) | 515,099,673 |
|
당기순이익(손실) |
- | - |
- |
- |
(10,661,646) | (10,661,646) |
| 해외사업환산이익 | - |
- |
- |
13,125,698 | - |
13,125,698 |
|
주식기준보상거래에 따른 증가(감소) |
- | - | 70,470 | - | - | 70,470 |
|
2024.03.31 (기말자본) |
589,604,508 | 6,319,646 | 8,837,347 | 95,709,308 | (182,836,615) | 517,634,195 |
|
2024.07.01 (기초자본) |
589,604,508 | 6,319,646 | 9,086,857 | 112,085,247 | (183,671,210) | 533,425,049 |
|
당기순이익(손실) |
- |
- |
- |
- |
90,444,336 | 90,444,336 |
| 해외사업환산이익 | - |
- |
- |
33,890,784 | - | 33,890,784 |
|
주식기준보상거래에 따른 증가(감소) |
- |
- |
854,598 | - |
- |
854,598 |
|
2025.03.31 (기말자본) |
589,604,508 | 6,319,646 | 9,941,456 | 145,976,031 | (93,226,874) | 658,614,767 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 10 기 3분기 2024.07.01 부터 2025.03.31 까지 |
|
제 9 기 3분기 2023.07.01 부터 2024.03.31 까지 |
|
(단위 : 천원) |
|
제 10 기 3분기 |
제 9 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(13,347,755) | (18,629,235) |
|
영업에서 창출된 현금흐름 |
(21,618,860) | (26,035,766) |
|
이자의 수취 |
8,271,104 | 7,594,214 |
|
이자지급 |
- | (5,796) |
|
법인세의 납부 |
- | (181,887) |
|
투자활동현금흐름 |
(112,659,804) | 107,386,299 |
|
단기금융상품의 감소 |
- | 115,502,625 |
|
단기금융상품의 증가 |
(53,271,060) | - |
|
보증금의 증가 |
(32,264) | (115,434) |
|
보증금의 감소 |
- | 47,454 |
|
종속기업투자주식취득 |
(147,666,582) | - |
|
유형자산의 취득 |
(234,564) | (44,902) |
| 유형자산의 처분 | 174 | - |
|
무형자산의 취득 |
(1,233,404) | (6,294,621) |
|
대여금의 감소 |
91,791,037 | 1,058,638 |
|
대여금의 증가 |
(452,428) | (2,670,058) |
|
자본화된 이자의 지급 |
(1,560,713) | (97,402) |
|
재무활동현금흐름 |
52,410,596 | (1,145,666) |
|
단기차입금의 차입 |
53,271,060 | - |
|
리스부채의 상환 |
(860,464) | (1,145,666) |
|
환율변동으로 인한 현금의 변동 |
6,779,139 | 3,559,794 |
|
현금및현금성자산의 증가(감소) |
(66,817,824) | 91,171,192 |
|
기초현금및현금성자산 |
184,343,359 | 68,846,639 |
|
기말현금및현금성자산 |
117,525,535 | 160,017,831 |
5. 재무제표 주석
| 당분기 2025년 03월 31일 현재 |
| 전 기 2024년 06월 30일 현재 |
| Prestige BioPharma Limited |
1. 일반 사항
Prestige BioPharma Limited(이하 "회사")는 항암치료제의 연구, 개발 및 판매업 등을 주된 사업목적으로 하고 있습니다. 회사는 2015년 7월 13일 설립되었으며, 본사는 싱가포르에 소재하고 있습니다. 회사는 2021년 2월 5일 한국증권거래소가 개설한유가증권시장에 상장하였으며, 보고기간말 현재 자본금은 USD 525,727,248입니다.
보고기간말 현재 회사의 주요 보통주 주주 구성내역은 다음과 같습니다.
| 주주명 | 주식수 | 증권예탁증권수(주1) | 지분율 |
|---|---|---|---|
| Mayson Partners Pte. Ltd. | 2,602,074 | 13,010,372 | 21.7% |
| Octava Fund Limited | 2,177,787 | 10,888,935 | 18.1% |
| 박소연 | 1,851,256 | 9,256,281 | 15.4% |
| Michael Jinwoo, Kim | 1,795,720 | 8,978,600 | 14.9% |
| 기타 | 3,592,394 | 17,961,967 | 29.9% |
| 합 계 | 12,019,231 | 60,096,155 | 100.0% |
(주1) 증권예탁증권(Depositary Receipts)의 원주 교환비율은 5 DR(Depositary
Receipts, 이하 DR)당 1주입니다.
2. 중요한 회계정책
2.1 회계정책의 변경과 공시
회사의 2025년 03월 31일로 종료하는 9개월 보고기간에 대한 분기재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 이 분기재무제표는 보고기간 종료일인 2025년 03월 31일 현재 유효한 한국채택국제회계기준에 따라 작성되었습니다. 분기재무제표를 작성하기 위하여 채택한 중요한 회계정책은 별도의 언급이 없는 한 전기 연차재무제표 작성시 채택한 회계정책과 동일하게 적용되었습니다.
2.1.1 회사가 채택한 제ㆍ개정 기준서 및 해석서
회사는 2024년 7월 1일로 개시하는 회계기간부터 다음의 제ㆍ개정 기준서 및 해석서를 신규로 적용하였습니다.
(1) 기업회계기준서 제1001호 '재무제표 표시' (개정) - 부채의 유동/비유동 분류
동 개정사항은 유동부채와 비유동부채의 분류는 보고기간말에 존재하는 기업의 권리
에 근거한다는 점을 명확히 하고 기업이 부채의 결제를 연기할 수 있는 권리를 행사할지 여부에 대한 기대와는 무관하다는 점을 강조합니다. 그리고 보고기간말에 차입약정을 준수하고 있다면 해당 권리가 존재한다고 설명하고 결제는 현금, 지분상품, 그 밖의 자산 또는 용역을 거래상대방에게 이전하는 것으로 그 정의를 명확히 합니 다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(2) 기업회계기준서 제1116호 '리스' (개정) - 판매후리스에서 생기는 부채
동 개정사항은 판매후리스 거래의 후속측정에 대해 규정합니다. 판매후리스 사용권자산 및 리스부채에도 일반적인 리스 후속측정 방식을 적용하되, 판매자-리스이용자가 보유하는 사용권에 대해서는 관련 손익을 인식하지 않는 방식으로 리스부채를 인식하고 '(수정)리스료'를 산정합니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(3) 기업회계기준서 제1007호 '현금흐름표' 및 제1107호 '금융상품:공시' (개정) - 공급자금융약정
동 개정사항은 재무제표 이용자가 기업의 부채와 현금흐름에 미치는 영향을 평가할 수 있도록 재무활동에서 생기는 부채의 변동에 공급자금융약정 정보를 구분하여 공시하고 공급자금융약정으로 발생하는 유동성 위험을 공시하도록 규정하고 있습니다.개정내용을 최초로 적용하는 회계연도 내 표시하는 중간보고기간에는 경과규정에 따라 해당 내용을 공시할 필요가 없습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
2.1.2 공표되었으나 아직 시행되지 않은 제ㆍ개정 기준서 및 해석서
당분기말 현재 제정ㆍ공표되었으나 아직 시행일이 도래하지 않아 적용하지 아니한 한국채택국제회계기준의 내역은 다음과 같습니다.
(1) 기업회계기준서 제1021호 '환율변동효과'와 제1101호 '한국채택국제회계기준의 최초채택' (개정) - 교환가능성 결여
동 개정사항은 한 통화를 다른 통화로 교환 가능한지 여부를 평가하고 교환 가능하지않은 경우 사용할 현물환율을 결정할 때 일관된 접근 방식을 적용하고 관련 정보를 공시하도록 요구합니다. 동 개정사항은 2025년 1월 1일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다. 회사는 동 개정으로 인한 재무제표의 영향을 검토 중에 있습니다.
2.2 재무제표 작성기준
분기재무제표의 작성에 적용된 유의적 회계정책과 계산방법은 주석 2.1.1에서 설명하는 제ㆍ개정 기준서의 적용으로 인한 변경 및 아래 문단에서 설명하는 사항을 제외하고는 전기 재무제표 작성에 적용된 회계정책이나 계산방법과 동일합니다.
2.2.1 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전손익에 적용하여 계산합니다.
3. 중요한 회계추정 및 가정
재무제표 작성에는 미래에 대한 가정 및 추정이 요구되며 경영진은 회사의 회계정책을 적용하기 위해 판단이 요구됩니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에 비추어 합리적으로 예측가능한 미래의 사건을 고려하여 이루어집니다. 회계추정의 결과가 실제 결과와 동일한 경우는 드물 것이므로 중요한 조정을유발할 수 있는 유의적인 위험을 내포하고 있습니다.
분기 재무제표 작성시 사용된 중요한 회계추정 및 가정은 주석 2.2.1에서 설명하는 법인세비용을 결정하는데 사용된 추정의 방법을 제외하고는 전기 재무제표 작성시 적용된 회계추정 및 가정과 동일합니다.
4. 금융상품 공정가치
4.1 금융상품 종류별 공정가치
보고기간말 현재 회사의 금융상품 종류별 공정가치는 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 상각후원가 측정 금융자산 | ||||
| 현금및현금성자산 | 80,140,035 | 80,140,035 | 132,697,494 | 132,697,494 |
| 단기금융상품 | 38,000,000 | 38,000,000 | - | - |
| 매출채권 | 126,000 | 126,000 | - | - |
| 기타유동금융자산 | 1,479,452 | 1,479,452 | 5,742,181 | 5,742,181 |
| 기타비유동금융자산 | 5,898,918 | 5,898,918 | 56,569,937 | 56,569,937 |
| 금융자산 합계 | 125,644,405 | 125,644,405 | 195,009,612 | 195,009,612 |
| 상각후원가 측정 금융부채 | ||||
| 미지급금 | 5,542,415 | 5,542,415 | 6,090,708 | 6,090,708 |
| 단기차입금 | 38,000,000 | 38,000,000 | - | - |
| 기타유동금융부채 | 2,634,686 | 2,634,686 | 3,667,993 | 3,667,993 |
| 리스부채 | 1,381,338 | 1,381,338 | 1,005,068 | 1,005,068 |
| 금융부채 합계 | 47,558,439 | 47,558,439 | 10,763,769 | 10,763,769 |
4.2 금융상품 공정가치 서열 체계
공정가치로 측정되거나 공정가치가 공시되는 항목은 공정가치 서열체계에 따라 구분하며, 정의된 수준들은 다음과 같습니다.
- 동일한 자산이나 부채에 대한 활성시장의(조정되지 않은) 공시가격(수준 1)
- 직접적으로(예: 가격) 또는 간접적으로(예: 가격에서 도출되어) 관측 가능한, 자산 이나 부채에 대한 투입 변수를 이용하여 산정한 공정가치. 단, 수준 1에 포함된 공 시가격은 제외함(수준 2)
- 관측 가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입 변수(관측 가 능하지 않은 투입 변수)를 이용하여 산정한 공정가치(수준 3)
보고기간말 현재 공정가치로 측정되거나 공정가치가 공시되는 금융상품은 없습니다.
4.3 가치평가기법 및 투입 변수
보고기간말 현재 수준 3으로 분류되는 금융상품은 없으며, 당분기 중 회사의 금융자산과 금융부채의 공정가치에 영향을 미치는 사업환경 및 경제적인 환경의 유의적인 변동은 없습니다.
5. 범주별 금융상품
5.1 금융상품 범주별 장부금액
(1) 보고기간말 현재 회사의 범주별 금융자산은 아래와 같이 구성되어 있습니다.
| (단위: USD) |
|
금융자산 |
당분기말 | 전기말 |
|---|---|---|
| 상각후원가 측정 금융자산 | ||
| 현금및현금성자산 | 80,140,035 | 132,697,494 |
| 단기금융상품 | 38,000,000 | - |
| 매출채권 | 126,000 | - |
| 기타유동금융자산 | 1,479,452 | 5,742,181 |
| 기타비유동금융자산 | 5,898,918 | 56,569,937 |
| 합 계 | 125,644,405 | 195,009,612 |
(2) 보고기간말 현재 회사의 범주별 금융부채는 아래와 같이 구성되어 있습니다.
| (단위: USD) |
| 금융부채 | 당분기말 | 전기말 |
|---|---|---|
| 상각후원가 측정 금융부채 | ||
| 미지급금 | 5,542,415 | 6,090,708 |
| 단기차입금 | 38,000,000 | - |
| 기타유동금융부채 | 2,634,686 | 3,667,993 |
| 리스부채 | 1,381,338 | 1,005,068 |
|
합 계 |
47,558,439 | 10,763,769 |
5.2 금융상품 범주별 순손익
당분기와 전분기 중 회사의 금융상품 범주별 순손익은 아래와 같이 구성되어 있습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 상각후원가 측정 금융자산 | ||
| 이자수익 | 6,204,921 | 9,453,596 |
| 외환이익(손실) | (354,884) | (157,027) |
| 기타대손상각비환입 | 10,485,584 | 25,000 |
| 상각후원가 측정 금융부채 | ||
| 외환이익(손실) | (77,497) | (9,332) |
| 이자비용 | (183,290) | (4,391) |
6. 현금및현금성자산 및 단기금융상품
보고기간말 현재 회사의 현금및현금성자산 및 단기금융상품의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 현금및현금성자산 | ||
| 보통예금(주1) | 3,650,064 | 3,053,898 |
| 정기예금(주1) | 76,489,971 | 129,643,596 |
| 소 계 | 80,140,035 | 132,697,494 |
| 단기금융상품(주2) | 38,000,000 | - |
| 합 계 | 118,140,035 | 132,697,494 |
(주1) 보고기간말 현재 사용이 제한되어 있는 예금은 없습니다.
(주2) 보고기간말 현재 회사는 단기금융상품을 차입금에 대한 담보로 제공하고 있습니다(주석 23 참조).
7. 기타금융자산
보고기간말 현재 회사의 기타금융자산의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 대여금(주1) | 7,529,707 | 68,914,560 |
| 미수수익(주1) | 3,399,246 | 7,300,374 |
| 미수금 | 348,000 | 508,000 |
| 보증금 | 444,385 | 417,736 |
| 차감: 손실충당금(주1) | (4,342,968) | (14,828,552) |
| 합 계 | 7,378,370 | 62,312,118 |
| 차감: 비유동항목 | (5,898,918) | (56,569,937) |
| 유동항목 | 1,479,452 | 5,742,181 |
(주1) 전기말 종속회사 프레스티지바이오로직스㈜의 대여금에 대해 설정된 손실충당금 USD 10,485,584이 당분기 중 전액 환입되었습니다. 기타특수관계자 Qion Pte. Ltd.에 대한 대여금 USD 3,017,399(전기말 : USD 3,017,399)와 미수수익 USD 1,325,569(전기말 : USD 1,325,569)은 전액 손실충당금이 설정되어 있습니다.
8. 기타자산
보고기간말 현재 회사의 기타자산의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 선급금 | 16,549,904 | 8,317,897 |
| 선급비용 | 608,884 | 604,778 |
| 부가세대급금 | 53,593 | 65,635 |
| 차감: 손실충당금(주1) | (2,419,200) | (2,419,200) |
| 합 계 | 14,793,181 | 6,569,110 |
| 차감 : 비유동항목 | - | - |
| 유동항목 | 14,793,181 | 6,569,110 |
(주1) 종속회사 프레스티지바이오로직스㈜의 선급금에 대하여 인식한 손실충당금은 USD 2,419,200입니다(주석 22 참조).
9. 재고자산
보고기간말 현재 회사의 재고자산의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 저장품 | 219,701 | 134,959 |
10. 종속기업투자
보고기간말 현재 회사의 종속기업투자 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 소재국가 | 지분율 | 당분기말 | 전기말 |
|---|---|---|---|---|
| Prestige BioPharma Australia Pty. Ltd. | 호주 | 100% | 35,896 | 35,896 |
| Prestige BioPharma Belgium BVBA(주1) | 벨기에 | 100% | 56,819 | 56,819 |
| 프레스티지바이오파마아이디씨㈜(주2) |
한국 | 100% | 138,440,000 | 100,440,000 |
| 프레스티지바이오로직스㈜(주2),(주3) |
한국 | 40.2% | 115,540,793 | 35,609,113 |
| 합 계 | 254,073,508 | 136,141,828 | ||
(주1) 전체 지분의 1%는 회사의 주요 경영진이 회사를 대신하여 보유하고 있어 회사의 실질 지분율을 100%로 판단하였습니다.
(주2) 회사는 당분기 중 종속회사인 프레스티지바이오파마아이디씨㈜에 USD 38,000,000, 프레스티지바이오로직스㈜에 USD 67,335,432을 유상증자하였으며, 프레스티지바이오로직스㈜에 설정된 종속기업투자주식손상차손 USD 12,596,248을 전액환입하였습니다.
(주3) 회사는 기존에 보유하고 있었던 프레스티지바이오로직스㈜ 주식 15,206,560주와 2024년 9월 프레스티지바이오로직스㈜의 제3자배정 유상증자 참여로 추가 취득한 15,916,168주를 합한 총 31,122,728주를 보유하고 있습니다. 이에 따라, 회사의 프레스티지바이오로직스㈜에 대한 지분율은 40.2%이며, 기타주주로부터 의결권을위임받아 실질 지배력을 보유함에 따라 회사의 종속기업으로 판단하였습니다.
11. 유형자산
(1) 유형자산의 내역
보고기간말 현재 회사의 유형자산의 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
|
취득원가 |
상각누계액 |
장부금액 |
취득원가 |
상각누계액 |
장부금액 |
|
| 연구설비 | 3,550,509 | (3,436,660) | 113,849 | 3,811,901 | (3,546,044) | 265,857 |
| 집기비품 | 477,537 | (470,649) | 6,888 | 656,384 | (625,910) | 30,474 |
| 임차개량자산 | 1,509,577 | (1,401,502) | 108,075 | 1,395,130 | (1,333,844) | 61,286 |
| 사용권자산 | 5,660,908 | (4,162,471) | 1,498,437 | 4,416,242 | (3,560,982) | 855,260 |
| 합 계 | 11,198,531 | (9,471,282) | 1,727,249 | 10,279,657 | (9,066,780) | 1,212,877 |
(2) 유형자산의 변동
당분기와 전분기 중 회사의 유형자산의 변동 내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 기초 | 취득 | 처분 | 감가상각 | 분기말 |
|---|---|---|---|---|---|
| 연구설비 | 265,857 | 51,842 | - | (203,850) | 113,849 |
| 집기비품 | 30,474 | 1,033 | - | (24,619) | 6,888 |
| 임차개량자산 | 61,286 | 114,447 | - | (67,658) | 108,075 |
| 사용권자산 | 855,260 | 1,244,666 | - | (601,489) | 1,498,437 |
| 합 계 | 1,212,877 | 1,411,988 | - | (897,616) | 1,727,249 |
2) 전분기
| (단위: USD) |
| 구 분 | 기초 | 취득 | 처분 | 감가상각 | 분기말 |
|---|---|---|---|---|---|
| 연구설비 | 742,696 | 34,016 | - | (391,005) | 385,707 |
| 집기비품 | 164,595 | - | - | (107,257) | 57,338 |
| 임차개량자산 | 312,006 | - | - | (194,330) | 117,676 |
| 사용권자산 | 1,900,339 | - | - | (783,810) | 1,116,529 |
| 합 계 | 3,119,636 | 34,016 | - | (1,476,402) | 1,677,250 |
12. 리스
(1) 사용권자산의 내역
보고기간말 현재 회사의 사용권자산의 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
|
취득원가 |
상각누계액 |
장부금액 |
취득원가 |
상각누계액 |
장부금액 |
|
| 건물 | 5,274,051 | (4,062,242) | 1,211,809 | 4,312,554 | (3,473,625) | 838,929 |
| 차량운반구 | 381,255 | (98,086) | 283,169 | 98,086 | (86,055) | 12,031 |
| 기타설비 | 5,602 | (2,143) | 3,459 | 5,602 | (1,302) | 4,300 |
| 합 계 | 5,660,908 | (4,162,471) | 1,498,437 | 4,416,242 | (3,560,982) | 855,260 |
(2) 사용권자산의 변동
당분기와 전분기 중 회사의 사용권자산 변동내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 건물 | 차량운반구 | 기타설비 | 합 계 |
|---|---|---|---|---|
| 기초 | 838,929 | 12,031 | 4,300 | 855,260 |
| 취득 | 961,497 | 283,169 | - | 1,244,666 |
| 감가상각 | (588,617) | (12,031) | (841) | (601,489) |
| 분기말 | 1,211,809 | 283,169 | 3,459 | 1,498,437 |
2) 전분기
| (단위: USD) |
| 구 분 | 건물 | 차량운반구 | 기타설비 | 합 계 |
|---|---|---|---|---|
| 기초 | 1,866,860 | 28,063 | 5,416 | 1,900,339 |
| 감가상각 | (770,949) | (12,024) | (837) | (783,810) |
| 분기말 | 1,095,911 | 16,039 | 4,579 | 1,116,529 |
(3) 리스부채의 변동
당분기와 전분기 중 회사의 리스부채의 변동내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | 1,005,068 | 2,158,176 |
| 리스자산의 취득 | 981,804 | - |
| 리스부채의 원리금 지급 | (685,404) | (946,088) |
| 이자비용 | 72,833 | 78,179 |
| 환율변동효과 | 7,037 | 9,332 |
| 분기말 | 1,381,338 | 1,299,599 |
(4) 당분기와 전분기 중 리스와 관련해서 포괄손익계산서에 인식된 금액은 다음과 같습니다.
| (단위: USD) |
|
구 분 |
당분기 | 전분기 |
|---|---|---|
|
사용권자산의 감가상각비(영업비용에 포함) |
601,489 | 783,810 |
|
리스부채에 대한 이자비용(주1) |
72,833 | 78,179 |
|
단기리스료(영업비용에 포함) |
923 | 1,032 |
(주1) 리스부채에 대한 이자비용은 각각 당분기 USD 71,607 전분기 USD 73,788의금액이 무형자산(개발비)으로 자본화되었습니다(주석 13 참조).
(5) 리스의 총 현금유출은 각각 당분기 USD 686,327과 전분기 USD 947,120입니다.
13. 무형자산
(1) 무형자산의 내역
보고기간말 현재 회사의 무형자산의 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | |||
|---|---|---|---|---|
|
취득원가 |
상각누계액 |
손상누계액 |
장부금액 |
|
| 개발비(주1) | 123,652,770 | - | (11,379,218) | 112,273,552 |
| 지적재산권(주1) | 6,406,373 | (3,912,632) | 2,493,741 | |
| 특허권 | 964,616 | - | (268,946) | 695,670 |
| 합 계 | 131,023,759 | - | (15,560,796) | 115,462,963 |
| (단위: USD) |
| 구 분 | 전기말 | |||
|---|---|---|---|---|
|
취득원가 |
상각누계액 |
손상누계액 |
장부금액 |
|
| 개발비(주1) | 121,846,814 | - | (53,779,639) | 68,067,175 |
| 지적재산권(주1) | 6,278,873 | - | (3,912,632) | 2,366,241 |
| 특허권 | 904,937 | - | (268,946) | 635,991 |
| 합 계 | 129,030,624 | - | (57,961,217) | 71,069,407 |
(주1) 회사는 내부적으로 창출한 무형자산의 경우, 임상 1상의 개시가 승인되면 기술적 실현가능성, 미래경제적효익 등을 포함한 자산 인식요건이 충족된 시점 이후 발생한 지출을 무형자산으로 인식하고 있습니다. 제3자로부터 지적재산권의 취득 등의 계약을 체결하면서 지급한 계약금 등의 지출에 대하여 무형자산의 정의 및 인식기준을 충족하는 경우 무형자산으로 인식하고 있습니다.
회사는 2019년 4월 29일 유럽 의약품청인 EMA(European Medicines Agency 이하, EMA)에 HD201 품목허가 신청서류를 제출하였습니다. 이후 2022년 5월 19일 회사는 EMA의인체의약품위원회인 Committee for Medicinal Products for Human Use (CHMP)로부터 품목허가에 대한 부정적 의견을 받았습니다. 회사는 EMA로부터 수령한 품목허가에 대한 부정적 의견 및 품목허가 재심사 신청 철회를 근거로, 과거기간에 HD201 관련한 무형자산 전액에 대해 손상차손을 인식하였습니다. 회사는 2024년 7월 25일,EMA CHMP로부터 공식적으로 HD201 파이프라인(유방암 및 전이성 위암치료제)의승인을 권고하는 긍정적 의견을 획득하였으며, 2024년 9월 20일 유럽연합진행위원회로부터 품목명 투즈뉴(Tuznue)로 최종 판매허가를 취득함에 따라 당분기에 손상차손 금액 중 USD 42,400,421을 환입하였습니다. 회사는 투즈뉴(Tuznue)의 글로벌 상업화를 위해 유럽 시장 외에도, 영국(MHRA), 스위스(Swissmedic), 호주(TGA), 캐나다(HCA) 그리고 한국(MFDS)에서 마케팅 허가를 신청할 계획입니다.
HD204는 보고기간말 현재 임상시험 3상이 진행 중에 있으며, PBP1502는 보고기간말 현재 임상시험 1상이 진행 중에 있습니다.
(2) 무형자산의 변동
당분기와 전분기 중 회사의 무형자산 변동 내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 기초 | 취득(주1) | 감가상각 | 손상차손환입(주2) | 분기말 |
|---|---|---|---|---|---|
| 개발비 | 68,067,175 | 1,805,956 | - | 42,400,421 | 112,273,552 |
| 지적재산권 | 2,366,241 | 127,500 | - | - | 2,493,741 |
| 특허권 | 635,991 | 59,679 | - | - | 695,670 |
| 합 계 | 71,069,407 | 1,993,135 | - | 42,400,421 | 115,462,963 |
(주1) 취득 금액에는 자본화된 차입원가 및 인건비가 포함되어 있습니다.
(주2) 당분기 중 HD201 개발비에 설정된 무형자산손상차손 USD 42,400,421을 환입하였습니다.
2) 전분기
| (단위: USD) |
| 구 분 | 기초 | 취득(주1) | 감가상각 | 분기말 |
|---|---|---|---|---|
| 개발비 | 61,566,213 | 6,500,962 | - | 68,067,175 |
| 지적재산권 | 2,303,327 | 62,914 | - | 2,366,241 |
| 특허권 | 550,450 | 85,541 | - | 635,991 |
| 합 계 | 64,419,990 | 6,649,417 | - | 71,069,407 |
(주1) 취득 금액에는 자본화된 차입원가 및 인건비가 포함되어 있습니다.
(3) 보고기간말 현재 주요 개발 프로젝트별 자산화된 내부창출 개발비 금액 및 잔여상각기간은 다음과 같습니다.
| (단위: USD) |
| 구 분 |
프로젝트 |
단 계 |
자산화한 연구개발비 금액(누계액) |
연 구 개발비 |
잔 여 상각기간 |
|||
|---|---|---|---|---|---|---|---|---|
| 임상 1상 | 임상 3상 | 손상차손 | 합 계 | |||||
| 바이오시밀러 | HD201 | 개발완료 | 524,369 | 53,255,270 | (11,379,218) | 42,400,421 | 170,075 | - |
| 바이오시밀러 | HD204 | 개발 중 | 11,789,722 | 55,018,556 | - | 66,808,278 | - | - |
| 바이오시밀러 | PBP1502 | 개발 중 | 3,064,853 | - | - | 3,064,853 | - | - |
| 합 계 | 15,378,944 | 108,273,826 | (11,379,218) | 112,273,552 | 170,075 | - | ||
상기 프로젝트는 허셉틴, 아바스틴 및 휴미라의 바이오시밀러 개발 프로젝트입니다. 품목명 투즈뉴인 허셉틴 바이오시밀러(HD201)는 암 치료제로 당분기 중 개발이 완료되었습니다. 아바스틴의 바이오시밀러(HD204)는 암 치료제, 휴미라의 바이오시밀러
(PBP1502)는 류마티스 관절염 등의 치료제로 개발 중에 있습니다. 이들은 보고기간 말 현재 개발 중인 프로젝트이며, 상각이 개시되지 않았습니다.
(4) 당분기와 전분기 중 적격 자산인 무형자산에 대해 자본화된 차입원가는 각각 당분기 USD 1,113,308이며, 전분기 USD 73,788입니다.
(5) 개발비의 손상
회사는 과거기간에 HD201 관련 개발비에 손상차손을 인식하였으나, 당분기에 유럽연합진행위원회로부터 최종 판매허가를 취득함에 따라 과거 인식하였던 손상차손 금액 중 USD 42,400,421을 환입하였습니다.
회수가능액은 미래현금흐름을 근거로 계산한 사용가치에 기초하여 결정하였으며, 미래현금흐름은 회사의 과거 경험과 향후 10년간의 사업계획 등을 근거로 추정하였습니다.
당분기말 현재 추정기간동안 사용가치 계산에 사용된 주된 가정은 다음과 같습니다.
이러한 가정을 통한 검토 결과, 사용가치가 장부금액을 USD 42,400,421 초과하여 무형자산손상차손환입을 인식하였습니다.
| 구 분 | 주요 가정치 |
|---|---|
| 매출성장률 | -7.59%~72.00% |
| 할인율 | 13.89% |
한편, 회사의 회수가능액은 사용된 회사의 주요 가정치에 대한 가정에 따라 변동되 며, 가정치 변동에 따른 효과는 다음과 같습니다.
| (단위: USD) |
| 구 분 | 할인율의 변동 | |
|---|---|---|
| 0.5% 증가 | 0.5% 감소 | |
| 회수가능액(사용가치) | 48,487,599 | 50,393,598 |
HD204 및 PBP1502 관련 개발비에 대해 인식된 손상은 없으며, 주요 가정에 대한 민감도 분석은 다음과 같습니다.
| (단위: USD) |
| 주요 가정 | 투입변수 민감도 |
CGU사용가치의 장부금액 초과분 (CGU사용가치 - CGU장부금액) |
||
|---|---|---|---|---|
| HD204 | PBP1502 | 합 계 | ||
| 예상 제품 판매 수량 | 10% 감소 | 18,027,001 | 34,102,022 | 52,129,023 |
| 할인율(주1) | 1% 증가 | 23,886,371 | 36,501,325 | 60,387,696 |
| 예상 제품 판매 승인 시점 | 1년 연기 | 5,904,258 | 26,334,764 | 32,239,022 |
(주1) 당분기말 미래 현금흐름추정의 할인에 사용된 세후할인율은 14.25%입니다.
다른 투입변수가 동일할 경우 무형자산 손상이 발생하게 되는 투입변수의 조정 수준은 다음과 같습니다.
| 주요 가정 | 손상이 발생하게 되는 가정의 변동 |
|---|---|
| HD204 예상 제품 판매 수량 | 23.63% 감소시 |
| HD204 할인율 | 20.71%로 변동시 |
14. 차입금
(1) 차입금 내역
보고기간말 현재 회사의 차입금 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 차입처 | 만기 | 이자율 | 당분기말 | 전기말 |
|---|---|---|---|---|---|
| 단기차입금 | Woori Bank Singapore Br. |
2025.07.21 | 5.85% | 15,000,000 | - |
| 2025.10.21 | 4.50% | 15,000,000 | - | ||
| 2025.11.25 | 4.50% | 8,000,000 | - | ||
| 합 계 | 38,000,000 | - | |||
(2) 보고기간말 현재 회사의 단기차입금에 대하여 단기금융상품이 담보로 제공되어 있습니다(주석 23 참조).
(3) 단기차입금에 대한 당분기 이자비용 USD 1,041,701의 금액이 무형자산(개발비)으로 자본화되었습니다(주석 13 참조).
15. 기타금융부채
보고기간말 현재 회사의 기타금융부채의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 미지급비용 | 2,634,686 | 3,667,993 |
| 차감: 비유동항목 | - | - |
| 유동항목 | 2,634,686 | 3,667,993 |
16. 기타부채
보고기간말 현재 회사의 기타부채의 구성 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 선수수익(주1) | 1,216,000 | 586,000 |
| 선수금(주2) | 13,632,000 | 13,632,000 |
| 기타부채(주3) | 408,010 | 1,176,000 |
| 합 계 | 15,256,010 | 15,394,000 |
| 차감: 비유동항목 | (1,443,359) | (586,000) |
| 유동항목 | 13,812,651 | 14,808,000 |
(주1) 선수수익은 전액 고객과의 계약과 관련한 계약부채입니다(주석 19 참조).
(주2) 2021년 8월 회사는 고객과 COVID-19 백신 공급 계약을 체결하기 위한 선수금으로 고객으로부터 USD 13,632,000를 수령하였습니다. 2021년 11월 회사는 고객과 COVID-19 백신 공급계약을 체결하였습니다.
(주3) 전기말 기타부채 USD 1,176,000은 고객과의 계약에 따라 수령한 HD201 관련 계약의 계약금(Upfront fee) 및 마일스톤 대가(Milestone fee)로 당분기 중 수익으로 인식하였습니다.
17. 자본금
보고기간말 현재 회사의 자본금의 구성 내역은 다음과 같습니다.
| (단위: 주, USD) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 발행주식수 | 12,019,231 | 12,019,231 |
| 자본금(주1) | 525,727,248 | 525,727,248 |
(주1) 회사는 2021년 2월 5일자로 회사의 주식을 한국증권거래소가 개설한 유가증권시장에 신규상장하였으며, 총 2,831,250주의 신주를 USD 410,326천에 발행하였습니다. 신주발행거래와 직접 관련한 USD 11,841천은 유상증자로 증가한 자본금에서 직접 차감하여 표시하였습니다.
18. 주식기준보상
(1) 회사는 2021 사업년도 주주총회 결의에 의거해서 회사의 임직원 등에게 주식선택권을 부여했으며, 그 주요 내용은 다음과 같습니다.
| ㆍ | 주식선택권으로 발행한 주식의 종류 : 기명식 보통주식 | |
| ㆍ | 부여방법 : 보통주 신주발행 | |
| ㆍ | 가득조건 : | |
| - | IPO 후 1년 경과 시점에 2년 이상 재직한 임직원의 경우 : 회사의 IPO 후 1년 경과시 전체부여주식의 30%, IPO 후 3년 경과 시 35%, IPO 후 5년 경과 시 35% 가득 됨 | |
| - | IPO 후 1년 경과 시점에 2년 미만 재직한 임직원의 경우 : 재직기간이 2년이 되는 시점 및 회사의 IPO 후 1년 경과 시점 중 늦은 시점에 전체 부여주식의 30%, 최초 가득일로부터 2년 경과 시 35%, 최초 가득일로부터 4년 경과 시 35% 가득 됨 | |
| - | 특정 인원의 경우 : 약정된 기술된 임상시험 진행 등 마일스톤 달성에 따라 가득됨 | |
(2) 주식선택권의 수량과 가중평균 행사가격의 변동은 다음과 같습니다.
| (단위: 주, USD) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
|
주식매수선택권 수량 |
가중평균행사 |
주식매수선택권 수량 |
가중평균행사 |
|
|
기초 잔여주 |
106,562 | 90 | 128,044 | 90 |
| 소멸 | - | - | (16,808) | 90 |
|
기말 잔여주 (주1) |
106,562 | 90 | 111,236 | 90 |
(주1) 외부 컨설턴트에 부여된 주식선택권 22,778주가 포함되어 있습니다.
보고기간말 현재 유효한 주식선택권의 가중평균 잔여만기는 5.6년, 행사 가격은 한주당 USD 90이며, 행사 가능한 주식선택권은 40,368주 입니다.
상기의 수량 및 행사가격은 회사의 주식 1주 기준이며, 회사의 주식 1주는 현재 유가증권시장에서 유통되고 있는 예탁증서 5DR에 해당합니다.
(3) 회사는 부여한 주식선택권에 대하여 부여일의 공정가치로 측정하며, 이로 인하여증가하는 총 자본은 가득기간에 걸쳐 주식기준보상비용으로 인식됩니다.
(4) 회사는 2021 사업년도 중 부여된 주식선택권의 보상원가를 블랙-숄즈모형을 이용한 공정가치접근법을 적용하여 산정했으며, 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| 구 분 | 내 역 |
|---|---|
|
부여된 주식선택권의 공정가치 |
USD 91.38 |
|
부여일의 주식가치 |
USD 115.29 |
|
주가변동성(주1) |
92% |
|
주식선택권의 계약상 만기(주2) |
10년 |
|
무위험수익률 |
0.66% |
(주1) 상장되어 있는 회사의 대용기업의 변동성을 사용하였습니다.
(주2) 주식선택권의 공정가치 측정 시에는 주식선택권 양도 제한 및 고용 중단 등의 영향으로 인한 종업원의 조기행사효과를 고려한 기대만기(5.6년~7.9년)를 적용하였습니다.
(5) 당분기와 전분기 중 인식한 주식기준보상 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 자본화된 개발비 | - | 158,656 |
| 주식기준보상비용(주1) | 609,613 | (105,271) |
| 합 계 | 609,613 | 53,385 |
(주1) 외부 컨설턴트에 부여된 주식선택권과 관련한 주식기준보상비용으로 USD 274,910(전분기 USD 220,080) 금액이 포함되어 있습니다.
19. 고객과의 계약에서 생기는 수익 및 관련 계약부채
(1) 고객과의 계약에서 생기는 수익
회사는 수익과 관련해 포괄손익계산서에 다음 금액을 인식하였습니다.
| (단위 : USD) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
|
고객과의 계약에서 생기는 수익 |
- | 1,512,000 | - | - |
(2) 고객과의 계약과 관련된 부채
회사가 인식하고 있는 고객과의 계약과 관련한 계약부채는 아래와 같습니다.
| (단위 : USD) |
|
구 분 |
당분기말 |
전기말 |
|---|---|---|
| 기타비유동부채(장기선수수익) | 1,216,000 | 586,000 |
회사의 계약부채는 계약체결 시점에 고객에게 청구 및 수령한 계약금(Upfront fee)과일정요건 달성시점에 고객에게 청구 및 수령한 마일스톤 대가(Milestone fee) 중 수익인식 시점이 차기 이후로 이연된 금액입니다. 추후기간 장기선수수익은 수익으로 인식될 것으로 예상하고 있습니다.
20. 유의적인 손익정보
당분기와 전분기 중 분기순이익은 성격, 크기, 빈도에 있어 비경상적인 다음 항목을 포함하고 있습니다.
| (단위: USD) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 기타대손상각비환입(주1) | - | 10,485,584 | - | 25,000 |
| 종속기업투자주식손상차손환입(주2) | - | 12,596,248 | - | - |
| 무형자산손상차손환입(주3) | 42,400,421 | 42,400,421 | - | - |
(주1) 회사는 당분기 중 프레스티지바이오로직스㈜에 대한 대여금 손실충당금 USD 10,485,584 전액 환입하였습니다.
(주2) 회사는 당분기 중 프레스티지바이오로직스㈜에 대한 종속기업투자주식손상차손 USD 12,596,248 전액 환입하였습니다.
(주3) 회사는 당분기 중 HD201 개발비에 설정된 무형자산손상차손 USD 42,400,421을 환입하였습니다.
21. 법인세비용
법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균 연간유효법인세율의 추정에 기초하여 인식하였습니다. 당분기 및 전분기 종료하는 회계연도의 예상평균연간법인세율은 0%입니다.
22. 특수관계자 거래
(1) 특수관계자 현황
회사의 주요 특수관계자 및 주요 경영진 등은 다음과 같습니다.
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 종속기업 | Prestige BioPharma Australia Pty. Ltd. Prestige BioPharma Belgium BVBA 프레스티지바이오파마아이디씨㈜ 프레스티지바이오로직스㈜ |
Prestige BioPharma Australia Pty. Ltd. Prestige BioPharma Belgium BVBA 프레스티지바이오파마아이디씨㈜ 프레스티지바이오로직스㈜ |
| 주요 주주 | Mayson Partners Pte. Ltd. Octava Fund Limited |
Mayson Partners Pte. Ltd. Octava Fund Limited |
| 주요 경영진 | 박소연, Michael Jinwoo, Kim |
박소연, Michael Jinwoo, Kim |
| 기타 특수관계자 |
Qion Pte. Ltd. | Qion Pte. Ltd. |
(2) 보고기간말 현재 회사의 특수관계자에 대한 주요 채권ㆍ채무 내역은 다음과 같습니다.
1) 당분기말
| (단위: USD) |
|
구 분 |
특수관계자명 | 채권 등 | 채무 | |||
|---|---|---|---|---|---|---|
| 대여금(주1) | 미수금 | 미수수익 | 선급금(주2) | 미지급금 | ||
| 종속기업 | Prestige BioPharma Australia Pty. Ltd. | 3,655,007 | - | 916,433 | - | - |
| Prestige BioPharma Belgium BVBA | 857,301 | - | 49,805 | - | - | |
| 프레스티지바이오로직스㈜ | - | 348,000 | - | 14,130,704 | 42,582 | |
| 합 계 | 4,512,308 | 348,000 | 966,238 | 14,130,704 | 42,582 | |
2) 전기말
| (단위: USD) |
|
구 분 |
특수관계자명 | 채권 등 | 채무 | ||||
|---|---|---|---|---|---|---|---|
| 대여금(주1) | 미수금 | 미수수익 | 선급금(주2) | 미지급금 | 미지급비용 | ||
| 종속기업 | Prestige BioPharma Australia Pty. Ltd. | 3,878,135 | - | 792,315 | - | - | - |
| Prestige BioPharma Belgium BVBA | 534,736 | - | 37,593 | - | - | - | |
| 프레스티지바이오파마아이디씨㈜ | - | - | - | - | - | 229,438 | |
| 프레스티지바이오로직스㈜ | 50,998,706 | 508,000 | 3,993,277 | 5,898,697 | 21,274 | 174,460 | |
| 합 계 | 55,411,577 | 508,000 | 4,823,185 | 5,898,697 | 21,274 | 403,898 | |
(주1) 보고기간말 현재 특수관계자 대여금 내역은 다음과 같습니다.
| (단위: USD) |
| 구 분 | 특수관계자명 | 통화 | 만기일 | 연이자율 | 금 액 | |
|---|---|---|---|---|---|---|
| 당분기말 | 당분기말 | 전기말 | ||||
| 종속기업 | Prestige Biopharma Australia Pty. Ltd. | AUD | 2028.10.01(*1) |
5.61% | 3,655,007 | 3,878,135 |
| Prestige Biopharma Belgium BVBA | EUR | 2030.12.01 | 2.01% | 857,301 | 534,736 | |
| 프레스티지바이오로직스㈜ | USD | 2024.10.11 | - | - | 61,484,290 | |
| 기타특수관계자 | Qion Pte. Ltd. | USD | 2026.06.16 ~ 2028.11.18 | 18.00% | 2,824,871 | 2,824,871 |
| SGD | 2028.07.10 ~ 2029.01.28 | 18.00% | 192,528 | 192,528 | ||
| 합 계 | 7,529,707 | 68,914,560 | ||||
| 차감: 손실충당금(*2) |
(3,017,399) | (13,502,983) | ||||
| 대여금(순액) | 4,512,308 | 55,411,577 | ||||
(*1) 대여금의 만기는 회사와 종속기업 간 합의로 연장 가능하며, 회사 및 종속기업은단기 내 대여금을 상환할 계획이 없습니다.
(*2) 당분기말 현재 Qion Pte. Ltd.에 대한 대여금 USD 3,017,399 전액이 손실충당금으로 설정되어 있습니다.
(주2) 당분기말 및 전기말 프레스티지바이오로직스㈜의 선급금에 대하여 인식된 손실충당금은 USD 2,419,200이며, 동 손실충당금 반영 후 당분기말 프레스티지바이오로직스㈜에 대한 선급금 잔액 USD 14,130,704은 HD201, HD204, PBP1510, PBP1502, PBP1601 개발과 관련한 선급금입니다.
(3) 당분기와 전분기 중 특수관계자와의 주요 거래내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 특수관계자명 | 수익 | 비용 |
|---|---|---|---|
| 이자수익 | 매입 등 | ||
| 종속기업 | Prestige BioPharma Australia Pty. Ltd. | 194,638 | - |
| Prestige BioPharma Belgium BVBA | 12,399 | - | |
| 프레스티지바이오로직스㈜ | 1,420,139 | 181,076 | |
| 합 계 | 1,627,176 | 181,076 | |
2) 전분기
| (단위: USD) |
| 구 분 | 특수관계자명 | 수익 | 비용 |
|---|---|---|---|
| 이자수익 | 매입 등 | ||
| 종속기업 | Prestige BioPharma Australia Pty. Ltd. | 207,973 | - |
| Prestige BioPharma Belgium BVBA | 8,424 | - | |
| 프레스티지바이오파마아이디씨㈜ | - | 552,724 | |
| 프레스티지바이오로직스㈜ | 3,353,289 | 10,670,754 | |
| 합 계 | 3,569,686 | 11,223,478 | |
(4) 당분기와 전분기 중 특수관계자와의 자금 거래내역은 다음과 같습니다.
1) 당분기
| (단위: USD) |
| 구 분 | 특수관계자명 | 자금대여(주1) | 자본거래 (주2) |
|
|---|---|---|---|---|
| 증가 | 감소 | |||
| 종속기업 | Prestige BioPharma Belgium BVBA | 322,732 | - | - |
| 프레스티지바이오파마아이디씨㈜ | - | - | 38,000,000 | |
| 프레스티지바이오로직스㈜ | 3,993,277 | 65,477,567 | 67,335,432 | |
| 합 계 | 4,316,009 | 65,477,567 | 105,335,432 | |
(주1) 프레스티지바이오로직스㈜의 대여금은 2024년 7월 1일에 계약 변경으로 미수이자 USD 3,993,277가 대여금 원본에 전입되었으며, 당분기 중 USD 65,477,567을 전액 회수하였습니다.
(주2) 회사는 당분기 중 종속회사인 프레스티지바이오파마아이디씨㈜에 USD 38,000,000 프레스티지바이오로직스㈜에 USD 67,335,432을 유상증자하였습니다.
2) 전분기
| (단위: USD) |
| 구 분 | 특수관계자명 | 자금대여 | 자본거래 | |
|---|---|---|---|---|
| 증가 | 감소 | |||
| 종속기업 | Prestige BioPharma Australia Pty. Ltd. | 32,805 | 745,860 | - |
| Prestige BioPharma Belgium BVBA | 5,630 | 56,120 | - | |
| 프레스티지바이오로직스㈜(*) |
1,984,290 | - | - | |
| 합 계 | 2,022,725 | 801,980 | - | |
(*) 프레스티지바이오로직스㈜로부터 증가된 자금대여 USD 1,984,290은 2023년 1월 1일부터 6월 30일까지 발생한 이자금액이 원금에 합산된 금액입니다.
(5) 회사의 운영에 대한 권한과 책임을 가진 이사회 구성원이 주요 경영진에 해당하며, 당분기와 전분기 중 주요 경영진에 대한 보상내역은 다음과 같습니다.
| (단위: USD) |
|
구 분 |
당분기 | 전분기 |
| 급여 | 845,826 | 745,597 |
| 주식기준보상비용 | 25,485 | (508,971) |
| 퇴직급여 | 19,780 | 18,076 |
| 합 계 | 891,091 | 254,702 |
(6) 지급보증 등
보고기간말 현재 회사의 차입금에 대해 특수관계자로부터 제공받고 있는 지급보증은없습니다.
23. 약정사항
(1) 회사는 기타특수관계자인 프레스티지바이오로직스㈜와의 계약을 통해서 HD201과 HD204를 공동 개발하며, 관련하여 발생한 순수익에 대해서 회사와 프레스티지바이오로직스㈜간 개발 비용 부담 비율에 따라 배분합니다.
(2) 회사는 프레스티지바이오로직스㈜로부터 바이오시밀러(PBP1502) 관련 제품을 공급받는 계약을 체결하고 있습니다. 해당 계약에 의하여 회사는 프레스티지바이오로직스㈜로부터 임상실험에 필요한 재화 및 용역을 제공받고 있으며, 총 계약금액 USD 2,648,000입니다. 해당 계약과 관련하여 당분기 중 인식된 비용은 없습니다.
(3) 회사는 보고기간말 현재 Pharmapark LLC, Dr. Reddy's Laboratories Ltd, Tabuk Pharmaceutical Manufacturing Company 등의 고객과 라이선스 및 제품 공급 계약을 체결하고 있습니다. 해당 계약과 관련하여 과거기간 중 고객으로부터 계약금(Upfront fee) 및 요건을 달성한 마일스톤 대가(Milestone fee)을 청구 및 일부 수령하였습니다. 수익인식이 차기 이후로 이연된 금액은 계약부채로 인식하였습니다.
(4) 2021년 11월 회사는 Stelis Pte. Ltd. 및 Enso Healthcare DMCC와 회사가 COVID-19 백신 제품을 공급하는 위탁생산 계약을 체결하였으며, 계약금은 USD13,632, 000입니다. 2022년 1월 회사는 프레스티지바이오로직스㈜와 회사가 COVID-19 백신 위탁생산을 발주하는 계약을 체결하였으며, 계약금액은 28,800백만원입니다.
(5) 2023년 8월 회사는 프레스티지바이오로직스㈜와 master service 계약을 체결하였습니다. 계약기간은 5년이며, 이 계약을 통해 회사는 현재 개발 중인 다수의 개발 프로젝트에 대해서 프레스티지바이오로직스㈜와 기본 조건을 재협상할 필요 없이 복합적인 작업지시를 수행할 수 있습니다.
(6) 회사는 2024년 7월 25일, EMA CHMP로부터 공식적으로 HD201 파이프라인(유방암 및 전이성 위암 치료제)의 승인을 권고하는 긍정적 의견을 획득하였으며, 2024년 9월 20일 유럽연합진행위원회로부터 품목명 투즈뉴(Tuznue)로 최종 판매허가를 취득하였습니다. 회사는 투즈뉴(Tuznue)의 글로벌 상업화를 위해 유럽 시장 외에도, 영국(MHRA), 스위스(Swissmedic), 호주(TGA), 캐나다(HCA), 그리고 한국(MFDS)에서 마케팅 허가를 신청할 계획입니다.
(7) 보고기간말 현재 차입금과 관련하여 담보로 제공된 자산은 다음과 같습니다.
| (단위: USD) |
| 담보제공자산 | 장부금액 | 설정금액 | 차입금종류 | 차입금액 | 담보권자 |
|---|---|---|---|---|---|
| 단기금융상품 | 38,000,000 | 38,000,000 | 단기차입금 | 38,000,000 | Woori Bank Singapore Br. |
6. 배당에 관한 사항
가. 당사의 정관에 기재된 배당에 관한 사항
|
배당금 120. 이사들이 회사의 수익금이 그러한 지급을 정당화한다고 판단하는 경우, 이사들은 반기별 기준일 또는 달리 지정된 지급일에 지급하도록 규정되어 있는 고정 배당금을 수반하는, 종류를 불문한 주식에 대하여 고정 배당금을 선언하고 지급할 수 있으며, 또한 수시로 종류를 불문한 주식에 대해 적절한 기간에 대해 적절한 금액을 적절한 날에 중간배당금으로 선언하고 지급할 수 있다. 121. 여하한 주식 또는 여하한 종류의 주식에 부가된 여하한 권리 또는 제한을 전제로, 회사법에 달리 허용된 경우는 제외하고: (a) 주식에 대한 모든 확정 배당금은 주주가 보유하는 주식의 수에 비례하여 지급하며, 그러한 배당금, 권리, 배정 또는 회사의 기타 분배를 수령할 주주의 권리를 판단하는 기준이 되는 날인 기준일은 6월 30일로 한다; 및 (b) 모든 배당금은 기준일 현재 주주명부에 이름이 기재되어 있거나 적법하게 등록된 주주에게 배분 및 지급되어야 한다. 본 조항의 목적 상, 매수청구(call) 전에 주식에 대해 납입된 또는 납입된 것으로 간주되는 금액은 무시한다. 122. (A) 관련 법령 상 분배 가능한 수익금 외에 달리 배당금을 지급해서는 안 된다. 이사들이 미청구 배당금 또는 주식에 대해 지급해야 하는 기타 금전을 별도 계좌에 지급하는 것은 회사를 이에 대하여 수탁인이 되게 하지 않는다. 이사들은 최초로 지급 가능하게 된 뒤 1년이 경과한 후에도 청구되지 않고 남아 있는 모든 배당금을 회사의 이익을 위해 투자하거나 또는 달리 사용할 수 있으며, 최초로 지급 가능하게 된 뒤 6년이 경과한 후에도 청구되지 않고 남아 있는 배당금 또는 그러한 금전은 몰수될 수 있으며 이 경우 회사에 귀속된다. 다만, 이사들은 그 후 수시로 전적인 재량에 따라 그러한 몰수를 취소하고, 몰수된 배당금을 몰수 전에 이에 대한 권리를 가졌던 자에게 지급할 수 있다. 명의개서대리인이 그러한 배당금 또는 금전을 회사에 환불하고, 그러한 배당금 선언일 또는 그러한 기타 금전이 먼저 지급 가능하게 된 날로부터 6년이 경과한 경우, 해당 실질소유자는 그러한 배당금 또는 금전과 관련하여 회사를 상대로 아무런 권리 또는 청구권을 갖지 않는다. (B) 배당금 또는 실질소유자에게 지급해야 하는 기타 금전을 회사가 한국예탁결제원에게 지급하는 것은 지급된 금액 범위 내에서 해당 지급과 관련하여 실질소유자에 대한 회사의 책임을 면제한다. 123. 배당금 또는 주식에 대해 지급해야 하는 기타 금전은 회사에 대해 이자가 발생하지 않는다. 124. (A) 이사들은 회사가 선취특권을 갖는 배당금 또는 주식에 대해 지급해야 하는 기타 금전을 보유하고, 이를 해당 선취특권의 원인이 되는 부채, 책임 또는 채무를 이행하는데 사용할 수 있다. (B) 이사들은 주식의 양도와 관련하여 위에 포함된 조항에 따라 주주가 될 권리가 있는 자, 또는 동 조항에 따라 양도할 권리가 있는 자와 관련하여, 주식에 대해 지급해야 하는 배당금을 해당 인이 해당 주식과 관련하여 주주가 될 때까지 또는 해당 주식을 양도할 때까지 보유할 수 있다. (C) 주식의 양도는 양도가 등록되기 전에 이에 대해 선언된 배당금에 대한 권리는 포함하지 않는다. (D) 이사들은 주식과 관련하여 주주에게 지급해야 하는 배당금 또는 기타 금전에서 회사가 매수청구(calls)로 인해 또는 이와 관련하여 해당 주주에게 지급해야 하는 (있는 경우) 금전의 합계를 공제할 수 있다. 125. 여하한 서류(인감 날인 여부를 불문함)를 통한 주식 배당금 전부 또는 일부에 대한 포기는 주주 (또는 보유자의 사망 또는 파산으로 인해 주식을 보유하게 된 자)가 해당 서류에 서명하여 회사에 교부하거나, 또는 회사가 이를 수락하거나 이에 따른 조치를 취한 경우 그 범위 내에서 효력이 발생한다. 126. 관련 법령에 따라, 회사는 이사들의 권고에 따라 일반결의를 통해 배당금 전부 또는 일부를 특정 자산(구체적으로, 다른 회사의 납입 주식 또는 사채로 또는 그러한 한 개 이상 방식을 통해)의 분배를 통해 지급하도록 지시할 수 있으며, 이사들은 그러한 결의를 실행해야 한다. 그러한 분배와 관련하여 어려움이 발생하는 경우, 이사들은 편리하다고 판단하는 방식에 따라 이를 해결할 수 있으며, 예를 들면 단주 주권을 발행하거나, 그러한 특정 자산 또는 그 일부의 분배를 위한 가치를 고정하거나, 모든 당사자들의 권리를 조정하기 위해 그렇게 고정된 가치를 기준으로 주주들에게 현금을 지급하기로 결정하거나, 및 이사들이 편리하다고 판단하는 바에 따라 그러한 특정 자산을 수탁인들에게 귀속시킬 수 있다. 127. 주식과 관련하여 현금으로 지급되는 배당금 또는 기타 금전은 수표 또는 신주인수권의 형태로 우편으로 주주명부에 등재된 등록주소 또는 이에 대한 권리가 있는 자(또는 보유자의 사망 또는 파산으로 인해 2인 이상이 주주명부에 등재되거나 또는 이에 대해 권리를 갖게 되는 경우, 그러한 자들 중 1인에게)에게, 또는 해당 주주 또는 그러한 자가 서면으로 지시하는 다른 자에게 및 다른 주소로 지급할 수 있다. 그러한 각 수표 또는 신주인수권은 이를 수신하는 자, 또는 보유자의 사망 또는 파산으로 인해 이를 보유하게 된 보유자, 공동 보유자 또는 이에 대한 권리를 보유하게 된 자가 지시하는 자의 명의로 발행해야 하며, 수표 또는 신주인수권 명의자에 대한 은행의 지급은 회사에 대해 유효한 이행으로 간주된다. 그러한 모든 수표 또는 신주인수권은 이에 기재된 금원에 대한 권리를 갖는 자의 위험 부담 하에 발송된다. 128. 보유자의 사망 또는 파산으로 인해 2인 이상이 주주명부에 등재되거나 또는 주식에 대해 공동 권리를 갖게 되는 경우, 그 중 1인이 해당 주식과 관련하여 지급되는 배당금, 자본 또는 기타 금전의 반납, 또는 이와 관련하여 분배되는 재산에 대해 유효한 영수증을 발행할 수 있다. 129. 주주총회에서 회사의 결의 또는 이사들의 결의에도 불문하고, 여하한 종류의 주식에 대해 배당금을 선언하는 결의는 특정일의 영업 종료시 주주명부에 해당 주식의 보유자로 등재된 자에게 이를 지급하도록 명시할 수 있으며, 이 경우 배당금은 그렇게 등재된 각각의 지분에 비례하여 지급하되, 이는 해당 주식의 양도인 및 양수인의 배당금과 관련하여 그들 간 권리에 영향을 미치지 않는다. 130. 이사들 또는 회사가 주주총회에서 회사의 보통주식에 대해 배당금(중간, 확정, 특별 또는 기타 배당금 포함) 지급 또는 선언을 결의하거나 또는 제안하는 경우, 이사들은 회사의 보통주식 또는 증권예탁증권이 대한민국에서 지정 증권거래소에 상장되어 있는 한 해당 배당금을 지급 받을 권리가 있는 주주에게 현금으로만 지급하기로 결의해야 한다. |
나. 주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제10기 3분기 | 제9기 | 제8기 | ||
| 주당액면가액(원) | - | - | - | |
| (연결)당기순이익(백만원) | 31,073 | -32,921 | 17,569 | |
| (별도)당기순이익(백만원) | 90,444 | -11,496 | 28,451 | |
| (연결)주당순이익(원) | 2,585 | -2,739 | 1,462 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
다. 과거 배당 이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
주1) 당사는 설립이후 보고서 제출일 현재까지 배당을 지급한 이력이 없습니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 증자(감자)현황
당사는 공시대상기간 중 자본변동 사항은 없습니다.
나. 미상환 전환사채 발행현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 제1회 무기명식 이권부 무보증 사모 전환사채 |
1회차 | 2018.07.31 | 2023.07.30 | 12,500,000 | 보통주 | '18.08.01~'23.06.30 | 100 | 5,196 | - | - | - |
| 제2회 무기명식 이권부 무보증 사모 전환사채 |
2회차 | 2018.08.30 | 2023.08.30 | 5,000,000 | 보통주 | '18.09.01~'23.07.30 | 100 | 5,196 | - | - | - |
| 제3회 무기명식 무보증 사모 전환사채 |
3회차 | 2023.03.20 | 2026.03.20 | 45,500,000 | 보통주 | '24.03.20~'26.02.20 | 100 | 3,534 | 45,500,000 | 12,874,929 | - |
| 합 계 | - | - | - | 63,000,000 | - | - | - | - | 45,500,000 | 12,874,929 | - |
(주1) 상기 전환사채는 종속회사 프레스티지바이오로직스㈜가 발행한 전환사채 내역입니다.
| [채무증권의 발행 등과 관련된 사항] |
가. 채무증권 발행실적
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| 프레스티지바이오로직스 | 회사채 | 사모 | 2023.03.20 | 45,500,000 | 0.00 | - | 2026.03.20 | 미상환 | - |
| - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - |
나. 기업어음증권 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
다. 단기사채 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
라. 회사채 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
마, 신종자본증권 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
바. 조건부자본증권 미상환 잔액
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 유가증권시장 상장 | - | 2021.01.28 | HD201 (품목허가 등) | 14,472,500 | HD201 (품목허가 등) | 15,165,258 | 주2) |
| 유가증권시장 상장 | - | 2021.01.28 | HD204 (품목허가,임상 등) | 46,312,000 | HD204 (품목허가,임상 등) | 57,998,270 | 주2) |
| 유가증권시장 상장 | - | 2021.01.28 | PBP1502 (품목허가,임상 등) | 74,941,400 | PBP1502 (품목허가,임상 등) | 9,247,987 | 주2) |
| 유가증권시장 상장 | - | 2021.01.28 | PBP1510 (품목허가,임상 등) | 119,253,400 | PBP1510 (품목허가,임상 등) | 8,616,607 | 주2) |
| 유가증권시장 상장 | - | 2021.01.28 | 기타파이프라인 | 181,709,755 | 기타파이프라인 | 12,051,386 | 주2) |
| 유가증권시장 상장 | - | 2021.01.28 | 운영자금 등 | - | 운영자금 등 | 73,568,703 | 주3) |
| 유가증권시장 상장 | - | 2021.01.28 | 해외종속기업투자 | - | 해외종속기업투자 | 223,840,215 | 주4), 주5) |
주1) 당사는 2021년 2월 5일 한국 유가증권시장에 상장되었으며, 납입일은 배정 공모주의 납입기일입니다.
주2) 당사는 상장일 이후 본 분기보고서 작성기준일 현재 파이프라인 개발에 대해서는 기존 조달되었던 사모자금 및 공모자금으로 충당하였습니다. 공모자금으로 사용된 파이프라인 개발비용은 자금 조달일로부터 당분기말까지의 평균환율 1,344.52/USD를 적용하여 환산했습니다.
주3) 당분기말까지 운영자금으로 사용된 공모자금 입니다.
주4) 본 분기보고서 작성기준일 현재 해외종속기업투자로 사용된 공모자금은 프레스티지바이오파마아이디씨의 백신사업부문 자본금 출자 및 프레스티지바이오로직스 자본금 출자로 사용되었습니다.
주5) 해외종속기업투자는 유상증자 형식으로 아래와같이 투자하였습니다. 투자규모 금액은 당분기말 환율 1,466.50/USD 를 적용하여 원화로 환산했습니다.
| (단위: 천원) |
| 회사명 | 투자목적 | 투자형태 | 투자규모 | 지출액 | 비고 |
|---|---|---|---|---|---|
| 프레스티지바이오파마아이디씨 | 백신사업 | 유상증자 | 81,302,760 | 81,302,760 | 주1) |
| 프레스티지바이오로직스 | 지배구조개선 | 유상증자 | 162,845,096 | 162,845,096 | 주1), 주2) |
| 합계 | 244,147,856 | 244,147,856 | 주1) | ||
주1) 상기 표에 기재된 원화 금액은 당분기 기말환율인 1,466.50/USD를 적용하여 원화로 환산했습니다.
주2) 2024년 9월 중 당사는 프레스티지바이오로직스(주) 제3자배정 유상증자 참여하였습니다.
나. 사모자금의 사용내역
| (기준일 : | 2025.03.31 | ) | (단위 : 천원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 유상증자(CB) | 제1회 | 2018.07.31 | 공장신축 시설자금 및 운영자금 | 12,500,000 | 공장신축 시설자금 및 운영자금 | 12,500,000 | - |
| 유상증자(CB) | 제2회 | 2018.08.31 | 공장신축 시설자금 및 운영자금 | 5,000,000 | 공장신축 시설자금 및 운영자금 | 5,000,000 | - |
| 유상증자(CB) | 제3회 | 2023.03.20 | 운영자금 | 45,500,000 | 운영자금 | 40,500,000 | 운영자금으로 약 405억원 사용 |
미사용자금의 운용내역
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 정기예금 | 36,200,629 | - | - |
| 예ㆍ적금 | 정기예금 | 5,000,000 | - | - |
| 계 | 41,200,629 | - | ||
주1) 상기 표는 원화표시원칙에 따라 작성되었습니다.
주2) 공모당시 환율 1,095.87/USD 대비 환율 상승으로 인해 누적 평균 환율이 1,344.52/USD로 적용됨에 따라 공모자금 사용 금액이 증가하여 반영되었습니다. 현재 본 분기보고서 작성기준일 미사용자금은 USD 100,618,971입니다
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
(1) 재무제표를 재작성한 경우 재작성 사유, 내용 및 재무제표에 미치는 영향
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
(2) 합병, 분할, 자산양수도, 영업양수도
최근 3사업연도 내 합병, 분할, 자산양수도, 영업양수도에 관한 사항은 다음과 같습니다.
- 프레스티지바이오로직스㈜ 사업결합
당사는 그룹 지배구조 형성 및 그룹사간 시너지 효과를 증대시키기 위하여 2022년 8월 26일 이사회 결의에 의거 2022년 9월 5일 프레스티지바이오로직스㈜을 제3자배정 유상증자 참여의 방법으로 지분취득하였습니다. 당사는 기업회계기준서 제 1103호 '사업결합'에 따라 취득법을 적용하여 연결회계 처리하였으므로 취득한 자산과 부채는 공정가치로 측정되었습니다.
(3) 자산유동화와 관련한 자산매각의 회계처리 및 우발채무 등에 관한 사항
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
(4) 기타 재무제표 이용에 유의하여야 할 사항
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
나. 대손충당금 설정현황
(1) 최근 3개년의 계정과목별 대손충당금 설정내역
| (단위: 천원) |
| 계정과목 | 제10기 3분기말 | 제9기말 | 제8기말 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 금액 | 충당금 | 설정률 | 금액 | 충당금 | 설정률 | 금액 | 충당금 | 설정률 | |
| 대여금 | 4,425,016 | 4,425,016 | 100.00% | 4,191,771 | 4,191,771 | 100.00% | 3,961,241 | 3,961,241 | 100.00% |
| 미수수익 | 3,674,351 | 1,943,947 | 52.91% | 3,652,815 | 1,841,480 | 50.41% | 3,840,476 | 1,740,207 | 54.04% |
| 합 계 | 8,099,367 | 6,368,963 | 78.64% | 7,844,586 | 6,033,251 | 76.91% | 7,801,717 | 5,701,448 | 79.39% |
(주1) 연결재무상태표상 대여금과 미수수익은 기타금융자산항목에 포함되어 충당금을 차감한 금액으로 반영되었습니다.
(2) 최근 3개년의 대손충당금 변동현황
| (단위: 천원) |
| 구 분 | 제10기 3분기말 | 제9기말 | 제8기말 |
|---|---|---|---|
| 1. 기초 대손충당금 잔액 (주1) | 6,368,963 | 6,033,251 | 74,767,759 |
| 2. 순대손처리액(①-②±③) | - | - | - |
| ① 대손처리액(상각채권액) | - | - | - |
| ② 상각채권회수액 | - | - | - |
| ③ 기타증감액 | - | - | - |
| 3. 대손상각비 계상(환입)액 | - | - | -66,966,042 |
| 4. 기말 대손충당금 잔액 | 6,368,963 | 6,033,251 | 7,801,717 |
(주1) 당사의 연결재무제표는 USD로 표기되며, 각 회계연도 기말환율 차이로 인해 원화로 표기 시 전기 기말 대손충당금 잔액과 차이가 있습니다. 또한, 전전기 중 당사의 종속회사로 편입된 프레스티지바이오로직스㈜ 대여금에 대해 대손충당금을 전액 환입하였습니다.
(3) 대손충당금 설정방침
당사의 대여금에 대한 손상 설정에 관하여, 당사의 제9기 사업보고서 Ⅲ. 재무에 관한 사항 3. 연결재무제표 주석 3. 중요한 회계추정 및 가정 을 참조하시기 바랍니다.
(4) 보고기간말 현재 경과기간별 매출채권 잔액 현황
당사의 대손충당금은 주된 영업활동으로 인하여 발생한 매출채권 또는 미수금이 아니므로, 해당 사항이 없습니다.
다. 재고자산 현황 등
(1) 최근 3개년의 사업부문별 재고자산 보유현황
| (단위: 천원) |
| 사 업 부 문 | 구 분 | 제10기 3분기 | 제9기 | 제8기 |
| 2025년 3월말 | 2024년 6월말 | 2023년 6월말 | ||
| 항체사업 | 제품 | 6,682,257 | 11,903,758 | 12,265 |
| 원재료 | 8,528,867 | 6,011,756 | 6,939,965 | |
| 저장품 | 219,701 | 187,485 | 193,797 | |
| 합 계 | 15,430,825 | 18,102,999 | 7,146,027 | |
| 총 자산 대비 재고자산 | 2.85% | 2.54% | 0.96% | |
| 구성비율(%) | ||||
| 재고자산회전율(회수) | 1.26 | - | - | |
| [연환산 매출원가÷ {(기초재고+기말재고)÷2}] |
||||
(2) 재고자산의 실사내용
① 실사일자
ㆍ실사는 매년 6월말 ~ 7월초 기준 외부감사인 입회하 연 1회 실시하며, 내부기준에 따라 자체적으로 매월 실사를 시행함.
ㆍ실사일과 재무상태표일 사이의 입출고 발생분은 입/출고지시서 등으로 확인함.
② 실사방법
ㆍ매월 재고실사는 중요 자산별 샘플링 실사를 수행하고 기말결산 실사는 전수조사로 수행함.
ㆍ외부감사인은 당사의 재고실사에 입회ㆍ확인하고 일부 항목에 대해 표본을 추출하여 그 실재성 및 완전성을 확인함.
라. 수주계약 현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
마. 공정가치 평가내역
(1) 금융상품
공정가치 평가방법 및 내역은 Ⅲ. 재무에 관한 사항- 3. 연결재무제표 주석- 4. 금융상품의 공정가치 항목을 참조하시기 바랍니다.
IV. 이사의 경영진단 및 분석의견
당사는 기업공시서식 작성기준에 따라 분/반기 보고서의 이사의 경영진단 및 분석의견은 기재를 생략하며, 해당내용은 사업보고서에 기재될 예정입니다.
V. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
가. 회계감사인의 명칭 및 감사의견
| 사업연도 | 구분 | 감사인 | 감사의견 | 의견변형사유 | 계속기업 관련 중요한 불확실성 |
강조사항 | 핵심감사사항 |
|---|---|---|---|---|---|---|---|
| 제10기 (당분기) |
감사보고서 | 삼덕회계법인 | - | - | 해당사항 없음 | 해당사항 없음 | - 해당사항 없음 |
| 연결감사 보고서 |
삼덕회계법인 | - | - | 해당사항 없음 | 해당사항 없음 | - 해당사항 없음 | |
| 제9기 (전기) |
감사보고서 | 삼덕회계법인 | 적정의견 | - | 해당사항 없음 | 해당사항 없음 | - 무형자산의 손상검사 - 특수관계자 대여금에 대한 기대신용손실 |
| 연결감사 보고서 |
삼덕회계법인 | 적정의견 | - | 해당사항 없음 | 해당사항 없음 | - 무형자산의 손상검사 | |
| 제8기 (전전기) |
감사보고서 | 삼덕회계법인 | 적정의견 | - | 해당사항 없음 | 해당사항 없음 | - 무형자산의 손상검사 - 특수관계자 대여금에 대한 기대신용손실 |
| 연결감사 보고서 |
삼덕회계법인 | 적정의견 | - | 해당사항 없음 | 해당사항 없음 | - 무형자산의 손상검사 |
주1) 제 10기 당분기 재무제표에 대한 검토가 수행되었으며 중요성 관점에서 공정하게 표시되지 않은 사항이 발견되지 않았습니다.
나. 감사용역 체결현황
| (단위 : 백만원, 시간) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제10기(당분기) | 삼덕회계법인 | 분·반기 재무제표 검토 별도 및 연결 재무제표에 대한 감사 내부회계관리제도에 대한 감사 |
410 | 3,320 | 240 | 2,135 |
| 제9기(전기) | 삼덕회계법인 | 분·반기 재무제표 검토 별도 및 연결 재무제표에 대한 감사 내부회계관리제도에 대한 감사 |
410 | 3,260 | 410 | 3,965 |
| 제8기(전전기) | 삼덕회계법인 | 분·반기 재무제표 검토 별도 및 연결 재무제표에 대한 감사 내부회계관리제도에 대한 감사 |
390 | 3,200 | 390 | 3,697 |
다. 회계감사인과의 비감사용역 계약체결 현황
당사는 최근 3사업연도 및 본 분기보고서 작성기준일까지의 기간 중 당사의 외부감사인과 비감사용역계약을 체결한 사실 및 감사인(공인회계사)이 당사의 사외이사 또는 고문 등 실직적인 임직원을 겸임한 사실이 없습니다.
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제10기(당분기) | - | - | - | - | - |
| - | - | - | - | - | |
| 제9기(전기) | - | - | - | - | - |
| - | - | - | - | - | |
| 제8기(전전기) | - | - | - | - | - |
| - | - | - | - | - |
라. 내부감사기구가 회계감사인과 논의한 결과
본 분기보고서의 작성기준일이 속하는 사업연도의 개시일부터 본 분기보고서 제출일까지 기간동안 내부감사기구가 회계감사인과 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 논의한 내역은 다음과 같습니다.
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2023.09.06 | -감사위원회: 위원 3인 -회계팀장 -외부감사인: 삼덕회계법인 |
화상회의 | 제8기 연결 및 별도 재무제표 핵심 감사사항 제8기 내부회계관리제도 감사보고 |
| 2 | 2023.11.27 | -감사위원회: 위원 5인 -회계팀장 -외부감사인: 삼덕회계법인 |
화상회의 | 제9기 1분기 연결 및 별도 재무제표 주요 검토사항 |
| 3 | 2024.02.21 | -감사위원회: 위원 5인 -회계팀장 -외부감사인: 삼덕회계법인 |
화상회의 | 제9기 반기 연결 및 별도 재무제표 주요 검토사항 |
| 4 | 2024.05.21 | -감사위원회: 위원 5인 -회계팀장 -외부감사인: 삼덕회계법인 |
화상회의 | 제9기 3분기 연결 및 별도 재무제표 주요 검토사항 |
| 5 | 2024.09.04 | -감사위원회: 위원 5인 -회계팀장 -외부감사인: 삼덕회계법인 |
화상회의 | 제9기 연결 및 별도 재무제표 핵심 감사사항 제9기 내부회계관리제도 감사보고 |
| 6 | 2024.11.22 | -감사위원회: 위원 5인 -회계팀장 -외부감사인: 삼덕회계법인 |
화상회의 | 제10기 1분기 연결 및 별도 재무제표 주요 검토사항 |
| 7 | 2025.02.19 | -감사위원회: 위원 5인 -회계팀장 -외부감사인: 삼덕회계법인 |
화상회의 | 제10기 반기 연결 및 별도 재무제표 주요 검토사항 |
2. 내부통제에 관한 사항
당사는 신뢰할 수 있는 회계 정보 작성 및 공시를 위하여 회계의 부정과 오류를 예방하고 적시에 발견할 수 있도록 내부회계관리규정을 제정하여 실시하고 있습니다.
가. 경영진의 내부회계관리제도 효과성 평가 결과
| 사업연도 | 구분 | 운영실태 보고서 보고일자 |
평가 결론 | 중요한 취약점 |
시정조치 계획 등 |
|---|---|---|---|---|---|
| 제10기 (당분기) |
내부회계 관리제도 |
- | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제9기 (전기) |
내부회계 관리제도 |
2024.09.04 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제8기 (전전기) |
내부회계 관리제도 |
2023.08.14 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
- | - | - | - |
주1) 내부회계관리제도 효과성 평가 결과는 당분기에는 운영평가 대상이 아니므로 평가 결과를 표시하지 않습니다.
나. 감사위원회의 내부회계관리제도 효과성 평가 결과
| 사업연도 | 구분 | 평가보고서 보고일자 |
평가 결론 | 중요한 취약점 |
시정조치 계획 등 |
|---|---|---|---|---|---|
| 제10기 (당분기) |
내부회계 관리제도 |
- | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제9기 (전기) |
내부회계 관리제도 |
2024.09.12 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제8기 (전전기) |
내부회계 관리제도 |
2023.09.06 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | - | - |
| 연결내부회계 관리제도 |
- | - | - | - |
주1) 내부회계관리제도 효과성 평가 결과는 당분기에는 운영평가 대상이 아니므로 평가 결과를 표시하지 않습니다.
다. 감사인의 내부회계관리제도 감사의견
| 사업연도 | 구분 | 감사인 | 유형 (감사/검토) |
감사의견 또는 검토결론 |
지적사항 | 회사의 대응조치 |
|---|---|---|---|---|---|---|
| 제10기 (당분기) |
내부회계 관리제도 |
삼덕회계법인 | - | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | - | |
| 제9기 (전기) |
내부회계 관리제도 |
삼덕회계법인 | 감사 | 적정의견 | 해당사항없음 | - |
| 연결내부회계 관리제도 |
- | - | - | - | - | |
| 제8기 (전전기) |
내부회계 관리제도 |
삼덕회계법인 | 감사 | 적정의견 | 해당사항없음 | - |
| 연결내부회계 관리제도 |
- | - | - | - | - |
주1) 내부회계관리제도 효과성 평가 결과는 당분기에는 운영평가 대상이 아니므로 평가 결과를 표시하지 않습니다.
라. 내부회계관리·운영조직 인력 및 공인회계사 보유현황
| 소속기관 또는 부서 |
총 원 | 내부회계담당인력의 공인회계사 자격증 보유비율 |
내부회계담당 인력의 평균경력월수 |
||
|---|---|---|---|---|---|
| 내부회계 담당인력수(A) |
공인회계사자격증 소지자수(B) |
비율 (B/A*100) |
|||
| 감사위원회 | 5 | 5 | 1 | 20 | 51 |
| 이사회 | 9 | 5 | 1 | 20 | 51 |
| 회계처리부서 | 8 | 3 | 2 | 67 | 77 |
마. 회계담당자의 경력 및 교육실적
| 직책 (직위) |
성명 | 회계담당자 등록여부 |
경력 (단위:년, 개월) |
교육실적 (단위:시간) |
||
|---|---|---|---|---|---|---|
| 근무연수 | 회계관련경력 | 당기 | 누적 | |||
| 내부회계운영자 | Poh Hoi Chin | - | 1 | 5년 3개월 | - | - |
| 회계팀장 | Mei Ji Liew | - | 1 | 12년 3개월 | - | - |
VI. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 9 | 5 | - | - | 1 |
나. 중요의결사항
| 회차 | 개최 일자 |
의 안 내 용 | 가결 여부 |
이사의 성명 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 박소연 (출석률: 100%) |
Michael Jinwoo Kim (출석 률: 100%) |
방규호 (출석률: 100%) |
이의경 (출석률: 100%) |
전경희 (출석률: 100%) |
Kok Fatt Lee (출석률: 100%) |
Ong Kang Lin (출석률: 100%) |
Tan (출석률: |
Tan Ting Yong (출석률: |
Lai Wat Tay (출석률: 100%) |
오승주 (출석률: 100%) |
||||
| 1차 | '22.08.12 | 1. 제7기 회계연도의 '내부회계관리제도' 설계 및 운영 실태 보고 2. 제7기 K-IFRS '감사전' 연결/별도 재무제표 승인 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
NA NA |
NA NA |
NA NA |
NA NA |
- 찬성 |
- 찬성 |
| 2차 | '22.08.26 | 1. 내부거래위원회 추천 안건인 프레스티지바이오로직스(주)의 제3자 배정 유상증자(13,787,830주) 참여 승인 2. 제7기 K-IFRS '감사전' 연결재무제표와 주석 승인 3. 감사위원회 추천 안건인 제8기 외부 감사인 선임안 검토 및 주주총회 의안 상정 승인 |
가결 가결 가결 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
NA NA NA |
NA NA NA |
NA NA NA |
NA NA NA |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
| 3차 | '22.09.07 | 1. 제7기 회계연도의 '내부회계관리제도'에 대한 감사위원회의 평가 보고 2. 제7기 K-IFRS 연결/별도 재무제표 감사 보고서 승인 3. 보상위원회 추천 제8기 사내이사 및 사외이사 보수 한도의 주주총회 의안 상정 승인 4. 이사 4인(이의경, 전경희, Lee Kok Fatt, 오승주) 재선임에 대한 주주총회 의안 상정 승인 5. 주주총회 소집 결의 및 상정 의안 승인 |
- 가결 가결 가결 가결 |
- 찬성 찬성 찬성 찬성 |
- 찬성 찬성 찬성 찬성 |
- 찬성 찬성 찬성 찬성 |
- 찬성 찬성 찬성 찬성 |
- 찬성 찬성 찬성 찬성 |
NA NA NA NA NA |
NA NA NA NA NA |
NA NA NA NA NA |
NA NA NA NA NA |
- 찬성 찬성 찬성 찬성 |
- 찬성 찬성 찬성 찬성 |
| 4차 | '22.09.20 | 1. 제7기 K-IFRS 수정 연결/별도 재무제표 승인 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | NA | NA | NA | NA | 찬성 | 찬성 |
| 5차 | '22.09.28 | 1. 제7기 K-IFRS 연결/별도재무제표 감사 보고서에 대한 이사회 보고서의 승인 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | NA | NA | NA | NA | 찬성 | 찬성 |
| 6차 | '22.11.25 | 1. 제8기 1분기 K-IFRS 연결/별도 재무제표 검토 보고서 승인 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | NA | NA | NA | NA | 불참 | 찬성 |
| 7차 | '23.01.19 | 1.프레스티지바이오파마와 프레스티지바이오로직스 간의 백신 CDMO 계약 개정안 승인 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | NA | NA | NA | NA | 찬성 | 찬성 |
| 8차 | '23.02.22 | 1. 사내이사 김 마이클 진우 CFO와 ICFR Officer 임명보고 2. 자회사 Prestige Biopharma USA Inc 청산보고 3. 제8기 반기 K-IFRS 연결/별도 재무제표 검토 보고서 승인 |
- - 가결 |
- - 찬성 |
- - 찬성 |
- - 찬성 |
- - 찬성 |
- - 찬성 |
NA NA NA |
NA NA NA |
NA NA NA |
NA NA NA |
- - 찬성 |
- - 찬성 |
| 9차 | '23.05.25 | 1. 제8기 3분기 K-IFRS 연결/별도 재무제표 검토 보고서 승인 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | 찬성 | NA | NA | NA | NA | 찬성 | 찬성 |
| 10차 | '23.07.19 | 1. Prestige Biopharma 와 Prestige Biologics Co., Ltd (PBL) 간의 2021년 12월 28일 Loan 계약의 수정 내용의 검토와 승인의 건 | 가결 | 찬성 | 찬성 | 찬성 | 반대 | 찬성 | NA | NA | NA | NA | 찬성 | 반대 |
| 11차 | '23.08.14 | 1. 제8기 회계연도의 '내부회계관리제도' 설계 및 운영 실태 보고 2. 제8기 K-IFRS '감사전' 연결/별도 재무제표 승인 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
NA NA |
NA NA |
NA NA |
NA NA |
- 찬성 |
- 찬성 |
| 12차 | '23.09.11 | 1. 제8기 회계연도의 '내부회계관리제도'에 대한 감사위원회의 평가 보고 2. 제8기 K-IFRS 연결/별도 재무제표 감사 보고서 승인 3. 주주총회 소집 결의 및 상정 의안 승인 4. 이사회 내 위원회의 위원 재구성(안) 검토 |
- 가결 가결 - |
- 찬성 찬성 - |
- 찬성 찬성 - |
- 찬성 찬성 - |
- 찬성 찬성 - |
- 찬성 찬성 - |
NA NA NA NA |
NA NA NA NA |
NA NA NA NA |
NA NA NA NA |
- 찬성 찬성 - |
- 찬성 찬성 - |
| 13차 | '23.10.04 | 1. 이사회 내 위원회의 위원 재구성(안) 승인의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | 불참 | 찬성 | NA | NA | 찬성 | 찬성 |
| 14차 | '23.11.27 | 1. 감사위원회의 권고에 의거하여, 제9기 1분기 검토된 연결/별도 재무제표 검토 및 승인 2. 종속회사 설립에 대한 검토 및 승인 3. 이사 사임에 관한 보고 |
가결 가결 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
NA NA NA |
NA NA NA |
찬성 찬성 - |
찬성 찬성 - |
| 15차 | '24.02.27 | 1.제9기 반기 검토된 연결/별도 재무제표 보고 및 승인 2. 내부거래위원회 규정 개정안의 검토 및 승인 3. 프레스티지바이오파마아이디씨 주식회사의 R&D 건설현황, 현금운용 현황 및 주요 파이프라인 개발 현황 보고 |
가결 가결 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
NA NA NA |
NA NA NA |
NA NA NA |
찬성 찬성 - |
| 16차 | '24.05.24 | 1. 제9기 3분기 검토된 연결/별도 재무제표 보고 및 승인 2. 한국 산업자원부 현금지원 협약에 따른 프레스티지바이오파마아이디씨 주식회사의 투자금액 (USD 90 Million, 2021년 12월 17일 이사회 승인) 중 잔여 투자 (USD 45 Million)에 대한 공모자금 외 투자재원 마련을 위한 싱가포르 소재 은행으로부터 USD 45 Million 차입 승인 3. IBK 기업은행 계좌 해지 보고 4. 프레스티지바이오파마 추정현금흐름 보고 5. 프레스티지바이오파마아이디씨 주식회사의 R&D 건설현황, 현금운용 현황, 프레스티지바이오파마 주요 파이프라인 개발 현황 및 프레스티지바이오로직스 CMO 사업 전망 보고 |
가결 가결 - - - |
찬성 찬성 - - - |
찬성 찬성 - - - |
찬성 찬성 - - - |
찬성 찬성 - - - |
찬성 찬성 - - - |
찬성 찬성 - - - |
찬성 찬성 - - - |
NA NA NA NA NA |
NA NA NA NA NA |
NA NA NA NA NA |
찬성 찬성 - - - |
| 17차 | '24.07.17 | 1. 프레스티지바이오로직스(주) 대출 이자의 대여금 전환 제안 검토 및 승인 | 가결 | 찬성 | 불참 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | NA | NA | NA | 찬성 |
| 18차 | '24.08.14 | 1. 제9기 회계연도의 '내부회계관리제도' 설계 및 운영 실태 보고 2. 제9기 K-IFRS '감사전' 연결/별도 재무제표 승인 3. 투자자금 차입 및 IDC 투자 결과보고 4. 투즈뉴(Tuznue)의 품목승인 등 파이프라인 현황 보고 5. Biolexis (구, Stelis) & ENSO 소송 현황 보고 6. 종속회사 PBPUS (가칭) 설립 현황 보고 7. 프레스티지바이오파마 사무실 주소 변경 보고 |
- 가결 - - - - - |
- 찬성 - - - - - |
- 찬성 - - - - - |
- 찬성 - - - - - |
- 불참 - - - - - |
- 찬성 - - - - - |
- 찬성 - - - - - |
- 찬성 - - - - - |
NA NA NA NA NA NA NA |
NA NA NA NA NA NA NA |
NA NA NA NA NA NA NA |
- 찬성 - - - - - |
| 19차 | '24.09.12 |
1. 감사위원회의 FY2024 내부회계관리제도 운영평가 보고의 건 |
- - 가결 가결 가결 가결 |
- - 찬성 찬성 찬성 찬성 |
- - 찬성 찬성 찬성 찬성 |
- - 찬성 찬성 찬성 찬성 |
- - 찬성 찬성 찬성 찬성 |
- - 찬성 찬성 찬성 찬성 |
- - 찬성 찬성 찬성 찬성 |
- - 찬성 찬성 찬성 찬성 |
NA NA NA NA NA NA |
NA NA NA NA NA NA |
NA NA NA NA NA NA |
- - 찬성 찬성 찬성 찬성 |
| 20차 | '24.11.27 | 1. 감사위원회의 권고에 의거하여, 제10기 1분기 검토된 연결/별도 재무제표 검토 및 승인 2. 산업통상자원부와의 협약에 따른 프레스티지바이오파마아이디씨에 대한 투자 완료를 위하여, 2024년 11월 26일 USD 8 Million 추가 차입 실행 보고(2024년 5월 24일 이사회 승인) 3. Biolexis (구, Stelis) & ENSO 소송 현황 보고 |
가결 - - |
찬성 - - |
찬성 - - |
찬성 - - |
찬성 - - |
찬성 - - |
찬성 - - |
찬성 - - |
찬성 - - |
찬성 - - |
NA NA NA |
NA NA NA |
| 21차 | '25.02.26 | 1. 감사위원회의 권고에 의거하여, 제10기 반기 검토된 연결/별도 재무제표 검토 및 승인 2. 김 마이클 진우의 프레스티지바이오로직스 이사 선임안 승인 3. 파이프라인 현황 보고 |
가결 가결 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
찬성 찬성 - |
NA NA NA |
NA NA NA |
다. 이사회 내 위원회
(1) 이사회 내 위원회 구성현황
|
위원회명 |
구성 |
소속 이사명 |
설치목적 및 권한사항 |
비 고 |
|---|---|---|---|---|
| 내부거래위원회 | 사외이사 3명 | 이의경, 방규호, LEE KOK FATT | 경영 활동상 의사결정 및 집행에 있어 투명성을 높이기 위함 | - |
| 보상위원회 | 사외이사 3명 | 방규호, ONG KANG LIN, LEE KOK FATT | 회사의 내부통제 강화 및 소액주주 권리 보호 | - |
주1) 감사위원회와 사외이사후보 추천위원회는 기업공시서식 작성기준에 따라 제외하였습니다.
(내부거래위원회)
- 설치목적: 공정거래 자율준수 체제 구축을 통해 회사 경영의 투명성 제고
- 권한사항
ㆍ회사가 직접 또는 자회사를 통해 주주 및 계열사와의 이하의 거래에 참여하고자 하는 경우 (내부통제규정에 의해 금지되는 거래는 제외) 회사는 내부거래위원회 의 승인을 받아야 함
(보상위원회)
- 설치목적: 이사보수 결정과정의 객관성, 투명성 확보를 제고하기 위함
- 권한사항
ㆍ주주총회에 제출할 등기이사 보수의 한도
ㆍ등기이사에 대한 보상체계
ㆍ기타 이사회에서 위임한 사항
(2) 이사회 내 위원회 활동내역
(가) 보상위원회
| 개최일자 | 의안내용 | 가결여부 | 이의경 | 전경희 | LEE KOK FATT | Ong Kang Lin | 방규호 |
|---|---|---|---|---|---|---|---|
| 2022.09.06 | - 사내이사 보수 금액 검토 및 이사회 상정 - 사외이사 보수 금액 검토 및 이사회 상정 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
NA NA |
NA NA |
| 2023.09.06 | - 사내이사 보수 금액 검토 및 이사회 상정 - 사외이사 보수 금액 검토 및 이사회 상정 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
NA NA |
NA NA |
| 2024.09.04 | - 사내이사 보수 금액 검토 및 이사회 상정 - 사외이사 보수 금액 검토 및 이사회 상정 |
가결 가결 |
NA NA |
NA NA |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
(나) 내부거래위원회
| 개최일자 | 의안내용 | 가결여부 | 이의경 | 전경희 | LEE KOK FATT | 방규호 |
|---|---|---|---|---|---|---|
| 2022.08.26 | - 프레스티지바이오로직스(주)의 제3자 배정 유상증자 (13,787,830주) 참여 검토 및 해당안 이사회에 권고 결정 |
가결 | 찬성 | 찬성 | 찬성 | NA |
| 2022.10.07 | - 가격 경쟁력이 우수한 PBL과 PBP1510 200L 배치 2개를 임상 시험용으로 제조하는 계약 체결을 승인하기로 함 |
가결 |
찬성 |
찬성 |
찬성 |
NA |
| 2023.01.19 | -프레스티지바이오로직스와의 백신 CDMO 계약 개정안의 이사회 상정 승인 |
가결 |
찬성 |
찬성 |
찬성 |
NA |
| 2023.03.06 | - 프레스티지바이오로직스와의 PBP1601 및 PBP1602의 마스터세포은행과 제조용세포은행 개발용역 승인 -프레스티지바이오로직스의 공동개발계약에 따른 HD201과 HD204 임상개발비용 청구 승인 |
가결 |
찬성 |
찬성 찬성 |
찬성 찬성 |
NA NA |
| 2023.04.06 | - 프레스티지바이오로직스와의 HD204 및 PBP1502 임상용 임가공 용역 승인 |
가결 |
찬성 |
찬성 |
찬성 |
NA |
| 2023.06.27 | - 프레스티지바이오로직스에 대한 대여금 수정계약안 이사회 상정 승인 |
가결 |
찬성 |
찬성 |
찬성 |
NA |
| 2023.08.17 | - 프레스티지바이오로직스와의 Master Service Agreement (MSA) 승인 | 가결 | 찬성 | 찬성 | 찬성 | NA |
| 2024.01.07 | - 프레스티지바이오로직스와 협력하여 완제의약품을 자체 생산하는 내용과 완제 의약품 배치 생산 비용에 대한 표준가격 내용 승인 - 프레스티지바이오로직스와 협력하여 내부적으로 QC 분석 테스트를 수행하도록 진행 승인 - 그룹 포괄업무 지원 약정서 승인 |
가결 |
찬성 |
NA NA NA |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
| 2024.07.03 | - 프레스티지바이오로직스(주) 대출 이자의 대여금 전환 제안 | 가결 | 찬성 | NA | 찬성 | 찬성 |
| 2024.08.20 | - 임상 시험에 필요한 PBP1510의 원료의약품 제조를 위해 프레스티지바이오로직스와의 계약 체결을 승인하기로 함 | 가결 | 찬성 | NA | 찬성 | 찬성 |
| 2024.09.04 | - 프레스티지바이오아이디씨와 프레스티지바이오로직스 간의 백신 생산장비 자산 양수도에 대하여 이사회에 승인 권고결정 -프레스티지바이오로직스(주)의 제3자 배정 유상증자 (15,916,168주) 참여 검토 및 해당안 이사회에 권고 결정 |
가결 가결 |
찬성 찬성 |
NA NA |
찬성 찬성 |
찬성 찬성 |
| 2024.09.12 | - HD201의 원료의약품 3개의 PPQ 배치 제조를 위해 프레스티지바이오와의 계약 진행을 승인 | 가결 | 찬성 | NA | 찬성 | 찬성 |
| 2024.11.22 | - Prestige BioPharma Belgium BVBA 운영자금 대출한도 증액 승인 |
가결 | 찬성 | NA | 찬성 | 찬성 |
| 2024.12.02 | - HD201의 원료의약품 16배치에 대한 프레스티지바이오로직스와의 생산 계약 권고안 승인 | 가결 | 찬성 | NA | 찬성 | 찬성 |
라. 이사의 독립성
(1) 이사회 구성원의 독립성
이사는 주주총회에서 선임하며, 주주총회에서 선임할 이사 후보자는 이사회에서 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다. 이사의 선임과 관련하여 관련 법규에 의거한 주주제안이 있는 경우, 이사회는 적법한 범위 내에서 이를 주주총회에 의안으로 제출하고 있습니다. 상기와 같은 절차에 따라 선임된 당사의 이사는 최대주주 또는 주요주주와의 관계에 있어서 독립적입니다.
(2) 사외이사후보 추천위원회
당사는 주주총회에 사외이사후보를 추천하기 위한 사외이사후보 추천위원회를 설치하여 운영 중입니다.
(가) 사외이사후보추천위원회 구성 현황
| 구 성 | 소속 이사명 | 주요 역할 |
|---|---|---|
|
사외이사 3명 |
이의경, 방규호, ONG KANG LIN |
사외이사후보의 독립성, 다양성, 역량 등을 검증하여 추천 |
(나) 사외이사후보추천위원회 활동 내역
| 개최일자 | 의안내용 | 가결여부 | 전경희 | LEE KOK FATT | 이의경 | 방규호 | ONG KANG LIN |
|---|---|---|---|---|---|---|---|
| 2022.09.06 | - 사외이사의 독립성 검토 - 등기이사 4인의 재선임안 이사회 상정 |
가결 | 찬성 | 찬성 | 찬성 | NA | NA |
| 2023.09.06 | - 사외이사의 독립성 검토 - 사외이사 2인의 선임안 이사회 상정 |
가결 | 찬성 | 찬성 | 찬성 | NA | NA |
| 2024.09.04 | -추천 이사 이력 검토 -사내이사 2인 재선임안 이사회 상정 -사내이사 1인 및 비상무이사1인의 선임안 이사회상정 |
가결 | NA | NA | 찬성 | 찬성 | 찬성 |
마. 사외이사의 전문성
(1) 사외이사 지원 조직 현황
회사 내 지원조직은 사외이사가 이사회 및 이사회내 위원회에서 전문적인 직무수행이 가능하도록 보조하고 있습니다. 이사회 및 위원회 개최 전에 해당 안건 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고 필요시 별도의 설명회를 개최하고 있으며, 기타 사내 주요현안에 대해서도 수시로 정보를 제공하고 있습니다.
| 부서(팀)명 | 직원수 | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 재무팀 | 3 명 | 실장 1명, 매니저 2명 (평균근속연수: 2년 2개월) |
·주주총회, 이사회, 위원회 운영 ·각 이사에게 의결을 위한 정보 제공 ·회의 진행을 위한 실무 지원 ·이사회 및 위원회의 회의내용 기록 |
| Presidential Office | 1 명 | 매니저 1명 (근속연수: 5년 1개월) |
바. 사외이사 교육실시 현황
| 교육일자 | 교육실시주체 | 참석 사외이사 | 불참시 사유 | 주요 교육내용 |
|---|---|---|---|---|
| 2022.10.14 | 한국상장회사협의회 | 전원 | - | 2022 내부회계관리제도 모범규준 해설 온라인 설명회 |
| 2022.12.06 | 안진회계법인 동영상 교육 | 전원 | - | 연결 내부회계관리제도 동영상 교육 |
| 2023.05.09 | PWC Korea 동영상 교육 | 전원 | - | ESG 2.0 탄소관리와 공시 고도화 |
| 2023.07.06 | PWC Korea | 전원 | - | 내부회계관리제도 미래전략 |
| 2023.12.05 | 한국상장회사 협의회 및 딜로이트 안진 |
전원 | - | 연결 기준 내부회계관리제도 |
| 2024.06.14 | PWC Korea | 전원 | - | 내부회계관리제도 |
| 2024.12.09 | PWC Korea 동영상 교육 | 전원 | - | 2024 내부회계관리제도 |
2. 감사제도에 관한 사항
가. 감사위원회 위원의 인적사항 및 사외이사 여부
당사의 감사위원회는 3인의 사외이사로 구성되어 있으며, 근거 법령에서 규정하는 조건을 충족하고 있습니다. 본 분기보고서 작성기준일 현재 당사의 감사위원회 현황은 다음과 같습니다.
| 성명 | 사외이사 여부 |
경력 | 회계ㆍ재무전문가 관련 | ||
|---|---|---|---|---|---|
| 해당 여부 | 전문가 유형 | 관련 경력 | |||
| 이의경 | 예 |
('20.04~현재) Prestige Biopharma Limited 사외이사 ('95.09~현재) 대진대학교 경영학과 교수 ('14.01~'16.12) 대진대학교 사회과학대학장 ('05.01~'05.12) 한국재무관리학회 편집위원 및 상임이사 ('02.08~'03.06) University of Illinois at Urbana Champaign 연구교수 ('98.07~'98.09) 공인회계사 시험위원 ('94.03~'95.08) 전주대학교 회계학과 교수 ('87.09~'94.02) 삼일회계법인 등 (공인회계사) ('93) 서울대학교 대학원 경영학 박사 ('89) 서울대학교 대학원 경영학 석사 ('83) 성균관대학교 경영학과 졸업 |
예 | 교수 및 재무 전문가 |
대진대학교 경영학과 교수 |
| 전경희 | 예 |
('20.04~현재) Prestige Biopharma Limited 사외이사 ('00.10~현재) 법무법인 대륙아주 변호사 ('11.01~현재) 재단법인 수림문화재단 이사 ('09.06~현재) 대한상사중재원 중재인 ('17.09~현재) 법조윤리협의회 특별위원회 전문위원 ('13.02~'17.02) 대한변호사협회 비상임이사 ('12.12~'13.12) 방송통신위원회 시청자권익위원회 위원 ('11.03~'13.02) 대한변호사회 조사위원회위원 ('10.06~'14.01) 서울중앙지방법원 조정위원 ('09.02~'09.09) 국무총리행정심판위원회 비상임위원 ('03.09~'04.06) Havard Law School 동아시아법 연구소 객원 연구원 ('98.05~'00.01) 아람 법무법인 변호사 ('98) 제27기 사법연수원 ('95) 제37회 사법고시 ('94) 한양대학교 법학과 졸업 |
예 | 변호사 | 법무법인 대륙아주 변호사 |
| Lee Kok Fatt |
예 |
('20.04~현재) Prestige Biopharma Limited 사외이사 ('20.01~현재) Chandler's Institute of Governance, Chairman ('19.02~'19.11) United Overseas Bank 이사 ('17.02~'19.01) Future-Moves Group 이사 ('12.01~'16.04) Council of Presidential Advisers (대통령 자문위원) ('11.05~'12.03) Civil Service College 연구원 ('07.08~'11.05) Ministry of Finance (Singapore) Director ('06.08~'07.07) London Business School, Fellowship ('04.08~'06.08) Ministry of Finance (Singapore) Director ('00.01~'02.08) Singapore Customs (싱가포르 관세청) Assistant Director |
예 | 경영 전문가 |
Ministry of Finance (Singapore) Director |
| 방규호 | 예 |
('23.09~현재) Prestige Biopharma Limited 사외이사 ('18.03~현재) 경상국립대학교 제약공학과 교수 ('14.10~'17.10) 오송첨단의료산업진흥재단 바이오의약생산 센터장 ('00) 충남대학교 대학원 미생물학 박사 |
예 | 교수 | 경상국립 대학교 제약공학과 교수 |
| Ong Kang Lin |
예 | ('23.09~현재) Prestige Biopharma Limited 사외이사 ('24.08~현재) ClavystBio Pte. Ltd. 재무이사 ('24.10~현재) Clavystbio Investments Pte. Ltd. 이사 ('24.10~현재) Clavystbio Investments L Pte. Ltd. 이사 ('22.05~'23.05) DOCQUITY 재무이사 ('15~'18) SIS ASSET MANAGEMENT CEO ('08) THE WHARTON SCHOOL, UNIVERSITY OF PENNSYLVANIA 학사 |
예 | 경영 전문가 |
Group CFO |
나. 감사위원회 위원의 독립성
감사위원회 제도의 투명성과 독립성을 확보하기 위하여 상법에서는 위원의 선임과 구성에 대하여 엄격히 규정하고 있습니다. 감사위원회는 주주총회에서 선임된 이사 중에서 위원을 선임하여야 하고, 3명 이상의 이사로 구성되어야 하며, 사외이사가 위원의 3분의 2 이상이 되어야 합니다. 당사는 이 기준을 충족하고 있습니다.
참고로 당사 이사회는 감사위원 후보 선정 시 그 후보로 독립성이 확보된 사외이사로만 선정을 하고 있으며, 그 중 최소 1명은 회계/재무 전문가로 선임될 수 있도록 고려하고 있습니다. 또한, 감사위원회 위원과 당사와의 거래내역은 없습니다.
|
선출기준의 주요내용 |
선출기준의 당사 충족여부 |
관련법령 |
|---|---|---|
|
- 3명 이상의 이사로 구성 |
- 충족 (5명) |
상법 제415조의2 제2항 |
|
- 사외이사가 위원의 3분의2 이상 |
- 충족 (전원 사외이사) |
|
|
- 위원 중 1명 이상의 회계 또는 재무전문가 |
- 충족 (이의경 사외이사) |
상법 제542조의11 제2항 |
|
- 감사위원회의 대표는 사외이사 |
- 충족 (이의경 사외이사) |
|
|
- 그밖의 결격요건(최대주주의 특수관계자 등) |
- 충족 (해당사항없음) |
상법 제542조의11 제3항 |
다. 감사위원회의 활동
공시대상기간 중 감사위원회의 주요 활동은 다음과 같습니다.
| 개최일자 | 의안내용 | 가결 여부 |
이의경 | 전경희 | LEE KOK FATT |
방규호 | ONG KANG LIN |
|---|---|---|---|---|---|---|---|
| 2022.08.02 | 국제 제재 관련 조언 제공을 위한 로펌 임명 | 가결 | 찬성 | 찬성 | 찬성 | NA | NA |
| 2022.08.12 | 제7기 내부회계관리제도 운영실태에 대한 내부회계관리자로부터의 보고 제7기 감사전 별도 및 연결 재무제표(공시용) 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
NA NA |
NA NA |
| 2022.08.26 | 제7기 K-IFRS '감사전' 연결재무제표와 주석 검토 및 이사회 상정 제8기 외부 감사인 선임 관련 제안서 검토 및 이사회 상정 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
NA NA |
NA NA |
| 2022.09.06 | 제7기 외부감사인의 연결 및 별도 재무제표 감사업무 커뮤니케이션 제7기 내부회계관리제도 설계 및 운영에 대한 외부감사인과 커뮤니케이션 제7기 감사받은 연결 및 별도 재무제표의 검토 및 이사회 상정 |
- - 가결 |
- - 찬성 |
- - 찬성 |
- - 미참석 |
NA NA NA |
NA NA NA |
| 2022.09.07 | 제7기 회계연도의 '내부회계관리제도'에 대한 평가 이사회 보고 | - | - | - | - | NA | NA |
| 2022.09.28 | 제7기 회계연도의 '내부회계관리제도'에 대한 평가 주주총회 보고 | - | - | - | - | NA | NA |
| 2022.11.22 | 제8기 1분기 외부감사인의 연결 및 별도 재무제표 검토업무 커뮤니케이션 제8기 1분기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
NA NA |
NA NA |
| 2023.02.15 | 제8기 반기 외부감사인의 연결 및 별도 재무제표 검토업무 커뮤니케이션 제8기 반기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
NA NA |
NA NA |
| 2023.05.19 | 제8기 3분기 외부감사인의 연결 및 별도 재무제표 검토업무 커뮤니케이션 제8기 3분기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
NA NA |
NA NA |
| 2023.08.14 | 제8기 내부회계관리제도에 대한 외부 회계법인으로부터의 결과보고 제8기 내부회계관리제도 운영실태에 대한 내부회계관리자로부터의 보고 제8기 감사전 별도 및 연결 재무제표(공시용) 검토 및 이사회 상정 |
- - 가결 |
- - 찬성 |
- - 찬성 |
- - 찬성 |
NA NA NA |
NA NA NA |
| 2023.09.06 | 제8기 외부감사인의 연결 및 별도 재무제표 감사업무 커뮤니케이션 제8기 내부회계관리제도 설계 및 운영에 대한 외부감사인과 커뮤니케이션 제8기 감사받은 연결 및 별도 재무제표의 검토 및 이사회 상정 제9기 외부감사인 선임 관련 외부감사인의 제안 검토 및 이사회 상정 제8기 당사의 리스크 관리대장 보고 |
- - 가결 가결 - |
- - 찬성 찬성 - |
- - 찬성 찬성 - |
- - 찬성 찬성 - |
NA NA NA NA NA |
NA NA NA NA NA |
| 2023.11.17 | 제9기 1분기 연결 및 별도 재무제표에 대한 외부감사인의 보고 제9기 1분기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
| 2024.02.21 | 제9기 반기 연결 및 별도 재무제표에 대한 외부감사인의 보고 제9기 반기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
| 2024.05.21 | 제9기 3분기 연결 및 별도 재무제표에 대한 외부감사인의 보고 제9기 3분기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
| 2024.09.04 | 제9기 외부감사인의 연결 및 별도 재무제표 감사업무 커뮤니케이션 제9기 내부회계관리제도 설계 및 운영에 대한 외부감사인과 커뮤니케이션 제9기 감사받은 연결 및 별도 재무제표의 검토 및 이사회 상정 제10기 외부감사인 선임 관련 외부감사인의 제안 검토 및 이사회 상정 제9기 당사의 리스크 관리대장 보고 |
- - 가결 가결 - |
- - 찬성 찬성 - |
- - 찬성 찬성 - |
- - 찬성 찬성 - |
- - 찬성 찬성 - |
- - 찬성 찬성 - |
| 2024.11.22 | 제10기 1분기 연결 및 별도 재무제표에 대한 외부감사인의 보고 제10기 1분기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
| 2025.02.19 | 제10기 반기 연결 및 별도 재무제표에 대한 외부감사인의 보고 제10기 반기 검토받은 연결 및 별도 재무제표 검토 및 이사회 상정 |
- 가결 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
- 찬성 |
라. 교육 실시 계획
| 교육일자 | 교육실시주체 | 주요 교육내용 |
|---|---|---|
| 2023.07 | PWC코리아 | 내부회계관리제도 미래전략 |
| 2023.12 | 한국상장회사협의회 및 딜로이트 안진 | 연결 기준 내부회계관리제도 |
| 2024.06 | PWC코리아 | 내부회계관리제도 |
| 2024.11 | PWC코리아 | 내부회계관리제도 미래전략 |
| 2025.05 | PWC코리아 | 연결 기준 내부회계관리제도 |
| 2025.11 | 금융감독원 | 제약바이오 보고서 주의사항 |
주1) 당사는 주요 사업이나 회계 정책에 주요한 업데이트 등에 대한 교육을 필요시 사외이사 대상으로 수립하고 시행할 예정입니다.
마. 감사위원회 교육실시 현황
| 교육일자 | 교육실시주체 | 참석 감사위원 | 불참시 사유 | 주요 교육내용 |
|---|---|---|---|---|
| 2022.10.14 | 한국상장사협의회 | 전원 | - | 2022 내부회계관리제도 모범규준 해설 온라인 설명회 |
| 2022.12.06 | 안진회계법인 | 전원 | - | 연결 내부회계관리제도 동영상 교육 |
| 2023.05.09 | PWC Korea | 전원 | - | ESG 2.0 탄소관리와 공시 고도화 |
| 2023.07.06 | PWC Korea | 전원 | - | 내부회계관리제도 미래전략 |
| 2023.12.05 | 한국상장회사협의회 및 딜로이트 안진 | 전원 | - | 연결 기준 내부회계관리제도 |
| 2024.06.14 | PWC Korea | 전원 | - | 내부회계관리제도 |
| 2024.12.09 | PWC Korea 동영상 교육 | 전원 | - | 2024 내부회계관리제도 |
바. 감사위원회 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 재무팀 | 3 | 실장 1명, 매니저 2명 (평균근속연수: 2년 2개월) |
감사위원회 운영 지원 |
| Presidential Office | 1 | 매니저 1명 (근속연수: 5년 1개월) |
감사위원회 운영 지원 |
사. 준법지원인 등 지원조직 현황
당사는 본 분기보고서 작성기준일 현재 해당사항이 없습니다.
3. 주주총회 등에 관한 사항
가. 투표제도 현황
| (기준일 : | 2025년 03월 31일 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 미도입 |
| 실시여부 | - | - | - |
주1) 당사는 싱가포르법에 따라 설립된 기업으로서, 한국 상법에 따른 분류인 상기 투표제도는 해당사항이 없습니다. 다만, 정기 주주총회시에는 한국예탁결제원을 통해 '의결권 행사 신청서'가 첨부된 주주총회 소집통지서를 주주들에게 발송해 주주가 해당 신청서를 한국예탁결제원에 제출함으로써 의결권을 행사할 수 있도록 했습니다.
나. 소수주주권
당사는 설립 이후 본 분기보고서 작성기준일 현재까지 소수주주권의 행사 사실이 존재하지 않습니다.
다. 경영권 경쟁
당사는 설립 이후 본 분기보고서 작성기준일 현재까지 경영권과 관련하여 경쟁이 발생한 사실이 없습니다.
라. 의결권 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 12,019,231 | - |
| 우선주 | - | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 12,019,231 | - |
| 우선주 | - | - |
마. 주식사무
|
정관상 신주인수권의 내용 |
신주를 발행하기 위해서는 주주총회 일반 결의가 있어야 함(정관 제3조 (A)). 싱가포르 법령 상 신주 또는 그에 준하는 사채의 발행에 있어 주주총회의 결의가 필수적이며, 예외는 인정되지 않음. 다만 매년 주주총회의 결의로 향후 1년간 경영상의 필요 등 특수한 경우에 한정하여 신주발행 권한을 이사회에 위임할 수 있음. |
||
|
결산일 |
6월 30일 |
정기주주총회 |
회계연도 종료 후 3개월 이내 |
|
주주명부폐쇄시기 |
해당사항 없음 |
||
|
주권의 종류 |
각 보통주에 대해 5개의 주식예탁증서(DR) 발행 | ||
|
명의개서대리인 |
Tricor Singapore Pte.Ltd. |
||
| 원주보관기관 | Citibank, Singapore | ||
| 예탁기관 | 한국예탁결제원 | ||
| 주주의 특전 | - | ||
|
공고게재신문 |
정관 137조에 따름 |
||
바. 주주총회 의사록 요약
| 주총일자 | 안건 | 결의내용 |
|---|---|---|
| 제7기 정기주주총회 (2022.09.28) |
제1호의안: 이사 선임의 건 제1-1호의안: 사외이사 이의경 재선임의 건 제1-2호의안: 사외이사 전경희 재선임의 건 제1-3호의안: 사외이사 Lee Kok Fatt 재선임의 건 제1-4호의안: 기타비상무이사 오승주 재선임의 건 제2호의안: 사내이사 및 사외이사 보수 한도 승인의 건 제3호의안: Nexia TS Public Accounting Corporation(삼덕회계법인) 감사인 선임 및 감사보수 승인에 대한 이사회 권한 위임의 건 제4호의안: 스톡옵션 관련 이사회 위임의 건 제4-1호의안: 스톡옵션 제도 2020의 규정에 따른 스톡옵션의 제공 및 부여에 대한 이사회 위임의 건 제4-2호의안: 스톡옵션 제도 2020에 따른 옵션 행사에 따라 발행되어야 하는 주식의 수시 배정 및 발행에 대한 이사회 위임의 건 |
원안대로 승인 |
| 제8기 정기주주총회 (2023.09.26) |
제1호의안: 이사 선임의 건 제1-1호의안: 사외이사 방규호 선임의 건 제1-2호의안: 사외이사 Ong Kang Lin 선임의 건 제2호의안: 감사위원 선임의 건 제2-1호의안: 감사위원 방규호 선임의 건 제2-2호의안: 감사위원 Ong Kang Lin 선임의 건 제3호의안: 사내이사 및 사외이사 보수 한도 승인의 건 제4호의안: 사외이사 보수지급 승인의 건 제5호의안: Nexia Singapore PAC, Nexia 삼덕회계법인 감사인 선임 및 감사보수 승인에 대한 이사회 권한 위임의 건 제6호의안: 스톡옵션 관련 이사회 위임의 건 제6-1호의안: 스톡옵션 제도 2020의 규정에 따른 스톡옵션의 제공 및 부여에 대한 이사회 위임의 건 제6-2호의안: 스톡옵션 제도 2020에 따른 옵션 행사에 따라 발행되어야 하는 주식의 수시 배정 및 발행에 대한 이사회 위임의 건 |
원안대로 승인 |
| 제9기 정기 주주총회 (2024.09.27) |
제1호의안: 이사 선임의 건 제1-1호의안: 사내이사 박소연 재선임의 건 제1-2호의안: 사내이사 김 마이클 진우 재선임의 건 제1-3호의안: 사내이사 Tan Yong Chuang 선임의 건 제1-4호의안: 기타비상무이사 Tan Ting Yong 선임의 건 제2호의안: 사내이사 및 사외이사 보수 한도 승인의 건 제3호의안: 사외이사 보수지급 승인의 건 제4호의안: Nexia Singapore PAC, Nexia 삼덕회계법인 감사인 선임 및 감사보수 승인에 대한 이사회 권한 위임의 건 제5호의안: 스톡옵션 관련 이사회 위임의 건 제5-1호의안: 스톡옵션 제도 2020의 규정에 따른 스톡옵션의 제공 및 부여에 대한 이사회 위임의 건 제5-2호의안: 스톡옵션 제도 2020에 따른 옵션 행사에 따라 발행되어야 하는 주식의 수시 배정 및 발행에 대한 이사회 위임의 건 |
원안대로 승인 |
VII. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| Mayson Partners Pte. Ltd. | 최대주주 |
보통주 |
2,602,074 | 21.65 | 2,602,074 | 21.65 | - |
| 박소연 | 특수관계인 |
보통주 |
1,851,256 | 15.40 | 1,851,256 | 15.40 | - |
| Michael Jinwoo Kim | 특수관계인 | 보통주 | 1,795,720 | 14.94 | 1,795,720 | 14.94 | - |
| 전경희 | 특수관계인 | 보통주 | 350 | 0.00 | 350 | 0.00 | - |
| TAN TING YONG | 특수관계인 | 보통주 | 6,000 | 0.05 | 6,000 | 0.05 | - |
| 계 | 보통주 | 6,255,400 | 52.04 | 6,255,400 | 52.04 | - | |
| - | - | - | - | - | - | ||
2. 최대주주의 주요경력 및 개요
당사의 최대주주는 Mayson Partners Pte. Ltd.이며, 최대주주의 기본정보 등은 아래와 같습니다.
가. 최대주주(법인 또는 단체)의 기본정보
| 명 칭 | 출자자수 (명) |
대표이사 (대표조합원) |
업무집행자 (업무집행조합원) |
최대주주 (최대출자자) |
|||
|---|---|---|---|---|---|---|---|
| 성명 | 지분(%) | 성명 | 지분(%) | 성명 | 지분(%) | ||
| Mayson Partners Pte. Ltd. |
2 | 박소연 | 50 | - | - | 박소연 | 50 |
| Michael Jinwoo Kim | 50 | - | - | Michael Jinwoo Kim | 50 | ||
주1) Mayson Partners Pte. Ltd.는 경영안정성을 보다 공고히 하기 위하여 박소연(보유 주식수: 50주, 지분율 50%)과 Michael Jinwoo Kim(보유 주식수: 50주, 지분율 50%)가 공동 보유 중인 명목회사입니다.
나. 최대주주(법인 또는 단체)의 최근 결산기 재무현황
| (단위 : 백만원) |
| 구 분 | |
|---|---|
| 법인 또는 단체의 명칭 |
Mayson Partners Pte. Ltd. |
| 자산총계 | 95,077 |
| 부채총계 | 8,168 |
| 자본총계 | 86,910 |
| 매출액 | - |
| 영업이익 | -11,937 |
| 당기순이익 | -7,686 |
주1) 상기 재무현황은 2024년 6월말 기준이며, 원화 환산은 서울외국환중개㈜의 2024년 6월말 기말환율 1,022.75/SGD 및 평균환율 988.53/SGD 를 적용하였습니다.
다. 사업현황 등 회사 경영 안정성에 영향을 미칠 수 있는 주요 내용
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
3. 최대주주 변동현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| 2021.02.05 | Mayson Partners Pte. Ltd. | 2,519,135 | 20.96% | 유가증권상장 | (주1, 2) |
주1) Mayson Partners Pte. Ltd.는 경영안정성을 보다 공고히 하기 위하여 박소연(보유 주식수: 50주, 지분율 50%)과 Michael Jinwoo Kim(보유 주식수: 50주, 지분율 50%)가 공동 보유 중인 명목회사입니다.
주2) 본 분기보고서 작성기준일 현재 최대주주 Mayson Partners Pte. Ltd.의 소유주식수는 2,602,074 주 입니다.
4. 주식의 분포
가. 주식 소유현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | Mayson Partners Pte. Ltd. | 2,602,074 | 21.65 | 최대주주 |
| 박소연 | 1,851,256 | 15.40 | 대표이사 | |
| Michael Jinwoo Kim | 1,795,720 | 14.94 | 임원 | |
| Octava Fund Limited | 2,177,787 | 18.12 | - | |
| 우리사주조합 | - | - | - | |
나. 소액주주현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 34,291 | 34,299 | 99.76 | 3,586,043 | 12,019,231 | 29.83 | - |
5. 주가 및 주식거래실적
본 분기보고서 작성기준일로부터 최근 6개월간 주가와 거래실적은 아래와 같습니다.
| (단위: KDR, 원) |
| 종류 | 2024.10 | 2024.11 | 2024.12 | 2025.01 | 2025.02 | 2025.03 | ||
|---|---|---|---|---|---|---|---|---|
| 보통주 | 주가 | 최고 | 20,900 | 19,010 | 16,490 | 16,350 | 16,480 | 14,350 |
| 최저 | 13,120 | 14,110 | 13,140 | 14,500 | 13,580 | 11,460 | ||
| 평균 | 15,902 | 16,259 | 14,846 | 15,278 | 14,814 | 13,131 | ||
| 거래량 | 최고(일) | 1,954,990 | 365,639 | 245,416 | 98,494 | 1,314,394 | 274,938 | |
| 최저(일) | 76,912 | 72,806 | 39,585 | 38,947 | 32,322 | 29,418 | ||
| 월간 | 8,053,840 | 3,960,052 | 2,127,063 | 1,127,361 | 3,049,820 | 2,229,335 | ||
주1) 당사는 2021년 2월 5일자로 유가증권시장에 상장하였습니다.
주2) 당사의 주식은 현재 한국 유가증권시장에서 DR단위로 거래되고 있으며, '1주 = 5DR'에 상당합니다.
주3) 최고 및 최저 주가는 해당일자의 종가 기준입니다.
주4) 상기 표에 사용된 데이터의 출처는 'KRX 정보데이터시스템'입니다.
VIII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 박소연 | 여 | 1963.01 | 회장 | 사내이사 | 상근 | 대표 이사 |
('15.07~현재) Prestige Biopharma Limited 대표이사 ('15.09~'19.10) 프레스티지바이오로직스(한국)연구소장 ('12.01~'18.11)싱가포르 국립과학기술연구소(A*STAR) ('91.08~'95.12) Univ. of Missouri-Columbia, USA 생유기화학 박사 |
1,851,256 | - | 특수 관계인 |
9년 9개월 |
2027.09.27 |
| Michael Jinwoo Kim |
남 | 1964.06 | 부회장 | 사내이사 | 상근 | CFO |
('25.03~현재) 프레스티지바이오로직스 대표이사 ('16.09~'19.10) 프레스티지바이오로직스 등재 이사 ('89.08) New York Univ. 경영학 석사 |
1,795,720 | - | 특수 관계인 |
9년 9개월 |
2027.09.27 |
| Yong Chuang Tan |
남 | 1963.02 | 이사 | 사내이사 | 상근 | 경영지원 부문장 |
('19.09~현재) Prestige Biopharma Limited 이사 ('13.01~'19.01) Meyer Burger Singapore 부장 ('08.02~'12.12) Triumph HT Optics Suzhou Ltd, China 부장 ('05.07~'08.01) Fotronics Inc. (Singapore) 이사 |
- | - | - | 5년 6개월 |
2027.09.27 |
| 방규호 | 남 | 1963.08 | 이사 | 사외이사 | 비상근 | 내부거래 위원회 위원장, 감사위원회 위원, 보상위원회 위원, 사외이사 후보추천 위원회 위원 |
('23.09~현재) Prestige Biopharma Limited 사외이사 ('18.03~현재) 경상국립대학교 제약공학과 교수 ('14.10~'17.10) 오송첨단의료산업진흥재단 바이오의약생산 센터장 ('00) 충남대학교 대학원 미생물학 박사 |
- | - | - | 5년 3개월 |
2026.09.26 |
| 이의경 | 남 | 1959.12 | 이사 | 사외이사 | 비상근 | 감사위원회 위원장, 사외이사 후보추천 위원회 위원 |
('20.04~현재) Prestige Biopharma Limited 사외이사 ('95.09~현재) 대진대학교 경영학과 교수 ('14.01~'16.12) 대진대학교 사회과학대학장 ('93) 서울대학교 대학원 경영학 박사 |
- | - | - | 5년 | 2025.09.28 |
| 전경희 | 여 | 1968.03 | 이사 | 사외이사 | 비상근 | 감사위원회 위원 |
('20.04~현재) Prestige Biopharma Limited 사외이사 ('00.10~현재) 법무법인 대륙아주 변호사 ('11.01~현재) 재단법인 수림문화재단 이사 ('09.06~현재) 대한상사중재원 중재인 ('17.09~현재) 법조윤리협의회 특별위원회 전문위원 ('13.02~'17.02) 대한변호사협회 비상임이사 ('98) 제27기 사법연수원 ('95) 제37회 사법고시 ('94) 한양대학교 법학과 졸업 |
350 | - | - | 5년 | 2025.09.28 |
| Kok Fatt Lee |
남 | 1973.09 | 이사 | 사외이사 | 비상근 | 보상위원회 위원장, 감사위원회 위원, 내부거래 위원회 위원 |
('20.04~현재) Prestige Biopharma Limited 사외이사 ('20.01~현재) Chandler's Institute of Governance, Chairman ('19.02~'19.11) United Overseas Bank Limited 이사 ('17.02~'19.01) Future-Moves Group 이사 ('12.01~'16.04) Council of Presidential Advisers(대통령 자문위원) |
- | - | - | 5년 | 2025.09.28 |
| Ong Kang Lin |
남 | 1978.07 | 이사 | 사외이사 | 비상근 | 사외이사 후보추천 위원회 위원, 감사위원회 위원, 보상 위원회 위원 |
('23.09~현재) Prestige Biopharma Limited 사외이사 ('24.08~현재) ClavystBio Pte. Ltd. 재무이사 ('22.05~'23.05) DOCQUITY 재무이사 ('15~'18) SIS ASSET MANAGEMENT CEO ('08) THE WHARTON SCHOOL, UNIVERSITY OF PENNSYLVANIA 학사 |
- | - | - | 1년 6개월 |
2026.09.26 |
| Tan Ting Yong |
남 | 1963.11 | 이사 | 기타비상무이사 | 비상근 | 경영자문 | 2020.01 ~ 현재 : OCTAVA PTE LTD - Director 2019.02 ~ 현재 : Octava Esport Pte Ltd - Director 2010.06 ~ 2022.07 : Jeriko Resources Pte Ltd - Director |
6,000 | - | - | 6개월 | 2027.09.27 |
| Michael Ruppert |
남 | 1967.02 | 이사 | 미등기 | 상근 | 사업 개발 부문장 |
('17.06~현재) Prestige Biopharma Limited 사업개발 (Business development) 부문장 ('93~'96) Institute for Immunology and Genetics at the German Cancer Research Center, Heidelberg 면역학 박사 |
- | - | - | 7년 10개월 |
- |
| 신동조 | 남 | 1973.08 | 이사 | 미등기 | 상근 | 재무 부문장 |
('20.11~현재) Prestige Biopharma Limited 재무 부문장 ('08.10~'20.10) 대성삼경회계법인 공인회계사 ('05.07~'08.09) 한영회계법인 공인회계사 ('00) 국민대학교 회계정보학과 졸업 |
- | - | - | 4년 2개월 |
- |
| Sia Pheng Tan |
남 | 1969.11 | 이사 | 미등기 | 상근 | 제조 및 품질 관리 총괄 |
('24.03~현재) Prestige Biopharma Limited, 이사 ('18.01~'23.05) Amgen Biologics, Head of Quality ('14.07~'18.01) Lonza Biologics, Quality Operations Manager ('12.01~'14.06) Alcon, Quality Compliance Manager ('08~'11) GSK Biologics, Senior Validation Lead for Asia Pacific ('06~'08) Edwards Lifesciences, Staff Quality Engineer ('03~'06) Becton Dickinson, Senior Quality Engineer ('99~'03) Baxter Healthcare, Quality Engineer ('94) 난양공대 기계공학 학사 |
- | - | - | 1년 1개월 |
- |
| Sumiko Shiba | 여 | 1963.09 | Secretary | 집행임원 | 비상근 | Secretary 1) |
('24.07~현재) Prestige Biopharma Limited, Corporate Secretary | - | - | - | 8개월 | - |
1) Secretary는 모든 규제의무를 이행하기 위해 회사가 의존하는 사람(싱가포르 회사법)으로 사실상 임원(업무 집행 책임자에 해당)에 포함된다는 유권해석으로 임원현황에 추가하였습니다.
나. 타회사 임원 겸직 현황
|
성 명 (출생년월) |
회사명 |
직책명 |
담당업무 |
비 고 |
|---|---|---|---|---|
| Michael Jinwoo Kim | Qion Pte. Ltd. (싱가포르) |
대표이사 |
경영총괄 |
- |
| Prestige Biopharma Australia Pty Ltd |
대표이사 |
경영총괄 |
- |
|
| Prestige Biopharma Belgium BVBA |
대표이사 |
경영총괄 |
- |
|
| Mayson Partners Pte. Ltd. | 이사 | 주2) | - | |
| 프레스티지바이오로직스 주식회사 | 대표이사 | 경영총괄 | - | |
|
박소연 |
Mayson Partners Pte. Ltd. | 이사 | 주2) | - |
|
방규호 |
경상국립대학교 |
교수 |
제약공학과 교수 |
- |
|
이의경 |
대진대학교 |
교수 |
경영학 교수 |
- |
|
전경희 |
법무법인 대륙아주 |
변호사 |
변호사 |
- |
|
재단법인 수림문화재단 |
이사 |
이사 |
- |
|
|
대한상사중재원 |
중재인 |
중재인 |
- |
|
|
KOK FATT LEE |
Rysense Ltd |
Managing Director |
경영총괄 |
- |
| ONG KANG LIN | ClavystBio Pte. Ltd. | Chief Financial Officer | 재무이사 | - |
| Clavystbio Investments Pte. Ltd. | 이사 | 이사 |
- |
|
| Clavystbio Investments L Pte. Ltd | 이사 | 이사 | - |
| 주1) Mayson Partners Pte. Ltd.는 한국거래소 유가증권시장상장규정 시행세칙 제3조의 명목회사에 해당합니다. |
다. 직원 등 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 관리사무 | 남 | 8 | - | - | - | 8 | 2.6 | 551,456,741 | 65,304,088 | - | - | - | - |
| 관리사무 | 여 | 16 | - | - | - | 16 | 1.6 | 703,026,981 | 43,337,280 | - | |||
| 연구개발 | 남 | 10 | - | - | - | 10 | 1.7 | 504,436,113 | 52,183,046 | - | |||
| 연구개발 | 여 | 32 | - | - | - | 32 | 1.8 | 1,788,404,443 | 55,502,207 | - | |||
| 합 계 | 67 | - | - | - | 67 | 1.9 | 3,547,324,278 | 53,298,695 | - | ||||
주1) 작성지침에 따라 미등기임원을 포함하여 작성하였습니다.
주2) 1인평균 급여액은 작성지침에 따라 당기 사업연도 개시일로부터 본 분기보고서 작성기준일까지의 월별 평균 급여액의 합계로 산출하였습니다.
주3) 연간급여 총액 및 1인평균급여액은 서울외국환중개㈜의 해당 급여지급기간의 평균환율 1,050.66/SGD를 적용하여 원화로 환산하였으며 외화지급액은 다음과 같습니다.
| 사업부문 | 성별 |
적용환율(SGD/KRW) |
연간급여 총액(SGD) |
1인 평균 급여액(SGD) |
|---|---|---|---|---|
| 관리사무 | 남 | 1,050.66 | 524,867 | 62,155 |
| 관리사무 | 여 | 669,129 | 41,248 | |
| 연구개발 | 남 | 480,114 | 49,667 | |
| 연구개발 | 여 | 1,702,172 | 52,826 |
라. 미등기임원 보수 현황
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 3 | 483,132,385 | 161,044,128 | - |
주1) 미등기임원 보수 현황은 서울외국환중개㈜의 해당 급여 지급기간의 평균환율
1,050.66/SGD 및 1,502.79/EUR를 적용하여 원화로 환산하였습니다.
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
가. 주주총회 승인금액
| (단위 : 원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 등기이사 전체 | 10 | 2,778,400,000 | 주1) |
주1) 상기금액은 2024년 9월 27일에 개최된 제9기 정기주주총회에서 승인된 제10기 등기이사 전체에 대한 보수한도이며, 주주총회에서 승인된 금액은 USD2,000,000으로 서울외국환중개㈜의 당사 제9기 기말환율 1,389.20/USD를 적용하여 원화로 환산했습니다.
나. 보수지급금액
(1) 이사ㆍ감사 전체
| (단위 : 원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 9 | 1,336,237,632 | 148,470,848 | - |
주1) 상기 보수총액은 당분기에 지급된 사내이사와 사외이사의 보수지급액 합계입니다.
주2) 상기 보수는 서울외국환중개㈜의 해당 급여지급기간의 평균환율 1,050.66/SGD 와 1,401.87/USD를 적용해 원화로 환산하였습니다.
(2) 유형별
| (단위 : 원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
3 | 1,208,022,602 | 402,674,201 | 주1) |
| 사외이사 (감사위원회 위원 제외) |
1 | - | - | 주2) |
| 감사위원회 위원 | 5 | 128,215,030 | 25,643,006 | 주2) |
| 감사 | - | - | - | - |
주1) 상기 보수는 서울외국환중개㈜의 해당 급여지급기간의 평균환율 1,050.66/SGD를 적용해 원화로 환산하였습니다.
주2) 상기 보수는 서울외국환중개㈜의 해당 급여지급기간의 평균환율 1,401.87/USD를 적용해 원화로 환산하였습니다.
(3) 이사ㆍ감사의 보수지급기준
| 구분 | 지급기준 |
|---|---|
| 등기이사 (감사위원회 위원, 기타비상무이사 제외) |
- 주주총회에서 승인 받은 임원보수 한도 내에서 책정한 후, 보상위원회의 승인을 받아 지급 - 보상위원회는 회사의 실적 및 개별 임원의 기여도를 고려하여 임원의 성과를 평가하며, 임직원의 당해년도 임금 인상률 및 동종업계 등기이사의 보수수준을 함께 고려하여 개인별 연간 보수 금액을 승인 |
| 감사위원회 위원 (사외이사), 기타비상무 이사 |
- 주주총회에서 승인 받은 임원보수 한도 내에서 책정한 후, 보상위원회 및 이사회의 승인을 받아 지급 - 보상위원회는 사외이사의 위원회 활동 여부 및 이사회 기여도, 연간 회의 참석 횟수 등을 고려하여 사외이사의 연간 보수 금액을 승인 |
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
가. 개인별 보수지급금액
본 분기보고서 기준일 현재 해당사항 없습니다.
| (단위 : 원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
2. 산정기준 및 방법
본 분기보고서 기준일 현재 해당사항 없습니다.
| (단위 : ) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
가. 개인별 보수지급금액
본 분기보고서 기준일 현재 해당사항 없습니다.
| (단위 : 원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
나. 산정기준 및 방법
본 분기보고서 기준일 현재 해당사항 없습니다.
| (단위 : ) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
<주식매수선택권의 부여 및 행사현황>
가. 임원부여 주식매수선택권
| (단위 : 원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
1 | 35,726,657 | - |
| 사외이사 (감사위원회 위원 제외) |
- | - | - |
| 감사위원회 위원 또는 감사 | - | - | - |
| 업무집행지시자 등 | 1 | 45,016,849 | - |
| 계 | 2 | 80,743,506 | - |
주1) 상기 임원에게 부여된 주식매수선택권의 공정가치는 당기 손익계산서에 해당 주식매수선택권과 관련된 비용으로 계상된 금액으로, 본 분기보고서의 작성기준일이 속하는 사업연도 개시일부터 당분기 말까지의 평균환율 1,401.87/USD를 적용하여 원화로 환산하였습니다.
주2) 업무집행지시자는 미등기 임원 1인에 대한 주식매수선택권의 공정가치 총액을 기재하였습니다.
주3) 당사는 블랙 숄즈 머튼 모형을 이용한 공정가치접근법을 사용해 주식매수선택권의 공정가치를 계산하였습니다. 자세한 사항은 'III. 재무에 관한 사항- 5. 재무제표 주석- 주식기준보상' 항목을 참조하여 주시기 바랍니다.
나. 임직원부여 주식매수선택권
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| Tan Yong Chuang | 등기임원 | 2020.11.09 | 신주교부 | 보통주 | 4,674 | - | - | - | - | 4,674 | - | - | X | - |
| Michael Ruppert | 미등기임원 | 2020.11.09 | 신주교부 | 보통주 | 5,886 | - | - | - | - | 5,886 | - | - | X | - |
| Xavier Pivot (자문위원) |
- | 2020.11.09 | 신주교부 | 보통주 | 22,778 | - | - | - | - | 22,778 | - | - | X | - |
| Litha 외 12명 | 직원 | 2020.11.09 | 신주교부 | 보통주 | 77,898 | - | - | - | - | 77,898 | - | - | X | - |
| 합계 | - | - | - | - | 106,562 | - | - | - | - | 106,562 | - | - | X | - |
※ 공시서류작성기준일(2025년 03월 31일) 현재 종가 : 13,780원
주1) 행사가격은 USD 90이며, 서울외국환중개(주)에서 고시한 부여일의 환율 1,124.40/USD (2020.11.09)를 적용하여 원화로 환산하였습니다.
주2) 부여된 주식매수선택권은 IPO 후 1년 경과 시점에 2년 이상 재직한 직원의 경우, IPO 후 1년 경과 시 전체 부여주식의 30%, IPO 후 3년 경과 시 35%, IPO 후 5년 경과 시 35% 가득됩니다. IPO 후 1년 경과 시점에 2년 미만 재직한 직원의 경우, 2년 재직 및 IPO 후 1년 경과 시점 중 늦은 시점에 전체 부여주식의 30%, 최초 가득일로부터 2년 경과 시 35%, 최초 가득일로부터 4년 경과 시 35% 가득됩니다.
주3) 주식매수선택권 부여 결의 이후 퇴사한 직원에 한해서 주식매수선택권 부여 결의를 취소하였습니다.
IX. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| 프레스티지바이오파마 | 2 | 5 | 7 |
| ※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조 |
나. 회사와 계열회사간 임원 겸직 현황
| 겸직자 | 계열회사 겸직 현황 | |||
|---|---|---|---|---|
| 이름 | 직위 | 회사명 | 직위 | 상근 여부 |
| 박소연 | 회장 | Mayson Partners Pte. Ltd | 이사 | 비상근 |
| Michael Jinwoo Kim | 부회장 | Prestige Biopharma Australia Pty Ltd | 이사 | 비상근 |
| Prestige Biopharma Belgium BVBA | 이사 | 비상근 | ||
| 프레스티지바이오로직스 주식회사 | 대표이사 | 상근 | ||
| Mayson Partners Pte. Ltd. | 이사 | 비상근 | ||
| Qion Pte. Ltd. (싱가포르) | 이사 | 비상근 | ||
2. 타법인출자 현황(요약)
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 천원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | 1 | 3 | 4 | 189,128,227 | 142,579,066 | 40,891,506 | 372,598,799 |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | - | - | - | - | - | - |
| 계 | 1 | 3 | 4 | 189,128,227 | 142,579,066 | 40,891,506 | 372,598,799 |
| ※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조 |
X. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여등
당사는 본 분기보고서 작성기준일이 속하는 사업연도의 개시일부터 본 분기보고서 작성기준일까지의 기간동안 본 항목에 대한 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
당사는 본 분기보고서 작성기준일이 속하는 사업연도의 개시일부터 본 분기보고서 작성기준일까지의 기간동안 본 항목에 대한 해당사항이 없습니다.
3. 대주주와의 영업거래
당사는 본 분기보고서 작성기준일이 속하는 사업연도의 개시일부터 본 분기보고서 작성기준일까지의 기간동안 본 항목에 대한 해당사항이 없습니다.
4. 대주주 이외의 이해관계자와의 거래
해당 항목은 'Ⅲ. 재무에관한사항- 3. 연결재무제표 주석- 특수관계자 거래' 내용을 참고하시기 바랍니다.
XI. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
2. 우발부채 등에 관한 사항
가. 중요한 소송사건 등
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
나. 견질 또는 담보용 어음ㆍ수표 현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
다. 채무보증 현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
라. 채무인수약정 현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
마. 기타의 우발채무 등
(1) 당분기말 현재 당사가 금융기관과 체결하고 있는 약정사항은 다음과 같습니다.
| (단위 : 원) |
| 금융기관명 | 내 용 | 관련 차입금 | 실행금액 | 미실행금액 |
|---|---|---|---|---|
| KDB산업은행 | 시설자금대출 | 장기차입금 (유동성장기부채) |
48,346,640,000 | - |
(2) 당분기말 현재 당사가 타인으로부터 제공받은 보증내역은 다음과 같습니다.
| (단위 : 원) |
| 보증기관 | 보증처 | 보증내역 | 보증금액 |
|---|---|---|---|
| 서울보증보험 | 청주시 흥덕구청 | 인허가 보증보험, 도시가스 공급계약 | 422,071,400 |
(3) 당분기말 현재 당사의 차입금 등과 관련하여 담보로 제공된 당사의 자산은 다음과 같습니다.
| (단위 : 원) |
| 차입처 | 담보제공자산 | 차입금금액 | 채권최고액 | 비고 |
|---|---|---|---|---|
| KDB산업은행 | 토지 및 건물, 시설장치 등 (연제리 654, 정중리 799) |
48,346,640,000 | 66,600,000,000 | 장기차입금 (유동성장기부채) |
(4) 당분기말 현재 당사가 원고인 또는 피고인 소송사건은 다음과 같습니다.
| (단위 : 원) |
| 원고 | 피고 | 사건내용 | 소송가액 |
|---|---|---|---|
| 주식회사 신성이엔지 | 프레스티지바이오로직스 | 공사대금 소송 | 7,610,000,000 |
한편, 상기 소송사건 이외에 Alvotech hf.과 HD204에 대한 위탁생산 용역대금 USD
1,062,110.36 청구와 관련한 분쟁이 존재하며 당사는 당분기말 현재 소송과 분쟁의 결과를 신뢰성 있게 추정할 수 없어 관련 부채를 계상하지 아니하였습니다.
(5) 주요 보험 가입현황
당분기말 현재 당사의 건물과 기계장치 등은 DB손해보험(주)의 부보금액 266,062,750천원의 재산종합보험 및 9,645,724천원의 기계위험보장보험(연간 보험료 : 1,997천원)에 가입되어 있습니다. 동 보험에 대한 보험금 수령권은 KDB산업은행 청주지점에 100,655,832천원의 질권이 설정되어 있습니다.
3. 제재 등과 관련된 사항
가. 제재현황
당사는 본 분기보고서의 공시대상기간 중 한국거래소로부터 제재를 받은 내역이 있으며, 상세사항은 다음과 같습니다.
당사는 미국 베네비라사와 체결한 의약품 위탁생산을 위한 포괄계약 체결('22.06.15)의 지연공시('22.06.21)에 따른 '공시불이행'으로 인해 2022년 7월 6일 유가증권시장공시규정 제35조 및 제35조의2에 의거해 '불성실공시법인지정'이 되어 1,600만원의 공시위반제재금을 부과 받았습니다.
당사는 본 분기보고서 제출일 현재 부과된 공시위반제재금을 납부 완료하였으며, 관련 부서 공시교육을 강화하고 내부 정보 공유 체계를 개선하는 등 재발방지를 위해 노력하고 있습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
당사는 본 분기보고서 작성기준일 현재 해당사항이 없습니다.
나. 중소기업기준 검토표
당사는 본 분기보고서 작성기준일 현재 해당사항이 없습니다.
다. 외국지주회사의 자회사 현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
라. 법적위험 변동사항
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
마. 금융회사의 예금자 보호 등에 관한 사항
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
바. 기업인수목적회사의 요건 충족 여부
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
사. 기업인수목적회사의 금융투자업자의 역할 및 의무
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
아. 합병등의 사후정보
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
자. 녹색경영
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
차. 정부의 인증 및 그 취소에 관한 사항
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
카. 조건부자본증권의 전환.채무재조정 사유 등의 변동현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
파. 특례상장기업의 재무사항 비교표
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
하. 특례상장기업 관리종목 지정유예 현황
당사는 본 분기보고서 작성기준일 현재 해당사항 없습니다.
XII. 상세표
1. 연결대상 종속회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (단위 : 천원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| 프레스티지바이오로직스 주식회사 |
2015.06.02 | 충청북도 청주시 흥덕구 오송읍 오송생명1로 197 |
CDEMO | 289,414,061 | 기업 의결권의 과반수 소유 |
해당 |
| Prestige Biopharma Belgium BVBA |
2018.04.11 | Terhulpensest-eenweg 449, 3090 Overijse,Belgium |
인허가 | 212 | 기업 의결권의 과반수 소유 |
미해당 |
| Prestige Biopharma Australia Pty Ltd |
2018.06.07 | 58 Gipps Street, Collingwood,3066 Victoria, Australia |
임상개발 | 123,861 | 기업 의결권의 과반수 소유 |
미해당 |
| 프레스티지바이오파마 아이디씨주식회사 |
2021.04.21 | 부산광역시 강서구 명지국제7로 44 | 생명공학 연구 및 개발업 | 94,040,414 | 기업 의결권의 과반수 소유 |
해당 |
2. 계열회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | 2 | 프레스티지바이오파마 (Prestige Biopharma Limited) |
201528785G |
| 프레스티지바이오로직스 주식회사 | 110111-5739804 | ||
| 비상장 | 5 | Prestige Biopharma Australia Pty. Ltd. | 626 663 045 |
| Prestige Biopharma Belgium BVBA | BE 0694.655.503 | ||
| 프레스티지바이오파마아이디씨 주식회사 | 180111-******* | ||
| Qion Pte. Ltd. | 200511278R | ||
| Mayson Partners Pte. Ltd. | 201905021N |
3. 타법인출자 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2025년 03월 31일 | ) | (단위 : 백만원, 천주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| 프레스티지바이오 로직스 주식회사 |
상장 | 2022.09.05 | 생산시설 관련 투자 |
155,873 | 15,207 | 25 | 49,468 | 15,916 | 89,846 | 30,127 | 31,123 | 40.2 | 169,441 | 289,414 | -29,374 |
| Prestige Biopharma Belgium BVBA |
비상장 | 2018.04.11 | 인허가 관련투자 |
61 | - | 100 | 79 | - | - | 4 | - | 100 | 83 | 0 | -41 |
| Prestige Biopharma Australia Pty Ltd |
비상장 | 2018.06.07 | 임상관련 투자 |
38 | - | 100 | 50 | - | - | 3 | - | 100 | 53 | 124 | -431 |
| 프레스티지바이오파마 아이디씨 주식회사 |
비상장 | 2021.04.21 | 생명공학 연구 및 개발업 |
170,968 | 128,251 | 100 | 139,531 | 105,480 | 52,733 | 10,758 | 233,731 | 100 | 203,022 | 94,040 | -12,291 |
| 합 계 | - | - | 189,128 | 121,396 | 142,579 | 40,892 | 264,854 | - | 372,599 | 383,579 | -42,136 | ||||
주1) 프레스티지 바이오파마 벨기에 법인 전체 지분의 1%는 회사의 주요경영진이 회사를 대신하여 보유하고 있어 회사의 실질 지분율을 100%로 표기 하였습니다.
주2) 최초취득금액은 서울외국환중개㈜의 해당 취득일별 환율을 적용하였습니다.
| 회사명 | 최초취득일자 | 취득일 환율 (KRW/USD) |
취득금액 (USD) |
|---|---|---|---|
| 프레스티지바이오로직스 주식회사 | 2022-09-05 | 1,369.70 | 48,205,361 |
| 2024-09-24 | 1,334.30 | 67,335,432 | |
| 소계 | - | 115,540,793 | |
| Prestige Biopharma Belgium BVBA | 2018-04-11 | 1,067.70 | 56,819 |
| Prestige Biopharma Australia Pty Ltd | 2018-06-07 | 1,069.60 | 35,896 |
| 프레스티지바이오파마아이디씨 주식회사 | 2021-04-21 | 1,113.40 | 15,440,000 |
| 2021-08-12 | 1,155.00 | 30,000,000 | |
| 2021-09-28 | 1,175.90 | 10,000,000 | |
| 2022-01-28 | 1,214.10 | 45,000,000 | |
| 2024-07-23 | 1,388.60 | 15,000,000 | |
| 2024-10-24 | 1,382.00 | 15,000,000 | |
| 2024-11-28 | 1,396.80 | 8,000,000 | |
| 소계 | - | 115,440,000 |
주3) 상기 회사는 당사의 연결종속회사로, 상기 표의 기초 및 기말 잔액은 각각 전기 및 당분기의 기말환율 1,389.20/USD와 1,466.50/USD를 적용하여 원화로 환산하였습니다.
주4) 당분기 평가손익은 프레스티지바이오로직스 주식의 손상차손 환입액과 기초와 기말 적용환율 차이에 따라 발생한 금액입니다.
주5) 최근사업연도 재무현황은 상기 4개사 모두 2024년 6월 말 기준입니다.
【 전문가의 확인 】
1. 전문가의 확인
해당 사항 없습니다.
2. 전문가와의 이해관계
해당 사항 없습니다.