 |
|
확인서 |
분 기 보 고 서
(제 16 기)
| 사업연도 | 2025.01.01 | 부터 |
| 2025.03.31 | 까지 |
| 금융위원회 | |
| 한국거래소 귀중 | 2025년 5 월 14 일 |
| 제출대상법인 유형 : | 주권상장법인 |
| 면제사유발생 : | 해당사항 없음 |
| 회 사 명 : | (주)팬젠 |
| 대 표 이 사 : | 윤재승 |
| 본 점 소 재 지 : | 경기도 수원시 영통구 신원로 306 (원천동, 영통이노플렉스 2동 4층) |
| (전 화) 031-733-9165 | |
| (홈페이지) http://www.pangen.com | |
| 작 성 책 임 자 : | (직 책) 전무이사 (성 명)장재홍 |
| (전 화) 031-733-9165 | |
【 대표이사 등의 확인 】
 |
|
확인서 |
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 현황(해당사항 없음)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | - | - | - | - | - |
| 합계 | - | - | - | - | - |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조 |
나. 연결대상회사의 변동내용(해당사항 없음)
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
다. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
라. 회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 코스닥시장 상장 | 2016.03.11 | 기술성장기업의 코스닥시장 상장 |
마. 설립일자
당사는 바이오시밀러 EPO의약품의 생산 및 판매, CDMO사업등을 주요사업으로 하고 있습니다.
2010년 1월 29일에 분할설립 되었고 2016년 3월 11일에 기술성장기업으로 코스닥 시장에 상장되었습니다.
바. 회사의 법적/상업적 명칭
당사의 명칭은 "주식회사 팬젠"이라고 표기합니다. 영문으로는 PanGen Biotech, Inc.라고 하며 약식으로 표기할 때는 PanGen이라고 합니다.
사. 본사 주소, 전화번호 및 홈페이지
| 본사 | 주 소 | 경기도 수원시 영통구 신원로 306 (원천동, 영통이노플렉스 2동 4층) |
| 전화번호 | (031)733-9165 | |
| 홈페이지 | www.pangen.com |
아. 주요사업의 내용
당사는 바이오의약품 생산용 GMP시설과, 당사의 원천기술인 PanGen CHO-TECH™ 기술, 바이오의약품 제품화 기술을 활용하여 바이오시밀러 EPO의약품 생산 및 판매, 바이오의약품(비임상,임상시료포함) 위탁생산(CMO) 및 개발기술 이전서비스(CDO) 사업, 바이오의약품 개발 사업을 수행하고 있습니다.
- 바이오시밀러 의약품 생산 및 판매사업 :
· EPO의약품(만성 신부전 환자의 빈혈치료제)
- 바이오 의약품(비임상,임상시료포함) 위탁생산(CMO) 및 개발 기술 이전 서비스
사업(CDO) :
·CDMO(Contract Development and Manufacturing Organization)
- 바이오 의약품 개발사업 :
·혈우병A치료제 Factor VIII
·황반변성,황반부종등 치료제 Aflibercept
·중증열성 혈소판 감소 증후군 치료제 항SFTSV항체
·항암치료보조제 G-CSF
당사의 주요 사업에 대한 자세한 사항은 본 사업보고서의 "II. 사업의 내용"을 참조 하시기 바랍니다.
2. 회사의 연혁
가. 회사의 본점 소재지 및 그 변경
회사의 본점 소재지는 경기도 수원시 영통구 신원로 306 (원천동, 영통이노플렉스 2동 4층) 이며 공시대상 기간중 소재지 변경은 없습니다.
나. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2024.12.13 | 임시주총 | 기타비상무이사 윤성태 기타비상무이사 송수영 사내이사 윤인상 비상근감사 강신원 |
- | - |
| 2024.03.28 | 정기주총 | 사내이사 및 대표이사 윤재승 사내이사 및 대표이사 정인철 사내이사 김태진 사내이사 김진곤 비상근감사 이호영 |
- | - |
| 2023.01.12 | 임시주총 | 사내이사 및 대표이사 조중명 사내이사 신승수 사내이사 박노준 기타비상무이사 정정철 기타비상무이사 윤인상 비상근감사 안상국 |
- | - |
다. 최대주주의 변동
2023년 1월 12일 최대주주 변경을 수반하는 주식양수도 계약체결 이행완료에 따라 당사의 최대주주는 김영부외 특수관계인 7인에서 씨지인바이츠(주)(구상호 크리스탈지노믹스(주))로 변경되었습니다.
이후 2024년 11월 13일 휴온스외 1인이 제3자배정 유상증자 납입에 따라 당사의 최대주주는 씨지인바이츠(주)외 1인에서 (주)휴온스외 1인으로 변경되었습니다.
| (단위:주.%) |
| 변동일 | 변경전 최대주주명 | 변경후 최대주주명 | 소유주식수 | 지분율 |
| 2023.01.12 | 김영부외 7인 | 씨지인바이츠(주) | 1,534,878 | 14.37 |
| 2024.11.13 | 씨지인바이츠(주)외1명 | (주)휴온스외1명 | 2,590,725 | 20.28 |
※세부내역은 2024년 11월 13일의 "최대주주 변경" 공시를 참조하세요.
라. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
|
일 자 |
내 용 |
| 2019.01.31 | EPO바이오시밀러 말레이시아 식약청 품목등록(제품명:에리사) |
| 2019.03.25 | Factor VIII 한국 임상 1상 IND승인 |
| 2019.04.03 | 사우디아라비아 SAUDI VAX사와 EPO 판권계약 체결 |
| 2019.06.11 | 특허등록(항-혈액응고 제Ⅷ인자 항체 및 그 용도,한국 제 10-1989779호) |
| 2019.07.04 | 특허등록(동물세포발현벡터, 인도 제314687호) |
| 2019.10.08 | 특허등록(동물세포발현벡터, 말레이시아 MY-171316-A) |
| 2019.11.11 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도, 호주 제 2016346595호) |
| 2019.11.28 | EPO바이오시밀러 한국 식약처 품목등록(제품명:팬포틴) |
| 2020.01.06 | 중헌제약과 국내 EPO의약품 판권계약 체결 |
| 2020.02.13 | 베트남 Khuong Duy사와 EPO의약품 판권계약 체결 |
| 2020.02.13 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도, 미국 제 15/964,463호,미국 제 15/964,648호 ,미국 제 15/964,763호 |
| 2020.02.20 | 바이오시밀러 EPO의약품(제품명:팬포틴,Erysaa) 할랄인증 |
| 2020.03.25 | 벤처기업인증 (한국벤처캐피탈협회, 제20200300176호) |
| 2020.09.28 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도, 인도네시아) |
| 2021.03.29 | 의약품 제조소 GMP 적합판정(유효기간 2024.02.18) |
| 2021.05.14 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도,일본) |
| 2021.06.08 | 튀르키예 VEM사에 EPO 바이오시밀러 기술수출계약 체결($ 3백만불) |
| 2021.06.29 | Factor VIII 임상3상 IND 제출 |
| 2021.07.26 | 특허등록(동물세포발현벡터, 브라질) |
| 2021.08.05 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도,중국) |
| 2021.09.15 | 특허등록(항-혈액응고 제Ⅷ인자 항체 및 그 용도,미국) |
| 2021.09.17 | Factor VIII 임상3상 시험계획 승인(한국 식약처) |
| 2022.02.04 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도,멕시코) |
| 2022.02.20 | 바이오시밀러 EPO의약품(제품명:팬포틴,Erysaa) 할랄 재인증 |
| 2022.03.25 | 벤처기업인증 (한국벤처캐피탈협회, 제20220223010013호) |
| 2022.08.16 | EPO바이오시밀러 필리핀 식약청 품목등록(제품명:ERYSAA 4000IU) |
| 2022.10.17 | EPO바이오시밀러 필리핀 식약청 품목등록(제품명:ERYSAA 2000IU) |
| 2022.11.15 | 특허등록(SFTSV에 결합 가능한 나노항체 및 이의응용, 일본) |
| 2022.12.06 | 특허등록(SFTSV에 결합 가능한 나노항체 및 이의응용, 중국) |
| 2022.12.19 | 고용량 EPO 바이오시밀러 한국식약처에 NDA 제출(6000IU, 10000IU) |
| 2023.02.23 | 특허등록(SFTSV에 결합 가능한 나노항체 및 이의응용, 한국) |
| 2023.05.18 | EPO바이오시밀러 사우디아라비아 식약청 품목등록(제품명:팬포틴) |
| 2023.06.06 | 특허등록(항-혈액응고 제Ⅷ인자 항체 및 그 용도,중국) |
| 2023.08.25 | EPO바이오시밀러 한국 식약처 품목등록(제품명:팬포틴6000IU,10000IU) |
| 2023.09.22 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도,인도) |
| 2023.09.28 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도,말레이시아) |
| 2023.11.15 | 특허등록(항-혈액응고 제Ⅷ인자 항체 및 그 용도,인도) |
| 2024.02.13 | 의약품 제조소 GMP 적합판정(유효기간 2026.10.25) |
| 2024.07.25 | 특허등록(안과용 액상 조성물, 한국) |
| 2024.09.23 | EPO바이오시밀러 태국 식약청 품목등록(제품명:팬포틴2000IU,4000IU) |
| 2024.10.22 | 특허등록(인간및마우스 Sema3에교차결합하는항체및 그의 용도,브라질) |
3. 자본금 변동사항
자본금 변동추이
| (단위 :백만원,주 ) |
| 종류 | 구분 | 16기 1분기 (2025년 1분기) |
15기 (2024년말) |
14기 (2023년말) |
|---|---|---|---|---|
| 보통주 | 발행주식총수 | 12,898,197 | 12,898,197 | 10,677,630 |
| 액면금액 | 500 | 500 | 500 | |
| 자본금 | 6,449 | 6,449 | 5,339 | |
| 우선주 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 기타 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 합계 | 자본금 | 6,449 | 6,449 | 5,339 |
당사는 2024년 중에 제3자 배정 유상증자로 3월에 737,053주(주당발행가 5,427원), 11월에 1,157,545주(주당발행가 4,545원), 제3회 전환사채 전환권 행사로 10월~11월중 203,044주(전환가 4,925원), 11월에 122,925주(전환가 4,881원) 의 보통주를 발행하였습니다.
4. 주식의 총수 등
주식의 총수 현황
| (기준일 : | 2025.03.31 | ) | (단위 : 주, %) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 37,500,000 | 12,500,000 |
50,000,000 |
- | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 12,898,197 |
952,864 |
13,851,061 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 |
- |
952,864 |
952,864 |
- | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 |
- |
- |
- |
- | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 |
- |
952,864 |
952,864 |
- | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 12,898,197 | - | 12,898,197 | - | |
| Ⅴ. 자기주식수 |
- |
- |
- |
- | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 12,898,197 | - | 12,898,197 | - | |
| Ⅶ. 자기주식 보유비율 | - | - | - | - | |
5. 정관에 관한 사항
가. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2021.03.29 | 제11기정기주주총회 | - 우선주발행 한도 변경 - 제3자 배정 유상증자 한도 변경 - 신주의 동등배당 - 감사의 선임 및 해임 |
- 발행예정주식총수의 25%로 변경 - 제3자 자본유치의 원활화를 위해 한도 변경 - 동등배당원칙 명시 - 전자투표 도입시 감사선임요건 완화내용 반영 |
| 2024.03.28 | 제14기정기주주총회 | - 사업목적 추가 실버케어,디지털헬스케어, 디지털치료제,해외 의료사업 |
- 사업다각화 |
| 2025.03.31 | 제15기정기주주총회 | - 사업목적 삭제 실버케어,디지털헬스케어, 디지털치료제,해외 의료사업 |
- 최대주주(24.11.13) 변경으로 인해 해당 목적사업은 더이상 추진하지 않기로 하여 삭제 |
나. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| 1 | 의약품,의료용화합물 및 유전자재조합단백질 제조업 | 영위 |
| 2 | 화장품원료 제조업 | 미영위 |
| 3 | 바이오의약품생산용 원료 제조업 | 영위 |
| 4 | 자연과학 연구개발업 | 영위 |
| 5 | 도소매업 | 영위 |
| 6 | 무역업 | 영위 |
| 7 | 부동산임대업 | 영위 |
| 8 | 위 각호에 부대되는 사업 | 영위 |
다. 사업목적 변경 내용
| 구분 | 변경일 | 사업목적 | |
|---|---|---|---|
| 변경 전 | 변경 후 | ||
| 삭제 | 2025.03.31 | 실버케어,디지털헬스케어, 디지털치료제,해외 의료사업 |
삭제 |
변경 사유 : 최대주주(24.11.13) 변경으로 인해 해당 목적사업은 더이상 추진하지 않기로 하여 삭제
II. 사업의 내용
1. 사업의 개요
당사는 설립초기부터 바이오의약품 생산용 GMP시설을 구축하였고, GMP 시설과당사의 원천기술인 PanGen CHO-TECH™ 기술, 바이오의약품 제품화 기술을 활용하여 아래와 같이 바이오시밀러 EPO의약품의 생산 및 판매사업, 바이오의약품(비임상,임상시료포함) 위탁생산(CMO) 및 개발기술 이전서비스 (CDO)사업, 바이오의약품 개발 사업을 수행하고 있습니다.
- 바이오시밀러 의약품 생산 및 판매사업 :
·EPO의약품(만성 신부전 환자의 빈혈치료제)
- 바이오 의약품 위탁생산(CMO) 및 개발 기술 이전 사업(CDO) :
·CDMO(Contract Development and Manufacturing Organization)
- 바이오 의약품 개발사업 :
·혈우병A치료제 Factor VIII
·황반변성,황반부종등 치료제 Aflibercept
·중증열성 혈소판 감소 증후군치료제 항SFTSV항체
·항암치료보조제 G-CSF
자체 개발에 성공한 만성 신부전 환자의 빈혈 치료제인 바이오시밀러 EPO의약품은 2019년 1월에 말레이시아 식약청으로부터 제품명 Erysaa로 품목허가를 받아 2019년 3월부터 말레이시아 시장에 판매중에 있으며, 한국은 2019년 11월에 제품명 팬포틴으로 품목허가를 받아 2020년 2월부터 국내 판매를 시작 하였고, 필리핀은 2022년 8월에 4000IU(제품명 Erysaa), 2022년 10월에 2000IU(제품명 Erysaa)에 대한품목허가를 받아 2022년 12월 부터 판매중에 있고, 사우디아라비아는 23년 5월에 품목허가(제품명:Panpotin)를 획득하였고 2024년 3월부터 판매중에 있습니다. 23년 8월에는 한국식약처로부터 EPO고용량 제품(6000IU,10000IU)에 대해 품목 허가를 획득하였고 EPO 고용량 10000IU제품에 대해 23년 12월부터 판매를 시작하였습니다. 태국은 24년 9월에(제품명 Panpotin) 2품목(2000IU,4000IU)에 대해 품목 허가를 획득 하였습니다.
* PanGen CHO-TECH™ 기술이란 바이오의약품 개발을 위한 기반기술인 생산용 세포주 개발기술과 생산공정개발 기술을 포함하는 CHO세포에 특화된 단백질 발현기술로 당사에서 명명한 기술입니다.
2. 주요 제품 및 서비스
가. 주요 제품 등에 관한 사항
당사는 바이오의약품 개발 기술(PanGen CHO-TECH™ 기술) 및 바이오 의약품 제품화 기술, GMP 생산설비를 활용하여 다음과 같은 서비스등을 제공하고 있습니다.
- 의약품 생산 및 판매 :
·만성 신부전 환자의 빈혈치료제인 바이오시밀러 EPO의약품
·말레이시아 (제품명:Erysaa) : EPO 2000IU, 4000IU 품목허가 (2019.1월),
제품판매(2019.3월~)
·한국(제품명:팬포틴) : EPO 2000IU,4000IU 품목허가(2019.11월),
제품판매 (2020.2월~)
고용량EPO(6000IU,10000IU) 품목허가(2023.8월)
제품(10000IU)판매(2023.12월 ~)
·필리핀(제품명:Erysaa) : 품목허가 획득(2022.8월 4000IU, 2022년 10월 2000IU) 제품(4000IU)판매(2022. 12월~)
·사우디아라비아(제품명:Panpotin) : EPO 2000IU,4000IU 품목허가(2023.5월)
제품 판매(2024. 3월~)
·태국(제품명:Panpotin) : EPO 2000IU,4000IU 품목허가(2024.9월)
·튀르키예 - VEM사에 바이오시밀러 EPO 기술이전계약체결(2021년 6월)
- 제품(최종원액, FDS) 판매(2024. 11월 ~)
·베트남 품목허가 신청
- 바이오 의약품(비임상,임상시료포함) 위탁생산 및 개발 기술 이전 서비스등:
·우수한 성능의 재조합 CHO 생산 세포주 구축, 기술이전 (CDO)(로열티부과)
·바이오 의약품 개발에 필요한 생산공정 기술이전(CDO)
·비임상 또는 임상시험용 시료 및 바이오의약품 위탁생산(CMO)
- 바이오 의약품 개발사업 :
·혈우병A치료제 Factor VIII
·황반변성,황반부종등 치료제 Aflibercept
·중증열성 혈소판 감소 증후군치료제 항SFTSV항체
·항암치료보조제 G-CSF
|
바이오시밀러 EPO |
주요 사용 |
-적혈구 형성 자극 인자(Erythropoietin, EPO)로 만성 신부전 환자의 빈혈 치료제임. 즉, 만성 신부전 환자들이 혈액투석이나 복막 투석 중에 일어나는 급성 빈혈을 치료하는 데 사용됨. -그 외에도 증후성 빈혈이나 수혈이 필요한 빈혈에도 활용 가능함. -화학요법을 받는 암 환자에게 나타나는 빈혈치료 -자기혈액 채혈량 증가를 위한 적혈구 생성 촉진 및 대수술이 예정되어 있고 수술전 필요량의 자기 혈액 채혈이 어려운 환자의 헤모글로빈 농도 저하 방지 |
|
주요 기능 및 특징 |
-적혈구 형성 자극 인자는 신장에서 생성되는 당 단백질 성 호르몬으로 신체의 산소요구량에 따라 적혈구 생성을 조절하는 생체물질로 신장기능이 비정상인 만성 신부전 환자에서는 이 자극인자가 생성되지 않아 빈혈이 나타나게 됨. -본 제품은 유전자 재조합 기술을 이용하여 생산된 제제로 골수 중 조혈 조직의 전구세포에 작용 하여 적혈구 원시세포의 분열과 분화를 자극함으로써 적혈구 생성을 유도하게 됨. -만성 신부전 환자 대상으로 초기 투여량은 1회 50 IU/kg을 주 3회, 정맥주사 함. 헤모글로빈의 농도 증감에 따라 투여횟수 변경 또는 투여용량 증감이 가능함. 최적 헤모글로빈의 수준은 10-12 g/dL가 가장 적절한 것으로 알려져 있음. |
|
|
재조합 혈액응고 8인자 (Factor VIII) |
주요 사용 |
-혈우병 A (선천성 혈액응고 8인자 결핍증) 환자에서의 출혈의 조절 및 예방. -일상생활 및 수술 시 출혈 예방. |
|
주요 기능 및 특징 |
-Factor VIII은 인체의 간세포 (Hepatocyte)에서 생성되어 혈관 내를 순환하며, 혈액응고가 필요할 때 활성화 됨. -혈우병은 혈액응고인자 결핍으로 인한 출혈성 질환인데, 혈액 내 응고인자들은 1번 ~ 13번 인자들로 구성되어 있으며, 혈우병은 해당 인자의 유전적 결함으로 발생됨. 혈우병 A는 8인자 결핍이 원인이며, 출생 남아 5,000명당 1명 정도에서 발생하는 것으로 알려짐. 혈우병 B는 9인자 결핍이 원인이며, 출생 남아 20,000명당 1명 정도에서 발생하는 것으로 알려짐. -혈우병의 치료는 부족한 항 응고 인자를 보충해 주는 것으로 8인자와 9인자 제제가 사용되고 있으며, 항체가 생긴 경우에는 우회인자를 투여함. 투여방법에도 출혈이 있을 때 마다 투여하는 보충요법(on-demand)과 평소에 출혈이 발생되지 않더라도 부족한 응고인자를 정기적으로 투여해 출혈을 예방하는 유지요법(prophylaxis)이 있음. -재조합 Factor VIII 제품은 신생아를 포함하여, 성인 및 소아에게 적합하며, 투여용량과 투여기간은 8인자 결핍정도, 출혈 부위 및 정도, 환자의 임상적 상태에 따라 결정됨. 8인자의 투여 단위수는 8인자 활성에 대한 WHO 국제 기준인 International Units (IU)로 표시됨. 보통 재조합 Factor VIII 제품의 예방용 투여용량은 30 ± 5 IU/kg의 용량을 주 3회 예방적으로 투여하는 용법용량을 가짐. |
|
|
바이오시밀러 |
주요 사용 |
-항암치료 환자의 백혈구 증진(항암치료보조제) -고형암(악성임파종, 소세포폐암, 배세포종양(고환종양, 난소종양 등), 신경아세포종, 소아암, 기타암종)에 대해 항암화학요법을 받고 있는 환자의 호중구 감소증 -혈액종양에 대해 항암화학요법을 받고 있는 환자의 호중구 감소증 |
|
주요 기능 및 특징 |
-G-CSF는 골수에 있는 호중구 전구세포에 작용하여 호중구의 기능을 강화시키는 성장 인자이며 각종 고형암 치료를 위한 화학요법 치료와 면역억제요법에 수반되는 호중구 감소증의 치료와 재생불량성 빈혈환자에 나타나는 호중구 감소증의 치료 그리고 골수 세포와 조혈모세포 이식 시 호중구 증가 촉진 및 조혈모세포의 말초조혈모세포의 동원 등에 사용하고 있는 치료용 단백질임. -G-CSF는 골수의 monocyte, fibroblast, endothelial cell에서 생산되는 조혈성장인자로서 감염과 염증부위에서 neutrophil의 대식작용을 증강시키는 기능을 함. -레노그라스팀은 재조합 당화 G-CSF로서 Chinese Hamster Ovary 세포에서 생산된 분자량이 20 kDa이고, 사람 G-CSF와 당화 형태와 생물학적 활성이 유사하며, 비골수성 악성종양 (nonmyelogenous malignacy)의 치료에 있어서 항암요법의 보조치료제로 이용됨. -레노그라스팀은 항암요법의 보조제로 사용될 때의 용량은 150 mcg/m2/day (5 mcg/kg/day)로 항암제 투여를 종료한 다음 날 피하주사로 시작함. 국내에서는 골수이식, 골수이식형성 증후군, 재생불량성 빈혈로 인한 호중구 감소증일 때는 5 mcg/kg/day를 정맥으로 투여하며, chemotheraphy로 인한 호중구 감소증일 때는 2 mcg/kg/day를 피하주사 또는 5 mcg/kg/day를 정맥으로 투여하며, 선천성 또는 특발성 호중구 감소증일 대는 2 mcg/kg/day를 정맥 내 (IV) 또는 피하 (SC)로 투여함. -개발현황: 비임상 완료 |
|
| 바이오시밀러 Aflibercept |
주요 사용 |
- 신생혈관성 (습성) 연령 관련 황반변성의 치료 |
|
주요 기능 및 특징 |
- Aflibercept는 혈관내피인자 수용체 (VEGFR)와 항체의 Fc가 결합된 단백질로 신생혈관성 (습성) 연령관련 황반변성 (AMD) 치료제로 사용되고 있는 약품임. - 연령관련 황반변성은 50세 이상 고령에서 망막 중심부 신경조직인 황반 부위에 변성이 나타나는 질환으로 드루젠(drusen)과 색소이상, 지도모양위축이 나타나는 건성과 맥락막 신생혈관이 동반되는 습성으로 구분됨. - 맥락막에 산소가 부족하고 노폐물로 막히게 되면 신생혈관이 생성되기 쉽고, 신생혈관은 쉽게 터져 황반에 손상을 일으키게 됨. - 습성 연령관련 황반변성은 VEGF에 의해 황반부에 비정상적으로 생성되는 신생혈관과 이로부터 발생하는 출혈, 부종 때문에 시력저하가 발생하므로, 항혈관내피성장인자를 눈 내부에 직접 주사하여 VEGF를 비활성화시킴으로써 이상 혈관의 생성과 체액의 누출을 막는 치료법이 주로 사용되고 있음. - 현재 사용되는 약물로는 아일리아, 루센티스 그리고 아바스틴이 사용되고 있는데, 아일리아와 루센티스는 습성 황반변성 치료제로 FDA 허가를 받은 약물이고, 아바스틴은 다른 질환에 사용되는 약물을 안구 내 주사치료에 사용하고 있음. - 항혈관내피성장인자 주사법은 다른 치료법들보다 습성 황반변성에서 시력의 향상과 보존에 효과가 좋은 것으로 보고되고 있으나 주사 후 효과가 지속되는 기간이 짧아 1 ~ 수개월 간격으로 재치료를 받아야함. - 습성 연령관련 황반변성 치료의 권장용량은 2 mg으로 첫 3개월 동안 매월 1회 주사하고 이후 2개월마다 1회 주사함. 장기 사용 (처음 12개월 사용 이후)시 계속해서 2개월마다 주사하는 것이 권장됨. - 개발현황: 비임상 완료(20년 9월) |
|
|
항 SFTSV 항체 |
주요 사용 |
- 중증열성혈소판감소증후군의 치료 |
|
주요 기능 및 특징 |
- 중증열성혈소판감소증후군 (Severe Fever with Thrombocytopenia Syndrome, SFTS)은 SFTS 바이러스 (SFTSV)에 의해 발생하는 중증의 감염성 질환임. - SFTS는 주로 작은 소피참진드기 (Haemaphysalis longicornis)에 의해 매개되어 발생함. - 이 진드기는 중국, 한국, 일본, 러시아, 호주 등에 주로 분포하는 것으로 알려져 있으며, 해마다 사례 보고가 증가하고 있고, 사망률도 지속적으로 증가하는 추세임. - 인체 감염은 SFTS 바이러스에 감염된 진드기가 사람의 피부에 붙어 흡혈할 때 인체 내로 바이러스가 주입되어 SFTS를 일으키는 것으로 알려져 있음. - SFTS 바이러에 감염되면 발열, 위장관 증상, 호중구 감소증 및 혈소판 감소증 등의 임상증상 및 검사소견을 보이며 회복되지 않는 경우 빠르게 다발성 장기기능 장애로 진행하여 사망에 이름. - 진드기에 물린 후 바이러스의 체내 잠복기는 약 6일에서 14일로, 대부분 사망하는 환자는 증상 발생 후 평균 9일에서 14일 이내에 사망함. - 임상적인 진단은 고열, 혈소판과 백혈구감소증이 동반되면 SFTS 가능성을 의심하고, 실험실적인 진단은 환자의 혈액에서 RT-PCR 유전자 검출 검사를 수행하여 SFTSV RNA를 확인함. - SFTS에 대해서 확실히 효과가 증명된 치료법이 없으므로 경과를 지켜보면서 리바비린 등의 항바이러스제, 고농도의 스테로이드제 치료 및 혈장교환술 등이 시도되고 있음. - 개발중인 항 SFTSV 항체는 혈소판감소증후군을 일으키는 바이러스 (SFTSV)의 외막 당단백질에 특이적으로 결합하여 바이러스를 중화시키는 항체 치료제임. - 동물모델을 통해 그 효과가 검증된 항체 치료제로 향후 비임상 시험을 통해 SFTS에 대한 항체 치료제의 사용량 및 사용주기에 대한 연구가 진행될 예정임. |
나. 주요제품 매출현황
| (단위 :백만원,% ) |
|
품 목 |
제16기 1분기 |
제15기 |
제14기 |
제 품 설 명 |
|||
|---|---|---|---|---|---|---|---|
| 매출액 | 비율 | 매출액 | 비율 | 매출액 | 비율 | ||
| EPO의약품 | 2,959 | 86.0 | 5,642 | 38.5 | 3,410 | 46.6 | 만성신부전환자의 빈혈치료제 |
| 기술이전(CDO) | 262 | 7.6 | 623 | 4.2 | 969 | 13.2 |
바이오의약품 개발기술 이전매출 |
|
위탁생산(CMO) |
0 | 0.0 | 5,646 | 38.5 | 1,593 | 21.8 |
비임상 및 임상시료 위탁생산 서비스 |
|
로열티 |
0 | 0.0 | 1,150 | 7.8 | 271 | 3.7 |
바이오의약품 개발기술 이전 로열티 |
|
기타 |
220 | 6.4 | 1,612 | 11.0 | 971 | 13.3 |
연구용역,Protein 및 KIT판매등 |
|
소계 |
3,441 | 100.0 | 14,673 | 100.0 | 7,214 | 98.6 |
- |
|
상품 |
0 | 0.0 | 0 | 0.0 | 101 | 1.4 | - |
|
합계 |
3,441 | 100.0 | 14,673 | 100.0 | 7,315 | 100.0 |
- |
다. 주요 제품 등의 가격 변동 추이
현재 당사의 매출중 바이오의약품 개발 기술 이전 서비스(CDO)의 경우 생산세포주 및 생산공정 기술 이전 서비스 가격은 건당 7~8억원(로열티 별도) 내외의 가격이 형성되어 있고, 위탁생산(CMO) 서비스 가격은 생산 batch수, 생산기간, 생산공정등의 여러 계약조건에 에 따라 결정되며, EPO제품은 각 국가별, 용량별 가격이 상이하며 국내의 경우 최근 약 2년간 2~3%의 의료보험약가 인하가 있었습니다.
3. 원재료 및 생산설비
가. 매입현황
| (단위 :천원 ) |
|
구 분 |
제16기1분기 | 제15기 | 제14기 | |
|---|---|---|---|---|
|
(2025년1분기) |
(2024년) |
(2023년) |
||
|
상 품 |
국 내 |
- | - | 142,540 |
|
수 입 |
- | - | - | |
|
소 계 |
- | - | 142,540 | |
| 재료비등 |
국 내 |
600,357 | 1,613,425 | 1,685,721 |
|
수 입 |
- | - | - | |
|
소 계 |
600,357 | 1,613,425 | 1,685,721 | |
|
외주시험비,용역비등 |
국 내 |
429,968 | 1,366,673 | 792,199 |
|
수 입 |
- | - | - | |
|
소 계 |
429,968 | 1,366,673 | 792,199 | |
|
합 계 |
국 내 |
1,030,325 | 2,980,098 | 2,620,460 |
|
수 입 |
- | - | - | |
|
합 계 |
1,030,325 | 2,980,098 | 2,620,460 | |
주1) 재료비 및 외주시험비는 당사의 GMP 설비를 활용하여 EPO의약품 및 CDMO위탁 생산등을 하는데 소요되는 원료 및 시약, 소모품, 실험도구와 이에 대한 위탁 시험비 등 입니다.
나. 원재료 가격변동추이
| (단위 :천원 ) |
| 품 목 |
제16기1분기 |
제15기 |
제14기 (2023년) |
|---|---|---|---|
|
PowerCHO-2 CD Medium (1 L/병) |
170 | 170 | 160 |
|
PowerCHO-2 CD Medium (20 L bag) |
2,550 | 2,550 | 2,025 |
| XDA-200 L bag | - | 6,089 | 6,089 |
| XDA-200 L bag(ReadyKleer) | 10,483 | 10,168 | - |
| XDA-50 L bag(ReadyKleer) | 7,391 | 7,183 | - |
|
Kinetic-QCL Lysate |
165 | 165 | 159 |
|
LAL Reagent Water, 30 mL |
1,680 | 1,680 | 1,506 |
|
resDNASEQTM Quantitative CHO DNA kit |
4,057 | 3,938 | 3,934 |
바이오의약품 생산 및 연구개발에 사용되는 원재료, 부재료, 시약 및 실험소모품 등은 대부분 장기간 동안 지속적인 반복 구매를 하게 됩니다. 국내 대리업체를 통해 수입되는 품목이 많아 해외 제조사의 제조원가 상승에 따른 가격 인상 정책 또는 환율 변동에 따라 가격이 변동하게 되며, 구입시마다 거래처와의 협의를 통해 가격을 결정하게 됩니다.
다. 생산능력과 생산 실적
당사는 만성 신부전 환자의 빈혈치료제인 바이오시밀러 EPO의약품을 자체 개발하여 직접 의약품을 생산, 판매하고 있습니다. 기 확보한 GMP 생산시설에서 캠페인 생산 기법으로 첫 번째 제품인 바이오시밀러 EPO의약품 생산과 판매 그리고 위탁생산(CMO) 사업을 병행해서 GMP생산시설을 가동하고 있습니다.
당사가 자체 개발에 성공한 바이오시밀러 EPO의약품의 경우 원료의약품의 유효기간을 5년으로 확보함에 따라 제품의 생산 및 판매 계획을 장기적으로 수립할 수 있고 판매 계획에 따라 생산계획을 보다 신축적으로 운영할 수 있습니다.
당사는 GMP내에서 일회용 바이오리엑터 장비를 운용중에 있으며 일회용 바이오리엑터 장비 운용으로 인해 다품목의 생산이 가능하여 GMP생산시설의 가동율을 극대화 할 수 있습니다. 당사가 보유한 GMP 생산시설에서 바이오시밀러 EPO의약품의 생산능력은 아래 표와 같습니다.
| [바이오시밀러 EPO 연간 배양 생산능력] |
| 사업부문 | 품 목 | 연간생산능력(배치) | |
|---|---|---|---|
| 200L | 500L | ||
| 의약품생산 | 바이오시밀러 EPO | 48배치 | 48배치 |
연간생산능력 산출근거
- 연간 가동일수 : 320일(설비유지보수 45일 제외)
- 작업성공율 : 90%(작업자 실수 및 기계장치 오류에 따른 실패율 10% 추정)
- 1배치당 배양 소요일수(200L,500L) : 6일
- 연간 배양 생산능력
200L 배양기 (320일 / 6일) X 90% = 48배치
500L 배양기 (320일 / 6일) X 90% = 48배치
- 상기 연간 배양 생산능력은 각 배치별 생산시간 간격, 성공율, 생산제품의 수 등,
다양한 요인에 의해 변동될 수 있습니다.
라 생산 및 연구소등 설비에 관한 사항
(1) 현황
| (단위 :천원) |
| 사업소 | 소유 형태 |
소재지 | 용도 |
자산별 |
2025년 기초 장부가액 |
2025년1분기 증감액 |
2025년 1분기 상각액 |
2025년 1분기말 장부가액 |
|
|---|---|---|---|---|---|---|---|---|---|
|
증가 |
감소 |
||||||||
|
본사 |
자가 | 수원 (영통) |
제조공장 |
토지 |
636,662 | - | - | - | 636,662 |
|
건물 |
1,736,327 | - | - | 12,048 | 1,724,279 | ||||
|
생산설비등 |
1,182,499 | 44,700 | - | 98,121 | 1,129,078 | ||||
| 소계 | 3,555,488 | 44,700 | - | 110,169 | 3,490,019 | ||||
| 연구소 | 토지 | 367,769 | - | - | - | 367,769 | |||
| 건물 | 898,441 | - | - | 5,233 | 893,208 | ||||
| 연구설비등 | 233,993 | 60,000 | - | 33,643 | 260,350 | ||||
| 소계 | 1,500,203 | 60,000 | - | 38,876 | 1,521,327 | ||||
| 본사사무실 | 토지 | 169,248 | - | - | - | 169,248 | |||
| 건물 | 420,524 | - | - | 2,265 | 418,259 | ||||
| 소계 | 589,772 | - | - | 2,265 | 587,507 | ||||
| 합 계 | 5,645,463 | 104,700 | - | 151,310 | 5,598,853 | ||||
(2)설비의 투자 계획
당사는 바이오 의약품 개발단계에서 사전에 생산시설(GMP설비, 생산설비, 자가공장)을 조기에 확보하여 제품 생산에 필요한 대규모 투자는 필요하지 않고 일부 생산 및 시험장비등의 보완 투자가 발생할 수 있습니다.
4. 매출 및 수주상황
가. 매출 실적
| (단위 :백만원 ) |
|
매출유형 |
품 목 |
제16기1분기 | 제15기 | 제14기 | |
|---|---|---|---|---|---|
|
(2025년1분기) |
(2024년) |
(2023년) |
|||
| 제 조 | EPO의약품 |
수출 |
2,618 | 5,019 | 2,382 |
|
국내 |
341 | 623 | 1,028 | ||
|
소계 |
2,959 | 5,642 | 3,410 | ||
| 기술이전 서비스등 |
기술이전 |
수출 |
0 | 0 | |
|
국내 |
262 | 623 | 969 | ||
|
소계 |
262 | 623 | 969 | ||
|
위탁생산 |
수출 |
0 | 0 | ||
|
국내 |
5,646 | 1,593 | |||
|
소계 |
0 | 5,646 | 1,593 | ||
|
로열티 |
수출 |
693 | 0 | ||
|
국내 |
457 | 271 | |||
|
소계 |
0 | 1,150 | 271 | ||
|
기타 |
수출 |
94 | 192 | ||
|
국내 |
220 | 1,518 | 779 | ||
|
소계 |
220 | 1,612 | 971 | ||
|
상 품 |
수출 |
0 | 87 | ||
|
국내 |
0 | 14 | |||
|
소계 |
0 | 0 | 101 | ||
|
합 계 |
수출 |
2,618 | 5,806 | 2,661 | |
|
국내 |
823 | 8,867 | 4,654 | ||
|
소계 |
3,441 | 14,673 | 7,315 | ||
나. 수주상황
당사의 바이오시밀러 EPO의약품 및 바이오의약품(비임상,임상시료포함) 위탁생산(CMO) 및 개발기술 이전 서비스(CDO)등과 관련된 주요 수주현황은 다음과 같습니다.
| 기준일:2025.3.31 | (단위 :천원,$ ) |
| 품목 | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
|---|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
| CDO | 23.06.26 | 25.04.30 | - | 1,090,909 | - | 1,088,866 | - | 2,043 |
| CDO | 24.10.14 | 26.01.12 | - | 640,000 | - | 258,593 | - | 381,407 |
| CDO | 25.02.28 | 25.12.31 | - | 817,000 | - | 82,914 | - | 734,086 |
| EPO의약품(수출) | - | - | - | 5,357,744 $3,657,215 |
- | 2,617,838 $1,788,885 |
- | 2,739,906 $1,868,330 |
| EPO의약품(내수) | - | - | - | 964,017 | - | 964,017 | - | - |
| 시험용역 | 23.09.14 | 26.09.13 | - | 440,000 | - | 320,000 | - | 120,000 |
| 시험용역 | 24.03.07 | 28.03.06 | - | 93,000 | - | 57,910 | - | 35,090 |
| 시험용역 | 24.07.08 | 30.07.07 | - | 495,400 | - | 205,000 | - | 290,400 |
| 시험용역 | 24.11.11 | 25.04.10 | - | 31,990 | - | 31,990 | - | - |
| 시험용역 | 24.12.03 | 25.06.03 | - | 23,000 | - | 23,000 | - | - |
| 시험용역 | 25.02.21 | 27.02.20 | - | 173,377 ($118,225) |
- | -- | - | 173,377 ($118,225) |
| 기타 | - | - | - | 71,964 | - | 49,091 | - | 22,873 |
| 합 계 | 10,198,401 | 5,699,219 | 4,499,182 | |||||
주1) 기납품액은 수주일로부터 2025년 3월 31일까지 매출인식 완료한 합계금액 입니다.
주2) 수주잔고 외화평가시 적용환율은 1$=1,466.5원 입니다.(2025.3.31 서울외국환중개고시)
주3) EPO의약품은 수시 발주가 이루어져 수주일자 및 납기일을 생략 했습니다.
다. 판매경로 및 판매방법
(1) 판매조직
당사는 자체적인 판매조직은 없으며 공동임상에 참여한 파트너사에게 해당 국가의 판권을 부여하고 있으며 기타 국가의 경우 해당 국가의 주요 제약사들과 판권계약을 통해 판매를 담당하도록 하고 있습니다.
현재 바이오시밀러 EPO 제품과 관련하여 당사와 판권계약 체결을 완료한 파트너사는 아래와 같습니다.
|
제품 |
판매 파트너사 |
|---|---|
|
바이오시밀러 EPO |
말레이시아,브루나이,싱가폴: Duopharma Sdn Berhad사 태국: S.Charoen 사 필리핀:DB PHILIPPINES사 |
(2)판매경로
바이오시밀러 EPO의약품 및 위탁생산(CMO)의 경우 판매경로는 고객사나 판매파트너스와의 공급계약에 의해 생산된 완제의약품(DP), 최종원액(FDS), 원료의약품(DS) 또는 시료를 고객사나 판매파트너스가가 지정한 장소에 운송을 통하여 판매하고 있으며, 대리점 등 별도의 판매경로를 이용하고 있지 않습니다.
(3) 판매방법 및 조건
당사의 바이오시밀러 EPO의약품 및 CDMO의 수주시 판매 방법, 판매 조건은 고객사나 판매파트너사와의 계약을 통해 개별적으로 결정됩니다. EPO의약품의 경우 판매파트너사의 구매요청(PO)한 제품에 대하여 판매파트너사가 지정한 기일, 지정한 장소에 인도하고, 대금은 청구(인도)후 수출은 60~90일 이내, 국내는 180일 이내에 회수하고 있습니다. CDMO 사업은 고객과 계약후 약 1년 내외에 관련 용역의 개발 및 생산을 진행하며 대금은 진행 단계별로 청구하여 청구후 30~60일 이내에 현금으로 회수하고 있습니다.
5. 위험관리 및 파생거래
당사의 주요 금융부채는 매입채무및기타채무, 전환사채, 리스부채 및 기타금융부채로 구성되어 있으며, 이러한 금융부채는 영업활동 및 재무활동으로 발생하였습니다. 또한 당사는 영업활동에서 발생하는 현금및현금성자산, 매출채권및기타채권 등과 같은 금융자산도 보유하고 있습니다.
당사의 금융자산 및 금융부채에서 발생할 수 있는 주요 위험은 시장위험, 신용위험 및 유동성위험입니다. 당사의 주요 경영진은 아래에서 설명하는 바와 같이, 각 위험별 관리절차를 검토하고 정책에 부합하는지 검토하고 있습니다. 또한 당사는 투기 목적의 파생상품거래를 실행하지 않는 것이 기본적인 정책입니다.
가. 시장위험
시장위험은 시장가격의 변동으로 인하여 금융상품의 공정가치가 변동할 위험입니다. 시장위험은 이자율위험, 환위험 및 기타 가격위험의 세가지 유형으로 구성됩니다.
(1) 이자율위험
이자율위험은 시장이자율의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험입니다. 당사는 내부적으로 이자율 1% 변동을 기준으로 이자율위험을 측정하고있으며, 상기의 변동비율은 합리적으로 발생가능한 이자율변동위험에 대한 경영진의 평가
를 반영하고 있습니다.
당분기말 현재 변동이자율이 적용되는 차입금은 없으므로, 이자율변동이 금융부채의 현금흐름에 미치는 영향은 없습니다.
(2) 환위험
환위험은 환율의 변동으로 금융상품의 공정가치나 미래현금흐름이 변동할 위험입니다. 보고기간말 현재 기능통화 이외의 외화로 표시된 화폐성자산 및 부채의 장부금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 자산 | 부채 | 자산 | 부채 | |
| USD | 2,105,604 | 4,619 | 2,271,005 | - |
당사는 내부적으로 원화 환율 변동에 대한 환위험을 정기적으로 측정하고 있습니다. 보고기간말 현재 각 외화에 대한 기능통화의 환율 5% 변동시 환율변동이 당분기 및 전기 손익에미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전 기 | ||
|---|---|---|---|---|
| 5% 상승시 | 5% 하락시 | 5% 상승시 | 5% 하락시 | |
| USD | 105,049 | (105,049) | 113,550 | (113,550) |
상기 민감도 분석은 당분기말과 전기말 현재 기능통화 이외의 외화로 표시된 화폐성 자산 및부채를 대상으로 하였습니다.
(3) 기타 가격위험
기타 가격위험은 이자율위험이나 환위험 이외의 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험이며, 당사는 당분기말 현재 금융상품 중 상장지분상품 등을 보유하고 있지 않습니다.
나. 신용위험
신용위험은 거래상대방이 의무를 이행하지 않아 당사에 재무손실이 발생할 위험입니다.
당사는 신용위험을 관리하기 위하여 금융자산의 신용보강을 위한 정책과 절차를 마련하여운영하고 있으며, 회수가 지연되는 금융자산에 대하여는 회수지연 현황 및 회수대책이 보고된 후 지연사유에 따라 적절한 조치를 취하고 있습니다. 또한, 거래상대방의 신용에 따라 필요한 경우 담보 및 기타 신용보강을 요구하고 있습니다.
보고기간말 현재 당사의 신용위험에 대한 최대노출정도는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 현금성자산(*) | 2,051,606 | 1,428,994 |
| 매출채권및기타채권 | 3,011,897 | 2,961,065 |
| 계약자산 | 14,003 | - |
| 기타유동금융자산 | 9,177,968 | 10,301,909 |
| 기타비유동금융자산 | 97,649 | 95,685 |
| 합 계 | 14,353,123 | 14,787,653 |
(*) 당분기말 현재 현금시재액은 없으며, 전기말 현금시재액 1,120천원은 제외하였습니다.
당사는 매출채권및수취채권, 계약자산에 대해 손실충당금을 인식하였으며(주석 7,8참조),이외의 금융자산에 대해서는 채무불이행위험이 없다고 판단하여 기대신용손실을 인식하지 않았습니다.
다. 유동성위험
유동성위험은 만기까지 모든 금융계약상의 약정사항들을 이행할 수 있도록 자금을 조달하지 못할 위험입니다.
당사는 유동성 전략 및 계획을 통하여 자금부족에 따른 위험을 관리하고 있으며, 금융상품의 만기와 영업현금흐름의 추정치를 고려하여 금융자산과 금융부채의 만기를 대응시키고 있습니다.
보고기간말 현재 금융부채별 상환계획으로서 할인되지 않은 계약상의 금액은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 1년 이내 | 1년~5년 | 5년 이후 | 합 계 | |
|---|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 647,562 | - | - | 647,562 |
| 전환사채(*) | - | 1,100,000 | - | 1,100,000 | |
| 리스부채 | 1,473 | - | - | 1,473 | |
| 비유동 | 리스부채 | - | 396 | - | 396 |
| 기타금융부채 | - | 30,000 | - | 30,000 | |
| 합 계 | 649,035 | 1,130,396 | - | 1,779,431 | |
(*) 상기 전환사채의 만기구조는 계약 만기까지 사채권자의 전환권이 행사되지 않을 경우를 가정한 것입니다.
<전 기>
| (단위: 천원) |
| 구 분 | 1년 이내 | 1년~5년 | 5년 이후 | 합 계 | |
|---|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 1,219,478 | - | - | 1,219,478 |
| 전환사채(*) | - | 1,100,000 | - | 1,100,000 | |
| 리스부채 | 1,964 | - | - | 1,964 | |
| 비유동 | 리스부채 | - | 396 | - | 396 |
| 기타금융부채 | - | 30,000 | - | 30,000 | |
| 합 계 | 1,221,442 | 1,130,396 | - | 2,351,838 | |
(*) 상기 전환사채의 만기구조는 계약 만기까지 사채권자의 전환권이 행사되지 않을 경우를 가정한 것입니다.
라. 자본관리
자본관리의 주 목적은 당사의 영업활동을 유지하고 주주가치를 극대화하기 위하여 높은 신용등급과 건전한 자본비율을 유지하기 위한 것입니다.
당사는 자본구조를 경제환경의 변화에 따라 수정하고 있으며, 이를 위하여 배당정책을 수정하거나 자본감소 혹은 신주발행을 검토하도록 하고 있습니다. 한편, 당분기 중 자본관리의목적, 정책 및 절차에 대한 어떠한 사항도 변경되지 않았습니다.
당사는 총부채를 자기자본으로 나눈 부채비율을 사용하고 있으며, 보고기간말 현재 총부채 및 자기자본은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 총 부 채 | 5,261,939 | 5,635,969 |
| 자기자본 | 25,644,952 | 24,908,713 |
| 부채비율 | 20.52% | 22.63% |
6. 주요계약 및 연구개발활동
가. 경영상의 주요계약
주요 라이선스-아웃(License-out) 계약
|
품목 |
계약상대방 |
대상지역 |
계약체결일 |
계약종료일 |
총계약금액 |
진행단계 |
|
(1)단백질치료제 |
Beijing Tide Pharmaceutical (중국) |
중국 |
2013.11.28 |
매출발생시점부터 7년간 |
USD667,000 |
임상1상 |
|
(2)항체치료제 |
Beijing Tide Pharmaceutical (중국) |
중국 |
2014.05.30 |
매출발생시점부터 7년간 |
USD778,000 |
IND제출 |
|
(3)혈우병치료제 (Factor VII) |
Beijing Northland Biotech (중국) |
중국 |
2015.03.26 |
매출발생시점부터 10년간 |
CNY3,000,000 |
비임상 |
|
(4)빈혈치료제 (EPO) |
VEM Ilac San. ve Tic. A.S (튀르키예) |
튀르키예 | 2021.06.08 | 제품매출발생시점부터 10년간 | USD3,000,000 | 품목허가승인 |
(1) 품목: 단백질 치료제
|
계약상대방 |
Beijing Tide Pharmaceutical(중국) |
|
계약내용 |
단백질 치료제 생산세포주 기술이전계약 |
|
대상지역 |
중국 |
|
계약기간 |
계약일:2013.11.28 로열티 계약종료일: 매출발생시점으로부터 7년간 |
|
총계약금액 |
USD 667,000 |
|
수취금액 |
USD 667,000 |
|
계약조건 |
로열티는 순매출액의2%로 7년간 |
|
회계처리방법 |
계약금 수취금액 수익인식 |
|
대상기술 |
PanGen CHO-Tech 기술(바이오의약품 개발기술) |
|
개발진행경과 |
임상 1상 진행중 |
|
기타사항 |
- |
(2) 품목: 항체 치료제
|
계약상대방 |
Beijing Tide Pharmaceutical(중국) |
|
계약내용 |
항체 치료제 생산세포주 기술이전계약 |
|
대상지역 |
중국 |
|
계약기간 |
계약일:2014.05.30 로열티 계약종료일: 매출발생시점으로부터 7년간 |
|
총계약금액 |
USD 778,000 |
|
수취금액 |
USD 778,000 |
|
계약조건 |
로열티는 순매출액의2%로 7년간 |
|
회계처리방법 |
계약금 수취금액 수익인식 |
|
대상기술 |
PanGen CHO-Tech 기술(바이오의약품 개발기술) |
|
개발진행경과 |
IND제출 |
|
기타사항 |
- |
(3) 품목: 혈우병치료제(Factor VII)
|
계약상대방 |
Beijing Northland Biotech(중국) |
|
계약내용 |
혈우병치료제인 Factor VII인자 생산세포주 기술이전계약 |
|
대상지역 |
중국 |
|
계약기간 |
계약일:2015.03.26 로열티 계약종료일: 매출발생시점으로부터 10년간 |
|
총계약금액 |
CNY 3,000,000 |
|
수취금액 |
CNY 2,700,000 |
|
계약조건 |
로열티는 순매출액의 2%로 10년간 |
|
회계처리방법 |
계약금, 중도금 수취금액 수익인식 |
|
대상기술 |
PanGen CHO-Tech 기술(바이오의약품 개발기술) |
|
개발진행경과 |
비임상 |
|
기타사항 |
잔금 미수령액 CNY 300,000은 중국 임상 IND 승인 시 수령 |
(4) 품목: 빈혈치료제(EPO)
|
계약상대방 |
VEM Ilac San. ve Tic. A.S(튀르키예) |
|
계약내용 |
바이오시밀러 EPO 제품 생산기술 이전계약 |
|
대상지역 |
튀르키예 |
|
계약기간 |
계약체결일: 2021.06.08 로열티 계약종료일: 자체 제품출시후 10년간 |
|
총계약금액 |
USD 3,000,000(1단계 $1,500,000, 2단계 $1,500,000) |
|
수취금액 |
USD 1,500,000(1단계완료) |
|
계약조건 |
로열티는 순매출액의 2% |
|
회계처리방법 |
수취금액 수익인식 |
|
대상기술 |
바이오시밀러 EPO 제품 생산기술 |
|
개발진행경과 |
품목허가 승인(24.07) |
|
기타사항 |
- |
주요 라이선스-인(License-in) 계약
|
품목 |
계약상대방 |
대상지역 |
계약체결일 |
계약종료일 |
총계약금액 |
진행단계 |
|
중증열성혈소판감소 |
Y-Clone Medical Science |
전세계 | 2020.01.20 | - |
USD555,600 |
생산세포주 및 공정기술완료 비임상진행중 한국, 일본, 중국 특허등록 |
(1) 중증열성혈소판 감소증후군 치료제(항SFTSV항체)
|
계약상대방 |
Y-Clone Medical Science(중국) |
|
계약내용 |
중증열성혈소판 감소증후군 치료제(항SFTSV항체) 공동 개발 |
|
대상지역 |
전세계 |
|
계약기간 |
계약체결일: 2020.01.20 |
|
총계약금액 |
USD 555,600 |
|
지급금액 |
USD 555,600 |
|
계약조건 |
특허 공동소유, 공동개발 및 전세계 독점 상업화 |
|
회계처리방법 |
특허권 처리 |
|
대상기술 |
중증열성혈소판 감소증후군 치료용 항체 |
|
개발진행경과 |
생산세포주 및 공정기술완료(2020.08), 비임상 진행중 |
|
기타사항 |
- 특허등록(중국(CN.112105637), 한국(KR.10-2504884), |
판권계약
|
품목명 |
계약상대방 |
대상지역 |
계약체결일자 |
계약종료일 |
계약금액 |
지급금액 |
계약의 내용 |
|
바이오시밀러 |
Duopharma Sdn Berhad |
말레이시아,외2개국 |
2012.06.19 |
N/A |
- |
- |
EPO의약품 유통계약 |
| DB Philippines | 필리핀 | 2024.06.28 | N/A |
- |
- |
EPO의약품 유통계약 | |
|
S. Charoen |
태국 |
2015.08.31 |
등록 후 5년 |
- |
- |
EPO의약품 유통계약 | |
| Saudi Vax | Saudi외GCC 5개국 | 2019.04.03 | 등록 후 5년 | - | - | EPO의약품 유통계약 | |
| (주)중헌제약 | 한국 | 2020.01.06 | 2025.12.31 | - | - | EPO의약품 유통계약 | |
| Khuong Duy Pharma | 베트남 | 2020.02.10 | 등록 후 5년 | - | - | EPO의약품 유통계약 | |
| VEM Ilac San. ve Tic. A.S |
튀르키예 |
2021.06.08 |
등록 후 10년 |
- |
- |
EPO의약품 유통계약 | |
| Ismailiya | 이라크 | 2025.02.21 |
등록 후 3년 |
- |
- |
EPO의약품 유통계약 |
나. 연구개발 활동
(1) 연구개발 조직 개요
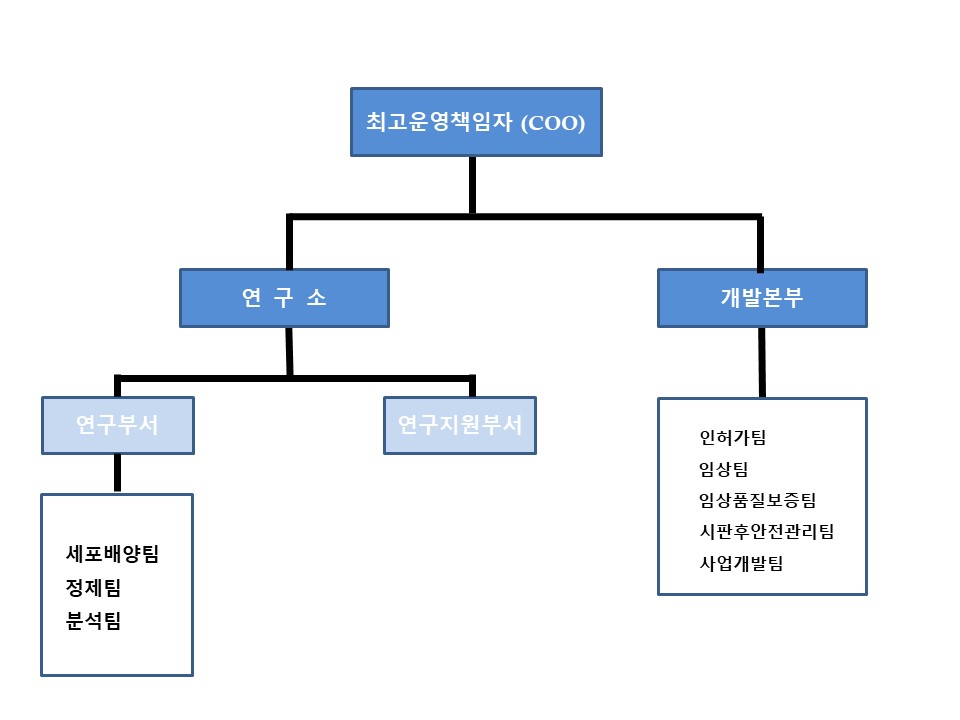 |
|
연구부서 조직도(2023.09) |
당사의 연구개발조직은 COO 아래 연구소와 개발본부로 구성되어 있으며 연구소의 2개 부서와 개발본부의 5개 팀에서 바이오의약품 개발에 필수적인 원천기술 및 연구프로젝트 사업화를 수행하고 있습니다. 연구소에서는 바이오의약품 개발관련 원천기술을 이용하여 주로 치료용 항체 및 치료용 단백질 바이오의약품을 대상으로 생산용 세포주를 개발하고 생산공정(배양, 정제 및 품질관리) 기술 개발을 수행하여 바이오의약품 개발 기술이전 서비스를 수행하는 한편 당사가 추진 중인 바이오의약품 제품의 공정을 개발하고 있습니다. 개발부서에서는 개발된 바이오의약품의 허가 등록, 비임상, 임상 진행, 신규품목 선정 및 기술이전 사업화 기능을 수행합니다.
|
조 직 |
역 할 |
|
|---|---|---|
|
최고운영책임자(COO), |
연구개발 운영 총괄 |
|
|
연구소장 |
연구 개발 총괄 |
|
|
연구소 |
연구부서 분석팀) |
- 바이오의약품 생산 세포주 개발 - 바이오의약품 배양공정기술 개발 |
| 연구지원부서 | - 연구지원 | |
|
개발 본부 |
인허가팀 |
- 바이오의약품 국내외 허가 등록 |
| 임상팀 | - 바이오의약품 임상 실시 | |
| 임상품질보증팀 | - 바이오의약품 임상의 품질 보증 | |
| 시판후안전관리팀 | - 바이오의약품 시판후 안정성정보 수집 관리 | |
|
사업개발팀 |
- 신규 바이오의약품 발굴 | |
(2) 연구개발 인력현황
당사는 보고서 작성 기준일 현재 연구개발 인력현황은 아래와 같습니다.
| (기준일 :2025.3.31현재) | (단위: 명) |
| 구 분 | 인원수 | ||||
| 박사 | 석사 | 기타 | 합 계 | ||
| 연구개발 인력현황 |
제1부설연구소 | 4 | 8 | 5 | 17 |
| 개발부서 | - | 2 | 3 | 5 | |
| 합 계 | 4 | 10 | 8 | 22 | |
(3) 핵심연구인력 현황
당사의 핵심 연구 인력은 연구소장인 박정수 상무 그리고 바이오시밀러 EPO의약품 및 FACTORⅧ 개발과 관련하여 프로젝트 매니저 역활을 수행하고 있는 개발본부 이종민 상무 이며 주요 경력 및 연구 실적은 아래와 같습니다.
| 직위 | 성명 | 담당업무 | 주요경력 | 주요연구실적 |
|---|---|---|---|---|
| 연구소장 (상무) |
박정수 | 연구개발총괄 (바이오의약품 생산세포주개발등) |
경희대 유전공학과 박사(01) 아주대 의대 연구실(95~00) |
1.특허 -RNA molecule biding to Anti-DNA autoantibody specifically, (KR1020010076989) -동물세포발현벡터(KR1020120033467) 2. 대표논문 -Unstable expression of recombinant antibody during long-term culture of CHO cells is accompanied by histone H3 hypoacetylation. Biotechnol. Lett. 2013; 35(7):987-993외 |
| 개발본부장 (상무) |
이종민 | EPO, FACTORⅧ 임상 및 허가등록 | 고려대 유전공학과 석사(91) 녹십자 책임연구원(93~03) 삼성정밀화학 책임연구원(03~05) |
1.특허 -Purification method of factor VIII by using chimeric antibody against von Willebrand factor, (KR1002545740000) -Mutein of human Interferon-beta and its preparation method(PCT/KR2004/000738) 2. 대표논문 -Purification of Recombinant Human B-Domain-Deleted Factor VIII Using Anti-factor VIII Monoclonal Antibody Selected by the surface plasmon Resonance Biosensor. Biotechnol. Prog. 17, 1119-1127외 |
(4) 연구개발비용
당사의 최근 3년간 연구개발비용은 아래와 같습니다.
| (단위: 천원) |
|
구 분 |
제16기1분기 | 제15기 | 제14기 | ||
|---|---|---|---|---|---|
|
(2025년1분기) |
(2024년) |
(2023년) |
|||
| 연구개발품목 | EPO 의약품 |
재료비등 | 0 | 1,130 | 139,297 |
| 위탁용역+시험비등 | 0 | 65,063 | 173,337 | ||
| 기 타 | 0 | 5 | 3,640 | ||
| 소계 | 0 | 66,198 | 316,274 | ||
| FactorⅧ | 재료비등 | 327 | 10,004 | 1,384,173 | |
| 위탁용역+시험비등 | 0 | 0 | 10,234 | ||
| 기 타 | 445 | 0 | 2,765 | ||
| 소계 | 772 | 10,004 | 1,397,172 | ||
| Aflibercept | 재료비등 | 2,213 | 3,449 | 3,007 | |
| 위탁용역+시험비등 | 0 | 0 | 0 | ||
| 기 타 | 2,418 | 9,383 | 8,768 | ||
| 소계 | 4,631 | 12,832 | 11,775 | ||
| 기타 | 재료비등 | 109,333 | 366,299 | 461,886 | |
| 위탁용역+시험비등 | 3,448 | 34,227 | 17,286 | ||
| 기 타 | 48,923 | 323,686 | 344,303 | ||
| 소계 | 161,704 | 724,212 | 823,475 | ||
| 인건비등(공통) | 298,666 | 1,253,221 | 1,235,015 | ||
| 연구개발비용 합계 | 465,773 | 2,066,467 | 3,783,711 | ||
| 회계처리내역 | 판매비와관리비 | 465,773 | 2,011,948 | 3,332,047 | |
| 개발비(무형자산) | 0 | 0 | 0 | ||
| 회계처리금액 계 | 465,773 | 2,011,948 | 3,332,047 | ||
| 정부보조금 | 0 | 54,519 | 451,664 | ||
| 연구개발비용 합계 | 465,773 | 2,066,467 | 3,783,711 | ||
| 연구개발비 / 매출액 비율 [연구개발비용합계 / 당기매출액 X 100) |
13.53% | 14.08% | 51.72% | ||
2018년에 금융위원회에서 발표한 "제약 바이오 기업의 연구개발비 회계처리 관련 감독지침"에 따라 처리하고 있으며 2018년~2024년 3분기중에 자산화한 연구개발비는 없고, 연구개발비에 대한 세부내역은 III. 재무에 관한 사항 5.재무제표주석 중 14. 무형자산을 참조하여 주시기 바랍니다.
(5). 연구개발실적
당사는 바이오의약품 개발기술인 PanGen CHO-TECH™기술과 바이오의약품 제품화 기술을 활용하여 다음과 같은 제품들의 개발을 진행하고 있습니다.
|
핵심기술 |
개발 제품 |
적응증 |
연구시작일 |
개발결과 |
현 개발단계 |
|---|---|---|---|---|---|
|
PanGen CHO-TECH™ 기술 및 바이오의약품 제품화 기술 |
고용량 바이오시밀러 EPO (용량 6000IU,10000IU) |
빈혈치료제 | 2021.12 | 안정성시험24M완료 | 고용량 PV 생산 완료 안정성시험 진행중 품목허가신청(22년 12월) 품목허가승인(23년 08월) |
|
재조합 Factor VIII (PGA40) |
혈우병A치료제 |
2014.02 |
개발후보 선정 세포주 개발 공정개발 비임상, 임상1상 |
비임상완료(17년 7월) |
|
|
바이오시밀러 G-CSF (PHA30) |
항암치료보조제 |
2013.01 |
개발후보 선정 세포주 개발 공정 개발 비임상시험완료 |
비임상완료(15년 2월) |
|
| 바이오시밀러 Aflibercept (PCH250) |
황반변성,황반부종등 치료제 |
2018.11 |
개발후보 선정 세포주 개발 공정 개발 |
비임상 완료(20년 9월) | |
| 항SFTSV항체 (PAK255) |
중증열성혈소판감소 증후군치료제 |
2020.01 | 생산세포주및 공정개발완료 |
생산세포주및 공정개발완료 비임상진행중 |
|
|
PanGen CHO-TECH™ 기술 |
바이오의약품 개발기술이전서비스 |
- |
- |
특허출원 6 특허등록 26 |
사업화 |
가) 품 목 : 고용량(6000IU, 10000IU) 바이오시밀러 EPO
| 구 분 |
바이오 시밀러 |
| 적 응 증 | - 신장 투석 환자 (만성 신부전)의 투석 중 일어나는 급성 빈혈 - 화학항암 요법 중 나타나는 빈혈 - 그 외 수혈이 필요한 환자 |
| 작용기전 |
- 적혈구 형성 자극 인자는 신장에서 생성되는 당 단백질 성 호르몬으로 신체의 산소요구량에 따라 적혈구 생성을 조절하는 생체물질로 신장기능이 비정상인 만성 신부전 환자에서는 이 자극인자가 생성되지 않아 빈혈이 나타나게 됨. - 본 제품은 유전자 재조합 기술을 이용하여 생산된 제제로 골수 중 조혈 조직의 전구세포에 작용 하여 적혈구 원시세포의 분열과 분화를 자극함으로써 적혈구 생성을 유도하게 됨. |
| 제품의 특성 | - 오리지널 EPREX 와 약동학, 약력학, 독성 동등성 확보 - 세계 2번째 Epoetin alfa 성분의 바이오시밀러 제품(대조약 EPREX) - 세계 최초 바이오시밀러 제품인 Binocrit® 에 비해 대조약과의 품질비교에서 동등성이 뛰어남 |
| 진행경과 | - 바이오시밀러 EPO 2000IU, 4000IU 두 제품에 대해 말레이시아 국영제약사인 DUOPHARMA BIOTECH BERHAD사의 자회사인 DUOPHARMA(M)사와 공동으로 한국과 말레이시아에서 임상3상시험을 진행 하여 2017년 9월에 임상 3상을 종료하였습니다. 2017년 3월에 말레이시아 식 약청에, 2018년 5월에는 한국 식약처에 품목허가(NDA)를 신청하였고, 2019년 1월에 말레이시아 식약청으로 부터 품목허가를 받았고 2019년 11월에 한국 식약처로부터 품목허가를 받아 말레이시아 시장은 2019년 3월부터, 한국 시장은 2020년 2월부터 판매를 시작 하였습니다. 이후 필리핀 식약청으로부터 2022년 8월에 4000IU 품목허가를,2022년 10월에 2000IU 품목허가를 받아 2022년 12월부터 필리핀 시장 판매를 시작 하였습니다 - 금번 바이오시밀러 EPO 고용량제품 6000IU, 10000IU 두 제품에 대해 2021년 11월부터 제품 개발에 착수 하였으며 2022년중에 6개월 안정성시험 후 2022년 12월 19일에 국내 식약청에 품목허가 신청서를 제출하였고 23년 8월에 품목허가를 획득 하였으며 10000IU제품은 23.12월 국내 판매를 시작하였습니다. - 24M 장기안정성 시험 완료 |
| 향후계획 | - 각 진출 국가별 품목허가 후 당사와 판권 계약을 체결한 말레이시아 국영 제약사인 DUOPHARMA BIOTECH BERHAD사의 자회사인 DUOPHARMA(M) 사와 말레이시아외 2개국, DB 필리핀에 필리핀 판매를, 한국은 중헌제약이, 튀르키예는 VEM사, 태국은 S.Charoen사, 베트남은 Khuong Duy Pharma사, 사우디아라비아와 GCC 5개국은 SAUDI VAX사와 판권계약을 체결하여 판매중 또는 판매계획이며, 기타 다 른 판매 국가등은 해당 지역에서 의약품 마케팅 인력, 조직, 영업망 및 know-how 등을 확보하고 있는 중대형제약사 들을 상대로 판권계약을 계획 중입니다. |
| 경쟁제품 | - 국내 : EPOKINE(HK이노엔), EPOGEN(LG화학 ) - 해외 : EPREX(Janssen), BINOCRIT(Sandoz), |
| 관련논문등 | - Pharmacokinetic and Pharmacodynamic Comparison of Two Recombinant Human Erythropoietin Formulations, PDA10 and Eprex, in Healthy Korean Male Volunteers: A Randomized,Double-Blinded, Single-Dose, Two-Period Crossover Study, Clin. Drug Investig. (2015) 35:659-664 |
| 시장규모 | - EPO 시장 규모 : 92억달러(2020년 기준 , Allied Marker Research) |
| 기타사항 | - 고용량 6개월 안정성 시험후 국내식약처에 품목허가 제출 완료(2022.12.19) - 품목허가(6000IU,10000IU) 승인 : 23년 8월 - 10000IU제품 국내판매 개시(23.12) |
나) 품 목 : 재조합 Factor VIII
| 구 분 | Stand alone |
|---|---|
| 적 응 증 | - 혈우병 A (선천성 혈액응고 8인자 결핍증) 환자에서의 출혈의 조절 및 예방 - 일상생활 및 수술 시 출혈 예방 |
| 작용기전 |
-혈우병의 치료는 부족한 항 응고 인자를 보충해 주는 것으로 8인자와 9인자 제제가 사용되고 있으며, 항체가 생긴 경우에는 우회인자를 투여함. 투여방법에도 출 혈이 있을 때 마다 투여하는 보충요법(on-demand)과 평소에 출혈이 발생되지 않더라도 부족한 응고인자를 정기적으로 투여해 출혈을 예방하는 유지요법(prop hylaxis)이 있음. -재조합 Factor VIII 제품은 신생아를 포함하여, 성인 및 소아에게 적합하며, 투여 용량과 투여기간은 8인자 결핍정도, 출혈 부위 및 정도, 환자의 임상적 상태에 따라 결정됨. 8인자의 투여 단위수는 8인자 활성 에 대한 WHO 국제 기준인 International Units (IU)로 표시됨. 보통 재조합 FactorⅧ 제품의 예방용 투여용량은 30 ± 5 IU/kg의 용량을 주 3회 예방적으로 투여하는 용법용량을 가짐. |
| 제품의 특성 | - 세계 3번째 B도메인 결손 재조합 Factor Ⅷ 제품으로 개발 중 (주)1 - 재조합 제품은 혈장유래 제품들에 비해 안전성이 높으며, B도메인이 결손된 제 품이 생산성이 높고 생산공정이 안정적 - 유럽 Factor VIII 가이드라인을 준수하여 신약에 준하는 Stand alone 으로 개발 (주2) |
| 진행경과 | - 2017년 7월에 비임상시험을 완료하였으며 2018년 10월에 한국식약처에 임상 IND를 제출하였고 2019년 3월에 한국임상1상 시험승인을 받았습니다. - 2019년 11월에 을지대학교 병원에서 임상1상 첫환자 투여 개시 - 2020년 7월 임상1상 마지막 환자 투여 완료 - 한국 임상1상 완료(2020.09) - 다국가 임상3상 IND 제출(2021.06) - 다국가 임상3상 IND 승인(2021.09) - 임상3상 시료 생산(23년 2월~5월) - 글로벌 파트너사들과 다수의 국가에서 공동 임상3상 및 판권계약을 진행할 계획임 |
| 향후계획 | - 향후 해외 또는 국내 바이오기업에 기술이전이나 다국가 공동 임상을 진행한 후 공동임상 계약을 맺은 파트너사에게 해당지역의 판권계약을 함께 체결하여 마케팅 네트워크을 구축할 계획임 |
| 경쟁제품 | - 국내, 해외 : 그린진-F(녹십자), ADVATE (BAXTER), KOGENATE FS (BAYER), Xyntha(Pfizer) |
| 관련논문등 | - 한국특허(제 10-1989779호), 항-혈액응고 제Ⅷ인자 항체 및 그 용도 |
| 시장규모 | - Factor VIII 시장규모: 105억달러(2021년 기준 , 360iResearch LLP) |
| 기타사항 | - 한국,미국,중국, 인도특허등록 : 항-혈액응고 제Ⅷ인자 항체 및 그 용도 |
주1) 첫 번째 제품은 Pfizer사가 보유한 Xyntha®/Refactor , 두 번째 제품은 녹십자의 그린진-F
주2) 재조합 Factor VIII 제품의 경우 단백질의 크기가 크고 구조가 복잡하여 바이오시밀러 개발이
불가능
다) 품 목 : 바이오시밀러 G-CSF
| 구 분 | 바이오시밀러 |
|---|---|
| 적 응 증 |
- 화학항암 요법 중 나타나는 호중구 감소 - 골수이형성성 증후군, 재생불량성 빈혈 등에 수반되는 호중구 감소 - 그 외 여러 질병에 의하여 수반되는 호중구 감소 |
| 작용기전 | - G-CSF는 골수에 있는 호중구 전구세포에 작용하여 호중구의 기능을 강화시키 는 성장 인자이며 각종 고형암 치료를 위한 화학요법 치료시와 면역억제요법에 수반되는 호중구 감소증의 치료와 재생불량성 빈혈환자에 나타나는 호중구 감소 증의 치료 그리고 골수 세포와 조혈모세포 이식 시 호중구 증가 촉진 및 조혈모세 포의 말초조혈모세포의 동원 등에 사용하고 있는 치료용 단백질임. |
| 제품의 특성 | - 오리지널 Lenograstim 바이오 시밀러 - 동물세포배양 방식으로 생산되어 미생물 배양으로 생산되는 filgrastim 성분의 제품보다 우수한 효능과 높은 안전성 |
| 진행경과 | - 비임상시험 완료(2015. 02) |
| 향후계획 | - 당사는 개발 중인 바이오 제품의 다국가 공동 임상시 공동임상 계약을 맺은 파트 너사에게 해당지역의 판권 계약도 함께 체결을 함으로 마케팅 네트워크을 조기 에 구축할 계획임 |
| 경쟁제품 | - 국내 : 제일기린, JW중외 - 해외 : Roche/Chugai사, Sandoz사 |
| 관련논문등 | - |
| 시장규모 | - G-CSF 시장규모 : 74억달러(2021년 기준 , 시장조사기관 : 리서치앤마켓) |
| 기타사항 | - |
라) 품 목 : 바이오시밀러 Aflibercept
| 구 분 | 바이오시밀러 |
|---|---|
| 적 응 증 |
- 신생혈관성 (습성) 연령 관련 황반변성 - 망막정맥폐쇄성 황반부종에 의한 신력 손상의 치료 - 당뇨병성 황반부종에 의한 시력 손상의 치료 - 병적근시로 인한 맥락막 신생혈관 형성에 따른 시력 손상 |
| 작용기전 |
- 습성 연령관련 황반변성은 VEGF에 의해 황반부에 비정상적으로 생성되는 신생혈관과 이로부터 발생하는 출혈, 부종 때문에 시력저하가 발생하는 질병임. - Aflibercept는 혈관내피인자 수용체(VEGFR)와 항체의 Fc가 결합된 항-혈관내피 성장인자 단백질로 눈 내부에 직접 주사하여VEGF를 비활성화시킴으로써 비정상적인 혈관의 생성과 체액의 누출을 막는 치료용 단백질임. |
| 제품의 특성 |
- 오리지널 아일리아 제품에 대한 바이오시밀러 - 오리지널 의약품과 단백질 품질에서 동등성 확보 |
| 진행경과 | - 비임상 시험 완료(2020.09) |
| 향후계획 | - 2020.9월에 비임상 시험을 완료 하였으며 향후 해외 또는 국내 바이오기업에 기술이전이나 다국가 공동 임상을 진행한 후 공동임상 계약을 맺은 파트너사에게 해당지역의 판권계약을 함께 체결하여 마케팅 네트워크를 구축할 계획임 |
| 경쟁제품 | - Eylea(Bayer사),Lucentis(Roche사) |
| 관련논문등 | - |
| 시장규모 | - Eylea 84억달러, Lucentis 35억달러(2020년, Evaluaate Pharma) |
| 기타사항 | - 한국특허등록,미국,유럽,일본,중국 특허출원 : 안과용 액상 조성물 |
마) 품 목 : 항 SFTSV 항체
| 구 분 | 신약 항체 |
|---|---|
|
적응증 |
- 중증열성혈소판감소증후군 (SFTS) |
|
작용기전 |
- SFTS는 SFTS바이러스(SFTSV)에 감염된 진드기에 의해 매개되는 감염병 질환으로 SFTSV에 감염되면 발열, 위장관 증상, 호중구 감소증 및 혈소판 감소증 등의 임상증상을 보이며 회복되지 않는 경우 빠르게 다발성 장기기능 장애로 진행하여 사망에 이름. - 항 SFTSV항체는 나노바디 (Nanobody) 구조로 일반항체에 비해 크기가 작아 안정성이 높고, 면역원성이 낮은 장점을 보유하고 있음. - 항SFTSV항체는 SFTS 바이러스의 외막 당단백질에 특이적으로 결합하여 바이러스를 중화시키는 항체 치료제임. |
|
제품의 특징 |
- 세계 최초의 진드기 매개 중증열성혈소판감소증후군 치료제 - 동물모델을 이용한 효력 검증완료 - 한국, 중국, 일본에서 발견되는 모든 SFTS 바이러스를 중화시킬 수 있는 항체 치료제 |
|
진행경과 |
- 생산 세포주 개발 및 대량생산을 위한 공정개발 완료, 비임상 진행중 |
|
향후계획 |
- 당사가 개발중인 항 SFTSV 항체 치료제는 비임상시료 생산이 완료되면 동물모델을 이용한 비임상 효력시험 및 독성시험을 수행하여 안정성을 확보한 후 가장 많은 환자가 발생하는 중국 시장내 기술력을 가진 기업과 함께 치료제 공동개발을 추진할 예정임. |
|
경쟁제품 |
- |
|
관련 논문등 |
- Severe Fever with Thrombocytopenia Syndrome, South Korea, 2012. Emerging Infectious Diseases (2013),19, 1892 ~ 1894. - An anti-Gn glycoprotein antibody from a convalescent patient potently inhibits the infection of severe fever with thrombocytopenia syndrome virus. PLOS Pathogens (2019), 15(2), 1 ~ 21. |
|
시장규모 |
- |
|
기타사항 |
한국, 중국, 일본 특허등록(공동특허 ,팬젠, Y-Clone Medical sciences) SFTSV에 결합 가능한 나노항체 및 이의응용 (Nano-antibody capable of binding to SFTSV and application thereof) |
(6) 연구개발 완료 실적
| 구분 | 품목 | 적응증 | 개발완료일 | 현재현황 | 비고 | |
| 바이오 | 바이오시밀러 | EPO 2품목 (2000IU, 4000IU) |
만성신부전환자의 빈혈치료제 |
임상 3상 시험종료(17년9월) Malaysia 품목허가(19년 1월) Malaysia 판매개시(19년 3월) 한국 품목허가(19년 11월) 한국 판매개시(20년 2월) 필리핀 4000IU 품목허가(22년 8월) 필리핀 2000IU 품목허가(22년 10월) 필리핀 판매개시(22년 12월) 사우디아라비아 품목허가(23년5월) 사우디아라비아 판매개시(24년3월) 태국 품목허가(24년 9월) |
- 한국,말레이시아,필리핀, 사우디아라비아 제품 판매중 - 베트남 품목허가신청 - 튀르키예 VEM사에 제품생산 기술 이전계약체결(21.06) |
- |
| 바이오 | 바이오시밀러 | EPO 2품목 (6000IU, 10000IU) |
만성신부전환자의 빈혈치료제 |
-한국식약처 품목허가제출(22년12월) -한국 품목허가(6000IU,10000IU) 승인 (23년 8월) |
- 10000IU제품 국내판매 개시(23.12) | - |
바이오시밀러 EPO의약품
| 구 분 |
바이오 시밀러 |
|---|---|
| 적 응 증 | - 신장 투석 환자 (만성 신부전)의 투석 중 일어나는 급성 빈혈 - 화학항암 요법 중 나타나는 빈혈 - 그 외 수혈이 필요한 환자 |
| 작용기전 |
- 적혈구 형성 자극 인자는 신장에서 생성되는 당 단백질 성 호르몬으로 신체의 산소요구량에 따라 적혈구 생성을 조절하는 생체물질로 신장기능이 비정상인 만성 신부전 환자에서는 이 자극인자가 생성되지 않아 빈혈이 나타나게 됨. - 본 제품은 유전자 재조합 기술을 이용하여 생산된 제제로 골수 중 조혈 조직의 전구세포에 작용 하여 적혈구 원시세포의 분열과 분화를 자극함으로써 적혈구 생성을 유도하게 됨. |
| 제품의 특성 | - 오리지널 EPREX 와 약동학, 약력학, 독성 동등성 확보 - 세계 2번째 Epoetin alfa 성분의 바이오시밀러 제품(대조약 EPREX) - 세계 최초 바이오시밀러 제품인 Binocrit® 에 비해 대조약과의 품질비교에서 동등성이 뛰어남 |
| 진행경과 | - 말레이시아 국영제약사인 DUOPHARMA BIOTECH BERHAD사의 자회사인 DUOPHARMA(M)사와 공동으로 한국과 말레이시아에서 임상3상시험을 진행 하여 2017년 9월에 임상 3상을 종료하였습니다. 2017년 3월에 말레이시아 식약청에, 2018년 5월에는 한국 식약처에 품목허가(NDA)를 신청하였고, 2019년 1월에 말레이시아 식약청으로 부터 품목허가를 받았고 2019년 11월에 한국 식약처로부터 품목허가를 받아 말레이시아 시장은 2019년 3월부터, 한국 시장은 2020년 2월부터 판매를 시작 하였습니다. 이후 필리핀 식약청으로부터 2022년 8월에 4000IU 품목허가를,2022년 10월에 2000IU 품목허가를 받아 2022년 12월부터 필리핀 시장 판매를 시작 하였습니다, 사우디아라비아는 23년 5월에 품목허가를 받아 24년 3월부터 판매를 시작하였고 태국은 24년 9월에 품목허가를 받아 판매 준비중에 있습니다 |
| 향후계획 | - 말레이시아 품목허가 후 당사와 공동임상 및 판권을 계약한 말레이시아 국영 제약사인 DUOPHARMA BIOTECH BERHAD사의 자회사인 DUOPHARMA(M) 사와 말레이시아외 2개국, DB필리핀과 필리핀 판매를, 한국은 중헌제약이, 사우디아라비아와 GCC 5개국은 SAUDI VAX사가 ,튀르키예는 VEM사, 태국은 S.Charoen사, 베트남은 Khuong Duy Pharma사와 판권계약을 체결하여 판매중 또는 판매계획이며, 기타 다 른 판매 국가등은 해당 지역에서 의약품 마케팅 인력, 조직, 영업망 및 know-how 등을 확보하고 있는 중대형제약사 들을 상대로 판권계약을 계획 중입니다. |
| 경쟁제품 | - 국내 : EPOKINE(HK이노엔), EPOGEN(LG화학 ) - 해외 : EPREX(Janssen), BINOCRIT(Sandoz), |
| 관련논문등 | - Pharmacokinetic and Pharmacodynamic Comparison of Two Recombinant Human Erythropoietin Formulations, PDA10 and Eprex, in Healthy Korean Male Volunteers: A Randomized,Double-Blinded, Single-Dose, Two-Period Crossover Study, Clin. Drug Investig. (2015) 35:659-664 |
| 시장규모 | - EPO 시장 규모 : 92억달러(2020년 기준 , Allied Marker Research) |
| 기타사항 | - 말레이시아 판매개시(19년 3월), 한국 판매개시(20년 2월) - 필리핀 품목허가(22년 8월 4000IU, 22년 10월 2000IU)및 판매개시(22년 12월) - 사우디아라비아 품목허가(23년 5월 2000IU, 4000IU) 및 판매개시(24년 3월) - 태국 품목허가(24년 9월, 2000IU,4000IU) - 베트남 품목허가신청 - 한국 한국이슬람교 중앙회(KMF)로 부터 할랄인증(20년 2월) - 튀르키예 VEM사에 제품생산기술이전계약체결(21년 06월) |
(7) 연구개발 향후 계획
혈우병A치료제인 재조합 Factor VIII은 비임상 시험을 완료(2017.7월) 하였으며 2018년 10월에 한국식약처에 임상 IND를 제출하였고 2019년 3월에 한국 임상1상 시험승인을 받아 을지대병원에서 임상1상 시험를 진행 하였습니다. 임상1상 시험은 총 12명의 환자를 대상으로 진행하였으며 2019년 11월에 임상1상 첫환자 투여가 시작 되었고 2020년 7월에 마지막 환자의 임상약 투여가 완료되어 현재 임상1상 시험을 완료 하였습니다. 2021년도 6월에 다국가 공동 임상을 위해 임상3상 IND를 국내 식약처에 제출하였고 2021년 9월에 식약처로 부터 임상3상 IND 승인을 받았고 2023년 2월 부터 5월초까지 임상3상 시료 생산을 완료 하여 현재 기술이전 또는 다국가 공동임상 3상을 준비중에 있습니다.
황반변성,황반부종등 치료제인 바이오시밀러 Aflibercept는 현재 비임상 시험을 완료하였고, 향후 해외,국내 바이오기업에 기술이전 또는 공동임상을 추진할 계획입니다.
중증열성혈소판감소증후군 치료제인 항SFTSV항체는 생산세포주 및 공정기술 개발을 완료 하였고 비임상 시험을 진행중 입니다.
바이오시밀러 EPO 고용량 제품(6000IU, 10000IU) 개발 : 국내외 판매 파트너사의 요구 및 시장확대에 따라 고용량 EPO 바이오시밀러 제품 개발을 진행하였으며 2022년 4월에 안정성시험을 시작하였고 6개월 안정성 시험 자료를 확보하여 2022년 12월 19일에 한국식약처(MFDS)에 품목허가 신청서를 제출하였고 23년 8월에 한국식약처로 부터 고용량 제품에 대해 품목허가를 받았습니다. 이후 10,000IU 제품은 23년 12월에 국내 판매를 시작하였습니다.
(8) 연구개발을 위한 정부출연과제 수행 실적
|
개발 제품 |
사업명 |
과제명 |
연구기간 |
비고 |
|---|---|---|---|---|
| 바이오의약품개발기술이전서비스 | 감영병위기대응 기술개발 |
차세대재조합 대상포진백신개발 |
18.04.30 ~ 21.12.31 |
완료 |
| 고성능 맞춤형 배지 첨가물 |
바이오산업 핵심기술개발 |
바이오의약품 생산용 배지 첨가물 개발 |
20.04.01~ 22.12.31 |
완료 |
| SFTS치료용 항체의약품 |
감염병 예방치료 기술개발 |
중증열성혈소판감소증(SFTS) 치료용 항체의약품 개발 | 21.04.01~ 22.12.31 |
완료 |
| 신종코로나와 인플루엔자혼합백신 |
미래성장 고부가가치백신개발 |
신종코로나와인플루엔자혼합프리미엄백신의후보물질개발 | 22.04.01~ 24.12.31 |
완료 |
7. 기타 참고사항
가. 지적재산권 보유현황
당사는 보고서 작성 기준일 현재 바이오시밀러 및 바이오의약품 개발기술 관련 당사가 보유하고 있는 상표권 및 특허권(출원포함)은 다음과 같습니다.
|
번호 |
구분 |
내용 |
권리자 |
출원국 |
출원일 |
등록일 |
적용 |
|---|---|---|---|---|---|---|---|
|
1 |
상표 |
PANGEN |
팬젠 |
대한민국 |
00.02.18 |
01.06.07 |
- |
|
2 |
상표 |
PANGENEPO |
팬젠 |
대한민국 |
11.12.21 |
13.01.15 |
바이오시밀러 |
|
3 |
상표 |
PANPOTIN |
팬젠 |
대한민국 |
11.12.21 |
13.03.05 |
|
|
4 |
상표 |
판제네포 |
팬젠 |
대한민국 |
11.12.21 |
13.03.05 |
|
|
5 |
상표 |
팬포틴 |
팬젠 |
대한민국 |
11.12.21 |
13.03.05 |
|
| 6 |
특허 |
동물세포발현벡터 Expression vector for animal cells |
팬젠 |
한국 |
12.03.30 |
14.04.08 |
바이오의약품 개발기술 |
| 7 |
미국 |
13.09.27 |
15.06.23 |
||||
| 8 |
인도 |
13.09.27 |
19.07.04 |
||||
| 9 |
말레이시아 |
13.09.30 |
19.10.08 |
||||
| 10 |
일본 |
13.09.30 |
16.04.26 |
||||
| 11 |
유럽 |
13.09.30 |
16.10.13 |
||||
| 12 |
브라질 |
13.09.30 |
21.08.10 |
||||
| 13 |
중국 |
13.10.25 |
15.10.07 | ||||
| 14 | 특허 |
인간 및 마우스 Sema3A에 교차 결합하는 항체 및 그의용도 |
팬젠/삼성생명공익재단 | 한국 | 16.09.26 | 18.04.26 | 신약항암항체 개발기술 |
| 15 | 특허 | 항-혈액응고 제Ⅷ인자 항체 및 그 용도 | 팬젠 | 한국 | 17.12.14 | 19.06.11 | 혈우병치료제 |
| 16 | 미국 | 19.05.27 | 21.10.26 | ||||
| 17 | 중국 | 19.06.14 | 23.06.06 | ||||
| 18 | 인도 | 19.06.03 | 23.11.15 | ||||
| 19 | 특허 |
인간 및 마우스 Sema3A에 교차 결합하는 항체 및 그의용도 human and mouse Sema3, and use thereof) |
팬젠/삼성생명공익재단 | 브라질 | 18.04.26 | 24.10.22 | 신약항암항체 개발기술 |
| 20 | 멕시코 | 18.04.26 | 22.02.04 | ||||
| 21 | 인도 | 18.05.25 | 23.09.22 | ||||
| 인도네시아 | 18.05.25 | 20.09.17 | |||||
| 22 | |||||||
| 23 | 호주 | 18.05.25 | 20.02.27 | ||||
| 24 | 일본 | 18.04.26 | 21.05.18 | ||||
| 25 | 미국 | 18.04.27 | 20.03.31 | ||||
| 26 | 중국 | 18.04.26 | 21.08.27 | ||||
| 27 | 말레이시아 | 18.04.26 | 23.09.28 | ||||
| 28 | 특허 |
안과용 액상 조성물 (OPHTHALMIC LIQUID COMPOSITION) |
팬젠 | 한국 | 21.07.23 | 24.07.25 | 바이오시밀러 aflibercept |
| 29 | 팬젠 | 미국 | 23.01.23 | - | |||
| 30 | 팬젠 | 유럽 | 23.02.03 | - | |||
| 31 | 팬젠 | 일본 | 23.01.24 | - | |||
| 32 | 팬젠 | 중국 | 23.01.30 | - | |||
| 33 | 특허 |
SFTSV에 결합 가능한 나노항체및 이의응용 (Nano-antibody capable of binding to SFTSV and application thereof) |
팬젠 Y-Clone Medical sciences |
한국 | 20.07.29 | 23.02.28 | 신약 |
| 34 | 중국 | 19.07.23 | 22.12.06 | ||||
| 35 | 일본 | 20.07.06 | 22.11.15 | ||||
| 36 | 특허 |
코로나바이러스 유래 신규 융합 단백질 및 이의용도 |
팬젠 | 한국 | 22.02.17 | - | 백신 |
| 37 | 특허 | 단백질 전달을 위한 지질 나노입자 |
팬젠/무진메디 | 한국 | 22.07.15 | - | 신약 |
나. 사업부문의 시장여건 및 영업의 개황
(1) 바이오 의약품 산업 특성
의약품은 일반적으로 화학합성 의약품과 바이오 의약품으로 구분할 수 있는데, 바이오 의약품은 사람이나 생물체에서 유래된 것을 원료 또는 재료로 하여 제조한 의약품으로서 생물학제제, 유전자 재조합 의약품, 세포배양 의약품, 세포치료제, 유전자 치료제, 기타 식약처장이 인정하는 제제 등을 말합니다.
|
구 분 |
바이오의약품 |
화학합성의약품 |
|---|---|---|
|
정 의 |
- 사람이나 생물체에서 유래된 것을 원료 또는 재료로 하여 제조한 의약품 |
- 화학적 방법으로 약효 성분을 추출하여 만들어낸 의약품 |
|
특징 |
- 분자량이 매우 크고 복잡한 3차원 복잡한 구조를 가짐 - 살아있는 세포를 통해 매우 복잡한 생물학적 공정 - 주로 유전자재조합 기술을 통해 형질도입된 숙주세포를 배양하고 필요한 물질을 |
- 분자량이 매우 작음(500 Dalton이하) - 화학적 구조가 잘 밝혀져 있음 - 화학물질의 화학반응을 통해 비교적 간단한 |
|
투약법 |
- 정맥 / 피하 주사 |
- 경구 투약(먹는 약) |
|
가 격 |
- 고가/높음 |
- 상대적으로 저가/낮음 |
|
부작용 |
- 부작용 경미함 (특정부위 부작용, 작용기전에 의한 국소 부작용) |
- 부작용 높음 (인체의 전 부분에 작용, 예상불가능 부작용) |
화학합성의약품은 새로운 작용 기전 개발이 어려워지고 막대한 연구개발비가 소요되는 관계로 혁신적인 신약 개발 건수가 점차 낮아지고 있고, 기존의 블록버스터 의약품들의 특허가 점차 만료됨에 따라 경쟁 카피제품(제네릭)의 개발이 쉬워지면서 가격이 하락하는 등 시장 성장에 어려움을 겪고 있는 반면, 바이오의약품은 생명공학기술을 기반으로 개발되어 생체내에 존재하는 특정 단백질을 타깃으로 하는 효과적이고 부작용이 적은 의약품으로 1980년대 유전자재조합 기술이 획기적으로 발전되면서 인슐린과 성장호르몬 같이 질환으로 인해 체내에 부족한 단백질을 보충하여 질병을 치료하는 1세대 바이오의약품이 처음으로 등장하게 되었습니다.
1세대 바이오의약품은 주로 세균, 효모 등을 숙주로 활용하여 생산한 것으로 인슐린과 성장 호르몬 등을 들 수 있으며, 2세대 바이오의약품은 주로 동물세포를 이용하여생산한 것으로 치료용 항체, 퓨전단백질, EPO, 인터페론 등을 들 수 있습니다. 최근에는 바이오의약품 대비 효능이나 편의성 등이 증가된 개량형 바이오베터(biobetter)개발을 위한 제약사 간의 경쟁이 진행되고 있으며, 오리지널 제품보다 인체 내 약효지속성이 증가된 제품들이 일부 출시되어 판매되고 있습니다. 또한, 최근에는 차세대바이오의약품으로서 세포치료제, 유전자치료제, 치료용 백신 등에 대한 연구개발이 활발해 지고 있는 상황이지만, 기술이 상용화되어 본격적으로 시장이 형성되기까지는 시간이 조금 더 필요한 상태입니다.
바이오의약품 산업에서 획기적인 변화는 2000년부터 블록버스터 바이오의약품의 특허가 만료됨에 따라 바이오신약에 비해 R&D비용과 기간을 획기적으로 줄일 수 있는바이오시밀러 제품 개발이 시작되었습니다. 합성의약품의 복제품 (generic)은 오리지널 합성의약품과 동일한 화학반응으로 생산하지만, 바이오시밀러 의약품은 살아있는숙주세포의 생물학적 반응을 이용하여 생산하기 때문에 100% 동일한 제품으로 생산할 수 없으며, 오리지널 바이오의약품과 생물학적 동등성을 입증해야만 바이오시밀러로 인정받을 수 있게됩니다. 이런 차이로 합성의약품의 복제약은 제너릭(generic)으로, 바이오의약품의 복제약은 바이오시밀러(biosimilar)라는 용어로 구분하게 됩니다. 특히 일반인들이 혼동하여 이해하고 있는 바이오시밀러의 개념을 다시 정리해 보면, 기존의 오리지널 의약품을 대체할 목적으로 개발되는 바이오 의약품으로는 바이오 시밀러와 Stand-alone으로 나눌 수 있는데 바이오시밀러는 오리지널 의약품과 품질의 비교 동등성이 확보된 후 등록된 제품을 말하며, Stand-alone은 오리지널 바이오의약품과 비교하지 않고 등록된 제품을 말합니다. 따라서 두 가지 제품은 서로 품질의 수준이 다르고, 서로 다른 허가 규정의 적용을 받게되며, 시장 진출시에도 서로 다른 시장을 형성할 수 있게 됩니다.
전 세계적으로 고령화 추세에 따라 치매 중풍 파킨스병 등 노인성 질환에 대한 치료 수요가 빠르게 증가하고 소득증대 및 생활 패턴의 변화에 따른 삶의 질 향상으로 건강증진 및 유지를 위한 의료분야의 지출이 크게 확대되고 있습니다. 이에 각국의 의료비가 가파르게 상승하고 있어 의료보험 지출 등 의료비 절감을 위한 방안을 찾고 있는 많은 국가들이 기존의 블록버스터 오리지널 바이오 의약품과 효능은 동일하면서 상대적으로 낮은 가격의 바이오시밀러 개발을 권장함과 동시에 이의 개발을 촉진하기 위한 규정 및 가이드라인을 제정하고 있습니다. 이에 전 세계적으로 많은 제약사들이 경쟁적으로 바이오시밀러 개발을 추진하고 있습니다.
| [ 바이오시밀러 주요 규정/가이드라인 현황] |
|
제목 |
발표연월 |
발표기관 |
|---|---|---|
|
동등생물의약품 평가 가이드라인 |
2009. 7. |
식품의약품안전처 |
|
에리스로포이에틴 동등생물의약품의 비임상 및 임상 평가 가이드라인 |
2011.12 |
식품의약품안전처 |
|
소마트로핀 동등생물의약품의 비임상 및 임상 평가 가이드라인 |
2011.12 |
식품의약품안전처 |
|
유전자재조합 과립구 집락 자극인자 (G-CSF) 동등생물의약품의 비임상 및 임상 평가 가이드라인 |
2012.10 |
식품의약품안전처 |
|
단클론항체 동등생물의약품의 비임상 및 임상 평가 가이드라인 |
2013. 9. |
식품의약품안전처 |
|
동등생물의약품 평가 가이드라인 (Rev. 2) |
2021.12 |
식품의약품안전처 |
|
동등생물의약품 허가 및 심사를 위한 질의 응답집 |
2022. 4 |
식품의약품안전처 |
|
Biosimilar medicinal products containing recombinant granulocyte-colony stimulating factor (Annex to guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues) |
2006. 2 |
European Medicines Agency |
|
Guideline on similar biological medicinal products containing monoclonal antibodies ? non-clinical and clinical issues |
2012. 5 |
European Medicines Agency |
|
Guideline on similar biological medicinal products containing interferon beta |
2013. 2 |
European Medicines Agency |
|
Guideline on non-clinical and clinical development of similar biological medicinal products containing recombinant human follicle stimulating hormone (r-hFSH) |
2013. 6 |
European Medicines Agency |
|
Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues (Rev 1) |
2014. 5 |
European Medicines Agency |
|
Guideline on similar biological medicinal products (Rev 1) |
2014.10 |
European Medicines Agency |
|
Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues (Rev 1) |
2014.12 |
European Medicines Agency |
|
Non-clinical and clinical development of similar biological medicinal products containing recombinant human insulin and insulin analogues |
2015. 2 |
European Medicines Agency |
|
Non-clinical and clinical development of similar biological medicinal products containing low-molecular-weight heparins |
2016.11 |
European Medicines Agency |
|
Guideline on non-clinical and clinical development of similar biological medicinal products containing recombinant erythropoietins (Rev 1) |
2018. 6 |
European Medicines Agency |
|
Similar medicinal products containing somatropin (Annex to guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues) |
2018. 6 |
European Medicines Agency |
|
Guidelines on evaluation of similar biotherapeutic products (SBPs) |
2009.10 |
World Health Organization |
|
Guidelines on evaluation of similar biotherapeutic products (SBPs), Annex 2. Technical Report Series No. 977 |
2009.10 |
World Health Organization |
|
Guidelines on evaluation on monoclonal antibodies as similar biotherapeutic products (SBPs), Annex 2, Technical Report Series No. 1004 |
2016.10 |
World Health Organization |
|
Guidelines on evaluation of similar biotherapeutic products. Proposed revision of Annex 2 of WHO Technical Report Series, No. 977 |
2021.04 |
World Health Organization |
(출처: 자체조사)
국내 바이오시밀러 관련 허가는 2009년 고시된 "동등생물의약품(바이오시밀러) 허가 심사를 위한 규정"에 따라 품질평가, 비임상평가, 임상평가, 적응증 외삽의 단계를 거쳐 이루어집니다.
다른 의약품과 마찬가지로 바이오시밀러의 판매를 위해서는 각국의 의약품 관련 허가기관으로부터 승인을 받아야 하며, 바이오시밀러의 승인을 위해서는 다른 신약이나 복제의약품과는 다른 승인 절차가 필요합니다.
이러한 승인을 위한 기준 및 절차 등을 명시한 규정을 가이드라인이라 하며, 바이오시밀러에 대한 가이드라인은 2004년 유럽에서 최초로 바이오시밀러에 대한 가이드라인을 제정한 후 2006년에 최초의 바이오시밀러 시판 허가를 내주었고, 이후 2009년 일본, 한국을 비롯한 많은 전 세계 국가들이 자국 내 바이오시밀러의 도입을 위해 가이드라인을 제정하였습니다. 미국은 2012년에 바이오시밀러에 대한 가이드라인을제정하였고 미국 FDA는 2018년 7월에 바이오시밀러의 처방 활성화를 목적으로 하는 바이오시밀러 시장강화정책(Biosimilars Action Plan, BAT)을, 2019년 5월에는 바이오시밀러 관련 가이드라인을 발표 하였습니다.
| [바이오시밀러 승인 평가과정과 기준] |
|
① 품질평가 |
특성분석 |
대조약과의 1차 및 고차구조 분석과 당화를 포함한 번역 후 변형, 물리화학적 성질, 생물학적 활성, 함량, 순도와 불순물, 불용성 미립자 등과 가속 및/또는 가혹조건 (온도, 빛, pH, 습도, 산화 등)에서 분해산물 비교시험을 통해 해당 단백질의 특성에 따른 불순물과 제조공정에서 발생하는 불순물에 대한 순도시험, 면역학적 동등성 평가. |
|
기준규격 |
관련 규정에 적합하고 제품 특이적인 품질항목이 대조약과 동등성이 확보될 수 있는 규격 선정 |
|
|
분석방법 |
최신 기술을 이용한 광범위한 특성 분석방법과 한 가지 품질항목에 한 가지 이상의 분석방법 사용 |
|
|
안정성시험 |
유효기간과 저장조건 설정을 위한 장기보존시험, 대조약과 비교한 가속 및 가혹 시험 |
|
|
② 비임상 평가 |
독성시험 |
단회 및/도는 반복투여 독성시험 자료 필요하며, 대조약과 비교동등성 입증하도록 디자인되어야 하고 독성동태시험 포함 |
|
in vitro 시험 |
수용체 결합시험, 세포증식 시험 등을 통해 대조약과의 동등성 평가 |
|
|
in vivo 시험 |
약동학, 약력학, 및 반복투여 독성시험 등을 통하여 대조약과의 동등성 평가 |
|
|
③ 임상 1상 평가 |
약동학 시험 |
대조약의 권장 용량 범위 내의 용량을 사용하여 대조약과 동등성 비교 |
|
약력학 시험 |
임상 효과와의 상관성에 근거한 약력학 변수 설정 |
|
|
④ 임상 3상 평가 |
유효성 시험 |
임상적 동등성 시험 |
|
확증적 약동력학 시험 |
대조약과 동등성 비교 |
|
|
안전성 |
이상반응에 대해 대조약과 비교 |
|
|
면역원성 |
면역반응에 의한 임상적 영향 비교 |
|
|
⑤ 적응증 외삽 |
- |
대조약과의 잠재적 차이를 증명하는 경우 적응증 외삽 가능 |
(2) 시장 현황
(가) 바이오의약품 시장
바이오의약품 전체 시장은 다양한 제품군들로 구성되는데, 주로 단백질 치료제, 항체치료제, 백신, 줄기세포 치료제 및 유전자 치료제 등으로 지칭됩니다. 복잡한 구조로 이뤄진 바이오의약품은 합성의약품에 비해 상대적으로 효능은 높고 부작용은 적어서 일반적으로 합성의약품보다 바이오 의약품이 고가임에도 불구하고 다양한 만성질환, 중증 질환, 주요 질병등을 치료하고자 하는 환자들에게 사용되고 있습니다.
세계 바이오의약품 시장규모는 조사기관 및 발표 시점에 따라 다소 차이가 존재하는데 Evaluate Pharma의 "Word Preview 2022.Outlook to 2028"에 의하면 2022년 기준 전체 처방의약품 시장은 11,390억달러(1,630조원)에서 연평균 6%로 성장하여 2028년에는 16,120억달러(약 2,307조원) 규모로 성장할 것으로 추정하고 있습니다.
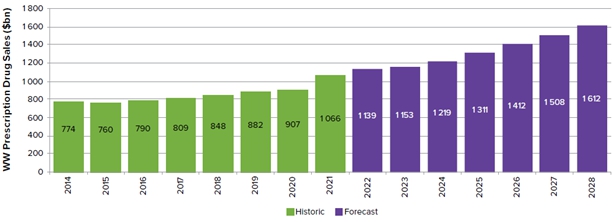 |
|
처방전의약품시장(22.08) |
(Source: Evaluate Pharma® (2022.08))
전세계 전체 의약품 시장에서 바이오 의약품이 차지하는 비중은 지속적으로 증가하여 글로벌 바이오 의약품 전체 시장에서 바이오 의약품이 차지하는 비중은 2021년 38%에서 2028년 41%로 증가할 것으로 예측하였으며, 특히 글로벌 매출 상위 100대 제품에서 바이오 의약품이 차지하는 비중은 2018년 50% 이상을 유지하며 2028년에 60%를 넘어설 것으로 예측 되어 향후 바이오의약품은 합성 의약품에 비하여 매우 높은 부가가치를 가지고 있는 산업으로서 미래 의약품시장의 성장은 바이오 의약품에 의하여 주도 될 것입니다.
의약품 종류별 시장 점유율 전망(2014~2028)
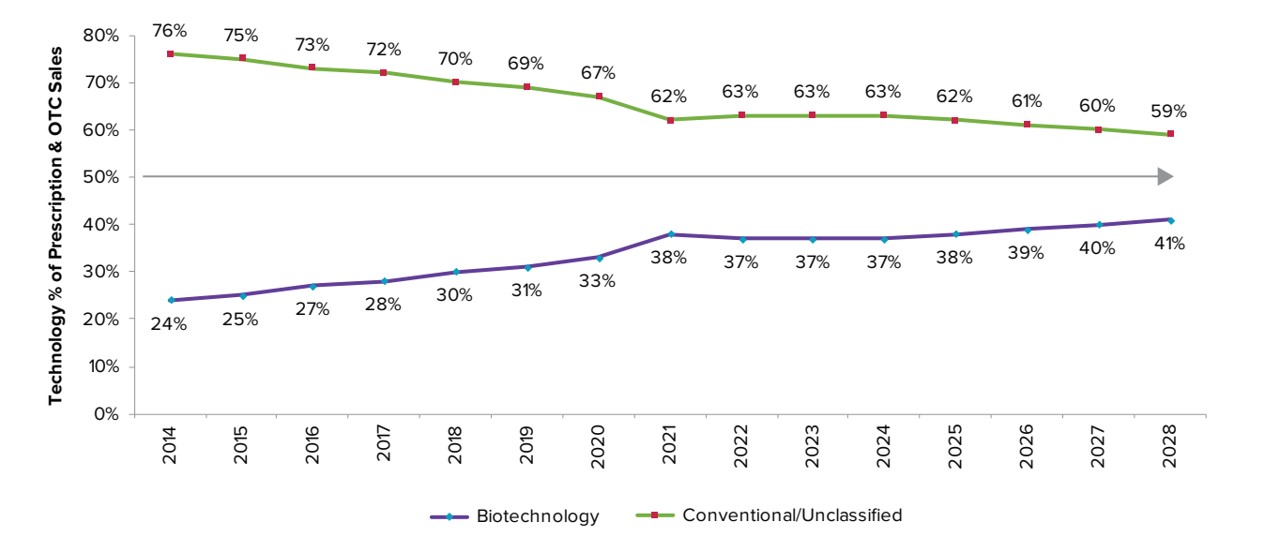 |
|
의약품 종류별 시장 점유율전망(2014~2028) |
(Source:Evaluate Pharma, World Preview 2022 Outlook to 2028(2022.10.8).
의약품 글로벌 매출 상위 100대 제품현황 및 전망2014~2028)
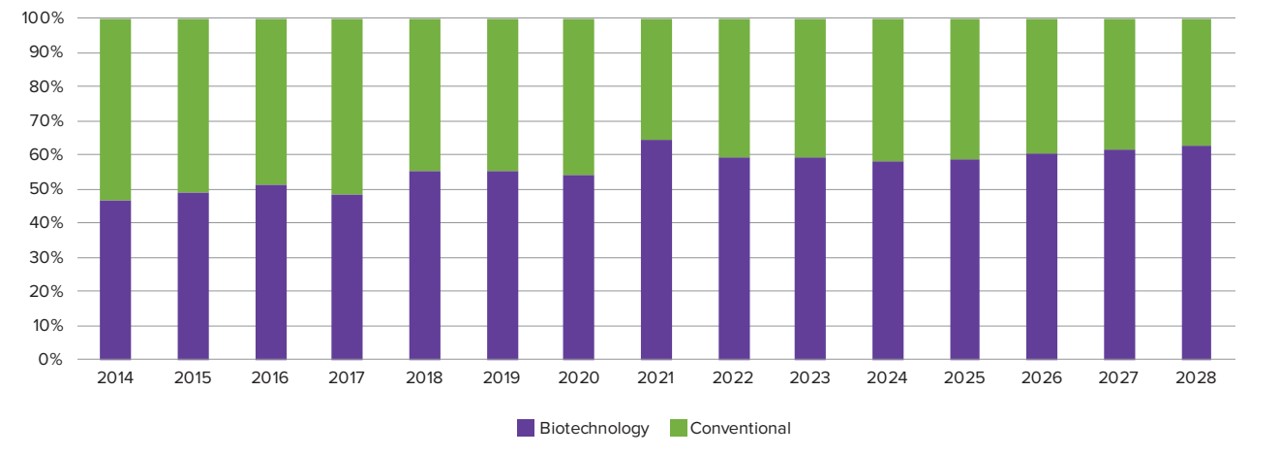 |
|
의약품 글로벌 매출 상위 100대 제품 현황(2014~2028) |
(Source:Evaluate Pharma, World Preview 2022 Outlook to 2028(2022.10.8).
이러한 바이오의약품의 시장 성장은 주로 항체치료제 또는 항체치료제 바이오시밀러제품들이 속속 개발되면서 성장을 주도하게 되겠지만, 이머징 마켓을 중심으로 만성신부전환자, 혈우병환자 등 만성질환 환자수가 크게 증가하고 있어 단백질치료제 시장도 지속적으로 증가하면서 바이오의약품 시장의 성장에 기여하게 될 전망입니다.
역사적으로 국내 바이오의약품 시장은 stand alone 시장이라고 할 수 있습니다. 1980년대 중반 국내제약사에서 시작한 유전자재조합 제품들은 모두 기존의 바이오의약품을 복제하는 것을 기반으로 시작하였고 성장호르몬, EPO, G-CSF 등 1세대 바이오의약품들이 국산화되어 이 제품들이 국내바이오의약품 시장을 선도하였습니다. 그러나 이들 제품들은 품질 수준에서 선진국 제품과 격차가 있었으며 허가 등록 자료 미비 등으로 선진국 시장으로 진출하지 못하고 제3세계에서 저가 제품들과 경쟁하면서 시장을 크게 성장시키지 못하였습니다.
그러나 2009년부터 국내 식약처가 바이오시밀러 개발을 위한 가이드라인을 만들기 시작하였고, ㈜팬젠, 셀트리온, 삼성바이오에피스등 여러 회사들이 바이오시밀러 항체 및 단백질 치료제를 개발하기 시작하였습니다. 최근 들어서는 블록버스터 항체의약품들에 대한 바이오시밀러가 국제적인 관심을 끌게 되자 국내 대기업에서도 개발경쟁이 치열하게 전개되었습니다. 그 결과 셀트리온, 삼성바이오에피스등 국내 여러회사들이 미국과 EU 인허가를 획득하며 선진국 시장 판매를 본격화하였고 바이오의약품 개발에 대한 연구개발이 지속적으로 이루어지고 있으며, 이로 인한 바이오의약품 시장의 확대가 예상됩니다.
(나) 바이오시밀러 시장
바이오시밀러는 오리지널 의약품과 품질비교, 임상시험 비교등을 통해 유사성이 확인되어 허가받은 제품을 의미하며 바이오신약에 비해 상대적으로 개발비용 절감 및 개발기간을 단축할 수 있고 이미 검증된 제품을 생산하기 때문에 단기간에 빠른성장이 가능합니다. 또한 세계 각국의 의료비 재정부담 축소와 블룩버스터 오리지널 바이오 의약품 특허 만료, 의약품에 대한 환자 접근성 개선을 위한 신약대비 저렴한 복제약 사용 장려등에 따라 바이오시밀러 시장은 급격히 확대될 전망입니다.
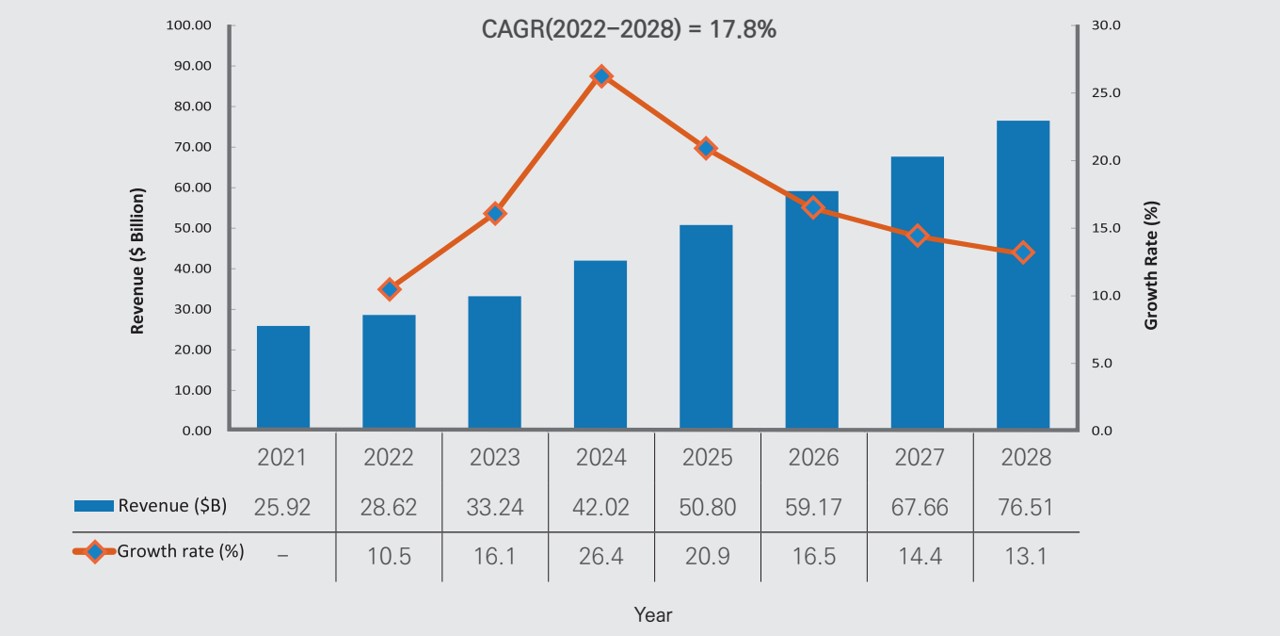
한국바이오협회의 "글로벌 바이오시밀러 시장 현황 및 매출전망(23.10.30)" 발표 자료에 따르면 바이오시밀러 시장은 2022년 286억달러에서 연평균 17.8%로 성장하여 2028년에는 765억달러에 달할 것으로 예상하고 있습니다.
 |
|
글로벌 바이오시밀러 매출전망(2023.10.30) |
출처: 한국바이오협회의 "글로벌 바이오시밀러 시장 현황 및 매출전망(23.10.30)"
이와 같은 바이오시밀러 시장의 높은 성장세는 바이오시밀러 의약품이 오리지널 바이오의약품과의 동등한 효능 대비 저렴한 약가, 오리지널 바이오의약품의 특허만료, 선진시장의 만성질환 환자의 지속적인 증가, 정부 보건의료 재정의 압박등에 따른 신규 바이오시밀러 제품 개발에 주로 기인한 것으로 판단됩니다.
또한 지역 특성상 풍부한 구매력을 보유한 이머징 마켓 내 인구의 노화, 만성질환의 확대, 소득증가에 따른 수요 증가 등은 바이오시밀러 시장 성장에 긍정적 요소로 작용할 것으로 전망됩니다.
(다) 바이오의약품 위탁개발 및 위탁생산(CDMO) 시장
바이오의약품 CDMO(Contract Development Manufacturing Organization) 는 바이오의약품 위탁개발(CDO)과 위탁생산(CMO)을 함께 일컫는 말로 의약품의 생산 및 개발 서비스를 제공하는 것으로 자체 생산역량이 부족한 바이오회사, 의약품 R&D 및 의약품 판매에 사업역량을 집중하기 위해 생산을 전략적으로 아웃소싱하는 바이오 제약사들을 고객으로하는 위탁 개발 및 위탁 생산 사업 입니다.
Forst & Sullivan의 "Growth Opportunities in the Biologics Contract Development and Manufacturing orgaization Sector"(2023.05) 보고서에 따르면 바이오의약품의 위탁개발(CDO) 및 생산 서비스(CMO)를 제공하는 바이오의약품 CDMO 시장은 2022년 약 203억 달러(약 26조 8,700억 원)에서 연평균 15.3%로 성장하여 2028년 약 477억 달러(약 63조 4,500억 원) 규모로 확대 할 것으로 전망 하고 있습니다.
(3) 시장 규모 및 전망
(가) 바이오시밀러 의약품 시장 규모 및 성장전망
한국바이오협회의 "글로벌 바이오시밀러 시장 현황 및 매출전망(23.10.30)" 발표 자료에 따르면 바이오시밀러 시장은 2022년 286억달러에서 연평균 17.8%로 성장하여 2028년에는 765억달러에 달할 것으로 예상하고 있습니다.
(나) 타겟시장 EPO 시장 규모 및 전망
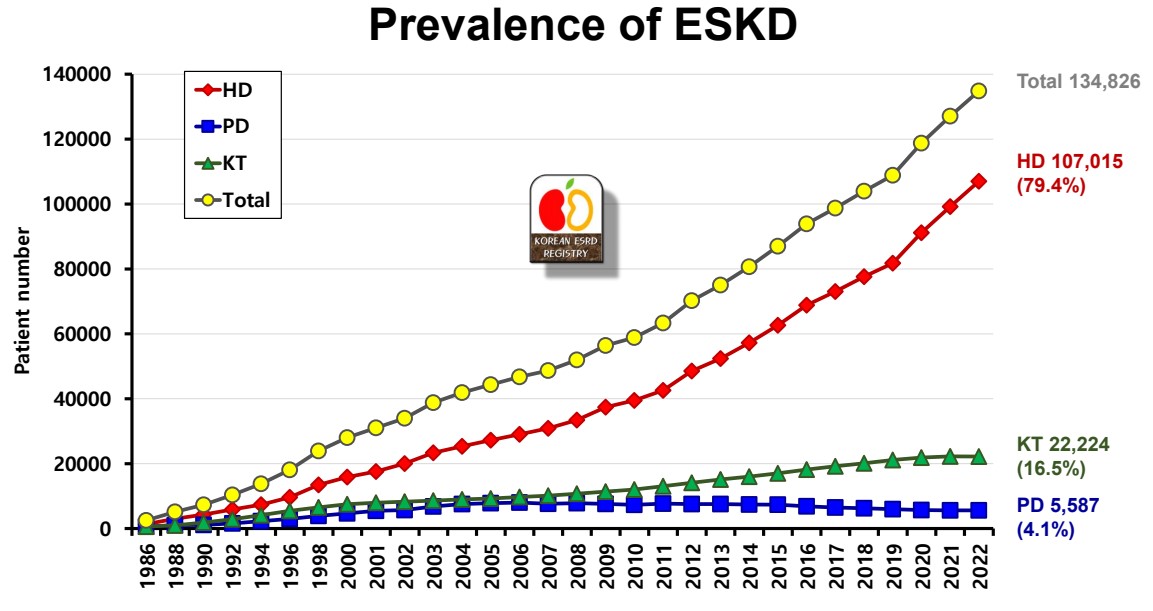
신장 투석 환자 (만성 신부전)의 투석 중 일어나는 급성 빈혈치료제인 EPO의 2022년 국내시장 규모은 약 983억원이며, 말레이시아 EPO 시장규모는 약 1.17억RM 입니다. 대한신장학회에 따르면 말기신부전 유병자수는 등록사업이 시작된 이후 계속 증가하고 있고 2022년말기준 국내 말기신부전의 총 유병자수는 134,826명(혈액투석 107,015명, 신장이식 22,224명, 복막투석 5,587명)으로 유병자수의 계속적인 증가에 따라 EPO시장도 증가가 예상됩니다.
 |
|
국내말기신장질환발병율(2022) |
※ESKD : End Stage Kidney Disease
(출처 : 2023 KORDS annual report)
타켓시장 EPO 시장 규모
| 구 분 | 2023년 | 2022년 | 2021년 |
| 한 국 | 1,014억원 | 983억원 | 942억원 |
| 말레이시아 | 1.29억RM | 1.17억RM | 1.14억RM |
(4) 개발 및 경쟁현황
당사가 개발하였거나 개발 중인 바이오의약품 제품에는 바이오시밀러 EPO의약품, 재조합 Factor VIII, 바이오시밀러 G-CSF, 바이오시밀러 Aflibercept, 항SFTSV항체 제품등이 있으며 그 외에 사업으로 바이오의약품(비임상,임상시료포함) 위탁생산(CMO) 및 바이오의약품 개발 기술 이전 서비스(CDO)등이 있습니다. 이 제품별 경쟁업체는 당사가 개발 중인 제품과 유사한 기술을 적용시킨 제품 및 사업을 주로하고 있는 회사들 가운데 대표적인 회사를 선정하였으며 주요 경쟁업체 현황은 다음과 같습니다.
|
기 술 (제품) |
국내경쟁사 |
해외경쟁사 |
|
|---|---|---|---|
|
바이오시밀러 EPO의약품 |
사업화 |
LG화학,HK이노엔 |
Sandoz사, Janssen사 |
|
재조합 Factor VIII |
임상1상완료 임상3상IND승인 |
녹십자 |
Pfizer사, Baxter사 |
|
바이오시밀러 G-CSF |
비임상완료 |
제일기린, JW중외 |
Roche/Chugai사, Sandoz사 |
| 바이오시밀러 Aflibercept (황반변성,황반부종등 치료제) |
비임상완료 | 바이엘코리아, | Bayer사, Roche사 |
| 항SFTSV항체 (중증열성혈소판감소증후군치료제) |
생산세포주,공정개발 완료 비임상진행중 |
- | - |
| 바이오의약품(비임상,임상시료포함) 위탁생산(CMO) | 사업화 | 삼성바이오로직스 | Lonza사 |
|
바이오의약품 |
사업화 | 삼성바이오로직스 |
Selexis사, Lonza사 |
(5) 회사 사업 개요
당사의 주요사업은 바이오시밀러 EPO의약품 생산 및 판매, 바이오의약품(비임상,임상시료포함) 위탁생산(CMO) 및 바이오의약품 개발 기술이전(CDO)사업, 바이오의약품 개발사업이 있습니다.
만성 신부전 환자의 빈혈 치료제인 바이오시밀러 EPO의약품 사업은 자체 제품개발에 성공하여 현재 국내(제품명:팬포틴) 및 말레이시아(제품명:Erysaa) 시장에서 판매중에 있으며 필리핀은 22년 8월에 4000IU, 22년 10월에 2000IU 품목허가를 받아 2022년 12월부터 판매중에 있고, 사우디아라비아는 23년 5월에 품목허가(제품명:Panpotin)를 획득하였고 2024년 3월부터 판매중에 있습니다. 또한 23년 8월에 한국식약처로부터 EPO고용량 제품(6000IU,10000IU)에 대해 품목 허가를 획득하여 23년 12월부터 10000IU제품에 대해 국내 판매를 시작 하였습니다. 2021년 6월에는 튀르키예 제약사인 VEM사에 바이오시밀러 EPO 기술이전($3,000,000) 계약을 체결하였습니다.
바이오의약품(비임상,임상시료포함) 위탁생산 및 바이오의약품 개발 기술 이전 서비스는 생산용 세포주 및 생산 공정 기술 이전 서비스(CDO)와 위탁생산서비스((CMO)등으로 설립 이후부터 현재까지 항체 치료제 13종을 포함한 바이오의약품 생산용 세포주를 약 50종을 구축하였고 수십건의 항체치료제 및 단백질 치료제 기술이전과 위탁생산(CMO)사업을 성공적으로 수행하였습니다.
그 밖에 개발중인 바이오의약품 제품에는 혈우병A 치료제인 FactorVIII(임상1상 완료,임상3상 허가), 황반변성,황반부종등 치료제인 바이오시밀러 Aflibercept(비임상완료), 항암치료 보조제인 바이오시밀러 G-CSF (비임상 완료), 중증열성혈소판감소증후군치료제인 항SFTSV항체(생산세포주 및 공정기술 개발완료, 비임상진행중)등이 있으며 순차적으로 제품개발 중에 있습니다.
| [팬젠의 주요 사업 개황] |
|
사업부분 |
해당기술 |
주요(개발)제품 및 서비스 |
진행사항 |
|---|---|---|---|
| 바이오시밀러의약품생산및판매 |
PanGen CHO-TECH™기술 및 바이오의약품,제품화 기술등 |
바이오시밀러 EPO 2000IU,4000IU (만성 신부전 환자의 빈혈치료제) |
자체제품개발성공 한국,말레이시아, 필리핀, 사우디아라비아 제품판매중 태국 품목허가(24년 9월) 베트남 품목허가신청 튀르키예 VEM사 기술이전계약체결 |
|
바이오시밀러 EPO 고용량제품 개발 |
고용량 PV 생산완료 안정성 시험진행중 품목허가신청(22년 12월) 품목허가취득(23년 08월) 10000IU 국내판매(23년 12월) |
||
|
바이오의약품 위탁생산 및 개발 기술 이전 서비스(CDMO) |
PanGen CHO-TECH™기술 |
생산용세포주 및 생산공정 기술이전 서비스(CDO) |
사업화 (기술이전) |
|
바이오의약품 제품화 기술 |
위탁생산서비스(CMO) |
사업화 |
|
|
바이오의약품 개발사업등 |
PanGen CHO-TECH™기술 및 바이오의약품,제품화 기술등 |
재조합 Factor VIII (혈우병A 치료제) |
한국 임상1상 완료(20년 9월) |
|
바이오시밀러 G-CSF (항암치료 보조제) |
비임상 완료(15년 2월) | ||
| 바이오시밀러 Aflibercept (황반변성,황반부종등 치료제) |
비임상 완료(20년 9월) | ||
| 항SFTSV항체 (중증열성혈소판감소증후군치료제) |
생산세포주 및 공정기술개발완료 비임상진행중 |
(가) 바이오시밀러 의약품 생산 및 판매사업
바이오시밀러 의약품 생산 및 판매사업은 자체 제품개발에 성공한 만성 신부전 환자의 빈혈치료제인 바이오시밀러 EPO 의약품의 생산 및 판매 사업으로, 바이오시밀러 EPO 의약품은 세계 2번째로 epoetin alfa 성분의 바이오시밀러 의약품으로 개발하였으며, 오리지널의약품은 Amgen사의 Eprex 입니다.
한국과 말레이시아에서 다국가 임상을 진행하여 2019년 1월에 말레이시아 식약청으로부터 품목허가(제품명:Erysaa)를 받았으며 2019년 11월에는 한국 식약처로부터 품목허가(제품명:팬포틴)를 받아 말레이시아 시장과 국내 시장에 판매하고 있고 필리핀은 22년 8월에 4000IU 품목허가(제품명:Erysaa)를, 22년 10월에 2000IU 품목허가를 받아 22년 12월부터 판매중에 있고, 사우디아라비아는 23년 5월에 품목허가(제품명:Panpotin)를 획득하였고 2024년 3월부터 판매중에 있습니다. 또한 23년 8월에 한국식약처로부터 EPO고용량 제품(6000IU,10000IU)에 대해 품목 허가를 획득하였고 EPO 고용량 10000IU 제품에 대해 23년 12월부터 국내 판매를 시작 하였습니다. 태국은 24년 9월에(제품명 Panpotin) 2품목(2000IU,4000IU)에 대해 품목허가를 회득하였습니다. 2021년에는 튀르키예 VEM사에 바이오시밀러 EPO 기술이전($3,000,000) 계약을 체결하였고 베트남은 품목허가를 기다리고 있습니다. 2020년 2월에 한국이슬람교중앙회(KMF)로 부터 할랄인증을 취득하여 향후 아세안시장의 주요 이슬람국가와 사우디아라비아 시장진출에 크게 도움이 될 수 있습니다.
EPO의약품 판권과 관련하여 2014년에 Duopharma Sdn Berhad사와 말레이시아외 2개국 판권계약을 체결하였고 2015년에 S.Charoen사와 태국 판권을, 2019년에 Saudi Vax사와 사우디아라비아외 GCC 5개국의 판권계약을, 2020년에는 중헌제약과 국내 판권계약을, Khuong Duy Pharma사와 베트남 판권계약을, 2021년에는 VEM사와 튀르키예판권 계약을 체결하였습니다.
(나) 바이오의약품(비임상,임상시료포함) 위탁생산 및 개발 기술이전 서비스 사업
당사의 바이오의약품(비임상,임상시료포함) 위탁생산 및 개발 기술이전 서비스 사업은 당사가 보유하고 있는 원천기술인 PanGen CHO-TECH™기술과 바이오의약품 제품화 기술 중 대량생산 기술 및 GMP 운영기술 등이 활용된 사업입니다. 국내외 기업들이 개발하고자 하는 바이오의약품 아이템 별로 우수한 생산용 세포주를 미리 개발한 후 로열티를 부가하여 판매하는 생산용 세포주 기술이전 및 생산공정 기술이전 서비스(CDO:Contract Development Organization)와 비임상시료, 임상시료, 원료의약품 위탁생산 (CMO; Contract Manufacturing Organization) 등의 사업형태로 이루어져 있습니다.
생산용 세포주 기술 이전 서비스 : 이 사업은 PanGen CHO-TECH™ 기술을 이용하여 타 경쟁사 대비 빠른 기간 내에 고 생산성, 고 안정성 바이오 의약품 생산용 CHO(Chinese Hamster Ovary)세포주를 개발하여 관련기술과 함께 세포주를 이전 하는 서비스로 upfront 수익 및 로열티를 부가로 판매하고 있는 사업입니다.
 |
|
세포주 개발 및 기술이전 서비스 공정기간 |
생산공정 기술 이전 서비스는 당사가 보유한 PanGen CHO-TECH™ 기술 외에도 우수한 공정개발 인력의 기술 노하우와 우수한 성능의 첨단 보유 설비들(아래 그림 참조)을 활용하여 우수하고 안정적인 공정개발 기술을 확립하여 고객에게 제공하는 기술이전 서비스입니다.
최근에는 세포주 기술이전 과 공정 기술 이전 계약이 동시에 이루어지고 있습니다.
 |
|
공정개발 기술이전 서비스에 활용되는 설비 |
위탁생산(CMO)서비스는 당사가 보유한 바이오의약품 제품화 기술의 일부와 PanGen CHO-TECH™ 기술, 바이오의약품 GMP 생산시설을 활용하여 국내외 기업들의 비임상 및 임상시험용 시료, 원료의약품 생산을 대행해 주는 서비스 사업입니다.
당사는 바이오의약품 생산용 세포주 개발부터 시작하여 이를 이용한 최적의 공정기술 개발 그리고 마지막 대량생산까지 전 개발 분야에서 원스톱 서비스가 가능한 회사로 타사 대비 경쟁력 있는 사업으로 꾸준히 사업화 실적을 보여주고 있습니다.
 |
|
GMP시설 내에서의 위탁생산 공정과정 |
(다) 바이오의약품 개발 사업
바이오의약품 개발 사업은 당사가 보유한 바이오의약품 개발에 필수적인 PanGen CHO-TECH™ 원천기술과 바이오의약품 제품화 기술을 활용하여 재조합 Factor VIII (혈우병A치료제) 및 바이오시밀러G-CSF(항암치료보조제), 바이오시밀러 Aflibercept(황반변성,황반부종등 치료제), 항SFTSV항체(중증열성혈소판감소증후군 치료제)등의 제품을 개발하는 사업입니다.
 |
|
개발중인 바이오시밀러 제품의 개요 |
혈우병A치료제인 재조합 Factor VIII 제품의 경우 단백질의 크기가 크고 구조가 복잡하여 바이오시밀러 개발이 불가능하므로 일반적인 바이오제네릭 제품으로 개발하고 있습니다. 당사가 개발중인 재조합 Factor VIII 제품은 세계 세 번째 B도메인 결손 재조합 Factor VIII 제품으로 첫 번째 제품은 Pfizer사가 보유한 Xyntha/ReFacto 제품이고 두번째 제품은 녹십자의 그린진-F입니다. Factor VIII은 2017년 7월에 비임상시험을 완료 하였으며, 2018년 10월에 한국식약처에 임상 IND제출하였고 2019년 3월에 한국임상1상 시험승인을 받았습니다. 국내 을지대 병원에서 임상1상 시험을 진행하여, 2019년 11월에 첫 환자 투여를 시작하였고, 2020년 7월에 마지막 환자의 임상약 투여가 완료되어 임상1상 시험이 종료되었습니다. 다국가 임상 3상 시험을 위해 21년 6월에 한국식약처에 임상3상 IND를 제출 하였고 21년 9월에 다국가 임상3상 IND 승인을 받았고 2023년 2월~5월초까지 임상3상 시료 생산을 완료 하였습니다.
항암치료 보조제인 바이오시밀러 G-CSF 제품의 경우 lenograstim 성분의 세계 최초 바이오시밀러 제품으로 개발하고 있습니다. 오리지널 제품은 Roche/Chugai사가 보유한 Neutrogin 제품이며, 당사의 제품은 동물세포배양 방식으로 생산되어 미생물 배양으로 생산되는 filgrastim 성분의 제품보다 효능이 우수하고 안전성이 높은 장점이 있습니다. 현재 비임상 시험을 완료하였습니다.
황반변성, 황반부종등의 치료제인 Aflibercept 바이오시밀러 제품은 바이오시밀러 제품으로 개발하고 있으며, 오리지널 제품은 Regeneron(판매사 Bayer)사의 아일리아 (Eylea)입니다. 오리지널 제품의 특허가 아직 만료되지 않아 전세계적으로 바이오시밀러 제품은 현재 시장에 없는 상황입니다. 오리지널 제품에 대한 특허가 국내 2024년, 미국 2023년, 유럽 2025년에 만료될 예정이므로 당사의 제품개발이 완료될 시점에는 대부분의 주요국가에서 특허가 만료되므로 충분한 시장이 확보될 것으로 보고 있습니다. 당사의 제품은 세포주의 생산성이 높으면서 단백질 품질이 오리지널 제품과 상당히 유사하여 제품생산시 생산 단가를 크게 낮출 수 있게 됨으로써 시장경쟁력 있는 약가가 책정될 수 있을 것으로 예상됩니다. 현재 비임상 시험을 완료하였습니다.
그 밖에 중증 열성 혈소판 감소증후군(Severe fever with thrombocytopenia syndrome) 치료제인 항SFTSV항체 제품이 있습니다. 현재 전세계적으로 치료제가 없으며 2011년 중국에서 처음 환자발생이 보고된 신종감염병으로 국내는 2012년 처음 감염환자 발생이 보고되었고 해마다 환자수가 증가하고 있으며 국내의 경우 최근 9년간(2013~2021년) 치사율이 18.4%에 이를 정도로 매우 높습니다. 당사는 2020년 1월에 중국의 와이클론메티칼 사이언스가 보유한 기술을 도입해 생산세포주 개발 및 공정기술 개발을 완료하였고 현재 비임상 진행중에 있습니다.
(라) 주요시설 현황
당사는 바이오의약품의 대량생산(제품생산)을 위한 바이오의약품 GMP공장을 아래와 같이 구축하여 한국 GMP 뿐만 아니라 ICH 규정에 따르는 GMP 공장을 2011년 2월에 완공하였습니다.
현재 확보된 GMP 생산시설에서 캠페인 생산 기법으로 첫 번째 제품인 바이오시밀러EPO의약품 생산과 위탁생산(CMO) 사업을 병행해서 추진하고 있습니다.
당사의 GMP 생산시설은 자체적으로 주사용수의 제조 및 관리를 하고 있으며, 일회용 바이오리엑터 장비 운용이라는 당사의 생산시설 특성에 따라 교차생산 방식으로 다품목의 생산이 가능하여 생산시설의 가동율을 극대화 할 수 있습니다.
| [주요시설 현황] |
|
시설명 |
주소 |
규모(평) |
비고 |
|---|---|---|---|
|
본 사 |
경기도 수원시 신원로 306 영통 이노플렉스 2동 502호 |
148 |
|
|
연구소 |
경기도 수원시 신원로 306 영통 이노플렉스 1동 510호외 |
355 | |
| GMP공장 및 사무소 |
경기도 수원시 신원로 306 영통 이노플렉스 2동 4층 |
719 | |
|
경기도 수원시 신원로 306 영통 이노플렉스 2동 501호 |
119 |
(마) 수익창출 전략
국내 바이오벤처회사의 사업 전략은 일반적으로 R&D 기반의 기술이전 사업 전략과 바이오의약품 제품생산 사업 전략으로 구별할 수 있습니다.
당사는 바이오의약품 상업화를 위한 GMP공장을 갖추고 직접 바이오의약품 제품의 생산 및 판매, 개발사업과 국내외 기업들이 개발하고자 하는 바이오의약품 아이템 별로우수한 생산용 세포주를 미리 개발한 후 로열티를 부가하여 판매하는 생산용 세포주 기술이전 서비스(CDO)와 생산 공정 개발 서비스, 비임상시료 및 임상시료 위탁생산(CMO) 사업을 병행하며 수익 창출을 하고 있습니다.
| [팬젠 수익창출 모델] |
|
구분 |
수익모델 |
주요(개발)제품 및 서비스 |
진행단계 |
|---|---|---|---|
|
바이오의약품 제품 생산 및 판매, 개발사업전략 |
바이오의약품 제품 개발-> 품목허가후 의약품 판매를 통한 수익창출 |
바이오시밀러 EPO의약품 (만성신부전환자의빈혈 치료제) |
자체제품개발성공 한국,말레이시아, 필리핀, 사우디아라비아 제품판매중 태국 품목허가(24년 9월) 베트남 품목허가신청 튀르키예 VEM사에 기술이전계약체결 |
|
재조합 Factor VIII (혈우병A 치료제) |
비임상완료(17년 7월) |
||
|
바이오시밀러 G-CSF (항암치료 보조제) |
비임상완료(15년 2월) | ||
| 바이오시밀러 Aflibercept (황반변성,황반부종등 치료제) |
비임상 완료(20년 9월) | ||
| 항SFTSV항체 (중증열성혈소판감소증후군치료제) |
생산세포주 및 공정기술개발완료 (20년 8월) 비임상 진행중 |
||
|
R&D 기반 바이오의약품 |
바이오의약품 개발 기술 |
생산용세포주 및 생산공정 기술이전 서비스 |
사업화 (기술이전) |
|
위탁생산서비스(CMO) |
사업화 |
III. 재무에 관한 사항
1. 요약재무정보
당사는 최근 사업연도말 현재의 자산총액이 1천억원 미만인 "소규모기업"에 해당하여 요약재무정보 등에 관한 사항의 기재를 생략합니다. 다음의 재무제표 본문을 참고하시기 바랍니다.
2. 연결재무제표
본 보고서 작성기준일 현재 해당사항 없습니다.
3. 연결재무제표 주석
본 보고서 작성기준일 현재 해당사항 없습니다.
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 16 기 1분기말 2025.03.31 현재 |
|
제 15 기말 2024.12.31 현재 |
|
(단위 : 원) |
|
제 16 기 1분기말 |
제 15 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
21,188,883,179 |
20,768,229,783 |
|
현금및현금성자산 |
2,051,606,485 |
1,430,113,807 |
|
매출채권 및 기타채권 |
3,011,896,957 |
2,961,064,901 |
|
계약자산 |
14,003,273 |
0 |
|
기타유동금융자산 |
9,177,967,883 |
10,301,909,041 |
|
기타유동자산 |
46,740,645 |
54,001,902 |
|
당기법인세자산 |
33,143,560 |
20,307,790 |
|
유동재고자산 |
6,853,524,376 |
6,000,832,342 |
|
비유동자산 |
9,718,008,632 |
9,776,452,586 |
|
기타비유동금융자산 |
97,648,632 |
95,685,331 |
|
기타비유동자산 |
119,376,658 |
34,442,368 |
|
투자부동산 |
432,015,561 |
434,016,255 |
|
유형자산 |
5,847,815,267 |
5,805,145,517 |
|
무형자산 |
3,221,152,514 |
3,407,163,115 |
|
자산총계 |
30,906,891,811 |
30,544,682,369 |
|
부채 |
||
|
유동부채 |
2,409,894,830 |
2,898,826,853 |
|
매입채무 및 기타채무 |
647,564,913 |
1,219,477,752 |
|
계약부채 |
446,140,305 |
401,608,085 |
|
유동성전환사채 |
850,047,311 |
816,300,976 |
|
유동파생상품부채 |
413,578,000 |
413,578,000 |
|
유동 리스부채 |
1,397,901 |
1,844,500 |
|
기타 유동부채 |
51,166,400 |
46,017,540 |
|
비유동부채 |
2,852,044,597 |
2,737,142,170 |
|
비유동 리스부채 |
391,028 |
391,028 |
|
기타비유동금융부채 |
30,000,000 |
30,000,000 |
|
순확정급여부채 |
2,821,653,569 |
2,706,751,142 |
|
부채총계 |
5,261,939,427 |
5,635,969,023 |
|
자본 |
||
|
자본금 |
6,449,098,500 |
6,449,098,500 |
|
주식발행초과금 |
67,109,603,692 |
67,109,603,692 |
|
기타자본구성요소 |
1,303,408,063 |
1,303,408,063 |
|
이익잉여금(결손금) |
(49,217,157,871) |
(49,953,396,909) |
|
자본총계 |
25,644,952,384 |
24,908,713,346 |
|
부채와자본총계 |
30,906,891,811 |
30,544,682,369 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 16 기 1분기 2025.01.01 부터 2025.03.31 까지 |
|
제 15 기 1분기 2024.01.01 부터 2024.03.31 까지 |
|
(단위 : 원) |
|
제 16 기 1분기 |
제 15 기 1분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출액 |
3,441,287,044 |
3,441,287,044 |
3,474,763,501 |
3,474,763,501 |
|
매출원가 |
1,731,600,713 |
1,731,600,713 |
2,361,653,547 |
2,361,653,547 |
|
매출총이익(손실) |
1,709,686,331 |
1,709,686,331 |
1,113,109,954 |
1,113,109,954 |
|
판매비와관리비 |
1,008,946,260 |
1,008,946,260 |
1,032,674,739 |
1,032,674,739 |
|
영업이익(손실) |
700,740,071 |
700,740,071 |
80,435,215 |
80,435,215 |
|
영업외손익 |
49,126,708 |
49,126,708 |
(13,719,970) |
(13,719,970) |
|
금융수익 |
106,205,600 |
106,205,600 |
52,129,075 |
52,129,075 |
|
금융비용 |
80,955,765 |
80,955,765 |
86,672,376 |
86,672,376 |
|
기타수익 |
26,069,399 |
26,069,399 |
22,867,229 |
22,867,229 |
|
기타비용 |
2,192,526 |
2,192,526 |
2,043,898 |
2,043,898 |
|
법인세비용차감전순이익(손실) |
749,866,779 |
749,866,779 |
66,715,245 |
66,715,245 |
|
법인세비용(수익) |
13,627,741 |
13,627,741 |
0 |
0 |
|
당기순이익(손실) |
736,239,038 |
736,239,038 |
66,715,245 |
66,715,245 |
|
기타포괄손익 |
0 |
0 |
0 |
0 |
|
후속적으로 당기손익으로 재분류되지 않는 항목 |
0 |
0 |
0 |
0 |
|
순확정급여부채의재측정요소 |
0 |
0 |
0 |
0 |
|
총포괄손익 |
736,239,038 |
736,239,038 |
66,715,245 |
66,715,245 |
|
주당손익 |
||||
|
기본주당손익 (단위 : 원) |
57 |
57 |
6 |
6 |
|
희석주당손익 (단위 : 원) |
57 |
57 |
6 |
6 |
4-3. 자본변동표
|
자본변동표 |
|
제 16 기 1분기 2025.01.01 부터 2025.03.31 까지 |
|
제 15 기 1분기 2024.01.01 부터 2024.03.31 까지 |
|
(단위 : 원) |
|
자본 |
|||||
|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본 |
미처분이익잉여금(미처리결손금) |
자본 합계 |
|
|
2024.01.01 (기초자본) |
5,338,815,000 |
56,799,551,443 |
1,303,408,063 |
(50,875,796,668) |
12,565,977,838 |
|
당기순이익(손실) |
0 |
0 |
0 |
66,715,245 |
66,715,245 |
|
순확정급여부채의재측정요소 |
0 |
0 |
0 |
0 |
0 |
|
유상증자 |
368,526,500 |
3,628,986,711 |
0 |
0 |
3,997,513,211 |
|
자본 증가(감소) 합계 |
368,526,500 |
3,628,986,711 |
0 |
66,715,245 |
4,064,228,456 |
|
2024.03.31 (기말자본) |
5,707,341,500 |
60,428,538,154 |
1,303,408,063 |
(50,809,081,423) |
16,630,206,294 |
|
2025.01.01 (기초자본) |
6,449,098,500 |
67,109,603,692 |
1,303,408,063 |
(49,953,396,909) |
24,908,713,346 |
|
당기순이익(손실) |
0 |
0 |
0 |
736,239,038 |
736,239,038 |
|
순확정급여부채의재측정요소 |
0 |
0 |
0 |
0 |
0 |
|
유상증자 |
0 |
0 |
0 |
0 |
0 |
|
자본 증가(감소) 합계 |
0 |
0 |
0 |
736,239,038 |
736,239,038 |
|
2025.03.31 (기말자본) |
6,449,098,500 |
67,109,603,692 |
1,303,408,063 |
(49,217,157,871) |
25,644,952,384 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 16 기 1분기 2025.01.01 부터 2025.03.31 까지 |
|
제 15 기 1분기 2024.01.01 부터 2024.03.31 까지 |
|
(단위 : 원) |
|
제 16 기 1분기 |
제 15 기 1분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(253,771,259) |
132,311,275 |
|
영업활동으로부터창출된현금흐름 |
(305,740,080) |
131,005,361 |
|
이자의 수취 |
78,476,641 |
2,762,909 |
|
이자의 지급 |
(44,309) |
(962,485) |
|
법인세환급(납부) |
(26,463,511) |
(494,510) |
|
투자활동현금흐름 |
875,710,536 |
161,456,577 |
|
투자활동으로인한현금유입액 |
7,167,090,909 |
313,000,000 |
|
기타유동금융자산의 감소 |
7,150,000,000 |
163,000,000 |
|
유형자산의 처분 |
17,090,909 |
150,000,000 |
|
투자활동으로인한현금유출액 |
(6,291,380,373) |
(151,543,423) |
|
기타유동금융자산의 취득 |
6,013,000,000 |
13,000,000 |
|
기타비유동금융자산의 취득 |
0 |
90,000,000 |
|
기타비유동자산의 증가 |
84,934,290 |
1,604,397 |
|
유형자산의 취득 |
191,240,663 |
17,821,026 |
|
무형자산의 취득 |
0 |
4,000,000 |
|
기타채무의 감소 |
2,205,420 |
25,118,000 |
|
재무활동현금흐름 |
(446,599) |
3,997,102,846 |
|
재무활동으로인한현금유입액 |
0 |
4,979,986,631 |
|
유상증자 |
0 |
3,999,986,631 |
|
단기차입금의 증가 |
0 |
980,000,000 |
|
재무활동으로인한현금유출액 |
(446,599) |
(982,883,785) |
|
리스부채의 감소 |
446,599 |
410,365 |
|
단기차입금의 상환 |
0 |
980,000,000 |
|
신주발행비 지급 |
0 |
2,473,420 |
|
현금및현금성자산의 증가(감소) |
621,492,678 |
4,290,870,698 |
|
외화표시 현금및현금성자산의 환율변동효과 |
0 |
0 |
|
기초현금및현금성자산 |
1,430,113,807 |
45,404,243 |
|
기말현금및현금성자산 |
2,051,606,485 |
4,336,274,941 |
5. 재무제표 주석
| 제16(당)기 1분기 2025년 01월 01일부터 2025년 03월 31일까지 |
| 제15(전)기 1분기 2024년 01월 01일부터 2024년 03월 31일까지 |
| 주식회사 팬젠 |
1. 회사의 개요
주식회사 팬젠(이하 "당사")는 2010년 1월 11일에 분할ㆍ신설되어, 바이오의약품 생산용 GMP시설과 당사의 원천기술인 PanGen CHO-TECH™ 기술, 바이오의약품 제품화 기술을 활용하여 바이오시밀러 EPO의약품 생산 및 판매, 바이오의약품 개발 사업, 바이오의약품 위탁생산 및 개발기술 이전서비스 사업을 수행하고 있으며, 경기도 수원시 영통구 신원로 306 영통이노플렉스 2동 4층에 본사를 두고 있습니다.
보고기간말 현재 당사의 최대주주는 (주)휴온스이고 당사의 자본금은 6,449,099천원(발행주식총수 12,898,197주이며, 2016년 03월 11일 코스닥시장에 상장하였고 주요 주주의 구성내역은 다음과 같습니다.
| (단위: 주) |
| 주 주 명 | 주식수 | 지분율(%) |
|---|---|---|
| (주)휴온스 및 특수관계자 | 4,531,192 | 35.13 |
| 화일약품(주) | 831,203 | 6.44 |
| DUOPHARMA BIOTECH BERHAD | 806,450 | 6.25 |
| 기타 | 6,729,352 | 52.18 |
| 합 계 | 12,898,197 | 100.00 |
2. 재무제표 작성기준
당사의 분기재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 동 분기재무제표에 대한 이해를 위해서는 한국채택국제회계기준에 따라 작성된 2024년 12월 31일자로 종료하는 회계연도에 대한 연차재무제표를 함께 이용하여야 합니다.
분기재무제표의 작성에 적용된 중요한 회계정책은 아래에서 설명하는 기준서나 해석서의 도입과 관련된 영향을 제외하고는 2024년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다.
2-1 당사가 신규 적용한 제ㆍ개정 기준서 및 해석서
당사는 2025년 1월 1일로 개시하는 회계기간부터 다음의 주요 제ㆍ개정 기준서 및 해석서를 신규로 적용하였으며, 해당 기준서 및 해석서의 개정이 당사의 분기재무제표에 미치는 중요한 영향은 없습니다.
- 기업회계기준서 제1021호 '환율변동효과' 및 제1101호 '한국채택국제회계기준의 최초채택'(개정): 교환가능성 결여
다른 통화와의 교환가능성을 평가하고 다른 통화와 교환이 가능하지 않다면 현물환율을 추정하고 기업의 재무성과, 재무상태 및 현금흐름에 미치는 영향을 공시하도록 요구하고 있습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없을 것으로 예상하고 있습니다.
2-2 당사가 적용하지 않은 제ㆍ개정 기준서 및 해석서
제정ㆍ공표되었으나 2025년 1월 1일 이후 시작하는 회계연도에 시행일이 도래하지 않았고 당사가 조기 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
- 기업회계기준서 제1109호 '금융상품' 및 제1107호 '금융상품: 공시'(개정): 금융상품 분류와 측정
특정조건을 모두 충족하는 경우 결제일 전에 전자지급시스템을 통해 금융부채가 결제된 것으로 간주할 수 있도록 허용하는 규정이 신설되었으며 계약상 현금흐름 특성을 평가할 때, 원리금 지급만으로 구성되어 있는 현금흐름 관련 규정이 명확화 되었습니다. 또한, 기타포괄손익-공정가치 측정 지분상품의 투자 종류별 공정가치 변동 및 실현손익 정보에 대한 공시 요구사항이 추가되었습니다. 개정사항은 2026년 1월 1일 이후 시작하는 회계연도부터 적용되며, 조기적용이 허용됩니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없을 것으로 예상하고 있습니다.
- 한국채택국제회계기준 연차개선
한국채택국제회계기준 연차개선은 2026년 1월 1일 이후 시작하는 회계연도부터 적용되며, 조기적용이 허용됩니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없을 것으로 예상하고 있습니다.
ㆍ 제1101호 '한국채택국제회계기준의 최초 채택': 불명확한 표현 및 기준서간 상이한 용어 개정
ㆍ 제1107호 '금융상품 공시': 용어 및 내용이 기준서간 일관되도록 개정
ㆍ 제1109호 '금융상품': 리스부채 제거 시 기업회계기준서 제1109호에 따라 당기손익으로 인식
ㆍ 제1110호 '연결재무제표': 사실상 대리인 여부는 판단의 대상임을 명확히 함
ㆍ 제1007호 '현금흐름표': '원가법'을 삭제하고 '원가'로 대체하여 기준서간 용어일치
3. 중요한 회계추정 및 가정
당사는 미래에 대하여 추정 및 가정을 하고 있습니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에서 합리적으로 예측 가능한 미래의 사건과 같은 다른 요소들을 고려하여 이루어집니다. 이러한 회계추정은 실제 결과와 다를 수도 있습니다.
분기재무제표 작성시 사용된 중요한 회계추정 및 가정은 법인세 비용을 결정하는데 사용된 추정의 방법을 제외하고는 전기 재무제표 작성에 적용된 회계추정 및 가정과 동일합니다.
4. 영업부문
4-1 영업부문의 식별
당사는 전략적인 영업단위를 5개의 보고부문으로 구분하였습니다. 최고영업의사결정자는각 전략적인 영업단위들에 대한 내부보고자료를 최소한 분기단위로 검토하고 있습니다. 한편, 부문별 정보 중 부문자산 및 부문부채에 관한 사항은 최고영업의사결정권자에게 정기적으로 보고되지 않으므로 별도 공시하지 아니합니다.
4-2 사업부문 및 제품유형
당사의 사업부문 및 주요 제품 유형은 다음과 같습니다.
| 구 분 | 제품유형 |
|---|---|
| EPO 의약품 | 만성신부전환자의 빈혈치료제 |
| 기술이전(CDO) | 바이오의약품 개발기술 이전매출 |
| 위탁생산(CMO) | 비임상 및 임상시료 위탁생산 서비스 |
| 로열티 | 바이오의약품 개발기술 이전 로열티 |
| 기타 | 연구용역, Protein 및 KIT, 기타상품 |
4-3 부문별 매출액에 대한 정보
당분기 및 전분기 중 주요 사업부문에 대한 매출내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| EPO 의약품 | 2,959,319 | 1,867,597 |
| 기술이전(CDO) | 261,794 | 73,077 |
| 위탁생산(CMO) | - | 1,271,546 |
| 기타 | 220,174 | 262,543 |
| 합 계 | 3,441,287 | 3,474,764 |
4-4 지역별 매출액에 대한 정보
당분기 및 전분기 중 지역별 매출내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 매출비중(%) | 매출액 | 매출비중(%) | 매출액 | |
| 국 내 | 23.9% | 823,449 | 50.7% | 1,762,288 |
| 해 외 | 76.1% | 2,617,838 | 49.3% | 1,712,476 |
| 합 계 | 100.0% | 3,441,287 | 100.0% | 3,474,764 |
4-5 주요 고객에 대한 의존도
당분기 및 전분기 중 당사 매출액 중 전체 매출의 10%이상을 차지하는 주요 고객 및 비중은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 사업부문 | 당분기 | 전분기 | ||
|---|---|---|---|---|---|
| 금 액 | 비 중 | 금 액 | 비 중 | ||
| A사 | EPO 의약품 | 1,887,457 | 54.8% | 1,348,137 | 38.8% |
| B사 | EPO 의약품 | 638,338 | 18.5% | 319,206 | 9.2% |
| C사 | 기술이전(CDO) | 171,023 | 5.0% | - | - |
| 위탁생산(CMO) | - | - | 1,266,546 | 36.4% | |
| 용역 | 16,725 | 0.5% | 8,441 | 0.2% | |
5. 범주별 금융상품
5-1 보고기간말 현재 금융자산의 범주별 분류내역은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익- 공정가치측정 금융자산 |
합 계 |
|---|---|---|---|---|---|
| 유동 | 현금및현금성자산 | 2,051,606 | - | - | 2,051,606 |
| 매출채권및기타채권 | 3,011,897 | - | - | 3,011,897 | |
| 기타금융자산 | 9,177,968 | - | - | 9,177,968 | |
| 소 계 | 14,241,471 | - | - | 14,241,471 | |
| 비유동 | 기타금융자산 | 97,649 | - | - | 97,649 |
| 합 계 | 14,339,120 | - | - | 14,339,120 | |
<전 기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익- 공정가치측정 금융자산 |
합 계 |
|---|---|---|---|---|---|
| 유동 | 현금및현금성자산 | 1,430,114 | - | - | 1,430,114 |
| 매출채권및기타채권 | 2,961,065 | - | - | 2,961,065 | |
| 기타금융자산 | 10,301,909 | - | - | 10,301,909 | |
| 소 계 | 14,693,088 | - | - | 14,693,088 | |
| 비유동 | 기타금융자산 | 95,685 | - | - | 95,685 |
| 합 계 | 14,788,773 | - | - | 14,788,773 | |
5-2 보고기간말 현재 금융부채의 범주별 분류내역은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융부채 |
당기손익- 공정가치측정 금융부채 |
합 계 |
|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 647,565 | - | 647,565 |
| 전환사채 | 850,047 | - | 850,047 | |
| 파생상품부채 | - | 413,578 | 413,578 | |
| 리스부채 | 1,398 | - | 1,398 | |
| 소 계 | 1,499,010 | 413,578 | 1,912,588 | |
| 비유동 | 리스부채 | 391 | - | 391 |
| 기타금융부채 | 30,000 | - | 30,000 | |
| 소 계 | 30,391 | - | 30,391 | |
| 합 계 | 1,529,401 | 413,578 | 1,942,979 | |
<전 기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융부채 |
당기손익- 공정가치측정 금융부채 |
합 계 |
|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 1,219,478 | - | 1,219,478 |
| 전환사채 | 816,301 | - | 816,301 | |
| 파생상품부채 | - | 413,578 | 413,578 | |
| 리스부채 | 1,845 | - | 1,845 | |
| 소 계 | 2,037,623 | 413,578 | 2,451,201 | |
| 비유동 | 리스부채 | 391 | - | 391 |
| 기타금융부채 | 30,000 | - | 30,000 | |
| 소 계 | 30,391 | - | 30,391 | |
| 합 계 | 2,068,014 | 413,578 | 2,481,592 | |
5-3 당분기 및 전분기 중 금융상품의 범주별 손익현황은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 상각후원가측정금융자산 | 당기손익- 공정가치측정 금융자산 |
기타포괄손익-공정가치측정 금융자산 |
상각후원가측정금융부채 | 당기손익- 공정가치측정 금융부채 |
합 계 |
|---|---|---|---|---|---|---|
| 이자수익 | 93,499 | - | - | - | - | 93,499 |
| 외환차익 | 5,512 | - | - | 1 | - | 5,513 |
| 외화환산이익 | 7,194 | - | - | - | - | 7,194 |
| 수익 합계 | 106,205 | - | - | 1 | - | 106,206 |
| 이자비용 | - | - | - | 33,791 | - | 33,791 |
| 외환차손 | 44,141 | - | - | 67 | - | 44,208 |
| 외화환산손실 | 2,878 | - | - | 78 | - | 2,957 |
| 비용 합계 | 47,019 | - | - | 33,936 | - | 80,956 |
<전분기>
| (단위: 천원) |
| 구 분 | 상각후원가측정금융자산 | 당기손익- 공정가치측정 금융자산 |
기타포괄손익-공정가치측정 금융자산 |
상각후원가측정금융부채 | 당기손익- 공정가치측정 금융부채 |
합 계 |
|---|---|---|---|---|---|---|
| 이자수익 | 6,138 | - | - | - | - | 6,138 |
| 외환차익 | 33,247 | - | - | - | - | 33,247 |
| 외화환산이익 | 12,566 | - | - | 4 | - | 12,571 |
| 리스상환이익 | 173 | - | - | - | - | 173 |
| 수익 합계 | 52,124 | - | - | 4 | - | 52,129 |
| 이자비용 | - | - | - | 85,167 | - | 85,167 |
| 외환차손 | 1,415 | - | - | 30 | - | 1,446 |
| 외화환산손실 | - | - | - | 59 | - | 59 |
| 비용 합계 | 1,415 | - | - | 85,256 | - | 86,672 |
6. 현금및현금성자산
보고기간말 현재 현금및현금성자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 거래처 | 당분기말 | 전기말 |
|---|---|---|---|
| 보 유 현 금 | - | - | 1,120 |
| 단 기 예 금 | 기업은행 등 | 2,051,606 | 1,428,994 |
| 합 계 | 2,051,606 | 1,430,114 | |
7. 매출채권및기타채권
7-1 보고기간말 현재 매출채권및기타채권의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 과 목 | 당분기말 | 전기말 |
|---|---|---|---|
| 유동자산 | 매출채권 | 3,159,356 | 3,238,875 |
| (손실충당금) | (280,000) | (280,000) | |
| 미수금 | 132,541 | 2,190 | |
| 합 계 | 3,011,897 | 2,961,065 | |
7-2 당분기 및 전기 중 매출채권및기타채권에 대한 손실충당금의 변동내역은 다음과 같습니다. 당사는 매출채권및기타채권에 대해 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용합니다.
<당분기>
| (단위: 천원) |
| 과목 | 전체기간 기대신용손실 | 합계 | ||
|---|---|---|---|---|
|
매출채권 (개별평가) |
매출채권 (집합평가) |
미수금 | ||
| 기초 손실충당금 | 280,000 | - | - | 280,000 |
| 설정(환입) | - | - | - | - |
| 기말 손실충당금 | 280,000 | - | - | 280,000 |
<전 기>
| (단위: 천원) |
| 과목 | 전체기간 기대신용손실 | 합계 | ||
|---|---|---|---|---|
|
매출채권 (개별평가) |
매출채권 (집합평가) |
미수금 | ||
| 기초 손실충당금 | 140,000 | - | - | 140,000 |
| 설정(환입) | 140,000 | - | - | 140,000 |
| 기말 손실충당금 | 280,000 | - | - | 280,000 |
8. 계약자산과 계약부채
8-1 보고기간말 현재 고객과의 계약으로 인한 계약자산과 계약부채는 아래와 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 계약자산 | 31,143 | 17,139 |
| (손실충당금) | (17,139) | (17,139) |
| 계약부채 | 446,140 | 401,608 |
| 이행되지 않은 수행의무에 배부된 거래가격 | 446,140 | 401,608 |
8-2 당분기 및 전기 중 계약자산과 계약부채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전기 | ||
|---|---|---|---|---|
| 계약자산 | 계약부채 | 계약자산 | 계약부채 | |
| 기 초 | - | 401,608 | 190,570 | 1,207,784 |
| 증 가 | 107,739 | 383,961 | 2,866,750 | 4,490,500 |
| 감 소 | 93,736 | 339,429 | 3,048,750 | 5,296,677 |
| 손실충당금 | - | - | 8,569 | - |
| 기 말 | 14,003 | 446,140 | - | 401,608 |
8-3 당분기 및 전기 중 계약자산에 대한 손실충당금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 과목 | 당분기말 | 전기말 |
|---|---|---|
| 기초 손실충당금 | 17,139 | 8,570 |
| 설정(환입) | - | 8,569 |
| 기말 손실충당금 | 17,139 | 17,139 |
8-4 보고기간말 현재 이행되지 않은 수행의무에 배부된 거래가격은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기술이전(CDO) | 205,079 | 50,330 |
| 분석용역 등 | 241,061 | 351,278 |
| 합 계 | 446,140 | 401,608 |
9. 기타금융자산
보고기간말 현재 기타금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 유동: | ||
| 단기금융상품 | 9,000,000 | 10,000,000 |
| 단기대여금 | 113,000 | 250,000 |
| 미수수익 | 62,668 | 49,609 |
| 임차보증금 | 2,300 | 2,300 |
| 소 계 | 9,177,968 | 10,301,909 |
| 비유동: | ||
| 임차보증금 | 83,621 | 81,658 |
| 기타보증금 | 14,028 | 14,028 |
| 소 계 | 97,649 | 95,685 |
| 합 계 | 9,275,617 | 10,397,594 |
10. 기타자산
보고기간말 현재 기타자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 유동: | ||
| 선급금 | 220 | 45 |
| 선급비용 | 46,521 | 53,957 |
| 소 계 | 46,741 | 54,002 |
| 비유동: | ||
| 선급금 | 119,377 | 34,442 |
| 합 계 | 166,117 | 88,444 |
11. 재고자산
보고기간말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 평가손실 충당금(*) |
장부금액 | 취득원가 | 평가손실 충당금(*) |
장부금액 | |
| 원 재 료 | 136,477 | - | 136,477 | 391,971 | - | 391,971 |
| 부 재 료 | 1,701,039 | (450,717) | 1,250,322 | 1,627,649 | (450,717) | 1,176,931 |
| 재 공 품 | 5,466,725 | - | 5,466,725 | 3,948,596 | - | 3,948,596 |
| 제 품 | - | - | - | 483,333 | - | 483,333 |
| 합 계 | 7,304,242 | (450,717) | 6,853,524 | 6,451,549 | (450,717) | 6,000,832 |
* 당분기 중 인식한 평가손실충당금은 없으며, 전기말 기준 부재료와 관련하여 인식한 평가손실충당금은 450,717천원입니다.
12. 투자부동산
12-1 보고기간말 현재 투자부동산의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 감가상각 누계액 |
장부금액 | 취득원가 | 감가상각 누계액 |
장부금액 | |
| 토 지 | 127,244 | - | 127,244 | 127,244 | - | 127,244 |
| 건 물 | 400,137 | (95,366) | 304,771 | 400,137 | (93,365) | 306,772 |
| 합 계 | 527,381 | (95,366) | 432,016 | 527,381 | (93,365) | 434,016 |
12-2 당분기 및 전기 중 당사의 투자부동산 장부가액의 변동내용은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 기 초 | 취 득 | 처 분 | 감가상각비 | 기타증감 | 기 말 |
|---|---|---|---|---|---|---|
| 토 지 | 127,244 | - | - | - | - | 127,244 |
| 건 물 | 306,772 | - | - | (2,001) | - | 304,771 |
| 합 계 | 434,016 | - | - | (2,001) | - | 432,016 |
<전 기>
| (단위: 천원) |
| 구 분 | 기 초 | 취 득 | 처 분 | 감가상각비 | 기타증감 | 기 말 |
|---|---|---|---|---|---|---|
| 토 지 | 127,244 | - | - | - | - | 127,244 |
| 건 물 | 314,775 | - | - | (8,003) | - | 306,772 |
| 합 계 | 442,019 | - | - | (8,003) | - | 434,016 |
12-3 당분기 및 전분기 중 투자부동산에서 발생한 손익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 임대수익 | 8,250 | 8,250 |
| 운영비용 | 2,024 | 2,027 |
13. 유형자산
13-1 보고기간말 현재 유형자산의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 감가상각 누계액 |
장부금액 | 취득원가 | 감가상각 누계액 |
장부금액 | |
| 토지 | 1,173,679 | - | 1,173,679 | 1,173,679 | - | 1,173,679 |
| 건물 | 3,909,383 | (873,637) | 3,035,746 | 3,909,383 | (854,090) | 3,055,293 |
| 기계장치 | 10,765,149 | (9,375,721) | 1,389,428 | 10,660,449 | (9,243,957) | 1,416,492 |
| 차량운반구 | 82,633 | (2,754) | 79,879 | 84,481 | (84,480) | 1 |
| 공구와기구 | 8,519 | (8,517) | 2 | 8,519 | (8,517) | 2 |
| 비품 | 1,040,771 | (880,524) | 160,247 | 1,012,754 | (864,320) | 148,434 |
| 사용권자산 | 24,449 | (15,614) | 8,834 | 24,449 | (13,205) | 11,243 |
| 합 계 | 17,004,583 | (11,156,767) | 5,847,815 | 16,873,715 | (11,068,569) | 5,805,146 |
13-2 당분기 및 전기 중 당사의 유형자산 장부가액의 변동내용은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 기초 | 취득 | 대체 | 처분 또는 폐기 | 감가상각 | 기 말 |
|---|---|---|---|---|---|---|
| 토지 | 1,173,679 | - | - | - | - | 1,173,679 |
| 건물 | 3,055,293 | - | - | - | (19,547) | 3,035,746 |
| 기계장치 | 1,416,492 | 104,700 | - | - | (131,764) | 1,389,428 |
| 차량운반구 | 1 | 82,633 | - | (1) | (2,754) | 79,879 |
| 공구와기구 | 2 | - | - | - | - | 2 |
| 비품 | 148,434 | 29,218 | - | (192) | (17,213) | 160,247 |
| 사용권자산 | 11,243 | - | - | - | (2,409) | 8,834 |
| 합 계 | 5,805,146 | 216,551 | - | (193) | (173,687) | 5,847,815 |
<전 기>
| (단위: 천원) |
| 구 분 | 기초 | 취득 | 대체 | 처분 또는 폐기 | 감가상각 | 기 말 |
|---|---|---|---|---|---|---|
| 토지 | 1,173,679 | - | - | - | - | 1,173,679 |
| 건물 | 3,133,481 | - | - | - | (78,188) | 3,055,293 |
| 기계장치 | 1,602,945 | 338,604 | 125,357 | (136,070) | (514,343) | 1,416,492 |
| 차량운반구 | 1 | - | - | - | - | 1 |
| 공구와기구 | 2 | - | - | - | - | 2 |
| 비품 | 197,950 | 23,657 | - | (161) | (73,012) | 148,434 |
| 사용권자산 | 6,127 | 15,825 | - | - | (10,709) | 11,243 |
| 건설중인자산 | 125,357 | - | (125,357) | - | - | - |
| 합 계 | 6,239,542 | 378,086 | - | (136,231) | (676,252) | 5,805,146 |
13-3 보험가입자산
| (단위: 천원) |
| 보험종류 | 자 산 | 장부가액 | 부보액 | 보험회사명 |
|---|---|---|---|---|
| 화재보험 | 건물 | 3,035,746 | 7,358,607 | KB손해보험㈜ |
| 기계장치 | 1,389,428 |
당사는 당분기말 현재 상기보험 이외에 가스사고배상책임보험(부보액 380,000천원), 영업배상책임보험(부보액 500,000천원) 및 생산물배상책임보험(부보액 3,580,000천원), 단기수출보험(부보액 USD 20,000)에 가입하고 있습니다.
14. 무형자산
14-1 보고기간말 현재 무형자산의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||||
|---|---|---|---|---|---|---|---|---|
| 취득원가 | 상각누계액 | 손상차손누계액 | 장부금액 | 취득원가 | 상각누계액 | 손상차손누계액 | 장부금액 | |
| 특허권 | 1,140,116 | (427,663) | - | 712,453 | 1,140,116 | (399,329) | - | 740,787 |
| 상표권 | 3,188 | (1,355) | - | 1,833 | 3,188 | (1,196) | - | 1,993 |
| 개발비 | 8,844,939 | (4,533,364) | (1,853,419) | 2,458,156 | 8,844,939 | (4,369,487) | (1,853,419) | 2,622,033 |
| 소프트웨어 | 119,169 | (70,458) | - | 48,710 | 108,779 | (66,428) | - | 42,351 |
| 합 계 | 10,107,412 | (5,032,841) | (1,853,419) | 3,221,153 | 10,097,022 | (4,836,440) | (1,853,419) | 3,407,163 |
14-2 당분기 및 전기 중 당사의 무형자산 장부가액의 변동내용은 다음과 같습니다.
<당분기>
| (단위 : 천원) |
| 구 분 | 특허권 | 상표권 | 개발비 | 소프트웨어 | 합 계 |
|---|---|---|---|---|---|
| 기초 장부금액 | 740,787 | 1,993 | 2,622,033 | 42,351 | 3,407,163 |
| 증가금액 | |||||
| 내부개발 | - | - | - | - | - |
| 개별취득 | - | - | - | 10,390 | 10,390 |
| 감소금액 | |||||
| 상각 | 28,335 | 159 | 163,876 | 4,030 | 196,401 |
| 손상차손 | - | - | - | - | - |
| 기말 장부금액 | 712,453 | 1,833 | 2,458,156 | 48,710 | 3,221,153 |
<전 기>
| (단위 : 천원) |
| 구 분 | 특허권 | 상표권 | 개발비 | 소프트웨어 | 합 계 |
|---|---|---|---|---|---|
| 기초 장부금액 | 822,988 | 2,630 | 3,277,537 | 54,313 | 4,157,469 |
| 증가금액 | |||||
| 내부개발 | - | - | - | - | - |
| 개별취득 | 29,294 | - | - | 4,500 | 33,794 |
| 감소금액 | |||||
| 상각 | 111,494 | 638 | 655,505 | 16,463 | 784,100 |
| 손상차손 | - | - | - | - | - |
| 기말 장부금액 | 740,787 | 1,993 | 2,622,033 | 42,351 | 3,407,163 |
14-3 당분기 중 개발비의 변동 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 기 초 | 증 가 | 상 각 | 손상차손 | 당분기말 | 잔여상각기간 |
|---|---|---|---|---|---|---|
| 세포주 개발 | 13 | - | - | - | 13 | - |
| EPO 개발 | 2,622,020 | - | (163,876) | - | 2,458,143 | 3.75년 |
| 합 계 | 2,622,033 | - | (163,876) | - | 2,458,156 |
14-4 EPO개발과 관련하여 당분기까지 인식한 연구개발비 자산화 내역은 다음과 같습니다.
| (단위: 천원) |
| 분 류 | 단 계 | 구 분 | 자산명 | 자산화한 연구개발비 금액(누계액) | 연구개발비 | 잔여 상각기간 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 전임상 | 임상1상 | 임상2상 | 임상3상 | 판매승인 | 합 계 | 장부금액 | 상각 누계액 |
손상차손 누계액 |
|||||
| 개발비 | 개발완료 | 바이오시밀러 | EPO | - | 1,210,177 | - | 7,263,843 | - | 8,474,020 | 2,458,143 | 4,162,458 | 1,853,419 | 3.75년 |
EPO는 신장투석환자(만성신부전증)의 투석 중 일어나는 급성 빈혈 치료제로서 개발을 위하여 말레이시아 국영제약사인 DUOPHARMA BIOTECH BERHAD의 자회사인 DUOPHARMA SDN BERHAD와 공동으로 한국과 말레이시아에서 임상시험을 진행하였으며, 당사는 2019년중 말레이시아 식약청(NPRA)과 한국식약처로부터 품목허가(NDA)를 승인받아 보고기간말현재 제품(제품명: 말레이시아 ERYSAA, 한국 PANPOTIN)을 판매 중에 있습니다. 또한, 2022년 8월에 필리핀 식약청으로부터 품목허가(NDA) 승인을 받아 제품(제품명: ERYSAA)을 판매 중에 있고, 2023년 5월에 사우디아라비아 식약청으로부터 품목허가(NDA) 승인을 받아(제품명: PANPOTIN) 판매 중에 있으며, 2024년 9월에 태국 식약청으로부터 품목허가(NDA) 승인을 받았습니다.
14-5 개발비 손상차손의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 개발자산 | 장부금액 | 상각누계액 | 손상차손 금액 | 회수가능액 평가방법 |
|
|---|---|---|---|---|---|---|
| 당분기 | 누계액 | |||||
| 개발비 | EPO 개발 | 2,458,143 | 4,162,458 | - | 1,853,419 | 사용가치 |
14-6 당분기 및 전분기 중 판매비와관리비에 포함하여 비용으로 인식한 연구개발비용은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| FACTORⅧ 개발 | 772 | - |
| EPO 개발 | - | 29,009 |
| Aflibercept 개발 | 4,631 | 3,866 |
| 기타연구개발 | 460,370 | 461,861 |
| 차감: 정부보조금 | - | - |
| 합 계 | 465,773 | 494,736 |
15. 매입채무및기타채무
보고기간말 현재 매입채무및기타채무의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 유동: | ||
| 매입채무 | 317,773 | 423,334 |
| 미지급금 | 329,792 | 796,144 |
| 합 계 | 647,565 | 1,219,478 |
16. 전환사채
16-1 보고기간말 현재 당사가 발행한 전환사채의 내역은 다음과 같습니다.
| 구 분 | 내 용 |
|---|---|
| 사채의 종류 및 명칭 | (주)팬젠 제3회 무보증 사모 전환사채 |
| 액면총액 | 3,200,000,000원 |
| 발행가액 | 3,200,000,000원 |
| 미상환액면총액 | 1,100,000,000원 |
| 발행일 | 2023년 4월 20일 |
| 만기일 | 2027년 4월 20일 |
| 표면이자율 | 연 0% |
| 보장이자율 | 분기단위 연복리 2% |
| 상환방법 | 전환권이 행사되지 아니하여 만기까지 보유하고 있는 본 사채권에 대해 만기일에 권면금액의 108.3071%를 지급 |
| 전환시 발행할 주식의 종류 및 수 | 기명식보통주 196,078주(*1) |
| 전환기간 | 2024년 4월 20일부터 2027년 3월 20일까지 |
| 전환비율 | 사채권면 금액의 100% |
| 전환가격 | 1주당 5,610원(*1) |
| 전환가액 조정(*2) | 주식가격변동 및 최초 전환가액을 하회하는 발행가액으로 유상증자 등을 함으로써 신주를 발행하는 경우 등 발행계약서에 정한 기준에 따라 전환가액은 조정될수 있음 |
| 투자자의 조기상환권 | 2024년 10월 20일 및 이후 매 3개월이 되는 날을 상환일로 하여, 만기 전 조기상환을 청구할 수 있음 |
| 발행자 또는 발행자가 지정하는 제3자의 매도청구권 (제3자 지정 콜옵션)(*3) | 2024년 4월 20일부터 2024년 10월 20일까지 매월의 20일을 매매일로 하여 본 사채 최초 권면총액 중 20% 이내의 범위에서 본 사채를 회사 또는 회사가 지정하는 자에게 매도할 것을 투자자에게 청구할 수 있음 |
(*1) 주식가격변동 또는 최초 전환가액을 하회하는 발행가액으로 한 유상증자로 인하여 조정된 전환가격 및 전환가능주식수를 반영하였습니다.
(*2) 발행자의 주가 변동에 따라 행사가격이 조정되어 변동가능한 수량의 자기지분상품을발행할 의무가 있는 해당 전환권을 파생상품부채로 인식하였습니다.
(*3) 전기 중 발행자 또는 발행자가 지정하는 제3자 매도청구권(제3자 지정 콜옵션)의 행사기간이 종료되었습니다.
16-2 당분기 및 전기 중 전환사채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전 기 |
|---|---|---|
| 기초금액 | 1,229,879 | 3,638,962 |
| 발행 | - | - |
| 이자비용 | 33,746 | 320,947 |
| 상환 | - | (555,051) |
| 전환 | - | (2,168,739) |
| 평가 | - | (6,240) |
| 기말금액 | 1,263,625 | 1,229,879 |
| 재무상태표 | ||
| 전환사채 | 850,047 | 816,301 |
| 파생상품부채 | 413,578 | 413,578 |
16-3 당분기 및 전기 중 유상증자와 시가변동에 따라 행사가격이 조정되어(리픽싱 조건) 파생상품부채로 인식된 전환사채의 내재파생상품이 당기손익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전 기 |
| 제3회 사모전환사채의 파생상품부채 | ||
| 최초 인식시점 장부금액 | 1,468,129 | 1,468,129 |
| 보고기간종료일 장부금액 | 413,578 | 413,578 |
| A. 법인세차감전계속사업이익(손실) | 749,867 | 1,003,590 |
| B. 당기 파생상품평가이익(손실) | - | 6,240 |
| C. 평가손익 제외 후 법인세차감전계속사업이익(손실)(A-B) | 749,867 | 997,350 |
17. 리스
17-1 리스약정에 따라 인식한 리스계약별 사용권자산 및 리스부채의 장부금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 내 역 | 당분기말 | 전기말 |
|---|---|---|---|
| 자산 | |||
| 사용권자산 | 토지 및 건물 | 8,834 | 11,243 |
| 부채 | |||
| 리스부채 | 유동리스부채 | 1,398 | 1,845 |
| 비유동리스부채 | 391 | 391 | |
| 리스부채 합계 | 1,789 | 2,236 | |
17-2 리스부채의 현재가치로 할인되지 않은 최소리스료의 만기내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 금 액 |
|---|---|
| 1개월 초과~3개월 이하 | 491 |
| 3개월 초과~1년 이하 | 982 |
| 1년 초과~5년 이하 | 396 |
| 합 계 | 1,869 |
17-3 당사가 리스부채의 상환금액을 포함하여 단기리스료 및 소액리스료 등 리스와 관련하여 당분기 및 전분기 중 인식한 총 현금유출금액은 각각 12,513천원 및 12,244천원입니다.
17-4 당분기 및 전분기 중 리스와 관련하여 손익으로 인식된 금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | |
|---|---|---|---|
| 비용 | 사용권자산 감가상각비 | ||
| 건물 | 2,409 | 3,481 | |
| 단기리스 관련 비용 | 6,557 | 6,559 | |
| 소액자산리스 관련 비용 | 5,465 | 5,194 | |
| 리스부채 관련 이자비용 | 44 | 81 | |
| 비용 합계 | 14,476 | 15,314 | |
| 수익 | 임차보증금 관련 이자수익 | 1,963 | 2,645 |
18. 기타금융부채
보고기간말 현재 기타금융부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 비유동: | ||
| 임대보증금 | 30,000 | 30,000 |
19. 기타부채
보고기간말 현재 기타부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 유동: | ||
| 예수금 | 51,166 | 46,018 |
20. 순확정급여부채
당사는 종업원을 위하여 확정급여제도를 운영하고 있으며, 확정급여부채의 보험수리적 평가는 예측단위적립방식을 사용하였습니다.
20-1 당분기 및 전기 중 순확정급여부채의 변동 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전 기 |
|---|---|---|
| 기초 순확정급여부채 | 2,706,751 | 2,432,294 |
| 급여비용(당기손익) | ||
| 근무원가 | 89,388 | 361,736 |
| 순이자비용 | 25,514 | 100,875 |
| 소 계 | 114,902 | 462,611 |
| 퇴직급여지급액 | - | (215,066) |
| 순확정급여부채의 재측정요소(기타포괄손익) | ||
| 재무적가정의 변동에서 발생하는 보험수리적손익 | - | 25,633 |
| 인구통계학적 가정변경에서 발생하는 보험수리적손익 | - | (6,703) |
| 경험조정 | - | 7,982 |
| 소 계 | - | 26,912 |
| 기말 순확정급여부채 | 2,821,654 | 2,706,751 |
| 재무상태표상 구성항목: | ||
| 확정급여채무의 현재가치 | 2,821,654 | 2,706,751 |
| 사외적립자산의 공정가치 | - | - |
| 합 계 | 2,821,654 | 2,706,751 |
20-2 보고기간말 현재 보험수리적 평가를 위하여 사용된 주요 가정은 다음과 같습니다.
| 구 분 | 당분기 | 전 기 |
|---|---|---|
| 할인율 | 4.000% | 4.000% |
| 사외적립자산의 기대수익률 | 4.000% | 4.000% |
| 미래임금상승률 | 5.955% | 5.955% |
20-3 당분기 및 전분기 중 확정급여제도 관련 비용의 계정과목별 금액은 다음과 같습니 다.
<당분기>
| (단위: 천원) |
| 구 분 | 제조원가 | 판매비와관리비 | 경상연구개발비 | 합 계 |
|---|---|---|---|---|
| 당기근무원가 | 57,877 | 15,618 | 15,893 | 89,388 |
| 순이자 | 15,301 | 5,448 | 4,765 | 25,514 |
| 합 계 | 73,178 | 21,066 | 20,658 | 114,902 |
<전분기>
| (단위: 천원) |
| 구 분 | 제조원가 | 판매비와관리비 | 경상연구개발비 | 합 계 |
|---|---|---|---|---|
| 당기근무원가 | 47,499 | 21,689 | 21,245 | 90,434 |
| 순이자 | 12,780 | 5,134 | 7,305 | 25,219 |
| 합 계 | 60,279 | 26,823 | 28,550 | 115,653 |
21. 정부보조금
당분기 및 전기 중 정부보조금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전 기 |
|---|---|---|
| 기 초 | - | - |
| 총수령액 | - | 58,199 |
| 총사용액(*) | - | 54,519 |
| 기타증감 | - | (3,680) |
| 기 말 | - | - |
(*)상환의무가 없는 정부보조금은 사용시 관련 비용과 상계처리하고 있습니다.
22. 지급보증 및 담보자산
(1) 당분기말 현재 특수관계가 없는 제3자에게 제공하고 있는 지급보증은 없으며, 서울보증보험㈜으로부터 16,600천원의 가스료 납부 이행보증, 매출계약에 대한 60,000천원의 계약보증 및 514,473천원의 선금 반환보증을 제공받고 있습니다(특수관계자와 관련된 지급보증은 주석24 참조).
(2) 당분기말 현재 차입금 등과 관련하여 담보로 제공한 자산의 내역은 다음과 같으며, 특수관계가 없는 제3자를 위하여 제공하고 있거나 제3자로부터 제공받은 담보는 없습니다(특수관계자와 관련된 담보내용은 주석24 참조).
| (단위: 천원) |
| 담보제공자산 | 담보설정일 | 장부금액 | 금융기관 | 약정금액 | 채권최고액 |
|---|---|---|---|---|---|
| 유형자산(토지) | 2022.10.05 | 854,123 | 기업은행 | 2,000,000 | 2,400,000 |
| 유형자산(건물) | 2022.10.05 | 2,376,062 |
23. 우발사항 및 약정사항
23-1 계류중인 소송사건
당사는 보고기간말 현재 피소되어 계류 중인 소송사건은 없습니다.
23-2 약정사항
당분기말 현재 차입금 및 무역금융 등과 관련한 금융기관 약정사항은 다음과 같습니다.
| (단위: 천원) |
| 금융기관 | 약정종류 | 약정금액 | 실행금액 |
|---|---|---|---|
| 기업은행 | 무역금융한도대출 | 2,000,000 | - |
24. 특수관계자
24-1 특수관계자 현황
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 당사에 유의적인 영향력을 행사하는 기업 | ㈜휴온스, 화일약품㈜, DUOPHARMA BIOTECH BERHAD | ㈜휴온스, 화일약품㈜, DUOPHARMA BIOTECH BERHAD |
| 기타의 특수관계자 | ㈜휴온스글로벌, ㈜휴메딕스, ㈜휴온스푸디언스, ㈜휴온스메디텍, ㈜휴온스랩, HUONS USA,INC., ㈜휴온스바이오파마, Huons Japan Co., Ltd., ㈜휴엠앤씨, ㈜푸드어셈블, ㈜휴온스생명과학, HuM&C Vina Co., Ltd., ㈜화일인터내셔날, DUOPHARMA SDN BERHAD, DB (PHILIPPINES) Inc. |
㈜휴온스글로벌, ㈜휴메딕스, ㈜휴온스푸디언스, ㈜휴온스메디텍, ㈜휴온스랩, HUONS USA,INC., ㈜휴온스바이오파마, Huons Japan Co., Ltd., ㈜휴엠앤씨, ㈜푸드어셈블, ㈜휴온스생명과학, HuM&C Vina Co., Ltd., ㈜화일인터내셔날, DUOPHARMA SDN BERHAD, DB (PHILIPPINES) Inc. |
24-2 특수관계자와의 거래내역
| (단위: 천원) |
| 구 분 | 특수관계자명 | 당분기 | 전분기 | ||
|---|---|---|---|---|---|
| 매출 | 이자수익 | 매출 | 이자수익 | ||
| 기타의 특수관계자 |
DUOPHARMA SDN BERHAD | 1,887,457 | - | 1,348,137 | - |
| DB (PHILIPPINES) Inc. | 638,338 | - | 319,206 | - | |
| ㈜휴온스랩 | 224,373 | - | 208,518 | - | |
| ㈜휴메딕스 | 31,990 | - | - | - | |
| 임직원 | 오ㅇㅇ 외 | - | 2,243 | - | 1,294 |
24-3 특수관계자와의 채권ㆍ채무내역
| (단위: 천원) |
| 구 분 | 특수관계자명 | 당분기말 | 전기말 | ||
|---|---|---|---|---|---|
| 채권 | 채무 | 채권 | 채무 | ||
| 당사에 유의적인 영향력을 행사하는 기업 | ㈜휴온스 | 4,380 | 3,982 | - | - |
| 기타의 특수관계자 |
DUOPHARMA SDN BERHAD | 1,089,145 | - | 401,442 | - |
| DB (PHILIPPINES) Inc. | 640,873 | - | 1,389,326 | - | |
| ㈜휴온스랩 | - | 408,177 | 140,030 | 330,300 | |
| ㈜휴메딕스 | - | - | - | 15,995 | |
| 임직원 | 오ㅇㅇ 외 | 114,754 | - | 255,732 | - |
24-4 특수관계자와의 자금거래내역
<당분기>
| (단위: 천원) |
| 구 분 | 특수관계자명 | 자금대여거래 | 자금차입거래 | ||
|---|---|---|---|---|---|
| 대여 | 회수 | 차입 | 상환 | ||
| 임직원 | 오ㅇㅇ 외 | 13,000 | 150,000 | - | - |
<전 기>
| (단위: 천원) |
| 구 분 | 특수관계자명 | 자금대여거래 | 자금차입거래 | ||
|---|---|---|---|---|---|
| 대여 | 회수 | 차입 | 상환 | ||
| 임직원 | 오ㅇㅇ 외 | 250,000 | 113,000 | - | - |
상기 임직원과의 자금 대여거래는 단기대여금으로 당사는 '임직원대출규정'에 따라 퇴직급여충당금 범위 내에서 대여할 수 있습니다.
24-5 지급보증 및 담보자산
당분기말 현재 당사가 특수관계자간 자금조달 등을 위하여 제공하고 있거나 제공받은 지급보증 및 담보는 없습니다.
24-6 주요 경영진에 대한 보상
주요 경영진은 이사(등기임원), 이사회의 구성원, 재무책임자 및 내부감사책임자를 포함하고 있습니다. 종업원 용역의 대가로서 주요 경영진에게 지급됐거나 지급될 보상금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급 여 | 115,944 | 98,325 |
| 퇴 직 급 여 | 10,867 | 8,568 |
| 주식기준보상 | - | - |
| 합 계 | 126,811 | 106,893 |
25. 자본
25-1 자본금
보고기간말 현재 당사가 발행할 주식 총수와 발행한 주식수 및 1주당 금액은 다음과 같습니다.
| (단위: 원, 주) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 수권주식수 | 50,000,000 | 50,000,000 |
| 1주의 금액 | 500 | 500 |
| 발행 주식수 | 12,898,197 | 12,898,197 |
| 보통주자본금 | 6,449,098,500 | 6,449,098,500 |
25-2 자본잉여금
보고기간말 현재 당사의 자본잉여금의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 주식발행초과금 | 67,109,604 | 67,109,604 |
25-3 당분기 중 보통주자본금 및 주식발행초과금의 변동내역은 없으며, 전기 중 보통주자본금 및 주식발행초과금의 변동내역은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 주식수(주) | 자본금 | 주식발행초과금 |
|---|---|---|---|
| 기초잔액 | 12,898,197 | 6,449,099 | 67,109,604 |
| 기말잔액 | 12,898,197 | 6,449,099 | 67,109,604 |
<전 기>
| (단위: 천원) |
| 구 분 | 주식수(주) | 자본금 | 주식발행초과금 |
|---|---|---|---|
| 기초잔액 | 10,677,630 | 5,338,815 | 56,799,551 |
| 유상증자 | 1,894,598 | 947,299 | 8,307,006 |
| 전환사채 전환 | 325,969 | 162,985 | 2,003,047 |
| 기말잔액 | 12,898,197 | 6,449,099 | 67,109,604 |
25-4 기타자본항목
보고기간말 현재 당사의 기타자본항목의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 주식매수선택권 | 700,823 | 700,823 |
| 기타(*) | 602,585 | 602,585 |
| 합 계 | 1,303,408 | 1,303,408 |
(*) 2018년 2월 발행한 제2회 전환사채의 전환권대가이며, 전기 이전에 해당 전환사채는 사채권자의 조기상환청구권 행사로 전액 만기전 취득하여 소각하였습니다.
26. 매출
26-1 당사의 매출은 모두 고객과의 계약에서 인식한 수익이며, 범주별 및 시기별 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 한 시점에 이전되는 수익 | ||
| 제품매출 | 2,989,319 | 3,145,443 |
| 기간에 걸쳐 이전되는 수익 | ||
| 제품매출 | 261,794 | 73,077 |
| 용역매출 | 190,174 | 256,243 |
| 합계 | 3,441,287 | 3,474,764 |
26-2 고객과의 계약으로 인한 수익과 영업부문의 수익과의 관계는 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | EPO 의약품 | 기술이전(CDO) | 위탁생산(CMO) | 로열티 | 기타 | 총 계 |
|---|---|---|---|---|---|---|
| 제품매출 | 2,959,319 | 261,794 | - | - | 30,000 | 3,251,113 |
| 용역매출 | - | - | - | - | 190,174 | 190,174 |
| 합 계 | 2,959,319 | 261,794 | - | - | 220,174 | 3,441,287 |
<전분기>
| (단위: 천원) |
| 구 분 | EPO 의약품 | 기술이전(CDO) | 위탁생산(CMO) | 로열티 | 기타 | 총 계 |
|---|---|---|---|---|---|---|
| 제품매출 | 1,867,597 | 73,077 | 1,271,546 | - | 6,300 | 3,218,521 |
| 용역매출 | - | - | - | - | 256,243 | 256,243 |
| 합 계 | 1,867,597 | 73,077 | 1,271,546 | - | 262,543 | 3,474,764 |
27. 비용의 성격별분류
27-1 당분기 및 전분기 중 발생한 비용(매출원가 및 판매비와관리비)을 성격별로 분류한 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 원/부재료의 사용액 | 826,840 | 517,581 |
| 재고자산의 변동 | (1,034,795) | 343,825 |
| 종업원급여 | 1,143,122 | 1,006,115 |
| 감가상각비 | 149,260 | 144,231 |
| 무형자산상각비 | 196,295 | 195,883 |
| 경상연구개발비(*) | 465,773 | 494,736 |
| 기타 | 994,052 | 691,958 |
| 합 계 | 2,740,547 | 3,394,328 |
(*) 경상연구개발비에는 연구소, 개발부서 직원에 대한 인건비 및 상각비가 포함된 금액입니다.
27-2 종업원급여의 내역
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급 여 | 1,010,835 | 879,629 |
| 퇴 직 급 여 | 94,244 | 87,103 |
| 복리후생비 | 38,042 | 39,383 |
| 합 계 | 1,143,122 | 1,006,115 |
28. 판매비와관리비
당분기 및 전분기 중 판매비와관리비의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급 여 | 230,309 | 263,568 |
| 퇴 직 급 여 | 21,066 | 26,823 |
| 복리후생비 | 8,873 | 10,657 |
| 여비교통비 | 3,616 | 7,575 |
| 접 대 비 | 1,424 | 1,166 |
| 세금과공과 | 14,459 | 13,230 |
| 감가상각비 | 12,408 | 10,648 |
| 경상연구개발비 | 465,773 | 494,736 |
| 운 반 비 | 115,088 | 68,592 |
| 차량유지비 | 2,755 | 2,486 |
| 보 험 료 | 17,138 | 18,955 |
| 무형자산상각비 | 31,482 | 30,861 |
| 지급수수료 | 75,232 | 72,649 |
| 소 모 품 비 | 173 | 1,313 |
| 기 타 | 9,150 | 9,417 |
| 합 계 | 1,008,946 | 1,032,675 |
29. 영업외손익
당분기 및 전분기 중 영업외손익의 내역은 다음과 같습니다.
29-1 금융수익
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 이자수익 | 93,499 | 6,138 |
| 외환차익 | 5,513 | 33,247 |
| 외화환산이익 | 7,194 | 12,571 |
| 리스상환이익 | - | 173 |
| 합 계 | 106,206 | 52,129 |
29-2 금융비용
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 이자비용 | 33,791 | 85,167 |
| 외환차손 | 44,208 | 1,446 |
| 외화환산손실 | 2,957 | 59 |
| 합 계 | 80,956 | 86,672 |
29-3 기타수익
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 임대료수익 | 8,250 | 8,250 |
| 유형자산처분이익 | 17,090 | 13,933 |
| 정부지원금 | 50 | - |
| 잡이익 | 679 | 684 |
| 합 계 | 26,069 | 22,867 |
29-4 기타비용
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 투자부동산감가상각비 | 2,001 | 2,001 |
| 유형자산처분손실 | 192 | 43 |
| 합 계 | 2,193 | 2,044 |
30. 법인세
당사는 전체 회계연도에 대해서 예상되는 최선의 가중평균 연간법인세율의 추정에 기초하여 법인세비용을 인식하고 있습니다.
30-1 당분기 및 전분기 중 발생한 법인세비용의 주요 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 법인세부담액 | 13,628 | - |
| 일시적차이로 인한 이연법인세 변동액 | - | - |
| 자본에 직접 반영된 법인세 | - | - |
| 법인세비용 | 13,628 | - |
31. 주식기준보상
31-1 당분기말 현재 당사가 보유하고 있는 주식기준 보상약정은 다음과 같습니다.
| 구분 | 6차부여 | 7차부여 | 8차부여 |
|---|---|---|---|
| 임원 및 일반직원 | 임원 및 일반직원 | 임원 | |
| 부여일 | 2018년 10월 18일 | 2021년 01월 15일 | 2021년 03월 29일 |
| 부여수량 | 97,000주 | 108,500주 | 7,000주 |
| 행사가격 | 14,850원 | 9,950원 | 9,950원 |
| 행사가능기간 | 2020.10.18 ~2025.10.17 |
2023.01.15 ~2028.01.14 |
2023.03.29 ~2028.03.28 |
| 가득조건 | 용역제공조건: 부여일로부터 2년 |
용역제공조건: 부여일로부터 2년 |
용역제공조건: 부여일로부터 2년 |
| 부여방법 | 신주발행교부 | 신주발행교부 | 신주발행교부 |
| 부여취소된 주식수(*) | 44,000주 | 12,000주 | - |
| 미행사주식수 | 53,000주 | 96,500주 | 7,000주 |
(*) 부여취소된 주식수는 부여일로부터 2년이내 퇴사로 인해 부여가 취소된 부분입니다.
31-2 부여일 현재의 주식기준보상 공정가치를 측정하기 위하여 사용된 기초자료는 다음과 같습니다.
| (단위: 원) |
| 구분 | 6차부여분 | 7차부여분 | 8차부여분 |
|---|---|---|---|
| 부여일 현재 주가(공정가치)(*1) | 14,500 | 9,770 | 9,180 |
| 행사가격(*1) | 14,850 | 9,950 | 9,950 |
| 기대주가변동성(가중평균변동성)(*2) | 15.60% | 44.50% | 47,40% |
| 기대 배당금(*3) | - | - | - |
| 무위험이자율(*4) | 2.27% | 1.56% | 1.82% |
(*1) 부여일 현재 주가(공정가치) 및 행사가격은 각 회차별 부여일 현재를 기준으로 산정되었습니다.
(*2) 6차부여분은 평가기준일 이전 180영업일 기준 당사의 변동성을 사용하였습니다. 7, 8차부여분은 평가기준일 이전 1년 영업일 기준 당사의 변동성을 사용하였습니다.
(*3) 주식선택권 부여일 현재 당사는 배당 이력이 없으므로 기대 배당은 없는 것으로 가정하였습니다.
(*4) 무위험이자율은 평가기관이 시장에서 수집된 유통가격 정보를 바탕으로 Fama-Bliss 방식의 Strip & Bootstrapping 방법을 활용하여 무위험채권(국고채)의 Spot Curve에서 산출하여 적용하였습니다.
32. 주당손익
32-1 기본주당손익
(1) 당분기 및 전분기 중 기본주당손익의 산정내역은 다음과 같습니다.
| (단위: 원,주) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 분기순이익 | 736,239,038 | 66,715,245 |
| 차감: 우선주배당금 | - | - |
| 보통주분기순이익 | 736,239,038 | 66,715,245 |
| 가중평균유통보통주식수 | 12,898,197 | 10,710,028 |
| 기본주당손익 | 57 | 6 |
(2) 상기 기본주당손익의 계산을 위한 가중평균유통보통주식수는 다음과 같이 산정되었습니다.
<당분기>
| (단위: 주, 일) |
| 기 간 | 구 분 | 유통주식수 | 일 수 | 적 수 |
|---|---|---|---|---|
| 01.01 ~ 03.31 | 기초 | 12,898,197 | 90 | 1,160,837,730 |
| 가감계 | 12,898,197 | 1,160,837,730 |
가중평균보통주식수: 1,160,837,730주/90일 = 12,898,197주
<전분기>
| (단위: 주, 일) |
| 기 간 | 구 분 | 유통주식수 | 일 수 | 적 수 |
|---|---|---|---|---|
| 01.01 ~ 03.31 | 기초 | 10,677,630 | 91 | 971,664,330 |
| 03.28 ~ 03.31 | 유상증자 | 737,053 | 4 | 2,948,212 |
| 가감계 | 11,414,683 | 974,612,542 |
가중평균보통주식수: 974,612,542주/91일 = 10,710,028주
32-2 희석주당손익
당분기 및 전분기의 희석주당손익은 잠재적 보통주의 반희석효과로 인하여 기본주당손익과 동일합니다. 당분기말 현재 희석효과가 발생하지 않은 잠재적 보통주의 내역은 다음과 같습니다.
| 구 분 | 청구기간 | 발행될 주식수 | 조 건 |
|---|---|---|---|
| 주식기준보상 | 2020.10.18 ~ 2028.03.28 | 156,500주 | 주당 9,950원 ~ 14,850원 |
| 전환사채 | 2024.04.20 ~ 2027.03.20 | 196,078주 | 주당 5,610원 |
33. 공정가치
33-1 금융상품의 종류별 장부금액과 공정가치
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | |||
|---|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | ||
| 금융자산: | |||||
| 유동 | 현금및현금성자산 | 2,051,606 | 2,051,606 | 1,430,114 | 1,430,114 |
| 매출채권및기타채권 | 3,011,897 | 3,011,897 | 2,961,065 | 2,961,065 | |
| 기타금융자산 | 9,177,968 | 9,177,968 | 10,301,909 | 10,301,909 | |
| 비유동 | 기타금융자산 | 97,649 | 97,649 | 95,685 | 95,685 |
| 금융자산 합계 | 14,339,120 | 14,339,120 | 14,788,773 | 14,788,773 | |
| 금융부채: | |||||
| 유동 | 매입채무및기타채무 | 647,565 | 647,565 | 1,219,478 | 1,219,478 |
| 전환사채 | 850,047 | 775,115 | 816,301 | 775,115 | |
| 파생상품부채 | 413,578 | 413,578 | 413,578 | 413,578 | |
| 리스부채 | 1,398 | 1,398 | 1,845 | 1,845 | |
| 비유동 | 리스부채 | 391 | 391 | 391 | 391 |
| 기타금융부채 | 30,000 | 30,000 | 30,000 | 30,000 | |
| 금융부채 합계 | 1,942,979 | 1,868,047 | 2,481,592 | 2,440,407 | |
경영진은 전환사채를 제외하고는 재무제표상 상각후원가로 측정된 금융자산과 금융부채의 장부금액은 공정가치와 근사하다고 판단하고 있습니다.
33-2 공정가치 서열체계
공정가치측정에 사용된 투입변수의 유의성을 반영하는 공정가치 서열체계에 따라 공정가치측정치를 분류하고 있으며, 공정가치 서열체계의 수준은 다음과 같습니다.
| 구 분 | 투입변수의 유의성 |
|---|---|
| 수준 1 | 측정일에 동일한 자산이나 부채에 대한 접근 가능한 활성시장의 (조정되지 않은) 공시가격 |
| 수준 2 | 수준 1의 공시가격 이외에 자산이나 부채에 대해 직접적으로 또는 간접적으로 관측가능한 투입변수를 사용하여 도출되는 공정가치 |
| 수준 3 | 자산이나 부채에 대한 관측가능하지 않은 투입변수를 활용하여 도출되는 공정가치 |
33-3 공정가치 서열체계별 공정가치
보고기간말 현재 공정가치로 측정되는 자산ㆍ부채의 공정가치 서열체계별 공정가치 금액은 다음과 같습니다.
<당분기말>
| (단위: 천원) |
| 구 분 | 공정가치(*) | |||
|---|---|---|---|---|
| 수준 1 | 수준 2 | 수준 3 | 합 계 | |
| 파생상품부채 | - | - | 413,578 | 413,578 |
(*) 당분기 중 수준간의 유의적인 이동은 없습니다.
<전 기>
| (단위: 천원) |
| 구 분 | 공정가치(*1) | |||
|---|---|---|---|---|
| 수준 1 | 수준 2 | 수준 3 | 합 계 | |
| 파생상품자산(*2) | - | - | - | - |
| 파생상품부채 | - | - | 413,578 | 413,578 |
(*1) 전기 중 수준간의 유의적인 이동은 없습니다.
(*2) 전기 중 전환사채 발행자 또는 발행자가 지정하는 제3자 매도청구권(제3자 지정 콜옵션)의 행사기간이 종료되었습니다.
33-4 당분기 및 전기 중 공정가치 서열체계 수준 3으로 측정된 금융상품의 변동내역은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 파생상품자산 | 파생상품부채 |
|---|---|---|
| 기초 | - | (413,578) |
| 증가 | - | - |
| 감소 | - | - |
| 평가 | - | - |
| 기말 | - | (413,578) |
<전 기>
| (단위: 천원) |
| 구 분 | 파생상품자산 | 파생상품부채 |
|---|---|---|
| 기초 | 137,389 | (1,624,943) |
| 증가 | - | - |
| 감소 | - | 1,205,125 |
| 평가 | (137,389) | 6,240 |
| 기말 | - | (413,578) |
33-5 가치평가기법과 투입변수
당분기말 현재 공정가치가 공시되는 금융상품의 가치평가기법과 투입변수는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 금 액 | 수준 | 가치평가기법 | 투입변수 |
|---|---|---|---|---|
| 파생상품자산(*2) | - | 3 | 위험조정할인모형 (T-F모형) |
- 기초자산가격: 5,700원(당사 2024년 12월 31일 주식 종가) - 주가변동성: 30.52% - 신용등급 CCC+ 의 할인율: YTM(*1) - 무위험수익률: 이자율의 기간구조를 고려한 국고채수익률 |
| 파생상품부채 | 413,578 | 3 |
(*1) 2024년 12월 31일 기준 KIS자산평가 홈페이지(http://kis-net.kr/)에서 조회한 기간별 YTM을 이용하였습니다.
(*2) 전기 중 전환사채 발행자 또는 발행자가 지정하는 제3자 매도청구권(제3자 지정 콜옵션)의 행사기간이 종료되었습니다.
34. 재무위험관리의 목적 및 정책
당사의 주요 금융부채는 매입채무및기타채무, 전환사채, 리스부채 및 기타금융부채로 구성되어 있으며, 이러한 금융부채는 영업활동 및 재무활동으로 발생하였습니다. 또한 당사는 영업활동에서 발생하는 현금및현금성자산, 매출채권및기타채권 등과 같은 금융자산도 보유하고 있습니다.
당사의 금융자산 및 금융부채에서 발생할 수 있는 주요 위험은 시장위험, 신용위험 및 유동성위험입니다. 당사의 주요 경영진은 아래에서 설명하는 바와 같이, 각 위험별 관리절차를 검토하고 정책에 부합하는지 검토하고 있습니다. 또한 당사는 투기 목적의 파생상품거래를 실행하지 않는 것이 기본적인 정책입니다.
34-1 시장위험
시장위험은 시장가격의 변동으로 인하여 금융상품의 공정가치가 변동할 위험입니다. 시장위험은 이자율위험, 환위험 및 기타 가격위험의 세가지 유형으로 구성됩니다.
(1) 이자율위험
이자율위험은 시장이자율의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험입니다. 당사는 내부적으로 이자율 1% 변동을 기준으로 이자율위험을 측정하고있으며, 상기의 변동비율은 합리적으로 발생가능한 이자율변동위험에 대한 경영진의 평가
를 반영하고 있습니다.
당분기말 현재 변동이자율이 적용되는 차입금은 없으므로, 이자율변동이 금융부채의 현금흐름에 미치는 영향은 없습니다.
(2) 환위험
환위험은 환율의 변동으로 금융상품의 공정가치나 미래현금흐름이 변동할 위험입니다. 보고기간말 현재 기능통화 이외의 외화로 표시된 화폐성자산 및 부채의 장부금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 자산 | 부채 | 자산 | 부채 | |
| USD | 2,105,604 | 4,619 | 2,271,005 | - |
당사는 내부적으로 원화 환율 변동에 대한 환위험을 정기적으로 측정하고 있습니다. 보고기간말 현재 각 외화에 대한 기능통화의 환율 5% 변동시 환율변동이 당분기 및 전기 손익에미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전 기 | ||
|---|---|---|---|---|
| 5% 상승시 | 5% 하락시 | 5% 상승시 | 5% 하락시 | |
| USD | 105,049 | (105,049) | 113,550 | (113,550) |
상기 민감도 분석은 당분기말과 전기말 현재 기능통화 이외의 외화로 표시된 화폐성 자산 및부채를 대상으로 하였습니다.
(3) 기타 가격위험
기타 가격위험은 이자율위험이나 환위험 이외의 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험이며, 당사는 당분기말 현재 금융상품 중 상장지분상품 등을 보유하고 있지 않습니다.
34-2 신용위험
신용위험은 거래상대방이 의무를 이행하지 않아 당사에 재무손실이 발생할 위험입니다.
당사는 신용위험을 관리하기 위하여 금융자산의 신용보강을 위한 정책과 절차를 마련하여운영하고 있으며, 회수가 지연되는 금융자산에 대하여는 회수지연 현황 및 회수대책이 보고된 후 지연사유에 따라 적절한 조치를 취하고 있습니다. 또한, 거래상대방의 신용에 따라 필요한 경우 담보 및 기타 신용보강을 요구하고 있습니다.
보고기간말 현재 당사의 신용위험에 대한 최대노출정도는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 현금성자산(*) | 2,051,606 | 1,428,994 |
| 매출채권및기타채권 | 3,011,897 | 2,961,065 |
| 계약자산 | 14,003 | - |
| 기타유동금융자산 | 9,177,968 | 10,301,909 |
| 기타비유동금융자산 | 97,649 | 95,685 |
| 합 계 | 14,353,123 | 14,787,653 |
(*) 당분기말 현재 현금시재액은 없으며, 전기말 현금시재액 1,120천원은 제외하였습니다.
당사는 매출채권및수취채권, 계약자산에 대해 손실충당금을 인식하였으며(주석 7,8참조),이외의 금융자산에 대해서는 채무불이행위험이 없다고 판단하여 기대신용손실을 인식하지 않았습니다.
34-3 유동성위험
유동성위험은 만기까지 모든 금융계약상의 약정사항들을 이행할 수 있도록 자금을 조달하지 못할 위험입니다.
당사는 유동성 전략 및 계획을 통하여 자금부족에 따른 위험을 관리하고 있으며, 금융상품의 만기와 영업현금흐름의 추정치를 고려하여 금융자산과 금융부채의 만기를 대응시키고 있습니다.
보고기간말 현재 금융부채별 상환계획으로서 할인되지 않은 계약상의 금액은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 1년 이내 | 1년~5년 | 5년 이후 | 합 계 | |
|---|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 647,562 | - | - | 647,562 |
| 전환사채(*) | - | 1,100,000 | - | 1,100,000 | |
| 리스부채 | 1,473 | - | - | 1,473 | |
| 비유동 | 리스부채 | - | 396 | - | 396 |
| 기타금융부채 | - | 30,000 | - | 30,000 | |
| 합 계 | 649,035 | 1,130,396 | - | 1,779,431 | |
(*) 상기 전환사채의 만기구조는 계약 만기까지 사채권자의 전환권이 행사되지 않을 경우를 가정한 것입니다.
<전 기>
| (단위: 천원) |
| 구 분 | 1년 이내 | 1년~5년 | 5년 이후 | 합 계 | |
|---|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 1,219,478 | - | - | 1,219,478 |
| 전환사채(*) | - | 1,100,000 | - | 1,100,000 | |
| 리스부채 | 1,964 | - | - | 1,964 | |
| 비유동 | 리스부채 | - | 396 | - | 396 |
| 기타금융부채 | - | 30,000 | - | 30,000 | |
| 합 계 | 1,221,442 | 1,130,396 | - | 2,351,838 | |
(*) 상기 전환사채의 만기구조는 계약 만기까지 사채권자의 전환권이 행사되지 않을 경우를 가정한 것입니다.
34-4 자본관리
자본관리의 주 목적은 당사의 영업활동을 유지하고 주주가치를 극대화하기 위하여 높은 신용등급과 건전한 자본비율을 유지하기 위한 것입니다.
당사는 자본구조를 경제환경의 변화에 따라 수정하고 있으며, 이를 위하여 배당정책을 수정하거나 자본감소 혹은 신주발행을 검토하도록 하고 있습니다. 한편, 당분기 중 자본관리의목적, 정책 및 절차에 대한 어떠한 사항도 변경되지 않았습니다.
당사는 총부채를 자기자본으로 나눈 부채비율을 사용하고 있으며, 보고기간말 현재 총부채 및 자기자본은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 총 부 채 | 5,261,939 | 5,635,969 |
| 자기자본 | 25,644,952 | 24,908,713 |
| 부채비율 | 20.52% | 22.63% |
35. 현금흐름표
35-1 현금흐름표상의 현금은 재무상태표상의 현금및현금성자산과 동일합니다.
35-2 당분기 및 전분기 중 영업활동으로부터 창출된 현금흐름의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 1. 분기순이익(손실) | 736,239 | 66,715 |
| 2. 비현금항목의조정 | 419,776 | 553,682 |
| 감가상각비 | 173,688 | 187,428 |
| 투자부동산감가상각비 | 2,001 | 2,001 |
| 무형자산상각비 | 196,401 | 196,146 |
| 퇴직급여 | 114,902 | 115,653 |
| 외화환산이익 | (7,194) | (12,571) |
| 외화환산손실 | 2,957 | 59 |
| 유형자산처분이익 | (17,090) | (13,933) |
| 유형자산처분손실 | 191 | 43 |
| 리스상환이익 | - | (173) |
| 이자수익 | (93,499) | (6,138) |
| 이자비용 | 33,791 | 85,167 |
| 법인세비용 | 13,628 | - |
| 3. 운전자본의조정 | (1,461,755) | (489,392) |
| 매출채권 | 83,835 | (32,786) |
| 기타채권 | (130,351) | (183,141) |
| 계약자산 | (14,003) | 70,654 |
| 재고자산 | (852,692) | 337,946 |
| 기타자산 | 7,261 | (50,815) |
| 매입채무 | (105,561) | 89,103 |
| 기타채무 | (499,925) | (103,623) |
| 계약부채 | 44,532 | (552,857) |
| 기타부채 | 5,149 | (2,748) |
| 퇴직금의지급 | - | (61,125) |
| 4. 영업활동으로부터 창출된 현금흐름 | (305,740) | 131,005 |
35-3 당분기 및 전분기 중 현금의 유입과 유출이 없는 중요한 거래는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 유ㆍ무형자산 취득 관련 미지급금 증가 | 35,700 | 6,754 |
| 사용권자산의 인식 | - | 15,825 |
| 리스해지로 인한 사용권자산과 감가상각누계액 상계 | - | 24,221 |
35-4 당분기 및 전분기 중 재무활동에서 생기는 부채의 변동 상세내역은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 당기초 | 현금흐름 | 비현금거래 | 당분기말 | |||
|---|---|---|---|---|---|---|---|
| 상각 | 공정가치변동 | 대체 | 기타 | ||||
| 전환사채 | 816,301 | - | 33,746 | - | - | - | 850,047 |
| 파생상품부채 | 413,578 | - | - | - | - | - | 413,578 |
| 리스부채 | 2,236 | (447) | - | - | - | - | 1,789 |
| 기타비유동금융부채 | 30,000 | - | - | - | - | - | 30,000 |
| 합 계 | 1,262,115 | (447) | 33,746 | - | - | - | 1,295,414 |
<전분기>
| (단위: 천원) |
|
구 분 |
전기초 |
현금흐름 |
비현금거래 |
전분기말 |
|||
|---|---|---|---|---|---|---|---|
|
발행 및 증가 |
상각 |
공정가치변동 |
대체 | ||||
| 전환사채 | 2,014,019 | - | - | 84,205 | - | - | 2,098,224 |
| 파생상품부채(*) | 1,487,554 | - | - | - | - | - | 1,487,554 |
| 리스부채 | 3,930 | (410) | - | - | - | - | 3,520 |
| 기타비유동금융부채 | 30,000 | - | - | - | - | - | 30,000 |
| 합 계 | 3,535,503 | (410) | - | 84,205 | - | - | 3,619,298 |
(*) 전환사채 관련 파생상품자산의 변동금액을 차감한 순액으로 표시하였습니다.
36. 보고기간 후 사건
36-1 유상증자
2025년 05월 02일 이사회결의를 통하여 제3자 배정 유상증자를 결정 하였습니다. 발행하는 기명식 보통주식수는 596,000주이며, 주당 발행가는 4,979원, 총 유상증자 불입액은 2,967백만원 입니다. 제3자배정 유상증자 참여자는 (주)휴온스이며, 2025년 05월 12일 납입완료되었고, 상장 예정일은 2025년 05월 29일 입니다.
6. 배당에 관한 사항
가. 배당에 관한 회사 정책
당사는 정관에 의거 이사회 결의 및 주주총회 결의를 통하여 회사이익의 일정부분을 주주에게 환원하는 주요수단으로 배당을 규정하고 있으나, 누적 결손에 따른 상법상 배당가능한도 산출이 어려워 과거 배당내역이 없습니다.
당사는 안정적인 수익창출을 통하여 조속히 배당가능 재원을 확보할 예정이며,
미래성장을 위한 투자재원확보, 기업의 재무구조 건전성 유지, 주주가치 제고등을 종합적으로 고려하여 배당정책을 결정할 예정입니다.
나. 배당관련 회사 정관 규정
당사의 정관상 배당에 관한 사항은 다음과 같습니다.
| 구분 | 내용 |
| 신주배당 기산일 |
제 10 조의 3 (신주의 배당기산일) 회사가 정한 배당기준일 전에 유상증자, 무상증자 및 주식배당에 의하여 발행한 주식에 대하여는 동등 배당한다. |
| 이익잉여금의 처분 |
제 49 조 (이익금의 처분) 회사의 매 사업년도의 처분전이익잉여금을 다음과 같이 처분한다. ① 이익 준비금 ② 기타의 법정적립금 ③ 배당금 ④ 임의적립금 ⑤ 기타의 이익잉여금처분액 |
| 이익배당 |
제 50 조 (이익배당) ① 이익의 배당은 금전과 금전 외의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 수종의 주식을 발행한 때에는 주주총회의 결의로 그와 다른 종류의 주식으로도 할 수 있다. ③ 제 1항의 배당은 매 결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. |
다. 최근 3사업연도 배당 내역
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
라. 배당관련 예측가능성 제공에 관한 사항
(1) 정관상 배당절차 개선방안 이행 가부
| 구분 | 현황 및 계획 |
| 정관상 배당액 결정 기관 | 이사회, 주주총회 |
| 정관상 배당기준일을 배당액 결정 이후로 정할 수 있는지 여부 | 당사는 배당기준일을 배당액 결정 이후로 정하는 정관 개정을 도입하지 않았습니다. |
| 배당절차 개선방안 이행 관련 향후 계획 | 현재로서는 도입계획이 없습니다. |
(2) 배당액 확정일 및 배당기준일 지정 현황
| 구분 | 결산월 | 배당여부 | 배당액 확정일 |
배당기준일 | 배당 예측가능성 제공여부 |
비고 |
|---|---|---|---|---|---|---|
| 제15기 | 2024.12 | X | - | - | X | - |
| 제14기 | 2023.12 | X | - | - | X | - |
| 제13기 | 2022.12 | X | - | - | X | - |
마.주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제16기1분기 | 제15기 | 제14기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | 736 | 944 | -4,489 | |
| (별도)당기순이익(백만원) | - | - | - | |
| (연결)주당순이익(원) | 57 | 82 | -420 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
사. 과거 배당 이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
최근 5년간 배당을 지급한 사실이 없어 배당 이력 산출을 하지 않았습니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
증자(감자)현황
| (기준일 : | 2025.03.31 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2022.02.04 | 주식매수선택권행사 | 보통주 | 3,300 | 500 | 4,750 | - |
| 2022.02.04 | 주식매수선택권행사 | 보통주 | 2,400 | 500 | 7,500 | - |
| 2024.03.28 | 유상증자(제3자배정) | 보통주 | 737,053 | 500 | 5,427 | - |
| 2024.10.07 | 전환권행사 | 보통주 | 60,913 | 500 | 4,925 | - |
| 2024.11.11 | 전환권행사 | 보통주 | 142,131 | 500 | 4,925 | - |
| 2024.11.14 | 유상증자(제3자배정) | 보통주 | 1,157,545 | 500 | 4,545 | - |
| 2024.11.20 | 전환권행사 | 보통주 | 122,925 | 500 | 4,881 | - |
미상환 전환사채 발행현황
| (기준일 : | 2025.03.31 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명사모 전환사채 |
제3회 | 2023.04.20 | 2027.04.20 | 3,200,000,000 | 보통주 | 24.4.20 ~ 27.3.20 |
100 | 5,610 | 1,100,000,000 | 196,078 | - |
| 합 계 | - | - | - | 3,200,000,000 | - | - | - | - | 1,100,000,000 | 196,078 | - |
| [채무증권의 발행 등과 관련된 사항] |
채무증권 발행실적
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| (주)팬젠 | 회사채 | 사모 | 2023.04.20 | 3,200 | 표면 0% 만기 2% |
- | 2027.04.20 | 미상환 | - |
| 합 계 | - | - | - | 3,200 | - | - | - | - | - |
기업어음증권 미상환 잔액
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
단기사채 미상환 잔액
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
회사채 미상환 잔액
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | 1,100 | - | - | - | - | 1,100 | |
| 합계 | - | - | 1,100 | - | - | - | - | 1,100 | |
신종자본증권 미상환 잔액
| (기준일 : | 2025.03.24 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
조건부자본증권 미상환 잔액
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 사모자금의 사용내역
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 제3자배정유상증자 | - | 2024.11.13 | 운영자금 | 5,261 | 운영자금 | 5,261 | - |
나. 운영자금 사용 세부내역
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 구 분 | 운영자금 사용내역 | |||
| 2025년1분기 | 2024년 | 합 계 | ||
| 운영자금 | 연구개발비 | 695 | 311 | 1,006 |
| 원부재료비구입 | 1,166 | 585 | 1,751 | |
| 기타운전자금 | 1,524 | 721 | 2,245 | |
| 설비 및 비품등 | 259 | - | 259 | |
| 합 계 | 3,644 | 1,617 | 5,261 | |
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
(1) 당사는 본 보고서 작성기준일 현재 재무제표를 재작성한 사항이 없습니다.
(2) 당사는 최근 3사업연도 중 합병, 분할, 자산양수도, 영업양수도 사항이 없습니다.
(3) 당사는 최근 3사업연도 중 자산유동화와 관련한 자산매각의 회계처리 및 우발채무 등에 관한 사항이 없습니다.
나. 대손충당금 설정현황
(1) 계정과목별 대손충당금 설정내역
| (단위: 천원) |
| 구 분 | 계정과목 | 채권 총액 | 대손충당금 | 대손충당금 설정률 |
| 제16기1분기 (2025년1분기) |
매출채권 | 3,159,356 | 280,000 | 8.9% |
| 계약자산 | 31,143 | 17,139 | 55.0% | |
| 대여금 | 113,000 | - | 0.0% | |
| 미수금 | 132,541 | - | 0.0% | |
| 합계 | 3,436,040 | 297,139 | 8.6% | |
| 제15기 (2024년) |
매출채권 | 3,238,875 | 280,000 | 8.6% |
| 계약자산 | 17,139 | 17,139 | 100.0% | |
| 대여금 | 250,000 | - | 0.0% | |
| 미수금 | 2,190 | - | 0.0% | |
| 합계 | 3,508,204 | 297,139 | 8.5% | |
| 제14기 (2023년) |
매출채권 | 2,348,489 | 140,000 | 6.0% |
| 계약자산 | 199,140 | 8,570 | 4.3% | |
| 대여금 | 113,000 | - | 0.0% | |
| 미수금 | 7,455 | - | 0.0% | |
| 합계 | 2,668,084 | 148,570 | 5.6% |
(2) 대손충당금 변동현황
| (단위: 천원) |
| 구 분 | 제16기1분기 (2025년1분기) |
제15기 (2024년) |
제14기 (2023년) |
| 1. 기초 대손충당금 잔액합계 | 297,139 | 148,570 | 0 |
| 2. 순대손처리액(①-②±③) | 0 | 0 | 0 |
| ① 대손처리액(상각채권액) | 0 | 0 | 0 |
| ② 상각채권회수액 | 0 | 0 | 0 |
| ③ 기타증감액 | 0 | 0 | 0 |
| 3. 대손상각비 계상(환입)액 | 0 | 148,569 | 148,570 |
| 4. 기말 대손충당금 잔액합계 | 297,139 | 297,139 | 148,570 |
(3) 매출채권관련 대손충당금 설정방침 및 처리기준
당사의 대손충당금 설정은 매출채권 전체기간 기대신용손실에 해당하는 금액을 손실충당금으로 측정하고 최초인식시점에 신용이 손상된 금융자산은 최초 인식 후 전체기간 기대신용손실의 누적변동분만을 손실충당금으로 계상합니다.
당사의 대손처리 기준은 아래와 같은 사유발생시 매출채권등에 대해 대손처리합니다- 세법상의 대손사유에 해당하는 소멸시효가 완성된 채권
- 파산, 부도, 강제집행, 사업의 폐지, 채무자의 사망, 실종 등으로 인해 채권의 회수
불능이 객관적으로 입증된 경우
- 소송에 패소하였거나 법적 청구권이 소멸한 경우
- 회수에 따른 비용이 채권금액을 초과하는 경우
(4) 당해 경과기간별 매출채권 잔액 현황
| 기준일 : 2025.3.31 | (단위: 천원) |
| 구분 | 3개월이하 | 3개월 초과 6개월이하 |
6개월 초과 1년이하 |
1년 초과 3년 이하 |
계 |
| 금 액 | 2,223,279 | 479,778 | 176,299 | 280,000 | 3,159,356 |
| 구성비율 | 70.4% | 15.2% | 5.6% | 8.8% | 100.0% |
다. 재고자산의 현황
(1) 재고자산의 보유현황
| (단위: 천원) |
| 사업부문 |
계정과목 |
제16기 |
제15기 |
제14기 |
비고 |
| 제 조 | 제품 | - | 483,333 | 590,454 | - |
| 원부재료 | 1,241,373 | 1,500,329 | 1,699,111 | - | |
| 재공품 | 5,466,725 | 3,948,596 | 4,536,530 | - | |
| 연구소 | 원부재료 | 145,426 | 68,574 | 99,345 | - |
| 합 계 | 6,853,524 | 6,000,832 | 6,925,440 | - | |
|
총자산대비 재고자산 구성비율(%) [재고자산합계÷기말자산총계×100] |
22.17% | 19.65% | 33.39% | - | |
|
재고자산회전율(회수) [연환산 매출원가÷{(기초재고+기말재고)÷2}] |
1.08회 | 1.47회 | 0.93회 | - | |
주1) 각 계정과목별 금액은 평가충담금을 차감한 순장부가액으로 기재 하였음.
(2) 재고자산의 실사현황
1) 재고실사일
- 자체재고조사
1분기: 25. 03. 26 ~ 04.02
(제조부분 : 25.03.26~03.31, 연구소 : 25.03.31~04.02, QC부분 25.03.27~03.31)
2) 당사는 매분기별로 자체 재고실사(연간 4회)를 진행하고 있습니다.
3) 재고실사내용 :제품, 재공품, 원부재료
4) 실사 방법 : 재고실사기준일(2025.3.31) 장부상 재고 수량과 실지재고수량을
확인하였으며, 중요한 차이가 발생되지 않았습니다.
(3) 장기체화재고등 현황
재고자산의 시가가 취득원가보다 하락한 경우에는 시가를 재무상태표가액으로 하고 있으며, 재고자산에 대한 평가내역은 다음과 같습니다.
| 기준일 : 2025.03.31 | (단위: 천원) |
| 계정과목 | 취득원가 | 보유금액 | 평가충당금 | 기말잔액 | 비고 |
| 제품 | - | - | - | - | - |
| 재공품 | 5,466,725 | 5,466,725 | - | 5,466,725 | - |
| 원부재료 | 1,837,517 | 1,837,517 | (450,717) | 1,386,799 | - |
| 합 계 | 7,304,242 | 7,304,242 | (450,717) | 6,853,524 | - |
(4) 재고자산의 담보제공
당사는 보고서 기준일 현재 재고자산을 담보로 제공한 사실이 없습니다.
라. 공정가치평가 내역
금융상품
금융자산의 인식 및 측정
당사는 금융자산의 관리를 위한 사업모형과 금융자산의 계약상 현금흐름 특성에 따라 금융자산을 상각후원가측정금융자산, 기타포괄손익-공정가치측정금융자산 및 당기손익-공정가치측정금융자산의 세가지 범주로 분류하고 분류 명칭에 따라 후속적으로 측정하고 있습니다.
당사가 복합계약의 보유자이고 해당 복합계약의 주계약이 기준서 제1109호의 적용범위에해당되는 경우에는, 내재파생상품은 분리하지 않고 복합계약 전체에 대해 위 세가지 범주중의 하나로 분류합니다.
유의적인 금융요소를 포함하지 않는 매출채권은 최초인식시점에 거래가격으로 측정하고 이외에는 공정가치로 측정하며, 당기손익-공정가치측정금융자산이 아닌 경우 금융자산의취득과 직접 관련되는 거래원가는 최초 인식시점에 공정가치에 가산하고 있습니다.
1) 상각후원가측정금융자산
계약상 현금흐름의 수취를 목적인 사업모형하에서 계약조건에 따라 특정일에 원금과 원금잔액에 대한 이자지급만으로 구성되는 현금흐름이 발생하는 금융자산을 상각후원가측정금융자산으로 인식하고 있습니다. 원금은 최초 인식시점의 공정가치이며 이자는 화폐의 시간가치에 대한 대가 및 신용위험에 대가 등을 포함합니다. 상각후원가측정금융자산은 유효이자율법에 따라 측정하고 이자수익은 당기손익에 반영하고 있습니다.
2) 기타포괄손익-공정가치측정금융자산
계약상 현금흐름의 수취와 매도를 목적으로 하는 사업모형하에서 계약조건에 따라 특정일에 원금과 원금잔액에 대한 이자지급만으로 구성되는 현금흐름이 발생하는 금융자산을 기타포괄손익-공정가치측정금융자산으로 인식하고 있습니다. 공정가치의 변동으로 인한 차이는 기타포괄손익에 반영하고 처분시 당기손익으로 재순환시키며 이자수익, 손상차손(환입) 및 외환손익은 당기손익에 반영하고 있습니다.
한편, 당사는 단기매매목적으로 보유하지 않는 지분상품은 최초 인식시점에 기타포괄손익-공정가치측정금융자산으로 취소불가능한 선택을 할 수 있습니다. 이러한 선택을 하는 경우에는 배당금을 제외하고 해당 지분상품으로부터 발생하는 모든 손익은 기타포괄손익으로 인식하고 후속적으로 당기손익으로 재순환시키지 않습니다.
3) 당기손익-공정가치측정금융자산
금융자산이 상각후원가 또는 기타포괄손익-공정가치로 측정하지 않는 경우에는 당기손익-공정가치측정금융자산으로 분류하며 단기매매목적의 지분증권, 파생상품 등을 포함하고있습니다. 기준서 1109호의 분류기준에 따라 상각후원가 또는 기타포괄손익-공정가치로 측정하는 금융자산으로 분류되더라도 회계불일치를 해소하기 위해 당기손익-공정가치측정금융자산으로 취소불가능한 지정을 할 수 있습니다. 당기손익-공정가치측정금융자산과관련된 손익은 당기손익으로 인식하고 있습니다.
금융부채의 분류 및 측정
당사는 계약의 실질에 따라 금융부채를 상각후원가측정금융부채, 당기손익-공정가치측정금융부채로 분류하고 있습니다. 한편, 당사가 복합금융상품을 발행한 경우에는 자본요소와 부채요소를 분리하고 부채요소의 공정가치를 측정하여 최초 장부금액을 부채요소에 먼저 배부하고 있습니다.
금융부채는 최초인식시점에 공정가치로 측정하며, 당기손익-공정가치측정금융부채가 아닌 경우 금융부채의 발행과 직접 관련되는 거래원가는 최초 인식시점에 공정가치에 가산하고 있습니다. 후속적으로는 상각후원가측정금융부채는 유효이자율을 적용하여 측정하고 관련 이자비용은 당기손익으로 인식하며, 당기손익-공정가치측정금융부채는 공정가치로 측정하고 공정가치의 변동액을 당기손익으로 인식합니다.
금융자산의 손상
당사는 상각후원가측정금융자산과 기타포괄손익-공정가치로 측정하는 채무상품에 대해 기대신용손실모형을 적용하고 있습니다.
당사는 신용손상측정대상 금융자산에 대해 최초 인식 후 신용위험의 유의적 증가가 있는지에 대한 개별평가 및 대상금융자산의 경제적 성격을 고려한 집합평가를 매 보고기간말에 수행하고 있습니다. 신용위험의 유의적인 증가가 있는지를 평가할 때 신용등급(외부평가기관 및 내부에서의 평가결과 모두 참고), 재무구조, 연체정보 및 현재 및 미래의 예측가능한 경제적 상황의 변동 등을 종합적으로 고려하여 판단하고 있습니다. 당사는 보고기간말 신용위험이 낮다고 판단되는 경우에는 최초인식 후 신용위험이 유의적으로 증가하지않은 것으로 하고 연체일수가 30일을 초과하는 경우에는 명백한 반증이 없는 한 신용위험이 유의적으로 증가한 것으로 회계처리하고 있습니다.
매 보고기간말에 매출채권은 전체기간 기대신용손실에 해당하는 금액을 손실충당금으로 측정하고 최초인식시점에 신용이 손상된 금융자산은 최초 인식 후 전체기간 기대신용손실의 누적변동분만을 손실충당금으로 계상합니다. 이외의 상각후원가측정금융자산 및 기타포괄손익-공정가치측정금융자산(지분증권 제외) 대해서는 12개월 기대신용손실로 측정한 손실충당금을 인식하며 최초 인식 후 신용위험의 유의적 증가가 있거나 신용손상이 있는 경우에는 전체기간 기대신용손실에 해당하는 금액을 손실충당금으로 측정하고 있습니다. 보고기간말에 측정한 손실충당금과 장부금액과의 차이는 손상차손(환입)으로 당기손익에 반영하고 있습니다.
금융상품의 제거
금융자산은 현금흐름에 대한 계약상 권리가 소멸하거나 금융자산을 양도하고 소유에 따른위험과 보상의 대부분을 이전한 경우에 제거됩니다.
당사가 금융자산을 양도한 경우라도 채무자의 채무불이행시의 소구권 등으로 양도한 금융자산의 소유에 따른 위험과 보상의 대부분을 당사가 보유하는 경우에는 이를 제거하지 않고 그 양도자산 전체를 계속하여 인식하되, 수취한 대가를 금융부채로 인식합니다. 해당 금융부채는 재무상태표에 '차입금'으로 분류하고 있습니다.
금융상품의 상계
금융자산과 부채는 인식한 자산과 부채에 대해 법적으로 집행가능한 상계권리를 현재 보유하고 있고, 순액으로 결제하거나 자산을 실현하는 동시에 부채를 결제할 의도를 가지고 있을 때 상계하여 재무상태표에 순액으로 표시합니다. 법적으로 집행가능한 상계권리는 미래사건에 좌우되지 않으며, 정상적인 사업과정의 경우와 채무불이행의 경우 및 지급불능이나 파산의 경우에도 집행가능한 것을 의미합니다.
복합금융상품
당사가 발행한 복합금융상품은 발행자 또는 발행자가 지정하는 제3자의 매도청구권(콜옵션)이 포함되어 있거나 보유자의 선택에 의해 상환을 요청할 수 있는 권리(풋옵션) 또는 지분상품으로 전환될 수 있는 권리(전환권) 등이 포함되어 있는 주계약과 복수의 파생상품이 결합된 금융상품입니다.
당사는 복합금융상품에 포함된 '발행자 또는 발행자가 지정하는 제3자의 매도청구권(콜옵션)'을 별도의 파생상품자산으로 구분하여 회계처리 하고 있습니다.
복합금융상품에 포함된 보유자의 선택에 의해 상환을 요청할 수 있는 권리(풋옵션)는 경제적 특성과 위험이 주계약과 밀접하게 관련된 경우에는 주계약과 분리하지 않고 부채요소로 분류하며 후속적으로 주계약과 함께 유효이자율법에 따른 상각후원가로 측정합니다.한편, 풋옵션의 경제적 특성과 위험이 주계약과 밀접하게 관련되지 않은 경우에는 주계약과 분리하여 파생상품부채로 분류하고 후속기간의 공정가치 변동은 당기손익으로 회계처리 하고 있습니다.
복합금융상품에 포함된 지분상품으로 전환될 수 있는 권리(전환권)는 경제적 특성과 위험이 주계약과 밀접하게 관련되지 않으므로 주계약과 분리합니다. 당해 전환권은 기초자산의 주가 변동에 따라 전환권 행사 시 발행해야 할 주식의 수량이 변동(리픽싱 조건)되는 경우에는 파생상품부채로 회계처리 하고 확정 대 확정 조건을 충족하는 경우에는 자본으로 회계처리 합니다.
발행시점에 내재파생상품이 파생상품부채로 분류되는 경우에는 복합금융상품 전체의 공정가치에서 파생상품부채의 공정가치를 차감한 잔여금액을 부채요소의 장부금액으로 배부합니다. 한편, 복합금융상품의 내재파생상품이 지분상품으로 분류되는 경우에는 복합금융상품 전체의 공정가치에서 부채요소의 공정가치를 차감한 나머지 금액을 자본요소로 배부하고 있습니다.
범주별 금융상품
보고기간말 현재 금융자산의 범주별 분류내역은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익- 공정가치측정 금융자산 |
합 계 |
|---|---|---|---|---|---|
| 유동 | 현금및현금성자산 | 2,051,606 | - | - | 2,051,606 |
| 매출채권및기타채권 | 3,011,897 | - | - | 3,011,897 | |
| 기타금융자산 | 9,177,968 | - | - | 9,177,968 | |
| 소 계 | 14,241,471 | - | - | 14,241,471 | |
| 비유동 | 기타금융자산 | 97,649 | - | - | 97,649 |
| 합 계 | 14,339,120 | - | - | 14,339,120 | |
<전 기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익- 공정가치측정 금융자산 |
합 계 |
|---|---|---|---|---|---|
| 유동 | 현금및현금성자산 | 1,430,114 | - | - | 1,430,114 |
| 매출채권및기타채권 | 2,961,065 | - | - | 2,961,065 | |
| 기타금융자산 | 10,301,909 | - | - | 10,301,909 | |
| 소 계 | 14,693,088 | - | - | 14,693,088 | |
| 비유동 | 기타금융자산 | 95,685 | - | - | 95,685 |
| 합 계 | 14,788,773 | - | - | 14,788,773 | |
보고기간말 현재 금융부채의 범주별 분류내역은 다음과 같습니다.
<당분기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융부채 |
당기손익- 공정가치측정 금융부채 |
합 계 |
|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 647,565 | - | 647,565 |
| 전환사채 | 850,047 | - | 850,047 | |
| 파생상품부채 | - | 413,578 | 413,578 | |
| 리스부채 | 1,398 | - | 1,398 | |
| 소 계 | 1,499,010 | 413,578 | 1,912,588 | |
| 비유동 | 리스부채 | 391 | - | 391 |
| 기타금융부채 | 30,000 | - | 30,000 | |
| 소 계 | 30,391 | - | 30,391 | |
| 합 계 | 1,529,401 | 413,578 | 1,942,979 | |
<전 기>
| (단위: 천원) |
| 구 분 | 과 목 |
상각후원가측정 금융부채 |
당기손익- 공정가치측정 금융부채 |
합 계 |
|---|---|---|---|---|
| 유동 | 매입채무및기타채무 | 1,219,478 | - | 1,219,478 |
| 전환사채 | 816,301 | - | 816,301 | |
| 파생상품부채 | - | 413,578 | 413,578 | |
| 리스부채 | 1,845 | - | 1,845 | |
| 소 계 | 2,037,623 | 413,578 | 2,451,201 | |
| 비유동 | 리스부채 | 391 | - | 391 |
| 기타금융부채 | 30,000 | - | 30,000 | |
| 소 계 | 30,391 | - | 30,391 | |
| 합 계 | 2,068,014 | 413,578 | 2,481,592 | |
보고기간말 현재 금융상품의 종류별 장부금액과 공정가치는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | |||
|---|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | ||
| 금융자산: | |||||
| 유동 | 현금및현금성자산 | 2,051,606 | 2,051,606 | 1,430,114 | 1,430,114 |
| 매출채권및기타채권 | 3,011,897 | 3,011,897 | 2,961,065 | 2,961,065 | |
| 기타금융자산 | 9,177,968 | 9,177,968 | 10,301,909 | 10,301,909 | |
| 비유동 | 기타금융자산 | 97,649 | 97,649 | 95,685 | 95,685 |
| 금융자산 합계 | 14,339,120 | 14,339,120 | 14,788,773 | 14,788,773 | |
| 금융부채: | |||||
| 유동 | 매입채무및기타채무 | 647,565 | 647,565 | 1,219,478 | 1,219,478 |
| 전환사채 | 850,047 | 775,115 | 816,301 | 775,115 | |
| 파생상품부채 | 413,578 | 413,578 | 413,578 | 413,578 | |
| 리스부채 | 1,398 | 1,398 | 1,845 | 1,845 | |
| 비유동 | 리스부채 | 391 | 391 | 391 | 391 |
| 기타금융부채 | 30,000 | 30,000 | 30,000 | 30,000 | |
| 금융부채 합계 | 1,942,979 | 1,868,047 | 2,481,592 | 2,440,407 | |
경영진은 전환사채를 제외하고는 재무제표상 상각후원가로 측정된 금융자산과 금융부채의 장부금액은 공정가치와 근사하다고 판단하고 있습니다.
IV. 이사의 경영진단 및 분석의견
당사는 기업공시서식 작성기준에 따라 분,반기 보고서의 이사의 경영진단 및 분석
의견의 기재는 생략 합니다.
V. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
가. 회계감사인의 명칭 및 감사의견
| 사업연도 | 구분 | 감사인 | 감사의견 | 의견변형사유 | 계속기업 관련 중요한 불확실성 |
강조사항 | 핵심감사사항 |
|---|---|---|---|---|---|---|---|
| 제16기 (당기) |
감사보고서 | 성현회계법인 | - | - | - | - | - |
| 연결감사 보고서 |
- | - | - | - | - | - | |
| 제15기 (전기) |
감사보고서 | 한울회계법인 | 적정의견 | 해당사항 없음 | 해당사항 없음 | 특기사항없음 | 제품 및 용역매출의 발생사실 |
| 연결감사 보고서 |
- | - | - | - | - | - | |
| 제14기 (전전기) |
감사보고서 | 한울회계법인 | 적정의견 | 해당사항 없음 | 해당사항 없음 | 특기사항없음 | 자산 손상평가 |
| 연결감사 보고서 |
- | - | - | - | - | - |
나. 감사용역 체결현황
| (단위 : 백만원, 시간) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제16기(당기) | 성현회계법인 | 재표제표 감사 | 100 | 846 | 30 | - |
| 제15기(전기) | 한울회계법인 | 재무제표 감사 | 65 | 538 | 65 | 529 |
| 제14기(전전기) | 한울회계법인 | 재무제표 감사 | 64 | 620 | 64 | 655 |
다. 회계감사인과의 비감사용역 계약체결 현황.
| (단위: 천원) |
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제16기(당기) | 2025년 04월 | 법인세 | 2026.01.01~03.31 | 8,000 | 성현회계법인 |
| 제15기(전기) | 2024년 05월 | 법인세 | 2025.01.01~03.31 | 7,000 | 한울회계법인 |
| 제14기(전전기) | 2023년 05월 | 법인세 | 2024.01.01~03.31 | 7,000 | 한울회계법인 |
라. 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 내부감사기구가 회계감사인과 논의한 결과
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2025.02.12 | 회사측: 감사 및 재무담당임원 외 1명 감사인측: 업무수행이사 외 4명 |
대면회의 | 회계감사 결과 |
2. 내부통제에 관한 사항
가. 경영진의 내부회계 관리제도 효과성 평가 결과
| 사업연도 | 구분 | 운영실태 보고서 보고일자 |
평가 결론 | 중요한 취약점 |
시정조치 계획 등 |
|---|---|---|---|---|---|
| 제16기 (당기) |
내부회계 관리제도 |
- | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제15기 (전기) |
내부회계 관리제도 |
2025.02.03 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | 해당사항없음 | 해당사항없음 |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제14기 (전전기) |
내부회계 관리제도 |
2024.02.05 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | 해당사항없음 | 해당사항없음 |
| 연결내부회계 관리제도 |
- | - | - | - |
나. 감사(위원회)의 내부회계관리제도 효과성 평가 결과
| 사업연도 | 구분 | 평가보고서 보고일자 |
평가 결론 | 중요한 취약점 |
시정조치 계획 등 |
|---|---|---|---|---|---|
| 제16기 (당기) |
내부회계 관리제도 |
- | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제15기 (전기) |
내부회계 관리제도 |
2025.03.07 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | 해당사항없음 | 해당사항없음 |
| 연결내부회계 관리제도 |
- | - | - | - | |
| 제14기 (전전기) |
내부회계 관리제도 |
2024.02.05 | 중요성의 관점에서 효과적으로 설계되어 운영되고 있다고 판단 | 해당사항없음 | 해당사항없음 |
| 연결내부회계 관리제도 |
- | - | - | - |
다. 감사인의 내부회계관리제도 감사의견(검토결론)
| 사업연도 | 구분 | 감사인 | 유형 (감사/검토) |
감사의견 또는 검토결론 |
지적사항 | 회사의 대응조치 |
|---|---|---|---|---|---|---|
| 제16기 (당기) |
내부회계 관리제도 |
성현회계법인 | 검토 | - | - | - |
| 연결내부회계 관리제도 |
- | - | - | - | - | |
| 제15기 (전기) |
내부회계 관리제도 |
한울회계법인 | 검토 | 적정의견 | 해당사항없음 | 해당사항없음 |
| 연결내부회계 관리제도 |
- | - | - | - | - | |
| 제14기 (전전기) |
내부회계 관리제도 |
한울회계법인 | 검토 | 적정의견 | 해당사항없음 | 해당사항없음 |
| 연결내부회계 관리제도 |
- | - | - | - | - |
라. 내부회계관리·운영조직 인력 및 공인회계사 보유현황
| 소속기관 또는 부서 |
총 원 | 내부회계담당인력의 공인회계사 자격증 보유비율 |
내부회계담당 인력의 평균경력월수 |
||
|---|---|---|---|---|---|
| 내부회계 담당인력수(A) |
공인회계사자격증 소지자수(B) |
비율 (B/A*100) |
|||
| 감사 | 1 | 1 | 1 | 100 | 305 |
| 이사회 | 7 | 1 | - | - | 303 |
| 회계및재무 | 4 | 4 | - | - | 223 |
| 인사,총무,공시 | 4 | 4 | - | - | 109 |
마. 회계담당자의 경력 및 교육실적
| 직책 (직위) |
성명 | 회계담당자 등록여부 |
경력 (단위:년, 개월) |
교육실적 (단위:시간) |
||
|---|---|---|---|---|---|---|
| 근무연수 | 회계관련경력 | 당기 | 누적 | |||
| 내부회계관리자 회계담당임원 |
장재홍 | 미등록 | 14 | 34 | 4 | 109 |
| 회계담당임원 | 조창범 | 미등록 | 7 | 29 | 2 | 30 |
| 회계담당직원 | 조영진 | 미등록 | 9 | 9 | 34 | 107 |
VI. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사회의 구성
당사의 이사회는 이사로 구성되고 법령 또는 정관에 정하여진 사항, 주주총회로부터 위임받은 사항, 회사의 기본방침 및 업무집행에 관한 주요사항을 의결하며 이사 및 경영진의 직무집행을 감독하고 있습니다. 본 보고서 작성기준일 현재 당사의 이사회는 7명의 이사(사내이사 3명, 기타비상무이사 4명)로 구성되어 있으며, 당사의 이사회 의장은 당사 정관 제35조 2항에 의거 대표이사가 의장을 겸직하고 있으며. 당사는 이사회 내 별도의 위원회는 구성되어 있지 않습니다.
- 사내이사 : 윤재승, 김진곤, 윤인상
- 기타비상무이사 : 정정철, 송수영, 윤성태, 레오나르드아리프빈압둘샤타
나. 이사회의 중요 의결사항
| 회차 |
개최일자 |
의안내용 |
가결 여부 |
이사의 성명 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 윤재승 (출석율:100%) |
송수영 (출석율:100%) |
윤성태 (출석율:100%) |
김진곤 (출석율:33%) |
정정철 (출석율:100%) |
레오나르드아리프 빈압둘샤타 (출석율100%) |
윤인상 (출석율: 100%) |
||||
| 1 | 2025.02.03 | 제15기 결산재무제표 승인의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 |
| 2 | 2025.03,07 | 정기주주총회 소집 및 의안 결정의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | 찬성 | 찬성 | 찬성 |
| 3 | 2025.03,07 | 회사규정 제정 및 개정 승인의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | 찬성 | 찬성 | 찬성 |
다. 이사회에서의 사외이사 주요 활동내역
당사는 사외이사가 선임되어 있지 않아 해당사항 없습니다.
라 이사회내의 위원회 구성현황과 그 활동내역
당사는 이사회내에 위원회가 구성되어 있지 않습니다.
마. 이사의 독립성
이사는 주주총회에서 선임하며, 주주총회에서 선임할 이사 후보자는 이사회가 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다. 이사의 선임과 관련하여 관련법규에 의거한 주주제안이 있는 경우 이사회는 적법한 범위 내에서 이를 주주총회에 의안으로 제출하고 있습니다.
회사 경영의 중요한 의사결정과 업무집행은 이사회의 심의 및 결정을 통하여 이루어지고 있습니다. 또한 당사는 대주주 등의 독단적인 경영과 이로 인한 소액주주의 이익 침해가 발생하지 않도록 이사회 운영규정 제정하여 성실히 준수하고 있습니다.
(기준일 : 2025.3.31)
| 담당직무 | 성명 | 활동분야 (담당업무) |
추천인 | 상근여부 | 회사와의 거래 |
최대주주와의 이해관계 |
연임횟수 |
| 대표이사 | 윤재승 | 경영총괄 | 이사회 | 상근 | 해당없음 | 계열사임원 | - |
| 사내이사 | 윤인상 | 경영자문 | 이사회 | 비상근 | 해당없음 | 등기임원 | - |
| 사내이사 | 김진곤 | 경영자문 | 이사회 | 비상근 | 해당없음 | 해당없음 | - |
| 기타비상무이사 | 정정철 | 경영자문 | 이사회 | 비상근 | 해당없음 | 해당없음 | - |
| 기타비상무이사 | 윤성태 | 경영자문 | 이사회 | 비상근 | 해당없음 | 등기임원 | - |
| 기타비상무이사 | 송수영 | 경영자문 | 이사회 | 비상근 | 해당없음 | 등기임원 | - |
| 기타비상무이사 | 레오나르드아리프빈압둘샤타 | 경영자문 | 이사회 | 비상근 | 해당없음 | 해당없음 | 3회 |
바. 사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 7 | - | - | - | - |
사. 사외이사의 전문성
당사는 사외이사가 선임되어 있지 않아 해당사항 없습니다.
사외이사 교육 미실시 내역
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | - |
2. 감사제도에 관한 사항
가. 감사위원회 설치여부
당사는 본 보고서 작성기준일 현재 감사위원회를 별도로 설치하고 있지 않으며, 주주총회 결의로 선임된 비상근 감사 1명(강신원감사)이 당사 정관 제44조에서 규정하고 있는 감사의 직무에 따라 감사업무를 충실히 수행하고 있습니다.
나. 감사의 인적사항
|
성명 |
주요 경력 |
결격요건 여부 |
비고 |
|---|---|---|---|
| 강신원 | 성균관대학교 경제학 학사 전)삼일회계법인, 전)핸즈코퍼레이션㈜, 메디포스트㈜ 현) ㈜휴온스글로벌 재무지원본부장 |
해당사항 없음 |
- |
다. 감사의 독립성
감사는 회계와 업무를 감사하며 이사회 및 타 부서로부터 독립된 위치에서 업무를 수행하고 있습니다. 또한 당사는 감사의 감사업무에 필요한 경영정보접근을 위하여 당사 정관에 다음과 같은 조항을 두고 있습니다.
|
관련조항 |
내 용 |
|---|---|
| 정관제 44 조 (감사의 직무) |
① 감사는 회사의 회계와 업무를 감사한다. ② 감사는 이사회에 출석하여 의견을 진술할 수 있다. ③ 감사는 회의의 목적 사항과 소집의 이유를 기재한 서면을 이사회에 제출하여 임시총회의 소집을 청구할 수 있다. ④ 감사는 그 직무를 수행하기 위하여 필요한 때에는 자회사에 대하여 영업의 보고를 요구할 수 있다. 이 경우 자회사가 지체없이 보고를 하지 아니할 때 또는 그 보고의 내용을 확인할 필요가 있는 때에는 자회사의 업무와 재산 상태를 조사할 수 있다. ⑤ 감사에 대해서는 정관 제34조 2의 제3항의 규정을 준용한다. ⑥ 감사는 회사의 비용으로 전문가의 도움을 구할 수 있다. ⑦ 감사는 필요하면 회의의 목적사항과 소집이유를 적은 서면을 이사(소집권자가 있는 경우에는 소집권자)에게 제출하여 이사회 소집을 청구할 수 있다. ⑧ 제7항의 청구를 하였는데도 이사가 지체 없이 이사회를 소집하지 아니하면 그 청구한 감사가 이사회를 소집할 수 있다. |
라. 감사의 주요 활동내역
| 회차 |
개최일자 |
활 동 내 용 |
활동내역 |
|---|---|---|---|
| 1 | 2025.02.03 | - 제15기 결산재무제표 승인 | 참석 |
| 2 | 2025.02.12 | - 제15기 회계감사 결과 | 대면회의 |
| 3 | 2025.03.07 | - 제15기 내부회계관리제도 운영실태 평가 보고 - 제15기 정기주주총회 소집 및 의안 결정의 건 |
보고 참석 |
| 4 | 2025.03.07 | - 회사규정 제정 및 개정 승인의 건 |
참석 |
| 5 | 2025.03.31 | - 제15기 정기주주총회 감사보고 | 보고 |
마. 감사위원회 교육 미실시 내역
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | 감사업무 수행에 필요한 전문성 및 적격성을 보유하고 있어 필요시 관련교육 진행 예정임 |
바. 감사위원회 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 경영지원 | 2 | 이사1명(6.8년) 과장1명(9.0년) |
재무제표,이사회등 경영전반에 관한 감사직무 수행지원 |
사. 준법지원인 및 지원조직 현황
당사는 본 보고서 작성일 현재 선임된 준법 지원인이 없어 해당사항 없습니다.
3. 주주총회 등에 관한 사항
가. 투표제도 현황
| (기준일 : | 2025.03.31 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 미도입 |
| 실시여부 | 미실시 | 미실시 | 미실시 |
나. 의결권 현황
| (기준일 : | 2025.03.31 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 12,898,197 | - |
|
우선주 |
- | - | |
| 의결권없는 주식수(B) |
보통주 |
- | - |
|
우선주 |
- | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) |
보통주 |
- | - |
|
우선주 |
- | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 |
- | - |
|
우선주 |
- | - | |
| 의결권이 부활된 주식수(E) |
보통주 |
- | - |
|
우선주 |
- | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 |
12,898,197 | - |
|
우선주 |
- | - |
다. 주식사무
|
정관상 |
제 10 조 (신주인수권) ① 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다. ② 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다. 1. 자본시장과 금융투자업에 관한 법률 제9조에서 정한 “유가증권시장 또는 코스닥시장(코넥스시 장 포함)”에 주권을 신규상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 2. 발행주식총수의 100분의 50을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 3. 상법 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 4. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 5. [근로복지기본법] 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 6. 발행할주식총수의 100분의 50을 초과하지 않는 범위 내에서 경영상의 필요로 또는 긴급한 자금조달을 위하여 국내외 투자자에게 신주를 발행하는 경우 7. 발행할주식총수의 100분의 50을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산,판매,자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 8. 발행할주식총수의 100분의 50을 초과하지 않는 범위내에서 주식예탁증서(DR)발행에 따라 신주를 발행하는 경우 ③ 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행 가격 등은 이사회의 결의로 정한다. 다만, 일반공모 증자의 경우에는 자본시장과 금융투자업에 관한 법률 시행령 제176조의8과 증권의 발행 및 공시 등에 관한 규정 제5-18조 제1항에 따라, 제3자배정증자의 경우에는 증권의 발행 및 공시 등에 관한 규정 제5-18조 제1항에 따라 발행가격을 산정한다. ④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사 회의 결의로 정한다. ⑤ 제2항에 따라 주주 외의 자에게 신주를 배정하는 경우 회사는 상법 제416조제1호, 제2호, 제2호의2, 제3호 및 제4호에서 정하는 사항을 그 납입기일의 2주 전까지 주주에게 통지하거나 공고 하여야 한다. 다만, 자본시장과 금융투자업에 관한 법률 제165조의 9에 따라 주요사항보고서를 금융위원회 및 거래소에 그납입일1주전까지 공시함으로써 그통지 및 공고를 갈음할 수 있다. |
||
|
결산일 |
12월 31일 |
정기주주총회 |
매 사업연도 종료 후 3개월 이내 |
|
주주명부폐쇄시기 |
매년 1월 1일부터 1월 15일까지 |
||
|
주권의 종류 |
주식ㆍ사채 등의 전자등록에 관한 법률 시행에 따라 권종 삭제 (시행일 2019.9.16) |
||
|
명의개서대리인 |
국민은행 증권대행부 |
||
|
주주의 특전 |
해당사항 없음 |
공고게재 |
홈페이지(www.pangen.com) |
라. 주주총회 의사록 요약
| 개최일자 | 안건 | 가결여부 |
|---|---|---|
| 제15기정기주총 (2025.03.31) |
제1호 의안 : 제15기 재무제표승인의 건 제4호 의안 : 감사 보수한도 승인의 건(감사보수한도 1억원) |
원안대로 승인 |
| 임시주주총회 (2024.12.13) |
제1호 의안 : 이사 선임의 건 제1-1호 의안 : 기타비상무이사 윤성태 선임의 건 제1-2호 의안 : 기타비상무이사 송수영 선임의 건 제1-3호 의안 : 사내이사 윤인상 선임의 건 제2호 의안 : 감사(비상근) 강신원 선임의 건 |
원안대로 승인 |
| 제14기정기주총 (2024.03.28) |
제1호 의안 : 제14기 재무제표승인의 건 제6호 의안 : 감사 보수한도 승인의 건(감사보수한도 1억원) |
원안대로 승인 |
| 임시주주주총 (2023.10.30) |
제1호 의안 : 이사 선임의 건 |
이사 및 감사 후보자 전원 자진사퇴로 의안 폐기 |
| 제13기정기주총 (2023.03.24) |
제1호 의안 : 제13기 재무제표승인의 건 제4호 의안 : 감사 보수한도 승인의 건(감사보수한도 1억원) |
원안대로승인 |
| 임시주주총회 (2023.1.12) |
제1호 의안 : 이사 신규 선임의 건 제1-1호의안 : 사내이사 조중명(신규선임) 제1-2호의안 : 사내이사 신승수(신규선임) 제1-3호의안 : 사내이사 박노준(신규선임) 제1-4호의안 : 기타비상무이사 정정철(신규선임) 제1-5호의안 : 기타비상무이사 윤인상(신규선임) 제2호 의안 : 감사(비상근) 선임의 건 : 안상국(신규선임) |
원안대로승인 |
VII. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2025.03.31 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| (주)휴온스 | 최대주주 | 보통주 | 3,983,167 | 30.88 | 3,983,167 | 30.88 | - |
| 윤성태 | 특수관계인 | 보통주 | 142,436 | 1.10 | 142,436 | 1.10 | - |
| 윤재승 | 특수관계인 | 보통주 | 400,000 | 3.10 | 400,000 | 3.10 | - |
| 이규연 | 특수관계인 | 보통주 | 4,500 | 0.04 | 4,500 | 0.04 | - |
| 김준철 | 특수관계인 | 보통주 | 1,089 | 0.01 | 1,089 | 0.01 | - |
| 계 | 보통주 | 4,531,192 | 35.13 | 4,531,192 | 35.13 | - | |
| - | - | - | - | - | - | ||
주) 위의 표 기말지분율은 2025.3.31 현재 발행주식 총수 12,898,197주를 기준으로 작성 하였습니다
2. 최대주주의 주요경력 및 개요
가. 최대주주(법인 또는 단체)의 기본정보
| 명 칭 | 출자자수 (명) |
대표이사 (대표조합원) |
업무집행자 (업무집행조합원) |
최대주주 (최대출자자) |
|||
|---|---|---|---|---|---|---|---|
| 성명 | 지분(%) | 성명 | 지분(%) | 성명 | 지분(%) | ||
| (주)휴온스 | 15,747 | 송수영 | - | - | - | (주)휴온스글로벌 | 40.74 |
| - | - | - | - | - | - | ||
나. 최대주주(법인 또는 단체)의 최근 결산기 재무현황
| (단위 : 백만원) |
| 구 분 | |
|---|---|
| 법인 또는 단체의 명칭 | (주)휴온스 |
| 자산총계 | 606,285 |
| 부채총계 | 255,690 |
| 자본총계 | 350,595 |
| 매출액 | 590,231 |
| 영업이익 | 39,695 |
| 당기순이익 | 29,073 |
주)최대주주의 최근 결산기 재무현황은 2024년 12월 31일 기준 입니다.
다. 사업현황 등 회사 경영 안정성에 영향을 미칠 수 있는 주요 내용
당사 최대주주인 (주)휴온스는 1965년에 창립하여 의약품 제조 및 판매를 주요 사업으로 영위하며, '인류건강을 위한 의학적 해결책을 제시한다'는 비전 아래 '신뢰, 품질, 감동' 세가지 경영이념을 바탕으로 최고 품질의 서비스를 제공하는 '토탈 헬스케어 기업' 입니다.
전문의약품 사업부문은 국소마취제, 점안제를 비롯해 다양한 질환군별 전문의약품을국내 병ㆍ의원ㆍ약국을 대상으로 공급하고 있습니다. 뷰티·웰빙 사업부문은 웰빙 의약품, 비만치료 의약품 외에도 사업다각화를 위해 의료기기, 건강기능식품 등으로사업 영역을 확장 했습니다. 주요 제품으로는 '리도카인 국소마취제', 국내 최초 여성갱년기 유산균 '메노락토', 연속혈당측정기 'Dexcom G7', 고용량 비타민 주사제 및 건강기능식품 '메리트 시리즈' 등이 있습니다.
휴온스는 2025년 3월 26일 정기주주총회에서 기존 건강기능식품 사업부문을 물적분할하여 종합 건강기능식품 기업인 종속회사(주)휴온스엔 (구 (주)휴온스푸디언스)에 분할합병하는 안건 승인 후 5월 2일 이를 종료하였습니다.
해당 분할합병은 (주)휴온스의 건기식사업부를 기존에 건기식 사업을 영위 중인 종속회사에 흡수합병하는 것으로 연결실체인 휴온스의 재무에 유의적 영향을 미치지는 않습니다. 영업 측면에서 휴온스는 제약사업부문에 집중하고 건기식사업은 휴온스엔에 역량을 집중함으로서 각각의 전문성 및 사업경쟁력을 제고할 계획입니다. 이를 통해 각 회사의 영업에 시너지를 창출할 수 있고 궁극적으로 재무구조에도 긍정적인 영향을 줄 수 있을 것으로 판단합니다.
3. 최대주주의 최대주주(법인 또는 단체)의 개요
가. 최대주주의 최대주주(법인 또는 단체)의 기본정보
| 명 칭 | 출자자수 (명) |
대표이사 (대표조합원) |
업무집행자 (업무집행조합원) |
최대주주 (최대출자자) |
|||
|---|---|---|---|---|---|---|---|
| 성명 | 지분(%) | 성명 | 지분(%) | 성명 | 지분(%) | ||
| (주)휴온스글로벌 | 9,796 | 송수영 | - | - | - | - | - |
| 윤성태 | 42.84 | - | - | 윤성태 | 42.84 | ||
주)최대주주 지분율은 2025.3.31일 기준입니다.
나. 최대주주의 최대주주(법인 또는 단체)의 최근 결산기 재무현황
| (단위 : 백만원) |
| 구 분 | |
|---|---|
| 법인 또는 단체의 명칭 | (주)휴온스글로벌 |
| 자산총계 | 1,405,949 |
| 부채총계 | 441,784 |
| 자본총계 | 964,165 |
| 매출액 | 813,461 |
| 영업이익 | 96,991 |
| 당기순이익 | 67,127 |
주)최대주주의 최근 결산기 재무현황은 2024년 12월 31일 기준입니다.
4. 최대주주 변동내역
최대주주 변동내역
| (기준일 : | 2025.03.31 | ) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| 2023.01.12 | 씨지인바이츠(주) | 1,534,878 | 14.37 | 주식양수도계약체결이행 | 주1) |
| 2024.11.13 | (주)휴온스외1명 | 2,590,725 | 20.28 | 제3자배정유상증자 | 주2) |
주1) 2023년 1월 12일 최대주주 변경을 수반하는 주식양수도 계약체결 이행완료에 따라 당사의 최대주주는 김영부외 특수관계인 7인에서 씨지인바이츠(주)(구상호 크리스탈지노믹스(주))로 변경되었습니다.
주2) 2024년 11월 13일 휴온스외 1인이 제3자배정 유상증자 납입에 따라 당사의 최대주주는 씨지인바이츠(주)외 1인에서 (주)휴온스외 1인으로 변경되었습니다.
5. 주식 소유현황
| (기준일 : | 2025.03.31 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | Duopharma Biotech Berhad | 806,450 | 6.25 | - |
| 화일약품(주) | 831,203 | 6.44 | - | |
| 우리사주조합 | 0 | 0 | - | |
6. 소액주주현황
소액주주현황
| (기준일 : | 2024.12.31 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 3,626 | 3,635 | 99.75 | 5,404,008 | 12,898,197 | 41.90 | 발행주식 총수의 100분의 1에 미달하는 주식을 보유한 주주 |
7. 주가 및 주식 거래 실적
한국거래소 코스닥 시장 - 보통주(222110)
| 구 분 | 24년 10월 | 24년 11월 | 24년 12월 | 25년 1월 | 25년 2월 | 25년 3월 | |
| 주 가 | 최 고 | 5,410 | 7,210 | 5,740 | 5,880 | 5,730 | 5,240 |
| 최 저 | 4,165 | 4,940 | 4,480 | 4,680 | 4,800 | 4,630 | |
| 평 균 | 4,821 | 6,032 | 5,308 | 5,379 | 5,249 | 5,006 | |
| 거래량 | 최고(일) | 746,688 | 2,552,712 | 105,989 | 103,910 | 80,534 | 41,723 |
| 최저(일) | 10,531 | 22,443 | 21,707 | 6,961 | 4,462 | 7,188 | |
| 월간 | 2,477,823 | 7,446,636 | 1,094,938 | 524,176 | 563,351 | 320,330 | |
주) 주가의 최고가, 최저가는 종가 기준입니다.
VIII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원 현황
| (기준일 : | 2025.03.31 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 윤재승 | 남 | 1961.02 | 대표이사 | 사내이사 | 상근 | 경영총괄 | Purdue Univ. 생물학 박사 경희대 교수 (주)팬젠 대표이사 |
400,000 | - | 계열회사임원 | 2010.01.29 ~ |
2027.03.28 |
| 윤인상 | 남 | 1989.12 | 사내이사 | 사내이사 | 비상근 | 경영자문 |
에모리대학교 화학과 학사 휴온스 로컬사업본부, 마케팅실, 개발실 휴온스글로벌 전략기획실장 휴온스 경영총괄본부장 |
- | - | 등기임원 | 2023.01.12 ~ |
2027.12.13 |
| 레오나르드 아리프 빈압둘샤타 |
남 | 1964.12 | 기타 비상무이사 |
기타비상무이사 | 비상근 | 경영자문 | Monash Univ. 경제학/법학 학사 Duopharma biotech CEO CCMB 그룹 대표이사 (주)팬젠기타비상무이사 |
- | - | - | 2014.03.24 ~ |
2026.03.23 |
| 김진곤 | 남 | 1964.06 | 사내이사 | 사내이사 | 비상근 | 경영자문 |
삼성전자 LCD 사업부 구매파트장 매그나칩 반도체 상무 에코볼트 사내이사 금호에이치티 대표이사 |
- | - | - | 2024.03.28 ~ |
2027.03.28 |
| 정정철 | 남 | 1968.07 | 기타 비상무이사 |
기타비상무이사 | 비상근 | 경영자문 |
서울대학교 대학원 (약학석사) SK글로벌 헬스케어팀, SK제약 개발부 화일약품 영업본부장 |
- | - | - | 2023.01.12 ~ |
2026.01.12 |
| 윤성태 | 남 | 1964.08 | 기타 비상무이사 |
기타비상무이사 | 비상근 | 경영자문 | 휴온스그룹 회장 | 142,436 | - | 등기임원 | 2024.12.13 ~ |
2027.12.13 |
| 송수영 | 남 | 1963.06 | 기타 비상무이사 |
기타비상무이사 | 비상근 | 경영자문 |
Deloitte Consulting Japan 대표이사 (주)휴온스글로벌, ㈜휴온스 대표이사 |
- | - | 등기임원 | 2024.12.13 ~ |
2027.12.13 |
| 강신원 | 남 | 1972.12 | 비상근감사 | 감사 | 비상근 | 감사 |
성균관대학교 경제학 학사 삼일회계법인 휴온스글로벌 재무지원본부장 |
- | - | 미등기임원 | 2024.12.13 ~ |
2027.12.13 |
| 장재홍 | 남 | 1966.08 | 전무이사 | 미등기 | 상근 | CFO | 강원대 회계학과 학사 ㈜팬젠 임원 |
7,600 | - | - | 2010.12.01 ~ |
- |
| 이종민 | 남 | 1967.01 | 상무이사 | 미등기 | 상근 | 개발본부장 | 고려대 유전공학 석사 ㈜팬젠 임원 |
27,470 | - | - | 2010.01.29 ~ |
- |
| 오한규 | 남 | 1969.07 | 상무이사 | 미등기 | 상근 | 품질본부장 | 수원대 생물학 석사 ㈜팬젠 임원 |
25,600 | - | - | 2010.01.29 ~ |
- |
| 박정수 | 여 | 1970.11 | 상무이사 | 미등기 | 상근 | 연구소 소장 |
경희대 분자유전학 박사 ㈜팬젠 임원 |
49,220 | - | - | 2010.01.29 ~ |
- |
| 박홍열 | 남 | 1973.11 | 이사 | 미등기 | 상근 | 공시,IR | 경희대 유전공학과 석사 (주)팬젠 임원 |
25,310 | - | - | 2010.01.29 ~ |
- |
| 조창범 | 남 | 1970.02 | 이사 | 미등기 | 상근 | 회계,재무 | 경희대 무역학과 학사 와이비파트너스(주) |
- | - | - | 2018.08.16 ~ |
- |
| 이승희 | 여 | 1973.10 | 이사 | 미등기 | 상근 | 생산지원 | 경희대 유전공학과 석사 (주)팬젠 임원 |
25,280 | - | - | 2010.01.29 ~ |
- |
| 박준호 | 남 | 1975.09 | 이사 | 미등기 | 상근 | 제조본부 부서장 |
경희대 유전공학과 석사 (주)팬젠임원 |
24,680 | - | - | 2010.01.29 ~ |
- |
나. 등기임원의 겸직현황
| (기준일 : | 2025.03.31 | ) |
| 겸 직 자 | 겸 직 회 사 | 비 고 | ||
| 성 명 | 직 위 | 회사명 | 직 위 | |
| 윤재승 | 대표이사 | (주)에이프릴바이오 | 사외이사 | - |
| 레오나르드아리프빈압둘샤타 | 기타비상무이사 | Duopharma Biotech Berhad | CEO | - |
| 에스씨엠생명과학(주) | 기타비상무이사 | - | ||
| 정정철 | 기타비상무이사 | 화일약품(주) | 미등기임원 | - |
| 윤성태 | 기타비상무이사 | (주)휴온스글로벌 | 대표이사 | - |
| (주)휴온스 | 기타비상무이사 | - | ||
| (주)휴메딕스 | 기타비상무이사 | - | ||
| (주)휴엠앤씨 | 기타비상무이사 | - | ||
| (주)휴온스바이오파마 | 기타비상무이사 | - | ||
| (주)휴온스메디텍 | 기타비상무이사 | - | ||
| (주)휴온스푸디언스 | 기타비상무이사 | - | ||
| (주)휴온스랩 | 대표이사 | - | ||
| Huons USA, Inc. | 사내이사 | - | ||
| Huons Japan Co., Ltd. | 사내이사 | |||
| (주)휴온스생명과학 | 기타비상무이사 | - | ||
| 송수영 | 기타비상무이사 | 주)휴온스글로벌 | 대표이사 | - |
| (주)휴온스 | 대표이사 | - | ||
| Huons USA, Inc. | 사내이사 | - | ||
| Huons Japan Co., Ltd. | 사내이사 | - | ||
| (주)푸드어셈블 | 기타비상무이사 | - | ||
| (주)휴온스생명과학 | 기타비상무이사 | - | ||
| 윤인상 | 사내이사 | (주)휴온스글로벌 | 사내이사 | - |
| (주)휴온스 | 사내이사 | - | ||
| (주)휴온스랩 | 기타비상무이사 | - | ||
| Huons USA, Inc. | 사내이사 | - | ||
| Huons Japan Co., Ltd. | 사내이사 | - | ||
| (주)푸드어셈블 | 기타비상무이사 | - | ||
| (주)휴온스생명과학 | 기타비상무이사 | - | ||
| 강신원 | 비상근감사 | (주)휴온스글로벌 | 미등기임원 | - |
| (주)휴온스푸디언스 | 기타비상무이사 | - | ||
| (주)휴온스랩 | 비상근감사 | - | ||
| (주)휴온스생명과학 | 비상근감사 | - | ||
| Huons Japan Co., Ltd. | 비상근감사 | - | ||
다. 직원 등 현황
| (기준일 : | 2025.03.31 | ) | (단위 : 천원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 전체 | 남 | 42 | - | - | - | 42 | 7.30 | 715,417 | 17,034 | - | - | - | - |
| 전체 | 여 | 33 | - | - | - | 33 | 6.39 | 452,308 | 13,940 | - | |||
| 합 계 | 75 | - | - | - | 75 | 6.90 | 1,167,725 | 15,684 | - | ||||
주)연간급여 총액 및 1인평균 급여액은 1분기 까지의 급여액 입니다.
1) 육아지원제도 사용 현황
| (단위 : 명) |
| 구분 | 제16기1분기 (25년1분기) |
제15기 (2024년) |
제14기 (2023년) |
| 육아휴직 사용자수(남) | 0 | 0 | 1 |
| 육아휴직 사용자수(여) | 1 | 3 | 2 |
| 육아휴직 사용자수(전체) | 1 | 3 | 3 |
| 육아휴직 사용률(남) | 0% | 0% | 100% |
| 육아휴직 사용률(여) | 100% | 100% | 100% |
| 육아휴직 사용률(전체) | 33.3% | 100% | 100% |
| 육아휴직 복귀 후 12개월 이상 근속자(여) | 0 | 1 | 1 |
| 육아휴직 복귀 후 12개월 이상 근속자(남) | 0 | 1 | 0 |
| 육아휴직 복귀 후 12개월 이상 근속자(전체) | 0 | 2 | 1 |
| 육아기 단축근무제 사용자 수 | 0 | 1 | 1 |
| 배우자 출산휴가 사용자 수 | 1 | 1 | 1 |
2) 유연근무제도 사용 현황
| (단위 : 명) |
| 구분 | 2025년1분기 | 2024년 | 2023년 |
| 유연근무제 활용 여부 | 미도입 | 미도입 | 미도입 |
| 시차출퇴근제 사용자수 | 0 | 0 | 0 |
| 선택근무제 사용자수 | 0 | 0 | 0 |
| 원격근무제(재택근무포함)사용자수 | 0 | 0 | 0 |
라. 미등기임원 보수 현황
| (기준일 : | 2025.03.31 | ) | (단위 : 천원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 8 | 242,806 | 30,351 | - |
주)연간급여 총액 및 1인평균 급여액은 1분기 까지의 급여액 입니다.
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
가. 주주총회 승인금액
| (단위 : 천원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 등기이사 | 7 | 1,000,000 | - |
| 등기감사 | 1 | 100,000 | - |
나. 보수지급금액
1) 이사ㆍ감사 전체
| (단위 : 천원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 8 | 79,597 | 9,950 | - |
주)보수총액 및 1인당 평균보수액은 1분기 까지의 금액 입니다.
2) 유형별
| (단위 : 천원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
7 | 76,097 | 10,871 | - |
| 사외이사 (감사위원회 위원 제외) |
- | - | - | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 3,500 | 3,500 | - |
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
3) 개인별 보수지급금액(해당 사항 없음)
| (단위 : 천원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
4). 개인별 보수지급금액(해당 사항 없음)
| (단위 : 천원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
다. 주식매수선택권의 부여 및 행사현황
<표1>
| (단위 : 천원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
- | - | - |
| 사외이사 (감사위원회 위원 제외) |
- | - | - |
| 감사위원회 위원 또는 감사 | - | - | - |
| 업무집행지시자 등 | - | - | - |
| 계 | - | - | - |
주) 주식매수선택권의 공정가치 산출방법은 III.재무에 관한 사항 ==>5.재무제표 주석 ==> 주석31. 주식기준보상을 참조하시기 바랍니다.
<표2>
| (기준일 : | 2025.03.31 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 김OO외19 | 직원 | 2018.10.18 | 신주발행 | 보통주 | 89,500 | - | - | - | 44,000 | 45,500 | 2020.10.18 ~ 2025.10.17 |
14,850 | X | - |
| 조00 | 미등기임원 | 2018.10.18 | 신주발행 | 보통주 | 7,500 | - | - | - | - | 7,500 | 2020.10.18 ~ 2025.10.17 |
14,850 | X | - |
| 변00외8명 | 미등기임원 | 2021.01.15 | 신주발행 | 보통주 | 48,500 | - | - | - | - | 48,500 | 2023.01.15~ 2028.01.14 |
9,950 | X | - |
| 김OO외19 | 직원 | 2021.01.15 | 신주발행 | 보통주 | 60,000 | - | - | - | 12,000 | 48,000 | 2023.01.15~ 2028.01.14 |
9,950 | X | - |
| 장00 | 미등기임원 | 2021.03.29 | 신주발행 | 보통주 | 7,000 | - | - | - | - | 7,000 | 2023.03.29~ 2028.03.28 |
9,950 | X | - |
| 계 | - | - | - | - | 212,500 | - | - | - | 56,000 | 156,500 | - | - | X | - |
주1) 주식매수선택권부여후 2년이내 퇴사한 직원의 주식매수선택권 56,000주에 대해 이사회결의로 취소 하였습니다.
주2) 공시서류 작성기준일인 2025년 3월 31일 종가는 4,630원 입니다.
IX. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (기준일 : | 2025.03.31 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| (주)휴온스글로벌 | 5 | 9 | 14 |
| ※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조 |
가. 계열회사 출자현황
(기준일:2025.3.31)
| 피출자회사 /출자회사 |
(주)팬젠 (129-86-42227) |
(주)휴온스 (863-87-00270) |
(주)휴메딕스 (204-81-76343) |
(주)휴엠앤씨 (137-81-46699) |
(주)휴온스 바이오파마 (181-86-02034) |
(주)휴온스 메디텍 (617-81-24930) |
(주)휴온스랩 (648-88-00926) |
HUONS USA, INC |
HUONS JAPAN |
(주)푸드어셈블 (877-86-01121) |
(주)휴온스 푸디언스 (305-81-82022) |
(주)휴온스 생명과학 (305-81-82022) |
휴엠앤씨 Vina |
| (주)휴온스글로벌 (129-81-07002) |
40.74% | 36.08% | 57.09% | 71.84% | 50.14% | 64.08% | 100% | 100% | 83.05% | ||||
| (주)휴온스 (863-87-00270) |
30.88% | 76.11% | 100% | ||||||||||
| (주)휴엠앤씨 (137-81-46699) |
100% |
※ 상기 지분율은 우선주를 제외한 보통주 기준입니다
나. 계열회사간 업무조정이나 이해관계를 조정하는 조직 : (주)휴온스글로벌
다. 회사와 계열회사간 임원의 겸직현황
| 성 명 | 회사명 | 직위 | 비고 |
| 윤성태 | (주)휴온스글로벌 | 대표이사 | 상근 |
| (주)휴온스 | 기타비상무이사 | 비상근 | |
| (주)휴메딕스 | 기타비상무이사 | 비상근 | |
| (주)휴엠앤씨 | 기타비상무이사 | 비상근 | |
| (주)휴온스바이오파마 | 기타비상무이사 | 비상근 | |
| (주)휴온스메디텍 | 기타비상무이사 | 비상근 | |
| (주)휴온스푸디언스 | 기타비상무이사 | 비상근 | |
| (주)휴온스랩 | 대표이사 | 상근 | |
| Huons USA, Inc. | 사내이사 | 비상근 | |
| Huons Japan Co., Ltd. | 사내이사 | 비상근 | |
| (주)휴온스생명과학 | 기타비상무이사 | 비상근 | |
| (주)팬젠 | 기타비상무이사 | 비상근 | |
| 송수영 | 주)휴온스글로벌 | 대표이사 | 상근 |
| (주)휴온스 | 대표이사 | 상근 | |
| Huons USA, Inc. | 사내이사 | 비상근 | |
| Huons Japan Co., Ltd. | 사내이사 | 비상근 | |
| (주)푸드어셈블 | 기타비상무이사 | 비상근 | |
| (주)휴온스생명과학 | 기타비상무이사 | 비상근 | |
| (주)팬젠 | 기타비상무이사 | 비상근 | |
| 윤인상 | (주)휴온스글로벌 | 사내이사 | 상근 |
| (주)휴온스 | 사내이사 | 비상근 | |
| (주)휴온스랩 | 기타비상무이사 | 비상근 | |
| Huons USA, Inc. | 사내이사 | 비상근 | |
| Huons Japan Co., Ltd. | 사내이사 | 비상근 | |
| (주)푸드어셈블 | 기타비상무이사 | 비상근 | |
| (주)휴온스생명과학 | 기타비상무이사 | 비상근 | |
| (주)팬젠 | 사내이사 | 비상근 |
2. 타법인출자 현황(해당사항 없음)
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | - | - | - | - | - | - |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | - | - | - | - | - | - |
| 계 | - | - | - | - | - | - | - |
| ※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조 |
X. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여등
본 보고서 작성기준일 현재 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
본 보고서 작성기준일 현재 해당사항이 없습니다.
3. 대주주와의 영업거래
본 보고서 작성기준일 현재 해당사항이 없습니다.
4. 대주주이외의 이해관계자와의 거래
가. 매출등 거래내역
| (단위: 백만원) |
|
특수관계구분 |
거래상대방 |
제16기1분기 |
제15기 |
제14기 |
비 고 | |||
|---|---|---|---|---|---|---|---|---|
| 매출 | 이자 수익 |
매출 | 이자 수익 |
매출 | 이자 수익 |
|||
| 기타이해관계자 | DUOPHARMA SDN | 1,887 | - | 2,886 | - | 1,597 | - | 주1) |
| 기타이해관계자 | DB (PHILIPPINES) Inc. | 638 | - | 1,694 | - | 835 | - | 주1) |
| 기타이해관계자 | ㈜휴온스랩 | 224 | - | 5,796 | - | 2,280 | - | 주1) |
| 기타이해관계자 | (주)휴메딕스 | 32 | - | - | - | - | - | 주1) |
| 임직원 | 오OO 외 | - | 2 | - | 10 | - | 2 | 주2) |
주1) Duopharma SDN와 DB(Philippines)은 당사의 지분 6.25%를 소유하고 있는 Duopharma Biotech Berhad(말레이시아법인)의 자회사이며 (주)휴온스는 2021년 6월 12일 제3자 유상증자 참여 후 2024년 12월 31일 기준 당사의 지분 30.9%를 소유하고 있으며, (주)휴온스랩,(주)휴메딕스은 (주)휴온스의 최대주주인 (주)휴온스글로벌의 계열회사 입니다.
주2) 이자수익는 임직원 단기대여금에 대한 수입이자 인식액 이며, 당사는 "임직원 가계대출규정"에 따라 퇴직급여충당금 범위내에서 단기대여를 하였습니다.
나. 특수관계자와의 자금대여 거래내역
| (단위: 백만원) |
|
구 분 |
특수관계자명 |
제16기1분기 (2025년1분기) |
제15기 (2024년) |
제14기 (2023년) |
|||
|---|---|---|---|---|---|---|---|
| 대여 | 회수 | 대여 | 회수 | 대여 | 회수 | ||
| 임직원 | 오OO 외 | 13 | 150 | 250 | 113 | 113 | 63 |
상기 임직원과의 자금 대여거래는 단기대여금으로 당사는 '임직원대출규정'에 따라 퇴직급여충당금 범위 내에서 대여할 수 있습니다.
다. 채권 채무 내역
| (단위: 백만원) |
| 특수관계구분 | 회사명 (성명) |
제16기1분기 (2025년1분기) |
제15기 (2024년) |
제14기 (2023년) |
비고 | |||
| 채권 | 채무 | 채권 | 채무 | 채권 | 채무 | |||
| 기타이해관계자 | Duopharma SDN | 1,089 | 401 | - | 469 | - | ||
| 기타이해관계자 | DB(Philippines) | 641 | 1,389 | - | 313 | - | ||
| 기타이해관계자 | (주)휴온스랩 | 408 | 140 | 330 | 913 | 208 | 주1) | |
| 기타이해관계자 | (주)휴메딕스 | - | - | - | 16 | - | - | 주1) |
| 최대주주 | (주)휴온스 | 4 | 4 | - | - | - | - | 주1) |
| 임직원 | 오OO외3명 | 115 | - | 256 | - | 114 | - | 주2) |
주1) 상기 채권,채무에는 매출채권 이외에 계약자산,계약부채 금액이 포함 되어 있습니다.
주2) 상기 채권은 임직원에 대한 단기대여금으로 회사의 "임직원가계대출규정"에 따라 퇴직급여충당금 범위내에서 대여를 진행하며 대여이자율은 국세청 인정이자율을 적용하고 있으며 대여금 및 미수이자가 포함되어 있습니다.
XI. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
| 단위: 천원,$) |
| 신고일자 | 계약내역 | 계약금액 | 판매금액 | 대금수령금액 | ||
| 당기 | 누계 | 당기 | 누적 | |||
| 23.06.27 | 1.계약내용 :연구용역 2.계약상대방:질병관리청 국립보건연구원 3.계약기간:23.06.26~25.04.30 4.주요계약조건:중증열성혈소판감소증후군(SFTS)치료 후보물질 확보를 위한 전임상 시료 생산 및 평가 |
1,090,909 | 7,857 | 1,088,866 | 545,454 | 1,090,909 |
| 23.07.31 | 1.계약내용 :원료의약품 공급 2.계약상대방:DB Philippines Inc. 3.계약기간:23.07.27 ~ 24.10.31 4.주요계약조건:원료의약품 공급 |
1,597,009 ($1,205,856) |
- - |
1,597,009 ($1,205,856) |
544,543 ($408,416.94) |
1,597,009 ($1,205,856) |
- 계약금액 , 판매금액, 대금수령금액은 부가세 제외 금액입니다.
- 외화 계약금액,판매금액,대금수령금액은 수출일의 환율을 적용하였습니다.
2. 우발부채 등에 관한 사항
가. 중요한 소송사건 등 : 보고서 작성기준일 현재 해당사항이 없습니다.
나. 견질 또는 담보용 어음,수표 현황 : 보고서 작성기준일 현재 해당사항이 없습
니다.
다. 채무보증 현황 : 보고서 작성기준일 현재 해당사항이 없습니다.
라. 그 밖의 우발채무 등 : 그 밖의 우발 채무 등은 Ⅲ. 재무에관한 사항, 5.재무제표 주석 22.지급보증 및 담보자산, 주석 23. 우발사항 및 약정사항을 참조 하세요.
약정사항
당반기말 현재 금융기관 약정사항은 다음과 같습니다.
| 금융기관 | 약정종류 | 약정금액 | 실행금액 |
| 기업은행 | 무역금융한도대출 | 20억원 | 0 |
한편, 당사는 당분기말 현재 서울보증보험㈜으로부터 16,600천원의 가스료 납부 이행보증을 제공받고 있으며, 매출계약에 대한 60,000천원의 계약보증과 514,473천원의 선금 반환 보증을 제공받고 있습니다.
담보제공 사항
당반기말 무역금융한도대출 약정과 관련하여 담보로 제공한 자산의 내용은 다음과 같습니다.
| 기준일 : 25.3.31 | (단위: 백만원) |
| 담보제공자산 | 담보설정일 | 장부금액 | 금융기관 | 약정금액 | 채권최고액 |
| 유형자산(토지) | 2022.10.05 | 854 | 기업은행 | 2,000 | 2,400 |
| 유형자산(건물) | 2022.10.05 | 2,376 |
견질 또는 담보용 어음ㆍ수표 현황 : 해당사항 없음
3. 제재 등과 관련된 사항
본 보고서 작성기준일 현재 해당사항이 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
2025년 05월 02일 이사회결의를 통하여 제3자 배정 유상증자를 결정 하였습니다. 발행하는 기명식 보통주식수는 596,000주이며, 주당 발행가는 4,979원, 총 유상증자 불입액은 2,967백만원 입니다. 제3자배정 유상증자 참여자는 (주)휴온스이며, 2025년 5월 12일 납입이 완료 되었고 상장 예정일은 2025년 05월 29일 입니다.
나. 중소기업 기준검토표
 |
|
중소기업확인서(2025년) |
다. 보호예수 현황
| (기준일 : | 2025.03.31 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 |
|---|---|---|---|---|---|---|
| 보통주 | 737,053 | 2024.04.22 | 2025.04.22 | 1년 | 사모발행 | 12,898,197 |
| 보통주 | 1,157,545 | 2024.11.29 | 2025.11.29 | 1년 | 사모발행 | 12,898,197 |
라. 매출액 미달에 대한 관리종목 지정유예 현황
(최근 사업연도 매출액 30억원 미만)
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|
| 사업연도 | 매출금액 | 해당여부 | 사유 | 종료시점 | |
| 2024년 | 14,673 | 미해당 | 미해당 | - | - |
마. 계속사업손실에 대한 관리종목 지정유예 현황
(자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속 사업손실 발생)
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원, %) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | ||||
|---|---|---|---|---|---|---|
| 사업연도 | 법인세 차감전 계속사업손익(A) |
자기자본금액 (B) |
비율(A/B) | 해당 여부 |
종료 시점 |
|
| 2022년 | -4,435 | 17,219 | -25.7 | 미해당 | 미해당 | - |
| 2023년 | -4,441 | 12,566 | -35.3 | |||
| 2024년 | 944 | 24,909 | 3.8 | |||
XII. 상세표
1. 연결대상 종속회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - |
2. 계열회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2025.03.31 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | 5 | (주)휴온스글로벌 | 110111-0400202 |
| (주)휴온스 | 131111-0446029 | ||
| (주)휴메딕스 | 110111-2727141 | ||
| (주)휴엠앤씨 | 120111-0290289 | ||
| (주)팬젠 | 131111-0248194 | ||
| 비상장 | 9 | (주)휴온스바이오파마 | 131111-0626704 |
| (주)휴온스메디텍 | 180111-0299817 | ||
| (주)휴온스랩 | 131411-0407489 | ||
| HUONS USA, INC. | - | ||
| Huons Japan Co., Ltd. | - | ||
| (주)푸드어셈블 | 180111-******* | ||
| (주)휴온스푸디언스 | 164211-0013489 | ||
| (주)휴온스생명과학 | 150111-0211651 | ||
| 휴엠앤씨 Vina | - |
3. 타법인출자 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2025.03.31 | ) | (단위 : 백만원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - | - | - | ||||
【 전문가의 확인 】
1. 전문가의 확인
본 보고서 작성기준일 현재 해당사항이 없습니다.
2. 전문가와의 이해관계
본 보고서 작성기준일 현재 해당사항이 없습니다.