 |
|
확인서 |
정 정 신 고 (보고)
| 2025년 04월 15일 |
| 1. 정정대상 공시서류 : | 증권신고서(지분증권) |
| 2. 정정대상 공시서류의 최초제출일 : | 2025년 03월 19일 |
| 3. 정정사항 |
* 정정사항 확인의 편의를 위하여 1차 정정사항은 파란색 글씨로, 2차 정정사항은 초록색 글씨로 정정하였습니다.
| 항 목 | 정정요구ㆍ명령 관련 여부 |
정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|---|
| ※ 금번 정정 증권신고서는 자진정정에 따른 기재내용 추가/수정사항을 반영하였으며, "굵은 초록색 글씨체"를 사용하여 구분 기재하였습니다. ※ 요약정보 및 제2부 내용은 증권신고서 본문의 정정사항을 반영하였으며, 정오표를 별도로 기재하지 않았습니다. ※ 단순 오타의 경우 별도의 색깔 구분 없이 정정하였습니다. |
||||
| 제1부. 모집 또는 매출에 관한 사항 | ||||
| I. 모집 또는 매출에 관한 일반사항 | ||||
| 공모 일정 | 아니오 | 자진정정 | (주1) 정정 전 | (주1) 정정 후 |
| III. 투자위험요소 | ||||
| 1.사업위험-다. | 아니오 | 자진정정 | (주2) 정정 전 | (주2) 정정 후 |
| 1.사업위험-라. | 아니오 | 자진정정 | (주3) 정정 전 | (주3) 정정 후 |
| 1.사업위험-마. | 아니오 | 자진정정 | (주4) 정정 전 | (주4) 정정 후 |
| 1.사업위험-바. | 아니오 | 자진정정 | (주5) 정정 전 | (주5) 정정 후 |
| 1.사업위험-사. | 아니오 | 자진정정 | (주6) 정정 전 | (주6) 정정 후 |
| 2.회사위험-가. | 아니오 | 자진정정 | (주7) 정정 전 | (주7) 정정 후 |
| 2.회사위험-라. | 아니오 | 자진정정 | (주8) 정정 전 | (주8) 정정 후 |
| 2.회사위험-마. | 아니오 | 자진정정 | (주9) 정정 전 | (주9) 정정 후 |
| 2.회사위험-사. | 아니오 | 자진정정 | (주10) 정정 전 | (주10) 정정 후 |
| IV. 인수인의 의견 | ||||
| 내용 본문 | 아니오 | 자진정정 | (주11) 정정 전 | (주11) 정정 후 |
| V. 자금의 사용목적 | ||||
| 내용 본문 | 아니오 | 자진정정 | (주12) 정정 전 | (주12) 정정 후 |
(주1) 정정 전
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 2025년 03월 18일 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6 제2항 제1호에 의거 엘에스증권(주), 한양증권(주)와 주주배정후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 8,400,000주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 : 원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 8,400,000 | 500 | 2,875 | 24,150,000,000 | 주주배정후실권주일반공모 |
| 주1) | 이사회 결의일 : 2025년 03월 18일 |
| 주2) | 1주의 모집가액 및 모집총액은 예정발행가액 기준입니다. |
(중략)
■ 공모일정 등에 관한 사항
당사는 2025년 03월 18일 이사회를 통해 유상증자를 결의하였으며, 세부 일정은 다음과 같습니다.
| [주요일정] |
| 날짜 | 업 무 내 용 | 비고 |
|---|---|---|
| 2025-03-18(화) | 이사회결의 | - |
| 2025-03-19(수) | 신주발행 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 2025-03-19(수) | 증권신고서 제출 | - |
| 2025-04-16(수) | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2025-04-18(금) | 권리락 | - |
| 2025-04-21(월) | 신주배정 기준일(주주확정) | - |
| 2025-05-08(목) | 신주배정 통지 | - |
| 2025-05-15(목) ~ 2025-05-21(수) |
신주인수권증서 상장 거래기간 | 5거래일 이상 거래 |
| 2025-05-22(목) | 신주인수권증서 상장 폐지 | 구주주 청약초일 5거래일 전 폐지 |
| 2025-05-29(목) | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2025-05-30(금) | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) 및 Dart전자공시시스템(http://dart.fss.or.kr) |
| 2025-06-03(화) ~ 2025-06-04(수) |
구주주 청약 및 초과청약 | - |
| 2025-06-05(목) | 일반공모 청약 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) |
| 2025-06-09(월) ~ 2025-06-10(화) |
일반공모 청약 | - |
| 2025-06-12(목) | 환불 및 배정 공고 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) |
| 2025-06-12(목) | 주금 납입 | - |
| 2025-06-25(수) | 신주유통 개시일 | - |
| 2025-06-25(수) | 신주상장 예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
2. 공모방법
| [공모방법 : 주주배정후 실권주 일반공모] |
| 모집대상 | 주식수 | 비 고 |
|---|---|---|
| 구주주 (신주인수권증서 보유자) 청약 |
8,400,000주 (100.0%) | - 구주 1주당 신주 배정비율 : 1주당 0.39804810주 - 신주배정 기준일 : 2025년 04월 21일 - 구주주 청약일 : 2025년 06월 03일 ~ 2025년 06월 04일 (2일간) - 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권증서가 배정됨) - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 청약 가능 |
| 초과 청약 | - | - 「자본시장과 금융투자업에 관한 법률」 제165조의6의 제2항 제2호에 의거 초과청약 - 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 - 초과 청약일 : 2025년 06월 03일 ~ 2025년 06월 04일 (2일간) |
| 일반공모 청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
- | - 구주주 및 초과청약 후 발생하는 단수주 및 실권주("일반공모 배정분")에 대해 배정. - 일반공모 청약일 : 2025년 06월 09일 ~ 2025년 06월 10일 (2일간) |
| 합 계 | 8,400,000주 (100.00%) | - |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.39804810주를 곱하여 산정된 배정주식수로 하되, 1주 미만은 절사합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 주식매수선택권의 권리행사, 자기주식수의 변동으로 인하여 1주당 배정주식수가 변동될 수 있습니다. |
| 주3) |
신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. (ii) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권증서의 수량 (iii) 초과청약 한도주식수 = 신주인수권증서 청약한도 주식수 X 초과청약 비율(20%) |
| 주4) |
"고위험고수익투자신탁등"이란 다음 각 호의 어느 하나에 해당하는 투자신탁 등을 말합니다. (1) 「조세특례제한법」 제91조의15 제1항에 따른 고위험고수익채권투자신탁(이하 "고위험고수익채권투자신탁"이라 함). 다만, 해당 투자신탁 등의 최초 설정일ㆍ설립일이 속하는 분기 또는 그 다음 분기 말일 전 배정하는 경우에는 같은 법 시행령 제93조 제1항 제1호 및 같은 조 제5항에도 불구하고 배정일 직전 영업일의 고위험고수익채권의 보유비율이 같은 법 시행령 제93조 제1항 제1호 각 목의 비율 이상이어야 합니다. (2) 법률 제19328호「조세특례제한법」의 시행일 이전의 제91조의15제1항에 따른 고위험고수익투자신탁(이하 "고위험고수익투자신탁"이라 함)으로서 최초 설정일ㆍ설립일이 2023년 12월 31일 이전인 것을 말합니다. 다만, 해당 투자신탁 등의 설정일ㆍ설립일부터 배정일까지의 기간이 6개월 미만일 경우에는 대통령령 제33499호 같은 법 시행령 시행일 이전의 제93조 제3항 제1호 및 같은 조 제7항에도 불구하고 배정일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다.. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 배정일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 배정일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35이상이어야 합니다. |
| 주6) |
일반공모 청약 : "구주주" 청약(초과청약 포함) 결과 발생한 미청약주식 및 단수주는 대표주관회사와 인수회사가 일반에게 공모하되「증권 인수업무 등에 관한 규정」 제9조 제2항 제6호에 따라 "고위험고수익투자신탁등"에 일반공모 배정분의 10%를 배정하고, "벤처기업투자신탁"에 일반공모 배정분의 25%를 배정합니다. 나머지 주식은 개인청약자 및 기관투자자에 구분없이 배정합니다. "고위험고수익투자신탁등"에 대한 일반공모 배정분 10%, "벤처기업투자신탁"에 대한 일반공모 배정분 25% 및 개인투자자 및 기관투자자에 대한 일반공모 배정분 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만 한 그룹만 청약미달이 발생할 경우 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. 일반공모에 관한 배정수량 계산시 대표주관회사와 인수회사의 청약물량(대표주관회사와 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미하며 대표주관회사와 인수회사에 대하여 개별적으로 산정한 청약주식수를 말한다)에 대해서는 대표주관회사와 인수회사의 총 청약물량(대표주관회사와 인수회사가 일반공모 방식으로 접수를 받은 청약물량의 합을 말한다)을 "일반공모 배정분" 주식수로 나눈 통합청약경쟁률에 따라 대표주관회사와 인수회사의 각 청약자에 배정하는 방식(이하 통합배정이라 한다)으로 합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사"가 합리적으로 판단하여 배정합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정합니다. 배정결과 발생하는 잔여주식은 "대표주관회사"와 "인수회사"가 각 인수의무비율대로 자기계산으로 잔액인수하기로 합니다. |
| 주7) | 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다. |
| 주8) |
자본시장법 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2025년 03월 19일부터 2025년 05월 29일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
(중략)
3. 공모가격 결정방법
(중략)
라. 최종 발행가액은 구주주 청약초일 전 제3거래일(2025년 05월 29일(목) 예정)에 결정되어 금융감독원 전자공시시스템에 2025년 05월 30일(금)에 공시될 예정이며, 회사의 인터넷 홈페이지(http://www.cellid.co.kr)에 공고하여 개별통지에 갈음할 예정입니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 8,400,000 | |||||||||||||||||||||||||||||||||||
| 주당 모집가액 | 예정가액 | 2,875 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 모집총액 | 예정가액 | 24,150,000,000 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
(1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수로 합니다. 다만, 신주배정기준일 현재 신주배정율은 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 변경될 수 있습니다(단, 1주 미만은 절사한다).
|
|||||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 | 개시일 | 2025년 06월 03일 | |||||||||||||||||||||||||||||||||
| 종료일 | 2025년 06월 04일 | |||||||||||||||||||||||||||||||||||
| 실권주 일반공모 | 개시일 | 2025년 06월 09일 | ||||||||||||||||||||||||||||||||||
| 종료일 | 2025년 06월 10일 | |||||||||||||||||||||||||||||||||||
| 청약 증거금 |
구주주 | 청약금액의 100% | ||||||||||||||||||||||||||||||||||
| 초 과 청 약 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 납 입 기 일 | 2025년 06월 12일 | |||||||||||||||||||||||||||||||||||
| 배당기산일(결산일) | 2025년 01월 01일 | |||||||||||||||||||||||||||||||||||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
|---|---|---|
| 신주 발행 및 배정기준일(주주확정일) 공고 |
2025년 03월 19일 | 회사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 모집가액 확정의 공고 | 2025년 05월 30일 | 회사 인터넷 홈페이지 (http://www.cellid.co.kr) 전자공시시스템(http://dart.fss.or.kr) |
| 실권주 일반공모 청약공고 | 2025년 06월 05일 | 회사 인터넷 홈페이지 (http://www.cellid.co.kr) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) |
| 실권주 일반공모 배정공고 | 2025년 06월 12일 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) |
| 주1) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
| 주2) | 모집가액은 2025년 5월 29일을 기준으로 확정되며, 다음 영업일인 2025년 5월 30일까지 공고할 예정입니다. |
| 주3) | 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 및 인수회사 홈페이지에 게시함으로써 개별통지에 갈음합니다. |
| 주4) | 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 일간 매일경제신문에 게재할 예정입니다. |
2) 청약방법
(중략)
바) 「자본시장법과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 의거, 2025년 03월 18일부터 2025년 05월 29일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집(매출)가액 의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항에 해당할 경우에는 공매도하거나 공매도 주문을 위탁하더라도 금번 모집(매출)에 따른 주식을 취득할 수 있으며, 세부적인 동법 시행령 제208조의4제2항의 내용은 하기와 같습니다.
(중략)
3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
엘에스증권(주) 본ㆍ지점 | 2025년 06월 03일~ 2025년 06월 04일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 당사 주식을 예탁하고 있는 당해 증권회사 본ㆍ지점 2) 엘에스증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
1) 엘에스증권(주) 본ㆍ지점 2) 한양증권(주) 본ㆍ지점 |
2025년 06월 09일~ 2025년 06월 10일 |
|
4) 청약결과 배정방법
가) 구주주(신주인수권증서 보유자) 청약 : 신주배정기준일(2025년 04월 21일 예정) 18시 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 본 주식을 1주당 0.39804810주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 신주배정기준일 이후 신주인수권증서의 매매를 통해 신주인수권증서를 보유한 자는 보유한 신주인수권증서 수량을 한도로 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
(중략)
6) 주권유통에 관한 사항
주권유통개시(예정)일: 2025년 06월 25일(신주 상장예정) (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2025년 06월 12일부터 해당 청약사무 취급처에서 환불합니다.
8) 주금납입장소 : 신한은행 서울대학교지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2025년 04월 21일 | 엘에스증권(주) | 00330424 |
| 한양증권(주) | 00162416 | |
(중략)
5) 당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2025년 05월 15일부터 2025년 05월 21일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2025년 05월 22일에 상장폐지될 예정입니다. 「코스닥시장 상장규정」 제16조 3(신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제44조의3 "신주인수권증서의 상장폐지기준"에 따라 신주청약 개시일 5거래일전에 상장폐지되어야 함)
6) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래 관련 사항은 다음과 같습니다.
가) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
나) 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2025년 05월 15일부터 2025년 05월 21일까지(5거래일간) 거래 | 신주배정통지일(2025년 05월 08일(예정))부터 2025년 05월 23일(신주인수권증서 상장폐지일의 익영업일)까지 거래 |
(1) 상장거래 : 2025년 05월 15일부터 2025년 05월 21일(5영업일간) 거래 가능합니다.
(2) 계좌대체거래 : 신주배정통지일인 2025년 05월 08일(예정)부터 2025년 05월 23일까지 거래 가능 합니다.
* 신주인수권증서의 계좌대체(장외거래)는 신주인수권증서 상장거래의 최종 결제일인 2025년 05월 23일까지 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다.
(3) 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다.
(후략)
(주1) 정정 후
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 2025년 03월 18일 이사회 결의, 2025년 04월 15일 정정 이사회 결의(일정 변경)를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6 제2항 제1호에 의거 엘에스증권(주), 한양증권(주)와 주주배정후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 8,400,000주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 : 원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 8,400,000 | 500 | 2,875 | 24,150,000,000 | 주주배정후실권주일반공모 |
| 주1) | 이사회 결의일 : 2025년 03월 18일, 이사회결의일 : 2025년 04월 15일(일정 변경) |
| 주2) | 1주의 모집가액 및 모집총액은 예정발행가액 기준입니다. |
(중략)
■ 공모일정 등에 관한 사항
당사는 2025년 03월 18일 이사회를 통해 유상증자를 결의하였으며, 2025년 04월 15일 이사회를 통해 일정을 변경하였습니다. 세부 일정은 다음과 같습니다.
| [주요일정] |
| 날짜 | 업 무 내 용 | 비고 |
|---|---|---|
| 2025-03-18(화) | 이사회결의 | - |
| 2025-03-19(수) | 신주발행 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 2025-03-19(수) | 증권신고서 제출 | - |
| 2025-04-15(화) | (정정) 이사회결의 | 일정 변경 |
| 2025-04-15(화) | (정정) 증권신고서 제출 | 일정 변경 및 기재내용 자진 정정 |
| 2025-04-15(화) | (정정) 신주발행 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 2025-04-30(수) | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2025-05-07(수) | 권리락 | - |
| 2025-05-08(목) | 신주배정 기준일(주주확정) | - |
| 2025-05-21(수) | 신주배정 통지 | - |
| 2025-05-28(수) ~ 2025-06-04(수) |
신주인수권증서 상장 거래기간 | 5거래일 이상 거래 |
| 2025-06-05(목) | 신주인수권증서 상장 폐지 | 구주주 청약초일 5거래일 전 폐지 |
| 2025-06-11(수) | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2025-06-12(목) | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) 및 Dart전자공시시스템(http://dart.fss.or.kr) |
| 2025-06-16(월) ~ 2025-06-17(화) |
구주주 청약 및 초과청약 | - |
| 2025-06-18(수) | 일반공모 청약 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) |
| 2025-06-19(목) ~ 2025-06-20(금) |
일반공모 청약 | - |
| 2025-06-24(화) | 환불 및 배정 공고 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) |
| 2025-06-24(화) | 주금 납입 | - |
| 2025-07-07(월) | 신주유통 개시일 | - |
| 2025-07-07(월) | 신주상장 예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
2. 공모방법
| [공모방법 : 주주배정후 실권주 일반공모] |
| 모집대상 | 주식수 | 비 고 |
|---|---|---|
| 구주주 (신주인수권증서 보유자) 청약 |
8,400,000주 (100.0%) | - 구주 1주당 신주 배정비율 : 1주당 0.39804810주 - 신주배정 기준일 : 2025년 05월 08일 - 구주주 청약일 : 2025년 06월 16일 ~ 2025년 06월 17일 (2일간) - 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권증서가 배정됨) - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 청약 가능 |
| 초과 청약 | - | - 「자본시장과 금융투자업에 관한 법률」 제165조의6의 제2항 제2호에 의거 초과청약 - 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 - 초과 청약일 : 2025년 06월 16일 ~ 2025년 06월 17일 (2일간) |
| 일반공모 청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
- | - 구주주 및 초과청약 후 발생하는 단수주 및 실권주("일반공모 배정분")에 대해 배정. - 일반공모 청약일 : 2025년 06월 19일 ~ 2025년 06월 20일 (2일간) |
| 합 계 | 8,400,000주 (100.00%) | - |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.39804810주를 곱하여 산정된 배정주식수로 하되, 1주 미만은 절사합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 주식매수선택권의 권리행사, 자기주식수의 변동으로 인하여 1주당 배정주식수가 변동될 수 있습니다. |
| 주3) |
신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. (ii) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권증서의 수량 (iii) 초과청약 한도주식수 = 신주인수권증서 청약한도 주식수 X 초과청약 비율(20%) |
| 주4) |
"고위험고수익투자신탁등"이란 다음 각 호의 어느 하나에 해당하는 투자신탁 등을 말합니다. (1) 「조세특례제한법」 제91조의15 제1항에 따른 고위험고수익채권투자신탁(이하 "고위험고수익채권투자신탁"이라 함). 다만, 해당 투자신탁 등의 최초 설정일ㆍ설립일이 속하는 분기 또는 그 다음 분기 말일 전 배정하는 경우에는 같은 법 시행령 제93조 제1항 제1호 및 같은 조 제5항에도 불구하고 배정일 직전 영업일의 고위험고수익채권의 보유비율이 같은 법 시행령 제93조 제1항 제1호 각 목의 비율 이상이어야 합니다. (2) 법률 제19328호「조세특례제한법」의 시행일 이전의 제91조의15제1항에 따른 고위험고수익투자신탁(이하 "고위험고수익투자신탁"이라 함)으로서 최초 설정일ㆍ설립일이 2023년 12월 31일 이전인 것을 말합니다. 다만, 해당 투자신탁 등의 설정일ㆍ설립일부터 배정일까지의 기간이 6개월 미만일 경우에는 대통령령 제33499호 같은 법 시행령 시행일 이전의 제93조 제3항 제1호 및 같은 조 제7항에도 불구하고 배정일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다.. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 배정일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 배정일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35이상이어야 합니다. |
| 주6) |
일반공모 청약 : "구주주" 청약(초과청약 포함) 결과 발생한 미청약주식 및 단수주는 대표주관회사와 인수회사가 일반에게 공모하되「증권 인수업무 등에 관한 규정」 제9조 제2항 제6호에 따라 "고위험고수익투자신탁등"에 일반공모 배정분의 10%를 배정하고, "벤처기업투자신탁"에 일반공모 배정분의 25%를 배정합니다. 나머지 주식은 개인청약자 및 기관투자자에 구분없이 배정합니다. "고위험고수익투자신탁등"에 대한 일반공모 배정분 10%, "벤처기업투자신탁"에 대한 일반공모 배정분 25% 및 개인투자자 및 기관투자자에 대한 일반공모 배정분 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만 한 그룹만 청약미달이 발생할 경우 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. 일반공모에 관한 배정수량 계산시 대표주관회사와 인수회사의 청약물량(대표주관회사와 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미하며 대표주관회사와 인수회사에 대하여 개별적으로 산정한 청약주식수를 말한다)에 대해서는 대표주관회사와 인수회사의 총 청약물량(대표주관회사와 인수회사가 일반공모 방식으로 접수를 받은 청약물량의 합을 말한다)을 "일반공모 배정분" 주식수로 나눈 통합청약경쟁률에 따라 대표주관회사와 인수회사의 각 청약자에 배정하는 방식(이하 통합배정이라 한다)으로 합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사"가 합리적으로 판단하여 배정합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정합니다. 배정결과 발생하는 잔여주식은 "대표주관회사"와 "인수회사"가 각 인수의무비율대로 자기계산으로 잔액인수하기로 합니다. |
| 주7) | 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다. |
| 주8) |
자본시장법 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2025년 03월 19일부터 2025년 06월 11일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
(중략)
3. 공모가격 결정방법
(중략)
라. 최종 발행가액은 구주주 청약초일 전 제3거래일(2025년 06월 11일(수) 예정)에 결정되어 금융감독원 전자공시시스템에 2025년 06월 12일(목)에 공시될 예정이며, 회사의 인터넷 홈페이지(http://www.cellid.co.kr)에 공고하여 개별통지에 갈음할 예정입니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 8,400,000 | |||||||||||||||||||||||||||||||||||
| 주당 모집가액 | 예정가액 | 2,875 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 모집총액 | 예정가액 | 24,150,000,000 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
(1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수로 합니다. 다만, 신주배정기준일 현재 신주배정율은 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 변경될 수 있습니다(단, 1주 미만은 절사한다).
|
|||||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 | 개시일 | 2025년 06월 16일 | |||||||||||||||||||||||||||||||||
| 종료일 | 2025년 06월 17일 | |||||||||||||||||||||||||||||||||||
| 실권주 일반공모 | 개시일 | 2025년 06월 19일 | ||||||||||||||||||||||||||||||||||
| 종료일 | 2025년 06월 20일 | |||||||||||||||||||||||||||||||||||
| 청약 증거금 |
구주주 | 청약금액의 100% | ||||||||||||||||||||||||||||||||||
| 초 과 청 약 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 납 입 기 일 | 2025년 06월 24일 | |||||||||||||||||||||||||||||||||||
| 배당기산일(결산일) | 2025년 01월 01일 | |||||||||||||||||||||||||||||||||||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
|---|---|---|
| 신주 발행 및 배정기준일(주주확정일) 공고 |
2025년 03월 19일, 2025년 04월 15일 |
회사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 모집가액 확정의 공고 | 2025년 06월 12일 | 회사 인터넷 홈페이지 (http://www.cellid.co.kr) 전자공시시스템(http://dart.fss.or.kr) |
| 실권주 일반공모 청약공고 | 2025년 06월 18일 | 회사 인터넷 홈페이지 (http://www.cellid.co.kr) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) |
| 실권주 일반공모 배정공고 | 2025년 06월 24일 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) |
| 주1) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
| 주2) | 모집가액은 2025년 6월 11일을 기준으로 확정되며, 다음 영업일인 2025년 6월 12일까지 공고할 예정입니다. |
| 주3) | 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 및 인수회사 홈페이지에 게시함으로써 개별통지에 갈음합니다. |
| 주4) | 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 일간 매일경제신문에 게재할 예정입니다. |
2) 청약방법
(중략)
바) 「자본시장법과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 의거, 2025년 03월 18일부터 2025년 06월 11일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집(매출)가액 의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항에 해당할 경우에는 공매도하거나 공매도 주문을 위탁하더라도 금번 모집(매출)에 따른 주식을 취득할 수 있으며, 세부적인 동법 시행령 제208조의4제2항의 내용은 하기와 같습니다.
(중략)
3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
엘에스증권(주) 본ㆍ지점 | 2025년 06월 16일~ 2025년 06월 17일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 당사 주식을 예탁하고 있는 당해 증권회사 본ㆍ지점 2) 엘에스증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
1) 엘에스증권(주) 본ㆍ지점 2) 한양증권(주) 본ㆍ지점 |
2025년 06월 19일~ 2025년 06월 20일 |
|
4) 청약결과 배정방법
가) 구주주(신주인수권증서 보유자) 청약 : 신주배정기준일(2025년 05월 08일 예정) 18시 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 본 주식을 1주당 0.39804810주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 신주배정기준일 이후 신주인수권증서의 매매를 통해 신주인수권증서를 보유한 자는 보유한 신주인수권증서 수량을 한도로 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
(중략)
6) 주권유통에 관한 사항
주권유통개시(예정)일: 2025년 07월 07일(신주 상장예정) (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2025년 06월 24일부터 해당 청약사무 취급처에서 환불합니다.
8) 주금납입장소 : 신한은행 서울대학교지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2025년 05월 08일 | 엘에스증권(주) | 00330424 |
| 한양증권(주) | 00162416 | |
(중략)
5) 당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2025년 05월 28일부터 2025년 06월 04일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2025년 06월 05일에 상장폐지될 예정입니다. 「코스닥시장 상장규정」 제16조 3(신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제44조의3 "신주인수권증서의 상장폐지기준"에 따라 신주청약 개시일 5거래일전에 상장폐지되어야 함)
6) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래 관련 사항은 다음과 같습니다.
가) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
나) 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2025년 05월 28일부터 2025년 06월 04일까지(5거래일간) 거래 | 신주배정통지일(2025년 05월 21일(예정))부터 2025년 06월 09일(신주인수권증서 상장폐지일의 익영업일)까지 거래 |
(1) 상장거래 : 2025년 05월 28일부터 2025년 06월 04일(5영업일간) 거래 가능합니다.
(2) 계좌대체거래 : 신주배정통지일인 2025년 05월 21일(예정)부터 2025년 06월 09일까지 거래 가능 합니다.
* 신주인수권증서의 계좌대체(장외거래)는 신주인수권증서 상장거래의 최종 결제일인 2025년 06월 09일까지 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다.
(3) 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다.
(후략)
(주2) 정정 전
|
[다. 코로나19 백신 경쟁 심화 위험] |
(중략)
오미크론 변이주를 타깃으로 한 코로나19 백신의 유망성은 변이주의 높은 전파력과 기존 백신의 효과 감소 문제를 해결할 수 있는 기술적 발전, 지속적인 수요 예측, 그리고 글로벌 보건 정책 변화에 기인합니다.
(중략)
또한, 코로나19가 전세계적으로 창궐한지 5년이 지난 현재, 전세계적으로 약 178개의 후보물질이 임상중에 있으며, 경쟁강도는 점차 심화되고 있습니다. 국내의 경우 당사만이 오미크론 변이 특화백신을 개발하고 있으나, 이미 모더나, 화이자 등의 개발사는 오미크론 변이 2가 백신을 공급하고 있으며, 추후 다른 경쟁사 역시 오미크론 변이 특화 백신을 개발할 가능성도 존재합니다. 이처럼 타 백신 개발사의 경쟁 백신이 개발될 경우 당사의 코로나19 백신 개발 등에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주2) 정정 후
|
[다. 코로나19 백신 경쟁 심화 위험] |
(중략)
현재 코로나19 백신은 매년 WHO(세계보건기구) 또는 FDA(미국 식품의약국)에서 권고하는 변이주에 대응하도록 업데이트되고 있습니다. 오미크론 BA.1 변이 기반의 AdCLD-CoV-19-1 OMI 백신 품목허가 후, 이를 기반으로 유행 중인 오미크론 하위 변이에 맞춰 항원을 교체하여 시장에 대응할 계획입니다. 당사는 현재 유행중인 XEC, LP.8.1 변이를 포함하여 73종의 변종백신(백신 라이브러리)을 지속적으로 구축하고 있습니다. 평균 월 1개의 신규 변이주에 대응하는 백신을 제조하고 평가하여 앞으로 사용될 백신에 대한 준비를 하고 있습니다. 특히, 당사의 플랫폼은 현재 유행 중인 JN.1 계열 변이와 그 하위 변이에 대해 강력한 면역 반응을 유도하는 백신을 개발하고 있으며, 이는 기존 XBB.1.5 백신보다 더 강력한 중화항체 반응을 보이고 있습니다. 하지만 이러한 반응은 언제까지나 현재 변이바이러스에 대한 면역 반응이며, 당사의 플랫폼을 통해 매년 백신을 업데이트하여 변이에 대응 가능한 백신을 개발 및 생산한다고 해도, 예상하지 못한 변이바이러스의 발현으로 인해 당사의 백신 플랫폼으로 대응할 수 없고, 이로 인해 당사의 경쟁력이 크게 하락할 수 있습니다.
오미크론 변이주를 타깃으로 한 코로나19 백신의 유망성은 변이주의 높은 전파력과 기존 백신의 효과 감소 문제를 해결할 수 있는 기술적 발전, 지속적인 수요 예측, 그리고 글로벌 보건 정책 변화에 기인합니다.
(중략)
WHO의 Global Vaccine Market Report 2023 Update 및 2024 자료에 따르면빅파마(Big Pharma)들의 코로나19 백신 시장 점유율은 다음과 같습니다
1. 글로벌 시장 점유율
화이자-바이오엔텍(Pfizer-BioNTech)은 2023년 기준 전체 시장 가치의 약 26%를 차지하며, 가장 높은 점유율을 기록했습니다. 이는 mRNA 기반 백신인 코미나티주(Comirnaty)의 성공 덕분입니다. 모더나(Moderna)는 약 7~15%의 점유율을 보이며, mRNA 기술을 활용한 백신 개발로 주목받았습니다. 존슨앤존슨(J&J)은 바이러스 벡터 기반 백신으로 약 2~3%의 시장 점유율을 기록하였으며, 아스트라제네카(AZ)는 약 2~4%의 점유율을 보이며, 특히 개발도상국에서 널리 사용되었습니다. 이 외에 중국 제조사들은 초기에는 높은 점유율을 보였으나, 최근 몇 년간 매출 감소로 인해 점유율이 축소되었습니다. 현재 시노팜(CNBG-Sinopharm)은 약 3%, 시노백(Sinovac)은 더 낮은 비중을 차지하고 있는 것으로 파악됩니다.
2. 아시아 시장 점유율
화이자-바이오엔텍(Pfizer-BioNTech)은 아시아 시장에서도 mRNA 백신 코미나티주(Comirnaty)를 통해 강력한 입지를 확보했습니다. 특히 일본, 한국, 싱가포르 등 선진국에서 높은 접종률을 기록했습니다. 모더나(Moderna)는 스파이크(Spikevax) 백신으로 글로벌 시장에서 두각을 나타냈으며, 아시아에서도 화이자(Pfizer)와 함께 mRNA 백신의 주요 공급자로 자리 잡았습니다. 일본과 한국 등에서 높은 수요를 보였습니다. 아스트라제네카(AZ) 바이러스 벡터 기반 백신 백스제브리아(Vaxzevria)는 초기 팬데믹 동안 동남아시아와 인도에서 널리 사용되었습니다. 특히 가격 경쟁력과 유통 용이성 덕분에 개발도상국에서 높은 점유율을 기록했습니다. 존슨앤존슨(J&J)은 단일 접종 백신으로 주목받았으나, 아시아 시장에서는 상대적으로 낮은 점유율을 보였습니다. 시노백(Sinovac) 및 시노팜(Sinopharm) 등 중국 기업들은 초기 팬데믹 동안 아시아 개발도상국에서 주요 공급자로 활약했으나, 최근에는 mRNA 백신에 밀려 점유율이 감소했습니다. 시노백(Sinovac)의 코로나백(CoronaVac)은 동남아시아와 중국 내에서 여전히 사용되고 있습니다13.
3. 지역별 특징
중국은 시노백(Sinovac) 및 시노팜(Sinopharm)이 주도하며, 자국 내 수요와 함께 동남아시아로의 수출이 많았습니다. 인도의 경우, 인도 최대 백신생산기업인 세럼인스티튜트 오브 인디아(Serum Institute of India(SII))는 아스트라제네카(AstraZeneca)와 협력해 대규모 생산을 담당하며, 아시아 및 글로벌 백신 공급망에서 중요한 역할을 했습니다. 일본 및 한국에서는 화이자(Pfizer)와 모더나(Moderna)가 주로 사용되며, 고소득 국가로서 mRNA 백신의 주요 시장입니다.
4. 저소득국가 특징
데이터가 마지막으로 집계된 2023년 기준 백신 접종률은 필리핀은 72.55% (2023년 5월 19일 기준), 베트남은 90.79% (2023년 06월 30일 기준)로 높은 수준을 보입니다. 동남아시아 중저소득국가는 코로나19 백신 접종 초기 단계에서 COVAX, GAVI 등 국제 백신 지원 프로그램을 통해 대규모 물량을 조달한 바 있습니다. 예를 들어, 2022년 1월 기준, 베트남은 2억 600만회분의 백신 중 아스트라제네카(AZ)가 6,000만도스, 화이자 및 모더나 8,800만도스, 시노팜 5,100만도스, 쿠바 압달라(Abdala) 500만도스, 스푸트니크V 150만도스 등을 들여왔습니다. 이 가운데 국가예산으로 구매한 백신은 1억 300만회분이고 나머지는 코백스(Covax)와 한·미·일·중·유럽·호주 등 다른 나라 및 기업들의 무상지원분입니다. 또한 2021년 11월 기준, 필리핀은 그동안 시노백 5050만회분, 아스트라제네카 1,610만회분, 화이자 3,210만회분, 존슨앤드존슨(얀센) 320만회분, 모더나 1,000만회분, 스푸트니크V 720만회분, 시노팜 110만회분을 들여온 바 있습니다. 하지만 COVAX 및 Gavi의 백신 무상 지원 프로그램이 종료되면서, 중저소득국가(LMICs)를 중심으로 저렴하고 안정적인 백신 공급에 대한 수요는 계속될 것으로 예상됩니다.
빅파마들은 아시아 지역에서 중국 기업들과의 경쟁이 심화되었으며, 가격 경쟁력과 유통망 구축이 중요한 요인으로 작용했습니다. 엔데믹 전환 이후 부스터 샷 수요 감소로 인해 전체 시장 규모가 축소되고 있으며, 이는 빅파마들의 점유율에도 영향을 미치고 있습니다. 결론적으로, 화이자-바이오엔텍(Pfizer-BioNTech)와 모더나(Moderna)가 아시아 선진국 중심으로 강세를 보였고, 아스트라제네카(AstraZeneca)와 중국 기업들이 개발도상국에서 중요한 역할을 했습니다.
당사의 백신은 Ad5/35 기반 저비용 생산, 상대적으로 유리한 보관 온도 요건(2~8℃)을 기반으로 중저소득국(LMICs)에서 가격 경쟁력과 공급 유연성 측면에서 유리하다고 판단됩니다. 코로나19 팬데믹 기간 동안 백신 플랫폼의 선택은 국가의 소득 수준과 조달 여건에 따라 큰 차이를 보였습니다. 고소득 국가(HICs)의 경우, 화이자(Pfizer), 모더나(Moderna) 등 mRNA 플랫폼 백신을 중심으로 조기 확보 및 접종이 이루어진 반면, 중저소득 국가(LMICs)는 시노백, 시노팜(불활화 백신), 아스트라제네카(바이럴 벡터 백신) 등 다양한 플랫폼 백신을 사용하였습니다. 이는 가격, 보관 조건, 공급 시기 등의 제약 요인 때문이며, 특히 저온 유통 인프라가 부족한 지역에서는 2~8℃ 보관이 가능한 백신이 선호되었습니다. 따라서, mRNA 백신이 접종을 주도한 고소득국과 달리, COVAX, Gavi 등의 지원을 통해 다양한 플랫폼 백신을 활용한 중저소득국의 백신 전략은 상대적으로 유연하면서도 현실적인 선택이었습니다. 이러한 배경은 당사의 Ad5/35 백신이 LMIC 시장에서 가격·공급 측면의 경쟁력을 가질 수 있는 근거로 볼 수 있습니다. 하지만 이는 언제까지나 당사 백신의 안전성 및 유효성이 입증되어야 추후 가능성이 존재하는 상황이며, 임상 3상 결과에 따라 조건부 품목허가 또는 정식 품목허가가 모두 승인이 나지 않을 가능성도 존재합니다.
따라서 당사의 아데노바이러스 백터 기반의 오미크론 변이 백신은 화이자 및 모더나처럼 mRNA 기반이 아닌 아스트라제네카와 같은 벡터 기반이기 때문에 상대적으로 부유하지 않은 개발도상국 등에서 경쟁력이 있을 것으로 판단됩니다. 특히, 아스트라제네카의 바이러스 백터 기반의 백신인 백스제브리아는 저렴한 가격과 유통 및 보관의 용이성을 경쟁력으로 동남아시아 등 개발도상국에서 높은 점유율을 차지한 것처럼, 당사도 고소득의 선진국보다는 상대적으로 가격 경쟁력이 더 발휘될 수 있는 개발도상국을 목표 시장으로 잡아야할 것으로 보입니다. 하지만 현재 당사는 해외 진출보다는 국내 정부 주도의 관급 시장에 진입하는 것을 목표로 하고 있으며, 국내 관급 시장에 진출이 불발될 가능성과 국내 관급 시장에 진입하더라도 해외 시장에 진출하지 못할 가능성 모두 존재하는 상황입니다.
또한, 코로나19가 전세계적으로 창궐한지 5년이 지난 현재, 전세계적으로 약 178개의 후보물질이 임상중에 있으며, 경쟁강도는 점차 심화되고 있습니다. 국내의 경우 당사만이 오미크론 변이 특화백신을 개발하고 있으나, 이미 모더나, 화이자 등의 개발사는 오미크론 변이 2가 백신을 공급하고 있으며, 추후 다른 경쟁사 역시 오미크론 변이 특화 백신을 개발할 가능성도 존재합니다. 이처럼 타 백신 개발사의 경쟁 백신이 개발될 경우 당사의 코로나19 백신 개발 등에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주3) 정정 전
| [라. 코로나19 바이러스 종식 가능성에 따른 위험] 정부는 2023년 03월 29일 중 중증화율,치명률 감소 등 질병 위험 하락과 기구축된 대응 역량을 감안하여 위기상황에서 벗어나 일상적 관리체계로의 전환 추진하기로 결정하였으며, 이후 사항들은 더욱 완화되어 2023년 06월 01일부터 시행되었습니다. 또한, 세계보건기구(WHO)는 코로나19 국제공중보건위기상황 해제를 발표하였습니다. 이처럼 코로나19의 확산세가 진정되고 치명률이 낮아지며 정부의 코로나19 방역 정책이 완화되는 추세가 지속됨에 따라 백신 접종률 역시 감소하고 있는 추세를 보이고 있습니다. 백신 부작용에 대한 우려, 돌파감염 등 백신 효과에 대한 불신 등의 이유로 2021년 10월 25일부터 시작된 3차 백신 접종과 2022년 2월 14일에 시작된 4차 백신 접종자 수는 큰 폭으로 감소하여, 2023년 3월 기준 3차 접종률 약 66%을 기록하였으며, 60세 이상을 대상으로 한 4차 접종과 동절기 접종은 접종 대상자인 60세 이상의 접종률이 약 44%를 기록하는 등 1차 및 2차 접종 대비 접종률이 하락하였습니다. 하지만, 2023년 11월 13일 기준 65세 이상의 누적 접종자는 2,943,293명이고 누적 접종률은 30.1%로 접종 시작 후 66일 차에 30%를 달성한 2022년 대비 빠른 속도로 접종률이 증가하였습니다. 2024년 1월 질병관리청은 코로나19 변이 바이러스 유행에 따라 코로나19 감염, 백신 접종 등을 통해 면역이 형성되지 않은 사람들의 중증도와 백신 접종군의 중증도를 비교한 연구 결과, 예방접종군 중증도는 미접종자 대비 델타시기 1/6배, 오미크론 시기 1/3배 낮다고 국제 학술지에 발표하였습니다. 또한 백신 재고관리에 대한 우려도 제기되고 있습니다. 2024년 10월에 발간된 국회예산정책처의 2025년도 예산안 위원회별 분석 보고서에 따르면, 코로나19 예방접종 실시의 내역사업인 코로나19 백신도입 사업의 2025년도 예산안은 2024년도 대비 약 2,051억원을 감액한 약 2,242억원을 기록편성하였습니다. 이는 전년 대비 47.8%p 감소한 수치이며, 이는 코로나19 백신 구매비를 국가예방접종(NIP)와 동일하게 지자체에서 재원을 일부 부담하는 지자체 보조사업으로 전환할 계획의 일환이라는 점에 기인합니다. 질병관리청은 2025년도 예산안에서 신규사업으로 팬데믹 대비 mRNA 백신 개발 지원사업에 약 290억원, 우선순위 감염병 대유행 대비 신속개발기술 구축 지원사업에 약 34억원을 편성하여, 신종 감염병 유행 대비 및 대응 차원에서 mRNA 백신 플랫폼 확보를 위한 지원사업을 추진하고, 우선순위 감염병의 백신 등 개발하여 신속개발 체계를 사전에 구축하려는 의지를 보여줬습니다. 이는 정부의 코로나19 백신 국산화 필요성을 의미하기도 하지만, 최근 임상 3상이 종료된 당사의 아데노바이러스 벡터 기반의 백신에 부정적인 영향을 미칠 수 있습니다. 당사가 개발하고 있는 오미크론 전용백신에 대한 품목허가 신청은 2025년 2분기 ~ 2025년 3분기를 예상하고 있으며, 2025년 ~ 2026년 변이에 대한 백신은 2025년 4분기에 긴급사용승인을 받고 2025년 4분기 ~ 2026년 1분기에 첫 백신 매출이 가능할 것을 목표로 하고 있으나, 초기에는 소규모일 것으로 예상하고 있습니다. 향후 본격적인 매출은 2025년 ~ 2026년 변이 바이러스에 대한 국가필수예방접종사업 대상자 15백만명 중에서 5백만명을 목표로 발생할 것으로 기대하고 있습니다. 다만 이는 당사의 예상에 불과하며, 임상 진행 경과 및 임상 성공 유무에 따라, 품목허가 신청이 이루어지지 못할 수도 있고, 매출 실현까지 이어지지 못하고 연구개발에 실패할 가능성도 존재합니다. 또한 당사는 면역력이 낮은 소아 및 고령층은 향후에도 코로나19 백신 접종률이 일정 수준 유지될 것으로 판단하여, 이를 집중 목표 시장으로 타겟하고는 있으나, 당사의 예상과 달리 코로나19 백신 접종에 대한 필요성 인식이 낮아질 경우, 당사는 향후 연구개발에 성공하더라도 매출 발생이 제한적일 가능성도 존재합니다. 당사의 오미크론 변이주 대응 백신이 긴급사용승인을 받으려면, 공중보건적 필요성과 임상적 우수성이 명확히 입증되어야 합니다. 하지만 현재 코로나19 위기 상황이 완화된 점과 기존 백신들이 이미 충분히 공급되고 있다는 점에서 승인 가능성은 다소 제한적일 수 있습니다. 다만, 새로운 변이가 출현하거나 고위험군 보호를 위한 추가적인 백신 옵션이 필요하다고 판단될 경우, 승인 가능성이 열릴 수도 있으나, 이는 현재 시점에서 불확실한 사항입니다. 또한 2024년 05월 01일부터 코로나19 바이러스에 대한 정부의 위기 단계 하향 '경계(3단계) → 관심(1단계)' 및 WHO의 국제공중보건위기상황 해제 등 코로나19 바이러스의 심각성 감소에 따른 조치 등으로 인해 코로나19 바이러스 백신 수요 감소 추세는 이어질 가능성이 존재합니다. 또한, 코로나19 바이러스가 지속적으로 변이됨에 따라 전파력과 면역 회피력이 높아졌음에도 불구하고, 낮아지고 있는 바이러스의 치명률은 코로나19 바이러스 백신 수요에 부정적인 영향을 미칠 수 있습니다. 이는 코로나19 바이러스 벡터를 개발하고 있는 당사의 사업에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
당사가 개발하고 있는 오미크론 전용백신에 대한 품목허가 신청은 2025년 2분기 ~ 2025년 3분기를 예상하고 있으며, 2025년 ~ 2026년 변이에 대한 백신은 2025년 4분기에 긴급사용승인을 받고 2025년 4분기 ~ 2026년 1분기에 첫 백신 매출이 가능할 것을 목표로 하고 있으나, 초기에는 소규모일 것으로 예상하고 있습니다. 향후 본격적인 매출은 2025년 ~ 2026년 변이 바이러스에 대한 국가필수예방접종사업 대상자 15백만명 중에서 5백만명을 목표로 발생할 것으로 기대하고 있습니다. 다만 이는 당사의 예상에 불과하며, 임상 진행 경과 및 임상 성공 유무에 따라, 품목허가 신청이 이루어지지 못할 수도 있고, 매출 실현까지 이어지지 못하고 연구개발에 실패할 가능성도 존재합니다. 또한 당사는 면역력이 낮은 소아 및 고령층은 향후에도 코로나19 백신 접종률이 일정 수준 유지될 것으로 판단하여, 이를 집중 목표 시장으로 타겟하고는 있으나, 당사의 예상과 달리 코로나19 백신 접종에 대한 필요성 인식이 낮아질 경우, 당사는 향후 연구개발에 성공하더라도 매출 발생이 제한적일 가능성도 존재합니다.
(중략)
특히, 코로나19 팬데믹 상황에서 엔더믹 상황으로 전환한 현재 시점에서 공중보건 위기상황이 종료되었다고 볼 수 있는 시각이 존재하기에 당사의 긴급사용승인 신청에 다소 제약사항이 발생할 수 있습니다. 2023년 5월 5일, 세계보건기구(WHO)는 코로나19를 국제적 공중보건 비상사태(PHEIC)로 더 이상 간주하지 않겠다고 선언했으며, 이에 따라 한국 정부도 2023년 6월 1일부터 코로나19를 '심각' 단계에서 '경계' 단계로 격하하고, 팬데믹 관련 대부분의 제한 조치를 해제했습니다. 이러한 변화는 코로나19가 이제 예측 가능하고 관리 가능한 상태가 되었음을 의미하며, 계절성 독감과 유사한 풍토병(endemic)으로 간주되고 있습니다. 이에 따라 국내에서는 7일 의무 격리가 5일 권고 격리로 변경되고, 실내 마스크 착용 의무도 병원 입원실을 제외한 대부분의 장소에서 해제되었습니다. 물론, 이는 코로나19의 완전한 종식을 의미하지는 않습니다. 질병관리청은 새로운 변이 발생 가능성을 염두에 두고 감시 체계를 유지하며, 고위험군 및 감염 취약 시설에 대한 관리 강화를 권고하고 있습니다.
그러나 긴급사용승인 제도는 공중보건 비상사태(PHE) 하에서 신속히 의료제품을 도입하기 위해 설계된 제도입니다. 따라서 공중보건 위기 상황이 아닌 경우 긴급사용승인의 필요성이 줄어들 수 있으며, 질병관리청 등 중앙행정기관의 요청에 의해 식약처가 승인 절차를 시작하기 때문에 만약 정부가 당사 백신의 긴급 도입 필요성을 느끼지 않는다면, 신청이 허가되지 않을 가능성이 많을 수 있습니다. 또한 당사는 1/2상 결과에서는 장기적인 면역 효과와 안전성이 입증되었지만, 3상의 최종 데이터가 충분히 신뢰할 만하지 않거나 기존 백신보다 우월한 효과를 보이지 않는다면 승인 가능성이 낮아질 수 있습니다.
따라서 당사의 오미크론 변이주 대응 백신이 긴급사용승인을 받으려면, 공중보건적 필요성과 임상적 우수성이 명확히 입증되어야 합니다. 하지만 현재 코로나19 위기 상황이 완화된 점과 기존 백신들이 이미 충분히 공급되고 있다는 점에서 승인 가능성은 다소 제한적일 수 있습니다. 다만, 새로운 변이가 출현하거나 고위험군 보호를 위한 추가적인 백신 옵션이 필요하다고 판단될 경우, 승인 가능성이 열릴 수도 있으나, 이는 현재 시점에서 불확실한 사항입니다.
(후략)
(주3) 정정 후
| [라. 코로나19 바이러스 종식 가능성에 따른 위험] 정부는 2023년 03월 29일 중 중증화율,치명률 감소 등 질병 위험 하락과 기구축된 대응 역량을 감안하여 위기상황에서 벗어나 일상적 관리체계로의 전환 추진하기로 결정하였으며, 이후 사항들은 더욱 완화되어 2023년 06월 01일부터 시행되었습니다. 또한, 세계보건기구(WHO)는 코로나19 국제공중보건위기상황 해제를 발표하였습니다. 이처럼 코로나19의 확산세가 진정되고 치명률이 낮아지며 정부의 코로나19 방역 정책이 완화되는 추세가 지속됨에 따라 백신 접종률 역시 감소하고 있는 추세를 보이고 있습니다. 백신 부작용에 대한 우려, 돌파감염 등 백신 효과에 대한 불신 등의 이유로 2021년 10월 25일부터 시작된 3차 백신 접종과 2022년 2월 14일에 시작된 4차 백신 접종자 수는 큰 폭으로 감소하여, 2023년 3월 기준 3차 접종률 약 66%을 기록하였으며, 60세 이상을 대상으로 한 4차 접종과 동절기 접종은 접종 대상자인 60세 이상의 접종률이 약 44%를 기록하는 등 1차 및 2차 접종 대비 접종률이 하락하였습니다. 하지만, 2023년 11월 13일 기준 65세 이상의 누적 접종자는 2,943,293명이고 누적 접종률은 30.1%로 접종 시작 후 66일 차에 30%를 달성한 2022년 대비 빠른 속도로 접종률이 증가하였습니다. 2024년 1월 질병관리청은 코로나19 변이 바이러스 유행에 따라 코로나19 감염, 백신 접종 등을 통해 면역이 형성되지 않은 사람들의 중증도와 백신 접종군의 중증도를 비교한 연구 결과, 예방접종군 중증도는 미접종자 대비 델타시기 1/6배, 오미크론 시기 1/3배 낮다고 국제 학술지에 발표하였습니다. 또한 백신 재고관리에 대한 우려도 제기되고 있습니다. 2024년 10월에 발간된 국회예산정책처의 2025년도 예산안 위원회별 분석 보고서에 따르면, 코로나19 예방접종 실시의 내역사업인 코로나19 백신도입 사업의 2025년도 예산안은 2024년도 대비 약 2,051억원을 감액한 약 2,242억원을 기록편성하였습니다. 이는 전년 대비 47.8%p 감소한 수치이며, 이는 코로나19 백신 구매비를 국가예방접종(NIP)와 동일하게 지자체에서 재원을 일부 부담하는 지자체 보조사업으로 전환할 계획의 일환이라는 점에 기인합니다. 질병관리청은 2025년도 예산안에서 신규사업으로 팬데믹 대비 mRNA 백신 개발 지원사업에 약 290억원, 우선순위 감염병 대유행 대비 신속개발기술 구축 지원사업에 약 34억원을 편성하여, 신종 감염병 유행 대비 및 대응 차원에서 mRNA 백신 플랫폼 확보를 위한 지원사업을 추진하고, 우선순위 감염병의 백신 등 개발하여 신속개발 체계를 사전에 구축하려는 의지를 보여줬습니다. 이는 정부의 코로나19 백신 국산화 필요성을 의미하기도 하지만, 최근 임상 3상이 종료된 당사의 아데노바이러스 벡터 기반의 백신에 부정적인 영향을 미칠 수 있습니다. 당사가 개발하고 있는 오미크론 전용백신에 대한 품목허가 신청은 2025년 2분기 ~ 2025년 3분기를 예상하고 있으며, 2025년 ~ 2026년 변이에 대한 백신은 2025년 4분기에 긴급사용승인을 받고 2025년 4분기 ~ 2026년 1분기에 첫 백신 매출이 가능할 것을 목표로 하고 있으나, 초기에는 소규모일 것으로 예상하고 있습니다. 향후 본격적인 매출은 2025년 ~ 2026년 변이 바이러스에 대한 국가필수예방접종사업 대상자 15백만명 중에서 5백만명을 목표로 발생할 것으로 기대하고 있습니다. 다만 이는 당사의 예상에 불과하며, 임상 진행 경과 및 임상 성공 유무에 따라, 품목허가 신청이 이루어지지 못할 수도 있고, 조건부 품목허가 신청이 이루어지더라도 긴급사용승인이 거절될 가능성도 있으며, 긴급사용승인이 완료되더라도 매출 실현까지 이어지지 못하고 연구개발에 실패할 가능성도 존재합니다. 또한 당사는 면역력이 낮은 소아 및 고령층은 향후에도 코로나19 백신 접종률이 일정 수준 유지될 것으로 판단하여, 이를 집중 목표 시장으로 타겟하고는 있으나, 당사의 예상과 달리 코로나19 백신 접종에 대한 필요성 인식이 낮아질 경우, 당사는 향후 연구개발에 성공하더라도 매출 발생이 제한적일 가능성도 존재합니다. 당사의 오미크론 변이주 대응 백신이 긴급사용승인을 받으려면, 공중보건적 필요성과 임상적 우수성이 명확히 입증되어야 합니다. 하지만 현재 코로나19 위기 상황이 완화된 점과 기존 백신들이 이미 충분히 공급되고 있다는 점에서 승인 가능성은 다소 제한적일 수 있습니다. 다만, 새로운 변이가 출현하거나 고위험군 보호를 위한 추가적인 백신 옵션이 필요하다고 판단될 경우, 승인 가능성이 열릴 수도 있으나, 이는 현재 시점에서 불확실한 사항입니다. 또한 2024년 05월 01일부터 코로나19 바이러스에 대한 정부의 위기 단계 하향 '경계(3단계) → 관심(1단계)' 및 WHO의 국제공중보건위기상황 해제 등 코로나19 바이러스의 심각성 감소에 따른 조치 등으로 인해 코로나19 바이러스 백신 수요 감소 추세는 이어질 가능성이 존재합니다. 또한, 코로나19 바이러스가 지속적으로 변이됨에 따라 전파력과 면역 회피력이 높아졌음에도 불구하고, 낮아지고 있는 바이러스의 치명률은 코로나19 바이러스 백신 수요에 부정적인 영향을 미칠 수 있습니다. 이는 코로나19 바이러스 벡터를 개발하고 있는 당사의 사업에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
당사가 개발하고 있는 오미크론 전용백신에 대한 품목허가 신청은 2025년 2분기 ~ 2025년 3분기를 예상하고 있으며, 2025년 ~ 2026년 변이에 대한 백신은 2025년 4분기에 긴급사용승인을 받고 2025년 4분기 ~ 2026년 1분기에 첫 백신 매출이 가능할 것을 목표로 하고 있으나, 초기에는 소규모일 것으로 예상하고 있습니다. 향후 본격적인 매출은 2025년 ~ 2026년 변이 바이러스에 대한 국가필수예방접종사업 대상자 15백만명 중에서 5백만명을 목표로 발생할 것으로 기대하고 있습니다. 다만 이는 당사의 예상에 불과하며, 임상 진행 경과 및 임상 성공 유무에 따라, 품목허가 신청이 이루어지지 못할 수도 있고, 조건부 품목허가 신청이 이루어지더라도 긴급사용승인이 거절될 가능성도 있으며, 긴급사용승인이 완료되더라도 매출 실현까지 이어지지 못하고 연구개발에 실패할 가능성도 존재합니다. 또한 당사는 면역력이 낮은 소아 및 고령층은 향후에도 코로나19 백신 접종률이 일정 수준 유지될 것으로 판단하여, 이를 집중 목표 시장으로 타겟하고는 있으나, 당사의 예상과 달리 코로나19 백신 접종에 대한 필요성 인식이 낮아질 경우, 당사는 향후 연구개발에 성공하더라도 매출 발생이 제한적일 가능성도 존재합니다.
(중략)
특히, 코로나19 팬데믹 상황에서 엔더믹 상황으로 전환한 현재 시점에서 공중보건 위기상황이 종료되었다고 볼 수 있는 시각이 지배적이기 때문에 당사의 긴급사용승인 신청 후 승인이 불발될 수 있습니다. 2023년 5월 5일, 세계보건기구(WHO)는 코로나19를 국제적 공중보건 비상사태(PHEIC)로 더 이상 간주하지 않겠다고 선언했으며, 이에 따라 한국 정부도 2023년 6월 1일부터 코로나19를 '심각' 단계에서 '경계' 단계로 격하하고, 팬데믹 관련 대부분의 제한 조치를 해제했습니다. 이러한 변화는 코로나19가 이제 예측 가능하고 관리 가능한 상태가 되었음을 의미하며, 계절성 독감과 유사한 풍토병(endemic)으로 간주되고 있습니다. 이에 따라 국내에서는 7일 의무 격리가 5일 권고 격리로 변경되고, 실내 마스크 착용 의무도 병원 입원실을 제외한 대부분의 장소에서 해제되었습니다. 물론, 이는 코로나19의 완전한 종식을 의미하지는 않습니다. 질병관리청은 새로운 변이 발생 가능성을 염두에 두고 감시 체계를 유지하며, 고위험군 및 감염 취약 시설에 대한 관리 강화를 권고하고 있습니다.
그러나 긴급사용승인 제도는 공중보건 비상사태(PHE) 하에서 신속히 의료제품을 도입하기 위해 설계된 제도입니다. 따라서 공중보건 위기 상황이 아닌 경우 긴급사용승인의 필요성이 줄어들 수 있으며, 질병관리청 등 중앙행정기관의 요청에 의해 식약처가 승인 절차를 시작하기 때문에 만약 정부가 당사 백신의 긴급 도입 필요성을 느끼지 않는다면, 신청이 허가되지 않을 가능성이 큽니다. 또한 당사는 1/2상 결과에서는 장기적인 면역 효과와 안전성이 입증되었지만, 3상의 최종 데이터가 충분히 신뢰할 만하지 않거나 기존 백신보다 우월한 효과를 보이지 않는다면 승인 가능성이 낮아질 수 있습니다.
따라서 당사의 오미크론 변이주 대응 백신이 긴급사용승인을 받으려면, 공중보건적 필요성과 임상적 우수성이 명확히 입증되어야 합니다. 하지만 현재 코로나19 위기 상황이 완화된 점과 기존 백신들이 이미 충분히 공급되고 있다는 점에서 승인 가능성은 낮다고 판단됩니다. 또한 현재와 같이 오미크론 변이의 중증도와 치명률이 낮은 상황에서는 긴급사용승인 가능성이 높지 않으며, 이에 따라 당사는 긴급사용승인이 정책적으로 가능하지 않을 경우, 조건부 품목허가 또는 정식 품목허가(사용승인)를 중심으로 대응할 계획입니다. 다만, 새로운 변이가 출현하거나 고위험군 보호를 위한 추가적인 백신 옵션이 필요하다고 판단될 경우, 승인 가능성이 올라갈 수도 있으나, 이는 현재 시점에서 불확실한 사항입니다.
(후략)
(주4) 정정 전
|
[마. 면역항암제 경쟁 심화 위험] 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황에서 점차 면역세포치료제 시장 경쟁이 심화됨에 따라 당사의 항암면역치료백신 사업에 부정적인 영향을 미칠 수 있으며, 또한 새로운 치료법의 등장, 시장 환경의 변화, 신규 면역항암제 개발 등으로 글로벌 경쟁력 및 기준에 부합하지 않게 되는 경우, 당사의 사업계획 및 수익창출 등에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
당사의 CeliVax 기술은 인체 내에서 항암 작용을 나타낼 수 있는 적응면역계와 선천면역계를 동시에 활성화하여 강력한 약효를 나타내는 것이 특징입니다. 즉, 적응면역계에서 주요 기능을 하는 세포독성 T세포를 활성화하고 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계에서 주요 기능을 하는 자연살해세포와 자연살해T세포를 활성화하여 항암면역반응을 일으킵니다. 또한 혈액 내 풍부히 존재하는 B세포 및 단구세포를 활용하기 때문에 수지상세포 백신보다 충분한 양을 투여하여 수지상세포와 동등한 수준의 항원 제시 효과를 유도할 수 있습니다. B세포를 활용한 치료백신의 임상시험이 현재 진행중에 있고, 아직 치료 대상 환자수가 제한적인 점이 있기 때문에 B세포를 이용한 기술의 우수성, 보편성을 확보하는데 시간이 더 소요될 것으로 판단됩니다.
(중략)
| [타 면역항암제 작용 기전 대비 Celivax 경쟁력] |
|
특징 |
Celivax |
수지상세포 백신 |
T세포 치료제 |
|
|
개인맞춤치료 |
○ |
○ |
○ |
|
|
항원특이적 |
항체 생산 |
○ |
○ |
× |
|
T세포 |
○ |
○ |
○ |
|
|
항원비특이적 |
자연살해세포 |
○ |
× |
× |
|
자연살해T세포 |
○ |
× |
× |
|
|
T세포 작용 회피 암세포 제거 (항원 혹은 MHC 분자 소실 암세포 제거 효과) |
○ |
× |
× |
|
| 출처) 당사 제시 |
(중략)
| [자가세포 기반 치료제 종류별 제조 비용 및 기간] |
|
특징 |
Celivax |
단클론항체 |
수지상세포 백신 |
T세포 치료제 |
|
제조기간 |
1일 |
Off-the -shelf |
7~10일 |
14~28일 |
|
공급의 신속성 |
○ |
○ |
× |
× |
|
제조비용 |
낮음 |
높음 |
높음 |
매우높음 |
| 출처) 당사 제시 |
(후략)
(주4) 정정 후
|
[마. 면역항암제 경쟁 심화 위험] 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황에서 점차 면역세포치료제 시장 경쟁이 심화됨에 따라 당사의 항암면역치료백신 사업에 부정적인 영향을 미칠 수 있으며, 또한 새로운 치료법의 등장, 시장 환경의 변화, 신규 면역항암제 개발 등으로 글로벌 경쟁력 및 기준에 부합하지 않게 되는 경우, 당사의 사업계획 및 수익창출 등에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
당사의 CeliVax 기술은 인체 내에서 항암 작용을 나타낼 수 있는 적응면역계와 선천면역계를 동시에 활성화하여 강력한 약효를 나타내는 것이 특징입니다. 즉, 적응면역계에서 주요 기능을 하는 세포독성 T세포를 활성화하고 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계에서 주요 기능을 하는 자연살해세포와 자연살해T세포를 활성화하여 항암면역반응을 일으킵니다. 또한 혈액 내 풍부히 존재하는 B세포 및 단구세포를 활용하기 때문에 수지상세포 백신보다 충분한 양을 투여하여 수지상세포와 동등한 수준의 항원 제시 효과를 유도할 수 있습니다. B세포를 활용한 치료백신의 임상시험이 현재 진행중에 있고, 아직 치료 대상 환자수가 제한적인 점이 있기 때문에 B세포를 이용한 기술의 우수성, 보편성을 확보하는데 시간이 더 소요될 것으로 판단됩니다.
한편, CeliVax 기술은 다양한 선천면역계를 동시에 활성화할 수 있기 때문에 최근 다양하게 연구되고 있는 자연살해유사T세포(NK유사T세포)의 활성화도 유도할 수 있을 것으로 판단하고 있습니다. CeliVax가 투여되면 환자의 자연살해T세포가 활성화되고, 활성화된 자연살해T세포는 다양한 면역활성 단백질(IL-12, IL-18 등)을 분비하게 됩니다. NK유사T세포에 관한 연구(논문, Journal of Hepatology(간학저널)., 77j, 1059-1070(2022))에 따르면 NK유사T세포가 IL-12, IL-15, IL-18와 같은 면역활성 단백질을 통해 활성화가 유도되고 세포 독성반응을 유도할 수 있기 때문에, 자연살해T세포를 통해 유사한 면역활성 단백질의 분비를 유도하는CeliVax 기술에 의하여 NK유사T세포의 활성화도 유도되고, 이를 통한 면역 치료 효과도 기대할 수 있을 것으로 판단됩니다.
(중략)
| [타 면역항암제 작용 기전 대비 Celivax 경쟁력] |
| 특징 | Celivax | 수지상세포 백신 | T세포 치료제 | |
| 개인맞춤치료 | ○ | ○ | ○ | |
| 항원특이적 | 항체 생산 | ○ | ○ | × |
| T세포 | ○ | ○ | ○ | |
| 항원비특이적 | 자연살해세포 (NK유사T세포 포함) |
○ | × | × |
| 자연살해T세포 | ○ | × | × | |
| T세포 작용 회피 암세포 제거 (항원 혹은 MHC 분자 소실 암세포 제거 효과) |
○ | × | × | |
| 출처) 당사 제시 |
(중략)
| [자가세포 기반 치료제 종류별 제조 비용 및 기간] |
|
특징 |
Celivax |
수지상세포 백신 |
T세포 치료제 |
|
제조기간 |
1일 |
7~10일 |
14~28일 |
|
공급의 신속성 |
○ (5일 이내) |
× (11~14일) |
× (18일~32일) |
|
판매가 |
낮음 (약 10만$) |
높음 (약 20만$) |
매우 높음 (약 40만$) |
| 출처) 당사 제시 |
| 주1) 대표적인 수지상세포 백신인 Provenge의 용법에 따라 3회 용량의 비용을 게시하였습니다. |
| 주2) T세포 치료제는 IHA(이스라엘 병원)의 유럽 혈액학 컨퍼런스 CART25- 프랑스 스트라스부르 2025 자료를 참고하였습니다. |
| 주3) Celivax와 유사한 세포치료제의 제조원가를 알 수 없어 판매가 기준의 가격을 제시하였습니다. 당사의 Celivax는 추정 판매가입니다. |
(후략)
(주5) 정정 전
| [바. 연구 개발 실패에 따른 위험] 한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이후 임상단계에서는 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 당사는 신약개발사로서, CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 면역항암치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용을 최소화하는 것을 목표로 하고 있습니다. 또한 당사는 아데노바이러스 벡터 기반 예방백신 기술을 보유하고 있으며 이 기술을 활용하여 COVID-19 예방백신을 개발 중입니다. 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 당사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실이 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
| [당사 백신 및 타 플랫폼 백신 특징 비교] |
|
구 분 |
Ad5/35 플랫폼 | 타 개발사 | |||
|---|---|---|---|---|---|
| 아데노바이러스 벡터 | mRNA | 재조합단백질 | 불활화백신 | ||
| 개발사 | CELLID | AstraZeneca, Janssen | Pfizer(BioNTech), Moderna | NovaVax, SK Bioscience | Sinopharm |
| 면역원성 | ++(기초접종시) ++++ (추가접종시) |
++ | ++++ | +++ | + |
| 안전성 | +++ | ++ | ++ | +++ | ++ |
| 생산단가 | Low | Low | High | Mid | Low |
| 변이주 대응 개발속도 | +++ | +++ | +++ | + | ++ |
| 플랫폼 확장 가능성 (타 감영병) |
+++ | +++ | +++ | ++ | + |
| 출처) 당사 제시 |
(중략)
이에 따라 당사는 2022년 01월에 식품의약품안전처로부터 승인받은 기초접종 용도로 개발한 코로나19 백신 'AdCLD-CoV19-1'의 임상 2b상 시험 계획(IND)을 철회하고 향후 지속적인 수요가 예측되는 추가 접종 변이주 대응 백신으로 전략을 변경하여, 동일한 아데노바이러스 벡터 플랫폼을 활용한 오미크론 전용 부스터샷 백신 'AdCLD-CoV19-1 OMI'를 개발하고 국내 총 320명을 대상으로 임상 1/2상 시험을 진행하였으며, 2023년 05월 임상 1/2상 초기 분석 데이터를 기반으로 임상 3상 IND를 식품의약품안전처에 신청하였습니다. 2023년 7월 임상 3상 수행 허가를 받아 본 보고서 제출일 현재 국내, 필리핀 및 베트남 식약처에도 임상3상 시험계획 신청 후 승인을 완료하여 진행 중에 있습니다.
(후략)
(주5) 정정 후
| [바. 연구 개발 실패에 따른 위험] 한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이후 임상단계에서는 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 당사는 신약개발사로서, CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 면역항암치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용을 최소화하는 것을 목표로 하고 있습니다. 또한 당사는 아데노바이러스 벡터 기반 예방백신 기술을 보유하고 있으며 이 기술을 활용하여 COVID-19 예방백신을 개발 중입니다. 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 당사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실이 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
| [당사 백신 및 타 플랫폼 백신 특징 비교] |
|
구 분 |
Ad5/35 플랫폼 | 타 개발사 | |||
|---|---|---|---|---|---|
| 아데노바이러스 벡터 | mRNA | 재조합단백질 | 불활화백신 | ||
| 개발사 | CELLID | AstraZeneca, Janssen | Pfizer(BioNTech), Moderna | NovaVax, SK Bioscience | Sinopharm |
| 면역원성 |
기초접종 시 기존 Ad5보다 우수한 초기 면역반응 추가접종 시 강한 면역 유도 |
면역원성 중간 수준, 단회 접종 시 중화항체 반응 제한적 | 강력한 중화항체 및 T세포 반응 | 상대적으로 낮은 중화항체 | 면역원성 낮음 |
| 안전성 |
임상 2상에서 중대한 이상반응 보고되지 않음. 발현된 이상반응의 대부분은 경증 grade 1에 해당함. |
일부 백신에서 혈전증 사례 보고 | 직접 감염원을 다루지 않아 안전성이 높음 | 기존 단백질 기반 백신과 유사하여 안전성 높음 | 전통적 플랫폼으로 안전성 높음 |
| 생산단가 |
낮음. 자체 플랫폼 보유, 2~8℃ 보관이 가능하여 운송 및 관리비 낮음. |
낮음. 기반기술 오래되어 대량생산 비용 저렴 |
높음. 생체 내 전달 비효율성으로 인해 별도의 전달기술 필요 RNA 및 지질 나노입자의 불안정성으로 운송·관리 어려움 |
중간. 세포배양 및 정제공정 필요 |
낮음. 대규모 배양 후 불활화로 비교적 비용 저렴 |
| 변이주 대응 개발속도 |
빠름. 바이럴벡터 플라스미드 교체만으로 수 주 내 업데이트 가능 |
빠름. 바이럴벡터 플라스미드 교체만으로 가능 |
빠름. 수 주 내 업데이트 가능 |
느림. 생산 공정상 시간이 소요됨 |
느림. 항원 전체를 새로 배양해야 하므로 느림 |
| 플랫폼 확장 가능성 (타 감영병) |
바이럴벡터 플라스미드 교체만으로 가능 | 다른 질환 백신에도 일부 적용 사례 있음 | 신속한 디자인으로 다양한 감염병 대응 가능 | 다수의 국가에서 기존 감염병 백신에 활용 | 다수의 국가에서 기존 감염병 백신에 활용 |
|
출처) 당사 제시 1) 백신 연구동향 보고서 (2022년 12월), 한국화학연구원 감염병기술전략센터 2) Wu et al. (2024). Comparative efficacy and safety of COVID-19 vaccines in phase III trials: a network meta-analysis(3상 임상에서 COVID-19 백신의 효능과 안전성을 네트워크 메타분석 방식으로 비교한 논문), BMC infectious diseases 3) Sadoff et al. (2021). Safety and efficacy of single-dose Ad26.COV2.S vaccine(Ad26.COV2.S 백신(얀센 백신)은 SARS-CoV-2(코로나19 바이러스)의 스파이크 단백질을 발현하도록 설계된 비복제성 아데노바이러스 26형 벡터 백신), NEJM. 4) Polack et al. (2020). Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine(BNT162b2(화이자-바이오엔텍 백신)는 SARS-CoV-2(코로나19 바이러스)의 스파이크 단백질을 발현하는 mRNA 백신), NEJM. 5) Coronavirus Disease 2019 (COVID-19) Vaccine Safety(코로나 백신의 안전성), CDC 6) Lee et al. (2022). Comparison of COVID-19 Vaccines Introduced in Korea(한국에서 사용 중인 다섯 가지 백신의 특성, 생산 플랫폼, 합성 원리, 승인 현황, 보호 효과, 면역 반응, 임상시험 결과, 이상반응 등을 비교), Biomedical Science Letters 7) 코로나19 백신 접근권, 백신 가격, 특허권 유예를 둘러싼 논쟁, MIT 테크놀로지리뷰 코리아 8) 아데노바이러스 플랫폼 기반의 백신 개발 동향 정보집 (2023), 식품의약품안전평가원 |
(중략)
이에 따라 당사는 2022년 01월에 식품의약품안전처로부터 승인받은 기초접종 용도로 개발한 코로나19 백신 'AdCLD-CoV19-1'의 임상 2b상 시험 계획(IND)을 철회하고 향후 지속적인 수요가 예측되는 추가 접종 변이주 대응 백신으로 전략을 변경하여, 동일한 아데노바이러스 벡터 플랫폼을 활용한 오미크론 전용 부스터샷 백신 'AdCLD-CoV19-1 OMI'를 개발하고 국내 총 320명을 대상으로 임상 1/2상 시험을 진행하였으며, 2023년 05월 임상 1/2상 초기 분석 데이터를 기반으로 임상 3상 IND를 식품의약품안전처에 신청하였습니다. 2023년 7월 임상 3상 수행 허가를 받아 본 보고서 제출일 현재 국내, 필리핀 및 베트남 식약처에도 임상3상 시험계획 신청 후 승인을 완료하여 진행 중에 있습니다.
AdCLD-CoV19-1 백신의 경우 기초접종 목적으로 개발되었으나, 국내 백신 접종률 증가와 감염 이력 보유자의 급증으로 인해 감염 이력이 없는 미접종자 모집이 현실적으로 어려워져 임상 시험을 중단하였습니다. 즉, 해당 시험의 중단은 임상 설계상 요구되는 대상자 조건(백신 미접종 및 감염 이력 없음)을 충족하기 어려운 상황이 주요 원이었습니다. 현재 진행 중인 AdCLD-CoV19-1 OMI 백신의 임상은 추가접종(booster)을 목적으로 설계되었으며, 감염 이력 여부와 관계없이 대상자 모집이 가능합니다. 따라서 기존 임상 중단은 오미크론 변이 유행 등의 문제가 아닌 대상자 모집의 현실적 어려움에 따른 것으로, 현재의 임상 진행에는 영향이 없다고 판단됩니다.
(후략)
(주6) 정정 전
|
[사. CMO 사업 관련 위험] |
(중략)
구체적으로 당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
당사의 CeliVax 기술은 세포 배양 과정이 필요하지 않음으로 인해 1일 제조공정의 신속성에 기반하여, 병원에 입원한 상황에서 환자의 혈액을 채혈하고 당사의 GMP센터로 이동하여 제품을 생산하고 품질검사 등을 거쳐 다시 입원한 환자에게 이송하여 투여하는 것이 경쟁력입니다. 국내의 암환자 대다수는 국내 빅5 병원에 내원을 주로 하고 있으며, 성남 GMP센터는 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원 등과 마곡 지구에 비해 상대적으로 가까운 거리에 위치하고 있습니다. 이처럼 다수 상급병원과의 거리가 짧은 것이 환자에게 혈액을 채취하고 다시 투여하는 과정에 있어, 이는 당사의 Celivax 기술의 경쟁력을 더욱 더 강화할 수 있는 지리적 이점으로 판단하였습니다.
이에 아래와 같이 2019년 상장 시 마곡 GMP 건물을 위해 모집한 자금은 성남 GMP센터 구축을 위해 활용되었으며, 마곡은 연구거점 일원화를 위한 기업부설연구소와 사무공간 활용 목적의 사옥으로 용도를 변경하였습니다.
| [상장 당시 GMP센터 구축 계획] |
| (단위: 천원) |
|
구분 |
내 역 |
2019E |
2020E |
2021E |
계 |
|
시설자금 |
마곡 GMP 건물 | 3,000,000 | 3,000,000 | 4,000,000 | 10,000,000 |
| 마곡 GMP 기계장치 | - | - | 4,000,000 | 4,000,000 | |
|
합계 |
3,000,000 | 3,000,000 | 8,000,000 | 14,000,000 | |
| 출처) 당사 증권신고서(지분증권)-2019.02.01 |
그러나, 건축설계와 착공준비 등이 진행되고 있음에도 레고랜드 사태에 따른 금융불안 요소와 자재비 인건비 등의 건설비 상승요소 등의 사유로 구축이 지연되고 있습니다. 현재 마곡 신사옥은 2023년 07월부터 건축공사를 본격적으로 진행하고 있어 2026년 03월 준공 뒤 2026년 04월에 입주할 예정입니다. (주1)
| (주1) | 마곡 신사옥 공사와 관련된 상세한 내용 및 기부채납과 관련하여 당사가 진행 중인 소송 현황은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-마" 부분 및 본 증권신고서 "제2부.X.그 밖에 투자자 보호를 위하여 필요한 사항-2.우발부채 등에 관한 사항" 부분을 참조하여 주시기 바랍니다. |
구체적으로 당사는 2019년 상장 전 마곡토지를 매입하였습니다. 당사의 제품특성상 임대하여 사용할 수 있는 공간을 확보하는 것에 어려움이 있었으며, 마곡GMP센터 설립 및 연구개발, 본사의 기능을 집중하기 위해 마곡 사옥 건설을 추진하게 되었습니다. 다만, 앞서 언급한 바와 같이 마곡에 상업용GMP센터를 설립에 규제가 있었으며, 마곡보다 성남이 지리적으로 상업화에 이점이 있었습니다. 마곡 사옥은 PF를 통해 건설 중에 있어, 완공 전 회사 자금 유출 및 부담이 적다고 판단하고 있습니다. 마곡 사옥은 완공 이후 매년 32억원을 10년간 분할 상환하는 조건으로 PF를 통해 건설하고 있어, 코로나백신 상업화를 통해 PF대출금을 상환할 예정입니다.
(후략)
(주6) 정정 후
|
[사. CMO 사업 관련 위험] |
(중략)
구체적으로 당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
특히, 당사가 독자적으로 연구중인 셀리벡스 플랫폼등은 환자에게 분리된 세포를 신속하게 원하는 시간에 신속히 제조를 해야하는 특징을 가지고 있으나 자체 GMP 시설을 운영하지 않으면 원하는 시간에 생산할 수 없습니다. 2022년 이전에는 타 회사 CDMO를 활용하였으나, 스케줄링 등이 원활하지 않아 임상속도 등에 어려움이 많았습니다. 게다가, 당사의 품목인 셀리벡스 플랫폼은 유전자 치료제와 세포 치료제 두 분야를 이해하고 전문적으로 다루어야 가능한 특성을 가지고 있으며, 대부분 세포 치료제 기반인 완제의약품(Drug product)는 한국에서 연구하거나 제조 할 수 있는 업체는 많으나 유전자 치료제 기반인 원료의약품(Drug substract)인 벡터를 직접 연구하고 제조할 수 있는 업체는 상대적으로 드문 상황입니다. 이러한 신속성 및 전문성을 갖춘 당사의 GMP 센터가 대형병원과 가까운 유리한 위치에 가용한 공간을 만들어 두어 당사 자체 파이프라인 뿐만 아니라 CDMO 사업을 통해 매출을 발생시키고 위해 노력하고 있습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
당사는 마곡사옥이 완공되면 연구개발시설 및 인원의 집중을 계획하고 있으나, 성남GMP에 연구시설을 배제하려는 계획은 아닙니다. 마곡에 연구개발시설을 집중하되, 성남GMP에 연구개발시설을 이원화하여 운영할 계획입니다. 당사의 연구소는 기초연구를 담당하는 신약탐색팀, 중개연구팀이 있으며, 기초연구와 공정연구를 담당하는 벡터공정팀, 완제공정팀이 있습니다. 또한, 성남은 국내 빅5 대형병원에서 약20km 거리에 위치하여 암환자의 치료 및 맞춤형 백신제조에 이점을 가지고 있습니다. 마곡의 연구를 중심으로 성남GMP에서도 관련 연구를 진행하는 이원화를 통해 연구개발에 집중할 계획입니다.
하지만 당사의 CMO 매출은 2022년도 480백만원, 2024년도 358백만원으로 총 838백만원이 발생하였으나, 이는 기대에 미치지 못하는 수치입니다. 또한 현재 대부분의 GMP 시설 장비는 유휴설비로 판단되며, 추후 충분한 CMO 매출이 발생하지 못하면 매출 없이 감가상각비만 증가하는 등 당사의 재무 상황이 악화될 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
당사의 CeliVax 기술은 세포 배양 과정이 필요하지 않음으로 인해 1일 제조공정의 신속성에 기반하여, 병원에 입원한 상황에서 환자의 혈액을 채혈하고 당사의 GMP센터로 이동하여 제품을 생산하고 품질검사 등을 거쳐 다시 입원한 환자에게 이송하여 투여하는 것이 경쟁력입니다. 국내의 암환자 대다수는 국내 빅5 병원에 내원을 주로 하고 있으며, 성남 GMP센터는 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원 등과 마곡 지구에 비해 상대적으로 가까운 거리에 위치하고 있습니다. 이처럼 다수 상급병원과의 거리가 짧은 것이 환자에게 혈액을 채취하고 다시 투여하는 과정에 있어, 이는 당사의 Celivax 기술의 경쟁력을 더욱 더 강화할 수 있는 지리적 이점으로 판단하였습니다.
이에 아래와 같이 2019년 상장 시 마곡 GMP 건물을 위해 모집한 자금은 성남 GMP센터 구축을 위해 활용되었으며, 마곡은 연구거점 일원화를 위한 기업부설연구소와 사무공간 활용 목적의 사옥으로 용도를 변경하였습니다.
| [상장 당시 GMP센터 구축 계획] |
| (단위: 천원) |
|
구분 |
내 역 |
2019E |
2020E |
2021E |
계 |
|
시설자금 |
마곡 GMP 건물 | 3,000,000 | 3,000,000 | 4,000,000 | 10,000,000 |
| 마곡 GMP 기계장치 | - | - | 4,000,000 | 4,000,000 | |
|
합계 |
3,000,000 | 3,000,000 | 8,000,000 | 14,000,000 | |
| 출처) 당사 증권신고서(지분증권)-2019.02.01 |
그러나, 건축설계와 착공준비 등이 진행되고 있음에도 레고랜드 사태에 따른 금융불안 요소와 자재비 인건비 등의 건설비 상승요소 등의 사유로 구축이 지연되고 있습니다. 현재 마곡 신사옥은 2023년 07월부터 건축공사를 본격적으로 진행하고 있어 2026년 03월 준공 뒤 2026년 04월에 입주할 예정입니다. (주1)
| (주1) | 마곡 신사옥 공사와 관련된 상세한 내용 및 기부채납과 관련하여 당사가 진행 중인 소송 현황은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-마" 부분 및 본 증권신고서 "제2부.X.그 밖에 투자자 보호를 위하여 필요한 사항-2.우발부채 등에 관한 사항" 부분을 참조하여 주시기 바랍니다. |
구체적으로 당사는 2019년 상장 전 마곡토지를 매입하였습니다. 당사의 제품특성상 임대하여 사용할 수 있는 공간을 확보하는 것에 어려움이 있었으며, 마곡GMP센터 설립 및 연구개발, 본사의 기능을 집중하기 위해 마곡 사옥 건설을 추진하게 되었습니다. 다만, 앞서 언급한 바와 같이 마곡에 상업용GMP센터를 설립에 규제가 있었으며, 마곡보다 성남이 지리적으로 상업화에 이점이 있었습니다. 마곡 사옥은 PF를 통해 건설 중에 있어, 완공 전 회사 자금 유출 및 부담이 적다고 판단하고 있습니다. 마곡 사옥은 완공 이후 매년 32억원을 10년간 분할 상환하는 조건으로 PF를 통해 건설하고 있어, 코로나백신 상업화를 통해 PF대출금을 상환할 예정입니다. 다만 코로나백신 상업화가 되지 않을 경우 당사는 유동성이 부족하여 신규 자금 조달이 이루어지지 않는다면, PF 대출금 상환이 어려울 수 있습니다. CMO 매출 및 이커머스 매출 분야에서 양(+)의 현금흐름이 발생하거나, 또는 Celivax 기술이전 등이 이루어져야 당사의 자체 자금으로 상환이 가능할 것으로 예상되나, 아직까지도 CMO 및 이커머스 분야에서 현금흐름 창출능력이 부족한 상태이며, 기술이전 가능성은 예측하기 어렵습니다. 결국 당사의 다양한 방면의 현금 확보 노력에도 불구하고, 현 시점에서 코로나백신 상업화에 실패하거나, 장기간 지연될 경우에는 당사는 향후 PF 대출금 상환 능력을 보유하기 어려울 수 있습니다. 따라서 신규 자금조달 등 지속적 투자 유치를 받는 것이 당사와 같이 실적이 부족하고, 연구개발에 비용을 쓰고 있는 기업들의 유일한 방안이라고 생각되는 것이 현실입니다. 따라서 당사는 PF 상환에 차질이 없도록 신규 투자 유치 활동에 보다 노력하려고 합니다. 신규 투자 유치마저 불가능하다면 당사는 심각한 유동성 위기에 처할 수 있음을 투자자 여러분들께서는 다시 한번 유의하여 주시기 바랍니다.
(후략)
(주7) 정정 전
| [가. 매출부진 및 지속적 손실 발생 위험] 당사는 매출이 부진한 가운데, 지속적으로 신약후보물질의 발굴과 보유 파이프라인의 적응증 증가를 위하여 다양한 비임상 및 임상시험을 준비하고 있으며 이에 따라 관련비용의 지출이 꾸준히 발생하여 2022년 영업손실 149.1억원, 2023년 영업손실 122억원, 2024년 영업손실 119.8억원이 발생하였습니다. 또한 영업 외적 측면에서도, 금융비용 등의 발생 영향으로 인해 2022년 당기순손실 228.7억원, 2023년 당기순손실 116.1억원, 2024년 당기순손실 122.6억원이 발생하는 등 지속적인 적자 구조를 면하지 못하고 있습니다. 따라서 당사의 파이프라인에서 임상 성공을 통한 기술이전, 상품화 성공 등의 성과를 이루어내지 못한다면 당사의 적자 구조를 개선하는 것은 불가능할 수 있으며, 자본력이 지속적으로 감소하여 지속적인 연구개발비용 등의 지출이 필요한 당사의 영업활동을 영위하는데 상당한 제약이 생길 수 있습니다. 또한 (주)포베이커의 지분 취득 및 합병과 관련하여, 이는 단기적으로는 당사의 기존 사업과는 무관한 분야의 신규사업 진출에 해당하며, 만일 신규사업에 대한 성과를 내지 못하거나 사업적 시너지를 중장기적으로 발생시키지 못할 경우 이는 당사 손익 내지 재무상태에 오히려 악영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
BVAC-E6E7은 현재 비임상개발 중으로, 2023년 12월 18일 임상 1/2a상 시험계획을 식품의약품안전처에 제출하였습니다. 2024년 11월 19일 IND 승인을 받아 국내에서 임상 개발에 주력할 계획입니다.
(중략)
2) CMO 부문
당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
(후략)
(주7) 정정 후
| [가. 매출부진 및 지속적 손실 발생 위험] 당사는 매출이 부진한 가운데, 지속적으로 신약후보물질의 발굴과 보유 파이프라인의 적응증 증가를 위하여 다양한 비임상 및 임상시험을 준비하고 있으며 이에 따라 관련비용의 지출이 꾸준히 발생하여 2022년 영업손실 149.1억원, 2023년 영업손실 122억원, 2024년 영업손실 119.8억원이 발생하였습니다. 또한 영업 외적 측면에서도, 금융비용 등의 발생 영향으로 인해 2022년 당기순손실 228.7억원, 2023년 당기순손실 116.1억원, 2024년 당기순손실 122.6억원이 발생하는 등 지속적인 적자 구조를 면하지 못하고 있습니다. 따라서 당사의 파이프라인에서 임상 성공을 통한 기술이전, 상품화 성공 등의 성과를 이루어내지 못한다면 당사의 적자 구조를 개선하는 것은 불가능할 수 있으며, 자본력이 지속적으로 감소하여 지속적인 연구개발비용 등의 지출이 필요한 당사의 영업활동을 영위하는데 상당한 제약이 생길 수 있습니다. 또한 (주)포베이커의 지분 취득 및 합병과 관련하여, 이는 단기적으로는 당사의 기존 사업과는 무관한 분야의 신규사업 진출에 해당하며, 만일 신규사업에 대한 성과를 내지 못하거나 사업적 시너지를 중장기적으로 발생시키지 못할 경우 이는 당사 손익 내지 재무상태에 오히려 악영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
BVAC-E6E7은 현재 비임상개발 중으로, 2023년 12월 18일 임상 1/2a상 시험계획을 식품의약품안전처에 제출하였습니다. 2024년 11월 19일 IND 승인을 받았으며, 금번 공모 증자로 인해 BVAC 파이프라인에 대한 연구개발 및 임상 등에 대한 자금이 조달된다면 국내에서 임상 개발에 주력할 계획입니다.
(중략)
2) CMO 부문
당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
특히, 당사가 독자적으로 연구중인 셀리벡스 플랫폼등은 환자에게 분리된 세포를 신속하게 원하는 시간에 신속히 제조를 해야하는 특징을 가지고 있으나 자체 GMP 시설을 운영하지 않으면 원하는 시간에 생산할 수 없습니다. 2022년 이전에는 타 회사 CDMO를 활용하였으나, 스케줄링 등이 원활하지 않아 임상속도 등에 어려움이 많았습니다. 게다가, 당사의 품목인 셀리벡스 플랫폼은 유전자 치료제와 세포 치료제 두 분야를 이해하고 전문적으로 다루어야 가능한 특성을 가지고 있으며, 대부분 세포 치료제 기반인 완제의약품(Drug product)는 한국에서 연구하거나 제조 할 수 있는 업체는 많으나 유전자 치료제 기반인 원료의약품(Drug substract)인 벡터를 직접 연구하고 제조할 수 있는 업체는 상대적으로 드문 상황입니다. 이러한 신속성 및 전문성을 갖춘 당사의 GMP 센터가 대형병원과 가까운 유리한 위치에 가용한 공간을 만들어 두어 당사 자체 파이프라인 뿐만 아니라 CDMO 사업을 통해 매출을 발생시키고 위해 노력하고 있습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
당사는 마곡사옥이 완공되면 연구개발시설 및 인원의 집중을 계획하고 있으나, 성남GMP에 연구시설을 배제하려는 계획은 아닙니다. 마곡에 연구개발시설을 집중하되, 성남GMP에 연구개발시설을 이원화하여 운영할 계획입니다. 당사의 연구소는 기초연구를 담당하는 신약탐색팀, 중개연구팀이 있으며, 기초연구와 공정연구를 담당하는 벡터공정팀, 완제공정팀이 있습니다. 또한, 성남은 국내 빅5 대형병원에서 약20km 거리에 위치하여 암환자의 치료 및 맞춤형 백신제조에 이점을 가지고 있습니다. 마곡의 연구를 중심으로 성남GMP에서도 관련 연구를 진행하는 이원화를 통해 연구개발에 집중할 계획입니다.
하지만 당사의 CMO 매출은 2022년도 480백만원, 2024년도 358백만원으로 총 838백만원이 발생하였으나, 이는 기대에 미치지 못하는 수치입니다. 또한 현재 대부분의 GMP 시설 장비는 유휴설비로 판단되며, 추후 충분한 CMO 매출이 발생하지 못하면 매출 없이 감가상각비만 증가하는 등 당사의 재무 상황이 악화될 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
(후략)
(주8) 정정 전
| [라. 현금흐름 악화 및 유동성 부족에 따른 재무불안정성 위험] 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
| [당사 향후 1년간 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2025년 1분기 | 2025년 2분기 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | ||
|---|---|---|---|---|---|---|---|
| 영업 현금흐름 |
(a)수입 | 매출대금(백신) | 0 | 0 | 0 | 22,000 | 0 |
| 매출대금(CMO) | 0 | 0 | 354 | 354 | 235 | ||
| 매출대금(이커머스) | 1,625 | 1,716 | 2,190 | 3,269 | 2,076 | ||
| 기타 | 552 | 360 | 360 | 360 | 456 | ||
| 계 | 2,177 | 2,076 | 2,904 | 25,984 | 2,767 | ||
| (b)지출 | 원재료 (백신) | 0 | 0 | 0 | 10,707 | 0 | |
| 원재료 (CMO) | 0 | 0 | 0 | 0 | 0 | ||
| 상품매입(이커머스) | 1,381 | 1,459 | 1,861 | 2,779 | 1,764 | ||
| 판매관리비 | 1,750 | 1,841 | 1,743 | 1,708 | 2,317 | ||
| 경상연구비 | 653 | 1,941 | 1,383 | 2,441 | 1,824 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 3,784 | 5,241 | 4,987 | 17,635 | 5,905 | ||
| 영업수지(=(a)-(b)) | (1,607) | (3,165) | (2,083) | 8,349 | (3,138) | ||
| 투자 현금흐름 |
(c)수입 | 기타 | 0 | 0 | 0 | 0 | 0 |
| 계 | 0 | 0 | 0 | 0 | 0 | ||
| (d)지출 | 연구개발투자 | 4,755 | 3,800 | 1,100 | 1,670 | 605 | |
| GMP 허가용 백신 생산 | 894 | 1,171 | 545 | 0 | 0 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 5,649 | 4,970 | 1,645 | 1,670 | 605 | ||
| 투자수지(=(c)-(d)) | (5,649) | (4,970) | (1,645) | (1,670) | (605) | ||
| 재무 현금흐름 |
(e)수입 | 유상증자 | 0 | 24,150 | 0 | 0 | 0 |
| 사모사채 | 0 | 5,000 | 0 | 0 | 0 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 0 | 29,150 | 0 | 0 | 0 | ||
| (f)지출 | 사모사채 | 0 | 5,000 | 0 | 0 | 0 | |
| 이자비용 | 0 | 125 | 0 | 0 | 0 | ||
| 기타 | 0 | 544 | 0 | 0 | 0 | ||
| 계 | 0 | 5,669 | 0 | 0 | 0 | ||
| 재무수지(=(e)-(f)) | 0 | 23,481 | 0 | 0 | 0 | ||
| 기초 자금 | 9,024 | 1,768 | 17,114 | 13,387 | 20,066 | ||
| 기말 자금 | 1,768 | 17,114 | 13,387 | 20,066 | 16,323 | ||
| (자료) | 당사 제시 |
| (주1) | 영업현금흐름 (a)수입 금액은 현금 회수시기를 고려한 금액이며, 회계적 매출 인식금액과는 차이가 있습니다. |
| (주2) | 영업현금흐름 (b)지출 중 경상연구비는 BVAC-C, BVAC-E6E7 관련된 예상 임상개발비입니다. |
| (주3) | 투자현금흐름 (d)지출 중 연구개발투자비는 AdCLD-CoV19-1 OMI 관련된 예상 임상개발비입니다. |
| (주4) | 재무현금흐름 (e)수입 중 유상증자 금액, (f)지출 중 기타(발행제비용)는 예정발행가액 기준으로 기재하였습니다. |
| (주5) | 재무현금흐름 (e)수입 중 사모사채는 현재 외부차입 및 투자 유치 계획 중인 것으로, 향후 실제 조달 금액은 실시간 당사의 유동성을 고려하여 결정할 예정이며, 실행 여부는 확정되지 않았습니다. |
| (주6) | 상기 자금수지 계획은 당사가 현재 계획 중인 현금흐름을 예상하여 반영한 것이므로, 실제 현금흐름 발생과는 차이가 생길 수 밖에 없습니다. |
영업현금흐름 중 2025년 4분기에 발생하는 백신 매출대금 220억원은 2024년에 질병관리청에서 24~25절기 예방접종을 위해 확보한 코로나19 백신 755만 회분 중 약 15%에 해당하는 물량에 대한 매출입니다. 즉, 당사가 약 1백만 회분(도즈)에 대한 정부 물량을 확보한다는 가정 하에 산출한 금액입니다. 이는 당사 입장에서 최대한 보수적인 시각으로 산정하였으나, 정부의 예방 접종을 위한 코로나19 백신 수요가 급격하게 감소하거나, 당사가 해당 정부 조달 시장에 진입하지 못할 가능성도 존재합니다.
(후략)
(주8) 정정 후
| [라. 현금흐름 악화 및 유동성 부족에 따른 재무불안정성 위험] 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
| [당사 향후 1년간 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2025년 1분기 | 2025년 2분기 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | ||
|---|---|---|---|---|---|---|---|
| 영업 현금흐름 |
(a)수입 | 매출대금(백신) | 0 | 0 | 0 | 22,000 | 0 |
| 매출대금(CMO) | 0 | 0 | 354 | 354 | 235 | ||
| 매출대금(이커머스) | 1,625 | 1,716 | 2,190 | 3,269 | 2,076 | ||
| 기타 | 552 | 360 | 360 | 360 | 456 | ||
| 계 | 2,177 | 2,076 | 2,904 | 25,984 | 2,767 | ||
| (b)지출 | 원재료 (백신) | 0 | 0 | 0 | 10,707 | 0 | |
| 원재료 (CMO) | 0 | 0 | 0 | 0 | 0 | ||
| 상품매입(이커머스) | 1,381 | 1,459 | 1,861 | 2,779 | 1,764 | ||
| 판매관리비 | 1,750 | 1,841 | 1,743 | 1,708 | 2,317 | ||
| 경상연구비 | 653 | 1,941 | 1,383 | 2,441 | 1,824 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 3,784 | 5,241 | 4,987 | 17,635 | 5,905 | ||
| 영업수지(=(a)-(b)) | (1,607) | (3,165) | (2,083) | 8,349 | (3,138) | ||
| 투자 현금흐름 |
(c)수입 | 기타 | 0 | 0 | 0 | 0 | 0 |
| 계 | 0 | 0 | 0 | 0 | 0 | ||
| (d)지출 | 연구개발투자 | 4,755 | 3,800 | 1,100 | 1,670 | 605 | |
| GMP 허가용 백신 생산 | 894 | 1,171 | 545 | 0 | 0 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 5,649 | 4,970 | 1,645 | 1,670 | 605 | ||
| 투자수지(=(c)-(d)) | (5,649) | (4,970) | (1,645) | (1,670) | (605) | ||
| 재무 현금흐름 |
(e)수입 | 유상증자 | 0 | 24,150 | 0 | 0 | 0 |
| 사모사채 | 0 | 5,000 | 0 | 0 | 0 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 0 | 29,150 | 0 | 0 | 0 | ||
| (f)지출 | 사모사채 | 0 | 5,000 | 0 | 0 | 0 | |
| 이자비용 | 0 | 125 | 0 | 0 | 0 | ||
| 기타 | 0 | 544 | 0 | 0 | 0 | ||
| 계 | 0 | 5,669 | 0 | 0 | 0 | ||
| 재무수지(=(e)-(f)) | 0 | 23,481 | 0 | 0 | 0 | ||
| 기초 자금 | 9,024 | 1,768 | 17,114 | 13,387 | 20,066 | ||
| 기말 자금 | 1,768 | 17,114 | 13,387 | 20,066 | 16,323 | ||
| (자료) | 당사 제시 |
| (주1) | 영업현금흐름 (a)수입 금액은 현금 회수시기를 고려한 금액이며, 회계적 매출 인식금액과는 차이가 있습니다. 또한 2025년 4분기에 발생할 예정인 매출대금(백신) 22,000백만원은 당사의 예측 정보이며, 예측치와 실제 결과치가 다를 수 있습니다. |
| (주2) | 영업현금흐름 (b)지출 중 경상연구비는 BVAC-C, BVAC-E6E7 관련된 예상 임상개발비입니다. |
| (주3) | 투자현금흐름 (d)지출 중 연구개발투자비는 AdCLD-CoV19-1 OMI 관련된 예상 임상개발비입니다. |
| (주4) | 재무현금흐름 (e)수입 중 유상증자 금액, (f)지출 중 기타(발행제비용)는 예정발행가액 기준으로 기재하였습니다. |
| (주5) | 재무현금흐름 (e)수입 중 사모사채는 현재 외부차입 및 투자 유치 계획 중인 것으로, 향후 실제 조달 금액은 실시간 당사의 유동성을 고려하여 결정할 예정이며, 실행 여부는 확정되지 않았습니다. |
| (주6) | 상기 자금수지 계획은 당사가 현재 계획 중인 현금흐름을 예상하여 반영한 것이므로, 실제 현금흐름 발생과는 차이가 생길 수 밖에 없습니다. |
영업현금흐름 중 2025년 4분기에 발생하는 백신 매출대금 220억원은 2024년에 질병관리청에서 24~25절기 예방접종을 위해 확보한 코로나19 백신 755만 회분 중 약 15%에 해당하는 물량에 대한 매출입니다. 즉, 당사가 약 1백만 회분(도즈)에 대한 정부 물량을 확보한다는 가정 하에 산출한 금액입니다. 이는 당사 입장에서 산정한 물량이나, 정부의 예방 접종을 위한 코로나19 백신 수요가 급격하게 감소하거나, 당사가 해당 정부 조달 시장에 진입하지 못할 가능성도 존재합니다.
또한 해당 백신 매출대금 220억원이 발생하지 않는다면 위의 자금수지계획 상 2025년 4분기에 당사의 기말 현금은 음(-)수로 나타나며 이는 당사가 추가적인 자금조달이 필요할 수 있으며, 추가적인 자금조달을 못할 경우에는 재무적인 불확실성에 크게 노출될 수 있음을 의미합니다. 물론 백신 생산을 하지 않아원재료(백신) 지출대금 10,707백만원이 발생하지 않는다면 2025년 4분기말 현금 자금은 8,773백만원으로 예상되지만, 원재료(백신) 지출대금이 10,707백만원 발생한 이후 생산한 백신이 매출로 이어지지 않을 경우, 위에서 언급하였듯이 당사는 재무적인 위험에 크게 노출되어 추가적인 자금 조달이 필요한 상황에 놓이게 됩니다.
이처럼 당사가 제시한 백신 매출대금 220억원은 질병관리청이 24~25절기 예방접종을 위해 확보한 코로나19 백신 755만 회분 중 약 1백만 회분을 확보한다는 가정 하에 산정된 수치이며, 실제 결과치와 크게 다를 경우 예상 백신 매출이 급격하게 감소하거나 심지어 발생하지 않을 가능성이 있습니다. 따라서 당사의 재무적 불확실성은 지속적으로 존재하는 상황이며, 결과적으로 계속기업의 가정 역시 불확실할 수 있기에 투자자 여러분께서는 이 점 유의하시기 바랍니다.
(후략)
(주9) 정정 전
| [마. 신사옥 준공 관련 채무부담, 우발채무 및 그 외 유형자산 관련 위험] 당사는 토지 재평가이익을 기타포괄손익으로 인식함에 따라 2023년말 자본총계가 증가한 효과가 발생했으며, 만일 재평가이익을 인식하지 않았다면 2023년말 기준 당사 자본총계 대비 법인세비용차감전순손실 비중은 40%를 초과하는 수준입니다. 이는 코스닥시장 관리종목 지정요건의 기준점인 50%에 근접한 수준일만큼, 투자자 여러분들께서는 당사 자본규모 대비 법인세비용차감전순손실 발생 비중이 크게 발생하고 있는 점을 유의하여 주시기 바랍니다. 한편, 당사는 2023년 7월 7일 이사회 결의를 통해 마곡 대규모 산업클러스터 단지 내 신사옥 및 기존 서울 및 성남 연구소를 통합한 R&D 센터를 구축하여 업무 효율성 증대와 미래 성장기반을 확보하고자 약 237억원의 투자를 결정하였습니다. 이를 위해 당사를 포함해 3개社(당사 22%, (주)제넥신 28%, (주)프로젠 50%)가 포함된 마곡컨소시엄제일차(주)(부동산 PF 대출의 차주인 SPC입니다)는 채권자인 하나캐피탈(주) 외 11곳으로부터 대출약정금 1,480억원을 확보하였으며, 채권자로 하여금 관리형토지신탁에 따른 우선수익권 등을 담보로 설정하였습니다. 당사는 마곡 컨소시엄제일차(주)의 연대보증인으로서 대출약정금 1,480억원 중 당사 부담비율인 22%에 해당하는 약 326억원에 대하여 채무보증이 되어있고 보증한도는 약 423억원(당사 부담금 약 326억원의 130%)이며, 이에 대한 채무보증기간은 2023년 7월 12일부터 2026년 7월 11일까지입니다. 만일 신사옥 준공 후 부동산 경기 불황 또는 관련 정책 및 제도의 변경 등 예상치 못한 사유로 인해 부동산 담보대출 전환이 이루어지지 않거나, 당사 자체자금 창출능력이 향후에도 발생하지 않을 경우에는 당사는 채무 부담에 따른 유동성 위기가 생길 수 있습니다. 또한 신사옥 준공 이전에도 현재 예상할 수 없는 대내외적 변수로 인하여, 공사 진행에 문제가 생기거나, 부동산 PF 대주단의 대출약정서상 기한이익 상실선언 사유가 발생할 경우, 당사가 담보로 제공한 자산에 가압류 등의 조치가 취해질 수 있으며, 혹은 당사의 연대보증 의무가 발현되는 등 일시에 대규모 채무상환 부담이 생길 위험성이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. 한편, 당사는 마곡산업단지 토지 취득과 관련하여 서울경제진흥원으로부터 약 3.2억원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령취소 소송을 제넥신 등과 공동으로 진행하였고 2023년 9월 22일 1심 패소, 2024년 12월 18일 2심 패소 이후 2025년 1월 9일 불복하기 위한 상고심을 제기하였습니다. 현재 동 소송의 전망은 예측할 수 없습니다. 이와 같은 법률 분쟁은 통상적으로 장기간에 걸쳐 진행되며, 사안에 따라 매우 큰 규모의 분쟁이 될 경우 큰 규모의 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
당사는 연대보증인으로서, 2026년 3월 건물이 준공된 후 PF 대출금 상환을 위해 상기 신사옥 및 연구센터를 담보로 하는 금융기관 담보대출로 전환하여 2026년부터 향후 10년 간 연간 약 32억원씩 상환할 계획입니다. 또한, 당사에서 목표하고 있는 코로나19 백신 매출 및 CMO 매출 등 자체 자금에 따른 수익 또한 상환재원으로 충당할 계획을 가지고 있습니다.
(후략)
(주9) 정정 후
| [마. 신사옥 준공 관련 채무부담, 우발채무 및 그 외 유형자산 관련 위험] 당사는 토지 재평가이익을 기타포괄손익으로 인식함에 따라 2023년말 자본총계가 증가한 효과가 발생했으며, 만일 재평가이익을 인식하지 않았다면 2023년말 기준 당사 자본총계 대비 법인세비용차감전순손실 비중은 40%를 초과하는 수준입니다. 이는 코스닥시장 관리종목 지정요건의 기준점인 50%에 근접한 수준일만큼, 투자자 여러분들께서는 당사 자본규모 대비 법인세비용차감전순손실 발생 비중이 크게 발생하고 있는 점을 유의하여 주시기 바랍니다. 한편, 당사는 2023년 7월 7일 이사회 결의를 통해 마곡 대규모 산업클러스터 단지 내 신사옥 및 기존 서울 및 성남 연구소를 통합한 R&D 센터를 구축하여 업무 효율성 증대와 미래 성장기반을 확보하고자 약 237억원의 투자를 결정하였습니다. 이를 위해 당사를 포함해 3개社(당사 22%, (주)제넥신 28%, (주)프로젠 50%)가 포함된 마곡컨소시엄제일차(주)(부동산 PF 대출의 차주인 SPC입니다)는 채권자인 하나캐피탈(주) 외 11곳으로부터 대출약정금 1,480억원을 확보하였으며, 채권자로 하여금 관리형토지신탁에 따른 우선수익권 등을 담보로 설정하였습니다. 당사는 마곡 컨소시엄제일차(주)의 연대보증인으로서 대출약정금 1,480억원 중 당사 부담비율인 22%에 해당하는 약 326억원에 대하여 채무보증이 되어있고 보증한도는 약 423억원(당사 부담금 약 326억원의 130%)이며, 이에 대한 채무보증기간은 2023년 7월 12일부터 2026년 7월 11일까지입니다. 만일 신사옥 준공 후 부동산 경기 불황 또는 관련 정책 및 제도의 변경 등 예상치 못한 사유로 인해 부동산 담보대출 전환이 이루어지지 않거나, 당사 자체자금 창출능력이 향후에도 발생하지 않을 경우에는 당사는 채무 부담에 따른 유동성 위기가 생길 수 있습니다. 또한 신사옥 준공 이전에도 현재 예상할 수 없는 대내외적 변수로 인하여, 공사 진행에 문제가 생기거나, 부동산 PF 대주단의 대출약정서상 기한이익 상실선언 사유가 발생할 경우, 당사가 담보로 제공한 자산에 가압류 등의 조치가 취해질 수 있으며, 혹은 당사의 연대보증 의무가 발현되는 등 일시에 대규모 채무상환 부담이 생길 위험성이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. 한편, 당사는 마곡산업단지 토지 취득과 관련하여 서울경제진흥원으로부터 약 3.2억원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령취소 소송을 제넥신 등과 공동으로 진행하였고 2023년 9월 22일 1심 패소, 2024년 12월 18일 2심 패소 이후 2025년 1월 9일 불복하기 위한 상고심을 제기하였습니다. 현재 동 소송의 전망은 예측할 수 없습니다. 이와 같은 법률 분쟁은 통상적으로 장기간에 걸쳐 진행되며, 사안에 따라 매우 큰 규모의 분쟁이 될 경우 큰 규모의 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
(중략)
당사는 연대보증인으로서, 2026년 3월 건물이 준공된 후 PF 대출금 상환을 위해 상기 신사옥 및 연구센터를 담보로 하는 금융기관 담보대출로 전환하여 2026년부터 향후 10년 간 연간 약 32억원씩 상환할 계획입니다. 또한, 당사에서 목표하고 있는 코로나19 백신 매출 및 CMO 매출 등 자체 자금에 따른 수익 또한 상환재원으로 충당할 계획을 가지고 있습니다.
다만 코로나백신 상업화가 되지 않을 경우 당사는 유동성이 부족하여 신규 자금 조달이 이루어지지 않는다면, PF 대출금 상환이 어려울 수 있습니다. CMO 매출 및 이커머스 매출 분야에서 양(+)의 현금흐름이 발생하거나, 또는 Celivax 기술이전 등이 이루어져야 당사의 자체 자금으로 상환이 가능할 것으로 예상되나, 아직까지도 CMO 및 이커머스 분야에서 현금흐름 창출능력이 부족한 상태이며, 기술이전 가능성은 예측하기 어렵습니다. 결국 당사의 다양한 방면의 현금 확보 노력에도 불구하고, 현 시점에서 코로나백신 상업화에 실패하거나, 장기간 지연될 경우에는 당사는 향후 PF 대출금 상환 능력을 보유하기 어려울 수 있습니다. 따라서 신규 자금조달 등 지속적 투자 유치를 받는 것이 당사와 같이 실적이 부족하고, 연구개발에 비용을 쓰고 있는 기업들의 유일한 방안이라고 생각되는 것이 현실입니다. 따라서 당사는 PF 상환에 차질이 없도록 신규 투자 유치 활동에 보다 노력하려고 합니다. 신규 투자 유치마저 불가능하다면 당사는 심각한 유동성 위기에 처할 수 있음을 투자자 여러분들께서는 다시 한번 유의하여 주시기 바랍니다.
(후략)
(주10) 정정 전
|
[사. 잦은 자금조달 관련 위험] |
(중략)
이에 140억원은 2021년까지 성남 GMP센터 구축을 위한 시설자금으로 모두 사용하였습니다. 한편 마곡 지구는 연구거점 일원화를 위한 기업부설연구소와 사무공간 활용 목적의 사옥으로 용도를 변경하여 투자하게 되었으며, 이는 부동산 PF 구조를 활용하여 진행 중인 상태입니다. 현재 마곡 신사옥은 2023년 7월 건축공사를 본격적으로 진행하여 2026년 3월 준공 뒤 2026년 4월에 입주할 예정입니다. (주1)
| (주1) | 마곡 신사옥 관련 내용은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-마" 부분을 참고하여 주시기 바랍니다. |
(중략)
당사가 최초 계획했던 파이프라인의 중요도 및 우선순위는 변동된 바 없으며, 실제 조달된 금액을 상기와 같이 배분해서 집행할 계획을 세우게 되었으며, 2024년 말까지 본사업 부분의 파이프라이별 자금 사용내역은 다음과 같습니다.
| [본사업 사용 내역] |
| (단위 : 천원) |
| 구분 | 자금용도 | 세부내용 | 7월 | 8월 | 9월 | 10월 | 11월 | 12월 | 합계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 2,321,565 | 4,903,031 | 883,188 | 1,674,696 | 1,906,868 | 1,262,647 | 12,951,995 |
| BVAC-C | 26,934 | 42,877 | 171,557 | 8,680 | 6,745 | 5,573 | 262,366 | |||
| BVAC-E6E7 | 19,040 | 32,304 | 0 | 93,328 | 10,207 | 90,569 | 245,448 | |||
| 합계 | 2,367,539 | 4,978,212 | 1,054,745 | 1,776,704 | 1,923,820 | 1,358,789 | 13,459,809 | |||
| (자료) | 당사 사업보고서, 당사 제시자료 및 회계법인 실사자료 |
실제 자금사용내역은 다음과 같습니다.
| [주주배정 후 실권주 일반공모 유상증자 모집금액의 실제 사용내역] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 24년 3분기 | 24년 4분기 | 25년 1분기 | 25년 2분기 | 25년 2분기 이후 | 합계 | |
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 8,108 | 4,844 | 12,952 | |||
| BVAC-C | 241 | 21 | 262 | ||||||
| BVAC-E6E7 | 51 | 194 | 245 | ||||||
| 잔여공모자금 | - | - | 0 | ||||||
| 수수료 지급 | 유상증자 수수료 외 | 401 | - | 401 | |||||
| 기타자금사용 | 이커머스 외 | 521 | (25) | 496 | |||||
| 합계 | 9,322 | 5,034 | 14,356 | ||||||
| (자료) | 당사 사업보고서, 당사 제시자료 및 회계법인 실사자료 |
당사는 주주배정 후 실권주 일반공모 유상증자로 조달한 금액 약 232억원 중 2024년말까지 유상증자 수수료 및 각 파이프라인별 연구개발비 등의 운영자금 용도로 약 144억원을 집행하였습니다. 잔여금액은 조달 용도에 맞게 각 파이프라인별 연구개발비 등 운영자금으로 사용할 예정입니다. 현재 2025년 1분기 실제 자금 사용 내역은 집계 중이며, 추후 집계 및 회계법인의 실사가 완료되는대로 공시할 예정입니다.
(후략)
(주10) 정정 후
|
[사. 잦은 자금조달 관련 위험] |
(중략)
이에 140억원은 2021년까지 성남 GMP센터 구축을 위한 시설자금으로 모두 사용하였습니다. 한편 마곡 지구는 연구거점 일원화를 위한 기업부설연구소와 사무공간 활용 목적의 사옥으로 용도를 변경하여 투자하게 되었으며, 이는 부동산 PF 구조를 활용하여 진행 중인 상태입니다. 현재 마곡 신사옥은 2023년 7월 건축공사를 본격적으로 진행하여 2026년 3월 준공 뒤 2026년 4월에 입주할 예정입니다. (주1)
| (주1) | 마곡 신사옥 관련 내용은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-마" 부분을 참고하여 주시기 바랍니다. |
구체적으로 당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
특히, 당사가 독자적으로 연구중인 셀리벡스 플랫폼등은 환자에게 분리된 세포를 신속하게 원하는 시간에 신속히 제조를 해야하는 특징을 가지고 있으나 자체 GMP 시설을 운영하지 않으면 원하는 시간에 생산할 수 없습니다. 2022년 이전에는 타 회사 CDMO를 활용하였으나, 스케줄링 등이 원활하지 않아 임상속도 등에 어려움이 많았습니다. 게다가, 당사의 품목인 셀리벡스 플랫폼은 유전자 치료제와 세포 치료제 두 분야를 이해하고 전문적으로 다루어야 가능한 특성을 가지고 있으며, 대부분 세포 치료제 기반인 완제의약품(Drug product)는 한국에서 연구하거나 제조 할 수 있는 업체는 많으나 유전자 치료제 기반인 원료의약품(Drug substract)인 벡터를 직접 연구하고 제조할 수 있는 업체는 상대적으로 드문 상황입니다. 이러한 신속성 및 전문성을 갖춘 당사의 GMP 센터가 대형병원과 가까운 유리한 위치에 가용한 공간을 만들어 두어 당사 자체 파이프라인 뿐만 아니라 CDMO 사업을 통해 매출을 발생시키고 위해 노력하고 있습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
당사는 마곡사옥이 완공되면 연구개발시설 및 인원의 집중을 계획하고 있으나, 성남GMP에 연구시설을 배제하려는 계획은 아닙니다. 마곡에 연구개발시설을 집중하되, 성남GMP에 연구개발시설을 이원화하여 운영할 계획입니다. 당사의 연구소는 기초연구를 담당하는 신약탐색팀, 중개연구팀이 있으며, 기초연구와 공정연구를 담당하는 벡터공정팀, 완제공정팀이 있습니다. 또한, 성남은 국내 빅5 대형병원에서 약20km 거리에 위치하여 암환자의 치료 및 맞춤형 백신제조에 이점을 가지고 있습니다. 마곡의 연구를 중심으로 성남GMP에서도 관련 연구를 진행하는 이원화를 통해 연구개발에 집중할 계획입니다.
하지만 당사의 CMO 매출은 2022년도 480백만원, 2024년도 358백만원으로 총 838백만원이 발생하였으나, 이는 기대에 미치지 못하는 수치입니다. 또한 현재 대부분의 GMP 시설 장비는 유휴설비로 판단되며, 추후 충분한 CMO 매출이 발생하지 못하면 매출 없이 감가상각비만 증가하는 등 당사의 재무 상황이 악화될 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
(중략)
당사가 최초 계획했던 파이프라인의 중요도 및 우선순위는 변동된 바 없으며, 실제 조달된 금액을 상기와 같이 배분해서 집행할 계획을 세우게 되었으며, 2025년 1분기말까지 본사업 부분의 파이프라이별 자금 사용내역은 다음과 같습니다.
| [본사업 사용 내역] |
| (단위 : 천원) |
| 구분 | 자금용도 | 세부내용 | 7월 | 8월 | 9월 | 10월 | 11월 | 12월 | 25년 1월 | 25년 2월 | 25년 3월 | 합계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 2,321,565 | 4,903,031 | 883,188 | 1,674,696 | 1,906,868 | 1,262,647 | 3,753,040 | 2,506,311 | 1,246,767 | 20,458,113 |
| BVAC-C | 26,934 | 42,877 | 171,557 | 8,680 | 6,745 | 5,573 | 105,893 | 151,056 | 48,475 | 567,790 | |||
| BVAC-E6E7 | 19,040 | 32,304 | 0 | 93,328 | 10,207 | 90,569 | 0 | 0 | 21,851 | 267,299 | |||
| 합계 | 2,367,539 | 4,978,212 | 1,054,745 | 1,776,704 | 1,923,820 | 1,358,789 | 3,858,933 | 2,657,367 | 1,317,093 | 21,293,202 | |||
| (자료) | 당사 사업보고서, 당사 제시자료 및 회계법인 실사자료 |
실제 자금사용내역은 다음과 같습니다.
| [주주배정 후 실권주 일반공모 유상증자 모집금액의 실제 사용내역] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 24년 3분기 | 24년 4분기 | 25년 1분기 | 25년 2분기 | 25년 2분기 이후 | 합계 | |
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 8,108 | 4,844 | 7,506 | 20,458 | ||
| BVAC-C | 241 | 21 | 305 | 567 | |||||
| BVAC-E6E7 | 51 | 194 | 22 | 267 | |||||
| 잔여공모자금 | - | - | - | - | |||||
| 수수료 지급 | 유상증자 수수료 외 | 401 | - | - | 401 | ||||
| 기타자금사용 | 이커머스 외 | 521 | (25) | (496) | - | ||||
| 합계 | 9,322 | 5,034 | 7,337 | 21,693 | |||||
| (자료) | 당사 사업보고서, 당사 제시자료 및 회계법인 실사자료 |
당사는 주주배정 후 실권주 일반공모 유상증자로 조달한 금액 약 232억원 중 2025년1분기말까지 유상증자 수수료 및 각 파이프라인별 연구개발비 등의 운영자금 용도로 약 217억원을 집행하였습니다. 잔여금액은 조달 용도에 맞게 각 파이프라인별 연구개발비 등 운영자금으로 사용할 예정입니다.
(후략)
(주11) 정정 전
IV. 인수인의 의견(분석기관의 평가의견)
(중략)
3. 기업실사 일정 및 주요 내용
| 일자 | 실사내용 |
|---|---|
| 2025-02-20 |
* 발행회사 방문 - 자금조달 목적 등 발행회사 의견 청취 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 주요 사항 및 일정 체크 - 유상증자 상세 일정 등 업무 협의 |
| 2025-02-21 ~ 2025-03-05 |
* 발행회사 및 해당 산업 조사 - 회사 정관 등 기본자료 수령 - 공시 및 뉴스 내용 등을 통한 발행회사 및 산업 이해 - 경영진 평판 리스크 검토 - 관련 Q&A 등 * 유상증자 리스크검토 - 발행시장 상황, 자금조달규모 적정성공모가액 희망 할인율 검토 |
| 2025-03-06 ~ 2025-03-14 |
* 발행회사 방문 및 보고서 작성 * Due-diligence checklist에 따라 투자위험요소 실사 1) 사업위험관련 실사 - 영위중인 사업 등에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 - 최대주주의 지분율 및 경영권 안정성 검토 - 주요 계정과목별 재무수치 변동요인 검토 - 원장 및 각종 명세서 등 검토 - 주요 계약관련 계약서 및 등의 확인 - 각 부서 주요 담당자 인터뷰 * 주요 경영진 면담 - 경영진 평판 리스크 검토 - 자금 사용 목적 등에 관한 청취 |
| 2025-03-15 ~ 2025-03-19 |
* 실시간 실사자료 요청 및 확인/검토 * 증권신고서 작성에 대한 조언 * 이사회의사록 검토/인수계약서 작성 및 검토 |
| 2025-03-20 ~ 2025-04-02 |
* 자진 기재정정 내용 관련 실사자료 요청 및 확인/검토 - Covid19 시장규모 관련 리서치 - 신규 진출한 이머커머스사업 계획 관련 상세내용 - 면역항암제 파이프라인 현황 및 계획 등 상세내용 확인 - 자금사용목적상 예산 수립과정 확인 - 기타 정정내용 관련 주요 경영진 면담 및 실사자료 확인 * 증권신고서 작성에 대한 조언 및 검토 |
4. 기업실사 참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 엘에스증권(주) | 기업금융2팀 | 안종섭 | 팀장 | 기업실사 총괄 | 2025년 02월 20일 ~ 2025년 04월 02일 |
기업금융업무 등 13년 |
| 엘에스증권(주) | 기업금융2팀 | 문재준 | 선임매니저 | 실사책임 및 검토 | 2025년 02월 20일 ~ 2025년 04월 02일 |
기업금융업무 등 9년 |
| 엘에스증권(주) | 기업금융2팀 | 유한종 | 선임매니저 | 기업실사 및 서류작성 등 | 2025년 02월 20일 ~ 2025년 04월 02일 |
기업금융업무 등 5년 |
[ 발행회사 ]
| 소속 | 부서 | 성명 | 직책 | 담당업무 |
|---|---|---|---|---|
| (주)셀리드 | 경영지원실 | 김민수 | 상무 | 발행업무 총괄 |
| (주)셀리드 | 경영지원실 | 황대혁 | 팀장 | 실사대응 및 서류작성 |
| (주)셀리드 | 경영지원실 | 최가영 | 사원 | 실사대응 및 서류작성 |
| (주)셀리드 | 경영지원실 | 김유진 | 사원 | 실사대응 및 서류작성 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 엘에스증권(주)는 (주)셀리드가 2025년 03월 18일 이사회에서 결의한 기명식 보통주 8,400,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이를 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 |
▶ 글로벌 면역항암제 시장은 암 유병률은 줄고 유병자 수가 늘어나면서 지속적으로 빠르게 성장할 것으로 예상되고 있습니다. 글로벌 리서치 기관인 The Business Research Company 자료에 따르면 글로벌 면역항암제 시장 규모는 인구 증가와 고령화에 따른 질병 유병률 증가, 기존 치료법의 한계를 개선하는 치료방식, 이에 따른 해당 시장에 대한 관심 및 R&D 활동의 증가로 2024년 942억 달러에서 연 평균 9.4% 성장(2024-2029)하여 2029년에는 1,532억 달러에 이를 것으로 전망됩니다. 특히 항암제 중 면역항암제는 과거 약물보다 부작용이 적고 안전하게 쓸 수 있다는 장점이 있어 시장이 확대될 것으로 예상됩니다.
|
| 부정적 요인 |
▶ BIO(Biotechnology Innovation Organization), Informa, QLS(Quantitative Life Sciences)에서 발간한 보고서에 따르면, 2011~2020년 간 임상 1상 단계의 후보물질이 최종적으로 미국 FDA의 허가를 득하고 시장에 출시될 확률(LOA)은 7.9%에 불과합니다. 그중 자가면역질환의 경우 11%,내분비질환의 경우 7% 수준인데 반해 항암제는 5% 수준으로 전체 분야에서 가장 낮은 성공 확률을 보이는 것으로 나타납니다. 의약품 개발 시 임상2상 단계가 가장 성공률이 낮아 임상 2상 후보물질의 28.9%만이 다음 개발 단계로 진행되고 있습니다. 전체 항암제 중에서는 면역항암치료제의 LOA가 12.4%로 허가 확률이 높은 편에 해당되며, 평균적으로 임상 1상부터 품목허가까지 10.5년이 소요되고 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 주요 파이프라인별 연구개발비 등 운영자금으로 활용할 계획입니다. 동사는 아직 매출이 부진한 상태로서 자체 영업현금흐름 창출 능력이 낮기 때문에, 향후 계속기업으로서의 존속을 위하여 임상 진행 중인 파이프라인의 연구개발 성과가 가시화되어야 하는 상황에 처해있으며, 이는 대규모 연구개발비의 지출을 수반해야 합니다. 이를 위해 본 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 동사는 2023년 9월에는 주주우선공모 방식의 신주 발행을 통해 운영자금 17,481백만원의 자금을 자본으로 조달하였으나, 이는 당시 최초에 목표했던 조달금액 400억원에 한참 미치지 못한 수준이므로, 현재 추가적인 자금 및 자본의 동시 확충이 반드시 필요한 상황이었습니다. 이에 2024년 8월에는 주주배정 후 실권주 일반공모 방식의 유상증자 신주 발행을 통해 운영자금 23,175백만원을 조달하였습니다. 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하였으며, 계획된 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 계획입니다. 이에 해당 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 등 필요한 추가 자본을 조달하고 있는 상황입니다. 따라서 금번 추가 유상증자를 통한 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 목적은 본 증권신고서 "제1부.V. 자금의 사용목적" 부분을 참고하시기 바랍니다. |
나. 대표주관회사는 실사 과정에서 발행회사로부터 각 파이프라인별 임상 진행 경과 및 향후 계획 등에 대해 관련 자료를 제공받았으며, 본 증권신고서상 기재된 내용과 상충되지 않음을 성실하게 검토하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다. 또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025. 04. 02. |
| 대표주관회사: 엘에스증권 주식회사 |
| 대표이사 김 원 규 |
(주11) 정정 후
IV. 인수인의 의견(분석기관의 평가의견)
(중략)
3. 기업실사 일정 및 주요 내용
| 일자 | 실사내용 |
|---|---|
| 2025-02-20 |
* 발행회사 방문 - 자금조달 목적 등 발행회사 의견 청취 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 주요 사항 및 일정 체크 - 유상증자 상세 일정 등 업무 협의 |
| 2025-02-21 ~ 2025-03-05 |
* 발행회사 및 해당 산업 조사 - 회사 정관 등 기본자료 수령 - 공시 및 뉴스 내용 등을 통한 발행회사 및 산업 이해 - 경영진 평판 리스크 검토 - 관련 Q&A 등 * 유상증자 리스크검토 - 발행시장 상황, 자금조달규모 적정성공모가액 희망 할인율 검토 |
| 2025-03-06 ~ 2025-03-14 |
* 발행회사 방문 및 보고서 작성 * Due-diligence checklist에 따라 투자위험요소 실사 1) 사업위험관련 실사 - 영위중인 사업 등에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 - 최대주주의 지분율 및 경영권 안정성 검토 - 주요 계정과목별 재무수치 변동요인 검토 - 원장 및 각종 명세서 등 검토 - 주요 계약관련 계약서 및 등의 확인 - 각 부서 주요 담당자 인터뷰 * 주요 경영진 면담 - 경영진 평판 리스크 검토 - 자금 사용 목적 등에 관한 청취 |
| 2025-03-15 ~ 2025-03-19 |
* 실시간 실사자료 요청 및 확인/검토 * 증권신고서 작성에 대한 조언 * 이사회의사록 검토/인수계약서 작성 및 검토 |
| 2025-03-20 ~ 2025-04-02 |
* 자진 기재정정 내용 관련 실사자료 요청 및 확인/검토 - Covid19 시장규모 관련 리서치 - 신규 진출한 이머커머스사업 계획 관련 상세내용 - 면역항암제 파이프라인 현황 및 계획 등 상세내용 확인 - 자금사용목적상 예산 수립과정 확인 - 기타 정정내용 관련 주요 경영진 면담 및 실사자료 확인 * 증권신고서 작성에 대한 조언 및 검토 |
| 2025-04-03 ~ 2025-04-15 |
* 일정 변경으로 인한 정정 이사회의사록 검토/인수계약서 작성 및 검토 * 자진 기재정정 내용 관련 실사자료 요청 및 확인/검토 - Covid19 시장규모 관련 리서치 - 긴급사용승인 제도 관련 상세내용 - 면역항암제 파이프라인 현황 및 계획 등 상세내용 확인 - 자금사용목적상 예산 수립과정 확인 - 기타 정정내용 관련 주요 경영진 면담 및 실사자료 확인 * 증권신고서 작성에 대한 조언 및 검토 |
4. 기업실사 참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 엘에스증권(주) | 기업금융2팀 | 안종섭 | 팀장 | 기업실사 총괄 | 2025년 02월 20일 ~ 2025년 04월 15일 |
기업금융업무 등 13년 |
| 엘에스증권(주) | 기업금융2팀 | 문재준 | 선임매니저 | 실사책임 및 검토 | 2025년 02월 20일 ~ 2025년 04월 15일 |
기업금융업무 등 9년 |
| 엘에스증권(주) | 기업금융2팀 | 유한종 | 선임매니저 | 기업실사 및 서류작성 등 | 2025년 02월 20일 ~ 2025년 04월 15일 |
기업금융업무 등 5년 |
[ 발행회사 ]
| 소속 | 부서 | 성명 | 직책 | 담당업무 |
|---|---|---|---|---|
| (주)셀리드 | 경영지원실 | 김민수 | 상무 | 발행업무 총괄 |
| (주)셀리드 | 경영지원실 | 황대혁 | 팀장 | 실사대응 및 서류작성 |
| (주)셀리드 | 경영지원실 | 최가영 | 사원 | 실사대응 및 서류작성 |
| (주)셀리드 | 경영지원실 | 김유진 | 사원 | 실사대응 및 서류작성 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 엘에스증권(주)는 (주)셀리드가 2025년 03월 18일 및 2025년 04월 15일 이사회에서 결의한 기명식 보통주 8,400,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이를 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 |
▶ 글로벌 면역항암제 시장은 암 유병률은 줄고 유병자 수가 늘어나면서 지속적으로 빠르게 성장할 것으로 예상되고 있습니다. 글로벌 리서치 기관인 The Business Research Company 자료에 따르면 글로벌 면역항암제 시장 규모는 인구 증가와 고령화에 따른 질병 유병률 증가, 기존 치료법의 한계를 개선하는 치료방식, 이에 따른 해당 시장에 대한 관심 및 R&D 활동의 증가로 2024년 942억 달러에서 연 평균 9.4% 성장(2024-2029)하여 2029년에는 1,532억 달러에 이를 것으로 전망됩니다. 특히 항암제 중 면역항암제는 과거 약물보다 부작용이 적고 안전하게 쓸 수 있다는 장점이 있어 시장이 확대될 것으로 예상됩니다.
|
| 부정적 요인 |
▶ BIO(Biotechnology Innovation Organization), Informa, QLS(Quantitative Life Sciences)에서 발간한 보고서에 따르면, 2011~2020년 간 임상 1상 단계의 후보물질이 최종적으로 미국 FDA의 허가를 득하고 시장에 출시될 확률(LOA)은 7.9%에 불과합니다. 그중 자가면역질환의 경우 11%,내분비질환의 경우 7% 수준인데 반해 항암제는 5% 수준으로 전체 분야에서 가장 낮은 성공 확률을 보이는 것으로 나타납니다. 의약품 개발 시 임상2상 단계가 가장 성공률이 낮아 임상 2상 후보물질의 28.9%만이 다음 개발 단계로 진행되고 있습니다. 전체 항암제 중에서는 면역항암치료제의 LOA가 12.4%로 허가 확률이 높은 편에 해당되며, 평균적으로 임상 1상부터 품목허가까지 10.5년이 소요되고 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 주요 파이프라인별 연구개발비 등 운영자금으로 활용할 계획입니다. 동사는 아직 매출이 부진한 상태로서 자체 영업현금흐름 창출 능력이 낮기 때문에, 향후 계속기업으로서의 존속을 위하여 임상 진행 중인 파이프라인의 연구개발 성과가 가시화되어야 하는 상황에 처해있으며, 이는 대규모 연구개발비의 지출을 수반해야 합니다. 이를 위해 본 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 동사는 2023년 9월에는 주주우선공모 방식의 신주 발행을 통해 운영자금 17,481백만원의 자금을 자본으로 조달하였으나, 이는 당시 최초에 목표했던 조달금액 400억원에 한참 미치지 못한 수준이므로, 현재 추가적인 자금 및 자본의 동시 확충이 반드시 필요한 상황이었습니다. 이에 2024년 8월에는 주주배정 후 실권주 일반공모 방식의 유상증자 신주 발행을 통해 운영자금 23,175백만원을 조달하였습니다. 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하였으며, 계획된 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 계획입니다. 이에 해당 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 등 필요한 추가 자본을 조달하고 있는 상황입니다. 따라서 금번 추가 유상증자를 통한 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 목적은 본 증권신고서 "제1부.V. 자금의 사용목적" 부분을 참고하시기 바랍니다. |
나. 대표주관회사는 실사 과정에서 발행회사로부터 각 파이프라인별 임상 진행 경과 및 향후 계획 등에 대해 관련 자료를 제공받았으며, 본 증권신고서상 기재된 내용과 상충되지 않음을 성실하게 검토하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다. 또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025. 04. 15. |
| 대표주관회사: 엘에스증권 주식회사 |
| 대표이사 김 원 규 |
(주12) 정정 전
V. 자금의 사용목적
(중략)
다. 유상증자 진행 배경
당사는 2024년도에 주주배정 후 실권주 일반공모 유상증자를 진행하여 AdCLD-CoV19-1 OMI 백신 임상 3상 비용 및 BVAC 파이프라인에 대한 연구개발비 등의 목적으로 약 232억원을 조달하였습니다. 하지만 국내에서 임상 대상자 수가 400명에서 1,129명으로 늘어나면서 CRO(임상수탁기관) 및 실시기관비용이 증가하였고, 계약 당시 1,350원대였던 원화 환율은 대금 지급 시점에 1,450원대까지 치솟으면서 당사의 예상보다 비용이 증가하였습니다. 게다가 2024년 유상증자 당시 임상 3상 시험의 중간분석 결과 도출 시기를 2025년 1분기로 계획하고 예상하였으나, 해외 임상시험 수행으로 현지 보건 당국의 규제 및 절차로 임상시험대상자 투여완료에 추가 시일이 발생하였고, 임상시험 승인에 베트남 6개월, 필리핀 3개월이 각각 추가 소요되었습니다.
(후략)
(주12) 정정 후
V. 자금의 사용목적
(중략)
다. 유상증자 진행 배경
당사는 2024년도에 주주배정 후 실권주 일반공모 유상증자를 진행하여 AdCLD-CoV19-1 OMI 백신 임상 3상 비용 및 BVAC 파이프라인에 대한 연구개발비 등의 목적으로 약 232억원을 조달하였습니다. 하지만 국내에서 임상 대상자 수가 400명에서 1,129명으로 늘어나면서 CRO(임상수탁기관) 및 실시기관비용이 증가하였고, 계약 당시 1,350원대였던 원화 환율은 대금 지급 시점에 1,450원대까지 치솟으면서 당사의 예상보다 비용이 증가하였습니다. 게다가 2024년 유상증자 당시 임상 3상 시험의 중간분석 결과 도출 시기를 2025년 1분기로 계획하고 예상하였으나, 해외 임상시험 수행으로 현지 보건 당국의 규제 및 절차로 임상시험대상자 투여완료에 추가 시일이 발생하였고, 임상시험 승인에 베트남 6개월, 필리핀 3개월이 각각 추가 소요되었습니다.
이에 따라 다국가 임상 3상 수행비용은 최초 계획 때 국내 약 48억원, 해외 약 111억원으로 총 159억원이었으나, 실제로는 국내 약 80억원, 해외 약 107억원으로 총 187억원이 소요되었으며, 약 2,758백만원 차이가 발생하였습니다. 2024년 증자 자금사용목적 중 다국가 임상 3상 수행비용을 위한 자금으로 11,228백만원을 편성하였으며, 이는 최초 계획 때 편성한 15,907백만원에 비해 4,679백만원이 부족한 금액입니다. 따라서 당사는 금번 증자의 자금조달 목적 중 부족한 다국가 임상 3상 수행비용 7,437백만원 중 7,214백만원을 계획하고 있으며, 나머지 금액인 223백만원은 자체 현금 등으로 충당하여 진행할 예정입니다.
| [다국가 임상 3상 수행비용 계획 및 실제내역] |
| (단위 : 백만원) |
| 최초 계획 | 실제 | ||
|---|---|---|---|
| 구분 | 금액 | 구분 | 금액 |
| 국내 | 4,782 | 국내 | 7,964 |
| 해외(베트남, 필리핀) | 11,125 | 해외(베트남, 필리핀) | 10,701 |
| 합계 | 15,907 | 합계 | 18,665 |
| (자료) | 당사 제시 |
(후략)
【 대표이사 등의 확인 】
 |
|
확인서 |
증 권 신 고 서
| ( 지 분 증 권 ) |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2025년 03월 19일 | 증권신고서(지분증권) | 최초 제출 |
| 2025년 04월 02일 | [기재정정]증권신고서(지분증권) | 기재 정정(파란색) |
| 2025년 04월 15일 | [기재정정]증권신고서(지분증권) | 기재 정정(초록색) |
| 금융위원회 귀중 | 2025년 04월 15일 |
| 회 사 명 : |
주식회사 셀리드 |
| 대 표 이 사 : |
강창율 |
| 본 점 소 재 지 : |
서울특별시 관악구 관악로 1 |
| (전 화) 02-3285-7860 | |
| (홈페이지) http://www.cellid.co.kr | |
| 작 성 책 임 자 : | (직 책) 상 무 (성 명) 김 민 수 |
| (전 화) 02-3285-7860 | |
| 모집 또는 매출 증권의 종류 및 수 : | 기명식 보통주 8,400,000주 | |
| 모집 또는 매출총액 : | 24,150,000,000 | 원 |
| 증권신고서 및 투자설명서 열람장소 |
| 가. 증권신고서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 투자설명서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : (주)셀리드 → 서울특별시 관악구 관악로 1 엘에스증권(주) → 서울특별시 영등포구 여의나루로 60 한양증권(주) → 서울특별시 영등포구 국제금융로6길 7 |
【 대표이사 등의 확인 】
 |
|
확인서._1 |
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 |
[가. 국내외 거시경기 침체 및 불확실성이 미치는 위험] [마. 면역항암제 경쟁 심화 위험] 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황에서 점차 면역세포치료제 시장 경쟁이 심화됨에 따라 당사의 항암면역치료백신 사업에 부정적인 영향을 미칠 수 있으며, 또한 새로운 치료법의 등장, 시장 환경의 변화, 신규 면역항암제 개발 등으로 글로벌 경쟁력 및 기준에 부합하지 않게 되는 경우, 당사의 사업계획 및 수익창출 등에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| 회사위험 |
[가. 매출부진 및 지속적 손실 발생 위험] [자. 정부 연구개발 과제 수행 관련 위험] 당사는 설립 이래 총 10건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하였으며, 현재 진행중인 정부 과제에 대해서도 연구 목적 및 내용 달성을 위해 성실히 수행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔으며, 기술실시 권리를 가진 기술소유권자로서 해당 기술의 사업화를 위해 노력해왔습니다. 따라서 당사는 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
|
| 기타 투자위험 |
[가. 금융감독기관의 관리감독기준 강화에 따른 위험] [바. 주식매수선택권 행사에 따른 주가 하락 위험] 향후 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 8,400,000 | 500 | 2,875 | 24,150,000,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 엘에스증권 | 보통주 | 5,040,000 | 14,490,000,000 | 기본인수수수료: 최종모집금액의 1.8% * 60% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 30억원 이하일 경우 15%, 30억원 초과 50억원 이하일 경우 18%, 50억원 초과할 경우 20% |
잔액인수 |
| 인수 | 한양증권 | 보통주 | 3,360,000 | 9,660,000,000 | 기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 30억원 이하일 경우 15%, 30억원 초과 50억원 이하일 경우 18%, 50억원 초과할 경우 20% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2025년 06월 16일 ~ 2025년 06월 17일 | 2025년 06월 24일 | 2025년 06월 18일 | 2025년 06월 24일 | 2025년 05월 08일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2025년 03월 19일 | 2025년 06월 11일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 운영자금 | 23,606,333,000 |
| 발행제비용 | 543,667,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | - |
| 【기 타】 |
1) 금번 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 엘에스증권(주)이며, 그 외 인수회사는 한양증권(주)입니다.
|
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 2025년 03월 18일 이사회 결의, 2025년 04월 15일 정정 이사회 결의(일정 변경)를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6 제2항 제1호에 의거 엘에스증권(주), 한양증권(주)와 주주배정후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 8,400,000주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 : 원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 8,400,000 | 500 | 2,875 | 24,150,000,000 | 주주배정후실권주일반공모 |
| 주1) | 이사회 결의일 : 2025년 03월 18일, 이사회결의일 : 2025년 04월 15일(일정 변경) |
| 주2) | 1주의 모집가액 및 모집총액은 예정발행가액 기준입니다. |
발행가액은 「증권의 발행 및 공시 등에 관한 규정」 제5-18조 (유상증자의 발행가액 결정)에 의거, 주주배정증자시 할인율 등이 자율화 되어 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 산정할 예정입니다.
■ 예정발행가액의 산출근거
이사회결의일 직전 거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 할인율 25%를 적용하고 증자비율을 고려하여, 아래 산식에 의하여 산정된 발행가액(예정발행가액)으로 합니다. 단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.
| 기준주가 X 【 1 - 할인율(25%) 】 | ||
| ▶ 예정발행가액 |
= | ---------------------------------------- |
| 1 + 【유상증자비율 X 할인율(25%)】 |
| [예정발행가액 산정표] 기산일 : 2025년 03월 17일 |
(단위 : 원, 주) |
| 일자 | 가중산술평균주가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2025/03/17 | 4,210원 | 323,319주 | 1,361,143,636원 |
| 2025/03/14 | 4,046원 | 172,911주 | 699,639,880원 |
| 2025/03/13 | 3,990원 | 179,409주 | 715,916,107원 |
| 2025/03/12 | 4,067원 | 169,938주 | 691,160,235원 |
| 2025/03/11 | 4,033원 | 261,674주 | 1,055,247,825원 |
| 2025/03/10 | 4,100원 | 157,856주 | 647,241,196원 |
| 2025/03/07 | 4,119원 | 274,394주 | 1,130,134,290원 |
| 2025/03/06 | 4,341원 | 328,212주 | 1,424,740,676원 |
| 2025/03/05 | 4,517원 | 211,590주 | 955,740,135원 |
| 2025/03/04 | 4,519원 | 237,197주 | 1,071,993,295원 |
| 2025/02/28 | 4,661원 | 248,139주 | 1,156,606,130원 |
| 2025/02/27 | 4,752원 | 184,765주 | 878,078,715원 |
| 2025/02/26 | 4,756원 | 330,939주 | 1,573,968,055원 |
| 2025/02/25 | 4,776원 | 492,881주 | 2,353,856,890원 |
| 2025/02/24 | 5,016원 | 1,856,147주 | 9,310,413,080원 |
| 2025/02/21 | 4,585원 | 272,703주 | 1,250,240,225원 |
| 2025/02/20 | 4,711원 | 257,733주 | 1,214,073,570원 |
| 2025/02/19 | 4,782원 | 451,541주 | 2,159,124,570원 |
| 2025/02/18 | 4,669원 | 251,974주 | 1,176,510,570원 |
| 1개월 가중산술평균주가 (A) | 4,626원 | 6,663,322주 | 30,825,829,080원 |
| 1주일 가중산술평균주가 (B) | 4,085원 | 1,107,251주 | 4,523,107,683원 |
| 기산일 가중산술평균주가 (C) | 4,210원 | 323,319주 | 1,361,143,636원 |
| A,B,C의 산술평균 (D) | 4,307원 | (A + B + C) ÷ 3 | |
| 기준주가 (E) | 4,210원 | (C와 D중 낮은 가액) | |
| 할인율 | 25.00% | - | |
| 증자비율 | 39.80% | - | |
| 예정발행가액 | 2,875원 | (기준주가 × (1-할인율)) ÷ (1 + (증자비율 × 할인율)) |
|
상기 방법에 따라 산정된 예정발행가액은 참고용이며, 구주주 청약일전 3거래일에 확정발행가액이 결정될 예정입니다.
■ 공모일정 등에 관한 사항
당사는 2025년 03월 18일 이사회를 통해 유상증자를 결의하였으며, 2025년 04월 15일 이사회를 통해 일정을 변경하였습니다. 세부 일정은 다음과 같습니다.
| [주요일정] |
| 날짜 | 업 무 내 용 | 비고 |
|---|---|---|
| 2025-03-18(화) | 이사회결의 | - |
| 2025-03-19(수) | 신주발행 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 2025-03-19(수) | 증권신고서 제출 | - |
| 2025-04-15(화) | (정정) 이사회결의 | 일정 변경 |
| 2025-04-15(화) | (정정) 증권신고서 제출 | 일정 변경 및 기재내용 자진 정정 |
| 2025-04-15(화) | (정정) 신주발행 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 2025-04-30(수) | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2025-05-07(수) | 권리락 | - |
| 2025-05-08(목) | 신주배정 기준일(주주확정) | - |
| 2025-05-21(수) | 신주배정 통지 | - |
| 2025-05-28(수) ~ 2025-06-04(수) |
신주인수권증서 상장 거래기간 | 5거래일 이상 거래 |
| 2025-06-05(목) | 신주인수권증서 상장 폐지 | 구주주 청약초일 5거래일 전 폐지 |
| 2025-06-11(수) | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2025-06-12(목) | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) 및 Dart전자공시시스템(http://dart.fss.or.kr) |
| 2025-06-16(월) ~ 2025-06-17(화) |
구주주 청약 및 초과청약 | - |
| 2025-06-18(수) | 일반공모 청약 공고 | 당사 인터넷 홈페이지 (http://www.cellid.co.kr) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) |
| 2025-06-19(목) ~ 2025-06-20(금) |
일반공모 청약 | - |
| 2025-06-24(화) | 환불 및 배정 공고 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(http://www.hygood.co.kr) |
| 2025-06-24(화) | 주금 납입 | - |
| 2025-07-07(월) | 신주유통 개시일 | - |
| 2025-07-07(월) | 신주상장 예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
2. 공모방법
| [공모방법 : 주주배정후 실권주 일반공모] |
| 모집대상 | 주식수 | 비 고 |
|---|---|---|
| 구주주 (신주인수권증서 보유자) 청약 |
8,400,000주 (100.0%) | - 구주 1주당 신주 배정비율 : 1주당 0.39804810주 - 신주배정 기준일 : 2025년 05월 08일 - 구주주 청약일 : 2025년 06월 16일 ~ 2025년 06월 17일 (2일간) - 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권증서가 배정됨) - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 청약 가능 |
| 초과 청약 | - | - 「자본시장과 금융투자업에 관한 법률」 제165조의6의 제2항 제2호에 의거 초과청약 - 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 - 초과 청약일 : 2025년 06월 16일 ~ 2025년 06월 17일 (2일간) |
| 일반공모 청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
- | - 구주주 및 초과청약 후 발생하는 단수주 및 실권주("일반공모 배정분")에 대해 배정. - 일반공모 청약일 : 2025년 06월 19일 ~ 2025년 06월 20일 (2일간) |
| 합 계 | 8,400,000주 (100.00%) | - |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.39804810주를 곱하여 산정된 배정주식수로 하되, 1주 미만은 절사합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 주식매수선택권의 권리행사, 자기주식수의 변동으로 인하여 1주당 배정주식수가 변동될 수 있습니다. |
| 주3) |
신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. (ii) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권증서의 수량 (iii) 초과청약 한도주식수 = 신주인수권증서 청약한도 주식수 X 초과청약 비율(20%) |
| 주4) |
"고위험고수익투자신탁등"이란 다음 각 호의 어느 하나에 해당하는 투자신탁 등을 말합니다. (1) 「조세특례제한법」 제91조의15 제1항에 따른 고위험고수익채권투자신탁(이하 "고위험고수익채권투자신탁"이라 함). 다만, 해당 투자신탁 등의 최초 설정일ㆍ설립일이 속하는 분기 또는 그 다음 분기 말일 전 배정하는 경우에는 같은 법 시행령 제93조 제1항 제1호 및 같은 조 제5항에도 불구하고 배정일 직전 영업일의 고위험고수익채권의 보유비율이 같은 법 시행령 제93조 제1항 제1호 각 목의 비율 이상이어야 합니다. (2) 법률 제19328호「조세특례제한법」의 시행일 이전의 제91조의15제1항에 따른 고위험고수익투자신탁(이하 "고위험고수익투자신탁"이라 함)으로서 최초 설정일ㆍ설립일이 2023년 12월 31일 이전인 것을 말합니다. 다만, 해당 투자신탁 등의 설정일ㆍ설립일부터 배정일까지의 기간이 6개월 미만일 경우에는 대통령령 제33499호 같은 법 시행령 시행일 이전의 제93조 제3항 제1호 및 같은 조 제7항에도 불구하고 배정일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다.. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 배정일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 배정일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35이상이어야 합니다. |
| 주6) |
일반공모 청약 : "구주주" 청약(초과청약 포함) 결과 발생한 미청약주식 및 단수주는 대표주관회사와 인수회사가 일반에게 공모하되「증권 인수업무 등에 관한 규정」 제9조 제2항 제6호에 따라 "고위험고수익투자신탁등"에 일반공모 배정분의 10%를 배정하고, "벤처기업투자신탁"에 일반공모 배정분의 25%를 배정합니다. 나머지 주식은 개인청약자 및 기관투자자에 구분없이 배정합니다. "고위험고수익투자신탁등"에 대한 일반공모 배정분 10%, "벤처기업투자신탁"에 대한 일반공모 배정분 25% 및 개인투자자 및 기관투자자에 대한 일반공모 배정분 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만 한 그룹만 청약미달이 발생할 경우 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. 일반공모에 관한 배정수량 계산시 대표주관회사와 인수회사의 청약물량(대표주관회사와 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미하며 대표주관회사와 인수회사에 대하여 개별적으로 산정한 청약주식수를 말한다)에 대해서는 대표주관회사와 인수회사의 총 청약물량(대표주관회사와 인수회사가 일반공모 방식으로 접수를 받은 청약물량의 합을 말한다)을 "일반공모 배정분" 주식수로 나눈 통합청약경쟁률에 따라 대표주관회사와 인수회사의 각 청약자에 배정하는 방식(이하 통합배정이라 한다)으로 합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사"가 합리적으로 판단하여 배정합니다. 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정합니다. 배정결과 발생하는 잔여주식은 "대표주관회사"와 "인수회사"가 각 인수의무비율대로 자기계산으로 잔액인수하기로 합니다. |
| 주7) | 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다. |
| 주8) |
자본시장법 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2025년 03월 19일부터 2025년 06월 11일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
※ 참고 : 구주주 1주당 배정비율 산출 근거
| 구 분 | 상세 내역 |
|---|---|
| A. 보통주식 | 21,102,977 |
| B. 우선주식 | - |
| C. 발행주식총수(A+B) | 21,102,977 |
| D. 자기주식 + 자기주식신탁 | - |
| E. 자기주식을 제외한 발행주식총수 (C-D) | 21,102,977 |
| F. 유상증자 주식수 | 8,400,000 |
| G. 증자비율 (F/C) | 39.80% |
| H. 우리사주조합 배정 | - |
| I. 구주주배정 (F-H) | 8,400,000 |
| J. 구주주 1주당 배정비율 (I/E) | 0.39804810 |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」 제5-18조에 의거 주주배정 증자시 가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
가. 1차 발행가액: 신주배정기준일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가, 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용하고 증자비율을 고려하여, 아래의 산식에 의하여 산정된 발행가액(1차 발행가액)으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
▶ 1차 발행가액 = 기준주가 × (1-할인율) / [1 + (증자비율 × 할인율)]
나. 2차 발행가액: 구주주 청약일 전 제 3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용, 아래의 산식에 의하여 산정된 발행가액(2차 발행가액)으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
▶ 2차 발행가액 = 기준주가 × (1-할인율)
다. 확정 발행가액: 확정 발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 한다. 다만 「자본시장법」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은 가액이 구주주 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가를 기준주가로 하여 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. 단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만일 경우에는 액면가액을 발행가액으로 합니다.
▶ 확정 발행가액 = MAX【MIN(1차 발행가액, 2차 발행가액), 기준주가의 60%】
* 기준주가= 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가
라. 최종 발행가액은 구주주 청약초일 전 제3거래일(2025년 06월 11일(수) 예정)에 결정되어 금융감독원 전자공시시스템에 2025년 06월 12일(목)에 공시될 예정이며, 회사의 인터넷 홈페이지(http://www.cellid.co.kr)에 공고하여 개별통지에 갈음할 예정입니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 8,400,000 | |||||||||||||||||||||||||||||||||||
| 주당 모집가액 | 예정가액 | 2,875 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 모집총액 | 예정가액 | 24,150,000,000 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
(1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수로 합니다. 다만, 신주배정기준일 현재 신주배정율은 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 변경될 수 있습니다(단, 1주 미만은 절사한다).
|
|||||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 | 개시일 | 2025년 06월 16일 | |||||||||||||||||||||||||||||||||
| 종료일 | 2025년 06월 17일 | |||||||||||||||||||||||||||||||||||
| 실권주 일반공모 | 개시일 | 2025년 06월 19일 | ||||||||||||||||||||||||||||||||||
| 종료일 | 2025년 06월 20일 | |||||||||||||||||||||||||||||||||||
| 청약 증거금 |
구주주 | 청약금액의 100% | ||||||||||||||||||||||||||||||||||
| 초 과 청 약 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 납 입 기 일 | 2025년 06월 24일 | |||||||||||||||||||||||||||||||||||
| 배당기산일(결산일) | 2025년 01월 01일 | |||||||||||||||||||||||||||||||||||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
|---|---|---|
| 신주 발행 및 배정기준일(주주확정일) 공고 |
2025년 03월 19일, 2025년 04월 15일 |
회사 인터넷 홈페이지 (http://www.cellid.co.kr) |
| 모집가액 확정의 공고 | 2025년 06월 12일 | 회사 인터넷 홈페이지 (http://www.cellid.co.kr) 전자공시시스템(http://dart.fss.or.kr) |
| 실권주 일반공모 청약공고 | 2025년 06월 18일 | 회사 인터넷 홈페이지 (http://www.cellid.co.kr) 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) |
| 실권주 일반공모 배정공고 | 2025년 06월 24일 | 엘에스증권(주) 홈페이지(http://www.ls-sec.co.kr) 한양증권(주) 홈페이지(www.hygood.co.kr) |
| 주1) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
| 주2) | 모집가액은 2025년 6월 11일을 기준으로 확정되며, 다음 영업일인 2025년 6월 12일까지 공고할 예정입니다. |
| 주3) | 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 및 인수회사 홈페이지에 게시함으로써 개별통지에 갈음합니다. |
| 주4) | 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 일간 매일경제신문에 게재할 예정입니다. |
2) 청약방법
가) 구주주 청약(신주인수권증서 보유자 청약): 구주주 중 주권을 증권회사에 예탁한 주주(기존 "실질주주")는 주권을 예탁한 증권회사의 본/지점 및 대표주관회사의 본/지점에서 청약할 수 있습니다. 다만, 구주주 중 명의개서대행기관 특별계좌에 주식을 가지고 있는 주주(기존 "명부주주")는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 대표주관회사의 본/지점에서 청약할 수 있습니다. 청약시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출하여야 합니다.
| 2019년 9월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 엘에스증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
|
「주식ㆍ사채 등의 전자등록에 관한 법률」 |
나) 신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도 주식수의 20%를 추가로 청약할 수 있습니다. 이때, 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
다) 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자는 「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약합니다. 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자의 청약 시, 각 청약처별로 다중청약은 가능하나, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구를 제외한 청약자의 한 개 청약처에 대한 복수청약은 불가능합니다. 또한 고위험고수익투자신탁등은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제18호에 따른 요건을 충족함을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다. 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제20호에 따른 요건을 충족하고, 제9조제10항에 따른 확약서 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
라) 일반청약자의 청약은 청약주식의 단위에 따라 될 수 있으며, 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 하고 청약사무 취급처는 그 차액을 납입일까지 당해 청약자에게 반환하며, 이때 받은 날부터의 이자는 지급하지 않습니다.
마) 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」 제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제 132조에 따라 투자설명서의 교부가 면제되는자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다.
바) 「자본시장법과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 의거, 2025년 03월 18일부터 2025년 06월 11일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집(매출)가액 의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항에 해당할 경우에는 공매도하거나 공매도 주문을 위탁하더라도 금번 모집(매출)에 따른 주식을 취득할 수 있으며, 세부적인 동법 시행령 제208조의4제2항의 내용은 하기와 같습니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우(매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
엘에스증권(주) 본ㆍ지점 | 2025년 06월 16일~ 2025년 06월 17일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 당사 주식을 예탁하고 있는 당해 증권회사 본ㆍ지점 2) 엘에스증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
1) 엘에스증권(주) 본ㆍ지점 2) 한양증권(주) 본ㆍ지점 |
2025년 06월 19일~ 2025년 06월 20일 |
|
4) 청약결과 배정방법
가) 구주주(신주인수권증서 보유자) 청약 : 신주배정기준일(2025년 05월 08일 예정) 18시 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 본 주식을 1주당 0.39804810주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 신주배정기준일 이후 신주인수권증서의 매매를 통해 신주인수권증서를 보유한 자는 보유한 신주인수권증서 수량을 한도로 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 행사, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
나) 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주 및 단수주가 있는 경우, 실권주 및 단수주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율 : 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다.(단, 초과청약 주식수가 실권주 및 단수주에 미달한 경우 100% 배정)
(ⅰ) 청약한도 주식수 = 신주인수권증서 청약한도 주식수 + 초과청약한도 주식수
(ⅱ) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권증서의 수량
(ⅲ) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 × 초과청약 비율(20%)
다) 일반공모 청약:
(1) 상기 구주주 청약 및 초과청약 결과 발생한 실권주 및 단수주(이하 "일반공모 배정분"이라 한다)는 대표주관회사와 인수회사가 일반에게 공모하되, '증권 인수업무 등에 관한 규정' 제9조 제2항 제6호에 따라 "고위험고수익투자신탁등"에 공모주식의 10%를 배정하고, 벤처기업투자신탁에 공모주식의 25%를 배정합니다. 나머지 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자 포함)에게 구분 없이 배정합니다. 각 그룹에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 어떤 그룹에 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
(2) 일반공모에 관한 배정수량 계산시 대표주관회사와 인수회사의 "청약물량"(대표주관회사와 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미하며, 대표주관회사와 인수회사에 대하여 개별적으로 산정한 청약주식수를 말한다)에 대해서는 대표주관회사와 인수회사의 총청약물량(대표주관회사와 인수회사가 일반공모 방식으로 접수를 받은 청약물량의 합을 말한다)을 일반공모 배정분 주식수로 나눈 통합 청약경쟁률에 따라 대표주관회사와 인수회사의 각 청약자에 배정하는 방식(이하 "통합배정"이라 한다)으로 합니다.
(3) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사"와 "인수회사"가 합리적으로 판단하여 배정합니다.
(4) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정하며, 배정결과 발생하는 잔여주식은 "대표주관회사", "인수회사"가 인수의무비율에 따라 각각 자기의 계산으로 인수합니다.
[인수계약 내용에 따른 대표주관회사 및 인수회사의 인수의무비율]
| 구분 | 인수의무비율 | |
|---|---|---|
| 대표주관회사 | 엘에스증권 주식회사 | 60.00% |
| 인수회사 | 한양증권 주식회사 | 40.00% |
| 합 계 | 100.00% | |
(5) 단, "증권 인수업무 등에 관한 규정" 제9조 제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁, 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고, 대표주관회사가 단독으로 자기계산으로 인수하거나 대표주관회사 및 인수회사가 각 인수의무비율대로 자기계산으로 인수할 수 있습니다.
5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」 제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 당사 및 대표주관회사, 인수회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- "본 주식”에 청약하고자 하는 투자자("자본시장과 금융투자업에 관한 법률" 제9조 제5항에 규정된 전문투자자 및 "자본시장과 금융투자업에 관한 법률 시행령" 제132조에 따라 투자설명서의 교부가 면제되는 자 제외)는 청약 전 투자설명서를 교부받아야 합니다. 단, 투자설명서 수령거부의사표시는 서면, 전화, 전신, 팩스, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 가능합니다.
-전자문서의 방법으로 투자설명서를 교부받고자 하는 투자자는 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각호의 요건을 모두 충족하여야 합니다.
가) 투자설명서 교부 방법 및 일시
| 구분 | 교부방법 | 교부일시 |
|---|---|---|
| 구주주 청약자 |
1),2),3)을 병행 1) 등기우편 송부 2) "대표주관회사"의 본, 지점 교부 3) "대표주관회사"의 홈페이지나 HTS, MTS에서 교부 |
1) 우편송부 시: 구주주 청약초일인 2025년 06월 16일 전 수취 가능 2) "대표주관회사"의 본, 지점 : 청약종료일(2025년 06월 17일)까지 3) "대표주관회사"의 홈페이지 또는 HTS, MTS 교부 : 청약종료일(2025년 06월 17일)까지 |
| 일반 청약자 |
1), 2)를 병행 1) "대표주관회사" 및 "인수회사"의 본, 지점에서 교부 2) "대표주관회사" 및 "인수회사"의 홈페이지나 HTS, MTS 에서 교부 |
1) "대표주관회사" 및 "인수회사"의 본, 지점 : 청약종료일(2025년 06월 20일)까지 2) "대표주관회사" 및 "인수회사"의 홈페이지 또는 HTS, MTS 교부: 청약종료일(2025년 06월 20일)까지 |
※ 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
나) 확인절차
(1) 우편을 통한 투자설명서 수령 시
(가) 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
(나) HTS 또는 MTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
(2) 지점 방문을 통한 투자설명서 수령 시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
(3) 홈페이지 또는 HTS, MTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
다) 기타
(1) 금번 유상증자에서 당사는 본 증권신고서의 효력발생 이후 주주명부상 주주분들에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는 지점 방문을 통해 인쇄물을 받으실 수 있으며, 또한 동일한 내용의 투자설명서를 전자문서의 형태로 대표주관회사의 홈페이지에서 다운로드 받으실 수 있습니다. 다만, 전자문서의 형태로 교부 받으실 경우, 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각 호의 요건을 모두 충족해야만 청약이 가능합니다.
(2) 구주주 청약 시 대표주관회사 이외의 증권회사를 이용한 청약 방법
- 해당 증권회사의 청약 방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
| ※ 관련법규 「자본시장과 금융투자업에 관한 법률」 제9조 (그 밖의 용어의 정의) ⑤ 이 법에서 "전문투자자"란 금융투자상품에 관한 전문성 구비 여부, 소유자산규모 등에 비추어 투자에 따른 위험감수능력이 있는 투자자로서 다음 각 호의 어느 하나에 해당하는 자를 말한다. 다만, 전문투자자 중 대통령령으로 정하는 자가 일반투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우 금융투자업자는 정당한 사유가 있는 경우를 제외하고는 이에 동의하여야 하며, 금융투자업자가 동의한 경우에는 해당 투자자는 일반투자자로 본다. <개정 2009.2.3> 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자 제124조 (정당한 투자설명서의 사용) ① 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외한다)에게 제123조에 적합한 투자설명서(집합투자증권의 경우 투자자가 제123조에 따른 투자설명서의 교부를 별도로 요청하지 아니하는 경우에는 제2항제3호에 따른 간이투자설명서를 말한다. 이하 이 항 및 제132조에서 같다)를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 아니 된다. 이 경우 투자설명서가 제436조에 따른 전자문서의 방법에 따르는 때에는 다음 각 호의 요건을 모두 충족하는 때에 이를 교부한 것으로 본다.<개정 2013.5.28> 1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 "전자문서수신자"라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 「자본시장과 금융투자업에 관한 법률 시행령」 제11조(증권의 모집ㆍ매출) ① 법 제9조제7항 및 제9항에 따라 50인을 산출하는 경우에는 청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다. 다만, 다음 각 호의 어느 하나에 해당하는 자는 합산 대상자에서 제외한다. <개정 2009. 10. 1., 2010. 12. 7., 2013. 6. 21., 2013. 8. 27., 2016. 6. 28., 2016. 7. 28.> 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 전문투자자 나. 삭제<2016. 6. 28.> 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사ㆍ감정인ㆍ변호사ㆍ변리사ㆍ세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주[「금융회사의 지배구조에 관한 법률」 제2조제6호가목에 따른 최대주주를 말한다. 이 경 우 "금융회사"는 "법인"으로 보고, "발행주식(출자지분을 포함한다. 이하 같다)"은 "발행주식"으로 본다. 이하 같다]와 발행주식 총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본 법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열 회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는 그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자 제132조 (투자설명서의 교부가 면제되는 자) 법 제124조제1항 각 호 외의 부분 전단에서 "대통령령으로 정하는 자"란 다음 각 호의 어느 하나에 해당하는 자를 말한다. <개정 2009.7.1, 2013.6.21> 1. 제11조 제1항 제1호 다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화·전신·팩스, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. |
6) 주권유통에 관한 사항
주권유통개시(예정)일: 2025년 07월 07일(신주 상장예정) (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2025년 06월 24일부터 해당 청약사무 취급처에서 환불합니다.
8) 주금납입장소 : 신한은행 서울대학교지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2025년 05월 08일 | 엘에스증권(주) | 00330424 |
| 한양증권(주) | 00162416 | |
1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」 제165의6조3항 및 「증권의 발행 및 공시 등에 관한 규정」 제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 9월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 엘에스증권(주) 및 인수회사인 한양증권(주)로 합니다.
4) 신주인수권증서 매매 등
가) 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
나) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 엘에스증권(주)의 본점 및 지점을 통해 해당 신주인수권증서에 기재되어 있는 수량만큼 청약할 수 있으며, 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
5) 당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2025년 05월 28일부터 2025년 06월 04일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2025년 06월 05일에 상장폐지될 예정입니다. 「코스닥시장 상장규정」 제16조 3(신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제44조의3 "신주인수권증서의 상장폐지기준"에 따라 신주청약 개시일 5거래일전에 상장폐지되어야 함)
6) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래 관련 사항은 다음과 같습니다.
가) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
나) 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2025년 05월 28일부터 2025년 06월 04일까지(5거래일간) 거래 | 신주배정통지일(2025년 05월 21일(예정))부터 2025년 06월 09일(신주인수권증서 상장폐지일의 익영업일)까지 거래 |
(1) 상장거래 : 2025년 05월 28일부터 2025년 06월 04일(5영업일간) 거래 가능합니다.
(2) 계좌대체거래 : 신주배정통지일인 2025년 05월 21일(예정)부터 2025년 06월 09일까지 거래 가능 합니다.
* 신주인수권증서의 계좌대체(장외거래)는 신주인수권증서 상장거래의 최종 결제일인 2025년 06월 09일까지 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다.
(3) 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다.
다) 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
(1) '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다.
(2) '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
1) 본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자시 이러한 점을 감안하시기 바랍니다.
2) 「자본시장과 금융투자업에 관한 법률」 제120조3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
3) 당사는 본 증권신고서를 통하여 청약 전에 투자자께서 숙지하셔야 하는 부분에 대하여 성실히 기재하고자 노력하고 있습니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 아래 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수 없으므로, 투자자는 본 증권신고서 제1부.III.투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 투자자 자신의 독자적이고도 세밀한 판단에 의해야 합니다. 따라서 본 공시서류에 기재된 사항은 투자 판단 시 참고 자료로 활용하실 것을 권고 드리며, 투자자의 투자 판단에 대한 결과는 투자자 본인에게 귀속됩니다.
4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
5) 본 증권신고서의 예정 모집가액은 확정되어 있는 것은 아니며, 청약일 3거래일 전에 확정 발행가액을 산정함으로써 확정될 예정입니다. 또한, 본 증권신고서의 발행예정금액은 추후 주당 발행가액이 확정되는 내용에 따라 변경될 수 있음을 유의하여 주시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
|---|---|---|---|
| 대표주관회사 | 엘에스증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(60.00%) |
기본인수수수료: 최종모집금액의 1.8% * 60% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 30억원 이하일 경우 15%, 30억원 초과 50억원 이하일 경우 18%, 50억원 초과할 경우 20% |
| 인수회사 | 한양증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 ×인수비율(40.00%) |
기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 실권수수료율 : 총 실권금액이 30억원 이하일 경우 15%, 30억원 초과 50억원 이하일 경우 18%, 50억원 초과할 경우 20% |
| 주1) 최종 실권주 : 구주주청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 주2) 최종모집금액 : 최종 발행가액 X 총 발행주식수 주3) 상기 일반공모를 거친 후에도 미청약된 잔여주식에 대하여는 대표주관회사 및 인수회사가 인수계약서 상 인수의무주식수를 한도로 하여 각각 인수의무주식수만큼 자기 책임 하에 인수하기로 합니다. |
II. 증권의 주요 권리내용
당사가 금번 주주배정후 실권주 일반공모 유상증자를 통하여 발행할 증권은 기명식 보통주이며, 동 증권의 주요 권리내용은 다음과 같습니다.
1. 주식에 관한 사항
|
제5조(발행예정주식총수) 회사가 발행할 주식의 총수는 100,000,000주로 한다. 제6조(설립시에 발행하는 주식의 총수) 회사가 설립시에 발행하는 주식의 총수는 29,600주(1주의 금액 5,000원 기준)로 한다. 제7조(1주의 금액) 주식 1주의 금액은 500원으로 한다. 제8조(주식의 종류) 회사가 발행하는 주식은 기명식으로 한다. 제8조의2(주식 등의 전자등록) 회사는 「주식·사채 등의 전자등록에 관한 법률」 제2조 제1호에 따른 주식 등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식 등을 전자등록하여야 한다. 다만, 회사가 법령에 따른 등록의무를 부담하지 않는 주식등의 경우에는 그러하지 아니할 수 있다. 제9조(주식의 종류) ② 회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다. 제14조(명의개서대리인) ② 명의개서대리인 및 그 영업소와 대행업무의 범위는 이사회의 결의로 정한다. ③ 회사는 주주명부 또는 그 복본을 명의개서대리인의 사무취급장소에 비치하고, 주식의 전자등록, 주주명부의 관리, 기타 주식에 관한 사무는 명의개서대리인으로 하여금 취급케 한다. ④ 제3항의 사무취급에 관한 절차는 명의개서대리인의 증권명의개서대행 업무규정에 따른다. 제15조의2(주주명부) 제16조(주주명부의 폐쇄 및 기준일) ② 회사는 매년 12월 31일 현재 주주명부에 기재되어 있는 주주를 그 결산기에 관한 정기주주총회에서 권리를 행사할 주주로 한다. ③ 회사는 임시주주총회의 소집 기타 필요한 경우 이사회의 결의로 3개월을 경과하지 아니하는 일정한 기간을 정하여 권리에 관한 주주명부의 기재변경을 정지하거나, 이사회의 결의로 3개월내로 정한 날에 주주명부에 기재되어 있는 주주를 그 권리를 행사할 주주로 할 수 있다. 이 경우 이사회는 필요하다고 인정하는 때에는 주주명부의 기재변경 정지와 기준일의 지정을 함께 할 수 있으며, 회사는 주주명부 폐쇄기간 또는 기준일의 2주간 전에 이를 공고하여야 한다. |
2. 신주인수권에 관한 사항
|
제10조(신주인수권) ② 회사는 제1항의 규정에도 불구하고 다음 각 호의 경우에는 이사회 결의로 특정한 자(이 회사의 주식을 소유한 자를 포함한다.)에게 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 상법 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4. 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 중소기업 창업지원법에 의한 중소기업 창업투자회사에 총 발행주식의 30%까지 배정하는 경우 6. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산, 판매, 자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 발행주식총수의 100 분의 20을 초과하지 않는 범위 내에서 재무구조 개선, 신규사업 추진 및 긴급한 자금조달 등 회사의 경영상 목적을 달성하기 위하여 국내외 금융기관, 기관투자자, 전문투자자 (기업구조조정조합, 사모투자전문회사 등) 및 기타 이사회에서 정한 자에게 신주를 발행하는 경우 (단, 이사회는 재무구조개선, 긴급한 자금조달의 경우에한하여 이사 3분의 2의 결의로 발행주식총수의 100 분의 100을 초과하지 않는 범위내에서 신주를 배정할 수 있음) 8. 회사가 주권을 유가증권시장이나 코스닥시장에 신규상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 ④신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. |
3. 의결권에 관한 사항
|
제28조(주주의 의결권) 주주의 의결권은 1주마다 1개로 한다. 제29조(상호주에 대한 의결권 제한) 회사, 회사와 회사의 자회사 또는 회사의 자회사가 다른 회사의 발행주식총수의 10분의 1을 초과하는 주식을 가지고 있는 경우, 그 다른 회사가 가지고 있는 이 회사의 주식은 의결권이 없다. 제30조(의결권의 불통일행사) ① 2 이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3일전에 회사에 대하여 서면으로 그 뜻과 이유를 통지하여야 한다. ② 회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 그러나 주주가 주식의 신탁을 인수하였거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니하다. 제31조(의결권의 대리행사) ① 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있다. ② 제1항의 대리인은 주주총회 개시전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다. |
4. 배당에 관한 사항
|
제13조(신주의 배당기산일) 회사가 유상증자, 무상증자 및 주식배당에 의하여 발행한 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전영업연도말에 발행된 것으로 본다. 제56조(이익배당) ② 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. ③ 제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익배당은 주주총회의 결의로 정한다. |
III. 투자위험요소
| [투자자 유의사항] |
|---|
| ■ 금번 당사의 유상증자에 참여하고자 하는 투자자분들께서는 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라, 특히 아래 기재된 투자위험요소를 주의 깊게 검토한 후 이를 고려하여, 최종적인 투자 판단을 해야 합니다. ■ 만일, 아래 기재한 투자위험요소가 실제로 발생하는 경우, 당사의 사업, 재무상태, 기타 영업활동에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있음을 유의하시기 바랍니다. ■ 당사는 본 공시서류를 통하여 청약 전에 투자자께서 숙지하셔야 하는 부분에 대하여 성실히 기재하고자 노력하고 있습니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 아래 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수 없으므로, 투자자는 아래 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 투자자 자신의 독자적이고도 세밀한 판단에 의해야 합니다. 따라서 본 공시서류에 기재된 사항은 투자 판단 시 참고 자료로 활용하실 것을 권고 드리며, 투자자의 투자 판단에 대한 결과는 투자자 본인에게 귀속됩니다. ■ 2009년 02월 04일 부로 시행된 「자본시장과 금융투자업에 관한 법률」제124조에 의거 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외함)에게 적합한 투자설명서를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 안됩니다. 다만, 「자본시장과 금융투자업에 관한 법률 시행령」제132조에 의거하여 투자설명서를 받기를 거부한다는 의사를 서면으로 표시한 자는 투자설명서의 교부없이 청약이 가능합니다. ■ 본 공시서류의 기재사항이 진실 또는 정확하다는 것을 정부가 인정하거나, 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자의 책임은 전적으로 투자자에게 귀속됩니다. |
| [주요 용어의 정의] |
|
용어 |
해설 |
|---|---|
|
Abiraterone |
Androgen 생성에 관여하는 CYP17A1 억제제로 남성호르몬에 의존적인 거세저항성 전립선암(Castration-resistant prostate cancer) 치료에 사용 |
|
Adjuvant 치료법 |
일반적으로 암환자의 수술 후 보조요법을 의미하며 일차치료에 더하여 미세전이 등으로 발견하기 어려운 암세포를 제거하고 재발을 방지하기 위해 실시함 |
|
Axalimogene |
유전자 조작을 한 리스테리아 균을 활용하여 자궁경부암세포를 공격하도록 면역계를 자극하는 면역 치료 방법 |
|
B 세포 |
림프구의 일종으로 적응면역계에 작용하여 항원 특이적 항체를 생산하며 항원제시세포로 역할을 할 수 있음 |
|
BVAC |
CELIVAX의 파이프라인 코드명 |
|
CAR-T |
환자의 혈액에서 T세포를 추출하여 암세포에 반응하는 수용체 DNA를 이용하여 키메릭 항원 수용체를 만들어 암을 공격하도록 만든 치료제 |
|
CD1d |
다양한 인간 항원제시세포의 표면에 발현되어 T 세포로의 지질성 항원 제시에 관여하는 당단백의 일종 |
|
CD4 T 세포 |
세포 표면에 CD4가 있는 T 세포로 다른 백혈구의 분화 및 활성화를 조절함으로써 다양한 면역반응을 촉진하는 세포 |
| CD46 | 다양한 세포의 표면에 발현되어 species B에 속하는 아데노바이러스 serotype의 세포 부착에 관여하는 단백질 |
| CD46 수용체 | 일부 암종에서 과발현되는 MCP(membrane cofactor protein) CD46와 결합하는 수용체로 항암면역반응에 작용 |
|
CD8 T 세포 |
세포 표면에 CD8이 있는 T 세포로 세포독성물질을 분비하여 바이러스, 감염세포나 종양세포 등을 사멸할 수 있는 적응면역을 담당하는 세포 |
|
CELIVAX |
㈜셀리드의 항암면역치료백신 브랜드명 |
| CMO | Contract Manufacturing Organization의 약자임. 의약품을 위탁생산하는 의약품 전문 생산사업 |
| CDMO | Contract Development & Manufacturing Organization의 약자임. 의약품 위탁생산을 뜻하는 CMO에 개발(Development)을 더한 의약품 위탁개발생산을 의미함 |
| Chimeric Antigen Receptor (CAR) |
암 세포의 특정 단백질에 결합하도록 고안된 특수 수용체임. CAR-T 치료제에서 면역세포인 티(T)세포에 발현시켜 이 수용체에 결합하는 특정 단백질이 있는 암세포를 죽이는 역할을 수행함 (키메라항원수용체) |
| COVID19 | 흔히 코로나19로 불리는 바이러스 감염증. 원인바이러스는 SARS-CoV-2 이며, 감염시 발열, 호흡곤란, 다기관 염증 반응 등의 증상이 나타날 수 있음. |
|
DNA 백신 |
유전학적으로 변형된 DNA를 생체 내에 주입하여 체내 세포가 직접 항원 및 이 항원에 대응하는 항체를 생산하도록 유도하는 형태의 백신 |
|
epitope peptide |
암세포 혹은 항원제시세포의 MHC(주조직적합복합체)에 의해 제시된 항원의 작은 단백질 부분 |
|
Exome-Seq |
세포 내의 DNA 염기서열 중 유전자를 포함하고 있는 exon 부위의 염기서열 판독. 인체 단백질의 변형을 유도하는 유전자의 다양성 혹은 돌연변이를 확인하는 데 활용 |
|
GLP |
의약품 등의 안정성 유효성 심사에 관한 규정에 의하여 의약품 등의 제조 및 수입 허가 신청 등을 위한 비임상 시험의 계획, 실시, 점검, 기록, 보고 및 보관을 위한 시험기관에서의 절차 및 조건 등을 정한 비임상시험관리기준 |
|
GMP |
의약품 등의 안정성과 유효성을 품질면에서 보증하는 기준조건으로서 의약품 등의 제조관리기준 |
|
IFN-γ |
사이토카인의 일종으로 선천면역계와 적응면역계에 중요한 요소로 작용. 대식세포와 MHC class II의 발현에도 중요하며 NK세포, NKT세포, T세포 등에 의해 주로 생산 및 분비됨 |
| iNKT cell | invariant NKT 세포로 면역 세포에 의한 당지질(glicylipid)이 항원 제시될 경우 인터페론을 포함하여 다양한 사이토카인을 분비함 |
|
Immuno-Oncology |
암을 타겟으로 하는 면역 치료 방법 |
|
irRC |
암치료 시 환자의 종양이 소멸, 축소, 유지 또는 악화되는 것을 정의하는 기준 |
|
irPD |
암치료 효과 판정기준(irRC)으로 종양의 크기가 기저치에 비해 25% 증가한 경우 |
|
irPR |
암치료 효과 판정기준(irRC)으로 종양의 크기가 기저치에 비해 50% 감소한 경우 |
|
irSD |
irRC에서 irPR과 irPD에 해당하지 않는 경우 |
|
MHC-I |
사람의 주조직적합성 복합체 (MHC) 종류 중 하나로 모든 유핵세포의 표면에 존재. HLA-A, B, C 항원 타입이 있으며 CD8 T 세포에 항원을 제시하여 감염된 세포 및 암세포를 파괴하는데 중요한 역할을 함 |
|
mRNA |
RNA의 일종으로 DNA에서 유전정보를 전사(transcription)하여 리보솜에 전달하는 기능을 함 |
|
Neoadjuvant 치료법 |
일차적 치료에 선행하는 암치료 방법으로 통상 종양 크기를 축소하여 향후 치료를 용이하게 하고, 치료효과를 증진시킬 목적으로 시행 |
|
Neo-antigen |
환자 개개인에 맞춤화된 항원으로써 각 환자의 암세포 유전체를 분석하여 정상세포의 염기서열과 비교한 뒤 환자의 암세포에서만 나타나는 염기서열상 돌연변이를 이용한 항원 |
|
Neo-epitope |
환자 개개인의 neo-antigen의 항원결정기 |
|
NK세포 |
선천면역계에 작용하는 세포독성 림프구의 일종으로 감염세포 및 암세포를 공격하여 제거하는 기능을 함 |
|
NKT세포 |
T 림프구로서 자연살해(NK) 세포 수용체를 발현하여 NK세포 기능을 공유하며 면역 조절 작용 및 면역 강화 작용을 수행함 |
|
PD-1 |
면역 작용 억제 인자의 하나로 억제될 경우 면역 활성이 유도되어 항암 작용이 일어남 |
| Peptide | 아미노산 단위체들이 인공적으로 혹은 자연 발생적으로 연결된 중합체 |
|
Proof of Concept (POC) |
기존 시장에 없었던 신기술을 도입하기 전에 제품, 기술, 정보 시스템 등이 조직의 특수 문제 해결을 실현할 수 있다는 증명 과정 |
| RNA | 염기와 리보오스(5탄당)와 인산기가 결합된 폴리머로, 유전자 정보를 매개, 유전자의 발현의 조절 등에 관여함 |
|
RNA-Seq |
세포 내의 RNA 염기서열을 판독하는 것으로, 유전자의 발현 정도와 그 변화를 확인할 때 많이 사용되어 개인화된 유전자 발현 정보 확인에 활용 가능함 |
| SARS-CoV-2 | 코비드19 감염증을 일으키는 코로나바이러스로 WHO에 의해 SARS-CoV-2로 명명되었음. |
| Spike 항원단백질 | 코비드19의 원인 바이러스인 SARS-CoV-2의 표면 돌기 단백질임. 사람세포의 ACE2 (angiotensin converting enzyme 2)와 결합하여 세포내로 바이러스가 감염됨 |
|
T 세포 |
백혈구의 일종으로 세포 면역반응에 주된 역할을 수행함. 면역체계의 기억능력을 담당하며 B세포가 항체를 생성하도록 도움 |
|
αGC |
Alpha-galactosylceramide의 약자로 당지질의 일종. iNKT cell을 활성화시킬 수 있으며, CD1d 분자와 결합하여 강한 면역 반응을 일으킬 수 있음 |
| 가수분해 | 화학 반응시, 물과 반응하여 원래 하나였던 큰 분자가 몇 개의 이온이나 분자로 분해되는 반응 |
|
기억면역반응 |
항원의 일차적 노출 시 생성된 기억세포에 의해 동일한 항원이 재차 감염되었을 때 광범위하고 신속하게 일어나는 면역반응 |
| 다가백신 | 같은 종의 바이러스나 세균이라도 여러 형이 있기 때문에 항원성이 다를 경우에 면역효과가 있는 혼합백신 |
|
단구 |
백혈구의 일종으로 혈액이나 조직에서 세균이나 이물질을 공격하여 제거하는 기능을 하며 활성화될 경우 항원제시세포의 역할을 수행함 |
|
단클론항체의약품 |
단일 세포 클론에서 유래한 항체를 주성분으로 하는 바이오의약품 |
|
당단백 |
단백질의 일종으로 단백질에 올리고당 사슬이 결합해있으며 세포막에 부착되어 있거나 분비되는 형태로 세포 간 상호작용에 관여하는 생리 역할을 수행함. 면역세포에서는 세포막에서 항원과 직접 상호 작용하는 항체 같은 분자를 포함 |
|
대조군 |
투약군과 비교하여 처치는 동일하나 실제 약제를 투여하지 않고 위약 또는 이와 유사한 처치를 하여 투약효과를 비교, 판정할 수 있는 기준이 되는 환자군 |
|
도입유전자 |
바이러스 등을 통해 체내에 도입하고자 목적한 항원 유전자 |
|
독성시험 |
비임상시험에서 약물의 독성을 판정, 예측하기 위해 실시하는 시험 |
|
리간드 |
세포막 또는 세포질에 존재하며, 세포 밖에서의 물질 또는 물리적 자극을 인식하여 세포에 특정한 반응을 일으키는 수용체에 결합하는 물질. 세포 외부로부터 신호를 전달함에 있어서 관여하는 단백질들을 리간드 (ligand)와 수용체(receptor)로 구분함 |
| 리보솜 | 세포 활동에 필요한 단백질을 합성하는 기관으로, 세포질에 떠 있거나 소포체(endoplasmic reticulum)에 부착되어 있음 |
|
림프구 |
질병을 일으키는 각종 원인(물질)에 대항하여 신체를 방어하는 세포들로 B cell, T cell, NK cell 등으로 구성됨 |
|
림프구성분채집술 |
혈액으로부터 백혈구를 분리해내는 기술 |
|
말초혈액단핵세포 |
백혈구 중 핵이 하나인 세포로 T 세포, B 세포, NK 세포, 단구 등이 해당됨 |
|
면역관문저해제 |
암세포의 면역 회피신호를 저해하여 면역세포가 암세포를 공격하도록 유도하는 약물 |
|
면역증강제 |
항원이 일으키는 면역반응의 효율/효력을 증강시키는 물질 |
|
면역치료백신 |
환자에게 투여하여 환자 스스로의 강력한 면역반응을 유도함으로써 암 및 감염증 등을 치료할 목적으로 사용하는 백신 |
|
면역항암제 |
인체의 면역기능 활성화 및 면역 체계 간 신호 경로를 공략하여 암을 치료할 목적으로 사용하는 의약품 |
|
면역회피기전 |
종양세포가 숙주의 면역감시를 회피하여 증식하는 것에 관여하는 기전 |
|
무진행생존기간 |
질병의 치료 도중 혹은 치료 후 환자가 질병을 갖고 있지만 질병이 악화되지 않고 생존하는 기간 |
|
반응률 (ORR, Objective response rate) |
암환자의 치료 후 전체 치료환자 중에서 부분반응이상을 보인 환자의 비율 |
|
병용투여 |
한 약물에 보완적인 다른 약물을 함께(두 가지 이상의 의약품을 동시에 혹은 연속적으로 투여)하여 치료에 효과를 높이는 방법 |
|
분포시험 |
약물을 투여한 뒤 체내 조직 및 기관에 분포하는 경로와 패턴을 파악하기 위해 실시하는 비임상시험 |
|
비임상시험 |
신약후보물질을 동물에게 먼저 투여하여 부작용, 독성, 효과 등을 전반적으로 알아보는 시험 |
|
사이토카인 |
인체의 면역체계가 과도한 반응을 일으켜 면역계의 세포들이 서로 통신하기 위해 분비하는 여러 단백질 분자 |
|
상피성장인자수용체 (hEGFR) |
세포막 표면에 위치하는 수용체의 일종으로 상피성장인자(EGF)가 결합하는 부위. 세포 내부로 신호전달을 일으켜 세포가 분열, 증식하도록 함. 암세포에서 비정상적으로 많이 발현되는 경향이 있음 |
|
선천면역계 |
NK세포, 대식세포 등이 관여하여 비자기 항원에 대해 비특이적으로 작용하는 면역계 |
|
세포독성 T세포 |
T 세포의 일종으로 MHC를 인식하여 비자기 항원 및 변형 단백질을 포함하고 있는 세포를 직접 사멸시킴 |
|
수지상세포 (DC, Dendritic cell) |
면역세포의 일종으로 항원물질을 세포표면에 발현하여 T세포에 제시하는 항원제시세포의 역할을 함 |
|
수지상세포백신 |
수지상세포를 항원제시세포로 사용하여 자가면역세포를 활성화시켜 암 등의 치료 목적으로 사용하는 백신 |
|
조절T 세포 |
억제 T 세포로도 불리며 자기항원에 대한 면역관용, 자가면역질환의 예방유지에 관여하는 T세포의 일종 |
|
신호전달기작 |
세포 내에서 신호를 전달하는 과정으로 핵에서의 유전자 발현 정도 조절 등 다양한 인체반응을 매개하는 기전 |
|
아데노바이러스 |
이중나선 DNA 바이러스의 일종으로 넓은 범위의 척추동물 숙주를 가지고 있으며, 감염 시 감기와 같은 가벼운 호흡기 질환을 유발함 |
| 안정 질환 | 암의 치료효과 판정에 관한 용어로, 종양 축소가 부분관해가 되는 데는 충분하지 않고, 종양 증대가 진행되는 데는 충분하지 않은 것 (Stable disease) |
|
암-고환 항원 (CTA, cancer/testis antigen) |
고환, 태아 난소나 영양막 등 일부의 정상조직과 일부 암에서만 발현되는 항원으로 면역 자극적임 |
|
암항원 |
암세포에서 특이적으로 발현되어 면역반응을 일으킬 수 있는 물질 |
|
연구자 임상 |
임상시험자가 외부의 의뢰 없이 안전성 및 유효성이 검증되지 않은 의약품 또는 시판 중인 의약품으로 허가되지 않은 새로운 효능, 효과, 용법, 용량에 대해 독자적으로 수행하는 임상시험 |
|
완전관해 |
암 치료 후 기존종양이 모두 없어지고 새로운 종양도 출현하지 않은 경우 |
| 완제공정 | 원료의약품을 용기에 담고 포장해 완제의약품으로 생산하는 과정으로 충전, 라벨링, 포장 작업 등을 포함함 |
|
이상약물반응 |
의약품 등을 정상적으로 투여 혹은 사용하여 발생한 유해하고 의도하지 아니한 반응으로서 해당 의약품 등과의 인과관계를 배제할 수 없는 경우를 뜻함 |
| 이중항체 | 하나의 항원을 인식해 결합하는 일반적인 항체와 달리, 두 종류의 항원에 동시에 결합할 수 있는 항체 |
| 인산 모노에스텔 (인산 모노에스테르) |
한 개의 에스테르 결합과 인산기 가지는 화합물로, 인지질 세포막의 구성 요소 |
|
인유두종바이러스(HPV) |
DNA 바이러스의 일종으로 사람을 비롯한 여러 동물에 감염되어 다양한 암 및 질병의 원인이 됨. 자궁경부암의 발생 원인임 |
| 인터페론 치료법 | 인터페론은 바이러스 감염과 증식을 억제하는 능력을 지니고 있어 유전공학을 통해 인공적인 대량 생산을 하여 바이러스성 질병 치료에 사용함 |
|
임상 1상 시험 |
의약품을 최초로 사람에게 투여하는 단계로 소규모의 사람을 대상으로 약물의 안전성 및 약동학, 약력학적 정보 등을 구하기 위해 실시하는 임상시험 |
|
임상 2상 시험 |
치료적 탐색단계로 소규모 환자들을 대상으로 약물의 유효성과 부작용을 평가하며 최적 용법용량을 결정하고자 하는 임상시험 |
|
임상 3상 시험 |
치료적 확증 단계로 의약품의 안전성과 유효성을 확증하기 위해 대규모 환자들을 대상으로 장기 투여를 진행하는 임상시험 |
|
저항성 |
약물을 반복적으로 투여시 약효가 저하되거나 무반응이 나타나는 현상 |
|
적응면역계 |
침입한 항원에 대해 특이적으로 작용하는 면역계로 B 세포 등이 관여함 |
| 전사 | DNA를 원본으로 사용하여 RNA를 만드는 과정 (transcription) |
|
조건부 허가 |
생명을 위협하거나 중증의 비가역 질환, 의학적 미충족 상태인 질병에 적용하려는 의약품에 대해 차후 치료적 확증 임상시험 자료를 제출하는 것을 조건으로 치료적 탐색 임상시험인 임상2상 결과만을 토대로 시판을 허가하는 제도 |
|
종양미세환경 |
분자 및 세포외 기질에 신호를 보내는 주변 혈관, 면역세포, 섬유아세포 등을 포함한 종양주위의 세포환경을 의미함. 종양은 자신의 미세환경을 변경할 수 있으며 미세환경은 종양이 성장하고 퍼져 나가는 방식에 영향을 미칠 수 있기에 종양미세환경을 연구하여 암치료에 이용하려는 노력이 활발하게 이루어지고 있음 |
|
종양침윤 T 세포 |
T 세포의 일종으로 혈액에서 종양으로 침투하는 세포들을 의미하며 종양에 대한 면역과 연관이 있음 |
| 중화항체 | B 세포가 항원 단백질에 대해 분비하는 여러 항체 중, 병원성 바이러스의 세포 감염을 차단하는 핵심 역할을 하는 항체 |
| 지질성 항원 제시 | 지질성 항원이 세포 표면에서 CD1 분자에 결합, 전시됨으로 T세포 및 iNKT 세포를 활성화를 유도함(항원은 단백질, 당, 지질, 기타 등이 있음) |
|
질병조절율 |
약을 복용하고 나타나는 효과에 따라 완전관해, 부분관해, 진행중지를 달성한 환자의 백분율 |
|
투여군 |
임상시험에서 평가하고자 하는 의약품을 투여한 환자군 |
|
파포바 바이러스 |
이중나선 DNA 바이러스의 일종으로 협막이 없으며 이십면체 모양을 가지고 있음. 포유류가 숙주이며, 출혈성 방광염, 진행성 다발성 백질 뇌증 등의 원인이 됨 |
|
표적항암제 |
정상세포에는 존재하지 않거나 매우 낮은 빈도로 발현되지만 암세포에는 특징적으로 발현되는 항원 및 인자를 표적으로 한 항암제 |
|
표준치료 |
암환자에서 신뢰할 수 있는 임상적 입증자료를 기반으로 환자에게 우선 적용하도록 동의되어진 치료법 |
|
항암바이러스 |
바이러스가 인체세포에 효과적으로 침투한 뒤 증식하는 특성을 이용하여 유전자조작을 통해 항암효과를 내도록 한 바이러스 |
| 항원 | 면역 반응을 일으켜 특히 항체를 생산하게끔 만드는 물질로써 일반적으로 생명체내에서 이물질로 간주되는 물질의 총체 |
|
항원제시세포 |
항원인자를 받아들여 처리한 후 세포표면에 항원 에피톱을 제시하여 체내 주요 면역세포들이 항원을 인식하게 함으로써 면역반응을 유도할 수 있는 세포 |
|
항체 |
항원에 특이적으로 결합하여 이를 비활성화시키는 단백질 |
|
희귀의약품 |
적응증이 희귀질환이거나 대체의약품이 없어 긴급하게 도입할 필요가 있는 의약품 |
| 출처) | 당사 제시 |
1. 사업위험
|
[가. 국내외 거시경기 침체 및 불확실성이 미치는 위험] 한편, 트럼프 대통령이 서명한 행정명령에 따르면, 2025년 2월 4일부터 캐나다 및 멕시코산 수입품에 25% 및 중국산 수입품에 10%의 추가 관세 부과 등을 선언하였고, 캐나다 및 멕시코는 한달간의 유예기간 중에 있습니다. 이는 미국의 무역적자 해소 및 자국 산업 보호를 위한 조치로, 향후 글로벌 교역 환경 변화에 따라 국내 경제에도 영향을 미칠 가능성이 있습니다. 특히, 중국을 경유한 대(對)미 수출이 감소할 경우, 중국에 대한 수출 의존도가 높은 국내 제조업 및 수출 산업 전반에 걸쳐 부정적 영향을 미칠 것으로 예상됩니다. |
① IMF 세계경제전망
국제통화기금(IMF)이 2025년 01월 발표한 "World Economic Outlook"에 따르면, 2025년 세계경제성장률 추정치는 3.3%로 전망되었습니다. 이는 2024년 10월 추정치 대비 0.1%p 상향된 수치입니다. IMF가 전망한 한국의 경제성장률은 2.0%로 2024년 대비 0.2%p 하향되었습니다. 선진국 그룹의 2025년 경제성장률 전망치는 1.9%로 상향 조정되었으며, 미국 성장률은 2.7%로 크게 상승했습니다. 반면, 유로존 국가들은 지정학적 긴장과 제조업 약세로 성장률이 하향 조정되었습니다. 신흥개도국 그룹(중국, 인도, 러시아, 브라질 등)의 2025년 경제성장률 전망치는 4.2%로 유지되었습니다.
IMF는 무역협정 확대, 노동력 확충, 혁신 지원을 긍정적 요인으로, 미국의 보호무역주의 강화와 확장적 재정정책을 부정적 요인으로 언급했습니다. 특히, 미국의 재정정책이 단기적으로는 긍정적 영향을 줄 수 있으나, 글로벌 금리 상승과 신흥국 자본 유출을 초래할 위험이 있다고 경고했습니다. 무역 갈등과 노동력 공급 차질이 세계 경제에 부정적 영향을 미칠 가능성도 지적했습니다.
IMF는 지속가능한 부채 관리를 위한 재정 건전화와 성장 친화적 투자, 취약계층 보호를 강조하였습니다. 또한, 자본 변동성 확대에 대비한 외환시장 개입, 거시건전성 조치, 자본 흐름 제한 조치 활용을 제안했습니다. 노동시장 개혁과 디지털화 촉진, 무역 협력 강화를 통한 생산성 향상도 필요하다고 강조했습니다. 2025년 1월 IMF의 세계 및 주요 경제 성장률 전망은 아래와 같습니다.
| [2025년 01월 국제통화기금 세계 경제성장률 전망] |
| (단위: %, %p) |
|
구분 |
2024년 |
2025년(E) |
2026년(E) |
||||
|
24년 10월 |
25년 01월 |
조정폭 |
24년 10월 |
25년 01월 |
조정폭 |
||
|
(A) |
(B) |
(B-A) |
(C) |
(D) |
(D-C) |
||
|
세 계 |
3.2 |
3.2 | 3.3 | 0.1 | 3.3 | 3.3 | 0.0 |
|
선진국 |
1.7 |
1.8 | 1.9 | 0.1 | 1.8 | 1.8 | 0.0 |
|
미국 |
2.8 |
2.2 | 2.7 | 0.5 | 2.0 | 2.1 | 0.1 |
|
유로존 |
0.8 |
1.2 | 1.0 | -0.2 | 1.5 | 1.4 | -0.1 |
| 독일 | -0.2 | 0.8 | 0.3 | -0.5 | 1.4 | 1.1 | -0.3 |
| 영국 | 0.9 | 1.5 | 1.6 | 0.1 | 1.5 | 1.5 | 0.0 |
|
일본 |
-0.2 |
1.1 | 1.1 | 0.0 | 0.8 | 0.8 | 0.0 |
|
한국 |
2.2 |
2.2 | 2.0 | -0.2 | 2.2 | 2.1 | -0.1 |
|
신흥국 |
4.2 |
4.2 | 4.2 | 0.0 | 4.2 | 4.3 | 0.1 |
|
중국 |
4.8 |
4.5 | 4.6 | 0.1 | 4.1 | 4.5 | 0.4 |
|
인도 |
6.5 |
6.5 | 6.5 | 0.0 | 6.5 | 6.5 | 0.0 |
| 출처) | 국제통화기금(World Economic Oulook, 2025.01) |
2025년에는 미국ㆍ유럽의 경기연착륙 기대, 인플레이션의 완화, 그리고 기준금리 인하 등으로 경제 상황이 개선이 전망됩니다. 다만, 러시아-우크라이나 전쟁으로 인한 지정학적 리스크, 높은 시장 금리가 지속됨에 따른 금융 불안정성, 경기 침체 우려등 국내외 경제에 큰 영향을 미칠 수 있는 불확실성 역시 상존하고 있습니다. 향후 세계 경제성장률과 국가별 경기 회복의 속도는 주요국 인플레이션통제와 기준금리 조정 시기에 맞물려 결정될 것으로 예상됩니다.
2024년 11월 미국 대선에서 트럼프 대통령이 재선에 성공함으로써 이전 집권 1기 당시의 보호무역 기조가 집권 2기에서 보다 강하게 시행될 것으로 전망하고 있습니다. 이러한 보호무역 정책을 통해 미국은 외국산 제품에 부과하는 관세를 대폭 인상하게 되고 이는 물가상승을 자극하여 고금리 기조의 장기화를 야기할 수 있습니다.
트럼프 대통령 당선 확정 이후 미 연준이 11·12월 각각 FOMC에서 기준금리 25bp 인하를 단행하며 기준금리 인하 기조가 유지되고 있음을 보였지만, 연준의 매파적 스탠스 및 트럼프 대통령 재집권에 따른 정책기조로 인해 금리 인하 속도가 예상 대비 늦춰질 가능성이 존재하며, 트럼프 2기 정부의 정책 강도 및 시행시기에 따라 외환 및 금융시장의 불확실성이 높은 상황입니다.
② 한국은행 국내경제전망
한국은행이 2025년 2월 발간한 '경제전망보고서'에 따르면 2024년 국내 경제성장률은 2.0%, 2025년 국내 경제성장률은 1.5% 수준을 나타낼 것이라고 전망하였습니다. 2024년 경제성장률은 직전('24년 11월) 전망 대비 0.2%p 감소하였으며, 2025년 경제성장률은 직전('24년 11월) 전망 대비 0.4%p 감소하였습니다. 한국은행은 국내 경제가 고물가, 고금리 영향이 감소하여 소비를 중심으로 완만한 성장세를 이어갈 것으로 전망하였으나, 주요국의 보호무역주의 강화 및 한국 주력 수출품목에 대한 중국 저가공급 확대로 인한 위험요소가 존재하는 것으로 평가하였습니다.
한국은행은 각 부문에 대해서 다음과 같이 전망하고 있습니다. 민간소비는 심리위축등으로 부진한 흐름을 보이고 있으나 2분기 이후에는 정치적 불확실성이 줄어들고 금융여건 완화 영향도 나타면서 점차 회복될 것이라 전망하고 있습니다. 건설투자는 수주 및 착공 위축의 영향으로 감소 흐름을 보이겠으나, 하반기부터는 낮은 수준에서 점차 회복할 것으로 전망하고 있습니다. 설비투자의 경우 반도체 기업의 AI 및 첨단공정 관련 투자가 확대됨에 따라 2024년 하반기 크게 반등하였으며, 올해에도 양호한 흐름을 이어갈 것으로 전망됩니다. 재화수출은 글로벌 IT 경기 호조에 힘입어 견조한 증가세를 지속할 것으로 보이나, 미국 신정부의 관세 정책 등을 감안하면 증가세가 둔화될 것으로 전망됩니다.
| [한국은행 국내 경제전망] |
| (단위: %) |
|
구분 |
2023년 |
2024년 |
2025년(E) |
2026년(E) | ||||
|---|---|---|---|---|---|---|---|---|
|
연간 |
상반기 |
하반기 |
연간 |
상반기 |
하반기 |
연간 |
연간 | |
|
GDP |
1.4 |
2.8 | 1.3 | 2.0 | 0.8 | 2.2 | 1.5 | 1.8 |
|
민간소비 |
1.8 | 1.0 | 1.3 | 1.1 | 1.0 | 1.7 | 1.4 | 1.8 |
|
설비투자 |
1.1 |
(-)1.8 | 5.3 | 1.8 | 5.7 | (-)0.2 | 2.6 | 2.0 |
|
지식재산생산물투자 |
1.7 | 1.5 | (-)0.1 | 0.7 | 2.5 | 4.9 | 3.7 | 3.1 |
|
건설투자 |
1.5 | 0.4 | (-)5.5 | (-)2.7 | (-)6.7 | 1.1 | (-)2.8 | 2.5 |
|
재화수출 |
2.9 | 8.4 | 4.3 | 6.3 | 0.7 | 1.2 | 0.9 | 0.8 |
|
재화수입 |
(-)0.3 |
(-)1.3 | 3.6 | 1.2 | 2.0 | 0.2 | 1.1 | 1.9 |
| 출처) | 한국은행 경제전망보고서(2025년 02월) |
이와 별개로 '12.3 비상계엄 사태'와 이후 촉발된 탄핵 정국으로 인해 국내 정치적 리스크가 고조되었으며, 이는 국내 경기 둔화와 중장기 경제성장 저하로 이어질 수 있다는 우려가 존재합니다. 글로벌 투자은행 골드만삭스는 2024년 12월 9일 '짧은 계엄령 사태의 여파'라는 제목의 보고서를 통해 비상계엄 사태와 탄핵 정국 등 정치적 불안으로 인해 한국 경제 성장률의 하방 리스크가 확대됐다는 분석을 발표했습니다. 신고서 제출일 현재 '12.3 비상계엄 사태'가 촉발한 정치적 불확실성이 언제 해소될 지는 쉽게 가늠하기 어려운 상황임에 따라, 향후 탄핵 정국 등 국정 혼란이 장기화될 경우 환율과 증시 등 금융시장, 대외 신인도 등에 부정적인 영향을 미칠 수 있습니다.
상기 기재한 바와 같이, 2025년에도 세계경제의 둔화흐름이 이어지겠으나 미국과 대형 신흥시장 및 개발도상국의 예상보다 큰 회복력, 기준금리 인하, 인플레이션율 하락 등으로 인해 둔화흐름은 개선될 것으로 전망됩니다. 그럼에도 불구하고, 글로벌 공급차질 지속, 러시아-우크라이나 전쟁 및 중동분쟁에 따른 지정학적 리스크 증가 그리고 각 국가의 긴축적인 통화정책 및 재정정책에 따라 경제활동이 장기적으로 둔화될 경우, 소비 위축 및 투자 이연 등에 따른 경기 침체 가능성이 높아질 수 있습니다.
한편, 트럼프 대통령이 서명한 행정명령에 따르면, 2025년 2월 4일부터 캐나다 및 멕시코산 수입품에 25% 및 중국산 수입품에 10%의 추가 관세 부과 등을 선언하였고, 캐나다 및 멕시코는 한달간의 유예기간 중에 있습니다. 이는 미국의 무역적자 해소 및 자국 산업 보호를 위한 조치로, 향후 글로벌 교역 환경 변화에 따라 국내 경제에도 영향을 미칠 가능성이 있습니다. 특히, 중국을 경유한 대(對)미 수출이 감소할 경우, 중국에 대한 수출 의존도가 높은 국내 제조업 및 수출 산업 전반에 걸쳐 부정적 영향을 미칠 것으로 예상됩니다.
아울러, 국내외 경기 침체가 지속되거나 반등하지 못할 경우 소비 심리 위축으로 이어질 가능성이 있으며, 실물 경제가 부진할 경우 국내외 경기는 물론 당사가 영위하는 사업 및 당사 재무 상황에도 부정적 영향을 미칠 가능성이 높으므로 투자자께서는 이 점 유의하시기 바랍니다.
| [나. 글로벌 의약품 시장 성장 관련 위험] 지난 3년간 의약품 시장의 큰 폭의 성장세는 COVID-19라는 변수가 크게 작용했기에, 2025년 이후부터는 COVID-19 확산 이전의 패턴으로 돌아가 성장률이 다시 낮아질 가능성을 배제할 수 없습니다. 이 외에도 보험사들의 가격 인하 압박, 매출 상위제품에 대한 바이오시밀러 또는 제네릭화, 평균 R&D 비용 상승 등은 의약품 시장 성장의 저해요인으로 작용할 수 있습니다. 상기한 요인들로 인해 국내외 의약품 시장에 대한 전망이 악화될 경우, 당사의 매출 및 수익성에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 항암면역치료백신 기반기술인 CeliVax와 아데노바이러스 벡터 기반 감염병 예방백신 기반기술인 Ad5/35를 보유한 바이오제약기업으로, 2종의 기반기술을 활용한 다양한 신약 파이프라인을 개발 중입니다.
의약품은 일반적으로 화학합성의약품(저분자의약품이라고도 함)과 바이오의약품으로 나눌 수 있으며, 합성의약품은 화학합성에 의해 제조하는 의약품으로서 일반적으로 복용하는 고혈압약, 진통제 등이 합성의약품에 속하고 있습니다. 바이오의약품은 생물공학기술을 이용하여 사람이나 다른 생물체에서 유래된 것(단백질)을 원료 및 재료로 해서 만든 의약품으로서 백신, 인슐린, 항체 의약품 등이 있습니다. 바이오의약품은 합성의약품에 비하여 크기가 크고 복잡한 고분자 구조를 가지고 있으며, 생물체를 이용하여 복잡한 제조공정을 거쳐야 되므로 변화에 민감합니다. 이러한 특징으로 합성의약품은 합성 물질의 합성 비율만 알면 쉽게 제조가 가능한 반면 바이오의약품의 경우 배양 기술과 환경, 방법에 따라 최종 생성물에서 차이가 발생할 수 있기 때문에 기술적으로 복잡하고 제조과정에서 고도의 기술력이 필요로 하여 상대적으로 부작용이 적고 안정성이 높습니다.
| [합성의약품과 바이오의약품 차이점] |
| 구분 | 합성의약품 | 바이오의약품 |
| 원료 | 합성화학물질 | 생물체 유래물질(세포, 조직, 유전물질 등) |
| 원료의 고려사항 |
품질(시험분석으로 확인 가능) | 시험분석으로 확인 가능한 품질 외에 공여(기증)자의 동의 등 윤리성, 감염질환 확인 등 안전성 확보 필요 |
| 구조 | 물리화학적 특성이 명확한 저분자 구조 | 정확한 특성 분석이 불가능하고, 활성과 구조가 일정하지 않음 |
| 제품의 안정성 |
대부분 온도·빛 등 환경에 안정적 | 온도·빛·pH 등 외부 환경에 민감, 미생물 오염에 취약 |
| 대부분 36개월 | (세포치료제 사례) 대부분 3일 이내 (유전자치료제 사례) 영하 135℃에서 24개월 |
|
| 제조 | 간단한 화학적 합성으로 대량생산 | 복잡한 제조과정의 맞춤형 소량 생산 |
| 원료, 공정, 설비변화가 품질에 영향이 비교적 적음 (제조공정의 변이성이 매우 낮음) |
원료, 공정, 설비의 변화가 의약품 자체를 변화 (제조공정의 변이성이 매우 높음) |
|
| 상대적으로 복제가 쉽고 낮은 제조비용 | 복제가 불가능하고 높은 제조비용 | |
| 치료효과 | 비교적 명확한 약리기전, 대다수 사람에게 일관적 효과 기대 |
(세포치료제)약리기전이 불확실 (유전자치료제)복합적인 기전 환자에 따른 맞춤형 치료 가능 |
| 대부분 질병의 증상개선에 그침 | 질병의 근본적인 원인치료 가능 | |
| 안전성 | 약물 특이적이거나 약물 대사와 관련된 이상반응 | 생물체 유래물로 고유독성은 낮으나 면역 거부 반응, 종양발생 등의 이상반응이 있음. 특히 장기 안전성 결과는 매우 부족 |
| 비임상 시험 |
동물 시험을 통하여 약물의 독성 및 효과를 예측 가능 | 동물 시험으로 인체결과를 예측하는데 한계 |
| 투약방법 | 대부분 경구·주사 등 일반적 투여경로 | 대부분 주사 또는 주입, 이식 등 시술을 동반한 투여 |
| 출처) 식품의약품안전처(첨단바이오의약품법안 검토 보고서, 의안정보시스템, 2017.11) |
한편, 바이오의약품은 성분에 따라 생물학적 제제, 단백질의약품, 항체의약품(당사 주요 개발분야), 세포치료제 및 유전자치료제 등으로 구분하고 있습니다. 또한, 바이오의약품은 합성의약품처럼 체내에서 발생되는 대사산물이 없어 독성이 낮고 작용기전이 명확하여 희귀·난치성 및 만성 질환의 치료 효과가 뛰어나기 때문에 주로 기존 치료법에 대한 미충족 수요가 높은 퇴행성, 난치성 질환 치료제 또는 환자 맞춤형 표적치료제로 사용되고 있습니다.
| [바이오의약품 분류] |
|
분 류 |
정 의 |
|
생물학적 제제 |
생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품으로서 물리적 ·화학적 시험만으로는 그 역가와 안전성을 평가할 수 없는 백신·혈장분획제제 및 항독소 등 |
|
유전자재조합 |
유전자조작기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품 항체의약품, 펩타이드 또는 단백질의약품, 세포배양의약품 등을 포함(세포배양의약품이란 세포배양기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품) |
|
재생의약품 |
살아있는 자가·동종·이종세포를 체외에서 배양·증식하거나 선별하는 등 물리적·화학적·생물학적 방법으로 조작하여 제조하는 의약품 다만, 의료기관에서 자가 또는 동종세포를 당해 수술이나 처치과정에서 안정성 문제가 없는 최소한의 조작만을 하는 경우는 제외(생물학적 특성이 유지되는 범위에서 단순분리, 세척, 냉동, 해동 등) |
|
재생의약품 |
질병치료 등을 목적으로 인체에 투입하는 유전물질 또는 유전물질을 포함하고 있는 의약품 |
|
동등생물의약품 (바이오시밀러) |
이미 제조판매 또는 수입품목 허가를 받은 품목과 품질 및 비임상, 임상적 비교동등성이 입증된 의약품 |
|
개량생물의약품 (바이오베터) |
이미 허가된 바이오의약품에 비해 안전성, 유효성 또는 유용성이 개선되었거나 의약기술에 있어 진보성이 있는 의약품 |
| 출처) 식품의약품안전처 생물학적제재 등의 품목허가심사 규정 고시 재구성 |
글로벌 의약품 시장은 인구 고령화 심화, 자가면역질환 증가 등으로 인해 관련 수요가 지속적으로 증가하고 있으며, 연구개발 비중 또한 상승할 것으로 전망되고 있습니다. 국내 제약 시장의 경우에도 복제약 판매에 치중했던 과거와는 달리 최근 기술 역량 향상 및 투자 확대에 힘입어 신약 개발 분야에서도 적지 않은 성과를 거두고 있습니다. 일반의약품 뿐만 아니라 바이오의약품에도 투자와 인력이 집중되고 있으며, 이를 주도하는 제약사들이 국내 제약 산업의 성장을 견인하고 있습니다.
한국제약바이오협회에서 글로벌 시장조사 기관, 보건복지부, 식품의약품안전처 등으로부터 관련 정보를 취합, 가공하여 발간한 '2024 제약산업 DATABOOK'에 따르면, 2023년 글로벌 의약품 시장 규모는 전년 대비 3.6% 증가한 1조 4,924만 달러를 기록하며 역대 최대치를 경신하였습니다. 세계 의약품 시장은 2022년에 소폭 성장이 둔화하였으나, 2023년에 성장률이 반등하며 현재까지 꾸준한 성장세를 보이고 있습니다. 한국제약바이오협회에서 발표한 최근 4년간 글로벌 의약품 시장 규모 추이는 다음과 같습니다.
| [글로벌 의약품 시장 규모 추이] |
| (단위: 십억 달러, %) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 |
| 전체 시장 | 1,251.7 | 1,415.1 | 1,441.0 | 1,492.4 |
| 성장률 | 2.10% | 13.05% | 1.83% | 3.57% |
| 북미 | 407.3 | 441.9 | 475.8 | 492.8 |
| 아프리카, 아시아, 오세아니아, 중동 | 418.2 | 473.9 | 461.4 | 479.5 |
| 유럽 | 359.8 | 415.8 | 427.9 | 448.1 |
| 남미 | 66.4 | 83.5 | 75.9 | 72.0 |
| 출처) 2024 제약산업 DATABOOK, 한국제약바이오협회(2024.12) |
글로벌 의약품 시장이 2022년에 성장폭이 둔화하였으나, 2021년에 13.1%라는 큰 성장세를 보일 수 있었던 주요한 이유는 COVID-19의 확산입니다. COVID-19의 확산이 제약/바이오 기업들의 신약 임상 스케줄에 차질을 준 측면도 존재하나, 오히려 환자 대상의 가상 임상, 원격을 통한 임상 모니터링, 빅데이터와 AI 기술 도입 등 신약 임상시험의 디지털화가 촉진되었습니다. 또한, COVID-19 확산 초기에는 의료기관 방문 감소로 인한 처방의약품 매출 감소가 예상되었으나 오히려 COVID-19 백신 매출 가세로 인해 백신 관련 매출액이 급증하였습니다.
한국보건산업진흥원의 '2024 글로벌 보건산업 시장규모'에 따르면, 글로벌 의약품 시장은 2023년부터 2029년까지 5.2% 수준의 연평균 성장률을 보이며 2029년 약 2조 184억 달러에 이를 것으로 전망하고 있습니다. 글로벌 시장의 성장은 주로 바이오 의약품, 특히 백신 부문에서 기인할 것으로 예상됩니다. 코로나19의 지속, 분산형 임상시험의 증가, 세포 및 유전자 치료제 제조 증대, 의약품 공급망의 디지털화 등이 향후 의약품 시장의 성장에 중요한 역할을 할 것으로 예상됩니다. 2029년까지의 시장 전망은 다음과 같습니다.
| [글로벌 의약품 시장 전망] |
| (단위: 십억 달러, %) |
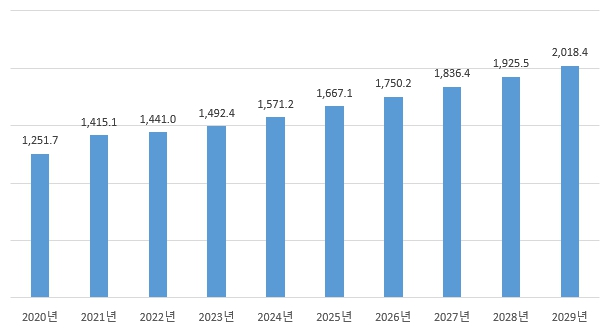 |
|
글로벌 의약품 시장 전망 |
| 출처) 2024 글로벌 보건산업 시장규모, 한국보건산업진흥원(2024.04) |
한국제약바이오협회에 따르면 2023년 국내 의약품 시장 규모(생산금액+수입금액-수출금액)은 전년 대비 5.3% 증가한 31조 4,513억원을 기록하며, 국내 의약품 시장은 역대 최대치를 달성하였습니다. 국내 의약품 시장 규모는 꾸준한 증가세를 보이고 있으며, 특히 2021년의 경우 최근 5년간의 연평균 성장률을 크게 상회하는 9.6%의 성장률을 보였는데, 이는 2020년 이후 COVID-19 백신 치료제 보급 정책에 따라 국내 생산량이 크게 증가하였기 때문입니다. 또한, 타이레놀 등의 일부 진통제와 감기약의 판매량이 증가한 것도 높은 성장세에 기여하였습니다. 최근 5년간 국내 의약품 시장 규모 추이는 다음과 같습니다.
| [국내 의약품 시장 규모 추이] |
| (단위: 억원) |
| 구분 | 2019년 | 2020년 | 2021년 | 2022년 | 2023년 |
|---|---|---|---|---|---|
| 생산 | 223,132 | 245,662 | 254,906 | 289,503 | 306,303 |
| 수출 | 60,581 | 99,648 | 113,642 | 104,561 | 98,851 |
| 수입 | 80,549 | 85,708 | 112,668 | 113,653 | 107,061 |
| 무역수지 | -19,968 | 13,940 | 974 | -9,092 | -8,210 |
| 시장규모 | 243,100 | 231,722 | 253,932 | 298,595 | 314,513 |
| 출처) 2024 제약산업 DATABOOK, 한국제약바이오협회(2024.12) |
정부는 국내 의약품산업을 국가 전략산업으로 육성하기 위해 핵심기술에 선제적으로 투자하고, 글로벌 수준의 규제 합리화 및 전후방 생태계 조성으로 활력을 제고하기 위해 노력하고 있습니다. 특히 보건복지부에서 운영 및 관리하는 혁신형 제약기업 인증 및 육성 지원을 통해 의약품산업의 구조적 선진화 및 글로벌 진출 역량을 강화하려는 정책도 지속적으로 추진하고 있습니다. 또한, 국내 고령인구 및 만성질환의 지속적인 증가세 역시 의약품 산업 확대에 많은 영향을 끼치고 있습니다.
통계청이 2024년 09월에 발표한 '2024 고령자 통계'에 의하면, 2024년 65세 이상 고령 인구는 약 994만 명으로, 전체 인구의 19.2%를 차지하고 있습니다. UN 기준에 따르면 65세 이상 인구가 총 인구 중 차지하는 비중이 14% 이상일 경우 고령사회로 정의하고 있으므로 우리나라는 이미 고령사회에 진입한 상태이며, 향후에도 계속 증가하여 2025년에는 20%, 2036년에는 30%, 2050년에는 40%를 넘어설 것으로 전망됩니다. 과학기술의 발전으로 인간의 기대 수명이 연장되었으며, 기대 수명의 연장은 다시 의약품 등에 대한 수요를 증가시키고 있습니다. 우리나라의 경우 초고령사회로의 진행 속도가 세계에서 가장 빠른 수준인 만큼, 국내 의약품 및 제약산업의 중요성이 더욱 확대될 것으로 예상됩니다.
이 외에도 혁신신약의 약가 개선, 노인 의료비 증가, 공공의료 인프라 개선에 따른 환자 수 증가, 디지털헬스 및 원격의료의 성장과 신제품 출시 등으로 인해 국내 제약산업의 지속적인 성장이 전망되고 있습니다. 상기한 바와 같이, 2021년 국내외 의약품 시장은 9%가 넘는 높은 성장률을 보였으며, 고령화 심화, COVID-19 지속 등이 의약품 시장 확대에 크게 기여하였습니다. 이 외에도 원격의료의 활성화, CMO시장의 다각화 등을 통해 의약품 시장이 지속적인 성장세를 보일 것으로 전망됩니다. 그러나 지난 3년간 의약품 시장의 큰 폭의 성장세는 COVID-19라는 변수가 크게 작용했기에, 2025년 이후부터는 COVID-19 확산 이전의 패턴으로 돌아가 성장률이 다시 낮아질 가능성을 배제할 수 없습니다. 이 외에도 보험사들의 가격 인하 압박, 매출 상위제품에 대한 바이오시밀러 또는 제네릭화, 평균 R&D 비용 상승 등은 의약품 시장 성장의 저해요인으로 작용할 수 있습니다. 상기한 요인들로 인해 국내외 의약품 시장에 대한 전망이 악화될 경우, 당사의 매출 및 수익성에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[다. 코로나19 백신 경쟁 심화 위험] |
코로나19 바이러스는 2019년 12월 중국 우한에서 처음 발생한 이후 중국 전역과 현재는 전 세계로 확산된, 새로운 유형의 병원체 사스-코로나바이러스(SARS-CoV-2)에 의한 급성 호흡기 감염질환입니다. 코로나바이러스는 감기 등 호흡기 질환을 유발하는 RNA 바이러스로서 감염자의 비말(침방울)이 호흡기나 눈·코·입의 점막으로 침투될 때 전염되며 사람을 포함한 다양한 동물에게 감염을 일으킵니다. 감염되면 약 2~14일(추정)의 잠복기를 거친 뒤 발열(37.5도) 및 기침이나 호흡곤란 등 호흡기 증상, 폐렴이 주 증상으로 나타나지만 무증상 감염 사례도 나오고 있으며 건강한 성인은 시간이 지나면 회복될 가능성이 크지만, 노약자나 기저 질병이 있던 사람 등 면역 기능이 낮은 사람이 감염될 경우 치명적일 수 있습니다. 일부는 감염 후 급성 호흡곤란 증후군(ARDS)·급성 폐 손상·패혈성 쇼크·급성 신장 손상 등으로 진행되기도 하며, 심할 경우 사망에 이를 수 있습니다. 이에 따라 전 세계적으로 유수의 제약회사 등이 코로나19 바이러스 감염증을 종식하기 위한 백신 개발이 활발히 진행되었으며, 그 분류는 다음과 같습니다.
| [코로나19 바이러스 예방백신 분류] |
| 플랫폼 | 설명 | 장점 | 단점 |
| mRNA 백신 | 항원을 암호화하는 mRNA를 투여 | 직접 감염원을 다루지 않아 안전성 높음 신속한 개발 및 생산이 가능 소규모 GMP 시설로 저비용 생산 가능 |
생체 내 전달 비효율성으로 인해 별도의 전달기술 필요 RNA 및 지질 나노입자의 불안정성으로 운송, 관리 어려움 |
| DNA 백신 | 항원을 암호화하는 DNA를 투여 | 직접 감염원을 다루지 않아 안전성이 높음 신속한 개발 및 생산이 가능 소규모 GMP 시설로 저비용 생산 가능 열에 대해 안정 기존 연구로 인체 안전성 검증 |
생체 내 전달의 비효율성 세포핵 내로 이동 필요 |
| 재조합 단백질 백신 | 병원체의 구성성분 또는 항원을 투여 | 직접 감염원을 다루지 않아 안전성 높음 면역원성을 높이기 위한 면역증강제 사용 가능 |
일부 부위만 발현하여 항원 또는 항원결정부위(epitope)의 구조 손상 가능성 생산 시 고수율 확보가 필요 대량 배양시설 필요로 생산능력 제한 |
| 바이러스 벡터 백신 | 무해한 바이러스나 세균을 전달체로 사용하여 병원체의 유전물질을 세포 내로 도입 |
메르스(MERS)등 신종 바이러스에 대한 우수한 전임상/임상 데이터 확보 | 벡터 자체가 면역반응을 일으킬 우려 |
| 약독화 생백신 | 약한 상태의 병원체를 투여 | 기존 cGMP급 백신 생산 인프라 활용 가능 | 약독화 바이러스주를 확보하기 위해 장기간 계대 배양 필요 감염성이 있는 살아있는 바이러스를 사용하여 독성 재획득 우려 |
| 불활화 백신 | 불활성 상태 또는 죽은 병원체를 투여 | 기존 cGMP급 백신 생산 인프라 활용 가능 면역원성을 높이기 위한 면역증강제 사용 가능 |
불활성화 과정에서 항원 또는 항원결정부위(epitope)의 구조 손상 가능성 |
| 출처) KISTEP 기술동향브리프, 백신 플랫폼 기술(2021.08). |
당사는 코로나19 바이러스 예방 백신 중에서 바이러스 벡터 백신을 개발하고 있으며, 전달체로는 아데노바이러스를 사용하고 있습니다. 당사 백신은 체내 면역세포에 효율적 도입이 가능한 아데노바이러스 벡터에 독창적인 항원을 탑재하여, 효과적으로 중화항체를 다량 생성하고 세포독성 T 세포 면역을 효율적으로 유도할 수 있으며, 생산이 용이합니다. 설치류와 영장류를 대상으로 진행하였던 전임상 시험에서 단회 투여 만으로 면역반응을 유도함을 보인 바 있고, 임상 1/2a상 및 새로운 임상 1상에서도 중화항체 및 세포독성 T 세포 유도능력이 있음을 입증하였습니다. 당사는 자체 개발한 코로나19 백신의 임상시험을 통해 안전성과 유효성을 확인하였으며, 이를 바탕으로 현재 오미크론 변이 바이러스 특화백신의 개발 및 허가에 당사 역량을 집중하고 있습니다.
다음은 당사의 임상 1/2a상 결과에 대한 공시내용입니다. 해당 결과에 따르면, 감염이력이 없는 군의 중화항체 역가 상승 비율(GMFR)은 10.08배로 확인되었습니다. 이는 동일 조건(감염이력이 없는 군) 기준으로 보고된 문헌상의 화이자 백신 9.1배(오미크론 BA.1 변이에 적응된 2가 BNT162b2 부스터 백신의 효능과 안전성 평가(학술자료) / Winokur et al., NEJM, 2023), 모더나 백신 7.96배(2가 mRNA-1273.214 부스터 백신의 안전성과 면역원성(학술자료) / Chalkias et al., NEJM, 2022)보다 비슷하거나 높은 수치입니다. 다만, 해당 수치는 직접 비교가 아닌 문헌 기반의 간접 비교로, 시험 대상자의 연령, 인종, 접종 이력, 임상 수행 시기 등 여러 조건이 상이하기 때문에 실제 나타나는 중화항체 역가 상승 비율과 다를 가능성이 있습니다. 또한, 코로나19의 대유행으로 인해, 임상 3상 참여자의 상당수가 기존 감염 이력을 보유하고 있을 가능성이 높고, 대조 백신과 당사 백신 간의 항원 구성 차이 등으로 인해 면역원성 결과에 변동이 있을 수 있습니다. 따라서 당사의 임상 1/2상과 3상의 결과가 완전히 일치할 것이라고 단정하기는 어려우며, 해당 문헌상의 정보보다 실제로 나타나는 화이자 및 모더나 백신의 면역원성이 당사의 백신보다 뛰어날 수 있다는 점을 유의하시기 바랍니다.
면역원성과 관련한 지표는 혈청반응률(Seroresponse rate, SRR), 기하평균역가(Geometric Mean Titer, GMT), 기하평균증가율(GMFR)이 있습니다. 먼저 혈청반응률이란 전체 참가자 수 대비 혈청 반응을 보인 참가자 수를 의미하며, 수치가 1에 가까울수록 백신 접종 후 면역 반응의 비율이 높임을 뜻합니다. 기하평균역가(GMT)는 기하평균 항체 역가로, 백신 접종 후 생성된 항체 역가의 기하평균값이며, 항체 반응 강도를 측정하는 목적으로 사용됩니다. 기하평균증가율(GMFR)은 기하평균 배수 상승치로, 백신 접종 전후 항체 역가의 증가 배수를 기하평균으로 계산한 값으로, 항체 역가 상승폭을 평가하고 수치가 1일 경우 변화가 없음을 의미합니다.
안전성과 관련하여 살펴보면 임상 1상은 20명을 대상으로 진행하였으며, 중대한 이상반응이 1건 발생하였고 이는 급성 횡단성 척수염(acute transverse myelitis)의 발생이었으나 약물 치료 후 회복되었습니다. 전체 이상반응의 대부분은 가벼운 통증, 피로, 두통 등 경미한 반응이었습니다. 임상 2상에서는 생리식염수를 투여한 위약군 51명 중 중대한 이상반응이 1건 발생하였으며, 이는 시험백신과는 관련 없는 것으로 확인하였습니다. 시험군 249명 중에서는 중대한 이상반응이 발생하지 않았으며, 백신 투여 후 7일 이내 발생한 이상반응 중 가장 흔한 증상은 압통, 피로, 근육통, 두통 등 대부분 경미(Grade 1) 수준으로, 모두 회복하였습니다.
아울러 임상 1/2상은 비교적 소규모 집단에서 면역원성과 안전성을 평가한 초기 단계로, 광범위한 인구 집단에서의 적용 가능성을 판단하기에는 한계가 있습니다.
| [COVID19 예방 백신 AdCLDCoV191 OMI의 제1/2상 임상시험 결과에 관한 공시내용 (2024.11.06)] |
| 투자 유의사항 | 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 존재합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 결과 | |
| 2. 주요내용 | 1) 임상시험명칭 | 만 19세 이상 성인 자원자를 대상으로 COVID-19 예방 백신 AdCLD-CoV19-1 OMI 추가접종의 안전성, 면역원성을 확인하기 위한 제1/2상 (단일기관, 공개, 제1상 및 다기관, 이중 눈가림, 무작위배정, 위약 대조, 제2상) 임상시험 |
| 2) 임상시험단계 | 국내 제1/2상 임상시험 | |
| 3) 임상시험승인기관 | 국내 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 대한민국 | |
| 5) 임상시험실시기관 | 고려대학교 구로병원 외 7개 기관 | |
| 6) 대상질환 | SARS-CoV-2 Omicron variant에 의한 COVID-19 예방 | |
| 7) 신청일 | 2022-05-27 | |
| 8) 승인일 | 2022-08-04 | |
| 9) 등록번호 | - 임상시험승인번호 : 100968 - 임상시험일련번호 : 202200640 |
|
| 10) 임상시험 목적 | 가. 임상 1상 - 일차 목적 : AdCLD-CoV19-1 OMI 추가접종 후 28일 동안의 안전성 및 면역원성을 확인하여 임상 2상 진입 여부 평가 나. 임상 2상 - 일차 목적 : AdCLD-CoV19-1 OMI 추가접종으로 유도되는 SARS-CoV-2 Omicron variant에 대한 면역원성을 투여 후 2주, 4주 시점에 neutralization antibody 검사로 평가 |
|
| 11) 임상시험 방법 | 가. 임상 1상 - 단일기관, 공개 제1상 임상시험으로 국내 1개 기관에서 COVID-19 예방백신의 마지막 접종 완료 및/또는 COVID-19에 의한 격리 해제 후 최소 16주 이상 48주 미만 경과한 만 19세 이상 64세 이하 성인 자원자 20명을 모집하고 임상시험용 의약품 접종 후 28일 동안의 안전성 및 면역원성을 확인하여 임상 2상 진입 여부를 평가함 나. 임상 2상 - 다기관, 이중눈가림, 무작위배정, 위약대조 제 2상 임상시험으로 국내 8개 기관에서 COVID-19 예방백신의 마지막 접종 완료 및/또는 COVID-19에 의한 격리 해제 후 최소 16주 이상 48주 미만 경과한 만 19세 이상 성인 자원자 300명을 모집하고 임상시험용 의약품 또는 위약을 5:1로 무작위배정하여 접종 후 안전성과 면역원성을 평가함 |
|
| 12) 1차 지표 | 가. 안전성 평가 - 임상시험용 의약품 접종 후 30분 이내(만 75세 이상 고령자의 경우 2시간 이내)에 발생한 즉각적 이상반응 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 이상반응 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응 나. 면역원성 평가 - 임상시험용 의약품 접종 후 2주, 4주 시점에 wild-type virus neutralization method로 분석한 SARS-CoV-2 B.1.1.529 중화항체의 혈청반응률(Seroresponse rate, SRR), 기하평균역가(Geometric Mean Titer, GMT), 기하평균증가율(GMFR) |
|
| 13) 임상시험기간 | 2022.09.21 ~ 2024.02.28 | |
| 14) 목표 시험대상자 수 | - 임상 1상 : 20명 - 임상 2상 : 300명 |
|
| 3. 시험결과 | 1) 1차 지표 통계분석방법 | 본 임상시험은 안전성 및 면역원성 탐색 목적의 제1/2상 임상시험으로 검증하고자 하는 가설이 없어 통계적 유의성 검증에 해당사항 없음 |
| 2) 결과값 | 가. 임상 1상 1) 안전성 평가 - 임상시험용 의약품 접종 후 30분 이내에 발생한 즉각적 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 국소적/전신적 이상반응은 14명(70.00%)에게서 42건 발생하였고, 중대한 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응은 6명(30.00%)에게서 7건 발생하였고, 중대한 이상반응은 1건 발생함 2) 면역원성 평가 - 시험군 19명의 베이스라인 시점에서의 GMT는 734.39였고, 임상시험용 의약품 접종 후 2주 시점에서의 GMT는 3899.49로 베이스라인 대비 5.31배(GMFR) 증가함. 4주 시점에서의 GMT는 3404.85로 베이스라인 대비 4.64배(GMFR) 증가하였으며, 2주 및 4주 시점에서의 혈청반응율은 78.95%로 나타남 나. 임상 2상 1) 안전성 평가 - 임상시험용 의약품 접종 후 30분이내 발생한 즉각적 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 국소적/전신적 이상반응은 시험군 199명(79.92%)에게서 744건 발생하였으며, 위약군 25명(49.02%)에게서 54건 발생함. 시험군과 위약군 모두 중대한 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응은 시험군 71명(28.51%)에게서 115건 발생하였으며, 위약군 17명(33.33%)에게서 26건이 발생했음. 중대한 이상반응은 위약군에게서 1건 발생함. 2) 면역원성 평가 - 시험군 234명의 베이스라인 시점에서의 GMT는 2036.66이었고, 임상시험용 의약품 접종 후 2주 시점에서의 GMT는 7386.23으로 베이스라인 대비 3.63배(GMFR) 증가하였으며, 4주 시점에의 GMT는 7135.41로 베이스라인 대비 3.50배(GMFR) 증가하였으며, 2주 및 4주 시점에서의 혈청반응율은 65.38%로 나타남 - 2주 및 4주 시점에서의 위약군 대비 시험군의 GMT ratio는 각각 3.12배, 3.41배로 나타남 |
|
| 4. 사실발생(확인)일 | 2024-11-06 | |
| 5. 향후계획 | AdCLD-CoV19-1 OMI 임상 3상 시험의 4,000명 투여를 완료하고, 임상3상 시험의 중간분석 결과를 바탕으로 조건부 품목허가를 신청할 예정 | |
| 6. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 4. 사실발생(확인)일은 임상시험수탁기관(CRO)으로부터 임상 1/2상 임상시험 결과보고서 (Clinical Study Report)를 수령한 날짜 입니다. - 본 공시 내용은 향후 당사의 보도자료 및 IR자료로 사용될 예정입니다. |
||
| ※ 관련 공시 | 2022-05-27 투자판단 관련 주요경영사항(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 계획(IND) 신청) 2022-08-04 투자판단 관련 주요경영사항(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 계획(IND) 승인) 2023-07-14 투자판단 관련 주요경영사항(임상시험 결과)(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 Top-line 결과 발표) |
|
| (자료) | DART 전자공시시스템 |
한편, 2023년 02월 WHO의 COVID-19 - Landscape of novel coronavirus candidate vaccine development worldwide에 따르면 178개의 코로나19 바이러스 백신 후보물질이 임상시험 중으로, 이 중 61개가 임상 3상 또는 4상에 진입 및 199개의 백신 후보물질이 전임상 개발 단계에 있습니다. 국내에서는 식품의약품안전처에 따르면, 2025년 01월 기준 5곳의 개발사에서 진행 중인 코로나19 바이러스 예방 백신 임상승인을 받았습니다.
| [국내 코로나19 바이러스 예방 백신 임상 현황] |
| 개발사 | 후보백신 종류 | 임상 단계 | 후보백신 종류 (임상시험용 의약품명) |
|
㈜셀리드 |
비복제성 바이러스 전달체 |
임상 1/2a상 |
비복제성 바이러스 전달체 백신 (AdCLD-CoV19) |
| 임상 2b상 (조기종료) |
비복제성 바이러스 전달체 백신 (AdCLD-CoV19-1) |
||
| 임상 3상 (투여완료) |
비복제성 바이러스 전달체 백신 (AdCLD-CoV19-1 OMI) |
||
|
SK 바이오사이언스㈜ |
재조합단백질 |
허가 |
재조합단백질 나노입자 백신(GBP510) |
|
㈜유바이오로직스 |
재조합단백질 |
임상 3상 |
재조합단백질 백신(EuCorVac-19) |
|
진원생명과학㈜ |
DNA |
임상 1/2a상(완료) |
DNA(GLS-5310) |
| ㈜큐라티스 | RNA | 임상 1상(완료) |
RNA(QTP104) |
| 아이진㈜ |
RNA | 임상 1상 완료 임상 2a상(진행중) |
RNA(EG-COVID) |
| 에스티팜㈜ |
RNA | 임상 1상 (자진취하) |
(STP2104) |
| 출처) 식품의약품안전처 및 DART 전자공시시스템 |
또한, 임상승인 뿐만이 아니라 mRNA 기반의 모더나와 화이자, 바이러스 벡터 기반의 아스트라제네카, 얀센, 재조합 단백질 기반의 에스케이바이오사이언스 등의 개발사에서 개발한 코로나19 바이러스 예방 백신 중 총 14개의 백신이 허가되어 총 1억 6,733만 도즈가 출하승인을 받았습니다.
| [국내 코로나19 바이러스 백신 허가 현황] |
| 업체명 | 제품명 | 허가일 | 플랫폼 |
| 한국아스트라제네카 | 한국아스트라제네카백스제브리아주 (사스코로나바이러스-2 바이러스 벡터 백신) |
2021-02-10 | 바이러스 벡터 백신 |
| 한국화이자제약 | 코미나티주(토지나메란) (사스코로나바이러스-2 mRNA 백신) |
2021-03-05 | mRNA 백신 |
| 한국얀센 | 코비드-19백신얀센주 (사스코로나바이러스-2 바이러스 벡터 백신) |
2021-04-07 | 바이러스 벡터 백신 |
| 모더나코리아 | 모더나스파이크박스주 (사스코로나바이러스-2 mRNA 백신) |
2021-05-21 | mRNA 백신 |
| 한국아스트라제네카 | 백스제브리아주 (사스코로나바이러스-2 바이러스 벡터 백신) |
2021-05-21 | 바이러스 벡터 백신 |
| 모더나코리아 | 스파이크박스주 (사스코로나바이러스-2 mRNA 백신) |
2021-12-13 | mRNA 백신 |
| 에스케이바이오사이언스 | 뉴백소비드프리필드시린지 (사스코로나바이러스-2 표면항원 백신(유전자재조합) |
2022-01-12 | 재조합 백신 |
| 한국화이자제약 | 코미나티주0.1mg/mL(토지나메란) (사스코로나바이러스-2 mRNA 백신) |
2022-01-28 | mRNA 백신 |
| 한국화이자제약 | 코미나티주0.1mg/mL(5-11세용)(토지나메란) (사스코로나바이러스-2 mRNA 백신) |
2022-02-23 | mRNA 백신 |
| 에스케이바이오사이언스 | 스카이코비원멀티주 (사스코로나바이러스-2 표면항원 백신(유전자재조합)) |
2022-06-29 | 재조합 백신 |
| 모더나코리아 | 모더나스파이크박스2주(엘라소메란, 이멜라소메란) (사스코로나바이러스-2 mRNA 백신) |
2022-09-08 | mRNA 백신 |
| 모더나코리아 | 스파이크박스2주(엘라소메란, 이멜라소메란) (사스코로나바이러스-2 mRNA 백신) |
2022-10-07 | mRNA 백신 |
| 한국화이자제약 | 코미나티2주0.1mg/mL(토지나메란,릴토지나메란) (사스코로나바이러스-2 mRNA 백신) |
2022-10-07 | mRNA 백신 |
| 한국화이자제약 | 코미나티주0.1mg/mL(6개월~4세용)(토지나메란) (사스코로나바이러스-2 mRNA 백신) |
2022-11-25 | mRNA 백신 |
| 출처) 식품의약품안전처 |
코로나19 바이러스는 2019년 12월 우한에서 최초 발견 된 이후 2020년 10월 인도에서 발견되어 더 빠른 전파속도와 더 심각한 증상을 유발하는 델타 변이 바이러스가 빠르게 확산되었고, 국내 역시 2021년 하반기에 빠르게 확산되었습니다. 또한, 2021년 11~12월에는 남아공 과학자들이 스파이크 단백질에 32가지 유전자 변이를 일으킨 새로운 변이, 'B.1.1.529' 일명 오미크론 변이가 발견되었다고 보고된 후 2022년전세계적으로 오미크론 바이러스 대유행 사태가 발생하였습니다. 그 결과, 국내에서 2021년 하반기 들어 백신 접종과 방역 체계가 강화되면서 위드 코로나 정책이 유지될 것으로 예상되었음에도 불구하고, 변이 바이러스인 오미크론의 등장과 확진자 수 급증으로 국내 방역조치는 강화되었습니다. 이후 현재 코로나19 바이러스는 오미크론의 하위 변이인 KP.3 및 JN.1 등이 우세를 점하고 있습니다.
세계보건기구(WHO) 자료에 따르면 KP.3(JN.1.11.13)으로 알려진 새로운 오미크론 하위변이는 2024년 2월미국에서 첫검출 이후 52개국에서 29,804건이 확인되었습니다. 이에 세계보건기구(WHO)는 KP.3을 모니터링변이로 감시 중이며 JN.1 대비 S단백질에 3개의 추가 변이를 가지고 있어 면역회피능의 소폭 증가가 확인되나, 전파력 및 중증도 증가 관련 보고는 없는 상황입니다. 따라서, 각종 변이 코로나-19가 확산되는 등 장기화될 가능성은 여전히 존재하고 있는 상황입니다.
그러나, 상기 코로나19 바이러스 백신 개발사 중 코로나19 바이러스와 오미크론 변이 바이러스에 모두 대응이 가능한 2가 백신으로서 시판 중인 회사는 모더나와 화이자만이 가능하며, 그 외 개발사의 코로나19 바이러스 백신은 wild type virus를 타겟으로 개발된 것으로 오미크론 변이에 특화된 백신이 아니기에, 이를 부스터로 접종할 경우 오미크론 변이 특화 중화항체 유도능은 기존 바이러스 대항 중화항체 유도능 대비 낮습니다.
당사는 국내에서 유일하게 오미크론 변이 바이러스에 효과적으로 대응하기 위해 오미크론 변이 바이러스 특화백신의 개발을 자체 플랫폼을 활용하여 진행하고 있습니다. 당사는 자체 개발 중인 오미크론 변이 바이러스 특화백신의 개발 및 허가를 통해 향후 다가백신으로 확장할 전략입니다. 당사가 개발하는 백신의 상업화를 통해, 글로벌 Unmet needs가 있는 COVID-19 예방백신시장에서 효과적으로 포지셔닝하고 향후 발생가능한 감염병 위험에서도 검증된 플랫폼으로 신속하게 대응할 수 있을 것으로 기대하고 있습니다.
현재 코로나19 백신은 매년 WHO(세계보건기구) 또는 FDA(미국 식품의약국)에서 권고하는 변이주에 대응하도록 업데이트되고 있습니다. 오미크론 BA.1 변이 기반의 AdCLD-CoV-19-1 OMI 백신 품목허가 후, 이를 기반으로 유행 중인 오미크론 하위 변이에 맞춰 항원을 교체하여 시장에 대응할 계획입니다. 당사는 현재 유행중인 XEC, LP.8.1 변이를 포함하여 73종의 변종백신(백신 라이브러리)을 지속적으로 구축하고 있습니다. 평균 월 1개의 신규 변이주에 대응하는 백신을 제조하고 평가하여 앞으로 사용될 백신에 대한 준비를 하고 있습니다. 특히, 당사의 플랫폼은 현재 유행 중인 JN.1 계열 변이와 그 하위 변이에 대해 강력한 면역 반응을 유도하는 백신을 개발하고 있으며, 이는 기존 XBB.1.5 백신보다 더 강력한 중화항체 반응을 보이고 있습니다. 하지만 이러한 반응은 언제까지나 현재 변이바이러스에 대한 면역 반응이며, 당사의 플랫폼을 통해 매년 백신을 업데이트하여 변이에 대응 가능한 백신을 개발 및 생산한다고 해도, 예상하지 못한 변이바이러스의 발현으로 인해 당사의 백신 플랫폼으로 대응할 수 없고, 이로 인해 당사의 경쟁력이 크게 하락할 수 있습니다.
오미크론 변이주를 타깃으로 한 코로나19 백신의 유망성은 변이주의 높은 전파력과 기존 백신의 효과 감소 문제를 해결할 수 있는 기술적 발전, 지속적인 수요 예측, 그리고 글로벌 보건 정책 변화에 기인합니다.
먼저 오미크론 변이주는 스파이크 단백질에 다중 돌연변이를 보유하며 기존 백신으로 생성된 항체를 회피하는 능력이 뛰어납니다2. 2023년 6월 CDC(미국 질병통제예방센터) 연구에 따르면 3회 접종 시 중증 예방효과는 80% 이상 유지되지만, 감염 예방효과는 120일 후 14% 미만으로 급감합니다1. 이는 변이 특화 백신의 필요성을 시사합니다. 또한 모더나의 2가 백신(BA.1/원조주)은 BA.4/BA.5에 대한 중화항체를 6.3배 증가시켰으며, 2023년 10월 발표된 데이터에 따르면 XBB.1.5 대응 백신은 8.7배 높은 항체 반응 기록하는 등 기존 백신의 효과 감소 문제를 해결하고 있는 모습을 보이고 있습니다.
1983년에 일본에서 설립되어, 고품질 시장 조사 데이터를 제공하며 글로벌 비즈니스 정보 서비스 분야에서 선도적인 역할을 하고 있는 Global Information에 따르면 글로벌 시장에서 오미크론 대응 백신의 규모는 2024년 134.3억 달러 수준에서 연평균 9.8% 성장하여 2033년에는 299.8억 달러에 달할 것으로 전망하고 있습니다. 북미 지역에서는 FDA에서 2024년 9월 XBB.1.5 대응 백신 승인 이후 6개월 내 2억 7천만 회분 공급 계획을 가지고 있으며, 유럽에서는 2025년부터 계절성 코로나19 백신 접종 체계 도입을 검토하고 있습니다. 또한, 아시아 지역에서 중국은 400억 위안(58억 달러) 규모의 소비자 분석을 반영한 백신 프로그램 운영하고 있으며, 인도네이시아에서는 2025년까지 자체 백신 생산 능력을 4억 회분으로 확대할 계획을 가지고 있습니다.
| [시장성 분석 핵심 지표] |
| 구분 | 2024년 예상 | 2033년 전망 | CAGR | 주요 동력 |
|---|---|---|---|---|
| 글로벌 시장 | 134.3억 달러 | 299.8억 달러 | 9.8% | 부스터 접종 확대, 정부 조달 프로그램8 |
| 아시아-태평양 | 47억 달러 | 112억 달러 | 10.2% | 인도 mRNA 부스터(GEMCOVAC-OM), 인도네시아 국산 백신 개발8 |
| 출처) Global COVID-19 Vaccine Market - 2025-2033, Global Informaiton(2025.02) |
하지만 BA.2.75.2, BQ.1.1 등 신규 변이에 대한 중화능 저하 문제 지속되며 바이러스 진화에 대한 불확실성이 산재한 상태이며, GlobalData(1999년 영국 런던에 설립한 글로벌 시장 조사 회사로, 런던증권거래소 AIM시장에 DATA라는 코드로 상장함)에 따르면 2026년 주요 7개국의 코로나19 백신 시장 규모를 50억 달러 미만 전망(연평균 14.5% 감소)하면서 수요가 지속 감소할 것이라고 전망하고 있습니다. 반면에 Global Information에 따르면 동남아시아를 중심으로 2025-2033년 연간 12% 성장하여, 저렴한 코로나19 백신 수요가 증가할 것으로 전망하고 있습니다.
이처럼 BA.1 오미크론 변이가 백신 개발 당시 전 세계적으로 가장 널리 유행하던 시기에 국제적으로 주요 백신 기업들이 해당 변이를 기반으로 백신을 개발한 사례가 많았기에 당사도 당시의 유행 상황과 국제적 백신 개발 동향을 반영하여 BA.1 오미크론 변이를 우선 선택하였습니다. 현재 코로나19 백신은 매년 WHO 및 미국 FDA에서 권고하는 변이주에 대응하도록 업데이트되고 있으며, 국내에서는 이러한 백신을 대부분 해외에서 수입하여 도입하고 있는 상황입니다.
이에 당사는 오미크론 변이 바이러스 특화백신의 개발을 자체 플랫폼을 활용하여 진행하고 있으며, 이를 통해 향후 다가백신으로 확장하고 당사가 개발하는 백신의 상업화를 통해, 로벌 코로나19 예방백신시장에서 효과적으로 포지셔닝하고 향후 발생가능한 감염병 위험에서도 검증된 플랫폼으로 신속하게 대응할 수 있을 것으로 목표로 하고 있습니다. 하지만 임상 3상에서 당사의 기대에 미치지 못하는 임상결과가 나오거나, 오미크론 변이주에 대응하는 백신의 시장성 감소로 인해 당사가 예상한 것 보다 더 급격한 백신 수요의 감소로 인해 예방백신 공급시장에 진입 자체를 못할 수 있으며, 오미크론 변이주 이후 새로운 바이러스가 유행할 경우, 당사의 백신 개발 플랫폼이 신속하게 백신 항원을 변경하여 대응하는 데 실패하여 추후 상업화를 하지 못하는 등 여러 가지 대내외적인 불확실성이 존재하는 상황입니다.
한편, COVID-19 예방백신 시장의 성장성이 낮아질 가능성이 존재하며, 이 경우에는 향후 당사가 목표로 하고 있는 시장에 성공적으로 진입하게 되더라도 당사의 수익 실현이 제한될 수 있습니다. (주1)
| (주1) | COVID-19 예방백신 시장 규모와 관련된 내용은 본 증권신고서 "제1부.III.투자위험요소-사업위험-라" 부분에도 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
시장 조사 기관 IQVIA(IQVIA는 미국 노스캐롤라이나에 본사를 둔 글로벌 기업으로, 주로 임상 연구, 의료 데이터 분석, AI 및 IT 솔루션을 제공하는 계약 연구 기관(CRO)으로, 2016년 Quintiles와 IMS Health의 합병을 통해 설립되었으며, 현재 약 88,000명의 직원이 100여 개국에서 일하고 있습니다)에 따르면 글로벌 코로나19 백신 소비는 2023년 150억 달러 수준으로 파악되며, 2024년부터 2028년까지 8년간 총 약 2,130억 달러 수준으로 추정되고 있습니다. 기존 추정치인 2024년부터 2027년까지 7년간 총 약 3,800억 달러 대비 44% 감소한 수치인데, 이는 여러 국가들의 엔더믹 선언과 독감 예방 주사처럼 코로나 백신을 관리하기 시작하는 점에 기인합니다.
| [글로벌 코로나19 백신 소비 시나리오] |
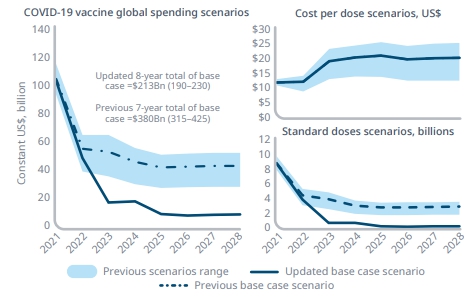 |
|
covid-19 vaccination spending and volume forecasts |
| 출처) Global Use of Medicines 2024, IQVIA(2024.12) |
국내/외 구분없이 코로나19 양성자/사망자는 꾸준히 발생하고 있으며, 그 위험도는 동절기에, 고령층 등 고위험군에서 높아지고 있습니다. 코로나19 경계 단계에서 관심 단계로 하향하면서 현재는 종료된 질병관리청의 코로나19 양성자(표본) 감시 주간소식지(2024년 4월 4주차)에 따르면 전체 양성자 대비 고위험군에 해당하는 60세 이상 인구의 양성자 비율은 52.6%로 증가세를 지속하였습니다. 미국에서는 2022년 8월부터 2024년 4월까지 1년 9개월간 매주 300명 ~ 3,500명의 사망자가 발생했으며, 동절기에 사망자 및 입원환자 수가 증가하는 경향을 보이고 있습니다. 또한 질병관리청에서 매주 공표하는 감염병 표본감시 주간소식지에 따르면 2025년 현재 큰 폭의 코로나19 바이러스의 검출이 나타나고 있지는 않지만, 20-22평균 및 23-24평균을 고려했을 때, 30주차 내외부터 검출 현황이 급증하기 때문에 2025년 여름 경에도 비슷한 계절성으로 코로나19 바이러스가 증대될 수 있습니다.
| [호흡기바이러스 주별 검출 현황] |
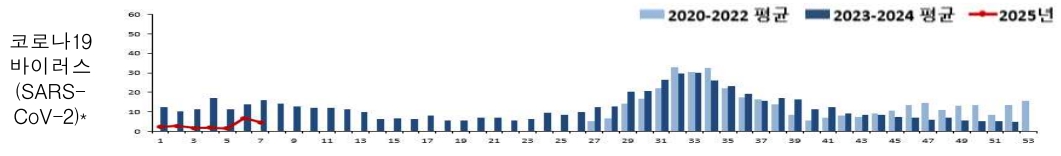 |
|
호흡기바이러스 주별 검출 현황 (2017. 1. 1. ~ 2025. 2. 15.) |
| 출처) 감염병 표본감시 주간소식지(2025년 7주차), 질병관리청 |
신규 변이주가 지속적으로 출현하고 있으며 현재 허가된 백신으로는 최신 변이주 감염 예방에 대응하기엔 역부족이므로 매년 업데이트된 백신 접종이 필수적입니다. 2025년 2월에 한국을 포함한 전세계 코로나19 우세종은 KP.3를 포함한 JN.1 변이주이며, 국내에서 활용중인 코로나19 백신은 XBB.1.5 변이주 대응에 최적화된 백신이기 때문에 JN.1을 포함한 최신 변이주 감염 방어에는 효과가 제한적입니다. 이처럼 효과적인 코로나19 예방을 위해서는 최소 매년 1회의 업데이트된 백신을 이용한 예방접종이 필요합니다.
이에 질병관리청은 고위험군의 중증화 및 사망을 예방하기 위해 코로나19 백신의 국가필수예방접종 전환을 2024년 주요 정책계획 중 하나로 발표하였습니다. 하지만 코로나19 예방접종을 지자체보조 전환함에 따라 2025년 코로나19 예방접종 관련예산 2,242억원을 배정하였습니다. 이 중 코로나19 백신 도입 예산으로 1,649억원을 편성하여 24년 대비 대폭 축소하였습니다.(주1)
| (주1) | 관련 내용은 본 증권신고서 "제1부.III.투자위험요소-사업위험-라" 부분에도 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이처럼 팬데믹 종료 이후에도 글로벌 백신 시장에서 코로나19 백신이 차지하는 시장 규모의 크기, 고위험군 및 동절기에 증가하는 양성 비율, 지속적으로 발생하는 신규 변이바이러스 및 이에 따른 코로나19 백신의 국가필수예방접종 전환 움직임 등을 고려해볼 때 코로나19 백신에 대한 시장 규모는 비록 감소세를 보인다 하더라도 당사가 진출을 목표하기에는 적절한 시장이 유지될 것으로 판단하고 있습니다. 다만, 당사에서 추후 진출할 계획이 있으나 필리핀, 베트남 등 특정 중/저소득 국가에서의 코로나19 백신 시장 규모는 현재 객관적인 통계 자료가 존재하지 않아 시장성을 판단하기에는 어려움이 있습니다. 이는 현재 개발된 코로나19 백신의 가격이 비싸고 초저온 보관이 필수적이기 때문에 국가 경제 규모나 인프라 면에서 적극적으로 백신을 활용하기 어려워 관련 시장에 대한 정확한 통계가 어렵기 때문인 것으로 생각됩니다. 또한 당사는 베트남 및 필리핀에서 임상을 진행한 이유는 해당 국가에 진출하려는 목적보다는 해외 임상을 진행하기 위한 목적이 주된 목적이었습니다. 필리핀과 베트남은 임상시험을 신속하게 수행할 수 있고, 당사와 협력 중인 CRO(임상시험수탁기관)사가 네트워크를 보유한 국가로, 임상 운영 효율성과 실행 가능성을 종합적으로 고려해 선정했습니다. 해당 해외 임상은 해당 국가에서의 판매 목적은 부수적이고, 주된 목적은 WHO 사전적격성평가(Prequalification, PQ) 획득을 위한 기반을 마련하는 데 있습니다. WHO PQ 심사에서는 다양한 인구집단에서의 안전성과 면역원성 데이터 확보가 중요하게 고려되며, 단일 국가 임상만으로는 글로벌 조달 시장 진입 시 신뢰도 측면에서 한계가 있기 때문입니다. 이처럼 당사는 필리핀, 베트남 등 복수 국가에서 임상 데이터를 확보함으로써, WHO PQ 심사에서의 경쟁력을 높이고자 하였습니다. 이는 향후 필리핀과 베트남뿐만 아니라, WHO PQ 획득을 발판으로 아시아 외 중남미 등 글로벌 시장 진출을 위한 전략적 선택입니다. 따라서 당사가 국내, 필리핀, 베트남에서의 임상 결과 유의미한 결과를 도출하고 향후 상품화에 성공하더라도 국내를 포함한 글로벌 시장에서의 백신 수요가 낮을 수 있습니다. 이 경우 당사는 막대한 연구개발 비용을 투입했음에도 불구하고, 그 이상의 수익을 창출하는 것이 어려울 수 있습니다.
코로나19 백신 개발 과정에서 해외 임상시험의 필요성을 살펴보면 다음과 같습니다. 해외 임상시험의 필요성은 다양한 인구집단 대응, 변이바이러스 감시, 글로벌 규제 기준 충족, 개발 속도 향상이라는 4대 축을 중심으로 설명됩니다.
1. 인종/지역별 면역 반응 차이 대응
1985년부터 Sergio Arouca 국립공중보건학교(ENSP)가 발행을 시작한 공중보건 및 관련 분야의 연구를 다루는 브라질의 학술 저널인 Cadernos de Saude Publica (CSP)에 따르면 백신 효능은 HLA(인간백혈구항원) 유전형에 따라 차이가 발생할 수 있습니다. 예를 들어, 아시아인과 유럽인의 항원 인식 패턴 차이가 보고되었으며, 당뇨병, 비만 유병률이 지역별로 상이해 예방효과 분석에 해외 데이터 필수적입니다.
2. 변이주 감시 및 효과 검증
2022년 WHO 솔리대리티 임상(STV)은 15개국에서 40종 백신을 테스트하며 변이 대응력을 평가한 사례가 있으며, 남아공 베타(B.1.351), 인도 델타(B.1.617.2) 변이 등은 현지 임상에서 최초 확인되었습니다. 또한 유럽연합의 의약품 평가 및 감독을 담당하는 과학 기관인 EMA는 1년 이상 추적 관찰을 요구하며, 남미 및 아프리카 참여 임상에서 모더나 백신의 XBB.1.5 대응 항체가 6개월 후 58% 감소하는 패턴을 확인한 사례가 있습니다.
3. 글로벌 규제 승인 요건 충족
미국 FDA와 유럽 EMA는 임상 데이터의 인종 다양성 확보를 승인 전제조건으로 규정하고 있으며, 일본 PMDA(의료약품의료기기종합기구)는 해외 임상 3상 데이터를 50% 이상 요구하고 있습니다. 화이자 백신의 경우 6개 대륙 153개 사이트에서 4.4만 명 참여로 긴급사용승인(EUA)을 획득하였으며, 아스트라제네카는 태국, 브라질에서 2만 명 대상으로 면역원성 데이터 추가 수집한 사례가 있습니다.
4. 개발 기간 단축 및 비용 최적화
미국 FDA의 'Real-Time Oncology Review' 방식(항암치료제의 심사 과정을 혁신적으로 개선한 프로그램으로 기존 6개월 이상 소요되던 심사 기간을 최대 80% 단축한 프로그램)을 백신에 적용하여 미국 내 1상과 동시에 브라질에서 2/3상 진행이 가능한 등 개발 기간이 단축되는 효과가 있습니다.
| [해외 임상의 전략적 활용 사례] |
| 백신명 | 임상 참여국가 | 주요 성과 |
|---|---|---|
| 화이자 | 6개 대륙 153개 사이트 | 95% 전반적 효능 확인 |
| 스푸트니크V | 러시아+아르헨티나+인도 | 냉장 보관 가능성 입증 |
| 코백실 | 영국+남아공+브라질 | 베타 변이 대응력 추가 검증 |
| 출처) COVID-19 vaccines: studies for approval, EMA |
이처럼 해외 임상은 단순 데이터 확보를 넘어 현지 생산설비 검증(모더나, 2023년 아프리카 mRNA 허브 구축) 및 긴급사용승인(EUA) 동시획득 전략(시노백, 45개국 병행 신청)의 기반이 됩니다. 다만 일부의 윤리적 문제와 데이터 표준화의 어려움은 지속적인 개선 과제로 남아 있습니다.
WHO의 Global Vaccine Market Report 2023 Update 및 2024 자료에 따르면빅파마(Big Pharma)들의 코로나19 백신 시장 점유율은 다음과 같습니다
1. 글로벌 시장 점유율
화이자-바이오엔텍(Pfizer-BioNTech)은 2023년 기준 전체 시장 가치의 약 26%를 차지하며, 가장 높은 점유율을 기록했습니다. 이는 mRNA 기반 백신인 코미나티주(Comirnaty)의 성공 덕분입니다. 모더나(Moderna)는 약 7~15%의 점유율을 보이며, mRNA 기술을 활용한 백신 개발로 주목받았습니다. 존슨앤존슨(J&J)은 바이러스 벡터 기반 백신으로 약 2~3%의 시장 점유율을 기록하였으며, 아스트라제네카(AZ)는 약 2~4%의 점유율을 보이며, 특히 개발도상국에서 널리 사용되었습니다. 이 외에 중국 제조사들은 초기에는 높은 점유율을 보였으나, 최근 몇 년간 매출 감소로 인해 점유율이 축소되었습니다. 현재 시노팜(CNBG-Sinopharm)은 약 3%, 시노백(Sinovac)은 더 낮은 비중을 차지하고 있는 것으로 파악됩니다.
2. 아시아 시장 점유율
화이자-바이오엔텍(Pfizer-BioNTech)은 아시아 시장에서도 mRNA 백신 코미나티주(Comirnaty)를 통해 강력한 입지를 확보했습니다. 특히 일본, 한국, 싱가포르 등 선진국에서 높은 접종률을 기록했습니다. 모더나(Moderna)는 스파이크(Spikevax) 백신으로 글로벌 시장에서 두각을 나타냈으며, 아시아에서도 화이자(Pfizer)와 함께 mRNA 백신의 주요 공급자로 자리 잡았습니다. 일본과 한국 등에서 높은 수요를 보였습니다. 아스트라제네카(AZ) 바이러스 벡터 기반 백신 백스제브리아(Vaxzevria)는 초기 팬데믹 동안 동남아시아와 인도에서 널리 사용되었습니다. 특히 가격 경쟁력과 유통 용이성 덕분에 개발도상국에서 높은 점유율을 기록했습니다. 존슨앤존슨(J&J)은 단일 접종 백신으로 주목받았으나, 아시아 시장에서는 상대적으로 낮은 점유율을 보였습니다. 시노백(Sinovac) 및 시노팜(Sinopharm) 등 중국 기업들은 초기 팬데믹 동안 아시아 개발도상국에서 주요 공급자로 활약했으나, 최근에는 mRNA 백신에 밀려 점유율이 감소했습니다. 시노백(Sinovac)의 코로나백(CoronaVac)은 동남아시아와 중국 내에서 여전히 사용되고 있습니다13.
3. 지역별 특징
중국은 시노백(Sinovac) 및 시노팜(Sinopharm)이 주도하며, 자국 내 수요와 함께 동남아시아로의 수출이 많았습니다. 인도의 경우, 인도 최대 백신생산기업인 세럼인스티튜트 오브 인디아(Serum Institute of India(SII))는 아스트라제네카(AstraZeneca)와 협력해 대규모 생산을 담당하며, 아시아 및 글로벌 백신 공급망에서 중요한 역할을 했습니다. 일본 및 한국에서는 화이자(Pfizer)와 모더나(Moderna)가 주로 사용되며, 고소득 국가로서 mRNA 백신의 주요 시장입니다.
4. 저소득국가 특징
데이터가 마지막으로 집계된 2023년 기준 백신 접종률은 필리핀은 72.55% (2023년 5월 19일 기준), 베트남은 90.79% (2023년 06월 30일 기준)로 높은 수준을 보입니다. 동남아시아 중저소득국가는 코로나19 백신 접종 초기 단계에서 COVAX, GAVI 등 국제 백신 지원 프로그램을 통해 대규모 물량을 조달한 바 있습니다. 예를 들어, 2022년 1월 기준, 베트남은 2억 600만회분의 백신 중 아스트라제네카(AZ)가 6,000만도스, 화이자 및 모더나 8,800만도스, 시노팜 5,100만도스, 쿠바 압달라(Abdala) 500만도스, 스푸트니크V 150만도스 등을 들여왔습니다. 이 가운데 국가예산으로 구매한 백신은 1억 300만회분이고 나머지는 코백스(Covax)와 한·미·일·중·유럽·호주 등 다른 나라 및 기업들의 무상지원분입니다. 또한 2021년 11월 기준, 필리핀은 그동안 시노백 5050만회분, 아스트라제네카 1,610만회분, 화이자 3,210만회분, 존슨앤드존슨(얀센) 320만회분, 모더나 1,000만회분, 스푸트니크V 720만회분, 시노팜 110만회분을 들여온 바 있습니다. 하지만 COVAX 및 Gavi의 백신 무상 지원 프로그램이 종료되면서, 중저소득국가(LMICs)를 중심으로 저렴하고 안정적인 백신 공급에 대한 수요는 계속될 것으로 예상됩니다.
빅파마들은 아시아 지역에서 중국 기업들과의 경쟁이 심화되었으며, 가격 경쟁력과 유통망 구축이 중요한 요인으로 작용했습니다. 엔데믹 전환 이후 부스터 샷 수요 감소로 인해 전체 시장 규모가 축소되고 있으며, 이는 빅파마들의 점유율에도 영향을 미치고 있습니다. 결론적으로, 화이자-바이오엔텍(Pfizer-BioNTech)와 모더나(Moderna)가 아시아 선진국 중심으로 강세를 보였고, 아스트라제네카(AstraZeneca)와 중국 기업들이 개발도상국에서 중요한 역할을 했습니다.
당사의 백신은 Ad5/35 기반 저비용 생산, 상대적으로 유리한 보관 온도 요건(2~8℃)을 기반으로 중저소득국(LMICs)에서 가격 경쟁력과 공급 유연성 측면에서 유리하다고 판단됩니다. 코로나19 팬데믹 기간 동안 백신 플랫폼의 선택은 국가의 소득 수준과 조달 여건에 따라 큰 차이를 보였습니다. 고소득 국가(HICs)의 경우, 화이자(Pfizer), 모더나(Moderna) 등 mRNA 플랫폼 백신을 중심으로 조기 확보 및 접종이 이루어진 반면, 중저소득 국가(LMICs)는 시노백, 시노팜(불활화 백신), 아스트라제네카(바이럴 벡터 백신) 등 다양한 플랫폼 백신을 사용하였습니다. 이는 가격, 보관 조건, 공급 시기 등의 제약 요인 때문이며, 특히 저온 유통 인프라가 부족한 지역에서는 2~8℃ 보관이 가능한 백신이 선호되었습니다. 따라서, mRNA 백신이 접종을 주도한 고소득국과 달리, COVAX, Gavi 등의 지원을 통해 다양한 플랫폼 백신을 활용한 중저소득국의 백신 전략은 상대적으로 유연하면서도 현실적인 선택이었습니다. 이러한 배경은 당사의 Ad5/35 백신이 LMIC 시장에서 가격·공급 측면의 경쟁력을 가질 수 있는 근거로 볼 수 있습니다. 하지만 이는 언제까지나 당사 백신의 안전성 및 유효성이 입증되어야 추후 가능성이 존재하는 상황이며, 임상 3상 결과에 따라 조건부 품목허가 또는 정식 품목허가가 모두 승인이 나지 않을 가능성도 존재합니다.
따라서 당사의 아데노바이러스 백터 기반의 오미크론 변이 백신은 화이자 및 모더나처럼 mRNA 기반이 아닌 아스트라제네카와 같은 벡터 기반이기 때문에 상대적으로 부유하지 않은 개발도상국 등에서 경쟁력이 있을 것으로 판단됩니다. 특히, 아스트라제네카의 바이러스 백터 기반의 백신인 백스제브리아는 저렴한 가격과 유통 및 보관의 용이성을 경쟁력으로 동남아시아 등 개발도상국에서 높은 점유율을 차지한 것처럼, 당사도 고소득의 선진국보다는 상대적으로 가격 경쟁력이 더 발휘될 수 있는 개발도상국을 목표 시장으로 잡아야할 것으로 보입니다. 하지만 현재 당사는 해외 진출보다는 국내 정부 주도의 관급 시장에 진입하는 것을 목표로 하고 있으며, 국내 관급 시장에 진출이 불발될 가능성과 국내 관급 시장에 진입하더라도 해외 시장에 진출하지 못할 가능성 모두 존재하는 상황입니다.
또한, 코로나19가 전세계적으로 창궐한지 5년이 지난 현재, 전세계적으로 약 178개의 후보물질이 임상중에 있으며, 경쟁강도는 점차 심화되고 있습니다. 국내의 경우 당사만이 오미크론 변이 특화백신을 개발하고 있으나, 이미 모더나, 화이자 등의 개발사는 오미크론 변이 2가 백신을 공급하고 있으며, 추후 다른 경쟁사 역시 오미크론 변이 특화 백신을 개발할 가능성도 존재합니다. 이처럼 타 백신 개발사의 경쟁 백신이 개발될 경우 당사의 코로나19 백신 개발 등에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| [라. 코로나19 바이러스 종식 가능성에 따른 위험] 정부는 2023년 03월 29일 중 중증화율,치명률 감소 등 질병 위험 하락과 기구축된 대응 역량을 감안하여 위기상황에서 벗어나 일상적 관리체계로의 전환 추진하기로 결정하였으며, 이후 사항들은 더욱 완화되어 2023년 06월 01일부터 시행되었습니다. 또한, 세계보건기구(WHO)는 코로나19 국제공중보건위기상황 해제를 발표하였습니다. 이처럼 코로나19의 확산세가 진정되고 치명률이 낮아지며 정부의 코로나19 방역 정책이 완화되는 추세가 지속됨에 따라 백신 접종률 역시 감소하고 있는 추세를 보이고 있습니다. 백신 부작용에 대한 우려, 돌파감염 등 백신 효과에 대한 불신 등의 이유로 2021년 10월 25일부터 시작된 3차 백신 접종과 2022년 2월 14일에 시작된 4차 백신 접종자 수는 큰 폭으로 감소하여, 2023년 3월 기준 3차 접종률 약 66%을 기록하였으며, 60세 이상을 대상으로 한 4차 접종과 동절기 접종은 접종 대상자인 60세 이상의 접종률이 약 44%를 기록하는 등 1차 및 2차 접종 대비 접종률이 하락하였습니다. 하지만, 2023년 11월 13일 기준 65세 이상의 누적 접종자는 2,943,293명이고 누적 접종률은 30.1%로 접종 시작 후 66일 차에 30%를 달성한 2022년 대비 빠른 속도로 접종률이 증가하였습니다. 2024년 1월 질병관리청은 코로나19 변이 바이러스 유행에 따라 코로나19 감염, 백신 접종 등을 통해 면역이 형성되지 않은 사람들의 중증도와 백신 접종군의 중증도를 비교한 연구 결과, 예방접종군 중증도는 미접종자 대비 델타시기 1/6배, 오미크론 시기 1/3배 낮다고 국제 학술지에 발표하였습니다. 또한 백신 재고관리에 대한 우려도 제기되고 있습니다. 2024년 10월에 발간된 국회예산정책처의 2025년도 예산안 위원회별 분석 보고서에 따르면, 코로나19 예방접종 실시의 내역사업인 코로나19 백신도입 사업의 2025년도 예산안은 2024년도 대비 약 2,051억원을 감액한 약 2,242억원을 기록편성하였습니다. 이는 전년 대비 47.8%p 감소한 수치이며, 이는 코로나19 백신 구매비를 국가예방접종(NIP)와 동일하게 지자체에서 재원을 일부 부담하는 지자체 보조사업으로 전환할 계획의 일환이라는 점에 기인합니다. 질병관리청은 2025년도 예산안에서 신규사업으로 팬데믹 대비 mRNA 백신 개발 지원사업에 약 290억원, 우선순위 감염병 대유행 대비 신속개발기술 구축 지원사업에 약 34억원을 편성하여, 신종 감염병 유행 대비 및 대응 차원에서 mRNA 백신 플랫폼 확보를 위한 지원사업을 추진하고, 우선순위 감염병의 백신 등 개발하여 신속개발 체계를 사전에 구축하려는 의지를 보여줬습니다. 이는 정부의 코로나19 백신 국산화 필요성을 의미하기도 하지만, 최근 임상 3상이 종료된 당사의 아데노바이러스 벡터 기반의 백신에 부정적인 영향을 미칠 수 있습니다. 당사가 개발하고 있는 오미크론 전용백신에 대한 품목허가 신청은 2025년 2분기 ~ 2025년 3분기를 예상하고 있으며, 2025년 ~ 2026년 변이에 대한 백신은 2025년 4분기에 긴급사용승인을 받고 2025년 4분기 ~ 2026년 1분기에 첫 백신 매출이 가능할 것을 목표로 하고 있으나, 초기에는 소규모일 것으로 예상하고 있습니다. 향후 본격적인 매출은 2025년 ~ 2026년 변이 바이러스에 대한 국가필수예방접종사업 대상자 15백만명 중에서 5백만명을 목표로 발생할 것으로 기대하고 있습니다. 다만 이는 당사의 예상에 불과하며, 임상 진행 경과 및 임상 성공 유무에 따라, 품목허가 신청이 이루어지지 못할 수도 있고, 조건부 품목허가 신청이 이루어지더라도 긴급사용승인이 거절될 가능성도 있으며, 긴급사용승인이 완료되더라도 매출 실현까지 이어지지 못하고 연구개발에 실패할 가능성도 존재합니다. 또한 당사는 면역력이 낮은 소아 및 고령층은 향후에도 코로나19 백신 접종률이 일정 수준 유지될 것으로 판단하여, 이를 집중 목표 시장으로 타겟하고는 있으나, 당사의 예상과 달리 코로나19 백신 접종에 대한 필요성 인식이 낮아질 경우, 당사는 향후 연구개발에 성공하더라도 매출 발생이 제한적일 가능성도 존재합니다. 당사의 오미크론 변이주 대응 백신이 긴급사용승인을 받으려면, 공중보건적 필요성과 임상적 우수성이 명확히 입증되어야 합니다. 하지만 현재 코로나19 위기 상황이 완화된 점과 기존 백신들이 이미 충분히 공급되고 있다는 점에서 승인 가능성은 다소 제한적일 수 있습니다. 다만, 새로운 변이가 출현하거나 고위험군 보호를 위한 추가적인 백신 옵션이 필요하다고 판단될 경우, 승인 가능성이 열릴 수도 있으나, 이는 현재 시점에서 불확실한 사항입니다. 또한 2024년 05월 01일부터 코로나19 바이러스에 대한 정부의 위기 단계 하향 '경계(3단계) → 관심(1단계)' 및 WHO의 국제공중보건위기상황 해제 등 코로나19 바이러스의 심각성 감소에 따른 조치 등으로 인해 코로나19 바이러스 백신 수요 감소 추세는 이어질 가능성이 존재합니다. 또한, 코로나19 바이러스가 지속적으로 변이됨에 따라 전파력과 면역 회피력이 높아졌음에도 불구하고, 낮아지고 있는 바이러스의 치명률은 코로나19 바이러스 백신 수요에 부정적인 영향을 미칠 수 있습니다. 이는 코로나19 바이러스 벡터를 개발하고 있는 당사의 사업에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
코로나19 바이러스는 2019년 12월 01일 중국 후베이성 우한시에서 첫 환자가 발생한 이후 높은 감염성으로 인해 전세계로 확대됨과 동시에 중증 이상 환자의 숫자가 빠르게 증가하여, 세계보건기구(WHO)는 2020년 01월 31일 국제적 공중보건 비상사태를 선포했고 2020년 03월 11일에 범유행(팬데믹)을 선포하였습니다.
국내에서는 2020년 03월 22일 강도 높은 사회적 거리두기 대책을 발표하면서 감염 위험이 높은 종료, 실내체육, 유흥시설 등 일부 시설과 업종의 운영을 제한하였으며 국민들에게 많은 사람들이 모이는 행사 및 모임 참가 자제, 외출 자제, 재택근무 확대 등을 요청하였습니다. 이후 2021년 06월 20일에는 사회적 거리두기 체계 개편(안)을 공개하면서 자율과 책임을 기반으로한 지속 가능한 거리두기 체계를 구축하였으나, 장기간 지속된 방역조치로 자영업자, 소상공인 영업 피해, 취약계층 지원 감소, 학생 학습 손실 등 전 사회부문에서 피해가 누적됨에 따라 당국은, 방역 대책의 효과성과 지속 가능성이 저하됨을 인지하여 사회적 회복을 위한 새로운 방역 대책인 '단계적 일상회복, 위드코로나'를 2021년 11월 시행하였습니다.
| [모임·행사·집회 단계별 방역수칙] |
| 구분 | 1단계 | 2단계 | 3단계 | 4단계 |
| 모임 | 방역수칙 준수 | 8명까지 모임 가능 (9인 이상 사적모임 금지) |
4명까지 모임 가능 (5인 이상 사적모임 금지) |
18시 이후 2명까지 모임 가능 (3인 이상 사적모임 금지) |
| 행사 | 500인 이상 행사 시 지자체 사전 신고 |
100인 이상 행사 금지 | 50인 이상 행사 금지 | 행사 금지 |
| 집회 | 500인 이상 집회 금지 | 100인 이상 집회 금지 | 50인 이상 집회 금지 | 1인 시위 외 집회 금지 |
| 자료 : COVID-19(http://ncov.mohw.go.kr/) 보도자료, (2021.06.20) |
| [단계적 거리두기 개편 기본방향] |
| 구분 | 1차 개편 | 2차 개편 | 3차 개편 |
| 방향 | 생업시설 운영제한 완화 | 대규모 행사 허용 | 사적모임 제한 해제 |
| 전환기준 |
① 예방접종완료율 (1차 70%, 2차 80%) ② 중환자실, 입원병상 여력 (>40%) ③ 주간 중증환자, 사망자 발생 규모 ④ 유행 규모, 재생산지수 등 ※ 세부지표는 방역의료분과에서 논의 예정 |
||
| 자료 : 보건복지부 보도자료 (2021.10.29) |
그러나, 2021년 12월 새로운 변이 바이러스인 오미크론 변이 바이러스(B.1.1.529/아프리카 최초 발견 이후 남아프리카공화국 확산 시작으로 현재 유럽, 브라질 등 글로벌 전파중)의 국내 확진 판정으로 새로운 바이러스의 출현과 위드코로나 시행 이후 폭증한 확진자 수(11월 말 ~ 12월 초 일평균 4천여명)로 인해 기존 거리두기 강화 조치를 2022년 01월 16일까지 추가 연장하기로 발표하였습니다. 이후에도 확진자 수의 지속적인 증가로 일일 신규 확진자는 2022년 03월 60만명을 돌파하기도 하면서 사회적 거리두기 정책은 지속적으로 연장 적용되었습니다.
한편, 2022년 04월부터는 확산 추세가 진정되고 치명률이 낮아짐에 따라 정부는 2022년 04월 18일자로 마스크 착용을 제외한 사회적 거리두기의 모든 조치를 해제하기로 발표하였습니다. 구체적으로는 운영시간, 사적모임, 행사 및 집회, 종교활동 등에 관련된 모든 조치를 해제하며, 실내외 마스크 착용 의무만 현행 기준을 유지한다고 밝혔습니다. 또한 2022년 04월 25일부터 실내 다중이용시설 취식, 노인여가복지시설 운영 허용 등의 새로운 규정을 추가 발표하였습니다. 이후 09월 26일부터는 실외마스크 착용 의무를 해제하고 착용 권고로 전환하는 실외 마스크 착용 자율 전환 방안을 발표하였습니다. 또한, 정부는 신규 환자 발생 규모가 당국의 방역 역량으로 관리 가능한 수준에 머무를 가능성이 높을 것으로 전망하였으며, 유행 중인 오미크론 변이는 기타 변이보다 낮은 질병 부담(위중증, 사망자 발생 등)을 보이는 상황으로 판단하였습니다. 그 결과 2023년 01월 30일부터 실내 마스크 착용 의무 조정 1단계가 시행되었습니다.
| [실내 마스크 착용 의무 조정 1단계 관련 사항] |
 |
|
실내 마스크 착용 의무 조정 1단계 관련 보도자료 |
| 자료 : 보건복지부 보도자료 (2023.01.20) |
추가적으로, 정부는 2023년 03월 29일 중 중증화율,치명률 감소 등 질병 위험 하락과 기구축된 대응 역량을 감안하여 위기상황에서 벗어나 일상적 관리체계로의 전환 추진하기로 결정하였으며, 이후 사항들은 더욱 완화되어 2023년 06월 01일부터 시행되었습니다. 이후 2023년 8월 31일부터 코로나19 감염병 등급을 2급에서 4급으로 하향 조정하였으며, 2024년 5월 1일 부로 코로나 위기 단계를 현행 '경계(3단계)'에서 '관심(1단계)'로 낮추기로 하면서 병의원과 약국 등 일부 시설에서 유지됐던 실내 마스크 착용 의무 등 남은 방역 규제가 대부분 사라졌습니다.
또한, 세계보건기구(WHO)는 ①주간 사망, 입원 및 위중증 환자 수 감소, ②감염 및 예방접종 등을 통해 높은 수준의 인구면역 보유, ③유행 변이 바이러스의 독성 수준 동일 등 향후 대응에 있어 긍정적으로 평가함과 동시에 ①변이 심각성이 낮고 확진자 발생이 감소하는 점 ②전 세계적인 SARS-CoV-2 바이러스 유행이 지속되더라도 예상치 못한 위험을 초래하지는 않는 점 ③의료체계 회복탄력성 증가로 코로나19 환자 대응 및 기타 의료서비스 유지가 가능한 점 등을 고려하여 비상사태에서 벗어나 장기적인 관리체계로 전환할 시점이라고 판단한 결과 2020년 01월 30일 위기상황 선포 후 3년 04개월만에 2023년 05월 04일 제15차 COVID-19 긴급위원회 결정을 수용하여 코로나19 국제공중보건위기상황 해제를 발표하였습니다.
| [국내 코로나19 위기단계 조정 로드맵] |
| 분야 | 과거 | 2023년 03월 29일 (당초) |
2023년 06월 01일 (변경) |
2023년 08월 31일 (위기단계 로드맵 2단계 시행) |
2024년 05월 01일 (위기단계 '관심'(1단계)로 하향 조정) |
|---|---|---|---|---|---|
| 격리 | - 확진자 7일 격리 | - 격리기간 단축 (7일 -> 5일) |
- 5일 권고전환 | - 5일 권고 | - 코로나19 주요 증상이 호전된 후 24시간 경과 시까지 권고 |
| 마스크 | - 일부 유지 (입소형 감염취약시설, 의료기관 및 약국) |
- 유지 | - 권고 전환 - 일부 유지 (병원급 이상 의료기관, 입소형 감염취약시설) |
- 권고 전환 - 일부 유지 (병원급 이상 의료기관, 입소형 감염취약시설) |
- 권고 전환 |
| 취약시설보호 | - 입소자(입소시) / 종사자(주1회) 선제검사(PCR) |
- | - 종사자선제검사권고전환 (유증상, 다수인 접촉 등 필요시 PCR 또는 RAT) - 접촉 대면 면회시 취식 허용(방역수칙 준수) |
- 접종력에 관계없이 외출 및 외박 허용 - 대면 면회시 면회객 사전음성 확인 |
- 권고 전환 |
| 검역 | - 입국 후 3일차 PCR 권고 | - 입국 후 3일차 PCR 권고 종료 | - 당초 계획 유지 | - 당초 계획 유지 | - 당초 계획 유지 |
| 출처) 질병관리청(2023.05.11) 및 언론보도 |
이처럼 코로나19의 확산세가 진정되고 치명률이 낮아지며 정부의 코로나19 방역 정책이 완화되는 추세가 지속됨에 따라 백신 접종률 역시 감소하고 있는 추세를 보이고있습니다.
2021년 02월 10일 국내에서 최초로 아스트라제네카의 바이러스 벡터 백신이 허가를 받은 이후 2021년 상반기 얀센, 모더나, 화이자의 코로나19 백신 등이 추가로 허가됨에 따라 2021년 백신 접종이 활발하게 이루어져, 2021년 12월 31일 기준으로 누적 백신 접종자 수는 1차 약 4천 4백만명, 2차 약 4천 2백만 명을 기록하여 각각 접종률 약 86%, 83%를 기록하였습니다.
| [국내 코로나19 바이러스 백신 1차 및 2차 접종자 수 추이] |
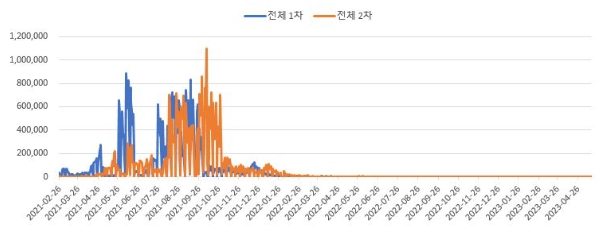 |
|
코로나19 백신 국내 접종자 수 추이 |
| 출처) 질병관리청 |
그러나, 백신 부작용에 대한 우려, 돌파감염 등 백신 효과에 대한 불신 등의 이유로 2021년 10월 25일부터 시작된 3차 백신 접종과 2022년 02월 14일에 시작된 4차 백신 접종자 수는 큰 폭으로 감소하여, 2023년 03월 기준 3차 접종률 약 66%을 기록하였으며, 60세 이상을 대상으로 한 4차 접종과 동절기 접종은 접종 대상자인 60세 이상의 접종률이 약 44%를 기록하는 등 1차 및 2차 접종 대비 접종률이 하락하였습니다.
| [접종 차수별 접종건수 및 접종률] |
| 구분 | 시작일 | 접종건수(명) | 접종률(%) |
| 1차 접종 | 2021년 02월 26일 | 45,259,652 | 87.6 |
| 2차 접종 | 44,808,051 | 86.8 | |
| 3차 접종 | 2021년 10월 25일 | 33,743,898 | 65.7 |
| 4차 접종 | 2022년 02월 14일 | 7,601,114 | 44.3 |
| 동절기 추가접종 | 2022년 10월 11일 | 6,587,859 | 35.3 |
| 출처) 질병관리청(2023.03.29) |
| 주1) 2022년 12월 17일 기준 단가백신을 활용한 3차 및 4차 접종은 중단되었습니다. |
| 주2) 동절기 추가접종의 경우 3차 및 4차 접종이 중단되며, 추가접종 유형이 동절기 추가접종으로 단일화되었습니다. |
| 주3) 동절기 및 4차접종은 대상자(60세 이상) 대비 접종률, 나머지는 인구 대비 접종률입니다. |
하지만, 2023년 11월 13일 기준 65세 이상의 누적 접종자는 2,943,293명이고 누적 접종률은 30.1%로 접종 시작 후 66일 차에 30%를 달성한 2022년 대비 빠른 속도로 접종률이 증가하였습니다. 2024년 1월 질병관리청은 코로나19 변이 바이러스 유행에 따라 코로나19 감염, 백신 접종 등을 통해 면역이 형성되지 않은 사람들의 중증도와 백신 접종군의 중증도를 비교한 연구 결과, 예방접종군 중증도는 미접종자 대비 델타시기 1/6배, 오미크론 시기 1/3배 낮다고 발표하였습니다.
| ['22년 동절기 추가접종과 '23~'24절기 접종률 비교(65세 이상)] |
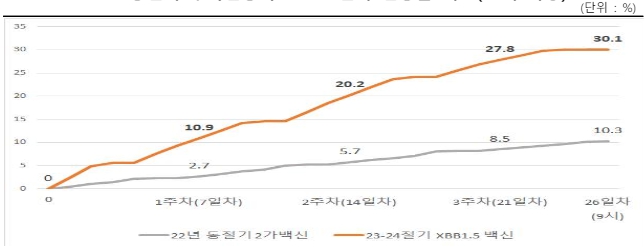 |
|
’22년 동절기 추가접종과 ’23-’24절기 접종률 비교(65세 이상) |
| 출처) 질병관리청(2023.11.13) |
또한, 2022년 오미크론 변이 대유행 이후 이에 대응하기 위한 백신 역시 개발되었습니다. 2022년 09~10월에는 모더나와 화이자의 2가 백신(코로나19 초기바이러스, 오미크론 변이 바이러스 두 가지를 예방하는 성분이 들어있는 백신)이 허가를 받아 2022년 11월 07일부터 접종되었습니다. 그럼에도 불구하고, 2023년 09월 06일 기준으로 감염취약시설 접종률 60.7%를 제외하고, 60세 이상 접종률은 34.5%, 18세 이상 접종률은 15.6%를 기록하는 등 전체적으로 낮은 접종률을 보였습니다.
| [코로나19 바이러스 2가 백신 접종 현황] |
| (단위 : 명, %) |
| 구분 | 대상자 | 접종자 | 접종률 | |
| 주간 신규 | 누적 | |||
| 60세 이상 | 13,556,507 | 798 | 4,678,339 | 34.5 |
| 감염취약시설 | 777,838 | 86 | 471,776 | 60.7 |
| 면역저하자 | 1,333,997 | 72 | 386,351 | 29.0 |
| 18세 이상 | 42,776,281 | 1,450 | 6,676,239 | 15.6 |
| 12세 이상 | 44,250,917 | 1,460 | 6,709,156 | 15.2 |
| 출처) 질병관리청(2023.09.06) |
| 주1) 대상자 : 2023년 08월 31일 기준 마지막 접종일로부터 90일이 지난 사람 |
| 주2) 감염취약시설에는 요양병원, 요양시설, 정신건강증진시설, 노숙인 및 장애인시설, 노인주거복지시설, 결핵 및 한센인 거주시설 이용 입소 입원 종사자가 포함되어있습니다. |
그러나 접종 54일차 24-25절기 코로나19 예방접종 65세 이상누적자 수는 4,654,259명으로 지난 절기 동기간 접종률 38.8% 보다 높은 수준인 45.2%를 기록하고 있습니다. 접종 54일차 65세 이상 접종률은 22-23절기 23.9%, 23-24절기 38.8%, 24-25절기 45.2%로 지속 증가하고 있으며, 이는 코로나19 백신과 인플루엔자 백신의 동시 접종을 지속해서 권고하여 두 백신의 접종에 대한 수용성이 매년 점차 증가한 것이 원인으로 파악됩니다.
| [최근 3개년 절기 코로나19 백신 접종률 비교] |
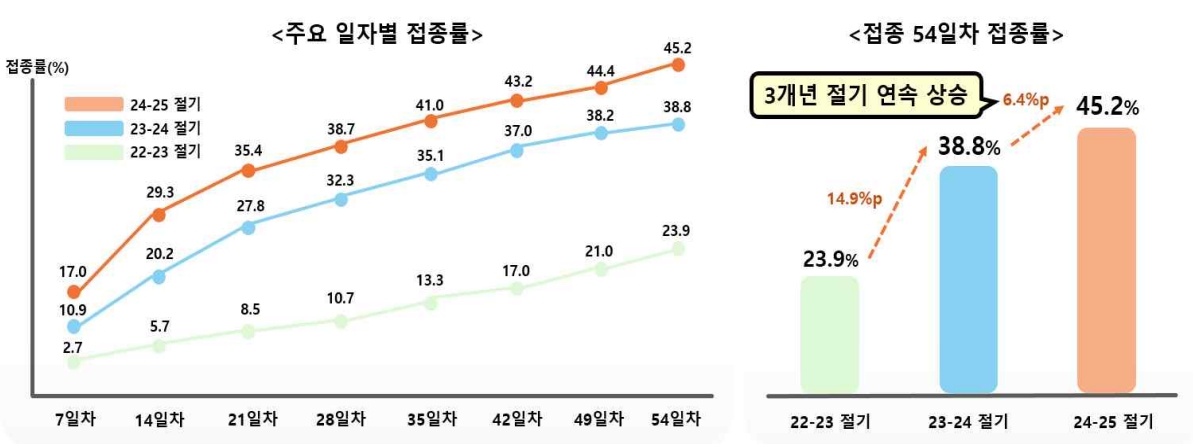 |
|
최근 3개년 절기 코로나19 백신 접종률 비교 |
| 출처) 질병관리청(2024.12.04) |
또한 백신 재고관리에 대한 우려도 제기되고 있습니다. 2024년 10월에 발간된 국회예산정책처의 2025년도 예산안 위원회별 분석 보고서에 따르면, 코로나19 예방접종 실시의 내역사업인 코로나19 백신도입 사업의 2025년도 예산안은 2024년도 대비 약2,051억원을 감액한 약 2,242억원을 기록편성하였습니다. 이는 전년 대비 47.8%p 감소한 수치이며, 이는 코로나19 백신 구매비를 국가예방접종(NIP)와 동일하게 지자체에서 재원을 일부 부담하는 지자체 보조사업으로 전환할 계획의 일환이라는 점에 기인합니다.
그럼에도 불구하고 질병관리청은 65세 이상, 면역저하자 등 고위험군에게 무료접종을 지속 지원할 예정이며, 백신 공급은 실제 공급계약을 체결하고 도입까지 장기간이 소요 되기 때문에 이에 대비하여 충분한 백신 물량 확보가 필요하며, 백신 활용도 제고를 위해 여유물량에 대해서 공급물량 및 공급일정 등을 제약사와 지속적으로 협의하여 재고 관리 효율성을 높일 수 있을 것으로 예상하고 있습니다. 또한, 코로나19 오미크론 변이 이후 또 다른 다양한 변이들이 유입되어 새로운 유행이 반복될 가능성도 존재합니다.
질병관리청은 2025년도 예산안에서 신규사업으로 팬데믹 대비 mRNA 백신 개발 지원사업에 약 290억원, 우선순위 감염병 대유행 대비 신속개발기술 구축 지원사업에 약 34억원을 편성하여, 신종 감염병 유행 대비 및 대응 차원에서 mRNA 백신 플랫폼 확보를 위한 지원사업을 추진하고, 우선순위 감염병의 백신 등 개발하여 신속개발 체계를 사전에 구축하려는 의지를 보여줬습니다. 이는 정부의 코로나19 백신 국산화 필요성을 의미하기도 하지만, 최근 임상 3상이 종료된 당사의 아데노바이러스 벡터 기반의 백신에 부정적인 영향을 미칠 수 있습니다.
| [질병관리청 소관 2025년도 예산안 신규사업] |
| 구분 | 세부사업명 | 예산안(백만원) |
| 일반회계 (3개) |
의료현장 감염 대응 역량 고도화 기술 개발(R&D) | 1,412 |
| 팬데믹 대비 mRNA 백신 개발 지원사업(R&D) |
29,033 | |
| 우선순위 감염병 대유행 대비 신속개발기술 구축 지원사업(R&D) |
3,375 | |
| 합계 | 33,820 | |
| 출처) 질병관리청 |
한편, 정부 예산의 경우, 매년 9월 정도에 열리는 예산안 위원회별 분석에 따라 정해지기 때문에 2025년 3월 현재 2025년도 예산안의 변동폭을 예측하기가 어렵습니다. 하지만 2022년도 코로나 백신 도입 예산안이 약 2조 6천억원이었으나 실제 결산은 약 1조 8,712억원으로 예산안 대비 28%p 감소하였고, 2023년도 코로나 백신 도입 예산안이 기존 7,167억원에서 2,151억원으로 70%p 감소하였으므로 2025년도 코로나 백신 도입 예산안 역시 큰 폭으로 감소할 가능성이 존재합니다. 또한 코로나 19의 완전한 종식이나 백신 개발 경쟁사의 우월한 성능의 백신 개발 등 예기치 못한 사건으로 인해 정부의 2025년도 코로나 백신 도입 예산안이 대폭 축소될 수도 있다는 점을 반드시 유의하여 주시기 바랍니다. 게다가 현재는 국가예방접종(NIP) 지원사업으로 전환이 되지 않았기 때문에 수의계약 형태이며, 이에 따라 계약의 예상 시점을 특정할 수 없으며, 추후 국가예방접종(NIP) 지원사업으로 전환되더라도 입찰 형식의 계약으로 진행될 것으로 예상되기에 해당 시점 및 당사의 계약 성사 여부 등의 사항 역시 불확실하다는 점도 유의하여 주시기 바랍니다.
2021년 11월 남아프리카공화국에서 보고된 오미크론 변이는 확산을 거듭하며 BA.1, BA.2, BA.4, BA.5, BA.2.75와 같은 계통으로 세분화되었습니다. 2022년 상반기 BA.1과 BA.2(스텔스 오미크론)에 이어 2022년 07월 이후 BA.5 변이가 장기간 우세종을 차지했으나, 2022년 하반기 BA.2와 BA.5의 특성을 모두 갖고 있는 BA.2.75(켄타우로스 변이) 역시 등장 및 유행하였습니다. 2022년 12월 말에는 BA.2.75의 하위변이인 BN.1의 확산이 시작되며, 2023년 1분기 BA.5을 제치고 국내 우세종을 차지하였으나 2022년 4분기 미국에서 우세종으로 급부상한 XBB.1.5 변이 바이러스와 결막염을 유발하는 것으로 알려진 XBB.1.16 변이가 국내에서도 가파르게 확산되었습니다. 이 후 2024년 07월 기준 오미크론 JN.1 계열의 세부계통 변이가 국내 코로나19 변이 바이러스 검출율의 대부분을 차지하고 있습니다.
코로나19 변이 바이러스는 일본, 독일, 호주, 싱가포르 등에서도 국내와 유사한 다양성을 확인할 수 있고, 종합적으로 볼 때 국가마다 유행하는 변이와 그 우세 정도에 차이가 있습니다. 2025년 07월 기준, 국내의 경우 KP.3이 가장 높은 비율을 차지하고 있습니다. 약 86%의 국민이 백신 접종을 완료한 상태지만, 지속적으로 새로운 변이가 등장하는 과정에서 바이러스의 전파력과 면역 회피 능력이 점차 상승하는 모습을 보이며 확진자가 계속해서 발생하는 상황입니다.
| [국내 코로나19 변이바이러스 세부계통 점유율(2024년 7월 기준)] |
| (단위 : %) |
| 변이바이러스 세부계통 | 4월 | 5월 | 6월 | 7월 |
|---|---|---|---|---|
| KP.3 | 0.3 | 2.5 | 12.1 | 45.5 |
| KP.2 | 1.3 | 5.9 | 5.7 | 15.8 |
| JN.1 | 83.1 | 67.2 | 59.3 | 14.6 |
| LB.1 | 0.1 | 1.3 | 2.5 | 5.4 |
| JN.1.16 | 9 | 17.4 | 19.1 | 10.4 |
| XDQ | 3.7 | 2.8 | 0 | 0 |
| 출처) 질병관리청(2024.08.09) |
| 주) JN.1은 JN.1.16, KP.2, KKP.3, LB.1을 제외한 JN.1의 모든 세부계통을 포함. |
이처럼 전파력과 면역회피 능력이 향상된 변이 바이러스가 지속적으로 등장하기 때문에 코로나19 바이러스에 대한 방역체계가 다시 강화되고, 이에 따른 백신 접종률이 올라가는 상황을 배제하기는 어려울 것으로 예측되고 있습니다. 또한, 질병관리청에 따르면 75세 이상 2회 감염자의 중증화율은 미접종군 2.45%, 단가백신 접종군 1.21%, 2가백신 접종군 0.68%로 모든 접종군에서 중증화율이 가장 높았으며, 특히 미접종군(2.45%)에서 가장 높았습니다. 또한, 단가백신의 중증화 예방효과가 약 68.4%, 2가백신의 중증화 예방효과가 77.1%를 기록하는 등 위중증에 대한 비교적 높은 예방효과를 보유하고 있기 때문에 코로나19 바이러스 백신의 중증화 예방효과로 인해 고위험군을 중심으로 한 백신 접종은 지속적으로 이루어지고 있고, 이를 위한 백신 추가도입이 이루어지고 있습니다.
| [60세 이상 재감염 추정사례(2회 감염)의 중증화 예방효과] |
| (단위 : 명, %) |
| 구분 | 2회 감염자 | 중증화수 | 중증화율 | 상대위험비(95% CI) | 예방효과 | |
|---|---|---|---|---|---|---|
| 미접종 | 전체 | 27,067 | 436 | 1.61 | - | - |
| 60-74세 | 14,813 | 136 | 0.92 | - | - | |
| 75세이상 | 12,254 | 300 | 2.45 | - | - | |
| 단가백신 | 전체 | 325,456 | 1,657 | 0.51 | 0.32(0.29-0.35) | 68.4 |
| 60-74세 | 226,211 | 455 | 0.20 | - | - | |
| 75세이상 | 99,245 | 1,202 | 1.21 | - | - | |
| 2가백신 | 전체 | 105,801 | 391 | 0.37 | 0.23(0.20-0.26) | 77.1 |
| 60-74세 | 58,903 | 70 | 0.12 | - | - | |
| 75세이상 | 46,898 | 321 | 0.68 | - | - | |
| 출처) 질병관리청(2023.11.16) |
| 주1) 분석기간은 2020년 1월 20일 ~ 2023년 7월 22일 확진자 30,266,448명 대상입니다. |
| 주2) 확진 당시 예방접종력으로 1차 접종자는 불완전 접종으로 미접종군으로 분류하였고, 단가백신 접종군은 2~4차 접종자를 의미합니다. |
| 주3) 중증화(중증+사망) 수는 확진 후 28일을 모니터링한 결과입니다. |
또한 질병관리청은 코로나19 변이 바이러스 유행에 따라 코로나19 감염, 백신 접종 등을 통해 면역이 형성되지 않은 사람들의 중등도와 백신 접종군의 중증도를 비교한 연구 결과를 국제 학술지(BMC Infectious Diseases)에 발표하였는데, 예방접종군 중증도는 미접종자 대비 델타시기 1/6배. 오미크론 시기 1/3배 수준으로 낮은 결과를 보였습니다.
| [월별 미접종군 등의 중증도와 백신접종군의 중증도 추이] |
 |
|
월별 미접종군 등의 중증도와 백신접종군의 중증도 |
| 출처) 질병관리청(2024.01.24) |
코로나19 유행이 팬데믹에서 엔데믹으로 전환되는 상황 속에서 코로나19 백신 접종 수요는 하락하는 양상을 보이고 있으나, 오미크론의 세부 아형들의 우세 기간이 짧아지며 우세종이 월 단위로 변화함에 따라 전 세계적으로 여전히 높은 확산세 및 재감염율을 이어가고 있습니다. 이에 전 세계 정부에서 지속적인 백신 접종을 통한 추가 면역 획득을 위해 접종 정례화 도입을 추진하고 있는 만큼 코로나19 백신 시장은 초기 시장 대비 감소하였지만 계속해서 큰 규모의 시장을 형성할 것으로 전망되고 있습니다. 실제로 대한민국 국민의 약 86.8%가 기초 접종을 완료한 상황에서도 확진자는 꾸준히 발생하고 있습니다. 특히 60세 이상 재감염 추정사례 비율은 2회 감염자 19.7%, 3회 감염자 28.6%, 4회 이상 감염자 31.9%로 감염 횟수가 증가할수록 60세 이상의 비율이 점진적으로 증가하고 있습니다.
| [확진자 재감염추정사례 발생현황(2020.01.20 ~ 2023.07.22)] |
| 구분 | 총 확진자(명) | 재감염(2회 이상) 추정사례(명) | 확진자 중 구성비(%) | |
| 연령대 | 0-17세 | 5,386,288 | 588,449 | 10.9 |
| 18-59세 | 18,131,283 | 1,300,420 | 7.2 | |
| 60-74세 | 4,686,825 | 305,582 | 6.5 | |
| 75세이상 | 2,062,052 | 162,551 | 7.9 | |
| 예방접종력 | 미접종 | 5,834,662 | 621,242 | 10.6 |
| 단가백신 | 23,845,771 | 1,581,335 | 6.6 | |
| 2가백신 | 586,015 | 154,425 | 26.4 | |
| 출처) 질병관리청(2023.11.16) |
| 주1) 분석기간은 2020년 1월 20일 ~ 2023년 7월 22일 확진자 30,266,448명 대상입니다. |
| 주2) 확진 당시 예방접종력으로 1차 접종자는 불완전 접종으로 미접종군으로 분류하였고, 단가백신 접종군은 2~4차 접종자를 의미합니다. |
또한, 2022년 07월 24일부터 12월 10일까지의 확진자 7,705,379명을 대상으로 연령별 감염 횟수에 따른 치명률 조사 결과, 2회 감염시 사망위험도는 1회 감염 보다 1.72배 높게 나타나며 고연령층에서는 최대 3배까지 증가하는 것으로 확인되었습니다.
| [BA.5. 유행 사례를 통한 사망위험도 분석] |
| 연령대 | BA.5. 유행시기(22.07.24~22.12.10) | 사망위험도 | |||||
| 1회 | 2회 | ||||||
| 감염 | 사망 | 치명률 | 감염 | 사망 | 치명률 | (2회/1회) | |
| 0-17 | 1,240,508 | 11 | <0.01 | 292,877 | 2 | <0.01 | 0.77 |
| 18-29 | 1,286,307 | 10 | <0.01 | 113,464 | 2 | <0.01 | 2.27 |
| 30-39 | 1,100,106 | 21 | <0.01 | 99,210 | 4 | <0.01 | 2.11 |
| 40-49 | 1,167,725 | 65 | 0.01 | 85,090 | 12 | 0.01 | 2.53 |
| 50-59 | 1,136,836 | 201 | 0.02 | 54,711 | 29 | 0.05 | 3 |
| 60이상 | 1,773,897 | 4,403 | 0.25 | 121,983 | 521 | 0.43 | 1.72 |
| 계 | 7,705,379 | 4,711 | 0.28 | 767,335 | 570 | 0.49 | 12.4 |
| 출처) 질병관리청 |
이는 국내 조사 결과뿐만 아니라 미국 워싱턴대 의과대학 알 알리 교수 팀의 연구 결과에서도 1회 감염 대비 2회 감염시 입원율, 심장, 폐, 콩팥 등 각종 장기의 후유증이 증가하고 3회 감염시 그 정도가 더욱 증가하는 것을 확인할 수 있습니다. 따라서 감염 예방뿐만 아니라 재감염과 중증 진행을 낮추기 위해 새로운 변이에 대응 가능한 코로나19 백신 접종의 필요성이 높아지고 있습니다.
| [코로나19 n차 감염별 후유증 추이] |
 |
|
코로나19 n차 감염별 후유증 추이 |
| 출처) Bowe et al. 2022 Nature medicine |
이러한 백신의 감염 및 중증/사망 예방효과와 항체 지속기간 등 객관적 근거를 기반으로 2023년 3월 질병관리청은 코로나19 백신을 모든 국민을 대상으로 연 1회, 단 면역저하자는 연 2회 접종을 시행한다는 내용의 '코로나19 백신 접종 기본방향'을 발표한 바 있습니다. 특히 65세 이상, 기저질환자 등의 고위험군에 백신 접종을 적극적으로 권고하고 있습니다. 다른 국가들 역시 국내와 유사한 2023년 접종계획을 발표하고 있습니다. 미국 FDA는 기초 접종을 완료한 국민을 대상으로 연 1회 가을에 2가 백신 접종을, 고위험군은 연 2회 접종을 권고하였으며, 일본 또한 코로나19 백신 접종을 매년 1회 이상 연례 접종으로 전환하였고 호주도 동절기를 대비하여 65세 이상 및 고위험군에 백신 접종을 권고하고 있습니다.
당사의 목표 시장은 면역력이 낮은 13세 이하 어린이 및 65세 이상 글로벌 27.8억명 및 한국 14.7백만명으로 도즈 당 14,000원 가격을 기준으로 산정 시 글로벌 38.9 조원 및 한국 2,058 억원의 시장 규모가 예상되며, 국내의 경우 독감백신을 의무적으로 접종해야 하는 군인 약 60만 명을 추가할 경우 국내 코로나19 백신 정부 조달 시장 규모는 약 2,142 억원으로 추정할 수 있습니다. 현재 글로벌 시장에서 높은 점유율을 보유한 화이자/BioNTech, 모더나 백신은 정부 계약에서 민간 시장으로 전환 시 도즈 당 110~130달러의 가격으로 공급할 것을 발표하고 있습니다. 당사 자체 개발 코로나19 백신은 mRNA백신 2개 사의 공급가격 대비 경쟁력 있는 가격에 공급 가능하며, 효능 및 유통/보관 편의성 등의 제품 경쟁력을 기반으로 개발도상국 이하 시장에서 점유율을 확보할 수 있을 것으로 기대됩니다.
질병관리청의 보도자료에 따르면 2024년 질병관리청은 코로나19 예방접종 및 이상반응 관리를 위해 총 4,414억 원의 예산을 편성하였으며, 코로나19 백신 755만 회분을 전량 해외에서 도입한 바 있습니다. 이를 바탕으로 도즈당 가격은 약 4~5만 원으로 추정됩니다. 현재 코로나19 변이(오미크론 전용 백신 및 추가접종용)에 대응할 수 있는 국내 백신 플랫폼 보유 기업은 없는 상황으로, 백신 수급의 해외 의존도는 앞으로도 지속될 가능성이 높습니다. 이러한 점을 고려할 때, 당사의 백신을 해외 백신의 절반 수준의 가격으로 공급하더라도 상업성은 충분하다고 판단하였습니다. (주1)
| (주1) | 당사의 백신 가격 산정과 관련된 내용은 본 증권신고서 "제1부-III.투자위험요소-2.회사위험-라." 및 "제1부-I-Ⅴ.자금사용목적" 부분에 상세 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
다만, 향후 정부 정책 및 시장 상황에 따라 긍정적 또는 부정적 요인이 발생할 수 있어, 이에 대한 단정은 어려운 상황입니다.
당사가 개발하고 있는 오미크론 전용백신에 대한 품목허가 신청은 2025년 2분기 ~ 2025년 3분기를 예상하고 있으며, 2025년 ~ 2026년 변이에 대한 백신은 2025년 4분기에 긴급사용승인을 받고 2025년 4분기 ~ 2026년 1분기에 첫 백신 매출이 가능할 것을 목표로 하고 있으나, 초기에는 소규모일 것으로 예상하고 있습니다. 향후 본격적인 매출은 2025년 ~ 2026년 변이 바이러스에 대한 국가필수예방접종사업 대상자 15백만명 중에서 5백만명을 목표로 발생할 것으로 기대하고 있습니다. 다만 이는 당사의 예상에 불과하며, 임상 진행 경과 및 임상 성공 유무에 따라, 품목허가 신청이 이루어지지 못할 수도 있고, 조건부 품목허가 신청이 이루어지더라도 긴급사용승인이 거절될 가능성도 있으며, 긴급사용승인이 완료되더라도 매출 실현까지 이어지지 못하고 연구개발에 실패할 가능성도 존재합니다. 또한 당사는 면역력이 낮은 소아 및 고령층은 향후에도 코로나19 백신 접종률이 일정 수준 유지될 것으로 판단하여, 이를 집중 목표 시장으로 타겟하고는 있으나, 당사의 예상과 달리 코로나19 백신 접종에 대한 필요성 인식이 낮아질 경우, 당사는 향후 연구개발에 성공하더라도 매출 발생이 제한적일 가능성도 존재합니다.
조건부 품목허가와 긴급사용승인은 각각 다른 목적과 절차를 가지고 있으며, 주로 의약품의 빠른 시장 출시를 지원하기 위해 사용됩니다. 먼저 조건부 품목허가는 의약품이 충분한 임상 데이터를 갖추지 못했지만, 특정 조건 하에서 허가될 수 있는 제도입니다. 주로 희귀 질환이나 치료 옵션이 제한된 경우에 사용되며, 심사기관이 신청서를 심사하여 허가 여부를 결정합니다. 일반적으로 6개월에서 1년 정도 소요되지만, 상황에 따라 달라질 수 있습니다.
다음으로 긴급사용승인은 공중보건 위기 상황에서 효과적인 치료법이 부족할 때, 임상 시험이 완료되지 않은 의약품을 긴급하게 사용할 수 있도록 허가하는 제도입니다. 조건부 품목허가와 마찬가지로 심사 기관이 신청서를 신속하게 심사하여 승인 여부를 결정합니다. 일반적으로 몇 주에서 몇 개월 정도 소요되며, 상황에 따라 신속하거나 늦게 처리될 수 있습니다.
위 두 가지 제도는 모두 의약품의 빠른 시장 출시를 지원하기 위해 사용되지만, 조건부 품목허가는 특정 조건 하에서 장기적인 사용을 목표로 하고, 긴급사용승인은 공중보건 위기 상황에서 임시적으로 사용할 수 있도록 허가하는 차이가 있습니다. 관련 법령에 따라 위의 제도들을 살펴보면 다음과 같습니다.
공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법(약칭, 위기대응의료제품법)에 따르면 조건부 품목허가는 항암제, 생명을 위협하는 희귀한 질환이나 긴박한 상황 하에서 적용되는 의약품을 환자의 치료기회 확대를 위해 3상 임상시험(치료적 확증 임상시험) 결과 제출을 조건으로 허가하고 있습니다. 조건부 품목허가 신청을 위해 신청사는 )「의약품 등의 안전에 관한 규칙」제39조의2제2항에 따라해당 품목이 질병이나 질환 등에 대한 임상적 유익성 또는 그 효능ㆍ효과를 객관적으로 확인할 수 있는 임상적 평가변수에 대하여 효과가 있음을 입증하는 임상시험 자료 또는 해당 품목이 약물역학, 약물치료학, 병태생리학 등의 관점에서 임상적 효과를 합리적으로 예측할 수 있는 대리평가변수를 통해 효과가 있음을 입증하는 임상시험 자료를「의약품 등의 안전에 관한 규칙」제4조제1항 각 호의 서류(제4조 제1항제1호의 서류 중 임상시험성적에 관한 자료를 제외한다)와 함께 제출하여야 합니다.
품목허가 사항은 품목 조건부 허가의 완결성 및 허가조건 합목적성을 위한 중앙약사심의위원회를 실시하며, 주요 허가조건은 인체에 대한 안전성ㆍ유효성 등을 확증하기 위하여 투약자 대상 임상시험 자료 등을 별도로 정하는 기간 내에 제출할 것을 단계에서조건으로 부관(추후 조건이행 완료 시 삭제)합니다.
당사의 조건부 품목허가 신청은 투여가 완료된 임상 3상에 대한 중간분석 결과를 수령하고 이를 바탕으로 진행할 예정이나, 조건부 품목허가 신청을 위한 자료 제출이 지연되거나, 제출을 하더라도 조건부 품목허가의 심사가 길어지거나 심사단계에서 예기치 못한 사유 등으로 인해 허가가 나지 않을 가능성이 없진 않은 상황입니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
| [공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법 (약칭: 위기대응의료제품법)] |
|
제11조(조건부 품목허가) ① 식품의약품안전처장은 의약품의 안전성ㆍ유효성 및 대상 질병의 특성상 치료적 확증 임상시험과 그 형태와 목적이 유사한 치료적 탐색 임상시험을 완료한 예비 위기대응 의약품에 대하여 해당 의약품의 치료적 확증 임상시험 자료 등을 별도로 정하는 기간 내에 제출할 것을 조건으로 하여 품목허가를 할 수 있다. 이 경우 다음 각 호에서 정하는 자료를 제출하여야 한다. |
| [공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법 시행규칙 (약칭: 위기대응의료제품법)] |
| 제12조(조건부 품목허가의 신청 등) ① 법 제11조제1항부터 제3항까지에 따른 조건부 품목허가 신청서는 별지 제7호서식과 같다. ② 법 제11조제1항제2호에서 “총리령으로 정하는 자료”란 다음 각호의 자료를 말한다. 1. 「의약품 등의 안전에 관한 규칙」 제4조제1항제1호부터 제3호까지, 제6호, 제7호, 제9호부터 제11호까지의 규정에 해당하는 자료 중 치료적 확증 임상시험 자료를 제외한 자료. 다만, 건강한 사람에게 감염증 예방 목적으로 투여하는 백신에 대하여 조건부 품목허가를 받으려는 경우에는 치료적 확증 임상시험 자료의 중간결과를 포함하여 제출한다. 2. 법 제11조제1항제1호의 자료 및 제1호 단서에 따른 임상시험 자료를 외국 자료로 제출하려는 경우에는 해당 자료가 해당 국가의 법령에 따른 허가(조건부허가, 긴급사용승인 등 허가에 준하는 조치를 포함한다)를 위하여 제출ㆍ평가받은 임상시험 자료임을 확인할 수 있는 자료. 다만, 해당 자료를 함께 제출할 수 없는 경우에는 담당 공무원이 해당 국가의 승인품목정보를 직접 확인하는 것으로 대신할 수 있다. ③ 법 제11조제2항제2호에서 “총리령으로 정하는 자료”란 임상시험계획(체외진단의료기기의 경우 임상적 성능시험 계획을 말한다)에 관한 자료와 다음 각 호의 구분에 따른 자료를 말한다. 1. 의료기기(체외진단의료기기는 제외한다) 가. 「의료기기법 시행규칙」 제5조제1항제1호 및 제3호에 따른 자료 나. 「의료기기법 시행규칙」 제9조제2항제2호 및 제4호에 따른 자료 2. 체외진단의료기기 가. 「체외진단의료기기법 시행규칙」 제6조제1항제1호 및 제2호에 따른 자료 나. 「의료기기법 시행규칙」 제9조제3항에 해당하는 자료(임상적 성능시험에 관한 자료는 제외한다) ④ 법 제11조제3항제3호다목에서 “총리령으로 정하는 자료”란 임상시험계획(체외진단의료기기의 경우 임상적 성능시험 계획을 말한다)에 관한 자료와 다음 각 호의 구분에 따른 자료를 말한다. 1. 의료기기(체외진단의료기기는 제외한다): 제3항제1호의 자료 2. 체외진단의료기기: 제3항제2호의 자료 ⑤ 식품의약품안전처장은 법 제11조제1항부터 제3항까지의 규정에 따라 조건부 품목허가를 하는 경우에는 별지 제8호서식의 조건부 품목허가증을 발급한다. 이 경우 조건부 품목허가 당시 미제출된 자료에 대한 제출 일정을 조건부 품목허가증에 기재해야 한다. ⑥ 식품의약품안전처장은 법 제11조제1항부터 제3항까지의 규정에 따라 조건부 품목허가를 받은 자가 그 조건을 이행한 때에는 조건 이행 사실을 확인하여 다음 각 호의 구분에 따라 품목허가증 등을 발급한다. 1. 의약품등(첨단바이오의약품은 제외한다): 「의약품 등의 안전에 관한 규칙」 별지 제10호서식에 따른 품목허가증 2. 첨단바이오의약품: 「첨단바이오의약품 안전 및 지원에 관한 규칙」 별지 제13호서식에 따른 품목허가증 3. 의료기기(체외진단의료기기는 제외한다): 「의료기기법 시행규칙」 별지 제4호서식의 의료기기 제조(수입) 허가증 또는 별지 제6호서식의 의료기기 제조(수입) 인증서 4. 체외진단의료기기: 「체외진단의료기기법 시행규칙」 별지 제4호서식의 체외진단의료기기 제조(수입) 허가증 또는 별지 제6호서식의 체외진단의료기기 제조(수입) 인증서 ⑦ 법 제11조제5항 단서에서 “해당 의료제품을 투여ㆍ사용하는 자의 치료기회 보장이 필요한 경우 등 총리령으로 정하는 경우”란 조건부 품목허가를 받은 의료제품을 투여ㆍ사용하는 자에게 해당 의료제품을 계속적으로 투여ㆍ사용할 필요가 있다고 치료를 담당한 의사가 인정한 경우를 말한다. ⑧ 식품의약품안전처장은 법 제11조제5항 단서에 따라 품목허가를 취소하려는 경우 조건부 품목허가를 받은 자에게 필요한 조치를 시행하도록 통지해야 하고, 필요한 조치 시행 이후 조건부 품목허가가 취소될 수 있음을 안내해야 한다. ⑨ 제1항부터 제8항까지에서 규정한 사항 외에 조건부 품목허가의 신청, 처리 절차 등에 필요한 세부사항은 식품의약품안전처장이 정하여 고시한다. |
동 법령 및 시행규칙에 따르면 국내 의약품 긴급사용승인제도는 공중보건 위기상황에서 필요한 의료제품을 국내 허가를 받지 않았음에도 불구하고 긴급하게 제조 및 수입하여 공급하도록 하는 특례 제도입니다. 동 법 제12조 제1항 1호에 따르면, 「약사법」 제31조제2항ㆍ제4항 및 제42조제1항, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」 제23조제2항 및 제27조제1항에 따라 품목허가 취득이나 품목 신고를 하지 않은 의약품 중 외국에서 허가 등에 준하는 조치를 받은 의약품에 한하여 적용됩니다.
긴급사용승인 제도의 신청은 식품의약품안전처장이 필요하다고 인정하는 경우, 질병관리청 등 관계 중앙행정기관장의 요청이 있는 경우 및 특정 분야 의료제품의 긴급사용승인이 필요하다고 인정되는 경우에 제조(수입)업자에 의해 신청이 가능합니다.
신청 후 자료검토를 거쳐 위원회의 심의 및 의결을 진행하여 승인될 경우 긴급사용승인통지서를 발급하며, 임상시험 결과, 국내외 허가 등의 현황, 긴급사용승인 신청 사유서, 의료제품의 사용설명서 등을 제출하여야 합니다.
당사는 중간분석 결과 수령, 조건부 품목허가 신청 및 승인 절차를 거쳐, 이를 바탕으로 변이 바이러스 대응이 가능한 25-26절기 코로나19 백신을 긴급사용승인 신청을 진행할 예정입니다. 허나, 법령에 따른 취소 사유가 없는 한 판매를 지속할 수 있는 조건부 품목허가와 달리, 긴급사용승인은 공중보건 위기상황이 종료된 경우 제조 및 수입 중지, 회수 및 폐기, 사용 중지 등의 필요한 조치를 명할 수 있습니다.
특히, 코로나19 팬데믹 상황에서 엔더믹 상황으로 전환한 현재 시점에서 공중보건 위기상황이 종료되었다고 볼 수 있는 시각이 지배적이기 때문에 당사의 긴급사용승인 신청 후 승인이 불발될 수 있습니다. 2023년 5월 5일, 세계보건기구(WHO)는 코로나19를 국제적 공중보건 비상사태(PHEIC)로 더 이상 간주하지 않겠다고 선언했으며, 이에 따라 한국 정부도 2023년 6월 1일부터 코로나19를 '심각' 단계에서 '경계' 단계로 격하하고, 팬데믹 관련 대부분의 제한 조치를 해제했습니다. 이러한 변화는 코로나19가 이제 예측 가능하고 관리 가능한 상태가 되었음을 의미하며, 계절성 독감과 유사한 풍토병(endemic)으로 간주되고 있습니다. 이에 따라 국내에서는 7일 의무 격리가 5일 권고 격리로 변경되고, 실내 마스크 착용 의무도 병원 입원실을 제외한 대부분의 장소에서 해제되었습니다. 물론, 이는 코로나19의 완전한 종식을 의미하지는 않습니다. 질병관리청은 새로운 변이 발생 가능성을 염두에 두고 감시 체계를 유지하며, 고위험군 및 감염 취약 시설에 대한 관리 강화를 권고하고 있습니다.
그러나 긴급사용승인 제도는 공중보건 비상사태(PHE) 하에서 신속히 의료제품을 도입하기 위해 설계된 제도입니다. 따라서 공중보건 위기 상황이 아닌 경우 긴급사용승인의 필요성이 줄어들 수 있으며, 질병관리청 등 중앙행정기관의 요청에 의해 식약처가 승인 절차를 시작하기 때문에 만약 정부가 당사 백신의 긴급 도입 필요성을 느끼지 않는다면, 신청이 허가되지 않을 가능성이 큽니다. 또한 당사는 1/2상 결과에서는 장기적인 면역 효과와 안전성이 입증되었지만, 3상의 최종 데이터가 충분히 신뢰할 만하지 않거나 기존 백신보다 우월한 효과를 보이지 않는다면 승인 가능성이 낮아질 수 있습니다.
따라서 당사의 오미크론 변이주 대응 백신이 긴급사용승인을 받으려면, 공중보건적 필요성과 임상적 우수성이 명확히 입증되어야 합니다. 하지만 현재 코로나19 위기 상황이 완화된 점과 기존 백신들이 이미 충분히 공급되고 있다는 점에서 승인 가능성은 낮다고 판단됩니다. 또한 현재와 같이 오미크론 변이의 중증도와 치명률이 낮은 상황에서는 긴급사용승인 가능성이 높지 않으며, 이에 따라 당사는 긴급사용승인이 정책적으로 가능하지 않을 경우, 조건부 품목허가 또는 정식 품목허가(사용승인)를 중심으로 대응할 계획입니다. 다만, 새로운 변이가 출현하거나 고위험군 보호를 위한 추가적인 백신 옵션이 필요하다고 판단될 경우, 승인 가능성이 올라갈 수도 있으나, 이는 현재 시점에서 불확실한 사항입니다.
또한 조건부 품목허가 신청처럼 심사 및 심의 단계에서 당사의 예상보다 시간이 더 오래 걸릴 수 있으며, 승인이 나지 않을 가능성 역시 존재합니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
| [공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법 (약칭: 위기대응의료제품법)] |
| 제12조(긴급사용승인 등) ① 식품의약품안전처장은 공중보건 위기상황에 적절히 대처하기 위하여 필요하다고 인정하는 경우 또는 관계 중앙행정기관의 장의 요청이 있는 경우 위원회의 심의를 거쳐 다음 각 호의 어느 하나에 해당하는 처분(이하 “긴급사용승인”이라 한다)을 할 수 있다. 다만, 긴급한 경우에는 위원회의 심의를 거치지 아니할 수 있다. 1. 「약사법」 제31조제2항ㆍ제4항 및 제42조제1항, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」 제23조제2항 및 제27조제1항에 따른 품목허가를 받거나 품목신고를 하지 아니한 의약품등을 제조업자 또는 수입업자에게 제조 또는 수입하게 하여 공급하게 하는 행위. 다만, 의약품 수입ㆍ공급을 승인하는 경우 우리나라와 동등 이상의 수준으로 의약품 안전관리를 실시한다고 식품의약품안전처장이 인정하는 외국에서 「약사법」 제31조 및 제42조 또는 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」 제23조 및 제27조에 따른 허가 등에 준하는 조치를 받은 의약품에 한한다. 2. 이미 품목허가를 받거나 품목신고를 한 의약품등에 대하여 허가 또는 신고된 내용과 다른 용법ㆍ용량, 효능ㆍ효과 및 사용기간 등을 정하여 의약품등 제조업자에게 제조하게 하거나 수입업자에게 수입하게 하여 공급하게 하는 행위 3. 「의료기기법」 제6조제2항 및 제15조제2항, 「체외진단의료기기법」 제5조제3항 및 제11조제2항에 따른 제조ㆍ수입허가 또는 제조ㆍ수입인증을 받지 아니하거나 제조ㆍ수입신고를 하지 아니한 의료기기를 제조업자 또는 수입업자에게 제조 또는 수입하게 하여 공급하게 하는 행위. 다만, 의료기기 수입ㆍ공급을 승인하는 경우 우리나라와 동등 이상의 수준으로 의료기기 안전관리를 실시한다고 식품의약품안전처장이 인정하는 외국에서 「의료기기법」 제6조 및 제15조 또는 「체외진단의료기기법」 제5조 및 제11조에 따른 허가 등에 준하는 조치를 받은 의료기기에 한한다. ② 식품의약품안전처장은 제1항에 따라 긴급사용승인을 하기 위하여 해당 의료제품의 제조업자ㆍ수입업자 또는 관계 중앙행정기관의 장에게 필요한 자료의 제출을 요청할 수 있다. ③ 식품의약품안전처장은 공중보건 위기상황의 효과적인 극복을 위하여 특정 분야 의료제품에 대한 긴급사용승인이 필요하다고 인정되는 경우 다음 각 호에 해당하는 사항을 공고하여 의료제품의 제조업자ㆍ수입업자의 긴급사용승인 신청을 받을 수 있다. 이 경우 긴급사용승인을 신청하는 의료제품의 제조업자ㆍ수입업자는 총리령으로 정하는 바에 따라 해당 의료제품의 안전성 및 유효성을 입증할 수 있는 자료 등을 제출하여야 한다. 1. 긴급사용승인의 대상이 되는 의료제품의 범위 2. 그 밖에 긴급사용승인 요건, 승인기간 등 식품의약품안전처장이 필요하다고 정하는 사항 ④ 식품의약품안전처장은 제1항에 따라 긴급사용승인을 받은 의료제품의 제조업자 또는 수입업자에게 제13조부터 제15조까지에 따른 조치를 할 것을 명할 수 있다. ⑤ 식품의악품안전처장은 다음 각 호의 어느 하나에 해당하는 경우에는 대통령령으로 정하는 바에 따라 긴급사용승인을 받은 의료제품의 제조업자ㆍ수입업자 또는 의료기관 개설자 등에게 제조ㆍ수입의 중지, 회수ㆍ폐기, 사용 중지 및 긴급사용승인 취소 등 필요한 조치를 명할 수 있다. 다만, 제2호에 해당하는 경우에는 제조ㆍ수입의 중지, 회수ㆍ폐기, 사용 중지 및 긴급사용승인 취소 조치를 하여야 한다. <개정 2024. 2. 6.> 1. 공중보건 위기상황이 종료된 경우 2. 해당 의료제품의 사용현황 및 효과 등을 확인ㆍ평가한 결과 국민건강에 중대한 피해를 주거나 치명적인 영향을 주거나 줄 가능성이 있는 것으로 인정되는 경우 3. 해당 의료제품을 제조ㆍ수입하는 자가 이 법에 따른 조치 또는 의무를 이행하지 아니하는 경우 4. 긴급사용승인을 받은 의료제품이 제6항에 따라 품목허가를 받은 경우 5. 긴급사용승인을 받은 의료제품이 다음 각 목의 어느 하나에 해당하는 경우 가. 「약사법」 제31조제2항ㆍ제4항 및 제42조제1항, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」 제23조제2항 및 제27조제1항에 따른 품목허가를 받거나 품목신고를 한 경우 나. 「의료기기법」 제6조제2항 및 제15조제2항, 「체외진단의료기기법」 제5조제3항 및 제11조제2항에 따른 제조ㆍ수입허가 또는 제조ㆍ수입인증을 받거나 제조ㆍ수입신고를 한 경우 ⑥ 식품의약품안전처장은 제1항에 따른 긴급사용승인을 받은 자가 총리령으로 정하는 바에 따라 품목허가를 신청하는 경우 해당 의료제품의 안전성 및 유효성을 확증할 수 있는 해당 의료제품의 사용 결과 자료나 임상시험 자료 등을 별도로 정하는 기간 내에 제출할 것을 조건으로 하여 품목허가를 할 수 있다. ⑦ 식품의약품안전처장은 제6항에 따라 품목허가 신청된 의료제품에 대하여 제7조부터 제9조까지의 규정을 적용할 수 있다. ⑧ 제6항에 따라 품목허가를 받은 의료제품 또는 그 품목허가를 받은 자에 관하여는 제11조제4항ㆍ제5항, 제13조부터 제16조까지를 준용한다. ⑨ 제1항에 따른 처분, 제3항에 따른 신청 절차 및 제출 자료의 범위, 제5항에 따른 조치, 제6항에 따른 처리 절차 등에 필요한 세부사항은 총리령으로 정한다. |
| [공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법 시행규칙 (약칭: 위기대응의료제품법)] |
| 제13조(긴급사용승인의 절차 및 방법 등) ① 관계 중앙행정기관의 장은 법 제12조제1항에 따라 식품의약품안전처장에게 긴급사용승인을 요청하는 경우 다음 각 호의 사항을 명시한 서면으로 해야 한다. 1. 요청 사유 2. 대상 품목 3. 사용 기간 4. 긴급사용승인 물량. 이 경우 신청 당시 물량을 확정하기 어려운 경우 긴급사용승인 이후 물량을 통보할 수 있다. 5. 관계 중앙행정기관의 장이 필요로 하는 제품의 성능 기준 등 사양에 관한 자료(의료기기만 해당한다) ② 식품의약품안전처장은 법 제12조제1항에 따라 긴급사용승인을 했을 때에는 그 승인한 사항을 관계 중앙행정기관의 장에게 회신하고, 별지 제9호서식의 긴급사용승인 통지서를 긴급사용승인된 의료제품의 제조업자ㆍ수입업자에게 발급한다. ③ 법 제12조제3항에 따라 긴급사용승인을 신청하려는 자는 별지 제10호서식의 긴급사용승인 신청서에 다음 각 호의 자료를 첨부하여 식품의약품안전처장에게 제출해야 한다. 1. 공고일까지 연구된 의료제품의 임상시험 결과 2. 국내외 허가 등의 현황 3. 긴급사용승인 신청 사유서 4. 해당 의료제품의 사용설명서 5. 해외 제조소 등의 품질검사 결과 등 공고일까지 확보된 품질에 관한 자료 및 그 근거 자료 6. 제12조제3항제1호나목 또는 제2호나목에 따른 자료(의료기기만 해당한다) ④ 법 제12조제6항에 따라 긴급사용승인을 받은 자가 조건부 품목허가를 신청하려는 경우에는 별지 제11호서식의 긴급사용승인 후 조건부 품목허가 신청서에 다음 각 호의 구분에 따른 자료를 첨부하여 식품의약품안전처장에게 제출해야 한다. 1. 의약품의 경우 가. 제12조제2항제1호에 따른 자료 나. 긴급사용승인을 받은 후 사용 성적이 있는 경우 그 사용 성적에 관한 자료 2. 의료기기의 경우 가. 제12조제3항제1호 또는 제2호에 따른 자료 나. 긴급사용승인을 받은 후 사용 성적이 있는 경우 그 사용 성적에 관한 자료 ⑤ 식품의약품안전처장은 법 제12조제6항에 따라 긴급사용승인을 받은 의료제품에 대하여 조건부 품목허가를 했을 때에는 별지 제12호서식의 긴급사용승인 후 조건부 품목허가증을 발급한다. 이 경우 조건부 품목허가 당시 미제출된 자료에 대한 제출 일정을 조건부 품목허가증에 기재해야 한다. ⑥ 제1항부터 제5항까지에서 규정한 사항 외에 긴급사용승인 및 긴급사용승인 후 조건부 품목허가의 신청, 처리 절차 등에 관하여 필요한 세부 사항은 식품의약품안전처장이 정하여 고시한다. 제14조(긴급사용승인 후 회수ㆍ폐기 등의 조치) 식품의약품안전처장은 법 제12조제5항에 따라 제조ㆍ수입의 중지, 회수ㆍ폐기 및 사용 중지 등 필요한 조치를 명하려는 경우에는 긴급사용승인을 받은 의료제품의 제조업자ㆍ수입업자 또는 의료기관 개설자 등에게 다음 각 호의 사항을 통지해야 한다. 1. 의료제품의 명칭 2. 조치의 내용 및 사유 |
또한 2024년 05월 01일부터 코로나19 바이러스에 대한 정부의 위기 단계 하향 '경계(3단계) → 관심(1단계)' 및 WHO의 국제공중보건위기상황 해제 등 코로나19 바이러스의 심각성 감소에 따른 조치 등으로 인해 코로나19 바이러스 백신 수요 감소 추세는 이어질 가능성이 존재합니다. 또한, 코로나19 바이러스가 지속적으로 변이됨에 따라 전파력과 면역 회피력이 높아졌음에도 불구하고, 낮아지고 있는 바이러스의 치명률은 코로나19 바이러스 백신 수요에 부정적인 영향을 미칠 수 있습니다. 이는 코로나19 바이러스 벡터를 개발하고 있는 당사의 사업에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[마. 면역항암제 경쟁 심화 위험] 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황에서 점차 면역세포치료제 시장 경쟁이 심화됨에 따라 당사의 항암면역치료백신 사업에 부정적인 영향을 미칠 수 있으며, 또한 새로운 치료법의 등장, 시장 환경의 변화, 신규 면역항암제 개발 등으로 글로벌 경쟁력 및 기준에 부합하지 않게 되는 경우, 당사의 사업계획 및 수익창출 등에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
암이란 세포에 발생한 돌연변이에 의해 정상세포가 비정상적으로 세포분열을 일으켜 발생하는 질병입니다. 형태에 따라 고형암과 혈액암으로 구분되며 고형암은 체내 조직이나 장기에 덩어리(종양)를 형성하는 질환이고 혈액암은 특정한 혈액세포가 비정상적으로 증식하면서 미성숙 혈액세포가 증가되는 등 인체의 기능이 비정상적으로 작동하여 손상을 입게 되는 것을 말합니다.
항암치료의 방법으로는 절제수술, 방사선요법 및 화학요법이 대표적입니다. 수술을 통한 병변의 절제는 완치를 기대할 수 있는 가장 근원적인 방법으로 조기에 발견, 진단된 암에서는 적극적으로 수술을 고려할 수 있습니다.
| [세대별 항암제 종류 및 특징] |
|
구분 |
특징 |
|
|
1세대 (1950년대~) |
화학항암제 |
- 약물을 이용하여 암세포를 죽이는 전신치료 방법 |
|
2세대 (2000년대~) |
표적항암제 |
- 암세포나 암조직에만 많이 발현되는 특정 단백질이나 유전자 변화를 표적으로 삼아 암의 성장과 암의 발생에 관여하는 활동을 방해하는 치료방법 - 암세포만을 식별해 공격하는 장점이 있지만, 유전자 변이를 가진 환자에만 사용할 수 있어 다양한 암치료가 불가능 |
|
3세대 (2010년대~) |
면역항암제 |
- 인체 면역세포를 활성화시켜 암세포를 사멸시키는 방법 |
| 출처) 약학정보원 및 업계자료 취합 |
수술과는 별개로 또는 수술 전/후에 방사선요법이나 화학요법(화학항암제)을 실시할 수 있는데 두 방법 모두 암의 증식원리인 세포분열 과정을 억제하거나 차단하여 암의 진전을 막는 치료방법입니다. 방사선요법은 에너지가 높은 방사선을 쬐어 암세포의 사멸을 유도하고, 화학요법은 세포독성항암제와 같은 화합물을 경구투여 또는 정맥으로 주사하여 암세포의 사멸을 유도합니다. 하지만 이러한 고전적 치료방법은 암세포와 정상세포를 구분하여 치료하는 것이 아니기 때문에 정상세포에도 방사선이나 세포독성항암제의 작용이 나타나 심각한 부작용을 일으키며, 이로 인해 암세포만 선택적으로 공격할 수 있는 새로운 치료법에 대한 연구가 계속되었습니다.
그 결과 개발된 것이 2000년대의 표적항암제입니다. 표적항암제는 암세포에만 특이적으로 높게 발현되는 단백질이나 신호전달체계에만 작용해 암세포를 억제하는 치료기전을 가지고 있습니다. 따라서, 무차별적인 방사선요법이나 세포독성항암제와는 달리 정상세포는 공격하지 않아서 상대적으로 항암효과는 있으면서 부작용은 매우 약하거나 거의 나타나지 않는 것이 특징입니다. 하지만, 돌연변이가 흔하게 일어나는 암세포/조식에서는 표적항암제를 무력화시키거나 표적단백질 외에 다른 단백질을 통해 생상을 이어가는 방식을 표출하는 등 단기간에 표적항암제에 내성을 획득하는 기전이 보고된 바, 이를 극복하기 위한 더 나은 발전이 필요하였습니다.
여기에 면역항암제로 최초의 면역관문억제제인 여보이가 출시되면서 항암치료의 새로운 장이 열렸고, 면역항암제는 우리 몸의 면역체계를 이용하여 암을 치료하는 방법으로 효과 및 안정성 측면에서 큰 주목을 받고 있으며, 모든 항암치료방법은 현재 각각 단독으로 또는 다양한 병용의 방법으로 환자들에게 사용되고 있습니다. 따라서 현재 세계 항암제 시장은 특성이 상이한 방사선 치료를 제외하면 전통적인 화학항암제와 표적항암제, 면역항암제로 구분되어 발전하고 있는 상황이고 특히 면역항암제의 개발 및 성장속도가 매우 높습니다.
| [각 세대별 항암제 원리] |
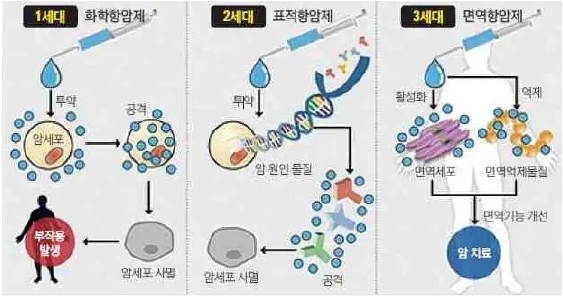 |
|
각 세대별 항암제의 원리 |
| 출처) 표적치료에 대한 이해(2016.10), 삼성서울병원 |
한편, 면역항암제의 경우 2010년 최초의 면역항암제이면서 최초의 수지상세포백신인 Dendreon의 Provenge가 승인되고 T세포 면역조절항체인 Yervoy가 2011년 승인을 받으면서 면역항암제에 대한 시장의 관심이 높아졌습니다. 이후에는 PD-1, PD-L1 저해제로 대표되는 면역관문저해 항체의약품(여보이, 키트루다, 옵디보, 티센트릭, 임핀지, 바벤시오 등)이 승인되었습니다.
| [면역항암제 제품과 발전 단계] |
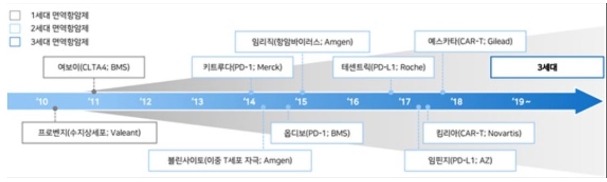 |
|
면역항암제 제품과 발전단계 |
| 출처) 메리츠증권 리서치센터(2018.02.26) |
그 외에도 면역항암제의 다른 기전으로서 이중항체와 항암바이러스, 최초의 유전자 조작 면역세포치료제인 CAR-T 2종이 승인되어, 면역세포치료제(예스카타, 킴리아 등)와 항암바이러스치료제(임리직 등) 등이 다수 판매되고 있고 있습니다. 이같은 2세대 면역항암제는 2015년부터 거대한 신규시장을 창출하기 시작하였으며, 본 신고서 제출일 현재 차세대 면역항암제, 항암면역 요법 등이 지속적으로 개발되고 있습니다. 이 중 차세대 면역항암제는 당사의 면역항암제 플랫폼인 CeliVax와 같은 세포 기반 치료백신이 주류를 이루고 있습니다.
| [면역항암제 발전 단계별 제품 분류] |
|
1세대 |
2세대 |
차세대 |
|
수지상세포백신 면역조절항체 |
면역관문저해제 이중항체 항암바이러스 CAR-T 세포치료제 |
CeliVax 치료백신 완전개인맞춤형 치료백신 면역항암제 병용투여요법 면역세포치료제 - NK, NKT, TIL, CAR-NK |
| 출처) 당사 제시 |
Evaluate Pharma 'World Preview 2023'에서 발표한 2028년 전 세계 판매 상위 Top 10 의약품 중 면역항암제 Keytruda(키트루다)를 1위로 예측하며, 시장을 지배할 것으로 예상하고 있습니다(Evaluate Pharma는 영국 런던에 본사를 둔 기업으로, 1996년에 설립되어 제약 산업에 대한 상업적 지능과 예측 분석을 제공하는 회사입니다). Merck사의 면역항암제 Keytruda(키트루다)는 2022년 209억 달러를 판매한 품목으로, 2028년 예상매출은 300억 달러로 글로벌 매출액 1위를 유지할 것으로 예상됩니다. 또한 BMS사의 면역항암제 Opdivo(옵디보) 는 2022년 매출액 93억달러의 매출을 기록했으며, 2028년 140억달러에 이르는 글로벌 매출액을 예상하고 있습니다.
| [2028년 매출 상위 10대 의약품 전망] |
| (단위 : 십억 달러) |
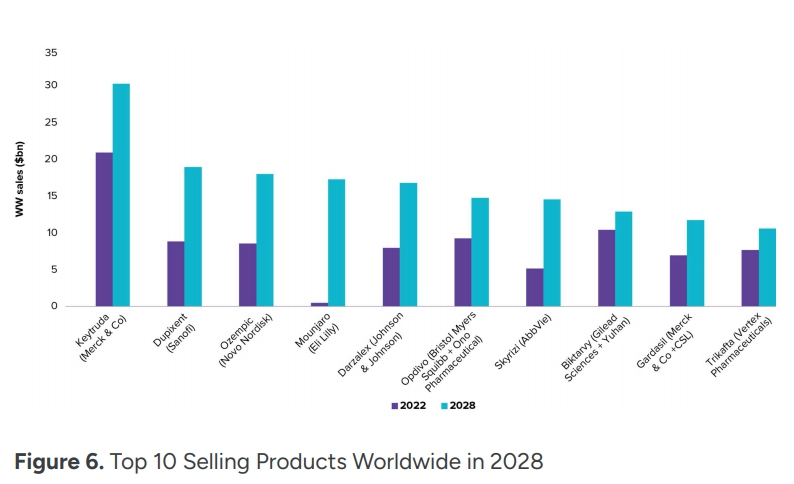 |
|
2028년 매출 상위 10대 의약품 전망 |
| 출처) World Preview 2023, Evaluate Pharma |
이처럼 글로벌 면역항암제 시장은 키트루다, 옵디보, 티센트릭, 임핀지 등 면역관문억제제들의 적응증 확대, 킴리아, 예스카타 등 CAR-T 치료제의 출시, 병용요업 및 수술 전·후 보조요법으로 적용 방식 확대, 신규 면역항암제의 출시 등으로 인해 지소적으로 고성장할 것으로 전망됩니다. The Business Research Company(영국 런던에 본사를 둔 글로벌 시장 조사 회사로, 2012년에 설립되어 다양한 산업 분야에 걸쳐 전문적인 조사 및 컨설팅 서비스를 제공합니다) 자료에 따르면 글로벌 면역항암제 시장 규모는 인구 증가와 고령화에 따른 질병 유병률 증가, 기존 치료법의 한계를 개선하는 치료방식, 이에 따른 해당 시장에 대한 관심 및 R&D 활동의 증가로 2024년 942억 달러에서 연 평균 9.4% 성장(2024-2029)하여 2029년에는 1,532억 달러에 이를 것으로 전망됩니다.
| [글로벌 면역항암제 시장 현황 및 전망] |
| (단위: 십억 달러) |
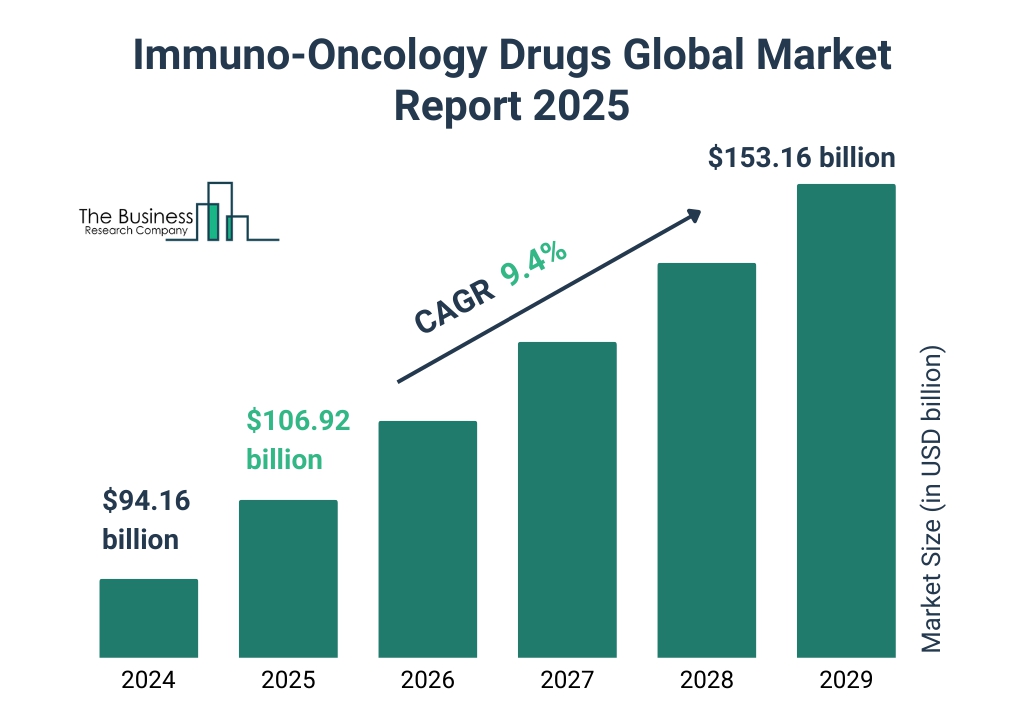 |
|
글로벌 면역항암제 시장 현황 및 전망 |
| 출처) The Business Research Company, 2025.01 |
이처럼 항암치료제 분야는 면역항암제로 패러다임 전환이 이뤄지고 있습니다. 그 중에서도 현재는 면역관문억제제가 면역항암제 시장을 견인하고 있는 상황이며, 2017년 CAR-T 세포 치료제의 승인 및 본격적인 적용을 시작으로 다양한 세포 치료제에 대한 연구개발 또한 활발히 진행되고 있습니다.
현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황입니다. 나아가, 면역세포치료제 또한 상용화가 가속화되면서 시장이 빠르게 확대되고 있습니다. 재생의료연합에 따르면 2020년 세포기반면역항암제의 임상시험 건수는 총 1,220건으로 확인되었으며,임상 3상 개수는 25개에 이르면서 점차 면역세포치료제 시장 또한 경쟁이 심화될 예정입니다. 미국 FDA에서 허가를 받은 CAR-T 치료제는 Novartis 社의 킴리아(Kymriah), Gilead 社의 예스카타(Yescarta)와 테카투스(Tecartus), BMS 社의 브레얀지(Breyanzi)와 아베크마(Abecma) 등이 이미 존재하고 있습니다. 위와 같이, 면역항암치료제 시장의 높은 시장성을 보고 다수의 제약사들이 임상을 확대하여 속도를 내고 있다는 점은 당사 사업에 위협 요인으로 작용할 수 있습니다. 해당 경쟁 파이프라인이 당사 제품의 임상속도보다 앞서 임상에 성공하여 시장에 진입할 경우, 당사 면역항암치료제 파이프라인의 시장 경쟁력이 약화될 수 있습니다. 당사가 파악한 당사 제품 유사 적응증의 개발 현황은 아래와 같습니다.
| [유사 적응증에 대한 타사 개발 현황] |
| 개발 주체 | 개발 제품 중 당사 유사 적응증 | 개발 현황 |
| Ayala (Advaxis) | 전립선암 | 임상 1상 |
| Bavarian Nordic | 고형암 | 임상 1상 |
| BioNTech | 흑색종, 두경부암 등 | 임상 2상 |
| 전립선암, 췌장암 등 | 임상 1상 | |
| 개인맞춤형 치료백신 | 임상 1상 | |
| BioSante (Cell Genesys) | 췌장암,대장암 등 | 임상 2상 |
| Bristol-Myers Squibb | 두경부암 등 고형암 | 임상 2/3상 |
| Curevac | 흑색종 등 | 임상 1상 |
| Dendreon | 전립선암 | 시판 |
| Gritstone bio | 개인맞춤형 치료백신 | 임상 2상 |
| Immugene | 위암 | 임상 2상 |
| Immunecellular Therapeutics | 고형암 | 임상 1상 |
| Immunocore | 흑색종 | 시판 |
| Inovio | 자궁경부이형증 | 임상 3상 |
| ISA Pharmaceuticals | 자궁경부암 | 임상 1/2상 |
| 두경부암 | 임상 2상 | |
| Moderna Therapeutics | 흑색종 등 개인맞춤형 치료백신 | 임상 2상 |
| MSD | 자궁경부암, 흑색종 등 | 시판 |
| Nykode Therapeutics | 자궁경부암 | 임상 2상 |
| 두경부암 | 임상 1상 | |
| PDC*line pharma | 흑색종 | 임상 1상 |
| 개인맞춤형 치료백신 | 비임상 | |
| Sotio | 위암/전립선암 | 임상 1/2상 |
| 기타 고형암 등 | 임상 2상 | |
| Turnstone Biologics | 유방암, 대장암, 포도막 흑색종 (병용) | 임상 1상 |
| 피부 흑색종/비피부 흑색종 | 임상 1상 | |
| 비엘 | 자궁경부전암 | 임상 2상 |
| 자궁경부상피이형증 | 임상 3상 | |
| 제넥신 | 자궁경부암 (병용투여) | 임상 2상 |
| 두경부암 (병용투여 연구자 주도 시험) | 임상 2a상 | |
| 지아이이노베이션 | 고형암 (병용투여) | 임상 1/2상 |
| 고형암 (병용투여) | 임상 2상 | |
| 에스티큐브 | 폐암, 두경부암 등 고형암 | 임상 1상 |
| 출처) 당사 제시 |
그러나, 기존 면역항암제의 단점은 약의 효능이 작용하는 반응률이 통상적으로 20~30%에 그치는 등 낮은 치료 반응성과 치료 효과를 극대화하기 위해서는 다른 면역항암제와 병용 투여를 해야 하는 한계 외에도 공정상의 어려움, 치료비 부담 등의 문제를 가지고 있으며, 나아가, 모든 암종에 적용하기 어렵다는 범위의 한계가 있습니다.
반면에, 당사의 CeliVax 항암면역치료백신 (Cancer Therapeutic Vaccine) 기반기술은 면역항암의약품 중 하나인 세포기반 항암면역치료백신 기술로, 환자에서 유래한 자가 B세포 및 단구를 항원제시세포로 이용하며, 암항원과 면역증강제(α-galactosyl ceramide, α-GC)를 함유한 유전자 도입 세포치료제로 당사에서 개발하고 있습니다.
당사가 파악한 바 과거 B세포의 항암치료 적용 가능성에 대한 학술적인 연구는 몇 차례 진행된 바 있습니다. 예컨대, B세포 표면의 CD40분자를 통해 B세포를 활성화하면 B세포를 고효율의 항원제시세포로 활용가능하다는 연구결과는 1997년에 발표된 바 있습니다 (J. Clin. Invest. 1997. 100(11), 2757-2765). 이후 CD40로 활성화된 B세포를 항원제시세포로 활용한 항암면역백신의 개발 관련 연구가 발표된 바 있으며, 독일 콜론 대학의 von Bergwelt-Baildo 교수 그룹에서 B세포와 CD40 특이적 단클론항체를 이용한 항암동물실험 결과를 발표한 바 또한 존재합니다.
다만 당사가 파악한 바 상기 연구들은 상업화로 이어지지 아니하였으며, 당사는 B세포와 단구세포를 활용한 상업화 목적의 개발을 진행하고 있습니다. 당사는 과거 B세포를 항암치료에 적용하고자 하였던 사례는, 그 연구 상 B세포의 항암면역반응 활성화 정도가 높지 않았으며 단클론항체, 배양 공정 등을 필요로 하였기에 상업화되기 어려웠던 것으로 추정하고 있습니다.
당사가 개발 중인 제품은 항암면역반응의 활성도가 높게 나타나며 동시에 분화 및 증식 공정을 필요치 않는다는 점에서 기존 연구의 한계를 극복한 치료제인 것으로 판단됩니다. 또한 수지상세포 백신과 유사한 효과를 유도할 수 있으면서, 제조 기간을 짧아 빠르게 환자에게 공급할 수 있다는 장점이 있고, 선천면역계 반응도 유도할 수 있습니다. 하지만 B세포를 활용한 백신에 필요한 높은 개발 비용, 제조 및 규모 확대의 어려움, 아직까지 부족한 시장 잠재성, 빅파마들의 기존 플랫폼 선호 등으로 인해 관련 연구는 아직까지 소규모 바이오테크 기업이나 학술 연구소 등에서 수행되고 있으며, 결론적으로 상업화까지는 다소 시간이 소요될 것으로 보입니다.
| [B세포 활용 백신 관련 논문] |
| 연번 | 저널 | 논문명 |
| 작성주체 | 결론사항 | |
|
1 |
Cancer Res. 2006, 66(13), 6843-50. |
CD1d-restricted T cells license B cells to generate long-lasting cytotoxic antitumor immunity in vivo. |
|
서울대학교 약학대학 강창율 교수 연구실 |
CD1d에 제한적인 T세포(NKT세포)를 이용하여 B세포를 항원제시세포로써 활용할 경우 생체 내에서 지속적인 세포 독성 반응을 일으킬 수 있음을 최초로 확인함. | |
|
2 |
Int J Cancer. 2008, 122(12), 2774-83. |
a-Galactosylceramide-loaded, antigen-expressing B cells prime a wide spectrum of antitumor immunity. |
|
서울대학교 약학대학 강창율 교수 연구실 |
항원을 발현시키고, α-galactosylceramide를 도입한 B 세포를 항암 면역 치료 백신으로 사용할 경우 NK세포, CD4+ T세포, CD8+ T세포 등 다양한 면역반응을 유도하는 것을 확인 | |
|
3 |
J Immunol. 2009, 182(4), 1818-28. |
Immunosuppressive myeloid-derived suppressor cells can be converted into immunogenic APCs with the help of activated NKT cells: an alternative cell-based antitumor vaccine. |
|
서울대학교 약학대학 강창율 교수 연구실 |
α-galactosylceramide를 활용할 경우, 면역억제성 골수유래 세포를 항암 치료 백신으로 활용할 수 있음을 최초로 확인함. | |
| 4 |
Hum Gene Thera.2010 21(12),1697-706. |
CD40-targeted recombinant adenovirus significantly enhances the efficacy of antitumor vaccines based on |
|
서울대학교 약학대학 강창율 교수 연구실 |
마우스 모델에서 CD40 단백질을 활용하여 항원 전달 효율을 향상시켰을 때 수지상 세포나 B세포 기반 항암 치료 백신의 치료 효과가 증가하는 것을 확인함. | |
| 5 | Cellular Immunology. 2011, 270, 135-144 |
NKT ligand-loaded, antigen-expressing B cells function as long-lasting antigen presenting cells in vivo. |
|
서울대학교 약학대학 강창율 교수 연구실 |
B세포를 활용한 마우스 CeliVax의 항암 치료 백신의 유효성, 생체 내 분포 및 잔류양상, 독성 등 비임상 연구 데이터를 수집함. | |
| 6 |
Gene Therapy. 2014, 21(1):106-14 |
Enhanced antitumor immunotherapeutic effect of B cell based vaccine transduced with modified adenoviral |
|
서울대학교 약학대학 강창율 교수 연구실 |
재조합 아데노바이러스 벡터를 활용하여 항원 전달 효율을 개선할 경우 CeliVax의 항암 치료 효과 및 면역반응 유도 효과가 증가되는 것을 확인함. | |
| 7 |
Cancer Res. 2014, |
Tumor-derived osteopontin suppresses antitumor immunity by promoting extramedullary myelopoiesis |
|
서울대학교 약학대학 강창율 교수 연구실 |
마우스 암세포에서 분비되는 osteopontin 단백질이 항암 면역반응을 억제하고 골수 외 골수성세포 증식을 유도하며, 따라서osteopontin 단백질을 중화시키는 치료과CeliVax와 병용될 경우 치료 효과가 증가하는 것을 확인함. | |
|
8 |
Nature Communications 2017. |
IL-21-mediated reversal of NK cell exhaustion facilitates anti-tumour immunity in MHC class I-deficient tumours |
|
서울대학교 약학대학 강창율 교수 연구실 |
1형 주조직접합성복합체 결핌 암에서 발생하는 자연살해세포의 기능저하가 CeliVax에 의해 활성화된 NKT세포가 분비한 IL-21에 의해 활성을 회복하는 것을 확인함. | |
| 9 | Cancer Res. 2018 78(18), 5315-26 | Activation of NKT cells in an anti-PD-1-resistant tumor model enhances anti-tumor immunity by reinvigorating exhausted CD8 T cells |
|
서울대학교 약학대학 강창율 교수 연구실 |
α-galactosylceramide에 의해 NKT세포의 활성화할 경우 IL-2와 IL-12가 분비되고 이를 통해 기능 저하 CD8 T세포가 재활성화되어 면역관문억제제에 내성을 가지는 암세포에 대하여 항암 치료 효과를 유도하는 것을 확인함. | |
| 10 | J. Clin. Med. 2020 9(1), 147 | Phase I Study of a B Cell-Based and Monocyte-Based Immunotherapeutic Vaccine, BVAC-C in Human Papillomavirus Type 16-or 18-Positive Recurrent Cervical Cancer |
| 삼성서울병원 산부인과 김병기 교수 | BVAC-C의 임상 1상 연구 결과를 정리하여 효력 및 안전성을 확인함. | |
| 11 | Vaccines. 2020 8(3), 403 | Enhanced immunogenicity of engineered HER2 Antigens Potentiates Antitumor Immune Responses |
|
서울대학교 약학대학 강창율 교수 연구실 |
기존의 암 항원인 HER2를 활용한 재조합 항원을 개발하여 CeliVax에 적용하고, 동물 모델 및 인간 면역 세포 연구를 통해 증가된 면역 반응을 유도할 수 있음을 확인함. | |
| 12 | Cancer Lett. 2021 520, 38-47 | Inhibition of topoisomerase I shapes antitumor immunity through the induction of monocyte-derived dendritic cells |
|
서울대학교 약학대학 강창율 교수 연구실 |
마우스 모델에서 topoisomerase I inhibitor를 BVAC-C와 병용투여 시 치료 효과가 증가하는 것을 확인하고, 이러한 현상이 topoisomerase I inhibitor에 의한 항원 제시 효과의 증가에 의한 것을 확인함. | |
| 13 | Front Immunol. 2024, 15:1371353 | Efficacy and safety of BVAC-C in HPV type 16- or 18?positive cervical carcinoma who failed 1st platinum-based chemotherapy: a phase I/IIa study |
| 삼성서울병원 산부인과 김병기 교수 | BVAC-C의 임상 1/2a상 연구 결과를 정리하여 효력 및 안전성을 확인함. |
| 출처) 당사 제시 |
글로벌 빅파마들이 B세포를 활용한 백신 연구개발에 적극적으로 나서지 않는 이유는 다음과 같은 과학적, 기술적, 경제적, 그리고 시장적 요인에 기인합니다.
1. 과학적 및 기술적 요인
CeliVax와 달리 일반적으로 B 세포를 활용하여 항원 제시 세포로 활용하기 위해서는 약 15일의 기간동안 복잡한 배양 방식을 통해 분화 및 증식을 유도하는 과정이 필요합니다. 하지만 같은 기간 상대적으로 쉽고 간단하게 수지상 세포를 활용한 항원 제시 세포를 만들 수 있습니다. 또한 B 세포에 비하여 수지상 세포가 항원 제시 세포로 더 많이 알려져 있기 때문에 개발 대상으로 선호되지 않은 것이 원인이라 추정합니다.
2. 경제적 및 사업적 요인
치료 백신 개발에는 평균적으로 약 7억~10억 달러가 소요되며, B세포 기반 치료 백신은 추가적인 연구와 기술 개발, 높은 수준의 세포 처리 시설의 확보가 요구되기 때문에 비용이 더 증가할 수 있습니다. 빅파마는 일반적으로 시장 잠재력이 높은 제품에 투자하며, B세포 기반 치료 백신은 아직 상업적으로 확립된 시장이 부족하고, 통상적으로 수지상 세포 기반 치료 백신에 비해 효과가 약할 것으로 추정됩니다.
3. 시장적 요인
빅파마는 일반적으로 대규모 환자군이 있는 질병(예: 독감, 코로나19)에 집중하며, B세포 기반 백신은 아직 주요 질병에 대한 확실한 상업적 성공 사례가 부족합니다. 희귀 질환이나 특정 암 치료를 위한 B세포 기반 백신은 상대적으로 작은 시장 규모를 가지며 이에 따라 ROI(투자 수익률)가 낮을 가능성이 있습니다. 또한 자가 세포를 활용하는 치료제의 특성상 개인이 부담해야 하는 의약품의 제조 단가가 높아 경제적 수준이 높은 국가에서 한정적으로 접근이 가능합니다.
4. 경쟁 및 우선순위
빅파마는 이미 확립된 mRNA, 바이러스 벡터, 단백질 기반 백신 플랫폼에 집중하고 있으며, 이러한 기술들은 상대적으로 개발 속도가 빠르고 성공 가능성이 높습니다. 또한 B세포 기반 백신 연구는 주로 소규모 바이오테크 기업이나 학술 연구소에서 수행되고 있으며, 빅파마는 이러한 기술이 상업적으로 입증된 후 인수하거나 협력하는 경향이 있습니다.
따라서 빅파마들이 B세포 활용 백신 개발에 적극적으로 나서지 않는 이유는 과학적 및 기술적 불확실성과 높은 개발 비용, 제조 및 유통의 어려움, 그리고 시장 잠재력 부족 때문으로 판단됩니다. 그러나 이 분야는 소규모 바이오테크 기업과 학술 기관에서 점차 발전하고 있으며, 빅파마가 향후 성공적인 사례를 바탕으로 참여를 확대할 가능성도 있습니다.
당사의 CeliVax 기술은 인체 내에서 항암 작용을 나타낼 수 있는 적응면역계와 선천면역계를 동시에 활성화하여 강력한 약효를 나타내는 것이 특징입니다. 즉, 적응면역계에서 주요 기능을 하는 세포독성 T세포를 활성화하고 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계에서 주요 기능을 하는 자연살해세포와 자연살해T세포를 활성화하여 항암면역반응을 일으킵니다. 또한 혈액 내 풍부히 존재하는 B세포 및 단구세포를 활용하기 때문에 수지상세포 백신보다 충분한 양을 투여하여 수지상세포와 동등한 수준의 항원 제시 효과를 유도할 수 있습니다. B세포를 활용한 치료백신의 임상시험이 현재 진행중에 있고, 아직 치료 대상 환자수가 제한적인 점이 있기 때문에 B세포를 이용한 기술의 우수성, 보편성을 확보하는데 시간이 더 소요될 것으로 판단됩니다.
한편, CeliVax 기술은 다양한 선천면역계를 동시에 활성화할 수 있기 때문에 최근 다양하게 연구되고 있는 자연살해유사T세포(NK유사T세포)의 활성화도 유도할 수 있을 것으로 판단하고 있습니다. CeliVax가 투여되면 환자의 자연살해T세포가 활성화되고, 활성화된 자연살해T세포는 다양한 면역활성 단백질(IL-12, IL-18 등)을 분비하게 됩니다. NK유사T세포에 관한 연구(논문, Journal of Hepatology(간학저널)., 77j, 1059-1070(2022))에 따르면 NK유사T세포가 IL-12, IL-15, IL-18와 같은 면역활성 단백질을 통해 활성화가 유도되고 세포 독성반응을 유도할 수 있기 때문에, 자연살해T세포를 통해 유사한 면역활성 단백질의 분비를 유도하는CeliVax 기술에 의하여 NK유사T세포의 활성화도 유도되고, 이를 통한 면역 치료 효과도 기대할 수 있을 것으로 판단됩니다.
CeliVax가 유도하는 면역 반응은 하기 그림에서와 같이 적응면역계 반응으로 CD8+ T 세포 및 CD4+ T 세포 반응 (그림 [3])과 항원 특이적 항체 분비 반응 (그림 [4])이 있고, 자연살해 세포(그림[2]) 및 자연살해 T 세포 (그림 [1])등 선천면역계 반응도 유도합니다. 또한, 종양미세환경 내에서 기능이 저하된 T세포 (그림 [5]) 및 NK세포 (그림 [6])의 기능을 복원하여 재활성화함으로써 암세포를 공격하도록 합니다. 면역체계의 활성화로 인해 기억면역반응을 일으켜 암의 재발을 방지할 수 있는 기전도 CeliVax기술의 특징입니다.
| [CeliVax 기반 파이프라인의 항암면역작용 활성화 유도 작용기전] |
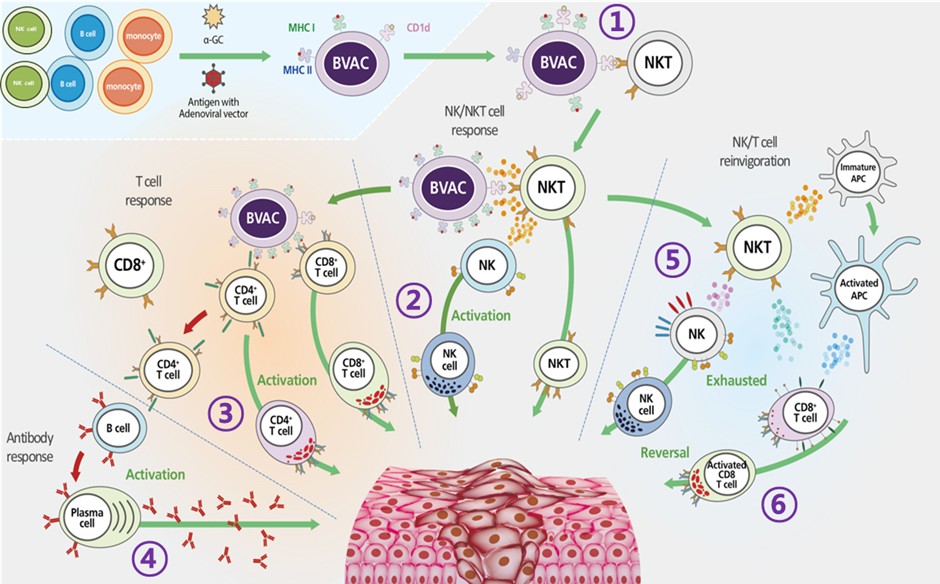 |
|
celivax 기반 파이프라인의 항암면역작용 활성화 유도 작용 기전 |
| 출처) 당사 제시 |
또한, 하기 그림에서와 같이 CeliVax가 유도하는 적응면역계 반응과 선천면역계 반응이 항원-비균질성 암세포의 제거에 직접적으로 관여합니다. 특히 선천면여계 반응을 통해 암세포가 가지는 주요 면역회피기전 중 MHC-I 소실을 극복하여 암세포를 살상할 수 있습니다.
| [CeliVax 기반 파이프라인의 항원-비균질성 암세포의 제거기전] |
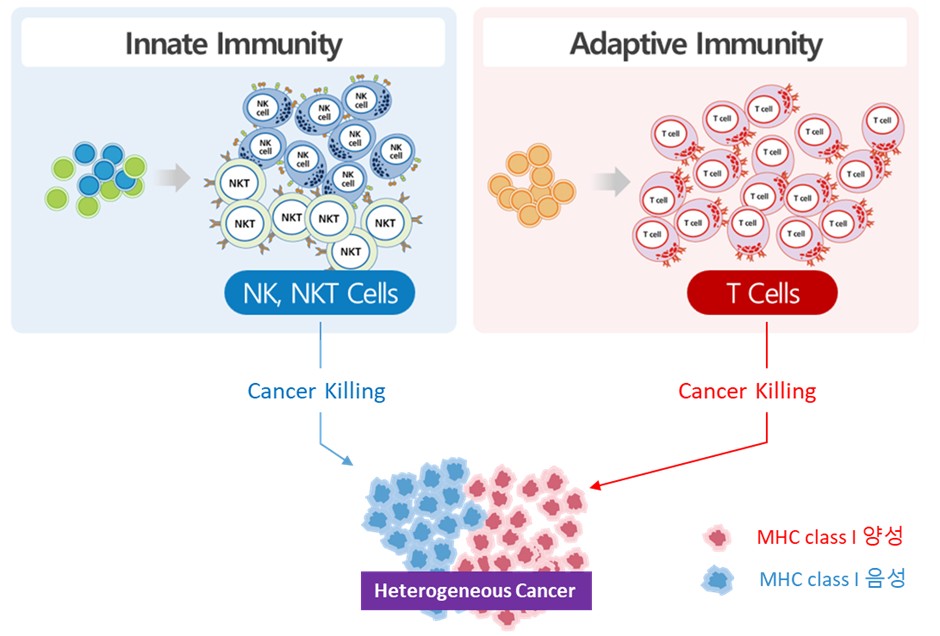 |
|
celivax 기반 파이프라인의 항원-비균질성 암세포의 제거기전 |
| 출처) 당사 제시 |
이처럼 당사의 CeliVax 기술은 암항원 특이적으로 항암효과를 나타내는 세포독성 T세포와 항체를 활성화하고, 암항원 비특이적으로 항암효과를 나타내는 자연살해세포와 자연살해 T세포가 복합적인 항암 작용을 일으켜 어느 한 가지의 성격만 가지고 있는 암세포가 아니라 비균질함 때문에 높은 치료효과를 기대하기 어려운 암세포를 제거할 수 있습니다. 이는 적응면역계 반응만 유도할 수 있는 수지상세포 백신이나 적응면역계 반응을 직접 일으키는 T세포 치료제와의 차별되는 경쟁력을 보유하고 있습니다. 한편으로 T세포 치료제와는 다르게 CeliVax나 수지상세포 백신은 적응계면역 반응을 통해 장기 기억반응을 유도하여 암세포의 전이 및 재발을 보다 효과적으로 억제할 수 있습니다.
| [타 면역항암제 작용 기전 대비 Celivax 경쟁력] |
| 특징 | Celivax | 수지상세포 백신 | T세포 치료제 | |
| 개인맞춤치료 | ○ | ○ | ○ | |
| 항원특이적 | 항체 생산 | ○ | ○ | × |
| T세포 | ○ | ○ | ○ | |
| 항원비특이적 | 자연살해세포 (NK유사T세포 포함) |
○ | × | × |
| 자연살해T세포 | ○ | × | × | |
| T세포 작용 회피 암세포 제거 (항원 혹은 MHC 분자 소실 암세포 제거 효과) |
○ | × | × | |
| 출처) 당사 제시 |
또한, CeliVax 기술은 면역 세포를 활용하여 환자의 면역반응을 유도하는 백신의 형태를 가진 치료제로, 암항원 유전자를 암종에 따라 교체하는 방식으로 다수의 파이프라인을 신속하게 개발할 수 있습니다. 동일한 원천기술을 기반으로 확장된 파이프라인을 구축하기 때문에 비임상시험 단계의 유효성, 독성시험, 비임상 시제품 제조 및 품질 시험 방법과 자료 구축 등이 동일한 방식으로 진행되므로 선도제품 이후의 개발 제품들은 개발속도를 가속화할 수 있는 장점이 있습니다. 특히 대부분의 암종에서 환자특이적으로 과발현하는 암항원이 밝혀져 있는 경우가 많고, 이렇게 과발현된 암항원이 존재하는 암종에는 CeliVax 원천기술을 적용할 수 있습니다. 그 외에도 자가세포 기반 생산 치료제는 통상적으로 세포를 배양하는 과정으로 인해 제조공정이 오래 소요됨에도 불구하고, 당사는 GMP 1일 제조 공정을 통해 신속하게 제조하여 환자에게 투약할 수 있습니다.
CeliVax와 유사하게 자가세포를 활용하는 치료제로 수지상세포 백신과 CAR-T 등 T세포 치료제가 있습니다. 하지만 CeliVax와는 다르게 각 치료제들은 모두 긴 배양 기간을 통해 세포를 분화 및 증식을 유도하는 공정이 있습니다. 통상적으로 수지상세포백신의 경우 7~10일, CAR-T 등 T세포 치료제의 경우 14~28일의 제조일이 소요되는 것을 고려하면 당사 제품의 제조기간은 1일로 상대적으로 빠르고 환자들에게 최종 공급되는 것도 수일내에 완료되는 장점이 있습니다. 자가세포 기반 세포치료제는 개인의 세포에서 기반한 개인 맞춤형 제품이기 때문에 GMP 제조시 각 롯드(lot)가 1개 생산라인을 점유하는데, 제조소요시간이 짧은 Celivax 기술의 경우 GMP 제조라인의 활용도를 높일 수 있습니다. 또한, 수지상세포 백신처럼 장기간 배양이 필요하지 않으므로 고가의 사이토카인이나 단백질 등의 원자재를 사용하지 않는 장점도 보유하고 있습니다.
CeliVax 기술이 적용된 제품들은 수지상 세포나 T세포 기반 치료제에 비하여 제조 비용이 상대적으로 저렴하다고 볼 수 있으나, 환자 개인 맞춤으로 개별 롯드(lot)를 생산해야 하는 자가세포 기반 세포치료제의 특징에 따라 생산 비용이 고가에 해당하며, 인체세포를 처리할 수 있는 허가 받은 GMP 시설을 통해서만 제조할 수 있다는 제약점을 가지고 있습니다. 또한 환자의 면역세포를 원료로 사용하기 때문에 환자의 면역세포를 채취하는 병원과 근접한 위치에 GMP 시설이 위치해야 원활한 제조가 가능하다는 단점이 있습니다.
따라서 당사의 Celivax 기술은 짧은 생산 소요 기간과 낮은 생산비를 통해 타 면역항암제 치료 대비 경쟁력을 보유하고 있습니다. 당사는 상기와 같은 장점을 극대화하기 위하여 세포유전자치료제 GMP센터를 완공하여 인허가 취득을 완료했습니다. 당사의 GMP 사업과 관련한 위험은 본 증권신고서 제1부 모집 또는 매출에 관한 일반사항 - Ⅲ. 투자위험요소 - 1. 사업위험 - 사. CMO 사업 관련 위험을 참고하시기 바랍니다. 또한, 당사 면역항암치료백신인 Celivax 기술 및 이를 활용한 파이프라인의 경쟁력 및 개발 현황에 대한 내용은 본 증권신고서 제2부 발행인에 관한 사항 - Ⅱ. 사업의 내용 -7. 기타 참고사항을 참고하여 주시기 바랍니다.
| [자가세포 기반 치료제 종류별 제조 비용 및 기간] |
|
특징 |
Celivax |
수지상세포 백신 |
T세포 치료제 |
|
제조기간 |
1일 |
7~10일 |
14~28일 |
|
공급의 신속성 |
○ (5일 이내) |
× (11~14일) |
× (18일~32일) |
|
판매가 |
낮음 (약 10만$) |
높음 (약 20만$) |
매우 높음 (약 40만$) |
| 출처) 당사 제시 |
| 주1) 대표적인 수지상세포 백신인 Provenge의 용법에 따라 3회 용량의 비용을 게시하였습니다. |
| 주2) T세포 치료제는 IHA(이스라엘 병원)의 유럽 혈액학 컨퍼런스 CART25- 프랑스 스트라스부르 2025 자료를 참고하였습니다. |
| 주3) Celivax와 유사한 세포치료제의 제조원가를 알 수 없어 판매가 기준의 가격을 제시하였습니다. 당사의 Celivax는 추정 판매가입니다. |
그러나, 이러한 당사의 기술 수준에도 불구하고, 본 증권신고서 제출일 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황에서 점차 면역세포치료제 시장 경쟁이 심화됨에 따라 당사의 항암면역치료백신 사업에 부정적인 영향을 미칠 수 있으며, 또한 새로운 치료법의 등장, 시장 환경의 변화, 신규 면역항암제 개발 등으로 글로벌 경쟁력 및 기준에 부합하지 않게 되는 경우, 당사의 사업계획 및 수익창출 등에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [바. 연구 개발 실패에 따른 위험] 한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이후 임상단계에서는 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 당사는 신약개발사로서, CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 면역항암치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용을 최소화하는 것을 목표로 하고 있습니다. 또한 당사는 아데노바이러스 벡터 기반 예방백신 기술을 보유하고 있으며 이 기술을 활용하여 COVID-19 예방백신을 개발 중입니다. 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 당사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실이 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
신약(New Drug)은 기존 약물에 모방이나 개량 합성에 의한 것이 아닌, 기존약물의 부작용과 현저한 기능 개선이 포함되어야 하며, 화학합성, 미생물·배양조직세포로부터 유전자재조합을 이용한 생산, 천연물 추출 등의 신물질 탐색 작업, 비임상시험, 임상시험 등을 거쳐 제조 승인을 받은 의약품 입니다. 신약개발 사업은 사업화에 성공시 통상적으로 특허권에 의해 일정기간 동안 독점권으로 보호받게 되며, 시판 승인 후 일정기간 동안 독점 판매기간을 인정받을 수도 있습니다. 대부분의 국가에서 특허 존속기간은 출원 후 20년이며, 특허의 존속기간과 관계없이 신약의 경우, 미국은 시판 승인 후 5년 이상의 시장독점권, EU는 10년의 시장독점권, 국내는 6년의 시장독점권을 보장받을 수 있습니다. 이처럼 특허권 및 독점판매권(시장독점권)을 통해 일정기간 배타적 수익을 보장받을 수 있기 때문에 글로벌 블록버스터급 신약 개발에 성공 시 막대한 수익을 창출할 수 있는 고부가가치 사업입니다.
그러나, 신약 개발 과정은 후보물질의 유효성과 안전성을 평가하고 이에 대한 근거를 마련하기 위한 중요한 과정으로 관련 규정과 절차를 반드시 준수해야합니다. 먼저, 타겟 질환에 대해 약리적인 효과가 있을 것으로 예상되는 후보물질 탐색 및 발굴을 시작으로, 동물을 대상으로 하는 전임상 연구(preclinical study)와 사람을 대상으로 하는 임상 연구(clinical study)를 통해 후보물질의 안전성과 유효성에 대한 자료를 분석하여, 최종적으로는 규제 당국으로부터 자료의 적합성 심사를 통해 의약품 품목 허가를 받아야 합니다. 또한, 제품이 안전하고 일정한 품질 수준을 유지한 채 생산되어야 하기에 공정개발 및 검증이 동시에 성공적으로 진행되어야 합니다.
한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이 과정에서는 신약의 효능이나 작용기전을 기반으로 신약개발 대상물질을 선정합니다. 유효물질(hit compound), 선도물질(lead compound)을 거쳐 신약 후보물질이 선정되면 후보물질의 안정성과 효과를 확인하기 위해 동물 모델을 대상으로 전임상시험(pre-clinical trial)을 진행합니다. 전임상시험을 통해 후보물질의 효과와 안전성을 검증하면 허가기관에 임상시험 허가신청(IND : Investigational New Drug Application)을 하는 등 일반인 또는 환자를 대상으로 하는 임상시험에 앞서 효능 및 안전성과 관련하여 임상시험 이전 단계부터 엄격한 규제에 의해 축적된 다양한 데이터를 각 국가의 규제 당국에 제출하여야 합니다.
이후 임상단계에서는 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 임상 1상은 주로 약물의 효과는 평가하지 않고 안전성에 주로 초점을 맞추기 때문에 대부분 성공률이 높습니다. 임상 2상은 인체(환자)를 대상으로 부작용 뿐 아니라 약효를 테스트하는 첫 번째 관문이기 때문에 성공률이 제일 낮을 수밖에 없습니다. 임상 3상은 임상 2상과 같이 환자를 대상으로 약효와 부작용을 보는 단계이지만, 환자 수가 훨씬 크고 약의 dose(복용량)를 결정하는 단계입니다.
| [임상시험 구분] |
| 구분 | 목적 | 내용 |
| Phase 1 (1상) |
ㆍ안전성 검토 ㆍ내약성 평가 ㆍPK/PD 정의/서술 ㆍ치료효과 추정 |
ㆍ용량-내약성 임상시험 ㆍ안전용량 범위와 부작용 확인 ㆍ체내 약물 동태 검토 ㆍ1a: SAD, 1b: MAD |
| Phase 2 (2상) |
ㆍ단기 유효성/안전성 검토 ㆍ목표 적응증에 대한 탐구 ㆍ후속 시험을 위한 용량 추정 ㆍ치료확증 시험을 위한 시험설계, 평가항목, 평가방법에 대한 근거 제공 |
ㆍ용량-반응 탐색 임상시험 ㆍ소수의 환자에서의 비교적 단기간에 걸친 초기 임상시험 ㆍ2a: 약효확인, 유효용량 검토 ㆍ2b: 약효입증, 유효용량 확인, 유효성 및 안전성의 균형 검토 |
| Phase 3 (3상) |
ㆍ안전성, 유효성 재확인 ㆍ임상적용을 위한 Risk/Benefit의 상대평가 근거제공 ㆍ용량과 반응에 대한 관계 확립 ㆍ효과에 대한 검증 |
ㆍ무작위 배정에 의한 용량-반응 임상시험 ㆍ유효성 확립을 위한 적절하고 잘 통제된 임상시험 ㆍ이환율/사망률을 위한 임상시험 ㆍ충분한 환자에서 유효성 및 안전성 확립 ㆍ대조군을 이용한 비교 임상시험 ㆍ대규모 임상시험 |
| Phase 4 (4상, PMS) |
ㆍ시판 후 안전성 조사 및 추가 임상시험 ㆍ일반 또는 특정 대상군/환경에서 Risk/Benefit에 대한 이해 ㆍ흔하지 않은 이상반응 확인 ㆍ추천되는 용량을 확인 ㆍ모든 시험 디자인이 가능 |
ㆍ장기투여시 부작용 검토 ㆍ안전성 재확립 ㆍ새로운 적응증 등 탐색 연구 ㆍ대조군을 이용한 유효성 임상시험 ㆍ이환율/사망률에 대한 임상시험 ㆍ부가적인 평가 항목에 대한 임상시험 ㆍ약물경제학적 측면의 임상시험 |
| 주1) 약물의 농도-반응 관계를 PK/PD라고 합니다. PK(Pharmacokinetics 약동학)는 약물의 흡수, 분포, 생체 내 변화 및 배설을 연구합니다. PD(Pharmacodynamics 약력학)는 생체에 대한 약물의 생리학적 및 생화학적 작용과 그 작용 기전, 즉 약물이 일으키는 생체의 반응을 주로 연구합니다. |
| 주2) SAD(단회용량상승, single ascending dose) : 단회용량을 투여한 후 안전성과 내약성을 확인합니다. |
| 주3) MAD(다중용량 상승, multiple ascending dose) : 반복 투여를 통해 더 높은 용량으로 증량해가면서 최대 내약 용량을 확인합니다. |
임상시험을 마친 후에는 식약처에 임상시험 결과를 제출하게 되는데, 이를 신약허가신청이라고 합니다. 신약허가신청 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 관리 규정을 따라야 하며, 제4상 임상시험으로 분류되는 시판후안전성조사(PMS : Post-Market Surveillance)를 통해 임상시험에서 발견하기 어려웠던 부작용에 대해서 추적 조사를 수행합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공확률이 매우 낮은, 대표적인 High Risk, High Return, Long Term Investment 사업입니다.
| [신약 개발 과정] |
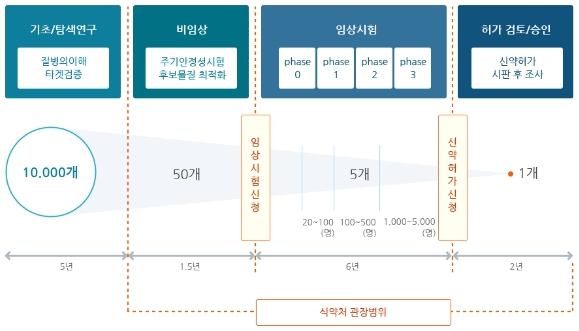 |
|
신약개발과정 |
| 출처) 의약품안전나라 의약품통합정보시스템 |
신약개발 과정에 소요되는 기간 및 비용 분석에 관하여 분석기관마다 편차는 있으나, 일반적으로 신약후보물질이 초기 연구 및 임상시험을 거쳐 출시되기까지 보통 10~15년 정도가 소요되는 것으로 알려져 있습니다. 또한 Evaluate Pharma의 World Preview 2024에 따르면 전 세계 제약 R&D 비용은 2016년 1,610억달러에서 꾸준히 상승하여 2024년 3,060억달러, 2030년에는 3,660억달러가 소요될 것으로 예상하였습니다.
| [전 세계 제약 R&D 비용 추이] |
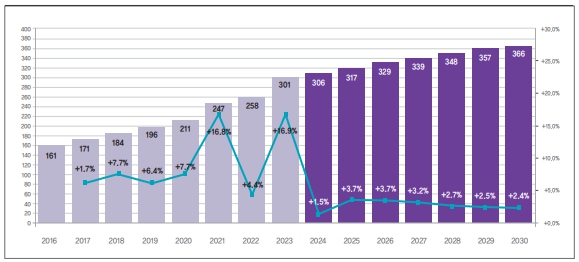 |
|
세계 의약품 시장 연구개발 비용 |
| 출처) World Preview 2024, Evaluate Pharma |
이러한 시간적, 재정적 막대한 투자에도 불구하고, 신약개발의 최종 성공률은 다소 낮은 수준입니다. IQVIA Institute(2024) 보고서에 따르면, 2010년부터 2023년까지 FDA 임상 파이프라인을 대상으로 조사된 임상의 성공률은 평균 7.6%로 나타났습니다.
| [연도별 임상 단계별 이행성공률 및 임상 성공률 추이(2010~2023, FDA)] |
 |
|
임상단계별 이행 성공율 및 임상성공율 |
| 출처) Global Trends in R&D 2024, IQVIA Institute(2024.02) |
당사는 신약개발사로서, CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 면역항암치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용을 최소화하는 것을 목표로 하고 있습니다. 또한, 당사는 아데노바이러스 벡터 기반 예방백신 기술을 보유하고 있으며 이 기술을 활용하여 COVID-19 예방백신을 개발 중입니다. 추후 아데노바이러스 벡터 플랫폼 기술을 더욱 견고히 하여 향후 출현 가능성이 있는 신종 전염병 등에 대한 예방백신 파이프라인을 추가할 계획입니다. 당사의 보유 파이프라인과 그 현황은 하기와 같습니다.
| [당사 보유 파이프라인 현황] |
| 구분 | 보유 파이프라인 | 적용 질환 | 항원 | 수익모델 | 개발현황 | |
| 국내 | 글로벌 | |||||
| 코로나19 예방백신 (아데노바이러스 벡터 기술) |
AdCLD-CoV19-1 OMI | 오미크론 변이 바이러스 | SARS-CoV-2 B.1.1.529 spike protein 재조합유전자 |
임상개발을 통한 제품매출 및 라이센스 아웃 매출 |
다국가(국내, 베트남, 필리핀) 임상 3상 진행중 | |
| 다가백신 | 코로나19 변이 바이러스 | - | 비임상시험 진행중 | 임상 진행 예정 |
||
| 항암면역치료백신 (CeliVax 기술) |
BVAC-C | 자궁경부암 등 | HPV 16/18, E6/E7 | 임상 1/2a상 완료 연구자주도 병용투여 임상시험 진행중 |
||
| BVAC-E6E7 | 두경부암 등 | 임상 1/2a상 IND 신청 | ||||
| BVAC-B | 위암, 유방암, 췌장암, 폐암, 난소암 등 | HER2/neu | 임상 2a상 준비중 | |||
| BVAC-P | 전립선암, 뇌종양 등 | PAP/PSMA | 임상 1상 준비중 | |||
| BVAC-M | 흑색종, 유방암, 폐암, 육종, 방광암, 간암 | MAGE-A3/GP100 | 비임상시험 진행중 | |||
| BVAC-Neo | 다양한 암종(개인 맞춤형) | Neo-epitopes | 비임상시험 진행중 | |||
| 출처) 당사 제시 |
(1) 코로나19 예방백신 (아데노바이러스 벡터 기술)
정부는 2020년 04월 대통령 주재 산ㆍ학ㆍ연ㆍ병 합동회의를 계기로 코로나19 치료제 및 백신 개발 집중 지원하여, 신속히 성과를 창출할 수 있도록 민관합동 범정부 지원단을 구성하였으며, 질병관리본부는 국내 자체 백신개발을 위한 '백신실용화기술개발사업'에 대규모 연구 투자를 시작했습니다.
당사의 코로나19 바이러스벡터 백신((AdCLD-CoV19)은 2020년 06월 원숭이 효력시험에서 'AdCLD-CoV19' 1회 투여로 항원특이적 T세포 면역반응, 결합항체반응, 중화항체 생성을 확인한 뒤 07월 과학기술정보통신부의 2020년도 바이오·의료기술 개발사업 국책과제(아데노바이러스 벡터에 기반한 1세대 및 2세대 코비드-19 예방백신 개발)에 선정 되었습니다. 이후 2020년 12월 임상 1/2a상 시험계획 승인되었고, 2022년 01월에는 임상 2b상 시험계획 승인을 받았습니다.
당사가 판단하기에, 타사 mRNA 백신 및 타 백신 플랫폼 대비 당사의 아데노바이러스 벡터를 활용한 백신 플랫폼의 경쟁력과 특징은 다음과 같습니다.
| [타사 mRNA 백신 대비 경쟁력] |
|
구 분 |
당사 | mRNA 백신 | |
|---|---|---|---|
| 플랫폼 | Adenovirus vector (Ad5/35) | mRNA (LNP) | |
|
공급가격(예상) |
10~20 USD/dose | 37 USD/dose (정부 납품가 (예상)) 110~130 USD/dose (민간시장 납품가 (예상)) |
|
| 보관/운송 조건 | -20℃(다년간 보관 가능), 2~8℃(9개월 이상 ~) | 화이자: -90~-60℃(18개월), 2~-8℃(10주) 모더나: -50~-15℃(9개월), 2~-8℃(30일) |
|
| 주력 개발 품목 | AdCLD-CoV19-1 OMI (BA.1) 2024-2025 유행주 타겟 백신 (TBD) |
XBB.1.5 대응 단가백신 | |
| 중화항체 역가 상승 비율(GMFR) |
10.08 (AdCLD-CoV19-1 OMI 임상 1/2상 결과) |
화이자: 9.1 (Winokuret al., NEJM, 2023) |
모더나: 7.96 (Chalkias et al., NEJM, 2022) |
| 출처) 당사 제시, 학술자료(Vaccines(Basel) 저널, 2023.03 및 Eur Rev Med Pharmacol Sci 저널, 2021.02), 언론보도(Moderna expects to price its COVID vaccine at about $130 in the US, 로이터, 2021.03), 화이자 홈페이지 및 Spikevax, EPAR - Product Information, 유럽의약품청(EMA) |
| 주1) 중화항체 역가는 각 단백질에 대해 바이러스의 세포 침투를 막을 수 있는 항체 수준을 의미합니다. |
| 주2) 코로나19 감염이력 없는 대상자 기준입니다. |
| 주3) 각 임상시험의 수행시기, 인종, 연령 등의 모집군 정보가 다르기 때문에, 결과 해석에 주의가 필요합니다. |
| [당사 백신 및 타 플랫폼 백신 특징 비교] |
|
구 분 |
Ad5/35 플랫폼 | 타 개발사 | |||
|---|---|---|---|---|---|
| 아데노바이러스 벡터 | mRNA | 재조합단백질 | 불활화백신 | ||
| 개발사 | CELLID | AstraZeneca, Janssen | Pfizer(BioNTech), Moderna | NovaVax, SK Bioscience | Sinopharm |
| 면역원성 |
기초접종 시 기존 Ad5보다 우수한 초기 면역반응 추가접종 시 강한 면역 유도 |
면역원성 중간 수준, 단회 접종 시 중화항체 반응 제한적 | 강력한 중화항체 및 T세포 반응 | 상대적으로 낮은 중화항체 | 면역원성 낮음 |
| 안전성 |
임상 2상에서 중대한 이상반응 보고되지 않음. 발현된 이상반응의 대부분은 경증 grade 1에 해당함. |
일부 백신에서 혈전증 사례 보고 | 직접 감염원을 다루지 않아 안전성이 높음 | 기존 단백질 기반 백신과 유사하여 안전성 높음 | 전통적 플랫폼으로 안전성 높음 |
| 생산단가 |
낮음. 자체 플랫폼 보유, 2~8℃ 보관이 가능하여 운송 및 관리비 낮음. |
낮음. 기반기술 오래되어 대량생산 비용 저렴 |
높음. 생체 내 전달 비효율성으로 인해 별도의 전달기술 필요 RNA 및 지질 나노입자의 불안정성으로 운송·관리 어려움 |
중간. 세포배양 및 정제공정 필요 |
낮음. 대규모 배양 후 불활화로 비교적 비용 저렴 |
| 변이주 대응 개발속도 |
빠름. 바이럴벡터 플라스미드 교체만으로 수 주 내 업데이트 가능 |
빠름. 바이럴벡터 플라스미드 교체만으로 가능 |
빠름. 수 주 내 업데이트 가능 |
느림. 생산 공정상 시간이 소요됨 |
느림. 항원 전체를 새로 배양해야 하므로 느림 |
| 플랫폼 확장 가능성 (타 감영병) |
바이럴벡터 플라스미드 교체만으로 가능 | 다른 질환 백신에도 일부 적용 사례 있음 | 신속한 디자인으로 다양한 감염병 대응 가능 | 다수의 국가에서 기존 감염병 백신에 활용 | 다수의 국가에서 기존 감염병 백신에 활용 |
|
출처) 당사 제시 1) 백신 연구동향 보고서 (2022년 12월), 한국화학연구원 감염병기술전략센터 2) Wu et al. (2024). Comparative efficacy and safety of COVID-19 vaccines in phase III trials: a network meta-analysis(3상 임상에서 COVID-19 백신의 효능과 안전성을 네트워크 메타분석 방식으로 비교한 논문), BMC infectious diseases 3) Sadoff et al. (2021). Safety and efficacy of single-dose Ad26.COV2.S vaccine(Ad26.COV2.S 백신(얀센 백신)은 SARS-CoV-2(코로나19 바이러스)의 스파이크 단백질을 발현하도록 설계된 비복제성 아데노바이러스 26형 벡터 백신), NEJM. 4) Polack et al. (2020). Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine(BNT162b2(화이자-바이오엔텍 백신)는 SARS-CoV-2(코로나19 바이러스)의 스파이크 단백질을 발현하는 mRNA 백신), NEJM. 5) Coronavirus Disease 2019 (COVID-19) Vaccine Safety(코로나 백신의 안전성), CDC 6) Lee et al. (2022). Comparison of COVID-19 Vaccines Introduced in Korea(한국에서 사용 중인 다섯 가지 백신의 특성, 생산 플랫폼, 합성 원리, 승인 현황, 보호 효과, 면역 반응, 임상시험 결과, 이상반응 등을 비교), Biomedical Science Letters 7) 코로나19 백신 접근권, 백신 가격, 특허권 유예를 둘러싼 논쟁, MIT 테크놀로지리뷰 코리아 8) 아데노바이러스 플랫폼 기반의 백신 개발 동향 정보집 (2023), 식품의약품안전평가원 |
이처럼 당사의 아데노바이러스 기반의 코로나 19 백신 플랫폼은 타 플랫폼 대비 면역원성 및 안전성이 열등하지 않다고 판단하고 있으며, 특히 mRNA 백신 대비 면역원성은 유사하나 절반 수준의 가격에 공급이 가능하기 때문에 가격 경쟁력이 있으며, 국가예방접종 프로그램에 적용할 시 국가예산 절감 효과를 기대하고 있습니다. 또한 장기간 냉장 보관이 가능하여 유통 및 보관의 용이성을 확보하였기 때문에 중/저소득 국가 진출에 용이할 것으로 예상하고 있습니다. 단, 이는 당사의 판단 및 예측에 불과할 뿐 실제 결과는 상이할 수 있는 점을 반드시 유의하여 주시기 바랍니다.
상기 파이프라인의 임상 1/2a상 결과는 다음과 같습니다.
| [투자판단 관련 주요경영사항(COVID19 예방 백신 AdCLDCoV191 OMI의 제1/2상 임상시험 결과) |
| 구분 | 내용 | |
|---|---|---|
| 투자 유의사항 | 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 존재합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 결과 | |
| 2. 주요내용 | 1) 임상시험명칭 | 만 19세 이상 성인 자원자를 대상으로 COVID-19 예방 백신 AdCLD-CoV19-1 OMI 추가접종의 안전성, 면역원성을 확인하기 위한 제1/2상 (단일기관, 공개, 제1상 및 다기관, 이중 눈가림, 무작위배정, 위약 대조, 제2상) 임상시험 |
| 2) 임상시험단계 | 국내 제1/2상 임상시험 | |
| 3) 임상시험승인기관 | 국내 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 대한민국 | |
| 5) 임상시험실시기관 | 고려대학교 구로병원 외 7개 기관 | |
| 6) 대상질환 | SARS-CoV-2 Omicron variant에 의한 COVID-19 예방 | |
| 7) 신청일 | 2022-05-27 | |
| 8) 승인일 | 2022-08-04 | |
| 9) 등록번호 | - 임상시험승인번호 : 100968 - 임상시험일련번호 : 202200640 |
|
| 10) 임상시험 목적 | 가. 임상 1상 - 일차 목적 : AdCLD-CoV19-1 OMI 추가접종 후 28일 동안의 안전성 및 면역원성을 확인하여 임상 2상 진입 여부 평가 나. 임상 2상 - 일차 목적 : AdCLD-CoV19-1 OMI 추가접종으로 유도되는 SARS-CoV-2 Omicron variant에 대한 면역원성을 투여 후 2주, 4주 시점에 neutralization antibody 검사로 평가 |
|
| 11) 임상시험 방법 | 가. 임상 1상 - 단일기관, 공개 제1상 임상시험으로 국내 1개 기관에서 COVID-19 예방백신의 마지막 접종 완료 및/또는 COVID-19에 의한 격리 해제 후 최소 16주 이상 48주 미만 경과한 만 19세 이상 64세 이하 성인 자원자 20명을 모집하고 임상시험용 의약품 접종 후 28일 동안의 안전성 및 면역원성을 확인하여 임상 2상 진입 여부를 평가함 나. 임상 2상 - 다기관, 이중눈가림, 무작위배정, 위약대조 제 2상 임상시험으로 국내 8개 기관에서 COVID-19 예방백신의 마지막 접종 완료 및/또는 COVID-19에 의한 격리 해제 후 최소 16주 이상 48주 미만 경과한 만 19세 이상 성인 자원자 300명을 모집하고 임상시험용 의약품 또는 위약을 5:1로 무작위배정하여 접종 후 안전성과 면역원성을 평가함 |
|
| 12) 1차 지표 | 가. 안전성 평가 - 임상시험용 의약품 접종 후 30분 이내(만 75세 이상 고령자의 경우 2시간 이내)에 발생한 즉각적 이상반응 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 이상반응 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응 나. 면역원성 평가 - 임상시험용 의약품 접종 후 2주, 4주 시점에 wild-type virus neutralization method로 분석한 SARS-CoV-2 B.1.1.529 중화항체의 혈청반응률(Seroresponse rate, SRR), 기하평균역가(Geometric Mean Titer, GMT), 기하평균증가율(GMFR) |
|
| 13) 임상시험기간 | 2022.09.21 ~ 2024.02.28 | |
| 14) 목표 시험대상자 수 | - 임상 1상 : 20명 - 임상 2상 : 300명 |
|
| 3. 시험결과 | 1) 1차 지표 통계분석방법 | 본 임상시험은 안전성 및 면역원성 탐색 목적의 제1/2상 임상시험으로 검증하고자 하는 가설이 없어 통계적 유의성 검증에 해당사항 없음 |
| 2) 결과값 | 가. 임상 1상 1) 안전성 평가 - 임상시험용 의약품 접종 후 30분 이내에 발생한 즉각적 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 국소적/전신적 이상반응은 14명(70.00%)에게서 42건 발생하였고, 중대한 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응은 6명(30.00%)에게서 7건 발생하였고, 중대한 이상반응은 1건 발생함 2) 면역원성 평가 - 시험군 19명의 베이스라인 시점에서의 GMT는 734.39였고, 임상시험용 의약품 접종 후 2주 시점에서의 GMT는 3899.49로 베이스라인 대비 5.31배(GMFR) 증가함. 4주 시점에서의 GMT는 3404.85로 베이스라인 대비 4.64배(GMFR) 증가하였으며, 2주 및 4주 시점에서의 혈청반응율은 78.95%로 나타남 나. 임상 2상 1) 안전성 평가 - 임상시험용 의약품 접종 후 30분이내 발생한 즉각적 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 국소적/전신적 이상반응은 시험군 199명(79.92%)에게서 744건 발생하였으며, 위약군 25명(49.02%)에게서 54건 발생함. 시험군과 위약군 모두 중대한 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응은 시험군 71명(28.51%)에게서 115건 발생하였으며, 위약군 17명(33.33%)에게서 26건이 발생했음. 중대한 이상반응은 위약군에게서 1건 발생함. 2) 면역원성 평가 - 시험군 234명의 베이스라인 시점에서의 GMT는 2036.66이었고, 임상시험용 의약품 접종 후 2주 시점에서의 GMT는 7386.23으로 베이스라인 대비 3.63배(GMFR) 증가하였으며, 4주 시점에의 GMT는 7135.41로 베이스라인 대비 3.50배(GMFR) 증가하였으며, 2주 및 4주 시점에서의 혈청반응율은 65.38%로 나타남 - 2주 및 4주 시점에서의 위약군 대비 시험군의 GMT ratio는 각각 3.12배, 3.41배로 나타남 |
|
| 4. 사실발생(확인)일 | 2024-11-06 | |
| 5. 향후계획 | AdCLD-CoV19-1 OMI 임상 3상 시험의 4,000명 투여를 완료하고, 임상3상 시험의 중간분석 결과를 바탕으로 조건부 품목허가를 신청할 예정 | |
| 6. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 4. 사실발생(확인)일은 임상시험수탁기관(CRO)으로부터 임상 1/2상 임상시험 결과보고서 (Clinical Study Report)를 수령한 날짜 입니다. - 본 공시 내용은 향후 당사의 보도자료 및 IR자료로 사용될 예정입니다. |
||
| ※ 관련 공시 | 2022-05-27 투자판단 관련 주요경영사항(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 계획(IND) 신청) 2022-08-04 투자판단 관련 주요경영사항(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 계획(IND) 승인) 2023-07-14 투자판단 관련 주요경영사항(임상시험 결과)(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 Top-line 결과 발표) |
|
| (자료) | DART 전자공시시스템 |
그러나, 2022년 01월에 식품의약품안전처로부터 승인받은 기초접종 용도로 개발한 코로나19 백신 'AdCLD-CoV19-1'의 임상 2b상 시험의 경우, 코로나19 백신 접종 이력과 코로나19 감염 이력이 없는 성인 자원자를 대상으로 진행됨에 따라 국내외 백신 접종율 증가 및 전 세계적인 오미크론 확산에 따른 코로나19 감염율 증가로 인해, 백신 접종 및 감염 이력이 없는 대상자 모집이 불가능하다고 판단하여 2022년 12월 코로나19 백신 'AdCLD-CoV19-1'의 임상 2b상 시험 중단을 결정하였습니다.
'AdCLD-CoV19-1'의 임상 개시 시점에 한국을 포함한 전세계 주요국은 높은 코로나19 백신 접종율을 나타내었으나, 아프리카 지역은 백신 접종율이 상대적으로 낮고 100,000명당 누적 확진율도 낮은 것으로 판단됨에 따라 신속히 임상시험을 수행할 경우 2b상 시험 대상자 모집이 가능할 것으로 당사는 판단하였습니다.
| [전세계 코로나19 누적확진자 비율 및 백신접종율(2022.03.14)] |
 |
|
전세계 코로나19 누적확진자 비율(좌) 및 백신접종율(우) |
| 출처) ourworldindata.org |
| [대한민국 및 아프리카 국가들의 코로나19 누적확진율 및 백신접종율(2022.03.14)] |
| 국가 | 확진자(백만명) | 백신접종자 (1회 이상) |
백신접종자(2회 이상) |
| 대한민국 | 139,504 | 86.76% | 85.85% |
| 남아프리카공화국 | 61,695 | 34.48% | 27.27% |
| 케냐 | 5,982 | 14.91% | 14.76% |
| 탄지니아 | 514 | 5.49% | 4.24% |
| 출처) ourworldindata.org 및 당사 제시 |
이에 당사는 현지 의료 인프라를 고려하여 남아프리카 공화국을 국외 임상시험 수행 국가로 선정하였으나, 2022년 03월 중순에 남아프리카 공화국에서 수집된 3,395개의 혈장 샘플을 이용하여 코로나19 항체 보유 여부를 확인하는 혈청학적 유병율을 분석한 시험 결과가 2022년 05월 말 발표되었습니다. (Jeremy Bingham et al., Research square, 2022) 발표된 시험 분석 결과에 따르면 모든 코로나19 항체에 음성인 샘플의 비율은 단 2.2%인 것으로 확인되었습니다.
이에 남아프리카공화국에서 현실적으로 임상시험 수행이 불가능할 것으로 판단하였으며, 상대적으로 코로나19 확진자 비율이 낮은 케냐와 탄자니아를 최종 임상시험 수행국가로 변경하고 총 3개 임상시험 수행기관에 IRB(Institutional Review Board; 임상시험심사위원회 및 임상시험윤리위원회) 승인 신청하였습니다. 그러나, 국외 임상시험 개시 시점에 탄자니아의 백신 접종율 상승 및 케냐의 코로나19 항체 보유율이 70%~80% 이상이라는 연구결과가 발표되었습니다. (Kagucia EW et al., MedRxiv, 2022) 또한, 국내외 높은 백신 접종율에 따라 초기 접종 용도 대비 추가 접종 백신의 수요가 증가하는 상황이며, 전 세계적인 코로나19의 변이주 검출 현황에서 초기 바이러스를 제외한 BA.1, BA.2, BA.5 등의 하위 변이주가 검출됨에 따라 초기주 대응 백신의 수요가 감소하였습니다.
| [대한민국 및 아프리카 국가들의 코로나19 누적확진율 및 백신접종율(2022.11.30)] |
| 국가 | 확진자(백만명) | 백신접종자 (1회 이상) |
백신접종자(2회 이상) |
| 대한민국 | 524,083 | 87.10% | 86.27% |
| 남아프리카공화국 | 67,484 | 37.51% | 32.62% |
| 케냐 | 6,323 | 26.09% | 19.82% |
| 탄지니아 | 620 | 43.06% | 39.39% |
| 자료 : ourworldindata.org 및 당사 제시 |
이에 따라 당사는 2022년 01월에 식품의약품안전처로부터 승인받은 기초접종 용도로 개발한 코로나19 백신 'AdCLD-CoV19-1'의 임상 2b상 시험 계획(IND)을 철회하고 향후 지속적인 수요가 예측되는 추가 접종 변이주 대응 백신으로 전략을 변경하여, 동일한 아데노바이러스 벡터 플랫폼을 활용한 오미크론 전용 부스터샷 백신 'AdCLD-CoV19-1 OMI'를 개발하고 국내 총 320명을 대상으로 임상 1/2상 시험을 진행하였으며, 2023년 05월 임상 1/2상 초기 분석 데이터를 기반으로 임상 3상 IND를 식품의약품안전처에 신청하였습니다. 2023년 7월 임상 3상 수행 허가를 받아 본 보고서 제출일 현재 국내, 필리핀 및 베트남 식약처에도 임상3상 시험계획 신청 후 승인을 완료하여 진행 중에 있습니다.
AdCLD-CoV19-1 백신의 경우 기초접종 목적으로 개발되었으나, 국내 백신 접종률 증가와 감염 이력 보유자의 급증으로 인해 감염 이력이 없는 미접종자 모집이 현실적으로 어려워져 임상 시험을 중단하였습니다. 즉, 해당 시험의 중단은 임상 설계상 요구되는 대상자 조건(백신 미접종 및 감염 이력 없음)을 충족하기 어려운 상황이 주요 원이었습니다. 현재 진행 중인 AdCLD-CoV19-1 OMI 백신의 임상은 추가접종(booster)을 목적으로 설계되었으며, 감염 이력 여부와 관계없이 대상자 모집이 가능합니다. 따라서 기존 임상 중단은 오미크론 변이 유행 등의 문제가 아닌 대상자 모집의 현실적 어려움에 따른 것으로, 현재의 임상 진행에는 영향이 없다고 판단됩니다.
| [AdCLD-CoV19-1 OMI 개요] |
|
구분 |
바이오 신약 |
|
적응증 |
COVID-19 감염 예방 |
|
작용기전 |
AdCLD-CoV19-1 OMI는 근육투여를 통해 SARS-CoV-2 바이러스의 S 단백질 항원 특이적인 항체 생성을 유도하고, 세포독성 T세포 반응을 유도하여 SARS-CoV-2 바이러스에 대한 기억면역반응을 생성함. 백신 접종 후 실제 감염 시 신속하고 강력한 T세포 반응이 재활성화되고, 이어서 항체생성이 이루어지면서 발병을 예방함. |
|
제품의 특성 |
AdCLD-CoV19-1 OMI: AdCLD-CoV19-1의 항원 유전자를 SARS-CoV-2 Omicron (BA.1) Spike 단백질로 치환하여 오미크론 변이주 대응에 특화하여 개발한 백신. |
|
진행경과 |
AdCLD-CoV19-1 OMI : 마우스와 영장류 시험을 통해 면역원성을 확인함. 기초 백신 (AdCLD-CoV19-1)을 접종한 동물에 추가 접종한 경우, SARS-CoV-2 초기주에 대한 중화항체와, 오미크론 변이주 (BA.1, BA.2)에 대한 중화항체가 모두 효과적으로 생성되는 것을 확인함. 현재 임상시험 약 제조가 완료되었으며, 임상 1/2상 시험 계획을 식약처에 제출하여 2022년 8월 수행을 허가받음. 2023년 2월 임상 1/2상 모집 및 투여를 완료하였으며, 안전성 및 면역원성 중간결과를 확보함. 2023년 7월 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 Top-line 결과를 발표함. 2023년 5월 임상 3상 시험 계획을 식약처에 제출하여 7월 수행을 허가받음. 본 보고서 제출일 현재 필리핀 및 베트남 식약처에도 임상 3상 시험계획 신청 후 승인을 완료하여 임상 진행 중임. 2024년 11월 12일 계획한 임상 3상 시험 대상자에게 투여 완료하였음. |
|
향후계획 |
다국가 임상 3상을 진행하여 중간결과를 확보 후 국내 및 국외 품목허가 신청 계획임. |
|
경쟁제품 |
수 종의 COVID-19 예방백신이 개발되어 각국에서 사용 중임. 대표적으로 미국의 Moderna, 독일의 Pfizer/BioNTech 사가 mRNA 기반 기술을 활용한 백신을 개발하였으며, 아스트라제네카와 존슨앤존슨 사는 아데노바이러스 벡터 기반 백신을 개발하였음. |
| 관련 논문 등 | - Boosting with variant-matched adenovirus-based vaccines promotes neutralizing antibody responses against SARS-CoV-2 Omicron sublineages in mice, Int J Antimicrob Agents. 30;63(3):107082 - Strategy to develop broadly effective multivalent COVID-19 vaccines against emerging variants based on Ad5/35 platform, Proc Natl Acad Sci U S A. 121(10):e2313681121 |
|
시장규모 |
AdCLD-CoV19-1 OMI와 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 수 있음. |
|
기타사항 |
AdCLD-CoV19-1과 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 것으로 전망함. |
| 출처) 당사 정기보고서 |
또한, 2023년 05월 글로벌백신기술선도사업단의 2023년 제1차 신규지원 대상 국책과제 (아데노바이러스 벡터 플랫폼 기반 COVID-19 변이에 대한 다가백신 개발)에 선정되었습니다. 당사의 코로나19 바이러스 벡터 백신의 연구개발 진행과정은 하기와 같습니다.
| [당사 코로나19 바이러스벡터 백신((AdCLD-CoV19) 연구개발 진행과정] |
| 일자 | 내용 | 비 고 |
| 2020년 06월 | 원숭이 효력시험에서 'AdCLD-CoV19' 1회 투여로 우수한 항원특이적 T세포 면역반응, 결합항체반응, 중화항체 생성을 확인함 | AdCLD-CoV19 |
| 2020년 07월 | 과학기술정보통신부의 2020년도 바이오·의료기술 개발사업 국책과제 선정 (아데노바이러스 벡터에 기반한 1세대 및 2세대 코비드-19 예방백신 개발) | AdCLD-CoV19 |
| 2020년 12월 | 'AdCLD-CoV19'의 임상 1/2a상 시험계획 승인 | AdCLD-CoV19 |
| 영장류 공격접종 시험에서 'AdCLD-CoV19' 단회 투여로 우수한 방어효능 확인 | AdCLD-CoV19 | |
| 고려대학교 구로병원과 임상시험 업무협약 체결 | AdCLD-CoV19 | |
| 2021년 01월 | 국제백신연구소와 코로나19 예방백신 연구용역 계약 체결 | AdCLD-CoV19 |
| 'AdCLD-CoV19'의 임상 1상 첫번째 시험대상자 투여 완료 | AdCLD-CoV19 | |
| 2021년 02월 | 'AdCLD-CoV19'의 임상 1상 대상자 30명 등록 및 투여 완료 | AdCLD-CoV19 |
| 2021년 03월 | 범부처신약개발단의 2020년 제3차 코로나19 백신 임상지원 사업 국책과제 선정 (아데노바이러스 벡터를 기반으로 한 코로나19 예방백신의 임상 1/2a상 개발) | AdCLD-CoV19 |
| 2021년 04월 | 고려대학교 구로병원 외 4개 기관에서 임상 2a상 등록 시작 및 첫번째 시험대상자 투여 완료 | AdCLD-CoV19 |
| 2021년 05월 | 'AdCLD-CoV19'의 임상 2a상 대상자 120명 투여 완료 | AdCLD-CoV19 |
| 2021년 07월 | 대량생산을 위해 개량된 아데노바이러스 벡터 기반 코로나19 백신 'AdCLD-CoV19-1'의 임상 1상 시험계획 승인 | AdCLD-CoV19-1 |
| 2021년 08월 | 국가임상시험재단(KoNECT) `2021년도 임상시험 글로벌 아웃바운드 지원사업` 선정 | AdCLD-CoV19-1 |
| 바이넥스와 코로나19 백신 위탁생산(CMO) 계약 체결 | AdCLD-CoV19-1 | |
| 2021년 09월 | 'AdCLD-CoV19'의 임상 1/2a상 중간 분석결과를 통해 우수한 안전성과 중화항체 및 T세포 반응 유도를 확인함 | AdCLD-CoV19 |
| 2021년 10월 | 'AdCLD-CoV19-1'의 임상 1상 대상자 40명 투여 완료 | AdCLD-CoV19-1 |
| 2022년 01월 | 'AdCLD-CoV19-1'의 임상 2b상 시험계획 승인 | AdCLD-CoV19-1 |
| 2022년 05월 | 코로나19 치료제·백신 신약개발사업단의 2021년 제5차 코로나19 백신 임상지원사업 국책과제 선정 (아데노바이러스 벡터를 기반으로 한 코로나19 예방백신의 임상 2b/3상 개발) | AdCLD-CoV19-1 |
| 오미크론 전용 백신 'AdCLD-CoV19-1 OMI' 추가접종 동물실험에서 오미크론 변이 특이적 중화항체 생성 확인 | AdCLD-CoV19-1 OMI | |
| 2022년 08월 | 'AdCLD-CoV19-1'의 임상 2b상 대상자 등록 및 투여 시작 | AdCLD-CoV19-1 |
| 'AdCLD-CoV19-1 OMI'의 임상 1/2상 시험계획 승인 | AdCLD-CoV19-1 OMI | |
| 코로나19 치료제·백신 신약개발사업단」의 2022년 제2차 코로나19 백신 신약개발 임상지원사업 국책과제 선정 (아데노바이러스 벡터 플랫폼 기반 COVID-19 변이 대응 백신의 임상 1/2상 개발) | AdCLD-CoV19-1 OMI | |
| 2022년 09월 | 'AdCLD-CoV19-1 OMI'의 임상 1상 대상자 20명 등록 및 투여 완료 | AdCLD-CoV19-1 OMI |
| 2022년 11월 | 'AdCLD-CoV19-1 OMI'의 임상 2상 대상자 등록 및 첫번째 대상자 투여 완료 | AdCLD-CoV19-1 OMI |
| 2022년 12월 | 국내외 높은 항체 보유율 및 백신 접종율로 대상자 모집의 어려움과 추가접종 백신 대비 경제성을 고려하여 'AdCLD-CoV19-1'의 임상 2b상의 조기종료를 보고함 | AdCLD-CoV19-1 |
| 2023년 01월 | 영장류 공격접종시험에서 'AdCLD-CoV19-1 OMI' 단회 투여로 우수한 방어 효능, T세포 반응, 오미크론 특이적 중화항체 반응 유도능 확인 | AdCLD-CoV19-1 OMI |
| 2023년 02월 | 'AdCLD-CoV19-1 OMI'의 임상 2상 대상자 300명 투여 완료 | AdCLD-CoV19-1 OMI |
| 2023년 03월 | 'AdCLD-CoV19-1 OMI'의 임상 1/2상 중간분석을 위한 검체 확보 | AdCLD-CoV19-1 OMI |
| 마우스 면역원성 시험에서 자체 개발한 다가백신 후보물질의 여러 변이에 대한 광범위한 방어효과 확인 | 다가백신 | |
| 2023년 05월 | 글로벌백신기술서도사업단의 2023년 제1차 신규지원 대상 국책과제 선정 (아데노바이러스 벡터 플랫폼 기반 COVID-19 변이에 대한 다가백신 개발) | 다가백신 |
| 'AdCLD-CoV19-1 OMI'의 임상 3상 시험계획(IND) 신청 | AdCLD-CoV19-1 OMI | |
| 2023년 07월 | 'AdCLD-CoV19-1 OMI'의 임상 1/2상 Top-line 결과를 발표함 | AdCLD-CoV19-1 OMI |
| 2024년 03월 | 'AdCLD-CoV19-1 OMI'의 임상 3상 해외 시험계획(IND) 승인(필리핀, 베트남) | AdCLD-CoV19-1 OMI |
| 2024년 05월 | 'AdCLD-CoV19-1 OMI'의 임상 3상 시험 코호트A 투여 완료 | AdCLD-CoV19-1 OMI |
|
출처) 당사 제시 |
| [당사 코로나19 백신/개발 현황 상세내역] |
| 구분 | 진행 단계 | 내용 |
| 기초접종 코로나19 예방백신 (AdCLD-CoV19/19-1) |
임상 1/2a상 (Part A & B) |
- 고려대학교 구로병원에서 임상 1상 대상자 30명에 'AdCLD-CoV19' 저용량, 중용량, 고용량별 각 1회 투여 |
| - 'AdCLD-CoV19'의 안전성 및 면역원성 확인 후 '데이터 안전성 모니터링 위원회(DSMB)'의 권고에 따라 중용량, 고용량 2가지 용량을 설정하여 임상 2a상 개시 |
||
| - 임상 1/2a상 중간분석 결과를 통해 'AdCLD-CoV19'의 우수한 안전성 및 면역원성 (중화항체, 결합항체, T세포면역반응) 확인 | ||
| - 임상1/2a상 추적관찰 종료 후 결과보고서 작성 완료 | ||
| - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 이상반응 수집 | ||
| - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응 수집 | ||
| - 임상시험용 의약품 접종 후 12개월까지 발생한 중대한 이상반응 및 특별관심대상 이상반응 수집 | ||
| - 임상시험용 의약품 접종 후 SARS-CoV-2 중화항체의 항체양전율 확보 | ||
| - 임상시험용 의약품 접종 후 SARS-CoV-2 중화항체의 기하평균역가 확보 | ||
| - 임상시험용 의약품 접종 후 S 단백질 특이적 항체의 기하평균역가 확보 | ||
| - 임상시험용 의약품 접종 후 분석한 T 세포 면역반응 확보 | ||
| 임상 1상 (Part C) | - 고려대학교 구로병원 외 2개 기관에서 대상자 40명에 'AdCLD-CoV19-1' 저용량 및 고용량을 순차적으로 배정 및 투여 | |
| - 중간분석 결과를 통해 'AdCLD-CoV19-1'의 우수한 안전성 및 면역원성 (중화항체, 결합항체, T세포면역반응) 확인 | ||
| - 임상 1상 추적관찰 종료 후 결과보고서 작성 완료 | ||
| - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 이상반응 수집 | ||
| - 임상시험용 의약품 접종 후 7일 및 28일까지 발생한 예측되지 않은 이상반응 수집 | ||
| - 임상시험용 의약품 접종 후 12개월까지 발생한 중대한 이상반응 및 특별관심대상 이상반응 수집 | ||
| - 임상시험용 의약품 접종 후 분석한 T 세포 면역반응 확보 SARS-CoV-2 중화항체의 기하평균역가 및 항체양전율 확보 | ||
| - 임상시험용 의약품 접종 후 S 항원 결합항체의 기하평균역가 확보 | ||
| - 임상시험용 의약품 접종 후 분석한 T 세포 면역반응 확보 | ||
| 추가접종 코로나19 예방백신 (AdCLD-CoV19-1 OMI) |
임상 1/2상 | - 고려대학교 구로병원에서 임상 1상 대상자 20명에 'AdCLD-CoV19-1 OMI' 부스터샷 투여 |
| - 'AdCLD-CoV19-1 OMI'의 안전성 확인 후 데이터 안전성 모니터링 위원회(DSMB)의 권고에 따라 임상 2상 개시 (300명) | ||
| 임상3상 | - 질병관리청으로부터 'AdCLD-CoV19-1 OMI' 임상 3상 시험을 위한 대조백신을 무상으로 확보 | |
| - 고려대학교 구로병원을 포함한 국내 13개 임상시험 실시기관에서 투여 개시 | ||
| - 필리핀 FDA와 베트남MOH로부터 임상시험계획(IND) 승인 | ||
| - 면역원성과 안전성을 평가하는 코호트A (1,200명) 투여 완료 | ||
| - 안전성을 평가하는 코호트B(2,800명) 해외 투여를 위한 절차 진행 |
|
출처) 당사 제시 |
당사는 정부로부터의 보조금 이외에도 금번 주주배정 후 실권주 일반공모 유상증자를 통하여 유입되는 자금 중 일부를 사용하여, 코로나19 오미크론 백신 임상 3상 시험을 진행할 예정입니다. 세부적인 내용에 대해서는 본 증권신고서 제1부 모집 또는 매출에 관한 사항 - Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
당사는 2023년 05월 23일 COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND)을 신청하였으며, 그 내용은 다음과 같습니다.
| [투자판단관련주요경영사항(임상시험계획승인신청) (COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND) 신청)] |
| 1. 제목 | COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND) 신청 | |
| 2. 주요내용 | 1) 임상시험명칭 | 만 19세 이상 성인 자원자를 대상으로 COVID-19 예방 백신 AdCLD-CoV19-1 OMI 추가접종의 면역원성 및 안전성을 평가하기 위한 다국가, 다기관, 관찰자 눈가림, 무작위배정, 활성 대조 제 3상 임상시험 |
| 2) 임상시험단계 | 제3상 임상시험 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 국내외 | |
| 5) 임상시험실시기관 | 국내 및 해외 기관 | |
| 6) 대상질환 | SARS-CoV-2 Omicron variant에 의한 COVID-19 예방 | |
| 7) 신청일 | 2023-05-23 | |
| 8) 임상시험목적 | AdCLD-CoV19-1 OMI 추가접종의 면역원성 및 안전성 평가 | |
| 9) 임상시험방법 | 다기관, 관찰자 눈가림, 무작위배정, 활성 대조 제3상 임상시험으로 COVID-19 예방백신의 마지막 접종 완료 및/또는 COVID-19에 의한 격리 해제 후 최소 16주(112일) 이상 경과한 만 19세 이상 성인 자원자에게 AdCLD-CoV19-1 OMI 또는 대조약(화이자社의 코미나티 2주)을 투여하여 면역원성 및 안전성을 평가함 | |
| 10) 임상시험기간 | 임상시험심사위원회(IRB) 승인일로부터 18개월 (시험대상자 모집 속도에 따라 변경될 수 있음) |
|
| 11) 목표 시험대상자 수 | 4,000명 | |
| 3. 사실발생(확인)일 | 2023-05-23 | |
| 4. 기타 투자판단과 관련한 중요사항 | ||
| 1) 사실발생(확인)일 및 결정일은 식품의약품안전처(MFDS)에 임상시험 계획(IND)을 신청한 날짜입니다. 2) 대한민국 외 동남아시아 지역 등의 다국가에 임상시험 계획을 신청할 예정입니다. 3) 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정입니다. |
||
| ※ 관련공시 | - | |
| 출처) DART 전자공시시스템 |
당사는 2023년 07월 21일 COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND)을 승인 받았으며, 그 내용은 다음과 같습니다.
| [투자판단관련주요경영사항(임상시험계획승인신청) (COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND) 승인)] |
| 1. 제목 | COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND) 신청 | |
| 2. 주요내용 | 1) 임상시험명칭 | 만 19세 이상 성인 자원자를 대상으로 COVID-19 예방 백신 AdCLD-CoV19-1 OMI 추가접종의 면역원성 및 안전성을 평가하기 위한 다국가, 다기관, 관찰자 눈가림, 무작위배정, 활성 대조 제 3상 임상시험 |
| 2) 임상시험단계 | 제3상 임상시험 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 국내외 | |
| 5) 임상시험실시기관 | 국내 및 해외 기관 | |
| 6) 대상질환 | SARS-CoV-2 Omicron variant에 의한 COVID-19 예방 | |
| 7) 신청일 | 2023-05-23 | |
| 8) 승인일(결정일) | 2023-07-21 | |
| 9) 등록번호 | 100968 | |
| 10) 임상시험목적 | AdCLD-CoV19-1 OMI 또는 코미나티2주를 접종하고 면역원성 비열등성을 입증 | |
| 11) 임상시험방법 | 다국가, 다기관, 관찰자 눈가림, 무작위배정, 활성 대조 제3상 임상시험으로 SARS-Cov-2 백신 접종 완료 및 /또는 COVID-19 확진에 의한 격리 해제 후 최소 16주 이상 경과한 만 19세 이상 건강한 성인 자원자 4,000명을 모집하여 'AdCLD-CoV19-1 OMI' 또는 '코미나티2주'를 접종 후 면역원성 및 안정성 평가 | |
| 12) 1차 지표 | 중화항체가 및 혈청반응율 등의 확인을 통한 면역원성 평가 | |
| 13) 1차 지표 통계분석방법 | GMT, SRR non-inferiority | |
| 14) 임상시험기간 | 임상시험심사위원회(IRB) 승인일로부터 18개월 | |
| 15) 목표 시험대상자 수 | 4,000명 | |
| 16) 예상종료일 | 2025-03-01 | |
| 3. 사실발생(확인)일 | 2023-07-21 | |
| 4. 기타 투자판단과 관련한 중요사항 | ||
| 1) 상기 사실발생(확인)일은 한국 식품의약품안전처(MFDS)에 임상시험 계획(IND) 승인을 통보받은 날짜입니다. 2) 상기 임상시험기간 및 예상종료일은 임상시험 진행 상황에 따라 변동될 수 있습니다. 3) 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정입니다. |
||
| ※ 관련공시 | 2023-05-23 투자판단 관련 주요경영사항(임상시험 계획 승인신청)(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND) 신청) | |
| 출처) DART 전자공시시스템 |
당사는 상기와 같이 2023년 05월 23일 'AdCLD-CoV19-1 OMI'의 임상 3상 시험계획(IND)를 제출한 이후 2023년 07월 21일 시험계획(IND)을 승인 받았습니다. 당사는 현재 국내외 3개국(한국, 베트남, 필리핀)에서 임상 3상을 완료하였고, 현재 중간 분석 결과를 기다리고 있습니다. 임상 3상은 COVID-19 예방백신의 마지막 접종 완료 또는 COVID-19에 의한 격리해제 후 최소 16주 이상 경과한 만 19세 이상 자원자 4,000명을 대상으로 진행하였습니다. 코호트A는 1,200명을 대상으로 면역원성과 안전성을, 코호트B는 2,800명을 대상으로 안정성을 평가합니다. 국내는 2023년 11월 27일 첫 투여를 시작으로 2024년 04월 30일자로 코호트A에 대한 투여를 완료하였고, 코호트B의 대상자 모집과 투여는 2024년 11월 12일 완료하였습니다.
임상 3상에서 확보한 결과를 기반으로 조건부 품목허가를 받고, 신규 변이에 대응한 백신은 정부로부터 긴급사용승인을 받은 후 수의 계약 혹은 입찰 형태 계약으로 참여하여 확정이 된다면 정부 조달 시장에 공급이 가능할 것으로 예상하고 있습니다. 2024년도 예산안 위원회별 분석(보건복지위원회, 여성가족위원회)에 따르면 정부에서 질병관리청을 통해 확보한 코로나19 백신은 화이자, 모더나, 노바백스, 아스트라제네카 등이 있으며, 전부 외국 기업에서 제조하여 공급한 물량입니다. 현재 각 국가에서 65세 이상 고령층 및 면역 저하자에 대한 접종 연례화를 추진하고 있는 만큼 국내에서 연간 1,530만 도즈(현탁액주사제(1인 환자용))의 정부 조달이 필요할 것으로 예상되며, 전 세계적으로 약 27.8억 도즈 이상 수요가 있을 것으로 전망되고 있습니다. 당사는 자체 개발한 코로나19 백신의 경쟁력 있는 가격과 유통/보관의 편의성을 기반으로 국내뿐만 아니라 베트남, 필리핀 등 동남아시아 국가를 중점적으로 점유율을 확보할 계획입니다.
일반적으로 국가예방접종지원 사업에 필요한 백신 조달 방식은 희망수량 경쟁입찰 방식입니다. 최근 질병관리청이 2024~2025절기 인플루엔자 국가예방접종지원 사업에 필요한 백신 조달 계약을 마무리했는데, 희망수량 경쟁입찰 방식으로 조달계약 업체를 선정하였습니다. 희망수량 경쟁입찰 방식은 예정가격 기준 최저가격 입찰자 순으로 총 수요량에 도달할 때까지 입찰자를 낙찰자로 결정해 구매하는 방식으로, 경제성이 가장 중요한 입찰 방식입니다. 당사가 진입하려는 코로나19 백신 정부 조달 시장도 국가예방접종지원 사업이기 때문에 가격경쟁력이 중요할 것으로 판단됩니다.하지만 코로나19 백신에 대한 국가예방접종지원 사업이 인플루엔자 사업과 동일한 방식으로 진행되는 것은 확정되지 않았으며, 현재 질병관리청에서 어떠한 방식으로 국가예방접종지원 사업을 진행할지 논의 중에 있습니다.
다만, 본 증권신고서 "제1부.III.투자위험요소-1.사업위험-다.~라." 부분에 기재된 바와 같이, 전반적인 코로나 19 백신 시장의 성장성이 제한될 수 있고, 특히 당사가 임상 진행 중인 베트남, 필리핀의 정확한 시장 규모를 예측하는 것이 어려우므로 당사가 목표하는 시장이 당사의 예상보다 그 규모가 낮을 수 있습니다.
당사는 향후 코로나 19 환자 대상 임상 시험을 지속적으로 진행할 예정이나, 임상시험에 따른 지속적인 개발비 지출에도 불구하고 유의미한 임상 결과를 도출하지 못할 가능성도 존재합니다. 또한, 연구개발이 완료되어 시판되는 시점에서 코로나19 바이러스의 유행성이 멈출 경우 해당 백신에 대한 수익성이 발생하지 않을 가능성도 배제할 수는 없습니다. 타 경쟁사들이 우선적으로 백신 개발에 성공할 경우에도 당사의 수익성에 부정적인 영향을 미칠 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다.
그 외에도 최초 임상시험계획서 제출 당시 예상하지 못한 변수 등으로 추가적인 임상시험 승인이 늦어지거나, 환자 등록이 원활하지 않는 등 임상시험의 계획적인 진행에 차질이 발생할 수 있습니다. 이처럼 임상시험의 일정이 지연되는 경우에는 임상시험 비용이 예산을 초과하여 발생할 수 있고, 판매가 지연됨에 따라 매출 발생 또한 늦어질 수 있습니다. 만약 당사의 코로나19 백신 연구개발 및 임상시험이 실패할 경우 연구개발 및 임상시험에 투자한 비용은 회수가 어려워 재무 건전성에 부정적인 영향을 미칠 수 있으며, 임상 진행에 따른 추가적인 비용 역시 재무 건전성을 악화시킬 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
(2) 면역항암제
당사는 CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 면역항암치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용은 최소화된 의약품입니다. 기반기술은 면역항암의약품 중 하나인 세포기반 항암면역치료백신 기술로, 환자에서 유래한 자가 B세포 및 단구를 항원제시세포로 이용하며, 암항원과 면역증강제(α-galactosyl ceramide, α-GC)를 함유한 유전자 도입 세포치료제라 할 수 있습니다. 인체 내에서 항암 작용을 나타낼 수 있는 적응면역계와 선천면역계를 동시에 활성화하여 강력한 약효를 나타내는 것이 특징입니다. 즉, 적응면역계에서 주요 기능을 하는 세포독성T세포를 활성화하고 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계에서 주요 기능을 하는 자연살해세포와 자연살해T세포를 활성화하여 항암면역반응을 일으킵니다.
당사는 현재의 의학적, 기술적 한계로는 치료가 어려운 난치성 암 및 감염성 질환의 치료에 새로운 패러다임을 제시하는 면역치료백신 개발의 비전을 가지고 설립되었습니다. 면역항암 연구 분야의 탁월한 전문성과 원천기술의 독창성, 유효성, 확장성 및 사업성을 바탕으로 면역치료제 시장의 세계적인 선도 기업으로 거듭나고자 하며, 면역항암제 주요 파이프라인은 다음과 같습니다.
| [당사의 면역항암제 주요 파이프라인] |
|
파이프라인 |
주요 적응분야 |
개발단계 |
|
BVAC-C |
인유두종바이러스 16형 및 18형 암항원을 발현하는 모든 암 (예) 자궁경부암, 항문암, 성기암 등 |
[국내] 자궁경부암 |
| BVAC-E6E7 |
인유두종바이러스 16형 및 18형 암항원을 발현하는 모든 암 (예) 두경부암, 항문암, 성기암 등 |
[국내] 두경부암 임상 1/2a상 IND 승인 |
|
BVAC-B |
HER2/neu 암항원을 발현하는 모든 암 (예) 위암, 유방암 등 |
[국내] 위암 |
|
BVAC-P |
PAP 또는 PSMA 암항원을 발현하는 모든 암 (예) 전립선암, 뇌종양 등 |
[국내] 전립선암 |
|
BVAC-M |
MAGE-A3 또는 GP100 암항원을 발현하는 모든 암 (예) 흑색종, 폐암, 대장암, 췌장암 등 |
[국내] 흑색종 |
|
BVAC-Neo |
개인별로 특화된 암항원인 Neo-antigen이 발굴된 모든 암 |
다양한 고형암 |
| 출처) 당사 제시 |
① BVAC-C 개요
| ①구 분 | 바이오 신약 |
| ②적응증 | 인유두종바이러스 (HPV) 16형 및 18형 암항원 발현 모든 암종(자궁경부암, 두경부암, 항문암, 성기암 등) |
| ③작용기전 | BVAC-C는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화를 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| ④제품의특성 | BVAC-C 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 형태 측면에서 세계적으로 퍼스트-인-클라스 (First-in-class), 퍼스트-인-카인드 (First-in-kind) 의약품으로, 세계시장을 지배할 수 있는 잠재력을 가지고 있음. 임상 1/2a상에서 안전성과 경쟁제품 대비 우월한 예비유효성을 확인하였음 |
| ⑤진행경과 | - 2016년 04월 임상 1상 시험 한국 MFDS 승인 |
| - 2016년 08월 임상 1상 시험 개시 | |
| - 2017년 12월 임상 2a상 시험 한국 MFDS 승인 | |
| - 2018년 06월 임상 1상 시험 종료 | |
| - 2018년 06월 임상 2a상 시험 개시 | |
| - 2020년 임상 2a상 시험 투여 완료 | |
| - 2020년 08월 병용투여 연구자 임상시험 한국 MFDS 승인 | |
| - 2021년 11월 병용투여 연구자 임상시험 개시 | |
| - 2023년 09월 임상 2a상 시험 결과 발표 | |
| ⑥향후계획 | BVAC-C는 현재 면역관문저해제와 병용투여 임상 2a상 연구자주도 임상시험을 진행 중임. 자궁경부암을 적응증으로 조건부허가를 신청할 계획임. 이를 위해 경기도 성남시 SK V1 TOWER 에 상업용 GMP 생산시설을 완공하였음. |
| ⑦경쟁제품 | 인유두종바이러스 유래 암종을 적응증으로 하는 항암면역치료백신은 상품화된 제품은 없음. 현재 네덜란드 ISA Pharmaceuticals의 HPV16 펩타이드 백신 ISA101b, 미국 PDS Biotech의 HPV16 펩타이드 백신 PDS0101, 노르웨이 Nykode Therapeutics의 HPV16 DNA 백신 VB10.16 등 이 화학적 항암제 또는 면역관문차단제와 병용요법으로 임상 2상을 진행 중임. |
| ⑧관련논문등 | - Phase I Study of a B Cell-Based and Monocyte-Based Immunotherapeutic Vaccine, BVAC-C in Human Papillomavirus Type 16- or 18-Positive Recurrent Cervical Cancer. J Clin Med.2020 Jan 5;9(1) - Activation of NKT cells in an anti-PD-1-resistant tumor model enhances anti-tumor immunity by reinvigorating exhausted CD8 T cells (IF 9.28) Cancer Res. 2018 78(18):5315 - IL-21-mediated reversal of NK cell exhaustion facilitates anti-tumour immunity in MHC class I-deficient tumours (IF 11.47) Nature Communications 2017. 8:15776 |
| ⑨시장규모 | 당사가 영위하는 면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-C의 경우, 현재는 자궁경부암에 대한 임상을 진행 중이나 향후 성기암, 항문암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| ⑩기타사항 | 2018년 ESMO 진행사항 발표, 2020년 AACR 초록 채택 및 온라인 구두 발표 2021년 ASCO 구두발표 2024년 ASCO 병용투여 연구자주도 임상시험 중간결과 구두 발표 2025년 미국부인종양학회(SGO)서 연구자주도 임상시험 중간결과 업데이트내용 구두 발표 |
| 출처) 당사 제시, Global Oncology Trends 2024, IQVIA(2024.05) 및 The Business Research Company(2025.01) |
한편, 당사는 2014년 12월 20일 BVAC-C 파이프라인과 관련된 기술 및 특허를 미국에서 실시할 수 있는 독점 배타적 전용 실시권에 대하여 미국의 NeoImmuneTech사와 아래와 같이 라이선스아웃 계약을 체결한 바 있습니다. NeoImmuneTech 사에서 수행 중인 임상 시험 숫자가 증가하던 시기에 인력 및 자금 사정을 고려해 단기적으로 BVAC-C의 신속한 임상 수행이 어려울 것으로 판단되며 NeoImmunTech 사에서 라이선스 반납 의사를 피력함에 따라 상기 계약은 2021년 9월 23일부로 해지되었습니다.(주1), (주2)
| (주1) | 해당 라이선스아웃 계약이 해지된 사실은 당사의 사업보고서(2021.12) "II.사업의 내용-6. 주요계약 및 연구개발활동" 부분에 공시되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
| (주2) | 해당 라이선스아웃 계약의 체결 및 해지 관련 상세한 내용은 본 증권신고서 "제1부.III.투자위험요소-2.사업위험-자" 부분을 참고하여 주시기 바랍니다. |
② BVAC-E6E7
| ①구 분 | 바이오 신약 |
| ②적응증 | 인유두종바이러스 (HPV) 16형 및 18형 암항원 발현 모든 암종(두경부암, 항문암, 성기암 등) |
| ③작용기전 | BVAC-E6E7은 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화를 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| ④제품의특성 | BVAC-E6E7 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히, BVAC-E6E7은 대량생산에 용이하도록 개선된 아데노바이러스 벡터로 구성되어 우수한 항암효과를 유지하며 원료 바이러스 생산 비용 절감이 가능. |
| ⑤진행경과 | - 2022년 1분기 비임상 개발 시작 - 2023년 제1/2a상 임상시험계획(IND) 신청 - 2024년 제1/2a상 임상시험계획(IND) 승인 |
| ⑥향후계획 | BVAC-E6E7은 보고서 작성기준일 현재 국내 1/2a상 시험계획을 식품의약품안전처에 제출하였으며, 식약처 IND 승인 후 국내에서 임상 개발에 주력할 계획임. |
| ⑦경쟁제품 | 두경부암 대상 면역 치료제 개발이 단독 또는 병용투여 요법으로 국내외에서 진행 중임. 제넥신이 두경부 편평세포암 DNA백신 GX-188E, 면역항암제로 개발 중인 GX-I7과 BMS·오노의 면역항암제인 옵디보의 삼중병용요법 연구자 주도 임상 2상을 진행 중임. |
| ⑧관련논문등 | BVAC-E6E7은 현재 비임상 개발 중으로 논문 및 학회 발표 이력이 없음 |
| ⑨시장규모 | 당사가 영위하는 면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-E6E7의 경우, 현재는 두경부암에 대한 임상 진행을 계획 중이나 향후 성기암, 항문암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| ⑩기타사항 | - |
| 출처) 당사 제시, Global Oncology Trends 2024, IQVIA(2024.05) 및 The Business Research Company(2025.01) |
③ BVAC-B
| ①구 분 | 바이오 신약 |
| ②적응증 | HER2/neu 암항원 발현 모든 암종 (위암, 유방암, 췌장암, 폐암, 난소암 등) |
| ③작용기전 | BVAC-B는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| ④제품의특성 | BVAC-B 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 시장성이 매우 큰 위암, 유방암 등을 적응증으로 개발 중으로 개발 성공 시 매출 창출이 용이함. |
| ⑤진행경과 | - 2018년 1월 임상 1상 시험 한국 MFDS 승인 |
| - 2018년 2월 임상 1상 시험 개시 | |
| - 2020년 1월 임상 1 시험 종료 | |
| ⑥향후계획 | BVAC-B는 보고서 작성기준일 현재 임상 1상 시험 결과보고서 작성을 완료하고, 2a상 시험의 적응증을 검토 중에 있음. 식약처에 임상 2상 시험 계획 승인을 신청할 계획임. |
| ⑦경쟁제품 | BVAC-B에 사용한 HER2/neu 암항원을 타겟하는 항암면역치료백신으로 판매 중인 제품은 없으며, Zymeworks 사에서 유방암 대상 임상 2상을 진행 중임. Imugene 사의 HER-Vaxx가 위암 대상 임상 2상 개발 중임. |
| ⑧관련논문등 | - A combination of chemoimmunotherapies can efficiently break self-tolerance and induce antitumor immunity in a tolerogenic murine tumor model. (IF 9.28) Cancer Res. 2007, 67(15), 7477-86. - alpha-Galactosylceramide-loaded, antigen-expressing B cells prime a wide spectrum of antitumor immunity. (IF 5.0) Int J Cancer. 2008, 122(12), 2774-83 - CD40-targeted recombinant adenovirus significantly enhances the efficacy of antitumor vaccines based on dendritic cells and B cells. (IF 3.62) Hum Gene Thera.2010 21(12),1697-706. - Enhanced antitumor immunotherapeutic effect of B cell based vaccine transduced with modified adenoviral vector containing type 35 fiber structures. (IF 4.32) Gene Therapy. 2014, 21(1):106-14. - Enhanced Immunogenicity of Engineered HER2 Antigens Potentiates Antitumor Immune Responses. Vaccines (Basel). 2020 Jul 22;8(3):403. |
| ⑨시장규모 | 당사가 영위하는 면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-B의 경우, 현재는 위암에 대한 임상을 진행 중이나 향후 유방암, 췌장암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| ⑩기타사항 | 2020년 ASCO 초록 채택 및 발표 |
| 출처) 당사 제시, Global Oncology Trends 2024, IQVIA(2024.05) 및 The Business Research Company(2025.01) |
④ BVAC-P
| ①구 분 | 바이오 신약 |
| ②적응증 | PAP 또는 PSMA 암항원 발현 모든 암종 (전립선암, 뇌종양 등) |
| ③작용기전 | BVAC-P는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| ④제품의특성 | BVAC-P 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히 PAP와 PSMA를 기반으로 융합형 암항원을 제작하여 사용하여 약효와 시장성을 확보할 수 있으며, 융합형 암항원은 특허를 출원할 계획임. |
| ⑤진행경과 | - 2017년 1분기 비임상개발 시작 |
| - 2019년 03월 식약처 임상 1상 시험 계획 신청 | |
| - 2020년 3월 임상 1상 시험 한국 MFDS 승인 | |
| ⑥향후계획 | 국내 임상 1상을 개시할 계획임 |
| ⑦경쟁제품 | 전립선암 치료백신으로 미국에 시판 중인 수지상세포백신 Provenge가 있으며, 암세포주를 이용한 GVAX (BioSante 사)가 현재 임상 2상 개발 중임. Ayala가Advaxis사 인수 후 전립선암 대상 치료백신을 임상 1상 시험 중임. |
| ⑧관련논문등 | BVAC-P는 논문 및 학회 발표 이력이 없음 |
| ⑨시장규모 | 당사가 영위하는 면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-P의 경우, 현재는 전립선암에 대한 전임상을 진행 중이나 향후 뇌종양 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| ⑩기타사항 | - |
| 출처) 당사 제시, Global Oncology Trends 2024, IQVIA(2024.05) 및 The Business Research Company(2025.01) |
⑤ BVAC-M
| ①구 분 | 바이오 신약 |
| ②적응증 | MAGE-A3 또는 GP100 암항원 발현 모든 암종 (흑색종, 폐암, 대장암, 췌장암 등) |
| ③작용기전 | BVAC-M은 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| ④제품의특성 | BVAC-M 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히 GP100와 MAGE-A3를 동시에 타깃할 수 있어 약효와 시장성을 확보할 수 있는 점이 큰 장점임. |
| ⑤진행경과 | - 2016년 4분기 비임상개발 시작 |
| - 임상 1상 시험 계획 신청 준비 중 | |
| ⑥향후계획 | BVAC-M의 임상 1상 시험계획을 신청할 계획임 |
| ⑦경쟁제품 | 흑색종 대상 면역 치료제 개발이 국내외에서 진행 중이며, GP100을 발현하는 포도막 흑색종 타겟의 면역치료제인 Tebentafusp (상품명 Kimmtrak)가 2022년 미국 FDA 승인을 받음. |
| ⑧관련논문등 | BVAC-M은 현재 비임상개발 중으로 논문 및 학회 발표 이력은 없음 |
| ⑨시장규모 | 당사가 영위하는 면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC- M의 경우, 현재는 흑색종에 대한 전임상을 진행 중이나 향후 폐암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| ⑩기타사항 | - |
| 출처) 당사 제시, Global Oncology Trends 2024, IQVIA(2024.05) 및 The Business Research Company(2025.01) |
⑥ BVAC-Neo
| ①구 분 | 바이오 신약 |
| ②적응증 | Neo-antigen이 발굴된 모든 암종 |
| ③작용기전 | BVAC-Neo는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| ④제품의특성 | BVAC-Neo 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 세포치료제 형태임. 완전개인맞춤형 제품으로 환자 자신의 암세포에만 존재하는 neo-antigen을 게놈 서열 분석으로 발굴하고, 이 중 항원성이 있는 epitope 부위를 예측 및 검증하여 완제품의 항원으로 사용하는 제품임. 항원의 특이성과 항원성이 매우 강하여 암 완치에 도전할 수 있으며, 치료 및 수술 후 재발 방지 목적으로 개발할 계획임. 또한, neo-antigen이 발견되는 모든 암종에 적용이 가능하며, 완전개인형 neo-angtigen과 더불어 암환자에서 빈번히 발생하는 돌연변이를 기반으로 한 shared neo-antigen을 활용하는 전략도 가능함. |
| ⑤진행경과 | - 2006년 BVAC-NEO의 기본 개념을 동물모델에서 증명 |
| - 독성시험, 생산공정 등 비임상개발 진행 중 | |
| ⑥향후계획 | 비임상 개발 중이며, LG화학에 기술이전을 완료하고 양사 공동으로 임상에 진입할 계획임 |
| ⑦경쟁제품 | 완전 개인맞춤형 항암치료 백신은 현재까지 상용화된 제품은 없으며, 미국의 Moderna과 Gritstone Bio, 독일의 BioNTech과 Curevac 사가 mRNA나 펩타이드 기반 기술을 활용한 파이프라인을 선두주자로 개발하여, 임상 1상 또는 2상 시험 중임. 이러한 파이프라인들은 T 세포 면역 반응은 유도하나 NK 세포나 NKT 세포와 같은 선천성 면역 반응은 유도하기 어려움. |
| ⑧관련논문등 | CD1d-restricted T cells license B cells to generate long-lasting cytotoxic antitumor immunity in vivo. (IF 9.28) Cancer Res. 2006, 66(13), 6843-50 |
| ⑨시장규모 | 당사가 영위하는 면역치료백신에 대하여 외부기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-Neo의 경우 Neo-antigen이 발굴된 모든 암종으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| ⑩기타사항 | - |
| 출처) 당사 제시, Global Oncology Trends 2024, IQVIA(2024.05) 및 The Business Research Company(2025.01) |
당사는 자체 원천 기술 CeliVax를 활용한 상기의 BVAC 파이프라인 연구개발 및 임상시험 진입을 계획하고 있으며, 임상 종료 후 허가 승인을 얻고자 합니다. 이 외에도 당사는 국제적 학회 및 컨퍼런스 참여를 통해 네트워크를 확장하고 국내외 제약·바이오기업들과 기술 이전을 진행할 계획입니다. 단, 본 증권신고서 "제1부.III.투자위험요소-1.사업위험-아.~자."에 기재된 바와 같이 기술이전에 실패할 수 있는 점을 유의하여 주시기 바랍니다. 또한, 미국의 NeoImmuneTech사에 BVAC-C 파이프라인과 관련된 기술 및 특허에 대한 라이선스아웃 계약을 했으나, 2021년 9월 23일부로 해지되었으며, LG화학에 BVAC-Neo 파이프라인에 대한 기술이전 계약을 맺었으나 마일스톤을 수취할만큼의 성과가 없는 점 등 기술이전 계약을 맺은 건은 2건이며, 이마저 1건은 중도해지된 상태이고, 나머지 1건도 현재까지 진전이 더딘 상황입니다. 이처럼 당사의 자체 원천 기술 CeliVax를 활용한 BVAC 파이프라인의 실제 대외적인 성과는 미미한 편으로, 이는 국내외 바이오 기업 및 해당 시장에서는 BVAC 파이프라인의 경쟁력 및 시장성 등을 그다지 높게 평가하지 않음을 의미할 수 있습니다.
종합적으로, 신약개발은 시간과 노력에 비해 성공확률이 낮기 때문에 높은 위험 부담이 있습니다. 당사의 신약개발 물질의 핵심적 작용기전이 입증되지 않거나 심각한 부작용이 있을 경우 추가적인 시간과 비용이 소요될 수 있으며, 이에 따라 전반적인 임상 연구 및 제품화에도 부정적인 영향을 미칠 수 있습니다. 이 밖에 당사의 신약개발 일정이 지연된다면 제품화까지 예상 대비 기간이 더 소요될 수 있으며, 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구가 지연 또는 중단되고, 사용된 연구개발 비용은 회수하기가 어렵습니다.
당사는 코스닥시장 상장 신약 바이오 제약회사로서 제한된 연구개발비 내에서 실질적인 수익 창출 기여도를 높이기 위한 의약품 개발에 집중하고 있습니다. 그럼에도 불구하고 당사의 임상단계를 거치고 있는 파이프라인은 추가적인 연구개발이 필요하며 이에 따라, 향후 연구개발활동이 확대될 것으로 예상됩니다. 하지만, 현재까지 연구개발에 대한 성과가 큰 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 다만, 이같은 지속적인 영업적자를 보완하기 위함과 동시에 신약 개발과의 시너지 효과를 목적으로 당사는 2020년 11월 30일 백신&세포유전자치료제 GMP센터를 완공하였으며, 당사 제품의 임상 단계에 필요한 생산과 향후 GMP 인증 후 시판 예정인 제품의 생산능력을 보유하고 있습니다. 또한 첨단 바이오의약품 위탁생산을 목적으로 2022년 09월 첫 계약을 체결하고 본격적인 바이오의약품의 위탁생산(CMO) 및 위탁개발생산(CDMO) 사업을 전개하고 있습니다. 이와 관련된 내용은 본 증권신고서 제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 1. 사업위험 - 사. CMO 사업 관련 위험을 참고하시기 바랍니다. .
이와 같이 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 당사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실이 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[사. CMO 사업 관련 위험] |
당사는 2020년 11월 30일 백신&세포유전자치료제 GMP센터를 완공하였으며, 당사 제품의 임상 단계에 필요한 생산과 향후 GMP 인증 후 시판 예정인 제품의 생산능력을 보유하고 있습니다. 또한 첨단 바이오의약품 위탁생산을 목적으로 2022년 9월 첫 계약을 체결하고 본격적인 바이오의약품의 위탁생산(CMO) 및 위탁개발생산(CDMO) 사업을 전개하고 있으며, CMO 및 CDMO 용역매출은 2022년 연간 기준 매출액의 100%를 차지하고 있습니다. 첨단 바이오의약품 위탁생산 사업 확장을 위해 전시 및 컨퍼런스 참가 등을 통하여 당사의 최신장비, 시설, 우수한 인재 및 서비스에 대한 정보를 제공하고 있습니다.
당사는 CMO 및 CDMO 사업에 진출하기 위해서 2020년 11월 경기도 성남시 GMP센터를 완공하였고 이후 2021년 생물학적제재 등에 해당하는 의약품 제조업, 인체세포등 관리업 및 첨단바이오의약품 제조업에 대한 허가를 획득하였습니다. 당사의 GMP 시설은 크게 벡터 GMP 플랜트(원료 의약품 생산 설비)와 세포유전자치료제 GMP 플랜트(완제 의약품 생산설비) 2개로 나누어 운영이 가능합니다.
| [성남 GMP센터 연혁] |
| 일자 | 주요 내용 |
| 2019년 08월 | 성남 SK V1 TOWER 계약(6층) |
| 2020년 02월 | 성남 SK V1 TOWER 계약(4층) |
| 2020년 11월 | 성남 GMP센터 완공 |
| 2021년 01월 | 의약품 제조업 허가 (생물학적 제제 등) |
| 2021년 08월 | 인체세포 등 관리업 허가 |
| 2021년 12월 | 첨단바이오의약품 제조업 허가 |
| 2022년 08월 | 임상시험용의약품 제조 GMP 적합 승인 (BVAC-C, COVID-19 백신) |
| 출처) 당사 제시 |
이를 통해 당사는 세포치료제(BVAC-C DP) 기준 년간 최대 1,000 1lot을 생산할 수 있게 되었으며, 식품의약품안전처(MFDS) 및 PIC/S, 첨단바이오의약품(ATMP) 가이드라인에 적합하게 설계 및 구성됨은 물론 높은 품질의 제품생산을 위하여 QMS 품질시스템을 도입하였습니다.
| [GMP 공정] |
 |
|
gmp 공정 |
| 출처) 당사 홈페이지 |
또한, 2022년 08월에는 당사의 항암면역치료제 BVAC-C 임상시험용 의약품이 식품의약품안전처로부터 제조소 변경을 승인받았습니다. 이를 통해 당사는 1차 화학요법에 실패한 자궁경부암 환자를 대상으로 BVAC-C와 글로벌 제약사의 면역관문억제제(성분명 '더발루맙')의 병용투여 연구자 주도 임상시험에 대한 BVAC-C 임상시험용 의약품 제조소를 외부 세포치료제 GMP센터에서 당사의 자체 GMP센터로 변경하여 코로나19 백신 'AdCLD-CoV19-1 OMI' 임상시험용 의약품에 이어 항암면역치료제 BVAC-C 임상시험용 의약품 생산시설도 GMP 적합 승인을 획득하였습니다. 당사 GMP 센터의 생산 능력은 다음과 같습니다.
| [당사 GMP 센터 생산 능력 현황] |
| 분류 | 생산규모 | 생산규모근거 | 비고 | ||
| 대분류 | 소분류 | 연간 | 단위 | ||
| 6F | 세포유전차치료제 | 736 | Lot | - 산출기준: Suite 3개 가동을 기준으로 BVAC DP 공정기간을 반영 - 산출기준: Suite 1개 가동을 기준으로 CAR-T(CMO) 공정기간을 반영 |
DP 기준 |
| Vial production | 1,080,000 | vial | - 산출기준: 1,000 x 6시간 x 5회 x 40주 x 90% | - | |
| 4F | Viral Vector | 24 | Lot | - 산출기준: Suite 2개 가동을 기준으로 Vector DS 공정시간을 반영 | DS 기준 |
| 출처) 당사 정기보고서 |
| 주1) Suite : 독립적으로 생산이 가능하도록 분리된 생산 제조소 단위. 1 Suite = 단일 품목의 제품을 생산할 수 있도록 독립적으로 분리되어 운영됩니다. |
| 주2) DP : 완제의약품 (Drug product : 환자에게 투여되는 완제의약품을 의미함.) |
|
주3) Vector DS : 벡터 원료 의약품 (Drug substance : 원료의약품 = 완제의약품을 만드는 원료) |
|
주4) 식약처 허가 자료 제출시 DS 파트와 DP 파트로 구분하여 허가자료를 작성하며 허가를 DS와 DP로 받게 됩니다. 따라서 DP는 완제의약품의 통상적인 지칭을 의미합니다. |
| 주5) Lot : 동일한 제조공정으로 제조되어 균질성을 가지는 의약품의 일정한 분량 |
| 주6) Vial : 유리 바이알 1개를 의미합니다. |
당사는 바이러스 벡터와 세포유전자치료제 생산 시설 모두 높은 수준의 의약품 제조 및 품질 관리 역량을 확보하였음을 인정받음은 물론, 그동안 외부 생산에 의존하던 항암면역치료제 BVAC-C 임상시험용 의약품을 자체 생산하게 됨으로써 생산비용의 절감과 함께 상업화시 추가적인 수익성도 확보하고, 생산 효율성 및 임상시험과의 시너지를 극대화 할 수 있는 시스템을 구축하였습니다.
이를 통해 당사는 2023년 03월 이노베이션바이오의 이중표적 CAR-T 세포치료제 'IBC101'의 임상 1/2a상 임상의약품 GMP 생산과 품질관리 및 출하 등의 업무와 관련하여 4,888백만원 규모의 CMO 계약을 체결하였습니다. 2024년 01월 11일자로 식품의약안전처로부터 IND 승인을 받았고, 2024년 8월 IRB 심사가 완료되었습니다.
| [당사 CMO/CDMO 수주 현황] |
| (단위: 백만원) |
| 품목 | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
| 세포유전자치료제 | 2023.03.16 | (주) | - | 4,888 | - | 312 | - | 4,576 |
| 합 계 | - | 4,888 | - | 312 | - | 4,576 | ||
| 출처) 당사 정기보고서 |
| 주) 수주일자는 본 계약을 체결한 일자이며, 납기는 임상 2a상 최초 IRB 승인일로부터 18개월입니다. |
또한, 당사는 2019년 상장 시 파이프라인의 자체생산 및 CMO 사업 확대를 위해 제넥신 컨소시엄의 구성원으로 마곡(D9-1) 위치에 GMP센터를 구축할 계획을 가지고 있었으나, 지리적으로 성남에 GMP센터를 구축하는 것이 유리하다는 판단 하에 2020년 성남 GMP센터를 구축하였습니다.
구체적으로 당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
특히, 당사가 독자적으로 연구중인 셀리벡스 플랫폼등은 환자에게 분리된 세포를 신속하게 원하는 시간에 신속히 제조를 해야하는 특징을 가지고 있으나 자체 GMP 시설을 운영하지 않으면 원하는 시간에 생산할 수 없습니다. 2022년 이전에는 타 회사 CDMO를 활용하였으나, 스케줄링 등이 원활하지 않아 임상속도 등에 어려움이 많았습니다. 게다가, 당사의 품목인 셀리벡스 플랫폼은 유전자 치료제와 세포 치료제 두 분야를 이해하고 전문적으로 다루어야 가능한 특성을 가지고 있으며, 대부분 세포 치료제 기반인 완제의약품(Drug product)는 한국에서 연구하거나 제조 할 수 있는 업체는 많으나 유전자 치료제 기반인 원료의약품(Drug substract)인 벡터를 직접 연구하고 제조할 수 있는 업체는 상대적으로 드문 상황입니다. 이러한 신속성 및 전문성을 갖춘 당사의 GMP 센터가 대형병원과 가까운 유리한 위치에 가용한 공간을 만들어 두어 당사 자체 파이프라인 뿐만 아니라 CDMO 사업을 통해 매출을 발생시키고 위해 노력하고 있습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
당사는 마곡사옥이 완공되면 연구개발시설 및 인원의 집중을 계획하고 있으나, 성남GMP에 연구시설을 배제하려는 계획은 아닙니다. 마곡에 연구개발시설을 집중하되, 성남GMP에 연구개발시설을 이원화하여 운영할 계획입니다. 당사의 연구소는 기초연구를 담당하는 신약탐색팀, 중개연구팀이 있으며, 기초연구와 공정연구를 담당하는 벡터공정팀, 완제공정팀이 있습니다. 또한, 성남은 국내 빅5 대형병원에서 약20km 거리에 위치하여 암환자의 치료 및 맞춤형 백신제조에 이점을 가지고 있습니다. 마곡의 연구를 중심으로 성남GMP에서도 관련 연구를 진행하는 이원화를 통해 연구개발에 집중할 계획입니다.
하지만 당사의 CMO 매출은 2022년도 480백만원, 2024년도 358백만원으로 총 838백만원이 발생하였으나, 이는 기대에 미치지 못하는 수치입니다. 또한 현재 대부분의 GMP 시설 장비는 유휴설비로 판단되며, 추후 충분한 CMO 매출이 발생하지 못하면 매출 없이 감가상각비만 증가하는 등 당사의 재무 상황이 악화될 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
당사의 CeliVax 기술은 세포 배양 과정이 필요하지 않음으로 인해 1일 제조공정의 신속성에 기반하여, 병원에 입원한 상황에서 환자의 혈액을 채혈하고 당사의 GMP센터로 이동하여 제품을 생산하고 품질검사 등을 거쳐 다시 입원한 환자에게 이송하여 투여하는 것이 경쟁력입니다. 국내의 암환자 대다수는 국내 빅5 병원에 내원을 주로 하고 있으며, 성남 GMP센터는 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원 등과 마곡 지구에 비해 상대적으로 가까운 거리에 위치하고 있습니다. 이처럼 다수 상급병원과의 거리가 짧은 것이 환자에게 혈액을 채취하고 다시 투여하는 과정에 있어, 이는 당사의 Celivax 기술의 경쟁력을 더욱 더 강화할 수 있는 지리적 이점으로 판단하였습니다.
이에 아래와 같이 2019년 상장 시 마곡 GMP 건물을 위해 모집한 자금은 성남 GMP센터 구축을 위해 활용되었으며, 마곡은 연구거점 일원화를 위한 기업부설연구소와 사무공간 활용 목적의 사옥으로 용도를 변경하였습니다.
| [상장 당시 GMP센터 구축 계획] |
| (단위: 천원) |
|
구분 |
내 역 |
2019E |
2020E |
2021E |
계 |
|
시설자금 |
마곡 GMP 건물 | 3,000,000 | 3,000,000 | 4,000,000 | 10,000,000 |
| 마곡 GMP 기계장치 | - | - | 4,000,000 | 4,000,000 | |
|
합계 |
3,000,000 | 3,000,000 | 8,000,000 | 14,000,000 | |
| 출처) 당사 증권신고서(지분증권)-2019.02.01 |
그러나, 건축설계와 착공준비 등이 진행되고 있음에도 레고랜드 사태에 따른 금융불안 요소와 자재비 인건비 등의 건설비 상승요소 등의 사유로 구축이 지연되고 있습니다. 현재 마곡 신사옥은 2023년 07월부터 건축공사를 본격적으로 진행하고 있어 2026년 03월 준공 뒤 2026년 04월에 입주할 예정입니다. (주1)
| (주1) | 마곡 신사옥 공사와 관련된 상세한 내용 및 기부채납과 관련하여 당사가 진행 중인 소송 현황은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-마" 부분 및 본 증권신고서 "제2부.X.그 밖에 투자자 보호를 위하여 필요한 사항-2.우발부채 등에 관한 사항" 부분을 참조하여 주시기 바랍니다. |
구체적으로 당사는 2019년 상장 전 마곡토지를 매입하였습니다. 당사의 제품특성상 임대하여 사용할 수 있는 공간을 확보하는 것에 어려움이 있었으며, 마곡GMP센터 설립 및 연구개발, 본사의 기능을 집중하기 위해 마곡 사옥 건설을 추진하게 되었습니다. 다만, 앞서 언급한 바와 같이 마곡에 상업용GMP센터를 설립에 규제가 있었으며, 마곡보다 성남이 지리적으로 상업화에 이점이 있었습니다. 마곡 사옥은 PF를 통해 건설 중에 있어, 완공 전 회사 자금 유출 및 부담이 적다고 판단하고 있습니다. 마곡 사옥은 완공 이후 매년 32억원을 10년간 분할 상환하는 조건으로 PF를 통해 건설하고 있어, 코로나백신 상업화를 통해 PF대출금을 상환할 예정입니다.
다만 코로나백신 상업화가 되지 않을 경우 당사는 유동성이 부족하여 신규 자금 조달이 이루어지지 않는다면, PF 대출금 상환이 어려울 수 있습니다. CMO 매출 및 이커머스 매출 분야에서 양(+)의 현금흐름이 발생하거나, 또는 Celivax 기술이전 등이 이루어져야 당사의 자체 자금으로 상환이 가능할 것으로 예상되나, 아직까지도 CMO 및 이커머스 분야에서 현금흐름 창출능력이 부족한 상태이며, 기술이전 가능성은 예측하기 어렵습니다. 결국 당사의 다양한 방면의 현금 확보 노력에도 불구하고, 현 시점에서 코로나백신 상업화에 실패하거나, 장기간 지연될 경우에는 당사는 향후 PF 대출금 상환 능력을 보유하기 어려울 수 있습니다. 따라서 신규 자금조달 등 지속적 투자 유치를 받는 것이 당사와 같이 실적이 부족하고, 연구개발에 비용을 쓰고 있는 기업들의 유일한 방안이라고 생각되는 것이 현실입니다. 따라서 당사는 PF 상환에 차질이 없도록 신규 투자 유치 활동에 보다 노력하려고 합니다. 신규 투자 유치마저 불가능하다면 당사는 심각한 유동성 위기에 처할 수 있음을 투자자 여러분들께서는 다시 한번 유의하여 주시기 바랍니다.
한편, CMO 및 CDMO 사업은 바이오의약품이 제약 산업의 신성장 동력으로 부상하면서 주요 제약사들의 수요가 빠르게 증가하고 있습니다. 과거에는 기술 유출 등의 문제로 제약사들이 자체 생산능력 확보를 통한 생산을 선호하였으나, 최근에는 다양한 요인에 의해 자체 생산능력을 확보하는 전략보다는 위탁생산업체(CMO)의 생산능력을 이용하는 이점이 커짐에 따라 위탁생산업체에 생산을 아웃소싱하는 사례가 빠르게 증가하고 있습니다.
이에 따라 의약품 생산시장 내 CMO 생산비중은 향후에도 확대될 것으로 예상되고 있습니다. Frost&Sullivan에 의하면, 바이오의약품을 위탁생산하는 CMO 사업 및 세포주개발, 공정, 제형, 분석법 등 세포주 개발~초기 임상까지 개발서비스를 제공하는 CDO사업을 모두 포괄하는 바이오 CDMO 시장의 규모는 2023년 기준 197억 달러에서 향후 5년간 연평균 14.3% 성장해 2029년 439억불 규모로 성장할 것으로 전망됩니다.
| [바이오 의약품 CDMO 시장규모 전망] |
 |
|
bio-cdmo market, revenue forecast, global, 2021-2029 |
| 출처) 글로벌 바이오의약품 CDMO 시장현황 및 전망, 한국바이오협회(2024.07.29) |
상기와 같이 글로벌 제약사의 바이오의약품에 대한 전략적인 아웃소싱 규모 증가에 따라 향후 글로벌 CMO 시장 규모는 지속적으로 성장할 것으로 예상되고 있습니다.
높고 까다로운 국가적 규제와 전문적인 공정 프로세스 운영을 요하기 때문에 CMO, CDMO 사업이 성장하는 추세이며, 주로 거대한 생산능력(CAPA)을 가진 기업의 성장을 견인하고 있습니다. 또한 거대한 CAPA가 필요한 CDMO 분야 외에, 환자 맞춤형 첨단 바이오 의약품 분야가 신약 개발 트렌드의 많은 부분을 차지하고 있습니다. 대부분 신약 개발 초기 단계에서 GMP 시설은 독립적으로 구축하기보다는 이미 잘 운영되고 있는 GMP 시설을 활용하는 것이 트렌드화 되고 있습니다. 자체 GMP 시설의 운영은 많은 노하우와 초기 자본이 많이 필요하기 때문입니다.
당사 GMP 센터는 거대한 CAPA가 필요한 바이오 의약품 부분이 아니라, 더 이상 치료가 불가능하여, 첨단 기법으로만 치료가 가능한 환자를 위해 개발 중인 면역 분야의 암치료제와 자가면역질환에 특화된 CDMO가 가능합니다. 당사는 자체 연구 성과로 CDMO 부문에 축적된 노하우를 가지고 있으며, 이러한 노하우를 바탕으로 국내 뿐 아니라 미국 등 해외 개발업체에 공략 가능한 전략을 수립하고 있습니다. 단, 절차가 까다롭고 허가에 상당 시간이 소요될 수 있는 한계점 역시 존재하고 있습니다.
당사는 세포 유전자 치료제 개발 회사로서 Viral Vector를 활용하여 유전자를 면역세포에 도입하는 기술로 CMO/CDMO 시장에 영향력을 확대하고자 노력하고 있습니다. 세포유전자치료제 중 CAR-T 치료제는 혈액암에서 고형암으로 연구개발과 임상을 활발히 진행하고 있는 가운데, 당사는 CAR-T 치료제 CMC 작성, 제조 및 제품 출하시험에 특화된 강점이 있으며, 이를 CMO/CDMO 사업의 주요 타겟 시장으로 집중하고 있습니다.
CMO/CDMO 서비스는 후보물질 연구개발 단계에서 자체 제조시설을 보유하지 않은 바이오 기업에 CMO 서비스를 제공할 수 있습니다. 더욱이 후보 물질은 있으나 CMC 작성, 시험법 개발, 제조공정 최적화에 어려움을 겪는 기업에 당사의 CDMO 서비스를 제공하여 개발 중인 제품의 임상시험을 시작할 수 있게 지원하는 서비스까지 제공할 수 있습니다. 단, 소규모 바이오기업의 경우, CMO/CDMO 계약이 체결된 후 의뢰한 기업의 자금 여건에 따라 계획이 지연되는 리스크가 존재합니다.
당사는 Viral Vector를 제조하기 위한 자체 플랫폼을 보유하고 있고, 관련 제조 시설을 보유하고 있습니다. Viral Vector는 배양세포 또는 면역세포에 유전자를 효과적으로 전달하기 위해 보편적으로 사용되며, 직접 치료제로 사용되기도 합니다. Viral Vector는 1회 생산으로 수년간 사용되어 제조시설을 직접 보유하는 경우가 극히 드물며, 보통 CMO를 의뢰하고 있습니다. 당사는 Viral Vector 생산이 필요한 중소 바이오 기업에 서비스를 제공하고, 식약처에 제출 가능한 제조 및 품질시험 관련 문서 제공 서비스를 제공할 수 있습니다. 단, 과거부터 Viral Vector의 제조는 관례적으로 외국 업체에 의뢰하였으며, 해외 업체의 자료가 식약처에 지속 제공되는 점은 신규 CMO 계약 체결의 일부 리스크로 작용되고 있습니다.
다만, 글로벌 바이오 시장은 급격한 변화를 겪어 왔으며, 특히 바이오 산업에 대한 규제 변화, 특허 및 지적재산권 보호에 관한 우려 증가, 환자 보호법 강화, 바이오 의약품 약가 규제 및 배상 강화 등의 요인으로 제약사들의 아웃소싱 전략에도 급격한 변화가 발생할 가능성을 배제할 수 없습니다. 만약 향후 타 제약사들이 자체 생산 비중을 확대하는 전략 변경이 현실화될 경우, 당사의 CMO 사업의 확장에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하시기 바랍니다.
또한, 시장 규모가 지속적으로 성장할 것으로 전망됨에 따라 CMO 및 CDMO 사업을 영위하는 경쟁기업들 또한 빠르게 설비투자를 진행하여 공급을 늘릴 계획을 가지고 있습니다. 따라서 향후 시장 전체의 생산능력이 시장의 생산수요를 초과하게 되는 공급과잉 상태가 발생하게 될 위험이 있으며, 이 경우 시장 내 과도한 경쟁으로 인해 당사가 제공하는 제품 및 서비스의 가격 하락, 영업마진의 악화 등의 위험에 노출될 수 있습니다. 투자자들께서는 투자의사결정시 이 점 유의하시기 바랍니다. 따라서 향후 시장 전체의 생산능력이 시장의 생산수요를 초과하게 되는 공급과잉 상태가 발생하게 될 위험이 있으며, 이 경우 시장 내 과도한 경쟁으로 인해 당사가 제공하는 제품 및 서비스의 가격 하락, 영업마진의 악화 등의 위험에 노출될 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [아. 기술이전 지연 및 실패에 따른 위험] 당사와 같은 신약개발전문 생명공학기업은 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 삼고 있습니다. 당사는 2021년 LG화학과의 기술이전 계약체결이라는 성과를 이뤄냈으며, 타 파이프라인에 대해서도 현재 다양한 경로를 통하여 기술이전을 위해 노력하고 있습니다. 그러나, 당사는 지속적인 기술이전을 위한 노력에도 불구하고 당사가 보유한 파이프라인의 향후 기술개발이 지연되거나 중단되어 추가 기술이전이 발생하지 않거나, 기술개발이 성공해도 잠재 기술이전 파트너사와의 협의가 원활하지 않아 기술이전 계약이 지연ㆍ실패할 경우에는 당사의 수익성이 악화되거나 사업에 부정적 영향을 줄 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사와 같은 신약개발전문 생명공학기업은 신약 개발사업이 태생적으로 부담하고 있는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 국내외 대형 제약사와 분산하기 위하여 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 삼고 있습니다. 파이프라인의 기술이전이 성공하면, 일반적으로 기술이전의 대가로 초기 계약금을 수령하게 되며, 임상단계 또는 허가단계 성공시마다 지급되는 마일스톤 수입, 신약 발매 후 매출액의 일정 비율에 해당하는 로열티 수입, 특정 금액 이상의 매출 발생시 지급되는 판매 마일스톤 수입이 발생하게 됩니다.
당사 역시 임상 또는 전임상 단계에서 기술이전을 성공시켜 기술이전 관련 수익을 최대화하고 이후 계약상대방인 제약사가 제품을 판매함에 따른 로열티 수익을 추가 수령하는 전략을 취하고 있습니다. 그 결과 2021년 LG화학과 환자에서 유래한 자가 B세포 및 단구를 항원제시세포로 이용하는 유전자 도입 세포치료제인 CeliVax 원천기술을 활용한 개인 맞춤형 항암면역치료백신의 기술이전 계약체결이라는 성과를 이뤄냈습니다. 이를 통해 당사는 신생항원(Neo-antigen) 유래 암 항원을 탑재하는 개인 맞춤형 항암면역치료백신에 대한 전 세계 독점 개발 및 상업화 권리를 LG화학에 이전하였습니다. LG화학과의 기술이전 관련 세부 내역은 본 신고서의 "제1부 모집 또는 매출에 관한 사항 - Ⅲ. 투자위험요소 - 1. 사업위험 - '자. 기술이전 파트너사의 약물 상업화 실패에 따른 수익 감소의 위험'을 참고하시기 바랍니다.
| [기술이전(License-out) 관련 계약] |
| (단위 : 백만원) |
| 품목 | 계약 상대방 |
대상지역 | 계약 체결일 |
계약 종료일 |
총 계약금액 | 수취금액 | 진행단계 |
| BVAC-Neo | (주)LG화학 | 전 세계 | 2021.05.26 | 로열티 지급 기한 (판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날) |
183,500 | 1,000 | 비임상 |
| 출처) 당사 제시 |
1) BVAC-Neo
| ① 계약상대방 | (주)LG화학 |
| ② 계약내용 | - Neo-Antigen 유래 암항원을 포함/탑재하는 완전 개인맞춤형 항암면역치료백신과 관련된 기술 및 특허를 전 세계에서 실시할 수 있는 독점배타적 전용 실시권 - 제3자에 대한 재실시권 |
| ③ 대상지역 | 전 세계 |
| ④ 계약기간 | 계약체결일: 2021년 5월 26일 계약종료일: 로열티 지급 기한 (판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날) |
| ⑤ 총 계약금액 | 183,500백만원, 로열티는 별도 |
| ⑥ 수취금액 | <반환의무 없는 금액> 계약금(Upfront Payment): 1,000백만원, 2021년 6월 25일 수취 <반환의무 있는 금액> 해당 사항 없음 |
| ⑦ 계약조건 | 계약금(Upfront Payment): 1,000백만원 - 수취조건: 계약 체결 시 마일스톤(Milestione): 182,500백만원 - 수취조건: 개발, 인허가 및 판매 등 로열티(Royalty): 순매출액에 따라 별도 수령 - 수취조건: 매출 발생 시 임상시험, 허가, 규제 승인 미실현 등으로 계약은 종료될 수 있으며, 계약 종료 시에도 회사의 위약금 지급의무는 없음 |
| ⑧ 대상기술 | BVAC-Neo (Neo-Antigen 유래 암항원을 포함/탑재하는 완전 개인맞춤형 항암면역치료백신) |
| ⑨ 개발 진행경과 | 계약 후 LG화학과 공동개발위원회를 발족하였음. LG화학이 요청한 기술자료를 제공하고 있음. 생산 기술이전을 실시하기 위해 준비 중임. |
| 출처) 당사 제시 |
현재 당사가 파악한 바로는 LG화학의 담당 연구개발책임자 퇴사로 인한 인력 변동과 연구소 내 항암 파이프라인 개편 작업 등 LG화학의 내부 사정으로 인해 BVAC-Neo 연구에 진척이 없는 것으로 알고 있으며, LG화학의 구체적인 내부 사정은 파악하기 어렵습니다. BVAC-NEO의 라이선스아웃 계약은 암 환자 개인의 신생항원 (private neo-antigen)을 탑재한 개인 맞춤형 항암 치료 백신에 한정되어 있으므로, 다른 암 항원을 표적하는 타 BVAC 파이프라인의 권리에 크게 영향을 미치지 않을 것으로 판단되며, 장기적으로는 당사가 자체적으로 연구 수행할 것을 고려하고 있습니다.
당사는 상기 개발 중인 파이프라인의 기술이전을 위해 노력함에도 불구하고 당사가 보유한 파이프라인의 향후 기술개발이 지연되거나 중단되어 추가 기술이전이 발생하지 않거나, 기술개발이 성공해도 잠재 기술이전 파트너사의 협의가 원활하지 않아 기술이전 계약이 지연되거나 실패할 경우에는 당사의 수익성이 악화되거나 사업에 부정적 영향을 줄 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[자. 기술이전 파트너사의 약물 상업화 실패에 따른 위험] |
높은 비용과 임상실패율, 오랜시간이 소요된다는 신약개발 사업의 특성상 많은 바이오기업들이 일정한 파이프라인에 대해서는 기술이전을 사업모델로 하고 있습니다. 당사의 매출발생 또한 기술이전을 통해서 이루어지며, 당사는 라이센스 아웃을 위한 국내외 제약회사를 대상으로 학회, 전시회 및 비즈니스 파트너링 행사 등 기술 교류의 장을 통한 지속적 개발 업데이트와 교류활동을 하고 있습니다.
일반적으로 기술이전이 이루어지게 되면, 추가개발은 라이센스 인을 한 기업에서 진행하며 계약에 따라 별도로 추가개발을 진행할 수도 있습니다. 라이센스 인한 기업에서는 추가개발 상황 및 임상시험결과에 따라 마일스톤 및 로열티를 지급하게 되는데 이러한 수익구조는 다음과 같이 정리할 수 있습니다.
| [라이센스 계약 수익구조] |
| 구분 | 내용 | |
| 총계약금액 | 계약금 | 계약 체결 직후 또는 일정기간 내에 받게 되는 금액 |
| 마일스톤 | 전임상, 임상, 허가신청, 허가완료 등 개발 단계별로 성공시 받게 되는 금액 | |
| 로열티 | 기술 이전으로 생산된 제품의 매출에 따라 받게 되는 금액 (통상 매출액 대비 비율로 책정) |
|
| 출처) 금융감독원 보도자료 "제약·바이오 기업의 공시실태 및 투자자 보호방안" |
당사는 2014년 12월 20일 BVAC-C 파이프라인과 관련된 기술 및 특허를 미국에서 실시할 수 있는 독점 배타적 전용 실시권에 대하여 미국의 NeoImmuneTech사와 아래와 같이 라이선스아웃 계약을 체결한 바 있습니다.
|
[라이선스아웃 계약 총괄표] |
|
(단위 : 천달러) |
|
품목 |
계약 상대방 |
대상지역 |
계약 체결일 |
계약 종료일 |
계약 금액 |
진행 단계 |
|
BVAC-C |
Neo |
미국 |
2014.12.20 |
특허만료일 (특허권 존속기간의 연장기간을 포함함) |
567 |
비임상 |
|
합 계 |
567 |
|||||
1) BVAC-C
|
① 계약상대방 |
NeoImmuneTech |
|
② 계약내용 |
- BVAC-C과 관련된 기술 및 특허를 미국에서 실시할 수 있는독점배타적 전용 실시권 - 당사의 사전 동의에 따라, 제3자에 대한 재실시권 |
|
③ 대상지역 |
미국 |
|
④ 계약기간 |
계약체결일: 2014.12.20 계약종료일: 특허만료일(특허권 존속기간의 연장기간을 포함) |
|
⑤ 총 계약금액 |
$567,000, 로열티 및 재실시권 수익분배는 별도 |
|
⑥ 수취금액 |
<반환의무 없는 금액> 계약금(Upfront Payment) : $567,000 <반환의무 발생가능 금액> 해당사항 없음 |
|
⑦ 계약조건 |
계약금(Upfront Payment) : $567,000 - 수취조건 : 계약체결 시 로열티(Royalty): 제품 순매출의 4% - 수취조건 : 각 회계연도의 마지막날부터 90일 이내 |
|
⑨ 대상기술 |
BVAC-C (HPV 감염으로부터 유발되는 암 및 감염질환치료 목적으로 개발하고 있는 치료제) |
|
⑩ 개발 진행경과 |
<거래상대방> 2019년 IND 승인 후 2020년 연구자 주도 임상 시행을 계획 중 |
| 출처) | 당사 사업보고서(2018.12) |
그러나 NeoImmuneTech 사에서 BVAC-C 관련 개발 진행이 신속하게 이루어지지 않음에 따라 상기 계약은 2021년 9월 23일부로 해지되었습니다.(주1) 따라서 이미 계약이 해지된 상태이므로, 당사의 BVAC-C 파이프라인은 현재 다른 대상자에게 라이선스 아웃을 시도할 수 있는 상황입니다. 이처럼 라이선스 아웃 계약이 이루어지더라도, 계약 후 개발 진행 단계가 더디거나, 계약 당시 예상치 못했던 사유 등으로 인해 해지될 수 있는 성격을 가지고 있습니다.
| (주1) | 해당 라이선스아웃 계약이 해지된 사실은 당사의 사업보고서(2021.12) "II.사업의 내용-6. 주요계약 및 연구개발활동" 부분에 공시되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
당사는 2021년 환자에서 유래한 자가 B세포 및 단구를 항원제시세포로 이용하는 유전자 도입 세포치료제인 CeliVax 원천기술을 활용한 신생항원(Neo-antigen) 유래 암 항원을 탑재하는 개인 맞춤형 항암면역치료백신에 대한 전 세계 독점 개발 및 상업화 권리를 LG화학에 이전한 바 있으며 그 계약 내용은 다음과 같습니다.
| [기술이전(License-out) 관련 계약] |
| (단위 : 백만원) |
| 품목 | 계약 상대방 |
대상지역 | 계약 체결일 |
계약 종료일 |
총 계약금액 |
수취금액 | 진행단계 |
| BVAC-Neo | (주)LG화학 | 전 세계 | 2021.05.26 | 로열티 지급 기한 (판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날) |
183,500 | 1,000 | 비임상 |
| 출처) 당사 제시 |
| [기타 경영사항(자율공시) - 개인맞춤형 항암면역치료백신 라이선스 계약 체결] |
| 1. 제목 | 개인맞춤형 항암면역치료백신 라이선스 계약 체결 |
| 2. 주요내용 | ※ 투자 유의사항 본 계약을 통한 수익 인식은 임상시험과 품목허가 등의 성공 여부에 따라 달라질 수 있습니다. 계약 조건에 따라 규제기관에 의한 연구/개발의 중단, 품목허가 실패 등 발생 시 계약이 해지될 수 있습니다. 가. 계약 상대방: LG화학 나. 계약기술: Neo-Antigen 유래 암항원을 포함/탑재하는 완전 개인맞춤형 항암면역치료백신 다. 계약금액 1) 선급금: 10억원 (자기자본 대비 2.11%) 2) 마일스톤료: 개발, 인허가 및 판매에 따른 단계별 마일스톤 최대 1,825억원 수령 예정 3) 로열티: 순매출액에 따라 별도 수령 예정 라. 계약지역: 전 세계 마. 계약기간: 계약일로부터 로열티 지급 기한(판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날)까지 |
| 3. 결정(확인)일자 | 2021-05-26 |
| 4. 기타 투자판단에 참고할 사항 | |
| 1) 향후 계약 내용 변경 및 공시 의무 발생시 즉시 공시할 예정입니다. 2) 상기 자기자본은 당사의 최근 사업연도말(2020년) 개별 재무제표 47,295,782,651원 기준입니다. 3) 상기 결정(확인)일자는 이사회 결의일 및 계약 체결일입니다. 4) 본 계약의 선급금을 포함하여 각 단계별로 지급하는 모든 마일스톤과 로열티는 반환 의무가 없습니다. 5) 개발에 따른 마일스톤료는 개발 진행에 따른 각 단계별 마일스톤 달성 시 지급받는 금액입니다. 6) 본 라이선스 계약의 수익 인식은 임상시험과 허가 등의 성공 여부에 따라 달라질 수 있으며, 미실현 가능성도 있습니다. 7) 임상시험, 허가, 규제 승인 미실현 등으로 본 라이선스 계약은 중도에 종료될 수 있으며, 이 경우 계약 종료에 따른 위약금 지급 의무는 없습니다. |
|
| ※ 관련공시 | - |
| 출처) DART 전자공시시스템 |
이번 계약에 따라 당사는 LG화학으로부터 선급금으로 10억원을 수령하였으며, 향후 개인 맞춤형 항암면역치료백신에 개발, 허가, 판매에 따른 단계별 마일스톤으로 최대 1,825억원을 받게 될 예정이고, 판매에 따른 로열티 수수료도 별도로 지급받게됩니다. 단계별 마일스톤료의 세부내용은 다음과 같습니다.
| [단계별 마일스톤료] |
| (단위 : 백만원) |
| 구 분 | 금액 |
| 개발 마일스톤료 | 11,500 |
| 인허가 마일스톤료 | 26,000 |
| 판매 마일스톤료 | 145,000 |
| 출처) 당사 제시 |
당사가 LG화학에 이전한 신생항원(Neo-antigen) 유래 암 항원을 탑재하는 개인 맞춤형 항암면역치료백신에 대한 보다 자세한 내용은 다음과 같습니다.
(1) Neo-antigen의 생성
정상세포에 돌연변이가 지속적으로 발생하면 암화되어 암세포가 됩니다. 암세포는 인체의 정상 면역기능에 의해 제어되지만, 면역회피기능이 생긴 암세포는 암조직으로 커지게 됩니다. 암세포는 돌연변이 단백질을 발현하고, 이 중 일부는 항원성을 갖게 됩니다. 암세포에 새롭게 나타난 Neo-antigen은 암세포에만 특이적으로 발현하고, 정상세포에는 전혀 발현하지 않습니다. 또한, 돌연변이에 의해 인체에 완전 새롭게 나타난 항원이므로 인체 면역체계는 이를 병원균과 같은 외부 항원으로 인식하고 면역관용 작용에 구애받지 않으며 항원성이 매우 강합니다. 한편, Neo-antigen은 다수의 환자에서 빈번히 보고되는 공통(public 또는 shared) neo-antigen 과 1명의 환자에서만 발견되는 개인(private) neo-antigen으로 나뉩니다.
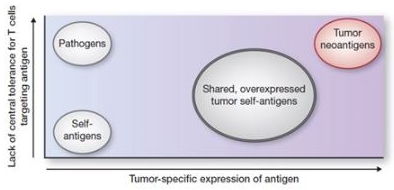 |
|
neo-angtigen의 항원성과 특이성 |
|
출처) cancer immunology research 2013 및 당사 정기보고서 |
(2) Neo-antigen의 발굴 및 적용(BVAC-Neo)
차세대 염기서열분석 기술이 보편화되고 유전체의 유전정보를 대규모로 분석할 수 있게 되면서 암 환자 개인의 유전정보를 비교적 쉽고 빠르게 확보할 수 있게 되었습니다. 따라서, 환자의 종양유래 검체에서 암세포를 분리하고 DNA를 추출한 뒤 전체 염기서열을 RNA-Seq, Exome-Seq 등의 방법으로 분석합니다. 정상 세포의 염기서열과 비교 분석해 돌연변이 염기서열을 확인한 후 돌연변이에 생성된 neo-antigen을 발굴하고 이로부터 Neo-epitope를 유추합니다. 유추된 neo-epitope는 암항원으로 사용되며, BVAC-Neo는 이같은 암항원 epitope peptide를 적재하여 암세포를 효율적으로 살상할 수 있는 파이프라인입니다.
 |
|
neo-antigen의 발굴과 bvac-neo 제조 및 투여 과정 |
|
출처) bioorg med chem(2018) 및 당사 정기보고서 |
BVAC-Neo는 환자 개인이 가진 종양세포의 항원을 탐지, 발굴해서 면역체계를 활성화시키는 백신으로 완전 개인 맞춤형 항원을 사용하기 때문에 월등한 항암효력을 기대할 수 있고, 이상반응은 최소화되므로 강력한 경쟁력을 갖습니다. 또한, 암종에 관계없이 암세포에서 돌연변이가 확인되는 모든 암종에 적용이 가능한 장점이 있습니다. 또한, 발굴한 Neo-antigen으로부터 neo-epitope를 유추하고, 이 정보를 바탕으로 9-mer 길이의 peptides 유전자를 GMP 내에서 합성하여, 이를 항원으로 이용하여 1일 제조공정으로 BVAC-Neo를 제조할 수 있으며 극소량의 peptide나 유전자로도 제품 제조가 가능하여 경제성을 갖고 있습니다.
현재 당사의 BVAC-Neo 파이프라인은 다수의 환자에서 빈번히 보고되는 공통(public 또는 shared) Neo-antigen과 1명의 환자에서만 발견되는 개인(Private) Neo-antigen 이 두 종류 모두에 이용될 수 있으며, 본 증권신고서 제출일 현재 개발의 1단계로 공통 neo-antigen을 활용하는 파이프라인을 연구개발 중이고, 개인 neo-antigen을 타겟으로 한 파이프라인 개발도 개시하였습니다.
당사는 계약금에 대한 반환의무는 존재하지 않으며, 당사의 기술이전 파이프라인 및 향후 개발 진행 예정인 파이프라인의 임상 등에서의 예상치 못한 독성이 관찰되거나 효능이 기대에 미치지 못할 경우 당사의 수익성에 큰 영향을 끼칠 수 있는 마일스톤 및 로열티가 감소할 수 있습니다. 또한 기술이전한 파트너사의 임상수행 능력, 파트너사 내부적인 이유로 임상진행이 지연 및 중단될 가능성도 존재합니다. 더불어, 규제기관의 품목허가 혹은 판매 승인 실패할 경우 약물의 상업화가 불가능해집니다. 이로 인해 수취 예정인 마일스톤 및 로열티가 감소하여 수익성과 재무안정성에 부정적인 영향을 줄 수 있으므로 투자자께서는 이 점 유의하시기 바랍니다. 이 외에도 당사가 기술이전한 개인맞춤형 항암치료백신 기술의 경쟁사들의 개발이 보다 빠르게 완료되어 시장을 선점할 경우 당사의 로열티 수익에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [전 세계 개인맞춤형 항암치료백신 개발 현황] |
|
주요기관명 |
개발단계 |
설명 |
| Gritstone bio | 임상2/3상 | Lipid-encapsulated mRNA 백신 플랫폼과 면역관문차단제 병용 요법 (Granite-001 임상 2/3상_microsatellite-stable colorectal cancer 환자 대상 & Slate-001 임상 2상_KRasmut암 환자 대상) |
| Moderna / Merck & Co. (MSD) | 임상2상 | Moderna의lipid-encapsulated mRNA 백신 플랫폼 mRNA-4157/V940과 Merck & Co.의 anti-PD-1 therapy (Keytruda)의 흑색종 환자 대상의 병용 요법 |
| Curevac | 임상2상 | 비소세포성 폐암 환자 대상의 펩타이드 백신 플랫폼 FRAME-001 |
| Biontech/Roche | 임상2상 | 흑색종/대장암/비소세포성 폐암 환자 대상의 lipid-encapsulated mRNA 백신 플랫폼 Autogene cevumeran/BNT122 |
| Biontech | 임상1상 | 흑색종 환자 대상의 tumor-infiltrating lymphocyte를 활용한 세포 치료제 플랫폼 BNT221/NEO-PTC-01 |
| 출처) 당사 제시 |
| [차. 연구개발 인력 유출 위험] 연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 가장 중요한 요소입니다. 이는 제약 산업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 또한, 주요 연구 인력의 유출이 있을 경우 해당 연구 개발과제가 지연되거나 개발전략을 수정해야 할 가능성이 존재하며, 개발비 부담 등으로 당사의 경쟁력 및 성장 가능성이 악화될 수 있습니다. 당사의 연구소 중 서울대학교 내에 위치한 신약탐색팀, 백신중개연구팀, RA/기획팀은 항암면역치료백신과 예방백신의 기초연구 전반을 다루며, 성남에 위치한 벡터공정팀, 완제공정팀은 발굴한 파이프라인의 비임상개발과 임상진입, 완제의약품 공정개발, 품질관리를 수행하고 있습니다. “임상개발실”은 임상시험 전략수립, 기획 및 운용, 인허가 및 연구관리 등의 업무를 수행하고 있습니다. 전 연구원은 규제당국의 규정과 가이드라인 등을 깊게 이해하여 개발속도를 증진하고 규제당국의 보완 요청 등에 신속히 대응할 수 있도록 준비하고 있습니다. 일반적으로 업계 연구 인력들의 특성이 학계나 국가 연구원 등에서 근무하는 것을 선호하고 있으며, 개인적인 학업 증진을 위한 해외유학 등의 사유로 핵심연구 인력의 이탈이 발생할 수 있습니다. 이에 대한 대안으로 당사는 주식매수선택권 부여와 차별화된 대우 및 보상(특별 인센티브), 급여성/비급여성 복리후생 강화, 신약을 포함한 다양한 프로젝트 추진 환경 및 기회 제공 등을 시행 중입니다. 그러나 이와 같은 각종 보상책에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히 타경쟁사의 당사 우수인력의 스카우트는 당사가 사업을 영위함에 있어 큰 문제가 될 수 있습니다. 또한, 핵심인력 이탈과 함께 당사의 주요 기술이 유출될 경우, 당사의 경쟁력이 악화될 수 있으며, 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 가장 중요한 요소입니다. 이는 제약 산업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 또한, 주요 연구 인력의 유출이 있을 경우 해당 연구 개발과제가 지연되거나 개발전략을 수정해야 할 가능성이 존재하며, 개발비 부담 등으로 당사의 경쟁력 및 성장 가능성이 악화될 수 있습니다.
| [연구개발조직도] |
 |
|
연구개발조직도_1 |
| 출처) 당사 제시 |
본 증권신고서 제출일 현재 당사는 박사급 4명, 석사급 16명, 기타 1명 등 총 21명의 연구인력을 보유하고 있으며, 그 현황은 다음과 같습니다.
| [당사 연구개발인력 현황] |
| 구 분 | 인 원 | ||||
| 박사 | 석사 | 학사 | 합 계 | ||
| 연구소 | 신약탐색팀 | 1 | 3 | - | 4 |
| 백신중개연구팀 | 1 | 2 | - | 3 | |
| RA/기획팀 | - | 1 | - | 1 | |
| 벡터공정팀 | 1 | 6 | - | 7 | |
| 완제공정팀 | 1 | 3 | - | 4 | |
| 임상개발실 | 임상개발팀 | - | 1 | 1 | 2 |
| 합계 | 4 | 16 | 1 | 21 | |
| 출처) 당사 정기보고서 |
| 주) 대표이사는 상기 표에서 제외하였음 |
과거 3개년부터 2024년 말까지 당사 연구인력의 유출입 현황은 다음과 같습니다.
| 연도 | 구분 | 박사 | 석사 | 학사 | 기타 | 합계 |
| 기존인원 | 6 | 17 | 5 | - | 28 | |
| 2022년 | 유입 | 1 | 6 | 1 | - | 8 |
| 유출 | 2 | 6 | 1 | - | 9 | |
| 총원 | 5 | 17 | 5 | - | 27 | |
| 평균 근속년수 |
2년 3개월 | 1년 9개월 | 2년 8개월 | - | 2년 0개월 | |
| 2023년 | 유입 | - | 1 | 2 | - | 3 |
| 유출 | - | 3 | 2 | - | 5 | |
| 총원 | 5 | 15 | 5 | - | 25 | |
| 평균 근속년수 |
3년 3개월 | 2년 8개월 | 3년 0개월 | - | 2년 10개월 | |
| 2024년 | 유입 | - | 1 | - | - | 1 |
| 유출 | 1 | - | 4 | - | 5 | |
| 총원 | 4 | 16 | 1 | - | 21 | |
| 평균 근속년수 |
4년 1개월 | 3년 0개월 | 8년 9개월 | - | 3년 8개월 | |
| 출처) 당사 제시 |
총 연구인력 규모가 지속적으로 감소하고 있으나 그 정도가 크지 않고, 각 팀의 중추적인 석/박사급 핵심인력들은 유지되고 있기 때문에 각 파이프라인별 임상의 연속성 및 지속성에는 큰 문제가 없다고 판단합니다.
각 파이프라인별 최소 개발인력은 현재 진행중인 개발 단계에 따라, BVAC-E6E7은 임상 시험 관리 및 임상시험용 의약품의 특성분석을 위한 연구인력 4명, BVAC-C는 임상 2b상 시험을 위한 CMC 개발 연구인력 3명, BVAC-Neo는 비임상 유효성 및 독성/분포 분석을 위한 연구인력 3명이 필요할 것으로 판단하고 있습니다. 한편, BVAC-B, BVAC-P와 BVAC-M은 개발 역량을 BVAC-E6E7, BVAC-C, BVAC-Neo에 중점적으로 집중하고자 추가적인 투자는 임시로 중단한 상태입니다. 따라서 나머지 인력으로 오미크론 변이주 대응 백신 개발 파이프라인에 집중할 수 있으며, 상황에 따라 유동적으로 인력을 재배치하여 대응할 수 있습니다. 하지만 각 파이프라인별 중요한 역할을 한 석/박사급 핵심 인력들이 대거 이탈하거나, 연구인력의 회전율이 더 빨라져 관련 업무의 인계가 잘 이루어지지 않는 경우 당사가 진행하고 있는 임상들에 차질이 생길 가능성이 있습니다.
당사의 핵심 연구인력의 현황은 다음과 같습니다.
| 직위 | 성명 | 담당업무 | 주요경력 | 주요 연구실적 |
| 대표이사 | 강창율 | 연구개발 총괄 |
- 서울대학교 약학 학사('73.03~'77.02) - 서울대학교 약학 석사('77.03~'81.02) - State University of New York at Buffalo - IDEC Pharmaceutical Corporation, La Jolla, - 서울대학교 약대 정교수('94.03~'20.02) - (주)셀리드('14.06~현재) |
[주요 논문] - Activation of NKT cells in an anti-PD-1-resistant tumor model enhances anti-tumor immunity by reinvigorating ex hausted CD8 T cells. Cancer Research (78(18); 5315-26), 2018. - IL-21 therapy combined with PD-1 and Tim-3 blockade provides enhanced NK cell antitumor activity against MHC class I-deficient tumors. Cancer Immunology Research (6(6); 685-695), 2018. - IL-21-mediated reversal of NK cell ex haustion facilitates anti-tumour immunity in MHC class I-deficient tumours. Nature Communications (6; 8; 15776), 2017. - GITR drives TH9-mediated antitumor immunity. Oncoimmunology (5(5):e1122862), 2016 - Characterization of age-associated ex hausted CD8 + T cells defined by increased ex pression of Tim-3 and PD-1. 2016 - Glucocorticoid-induced tumor necrosis factor receptor-related protein co-stimulation facilitates tumor regression by inducing IL-9-producing helper T cells. Nature Medicine (21(9):1010-1017), 2015. - A multimeric carcinoembryonic antigen signal inhibits the activation of human T cells by a SHP-independent mechanism: a potential mechanism for tumor-media ted suppression of T-cell immunity. International Journal of Cancer (1;136(11):2579-87), 2015. - Tumore-derived osteopontin suppresses antitumor immunity by promoting ex tramedullary myelopoiesis. Cancer Research (15;74(22):6705-6716), 2014. - Serum amyloid A3 ex acerbates cancer by enhancing the suppressive capacity of myeloid-derived suppressor cells via TLR2-dependent STAT3 activation, European Journal of Immunology (44(6);1672-84), 2014. - Tumor microenvironmental conversion of natural killer cells into myeloid-derived suppressor cells. Cancer Research (15;73(18):5669-5681), 2013. [ 특허 등록 및 출원] - 자연살해T세포의 리간드와 항원을 적재한 B세포를 매개로 하는 백신(등록) - 자연살해T세포의 리간드와 항원을 적재한 단핵구 또는 미분화 골수성 세포를 포함하는 백신(등록) - 항 PD-1 항체 또는 항 PD-L1 항체를 포함하는 항암제(등록) - 알파-갈락토실세라마이드의 유도체, 이의 약학적으로 허용가능한 염, 이의 제조방법 및 이를 유효성분으로 함유하는 면역보조용 약학적 조성물(등록) - 오스테오폰틴 단백질의 발현 또는 활성 억제제를 유효성분으로 함유하는 암 치료용 약학적 조성물(출원) |
| 책임연구원 | 박봉주 | 신약개발 | - 서울시립대학교 학사('02.03~'09.02) - 서울시립대학교 석사('09.03~'11.02) - 서울시립대학교 박사('11.03~'17.02) - 서울시립대학교 부설 자연과학연구소 선임연구원('17.03~'18.10) - 서울시립대학교 연구교수('18.11~'19.03) - (주)셀리드('19.04~현재) |
[주요 논문] - New ethanol extraction improves the anti-obesity effects of black tea. Arch Pharm Res. 39(3):310-20. 2016. - Hypoxic reprograming of H3K27me3 and H3K4me3 at the INK4A locus. FEBS Lett. 590(19):3407-3415. 2016. - Wnt3a disrupts GR-TEAD4-PPARγ2 positive circuits and cytoskeletal rearrangement in a β-catenin-dependent manner during early adipogenesis. Cell Death Dis. 10(1):16. 2019. |
| 선임연구원 | 전인수 | 신약개발 | - 서강대학교 생명과학과 학사('06.03~'13.02) - 서울대학교 융합과학기술대학원 분자의학및 바이오제약학과 석,박사('13.03~'20.08) - (주)셀리드('20.10~현재) |
[주요 논문] - Enhanced Immunogenicity of Engineered HER2 Antigens Potentiates Antitumor Immune Responses. Vaccines. 8(3), 403. 2020 |
| 선임연구원 | 송보영 | 신약개발 |
- 포항공과대학교 생명과학과 학사('07.03~'11.08) - 서울대학교 융합과학기술대학원 분자의학및 바이오제약학과 석,박사('11.09~'20.02) - 서울대학교 종합약학연구소 연수연구원 - (주)셀리드('21.03~현재) |
[주요 논문] - GITR agonism triggers antitumor immune responses through IL21-expressing follicular helper T cells. Cancer Immunology Research. 8(5):698. 2020 - Differentiation of c-Kit+CD24+ natural killer cells into myeloid cells in a GATA-2-dependent manner. FASEB Journal. 34(3):4462. 2020 |
| 선임연구원 | 장수정 | 신약개발 | - 서울시립대학교 생명과학과 학사('09.03~13.02) - 서울시립대학교 석사 ('13.02~'14.08) - 서울시립대학교 자연과학연구소 연구원 ('14.09~15.02) - 서울시립대학교 박사 ('15.03~'21.08) - 서울시립대학교 연구교수 ('21.09~22.06.) - (주)셀리드('22.07~현재) |
[주요 논문] - Hypoxic reprograming of H3K27me3 and H3K4me3 at the INK4A locus. FEBS Letters. 590(19):3407-3415. 2016 - Cancer driver genes, IDH1/2, JARID1C/ KDM5C, and UTX/ KDM6A: Crosstalk between histone demethylation and hypoxic reprogramming in cancer metabolism. Experimental and Molecular Medicine. 51(6):1-17. 2019 - High-Spatial and Colourimetric Imaging of Histone Modifications in Single Senescent Cells Using Plasmonic Nanoprobes, Nature communications 8;12(1):5899. 2021 |
| 출처) 당사 정기보고서 |
일반적으로 업계 연구 인력들의 특성이 학계나 국가 연구원 등에서 근무하는 것을 선호하고 있으며, 개인적인 학업 증진을 위한 해외유학 등의 사유로 핵심연구 인력의 이탈이 발생할 수 있습니다. 이에 대한 대안으로 당사는 주식매수선택권 부여와 차별화된 대우 및 보상(특별 인센티브), 급여성/비급여성 복리후생 강화, 신약을 포함한 다양한 프로젝트 추진 환경 및 기회 제공 등을 시행 중입니다. (주1)
| (주1) | 당사 주식매수선택권 부여 내역은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-아" 부분을 참고하여 주시기 바랍니다. |
그러나 이와 같은 각종 보상책에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히타경쟁사의 당사 우수인력의 스카우트는 당사가 사업을 영위함에 있어 큰 문제가 될 수 있습니다. 또한, 핵심인력 이탈과 함께 당사의 주요 기술이 유출될 경우, 당사의 경쟁력이 악화될 수 있으며, 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[카. 지적재산권 관련 위험] |
당사와 같은 신약 연구개발기업은 특허의 출원 및 등록 관련제도를 통한 지적재산권의 철저한 보호 등 핵심 원천기술 확보가 기업가치 유지의 핵심적인 요소입니다.증권신고서 제출일 기준 당사가 보유한 지적재산권 현황은 아래와 같습니다.
| [당사 보유 지적재산권 현황] |
| 번호 | 구분 | 내용 | 출원일 | 등록일 | 등록만료일 | 적용제품 | 출원국 |
|---|---|---|---|---|---|---|---|
| 1 | 특허권 | 자연살해 T 세포의 리간드와 항원을 적재한 B 세포를 매개로 하는 백신 | 2006.04.27 | 2008.02.27 | 2026.04.27 | BVAC | 한국 |
| 2007.04.30 | 2014.12.03 | 유럽 | |||||
| 2007.05.01 | 2011.08.23 | 미국 | |||||
| 2007.07.06 | 2011.04.01 | 일본 | |||||
| 2008.09.17 | 2017.10.25 | 인도 | |||||
| 2008.10.14 | 2011.06.10 | 러시아 | |||||
| 2008.10.24 | 2013.03.27 | 중국 | |||||
| 2008.10.14 | 2021.07.27 | 브라질 | |||||
| 2 | 특허권 | 자연살해 T 세포의 리간드와 항원을 적재한 단핵구 또는 미분화 골수성 세포를 포함한 백신 | 2007.11.19 | 2010.11.12 | 2027.11.19 | BVAC | 한국 |
| 2010.10.12 | 2011.08.03 | 2027.11.19 | |||||
| 2008.08.11 | 2016.12.13 | 2027.11.28 | 미국 | ||||
| 2010.05.14 | 2012.12.14 | 2027.11.28 | 일본 | ||||
| 2010.05.18 | 2013.08.28 | 2027.11.28 | 중국 | ||||
| 2010.06.15 | 2017.05.17 | 2027.11.28 | 유럽 | ||||
| 3 | 특허권 | 알파-갈락토실세라마이드를 아쥬반트로 포함하는 비강투여용 백신 조성물 | 2005.07.13 | 2007.10.01 | 2025.07.13 | - | 한국 |
| 2008.01.02 | 2011.05.11 | 만료 | - | 중국 | |||
| 4 | 특허권 | 코로나바이러스감염증 예방용 백신의 투여 및 용량 | 2021.08.31 | - | - | AdCLD-CoV19-1 OMI | 한국 |
| 5 | 특허권 | 복제가능 아데노바이러스를 포함하지 않는 신규 아데노바이러스 벡터 및 이의 용도 |
2022.01.20 | - | - | AdCLD-CoV19-1 OMI | 한국 |
| 2022.01.20 | - | - | AdCLD-CoV19-1 OMI | PCT | |||
| 2023.06.08 | - | - | AdCLD-CoV19-1 OMI | 싱가포르 | |||
| 2023.06.09 | - | - | AdCLD-CoV19-1 OMI | 유럽 | |||
| 2023.06.20 | - | - | AdCLD-CoV19-1 OMI | 베트남 | |||
| 2023.06.20 | 2024.06.28 | 2042.01.20 | AdCLD-CoV19-1 OMI | 러시아 | |||
| 2023.06.21 | 2024.09.17 | 2042.01.20 | AdCLD-CoV19-1 OMI | 중국 | |||
| 2023.06.21 | 2024.09.24 | 2042.01.20 | AdCLD-CoV19-1 OMI | 미국 | |||
| 2023.06.21 | 2024.09.13 | 2042.01.20 | AdCLD-CoV19-1 OMI | 일본 | |||
| 2023.06.28 | - | - | AdCLD-CoV19-1 OMI | 태국 | |||
| 2023.07.18 | - | - | AdCLD-CoV19-1 OMI | 브라질 | |||
| 2023.07.21 | - | - | AdCLD-CoV19-1 OMI | 인도 | |||
| 2023.07.24 | - | - | AdCLD-CoV19-1 OMI | 인도네시아 | |||
| 6 | 특허권 | 자연 살해 T 세포의 리간드와 암 항원을 적재한 말초혈액단핵세포를 포함하는 백신 |
2023.09.15 | - | - | BVAC | 한국 |
| 2023.09.15 | - | - | BVAC | PCT | |||
| 2025.01.23 | - | - | BVAC | 베트남 | |||
| 2025.02.06 | - | - | BVAC | 러시아 | |||
| 2025.02.17 | - | - | BVAC | 인도 | |||
| 2025.02.17 | - | - | BVAC | 인도네시아 | |||
| 2025.02.12 | - | - | BVAC | 싱가포르 | |||
| 2025.03.04 | - | - | BVAC | 태국 | |||
| 2025.03.12 | - | - | BVAC | 중국 | |||
| 2025.03.13 | - | - | BVAC | 일본 | |||
| 2025.03.14 | - | - | BVAC | 미국 | |||
| 2025.02.04 | - | - | BVAC | 유럽 | |||
| 7 | 특허권 | 신규한 코로나바이러스 재조합 스파이크 단백질, 이를 코딩하는 폴리뉴클레오티드, 상기 폴리뉴클레오티드를 포함하는 벡터 및 상기 벡터를 포함하는 코로나바이러스감염증 예방용 백신 |
2021.08.27 | - | - | AdCLD-CoV19-1 OMI | PCT |
| 2023.02.24 | - | - | AdCLD-CoV19-1 OMI | 중국 | |||
| 2023.02.24 | - | - | AdCLD-CoV19-1 OMI | 미국 | |||
| 2023.02.28 | - | - | AdCLD-CoV19-1 OMI | 유럽 | |||
| 2023.02.24 | 2024.12.19 | 2041.08.27 | AdCLD-CoV19-1 OMI | 일본 | |||
| 2023.02.27 | 2024.04.02 | 2041.08.27 | AdCLD-CoV19-1 OMI | 러시아 | |||
| 2023.02.27 | - | - | AdCLD-CoV19-1 OMI | 인도 | |||
| 2023.02.27 | - | - | AdCLD-CoV19-1 OMI | 브라질 | |||
| 2023.02.22 | - | - | AdCLD-CoV19-1 OMI | 인도네시아 | |||
| 2023.02.17 | - | - | AdCLD-CoV19-1 OMI | 베트남 | |||
| 2023.02.21 | - | - | AdCLD-CoV19-1 OMI | 싱가포르 | |||
| 2023.02.22 | - | - | AdCLD-CoV19-1 OMI | 태국 | |||
| 2023.04.28 | 2025.01.31 | 2041.08.27 | AdCLD-CoV19-1 OMI | 한국 | |||
| 8 | 특허권 | 자연 살해 T 세포의 리간드와 암 항원을 적재한 자연 살해 세포를 포함하는 백신 |
2023.02.28 | 2025.03.13 | 2043.02.28 | BVAC | 한국 |
| 2023.05.19 | - | - | BVAC | PCT | |||
| 2024.11.26 | - | - | BVAC | 싱가포르 | |||
| 2024.12.05 | - | - | BVAC | 인도네시아 | |||
| 2024.12.05 | - | - | BVAC | 러시아 | |||
| 2024.12.09 | - | - | BVAC | 미국 | |||
| 2024.12.11 | - | - | BVAC | 태국 | |||
| 2024.12.12 | - | - | BVAC | 유럽 | |||
| 2024.12.16 | - | - | BVAC | 일본 | |||
| 2024.12.19 | - | - | BVAC | 베트남 | |||
| 2025.01.07 | - | - | BVAC | 인도 | |||
| 2024.12.03 | - | - | BVAC | 중국 | |||
| 9 | 상표권 |
CeliVax |
2016.12.23 | 2017.10.18 | - | BVAC | 한국 |
| 2019.08.05 | 2020.06.14 | - | BVAC | 중국 |
| 출처) 당사 제시 |
당사는 기술 동향 및 비즈니스 상황을 종합적으로 고려하여 특허의 출원, 공개, 심사 타이밍을 결정함으로써 독자 기술이 쉽게 공개되지 않도록 보호하는 한편 일부 핵심 기술은 영업비밀로 보호하고 있습니다.
당사의 이 같은 노력에도 불구하고 현재 출원 중인 또는 출원 예정인 특허가 최종적으로 등록이 되지 않을 수 있으며, 등록된 특허가 제품 출시 전에 만료, 표기, 소멸될 수 있습니다. 국가별로 현행 특허관련 법률이 개정되어 특허 보호 범위나 기간이 축소될 수도 있습니다.
또한, 경쟁 업체가 당사 보유 특허 기술과 유사한 기술을 발견하여 당사의 특허권을 침해하거나 당사 보유 특허 기술과 유사한 기술을 이미 보유하여 당사가 이를 침해했다고 주장하는 경우, 소송 등의 분쟁이 발생할 수 있습니다. 특허 분쟁이 발생할 경우 당사의 영업 및 재무 상황에 부정적 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[타. 정부 정책 및 규제 변화에 따른 위험] |
제약산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업으로, 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 제약 및 신약개발 사업과 관련된 국내 법률 중 당사의 사업과 밀접하게 연관된 법률로는 식품의약품안전처 및 보건복지부 소관의 '약사법'이 대표적이며, 그 외 보건복지부 소관의 「국민건강보험법」, 「생명윤리 및 안전에 관한 법률」, 「제약산업 육성 및 지원에 관한 특별법」, 「희귀질환관리법」, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」과 식품의약품안전처 소관의 「실험동물에 관한 법률」 등이 있습니다.
특히, 「약사법」 하위 시행령/시행규칙 중 의약품 등의 안전에 관한 규칙, 의약품 등의 제조업 및 수입자의 시설기준령 시행규칙, 생물학적 제제 등의 제조ㆍ판매관리 규칙, 동물용 의약품등 취급규칙 등과 이의 하위 규정을 준수해야 합니다. 이에 따라, 신약 후보물질의 발굴에서부터 동물을 대상으로 하는 비임상시험, 인체를 대상으로 하는 임상시험, 품목허가에 이르기까지 임상 승인에 관한 규정, 의약품의 약리 및 독성, 안정성 시험 기준, 임상시험 실시기관 지정에 관한 규정, 품목허가ㆍ심사 등의 규정 등을 반드시 준수하여 진행해야 합니다. 또한 제조 및 판매 단계에서도 제조소 시설 기준, 제조 및 품질관리 규정, 포장 및 공급에 관한 규정, 표시 등에 관한 규정을 준수해야 하며, 사후에도 정기적으로 규제기관으로부터 제품 생산 공정 및 품질관리 전반에 대한 실사 및 관리, 감독을 받게 됩니다. 이러한 규제 및 검증을 통해 제약산업의 선진화 정책을 시현할 수 있지만, 각종 규제 및 절차, 검증 강화로 인한 부담이 높아지는 경우, 당사의 사업에 부정적인 영향을 미칠 수 있습니다.
| [제약ㆍ바이오산업과 관련된 주요법령 및 규제] |
| 국가 | 법규 | 주요내용 |
|---|---|---|
| 대한 민국 |
약사법 |
- 의약품의 제조, 수입, 특허권의 등재, 판매, 취급 등에 관한 전반적인 규제 - 관련 내용을 위반하는 경우 행정처분(허가 취소 등) 또는 형사처벌(징역 또는 벌금형) 부과 |
| 국민건강보험법 | - 국민의 질병, 부상에 대한 예방, 진단, 치료, 출산 및 건강증진에 대한 보험급여를 실시 | |
| 생명윤리 및 안전에 관한 법률 | - 인간과 인체유래물 등을 연구하거나 취급할 때 인간의 존엄과 가치를 침해하거나 인체에 위해를 끼치는 것을 방지하도록 규정 | |
| 제약산업 육성 및 지원에 관한 특별법 | - 제약산업 발전기반 조성 및 경쟁력 강화 촉진을 위해 5년 마다 지원 종합계획을 수립하도록 규정 | |
| 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 | - 첨단재생의료의 안전성 확보, 기술 혁신, 실용화에 필요한 사항 규정 - 첨단바이오의약품의 품질, 안전성, 유효성 확보, 제품화 지원에 필요한 사항 규정 |
|
| 생물학적 제제 등의 제조ㆍ 판매관리 규칙 |
- 생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품, 유전자재조합의약품, 세포배양의약품, 세포 치료제, 유전자 치료제 및 이와 유사한 제제의 제조 및 판매 관리 규제 | |
| 식품ㆍ의약품분야 시험ㆍ검사 등에 관한 법률 |
- 식품ㆍ의약품분야의 시험ㆍ검사 및 시험ㆍ검사기관의 관리 등에 관한 사항을 규정 | |
| 산업기술의 유출방지 및 보호에 관한 법률 |
- 산업기술의 부정한 유출 및 침해 방지 및 보호 규정 | |
| 특허법 | - 공동출원, 통상실시권, 특허권 침해 등에 관하여 규정 | |
| 실용신안법 | - 특허법에서 규율하지 않는 실용적인 고안을 보호, 장려 | |
| 부정경쟁방지 및 영업비밀보호에 관한 법률 | - 고객사의 영업비밀을 부정하게 사용하거나 공개하는 행위 규제 | |
| 하도급거래 공정화에 관한 법률 |
- 위탁받은 사업을 재위탁하는 경우 관한 규제 |
또한, 국내는 단일보험자(국민건강보험공단)에 의한 전국민 건강보험제도를 운영하고 있는 상황으로, 건강보험의 지속가능성 제고와 적정수준의 국민의료비 유지, 불법 리베이트 차단 등의 목표 하에 약가에 대해 정책적 개입이 이루어지고 있습니다. 국내의 약가 사후관리제도는 대내외 보건의료 환경변화에 의하여 수 차례 변화되어, 현재는 실거래가 조사에 의한 약가 인하, 사용량-약가 연동 협상, 급여범위 확대 시 약가인하, 제네릭의약품 등재 시 오리지널의약품의 약가 인하 등의 제도가 운영되고 있습니다. 약가는 산업 정책과 보건의료 정책이 상충하여 변동성이 상존해 있는 상황으로, 현재 제네릭 약가 차등제가 시행 예정되어 있는 상황입니다. 이러한 점진적인 약가 인하 정책은 제약산업에서 간과할 수 없는 중요 요인이며, 당사의 사업에도 부정적인 영향을 미칠 수 있습니다.
| [약가 인하 정책 추이] |
|
시기 |
인하제도 |
내용 |
|
2000년 ~ 2009년 |
실거래가약가인하 (표본조사) |
표본조사(전국 80개 요양기관)를 통해 의약품 청구 실태 조사 후 약가인하 |
| 2002년 ~ 2012년 |
약가 재평가 |
최초 상한금액 산정이후 3년마다 7개국 조정 평균가를 |
| 2007년 ~ 2014년 |
기등재 목록정비 |
2007년 선별등재제도로 전환하면서 기존약재의 경우 20% |
| 2012년 |
일괄 약가인하 |
상한금액대비 53.55%수준까지 일괄 약가인하 |
| 2016년 ~ |
실거래가약가인하 (전수조사) |
유통정보센터 유통정보를 근거로 가중평가가격 까지 약가 인하 |
|
현행 |
특허만료 약가인하 |
개별약제 특허만료시 1년간 70%, 1년 후 53.55%로 약가인하 |
|
현행 |
사전 약가인하 |
개별약제 급여기준 확대 이전에 협의를 통하여 약가인하 |
|
현행 |
사용량 약가연동 |
개별약제 약가와 사용량을 연계하여 등재 후 사용량이 일정 % 증가할 때 약가 인하 |
당사는 내부에 담당 인력과 외부 전문가들을 통하여 국내 및 해외 제약 산업 정책 및 규제 환경을 지속적으로 모니터링하고 있으며, 각국의 규제 당국과의 소통을 통해 정책 및 규제 환경의 변화에 효과적으로 대비하기 위해 최선의 노력을 다하고 있습니다. 당사는 사업관련 법규 개정 및 제정시 당사의 석/박사급 전문 인력이 검토하고 외부 법무법인의 법률 자문을 통해 현행 법률에 대응하고 있습니다. 당사가 자문을 받고 있는 법무법인은 제약,바이오,헬스케어 등 분야에 특화된 법률 서비스를 제공하고 있으며, 약사법 및 사업제안, 임상시험, 라이센스, 공동사업 수행 등 자문을 제공하고 있습니다.
그럼에도 불구하고 국내를 포함한 주요 국가에서의 제약 산업 관련 정책이 비우호적 분위기로 전환되거나 규제가 강화되는 경우, 당사의 사업에 부정적인 영향을 미칠 수 있습니다.
한편, 국내를 비롯한 미국, 유럽 등 글로벌 선진국에서는 제약·바이오 산업을 국민의 건강을 증진하고 일자리와 고부가가치를 창출하는 핵심 기간산업이자 미래 신성장 동력 산업으로 인지하고, 제약ㆍ바이오 산업에 대한 우호적 정책을 펼치고 있는 상황입니다.
국내 정부의 경우, 한-미 FTA 발효, 약가제도 개편 등 제약산업의 환경 악화로 2012년 제약산업 육성대책 마련 필요성이 제기되었으며, 제약산업 발전기반 조성 및 국제 경쟁력 강화를 촉진하기 위하여, 2012년 '제약산업 육성 및 지원에 관한 특별법'을 시행하였습니다. 이에 따라 2013년부터 5년 단위의 제약산업육성ㆍ지원 종합계획과 1년 단위의 제약산업육성ㆍ지원 시행계획을 수립ㆍ시행하여 세부 과제를 추진하고 있습니다. 또한 국내 정부는 2019년 5월, 바이오헬스 분야 기술개발, 인허가, 생산, 시장출시 등 전주기에 걸쳐 단계별 지원내용을 담고 있는 '바이오헬스 산업 혁신전략'을 발표하였습니다. 이러한 정부 방침에 지방자치단체들도 바이오 산업을 지역 역점산업으로 육성하기 위해 노력하고 있습니다.
또한 정부는 2023년 3월에 바이오헬스 글로벌 중심국가 도약을 위한 제 3차 제약·바이오산업 육성ㆍ지원 5개년 종합계획을 발표하였으며, 주요 골자는 블록버스터급 혁신 신약 2개, 수출 2배 달성 등 글로벌 6대 제약 강국 도약으로 민관 연구개발 투자 지속 확대와 차세대 유명 신기술 발굴 및 지원을 강화하며, 개방형 혁신 데이터 체제와, AIㆍ빅데이터를 활용한 신약개발 분야 R&D를 집중 지원하기로 결정하였습니다. 국가에서 이번 제 3차 제약바이오산업 육성ㆍ지원 종합계획을 통해 5년 후 달성하고자 하는 목표는 다음과 같습니다.
| [제3차 제약바이오산업 육성ㆍ지원 5개년 종합계획] |
 |
|
2023-2027 제약 바이오산업 육성지원 정부 종합계획 |
| 출처) 보건복지부 |
이에 더불어, 최근에는 재생의료 임상연구실시 및 첨단바이오의약품 패스트트랙을 골자로 하는 「첨단재생의료법(첨단재생의료 및 첨단바이오의약품의 안전ㆍ지원에 관한 법률)」이 국회 본회의를 통과하여 2020년 8월부터 시행된 후 몇 차례 개정을 거쳐 현재는 2025년 2월 21일 개정법이 시행되고 있습니다. 첨단바이오의약품은 세포치료제, 유전자체료제, 조직공학제 등 살아있는 세포ㆍ조직 또는 유전자를 원료로 제조한 의약품을 의미합니다. 첨단재생의료법은 첨단재생의료의 안전성 확보 체계 및 기술 혁신ㆍ실용화 방안을 마련하고, 약사법, 생명윤리법 등에 산재한 바이오의약품 관련 규제를 일원화하며, 신속허가제도 도입 및 안전관리체계를 구축하는 것이 핵심입니다. 본 법을 통해 재생의료 임상연구가 가능해져 의료기술의 기술경쟁력을 제고하여 희귀ㆍ난치 질환자에게 새로운 치료 기회를 제공할 수 있을 뿐만 아니라, 품목허가 검증 체계를 첨단바이오의약품 특성에 맞게 재편하여 맞춤형 심사, 우선 심사, 조건부 허가 등의 혜택이 가능할 것으로 기대됩니다.
| [개정 첨단재생바이오법 주요 내용] |
 |
|
개정 첨생법 주요내용 |
| 출처) 보건복지부 |
상기 언급된 제약 및 신약개발 산업에 대한 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에도 불구하고, 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 또한 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않을 경우, 규제 완화의 범위가 축소될 수 있습니다. 이러한 정부의 우호적인 정책 및 규제 완화의 변동 가능성은 당사의 사업에 부정적인 영향을 끼칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[파. (주)포베이커 지분 취득 및 합병에 따른 신규사업 진출 관련 위험] |
당사는 2024년 3월 7일 주식회사 포베이커의 주식 1백만주(지분율 100%)를 금 5억원에 취득하여 지배력을 획득하였으며, 2024년 3월 31일을 간주취득일로 하여 당사 연결 종속회사에 포함되었습니다. 이후, 당사는 (주)포베이커를 피합병회사로 하여 흡수합병(소규모합병)을 결정하였으며, 2024년 5월 14일을 합병기일, 2024년 5월 21일 합병등기 신청을 하며 흡수합병을 완료하였습니다. (주1), (주2)
| (주1) | (주)포베이커 취득 및 합병과 관련된 상세 내용은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-가." 부분에 기재되어 있으니 해당 부분을 참고하여 주시기 바랍니다. |
| (주2) | (주)포베이커는 당사에 포함되었으므로, 본 증권신고서 전반적 부분에 "(주)포베이커" 또는 "당사"로 표기하였으니, 오해 없으시기 바랍니다. |
(주)포베이커는 푸드콘텐츠 종합거래소로서의 사업모델을 지향하고 있으며 저가의 소비기한 임박 식재료, 베이킹 재료 및 외식 각종 소모품, 베이킹 기자재 등의 유통 판매업을 플랫폼을 통해 영위해 오고 있습니다. 이는 당사에서 기존에 영위해오고 있는 연구개발업과는 무관한 영역에 해당되며, 연구개발업과는 다른 산업 영역인 식품산업 및 온라인 식품 유통업과 관련된 사업위험 요소가 존재하오니, 투자자 여러분들께서는 아래에 기재된 사업위험을 반드시 유의하여 주시기 바랍니다.(주1)
| (주1) | 본 투자위험요소 본문에서는 (주)포베이커의 사업영역(식품산업, 온라인 유통판매업)과 관련된 산업의 전반적인 위험요소를 기재하였습니다. (주)포베이커의 사업적 위험 외에도, 당사는 기존 사업과 무관한 신규 사업에 진출함에 따라 이와 관련된 각종 회사의 운영 위험, 재무적 위험 등이 존재하며, 이와 관련된 상세 내용은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-가." 부분에 상세하게 기재되어 있으니 해당 부분을 참고하여 주시기 바랍니다. |
1) 식품산업의 성장성과 경기변동의 위험
식품산업은 인간이 삶을 영위해 나가는데 있어 가장 기초적인 요소인 식품을 공급한다는 측면에서 소비자들의 실생활과 밀접하게 관련되어 있으며, 이에 따라 국민소득수준 및 인구통계적 특성 변화 등에 따라 산업전반의 성장성이 영향을 받고 있습니다. 다만, 전형적인 내수 업종인 식품산업은 생활필수품으로서 수요탄력성이 낮기 때문에 과거 글로벌 금융위기를 기점으로 시작된 세계 경제 성장세 둔화, 국내외 물가상승 압력 등 악화된 경제 여건으로 인해 국내 소비심리가 위축된 상태가 지속된 상황에서도 음식료산업은 여타 산업에 비하여 낮은 경기 민감도를 보여주었습니다. 이와 같이 기본적인 식생활에 필요한 제품을 공급하는 산업의 특성에 따라 전반적인 산업 환경은 성장성은 낮지만, 비교적 안정적인 수준으로 판단됩니다.
식료품 제조업의 전체적인 출하지수 추이는 성장세 둔화 후 2023년부터 역성장을 하고 있습니다. 그러나 2018년과 2019년 식료품 제조업 출하지수는 전년대비 각각 1.19%, 3.46% 증가한데 반해, 2020년, 2021년 및 2022년은 전년대비 각각 0.92%, 0.10% 및 1.00% 증가하면서 성장이 정체된 모습을 보였습니다. 이 후 2023년 및 2024년은 전년대비 각각 -4.45%, -0.21%로 역성장하는 모습을 보이고 있습니다.
| [식료품제조업 출하지수 및 증감률] |
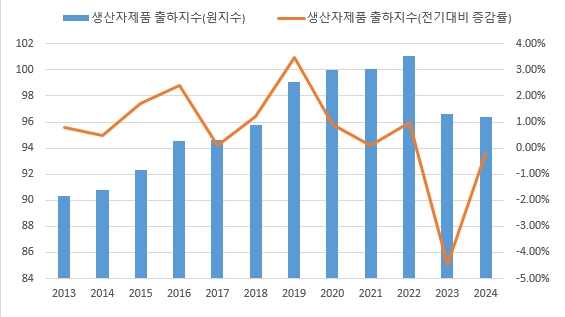 |
|
식료품제조업 출하지수 및 증감률 |
| 출처) 한국은행 경제통계시스템(ECOS) 주) 식료품 출하지수는 2020년의 출하지수가 100으로 이를 기준으로 함. |
식료품제조업 출하지수 증감률과 GDP성장률은 비교적 상관관계가 높은 모습을 보이고 있습니다. 그러나 금융위기 여파 및 코로나19 특수의 2019년과 2020년을 제외하고 동 출하지수 증감률은 GDP 성장률 대비 저조하였으며 이는 식료품 산업의 구조적 성장 정체로 확인됩니다.
| [식료품제조업 출하지수 증감률 및 GDP성장률] |
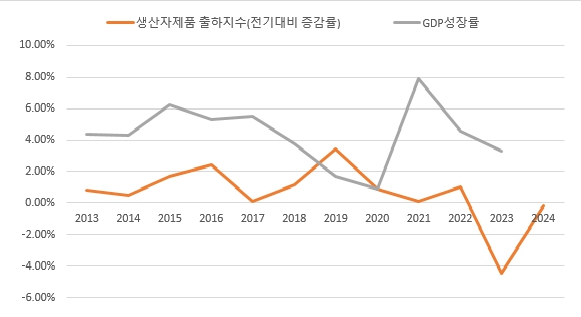 |
|
식료품제조업 출하지수 증감률 및 gdp성장률 |
| 출처) 한국은행 경제통계시스템(ECOS) 주1) 식료품 출하지수는 2020년의 출하지수가 100으로 이를 기준으로 함 주2) 2024년 GDP 성장률은 집계 전 |
식료품업의 기업경기 실사 지수를 살펴보면, 식료품업의 업황실적과 가동률실적은 등락이 반복하고 있으며 2020년까지 우하향하는 모습을 보이다가 2021년부터 경기 활황 기대감이 조성되면서 회복세를 보였습니다. 하지만 2023년 하반기부터 식료품업의 업황실적과 가동률실적은 다시 우하향하는 모습을 보이며, 경기 둔화 및 침체에대한 불안감이 커지고 있는 상황입니다.
| [기업경기 실사 지수(식료품업)] |
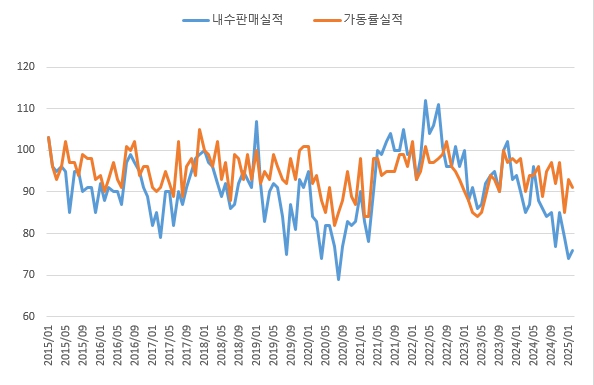 |
|
기업경기 실사지수(식료품업) |
| 출처) 한국은행 경제통계시스템(ECOS) |
한편, 통계청의 장래인구추이에 따르면 우리나라 인구는 2024년 5,175만명을 정점으로 점차 감소하여 2072년 3,623만명(1977년 수준)에 이를 것으로 전망됩니다. 또한 신생아 수 감소, 노령인구 증가 등의 인구구조 변화도 전망되어 식품 산업 성장성의 정체가 예상되고 있습니다.
| [연령별 인구구조] |
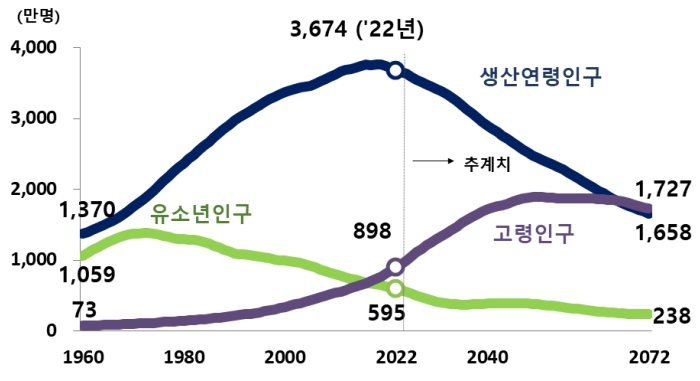 |
|
연령별 인구구조 |
| 출처) 장래인구추계, 통계청(2023.12) |
| [연령별 인구구성비] |
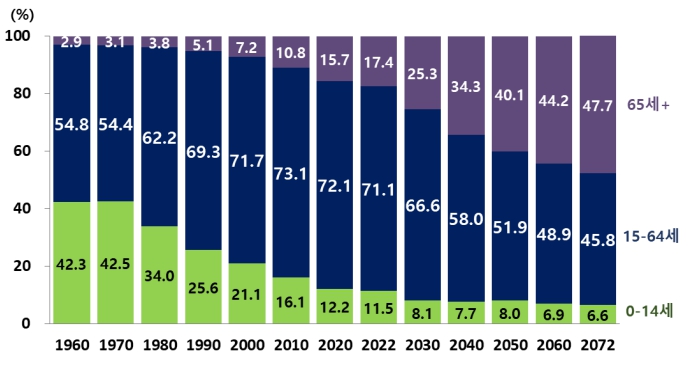 |
|
연령별 인구구성비 |
| 출처) 장래인구추계, 통계청(2023.12) |
이와 같이 식품산업은 인구구조의 변화 등 구조적으로 성장 정체기에 접어들고 있는 성숙기 산업의 모습을 보여주고 있습니다. 뿐만 아니라 웰빙 문화의 확산 등 소비자들의 건강에 대한 관심과 이로 인한 소비자 기호의 변화는 고가 웰빙 식품, 건강 보조식품 등 일부의 제품군을 통한 성장의 기회가 되기도 하지만 전반적인 음식료산업에 대해서는 양적 성장의 한계가 될 수 있는 위험요소가 되고 있습니다. 이러한 음식료산업 전체의 성장 정체는 당사의 실적에 부정적인 영향을 줄 수 있습니다.
상기와 같이 당사가 영위중인 식품산업은 생활 필수요소로서 타 산업 대비 안정적인 특징을 가지고 있으나, 장기화되고 있는 대내외 경기둔화 및 이에 따른 소비심리 둔화, 내수산업으로서의 성장한계 등에 따라 성장세의 일정부분 제약이 있을 수 있는 점 투자자 여러분께서는 유의하시기 바랍니다.
2) 온라인 식품 유통시장에서의 경쟁 심화 위험
국내 전체 식료품 소매 시장은 1인 가구 증가에 따른 HMR 등 가정간편식 시장의 성장, 건강에 대한 민감도 증가에 따른 식료품의 프리미엄화 등 다양한 성장 요인에 의하여 전체 온라인 거래액 중 식품 비중이 차지하는 비중이 점차 증가하고 있는 추세입니다.
|
[국내 온라인 거래 중 식품 비중 추이] |
||
| (단위: 조원) | ||
|
||
| 출처) 국가통계포털(KOSIS) | ||
| 주) 2024년은 잠정치임 |
당사의 주요 목표시장인 온라인 식료품/식품 시장은 2017년 8조원 규모에서 2024년 약 34.3조 규모로 약 3배 이상의 가파른 성장세를 보였습니다. 식품 소비의 트렌드가 오프라인에서 온라인으로 전반적으로 변화해나감에 따라 국내식료품 시장이 향후 견조한 성장세를 보일것으로 전망되는 가운데 온라인 채널의 비중은 보다 확대될 것으로 전망됩니다.
|
[국내 온라인 식품 시장 규모] |
||
| (단위: 조원) | ||
|
||
| 출처) 국가통계포털(KOSIS) | ||
| 주) 2024년은 잠정치임 |
식품은 과거 온라인 보다는 오프라인에서 구매하는 경우가 압도적이었습니다. 이는 구매 과정에서 정보를 제대로 파악하기 어려운 점과 배송 과정에서의 위생 문제 등에 대한 불안감이 존재했기 때문입니다. 특히 농축수산물의 경우 제품별로 품질 차이가 크기 때문에 오프라인 구매 비중이 절대적이었습니다. 그러나 콜드체인 기술의 발달로 배송 과정에서의 위생 문제가 개선되며 온라인을 통한 식품 구매에 대한 신뢰도가 높아졌고, 새벽배송 서비스 등으로 인해 편의성이 크게 증가하며 시장 규모가 비약적으로 성장하였습니다.
아래 OpenSurvey의 소비자 설문 결과를 살펴보아도 온라인을 통한 식품 구매가 사회 전반적인 트렌드로 자리 잡고 있는 것을 확인할 수 있습니다. 온라인에서의 식료품 구매빈도가 한달에 4.53회로 식료품 구매의 대세로 자리잡고 있습니다. 온라인으로 식료품을 구매하는 비중은 2023년과 유사한 가운데, 1인가구의 경우 온라인 위주로 구매하는 비중이 증가하는 것으로 나타났습니다.
|
[온라인을 통해 식품을 구매하는 가구 비중 추이] |
||
|
||
| 출처) 온라인 식료품 구매 트렌드 리포트 2025, OpenSurvey |
퀵커머스(식료품 및 각종 생필품 등을 주문한 후 몇 시간 이내에 받아볼 수 있는 서비스) 인지도는 2023년과 큰 변화는 없지만, 이용 경험은 2~3인 가구 중심으로 증가하였습니다. 2020년 이후 COVID-19로 인한 비대면 수요 증가로 온라인 식품 시장과 새벽배송 시장이 더욱 활성화되며 새벽배송의 편리함과 온라인 신선식품의 신선함에 대한 높은 신뢰도를 보다 많은 사람이 경험하게 되면서 온라인으로 식료품을 구매하는 것에 대한 인식이 많이 개선된 것을 알 수 있습니다.
|
[퀵커머스 인식 현황 및 구매빈도] |
||
|
||
| 출처) 온라인 식료품 구매 트렌드 리포트 2025, OpenSurvey |
하지만 온라인 식품 시장은 쿠팡, 컬리, 오아시스, 네이버 등 온라인 플랫폼을 기반으로 사업을 영위하는 온라인 사업자뿐만 아니라 오프라인 유통채널을 기반으로 온라인 시장으로 확장하고자 하는 오프라인 기반 사업자까지 진입하며 치열한 점유율 경쟁이 펼쳐지고 있습니다. 특히 그 중에서도 현재 당사가 주요 목표시장으로 집중하고 있는 온라인 식품 배송 시장은 높은 성장성으로 인하여 국내 유수의 유통 대기업을 비롯 다양한 경쟁사가 시장에 진입해왔습니다.
특히, 신선식품 배송 시장에는 ① 상품 소싱 역량, ② 재고관리 역량, ③ 콜드체인 물류 역량 ④ 브랜드 평판 및 인지도 확보 등의 다양한 기능의 조화가 요구되는 높은 시장 진입장벽이 존재하며, 이에 따라 신규진입자가 진입하여 수익성을 확보하기 어렵습니다.
이와 더불어 국내 온라인 쇼핑 시장 내 거래액 1위 사업자인 네이버, 그리고 코스트코 코리아 또한 CJ대한통운과의 협업을 통해 새벽배송 시장에 진출함에 따라 경쟁 강도는 보다 치열해질 것으로 전망됩니다.
이처럼 주요한 플레이어들이 시장에 신규 진입하는 등 경쟁 구도가 보다 심화되거나 경쟁업체가 획기적인 서비스를 출시하고 가격적인 측면에서 큰 메리트를 제공하여 당사에게 불리하게 작용하는 경우 당사의 기존 고객들이 이탈해 가격 경쟁, 고객 확보 경쟁으로 이어져 당사의 성장성과 수익성에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분께서는 반드시 이 점을 유의하여 주시기 바랍니다.
3) 관련 법규 및 규제 관련 위험
국민 소득 및 생활 수준의 전반적인 향상으로 건강 및 웰빙에 대한 사회적 관심이 높아지고 있습니다. 지속적으로 발생하고 있는 식품 관련 각종 사건 사고들로 인해 식품 안전과 위생에 대한 소비자 관심이 집중됨에 따라 식품의 보관, 유통 및 제조 등 모든 단계에 대한 규제 역시 강화되고 있습니다.
당사의 주요 사업은 온라인 채널(이커머스)을 활용한 B2C 유통업으로, 주력 상품 카테고리는 식품입니다. 이에 전자상거래 등에서의 소비자보호에 관한 법률, 정보통신망 이용촉진 및 정보보호 등에 관한 법률, 식품위생법, 식품안전기본법, 축산물위생관리법, 농수산물 원산지 표시에 관한 법률 등을 적용 받으며, 이를 준수할 의무가 있습니다.
| [당사 영업환경에서 적용 받는 주요 규제사항] |
| 구분 | 규제내용 |
| 전자상거래 등에서의 소비자보호에 관한 법률 | - 거래기록의 보존, 전자적 대금지급의 신뢰확보, 배송사업자 등의 협력, 사이버몰의 운영, 전자게시판서비스 제공자의 책임, 소비자에 관한 정보의 이용, 신원 및 거래조건에 대한 정보의 제공 등 |
| 정보통신망 이용촉진 및 정보보호 등에 관한 법률 | - 일부 예외적인 상황을 제외하고는 전자적 전송매체를 이용하여 영리목적의 광고성 정보를 전송하려면 그 수신자의 명시적인 사전 동의를 필수로 함 |
| 축산물위생관리법 | - 안전관리인증기준 준수, 소비자 등의 위생검사등 요청, 위생교육 등 |
| 농수산물 원산지 표시에 관한 법률 | - 농산물·수산물이나 그 가공품 등에 대하여 적정하고 합리적인 원산지 표시를 하도록 하여 소비자의 알권리를 보장하고, 공정한 거래를 유도함 |
| 식품안전기본법 | - 식품의 안전에 관한 국민의 권리·의무와 국가 및 지방자치단체의 책임을 명확히 하고, 식품안전정책의 수립·조정 등에 관한 기본적인 사항을 규정 |
| 식품위생법 | - 위해식품등의 판매 등 금지, 병든 동물 고기 등의 판매 등 금지, 기준ㆍ규격이 정하여지지 아니한 화학적 합성품 등의 판매 등 금지, 식품 또는 식품첨가물에 관한 기준 및 규격, 유독기구 등의 판매ㆍ사용 금지, 허위표시 등의 금지 등 |
| 식품위생법 HACCP (위해요소중점관리기준) |
- 식품을 만드는 과정에서 생물학적, 화학적, 물리적 위해요인들이 발생할 수 있는 상황을 과학적으로 분석하고 사전에 위해요인의 발생여건들을 차단하여 소비자에게 안전하고 깨끗한 제품을 공급하기 위한 시스템적인 규정 |
| - 식품위생법에 따라 빙과류 및 비가열음료 등 품목별로 식품제조·가공업소에 HACCP을 의무적용하고 있음 | |
| - HACCP을 적용받지 않고 의무적용대상 품목을 제조할 경우, 식품위생법 의거 적발횟수에 따라 영업정지 7일부터 최대 영업취소까지 행정처분을 받을 수 있음 | |
| PLS(Positive List System, 농약 허용물질 목록 관리)제도 | - 농산물별로 국내·외 등록된 농약에 대해서는 잔류허용기준을 설정하여 관리하고 그 외 잔류허용기준이 없는 농약은 일률적으로 0.01ppm을 적용하는 제도 |
| - 과·채가공품 제조에 사용되는 모든 국·내외 농산물 원료는 PLS제도에 적합한 원료만을 사용하여야 함 |
식품은 식품의약품안전처에서 제정한 식품위생법을 준수하여 제조, 유통, 판매되어야 하며, 가공식품은 식품 및 식품첨가물공전에서 명시한 식품별 기준 및 규격에 맞춰 제조하고 준수 여부를 검사받아야 합니다. 가공식품의 용기, 포장에는 '식품 등의 표시기준'에 따라 표시기준에 관한 사항 및 영양성분 등을 표시하여야 합니다.
또한, 1995년부터 국내 도입된 HACCP(Hazard Analysis Critical Control Point, 위해요소중점관리기준)은 식품을 만드는 과정에서 생물학적, 화학적, 물리적 위해요인들이 발생할 수 있는 상황을 과학적으로 분석하고 사전에 위해 요인의 발생여건들을 차단하여 소비자에게 안전하고 깨끗한 제품을 공급하기 위한 시스템적인 규정을 말합니다.
당사는 베이킹 재료 및 각종 소모품, 베이킹 기자재 등을 외부로부터 조달하여 일반소비자에게 판매하고 있기 때문에 식품 위생과 안전을 최우선 목표로 삼고 유통 상품의 신선도 및 품질 관리에 최선을 다하고 있습니다.
이커머스사업부의 사업계획은 다음과 같습니다. 먼저, 소분상품과 대용량 벌크상품군 확대, PB상품 개발로 경쟁사와 차별화를 통해 매출증대 및 수익성 개선을 추진하고자 합니다. 둘째, 비수기(여름) 시즌상품과 트렌드상품, 프리미엄 식료품을 선제적으로 발굴 및 조달하여 매출증대 계획 입니다. 셋째, 블로그, 인스타 등 소셜미디어를 활용한 SNS 마케팅을 통해 충성고객을 지속적으로 확보하여, 재구매율을 증대할 계획입니다. 마지막으로 유제품(버터, 치즈), 초콜릿 등 기후이상에 따라 가격 변동성이 큰 상품군을 선매입 재고보유를 통해 수익율을 극대화하려고 합니다.
하지만 온라인 판매 및 이커머스시장은 진입장벽이 낮아 다수의 경쟁자가 존재하며, 완전경쟁시장에 가까운 사업 구조를 가진 산업이기 때문에 당사의 계획대로 매출액이 증대되지 않거나, 증대되더라도 수익성이 악화될 수 있습니다. 또한 이커머스사업부의 매출액 비중이 증대됨에 따라 한국거래소의 주요 업종 변경의 가능성도 존재합니다. 유가증권시장 상장규정 시행세칙 제132조에 따르면 매출액 비율이 큰 사업의 업종으로 업종 변경을 하는 것이 일반적이나, 다만 해당기업의 업력, 향후 영업전망, 연결재무제표 등을 고려하여 업종변경을 하는 것이 필요하지 않다고 거래소가 인정하는 경우에는 업종변경을 하지 않습니다. 이에 따라 당사도 매출액 비율을 고려했을 때 이커머스 사업부와 관련된 업종으로 변경될 가능성이 존재하므로 이 점을 투자자 여러분께서 유의하시기 바랍니다.
| [유가증권시장 상장규정 시행세칙] |
|
제132조(업종분류 기준)① 규정 제166조에 따라 거래소는 시세정보 등의 공표를 위하여 주권상장법인의 업종을 분류할 수 있다. 이 경우 업종은 「통계법」에 따라 통계청장이 고시하는 한국표준산업분류(이하 "한국표준산업분류"라 한다)를 기준으로 별표 11에서 정하는 업종 및 코드분류표에 따라 대분류, 중분류 및 소분류로 분류하고 업종코드를 부여한다. ② 제1항의 업종분류는 다음 각 호의 방법으로 한다. <개정 2018. 12. 28.> 1. 주권상장법인의 사업 종류가 2 이상인 경우에는 매출액 비율이 큰 사업의 업종으로 하고, 이의 적용이 곤란한 경우에는 종업원 수, 설비 등을 고려하여 분류한다. 2. 사업 내용이 불분명하여 업종분류가 곤란한 경우에는 유사산업의 기타 업종으로 분류한다. 3. 제조업 또는 도소매업의 분류에 관한 한국표준산업분류 기준에도 불구하고 도소매업으로 분류하는 것이 적절치 않다고 거래소가 인정하는 경우 해당 제품의 제조업으로 분류할 수 있다. 4. 지주회사의 경우 한국표준산업분류에 따라 분류하되, 특정 산업부문의 매출액이 연결재무제표상 50% 이상인 경우에는 해당 산업의 업종으로 분류한다. 이 경우 지주회사는 업종분류와 관련한 경영계획 등 자료를 제출할 수 있으며, 거래소는 공익실현 및 투자자 보호 등을 종합적으로 고려하여 업종을 분류할 수 있다. ③ 업종변경은 해당 주권상장법인이 다음 각 호의 어느 하나에 해당되는 경우에 한다. 다만, 해당 주권상장법인의 업력, 향후 영업전망, 연결재무제표 등을 고려하여 업종변경을 하는 것이 필요하지 않다고 거래소가 인정하는 경우에는 업종변경을 하지 않으며 같은 중분류 내에서의 소분류 변경은 하지 않을 수 있다. <개정 2015. 7. 31.> 1. 한국표준산업분류의 개정에 따라 업종분류의 변경이 필요한 경우 2. 합병, 분할, 분할합병 또는 영업의 양도·양수 등으로 주된 사업내용이 변경된 경우 3. 주요제품의 매출액 비율 순위가 최근 2사업연도 계속하여 변동이 있고, 앞으로도 분류되어 있는 업종으로서의 신장이 기대될 수 없는 경우 4. 법률의 규정 및 주주총회에서 행한 결의에 따라 업종이 전환된 경우 5. 지주회사로 전환되거나 지주회사에 해당하지 않게 된 경우 6. 그 밖에 업종의 변경이 필요하다고 인정하는 경우 ④ 제3항에 따른 업종변경의 시기는 다음 각 호와 같다. 1. 제3항제1호, 제4호 및 제6호의 경우: 해당 사실이 확인된 때 2. 제3항제2호 및 제5호의 경우: 해당 사실의 확인을 위한 입증자료가 제출된 때 3. 제3항제3호의 경우: 해당 주권상장법인의 결산일이 속한 달의 다음 달부터 5개월이 되는 달의 최초 매매거래일 ⑤ 주권상장법인은 업종분류 심사에 필요한 자료를 사업보고서 제출 기한까지 거래소에 제출하여야 한다. ⑥ 제4항 및 제5항에도 불구하고 거래소는 외국주권등 상장법인의 본국 법령에 따른 사업보고서 제출 기한을 고려하여 업종의 변경 시기와 심사 자료의 제출 기한을 변경할 수 있다. |
당사는 관련 법규를 준수하며 영업활동을 진행하고 있으나, 농축수산물을 비롯하여 당사가 취급하는 식료품의 특성상 예기치 못한 식품 위생 관련 이슈가 발생할 수 있습니다. 유통 과정에서의 상품 변질 등 당사의 관리 책임 미비로 관련 법률에 저촉될 경우 벌금, 과태료, 영업 정지, 당사 브랜드 가치 훼손, 고객 보상 비용, 법률 비용의 발생 등을 초래할 수 있으며 이는 당사 사업에 부정적인 영향을 미칠 수 있으니 투자자분들께서는 이 점 유의하시기 바랍니다.
결론적으로 당사는 기존에 본사에서 영위하고 있던 사업과는 연관성이 낮은 사업에 신규 진출한 상황이므로, 해당 사업에서 발생 가능한 위험 요소들을 통제하는 데 있어서 기존 경영진들의 관련 산업군에서의 경험이 부족한 상황입니다. 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-가." 부분에 기재된 바와 같이, 이를 극복하고자 일부 인력을 승계하고, 사업 전개가 원활하도록 노력하고 있으나, 사업의 성패를 장담할 수 없고, 신규사업 진출이 당사에 악영향을 미치는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
2. 회사위험
| [가. 매출부진 및 지속적 손실 발생 위험] 당사는 매출이 부진한 가운데, 지속적으로 신약후보물질의 발굴과 보유 파이프라인의 적응증 증가를 위하여 다양한 비임상 및 임상시험을 준비하고 있으며 이에 따라 관련비용의 지출이 꾸준히 발생하여 2022년 영업손실 149.1억원, 2023년 영업손실 122억원, 2024년 영업손실 119.8억원이 발생하였습니다. 또한 영업 외적 측면에서도, 금융비용 등의 발생 영향으로 인해 2022년 당기순손실 228.7억원, 2023년 당기순손실 116.1억원, 2024년 당기순손실 122.6억원이 발생하는 등 지속적인 적자 구조를 면하지 못하고 있습니다. 따라서 당사의 파이프라인에서 임상 성공을 통한 기술이전, 상품화 성공 등의 성과를 이루어내지 못한다면 당사의 적자 구조를 개선하는 것은 불가능할 수 있으며, 자본력이 지속적으로 감소하여 지속적인 연구개발비용 등의 지출이 필요한 당사의 영업활동을 영위하는데 상당한 제약이 생길 수 있습니다. 또한 (주)포베이커의 지분 취득 및 합병과 관련하여, 이는 단기적으로는 당사의 기존 사업과는 무관한 분야의 신규사업 진출에 해당하며, 만일 신규사업에 대한 성과를 내지 못하거나 사업적 시너지를 중장기적으로 발생시키지 못할 경우 이는 당사 손익 내지 재무상태에 오히려 악영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [당사 손익 추이] |
| (단위 : 백만원) |
| 과 목 | 2024년 | 2023년 | 2022년 | |
|---|---|---|---|---|
| 매출 | 4,165 | 0 | 480 | |
| 위탁생산 | 358 | 0 | 480 | |
| 기술이전(BVAC-NEO) | 0 | 0 | 0 | |
| 이커머스사업부(식품 및 베이킹 기자재) | 3,807 | 0 | 0 | |
| 매출원가 | 3,460 | 0 | 325 | |
| 매출총이익 | 705 | 0 | 155 | |
| 판매비와관리비 | 9,199 | 7,159 | 7,180 | |
| 급여 | 2,061 | 2,283 | 2,234 | |
| 퇴직급여 | 287 | 312 | 319 | |
| 복리후생비 | 336 | 364 | 378 | |
| 여비교통비 | 10 | 21 | 11 | |
| 접대비 | 13 | 10 | 9 | |
| 통신비 | 10 | 9 | 10 | |
| 세금과공과 | 38 | 48 | 249 | |
| 지급임차료 | 159 | 116 | 76 | |
| 보험료 | 30 | 42 | 36 | |
| 차량유지비 | 7 | 5 | 4 | |
| 운반비 | 223 | 27 | 22 | |
| 교육훈련비 | 2 | 3 | 3 | |
| 도서인쇄비 | 1 | 1 | 1 | |
| 수도광열비 | 368 | 273 | 231 | |
| 소모품비 | 1,155 | 271 | 338 | |
| 지급수수료 | 1,631 | 889 | 830 | |
| 감가상각비 | 2,318 | 2,322 | 2,225 | |
| 무형자산상각비 | 1 | 0 | 0 | |
| 포장비 | 3 | 0 | 0 | |
| 대손상각비 | 269 | 0 | 0 | |
| 광고선전비 | 57 | 10 | 0 | |
| 주식보상비용 | 220 | 151 | 204 | |
| 경상연구개발비 | 3,487 | 5,039 | 7,886 | |
| 영업손익 | (11,980) | (12,198) | (14,911) | |
| 기타수익 | 29 | 86 | 153 | |
| 잡이익 | 23 | 4 | 153 | |
| 외환차익 | 1 | 82 | 0 | |
| 리스해지이익 | 5 | |||
| 기타비용 | 144 | 141 | 130 | |
| 잡손실 | 1 | 2 | 0 | |
| 외환차손 | 6 | 6 | 0 | |
| 기부금 | 137 | 133 | 130 | |
| 금융수익 | 1,072 | 2,281 | 956 | |
| 이자수익 | 448 | 633 | 956 | |
| 당기손익공정가치측정금융자산평가이익 | 0 | 213 | 0 | |
| 당기손익공정가치측정금융자산처분이익 | 39 | 113 | 0 | |
| 파생상품평가이익 | 396 | 1,027 | 0 | |
| 사채상환이익 | 189 | 294 | 0 | |
| 금융원가 | 1,235 | 1,639 | 8,932 | |
| 이자비용 | 472 | 1,264 | 1,628 | |
| 당기손익공정가치측정금융자산평가손실 | 37 | 0 | 525 | |
| 당기손익공정가치측정금융자산처분손실 | 0 | 0 | 9 | |
| 파생상품평가손실 | 726 | 375 | 6,769 | |
| 법인세차감전순손익 | (12,259) | (11,611) | (22,865) | |
| 법인세비용 | 0 | 0 | 0 | |
| 당기순손익 | (12,259) | (11,611) | (22,865) | |
| 후속적으로 당기손익으로 재분류 되지않는 항목 | (67) | 0 | 0 | |
| |
순확정급여제도의 재측정요소 | (67) | (49) | 241 |
| 토지의 재평가이익 | 0 | 11,974 | 0 | |
| 총포괄손익 | (12,326) | 314 | (22,624) | |
| (자료 : 당사 감사보고서) |
당사는 항암면역치료백신 기반기술인 CeliVax와 아데노바이러스 벡터 기반 감염병 예방백신 기반기술인 Ad5/35를 보유한 바이오제약기업으로, 2종의 기반기술을 활용하여 CeliVax 항암면역치료백신과 COVID-19 예방백신을 연구개발하고 있으며, 기술이전 또는 임상 성공 및 상품화 성공을 통한 매출 발생을 목표로 하고 있습니다. 또한 당사가 보유한 GMP시설을 활용한 CMO 사업 부문에서의 위탁 생산을 영위하고 있으며, 2024년 1분기 중 취득한 (주)포베이커 부문에서 베이커리 관련 개발 및 판매업을 영위하고 있습니다.
그러나 아직까지 백신 개발 부문에서는 매출 가시화가 이루어지지 않았고, GMP시설에서의 위탁생산 매출은 수주 여부에 따라 비정기적으로 발생하고 있으며, (주)포베이커 부문의 베이커리 매출은 2024년 1분기말 간주취득함에 따라 2024년 말 기준 당사 매출의 91.4%를 차지하고 있습니다.
매출이 부진한 상태에서, 임상 진행 등 연구개발 과정에서의 임상비용 지출, 지급수수료 지출 등 연구개발비용이 지속적으로 발생하고 있으며, 인건비, 유무형자산 투자 관련 감가상각비 등이 매년 고정적으로 발생함에 따라 영업손실 및 당기순손실 발생이 지속되고 있는 상태입니다. 따라서 투자자 여러분들께서는 아래와 같이 당사의 매출, 영업손실, 당기순손실 발생 추이에 대해 반드시 유의하여 주시길 바랍니다.
당사의 부문별 매출 현황을 살펴보면 다음과 같습니다.
1) 백신 개발 부문
당사는 2019년 코스닥시장 IPO 당시 항암면역치료제를 개발하는 기업으로서 다양한 BVAC 파이프라인 연구개발을 진행해 왔으며, IPO 당시 증권신고서상 대표주관회사인 삼성증권에서 추정한 당사의 파이프라인별 매출은 다음과 같았습니다.
| [IPO 당시 대표주관회사의 매출 추정 내역] |
| (단위 : 백만원) |
| 구분 | 2018E | 2019E | 2020E | 2021E | 2022E | 2023E |
|---|---|---|---|---|---|---|
| 제품 | - | - | - | 6,750 | 39,600 | 79,920 |
| BVAC-C (자궁경부암) | - | - | - | 6,750 | 8,640 | 10,440 |
| BVAC-C (두경부암) | - | - | - | - | - | 7,560 |
| BVAC-B (위암) | - | - | - | - | 30,960 | 42,300 |
| BVAC-B (유방암) | - | - | - | - | - | 8,820 |
| BVAC-P (전립선암) | - | - | - | - | - | 10,800 |
| BVAC-M (흑색종) | - | - | - | - | - | - |
| BVAC-Neo | - | - | - | - | - | - |
| 기술이전 | - | 5,000 | 5,000 | 13,000 | 3,000 | - |
| BVAC-C (자궁경부암) | - | - | 2,000 | - | - | - |
| BVAC-C (두경부암) | - | - | - | - | - | - |
| BVAC-B (위암) | - | - | 3,000 | - | - | - |
| BVAC-B (유방암) | - | - | - | - | - | - |
| BVAC-P (전립선암) | - | - | - | 3,000 | - | - |
| BVAC-M (흑색종) | - | - | - | - | 3,000 | - |
| BVAC-Neo | - | 5,000 | - | 10,000 | - | - |
| (자료 : 당사 증권신고서(지분증권)-2019.01.24) |
그러나 2020년 3월 세계보건기구(WHO)의 코로나19 팬데믹 선언 후 사회적 거리두기 4단계 시행으로 방역조치가 강화됨에 따라 항암면역치료제 BVAC 파이프라인 연구개발에 필요한 임상시험 대상자의 모집, 방문 일정 수립 등 임상시험 진행이 원활하게 수행되지 못하였고, 각 파이프라인별 상세한 매출 지연 사유는 다음과 같습니다.
| [BVAC 파이프라인별 매출 지연 사유] |
| 구분 | 매출 지연 사유 |
|---|---|
| BVAC-C (자궁경부암) |
자궁경부암 대상 항암면역치료제 BVAC-C는 임상 2상 종료 후 2021년 조건부허가를 통한 매출 시현을 목표로 하였으나, 최근 서로 다른 기전의 의약품과 병용투여를 통해 항암면역시장에 진입하는 추세가 증가함에 따라, 국내외 경쟁력 및 시장성을 고려하여 개발 전략을 재수립하였습니다. 당사는 현재 진행 중인 병용투여 연구자 주도 임상시험을 선제적으로 진행한 후, 그 시험 결과를 기반으로 BVAC-C의 향후 후기 임상 2b/3상 개발 전략을 수립하여 임상 2b상 진행 후 조건부허가를 신청할 계획입니다. 이에 기존 계획했던 조건부허가를 통한 매출 시현이 지연되고 있습니다. 또한 BVAC-C 의 임상 2상 시점 전후 또는 임상 개발 전략을 고려하여 기술 이전을 계획하였으나, 코로나19로 인한 임상시험 대상자 모집 지연 및 개발 전략 변경으로 기술 이전에 따른 매출 시현이 지연되고 있습니다. 현재 당사는 향후 기술 이전을 위해 국제적 바이오 컨퍼런스, 학회 등을 지속적으로 참석하며 국내외 제약·바이오기업과 네트워크를 구축해 나가고 있습니다. |
| BVAC-C (두경부암) |
당사는 BVAC-C의 자궁경부암 환자 대상 조건부허가를 기반으로 두경부암으로 적응증을 확장하여 2023년 조건부허가를 통한 매출 시현을 목표로 하였으나, 자궁경부암 대상 BVAC-C의 임상시험의 개발 전략이 수정됨에 따라 적응증 확장을 위한 임상시험이 지연되었습니다. 현재 당사는 대량 생산에 최적화된 아데노바이러스 벡터로 구성한 BVAC-E6E7 파이프라인을 개발하여 비임상시험을 진행 중이며, 두경부암 환자를 대상으로 2023년 4분기 임상 1/2a상 시험계획(IND)를 신청하여 2024년 4분기에 임상 1/2a상 시험계획(IND) 승인을 완료하였습니다. |
| BVAC-B (위암) | 당사는 2018년 2월 위암 대상 BVAC-B 임상 1상 시험을 개시하고 2020년 1월 임상 1상 시험을 종료하였습니다. BVAC-B의 임상 2상 진행 후 조건부허가 및 기술이전를 통한 매출이 발생할 것으로 예상하였으나, 코로나19 팬데믹 대응 및 국내 백신 주권 확보를 위해 한정된 자원과 인력을 기반으로 코로나19 백신 파이프라인 개발에 주력함에 따라 BVAC-B의 임상 2상 진행을 일시적으로 유보하였습니다. |
| BVAC-B (유방암) | 당사는 BVAC-B 위암 환자 대상 조건부허가를 기반으로 유방암 환자 대상 적응증 확장을 통해 2023년 조건부허가를 통한 매출 시현을 목표하였으나, BVAC-B 파이프라인 개발이 연기됨에 따라 유방암 대상 BVAC-B 매출 시현이 지연되고 있습니다. |
| BVAC-P (전립선암) | 당사는 2019년 3월 식품의약품안전처에 전립선암 대상 BVAC-P의 임상 1상 시험계획(IND)을 신청하고 2020년 3월 최종 승인받았으나, 코로나19 백신 파이프라인 개발에 주력함에 따라 BVAC-P 임상 1상 개시를 일시적으로 유보하였습니다. 이에 기존 임상 1상 시험 결과를 기반으로 기술이전 및 임상 2상 진행 후 조건부허가를 통한 매출 시현이 지연되고 있습니다. |
| BVAC-M (흑색종) | 당사는 흑색종 대상 BVAC-M의 임상 1상 진입 후 시험 결과를 기반으로 2022년 기술이전을 진행할 계획이었으나, 코로나19 백신 신규 파이프라인 도입으로 인해 임상 1상 시험 계획(IND) 신청이 지연되었습니다. 당사는 현재 비임상시험 등 BVAC-M의 임상 1상 IND 신청을 위한 자료를 준비하고 있으며, 2024년 상반기 식품의약품안전처에 임상 1상 IND 신청을 목표하고 있습니다. |
| BVAC-NEO | 당사는 2019년 개인면역항암치료제 BVAC-NEO에 대한 기술이전을 통해 매출 시현을 목표로 하였으나 잠재 파트너사 확보, 선정, 계약 조건 협의 과정이 계획 대비 지연되었으며, 2021년 LG화학과 BVAC-NEO에 대한 기술이전 계약을 체결하였습니다. 당사는 현재까지 기존 예상한 총 150억원 기술이전 매출 대비 감소한 계약금 909백만원을 BVAC-NEO 기술이전 매출로 인식하였으나 향후 개발, 허가, 판매에 따른 마일스톤 최대 182,500백만원을 수령할 계획이며, 판매에 따른 로열티 수수료도 별도로 지급받을 예정입니다. |
| (자료 : 당사 제시) |
한편, 코로나19 팬데믹 대응을 위해 자체 원천 기술인 아데노바이러스 벡터 플랫폼을 활용하여 코로나19 백신 신규 파이프라인 개발에 회사의 모든 역량을 집중함으로써 기존 파이프라인 개발 계획이 변경 또는 지연된 영향도 있습니다.
이에 따라 BVAC 파이프라인의 조건부허가 및 기술이전을 통한 매출 실현 목표가 지연되고 있으며, 현재 당사가 집중하고 있는 주요 각 파이프라인별 현황은 다음과 같습니다.
| [당사 파이프라인 현황 요약표] |
|
파이프라인 |
주요 적응분야 |
개발단계 |
|---|---|---|
|
BVAC-C |
인유두종바이러스 16형 및 18형 암항원을 발현하는 모든 암 (예) 자궁경부암, 항문암, 성기암 등 |
[국내] 자궁경부암 |
| BVAC-E6E7 |
인유두종바이러스 16형 및 18형 암항원을 발현하는 모든 암 (예) 두경부암, 항문암, 성기암 등 |
[국내] 두경부암 임상 1/2a상 IND 승인 |
|
BVAC-B |
HER2/neu 암항원을 발현하는 모든 암 (예) 위암, 유방암 등 |
[국내] 위암 |
|
BVAC-P |
PAP 또는 PSMA 암항원을 발현하는 모든 암 (예) 전립선암, 뇌종양 등 |
[국내] 전립선암 |
|
BVAC-M |
MAGE-A3 또는 GP100 암항원을 발현하는 모든 암 (예) 흑색종, 폐암, 대장암, 췌장암 등 |
[국내] 흑색종 |
|
BVAC-Neo |
개인별로 특화된 암항원인 Neo-antigen이 발굴된 모든 암 |
다양한 고형암 |
|
AdCLD-CoV19 /AdCLD-CoV19-1 |
COVID-19 (코로나19 바이러스 감염증) 예방 | [국내] AdCLD-CoV19: 임상 1/2a상 [국내, 국외] AdCLD-CoV19-1: 임상 2b상 조기종료 |
| AdCLD-CoV19-1 OMI | COVID-19 (코로나19 바이러스 감염증) 예방 (추가 접종 백신) | [국내외] 임상 3상 |
| (자료) : 당사 제시 |
당사는 CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 항암면역치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 항암면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용은 최소화된 의약품입니다.
CeliVax 항암면역치료백신 (Cancer Therapeutic Vaccine) 기반기술은 면역항암의약품 중 하나인 세포기반 항암면역치료백신 기술입니다. 환자에서 유래한 자가 B세포 및 단구를 항원제시세포로 이용하며, 암항원과 면역증강제(α-galactosyl ceramide, α-GC)를 함유한 유전자 도입 세포치료제 또는 세포치료제라 할 수 있습니다.
인체 내에서 항암 작용을 나타낼 수 있는 적응면역계와 선천면역계를 동시에 활성화하여 강력한 약효를 나타내는 것이 특징입니다. 즉, 적응면역계에서 주요 기능을 하는 세포독성T세포를 활성화하고 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계에서 주요 기능을 하는 자연살해세포와 자연살해T세포를 활성화하여 항암면역반응을 일으킵니다. 또한 혈액 내 풍부히 존재하는 B세포 및 단구세포를 활용하기 때문에 수지상세포 백신보다 충분한 양을 투여하여 수지상세포와 동등한 수준의 항원 제시 효과를 유도할 수 있습니다. B세포를 활용한 치료백신의 임상시험이 현재 진행중에 있고, 아직 치료 대상 환자수가 제한적인 점이 있기 때문에 B세포를 이용한 기술의 우수성, 보편성을 확보하는데 시간이 더 소요될 것으로 판단됩니다.
CeliVax가 유도하는 면역 반응은 하기 그림에서와 같이 적응면역계 반응으로 CD8+ T 세포 및 CD4+ T 세포 반응 (그림 [3])과 항원 특이적 항체 분비 반응 (그림 [4])이 있고, 자연살해 세포(그림[2]) 및 자연살해 T 세포 (그림 [1])등 선천면역계 반응도 유도합니다. 또한, 종양미세환경 내에서 기능이 저하된 T세포 (그림 [5]) 및 NK세포 (그림 [6])의 기능을 복원하여 재활성화함으로써 암세포를 공격하도록 합니다. 면역체계의 활성화로 인해 기억면역반응을 일으켜 암의 재발을 방지할 수 있는 기전도 CeliVax기술의 특징입니다.
| [CeliVax 기반 파이프라인의 항암면역작용 활성화 유도 작용기전] |
 |
|
celivax 기반 파이프라인의 항암면역작용 활성화 유도 작용 기전 |
| 출처) 당사 제시 |
또한, 하기 그림에서와 같이 CeliVax가 유도하는 적응면역계 반응과 선천면역계 반응이 항원-비균질성 암세포의 제거에 직접적으로 관여합니다. 특히 선천면여계 반응을 통해 암세포가 가지는 주요 면역회피기전 중 MHC-I 소실을 극복하여 암세포를 살상할 수 있습니다.
| [CeliVax 기반 파이프라인의 항원-비균질성 암세포의 제거기전] |
 |
|
celivax 기반 파이프라인의 항원-비균질성 암세포의 제거기전 |
| 출처) 당사 제시 |
1세대 세포독성 항암제, 2세대 표적항암제의 뒤를 이어 3세대 면역항암제가 유효성 및 안전성 측면에서 암환자 치료의 새로운 대안으로 떠오르고 있습니다. 면역항암제는 선별된 환자에서 장기간의 항암약효와 생존기간 연장이 증명되어 항암치료의 중요한 축으로 역할을 하고 있고, 현재 면역관문저해제 등 항체류, CAR-T (Chimeric Antigen Receptor T cell)와 같은 유전자 도입 세포치료제, 항암바이러스, 수지상세포 백신 등이 시판 중입니다. 하지만 이들 제품들도 낮은 치료반응성과 치료비 부담, 공정상의 어려움 등 시장의 요구에 완벽하게 부응하지 못하고 있는 상황이며 이에 CeliVax와 같은 차세대 항암면역치료백신 개발은 단독으로 사용, 또는 기존 제품들과의 병용을 통해 시장의 미충족 의학적 수요를 충족시키기 위해 노력하고 있습니다.
CeliVax 기술은 면역 세포를 활용하여 환자의 면역반응을 유도하는 백신의 형태를 가진 치료제로, 암항원 유전자를 암종에 따라 교체하는 방식으로 다수의 파이프라인을 신속하게 개발할 수 있습니다. 동일한 원천기술을 기반으로 확장된 파이프라인을 구축하기 때문에 비임상시험 단계의 유효성, 독성시험, 비임상 시제품 제조 및 품질 시험 방법과 자료 구축 등이 동일한 방식으로 진행되므로 선도제품 이후의 개발 제품들은 개발속도를 가속화할 수 있는 장점이 있습니다.
대부분의 암종에서 환자특이적으로 과발현하는 암항원이 밝혀져 있는 경우가 많고, 이렇게 과발현된 암항원이 존재하는 암종에는 CeliVax 원천기술을 적용할 수 있습니다.
CeliVax 기술이 적용된 제품들은 타 세포 기반 치료제에 비하여 제조 비용이 상대적으로 저렴하다고 볼 수 있으나, 환자 개인 맞춤으로 개별 롯드(lot)를 생산해야 하는 자가세포 기반 세포치료제의 특징에 따라 생산 비용이 고가에 해당하며, 인체세포를 처리할 수 있는 허가 받은 GMP 시설을 통해서만 제조할 수 있다는 제약점을 가지고 있습니다. 또한 환자의 면역세포를 원료로 사용하기 때문에 환자의 면역세포를 채취하는 병원과 근접한 위치에 GMP 시설이 위치해야 원활한 제조가 가능하다는 단점이 있습니다.
최근 유전자세포치료제 CAR-T가 높은 반응성과 완치율로 미국에서 허가를 받아 $475,000에 판매 중입니다. T세포 치료제인 CAR-T와 함께 면역항암제 시장을 이끌 신기술로 neo-antigen (신항원)을 사용한 항암면역치료백신이 주목받고 있으며, CeliVax 기술은 neo-antigen 유래 neo-epitope를 암항원으로 사용하여 개인 맞춤형 정밀의료 기반 항암치료가 가능한 기반기술입니다.
2025년 3월말 기준 BVAC 파이프라인별 현황 및 투자계획은 다음과 같습니다. 두경부암 대상 BVAC-E6E7의 임상 1/2a상 시험의 수행을 위하여 각 임상시험 수행 병원에서 IRB 신청을 포함한 임상 시험 수행을 위한 행정적인 절차를 진행하고 있으며, 대략 2025년 10월 투약을 시작하여 2027년 12월 전체 환자 모집 및 투약 완료를 목표로 계획하고 있고, 약 26억의 자금이 임상시험을 위하여 사용될 것으로 판단됩니다. BVAC-C는 임상 2b상 시험을 진행하기 위하여 필요한 임상 전략을 검토하고 있으며 2027년 4분기에 임상 2b상 IND를 신청하고, 2031년 3분기에 임상시험 완료를 계획하고 있습니다. BVAC-Neo는 현재 비임상 연구를 지속하고 있고, 2026년 2분기까지 약 6억의 연구비를 투자할 계획입니다. 임상 1상 시험을 위한 식약처 IND 신청을 약 2027년 4분기를 예상하고 있습니다.
각 파이프라인별 최소 개발인력은 현재 진행중인 개발 단계에 따라, BVAC-E6E7은 임상 시험 관리 및 임상시험용 의약품의 특성분석을 위한 연구인력 4명, BVAC-C는 임상 2b상 시험을 위한 CMC 개발 연구인력 3명, BVAC-Neo는 비임상 유효성 및 독성/분포 분석을 위한 연구인력 3명이 필요할 것으로 판단하고 있습니다. 한편, BVAC-B, BVAC-P와 BVAC-M은 개발 역량을 BVAC-E6E7, BVAC-C, BVAC-Neo에 중점적으로 집중하고자 추가적인 투자는 임시로 중단한 상태입니다.
당사의 각 파이프라인별 상세 현황은 다음과 같습니다.(주1)
| (주1) | 당사의 각 파이프라인별 상세 현황은 본 증권신고서 "제1부.III.투자위험요소-1.사업위험" 내 전반적인 부분에도 상세히 기재되어 있으며, 이와 관련된 전반적인 사업 관련 위험요소들이 기재되어 있습니다. 투자자 여러분들께서는 해당 부분을 참조하여 주시기 바랍니다. |
① BVAC-C
| 구분 | 바이오 신약 | ||||||||||||||||||||||
| 적응증 | 인유두종바이러스 (HPV) 16형 및 18형 암항원 발현 모든 암종(자궁경부암, 두경부암, 항문암, 성기암 등) | ||||||||||||||||||||||
| 작용기전 | BVAC-C는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화를 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. | ||||||||||||||||||||||
| 제품의 특성 | BVAC-C 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 형태 측면에서 세계적으로 퍼스트-인-클라스 (First-in-class), 퍼스트-인-카인드 (First-in-kind) 의약품으로, 세계시장을 지배할 수 있는 잠재력을 가지고 있음. 임상 1상에서 안전성과 경쟁제품 대비 우월한 예비유효성을 확인하였음. | ||||||||||||||||||||||
| 진행경과 |
|
||||||||||||||||||||||
| 향후계획 | BVAC-C는 현재 면역관문저해제와 병용투여 임상 2a상 연구자주도 임상시험을 진행 중임. 자궁경부암을 적응증으로 조건부허가를 신청할 계획임. 이를 위해 경기도 성남시 SK V1 TOWER 에 상업용 GMP 생산시설을 완공하였음. | ||||||||||||||||||||||
| 경쟁제품 | 인유두종바이러스 유래 암종을 적응증으로 하는 항암면역치료백신은 상품화된 제품은 없음. 현재 네덜란드 ISA Pharmaceuticals의 HPV16 펩타이드 백신 ISA101b, 미국 PDS Biotech의 HPV16 펩타이드 백신 PDS0101, 노르웨이 Nykode Therapeutics의 HPV16 DNA 백신 VB10.16 등 이 화학적 항암제 또는 면역관문차단제와 병용요법으로 임상 2상을 진행 중임. | ||||||||||||||||||||||
| 관련 논문 등 | - Phase I Study of a B Cell-Based and Monocyte-Based Immunotherapeutic Vaccine, BVAC-C in Human Papillomavirus Type 16- or 18-Positive Recurrent Cervical Cancer. J Clin Med.2020 Jan 5;9(1) - Activation of NKT cells in an anti-PD-1-resistant tumor model enhances anti-tumor immunity by reinvigorating exhausted CD8 T cells (IF 9.28) Cancer Res. 2018 78(18):5315 - IL-21-mediated reversal of NK cell exhaustion facilitates anti-tumour immunity in MHC class I-deficient tumours (IF 11.47) Nature Communications 2017. 8:15776 - Efficacy and safety of BVAC-C in HPV type 16- or 18.positive cervical carcinoma who failed 1st platinum-based chemotherapy: a phase I/IIa study. Frontiers in Immunology 2024. 15:1371353. |
||||||||||||||||||||||
| 시장규모 | 당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-C의 경우, 현재는 자궁경부암에 대한 임상을 진행 중이나 향후 성기암, 항문암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
||||||||||||||||||||||
| 기타사항 | 2018년 ESMO 진행사항 발표, 2020년 AACR 초록 채택 및 온라인 구두 발표 2021년 ASCO 구두발표 2024년 ASCO 병용투여 연구자주도 임상시험 중간결과 구두 발표 2025년 미국부인종양학회(SGO)서 연구자주도 임상시험 중간결과 업데이트내용 구두 발표 |
○ 인유두종바이러스 유래 암
BVAC-C는 인유두종바이러스 (HPV, Human papilloma virus) 유래 모든 암종을 적응증으로 하는 항암면역치료백신으로 현재 임상 2상 개발 중입니다. HPV는 인체감염 시 사마귀, 자궁경부암 등의 발생 원인이 되는 파포바 바이러스과에 속하는 이중 나선상 DNA 바이러스입니다. 현재까지 알려진 100여 종의 인유두종 바이러스 중에서 40여종이 생식기관에서 발견되며, 자궁경부 상피 내에 병적인 변화를 일으키는 것으로 알려져 있습니다. 이 중 고위험군 (high-risk group)인 발암성 인유두종 바이러스가 자궁경부암과 연관성이 높다고 알려져 있으며, 발암성 인유두종 바이러스 중 16, 18형이 가장 중요하고 전세계적으로 70% 이상의 자궁경부암에서 발견됩니다. 또한, 두경부암, 항문암, 성기암, 질암 등을 일으킵니다. HPV 바이러스의 암화 유전자 (Oncogene)인 E6와 E7이 이러한 암 발병의 원인임과 동시에 암항원입니다. 자궁경부암 암세포는 E6, E7을 발현하고 있으므로 E6와 E7을 작용점으로 하는 면역치료가 성공할 가능성이 높습니다.
○ BVAC-C의 개발
BVAC-C는 CeliVax™ 기반기술을 이용하여 제조한 인유두종 바이러스 암항원 양성 난치성암 항암면역치료백신으로, HPV 16 및 18형의 E6, E7의 재조합유전자를 암항원으로 도입하고 면역증강제 α-GC를 CD1d 분자에 적재하였습니다. 암항원 유전자는 HPV E6 유전자와 HPV E7 유전자의 융합형 암항원으로, 암화 유전자 부위는 제거하고 항원성이 높은 부위만을 선별하여 재조합하여 항원성을 극대화한 것으로, ㈜제넥신으로부터 기술도입하였습니다. 2014년 비임상 개발을 시작하였으며, 표준치료에 실패한 자궁경부암 환자 9명을 대상으로 임상 1상을 마쳤으며 현재 임상 2상시험 중입니다. 임상 1상에서 안전성을 확인하였으며, 9명 중 6명에서 안정 질환 (Stable disease) 이상의 임상적 유용성을 확인하였습니다 (하단 표). 임상 1상 시험 결과는 2020년 1월 Journal of Clinical Medicine (Impact Factor 5.688) 에 게재되었으며, 2020년 AACR (미국 암학회) 연례학회에도 임상시험 결과를 발표하였습니다. 임상 2a상 시험은 일부 환자에서 완전관해 관찰 등 긍정적 중간결과를 종합하여 2021년 6월 ASCO (미국 임상종양학회)에서 발표하였습니다. 2023년 9월 21일 임상2a상 결과를 발표하였고, 현재 허가받은 면역관문저해제와의 병용투여 임상 2a상 연구자주도 임상 시험을 진행 중입니다. 해당 연구자임상시험의 중간결과가 2024년 6월 미국 ASCO 에서 발표되었으며, 표준치료에 실패한 자궁경부암 환자를 대상으로 다수의 완전관해 및 부분관해 사례를 관찰하여 안전성과 유효성을 다시금 확인하였습니다.
|
단계 |
개발 내용 |
|
|---|---|---|
|
제품개발 |
HPV 융합형 암항원 유전자 사용 BVAC-C 후보물질의 개발 (2013) |
|
|
비임상 |
BVAC-C의 비임상 유효성 및 독성 시험. 임상 1상 시험 계획의 승인 획득 |
|
|
임상 |
임상 1상 |
표준치료에 실패한 자궁경부암 환자 대상 안전성 및 |
|
임상 2상 |
임상 2a상 개시 (2018.6) |
|
| 연구자 임상 | 면역관문저해제와 병용투여 임상 개시 (2021.11) 연구자임상시험 중간결과 발표 (2024.06) 미국부인종양학회(SGO)서 연구자주도 임상시험 중간결과 업데이트내용 구두 발표(2025.03) |
|
| (자료) : 당사 제시 |
○ BVAC-C의 경쟁력
- 전이성 자궁경부암은 전신에 암세포가 퍼지는 만큼 전신적 요법의 치료가 적용되어야 하므로 화학적 요법이 주로 사용되나 환자가 감수해야 하는 부작용이 심하고 그 효과도 매우 제한적입니다. 전이성 자궁경부암의 치료에 사용하는 1차 항암화학요법에는 taxane과 cisplatin, carboplatin과 같은 백금계 항암제와 단일클론항체 Avastin (Bevacizumab)을 병용하나 그 약효가 한정적이고 내성과 재발이 빈번히 나타나 치료 후 재발 시 기대수명이 1년 내외로 매우 짧으므로 항암면역치료제와 같은 신규 치료제의 개발이 절실합니다. 이러한 점에서 항암면역치료백신이 전이성 자궁경부암에 대한 대안이 될 수 있으나, 전이성 암에 대한 우수한 치료백신이 되기 위해서는 다양한 면역세포의 항암면역반응 유도를 통한 암세포 특이적인 강력하고 복합적인 항암효력을 나타낼 수 있어야 하며, 암세포의 면역회피기전을 극복할 수 있어야 합니다.
- BVAC-C는 HPV의 E6, E7 암 항원을 발현하고, 자연살해 T 세포 리간드가 적재된 B 세포와 단구 세포를 항원제시세포로 활용한 치료백신으로, CD4 T세포, CD8 T세포뿐 아니라 자연살해세포와 자연살해 T세포 등의 항암 면역 반응을 유도하므로 강력하고 복합적인 항암 면역 반응을 유도합니다. BVAC-C는 임상 1/2a상에서 1차 항암 표준치료에 실패한 자궁경부암 말기 환자 23명을 대상으로 안전성을 이미 확인하였으며, 질병조절율(Disease control rate)은 52.1%에 달하였습니다. 일부 환자의 무진행성생존 기간 (PFS, Progression free survival)을 기존 재발성 자궁경부암 PFS 중위값 5.8개월까지, 전체생존 기간 (OS, overall survival)도 17.7개월까지 연장하는 등 긍정적 약효를 확인하였습니다 (하단 표). 이는 BVAC-C가 1) 암세포 특이적인 강력한 면역반응을 일으킬 수 있으며 2) 다양한 면역세포의 항암 면역반응 유도를 통한 복합적 항암효과를 나타낼 수 있음을 보여주는 결과이며, PD-1 저해제인 Pembrolizumab의 임상시험 결과에 비교 시 효력이 뛰어남을 확인하였습니다 (하단 표). 하지만 이는 상대적으로 초기 단계의 임상 결과이며, 소규모 환자 집단을 대상으로 진행되기에 치료 효과의 변동성을 증폭시켜 통계적 유의성 확보가 어렵습니다. 또한 초기 단계에서 임상 시험의 중간 결과 공개는 참여 환자의 인구통계학적 특성과 임상적 프로필을 변화시켜 연구 결과의 일반화 가능성을 저해할 수 있으며, 초기 단계에서는 단기적 독성 평가에 집중하므로 장기적 안전성 데이터가 부족합니다. 마지막으로 당사의 임상 1상 결과가 임상 2상, 3상 등에서도 강력한 면역반응과 복합적 항암효과를 나타낼 수 있다는 보장이 될 수 없습니다.
|
약물 |
임상시험(*1) |
치료반응율 |
질병조절율 |
무진행생존(월) 중위값 |
생존(월) 중위값 |
|---|---|---|---|---|---|
|
아브락산 (Nab-paclitaxel) |
2상 (37명) |
28.6 % |
71.4 % |
5.0 |
9.4 |
|
아바스틴 |
2상 (46명) |
10.9 % |
No data |
3.4 |
7.3 |
|
키트루다 |
2상 (98명) |
13 % |
30 % |
2.1 |
9.4 |
|
BVAC-C |
1/2a상 (30명) | 19.2% | 53.8% | 5.8 | 17.7 |
| (자료) | 당사 제시 |
| (주1) | Gynecol Oncol. 2012 Dec;127(3):451-5; J Clin Oncol. 2009 Mar 1; 27(7): 1069-1074; Journal of Clinical Oncology 36, no. 15_suppl (May 2018) 5522-5522. |
| (주2) | 참여환자의 생존 기간은 주기적으로 확인 중이므로 기간은 더 늘어날 수 있음. |
- 암세포는 인체의 항암면역기능의 공격을 회피하며 말기암이 될수록 면역작용에 내성을 보이는 세포가 나타나 비균질한 상태가 됩니다. 대표적인 면역회피기전으로는 MHC-I 분자의 소실과 발현 저하, 암항원의 소실에 기인한 T세포의 작용 회피와 T세포와 NK세포 등 항암면역세포의 기능소실 (exhaustion) 유도 등이 있습니다. BVAC-C는 세계 최초 인체 내 가용한 모든 항암 면역기능의 활성화를 유도하는 항암면역치료백신으로 MHC-I가 소실된 암세포를 NK세포와 NKT세포의 활성화를 통해 제거할 수 있고, 종양세포 주변에 침윤되어 기능저하 상태인 T세포와 NK세포의 기능을 다시 회복시키므로 암세포의 면역회피기전을 극복할 수 있습니다. 이는 경쟁제품들이 전혀 갖추지 못한 강력한 특징입니다. 또한, 현재 자궁경부암에 사용 중인 화학요법제인 Topotecan 또는 임상시험 중인 면역관문제와 병용 투여시 약효가 상승함을 동물모델에서 확인하였습니다.
- 항암치료백신과 면역관문저해제는 병용투여 시 약효 상승과 더 높은 치료효과를 기대할 수 있는 조합으로 잘 알려져 있으며, 당사는 BVAC-C와 허가받은 면역관문저해제와의 병용투여를 연구자주도 임상 연구의 형식으로 진행 중입니다.
○ BVAC-C의 기술이전 및 해지 이력
한편, 당사는 2014년 12월 20일 BVAC-C 파이프라인과 관련된 기술 및 특허를 미국에서 실시할 수 있는 독점 배타적 전용 실시권에 대하여 미국의 NeoImmuneTech사와 아래와 같이 라이선스아웃 계약을 체결한 바 있습니다. NeoImmuneTech 사에서 수행 중인 임상 시험 숫자가 증가하던 시기에 인력 및 자금 사정을 고려해 단기적으로 BVAC-C의 신속한 임상 수행이 어려울 것으로 판단되며 NeoImmunTech 사에서 라이선스 반납 의사를 피력함에 따라 상기 계약은 2021년 9월 23일부로 해지되었습니다.(주1), (주2)
| (주1) | 해당 라이선스아웃 계약이 해지된 사실은 당사의 사업보고서(2021.12) "II.사업의 내용-6. 주요계약 및 연구개발활동" 부분에 공시되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
| (주2) | 해당 라이선스아웃 계약의 체결 및 해지 관련 상세한 내용은 본 증권신고서 "제1부.III.투자위험요소-2.사업위험-자" 부분을 참고하여 주시기 바랍니다. |
② BVAC-E6E7
| 구분 | 바이오 신약 |
| 적응증 | 인유두종바이러스 (HPV) 16형 및 18형 암항원 발현 모든 암종(두경부암, 항문암, 성기암 등) |
| 작용기전 | BVAC-E6E7은 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화를 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| 제품의 특성 | BVAC-E6E7 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히, BVAC-E6E7은 대량생산에 용이하도록 개선된 아데노바이러스 벡터로 구성되어 우수한 항암효과를 유지하며 원료 바이러스 생산 비용 절감이 가능함. |
| 진행경과 | - 2022년 1분기 비임상 개발 시작 - 2023년 제1/2a상 임상시험계획(IND) 신청 - 2024년 제1/2a상 임상시험계획(IND) 승인 |
| 향후계획 | BVAC-E6E7은 보고서 작성기준일 현재 국내 임상 1/2a상 시험 계획을 식품의약품안전처에 제출하였으며, 식약처 IND 승인 후 국내에서 임상 개발에 주력할 계획임. |
| 경쟁제품 | 두경부암 대상 면역 치료제 개발이 단독 또는 병용투여 요법으로 국내외에서 진행 중임. 제넥신이 두경부 편평세포암 DNA백신 GX-188E, 면역항암제로 개발 중인 GX-I7과 BMS·오노의 면역항암제인 옵디보의 삼중병용요법 연구자 주도 임상 2상을 진행 중임. |
| 관련 논문 등 | BVAC-E6E7은 현재 비임상 개발 중으로 논문 및 학회 발표 이력이 없음 |
| 시장규모 | 당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-E6E7의 경우, 현재는 두경부암에 대한 임상 진행을 계획 중이나 향후 성기암, 항문암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| 기타사항 | - |
○ BVAC-E6E7의 개발 배경 및 계획
BVAC-E6E7에 적용된 암 항원은 HPV 16형 및 18형의 E6, E7 재조합유전자 입니다. 이는 BVAC-C에 적용되어 있는 암 항원과 동일한 것입니다. 따라서 BVAC-C와 마찬가지로 두경부암, 자궁경부암을 포함하여 인유두종바이러스가 발병 원인으로 알려져 있는 모든 암종에 활용될 수 있습니다.
당사는 COVID-19 예방백신 개발 과정에서 생산성, 안전성 측면에서 크게 개선된 개량형 Ad5/35 벡터를 개발하였으며, 현재 해당 벡터가 적용된 오미크론 변이 대응 백신 AdCLD-CoV19-1 OMI는 임상 3상 시험계획을 식약처에 제출하고 승인받았습니다. BVAC-E6E7은 해당 벡터를 항암면역치료백신에 적용하고자 하는 첫 번째 시도로, 당사가 개발한 플랫폼 기술의 확장성을 입증할 수 있는 기회가 될 것으로 판단하고 있습니다.
BVAC-E6E7은 암 항원 및 작용기전이 BVAC-C와 동일하기 때문에 위의 (가) 항에 서술된 바와 같이 BVAC-C가 입증한 경쟁력을 동등한 수준으로 가지고 있을 것으로 판단되며, 인유두종바이러스 유래의 모든 암종에 적용할 수 있으므로 시장성도 있을 것으로 예상할 수 있습니다. 추가로 생산성이 대폭 향상되어 생산 공정 단순화를 통해 생산 원가 절감에 큰 장점을 가지고 있습니다.
BVAC-E6E7은 현재 비임상개발 중으로, 2023년 12월 18일 임상 1/2a상 시험계획을 식품의약품안전처에 제출하였습니다. 2024년 11월 19일 IND 승인을 받았으며, 금번 공모 증자로 인해 BVAC 파이프라인에 대한 연구개발 및 임상 등에 대한 자금이 조달된다면 국내에서 임상 개발에 주력할 계획입니다.
③ BVAC-B
| 구분 | 바이오 신약 | ||||||||
| 적응증 | HER2/neu 암항원 발현 모든 암종 (위암, 유방암, 췌장암, 폐암, 난소암 등) | ||||||||
| 작용기전 | BVAC-B는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. | ||||||||
| 제품의 특성 | BVAC-B 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 시장성이 매우 큰 위암, 유방암 등을 적응증으로 개발 중으로 개발 성공 시 매출 창출이 용이함. | ||||||||
| 진행경과 |
|
||||||||
| 향후계획 | BVAC-B는 보고서 작성기준일 현재 임상 1상 시험 결과보고서 작성을 완료하고, 2a상 시험의 적응증을 검토 중에 있음. 식약처에 임상 2상 시험 계획 승인을 신청할 계획임. | ||||||||
| 경쟁제품 | BVAC-B에 사용한 HER2/neu 암항원을 타겟하는 항암면역치료백신으로 판매 중인 제품은 없으며, Zymeworks 사에서 유방암 대상 임상 2상을 진행 중임. Imugene 사의 HER-Vaxx가 위암 대상 임상 2상 개발 중임. | ||||||||
| 관련 논문 등 | - A combination of chemoimmunotherapies can efficiently break self-tolerance and induce antitumor immunity in a tolerogenic murine tumor model. (IF 9.28) Cancer Res. 2007, 67(15), 7477-86. - alpha-Galactosylceramide-loaded, antigen-expressing B cells prime a wide spectrum of antitumor immunity. (IF 5.0) Int J Cancer. 2008, 122(12), 2774-83 - CD40-targeted recombinant adenovirus significantly enhances the efficacy of antitumor vaccines based on dendritic cells and B cells. (IF 3.62) Hum Gene Thera.2010 21(12),1697-706. - Enhanced antitumor immunotherapeutic effect of B cell based vaccine transduced with modified adenoviral vector containing type 35 fiber structures. (IF 4.32) Gene Therapy. 2014, 21(1):106-14. - Enhanced Immunogenicity of Engineered HER2 Antigens Potentiates Antitumor Immune Responses. Vaccines (Basel). 2020 Jul 22;8(3):403. |
||||||||
| 시장규모 | 당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-B의 경우, 현재는 위암에 대한 임상을 진행 중이나 향후 유방암, 췌장암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
||||||||
| 기타사항 | 2020년 ASCO 초록 채택 및 발표 |
○ HER2/neu 암항원
BVAC-B는 B세포와 단구 세포를 기반으로 하는 유전자 치료제 형태의 항암면역치료백신입니다. 상피성장인자수용체 (human Epidermal Growth Factor Receptor, hEGFR) 중 하나인 HER2/neu를 발현하는 모든 암종에 적용하는 것을 최종개발목표로 하며 현재 위암 환자 대상 임상 1상 시험을 통해 안전성을 확보하였습니다. 인체 상피 성장 인자 수용체 HER2/neu는 인간 상피 성장 인자 수용체 패밀리의 일원으로 세포성장을 촉진하는 특정 성장인자의 수용체이며 정상적인 세포의 세포막 표면에서 낮은 농도로 발견되는 세포막 단백질입니다. 구조적 유사성을 가진 HER2 패밀리에는 HER1, HER2, HER3, HER4가 존재하며, 이 중 HER2 수용체를 규정하는 HER2/neu는 암을 일으키는 유전자로 침습적 유방암 및 난소암, 방광암 등에서 HER2/neu 유전자의 증폭 및 단백질의 과다발현이 인정되고 있습니다. HER2/neu가 과다발현된 종양은 더 공격적으로 성장하고, 호르몬 치료 및 일부 항암 치료에 저항성을 갖는 경향이 있습니다. 이러한 이유로 HER2/neu 양성 암을 가진 환자는 예후가 더 불량한 경향이 있지만, HER2 단백질을 표적하는 치료제를 사용할 수 있습니다. HER2 단백질을 표적하는 치료제는 대표적으로 로슈의 Trastuzumab 항체의약품이 있습니다.
○ HER2/neu 암항원 발현 암종
HER2/neu는 여러 암종에 다양한 비율로 발현하고 있습니다 (하단 표). HER2/neu 발현에 대한 동반진단검사를 이용하여 HER2/neu 발현이 진단된 암종에 BVAC-B를 사용할 수 있도록 허가를 받는 것이 BVAC-B 개발의 최종 목표입니다.
|
암항원 |
암종 |
발현비율 |
|---|---|---|
| HER2/neu |
유방암 |
20~30 % |
|
위암 |
4~53 % |
|
|
난소암 |
5~19 % |
|
|
췌장암 |
7~61 % |
|
|
폐암 |
7~23 % |
|
|
자궁내막암 |
17~52 % |
|
|
빌름스종양 |
51 % |
|
|
대장암 |
26~48 % |
○ BVAC-B의 개발
BVAC-B는 HER2/neu의 재조합 유전자 HER2K1117에 의해 만들어지는 항원단백질을 발현하고 동시에 자연살해 T세포의 리간드인 α-GC가 적재되어, 다양한 면역세포에 의한 위암의 암세포 특이적 면역반응과 자연살해세포 등 비특이적인 면역반응을 동시에 일으킬 수 있도록 설계되었습니다. BVAC-B의 약효 최적화를 위해 HER2/neu 단백질의 세포 내 발현 부분 중 발암성을 지닌 tyrosine kinase domain을 제외한 domain을 항원유전자에 추가하여 그 효력을 시험하였습니다. 신규 항원유전자는 보다 다양한 항원 epitope를 발현하므로 보다 강한 항암면역반응을 기대할 수 있어 약효를 극대화한 새로운 BVAC-B 면역백신을 개발할 수 있습니다. 임상 1상 시험을 마무리하였으며, 시험 결과를 미국 임상암학회(ASCO) 2020년 연례학회에 발표하였습니다. 임상 1상 시험 결과, BVAC-B의 안전성을 위암 환자에게서 확인하였으며, BVAC-B의 약효를 가장 잘 확인할 수 있는 HER2/neu 발현 암종과 환자군 선정을 검토 중입니다.
○ HER2 발현 위암의 미충족 의학적 수요
- 위암 병기상 3기 이후의 위암의 경우 5년 생존율이 급격히 낮아지며 4기 위암 환자의 5년 생존율은 10%에 그치고 있습니다. 특히 진행성 전이성 위암의 경우 예후가 매우 좋지 않으며 효과적인 치료법이 없습니다. 조기 위암을 제외한 절제 가능한 위암에서도 근치적 위절제술을 시행한 후에도 40-80%의 재발률을 보이며, 대부분이 복막 재발, 혈행성 전이 혹은 림프절 전이와 같은 원격 재발로 나타나며, 이 경우 5년 생존율이 40%로 매우 나쁜 예후를 보입니다.
- 위암은 동아시아 지역 호발암으로서 한국, 중국 등에서 미충족 의학적 수요가 높은 반면 주요 글로벌 제약사의 신약 개발 투자에서 제외되어 위암을 타깃으로 한 신약 파이프라인은 매우 빈약합니다. 그러므로 BVAC-B 위암 항암면역치료백신의 시장성이 매우 밝습니다. 세계적으로도 한국의 위암 발생률이 타 지역보다 월등히 높아 한국인의 유전적 및 환경적 특성에 맞는 개인 맞춤형 위암치료기술의 개발이 절실합니다.
○ BVAC-B의 경쟁력
- HER2/neu 암항원을 발현하는 유방암, 위암, 췌장암, 난소암 등에 사용이 가능하므로 시장성과 사업성이 매우 높습니다. HER2/neu 암항원은 항체의약품으로 이미 검증된 약품 타깃으로, 개발 성공 시 국내 및 해외의 대규모 시장 공략이 가능합니다. 특히, 검증된 타깃 활용으로 기술이전이 용이할 수 있습니다.
- 당사의 B세포 및 단구 세포를 기반으로하는 항암면역치료백신은 Herceptin, Perjeta 등의 단일클론 항체와 같이 주작용이 단순히 HER2/neu의 신호전달 작용을 억제하는 것이 아니라 HER2/neu를 발현하고 있는 암세포를 타깃으로하는 보다 적극적인 치료 방법으로, 단일클론 항체의 약점인 암세포의 면역회피기전(암세포 표면의 HER2/neu 항원의 세포표면 발현이 없어지는 경우 단클론항체는 작용할 수 없음)을 극복할 수 있는 항암면역치료백신입니다. 반면, 이를 개발 중인 HER2/neu 표적 면역치료 제품들은 수지상 세포 혹은 자가활성화 T세포에 기반한 제품들로, 강력한 항암면역작용 중 하나인 자연살해세포의 활성화를 유도하지 못한다는 약점을 가지고 있습니다.
④ BVAC-P
| 구분 | 바이오 신약 |
| 적응증 | PAP 또는 PSMA 암항원 발현 모든 암종 (전립선암, 뇌종양 등) |
| 작용기전 | BVAC-P는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| 제품의 특성 | BVAC-P 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히 PAP와 PSMA를 기반으로 융합형 암항원을 제작하여 사용하여 약효와 시장성을 확보할 수 있으며, 융합형 암항원은 특허를 출원할 계획임. |
| 진행경과 | BVAC-P의 비임상개발은 2017년 1분기에 시작하였으며, 2019년 3월 식약처 임상 1상 시험 계획 신청하였음. 보완사항 제출 후 2020년 3월 최종 승인받음. 임상 1상 개시를 위해 연구진을 접촉하는 등 준비 중임. |
| 향후계획 | 국내 임상 1상을 개시할 계획임. |
| 경쟁제품 | 전립선암 치료백신으로 미국에 시판 중인 수지상세포백신 Provenge가 있으며, 암세포주를 이용한 GVAX (BioSante 사)가 현재 임상 2상 개발 중임. Ayala가Advaxis사 인수 후 전립선암 대상 치료백신을 임상 1상 시험 중임. |
| 관련 논문 등 | BVAC-P는 논문 및 학회 발표 이력이 없음 |
| 시장규모 | 당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-P의 경우, 현재는 전립선암에 대한 전임상을 진행 중이나 향후 뇌종양 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| 기타사항 | - |
○ PAP, PSMA 암항원
PAP(Prostatic Acid Phosphatase, PAP)는 전립선암의 진단에 널리 사용되는 표지자로서 인체 전립선에 가장 많이 존재하는 탈 인산화효소입니다. 전립선 상피 세포에서 생산되는 전립선 특이적인 효소로서 산성 조건 하에서 인산 모노에스텔을 가수분해합니다. 전립선비대증, 급성전립선염, 전립선결석, 전립선 종양 시 약간 상승하고 진행성 전립선암, 전립선 경색 시에는 높은 수치를 보입니다. PAP를 암항원으로 사용한 수지상세포백신인 Sipuleucel-T (Provenge, Dendreon, USA)가 2010년 미 FDA을 허가를 취득하여 현재 판매 중으로, 항원성과 임상적 유용성이 검증된 암항원입니다.
전립선 특이적 막항원(Prostate-Specific Membrane Antigen, PSMA)은 일반적으로 건강한 전립선 세포에 나타나는 세포막 단백질로 중추신경계나 정상 소장 및 대장 점막, 신세뇨관 등에서도 발현되는데, 이 중 전립선에서 가장 많이 생성됩니다. 진단적 측면으로 볼 때 정상 전립선 조직보다 전립선암 조직에서 많이 발현되며(전립선암의 90%에서 발견됨), 세포의 표면에 발현되므로 표적치료제 사용 시 종양표지자로 유용하게 사용될 수 있습니다. DNA 백신 등의 형태로 면역항암제로서 임상개발된 사례가 있습니다.
○ PAP, PSMA 암항원 발현 암종
PAP는 전이성 전립선암에 가장 높은 수치로 발현되므로 BVAC-P는 전립선암을 주 적응증으로 개발할 계획이나, 골수종, 폐암 등에서도 발현이 보고되고 있으므로 적응증 확대가 가능합니다. PSMA는 전립선암에 주로 발현되고 이외에도 폐암, 유방암, 뇌종양, 자궁암이나 난소암등의 부인암과 같은 고형암의 혈관에서도 발견되기 때문에 PSMA 표적 시 전립선암 뿐만이 아니라 타 암종으로 적응증 확대가 가능합니다.
○ BVAC-P의 개발
BVAC-P는 PAP 암항원과 PSMA 암항원의 융합형 암항원을 발현하고 동시에 자연살해 T세포의 리간드인 α-GC가 적재되어, 다양한 면역세포에 의한 전립선암 암세포 특이적 면역반응과 비특이적인 면역반응을 동시에 일으킬 수 있도록 설계되었습니다. 융합형 암항원 PAP-PSMA의 개발을 통해 이상반응을 초래할 가능성은 최소화하고 유효성은 최대화하였습니다. PAP-PSMA를 최종 암항원으로 선정하여 BVAC-P를 개발하였습니다. 2019년 전립선암 환자 대상 임상 1상 시험 계획서를 식약처에 제출하였으며, 2020년 2월 최종 승인받았습니다. 현재 연구책임자 선정 등 임상 1상 시험 준비를 진행하고 있습니다.
○ BVAC-P의 경쟁력
- 전립선암의 미충족 의학적 수요: 거세저항성 전이성 전립선암의 1차 치료제는 Abiraterone과 표적치료제인 Enzalutamide를 주로 사용합니다. 2차 치료는 Docetaxel과 같은 독성이 심한 화학항암제, 세포치료제 Sipuleucel-T, 방사선치료제 Radium-223 등이 전이 상태, 치료이력 등에 따라 복잡하게 사용되는 형편으로, 생존기간을 늘여주는 신규 치료제의 개발이 시급합니다.
- BVAC-P의 경쟁력: 전립선암에서 높은 비율로 발현하는 두 종의 암항원으로 이루어진 융합형 암항원을 사용하는 BVAC-P는 다양한 종류의 epitope를 포함하므로, 복합적이고 강력한 항암면역작용이 암세포를 살상할 수 있습니다. 또한, 자연살해 T세포와 자연살해세포의 작용으로 암세포의 면역회피작용을 일부 극복할 수 있어 비균질성의 전이암에서의 효력을 기대할 수 있습니다. Sipuleucel-T의 경우 3회 투여를 위해 3회 제조가 필요한 반면 BVAC-P는 1회 제조로 다회 투여가 가능한 장점을 가지고 있습니다.
⑤ BVAC-M
| 구분 | 바이오 신약 |
| 적응증 | MAGE-A3 또는 GP100 암항원 발현 모든 암종 (흑색종, 폐암, 대장암, 췌장암 등) |
| 작용기전 | BVAC-M은 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| 제품의 특성 | BVAC-M 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히 GP100와 MAGE-A3를 동시에 타깃할 수 있어 약효와 시장성을 확보할 수 있는 점이 큰 장점임. |
| 진행경과 | BVAC-M의 비임상개발은 2016년 4분기에 시작하였으며, 식약처에 임상 1상 시험 계획을 신청할 계획임. |
| 향후계획 | BVAC-M의 임상 1상 시험계획을 신청할 계획임 |
| 경쟁제품 | 흑색종 대상 면역 치료제 개발이 국내외에서 진행 중이며, GP100을 발현하는 포도막 흑색종 타겟의 면역치료제인 Tebentafusp (상품명 Kimmtrak)가 2022년 미국 FDA 승인을 받음. |
| 관련 논문 등 | BVAC-M은 현재 비임상개발 중으로 논문 및 학회 발표 이력은 없음 |
| 시장규모 | 당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC- M의 경우, 현재는 흑색종에 대한 전임상을 진행 중이나 향후 폐암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| 기타사항 | - |
○ BVAC-M 암항원: GP100, MAGE-A3
- GP100 암항원은 멜라닌 세포에서 발견된 흑색종 항원입니다. 661개의 아미노산으로 이루어진 멜라노마 분화 항원으로 멜라닌을 만들어내는 멜라노솜에 다량으로 존재하는 당단백입니다. 멜라노솜의 성숙과 멜라닌 합성에 관여합니다. 정상 멜라닌 세포에 비해 멜라노마의 모든 진행 단계에서 과발현됩니다. GP100이 가지고 있는 epitope는 종양침윤T세포와 순환T세포에 의해 인식이 되는 항원성이 있으며, 이에 근거하여 GP100 peptide 또는 GP100 단백질을 사용하는 암백신들의 개발이 시도되었으나 임상시험에서 유의성을 검증하지 못하였습니다.
- MAGE-A3 암항원: 암-고환 항원(cancer/testis antigen, CTA) 중 하나인 MAGE 항원은 악성흑색종에서 처음 발견된 흑색종 항원으로, 악성흑색종 뿐만 아니라 위암, 두경부암, 폐암(30%), 육종, 방광암, 간암 등에서도 발현되나 정상 조직에서는 오직 고환의 생식세포에서만 발현됩니다. 정상세포에서는 비활성화된 DNA 상태로 존재하지만 종양세포에서는 promoter 부위가 비특이적으로 탈메틸화되면서 활성화되는 것으로 추정되고 있습니다. 여러 종류의 암에서 MAGE-A 암항원이 발현되는 경우 예후가 불량하다는 것이 관찰되었습니다. MAGE-A는 진행된 암에서 나타나는 DNA의 탈메틸화와 관련되어 있는 것이 염색체 수준에서와 단백질 발현 수준에서 모두 보고되었습니다.
○ GP100, MAGE-A3 암항원 발현 암종
|
암항원 |
암종 |
발현비율 |
|---|---|---|
| GP100 |
흑색종 |
~100 % |
|
수막종, 교아종 |
38 % |
|
| MAGE-A3 |
흑색종 |
76 % |
|
비소세포성폐암 |
25~45 % |
|
|
방광암 |
46.5 % |
|
|
간세포암 |
34.6 % |
○ BVAC-M의 개발
당사의 아데노바이러스 기술을 활용하여 GP100 암항원과 MAGE-A3 암항원을 한번에 타깃할 수 있는 제품을 개발하였습니다. 두 암항원을 사용함으로써 적용범위를 넓힐 수 있고, 암항원 발현 저하에 따른 면역회피 작용도 극복 가능합니다.
○ 흑색종의 미충족 의학적 수요
- 고위험 수술 가능 흑색종 환자에서 neoadjuvant 치료법과 adjuvant 치료법이 절실합니다. 이 환자군은 재발 위험이 크고 현재 사용 중인 인터페론 치료법은 약효가 미미하고 부작용이 큽니다. BVAC-M은 항암치료백신으로 수술 후 잔존암 제거에 매우 유리하고, 기억면역반응 생성을 통해 재발을 방지할 수 있습니다.
- 면역관문저해제 치료 무반응 또는 반응 후 재발환자, 특히 BRAF 야생형 진행암인 경우 치료방법이 전무합니다. BVAC-M은 면역관문저해제와 병용투여하여 이러한 환자군에게 새로운 치료법을 제시할 수 있습니다.
○ BVAC-M의 경쟁력
- 강력하고 복합적인 항암면역반응의 활성화: 경쟁제품의 개발 실패 요인은 대부분 암세포를 살상할 수 있는 강력한 항암면역반응의 활성화 작용이 낮았기 때문입니다. CeliVax 기술을 활용한 BVAC-M은 강력하고 복합적인 항암면역반응을 유도할 수 있습니다.
- GP100 암항원과 MAGE-A3 암항원을 한 번에 타깃할 수 있는 제품으로 두 암항원을 모두 발현하는 암을 강력히 억제할 수 있고, 한 종의 암항원만 발현하는 경우에도 사용 가능하므로 적용범위를 넓힐 수 있고, 암항원 발현 저하에 따른 면역회피 작용도 극복 가능합니다.
⑥ BVAC-Neo
| 구분 | 바이오 신약 |
| 적응증 | Neo-antigen이 발굴된 모든 암종 |
| 작용기전 | BVAC-Neo는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
| 제품의 특성 | BVAC-Neo 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 세포치료제 형태임. 완전개인맞춤형 제품으로 환자 자신의 암세포에만 존재하는 neo-antigen을 게놈 서열 분석으로 발굴하고, 이 중 항원성이 있는 epitope 부위를 예측 및 검증하여 완제품의 항원으로 사용하는 제품임. 항원의 특이성과 항원성이 매우 강하여 암 완치에 도전할 수 있으며, 치료 및 수술 후 재발 방지 목적으로 개발할 계획임. 또한, neo-antigen이 발견되는 모든 암종에 적용이 가능하며, 완전개인형 neo-angtigen과 더불어 암환자에서 빈번히 발생하는 돌연변이를 기반으로 한 shared neo-antigen을 활용하는 전략도 가능함. |
| 진행경과 | BVAC-Neo의 기본 개념은 2006년 동물모델에서 이미 증명하여 Cancer Research 저널에 발표하였음. 혁신적 완전개인맞춤형 제품으로 식약처 가이드라인이 존재하지 않아 식약처와 사전 상담을 진행 중임. 개인맞춤형 제품에 맞는 독성시험, 생산공정 등 비임상 개발을 진행 중임. |
| 향후계획 | BVAC-Neo는 비임상 개발 중이며, LG화학에 기술이전을 완료하고 양사 공동으로 임상진입을 준비 중임. |
| 경쟁제품 | 완전 개인맞춤형 항암치료 백신은 현재까지 상용화된 제품은 없으며, 미국의 Moderna과 Gritstone Bio, 독일의 BioNTech과 Curevac 사가 mRNA나 펩타이드 기반 기술을 활용한 파이프라인을 선두주자로 개발하여, 임상 1상 또는 2상 시험 중임. 이러한 파이프라인들은 T 세포 면역 반응은 유도하나 NK 세포나 NKT 세포와 같은 선천성 면역 반응은 유도하기 어려움. |
| 관련 논문 등 | CD1d-restricted T cells license B cells to generate long-lasting cytotoxic antitumor immunity in vivo. (IF 9.28) Cancer Res. 2006, 66(13), 6843-50 |
| 시장규모 | 당사가 영위하는 면역치료백신에 대하여 외부기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-Neo의 경우 Neo-antigen이 발굴된 모든 암종으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
| 기타사항 | - |
BVAC-Neo는 완전개인맞춤형 항암치료백신 (Personalized cancer vaccine)입니다. 환자 개인의 암세포의 유전정보를 분석하여 항원성이 매우 강한 neo-antigen 기반 neo-epitope을 선정하여 peptide 형태의 암항원으로 이용하거나, 유전자 형태로 사용합니다. 환자 개인이 가진 종양세포의 항원을 탐지, 발굴해서 면역체계를 활성화시키는 백신을 제작하는 것입니다. 완전 개인 맞춤형 항원을 사용하므로, 월등한 항암효력을 기대할 수 있고, 이상반응은 최소화되므로 강력한 경쟁력을 갖습니다. 또한, 암종에 관계없이 암세포에서 돌연변이가 확인되는 모든 암종에 적용이 가능하여 매우 큰 시장을 형성할 수 있습니다.
○ BVAC-Neo 암항원: Neo-antigen
- Neo-antigen의 생성: 정상세포에 돌연변이가 지속적으로 발생하면 암화되어 암세포가 됩니다. 암세포는 인체의 정상 면역기능에 의해 제어되지만, 면역회피기능이 생긴 암세포는 암조직으로 커지게 됩니다. 암세포는 돌연변이 단백질을 발현하고, 이 중 일부는 항원성을 갖게 됩니다. 암세포에 새롭게 나타난 neo-antigen은 암세포에만 특이적으로 발현하고, 정상세포에는 전혀 발현하지 않습니다. 또한, 돌연변이에 의해 인체에 완전 새롭게 나타난 항원이므로 인체 면역체계는 이를 병원균과 같은 외부 항원으로 인식하고 면역관용 작용에 구애받지 않습니다.
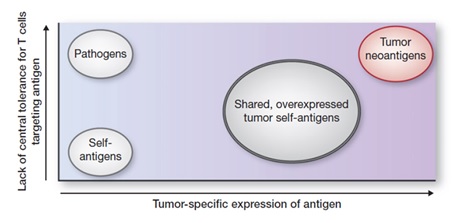 |
|
회사-다-그림2. neo-antigen의 항원성과 특이성 |
- Neo-antigen의 발굴: 차세대 염기서열분석 기술이 보편화되고 유전체의 유전정보를 대규모로 분석할 수 있게 되면서 암 환자 개인의 유전정보를 비교적 쉽고 빠르게 확보할 수 있습니다 (그림 Neo-antigen의 발굴과 BVAC-Neo 제조 및 투여 과정, Bioorg Med Chem. 2018). 환자의 종양유래 검체에서 암세포를 분리하고 DNA를 추출한 뒤 전체 염기서열을 RNA-Seq, Exome-Seq 등의 방법으로 분석합니다. 정상 세포의 염기서열과 비교 분석해 돌연변이 염기서열을 확인합니다. 돌연변이에 생성된 neo-antigen을 발굴하고 이로부터 neo-epitope를 유추합니다. 최근 여러 암환자에서 공통으로 발견되는 Neo-antigen이 존재하고, 이를 항암면역치료에 이용할 수 있다는 보고가 다수 발표되었습니다. 당사에서도 이러한 공통(shared) neo-antigen이나 개인 neo-antigen을 BVAC-Neo에 활용하는 방안을 연구개발 중에 있습니다.
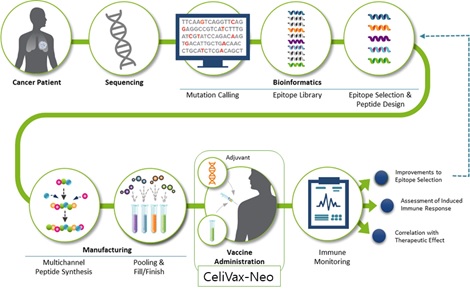 |
|
회사-다-그림3. neo-antigen의 발굴과 bvac-neo 제조 및 투여과정 |
○ BVAC-Neo의 제조 및 경쟁력
발굴한 Neo-antigen으로부터 neo-epitope를 유추하고, 이 정보를 바탕으로 9-mer 길이의 peptides나 유전자를 GMP 내에서 합성합니다. 합성한 peptide나 유전자를 항원으로 이용하여 1일 제조공정으로 BVAC-Neo를 제조합니다. 선천면역계와 적응면역계의 모든 항암면역기능을 활성화하고 면역회피기전의 암세포까지 살상할 수 있으며, 세포기반 항암치료백신으로 극소량의 peptide나 유전자로도 제품 제조가 가능하고, 1일 제조의 신속성으로 환자에게 제품을 공급할 수 있습니다.
○ License-Out 실적
당사는 이미 Celivax 기술로 암항원 epitope peptide를 적재하여 암세포를 효율적으로 살상할 수 있음을 동물모델에서 증명하였으며, 현재 비임상 개발 중입니다. Neo-antigen은 다수의 환자에서 빈번히 보고되는 공통(public 또는 shared) neo-antigen 과 1명의 환자에서만 발견되는 개인(private) neo-antigen으로 나뉘는데, CeliVax 기술은 이 두 종류 모두를 이용할 수 있습니다. 개발의 1단계로 공통 neo-antigen을 활용하는 파이프라인을 연구개발 중입니다. 개인 neo-antigen을 타겟으로 한 파이프라인 개발도 개시하였으며, 이와 관련하여, 당사는 2021년 LG화학에게 환자에서 유래한 자가 B세포 및 단구를 항원제시세포로 이용하는 유전자 도입 세포치료제인 CeliVax 원천기술을 활용한 개인 맞춤형 항암면역치료백신의 기술이전 계약을 체결함에 따라 계약금 10억원이 발생하였고, 부가가치세를 제외하여 매출액 9억 9백만원을 인식하였습니다. LG화학과 체결한 기술이전의 내용은 다음과 같습니다.
|
[라이선스 아웃 계약 총괄표] |
| (단위 : 백만원) |
|
품목 |
계약 상대방 |
대상지역 |
계약 체결일 |
계약 종료일 |
총 계약금액 |
수취금액 |
진행단계 |
| BVAC-Neo | (주)LG화학 | 전 세계 | 2021.05.26 | 로열티 지급 기한 (판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날) |
183,500 | 1,000 | 비임상 |
| 자료 : 당사 정기보고서 |
| [LG화학 기술이전 내용] |
|
① 계약상대방 |
(주)LG화학 |
|
② 계약내용 |
- Neo-Antigen 유래 암항원을 포함/탑재하는 완전 개인맞춤형 항암면역치료백신과 관련된 기술 및 특허를 전 세계에서 실시할 수 있는 독점배타적 전용 실시권 - 제3자에 대한 재실시권 |
|
③ 대상지역 |
전 세계 |
|
④ 계약기간 |
계약체결일: 2021년 5월 26일 계약종료일: 로열티 지급 기한 (판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날) |
|
⑤ 총 계약금액 |
183,500백만원, 로열티는 별도 |
|
⑥ 수취금액 |
<반환의무 없는 금액> 계약금(Upfront Payment): 1,000백만원, 2021년 6월 25일 수취 <반환의무 있는 금액> 해당 사항 없음 |
|
⑦ 계약조건 |
계약금(Upfront Payment): 1,000백만원 - 수취조건: 계약 체결 시
마일스톤(Milestione): 182,500백만원 - 수취조건: 개발, 인허가 및 판매 등
로열티(Royalty): 순매출액에 따라 별도 수령 - 수취조건: 매출 발생 시
임상시험, 허가, 규제 승인 미실현 등으로 계약은 종료될 수 있으며, 계약 종료 시에도 회사의 위약금 지급의무는 없음 |
|
⑧ 대상기술 |
BVAC-Neo (Neo-Antigen 유래 암항원을 포함/탑재하는 완전 개인맞춤형 항암면역치료백신) |
|
⑨ 개발 진행경과 |
계약 후 LG화학과 공동개발위원회를 발족하였음. LG화학이 요청한 기술자료를 제공하고 있음. 생산 기술이전을 실시하기 위해 준비 중임. |
| 자료 : 당사 정기보고서 |
현재 당사가 파악한 바로는 LG화학의 담당 연구개발책임자 퇴사로 인한 인력 변동과 연구소 내 항암 파이프라인 개편 작업 등 LG화학의 내부 사정으로 인해 BVAC-Neo 연구에 진척이 없는 것으로 알고 있으며, LG화학의 구체적인 내부 사정은 파악하기 어렵습니다. BVAC-NEO의 라이선스아웃 계약은 암 환자 개인의 신생항원 (private neo-antigen)을 탑재한 개인 맞춤형 항암 치료 백신에 한정되어 있으므로, 다른 암 항원을 표적하는 타 BVAC 파이프라인의 권리에 크게 영향을 미치지 않을 것으로 판단되며, 장기적으로는 당사가 자체적으로 연구 수행할 것을 고려하고 있습니다.
⑦ AdCLD-CoV19 /AdCLD-CoV19-1
| 구분 | 바이오 신약 |
| 적응증 | COVID-19 감염 예방 |
| 작용기전 | AdCLD-CoV19과 AdCLD-CoV19-1은 근육투여로 SARS-CoV-2 바이러스의 S 단백질 항원 특이적인 항체 생성을 유도하고, 세포독성 T세포 반응을 유도하여 SARS-CoV-2 바이러스에 대한 기억면역반응을 생성함. 백신 접종 후 실제 감염 시 신속하고 강력한 T세포 반응이 재활성화되고, 이어서 항체생성이 이루어지면서 발병을 예방함. |
| 제품의 특성 | AdCLD-CoV19 : 복제불능성 아데노바이러스 벡터에 SARS-COV-2의 S단백질 항원을 삽입한 형태로, 아데노바이러스 벡터가 예방백신 완제의약품임. 1회 근육투여만으로 예방효력을 기대할 수 있는 제품임. AdCLD-CoV19-1 : 백신의 대량생산 및 공급을 원활히 하여 상업적 경쟁력을 높이기 위해 AdCLD-CoV19의 벡터 구조를 개량한 형태의 백신. |
| 진행경과 | AdCLD-CoV19 : 2020년 4월 개발을 개시하였으며, 마우스와 영장류 시험에서 고농도의 항원특이적 항체 생성을 확인하였음. 또한, 영장류 감염모델 시험을 통해 SARS-COV-2 바이러스를 예방할 수 있음을 입증하였음. 임상 1/2a상 시험을 통해 건강한 성인에게서 바이러스 중화항체반응 및 항원-특이적 T 세포 반응을 유도할 수 있음을 확인하였음. AdCLD-CoV19-1 : 개발 완료 후 마우스와 영장류 시험을 통해 면역원성이 AdCLD-CoV19 수준 이상으로 잘 유지되는 것을 확인하였음. 수차례 다계대 배양을 통해 대량생산의 용이성을 확인하였음. 2021년 7월 임상 1상 시험 승인받아 임상시험을 개시하였으며, 시험 참여자 전원에게서 안전성 및 우수한 면역원성을 확인하였음. 임상 1상 자료를 기반으로 2022년 1월 임상 2b상 시험을 승인받았으나, 급격한 오미크론 하위 변이의 확산과 높은 백신 접종율로 임상시험 대상자 모집에 어려움이 있어 임상시험을 조기종료함. |
| 향후계획 | 추가 접종 용도로 개발한 오미크론 전용 백신 AdCLD-CoV19-1 OMI 개발에 주력할 계획 |
| 경쟁제품 | 수 종의 COVID-19 예방백신이 개발되어 각국에서 사용 중임. 대표적으로 Moderna, Pfizer/BioNTech 사가 mRNA 기반 기술을 활용한 백신을 개발하였으며, 아스트라제네카와 존슨앤존슨 사는 아데노바이러스 벡터 기반 백신을 개발하였음. |
| 관련 논문 등 | The Chimeric Adenovirus (Ad5/35) Expressing Engineered Spike Protein Confers Immunity against SARS-CoV-2 in Mice and Non-Human Primates, Vaccines 2022, 10(5), 712 |
| 시장규모 | 예방의 지속효력이 짧은 현재 기허가 백신의 특성상, 접종 완료 후 일정 기간 이후에 부스터 접종이 필요할 것으로 예상됨 (6개월~1년으로 예상). 이를 통해 볼 때, 국내 성인 기준 매년 3천만회 분량의 수요가 있으며, 전 세계적으로 매년 50억회 분량의 수요가 있을 것으로 예측함. |
| 기타사항 | AdCLD-CoV19-1과 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 것으로 전망함. |
당사는 아데노바이러스 벡터 기반 예방백신 플랫폼을 활용하여 COVID-19 예방백신 AdCLD-CoV19의 임상 제1/2a상 시험을 진행하고 대량생산 및 안정적인 공급이 가능하도록 벡터 구조를 조정한 개량형 백신 AdCLD-CoV19-1을 개발하여 임상 1상 시험을 진행했습니다. 당사는 AdCLD-CoV19-1의 우수한 임상 1상 시험 결과를 기반으로 임상 2b상 시험에 진입하였으나, 초기주 타겟 백신의 향후 경제성과 높은 국내외 항체 보유율 및 백신 접종율로 인한 임상시험 대상자 모집의 현실적인 한계를 고려하여 임상 2b상 시험이 조기 종료하고 추가접종 용도로 개발 중인 오미크론 전용 백신 'AdCLD-CoV19-1 OMI' 개발에 주력하고 있습니다.
⑧ AdCLD-CoV19-1 OMI
| 구분 | 바이오 신약 |
| 적응증 | COVID-19 감염 예방 |
| 작용기전 | AdCLD-CoV19-1 OMI는 근육투여를 통해 SARS-CoV-2 바이러스의 S 단백질 항원 특이적인 항체 생성을 유도하고, 세포독성 T세포 반응을 유도하여 SARS-CoV-2 바이러스에 대한 기억면역반응을 생성함. 백신 접종 후 실제 감염 시 신속하고 강력한 T세포 반응이 재활성화되고, 이어서 항체생성이 이루어지면서 발병을 예방함. |
| 제품의 특성 | AdCLD-CoV19-1 OMI: AdCLD-CoV19-1의 항원 유전자를 SARS-CoV-2 Omicron (BA.1) Spike 단백질로 치환하여 오미크론 변이주 대응에 특화하여 개발한 백신. |
| 진행경과 | AdCLD-CoV19-1 OMI : 마우스와 영장류 시험을 통해 면역원성을 확인함. 기초 백신 (AdCLD-CoV19-1)을 접종한 동물에 추가 접종한 경우, SARS-CoV-2 초기주에 대한 중화항체와, 오미크론 변이주 (BA.1, BA.2)에 대한 중화항체가 모두 효과적으로 생성되는 것을 확인함. 현재 임상시험 약 제조가 완료되었으며, 임상 1/2상 시험 계획을 식약처에 제출하여 2022년 8월 수행을 허가받음. 2023년 2월 임상 1/2상 모집 및 투여를 완료하였으며, 안전성 및 면역원성 중간결과를 확보함. 2023년 7월 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 Top-line 결과를 발표함. 2023년 5월 임상 3상 시험 계획을 식약처에 제출하여 7월 수행을 허가받음. 본 보고서 제출일 현재 필리핀 및 베트남 식약처에도 임상 3상 시험계획 신청 후 승인을 완료하여 임상 진행 중임. 2024년 11월 12일 계획한 임상 3상 시험 대상자에게 투여 완료하였음. |
| 향후계획 | 다국가 임상 3상을 진행하여 중간결과를 확보 후 국내 및 국외 품목허가 신청 계획임. |
| 경쟁제품 | 수 종의 COVID-19 예방백신이 개발되어 각국에서 사용 중임. 대표적으로 Moderna, Pfizer/BioNTech 사가 mRNA 기반 기술을 활용한 백신을 개발하였으며, 아스트라제네카와 존슨앤존슨 사는 아데노바이러스 벡터 기반 백신을 개발하였음. |
| 관련 논문 등 | - Boosting with variant-matched adenovirus-based vaccines promotes neutralizing antibody responses against SARS-CoV-2 Omicron sublineages in mice, Int J Antimicrob Agents. 30;63(3):107082 - Strategy to develop broadly effective multivalent COVID-19 vaccines against emerging variants based on Ad5/35 platform, Proc Natl Acad Sci U S A. 121(10):e2313681121 |
| 시장규모 | AdCLD-CoV19-1 OMI와 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 수 있음. 또한 AdCLD-CoV19-1 OMI는 오미크론 변이 전용 백신으로서, 현재 사용되고 있는 백신에 비해 오미크론 변이에 대응하는 중화항체 및 T 세포를 더욱 효율적으로 유도할 수 있을 것으로 기대하고 있음. 한국 질병관리청은 2024년 코로나19 백신접종 관련예산으로 4414억 배정하였음. 2024-2025 유행주 대응 백신을 활용하여 고령층, 면역저하자 등 고위험군 접종을 지원할 계획이라고 발표하였음.. |
| 기타사항 | AdCLD-CoV19-1과 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 것으로 전망함. |
○ 아데노바이러스 벡터 Ad5/35 기술의 개요
당사가 보유한 아데노바이러스 Ad5/35 벡터는 당사가 항암면역치료백신에 암 항원 전달을 위해 사용해 왔던 벡터입니다. Ad5/35 벡터는 복제불능 아데노바이러스 혈청형 5 (Ad5)의 돌기(knob) 유전자가 아데노바이러스 혈청형 35 (Ad35)의 돌기 유전자로 치환된 형태입니다. 이러한 변형을 통해 Ad5/35 벡터는 기존 Ad5의 세포 수용체가 아닌 인간 면역세포에 높게 발현하는 CD46 수용체를 통해 세포 내로 도입될 수 있게 됩니다. 즉, Ad5/35는 인간의 항원제시세포로 효율적으로 도입되어, 항원의 생산을 극대화할 수 있는 효율적인 백신 플랫폼입니다. 또한 Ad5/35 벡터는 Ad5 벡터와 비교했을 때, 간독성을 유발할 위험성이 현저히 낮다는 것이 보고된 바 있습니다. 실제로 당사에서는 벡터를 이용해 암 환자에게 암항원 유전자를 전달하면 높은 수준의 면역반응이 유도됨을 전임상 및 임상시험에서 확인한 바 있으며, 임상시험에서 다수의 환자들에게 투여되었을 때 안전성 및 독성과 관련한 문제도 발생하지 않은 것으로 확인되었습니다. 따라서 당사는 Ad5/35 벡터 플랫폼을 활용하여 유망한 코비드-19 예방백신을 개발할 수 있다고 판단하였고, SARS-CoV-2 바이러스의 세포 감염에 핵심적인 역할을 하는 Spike 단백질을 유전자 형태로 Ad5/35 벡터에 도입하여 예방백신 (AdCLD-CoV19)을 개발하였습니다.
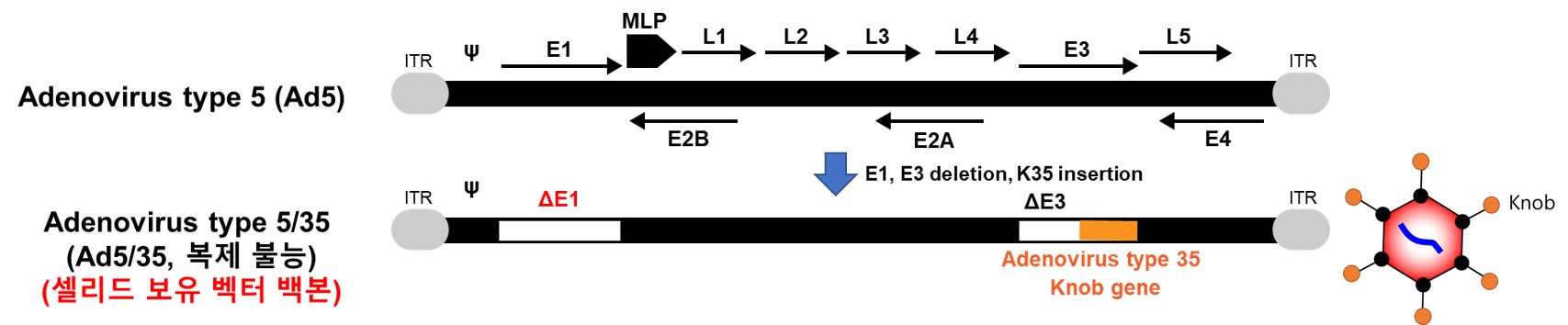 |
|
회사-다-그림4. 아데노바이러스 벡터 |
○ 아데노바이러스 벡터 기술의 유용성
생명공학 기술의 발전에 따라 새로운 플랫폼의 백신 제형이 개발되기 시작했는데, 그 중 하나가 바이러스 벡터 기반 백신 (Viral vector vaccine)입니다. 벡터 기반 백신은 인체 세포에 백신 항원 유전자를 전달하여 항원 단백질을 체내에서 스스로 생성하게 하여 면역반응을 활성화합니다. 바이러스 벡터 기반 백신은 안전하며, 높은 수준의 면역반응을 유도하기 때문에 반복 투여가 필요없이 단회 투여만으로 효율적인 면역화가 가능합니다. 또한 구조적으로 바이러스에 기반하기 때문에, 항체 생성 뿐 아니라 세포독성 T 세포 면역을 효율적으로 유도할 수 있는 장점이 있습니다. 많은 바이러스가 유전자 벡터로서 연구가 되고 있으며, 그 중 아데노바이러스 (Adenovirus)는 비교적 크기가 큰 항원을 전달할 수 있기 때문에 여러 분야에 유용하게 응용되어 사용되고 있습니다. 아데노바이러스 벡터는 자가복제를 담당하는 E1 유전자를 제거한 형태로 주로 이용되며, E1 유전자가 제거된 아데노바이러스 벡터는 인체 세포에서는 자가 복제가 불가능하기 때문에 체내에서 병원성을 유발하지 않습니다.
○ 아데노바이러스 벡터 기술의 확장성
아데노바이러스 벡터 기반 예방백신 기술은 다른 바이러스 벡터 기반 예방백신 기술과 유사하게, 벡터 게놈 내에 항원유전자를 손쉽게 교체함으로써 여러 예방백신 파이프라인을 신속하게 개발할 수 있는 확장성이 있습니다. 이번 COVID-19와 같이 신종 전염병의 유전자 정보가 파악되는 즉시 항원성이 있는 부위의 유전자를 합성하여 아데노바이러스 벡터에 삽입함으로써 백신 파이프라인을 개발할 수 있습니다. 특히, 독감, 호흡기세포융합바이러스 (Respiratory syncytial virus)와 같은 바이러스 감염증에 대한 예방백신을 개발하거나 변이 바이러스에 대한 새로운 백신을 신속히 개발하여야 할 때 매우 효율적입니다. 당사에서도 앞으로 아데노바이러스 벡터의 확장성을 활용하여 다양한 백신 파이프라인을 개발할 계획입니다.
○ 아데노바이러스 벡터 Ad5/35 기술의 경쟁력
전통적으로 백신 제형으로 많이 이용 되어 왔던 사백신 (Inactivated vaccine)과 약독화 생백신 (Attenuated vaccine)은 제작과정이 간단한 장점이 있지만, 사백신의 경우 높은 수준의 면역반응을 유도하지 못하고, 약독화 생백신은 돌연변이를 통해 병원성을 다시 획득할 수 있는 위험성이 존재합니다. 단백질 서브유닛 백신 (Subunit vaccine)은 면역 반응을 잘 유도하지 못하기 때문에 면역증강제를 함께 사용해야 한다는 제한점이 있습니다. 유전자 기반의 DNA, RNA 백신은 면역반응은 잘 유도하나 2회이상 투여해야하는 제한점이 있습니다.
아데노바이러스 벡터 Ad5/35 기반 예방백신은 안전하며, 높은 수준의 면역반응을 유도하기 때문에 반복 투여가 필요없이 단회 투여만으로 효율적인 면역화가 가능합니다. 또한 구조적으로 바이러스에 기반하기 때문에, 항체 생성 뿐 아니라 세포독성 T 세포 면역을 효율적으로 유도할 수 있는 장점이 있습니다. 당사에서 CeliVax 기술의 한 요소로서 장기간 개발해온 경험과 자료가 있기 때문에, 신속한 개발과 임상진입을 기대할 수 있습니다.
○ COVID-19 예방백신 'AdCLD-CoV19-1 OMI'
COVID-19 팬데믹의 확산, 향후 재유행에 대비하기 위한 신속한 예방백신 개발을 지난 4월 시작하였습니다. 개발 플랫폼은 복제불능 아데노바이러스 벡터 (Ad5/35)를 이용하였습니다. SARS-CoV-2 바이러스의 세포 감염에 핵심적인 역할을 하는 Spike 단백질을 유전자 형태로 Ad5/35 벡터에 도입하여 예방백신 (AdCLD-CoV19)을 제작하였습니다.
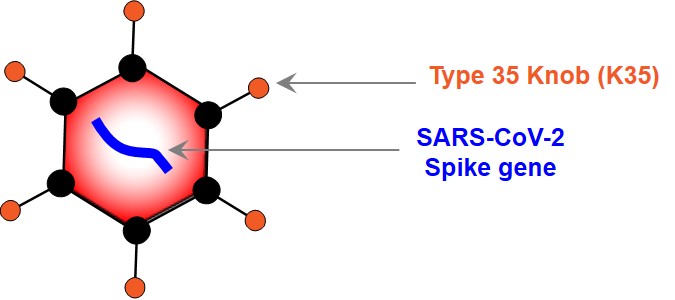 |
|
회사-다-그림5. 예방백신의 형태 |
AdCLD-CoV19는 투여 후 항원제시세포로 도입되어 체내에서 Spike 단백질 항원을 생산하고, 생산된 Spike 단백질은 세포 밖으로 분비됩니다. B 세포는 발현된 Spike 항원을 인식하여 활성화되며, 중화항체를 포함한 항원 특이 항체를 다량으로 생산합니다. 생성된 중화항체는 오랜기간 유지되며, 항원에 의해 활성화된 B 세포는 기억 면역을 획득합니다. 한편, 발현된 항원은 항원제시세포 표면의 MHC 분자와 결합하여 CD8 T 세포와 CD4 T 세포를 활성화시킵니다. 이렇게 활성화된 T 세포는 기억 면역을 획득하여 추후 같은 항원에 노출되었을 때 신속하고 강력한 면역반응을 재유도할 수 있게 됩니다.
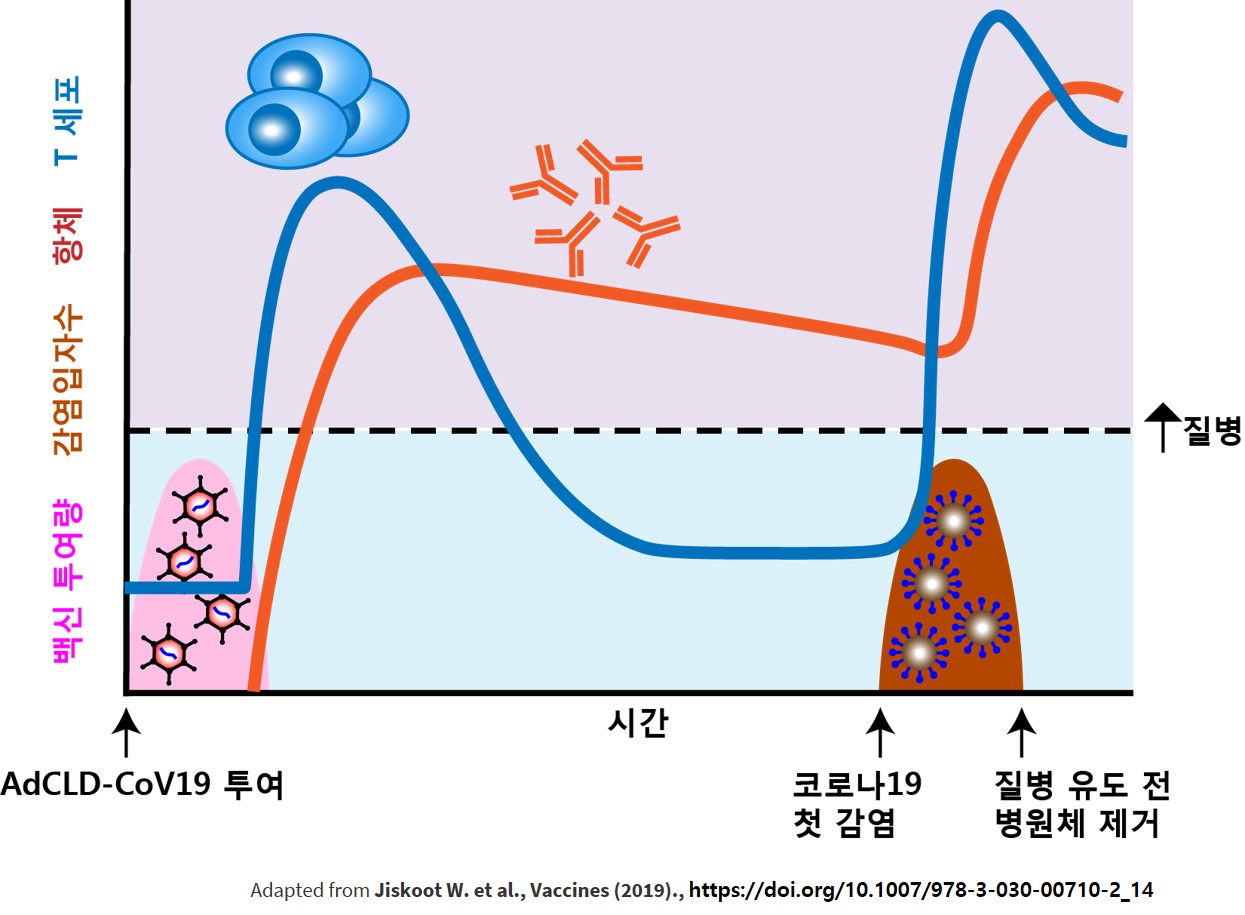 |
|
회사-다-그림6. adcld-cov19의 코비드-19 예방 효력 |
SARS-CoV-2 바이러스에 감염되었을 때, 항원을 인지한 T 세포는 빠르게 항원 특이적 반응을 시작하여, 바이러스에 감염된 세포들을 초기에 제거할 수 있습니다. 또한, B 세포에 의해 생산된 중화항체는 SARS-CoV-2 바이러스를 제거하거나, 세포 수용체 결합부위 (Receptor binding domain)에 결합하여 바이러스의 세포 감염을 차단합니다.
AdCLD-CoV19 의 마우스 유효성 시험에서 체내에서 높은 수준의 S단백질 특이적 항체 생성량을 확인하였고, 그 중화능력을 유사바이러스 시험법으로 입증하였으며, Spike 단백질 특이적 T 세포 반응도 생성됨을 확인하였습니다. 영장류 유효성 시험에서도 체내에서 높은 수준의 S단백질 특이적 항체 생성량을 확인하였고, 그 중화능력을 유사바이러스 시험법과 코로나 생바이러스 중화시험법으로 입증하였으며, Spike 단백질 특이적 T 세포 반응도 생성됨을 확인하였습니다. 이러한 비임상 유효시험 결과를 바탕으로 비임상 독성시험, 생산 검증 등을 수행하였으며, 2020년 12월 임상 1/2a상 시험 계획(IND)을 승인받았습니다. 임상 1상에 해당하는 파트A, 임상 2a상에 해당하는 파트B의 투여를 마치고 접종 후 4주차까지의 면역원성 분석을 완료하였습니다. 분석 결과는 2021년 11월 4일 화순국제백신포럼에서 발표한 바 있습니다.
2021년에는 백신의 대량생산, 안정성 향상을 통한 안정적인 공급이 가능하도록 AdCLD-CoV19을 개량한 형태의 백신 AdCLD-CoV19-1의 개발에 주력했습니다. AdCLD-CoV19-1은 GLP 비임상시험을 통해 안전성을 입증하였으며, 중화항체 반응, T 세포 반응도 AdCLD-CoV19과 비교했을 때 동등한 수준임을 확인하여, 2021년 7월 임상 1상 시험 계획을 승인받았습니다. 해당 임상시험 결과를 기반으로 AdCLD-CoV19-1의 임상 2b상 시험을 승인받아 국내 임상 2b상을 개시하였으나, 코로나19 감염 상황의 악화 및 백신 접종율 상승 등으로 인해 시험대상자 모집이 어려워졌으며, 초기 유행주를 타겟한 AdCLD-CoV19-1은 다양한 변이주가 출현하는 상황에서 추가 접종 백신 대비 시장성이 높지 않을 것으로 판단하였습니다. 따라서 임상 2b상을 조기 종료하고 개발 역량을 코로나19 변이주 대응 개발에 주력하고 있습니다.
AdCLD-CoV19-1 임상을 종료하고 AdCLD-CoV19-1 OMI 개발로 넘어간 경위를 자세하게 살펴보면 다음과 같습니다. 먼저 2022년 01월에 식품의약품안전처로부터 승인받은 기초접종 용도로 개발한 코로나19 백신 'AdCLD-CoV19-1'의 임상 2b상 시험의 경우, 코로나19 백신 접종 이력과 코로나19 감염 이력이 없는 성인 자원자를 대상으로 진행됨에 따라 국내외 백신 접종율 증가 및 전 세계적인 오미크론 확산에 따른 코로나19 감염율 증가로 인해, 백신 접종 및 감염 이력이 없는 대상자 모집이 불가능하다고 판단하였습니다.
'AdCLD-CoV19-1'의 임상 개시 시점에 한국을 포함한 전세계 주요국은 높은 코로나19 백신 접종율을 나타내었으나, 아프리카 지역은 백신 접종율이 상대적으로 낮고 100,000명당 누적 확진율도 낮은 것으로 판단됨에 따라 신속히 임상시험을 수행할 경우 2b상 시험 대상자 모집이 가능할 것으로 당사는 판단하였습니다.
| [전세계 코로나19 누적확진자 비율 및 백신접종율(2022.03.14)] |
 |
|
전세계 코로나19 누적확진자 비율(좌) 및 백신접종율(우) |
| 출처) ourworldindata.org |
| [대한민국 및 아프리카 국가들의 코로나19 누적확진율 및 백신접종율(2022.03.14)] |
| 국가 | 확진자(백만명) | 백신접종자 (1회 이상) |
백신접종자(2회 이상) |
| 대한민국 | 139,504 | 86.76% | 85.85% |
| 남아프리카공화국 | 61,695 | 34.48% | 27.27% |
| 케냐 | 5,982 | 14.91% | 14.76% |
| 탄지니아 | 514 | 5.49% | 4.24% |
| 출처) ourworldindata.org 및 당사 제시 |
이에 당사는 현지 의료 인프라를 고려하여 남아프리카 공화국을 국외 임상시험 수행 국가로 선정하였으나, 2022년 03월 중순에 남아프리카 공화국에서 수집된 3,395개의 혈장 샘플을 이용하여 코로나19 항체 보유 여부를 확인하는 혈청학적 유병율을 분석한 시험 결과가 2022년 05월 말 발표되었습니다(남아프리카 공화국 혈액 기증자들 사이에서 SARS-CoV-2 항체의 유병률 추정(학술자료) / Jeremy Bingham et al., Research square, 2022). 발표된 시험 분석 결과에 따르면 모든 코로나19 항체에 음성인 샘플의 비율은 단 2.2%인 것으로 확인되었습니다.
이에 남아프리카공화국에서 현실적으로 임상시험 수행이 불가능할 것으로 판단하였으며, 상대적으로 코로나19 확진자 비율이 낮은 케냐와 탄자니아를 최종 임상시험 수행국가로 변경하고 총 3개 임상시험 수행기관에 IRB(Institutional Review Board; 임상시험심사위원회 및 임상시험윤리위원회) 승인 신청하였습니다. 그러나, 국외 임상시험 개시 시점에 탄자니아의 백신 접종율 상승 및 케냐의 코로나19 항체 보유율이 70%~80% 이상이라는 연구결과가 발표되었습니다(케냐의 건강 인구 감시 시스템에서 SARS-CoV-2 항체 유병률과 인구 면역에 대한 함의(학술자료) / Kagucia EW et al., MedRxiv, 2022). 또한, 국내외 높은 백신 접종율에 따라 초기 접종 용도 대비 추가 접종 백신의 수요가 증가하는 상황이며, 전 세계적인 코로나19의 변이주 검출 현황에서 초기 바이러스를 제외한 BA.1, BA.2, BA.5 등의 하위 변이주가 검출됨에 따라 초기주 대응 백신의 수요가 감소하였습니다.
| [대한민국 및 아프리카 국가들의 코로나19 누적확진율 및 백신접종율(2022.11.30)] |
| 국가 | 확진자(백만명) | 백신접종자 (1회 이상) |
백신접종자(2회 이상) |
| 대한민국 | 524,083 | 87.10% | 86.27% |
| 남아프리카공화국 | 67,484 | 37.51% | 32.62% |
| 케냐 | 6,323 | 26.09% | 19.82% |
| 탄지니아 | 620 | 43.06% | 39.39% |
| 자료 : ourworldindata.org 및 당사 제시 |
이에 따라 당사는 2022년 01월에 식품의약품안전처로부터 승인받은 기초접종 용도로 개발한 코로나19 백신 'AdCLD-CoV19-1'의 임상 2b상 시험 계획(IND)을 철회하고 향후 지속적인 수요가 예측되는 추가 접종 변이주 대응 백신으로 전략을 변경하여, 동일한 아데노바이러스 벡터 플랫폼을 활용한 오미크론 전용 부스터샷 백신 'AdCLD-CoV19-1 OMI'를 개발하고 국내 총 320명을 대상으로 임상 1/2상 시험을 진행하였으며, 2023년 05월 임상 1/2상 초기 분석 데이터를 기반으로 임상 3상 IND를 식품의약품안전처에 신청하였습니다. 2023년 7월 임상 3상 수행 허가를 받아 본 보고서 제출일 현재 국내, 필리핀 및 베트남 식약처에도 임상3상 시험계획 신청 후 승인을 완료하여 진행 중에 있습니다.
당사는 그 동안 비임상 개발이 완료된 백신의 임상시험 이외에도, 코로나19 변이주에 신속히 대응할 수 있도록 변이주 대응 백신 연구를 꾸준히 수행해 왔습니다. 2021년 하반기에는 델타 변이주에 대응하는 백신을 개발하여 영장류, 마우스에서 우수한 수준의 중화항체 반응 및 T 세포 반응을 유도함을 확인하였으며, 2022년 상반기에는 오미크론 변이주에 대응하는 백신 AdCLD-CoV19-1 OMI의 제작을 마치고 비임상시험을 완료하였습니다. AdCLD-CoV19-1 OMI는 단회 접종 모델과 기초 백신 접종을 완료한 동물에 추가 접종한 모델 모두에서, 오미크론 변이주에 대한 중화항체가 효과적으로 생성됨을 관찰하였으며, 임상 1/2상을 통해 면역원성과 안전성을 확인하였습니다. 임상 2상 중간 분석 결과, AdCLD-CoV19-1 OMI' 투여 후 임상시험 대상자들의 코로나19 예방 백신 접종과 감염으로 인한 높은 기저치에도 불구하고, 면역원성 분석 결과 접종 후 4주 시점에 분석한 오미크론 변이에 대한 중화항체가는 접종 전 대비 시험군에서 3.49배 증가한 것을 확인하였습니다. 2023년 7월 14일 임상 1/2상 Top-line 결과를 발표했습니다.
당사는 본 증권신고서 제출일 현재 'AdCLD-CoV19-1 OMI'의 임상 3상 시험을 수행 중입니다. 필리핀 및 베트남 규제당국에도 임상 3상 시험계획( IND)신청을 완료하였고, IND 승인을 받아 임상 3상 시험을 진행하고 있습니다. 'AdCLD-CoV19-1 OMI'의 임상 3상시험은 기허가 백신과의 비열등성시험으로 진행합니다. 시험군과 대조군 간 안전성과 면역원성을 비교하는 코호트 A 대상자군과 안전성을 비교하는 코호트 B 대상자군으로 시험 대상장 4,000명을 모집합니다. 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하였으며, 계획된 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 계획입니다.
AdCLD-CoV19-1 OMI과 같은 오미크론 변이주를 타깃으로 한 코로나19 백신의 유망성은 변이주의 높은 전파력과 기존 백신의 효과 감소 문제를 해결할 수 있는 기술적 발전, 지속적인 수요 예측 및 글로벌 보건 정책 변화에 기인합니다.
먼저 오미크론 변이주는 스파이크 단백질에 다중 돌연변이를 보유하며 기존 백신으로 생성된 항체를 회피하는 능력이 뛰어납니다2. 2023년 6월 CDC(미국 질병통제예방센터) 연구에 따르면 3회 접종 시 중증 예방효과는 80% 이상 유지되지만, 감염 예방효과는 120일 후 14% 미만으로 급감합니다1. 이는 변이 특화 백신의 필요성을 시사합니다. 또한 모더나의 2가 백신(BA.1/원조주)은 BA.4/BA.5에 대한 중화항체를 6.3배 증가시켰으며, 2023년 10월 발표된 데이터에 따르면 XBB.1.5 대응 백신은 8.7배 높은 항체 반응 기록하는 등 기존 백신의 효과 감소 문제를 해결하고 있는 모습을 보이고 있습니다.
1983년에 일본에서 설립되어, 고품질 시장 조사 데이터를 제공하며 글로벌 비즈니스 정보 서비스 분야에서 선도적인 역할을 하고 있는 Global Information에 따르면 글로벌 시장에서 오미크론 대응 백신의 규모는 2024년 134.3억 달러 수준에서 연평균 9.8% 성장하여 2033년에는 299.8억 달러에 달할 것으로 전망하고 있습니다. 북미 지역에서는 FDA에서 2024년 9월 XBB.1.5 대응 백신 승인 이후 6개월 내 2억 7천만 회분 공급 계획을 가지고 있으며, 유럽에서는 2025년부터 계절성 코로나19 백신 접종 체계 도입을 검토하고 있습니다. 또한, 아시아 지역에서 중국은 400억 위안(58억 달러) 규모의 소비자 분석을 반영한 백신 프로그램 운영하고 있으며, 인도네이시아에서는 2025년까지 자체 백신 생산 능력을 4억 회분으로 확대할 계획을 가지고 있습니다.
| [시장성 분석 핵심 지표] |
| 구분 | 2024년 예상 | 2033년 전망 | CAGR | 주요 동력 |
|---|---|---|---|---|
| 글로벌 시장 | 134.3억 달러 | 299.8억 달러 | 9.8% | 부스터 접종 확대, 정부 조달 프로그램8 |
| 아시아-태평양 | 47억 달러 | 112억 달러 | 10.2% | 인도 mRNA 부스터(GEMCOVAC-OM), 인도네시아 국산 백신 개발8 |
| 출처) Global COVID-19 Vaccine Market - 2025-2033, Global Informaiton(2025.02) |
하지만 BA.2.75.2, BQ.1.1 등 신규 변이에 대한 중화능 저하 문제 지속되며 바이러스 진화에 대한 불확실성이 산재한 상태이며, GlobalData(1999년 영국 런던에 설립한 글로벌 시장 조사 회사로, 런던증권거래소 AIM시장에 DATA라는 코드로 상장함)에 따르면 2026년 주요 7개국의 코로나19 백신 시장 규모를 50억 달러 미만 전망(연평균 14.5% 감소)하면서 수요가 지속 감소할 것이라고 전망하고 있습니다. 반면에 Global Information에 따르면 동남아시아를 중심으로 2025-2033년 연간 12% 성장하여, 저렴한 코로나19 백신 수요가 증가할 것으로 전망하고 있습니다. 이처럼 오미크론 변이주를 타깃으로 한 AdCLD-CoV19-1 OMI은 기존 파이프라인인 AdCLD-CoV19-1이 가진 임상 진행의 어려움, 다양한 변이주 출현으로 인한 낮은 시장성 등에서 상대적으로 자유로워 오미크론 변이주 대응 백신 플랫폼 개발에 집중하게 되었습니다. 다만, 현재 오미크론 변이주 내 하위 변이들이 발생하면서 돌아가면서 유행이 되고 있으나 추후 오미크론 변이주의 소멸 및 다른 변이주의 발생으로 인해 당사가 예상했던 오미크론 변이주 대응 백신 시장이 급격하게 감소할 수 있으며, 이 점 투자자 여러분께서 유의하시기 바랍니다.
2) CMO 부문
당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
특히, 당사가 독자적으로 연구중인 셀리벡스 플랫폼등은 환자에게 분리된 세포를 신속하게 원하는 시간에 신속히 제조를 해야하는 특징을 가지고 있으나 자체 GMP 시설을 운영하지 않으면 원하는 시간에 생산할 수 없습니다. 2022년 이전에는 타 회사 CDMO를 활용하였으나, 스케줄링 등이 원활하지 않아 임상속도 등에 어려움이 많았습니다. 게다가, 당사의 품목인 셀리벡스 플랫폼은 유전자 치료제와 세포 치료제 두 분야를 이해하고 전문적으로 다루어야 가능한 특성을 가지고 있으며, 대부분 세포 치료제 기반인 완제의약품(Drug product)는 한국에서 연구하거나 제조 할 수 있는 업체는 많으나 유전자 치료제 기반인 원료의약품(Drug substract)인 벡터를 직접 연구하고 제조할 수 있는 업체는 상대적으로 드문 상황입니다. 이러한 신속성 및 전문성을 갖춘 당사의 GMP 센터가 대형병원과 가까운 유리한 위치에 가용한 공간을 만들어 두어 당사 자체 파이프라인 뿐만 아니라 CDMO 사업을 통해 매출을 발생시키고 위해 노력하고 있습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
당사는 마곡사옥이 완공되면 연구개발시설 및 인원의 집중을 계획하고 있으나, 성남GMP에 연구시설을 배제하려는 계획은 아닙니다. 마곡에 연구개발시설을 집중하되, 성남GMP에 연구개발시설을 이원화하여 운영할 계획입니다. 당사의 연구소는 기초연구를 담당하는 신약탐색팀, 중개연구팀이 있으며, 기초연구와 공정연구를 담당하는 벡터공정팀, 완제공정팀이 있습니다. 또한, 성남은 국내 빅5 대형병원에서 약20km 거리에 위치하여 암환자의 치료 및 맞춤형 백신제조에 이점을 가지고 있습니다. 마곡의 연구를 중심으로 성남GMP에서도 관련 연구를 진행하는 이원화를 통해 연구개발에 집중할 계획입니다.
하지만 당사의 CMO 매출은 2022년도 480백만원, 2024년도 358백만원으로 총 838백만원이 발생하였으나, 이는 기대에 미치지 못하는 수치입니다. 또한 현재 대부분의 GMP 시설 장비는 유휴설비로 판단되며, 추후 충분한 CMO 매출이 발생하지 못하면 매출 없이 감가상각비만 증가하는 등 당사의 재무 상황이 악화될 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
당사는 2020년 백신 및 세포유전자치료제 GMP센터를 완공하여 2021년 생물학적제제 등에 해당하는 의약품 제조업, 인체세포등 관리업 및 첨단바이오의약품 제조업에 대한 허가를 획득하였고, 2022년 당사가 개발 중인 오미크론 특화 백신 및 BVAC-C의 임상시험용의약품 제조와 관련하여 GMP적합 실사 통과하였으며, 2022년 9월 국내 면역관문 항체치료제 및 CAR-T 치료제 개발사 (주)이노베이션바이오와 이중표적 CAR-T 세포 치료제 'IBC101' 위탁생산(CMO) 계약을 체결하며 해당 업무를 조기 수행하였으며 약 4억원의 매출액이 발생하였습니다.
이어, 당사는 지난 2023년 3월 16일 (주)이노베이션바이오와 4,880백만원 규모의 임상 1/2상 임상시험약 위탁생산(CMO) 추가 계약을 체결하였습니다. 이와 관련하여 2024년 1월 IND 승인 이후, 관련 매출이 진행률에 따라 발생하고 있습니다. 향후 진행율 및 이노베이션바이오의 지급능력 등을 감안하여 매출을 인식할 예정입니다.
당사는 현재 추가 계약 체결을 위해 국내외 제약·바이오기업들과 논의를 진행하고 있으며, 전시 및 컨퍼런스 참가 등을 통하여 당사의 최신장비, 시설, 우수한 인재 및 서비스에 대한 정보를 업데이트하여 제공하여 향후 추가 매출이 발생할 수 있도록 노력하고 있습니다.
3) 이커머스사업(베이커리 개발 및 판매업) 부문
당사는 2024년 3월 7일 주식회사 포베이커의 주식 1백만주(지분율 100%)를 금 5억원에 취득하여 지배력을 획득하였으며, 2024년 3월 31일을 간주취득일로 하여 당사 연결 종속회사에 포함되었습니다. 당사가 (주)포베이커의 지분을 취득하게 된 경위는 다음과 같습니다.
당사는 매출이 발생하기까지 장기간의 연구개발 기간을 거치고, 연구개발에 성공해야 하는 백신 개발업을 주업으로 수행하고 있기에, 자체자금 창출능력이 장기간 저하된 상황이었습니다. 또한 연간 매출액 요건 관련된 관리종목 편입 위험을 방지하는 것에 있어서(주1), 상대적으로 안정적인 매출이 발생하고 있는 업체를 탐색하여 인수하는 것이 당사가 보다 안정적으로 운영되고, 주주들의 이해관계에 부합할 수 있는 최선의 전략이라고 판단하였습니다.
| (주1) | 관리종목 편입과 관련된 위험요소는 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-다." 부분을 참고하여 주시기 바랍니다. |
이 과정에서, 서울대학교 약학대학 교수로 약 30년간 재직했던 당사 강창율 대표이사는 동 대학 출신이 운영하던 베이커리 관련 식품 및 식자재 등 유통업을 영위하고 있는 (주)포베이커라는 업체를 알게 되었습니다. 한편, (주)포베이커 지분구조상 (주)포베이커 및 (주)포베이커의 이해관계인 등과, 당사 또는 당사 이해관계인 등간의 특수관계는 존재하지 않았고, (주)포베이커는 당사와 특정 거래 관계가 있는 업체는 아니었습니다.
당사는 (주)포베이커를 인수할 경우, 기본적으로 안정적인 매출이 발생할 수 있고, 또한 당사 입장에서는 항암면역치료 백신의 임상시험 과정에서 암 환자의 면역체계를 건강하게 유지하는 것이 암치료 백신의 효과를 극대화할 수 있다는 사실을 인지하였고, 향후 암환자에 특화된 건강기능식품을 발굴하고 제공하는 사업 방향성에 대해 고민해오고 있었던 터라, 식품 유통업을 영위하고 있는 (주)포베이커를 인수한다면 중장기적으로 향후 건강기능식품 유통업으로의 사업을 전개해나갈 수 있는 초석을 마련할 수 있을 것으로 기대하여, 비록 기존 사업과는 관련성이 낮은 신규사업에 진출함에도 불구하고, 중장기적으로는 사업적 시너지가 발생할 수 있을 것으로 판단하였습니다.
또한 (주)포베이커 입장에서도, 2018년 설립 후 매출액은 점진적으로 증가 추이를 보인 것으로 파악되었으나, 매년 마케팅 비용 등이 수반되어 적자를 기록하고 있던 상황이고, 임직원 8명을 갖춘 소형 법인 형태에서는 단독으로 회사를 지속 성장시키는 데에 어려움이 있던 상황이었기 때문에 당사에 인수될 경우 상대적으로 좀 더 안정적인 조직 운영이 가능할 것으로 판단하였습니다.
이처럼 양자간 이해관계가 일치함을 확인한 이후, 당사는 오성회계법인을 통하여 (주)포베이커의 재무 실사를 마친 후, 지분 가치를 평가받았으며, 해당 평가 결과에 의거하여, (주)포베이커의 지분 100%를 5억원에 인수하게 되었습니다. (주)포베이커의 기업 개요 및 당사의 합병 과정, 합병 후 당사가 예상하는 시너지 효과 및 한계점, 관련 위험 요소 등과 관련된 상세 내용은 아래 기재된 바와 같습니다.
| [흡수합병 당시 (주)포베이커 기업 개요] |
|
구 분 |
내 용 |
|---|---|
|
상호명 |
주식회사 포베이커 |
|
소재지 |
경기도 남양주시 진접읍 내각1로 73번길 64, 2동 |
| 설립일 | 2018.01.02 |
|
대표이사 |
김철용 |
|
법인구분 |
비상장법인 |
| 자본금 | 5억원 |
| 임직원 | 8명 (2024년 2월말 기준) |
| 핵심인력 | 이한주 : 푸드마케터 / 콘텐츠 & 마케팅 총괄 김학진 : 유통전문가 / 물류시스템 개발관리 서연지 : 푸드크리에이터 / 영상 콘텐츠 제작관리 |
| 사업영역 | 사업모델 : 푸드콘텐츠 종합거래소 1) 베이킹+외식 원부자재 유통 - B2B,B2C 베이커리 원부재료 거래 - PB상품 개발 - 냉동 생지 등 반제품 라인업 강화 - 각종 유제품 수입 및 제조판매 - 유통기한 임박상품 유통판매 - 베이커리 외식 포장기자재 2) 베이킹+외식 디바이스 유통 - 베이커리 외식 관련 소도구 전문업체 제휴 - 가정용, 업소용 기물 추천 유통 3) 해외 수출/자사몰 외국어 서비스 - 자체 생산 제품 해외 수출 - 원재료 해외 소싱을 통한 원가 경쟁력 확보 4) 컨설팅 - 창업자 맞춤형 전문 컨설팅 - 브랜딩, 마케팅 기본 교육 - 매장컨셉, 메뉴, 레시피 및 관리 네트워킹 |
| 플랫폼 회원수 | 약 87,000명 (2023년 12월말 기준) |
(주)포베이커는 푸드콘텐츠 종합거래소로서의 사업모델을 지향하고 있습니다. 저가의 소비기한 임박 식재료, 베이킹 재료 및 외식 각종 소모품, 베이킹 기자재 등의 유통 판매업을 플랫폼을 통해 영위하고 있으며, 회원수는 2025년 2월말 기준 약 103,808명으로 꾸준히 증가하고 있습니다. 흡수합병 전 (주)포베이커의 개별 재무 현황은 다음과 같습니다.
| [개별 재무상태표] |
| (단위 : 백만원) |
|
구분 |
2024년 1분기말 | 2023년 |
2022년 |
2021년 |
|---|---|---|---|---|
| 유동자산 | 199 | 976 | 1,751 | 1,810 |
| 비유동자산 | 0 | 0 | 0 | 0 |
| 자산총계 | 199 | 976 | 1,751 | 1,810 |
| 유동부채 | 362 | 1,163 | 1,111 | 1,400 |
| 비유동부채 | 295 | 295 | 300 | 0 |
| 부채총계 | 657 | 1,458 | 1,411 | 1,400 |
| 자본금 | 500 | 500 | 500 | 500 |
| 이익잉여금 | (958) | (981) | (159) | (91) |
| 자본총계 | (458) | (481) | 341 | 409 |
| (자료) | (주)포베이커 제시, 당사 주요사항보고서(2024.03.12) 및 분기보고서 |
| (주1) | 상기 수치는 외부감사인의 감사/검토를 받지 않은 수치입니다. |
| [개별 손익계산서] |
| (단위 : 백만원) |
|
구분 |
2024년 1분기 | 2023년 |
2022년 |
2021년 |
|---|---|---|---|---|
| 매출액 | 748 | 5,577 | 3,607 | 3,394 |
| 매출원가 | 508 | 5,649 | 3,037 | 3,326 |
| 매출총이익 | 240 | (72) | 570 | 69 |
| 판매비와관리비 | 161 | 553 | 620 | 90 |
| 영업이익(손실) | 78 | (625) | (50) | (22) |
| 영업외 수익 | 28 | 162 | 1 | 16 |
| 영업외 비용 | 84 | 359 | 20 | 29 |
| 법인세비용차감전 순이익 | 23 | (822) | (69) | (35) |
| 법인세비용 | 0 | 0 | 0 | 0 |
| 당기순이익 | 23 | (822) | (69) | (35) |
| (자료) | (주)포베이커 제시, 당사 주요사항보고서(2024.03.12) 및 분기보고서 |
| (주1) | 상기 수치는 외부감사인의 감사/검토를 받지 않은 수치입니다. |
| (주2) | (주)포베이커 간주취득일은 2024년 3월 31일입니다. 이에 2024년 1분기 (주)포베이커 손익은 당사 연결 손익에 포함되어 있지 않습니다. |
(주)포베이커의 매출은 2021년부터 2023년까지 성장세를 유지하였으나, 사업 화장 과정에서 관련 마케팅비용 등의 지출에 의해 지속적 영업손실 및 당기순손실이 발생하였습니다. 2024년 1분기에는 23백만원의 당기순이익을 실현하였으나, 매출 규모는 748백만원으로 2023년 평균 분기 매출보다는 낮은 실적을 기록하였습니다.
한편, 당사는 (주)포베이커 지분 100% 취득 후, (주)포베이커를 피합병회사로 하여 흡수합병(소규모합병)을 결정하였으며, 다음과 같이 2024년 5월 14일을 합병기일로 하여 흡수합병을 완료하였습니다.
| [주요사항보고서(회사합병결정) - 2024.03.12] |
| 구 분 | 내 용 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1. 합병방법 | (주)셀리드가 (주)포베이커를 흡수합병(소규모합병) -존속회사(합병회사) : (주)셀리드 -소멸회사(피합병회사) : (주)포베이커 |
||||||||
| - 합병형태 | 소규모합병 | ||||||||
| 2. 합병목적 | 재무구조 개선 및 사업다각화 | ||||||||
| 3. 합병의 중요영향 및 효과 | 본 보고서 제출일 현재 (주)셀리드는 (주)포베이커의 지분 100%를 보유하고 있습니다. 따라서 본 합병 완료 시 (주)셀리드는 합병으로 인한 신주 발행 없이 존속회사로 남아있게 되며, 피합병회사인 (주)포베이커는 합병 후 소멸됩니다. 또한 합병회사와 피합병회사의 합병비율은 1.000000 : 0.000000 으로 흡수합병하며, 본 합병으로 인하여 합병회사가 발행한 신주는 없으며, 본 합병 완료 후 (주)셀리드의 최대주주 변경은 없습니다. | ||||||||
| 4. 합병비율 | (주)셀리드 : (주)포베이커 1.000000 : 0.000000 |
||||||||
| - 기업인수목적회사 소멸합병의 경우 | |||||||||
| 기업인수목적회사 마지막 거래일 종가 대비 합병신주의 상장 당일 기준가격의 배수 | - | ||||||||
| 5. 합병비율 산출근거 | 합병회사인 (주)셀리드는 피합병회사인 (주)포베이커의 주식을 100% 소유하고 있으며, 합병 시 피합병회사의 주식에 대하여 신주를 발행하지 않으므로 합병비율을 1.000000 : 0.000000 으로 산출하였습니다. | ||||||||
| 6. 외부평가에 관한 사항 | 외부평가 여부 | 미해당 | |||||||
| - 근거 및 사유 | 자본시장과 금융투자업에 관한 법률 제 165조의4 및 동법 시행령 제176조의5 제7항 제2호 나목 단서에 의하여, 다른 회사의 발행주식총수를 소유하고 있는 회사가 그 다른 회사를 합병하면서 신주를 발행하지 않은 경우에는 합병가액의 적정성에 대한 외부평가기관의 평가를 받을 의무가 없는 바, 본 합병은 이에 해당하므로 위 규정에 따라 외부평가기관의 평가를 거치지 아니하였습니다. | ||||||||
| 외부평가기관의 명칭 | - | ||||||||
| 외부평가 기간 | - | ||||||||
| 외부평가 의견 | - | ||||||||
| 7. 합병신주의 종류와 수(주) | 보통주식 | - | |||||||
| 종류주식 | - | ||||||||
| 8. 합병상대회사 | 회사명 | (주)포베이커 | |||||||
| 주요사업 | 베이커리 판매 및 개발업 | ||||||||
| 회사와의 관계 | 자회사 | ||||||||
| 최근 사업연도 재무내용(원) | 자산총계 | 976,148,260 | 자본금 | 500,000,000 | |||||
| 부채총계 | 1,457,562,658 | 매출액 | 5,576,793,616 | ||||||
| 자본총계 | -481,414,398 | 당기순이익 | -821,914,414 | ||||||
| - 외부감사 여부 | 기관명 | - | 감사의견 | - | |||||
| - 기업인수목적회사 소멸합병의 경우 | |||||||||
| 대표이사 | - | 설립연월일 | - | ||||||
| 본점소재지 | - | 증권신고서 제출예정일 |
- | ||||||
| 9. 신설합병회사 | 회사명 | - | |||||||
| 설립시 재무내용(원) | 자산총계 | - | 부채총계 | - | |||||
| 자본총계 | - | 자본금 | - | ||||||
| - | 현재기준 | ||||||||
| 신설사업부문 최근 사업연도 매출액(원) | - | ||||||||
| 주요사업 | - | ||||||||
| 재상장신청 여부 | 해당사항없음 | ||||||||
| 10. 합병일정 | 합병계약일 | 2024년 03월 13일 | |||||||
| 주주확정기준일 | 2024년 03월 27일 | ||||||||
| 주주명부 폐쇄기간 |
시작일 | - | |||||||
| 종료일 | - | ||||||||
| 합병반대의사통지 접수기간 | 시작일 | 2024년 03월 27일 | |||||||
| 종료일 | 2024년 04월 10일 | ||||||||
| 주주총회예정일자 | - | ||||||||
| 주식매수청구권 행사기간 |
시작일 | - | |||||||
| 종료일 | - | ||||||||
| 구주권 제출기간 |
시작일 | - | |||||||
| 종료일 | - | ||||||||
| 매매거래 정지예정기간 | 시작일 | - | |||||||
| 종료일 | - | ||||||||
| 채권자이의 제출기간 | 시작일 | 2024년 04월 12일 | |||||||
| 종료일 | 2024년 05월 13일 | ||||||||
| 합병기일 | 2024년 05월 14일 | ||||||||
| 종료보고 총회일 | 2024년 05월 14일 | ||||||||
| 합병등기예정일자 | 2024년 05월 21일 | ||||||||
| 신주권교부예정일 | - | ||||||||
| 신주의 상장예정일 | - | ||||||||
| 11. 우회상장 해당 여부 | 해당사항없음 | ||||||||
| 12. 타법인의 우회상장 요건 충족여부 | 해당사항없음 | ||||||||
| 13. 주식매수청구권에 관한 사항 | 행사요건 | 상법 제527조의3 규정에 의거한 소규모합병 절차에 따라 진행되는 바, (주)셀리드 주주에게는 주식매수청구권이 부여되지 않습니다. | |||||||
| 매수예정가격 | - | ||||||||
| 행사절차, 방법, 기간, 장소 | - | ||||||||
| 지급예정시기, 지급방법 | - | ||||||||
| 주식매수청구권 제한 관련 내용 | - | ||||||||
| 계약에 미치는 효력 | - | ||||||||
| 14. 이사회결의일(결정일) | 2024년 03월 12일 | ||||||||
| - 사외이사참석여부 | 참석(명) | - | |||||||
| 불참(명) | - | ||||||||
| - 감사(사외이사가 아닌 감사위원) 참석여부 | 불참 | ||||||||
| 15. 풋옵션 등 계약 체결여부 | 아니오 | ||||||||
| - 계약내용 | - | ||||||||
| 16. 증권신고서 제출대상 여부 | 아니오 | ||||||||
| - 제출을 면제받은 경우 그 사유 | 본 합병은 합병신주를 발행하지 않는 무증자합병 방식으로 진행하므로, 본 합병의 과정에서는 증권신고서 제출이 필요한 증권의 모집이나 매출이 이루어지지 않습니다. | ||||||||
|
17. 향후 회사구조개편에 관한 계획 본 보고서 제출일 현재 합병 완료 후 추진 중이거나 계획 중인 회사의 구조 개편에 관하여 확정된 사항은 없습니다. 18. 기타 투자판단과 관련한 중요사항 (1) 본 합병은 상법 제527조의3에 의한 소규모합병 방식으로 진행되므로 (주)셀리드 주주들에게 주식매수청구권이 인정되지 않으며, 합병에 대한 주주총회의 승인은 이사회 승인으로 갈음합니다. (2) 상기 '10. 합병일정'의 합병반대의사 통지 접수기간은 상법 제527조의3 제4항에 따른 소규모합병에 대한 반대의사표시 접수기간을 의미하며, 상법 제527조의3 제4항에 의하여 합병회사인 (주)셀리드의 발행주식 총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 합병 공고일로부터 2주간 내에 서면으로 합병에 반대하는 의사를 통지하는 때에는 소규모합병으로 본 합병을 진행할 수 없으며, 이 경우 추후 이사회를 통해 진행 여부를 결정합니다. ※ 종료보고 총회는 상법 제526조 제3항에 의거하여 이사회 결의에 따라 공고절차로 갈음할 예정입니다. (3) 합병계약 체결일로부터 합병등기일까지 사이에 관계기관과의 협의 및 관계기관의 요구, 본 계약 체결일 당시 예견할 수 없었던 천재지변, 경제상황의 급격한 변동, 기타 본 계약을 변경할 필요성이 있는 사정변경이 발생한 경우, (주)셀리드와 (주)포베이커는 상호 합의에 의하여 본 계약의 합병조건이나 일정을 변경할 수 있으며 다만, 이러한 합병조건이나 일정의 변경으로도 본 계약의 목적을 달성할 수 없는 경우 당사자는 본 계약을 해제할 수 있습니다. (4) 상기 합병일정은 공시시점 현재의 예상 일정이며, 관계기관과의 협의 및 승인 과정 등에 의해 변경될 수 있습니다. 【합병관련 주요사항 상세기재】 1. 합병의 개요 가. 합병 등의 상대방과 배경
주1) 본 합병은 상법 제527조의3에 의한 소규모합병 방식으로 진행되므로 (주)셀리드의 주주들에게 주식매수청구권이 인정되지 않으며 합병에 대한 주주총회의 승인은 이사회 승인으로 갈음합니다.(합병승인 이사회 예정일: 2024년 04월 11일)
해당사항 없습니다.
2. 합병 상대방회사에 관한 사항 가. 상대방 회사의 개요
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (자료 : DART) |
당사는 2024년 5월 21일 (주)포베이커를 흡수합병 등기를 신청함으로써, 합병 효력이 발생하였으며, 유일한 연결종속회사였던 (주)포베이커를 합병함으로써, 합병 후에는 더 이상 연결대상 종속회사는 존재하지 않습니다. 이에 합병 후 (주)포베이커의 매출은 당사 개별 재무제표상 매출에 포함됩니다. 당사는 (주)포베이커 합병을 통해 사업부문 다각화 및 매년 일정수준 매출이 발생하여 당사 재무적 상황이 개선될 수 있을 것으로 기대하고 있습니다.
한편, (주)포베이커가 영위하던 사업은 당사의 기존 사업과는 무관한 영역의 사업분야이므로, 당사의 연구개발업과의 단기적인 사업적 시너지 효과를 기대할 수는 없으며, 당사가 합병 후 경영에 참여했을 때 기존의 실적을 달성하지 못할 수도 있습니다. 다만, 중장기적 관점에서는 앞서 기재한 바와 같이, 당사가 항암면역치료 백신의 연구개발업을 지속 영위함과 동시에, 환자의 면역체계를 건강하게 유지할 수 있는 건강기능식품 등 제품군을 (주)포베이커 사업 부문에서 전략적으로 확장해나가는 사업 방향성을 목표하고 있으며, 향후 (주)포베이커 사업 부문의 이커머스 플랫폼을 활성화해나간다면 합병에 따른 중장기적인 사업 시너지는 발생할 수 있을 것으로 기대하고 있습니다. 다만 이에 관하여 아직 구체화된 계획은 없으며, 우선적으로 당사는 현 체제 하에서 사업 안정화 및 재무적 상황을 개선하는데에 초점을 두려고 합니다.
이커머스사업부의 사업계획은 다음과 같습니다. 먼저, 소분상품과 대용량 벌크상품군 확대, PB상품 개발로 경쟁사와 차별화를 통해 매출증대 및 수익성 개선을 추진하고자 합니다. 둘째, 비수기(여름) 시즌상품과 트렌드상품, 프리미엄 식료품을 선제적으로 발굴 및 조달하여 매출증대 계획 입니다. 셋째, 블로그, 인스타 등 소셜미디어를 활용한 SNS 마케팅을 통해 충성고객을 지속적으로 확보하여, 재구매율을 증대할 계획입니다. 마지막으로 유제품(버터, 치즈), 초콜릿 등 기후이상에 따라 가격 변동성이 큰 상품군을 선매입 재고보유를 통해 수익율을 극대화하려고 합니다.
하지만 온라인 판매 및 이커머스시장은 진입장벽이 낮아 다수의 경쟁자가 존재하며, 완전경쟁시장에 가까운 사업 구조를 가진 산업이기 때문에 당사의 계획대로 매출액이 증대되지 않거나, 증대되더라도 수익성이 악화될 수 있습니다. 또한 이커머스사업부의 매출액 비중이 증대됨에 따라 한국거래소의 주요 업종 변경의 가능성도 존재합니다. 유가증권시장 상장규정 시행세칙 제132조에 따르면 매출액 비율이 큰 사업의 업종으로 업종 변경을 하는 것이 일반적이나, 다만 해당기업의 업력, 향후 영업전망, 연결재무제표 등을 고려하여 업종변경을 하는 것이 필요하지 않다고 거래소가 인정하는 경우에는 업종변경을 하지 않습니다. 이에 따라 당사도 매출액 비율을 고려했을 때 이커머스 사업부와 관련된 업종으로 변경될 가능성이 존재하므로 이 점을 투자자 여러분께서 유의하시기 바랍니다.
| [유가증권시장 상장규정 시행세칙] |
|
제132조(업종분류 기준)① 규정 제166조에 따라 거래소는 시세정보 등의 공표를 위하여 주권상장법인의 업종을 분류할 수 있다. 이 경우 업종은 「통계법」에 따라 통계청장이 고시하는 한국표준산업분류(이하 "한국표준산업분류"라 한다)를 기준으로 별표 11에서 정하는 업종 및 코드분류표에 따라 대분류, 중분류 및 소분류로 분류하고 업종코드를 부여한다. ② 제1항의 업종분류는 다음 각 호의 방법으로 한다. <개정 2018. 12. 28.> 1. 주권상장법인의 사업 종류가 2 이상인 경우에는 매출액 비율이 큰 사업의 업종으로 하고, 이의 적용이 곤란한 경우에는 종업원 수, 설비 등을 고려하여 분류한다. 2. 사업 내용이 불분명하여 업종분류가 곤란한 경우에는 유사산업의 기타 업종으로 분류한다. 3. 제조업 또는 도소매업의 분류에 관한 한국표준산업분류 기준에도 불구하고 도소매업으로 분류하는 것이 적절치 않다고 거래소가 인정하는 경우 해당 제품의 제조업으로 분류할 수 있다. 4. 지주회사의 경우 한국표준산업분류에 따라 분류하되, 특정 산업부문의 매출액이 연결재무제표상 50% 이상인 경우에는 해당 산업의 업종으로 분류한다. 이 경우 지주회사는 업종분류와 관련한 경영계획 등 자료를 제출할 수 있으며, 거래소는 공익실현 및 투자자 보호 등을 종합적으로 고려하여 업종을 분류할 수 있다. ③ 업종변경은 해당 주권상장법인이 다음 각 호의 어느 하나에 해당되는 경우에 한다. 다만, 해당 주권상장법인의 업력, 향후 영업전망, 연결재무제표 등을 고려하여 업종변경을 하는 것이 필요하지 않다고 거래소가 인정하는 경우에는 업종변경을 하지 않으며 같은 중분류 내에서의 소분류 변경은 하지 않을 수 있다. <개정 2015. 7. 31.> 1. 한국표준산업분류의 개정에 따라 업종분류의 변경이 필요한 경우 2. 합병, 분할, 분할합병 또는 영업의 양도·양수 등으로 주된 사업내용이 변경된 경우 3. 주요제품의 매출액 비율 순위가 최근 2사업연도 계속하여 변동이 있고, 앞으로도 분류되어 있는 업종으로서의 신장이 기대될 수 없는 경우 4. 법률의 규정 및 주주총회에서 행한 결의에 따라 업종이 전환된 경우 5. 지주회사로 전환되거나 지주회사에 해당하지 않게 된 경우 6. 그 밖에 업종의 변경이 필요하다고 인정하는 경우 ④ 제3항에 따른 업종변경의 시기는 다음 각 호와 같다. 1. 제3항제1호, 제4호 및 제6호의 경우: 해당 사실이 확인된 때 2. 제3항제2호 및 제5호의 경우: 해당 사실의 확인을 위한 입증자료가 제출된 때 3. 제3항제3호의 경우: 해당 주권상장법인의 결산일이 속한 달의 다음 달부터 5개월이 되는 달의 최초 매매거래일 ⑤ 주권상장법인은 업종분류 심사에 필요한 자료를 사업보고서 제출 기한까지 거래소에 제출하여야 한다. ⑥ 제4항 및 제5항에도 불구하고 거래소는 외국주권등 상장법인의 본국 법령에 따른 사업보고서 제출 기한을 고려하여 업종의 변경 시기와 심사 자료의 제출 기한을 변경할 수 있다. |
당사 기존 조직에서는 (주)포베이커가 영위하던 사업 부문에 대한 경험과 전문성이 부족하기 때문에 당사는 (주)포베이커 합병 후 기존 인력 4명(물류관리 및 시스템 운영 2인, 판매채널 운영 및 관리 1인, 상품 소싱 및 기획 담당 1인)을 승계하였고, 신규로 사업부장 1인을 포함하여 2인을 채용하여 총 6명의 전문 인력을 갖추고 사업을 지속하고 있습니다. 다만, 당사의 기존 경영진들은 식품업 내지 온라인 유통업에 대한 전문성과 경험이 상대적으로 부족한 점은 사실이며, 이는 사업 확장의 한계점으로 작용할 수 있는 점에 대하여 유의하여 주시기 바랍니다.
또한, 재무적인 측면에서는 2021년부터 2023년까지 (주)포베이커의 매출은 증가세를 유지하였으나, 지속적 영업손실 및 당기순손실을 기록하는 등 수익성이 악화되는 추이를 기록해왔으며, 특히 2023년에는 822백만원의 당기순손실이 발생하며 순자산은 -481백만원으로 자본잠식 상태에 이르렀습니다. 2024년 1분기에는 매출 748백만원, 당기순이익 23백만원을 기록하며 흑자전환하였으나, 2023년 평균 분기매출 규모보다 낮은 수준의 매출이 발생하였습니다. 2024년 매출은 약 3,807백만원으로, 간주취득일 이전인 2024년 1분기 매출액 748백만원과 4월부터 합병기일까지의 예매출액(작년 월평균 매출액의 1.5개월분으로 추정) 651백만원을 합하더라도 총 5,206백만원으로 전기 대비 6.7% 하락하였습니다.
다만, 당사 판단에 의하면, 식품 유통업은 계절적인 요인이 다소 작용하는 성격이 있어, 2024년 상반기에는 매출이 저조했던 것으로 분석하고 있습니다. 그나마 2024년 2분기에는 신규상품(빵류, 크림류 등)을 플랫폼에 런칭한 결과, 5월말 기준으로 2분기에는 월평균 4억원 이상의 매출이 발생한 것으로 집계되었으며, 네이버 스마트스토어 고객수 기준으로 5천명 이상 회원 수가 증가하여, 이 역시 사업 전개에 고무적인 상황으로 판단하고 있습니다. 이후 2024년 하반기에는 연말 크리스마스 시즌 등에 당사의 이커머스 사업부 매출이 올라가는 계절성을 보이며, 2024년 3분기 1,266백만원, 2024년 4분기 2,054백만원을 기록하였습니다. 향후에도 당사는 트렌드에 부합한 상품군의 지속 런칭을 통해 매출 확대 노력을 할 예정이며, 적자 발생 손익 구조를 개선하기 위해 최소한의 마케팅 비용 및 인건비 등으로 최대의 효과를 낼 수 있도록 현재 인력들 개개인의 업무를 지원하되, 무리한 조직 확장계획 또는 자금 투자계획은 세우고 있지 않으며, 최대한 비용 통제를 위한 노력을 할 예정입니다.
그럼에도 불구하고 (주)포베이커를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)포베이커 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다.
| [매출액, 영업손익, 당기순손익, 포괄손익 추이] |
| (단위 : 백만원) |
| 과 목 | 2024년 | 2023년 | 2022년 | |
|---|---|---|---|---|
| 매출 | 4,165 | 0 | 480 | |
| 위탁생산 | 358 | 0 | 480 | |
| 기술이전(BVAC-NEO) | 0 | 0 | 0 | |
| 이커머스사업부(식품 및 베이킹 기자재) | 3,807 | 0 | 0 | |
| 영업손익 | (11,980) | (12,198) | (14,911) | |
| 당기순손익 | (12,259) | (11,611) | (22,865) | |
| 총포괄손익 | (12,326) | 314 | (22,624) | |
| (자료) 당사 감사보고서 |
| [영업비용 추이] |
| (단위 : 백만원) |
| 구분 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|
| 매출원가 | 3,460 | 0 | 325 |
| 판매비와관리비 | 9,199 | 7,159 | 7,180 |
| 경상연구개발비 | 3,487 | 5,039 | 7,886 |
| 영업비용 소계 | 16,146 | 12,198 | 15,391 |
| [비용의 성격별 분류] | |||
| 재고자산변동 | 3,281 | 0 | 0 |
| 종업원급여 | 3,758 | 4,092 | 4,390 |
| 복리후생비 | 494 | 560 | 645 |
| 지급임차료 | 159 | 116 | 76 |
| 소모품비 | 1,529 | 652 | 1,183 |
| 지급수수료 | 2,770 | 3,046 | 5,481 |
| 감가상각비 | 2,636 | 2,615 | 2,519 |
| 무형자산상각비 | 3 | 16 | 15 |
| 사용권자산상각비 | 94 | 33 | 66 |
| 주식보상비용 | 358 | 543 | 372 |
| 대손상각비 | 269 | 0 | 0 |
| 기타비용 | 795 | 525 | 644 |
| 영업비용 소계 | 16,146 | 12,198 | 15,391 |
| (자료) 당사 감사보고서 |
당사는 매출이 부진한 가운데, 당사의 본업인 백신 등의 연구개발 과정에서 지속적인 인건비, 임상비용, 외주연구개발 관련 지급수수료 등 지출이 매년 발생하고 있고, CMO 사업 등을 영위하기 위해 투자한 유형자산의 감가상각비 등이 매년 고정비용으로 발생하고 있기 때문에 지속적인 적자 발생을 면하지 못하고 있습니다.
당사는 2022년 GMP시설의 위탁생산계약 매출 약 4.8억원이 발생하였으나, 종업원급여 43.9억원, 유무형자산상각비 25.3억원이 발생하였으며, 연구개발 및 임상시험 지속 과정에서 지급수수료가 54.8억원 발생하는 등 총 영업비용 154억원이 발생하였습니다. 이에 2022년 영업손실 149억원이 발생하였으며, 한편, 2022년 5월 금융감독원에서 공표한 '전환사채 콜옵션 회계처리' 감독지침에 따라 당사는 2021년 3월 19일 발행한 제2회 전환사채의 콜옵션을 별도로 분리하여 회계처리 하는 것으로 수정하였고, 투자자의 조기상환청구권에 대해서도 별도로 구분하여 파생상품부채로 회계처리 한 결과, 전환사채의 전환가격과 주가 간 차이로 인해 파생상품 평가손실이 약 68억원 발생하였고, 이자비용 16.3억원이 발생한 점이 주요 원인으로 작용하여 당기순손실 228.7억원이 발생하였습니다.
이어, 당사는 2023년에는 매출이 발생하지 않았으며, 종업원급여 40.9억원, 유무형자산상각비 26.3억원이 발생하였으며, 연구개발 및 임상시험 지속 과정에서 지급수수료가 30.5억원 발생하는 등 총 영업비용 122억원이 발생하였습니다. 이에 2023년 영업손실 122억원이 발생하였으며, 금융손익 및 기타손익 반영 후 당기순손실 116.1억원이 발생하였습니다. 한편, 2023년말 당사 보유 토지에 대한 재평가가 이루어졌으며, 세금효과를 고려한 후의 재평가이익 119.3억원이 기타포괄손익으로 인식되며 2023년에는 일시적으로 총포괄이익 3.1억원을 인식하였습니다.
이어, 당사는 2024년에는 (주)포베이커를 흡수합병하여 이커머스사업부의 매출 약 38.1억원 및 GMP시설의 위탁생산계약 매출 약 3.6억원, 총 매출 약 41.7억원이 발생하였으나, 재고자산변동 32.8억원, 종업원급여 37.6억원, 유형자산상각비 26.4억원이 발생하였으며, 연구개발 및 임상시험 지속 과정에서 지급수수료가 27.7억원 발생하는 등 총 영업비용 161.5억원이 발생하였습니다. 이에 2024년 영업손실 119.8억원이 발생하였으며, 금융손익 및 기타손익 반영 후 당기순손실 122.6억원이 발생하였습니다.
당사의 2024년 매출 중 위탁생산 부분은 당사 GMP시설에서 이노베이션바이오와의 위탁생산계약(계약규모 4,880백만원)에 따른 진행기준 매출에 해당됩니다. 이어, 일부 타 업체들과도 당사 GMP시설에서의 신규 위탁생산 수주가 이루어지도록 영업활동을 전개하고 있으나 GMP시설을 갖추고 있는 업체들이 다수 존재하므로, 신규 수주 여부는 당사의 영업 경쟁력에 좌우될 수 있는 불안정성이 있고 당사의 노력은 실제 성과로 이어지지 못할 수 있습니다.
이처럼 당사는 매출이 부진한 가운데, 지속적으로 신약후보물질의 발굴과 보유 파이프라인의 적응증 증가를 위하여 다양한 비임상 및 임상시험을 준비하고 있으며 이에 따라 관련비용의 지출이 꾸준히 발생하여 2022년 영업손실 149.1억원, 2023년 영업손실 122억원, 2024년 영업손실 119.8억원이 발생하였습니다. 또한 영업 외적 측면에서도, 금융비용 등의 발생 영향으로 인해 2022년 당기순손실 228.7억원, 2023년 당기순손실 116.1억원, 2024년 당기순손실 122.6억원이 발생하는 등 지속적인 적자 구조를 면하지 못하고 있습니다. 따라서 당사의 파이프라인에서 임상 성공을 통한 기술이전, 상품화 성공 등의 성과를 이루어내지 못한다면 당사의 적자 구조를 개선하는 것은 불가능할 수 있으며, 자본력이 지속적으로 감소하여 지속적인 연구개발비용 등의 지출이 필요한 당사의 영업활동을 영위하는데 상당한 제약이 생길 수 있습니다. 또한 (주)포베이커의 지분 취득 및 합병과 관련하여, 이는 단기적으로는 당사의 기존 사업과는 무관한 분야의 신규사업 진출에 해당하며, 만일 신규사업에 대한 성과를 내지 못하거나 사업적 시너지를 중장기적으로 발생시키지 못할 경우 이는 당사 손익 내지 재무상태에 오히려 악영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [나. 계속기업으로서의 존속능력에 대한 불확실성 위험] 당사의 재무제표는 계속기업으로서 존속할 것이라는 가정을 전제로 작성되었으므로 당사의 자산과 부채가 정상적인 사업활동 과정을 통하여 회수되거나 상환될 수 있다는 가정 하에 회계처리 되었습니다. 그러나 당사는 지속적인 영업손실과 당기순손실 발생 및 부의 영업현금흐름 발생, 이에 따른 결손금 누적과 재무상태 악화로 인하여 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 존재하는 상황입니다. 당사는 자회사 합병을 통한 사업다각화 및 기본적인 매출 확보, 자본 확충을 통한 재무 개선, 파이프라인 연구개발 매진 및 임상 성공 노력, GMP시설을 활용한 위탁생산 추가 수주 및 매출 확보 등 재무적 개선 목적의 최선의 노력을 다하고 있으나, 당사의 계획에는 차질이 생길 수 있으며, 대내외적 사유로 인해 당사의 개선 노력은 실제 성과로 이어지지 않을 수 있습니다. 이 경우 당사의 재무구조는 더욱 악화되어 당사의 계속기업으로서의 존속능력에 대한 불확실성은 더욱 증가할 수 있고, 그 결과 당사의 자산과 부채를 정상적인 영업활동 과정을 통하여 장부가액으로 회수하거나 상환하지 못할 수도 있습니다. 당사가 계속기업으로서의 존속능력에 대한 불확실성을 해소해 나가지 못할 경우, 당사는 향후 감사인의 감사의견상 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정의견을 받을 가능성이 존재하며, 이 경우 투자주의환기종목으로 지정될 수 있고, 이를 해소하지 못할 경우 상장 폐지에 이를 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [주요 재무사항 총괄표] | |
| (단위 : 백만원, %) | |
| 구 분 | 2024년 | 2023년 | 2022년 | 비 고 | ||
|---|---|---|---|---|---|---|
| 외부감사인 | 삼정회계법인 | 삼정회계법인 | 삼정회계법인 | - | ||
| 감사의견 | 적정 | 적정 | 적정 | - | ||
| (계속기업 불확실성 관련 주석기재) | 해당 | 해당 | 해당 | - | ||
| (작성기준) | 개별 | 개별 | 개별 | - | ||
| 1. 자산총계 | 76,086 | 63,922 | 45,857 | - | ||
| 유동자산 | 11,450 | 16,874 | 20,978 | - | ||
| 비유동자산 | 64,637 | 47,048 | 24,880 | - | ||
| 2. 부채총계 | 24,883 | 23,427 | 23,419 | - | ||
| 유동부채 | 4,943 | 10,325 | 20,539 | - | ||
| 비유동부채 | 19,941 | 13,102 | 2,879 | - | ||
| 3. 자본총계 | 51,203 | 40,495 | 22,439 | - | ||
| 자본금 | 10,552 | 6,801 | 4,866 | - | ||
| 자본잉여금 | 83,446 | 64,521 | 49,257 | - | ||
| 기타자본항목 | 10,253 | 9,895 | 9,352 | - | ||
| 이익잉여금(결손금) | (65,022) | (52,696) | (41,036) | - | ||
| 기타포괄손익누계액 | 11,974 | 11,974 | 0 | - | ||
| 4. 부채비율(%) | 49% | 58% | 104% | 부채총계 ÷ 자본총계 | ||
| 5. 유동비율(%) | 232% | 163% | 102% | 유동자산 ÷ 유동부채 | ||
| 6. 총차입금 | 13,172 | 14,293 | 19,309 | 유동성 차입금 + 비유동성 차입금 | ||
| 유동성 차입금 | 54 | 7,806 | 19,300 | - | ||
| 전환사채 | 0 | 5,497 | 11,875 | - | ||
| 파생상품부채 | 0 | 2,299 | 7,382 | 전환사채 Put Option | ||
| 유동리스부채 | 54 | 10 | 43 | |||
| 비유동성 차입금 | 13,118 | 6,487 | 9 | - | ||
| 장기차입금 | 13,070 | 6,487 | 0 | - | ||
| 금융리스부채 | 48 | 0 | 9 | - | ||
| - 총차입금 의존도(%) | 17.3% | 22% | 42% | 총차입금 ÷ 자산총계 | ||
| - 유동성 차입금 비중(%) | 0% | 55% | 100% | 유동성 차입금 ÷ 총차입금 | ||
| 7. 영업활동 현금흐름 | (10,315) | (7,115) | (12,216) | - | ||
| - 영업활동현금흐름 총부채 비율(%) | -41% | -30% | -52% | 영업활동현금흐름 ÷ 부채총계 | ||
| 8. 투자활동 현금흐름 | (15,066) | (752) | 14,002 | - | ||
| 9. 재무활동 현금흐름 | 21,025 | 12,993 | 1,263 | - | ||
| 10. 현금 및 현금성자산 | 9,024 | 13,381 | 8,254 | - | ||
| 11. 순차입금 | 4,148 | 913 | 11,055 | 총차입금 - 현금 및 현금성자산 | ||
| - 순차입금 의존도(%) | 5% | 1% | 24% | 순차입금 ÷ 자산총계 | ||
| 12. 매출액 | 4,165 | 0 | 480 | - | ||
| 13. 매출원가 | 3,460 | 0 | 325 | - | ||
| - 매출원가율(%) | 83% | N/A | 68% | 매출원가 ÷ 매출액 | ||
| 14. 매출총이익 | 705 | 0 | 155 | - | ||
| 15. 판매비와관리비 | 9,199 | 7,159 | 7,180 | - | ||
| - 판매비와관리비율(%) | 221% | N/A | 1496% | 판매비와관리비 ÷ 매출액 | ||
| 16. 경상연구개발비 | 3,487 | 5,039 | 7,886 | |||
| 17. 영업이익 | (11,980) | (12,198) | (14,911) | - | ||
| - 영업이익률(%) | -288% | N/A | -3107% | 영업이익 ÷ 매출액 | ||
| 18. 기타수익 | 29 | 86 | 153 | - | ||
| 19. 기타비용 | 144 | 141 | 130 | - | ||
| 20. 금융수익 | 1,072 | 2,281 | 956 | - | ||
| 21. 금융비용 | 1,235 | 1,639 | 8,932 | - | ||
| 이자비용 | 472 | 1,264 | 1,628 | - | ||
| - 이자보상배수(배) | N/A | N/A | N/A | 영업이익 ÷ 이자비용 | ||
| 22. 법인세비용차감전계속사업이익 | (12,259) | (11,611) | (22,865) | - | ||
| - 자기자본 대비 비중(%) | -23.9% | -28.7% | -101.9% | 법인세비용차감전계속사업이익 ÷ 자기자본 | ||
| 23. 법인세비용 | 0 | 0 | 0 | - | ||
| 24. 당기순이익 | (12,259) | (11,611) | (22,865) | - | ||
| - 당기순이익률(%) | -294% | N/A | -4763% | 당기순이익 ÷ 매출액 | ||
| (자료) : 당사 감사보고서 |
당사의 재무제표는 계속기업으로서 존속할 것이라는 가정을 전제로 작성되었으므로 당사의 자산과 부채가 정상적인 사업활동 과정을 통하여 회수되거나 상환될 수 있다는 가정 하에 회계처리 되었습니다. 그러나 당사는 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 기재된 바와 같이 지속적인 영업손실과 당기순손실 발생 및 부의 영업현금흐름 발생, 이에 따른 결손금 누적과 재무상태 악화로 인하여 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 존재하는 상황입니다.
당사는 이를 해소하고자 자본확충 및 재무구조 개선을 위하여 다음과 같이 계획을 세우고 노력하고 있습니다.
| [ 하단의 개선 계획에 대한 유의사항 ] |
|---|
| 하단의 내용은 증권신고서 제출 전일 현재 시점에서 당사가 계속기업가정에 관한 중요한 불확실성을 해소하고자 취하고 있는 노력을 기재한 것으로써, 이는 미래에 대한 당사의 주관적 판단이 개입되었을 수 있고, 향후 실제 성과와는 상이할 수 있습니다. 투자자 여러분들께서는 하단의 개선 계획은 당사의 전망과 예상, 주관적 판단 등에 따른 것임을 반드시 유의하여 주시기 바랍니다. |
① 합병을 통한 사업다각화 및 안정적 매출 확보
당사는 2021년 BVAC-NEO 파이프라인의 기술이전을 통해 909백만원의 매출이 발생하였고, CeliVax 기반기술을 활용한 6종의 항암면역치료백신 파이프라인과 COVID-19 예방백신을 개발 중이나, 현재 비임상 또는 임상 단계의 연구 중으로 시판 중인 제품은 없어서 2022년부터는 바이오신약 개발 부문에서의 매출이 아직까지 발생하지 않고 있습니다. 또한 2022년 GMP 시설을 활용한 위탁생산 매출은 480백만원, 2024년 위탁생산 매출 312백만원과 용역 매출 46백만원이 발생하였으나, 추가적인 신규 수주를 하지 못할 경우에는 매년 안정적인 매출을 발생하기에는 한계가 있는 불안정적 사업 구조를 가지고 있습니다.
이에 당사는 안정적인 매출을 확보할 수 있는 사업부문의 다각화가 필요했으며, 이에 2024년 3월 7일 베이커리류 및 온라인 식품 유통판매업을 영위하고 있는 (주)포베이커의 주식 1백만주(지분율 100%)를 취득하여 지배력을 획득하였으며, 취득 직후 (주)포베이커를 피합병회사로 하여, 2024년 5월 14일을 합병기일, 2024년 5월 21일 합병등기 신청을 함으로써, 흡수합병을 완료하였습니다.
(주)포베이커는 2021년 3,394백만원, 2022년 3,607백만원, 2023년 5,577백만원, 2024년 1분기 748백만원의 별도 매출을 기록하였습니다. 당사는 2024년 5월 중 (주)포베이커를 흡수합병 완료함으로써, 합병 후 (주)포베이커의 매출은 당사 개별 재무제표상 매출에 포함됩니다. (주1), (주2)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 (주)포베이커 취득 및 흡수합병 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
| (주2) | 2024년 1분기 (주)포베이커의 별도 매출은 748백만원이나, 당사의 (주)포베이커 간주취득일은 2024년 3월 31일인 관계로, (주)포베이커의 1분기 매출은 간주취득일 이전 시점의 손익에 해당하여 2024년 1분기 당사 연결재무제표상 매출액에 포함되어 있지 않습니다. |
당사는 (주)포베이커 취득 및 합병에 따라, 당사 사업부문을 다각화함과 동시에 일정수준의 매출이 매년 발생할 것으로 기대하고 있습니다.
단, (주)포베이커는 외부감사 대상이 되지 않는 비상장법인이었기 때문에, 당사의 지분 취득 및 합병 당시 (주)포베이커의 재무 수치는 외부감사를 받지 않은 수치이므로 회계적 신뢰성을 보장할 수는 없는 상황이며, 당사의 기존 사업과는 무관한 영역의 사업분야이므로, 당사의 연구개발업과의 사업적 시너지 효과를 기대할 수는 없으며, 당사가 합병 후 경영에 참여했을 때 기존의 실적을 달성하지 못할 수도 있습니다. 또한 2021년부터 2023년까지 (주)포베이커의 매출은 증가세를 유지하였으나, 지속적 영업손실 및 당기순손실을 기록하는 등 수익성이 악화되는 추이를 기록해왔으며, 특히 2023년에는 822백만원의 당기순손실이 발생하며 순자산은 -481백만원으로 자본잠식 상태에 이르렀습니다. 2024년 1분기에는 매출 748백만원, 당기순이익 23백만원을 기록하며 흑자전환하였으나, 2023년 평균 분기매출 규모보다 낮은 수준의 매출이 발생하였습니다. 또한 흡수합병 후 이커머스사업부(구. 포베이커)의 2024년 매출은 약 3,807백만원으로, 간주취득일 이전인 2024년 1분기 매출액 748백만원과 4월부터 합병기일까지의 예상 매출액(작년 월평균 매출액의 1.5개월분으로 추정) 651백만원을 합하더라도 총 5,206백만원으로 전기 대비 6.7% 하락하였습니다(주1). 따라서 (주)포베이커를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)포베이커 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다.
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 (주)포베이커 손익 및 재무상태 추이 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
② 자본 확충 및 재무 개선
당사는 현재까지 안정적인 매출원이 없는 상태에서 지속적으로 연구개발업에 매진해오고 있어, 매년 연구개발비용, 기타 운영자금 등의 지출이 비용으로 인식되며 지속적인 적자 및 부의 영업현금흐름이 발생하는 사업 구조를 가지고 있기 때문에, 자체 현금흐름 창출능력이 떨어지므로 주기적인 외부 자금 조달이 필요한 상황이며, 자금 조달 방식에 있어서도, 관리종목 지정 부담 또는 자본잠식 부담 등을 종합적으로 고려하면 부채보다는 자본으로 인정될 수 있는 방식의 조달을 해야 하는 상황입니다.
당사는 2019년 2월 코스닥시장에 상장하며 신주 발행을 통해 운영자금 및 시설자금 등 목적으로 39,357백만원의 자금을 자본으로 조달하였습니다. 2021년 3월에는 운영자금 및 시설자금 등 목적으로 전환사채 발행을 통해 19,000백만원의 자금을 조달하였으나 2024년 6월 19일을 끝으로 전액 상환 완료되었습니다. 이에 전환사채의 주식 전환에 따른 자본 증가 효과는 발생한 바 없습니다.
이어 2023년 9월에는 주주우선공모 방식의 신주 발행을 통해 운영자금 17,481백만원의 자금을 자본으로 조달하였으나, 이는 당시 최초에 목표했던 조달금액 400억원에 한참 미치지 못한 수준이므로, 추가적인 자금 및 자본의 동시 확충이 반드시 필요한 상황이었습니다. 이에 2024년 8월에는 주주배정 후 실권주 일반공모 방식의 유상증자 신주 발행을 통해 운영자금 23,175백만원을 조달하였습니다. 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하였으며, 계획된 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 계획입니다. 이에 해당 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 등 필요한 추가 자본을 조달하고 있는 상황입니다. (주1)
| (주1) | 당사의 잦은 자금조달 관련 위험요소는 본 증권신고서 "제1부-III.투자위험요소-2.회사위험-사." 부분을 참고하여 주시기 바랍니다. |
당사는 본 유상증자를 통해 자금 조달 및 자본 확충을 이루고, 해당 자금으로 지속적 연구개발 매진 및 임상 성공에 노력하고, 그 과정에서 회사 운영에 필요한 자금을 지출하며, 향후 자금 부족으로 인한 영업활동 문제가 생기지 않게끔 최선의 노력을 하고 있습니다.
단, 본 유상증자시 주가 하락 등의 사유로 최종 발행가액이 하락할 경우 또는 청약 결과 실권이 발생하여 15% ~ 20%의 실권수수료를 지급하게 될 경우, 그 외 예상치 못한 기타 사유 발생 등에 의해 유상증자를 철회하게 될 경우 등 당사가 계획한 목표 자본을 조달하지 못할 가능성이 존재합니다. 이 경우 당사의 재무구조 개선은 실패할 수 있고, 당사의 계속기업으로서의 존속능력 불확실성은 더욱 커질 수 있습니다.
③ 파이프라인 연구개발 매진 및 임상 성공 노력
당사는 항암면역치료백신 기반기술인 CeliVax와 아데노바이러스 벡터 기반 감염병 예방백신 기반기술인 Ad5/35를 보유한 바이오제약기업으로, 2종의 기반기술을 활용하여 CeliVax 항암면역치료백신과 COVID-19 예방백신을 연구개발하고 있으며, 기술이전 또는 임상 성공 및 상품화 성공을 통한 매출 발생을 목표로 하고 있습니다.(주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-1.사업위험" 내 전반적인 부분 및 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 당사의 각 파이프라인별 내용 및 진행상황 등 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
현재 당사는 자체 개발 중인 아데노바이러스 벡터 플랫폼 기반 오미크론 전용 백신 'AdCLD-CoV19-1 OMI'의 허가를 득하고 다가백신 등 파이프라인을 확장하여 경쟁력 있는 코로나19 백신 공급을 통한 매출 확대를 기대하고 있습니다.
당사는 2023년 5월 23일 식품의약품안전처에 오미크론 전용 코로나19 백신 'AdCLD-CoV19-1 OMI'의 임상 3상 시험계획(IND)를 제출하였으며, 2023년 7월 21일에 'AdCLD-CoV19-1 OMI' 임상 3상 승인을 획득하였습니다. 현재 국내, 필리핀, 베트남에서 다국가 임상 3상 시험계획 신청 후 승인을 완료하여 진행 중에 있으며, 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하습니다. 임상 3상에서 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 확보한 중간 분석 결과를 기반으로 허가 신청 후 승인 시 정부 조달 시장에 백신을 공급할 목표를 가지고 있습니다.
감염병으로부터 면역력이 취약한 대상자는 각 13세 이하, 65세 이상, 임신부로 정의되고, 이 대상자들을 위해 정부는 조달청을 통해 백신을 일괄 구매한 뒤 정부 조달 무료 접종을 지원하고 있습니다. 정부 조달 무료접종 감염병 질환은 대표적으로 독감이 있으며, 매년 독감백신의 접종 사유는 당해년 유행할 것으로 예측되는 독감 변이바이러스에 효과적으로 대응하기 위함입니다. 코로나19의 경우에도 팬데믹 이후 엔데믹으로 변화되고 있으나 국지적으로 발생하는 코로나19 변이 바이러스에 효과적으로 대응하기 위해 동일한 대상자를 대상으로 독감백신 무료접종사업이 필수적일 것이라 판단되고 있으며 이는 전세계적으로 동일한 의견으로, 당사의 'AdCLD-CoV19-1 OMI'의 임상 3상이 조건부 품목허가를 받고, 신규 변이에 대응한 백신은 정부로부터 긴급사용승인을 받게될 경우 정부 조달 시장에 공급이 가능할 것으로 예상하고 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-1.사업위험-라. 및 1.사업위험-바." 부분에 정부 조달 시장에 관한 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
2022년 12월 말 행정안전부 자료에 의하면, 국내 무료 접종 지원 대상군은 13세 이하 약 5.4백만명과 65세 이상 9.3백만명으로서 약 14.7백만명에 해당되고 여기에 임신부 및 기타 무료접종 대상자인 군인 약 60만명 등을 포함하면 향후 정부예상 공급량은 약 15백만명 규모일 것으로 예상됩니다. 접종 지원 대상군 1명 당 부스터 1회 접종으로 가정한다면 약 15백만 도즈(현탁액주사제(1인 환자용))의 공급 규모로 추정가능합니다.
당사의 경우, 현재 공급되고 있는 화이자 및 모더나 등의 기존 mRNA백신과 비교하여, 당사가 자체 개발한 항원을 이용하기 때문에 상대적으로 가격경쟁력이 높을 것으로 예상되고, 또한 국내에서는 당사가 오미크론변이 부스터 및 다가백신에 대해 가장 적극적으로 개발 중인 상황이므로 정부 예상 공급량의 다수를 점유할 것으로 예측하고 있습니다.
국내 외에도 전 세계적으로 약 27.8억 도즈 이상 수요가 있을 것으로 전망되고 있습니다. 당사는 자체 개발한 코로나19 백신의 경쟁력 있는 가격과 유통/보관의 편의성을 기반으로 국내뿐만 아니라 베트남, 필리핀 등 동남아시아 국가를 중점적으로 점유율을 확보하여 코로나19 백신 관련 매출을 확대하는 데 노력할 예정입니다.
한편, 코로나19 백신 외에도 당사의 기존 주요 파이프라인인 BVAC 관련해서도 라이선스 아웃 등의 추가 매출을 실현하고자 노력하고 있습니다.
당사는 2021년 개인 맞춤형 항암면역치료제 BVAC-Neo에 대한 기술이전 계약을 LG화학과 체결하였으며, 기술 이전 완료에 따른 마일스톤 수령을 기대하고 있습니다. 현재 BVAC-Neo에 대한 비임상 시험을 진행 중이며, 임상시험 진입에 따른 단계별 마일스톤을 수령하여 매출 확대를 도모할 계획입니다.
또한 BVAC-NEO 외에도, 당사는 자체 원천 기술 CeliVax를 활용하여 BVAC 파이프라인 5종을 보유하고 있으며, 각 파이프라인별 연구개발 및 임상시험 진입을 계획하고 있습니다. 또한 당사는 국제적 학회 및 컨퍼런스 참여를 통해 네트워크를 확장하고 국내외 제약·바이오기업들과 기술 이전을 진행할 계획입니다.
단, 당사의 연구개발 노력에도 불구하고, 연구개발 과정에서는 당사의 자본력 대비 지속적으로 막대한 자금이 투입되어야 하므로 당사가 보유한 파이프라인 중 임상에 성공하거나, 기술이전이 이루어지거나 또는 상품화 추진까지 이어지지 못할 경우에는 자본력 감소, 매출 미발생, 지속적 대규모 적자 발생 등 더 이상 계속기업으로서 존속할 수 없는 상황에 이를 수 있습니다.
④ GMP시설 CMO 위탁생산 관련 추가 수주 노력
당사는 자체 보유한 성남 GMP 센터를 활용하여 CMO 및 CDMO 사업에 진출하였으며, 2022년 9월 (주)이노베이션바이오와 이중 CAR-T 세포치료제 임상시험 IND 제출용 위탁생산 계약을 체결하고 3개월 만에 계약을 수행 완료하며 2022년 위탁생산에 따른 매출 480백만원이 발생하였습니다. 이어 2023년 3월 동사와 4,880백만원 규모의 임상시험용의약품 생산 계약을 추가적으로 체결하였으며, 2024년 추가 위탁생산 계약에 따른 금액 4,880백만원 중 진행률에 따른 매출 312백만원과 용역 매출 46백만원이 발생하였습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 당사의 GMP시설 CMO 사업 관련 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이어, 일부 타 업체들과도 당사 GMP시설에서의 신규 위탁생산 수주가 이루어지도록 홈페이지, 학회 및 부스활동 등의 홍보활동을 지속적으로 진행하고 있으며, 전문성 있는 연구/생산/품질의 일원화된 팀과 고도화된 GMP 시설을 활용하여 고객사의 요구사항에 대한 맞춤형 서비스를 제공하며 적극적인 영업활동을 전개하고 있습니다.
단, GMP시설을 갖추고 있는 업체들이 다수 존재하므로, 신규 수주 여부는 당사의 영업 경쟁력에 좌우될 수 있는 불안정성이 있고 당사의 노력은 실제 성과로 이어지지 못할 수 있습니다.
이처럼 당사는 자회사 합병을 통한 사업다각화 및 기본적인 매출 확보, 자본 확충을 통한 재무 개선, 파이프라인 연구개발 매진 및 임상 성공 노력, GMP시설을 활용한 위탁생산 추가 수주 및 매출 확보 등 재무적 개선 목적의 최선의 노력을 다하고 있으나, 당사의 계획에는 차질이 생길 수 있으며, 대내외적 사유로 인해 당사의 개선 노력은 실제 성과로 이어지지 않을 수 있습니다. 이 경우 당사의 재무구조는 더욱 악화되어 당사의 계속기업으로서의 존속능력에 대한 불확실성은 더욱 증가할 수 있고, 그 결과 당사의 자산과 부채를 정상적인 영업활동 과정을 통하여 장부가액으로 회수하거나 상환하지 못할 수도 있습니다. 당사가 계속기업으로서의 존속능력에 대한 불확실성을 해소해 나가지 못할 경우, 당사는 향후 감사인의 감사의견상 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정의견을 받을 가능성이 존재하며, 이 경우 투자주의환기종목으로 지정될 수 있고, 이를 해소하지 못할 경우 상장 폐지에 이를 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [다. 관리종목 지정 및 상장폐지 위험] 당사는 코스닥시장에서의 주요 관리종목 지정 요건 중 (1)매출액 요건 또는 (2)법인세비용차감전계속사업손실 요건에 해당될 수 있는 위험이 큰 상태입니다. 2025년 당사의 개별재무제표상 매출액이 30억원 이상 발생하지 않을 경우 또는 각 사업연도말 자기자본총계 대비 50%를 초과하는 법인세비용차감전계속사업손실이 2025년, 2026년 및 2027년 중 2회 이상 발생할 경우 당사는 관리종목으로 지정됩니다. 2024년말까지 당사 매출액은 4,165백만원에 그치고 있으며, (주)포베이커 지분 취득 및 합병, GMP시설 매출 인식 등 노력에도 불구하고 2025년 매출은 30억원 이상을 달성하지 못할 수 있습니다. 또한 본 유상증자 자본 확충 노력에도 불구하고, 자본 확충 규모가 예상보다 감소할 수 있고, 연구개발비 및 운영자금 등 비용 지출로 인한 손실 발생, 자산화된 개발비 등의 손상평가, 그 외 예상치 못하거나 통제하기 어려운 손실 발생 등 대규모 세전손실이 발생할 우려가 있기에 2025년말, 2026년말 및 2027년말 자기자본총계 대비 50%를 초과하는 법인세비용차감전계속사업손실이 발생할 수 있습니다. 한편 2025년 1월, 금융위원회와 금융감독원, 한국거래소, 금융투자협회, 자본시장연구원은 서울 여의도 한국거래소 1층 컨퍼런스홀에서 공동세미나를 열고 IPO 및 상장폐지 제도 개선 방안을 공개하였습니다. 저성과기업의 적시 적절한 퇴출을 통한 증시 전반의 밸류업에 기여하기 위해 상장폐지 요건은 강화하고, 절차는 효율화하면서 퇴출확대로 인한 투자자보호 이슈를 보완하기 위해 비상장 거래 및 공시 관련 제도를 함께 개선하기 위함이라고 밝혔습니다. 현재 당사는 시총 600억 이상이기 때문에 매출액 요건에 적용받지 아니하지만, 추후 시총이 감소하게 되면 시가총액 및 매출액 요건에 지정될 가능성이 있습니다. 단순 매출액만 고려하면 당사의 매출은 2024년 기준 4,165백만원으로 상향된 매출액 요건을 적용하면 2027년도부터 매출액 요건인 50억원에 미달하는 상태입니다. 또한 감사의견 미달 사유(한정, 부적정, 의견거절) 발생 이후 다음 사업연도 감사의견 미달(사업보고서 미제출도 포함)시 즉시 상장폐지가 되기 때문에 당사의 감사의견을 투자자 여러분 께서는 필히 주기적으로 확인하셔야 합니다. 또한 코스닥 상장적격성 실질심사 심의단계 및 개선기간 축소에 따라 해당 사유가 발생하게 될 경우, 기존 상장폐지 절차보다 더 빠르게 상장폐지가 진행될 수 있으며, 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. 만일 상장적격성 실질심사 대상이 될 경우 코스닥시장에서의 주식 거래는 장기간 정지될 수 있고, 실질심사 과정에서 상장폐지까지 이어질 위험성이 존재합니다. 또한 만일 당사가 관리종목으로 지정될 경우 중요 사유 발생시마다 한국거래소는 일정기간 매매거래정지 명령을 발동할 수 있습니다. 이외에도 주식의 미수나 신용거래가 금지되며, 미수나 신용거래의 증거금이 되는 대용유가증권으로도 사용할 수 없습니다. 또한 이러한 관리종목 지정사유 확인 당일 코스닥시장에서의 거래는 정지되며, 이를 각 요건별로 정해진 기한 내에 해결하지 못한다면 코스닥시장 상장폐지 사유에 해당하여, 당사 주식은 향후 장내에서 거래가 이루어지지 못하여 투자자 여러분들께서는 투자 원금의 전부 또는 일부를 회수하지 못할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 2019년 2월 기술성장특례 요건을 통해 코스닥시장에 상장하였습니다.
| [기술성장특례 상장 시 기술평가 내역] |
| 평가기관 | 기술평가등급 | 평가일자 | 평가내용(요약) |
|---|---|---|---|
| 한국기업데이터 | A | 2018.09.17 | (주)셀리드(이하 '동사')는 2006년 12월 설립된 비외감법인으로 항암면역치료백신 개발을 주력제품(사업)으로 하는 의학 및 약학 연구개발업을 영위중으로 2018년 5월 납입자본금을 4,083백만원으로 증자하였으며, 2017년 12월말 현재 총자산 4,963백만원, 자기자본 -1,592백만원(납입자본금 6,766백만원), 평가기준일 현재 상시종업원 6명 규모의 소상공인으로 주요 관계회사로는 아미코젠(주)(기타 식품 첨가물 제조업, 효소, N-아세틸글루코사민외) 등이 있음. 동사가 보유하고 있는 관련 핵심기술은 “B세포 및 단구기반 항암면역치료 백신 개발 기술”로 기존의 수지상세포 기반 백신과 달리 B세포 및 단핵구 세포를 대상으로 개발이 이루어졌다는 점으로 볼 수 있음. 최근의 개발동향은 세포를 사용한 치료백신의 경우 능동적 면역유도를 위해서는 대부분 수지상세포를 사용하고 있으며 수동적 면역능 제공을 위해서는 주로 T세포 및 NK세포를 대상으로 연구개발이 진행되어 왔으나, 해당기술은 B세포 및 단핵구세포를 대상으로 하고 있어 차별화 되어 있음. 또한, B세포 및 단핵구에 NK세포의 활성화를 유도할 수 있는 리간드를 추가하여 선천면역체계의 활성화를 동시에 유도할 수 있게 되어 있으며, 임상에서의 추가적인 효능평가가 요구되기는 하지만 B세포를 표적으로 하는 경우 항체생성을 촉진하는 효과가 있어 선천면역반응, 세포성 면역반응, 체액성 면역반응을 모두 촉진하는 복합적인 효과를 나타낼 수 있을 것으로 판단되며 이는 기존의 기술들과는 다른 차별성을 보유하고 있는바, 높은 수준의 기술력을 가진 기업으로 평가함. |
| 나이스디앤비 | BBB | 2018.09.17 | (주)셀리드 (이하 '동사')는 항암면역세포치료제 개발을 목적으로 2006 년 설립된 연구개발 전문기업으로 CeliVax 기반기술로 항암면역치료백신을 개발하고 있음. CeliVax는 자가면역세포를 이용한 치료백신 개발기술로 환자 혈액에서 B 세포와 단구를 채취 하여 환자가 가지고 있는 암세포에 대한 면역반응을 유발하도록 세포에 조작을 가한 후 이를 다시 환자 자신의 체내에 주입 하여 환자 체내에 있는 항암면역기능을 활성화시킴으로써 암세포를 제거하는 기술임. CeliVax기반기술은 항원제시세포 면역증강제 아데노바이러스 벡터를 주요 구성요소로 포함함. 대표적인 항원제시 세포인 수지상세포를 이용하는 경우 항원제시기능은 우수하나 세포수가 적어 오랜 배양시간이 걸리는 단점이 있음. 이를 극복하기 위하여 동사는 혈중에 충분량 존재하고 쉽게 채취가 용이한 B 세포와 단구를 항원제시세포로 이용하고 수지상세포와 같이 우수한 항원제시기능을 부가하기 위하여 NKT 세포 리간드인 αGC 를 면역증강제로 이용함. 또한 CeliVax 의 완제의약품 1 일 제조기술과 융합형 암항원 개발기술로, 동사는 환자에게 항암면역치료백신의 신속한 공급이 가능하고 , 암항원 유전자를 대상 암종별로 교체하여 다수의 파이프라인을 신속히 개발할 수 있음. |
| 자료 : 한국기업데이터, 나이스디앤비(2018.09.17) |
당사는 현재 코스닥 상장법인으로서, 관련 거래소 규정에 따라 관리종목 지정 또는 상장폐지 요건에 해당될 가능성이 생길 수 있으므로, 투자자 여러분들께서는 다음과 같이 코스닥시장에서의 관리종목 지정요건 및 상장폐지 요건에 대해 반드시 유의해주셔야 합니다.
| [코스닥시장 관리종목 지정요건 및 해당여부 검토] |
| 구 분 | 관리종목 지정(코스닥 상장규정 제53조) | 관리종목지정유예 | 관리종목 지정요건 적용여부 |
회사현황 | ||
|---|---|---|---|---|---|---|
| 해당여부 | 유예기간 | 사업연도 | 금액(백만원) / 비율(%) / 내용 | |||
| (1) 매출액 미달 | 최근 사업연도 30억원 미만 (지주회사는 연결기준) - 이익미실현기업 또는 기술성장기업은 상장후 5년간 미적용 - 기술성장기업 중 A), B), C) 중 어느 하나에 해당하는 제약·바이오기업은 최근 사업연도 미적용 A) 최근 사업연도 말「제약산업 육성 및 지원에 관한 특별법」에 따른 혁신제약기업이 세칙으로 정한 요건을 충족하는 경우 B) 최근 사업연도의 일평균 시가총액 4,000억 이상이며, 그 금액이 현재의 자본금을 초과하는 기업이 세칙으로 정하는 요건을 충족하는 경우 C) 최근 3사엽언도의 매출액 합계 90억 이상이며, 최근 사업연도의 직전 사업연도의 매출액이 30억 이상인 경우 |
해당 후 종료 |
2024년부터 적용 |
2024년부터 최근 사업연도 매출액 30억원 미만시 해당 |
2024년 | 4,165백만원 |
| (2) 법인세비용차감전 계속사업손실 |
최근 3사업연도중 2사업연도에 각각 10억원 이상이면서 해당 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 (다만, 상장일부터 상장일이 속한 사업연도의 말일까지의 기간이 3개월 미만인 경우에는 상장일이 속하는 사업연도와 그 이후 5개 사업연도로 한다) - 기술성장기업은 상장후 3년간 미적용(다만, 상장일부터 상장일이 속한 사업연도의 말일까지의 기간이 3개월 미만인 경우에는 상장일이 속하는 사업연도와 그 이후 3개 사업연도로 한다) |
해당 후 종료 |
2022년부터 3사업연도 적용 |
2025년부터 3사업연도 중 2사업연도에 법인세비용차감전계속사업손실이 각 사업연도말 자기자본의 50% 초과시 해당 | 2022년 2023년 2024년 |
22,865백만원 손실 / 101.9% 11,611백만원 손실 / 28.7% 12,259백만원 손실 / 23.9% |
| (3) 자본잠식 등 | 최근 사업연도말 현재 자본잠식률이 100분의 50 이상인 경우 | - | - | 최근 사업연도말 자본잠식률이 100분의 50 이상일 경우 해당 |
2024년말 | 자본금 : 10,552백만원 자본총계 : 51,203백만원 자본잠식률 : - |
| (4)자기자본 미달 | 최근 사업연도말 현재 자기자본이 10억원 미만인 경우 | - | - | 최근 사업연도말 자기자본이 10억원 미만일 경우 해당 | 2024년말 | 자본총계 : 51,203백만원 |
| (5) 시가총액 미달 | 보통주 시가총액 40억원미만 30일간 지속 - 천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
- | - | 현재 미해당 | 현재 기준 | 현재 충족 |
| (6) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 | - | - | 현재 미해당 | 현재 기준 | 현재 특이사항 없음 |
| (7) 지배구조 미달 | 최근 사업연도 사업보고서상 A)사외이사의 수가 「상법」 제542조의8의 규정에서 정하는 수에 미달하는 경우 B) 「상법」 제542조의11의 규정에서 정하는 감사위원회를 구성하지 않거나 감사위원회의 구성요건을 충족하지 못하는 경우 *「상법」 제542조의8에 의거 자산총액 1,000억원 미만의 코스닥 상장 벤처기업은 사외이사 선임 의무 면제 **「상법」 제542조의11에 의거 자산총액 2조원 미만의 상장회사는 감사위원회 설치 의무 면제 |
- | - | 현재 미해당 | 2024년말 | 사외이사 선임 의무 면제 (자산총액 : 76,086백만원) |
| (8) 거래량 미달 | 분기월평균거래량이 유동주식수의 1%에 미달 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다. - 신규상장법인(신규상장일이 속하는 분기에 한정) - 분기의 월평균거래량 1만주 이상(액면가액 5,000원 기준) - 「코스닥시장 업무규정」(이하 “업무규정”이라 한다) 제12조의3제1항에 따른 유동성공급계약이 체결된 경우 - 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. |
- | - | 현재 미해당 | 2024년말 | 소액주주 지분율 87.45% 34,080명 |
| (9) 주식분산 미달 | 소액주주 200인미만 or 소액주주지분 20%미만 - 300인이상의 소액주주가 유동주식수의 10%이상으로서 100만주이상을 소유, 해외증권시장에 상장된 경우는 적용배제 |
- | - | 현재 미해당 | 2024년말 | 소액주주 지분율 87.45% 34,080명 |
| (10) 회생절차 개시신청 | "채무자 회생 및 파산에 관한 법률" 제34조에 의한 회생 절차개시 신청이 있는 경우 | - | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| (11) 파산신청 | 코스닥시장 상장법인에 대하여 "채무자 회생 및 파산에 관한 법률" 제294조에 의한 파산신청이 있는 경우 | - | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| (12) 기타 | - 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 - 변경·추가상장이 유예된 기간 중에「증권의 발행 및 공시 등에 관한 규정」에 따른 재무관리기준을 위반한 경우 |
- | - | 현재 미해당 | 현재 기준 | 해당사항 없음 |
| 자료 : 당사 사업보고서 |
| 주) 2022년~2024년 : 개별 재무제표 기준입니다.(연결 종속회사 없음) |
당사는 기술성장특례 요건을 통해 코스닥시장에 2019년 2월 상장하였으며, 상기 규정에 따라 관리종목 지정 요건 중 재무 관련 사항 일부(매출액 요건, 법인세비용차감전 세전손실 요건)를 일정기간 동안 유예받아 왔으나, 현재 모든 유예기간이 종료된 상태입니다. 주요 요건별로, 관리종목 지정 가능성을 살펴보면 다음과 같습니다.
(1) 매출액 미달 여부 검토
| [매출액 미달 여부 검토] |
| (단위 : 백만원) |
| 구분 | 2024년 | 2023년 | 2022년 | |
|---|---|---|---|---|
| 매출 | 4,165 | - | 480 | |
| 위탁생산 | 358 | - | 480 | |
| 기술이전 | - | - | - | |
| 이커머스(베이커리) | 3,807 | - | - | |
| 자료 : 당사 사업보고서 |
코스닥시장 상장규정 제53조 1항 1호에 따라 최근 사업연도의 매출액이 30억 미만일 경우 관리종목으로 지정됩니다. 그러나 당사는「코스닥시장 상장규정」제2조 제39항에서 정하는 기술성장 기업으로서, 동 규정 제53조 제1항 1호 가목에 따라 최근사업연도의 매출액 미달 요건으로 인한 관리종목 지정은 2023년 사업연도까지 유예된 바 있습니다. 이에 2019년 상장 후 2023년 사업연도까지 매출액은 지속적으로 30억원 미만을 달성하였음에도 불구하고, 당사는 관리종목으로 지정되지 않았습니다. 하지만 2024년부터는 유예기간이 종료됨에 따라 당사는 2024년을 포함하여, 향후에는 매년 매출액(K-IFRS 개별/별도 기준) 30억원 이상 달성해야만, 관리종목에 지정되지 않습니다. 따라서 투자자 여러분들께서는 2025년부터 항후 매출 발생 추이를 실시간 주시해주셔야 합니다.
당사의 2024년 매출은 4,165백만원이며, 이는 당사가 흡수합병한 (주)포베이커(현. 당사의 이커머스사업부)의 매출 3,807백만원과 당사 GMP시설에서 이노베이션바이오와의 위탁생산계약(계약규모,880백만원)에 따른 진행기준 매출 312백만원과 용역매출인 46백만원이 해당됩니다. 이어, 일부 타 업체들과도 당사 GMP시설에서의 신규 위탁생산 수주가 이루어지도록 영업활동을 전개하고 있으나 GMP시설을 갖추고 있는 업체들이 다수 존재하므로, 신규 수주 여부는 당사의 영업 경쟁력에 좌우될 수 있는 불안정성이 있고 당사의 노력은 실제 성과로 이어지지 못할 수 있습니다.
| [(주)포베이커 별도 매출] |
| (단위 : 백만원) |
| 구 분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 매출 | 748 | 5,577 | 3,607 | 3,394 |
| 자료 : 당사 사업보고서 및 분기보고서, (주)포베이커 | |
| (주1) | 상기 수치는 외부감사인의 감사를 받지 않은 수치입니다. |
한편, 당사가 2024년 3월말(간주취득일) 100% 지분을 취득한(2024년 5월 14일을 합병기일로 하여, 당사가 흡수합병함) (주)포베이커는 2021년 매출 3,394백만원, 2022년 매출 3,607백만원, 2023년 매출 5,577백만원을 기록하였습니다. 당사에 흡수합병 후 2024년 매출은 3,807백만원을 기록하였으며, 간주취득일 이전에 발생하여 당사의 매출로 계상되지 않은 (주)포베이커의 2024년 1분기 매출 748백만원과 4월부터 합병기일까지의 예매출액(작년 월평균 매출액의 1.5개월분으로 추정) 651백만원을 합산하면 2024년 매출은 총 5,206백만원으로 계산할 수 있습니다.
이는 2023년 대비 6.7% 줄어든 금액이며, 당사의 이커머스사업부(구. (주)포베이커) 관련 매출이 기대 이상으로 발생하지 못할 경우, 당사가 관리종목 지정 매출 요건을 맞추지 못할 위험성이 높아집니다.
이 외에도, 당사는 각 파이프라인별로 연구개발에 매진하여 기술이전, 임상성공 등 성과가 발생하도록 노력하고 있으나, 향후 라이선스 아웃 및 임상 실패/지연 등으로 인해 실제 매출 발생로 연결되기 어려울 수 있습니다.
따라서 당사 2025년 매출이 30억원 이상 달성하지 못할 위험이 존재하며 이는 관리종목 지정으로 직결되는 만큼 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
(2) 자기자본 50% 초과 법인세차감전계속사업손실 발생 여부 검토
| [법인세차감전계속사업손실 발생 여부 검토] | |
| (단위 : 백만원, %) | |
| 구분 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|
| 법인세비용차감전순손실 | (12,259) | (11,611) | (22,865) |
| 자기자본 | 51,203 | 40,495 | 22,439 |
| 법인세비용차감전순손실/자기자본 | -23.9% | -28.7% | -101.9% |
| 자료 : 당사 사업보고서 |
코스닥시장 상장규정 제53조 1항 2호에 따라 최근 3사업연도 중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근 사업연도에 법인세비용차감전계속사업손실이 있는 경우 관리종목으로 지정됩니다. 그러나 당사는「코스닥시장 상장규정」제2조 제39항에서 정하는 기술성장 기업으로서, 법인세비용차감전계속사업손실 요건으로 인한 관리종목 지정은 2021년 사업연도까지 유예된 바 있습니다. 하지만 2022년부터는 유예기간이 종료됨에 따라 당사는 2022년부터 해당 요건을 적용받게 됩니다. 이에, 최근 3사업연도(2022년, 2023년, 2024년) 중 2사업연도에 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고, 2024년에 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 발생할 경우 관리종목에 지정되나, 2024년 기준 23.9%로 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 발생하지 않아 해당 관리종목 지정 요건은 충족하지 않습니다.
당사는 2022년 법인세비용차감전순손실 22,865백만원을 기록하였고, 이는 자기자본의 101.9%로 50%를 초과하였습니다. 2023년에는 자기자본 대비 28.7% 규모의 법인세비용차감전순손실이 발생하였으나 이는 유상증자 및 토지 재평가이익 인식에 따라 자기자본이 40,495백만원으로 증가함에 따른 것으로 판단됩니다. 2024년에는 법인세비용차감전순손실 12,259백만원을 기록하였고, 이는 자기자본의 23.9%로 50%를 초과하지는 않았습니다. 따라서 당사는 앞으로 2025년도, 2026년도, 2027년도 중 2개 사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근 사업연도(2026년도 또는 2027년도)에 법인세비용차감전계속사업손실이 있는 경우 관리종목으로 지정됩니다.
2024년말 기준 당사 자기자본 총계는 51,203백만원이며, 세전손실은 12,259백만원이 발생하였습니다. 당사는 자기자본 확대를 위해 본 유상증자를 통해 자본 확충을 이루고자 하며, 향후 손실 통제에 최선을 다할 예정입니다. 그러나 본 유상증자 결과, 당사 목표 금액보다 적은 금액이 조달되어, 자본 확충 효과가 부진할 수 있고, 당사 손실 통제에도 불구하고 대규모 세전손실 발생에 의해 2025년말 기준 당사 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 발생할 위험이 존재합니다.
예정 발행가액 기준으로 당사 모집총액은 24,150,000,000원이나, 청약 결과 실권 규모 등에 의해 실권 수수료 지급 후 실제 자본 확충 금액은 24,150백만원보다 감소할 수 있으며,이 경우 2025년말 기준 당사 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 발생할 위험이 증가할 수 있습니다.
2025년말 당사 보유 자산에 대한 손상차손 평가 등 현 시점에서 당사가 예상하기 어려운 손실 발생 가능성이 존재하며, 특히 당사는 임상3상 진행을 완료한 파이프라인 연구개발비 관련하여 2024년말 기준 개발비 18,530백만원을 자산화해서 인식하고 있으며, 임상 실패시 이는 일시에 대규모 손상차손을 인식하게 될 수도 있습니다. 또한 임상이 아무리 순조롭게 진행되고 있다고 하더라도, 해당 자산 관련하여 시장성 평가, 미래 현금흐름 창출능력 보유여부 등을 고려하여 2025년말까지 누적적으로 자산화된 개발비에 대하여 일시에 대규모 손상을 인식할 수 있으므로 본 유상증자를 성공적으로 완료하여, 자본을 확충함에도 불구하고도 50%를 초과하는 대규모 세전손실이 발생하여, 관리종목으로 지정될 수 있습니다. 또한 2025년에는 유상증자 효과 및 비용 통제 노력 결과 관리종목 지정 위험에 대응할 수 있다고 가정하더라도, 궁극적으로 당사의 파이프라인 연구개발, 임상 진행, 제품화 성공 등이 이루어지지 않는다면 중장기적으로 당사의 손익은 개선되지 못하므로 이는 일시적으로 관리종목 지정을 회피하는 것에 그칠 수 있습니다.
(3) 자본잠식 여부 검토
| [자본잠식 여부 검토] | |
| (단위 : 백만원) | |
| 구분 | 2024년말 | 2023년말 | 2022년말 |
|---|---|---|---|
| 자기자본 | 51,203 | 40,495 | 22,439 |
| 자본금 | 10,552 | 6,801 | 4,866 |
| 자본잠식여부 | 미해당 | 미해당 | 미해당 |
| 자료 : 당사 사업보고서 |
코스닥시장 상장규정 제53조 1항 4호에 따라 최근 사업연도 말을 기준으로 자본잠식률 50%이상인 경우 관리종목으로 지정됩니다. 당사는 2024년말 현재 자본금 10,552백만원, 자기자본 51,203백만원으로 자본잠식 상태에 이르지는 않았으며, 본 유상증자 후에는 자본금 대비 자기자본 확대가 다시 한번 이루어지므로 2025년 중 자본잠식에 의한 관리종목 지정 위험은 대응 가능할 것으로 판단하고 있습니다. 단, 대규모 손실 발생시에는 자기자본이 크게 감액될 수 있으므로 자본잠식 여부에 대해서도 투자자 여러분들께서는 당사 재무 추이에 대해 실시간 주시해주셔야 합니다.
(4) 시가총액 미달여부 검토
| [시가총액 미달여부 검토] |
| (단위: 백만원) |
| 구분 | 시가총액(최고) | 시가총액(최저) | 시가총액(평균) |
|---|---|---|---|
| 2024년 | 193,706 | 23,941 | 77,913 |
| 자료 : KRX 정보데이터시스템 |
코스닥시장 상장규정 제53조 1항 5호에 따라 보통주 시가총액 40억원 미만 30일간 지속되는 경우 관리종목으로 지정됩니다. 당사의 2024년 시가총액은 최고 1,937억원, 최저 239억원, 평균 779억원이며 최근일 현재까지 시가총액 40억원 미만을 기록한 바는 없으므로, 현재까지는 시가총액 미달에 따른 관리종목 지정 요건에 해당된 바 없습니다.
(5) 정기보고서 미제출 여부 검토
코스닥시장 상장규정 제53조 1항 6호에 따라 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 관리종목으로 지정됩니다. 당사는 최근일 현재까지 정기보고서를 법정제출기한 내에 제출해오고 있습니다. 따라서 현재까지는 정기보고서 미제출에 따른 관리종목 지정 요건에 해당된 바 없습니다.
(6) 지배구조 미달 여부 검토
코스닥시장 상장규정 제53조 1항 7호에 따라 최근 사업연도 사업보고서상 A)사외이사의 수가 법에서 정하는 수에 미달 B) 법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 관리종목으로 지정됩니다.
당사는 본 공시서류 제출일 전일 현재 이사 4명 중 사외이사는 존재하지 않습니다. 또한, 감사위원회가 존재하지 않습니다. 다만, 상법 제542조의 8에 따르면 자산총액 1,000억원 미만의 코스닥 상장 벤처기업은 사외이사 선임 의무가 면제됩니다. 당사는 2024년말 현재 코스닥 상장 벤처기업으로 자산총액이 약 761억원이기 때문에 사외이사 선임 의무가 면제되고 감사위원회 설치 의무 역시 면제됩니다. 따라서 현재까지는 지배구조 요건 미달에 따른 관리종목 지정 요건에 해당된 바 없습니다.
(7) 거래량 미달 여부 검토
코스닥시장 상장규정 제53조 1항 8호에 따라 분기월평균거래량이 유동주식수의 1%에 미달하는 경우 관리종목으로 지정됩니다. 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다. 가) 신규 신규상장법인의 경우. 다만, 신규상장일이 속하는 분기에 한정하는 경우, 나) 분기의 월평균거래량이 1만주 이상인 경우. 이 경우 보통주식 상장법인이 액면주식을 발행한 때에는 액면가액 5,000원을 기준, 다) 세칙으로 정하는 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. 이 경우 소액주주가 소유한 주식 수와 소액주주의 수는 최근 사업연도 말을 기준으로 하되, 최근 사업연도 말 이후 주주명부를 폐쇄한 경우에는 그 폐쇄시점 현재를 기준으로 거래소에 제출한 주주명부 및 「주식·사채 등의 전자등록에 관한 법률」에 따른 소유자명세를 기준으로 하는 경우입니다.
당사는 2024년말 기준 소액주주 지분율 87.45%, 소액주주 수 34,080명임에 따라 상기 다) 항목에 해당되어 현재까지는 거래량 미달에 따른 관리종목 지정 요건에 해당된 바 없습니다.
(8) 주식분산 미달 여부 검토
코스닥시장 상장규정 제53조 1항 9호에 따라 최근 사업연도말 소액주주가 200인 미만이거나 소액주주지분이 20% 미만일 경우 관리종목으로 지정됩니다.
당사는 2024년말 기준 소액주주 지분율 87.45%, 소액주주 수 34,080명임에 따라 현재까지는 주식분산 미달에 따른 관리종목 지정 요건에 해당된 바 없습니다.
(9) 기타사항
코스닥시장 상장규정 제53조 1항 10호에서 13호까지에 따라 회생절차개시신청, 파산신청, 상장폐지사유발생, 재무관리기준 위반 요건에 해당하는 경우 관리종목으로 지정됩니다.
당사는 현재까지는 상기 기타사항 관련하여, 관리종목 지정 요건에 해당된 바 없습니다.
이처럼 당사는 코스닥시장에서의 주요 관리종목 지정 요건 중 (1)매출액 요건 또는 (2)법인세비용차감전계속사업손실 요건에 해당될 수 있는 위험이 큰 상태입니다. 2025년 당사의 개별재무제표상 매출액이 30억원 이상 발생하지 않을 경우 또는 각 사업연도말 자기자본총계 대비 50%를 초과하는 법인세비용차감전계속사업손실이 2025년, 2026년 및 2027년 중 2회 이상 발생할 경우 당사는 관리종목으로 지정됩니다. 2024년말까지 당사 매출액은 4,165백만원에 그치고 있으며, (주)포베이커 지분 취득 및 합병, GMP시설 매출 인식 등 노력에도 불구하고 2025년 매출은 30억원 이상을 달성하지 못할 수 있습니다. 또한 본 유상증자 자본 확충 노력에도 불구하고, 자본 확충 규모가 예상보다 감소할 수 있고, 연구개발비 및 운영자금 등 비용 지출로 인한 손실 발생, 자산화된 개발비 등의 손상평가, 그 외 예상치 못하거나 통제하기 어려운 손실 발생 등 대규모 세전손실이 발생할 우려가 있기에 2025년말, 2026년말 및 2027년말 자기자본총계 대비 50%를 초과하는 법인세비용차감전계속사업손실이 발생할 수 있습니다.
한편 2025년 1월, 금융위원회와 금융감독원, 한국거래소, 금융투자협회, 자본시장연구원은 서울 여의도 한국거래소 1층 컨퍼런스홀에서 공동세미나를 열고 IPO 및 상장폐지 제도 개선 방안을 공개하였습니다. 저성과기업의 적시 적절한 퇴출을 통한 증시 전반의 밸류업에 기여하기 위해 상장폐지 요건은 강화하고, 절차는 효율화하면서 퇴출확대로 인한 투자자보호 이슈를 보완하기 위해 비상장 거래 및 공시 관련 제도를 함께 개선하기 위함이라고 밝혔습니다.
(상장폐지 요건 강화 / 재무) 상장폐지 제도 개선안 관련하여 우선 시가총액 기준을 코스피는 50억원에서 500억원으로, 코스닥은 40억원에서 300억원으로 오는 2028년까지 단계적으로 상향하며, 매출액 요건도 코스피의 경우 50억원에서 300억원으로, 코스닥은 75억원에서 300억원으로 강화하기로 하였습니다. 다만, 매출액 요건 강화로 인한 부담을 완화하기 위해 성장 잠재력이 높은 기업에 대해 최소 시가총액 요건을 충족하면 매출액 요건이 면제되며, 코스닥 기업의 경우 최소 시가총액 600억 요건 충족 시, 매출액 요건이 면제됩니다.
| [시총 및 매출액 요건 단계별 강화방안] |
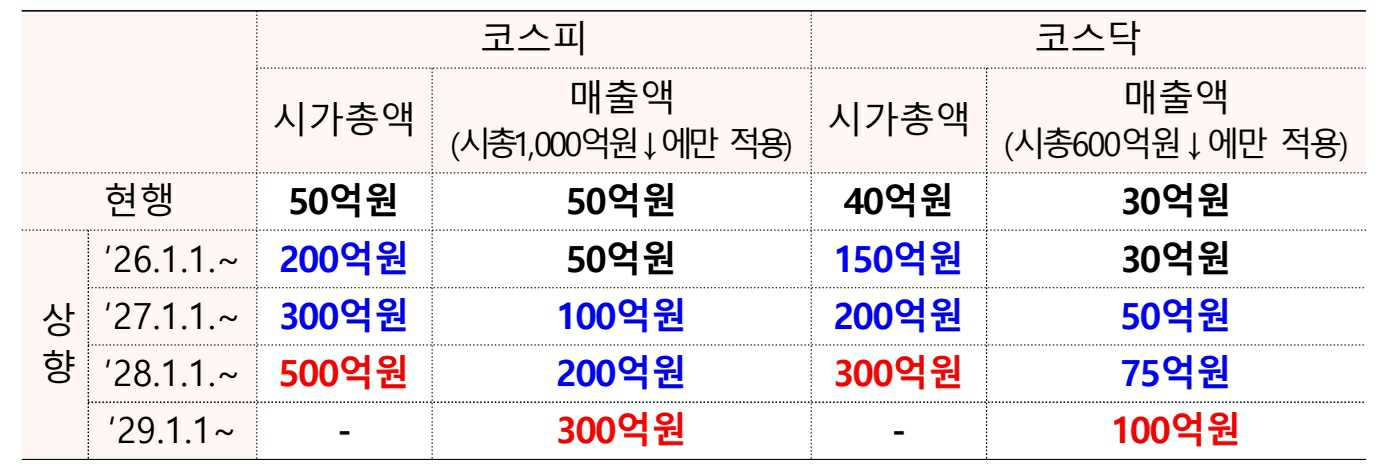 |
|
시총 및 매출액 요건 단계별 강화방안 |
| 자료 : 상장폐지 제도 개선방안 |
(상장폐지 요건 강화 / 비재무) 2회 연속 감사의견 미달(한정, 부적정, 의견거절)이 발생하면 이의신청 불가 형식적 사유로 규정하여 즉시 상장폐지됩니다. 예외적으로 국민경제에 미치는 영향을 고려하여 회생 및 워크아웃 기업에 대해서는 제한적으로 추가 개선기간 1년을 허용하기로 하였습니다.
| [감사의견 미달요건 기준 강화] |
 |
|
감사의견 미달요건 기준 강화 |
| 자료 : 상장폐지 제도 개선방안 |
(상장폐지 절차 효율화 / 심의단계 및 최대 개선기간 축소) 상장폐지 절차는 심의 단계와 개선 기간을 단축해 효율성을 높이기로 하였습니다. 코스피는 형식적 사유에 대한 이의 신청시, 최대 2년에서 1년으로, 실질심사시, 최대 4년(1,2심 각 2년)에서 2년(1,2심 각 1년)으로, 코스닥은 실질심사의 경우 심의단계부터 심의주체가 동일한 2심과 3심을 합쳐 2심제로 축소하고, 실질심사시, 최대 2년(1~3심 합산)에서 1년 6개월(1,2심 합산)로 줄이기로 하였습니다.
| [심의단계 및 개선기간 축소방안] |
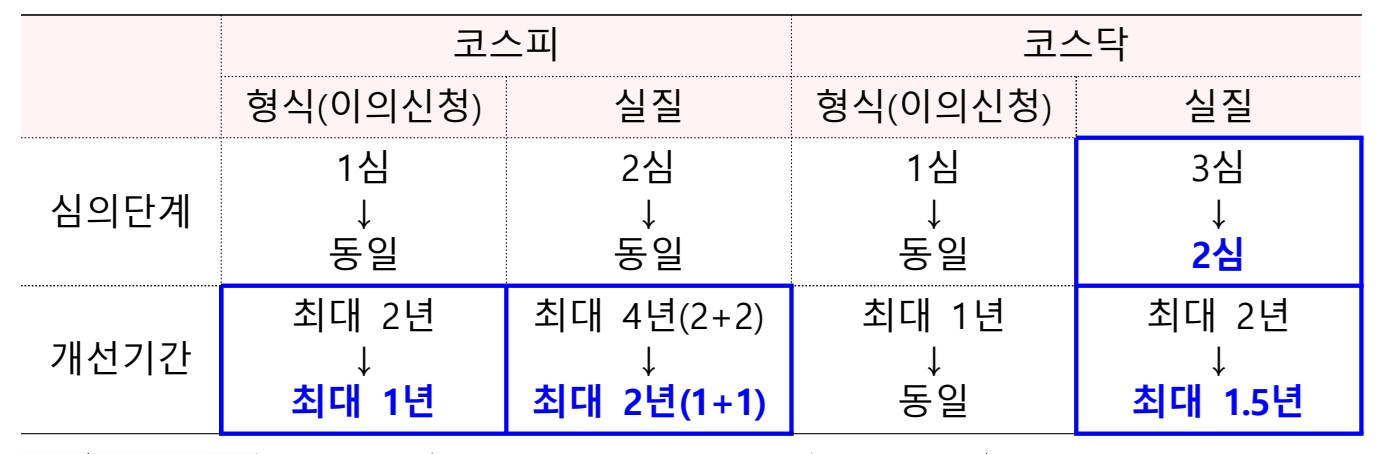 |
|
심의단계 및 개선기간 축소방안 |
| 자료 : 상장폐지 제도 개선방안 |
(상장폐지 절차 효율화 / 형식 및 실질사유 중복발생시 심사병행) 형식적 사유의 개선기간 부여 및 심의완료 후 새롭게 실질심사를 시작하는 구조가 절차지연 요인으로 작용하기 때문에 형식적 상장폐지 사유와 실질적 상장폐지 사유가 동시에 발생할 경우 심사를 병행하고, 하나라도 먼저 상장폐지 결정시 최종 상장폐지로 진행하도록 하였습니다.
| [형식 및 실질사유 중복발생시 심사병행] |
 |
|
형식및실질사유 중복발생시 심사병행 |
| 자료 : 상장폐지 제도 개선방안 |
증권신고서 제출일 현재 거래소 세칙은 개정되어 시행되고 있으나, 거래소 규정 개정은 2025년 상반기 중 완료될 예정입니다. 따라서 증권신고서 제출일 현재 절차개선 중 세칙사항인 상장적격성 실질 심사 절차에 대한 개선기간이 최대 2년에서 최대 1.5년으로 축소된 부분만 시행되고 있습니다. 다만, 시행시기는 충분한 기업 투자자 안내를 고려하여 2025년도 하반기 이후로 시행될 예정이며, 재무요건 강화는 2026년 초부터 단계별로 시행하고, 감사의견 미달 및 분할재상장 관련 요건 강화는 2025년 7월 1일부터 시행할 예정입니다. 또한 세칙 사항인 최대 개선기간 축소, 형식 실질 병행심사는 현재 시행되고 있으며, 규정 사항인 심의단계 축소는 2025년 7월 1일부로 시행할 예정입니다.
| [추진 계획] |
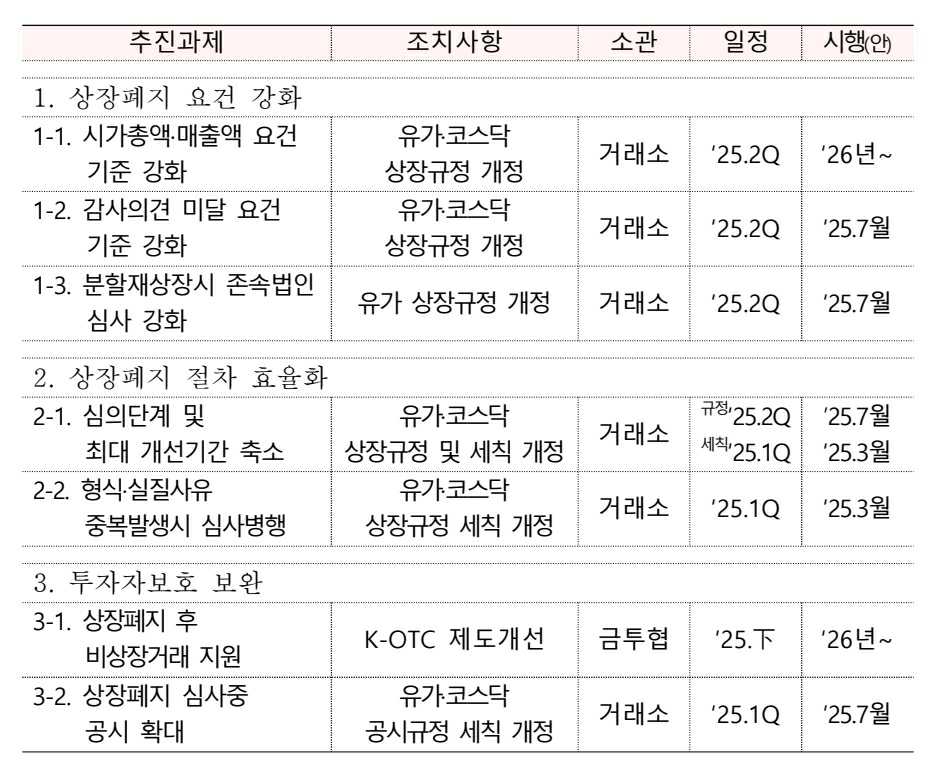 |
|
추진계획 |
| 자료 : 상장폐지 제도 개선방안 |
따라서 현재 당사는 시총 600억 이상이기 때문에 매출액 요건에 적용받지 아니하지만, 추후 시총이 감소하게 되면 시가총액 및 매출액 요건에 지정될 가능성이 있습니다. 단순 매출액만 고려하면 당사의 매출은 2024년 기준 4,165백만원으로 상향된 매출액 요건을 적용하면 2027년도부터 매출액 요건인 50억원에 미달하는 상태입니다. 또한 감사의견 미달 사유(한정, 부적정, 의견거절) 발생 이후 다음 사업연도 감사의견 미달(사업보고서 미제출도 포함)시 즉시 상장폐지가 되기 때문에 당사의 감사의견을 투자자 여러분 께서는 필히 주기적으로 확인하셔야 합니다. 또한 코스닥 상장적격성 실질심사 심의단계 및 개선기간 축소에 따라 해당 사유가 발생하게 될 경우, 기존 상장폐지 절차보다 더 빠르게 상장폐지가 진행될 수 있으며, 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
또한, 상기 관리종목 지정 요건 중 매출액 요건은 연 매출액을 기준으로 판단하지만, 코스닥시장상장규정 제56조 및 코스닥시장상장규정 시행세칙 제61조에 의하면 최근 분기의 매출액이 3억원 미만이거나, 최근 반기의 매출액이 7억원 미만일 경우 주된 영업이 정지되거나 또는 매출이 현저하게 부진한 상황으로 인식되어, 당사 주식은 상장적격성 실질심사 대상이 될 수 있습니다. 상기와 같이, 당사의 2024년 매출액은 4,165백만원으로, 1분기 3억원, 2분기 6억원(상반기 기준 9억원), 3분기 14억원, 4분기 19억원(하반기 기준 33억원) 분기 3억원 및 반기 7억원을 모두 초과한 것으로 나타났으나, 이는 이커머스사업부의 매출 및 (주)이노베이션바이오와의 CMO 위수탁 계약에 따라, 당사가 관련 계약상 공정별 용역금액 및 각 공정별 진행률을 산출하여, 자체적으로 판단한 매출을 인식한 것에 기인합니다. 이는 분기 매출액 3억원 및 반기 매출액 7억원을 초과할 가능성이 상대적으로 높아보이지만, 급작스러운 이커머스 사업부의 베이커리 매출 감소 및 더 이상 진행률에 따라 CMO 위수탁 계약의 매출 인식이 불가능한 상황의 발생 등 달성하지 못할 가능성을 배제할 수 없습니다.
이에 따라 만일 상장적격성 실질심사 대상이 될 경우 코스닥시장에서의 주식 거래는 장기간 정지될 수 있고, 실질심사 과정에서 상장폐지까지 이어질 위험성이 존재합니다. 또한 만일 당사가 관리종목으로 지정될 경우 중요 사유 발생시마다 한국거래소는 일정기간 매매거래정지 명령을 발동할 수 있습니다. 이외에도 주식의 미수나 신용거래가 금지되며, 미수나 신용거래의 증거금이 되는 대용유가증권으로도 사용할 수 없습니다. 또한 이러한 관리종목 지정사유 확인 당일 코스닥시장에서의 거래는 정지되며, 이를 각 요건별로 정해진 기한 내에 해결하지 못한다면 코스닥시장 상장폐지 사유에 해당하여, 당사 주식은 향후 장내에서 거래가 이루어지지 못하여 투자자 여러분들께서는 투자 원금의 전부 또는 일부를 회수하지 못할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [다-2. 투자주의 환기종목 지정 위험] 향후 당사가 관련 거래소 규정에 따라 투자주의 환기종목으로 지정될 경우, 상장폐지까지 이어질 위험성이 생길 수 있습니다. 이 경우 당사 주식은 향후 장내에서 거래가 이루어지지 못하여 투자자 여러분들께서는 투자 원금의 전부 또는 일부를 회수하지 못할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 현재 코스닥 상장법인으로서, 관련 거래소 규정에 따라 투자주의 환기종목으로 지정될 가능성이 생길 수 있으므로, 투자자 여러분들께서는 다음과 같이 코스닥 시장에서의 투자주의 환기종목 지정 요건 및 관련 제재사항 등에 대해 반드시 유의해주셔야 합니다.
| [코스닥시장 상장규정 제52조(투자주의 환기종목)] |
|
제52조(투자주의 환기종목) 1. 정기지정: 보통주식 상장법인의 영업·재무·경영 등에 관한 계량적·비계량적 변수 등을 고려하여 세칙으로 정하는 기업부실위험 선정기준에 해당하는 경우 2. 수시지정: 보통주식 상장법인이 다음 각 목의 어느 하나에 해당하는 경우 가. 외부감사법 제8조에 따른 내부회계관리제도의 운영실태에 대한 감사인의 검토·감사 결과 중요한 취약점이 발견되거나 중요한 범위제한이 있는 경우 또는 검토·감사의견이 표명되지 않은 경우 나. 제17조제1항을 위반하여 이 규정에 따른 의무보유 대상 주식등을 사실상 매각한 경우. 다만, 최대주주 변경을 수반하는 경우로 한정한다. 다. 제3자 배정 방식의 유상증자로 해당 보통주식 상장법인의 신주를 취득한 자에게 해당 취득일부터 6개월 이내에 선급금 지급, 금전의 가지급, 금전 대여, 증권(법 제4조제2항 각 호의 증권, 어음, 양도성 예금증서를 말한다)의 대여, 출자(타법인이 발행한 주식등 또는 출자증권의 취득을 말한다) 등을 한 사실이 공시 등을 통해 확인된 경우 라. 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정인 경우 마. 최대주주 변경으로 제51조제1항에 따른 의무보유가 적용되는지 여부가 확인되지 않은 경우 바. 제51조제1항에 따른 의무보유 대상자가 해당 의무보유를 이행하지 않은 경우 사. 최근 5개 사업연도에 각각 영업손실이 발생한 경우. 다만, 세칙으로 정하는 기술성장기업에는 이 목을 적용하지 않는다. 아. 최근 반기 말 현재 자본잠식률이 100분의 50 이상인 경우 자. 최근 반기 말 현재 자기자본이 10억원 미만인 경우 차. 최근 반기의 개별재무제표 또는 연결재무제표에 대한 감사인의 검토의견 또는 감사의견이 부적정, 의견거절이거나 감사범위 제한에 따른 한정인 경우 ② 거래소는 보통주식 상장법인을 투자주의 환기종목으로 지정하거나 해제하는 경우 지체 없이 공시매체에 공표하여야 한다. ③ 투자주의 환기종목 지정 사유의 적용방법과 지정 및 해제 시기, 그 밖에 필요한 사항은 세칙으로 정한다. |
| [코스닥시장 상장규정시행세칙 제48조(투자주의 환기종목의 지정 및 해제 등)] |
|
제48조(투자주의 환기종목의 지정 및 해제 등) ② 기업부실위험 선정기준은 다음 각 호에 따라 적용한다. 1. 12월 결산법인의 사업보고서 법정 제출기한까지 제출된 최근 사업연도의 감사보고서상 재무정보와 공시사항 등을 기준으로 판단할 것. 다만, 제52조제1항 각 호의 어느 하나에 해당하는 사유가 발생하여 법정 제출기한까지 사업보고서를 제출하지 못하는 경우에는 기업부실위험 선정 기준 해당 여부를 판단하는 기준일과 투자주의 환기종목 지정 및 해제 시기를 달리 정할 수 있다. 2. 지정일 전일 현재 규정 제54조의 형식적 상장폐지사유(규정 제54조제1항제5호의 주식분산 미달, 규정 제54조제1항제8호의 주식양도 제한, 규정 제54조제1항제11호의 지배구조 미달 사유는 제외한다)가 발생하였거나, 규정 제56조제1항제1호 및 제3호 각 목의 어느 하나에 해당하는 사실이 확인된 보통주식 상장법인에 대하여는 적용하지 않을 것 ③ 규정 제52조제1항제2호에 따른 수시지정 사유는 다음 각 호에 따라 적용한다. 1. 규정 제52조제1항제2호가목, 라목, 사목부터 차목까지의 사유: 공시규정 제6조제1항제2호마목(1)에 따라 신고된 검토·감사보고서를 기준으로 적용할 것. 이 경우 해당 신고에 대한 정정신고가 있는 때에는 정정하여 신고된 내용을 기준으로 신고일의 다음 날에 투자주의 환기종목으로 지정하거나 해제한다. 2. 규정 제52조제1항제2호사목부터 자목까지의 사유: 보통주식 상장법인이 지주회사로 전환하기 위하여 분할하였으나 지주회사 전환이 완료되지 않은 경우에는 분할기일이 속하는 사업연도와 그 다음 사업연도에는 적용하지 않을 것 3. 규정 제52조제1항제2호사목의 사유: 다음 각 목에 따라 적용할 것 가. 규정 제3조제7항제2호에도 불구하고 규정 제3조제7항제1호의 법인을 제외한 경우에는 개별재무제표를 기준으로 할 것 나. 보통주식 상장법인의 결산기 변경 등으로 사업연도가 6개월 미만인 경우 해당 사업연도에는 적용하지 않을 것 ④ 규정 제52조제1항제2호사목 단서에서 “세칙으로 정하는 기술성장기업”이란 우량기업부로 소속부가 변경지정되지 않은 기술성장기업을 말한다. ⑤ 규정 제52조제3항에 따른 투자주의 환기종목의 지정 및 해제 시기는 별표 9에서 정한다. ⑥ 제1항부터 제5항까지의 규정 외에 투자주의 환기종목의 지정과 해제 및 그 밖에 필요한 사항은 거래소가 따로 정한다. [전문개정 2022.12.9] |
| [코스닥시장 상장규정시행세칙 별표 8(기업부실위험 선정기준)] |
|
기업부실위험 선정기준 (세칙 제48조 관련)
1. 거래소는 기업부실에 유의한 영향을 미치는 아래의 기업부실위험 선정 변수, 변수별 기준치 및 변수별 가중치에 따라 코스닥시장 상장법인(기업인수목적회사를 제외한다. 이하 이 표에서 같다)의 부실 정도를 측정한다.
< 기업부실위험 선정 변수, 기준치 및 가중치 >
주1) 기준치는 변수별로 부실징후에 유의한 영향을 미치는지 여부를 판단하는 기준을 말하고,기준치의 변수값은 기준치를 충족하는 경우 1, 미충족하는 경우 0으로 한다. 다만, 기준치가 없는 변수의 경우에는 변수 측정치를 변수값으로 하되, 변수 측정치가 아래의 상한 또는 하한을 벗어나는 경우에는 해당 상한 또는 하한을 변수값으로 본다.
주2) 감사의견이 적정이나, 감사보고서상 계속기업존속 불확실성이 특기사항으로 기재된 경우를 포함한다.
2. 거래소는 코스닥시장 상장법인에 대하여 변수별로 측정된 부실 정도에 따라 아래의 방법으로 부실 징후 종합 측정치를 산출하고, 종합 측정치가 종합 임계치주1)를 초과하는지 여부 등을 감안하여 투자주의 환기종목으로 지정한다. < 부실 징후 종합 측정치 산출 방법주2) > 부실점수(z) = ∑(변수별 변수값 × 변수별 가중치) - 4.494 부실 징후 종합 측정치 = ez ÷ (1 + ez) 주1) 종합 임계치는 0.7로 한다. 주2) e는 자연상수(자연로그의 밑값)를 말한다.
3. 거래소는 지정결과 및 기준치에 해당하는 기업부실위험 선정변수 등을 투자주의 환기종목으로 지정된 코스닥시장 상장법인에 통지한다. |
| (자료) | KRX 법규서비스 |
(1) 정기지정
거래소는 보통주식 상장법인의 영업·재무·경영 등에 관한 계량적·비계량적 변수 등을 고려하여 코스닥시장 상장규정 시행세칙 [별표8]에서 정하는 기업부실위험 선정기준에 해당하는 경우 해당 주식을 투자주의 환기종목으로 지정합니다.
거래소는 기업부실에 유의한 영향을 미치는 기업부실위험 선정 변수, 변수별 기준치 및 변수별 가중치에 따라 코스닥시장 상장법인의 부실 정도를 측정합니다. 이어, 거래소는 코스닥시장 상장법인에 대하여 변수별로 측정된 부실 정도에 따라 아래의 방법으로 부실 징후 종합 측정치를 산출하고, 종합 측정치가 종합 임계치(주1)를 초과하는지 여부 등을 감안하여 투자주의 환기종목으로 지정합니다.
< 부실 징후 종합 측정치 산출 방법(주2) >
부실점수(z) = ∑(변수별 변수값 × 변수별 가중치) - 4.494
부실 징후 종합 측정치 = ez ÷ (1 + ez)
| (주1) | 종합 임계치는 0.7로 한다. |
| (주2) | e는 자연상수(자연로그의 밑값)를 말한다. |
기업부실위험 선정기준은 최근 사업연도의 감사보고서상 재무정보와 공시사항 등을 기준으로 판단하며, 현재 당사 현황을 검토하면 다음과 같습니다.
| [기업부실위험 선정기준 변수에 대한 당사 현황 검토] |
|
구분 |
변수 |
기준치(주1) |
가중치 |
당사 현황 (2023년말) |
당사 현황 (2024년말) |
비 고 |
|---|---|---|---|---|---|---|
|
재무변수 |
①단기차입금 의존도 |
- |
0.569 |
12.2% | 0.1% | - |
|
②총자산대비영업현금흐름비율 |
- |
-2.332 |
-11.1% | -13.5% | - | |
|
③법인세차감전계속사업이익 |
손실 발생 |
1.078 |
(11,611백만원) 기준치 충족 |
(12,259백만원) 기준치 충족 |
- | |
|
④이자보상배율 |
1 미만 |
0.426 |
N/A(적자) 기준치 충족 |
N/A(적자) 기준치 충족 |
- | |
|
⑤자본잠식 |
30% 이상 |
0.940 |
기준치 미충족 | 기준치 미충족 | - | |
|
⑥매출액 규모 |
50억원 미만 |
0.415 |
0원 기준치 충족 |
4,165백만원 기준치 충족 |
- | |
|
⑦총자산회전율 |
- |
-0.211 |
N/A(매출 0원) | 5.5% | - | |
|
질적변수 |
⑧최대주주 변경(횟수) |
3년간 2회 이상 |
0.282 |
- | 최근 3년간 없음 | 최근일 기준 |
|
⑨대표이사 변경(횟수) |
3년간 3회 이상 |
0.577 |
- | 최근 3년간 없음 | 최근일 기준 | |
|
⑩제3자배정 방식의 유상증자(횟수) |
3년간 2회 이상 |
0.093 |
- | 최근 3년간 없음 | 최근일 기준 | |
|
⑪제3자배정 방식의 전환사채, 신주인수권부사채, 교환사채 발행(횟수) |
3년간 2회 이상 |
0.511 |
- | 최근 3년간 1회 | 최근일 기준 | |
|
⑫불성실공시(횟수) |
3년간 2회 이상 |
0.327 |
- | 최근 3년간 없음 | 최근일 기준 | |
|
⑬최대주주등 지분율 |
25% 미만 |
0.751 |
- | 15.55% 기준치 충족 |
최근일 기준 | |
|
⑭감사보고서 상 계속기업존속 불확실성 사유 발생(주2) |
불확실성 발생 |
0.737 |
감사보고서 특기사항 으로는 기재되지 않음 |
감사보고서 특기사항 으로는 기재되지 않음 |
단, 재무제표 주석사항에 불확실성 기재되어 있음. |
| (주1) |
기준치는 변수별로 부실징후에 유의한 영향을 미치는지 여부를 판단하는 기준을 말하고,기준치의 변수값은 기준치를 충족하는 경우 1, 미충족하는 경우 0으로 합니다. 다만, 기준치가 없는 변수의 경우에는 변수 측정치를 변수값으로 하되, 변수 측정치가 아래의 상한 또는 하한을 벗어나는 경우에는 해당 상한 또는 하한을 변수값으로 봅니다.
|
||||||||||||
| (주2) | 감사의견이 적정이나, 감사보고서상 계속기업존속 불확실성이 특기사항으로 기재된 경우를 포함합니다. |
당사는 상기 재무변수 중 자본잠식에 대한 기준치는 아직 미충족하고 있습니다. 그 외 다른 모든 변수들에 대해서는 2024년 감사보고서상 수치에 따라 기준치를 충족한 상황입니다. 이는 당사의 재무상태가 부실한 요소를 두루 갖추고 있다는 점을 의미합니다.
또한 상기 질적변수 중 최대주주등 지분율이 25% 미만에 해당되어, 기준치를 충족하고 있고, 감사보고서상 계속기업존속 불확실성 사유 발생과 관련하여, 2024년 감사보고서 본문의 특기사항으로 기재되어 있지는 않으나, 재무제표 주석사항에는 계속기업존속 불확실성 관련 내용이 기재되어 있습니다.
이처럼 당사 주식이 투자주의 환기종목 정기지정 사유에 해당될 위험성이 존재하는 점에 대하여 투자자 여러분들께서는 반드시 유의하여 주시기 바랍니다.
(2) 수시지정
거래소는 보통주식 상장법인에 대하여 상기 코스닥시장 상장규정 제52조 제1항 제2호 가목 내지 차목에 해당될 경우 해당 주식을 투자주의 환기종목으로 수시 지정합니다. 이와 관련하여 현재 당사 현황을 검토하면 다음과 같습니다.
| [수시지정 요건에 대한 당사 현황 검토] |
| 구 분 | 내 용 | 당사 현황 (2023년말) |
당사 현황 (2024년말) |
비 고 |
|---|---|---|---|---|
| ①내부회계관리제도 | 외부감사법 제8조에 따른 내부회계관리제도의 운영실태에 대한 감사인의 검토·감사 결과 중요한 취약점이 발견되거나 중요한 범위제한이 있는 경우 또는 검토·감사의견이 표명되지 않은 경우 | 미해당 | 미해당 | - |
| ②코스닥시장상장규정 제17조제1항 위반 | 이 규정에 따른 의무보유 대상 주식등을 사실상 매각한 경우. 다만, 최대주주 변경을 수반하는 경우로 한정한다. | 미해당 | 미해당 | - |
| ③제3자배정 신주 취득자와의 단기 금전거래 등 | 제3자 배정 방식의 유상증자로 해당 보통주식 상장법인의 신주를 취득한 자에게 해당 취득일부터 6개월 이내에 선급금 지급, 금전의 가지급, 금전 대여, 증권(법 제4조제2항 각 호의 증권, 어음, 양도성 예금증서를 말한다)의 대여, 출자(타법인이 발행한 주식등 또는 출자증권의 취득을 말한다) 등을 한 사실이 공시 등을 통해 확인된 경우 | 미해당 | 미해당 | - |
| ④감사의견 | 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정인 경우 | 미해당 | 미해당 | - |
| ⑤최대주주 변경 관련 | 최대주주 변경으로 제51조제1항에 따른 의무보유가 적용되는지 여부가 확인되지 않은 경우 | 미해당 | 미해당 | - |
| 제51조제1항에 따른 의무보유 대상자가 해당 의무보유를 이행하지 않은 경우 | 미해당 | 미해당 | - | |
|
⑥영업손실 |
최근 5개 사업연도에 각각 영업손실이 발생한 경우. 다만, 세칙으로 정하는 기술성장기업에는 이 목을 적용하지 않는다. | 미적용 (기술성장기업) |
미적용 (기술성장기업) |
최근 5개 사업연도에 영업손실 지속 발생했으나, 기술성장기업에 해당되어 미적용 |
| ⑦자본잠식률 | 최근 반기 말 현재 자본잠식률이 100분의 50 이상인 경우 | - 미해당 |
- 미해당 |
현재 자본잠식 없음 |
| ⑧자기자본 | 최근 반기 말 현재 자기자본이 10억원 미만인 경우 | 40,495백만원 미해당 |
51,203백만원 미해당 |
- |
| ⑨검토/감사의견 | 최근 반기의 개별재무제표 또는 연결재무제표에 대한 감사인의 검토의견 또는 감사의견이 부적정, 의견거절이거나 감사범위 제한에 따른 한정인 경우 | 미해당 | 미해당 | - |
당사는 상기 수시 지정 요건 중 최근 5개 사업연도에 각각 영업손실이 발생한 경우에 해당되나, 기술성장기업에 해당되어 해당 요건은 적용받지 않습니다. 또한 그 외 수시 지정 요건에는 현재까지 해당된 바는 없습니다. 단, 투자자 여러분들께서는 당사의 재무상태, 실적 추이 등을 실시간 주시하시고, 상기 요건에 해당될 위험성에 대하여 상시 모니터링 하시기 바랍니다.
투자주의 환기종목으로 지정될 경우에는 다음의 어느 하나에 해당하는 경우 상장적격성 실질심사 대상이 될 수 있습니다.
① 경영권 변동사실이 공시 등을 통해 확인되는 경우(다만, 경영정상화를 위한 유상증자, 출자전환 등에 따라 신주를 발행하여 경영권 변동이 발생한 경우는 제외합니다.)
② 제3자 배정 방식의 유상증자로 신주를 취득한 자에게 해당 신주의 취득일부터 6개월 이내에 선급금 지급, 금전의 가지급, 금전 대여, 증권(법 제4조제2항 각 호의 증권, 어음 또는 양도성 예금증서를 말한다)의 대여, 출자(타법인이 발행한 주식등 또는 출자증권의 취득을 말한다)에 관한 결정 등을 한 사실이 공시 등을 통해 확인되는 경우
③ 코스닥시장 상장규정 제52조제1항제2호라목에 따라 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정으로 투자주의 환기종목으로 지정된 보통주식 상장법인이 최근 사업연도의 개별재무제표 또는 연결재무제표에 대한 감사인의 감사의견이 계속기업으로서의 존속능력에 대한 불확실성에 의한 한정인 경우
따라서 만일 향후 당사가 관련 거래소 규정에 따라 투자주의 환기종목으로 지정될 경우, 상장폐지까지 이어질 위험성이 생길 수 있습니다. 이 경우 당사 주식은 향후 장내에서 거래가 이루어지지 못하여 투자자 여러분들께서는 투자 원금의 전부 또는 일부를 회수하지 못할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [라. 현금흐름 악화 및 유동성 부족에 따른 재무불안정성 위험] 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [당사 현금흐름 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년 | 2023년 | 2022년 | |||
|---|---|---|---|---|---|---|
| 영업활동으로 인한 현금흐름 | (10,315) | (7,115) | (12,216) | |||
| 영업으로부터 창출된 현금흐름 | (9,881) | (7,526) | (13,101) | |||
| 법인세비용차감전순손익 | (12,259) | (11,611) | (22,865) | |||
| 조정 | 2,378 | 4,085 | 9,764 | |||
| 감가상각비(사용권자산상각비 포함) | 2,730 | 2,648 | 2,585 | |||
| 무형자산상각비 | 3 | 16 | 15 | |||
| 재고자산평가손실 | 35 | 543 | 372 | |||
| 대손상각비 | 269 | 0 | 0 | |||
| 주식보상비용 | 358 | 543 | 372 | |||
| 퇴직급여 | 426 | 416 | 506 | |||
| 이자비용 | 472 | 1,264 | 1,628 | |||
| 파생상품평가손실 | 726 | 375 | 6,769 | |||
| 당기손익-공정가치측정금융자산평가손실 | 38 | 0 | 525 | |||
| 당기손익-공정가치측정금융자산처분손실 | 0 | 0 | 9 | |||
| 이자수익 | (448) | (633) | (956) | |||
| 당기손익-공정가치측정금융자산평가이익 | 0 | (213) | 0 | |||
| 당기손익-공정가치측정금융자산처분이익 | (39) | (113) | 0 | |||
| 파생상품평가이익 | (396) | (1,027) | 0 | |||
| 사채상환이익 | (188) | (294) | 0 | |||
| 리스해지이익 | (5) | (1) | (6) | |||
| 매출채권의 감소(증가) | (169) | 370 | (370) | |||
| 재고자산의 감소(증가) | (481) | |||||
| 계약자산의 감소(증가) | (195) | 48 | (48) | |||
| 기타금융자산의 감소(증가) | 1 | 46 | (43) | |||
| 기타유동자산의 감소(증가) | (621) | 35 | (55) | |||
| 매입채무의 증가(감소) | 148 | |||||
| 기타금융부채의 증가(감소) | (167) | 858 | (1,199) | |||
| 기타부채의 증가(감소) | 193 | (95) | 203 | |||
| 퇴직금의 지급 | (312) | (156) | (171) | |||
| 이자의 수취 | 464 | 654 | 942 | |||
| 이자의 지급 | (944) | (297) | 0 | |||
| 법인세의 환급(납부) | 46 | 54 | (57) | |||
| 투자활동으로 인한 현금흐름 | (15,066) | (752) | 14,002 | |||
| 투자활동으로 인한 현금유입액 | 4,398 | 10,767 | 18,304 | |||
| 단기금융상품의 감소 | 0 | 0 | 5,000 | |||
| 당기손익-공정가치측정금융자산의 처분 | 2,282 | 2,500 | 4,999 | |||
| 상각후원가측정금융자산의 처분 | 1,986 | 8,000 | 8,000 | |||
| 기타금융자산의 감소 | 127 | 19 | 94 | |||
| 정부보조금 수령 | 0 | 248 | 211 | |||
| 사업결합으로 인한 현금 증가 | 3 | 0 | 0 | |||
| 투자활동으로 인한 현금유출액 | (19,464) | (11,519) | (4,302) | |||
| 당기손익-공정가치측정금융자산의 취득 | 0 | 0 | (3,000) | |||
| 기타금융자산의 증가 | (359) | (108) | (20) | |||
| 종속기업투자주식의 취득 | (500) | 0 | 0 | |||
| 기타비유동자산의 증가 | (190) | (127) | 0 | |||
| 유형자산의 취득 | (5,908) | (6,922) | (79) | |||
| 무형자산의 취득 | (12,507) | (4,362) | (1,203) | |||
| 재무활동으로 인한 현금흐름 | 21,025 | 12,993 | 1,263 | |||
| 재무활동으로 인한 현금유입액 | 32,595 | 24,432 | 1,343 | |||
| 정부보조금 수령 | 27 | 746 | 1,343 | |||
| 유상증자 | 22,675 | 17,199 | 0 | |||
| 단기차입금의 차입 | 441 | 0 | 0 | |||
| 장기차입금의 차입 | 6,512 | 6,487 | 0 | |||
| 사채의 발행 | 2,940 | 0 | 0 | |||
| 재무활동으로 인한 현금유출액 | (11,570) | (11,439) | (80) | |||
| 리스부채의 상환 | (90) | (39) | (80) | |||
| 전환사채의 상환 | (7,600) | (11,400) | 0 | |||
| 단기차입금의 상환 | (590) | 0 | 0 | |||
| 단기차입금의 감소 | (90) | 0 | 0 | |||
| 사채의 상환 | (3,000) | 0 | 0 | |||
| 장기차입금의 상환 | (200) | 0 | 0 | |||
| 현금및현금성자산의증가 | (4,356) | 5,126 | 3,049 | |||
| 기초 현금및현금성자산 | 13,381 | 8,254 | 5,205 | |||
| 기말 현금및현금성자산 | 9,024 | 13,381 | 8,254 | |||
| 자료 : 당사 사업보고서 |
당사는 2022년 228.7억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 122억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 당기손익-공정가치측정금융자산의 취분/처득, 상각후원가측정금융자산의 취득/처분 등 당사가 누적해서 조달한 자금 운용 과정에서 보유중이던 금융상품의 가입/해지 등 유출입이 발생했으며, 총 140억원의 양(+)의 투자활동으로 인한 현금흐름이 발생하였습니다. 재무활동 부문에서는 정부보조금 수령 등 유입액이 존재했으며, 총 12.6억원의 양(+)의 현금흐름이 발생하였습니다.
2023년에는 116.1억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 71.2억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 당기손익-공정가치측정금융자산의 취분/처득, 상각후원가측정금융자산의 취득/처분 등 당사가 누적해서 조달한 자금 운용 과정에서 보유중이던 금융상품의 가입/해지 등 유출입이 발생했으며, 마곡지구 신사옥 부지 관련한 건설중인자산의 취득이 발생하면서, 총 7.5억원의 음(-)의 투자활동으로 인한 현금흐름이 발생하였습니다. 재무활동 부문에서는 2023년 중 주주우선공모 방식의 유상증자로 172억원을 조달하였으며, 마곡지구 신사옥 부지 관련하여 장기차입금 증가하며, 총 130억원의 양(+)의 현금흐름이 발생하였습니다.
2024년에는 122.6억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 98.8억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 마곡지구 신사옥 부지 관련한 건설중인자산 취득이 발생하였고, 임상3상 단계에 진입한 연구개발비용의 개발비 계정 자산화 관련 지출 등이 발생했으며, 총 150.7억원의 음(-)의 투자활동으로 인한 현금흐름이 발생하였습니다. 재무활동 부문에서는 마곡지구 신사옥 부지 관련하여 장기차입금 증가하였고, 주주배정 후 실권주 일반공모 유상증자로 인한 현금 유입 및 전환사채 상환을 통한 현금 유츨 등으로, 총 210.3억원의 양(+)의 현금흐름이 발생하였습니다. 그 결과 2024년말 기준 당사는 90.2억원의 현금및현금성자산을 보유하고 있습니다.
이처럼 당사는 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있습니다. 사업을 영위하는 과정에서, 투자활동현금흐름은 매년 유출입의 변동이 있으며, 영업활동에서 현금흐름창출능력을 보유하지 못하여, 영업에 필요한 자금은 투자활동 및 재무활동에서 창출하고 있는 상태입니다. 당사의 백신, 신약 등 개발사업 부문에서는 후보물질발굴부터 임상 진행, 품목허가까지 대규모의 자금이 소요되는 사업을 영위하고 있는 반면에, 라이센스 아웃, 임상성공 및 상품화 성공 등이 이루어지지 않을 경우 영업활동에서 현금흐름을 창출해내기는 어려운 구조를 가지고 있으며, 외부 자금 조달 의존도가 높습니다.
당사의 재무안정성과 관련된 주요 지표는 다음과 같습니다.
| [주요 재무안정성 지표 추이] | |
| (단위 : 백만원, %) | |
| 구 분 | 2024년 | 2023년 | 2022년 | 비 고 | ||
|---|---|---|---|---|---|---|
| 1. 자산총계 | 76,086 | 63,922 | 45,857 | - | ||
| 유동자산 | 11,450 | 16,874 | 20,978 | - | ||
| 비유동자산 | 64,637 | 47,048 | 24,880 | - | ||
| 2. 부채총계 | 24,883 | 23,427 | 23,419 | - | ||
| 유동부채 | 4,943 | 10,325 | 20,539 | - | ||
| 비유동부채 | 19,941 | 13,102 | 2,879 | - | ||
| 3. 자본총계 | 51,203 | 40,495 | 22,439 | - | ||
| 자본금 | 10,552 | 6,801 | 4,866 | - | ||
| 자본잉여금 | 83,446 | 64,521 | 49,257 | - | ||
| 기타자본항목 | 10,253 | 9,895 | 9,352 | - | ||
| 이익잉여금(결손금) | (65,022) | (52,696) | (41,036) | - | ||
| 기타포괄손익누계액 | 11,974 | 11,974 | 0 | - | ||
| 4. 부채비율(%) | 49% | 58% | 104% | 부채총계 ÷ 자본총계 | ||
| 5. 유동비율(%) | 232% | 163% | 102% | 유동자산 ÷ 유동부채 | ||
| 6. 총차입금 | 13,172 | 14,293 | 19,309 | 유동성 차입금 + 비유동성 차입금 | ||
| 유동성 차입금 | 54 | 7,806 | 19,300 | - | ||
| 전환사채 | 0 | 5,497 | 11,875 | - | ||
| 파생상품부채 | 0 | 2,299 | 7,382 | 전환사채 Put Option | ||
| 유동리스부채 | 54 | 10 | 43 | |||
| 비유동성 차입금 | 13,118 | 6,487 | 9 | - | ||
| 장기차입금 | 13,070 | 6,487 | 0 | - | ||
| 금융리스부채 | 48 | 0 | 9 | - | ||
| - 총차입금 의존도(%) | 17% | 22% | 42% | 총차입금 ÷ 자산총계 | ||
| - 유동성 차입금 비중(%) | 0% | 55% | 100% | 유동성 차입금 ÷ 총차입금 | ||
| 7. 영업활동 현금흐름 | (10,315) | (7,115) | (12,216) | - | ||
| - 영업활동현금흐름 총부채 비율(%) | -41% | -30% | -52% | 영업활동현금흐름 ÷ 부채총계 | ||
| 8. 투자활동 현금흐름 | (15,066) | (752) | 14,002 | - | ||
| 9. 재무활동 현금흐름 | 21,025 | 12,993 | 1,263 | - | ||
| 10. 현금 및 현금성자산 | 9,024 | 13,381 | 8,254 | - | ||
| 11. 순차입금 | 4,148 | 913 | 11,055 | 총차입금 - 현금 및 현금성자산 | ||
| - 순차입금 의존도(%) | 5% | 1% | 24% | 순차입금 ÷ 자산총계 | ||
| (자료) : 당사 감사보고서 |
당사는 지속적으로 영업적자 및 부(-)의 영업활동현금흐름이 발생하며 640.3억원의 결손금이 누적되어 있는 상태이지만 2019년 IPO 유상증자 393.6억원, 2021년 전환사채 190억원 발행, 2023년 주주우선공모 유상증자 174.8억원, 2024년 주주배정 후 실권주 일반공모 유상증자 231.8억원 등 네 차례에 걸쳐 자본시장에서 외부자금을 조달하여 영업활동을 영위하고 있는 상태이며 금번에도 백신 생산비 등 운영자금 조달을 위해 본 유상증자를 진행하고 있습니다.(주1)
| (주1) | 당사의 잦은 자금조달 관련 위험요소는 본 증권신고서 "제1부-III.투자위험요소-2.회사위험-사." 부분을 참고하여 주시기 바랍니다. |
2024년말 현재 당사 유동비율은 232%, 부채비율은 49%이며, 현금 및 현금성자산은 90.2억원을 보유하고 있으며 총차입금 잔액은 131.7억원으로, 자산총계 대비 순차입금 의존도는 5%입니다. 총차입금 131.7억원은 유동성차입금 0.5억원 및 비유동성차입금 131.2억원으로 구성되어 있습니다.
유동성차입금 0.5억원은 전액 1년 이내의 리스부채이며, 내역은 다음과 같습니다.
| [리스부채 내역] |
| (단위 : 백만원) |
| 구 분 | 리스료 | 리스료의 현재가치 |
|---|---|---|
| 1년 이내 | 60 | 54 |
| 1년 초과 | 50 | 48 |
| 합 계 | 110 | 102 |
| (자료) | 당사 감사보고서 및 사업보고서 |
2024년말 기준 당사가 보유 중인 현금및현금성자산 약 7백만원이 정부보조금 및 신탁예금으로 사용제한되어있습니다.
| [사용제한 금융상품 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년말 | 비고 |
| 현금및현금성자산 | 7 | 정부보조금, 신탁예금 |
| 합 계 | 7 | - |
| (자료) | 당사 사업보고서 |
2024년말 현재 당사의 비유동성차입금 131.2억원은 마곡지구 신사옥 건설과 관련된 장기차입금 130.7억원 및 금융리스부채 0.5억원으로 구성되어 있습니다.
당사는 2023년 7월 7일 마곡 신사옥 및 R&D센터 신규시설 투자 목적으로 당사를 포함한 3개사와 컨소시엄을 구성하여 1,480억원(당사 지분율 22%에 해당되는 금액 : 325.6억원)의 차입약정을 체결하였습니다. 당사는 해당 차입금에 대하여 423.28억원(당사분 차입금액의 130%)의 채무보증을 실행하였으며, 부동산 담보(마곡 사옥 부지 및 성남에스케이브이1타워 14개호실에 대한 채권최고액 358.16억원)를 추가로 제공하였습니다(주1). 2024년말 현재 당사가 재무제표상 인식하고 있는 장기차입금 장부금액 130.7억원은 현재까지의 대출실행 잔액에 해당되며, 공사 진행 기간 동안 차입약정에 따른 장기차입금 잔액에 대하여, 대출실행 잔액에 맞추어 기간별로 인식하게 될 예정입니다. 당사는 해당 차입금에 대하여 부동산 준공 후 담보대출 등으로 차입 전환하여 상환할 계획을 가지고 있습니다.
| (주1) | 마곡지구 신사옥 건설과 관련된 상세 내용은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-마." 부분을 참고하여 주시기 바랍니다. |
| [장기차입금 내역] |
| (단위 : 백만원, %) |
| 구 분 | 차입처 | 이자율(%) | 2024년 1분기말 |
|---|---|---|---|
| 담보부차입거래(*) | 마곡컨소시엄제일차 | 8~11 | 13,070 |
| 차감:유동성장기차입금 | 0 | ||
| 차감잔액 | 13,070 | ||
| (자료) | 당사 사업보고서 |
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 마곡 신사옥 시설 투자로 인해 장기차입금이 누적해서 인식될 예정이므로, 향후 당사의 차입금 상환 부담 규모가 증가하고, 재무안정성은 저하될 수 있습니다. 이에 당사는 향후 1년간 자금수지 계획을 수립하고, 유동성 관리에 노력하고 있습니다.
| [당사 향후 1년간 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2025년 1분기 | 2025년 2분기 | 2025년 3분기 | 2025년 4분기 | 2026년 1분기 | ||
|---|---|---|---|---|---|---|---|
| 영업 현금흐름 |
(a)수입 | 매출대금(백신) | 0 | 0 | 0 | 22,000 | 0 |
| 매출대금(CMO) | 0 | 0 | 354 | 354 | 235 | ||
| 매출대금(이커머스) | 1,625 | 1,716 | 2,190 | 3,269 | 2,076 | ||
| 기타 | 552 | 360 | 360 | 360 | 456 | ||
| 계 | 2,177 | 2,076 | 2,904 | 25,984 | 2,767 | ||
| (b)지출 | 원재료 (백신) | 0 | 0 | 0 | 10,707 | 0 | |
| 원재료 (CMO) | 0 | 0 | 0 | 0 | 0 | ||
| 상품매입(이커머스) | 1,381 | 1,459 | 1,861 | 2,779 | 1,764 | ||
| 판매관리비 | 1,750 | 1,841 | 1,743 | 1,708 | 2,317 | ||
| 경상연구비 | 653 | 1,941 | 1,383 | 2,441 | 1,824 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 3,784 | 5,241 | 4,987 | 17,635 | 5,905 | ||
| 영업수지(=(a)-(b)) | (1,607) | (3,165) | (2,083) | 8,349 | (3,138) | ||
| 투자 현금흐름 |
(c)수입 | 기타 | 0 | 0 | 0 | 0 | 0 |
| 계 | 0 | 0 | 0 | 0 | 0 | ||
| (d)지출 | 연구개발투자 | 4,755 | 3,800 | 1,100 | 1,670 | 605 | |
| GMP 허가용 백신 생산 | 894 | 1,171 | 545 | 0 | 0 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 5,649 | 4,970 | 1,645 | 1,670 | 605 | ||
| 투자수지(=(c)-(d)) | (5,649) | (4,970) | (1,645) | (1,670) | (605) | ||
| 재무 현금흐름 |
(e)수입 | 유상증자 | 0 | 24,150 | 0 | 0 | 0 |
| 사모사채 | 0 | 5,000 | 0 | 0 | 0 | ||
| 기타 | 0 | 0 | 0 | 0 | 0 | ||
| 계 | 0 | 29,150 | 0 | 0 | 0 | ||
| (f)지출 | 사모사채 | 0 | 5,000 | 0 | 0 | 0 | |
| 이자비용 | 0 | 125 | 0 | 0 | 0 | ||
| 기타 | 0 | 544 | 0 | 0 | 0 | ||
| 계 | 0 | 5,669 | 0 | 0 | 0 | ||
| 재무수지(=(e)-(f)) | 0 | 23,481 | 0 | 0 | 0 | ||
| 기초 자금 | 9,024 | 1,768 | 17,114 | 13,387 | 20,066 | ||
| 기말 자금 | 1,768 | 17,114 | 13,387 | 20,066 | 16,323 | ||
| (자료) | 당사 제시 |
| (주1) | 영업현금흐름 (a)수입 금액은 현금 회수시기를 고려한 금액이며, 회계적 매출 인식금액과는 차이가 있습니다. 또한 2025년 4분기에 발생할 예정인 매출대금(백신) 22,000백만원은 당사의 예측 정보이며, 예측치와 실제 결과치가 다를 수 있습니다. |
| (주2) | 영업현금흐름 (b)지출 중 경상연구비는 BVAC-C, BVAC-E6E7 관련된 예상 임상개발비입니다. |
| (주3) | 투자현금흐름 (d)지출 중 연구개발투자비는 AdCLD-CoV19-1 OMI 관련된 예상 임상개발비입니다. |
| (주4) | 재무현금흐름 (e)수입 중 유상증자 금액, (f)지출 중 기타(발행제비용)는 예정발행가액 기준으로 기재하였습니다. |
| (주5) | 재무현금흐름 (e)수입 중 사모사채는 현재 외부차입 및 투자 유치 계획 중인 것으로, 향후 실제 조달 금액은 실시간 당사의 유동성을 고려하여 결정할 예정이며, 실행 여부는 확정되지 않았습니다. |
| (주6) | 상기 자금수지 계획은 당사가 현재 계획 중인 현금흐름을 예상하여 반영한 것이므로, 실제 현금흐름 발생과는 차이가 생길 수 밖에 없습니다. |
영업현금흐름 중 2025년 4분기에 발생하는 백신 매출대금 220억원은 2024년에 질병관리청에서 24~25절기 예방접종을 위해 확보한 코로나19 백신 755만 회분 중 약 15%에 해당하는 물량에 대한 매출입니다. 즉, 당사가 약 1백만 회분(도즈)에 대한 정부 물량을 확보한다는 가정 하에 산출한 금액입니다. 이는 당사 입장에서 산정한 물량이나, 정부의 예방 접종을 위한 코로나19 백신 수요가 급격하게 감소하거나, 당사가 해당 정부 조달 시장에 진입하지 못할 가능성도 존재합니다.
또한 해당 백신 매출대금 220억원이 발생하지 않는다면 위의 자금수지계획 상 2025년 4분기에 당사의 기말 현금은 음(-)수로 나타나며 이는 당사가 추가적인 자금조달이 필요할 수 있으며, 추가적인 자금조달을 못할 경우에는 재무적인 불확실성에 크게 노출될 수 있음을 의미합니다. 물론 백신 생산을 하지 않아원재료(백신) 지출대금 10,707백만원이 발생하지 않는다면 2025년 4분기말 현금 자금은 8,773백만원으로 예상되지만, 원재료(백신) 지출대금이 10,707백만원 발생한 이후 생산한 백신이 매출로 이어지지 않을 경우, 위에서 언급하였듯이 당사는 재무적인 위험에 크게 노출되어 추가적인 자금 조달이 필요한 상황에 놓이게 됩니다.
이처럼 당사가 제시한 백신 매출대금 220억원은 질병관리청이 24~25절기 예방접종을 위해 확보한 코로나19 백신 755만 회분 중 약 1백만 회분을 확보한다는 가정 하에 산정된 수치이며, 실제 결과치와 크게 다를 경우 예상 백신 매출이 급격하게 감소하거나 심지어 발생하지 않을 가능성이 있습니다. 따라서 당사의 재무적 불확실성은 지속적으로 존재하는 상황이며, 결과적으로 계속기업의 가정 역시 불확실할 수 있기에 투자자 여러분께서는 이 점 유의하시기 바랍니다.
당사는 향후 1년간 CMO 사업 및 이커머스사업 관련 매출을 통해 영업현금흐름이 발생할 것으로 예상하고 있습니다. 단, 현 시점에서 당사가 계획 중인 주요 연구개발비 등을 충당하기에는 그 규모가 부족할 것으로 생각되며, 영업수지상 음(-)의 현금흐름이 발생할 것으로 예상하고 있습니다. 이에 본 유상증자 및 외부차입 등 재무활동을 통해 당사 운영자금 등을 조달하고자 합니다. 단, 재무활동을 통해서도 목표 자금을 조달하지 못한다면 당사에 유동성 위기가 생길 수 있고, 영업활동을 영위해나가는데 상당한 제약이 생길 수 있습니다.
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [마. 신사옥 준공 관련 채무부담, 우발채무 및 그 외 유형자산 관련 위험] 당사는 토지 재평가이익을 기타포괄손익으로 인식함에 따라 2023년말 자본총계가 증가한 효과가 발생했으며, 만일 재평가이익을 인식하지 않았다면 2023년말 기준 당사 자본총계 대비 법인세비용차감전순손실 비중은 40%를 초과하는 수준입니다. 이는 코스닥시장 관리종목 지정요건의 기준점인 50%에 근접한 수준일만큼, 투자자 여러분들께서는 당사 자본규모 대비 법인세비용차감전순손실 발생 비중이 크게 발생하고 있는 점을 유의하여 주시기 바랍니다. 한편, 당사는 2023년 7월 7일 이사회 결의를 통해 마곡 대규모 산업클러스터 단지 내 신사옥 및 기존 서울 및 성남 연구소를 통합한 R&D 센터를 구축하여 업무 효율성 증대와 미래 성장기반을 확보하고자 약 237억원의 투자를 결정하였습니다. 이를 위해 당사를 포함해 3개社(당사 22%, (주)제넥신 28%, (주)프로젠 50%)가 포함된 마곡컨소시엄제일차(주)(부동산 PF 대출의 차주인 SPC입니다)는 채권자인 하나캐피탈(주) 외 11곳으로부터 대출약정금 1,480억원을 확보하였으며, 채권자로 하여금 관리형토지신탁에 따른 우선수익권 등을 담보로 설정하였습니다. 당사는 마곡 컨소시엄제일차(주)의 연대보증인으로서 대출약정금 1,480억원 중 당사 부담비율인 22%에 해당하는 약 326억원에 대하여 채무보증이 되어있고 보증한도는 약 423억원(당사 부담금 약 326억원의 130%)이며, 이에 대한 채무보증기간은 2023년 7월 12일부터 2026년 7월 11일까지입니다. 만일 신사옥 준공 후 부동산 경기 불황 또는 관련 정책 및 제도의 변경 등 예상치 못한 사유로 인해 부동산 담보대출 전환이 이루어지지 않거나, 당사 자체자금 창출능력이 향후에도 발생하지 않을 경우에는 당사는 채무 부담에 따른 유동성 위기가 생길 수 있습니다. 또한 신사옥 준공 이전에도 현재 예상할 수 없는 대내외적 변수로 인하여, 공사 진행에 문제가 생기거나, 부동산 PF 대주단의 대출약정서상 기한이익 상실선언 사유가 발생할 경우, 당사가 담보로 제공한 자산에 가압류 등의 조치가 취해질 수 있으며, 혹은 당사의 연대보증 의무가 발현되는 등 일시에 대규모 채무상환 부담이 생길 위험성이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. 한편, 당사는 마곡산업단지 토지 취득과 관련하여 서울경제진흥원으로부터 약 3.2억원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령취소 소송을 제넥신 등과 공동으로 진행하였고 2023년 9월 22일 1심 패소, 2024년 12월 18일 2심 패소 이후 2025년 1월 9일 불복하기 위한 상고심을 제기하였습니다. 현재 동 소송의 전망은 예측할 수 없습니다. 이와 같은 법률 분쟁은 통상적으로 장기간에 걸쳐 진행되며, 사안에 따라 매우 큰 규모의 분쟁이 될 경우 큰 규모의 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [유형자산 및 감가상각비 현황] |
| (단위 : 백만원) |
| 구 분 | 2024년말 | 2023년말 | 2022년말 | ||
|---|---|---|---|---|---|
| 유형자산 | 44,629 | 40,339 | 20,616 | ||
| 토지 | 23,384 | 23,384 | 7,714 | ||
| 취득원가 | 8,246 | 8,246 | 7,714 | ||
| 재평가 | 15,138 | 15,138 | 0 | ||
| 감가상각누계액 | 0 | 0 | 0 | ||
| 건물 | 4,693 | 4,839 | 4,973 | ||
| 취득원가 | 5,377 | 5,377 | 5,377 | ||
| 감가상각누계액 | (684) | (539) | (404) | ||
| 차량운반구 | 0 | 17 | 35 | ||
| 취득원가 | 125 | 125 | 125 | ||
| 감가상각누계액 | (125) | (108) | (90) | ||
| 공구와기구 | 1,647 | 2,798 | 3,760 | ||
| 취득원가 | 6,965 | 6,890 | 6,602 | ||
| 감가상각누계액 | (5,147) | (3,848) | (2,558) | ||
| 정부보조금 | (479) | (479) | (444) | ||
| 감가상각누계액(정부보조금) | 308 | 235 | 160 | ||
| 비품 | 123 | 199 | 298 | ||
| 취득원가 | 540 | 520 | 511 | ||
| 감가상각누계액 | (413) | (314) | (213) | ||
| 정부보조금 | (7) | (7) | 0 | ||
| 감가상각누계액(정부보조금) | 3 | 1 | 0 | ||
| 시설장치 | 1,269 | 2,253 | 3,401 | ||
| 취득원가 | 5,923 | 5,758 | 5,758 | ||
| 감가상각누계액 | (4,655) | (3,504) | (2,357) | ||
| 건설중인자산(주1) | 13,513 | 6,849 | 435 | ||
| 취득원가 | 13,513 | 6,849 | 435 | ||
| 감가상각누계액 | 0 | 0 | 0 | ||
| 정부보조금 | 0 | 0 | 0 | ||
| 감가상각비(주2) | 2,730 | 2,648 | 2,585 | ||
| (자료) | 당사 감사보고서 및 사업보고서 |
| (주1) | 신규 사옥 건설과 관련하여 발생한 차입원가 194백만원이 포함되어 있습니다. |
| (주2) | 현금흐름표상의 유형자산 감가상각비 금액입니다. |
2024년말 기준 당사의 유형자산 장부금액은 446.3억원으로 당사 자산총계 대비 58.7%의 비중을 차지하고 있으며, 최근 3개년간 25억원 이상의 감가상각비가 발생하고 있어, 당사 주요 영업비용으로 작용하고 있습니다. 당사 유형자산과 관련된 주요 내용 및 위험요소는 다음과 같습니다.
당사는 독립적인 전문평가인의 감정평가결과를 근거로 2023년 12월 31일 기준으로 토지를 재평가하였습니다. 대상 토지와 인근지역에 있는 유사한 이용가치를 지닌 표준지의 공시지가를 기준으로 공시기준일로부터 기준시점 현재까지의 지가변동률, 생산자물가상승률, 당해 토지의 위치, 형상, 환경, 이용상황, 기타 가치형성요인 등을 종합적으로 고려하여 공시지가기준법으로 평가하였습니다.
| [자산재평가 결과 - 공시내용] |
| 구 분 | 내 용 | |||
|---|---|---|---|---|
| 1. 재평가 목적물 | 토지 | |||
| 2. 재평가 대상 | ① 서울시 강서구 마곡동 762-3 (주)셀리드 소유 토지 ② 경기도 성남시 중원구 상대원동 5460 성남 SK V1타워 426호~431호, 616호~623호 (주)셀리드 소유 토지 |
|||
| 3. 재평가 기준일 | 2023-12-31 | |||
| 4. 재평가 내역(단위:원) | 재평가 목적물 | 장부가액 | 재평가금액 | 재평가차액 |
| 토지 | 8,245,771,818 | 23,383,924,400 | 15,138,152,582 | |
| 합계 | 8,245,771,818 | 23,383,924,400 | 15,138,152,582 | |
| 자산총액 | 51,267,666,125 | |||
| 재평가차액의 자산총액대비 비율(%) | 29.53 | |||
| 대기업여부 | 미해당 | |||
| 5. 회계처리 예정내역 | 1) 자산의 증가 - 토지(유형자산)의 증가 : 15,138,152,582원 증가 2) 자본의 증가 - 기타포괄손익누계액의 증가(자산재평가잉여금) : 15,138,152,582원 증가 * 이연법인세 효과는 기말 결산시 산정하여 반영 예정 |
|||
| 6. 평가기관 | (주)제일감정평가법인 | |||
| 7. 결정(확인)일자 | 2024-01-03 | |||
| 8. 기타 투자판단에 참고할 사항 | 1) 상기 장부가액 및 자산총액은 2023년 9월 30일 개별재무제표 기준입니다. 2) 상기 5항의 회계처리 예정내역은 향후 외부감사인의 감사에따라 변경될 수 있습니다. 3) 상기 7항의 결정(확인)일자는 감정평가법인으로부터 감정평가서를 수령한 일자입니다. |
|||
| ※관련공시 | 2023-11-16 자산재평가 실시 결정(자율공시) | |||
| (자료) | DART 전자공시시스템 |
당사는 2023년말 상기 토지 재평가로 인해 151.4억원(법인세효과 차감 전)을 기타포괄손익으로 인식하였으며, 재평가기준일 현재 재평가에 따른 토지의 장부금액과 원가모형으로 평가되었을 경우의 장부금액은 다음과 같습니다.
| [재평가에 따른 토지의 장부금액 및 원가모형 평가에 따른 장부금액] |
| (단위 : 백만원) |
| 구 분 | 재평가모형 | 원가모형 |
| 토지 | 23,383,924,400 | 8,245,771,818 |
당사는 토지 재평가이익을 기타포괄손익으로 인식함에 따라 2023년말 자본총계가 증가한 효과가 발생했으며, 만일 재평가이익을 인식하지 않았다면 2023년말 기준 당사 자본총계 대비 법인세비용차감전순손실 비중은 40%를 초과하는 수준입니다. 이는 코스닥시장 관리종목 지정요건의 기준점인 50%에 근접한 수준일만큼, 투자자 여러분들께서는 당사 자본규모 대비 법인세비용차감전순손실 발생 비중이 크게 발생하고 있는 점을 유의하여 주시기 바랍니다.
한편, 당사는 2023년 7월 7일 이사회 결의를 통해 마곡 대규모 산업클러스터 단지 내 신사옥 및 기존 서울 및 성남 연구소를 통합한 R&D 센터를 구축하여 업무 효율성 증대와 미래 성장기반을 확보하고자 약 237억원의 투자를 결정하였습니다. 현재 시공사 (주)신세계건설에서 공사가 진행 중이며, 준공 예정일은 2026년 3월입니다. 이는 준공 전까지 공사 진행에 따라 재무제표상 건설중인자산으로 인식될 예정이며, 2024년말 현재 135.1억원의 건설중인자산을 인식하고 있습니다.
| [신규 시설투자 등] |
| 1. 투자구분 | 마곡 신사옥 및 R&D 센터에 대한 신규시설투자 | |
| 2. 투자내역 | 투자금액(원) | 23,685,000,000 |
| 자기자본(원) | 22,438,888,800 | |
| 자기자본대비(%) | 105.55 | |
| 대규모법인여부 | 코스닥상장법인 | |
| 3. 투자목적 | 마곡 대규모 산업클러스터 단지 내 신사옥 및 R&D센터 구축을 통한 업무 효율성 증대와 미래 성장기반 확보 | |
| 4. 투자기간 | 시작일 | 2023-07-12 |
| 종료일 | 2026-03-11 | |
| 5. 이사회결의일(결정일) | 2023-07-07 | |
| -사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| 6. 감사(감사위원) 참석여부 | 참석 | |
| 7. 공시유보 관련내용 | 유보사유 | - |
| 유보기한 | - | |
| 8. 기타 투자판단에 참고할 사항 | 1. 상기 내용의 자기자본은 한국채택국제회계기준(K-IFRS)에 따라 작성된 최근 사업연도말(2022년말) 개별재무제표 금액에서 제출일까지의 자본금 및 자본잉여금 변동분을 반영한 금액입니다. 2. 본 건은 마곡 도시개발사업지구단위 계획구역 내 당사 (22%) 외 2개社가 컨소시엄의 형태로 참여한 신사옥 및 R&D센터 개발사업입니다. 3. 신규 시설투자 소재지: - 서울시 강서구 마곡동 762-3(D9-1 블록) 4. 상기 투자기간의 시작일과 종료일은 계획상 건축 공사 시작일 및 준공일입니다. 5. 상기 투자금액은 부가가치세를 제외한 건축물 건설 비용이며, 기 취득한 토지에 건립함에 따라 토지 취득금액은 포함되어 있지 않습니다. 6. 투자 자금은 본 개발사업의 미래 현금흐름 등을 담보로 외부자금 장기차입을 통해 충당할 예정입니다. 7. 투자금액 및 투자기간은 인허가 여부, 향후 추진과정 및 경영환경 등에 따라 변경될 수 있습니다. |
|
| (자료) | DART 전자공시시스템(2023.07.07) |
이를 위해 당사를 포함해 3개社(당사 22%, (주)제넥신 28%, (주)프로젠 50%)가 포함된 마곡컨소시엄제일차(주)(부동산 PF 대출의 차주인 SPC입니다)는 채권자인 하나캐피탈(주) 외 11곳으로부터 대출약정금 1,480억원을 확보하였으며, 채권자로 하여금 관리형토지신탁에 따른 우선수익권 등을 담보로 설정하였습니다. 당사는 마곡 컨소시엄제일차(주)의 연대보증인으로서 대출약정금 1,480억원 중 당사 부담비율인 22%에 해당하는 약 326억원에 대하여 채무보증이 되어있고 보증한도는 약 423억원(당사 부담금 약 326억원의 130%)이며, 이에 대한 채무보증기간은 2023년 7월 12일부터 2026년 7월 11일까지입니다.
| [타인에 대한 담보 제공 결정] |
| 1. 채무자 | 마곡컨소시엄제일차(주) | ||
| - 회사와의 관계 | - | ||
| 2. 채권자 | 하나캐피탈(주) 외 | ||
| 3. 채무(차입)금액(원) | 32,560,000,000 | ||
| 4. 담보제공 내역 | 담보설정금액(원) | 42,328,000,000 | |
| 자기자본(원) | 22,438,888,800 | ||
| 자기자본대비(%) | 188.64 | ||
| 대기업해당여부 | 미해당 | ||
| 담보제공재산 | 관리형토지신탁에 따른 우선수익권 외 | ||
| 담보제공기간 | 시작일 | 2023-07-12 | |
| 종료일 | 2026-07-11 | ||
| 5. 담보제공 총 잔액(원) | 42,328,000,000 | ||
| 6. 이사회결의일(결정일) | 2023-07-07 | ||
| -사외이사 참석여부 | 참석(명) | - | |
| 불참(명) | - | ||
| -감사(감사위원) 참석여부 | 참석 | ||
| 7. 기타 투자판단에 참고할 사항 | 1. 본건은 마곡 신사옥 및 R&D센터 신규시설투자 차입금에 대한 담보 제공의 건입니다. 2. 상기 채무금액은 마곡컨소시엄제일차(주)의 총 채무금액 중 당사 부담금(22%)입니다. 3. 상기 담보설정금액은 채무금액에 담보비율 130%를 반영한 채권최고액입니다. 4.상기 내용의 자기자본은 한국채택국제회계기준(K-IFRS)에 따라 작성된 최근 사업연도말(2022년말) 감사보고서의 개별 재무제표 금액에서 제출일까지의 자본금 및 자본잉여금 변동분을 반영한 금액입니다. 5. 상기 담보제공기간 시작일은 최초 인출일이며 만기는 인출일로부터 36개월입니다. 5. 마곡컨소시엄제일차(주)는 2023년 설립하여 하기 채무자 요약 재무상황은 기입하지 않았습니다. |
||
[채무자별 담보제공 잔액]
| 채무자 | 관계 | 담보설정잔액(원) | 담보제공기간 | 담보제공재산 | 비고 |
|---|---|---|---|---|---|
| 마곡컨소시엄제일차(주) | - | 42,328,000,000 | 2023.07.12~2026.07.11 | 관리형토지신탁에 따른 우선수익권 외 | 마곡 신사옥 및 R&D센터 신규시설투자 차입금에 대한 담보 제공의 건 |
| ※관련 공시법규 | 자본시장법 |
[채무자에 관한 사항]
| 1. 인적사항 | |||
| - 기본사항 | |||
| 성명(명칭) | 국적 | 주소(본점소재지)[읍ㆍ면ㆍ동까지만 기재] | 생년월일(사업자등록번호 등) |
| 마곡컨소시엄제일차(주) | 대한민국 | 서울특별시 영등포구 문래동 | 202-86-02933 |
| 직업(사업내용) | 금융업 | ||
| - 최대주주ㆍ대표이사ㆍ대표집행임원 현황 및 재무상황 등(채무자가 법인인 경우) | |||
| 구분 | 성명 | 주식수 | 지분율(%) |
| 대표이사 | 박성진 | 5 | 50 |
| 대표집행임원 | - | - | - |
| (단위 : 백만원) | |||
| 해당 사업연도 | 2023 | 결산기 | 12월 |
| 자산총계 | - | 자본금 | - |
| 부채총계 | - | 매출액 | - |
| 자본총계 | - | 당기순손익 | - |
| 외부감사인 | - | 휴업 여부 | 아니오 |
| 감사의견 | - | 폐업 여부 | 아니오 |
| 2. 채무자와의 관계 | |||
| 1. 회사와 채무자와의 관계 | - | ||
| 2. 회사의 최대주주ㆍ임원과 채무자와의 관계 | 성명 | 채무자와의 관계 | |
| - | - | - | |
| 3. 최근 3년간 거래내역(일상적 거래 제외) | |||
| 구분 | 거래 내역 | ||
| 당해년도 | - | ||
| 전년도 | - | ||
| 전전년도 | - | ||
| (자료) | DART 전자공시시스템 |
| 연대보증 계약 세부 내용 |
|---|
| 제3조 연대보증사항 (1) 연대보증인은 대출약정서 각 조항을 승인하고 다음 각호와 같은 내용으로 연대보증채무를 부담한다. 1. 채권자(대주) : (주)오에스비저축은행, 하나캐피탈(주), (주)아이비케이캐피탈, 케이비케피탈(주), (주)디비저축은행, (주)오케이저축은행, (주)한국투자저축은행, (주)대신저축은행, (주)푸른상호저축은행, 제이티친애저축은행(주), (주)애큐온저축은행, 그레이이글제일차(주) 2. 채무자(차주): 마곡컨소시엄제일차(주) 3. 연대보증인 : (주)셀리드 4. 피보증채무의 범위 : 연대보증인은 대출약정서상의 대출원리금 상환채무 및 기타 금융계약상의 제반 채무(이하"피보증채무")에 대하여 채무자와 연대하여 보증한다. 5. 보증한도 : 대출약정금 합계 금 일천사백팔십억원(\148,000,000,000)에 대한 연대보증인의 지분비율(22%)의 130%인 금 사백이십삼억이천팔백만원(\42,328,000,000)이며, 상기 보증한도는 대출실행금액 비율에 따라 안분배분됨 6. 보증기한 : 본 채무 전액 상환시까지 연대보증계약은 유지되는 것으로 한다. (2) 연대보증인은 차주의 피보증채무를 연대하여 보증하는 것으로 한다. 연대보증인은 대출약정서상 채무자에게 기한이익상실 또는 채무불이행사유가 발생한 경우 즉시 연대보증채무를 이행하여야 한다. (3) 연대보증인의 본 조 기재 연대보증채무의 내용은 한정근보증에 해당함을 확인한다. (4) 채무자가 채권자에 대한 채권으로 상계를 한 경우, 연대보증인은 피보증채무가 남아 있는 한, 동 상계로 인하여 피보증채무가 감소되었음을 주장하지 못한다. (5) 연대보증인은 채권자가 피보증채무를 전액 변제받기 전까지 채무자에 대하여 구상권을 행사하지 아니할 것임을 확약한다. (6) 연대보증인이 피보증채무에 관하여 따로 보증 등을 하고 있거나 하게 되는 경우, 그 보증 등은 이 연대보증에 의하여 변경되지 아니하며, 따로 한 보증 등에 관하여 한도 약정이 있는 때에는 그에 추가하여 이 연대보증에 의한 피보증채무가 더해지는 것으로 한다. (7) 연대보증인은 피담보채무에 대하여 연대보증인이 추가되는 경우, 연대보증인과 추가되는 연대보증인간에는 분별의 이익이 없고, 연대보증인은 각자 독립하여 피보증채무 전체를 변제해야 한다는 것을 인정한다. (8) 연대보증인은 채권자가 대출약정서에서 정하는 바에 따라 피보증채무의 전부 또는 일부를 양도할 수 있음을 인정하며, 이 경우 연대보증인은 이를 양수한 자에 대하여도 양도 전 채권자에게 부담하였던 것과 같은 내용의 연대보증채무를 부담한다. 그러나 연대보증인은 채권자의 사전 동의 없이 이 연대보증채무를 양도하지 못한다. (9) 이 연대보증은 피보증채무가 완전히 소멸되는 날에 종료한다. |
| (자료) | 당사 제시 |
본 대출약정금 1,480억원에 대한 상세내역 및 당사의 상환계획은 다음과 같습니다.
| [대출약정금 상세내역] |
| (단위 : 억원) |
| 대주 | 취급일 | 만기일 | 금리 | 차입용도 | 담보자산 | 보증사항 | 상환계획 | 한도액 | 셀리드 보증 금액 |
|---|---|---|---|---|---|---|---|---|---|
| ㈜오에스비저축은행 | 2023.07.12 | 2026.07.11 | 8.00% | PF 자금 |
관리형토지신탁에 따른 우선수익권 외 |
연대보증 130% |
준공 후 토지건물 담보대출 |
45 | 9.9 |
| 하나캐피탈㈜ | 8.00% | 300 | 66 | ||||||
| ㈜아이비캐이캐피탈 | 8.00% | 100 | 22 | ||||||
| 케이비캐피탈㈜ | 8.00% | 200 | 44 | ||||||
| ㈜디비저축은행 | 8.00% | 90 | 19.8 | ||||||
| ㈜오케이저축은행 | 8.00% | 80 | 17.6 | ||||||
| ㈜한국투자저축은행 | 8.00% | 80 | 17.6 | ||||||
| ㈜대신저축은행 | 8.00% | 40 | 8.8 | ||||||
| ㈜푸른상호저축은행 | 8.00% | 60 | 13.2 | ||||||
| 제이티친애저축은행㈜ | 8.00% | 45 | 9.9 | ||||||
| ㈜애큐온저축은행 | 8.00% | 70 | 15.4 | ||||||
| 그레이이글제일차㈜ | 11.00% | 370 | 81.4 | ||||||
| 합 계 | 1,480 | 325.6 | |||||||
| (자료) | 당사 제시 |
| (주1) | 한도액은 마곡컨소시엄제일차(주) 총 대출금에 대한 금액이고, 셀리드 보증금액은 그 중 당사 부담비율인 22%를 적용한 금액임 |
| [대출약정금 상환계획] |
| (단위 : 백만원) |
| 구 분 | 2026년 | 2027년 | 2028년 | 2029년 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2분기 | 3분기 | 4분기 | 1분기 | 2분기 | 3분기 | 4분기 | 1분기 | 2분기 | 3분기 | 4분기 | 1분기 | 2분기 | 3분기 | 4분기 | |
| 담보대출 잔액 | 32,560 | 31,746 | 30,932 | 30,118 | 29,304 | 28,490 | 27,676 | 26,862 | 26,048 | 25,234 | 24,420 | 23,606 | 22,792 | 21,978 | 21,164 |
| 분기별 상환액 | - | 814 | 814 | 814 | 814 | 814 | 814 | 814 | 814 | 814 | 814 | 814 | 814 | 814 | 814 |
| (자료) | 당사 제시 |
| (주1) | 마곡 신사옥 및 연구센터 PF 대출금을 담보대출로 전환하여 상환할 예정임 |
당사는 연대보증인으로서, 2026년 3월 건물이 준공된 후 PF 대출금 상환을 위해 상기 신사옥 및 연구센터를 담보로 하는 금융기관 담보대출로 전환하여 2026년부터 향후 10년 간 연간 약 32억원씩 상환할 계획입니다. 또한, 당사에서 목표하고 있는 코로나19 백신 매출 및 CMO 매출 등 자체 자금에 따른 수익 또한 상환재원으로 충당할 계획을 가지고 있습니다.
다만 코로나백신 상업화가 되지 않을 경우 당사는 유동성이 부족하여 신규 자금 조달이 이루어지지 않는다면, PF 대출금 상환이 어려울 수 있습니다. CMO 매출 및 이커머스 매출 분야에서 양(+)의 현금흐름이 발생하거나, 또는 Celivax 기술이전 등이 이루어져야 당사의 자체 자금으로 상환이 가능할 것으로 예상되나, 아직까지도 CMO 및 이커머스 분야에서 현금흐름 창출능력이 부족한 상태이며, 기술이전 가능성은 예측하기 어렵습니다. 결국 당사의 다양한 방면의 현금 확보 노력에도 불구하고, 현 시점에서 코로나백신 상업화에 실패하거나, 장기간 지연될 경우에는 당사는 향후 PF 대출금 상환 능력을 보유하기 어려울 수 있습니다. 따라서 신규 자금조달 등 지속적 투자 유치를 받는 것이 당사와 같이 실적이 부족하고, 연구개발에 비용을 쓰고 있는 기업들의 유일한 방안이라고 생각되는 것이 현실입니다. 따라서 당사는 PF 상환에 차질이 없도록 신규 투자 유치 활동에 보다 노력하려고 합니다. 신규 투자 유치마저 불가능하다면 당사는 심각한 유동성 위기에 처할 수 있음을 투자자 여러분들께서는 다시 한번 유의하여 주시기 바랍니다.
그러나 신사옥 준공 후 부동산 경기 불황 또는 관련 정책 및 제도의 변경 등 예상치 못한 사유로 인해 부동산 담보대출 전환이 이루어지지 않거나, 당사 자체자금 창출능력이 향후에도 발생하지 않을 경우에는 당사는 채무 부담에 따른 유동성 위기가 생길 수 있습니다. 또한 신사옥 준공 이전에도 현재 예상할 수 없는 대내외적 변수로 인하여, 공사 진행에 문제가 생기거나, 부동산 PF 대주단의 대출약정서상 기한이익 상실선언 사유가 발생할 경우, 당사가 담보로 제공한 자산에 가압류 등의 조치가 취해질 수 있으며, 혹은 당사의 연대보증 의무가 발현되는 등 일시에 대규모 채무상환 부담이 생길 위험성이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
한편, 당사는 마곡산업단지 토지 취득과 관련하여 서울경제진흥원으로부터 약 3.2억원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령취소 소송을 제넥신 등과 공동으로 진행하였고 2023년 9월 22일 1심 패소, 2024년 12월 18일 2심 패소 이후 2025년 1월 9일 불복하기 위한 상고심을 제기하였습니다.
당사는 이미 기부채납을 완료한 상황이나 법무법인의 자문을 받은 결과 기부채납 이행이 불요하다고 판단하였으며, 이에 상기와 같이 기부채납을 반환받고자 공동 소송에 참여하게 되었습니다. 제1심에서 패소하였으나, 현재 항소 제기하여, 상급심 진행 중인 상태입니다. 이와 관련하여, 본 증권신고서 "제2부.X.그 밖에 투자자 보호를 위하여 필요한 사항-2.우발부채 등에 관한 사항" 부분을 참조하여 주시기 바랍니다.
현재 동 소송의 전망은 예측할 수 없습니다. 이와 같은 법률 분쟁은 통상적으로 장기간에 걸쳐 진행되며, 사안에 따라 매우 큰 규모의 분쟁이 될 경우 큰 규모의 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [바. 개발비, 영업권 등의 손상차손 인식 위험] 당사는 현재 개발비 및 영업권 등의 무형자산을 인식하고 있으나, 향후 개발비 및 영업권에 대한 가치 평가시, 자산화된 내역을 인정받지 못하고 일부 또는 전부에 대하여 손상차손을 인식하게 될 수 있습니다. 이는 당사의 법인세차감전계속사업손익에 일시에 악영향을 미칠 수 있고, 당사의 관리종목 지정 위험을 확대시킬 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [무형자산 및 감가상각비 현황] |
| (단위 : 백만원) |
| 구 분 | 2024년말 | 2023년말 | 2022년말 | ||
|---|---|---|---|---|---|
| 무형자산 | 19,424 | 4,160 | 18 | ||
| 산업재산권 | 0 | 3 | 18 | ||
| 취득원가 | 152 | 152 | 152 | ||
| 감가상각누계액 | (152) | (149) | (134) | ||
| 소프트웨어 | 5 | 7 | 0 | ||
| 취득원가 | 212 | 212 | 0 | ||
| 감가상각누계액 | (34) | (12) | 0 | ||
| 정부보조금 | (205) | (205) | 0 | ||
| 감가상각누계액(정부보조금) | 32 | 12 | 0 | ||
| 개발비 | 18,530 | 4,150 | 0 | ||
| 취득원가 | 18,530 | 4,150 | 0 | ||
| 감가상각누계액 | 0 | 0 | 0 | ||
| 영업권 | 887 | 0 | 0 | ||
| 취득원가 | 887 | 0 | 0 | ||
| 감가상각누계액 | 0 | 0 | 0 | ||
| 감가상각비 | 3 | 16 | 15 | ||
| (자료) | 당사 감사보고서 및 사업보고서 |
2024년말 기준 당사의 무형자산 장부금액은 194억원으로 당사 자산총계 대비 25.5%의 비중을 차지하고 있습니다. 2023년부터 임상3상 단계에 돌입한 파이프라인의 연구개발비용을 개발비 항목으로 자산화하고 있으며, 2024년말 기준 개발비 잔액은 185.3억원입니다. 또한 2024년 1분기 중에 (주)포베이커 합병에 따른 영업권 9.6억원을 인식하였습니다. 당사 무형자산과 관련된 주요 내용 및 위험요소는 다음과 같습니다.
| [연구개발비 자산화 내역] | |
| (2024년말) | (단위 : 백만원) |
| 단계 | 구분 | 개별자산명 | 자산화한 연구개발비 금액(누계) | 연구개발비 | 잔여상각기간 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전임상 | 임상1상 | 임상2상 | 임상3상 | 판매승인 | 계 | 손상차손누계액 | 장부금액 | ||||
| 개발중 | 신약 | AdCLD-CoV19-1 OMI | - | - | - | 18,530 | - | 18,530 | - | 18,530 | - |
당사는 개발활동 과정에서, 임상 3상 개시 승인을 득한 이후부터 발생한 연구개발비 지출을 무형자산 개발비 계정으로 자산화하고 있으며, 이외 단계에서 지출된 금액은 모두 당기 비용으로 처리하고 있습니다.
당사가 2024년말까지 누적으로 자산화 인식한 개발비는 185.3억원이며 이는 AdCLD-CoV19-1 OMI 백신 개발 프로젝트로서, 현재 임상 3상을 완료한 상태로, 2025년 허가를 목표로 하고 있습니다. 해당 자산은 상각요건을 충족하지 않아 미상각하고 있으며, 현재까지 인식된 손상차손 금액은 없습니다.
만일, 임상 평가 과정에서 예상치 못한 변수가 발생하여 임상이 실패했다고 판단할 경우 또는 임상에 성공하더라도 시장성이 없다고 판단될 경우, 당사가 자산화한 개발비는 전부 또는 일부가 손상처리될 위험성이 존재합니다.
한편, 당사는 2024년 1분기 중 ㈜포베이커의 지분 100%를 취득하여 지배력을 획득하였고, 취득한 자산과 인수한 부채의 계상액보다 초과하여 지출한 이전대가에 대하여 영업권 8.9억원을 인식하였으며, 인식된 영업권은 세무상 손금으로 인정되지 않습니다. 당사가 지불한 이전대가와 취득일의 인수한 자산, 부채의 가액 및 ㈜포베이커에 대한 취득일의 비지배지분은 아래와 같습니다.
| [이전대가, 취득일의 인수한 자산 및 부채의 가액] |
| (단위 : 백만원) |
| 구 분 | 금 액 |
|---|---|
| 이전대가 | |
| - 기존 보유지분의 장부금액 | 500 |
| 취득한 자산의 장부금액 | |
| - 현금 및 현금성자산 | 3 |
| - 매출채권 | 179 |
| - 기타유동금융자산 | 4 |
| - 기타유동자산 | 32 |
| - 재고자산 | 116 |
| - 무형자산(영업권) | 887 |
| 소계 | 1,221 |
| 인수한 부채의 장부금액 | |
| - 매입채무 | 104 |
| - 기타유동금융부채 | 116 |
| - 기타유동부채 | 61 |
| - 단기차입금 | 149 |
| - 유동성장기부채 | 90 |
| - 장기차입금 | 200 |
| 소계 | 721 |
| 인수한 순자산의 장부금액 | 570 |
| 합 계 | 500 |
당사가 인식한 영업권 또한 향후 손상차손 인식 등 비용처리될 수 있습니다.
이처럼 당사는 현재 개발비 및 영업권 등의 무형자산을 인식하고 있으나, 향후 개발비 및 영업권에 대한 가치 평가시, 자산화된 내역을 인정받지 못하고 일부 또는 전부에 대하여 손상차손을 인식하게 될 수 있습니다. 이는 당사의 법인세차감전계속사업손익에 일시에 악영향을 미칠 수 있고, 당사의 관리종목 지정 위험을 확대시킬 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[사. 잦은 자금조달 관련 위험] |
| [상장 및 이후 자본시장에서 조달한 자금 내역] |
| (단위: 백만원) |
| 납입일 | 종류 | 사용용도 | 금액 |
|---|---|---|---|
| 2019-02-15 | 코스닥 상장 유상증자(일반공모) | 운영자금 | 25,357 |
| 시설자금 | 14,000 | ||
| 2021-03-19 | 제2회 사모 전환사채 | 운영자금 | 10,000 |
| 시설자금 | 9,000 | ||
| 2023-09-08 | 주주우선공모 유상증자 | 운영자금 | 17,481 |
| 2024-08-09 | 주주배정 후 실권주 일반공모 유상증자 | 운영자금 | 23,175 |
| 합계 | 99,013 | ||
| 자료 : 당사 정기보고서 |
당사는 2019년 2월 15일 코스닥시장 상장을 통한 유상증자 약 394억원, 2021년 3월 19일 제2회 사모 전환사채 190억원, 2023년 9월 주주우선공모 방식의 유상증자 약 175억원, 2024년 8월 주주배정 후 실권주 일반공모 방식의 유상증자 약 232억원 등 총 758억원을 운영자금 및 시설자금 목적으로 자본시장에서 조달하였습니다.
1) 코스닥시장 상장을 통한 유상증자 약 394억원의 사용내역
2019년 2월 당사는 코스닥시장에 상장하였으며, 당시 공모자금 394억원은 운영자금 254억원 및 시설자금 140억원의 용도로 사용할 계획이었습니다.
이 중 당사가 상장할 당시 계획했던 운영자금 254억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 내 역 | 2019년 | 2020년 | 2021년 | 계 |
|---|---|---|---|---|---|
| 경상연구개발비 (운영자금) |
BVAC-C 자궁경부암 | 1,500 | 1,500 | 5,000 | 8,000 |
| BVAC-C 두경부암 | 1,500 | 1,500 | 1,500 | 4,500 | |
| BVAC-B 위암 | 1,500 | 1,500 | 1,500 | 4,500 | |
| BVAC-B 유방암 | 200 | 1,500 | 1,500 | 3,200 | |
| BVAC-P 전립선암 | 200 | 200 | 1,500 | 1,900 | |
| BVAC-M 흑색종 | 200 | 200 | 1,500 | 1,900 | |
| BVAC-Neo | 200 | 200 | 957 | 1,357 | |
| 계 | 5,300 | 6,600 | 13,457 | 25,357 | |
| (자료) | 당사 증권신고서(지분증권)-2019.02.01 |
| [실제 자금사용 내역] |
| (단위 : 백만원) |
| 구분 | 내역 | 2019년 | 2020년 | 2021년 | 2022년 | 2023년 | 계 |
|---|---|---|---|---|---|---|---|
| 경상연구개발비 (운영자금) |
BVAC-C 자궁경부암 | 1,836 | 1,108 | 2,932 | 1,939 | 1,893 | 9,707 |
| BVAC-C 두경부암 | 0 | 0 | 0 | 0 | 0 | 0 | |
| BVAC-B 위암 | 24 | 0 | 141 | 0 | 0 | 165 | |
| BVAC-B 유방암 | 0 | 0 | 0 | 0 | 0 | 0 | |
| BVAC-P 전립선암 | 7 | 0 | 0 | 0 | 0 | 7 | |
| BVAC-M 흑색종 | 195 | 110 | 502 | 0 | 0 | 807 | |
| BVAC-Neo | 0 | 0 | 0 | 0 | 0 | 0 | |
| BVAC-E6E7 | 0 | 0 | 0 | 862 | 2,134 | 2,996 | |
| AdClD-CoV19-1 OMI | 0 | 0 | 0 | 2,540 | 1,952 | 4,492 | |
| COVID-19 | 0 | 1,956 | 555 | 2,545 | 2,126 | 7,183 | |
| 계 | 2,063 | 3,173 | 4,129 | 7,886 | 8,105 | 25,357 | |
| (자료) | 당사 제시 |
당사는 2019년 IPO 당시 항암면역치료제를 개발하는 기업으로서 다양한 BVAC 파이프라인 연구개발을 진행하였으나, 2020년 3월 세계보건기구(WHO)의 코로나19 팬데믹 선언 후 사회적 거리두기 4단계 시행으로 방역조치가 강화됨에 따라 임상시험 대상자의 모집, 방문 일정 수립 등 임상시험 진행이 원활하게 수행되지 못하였습니다. 또한, 코로나19 팬데믹 대응을 위해 자체 원천 기술인 아데노바이러스 벡터 플랫폼을 활용하여 코로나19 백신 신규 파이프라인 개발에 회사의 모든 역량을 집중함으로써 기존 파이프라인 개발 계획이 변경 또는 지연되며, IPO 당시 계획했던 각 파이프라인별 자금사용목적 계획과 실제 자금사용 내역간 각 파이프라인별 집행금액의 차이가 발생하였습니다.
이는 당사의 영업환경 및 각 파이프라인별 진행상황, 성공 가능성 등을 실시간 판단한 결과 당사의 전략 변화에 의한 것이며, 당사는 기존 목적인 운영자금 용도에 부합하도록 경상연구개발비 등의 운영자금으로 2023년까지 254억원을 사용하였습니다.
한편, 2019년 2월 당사가 상장할 당시 계획했던 시설자금 140억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 내 역 | 2019년 | 2020년 | 2021년 | 계 |
|---|---|---|---|---|---|
| 시설자금 | 마곡 GMP 건물 | 3,000 | 3,000 | 4,000 | 10,000 |
| 마곡 GMP 기계장치 | 0 | 0 | 4,000 | 4,000 | |
| 계 | 3,000 | 3,000 | 8,000 | 14,000 | |
| (자료) | 당사 증권신고서(지분증권)-2019.02.01 |
| [실제 자금사용 내역] |
| (단위 : 백만원) |
| 구분 | 내 역 | 2019년 | 2020년 | 2021년 | 계 |
|---|---|---|---|---|---|
| 시설자금 | 성남 GMP 건물 | 3,086 | 3,178 | 0 | 6,264 |
| 성남 GMP 기계장치 | 0 | 4,411 | 3,325 | 7,736 | |
| 계 | 3,086 | 7,589 | 3,325 | 14,000 | |
| (자료) | 당사 제시 |
당사는 2019년 IPO 당시 CMO 및 CDMO 사업 확대를 위한 마곡 GMP센터 설립을 위해 시설자금으로 140억원을 투입할 예정으로 제넥신 컨소시엄의 구성원으로서 마곡(D9-1) 위치에 GMP센터를 구축할 계획을 가지고 있었으나, 지리적으로 성남에 GMP센터를 구축하는 것이 유리하다는 판단 하에 2020년 성남 GMP센터를 구축하고 2021년까지 시설장비를 투자하였습니다.(주1)
| (주1) | 관련 내용은 본 증권신고서 "제1부.III.투자위험요소-1.사업위험-사" 부분을 참고하여 주시기 바랍니다. |
이에 140억원은 2021년까지 성남 GMP센터 구축을 위한 시설자금으로 모두 사용하였습니다. 한편 마곡 지구는 연구거점 일원화를 위한 기업부설연구소와 사무공간 활용 목적의 사옥으로 용도를 변경하여 투자하게 되었으며, 이는 부동산 PF 구조를 활용하여 진행 중인 상태입니다. 현재 마곡 신사옥은 2023년 7월 건축공사를 본격적으로 진행하여 2026년 3월 준공 뒤 2026년 4월에 입주할 예정입니다. (주1)
| (주1) | 마곡 신사옥 관련 내용은 본 증권신고서 "제1부.III.투자위험요소-2.회사위험-마" 부분을 참고하여 주시기 바랍니다. |
구체적으로 당사는 성남GMP센터 설립 전, 타사의 GMP 시설을 다수 이용하였으나, 당사가 원하는 시기에 타사의 GMP시설을 활용하여 연구 및 제품 생산에 어려움이 있었으며, 연구개발의 차질이 발생하는 경우가 있었습니다. 변종 백신을 만드는 경우, 단기간 내 신속하게 여러 종류의 백신을 생산하는 것에 시간상 제약이 있었으며 연구개발 목표를 달성에 어려움이 있었습니다. 당사 시설을 구축하여 적기에 백신을 생산하는 것이 연구개발 및 사업화에 이점이 있다고 판단하였습니다.
특히, 당사가 독자적으로 연구중인 셀리벡스 플랫폼등은 환자에게 분리된 세포를 신속하게 원하는 시간에 신속히 제조를 해야하는 특징을 가지고 있으나 자체 GMP 시설을 운영하지 않으면 원하는 시간에 생산할 수 없습니다. 2022년 이전에는 타 회사 CDMO를 활용하였으나, 스케줄링 등이 원활하지 않아 임상속도 등에 어려움이 많았습니다. 게다가, 당사의 품목인 셀리벡스 플랫폼은 유전자 치료제와 세포 치료제 두 분야를 이해하고 전문적으로 다루어야 가능한 특성을 가지고 있으며, 대부분 세포 치료제 기반인 완제의약품(Drug product)는 한국에서 연구하거나 제조 할 수 있는 업체는 많으나 유전자 치료제 기반인 원료의약품(Drug substract)인 벡터를 직접 연구하고 제조할 수 있는 업체는 상대적으로 드문 상황입니다. 이러한 신속성 및 전문성을 갖춘 당사의 GMP 센터가 대형병원과 가까운 유리한 위치에 가용한 공간을 만들어 두어 당사 자체 파이프라인 뿐만 아니라 CDMO 사업을 통해 매출을 발생시키고 위해 노력하고 있습니다.
또한 당사는 파이프라인을 연구개발하여 백신 제조 및 판매를 위한 상업화를 목표로 하고 있습니다. 2019년 상장 전 마곡토지를 매입하여 마곡에 GMP센터 설립을 계획하였습니다, 다만, 서울시에서 매입한 마곡 토지에 GMP센터를 설립할 경우, 임상시험 및 연구개발 용도의 GMP센터 설립만을 허가해주고 있어, 성남에 상업용GMP센터를 설립하게 되었습니다. 성남은 국내 빅5 대형병원인 서울아산병원, 삼성의료원, 서울대학교 분당병원, 세브란스 강남분원, 카톨릭대학교 병원에 약 20km의 거리에 인접하여, 국내 암환자의 대다수가 빅5 병원에 내원 및 치료를 받고 있어 암환자 치료 및 당사 백신 제조를 위한 지리적 이점이 있습니다. 게다가, 성남GMP센터 설립 초기에 새롭게 등장하는 유전자 및 세포치료제 수요가 늘어나고 있었으며, GMP시설이 없는 바이오기업의 바의오 의약품 생산 수요를 충족할 것으로 예상하여, CDMO 사업을 위해 GMP센터를 설립하게 되었습니다.
당사는 마곡사옥이 완공되면 연구개발시설 및 인원의 집중을 계획하고 있으나, 성남GMP에 연구시설을 배제하려는 계획은 아닙니다. 마곡에 연구개발시설을 집중하되, 성남GMP에 연구개발시설을 이원화하여 운영할 계획입니다. 당사의 연구소는 기초연구를 담당하는 신약탐색팀, 중개연구팀이 있으며, 기초연구와 공정연구를 담당하는 벡터공정팀, 완제공정팀이 있습니다. 또한, 성남은 국내 빅5 대형병원에서 약20km 거리에 위치하여 암환자의 치료 및 맞춤형 백신제조에 이점을 가지고 있습니다. 마곡의 연구를 중심으로 성남GMP에서도 관련 연구를 진행하는 이원화를 통해 연구개발에 집중할 계획입니다.
하지만 당사의 CMO 매출은 2022년도 480백만원, 2024년도 358백만원으로 총 838백만원이 발생하였으나, 이는 기대에 미치지 못하는 수치입니다. 또한 현재 대부분의 GMP 시설 장비는 유휴설비로 판단되며, 추후 충분한 CMO 매출이 발생하지 못하면 매출 없이 감가상각비만 증가하는 등 당사의 재무 상황이 악화될 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
2) 제2회 사모 전환사채 발행 190억원의 사용 내역
당사는 2021년 3월 제2회 사모 전환사채 190억원 발행 당시 코로나19 백신 등 연구개발비 및 임상시험비를 위해 운영자금 100억원을 집행하고, 그 외 90억원은 시설자금으로 집행할 목적이었습니다.
운영자금 100억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [제2회 사모 전환사채 발행 당시 자금사용목적] |
| (단위 : 백만원) |
| 자금용도 | 세부내역* | 합계 |
|---|---|---|
| 운영자금 | 코로나19 백신 등 연구개발비 및 임상시험비 | 10,000 |
| (자료) | 당사 주요사항보고서(전환사채권발행결정)-2021.03.17 |
| (주1) | 해당 자금은 사모 발행 자금으로서, 자세한 사항은 본 사채 발행 결정일 현재 미정이나, 단, 총 100억원을 운영자금 용도로 사용할 것으로 사모 투자자와 사전 합의 후 발행하였습니다. |
| [제2회 사모 전환사채 자금사용 내역] |
| (단위 : 백만원) |
| 자금용도 | 세부내역 | 연도별 사용 금액 | ||
|---|---|---|---|---|
| 2022년 | 2023년 | 합계 | ||
| 운영자금 | 코로나19 백신 등 연구개발비 및 임상시험비 | 3,772 | 316 | 4,088 |
| (자료) | 당사 제시 |
당사는 사모 전환사채 조달금액 중 41억원을 2023년까지 코로나19 백신 등 연구개발비 및 임상시험비 등의 운영자금으로 사용하였습니다. 그 외 149억원은 당초 계획에 맞추어 운영자금 및 시설자금으로 사용할 예정이었으나, 지속적 주가 하락에 따라 사채권자의 조기상환 가능성에 대비할 필요가 있었기에, 조달금액 사용은 제한적인 상황이었습니다.
2023년 2월에는 전환사채 76억원이 조기상환 청구됨에 따라, 전환사채 조달금액 잔여분 149억원 중 76억원은 상환자금으로 사용하였으며, 이후 잔여금액 73억원 또한 조기상환 가능성에 대비할 필요가 있었기에, 사용에 제한적인 상황이었습니다.
이어, 2023년 11월에도 전환사채 38억원이 조기상환 청구되었고, 이는 자체자금으로 상환하였습니다. 상환 당시 자체자금을 사용하게 되더라도, 2023년 9월 주주우선공모 유상증자로 유입된 금액으로 당사의 연구개발비 등 임상비용 집행이 당분간 가능하였기 때문입니다.
한편, 2024년 2월 사채권자와의 합의에 따라 사채권자는 당사의 전환사채 조달금액 중 미사용 잔여금액 73억원에 대해 조기상환 행사용도로 질권 설정하였으며, 이는 전환사채 미상환금액 76억원에 대하여, 2024년 6월 19일 조기상환 용도로 사용될 예정입니다.
이처럼 당사는 사모 전환사채 190억원을 조달하였으나, 주가 하락 등 사유로 사채권자의 주식 전환이 이루어지지 않고, 사채권 조기상환 요청에 대응하게 되었으며, 조달금액 중 실질적으로 당사의 운영자금으로 사용한 금액은 약 41억원에 그치며, 나머지 금액은 모두 조기상환 용도로 사용되었습니다. 따라서 당사는 2023년 조기상환 청구에 대응하는 과정에서 전환사채 조달금액은 실질적으로 사용이 제한적인 상황이었기 때문에, 아래와 같이 주주우선공모 방식의 유상증자를 실행하여, 실질적으로 당사의 영업에 필요한 임상비용 등의 연구개발비 집행 목적의 자금 조달을 실행하게 되었습니다.
3) 주주우선공모 유상증자 175억원의 사용내역
당사는 2023년 6월 최초 예정발행가액 6,290원 기준으로 주주우선공모 유상증자로 400억원을 모집할 계획이었으며, 유상증자 수수료 지급을 제한 모집금액은 당사가 집중하고 있는 파이프라인의 연구개발비 등의 운영자금으로 소진할 예정이었습니다.
당시 예정발행가액 6,290원 기준으로 예산을 잡았던 운영자금 400억원에 대한 자금사용목적은 다음과 같습니다.
| [주주우선공모 유상증자 발행결정 당시 예정발행가액 기준 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 23년 3분기 | 23년 4분기 | 24년 1분기 | 24년 2분기 | 24년 3분기 | 24년 4분기 | 합계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 5,650 | 9,130 | 8,500 | 4,450 | 3,350 | 1,600 | 32,680 |
| BVAC-C | - | - | 1,000 | 1,000 | 1,000 | 1,000 | 4,000 | |||
| BVAC-E6E7 | 450 | 430 | 450 | - | 610 | - | 1,940 | |||
| COVID-19 다가백신 | 210 | 210 | 220 | 180 | 167 | - | 987 | |||
| 수수료 지급 | 유상증자 수수료 외 | 393 | - | - | - | - | - | 393 | ||
| 합계 | 6,703 | 9,770 | 10,170 | 5,630 | 5,127 | 2,600 | 40,000 | |||
| (자료) | 당사 증권신고서(지분증권)-2023.06.16 |
| (주1) | 상기 자금사용목적은 최초 증권신고서 제출 당시 예정발행가액 기준으로 400억원 전액이 모집되었을 경우를 가정하고 산출한 자금사용 예상 계획입니다. |
당사는 400억원 전액이 조달될 경우, AdCLD-CoV19-1 OMI 등 파이프라인 4개의 임상개발비로 2024년 4분기까지 400억원을 집행할 계획을 가지고 있었습니다. 단, 주주우선 공모 방식의 유상증자 당시 확정발행가액은 청약일 전 주가 하락으로 인해 최종 1주당 4,515원으로 결정되었으며, 약 287억원을 최종 모집금액으로 하여 청약을 받게 되었습니다.
그러나 2023년 9월 최종 모집 결과, 당사는 최초 목표했던 금액 400억원에 못 미치는 약 175억원을 조달하게 되었습니다. 청약 후 실권주가 발생하더라도 주관회사에서 총액인수하는 방식이 아니라 모집주선하는 방식이었기 때문에 실권주가 미발행되었기 때문입니다.
이에 당사는 실제 조달된 금액 175억원을 기준으로, 공모자금의 각 파이프라인별 연구개발비 투입 계획을 다음과 같이 재조정하였습니다.
| [주주우선공모 유상증자 발행결과 최종 조달금액 기준 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 23년 3분기 | 23년 4분기 | 24년 1분기 | 24년 2분기 | 합계 | |
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 2,589 | 4,260 | 4,300 | 900 | 12,049 |
| BVAC-C | - | 1,000 | 1,000 | 1,000 | 3,000 | |||
| BVAC-E6E7 | - | 450 | 430 | 450 | 1,330 | |||
| COVID-19 다가백신 | 210 | 210 | 220 | 180 | 820 | |||
| 수수료 지급 | 유상증자 수수료 외 | 282 | - | - | - | 282 | ||
| 합계 | 3,081 | 5,920 | 5,950 | 2,530 | 17,481 | |||
| (자료) | 당사 증권발행실적보고서(지분증권)-2023.09.08 |
| (주1) | 상기 자금사용목적은 최종 모집결과 조달된 17,481백만원을 기준으로 재수립한 분기별 자금사용 예상 계획입니다. |
당사가 최초 계획했던 파이프라인의 중요도 및 우선순위는 변동된 바 없으며, 실제 조달된 금액을 상기와 같이 배분해서 집행할 계획을 세우게 되었으며, 2024년 2분기까지의 자금 사용내역은 다음과 같습니다.
| [주주우선공모 유상증자 모집금액의 실제 사용내역] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 23년 3분기 | 23년 4분기 | 24년 1분기 | 24년 2분기 | 합계 | |
|---|---|---|---|---|---|---|---|---|
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 1,868 | 2,910 | 4,577 | 3,675 | 13,030 |
| BVAC-C | 219 | 731 | 962 | 127 | 2,039 | |||
| BVAC-E6E7 | 597 | 253 | 0 | 116 | 966 | |||
| COVID-19 다가백신 | 16 | 45 | 3 | - | 64 | |||
| 기타 운영자금 | 연구관련 운영자금 | 393 | 461 | 355 | - | 1,209 | ||
| 수수료 지급 | 유상증자 수수료 등 | 285 | - | - | - | 285 | ||
| 합계 | 3,379 | 4,400 | 5,897 | 3,918 | 17,593 | |||
| (자료) | 당사 사업보고서, 당사 제시자료 및 회계법인 실사자료 |
당사는 주주우선공모 유상증자로 조달한 금액 약 175억원 중 2024년 2분기까지 유상증자 수수료 및 각 파이프라인별 연구개발비 등의 운영자금 용도로 약 175억원 전부를 집행 완료하였으며, 자체자금 112백만원을 사용하여 총 17,593백만원을 사용하였습니다.
4) 주주배정 후 실권주 일반공모 유상증자 232억원의 사용내역
당사는 2024년 5월 최초 예정발행가액 2,335원 기준으로 주주배정 후 실권주 일반공모 유상증자로 175억원을 모집할 계획이었으며, 유상증자 수수료 지급을 포함하여 모집금액은 당사가 집중하고 있는 파이프라인의 연구개발비 등의 운영자금으로 소진할 예정이었습니다.
당시 예정발행가액 2,335원 기준으로 예산을 잡았던 운영자금 175억원에 대한 자금사용목적은 다음과 같습니다.
| [주주배정 후 실권주 일반공모 유상증자 발행결정 당시 예정발행가액 기준 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 24년 3분기 | 24년 4분기 | 25년 1분기 | 25년 2분기 | 합계 | |
|---|---|---|---|---|---|---|---|---|
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 7,663 | 4,800 | 1,166 | 290 | 13,918 |
| BVAC-C | 750 | 750 | 1,000 | - | 2,500 | |||
| BVAC-E6E7 | 273 | 210 | 246 | - | 729 | |||
| 수수료 지급 | 유상증자 수수료 외 | 365 | - | - | - | 365 | ||
| 합계 | 9,051 | 5,760 | 2,412 | 290 | 17,513 | |||
| (자료) | 당사 증권신고서(지분증권)-2024.05.27 |
| (주1) | 상기 자금사용목적은 최초 증권신고서 제출 당시 예정발행가액 기준으로 175억원 전액이 모집되었을 경우를 가정하고 산출한 자금사용 예상 계획입니다. |
당사는 175억원 전액이 조달될 경우, AdCLD-CoV19-1 OMI 등 파이프라인 3개의 임상개발비로 2024년 2분기까지 175억원을 집행할 계획을 가지고 있었습니다. 이후 주주배정 후 실권주 공모 방식의 유상증자 당시 확정발행가액은 청약일 전 주가 상승으로 인해 최종 1주당 3,090원으로 결정되었으며, 약 232억원을 최종 모집금액으로 하여 청약을 받게 되었습니다.
2024년 8월 최종 모집 결과, 당사는 최초 목표했던 금액 175억원보다 더 많은 약 232억원을 조달하게 되었습니다. 구주주 청약율 85.6%, 일반공모 청약율 21,280.1%로 총 청약율 3,144.1%를 달성하여 실권주 없이 확정모집금액 전부를 발행했기 때문입니다.
이에 당사는 실제 조달된 금액 232억원을 기준으로, 공모자금의 각 파이프라인별 연구개발비 투입 계획을 다음과 같이 재조정하였습니다.
| [주주배정 후 실권주 일반공모 유상증자 발행결과 최종 조달금액 기준 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 24년 3분기 | 24년 4분기 | 25년 1분기 | 25년 2분기 | 25년 2분기 이후 | 합계 | |
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 7,663 | 4,800 | 1,166 | 836 | 14,465 | |
| BVAC-C | 750 | 750 | 1,000 | 1,000 | 3,500 | ||||
| BVAC-E6E7 | 273 | 210 | 246 | 480 | 1,209 | ||||
| 잔여공모자금 | 3,504 | 3,504 | |||||||
| 수수료 지급 | 유상증자 수수료 외 | 498 | 498 | ||||||
| 합계 | 9,184 | 5,760 | 2,412 | 2,316 | 3,504 | 23,176 | |||
| (자료) | 당사 증권발행실적보고서(지분증권)-2024.08.12 |
| (주1) | 상기 자금사용목적은 최종 모집결과 조달된 23,175백만원을 기준으로 재수립한 분기별 자금사용 예상 계획입니다. |
| (주2) | 당사는 2025년 2분기까지 향후 1년간 19,174백만원의 연구개발비 집행을 예상하고 있으며, 잔여 공모자금 3,504백만원은 그 이후 연구개발비 목적으로 사용할 예정이며, 집행시기 및 집행금액은 시장 상황 및 각 파이프라인의 우선순위, 연구개발 진척도 등을 종합적으로 고려하여 결정할 예정입니다. |
당사가 최초 계획했던 파이프라인의 중요도 및 우선순위는 변동된 바 없으며, 실제 조달된 금액을 상기와 같이 배분해서 집행할 계획을 세우게 되었으며, 2025년 1분기말까지 본사업 부분의 파이프라이별 자금 사용내역은 다음과 같습니다.
| [본사업 사용 내역] |
| (단위 : 천원) |
| 구분 | 자금용도 | 세부내용 | 7월 | 8월 | 9월 | 10월 | 11월 | 12월 | 25년 1월 | 25년 2월 | 25년 3월 | 합계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 2,321,565 | 4,903,031 | 883,188 | 1,674,696 | 1,906,868 | 1,262,647 | 3,753,040 | 2,506,311 | 1,246,767 | 20,458,113 |
| BVAC-C | 26,934 | 42,877 | 171,557 | 8,680 | 6,745 | 5,573 | 105,893 | 151,056 | 48,475 | 567,790 | |||
| BVAC-E6E7 | 19,040 | 32,304 | 0 | 93,328 | 10,207 | 90,569 | 0 | 0 | 21,851 | 267,299 | |||
| 합계 | 2,367,539 | 4,978,212 | 1,054,745 | 1,776,704 | 1,923,820 | 1,358,789 | 3,858,933 | 2,657,367 | 1,317,093 | 21,293,202 | |||
| (자료) | 당사 사업보고서, 당사 제시자료 및 회계법인 실사자료 |
실제 자금사용내역은 다음과 같습니다.
| [주주배정 후 실권주 일반공모 유상증자 모집금액의 실제 사용내역] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 24년 3분기 | 24년 4분기 | 25년 1분기 | 25년 2분기 | 25년 2분기 이후 | 합계 | |
| 운영자금 | 연구개발비 | 임상개발비 등 | AdCLD-CoV19-1 OMI | 8,108 | 4,844 | 7,506 | 20,458 | ||
| BVAC-C | 241 | 21 | 305 | 567 | |||||
| BVAC-E6E7 | 51 | 194 | 22 | 267 | |||||
| 잔여공모자금 | - | - | - | - | |||||
| 수수료 지급 | 유상증자 수수료 외 | 401 | - | - | 401 | ||||
| 기타자금사용 | 이커머스 외 | 521 | (25) | (496) | - | ||||
| 합계 | 9,322 | 5,034 | 7,337 | 21,693 | |||||
| (자료) | 당사 사업보고서, 당사 제시자료 및 회계법인 실사자료 |
당사는 주주배정 후 실권주 일반공모 유상증자로 조달한 금액 약 232억원 중 2025년1분기말까지 유상증자 수수료 및 각 파이프라인별 연구개발비 등의 운영자금 용도로 약 217억원을 집행하였습니다. 잔여금액은 조달 용도에 맞게 각 파이프라인별 연구개발비 등 운영자금으로 사용할 예정입니다.
당사는 진행 중이던 다국가(국내, 필리핀 및 베트남) 임상3상을 2024년 11월 마지막 대상자까지 투여를 완료하여 현재 중간 분석 결과를 기다리고 있습니다. 적정한 수준 이상의 안전성과 면역항원성이 나오는 중간 분석 결과가 나온다면 당사는 먼저 국내 식약처에 조건부 품목 허가를 신청할 계획입니다. 이후 조건부 품목 허가 승인이 완료된다면 AdCLD-CoV19-1 OMI 백신 생산을 위한 생산비용 및 운영자금 등의 자금 조달이 재차 필요한 상황입니다.
당사는 2023년 9월 주주우선공모 유상증자 및 2024년 8월 주주배정 후 실권주 일반공모 유상증자시 각 파이프라인의 임상 진행 등 적극적 연구개발을 위한 자금 조달금액이 목표치에 미달할 경우, 주주들의 지분 희석을 방지하고 부담을 줄이고자, 당시 유상증자로 조달하지 못했던 부족한 자금은 자체자금을 통해 조달할 계획을 가지고 있었습니다.
이를 위해 2023년 및 2024년 두 차례 유상증자 후 현재까지 지속적으로 자체 운전자금 확보를 위한 CMO 수주 노력을 기울이고 있습니다. 또한 (주)포베이커를 인수하여, 비용을 실시간 통제하며 수익성 개선을 이루어 자체 운전자금을 확보하는 데에 있어 최대한의 노력을 기울이고 있습니다.
그러나 당사가 개발하고자 하는 연구개발업에 소요되는 비용을 적시에 충당하기에는 아직 당사의 자금창출 능력이 현저히 부족한 수준입니다. 따라서 자체 자금만으로는 한계가 있는 상황임을 인지하고, 본 유상증자 이전에 증권사, 자산운용사, VC 등 금융권 회사들과도 접촉하여, 최대한 주주들의 부담이 없는 제3자로부터의 투자 유치 노력도 기울였습니다. 하지만 투자 검토 기간이 장기간 소요되고, 투자 유치 성공 여부에 대한 불확실성이 존재하였기 때문에 궁극적으로 당사의 임상 진행 비용과 조건부 품목 허가 승인이 완료된다는 전제 하의 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 등을 적시에 조달하려면 가장 현실적인 자금 조달 방안은 본 유상증자를 추진하는 것으로 판단하게 되었습니다. 특히 당사의 핵심 파이프라인인 코로나19 백신의 글로벌 임상3상이 순조롭게 완료된 가운데, 계속 자금 조달이 지체될 경우 백신 생산을 위한 준비 과정에 차질이 생기고, 핵심 파이프라인 연구개발에 실패할 위험성을 우려하게 되었습니다. 이로 인해 비록 기존 주주들에게 재무적 부담을 주는 자금조달 방식인 점에도 불구하고, 자금 조달이 지체되어 임상 진행에 차질이 생길 수 있는 위험이 궁극적으로 주주들에게 더 악영향을 미치는 길이라고 판단하여 본 조달을 결정하게 되었습니다.
이처럼 아직은 당사의 영업현금흐름 창출능력이 부진하기 때문에 본 주주배정 후 실권주 일반공모 방식의 유상증자를 통한 자금 조달을 불가피하게 진행하게 되었습니다. 당사는 본 유상증자로 조달된 금액을 당사의 현 상황에서 가장 중요한 파이프라인별 우선순위를 고려하여, AdCLD-CoV19-1 OMI 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 및 각 파이프라인에 필요한 임상개발비 등의 운영자금 용도로 집행할 계획을 세우고 있습니다.(주1)
| (주1) | 본 유상증자의 자금사용목적은 본 증권신고서 "제1부.V.자금의 사용목적" 부분을 참고하여 주시기 바랍니다. |
이처럼 당사는 상장 이후 자본시장에서 운영자금 및 시설자금 등의 목적으로 대규모 자금을 조달해왔습니다. 자금 집행 과정에서 조달 당시 계획했던 구체적인 파이프라인별 자금 계획과는 일부 차이가 존재했으나, 이는 코로나19 팬데믹 발생으로 인해 임상 대상자 모집이 어려운 점과 더불어 코로나19 백신이라는 신규 파이프라인 개발에 집중하기 위함이었으며, 당사의 연구개발 목적으로 사용한 점은 변한 바 없습니다. 또한 CMO/CDMO 사업을 위한 GMP 센터 설립은 센터 위치가 바뀌었을 뿐, 본래 목적과 같이 GMP 설립을 위해 자금이 집행되었습니다. 당사는 금번 유상증자 납입자금은 자금 사용목적의 용도에 맞게끔 사용할 계획이나, 임상 3상을 완료한 AdCLD-CoV19-1 OMI 백신의 조건부 품목 허가가 승인이 되지 않거나, 당사가 직면한 신약개발 일정의 변동 및 예상치 못한 불가피한 자금 지출 수요 등에 따라 변동될 가능성을 배제할 수 없습니다. 또한 당사는 자체적인 현금 창출능력이 부족한 상황에서 자본시장에서의 잦은 자금 조달에 의존하고 있으며, 향후에도 당사의 현금흐름 발생 상황에 따라 추가로 자금 조달을 진행할 가능성이 존재합니다. 당사와 같이 아직 매출이 가시화되지 않은 상태에서 연구개발업을 영위하고 있는 업체는 담보제공능력 내지 신용도가 낮기 때문에 금융권에서의 차입을 통한 자금 조달은 용이하지 않고, 자본시장에서 주식관련사채 발행 또는 유상증자를 통한 자금 조달 의존도가 높을 수 밖에 없습니다. 따라서 추가 자금 조달을 진행할 경우, 지분 희석 등 주주 가치가 훼손될 수 있는 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[아. 최대주주 및 특수관계인 지분희석 및 경영권 관련 위험] |
| [주주 현황] | |
| (증권신고서 제출일 전일 기준) | (단위 : 주, %) |
| 주주명 | 생년월일 | 관계 | 보통주 | 지분율 |
|---|---|---|---|---|
| 강창율 | 541128 | 최대주주 본인 | 2,271,523 | 10.76% |
| 오양희 | 310912 | 모 | 3,888 | 0.02% |
| 강복자 | 560906 | 남매 | 123,500 | 0.59% |
| 강수언 | 600925 | 남매 | 175,269 | 0.83% |
| 강미자 | 581006 | 남매 | 114,200 | 0.54% |
| 강창익 | 530412 | 형제 | 77,214 | 0.37% |
| 강동민 | 851126 | 자 | 100,000 | 0.47% |
| 이영윤 | 590101 | 처 | 5,000 | 0.02% |
| 이정화 | 530303 | 매부 | 123,635 | 0.59% |
| 이효진 | 850426 | 조카 | 35,694 | 0.17% |
| 이혜진 | 861101 | 조카 | 22,500 | 0.11% |
| 장경숙 | 570130 | 형수 | 27,856 | 0.13% |
| 김종철 | 590818 | 매부 | 47,745 | 0.23% |
| 김태훈 | 890920 | 조카 | 15,232 | 0.07% |
| 김아름 | 891125 | 질부 | 600 | 0.00% |
| 김태우 | 920223 | 조카 | 29,622 | 0.14% |
| 강동현 | 831103 | 조카 | 20,000 | 0.09% |
| 강현정 | 900220 | 조카 | 17,700 | 0.08% |
| 김경민 | 920617 | 조카 | 21,000 | 0.10% |
| 김주희 | 931110 | 조카 | 26,447 | 0.13% |
| 강재훈 | 171227 | 종손 | 776 | 0.00% |
| 김유경 | 740216 | 임원 | 1,661 | 0.01% |
| 곽의종 | 550302 | 임원 | 20,012 | 0.09% |
| 김민수 | 740517 | 임원 | 0 | 0.00% |
| 최대주주 등 소계 | 3,281,074 | 15.55% | ||
| 기타 | 17,821,903 | 84.45% | ||
| 발행주식총수 | 21,102,977 | 100.0% | ||
| (자료) | DART 전자공시시스템 |
당사의 최대주주는 대표이사 강창율이며, 증권신고서 제출일 전일 기준 2,271,523주(지분율 10.8%)를 보유하고 있으며, 특수관계인 합산시 3,281,074주(지분율 15.6%)를 보유하고 있습니다.
| [최대주주 등 예상 배정주식수] |
| (단위 : 주, 원, %) |
| 주주명 | 관계 | 현재 | 배정주식수 (주1) |
배정금액 (주2) |
|
|---|---|---|---|---|---|
| 보통주 | 지분율 | ||||
| 강창율 | 최대주주 본인 | 2,271,523 | 10.8% | 904,175 | 2,599,503,125 |
| 특수관계인 | 특수관계인 | 1,009,551 | 4.8% | 401,849 | 1,155,315,875 |
| 최대주주 등 소계 | 3,281,074 | 15.5% | 1,306,024 | 3,754,819,000 | |
| 발행주식총수 | 21,102,977 | 100.00% | 8,400,000 | 24,150,000,000 | |
| (주1) | 신주배정비율은 보통주 1주당 0.39804810주입니다. |
| (주2) | 배정금액은 예정 발행가액 기준입니다. |
당사 최대주주 및 특수관계인 등은 본 유상증자시 총 1,306,024주의 신주를 배정받을 예정이며, 예정발행가액 기준 총 배정금액은 약 38억원에 해당됩니다. 만일 최대주주 및 특수관계인 등이 자금 사정 등에 의해 금번 유상증자 청약시 배정분의 전량을 미참여하게 될 경우를 가정한다면 배정받게 될 1,306,024주(신주 발행주식수의 15.5%)가 실권 위험에 노출될 수 있습니다.
다만 예정 발행가액 기준 당사 최대주주 강창율 본인은 금액 기준으로 7억원 정도 청약에 참여할 계획을 가지고 있으며, 이는 현재 신주 배정분의 약 27% 정도에 해당합니다. 특수관계인들은 본인의 자금 사정 등을 고려하여 일부 가능한 범위 내에서 청약에 참여할 계획을 가지고 있었습니다.(주1)
| (주1) | 당사 최대주주 강창율은 예정 발행가액 기준으로 신주 배정분의 27% 가량 청약에 참여할 계획을 가지고 있었으며, 자기자금 7억원 등을 청약재원으로 활용할 계획입니다. |
당사 최대주주 및 특수관계인 등의 본 유상증자 청약 참여 여부는 향후 청약재원 마련에 실패하는 등 예상치 못한 상황에 따라 변동될 수는 있으나, 증권신고서 제출일 전일 기준 계획상으로는, 최대주주 등은 자기자금으로 대부분의 청약재원을 조달할 예정이며, 자금 사정상 청약하기 어려운 부분에 대한 신주인수권증서는 장내외 매각을 통해 현금화하여, 이를 청약재원으로 활용할 계획을 가지고 있습니다.
최대주주 강창율 본인의 신주 배정분의 27%에 해당하는 금액은 예정발행가액 기준으로 약 700백만원입니다. 최대주주는 보유 중인 자기자금 700백만원을 청약자금으로 사용할 계획이며, 발행가액 변동 등에 따라 추가로 필요한 금액에 대해서는 금번 유상증자에 참여하지 못하는 부분에 해당되는 신주인수권증서의 매각대금 등으로 충당할 계획을 가지고 있습니다. 작년에 이어 불가피하게 금번 유상증자를 재차 진행하는 상황이므로, 최대주주는 가능한 최대한의 범위에서 참여하고자 하며, 자기자금 및 신주인수권증서 일부 매각 대금을 활용하여, 신주 배정분의 27% 정도 청약할 예정입니다.
특수관계인들의 경우 각자의 자금 사정을 당사에서 실시간 확인하기는 용이하지 않으나, 보유 중인 자기자금 내지 미청약분에 대한 신주인수권증서 매각대금 등을 활용하여 가능한 범위 내에서 최대한 적극적으로 청약에 참여할 계획을 가지고 있습니다.
현재 기준으로 당사 최대주주는 금액 기준으로 7억원에 해당하는 수준인 신주 배정분의 약 27%를 청약에 참여할 예정이며, 그 외 특수관계인들 청약에 참여하지 않는다고 가정할 경우, 지분율 변동 시뮬레이션 결과는 다음과 같습니다.
|
[최대주주 등 지분율 변동 시뮬레이션] |
|
| (증권신고서 제출일 전일 기준) |
(단위: 주, %) |
| 주주명 | 관계 | 현재 | 배정주식수 | 배정금액 | 청약주식수 | 청약금액 | 증자 후 | ||
|---|---|---|---|---|---|---|---|---|---|
| 보통주 | 지분율 | 보통주 | 지분율 | ||||||
| 강창율 | 최대주주 본인 | 2,271,523 | 10.76% | 904,175 | 2,599,503,125 | 243,478 | 699,999,250 | 2,515,001 | 8.52% |
| 특수관계인 | 특수관계인 | 1,009,551 | 4.78% | 401,849 | 1,155,315,875 | 0 | 0 | 1,009,551 | 3.42% |
| 최대주주 등 소계 | 3,281,074 | 15.55% | 1,306,024 | 3,754,819,000 | 243,478 | 699,999,250 | 3,524,552 | 11.95% | |
| 발행주식총수 | 21,102,977 | 100.00% | 8,400,000 | 24,150,000,000 | 29,502,977 | 100.00% | |||
| (주1) | 신주배정비율은 보통주 1주당 0.39804810주입니다. |
| (주2) | 배정금액 및 청약금액은 예정발행가액 기준입니다. |
| (주3) | 최대주주의 청약주식수는 배정주식수의 27%를 가정하였습니다. 특수관계인은 청약에 참여하지 않는다고 가정하였습니다. |
| (주4) | 주식매수선택권으로 인한 지분 변동은 고려하지 않은 수치입니다. |
당사 최대주주가 배정분의 27%를 청약한다고 가정했을 때, 유상증자 완료 후 최대주주 등의 보통주 지분율은 현재 15.6%에서 12%까지 감소할 예정입니다. 한편 그 외, 잔존하고 있는 주식매수선택권이 향후에 전량 행사될 경우에는 최대주주 등의 보통주 지분율은 추가로 변동될 수 있습니다.
| [주식매수선택권 내역] | |
| (증권신고서 제출일 전일 기준) | (단위 : 원, %) |
| 구 분 | 부여일 | 의무복무기간 | 행사가능기간 | 현재 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|
| 보유수량 | 행사가격 | 조정 후 행사가능수량 | 조정 후 행사가격 | ||||
| 1 | 2020-02-25 | 3년 | 행사시작일로부터 5년('23.2.26~'28.2.25) | 54,975 | 12,441 | 70,385 | 9,717 |
| 2 | 2020-08-12 | 3년 | 행사시작일로부터 5년('23.8.13~'28.8.12) | 21,240 | 17,606 | 27,883 | 13,411 |
| 3 | 2021-02-24 | 3년 | 행사시작일로부터 5년('24.02.25~'29.02.24) | 17,636 | 19,665 | 23,299 | 14,884 |
| 4 | 2021-06-11 | 3년 | 행사시작일로부터 5년('24.06.12~'29.06.11) | 6,260 | 51,314 | 8,560 | 37,522 |
| 5 | 2021-10-22 | 2년 ~ 5년 | 행사시작일로부터 5년('23.10.23~'28.10.22) | 35,161 | 41,769 | 47,845 | 30,695 |
| 6 | 2022-02-23 | 2년 ~ 5년 | 행사시작일로부터 5년('24.02.24~'29.02.23) | 23,368 | 18,943 | 30,807 | 14,368 |
| 7 | 2022-05-20 | 2년 ~ 5년 | 행사시작일로부터 5년('24.05.21~'29.05.20) | 5,538 | 12,995 | 7,116 | 10,113 |
| 8 | 2023-02-23 | 2년 ~ 5년 | 행사시작일로부터 5년('25.02.24~'30.02.23) | 8,150 | 7,765 | 9,931 | 6,372 |
| 9 | 2024-03-07 | 2년 ~ 5년 | 행사시작일로부터 5년('26.03.08~'31.03.07) | 79,434 | 3,874 | 85,728 | 3,589 |
| 10 | 2024-03-28 | 2년 ~ 5년 | 행사시작일로부터 5년('26.03.29~'31.03.28) | 8,776 | 3,751 | 9,402 | 3,501 |
| 계 | 260,538 | 320,956 | |||||
| (자료) | 공시자료 및 당사제시자료 |
| (주1) | 본 유상증자 완료시, 본 유상증자로 인한 지분 희석 방지 조항에 따라 주식매수선택권의 행사가격 및 행사수량이 조정될 예정입니다. 상기 조정 후 행사가능수량과 조정 후 행사가격은 예정발행가액을 기준으로 산출하였습니다. |
| (주2) | 5번부터 10번의 의무복무기간은 복무 2년 후부터 매년마다 25%씩 행사가능수량이 증가하는 구조입니다. |
현재 부여된 주식선택권의 수량은 260,538주이나, 본 유상증자 완료시, 본 유상증자로 인한 지분 희석 방지 조항에 따라 행사가액이 하향조정되고, 행사가능수량이 상향조정될 예정입니다. (주1)
| (주1) 주식매수선택권 행사가격 및 행사수량 조정 사항 |
|---|
| 행사가격보다 낮은 발행가액으로 유상증자가 행하여지는 경우 : 조정후 행사가격 = {(유상증자 직전 발행주식총수 x 조정 전 행사가격) + (유상증자 발행주식수 x 유상증자 주당발행가액)} / (유상증자 직전 발행주식수 + 유상증자 발행주식수) |
| 조정 후 행사수량 = (조정 전 행사수량 x 조정 전 행사가격) /조정 후 행사 가격 |
| (자료) 당사 제시자료 |
따라서 본 유상증자에 최대주주 본인이 배정분의 27%를 참여하고, 특수관계인들은 청약에 참여하지 않는다고 가정했을 때, 이후 주식매수선택의 행사가액 조정 및 전량 행사되었을 경우를 감안한 지분율 변동 시뮬레이션 결과는 다음과 같습니다.
|
[최대주주 등 지분율 변동 시뮬레이션] |
|
| (증권신고서 제출일 전일 기준) |
(단위: 주, %) |
| 주주명 | 관계 | 현재 | 증자 후 | 추가 발행가능주식수 | 잠재주식 전환 및 행사 후 | |||
|---|---|---|---|---|---|---|---|---|
| 보통주 | 지분율 | 보통주 | 지분율 | 주식매수선택권 행사 | 보통주 | 지분율 | ||
| 강창율 | 최대주주 본인 | 2,271,523 | 10.76% | 2,524,687 | 8.56% | 0 | 2,515,001 | 8.43% |
| 특수관계인 | 특수관계인 | 1,009,551 | 4.78% | 1,009,551 | 3.42% | 167,142 | 1,176,693 | 3.95% |
| 최대주주 등 소계 | 3,281,074 | 15.55% | 3,534,238 | 11.98% | 0 | 3,524,552 | 11.82% | |
| 주식매수선택권 보유자 | - | - | - | - | 153,814 | 153,814 | 0.52% | |
| 발행주식총수 | 21,102,977 | 100.00% | 29,502,977 | 100.00% | 320,956 | 29,823,933 | 100.00% | |
| (자료) | 공시자료 및 당사제시자료 |
| (주1) | 최대주주의 청약주식수는 배정주식수의 27%를 가정하였습니다. 특수관계인은 청약에 참여하지 않는다고 가정하였습니다. |
| (주2) | 본 유상증자 완료시, 본 유상증자로 인한 지분 희석 방지 조항에 따라 주식매수선택권의 행사가격 및 행사수량이 조정될 예정입니다. 상기 조정 후 행사가능수량과 조정 후 행사가격은 예정발행가액을 기준으로 산출하였습니다. |
주식매수선택권의 행사 여부는 주가와 행사가액의 실시간 괴리율에 따라 행사 가능성이 달라집니다. 주식매수선택권은 임직원을 대상으로 발행되었으며, 의무복무기간 등 가득조건이 서로 상이하므로, 일시에 모든 물량이 행사될 가능성은 높지 않을 것으로 예상하고 있습니다.
이처럼 당사 최대주주 본인이 배정분의 27%(예정발행가액 기준 7억원 금액 한도)에 대해 청약에 참여하고 특수관계인들은 청약에 참여하지 않는다고 가정한다면 최대주주 등의 지분율은 본 유상증자 후 지분율이 11.8% 수준까지 희석될 수 있으며, 이는 경영권을 안정적으로 유지하기에는 부족한 수준의 지분율로서, 적대적 M&A 등에 의한 경영권 변경 위험을 배제할 수 없습니다. 또한 최대주주 등이 예상치 못한 사유 등으로 인해 청약에 필요한 자금을 마련하지 못할 경우, 청약 계획에 변동이 생겨, 지분이 추가 희석될 수 있는 위험성을 배제할 수 없습니다. 또한 당사는 지속적으로 자본시장에서의 자금 조달에 의존하고 있는 만큼 향후 추가적인 유상증자, 주식관련사채 등의 발행에 따라 최대주주 및 특수관계인 등의 지분율이 추가로 희석될 가능성 또한 존재하며, 또는 최대주주 및 특수관계인 등의 지분율 추가 희석을 우려하여, 자본시장에서 자금 조달을 진행하는데 어려움이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[자. 정부 연구개발 과제 수행 관련 위험] 당사는 설립 이래 총 10건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하였으며, 현재 진행중인 정부 과제에 대해서도 연구 목적 및 내용 달성을 위해 성실히 수행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔으며, 기술실시 권리를 가진 기술소유권자로서 해당 기술의 사업화를 위해 노력해왔습니다. 따라서 당사는 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
|
당사는 설립 이래 총 10건의 정부과제를 주관기관 또는 참여기관으로서 성공적으로 수행하여 총 294억원의 정부보조금을 수령하였으며, 현재 진행중인 정부 과제에 대해서도 연구 목적 및 내용 달성을 위해 성실히 수행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔습니다. 또한, 지속적이고 책임감있는 연구개발을 위해 협약된 사업의 종료 후 정부납부기술료를 납부하거나 청년고용을 통한 기술료 감면 혜택을 받아 기술실시 권리를 온전히 확보하고 있으며, 기술소유권자로서 해당 기술의 사업화를 위해 적극적으로 노력해왔습니다. 현재 진행중인 정부과제 또한, 협약 종료 후 제품화 및 기술이전 등 관련 매출의 발생 시 일정금액의 정부납부기술료를 제외한 금액이 당사의 이익으로 연결되는 만큼 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
| [설립 이후 당사가 수행한 정부 연구개발과제 현황] |
| (단위: 백만원) |
| 순번 | 주관부처 | 계약상대방 | 계약일 | 계약명칭 | 관련 파이프라인 | 계약기간 | 정부보조금 | 성과 | 비고 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 과학기술정보통신부 | 한국연구재단 | 2016.11.01 | 신규 융합형 암항원의 개발과 항원제시세포 기반 면역치료백신에의 적용 | BVAC-M | 2016.11.01 ~ 2021.12.31 | 1,605 (총 사업비 : 약 21.4억원) |
참여기관 | 종료 |
| 2 | 산업통상자원부 | 한국산업기술진흥원 | 2017.04.01 | 난치성암 치료용 B세포 및 단구 기반 면역치료백신 CeliVax의 사업화를 위한 비임상 및 임상개발 | BVAC-B BVAC-P |
2017.04.01 ~ 2018.12.31 | 1,258 (총 사업비 : 약 21억원) |
주관기관 | 종료 |
| 3 | 보건복지부 | 한국보건산업진흥원 | 2018.04.30 | 항원제시세포를 기반으로 한 자궁경부암 항암면역치료백신의 임상 2상 개발 | BVAC-C | 2018.04.30 ~ 2021.12.31 | 2,993 (총 사업비 : 약 40.6억원) |
주관기관 | 종료 |
| 4 | 과학기술정보통신부 | 한국연구재단 | 2020.07.01 | 아데노바이러스 벡터에 기반한 1세대 및 2세대 코비드-19 예방백신 개발 | AdCLD-CoV19 | 2020.07.01 ~ 2022.12.31 | 3,700 (총 사업비 : 약 49억원) |
주관기관 | 종료 |
| 5 | 보건복지부 | 범부처신약개발사업단 | 2021.02.01 | 아데노바이러스 벡터를 기반으로 한 코로나19 예방백신의 임상 1/2a상 개발 | AdCLD-CoV19 | 2021.02.01 ~ 2022.01.31 | 6,323 (총 사업비 : 약 84억원) |
주관기관 | 종료 |
| 6 | 보건복지부 | 한국보건산업진흥원 | 2021.10.18 | AdCLD-CoV19-1 코로나19 예방백신의 원료인 마스터 및 제조용 바이러스 은행 생산을 위한 부유세포 생산공정 장비 구축 | AdCLD-CoV19-1 | 2021.10.18 ~ 2023.07.31 | 250 (총 사업비 : 약 7.2억원) |
주관기관 | 종료 |
| 7 | 보건복지부 | 코로나19 치료제·백신 신약개발사업단 | 2022.03.14 | 아데노바이러스 벡터를 기반으로 한 코로나19 예방백신의 임상 2b/3상 개발 | AdCLD-CoV19 AdCLD-CoV19-1 |
2022.03.14 ~ 2022.12.09 | 2,962 (총 사업비 : 약 39.5억원) |
주관기관 | 종료 |
| 8 | 보건복지부 | 코로나19 치료제·백신 신약개발사업단 | 2022.07.22 | 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이 대응 백신의 임상 1/2상 개발 | AdCLD-CoV19-1 OMI |
2022.07.22 ~ 2023.07.21 | 8,309 (총 사업비 : 약 110.8억원) |
주관기관 | 종료 |
| 9 | 보건복지부 | 글로벌백신기술선도사업단 | 2023.04.01 | 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이에 대한 다가 백신 개발(주1) | 다가백신 | 2023.04.01 ~ 2024.06.30 | 1,017 (총 사업비 : 약 13.5억원) |
주관기관 | 종료 |
| 10 | 서울특별시 | 서울경제진흥원 | 2024.06.20 | 국산 기술로 개발된 국내 최초 코로나19 오미크론 변이 대응 부스터샷 백신의 품질 및 특성분석 | AdCLD-CoV19-1 OMI | '2024.08.01 ~ '2026.07.31 |
1.3억 원 (총 사업비 : 약 5.3억원) |
주관기관 | 진행중 |
|
주1) |
2024년 3월 15일 정부R&D예산 축소로 인한 사업비 규모 및 연구기간이 변경되었습니다. |
| 주2) | 당사가 주관 또는 참여기업으로서 진행된 정부과제는 정부보조금 수령시 계약기관에서 지정한 정부납부기술료를 지급함으로써 그 기술소유권자를 당사로 귀속시키게 되어있어, 매출발생시 당사매출로 인식됩니다. |
당사는 정부 차원에서 신약 연구개발의 중요성을 감안하여, 다양한 정부과제를 통해 연구개발비 지원을 지속적으로 확대하고 있으므로, 당사는 이에 적극적으로 참여함으로써 향후 신규 사업의 추진에 있어서 객관적인 평가와 공신력을 획득하고 정부의 연구개발 진도 관리에 따라 과제의 성공 가능성을 높일 계획입니다.
한편, 정부보조금의 반환 조건은 연구개발 과제의 수행계획에 따라 집행한 예산의 잔액과 연구과제 회계감사에 따른 불인정 금액 및 최종 평가시 실패 과제, 국가연구개발혁신법 제32조(부정행위 등에 대한 제재 처분)에 해당하는 경우 반환을 하게 되며, 연구과제 회계감사와 과제 종료 후 3개월 이내 사용실적 보고서 제출 후 반환 여부가 결정됩니다. 다만, 현재까지 당사는 연구개발 과제에 대해 성실하게 수행해 왔으며, 상기 사유로 인해 정부보조금을 반환한 적은 없습니다.
당사가 참여한 상기 도표상 1번 내지 8번까지의 연구개발과제는 모두 종료되었으며, 현재 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이에 대한 다가 백신 개발 과제는 진행 중입니다. 당사는 연구개발 과제를 충실히 수행하고자 배정된 예산을 연구 과제의 목적에 부합하게 집행하였으며 잔여 예산은 없습니다. 당사는 이와 관련하여 추후 정부보조금 반환 사유에 해당될 가능성은 제한적일 것으로 예상하고 있습니다.
하지만 향후 당사의 신약개발 파이프라인에 대한 국책과제 추가 선정의 불확실성, 현재 진행중인 과제의 실패에 따른 과제 참여의 제한, 정부의 정책 변화에 따른 국고보조금의 감소 등은 지속적으로 자금이 투입되어야 하는 당사의 연구개발활동에 부정적인 영향을 미칠 수 있습니다. 특히, 현행 제도 상 정부 출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제 받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제제 조치가 가해질 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [차. 내부회계관리제도 및 내부통제 관련 위험] 당사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 검토한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 코스닥 상장법인으로「주식회사 등의 외부감사에 관한 법률」(이하 '외감법')에 따라 신뢰할 수 있는 회계정보의 작성과 공시를 위해 내부회계관리규정 및 내부회계관리제도를 갖추고 있어야 합니다. 또한, 외부감사인은 당사의 내부회계관리제도 운영실태를 검토를 진행하여야 하며, 해당 결과는 감사보고서에 표명하도록 되어 있습니다. 최근 사업연도 기준 당사 외부감사인의 내부회계관리제도 검토 의견은 아래와 같습니다.
| [내부회계관리제도 검토의견] |
| 사업연도 | 감사인 | 감사의견 및 검토 의견 | 지적사항 |
|---|---|---|---|
| 제19기 (2024년) |
삼정회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 "중소기업에 대한 적용"의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제18기 (2023년) |
삼정회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 "중소기업에 대한 적용"의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제17기 (2022년) |
삼정회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 "중소기업에 대한 적용"의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 자료 : 당사 감사보고서 |
당사는 내부회계관리제도 규정을 제정하여 2017년 09월 26일 이사회 보고를 완료하였습니다. 당사는 재무활동 건전성 및 타당성을 검토하고 내부회계관리제도 운영실태를 평가하며, 현 내부회계관리제도를 철저히 운영하여 외부감사인의 내부회계관리제도에 대한 의견을 받고 있습니다.
다만, 내부회계관리를 철저히 운영함에도 불구하고 회계처리 위반, 혹은 관련 임직원의 배임 및 횡령 등 발생으로 내부회계관리가 적절하게 운영되지 않을 경우 과태료 등의 법적 제재가 부과될 수 있습니다. 과태료 부과 시 법정최고금액에 과태료 예정금액 산정표에 따른 비율을 적용하여 예정금액을 산정하고, 가증, 감경하여 최종 과태료부과금액을 결정하고 있습니다.
특히, 이사 등 내부회계관리제도 운영 관련자가 회계정보를 내부회계관리제도에 의하지 아니하고 위조, 변조, 훼손 또는 파기한 사실이 확인되는 경우, 5년 이하의 징역 또는 5천만원 이하의 벌금이 부과될 수 있습니다.
또한, 코스닥시장 상장규정에 따라 내부회계관리제도 비적정 시 투자주의환기종목에 지정될 수 있으며(「코스닥시장 상장규정」제52조), 2년 연속 내부회계관리제도 비적정 의견을 받는 경우 상장적격성 실질심사에 따른 상장폐지 요건에 해당할 수 있습니다(「코스닥시장 상장규정」제56조).
종합적으로 당사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 검토한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [카. 특수관계자 거래 관련 위험] 당사는 특수관계자와의 거래시 이사회 운영 규정 제10조에 따라 사전에 이사회 결의를 거쳐야 하며, 내부회계 관리 규정 등 당사 내부통제기준에 따라 거래 투명성을 확보하는 등 절차를 준수하고 있습니다. 향후에도 특수관계자와의 거래가 발생하게 될 경우 특수관계자에 대한 부당한 이익 제공 등에 해당하지 않는 범위에서 거래가 진행되도록 사전에 내부 규정에 따른 관련 절차를 준수할 예정입니다. 만일 특수관계자와의 거래 조건 등이 제3자와의 거래와 비교하여 적정성이 유지되지 않을 경우 이는 주주의 이익을 침해하는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
최근 3개년간 당사와 거래 또는 채권/채무 잔액이 있는 특수관계자 및 주요 거래 내용은 다음과 같습니다.
| 구 분 | 내용 |
| 유의적인 영향력을 행사하는 개인 | 대표이사 |
| [특수관계자와의 주요 거래 내용] |
| 구 분 | 내용 | 2024년 | 2023년 | 2022년 |
|---|---|---|---|---|
| 대표이사 | 단기급여 | 371 | 350 | 302 |
| 퇴직급여 | 117 | 89 | 80 |
| (자료) | 당사 각 사업연도 감사보고서 및 정기보고서 |
한편, 당사가 2024년 1분기 중 지분 100%를 취득하고 2024년 5월 21일 흡수 합병 완료한 (주)포베이커의 경우, 해당 법인은 과거 비상장법인이며 비외감법인이었던 관계로 지분 취득 전 과거 3개년치의 특수관계자간의 거래 내용은 입수하지 못하였습니다.
다만, 당사는 (주)포베이커 지분 취득 당시 오성회계법인을 통해서 취득 시점의 재무상태에 대하여 실사를 수행하였으며, 실사 결과 (주)포베이커는 (주)포베이커 (전)대표이사 김철용을 대상으로 10백만원의 단기대여금이 잔존하고 있는 것으로 확인하였고, 그 외에는 특수관계자와의 채권/채무 잔존금액은 없는 것으로 확인하였습니다. 해당 채권은 아직 회수되지 못한 상황이며, (주)포베이커는 당사에서 흡수합병 완료하였으므로, 그 후 당사가 상장법인으로서 준수하고 있는 특수관계자 거래 관련 사내 규정을 준수하게 됩니다. 해당 단기대여금은 법인세법 시행규칙에 따라 연 4.6%의 당좌대출이자율을 적용하여 2024년말 기준 인정이자 435,265원이 존재합니다. 당사는 단기대여금과 인정이자 회수를 위해 서면, 이메일 등의 고지 방법으로 지속적인 회수 요청을 하였으나, (주)포베이커 전 대표이사 개인의 자금 여건으로 단기대여금 회수의 시기는 불투명한 상황이며, 조속히 상환을 받기 위해 노력하고 있습니다.
당사는 특수관계자와의 거래시 이사회 운영 규정 제10조에 따라 사전에 이사회 결의를 거쳐야 하며, 내부회계 관리 규정 등 당사 내부통제기준에 따라 거래 투명성을 확보하는 등 절차를 준수하고 있습니다. 향후에도 특수관계자와의 거래가 발생하게 될 경우 특수관계자에 대한 부당한 이익 제공 등에 해당하지 않는 범위에서 거래가 진행되도록 사전에 내부 규정에 따른 관련 절차를 준수할 예정입니다. 만일 특수관계자와의 거래 조건 등이 제3자와의 거래와 비교하여 적정성이 유지되지 않을 경우 이는 주주의 이익을 침해하는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
3. 기타위험
| [가. 금융감독기관의 관리감독기준 강화에 따른 위험] 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 투자주의환기종목 지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. 또한 2024년 2월 27일, 금융감독원은 기업공개(IPO), 유상증자 주관 업무 관련하여 16개 증권사와 간담회를 갖고 주관 업무 관련 불공정거래 및 위규 행위에 대해 엄정하게 대응하겠다고 밝혔습니다. 주주권익 훼손 우려가 있는 유상증자에 대해서는 증권신고서가 주주와의 공식적 소통 창구가 될 수 있도록 심사 절차 및 기준을 정비하고 이를 공개하였습니다. 특히, △ 주주 가치 희석화, △ 일반주주 권익 훼손 우려, △ 주관사의 의무 소홀 등 7개 사유 중 하나에 해당하는 경우 '중점심사 유상증자' 대상으로 선정해 유상증자의 당위성, 의사결정 과정, 이사회 논의 내용, 주주 소통계획 등 기재 사항을 집중심사한다고 밝혔습니다. 이처럼 당사가 중점심사 대상 기준에 부합하여 본 공모 유상증자가 진행될 경우, 중점 심사항목 위주로 1주일 이내 집중심사를 진행하고 최소 1회 이상의 대면협의를 진행하게 됩니다. 이에 따라 기존 예상보다 일정이 빨라지거나 지연될 수 있으며, 중점심사 유상증자에 해당된 사유가 충실히 기재 및 설명이 되지 않을 경우 예상보다 일정이 지연될 가능성이 커질 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다. |
최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 투자주의환기종목 지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다.
| (주1) | (본 증권신고서 "제1부.III.투자위험요소-2.회사위험 - 다" 부분을 참고하여 주시기 바랍니다). |
특히, "코스닥시장 상장규정 제28조(관리종목), 코스닥시장 상장규정 제38조(상장의 폐지) 및 코스닥시장 상장규정 제38조의2(실질심사위원회의 심사 등"에 유의하시기 바랍니다. 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
또한 2025년 2월 27일, 금융감독원은 기업공개(IPO), 유상증자 주관 업무 관련하여 16개 증권사와 간담회를 갖고 주관 업무 관련 불공정거래 및 위규 행위에 대해 엄정하게 대응하겠다고 밝혔습니다. 주주권익 훼손 우려가 있는 유상증자에 대해서는 증권신고서가 주주와의 공식적 소통 창구가 될 수 있도록 심사 절차 및 기준을 정비하고 이를 공개하였습니다. 특히, △ 주주 가치 희석화, △ 일반주주 권익 훼손 우려, △ 주관사의 의무 소홀 등 7개 사유 중 하나에 해당하는 경우 '중점심사 유상증자' 대상으로 선정해 유상증자의 당위성, 의사결정 과정, 이사회 논의 내용, 주주 소통계획 등 기재 사항을 집중심사한다고 밝혔습니다.
| [유상증자 증권신고서 심사 방향 및 개선 방안] |
 |
|
유상증자 증권신고서 심사 방향 |
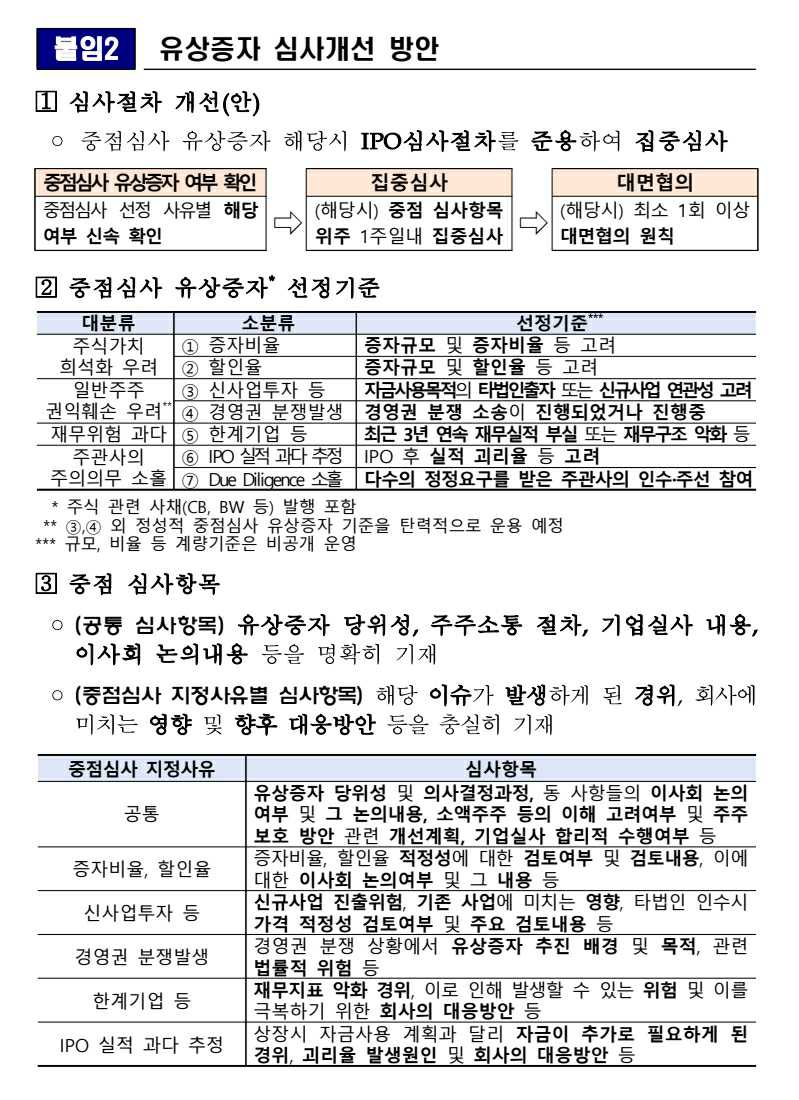 |
|
붙임2) 유상증자 심사개선 방안 |
| 자료 : IPO/유상증자 증권신고서 심사 관련 주관사 간담회, 금융감독원(2025.02) |
증권신고서 제출일 현재 당사는 중점심사 대상에 지정됐는지 그 여부를 알 수 없으나, 중점심사 대상 선정을 가정한 주요 심사항목에 대한 내용은 다음과 같습니다.
(공통) 당사의 본 공모 유상증자 추진 목적은 AdCLD-CoV19-1 OMI 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금의 조달입니다. 당사는 2023년 5월 23일 식품의약품안전처에 오미크론 전용 코로나19 백신 'AdCLD-CoV19-1 OMI'의 임상 3상 시험계획(IND)를 제출하였으며, 2023년 7월 21일에 'AdCLD-CoV19-1 OMI' 임상 3상 승인을 획득하였습니다. 이후 2024년 11월 12일 진행중이던 AdCLD-CoV19-1 OMI의 임상 3상시험 대상자(4,000명)에게 투여 완료하였으며, 식약처에 안전성 및 면역원성 중간 분석 결과를 종합하여 AdCLD-CoV19-1 OMI의 조건부 품목허가를 신청할 계획입니다. 임상 3상에서 확보한 결과를 기반으로 조건부 품목허가를 받고, 신규 변이에 대응한 백신은 정부로부터 긴급사용승인을 받은 후 수의 계약 혹은 입찰 형태 계약으로 참여하여 확정이 된다면 정부 조달 시장에 공급이 가능할 것으로 예상하고 있습니다. 이에 해당 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 등 필요한 추가 자본을 조달하고 있는 상황입니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-Ⅴ.자금사용목적." 부분에 본 공모 유상증자 자금조달 상세 목적 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
반복되는 자금조달로 인해 주주들의 희석화 우려 및 앞으로의 회사 발전 방향 등 시장에서 야기되는 문제들에 대해 당사는 증권신고서 제출 전일에 주주서한을 홈페이지에 게시하여 금번 공모 유상증자와 관련된 주요 일정, 세부 사항, 목적 및 필요성을 투명하게 제공하였습니다. 또한, 이를 본 유상증자 투자설명서 발송 시 주주 서한 형태의 안내문을 통해 개별적으로 고지할 예정입니다.
| [주주서한] |
 |
|
주주서한 |
| 자료 : 당사 홈페이지 |
또한 더 면밀하고 상세한 기업실사를 위해 단순히 대표주관사에게만 기업실사를 의존하는게 아니라 회계법인을 선임하여 실사에 대한 용역 계약을 맺고 주관사, 회계법인 투트랙의 기업 실사를 진행하였습니다. 게다가 이사회에서도 단순히 본 유상증자에 정량적 조건에 따른 결의만 진행한 게 아니라, 유상증자의 당위성 및 주주소통 절차 등 주주 보호를 위해 정성적 기준으로 본 유상증자에 대한 목적 및 필요성 등을 논의하였으며, 이러한 조치를 통해 당사는 유상증자 절차의 투명성을 확보하고, 주주의 신뢰를 제고하는 데 최선을 다하기 위해 노력하고 있습니다.
| [이사회의사록_발췌] |
 |
|
이사회의사록_발췌 |
| 자료 : 당사 제시 |
(증자비율, 할인율 등) 본 공모 유상증자의 증자비율은 39.80%이며, 할인율은 25%입니다. 최근 4개년 공모 유상증자 증자비율 및 할인율 추이를 살펴보면 본 공모처럼 주주배정 후 실권주 일반공모의 경우, 2021년 증자비율 42%, 할인율 22%, 2022년 증자비율 36%, 할인율 22%, 2023년 증자비율 41%, 할인율 23%, 2024년 증자비율 47%, 할인율 24% 입니다. 이는 본 공모 유상증자의 증자비율은 최근 4개년 데이터에 비해 다소 낮은 편이며, 할인율은 유사한 수준으로 판단됩니다.
| [최근 4개년 공모 유상증자 증자비율 및 할인율] |
| 구분 | 2021년 | 2022년 | 2023년 | 2024년 | ||||
|---|---|---|---|---|---|---|---|---|
| 증자비율 | 할인율 | 증자비율 | 할인율 | 증자비율 | 할인율 | 증자비율 | 할인율 | |
| 일반공모 | 107.89% | 12.22% | 39.26% | 30.00% | 18.98% | 15.00% | 59.34% | 26.25% |
| 주주배정 | 1.79% | 45.00% | 33.30% | 16.67% | 127.09% | 20.83% | 45.32% | 17.50% |
| 주주우선공모 | 118.27% | 27.50% | 69.26% | 28.50% | 76.95% | 28.75% | 92.26% | 27.50% |
| 주주배정 후 실권주 일반공모 | 42.11% | 21.99% | 36.17% | 22.08% | 40.85% | 23.09% | 47.13% | 23.94% |
| 평균 | 52.43% | 60.85% | 38.69% | 37.93% | 51.50% | 22.97% | 50.96% | 24.12% |
| 자료 : Dart 전자공시시스템 |
| 주) 최초 증권신고서 제출일 기준으로 해당 사업연도 산정 |
(신사업투자 등) 당사는 안정적인 매출을 확보할 수 있는 사업부문의 다각화가 필요했으며, 이에 2024년 3월 7일 베이커리류 및 온라인 식품 유통판매업을 영위하고 있는 (주)포베이커의 주식 1백만주(지분율 100%)를 취득하여 지배력을 획득하였으며, 취득 직후 (주)포베이커를 피합병회사로 하여, 2024년 5월 14일을 합병기일, 2024년 5월 21일 합병등기 신청을 함으로써, 흡수합병을 완료하였습니다.
그럼에도 불구하고 (주)포베이커를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)포베이커 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가. 및 2.회사위험-나." 부분에 (주)포베이커 취득 및 흡수합병 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
(경영권 분쟁발생) 당사는 현재까지 경영권 관련 분쟁이 발생한 적이 없으나, 증권신고서 제출일 전일 기준 현재 최대주주의 지분율 10.8%, 특수관계인 포함시 15.6%로 다소 낮은 편이며, 최대주주 등이 청약에 100% 참여하지 못할 경우 지분율은 더욱 희석될 예정입니다. 이와 관련하여 추후 경영권 분쟁이 발생할 수도 있는 점, 투자자께서는 유의하시기 바랍니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-아." 부분에 지분율 희석에 따른 경영권 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
(한계기업 등)당사는 매출이 부진한 가운데, 지속적으로 신약후보물질의 발굴과 보유 파이프라인의 적응증 증가를 위하여 다양한 비임상 및 임상시험을 준비하고 있으며 이에 따라 관련비용의 지출이 꾸준히 발생하여 2022년 영업손실 149.1억원, 2023년 영업손실 122억원, 2024년 영업손실 119.8억원이 발생하였습니다. 또한 영업 외적 측면에서도, 금융비용 등의 발생 영향으로 인해 2022년 당기순손실 228.7억원, 2023년 당기순손실 116.1억원, 2024년 당기순손실 122.6억원이 발생하는 등 지속적인 적자 구조를 면하지 못하고 있습니다. 따라서 당사의 파이프라인에서 임상 성공을 통한 기술이전, 상품화 성공 등의 성과를 이루어내지 못한다면 당사의 적자 구조를 개선하는 것은 불가능할 수 있으며, 자본력이 지속적으로 감소하여 지속적인 연구개발비용 등의 지출이 필요한 당사의 영업활동을 영위하는데 상당한 제약이 생길 수 있습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 매출 부진 및 지속적 손실 발생 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이에 따라 당사는 지속적인 영업손실과 당기순손실 발생 및 부의 영업현금흐름 발생, 이에 따른 결손금 누적과 재무상태 악화로 인하여 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 존재하는 상황입니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-나." 부분에 계속기업 가정의 불확실성 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
또한 당사가 상장적격성 실질심사 대상이 될 가능성도 존재하며, 코스닥시장에서의 주식 거래는 장기간 정지될 수 있고, 실질심사 과정에서 상장폐지까지 이어질 위험성이 존재합니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-다. 및 2.회사위험-다-2." 부분에 관리종목 및 환기종목 지정 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이외에도 당사는 현금흐름 악화에 따른 유동성 위험, 신사옥 준공에 따른 우발채무 등의 위험, AdCLD-CoV19-1 OMI 백신 개발비의 무형자산화에 따른 손상 가능성 위험 등이 상존하는 상황이오니, 투자자 여러분께서는 이 점 유의하시기 바랍니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-라., 2.회사위험-마. 및 2.회사위험-바." 부분에 현금흐름 악화 위험, 우발채무 등의 위험 및 개발비 등의 손상차손 인식 위험 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
(IPO 실적 과다 추정 등) 당사는 2019년 코스닥시장 IPO 당시 항암면역치료제를 개발하는 기업으로서 다양한 BVAC 파이프라인 연구개발을 진행해 왔습니다. 그러나, 2020년 3월 세계보건기구(WHO)의 코로나19 팬데믹 선언 후 사회적 거리두기 4단계 시행으로 방역조치가 강화됨에 따라 항암면역치료제 BVAC 파이프라인 연구개발에 필요한 임상시험 대상자의 모집, 방문 일정 수립 등 임상시험 진행이 원활하게 수행되지 못하였고, IPO 당시 목표했던 실적을 달성하지 못하였습니다. (주1)
| (주1) | 본 증권신고서 "제1부-I-III.투자위험요소-2.회사위험-가." 부분에 파이프라인별 매출 지연 사유 관련하여 상세 내용이 기재되어 있습니다. 해당 부분을 참고하여 주시기 바랍니다. |
이처럼 당사가 중점심사 대상 기준에 부합하여 본 공모 유상증자가 진행될 경우, 중점 심사항목 위주로 1주일 이내 집중심사를 진행하고 최소 1회 이상의 대면협의를 진행하게 됩니다. 이에 따라 기존 예상보다 일정이 빨라지거나 지연될 수 있으며, 중점심사 유상증자에 해당된 사유가 충실히 기재 및 설명이 되지 않을 경우 예상보다 일정이 지연될 가능성이 커질 수 있습니다. 투자자 여러분께서는 이 점 유의하시기 바랍니다.
| [나. 인수인의 실권주 인수분 물량 출회에 따른 주가하락 위험] 실권주를 인수한 대표주관회사 또는 인수회사가 수익 확정을 위해 인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 각 사에서 인수한 실권주를 일정 기간 보유하더라도, 동 인수물량이 잠재 매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사 및 인수회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 15.0% ~ 20.0%를 추가수수료로 지급하게 되며, 이를 고려시 대표주관회사 및 인수회사의 실권주 매입단가는 청약자들보다 15.0% ~ 20.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 금번 유상증자를 주주배정후 실권주 일반공모 방식으로 진행하고 있으며, 구주주 청약 및 일반공모 청약 이후 발생한 최종 실권주는 대표주관회사인 엘에스증권(주)와 한양증권(주)에서 각자의 인수비율에 따라 자기계산으로 인수하게 됩니다.
| [대표주관회사 및 인수회사의 인수조건] |
| 구 분 | 인 수 인 | 인수주식의 종류 및 수 | 수수료 |
|---|---|---|---|
| 대표주관회사 | 엘에스증권(주) | 종류: 기명식 보통주식 수: 최종 실권주의 60% |
기본인수수수료: 최종모집금액의 1.8% * 60% 실권수수료: 잔액인수금액 * 실권수수료율 ※ 총 실권금액이 30억원 이하일 경우 15%, 30억원 초과 50억원 이하일 경우 18%, 50억원 초과할 경우 20% |
| 인수회사 | 한양증권(주) | 종류: 기명식 보통주식 수: 최종 실권주의 40% |
기본인수수수료: 최종모집금액의 1.8% * 40% 실권수수료: 잔액인수금액의 18.0% ※ 총 실권금액이 30억원 이하일 경우 15%, 30억원 초과 50억원 이하일 경우 18%, 50억원 초과할 경우 20% |
만일 구주주 청약 및 일반공모 청약 이후 최종 실권주가 발생할 경우에는 대표주관회사인 엘에스증권(주)와 인수회사 한양증권(주)에서 각자의 인수비율에 따라 자기계산으로 인수하게 되며, 당사는 각 증권사에게 인수의무비율에 따른 잔액인수금액의 15.0% ~ 20.0%를 실권수수료로 지급하게 됩니다.
따라서 실권주를 인수한 대표주관회사 또는 인수회사가 수익 확정을 위해 인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 각 사에서 인수한 실권주를 일정 기간 보유하더라도, 동 인수물량이 잠재 매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사 및 인수회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 15.0% ~ 20.0%를 추가수수료로 지급하게 되며, 이를 고려시 대표주관회사 및 인수회사의 실권주 매입단가는 청약자들보다 15.0% ~ 20.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [다. 유상증자 신주발행에 따른 물량 출회 및 주가 희석화 위험] 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 확정발행가액보다 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 존재합니다. 또한 본 유상증자의 발행예정주식수 8,400,000주는 당사 발행주식총수 21,102,977주의 39.8%에 해당하는 규모로, 보호예수되지 않아 일시적 물량 출회로 인한 주가 하락 위험이 존재합니다. 또한 유상증자 후 주식매수선택권 320,956주는 현재 당사 발행주식총수 21,102,977주의 1.2%에 해당하는 규모로, 이 역시 행사가능 시기가 도래하면, 시장에 출회될 수 있습니다. 이처럼 주가희석화 및 물량수급의 불균형에 따른 주가하락의 가능성이 존재하므로 투자자의 손실을 초래할 위험이 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 금번 유상증자를 주주배정후 실권주 일반공모 방식으로 진행하고 있습니다. 금번 유상증자에 따른 모집가액은 '증권의 발행 및 공시 등에 관한 규정' 제5-18조에 의거 주주배정 증자 시 가격 산정절차 폐지 및 가격 산정의 자율화에 따라 발행가액을 자유롭게 산정할 수 있으나, '(舊) 유가증권의 발행 및 공시 등에 관한 규정' 제57조를 적용하여 산정합니다.(주1)
| (주1) | 본 증권신고서 "제1부.I.모집 또는 매출에 관한 일반사항-3.공모가격 결정방법" 부분을 참고하여 주시기 바랍니다. |
| [출회가능 주식수] |
| (단위 : 주, %) |
| 구 분 | 주식수 | 현재 주식수 대비 |
유상증자 후 주식수 대비 |
주식매수선택권 행사 후 주식수 대비 |
|
|---|---|---|---|---|---|
| 모집예정주식수 | 8,400,000 | 39.80% | 28.47% | 28.17% | |
| 주식매수선택권 | 320,956 | 1.52% | 1.09% | 1.08% | |
| 소계 | 7,774,149 | 36.84% | 26.35% | 26.07% | |
| 발행주식총수 | 현재 | 21,102,977 | 100.00% | 71.53% | 70.76% |
| 유상증자 후 | 29,502,977 | - | 100.00% | 98.92% | |
| 주식매수선택권 행사 후 | 29,823,933 | - | - | 100.00% | |
| (주1) | 주식매수선택권 320,956주는 유상증자로 인한 행사가액 및 행사비율 조정을 감안한 수치입니다. 주식매수선택권 관련하여 상세한 내용은, 본 증권신고서 "제1부.III.투자위험요소-3.기타위험-마" 부분을 참고하여 주시기 바랍니다. 한편, 상기 수치는 유상증자 예정발행가액을 기준으로 산출하였습니다. |
그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 확정발행가액보다 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 존재합니다. 또한 본 유상증자의 발행예정주식수 8,400,000주는 당사 발행주식총수 21,102,977주의 39.8%에 해당하는 규모로, 보호예수되지 않아 일시적 물량 출회로 인한 주가 하락 위험이 존재합니다. 또한 유상증자 후 주식매수선택권 320,956주는 현재 당사 발행주식총수 21,102,977주의 1.5%에 해당하는 규모로, 이 역시 행사가능 시기가 도래하면, 시장에 출회될 수 있습니다. 이처럼 주가희석화 및 물량수급의 불균형에 따른 주가하락의 가능성이 존재하므로 투자자의 손실을 초래할 위험이 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [라. 환금성 제약 및 원금 손실 가능성에 대한 위험] 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다. 또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장 전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 코스닥시장 상장법인으로서 이번 유상증자로 발행되는 신주는 코스닥시장에상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다.
그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다. 또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장 전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [마. 주가하락에 따른 발행금액 감소 위험] 확정발행가액이 당초 계획 대비 하락할 경우에는 당사가 계획했던 공모자금 조달 규모가 감소하게 되어, 자금운용계획의 변동이 불가피하며, 당사 영업활동에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
금번 유상증자의 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 결정됩니다. 다만 '자본시장과 금융투자업에 관한 법률' 제165조의6 및 '증권의 발행 및 공시 등에 관한 규정' 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. (단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
따라서 확정발행가액이 당초 계획 대비 하락할 경우에는 당사가 계획했던 공모자금 조달 규모가 감소하게 되어, 자금운용계획의 변동이 불가피하며, 당사 영업활동에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
[바. 주식매수선택권 행사에 따른 주가 하락 위험] 향후 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
본 증권신고서 "제1부.III.투자위험요소-2.회사위험-아." 부분에 기재된 바와 같이 당사는 현재 임직원 등에 부여한 주식매수선택권 260,538주가 잔존하고 있습니다. 향후 당사 주식수에 변동이 생길 수 있는 기발행된 잠재주식은 주식매수선택권에 해당됩니다.
| [주식매수선택권 내역] | |
| (증권신고서 제출일 전일 기준) | (단위 : 원, %) |
| 구 분 | 부여일 | 의무복무기간 | 행사가능기간 | 현재 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|
| 보유수량 | 행사가격 | 조정 후 행사가능수량 | 조정 후 행사가격 | ||||
| 1 | 2020-02-25 | 3년 | 행사시작일로부터 5년('23.2.26~'28.2.25) | 54,975 | 12,441 | 70,385 | 9,717 |
| 2 | 2020-08-12 | 3년 | 행사시작일로부터 5년('23.8.13~'28.8.12) | 21,240 | 17,606 | 27,883 | 13,411 |
| 3 | 2021-02-24 | 3년 | 행사시작일로부터 5년('24.02.25~'29.02.24) | 17,636 | 19,665 | 23,299 | 14,884 |
| 4 | 2021-06-11 | 3년 | 행사시작일로부터 5년('24.06.12~'29.06.11) | 6,260 | 51,314 | 8,560 | 37,522 |
| 5 | 2021-10-22 | 2년 ~ 5년 | 행사시작일로부터 5년('23.10.23~'28.10.22) | 35,161 | 41,769 | 47,845 | 30,695 |
| 6 | 2022-02-23 | 2년 ~ 5년 | 행사시작일로부터 5년('24.02.24~'29.02.23) | 23,368 | 18,943 | 30,807 | 14,368 |
| 7 | 2022-05-20 | 2년 ~ 5년 | 행사시작일로부터 5년('24.05.21~'29.05.20) | 5,538 | 12,995 | 7,116 | 10,113 |
| 8 | 2023-02-23 | 2년 ~ 5년 | 행사시작일로부터 5년('25.02.24~'30.02.23) | 8,150 | 7,765 | 9,931 | 6,372 |
| 9 | 2024-03-07 | 2년 ~ 5년 | 행사시작일로부터 5년('26.03.08~'31.03.07) | 79,434 | 3,874 | 85,728 | 3,589 |
| 10 | 2024-03-28 | 2년 ~ 5년 | 행사시작일로부터 5년('26.03.29~'31.03.28) | 8,776 | 3,751 | 9,402 | 3,501 |
| 계 | 260,538 | 320,956 | |||||
| (자료) | 공시자료 및 당사제시자료 |
| (주1) | 본 유상증자 완료시, 본 유상증자로 인한 지분 희석 방지 조항에 따라 주식매수선택권의 행사가격 및 행사수량이 조정될 예정입니다. 상기 조정 후 행사가능수량과 조정 후 행사가격은 예정발행가액을 기준으로 산출하였습니다. |
| (주2) | 5번부터 10번의 의무복무기간은 복무 2년 후부터 매년마다 25%씩 행사가능수량이 증가하는 구조입니다. |
본 유상증자 완료 후 주식매수선택권은 지분 희석 방지 조항에 따라 행사가액이 하향조정되고, 총 행사가능수량이 320,956주로 상향조정될 예정입니다. (예정발행가액을 기준으로 산출하였습니다.)
따라서 향후 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [사. 유상증자 일정 관련 위험 및 철회 가능성 관련 위험] 본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경되거나 관계기관과의 업무 진행과정에서 본 증권신고서상의 예상 일정에 차질을 가져올 수 있습니다. 또한 금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사 및 인수회사의 잔액인수 방식으로 진행되며, 인수계약서에 의거하여, 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생할 경우에는 당사 혹은 대표주관회사 등의 판단에 따라 유상증자가 철회될 수 있습니다. 만일 유상증자 진행이 철회될 경우, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있고 이는 보상받지 못할 수 있습니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
「자본시장과 금융투자업에 관한 법률」 제120조 3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 본 공시서류를 참조하시기 바랍니다.
본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경되거나 관계기관과의 업무 진행과정에서 본 증권신고서상의 예상 일정에 차질을 가져올 수 있습니다.
또한 금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사 및 인수회사의 잔액인수 방식으로 진행되며, 인수계약서에 의거하여, 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생할 경우에는 당사 혹은 대표주관회사 등의 판단에 따라 유상증자가 철회될 수 있습니다. 만일 유상증자 진행이 철회될 경우, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있고 이는 보상받지 못할 수 있습니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [아. 분석정보의 한계 및 투자판단 관련 위험] 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있습니다. 본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단하시기 바랍니다. |
당사의 주식가치는 금번 유상증자 실시에 따른 전 과정에서 다양한 영향을 받아 하락할 수 있습니다.
본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 본 주식을 청약하고자 하는 투자자께서는 투자결정을 하기 전에 본 공시서류의 상기 투자위험요소 뿐만 아니라 다른 부분 또한 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없습니다. 따라서 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단할 필요가 있습니다.
당사는 상기에 기술된 투자위험요소 외에도 불안정한 경제상황 등에 의하여 직·간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 실제 결과는 현재시점에서의 평가와는 상당히 다를 수 있는 점을 유의하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생할 경우, 당사의 사업환경과 재무상태, 기타 운영결과에 부정적인 영향을 미칠 수 있습니다. 이에 따른 주가 하락으로 투자자께서는 금번 공모 과정에서 취득하게 되는 주식의 투자금액의 일부 또는 전부를 잃을 수 있습니다.
또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 최초에 예측했던 것과 다를 수 있는 점을 유의하시기 바랍니다.
| [자. 집단 소송 제기 위험] 공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| [차. 차입공매도 유상증자 참여 제한 관련 위험] 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률과 시행령」이 개정되어 2021년 4월 6일부터 시행됨에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막 날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자 참여를 제한하되, 예외적인 경우에만 증자 참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 상기 사항을 위반 시 과징금 등의 제재 조치를 받을 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
주권상장법인이 유상증자 계획을 공시한 이후 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우 증자참여를 허용하고 있습니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 이와 관련 유상증자 참여가 제한되는 공매도 시점과 증자참여가 허용되는 예외사유를 시행령에서 정하도록 위임하고 있습니다.
시행령에 따르면, 유상증자 계획이 공시된 다음 날부터, 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지 공매도 한 경우 증자참여가 제한됩니다 (「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제1항)
다만, 다음의 경우 공매도를 통해 발행가격에 부당한 영향을 미쳤다고 보지 않아 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제2항「금융투자업규정」제6-34조)
ⅰ) 마지막 공매도 이후 발행가격 산정 기산일까지 공매도 주문 수량 이상을 증권시장 정규거래시간에 매수(체결일 기준)
ⅱ) 금융위원회가 정하는 기준을 충족한 독립된 거래단위를 운영하는 법인 내에서 공매도를 하지 않은 거래단위가 증자참여
ⅲ) 시장조성 또는 유동성공급을 위한 거래과정에서 공매도
상기 공매도제도 개선 관련 자본시장법 시행령 시행에 따라, 당사의 주식을 해당 기간 동안 공매도하는 투자자께서는 금번 유상증자 참여가 제한될 수 있음을 유의하시기 바랍니다. 해당 법령과 관련된 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| [카. 기타 투자자 유의사항] 당사의 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우, 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 공시서류에 기재된 정보에만 의존하여 투자 판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 유의하시어 투자에 임하시기 바랍니다. |
(1) 금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분들께서는 이 점을 유의하여 주시기 바랍니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
(3) 본 공시서류의 공시심사 과정에서 기재사항은 청약일 이전에 변경될 수 있고, 일부 내용은 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 공시서류상의 일정에 차질을 가져올 수 있습니다. 또한 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다.
(4) 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
(5) 당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점을 유의하여 투자에 임하시기 바랍니다.
(6) 만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다.
(7) 본건 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
(8) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있으니 투자의사를 결정하시는 데 참조하시기 바랍니다.
이와 같이, 본 건 유상증자를 통해 취득한 당사의 주식 가치는 하락할 수 있으며, 본본 공시서류에서 제시된 투자위험요소 및 기타 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 다시 한번 유의하여 주시기 바랍니다.
| ※ 상기 제반사항을 고려하시어 투자자 제위의 현명한 판단을 바랍니다. 투자자는 본건 공모주식에의 투자 여부를 결정함에 있어서 필요한 경우 스스로 별도의 독립된 자문을 받아야 하며, 이에 따른 투자의 결과에 대하여는 투자자가 책임을 부담합니다. |
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 「금융투자회사의 기업실사 모범규준」에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 엘에스증권(주)입니다. 발행회사인 (주)셀리드는 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 금융투자업자(분석기관) | |
|---|---|---|
| 회 사 명 | 고 유 번 호 | |
| 대표주관회사 | 엘에스증권(주) | 00330424 |
2. 분석의 개요
대표주관회사인 엘에스증권(주)는「자본시장과 금융투자업에 관한 법률」 제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한 「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 지분증권, 채무증권 증권신고서를 대상으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사가 기업실사 과정을 통해 발행회사부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
| 「금융투자회사의 기업실사 모범규준」 |
|---|
| 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 '리스크관리위원회 등')의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요 내용
| 일자 | 실사내용 |
|---|---|
| 2025-02-20 |
* 발행회사 방문 - 자금조달 목적 등 발행회사 의견 청취 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 주요 사항 및 일정 체크 - 유상증자 상세 일정 등 업무 협의 |
| 2025-02-21 ~ 2025-03-05 |
* 발행회사 및 해당 산업 조사 - 회사 정관 등 기본자료 수령 - 공시 및 뉴스 내용 등을 통한 발행회사 및 산업 이해 - 경영진 평판 리스크 검토 - 관련 Q&A 등 * 유상증자 리스크검토 - 발행시장 상황, 자금조달규모 적정성공모가액 희망 할인율 검토 |
| 2025-03-06 ~ 2025-03-14 |
* 발행회사 방문 및 보고서 작성 * Due-diligence checklist에 따라 투자위험요소 실사 1) 사업위험관련 실사 - 영위중인 사업 등에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 - 최대주주의 지분율 및 경영권 안정성 검토 - 주요 계정과목별 재무수치 변동요인 검토 - 원장 및 각종 명세서 등 검토 - 주요 계약관련 계약서 및 등의 확인 - 각 부서 주요 담당자 인터뷰 * 주요 경영진 면담 - 경영진 평판 리스크 검토 - 자금 사용 목적 등에 관한 청취 |
| 2025-03-15 ~ 2025-03-19 |
* 실시간 실사자료 요청 및 확인/검토 * 증권신고서 작성에 대한 조언 * 이사회의사록 검토/인수계약서 작성 및 검토 |
| 2025-03-20 ~ 2025-04-02 |
* 자진 기재정정 내용 관련 실사자료 요청 및 확인/검토 - Covid19 시장규모 관련 리서치 - 신규 진출한 이머커머스사업 계획 관련 상세내용 - 면역항암제 파이프라인 현황 및 계획 등 상세내용 확인 - 자금사용목적상 예산 수립과정 확인 - 기타 정정내용 관련 주요 경영진 면담 및 실사자료 확인 * 증권신고서 작성에 대한 조언 및 검토 |
| 2025-04-03 ~ 2025-04-15 |
* 일정 변경으로 인한 정정 이사회의사록 검토/인수계약서 작성 및 검토 * 자진 기재정정 내용 관련 실사자료 요청 및 확인/검토 - Covid19 시장규모 관련 리서치 - 긴급사용승인 제도 관련 상세내용 - 면역항암제 파이프라인 현황 및 계획 등 상세내용 확인 - 자금사용목적상 예산 수립과정 확인 - 기타 정정내용 관련 주요 경영진 면담 및 실사자료 확인 * 증권신고서 작성에 대한 조언 및 검토 |
4. 기업실사 참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 엘에스증권(주) | 기업금융2팀 | 안종섭 | 팀장 | 기업실사 총괄 | 2025년 02월 20일 ~ 2025년 04월 15일 |
기업금융업무 등 13년 |
| 엘에스증권(주) | 기업금융2팀 | 문재준 | 선임매니저 | 실사책임 및 검토 | 2025년 02월 20일 ~ 2025년 04월 15일 |
기업금융업무 등 9년 |
| 엘에스증권(주) | 기업금융2팀 | 유한종 | 선임매니저 | 기업실사 및 서류작성 등 | 2025년 02월 20일 ~ 2025년 04월 15일 |
기업금융업무 등 5년 |
[ 발행회사 ]
| 소속 | 부서 | 성명 | 직책 | 담당업무 |
|---|---|---|---|---|
| (주)셀리드 | 경영지원실 | 김민수 | 상무 | 발행업무 총괄 |
| (주)셀리드 | 경영지원실 | 황대혁 | 팀장 | 실사대응 및 서류작성 |
| (주)셀리드 | 경영지원실 | 최가영 | 사원 | 실사대응 및 서류작성 |
| (주)셀리드 | 경영지원실 | 김유진 | 사원 | 실사대응 및 서류작성 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 엘에스증권(주)는 (주)셀리드가 2025년 03월 18일 및 2025년 04월 15일 이사회에서 결의한 기명식 보통주 8,400,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이를 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 |
▶ 글로벌 면역항암제 시장은 암 유병률은 줄고 유병자 수가 늘어나면서 지속적으로 빠르게 성장할 것으로 예상되고 있습니다. 글로벌 리서치 기관인 The Business Research Company 자료에 따르면 글로벌 면역항암제 시장 규모는 인구 증가와 고령화에 따른 질병 유병률 증가, 기존 치료법의 한계를 개선하는 치료방식, 이에 따른 해당 시장에 대한 관심 및 R&D 활동의 증가로 2024년 942억 달러에서 연 평균 9.4% 성장(2024-2029)하여 2029년에는 1,532억 달러에 이를 것으로 전망됩니다. 특히 항암제 중 면역항암제는 과거 약물보다 부작용이 적고 안전하게 쓸 수 있다는 장점이 있어 시장이 확대될 것으로 예상됩니다.
|
| 부정적 요인 |
▶ BIO(Biotechnology Innovation Organization), Informa, QLS(Quantitative Life Sciences)에서 발간한 보고서에 따르면, 2011~2020년 간 임상 1상 단계의 후보물질이 최종적으로 미국 FDA의 허가를 득하고 시장에 출시될 확률(LOA)은 7.9%에 불과합니다. 그중 자가면역질환의 경우 11%,내분비질환의 경우 7% 수준인데 반해 항암제는 5% 수준으로 전체 분야에서 가장 낮은 성공 확률을 보이는 것으로 나타납니다. 의약품 개발 시 임상2상 단계가 가장 성공률이 낮아 임상 2상 후보물질의 28.9%만이 다음 개발 단계로 진행되고 있습니다. 전체 항암제 중에서는 면역항암치료제의 LOA가 12.4%로 허가 확률이 높은 편에 해당되며, 평균적으로 임상 1상부터 품목허가까지 10.5년이 소요되고 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 주요 파이프라인별 연구개발비 등 운영자금으로 활용할 계획입니다. 동사는 아직 매출이 부진한 상태로서 자체 영업현금흐름 창출 능력이 낮기 때문에, 향후 계속기업으로서의 존속을 위하여 임상 진행 중인 파이프라인의 연구개발 성과가 가시화되어야 하는 상황에 처해있으며, 이는 대규모 연구개발비의 지출을 수반해야 합니다. 이를 위해 본 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 동사는 2023년 9월에는 주주우선공모 방식의 신주 발행을 통해 운영자금 17,481백만원의 자금을 자본으로 조달하였으나, 이는 당시 최초에 목표했던 조달금액 400억원에 한참 미치지 못한 수준이므로, 현재 추가적인 자금 및 자본의 동시 확충이 반드시 필요한 상황이었습니다. 이에 2024년 8월에는 주주배정 후 실권주 일반공모 방식의 유상증자 신주 발행을 통해 운영자금 23,175백만원을 조달하였습니다. 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하였으며, 계획된 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 계획입니다. 이에 해당 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 등 필요한 추가 자본을 조달하고 있는 상황입니다. 따라서 금번 추가 유상증자를 통한 공모자금 조달은 반드시 필요할 것으로 보입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 목적은 본 증권신고서 "제1부.V. 자금의 사용목적" 부분을 참고하시기 바랍니다. |
나. 대표주관회사는 실사 과정에서 발행회사로부터 각 파이프라인별 임상 진행 경과 및 향후 계획 등에 대해 관련 자료를 제공받았으며, 본 증권신고서상 기재된 내용과 상충되지 않음을 성실하게 검토하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다. 또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025. 04. 15. |
| 대표주관회사: 엘에스증권 주식회사 |
| 대표이사 김 원 규 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
|
(단위 : 원) |
|
구 분 |
금 액 |
|---|---|
|
모집 또는 매출총액(1) |
24,150,000,000 |
|
발행제비용(2) |
543,667,000 |
|
순 수 입 금 [ (1)-(2) ] |
23,606,333,000 |
| 주1) | 상기 금액은 예정발행가액을 기준으로 산정하였습니다. |
| 주2) | 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) | 발행제비용은 공모금액 및 실권규모, 유관기관과의 협의, 상장신청일 전일 당사 주가추이 등에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 발행제비용은 공모금액에서 지급될 예정이나, 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 연구개발비로 지출할 예정입니다. |
나. 발행제비용의 내역
|
(단위 : 원) |
|
구 분 |
금 액 |
계산근거 |
|---|---|---|
|
발행분담금 |
4,347,000 |
모집총액의 0.018% (10원 미만 절사) |
|
실사수수료 |
20,000,000 | 금 2천만원 |
|
인수수수료 |
434,700,000 |
모집총액의 1.8% |
|
상장수수료 |
4,460,000 | 430만원 + 300억원 초과금액(추가상장분 시가총액)의 10억원당 8만원 |
|
등록세 |
16,800,000 |
증자 자본금의 0.4% |
|
교육세 |
3,360,000 |
등록세의 20% |
|
기타비용 |
60,000,000 |
구주주 청약서, 투자설명서 인쇄 및 발송비 등 |
|
합 계 |
543,667,000 |
- |
| 주1) | 상기 금액은 예정발행가액을 기준으로 산정하였습니다. |
| 주2) | 발행제비용은 공모금액 및 실권규모, 유관기관과의 협의, 상장신청일 전일 당사 주가추이 등에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 발행제비용은 공모금액에서 지급될 예정이나, 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 연구개발비로 지출할 예정입니다. |
| 주3) | 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
| (기준일 : | 2025년 03월 18일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 24,150 | - | - | - | 24,150 |
나. 공모자금 세부 사용목적
| [공모자금의 우선순위 및 사용계획] |
| (단위 : 백만원) |
| 구분 | 자금용도 | 세부내용 | 25년 2분기 | 25년 3분기 | 25년 4분기 | 26년 1분기 | 26년 2분기 | 합계 | 비고 |
| 운영자금 | 연구개발비 | AdCLD-CoV19-1 OMI | 4,864 | 1,595 | 1,670 | 605 | 1,815 | 10,549 | 1순위 |
| BVAC Pipeline | 600 | 570 | 1,370 | 510 | 273 | 3,323 | 3순위 | ||
| 소계 | 5,464 | 2,165 | 3,040 | 1,115 | 2,088 | 13,872 | |||
| 백신제조 | CoV19 백신 제조 | 0 | 0 | 9,734 | 0 | 0 | 9,734 | 2순위 | |
| 유상증자 | 발행제비용 | 544 | 0 | 0 | 0 | 0 | 544 | 수수료 | |
| 합계 | 6,008 | 2,165 | 12,774 | 1,115 | 2,088 | 24,150 | |||
| 주1) | 상기 발행제비용 중 일부는 지급시기에 따라 공모자금 외 자체자금으로 집행할 수 있습니다. 해당 비용에 대한 공모자금 미사용액은 연구개발비로 지출할 예정입니다. |
| 주2) | 상기 자금은 예정발행가액을 기준으로 산정되었습니다. |
당사는 금번 유상증자를 통해 조달할 자금 24,150백만원 중 예상 발행제비용 544백만원을 제외한 23,606
백만원을 AdCLD-CoV19-1 OMI 파이프라인의 연구개발비(임상 3상 중간분석 결과를 위한 수행 및 분석비용 등), 허가용 백신의 생산 비용, 상업용 코로나19 백신 제조비용 및 당사의 주력 파이프라인인 BVAC의 연구개발비(임상 수행비용 등) 등으로 사용할 예정입니다.
향후 당사는 하단에 기재한 내용과 같이, 주요 파이프라인에 대한 총 연구개발비 및 코로나 백신 생산비용으로 23,606백만원이 소요될 것으로 예상하고 있으며, 당사의 공모자금을 매 분기별로 각 파이프라인별 우선순위를 고려하여 사용해나갈 예정입니다. 이후 부족한 금액은 당사의 자체자금 또는 외부차입 등을 활용하여 향후 연구개발 영업활동을 지속 전개해 나가려고 합니다.
| [당사 파이프라인별 향후 지출계획(~26년 상반기)] |
| (단위 : 백만원) |
| 우선순위 | 구분 | 세부내역 | 금액 |
| 1 | AdCLD-CoV19-1 OMI | 다국가 임상3상 수행비용 | 7,214 |
| 다국가 임상3상 분석비용 | 1,776 | ||
| 허가용 백신 생산비용 | 1,559 | ||
| 소계 | 10,549 | ||
| 2 | CoV19 백신 제조 | 상업용 CoV19 백신 제조 | 9,734 |
| 3 | BVAC Pipeline | 임상시험 수행비용 | 3,323 |
| 합계 | 23,606 | ||
| (자료) | 당사 제시 |
당사는 현재 임상 단계가 가장 많이 진전된 파이프라인 순으로 우선순위를 두고, 향후 2026년 상반기까지 당사의 주요 파이프라인별 지출 예산 및 분기별 지출 계획을 수립하였습니다. 각 파이프라인별 계획은 다음과 같습니다.
(1) AdCLD-CoV19-1 OMI
| [AdCLD-CoV19-1 OMI 임상3상 계획 승인 등 결정에 관한 공시내용(2023.07.21)] |
| 구 분 | 내 용 | |
|---|---|---|
| 투자 유의사항 | 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 존재합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND) 승인 | |
| 2. 주요내용 | 1) 임상시험명칭 | 만 19세 이상 성인 자원자를 대상으로 COVID-19 예방 백신 AdCLD-CoV19-1 OMI 추가접종의 면역원성 및 안전성을 평가하기 위한 다국가, 다기관, 관찰자 눈가림, 무작위배정, 활성 대조 제 3상 임상시험 |
| 2) 임상시험단계 | 제3상 임상시험 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 국내외 | |
| 5) 임상시험실시기관 | 국내 및 해외 기관 | |
| 6) 대상질환 | SARS-CoV-2 Omicron variant에 의한 COVID-19 예방 | |
| 7) 신청일 | 2023-05-23 | |
| 8) 승인일(결정일) | 2023-07-21 | |
| 9) 등록번호 | 100968 | |
| 10) 임상시험 목적 | AdCLD-CoV19-1 OMI 또는 코미나티2주를 접종하고 면역원성 비열등성을 입증 | |
| 11) 임상시험 방법 | 다국가, 다기관, 관찰자 눈가림, 무작위배정, 활성 대조 제3상 임상시험으로 SARS-CoV-2 백신 접종 완료 및/또는 COVID-19 확진에 의한 격리 해제 후 최소 16주 이상 경과한 만 19세 이상의 건강한 성인 자원자 4,000명을 모집하여 'AdCLD-CoV19-1 OMI' 또는 '코미나티2주'를 접종 후 면역원성 및 안전성 평가 | |
| 12) 1차 지표 | 중화항체가 및 혈청반응율 등의 확인을 통한 면역원성 평가 | |
| 13) 1차 지표 통계분석방법 | GMT,SRR non-inferiority | |
| 14) 임상시험기간 | 임상시험심사위원회(IRB) 승인일로부터 18개월 | |
| 15) 목표 시험대상자 수 | 4,000명 | |
| 16) 예상종료일 | 2025-03-01 | |
| 3. 사실발생(확인)일 | 2023-07-21 | |
| 4. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 사실발생(확인)일은 한국 식품의약품안전처(MFDS)로부터 임상시험 계획(IND) 승인을 통보받은 날짜입니다. - 상기 임상시험기간 및 예상종료일은 임상시험 진행 상황에 따라 변동될 수 있습니다. - 공시 내용은 향후 당사의 보도자 및 IR자료로 사용될 예정입니다. |
||
| ※ 관련공시 | 2023-05-23 투자판단 관련 주요경영사항(임상시험 계획 승인신청)(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제3상 임상시험 계획(IND) 신청) | |
| (자료) | DART 전자공시시스템 |
| [COVID19 예방 백신 AdCLDCoV191 OMI의 제1/2상 임상시험 결과에 관한 공시내용 (2024.11.06)] |
| 투자 유의사항 | 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 존재합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 결과 | |
| 2. 주요내용 | 1) 임상시험명칭 | 만 19세 이상 성인 자원자를 대상으로 COVID-19 예방 백신 AdCLD-CoV19-1 OMI 추가접종의 안전성, 면역원성을 확인하기 위한 제1/2상 (단일기관, 공개, 제1상 및 다기관, 이중 눈가림, 무작위배정, 위약 대조, 제2상) 임상시험 |
| 2) 임상시험단계 | 국내 제1/2상 임상시험 | |
| 3) 임상시험승인기관 | 국내 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 대한민국 | |
| 5) 임상시험실시기관 | 고려대학교 구로병원 외 7개 기관 | |
| 6) 대상질환 | SARS-CoV-2 Omicron variant에 의한 COVID-19 예방 | |
| 7) 신청일 | 2022-05-27 | |
| 8) 승인일 | 2022-08-04 | |
| 9) 등록번호 | - 임상시험승인번호 : 100968 - 임상시험일련번호 : 202200640 |
|
| 10) 임상시험 목적 | 가. 임상 1상 - 일차 목적 : AdCLD-CoV19-1 OMI 추가접종 후 28일 동안의 안전성 및 면역원성을 확인하여 임상 2상 진입 여부 평가 나. 임상 2상 - 일차 목적 : AdCLD-CoV19-1 OMI 추가접종으로 유도되는 SARS-CoV-2 Omicron variant에 대한 면역원성을 투여 후 2주, 4주 시점에 neutralization antibody 검사로 평가 |
|
| 11) 임상시험 방법 | 가. 임상 1상 - 단일기관, 공개 제1상 임상시험으로 국내 1개 기관에서 COVID-19 예방백신의 마지막 접종 완료 및/또는 COVID-19에 의한 격리 해제 후 최소 16주 이상 48주 미만 경과한 만 19세 이상 64세 이하 성인 자원자 20명을 모집하고 임상시험용 의약품 접종 후 28일 동안의 안전성 및 면역원성을 확인하여 임상 2상 진입 여부를 평가함 나. 임상 2상 - 다기관, 이중눈가림, 무작위배정, 위약대조 제 2상 임상시험으로 국내 8개 기관에서 COVID-19 예방백신의 마지막 접종 완료 및/또는 COVID-19에 의한 격리 해제 후 최소 16주 이상 48주 미만 경과한 만 19세 이상 성인 자원자 300명을 모집하고 임상시험용 의약품 또는 위약을 5:1로 무작위배정하여 접종 후 안전성과 면역원성을 평가함 |
|
| 12) 1차 지표 | 가. 안전성 평가 - 임상시험용 의약품 접종 후 30분 이내(만 75세 이상 고령자의 경우 2시간 이내)에 발생한 즉각적 이상반응 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 이상반응 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응 나. 면역원성 평가 - 임상시험용 의약품 접종 후 2주, 4주 시점에 wild-type virus neutralization method로 분석한 SARS-CoV-2 B.1.1.529 중화항체의 혈청반응률(Seroresponse rate, SRR), 기하평균역가(Geometric Mean Titer, GMT), 기하평균증가율(GMFR) |
|
| 13) 임상시험기간 | 2022.09.21 ~ 2024.02.28 | |
| 14) 목표 시험대상자 수 | - 임상 1상 : 20명 - 임상 2상 : 300명 |
|
| 3. 시험결과 | 1) 1차 지표 통계분석방법 | 본 임상시험은 안전성 및 면역원성 탐색 목적의 제1/2상 임상시험으로 검증하고자 하는 가설이 없어 통계적 유의성 검증에 해당사항 없음 |
| 2) 결과값 | 가. 임상 1상 1) 안전성 평가 - 임상시험용 의약품 접종 후 30분 이내에 발생한 즉각적 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 국소적/전신적 이상반응은 14명(70.00%)에게서 42건 발생하였고, 중대한 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응은 6명(30.00%)에게서 7건 발생하였고, 중대한 이상반응은 1건 발생함 2) 면역원성 평가 - 시험군 19명의 베이스라인 시점에서의 GMT는 734.39였고, 임상시험용 의약품 접종 후 2주 시점에서의 GMT는 3899.49로 베이스라인 대비 5.31배(GMFR) 증가함. 4주 시점에서의 GMT는 3404.85로 베이스라인 대비 4.64배(GMFR) 증가하였으며, 2주 및 4주 시점에서의 혈청반응율은 78.95%로 나타남 나. 임상 2상 1) 안전성 평가 - 임상시험용 의약품 접종 후 30분이내 발생한 즉각적 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 7일까지 발생한 예측된 국소적/전신적 이상반응은 시험군 199명(79.92%)에게서 744건 발생하였으며, 위약군 25명(49.02%)에게서 54건 발생함. 시험군과 위약군 모두 중대한 이상반응은 발생하지 않음 - 임상시험용 의약품 접종 후 28일까지 발생한 예측되지 않은 이상반응은 시험군 71명(28.51%)에게서 115건 발생하였으며, 위약군 17명(33.33%)에게서 26건이 발생했음. 중대한 이상반응은 위약군에게서 1건 발생함. 2) 면역원성 평가 - 시험군 234명의 베이스라인 시점에서의 GMT는 2036.66이었고, 임상시험용 의약품 접종 후 2주 시점에서의 GMT는 7386.23으로 베이스라인 대비 3.63배(GMFR) 증가하였으며, 4주 시점에의 GMT는 7135.41로 베이스라인 대비 3.50배(GMFR) 증가하였으며, 2주 및 4주 시점에서의 혈청반응율은 65.38%로 나타남 - 2주 및 4주 시점에서의 위약군 대비 시험군의 GMT ratio는 각각 3.12배, 3.41배로 나타남 |
|
| 4. 사실발생(확인)일 | 2024-11-06 | |
| 5. 향후계획 | AdCLD-CoV19-1 OMI 임상 3상 시험의 4,000명 투여를 완료하고, 임상3상 시험의 중간분석 결과를 바탕으로 조건부 품목허가를 신청할 예정 | |
| 6. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 4. 사실발생(확인)일은 임상시험수탁기관(CRO)으로부터 임상 1/2상 임상시험 결과보고서 (Clinical Study Report)를 수령한 날짜 입니다. - 본 공시 내용은 향후 당사의 보도자료 및 IR자료로 사용될 예정입니다. |
||
| ※ 관련 공시 | 2022-05-27 투자판단 관련 주요경영사항(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 계획(IND) 신청) 2022-08-04 투자판단 관련 주요경영사항(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 계획(IND) 승인) 2023-07-14 투자판단 관련 주요경영사항(임상시험 결과)(COVID-19 예방 백신 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 Top-line 결과 발표) |
|
| (자료) | DART 전자공시시스템 |
당사의 핵심 파이프라인인 AdCLD-CoV19-1 OMI는 국내 최초의 SARS-CoV-2 Omicron variant에 의한 COVID-19 예방백신으로서 부스터샷 백신에 해당됩니다. 당사는 2023년 7월 21일 한국 식품의약품안전처(MDFS)로부터 임상3상 시험 계획(IND) 승인을 통보받았으며, 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하였습니다. 계획된 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 계획입니다.
| [임상3상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | COVID-19 예방백신의 마지막 접종 또는 COVID-19 확진으로 인한 격리 해제 후 최소 16주 이상 경과한 성인에서 AdCLD-CoV19-1 OMI로 유도되는 면역원성을 대조백신과 비교하고 면역가교를 통해 유효성을 입증합니다. |
| 임상시험 대상국가 | 대한민국 및 동남아시아 (필리핀, 베트남) |
| 임상시험 수행방법 | 시험 대상자 : 4,000명의 평가 가능한 시험대상자 시험대상자 수는 식품의약품안전처 가이드라인 (코로나19 백신 개발 시 고려사항)에 따라 안전성 평가 가능한 시험군 3,000명 및 대조군 1,000을 확보하기 위해 결정되었습니다. 다국가, 다기관, 관찰자 눈가림, 무작위 배정, 활성 대조로 설계되었으며, 전체 임상시험 수행기간은 대상자 모집 6개월, 모집 이후 추적관찰 12개월, 총 18개월로 예정되었습니다. |
| 기대효과 | AdCLD-CoV19-1 OMI는 ㈜셀리드에서 자체 개발하여 임상 3상 시험에 진입한 COVID-19 예방백신이자 대한민국 최초 오미크론 변이 예방 백신 후보물질로, 대조백신과의 면역가교를 통해 유효성을 입증하면 국내에서 추가접종용으로 사용될 수 있습니다. 또한, 본 COVID-19 예방백신 품목허가 시, 후속으로 개발하는 백신은 AdCLD-CoV19-1 OMI와의 면역가교를 통해 그 유효성을 신속히 입증할 수 있으며, 본 임상시험을 통해 3,000명의 안전성 자료를 확보하였기에 후속 임상시험에서는 그 규모를 크게 축소할 수 있습니다. |
| (자료) | 당사 제시 |
2024년 4월 26일 WHO 코로나19 백신 구성 기술 자문그룹(TAG-CO-VAC)은 SARS-CoV-2 바이러스가 JN.1 변이에서 계속 진화할 것으로 예상됨에 따라 향후 COVID-19 백신으로 JN.1 계통의 단가백신을 사용할 것을 권고하였습니다. 당사는 JN.1 변이의 유행을 예측하여 준비하고 있었으며, 대량 생산을 목적으로 현재 초기 단계에서 노력을 기울이고 있습니다.
당사는 2023년 5월 23일 식품의약품안전처에 오미크론 전용 코로나19 백신 'AdCLD-CoV19-1 OMI'의 임상 3상 시험계획(IND)를 제출하였으며, 2023년 7월 21일에 'AdCLD-CoV19-1 OMI' 임상 3상 승인을 획득하였습니다. 현재 국내, 필리핀, 베트남에서 다국가 임상 3상 시험계획 신청 후 승인을 완료하여 진행 중에 있으며, 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하습니다. 임상 3상에서 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 확보한 중간 분석 결과를 기반으로 조건부 품목허가를 받고, 신규 변이에 대응한 백신은 정부로부터 긴급사용승인을 받은 후 수의 계약 혹은 입찰 형태 계약으로 참여하여 확정이 된다면 정부 조달 시장에 공급이 가능할 것으로 예상하고 있습니다.
따라서 AdCLD-CoV19-1 OMI 다국가 임상 3상 수행비용 7,214백만원을 해외 실시기관에 지급할 예정이며, 중간분석 결과를 수령하기 위한 임상 3상 분석비용 1,776백만원, 허가용 백신 생산비용 1,559백만원을 사용할 계획입니다. 이처럼 AdCLD-CoV19-1 OMI 파이프라인을 위해 금번 유상증자 대금 중 10,549백만원을 사용할 계획입니다.
(2) CoV19 백신 제조
당사는 2025년 2분기 ~ 2025년 3분기 사이에 조건부 품목허가 신청을 하여 2025년 4분기 내에 승인을 받아 신규 변이에 대응한 백신을 정부로부터 긴급사용승인을 받는 것을 목표로 하고 있습니다. 예정대로 진행된다면 가격 경쟁력을 통해 정부 조달 시장에 공급할 가능성이 존재하며, 이에 대한 상업용 CoV19 백신을 제조할 계획을 가지고 있습니다.
당사는 상업용 CoV19 백신을 위탁생산(CDMO)으로 제조할 예정이며, 위탁 생산 비용은 원료의약품(DS, Drug Substance), 완제의약품(DP, Drug Product)으로 구분됩니다. 당사는 상업용 백신 생산을 위해 2025년 4분기에 총 9,734백만원을 사용할 계획이며, 이는 DS, DP 생산을 위한 원료 및 부자재 구매비용과 위탁생산비용, 품질 및 특성 시험비용이 모두 포함된 비용입니다.
상업용 백신의 세부적인 지출 계획은 다음과 같습니다.
| [상업용 백신 지출계획] |
| (단위 : 억원) |
| 구분 | 세부내역 | 금액 |
| DS(Drug Substance) |
DS 생산 CDMO | 35.0 |
| 원부자재 | 19.6 | |
| 품질 | 10.6 | |
| 소계 | 65.2 | |
| DP( Drug Product) |
DP 생산 CDMO | 20.0 |
| 원부자재 | 4.5 | |
| 품질 | 7.6 | |
| 소계 | 32.1 | |
| 합계 | 97.3 | |
| (자료) | 당사 제시 |
원료의약품(DS) 공정에서는 이를 생산하기 위한 위탁생산비용 35억원, 해당 백신 성분을 제조하기 위해 필요한 원부자재 비용 19.6억원, 생산된 원료의약품의 순도, 안정성, 효능 등을 검증하기 위한 품질 시험 및 관리 비용 10.6억원, 총 65.2억원이 지출될 계획입니다. 완제의약품(DP) 공정에서는 역시 완제의약품을 생산하기 위한 위탁생산비용 20억원이 가장 비중이 크며, 공정 중 사용되는 소모품이나 포장을 위한 원부자재 비용 4.5억원, 안전성과 효능을 보장하기 위한 품질 검사 및 인증 절차 관련 비용 7.6억원, 총 32.1억원이 소요될 계획입니다.
(3-1) BVAC-E6E7
| [항암면역치료백신 BVACE6E7의 제1/2a상 임상시험 계획승인에 관한 공시내용(2023.09.21)] |
| 투자 유의사항 | 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | 항암면역치료백신 BVAC-E6E7의 제1/2a상 임상시험 계획승인 | |
| 2. 주요내용 | 1) 임상시험명칭 | HPV 16-양성 및/또는 HPV 18-양성인 절제 불가능한 재발성 또는 전이성 두경부편평상피세포암 환자를 대상으로 BVAC-E6E7 의 안전성, 면역반응 및 유효성을 평가하기 위한 제 1/2a 상(다기관, 공개, 단계적 증량 제 1 상 및 다기관, 공개, 단일군, 탐색적 제 2a 상) 임상시험 |
| 2) 임상시험단계 | 국내 제1/2a상 임상시험 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 대한민국 | |
| 5) 임상시험실시기관 | 서울대학교병원 종양내과 외 2개 기관 | |
| 6) 대상질환 | HPV 16-양성 및/또는 HPV 18-양성인 절제 불가능한 재발성 또는 전이성 두경부편평상피세포암 | |
| 7) 신청일 | 2023-12-18 | |
| 8) 승인일(결정일) | 2024-11-19 | |
| 9) 등록번호 | 임상시험 승인번호: 102375 임상시험 일련번호 : 202400855 |
|
| 10) 임상시험 목적 | 가. 임상 1상 - 일차 목적 : HPV 16-양성 및/또는 HPV 18양성 두경부편평상피세포암 환자를 대상으로 BVAC-E6E7 투여 시 안전성 및 내약성을 평가하여 최대내약용량(Maximum Tolerated Dose, MTD) 및 제 2a 상에서의 권장용량(Recommended Phase II Dose, RP2D)을 결정함. 나. 임상 2a상 - 일차 목적 : HPV 16-양성 및/또는 HPV 18-양성 두경부편평상피세포암 환자를 대상으로 BVAC-E6E7 투여 시 유효성을 평가함. |
|
| 11) 임상시험 방법 | 가. 임상 1상 - 3+3 design 으로 저용량군부터 최대내약용량(MTD)이 결정될 때까지 진행함. - MTD 결정 방법에 따라 용량 단계별로 순차적으로 3 ~ 6 명의 시험대상자를 등록하여 BVAC-E6E7 투여 후 용량제한독성(Dose Limiting Toxicity, DLT)을 평가함. 나. 임상 2a상 - 임상1상 시험에서 결정된 BVAC-E6E7 RP2D 용량으로 약 25 명의 시험대상자를 순차적으로 등록하여 종양반응으로 유효성, 안전성 및 면역반응을 평가함. |
|
| 12) 1차 지표 | 가. 임상 1상 - BVAC-E6E7 투여 후 평가된 용량제한독성(DLT)의 발생빈도 나. 임상 2a상 - 유효성 평가 ① 객관적 반응률(Objective Response Rate, ORR) ② 질병 조절률(Disease Control Rate, DCR) ③ 반응 지속 기간(Duration of Response, DOR) ④ 6 개월 시점의 무진행 생존율(Progression Free Survival rate, PFS rate) 및 무진행 생존 기간(Progression Free Survival, PFS) ⑤ 12 개월 시점의 전체 생존율(Overall Survival rate, OS rate) 및 전체 생존 기간(Overall Survival, OS) |
|
| 13) 1차 지표 통계분석방법 | 본 임상시험은 BVAC-E6E7 투여 시 안전성 및 내약성을 평가하여 MTD 확인 및 제 2a 상에서의 권장용량(RP2D) 결정을 목적으로 하므로 예비적 유효성 탐색을 위한 가설 검정을 시행하지 않음. | |
| 14) 임상시험기간 | 가. 전체 임상시험심사위원회(IRB)의 승인일로부터 약 24 개월(시험대상자 등록 속도에 따라 변경될 수 있음) - 시험대상자 모집 기간: 12 개월 - 추적관찰 기간: 마지막 시험대상자의 임상시험용 의약품 첫 투여일로부터 12 개월 |
|
| 15) 목표 시험대상자 수 | 가. 임상 1상 : 약 6~12 명 나. 임상 2a 상 : 약 25 명 |
|
| 16) 예상종료일 | 2027-03-31 | |
| 3. 사실발생(확인)일 | 2024-11-19 | |
| 4. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 승인일(결정일), 사실발생(확인)은 국내 식품의약품안전처(MFDS)에 임상시험 계획(IND) 승인 등을 통보받은 날짜입니다. - 상기 임상시험기간 및 예상종료일은 임상시험 진행 상황에 따라 변동될 수 있습니다. 3) 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정입니다. |
||
| ※ 관련공시 | 2023-12-18 투자판단 관련 주요경영사항(임상시험 계획 승인신청)(항암면역치료백신 BVAC-E6E7의 제1/2a상 임상시험 계획 승인신청) | |
| (자료) | DART 전자공시시스템 |
BVAC-E6E7은 인유두종바이러스(HPV)에 의해 유도되는 두경부암 환자를 대상으로 하는 자가세포치료제입니다. HPV 특이적인 면역반응을 유도하여 HPV 감염에 의한 암세포의 특이적 사멸을 유도하는 예방 백신과는 차별화된 특이적 치료 방법으로, HPV에 의해 유도된 두경부암 환자를 대상으로 임상시험을 준비하고 있으며, HPV 예방 백신의 한계 극복을 위해 현재 개발중인 백신입니다.
| [임상 1/2a상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | HPV type 16 또는 18에 양성인 재발성 또는 전이성 두경부편평상피세포암 환자에서 BVAC-E6E7의 안전성, 면역반응 및 유효성을 평가하기 위한 임상시험 |
| 임상시험 대상국가 | 대한민국 |
| 임상시험 수행방법 | 시험 대상자: 최소 31~최대 37명 (1상 : 최소 6~최대 12명, 2a상: 25명) 임상 1상 시험은 전통적인 3+3 디자인에 근거하여 대상자 수는 최소 6명에서 최대 12명이 될 것으로 예상하고 있습니다. 임상 2a상 시험은 유효성 및 면역원성을 탐색하기 위해 최대 25명을 대상으로 수행할 예정입니다. 따라서 전체 임상시험 대상자 수는 최소 31에서 최대 37명으로 예상됩니다. 신속한 대상자 모집을 위해 다기관 임상시험을 고려하고 있으며, 대상자의 특성을 고려하여 별도의 위약은 사용하지 않을 예정입니다. |
| 기대효과 | BVAC-E6E7은 HPV 특이적인 면역반응을 유도하여 HPV 감염에 의한 암세포의 특이적 사멸을 유도하는 예방 백신과는 차별화된 특이적 치료 방법으로, HPV에 의해 유도된 두경부암 환자를 대상으로 임상시험을 준비하고 있으며, HPV 예방 백신의 한계 극복을 할 수 있을 것으로 예측됩니다. |
| (자료) | 당사 제시 |
현재 당사는 비임상 독성/분포, 유효성 시험 등을 마무리하고 임상시험에 진입할 목표를 가지고 있으며, 이와 관련하여 2023년 12월 BVAC-E6E7의 임상 1/2a상 시험 IND 신청을 하였습니다. 이후 2024년 11월 19일 IND 승인을 받아 국내에서 임상 개발에 주력할 계획입니다.
이처럼 당사는 BVAC-E6E7 파이프라인에 대한 연구개발을 지속해나가고자 하며, 이와 관련하여 향후 2026년 상반기까지 BVAC 파이프라인 자체에 총 3,323백만원의 연구개발비 집행을 계획하고 있으나, 각 세부 파이프라인 별로 얼마만큼, 어느 시점에 사용할지는 아직 확정된 부분이 없습니다. 이후 2026년 하반기부터 필요한 지출금액은 자체자금 등을 활용하여 연구개발을 지속해나갈 목표를 세우고 있습니다.
(3-2) BVAC-C
| [BVAC-C 제2a상 임상시험 결과에 관한 공시내용(2023.09.21)] |
| 구 분 | 내 용 | |
|---|---|---|
| 투자 유의사항 | 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 존재합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | 항암면역치료백신 BVAC-C의 제2a상 임상시험 결과 | |
| 2. 주요내용 | 1) 임상시험명칭 | HPV Type 16 또는 18에 양성인 자궁경부암 환자 중 표준치료에 실패한 다발성 전이를 가진 진행성 또는 재발성 환자를 대상으로 단독 투여 및 Topotecan과 병용 투여한 BVAC-C의 안전성, 내약성, 면역반응 및 예비 유효성을 평가하기 위한 공개,단계적 증량, 반복 투여, 제1/2a상 임상시험 |
| 2) 임상시험단계 | 국내 제1/2a상 임상시험 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 대한민국 | |
| 5) 임상시험실시기관 | 삼성서울병원 외 5개 기관 | |
| 6) 대상질환 | 표준치료에 실패한 다발성 전이를 가진 진행성 환자 또는 표준치료에 실패한 재발성 환자 중 HPV Type 16 또는 18에 양성인 자궁경부암 환자 | |
| 7) 신청일 | 2016-02-16 | |
| 8) 승인일 | 2016-04-29 | |
| 9) 등록번호 | 201600175 | |
| 10) 임상시험 목적 | HPV Type 16 또는 18 에 양성인 자궁경부암 환자 중 표준치료에 실패한 다발성 전이를 가진 진행성 또는 재발성 환자에서 단독 투여 및 Topotecan 과 병용 투여한 BVAC-C 의 유효성을 평가한다. | |
| 11) 임상시험 방법 | - 스크리닝 검사에서 선정/제외기준을 만족하는 대상자를 3개의 군에 1:1:1 로 순차적으로 배정함. - Group 1: BVAC-C 고용량(1.0x10^8 cells/dose)을 정맥 내(intravenous, IV) 주입으로 3 회 반복 투여함. - Group 2: BVAC-C 저용량 (5.0x10^7 cells/dose)을 정맥 내(intravenous,IV) 주입으로 4 회 반복 투여함. - Group 3 : BVAC-C 저용량 (5.0x10^7cells/dose)을 정맥 내(intravenous,IV) 주입으로 4 회 반복 투여하고 매 Topotecan 투여 방문(2주, 6주, 10주, 14주)에는 3일간 Topotecan을 투여함. |
|
| 12) 1차 지표 | - 객관적 반응율 (Overall Response Rate) - 6 개월 무진행 생존율 (Progression Free survival) - 12 개월 생존율 (survival rate) |
|
| 13) 임상시험기간 | 2018년 10월 2일 ~ 2021년 12월 1일 | |
| 14) 목표 시험대상자 수 | 21 명 | |
| 3. 시험결과 | 1) 1차 지표 통계분석방법 | - 연속형 자료는 기술통계량(시험대상자 수, 산술평균, 표준편차, 중앙값, 최소값, 최대값 등)을 제시하며,범주형 자료에 대해서는 각 범주별 시험대상자 수 및 비율을 제시함. - 중도탈락자의 중도탈락 이후 자료 또는 결측치는 대체하지 않았으며, 본 임상시험은 안전성 및 면역원성 탐색 목적의 제1/2a상 임상시험으로 검증하고자 하는 가설이 없어 통계적 유의성 검증에 해당사항 없음. |
| 2) 결과값 | 1) 객관적 반응율 : - Group 1 (고용량 3 회 투여) : 33.33% - Group 2 (저용량 4 회 투여) : 40.00% - Group 3 (저용량 4 회 투여+항암화학요법 병용) : 0.00% 2) 6 개월 무진행 생존율 : - Group 1 : 33.33% - Group 2 : 40.00% - Group 3 : 28.57% 3) 12 개월 생존율 : - Group 1 : 16.67% - Group 2 : 40.00% - Group 3 : 0.00% ※ 해당 결과값은 연구계획서 순응 대상자군 총18명(Group 1 : 6명, Group 2 : 5명, Group 3: 7명)을 기준으로 산정된 결과입니다. |
|
| 4. 사실발생(확인)일 | 2023-09-21 | |
| 5. 향후계획 | 현재 진행 중인 BVAC-C와 Durvalumab의 병용투여 연구자주도 임상시험 결과를 기반으로 BVAC-C 후기 임상시험에 대한 전략을 수립할 예정이며, 후기 임상시험 수행 후 조건부품목허가를 신청할 계획임 | |
| 6. 기타 투자판단과 관련한 중요사항 | ||
| 1) 금번 공시는 BVAC-C의 제 1/2a상 임상시험 중 임상 2a상에 대한 임상시험 결과이며, 임상 1상 결과보고서는 2019년 3월 별도 수령하였습니다. 2) 상기 사실발생(확인)일은 임상시험수탁기관(CRO)으로부터 임상 2a상 결과보고서를 수령한 날짜입니다. 3) 본 공시 내용은 향후 당사의 보도자료 및 IR자료로 사용될 예정입니다. |
||
| ※ 관련 공시 | - | |
| (자료) | DART 전자공시시스템 |
BVAC-C는 인유두종바이러스(HPV) 16형 및 18형 암항원 발현 모든 암종(자궁경부암, 두경부암, 항문암, 성기암 등)에 적용하는 항암면역치료 백신으로, 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 형태 측면에서 세계적으로 First-in-class, First-in-kind 의약품입니다. 임상1상에서 안전성과 경쟁제품 대비 우월한 예비 유효성을 확인하였고, 임상2a상에서 완전관해 반응 등을 관찰하였습니다.
| [임상 2b/3상 개요] |
| 구분 | 개요 |
|---|---|
| 임상시험 목적 | HPV type 16 또는 18에 양성인 자궁경부암 환자 중 표준치료에 실패한 전이성/재발성 환자를 대상으로 BVAC-C의 유효성을 표준치료와 비교하여 입증한다. |
| 임상시험 대상국가 | 대한민국 외 (미정) |
| 임상시험 수행방법 | 시험 대상자 : 총 170명 (2b상 : 102명, 3상: 68명) 대상자 수는 기존 2차 치료로 사용되는 항암화학요법의 무진행생존기간 중앙값은 약 3개월로 BVAC-C 임상 1/2a상 시험에서 관찰된 최소 무진행생존기간 중앙값 약 5개월에 기반하여 산정하였습니다. 본 임상시험 수행을 위해 필요한 대상자 수는 임상 2b상 시험에 약 102명 (시험군:대조군=1:1) 임상 3상 시험에 68명 (시험군:대조군=1:1)로 임상 2b상 시험결과에 따라 중간분석을 수행하고 해당 결과로 조건부 품목허가를 받을 경우, 본 임상시험이 아닌 별도의 임상 3상 시험을 수행할 예정입니다. 원활한 대상자 모집을 위해 글로벌 임상시험을 고려하고 있으며, 각 의약품의 투여방식 한계로 관찰자 눈가림으로 수행될 예정입니다. 기존 임상시험에서의 대상자 모집 속도를 고려하여 2b상의 대상자 모집에 약 18개월, 이후 추적관찰에 약 24개월이 소요될 것으로 예상합니다. |
| 기대효과 | BVAC-C는 당사에서 개발한 최초의 B세포 및 단구세포를 이용한 항암면역치료백신으로 first in class 제품입니다. 본 제품의 신속한 개발을 통해 조건부 품목 허가를 득할 경우, 플랫폼 자체의 안전성이 입증되며, 후속 의약품의 개발도 가속화될 것으로 예측됩니다. |
| (자료) | 당사 제시 |
당사는 현재 면역관문 저해제와 병용투여 임상2a상 연구자 주도 임상시험을 진행 중이며, 향후 임상2b/3상 단계에 진입하여 후속 개발을 해나갈 목표를 가지고 있습니다.
이처럼 당사는 BVAC-C 파이프라인에 대한 연구개발을 지속해나가고자 하며, 이와 관련하여 향후 2026년 상반기까지 BVAC 파이프라인 자체에 총 3,323백만원의 연구개발비 집행을 계획하고 있으나, 각 세부 파이프라인 별로 얼마만큼, 어느 시점에 사용할지는 아직 확정된 부분이 없습니다. 이후 2026년 하반기부터 필요한 지출금액은 자체자금 등을 활용하여 연구개발을 지속해나갈 목표를 세우고 있습니다.
당사는 상기 내용과 같이, 주요 파이프라인에 대한 연구개발비로 당사 공모자금을 집행할 계획입니다. 다만, 이는 현 시점에서 당사의 주요 파이프라인별 임상 단계, 향후 계획 등을 고려하여 수립한 예산에 따른 것이므로 향후 당사의 파이프라인별 실시간 점검, 연구개발 성공 가능성 점검, 대내외적 자금조달 환경 또는 영업환경 등의 변화 등 향후 당사 영업활동 과정에서 세부 집행 계획은 변동될 수 있습니다.
다. 유상증자 진행 배경
당사는 2024년도에 주주배정 후 실권주 일반공모 유상증자를 진행하여 AdCLD-CoV19-1 OMI 백신 임상 3상 비용 및 BVAC 파이프라인에 대한 연구개발비 등의 목적으로 약 232억원을 조달하였습니다. 하지만 국내에서 임상 대상자 수가 400명에서 1,129명으로 늘어나면서 CRO(임상수탁기관) 및 실시기관비용이 증가하였고, 계약 당시 1,350원대였던 원화 환율은 대금 지급 시점에 1,450원대까지 치솟으면서 당사의 예상보다 비용이 증가하였습니다. 게다가 2024년 유상증자 당시 임상 3상 시험의 중간분석 결과 도출 시기를 2025년 1분기로 계획하고 예상하였으나, 해외 임상시험 수행으로 현지 보건 당국의 규제 및 절차로 임상시험대상자 투여완료에 추가 시일이 발생하였고, 임상시험 승인에 베트남 6개월, 필리핀 3개월이 각각 추가 소요되었습니다.
이에 따라 다국가 임상 3상 수행비용은 최초 계획 때 국내 약 48억원, 해외 약 111억원으로 총 159억원이었으나, 실제로는 국내 약 80억원, 해외 약 107억원으로 총 187억원이 소요되었으며, 약 2,758백만원 차이가 발생하였습니다. 2024년 증자 자금사용목적 중 다국가 임상 3상 수행비용을 위한 자금으로 11,228백만원을 편성하였으며, 이는 최초 계획 때 편성한 15,907백만원에 비해 4,679백만원이 부족한 금액입니다. 따라서 당사는 금번 증자의 자금조달 목적 중 부족한 다국가 임상 3상 수행비용 7,437백만원 중 7,214백만원을 계획하고 있으며, 나머지 금액인 223백만원은 자체 현금 등으로 충당하여 진행할 예정입니다.
| [다국가 임상 3상 수행비용 계획 및 실제내역] |
| (단위 : 백만원) |
| 최초 계획 | 실제 | ||
|---|---|---|---|
| 구분 | 금액 | 구분 | 금액 |
| 국내 | 4,782 | 국내 | 7,964 |
| 해외(베트남, 필리핀) | 11,125 | 해외(베트남, 필리핀) | 10,701 |
| 합계 | 15,907 | 합계 | 18,665 |
| (자료) | 당사 제시 |
또한 당사는 2025년 3월 26일 주주총회에서 밝혔듯이 2024년 유상증자 전후, 코로나 예방백신 및 항암치료제 개발에 시너지를 내기 위한 사업파트너 물색 및 제3자 배정 유상증자 대상 및 투자자 발굴을 위해 다방면의 노력을 하였으나, 당사의 사업구조에 적합한 사업파트너 및 투자자 발굴에 어려움을 겪었으며, 정부 지원 및 정책 자금의 한계를 느끼게 되었습니다. 이에 당사는 예상치 못한 임상 비용의 증가 및 사모 자금조달의 어려움을 느끼면서 다시 한번 불가피하게 본 공모 유상증자를 진행하게 되었고, 곧바로 주주서한을 당사 홈페이지에 게재하고 최근 주주총회에서도 본 공모 유상증자의 배경과 필요성, 코로나19 백신 임상시험의 진행 현황 및 향후 계획 등에서 대해서 최대한 소통을 하기 위해 노력하였습니다.
당사의 본 공모 유상증자 추진 목적은 AdCLD-CoV19-1 OMI 백신의 조건부 품목허가 신청 및 생산, BVAC 파이프라인에 대한 연구개발비 등을 위한 운영자금입니다. 당사는 2023년 5월 23일 식품의약품안전처에 오미크론 전용 코로나19 백신 'AdCLD-CoV19-1 OMI'의 임상 3상 시험계획(IND)를 제출하였으며, 2023년 7월 21일에 'AdCLD-CoV19-1 OMI' 임상 3상 승인을 획득하였습니다. 이후 2024년 11월 12일 진행중이던 AdCLD-CoV19-1 OMI의 임상 3상시험 대상자에게 투여 완료하였으며, 식약처에 안전성 및 면역원성 중간 분석 결과를 종합하여 AdCLD-CoV19-1 OMI의 조건부 품목허가를 신청할 계획입니다. 임상 3상에서 확보한 결과를 기반으로 조건부 품목허가를 받고, 신규 변이에 대응한 백신은 정부로부터 긴급사용승인을 받은 후 수의 계약 혹은 입찰 형태 계약으로 참여하여 확정이 된다면 정부 조달 시장에 공급이 가능할 것으로 예상하고 있습니다. 이에 상기 기재한 공모자금 세부 사용목적에 따라 해당 백신의 조건부 품목허가 신청 및 생산 등을 위한 운영자금 등 필요한 추가 자본을 조달하고 있는 상황입니다.
또한 당사 파이프라인 중 인유두종바이러스(HPV)에 의해 유도되는 두경부암 환자를 대상으로 하는 자가세포치료제인 BVAC-E6E7 및 인유두종바이러스(HPV) 16형 및 18형 암항원 발현 모든 암종(자궁경부암, 두경부암, 항문암, 성기암 등)에 적용하는 항암면역치료 백신인 BVAC-C 등 BVAC 파이프라인과 관련하여 2026년 상반기까지 임상시험에 필요한 자금을 조달하고자 합니다.
당사의 BVAC-E7E7는 HPV 특이적인 면역반응을 유도하여 HPV 감염에 의한 암세포의 특이적 사멸을 유도하는 예방 백신과는 차별화된 특이적 치료 방법으로, HPV에 의해 유도된 두경부암 환자를 대상으로 임상시험을 준비하고 있으며, HPV 예방 백신의 한계 극복을 위해 현재 개발중인 백신입니다. BVAC-C는 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 형태 측면에서 세계적으로 First-in-class, First-in-kind 의약품입니다. 특히, 임상1상에서 안전성과 경쟁제품 대비 우월한 예비 유효성을 확인하였고, 임상2a상에서 완전관해 반응 등을 관찰하였습니다.
라. 주주 권익 보호를 위한 사항
반복되는 자금조달로 인해 주주들의 희석화 우려 및 앞으로의 회사 발전 방향 등 시장에서 야기되는 문제들에 대해 당사는 증권신고서 제출 전일에 주주서한을 홈페이지에 게시하여 금번 공모 유상증자와 관련된 주요 일정, 세부 사항, 목적 및 필요성을 투명하게 제공하였습니다. 또한, 이를 본 유상증자 투자설명서 발송 시 주주 서한 형태의 안내문을 통해 개별적으로 다시 한 번 고지할 예정입니다.
| [주주서한] |
 |
|
주주서한 |
| 자료 : 당사 홈페이지 |
또한 더 면밀하고 상세한 기업실사를 위해 단순히 대표주관사에게만 기업실사를 의존하는게 아니라 회계법인을 선임하여 실사에 대한 용역 계약을 맺고 주관사, 회계법인 투트랙의 기업 실사를 진행하였습니다. 게다가 이사회에서도 단순히 본 유상증자에 정량적 조건에 따른 결의만 진행한 게 아니라, 유상증자의 당위성 및 주주소통 절차 등 주주 보호를 위해 정성적 기준으로 본 유상증자에 대한 목적 및 필요성 등을 논의하였으며, 이러한 조치를 통해 당사는 유상증자 절차의 투명성을 확보하고, 주주의 신뢰를 제고하는 데 최선을 다하기 위해 노력하고 있습니다.
| [이사회의사록_발췌] |
 |
|
이사회의사록_발췌 |
| 자료 : 당사 제시 |
당사는 유상증자와 관련된 주요 일정, 세부 사항, 목적 및 필요성을 전자공시시스템(DART) 및 회사 홈페이지를 통해 투명하게 제공할 예정입니다. 또한, 유상증자 투자설명서 발송 시 주주 서한 형태의 안내문을 통해 개별적으로 안내해드릴 계획입니다.
아울러, 유상증자의 목적과 중요성에 대한 주주 여러분의 이해를 돕기 위해 2025년 3월 26일 개최되는 제19기 정기주주총회에서 배경 및 필요성을 상세히 설명드릴 예정입니다.
또한, 주주 여러분과의 실시간 소통을 강화하기 위해 주주의 문의에 대하여 IR팀에서 신속히 응대하고, 주요 질의사항에 대한 답변을 정리하여 FAQ 형태로 홈페이지에 게시함으로써 소액 주주를 포함한 모든 주주의 정보 접근성을 높이고자 합니다.
당사는 상기와 같이 주주 및 시장과의 적극적인 소통을 통해 회사의 경영 전략 및 본 유상증자의 배경과 필요성을 명확히 전달하는 한편, 본 유상증자와 관련 후속 정보를 지속적으로 제공해 나가겠습니다.
3. 자금의 운용계획
공모자금 입금 후 실제 투자집행 시기까지의 자금보유 기간에는 국내 제 1금융권 및 증권사 등 안정성이 높은 금융기관의 상품에 예치할 계획이며, 자금의 사용시기가 도래하여 단기간 내에 자금의 사용이 예상되는 경우에는 당사의 단기금융상품 계좌 등에 일시 예치하여 운용할 예정입니다.
한편, 동 금액은 임상시험 비용만을 포함하고 있으며 실제 당사의 전체 경상연구개발비와 차이가 있을 수 있습니다. 당사는 필요 시 추가로 소요되는 자금은 자체자금 또는 외부 차입/투자유치 등 재무활동을 통해 조달할 예정입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
해당사항 없습니다.
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 개황
연결대상 종속회사 현황(요약)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | - | 1 | 1 | - | - |
| 합계 | - | 1 | 1 | - | - |
1-1. 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
(주)포베이커 | 당반기 중 흡수합병을 완료함. |
| - | - |
주) 당사는 2024년 3월 12일 이사회 결의에 의거하여 주식회사 포베이커를 소규모 합병의 형태로 흡수합병을 결정하였습니다. 또한 2024년 5월 14일을 합병기일로 하여 흡수합병을 완료하였습니다. 자세한 내용은 2024년 3월 12일 '주요사항보고서(회사합병결정)' 과 2024년 5월 21일 '합병등종료보고서(합병)' 공시를 참고하시기 바랍니다.
나. 회사의 법적ㆍ상업적 명칭
당사의 명칭은 "주식회사 셀리드"라고 표기합니다. 영문으로는 Cellid Co., Ltd. 라고 표기합니다. 약식으로 표기할 때는 (주)셀리드 또는 Cellid라고 합니다.
다. 설립일자
당사는 연구중심의 항암면역치료백신 및 COVID-19 예방백신 개발 전문 바이오벤처기업으로서 2006년 12월 11일 서울특별시에 설립되었습니다.
라. 본사의 주소, 전화번호, 홈페이지 주소
| 구분 | 주소 |
|---|---|
| 주소 | 서울특별시 관악구 관악로 1 서울대학교 142동 5층 |
| 전화번호 | (02) 3285-7860 |
| 홈페이지 | www.cellid.co.kr |
마. 중소기업 등 해당 여부
중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
바. 주요 사업의 내용
당사는 지난 2006년 12월에 설립되어 자체 원천기술인 CeliVax를 기반으로 항암면역치료백신과 아데노바이러스 벡터 기반 COVID-19 예방백신을 개발하고 있습니다. 항암면역치료백신은 제품별로 임상시험ㆍ비임상시험을 진행하고 있으며, 오미크론 전용 코로나19 백신 'AdCLD-CoV19-1 OMI'는 식품의약품안전처로부터 임상 3상 IND를 승인받고 2024년 11월 13일 임상 3상 시험 대상자에게 투여 완료하였습니다. 당사는 2020년 12월 완공한 자체 GMP시설을 활용하여 바이오의약품의 위탁생산(CMO) 및 위탁개발생산(CDMO) 사업을 전개하고 있습니다. 또한, 이커머스 사업을 통해 베이킹재료, 각종 소모품, 베이킹 기자재 등 온라인 식품 유통 판매업을 영위하고 있습니다.
제품별 자세한 사항은 동 공시서류의 “Ⅱ. 사업의 내용”을 참조하시기 바랍니다.
사. 신용평가에 관한 사항
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
아. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 코스닥시장 상장 | 2019년 02월 20일 | 기술성장기업의 코스닥시장 상장 |
2. 회사의 연혁
가. 회사의 본점 소재지 및 그 변경
| 일자 | 소재지 | 비고 |
|---|---|---|
| 2006.12.01 | 서울특별시 관악구 봉천동 218-32 | 설립 시 본점 |
| 2009.12.22 | 서울특별시 관악구 신림동 산56-1 서울대학교 203동 5층 | 본점 이전 |
| 2014.04.07 | 서울특별시 관악구 관악로 1 서울대학교 142동 5층 | 본점 이전 |
나. 경영진 및 감사의 중요한 변동
경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2020.03.25 | 정기주총 | 사내이사 정세현 | 대표이사 강창율 사내이사 오태권 기타비상무이사 안종성 |
- |
| 2021.03.24 | 정기주총 | - | 기타비상무이사 이정화 | - |
| 2021.09.30 | - | - | - | 사내이사 오태권 |
| 2022.03.23 | 정기주총 | - | 감사 박명환 | - |
| 2023.03.29 | 정기주총 | 사내이사 김유경 기타비상무이사 곽의종 |
대표이사 강창율 사내이사 정세현 |
기타비상무이사 안종성 |
| 2024.03.28 | 정기주총 | 사내이사 김민수 (주1) | - | 기타비상무이사 이정화 (주2) |
| 2024.04.01 | - | - | - | 사내이사 정세현 (주3) |
(주1) 2024년 3월 28일 개최된 제18기 정기주주총회에서 사내이사 김민수가 신규 선임 되었습니다.
(주2) 기타비상무이사 이정화는 2024년 3월 23일 임기만료로 사임하였습니다.
(주3) 사내이사 정세현은 2024년 4월 1일 일신상의 이유로 사임하였습니다.
다. 최대주주의 변동
당사는 설립 이후 현재까지 최대주주의 변동은 없습니다.
라. 상호의 변동
당사는 설립 이후 현재까지 상호의 변경은 없습니다.
마. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행 중인 경우 그 결과
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
바. 회사가 합병 등을 한 경우 그 내용
(1) SK V1 TOWER 6층 (자산양수도)
당사는 2019년 8월 6일자 이사회 결의에 의거 2020년 1월 3일자로 경기도 성남시 중원구 상대원동 145-1,2,4번지 SK V1 TOWER 6층 7개호실을 케이비부동산신탁주식회사와 김종평으로부터 3,086 백만원에 인수하였습니다. 자세한 내용은 2019년 8월 6일 '주요사항보고서(유형자산양수결정)' 과 2020년 1월 31일 '합병등 종료보고서(자산양수도)' 공시를 참고하시기 바랍니다.
(2) SK V1 TOWER 4층 (자산양수도)
당사는 2020년 2월 3일자 이사회 결의에 의거 2020년 2월 21일자로 경기도 성남시 중원구 상대원동 145-1,2,4번지 SK V1 TOWER 4층 6개호실을 케이비부동산신탁주식회사와 장연식으로부터 3,178 백만원에 인수하였습니다. 자세한 내용은 2020년 2월 3일 '주요사항보고서(유형자산양수결정)' 과 2020년 2월 21일 '합병등 종료보고서(자산양수도)' 공시를 참고하시기 바랍니다.
(3) 소규모합병
당사는 2024년 3월 12일 이사회 결의에 의거하여 주식회사 포베이커를 소규모 합병의 형태로 흡수합병을 결정하였습니다. 2024년 5월 14일을 합병기일로 하여 흡수합병을 완료하였습니다. 자세한 내용은 2024년 3월 12일 '주요사항보고서(회사합병결정)' 과 2024년 5월 21일 '합병등종료보고서(합병)' 공시를 참고하시기 바랍니다.
사. 회사의 업종 또는 주된 사업의 변화
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
아. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
| 일자 | 주요내용 | 비고 |
|---|---|---|
| 2019.02 | 코스닥시장 상장 | - |
| 2019.08 | 성남 SK V1 TOWER 계약 (6층) | 케이비부동산신탁(주) 외 |
| 2020.02 | 성남 SK V1 TOWER 계약 (4층) | 케이비부동산신탁(주) 외 |
| 2020.03 | BVAC-P 제품 임상 1상 IND 승인 | 식품의약품안전처 |
| 2020.07 | 과학기술정보통신부 국책과제 선정 | 총 사업비 4,933백만원 |
| 2020.12 | 코로나바이러스감염증-19 예방백신 임상 1/2a상 시험 계획 승인 |
식품의약품안전처 |
| 2021.03 | 범부처신약개발사업단 국책과제 선정 | 총 사업비 8,430백만원 |
| 2021.03 | 전환사채권 발행(190억원) | 데일리바이오헬스케어1호창업 벤처전문사모투자 합자회사 |
| 2021.05 | 개인맞춤형 항암면역치료백신 라이선스 계약 체결 |
1. 계약상대방 : LG화학 2. 계약금액 : (1) 선급금 100백만원 (2) 마일스톤료 : 단계별 최대 182,500백만원 수령 예정 (3) 로열티 : 순매출액에 따라 별도 수령 예정 |
| 2021.07 | 코로나바이러스감염증-19 예방백신 임상 1/2a상 시험 계획 변경 승인 |
식품의약품안전처 |
| 2022.01 | 코로나바이러스감염증-19 예방백신 임상 2b상 시험 계획 승인 |
식품의약품안전처 |
| 2022.05 | 코로나19 치료제·백신 신약개발사업단 국책과제 선정 |
총 사업비 3,949백만원 |
| 2022.08 | 코로나바이러스감염증-19 예방백신 부스터샷 임상 1/2상 시험 계획 승인 |
식품의약품안전처 |
| 2022.08 | 코로나19 치료제·백신 신약개발사업단 국책과제 선정 |
총 사업비 11,078백만원 |
| 2022.09 | 이중표적 CAR-T세포 위수탁 계약 체결 |
1. 계약상대방 : 이노베이션바이오 2. 계약 금액 : 480백만원 3. 계약 조건 : 본 계약 이후 임상 1/2상 IND 승인에 따른 임상시험약 위수탁 추가계약에 우선협상 대상자 참여 예정 |
| 2022.12 | 코로나바이러스감염증-19 예방백신 임상 2b상 시험 조기종료 보고 |
식품의약품안전처 |
| 2023.03 | 이중표적 CAR-T세포 위수탁계약 체결 |
1. 계약상대방 : 이노베이션바이오 2. 계약 금액 : 4,890백만원 3. 계약 조건 : 임상 1/2a상 임상시험용의약품 제조 및 납품 |
| 2023.05 | 글로벌백신기술선도사업단 국책과제 선정 |
총 사업비 1,355백만원 |
| 코로나바이러스감염증-19 예방백신 부스터샷 임상 3상 시험 계획 신청 |
식품의약품안전처 | |
| 2023.07 | 마곡 신사옥 및 R&D센터에 대한 신규시설 투자 |
투자금액 23,685백만원 |
| 마곡 신사옥 및 R&D센터 신규시설 투자 차입금에 대한 담보 제공 |
1. 채무자 : 마곡컨소시엄제일차(주) 2. 채권자 : 하나캐피탈(주) 외 3. 채무금액 : 32,560백만원 4. 담보설정금액 : 42,328백만원 5. 담보제공재산 : 관리형토지신탁에 따른 우선수익권 외 |
|
| 코로나바이러스감염증-19 예방백신 부스터샷 임상 3상 시험 계획 승인 |
식품의약품안전처 | |
| 2023.09 | 주주우선공모 신주 발행 | 1. 발행수량 : 3,871,785주 2. 발행금액 : 17,481백만원 3. 신주상장 및 유통일 : 2023년 9월 25일 |
| 2023.11 | 자산재평가 | 1. 재평가 목적물 : 토지 2. 재평가 기준일 : 2023년 12월 31일 3. 재평가 금액 : 23,383백만원 4. 재평가 차액 : 15,138백만원 |
| 2024.03 | (주)포베이커 자회사 편입 | 주식양수도 계약 체결 |
| 2024.05 | (주)포베이커 흡수합병 완료 | - |
| 2024.08 | 주주배정후 실권주 일반공모 유상증자 신주 발행 |
1. 발행수량 : 7,500,000주 2. 발행금액 : 23,175백만원 3. 신주상장 및 유통일 : 2024년 08월 23일 |
3. 자본금 변동사항
당사는 본 보고서 작성기준일 현재 기업공시서식 작성기준에 따른 소규모 기업에 해당하므로 상기 자본금 변동추이를 기재하지 않았습니다.
4. 주식의 총수 등
가. 주식의 총수
주식의 총수 현황
| (기준일 : | 2025년 04월 14일 | ) | (단위 : 주, %) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 75,000,000 | 25,000,000 | 100,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 21,102,977 | - | 21,102,977 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | - | - | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | - | - | - | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 21,102,977 | - | 21,102,977 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 21,102,977 | - | 21,102,977 | - | |
| Ⅶ. 자기주식 보유비율 | - | - | - | - | |
나. 자기 주식
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
다. 다양한 종류의 주식
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
5. 정관에 관한 사항
가. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2020.03.25 | 제14기 정기주주총회 | 제2조(목적) 제17조(전환사채의 발행) 제18조(신주인수권부사채의 발행) 제19조(이익참가부사채의 발행) 제20조(교환사채의 발행) |
- 관련 사업 확장가능성에 따른 신규 목적사업 추가 - 한도 증액 - 한도 증액 - 한도 증액 - 한도 증액 |
| 2022.03.23 | 제16기 정기주주총회 | 제2조(목적) 제8조의 2(주식 등의 전자등록) 제47조(감사의 선임) |
- 관련 사업 확장가능성에 따른 신규 목적사업 추가 - 전자증권제도 도입 반영 - 감사 선임에 관한 조문 정비 및 전자투표 도입 시 결의 요건 내용 반영 |
| 2024.03.28 | 제18기 정기주주총회 | 제2조(목적) 제10조(신주인수권) 제39조의2(이사의 책임감경) |
- 신사업 진행을 위한 사업 목적 추가 - 긴급한 자금조달을 위해 대상자 범위 확대를 위한 조문 정비 - 표준정관에 따른 조항 신설 |
나. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| 1 | 면역학 및 분자생물학 기법을 이용한 신약의 연구개발 및 제조, 판매업 | 영위 |
| 2 | 위 연구개발에 따른 국내외에서의 지적재산권 획득 및 이전 | 영위 |
| 3 | 면역학 및 분자생물학 기법을 이용한 연구용역사업 | 미영위 |
| 4 | 의약품 및 건강기능식품의 제조, 판매 및 수출입업 | 영위 |
| 5 | 의약품 및 건강기능식품의 재료 제조, 판매 및 수출입업 | 영위 |
| 6 | 의약품 및 건강기능식품의 수탁업, 자문업 | 영위 |
| 7 | 의료용품의 제조, 수입, 판매공급업 | 미영위 |
| 8 | 세포치료제 유통, 판매에 대한 권리양도 | 미영위 |
| 9 | 의약품 관련 연구개발업, 수탁업, 자문업 | 영위 |
| 10 | 국내외의 다른 기관과 공동연구 | 미영위 |
| 11 | 국내외의 다른 단체(기관)로부터 기술연구 등 용역수탁 | 영위 |
| 12 | 세포치료제 연구 및 개발사업 | 영위 |
| 13 | 유전공학방식을 이용한 신약연구 및 개발업 | 영위 |
| 14 | 임상약리학적 검사업 | 미영위 |
| 15 | 진단검사 중개업 | 미영위 |
| 16 | 부동산 매매 및 임대업 | 미영위 |
| 17 | 수입품의 판매업 및 위탁업 | 미영위 |
| 18 | 원료와 제품의 판매업 및 동 대행업 | 미영위 |
| 19 | 비임상 및 임상실험 대행업 | 미영위 |
| 20 | 실험동물을 이용한 연구 대행 및 자문업 | 미영위 |
| 21 | 실험동물 관련 연구개발업 및 이에 관련한 제품의 제조와 수출입업 | 미영위 |
| 22 | 전자상거래 도소매업 | 영위 |
| 23 | 식품수입업 | 미영위 |
| 24 | 곡물 혼합 분말 및 반죽 제조업 | 미영위 |
| 25 | 통신판매업 | 영위 |
다. 사업 목적 변경
1. 사업목적 변경 내용
| 구분 | 변경일 | 사업목적 | |
|---|---|---|---|
| 변경 전 | 변경 후 | ||
| 추가 | 2022년 03월 23일 | - | 19. 비임상 및 임상실험 대행업 |
| 추가 | 2022년 03월 23일 | - | 20. 실험동물을 이용한 연구 대행 및 자문업 |
| 추가 | 2022년 03월 23일 | - | 21. 실험동물 관련 연구개발업 및 이에 관련한 제품의 제조와 수출입업 |
| 추가 | 2024년 03월 28일 | - | 22. 전자상거래 도소매업 |
| 추가 | 2024년 03월 28일 | - | 23. 식품수입업 |
| 추가 | 2024년 03월 28일 | - | 24. 곡물 혼합 분말 및 반죽 제조업 |
| 추가 | 2024년 03월 28일 | - | 25. 통신판매업 |
2. 변경 사유
마곡 신사옥 입주 후 비임상 및 동물실험 연구 수탁기관 사업 진행을 위해 이사회에서 주주총회 안건으로 상정되었으며, 2022년 3월 23일 개최한 제16기 정기주주총회에서 특별결의 요건을 충족하여 정관 목적사업을 추가하였습니다.
2024년 3월 당시, 자회사 (주)포베이커를 흡수합병하여 신규 사업 진행을 위해 이사회에서 주주총회 안건으로 상정되었으며, 2024년 3월 28일 개최한 제18기 정기주주총회에서 특별결의 요건을 충족하여 정관 목적사업을 추가하였습니다.
정관상 사업목적 추가 현황표
| 구 분 | 사업목적 | 추가일자 |
|---|---|---|
| 1 | 비임상 및 임상실험 대행업 | 2022.03.23 |
| 2 | 실험동물을 이용한 연구 대행 및 자문업 | 2022.03.23 |
| 3 | 실험동물 관련 연구개발업 및 이에 관련한 제품의 제조와 수출입업 | 2022.03.23 |
| 4 |
전자상거래 도소매업 |
2024.03.28 |
| 5 |
식품수입업 |
2024.03.28 |
| 6 |
곡물혼합분말 및 반죽제조업 |
2024.03.28 |
| 7 |
통신판매업 |
2024.03.28 |
2022년 3월 23일 추가된 3개의 사업목적은 영위하고자 하는 사업의 내용이 유사하여 아래와 같이 통합하여 기재합니다.
(1) 그 사업 분야(업종, 제품 및 서비스의 내용 등) 및 진출 목적
비임상 시험은 신약개발 과정에서 사람을 대상으로 하는 임상시험 전 단계로 독성(안전성)과 약효(유효성)를 동물실험을 통하여 사전 검증하는 시험입니다. 당사는 항암면역치료백신 및 감염성 예방질환 백신을 개발하는 회사로 당사의 제품개발 속도 가속화에 기여하기 위해 신약 개발에 필수적인 동물실험실을 마곡 신사옥에 구축할 계획입니다. 당사의 우수한 R&D 역량과 동물실험실을 활용하여 비임상 CRO 사업에 진출이 가능할 것으로 판단하였습니다.
(2) 시장의 주요 특성ㆍ규모 및 성장성
전 세계적으로 바이오 및 제약업체들의 신약 개발 투자가 증가하고 있는 추세로 동물실험 등 비임상 CRO는 지속적으로 성장할 것으로 예상됩니다. 한국바이오산업정보서비스가 발간한 글로벌 CRO 시장 현황 및 전망 보고서에 따르면 비임상 CRO 시장은 2021년 167.4억 달러에서 2027년 320.1억 달러로 연평균 11.4% 증가할 전망입니다. 식품의약품안전처의 허가를 받아 임상시험에 진입하기 위해서는 객관적인 자료 확보가 중요한 상황이며, 이를 위해 체계적이고 전문적인 연구인력, 시험 장비 및 시설, 동물실험실 인허가 등을 보유한 전문 업체에 벤처기업, 중소형 제약사 등 다양한 신약개발 업체들이 아웃소싱을 하고 있습니다.
(3) 신규사업과 관련된 투자 및 예상 자금소요액 (총 소요액, 연도별 소요액), 투자자금 조달원천, 예상투자회수기간 등
당사는 신규 파이프라인 개발 가속화를 위해 2026년 3월 준공 예정인 마곡 신사옥 및 R&D센터 내 동물실험실을 구축할 예정이며, 해당 실험실을 사업에 활용할 계획으로 공시 작성기준일 현재 별도의 투자 계획은 없습니다.
(4) 사업 추진현황 (조직 및 인력구성 현황, 연구개발활동 내역, 제품 및 서비스 개발 진척도 및 상용화 여부, 매출 발생여부 등)
당사는 2006년 12월 설립 후 자체 원천 기술을 활용한 항암면역치료백신 및 감염성 예방백신을 개발하고 있으며, 비임상시험 연구결과를 진행하여 식품의약품안전처로부터 다수의 임상시험 계획을 승인받은 바 있습니다. 이에 당사는 비임상 대행 사업 추진 시 보유하고 있는 연구인력, 설비 등을 활용할 계획입니다.
(5) 기존 사업과의 연관성 및 주요위험
비임상 CRO 산업의 특성상 초기투자비용이 높고, 높은 수준의 시험기자재, 숙련된 연구원 등 인프라 구축이 필요함에 따라 진입장벽이 높은 산업적 특성을 가지고 있습니다. 당사는 자체 파이프라인 개발을 통해 높은 수준의 R&D 역량을 보유하고 있으며, 신규 파이프라인 개발을 위해 구축 중인 동물실험실을 활용하여 사업을 진행할 계획으로 기존 영위 사업에 큰 영향을 미치지 않을 것으로 판단하고 있습니다.
(6) 미추진 사유 및 향후 추진계획
당사는 2023년 7월 7일 마곡 대규모 산업클러스터 단지 내 신사옥 및 R&D센터 구축에 대한 투자를 결정하고 센터 내 동물실험실을 구축 중으로 본격적인 조직 및 인력구성, 연구개발 활동, 매출 등이 발생하지 않았으며, 2026년 3월 준공 완료 후 사업을 추진할 계획입니다.
2024년 3월 28일 추가된 4개의 사업목적은 영위하고자 하는 사업의 내용이 유사하여 아래와 같이 통합하여 기재합니다.
(1) 그 사업 분야(업종, 제품 및 서비스의 내용 등) 및 진출 목적
㈜셀리드는 신규사업 추진을 위하여 합병회사 ㈜셀리드가 피합병회사 ㈜ 포베이커를 합병비율 1.000000 : 0.000000 으로 흡수(소규모)합병을 결정하였으며, 2024년 5월 14일을 합병기일로 하여 합병을 완료하였습니다. 본 소규모(흡수) 합병을 통해 안정적인 매출을 확보함으로써 당사의 재무구조 개선 및 계속기업으로서의 기반을 마련하였습니다.
(2) 시장의 주요 특성ㆍ규모 및 성장성
베이커리 유통 및 판매를 영위하고 있으며, 시장은 식사 대용 빵을 찾는 소비자들이 늘면서 베이커리 산업이 성장 추세입니다. 한국농수산식품유통공사(aT)에 따르면 세계 빵류 시장규모는 2028년 591달러로 연평균 성장률 5.12%로 성장할 것으로 전망되고 있습니다.
(3) 신규사업과 관련된 투자 및 예상 자금소요액 (총 소요액, 연도별 소요액), 투자자금 조달원천, 예상투자회수기간 등
내부 영업비밀 사항으로 공시기준에 따라 기재를 생략합니다.
(4) 사업 추진현황 (조직 및 인력구성 현황, 연구개발활동 내역, 제품 및 서비스 개발 진척도 및 상용화 여부, 매출 발생여부 등)
내부 영업비밀 사항으로 공시기준에 따라 기재를 생략 합니다.
(5) 기존 사업과의 연관성 및 주요 위험
해당사항 없음
(6) 향후 추진계획
당사는 2024년 5월 14일을 합병기일로 하여 (주)포베이커 흡수합병을 완료하였습니다. 이커머스 사업부를 신설해 베이커리 유통 및 판매 사업을 영위해 매출을 확보하고 있습니다.
II. 사업의 내용
1. 사업의 개요
당사는 항암면역치료백신 기반기술인 CeliVax와 아데노바이러스 벡터 기반 감염병 예방백신 기반기술인 Ad5/35를 보유한 바이오제약기업으로, 2종의 기반기술을 활용한 다양한 신약 파이프라인을 개발 중입니다. 개발 중인 파이프라인의 기술이전을 추구하면서, 독자적인 사업화를 통한 매출창출을 목표로 합니다. CeliVax 항암면역치료백신과 COVID-19 예방백신을 연구개발하고 있는 회사로 본 보고서 작성기준일 현재 보유 파이프라인의 상용화를 위해 임상연구 및 비임상연구를 진행하고 있습니다. 보유한 파이프라인의 연구시약 매입, 임상연구 및 제조 위탁을 하고 있으며, 이를 하기 보고서에 기술하였습니다.
CeliVax 기반기술을 활용한 6종의 항암면역치료백신 파이프라인과 COVID-19 예방백신을 개발 중이며 현재 비임상 또는 임상 단계의 연구 중으로 시판 중인 제품은 없습니다. 따라서, 판매조직은 구성되어 있지 않습니다. CeliVax 기반기술은 세포유전자치료제 형태의 항암면역치료백신 기반기술로서 환자 자신의 B세포와 단구를 채집하여 원료로 사용합니다. 환자의 암세포를 타깃할 수 있도록 환자 암세포가 발현하는 암항원 유전자를 자가 B세포와 단구에 도입하고, 알파-갈락토실세라마이드라는 면역증강제를 추가함으로써, 암세포를 살상할 수 있는 적응면역계의 T세포반응, 항체반응과 선천면역계의 자연살해세포, 자연살해 T세포 반응을 강력히 유도합니다. BVAC-C 등 여러 파이프라인을 개발 중이며, BVAC-C 임상 2a상 시험에 참여한 환자에서 완전관해반응 등을 관찰하였습니다. 현재는 BVAC-C와 면역관문 저해제의 병용투여 임상시험을 진행함과 동시에, 두경부암을 타겟으로 하는 BVAC-E6E7는 2023년 12월 18일 임상1/2a상 시험계획을 식품의약품안전처에 제출하였으며, 2024년 11월 19일 임상1/2a상 시험계획을 승인 받아 대상자 모집을 시작할 계획입니다. BVAC-E6E7은 BVAC-C에 사용된 것과 같은 암 항원을 사용하며, 생산성 측면에서 크게 개선된 개량 아데노바이러스 벡터를 활용합니다.
당사는 아데노바이러스 5/35 벡터 예방백신 기반기술을 활용한 코로나 백신의 임상 1/2a상 시험을 통해 우수한 안전성과 중화항체 및 T 세포 반응유도를 확인하였으며, 대량생산이 가능한 AdCLD-CoV19-1 백신을 추가 개발하여 임상시험에 진입함에 따라 안전성 및 면역원성 자료를 확보하였습니다. 현재는 코로나19 변이에 대응하기 위해 동일 플랫폼을 활용한 오미크론 변이 코로나 바이러스 추가접종 백신 AdCLD-CoV19-1 OMI를 개발하여 임상 1/2상 시험계획을 2022년 8월 4일 승인받고 AdCLD-CoV19-1 OMI의 임상 1/2상 모집 및 투여를 완료하였습니다. 임상시험대상자의 안전성 및 면역원성을 확인 후 임상 3상 시험 계획을 식품의약품안전처로부터 승인받아 임상3상시험을 진행 중입니다.
당사는 2020년 11월 30일 백신&세포유전자치료제 GMP센터를 완공하였으며, 당사 제품의 임상 단계에 필요한 생산과 향후 GMP 인증 후 시판 예정인 제품의 생산능력을 보유하고 있습니다. 또한 첨단 바이오의약품 위탁생산을 목적으로 2022년 9월 첫 계약을 체결하고 본격적인 바이오의약품의 위탁생산(CMO) 및 위탁개발생산(CDMO) 사업을 전개하고 있습니다. 첨단 바이오의약품 위탁생산 사업 확장을 위해 전시 및 컨퍼런스 참가 등을 통하여 당사의 최신장비, 시설, 우수한 인재 및 서비스에 대한 정보를 제공하고 있습니다.
당사는 보고서 작성기준일 현재 신약연구개발을 위한 조직을 아래와 같이 구분하여 운영하고 있습니다. "연구소" 중 서울대학교 내에 위치한 신약탐색팀, 백신중개연구팀, RA/기획팀은 항암면역치료백신과 예방백신의 기초연구 전반을 다루며, 성남에 위치한 벡터공정팀, 완제공정팀은 발굴한 파이프라인의 비임상개발과 임상진입, 완제의약품 공정개발, 품질관리를 수행하고 있습니다.
당사의 최근 3개년 정부 연구개발비를 차감하지 아니한 연구개발 비용은 2022년 184억원, 2023년 120억 원, 2024년 182억원 입니다. 연구개발 비용의 상세내역은 II. 사업의 내용 6. 주요계약 및 연구개발활동 마. 연구개발 비용을 참고해 주시기 바랍니다.
또한 당사는 2024년 5월 14일을 합병기일로 하여 (주)포베이커를 소규모 흡수합병을 완료하였습니다. 당사는 이커머스 사업부를 신설하여 플랫폼을 통해 베이킹 재료 및 각종 소모품, 베이킹 기자재 등 온라인 식품 유통 판매업을 영위하고 있습니다.
2. 주요 제품 및 서비스
가. 주요 제품 등의 현황
당사는 CeliVax 기반기술을 활용한 6종의 항암면역치료백신 파이프라인과 COVID-19 예방백신을 개발 중이며 현재 비임상 또는 임상 단계의 연구 중으로 시판 중인 제품은 없습니다.
| (단위 : 천원) |
| 사업 부문 | 매출 유형 | 품 목 | 2024년 (제19기) |
2023년 (제18기) |
2022년 (제17기) |
|||
|---|---|---|---|---|---|---|---|---|
| 매출액 | 비율 | 매출액 | 비율 | 매출액 | 비율 | |||
| 바이오신약 개발 | 제품 | 항암면역치료백신 | - | - | - | - | - | - |
| COVID-19 예방백신 | - | - | - | - | - | - | ||
| 기술이전 | 항암면역치료백신 | - | - | - | - | - | - | |
| 위탁생산(CMO) 및 위탁개발생산(CDMO) |
용역 | 세포유전자치료제 | 358,051 | 9% | - | - | 480,000 | 100% |
| 이커머스사업부 | 상품 판매 | 식품 및 베이킹 기자재 등 | 3,807,041 | 91% | - | - | - | - |
| 합 계 | 4,165,092 | 100% | - | - | 480,000 | 100% | ||
나. 주요 제품 등의 가격 변동 추이
당사는 연구개발 및 임상시험을 진행하는 회사로 시판중인 제품이 없어 제품의 가격 변동 추이를 기재하지 않았습니다.
당사가 국내 및 글로벌 임상시험을 성공적으로 종료하고 시판 승인을 받아 판매가 개시될 경우, 판매가격은 국가별 상황을 고려하고 보험적용 여부 등을 반영하여 책정될 예정이며, 각 국가의 규제 당국으로부터 승인 또는 협의를 거쳐 확정될 것으로 예상합니다.
또한, 공시대상기간 중 위탁생산(CMO) 및 위탁개발생산(CDMO) 사업부문의 수익성에 중요한 영향을 미치는 가격 변동이 없습니다. 이커머스 사업부는 원재료를 매입하여 제조하는 제품이 없기 때문에 기재하지 않았습니다.
3. 원재료 및 생산설비
당사는 신약을 개발 중인 회사로 생산 및 판매 중인 제품이 없어 원재료 등의 매입 현황을 기재하지 않았습니다. 다만, 당사는 CeliVax 및 COVID-19 예방백신 임상을 위하여 연구시약 매입, 임상연구 및 제조 위탁을 하고 있으며, 이를 가. 매입 현황에 기술하였습니다.
가. 매입현황
|
(단위 : 천원) |
| 매입유형 | 품목 | 구분 |
2024년 (제19기) |
2023년 (제18기) |
2022년 (제17기) |
|---|---|---|---|---|---|
| 소모품비 | 연구시약 | 국내 | 371,037 | 381,889 | 799,491 |
| 지급수수료 | 위탁 | 국내 | 1,134,735 | 2,156,324 | 4,623,138 |
| 상품 | 식품 등 | 국내 | 3,728,102 | - | - |
| 합계 | 5,233,874 | 2,538,212 | 5,422,629 | ||
(주1) 매입액은 손익계산서의 경상연구개발비 중 소모품비 및 지급수수료이며, 정부보조금 수취분을 차감한 금액입니다.
(주2) CMO에 대한 원재료는 고객사가 구매하여 당사에 공급하고, 만일 당사가 원부자재를 구입할 경우 고객사에게 청구하는 것으로 계약을 체결하였으므로 CMO 관련 원재료에 대한 내용은 별도 기재하지 않았습니다.
나. 원재료 가격변동추이
(1) 바이오신약 개발 부문
당사는 본 보고서 작성기준일 현재 신약을 개발 중인 회사로 생산 및 판매 중인 제품이 없어 원재료 가격변동 추이가 없습니다.
(2) CMO 및 CDMO 부문
의약품에 투입되는 주요 원재료는 품질관리 등의 사유로 고객사로부터 공급받거나 또는 고객사가 지정하는 거래처를 통해 구매가 이루어지며, 구매한 원재료 및 부대비용에 대해서는 고객사로부터 대부분 사전 또는 사후 정산(환급)이 이루어집니다. 이러한 계약조건으로 인해 가격변동과 같은 원재료 매입과 관련한 위험은 제한적입니다.
(3) 이커머스 사업 부문
이커머스 사업부는 원재료를 매입하여 제조하는 제품이 없어 원재료 가격변동 추이가 없습니다.
다. 생산능력 및 생산실적
당사는 2020년 11월 30일 백신&세포유전자치료제 GMP센터를 완공하였으며, 당사 제품의 임상 단계 및 향후 GMP 인증 후 시판 예정인 제품의 생산과 위탁생산 서비스에 대한 생산능력을 아래와 같이 보유하고 있습니다. 아래 표에서는 각 제품별 생산능력을 표시하였습니다.
(1) 생산 능력
| (기준일 : | 2024년 12월 31일 | ) |
| 분류 | 생산규모 | 생산규모근거 | 비고 | ||
|---|---|---|---|---|---|
| 대분류 | 소분류 | 연간 | 단위 | ||
| 6F | 세포유전차치료제 | 736 | Lot | - 산출기준: Suite 3개 가동을 기준으로 BVAC DP 공정기간을 반영 - 산출기준: Suite 1개 가동을 기준으로 CAR-T(CMO) 공정기간을 반영 |
DP 기준 |
| Vial production | 1,080,000 | vial | - 산출기준: 1,000 x 6시간 x 5회 x 40주 x 90% | - | |
| 4F | Viral Vector | 24 | Lot | - 산출기준: Suite 2개 가동을 기준으로 Vector DS 공정시간을 반영 | DS 기준 |
(2) 생산실적 및 가동률
| (기준일 : | 2024년 12월 31일 | ) |
| 분 류 | 생산능력 | 단위 | 생산실적 | 가동률 | 비 고 |
| 세포유전자치료제 | 736 | Lot | - | - | DP 기준 |
| viral vector | 24 | Lot | - | - | - |
| vial production | 1,080,000 | vial | - | - | - |
주) 연구개발 활동에 사용된 바이오의약품은 생산 실적에서 제외하였습니다.
라. 생산설비에 관한 사항
|
(단위 : 천원) |
| 구분 | 자산과목 | 소재지 | 기초 장부가액 |
당기 증감 |
상각 |
기말 장부가액 |
||
|---|---|---|---|---|---|---|---|---|
|
증가 |
감소 |
|||||||
| 연구소 |
공구와기구 |
연구장비 |
서울 | 894,433 | 70,000 | 0 | -409,730 | 554,703 |
|
(정부보조금) |
서울 | -58,387 | 0 | 0 | 17,973 | -40,414 | ||
| 계 | 836,046 | 70,000 | 0 | -391,757 | 514,289 | |||
|
GMP 센터 |
공구와 기구 |
연구장비 |
성남 | 2,147,877 | 0 | 0 | -889,315 | 1,258,562 |
|
(정부보조금) |
성남 | -186,124 | 0 | 0 | 55,255 | -130,869 | ||
| 계 | 1,961,753 | 0 | 0 | -834,060 | 1,127,693 | |||
| 시설장치 | 성남 | 2,253,499 | 0 | 0 | -1,147,226 | 1,106,273 | ||
| 이커머스사업부 | 공구와기구 | 남양주 | 0 | 5,400 | 0 | 225 | 5,175 | |
| 시설장치 | 남양주 | 0 | 165,800 | 0 | 3,243 | 162,557 | ||
마. 설비의 신설/매입계획
당사는 현재 본점 및 성남 소재지의 기업부설연구소와 사무공간을 서울 마곡지구로 이전할 계획을 가지고 있으며, 자세한 내용은 아래와 같습니다.
| 1. 투자목적 | 마곡 대규모 산업클러스터 단지 내 신사옥 및 R&D센터 구축을 통한 업무 효율성 증대와 미래 성장기반 확보 | |
| 2. 투자금액 | 23,685,000,000원 | |
| 3. 투자기간 | 시작일 | 2023-07-12 |
| 종료일 | 2026-02-11 | |
| 4. 이사회결의일 | 2023-07-07 | |
| 5. 기타 참고사항 | 1. 본 건은 마곡 도시개발사업지구단위 계획구역 내 대지면적 7,853.90㎡(약2,375평) , 연면적 41,567.25㎡(약12,596평) 규모로 당사 (22%) 외 2개社가 컨소시엄의 형태로 참여한 신사옥 및 R&D센터 개발사업입니다. 2. 신규 시설투자 소재지: - 서울시 강서구 마곡동 762-3(D9-1 블록) 3. 상기 투자기간의 시작일과 종료일은 계획상 건축 공사 시작일 및 완공일이며, 2026년 3월 11일 준공 완료 예정입니다. 4. 상기 투자금액은 부가가치세를 제외한 건축물 건설 비용이며, 기 취득한 토지에 건립함에 따라 토지 취득금액은 포함되어 있지 않습니다. 5. 투자 자금은 본 개발사업의 미래 현금흐름 등을 담보로 외부자금 장기차입을 통해 충당할 예정입니다. 6. 투자금액 및 투자기간은 인허가 여부, 향후 추진과정 및 경영환경 등에 따라 변경될 수 있습니다. |
|
4. 매출 및 수주상황
가. 매출실적
(단위 : 천원)
|
매출유형 |
2024년 (제19기) |
2023년 (제18기) |
2022년 (제17기) |
|
|---|---|---|---|---|
| 기술이전 매출 | 수출 | - | - | - |
| 내수 | - | - | - | |
| 소계 | - | - | - | |
| 상품매출 | 수출 | - | - | - |
| 내수 | 3,807,041 | - | - | |
| 소계 | 3,807,041 | - | - | |
| 위탁생산 매출 | 수출 | - | - | - |
| 내수 | 358,051 | - | 480,000 | |
| 소계 | 358,051 | - | 480,000 | |
| 합계 | 수출 | - | - | - |
| 내수 | - | - | 480,000 | |
| 합계 | 4,165,092 | - | 480,000 | |
(주1) 당사는 2024년(제19기) 이커머스 사업부 및 C(D)MO를 통해 수익이 발생하였습니다.
(주2) 당사는 2022년(제17기)과 2024년(제19기)은 C(D)MO로 인한 수익이 발생하였습니다.
나. 판매경로 등
1) 바이오신약 개발
(가) 판매조직
셀리드는 CeliVax 기반기술을 활용한 6종의 항암면역치료백신 파이프라인과 COVID-19 예방백신 개발 중으로 현재 비임상 또는 임상 단계의 연구 중으로 시판 중인 제품은 없습니다. 또한 국내외 제약바이오회사의 첨단 바이오의약품을 위탁 생산 및 의약품 개발 과정 참여를 통해 개발단계별 맞춤형 서비스를 제공하며 다양한 형태의 고객과 협력체계를 구축 중입니다. 따라서, 현재 판매조직은 구성되어 있지 않습니다.항암제 및 예방백신 판매조직은 각 제품에만 특화된 전문성있는 마케팅/영업/학술의 일원화된 팀 구성이 필수적이며, 각 제품의 허가 일정에 발 맞추어 전담조직을 구성할 예정입니다.
(나) 판매경로
당사는 본 보고서 작성기준일 현재 판매 경로 관련 해당 사항이 없습니다.
(다) 판매전략
국내의 경우 암환자의 치료가 국내 대학병원급 주요 병원으로 집중되고, 병원내 암센터를 운영하거나 암특화된 병원들이 잘 알려져 있는 만큼 이들 병원들을 중심으로 판매 기반을 다져나갈 예정입니다. 암환자를 치료하는 의료진의 경우 특히 제품의 임상결과를 가장 중요시하고, 직접 사용해 본 약제에 대한 신뢰가 높은만큼 당사의 제품을 이용하여 회사 주도적 임상시험 및 연구자 주도적 임상시험을 활발하게 실시하여 조기에 시장의 인지도를 강화하는 전략입니다. 또한 대한암학회, 한국임상암학회, 항암요법연구회 등 암 전문 의료진 그룹과의 학술적인 유대관계를 강화하여 판매기반을 다져나가고자 합니다.
해외로는 BVAC 파이프라인을 개발하면서 해외 기술이전을 꾸준히 추진할 계획입니다. 제품의 강점이 극대화되기 위해서는 면역관문억제제 등 병용 시 효과의 상승작용을 기대할 수 있는 제품군을 보유한 글로벌 제약회사와의 협력에 집중하면서, 기존 표준치료에 미충족수요가 큰 암종 및 치료단계에 해법을 제시할 수 있는 제품으로 성장시키고자 합니다.
COVID-19 예방백신의 경우 민간시장보다는 정부조달시장이 대부분을 차지할 것으로 예상하며, 백신의 허가승인을 받기 위해 최선을 다하고 있습니다.
2) 위탁생산(CMO) 및 위탁개발생산(CDMO)
(가) 판매조직
셀리드는 GMP 및 연구소 부서의 협업으로 CMO/CDMO 수주를 위해 활동하고 있습니다. 당사는 CeliVax 기반기술을 활용한 6종의 항암면역치료백신 파이프라인과 COVID-19 예방백신 개발 중인 기술력을 바탕으로 고객사의 요구사항에 대한 맞춤형 서비스를 제공하기 위해 전문성 있는 연구/생산/품질 부서에서, 원스탑 서비스를 제공하고 있습니다.
(나) 판매경로
CMO/CDMO 수주를 위해 홈페이지, 학회, 부스홍보, 유관기관(KOTRA, KDDF 등)을 통한 홍보활동을 지속적으로 강화하고 있습니다. 특히 당사는 고객사와의 계약에 의거하여 수탁 생산된 제품을 고객사가 지정한 운송업체 또는 창고를 통하여 고객사에 판매할 예정이며 대리점 등 별도의 판매경로를 이용하고 있지 않습니다.
(다) 판매전략
| 사업구분 | 위탁사 | 전략 |
| CMO/CDMO | 세포 및 유전자 치료제/ 바이러스 벡터 개발社 |
1. 위탁 고객사 유치 및 CMO/CDMO 역량, GMP 시설 등 소개 자료 제공 2. 주요 계약 조건 협상 및 조정, 계약 체결, 비밀유지계약 체결 3. 수탁업무 수행 및 납기 준수 (연구소/성남 GMP center/RA 협업) |
3) 이커머스 사업
(가) 판매조직
이커머스 사업부에서 베이커리 관련 개발 및 판매업을 진행하고 있습니다.
(나) 판매경로
온라인 플랫폼을 활용하여 베이킹 등 식품 유통 판매를 진행하고 있으며, 고객 편의성과 고객의 요구에 만족하는 상품을 구성하기 위해 시장분석 및 커머스 시스템의 차별화를 모색하고 있습니다.
(다) 판매전략
푸드콘텐츠 종합거래소로서의 사업모델을 지향하고 있으며 플랫폼을 통해 합리적인 가격으로 베이킹 재료 및 각종 소모품, 베이킹 기자재 등의 유통 판매업을 영위 하고 있습니다. 향후 이커머스 플랫폼을 활성화 하여 전략적으로 확장해 나갈 계획입니다.
다. 수주상황
| (단위 : 천원 ) |
| 품목 | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
|---|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
| 세포유전자치료제 | 2023.03.16 | (주1) | - | 4,888,000 | - | 312,000 | - | 4,576,000 |
| 합 계 | - | 4,888,000 | - | 312,000 | - | 4,576,000 | ||
(주1) 수주일자는 본 계약을 체결한 일자이며, 납기는 임상 2a상 최초 IRB 승인일로부터 18개월입니다.
5. 위험관리 및 파생거래
가. 환위험 및 위험관리
환위험은 환율의 변동으로 인하여 금융상품의 미래현금흐름에 대한 공정가치가 변동할 위험입니다. 당사는 본 보고서 작성기준일 현재 기능통화 이외의 외화로 표시된 화폐성 자산이 없어 당사의 손익에 미치는 영향은 중요하지 않습니다.
나. 유동성위험 및 위험관리
유동성위험이란 당사가 일시적인 자금부족으로 정해진 결제시점에서 결제의무를 이행하지 못함으로써 거래 상대방의 자금조달계획 등에 악영향을 미치게 되는 위험을 의미합니다. 당사는 적정 유동성의 유지를 위하여 주기적인 자금수지 예측, 조정을 통해 유동성위험을 관리하고 있습니다.
다. 이자율위험 및 위험관리
이자율위험은 미래의 시장 이자율 변동에 따라 예금 또는 차입금 등에서 발생하는 이자수익 및 이자비용이 변동될 위험을 뜻합니다. 당사는 본 보고서 작성기준일 현재 변동금리부 조건의 예금과 차입금이 없어 당사의 손익에 미치는 영향은 중요하지 않습니다.
라. 기타위험 및 위험관리
상기 언급된 위험들 이외에 대한 자세한 사항은 - III. 재무에 관한사항 - 5. 재무제표 주석을 참조하시기 바랍니다.
마. 위험관리조직 및 관리정책
당사는 상기 언급된 위험들에 대한 관리는 재무팀에서 주관하고 있으며, 주기적으로 국내외 금융시장 현황을 파악하여 영업과 관련한 금융위험을 감시하고 금융상품 평가, 자금 유동성 평가, 운영 방안 보고 등을 실행하고 있습니다.
당사는 투기적 목적으로 파생금융상품을 포함한 금융상품계약을 체결하거나 거래하지 않습니다.
바. 파생거래
당사가 2021년 3월 19일에 발행한 제2회 무기명식 무보증 사모 전환사채에는 조기상환청구권(Put option)과 중도상환청구권(Call option)이 포함되어 있습니다. 당기말 현재 전환사채의 내용은 다음과 같습니다.
| 구 분 | 내역 | |
| 사채의 종류 | 제2회 무기명식 무보증 사모 전환사채 | |
| 발행가액 (단위: 천원) | 19,000,000 | |
| 미상환사채 권면총액 (단위: 천원)(*1) | 0 | |
| 이자지급조건 | 없음 | |
| 연이자율 | 0.0% | |
| 보장수익률 | 0.0% | |
| 발행일 | 2021년 3월 19일 | |
| 상환일 | 2026년 3월 19일 | |
| 전환청구기간 | 시작일 | 2022년 3월 19일 |
| 종료일 | 2026년 2월 19일 | |
| 전환에 따라 발행할 주식 |
종류 | 주식회사 셀리드 기명식 보통주식 |
| 전환가액(원/주)(*2) | 4,515 | |
| 주식수(*2) | 1,683,277주 | |
| 전환비율(%) | 100 | |
| 전환가액의 조정조건 | 1.본건 전환사채의 전환가액을 하회하는 발행가액, 전환가액 또는 행사가액으로 유상증자 또는 그에 준하는 주식연계증권(전환사채, 신주인수권부 사채 포함)의 발행, 신주인수권 등의 부여 등 주식을 인수할 권리를 표창하는 일체의 주식연계증권 등을 발행하는 경우 기타 이와 유사한 상황이 발생하는 경우로서 본건 주식의 지분율이 희석될 수 있는 요인이 발생한 경우 | |
| 2. 발행회사의 주식이 더 많은 수의 주식으로 분할된 경우 또는 주식배당이 이루어진 경우, 발행회사의 주식이 더 적은 수의 주식으로 병합된 경우 | ||
| 3. 발행회사의 주식이 자본조정, 재분류 기타 사유(제2항에 규정된 주식의 분할 또는 병합은 제외)로 인하여 그 조건 및/또는 수량이 변경되는 경우 | ||
| 4.발행회사의 합병, 분할, 분할합병, 포괄적 주식교환, 포괄적 주식이전 및 자본의 감소(통칭하여 “합병 등”)가 이루어지는 경우 | ||
| 5.감자 및 주식 병합 등 주식가치 상승사유가 발생하는 경우 | ||
| 6. 본건 전환사채 발행일로부터 3개월이 되는 날부터 매 3개월마다 전환가액을 조정하되, 전환가액 조정일 전일을 기산일로 하여 기산일부터 소급하여 산정한 산술평균 가액이 직전의 전환가액을 하회할 경우 | ||
| 중도상환 청구권 [call option] |
발행회사 또는 발행회사가 지정하는 자는 사채발행일로부터 1년째 되는 날인 2022년 3월 19일부터 2024년 3월 19일까지 매 3개월이 되는 날에, 인수인이 본 계약에 따라 인수한 본 사채의 20% 범위 내(액면가액 3,800,000천원)에서 매수인에게 매도하여 줄 것을 청구할 수 있으며, 인수인은 이 청구에 따라 보유하고 있는 본 사채를 매수인에게 매도하여야 한다. | |
| 조기상환 청구권 [put option] |
사채발행일로부터 2년째 되는 날인 2023년 3월 19일 및 그로부터 매 3개월이 되는 날에 발행회사에게 사채권자가 보유한 사채의 전부 또는 일부에 대하여 조기상환일 60일 전부터 30일 전까지 조기상환을 청구할 수 있다. | |
(*1) 2024년 6월 19일 전환사채 잔액 76억 원을 모두 상환하여, 미상환사채 잔액은 없습니다. 상세 내역은 2024년 6월 19일 기 제출한 전환사채(해외전환사채포함)발행후만기전사채취득 공시를 참조하시기 바랍니다.
(*2) 최초 전환가액은 36,872원이었으나, 시가하락 및 유상증자에 따른 전환가액 조정으로 4,515원으로 변경되었으며, 전환가능주식수는 최초 515,296주에서 1,683,277주로 변경되었습니다.
(1) 당기말과 전기말 현재 파생상품자산ㆍ부채의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 파생상품자산 | - | - | 725,598,600 | - |
| 파생상품부채 | - | - | 2,298,544,000 | - |
당사는 전환사채 투자자가 보유한 조기상환청구권(Put option)을 파생상품부채로 회계처리하였고, 전환사채 발행자가 보유한 매도청구권(Call option)을 파생상품자산으로 회계처리하였습니다.
(2) 당기와 전기 중 파생상품자산ㆍ부채의 변동내역은 다음과 같습니다.
① 파생상품자산
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초잔액(*1) | 725,598,600 | 1,100,297,600 |
| 공정가치의 변동 | - | - |
| 소멸(*2) | (725,598,600) | (374,699,000) |
| 기말잔액 | - | 725,598,600 |
② 파생상품부채
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초잔액(*1) | 2,298,544,000 | 7,381,576,000 |
| 풋옵션 행사 | (1,902,561,200) | (4,055,785,600) |
| 공정가치의 변동 | (395,982,800) | (1,027,246,400) |
| 기말잔액 | - | 2,298,544,000 |
(*1) 당사가 발행한 전환사채는 콜옵션 권리행사자를 제3자로 지정하여 다른 금융상품(전환사채 및 풋옵션)과 독립적으로 해당 콜옵션을 양도할 수 있는 경우에 해당하여 그 콜옵션은 내재파생상품이 아니라 별도의 금융상품으로 처리해야 하므로 콜옵션, 풋옵션에 대해 각각 파생상품자산, 파생상품부채로 인식하였습니다.
(*2) 콜옵션은 당분기 중 행사기간 만료에 따라 소멸되었으며 파생상품평가손실로
처리되었습니다.
6. 주요계약 및 연구개발활동
가. 라이선스 아웃(License-out) 계약
본 보고서 작성기준일 현재 당사가 체결한 라이선스 아웃(License-out) 계약의 현황은 다음과 같습니다.
|
[라이선스 아웃 계약 총괄표] |
|
(단위 : 백만원) |
|
품목 |
계약 상대방 |
대상지역 |
계약 체결일 |
계약 종료일 |
총 계약금액 |
수취금액 |
진행단계 |
| BVAC-Neo | (주)LG화학 | 전 세계 | 2021.05.26 | 로열티 지급 기한 (판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날) |
183,500 | 1,000 | 비임상 |
1) BVAC-Neo
|
① 계약상대방 |
(주)LG화학 |
|
② 계약내용 |
- Neo-Antigen 유래 암항원을 포함/탑재하는 완전 개인맞춤형 항암면역치료백신과 관련된 기술 및 특허를 전 세계에서 실시할 수 있는 독점배타적 전용 실시권 - 제3자에 대한 재실시권 |
|
③ 대상지역 |
전 세계 |
|
④ 계약기간 |
계약체결일: 2021년 5월 26일 계약종료일: 로열티 지급 기한 (판매개시일로부터 10년이 되는 날 또는 유효청구항의 최종 소멸일 중 늦은 날) |
|
⑤ 총 계약금액 |
183,500백만원, 로열티는 별도 |
|
⑥ 수취금액 |
<반환의무 없는 금액> 계약금(Upfront Payment): 1,000백만원, 2021년 6월 25일 수취 <반환의무 있는 금액> 해당 사항 없음 |
|
⑦ 계약조건 |
계약금(Upfront Payment): 1,000백만원 - 수취조건: 계약 체결 시
마일스톤(Milestione): 182,500백만원 - 수취조건: 개발, 인허가 및 판매 등
로열티(Royalty): 순매출액에 따라 별도 수령 - 수취조건: 매출 발생 시
임상시험, 허가, 규제 승인 미실현 등으로 계약은 종료될 수 있으며, 계약 종료 시에도 회사의 위약금 지급의무는 없음 |
|
⑧ 대상기술 |
BVAC-Neo (Neo-Antigen 유래 암항원을 포함/탑재하는 완전 개인맞춤형 항암면역치료백신) |
|
⑨ 개발 진행경과 |
계약 후 LG화학과 공동개발위원회를 발족하였음. LG화학이 요청한 기술자료를 제공하고 있음. 생산 기술이전을 실시하기 위해 준비 중임. |
나. 부동산 매입계약
본 보고서 제출일 현재 당사가 체결한 부동산 매입 계약 현황은 다음과 같습니다.
| 계약명 | 마곡일반산업단지 입주 계약 |
| 입주자 | 제넥신컨소시엄 ((주)제넥신, (주)프로젠, (주)셀리드) |
| 부지소재지 | 2017년 12월 14일 고시 마곡 도시개발구역 필지번호 D9-1 |
| 계약면적 | 7,853㎡((주)셀리드 지분면적 : 1,727.66㎡) |
| 계약체결일 | 2018년 8월 7일 |
| 착공일 | 2023년 7월 |
| 준공예정일 | 2026년 3월 |
다. 연구개발활동의 개요
당사는 항암면역치료백신과 COVID-19 예방백신을 연구개발하고 있는 회사로 본 보고서 작성기준일 현재 보유 파이프라인의 상용화를 위해 임상 연구 및 비임상 연구를 진행하고 있습니다.
라. 연구개발 담당조직
1) 연구개발 조직 개요
당사는 보고서 작성기준일 현재 신약연구개발을 위한 조직을 아래와 같이 구분하여 운영하고 있습니다. “연구소”중 서울대학교 내에 위치한 신약탐색팀, 중개연구팀, RA/기획팀은 항암면역치료백신과 예방백신의 기초연구 전반을 다루며, 성남에 위치한 벡터공정팀, 완제공정팀은 발굴한 파이프라인의 비임상개발과 임상진입, 완제의약품 공정개발, 품질관리를 수행하고 있습니다. “임상개발실”은 임상시험 전략수립, 기획 및 운용, 인허가 및 연구관리 등의 업무를 수행하고 있습니다.
전 연구원은 규제당국의 규정과 가이드라인 등을 깊게 이해하여 개발속도를 증진하고 규제당국의 보완 요청 등에 신속히 대응할 수 있도록 준비하고 있습니다.
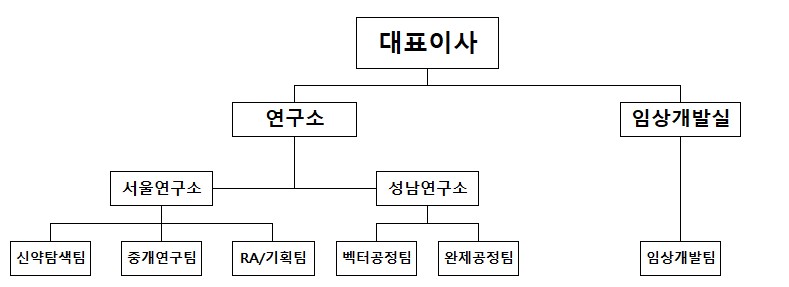 |
|
연구개발조직도 |
2) 연구개발인력 현황
당사는 보고서 작성기준일 현재 당사는 박사 4명, 석사 16명, 학사 1명 총 21명의 연구개발인력을 보유하고 있으며, 그 현황은 다음과 같습니다.
(단위 : 명)
| 구 분 | 인 원 | ||||
|---|---|---|---|---|---|
| 박사 | 석사 | 학사 | 합 계 | ||
| 연구소 | 신약탐색팀 | 1 | 3 | - | 4 |
| 백신중개연구팀 | 1 | 2 | - | 3 | |
| RA/기획팀 | - | 1 | - | 1 | |
| 벡터공정팀 | 1 | 6 | - | 7 | |
| 완제공정팀 | 1 | 3 | - | 4 | |
| 임상개발실 | 임상개발팀 | - | 1 | 1 | 2 |
| 합 계 (주) | 4 | 16 | 1 | 21 | |
(주) 대표이사를 제외한 인원입니다(박사 1명 : 강창율 대표이사).
3) 핵심 연구인력
|
직위 |
성명 |
담당업무 |
주요경력 |
주요 연구실적 |
|---|---|---|---|---|
|
대표이사 |
강창율 |
연구개발 |
- 서울대학교 약학 학사('73.03~'77.02) - 서울대학교 약학 석사('77.03~'81.02) - State University of New York at Buffalo - IDEC Pharmaceutical Corporation, La Jolla, - 서울대학교 약대 정교수('94.03~'20.02) - (주)셀리드('14.06~현재) |
[주요 논문] - Activation of NKT cells in an anti-PD-1-resistant tu mor model enhances anti-tumor immunity by reinvigor ating ex hausted CD8 T cells. Cancer Research (78(1 8); 5315-26), 2018. - IL-21 therapy combined with PD-1 and Tim-3 block ade provides enhanced NK cell antitumor activity agai nst MHC class I-deficient tumors. Cancer Immunology Research (6(6); 685-695), 2018. - IL-21-mediated reversal of NK cell ex haustion facilit ates anti-tumour immunity in MHC class I-deficient tu mours. Nature Communications (6; 8; 15776), 2017. - GITR drives TH9-mediated antitumor immunity. Onc oimmunology (5(5):e1122862), 2016 - Characterization of age-associated ex hausted CD8 + T cells defined by increased ex pression of Tim-3 an d PD-1. 2016 - Glucocorticoid-induced tumor necrosis factor recept or-related protein co-stimulation facilitates tumor regre ssion by inducing IL-9-producing helper T cells. Natur e Medicine (21(9):1010-1017), 2015. - A multimeric carcinoembryonic antigen signal inhibits the activation of human T cells by a SHP-independe nt mechanism: a potential mechanism for tumor-media ted suppression of T-cell immunity. International Journ al of Cancer (1;136(11):2579-87), 2015. - Tumore-derived osteopontin suppresses antitumor i mmunity by promoting ex tramedullary myelopoiesis. C ancer Research (15;74(22):6705-6716), 2014. - Serum amyloid A3 ex acerbates cancer by enhancin g the suppressive capacity of myeloid-derived suppre ssor cells via TLR2-dependent STAT3 activation, Eur opean Journal of Immunology (44(6);1672-84), 2014. - Tumor microenvironmental conversion of natural kille r cells into myeloid-derived suppressor cells. Cancer Research (15;73(18):5669-5681), 2013. [ 특허 등록 및 출원] - 자연살해T세포의 리간드와 항원을 적재한 B세포를 매개로 하는 백신(등록) - 자연살해T세포의 리간드와 항원을 적재한 단핵구 또는 미분화 골수성 세포를 포함하는 백신(등록) - 항 PD-1 항체 또는 항 PD-L1 항체를 포함하는 항 암제(등록) - 알파-갈락토실세라마이드의 유도체, 이의 약학적으 로 허용가능한 염, 이의 제조방법 및 이를 유효성분으 로 함유하는 면역보조용 약학적 조성물(등록) - 오스테오폰틴 단백질의 발현 또는 활성 억제제를 유효성분으로 함유하는 암 치료용 약학적 조성물(출 원) |
|
책임연구원 |
박봉주 |
신약개발 | - 서울시립대학교 학사('02.03~'09.02) - 서울시립대학교 석사('09.03~'11.02) - 서울시립대학교 박사('11.03~'17.02) - 서울시립대학교 부설 자연과학연구소 선임연구원('17.03~'18.10) - 서울시립대학교 연구교수('18.11~'19.03) - (주)셀리드('19.04~현재) |
[주요 논문] - New ethanol extraction improves the anti-obesity effects of black tea. Arch Pharm Res. 39(3):310-20. 2016. - Hypoxic reprograming of H3K27me3 and H3K4me3 at the INK4A locus. FEBS Lett. 590(19):3407-3415. 2016. - Wnt3a disrupts GR-TEAD4-PPARγ2 positive circuits and cytoskeletal rearrangement in a β-catenin-dependent manner during early adipogenesis. Cell Death Dis. 10(1):16. 2019. |
| 선임연구원 | 전인수 | 신약개발 | - 서강대학교 생명과학과 학사('06.03~'13.02) - 서울대학교 융합과학기술대학원 분자의학및 바이오제약학과 석,박사('13.03~'20.08) - (주)셀리드('20.10~현재) |
[주요 논문] - Enhanced Immunogenicity of Engineered HER2 Antigens Potentiates Antitumor Immune Responses. Vaccines. 8(3), 403. 2020 |
| 책임연구원 | 송보영 | 신약개발 |
- 포항공과대학교 생명과학과 학사 - 서울대학교 융합과학기술대학원 분자의학및 바이오제약학과 석,박사 - 서울대학교 종합약학연구소 연수연구원 - (주)셀리드('21.03~현재) |
[주요 논문] - Differentiation of c-Kit+CD24+ natural killer cells into myeloid cells in a GATA-2-dependent manner. FASEB Journal. 34(3):4462. 2020 |
| 선임연구원 | 장수정 | 신약개발 | - 서울시립대학교 생명과학과 학사 ('09.03~13.02) - 서울시립대학교 석사 ('13.02~'14.08) - 서울시립대학교 자연과학연구소 연구원 ('14.09~15.02) - 서울시립대학교 박사 ('15.03~'21.08) - 서울시립대학교 연구교수 ('21.09~22.06.) - (주)셀리드('22.07~현재) |
[주요 논문] - Hypoxic reprograming of H3K27me3 and H3K4me3 at the INK4A locus. FEBS Letters. 590(19):3407-3415. 2016 - Cancer driver genes, IDH1/2, JARID1C/ KDM5C, and UTX/ KDM6A: Crosstalk between histone demethylation and hypoxic reprogramming in cancer metabolism. Experimental and Molecular Medicine. 51(6):1-17. 2019 - High-Spatial and Colourimetric Imaging of Histone Modifications in Single Senescent Cells Using Plasmonic Nanoprobes, Nature communications 8;12(1):5899. 2021 |
마. 연구개발 비용
당사의 최근 3개년 정부 연구개발비를 차감하지 아니한 연구개발비용은 2022년 184억원, 2023년 120억원, 2024년 182억원입니다. 연구개발비용의 상세내역은 다음과 같습니다.
(단위 : 천원)
| 구분 |
2024년 (제19기) |
2023년 (제18기) |
2022년 (제17기) |
비고 | |
|---|---|---|---|---|---|
| 비용의 성격별 분류 |
인건비 | 1,611,790 | 2,084,574 | 2,072,273 | (주1) |
| 감가상각비 | 339,220 | 341,122 | 329,925 | - | |
|
소모품비 |
561,349 | 1,316,938 | 2,152,164 | (주2) | |
|
지급수수료 |
1,164,807 | 4,443,917 | 13,652,135 | (주3) | |
|
기타 |
14,480,632 | 3,774,477 | 236,450 | - | |
|
연구개발비용 합계 |
18,157,798 | 11,961,028 | 18,442,946 | - | |
| 회계처리 내역 |
경상연구개발비 | 3,486,613 | 5,039,030 | 7,886,432 | - |
|
제조경비 |
- | - | - | - | |
|
개발비(무형자산) |
14,380,192 | 4,150,304 | - | - | |
|
회계처리금액 계 |
17,866,805 | 9,189,334 | 7,886,432 | - | |
|
정부 연구개발비 |
290,993 | 2,771,694 | 10,556,514 | - | |
|
연구개발비용 합계 |
18,157,798 | 11,961,028 | 18,442,946 | - | |
| 매출액 | 4,165,092 | - | 480,000 | - | |
| 연구개발비용/매출액 | 436% | - | 3,842% | - | |
(주1) 인건비는 연구인력에 대한 급여, 퇴직급여, 복리후생비, 주식보상비용을 포함한 금액입니다.
(주2) 소모품비는 실험에 사용되는 시약비 등입니다.
(주3) 지급수수료는 외부에 지급한 위탁연구비 등입니다.
(주4) 개발비(무형자산)는 AdCLD-CoV19-1 OMI 임상3상 관련 연구개발비 등을 포함한 건설중인자산 금액입니다.
바. 연구개발실적
1) 연구개발 진행 현황 및 향후 계획
본 보고서 작성기준일 현재 당사가 연구개발 진행 중인 프로젝트 현황은 다음과 같습니다. 하기의 모든 파이프라인은 바이오신약에 해당됩니다.
| 구분 | 품목 | 파이프라인 | 적응증 | 연구시작일 | 현재 진행단계 | 비고 | |
|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||
| 바이오신약 | 항암면역치료백신 | BVAC-C |
자궁경부암 |
2014년 |
임상 2a상(국내) |
2018년 |
- |
| BVAC-E6E7 | 두경부암 | 2022년 | 임상 1/2a상(국내) | 2024년 | - | ||
| BVAC-B |
위암 |
2015년 |
임상 1상(국내) |
2018년 |
- |
||
| BVAC-P |
전립선암 |
2016년 |
임상 1상(국내) |
2020년 |
- |
||
| BVAC-M |
흑색종 |
2016년 |
전임상(국내) |
- |
- |
||
| BVAC-Neo |
Neo-antigen이 |
2017년 |
전임상 |
- |
라이선스 아웃 |
||
| 예방백신 | AdCLD-CoV19/ AdCLD-CoV19-1 |
COVID-19 | 2020년 2021년 |
임상 1/2a상(국내) 임상 2b상(국내) |
2020년 2022년 |
- 조기종료 |
|
| AdCLD-CoV19-1 OMI | COVID-19 | 2021년 | 임상 3상(국내외) | 2023년 | - | ||
(가) 파이프라인: BVAC-C
|
구분 |
바이오 신약 |
||||||||||||||||||||||
|
적응증 |
인유두종바이러스 (HPV) 16형 및 18형 암항원 발현 모든 암종(자궁경부암, 두경부암, 항문암, 성기암 등) |
||||||||||||||||||||||
|
작용기전 |
BVAC-C는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화를 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
||||||||||||||||||||||
|
제품의 특성 |
BVAC-C 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 형태 측면에서 세계적으로 퍼스트-인-클라스 (First-in-class), 퍼스트-인-카인드 (First-in-kind) 의약품으로, 세계시장을 지배할 수 있는 잠재력을 가지고 있음. 임상 1상에서 안전성과 경쟁제품 대비 우월한 예비유효성을 확인하였음. |
||||||||||||||||||||||
| 진행경과 |
|
||||||||||||||||||||||
|
향후계획 |
BVAC-C는 현재 면역관문저해제와 병용투여 임상 2a상 연구자주도 임상시험을 진행 중임. 자궁경부암을 적응증으로 조건부허가를 신청할 계획임. 이를 위해 경기도 성남시 SK V1 TOWER 에 상업용 GMP 생산시설을 완공하였음. |
||||||||||||||||||||||
|
경쟁제품 |
인유두종바이러스 유래 암종을 적응증으로 하는 항암면역치료백신은 상품화된 제품은 없음. 현재 네덜란드 ISA Pharmaceuticals의 HPV16 펩타이드 백신 ISA101b, 미국 PDS Biotech의 HPV16 펩타이드 백신 PDS0101, 노르웨이 Nykode Therapeutics의 HPV16 DNA 백신 VB10.16 등 이 화학적 항암제 또는 면역관문차단제와 병용요법으로 임상 2상을 진행 중임. | ||||||||||||||||||||||
| 관련 논문 등 | - Phase I Study of a B Cell-Based and Monocyte-Based Immunotherapeutic Vaccine, BVAC-C in Human Papillomavirus Type 16- or 18-Positive Recurrent Cervical Cancer. J Clin Med.2020 Jan 5;9(1) - Activation of NKT cells in an anti-PD-1-resistant tumor model enhances anti-tumor immunity by reinvigorating exhausted CD8 T cells (IF 9.28) Cancer Res. 2018 78(18):5315 - IL-21-mediated reversal of NK cell exhaustion facilitates anti-tumour immunity in MHC class I-deficient tumours (IF 11.47) Nature Communications 2017. 8:15776 - Efficacy and safety of BVAC-C in HPV type 16- or 18.positive cervical carcinoma who failed 1st platinum-based chemotherapy: a phase I/IIa study. Frontiers in Immunology 2024. 15:1371353. |
||||||||||||||||||||||
|
시장규모 |
당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-C의 경우, 현재는 자궁경부암에 대한 임상을 진행 중이나 향후 성기암, 항문암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
||||||||||||||||||||||
|
기타사항 |
2018년 ESMO 진행사항 발표, 2020년 AACR 초록 채택 및 온라인 구두 발표 2021년 ASCO 구두발표 2024년 ASCO 병용투여 연구자주도 임상시험 중간결과 구두 발표 |
(나) 파이프라인: BVAC-E6E7
|
구분 |
바이오 신약 |
|
적응증 |
인유두종바이러스 (HPV) 16형 및 18형 암항원 발현 모든 암종(두경부암, 항문암, 성기암 등) |
|
작용기전 |
BVAC-E6E7은 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화를 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
|
제품의 특성 |
BVAC-E6E7 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히, BVAC-E6E7은 대량생산에 용이하도록 개선된 아데노바이러스 벡터로 구성되어 우수한 항암효과를 유지하며 원료 바이러스 생산 비용 절감이 가능함. |
| 진행경과 | - 2022년 1분기 비임상 개발 시작 - 2023년 제1/2a상 임상시험계획(IND) 신청 - 2024년 제1/2a상 임상시험계획(IND) 승인 |
|
향후계획 |
BVAC-E6E7은 보고서 작성기준일 현재 국내 임상 1/2a상 시험 계획을 식품의약품안전처에서 승인 받아 국내에서 임상 개발에 주력할 계획임. |
|
경쟁제품 |
두경부암 대상 면역 치료제 개발이 단독 또는 병용투여 요법으로 국내외에서 진행 중임. 제넥신이 두경부 편평세포암 DNA백신 GX-188E, 면역항암제로 개발 중인 GX-I7과 BMS·오노의 면역항암제인 옵디보의 삼중병용요법 연구자 주도 임상 2상을 진행 중임. |
| 관련 논문 등 | BVAC-E6E7은 현재 비임상 개발 중으로 논문 및 학회 발표 이력이 없음 |
|
시장규모 |
당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-E6E7의 경우, 현재는 두경부암에 대한 임상 진행을 계획 중이나 향후 성기암, 항문암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
|
기타사항 |
- |
(다) 파이프라인: BVAC-B
|
구분 |
바이오 신약 |
||||||||
|
적응증 |
HER2/neu 암항원 발현 모든 암종 (위암, 유방암, 췌장암, 폐암, 난소암 등) |
||||||||
|
작용기전 |
BVAC-B는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
||||||||
|
제품의 특성 |
BVAC-B 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 시장성이 매우 큰 위암, 유방암 등을 적응증으로 개발 중으로 개발 성공 시 매출 창출이 용이함. |
||||||||
|
진행경과 |
|
||||||||
|
향후계획 |
BVAC-B는 보고서 작성기준일 현재 임상 1상 시험 결과보고서 작성을 완료하고, 2a상 시험의 적응증을 검토 중에 있음. 식약처에 임상 2상 시험 계획 승인을 신청할 계획임. | ||||||||
|
경쟁제품 |
BVAC-B에 사용한 HER2/neu 암항원을 타겟하는 항암면역치료백신으로 판매 중인 제품은 없으며, Zymeworks 사에서 유방암 대상 임상 2상을 진행 중임. Imugene 사의 HER-Vaxx가 위암 대상 임상 2상 개발 중임. | ||||||||
|
관련 논문 등 |
- A combination of chemoimmunotherapies can efficiently break self-tolerance and induce antitumor immunity in a tolerogenic murine tumor model. (IF 9.28) Cancer Res. 2007, 67(15), 7477-86. - alpha-Galactosylceramide-loaded, antigen-expressing B cells prime a wide spectrum of antitumor immunity. (IF 5.0) Int J Cancer. 2008, 122(12), 2774-83 - CD40-targeted recombinant adenovirus significantly enhances the efficacy of antitumor vaccines based on dendritic cells and B cells. (IF 3.62) Hum Gene Thera.2010 21(12),1697-706. - Enhanced antitumor immunotherapeutic effect of B cell based vaccine transduced with modified adenoviral vector containing type 35 fiber structures. (IF 4.32) Gene Therapy. 2014, 21(1):106-14. - Enhanced Immunogenicity of Engineered HER2 Antigens Potentiates Antitumor Immune Responses. Vaccines (Basel). 2020 Jul 22;8(3):403. |
||||||||
|
시장규모 |
당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-B의 경우, 현재는 위암에 대한 임상을 진행 중이나 향후 유방암, 췌장암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
||||||||
|
기타사항 |
2020년 ASCO 초록 채택 및 발표 |
(라) 파이프라인: BVAC-P
|
구분 |
바이오 신약 |
|
적응증 |
PAP 또는 PSMA 암항원 발현 모든 암종 (전립선암, 뇌종양 등) |
|
작용기전 |
BVAC-P는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해 T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
|
제품의 특성 |
BVAC-P 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히 PAP와 PSMA를 기반으로 융합형 암항원을 제작하여 사용하여 약효와 시장성을 확보할 수 있으며, 융합형 암항원은 특허를 출원할 계획임. |
|
진행경과 |
BVAC-P의 비임상개발은 2017년 1분기에 시작하였으며, 2019년 3월 식약처 임상 1상 시험 계획 신청하였음. 보완사항 제출 후 2020년 3월 최종 승인받음. 임상 1상 개시를 위해 연구진을 접촉하는 등 준비 중임. |
|
향후계획 |
국내 임상 1상을 개시할 계획임. |
|
경쟁제품 |
전립선암 치료백신으로 미국에 시판 중인 수지상세포백신 Provenge가 있으며, 암세포주를 이용한 GVAX (BioSante 사)가 현재 임상 2상 개발 중임. Ayala가Advaxis사 인수 후 전립선암 대상 치료백신을 임상 1상 시험 중임. |
|
관련 논문 등 |
BVAC-P는 논문 및 학회 발표 이력이 없음 |
|
시장규모 |
당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-P의 경우, 현재는 전립선암에 대한 전임상을 진행 중이나 향후 뇌종양 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
|
기타사항 |
- |
(마) 파이프라인: BVAC-M
|
구분 |
바이오 신약 |
|
적응증 |
MAGE-A3 또는 GP100 암항원 발현 모든 암종 (흑색종, 폐암, 대장암, 췌장암 등) |
|
작용기전 |
BVAC-M은 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
|
제품의 특성 |
BVAC-M 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 제품임. 특히 GP100와 MAGE-A3를 동시에 타깃할 수 있어 약효와 시장성을 확보할 수 있는 점이 큰 장점임. |
|
진행경과 |
BVAC-M의 비임상개발은 2016년 4분기에 시작하였으며, 식약처에 임상 1상 시험 계획을 신청할 계획임. |
|
향후계획 |
BVAC-M의 임상 1상 시험계획을 신청할 계획임 |
|
경쟁제품 |
흑색종 대상 면역 치료제 개발이 국내외에서 진행 중이며, GP100을 발현하는 포도막 흑색종 타겟의 면역치료제인 Tebentafusp (상품명 Kimmtrak)가 2022년 미국 FDA 승인을 받음. |
|
관련 논문 등 |
BVAC-M은 현재 비임상개발 중으로 논문 및 학회 발표 이력은 없음 |
|
시장규모 |
당사가 영위하는 항암면역치료백신에 대하여 외부 기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC- M의 경우, 현재는 흑색종에 대한 전임상을 진행 중이나 향후 폐암 등으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
|
기타사항 |
- |
(바) 파이프라인: BVAC-Neo
|
구분 |
바이오 신약 |
|
적응증 |
Neo-antigen이 발굴된 모든 암종 |
|
작용기전 |
BVAC-Neo는 인체 내에서 항암 작용을 나타내는 적응면역계의 세포독성 T세포의 활성화와 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계 중 항암 작용을 지닌 자연살해세포와 자연살해T세포의 활성화를 유도함. 즉, 인체에서 항암효과를 발휘할 수 있는 모든 면역반응을 동시에 유도함으로써 강력한 약효를 나타냄. |
|
제품의 특성 |
BVAC-Neo 항암면역치료백신은 적응면역계와 선천면역계의 모든 항암 작용의 활성화를 유도하는 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 세포치료제 형태임. 완전개인맞춤형 제품으로 환자 자신의 암세포에만 존재하는 neo-antigen을 게놈 서열 분석으로 발굴하고, 이 중 항원성이 있는 epitope 부위를 예측 및 검증하여 완제품의 항원으로 사용하는 제품임. 항원의 특이성과 항원성이 매우 강하여 암 완치에 도전할 수 있으며, 치료 및 수술 후 재발 방지 목적으로 개발할 계획임. 또한, neo-antigen이 발견되는 모든 암종에 적용이 가능하며, 완전개인형 neo-angtigen과 더불어 암환자에서 빈번히 발생하는 돌연변이를 기반으로 한 shared neo-antigen을 활용하는 전략도 가능함. |
|
진행경과 |
BVAC-Neo의 기본 개념은 2006년 동물모델에서 이미 증명하여 Cancer Research 저널에 발표하였음. 혁신적 완전개인맞춤형 제품으로 식약처 가이드라인이 존재하지 않아 식약처와 사전 상담을 진행 중임. 개인맞춤형 제품에 맞는 독성시험, 생산공정 등 비임상 개발을 진행 중임. |
|
향후계획 |
BVAC-Neo는 비임상 개발 중이며, LG화학에 기술이전을 완료하고 양사 공동으로 임상진입을 준비 중임. |
|
경쟁제품 |
완전 개인맞춤형 항암치료 백신은 현재까지 상용화된 제품은 없으며, 미국의 Moderna과 Gritstone Bio, 독일의 BioNTech과 Curevac 사가 mRNA나 펩타이드 기반 기술을 활용한 파이프라인을 선두주자로 개발하여, 임상 1상 또는 2상 시험 중임. 이러한 파이프라인들은 T 세포 면역 반응은 유도하나 NK 세포나 NKT 세포와 같은 선천성 면역 반응은 유도하기 어려움. |
| 관련 논문 등 | CD1d-restricted T cells license B cells to generate long-lasting cytotoxic antitumor immunity in vivo. (IF 9.28) Cancer Res. 2006, 66(13), 6843-50 |
|
시장규모 |
당사가 영위하는 면역치료백신에 대하여 외부기관이 산정한 적응증별 시장 규모는 파악이 어렵습니다. 또한 당사가 개발 중인 항암면역치료백신은 제품에 적용되는 항원을 교체함으로서, 항원을 발현하는 모든 암종으로 적응증을 확대하는 것이 가능합니다. 예컨대, BVAC-Neo의 경우 Neo-antigen이 발굴된 모든 암종으로 확장이 가능합니다. 이러한 특성을 고려하여, 당사의 항암면역치료백신은 일차적으로 면역항암제 계열에 속하는 바 다음과 같이 항암제 및 면역항암제 시장 규모로 갈음하고자 합니다. IQVIA(2024)에 따르면 2023년 글로벌 항암제 지출 규모가 2,230억 달러에서 연평균 성장률 9.9%로 증가하여 2028년 4,090억 달러에 이를 것으로 전망되고 있습니다. 또한, The Business Research Company(2025)에 따르면 글로벌 면역항암제 시장 규모가 2024년 942억 달러에서 연평균 9.4% 성장하여 2029년에는 1,532억 달러에 이를 것으로 전망한 바 있습니다. |
|
기타사항 |
- |
(사) 파이프라인: AdCLD-CoV19/AdCLD-CoV19-1
|
구분 |
바이오 신약 |
|
적응증 |
COVID-19 감염 예방 |
|
작용기전 |
AdCLD-CoV19과 AdCLD-CoV19-1은 근육투여로 SARS-CoV-2 바이러스의 S 단백질 항원 특이적인 항체 생성을 유도하고, 세포독성 T세포 반응을 유도하여 SARS-CoV-2 바이러스에 대한 기억면역반응을 생성함. 백신 접종 후 실제 감염 시 신속하고 강력한 T세포 반응이 재활성화되고, 이어서 항체생성이 이루어지면서 발병을 예방함. |
|
제품의 특성 |
AdCLD-CoV19 : 복제불능성 아데노바이러스 벡터에 SARS-COV-2의 S단백질 항원을 삽입한 형태로, 아데노바이러스 벡터가 예방백신 완제의약품임. 1회 근육투여만으로 예방효력을 기대할 수 있는 제품임. AdCLD-CoV19-1 : 백신의 대량생산 및 공급을 원활히 하여 상업적 경쟁력을 높이기 위해 AdCLD-CoV19의 벡터 구조를 개량한 형태의 백신. |
|
진행경과 |
AdCLD-CoV19 : 2020년 4월 개발을 개시하였으며, 마우스와 영장류 시험에서 고농도의 항원특이적 항체 생성을 확인하였음. 또한, 영장류 감염모델 시험을 통해 SARS-COV-2 바이러스를 예방할 수 있음을 입증하였음. 임상 1/2a상 시험을 통해 건강한 성인에게서 바이러스 중화항체반응 및 항원-특이적 T 세포 반응을 유도할 수 있음을 확인하였음. |
|
향후계획 |
추가 접종 용도로 개발한 오미크론 전용 백신 AdCLD-CoV19-1 OMI 개발에 주력할 계획 |
|
경쟁제품 |
수 종의 COVID-19 예방백신이 개발되어 각국에서 사용 중임. 대표적으로 Moderna, Pfizer/BioNTech 사가 mRNA 기반 기술을 활용한 백신을 개발하였으며, 아스트라제네카와 존슨앤존슨 사는 아데노바이러스 벡터 기반 백신을 개발하였음. |
| 관련 논문 등 | The Chimeric Adenovirus (Ad5/35) Expressing Engineered Spike Protein Confers Immunity against SARS-CoV-2 in Mice and Non-Human Primates, Vaccines 2022, 10(5), 712 |
|
시장규모 |
예방의 지속효력이 짧은 현재 기허가 백신의 특성상, 접종 완료 후 일정 기간 이후에 부스터 접종이 필요할 것으로 예상됨 (6개월~1년으로 예상). 이를 통해 볼 때, 국내 성인 기준 매년 3천만회 분량의 수요가 있으며, 전 세계적으로 매년 50억회 분량의 수요가 있을 것으로 예측함. |
|
기타사항 |
AdCLD-CoV19-1과 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 것으로 전망함. |
(아) 파이프라인: AdCLD-CoV19-1 OMI
|
구분 |
바이오 신약 |
|
적응증 |
COVID-19 감염 예방 |
|
작용기전 |
AdCLD-CoV19-1 OMI는 근육투여를 통해 SARS-CoV-2 바이러스의 S 단백질 항원 특이적인 항체 생성을 유도하고, 세포독성 T세포 반응을 유도하여 SARS-CoV-2 바이러스에 대한 기억면역반응을 생성함. 백신 접종 후 실제 감염 시 신속하고 강력한 T세포 반응이 재활성화되고, 이어서 항체생성이 이루어지면서 발병을 예방함. |
|
제품의 특성 |
AdCLD-CoV19-1 OMI: AdCLD-CoV19-1의 항원 유전자를 SARS-CoV-2 Omicron (BA.1) Spike 단백질로 치환하여 오미크론 변이주 대응에 특화하여 개발한 백신. |
|
진행경과 |
AdCLD-CoV19-1 OMI : 마우스와 영장류 시험을 통해 면역원성을 확인함. 기초 백신 (AdCLD-CoV19-1)을 접종한 동물에 추가 접종한 경우, SARS-CoV-2 초기주에 대한 중화항체와, 오미크론 변이주 (BA.1, BA.2)에 대한 중화항체가 모두 효과적으로 생성되는 것을 확인함. 현재 임상시험 약 제조가 완료되었으며, 임상 1/2상 시험 계획을 식약처에 제출하여 2022년 8월 수행을 허가받음. 2023년 2월 임상 1/2상 모집 및 투여를 완료하였으며, 안전성 및 면역원성 중간결과를 확보함. 2023년 7월 AdCLD-CoV19-1 OMI의 제1/2상 임상시험 Top-line 결과를 발표함. 2023년 5월 임상 3상 시험 계획을 식약처에 제출하여 7월 수행을 허가받음. 본 보고서 제출일 현재 필리핀 및 베트남 식약처에도 임상 3상 시험계획 신청 후 승인을 완료하여 진행 중에 있음. 2024년 11월 13일 임상 3상 시험 대상자에게 투여 완료하였음. |
|
향후계획 |
다국가 임상 3상을 진행하여 중간결과를 확보 후 국내 및 국외 품목허가 신청 계획임. |
|
경쟁제품 |
수 종의 COVID-19 예방백신이 개발되어 각국에서 사용 중임. 대표적으로 Moderna, Pfizer/BioNTech 사가 mRNA 기반 기술을 활용한 백신을 개발하였으며, 아스트라제네카와 존슨앤존슨 사는 아데노바이러스 벡터 기반 백신을 개발하였음. |
| 관련 논문 등 | - Boosting with variant-matched adenovirus-based vaccines promotes neutralizing antibody responses against SARS-CoV-2 Omicron sublineages in mice, Int J Antimicrob Agents. 30;63(3):107082 - Strategy to develop broadly effective multivalent COVID-19 vaccines against emerging variants based on Ad5/35 platform, Proc Natl Acad Sci U S A. 121(10):e2313681121 |
|
시장규모 |
AdCLD-CoV19-1 OMI와 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 수 있음. |
|
기타사항 |
AdCLD-CoV19-1과 같은 아데노바이러스 벡터 기반 백신은 냉장조건에서도 수개월간 안전하기 때문에, 제 3세계 등 백신 보급의 인프라가 부족한 국가에서도 수요가 있을 것으로 전망함. |
2) 연구개발 완료 실적
당사는 본 보고서 작성기준일 현재 연구개발이 완료되어 상용화된 제품이 없습니다.
3) 기타 연구개발 실적
당사가 본 보고서 작성기준일 현재 수행한 정부출연과제 현황은 다음과 같습니다.
| 연구과제명 | 주관부처 | 연구기간 | 정부출연금 | 관련 파이프라인 | 비고 |
|---|---|---|---|---|---|
| 국산 기술로 개발된 국내 최초 코로나19 오미크론 변이 대응 부스터샷 백신의 품질 및 특성분석 | 서울특별시 | '24.08 ~ '26.07 |
1.3억 원 (총 사업비 : 약 5.3억원) |
AdCLD-CoV19-1 OMI | 주관기관 /진행중 |
| 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이에 대한 다가백신 개발 (주1) | 보건복지부 | '23.04 ~ '24.06 |
10.1억원 (총 사업비 : 약 13.5억원) |
다가백신 | 주관기관 /종료 |
| 아데노바이러스 벡터를 기반으로 한 코로나19 변이 대응 예방백신 임상 1/2상 개발 |
보건복지부 | '22.07 ~ '23.07 |
83.1억원 (총 사업비 : 약 110.8억원) |
AdCLD-CoV19-1 OMI | 주관기관 /종료 |
| (임상 2b/3상) 아데노바이러스 벡터를 기반으로 한 코로나19 예방백신 임상 2b/3상 개발 |
보건복지부 | '22.03 ~ '22.12 |
29.6억원 (총 사업비 : 약 39.5억원) |
AdCLD-CoV19/ AdCLD-CoV19-1 |
주관기관 /종료 |
| 아데노바이러스 벡터에 기반한 1세대 및 2세대 코비드-19 예방백신 개발 |
과학기술정보 통신부 |
'20.07 ~ '22.12 |
37억원 (총 사업비 : 약 49억원) |
AdCLD-CoV19 |
주관기관 /종료 |
| AdCLD-CoV19-1 코로나19 예방백신의 원료인 마스터 및 제조용 바이러스 은행 생산을 위한 부유세포 생산공정 장비 구축 |
보건복지부 | '21.10 ~ '23.07 |
2.5억원 (총 사업비 : 7.17억원) |
AdCLD-CoV19-1 | 주관기관 /종료 |
| (임상 1/2a상) 아데노바이러스 벡터를 기반으로 한 코로나19 예방백신의 임상 1/2a상 개발 |
보건복지부 | '21.02 ~ '22.01 |
63.2억원 (총 사업비 : 약 84억원) |
AdCLD-CoV19 |
주관기관 /종료 |
| 항원제시세포를 기반으로 한 자궁경부암 항암면역치료 백신의 임상 2상 개발 |
보건복지부 | '18.04 ~ '21.12 |
30억원 (총 사업비 : 약 40.6억원) |
BVAC-C |
주관기관 /종료 |
| 난치성암 치료용 B세포 및 단구기반 면역치료백신 CeliVax의 사업화를 위한 비임상 및 임상개발 | 산업통상자원부 | '17.04 ~ '18.12 |
13억원 (총 사업비 : 약 21억원) |
BVAC-B BVAC-P |
주관기관 /종료 |
| 신규 융합형 암항원의 개발과 항원제시세포 기반 면역치료백신에의 적용 |
과학기술정보 통신부 |
'16.11 ~ '21.12 |
16억원 (총 사업비 : 약 21.4억원) |
BVAC-M |
참여기관 /종료 |
(주1) 정부R&D예산 축소로 인한 사업비 규모 및 연구기간이 변경되었습니다. 기타 세부 사항은 2024년 3월 15일 기 제출한 기타경영사항을 참조하시길 바랍니다.
7. 기타 참고사항
당사가 영위하는 사업내용의 이해를 돕기 위해 아래와 같이 주요 용어에 대하여 간략히 설명드립니다.
[용어정리]
|
용어 |
해설 |
|---|---|
|
Abiraterone |
Androgen 생성에 관여하는 CYP17A1 억제제로 남성호르몬에 의존적인 거세저항성 전립선암(Castration-resistant prostate cancer) 치료에 사용 |
|
Adjuvant 치료법 |
일반적으로 암환자의 수술 후 보조요법을 의미하며 일차치료에 더하여 미세전이 등으로 발견하기 어려운 암세포를 제거하고 재발을 방지하기 위해 실시함 |
|
Axalimogene |
유전자 조작을 한 리스테리아 균을 활용하여 자궁경부암세포를 공격하도록 면역계를 자극하는 면역 치료 방법 |
|
B 세포 |
림프구의 일종으로 적응면역계에 작용하여 항원 특이적 항체를 생산하며 항원제시세포로 역할을 할 수 있음 |
|
BVAC |
CELIVAX의 파이프라인 코드명 |
|
CAR-T |
환자의 혈액에서 T세포를 추출하여 암세포에 반응하는 수용체 DNA를 이용하여 키메릭 항원 수용체를 만들어 암을 공격하도록 만든 치료제 |
|
CD1d |
다양한 인간 항원제시세포의 표면에 발현되어 T 세포로의 지질성 항원 제시에 관여하는 당단백의 일종 |
|
CD4 T 세포 |
세포 표면에 CD4가 있는 T 세포로 다른 백혈구의 분화 및 활성화를 조절함으로써 다양한 면역반응을 촉진하는 세포 |
| CD46 | 다양한 세포의 표면에 발현되어 species B에 속하는 아데노바이러스 serotype의 세포 부착에 관여하는 단백질 |
| CD46 수용체 | 일부 암종에서 과발현되는 MCP(membrane cofactor protein) CD46와 결합하는 수용체로 항암면역반응에 작용 |
|
CD8 T 세포 |
세포 표면에 CD8이 있는 T 세포로 세포독성물질을 분비하여 바이러스, 감염세포나 종양세포 등을 사멸할 수 있는 적응면역을 담당하는 세포 |
|
CELIVAX |
㈜셀리드의 항암면역치료백신 브랜드명 |
| CMO | Contract Manufacturing Organization의 약자임. 의약품을 위탁생산하는 의약품 전문 생산사업 |
| CDMO | Contract Development & Manufacturing Organization의 약자임. 의약품 위탁생산을 뜻하는 CMO에 개발(Development)을 더한 의약품 위탁개발생산을 의미함 |
| Chimeric Antigen Receptor (CAR) |
암 세포의 특정 단백질에 결합하도록 고안된 특수 수용체임. CAR-T 치료제에서 면역세포인 티(T)세포에 발현시켜 이 수용체에 결합하는 특정 단백질이 있는 암세포를 죽이는 역할을 수행함 (키메라항원수용체) |
| COVID19 | 흔히 코로나19로 불리는 바이러스 감염증. 원인바이러스는 SARS-CoV-2 이며, 감염시 발열, 호흡곤란, 다기관 염증 반응 등의 증상이 나타날 수 있음. |
|
DNA 백신 |
유전학적으로 변형된 DNA를 생체 내에 주입하여 체내 세포가 직접 항원 및 이 항원에 대응하는 항체를 생산하도록 유도하는 형태의 백신 |
|
epitope peptide |
암세포 혹은 항원제시세포의 MHC(주조직적합복합체)에 의해 제시된 항원의 작은 단백질 부분 |
|
Exome-Seq |
세포 내의 DNA 염기서열 중 유전자를 포함하고 있는 exon 부위의 염기서열 판독. 인체 단백질의 변형을 유도하는 유전자의 다양성 혹은 돌연변이를 확인하는 데 활용 |
|
GLP |
의약품 등의 안정성 유효성 심사에 관한 규정에 의하여 의약품 등의 제조 및 수입 허가 신청 등을 위한 비임상 시험의 계획, 실시, 점검, 기록, 보고 및 보관을 위한 시험기관에서의 절차 및 조건 등을 정한 비임상시험관리기준 |
|
GMP |
의약품 등의 안정성과 유효성을 품질면에서 보증하는 기준조건으로서 의약품 등의 제조관리기준 |
|
IFN-γ |
사이토카인의 일종으로 선천면역계와 적응면역계에 중요한 요소로 작용. 대식세포와 MHC class II의 발현에도 중요하며 NK세포, NKT세포, T세포 등에 의해 주로 생산 및 분비됨 |
| iNKT cell | invariant NKT 세포로 면역 세포에 의한 당지질(glicylipid)이 항원 제시될 경우 인터페론을 포함하여 다양한 사이토카인을 분비함 |
|
Immuno-Oncology |
암을 타겟으로 하는 면역 치료 방법 |
|
irRC |
암치료 시 환자의 종양이 소멸, 축소, 유지 또는 악화되는 것을 정의하는 기준 |
|
irPD |
암치료 효과 판정기준(irRC)으로 종양의 크기가 기저치에 비해 25% 증가한 경우 |
|
irPR |
암치료 효과 판정기준(irRC)으로 종양의 크기가 기저치에 비해 50% 감소한 경우 |
|
irSD |
irRC에서 irPR과 irPD에 해당하지 않는 경우 |
|
MHC-I |
사람의 주조직적합성 복합체 (MHC) 종류 중 하나로 모든 유핵세포의 표면에 존재. HLA-A, B, C 항원 타입이 있으며 CD8 T 세포에 항원을 제시하여 감염된 세포 및 암세포를 파괴하는데 중요한 역할을 함 |
|
mRNA |
RNA의 일종으로 DNA에서 유전정보를 전사(transcription)하여 리보솜에 전달하는 기능을 함 |
|
Neoadjuvant 치료법 |
일차적 치료에 선행하는 암치료 방법으로 통상 종양 크기를 축소하여 향후 치료를 용이하게 하고, 치료효과를 증진시킬 목적으로 시행 |
|
Neo-antigen |
환자 개개인에 맞춤화된 항원으로써 각 환자의 암세포 유전체를 분석하여 정상세포의 염기서열과 비교한 뒤 환자의 암세포에서만 나타나는 염기서열상 돌연변이를 이용한 항원 |
|
Neo-epitope |
환자 개개인의 neo-antigen의 항원결정기 |
|
NK세포 |
선천면역계에 작용하는 세포독성 림프구의 일종으로 감염세포 및 암세포를 공격하여 제거하는 기능을 함 |
|
NKT세포 |
T 림프구로서 자연살해(NK) 세포 수용체를 발현하여 NK세포 기능을 공유하며 면역 조절 작용 및 면역 강화 작용을 수행함 |
|
PD-1 |
면역 작용 억제 인자의 하나로 억제될 경우 면역 활성이 유도되어 항암 작용이 일어남 |
| Peptide | 아미노산 단위체들이 인공적으로 혹은 자연 발생적으로 연결된 중합체 |
|
Proof of Concept (POC) |
기존 시장에 없었던 신기술을 도입하기 전에 제품, 기술, 정보 시스템 등이 조직의 특수 문제 해결을 실현할 수 있다는 증명 과정 |
| RNA | 염기와 리보오스(5탄당)와 인산기가 결합된 폴리머로, 유전자 정보를 매개, 유전자의 발현의 조절 등에 관여함 |
|
RNA-Seq |
세포 내의 RNA 염기서열을 판독하는 것으로, 유전자의 발현 정도와 그 변화를 확인할 때 많이 사용되어 개인화된 유전자 발현 정보 확인에 활용 가능함 |
| SARS-CoV-2 | 코비드19 감염증을 일으키는 코로나바이러스로 WHO에 의해 SARS-CoV-2로 명명되었음. |
| Spike 항원단백질 | 코비드19의 원인 바이러스인 SARS-CoV-2의 표면 돌기 단백질임. 사람세포의 ACE2 (angiotensin converting enzyme 2)와 결합하여 세포내로 바이러스가 감염됨 |
|
T 세포 |
백혈구의 일종으로 세포 면역반응에 주된 역할을 수행함. 면역체계의 기억능력을 담당하며 B세포가 항체를 생성하도록 도움 |
|
αGC |
Alpha-galactosylceramide의 약자로 당지질의 일종. iNKT cell을 활성화시킬 수 있으며, CD1d 분자와 결합하여 강한 면역 반응을 일으킬 수 있음 |
| 가수분해 | 화학 반응시, 물과 반응하여 원래 하나였던 큰 분자가 몇 개의 이온이나 분자로 분해되는 반응 |
|
기억면역반응 |
항원의 일차적 노출 시 생성된 기억세포에 의해 동일한 항원이 재차 감염되었을 때 광범위하고 신속하게 일어나는 면역반응 |
| 다가백신 | 같은 종의 바이러스나 세균이라도 여러 형이 있기 때문에 항원성이 다를 경우에 면역효과가 있는 혼합백신 |
|
단구 |
백혈구의 일종으로 혈액이나 조직에서 세균이나 이물질을 공격하여 제거하는 기능을 하며 활성화될 경우 항원제시세포의 역할을 수행함 |
|
단클론항체의약품 |
단일 세포 클론에서 유래한 항체를 주성분으로 하는 바이오의약품 |
|
당단백 |
단백질의 일종으로 단백질에 올리고당 사슬이 결합해있으며 세포막에 부착되어 있거나 분비되는 형태로 세포 간 상호작용에 관여하는 생리 역할을 수행함. 면역세포에서는 세포막에서 항원과 직접 상호 작용하는 항체 같은 분자를 포함 |
|
대조군 |
투약군과 비교하여 처치는 동일하나 실제 약제를 투여하지 않고 위약 또는 이와 유사한 처치를 하여 투약효과를 비교, 판정할 수 있는 기준이 되는 환자군 |
|
도입유전자 |
바이러스 등을 통해 체내에 도입하고자 목적한 항원 유전자 |
|
독성시험 |
비임상시험에서 약물의 독성을 판정, 예측하기 위해 실시하는 시험 |
|
리간드 |
세포막 또는 세포질에 존재하며, 세포 밖에서의 물질 또는 물리적 자극을 인식하여 세포에 특정한 반응을 일으키는 수용체에 결합하는 물질. 세포 외부로부터 신호를 전달함에 있어서 관여하는 단백질들을 리간드 (ligand)와 수용체(receptor)로 구분함 |
| 리보솜 | 세포 활동에 필요한 단백질을 합성하는 기관으로, 세포질에 떠 있거나 소포체(endoplasmic reticulum)에 부착되어 있음 |
|
림프구 |
질병을 일으키는 각종 원인(물질)에 대항하여 신체를 방어하는 세포들로 B cell, T cell, NK cell 등으로 구성됨 |
|
림프구성분채집술 |
혈액으로부터 백혈구를 분리해내는 기술 |
|
말초혈액단핵세포 |
백혈구 중 핵이 하나인 세포로 T 세포, B 세포, NK 세포, 단구 등이 해당됨 |
|
면역관문저해제 |
암세포의 면역 회피신호를 저해하여 면역세포가 암세포를 공격하도록 유도하는 약물 |
|
면역증강제 |
항원이 일으키는 면역반응의 효율/효력을 증강시키는 물질 |
|
면역치료백신 |
환자에게 투여하여 환자 스스로의 강력한 면역반응을 유도함으로써 암 및 감염증 등을 치료할 목적으로 사용하는 백신 |
|
면역항암제 |
인체의 면역기능 활성화 및 면역 체계 간 신호 경로를 공략하여 암을 치료할 목적으로 사용하는 의약품 |
|
면역회피기전 |
종양세포가 숙주의 면역감시를 회피하여 증식하는 것에 관여하는 기전 |
|
무진행생존기간 |
질병의 치료 도중 혹은 치료 후 환자가 질병을 갖고 있지만 질병이 악화되지 않고 생존하는 기간 |
|
반응률 (ORR, Objective response rate) |
암환자의 치료 후 전체 치료환자 중에서 부분반응이상을 보인 환자의 비율 |
|
병용투여 |
한 약물에 보완적인 다른 약물을 함께(두 가지 이상의 의약품을 동시에 혹은 연속적으로 투여)하여 치료에 효과를 높이는 방법 |
|
분포시험 |
약물을 투여한 뒤 체내 조직 및 기관에 분포하는 경로와 패턴을 파악하기 위해 실시하는 비임상시험 |
|
비임상시험 |
신약후보물질을 동물에게 먼저 투여하여 부작용, 독성, 효과 등을 전반적으로 알아보는 시험 |
|
사이토카인 |
인체의 면역체계가 과도한 반응을 일으켜 면역계의 세포들이 서로 통신하기 위해 분비하는 여러 단백질 분자 |
|
상피성장인자수용체 (hEGFR) |
세포막 표면에 위치하는 수용체의 일종으로 상피성장인자(EGF)가 결합하는 부위. 세포 내부로 신호전달을 일으켜 세포가 분열, 증식하도록 함. 암세포에서 비정상적으로 많이 발현되는 경향이 있음 |
|
선천면역계 |
NK세포, 대식세포 등이 관여하여 비자기 항원에 대해 비특이적으로 작용하는 면역계 |
|
세포독성 T세포 |
T 세포의 일종으로 MHC를 인식하여 비자기 항원 및 변형 단백질을 포함하고 있는 세포를 직접 사멸시킴 |
|
수지상세포 (DC, Dendritic cell) |
면역세포의 일종으로 항원물질을 세포표면에 발현하여 T세포에 제시하는 항원제시세포의 역할을 함 |
|
수지상세포백신 |
수지상세포를 항원제시세포로 사용하여 자가면역세포를 활성화시켜 암 등의 치료 목적으로 사용하는 백신 |
|
조절T 세포 |
억제 T 세포로도 불리며 자기항원에 대한 면역관용, 자가면역질환의 예방유지에 관여하는 T세포의 일종 |
|
신호전달기작 |
세포 내에서 신호를 전달하는 과정으로 핵에서의 유전자 발현 정도 조절 등 다양한 인체반응을 매개하는 기전 |
|
아데노바이러스 |
이중나선 DNA 바이러스의 일종으로 넓은 범위의 척추동물 숙주를 가지고 있으며, 감염 시 감기와 같은 가벼운 호흡기 질환을 유발함 |
| 안정 질환 | 암의 치료효과 판정에 관한 용어로, 종양 축소가 부분관해가 되는 데는 충분하지 않고, 종양 증대가 진행되는 데는 충분하지 않은 것 (Stable disease) |
|
암-고환 항원 (CTA, cancer/testis antigen) |
고환, 태아 난소나 영양막 등 일부의 정상조직과 일부 암에서만 발현되는 항원으로 면역 자극적임 |
|
암항원 |
암세포에서 특이적으로 발현되어 면역반응을 일으킬 수 있는 물질 |
|
연구자 임상 |
임상시험자가 외부의 의뢰 없이 안전성 및 유효성이 검증되지 않은 의약품 또는 시판 중인 의약품으로 허가되지 않은 새로운 효능, 효과, 용법, 용량에 대해 독자적으로 수행하는 임상시험 |
|
완전관해 |
암 치료 후 기존종양이 모두 없어지고 새로운 종양도 출현하지 않은 경우 |
| 완제공정 | 원료의약품을 용기에 담고 포장해 완제의약품으로 생산하는 과정으로 충전, 라벨링, 포장 작업 등을 포함함 |
|
이상약물반응 |
의약품 등을 정상적으로 투여 혹은 사용하여 발생한 유해하고 의도하지 아니한 반응으로서 해당 의약품 등과의 인과관계를 배제할 수 없는 경우를 뜻함 |
| 이중항체 | 하나의 항원을 인식해 결합하는 일반적인 항체와 달리, 두 종류의 항원에 동시에 결합할 수 있는 항체 |
| 인산 모노에스텔 (인산 모노에스테르) |
한 개의 에스테르 결합과 인산기 가지는 화합물로, 인지질 세포막의 구성 요소 |
|
인유두종바이러스(HPV) |
DNA 바이러스의 일종으로 사람을 비롯한 여러 동물에 감염되어 다양한 암 및 질병의 원인이 됨. 자궁경부암의 발생 원인임 |
| 인터페론 치료법 | 인터페론은 바이러스 감염과 증식을 억제하는 능력을 지니고 있어 유전공학을 통해 인공적인 대량 생산을 하여 바이러스성 질병 치료에 사용함 |
|
임상 1상 시험 |
의약품을 최초로 사람에게 투여하는 단계로 소규모의 사람을 대상으로 약물의 안전성 및 약동학, 약력학적 정보 등을 구하기 위해 실시하는 임상시험 |
|
임상 2상 시험 |
치료적 탐색단계로 소규모 환자들을 대상으로 약물의 유효성과 부작용을 평가하며 최적 용법용량을 결정하고자 하는 임상시험 |
|
임상 3상 시험 |
치료적 확증 단계로 의약품의 안전성과 유효성을 확증하기 위해 대규모 환자들을 대상으로 장기 투여를 진행하는 임상시험 |
|
저항성 |
약물을 반복적으로 투여시 약효가 저하되거나 무반응이 나타나는 현상 |
|
적응면역계 |
침입한 항원에 대해 특이적으로 작용하는 면역계로 B 세포 등이 관여함 |
| 전사 | DNA를 원본으로 사용하여 RNA를 만드는 과정 (transcription) |
|
조건부 허가 |
생명을 위협하거나 중증의 비가역 질환, 의학적 미충족 상태인 질병에 적용하려는 의약품에 대해 차후 치료적 확증 임상시험 자료를 제출하는 것을 조건으로 치료적 탐색 임상시험인 임상2상 결과만을 토대로 시판을 허가하는 제도 |
|
종양미세환경 |
분자 및 세포외 기질에 신호를 보내는 주변 혈관, 면역세포, 섬유아세포 등을 포함한 종양주위의 세포환경을 의미함. 종양은 자신의 미세환경을 변경할 수 있으며 미세환경은 종양이 성장하고 퍼져 나가는 방식에 영향을 미칠 수 있기에 종양미세환경을 연구하여 암치료에 이용하려는 노력이 활발하게 이루어지고 있음 |
|
종양침윤 T 세포 |
T 세포의 일종으로 혈액에서 종양으로 침투하는 세포들을 의미하며 종양에 대한 면역과 연관이 있음 |
| 중화항체 | B 세포가 항원 단백질에 대해 분비하는 여러 항체 중, 병원성 바이러스의 세포 감염을 차단하는 핵심 역할을 하는 항체 |
| 지질성 항원 제시 | 지질성 항원이 세포 표면에서 CD1 분자에 결합, 전시됨으로 T세포 및 iNKT 세포를 활성화를 유도함(항원은 단백질, 당, 지질, 기타 등이 있음) |
|
질병조절율 |
약을 복용하고 나타나는 효과에 따라 완전관해, 부분관해, 진행중지를 달성한 환자의 백분율 |
|
투여군 |
임상시험에서 평가하고자 하는 의약품을 투여한 환자군 |
|
파포바 바이러스 |
이중나선 DNA 바이러스의 일종으로 협막이 없으며 이십면체 모양을 가지고 있음. 포유류가 숙주이며, 출혈성 방광염, 진행성 다발성 백질 뇌증 등의 원인이 됨 |
|
표적항암제 |
정상세포에는 존재하지 않거나 매우 낮은 빈도로 발현되지만 암세포에는 특징적으로 발현되는 항원 및 인자를 표적으로 한 항암제 |
|
표준치료 |
암환자에서 신뢰할 수 있는 임상적 입증자료를 기반으로 환자에게 우선 적용하도록 동의되어진 치료법 |
|
항암바이러스 |
바이러스가 인체세포에 효과적으로 침투한 뒤 증식하는 특성을 이용하여 유전자조작을 통해 항암효과를 내도록 한 바이러스 |
| 항원 | 면역 반응을 일으켜 특히 항체를 생산하게끔 만드는 물질로써 일반적으로 생명체내에서 이물질로 간주되는 물질의 총체 |
|
항원제시세포 |
항원인자를 받아들여 처리한 후 세포표면에 항원 에피톱을 제시하여 체내 주요 면역세포들이 항원을 인식하게 함으로써 면역반응을 유도할 수 있는 세포 |
|
항체 |
항원에 특이적으로 결합하여 이를 비활성화시키는 단백질 |
|
희귀의약품 |
적응증이 희귀질환이거나 대체의약품이 없어 긴급하게 도입할 필요가 있는 의약품 |
가. 지적재산권 현황
당사의 지적재산권 보유 현황은 다음과 같습니다.
| 번호 | 구분 | 내용 | 출원일 | 등록일 | 적용제품 | 출원국 | ||
|---|---|---|---|---|---|---|---|---|
| 1 | 특허권 | 자연살해 T 세포의 리간드와 항원을 적재한 B 세포를 매개로 하는 백신 | 2006.04.27 | 2008.02.27 | BVAC | 한국 | ||
| 2007.04.30 | 2014.12.03 | 유럽 | ||||||
| 2007.05.01 | 2011.08.23 | 미국 | ||||||
| 2007.07.06 | 2011.04.01 | 일본 | ||||||
| 2008.09.17 | 2017.10.25 | 인도 | ||||||
| 2008.10.14 | 2011.06.10 | 러시아 | ||||||
| 2008.10.24 | 2013.03.27 | 중국 | ||||||
| 2008.10.14 | 2021.07.27 | 브라질 | ||||||
| 2 | 특허권 | 자연살해 T 세포의 리간드와 항원을 적재한 단핵구 또는 미분화 골수성 세포를 포함한 백신 | 2007.11.19 | 2010.11.12 | BVAC | 한국 | ||
| 2010.10.12 | 2011.08.03 | |||||||
| 2008.08.11 | 2016.12.13 | 미국 | ||||||
| 2010.05.14 | 2012.12.14 | 일본 | ||||||
| 2010.05.18 | 2013.08.28 | 중국 | ||||||
| 2010.06.15 | 2017.05.17 | 유럽 | ||||||
| 3 | 특허권 | 알파-갈락토실세라마이드를 아쥬반트로 포함하는 비강투여용 백신 조성물 | 2005.07.13 | 2007.10.01 | - | 한국 | ||
| 2008.01.02 | 2011.05.11 | - | 중국 | |||||
| 4 | 특허권 | 코로나바이러스감염증 예방용 백신의 투여 및 용량 | 2021.08.31 | - | AdCLD-CoV19-1 OMI | 한국 | ||
| 5 | 특허권 | 복제가능 아데노바이러스를 포함하지 않는 신규 아데노바이러스 벡터 및 이의 용도 | 2022.01.20 | - | AdCLD-CoV19-1 OMI | 한국 | ||
| 2022.01.20 | - | AdCLD-CoV19-1 OMI | PCT | |||||
| 2023.06.08 | - | AdCLD-CoV19-1 OMI | 싱가포르 | |||||
| 2023.06.09 | - | AdCLD-CoV19-1 OMI | 유럽 | |||||
| 2023.06.20 | - | AdCLD-CoV19-1 OMI | 베트남 | |||||
| 2023.06.20 | 2024.06.28 | AdCLD-CoV19-1 OMI | 러시아 | |||||
| 2023.06.21 | 2024.09.17 | AdCLD-CoV19-1 OMI | 중국 | |||||
| 2023.06.21 | 2024.09.24 | AdCLD-CoV19-1 OMI | 미국 | |||||
| 2023.06.21 | 2024.09.13 | AdCLD-CoV19-1 OMI | 일본 | |||||
| 2023.06.28 | - | AdCLD-CoV19-1 OMI | 태국 | |||||
| 2023.07.18 | - | AdCLD-CoV19-1 OMI | 브라질 | |||||
| 2023.07.21 | - | AdCLD-CoV19-1 OMI | 인도 | |||||
| 2023.07.24 | - | AdCLD-CoV19-1 OMI | 인도네시아 | |||||
| 6 | 특허권 | 자연 살해 T 세포의 리간드와 암 항원을 적재한 말초혈액단핵세포를 포함하는 백신 | 2023. 09.15 | - | BVAC | 한국 | ||
| - | PCT | |||||||
| 7 | 특허권 | 신규한 코로나바이러스 재조합 스파이크 단백질, 이를 코딩하는 폴리뉴클레오티드, 상기 폴리뉴클레오티드를 포함하는 벡터 및 상기 벡터를 포함하는 코로나바이러스감염증 예방용 백신 | 2021.08.27 | - | AdCLD-CoV19-1 OMI | PCT | ||
| 2023.02.24 | - | AdCLD-CoV19-1 OMI | 중국 | |||||
| 2023.02.24 | - | AdCLD-CoV19-1 OMI | 미국 | |||||
| 2023.02.28 | - | AdCLD-CoV19-1 OMI | 유럽 | |||||
| 2023.02.24 | 2024.12.19 | AdCLD-CoV19-1 OMI | 일본 | |||||
| 2023.02.27 | 2024.04.02 | AdCLD-CoV19-1 OMI | 러시아 | |||||
| 2023.02.27 | - | AdCLD-CoV19-1 OMI | 인도 | |||||
| 2023.02.27 | - | AdCLD-CoV19-1 OMI | 브라질 | |||||
| 2023.02.22 | - | AdCLD-CoV19-1 OMI | 인도네시아 | |||||
| 2023.02.17 | - | AdCLD-CoV19-1 OMI | 베트남 | |||||
| 2023.02.21 | - | AdCLD-CoV19-1 OMI | 싱가포르 | |||||
| 2023.02.22 | - | AdCLD-CoV19-1 OMI | 태국 | |||||
| 2023.04.28 | 2025.01.31 | AdCLD-CoV19-1 OMI | 한국 | |||||
| 8 | 특허권 | 자연 살해 T 세포의 리간드와 암 항원을 적재한 자연 살해 세포를 포함하는 백신 | 2023.02.28 | - | BVAC | 한국 | ||
| 2023.05.19 | - | BVAC | PCT | |||||
| 9 | 상표권 |
|
2016.12.23 | 2017.10.18 | BVAC | 한국 | ||
| 2019.08.05 | 2020.06.14 | BVAC | 중국 |
나. 산업의 현황
1) 항암면역치료제
(가) 항암치료의 개요 및 발전
암이란 세포에 발생한 돌연변이에 의해 정상세포가 비정상적으로 세포분열을 일으켜 발생하는 질병입니다. 형태에 따라 고형암과 혈액암으로 구분되며 고형암은 체내 조직이나 장기에 덩어리(종양)를 형성하는 질환이고 혈액암은 특정한 혈액세포가 비정상적으로 증식하면서 미성숙 혈액세포가 증가되는 등 인체의 기능이 비정상적으로 작동하여 손상을 입게 되는 것을 말합니다.
항암치료의 방법으로는 절제수술, 방사선요법 및 화학요법이 대표적입니다. 수술을 통한 병변의 절제는 완치를 기대할 수 있는 가장 근원적인 방법으로 조기에 발견, 진단된 암에서는 적극적으로 수술을 고려할 수 있습니다. 수술과는 별개로 또는 수술 전/후에 방사선요법이나 화학요법(화학항암제)을 실시할 수 있는데 두 방법 모두 암의 증식원리인 세포분열 과정을 억제하거나 차단하여 암의 진전을 막는 치료방법입니다. 방사선요법은 에너지가 높은 방사선을 쬐어 암세포의 사멸을 유도하고, 화학요법은 세포독성항암제와 같은 화합물을 경구투여 또는 정맥으로 주사하여 암세포의 사멸을 유도합니다. 하지만 이러한 고전적 치료방법은 암세포와 정상세포를 구분하여 치료하는 것이 아니기 때문에 정상세포에도 방사선이나 세포독성항암제의 작용이 나타나 심각한 부작용을 일으키며, 이로 인해 암세포만 선택적으로 공격할 수 있는 새로운 치료법에 대한 연구가 계속되었습니다. 그 결과 개발된 것이 2000년대의 표적항암제입니다. 표적항암제는 암세포에만 특이적으로 높게 발현되는 단백질이나 신호전달체계에만 작용해 암세포를 억제하는 치료기전을 가지고 있습니다. 따라서 무차별적인 방사선요법이나 세포독성항암제와는 달리 정상세포는 공격하지 않아서 상대적으로 항암효과는 있으면서 부작용은 매우 약하거나 거의 나타나지 않는 것이 특징입니다. 하지만 돌연변이가 흔하게 일어나는 암세포/조직에서는 표적항암제를 무력화시키거나 표적단백질 외에 다른 단백질을 통해 생장을 이어가는 방식을 표출하는 등 단기간에 표적항암제에 내성을 획득하는 기전이 보고된 바, 이를 극복하기 위한 더 나은 발전이 필요하였습니다. 여기에 면역항암제로 최초의 면역관문억제제인 여보이가 출시되면서 항암치료의 새로운 장이 열렸고, 면역항암제는 우리 몸의 면역체계를 이용하여 암을 치료하는 방법으로 효과 및 안전성 측면에서 큰 주목을 받고 있습니다.
 |
|
항암치료의 개발과 항암면역치료의 등장 (한국msd, 하이투자증권) |
모든 항암치료방법은 현재 각각 단독으로 또는 다양한 병용의 방법으로 환자들에게 사용되고 있으며 따라서 현재 세계 항암제 시장은 특성이 상이한 방사선 치료를 제외하면 전통적인 화학항암제와 표적항암제, 면역항암제로 구분되어 발전하고 있는 상황입니다. 특히 면역항암제의 개발 및 성장속도가 매우 높습니다.
(나) 항암면역치료제 시장
2020년 기준 전세계적으로 약 1천9백3십만명이 신규 암환자로 진단 및 약 1천만명이 암으로 인해 사망하고 있고 인구노령화로 인해 증가추세에 있는 상황으로(GLOBOCAN), 전 세계 항암제 시장은 2020년 1,527억 달러, 2021년 1,665억 달러 및 2030년 3,660억 달러로 연평균 9.1% 성장하는 시장으로 추산됩니다(Globe Newswire. 2022.04.04).면역항암제 시장은 2021년 850억 달러 및 2030년 2,771억 달러로 연평균 12.6% 성장하고 있고(Cancer Immunotherapy Market Size, Share, Report 2022 to 2030, Precedence Research), 항암면역백신 시장은 2021년 64.5억 달러에서 2030년 192.7억 달러 규모로 예측되며 2022~2030년 사이에는 연평균 14.75%의 고성장을 보일 것으로 전망됩니다(Bloomberg. 2023.02.08.).
(다) 항암면역치료제의 발전 및 현황
2010년 최초의 면역항암제이면서 최초의 수지상세포백신인 Dendreon의 Provenge가 승인된 이후, T세포 면역조절항체인 Yervoy가 2011년 승인을 받으면서 면역항암제의 시대가 시작되었습니다. 이후 PD-1, PD-L1 저해제로 대표되는 면역관문저해 항체의약품 6종이 순차적으로 승인되었습니다. 2019년에는 중국에서만 신규 면역관문저해 항체의약품 3종이 추가로 승인되었습니다. 다른 기전으로서 이중항체와 항암바이러스, 최초의 유전자 조작 면역세포치료제인 CAR-T 2종이 승인되었습니다. 2세대 면역항암제는 2015년부터 거대한 신규시장을 창출하기 시작하였으며, 차세대 면역항암제, 항암면역 요법이 속속 개발되고 있습니다. 이를 그림으로 정리하면 다음과 같습니다.
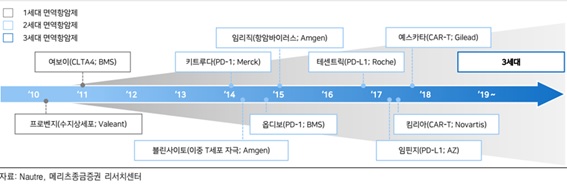 |
|
면역항암제 제품과 발전 단계 |
차세대에 속하는 면역항암치료제는 CeliVax와 같은 세포기반 치료백신이 주류를 이루고 있습니다.
[면역항암제 발전 단계별 제품 분류]
|
1세대 |
2세대 |
차세대 |
|---|---|---|
|
수지상세포백신 면역조절항체 |
면역관문저해제 이중항체 항암바이러스 CAR-T 세포치료제 |
CeliVax 치료백신 완전개인맞춤형 치료백신 면역항암제 병용투여요법 면역세포치료제 - NK, NKT, TIL, CAR-NK |
면역항암제는 개발의 순서 외에 암항원 특이적인 타깃을 보유한 제품인지 또는 환자 자신의 항암면역작용 활성화를 수반하는 능동성이 필요한지의 관점에 따라 다음과 같이 구분할 수 있습니다.
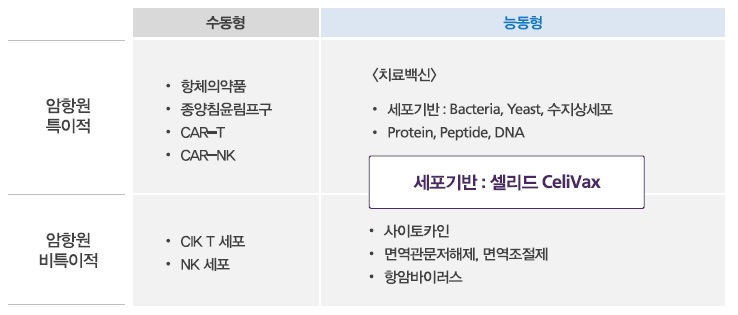 |
|
작용기전에 따른 면역항암제 분류 |
수동형 제품은 제품 자체가 제조과정에서 활성화되어 환자에게 투여 시 곧바로 직접 암세포에 작용하는 의약품으로, 자연살해세포, T세포 등의 adoptive cell therapy (입양세포치료제)가 대표적입니다. 이 기전이 승인된 제품에는 CAR-T가 6종 (미국, 유럽), 이뮨셀-LC (한국) 등이 있습니다. 능동형 제품은 환자의 항암면역작용을 활성화시키는 작용기전으로 환자 자신의 면역기능이 활성화되어야 효력이 나타나는 의약품입니다. 수지상세포백신 Provenge (미국)가 승인된 바 있고, 재조합 사이토카인, 면역관문저해 항체, 항암바이러스 등 수 종의 제품이 출시되었거나 개발 중에 있습니다. 능동형 제품은 환자의 면역기능이 정상적으로 작동하고 있을 때 큰 효력을 기대할 수 있는 반면, 일단 효력이 나타난 경우 장기간의 항암효과를 기대할 수 있다는 큰 장점이 있습니다. 항원특이성 면에서 보면 암세포에 특이적으로 발현하는 암항원을 타깃하는 경우 암세포만 특이적으로 살상하므로 부작용 발생이 낮은 장점이 있습니다. 여기에 해당하는 제품으로 치료백신, CAR-T, CAR-NK, 종양침윤림프구 등이 있습니다. 암항원 비특이적인 작용기전을 갖는 자연살해세포, 사이토카인, 면역관문저해제 등은 암항원과 무관하게 면역반응을 활성화하므로 종종 자가면역질환 유사 부작용 등이 발생하곤합니다. CeliVax 기술은 능동형 제품이면서 암항원 특이적으로 개발되어 두가지 특성의 장점을 고루 갖춘 치료제입니다.
(라) 면역항암제 시장 특성
면역항암제는 작용기전이 동일한 의약품 간에는 경쟁관계가 있으나, 서로 다른 작용기전의 의약품인 경우 병용투여 또는 순차투여 등 다양한 약제를 보완적으로 사용할 수 있는 치료방법의 개발이 필요하고 또 활발한 상황입니다. 최근 면역관문저해 항체의약품과 타 면역항암제 간 다양한 병용투여 임상시험이 급증하고 있는 것도 이러한 이유입니다 (그림 면역관문저해제의 병용투여 임상시험 현황). 대표적인 면역관문저해제를 보유한 MSD가 자사의 Keytruda와 타 면역항암제의 병용투여 임상시험을 650건 이상 진행 중인 것도 이러한 관점에서 이해할 수 있습니다. 더불어 기본치료 옵션으로 환자에게 권유되는 화학항암제 기반 치료에도 면역항암제는 병용투여 또는 순차투여를 고려할 수 있어 광범위한 암종에서 지속적으로 시장이 확대되는 효과가 있습니다. 따라서 단독제제로서의 안전성과 유효성이 확립된 이후 면역관문저해제 및 기존 항암치료제와의 병용/순차 투여 연구를 통해 표준치료법으로 인정받는 것이 면역항암제 시장에 성공적으로 진입하는 좋은 방법입니다.
 |
|
면역관문저해제의 병용투여 임상시험 현황 |
(마) 항암면역치료백신 시장
안전성 측면에서 항암면역치료백신의 프로필이 면역관문저해제보다 유리한 경우가 많다는 점을 고려하면 향후 암환자의 복합치료요법에서 항암면역치료백신이 유망한 후보가 될 것으로 전망됩니다. 중증의 전신 부작용이 발생할 우려가 있는 전통적인 화학약물요법제, 내성이 쉽게 발생하는 표적항암제들에 비해서도 우수한 제품 프로필을 가지고 있으므로 궁극적으로 환자의 치료성과를 높여 전체 생존기간을 증가시키고 더 많은 치료 기회를 제공할 수 있는 제품으로 시장 성장을 드라이브할 잠재력이 있습니다. 현재 항암면역백신류로는 자궁경부암 예방백신으로 잘 알려져있는 Gadasil (Merck)과 Cervarix (GlaxoSmithKline)를 제외하면 치료용 백신으로는 아직 시장을 주도하는 제품이 없는 상태입니다. 항암면역치료백신에는 대표적으로 수지상세포를 이용한 항암면역치료백신이 있으며, 이에 해당하는 Provenge (Dendreon)가 2010년 미국에서 허가를 받았습니다. Provenge는 전이성 전립선암 치료제로서 환자 1인당 치료비는 약 $99,000이며, 미국 메디케어 내 비싼 항암제 중 하나로 등록되어 있습니다.
해외에서 항암면역치료백신 파이프라인을 보유한 기업은 Advaxis, Bavarian Nordic, Inovio, Northwest Biotherapeutics, Moderna Therapeutics 등이 있습니다. Bavarian Nordic은 2015년에 전립선암 치료제인 PROSTVAC의 파이프라인을 BMS로 9.75억 달러에 기술 이전하였습니다. BMS는 자사의 면역관문저해제와 항암면역치료백신의 병행요법을 개발하기 위해 이 파이프라인을 도입한 것으로 알려져 있습니다. PROSTVAC은 수두바이러스를 이용해 PSA 항원을 도입하는 방식을 취하고 있으며, 임상 3상을 진행 중이나 1차 평가변수인 환자의 수명을 연장하는데 실패한 것으로 알려졌습니다. Moderna Therapeutics는 mRNA 기반의 항암면역치료백신을 개발하였습니다. 2016년 Merck로 mRNA를 이용한 항암면역치료백신을 2억 달러의 계약금을 받고 기술 이전하였고, 현재 Merck는 맞춤형 암 치료 백신 임상시험을 진행 중 입니다.
국내에서는 이노셀의 자가활성화림프구 이뮨셀-LC가 개발되어 시판 허가를 받았으나, 림프구 활성을 작용기전으로 사용하고 있어 CeliVax 기술과는 차이가 있습니다. 국내에서 항암면역치료백신을 개발하고 있는 기업으로는 JW크레아젠, Genexine, 헬릭스미스 등이 있습니다. JW 크레아젠은 간암 치료제 CreaVax HCC와 뇌암 치료제 CreaVax BC를 개발 중이고, Genexine은 자궁경부암 환자를 대상으로 DNA vaccine인 GX-188E와 Keytruda의 병용투여 임상시험을 진행 중입니다.
진행성 또는 전이성과 같이 말기암 환자나 기존 치료에 듣지 않는 저항성, 재발성 환자와 같은 경우 보다 적극적인 면역치료요법이 요구됩니다. 국내 제약사에서 수지상 세포 백신(능동형) 혹은 자연살해세포, 자가활성화 림프구를 이용한 수동형 항암면역치료제를 시판 혹은 임상시험 중에 있지만, 이들 치료제들은 암세포 살상에 필요한 면역반응을 전방위적으로 유도하는데는 한계가 있거나, 유도하더라도 지속시간이 짧은 것이 단점입니다. 또한, 인체의 항암면역기능을 회피하는 암세포에 대해서는 그 약효가 매우 제한적이어서 CeliVax 기술을 이용한 당사의 제품들은 충분한 경쟁력을 가질 것으로 생각됩니다. 더욱이 항암면역치료백신은 대상으로 하는 환자의 암종 및 암종별 병기에 따라 다양하게 개발이 가능하여 시장에서 충족하지 못한 수요에 대해 확장성이 있습니다. 또한, 항암면역치료백신만의 차별화된 작용기전으로 기존 제품 또는 개발 중인 다른 제품과의 병용투여로 인한 상승적 유효성의 증대를 기대할 수 있어 전략적인 시장 개척이 가능합니다.
2) 코로나바이러스감염증-19(COVID-19) 예방백신
(가) COVID-19 예방백신 시장
백신은 개발 플랫폼에 따라 다양하며 각 플랫폼마다의 장단점이 있고 이는 연구개발기간 및 생산 과정에 영향을 미칩니다. COVID-19 대응 주요 예방백신 플랫폼과 그 장단점은 다음과 같습니다(KISTEP 기술동향브리프, 백신 플랫폼 기술, 2021.08).
| 플랫폼 | 설명 | 장점 | 단점 |
| mRNA 백신 | 항원을 암호화하는 mRNA를 투여 | 직접 감염원을 다루지 않아 안전성 높음 신속한 개발 및 생산이 가능 소규모 GMP 시설로 저비용 생산 가능 |
생체 내 전달 비효율성으로 인해 별도의 전달기술 필요 RNA 및 지질 나노입자의 불안정성으로 운송, 관리 어려움 |
| DNA 백신 | 항원을 암호화하는 DNA를 투여 | 직접 감염원을 다루지 않아 안전성이 높음 신속한 개발 및 생산이 가능 소규모 GMP 시설로 저비용 생산 가능 열에 대해 안정 기존 연구로 인체 안전성 검증 |
생체 내 전달의 비효율성 세포핵 내로 이동 필요 |
| 재조합 단백질 백신 | 병원체의 구성성분 또는 항원을 투여 | 직접 감염원을 다루지 않아 안전성 높음 면역원성을 높이기 위한 면역증강제 사용 가능 |
일부 부위만 발현하여 항원 또는 항원결정부위(epitope)의 구조 손상 가능성 생산 시 고수율 확보가 필요 대량 배양시설 필요로 생산능력 제한 |
| 바이러스 벡터 백신 | 무해한 바이러스나 세균을 전달체로 사용하여 병원체의 유전물질을 세포 내로 도입 |
메르스(MERS)등 신종 바이러스에 대한 우수한 전임상/임상 데이터 확보 | 벡터 자체가 면역반응을 일으킬 우려 |
| 약독화 생백신 | 약한 상태의 병원체를 투여 | 기존 cGMP급 백신 생산 인프라 활용 가능 | 약독화 바이러스주를 확보하기 위해 장기간 계대 배양 필요 감염성이 있는 살아있는 바이러스를 사용하여 독성 재획득 우려 |
| 불활화 백신 | 불활성 상태 또는 죽은 병원체를 투여 | 기존 cGMP급 백신 생산 인프라 활용 가능 면역원성을 높이기 위한 면역증강제 사용 가능 |
불활성화 과정에서 항원 또는 항원결정부위(epitope)의 구조 손상 가능성 |
세계보건기구(WHO)는 오미크론 계통 변종이 지배하는 현재의 환경을 더 잘 반영하여 현재 유행하는 변이에 대한 위험성을 식별하기 위해 ▲관심 변이(VOI, Variants of Interest)와 ▲감시 변이(Variants Under Monitoring)로 분류하여 추적하고 있습니다. WHO는 2023년 12월, 기존 오미크론 변이에 비해 돌연변이가 많고, 빠르게 확산되는 코로나19 신종 변이 'JN.1’를 '관심 변이'로 지정했습니다. JN.1 변이는 기존 오미크론(BA.2) 변이와 비교해 스파이크 단백질에 37개의 돌연변이가 추가되어, 기존 변이들에 비해 면역 회피 특성이 더 높습니다 (Planas et al., 2024, Nature communications).
'JN.1 변이'는 2023년 8월 룩셈부르크에서 처음 발견되었고, 국내에서는 2023년 11월 처음 검출되었으며, 전 세계적으로 유행하였습니다. JN.1 변이는 KP.2, KP.3, KP.3.1.1, JN.1.18, LB.1, XEC, LP.8.1 등 WHO 감시변이를 포함하여 400개 이상의 하위 세부계통 변이로 파생되었고, 2024년 10월 현재는 JN.1 변이 스파이크 단백질에 3개의 추가적인 변이를 가진 KP.3 계열의 변이가 국내외에서 가장 높은 점유율을 보이고 있습니다. 질병관리청 진단분석국의 최근 연구 결과에 따르면, KP.3는 JN.1 대비 초기 감염성 바이러스 배출량 및 바이러스 증식성이 높아 최근 KP.3 전파력이 상승한 것으로 추정하고 있습니다 (PHWR, 2024.09.10). KP.3 세부 계통 변이의 점유율이 증가한 2024년 7월부터 국내 하수에서 SARS-CoV-2 농도가 급격히 증가했으며, 주간 코로나19 입원 환자 수가 8월 3주차에는 1,464 명에 달했습니다.
미국 질병통제예방센터(CDC) 자료에 따르면, 미국에서도 하수에서 검출되는 SARS-CoV-2 농도가 매년 증감을 반복하고 있으며, 이에 따라 코로나19로 인한 사망자 수 또한 증감을 반복하고 있습니다. 미국 내 코로나19로 인한 사망자 수는 2024년 4분기 기준 8,019명에 달하며, 같은 기간 겨울철로 인해 독감으로 인한 사망자가 증가하여 1,159명에 도달했음에도 약 7배 정도 많습니다. 이처럼 코로나19 유행은 여전히 증감을 반복하며 계속되고 있습니다.
KP.3 계열 변이에 의한 증상은 이전 변이들에 의한 코로나19 증상과 비슷하게 △고열 △콧물 또는 코막힘 △두통 △피로감 △기침 △인후통 △미각/후각 변화 등이 있습니다. 코로나19 증상의 중증도는 개인의 기본 건강 상태와 면역력에 큰 영향을 받는 것으로 보입니다. 때문에 면역저하자 및 고령층은 더욱 주의가 필요합니다.
질병관리청에서는 WHO가 권고한 JN.1 변이 대응 백신 755만 회분을 화이자, 모더나, 노바백스에서 도입하여 2024~2025절기 고위험군 (65세 이상 어르신, 생후 6개월 이상 면역저하자 및 감염취약시설 입원 입소자)을 대상으로 무료 접종을 시작했습니다. 하지만 고위험군 지정대상에 해당되지 않는 국민은 접종 비용을 자비로 부담해야 합니다 (질병관리청 2024.09.13 브리핑).
현재 코로나19 백신 및 치료제로서 시판 중인 주요 회사의 2024년 예상 매출을 보면, 화이자의 코로나19 관련 제품인 팍스로비드, 코미너티 매출의 경우 110억 달러로 예상하고 있으며 모더나의 경우 31억 달러에 이를 것으로 전망됩니다.(BUSINESS WIRE.2024.12.17, ACCESS Newswire.2025.02.14)
2023년 9월 미국 CDC advisory panel 미팅 이후, 화이자/BioNTech 120달러/도즈, 모더나 129달러/도즈 및 노바백스 130달러/도즈의 가격으로 공급하기로 보도되어 기존 미국 정부 구매가격인 26달러/도즈와 비교하여 최대 5배 가격이 상승하였습니다.(Reuters.2023.09.13)
한국의 경우, 화이자 및 모더나 XBB.1.5 변이 대응 백신을 약 1,500만 도즈 분을 도입하여 2023~2024절기 전국민 대상 무료 접종을 목적으로 투여를 진행했습니다.(파이낸셜뉴스.2023.10.04) 하지만 이후부터 코로나19 백신이 국가정기예방접종으로 전환될 경우 지정대상에 해당되지 않는 국민은 접종 비용을 자비로 부담해야 될 것으로 예상됩니다.
국산 백신의 경우, SK바이오사이언스에서 시판 중인 '스카이코비원'이 있으나 '스카이코비원'의 경우 wild-type 코로나바이러스 타겟으로 개발된 기초접종에 해당되는 백신으로서 현재 국산백신으로 코로나 19 변이 바이러스를 대상으로 개발 중인 부스터 백신은 셀리드가 유일한 상황이며, mRNA platform 기반의 화이자/BioNTech 또는 모더나 백신과 비교, 공급가격에서 충분한 경쟁력이 있을 것으로 기대하고 있습니다.
질병청 보도참고자료 '2024년도 예산안 1조 2,698억원 편성(8.30.금)'에 따르면, 질병청은 2025년 '코로나19예방접종은 65세 이상, 면역저하자 등 고위험군에게 무료접종 지원을 지속할 예정이며 2,242억원의 예산을 편성하였다고 발표하였습니다. 따라서 당사가 개발 중인 COVID-19 예방백신도 질병청에서 기 책정한 예산안에서 계약과 공급이 이루어 질 것으로 기대하고 있습니다. (질병청.2024.08.30)
당사가 개발 중인 COVID-19 예방 백신은 바이러스 벡터 백신으로 전달체로는 아데노바이러스를 사용하고 있습니다. 당사 백신은, 체내 면역세포에 효율적 도입이 가능한 아데노바이러스 벡터에 독창적인 항원을 탑재하여, 효과적으로 중화항체를 다량 생성하고 세포독성 T 세포 면역을 효율적으로 유도할 수 있으며, 생산이 용이합니다.
설치류와 영장류를 대상으로 진행하였던 전임상 시험에서 단회 투여 만으로 면역반응을 유도함을 보인 바 있고, 임상 1/2a상 및 새로운 임상 1상에서도 중화항체 및 세포독성 T 세포 유도능력이 뛰어남을 입증했고, 임상 1/2a상 시험 결과를 발표했습니다. 아울러 당사는 지난 2023년 7월 21일 임상 3상을 식품의약품안전처로 부터 승인 받은 이후, 국내를 비롯해 해외(베트남, 필리핀)도 임상시험계획(IND)을 승인 받아 2024년 11월 13일 임상 3상 시험 대상자에게 투여 완료하였습니다.
당사는 자체 개발한 코로나19 백신의 임상시험을 통해 우수한 안전성과 유효성을 확인하였고, 이를 바탕으로 현재 오미크론 변이 바이러스 특화백신의 개발 및 허가에 당사 역량을 집중하고 있으며, 미래 파이프라인 확대 및 잠재적 미충족 수요의 효과적으로 충족시키기 위해 다가백신도 개발하고 있습니다.
(나) COVID-19 예방백신 개발 및 현황
기존 백신 중 우한주를 타겟으로 개발된 백신의 경우, 오미크론 변이에 특화된 백신이 아니기에, 이를 부스터로 접종할 경우 오미크론 변이 특화 중화항체 유도능은 기존 바이러스 대항 중화항체 유도능 대비 4~6배 낮은 수준임을 보였습니다(Garcia-Beltran et al., Cell, 2022). 따라서, 현재 우세종인 오미크론 변이 바이러스를 효과적으로 방어하기 위해 오미크론 변이 바이러스 특화 백신이 필요하다고 할 수 있습니다.
당사는 2023년 7월 14일 오미크론 전용 백신 'AdCLD-CoV19-1 OMI'의 우수한 부스터샷 임상 1/2상 시험 중간분석 결과를 발표하였습니다. 당사 오미크론 전용 백신 임상 1/2상 시험은, 코로나 19 확진으로 인한 격리 해제 후 최소 16주~48주 경과한 만 19~65세 미만 지원자 20명을 대상으로 임상 1상을 진행하였고 임상 2상 시험에서는 대상자를 300명으로 늘려 안전성과 면역원성을 평가했습니다. 임상시험 대상자들은 코로나 19 예방 백신 접종과 감염을 경험한 상태였으나, 당사 오미크론 전용 백신 접종 4주 후 중화항체는 접종 전 대비 시험군에서 3.49배, 위약군에서 0.96배 증가했습니다. 당사는 이 결과를 바탕으로 2023년 5월 23일 식품의약품안전처에 화이자/BioNTech '코미나티2주'를 대조백신으로한 임상 3상 시험계획을 신청하여 2023년 7월 21일 승인받았으며, 2023년 7월 14일 임상 1/2상 Top-line 결과를 발표했습니다. 또한 2024년 11월 6일 임상 1/2상 결과를 발표했습니다. 당사는 필리핀 및 베트남 식약처에서도 임상 3상 시험계획(IND)승인을 받았으며, 2024년 11월 13일 임상 3상 시험 대상자에게 투여 완료하였습니다. 당사는 한국을 포함한 글로벌 임상 3상 시험을 성공적으로 수행하여 국내 정부조달 시장, 동남아시아 국가를 필두로 시장을 확대해 나갈 계획입니다.
당사가 예상하는 타겟 시장은 13세 이하 어린이 및 65세 이상 글로벌 27.8억명 및 한국 14.7백만명입니다. 독감백신의 2023년 9월 낙찰가격인 도즈 당 약 1만2천원으로 환산하여 추정하면, 시장 규모는 글로벌 33.4조원 및 한국 1,764억 원일 것으로 예상 가능합니다. 또한 한국에서 독감백신을 의무적으로 접종해야 하는 군인 약 55.5만 명을 추가할 경우 한국 시장 규모는 약 1,830억 원 규모로 추산 가능할 수 있습니다.
당사가 자체적으로 개발하는 오미크론 변이 바이러스 특화백신의 개발 및 허가를 통해 향후 변이 맞춤형 백신 및 다가백신으로 확장할 전략이며, 당사가 개발중인 아데노바이러스 벡터 플랫폼 백신은 기존 RNA 플랫폼 백신과 비교하여 경쟁력 있는 가격으로 공급 가능한 장점이 있습니다. 당사가 개발하는 백신의 상업화를 통해, 글로벌 미충족 수요가 있는 COVID-19 예방백신시장에서 효과적으로 포지셔닝하고 향후 발생가능한 감염병 위험에서도 검증된 플랫폼으로 신속하게 대응할 수 있을 것으로 기대하고 있습니다.
3) 바이오의약품 위탁생산사업(Contract Manufacturing Organization)
(가) 산업의 동향
바이오의약품은 합성의약품과 비교하여 약의 체내 분해시 발생하는 대사 산물이 없어 독성이 낮고, 질환의 발병기전과 관련된 체내 단백질에 선택적으로 작용한다는 장점을 가지고 있습니다. 다만 살아있는 세포에서 만들어지는 큰 단백질로 이루어져 있기 때문에 일반적으로 크기가 훨씬 작은 저분자 화합물(small molecule)로 구성되는 합성의약품보다 200~1,000배 가량 크고 구조적으로 복잡하여 제조 및 보관 조건에 민감하다는 특성을 가지고 있습니다. 치료상 장점과 생산 및 보관의 까다로움으로 인하여 합성의약품에 비해 바이오의약품 분야가 상대적으로 많은 시간과 자금이 소요되며, 높은 진입장벽을 가지고 있어 더 높은 시장가격을 인정받고 있습니다.
바이오의약품 산업의 가치사슬(Value Chain)은 연구개발, 생산, 운송과 유통 및 판매의 다양한 단계로 구분되며 각 단계는 매우 복잡하고 동시에 대규모 투자를 필요로 하므로 몇몇 소수의 다국적 거대 제약기업을 제외하고 전 기능을 단독으로 수행하기 어렵습니다. 바이오의약품의 생산을 위해서는 대규모 투자가 필요할 뿐만 아니라, 플랜트 및 엔지니어링 설계, 건설, 밸리데이션, 안정화 등에 최소 3년 이상의 시간이 필요합니다. 또한 동물세포를 이용하는 세포 배양, 정제, 충전 등 생산 전 과정에서 GMP(Good Manufacturing Practice)에 부합하는 높은 수준의 품질관리 역량이 필수적으로 요구됩니다.
이에 따라, 바이오의약품은 합성의약품과 달리 생산공정이 복잡하여 전문적인 CMO의 필요성이 더욱 커지고 있습니다. CMO는 산업 초기에 제약사들이 내부 제조 시설(in-house manufacturing)만으로 시장 수요를 충족시킬 수 없을 때, 추가적인 제조 역량을 제공하던 것에서 출발하여, 생산공정 기준 및 시험법 개발확인 등으로 업무범위가 확장되었습니다.
(나) 시장규모 및 전망
글로벌 바이오의약품 시장 현황 및 전망은 조사기관과 발표 시점에 따라 차이가 있으나, 아이큐비아(IQVIA, 글로벌 컨설팅 시장조사업체)의 의약품 매출자료 기반, 전 세계 바이오의약품 시장 규모는 2020년 기준 3,793억 달러로 과거 5년(2016~2020년) 기준으로 연평균 12% 성장하고 있으며, 2021년 Evaluate Pharma 보고서에 의하면 전체의약품 대비 바이오의약품 비중은 2012년 19%에서 2026년 37%로 지속 증가 추세 일 것으로 전망하고 있습니다.
바이오의약품의 시장규모 및 R&D투자의 증가는 개발사들의 비용효율 및 투자리스크 관리, 공급안정화 및 성장경쟁력 집중전략 등으로 인해 연구개발 및 제조의 아웃소싱 수요의 증가로 이어지고 있으며, Mordor Intelligence에 의하면 글로벌 바이오 CDMO 시장규모는 2021년 113억 달러 및 2027년 219억 달러의 시장이 형성될 것으로 전망하고 있습니다.
당사는 2020년 백신 및 세포유전자치료제 GMP센터를 완공하여 2021년 생물학적제제 등에 해당하는 의약품 제조업, 인체세포등 관리업 및 첨단바이오의약품 제조업에 대한 허가를 획득하였고, 2022년 당사가 개발 중인 오미크론 특화 백신 및 BVAC-C의 임상시험용의약품 제조와 관련하여 GMP적합 실사 통과하였으며, 2022년 9월 국내 면역관문 항체치료제 및 CAR-T 치료제 개발사 (주)이노베이션바이오와 이중표적 CAR-T 세포 치료제 'IBC101' 위탁생산(CMO) 계약을 체결하며 성공적으로 해당 업무를 조기 수행하였으며 2023년 3월에도 동사와 임상 1/2상 임상시험약 위탁생산(CMO) 추가 계약을 체결하였습니다. 당사는 증가하는 바이오의약품의 연구개발 및 제조의 아웃소싱 수요에 맞추기 위해, 전시 및 컨퍼런스 참가 등을 통하여 당사의 최신장비, 시설, 우수한 인재 및 서비스에 대한 정보를 업데이트하여 제공하고 있습니다.
다. 회사의 현황
1) 회사 사업의 요약
당사는 CeliVax 원천기술을 이용한 BVAC 파이프라인 제품의 개발 및 임상연구를 통해 항암면역치료제를 개발하고 있습니다. CeliVax는 환자 자신의 면역세포를 사용하는 개인 맞춤형 항암면역치료백신으로 인체 내 모든 면역세포의 기능 및 기전을 활성화시켜 강한 치료작용을 나타내면서 부작용은 최소화된 의약품입니다.
당사는 현재의 의학적, 기술적 한계로는 치료가 어려운 난치성 암 및 감염성 질환의 치료에 새로운 패러다임을 제시하는 항암면역치료백신 개발의 비전을 가지고 설립되었습니다. 면역항암 연구 분야의 탁월한 전문성과 원천기술의 독창성, 유효성, 확장성 및 사업성을 바탕으로 면역치료제 시장의 세계적인 선도 기업으로 거듭나고자 합니다.
또한 당사는 아데노바이러스 벡터 기반 예방백신 기술을 보유하고 있으며 이 기술을 활용하여 COVID-19 예방백신을 개발 중입니다. 추후 아데노바이러스 벡터 플랫폼 기술을 더욱 견고히 하여 향후 출현 가능성이 있는 신종 전염병 등에 대한 예방백신 파이프라인을 추가할 계획입니다.
2) 주요 파이프라인
현재 개발 중인 주요 파이프라인을 아래 표에 요약하였습니다.
|
파이프라인 |
주요 적응분야 |
개발단계 |
|---|---|---|
|
BVAC-C |
인유두종바이러스 16형 및 18형 암항원을 발현하는 모든 암 (예) 자궁경부암, 항문암, 성기암 등 |
[국내] 자궁경부암 |
| BVAC-E6E7 |
인유두종바이러스 16형 및 18형 암항원을 발현하는 모든 암 (예) 두경부암, 항문암, 성기암 등 |
[국내] 두경부암 임상 1/2a상 |
|
BVAC-B |
HER2/neu 암항원을 발현하는 모든 암 (예) 위암, 유방암 등 |
[국내] 위암 |
|
BVAC-P |
PAP 또는 PSMA 암항원을 발현하는 모든 암 (예) 전립선암, 뇌종양 등 |
[국내] 전립선암 |
|
BVAC-M |
MAGE-A3 또는 GP100 암항원을 발현하는 모든 암 (예) 흑색종, 폐암, 대장암, 췌장암 등 |
[국내] 흑색종 |
|
BVAC-Neo |
개인별로 특화된 암항원인 Neo-antigen이 발굴된 모든 암 |
다양한 고형암 |
|
AdCLD-CoV19 /AdCLD-CoV19-1 |
COVID-19 (코로나19 바이러스 감염증) 예방 | [국내] AdCLD-CoV19: 임상 1/2a상 [국내, 국외] AdCLD-CoV19-1: 임상 2b상 조기종료 |
| AdCLD-CoV19-1 OMI | COVID-19 (코로나19 바이러스 감염증) 예방 (추가 접종 백신) | [국내외] 임상 3상 |
BVAC-C는 자궁경부암 환자를 대상으로 한 임상 1상에서 의약품으로서의 안전성과 CeliVax 원천기술의 개념을 확증하여 (Proof of Concept: POC) 현재 유효성을 탐색하기 위한 임상 2a상 시험을 완료하였습니다.
BVAC-E6E7는 HPV16/18 양성 두경부암 환자를 대상으로 한 치료 백신으로 임상시험계획, 효력, 독성 분포 등 비임상 시험 자료, 제조 및 품질에 관한 자료를 식약처에 제출하여 2024년 11월 19일에 임상 1/2a상 시험계획(IND) 승인을 받았습니다. CeliVax 기술의 POC로 다른 BVAC 파이프라인의 개발도 가속화될 예정입니다.
아데노바이러스 벡터 기반 예방백신 플랫폼을 활용하여 COVID-19 예방백신 AdCLD-CoV19의 임상 제1/2a상 시험을 진행하고 대량생산 및 안정적인 공급이 가능하도록 벡터 구조를 조정한 개량형 백신 AdCLD-CoV19-1을 개발하여 임상 1상 시험을 진행했습니다. 당사는 AdCLD-CoV19-1의 우수한 임상 1상 시험 결과를 기반으로 임상 2b상 시험에 진입하였으나, 초기주 타겟 백신의 향후 경제성과 높은 국내외 항체 보유율 및 백신 접종율로 인한 임상시험 대상자 모집의 현실적인 한계를 고려하여 임상 2b상 시험이 조기 종료하고 추가접종 용도로 개발 중인 오미크론 전용 백신 'AdCLD-CoV19-1 OMI' 개발에 주력하고 있습니다.
AdCLD-CoV19-1 OMI의 임상 3상 시험 계획을 식품의약품안전처로부터 승인받아 국내 13개기관에서 수행 중입니다. 해외(베트남, 필리핀)도 임상 3상 시험계획(IND)을 승인 받아, 2024년 11월 12일 계획된 모든 대상자에게 투여를 완료하였습니다.
본 보고서 작성기준일 현재, 임상 3상 시험 대상자의 투여 완료 후 4주 차 안전성과 면역원성 데이터를 바탕으로 통계분석 등을 진행하여 중간분석 결과자료를 확보 하기위해 주력하고 있습니다.
3) 원천기술: CeliVax 항암면역치료백신
(가) 원천기술 개요
CeliVax 항암면역치료백신 (Cancer Therapeutic Vaccine) 기반기술은 면역항암의약품 중 하나인 세포기반 항암면역치료백신 기술입니다. 환자에서 유래한 자가 B세포 및 단구를 항원제시세포로 이용하며, 암항원과 면역증강제(α-galactosyl ceramide, α-GC)를 함유한 유전자 도입 세포치료제 또는 세포치료제라 할 수 있습니다.
타 제품들과는 달리 인체 내에서 항암 작용을 나타낼 수 있는 적응면역계와 선천면역계를 동시에 활성화하여 강력한 약효를 나타내는 것이 특징입니다. 즉, 적응면역계에서 주요 기능을 하는 세포독성T세포를 활성화하고 암항원 특이적 항체 생산을 강력히 유도함과 동시에 선천면역계에서 주요 기능을 하는 자연살해세포와 자연살해T세포를 활성화하여 항암면역반응을 일으킵니다.
 |
|
CeliVax 기반 파이프라인의 항암면역작용 활성화 유도 작용기전 |
상기 그림에서와 같이 항원을 인식하는 항체 (그림 [4])와 T세포 (그림 [3])뿐 아니라 항원 비특이적 암세포 살해세포인 자연살해T세포 (그림 [1])와 자연살해세포 (그림 [2])를 활성화시킴으로서 비균질성 암세포의 제거에 매우 효과적이며, 암세포가 가지는 주요 면역회피기전 중 MHC-I 소실을 극복하여 암세포를 살상할 수 있습니다. 또한, 종양미세환경 내에서 기능이 저하된 T세포 (그림 [5]) 및 NK세포 (그림 [6])의 기능을 복원하여 재활성화함으로써 암세포를 공격하도록 합니다. 면역체계의 활성화로 인해 기억면역반응을 일으켜 암의 재발을 방지할 수 있는 기전도 CeliVax기술의 최대 차별점입니다.
이렇게 복합적이고 강력한 항암 작용기전과 B세포 및 단구를 사용하는 형태 측면에서 세계적으로 퍼스트-인-클래스 (First-in-class), 퍼스트-인-카인드 (First-in-kind) 의약품으로, 세계시장을 선도할 수 있는 잠재력을 가지고 있습니다.
(나) 원천기술의 유용성
1세대 세포독성 항암제, 2세대 표적항암제의 뒤를 이어 3세대 면역항암제가 유효성 및 안전성 측면에서 암환자 치료의 새로운 대안으로 떠오르고 있습니다. 면역항암제는 선별된 환자에서 장기간의 항암약효와 생존기간 연장이 증명되어 항암치료의 중요한 축으로 역할을 하고 있고, 현재 면역관문저해제 등 항체류, CAR-T (Chimeric Antigen Receptor T cell)와 같은 유전자 도입 세포치료제, 항암바이러스, 수지상세포 백신 등이 시판 중입니다. 하지만 이들 제품들도 낮은 치료반응성과 치료비 부담, 공정상의 어려움 등 시장의 요구에 완벽하게 부응하지 못하고 있는 상황이며 이에 CeliVax와 같은 차세대 항암면역치료백신 개발은 단독으로 사용, 또는 기존 제품들과의 병용을 통해 시장의 미충족 의학적 수요에 대해 합당한 대안이 될 것으로 생각합니다.
(다) 원천기술의 확장성
(1) 다수의 파이프라인의 개발
CeliVax 기술 요소 중 하나인 암항원 유전자를 대상 암종별로 교체하여 다수의 파이프라인을 신속하게 개발할 수 있습니다. 동일한 원천기술을 기반으로 확장된 파이프라인을 구축하고 비임상시험 단계의 유효성, 독성시험, 비임상 시제품 제조 및 방법과 자료 구축 등이 동일하게 활용가능하므로 선도제품 이후의 개발 제품들은 개발속도를 가속화할 수 있는 장점이 있습니다.
대부분의 암종에서 환자특이적으로 과발현하는 암항원이 밝혀져 있는 경우가 많고, 이렇게 과발현된 암항원이 존재하는 암종에는 CeliVax 원천기술을 적용할 수 있어 파이프라인 및 시장확대의 가능성은 매우 높습니다.
(2) Neo-antigen 파이프라인의 개발
최근 유전자세포치료제 CAR-T가 높은 반응성과 완치율로 미국에서 허가를 받아 $475,000에 판매 중입니다. T세포 치료제인 CAR-T와 함께 면역항암제 시장을 이끌 신기술로 neo-antigen (신항원)을 사용한 항암면역치료백신이 주목받고 있으며, CeliVax 기술은 neo-antigen 유래 neo-epitope를 암항원으로 사용하여 완전한 개인 맞춤형 정밀의료 기반 항암치료가 가능한 기반기술입니다.
이미 Celivax 기술로 암항원 epitope peptide를 적재하여 암세포를 효율적으로 살상할 수 있음을 동물모델에서 증명하였으며, 현재 비임상 개발 중입니다. Neo-antigen은 다수의 환자에서 빈번히 보고되는 공통(public 또는 shared) neo-antigen 과 1명의 환자에서만 발견되는 개인(private) neo-antigen으로 나뉘는데, CeliVax 기술은 이 두 종류 모두를 이용할 수 있습니다. 개발의 1단계로 공통 neo-antigen을 활용하는 파이프라인을 연구개발 중입니다. 개인 neo-antigen을 타겟으로 한 파이프라인 개발도 개시하였으며, LG화학에 기술이전한 후 신속한 개발을 위해 양사가 공동으로 노력 중입니다.
(3) 감염성 질환의 치료백신
CeliVax 기술 기반 제품은 면역항암제 뿐 아니라 항원이 알려진 다양한 감염성 질환의 치료백신으로도 개발할 수 있습니다. 간염, HIV 등의 바이러스성 감염질환과 결핵과 같은 만성 세균성 질환 등 미충족 의학적 수요가 큰 감염증을 개발 대상으로 하고 있습니다. 또한, CeliVax 기술의 한 요소인 아데노바이러스 벡터는 예방백신 기반기술로도 활용할 수 있어 아데노바이러스 기반의 예방백신 파이프라인의 개발도 가능합니다. 아데노바이러스 기반 COVID-19 예방백신을 개발 중이며, 예방백신 추가 파이프라인 개발도 계획 중입니다.
(라) 원천기술의 경쟁력
(1) 새로운 작용기전
CeliVax는 당사 창업자인 강창율 대표가 독자 개발한 원천기술로, 세계 최초로 B세포 및 단구를 항원제시세포로 사용하는 신 개념의 항암면역치료백신 기술입니다. 기존에 출시된 면역치료제 중에서 항원제시세포로 B세포 및 단구를 사용한 예는 없으며, 퍼스트-인-클래스 (First-in-class) 수준의 개인 맞춤형 항암면역치료백신 기반기술이 됩니다. 새로운 작용기전은 특히 병용치료를 많이 사용하는 암환자의 경우 기존 약제 거의 모두와 병용이 가능하다는 뜻입니다. 신약이 출시되더라도 기존 제품과 작용기전이 동일한 경우 병용이 어렵고, 여러 치료단계에서 같은 작용기전을 사용하는 약제가 한 번 이상 사용된 환자는 동일한 작용기전의 약제에 잘 듣지 않는다는 점을 감안할 때 작용기전이 다른 First-in-Class의 신약은 이러한 제약을 가지지 않으므로 활용도가 매우 높습니다. 또한 First-in-Class로 개발되면 시장에 First mover로 진입하므로 단기간에 시장점유율을 높일 수 있고, 이후 Best-in-class 제품이 개발되어 경쟁관계가 될 때까지 상당기간 독보적인 시장 점유율을 지속할 잠재력이 있습니다.
(2) 강력한 약효
선천면역과 적응면역 항암 작용의 상승효과: 암항원 특이적으로 항암효과를 나타내는 세포독성 T세포와 항체를 활성화하고, 암항원 비특이적으로 항암효과를 나타내는 자연살해세포와 자연살해 T세포가 복합적인 항암 작용을 일으켜 어느 한 가지의 성격만 가지고 있는 암세포가 아니라 비균질함 때문에 높은 치료효과를 기대하기 어려운 암세포를 제거하는데 매우 효과적입니다. 면역항암제 분야에서 사용되고 있는 여러 기전의 치료제와 비교한 결과를 아래 표에 정리하였습니다.
|
특징 |
Celivax |
수지상세포 백신 |
T세포 치료제 |
|
|---|---|---|---|---|
|
개인맞춤치료 |
○ |
○ |
○ |
|
|
항원특이적 |
항체 생산 |
○ |
○ |
× |
|
T세포 |
○ |
○ |
○ |
|
|
항원비특이적 |
자연살해세포 |
○ |
× |
× |
|
자연살해T세포 |
○ |
× |
× |
|
|
T세포 작용 회피 암세포 제거 (항원 혹은 MHC 분자 소실 암세포 제거 효과) |
○ |
× |
× |
|
(3) 제조공정의 신속성과 경제성
자가세포를 기반으로 생산되는 제품임에도 GMP 1일 제조 공정으로 신속하게 제조하여 환자에게 투약할 수 있습니다. 수지상세포백신의 경우 7~10일, CAR-T 등 T세포 치료제의 경우 14~28일의 제조일이 소요되는 것을 고려하면 제품의 제조기간이 1일로 타 기술 대비 획기적으로 신속하며 환자들에게 최종 공급되는 것도 수일내에 완료된다는 점은 치료 수요자인 환자들과 치료의 주체인 의료진들에게 매우 강점으로 작용합니다.
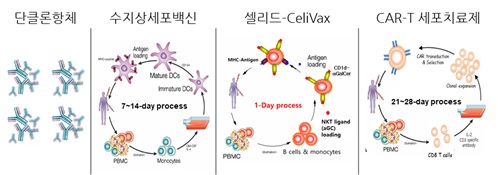 |
|
CeliVax 항암면역치료백신 제조의 경쟁력 |
|
특징 |
단클론항체 |
수지상세포 백신 |
Celivax |
T세포 치료제 |
|---|---|---|---|---|
|
제조기간 |
Off-the -shelf |
7~10일 |
1일 |
14~28일 |
|
공급의 신속성 |
○ |
× |
○ |
× |
|
제조비용 |
높음 |
높음 |
낮음 |
매우높음 |
공정상의 신속성은 경제성을 확보하는데도 기여합니다. 자가세포 기반 세포치료제는 개인 맞춤형 제품이라 GMP 제조시 각 롯드(lot)가 1개 생산라인을 점유하는데, 제조소요시간이 짧은 Celivax 기술의 경우 GMP 제조라인의 활용도를 크게 높일 수 있습니다. 또한 수지상세포 백신처럼 장기간 배양이 필요하지 않으므로 고가의 사이토카인이나 단백질 등의 원자재를 사용하지 않는 점도 장점입니다. 이렇게 자가세포 기반 세포치료제를 상업화하는데 걸림돌이 되었던 2~4주의 생산 소요시일과 높은 생산비 문제를 획기적으로 개선함으로써 공급의 신속성과 획기적 경제성을 확보한 것은 향후 저비용 고수익 구조의 사업화 추진을 가능하게 할 것으로 생각됩니다. 이러한 장점을 극대화하기 위하여 세포유전자치료제 GMP를 완공하였습니다.
4) 주요제품의 개요
(가) BVAC-C
○ 인유두종바이러스 유래 암
BVAC-C는 인유두종바이러스 (HPV, Human papilloma virus) 유래 모든 암종을 적응증으로 하는 항암면역치료백신으로 현재 임상 2상 개발 중입니다. HPV는 인체감염 시 사마귀, 자궁경부암 등의 발생 원인이 되는 파포바 바이러스과에 속하는 이중 나선상 DNA 바이러스입니다. 현재까지 알려진 100여 종의 인유두종 바이러스 중에서 40여종이 생식기관에서 발견되며, 자궁경부 상피 내에 병적인 변화를 일으키는 것으로 알려져 있습니다. 이 중 고위험군 (high-risk group)인 발암성 인유두종 바이러스가 자궁경부암과 연관성이 높다고 알려져 있으며, 발암성 인유두종 바이러스 중 16, 18형이 가장 중요하고 전세계적으로 70% 이상의 자궁경부암에서 발견됩니다. 또한, 두경부암, 항문암, 성기암, 질암 등을 일으킵니다 (그림 인유두종바이러스 유래 암의 종류 및 비율). HPV 바이러스의 암화 유전자 (Oncogene)인 E6와 E7이 이러한 암 발병의 원인임과 동시에 암항원입니다. 자궁경부암 암세포는 E6, E7을 발현하고 있으므로 E6와 E7을 작용점으로 하는 면역치료가 성공할 가능성이 높습니다.
 |
|
인유두종바이러스 유래 암의 종류 및 비율 |
○ BVAC-C의 개발
BVAC-C는 CeliVax™ 기반기술을 이용하여 제조한 인유두종 바이러스 암항원 양성 난치성암 항암면역치료백신으로, HPV 16 및 18형의 E6, E7의 재조합유전자를 암항원으로 도입하고 면역증강제 α-GC를 CD1d 분자에 적재하였습니다. 암항원 유전자는 HPV E6 유전자와 HPV E7 유전자의 융합형 암항원으로, 암화 유전자 부위는 제거하고 항원성이 높은 부위만을 선별하여 재조합하여 항원성을 극대화한 것으로, ㈜제넥신으로부터 기술도입하였습니다. 2014년 비임상 개발을 시작하였으며, 표준치료에 실패한 자궁경부암 환자 9명을 대상으로 임상 1상을 마쳤으며 현재 임상 2상시험 중입니다. 임상 1상에서 안전성을 확인하였으며, 9명 중 6명에서 안정 질환 (Stable disease) 이상의 임상적 유용성을 확인하였습니다 (하단 표). 임상 1상 시험 결과는 2020년 1월 Journal of Clinical Medicine (Impact Factor 5.688) 에 게재되었으며, 2020년 AACR (미국 암학회) 연례학회에도 임상시험 결과를 발표하였습니다. 임상 2a상 시험은 일부 환자에서 완전관해 관찰 등 긍정적 중간결과를 종합하여 2021년 6월 ASCO (미국 임상종양학회)에서 발표하였습니다. 2023년 9월 21일 임상2a상 결과를 발표하였고, 현재 허가받은 면역관문저해제와의 병용투여 임상 2a상 연구자주도 임상 시험을 진행 중입니다. 해당 연구자임상시험의 중간결과가 2024년 6월 미국 ASCO 에서 발표되었으며, 표준치료에 실패한 자궁경부암 환자를 대상으로 다수의 완전관해 및 부분관해 사례를 관찰하여 안전성과 유효성을 다시금 확인하였습니다.
|
단계 |
개발 내용 |
|
|---|---|---|
|
제품개발 |
HPV 융합형 암항원 유전자 사용 BVAC-C 후보물질의 개발 (2013) |
|
|
비임상 |
BVAC-C의 비임상 유효성 및 독성 시험. 임상 1상 시험 계획의 승인 획득 |
|
|
임상 |
임상 1상 |
표준치료에 실패한 자궁경부암 환자 대상 안전성 및 |
|
임상 2상 |
임상 2a상 개시 (2018.6) |
|
| 연구자 임상 | 면역관문저해제와 병용투여 임상 개시 (2021.11) 연구자임상시험 중간결과 발표 (2024.06) |
|
○ BVAC-C의 경쟁력
- 전이성 자궁경부암은 전신에 암세포가 퍼지는 만큼 전신적 요법의 치료가 적용되어야 하므로 화학적 요법이 주로 사용되나 환자가 감수해야 하는 부작용이 심하고 그 효과도 매우 제한적입니다. 전이성 자궁경부암의 치료에 사용하는 1차 항암화학요법에는 taxane과 cisplatin, carboplatin과 같은 백금계 항암제와 단일클론항체 Avastin (Bevacizumab)을 병용하나 그 약효가 한정적이고 내성과 재발이 빈번히 나타나 치료 후 재발 시 기대수명이 1년 내외로 매우 짧으므로 항암면역치료제와 같은 신규 치료제의 개발이 절실합니다. 이러한 점에서 항암면역치료백신이 전이성 자궁경부암에 대한 대안이 될 수 있으나, 전이성 암에 대한 우수한 치료백신이 되기 위해서는 다양한 면역세포의 항암면역반응 유도를 통한 암세포 특이적인 강력하고 복합적인 항암효력을 나타낼 수 있어야 하며, 암세포의 면역회피기전을 극복할 수 있어야 합니다.
- BVAC-C는 HPV의 E6, E7 암 항원을 발현하고, 자연살해 T 세포 리간드가 적재된 B 세포와 단구 세포를 항원제시세포로 활용한 치료백신으로, CD4 T세포, CD8 T세포뿐 아니라 자연살해세포와 자연살해 T세포 등의 항암 면역 반응을 유도하므로 강력하고 복합적인 항암 면역 반응을 유도하여 효력이 뛰어납니다. BVAC-C는 임상 1상에서 1차 항암 표준치료에 실패한 자궁경부암 말기 환자 9명을 대상으로 안전성을 이미 확인하였으며, 질병조절율(Disease control rate)은 66%에 달하였습니다. 일부 환자의 무진행성생존 기간 (PFS, Progression free survival)을 기존 재발성 자궁경부암 PFS 중위값 통계치 4개월 대비 12개월까지, 전체생존 기간 (OS, overall survival)도 26개월까지 연장하는 등 긍정적 약효를 확인하였습니다 (하단 표). 이는 BVAC-C가 1) 암세포 특이적인 강력한 면역반응을 일으킬 수 있으며 2) 다양한 면역세포의 항암 면역반응 유도를 통한 복합적 항암효과를 나타낼 수 있음을 보여주는 결과이며, PD-1 저해제인 Pembrolizumab의 임상시험 결과에 비교 시 효력이 뛰어남을 확인하였습니다 (하단 표).
|
약물 |
임상시험(*1) |
치료반응율 |
질병조절율 |
무진행생존(월) 중위값 |
생존(월) 중위값 |
|---|---|---|---|---|---|
|
아브락산 (Nab-paclitaxel) |
2상 (37명) |
28.6 % |
71.4 % |
5.0 |
9.4 |
|
아바스틴 |
2상 (46명) |
10.9 % |
No data |
3.4 |
7.3 |
|
키트루다 |
2상 (98명) |
13 % |
30 % |
2.1 |
9.4 |
|
BVAC-C |
1상 (9명) |
11 % |
66 % |
6.8 |
>12 |
*1 : Gynecol Oncol. 2012 Dec;127(3):451-5; J Clin Oncol. 2009 Mar 1; 27(7): 1069-1074; Journal of Clinical Oncology 36, no. 15_suppl (May 2018) 5522-5522.
*2 : 참여환자의 생존 기간은 주기적으로 확인 중이므로 기간은 더 늘어날 수 있음.
- 암세포는 인체의 항암면역기능의 공격을 회피하며 말기암이 될수록 면역작용에 내성을 보이는 세포가 나타나 비균질한 상태가 됩니다. 대표적인 면역회피기전으로는 MHC-I 분자의 소실과 발현 저하, 암항원의 소실에 기인한 T세포의 작용 회피와 T세포와 NK세포 등 항암면역세포의 기능소실 (exhaustion) 유도 등이 있습니다. BVAC-C는 세계 최초 인체 내 가용한 모든 항암 면역기능의 활성화를 유도하는 항암면역치료백신으로 MHC-I가 소실된 암세포를 NK세포와 NKT세포의 활성화를 통해 제거할 수 있고, 종양세포 주변에 침윤되어 기능저하 상태인 T세포와 NK세포의 기능을 다시 회복시키므로 암세포의 면역회피기전을 극복할 수 있습니다. 이는 경쟁제품들이 전혀 갖추지 못한 강력한 특징입니다. 또한, 현재 자궁경부암에 사용 중인 화학요법제인 Topotecan 또는 임상시험 중인 면역관문제와 병용 투여시 약효가 상승함을 동물모델에서 확인하였습니다.
- 항암치료백신과 면역관문저해제는 병용투여 시 약효 상승과 더 높은 치료효과를 기대할 수 있는 조합으로 잘 알려져 있으며, 셀리드는 BVAC-C와 허가받은 면역관문저해제와의 병용투여 임상 2a상 시험을 연구자주도 임상 연구의 형식으로 진행 중입니다.
(나) BVAC-E6E7
○ BVAC-E6E7의 개발 배경 및 계획
BVAC-E6E7에 적용된 암 항원은 HPV 16형 및 18형의 E6, E7 재조합유전자 입니다. 이는 BVAC-C에 적용되어 있는 암 항원과 동일한 것입니다. 따라서 BVAC-C와 마찬가지로 두경부암, 자궁경부암을 포함하여 인유두종바이러스가 발병 원인으로 알려져 있는 모든 암종에 활용될 수 있습니다.
당사는 COVID-19 예방백신 개발 과정에서 생산성, 안전성 측면에서 크게 개선된 개량형 Ad5/35 벡터를 개발하였으며, 현재 해당 벡터가 적용된 오미크론 변이 대응 백신 AdCLD-CoV19-1 OMI는 임상 3상 시험계획을 식약처에 제출하고 승인받았습니다. BVAC-E6E7은 해당 벡터를 항암면역치료백신에 적용하고자 하는 첫 번째 시도로, 당사가 개발한 플랫폼 기술의 확장성을 입증할 수 있는 기회가 될 것으로 판단하고 있습니다.
BVAC-E6E7은 암 항원 및 작용기전이 BVAC-C와 동일하기 때문에 위의 (가) 항에 서술된 바와 같이 BVAC-C가 입증한 경쟁력을 동등한 수준으로 가지고 있을 것으로 판단됩니다. 또한 타겟 암종인 두경부암의 경우 인유두종바이러스 유래의 암종에 속하면서 항원 특이적 면역 반응을 유도하는 허가된 치료제가 존재하지 않고, 미국, 유럽 등 선진국에서 HPV 양성 두경부암 환자의 발생 빈도도 증가하는 등 시장성도 매우 높을 것으로 예상할 수 있습니다.
BVAC-E6E7은 HPV16/18 양성의 전이 및 재발성 두경부암 환자를 대상으로하는 임상 1/2a상 시험계획(IND)를 2023년 12월 18일 식품의약품안전처에 제출하였으며, 2024년 11월 19일 IND 승인 받아 국내에서 임상 개발에 주력할 계획입니다.
(다) BVAC-B
○ HER2/neu 암항원
BVAC-B는 B세포와 단구 세포를 기반으로 하는 유전자 치료제 형태의 항암면역치료백신입니다. 상피성장인자수용체 (human Epidermal Growth Factor Receptor, hEGFR) 중 하나인 HER2/neu를 발현하는 모든 암종에 적용하는 것을 최종개발목표로 하며 현재 위암 환자 대상 임상 1상 시험을 통해 안전성을 확보하였습니다. 인체 상피 성장 인자 수용체 HER2/neu는 인간 상피 성장 인자 수용체 패밀리의 일원으로 세포성장을 촉진하는 특정 성장인자의 수용체이며 정상적인 세포의 세포막 표면에서 낮은 농도로 발견되는 세포막 단백질입니다. 구조적 유사성을 가진 HER2 패밀리에는 HER1, HER2, HER3, HER4가 존재하며, 이 중 HER2 수용체를 규정하는 HER2/neu는 암을 일으키는 유전자로 침습적 유방암 및 난소암, 방광암 등에서 HER2/neu 유전자의 증폭 및 단백질의 과다발현이 인정되고 있습니다. HER2/neu가 과다발현된 종양은 더 공격적으로 성장하고, 호르몬 치료 및 일부 항암 치료에 저항성을 갖는 경향이 있습니다. 이러한 이유로 HER2/neu 양성 암을 가진 환자는 예후가 더 불량한 경향이 있지만, HER2 단백질을 표적하는 치료제를 사용할 수 있습니다. HER2 단백질을 표적하는 치료제는 대표적으로 로슈의 Trastuzumab 항체의약품이 있습니다.
○ HER2/neu 암항원 발현 암종
HER2/neu는 여러 암종에 다양한 비율로 발현하고 있습니다 (하단 표). HER2/neu 발현에 대한 동반진단검사를 이용하여 HER2/neu 발현이 진단된 암종에 BVAC-B를 사용할 수 있도록 허가를 받는 것이 BVAC-B 개발의 최종 목표입니다.
|
암항원 |
암종 |
발현비율 |
|---|---|---|
| HER2/neu |
유방암 |
20~30 % |
|
위암 |
4~53 % |
|
|
난소암 |
5~19 % |
|
|
췌장암 |
7~61 % |
|
|
폐암 |
7~23 % |
|
|
자궁내막암 |
17~52 % |
|
|
빌름스종양 |
51 % |
|
|
대장암 |
26~48 % |
○ BVAC-B의 개발
BVAC-B는 HER2/neu의 재조합 유전자 HER2K1117에 의해 만들어지는 항원단백질을 발현하고 동시에 자연살해 T세포의 리간드인 α-GC가 적재되어, 다양한 면역세포에 의한 위암의 암세포 특이적 면역반응과 자연살해세포 등 비특이적인 면역반응을 동시에 일으킬 수 있도록 설계되었습니다. BVAC-B의 약효 최적화를 위해 HER2/neu 단백질의 세포 내 발현 부분 중 발암성을 지닌 tyrosine kinase domain을 제외한 domain을 항원유전자에 추가하여 그 효력을 시험하였습니다. 신규 항원유전자는 보다 다양한 항원 epitope를 발현하므로 보다 강한 항암면역반응을 기대할 수 있어 약효를 극대화한 새로운 BVAC-B 면역백신을 개발할 수 있습니다. 임상 1상 시험을 마무리하였으며, 시험 결과를 미국 임상암학회(ASCO) 2020년 연례학회에 발표하였습니다. 임상 1상 시험 결과, BVAC-B의 안전성을 위암 환자에게서 확인하였으며, BVAC-B의 약효를 가장 잘 확인할 수 있는 HER2/neu 발현 암종과 환자군 선정을 검토 중입니다.
○ HER2 발현 위암의 미충족 의학적 수요
- 위암 병기상 3기 이후의 위암의 경우 5년 생존율이 급격히 낮아지며 4기 위암 환자의 5년 생존율은 10%에 그치고 있습니다. 특히 진행성 전이성 위암의 경우 예후가 매우 좋지 않으며 효과적인 치료법이 없습니다. 조기 위암을 제외한 절제 가능한 위암에서도 근치적 위절제술을 시행한 후에도 40-80%의 재발률을 보이며, 대부분이 복막 재발, 혈행성 전이 혹은 림프절 전이와 같은 원격 재발로 나타나며, 이 경우 5년 생존율이 40%로 매우 나쁜 예후를 보입니다.
- 위암은 동아시아 지역 호발암으로서 한국, 중국 등에서 미충족 의학적 수요가 높은 반면 주요 글로벌 제약사의 신약 개발 투자에서 제외되어 위암을 타깃으로 한 신약 파이프라인은 매우 빈약합니다. 그러므로 BVAC-B 위암 항암면역치료백신의 시장성이 매우 밝습니다. 세계적으로도 한국의 위암 발생률이 타 지역보다 월등히 높아 한국인의 유전적 및 환경적 특성에 맞는 개인 맞춤형 위암치료기술의 개발이 절실합니다.
○ BVAC-B의 경쟁력
- HER2/neu 암항원을 발현하는 유방암, 위암, 췌장암, 난소암 등에 사용이 가능하므로 시장성과 사업성이 매우 높습니다. HER2/neu 암항원은 항체의약품으로 이미 검증된 약품 타깃으로, 개발 성공 시 국내 및 해외의 대규모 시장 공략이 가능합니다. 특히, 검증된 타깃 활용으로 기술이전이 용이할 수 있습니다.
- 당사의 B세포 및 단구 세포를 기반으로하는 항암면역치료백신은 Herceptin, Perjeta 등의 단일클론 항체와 같이 주작용이 단순히 HER2/neu의 신호전달 작용을 억제하는 것이 아니라 HER2/neu를 발현하고 있는 암세포를 타깃으로하는 보다 적극적인 치료 방법으로, 단일클론 항체의 약점인 암세포의 면역회피기전(암세포 표면의 HER2/neu 항원의 세포표면 발현이 없어지는 경우 단클론항체는 작용할 수 없음)을 극복할 수 있는 혁신적인 항암면역치료백신입니다. 반면, 이들 개발 중인 HER2/neu 표적 면역치료 제품들은 수지상 세포 혹은 자가활성화 T세포에 기반한 제품들로, 강력한 항암면역작용 중 하나인 자연살해세포의 활성화를 유도하지 못 한다는 약점을 가지고 있습니다.
(라) BVAC-P
○ PAP, PSMA 암항원
PAP(Prostatic Acid Phosphatase, PAP)는 전립선암의 진단에 널리 사용되는 표지자로서 인체 전립선에 가장 많이 존재하는 탈 인산화효소입니다. 전립선 상피 세포에서 생산되는 전립선 특이적인 효소로서 산성 조건 하에서 인산 모노에스텔을 가수분해합니다. 전립선비대증, 급성전립선염, 전립선결석, 전립선 종양 시 약간 상승하고 진행성 전립선암, 전립선 경색 시에는 높은 수치를 보입니다. PAP를 암항원으로 사용한 수지상세포백신인 Sipuleucel-T (Provenge, Dendreon, USA)가 2010년 미 FDA을 허가를 취득하여 현재 판매 중으로, 항원성과 임상적 유용성이 검증된 암항원입니다.
전립선 특이적 막항원(Prostate-Specific Membrane Antigen, PSMA)은 일반적으로 건강한 전립선 세포에 나타나는 세포막 단백질로 중추신경계나 정상 소장 및 대장 점막, 신세뇨관 등에서도 발현되는데, 이 중 전립선에서 가장 많이 생성됩니다. 진단적 측면으로 볼 때 정상 전립선 조직보다 전립선암 조직에서 많이 발현되며(전립선암의 90%에서 발견됨), 세포의 표면에 발현되므로 표적치료제 사용 시 종양표지자로 유용하게 사용될 수 있습니다. DNA 백신 등의 형태로 면역항암제로서 임상개발된 사례가 있습니다.
○ PAP, PSMA 암항원 발현 암종
PAP는 전이성 전립선암에 가장 높은 수치로 발현되므로 BVAC-P는 전립선암을 주 적응증으로 개발할 계획이나, 골수종, 폐암 등에서도 발현이 보고되고 있으므로 적응증 확대가 가능합니다. PSMA는 전립선암에 주로 발현되고 이외에도 폐암, 유방암, 뇌종양, 자궁암이나 난소암등의 부인암과 같은 고형암의 혈관에서도 발견되기 때문에 PSMA 표적 시 전립선암 뿐만이 아니라 타 암종으로 적응증 확대가 가능합니다.
○ BVAC-P의 개발
BVAC-P는 PAP 암항원과 PSMA 암항원의 융합형 암항원을 발현하고 동시에 자연살해 T세포의 리간드인 α-GC가 적재되어, 다양한 면역세포에 의한 전립선암 암세포 특이적 면역반응과 비특이적인 면역반응을 동시에 일으킬 수 있도록 설계되었습니다. 융합형 암항원 PAP-PSMA의 개발을 통해 이상반응을 초래할 가능성은 최소화하고 유효성은 최대화하였습니다. PAP-PSMA를 최종 암항원으로 선정하여 BVAC-P를 개발하였습니다. 2019년 전립선암 환자 대상 임상 1상 시험 계획서를 식약처에 제출하였으며, 2020년 2월 최종 승인받았습니다. 현재 연구책임자 선정 등 임상 1상 시험 준비를 진행하고 있습니다.
○ BVAC-P의 경쟁력
- 전립선암의 미충족 의학적 수요: 거세저항성 전이성 전립선암의 1차 치료제는 Abiraterone과 표적치료제인 Enzalutamide를 주로 사용합니다. 2차 치료는 Docetaxel과 같은 독성이 심한 화학항암제, 세포치료제 Sipuleucel-T, 방사선치료제 Radium-223 등이 전이 상태, 치료이력 등에 따라 복잡하게 사용되는 형편으로, 생존기간을 늘여주는 신규 치료제의 개발이 시급합니다.
- BVAC-P의 경쟁력: 전립선암에서 높은 비율로 발현하는 두 종의 암항원으로 이루어진 융합형 암항원을 사용하는 BVAC-P는 다양한 종류의 epitope를 포함하므로, 복합적이고 강력한 항암면역작용이 암세포를 살상할 수 있습니다. 또한, 자연살해 T세포와 자연살해세포의 작용으로 암세포의 면역회피작용을 일부 극복할 수 있어 비균질성의 전이암에서의 효력을 기대할 수 있습니다. Sipuleucel-T의 경우 3회 투여를 위해 3회 제조가 필요한 반면 BVAC-P는 1회 제조로 다회 투여가 가능하여 상업화의 가능성이 매우 높습니다.
(마) BVAC-M
○ BVAC-M 암항원: GP100, MAGE-A3
- GP100 암항원은 멜라닌 세포에서 발견된 흑색종 항원입니다. 661개의 아미노산으로 이루어진 멜라노마 분화 항원으로 멜라닌을 만들어내는 멜라노솜에 다량으로 존재하는 당단백입니다. 멜라노솜의 성숙과 멜라닌 합성에 관여합니다. 정상 멜라닌 세포에 비해 멜라노마의 모든 진행 단계에서 과발현됩니다. GP100이 가지고 있는 epitope는 종양침윤T세포와 순환T세포에 의해 인식이 되는 항원성이 있으며, 이에 근거하여 GP100 peptide 또는 GP100 단백질을 사용하는 암백신들의 개발이 시도되었으나 임상시험에서 유의성을 검증하지 못하였습니다.
- MAGE-A3 암항원: 암-고환 항원(cancer/testis antigen, CTA) 중 하나인 MAGE 항원은 악성흑색종에서 처음 발견된 흑색종 항원으로, 악성흑색종 뿐만 아니라 위암, 두경부암, 폐암(30%), 육종, 방광암, 간암 등에서도 발현되나 정상 조직에서는 오직 고환의 생식세포에서만 발현됩니다. 정상세포에서는 비활성화된 DNA 상태로 존재하지만 종양세포에서는 promoter 부위가 비특이적으로 탈메틸화되면서 활성화되는 것으로 추정되고 있습니다. 여러 종류의 암에서 MAGE-A 암항원이 발현되는 경우 예후가 불량하다는 것이 관찰되었습니다. MAGE-A는 진행된 암에서 나타나는 DNA의 탈메틸화와 관련되어 있는 것이 염색체 수준에서와 단백질 발현 수준에서 모두 보고되었습니다.
○ GP100, MAGE-A3 암항원 발현 암종
|
암항원 |
암종 |
발현비율 |
|---|---|---|
| GP100 |
흑색종 |
~100 % |
|
수막종, 교아종 |
38 % |
|
| MAGE-A3 |
흑색종 |
76 % |
|
비소세포성폐암 |
25~45 % |
|
|
방광암 |
46.5 % |
|
|
간세포암 |
34.6 % |
○ BVAC-M의 개발
셀리드의 아데노바이러스 기술을 활용하여 GP100 암항원과 MAGE-A3 암항원을 한번에 타깃할 수 있는 제품을 개발하였습니다. 두 암항원을 사용함으로써 적용범위를 넓힐 수 있고, 암항원 발현 저하에 따른 면역회피 작용도 극복 가능합니다.
○ 흑색종의 미충족 의학적 수요
- 고위험 수술 가능 흑색종 환자에서 neoadjuvant 치료법과 adjuvant 치료법이 절실합니다. 이 환자군은 재발 위험이 크고 현재 사용 중인 인터페론 치료법은 약효가 미미하고 부작용이 큽니다. BVAC-M은 항암치료백신으로 수술 후 잔존암 제거에 매우 유리하고, 기억면역반응 생성을 통해 재발을 방지할 수 있습니다.
- 면역관문저해제 치료 무반응 또는 반응 후 재발환자, 특히 BRAF 야생형 진행암인 경우 치료방법이 전무합니다. BVAC-M은 면역관문저해제와 병용투여하여 이러한 환자군에게 새로운 치료법을 제시할 수 있습니다.
○ BVAC-M의 경쟁력
- 강력하고 복합적인 항암면역반응의 활성화: 경쟁제품의 개발 실패 요인은 대부분 암세포를 살상할 수 있는 강력한 항암면역반응의 활성화 작용이 낮았기 때문입니다. CeliVax 기술을 활용한 BVAC-M은 강력하고 복합적인 항암면역반응을 유도할 수 있으므로 경쟁력이 높습니다.
- GP100 암항원과 MAGE-A3 암항원을 한 번에 타깃할 수 있는 제품으로 두 암항원을 모두 발현하는 암을 강력히 억제할 수 있고, 한 종의 암항원만 발현하는 경우에도 사용 가능하므로 적용범위를 넓힐 수 있고, 암항원 발현 저하에 따른 면역회피 작용도 극복 가능합니다.
(바) BVAC-Neo
BVAC-Neo는 완전개인맞춤형 항암치료백신 (Personalized cancer vaccine)입니다. 환자 개인의 암세포의 유전정보를 분석하여 항원성이 매우 강한 neo-antigen 기반 neo-epitope을 선정하여 peptide 형태의 암항원으로 이용하거나, 유전자 형태로 사용합니다. 환자 개인이 가진 종양세포의 항원을 탐지, 발굴해서 면역체계를 활성화시키는 백신을 제작하는 것입니다. 완전 개인 맞춤형 항원을 사용하므로, 월등한 항암효력을 기대할 수 있고, 이상반응은 최소화되므로 강력한 경쟁력을 갖습니다. 또한, 암종에 관계없이 암세포에서 돌연변이가 확인되는 모든 암종에 적용이 가능하여 매우 큰 시장을 형성할 수 있습니다. BVAC-Neo 기술은 LG화학에 기술이전하였으며, 양사는 공동개발을 통해 임상진입을 신속히 하기 위해 노력 중입니다.
○ BVAC-Neo 암항원: Neo-antigen
- Neo-antigen의 생성: 정상세포에 돌연변이가 지속적으로 발생하면 암화되어 암세포가 됩니다. 암세포는 인체의 정상 면역기능에 의해 제어되지만, 면역회피기능이 생긴 암세포는 암조직으로 커지게 됩니다. 암세포는 돌연변이 단백질을 발현하고, 이 중 일부는 항원성을 갖게 됩니다. 암세포에 새롭게 나타난 neo-antigen은 암세포에만 특이적으로 발현하고, 정상세포에는 전혀 발현하지 않습니다. 또한, 돌연변이에 의해 인체에 완전 새롭게 나타난 항원이므로 인체 면역체계는 이를 병원균과 같은 외부 항원으로 인식하고 면역관용 작용에 구애받지 않습니다 (그림 Neo-antigen의 항원성과 특이성, Cancer immunology research 2013).
 |
|
Neo-antigen의 항원성과 특이성 (cancer immunology research 2013) |
- Neo-antigen의 발굴: 차세대 염기서열분석 기술이 보편화되고 유전체의 유전정보를 대규모로 분석할 수 있게 되면서 암 환자 개인의 유전정보를 비교적 쉽고 빠르게 확보할 수 있습니다 (그림 Neo-antigen의 발굴과 BVAC-Neo 제조 및 투여 과정, Bioorg Med Chem. 2018). 환자의 종양유래 검체에서 암세포를 분리하고 DNA를 추출한 뒤 전체 염기서열을 RNA-Seq, Exome-Seq 등의 방법으로 분석합니다. 정상 세포의 염기서열과 비교 분석해 돌연변이 염기서열을 확인합니다. 돌연변이에 생성된 neo-antigen을 발굴하고 이로부터 neo-epitope를 유추합니다. 최근 여러 암환자에서 공통으로 발견되는 Neo-antigen이 존재하고, 이를 항암면역치료에 이용할 수 있다는 보고가 다수 발표되었습니다. 당사에서도 이러한 공통(shared) neo-antigen이나 개인 neo-antigen을 BVAC-Neo에 활용하는 방안을 연구개발 중에 있습니다.
 |
|
Neo-antigen의 발굴과 BVAC-Neo 제조 및 투여 과정 (bioorg med chem. 2018에서 일부 수정) |
○ BVAC-Neo의 제조 및 경쟁력
발굴한 Neo-antigen으로부터 neo-epitope를 유추하고, 이 정보를 바탕으로 9-mer 길이의 peptides나 유전자를 GMP 내에서 합성합니다. 합성한 peptide나 유전자를 항원으로 이용하여 1일 제조공정으로 BVAC-Neo를 제조합니다. 선천면역계와 적응면역계의 모든 항암면역기능을 활성화하고 면역회피기전의 암세포까지 살상할 수 있는 Celivax의 복합적이고 강력한 효력이 제일 큰 경쟁력입니다. 또한, CeliVax는 세포기반 항암치료백신으로 극소량의 peptide나 유전자로도 제품 제조가 가능하고, 1일 제조의 월등한 신속성은 어떤 치료백신보다 신속히 환자에게 제품을 공급할 수 있습니다.
5) 제조공정
(가) CeliVax 완제의약품 1일 제조
환자의 자가 세포를 이용하여 제조하는 개인 맞춤형 세포치료제 의약품은 다양하게 활용되고 있으며, 세포의 채집, 선별, 배양, 활성화 등의 공정이 필요합니다. 제품마다 제조기간이 최소 7일부터 28일까지 필요하며(하단 표) 또한 개인 맞춤형 제품으로 1명을 위한 롯드 생산에 고가의 인력, 원료, 시설, 장비 등이 소모되므로 제품의 생산원가가 매우 높습니다. 이에 반해 셀리드는 CeliVax 기반 BVAC 파이프라인의 1일 제조공정을 세계 최초로 개발하여 개인 맞춤형 제품임에도 불구하고 획기적 신속성과 경제성을 확보하였습니다 (그림 CeliVax 완제의약품 1일 제조).
|
제품 |
제조기간 |
|---|---|
|
CeliVax |
1일 |
|
CAR-T |
21~28일 |
|
수지상세포 백신 |
7~14일 |
|
T세포 치료제 |
21~28일 |
환자의 말초 혈액으로부터 림프구성분 채집술을 이용하여 말초 혈액 단핵구(PBMC, Pheripheral blood mononuclear cells)를 병원에서 채집합니다(Step 1). 채집한 PBMC를 GMP 생산시설로 이송한 후, B세포 및 단구 확보, 암항원 유전자 전달 및 면역증강제 적재공정을 수행합니다. 다음 공정에서 유전자가 도입되고 면역증강제가 적재된 세포를 수집하고 세척한 후, 동결제를 가하여 바이알 충진 후 -130도 이하의 액체질소 상에 냉동 보관합니다. 품질검사를 통과한 제품은 환자투여 당일 냉동상태로 이송하여 환자 곁에서 해동한 후 정맥 주사로 투여합니다. CeliVax 완제의약품 제조공정의 경쟁력을 배가하기 위하여 현 수작업 공정의 자동화를 목표로 다양한 세포처리 장비의 적용을 시험하였으며, BVAC-C 상업화 시 도입이 가능하도록 공정 최적화를 진행 중입니다.
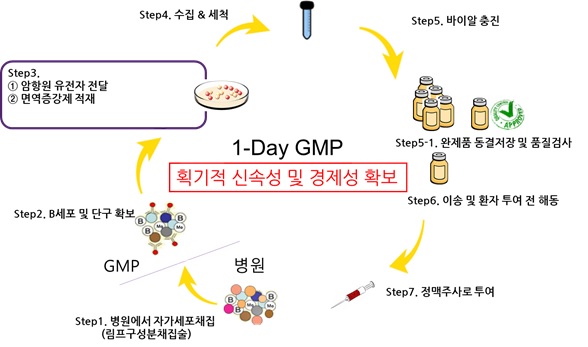 |
|
CeliVax 완제의약품 1일 제조 |
(나) CeliVax 완제의약품 제조 및 출하 과정
현재 CeliVax 완제의약품은 임상시험에서는 등록환자 방문 후 6일째에 투여를 위한 제품을 출하하고 있습니다(그림 CeliVax 완제의약품 제조 및 출하 과정). 방문일에 림프구성분채집술을 시행하고, 1일 제조를 마칩니다. 3일에 품질검사를 수행한 후 5일차에 결과를 확인한 뒤 6일에 신속 출하를 통해 제품을 공급합니다. 예후가 좋지 않은 많은 암환자에게 적기에 신속히 의약품을 공급하는것이 시장 안착과 매출 신장에 매우 중요합니다. 그러므로 기존의 세포기반면역항암치료제(CAR-T: 2~4주 소요) 대비 셀리드의 제품들은 공급의 신속성과 경제성 양측면에서 월등한 우위를 점하고 있습니다.
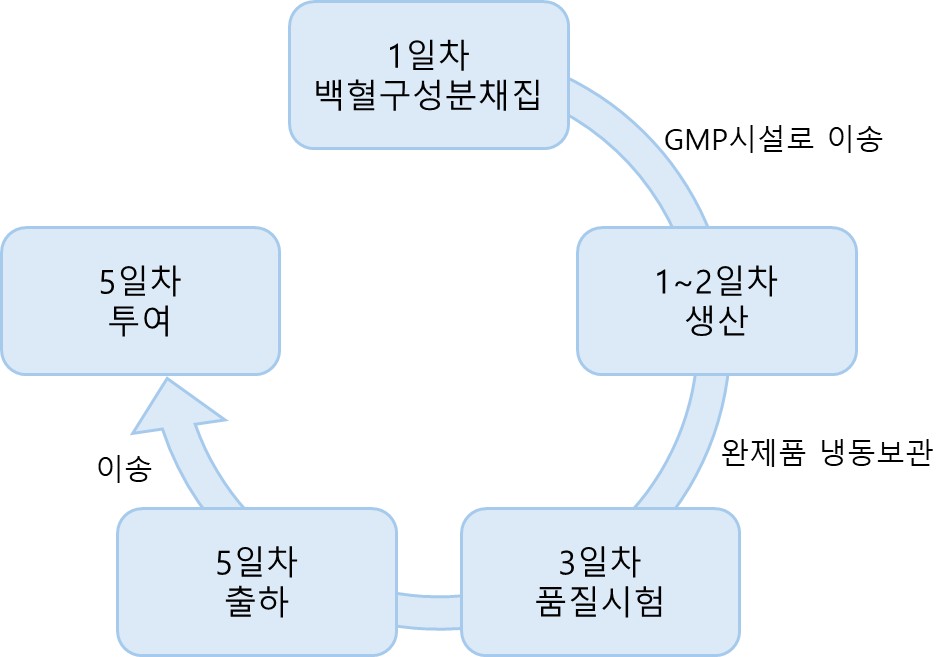 |
|
celivax 완제의약품 제조 및 출하 과정 |
6) 원천기술: 아데노바이러스 벡터 Ad5/35 기반 기술
○ 아데노바이러스 벡터 Ad5/35 기술의 개요
당사가 보유한 아데노바이러스 Ad5/35 벡터는 당사가 항암면역치료백신에 암 항원 전달을 위해 사용해 왔던 벡터입니다. Ad5/35 벡터는 복제불능 아데노바이러스 혈청형 5 (Ad5)의 돌기(knob) 유전자가 아데노바이러스 혈청형 35 (Ad35)의 돌기 유전자로 치환된 형태입니다. 이러한 변형을 통해 Ad5/35 벡터는 기존 Ad5의 세포 수용체가 아닌 인간 면역세포에 높게 발현하는 CD46 수용체를 통해 세포 내로 도입될 수 있게 됩니다. 즉, Ad5/35는 인간의 항원제시세포로 효율적으로 도입되어, 항원의 생산을 극대화할 수 있는 효율적인 백신 플랫폼입니다. 또한 Ad5/35 벡터는 Ad5 벡터와 비교했을 때, 간독성을 유발할 위험성이 현저히 낮다는 것이 보고된 바 있습니다. 실제로 ㈜셀리드에서는 벡터를 이용해 암 환자에게 암항원 유전자를 전달하면 높은 수준의 면역반응이 유도됨을 전임상 및 임상시험에서 확인한 바 있으며, 임상시험에서 다수의 환자들에게 투여되었을 때 안전성 및 독성과 관련한 문제도 발생하지 않았습니다. 따라서 당사는 Ad5/35 벡터 플랫폼을 활용하여 유망한 코비드-19 예방백신을 개발할 수 있다고 판단하였고, SARS-CoV-2 바이러스의 세포 감염에 핵심적인 역할을 하는 Spike 단백질을 유전자 형태로 Ad5/35 벡터에 도입하여 예방백신 (AdCLD-CoV19)을 개발하였습니다.
 |
|
아데노바이러스 5/35 벡터 |
○ 아데노바이러스 벡터 기술의 유용성
생명공학 기술의 발전에 따라 새로운 플랫폼의 백신 제형이 개발되기 시작했는데, 그 중 하나가 바이러스 벡터 기반 백신 (Viral vector vaccine)입니다. 벡터 기반 백신은 인체 세포에 백신 항원 유전자를 전달하여 항원 단백질을 체내에서 스스로 생성하게 하여 면역반응을 활성화합니다. 바이러스 벡터 기반 백신은 안전하며, 높은 수준의 면역반응을 유도하기 때문에 반복 투여가 필요없이 단회 투여만으로 효율적인 면역화가 가능합니다. 또한 구조적으로 바이러스에 기반하기 때문에, 항체 생성 뿐 아니라 세포독성 T 세포 면역을 효율적으로 유도할 수 있는 장점이 있습니다. 많은 바이러스가 유전자 벡터로서 연구가 되고 있으며, 그 중 아데노바이러스 (Adenovirus)는 비교적 크기가 큰 항원을 전달할 수 있기 때문에 여러 분야에 유용하게 응용되어 사용되고 있습니다. 아데노바이러스 벡터는 자가복제를 담당하는 E1 유전자를 제거한 형태로 주로 이용되며, E1 유전자가 제거된 아데노바이러스 벡터는 인체 세포에서는 자가 복제가 불가능하기 때문에 체내에서 병원성을 유발하지 않아 안전합니다.
○ 아데노바이러스 벡터 기술의 확장성
아데노바이러스 벡터 기반 예방백신 기술은 다른 바이러스 벡터 기반 예방백신 기술과 유사하게, 벡터 게놈 내에 항원유전자를 손쉽게 교체함으로써 여러 예방백신 파이프라인을 신속하게 개발할 수 있는 확장성이 있습니다. 이번 COVID-19와 같이 신종 전염병의 유전자 정보가 파악되는 즉시 항원성이 있는 부위의 유전자를 합성하여 아데노바이러스 벡터에 삽입함으로써 백신 파이프라인을 개발할 수 있습니다. 특히, 독감, 호흡기세포융합바이러스 (Respiratory syncytial virus)와 같은 바이러스 감염증에 대한 예방백신을 개발하거나 변이 바이러스에 대한 새로운 백신을 신속히 개발하여야 할 때 매우 효율적입니다. 당사에서도 앞으로 아데노바이러스 벡터의 확장성을 활용하여 다양한 백신 파이프라인을 개발할 계획입니다.
○ 아데노바이러스 벡터 Ad5/35 기술의 경쟁력
전통적으로 백신 제형으로 많이 이용 되어 왔던 사백신 (Inactivated vaccine)과 약독화 생백신 (Attenuated vaccine)은 제작과정이 간단한 장점이 있지만, 사백신의 경우 높은 수준의 면역반응을 유도하지 못하고, 약독화 생백신은 돌연변이를 통해 병원성을 다시 획득할 수 있는 위험성이 존재합니다. 단백질 서브유닛 백신 (Subunit vaccine)은 면역 반응을 잘 유도하지 못하기 때문에 면역증강제를 함께 사용해야 한다는 제한점이 있습니다. 유전자 기반의 DNA, RNA 백신은 면역반응은 잘 유도하나 2회이상 투여해야하는 제한점이 있습니다.
아데노바이러스 벡터 Ad5/35 기반 예방백신은 안전하며, 높은 수준의 면역반응을 유도하기 때문에 반복 투여가 필요없이 단회 투여만으로 효율적인 면역화가 가능합니다. 또한 구조적으로 바이러스에 기반하기 때문에, 항체 생성 뿐 아니라 세포독성 T 세포 면역을 효율적으로 유도할 수 있는 장점이 있습니다. 당사에서 CeliVax 기술의 한 요소로서 장기간 개발해온 경험과 자료가 있기 때문에, 신속한 개발과 임상진입이 가능합니다. 또한, 셀리드는 대량생산이 가능한 아데노바이러스 벡터 생산 플랫폼 기술을 개발완료하여 한층 높은 경쟁력을 확보하였습니다.
○ COVID-19 예방백신 'AdCLD-CoV19-1 OMI'
COVID-19 팬데믹의 확산, 향후 재유행에 대비하기 위한 신속한 예방백신 개발을 지난 4월 시작하였습니다. 개발 플랫폼은 복제불능 아데노바이러스 벡터 (Ad5/35)를 이용하였습니다. SARS-CoV-2 바이러스의 세포 감염에 핵심적인 역할을 하는 Spike 단백질을 유전자 형태로 Ad5/35 벡터에 도입하여 예방백신 (AdCLD-CoV19)을 제작하였습니다.
 |
|
AdCLD-CoV19 예방백신의 형태 |
AdCLD-CoV19는 투여 후 항원제시세포로 도입되어 체내에서 Spike 단백질 항원을 생산하고, 생산된 Spike 단백질은 세포 밖으로 분비됩니다. B 세포는 발현된 Spike 항원을 인식하여 활성화되며, 중화항체를 포함한 항원 특이 항체를 다량으로 생산합니다. 생성된 중화항체는 오랜기간 유지되며, 항원에 의해 활성화된 B 세포는 기억 면역을 획득합니다. 한편, 발현된 항원은 항원제시세포 표면의 MHC 분자와 결합하여 CD8 T 세포와 CD4 T 세포를 활성화시킵니다. 이렇게 활성화된 T 세포는 기억 면역을 획득하여 추후 같은 항원에 노출되었을 때 신속하고 강력한 면역반응을 재유도할 수 있게 됩니다.
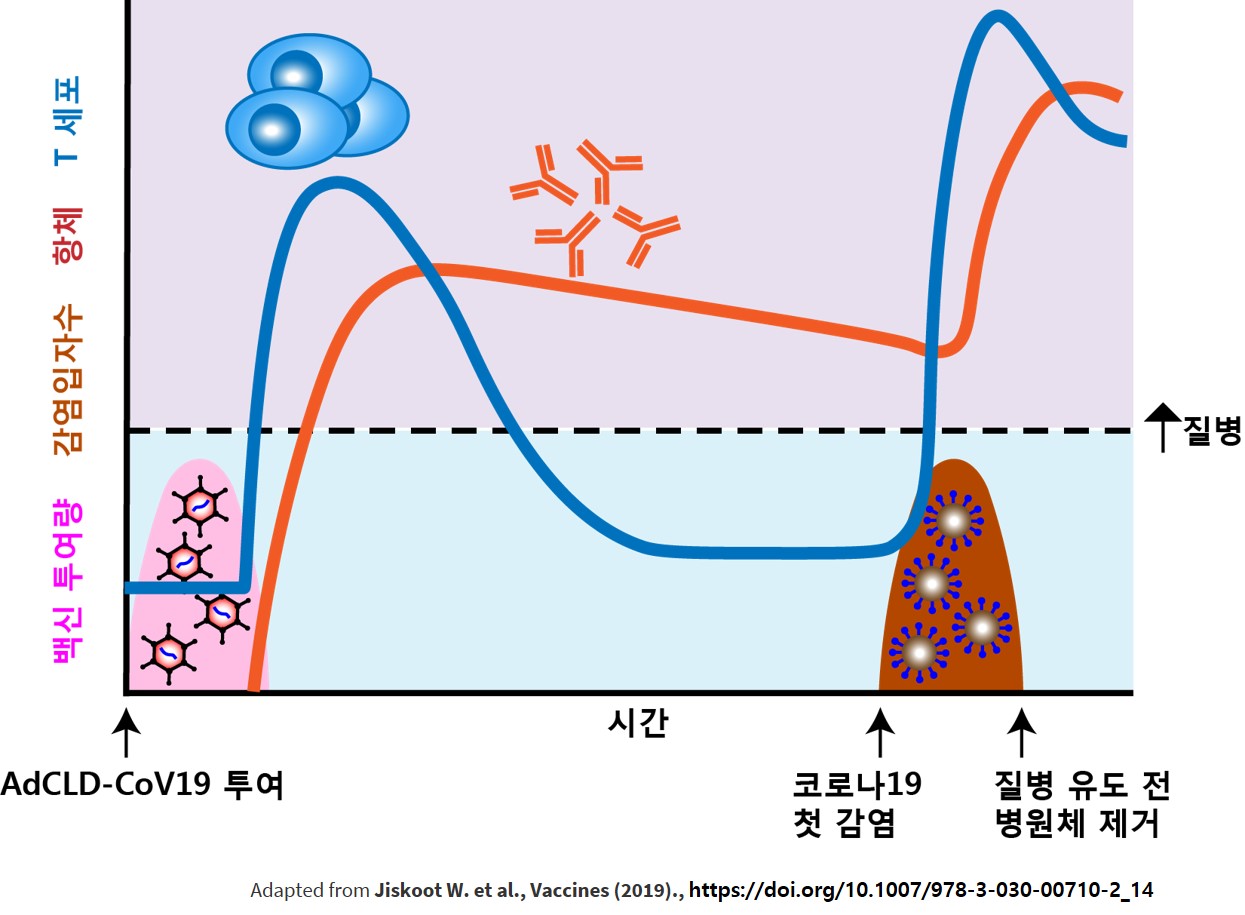 |
|
AdCLD-Cov19 의 코비드-19 예방 효력 |
SARS-CoV-2 바이러스에 감염되었을 때, 항원을 인지한 T 세포는 빠르게 항원 특이적 반응을 시작하여, 바이러스에 감염된 세포들을 초기에 제거할 수 있습니다. 또한, B 세포에 의해 생산된 중화항체는 SARS-CoV-2 바이러스를 제거하거나, 세포 수용체 결합부위 (Receptor binding domain)에 결합하여 바이러스의 세포 감염을 차단합니다.
AdCLD-CoV19 의 마우스 유효성 시험에서 체내에서 높은 수준의 S단백질 특이적 항체 생성량을 확인하였고, 그 중화능력을 유사바이러스 시험법으로 입증하였으며, Spike 단백질 특이적 T 세포 반응도 생성됨을 확인하였습니다. 영장류 유효성 시험에서도 체내에서 높은 수준의 S단백질 특이적 항체 생성량을 확인하였고, 그 중화능력을 유사바이러스 시험법과 코로나 생바이러스 중화시험법으로 입증하였으며, Spike 단백질 특이적 T 세포 반응도 생성됨을 확인하였습니다. 이러한 비임상 유효시험 결과를 바탕으로 비임상 독성시험, 생산 검증 등을 수행하였으며, 2020년 12월 임상 1/2a상 시험 계획(IND)을 승인받았습니다. 임상 1상에 해당하는 파트A, 임상 2a상에 해당하는 파트B의 투여를 마치고 접종 후 4주차까지의 면역원성 분석을 완료하였습니다. 분석 결과는 2021년 11월 4일 화순국제백신포럼에서 발표한 바 있습니다.
2021년에는 백신의 대량생산, 안정성 향상을 통한 안정적인 공급이 가능하도록 AdCLD-CoV19을 개량한 형태의 백신 AdCLD-CoV19-1의 개발에 주력했습니다. AdCLD-CoV19-1은 GLP 비임상시험을 통해 안전성을 입증하였으며, 중화항체 반응, T 세포 반응도 AdCLD-CoV19과 비교했을 때 동등한 수준임을 확인하여, 2021년 7월 임상 1상 시험 계획을 승인받았습니다. 임상시험을 통해 AdCLD-CoV19-1의 우수한 안전성 및 면역원성 결과를 확보하여, 플랫폼의 우수성을 다시 한 번 증명할 수 있었습니다. 이 결과를 기반으로 AdCLD-CoV19-1의 임상 2b상 시험을 승인받아 국내 임상 2b상을 개시하였으나, 코로나19 감염 상황의 악화 및 백신 접종율 상승 등으로 인해 시험대상자 모집이 어려워졌으며, 초기 유행주를 타겟한 AdCLD-CoV19-1은 다양한 변이주가 출현하는 상황에서 추가 접종 백신 대비 시장성이 높지 않을 것으로 판단하였습니다. 따라서 임상 2b상을 조기 종료하고 개발 역량을 코로나19 변이주 대응 개발에 주력하고 있습니다.
셀리드는 그 동안 비임상 개발이 완료된 백신의 임상시험 이외에도, 코로나19 변이주에 신속히 대응할 수 있도록 변이주 대응 백신 연구를 꾸준히 수행해 왔습니다. 2021년 하반기에는 델타 변이주에 대응하는 백신을 개발하여 영장류, 마우스에서 우수한 수준의 중화항체 반응 및 T 세포 반응을 유도함을 확인하였으며, 2022년 상반기에는 오미크론 변이주에 대응하는 백신 AdCLD-CoV19-1 OMI의 제작을 마치고 비임상시험을 완료하였습니다. AdCLD-CoV19-1 OMI는 단회 접종 모델과 기초 백신 접종을 완료한 동물에 추가 접종한 모델 모두에서, 오미크론 변이주에 대한 중화항체가 효과적으로 생성됨을 관찰하였으며, 임상 1/2상을 통해 우수한 면역원성과 안전성을 확인하였습니다. 임상 2상 중간 분석 결과, AdCLD-CoV19-1 OMI' 투여 후 임상시험 대상자들의 코로나19 예방 백신 접종과 감염으로 인한 높은 기저치에도 불구하고, 면역원성 분석 결과 접종 후 4주 시점에 분석한 오미크론 변이에 대한 중화항체가는 접종 전 대비 시험군에서 3.49배 증가한 것을 확인하였습니다. 2023년 7월 14일 임상 1/2상 Top-line 결과를 발표했습니다. 본 보고서 제출일 현재 'AdCLD-CoV19-1 OMI'의 임상 3상 시험을 수행중입니다. 필리핀 및 베트남 규제당국에도 임상 3상 시험계획( IND)신청을 완료하였고, IND 승인을 받아 임상 3상 시험을 진행하고 있습니다. AdCLD-CoV19-1 OMI의 임상 3상시험은 기허가 백신과의 비열등성시험으로 진행합니다. 시험군과 대조군 간 안전성과 면역원성을 비교하는 코호트 A 대상자군과 안전성을 비교하는 코호트 B 대상자군으로 시험 대상자 4,000명을 모집합니다. 2024년 11월 12일 임상 3상 시험 대상자에게 투여 완료하였으며, 계획된 모든 대상자의 투여 완료 후 4주 차의 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시하여 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부품목허가를 신청할 계획입니다.
III. 재무에 관한 사항
1. 요약재무정보
(단위 : 원)
| 구 분 | 제19기 (2024년 12월 31일) |
제18기 (2023년 12월 31일 ) |
제17기 (2022년 12월 31일) |
| 회계처리기준 | K-IFRS | K-IFRS | K-IFRS |
| [유동자산] | 11,449,766,232 | 16,874,029,726 | 20,977,751,045 |
| 현금및현금성자산 | 9,024,319,229 | 13,380,773,530 | 8,254,381,945 |
| 매출채권 | 273,097,827 | - | 369,600,000 |
| 계약자산 | - | - | 48,000,000 |
| 재고자산 | 562,673,764 | - | - |
| 당기손익-공정가치 측정 금융자산 | - | - | 2,387,375,000 |
| 상각후원가측정 금융자산 | - | 1,987,436,148 | 8,003,112,155 |
| 기타금융자산 | 339,749,438 | 149,186,397 | 115,042,042 |
| 파생상품자산 | - | 725,598,600 | 1,100,297,600 |
| 기타유동자산 | 1,187,319,174 | 522,652,871 | 537,711,203 |
| 당기법인세자산 | 62,606,800 | 108,382,180 | 162,231,100 |
| [비유동자산] | 64,636,697,365 | 47,048,212,261 | 24,879,639,709 |
| 당기손익-공정가치측정 금융자산 | - | 2,280,350,000 | 2,067,125,000 |
| 상각후원가측정 금융자산 | - | - | 1,992,054,275 |
| 기타금융자산 | 74,562,500 | 44,172,500 | 48,402,500 |
| 사용권자산 | 101,664,851 | 9,233,632 | 48,911,165 |
| 유형자산 | 44,628,737,878 | 40,338,662,571 | 20,616,279,133 |
| 무형자산 | 19,424,292,558 | 4,160,221,328 | 18,373,425 |
| 기타비유동자산 | 407,439,578 | 215,572,230 | 88,494,211 |
| 자산총계 | 76,086,463,597 | 63,922,241,987 | 45,857,390,754 |
| [유동부채] | 4,942,718,962 | 10,324,841,632 | 20,539,210,401 |
| [비유동부채] | 19,940,646,662 | 13,102,139,474 | 2,879,291,553 |
| 부채총계 | 24,883,365,624 | 23,426,981,106 | 23,418,501,954 |
| [자본금] | 10,551,488,500 | 6,801,488,500 | 4,865,596,000 |
| [주식발행초과금] | 83,445,790,165 | 64,520,507,642 | 49,257,173,213 |
| [기타자본항목] | 10,253,194,266 | 9,894,975,869 | 9,352,166,835 |
| [결손금] | (65,021,653,650) | (52,695,989,822) | (41,036,047,248) |
| [기타포괄손익누계액] | 11,974,278,692 | 11,974,278,692 | - |
| 자본총계 | 51,203,097,973 | 40,495,260,881 | 22,438,888,800 |
| 부채및자본총계 | 76,086,463,597 | 63,922,241,987 | 45,857,390,754 |
| 구 분 | 2024.01.01 ~2024.12.31 |
2023.01.01 ~2023.12.31 |
2022.01.01 ~2022.12.31 |
| 매출액 | 4,165,091,858 | - | 480,000,000 |
| 영업이익(손실) | (11,980,498,848) | (12,197,950,643) | (14,911,333,804) |
| 당기순이익(손실) | (12,259,048,237) | (11,611,435,383) | (22,864,575,136) |
| 총포괄이익(손실) | (12,325,663,828) | 314,336,118 | (22,623,760,238) |
| 기본주당이익(손실) | (743) | (1,078) | (2,350) |
2. 연결재무제표
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
3. 연결재무제표 주석
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 19 기 2024.12.31 현재 |
|
제 18 기 2023.12.31 현재 |
|
제 17 기 2022.12.31 현재 |
|
(단위 : 원) |
|
제 19 기 |
제 18 기 |
제 17 기 |
|
|---|---|---|---|
|
자산 |
|||
|
유동자산 |
11,449,766,232 |
16,874,029,726 |
20,977,751,045 |
|
현금및현금성자산 |
9,024,319,229 |
13,380,773,530 |
8,254,381,945 |
|
매출채권 |
273,097,827 |
369,600,000 |
|
|
계약자산 |
48,000,000 |
||
|
재고자산 |
562,673,764 |
||
|
당기손익-공정가치측정금융자산 |
2,387,375,000 |
||
|
상각후원가측정금융자산 |
1,987,436,148 |
8,003,112,155 |
|
|
기타금융자산 |
339,749,438 |
149,186,397 |
115,042,042 |
|
파생상품자산 |
725,598,600 |
1,100,297,600 |
|
|
기타유동자산 |
1,187,319,174 |
522,652,871 |
537,711,203 |
|
당기법인세자산 |
62,606,800 |
108,382,180 |
162,231,100 |
|
비유동자산 |
64,636,697,365 |
47,048,212,261 |
24,879,639,709 |
|
당기손익-공정가치측정금융자산 |
2,280,350,000 |
2,067,125,000 |
|
|
상각후원가측정금융자산 |
1,992,054,275 |
||
|
기타금융자산 |
74,562,500 |
44,172,500 |
48,402,500 |
|
사용권자산 |
101,664,851 |
9,233,632 |
48,911,165 |
|
유형자산 |
44,628,737,878 |
40,338,662,571 |
20,616,279,133 |
|
무형자산 |
19,424,292,558 |
4,160,221,328 |
18,373,425 |
|
기타비유동자산 |
407,439,578 |
215,572,230 |
88,494,211 |
|
자산총계 |
76,086,463,597 |
63,922,241,987 |
45,857,390,754 |
|
부채 |
|||
|
유동부채 |
4,942,718,962 |
10,324,841,632 |
20,539,210,401 |
|
매입채무 |
252,404,274 |
||
|
기타금융부채 |
4,122,493,749 |
2,258,985,203 |
884,490,205 |
|
기타부채 |
514,084,816 |
259,716,337 |
354,313,635 |
|
유동 리스부채 |
53,736,123 |
10,327,452 |
43,456,892 |
|
파생상품부채 |
2,298,544,000 |
7,381,576,000 |
|
|
전환사채 |
5,497,268,640 |
11,875,373,669 |
|
|
비유동부채 |
19,940,646,662 |
13,102,139,474 |
2,879,291,553 |
|
장기차입금 |
13,070,135,902 |
6,487,230,494 |
|
|
기타금융부채 |
2,387,706,422 |
2,361,047,822 |
2,089,109,290 |
|
순확정급여부채 |
1,270,723,394 |
1,089,987,268 |
781,330,794 |
|
비유동 리스부채 |
48,207,054 |
8,851,469 |
|
|
이연법인세부채 |
3,163,873,890 |
3,163,873,890 |
|
|
부채총계 |
24,883,365,624 |
23,426,981,106 |
23,418,501,954 |
|
자본 |
|||
|
자본금 |
10,551,488,500 |
6,801,488,500 |
4,865,596,000 |
|
주식발행초과금 |
83,445,790,165 |
64,520,507,642 |
49,257,173,213 |
|
기타자본항목 |
10,253,194,266 |
9,894,975,869 |
9,352,166,835 |
|
이익잉여금(결손금) |
(65,021,653,650) |
(52,695,989,822) |
(41,036,047,248) |
|
기타포괄손익누계액 |
11,974,278,692 |
11,974,278,692 |
|
|
자본총계 |
51,203,097,973 |
40,495,260,881 |
22,438,888,800 |
|
부채및자본총계 |
76,086,463,597 |
63,922,241,987 |
45,857,390,754 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 19 기 2024.01.01 부터 2024.12.31 까지 |
|
제 18 기 2023.01.01 부터 2023.12.31 까지 |
|
제 17 기 2022.01.01 부터 2022.12.31 까지 |
|
(단위 : 원) |
|
제 19 기 |
제 18 기 |
제 17 기 |
|
|---|---|---|---|
|
매출 |
4,165,091,858 |
480,000,000 |
|
|
매출원가 |
3,460,080,264 |
324,529,699 |
|
|
매출총이익 |
705,011,594 |
155,470,301 |
|
|
판매비와관리비 |
9,198,897,365 |
7,158,920,550 |
7,180,371,661 |
|
경상연구개발비 |
3,486,613,077 |
5,039,030,093 |
7,886,432,444 |
|
영업손실 |
(11,980,498,848) |
(12,197,950,643) |
(14,911,333,804) |
|
기타수익 |
28,702,495 |
86,053,180 |
152,728,922 |
|
기타비용 |
143,814,665 |
141,196,281 |
130,335,038 |
|
금융수익 |
1,071,668,167 |
2,280,822,597 |
955,905,275 |
|
금융원가 |
1,235,105,386 |
1,639,164,236 |
8,931,540,491 |
|
법인세비용차감전순손실 |
(12,259,048,237) |
(11,611,435,383) |
(22,864,575,136) |
|
법인세비용(수익) |
0 |
||
|
당기순이익(손실) |
(12,259,048,237) |
(11,611,435,383) |
(22,864,575,136) |
|
기타포괄손익 |
(66,615,591) |
11,925,771,501 |
240,814,898 |
|
후속적으로 당기손익으로 재분류 되지않는 항목 |
|||
|
유형자산재평가이익 |
11,974,278,692 |
||
|
순확정급여제도의 재측정요소 |
(66,615,591) |
(48,507,191) |
240,814,898 |
|
총포괄손실 |
(12,325,663,828) |
314,336,118 |
(22,623,760,238) |
|
주당손실 |
|||
|
기본주당손익 및 희석주당손익 (단위 : 원) |
(743) |
(1,078) |
(2,350) |
4-3. 자본변동표
|
자본변동표 |
|
제 19 기 2024.01.01 부터 2024.12.31 까지 |
|
제 18 기 2023.01.01 부터 2023.12.31 까지 |
|
제 17 기 2022.01.01 부터 2022.12.31 까지 |
|
(단위 : 원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
주식발행초과금 |
기타자본항목 |
결손금 |
기타포괄손익누계액 |
자본 합계 |
|
|
2022.01.01 (기초자본) |
4,865,596,000 |
49,257,173,213 |
4,156,930,262 |
(19,519,129,094) |
38,760,570,381 |
|
|
당기순손실 |
(22,864,575,136) |
(22,864,575,136) |
||||
|
전기오류수정 |
4,823,584,242 |
1,106,842,084 |
5,930,426,326 |
|||
|
순확정급여부채의 재측정요소 |
240,814,898 |
240,814,898 |
||||
|
토지의 재평가잉여금 |
||||||
|
유상증자 |
||||||
|
주식보상비용 |
371,652,331 |
371,652,331 |
||||
|
2022.12.31 (기말자본) |
4,865,596,000 |
49,257,173,213 |
9,352,166,835 |
(41,036,047,248) |
22,438,888,800 |
|
|
2023.01.01 (기초자본) |
4,865,596,000 |
49,257,173,213 |
9,352,166,835 |
(41,036,047,248) |
22,438,888,800 |
|
|
당기순손실 |
(11,611,435,383) |
(11,611,435,383) |
||||
|
전기오류수정 |
||||||
|
순확정급여부채의 재측정요소 |
(48,507,191) |
(48,507,191) |
||||
|
토지의 재평가잉여금 |
11,974,278,692 |
11,974,278,692 |
||||
|
유상증자 |
1,935,892,500 |
15,263,334,429 |
17,199,226,929 |
|||
|
주식보상비용 |
542,809,034 |
542,809,034 |
||||
|
2023.12.31 (기말자본) |
6,801,488,500 |
64,520,507,642 |
9,894,975,869 |
(52,695,989,822) |
11,974,278,692 |
40,495,260,881 |
|
2024.01.01 (기초자본) |
6,801,488,500 |
64,520,507,642 |
9,894,975,869 |
(52,695,989,822) |
11,974,278,692 |
40,495,260,881 |
|
당기순손실 |
(12,259,048,237) |
(12,259,048,237) |
||||
|
전기오류수정 |
||||||
|
순확정급여부채의 재측정요소 |
(66,615,591) |
(66,615,591) |
||||
|
토지의 재평가잉여금 |
||||||
|
유상증자 |
3,750,000,000 |
18,925,282,523 |
22,675,282,523 |
|||
|
주식보상비용 |
358,218,397 |
358,218,397 |
||||
|
2024.12.31 (기말자본) |
10,551,488,500 |
83,445,790,165 |
10,323,443,105 |
(65,021,653,650) |
11,974,278,692 |
51,203,097,973 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 19 기 2024.01.01 부터 2024.12.31 까지 |
|
제 18 기 2023.01.01 부터 2023.12.31 까지 |
|
제 17 기 2022.01.01 부터 2022.12.31 까지 |
|
(단위 : 원) |
|
제 19 기 |
제 18 기 |
제 17 기 |
|
|---|---|---|---|
|
영업활동으로 인한 현금흐름 |
(10,315,247,184) |
(7,115,155,704) |
(12,216,037,230) |
|
영업으로부터 창출된 현금흐름 |
(9,880,917,328) |
(7,526,072,452) |
(13,100,581,155) |
|
이자의 지급 |
(944,152,325) |
(297,341,754) |
|
|
이자의 수취 |
464,047,089 |
654,409,582 |
941,798,395 |
|
법인세의 환급(납부) |
45,775,380 |
53,848,920 |
(57,254,470) |
|
투자활동으로 인한 현금흐름 |
(15,066,209,618) |
(751,879,239) |
14,001,708,304 |
|
단기금융상품의 감소 |
5,000,000,000 |
||
|
정부보조금 수령 |
248,045,255 |
211,229,870 |
|
|
당기손익-공정가치측정 금융자산의 처분 |
2,281,909,647 |
2,500,000,000 |
4,998,969,579 |
|
상각후원가측정금융자산의처분 |
1,986,097,000 |
8,000,000,000 |
8,000,000,000 |
|
기타금융자산의 감소 |
126,798,497 |
19,230,000 |
93,980,000 |
|
사업결합으로 인한 현금증가 |
2,743,107 |
||
|
당기손익-공정가치측정금융자산의 취득 |
(3,000,000,000) |
||
|
기타금융자산의 증가 |
(359,155,285) |
(107,969,625) |
(20,200,000) |
|
종속기업투자주식의 취득 |
(500,000,000) |
||
|
유형자산의 취득 |
(5,908,402,924) |
(6,921,640,548) |
(1,202,950,214) |
|
무형자산의 취득 |
(12,506,775,912) |
(4,362,466,302) |
|
|
기타비유동자산의 증가 |
(189,423,748) |
(127,078,019) |
(79,320,931) |
|
재무활동으로 인한 현금흐름 |
21,025,002,501 |
12,993,426,528 |
1,263,457,204 |
|
정부보조금 수령 |
26,658,600 |
745,669,105 |
1,343,415,385 |
|
유상증자 |
22,675,282,523 |
17,199,226,929 |
|
|
단기차입금의 차입 |
441,080,465 |
||
|
장기차입금의 차입 |
6,512,000,000 |
6,487,230,494 |
|
|
사채의 발행 |
2,940,000,000 |
||
|
단기차입금의 상환 |
(590,053,406) |
||
|
단기차입금의 감소 |
(90,000,000) |
||
|
장기차입금의 상환 |
(200,000,000) |
||
|
사채의 상환 |
(3,000,000,000) |
||
|
전환사채의 상환 |
(7,600,000,000) |
(11,400,000,000) |
|
|
리스부채의 상환 |
(89,965,681) |
(38,700,000) |
(79,958,181) |
|
현금및현금성자산의순증감 |
(4,356,454,301) |
5,126,391,585 |
3,049,128,278 |
|
기초 현금및현금성자산 |
13,380,773,530 |
8,254,381,945 |
5,205,253,667 |
|
기말 현금및현금성자산 |
9,024,319,229 |
13,380,773,530 |
8,254,381,945 |
5. 재무제표 주석
| 당기말 2024년 12월 31일 현재 |
| 전기말 2023년 12월 31일 현재 |
| 주식회사 셀리드 |
1. 회사의 개요
주식회사 셀리드(이하 "당사")는 2006년 12월 11일 설립되어 신약의 연구개발, 제조 및 판매업을 주사업목적으로 하고 있으며 본사는 서울특별시 관악구 관악로 1에 소재하고 있습니다. 당사는 2019년 2월 20일 주식을 코스닥시장에 상장하였습니다.
당기말 현재 주요 보통주 주주현황은 다음과 같습니다.
| 주주명 | 보유주식수(주) | 지분율(%) |
|---|---|---|
| 강창율 | 2,355,064 | 11.16 |
| 기타 | 18,747,913 | 88.84 |
| 합 계 | 21,102,977 | 100.00 |
2. 재무제표 작성기준
당사는 주식회사등의외부감사에관한법률 제5조 1항 1호에서 규정하고 있는 국제회계기준위원회의 국제회계기준을 채택하여 정한 회계처리기준인 한국채택국제회계기준에 따라 재무제표를 작성하였습니다.
당사의 재무제표는 2025년 3월 7일자 이사회에서 승인되었으며, 2025년 3월 26일자주주총회에서 최종 승인될 예정입니다.
(1) 측정기준
재무제표는 아래에서 열거하고 있는 재무상태표의 주요 항목을 제외하고는 역사적원가를 기준으로 작성되었습니다.
- 공정가치로 측정되는 유형자산
- 공정가치로 측정되는 파생상품
- 공정가치로 측정되는 당기손익-공정가치측정금융자산
- 확정급여채무의 현재가치에서 사외적립자산의 공정가치를 차감한 확정급여부채
(2) 기능통화와 표시통화
당사의 재무제표는 영업활동이 이루어지는 주된 경제환경의 통화인 원화로 작성되어보고되고 있습니다.
(3) 추정과 판단
한국채택국제회계기준에서는 재무제표를 작성함에 있어서 회계정책의 적용이나, 보고기간말 현재 자산, 부채 및 수익, 비용의 보고금액에 영향을 미치는 사항에 대하여 경영진의 최선의 판단을 기준으로 한 추정치와 가정의 사용을 요구하고 있습니다. 보고기간말 현재 경영진의 최선의 판단을 기준으로 한 추정치와 가정이 실제 환경과 다를 경우 이러한 추정치와 실제 결과는 다를 수 있습니다.
추정치와 추정에 대한 기본 가정은 지속적으로 검토되고 있으며, 회계추정의 변경은 추정이 변경된 기간과 미래 영향을 받을 기간 동안 인식되고 있습니다.
① 경영진의 판단
재무제표에 인식된 금액에 유의한 영향을 미치는 회계정책의 적용과 관련된 주요한 경영진의 판단에 대한 정보는 다음의 주석에 포함되어 있습니다.
- 주석 20: 리스기간 연장선택권의 행사가능성이 상당히 확실한지 여부
② 가정과 추정의 불확실성
다음 보고기간 이내에 중요한 조정이 발생할 수 있는 유의한 위험이 있는 가정과 추정의 불확실성에 대한 정보는 다음의 주석에 포함되어 있습니다.
- 주석 17: 손상검사 - 무형자산의 회수가능성을 포함한 회수가능액 추정의 주요 가정
- 주석 22: 순확정급여부채 (주요 보험수리적 가정)
- 주석 36: 우발채무 (자원의 유출 가능성과 금액에 대한 가정)
③ 공정가치 측정
당사의 회계정책과 공시사항은 다수의 금융 및 비금융자산과 부채에 대해 공정가치 측정이 요구되고 있습니다. 당사는 공정가치평가 정책과 절차를 수립하고 있습니다. 동 정책과 절차에는 공정가치 서열체계에서 수준 3으로 분류되는 공정가치를 포함한모든 유의적인 공정가치 측정의 검토를 책임지는 평가부서의 운영을 포함하고 있으며, 그 결과는 재무담당임원에게 직접 보고되고 있습니다.
평가부서는 정기적으로 관측가능하지 않은 유의적인 투입변수와 평가 조정을 검토하고 있습니다. 공정가치측정에서 중개인 가격이나 평가기관과 같은 제3자 정보를 사용하는 경우, 평가부서에서 제3자로부터 입수한 정보에 근거한 평가가 공정가치 서열체계 내 수준별 분류를 포함하고 있으며 해당 기준서의 요구사항을 충족한다고 결론을 내릴 수 있는지 여부를 판단하고 있습니다. 당사는 유의적인 평가 문제를 내부감사에게 보고하고 있습니다.
자산이나 부채의 공정가치를 측정하는 경우, 당사는 최대한 시장에서 관측가능한 투입변수를 사용하고 있습니다. 공정가치는 다음과 같이 가치평가기법에 사용된 투입변수에 기초하여 공정가치 서열체계 내에서 분류됩니다.
|
구분 |
투입변수 |
|---|---|
|
수준 1 |
측정일에 동일한 자산이나 부채에 대한 접근 가능한 활성시장의 조정되지 않은 공시가격 |
|
수준 2 |
수준 1의 공시가격 이외에 자산이나 부채에 대해 직접적으로 또는 간접적으로 관측가능한 투입변수 |
|
수준 3 |
자산이나 부채에 대한 관측가능하지 않은 투입변수 |
자산이나 부채의 공정가치를 측정하기 위해 사용되는 여러 투입변수가 공정가치 서열체계 내에서 다른 수준으로 분류되는 경우, 당사는 측정치 전체에 유의적인 공정가치 서열체계에서 가장 낮은 수준의 투입변수와 동일한 수준으로 공정가치 측정치 전체를 분류하고 있으며, 변동이 발생한 보고기간 말에 공정가치 서열체계의 수준간 이동을 인식하고 있습니다.
공정가치 측정 시 사용된 가정의 자세한 정보는 주석 5에 포함되어 있습니다.
3. 회계정책의 변경
당사는 2024년 1월 1일부터 회계정책 공시 개정사항(기업회계기준서 제1001호 재무제표 표시, 기업회계기준서 제1007호 '현금흐름표', 기업회계기준서 제1116호 '리스')을 적용하였습니다.
당사의 경영진은 회계정책을 검토하였고,이 개정사항에 따라 주석4에 공시된 중요한회계정책 정보를 업데이트 하였습니다.
4. 중요한 회계정책
당사가 한국채택국제회계기준에 따른 재무제표 작성에 적용한 중요한 회계정책은 아래 기술되어 있으며, 주석 3에서 설명하고 있는 회계정책의 변경을 제외하고, 당기 및 비교표시된 전기의 재무제표는 동일한 회계정책을 적용하여 작성되었습니다.
(1) 현금및현금성자산
당사는 취득일로부터 만기일이 3개월 이내인 투자자산을 현금및현금성자산으로 분류하고 있습니다.
(2) 비파생금융자산
① 인식 및 최초 측정
매출채권과 발행 채무증권은 발행되는 시점에 최초로 인식됩니다. 다른 금융상품과 금융부채는 당사가 금융상품의 계약당사자가 되는 때에만 인식됩니다.
② 분류 및 후속측정
가. 금융자산 - 사업모형평가
당사는 사업이 관리되는 방식과 경영진에게 정보가 제공되는 방식을 가장 잘 반영하기 때문에 금융자산의 포트폴리오 수준에서 보유되는 사업모형 목적을 평가합니다.
이러한 목적을 위해 제거요건을 충족하지 않는 거래에서 제3자에게 금융자산을 이전하는 거래는 매도로 간주되지 않습니다. 단기매매의 정의를 충족하거나 포트폴리오의 성과가 공정가치 기준으로 평가되는 금융자산 포트폴리오는 당기손익-공정가치로 측정됩니다.
나. 금융자산 - 계약상 현금흐름이 원금과 이자로만 이루어져 있는지에 대한 평가
계약상 현금흐름이 원금과 이자에 대한 지급만으로 이루어져 있는지를 평가할 때, 당사는 해당 상품의 계약조건을 고려합니다. 금융자산이 계약상 현금흐름의 시기나 금액을 변경시키는 계약조건을 포함하고 있다면, 그 계약 조건 때문에 해당 금융상품의존속기간에 걸쳐 생길 수 있는 계약상 현금흐름이 원리금 지급만으로 구성되는지를 판단해야 합니다.
이를 평가할 때 당사는 다음을 고려합니다.
- 현금흐름의 금액이나 시기를 변경시키는 조건부 상황
- 변동 이자율 특성을 포함하여 계약상 액면 이자율을 조정하는 조항
- 중도상환특성과 만기연장특성
- 특정 자산으로부터 발생하는 현금흐름에 대한 당사의 청구권을 제한하는 계약조건
③ 제거
당사가 재무상태표에 인식된 자산을 이전하는 거래를 하였지만, 이전되는 자산의 소유에 따른 대부분의 위험과 보상을 보유하고 있는 경우에는 이전된 자산을 제거하지 않습니다.
④ 상계
당사는 당사가 인식한 자산과 부채에 대해 법적으로 집행가능한 상계권리를 현재 갖고 있고, 차액으로 결제하거나, 자산을 실현하는 동시에 부채를 결제할 의도가 있는 경우에만 금융자산과 금융부채를 상계하고 재무상태표에 순액으로 표시합니다.
(3) 금융자산의 손상
① 금융상품
당사는 다음 자산의 기대신용손실에 대해 손실충당금을 인식합니다.
- 상각후원가로 측정하는 금융자산
당사는 12개월 기대신용손실로 측정되는 다음의 금융자산을 제외하고는 전체기간 기대신용손실에 해당하는 금액으로 손실충당금을 측정합니다.
- 보고기간말에 신용이 위험이 낮다고 결정된 채무증권
- 최초 인식 이후 신용위험(즉, 금융자산의 기대존속기간동안에 걸쳐 발생할 채무불이행 위험)이 유의적으로 증가하지 않은 기타 채무증권과 은행예금
매출채권(리스채권 포함)과 계약자산에 대한 손실충당금은 항상 전체기간 기대신용손실에 해당하는 금액으로 측정됩니다.
기대신용손실을 측정할 때 고려하는 가장 긴 기간은 당사가 신용위험에 노출되는 최장 계약기간입니다.
② 신용이 손상된 금융자산
매 보고기간말에, 당사는 상각후원가로 측정되는 금융자산의 신용이 손상되었는지 평가합니다. 금융자산의 추정미래현금흐름에 악영향을 미치는 하나 이상의 사건이 발생한 경우에 해당 금융자산은 신용이 손상된 것입니다.
금융자산의 신용이 손상된 증거는 다음과 같은 관측 가능한 정보를 포함합니다.
- 발행자나 차입자의 유의적인 재무적 어려움
- 채무불이행이나 연체와 같은 계약 위반
- 차입자의 재무적 어려움에 관련된 경제적이나 계약상 이유로 당초 차입조건의 불가피한 완화
- 차입자의 파산가능성이 높아지거나 그 밖의 재무구조조정 가능성이 높아짐
- 재무적 어려움으로 인해 해당 금융자산에 대한 활성시장 소멸
③ 재무상태표 상 신용손실충당금의 표시
상각후원가로 측정하는 금융자산에 대한 손실충당금은 해당 자산의 장부금액에서 차감합니다.
④ 제각
금융자산의 계약상 현금흐름 전체 또는 일부의 회수에 대한 합리적인 기대가 없는 경우 해당 자산을 제거합니다. 당사는 회수에 대한 합리적인 기대가 있는지를 평가하여제각의 시기와 금액을 개별적으로 평가하고, 제각한 금액은 유의적으로 회수할 것이라는 기대를 갖지 않습니다. 그러나 제각된 금융자산은 당사의 만기가 된 금액의 회수 절차에 따라 회수활동의 대상이 될 수 있습니다.
(4) 재고자산
재고자산은 원가와 순실현가능가치 중 작은 금액으로 표시되고, 재고자산의 원가는 총평균법에 따라 결정됩니다.
(5) 유형자산
유형자산 중 토지는 감가상각을 하지 않으며, 그 외 유형자산은 자산의 취득원가에서잔존가치를 차감한 금액에 대하여 아래에 제시된 내용연수에 걸쳐 해당 자산에 내재되어 있는 미래 경제적 효익의 예상 소비 형태를 가장 잘 반영한 정액법으로 상각하고 있습니다.
토지를 제외한 자산은 최초 인식 후에 원가에서 감가상각누계액과 손상차손누계액을차감한 금액을 장부금액으로 하고 있으며, 토지는 최초 인식 후에 재평가일의 공정가치에서 이후의 손상차손누계액을 차감한 재평가금액을 장부금액으로 하고 있습니다.재평가는 보고기간 말에 자산의 장부금액이 공정가치와 중요하게 차이가 나지 않도록 주기적으로 수행하고 있습니다.
당사는 유형자산에 대하여 아래의 내용연수에 따라 정액법으로 감가상각하고 있습니다.
| 구 분 | 내 용 연 수 |
|---|---|
| 건 물 | 40년 |
| 차량운반구 | 5년 |
| 비 품 | 5년 |
| 공구와기구 | 5년 |
| 시 설 장 치 | 5년 |
(6) 정부보조금
당사는 사전에 정해진 연구활동과 관련해서만 사용해야 한다는 기본조건이 부과된 정부보조금을 수령하고 있으며, 보조금을 이연수익으로 인식하여 자산의 내용연수에걸쳐 당기손익으로 인식하고 있습니다.
당사는 정부보조금을 정부보조금으로 보전하려 하는 관련원가가 비용으로 인식되는 기간에 걸쳐 관련비용에서 차감하는 방법으로 인식하고 있습니다.
(7) 무형자산
무형자산은 최초 인식할 때 원가로 측정하며, 최초 인식 후에 원가에서 상각누계액과손상차손누계액을 차감한 금액을 장부금액으로 인식하고 있습니다.
무형자산은 사용 가능한 시점부터 잔존가치를 영("0")으로 하여 10년의 내용연수 동안 정액법으로 상각하고 있습니다. 다만, 일부 무형자산에 대해서는 이를 이용할 수 있을 것으로 기대되는 기간이 예측가능하지 않아 당해 무형자산의 내용연수가 비한정인 것으로 평가하고 상각하지 아니하고 있습니다.
| 구 분 | 내 용 연 수 |
|---|---|
| 산업재산권 | 10년 |
| 소프트웨어 | 10년 |
| 개발비, 영업권 | 비한정 |
① 연구 및 개발
연구 또는 내부프로젝트의 연구단계에 대한 지출은 발생시점에 비용으로 인식하고 있습니다. 개발단계의 지출은 자산을 완성할 수 있는 기술적 실현가능성, 자산을 완성하여 사용하거나 판매하려는 기업의 의도와 능력 및 필요한 자원의 입수가능성, 무형자산의 미래 경제적 효익을 모두 제시할 수 있고, 관련 지출을 신뢰성 있게 측정할 수 있는 경우에 무형자산으로 인식하고 있으며, 기타 개발관련 지출은 발생시점에 비용으로 인식하고 있습니다.
② 후속지출
후속지출은 관련되는 특정자산에 속하는 미래의 경제적 효익이 증가하는 경우에 한하여 자본화하며, 내부적으로 창출한 영업권 및 상표명 등을 포함한 다른 지출은 발생 즉시 비용화하고 있습니다.
(8) 비금융자산의 손상
고객과의 계약에서 생기는 수익에 따라 인식하는 계약자산과 종업원급여에서 발생한자산을 제외한 모든 비금융자산에 대해서는 매 보고기간말마다 자산손상을 시사하는징후가 있는지를 검토하며, 만약 그러한 징후가 있다면 당해자산의 회수가능액을 추정하고 있습니다. 단, 사업결합으로 취득한 영업권 및 내용연수가 비한정인 무형자 산, 아직 사용할 수 없는 무형자산에 대해서는 자산손상을 시사하는 징후와 관계없이매년 회수가능액과 장부금액을 비교하여 손상검사를 하고 있습니다.
회수가능액은 개별 자산별로, 또는 개별 자산의 회수가능액을 추정할 수 없다면 그 자산이 속하는 현금창출단위 별로 회수가능액을 추정하고 있습니다. 회수가능액은 사용가치와 순공정가치 중 큰 금액으로 결정하고 있습니다. 사용가치는 자산이나 현금창출단위에서 창출될 것으로 기대되는 미래현금흐름을 화폐의 시간가치 및 미래현금흐름을 추정할 때 조정되지 아니한 자산의 특유위험에 대한 현행 시장의 평가를 반영한 적절한 할인율로 할인하여 추정합니다.
자산이나 현금창출단위의 회수가능액이 장부금액에 미달하는 경우 자산의 장부금액을 감소시키며 즉시 당기손익으로 인식하고 있습니다.
(9) 리스
① 리스이용자
리스요소를 포함하는 계약의 개시일이나 변경유효일에 당사는 계약대가를 상대적 개별 가격에 기초하여 각 리스요소에 배분합니다.
리스부채는 리스개시일 현재 지급되지 않은 리스료의 현재가치로 최초 측정합니다. 리스료는 리스의 내재이자율로 할인하되, 내재이자율을 쉽게 산정할 수 없는 경우에는 당사의 증분차입이자율로 할인합니다. 일반적으로 당사는 증분차입이자율을 할인율로 사용합니다.
당사는 다양한 외부 재무 정보에서 얻은 이자율에서 리스의 조건과 리스 자산의 특성을 반영하기 위한 조정을 하고 증분차입이자율을 산정합니다.
당사는 재무상태표에서 투자부동산의 정의를 충족하지 않는 사용권자산을 '사용권자산'으로 표시하고 리스부채는 '리스부채'로 표시하였습니다.
당사는 리스기간이 12개월 이내인 단기리스와 소액 기초자산 리스에 대하여 사용권자산과 리스부채를 인식하지 않는 실무적 간편법을 선택하였습니다. 당사는 이러한 리스에 관련된 리스료를 리스기간에 걸쳐 정액법에 따라 비용으로 인식합니다.
(10) 비파생금융부채
당사는 계약상 내용의 실질과 금융부채의 정의에 따라 금융부채를 당기손익인식금융부채와 기타금융부채로 분류하고 계약의 당사자가 되는 때에 재무상태표에 인식하고있습니다.
(11) 종업원급여
확정급여부채는 매년 독립적인 계리사에 의해 예측단위적립방식으로 계산되고 있습니다.
(12) 전환사채
전환사채의 부채요소는 최초 인식 시 전환권이 없는 유사한 사채의 공정가치로 인식하고, 전환으로 인한 소멸 또는 만기까지 유효이자율법을 적용하여 상각후원가로 측정하고 있습니다. 자본요소는 최초 인식시 전체 전환사채의 공정가치에서 부채요소의 공정가치를 차감하여 법인세효과를 반영한 금액으로 인식하고, 이후 재측정하지 않고 있습니다. 직접거래원가는 부채요소와 자본요소의 장부금액의 비율로 안분하여계상합니다.
(13) 파생상품
파생상품은 최초 인식 시에 공정가치로 측정합니다. 최초 인식 이후에 공정가치로 측정하고 그 변동은 일반적으로 손익으로 인식합니다.
(14) 고객과의 계약에서 생기는 수익
당사는 고객과의 계약에서의 수행의무를 식별하고, 수행의무가 완료되는 시점에 (또는 완료되는 시점까지 기간에 걸쳐) 수익으로 인식하고 있습니다.
① 기술이전으로 인한 수익
기술이전으로 인한 수익은 통상계약체결시점에 수령하는 계약금, 개별 계약의 일정 조건의 일정요건 달성시점에 수령하는 마일스톤, 특허권 취득시 수령하는 로열티 등으로 구성되어 있습니다.
라이선스는 계약금 반환의무가 없고 고객에서 당사로 통제가 이전된 경우, 각 수행의무에 거래가격을 배분하여 수익으로 인식하고 있습니다. 마일스톤은 개별계약에서 규정된 일정요건이 만족되는 시점에 수익으로 인식하고 있습니다.
② CMO(Contract Manufacturing Organization)사업
회사는 주문생산방식의 바이오의약품을 생산공급하고 있습니다. 회사가 생산한 제품은 대체용도가 없으며, 수행을 완료한 부분에 대해 집행가능한 지급청구권이 있습니다. 회사는 투입된 원가에 적정한 이윤에 대한 보상을 청구할 수 있으므로, 고객과의 계약으로부터 발생하는 수익은 바이오의약품의 통제가 고객에게 이전되는 기간에 걸쳐 인식하고 있습니다.
③ 재화의 판매
회사는 상품을 온라인 플랫폼 등에 판매하고 있습니다. 상품 판매로 인한 수익은 고객에게 통제가 이전되는 시점에 인식하고 있습니다.
(15) 주식기준보상
당사는 제공받는 재화나 용역의 대가로 종업원에게 주식이나 주식선택권을 부여하는주식결제형 주식보상거래에 대하여 제공받는 재화나 용역의 공정가치 또는 제공받는재화나 용역의 공정가치를 신뢰성있게 측정할 수 없다면 부여한 지분상품의 공정가치에 기초하여 재화나 용역의 공정가치를 간접 측정하고 그 금액을 가득기간 동안에 종업원급여(당기비용)와 자본으로 인식하고 있습니다. 주식선택권의 가득조건이 용역제공조건 또는 시장조건이 아닌 가득조건인 경우에는 궁극적으로 가득되는 주식선택권의 실제 수량에 기초하여 결정되도록 인식된 종업원비용을 조정하고 있습니다.
(16) 금융수익과 비용
당사의 금융수익과 금융비용은 이자수익 및 이자비용을 포함하고 있습니다. 이자수익 혹은 이자비용은 유효이자율법을 사용하여 인식하였습니다.
(17) 미적용 제ㆍ개정 기준서
제정ㆍ공표되었으나 2024년 1월 1일 이후 시작하는 회계연도에 시행일이 도래하지 아니한 주요 제ㆍ개정 기준서 및 해석서는 다음과 같습니다. 당사는 다음의 제ㆍ개정기준서 및 해석서가 당사의 재무제표 작성시 중요한 영향을 미치지 않을 것으로 판단하여 조기적용하지 아니하였습니다.
- 교환가능성 결여 (K-IFRS 1021 환율변동효과)
- 금융상품 분류와 측정 요구사항 (K-IFRS 1107 금융상품: 공시, K-IFRS 1109 금융상품)
- 연차개선 (K-IFRS 1007 현금흐름표, K-IFRS 1101 한국채택국제회계기준의 최초채택, K-IFRS 1107 금융상품: 공시, K-IFRS 1109 금융상품)
5. 범주별 금융상품
(1) 당기말과 전기말 현재 범주별 금융자산 및 금융부채의 내역은 다음과 같습니다.
① 당기말
| (단위: 원) | |
|---|---|
| 구 분 | 상각후원가측정금융자산 |
| 현금및현금성자산 | 9,024,319,229 |
| 매출채권 | 273,097,827 |
| 기타금융자산 | 414,311,938 |
| 합 계 | 9,711,728,994 |
| (단위: 원) | |
|---|---|
| 구 분 | 상각후원가측정금융부채 |
| 매입채무 | 252,404,274 |
| 차입금 | 13,070,135,902 |
| 기타금융부채 | 6,510,200,171 |
| 리스부채 | 101,943,177 |
| 합 계 | 19,934,683,524 |
② 전기말
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 당기손익-공정가치측정 금융자산 |
상각후원가측정 금융자산 |
합 계 |
| 현금및현금성자산 | - | 13,380,773,530 | 13,380,773,530 |
| 당기손익-공정가치측정금융자산 | 2,280,350,000 | - | 2,280,350,000 |
| 상각후원가측정금융자산 | - | 1,987,436,148 | 1,987,436,148 |
| 파생상품자산 | 725,598,600 | - | 725,598,600 |
| 기타금융자산 | - | 193,358,897 | 193,358,897 |
| 합 계 | 3,005,948,600 | 15,561,568,575 | 18,567,517,175 |
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 당기손익-공정가치측정 금융부채 |
상각후원가측정 금융부채 |
합 계 |
| 차입금 | - | 6,487,230,494 | 6,487,230,494 |
| 기타금융부채 | - | 4,620,033,025 | 4,620,033,025 |
| 리스부채 | - | 10,327,452 | 10,327,452 |
| 전환사채 | - | 5,497,268,640 | 5,497,268,640 |
| 파생상품부채 | 2,298,544,000 | - | 2,298,544,000 |
| 합 계 | 2,298,544,000 | 16,614,859,611 | 18,913,403,611 |
(2) 당기와 전기 중 금융상품 범주별 순손익 구분내역은 다음과 같습니다.
① 당기
| (단위: 원) | |||||
| 구 분 | 당기손익-공정가치측정 금융자산 | 상각후원가측정 금융자산 |
당기손익-공정가치측정 금융부채 |
상각후원가측정 금융부채 |
합 계 |
| 이자수익 | 50,215,409 | 397,886,091 | - | - | 448,101,500 |
| 이자비용 | - | - | - | (471,956,786) | (471,956,786) |
| 당기손익-공정가치측정금융자산처분이익 | 39,109,647 | - | - | - | 39,109,647 |
| 당기손익-공정가치측정금융자산평가손실 | (37,550,000) | - | - | - | (37,550,000) |
| 파생상품평가이익 | - | - | 395,982,800 | - | 395,982,800 |
| 파생상품평가손실 | (725,598,600) | - | - | - | (725,598,600) |
| 사채상환이익 | - | - | - | 188,474,220 | 188,474,220 |
| 합 계 | (673,823,544) | 397,886,091 | 395,982,800 | (283,482,566) | (163,437,219) |
② 전기
| (단위: 원) | |||||
| 구 분 | 당기손익-공정가치측정 금융자산 | 상각후원가측정 금융자산 |
당기손익-공정가치측정 금융부채 |
상각후원가측정 금융부채 |
합 계 |
| 이자수익 | 189,693,492 | 443,746,046 | - | - | 633,439,538 |
| 이자비용 | - | - | - | (1,264,465,236) | (1,264,465,236) |
| 당기손익-공정가치측정금융자산평가이익 | 213,225,000 | - | - | - | 213,225,000 |
| 당기손익-공정가치측정금융자산처분이익 | 112,625,000 | - | - | - | 112,625,000 |
| 파생상품평가이익 | - | - | 1,027,246,400 | - | 1,027,246,400 |
| 파생상품평가손실 | (374,699,000) | - | - | - | (374,699,000) |
| 사채상환이익 | - | - | - | 294,286,659 | 294,286,659 |
| 합 계 | 140,844,492 | 443,746,046 | 1,027,246,400 | (970,178,577) | 641,658,361 |
(3) 공정가치 측정
당기말 현재 공정가치로 측정된 금융상품은 없으며, 전기말 현재 금융자산과 금융부채의 장부금액과 공정가치는 다음과 같습니다.
| (단위: 원) | |||||
| 구 분 | 장부금액 | 공정가치 | |||
| 수준 1 | 수준 2 | 수준 3 | 합 계 | ||
| 공정가치로 인식된 금융자산 | |||||
| 당기손익-공정가치측정 금융자산 | 2,280,350,000 | - | 2,280,350,000 | - | 2,280,350,000 |
| 파생상품자산 | 725,598,600 | - | 725,598,600 | 725,598,600 | |
| 금융자산 합계 | 3,005,948,600 | - | 2,280,350,000 | 725,598,600 | 3,005,948,600 |
| 공정가치로 인식된 금융부채 | |||||
| 파생상품부채 | 2,298,544,000 | - | - | 2,298,544,000 | 2,298,544,000 |
| 금융부채 합계 | 2,298,544,000 | - | - | 2,298,544,000 | 2,298,544,000 |
당사는 장부금액이 공정가치의 합리적인 근사치라고 판단되는 상각후원가로 인식된 금융상품에 대해서는 공정가치를 공시하지 않았습니다.
공정가치로 측정되거나 공정가치가 공시되는 항목은 공정가치 서열체계에 따라 구분하며, 정의된 수준들은 다음과 같습니다.
- 동일한 자산이나 부채에 대한 활성시장의 (조정되지 않은) 공시가격(수준 1)
- 직접적으로(예: 가격) 또는 간접적으로(예: 가격에서 도출되어) 관측가능한, 자산이나 부채에 대한 투입변수를 이용하여 산정한 공정가치. 단 수준 1에 포함된 공시가격은 제외함(수준 2)
- 관측가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입변수(관측가능하지 않은 투입변수)를 이용하여 산정한 공정가치 (수준 3)
③ 수준 3 공정가치
수준 3 공정가치의 기중 변동내역은 다음과 같습니다.
- 자산
| (단위:원) | ||
|---|---|---|
| 구분 | 당기 | 전기 |
| 기초잔액 | 725,598,600 | 1,100,297,600 |
| 공정가치의 변동 | (725,598,600) | (374,699,000) |
| 기말잔액 | - | 725,598,600 |
- 부채
| (단위:원) | ||
|---|---|---|
| 구분 | 당기 | 전기 |
| 기초잔액 | 2,298,544,000 | 7,381,576,000 |
| 풋옵션 행사 | (1,902,561,200) | (4,055,785,600) |
| 공정가치의 변동 | (395,982,800) |
(1,027,246,400) |
| 기말잔액 | - | 2,298,544,000 |
당기와 전기 중 공정가치 서열체계의 각 수준간 이동은 없습니다.
6. 금융위험관리
(1) 신용위험
금융자산의 장부금액은 신용위험에 대한 최대 노출정도를 나타내고 있습니다. 당사는 현금및현금성자산 및 단기금융상품을 신용등급이 우수한 금융기관에 예치하고 있어, 금융기관으로부터의 신용위험은 제한적입니다. 당기말과 전기말 현재 당사의 신용위험에 대한 최대 노출정도는 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 계정과목 | 당기말 | 전기말 |
| 현금및현금성자산 | 9,024,319,229 | 13,380,773,530 |
| 매출채권 | 273,097,827 | - |
| 계약자산 | - | - |
| 당기손익-공정가치측정금융자산 | - | 2,280,350,000 |
| 상각후원가측정금융자산 | - | 1,987,436,148 |
| 파생상품자산 | - | 725,598,600 |
| 기타금융자산 | 414,311,938 | 193,358,897 |
| 합계 | 9,711,728,994 | 18,567,517,175 |
(2) 유동성위험
당기말과 전기말 현재 당사가 보유한 금융부채의 계약상 만기는 다음과 같습니다.
① 당기말
| (단위:원) | ||||
|---|---|---|---|---|
| 계정과목 | 장부금액 | 계약상 현금흐름 | 1년 이하 | 1년에서 2년 이하 |
| 매입채무 | 252,404,274 | 252,404,274 | 252,404,274 | - |
| 차입금 | 13,070,135,902 | 14,871,403,172 | 1,143,636,891 | 13,727,766,280 |
| 기타금융부채 | 6,510,200,171 | 6,510,200,171 | 4,122,493,749 | 2,387,706,422 |
| 리스부채 | 101,943,177 | 110,000,000 | 60,000,000 | 50,000,000 |
| 합계 | 19,934,683,524 | 21,744,007,617 | 5,578,534,914 | 16,165,472,702 |
② 전기말
| (단위:원) | ||||
|---|---|---|---|---|
| 계정과목 | 장부금액 | 계약상 현금흐름 | 1년 이하 | 1년에서 3년 이하 |
| 차입금 | 6,487,230,494 | 6,487,230,494 | - | 6,487,230,494 |
| 기타금융부채 | 4,620,033,025 | 4,620,033,025 | 2,258,985,203 | 2,361,047,822 |
| 리스부채 | 10,327,452 | 10,800,000 | 10,800,000 | - |
| 전환사채 | 5,497,268,640 | 7,600,000,000 | 7,600,000,000 | - |
| 파생상품부채 | 2,298,544,000 | 2,298,544,000 | 2,298,544,000 | - |
| 합계 | 18,913,403,611 | 21,016,607,519 | 12,168,329,203 | 8,848,278,316 |
당기말과 전기말 현재 유동성위험과 관련된 금액은 이자지급액을 포함하고, 상계약정의 효과는 포함하지 않았습니다. 당사는 이 현금흐름이 유의적으로 더 이른 기간에발생하거나, 유의적으로 다른 금액일 것으로 기대하지 않습니다.
(3) 자본위험관리
당사의 자본관리는 건전한 자본구조의 유지를 통한 주주이익의 극대화를 목적으로 하고 있으며, 최적 자본구조 달성을 위해 부채비율 등의 재무비율을 매월 모니터링하여 필요할 경우 적절한 재무구조 개선방안을 실행하고 있습니다.
당기말과 전기말 현재 당사의 부채비율은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당기말 | 전기말 |
| 부채 (A) | 24,883,365,624 | 23,426,981,106 |
| 자본 (B) | 51,273,346,812 | 40,495,260,881 |
| 부채비율 (= A/B) | 48.53% | 57.85% |
7. 현금및현금성자산
(1) 당기말과 전기말 현재 현금및현금성자산의 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 보통예금 | 9,024,319,229 | 1,983,073,528 |
| 전자단기사채 등 | - | 11,397,700,002 |
| 합계 | 9,024,319,229 | 13,380,773,530 |
(2) 당기말과 전기말 현재 사용이 제한된 금융상품의 내용은 다음과 같습니다.
| (단위:원) | |||
|---|---|---|---|
| 구 분 | 당기말 | 전기말 | 비고 |
| 현금및현금성자산 | 7,292,391 | 345,023,021 | 정부보조금, 신탁예금 |
8. 당기손익-공정가치측정금융자산
(1) 당기말과 전기말 현재 당기손익-공정가치측정금융자산의 내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 영구채 | - | - | - | 2,280,350,000 |
(2) 당기와 전기 중 당기손익-공정가치측정금융자산의 변동은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당기 | 전기 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 기초 | - | 2,280,350,000 | 2,387,375,000 | 2,067,125,000 |
| 평가 | - | (37,550,000) | - | 213,225,000 |
| 처분 | - | (2,242,800,000) | (2,387,375,000) | - |
| 기말 | - | - | - | 2,280,350,000 |
9. 상각후원가측정금융자산
(1) 당기말과 전기말 현재 상각후원가측정금융자산의 내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 회사채 | - | - | 1,987,436,148 | - |
(2) 당기와 전기 중 상각후원가측정금융자산의 변동은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당기 | 전기 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 기초 | 1,987,436,148 | - | 8,003,112,155 | 1,992,054,275 |
| 상각 | (1,339,148) | - | (5,438,857) | (2,291,425) |
| 처분 | (1,986,097,000) | - | (8,000,000,000) | - |
| 유동성대체 | - | - | 1,989,762,850 | (1,989,762,850) |
| 기말 | - | - | 1,987,436,148 | - |
10. 매출채권 및 계약자산
(1) 당기말과 전기말 현재 매출채권과 계약자산의 내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 매출채권 | 332,127,827 | - |
| 대손충당금 | (59,030,000) | - |
| 계약자산 | 194,700,000 | - |
| 대손충당금 | (194,700,000) | - |
(2) 당기와 전기 중 매출채권의 손실충당금 변동내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초 | - | - |
| 대손상각비 | 269,099,916 | - |
| 제각 | (15,369,916) | - |
| 기말 | 253,730,000 | - |
11. 파생상품자산 및 파생상품부채
(1) 당기말과 전기말 현재 파생상품자산ㆍ부채의 내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 파생상품자산 | - | 725,598,600 |
| 파생상품부채 | - | 2,298,544,000 |
당사는 전환사채 투자자가 보유한 조기상환청구권(Put option)을 파생상품부채로 회계처리하였고, 전환사채 발행자가 보유한 매도청구권(Call option)을 파생상품자산으로 회계처리하였습니다.
(2) 당기와 전기 중 파생상품자산ㆍ부채의 변동내역은 다음과 같습니다.
① 파생상품자산
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초(*1) | 725,598,600 | 1,100,297,600 |
| 공정가치의 변동 | - | (374,699,000) |
| 소멸(*2) | (725,598,600) | - |
| 기말 | - | 725,598,600 |
② 파생상품부채
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초(*1) | 2,298,544,000 | 7,381,576,000 |
| 풋옵션 행사 | (1,902,561,200) | (4,055,785,600) |
| 공정가치의 변동 | (395,982,800) | (1,027,246,400) |
| 기말 | - | 2,298,544,000 |
(*1) 당사가 발행한 전환사채는 콜옵션 권리행사자를 제3자로 지정하여 다른 금융상품(전환사채 및 풋옵션)과 독립적으로 해당 콜옵션을 양도할 수 있는 경우에 해당하여 그 콜옵션은 내재파생상품이 아니라 별도의 금융상품으로 처리해야 하므로 콜옵션, 풋옵션에 대해 각각 파생상품자산, 파생상품부채로 인식하고 과거 누적 금액 효과를 전기 초 자본에 반영하였습니다.
(*2) 콜옵션은 당기 중 행사기간 만료에 따라 소멸되었으며 파생상품평가손실로 처리되었습니다.
12. 재고자산
당기말과 전기말 현재 재고자산의 내역은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기말 | 전기말 |
| 상품 | 597,141,536 | - |
| 재고자산평가충당금 | (34,467,772) | - |
| 합 계 | 562,673,764 | - |
당기의 재고자산평가손실 34,468천원은 매출원가에 가산하였습니다.
13. 기타금융자산
당기말과 전기말 현재 기타금융자산의 내역은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 단기대여금 | 293,942,984 | - | 87,969,625 | - |
| 미수금 | 371,189 | - | 1,552,302 | - |
| 미수수익 | 435,265 | - | 14,664,470 | - |
| 보증금 | 45,000,000 | 70,962,500 | 45,000,000 | 20,962,500 |
| 종업원대여금 | - | 3,600,000 | - | 23,210,000 |
| 합 계 | 339,749,438 | 74,562,500 | 149,186,397 | 44,172,500 |
14. 기타자산
당기말과 전기말 현재 기타자산의 내역은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 선급금 | 109,939,143 | 407,439,578 | 8,640,762 | 215,572,230 |
| 선급비용 | 74,696,438 | - | 102,627,304 | - |
| 부가세대급금 | 1,002,683,593 | - | 411,384,805 | - |
| 합 계 | 1,187,319,174 | 407,439,578 | 522,652,871 | 215,572,230 |
15. 사용권자산
(1) 당기말과 전기말 현재 당사의 사용권자산의 구성내역은 다음과 같습니다.
| (단위:원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||||
| 취득원가 | 감가상각누계액 | 장부금액 | 취득원가 | 감가상각누계액 | 장부금액 | |
| 건물 | 110,505,273 | (8,840,422) | 101,664,851 | 36,934,516 | (27,700,884) | 9,233,632 |
(2) 당기와 전기 중 사용권자산의 변동은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초 | 9,233,632 | 48,911,165 |
| 취득 | 239,958,784 | - |
| 리스변경 | 27,136,000 | - |
| 상각 | (94,126,895) | (33,256,542) |
| 해지 | (80,536,670) | (6,420,991) |
| 기말 | 101,664,851 | 9,233,632 |
(3) 당기와 전기 중 손익으로 인식된 금액은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 사용권자산 감가상각비 | 94,126,895 | 33,256,542 |
| 리스부채 이자비용 | 6,640,771 | 4,069,206 |
| 단기리스에서 발생한 비용 | 129,367,060 | 114,741,450 |
| 소액리스에서 발생한 비용 | 12,505,822 | 13,303,452 |
| 합 계 | 242,640,548 | 165,370,650 |
16. 유형자산
(1) 당기말과 전기말 현재 당사의 유형자산의 구성내역은 다음과 같습니다.
| (단위:원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||||||
| 취득원가 | 재평가 | 감가상각누계액 | 장부금액 | 취득원가 | 재평가 | 감가상각누계액 | 장부금액 | |
| 토지 | 8,245,771,818 | 15,138,152,582 | - | 23,383,924,400 | 8,245,771,818 | 15,138,152,582 | - | 23,383,924,400 |
| 건물 | 5,377,326,827 | - | (684,013,266) | 4,693,313,561 | 5,377,326,827 | - | (538,680,681) | 4,838,646,146 |
| 차량운반구 | 124,565,192 | - | (124,563,192) | 2,000 | 124,565,192 | - | (107,879,681) | 16,685,511 |
| 공구와기구 | 6,965,229,282 | - | (5,146,789,006) | 1,818,440,276 | 6,889,829,282 | - | (3,847,519,363) | 3,042,309,919 |
| 정부보조금 (공구와기구) |
(479,190,255) | - | 307,907,949 | (171,282,306) | (479,190,255) | - | 234,679,232 | (244,511,023) |
| 비품 | 539,905,545 | - | (413,118,552) | 126,786,993 | 519,619,824 | - | (314,215,724) | 205,404,100 |
| 정부보조금 (비품) |
(7,440,000) | - | 2,728,000 | (4,712,000) | (7,440,000) | - | 1,240,000 | (6,200,000) |
| 시설장치 | 5,923,411,230 | - | (4,654,582,087) | 1,268,829,143 | 5,757,611,230 | - | (3,504,111,964) | 2,253,499,266 |
| 건설중인자산(*) | 13,513,435,811 | - | - | 13,513,435,811 | 6,848,904,252 | - | - | 6,848,904,252 |
| 합 계 | 40,203,015,450 | 15,138,152,582 | (10,712,430,154) | 44,628,737,878 | 33,276,998,170 | 15,138,152,582 | (8,076,488,181) | 40,338,662,571 |
(*) 해당 건설중인자산은 마곡 신사옥 건설을 위해 PF 자금을 투입한 항목으로 이후 건물(유형자산)로 본계정 대체될 예정입니다.
(2) 당기와 전기 중 유형자산의 변동내역은 다음과 같습니다.
① 당기
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 기말 |
| 토지 | 23,383,924,400 | - | - | 23,383,924,400 |
| 건물 | 4,838,646,146 | - | (145,332,585) | 4,693,313,561 |
| 차량운반구 | 16,685,511 | - | (16,683,511) | 2,000 |
| 공구와기구 | 3,042,309,919 | 75,400,000 | (1,299,269,643) | 1,818,440,276 |
| 정부보조금(공구와기구) | (244,511,023) | - | 73,228,717 | (171,282,306) |
| 비품 | 205,404,100 | 20,285,721 | (98,902,828) | 126,786,993 |
| 정부보조금(비품) | (6,200,000) | - | 1,488,000 | (4,712,000) |
| 시설장치 | 2,253,499,266 | 165,800,000 | (1,150,470,123) | 1,268,829,143 |
| 건설중인자산(*) | 6,848,904,252 | 6,664,531,559 | - | 13,513,435,811 |
| 합 계 | 40,338,662,571 | 6,926,017,280 | (2,635,941,973) | 44,628,737,878 |
(*) 신규 사옥의 건설과 관련하여 발생한 차입원가 1,275,310천원이 포함되어 있습니다.
② 전기
| (단위:원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 재평가 | 기말 |
| 토지 | 7,713,916,893 | 531,854,925 | - | 15,138,152,582 | 23,383,924,400 |
| 건물 | 4,973,079,317 | - | (134,433,171) | - | 4,838,646,146 |
| 차량운반구 | 34,886,796 | - | (18,201,285) | - | 16,685,511 |
| 공구와기구 | 4,043,653,130 | 287,845,000 | (1,289,188,211) | - | 3,042,309,919 |
| 정부보조금(공구와기구) | (283,933,478) | (35,625,255) | 75,047,710 | - | (244,511,023) |
| 비품 | 298,409,418 | 8,670,000 | (101,675,318) | - | 205,404,100 |
| 정부보조금(비품) | - | (7,440,000) | 1,240,000 | - | (6,200,000) |
| 시설장치 | 3,400,976,057 | - | (1,147,476,791) | - | 2,253,499,266 |
| 건설중인자산(*) | 435,291,000 | 6,413,613,252 | - | - | 6,848,904,252 |
| 합 계 | 20,616,279,133 | 7,198,917,922 | (2,614,687,066) | 15,138,152,582 | 40,338,662,571 |
(*) 신규 사옥의 건설과 관련하여 발생한 차입원가 284,589천원이 포함되어 있습니다.
(3) 유형자산 재평가
당사는 독립적인 전문평가인의 감정평가결과를 근거로 2023년 12월 31일 기준으로 토지를 재평가하였습니다.
대상 토지와 인근지역에 있는 유사한 이용가치를 지닌 표준지의 공시지가를 기준으로 공시기준일로부터 기준시점 현재까지의 지가변동률, 생산자물가상승률, 당해 토지의 위치, 형상, 환경, 이용상황, 기타 가치형성요인 등을 종합적으로 고려하여 공시지가기준법으로 평가하였습니다.
당기말 현재 재평가에 따른 토지의 장부금액과 원가모형으로 평가되었을 경우의 장부금액은 다음과 같습니다.
| (단위: 원) | ||
| 구 분 | 재평가모형 | 원가모형 |
| 토지 | 23,383,924,400 | 8,245,771,818 |
17. 무형자산
(1) 당기말과 전기말 현재 당사의 무형자산의 구성내역은 다음과 같습니다.
| (단위:원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||||
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 산업재산권 | 152,194,600 | (151,760,095) | 434,505 | 152,194,600 | (149,040,635) | 3,153,965 |
| 소프트웨어 | 212,161,818 | (33,592,287) | 178,569,531 | 212,161,818 | (12,376,105) | 199,785,713 |
| 정부보조금(소프트웨어) | (204,980,000) | 32,455,166 | (172,524,834) | (204,980,000) | 11,957,166 | (193,022,834) |
| 영업권(*) | 887,317,094 | - | 887,317,094 | - | - | - |
| 개발비 | 18,530,496,262 | - | 18,530,496,262 | 4,150,304,484 | - | 4,150,304,484 |
| 합 계 | 19,577,189,774 | (152,897,216) | 19,424,292,558 | 4,309,680,902 | (149,459,574) | 4,160,221,328 |
(*) 당기 사업결합에 의하여 신규 취득하였습니다.
(2) 당기와 전기 중 무형자산의 변동내역은 다음과 같습니다.
① 당기
| (단위:원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 사업결합 | 기말 |
| 산업재산권 | 3,153,965 | - | (2,719,460) | - | 434,505 |
| 소프트웨어 | 199,785,713 | - | (21,216,182) | - | 178,569,531 |
| 정부보조금(소프트웨어) | (193,022,834) | - | 20,498,000 | - | (172,524,834) |
| 영업권 | - | - | - | 887,317,094 | 887,317,094 |
| 개발비 | 4,150,304,484 | 14,380,191,778 | - | - | 18,530,496,262 |
| 합 계 | 4,160,221,328 | 14,380,191,778 | (3,437,642) | 887,317,094 | 19,424,292,558 |
② 전기
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 기말 |
| 산업재산권 | 18,373,425 | - | (15,219,460) | 3,153,965 |
| 소프트웨어 | - | 212,161,818 | (12,376,105) | 199,785,713 |
| 정부보조금(소프트웨어) | - | (204,980,000) | 11,957,166 | (193,022,834) |
| 개발비 | - | 4,150,304,484 | - | 4,150,304,484 |
| 합 계 | 18,373,425 | 4,157,486,302 | (15,638,399) | 4,160,221,328 |
(3) 당기말 현재 당사가 연구개발비를 자산화한 금액의 상세는 다음과 같습니다.
| (단위:원) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 단 계 | 구 분 | 개별자산명 | 자산화한 연구개발비 금액(누계) | 연구개발비 | 잔여상각 기간(*2) |
||||||
| 전임상 | 임상1상 | 임상2상 | 임상3상 | 판매승인 | 계 | 손상차손누계액 | 장부금액 | ||||
| 개발중 | 신약 | AdCLD-CoV19-1 OMI(*1) | - | - | - | 18,530,496,262 | - | 18,530,496,262 | - | 18,530,496,262 | - |
(*1) AdCLD-CoV19-1 OMI는 백신 개발 프로젝트이며, 현재 임상 3단계로 2025년 허가를 목표로 하고 있습니다.
(*2) 상각요건을 충족하지 않아 미상각하고 있습니다.
당사는 개발활동이 임상 3상 개시 승인을 득한 이후부터 발생한 연구개발비 지출을 자산화하고 있습니다.
(4) 영업권 손상검토
당사는 영업권 무형자산의 손상검토를 위하여 회수가능액을 추정하였습니다. 회수가능액의 계산에 사용된 주요 가정은 미래 경향에 대한 경영진의 평가를 반영하고 있으며, 이는 외부정보와 내부정보(과거 역사적 정보)를 고려하여 결정하였습니다. 손상검토시 사용된 주요 가정치로 당기 적용한 할인율은 13.49%이며, 향후 발생할 것으로 예상되는 현금흐름에 대해서 연 1%의 성장률이 지속될 것이라 가정하였습니다. 영업권 손상검토 결과, 장부금액이 회수가능액을 초과하지 않아 손상차손을 인식하지 않았습니다.
18. 매입채무 및 기타금융부채
당기말과 전기말 현재 매입채무 및 기타금융부채의 내역은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 매입채무 | 252,404,274 | - | - | - |
| 미지급금 | 4,074,185,361 | 2,387,706,422 | 2,251,688,794 | 2,361,047,822 |
| 미지급비용 | 48,308,388 | - | 7,296,409 | - |
| 합 계 | 4,374,898,023 | 2,387,706,422 | 2,258,985,203 | 2,361,047,822 |
19. 차입금
당기말과 전기말 현재 장기차입금의 내역은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 차입처 | 이자율(%) | 당기말(*) | 전기말 |
| 담보부차입거래 | 마곡컨소시엄제일차 | 8~11 | 13,070,135,902 | 6,487,230,494 |
(*) 당기말 현재 실행잔액이며 약정한도는 32,560,000천원(총한도금액 148,000,000천원의 당사지분율 22%)입니다. 또한 해당차입금에 대하여 채무보증 및 부동산 담보를 제공하였으며 해당 약정사항은 주석 36번에서 설명하고 있습니다.
20. 리스부채
(1) 당기말과 전기말 현재 리스부채의 내역은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 당기말 | 전기말 | ||
| 리스료 | 리스료의 현재가치 | 리스료 | 리스료의 현재가치 | |
| 1년 이내 | 60,000,000 | 53,736,123 | 10,800,000 | 10,327,452 |
| 1년 초과 | 50,000,000 | 48,207,054 | - | - |
| 합 계 | 110,000,000 | 101,943,177 | 10,800,000 | 10,327,452 |
(2) 당기와 전기 중 리스부채의 변동내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초 | 10,327,452 | 52,308,361 |
| 인식 | 239,958,784 | - |
| 리스변경 | 27,136,000 | - |
| 지급 | (96,606,452) | (38,700,000) |
| 해지 | (85,513,378) | (7,350,115) |
| 이자비용 | 6,640,771 | 4,069,206 |
| 기말 | 101,943,177 | 10,327,452 |
(3) 당기와 전기에 발생한 리스의 총 현금유출은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 리스의 총 현금유출 | 238,479,334 | 166,744,902 |
당사의 리스계약은 임대인이 갱신하지 않겠다는 의사를 갖고 있다면 그 즉시 리스계약이 종료될 수 있다는 점에서 계약서 상의 표면적 임차기간을 리스기간으로 적용하였습니다. 당사가 통제 가능한 범위에 있는 유의적인 사건이 일어나거나 상황에 유의적인 변화가 있을 때 연장선택권을 행사할 것이 상당히 확실한지 다시 평가합니다.
21. 기타유동부채
당기말과 전기말 현재 당사의 기타유동부채의 내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 선수금 | 826,200 | - |
| 예수금 | 40,756,676 | 64,813,486 |
| 종업원급여(*) | 140,193,435 | 194,902,851 |
| 부가세예수금 | 332,308,505 | - |
| 합 계 | 514,084,816 | 259,716,337 |
(*) 종업원급여 관련 기타부채는 발생된 연차휴가 등을 포함하고 있습니다.
22. 순확정급여부채
(1) 당기말과 전기말 현재 재무상태표에 인식된 순확정급여부채 금액의 산정내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 기금이 적립되지 않은 확정급여채무의 현재가치 | 1,270,723,394 | 1,089,987,268 |
(2) 당기와 전기 중 현재 확정급여채무 현재가치의 변동내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초장부금액 | 1,089,987,268 | 781,330,794 |
| 당기근무원가 | 398,260,808 | 393,641,811 |
| 이자비용 | 27,494,378 | 22,613,892 |
| 재측정요소: | ||
| - 인구통계적가정의 변동으로 의한 보험수리적손익 | (5,343,377) | - |
| - 재무적가정의 변동으로 인한 보험수리적손익 | 48,211,042 | 52,822,580 |
| - 가정과 실제의 차이에 의한 보험수리적손익 | 23,747,926 | (4,315,389) |
| 제도에서의 지급액: | ||
| - 급여의 지급 | (311,634,651) | (156,106,420) |
| 기말장부금액 | 1,270,723,394 | 1,089,987,268 |
(3) 당기말과 전기말 현재 확정급여채무의 평가에 사용된 주요 보험수리적 가정은 다음과 같습니다.
| 구 분 | 당기말 | 전기말 |
|---|---|---|
| 할인율 | 3.93% | 4.52% |
| 미래임금상승률 | 5.80% | 5.80% |
당사는 확정급여채무의 현재가치계산을 위하여 당기말 현재 확정급여채무의 통화 및예상지급시기와 일관성이 있는 우량회사채의 시장수익률을 참조하여 할인율을 결정하였습니다.
당기말과 전기말 현재 확정급여채무의 가중평균 듀레이션은 각각 11.77년과 11.69년입니다.
(4) 당기말 현재 주요 보험수리적 가정에 대한 확정급여채무의 민감도 분석 결과는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 1% 상승시 | 1% 하락시 |
| 할인율 | (75,224,346) | 90,628,299 |
| 미래임금상승률 | 88,055,246 | (74,721,768) |
확정급여채무의 증가(감소)는 당기말 현재 확정급여채무의 현재가치를 기준으로 산출되었습니다. 민감도분석은 제도에서 발생할 것으로 기대되는 모든 현금흐름의 분산을 고려하지는 않았으나, 사용된 가정에 대한 민감도의 근사치를 제공하고 있습니다.
23. 전환사채
(1) 당기와 전기 중 전환사채의 변동내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 기초(*) | 5,497,268,640 | 11,875,373,669 |
| 상각 | 388,644,380 | 1,260,396,030 |
| 상환 | (5,885,913,020) | (7,638,501,059) |
| 기말 | - | 5,497,268,640 |
(*) 당사가 2021년에 발행한 전환사채는 콜옵션 권리행사자를 제3자로 지정하여 다른 금융상품(전환사채 및 풋옵션)과 독립적으로 해당 콜옵션을 양도할 수 있는 경우에 해당하여 그 콜옵션은 내재파생상품이 아니라 별도의 금융상품으로 처리해야 하므로 콜옵션, 풋옵션에 대해 파생상품자산, 파생상품부채로 인식하였습니다.
(2) 당기 중 상환된 현재 전환사채의 내용은 다음과 같습니다.
| 구 분 | 내역 | |
| 사채의 종류 | 제2회 무기명식 무보증 사모 전환사채 | |
| 액면가액(단위: 천원) | 19,000,000 | |
|
발행가액 (단위: 천원)(*) |
- | |
| 이자지급조건 | 없음 | |
| 연이자율 | 0.0% | |
| 보장수익률 | 0.0% | |
| 발행일 | 2021년 3월 19일 | |
| 상환일 | 2026년 3월 19일 | |
| 전환청구기간 | 시작일 | 2022년 3월 19일 |
| 종료일 | 2026년 2월 19일 | |
| 전환에 따라 발행할 주식 |
종류 | 주식회사 셀리드 기명식 보통주식 |
| 전환가액(원/주) | 4,515 | |
| 주식수 | 1,683,277주 | |
| 전환비율(%) | 100 | |
| 전환가액의 조정조건 | 1. 본건 전환사채의 전환가액을 하회하는 발행가액, 전환가액 또는 행사가액으로 유상증자 또는 그에 준하는 주식연계증권(전환사채, 신주인수권부 사채 포함)의 발행, 신주인수권 등의 부여 등 주식을 인수할 권리를 표창하는 일체의 주식연계증권 등을 발행하는 경우 기타 이와 유사한 상황이 발생하는 경우로서 본건 주식의 지분율이 희석될 수 있는 요인이 발생한 경우 | |
| 2. 발행회사의 주식이 더 많은 수의 주식으로 분할된 경우 또는 주식배당이 이루어진 경우, 발행회사의 주식이 더 적은 수의 주식으로 병합된 경우 | ||
| 3. 발행회사의 주식이 자본조정, 재분류 기타 사유(제2항에 규정된 주식의 분할 또는 병합은 제외)로 인하여 그 조건 및/또는 수량이 변경되는 경우 | ||
| 4. 발행회사의 합병, 분할, 분할합병, 포괄적 주식교환, 포괄적 주식이전 및 자본의 감소(통칭하여 "합병 등")가 이루어지는 경우 | ||
| 5. 감자 및 주식 병합 등 주식가치 상승사유가 발생하는 경우 | ||
| 6. 본건 전환사채 발행일로부터 3개월이 되는 날부터 매 3개월마다 전환가액을 조정하되, 전환가액 조정일 전일을 기산일로 하여 기산일부터 소급하여 산정한 산술평균 가액이 직전의 전환가액을 하회할 경우 | ||
| 중도상환 청구권 [call option] |
발행회사 또는 발행회사가 지정하는 자는 사채발행일로부터 1년째 되는 날인 2022년 3월 19일부터 2024년 3월 19일까지 매 3개월이 되는 날에, 인수인이 본 계약에 따라 인수한 본 사채의 20% 범위 내(액면가액 3,800,000천원)에서 매수인에게 매도하여 줄 것을 청구할 수 있으며, 인수인은 이 청구에 따라 보유하고 있는 본 사채를 매수인에게 매도하여야 한다. | |
| 조기상환 청구권 [put option] |
사채발행일로부터 2년째 되는 날인 2023년 3월 19일 및 그로부터 매 3개월이 되는 날에 발행회사에게 사채권자가 보유한 사채의 전부 또는 일부에 대하여 조기상환일 60일 전부터 30일 전까지 조기상환을 청구할 수 있다. | |
(*) 보고기간종료일 현재 전환사채는 전액 상환되었습니다.
(3) 당기말과 전기말 현재 전환사채의 부채요소 및 자본요소의 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 부채요소 | - | 5,497,268,640 |
| 자본요소(전환권대가) | - | 3,455,881,120 |
24. 자본금과 자본잉여금
(1) 당기말 현재 당사의 발행할 주식의 총수, 발행한 주식의 수 및 1주당 금액은 각각 100,000,000주와 21,102,977주 및 500원입니다.
(2) 당기와 전기 중 발행주식수, 자본금 및 자본잉여금의 변동내역은 다음과 같습니다.
| (단위:원) | ||||
| 구 분 | 발행주식수(주) | 자본금 | 자본잉여금 | 합 계 |
| 2023.01.01(전기초) | 9,731,192 | 4,865,596,000 | 49,257,173,213 | 54,122,769,213 |
| 유상증자 | 3,871,785 | 1,935,892,500 | 15,263,334,429 | 17,199,226,929 |
| 2023.12.31(전기말) | 13,602,977 | 6,801,488,500 | 64,520,507,642 | 71,321,996,142 |
| 2024.01.01(당기초) | 13,602,977 | 6,801,488,500 | 64,520,507,642 | 71,321,996,142 |
| 유상증자 | 7,500,000 | 3,750,000,000 | 18,925,282,523 | 22,675,282,523 |
| 2024.12.31(당기말) | 21,102,977 | 10,551,488,500 | 83,445,790,165 | 93,997,278,665 |
25. 기타자본항목 및 결손금
(1) 당기말과 전기말 현재 기타자본항목의 세부내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 주식선택권 | 1,613,491,466 | 1,255,273,069 |
| 전환권대가 | - | 3,455,881,120 |
| 전환권대가소멸이익 | 8,639,702,800 | 5,183,821,680 |
| 합계 | 10,253,194,266 | 9,894,975,869 |
(2) 당기말과 전기말 현재 결손금의 세부내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 미처리결손금 | (65,021,653,650) | (52,695,989,822) |
(3) 당기와 전기 당사의 결손금처리계산서는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당기 (처리예정일:2025년 3월 26일) |
전기 (처리확정일: 2024년 3월 28일) |
||
| I. 미처리결손금 | (65,021,653,650) | (52,695,989,822) | ||
| 전기이월미처리결손금 | (52,695,989,822) | (41,036,047,248) | ||
| 당기순손실 | (12,259,048,237) | (11,611,435,383) | ||
| 순확정급여부채의 재측정요소 | (66,615,591) | (48,507,191) | ||
| II. 결손금처리액 | - | - | ||
| III. 차기이월미처리결손금 (I - II) | (65,021,653,650) | (52,695,989,822) | ||
26. 기타포괄손익누계액
당기말과 전기말 현재 기타포괄손익의 세부내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당기말 | 전기말 |
| 재평가잉여금 | 11,974,278,692 | 11,974,278,692 |
27. 정부보조금
당기말 현재 당사가 주관연구기관으로 선정된 과제에 대한 정부보조금 중 기술료 등으로 향후 납부해야 할 것으로 예상되는 금액은 (장기)미지급금의 계정과목으로 기타금융부채로 계상하고 있습니다.
(1) 당기 및 전기 중 정부로부터 보조받은 금액 중 상환의무가 있는 보조금의 변동내역은 다음과 같습니다.
① 당기
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 수령 | 기타 | 기말 |
| (임상 2상) 항원제시세포를 기반으로 한 자궁경부암 항암면역치료백신의 임상 2상 개발 | 299,300,000 | - | - | 299,300,000 |
| 아데노바이러스 벡터에 기반한 1세대 및 2세대 코비드-19 예방백신 개발 | 370,000,000 | - | - | 370,000,000 |
| (임상1/2a상)아데노바이러스 벡터를 기반으로 한 코로나 19 예방백신의 임상 1/2a상 개발 | 632,250,000 | - | - | 632,250,000 |
| (임상 2b/3상) 아데노바이러스 벡터를 기반으로 한 코로나19 예방백신의 임상 2b/3상 개발 | 153,617,122 | - | - | 153,617,122 |
| 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이 대응백신의 임상 1/2상 개발 | 830,880,700 | - | - | 830,880,700 |
| 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이에 대한 다가 백신 개발 | 75,000,000 | 26,658,600 | - | 101,658,600 |
| 합 계 | 2,361,047,822 | 26,658,600 | - | 2,387,706,422 |
② 전기
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 수령 | 기타 | 기말 |
| (임상 2상) 항원제시세포를 기반으로 한 자궁경부암 항암면역치료백신의 임상 2상 개발 | 299,300,000 | - | - | 299,300,000 |
| 아데노바이러스 벡터에 기반한 1세대 및 2세대 코비드-19 예방백신 개발 | 370,000,000 | - | - | 370,000,000 |
| (임상1/2a상)아데노바이러스 벡터를 기반으로 한 코로나 19 예방백신의 임상 1/2a상 개발 | 632,250,000 | - | - | 632,250,000 |
| (임상 2b/3상) 아데노바이러스 벡터를 기반으로 한 코로나19 예방백신의 임상 2b/3상 개발 | 254,319,631 | 6,881,945 | (107,584,454) | 153,617,122 |
| 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이 대응백신의 임상 1/2상 개발 | 855,845,124 | 573,592,080 | (598,556,504) | 830,880,700 |
| 아데노바이러스 벡터 플랫폼 기반 COVID-19 변이에 대한 다가 백신 개발 | - | 165,195,080 | (90,195,080) | 75,000,000 |
| 합 계 | 2,411,714,755 | 745,669,105 | (796,336,038) | 2,361,047,822 |
28. 주식기준보상
(1) 당사는 주주총회 결의에 의거해서 당사의 임직원에게 주식선택권을 부여했으며, 그 주요 내용은 다음과 같습니다.
- 주식선택권으로 발행한 주식의 종류 : 기명식 보통주식
- 부여방법 : 보통주 신주발행 또는 자기주식 교부
- 가득조건 : 부여일 이후 2년 또는 3년이상 당사의 임직원으로 재직한 자
- 행사기간 : 선택권부여일에서 3년이 경과한 날로부터 5년내 또는 선택권 부여일에서 2년이 경과한 날로부터 5년 (단, 선택권 부여일로부터 3년이 경과한 후 퇴직하는 경우에는 퇴직일로부터 1년 이내)
(2) 주식매수선택권의 수량과 가중평균행사가격의 변동은 다음과 같습니다.
| 구 분 | 주식매수선택권 수량 | 가중평균행사가격 | ||
| 당기(주) | 전기(주) | 당기(원) | 전기(원) | |
| 기초 잔여주 | 122,862 | 94,020 | 25,395 | 44,098 |
| 부여 | 96,500 | 5,000 | 4,289 | 12,660 |
| 조정 | 63,887 | 30,893 | (7,224) | - |
| 소멸 | (22,711) | (7,051) | (6,673) | (45,720) |
| 기말 잔여주 | 260,538 | 122,862 | 15,787 | 31,398 |
당기말 현재 행사가능한 주식선택권은 117,692주이며, 당기말 현재 유효한 주식선택권의 가중평균잔여만기는 4.6년이며, 행사가격은 3,751원 ~ 51,314원입니다.
(3) 당사는 당기 및 전기 중 부여된 주식매수선택권의 보상원가를 이항모형을 이용한공정가치접근법을 적용하여 산정했으며, 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| 구 분 | 당기 | 전기 |
| 당기 중 부여된 선택권의 가중평균 공정가치 | 2,676원 | 7,405원 |
| 부여일의 가중평균 주가 | 4,089원 | 11,880원 |
| 주가변동성 | 64.47%~66.41% | 61.58% |
| 무위험수익률 | 3.40%~3.44% | 3.69% |
(4) 당기와 전기 중 주식결제형 주식기준보상과 관련하여 비용으로 인식한 주식기준보상은 각각 358,218,397원과 542,809,034원입니다.
(5) 당기 중 유상증자로 인해 부여했던 주식선택권의 조건이 변경되었으며 그 변경내역은 다음과 같습니다.
| 구 분 | 조건변경 전 | 조건변경 후 |
| 조건변경 시점 잔여 선택권의 가중평균 행사가격(원) | 20,370 | 15,787 |
| 조건변경 시점 잔여 선택권의 가중평균 공정가치(원) | 6,440 | 6,984 |
조건변경 시점의 공정가치 평가에 적용된 주요 변수는 다음과 같습니다.
| 구 분 | 주요 투입 변수 |
| 주가(원) | 10,250 |
| 주가변동성 | 95.00% |
| 무위험수익률 | 2.96% |
조건변경으로 인해 당기 중 493,360천원의 추가비용이 인식되었습니다.
29. 매출액 및 매출원가
(1) 당기와 전기 중 매출액의 상세내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 위탁생산매출 | 358,050,837 | - |
| 상품매출 | 3,807,041,021 | - |
| 합계 | 4,165,091,858 | - |
| 수익인식 시기: | ||
| 한 시점에 이행 | 3,807,041,021 | - |
| 기간에 걸쳐 이행 | 358,050,837 | - |
| 합계 | 4,165,091,858 | - |
(2) 당기와 전기 중 매출원가의 상세내역은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 위탁생산매출원가 | 178,983,028 | - |
| 상품매출원가 | 3,281,097,236 | - |
| 합계 | 3,460,080,264 | - |
30. 판매비와관리비
당기와 전기 중 판매비와관리비의 내역은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 급여 | 2,061,193,923 | 2,282,793,376 |
| 퇴직급여 | 287,178,424 | 312,422,961 |
| 복리후생비 | 335,989,385 | 364,201,921 |
| 여비교통비 | 10,140,118 | 21,497,731 |
| 접대비 | 12,882,740 | 10,036,500 |
| 통신비 | 9,840,244 | 9,248,743 |
| 세금과공과 | 38,318,280 | 48,200,292 |
| 지급임차료 | 158,728,397 | 115,841,450 |
| 보험료 | 29,891,525 | 42,356,748 |
| 차량유지비 | 7,026,317 | 4,864,939 |
| 운반비 | 222,932,809 | 27,030,700 |
| 교육훈련비 | 2,138,000 | 2,754,655 |
| 도서인쇄비 | 1,117,728 | 680,000 |
| 수도광열비 | 368,345,859 | 273,129,053 |
| 소모품비 | 1,154,666,003 | 270,580,787 |
| 지급수수료 | 1,631,213,785 | 889,442,180 |
| 감가상각비 | 2,317,509,733 | 2,322,041,055 |
| 무형자산상각비 | 718,182 | 418,939 |
| 수선비 | 300,000 | - |
| 포장비 | 2,310,000 | - |
| 대손상각비 | 269,099,916 | - |
| 광고선전비 | 57,321,685 | 10,000,000 |
| 주식보상비용 | 220,034,312 | 151,378,520 |
| 합 계 | 9,198,897,365 | 7,158,920,550 |
31. 비용의 성격별 분류
당기와 전기 중 발생한 비용을 성격별로 분류한 내역은 다음과 같습니다.
| (단위:원) | ||
| 구분 | 당기 | 전기 |
| 재고자산변동 | 3,281,097,236 | - |
| 종업원급여 | 3,757,795,216 | 4,092,083,715 |
| 복리후생비 | 494,277,217 | 560,477,864 |
| 지급임차료 | 158,728,397 | 115,841,450 |
| 소모품비 | 1,528,350,020 | 652,469,412 |
| 지급수수료 | 2,769,314,374 | 3,045,765,811 |
| 감가상각비 | 2,635,941,973 | 2,614,687,066 |
| 무형자산상각비 | 3,437,642 | 15,638,399 |
| 사용권자산상각비 | 94,126,895 | 33,256,542 |
| 주식보상비용 | 358,218,397 | 542,809,034 |
| 대손상각비 | 269,099,916 | - |
| 기타비용 | 795,203,423 | 524,921,350 |
| 합 계 | 16,145,590,706 | 12,197,950,643 |
32. 기타수익 및 기타비용
(1) 당기와 전기 중 기타수익의 내역은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 잡이익 | 23,007,051 | 4,476,789 |
| 외환차익 | 718,736 | 81,576,391 |
| 리스해지이익 | 4,976,708 | - |
| 합 계 | 28,702,495 | 86,053,180 |
(2) 당기와 전기 중 기타비용의 내역은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 잡손실 | 860,302 | 1,673,249 |
| 외환차손 | 5,869,363 | 6,088,032 |
| 기부금 | 137,085,000 | 133,435,000 |
| 합 계 | 143,814,665 | 141,196,281 |
33. 금융수익 및 금융원가
(1) 당기와 전기 중 금융수익의 내역은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 이자수익 | 448,101,500 | 633,439,538 |
| 당기손익공정가치측정금융자산평가이익 | - | 213,225,000 |
| 당기손익공정가치측정금융자산처분이익 | 39,109,647 | 112,625,000 |
| 파생상품평가이익 | 395,982,800 | 1,027,246,400 |
| 사채상환이익 | 188,474,220 | 294,286,659 |
| 합 계 | 1,071,668,167 | 2,280,822,597 |
(2) 당기와 전기 중 금융원가의 내역은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 이자비용 | 471,956,786 | 1,264,465,236 |
| 당기손익공정가치측정금융자산평가손실 | 37,550,000 | - |
| 파생상품평가손실 | 725,598,600 | 374,699,000 |
| 합 계 | 1,235,105,386 | 1,639,164,236 |
34. 법인세비용
(1) 당기와 전기 중 법인세비용의 구성내역은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 당기법인세부담액 | - | - |
| 일시적 차이의 발생과 소멸로 인한 이연법인세비용 | - | 3,163,873,890 |
| 당기손익 이외로 인식되는 항목과 관련된 법인세비용 | - | (3,163,873,890) |
| 법인세비용 | - | - |
(2) 당기와 전기 중 당기손익 이외로 인식되는 항목과 관련된 당기법인세와 이연법인세는 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 재평가잉여금 | - | (3,163,873,890) |
(3) 당기 및 전기의 회계이익과 법인세비용의 관계는 다음과 같습니다.
| (단위: 원) | ||
| 구 분 | 당기 | 전기 |
| 법인세비용차감전순손익 | (12,259,048,237) | (11,611,435,383) |
| 적용세율에 따른 법인세비용(수익) | (2,562,141,082) | (2,426,789,995) |
| 조정사항 | ||
| 세무상 과세되지 않는 수익 | - | - |
| 세무상 차감되지 않는 비용 | 56,707,405 | 3,295,131,082 |
| 세액공제 | 573,189,802 | (535,838,759) |
| 실현가능성 없는 이연법인세 증감 | 1,932,243,875 | (332,502,328) |
| 당기조정항목 | 2,562,141,082 | 2,426,789,995 |
| 법인세비용 | - | - |
(4) 당기말과 전기말 현재 상계전 이연법인세자산(부채)의 내역은 다음과 같습니다.
① 당기말
| (단위: 원) | ||||
| 구 분 | 기초 | 당기손익 반영 | 기타포괄손익 반영 | 기말 |
| 유형자산 | 61,104,550 | (13,800,731) | - | 47,303,819 |
| 무형자산 | 40,341,772 | (4,284,082) | - | 36,057,690 |
| 기타금융자산 | (3,064,874) | 2,973,904 | - | (90,970) |
| 기타금융부채 | 493,458,995 | 5,571,647 | - | 499,030,642 |
| 기타부채 | 34,970,989 | (5,679,074) | - | 29,291,915 |
| 순확정급여부채 | 227,807,339 | 23,851,191 | 13,922,659 | 265,581,189 |
| 리스부채 | 2,158,437 | 19,147,688 | - | 21,306,125 |
| 사용권자산 | (1,929,829) | (19,318,125) | - | (21,247,954) |
| 전환사채 | (439,470,854) | 439,470,854 | - | - |
| 상각후원가측정금융자산 | 2,625,778 | (2,625,778) | - | - |
| 당기손익-공정가치측정금융자산 | 135,034,900 | (135,034,900) | - | - |
| 파생상품자산 | (151,650,107) | 151,650,107 | - | - |
| 파생상품부채 | 480,395,696 | (480,395,696) | - | - |
| 재평가잉여금 | (3,163,873,890) | - | - | (3,163,873,890) |
| 소 계 | (2,282,091,098) | (18,472,995) | 13,922,659 | (2,286,641,434) |
| 이월결손금 | 9,011,439,791 | 2,617,071,316 | - | 11,628,511,107 |
| 이월세액공제 | 4,277,927,906 | (573,189,802) | - | 3,704,738,104 |
| 소 계 | 13,289,367,697 | 2,043,881,514 | - | 15,333,249,211 |
| 실현가능성이 낮아 인식하지 않은 이연법인세자산 | (11,007,276,599) | (5,189,282,409) | (13,922,659) | (16,210,481,667) |
| 합 계 | - | (3,163,873,890) | - | (3,163,873,890) |
② 전기말
| (단위: 원) | ||||
| 구 분 | 기초 | 당기손익 반영 | 기타포괄손익 반영 | 기말 |
| 유형자산 | 69,385,237 | (8,280,687) | - | 61,104,550 |
| 무형자산 | - | 40,341,772 | - | 40,341,772 |
| 기타금융자산 | (6,138,931) | 3,074,057 | - | (3,064,874) |
| 기타금융부채 | 471,130,011 | 22,328,984 | - | 493,458,995 |
| 기타부채 | 25,914,609 | 9,056,380 | - | 34,970,989 |
| 순확정급여부채 | 171,892,774 | 45,242,983 | 10,671,582 | 227,807,339 |
| 리스부채 | 11,507,839 | (9,349,402) | - | 2,158,437 |
| 사용권자산 | (23,918,473) | 21,988,644 | - | (1,929,829) |
| 전환사채 | (1,567,417,793) | 1,127,946,939 | - | (439,470,854) |
| 상각후원가측정금융자산 | 7,201,315 | (4,575,537) | - | 2,625,778 |
| 당기손익-공정가치측정금융자산 | 120,010,000 | 15,024,900 | - | 135,034,900 |
| 파생상품자산 | (242,065,472) | 90,415,365 | - | (151,650,107) |
| 파생상품부채 | 1,623,946,720 | (1,143,551,024) | - | 480,395,696 |
| 재평가잉여금 | - | - | (3,163,873,890) | (3,163,873,890) |
| 소 계 | 661,447,836 | 209,663,374 | (3,153,202,308) | (2,282,091,098) |
| 이월결손금 | 7,349,844,142 | 1,661,595,649 | - | 9,011,439,791 |
| 이월세액공제 | 3,742,089,147 | 535,838,759 | - | 4,277,927,906 |
| 소 계 | 11,091,933,289 | 2,197,434,408 | - | 13,289,367,697 |
| 실현가능성이 낮아 인식하지 않은 이연법인세자산 | (11,753,381,125) | (2,407,097,782) | 3,153,202,308 | (11,007,276,599) |
| 합 계 | - | - | - | - |
(5) 당기말과 전기말 현재 이연법인세자산으로 인식되지 않은 차감할 일시적차이는 4,299,384,592원과 6,970,684,484원 입니다.
(6) 당기말과 전기말 현재 미사용결손금 및 미사용세액공제의 만료 시기는 다음과 같습니다.
| (단위:원) | ||
| 구 분 |
당기말 |
전기말 |
| 이월결손금: | ||
| 5년이하 | 6,249,065,294 | 4,716,161,984 |
| 6년에서 15년이하 | 49,080,187,571 | 38,404,209,817 |
| 세액공제: | ||
| 2년이하 | 27,534,013 | - |
| 3년에서 10년이하 | 3,677,204,091 | 4,277,927,906 |
35. 주당순손실
(1) 기본주당순손실
당기와 전기 중 당사의 주당순손실의 계산내역은 다음과 같습니다.
| 구 분 | 당기 | 전기 |
| 보통주당기순손실 | 12,259,048,237 원 | 11,611,435,383 원 |
| 가중평균유통보통주식수 | 16,492,321 주 | 10,770,740 주 |
| 기본주당손실 | 743 원 | 1,078 원 |
(2) 당기와 전기 중 가중평균유통보통주식수는 다음과 같습니다.
① 당기
| 구분 | 유통기간 | 유통보통주식수(주) | 유통일수(일) | 적수(주) | |
|---|---|---|---|---|---|
| 기초 | 2024-01-01 | 2024-08-12 | 13,602,977 | 225 | 3,060,669,825 |
| 유상증자 | 2024-08-13 | 2024-12-31 | 21,102,977 | 141 | 2,975,519,757 |
| 합계 | 366 | 6,036,189,582 | |||
가중평균유통보통주식수는 16,492,321주 입니다.
② 전기
| 구분 | 유통기간 | 유통보통주식수(주) | 유통일수(일) | 적수(주) | |
|---|---|---|---|---|---|
| 기초 | 2023-01-01 | 2023-09-24 | 9,731,192 | 267 | 2,598,228,264 |
| 주식선택권 조정 | 2023-09-25 | 2023-12-31 | 13,602,977 | 98 | 1,333,091,746 |
| 합계 | 365 | 3,931,320,010 | |||
가중평균유통보통주식수는 10,770,740주 입니다.
(3) 희석주당손실
희석주당손실은 모든 희석성 잠재적보통주가 보통주로 전환된다고 가정하여 조정한 가중평균유통보통주식수를 적용하여 산정하고 있습니다. 당사가 보유하고 있는 잠재적보통주로는 주식선택권이 있습니다. 그러나, 희석주당손실은 당기와 전기 중 상기 잠재적보통주의 반희석효과로 인하여 산출하지 아니하였습니다.
36. 우발채무 및 약정사항
(1) 당사는 마곡산업단지 토지 취득과 관련하여 서울경제진흥원으로부터 320,284,843원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령취소 소송을 제넥신 등과 공동으로 진행하였고 2023년 9월 22일 1심 패소, 2024년 12월 18일 2심 패소 후 불복하기 위한 상고심을 준비 중입니다. 당기말 현재 동 소송의 전망은 예측할 수 없습니다.
(2) 당사는 당기말 현재 서울보증보험으로부터 316,668천원의 국가 지원사업에 따른협약지원금 반환 지급보증 등의 보증을 제공받고 있습니다.
(3) 당사는 2023년 7월 7일 마곡 신사옥 및 R&D센터 신규시설 투자 목적으로 당사를 포함한 3개사와 컨소시엄을 구성하여 148,000,000천원(당사분 32,560,000천원)의 차입약정을 체결하였습니다. 또한 해당 차입금에 대하여 42,328,000천원(당사분 차입금액의 130%)의 채무보증을 실행하였으며, 부동산 담보(마곡 사옥 부지 및 성남에스케이브이1타워 14개호실에 대한 채권최고액 35,816,000천원)를 추가로 제공하였습니다.
37. 특수관계자거래
(1) 당사와 거래 또는 채권ㆍ채무 잔액이 있는 특수관계자는 다음과 같습니다.
| 구 분 | 내용 |
| 유의적인 영향력을 행사하는 개인 | 대표이사 |
(2) 당기와 전기 중 특수관계자와의 주요한 거래내용은 다음과 같습니다.
| (단위:원) | |||
| 구 분 | 내용 | 당기 | 전기 |
| 대표이사 | 단기급여 | 371,220,660 | 350,201,480 |
| 퇴직급여 | 116,559,540 | 88,751,727 | |
(3) 당기와 전기 중 주요 경영진에 대한 보상은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 단기급여 | 650,744,880 | 624,125,420 |
| 퇴직급여 | 153,052,664 | 109,487,939 |
| 주식보상비용 | 150,220,226 | 119,831,715 |
| 합 계 | 954,017,770 | 853,445,074 |
38. 현금흐름표
(1) 당기와 전기 중 영업으로부터 창출된 현금은 다음과 같습니다.
| (단위:원) | ||
| 구 분 | 당기 | 전기 |
| 법인세비용차감전순손실 | (12,259,048,237) | (11,611,435,383) |
| 조정 : | ||
| 감가상각비(사용권자산상각비 포함) | 2,730,068,868 | 2,647,943,608 |
| 무형자산상각비 | 3,437,642 | 15,638,399 |
| 재고자산평가손실 | 34,467,772 | - |
| 대손상각비 | 269,099,916 | - |
| 주식보상비용 | 358,218,397 | 542,809,034 |
| 퇴직급여 | 425,755,186 | 416,255,703 |
| 이자비용 | 471,956,786 | 1,264,465,236 |
| 파생상품평가손실 | 725,598,600 | 374,699,000 |
| 당기손익공정가치측정금융자산평가손실 | 37,550,000 | - |
| 이자수익 | (448,101,500) | (633,439,538) |
| 당기손익공정가치측정금융자산평가이익 | - | (213,225,000) |
| 당기손익공정가치측정금융자산처분이익 | (39,109,647) | (112,625,000) |
| 파생상품평가이익 | (395,982,800) | (1,027,246,400) |
| 사채상환이익 | (188,474,220) | (294,286,659) |
| 리스해지이익 | (4,976,708) | (929,124) |
| 매출채권의 감소(증가) | (168,743,990) | 369,600,000 |
| 재고자산의 감소(증가) | (481,060,274) | - |
| 계약자산의 감소(증가) | (194,700,000) | 48,000,000 |
| 기타금융자산의 감소(증가) | 1,181,113 | 45,585,508 |
| 기타유동자산의 감소(증가) | (621,130,024) | 35,107,866 |
| 매입채무의 증가(감소) | 148,183,161 | - |
| 기타금융부채의 증가(감소) | (166,821,564) | 857,714,016 |
| 기타부채의 증가(감소) | 193,348,846 | (94,597,298) |
| 퇴직금의 지급 | (311,634,651) | (156,106,420) |
| 영업으로부터 창출된 현금흐름 | (9,880,917,328) | (7,526,072,452) |
(2) 당기와 전기 중 현금의 유입ㆍ유출이 없는 거래 중 중요한 사항은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구 분 | 당기 | 전기 |
| 리스의 해지 | 85,513,378 | 7,350,115 |
| 유형자산 취득 미지급금 증가 | 26,892,600 | 35,754,000 |
| 무형자산 취득 미지급금 증가 | 1,873,415,866 | - |
(3) 당기와 전기 중 재무활동에서 생기는 부채의 변동내용은 다음과 같습니다.
| (단위:원) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 미지급금(*) | 장기미지급금(*) | 전환사채 | 차입금 | 파생상품부채 | 리스부채 | ||||||
| 당기 | 전기 | 당기 | 전기 | 당기 | 전기 | 당기 | 전기 | 당기 | 전기 | 당기 | 전기 | |
| 기초 | - | 322,605,465 | 2,361,047,822 | 2,089,109,290 | 5,497,268,640 | 11,875,373,669 | 6,487,230,494 | - | 2,298,544,000 | 7,381,576,000 | 10,327,452 | 52,308,361 |
| 재무활동 | ||||||||||||
| 차입 | - | - | - | - | - | - | 6,953,080,465 | 6,487,230,494 | - | - | - | - |
| 정부보조금 수령 | - | 373,028,064 | 26,658,600 | 372,641,041 | - | - | - | - | - | - | - | - |
| 상환 | - | - | - | - | (5,697,438,800) | (7,638,501,059) | (880,053,406) | - | (1,902,561,200) | (4,055,785,600) | (96,606,452) | (38,700,000) |
| 소계 | - | 373,028,064 | 26,658,600 | 372,641,041 | (5,697,438,800) | (7,638,501,059) | 6,073,027,059 | 6,487,230,494 | (1,902,561,200) | (4,055,785,600) | (96,606,452) | (38,700,000) |
| 리스부채의 증감 | - | - | - | - | - | - | - | - | - | - | 181,581,406 | (7,350,115) |
| 상각 | - | - | - | - | 388,644,380 | 1,260,396,030 | 70,905,408 | - | - | - | 6,640,771 | 4,069,206 |
| 비용차감 | - | (695,633,529) | - | (100,702,509) | - | - | - | - | - | - | - | - |
| 평가 | - | - | - | - | - | - | - | (395,982,800) | (1,027,246,400) | - | - | |
| 상환이익 | - | - | - | - | (188,474,220) | - | - | - | - | - | - | - |
| 사업결합 | - | - | - | - | - | - | 438,972,941 | - | - | - | - | - |
| 기말 | - | - | 2,387,706,422 | 2,361,047,822 | - | 5,497,268,640 | 13,070,135,902 | 6,487,230,494 | - | 2,298,544,000 | 101,943,177 | 10,327,452 |
(*) 정부보조금 중 기술료로 향후 납부해야 할 것으로 예상되는 금액입니다.
39. 사업결합
(1) 회사는 2024년 5월 14일을 합병기일로 종속회사인 ㈜포베이커를 흡수합병하였습니다. ㈜포베이커는 회사가 100% 지분을 소유하고 있는 종속회사로 동 합병거래는 동일지배하의 사업결합에 해당됩니다. 당사는 동일지배하의 사업결합으로 취득한자산이나 부채를 연결장부금액으로 인식하였습니다.
(2) 사업결합으로 인해 인수한 ㈜포베이커의 주요 자산 및 부채의 장부금액은 다음과같습니다.
| (단위:원) | |
|---|---|
| 구 분 | 금 액 |
| 이전대가 | |
| 기존 보유지분의 장부금액 | 500,000,000 |
| 취득한 자산의 장부금액 | |
| 현금및현금성자산 | 2,743,107 |
| 매출채권 | 178,753,753 |
| 기타유동금융자산 | 4,006,571 |
| 기타유동자산 | 31,781,988 |
| 재고자산 | 116,081,262 |
| 무형자산(영업권) | 887,317,094 |
| 소 계 | 1,220,683,775 |
| 인수한 부채의 장부금액 | |
| 매입채무 | 104,221,113 |
| 기타유동금융부채 | 116,470,088 |
| 기타유동부채 | 61,019,633 |
| 단기차입금 | 148,972,941 |
| 유동성장기부채 | 90,000,000 |
| 장기차입금 | 200,000,000 |
| 소 계 | 720,683,775 |
| 인수한 순자산 장부금액 | 570,248,839 |
| 합 계 | 500,000,000 |
40. 영업부문 정보
당사의 경영진은 매출을 기준으로 영업부문을 결정하고 있습니다.
(1) 당기 중 영업부문별 영업손익은 다음과 같습니다.
| (단위:원) | ||||
| 구 분 | 당기 | 전기 | ||
| 신약개발사업부 | 이커머스사업부 | 합 계 | 신약개발사업부 | |
| 매출액 | 358,050,837 | 3,807,041,021 | 4,165,091,858 | - |
| 매출원가 | 178,983,028 | 3,281,097,236 | 3,460,080,264 | - |
| 매출총이익 | 179,067,809 | 525,943,785 | 705,011,594 | - |
| 판매비와관리비 | 8,234,580,610 | 964,316,755 | 9,198,897,365 | 7,158,920,550 |
| 경상연구개발비 | 3,486,613,077 | - | 3,486,613,077 | 5,039,030,093 |
| 영업손실 | (11,542,125,878) | (438,372,970) | (11,980,498,848) | (12,197,950,643) |
(2) 당기말 현재 영업부문별 자산 및 부채 내역은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구 분 | 신약개발사업부 | 이커머스사업부 | 조정 | 합 계 |
| 자산 | 74,046,065,141 | 1,653,081,362 | 387,317,094 | 76,086,463,597 |
| 부채 | 24,155,899,891 | 727,465,733 | - | 24,883,365,624 |
| 순자산 | 49,890,165,250 | 925,615,629 | 387,317,094 | 51,203,097,973 |
(3) 당기와 전기의 매출액 내역은 다음과 같습니다.
| (단위:원) | ||||
| 구 분 | 당기 | 전기 | ||
| 신약개발사업부 | 이커머스사업부 | 합 계 | 신약개발사업부 | |
| 위탁생산매출 | 358,050,837 | - | 358,050,837 | - |
| 상품매출 | - | 3,807,041,021 | 3,807,041,021 | - |
| 합 계 | 358,050,837 | 3,807,041,021 | 4,165,091,858 | - |
41. 계속기업에 대한 가정
당사의 재무제표는 계속기업으로서 존속할 것이라는 가정을 전제로 작성되었습니다.따라서, 자산과 부채를 정상적인 영업활동 과정을 통하여 장부가액으로 회수하거나 상환할 수 있다는 가정하에 회계처리 되었습니다. 그러나, 당사는 지속적인 영업손실과 당기순손실 발생 및 부의 영업현금흐름발생, 이에 따른 결손금누적과 재무상태 악화로 당사의 계속기업으로서의 존속능력에 유의적인 불확실성이 존재하는 상황입니다.
다만, 당사의 당기말 유동자산 11,396,819천원이 유동부채 4,223,218천원을 상회하고 있으며, 임상 3상 시험 이후 신제품 상용화를 통하여 실적개선과 신규자금 조달 및 재무상태 개선을 계획하고 있습니다.
상기와 같은 상황 하에서 당사의 사업계획 및 자금조달 계획 등에 차질이 발생하는 경우 당사의 자산과 부채를 장부가액으로 회수하거나 상환하지 못할 수도 있습니다.이 경우에 발생될 수도 있는 자산과 부채의 금액 및 분류 표시에 대한 수정사항은 재
무제표에 반영되어 있지 않습니다.
6. 배당에 관한 사항
1. 회사의 배당정책에 관한 사항
당사는 최근 3년간 계속 연구개발에 대한 투자 확대 등에 따라 결손금이 누적되어 배당을 시행하지 못하고 있습니다. 향후 안정적인 수익창출을 통하여 조속히 배당가능재원을 확보할 예정이며, 배당을 주주에 대한 이익반환의 기본 형태로 보고 적극적인 주주 환원 정책을 펴나가겠습니다.
당사는 상법상 배당가능재원 확보시, 회사 정관 규정에 의거하여 이익 규모 및 미래성장을 위한 투자재원 확보, 기업의 재무구조 건전성 유지 등의 요인을 종합적으로 고려하여 배당정책을 결정할 예정입니다. 또한, 지속적인 주주가치 증대를 위해 핵심사업에 대한 경쟁력 확보와 안정적 수익 창출을 통하여, 주주의 배당요구를 충족시킬 수 있도록 배당을 실시할 계획이며 사업환경, 투자, Cash Flow, 부채비율에 따른 재무구조 개선여부 등을 종합적으로 고려한 잉여현금흐름을 배당재원으로 하여, 배당성향을 점차 늘려나갈 계획입니다.
또한, 당사의 향후 배당방향 등 주주환원정책은 IR 활동을 통하여 주주에게 충분히 안내드릴 예정이며, 주주 친화적인 배당정책이 달성 가능하도록 지속적으로 노력하겠습니다. 향후 배당정책의 결정은 내부 이사회 등의 결의를 거쳐 공시, 회사 홈페이지 등을 통해 안내드릴 수 있도록 할 예정입니다.
2. 배당관련 예측가능성 제공에 관한 사항
가. 정관상 배당절차 개선방안 이행 가부
| 구분 | 현황 및 계획 |
| 정관상 배당액 결정 기관 | 이사회 및 주주총회 |
| 정관상 배당기준일을 배당액 결정 이후로 정할 수 있는지 여부 | 부 |
| 배당절차 개선방안 이행 관련 향후 계획 | 당사 사업현황 등을 고려하여 배당 절차 개선방안에 대해 검토할 계획 |
나. 배당액 확정일 및 배당기준일 지정 현황
| 구분 | 결산월 | 배당여부 | 배당액 확정일 |
배당기준일 | 배당 예측가능성 제공여부 |
비고 |
|---|---|---|---|---|---|---|
| - | - | X | - | - | X | - |
| - | - | X | - | - | X | - |
| - | - | X | - | - | X | - |
3. 기타 참고사항(배당 관련 정관의 내용 등)
| 구분 | 내용 |
|---|---|
| 신주배당 기산일 | 제13조(신주의 배당기산일) 회사가 유상증자, 무상증자 및 주식배당에 의하여 발행한 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전영업연도말에 발행된 것으로 본다. |
| 이익금의 처분 |
제55조(이익금의 처분) 1. 이익준비금 2. 기타의 법정준비금 3. 배당금 4. 임의적립금 5. 기타의 이익잉여금처분액 |
| 이익배당 |
제56조(이익배당) ② 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. ③ 제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익배당은 주주총회의 결의로 정한다. |
주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제19기 | 제18기 | 제17기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | - | - | - | |
| (별도)당기순이익(백만원) | -12,259 | -11,611 | -22,865 | |
| (연결)주당순이익(원) | -743 | -1,078 | -2,350 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
과거 배당 이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
(주) 당사는 최근 5년간 배당을 지급하지 않아 과거 배당 이력이 없습니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 지분증권의 발행 및 감소 현황
증자(감자)현황
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2020.03.11 | 주식매수선택권행사 | 보통주 | 70,000 | 500 | 3,200 | - |
| 2020.11.03 | 주식매수선택권행사 | 보통주 | 50,000 | 500 | 1,800 | - |
| 2021.03.24 | 주식매수선택권행사 | 보통주 | 5,000 | 500 | 12,000 | - |
| 2021.06.24 | 주식매수선택권행사 | 보통주 | 5,000 | 500 | 12,000 | - |
| 2021.09.13 | 주식매수선택권행사 | 보통주 | 22,500 | 500 | 12,000 | - |
| 2023.09.09 | 유상증자(주주우선공모) | 보통주 | 3,871,785 | 500 | 4,515 | - |
| 2024.08.10 | 유상증자(주주배정) | 보통주 | 7,500,000 | 500 | 3,090 | - |
나. 향후 지분증권으로 변경될 가능성이 있는 채무증권
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
| [채무증권의 발행 등과 관련된 사항] |
가. 채무증권 발행 실적
채무증권 발행실적
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| 주식회사 셀리드 |
회사채 | 사모 | 2021.03.19 | 19,000 | 0.0 | - | 2026.03.19 | 상환 완료 | - |
| 주식회사 셀리드 |
회사채 | 사모 | 2024.07.01 | 3,000 | 17.0 | - | 2024.09.01 | 상환 완료 | - |
| 합 계 | - | - | - | 22,000 | 17.0 | - | - | - | - |
(주1) 제2회 무기명식 무보증 사모 전환사채의 40%에 대하여 2023년 2월 17일 조기상환을 청구 받았으며, 2023년 3월 20일 본 사채의 40%인 7,600,000,000원에 대한 상환을 완료했습니다.
(주2) 제2회 무기명식 무보증 사모 전환사채의 20%에 대하여 2023년 11월 20일 조기상환을 청구 받았으며, 2023년 12월 19일 본 사채의 20%인 3,800,000,000원에 대한 상환을 완료했습니다.
(주3) 제2회 무기명식 무보증 사모 전환사채의 잔여분 40%에 대하여 2024년 5월 20일 조기상환을 청구 받았으며, 2024년 6월 19일 본 사채 미상환잔액 7,600,000,000원에 대해 상환을 완료하였습니다.
(주4) 제1회 무기명식 이권부 무보증 사모사채는 2024년 8월 23일 본 사채 3,000,000,000원에 대한 상환을 완료하였습니다.
나. 만기별 미상환 채무증권 잔액
1) 기업어음증권 미상환 잔액
기업어음증권 미상환 잔액
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
(주) 당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
2) 단기사채 미상환 잔액
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
(주) 당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
3) 회사채 미상환 잔액
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
(주1) 제2회 무기명식 무보증 사모 전환사채의 잔여분 40%에 대하여 2024년 5월 20일 조기상환을 청구 받았으며, 2024년 6월 19일 본 사채 미상환잔액 7,600,000,000원에 대해 상환을 완료 하였습니다.
(주2) 제1회 무기명식 이권부 무보증 사모사채는 2024년 8월 23일 본 사채 3,000,000,000원에 대한 상환을 완료하였습니다.
4) 신종자본증권 미상환 잔액
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
(주) 당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
5) 조건부자본증권 미상환 잔액
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
(주) 당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
다. 미상환 회사채와 관련된 사채관리계약
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
라. 회계상 자본으로 인정되는 미상환 채무증권
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
공모자금의 사용내역
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 기업공개 (코스닥시장 상장) |
- | 2019.02.14 | 운영자금 및 시설자금 | 39,357 | 운영자금(연구개발 등) 및 시설자금(연구생산 장비 등) |
39,357 | 본 자금은 당사의 연구개발비를 포함한 운영자금 및 GMP 연구생산 장비 등 시설자금으로 사용하였습니다. |
| 유상증자 | - | 2023.09.08 | 운영자금 | 17,481 | 운영자금 (연구개발비, 증자수수료 등) |
17,481 | 본 자금은 당사의 연구개발비 등 운영자금으로 사용하였습니다. |
| 유상증자 | - | 2024.08.09 | 운영자금 | 23,175 | 운영자금 (연구개발비, 증자수수료 등) |
14,356 | 본 자금은 당사의 연구개발비 등 운영자금으로 사용될 예정입니다. |
나. 사모자금의 사용내역
사모자금의 사용내역
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 전환사채 | 2 | 2021.03.19 | 운영자금 및 시설자금 | 19,000 | 운영자금(연구개발 등) 및 전환사채 조기상환 |
19,000 | - |
| 사모사채 | 1 | 2024.07.01 | 운영자금 | 3,000 | 운영자금(연구개발 등) | 3,000 | - |
주1) 제2회 무기명식 무보증 사모 전환사채의 40%에 대하여 2023년 2월 17일 조기상환을 청구 받았으며, 2023년 3월 20일 본 사채의 40%인 7,600,000,000원에 대한 상환을 완료했습니다.
주2) 제2회 무기명식 무보증 사모 전환사채의 20%에 대하여 2023년 11월 20일 조기상환을 청구 받았으며, 2023년 12월 19일 본 사채의 20%인 3,800,000,000원에 대한 상환을 완료했습니다.
주3) 제2회 무기명식 무보증 사모 전환사채의 잔여분 40%에 대하여 2024년 5월 20일 조기상환을 청구 받았으며, 2024년 6월 19일 본 사채 미상환잔액 7,600,000,000원에 대해 상환을 모두 완료하였습니다.
주4) 제1회 무기명식 이권부 무보증 사모사채는 2024년 8월 23일 본 사채 3,000,000,000원에 대해 모두 상환을 완료하였습니다.
다. 미사용자금의 운용내역
미사용자금의 운용내역
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 보통예금 외 | 8,819 | - | - |
| 계 | 8,819 | - | ||
주) 운용금액은 금융상품에 대한 이자수익 및 평가손실이 포함된 금액입니다.
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
1) 재무제표 재작성
당사는 본 보고서 작성기준일 현재 해당 사항 없습니다.
2) 합병, 분할, 자산양수도, 영업양수도에 관한 사항
가) SK V1 TOWER 6층 (자산양수도)
당사는 2019년 8월 6일자 이사회 결의에 의거 2020년 1월 3일자로 경기도 성남시 중원구 상대원동 145-1,2,4번지 SK V1 TOWER 6층 7개호실을 케이비부동산신탁주식회사와 김종평으로부터 3,086 백만원에 인수하였습니다. 자세한 내용은 2019년 8월 6일 '주요사항보고서(유형자산양수결정)' 과 2020년 1월 31일 '합병등 종료보고서(자산양수도)' 공시를 참고하시기 바랍니다.
나) SK V1 TOWER 4층 (자산양수도)
당사는 2020년 2월 3일자 이사회 결의에 의거 2020년 2월 21일자로 경기도 성남시 중원구 상대원동 145-1,2,4번지 SK V1 TOWER 4층 6개호실을 케이비부동산신탁주식회사와 장연식으로부터 3,178 백만원에 인수하였습니다. 자세한 내용은 2020년 2월 3일 '주요사항보고서(유형자산양수결정)' 과 2020년 2월 21일 '합병등 종료보고서(자산양수도)' 공시를 참고하시기 바랍니다.
다) 소규모합병
당사는 2024년 3월 12일 이사회 결의에 의거하여 주식회사 포베이커를 소규모 합병의 형태로 흡수합병을 결정하였습니다. 2024년 5월 14일을 합병기일로 하여 흡수합병을 완료하였습니다. 자세한 내용은 2024년 3월 12일 '주요사항보고서(회사합병결정)' 과 2024년 5월 21일 '합병등종료보고서(합병)' 공시를 참고하시기 바랍니다.
3) 자산유동화와 관련한 자산매각의 회계처리 및 우발채무 등에 관한 사항
마곡산업단지 토지 취득 관련 기부채납에 대해 마곡산업단지 기부채납 취소 공동대책위원회에 참여하여 행정소송을 진행 중이며 자세한 사항은 Ⅲ.재무에 관한 사항 5. 재무제표 주석을 참고하시기 바랍니다.
4) 기타 재무제표 이용에 유의하여야 할 사항
<감사보고서 상 강조사항과 핵심감사사항>
| 사업연도 | 강조사항 등 | 핵심감사사항 |
|---|---|---|
| 제19기(당기) | 해당사항 없음 | 상품 매출 실재성 |
| 제18기(당기) | 해당사항 없음 | 개발비 자산화 금액 적정성 |
| 제17기(전기) | 해당사항 없음 | 금융상품 계정분류의 적정성 |
나. 대손충당금 설정현황
1) 매출채권 관련 대손충당금 설정방침
당사는 공시서류 작성기준일 현재 매출채권 및 기타채권 잔액에 대하여 장래의 대손예상액을 고려하는 기대신용손실모형을 적용하여 대손충당금 설정합니다.
2) 대손충당금 설정현황
| 구 분 | 계정과목 | 채권금액 | 대손충당금 |
대손충당금 설정률 |
| 제19기 | 외상매출금 | 332,127,827 | 59,030,000 | 17.8% |
| 계약자산 | 194,700,000 | 194,700,000 | 100% | |
| 합 계 | 526,827,827 | 253,730,000 | 48.2% |
다. 재고자산 현황
1) 사업부문별 재고자산의 보유 현황
| (단위 : 천원, %, 회) | ||||
| 사업부문 | 계정과목 | 제19기 | 제18기 | 제17기 |
| 이커머스 사업부 | 상품 | 562,674 | - | - |
| 소계 | 562,674 | - | - | |
(주1) 당사는 2024년 5월 14일을 합병기일로 종속회사인 (주)포베이커를 흡수합병하여 이커머스 사업부를 신설하였습니다.
당사는 현재 비임상 또는 임상 단계의 연구를 진행 중이므로 본 보고서 작성기준일 현재 해당 사항이 없습니다.
또한, 위탁생산에 필요한 원부자재는 고객사가 구매하여 당사에 공급하며, 필요에 의해 당사가 원부자재를 구매한 경우 해당 원부자재 또는 당사가 가공한 반제품 및 완제품은 모두 고객사의 소유로 하고 당사는 이를 가공하기 위해서만 보관하고 있는 것으로 계약하였습니다. 이에 본 보고서 작성기준일 현재 해당 사항이 없습니다.
라. 수주 계약 현황
| (단위 : 천원) |
| 회사명 | 품목 | 발주처 | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 총액 | 손상차손 누계액 |
총액 | 대손 충당금 |
|||||||
| (주)셀리드 | 위탁생산 | (주)이노베이션바이오 | 2023년 03월 16일 | (주2) | 1,173,000 | 26.6 | 194,700 | 194,700 | 59,030 | 59,030 |
| (주)셀리드 | 위탁생산 | (주)이노베이션바이오 | 2023년 03월 16일 | (주2) | 3,715,000 | - | - | - | - | - |
| 합 계 | 6.4 | 194,700 | 194,700 | 59,030 | 59,030 | |||||
(주1) 본 계약은 2024년 3월 16일 기체결한 계약으로 자세한 내용은 2023년 3월 16일 기 제출한 단일판매 공급계약 체결과 2024년 02월 01 기 제출한 [정정] 단일판매 공급계약 체결을 참고하시기 바랍니다.
(주2) 수주계약 기간은 임상 2a상 최초 IRB 승인일로부터 18개월입니다.
(주3) 수주 총액은 약 4,888백만원이며, Part1 임상1상 1,173백만원, Part2 임상 2상 3,715백만원으로 진행됩니다.
마. 공정가치 평가 내역
III. 재무에 관한 사항 - 5. 재무제표 주석 - '2. 재무제표 작성기준', '4. 범주별 금융상품'을 참고하시기 바랍니다.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
1. 회계감사인의 명칭 및 감사의견(검토의견 포함한다. 이하 이 조에서 같다)을 다음의 표에 따라 기재한다.
회계감사인의 명칭 및 감사의견
| 사업연도 | 구분 | 감사인 | 감사의견 | 의견변형사유 | 계속기업 관련 중요한 불확실성 |
강조사항 | 핵심감사사항 |
|---|---|---|---|---|---|---|---|
| 제19기 (당기) | 감사보고서 | 삼정회계법인 | 적정의견 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 | 상품 매출 실재성 |
| 연결감사 보고서 |
- | - | - | - | - | - | |
| 제18기(전기) | 감사보고서 | 삼정회계법인 | 적정의견 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 | 재화나 용역에 대한 구매와 관련된 부채 및 관련 비용의 완전성 검토 |
| 연결감사 보고서 |
- | - | - | - | - | - | |
| 제17기(전전기) | 감사보고서 | 삼정회계법인 | 적정의견 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 | 금융상품 계정분류의 적정성 |
| 연결감사 보고서 |
- | - | - | - | - | - |
2. 감사용역 체결현황은 다음의 표에 따라 기재한다.
감사용역 체결현황
| (단위 : 백만원, 시간) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제19기 (당기) | 삼정회계법인 | 반기재무제표 검토, 개별재무제표 감사 및 내부회계관리제도 검토 |
93 | 890 | 93 (*) |
896 |
| 제18기(전기) | 삼정회계법인 | 반기재무제표 검토, 개별재무제표 감사 및 내부회계관리제도 검토 |
83 | 854 | 83 | 976 |
| 제17기(전전기) | 삼정회계법인 | 반기재무제표 검토, 개별재무제표 감사 및 내부회계관리제도 검토 |
75 | 750 | 75 | 779 |
3. 회계감사인과의 비감사용역 계약체결 현황은 다음의 표에 따라 기재한다.
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제19기 (당기) | - | - | - | - | - |
| - | - | - | - | - | |
| 제18기(전기) | - | - | - | - | - |
| - | - | - | - | - | |
| 제17기(전전기) | - | - | - | - | - |
| - | - | - | - | - |
4. 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 내부감사기구가 회계감사인과 논의한 결과를 다음의 표에 따라 기재한다.
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2024년 03월 19일 | 감사, 업무수행이사 | 서면보고 | - 감사종결단계의 지배기구 협의 1) 감사수행일정 2) 감사수행 중 발견된 이슈 3) 감사수수료 및 독립성 |
| 2 | 2024년 12월 30일 | 감사, 업무수행이사 | 서면보고 | - 감사계획단계의 지배기구 협의 1) 감사팀 구성 및 재무제표 감사의 목적 2) 책임구분 및 감사 방법론 3) 위험평가 및 감사계획 4) 감사수수료 및 독립성 |
| 3 | 2025년 03월 14일 | 감사, 업무수행이사 | 서면보고 | - 감사종결단계의 지배기구 협의 1) 감사수행일정 2)감사수행 중 발견된 이슈 3) 감사수수료 및 독립성 |
2. 내부통제에 관한 사항
가. 내부통제
당사는 본 신고서 작성기준일 현재 해당 사항이 없습니다.
나. 내부회계관리제도
1) 내부회계관리자가 내부회계관리제도에 대한 문제점 또는 개선방안 등을 제시한 경우 그 내용 및 후속 대책
당사는 본 신고서 작성기준일 현재 해당사항이 없습니다.
2) 공시대상기간 중 회계감사인이 내부회계관리제도에 대하여 의견표명을 한 경우 그 의견, 중대한 취약점이 있다고 지적한 경우 그 내용 및 개선대책
감사인은 제19기, 제18기 당사의 내부회계관리제도 운영실태 평가보고서를 검토하였으며, 운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 '중소기업에 대한 적용'의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였다는 의견을 표명하였습니다.
다. 내부통제구조의 평가
당사는 본 신고서 작성기준일 현재 해당사항이 없습니다.
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사회 구성 개요
당사의 이사회는 등기이사 전원으로 구성하고, 법령 또는 정관에 정하여진 사항, 주주총회로부터 위임받은 사항, 회사경영의 기본방침 및 업무집행에 관한 중요사항을 의결하며, 이사의 직무집행을 감독하고 있습니다.
당사의 이사회는 작성기준일 현재 사내이사 3인, 기타비상무이사 1인으로서 총 4인의 이사로 구성되어 있습니다. 이사회 의장은 강창율 사내이사로 대표이사를 겸직하고 있으며, 이사회 의장인 강창율 사내이사는 당사의 핵심 기술과 사업현황에 대한 이해도가 가장 높은 이사로서 이사회 운영을 담당하기에 적합하다고 인정되어 의장으로 선임됐습니다.
사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 4 | - | - | - | - |
나. 중요 의결사항
| 개최일자 | 의 안 내 용 | 의결 현황 | 사내이사 | 기타비상무이사 | ||||
| 강창율 | 정세현 (*1) | 김유경 | 김민수 (*2) | 이정화 (*3) | 곽의종 | |||
| (출석률:100%) | (출석률:100%) | (출석률:100%) | (출석률:100%) | (출석률:50%) | (출석률:38%) | |||
| 찬 반 여 부 | ||||||||
| 2024.02.19 | 제1호 의안 : 질권 설정의 건 | 가결 | 찬성 | 찬성 | 찬성 | - | 불참 | 불참 |
| 2024.03.07 | ※ 보고사항 ① 감사의 감사보고 ② 내부회계관리제도 운영실태 보고 ③ 내부회계관리제도 운영실태 평가보고 제1호 의안 : 제18기 재무제표 승인의 건 제2호 의안 : 제18기 영업보고서 승인의 건 제3호 의안 : 전자투표 도입의 건 제4호 의안 : 정관 일부 변경의 건 제4-1호 의안 : 정관 제2조 "목적" 추가의 건 제4-2호 의안 : 정관 제10조 "신주인수권" 일부 변경의 건 제4-3호 의안 : 정관 제39조의2 "이사의 책임감경" 신설의 건 제5호 의안 : 직원 주식매수선택권 부여 취소의 건 제6호 의안 : 직원 주식매수선택권 부여의 건 제7호 의안 : 임원 주식매수선택권 부여의 건 제8호 의안 : 사내이사 후보자 김민수 추천의 건 제9호 의안 : 임원보수규정 일부 변경의 건 제10호 의안 : 제18기 정기주주총회 소집의 건 제11호 의안 : 제18기 정기주주총회 회의 목적사항 결정의 건 |
가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 |
찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 찬성 |
|
| 2024.03.07 | 제1호 의안 : 타법인 주식취득 결정의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | |
| 2024.03.12 | 제1호 의안 : 소규모합병 계약 체결 승인의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | 불참 | |
| 2024.03.28 | 제1호 의안 : 임원 보수 지급의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | - |
찬성 |
| 2024.04.11 | 제1호 의안 : 소규모합병 승인의 건 | 가결 | 찬성 | - - |
찬성 | 찬성 | 불참 | |
| 2024.05.14 | 제1호 의안 : 합병경과 보고 및 공고의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | ||
| 2024.05.24 | 제1호 의안 : 유상증자 신주발행의 관한 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | ||
| 2024.05.24 | 제1호 의안 : 주식매수선택권 부여 취소의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | ||
| 2024.05.31 | 제1호 의안: 지점설치의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | ||
| 2024.06.11 | 제1호 의안: 유상증자 신주발행에 관한 내용 정정의 건 (일정변경 및 대표주관회사 사명변경) |
가결 | 찬성 | 찬성 | 찬성 | 불참 | ||
| 2024.07.01 | 제1호 의 안 : 제1회 무기명식 이권부 무보증 사모사채 발행의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | ||
| 2024.10.28 | 제1호 의 안 : 지점 이전의 건 제2호 의 안 : 직원 주식매수선택권 부여 취소의 건 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
불참 불참 |
||
(*1) 사내이사 정세현은 2024년 4월 1일 일신상의 이유로 사임하였습니다.
(*2) 2024년 3월 28일 개최된 제18기 정기주주총회에서 사내이사 김민수가 신규 선임 되었습니다.
(*3) 기타비상무이사 이정화는 2024년 3월 23일 임기만료로 사임하였습니다.
다. 이사회 내의 위원회 구성
당사는 본 보고서 작성기준일 현재 이사회 내의 위원회를 구성하고 있지 않습니다.
라. 이사의 독립성
당사의 이사는 주주총회에서 선임하며, 주주총회에서 선임할 이사 후보자는 이사회에서 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다. 이사의 선임과 관련하여 관련 법규에 의거한 주주제안이 있는 경우 이사회는 적법한 범위 내에서 이를 주주총회에 의안으로 제출하고 있습니다.
당사의 본 보고서 작성기준일 현재 이사 현황은 다음과 같습니다.
| 직명 | 성명 | 임기 | 연임 여부 |
연임 횟수 |
선임배경 | 추천인 | 활동분야 | 회사와의 거래 | 최대주주 또는 주요 주주와의 관계 |
|---|---|---|---|---|---|---|---|---|---|
| 사내이사 (대표이사) |
강창율 | 2026.03.28 | 해당 | 2회 | 셀리드 설립자이자 면역학 분야 최고 권위자로서 폭넓은 경험과 역량을 바탕으로 당사 파이프라인 상용화 등 경영을 총괄하며 회사 발전에 중요한 역할을 할 것으로 판단 | 이사회 | 경영총괄 | 해당없음 | 최대주주 |
| 사내이사 | 김유경 | 2026.03.28 | 미해당 | - | 셀리드의 GMP센터 생산본부장이며, 전문가로서의 지식과 풍부한 경험을 기반으로 본격적인 CMO 및 CDMO 사업 확장에 기여할 것으로 판단 | 이사회 | GMP센터 생산본부 |
해당없음 | 등기임원 |
| 사내이사 | 김민수 | 2027.03.27 | 미해당 | - | 회계, 총무 등 재무분야의 경험과 이해도를 기반으로 당사의 안정적인 경영관리에 기여할 것으로 판단 | 이사회 | 경영지원 | 해당없음 | 등기임원 |
| 기타비상무이사 | 곽의종 | 2026.03.28 | 미해당 | - | SK케미칼 신약연구실장, (주)파마킹 사장, 삼일제약(주) 사장 등을 역임하는 등 바이오 산업에 대한 높은 이해도와 전문성을 보유하고 있으며, 전문가로서의 식견과 역량을 발휘하여 당사 경쟁력 제고에 기여할 것으로 판단 | 이사회 | 경영자문 | 해당없음 | 등기임원 |
(*1) 본 보고서 제출일 현재 정세현 사내이사는 일신상의 이유로 2024.04.01 사임하였습니다.
(*2) 2024년 3월 28일 개최된 제18기 정기주주총회에서 사내이사 김민수가 신규 선임 되었습니다.
(*3) 기타비상무이사 이정화는 2024년 3월 23일 임기만료로 사임하였습니다.
마. 사외이사의 전문성
1) 사외이사 지원 조직
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
2) 교육실시 현황
사외이사 교육실시 현황
| 교육일자 | 교육실시주체 | 참석 사외이사 | 불참시 사유 | 주요 교육내용 |
|---|---|---|---|---|
| - | - | - | - | - |
| - | - | - | - | - |
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
2. 감사제도에 관한 사항
1) 감사의 인적사항
| 성명 | 주요 경력 | 결격요건 여부 | 비고 |
|---|---|---|---|
| 박명환 |
- 서울대학교 약학 학사('73.03~'77.02) - 서울대학교 약학 석사('77.03~'79.02) - 서울대학교 약학 박사('79.03~'85.02) - (주)대웅제약 연구소장('92.07~'99.06) - (재)경기바이오센터 총괄본부장('06.10~'10.06) - 엔젤코리아 대표('14.05~현재) |
해당사항 없음 | 비상근 |
2) 감사의 독립성
감사는 이사회에 참석하여 독립적으로 이사의 업무를 감독할 수 있으며, 제반 업무와 관련하여 관련 장부 및 관계 서류의 제출을 해당 부서에 요구할 수 있습니다. 또한, 필요시 당사로부터 영업에 관한 사항을 보고 받을 수 있으며, 적절한 방법으로 경영정보에 접근할 수 있습니다.
3) 감사의 주요 활동내용
| 개최일자 | 의 안 내 용 | 가결 여부 | 감사 |
| 박명환 | |||
| (출석률:38%) | |||
| 2024.02.19 | 제1호 의안 : 질권 설정의 건 | 가결 | 불참 |
| 2024.03.07 | ※ 보고사항 ① 감사의 감사보고 ② 내부회계관리제도 운영실태 보고 ③ 내부회계관리제도 운영실태 평가보고 제1호 의안 : 제18기 재무제표 승인의 건 제2호 의안 : 제18기 영업보고서 승인의 건 제3호 의안 : 전자투표 도입의 건 제4호 의안 : 정관 일부 변경의 건 제4-1호 의안 : 정관 제2조 "목적" 추가의 건 제4-2호 의안 : 정관 제10조 "신주인수권" 일부 변경의 건 제4-3호 의안 : 정관 제39조의2 "이사의 책임감경" 신설의 건 제5호 의안 : 직원 주식매수선택권 부여 취소의 건 제6호 의안 : 직원 주식매수선택권 부여의 건 제7호 의안 : 임원 주식매수선택권 부여의 건 제8호 의안 : 사내이사 후보자 김민수 추천의 건 제9호 의안 : 임원보수규정 일부 변경의 건 제10호 의안 : 제18기 정기주주총회 소집의 건 제11호 의안 : 제18기 정기주주총회 회의 목적사항 결정의 건 |
가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 |
참석 |
| 2024.03.07 | 제1호 의안 : 타법인 주식취득 결정의 건 | 가결 | 참석 |
| 2024.03.12 | 제1호 의안 : 소규모합병 계약 체결 승인의 건 | 가결 | 불참 |
| 2024.03.28 | 제1호 의안 : 임원 보수 지급의 건 | 가결 | 참석 |
| 2024.04.11 | 제1호 의안 : 소규모합병 승인의 건 | 가결 | 불참 |
| 2024.05.14 | 제1호 의안 : 합병경과 보고 및 공고의 건 | 가결 | 불참 |
| 2024.05.24 | 제1호 의안 : 유상증자 신주발행의 관한 건 | 가결 | 참석 |
| 2024.05.24 | 제1호 의안 : 주식매수선택권 부여 취소의 건 | 가결 | 참석 |
| 2024.05.31 | 제1호 의안: 지점설치의 건 | 가결 | 불참 |
| 2024.06.11 | 제1호 의안: 유상증자 신주발행에 관한 내용 정정의 건(일정변경 및 대표주관회사 사명변경) | 가결 | 불참 |
| 2024.07.01 | 제1호 의 안 : 제1회 무기명식 이권부 무보증 사모사채 발행의 건 | 가결 | 불참 |
| 2024.10.28 | 제1호 의 안 : 지점 이전의 건 제2호 의 안 : 직원 주식매수선택권 부여 취소의 건 |
가결 | 불참 |
감사 교육 미실시 내역
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | 감사의 경력사항을 고려할 때, 감사 업무를 수행하는데 필요한 경험과 지식을 충분히 보유하고 있어 별도의 교육에 대한 필요성이 발생하지 않음으로 인해 미실시하였으나, 향후 교육에 대한 필요성 발생 시에는 교육계획을 수립하여 적정한 교육을 실시할 계획입니다. |
5) 감사 지원조직 현황
당사는 감사의 직무수행을 보조하기 위한 별도의 지원조직을 갖추고 있지 않으나, 필요할 경우 경영지원실에서 감사의 직무수행 관련 업무를 보조하고 있습니다.
다. 준법지원인 등
당사는 본 보고서 작성기준일 현재 선임된 준법지원인이 없습니다.
3. 주주총회 등에 관한 사항
투표제도 현황
| (기준일 : | 2024.12.31 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 도입 |
| 실시여부 | 미실시 | 미실시 | 제18기(23년도) 정기주총 실시 제19기 (24년도) 정기주총 실시 |
주1) 당사는 상법 제368조의 4에 의거하여 2024년 3월 7일, 2025년 2월 26일 각각 이사회 결의를 통해 전자투표제도를 도입하였으며, 2024년 3월 28일 제18기 정기주주총회에서 실시하였으며, 2025년 3월 26일 제19기 정기주총에서 실시할 예정입니다. 이에 대한 관리 업무는 한국예탁결제원에 위탁하였습니다.
주2) 당사는 제18기 정기주주총회에서 직접교부, 우편 또는 모사전송, 인터넷 홈페이지 등에 위임장 용지 게시 등의 방법으로 의결권 대리행사 권유를 실시하였습니다.
주3) 제19기 정기주주총회에서 직접교부, 우편 또는 모사전송, 인터넷 홈페이지 등에 위임장 용지 게시 등의 방법으로 의결권 대리행사 권유를 실시할 예정입니다.
나. 소수주주권
당사는 본 보고서 작성기준일 현재까지 소수주주권의 행사사실이 존재하지 않습니다.
다. 경영권 경쟁
당사는 본 보고서 작성기준일 현재까지 경영권과 관련하여 경쟁이 발생한 사실이 없습니다.
라. 의결권 현황
의결권 현황
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 21,102,977 | - |
| 우선주 | - | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 21,102,977 | - |
| 우선주 | - | - |
마. 주식사무
| 구분 | 내용 | ||
|---|---|---|---|
| 정관상 신주인수권의 내용 |
제10조(신주인수권) ② 회사는 제1항의 규정에도 불구하고 다음 각 호의 경우에는 이사회 결의로 특정한 자(이 회사의 주식을 소유한 자를 포함한다.)에게 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 상법 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4. 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 중소기업 창업지원법에 의한 중소기업 창업투자회사에 총 발행주식의 30%까지 배정하는 경우 6. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산, 판매, 자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 8. 회사가 주권을 유가증권시장이나 코스닥시장에 신규상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 ③ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. |
||
| 결산일 | 12월 31일 | 정기주주총회 | 사업연도 종료 후 3월 이내 |
| 주주명부폐쇄시기 | 매년 1월 1일 부터 1월 31일 까지 | ||
| 주권의 종류 | 1주권, 5주권, 10주권, 50주권, 100주권, 500주권, 1,000주권 및 10,000주권의 8종류 | ||
| 명의개서대리인 (국민은행 증권대행부) |
제14조(명의개서대리인) ② 명의개서대리인 및 그 영업소와 대행업무의 범위는 이사회의 결의로 정한다. ③ 회사는 주주명부 또는 그 복본을 명의개서대리인의 사무취급장소에 비치하고, 주식의 명의개서, 질권의 등록 또는 말소, 신탁재산의 표시 또는 말소, 주권의 발행, 신고의 접수, 기타 주식에 관한 사무는 명의개서대리인으로 하여금 취급케 한다. ④ 제3항의 사무취급에 관한 절차는 명의개서대리인의 증권명의개서대행 업무규정에 따른다. |
||
| 공고방법 | 제4조(공고방법) 회사의 공고는 회사의 인터넷 홈페이지(http://www.cellid.co.kr)에 한다. 다만, 전산장애 또는 그 밖의 부득이한 사유로 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시내에서 발행되는 매일경제신문에 한다. |
||
바. 주주총회 의사록 요약
| 개최일자 | 구분 | 의안 | 결의내용 | 주요 논의 내용 | 비 고 |
| 2022.03.23 | 정기 | 제1호 제16기 재무제표 승인의 건 제2호 정관 일부 변경의 건 제2-1호 정관 제2조 "목적" 일부 변경의 건 제2-2호 정관 제 8의 2 "주식 등의 전자등록" 일부 변경의 건 제2-3호 정관 제47조 "감사의 선임" 일부 변경의 건 제3호 감사 선임의 건 제4호 직원주식매수선택권 승인의 건 제5호 이사 보수한도 승인의 건 제6호 감사 보수한도 승인의 건 |
가결 가결 가결 가결 가결 가결 가결 가결 |
- 주주제안 없음 - 안건 수정사항 없음 |
- |
| 2023.03.29 | 정기 | 제1호 제17기 재무제표 승인의 건 제2호 사내이사 선임의 건 제2-1호 사내이사 강창율 선임의 건 제2-2호 사내이사 정세현 선임의 건 제2-3호 사내이사 김유경 선임의 건 제3호 기타비상무이사 곽의종 선임의 건 제4호 직원 주식매수선택권 부여 승인의 건 제5호 이사 보수한도 승인의 건 제6호 감사 보수한도 승인의 건 |
가결 가결 가결 가결 가결 가결 가결 가결 |
- 주주제안 없음 - 안건 수정사항 없음 |
- |
| 2024.03.28 | 정기 |
제1호 의안: 제18기 재무제표(결손금처리계산서 포함) 승인의 건 제8호 의안: 임원보수규정 일부 변경 승인의 건 |
가결 가결 가결 가결 가결 가결 가결 가결 가결 가결 |
- 주주제안 없음 - 안건 수정사항 없음 |
- |
| 2025.03.26 | 정기 |
제1호 의안: 제19기 재무제표(결손금처리계산서 포함) 승인의 건 |
가결 가결 가결 가결 |
- 주주제안 없음 - 안건 수정사항 없음 |
- |
VI. 주주에 관한 사항
가. 최대주주 및 그 특수관계인의 주식소유 현황
1) 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2025년 04월 14일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 강창율 | 본인 | 보통주 | 2,015,040 | 14.81 | 2,271,523 | 10.76 | 유상신주취득 |
| 오양희 | 모 | 보통주 | 0 | 0 | 3,888 | 0.02 | 유상신주취득 |
| 강복자 | 남매 | 보통주 | 99,500 | 0.73 | 123,500 | 0.59 | 유상신주취득 |
| 강수언 | 남매 | 보통주 | 111,500 | 0.82 | 175,269 | 0.83 | 유상신주취득 |
| 강미자 | 남매 | 보통주 | 106,000 | 0.78 | 114,200 | 0.54 | 유상신주취득 |
| 강창익 | 형제 | 보통주 | 72,000 | 0.53 | 77,214 | 0.37 | 유상신주취득 |
| 강동민 | 자 | 보통주 | 100,000 | 0.74 | 100,000 | 0.47 | - |
| 이영윤 | 처 | 보통주 | 5,000 | 0.04 | 5,000 | 0.02 | - |
| 이정화 | 매부 | 보통주 | 74,407 | 0.55 | 123,635 | 0.59 | 유상신주취득 |
| 이효진 | 조카 | 보통주 | 24,500 | 0.18 | 35,694 | 0.17 | 유상신주취득 |
| 이혜진 | 조카 | 보통주 | 22,500 | 0.17 | 22,500 | 0.11 | 유상신주취득 |
| 장경숙 | 형수 | 보통주 | 31,856 | 0.23 | 27,856 | 0.13 | - |
| 김종철 | 매부 | 보통주 | 40,752 | 0.3 | 47,745 | 0.23 | 유상신주취득 |
| 김태훈 | 조카 | 보통주 | 15,212 | 0.11 | 15,232 | 0.07 | - |
| 김아름 | 질부 | 보통주 | 600 | 0 | 600 | 0.00 | - |
| 김태우 | 조카 | 보통주 | 27,000 | 0.2 | 29,622 | 0.14 | 유상신주취득 |
| 강동현 | 조카 | 보통주 | 21,000 | 0.15 | 20,000 | 0.09 | - |
| 강현정 | 조카 | 보통주 | 21,700 | 0.16 | 17,700 | 0.08 | - |
| 김경민 | 조카 | 보통주 | 23,400 | 0.17 | 21,000 | 0.10 | - |
| 김주희 | 조카 | 보통주 | 25,000 | 0.18 | 26,447 | 0.13 | - |
| 강재훈 | 종손 | 보통주 | 500 | 0.01 | 776 | 0.00 | 유상신주취득 |
| 김유경 | 임원 | 보통주 | 1,000 | 0.01 | 1,661 | 0.01 | 유상신주취득 |
| 곽의종 | 임원 | 보통주 | 12,044 | 0.09 | 20,012 | 0.09 | 유상신주취득 |
| 계 | 보통주 | 2,850,511 | 20.96 | 3,281,074 | 15.55 | (주1) | |
| 우선주 | - | - | - | - | - | ||
주1) 2024년 8월 23일 주주배정 유상증자에 따른 신주 상장으로 총 유통주식수가 증가되어 지분율이 변경되었습니다.
주2) 본 보고서 제출일 현재 최대주주 및 특관자의 주식수량이 일부 변동이 있습니다. 자세한 사항은 2025년 2월 7일 기 제출한 주식등의대량보유상황보고서(일반), 임원ㆍ주요주주특정증권등소유상황보고서를 참조하시기 바랍니다.
2) 최대주주 주요경력
| 성명 (생년월일) |
직책 | 주요 경력 | 비고 |
|---|---|---|---|
| 강창율 (1954.11.28) |
대표이사 |
[주요 경력] [주요 수상 실적] - GITR drives TH9-mediated antitumor immunity. Oncoimmunology (5(5):e1122862), 2016 - Characterization of age-associated exhausted CD8+ T cells defined by increased expression of Tim-3 and PD-1. 2016 - A multimeric carcinoembryonic antigen signal inhibits the activation of human T cells by a SHP-independent mechanism: a potential mechanism for tumor-mediated suppression of T-cell immunity. International Journal of Cancer (1;136(11):2579-87), 2015. - Tumore-derived osteopontin suppresses antitumor immunity by promoting extramedullary myelopoiesis. Cancer Research (15;74(22):6705-6716), 2014. - Tumor microenvironmental conversion of natural killer cells into myeloid-derived suppressor cells. Cancer Research (15;73(18):5669-5681), 2013.
|
- |
나. 최대주주 변동현황
최대주주 변동내역
| (기준일 : | 2025년 04월 14일 | ) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| - | - | - | - | - | - |
(주) 당사는 2006년 설립 이후 최대주주의 변동이 없습니다.
다. 주식의 분포
1) 5% 이상 주주와 우리사주조합 등의 주식 소유현황
주식 소유현황
| (기준일 : | 2025년 04월 14일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 강창율 | 2,271,523 | 10.76 | - |
| - | - | - | - | |
| 우리사주조합 | 300 | 0.00 | - | |
소액주주현황
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 34,080 | 34,082 | 99.99 | 18,463,758 | 21,102,977 | 87.45 | - |
(주) 상기 소액주주 현황은 기업공시서식 작성기준에 따라 2023년 12월 31일 현재의 소액주주 현황을 기재하였습니다.
라. 주가 및 주식거래실적
당사의 최근 6개월간 국내 주가 및 거래량은 다음과 같습니다.
| (단위: 원, 주) |
| 종 류 | 2024년 10월 | 2024년 11월 | 2024년 12월 | 2025년 01월 | 2025년 02월 | 2025년 03월 | |
| 보통주 | 최고 | 5,930 | 6,990 | 6,560 | 6,010 | 5,020 | 4,565 |
| 최저 | 4,465 | 3,940 | 4,975 | 5,000 | 4,555 | 3,340 | |
| 평균 | 5,168 | 5,281 | 5,539 | 5,489 | 4,756 | 3,896 | |
| 최고 일거래량 | 9,176,457 | 12,467,176 | 10,280,342 | 3,246,847 | 1,856,147 | 930,185 | |
| 최저 일거래량 | 410,483 | 475,427 | 356,011 | 199,787 | 184,765 | 124,108 | |
| 월간 거래량 | 1,551,142 | 3,590,881 | 1,857,884 | 845,109 | 440,700 | 321,988 | |
(주) 상기 주가는 종가 기준입니다.
(주) 월간 거래량은 월간 평균 거래량입니다.
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원의 현황
임원 현황
| (기준일 : | 2025년 04월 14일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 강창율 | 남 | 1954.11 | 대표이사 | 사내이사 | 상근 | 경영총괄 |
- 서울대학교 약학 학사, 석사 면역학 박사 La Jolla, California Scientist Ⅲ |
2,271,523 | - | 본인 |
10년 10개월 |
2026.03.28 |
| 김유경 | 여 | 1974.02 | 상무 | 사내이사 | 상근 | GMP 센터생산본부장 | - 충남대학교 미생물학과 학사 - 식약처 바이오정책과 GMP 조사관 - ㈜한미약품 팔탄플랜트 생산총괄 팀장 - (現) ㈜셀리드 GMP센터 생산본부장 |
1,661 | - | 등기임원 |
3년 7개월 |
2026.03.28 |
| 한범수 | 남 | 1969.10 | 이사 | 미등기 | 상근 | GMP센터 기술본부장 |
- 아주대학교 기계공학 석사 MEU팀 총괄이사 |
2,000 | - | - |
5년 5개월 |
- |
| 김민수 | 남 | 1974.05 | 상무 | 사내이사 | 상근 | 경영지원실장 | - 중앙대학교 경영학 학사 - ㈜한섬 회계팀 과장 - ㈜한미반도체 총무지원부 팀장 - 크리스에프앤씨 관리부 부장 - (現) ㈜셀리드 경영지원실장 |
- | - | 등기임원 |
5년 4개월 |
2027.03.27 |
| 곽의종 | 남 | 1955.03 |
기타 비상무이사 |
기타비상무이사 | 비상근 | 경영자문 | - 서울대학교 약학 학사, 석사, 박사 - SK케미칼(주) 신약연구실장 - (주)파마킹 사장 - (주)삼일제약 사장 - (現) (주)GH 제조책임자 - (現) ㈜셀리드 기타비상무이사 |
20,012 | - | 등기임원 |
2년 1개월 |
2026.03.28 |
| 박명환 | 남 | 1955.07 | 감사 | 감사 | 비상근 | 감사 |
- 서울대학교 약학 학사, 석사, 박사 - ㈜대웅제약 연구소장 - (재)경기바이오센터 총괄 본부장 - (現) 엔젤코리아 대표 |
- | - | 등기임원 |
6년 1개월 |
2025.03.22 |
등기임원 선임 후보자 및 해임 대상자 현황
| (기준일 : | 2024년 12월 31일 | ) |
| 구분 | 성명 | 성별 | 출생년월 | 사외이사 후보자 해당여부 |
주요경력 | 선ㆍ해임 예정일 |
최대주주와의 관계 |
|---|---|---|---|---|---|---|---|
| 선임 | 박명환 | 남 | 1955년 07월 | 해당없음 |
- 서울대학교 약학 학사, 석사, 박사 - ㈜대웅제약 연구소장 - (재)경기바이오센터 총괄 본부장 - (現) 엔젤코리아 대표 |
2025.03.26 | 관계없음 |
나. 직원 등의 현황
1. 직원 등 현황
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 천원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 전사 | 남 | 24 | - | 3 | - | 27 | 3년 1개월 |
1,408,226 |
51,032 | - | - | - | - |
| 전사 | 여 | 26 | - | 3 | - | 29 | 2년 3개월 |
1,271,272 |
42,722 | - | |||
| 합 계 | 50 | - | 6 | - | 56 | 2년 6개월 |
2,679,498 |
46,674 | - | ||||
(주1) 연간급여 총액 및 1인평균 급여액은「소득세법」제20조에 따라 관할 세무서에 제출하는 근로소득지급명세서의 근로소득공제 반영 전 급여이며, 사업연도 개시일로부터 공시작성대상기준일(1월~12월)까지를 기준으로 작성하였습니다.
(주2) 직원수는 기준일 현재 등기임원을 제외한 재직자 기준이며, 평균 근속연수는 중도입사자를 포함하여 산정하였습니다.
2. 육아지원제도 사용 현황
| (단위: 명, %) | |||
| 구분 | 당기(19기) | 전기(18기) | 전전기(17기) |
| 육아휴직 사용자수(남) | 1 | 1 | - |
| 육아휴직 사용자수(여) | 1 | 1 | - |
| 육아휴직 사용자수(전체) | 2 | 2 | - |
| 육아휴직 사용률(남) | 100% | 100% | - |
| 육아휴직 사용률(여) | 100% | 100% | - |
| 육아휴직 사용률(전체) | 100% | 100% | - |
| 육아휴직 복귀 후 12개월 이상 근속자(남) |
- | - | - |
| 육아휴직 복귀 후 12개월 이상 근속자(여) |
- | - | - |
| 육아휴직 복귀 후 12개월 이상 근속자(전체) |
- | - | - |
| 육아기 단축근무제 사용자 수 | - | - | - |
| 배우자 출산휴가 사용자 수 | 1 | - | - |
※ 육아휴직 사용률 계산법 산식 : (당해 출산 이후 1년 이내에 육아휴직을 사용한 근로자)/(당해 출생일로부터 1년 이내의 자녀가 있는 근로자)
3. 유연근무제도 사용 현황
| (단위: 명) | |||
| 구분 | 당기(19기) | 전기(18기) | 전전기(17기) |
| 유연근무제 활용 여부 | - | - | - |
| 시차출퇴근제 사용자 수 (주1) | 58 | 60 | 70 |
| 선택근무제 사용자 수 | - | - | - |
| 원격근무제(재택근무 포함) 사용자 수 |
- | - | - |
(주1) 전직원이 시차출퇴근제를 사용하고 있습니다.
4. 미등기임원 보수 현황
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 천원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 1 | 89,733 | 89,733 | - |
(주1) 인원수는 기준일 현재 재직자 기준입니다.
(주2) 연간급여 총액 및 1인평균 급여액은 소득세법 제20조에 따라 관할 세무서에 제출하는 근로소득지급명세서의 근로소득공제 반영 전 급여이며, 사업연도 개시일로부터 공시작성대상기준일(1월~12월)까지를 기준으로 작성하였습니다.
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
1. 주주총회 승인금액
| (단위 : 천원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 4 | 2,000,000 | - |
| 감사 | 1 | 100,000 | - |
(주1) 인원수는 기업공시서류 작성기준일 현재 재직자 기준입니다.
2. 보수지급금액
2-1. 이사ㆍ감사 전체
| (단위 : 천원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 5 | 670,907 | 95,843 | - |
(주1) 인원수는 기업공시서류 작성기준일 현재 재직자 기준입니다.
(주2) 보수총액은 소득세법 제20조의 근로소득을 기준으로 기재하고, 소득세법 제21조(기타소득) 또는 제22조(퇴직소득)에 따라 산정된 기타소득이나 퇴직소득이 있는 경우 이를 합산하여 산출하였으며, 사업연도 개시일로부터 공시작성대상기준일(1월~12월)까지를 기준으로 작성하였습니다.
(주3) 보수총액과 1인 평균 급여액은 사임및 임기만료로 퇴임한 등기임원 2명도 포함한 금액입니다.
2-2. 유형별
| (단위 : 천원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
4 | 658,907 | 109,817 | (주1)(주3) |
| 사외이사 (감사위원회 위원 제외) |
- | - | - | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 12,000 | 12,000 | (주1) |
(주1) 인원수는 작성기준일 현재 재직자 기준입니다.
(주2) 보수총액은 소득세법 제20조의 근로소득을 기준으로 기재하고, 소득세법 제21조(기타소득) 또는 제22조(퇴직소득)에 따라 산정된 기타소득이나 퇴직소득이 있는 경우 이를 합산하여 산출하였으며, 사업연도 개시일로부터 공시작성대상기준일(1월~12월)까지를 기준으로 작성하였습니다.
(주3) 보수총액과 1인 평균 급여액은 사임및 임기만료로 퇴임한 등기임원 2명도 포함한 금액입니다.
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
2. 산정기준 및 방법
| (단위 : 원) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
2. 산정기준 및 방법
| (단위 : 원 ) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
<주식매수선택권의 부여 및 행사현황>
<표1>
| (단위 : 원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
3 | 156,404,425 | (주1) (주2) |
| 사외이사 (감사위원회 위원 제외) |
- | - | - |
| 감사위원회 위원 또는 감사 | - | - | - |
| 업무집행지시자 등 | 2 | 50,934,664 | (주1) (주2) |
| 계 | 6 | 207,339,089 | - |
(주1) 당해 사업연도에 주식매수선택권과 관련하여 계상된 비용입니다.
(주2) 상기 주식매수선택권의 공정가치 산출방법은 재무제표 주석 25. 주식기준보상을 참고하시기 바랍니다.
(주3) 부여받은 인원수는 2024년 재직자를 기준으로 작성했습니다.
<표2>
| (기준일 : | 2025년 04월 14일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 정세현 | 퇴직자 | 2020.02.25 | 신주교부 | 보통주 | 36,651 | - | - | - | - | 36,651 | 23.02.26~28.02.25 | 12,441 | X | - |
| 한범수 | 미등기임원 | 2020.02.25 | 신주교부 | 보통주 | 9,162 | - | - | - | - | 9,162 | 23.02.26~28.02.25 | 12,441 | X | - |
| 김민수 | 등기임원 | 2020.02.25 | 신주교부 | 보통주 | 9,162 | - | - | - | - | 9,162 | 23.02.26~28.02.25 | 12,441 | X | - |
| 직원 3명 | 직원 | 2020.08.12 | 신주교부 | 보통주 | 26,240 | - | - | - | 5,000 | 21,240 | 23.08.13~28.08.12 | 17,606 | X | - |
| 직원 4명 | 직원 | 2021.02.24 | 신주교부 | 보통주 | 20,642 | - | - | - | 3,006 | 17,636 | 24.02.25~29.02.24 | 19,665 | X | - |
| 직원 1명 | 직원 | 2021.06.11 | 신주교부 | 보통주 | 9,009 | - | 2,749 | - | 2,749 | 6,260 | 24.06.12~29.06.11 | 51,314 | X | - |
| 옥창민 | 퇴직자 | 2021.10.22 | 신주교부 | 보통주 | 20,683 | - | - | - | - | 20,683 | 23.10.23~28.10.22 | 41,769 | X | - |
| 김유경 | 등기임원 | 2021.10.22 | 신주교부 | 보통주 | 14,478 | - | - | - | - | 14,478 | 23.10.23~28.10.22 | 41,769 | X | - |
| 권현수 | 퇴직자 | 2022.02.23 | 신주교부 | 보통주 | 13,634 | - | - | - | - | 13,634 | 24.02.24~29.02.23 | 18,943 | X | - |
| 직원 3명 | 직원 | 2022.02.23 | 신주교부 | 보통주 | 14,680 | - | 1,946 | - | 4,946 | 9,734 | 24.02.24~29.02.23 | 18,943 | X | - |
| 옥창민 | 퇴직자 | 2022.05.20 | 신주교부 | 보통주 | 2,600 | - | 2,600 | - | 2,600 | - | 24.05.21~29.05.20 | 18,455 | X | - |
| 김유경 | 등기임원 | 2022.05.20 | 신주교부 | 보통주 | 3,692 | - | - | - | - | 3,692 | 24.05.21~29.05.20 | 12,995 | X | - |
| 직원 1명 | 직원 | 2022.05.20 | 신주교부 | 보통주 | 3,146 | - | 1,300 | - | 1,300 | 1,846 | 24.05.21~29.05.20 | 12,995 | X | - |
| 직원 2명 | 직원 | 2023.02.23 | 신주교부 | 보통주 | 8,150 | - | - | - | - | 8,150 | 25.02.24~30.02.23 | 7,765 | X | - |
| 권현수 | 퇴직자 | 2024.03.07 | 신주교부 | 보통주 | 3,000 | - | 3,000 | - | 3,000 | - | 26.03.08~31.03.07 | 4,305 | X | - |
| 한범수 | 미등기임원 | 2024.03.07 | 신주교부 | 보통주 | 4,445 | - | - | - | - | 4,445 | 26.03.08~31.03.07 | 3,874 | X | - |
| 직원 34명 | 직원 | 2024.03.07 | 신주교부 | 보통주 | 79,042 | - | 15,165 | - | 15,165 | 63,877 | 26.03.08~31.03.07 | 3,874 | X | - |
| 김민수 | 등기임원 | 2024.03.07 | 신주교부 | 보통주 | 11,112 | - | - | - | - | 11,112 | 26.03.08~31.03.07 | 3,874 | X | - |
| 김유경 | 등기임원 | 2024.03.28 | 신주교부 | 보통주 | 8,776 | - | - | - | - | 8,776 | 26.03.29~31.03.28 | 3,751 | X | - |
주1) 주주배정 유상증자로 인해 2024년 8월 23일 신주 750만주가 상장되어 기 부여된 주식매수선택권의 가격과 수량이 변동되었습니다.
※ 공시서류작성기준일(2025년 04월 14일) 현재 종가 : 3,380원
VIII. 계열회사 등에 관한 사항
계열회사 현황(요약)
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| - | - | - | - |
타법인출자 현황(요약)
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | - | - | - | - | - | - |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | - | - | - | - | - | - |
| 계 | - | - | - | - | - | - | - |
IX. 대주주 등과의 거래내용
가. 대주주 등에 대한 신용공여 등
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
나. 대주주와의 자산양수도 등
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
다. 대주주와의 영업거래
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
라. 대주주 이외의 이해관계자와의 거래
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
마. 기업인수목적회사의 추가기재사항
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
가. 대주주 등에 대한 신용공여 등
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
나. 대주주와의 자산양수도 등
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
다. 대주주와의 영업거래
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
라. 대주주 이외의 이해관계자와의 거래
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
마. 기업인수목적회사의 추가기재사항
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
2. 우발부채 등에 관한 사항
가. 중요한 소송사건
당사는 마곡산업단지 토지 취득과 관련하여 서울경제진흥원으로부터 320,284,843원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령취소 소송을 제넥신 등과 공동으로 진행하였고 2023년 9월 22일 1심 패소, 2024년 12월 18일 2심 패소 후 불복하기 위한 상고심을 준비 중입니다. 당기말 현재 동 소송의 전망은 예측할 수 없습니다.
당사는 당기말 현재 서울보증보험으로부터 316,668천원의 국가 지원사업에 따른 협약지원금 반환 지급보증 등의 보증을 제공받고 있습니다.
당사는 2023년 7월 7일 마곡 신사옥 및 R&D센터 신규시설 투자 목적으로 당사를 포함한 3개사와 컨소시엄을 구성하여 148,000,000천원(당사분 32,560,000천원)의 차입약정을 체결하였습니다. 또한 해당 차입금에 대하여 42,328,000천원(당사분 차입금액의 130%)의 채무보증을 실행하였으며, 부동산 담보(마곡 사옥 부지 및 성남에스케이브이1타워 14개호실에 대한 채권최고액 35,816,000천원)를 추가로 제공하였습니다.
나. 견질 또는 담보용 어음ㆍ수표 현황
견질 또는 담보용 어음ㆍ수표 현황
| (기준일 : 2024년 12월 31일 ) | (단위 : 매, 백만원) |
| 제 출 처 | 매 수 | 금 액 | 비 고 |
|---|---|---|---|
| 은 행 | - | - | - |
| 금융기관(은행제외) | - | - | - |
| 법 인 | - | - | - |
| 기타(개인) | - | - | - |
(주) 당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
다. 채무보증 현황
당사는 마곡산업단지 토지 취득과 관련하여 서울경제진흥원으로부터 320,284,843원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령취소 소송을 제넥신 등과 공동으로 진행하였고 2023년 9월 22일 1심 패소, 2024년 12월 18일 2심 패소 후 불복하기 위한 상고심을 준비 중입니다. 당기말 현재 동 소송의 전망은 예측할 수 없습니다.
당사는 당기말 현재 서울보증보험으로부터 316,668천원의 국가 지원사업에 따른 협약지원금 반환 지급보증 등의 보증을 제공받고 있습니다.
당사는 2023년 7월 7일 마곡 신사옥 및 R&D센터 신규시설 투자 목적으로 당사를 포함한 3개사와 컨소시엄을 구성하여 148,000,000천원(당사분 32,560,000천원)의 차입약정을 체결하였습니다. 또한 해당 차입금에 대하여 42,328,000천원(당사분 차입금액의 130%)의 채무보증을 실행하였으며, 부동산 담보(마곡 사옥 부지 및 성남에스케이브이1타워 14개호실에 대한 채권최고액 35,816,000천원)를 추가로 제공하였습니다.
라. 채무인수약정 현황
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
마. 그 밖의 우발채무 등
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
3. 제재 등과 관련된 사항
가. 제재현황
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
나. 한국거래소 등으로부터 받은 제재
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.다. 단기매매차익의 발생 및 반환에 관한 사항
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
당사는 2025년 3월18일 이사회 결의를 통해 주주배정후 실권주 일반공모 형태의 유상증자를 결의했습니다. 자세한 사항은 2025년 3월 18일 기 제출한 주요사항보고서를 참고하시기 바랍니다.
나. 중소기업기준 검토표
당사는 중소기업기본법에 의거 본 보고서 작성기준일 현재 중소기업에 해당합니다.
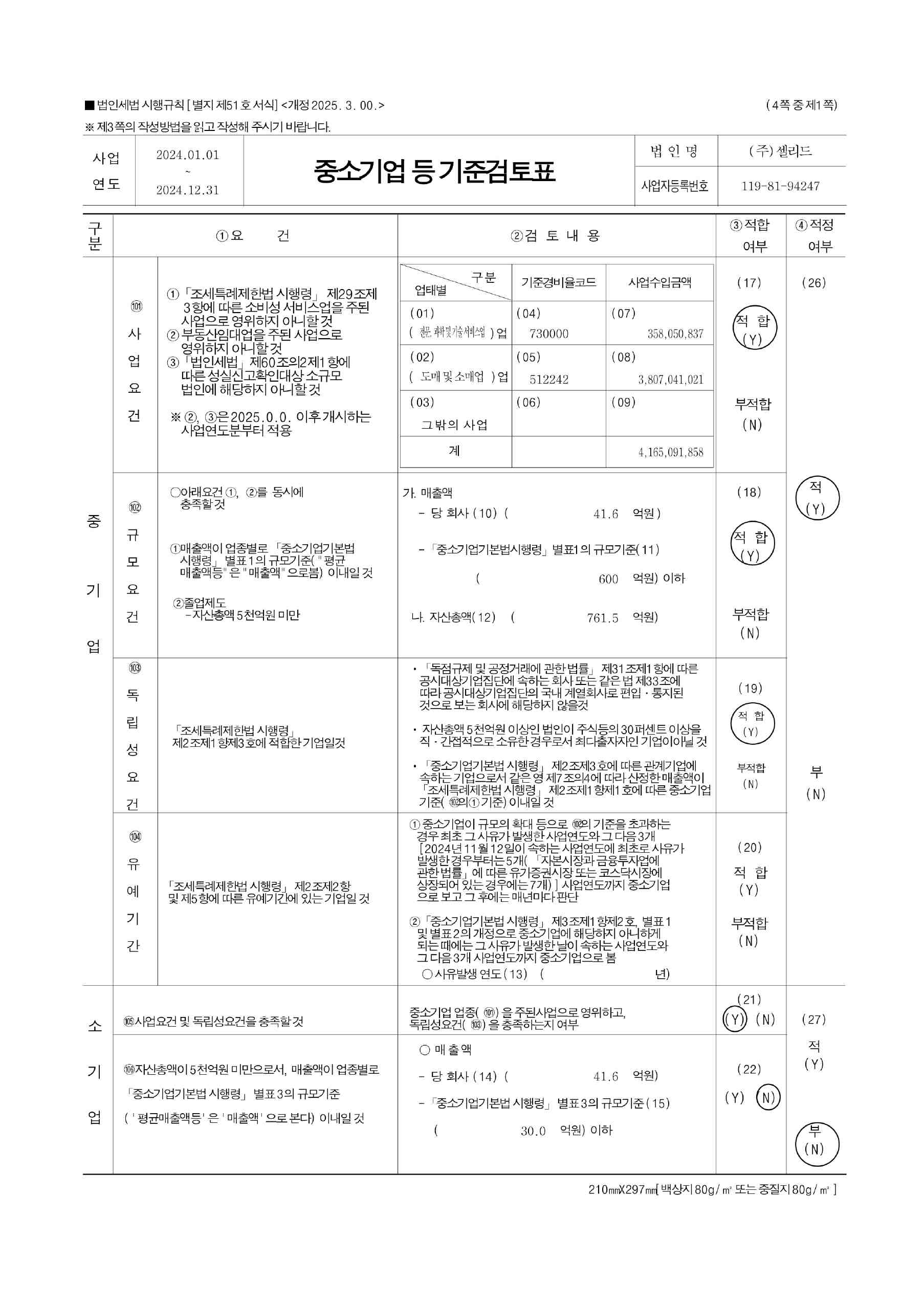 |
|
중소기업기준검토표_1 |
 |
|
중소기업기준검토표_2 |
다. 외국지주회사의 자회사 현황
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
라. 법적위험 변동사항
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
마. 합병 등의 사후정보
1) 합병
당사는 2024년 3월 12일 이사회 결의에 의거하여 주식회사 포베이커를 소규모 합병의 형태로 흡수합병을 결정하였습니다. 2024년 5월 14일을 합병기일로 하여 흡수합병을 완료하였습니다.
2) 합병의 내용
당사는 재무구조 개선 및 사업다각화를 위한 목적으로 100% 자회사인 주식회사 포베이커를 흡수합병하기로 2024년 3월 12일 이사회에서 결의하였습니다. 2024년 5월 14일을 합병기일로 하여 2024년 5월 21일(합병등기일)에 모든 합병절차가 완료되었습니다.
본 합병으로 인해 (주)셀리드의 경영권 변동에 미치는 영향은 없으며, 본 합병 완료 후 당사의 최대주주 변경도 없습니다. 합병비율은 (주)셀리드 : (주)포베이커 = 1:0이며, 본 합병으로 신주를 발행하지 않았으므로 발행주식 수 및 자본금의 변동은 없습니다.
자본시장과 금융투자업에 관한 법률 제 165조의4 및 동법 시행령 제176조의5 제7항 제2호 나목 단서에 의하여, 다른 회사의 발행주식총수를 소유하고 있는 회사가 그 다른 회사를 합병하면서 신주를 발행하지 않은 경우에는 합병가액의 적정성에 대한 외부평가기관의 평가를 받을 의무가 없는 바, 본 합병은 이에 해당하므로 위 규정에 따라 외부평가기관의 평가를 거치지 아니하였습니다.
3) 합병 일정
| 구 분 | 날짜 | 비고 | |
| 이사회 결의일 | 2024-03-12 | - | |
| 주주확정 기준일 설정 공고 | 2024-03-12 | - | |
| 합병계약일 | 2024-03-13 | - | |
| 주주확정 기준일 | 2024-03-27 | - | |
| 소규모합병 공고 | 2024-03-27 | - | |
| 합병반대의사 통지 접수기간 | 시작일 | 2024-03-27 | - |
| 종료일 | 2024-04-10 | - | |
| 합병승인 이사회 | 2024-04-11 | 주주총회 갈음 | |
| 채권자 이의제출 공고 | 2024-04-12 | - | |
| 채권자 이의제출 기간 | 시작일 | 2024-04-12 | - |
| 종료일 | 2024-05-13 | - | |
| 합병기일 | 2024-05-14 | - | |
| 합병종료보고 이사회 | 2024-05-14 | 주주총회 갈음 | |
| 합병종료보고 공고 | 2024-05-14 | - | |
| 합병등기신청일 | 2024-05-21 | - | |
본 합병과 관련한 상세 내용은 당사가 전자공시시스템(DART)에 2024년 3월 12일에공시한 주요사항보고서(회사합병결정)과, 2024년 5월 21일에 공시한 합병등종료보고서 (합병)을 참고하시기 바랍니다.
바. 정부의 인증 및 그 취소에 관한 사항
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
사. 조건부자본증권의 전환ㆍ채무재조정 사유 등의 변동현황
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
아. 보호예수 현황
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
자. 특례상장기업의 사후정보
매출액 미달에 대한 관리종목 지정유예 현황
(최근 사업연도 매출액 30억원 미만)
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 백만원) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|
| 사업연도 | 매출금액 | 해당여부 | 사유 | 종료시점 | |
| 2024년 | 4,165 | 미해당 | 미해당 | 당사는 2019년 2월 20일 코스닥 시장에 기술성장기업으로 상장하였습니다. 매출액 요건의 경우 신규 상장일이 속하는 사업연도를 포함한 5개 사업연도에 대해서는 관리종목 지정요건을 적용받지 않습니다. |
2023년 12월 31일 |
계속사업손실에 대한 관리종목 지정유예 현황
(자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속 사업손실 발생)
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 원, %) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | ||||
|---|---|---|---|---|---|---|
| 사업연도 | 법인세 차감전 계속사업손익(A) |
자기자본금액 (B) |
비율(A/B) | 해당 여부 |
종료 시점 |
|
| 2022년 | -22,864,575,136 | 22,438,888,800 | -101.89 | 미해당 | 미해당 | 2022년 12월 31일 |
| 2023년 | -11,611,435,383 | 43,659,134,771 | -26.60 | |||
| 2024년 | -12,259,048,237 | 51,203,097,973 | -23.94 | |||
XI. 상세표
1. 연결대상 종속회사 현황(상세)
| (단위 : 원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - |
2. 계열회사 현황(상세)
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | - | - | - |
| - | - |
3. 타법인출자 현황(상세)
| (기준일 : | 2024년 12월 31일 | ) | (단위 : 원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - | - | - | ||||
【 전문가의 확인 】
1. 전문가의 확인
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.
2. 전문가와의 이해관계
당사는 본 보고서 작성기준일 현재 해당 사항이 없습니다.