 |
|
대표이사 등의 확인(25.03.17) |
정 정 신 고 (보고)
| 2025년 03월 17일 |
| 1. 정정대상 공시서류 : | 투자설명서 |
| 2. 정정대상 공시서류의 최초제출일 : | 2025년 02월 07일 |
| 3. 정정사유 : | 최종 발행가액 확정에 따른 기재정정 |
| 4. 정정사항 |
| 항 목 | 정 정 전 | 정 정 후 |
|---|---|---|
| ※ 단순 오타 및 표현 수정 등은 별도의 색깔표시 없이 정정하였습니다. ※ 표지 및 인수인의 의견(분석기관의 평가의견)은 본문에 정정사항을 반영하였으며, 정오표를 별도로 기재하지 않았습니다. ※ 금번 정정사항은 최종 발행가액 확정에 따른 기재정정으로, 정정사항 확인의 편의를 위해 정정사항은 '굵은 초록색 글씨체'를 사용하여 기재하였습니다. |
||
| 요약정보 | ||
| 2. 모집 또는 매출에 관한 사항 | (주1) 정정 전 | (주1) 정정 후 |
| 제1부 모집 또는 매출에 관한 사항 | ||
| I. 모집 또는 매출에 관한 일반사항 | ||
| 1. 공모개요 | (주2) 정정 전 | (주2) 정정 후 |
| 4. 모집 또는 매출절차 등에 관한 사항 | (주3) 정정 전 | (주3) 정정 후 |
| III. 투자위험요소 - 1. 사업위험 | ||
| 사. 핵심인력 유출에 따른 위험 | (주4) 정정 전 | (주4) 정정 후 |
| III. 투자위험요소 - 2. 회사위험 | ||
| 가. 청약 등에 따른 최대주주 지분율 변동 및 경영권 안정성 관련 위험 | (주5) 정정 전 | (주5) 정정 후 |
| 라. 영업현금흐름 및 유동성 관련 위험 | (주6) 정정 전 | (주6) 정정 후 |
| 타. 금융감독원 공시 위반 관련 위험 | (주7) 정정 전 | (주7) 정정 후 |
| III. 투자위험요소 - 3. 기타위험 | ||
| 나. 증자방식, 청약절차에 대한 주의 및 주가하락 위험 | (주8) 정정 전 | (주8) 정정 후 |
| V. 자금의 사용목적 | (주9) 정정 전 | (주9) 정정 후 |
(주1) 정정 전
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 11,644,800 | 500 | 8,400 | 97,816,320,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 한국투자증권 | 보통주 | 11,644,800 | 97,816,320,000 | 인수수수료 : 모집총액의 1.5% 실권수수료 : 잔액인수금액의 15.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2025년 03월 19일 ~ 2025년 03월 20일 | 2025년 03월 27일 | 2025년 03월 21일 | 2025년 03월 27일 | 2025년 02월 12일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2024년 12월 21일 | 2025년 03월 14일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 운영자금 | 97,816,320,000 |
| 발행제비용 | 1,591,000,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | 주요사항보고서(유무상증자결정)-2025.02.10 |
| 【기 타】 | 1) 금번 (주)지아이이노베이션의 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 한국투자증권(주)입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것입니다. 대표주관회사는 주주배정후 실권주 일반공모 후 최종실권주를 잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 Ⅰ. 5. 인수 등에 관한 사항'을 참고하여 주시기 바랍니다. 대표주관회사인 한국투자증권(주)은 투자중개업자로서 타인의 계산으로 증권의 발행ㆍ인수에 대한 청약의 권유, 청약, 청약의 승낙 및 자본시장법 상의 증권의 인수업무를 수행합니다. 3) 상기 모집가액 및 발행제비용은 1차 발행가액으로 산정된 것으로 향후 변경될 수 있습니다. 확정가액은 청약일 전 제3거래일에 결정될 예정입니다. 4) 상기 청약기일은 구주주 청약 일정이며, 일반공모 청약은 2025년 03월 24일 ~ 2025년 03월 25일 2영업일간입니다. 5) 「증권 인수업무 등에 관한 규정」 제9조 제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니할 수 있습니다. 6) 금융감독원에서 본 증권신고서를 심사하는 과정에서 주요사항의 변동으로 인한 기재 내용의 정정 등으로 동 신고서에 기재된 일정이 변경될 수 있습니다. 7) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
(주1) 정정 후
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 11,644,800 | 500 | 9,550 | 111,207,840,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 한국투자증권 | 보통주 | 11,644,800 | 111,207,840,000 | 인수수수료 : 모집총액의 1.5% 실권수수료 : 잔액인수금액의 15.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2025년 03월 19일 ~ 2025년 03월 20일 | 2025년 03월 27일 | 2025년 03월 21일 | 2025년 03월 27일 | 2025년 02월 12일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2024년 12월 21일 | 2025년 03월 14일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 운영자금 | 111,207,840,000 |
| 발행제비용 | 1,790,000,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | 주요사항보고서(유무상증자결정)-2025.03.17 |
| 【기 타】 | 1) 금번 (주)지아이이노베이션의 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 한국투자증권(주)입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것입니다. 대표주관회사는 주주배정후 실권주 일반공모 후 최종실권주를 잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 Ⅰ. 5. 인수 등에 관한 사항'을 참고하여 주시기 바랍니다. 대표주관회사인 한국투자증권(주)은 투자중개업자로서 타인의 계산으로 증권의 발행ㆍ인수에 대한 청약의 권유, 청약, 청약의 승낙 및 자본시장법 상의 증권의 인수업무를 수행합니다. 3) 상기 모집가액, 모집총액 및 발행제비용은 확정된 가액입니다. 4) 상기 청약기일은 구주주 청약 일정이며, 일반공모 청약은 2025년 03월 24일 ~ 2025년 03월 25일 2영업일간입니다. 5) 「증권 인수업무 등에 관한 규정」 제9조 제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니할 수 있습니다. 6) 금융감독원에서 본 증권신고서를 심사하는 과정에서 주요사항의 변동으로 인한 기재 내용의 정정 등으로 동 신고서에 기재된 일정이 변경될 수 있습니다. 7) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
(주2) 정정 전
(전략)
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 11,644,800 | 500 | 8,400 | 97,816,320,000 | 주주배정후 실권주 일반공모 |
| 주1) | 이사회 결의일: 2024년 12월 20일, 2025년 2월 7일 |
| 주2) | 1주의 모집가액 및 모집총액은 1차 발행가액을 기준으로 한 예정금액으로, 확정되지 않은 금액입니다. |
(중략)
■ 1차 발행가액의 산출 근거
본 공시서류의 1차 발행가액은 신주배정기준일 전 3거래일(2025년 02월 07일)을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용, 아래의 산식에 의하여 산정된 발행가액으로 합니다. 단, 할인율 적용에 따른 모집가액이 액면가액 이하일 경우에는 액면가액을 발행가액으로 합니다. (단, 호가단위 미만은 절상함)
| 기준주가 ×【 1 - 할인율(25%)】 | ||
| ▶ 1차 발행가액 |
= | ------------------------------------- |
| 1 + 【증자비율 × 할인율(25%)】 |
상기 방법에 따라 산정된 1차 발행가액은 참고용이며, 구주주 청약일전 3거래일에 확정 발행가액이 결정될 예정입니다.
| [1차 발행가액 산정표] | |
| (기산일 : 2025년 02월 07일) | (단위 : 원, 주) |
| 일자 | 종가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2025-02-07 | 13,020 | 1,373,145 | 17,706,720,270 |
| 2025-02-06 | 12,280 | 964,952 | 11,684,140,320 |
| 2025-02-05 | 11,450 | 609,871 | 6,987,310,270 |
| 2025-02-04 | 11,380 | 368,210 | 4,155,872,360 |
| 2025-02-03 | 10,790 | 520,623 | 5,664,188,860 |
| 2025-01-31 | 11,380 | 601,819 | 6,869,097,990 |
| 2025-01-24 | 11,420 | 972,609 | 10,969,105,670 |
| 2025-01-23 | 10,950 | 1,511,740 | 16,118,837,850 |
| 2025-01-22 | 10,100 | 857,578 | 8,502,755,310 |
| 2025-01-21 | 9,480 | 233,546 | 2,192,753,840 |
| 2025-01-20 | 9,400 | 497,624 | 4,580,775,520 |
| 2025-01-17 | 8,930 | 544,625 | 4,830,339,920 |
| 2025-01-16 | 9,210 | 400,541 | 3,732,732,810 |
| 2025-01-15 | 9,140 | 218,426 | 1,996,428,730 |
| 2025-01-14 | 9,260 | 273,339 | 2,573,577,070 |
| 2025-01-13 | 9,300 | 381,415 | 3,605,918,970 |
| 2025-01-10 | 9,650 | 388,922 | 3,706,515,150 |
| 2025-01-09 | 9,250 | 441,753 | 4,107,053,470 |
| 2025-01-08 | 9,580 | 562,282 | 5,407,298,100 |
| 1개월 가중산술평균주가 (A) | 10,696원 | - | |
| 1주일 가중산술평균주가 (B) | 12,041원 | - | |
| 기산일 종가 (C) | 13,020원 | - | |
| A,B,C의 산술평균 (D) | 11,919원 | (A+B+C)/3 | |
| 기준주가 | 11,919원 | (C와 D중 낮은가액) | |
| 할인율 (F) | 25% | - | |
| 증자비율 (G) | 25.78% | - | |
| 1차 발행가액 (호가단위 절상) |
8,400원 | 기준주가 × (1-할인율) / 1 + (유상증자비율 × 할인율 ) |
|
(후략)
(주2) 정정 후
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 11,644,800 | 500 | 9,550 | 111,207,840,000 | 주주배정후 실권주 일반공모 |
| 주1) | 이사회 결의일: 2024년 12월 20일, 2025년 2월 7일 |
| 주2) | 1주의 모집가액 및 모집총액은 확정 발행가액을 기준으로 산출한 금액입니다. |
「증권의 발행 및 공시 등에 관한 규정」 제5-18조 (유상증자의 발행가액 결정)에 의거, 주주배정 증자시 가격산정 절차폐지 및 가격산정의 자율화에 따라 발행가액을 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 산정할 예정입니다.
■ 2차 발행가액의 산출 근거
본 증권신고서의 2차 발행가액은 구주주 청약 초일 전 3거래일(2025년 03월 14일)을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용, 아래의 산식에 의하여 산정된 발행가액(2차 발행가액)으로 합니다. 단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하일 경우에는 액면가액을 발행가액으로 합니다.
▶ 2차 발행가액 = 기준주가 × [1 - 할인율(25%)]
| [2차 발행가액 산정표] |
| 기산일 : 2025년 03월 14일 | (단위: 원, 주) |
| 일자 | 종가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2025-03-14 | 15,530 | 1,046,643 | 16,596,497,930 |
| 2025-03-13 | 15,950 | 1,280,180 | 20,203,549,635 |
| 2025-03-12 | 15,550 | 1,130,679 | 18,199,626,450 |
| 2025-03-11 | 15,970 | 985,316 | 15,661,461,640 |
| 2025-03-10 | 15,970 | 2,289,752 | 37,113,902,060 |
| 1주일 거래량 가중산술평균주가 (A) | 16,008원 | - | |
| 기산일 종가(B) | 15,530원 | - | |
| (A),(B)의 산술 평균 (C) | 15,769원 | [(A)+(B)] ÷ 2 | |
| 기준주가 (D) | 15,530 | (B)와 (C)중 낮은가액 | |
| 할인율 | 25.00% | - | |
| 2차 발행가액 (호가단위 미만은 호가단위로 절상, 액면가액 이하일 경우 액면가액을 발행가액으로 함) |
11,650 | 기준주가 × (1 - 할인율) | |
■ 확정 발행가액의 산출근거
확정 발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 합니다. 다만, 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은 가액이 구주주 청약 초일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가를 기준주가로 하여 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. 단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하일 경우에는 액면가액을 발행가액으로 합니다.
| [확정 발행가액 산정표] | |
| 기산일 : 2025년 03월 14일 | (단위 : 원, 주) |
| 일수 | 일자 | 종가 | 거래량 | 거래대금 |
|---|---|---|---|---|
| 1 | 2025-03-14 | 15,530 | 1,046,643 | 16,596,497,930 |
| 2 | 2025-03-13 | 15,950 | 1,280,180 | 20,203,549,635 |
| 3 | 2025-03-12 | 15,550 | 1,130,679 | 18,199,626,450 |
| 3거래일 가중산술평균 | 15,907.34 | |||
| 할인율 | 40% | |||
| 3거래일 가중산술평균주가의 60% (A) | 9,550 | (단, 호가단위 미만은 절상) | ||
| 1차 발행가액 (B) | 8,400 | - | ||
| 2차 발행가액 (C) | 11,650 | - | ||
| 확정 발행가액 | 9,550 | Max[A,(Min(B,C)] | ||
| 주1) | 3거래일 가중산술평균주가의 60%는 호가단위 미만은 절상하며, 액면가액 이하일 경우 액면가액으로 합니다. |
이에 따라 확정발행가액은 9,550원으로 결정되었습니다.
(후략)
(주3) 정정 전
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 11,644,800 | |||||||||||||||||||||||||||||||||||||
| 주당 모집가액 또는 매출가액 | 예정가액 | 8,400 | ||||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||||
| 모집총액 또는 매출총액 | 예정가액 | 97,816,320,000 | ||||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
1) 구주주
|
|||||||||||||||||||||||||||||||||||||
(중략)
(5) 본 증권신고서의 1차 발행가액은 확정되어 있는 것은 아니며, 청약일 3거래일 전에 확정 발행가액을 산정함으로써 확정될 예정입니다. 또한, 본 증권신고서의 발행예정금액은 추후 주당 발행가액이 확정되는 내용에 따라 변경될 수 있음을 유의하여 주시기 바랍니다.
(주3) 정정 후
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 11,644,800 | |||||||||||||||||||||||||||||||||||||
| 주당 모집가액 또는 매출가액 | 예정가액 | - | ||||||||||||||||||||||||||||||||||||
| 확정가액 | 9,550 | |||||||||||||||||||||||||||||||||||||
| 모집총액 또는 매출총액 | 예정가액 | - | ||||||||||||||||||||||||||||||||||||
| 확정가액 | 111,207,840,000 | |||||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
1) 구주주
|
|||||||||||||||||||||||||||||||||||||
(중략)
(5) 본 증권신고서의 발행가액 및 모집(매출)총액은 확정된 금액입니다.
(주4) 정정 전
(전략)
| [주식매수선택권 부여 내역] | |||
| (기준일: | 본 공시서류 제출일 전일 | ) | (단위 : 원, 주) |
| 회차 | 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
미행사수량 | 행사기간 | 행사가격 | 의무 보유 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | |||||||||
| 3 주2) |
오영민 외 2인 | 미등기임원 | 2018년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 188,083 | 81,003 | 89,101 | 2020년 03월 29일 ~ 2029년 03월 29일 |
1,433 | 1,433 | O |
| 7 (주2) |
조영규 외 6인 | 미등기임원 등 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 1,150,568 | 906,524 | 997,170 | 2021년 11월 26일 ~ 2029년 03월 29일 |
6,250 | 6,250 | O |
| 7 주2) |
OOO외 11인 | 직원 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 303,810 | 38,396 | 42,233 | 2021년 11월 26일 ~ 2026년 11월 25일 |
6,250 | 6,250 | X |
| 8 | 조영규 외 7인 | 미등기임원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 327,953 | 279,807 | 307,782 | 2022년 03월 30일 ~ 2029년 03월 29일 |
9,682 | 9,420 | O |
| 8 | OOO 외 12인 | 직원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 263,248 | 112,795 | 124,067 | 2022년 03월 30일 ~ 2027년 03월 29일 |
9,682 | 9,420 | X |
| 9 | 김국환 외 5인 | 미등기임원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 300,473 | 224,982 | 247,477 | 2022년 10월 05일 ~ 2029년 03월 29일 |
9,682 | 9,420 | O |
| 9 | OOO 외 12인 | 직원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 220,021 | 140,484 | 154,524 | 2022년 10월 05일 ~ 2025년 10월 04일 |
9,682 | 9,420 | X |
| 10 | 홍준호 | 등기임원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 263,981 | 239,983 | 263,981 | 2023년 03월 26일 ~ 2029년 03월 29일 |
15,592 | 14,118 | O |
| 10 | OOO 외 5인 | 직원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 122,986 | 109,992 | 120,986 | 2023년 03월 26일 ~ 2026년 03월 25일 |
15,592 | 14,118 | X |
| 11 | 홍준호 | 등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 219,984 | 199,986 | 219,984 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 11 | 김은성 | 미등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 54,995 | 49,996 | 54,995 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 11 | OOO외 7인 | 직원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 137,183 | 111,991 | 123,184 | 2023년 06월 16일 ~ 2026년 06월 15일 |
17,046 | 15,274 | X |
| 12 | 이병건 | 등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 549,962 | 499,966 | 549,962 | 2025년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 12 | 이우열 외 2인 | 미등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 135,986 | 59,995 | 65,993 | 2024년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 12 | OOO외 22인 | 직원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 370,681 | 247,567 | 272,294 | 2024년 03월 03일 ~ 2029년 03월 02일 |
17,046 | 15,274 | X |
| 13 | 이병건 | 등기임원 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 329,976 | 299,979 | 329,976 | 2025년 06월 13일 ~ 2028년 06월 12일 |
11,418 | 10,800 | X |
| 13 | 이우형 외 14인 | 미등기임원 등 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 227,740 | 197,970 | 217,742 | 2025년 06월 13일 ~ 2030년 06월 12일 |
11,418 | 10,800 | X |
| 14 | 임신생 외 11인 |
미등기임원 등 | 2024년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 173,200 | 112,000 | 123,200 | 2026년 03월 29일 ~ 2031년 03월 28일 |
12,720 | 11,835 | X |
| 합계 | - | - | - | - | 5,340,830 | 3,913,416 | 4,304,651 | - | - | - | - | |
| 주1) | 본 공시서류 제출일 전일 기준 당사 주식의 종가는 13,020원 입니다. |
| 주2) | 해당 회차의 경우 유상증자에 의해 주식매수선택권의 행사가격이 조정되지 않습니다. |
| 주3) | 부여받은 자에 기재된 직원수는 주식매수선택권 부여 당시 직원 수입니다. |
| 주4) | 현재 재직 중인 임직원의 관계는 본 공시서류 제출일 전일 현재의 현황을 기재하였습니다. |
| 주5) | 최초부여수량 및 행사가격에는 유ㆍ무상증자 및 주식분할로 인한 조정된 수량과 행사가격을 반영하였습니다. |
| 주6) | 의무보유가 있는 주식매수선택권의 경우 「코스닥시장 상장규정」제26조에 따라 상장일(2023년 03월 30일)로부터 3년 혹은 1년 의무보유 대상입니다. |
| 주7) | 상기 부여된 주식매수선택권 중 취소된 부여물량은 의무적으로 재임 또는 재직하여야 하는 기간에 대한 조건을 갖추지 못하고 퇴직함으로 인해 발생하였습니다. |
(후략)
(주4) 정정 후
(전략)
| [주식매수선택권 부여 내역] | |||
| (기준일: | 본 공시서류 제출일 전일 | ) | (단위 : 원, 주) |
| 회차 | 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
미행사수량 | 행사기간 | 행사가격 | 의무 보유 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | |||||||||
| 3 주2) |
오영민 외 2인 | 미등기임원 | 2018년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 188,083 | 81,003 | 89,101 | 2020년 03월 29일 ~ 2029년 03월 29일 |
1,433 | 1,433 | O |
| 7 (주2) |
조영규 외 6인 | 미등기임원 등 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 1,150,568 | 906,524 | 997,170 | 2021년 11월 26일 ~ 2029년 03월 29일 |
6,250 | 6,250 | O |
| 7 주2) |
OOO외 11인 | 직원 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 303,810 | 38,396 | 42,233 | 2021년 11월 26일 ~ 2026년 11월 25일 |
6,250 | 6,250 | X |
| 8 | 조영규 외 7인 | 미등기임원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 327,953 | 279,807 | 307,782 | 2022년 03월 30일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 8 | OOO 외 12인 | 직원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 263,248 | 112,795 | 124,067 | 2022년 03월 30일 ~ 2027년 03월 29일 |
9,682 | 9,655 | X |
| 9 | 김국환 외 5인 | 미등기임원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 300,473 | 224,982 | 247,477 | 2022년 10월 05일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 9 | OOO 외 12인 | 직원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 220,021 | 140,484 | 154,524 | 2022년 10월 05일 ~ 2025년 10월 04일 |
9,682 | 9,655 | X |
| 10 | 홍준호 | 등기임원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 263,981 | 239,983 | 263,981 | 2023년 03월 26일 ~ 2029년 03월 29일 |
15,592 | 14,355 | O |
| 10 | OOO 외 5인 | 직원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 122,986 | 109,992 | 120,986 | 2023년 03월 26일 ~ 2026년 03월 25일 |
15,592 | 14,355 | X |
| 11 | 홍준호 | 등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 219,984 | 199,986 | 219,984 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | 김은성 | 미등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 54,995 | 49,996 | 54,995 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | OOO외 7인 | 직원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 137,183 | 111,991 | 123,184 | 2023년 06월 16일 ~ 2026년 06월 15일 |
17,046 | 15,512 | X |
| 12 | 이병건 | 등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 549,962 | 499,966 | 549,962 | 2025년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | 이우열 외 2인 | 미등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 135,986 | 59,995 | 65,993 | 2024년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | OOO외 22인 | 직원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 370,681 | 247,567 | 272,294 | 2024년 03월 03일 ~ 2029년 03월 02일 |
17,046 | 15,512 | X |
| 13 | 이병건 | 등기임원 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 329,976 | 299,979 | 329,976 | 2025년 06월 13일 ~ 2028년 06월 12일 |
11,418 | 11,036 | X |
| 13 | 이우형 외 14인 | 미등기임원 등 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 227,740 | 197,970 | 217,742 | 2025년 06월 13일 ~ 2030년 06월 12일 |
11,418 | 11,036 | X |
| 14 | 임신생 외 11인 |
미등기임원 등 | 2024년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 173,200 | 112,000 | 123,200 | 2026년 03월 29일 ~ 2031년 03월 28일 |
12,720 | 12,071 | X |
| 합계 | - | - | - | - | 5,340,830 | 3,913,416 | 4,304,651 | - | - | - | - | |
| 주1) | 본 공시서류 제출일 전일 기준 당사 주식의 종가는 15,530원 입니다. |
| 주2) | 해당 회차의 경우 유상증자에 의해 주식매수선택권의 행사가격이 조정되지 않습니다. |
| 주3) | 부여받은 자에 기재된 직원수는 주식매수선택권 부여 당시 직원 수입니다. |
| 주4) | 현재 재직 중인 임직원의 관계는 본 공시서류 제출일 전일 현재의 현황을 기재하였습니다. |
| 주5) | 최초부여수량 및 행사가격에는 유ㆍ무상증자 및 주식분할로 인한 조정된 수량과 행사가격을 반영하였습니다. |
| 주6) | 의무보유가 있는 주식매수선택권의 경우 「코스닥시장 상장규정」제26조에 따라 상장일(2023년 03월 30일)로부터 3년 혹은 1년 의무보유 대상입니다. |
| 주7) | 상기 부여된 주식매수선택권 중 취소된 부여물량은 의무적으로 재임 또는 재직하여야 하는 기간에 대한 조건을 갖추지 못하고 퇴직함으로 인해 발생하였습니다. |
(후략)
(주5) 정정 전
본 공시서류 제출일 전일 기준 최대주주인 장명호 사내이사는 발행주식총수의 6.76%인 3,054,806주를 보유하고 있으며, 특수관계인 21인의 지분을 포함한 최대주주 및 특수관계인은 발행주식총수의 8.36%인 3,774,575주를 보유하고 있습니다. 또한 최대주주 및 특수관계인 21인은 당사 코스닥시장 상장일로부터 3년 동안 의무보유 중에 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 11,644,800주이며, 당사 최대주주인 장명호 사내이사는 787,646주를 배정 받을 예정입니다. 장명호 사내이사는 배정주식의 50%를 청약할 예정이며, 청약에 필요한 예상 자금은 개인 보유자금을 활용하여 마련할 예정입니다. 이에 따라 금번 유상증자 이후 당사 최대주주의 지분율은 6.07%로 본 공시서류 제출일 전일 지분율 대비 0.69%p. 하락할 것으로 예상됩니다.
한편, 최대주주를 제외한 당사 특수관계인 21인은 발행주식총수의 1.59%인 719,769주를 보유하고 있으며, 금번 유상증자를 통해 185,574주를 배정 받을 예정입니다. 특수관계인 21인은 개인 보유자금의 변동 및 최종 발행가액 확정에 따라 청약률이 변동될 수 있기 때문에 확정발행가액 산정 후 특수관계인 21인의 예상 청약률을 본 공시서류 및 투자설명서를 통해 공시할 예정입니다. 그럼에도 불구하고 특수관계인 21인의 실제 청약률이 본 공시서류 및 투자설명서에 기재된 예상 청약률 보다 낮을 수 있으니 투자자분들께서는 투자판단에 참고하시기 바랍니다.
| [최대주주 및 특수관계인 주식소유 현황] | |
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 | 소유주식수 및 지분율 | |
|---|---|---|---|---|
| 주식수 | 지분율 | |||
| 장명호 | 최대주주 본인 | 보통주 | 3,054,806 | 6.76% |
| 양윤석 | 최대주주의 친인척 | 보통주 | 139,296 | 0.31% |
| 양경림 | 최대주주의 친인척 | 보통주 | 40,986 | 0.09% |
| 김봉모 | 최대주주의 친인척 | 보통주 | 31,816 | 0.07% |
| 지형남 | 최대주주의 친인척 | 보통주 | 7,488 | 0.02% |
| 김도연 | 최대주주의 친인척 | 보통주 | 6,000 | 0.01% |
| 장은주 | 최대주주의 친인척 | 보통주 | 5,360 | 0.01% |
| 지동석 | 최대주주의 친인척 | 보통주 | 7,300 | 0.02% |
| 강창훈 | 최대주주의 친인척 | 보통주 | 2,000 | 0.00% |
| 오영두 | 최대주주의 친인척 | 보통주 | 1,820 | 0.00% |
| 김다슬 | 최대주주의 친인척 | 보통주 | 1,800 | 0.00% |
| 지형욱 | 최대주주의 친인척 | 보통주 | 48 | 0.00% |
| 오영민 | 발행회사 임원 | 보통주 | 165,458 | 0.37% |
| 이경화 | 발행회사 임원 | 보통주 | 42,273 | 0.09% |
| 윤나리 | 발행회사 임원 | 보통주 | 35,172 | 0.08% |
| 조영규 | 발행회사 임원 | 보통주 | 27,200 | 0.06% |
| 노은희 | 발행회사 임원 | 보통주 | 646 | 0.00% |
| 김국환 | 발행회사 임원 | 보통주 | 402 | 0.00% |
| 김지수 | 발행회사 임원 | 보통주 | 3,000 | 0.01% |
| 임신생 | 발행회사 임원 | 보통주 | 14,268 | 0.03% |
| 김진만 | 관계회사 임원 | 보통주 | 166,010 | 0.37% |
| 홍천표 | 관계회사 임원 | 보통주 | 21,426 | 0.05% |
| 합계 | 보통주 | 3,774,575 | 8.36% | |
| 우선주 | - | - | ||
| 주1) | 지분율의 경우 보통주와 우선주를 합한 발행주식의 총수를 기준으로 기재하였습니다. |
| 출처: | 당사 제공 |
(중략)
| [최대주주 지분율 변동 시뮬레이션 : 유상증자] | |
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %, %p.) |
| 성 명 | 주식의 종류 | 유상증자 전 | 배정 주식수 (예정) |
청약 참여 주식수(예정) |
유상증자 후(예정) | |||
|---|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | 지분율 변동 | ||||
| 장명호 | 의결권 있는 주식 | 3,054,806 | 6.76% | 787,646 | 393,823 | 3,448,629 | 6.07% | -0.69%p. |
| 주1) | 최대주주의 청약 참여 주식수는 배정주식수의 50%이며, 1주 미만의 단수주는 절사하였습니다. |
| 출처: | 당사 제공 |
당사 최대주주인 장명호 사장은 상기 기술한 바와 같이 배정주식의 50%로 청약에 참여할 예정입니다. 이에 따라 최대주주 예상 필요 청약자금은 약 33억원이며, 최대주주는 개인 보유자금을 활용해 청약에 참여할 예정입니다. 향후 유상증자 진행 과정에서 당사의 주가가 상승하더라도「(舊) 유가증권 발행 및 공시 등에 관한 규정」에 따라 1차 발행가액 대비 확정 발행가액이 상승할 수 없어 발행가격 상승에 따른 최대주주의 청약자금 부담 증가 가능성은 제한적입니다. 다만, 예기치 못한 상황으로 인해 최대주주의 청약자금 부담 증가로 인하여 청약주식수와 금액에 일부 변동이 발생할 수 있으며, 예상치 못한 상황으로 인한 청약 실패 가능성도 배제할 수 없으니 투자자께서는 투자 판단시 이 점 유의하시기 바랍니다. 전술한 바와 같이 금번 유상증자 이후 당사 최대주주의 지분율은 6.07%로 본 공시서류 제출일 전일 지분율 대비 0.69%p. 하락할 것으로 예상되며, 이는 당사 최대주주의 경영권 등에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
또한, 당사는 금번 유상증자 이후 2025년 04월 01일을 무상증자 신주배정기준일로 하여, 10% 규모의 무상증자를 진행할 예정입니다. 이 경우 최대주주는 344,862주를 무상 배정 받을 예정이며, 지분율은 6.07%로 본 공시서류 제출일 전일 최대주주 지분율 대비 0.69%p. 하락할 예정입니다.
(중략)
| [제8회차 전환우선주의 유상증자 후 전환비율 조정] |
|
| (기준일: 본 공시서류 제출일 전일) | (단위 : 원, 주) |
| 구분 | 발행일 | 존속기간 | 전환청구기간 | 전환우선주 주식수 (전환가능 주식수) |
전환대상주식 | 전환가액 | 전환비율 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 유상증자 조정 후 |
무상증자 조정 후 |
조정 전 | 유상증자 조정 후 |
무상증자 조정 후 |
||||||
| 제8회차 전환우선주 |
2024년 08월 08일 | 2029년 08월 08일 | 2025년 08월 08일 ~ 2029년 08월 07일 |
858,371 | 기명식 보통주 | 11,650 | 10,950 | 9,960 | 1: 1.00000 | 1 : 1.06393 | 1 : 1.16968 |
| 주1) | 우선주의 주주가 전환청구를 하기 전에 발행회사가 시가를 하회하는 가격으로 주식을 발행할 경우 전환비율이 조정됩니다. |
| 주2) | 유상증자 조정 후 전환가액 = 조정 전 전환가액 ×{ (기발행주식수 + 신발행주식수 ×1주당 발행가액 ÷ 시가(기준주가)) ÷ (기발행주식수 + 신발행주식수) } |
| 주3) | 무상증자 조정 후 전환가액 = 조정 전 전환가액 x (기 발행주식수) ÷ (기 발행주식수 + 신 발행주식수) |
| 주4) | 조정 후 전환비율 = 최초 발행시 전환가액 / 전환청구 시점의 조정 전환가액 |
| 출처: | 당사 제공 |
(중략)
본 공시서류 제출일 전일 현재 제8회차 전환우선주의 잔여 전환가능 주식수는 858,371주입니다. 해당 우선주가 보통주로 전환될 경우 기존주주들의 지분 희석이 발생하게 되며, 최대주주 장명호 사장의 지분율 또한 희석될 수 있습니다. 당사의 제8회차 전환우선주의 경우 상기의 발행 당시 계약서 상 '전환에 관한 사항' 관련 조항에 의거하여 금번 유ㆍ무상증자에 따라 전환가액 하향 조정이 발생할 수 있습니다. 이 경우 유ㆍ무상증자 이후 전환 청구를 통해 발행되는 보통주는 상기 전환비율에 따라 보통주 1,104,420주로 전환될 예정이며, 이는 유ㆍ무상증자 완료 후 총발행주식수의 1.77%에 해당하는 수준입니다.
(중략)
| [제1회차 전환사채 현황 및 전환가액 조정] | |
| (기준일: 본 공시서류 제출일 전일) | (단위: 원, 주) |
| 구분 | 발행일 | 만기일 | 권면 (전자등록) 총액 (백만원) |
전환대상 주식의 종류 |
전환청구 가능기간 |
전환조건 | 미상환사채 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환 비율 |
조정 전 전환가액 |
유상증자 조정 후 전환가액 |
무상증자 조정 후 전환가액 |
권면 (전자등록) 총액 (백만원) |
조정 전 전환가능 주식수 |
유상증자 조정 후 전환가능 주식수 |
무상증자 조정 후 전환가능 주식수 |
||||||
| 제1회 무기명식 전환사채 |
2024년 08월 08일 |
2029년 08월 08일 |
10,000 | 기명식 보통주 | 2025년 08월 08일~ 2029년 07월 08일 |
100 | 11,647 | 10,943 | 9,949 | 10,000 | 858,590 | 913,826 | 1,005,126 |
| 주1) | 자세한 사항은 2024년 07월 30일 주요사항보고서(전환사채권발행결정) 공시를 참고하시기 바랍니다. |
| 주2) | 사채권을 소유한 자가 전환청구를 하기 전에 발행회사가 시가를 하회하는 발행가격으로 주식을 발행할 경우 전환가액이 조정됩니다. |
| 주3) | 유상증자 조정 후 전환가액 = 조정 전 전환가액 ×{ (기발행주식수 + 신발행주식수 ×1주당 발행가액 ÷ 시가(기준주가)) ÷ (기발행주식수 + 신발행주식수) } |
| 주4) | 무상증자 조정 후 전환가액 = 조정 전 전환가액 x (기 발행주식수) ÷ (기 발행주식수 + 신 발행주식수) |
| 출처: | 당사 제공 |
(중략)
본 공시서류 제출일 전일 현재 제1회차 전환사채의 잔여 전환가능 주식수는 858,590주입니다. 해당 전환사채가 투자자의 전환권 행사에 의하여 보통주로 전환될 경우 기존주주들의 지분 희석이 발생하게 되며, 최대주주 장명호 사장의 지분율 또한 희석될 수 있습니다. 당사의 제1회차 전환사채의 경우 상기의 발행 당시 계약서 상 '전환가액의 조정' 관련 조항에 의거하여 금번 유ㆍ무상증자에 따라 전환가액 하향 조정이 발생할 수 있습니다. 이 경우 유ㆍ무상증자 이후 전환 청구를 통해 발행되는 보통주는 보통주 1,005,126주로 전환될 예정이며, 이는 유ㆍ무상증자 완료 후 총발행주식수의 1.61%에 해당하는 수준입니다.
결론적으로 금번 유ㆍ무상증자가 완료된 이후 추가로 전환우선주 및 전환사채의 전환청구가 완료될 경우 당사 최대주주인 장명호 사장의 지분율은 5.96%로 본 공시서류 제출일 전일 지분율 대비 0.80%p. 감소할 예정입니다.
| [최대주주 지분율 변동 시뮬레이션 : 유상증자 + 무상증자 + 전환청구] |
|
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %, %p.) |
| 성 명 | 주식의 종류 |
유ㆍ무상증자 후 | 전환우선주 전환청구 주식수 (주1, 2) |
전환사채 전환청구 주식수 (주1, 2) |
유ㆍ무상증자 및 전환청구 후 (예정) |
|||
| 주식수 | 지분율 | 주식수 | 지분율 | 지분율 변동(%p.) | ||||
| 장명호 | 의결권 있는 주식 | 3,793,491 | 6.07% | 1,104,420 | 1,005,126 | 3,793,491 | 5.96% | -0.11%p. |
| 주1) | 1차 발행가액 기준 주식수이며, 최종적으로 실제 전환우선주 및 전환사채의 전환청구 주식수는 확정 발행가액으로 결정될 예정입니다. |
| 주2) | 전환청구 주식수의 경우 금번 유ㆍ무상증자로 인한 조정 후 전환가액을 기준으로 산출한 전환비율을 기준으로 계산하였습니다. |
| 출처: | 당사 제공 |
(중략)
| [주식매수선택권 부여 내역] | |||
| (기준일: | 본 공시서류 제출일 전일 | ) | (단위 : 원, 주) |
| 회차 | 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
미행사수량 | 행사기간 | 행사가격 | 의무 보유 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | |||||||||
| 3 주2) |
오영민 외 2인 | 미등기임원 | 2018년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 188,083 | 81,003 | 89,101 | 2020년 03월 29일 ~ 2029년 03월 29일 |
1,433 | 1,433 | O |
| 7 (주2) |
조영규 외 6인 | 미등기임원 등 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 1,150,568 | 906,524 | 997,170 | 2021년 11월 26일 ~ 2029년 03월 29일 |
6,250 | 6,250 | O |
| 7 주2) |
OOO외 11인 | 직원 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 303,810 | 38,396 | 42,233 | 2021년 11월 26일 ~ 2026년 11월 25일 |
6,250 | 6,250 | X |
| 8 | 조영규 외 7인 | 미등기임원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 327,953 | 279,807 | 307,782 | 2022년 03월 30일 ~ 2029년 03월 29일 |
9,682 | 9,420 | O |
| 8 | OOO 외 12인 | 직원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 263,248 | 112,795 | 124,067 | 2022년 03월 30일 ~ 2027년 03월 29일 |
9,682 | 9,420 | X |
| 9 | 김국환 외 5인 | 미등기임원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 300,473 | 224,982 | 247,477 | 2022년 10월 05일 ~ 2029년 03월 29일 |
9,682 | 9,420 | O |
| 9 | OOO 외 12인 | 직원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 220,021 | 140,484 | 154,524 | 2022년 10월 05일 ~ 2025년 10월 04일 |
9,682 | 9,420 | X |
| 10 | 홍준호 | 등기임원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 263,981 | 239,983 | 263,981 | 2023년 03월 26일 ~ 2029년 03월 29일 |
15,592 | 14,118 | O |
| 10 | OOO 외 5인 | 직원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 122,986 | 109,992 | 120,986 | 2023년 03월 26일 ~ 2026년 03월 25일 |
15,592 | 14,118 | X |
| 11 | 홍준호 | 등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 219,984 | 199,986 | 219,984 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 11 | 김은성 | 미등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 54,995 | 49,996 | 54,995 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 11 | OOO외 7인 | 직원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 137,183 | 111,991 | 123,184 | 2023년 06월 16일 ~ 2026년 06월 15일 |
17,046 | 15,274 | X |
| 12 | 이병건 | 등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 549,962 | 499,966 | 549,962 | 2025년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 12 | 이우열 외 2인 | 미등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 135,986 | 59,995 | 65,993 | 2024년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,274 | O |
| 12 | OOO외 22인 | 직원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 370,681 | 247,567 | 272,294 | 2024년 03월 03일 ~ 2029년 03월 02일 |
17,046 | 15,274 | X |
| 13 | 이병건 | 등기임원 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 329,976 | 299,979 | 329,976 | 2025년 06월 13일 ~ 2028년 06월 12일 |
11,418 | 10,800 | X |
| 13 | 이우형 외 14인 | 미등기임원 등 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 227,740 | 197,970 | 217,742 | 2025년 06월 13일 ~ 2030년 06월 12일 |
11,418 | 10,800 | X |
| 14 | 임신생 외 11인 |
미등기임원 등 | 2024년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 173,200 | 112,000 | 123,200 | 2026년 03월 29일 ~ 2031년 03월 28일 |
12,720 | 11,835 | X |
| 합계 | - | - | - | - | 5,340,830 | 3,913,416 | 4,304,651 | - | - | - | - | |
| 주1) | 본 공시서류 제출일 전일 기준 당사 주식의 종가는 13,020원 입니다. |
| 주2) | 해당 회차의 경우 유상증자에 의해 주식매수선택권의 행사가격이 조정되지 않습니다. |
| 주3) | 부여받은 자에 기재된 직원수는 주식매수선택권 부여 당시 직원 수입니다. |
| 주4) | 현재 재직 중인 임직원의 관계는 작성 본 공시서류 제출일 전일 현재의 현황을 기재하였습니다. |
| 주5) | 최초부여수량 및 행사가격에는 유ㆍ무상증자 및 주식분할로 인한 조정된 수량과 행사가격을 반영하였습니다. |
| 주6) | 의무보유가 있는 주식매수선택권의 경우 「코스닥시장 상장규정」제26조에 따라 상장일(2023년 03월 30일)로부터 3년 혹은 1년 의무보유 대상입니다. |
| 주7) | 상기 부여된 주식매수선택권 중 취소된 부여물량은 의무적으로 재임 또는 재직하여야 하는 기간에 대한 조건을 갖추지 못하고 퇴직함으로 인해 발생하였습니다. |
(후략)
(주5) 정정 후
본 공시서류 제출일 전일 기준 최대주주인 장명호 사내이사는 발행주식총수의 6.76%인 3,054,806주를 보유하고 있으며, 특수관계인 21인의 지분을 포함한 최대주주 및 특수관계인은 발행주식총수의 8.36%인 3,759,975주를 보유하고 있습니다. 또한 최대주주 및 특수관계인 21인은 당사 코스닥시장 상장일로부터 3년 동안 의무보유 중에 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 11,644,800주이며, 당사 최대주주인 장명호 사내이사는 787,646주를 배정 받을 예정입니다. 장명호 사내이사는 배정주식의 50%를 청약할 예정이며, 청약에 필요한 예상 자금은 개인 보유자금을 활용하여 마련할 예정입니다. 이에 따라 금번 유상증자 이후 당사 최대주주의 지분율은 6.07%로 본 공시서류 제출일 전일 지분율 대비 0.69%p. 하락할 것으로 예상됩니다.
한편, 최대주주를 제외한 당사 특수관계인 21인은 신주배정기준일에 발행주식총수의 1.56%인 705,169주를 보유하였으며, 금번 유상증자를 통해 185,600주를 배정 받았습니다. 특수관계인 21인은 배정주식의 약 40.87%를 청약할 예정이며, 청약에 필요한 예상 자금은 개인 보유자금을 활용하여 마련할 예정입니다. 특수관계인 21인의 실제 청약률이 본 공시서류 및 투자설명서에 기재된 예상 청약률 보다 낮을 수 있으니 투자자분들께서는 투자판단에 참고하시기 바랍니다.
특수관계인 21인의 주식소유현황 및 예상 청약 주수 및 예상 청약률은 다음과 같습니다.
| [최대주주 및 특수관계인 주식소유 현황] | |
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 | 소유주식수 및 지분율 | ||||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 배정주식수 | 예상 청약주식수 | 예상 청약률 | |||
| 장명호 | 최대주주 본인 | 보통주 | 3,054,806 | 6.76% | 787,646 | 393,823 | 50.00% |
| 양윤석 | 최대주주의 친인척 | 보통주 | 139,296 | 0.31% | 35,915 | 18,415 | 51.27% |
| 양경림 | 최대주주의 친인척 | 보통주 | 40,986 | 0.09% | 10,567 | 17,500 | 165.61% |
| 김봉모 | 최대주주의 친인척 | 보통주 | 31,816 | 0.07% | 8,203 | 521 | 6.35% |
| 지형남 | 최대주주의 친인척 | 보통주 | 7,488 | 0.02% | 1,930 | 1,930 | 100.00% |
| 김도연 | 최대주주의 친인척 | 보통주 | 6,000 | 0.01% | 1,547 | 1,547 | 100.00% |
| 장은주 | 최대주주의 친인척 | 보통주 | 5,360 | 0.01% | 1,382 | 1,382 | 100.00% |
| 지동석 | 최대주주의 친인척 | 보통주 | 6,100 | 0.01% | 1,908 | 1,908 | 100.00% |
| 강창훈 | 최대주주의 친인척 | 보통주 | 2,000 | 0.00% | 515 | 0 | 0.00% |
| 오영두 | 최대주주의 친인척 | 보통주 | 1,820 | 0.00% | 469 | 469 | 100.00% |
| 김다슬 | 최대주주의 친인척 | 보통주 | 1,800 | 0.00% | 464 | 0 | 0.00% |
| 지형욱 | 최대주주의 친인척 | 보통주 | 48 | 0.00% | 12 | 1,012 | 8433.33% |
| 오영민 | 발행회사 임원 | 보통주 | 165,458 | 0.37% | 42,661 | 17,000 | 39.85% |
| 이경화 | 발행회사 임원 | 보통주 | 38,773 | 0.09% | 10,899 | 4,300 | 39.45% |
| 윤나리 | 발행회사 임원 | 보통주 | 35,172 | 0.08% | 9,068 | 5,000 | 55.14% |
| 조영규 | 발행회사 임원 | 보통주 | 19,200 | 0.04% | 7,013 | 0 | 0.00% |
| 노은희 | 발행회사 임원 | 보통주 | 646 | 0.00% | 166 | 166 | 100.00% |
| 김국환 | 발행회사 임원 | 보통주 | 1,002 | 0.00% | 103 | 103 | 100.00% |
| 김지수 | 발행회사 임원 | 보통주 | 500 | 0.00% | 773 | 927 | 119.92% |
| 임신생 | 발행회사 임원 | 보통주 | 14,268 | 0.03% | 3,678 | 3,678 | 100.00% |
| 김진만 | 관계회사 임원 | 보통주 | 166,010 | 0.37% | 42,803 | 0 | 0.00% |
| 홍천표 | 관계회사 임원 | 보통주 | 21,426 | 0.05% | 5,524 | 0 | 0.00% |
| 합계 | 보통주 | 3,759,975 | 8.33% | 973,246 | 469,681 | 48.26% | |
| 우선주 | - | - | - | - | - | ||
| 주1) | 지분율의 경우 보통주와 우선주를 합한 발행주식의 총수를 기준으로 기재하였습니다. |
| 출처: | 당사 제공 |
(중략)
당사 최대주주인 장명호 사장은 상기 기술한 바와 같이 배정주식의 50%로 청약에 참여할 예정입니다. 이에 따라 최대주주 예상 필요 청약자금은 약 37.6억원이며, 최대주주는 개인 보유자금을 활용해 청약에 참여할 예정입니다. 향후 유상증자 진행 과정에서 당사의 주가가 상승하더라도「(舊) 유가증권 발행 및 공시 등에 관한 규정」에 따라 1차 발행가액 대비 확정 발행가액이 상승할 수 없어 발행가격 상승에 따른 최대주주의 청약자금 부담 증가 가능성은 제한적입니다. 다만, 예기치 못한 상황으로 인해 최대주주의 청약자금 부담 증가로 인하여 청약주식수와 금액에 일부 변동이 발생할 수 있으며, 예상치 못한 상황으로 인한 청약 실패 가능성도 배제할 수 없으니 투자자께서는 투자 판단시 이 점 유의하시기 바랍니다. 전술한 바와 같이 금번 유상증자 이후 당사 최대주주의 지분율은 6.07%로 본 공시서류 제출일 전일 지분율 대비 0.69%p. 하락할 것으로 예상되며, 이는 당사 최대주주의 경영권 등에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
또한, 당사는 금번 유상증자 이후 2025년 04월 03일을 무상증자 신주배정기준일로 하여, 10% 규모의 무상증자를 진행할 예정입니다. 이 경우 최대주주는 344,862주를 무상 배정 받을 예정이며, 지분율은 6.07%로 본 공시서류 제출일 전일 최대주주 지분율 대비 0.69%p. 하락할 예정입니다.
(중략)
| [제8회차 전환우선주의 유상증자 후 전환비율 조정] |
|
| (기준일: 본 공시서류 제출일 전일) | (단위 : 원, 주) |
| 구분 | 발행일 | 존속기간 | 전환청구기간 | 전환우선주 주식수 (전환가능 주식수) |
전환대상주식 | 전환가액 | 전환비율 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 유상증자 조정 후 |
무상증자 조정 후 |
조정 전 | 유상증자 조정 후 |
무상증자 조정 후 |
||||||
| 제8회차 전환우선주 |
2024년 08월 08일 | 2029년 08월 08일 | 2025년 08월 08일 ~ 2029년 08월 07일 |
858,371 | 기명식 보통주 | 11,650 | 10,740 | 9,770 | 1: 1.00000 | 1 : 1.08473 | 1 : 1.19243 |
| 주1) | 우선주의 주주가 전환청구를 하기 전에 발행회사가 시가를 하회하는 가격으로 주식을 발행할 경우 전환비율이 조정됩니다. |
| 주2) | 유상증자 조정 후 전환가액 = 조정 전 전환가액 ×{ (기발행주식수 + 신발행주식수 ×1주당 발행가액 ÷ 시가(기준주가)) ÷ (기발행주식수 + 신발행주식수) } |
| 주3) | 무상증자 조정 후 전환가액 = 조정 전 전환가액 x (기 발행주식수) ÷ (기 발행주식수 + 신 발행주식수) |
| 주4) | 조정 후 전환비율 = 최초 발행시 전환가액 / 전환청구 시점의 조정 전환가액 |
| 출처: | 당사 제공 |
(중략)
본 공시서류 제출일 전일 현재 제8회차 전환우선주의 잔여 전환가능 주식수는 858,371주입니다. 해당 우선주가 보통주로 전환될 경우 기존주주들의 지분 희석이 발생하게 되며, 최대주주 장명호 사장의 지분율 또한 희석될 수 있습니다. 당사의 제8회차 전환우선주의 경우 상기의 발행 당시 계약서 상 '전환에 관한 사항' 관련 조항에 의거하여 금번 유ㆍ무상증자에 따라 전환가액 하향 조정이 발생할 수 있습니다. 이 경우 유ㆍ무상증자 이후 전환 청구를 통해 발행되는 보통주는 상기 전환비율에 따라 보통주 1,125,897주로 전환될 예정이며, 이는 유ㆍ무상증자 완료 후 총발행주식수의 1.80%에 해당하는 수준입니다.
(중략)
| [제1회차 전환사채 현황 및 전환가액 조정] | |
| (기준일: 본 공시서류 제출일 전일) | (단위: 원, 주) |
| 구분 | 발행일 | 만기일 | 권면 (전자등록) 총액 (백만원) |
전환대상 주식의 종류 |
전환청구 가능기간 |
전환조건 | 미상환사채 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환 비율 |
조정 전 전환가액 |
유상증자 조정 후 전환가액 |
무상증자 조정 후 전환가액 |
권면 (전자등록) 총액 (백만원) |
조정 전 전환가능 주식수 |
유상증자 조정 후 전환가능 주식수 |
무상증자 조정 후 전환가능 주식수 |
||||||
| 제1회 무기명식 전환사채 |
2024년 08월 08일 |
2029년 08월 08일 |
10,000 | 기명식 보통주 | 2025년 08월 08일~ 2029년 07월 08일 |
100 | 11,647 | 10,728 | 9,753 | 10,000 | 858,590 | 932,140 | 1,025,325 |
| 주1) | 자세한 사항은 2024년 07월 30일 주요사항보고서(전환사채권발행결정) 공시를 참고하시기 바랍니다. |
| 주2) | 사채권을 소유한 자가 전환청구를 하기 전에 발행회사가 시가를 하회하는 발행가격으로 주식을 발행할 경우 전환가액이 조정됩니다. |
| 주3) | 유상증자 조정 후 전환가액 = 조정 전 전환가액 ×{ (기발행주식수 + 신발행주식수 ×1주당 발행가액 ÷ 시가(기준주가)) ÷ (기발행주식수 + 신발행주식수) } |
| 주4) | 무상증자 조정 후 전환가액 = 조정 전 전환가액 x (기 발행주식수) ÷ (기 발행주식수 + 신 발행주식수) |
| 출처: | 당사 제공 |
(중략)
본 공시서류 제출일 전일 현재 제1회차 전환사채의 잔여 전환가능 주식수는 858,590주입니다. 해당 전환사채가 투자자의 전환권 행사에 의하여 보통주로 전환될 경우 기존주주들의 지분 희석이 발생하게 되며, 최대주주 장명호 사장의 지분율 또한 희석될 수 있습니다. 당사의 제1회차 전환사채의 경우 상기의 발행 당시 계약서 상 '전환가액의 조정' 관련 조항에 의거하여 금번 유ㆍ무상증자에 따라 전환가액 하향 조정이 발생할 수 있습니다. 이 경우 유ㆍ무상증자 이후 전환 청구를 통해 발행되는 보통주는 보통주 1,025,325주로 전환될 예정이며, 이는 유ㆍ무상증자 완료 후 총발행주식수의 1.64%에 해당하는 수준입니다.
결론적으로 금번 유ㆍ무상증자가 완료된 이후 추가로 전환우선주 및 전환사채의 전환청구가 완료될 경우 당사 최대주주인 장명호 사장의 지분율은 5.95%로 본 공시서류 제출일 전일 지분율 대비 0.81%p. 감소할 예정입니다.
| [최대주주 지분율 변동 시뮬레이션 : 유상증자 + 무상증자 + 전환청구] |
|
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %, %p.) |
| 성 명 | 주식의 종류 |
유ㆍ무상증자 후 | 전환우선주 전환청구 주식수 (주1, 2) |
전환사채 전환청구 주식수 (주1, 2) |
유ㆍ무상증자 및 전환청구 후 (예정) |
|||
| 주식수 | 지분율 | 주식수 | 지분율 | 지분율 변동(%p.) | ||||
| 장명호 | 의결권 있는 주식 | 3,793,491 | 6.07% | 1,125,897 | 1,025,325 | 3,793,491 | 5.95% | -0.12%p. |
| 주1) | 전환우선주 전환청구 주식수, 전환사채 전환청구 주식수는 확정 발행가액 기준 주식수이며, 향후 실제 전환청구 시점의 주식수는 변동될 수 있습니다. |
| 주2) | 전환청구 주식수의 경우 금번 유ㆍ무상증자로 인한 조정 후 전환가액을 기준으로 산출한 전환비율을 기준으로 계산하였습니다. |
| 출처: | 당사 제공 |
(중략)
| [주식매수선택권 부여 내역] | |||
| (기준일: | 본 공시서류 제출일 전일 | ) | (단위 : 원, 주) |
| 회차 | 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
미행사수량 | 행사기간 | 행사가격 | 의무 보유 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | |||||||||
| 3 주2) |
오영민 외 2인 | 미등기임원 | 2018년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 188,083 | 81,003 | 89,101 | 2020년 03월 29일 ~ 2029년 03월 29일 |
1,433 | 1,433 | O |
| 7 (주2) |
조영규 외 6인 | 미등기임원 등 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 1,150,568 | 906,524 | 997,170 | 2021년 11월 26일 ~ 2029년 03월 29일 |
6,250 | 6,250 | O |
| 7 주2) |
OOO외 11인 | 직원 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 303,810 | 38,396 | 42,233 | 2021년 11월 26일 ~ 2026년 11월 25일 |
6,250 | 6,250 | X |
| 8 | 조영규 외 7인 | 미등기임원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 327,953 | 279,807 | 307,782 | 2022년 03월 30일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 8 | OOO 외 12인 | 직원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 263,248 | 112,795 | 124,067 | 2022년 03월 30일 ~ 2027년 03월 29일 |
9,682 | 9,655 | X |
| 9 | 김국환 외 5인 | 미등기임원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 300,473 | 224,982 | 247,477 | 2022년 10월 05일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 9 | OOO 외 12인 | 직원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 220,021 | 140,484 | 154,524 | 2022년 10월 05일 ~ 2025년 10월 04일 |
9,682 | 9,655 | X |
| 10 | 홍준호 | 등기임원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 263,981 | 239,983 | 263,981 | 2023년 03월 26일 ~ 2029년 03월 29일 |
15,592 | 14,355 | O |
| 10 | OOO 외 5인 | 직원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 122,986 | 109,992 | 120,986 | 2023년 03월 26일 ~ 2026년 03월 25일 |
15,592 | 14,355 | X |
| 11 | 홍준호 | 등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 219,984 | 199,986 | 219,984 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | 김은성 | 미등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 54,995 | 49,996 | 54,995 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | OOO외 7인 | 직원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 137,183 | 111,991 | 123,184 | 2023년 06월 16일 ~ 2026년 06월 15일 |
17,046 | 15,512 | X |
| 12 | 이병건 | 등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 549,962 | 499,966 | 549,962 | 2025년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | 이우열 외 2인 | 미등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 135,986 | 59,995 | 65,993 | 2024년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | OOO외 22인 | 직원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 370,681 | 247,567 | 272,294 | 2024년 03월 03일 ~ 2029년 03월 02일 |
17,046 | 15,512 | X |
| 13 | 이병건 | 등기임원 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 329,976 | 299,979 | 329,976 | 2025년 06월 13일 ~ 2028년 06월 12일 |
11,418 | 11,036 | X |
| 13 | 이우형 외 14인 | 미등기임원 등 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 227,740 | 197,970 | 217,742 | 2025년 06월 13일 ~ 2030년 06월 12일 |
11,418 | 11,036 | X |
| 14 | 임신생 외 11인 |
미등기임원 등 | 2024년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 173,200 | 112,000 | 123,200 | 2026년 03월 29일 ~ 2031년 03월 28일 |
12,720 | 12,071 | X |
| 합계 | - | - | - | - | 5,340,830 | 3,913,416 | 4,304,651 | - | - | - | - | |
| 주1) | 본 공시서류 제출일 전일 기준 당사 주식의 종가는 15,530원 입니다. |
| 주2) | 해당 회차의 경우 유상증자에 의해 주식매수선택권의 행사가격이 조정되지 않습니다. |
| 주3) | 부여받은 자에 기재된 직원수는 주식매수선택권 부여 당시 직원 수입니다. |
| 주4) | 현재 재직 중인 임직원의 관계는 작성 본 공시서류 제출일 전일 현재의 현황을 기재하였습니다. |
| 주5) | 최초부여수량 및 행사가격에는 유ㆍ무상증자 및 주식분할로 인한 조정된 수량과 행사가격을 반영하였습니다. |
| 주6) | 의무보유가 있는 주식매수선택권의 경우 「코스닥시장 상장규정」제26조에 따라 상장일(2023년 03월 30일)로부터 3년 혹은 1년 의무보유 대상입니다. |
| 주7) | 상기 부여된 주식매수선택권 중 취소된 부여물량은 의무적으로 재임 또는 재직하여야 하는 기간에 대한 조건을 갖추지 못하고 퇴직함으로 인해 발생하였습니다. |
(후략)
(주6) 정정 전
(전략)
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 향후 당사의 지속적인 당기순손실 발생으로 인해 재무안정성은 저하될 수 있습니다. 이에 당사는 2025년 2분기부터 2027년 3분기까지의 자금수지 계획을 수립하고 유동성 관리에 노력하고 있습니다.
(중략)
| [당사 향후 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2025년 2분기 |
2025년 3분기 |
2025년 4분기 |
2026년 1분기 |
2026년 2분기 |
2026년 3분기 |
2026년 4분기 |
2027년 1분기 |
2027년 2분기 |
2027년 3분기 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영업현금흐름 | (a)수입 | 기술이전수익(기존 및 신규 L/O)(주1) | 30,000 | - | 39,800 | - | 4,900 | - | 20,000 | 30,000 | 15,000 | 50,000 |
| 계 | 30,000 | - | 39,800 | - | 4,900 | - | 20,000 | 30,000 | 15,000 | 50,000 | ||
| (b)지출 | 경상연구개발비(주2) | 6,721 | 7,023 | 8,754 | 6,560 | 6,797 | 7,321 | 9,068 | 12,570 | 7,584 | 6,811 | |
| GI-101 임상시험 | 1,482 | 1,355 | 1,249 | 640 | 441 | 631 | 636 | - | - | - | ||
| GI-102 임상시험 |
2,082 | 2,250 | 3,327 | 2,622 | 2,602 | 1,441 | 1,408 | 876 | 875 | 1,846 | ||
| GI-108 임상시험 |
277 | 210 | 214 | 169 | 158 | 158 | 162 | 191 | 191 | 181 | ||
| 신규도입과제 | 1,372 | 1,698 | 1,815 | 1,585 | 2,049 | 3,543 | 4,642 | 9,908 | 4,920 | 3,277 | ||
| 연구개발인건비 | 1,508 | 1,509 | 2,149 | 1,544 | 1,547 | 1,549 | 2,219 | 1,595 | 1,598 | 1,507 | ||
| 기타판매관리비(주3) | 1,616 | 1,643 | 2,264 | 1,739 | 1,624 | 1,663 | 2,320 | 1,775 | 1,672 | 1,609 | ||
| 계 | 8,338 | 8,666 | 11,018 | 8,300 | 8,421 | 8,983 | 11,388 | 14,346 | 9,256 | 8,420 | ||
| 영업수지(=(a)-(b)) | 21,662 | -8,666 | 28,782 | -8,300 | -3,521 | -8,983 | 8,612 | 15,654 | 5,744 | 41,580 | ||
| 투자현금흐름 | (c)지출 | 무형자산 취득 | 44 | 114 | 10 | 91 | 97 | 47 | 47 | 92 | 98 | 42 |
| 계 | 44 | 114 | 10 | 91 | 97 | 47 | 47 | 92 | 98 | 42 | ||
| 투자수지(=-c) | -44 | -114 | -10 | -91 | -97 | -47 | -47 | -92 | -98 | -42 | ||
| 재무현금흐름 | (d)수입 | 유상증자 | 97,816 | - | - | - | - | - | - | - | - | |
| 주식매수선택권 행사 등 | - | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| 계 | 97,816 | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| (e)지출 | 이자비용 | - | - | - | - | - | - | - | - | - | ||
| 계 | - | - | - | - | - | - | - | - | - | |||
| 재무수지(=(d)-(e)) | 97,816 | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| 기초 자금 | 1,000 | 120,435 | 111,655 | 140,428 | 132,589 | 129,524 | 121,045 | 130,162 | 146,277 | 152,475 | ||
| 기말 자금 | 120,435 | 111,655 | 140,428 | 132,589 | 129,524 | 121,045 | 130,162 | 146,277 | 152,475 | 194,565 | ||
| 주1) | 영업수익에는 추가 L/O 에 따른 예상 수익 및 기존에 체결된 기술이전에 따른 후속 마일스톤 등이 포함되어 있습니다. 계획한 기술이전 수익 규모는 파트너사의 전략 및 성향 기술이전 시점의 시장 상황, 당사의 임상 성과 등에 의해 변동될 가능성이 있을 뿐만 아니라 연구개발 과정에서 예상치 못한 실패나 기술이전 과정에서의 일정 지연 등이 발생할 불확실성이 존재합니다. |
| 주2) | 경상연구개발비는 주요 파이프라인 임상연구, 임상시험용 의약품(시료) 생산, 연구인력 인건비, 신규도입과제 비임상연구를 포함한 연구용 소모품비 등이 포함되어 있습니다. |
| 주3) | 기타판매관리비는 사무인력 인건비, 사무실 임차료, 위탁수수료 등 일반 관리비가 포함되어 있습니다. |
| 주4) | 2025년 2분기 기초자금은 당사가 예측한 예측치이며, 해당 금액은 변동될 가능성이 있습니다. |
| 출처: | 당사 제시 |
(후략)
(주6) 정정 후
(전략)
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 향후 당사의 지속적인 당기순손실 발생으로 인해 재무안정성은 저하될 수 있습니다. 이에 당사는 2025년 2분기부터 2027년 4분기까지의 자금수지 계획을 수립하고 유동성 관리에 노력하고 있습니다.
(중략)
| [당사 향후 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2025년 2분기 |
2025년 3분기 |
2025년 4분기 |
2026년 1분기 |
2026년 2분기 |
2026년 3분기 |
2026년 4분기 |
2027년 1분기 |
2027년 2분기 |
2027년 3분기 |
2027년 4분기 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영업현금흐름 | (a)수입 | 기술이전수익(기존 및 신규 L/O)(주1) | 30,000 | - | 39,800 | - | 4,900 | - | 20,000 | 30,000 | 15,000 | 50,000 | - |
| 계 | 30,000 | - | 39,800 | - | 4,900 | - | 20,000 | 30,000 | 15,000 | 50,000 | - | ||
| (b)지출 | 경상연구개발비(주2) | 6,721 | 7,023 | 8,754 | 6,560 | 6,797 | 7,321 | 9,068 | 12,570 | 7,584 | 7,242 | 10,381 | |
| GI-101 임상시험 | 1,482 | 1,355 | 1,249 | 640 | 441 | 631 | 636 | - | - | - | |||
| GI-102 임상시험 |
2,082 | 2,250 | 3,327 | 2,622 | 2,602 | 1,441 | 1,408 | 876 | 875 | 1,927 | 896 | ||
| GI-108 임상시험 |
277 | 210 | 214 | 169 | 158 | 158 | 162 | 191 | 191 | 191 | 1,252 | ||
| 신규도입과제 | 1,372 | 1,698 | 1,815 | 1,585 | 2,049 | 3,543 | 4,642 | 9,908 | 4,920 | 3,524 | 5,894 | ||
| 연구개발인건비 | 1,508 | 1,509 | 2,149 | 1,544 | 1,547 | 1,549 | 2,219 | 1,595 | 1,598 | 1,600 | 2,339 | ||
| 기타판매관리비(주3) | 1,616 | 1,643 | 2,264 | 1,739 | 1,624 | 1,663 | 2,320 | 1,775 | 1,672 | 1,708 | 2,425 | ||
| 계 | 8,338 | 8,666 | 11,018 | 8,300 | 8,421 | 8,983 | 11,388 | 14,346 | 9,256 | 8,950 | 12,806 | ||
| 영업수지(=(a)-(b)) | 21,662 | -8,666 | 28,782 | -8,300 | -3,521 | -8,983 | 8,612 | 15,654 | 5,744 | 41,050 | -12,806 | ||
| 투자현금흐름 | (c)지출 | 무형자산 취득 | 44 | 114 | 10 | 91 | 97 | 47 | 47 | 92 | 98 | 48 | 49 |
| 계 | 44 | 114 | 10 | 91 | 97 | 47 | 47 | 92 | 98 | 48 | 49 | ||
| 투자수지(=-c) | -44 | -114 | -10 | -91 | -97 | -47 | -47 | -92 | -98 | -48 | -49 | ||
| 재무현금흐름 | (d)수입 | 유상증자 | 111,208 | - | - | - | - | - | - | - | - | - | |
| 주식매수선택권 행사 등 | - | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| 계 | 111,208 | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| (e)지출 | 이자비용 | - | - | - | - | - | - | - | - | - | - | ||
| 계 | - | - | - | - | - | - | - | - | - | - | |||
| 재무수지(=(d)-(e)) | 111,208 | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| 기초 자금 | 1,000 | 133,826 | 125,047 | 153,819 | 145,981 | 142,915 | 134,437 | 143,554 | 159,668 | 165,866 | 207,420 | ||
| 기말 자금 | 133,826 | 125,047 | 153,819 | 145,981 | 142,915 | 134,437 | 143,554 | 159,668 | 165,866 | 207,420 | 195,117 | ||
| 주1) | 영업수익에는 추가 L/O 에 따른 예상 수익 및 기존에 체결된 기술이전에 따른 후속 마일스톤 등이 포함되어 있습니다. 계획한 기술이전 수익 규모는 파트너사의 전략 및 성향 기술이전 시점의 시장 상황, 당사의 임상 성과 등에 의해 변동될 가능성이 있을 뿐만 아니라 연구개발 과정에서 예상치 못한 실패나 기술이전 과정에서의 일정 지연 등이 발생할 불확실성이 존재합니다. |
| 주2) | 경상연구개발비는 주요 파이프라인 임상연구, 임상시험용 의약품(시료) 생산, 연구인력 인건비, 신규도입과제 비임상연구를 포함한 연구용 소모품비 등이 포함되어 있습니다. |
| 주3) | 기타판매관리비는 사무인력 인건비, 사무실 임차료, 위탁수수료 등 일반 관리비가 포함되어 있습니다. |
| 주4) | 2025년 2분기 기초자금은 당사가 예측한 예측치이며, 해당 금액은 변동될 가능성이 있습니다. |
| 출처: | 당사 제시 |
(후략)
(주7) 정정 전
(전략)
매수인은 Call Option을 통하여 취득한 전환사채로 전환권을 행사할 경우 최대치인 10% 행사 및 최초 전환가액 기준 당사 보통주 85,859주를 취득할 수 있게 되며, 리픽싱 70% 조정 후에는 최대 122,654주까지 취득할 수 있습니다. 금번 유상증자 및 무상증자에 의한 전환가액 조정 이후를 기준으로 할 경우 Call Option 행사를 통하여 최대치인 10% 행사 기준 당사 보통주 100,512주를 취득할 수 있습니다.
| [1회차 전환사채의 Call Option에 관한 사항] | |
| (기준일: 2024년 08월 08일) | (단위 : 원, 주) |
| 구분 | 제1회 무기명식 전환사채 |
|---|---|
| Call Option 행사자 | 발행회사 또는 발행회사가 지정하는 자 |
| 발행일 | 2024년 08월 08일 |
| 만기일 | 2029년 08월 08일 |
| Call Option 대상 권면(전자등록)총액 (백만원) |
1,000 |
| 전환대상 주식의 종류 | 기명식 보통주 |
| Call Option 행사가능기간 |
2025년 08월 08일~ 2026년 01월 08일 |
| Call Option 비율 | 최대 권면총액의 10% |
| 조정 전 전환가액 | 11,647 |
| 유상증자 조정 후 전환가액 |
10,942 |
| 무상증자 조정 후 전환가액 |
9,948 |
| 조정 전 Call Option 대상 주식수 |
85,859 |
| 유상증자 조정 후 전환가능 주식수 |
91,382 |
| 무상증자 조정 후 전환가능 주식수 |
100,512 |
(후략)
(주7) 정정 후
(전략)
매수인은 Call Option을 통하여 취득한 전환사채로 전환권을 행사할 경우 최대치인 10% 행사 및 최초 전환가액 기준 당사 보통주 85,859주를 취득할 수 있게 되며, 리픽싱 70% 조정 후에는 최대 122,654주까지 취득할 수 있습니다. 금번 유상증자 및 무상증자에 의한 전환가액 조정 이후를 기준으로 할 경우 Call Option 행사를 통하여 최대치인 10% 행사 기준 당사 보통주 102,532주를 취득할 수 있습니다.
| [1회차 전환사채의 Call Option에 관한 사항] | |
| (기준일: 2024년 08월 08일) | (단위 : 원, 주) |
| 구분 | 제1회 무기명식 전환사채 |
|---|---|
| Call Option 행사자 | 발행회사 또는 발행회사가 지정하는 자 |
| 발행일 | 2024년 08월 08일 |
| 만기일 | 2029년 08월 08일 |
| Call Option 대상 권면(전자등록)총액 (백만원) |
1,000 |
| 전환대상 주식의 종류 | 기명식 보통주 |
| Call Option 행사가능기간 |
2025년 08월 08일~ 2026년 01월 08일 |
| Call Option 비율 | 최대 권면총액의 10% |
| 조정 전 전환가액 | 11,647 |
| 유상증자 조정 후 전환가액 |
10,728 |
| 무상증자 조정 후 전환가액 |
9,753 |
| 조정 전 Call Option 대상 주식수 |
85,859 |
| 유상증자 조정 후 전환가능 주식수 |
93,214 |
| 무상증자 조정 후 전환가능 주식수 |
102,532 |
(후략)
(주8) 정정 전
(전략)
| [당사 주가 및 유상증자에 따른 발행주식수 및 가격] |
| 모집예정 주식 종류 | 주식수 및 금액 | 비 고 |
|---|---|---|
| 모집예정주식수 | 11,644,800주 | - |
| 현재 발행주식총수 | 45,163,170주 | 보통주: 44,304,799주 우선주: 858,371주 |
| 1차 발행가액 | 8,400원 | 증자비율 및 할인율 고려 |
| 기산일 종가 | 13,020원 | 2025.02.07 종가 |
(후략)
(주8) 정정 후
(전략)
| [당사 주가 및 유상증자에 따른 발행주식수 및 가격] |
| 모집예정 주식 종류 | 주식수 및 금액 | 비 고 |
|---|---|---|
| 모집예정주식수 | 11,644,800주 | - |
| 현재 발행주식총수 | 45,163,170주 | 보통주: 44,304,799주 우선주: 858,371주 |
| 확정 발행가액 | 9,550원 | 증자비율 및 할인율 고려 |
| 기산일 종가 | 15,530원 | 2025.03.14 종가 |
(후략)
(주9) 정정 전
(전략)
| (단위: 원) |
| 구 분 | 금 액 |
|---|---|
| 모집 또는 매출총액(1) | 97,816,320,000 |
| 발행제비용(2) | 1,591,000,000 |
| 순 수 입 금 [ (1)-(2) ] | 96,225,320,000 |
| 주1) | 상기 금액은 1차 발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) | 상기 모집총액은 하단에 기재된 유상증자 자금사용의 우선순위에 따라 사용할 예정입니다. |
| 주3) | 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. |
나. 발행제비용의 내역
| (단위 : 원) |
| 구분 | 금액 | 지급일자 | 비고 |
|---|---|---|---|
| 발행분담금 | 17,606,930 | 신고서제출일 | 모집총액의 0.018% (10원 미만 절사) |
| 인수수수료 | 1,467,244,800 | 납입일로부터 3영업일 이내 |
기본수수료: 최종 모집금액의 1.5% 실권수수료: 15.0%(실권수수료 미포함) |
| 표준코드발급수수료 | 10,000 | 표준코드발급 신청일 | 신주인수권증서(R) 건당 10,000원 |
| 보통주 추가상장수수료 |
8,980,000 | 신주상장일 | 730만원+700억원 초과금액의 10억원당 6만원(코스닥시장상장규정 시행세칙 별표 14) |
| 주식발행등록수수료 (신주인수권 및 주권) |
1,000,000 | - | 1,000주당 300원 (주식 및 신주인수권증서 각각 별도 징수, 수수료 건당 상한 50만원 및 하한 4천원)(주식·사채 등의 전자등록업무규정 시행세칙 별표) |
| 등록면허세 | 23,289,600 | 등기일 | 증자 자본금의 0.40% (지방세법 제28조, 10원 미만 절사) |
| 지방교육세 | 4,657,920 | 등기일 | 등록면허세의 20%(지방세법 제151조, 10원 미만 절사) |
| 기타비용 | 68,210,750 | - | 투자설명서, 통지서 인쇄 및 발송비 등 |
| 합계 | 1,591,000,000 | - | - |
| 주1) 상기 금액은 1차 발행가액을 기준으로 산정한 금액입니다. 주2) 금번 유상증자 결과 대표주관회사가 최종 실권주를 인수할 경우 당사는 실권주 인수금액의 15.0%를 추가수수료 지급하게됩니다. 주3) 실제 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가기준으로 산정되며, 유관기관 정책 등에 따라 변동될 수 있습니다. 주4) 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사가 금번 보통주 유상증자를 통해 조달 예정인 자금 97,816,320,000원은 운영자금(GI-101, GI-102, GI-108 임상, 신규도입과제, 연구개발 인건비 등 연구개발자금, 사무인력 인건비 등 필수 운영자금)으로 사용할 계획입니다.
| [자금의 사용목적] |
| (기준일 : | 2025년 02월 10일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 97,816 |
- | - | - | 97,816 |
나. 자금의 세부 사용 내역
당사는 금번 주주배정 후 실권주 일반공모 유상증자를 통한 납입자금에 대해서 아래와 같은 우선순위로 사용할 예정입니다.
| [자금사용 우선순위] |
| (단위: 백만원) |
| 구 분 | 목 적 | 자금 사용 시기 | 사용내역 | 금 액 | 우선순위 |
|---|---|---|---|---|---|
| 운영자금 | R&D 연구개발자금 | 2025년 2분기 ~ 2027년 3분기 |
GI-101/GI-102/GI-108 임상시험 비용 | 27,674 | 1순위 |
| 2025년 2분기 ~ 2027년 3분기 |
신규후보물질 개발을 위한 비임상 연구 관련 비용 및 연구개발인력 인건비를 포함한 연구개발자금 |
52,217 | 2순위 | ||
| 인건비 및 일반 관리 |
2025년 2분기 ~ 2027년 3분기 |
사무인력 인건비, 관리비 등 필수 운영자금 | 17,925 | 3순위 | |
| 총 계 | 97,816 | - | |||
| 출처: 당사 제시 |
(중략)
(1) 운영자금 - R&D 연구개발자금
당사는 금번 유상증자를 통하여 모집되는 자금 중 일부를 GI-101, GI-102, GI-108 파이프라인 임상개발 등에 27,674백만원, 신규도입과제 및 기타 연구개발자금으로 52,217백만원을 사용할 예정입니다.
1) GI-101/102
(중략)
GI-102는 종양미세환경에서 조절 T 세포를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진하는 면역항암제로서 현재 한국 및 미국에서 임상 1/2상을 진행 중에 있습니다. 또한, GI-101과 마찬가지로 MSD로부터 키트루다®를 무상으로 지원받아 임상을 진행 중에 있습니다. 현재 한국 및 미국 임상 1상의 경우 정맥 투여 제형 용량 증량 단계는 환자 등록을 완료하였고, 정맥 투여 제형 용량 확장 단계(한국, 미국 임상 2a상)/피하 투여 제형 용량 증량 및 확장(한국, 미국 임상 1b, 2a상)/ADC 및 화학항암제, 면역항암제 병용투여(한국, 미국 임상 2상) 단계의 환자 등록은 2025년 2분기 내에 완료될 예정입니다. 환자 등록이 완료된 이후 모집 환자에게 3주 간격으로 투약을 진행할 예정이며 이 과정에서 발생하는 개발 계획에 따른 임상시료생산 비용은 2027년 3분기까지, CRO 비용 등 직접 임상시험에 소요되는 비용은 2027년 3분기까지 발생할 것으로 예측됩니다.
현재 당사가 계획중인 GI-101 및 GI-102의 한국 및 미국 임상 1/2상 진행 및 임상시료생산을 위해 2025년 11,747백만원, 2026년 10,420백만원, 2027년 3,596백만원의 비용이 필요할 것으로 예상됩니다.
| [GI-101/102 연구개발비용 지출 관련 상세 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | ||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 소계 | ||||
| GI-101 | 고형암면역항암제 | 임상1/2상 비용 | 1,380 | 1,285 | 1,157 | 3,822 | 630 | 431 | 631 | 636 | 2,328 | - | - | - | - | 6,150 |
| 임상시료생산 등 | 103 | 71 | 92 | 266 | 10 | 10 | - | - | 20 | - | - | - | - | 286 | ||
| GI-102 | 임상1/2상 비용 | 1,962 | 2,172 | 3,221 | 7,355 | 2,621 | 2,581 | 1,441 | 1,391 | 8,034 | 797 | 797 | 716 | 2,310 | 17,699 | |
| 임상시료생산 등 | 120 | 78 | 106 | 304 | - | 20 | - | 18 | 38 | 78 | 78 | 1,130 | 1,286 | 1,628 | ||
| 합계 | 3,565 | 3,606 | 4,576 | 11,747 | 3,261 | 3,042 | 2,072 | 2,045 | 10,420 | 875 | 875 | 1,846 | 3,596 | 25,763 | ||
2) GI-108
GI-108은 대사면역에 관여하는 CD73를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진하는 대사면역항암제로, 전임상 시험 단계를 마치고 2024년 12월 11일 국내 식약처 IND 승인을 획득하여 국내 임상 1/2a상의 시작을 앞두고 있습니다. 2025년 3분기까지 단일 요법 용량 증량 및 확장 단계를 위한 환자 등록을 마무리할 예정입니다. 환자 등록이 완료된 이후 본격적인 임상 1/2a상을 진행하는 과정에서 발생하는 개발 계획에 따른 임상시료생산 비용은 2027년 3분기까지, CRO 비용 등 직접 임상시험에 소요되는 비용은 2027년 3분기까지 발생할 것으로 예측됩니다.
현재 당사가 계획중인 GI-108의 한국 임상 1/2a상 진행 및 임상시료생산을 위해 2025년 702백만원, 2026년 646백만원, 2027년 563백만원의 비용이 필요할 것으로 예상됩니다.
| [GI-108 연구개발비용 지출 관련 상세 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | ||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 소계 | ||||
| GI-108 | 고형암면역항암제 | 임상 1/2a상 비용 | 205 | 158 | 158 | 521 | 158 | 158 | 158 | 158 | 632 | 158 | 158 | 147 | 463 | 1,616 |
| 임상시료생산 등 | 73 | 52 | 56 | 181 | 10 | - | - | 4 | 14 | 33 | 33 | 34 | 100 | 295 | ||
| 합계 | 278 | 210 | 214 | 702 | 168 | 158 | 158 | 162 | 646 | 191 | 191 | 181 | 563 | 1,911 | ||
3) 임상개발 외 연구개발자금
(중략)
2025년 2분기부터 2027년 3분기까지 총 3개의 과제의 도입 혹은 전임상 진행을 목표로하고 있으며, 확보한 과제들의 비임상 개발 및 임상시험의약품 생산에 약 34,810백만원이 소요될 것으로 예상하여 비용을 확보하려 합니다.
또한, 연구개발인력의 인건비, 무형자산 취득비용 등으로 2025년 5,334백만원, 2026년 7,141백만원, 2027년 4,932백만원을 지출할 예정입니다.
| [임상개발 외 연구개발자금 관련 사용 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | ||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 소계 | ||||
| 연구개발자금 | 신규도입과제 | 비임상연구 | 20 | 562 | 700 | 1,282 | 617 | 1,001 | 2,522 | 3,422 | 7,562 | 8,927 | 3,859 | 2,296 | 15,082 | 23,926 |
| 연구용 소모품비 및 기타 주1) |
1,352 | 1,136 | 1,115 | 3,603 | 968 | 1,048 | 1,021 | 1,221 | 4,258 | 981 | 1,061 | 981 | 3,023 | 10,884 | ||
| 소계 | 1,372 | 1,698 | 1,815 | 4,885 | 1,585 | 2,049 | 3,543 | 4,643 | 11,820 | 9,908 | 4,920 | 3,277 | 18,105 | 34,810 | ||
| 연구개발 | 인건비 | 1,508 | 1,509 | 2,149 | 5,166 | 1,544 | 1,547 | 1,549 | 2,219 | 6,859 | 1,595 | 1,598 | 1,507 | 4,700 | 16,725 | |
| 무형자산 취득비용(특허 등) |
44 | 114 | 10 | 168 | 91 | 97 | 47 | 47 | 282 | 92 | 98 | 42 | 232 | 682 | ||
| 소계 | 1,552 | 1,623 | 2,159 | 5,334 | 1,635 | 1,644 | 1,596 | 2,266 | 7,141 | 1,687 | 1,696 | 1,549 | 4,932 | 17,407 | ||
| 합계 | 2,924 | 3,321 | 3,974 | 10,219 | 3,220 | 3,693 | 5,139 | 6,909 | 18,961 | 11,593 | 6,616 | 4,826 | 23,037 | 52,217 | ||
| 주1) 신규도입과제 기타비용은 연구용 시약 등으로 구성되어 있습니다. |
(2) 운영자금 - 인건비 및 관리비
당사는 사무인력 인건비 및 기타 관리비 등 필수운영자금에 2025년 5,523백만원, 2026년 7,347백만원, 2027년 5,056백만원 지출할 예정입니다. 기타 관리비에는 사무실 및 연구소 임차료, 위탁수수료, 사무용품 및 소모품 등이 포함되어 있습니다.
| [필수운영자금 사용 계획] |
| (단위: 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | |||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 소계 | |||
| 운영자금 | 사무인력 인건비 및 기타 관리비 | 1,616 | 1,643 | 2,264 | 5,523 | 1,740 | 1,624 | 1,663 | 2,320 | 7,347 | 1,775 | 1,672 | 1,609 | 5,056 | 17,926 |
(후략)
(주9) 정정 후
(전략)
| (단위: 원) |
| 구 분 | 금 액 |
|---|---|
| 모집 또는 매출총액(1) | 111,207,840,000 |
| 발행제비용(2) | 1,790,000,000 |
| 순 수 입 금 [ (1)-(2) ] | 109,417,840,000 |
| 주1) | 상기 금액은 확정 발행가액을 기준으로 산정한 금액입니다. |
| 주2) | 상기 모집총액은 하단에 기재된 유상증자 자금사용의 우선순위에 따라 사용할 예정입니다. |
| 주3) | 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. |
나. 발행제비용의 내역
| (단위 : 원) |
| 구분 | 금액 | 지급일자 | 비고 |
|---|---|---|---|
| 발행분담금 | 20,017,410 | 신고서제출일 | 모집총액의 0.018% (10원 미만 절사) |
| 인수수수료 | 1,668,117,600 | 납입일로부터 3영업일 이내 |
기본수수료: 최종 모집금액의 1.5% 실권수수료: 15.0%(실권수수료 미포함) |
| 표준코드발급수수료 | 10,000 | 표준코드발급 신청일 | 신주인수권증서(R) 건당 10,000원 |
| 보통주 추가상장수수료 |
13,150,000 | 신주상장일 | 910만원+1,000억원 초과금액의 10억원당 5만원(코스닥시장상장규정 시행세칙 별표 14) |
| 주식발행등록수수료 (신주인수권 및 주권) |
1,000,000 | - | 1,000주당 300원 (주식 및 신주인수권증서 각각 별도 징수, 수수료 건당 상한 50만원 및 하한 4천원)(주식·사채 등의 전자등록업무규정 시행세칙 별표) |
| 등록면허세 | 23,289,600 | 등기일 | 증자 자본금의 0.40% (지방세법 제28조, 10원 미만 절사) |
| 지방교육세 | 4,657,920 | 등기일 | 등록면허세의 20%(지방세법 제151조, 10원 미만 절사) |
| 기타비용 | 59,757,470 | - | 투자설명서, 통지서 인쇄 및 발송비 등 |
| 합계 | 1,790,000,000 | - | - |
| 주1) 상기 금액은 확정 발행가액 및 기산일 종가를 기준으로 산정한 금액입니다. 주2) 금번 유상증자 결과 대표주관회사가 최종 실권주를 인수할 경우 당사는 실권주 인수금액의 15.0%를 추가수수료 지급하게됩니다. 주3) 실제 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가기준으로 산정되며, 유관기관 정책 등에 따라 변동될 수 있습니다. 주4) 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사가 금번 보통주 유상증자를 통해 조달 예정인 자금 111,207,840,000원은 운영자금(GI-101, GI-102, GI-108 임상, 신규도입과제, 연구개발 인건비 등 연구개발자금, 사무인력 인건비 등 필수 운영자금)으로 사용할 계획입니다.
| [자금의 사용목적] |
| (기준일 : | 2025년 02월 10일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 111,208 | - | - | - | 111,208 |
나. 자금의 세부 사용 내역
당사는 금번 주주배정 후 실권주 일반공모 유상증자를 통한 납입자금에 대해서 아래와 같은 우선순위로 사용할 예정입니다.
| [자금사용 우선순위] |
| (단위: 백만원) |
| 구 분 | 목 적 | 자금 사용 시기 | 사용내역 | 금 액 | 우선순위 |
|---|---|---|---|---|---|
| 운영자금 | R&D 연구개발자금 | 2025년 2분기 ~ 2027년 4분기 |
GI-101/GI-102/GI-108 임상시험 비용 | 29,913 | 1순위 |
| 2025년 2분기 ~ 2027년 4분기 |
신규후보물질 개발을 위한 비임상 연구 관련 비용 및 연구개발인력 인건비를 포함한 연구개발자금 |
60,845 | 2순위 | ||
| 인건비 및 일반 관리 |
2025년 2분기 ~ 2027년 4분기 |
사무인력 인건비, 관리비 등 필수 운영자금 | 20,450 | 3순위 | |
| 총 계 | 111,208 | - | |||
| 출처: 당사 제시 |
(중략)
(1) 운영자금 - R&D 연구개발자금
당사는 금번 유상증자를 통하여 모집되는 자금 중 일부를 GI-101, GI-102, GI-108 파이프라인 임상개발 등에 29,913백만원, 신규도입과제 및 기타 연구개발자금으로 60,845백만원을 사용할 예정입니다.
1) GI-101/102
(중략)
GI-102는 종양미세환경에서 조절 T 세포를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진하는 면역항암제로서 현재 한국 및 미국에서 임상 1/2상을 진행 중에 있습니다. 또한, GI-101과 마찬가지로 MSD로부터 키트루다®를 무상으로 지원받아 임상을 진행 중에 있습니다. 현재 한국 및 미국 임상 1상의 경우 정맥 투여 제형 용량 증량 단계는 환자 등록을 완료하였고, 정맥 투여 제형 용량 확장 단계(한국, 미국 임상 2a상)/피하 투여 제형 용량 증량 및 확장(한국, 미국 임상 1b, 2a상)/ADC 및 화학항암제, 면역항암제 병용투여(한국, 미국 임상 2상) 단계의 환자 등록은 2025년 2분기 내에 완료될 예정입니다. 환자 등록이 완료된 이후 모집 환자에게 3주 간격으로 투약을 진행할 예정이며 이 과정에서 발생하는 개발 계획에 따른 임상시료생산 비용은 2027년 4분기까지, CRO 비용 등 직접 임상시험에 소요되는 비용은 2027년 4분기까지 발생할 것으로 예측됩니다.
현재 당사가 계획중인 GI-101 및 GI-102의 한국 및 미국 임상 1/2상 진행 및 임상시료생산을 위해 2025년 11,747백만원, 2026년 10,420백만원, 2027년 4,573백만원의 비용이 필요할 것으로 예상됩니다.
| [GI-101/102 연구개발비용 지출 관련 상세 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | |||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | ||||
| GI-101 | 고형암면역항암제 | 임상1/2상 비용 | 1,380 | 1,285 | 1,157 | 3,822 | 630 | 431 | 631 | 636 | 2,328 | - | - | - | - | - | 6,150 |
| 임상시료생산 등 | 103 | 71 | 92 | 266 | 10 | 10 | - | - | 20 | - | - | - | - | - | 286 | ||
| GI-102 | 임상1/2상 비용 | 1,962 | 2,172 | 3,221 | 7,355 | 2,621 | 2,581 | 1,441 | 1,391 | 8,034 | 797 | 797 | 716 | 817 | 3,208 | 18,597 | |
| 임상시료생산 등 | 120 | 78 | 106 | 304 | - | 20 | - | 18 | 38 | 78 | 78 | 1,130 | 79 | 1,365 | 1,707 | ||
| 합계 | 3,565 | 3,606 | 4,576 | 11,747 | 3,261 | 3,042 | 2,072 | 2,045 | 10,420 | 875 | 875 | 1,846 | 896 | 4,573 | 26,740 | ||
2) GI-108
GI-108은 대사면역에 관여하는 CD73를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진하는 대사면역항암제로, 전임상 시험 단계를 마치고 2024년 12월 11일 국내 식약처 IND 승인을 획득하여 국내 임상 1/2a상의 시작을 앞두고 있습니다. 2025년 3분기까지 단일 요법 용량 증량 및 확장 단계를 위한 환자 등록을 마무리할 예정입니다. 환자 등록이 완료된 이후 본격적인 임상 1/2a상을 진행하는 과정에서 발생하는 개발 계획에 따른 임상시료생산 비용은 2027년 4분기까지, CRO 비용 등 직접 임상시험에 소요되는 비용은 2027년 4분기까지 발생할 것으로 예측됩니다.
현재 당사가 계획중인 GI-108의 한국 임상 1/2a상 진행 및 임상시료생산을 위해 2025년 702백만원, 2026년 646백만원, 2027년 1,825백만원의 비용이 필요할 것으로 예상됩니다.
| [GI-108 연구개발비용 지출 관련 상세 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | |||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | ||||
| GI-108 | 고형암면역항암제 | 임상 1/2a상 비용 | 205 | 158 | 158 | 521 | 158 | 158 | 158 | 158 | 632 | 158 | 158 | 158 | 168 | 642 | 1,795 |
| 임상시료생산 등 | 73 | 52 | 56 | 181 | 10 | - | - | 4 | 14 | 33 | 33 | 33 | 1,084 | 1,183 | 1,378 | ||
| 합계 | 278 | 210 | 214 | 702 | 168 | 158 | 158 | 162 | 646 | 191 | 191 | 191 | 1,252 | 1,825 | 3,173 | ||
3) 임상개발 외 연구개발자금
(중략)
2025년 2분기부터 2027년 4분기까지 총 3개의 과제의 도입 혹은 전임상 진행을 목표로하고 있으며, 확보한 과제들의 비임상 개발 및 임상시험의약품 생산에 약 40,951백만원이 소요될 것으로 예상하여 비용을 확보하려 합니다.
또한, 연구개발인력의 인건비, 무형자산 취득비용 등으로 2025년 5,334백만원, 2026년 7,141백만원, 2027년 7,419백만원을 지출할 예정입니다.
| [임상개발 외 연구개발자금 관련 사용 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | |||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | ||||
| 연구개발자금 | 신규도입과제 | 비임상연구 | 20 | 562 | 700 | 1,282 | 617 | 1,001 | 2,522 | 3,422 | 7,562 | 8,927 | 3,859 | 2,490 | 4,641 | 19,917 | 28,761 |
| 연구용 소모품비 및 기타 주1) |
1,352 | 1,136 | 1,115 | 3,603 | 968 | 1,048 | 1,021 | 1,221 | 4,258 | 981 | 1,061 | 1,034 | 1,253 | 4,329 | 12,190 | ||
| 소계 | 1,372 | 1,698 | 1,815 | 4,885 | 1,585 | 2,049 | 3,543 | 4,643 | 11,820 | 9,908 | 4,920 | 3,524 | 5,894 | 24,246 | 40,951 | ||
| 연구개발 | 인건비 | 1,508 | 1,509 | 2,149 | 5,166 | 1,544 | 1,547 | 1,549 | 2,219 | 6,859 | 1,595 | 1,598 | 1,600 | 2,339 | 7,132 | 19,157 | |
| 무형자산 취득비용(특허 등) |
44 | 114 | 10 | 168 | 91 | 97 | 47 | 47 | 282 | 92 | 98 | 48 | 49 | 287 | 737 | ||
| 소계 | 1,552 | 1,623 | 2,159 | 5,334 | 1,635 | 1,644 | 1,596 | 2,266 | 7,141 | 1,687 | 1,696 | 1,648 | 2,388 | 7,419 | 19,984 | ||
| 합계 | 2,924 | 3,321 | 3,974 | 10,219 | 3,220 | 3,693 | 5,139 | 6,909 | 18,961 | 11,593 | 6,616 | 5,172 | 8,282 | 31,665 | 60,845 | ||
| 주1) 신규도입과제 기타비용은 연구용 시약 등으로 구성되어 있습니다. |
(2) 운영자금 - 인건비 및 관리비
당사는 사무인력 인건비 및 기타 관리비 등 필수운영자금에 2025년 5,523백만원, 2026년 7,347백만원, 2027년 7,580백만원 지출할 예정입니다. 기타 관리비에는 사무실 및 연구소 임차료, 위탁수수료, 사무용품 및 소모품 등이 포함되어 있습니다.
| [필수운영자금 사용 계획] |
| (단위: 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | ||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | |||
| 운영자금 | 사무인력 인건비 및 기타 관리비 | 1,616 | 1,643 | 2,264 | 5,523 | 1,740 | 1,624 | 1,663 | 2,320 | 7,347 | 1,775 | 1,672 | 1,708 | 2,425 | 7,580 | 20,450 |
(후략)
투 자 설 명 서
2025년 03월 17일 |
|
| ( 발 행 회 사 명 ) 주식회사 지아이이노베이션 |
|
| ( 증권의 종목과 발행증권수 ) 기명식 보통주 11,644,800주 |
|
| ( 모 집 또는 매 출 총 액 ) 111,207,840,000원 |
|
| 1. 증권신고의 효력발생일 : |
2025년 02월 07일 |
| 2. 모집가액 : |
9,550원 |
| 3. 청약기간 : |
구주주 청약일 : 2025년 03월 19일 ~ 20일 일반공모 청약일 : 2025년 03월 24일 ~ 25일 |
| 4. 납입기일 : |
2025년 03월 27일 |
| 5. 증권신고서 및 투자설명서의 열람장소 |
|
| 가. 증권신고서 : |
전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 일괄신고 추가서류 : |
해당사항 없음 |
| 다. 투자설명서 : | 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : (주)지아이이노베이션 → 서울특별시 송파구 송파대로 167, 에이동 1116호(문정동, 문정역테라타워) 한국투자증권(주) →서울시 영등포구 의사당대로88 | |
| 6. 안정조작 또는 시장조성에 관한 사항 | |
| 해당사항 없음 |
|
| 이 투자설명서에 대한 증권신고의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 증권의 가치를 보증 또는 승인한 것이 아니며, 이 투자설명서의 기재사항은 청약일 전에 정정될 수 있음을 유의하시기 바랍니다. |
| ( 대 표 주 관 회 사 명 ) 한국투자증권 주식회사 |
【 대표이사 등의 확인 】
 |
|
대표이사 등의 확인(25.03.17) |
【 본 문 】
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 |
가. 국내외 경기변동에 따른 위험 국제통화기금(IMF)이 2024년 10월 발표한 "World Economic Outlook"에 따르면 세계 경제성장률 전망치는 2024년 3.2%, 2025년 3.2%로 전망됩니다. IMF에 따르면 아시아 지역의 수출 증가 등 세계 무역 회복의 영향으로 세계 경제가 양호한 성장세를 보일 것으로 전망하였습니다. IMF는 지난 7월 전망에 비해 세계 경제 하방조정 위험요인이 보다 확대된 것으로 평가하였습니다. 상방조정 가능요인으로는 주요 선진국에서의 투자 회복과 구조개혁 모멘텀 확산에 의한 잠재성장률 제고 등을 제시하였습니다. 반면, 그간 긴축적 통화정책의 시차 효과에 따른 성장·고용에의 부정적 영향, 중국 부동산 부문 위축 지속, 전세계적인 보호무역주의 강화 및 지정학점 위기 심화에 따른 원자재 가격 상승 등을 하방조정 위험요인으로 지적하였습니다. 한편, 한국은행이 2024년 11월 발표한 경제전망보고서에 따르면, 국내 경제성장률은 2024년과 2025년에 각각 2.2%, 1.9% 수준으로 전망됩니다. 다. 기술이전 지연 및 실패에 따른 위험 당사와 같은 다수의 신약 개발 기업들은 신약 개발사업이 태생적으로 부담하고 있는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간 등의 리스크를 감소 또는 분산시키기 위하여, 개발 초기단계에서 국내외 대형제약사에 기술이전함으로써 조기에 수익을 시현하는 전략을 추구하고 있습니다. 당사는 기존 기술이전 파이프라인의 계약 대상지역 외 추가적인 기술이전 추진을 비롯하여 차기 후보물질 파이프라인의 기술이전을 활성화하기 위해 국내외 제약회사를 대상으로 글로벌 학회, 전시회 및 비즈니스 파트너링 등 기술 교류의 장을 통해 지속적으로 연구개발사항을 업데이트하며 적극적인 교류활동을 진행하며, 다수의 해외 파트너사들과 CDA를 맺고 기술이전을 위한 활동을 유지해 나가고 있습니다. 마. 목표시장 침체 위험 최근 암 치료는 기존 화학 및 표적항암제에서 면역항암제로 이른바 '패러다임 전환(paradigm shift)'이 이루어지고 있으며, 이에 따라 글로벌 면역항암제 시장은 2021년 450억 달러의 규모에서 2027년까지 연평균 21.2%의 고성장을 나타낼 것으로 전망됩니다. 한편, 산업화, 서구화 등 생활 환경의 변화로 인한 알레르기 질환 발병률 증가와 함께 알레르기에 관한 관심 및 인식의 확대, 지속적인 치료제 개발 및 출시 등은 알레르기 시장 성장을 빠르게 성장시키고 있습니다. 글로벌 주요 7개국의 천식 치료제 시장규모는 2019년 98억 달러에서, 2029년 112억 달러에 이를 것으로 전망되며, 글로벌 주요 7개국 아토피 피부염 치료제 시장 규모는 2020년 약 64억 달러에서 연평균 10.6% 성장하여 2030년에는 175억 달러에 이를 것으로 전망되고, 주요 8개국 땅콩 알레르기 치료제 시장은 2017년 2,600만 달러 규모에서 연평균 111%의 폭발적인 성장을 보이며 2027년 45억 달러 시장을 형성할 것으로 예측됩니다. 한편, 모든 암종에서 암이 증식 및 전이를 일으키는 과정에서 특이적인 대사과정을 거치기 때문에, 많은 연구진들이 대사면역항암제가 3세대에 해당하는 면역항암제의 뒤를 잇는 4세대 차세대 항암제로 부각될 것으로 기대하고 있습니다. 2020년에 보고된 GlobalData와 2022년 보고된 EvaluatePharma의 자료에 따르면, CD73 저해제를 포함한 대사면역항암제 글로벌 시장의 2021년부터 2028년까지 연평균성장률 181%의 폭발적인 성장으로 보일 것으로 예측되고 있습니다. 상기에서 살펴본 바와 같이, 당사의 주요 파이프라인이 속한 면역항암제 시장, 알레르기 치료제 시장 및 대사면역항암제 시장은 중장기적으로 지속적인 높은 성장세가 예상되나, 그럼에도 불구하고 예기치 못한 상황으로 인한 의료기관 이용 및 의약품 공급 제한, 보험급여 정책 축소, 시장 및 경기 불황 등으로 인한 제품 수요 감소 및 가격의 하락 등으로 목표 시장 및 전방 시장의 성장성이 예상보다 낮아질 수 있으며, 이 경우 당사의 임상 진행 및 사업화에 부정적인 영향을 미칠 수 있습니다. 자. 업무 위탁 기관 관련 위험 당사와 같이 신약 개발사업을 영위하고 있는 다수의 바이오벤처 업체는 신약개발의 효율성을 높이고 리스크를 감소시키기 위한 전략으로, 임상시험 전문수탁기관(Contract Research Organization, CRO)을 대상으로 비임상시험 및 임상시험을 위탁 진행하거나, 의약품 생산 전문대행기관(Contract Manufacturing Organization, CMO)을 대상으로 임상시험에 필요한 원료 및 완제 생산을 위탁 진행하고 있습니다. 당사는 자체적인 연구개발 조직이 구축되어 있으나, 신약개발의 효율성 증대, 리스크 감소, 공정성 및 객관성을 갖는 자료 확보를 위해 GLP, GCP 인증 등을 통해 국제적인 신뢰성을 인정받은 국내외 전문 CRO 기관을 활용하며, 삼성바이오로직스, 바이넥스 등과 같은 GMP 인증을 받은 CMO/CDMO 기관을 활용하고 있습니다.
|
| 회사위험 |
가. 청약 등에 따른 최대주주 지분율 변동 및 경영권 안정성 관련 위험 아. 정부 연구개발 과제 수행 관련 위험 신약 개발에 대한 정부 지원 정책이 축소되거나 효율적으로 이루어지 않는 경우, 그리고 임상 단계에서 적용되는 규정 등의 변화가 일어나는 경우 당사의 임상 개발 일정이 지연되거나 추가적인 비용이 발생하여 당사의 사업에 부정적인 영향을 미칠 수 있다는 점 주의하시기 바랍니다. 특히, 현행 제도상 정부출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제재 조치가 가해질 수 있음을 투자 판단에 참고하시기 바랍니다. |
| 기타 투자위험 | 가. 신주의 환금성 제약 및 주가 변동에 따른 손실 위험 당사의 금번 유상증자로 인한 발행신주는 주금 납입일 이후 코스닥시장에 추가 상장일까지 유동성이 제한될 수 있으며, 추가상장 시점에서 신주발행가액보다 주가의 수준이 낮은 경우 환금성 위험 및 원금 손실의 위험이 있습니다. 본 유상증자 기간동안 주가의 변동이 있을 수 있다는 점, 투자자께서는 유의하여 주시기 바랍니다. 나. 증자방식, 청약절차에 대한 주의 및 주가하락 위험 당사의 금번 유상증자로 인하여 기발행주식총수 45,163,170주의 25.78%에 해당하는 11,644,800주가 추가로 발행될 예정입니다. 본 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행됨에 따라 일반공모를 거쳐 배정 후에도 미 청약된 잔여주식에 대해서는 대표주관회사가 자기계산으로 잔액인수하게 됩니다. 만약 본 유상증자 청약에서 대량 실권이 발생하여 대표주관회사가 실권주를 인수하게 될 경우 주가에 어떠한 영향을 미칠지는 예상하기 어렵습니다. 다만, 대표주관회사가 당사 주식 인수 후 수익을 확정하기 위해 빠른 시일 내에 인수한 주식을 장내에서 매각하게 된다면 단기적으로 당사 주가에 악영향을 미칠 수 있으며, 대표주관회사가 인수한 주식을 일정 기간 보유하더라도 동 인수 물량이 잠재 매각 물량으로 존재하여 주가 상승에 부담으로 작용할 가능성이 있습니다. 대표주관회사가 최종 실권주를 인수할 경우, 당사는 실권주 인수금액의 15.0%를 추가수수료로 지급하게 됩니다. 이를 고려할 때, 대표주관회사의 실권주 매입단가는 일반청약자들 보다 15.0% 낮은 것과 같은 결과가 초래되어 인수 물량을 단기간에 처분하게 될 소지가 높을 것으로 예상되며 일시적으로 대규모 물량이 출회하여 주가가 하락할 가능성이 있습니다. 실질적으로 유상증자 청약자 및 대표주관회사는 신주상장 2영업일 전부터 입고예정 주식의 매도가 가능합니다. 투자자 여러분께서는 이 점에 유의하시어 투자에 임하시기 바랍니다. 다. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화 등으로 인하여 금번 유상증자 발행가격이 하락하면서 모집규모가 크게 줄어들 경우, 당사가 계획했던 사업추진 및 자금운용 등에 차질이 빚어지면서 사업실적 및 재무적 안정성에 부정적 영향을 미칠 수 있습니다. 투자자분들은 투자시 이점에 유의하시기 바랍니다. 라. 공시서류 정정에 따른 일정 변경 위험 본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 마. 분석정보의 한계 및 투자판단 관련 위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있습니다. 본 증권신고서의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단하시기 바랍니다. 바. 집단 소송 제기 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있습니다. 사. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다. 당사가 진행하는 금번 유상증자가 예기치 못한 사유로 인해 철회될 경우 당사는 자본 확충을 위하여 무상감자 등 주주에게 손실을 끼치는 방안 등을 진행할 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이 점 유의하시기 바랍니다. 아. 금융감독기관의 규제 강화에 따른 위험 최근 금융감독기관 등의 상장기업에 대한 관리감독기준은 투자자보호 차원에서 엄격해지고 있는 상황이며, 회사가 관련 규정을 위반할 경우 회사 및 회사가 발행한 주식에 대해 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 자. 차입공매도 유상증자 참여 제한 관련 위험 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률 시행령」일부개정에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우에만 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 투자자께서는 이 점 유의하시기 바랍니다. 차. 재무제표 작성 기준일 이후 재무상황 변동에 따른 위험 본 공시서류 상 재무제표에 관한 사항은 2024년 3분기 재무제표 (K-IFRS 기준) 작성기준일 이후의 변동을 반영하지 않았습니다. 당사는 금번 유상증자를 진행하는 과정에서 투자 의사결정에 중대한 영향을 미칠 것으로 판단되는 변동사항을 향후에도 상세하게 반영하여 공시할 예정입니다. 그럼에도 불구하고, 당사가 중요하지 않다고 판단하여 기재 및 서술을 생략한 사항 중 당사의 기업가치에 영향을 미칠 만한 사건이 없다고 단정할 수는 없어 주기적이고 면밀한 검토가 필요합니다. 카. 개인종합자산관리계좌(ISA) 납입한도에 따른 청약제한 위험 개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다. 타. 기타 투자자 유의사항 당사의 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우, 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 공시서류에 기재된 정보에만 의존하여 투자 판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 유의하시어 투자에 임하시기 바랍니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 11,644,800 | 500 | 9,550 | 111,207,840,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 한국투자증권 | 보통주 | 11,644,800 | 111,207,840,000 | 인수수수료 : 모집총액의 1.5% 실권수수료 : 잔액인수금액의 15.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2025년 03월 19일 ~ 2025년 03월 20일 | 2025년 03월 27일 | 2025년 03월 21일 | 2025년 03월 27일 | 2025년 02월 12일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2024년 12월 21일 | 2025년 03월 14일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 운영자금 | 111,207,840,000 |
| 발행제비용 | 1,790,000,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | 주요사항보고서(유무상증자결정)-2025.03.17 |
| 【기 타】 | 1) 금번 (주)지아이이노베이션의 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 한국투자증권(주)입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것입니다. 대표주관회사는 주주배정후 실권주 일반공모 후 최종실권주를 잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 Ⅰ. 5. 인수 등에 관한 사항'을 참고하여 주시기 바랍니다. 대표주관회사인 한국투자증권(주)은 투자중개업자로서 타인의 계산으로 증권의 발행ㆍ인수에 대한 청약의 권유, 청약, 청약의 승낙 및 자본시장법 상의 증권의 인수업무를 수행합니다. 3) 상기 모집가액, 모집총액 및 발행제비용은 확정된 가액입니다. 4) 상기 청약기일은 구주주 청약 일정이며, 일반공모 청약은 2025년 03월 24일 ~ 2025년 03월 25일 2영업일간입니다. 5) 「증권 인수업무 등에 관한 규정」 제9조 제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니할 수 있습니다. 6) 금융감독원에서 본 증권신고서를 심사하는 과정에서 주요사항의 변동으로 인한 기재 내용의 정정 등으로 동 신고서에 기재된 일정이 변경될 수 있습니다. 7) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6 제2항 제1호에 의거 당사와 대표주관회사인 한국투자증권(주) 간에 주주배정후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 11,644,800주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 11,644,800 | 500 | 9,550 | 111,207,840,000 | 주주배정후 실권주 일반공모 |
| 주1) | 이사회 결의일: 2024년 12월 20일, 2025년 2월 7일 |
| 주2) | 1주의 모집가액 및 모집총액은 확정 발행가액을 기준으로 산출한 금액입니다. |
「증권의 발행 및 공시 등에 관한 규정」 제5-18조 (유상증자의 발행가액 결정)에 의거, 주주배정 증자시 가격산정 절차폐지 및 가격산정의 자율화에 따라 발행가액을 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 산정할 예정입니다.
■ 2차 발행가액의 산출 근거
본 증권신고서의 2차 발행가액은 구주주 청약 초일 전 3거래일(2025년 03월 14일)을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용, 아래의 산식에 의하여 산정된 발행가액(2차 발행가액)으로 합니다. 단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하일 경우에는 액면가액을 발행가액으로 합니다.
▶ 2차 발행가액 = 기준주가 × [1 - 할인율(25%)]
| [2차 발행가액 산정표] |
| 기산일 : 2025년 03월 14일 | (단위: 원, 주) |
| 일자 | 종가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2025-03-14 | 15,530 | 1,046,643 | 16,596,497,930 |
| 2025-03-13 | 15,950 | 1,280,180 | 20,203,549,635 |
| 2025-03-12 | 15,550 | 1,130,679 | 18,199,626,450 |
| 2025-03-11 | 15,970 | 985,316 | 15,661,461,640 |
| 2025-03-10 | 15,970 | 2,289,752 | 37,113,902,060 |
| 1주일 거래량 가중산술평균주가 (A) | 16,008원 | - | |
| 기산일 종가(B) | 15,530원 | - | |
| (A),(B)의 산술 평균 (C) | 15,769원 | [(A)+(B)] ÷ 2 | |
| 기준주가 (D) | 15,530 | (B)와 (C)중 낮은가액 | |
| 할인율 | 25.00% | - | |
| 2차 발행가액 (호가단위 미만은 호가단위로 절상, 액면가액 이하일 경우 액면가액을 발행가액으로 함) |
11,650 | 기준주가 × (1 - 할인율) | |
■ 확정 발행가액의 산출근거
확정 발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 합니다. 다만, 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은 가액이 구주주 청약 초일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가를 기준주가로 하여 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. 단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하일 경우에는 액면가액을 발행가액으로 합니다.
| [확정 발행가액 산정표] | |
| 기산일 : 2025년 03월 14일 | (단위 : 원, 주) |
| 일수 | 일자 | 종가 | 거래량 | 거래대금 |
|---|---|---|---|---|
| 1 | 2025-03-14 | 15,530 | 1,046,643 | 16,596,497,930 |
| 2 | 2025-03-13 | 15,950 | 1,280,180 | 20,203,549,635 |
| 3 | 2025-03-12 | 15,550 | 1,130,679 | 18,199,626,450 |
| 3거래일 가중산술평균 | 15,907.34 | |||
| 할인율 | 40% | |||
| 3거래일 가중산술평균주가의 60% (A) | 9,550 | (단, 호가단위 미만은 절상) | ||
| 1차 발행가액 (B) | 8,400 | - | ||
| 2차 발행가액 (C) | 11,650 | - | ||
| 확정 발행가액 | 9,550 | Max[A,(Min(B,C)] | ||
| 주1) | 3거래일 가중산술평균주가의 60%는 호가단위 미만은 절상하며, 액면가액 이하일 경우 액면가액으로 합니다. |
이에 따라 확정발행가액은 9,550원으로 결정되었습니다.
■ 공모일정 등에 관한 사항
| [주요일정] |
| 날 짜 | 내 용 | 비 고 |
|---|---|---|
| 2024년 12월 20일 | 이사회결의 | 주요사항보고서 제출 |
| 2024년 12월 20일 | 최초 증권신고서(예비투자설명서) 제출 | - |
| 2024년 12월 23일 | 신주발행공고 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.gi-innovation.com) |
| 2025년 02월 07일 | 1차 발행가액 확정 | 신주배정기준일 전 제3거래일 |
| 2025년 02월 11일 | 권리락 | 신주배정기준일 전 제1거래일 |
| 2025년 02월 12일 | 유상증자 신주배정기준일(주주확정) | - |
| 2025년 02월 21일 | 신주배정 통지 | - |
| 2025년 03월 04일 ~ 2025년 03월 10일 |
신주인수권증서 상장 및 거래 기간 | 5거래일 이상 동안 거래 |
| 2025년 03월 11일 | 신주인수권증서 상장폐지 | 신주인수권증서 상장폐지일과 구주주청약 초일 사이 5거래일 확보 |
| 2025년 03월 14일 | 확정 발행가액 산정 | 구주주 청약 초일 3거래일 전 |
| 2025년 03월 17일 | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.gi-innovation.com) |
| 2025년 03월 19일 ~ 2025년 03월 20일 |
구주주 청약 | - |
| 2025년 03월 21일 | 일반공모청약 공고 | 당사 인터넷 홈페이지 (http://www.gi-innovation.com) 한국투자증권 홈페이지 (http://www.truefriend.com) |
| 2025년 03월 24일 ~ 2025년 03월 25일 |
일반공모청약 | - |
| 2025년 03월 27일 | 주금납입/환불/배정공고 | - |
| 2025년 04월 03일 | 무상증자 신주배정기준일(주주확정) | - |
| 2025년 04월 10일 | 유상증자 신주상장 예정일 | - |
| 2025년 04월 22일 | 무상증자 신주상장 예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
■ 무상증자에 관한 사항
당사는 2024년 12월 20일에 개최된 최초 이사회에서 무상증자를 결의하고 2025년 02월 07일 개최된 이사회에서 무상증자 일정 변경을 결의하였으며, 유상증자 납입일(2025년 03월 27일)의 5영업일 후인 2025년 04월 03일을 무상증자 신주배정기준일로 하여, 유상증자 후 주주명부에 기재된 주주(자기주식 제외)에 대하여 소유주식 1주당 0.1주의 비율로 신주를 무상으로 배정하는 증자를 시행할 예정입니다. 금번 유상증자로 인해 발행되는 신주의 경우에도 자동적으로 무상증자에 참여하여 신주를 받을 수 있는 권리가 발생하게 됩니다.
1) 신주의 재원 : 주식발행초과금
2) 단주 처리방법 : 신주의 상장 초일 종가를 기준으로 현금 지급합니다.
3) 무상증자에 관한 기타사항은 이사회를 통해 대표이사에게 위임되었으며, 상기 일정은 유관기관과의 협의를 통해 변경될 수 있습니다.(본 무상증자는 유상증자 청약자도 무상증자를 받을 수 있도록 진행되고 있습니다. 따라서, 만약 유상증자 일정이 변경되면, 본 무상증자의 일정 또한 변경될 수 있습니다.)
| [무상증자 개요] |
| 구분 | 내용 |
| 무상증자 신주배정 기준일 | 2025년 04월 03일 |
| 무상증자 신주의 주당 발행가액 | 500원 |
| 무상증자 신주의 종류와 수 | 보통주식 5,594,959주, 우선주 85,837주 |
| 1주당 신주배정 수 | 0.1주 |
| 무상증자 신주의 재원 | 주식발행초과금 |
| 무상증자 신주권 유통 예정일 | 2025년 04월 22일 |
| 무상증자 신주상장일 | 2025년 04월 22일 |
| 주1) | 무상증자 신주의 수는 현재까지 발행한 주식의 총수에서 자기주식을 제외한 유통주식수에 금번 유무상증자 이사회 결의시 결의한 유상증자 주식수를 더한 주식수에 0.1을 곱한 주식수 입니다.(단수주 절사) |
| 주2) | 무상증자 신주 수는 신주배정기준일 전 전환권의 행사, 종류주식의 권리 행사, 주식매수선택권의 권리 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동으로 인하여 변동될 수 있습니다. |
2. 공모방법
| [공모방법 : 주주배정후 실권주 일반공모] |
| 모 집 대 상 | 주식수(%) | 비 고 |
|---|---|---|
| 구주주 청약 (신주인수권증서 보유자 청약) |
11,644,800주 (100%) |
- 구주 1주당 신주 배정비율 : 1주당 0.2578384112주 - 신주배정 기준일 : 2025년 02월 12일 - 구주주 청약일 : 2025년 03월 19일 ~ 2025년 03월 20일 (2영업일간) - 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권 증서가 배정됨) |
| 초과 청약 | - | - 「자본시장과 금융투자업에 관한 법률」제165조의6 제2조 제2항에 의거 초과청약 - 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 |
| 일반모집 청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
- | - 구주주 및 초과청약 후 발생하는 단수주 및 실권주에 대해 배정됨 - 일반모집 청약일 : 2025년 03월 24일 ~ 2025년 03월 25일(2영업일간) |
| 합 계 | 11,644,800주 (100%) |
- |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주의 청약결과 발생하는 실권주 및 단수주에 대해서는 이를 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.2578384112 비율로 배정하되, 1주 미만의 단수주는 절사합니다. 단, 신주배정기준일 전 전환권의 행사, 종류주식의 권리 행사, 주식매수선택권의 권리 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동으로 인하여 1주당 신주배정주식수 비율 및 증자비율이 추가적으로 변동될 수 있습니다. |
| 주3) | 신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20.0%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. ① 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수 ② 신주인수권증서 청약 한도주식수 = 보유한 신주인수권 증서의 수량 ③ 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율(20.0%) |
| 주4) |
"고위험고수익투자신탁등"이란 다음 각 목의 어느 하나에 해당하는 투자신탁 등을 말합니다. ① 「조세특례제한법」 제91조의15 제1항에 따른 고위험고수익채권투자신탁(이하 '고위험고수익채권투자신탁'이라 한다). 다만, 해당 투자신탁 등의 최초 설정일·설립일이 속하는 분기 또는 그 다음 분기 말일 전 영업일까지 수요예측에 참여하는 경우에는 같은 법 시행령 제93조 제1항 제1호 및 같은 조 제5항에도 불구하고 수요예측 참여일 직전 영업일의 고위험고수익채권의 보유비율이 같은 법 시행령 제93조 제1항 제1호 각 목의 비율 이상이어야 한다. ② 법률 제19328호 조세특례제한법의 시행일 이전의 제91조의15 제1항에 따른 고위험고수익투자신탁(이하 '고위험고수익투자신탁'이라 한다)으로서 최초 설정일·설립일이 2023년 12월 31일 이전인 것. 다만, 해당 투자신탁 등의 최초 설정일·설립일로부터 수요예측 참여일까지의 기간이 6개월 미만인 경우에는 대통령령 제33499호 조세특례제한법 시행령 시행일 이전의 제93조제3항제1호 및 같은 조 제7항에도 불구하고 수요예측 참여일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 한다. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조 제1항 제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 수요예측 참여일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조 제1항 제3호에도 불구하고 수요예측 참여일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35이상이어야 합니다. |
| 주6) | 구주주 청약(초과청약 포함) 결과 발생한 미청약주식 및 단수주는 대표주관회사가 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」제9조 제2항 제6호 가목에 따라 "고위험고수익투자신탁등"에 일반공모 배정분의 10%를 배정하고, 「증권 인수업무 등에 관한 규정」제9조 제2항 제6호 나목에 따라 "벤처기업투자신탁"에 일반공모 배정분의 25%를 배정합니다. 나머지 주식은 개인청약자 및 기관투자자에 구분없이 배정합니다. "고위험고수익투자신탁등"에 대한 일반공모 배정분 10%, "벤처기업투자신탁"에 대한 일반공모 배정분 25% 및 개인투자자 및 기관투자자에 대한 일반공모 배정분 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 한 그룹만 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. ① 1단계: 총 청약물량이 일반공모 배정분 주식수를 초과하는 경우, 각 청약자에 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 다만, 고위험고수익투자신탁등에 대한 공모주식 10%와 벤처기업투자신탁에 대한 공모주식 25%, 개인투자자 및 기관투자자(집합투자업자포함)에 대한 공모주식 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 어느 한 그룹에서 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. ② 2단계: 1단계 배정 후 최종 잔여주식은 최대청약자부터 순차적으로 1주씩 우선 배정하되, 동순위 최대청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다. |
| 주7) | 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수에 미달하는 경우에는 청약주식수대로 배정하되 잔여주식은 대표주관회사가 자기의 계산으로 인수합니다. |
| 주8) | 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조 제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니하고 대표주관회사가 자기계산으로 인수할 수 있습니다. |
| 주9) |
「자본시장법」 제180조의4 및 같은 법 시행령 제208조의4 제1항에 따라 2024년 12월 21일부터 2025년 03월 14일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3 제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4 제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
▶ 구주주 1주당 배정비율 산출근거
| 구분 | 상세내역 |
|---|---|
| A. 보통주식 | 44,304,799주 |
| B. 우선주식 | 858,371주 |
| C. 발행주식총수 (A + B) | 45,163,170주 |
| D. 자기주식 + 자기주식신탁 | - |
| E. 자기주식을 제외한 발행주식총수 (C - D) | 45,163,170주 |
| F. 유상증자 주식수 | 11,644,800주 |
| G. 증자비율 (F / C) | 25,78% |
| H. 우리사주조합 배정 | - |
| I. 구주주 배정 (F - H) | 11,644,800주 |
| J. 구주주 1주당 배정비율 (I / E) | 0.2578384112 |
| 주1) | 단, 신주배정기준일 이전에 신주의 배정비율은 전환권의 행사, 종류주식의 권리 행사, 주식매수선택권의 권리 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동으로 인하여 변동될 수 있습니다. |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」 제5-18조(유상증자의 발행가액 결정)에 의거, 주주배정 증자시 할인율 등이 자율화되어 발행가액은 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (舊)「유가증권의 발행 및 공시 등에 관한 규정」 제 57조의 방식을 일부 준용하여 아래와 같이 발행가액을 산정합니다.
① 1차 발행가액: 신주배정기준일전 제 3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용,다음의 산식에 의하여 산정된 발행가액을 1차 발행가액으로 합니다. (단, 호가단위 미만은 절상하며, 1주당 발행가액이 액면가 미만일 경우에는 액면가로 합니다.)
| 기준주가 ×【 1 - 할인율(25%)】 | ||
| ▶ 1차 발행가액 | = | ------------------------------------- |
| 1 + 【증자비율 × 할인율(25%)】 |
② 2차 발행가액: 2차 발행가액은 구주주 청약일전 제 3거래일을 기산일로 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액에 동일한 할인율(25%)을 적용하여 다음의 산식에 의하여 산정한 발행가액으로 합니다.(단, 호가단위 미만은 절상하며, 1주당 발행가액이 액면가 미만일 경우에는 액면가로 합니다.)
▶ 2차 발행가액 = 기준주가 ×【1 - 할인율(25%)】
③ 확정 발행가액: 확정 발행가액은 ①의 1차 발행가액과 ②의 2차 발행가액 중 낮은 가액으로 합니다. 단, 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시에 관한 규정」제5-15조의2의 산출근거에 의거, 청약일 전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가를 기준주가로 할인율 40% 적용하여 산정한 가액이 ①의 1차 발행가액과 ②의 2차 발행가액 중 낮은 가액을 초과하는 경우 동 금액을 확정 발행가액으로 합니다. (단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
▶ 확정 발행가액 = Max{Min[1차 발행가액, 2차 발행가액], 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가의 60%}
④ 모집가액 확정 공시에 관한 사항: 1차 발행가액은 신주배정기준일 전 제3거래일(2025년 02월 07일)에 결정되어 2025년 02월 10일에 금융감독원 전자공시시스템에 공시될 예정이며, 확정 발행가액은 구주주청약일 전 제3거래일(2025년 03월 14일)에 결정되어 2025년 03월 17일에 금융감독원 전자공시시스템에 공시될 예정이며, 정관에서 정한 당사 인터넷 홈페이지(http://www.gi-innovation.com)에 공고하여 개별통지에 갈음할 예정입니다. 확정 발행가액 결정에 따라 정정 신고서(증권발행조건확정)가 금융감독원 전자공시시스템에 공시 됩니다.
※ 일반공모의 발행가액은 구주주 청약시에 적용된 확정 발행가액을 동일하게 적용합니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 11,644,800 | |||||||||||||||||||||||||||||||||||||
| 주당 모집가액 또는 매출가액 | 예정가액 | - | ||||||||||||||||||||||||||||||||||||
| 확정가액 | 9,550 | |||||||||||||||||||||||||||||||||||||
| 모집총액 또는 매출총액 | 예정가액 | - | ||||||||||||||||||||||||||||||||||||
| 확정가액 | 111,207,840,000 | |||||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
1) 구주주
|
|||||||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 (신주인수권증서 보유자) |
개시일 | 2025년 03월 19일 |
| 종료일 | 2025년 03월 20일 | ||
| 일반모집 또는 매출 | 개시일 | 2025년 03월 24일 | |
| 종료일 | 2025년 03월 25일 | ||
| 청약 증거금 |
구주주(신주인수권증서 보유자) | 청약금액의 100% | |
| 초 과 청 약 | 청약금액의 100% | ||
| 일반모집 또는 매출 | 청약금액의 100% | ||
| 납입기일 | 2025년 03월 27일 | ||
| 배당기산일(결산일) | 2025년 01월 01일 | ||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
(1) 공고의 일자 및 방법
| 구 분 | 일 자 | 공고방법 |
|---|---|---|
| 신주발행(신주배정기준일)의 공고 | 2024년 12월 23일 | 당사 인터넷 홈페이지 (http://www.gi-innovation.com) |
| 모집 또는 매출가액 확정의 공고 | 2025년 03월 17일 | 당사 인터넷 홈페이지 (http://www.gi-innovation.com) |
| 실권주 일반공모 청약공고 | 2025년 03월 21일 | 당사 인터넷 홈페이지 (http://www.gi-innovation.com) 한국투자증권(주) 홈페이지 (www.truefriend.com) |
| 실권주 일반공모 배정 및 환불 공고 | 2025년 03월 27일 | 한국투자증권(주) 홈페이지 (www.truefriend.com) |
| 주1) | 청약결과 초과청약금 환불에 대한 통지는 대표주관회사의 홈페이지에 게시함으로써 개별통지에 갈음합니다. |
| 주2) | 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지(http://www.gi-innovation.com)에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 일간 아시아경제신문에 공고합니다. |
(2) 청약방법
1) 구주주 청약(신주인수권증서 보유자 청약)
구주주 중 주권을 증권회사에 예탁한 주주(기존 "실질주주", 이하 "일반주주"라 합니다.)는 주권을 예탁한 증권회사의 본·지점 및 대표주관회사의 본ㆍ지점에서 청약할 수 있습니다. 다만, 구주주 중 명의개서대행기관 특별계좌에 주식을 가지고 있는 주주(기존 "명부주주". 이하 "특별계좌 보유자"라 합니다.)는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 대표주관회사의 본ㆍ지점에서 청약할 수 있습니다. 청약 시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출하여야 합니다.
| 2019년 9월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한국투자증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
| 「주식ㆍ사채 등의 전자등록에 관한 법률」 제29조(특별계좌의 개설 및 관리) ① 발행인이 제25조부터 제27조까지의 규정에 따라 이미 주권등이 발행된 주식등을 전자등록하는 경우 제25조제1항에 따른 신규 전자등록의 신청을 하기 전에 제27조제1항제2호에 따른 통지를 하지 아니하거나 주권등을 제출하지 아니한 주식등의 소유자 또는 질권자를 위하여 명의개서대행회사, 그 밖에 대통령령으로 정하는 기관(이하 이 조에서 "명의개서대행회사등"이라 한다)에 기준일의 직전 영업일을 기준으로 주주명부등에 기재된 주식등의 소유자 또는 질권자를 명의자로 하는 전자등록계좌(이하 "특별계좌"라 한다)를 개설하여야 한다. ② 제1항에 따라 특별계좌가 개설되는 때에 제22조제2항 또는 제23조제2항에 따라 작성되는 전자등록계좌부(이하 이 조에서 "특별계좌부"라 한다)에 전자등록된 주식등에 대해서는 제30조부터 제32조까지의 규정에 따른 전자등록을 할 수 없다. 다만, 다음 각 호의 어느 하나에 해당하는 경우에는 그러하지 아니하다. 1. 해당 특별계좌의 명의자가 아닌 자가 주식등이 특별계좌부에 전자등록되기 전에 이미 주식등의 소유자 또는 질권자가 된 경우에 그 자가 발행인에게 그 주식등에 관한 권리가 표시된 주권등을 제출(주권등을 제출할 수 없는 경우에는 해당 주권등에 대한 제권판결의 정본·등본을 제출하는 것을 말한다. 이하 제2호 및 제3호에서 같다)하고 그 주식등을 제30조에따라 자기 명의의 전자등록계좌로 계좌간 대체의 전자등록을 하려는 경우(해당 주식등에 질권이 설정된 경우에는 다음 각 목의 어느 하나에 해당하는 경우로 한정한다) 가. 해당 주식등에 설정된 질권이 말소된 경우 나. 해당 주식등의 질권자가 그 주식등을 특별계좌 외의 소유자 명의의 다른 전자등록계좌로 이전하는 것에 동의한 경우 2. 해당 특별계좌의 명의자인 소유자가 발행인에게 전자등록된 주식등에 관한 권리가 표시된 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 다른 전자등록계좌로 이전하려는 경우(해당 주식등에 질권이 설정된 경우에는 제1호 각 목의 어느 하나에 해당하는 경우로 한정한다) 3. 해당 특별계좌의 명의자인 질권자가 발행인에게 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 전자등록계좌로 이전하려는 경우 4. 그 밖에 특별계좌에 전자등록된 주식등의 권리자의 이익을 해칠 우려가 없는 경우로서 대통령령으로 정하는 경우 ③ 누구든지 주식등을 특별계좌로 이전하기 위하여 제30조에 따른 계좌간 대체의 전자등록을 신청할 수 없다. 다만, 제1항에 따라 특별계좌를 개설한 발행인이 대통령령으로 정하는 사유에 따라 신청을 한 경우에는 그러하지 아니하다. ④ 명의개서대행회사등이 발행인을 대행하여 제1항에 따라 특별계좌를 개설하는 경우에는 「금융실명거래 및 비밀보장에 관한 법률」 제3조에도 불구하고 특별계좌부에 소유자 또는질권자로 전자등록될 자의 실지명의를 확인하지 아니할 수 있다. |
2) 초과청약
신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도 주식수의 20%를 추가로 청약할 수 있습니다. 이때, 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
(i) 청약한도 주식수 = 신주인수권증서 청약한도 주식수 + 초과청약한도 주식수
(ii) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권 증서의 수량
(iii) 초과청약한도 주식수 = 신주인수권증서 청약한도 주식수 × 초과청약 비율(20%)
3) 일반공모 청약
고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자는「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약합니다. 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자의 청약 시, 각 청약처별로 다중청약은 가능하나, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구를 제외한 청약자의 한 개 청약처에 대한 복수청약은 불가능합니다. 또한 고위험고수익투자신탁등은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조 제18호에 따른 요건을 충족하고, 제9조 제4항에 해당하지 않음을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다. 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조 제20호에 따른 요건을 충족하고, 제9조 제10항에 따른 확약서 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
4) 일반청약자의 청약은 청약주식의 단위에 따라 할 수 있으며 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 하고, 청약사무취급처는 그 차액을 납입일에 당해 청약자에게 반환하며, 이때 받은 날부터의 이자는 지급하지 않습니다.
5) 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」 제9조 제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 따라 투자설명서의 교부가 면제되는자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다.
6) 청약한도
a. 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.2578384112주를 곱하여 산정된 신주인수권증서(단, 1주 미만은 절사)와 초과청약가능 주식수(보유하고 있는 신주인수권증서 1주당 0.2주를 곱하여 산정된 수, 단 1주 미만은 절사)를 합한 주식수로 합니다. 단, 신주배정기준일 전 전환권의 행사, 종류주식의 권리 행사, 주식매수선택권의 권리 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동으로 인하여 구주주의 1주당 배정비율은 변동될 수 있습니다.
b. 일반공모 청약자의 청약한도는 일반공모 총 공모주식 100% 범위 내로 하며, 청약한도를 초과하는 부분에 대해서는 청약이 없는 것으로 간주합니다.
7) 기타
a. 일반공모 배정을 함에 있어 이중청약이 있는 경우에는 그 청약자의 청약 전부를 청약하지 아니한 것으로 봅니다. 단, 구주주가 신주배정비율에 따라 배정받은 주식을 청약한 후 일반공모에 참여하는 경우에는 금지되는 이중청약이 있는 경우로 보지 않습니다. 단, 동일한 집합투자기구라도 운용주체(집합투자업자)가 다른 경우는 예외로 합니다.
b. 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 합니다.
c. 청약자는 '금융실명거래 및 비밀보장에 관한 법률'에 의거 실지 명의에 의해 청약해야 합니다.
d. 「자본시장과 금융투자업에 관한 법률」 제180조의4 및 같은 법 시행령 제208조의4 제1항에 따라 2024년 12월 21일부터 2025년 03월 14일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3 제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4 제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위(*)가 모집(매출)에 따른 주식을 취득하는 경우 (*)「금융투자업규정」 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
(3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
한국투자증권(주) 본ㆍ지점 | 2025년 03월 19일 ~ 2025년 03월 20일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 (주)지아이이노베이션의 주식을 예탁하고 있는 해당 증권회사 본ㆍ지점 2) 한국투자증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
한국투자증권(주) 본ㆍ지점 | 2025년 03월 24일 ~ 2025년 03월 25일 |
|
(4) 청약결과 배정방법
1) 구주주 청약(신주인수권증서 청약)
보유하고 있는 신주인수권증서 수량 범위 내에서 청약한 주식수에 따라 배정합니다.
단, 신주배정기준일 현재 신주의 배정비율은 신주배정기준일 전 전환권의 행사, 종류주식의 권리 행사, 주식매수선택권의 권리 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동 등으로 인하여 변동될 수 있습니다.
2) 초과청약
구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주 및 단수주가 있는 경우, 실권주 및 단수주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율: 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다.(단, 초과청약 주식수가 실권주 및 단수주에 미달한 경우 100% 배정)
(i) 청약한도 주식수 = 신주인수권증서 청약한도 주식수 + 초과청약한도 주식수
(ii) 신주인수권증서 청약한도 주식수 = 보유한 신주인수권 증서의 수량
(iii) 초과청약한도 주식수 = 신주인수권증서 청약한도 주식수 × 초과청약 비율(20%)
3) 일반공모 청약
상기 구주주 청약 및 초과청약 결과 발생한 미청약주식 및 단수주(이하 "일반공모 배정분"이라 합니다)는 "대표주관회사"가 다음 각 호와 같이 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」 제9조 제2항 제6호 가목에 따라 고위험고수익투자신탁등에 공모주식의 10%를 배정하고, 「증권 인수업무 등에 관한 규정」 제9조 제2항 제6호 나목에 따라 벤처기업투자신탁에 공모주식의 25%를 배정합니다. 나머지 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자 포함)에게 구분 없이 배정합니다. 고위험고수익투자신탁등에 대한 공모주식 10%와 벤처기업투자신탁에 공모주식의 25%와 개인투자자 및 기관투자자에 대한 공모주식 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 어떤 그룹에 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
(i) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분을 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동 순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다.
(ii) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 일반공모 배정분에 미달하는 경우에는 청약주식수대로 배정합니다. 배정결과 발생하는 잔여주식은 대표주관회사가 자기 계산으로 인수합니다.
(iii) 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」제9조 제2항 제7호에 따라 고위험고수익투자신탁등, 벤처기업투자신탁, 일반청약자에 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 자기 계산으로 인수할 수 있습니다.
(5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 당사 및 대표주관회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- 금번 유상증자에 청약하고자 하는 투자자께서는 (「자본시장과 금융투자업에 관한법률」제9조 제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」제132조에 따라 투자설명서의 교부가 면제되는 자 제외) 청약하시기 전 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
- 투자설명서 수령거부 의사표시는 서면, 전화, 전신, 모사전송, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 가능합니다.
-전자문서의 방법으로 투자설명서를 교부받고자 하는 투자자는 「자본시장과 금융투자업에 관한 법률」 제124조 제1항 각 호의 요건을 모두 충족하여야 합니다.
1) 투자설명서 교부 방법 및 일시
| 구분 | 교부방법 | 교부일시 |
|---|---|---|
|
구주주 청약자 |
1),2),3)을 병행 | 1) 우편송부시 : 구주주청약 초일인 2025년 03월 19일 전 수취가능 2) 한국투자증권(주)의 본ㆍ지점에서 교부 : 구주주청약 종료일(2025년 03월 20일)까지 3) 한국투자증권(주)의 홈페이지나 HTS, MTS에서 교부 : 구주주청약 종료일(2025년 03월 20일)까지 |
| 1) 우편 송부 | ||
| 2) 한국투자증권㈜의 본,지점에서 교부 | ||
| 3) 한국투자증권㈜의 홈페이지나 HTS, MTS에서 교부 | ||
|
일반 청약자 |
1),2)를 병행 | 1) 한국투자증권(주)의 본ㆍ지점에서 교부 : 일반청약 종료일(2025년 03월 25일)까지 2) 한국투자증권(주)의 홈페이지나 HTS, MTS에서 교부 : 일반청약 종료일(2025년 03월 25일)까지 |
| 1) 한국투자증권(주)의 본, 지점에서 교부 | ||
| 2) 한국투자증권(주)의 홈페이지나 HTS, MTS에서 교부 |
| ※ 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다. |
2) 확인절차
① 우편을 통한 투자설명서 수령시
- 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
- HTS 또는 MTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
- 주주배정 유상증자의 경우 유선청약이 가능합니다. 유선상으로 신분확인을 하신 후, 투자설명서 교부 확인을 해주시고 청약을 진행하여 주시기 바랍니다.
② 지점 방문을 통한 투자설명서 수령시
- 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
③ 홈페이지 또는 HTS, MTS를 통한 교부
- 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
3) 기타
① 금번 유상증자의 경우, 본 증권신고서의 효력발생 이후 주주명부상 주주에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는, 한국투자증권(주)의 본ㆍ지점 방문을 통해 인쇄물을 받으실 수 있으며, 또한 동일한 내용의 투자설명서를 전자문서의 형태로 한국투자증권(주)의 홈페이지에서 다운로드 받으실 수 있습니다. 한편, 일반공모 청약시 투자자께서는 대표주관회사에 방문하여 투자설명서 인쇄물을 수령하시거나 대표주관회사의 홈페이지에서 동일한 내용의 투자설명서를 전자문서의 형태로 다운로드 받으시는 2가지 방법으로 투자설명서를 교부받으실 수 있습니다. 다만, 전자문서의 형태로 교부 받으실 경우, 「자본시장과 금융투자업에 관한 법률」 제124조 제1항 각 호의 요건을 모두 충족해야만 청약이 가능합니다.
② 구주주 청약시 한국투자증권㈜ 이외의 증권회사를 이용한 청약 방법
해당 증권회사의 청약방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
| ※ 관련법규 「자본시장과 금융투자업에 관한 법률」 제9조 (그 밖의 용어의 정의) ⑤ 이 법에서 "전문투자자"란 금융투자상품에 관한 전문성 구비 여부, 소유자산규모 등에 비추어 투자에 따른 위험감수능력이 있는 투자자로서 다음 각 호의 어느 하나에 해당하는 자를 말한다. 다만, 전문투자자 중 대통령령으로 정하는 자가 일반투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우 금융투자업자는 정당한 사유가 있는 경우를 제외하고는 이에 동의하여야 하며, 금융투자업자가 동의한 경우에는 해당 투자자는 일반투자자로 본다. <개정 2009.2.3> 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자 제124조 (정당한 투자설명서의 사용) ① 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외한다)에게 제123조에 적합한 투자설명서(집합투자증권의 경우 투자자가 제123조에 따른 투자설명서의 교부를 별도로 요청하지 아니하는 경우에는 제2항제3호에 따른 간이투자설명서를 말한다. 이하 이 항 및 제132조에서 같다)를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 아니 된다. 이 경우 투자설명서가 제436조에 따른 전자문서의 방법에 따르는 때에는 다음 각 호의 요건을 모두 충족하는 때에 이를 교부한 것으로 본다.<개정 2013.5.28> 1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 "전자문서수신자"라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 「자본시장과 금융투자업에 관한 법률 시행령」 제11조 (증권의 모집·매출) ① 법 제9조제7항 및 제9항에 따라 50인을 산출하는 경우에는 청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다. 다만, 다음 각 호의 어느 하나에 해당하는 자는 합산 대상자에서 제외한다. <개정 2009.10.1, 2010.12.7, 2013.6.21, 2013.8.27> 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 제10조제1항제1호부터 제4호까지의 자 나. 제10조제3항제12호·제13호에 해당하는 자 중 금융위원회가 정하여 고시하는 자 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사·감정인·변호사·변리사·세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주(법 제9조제1항제1호에 따른 최대주주를 말한다. 이하 같다)와 발행주식총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는 그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자 제132조 (투자설명서의 교부가 면제되는 자) 법 제124조제1항 각 호 외의 부분 전단에서 "대통령령으로 정하는 자"란 다음 각 호의 어느 하나에 해당하는 자를 말한다. <개정 2009.7.1, 2013.6.21> 1. 제11조 제1항 제1호 다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화·전신·모사전송, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. |
(6) 주권 유통에 관한 사항
주권유통개시일: 2025년 04월 10일(유상증자 신주) (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
(7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2025년 03월 27일부터 해당 청약사무 취급처에서 환불합니다.
(8) 주금납입장소: 하나은행 문정법조타운지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2025년 02월 12일 | 한국투자증권(주) | 00160144 |
(1) 금번과 같이 주주배정 방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」제165의6조 제3항 및「증권의 발행 및 공시 등에 관한 규정」제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
(2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 9월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
(3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 한국투자증권(주)으로 합니다.
(4) 신주인수권증서 매매 등
- 금번 유상증자시 신주인수권증서는 전자증권제도 시행 이후에 발행되고 상장될 예정으로 실물은 발행 되지 않고 전자증권으로 등록발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
- 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(5) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 한국투자증권(주)의 본ㆍ지점을 통해 해당 신주인수권증서에 기재되어 있는 수량만큼 청약할 수 있으며 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(6) 신주인수권증서의 상장
당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2025년 03월 04일부터 2025년 03월 10일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2025년 03월 11일에 상장폐지될 예정입니다. 「코스닥시장 상장규정」 제83조(신주인수권증권 및 신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제85조(신주인수권증권 및 신주인수권증서의 상장폐지)에 따라 신주청약 개시일 5거래일전에 상장폐지되어야 합니다.
|
※ 관련법령 제165조의6(주식의 발행 및 배정 등에 관한 특례) ③ 주권상장법인은 제1항제1호의 방식으로 신주를 배정하는 경우 「상법」 제416조제5호 및 제6호에도 불구하고 주주에게 신주인수권증서를 발행하여야 한다. 이 경우 주주 등의 이익 보호, 공정한 시장질서 유지의 필요성 등을 고려하여 대통령령으로 정하는 방법에 따라 신주인수권증서가 유통될 수 있도록 하여야 한다. 제176조의8(주식의 발행 및 배정에 관한 방법 등) ④ 법 제165조의6제3항 후단에서 "대통령령으로 정하는 방법"이란 다음 각 호의 어느 하나에 해당하는 방법을 말한다. 1. 증권시장에 상장하는 방법 2. 둘 이상의 금융투자업자(주권상장법인과 계열회사의 관계에 있지 아니한 투자매매업자 또는 투자중개업자를 말한다)를 통하여 신주인수권증서의 매매 또는 그 중개ㆍ주선이나 대리업무가 이루어지도록 하는 방법. 이 경우 매매 또는 그 중개ㆍ주선이나 대리업무에 관하여 필요한 세부사항은 금융위원회가 정하여 고시한다.
제83조(신주인수권증권 및 신주인수권증서의 신규상장) ② 신주인수권증권을 신규상장하려면 다음 각 호의 심사요건을 모두 충족하여야 한다. 1. 신주인수권증권의 발행회사의 주식(외국주식예탁증권을 포함한다. 이하 이 장에서 같다)이 코스닥시장에 상장되어 있을 것 2. 신주인수권증권의 발행회사의 상장 주식이 상장신청일 현재 이 규정에 따른 관리종목으로 지정되지 않고, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유에 해당되지 않을 것 3. 신주인수권증권의 발행총수가 1만 증권 이상일 것. 이 경우 해당 증권의 목적인 신주가 액면주식인 경우에는 액면가액 5,000원을 기준으로 한다. 4. 신주인수권증권의 잔존 권리행사기간이 상장신청일 현재 1년 이상일 것 5. 신주인수권부사채권이 모집 또는 매출로 발행되었을 것. 다만, 주주에게 해당 사채권의 인수권이 주어진 경우에는 그러하지 아니하다. ③ 신주인수권증서를 신규상장하려면 다음 각 호의 심사요건을 모두 충족하여야 한다. 1. 신주인수권증서의 발행회사의 주식이 코스닥시장에 상장되어 있을 것 2. 신주인수권증서의 발행회사의 상장 주식이 상장신청일 현재 이 규정에 따른 관리종목으로 지정되지 않고, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유에 해당되지 않을 것 3. 신주인수권의 양도를 허용하고, 신주인수권을 갖는 모든 주주에게 신주인수권증서를 발행하였을 것 4. 신주인수권증서의 발행총수가 1만 증서 이상일 것. 이 경우 해당 증서의 목적인 신주가 액면주식인 경우에는 액면가액 5,000원을 기준으로 한다. 5. 신주인수권증서의 거래 가능 기간이 5일(매매거래일을 기준으로 한다) 이상일 것 제85조(신주인수권증권 및 신주인수권증서의 상장폐지) 1. 신주인수권증권의 목적인 주식이 관리종목으로 지정되거나, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 2. 신주인수권증권의 목적인 주식에 대한 상장폐지 신청으로 해당 주식이 상장폐지되는 경우 3. 신주인수권 행사기간이 만료되거나 행사가 완료된 경우 4. 그 밖에 공익 실현과 투자자 보호를 위하여 거래소가 신주인수권증권의 상장폐지가 필요하다고 인정하는 경우 ② 거래소는 신주인수권증서가 다음 각 호의 어느 하나에 해당하는 경우 해당 신주인수권증서의 상장을 폐지한다. 1. 신주인수권증서의 목적인 주식이 관리종목으로 지정되거나, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 2. 신주인수권증서의 목적인 주식에 대한 상장폐지 신청으로 해당 주식이 상장폐지되는 경우 3. 신주 청약 개시일의 5일(매매거래일을 기준으로 한다) 전이 된 경우. 다만, 신주인수권증서의 유통상황을 고려하여 세칙으로 정하는 경우에는 그 기간 전으로 한다. 4. 그 밖에 공익 실현과 투자자 보호를 위하여 거래소가 신주인수권증서의 상장폐지가 필요하다고 인정하는 경우 |
(7) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래관련 사항은 다음과 같습니다.
1) 상장방식: 전자등록발행된 신주인수권증서 전부를 상장합니다.
2) 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2025년 03월 04일부터 2025년 03월 10일까지(5거래일간) 거래 |
2025년 02월 21일(예정)부터 2025년 03월 12일까지 거래 |
① 상장거래: 2025년 03월 04일부터 2025년 03월 10일까지(5영업일간) 거래 가능합니다.
② 계좌대체거래: 2025년 02월 21일(예정)부터 2025년 03월 12일까지 거래 가능 합니다.
* 신주인수권증서 상장거래의 결제일인 2025년 03월 12일까지 계좌대체(장외거래) 가능하며, 해당일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다.
* 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다.
3) 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
① '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다.
② '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한국투자증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
(1) 본 증권신고서는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자시 이러한 점을 감안하시기 바랍니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
(3) 본 증권신고서에 기재된 내용은 본 공시서류 제출일 전일 현재까지 발생된 것으로 본 신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익상황에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다. 따라서, 주주 및 투자자가 투자의사를 결정함에 있어 유의하여야 할 사항이 본 증권신고서상에 누락되어 있지 않습니다.
(4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
(5) 본 증권신고서의 발행가액 및 모집(매출)총액은 확정된 금액입니다.
5. 인수 등에 관한 사항
| [인수방법 : 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
| 대표주관 | 한국투자증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종실권주 X 인수비율(100%) |
인수수수료: 모집총액의 1.5% 실권수수료 : 실권인수금액의 15.0% |
| 주1) | 최종실권주: 구주주 청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 |
| 주2) | 모집총액: 총발행주식수 X 확정발행가액 |
II. 증권의 주요 권리내용
금번 당사가 주주배정후 실권주 일반공모 유상증자를 통하여 발행할 증권은 상법에서 정하는 액면가액 500원의 기명식 보통주로서 특이사항은 없으며, 정관상 명시된 증권의 주요 권리 내용은 다음과 같습니다.
1. 액면금액
| 제7조(1주의 금액) 본 회사가 발행하는 주식 1주의 금액은 금 500원으로 한다. |
2. 주식의 발행 및 배정에 관한 사항
|
제5조(회사가 발행할 주식의 총수) 제10조 (종류주식의 수와 내용) ① 본 회사가 발행할 종류주식의 수는 발행주식총수의 100분의 50 범위 내로 한다. ② 본 회사가 신주를 발행하는 경우 종류주식에 대한 신주의 배정은 유상증자 및 주식배당의 경우에는 보통주식 또는 보통주식에 배정하는 주식과 같은 종류의 주식으로, 무상증자의 경우에는 그와 같은 종류의 주식으로 한다. 다만, 상환주식에 대하여는 유상증자 또는 무상증자를 실시하는 경우에도 신주를 배정하지 아니하는 것으로 정할 수 있다. 제10조의 2(이익배당에 관한 종류주식) ① 본 회사는 제9조 및 제10조에 따라 이사회의 결의로 이익배당에 관한 우선주식(이하 “우선주식”)을 발행할 수 있으며, 누적여부, 참가여부, 의결권 유무 등을 조합하여 독립적으로 또는 여러 형태로 발행할 수 있다. ② 우선주식에 대하여는 액면금액을 기준으로 연 1% 이상 10% 이내에서 발행시에 이사회가 정한 우선 비율에 따른 금액을 현금으로 우선 배당한다. ③ 우선주식에 대하여 제2항에 따른 배당을 하고 보통주식에 대하여 우선주식의 배당률과 동률의 배당을 한 후, 잔여배당가능이익이 있으면 보통주식과 우선주식에 대하여 동등한 비율로 배당하도록 정할 수 있다. ④ 우선주식에 대하여 어느 사업연도에 있어서 제2항의 규정에 의한 배당을 하지 못한 경우 다음 사업연도의 배당 시 누적적 또는 비누적적인 것으로 발행 시 이사회가 정할 수 있다. ⑤ 본 회사는 우선주식의 발행 시 이사회결의로 존속기간을 정할 수 있으며, 이 기간 만료와 동시에 보통주식으로 전환된다. 다만, 위 기간 중 소정의 배당을 하지 못한 경우에는 소정의 배당을 완료할 때까지 그 기간을 연장한다. 이 경우 전환으로 인하여 발행하는 주식에 대한 이익의 배당에 관하여는 제12조에 의한다. 제10조의3 (잔여재산 분배에 관한 종류주식) ①본 회사는 제9조 및 제10조에 따라 이사회의 결의로 잔여재산 분배에 관하여 우선적 내용이 있는 종류주식(이하 “잔여재산분배 종류주식”이라 한다)을 발행할 수 있다. ② 잔여재산분배우선 종류주식은 본 회사가 청산할 때 잔여재산 분배에 있어 최초 발행가액과 미지급 된 배당금 및 상환 종류주식의 경우 상환가액의 한도까지 보통주 주주에 우선하는 청구권을 갖는다. 또한 보통주식에 대한 잔여재산 분배율이 우선주식에 대한 잔여재산 분배율을 초과하는 경우 그 초과분에 대하여 보통주식과 동일한 분배율로 참가하여 분배를 받는다.
제10조의4 (전환주식) ① 본 회사는 제9조 및 제10조에 따라 종류주식을 발행함에 있어 이사회의 결의에 의하여 회사의 선택 또는 주주의 청구에 따라 보통주식 또는 다른 종류주식으로 전환할 수 있는 전환주식 (이하 "전환주식")을 발행할 수 있다. ② 전환으로 인하여 발행하는 주식의 수는 이사회의 결의로 정한다. 다만, 이사회는 주식분할, 병합 기타 법령상 허용되는 조정사유가 발생하는 때에는 전환비율을 조정하는 것으로 할 수 있다. ③ 전환을 청구할 수 있는 기간은 발행시에 이사회가 정한다. ④회사가 전환을 할 수 있는 사유, 전환조건, 전환으로 인하여 발행할 주식의 내용 등 기타 전환에 관한 사항은 주식발행시 이사회의 결의로 정한다 ⑤ 전환으로 인하여 발행하는 주식에 대한 이익의 배당에 관하여는 제12조의 규정을 준용한다.
제10조의5 (상환주식) ① 본 회사는 제9조 및 제10조에 따라 종류주식을 발행함에 있어서 이사회의 결의에 의하여 이를 주주의 상환청구에 따라 또는 회사의 선택에 따라 회사의 이익으로써 소각할 수 있는 상환주식(이하 "상환주식")을 발행할 수 있다. ②상환주식은 다음 각 호에 의거 회사의 선택 또는 주주의 청구에 의해 상환주식의 전부 또는 일부를 상환하거나 상환청구할 수 있다. 1. 상환가액은 발행가액 또는 이에 가산금액을 더한 금액으로 하며 가산금액은 이자율, 시장상황 기타 상환주식의 발행에 관련된 제반 사정을 고려하여 상환주식의 발행 시에 이사회가 정한다. 이 경우 주식의 분할 또는 병합, 무상증자 기타 상환주식수의 증감을 초래하는 사유 등 상환주식의 발행 시 이사회에서 정하는 사유가 있는 때에 상환가액을 조정하는 것으로 할 수 있다. 2. 상환기간 또는 상환청구기간은 발행 시에 이사회가 정한다. 다만, 상환기간 또는 상환청구기간이 만료되었음에도 불구하고 다음 각목의 사유에 해당하는 사유가 발생하는 경우 그 사유가 해소될 때까지 상환기간은 연장된다. 가) 우선적 배당이 완료되지 아니한 경우 나) 상환기간 또는 상환청구기간 내에 상환하지 못한 경우 3. 회사는 상환청구 당시에 배당가능이익이 부족한 경우에는 분할상환할 수 있으며 분할상환하는 경우에는 회사가 추첨으로 또는 안분비례의 방법에 의하여 상환할 주식을 정할 수 있고, 안분비례 시 발생하는 단주는 이를 상환하지 아니한다. 4. 상환청구주주는 2주일 이상의 기간을 정하여 상환할 뜻과 상환대상주식을 회사에 통지하여야 한다. 5. 회사는 상환대상인 주식의 취득일 2주일 전에 그 사실을 그 주식의 주주 및 주주명부에 기재된 권리자에게 통지 또는 공고하여야 한다. ③ 회사는 주식의 취득 대가로 현금 외의 유가증권(다른 종류의 주식은 제외한다)이나 그 밖의 자산을 교부할 수 있다. ④ 상환주식의 기타 조건 및 내용은 발행 시 이사회가 정한다.
제10조의6 (의결권 배제 주식) ① 본 회사는 종류주식을 발행하는 경우 발행주식총수의 100분의50 범위 내에서 관련 법령상 허용되는 한도까지 의결권이 배제되는 것으로 할 수 있다. ② 우선주식을 전항의 의결권이 배제되는 주식으로 발행한 경우, 동 우선주식에 대하여 소정의 배당을 하지 아니한다는 결의가 있는 경우에는 그 결의가 있는 총회의 다음 총회부터 그 우선적 배당을 한다는 결의가 있는 총회의 종료 시까지는 의결권이 있는 것으로 한다. |
3. 의결권에 관한 사항
|
제30조(의결권) 주주의 의결권은 1주마다 1개로 한다. ① 2 이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3일전에 회사에 대하여 서면으로 그 뜻과 이유를 통지하여야 한다. ② 본 회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 그러나 주주가 주식의 신탁을 인수하였거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니하다. 제33조(의결권의 행사) 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있으며, 이 경우 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다. |
4. 신주인수권에 관한 사항
|
제11조(신주인수권) ① 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다. ② 본 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 25을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 상법 제340조의2, 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4. 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 발행주식총수의 100분의 25을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 6. 발행주식총수의 100분의 25을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산ㆍ판매ㆍ자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 주권을 증권시장에 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 8. 증권시장 상장을 위한 기업공개업무를 주관한 대표주관회사에게 기업공개 당시 공모주식총수의 100분의 10을 초과하지 않는 범위 내에서 신주를 발행하는 경우 ③ 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. ④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. |
5. 주식매수선택권에 관한 사항
|
제13조(주식매수선택권) ① 본 회사는 주주총회의 특별결의로 발행주식총수의 100분의 10 범위 내에서 주식매수선택권을 부여할 수 있으며, 본 회사가 벤처인증을 받은 경우에는 발행주식총수의 100분의 50 범위 내에서 벤처기업육성에 관한 특별조치법 제16조의3 제1항 제2호의 규정에 의하여 대통령령이 정하는 자에게 주식매수선택권을 부여할 수 있다. 다만 본 회사가 상법 제542조의2에서 규정하는 증권시장에 상장된 주권을 발행한 주식회사에 해당하는 경우에는 상법 제542조의3 제3항에 따라 발행주식총수의 100분의 15 범위 내에서 주주총회 특별결의로 주식매수선택권을 부여할 수 있으며, 발행주식총수의 100분의 3 범위 내에서 이사회의 결의로 주식매수선택권을 부여할 수 있다. 주주총회 또는 이사회 결의에 의하여 부여되는 주식매수선택권은 경영성과 또는 주가지수 등에 연동하는 성과연동형으로 할 수 있다. ② 제1항 단서의 규정에 따라 이사회 결의로 주식매수선택권을 부여한 경우에는 그 부여 후 처음으로 소집되는 주주총회의 승인을 얻어야 한다. ③ 제1항의 규정에 의한 주식매수선택권 부여대상자는 회사의 설립ㆍ경영과 기술혁신 등에 기여하거나 기여할 수 있는 회사의 이사ㆍ감사 또는 피용자 및 상법 제542조의3 제1항과 상법 시행령 제30조 제1항이 정하는 관계회사의 이사ㆍ감사 또는 피용자로 한다. 다만, 회사의 이사에 대하여는 이사회의 결의로 주식매수선택권을 부여할 수 없다. ④ 제3항의 규정에 불구하고 상법 제542조의8 제2항 제5호의 최대주주(이하 "최대주주"라 함)와 주요주주 및 그 특수관계인에게는 주식매수선택권을 부여할 수 없다. 다만, 회사 또는 제3항의 관계회사의 임원이 됨으로써 특수관계인에 해당하게 된 자(그 임원이 계열회사의 상무에 종사하지 아니하는 이사ㆍ감사인 경우를 포함한다)에게는 주식매수선택권을 부여할 수 있다. ⑤ 임원 또는 직원 1인에 대하여 부여하는 주식매수선택권은 발행주식총수의 100분의 10을 초과할 수 없다 ⑥ 다음 각 호의 어느 하나에 해당하는 경우에는 이사회의 결의로 주식매수선택권의 부여를 취소할 수 있다. 1. 주식매수선택권을 부여받은 자가 본인의 의사에 따라 퇴임 또는 퇴직한 경우 2. 주식매수선택권을 부여받은 자가 고의 또는 과실로 회사에 중대한 손해를 입힌 경우 3. 회사의 파산 또는 해산 등으로 주식매수선택권의 행사에 응할 수 없는 경우 4. 기타 주식매수선택권 부여계약에서 정한 취소사유가 발생한 경우 ⑦ 본 회사는 주식매수선택권을 다음 각 호의 1에서 정한 방법으로 부여한다. 1. 주식매수선택권의 행사가격으로 새로이 기명식 보통주식(또는 기명식 우선주식)을 발행하여 교부하는 방법 2. 주식매수선택권의 행사가격으로 기명식 보통주식(또는 기명식 우선주식)의 자기주식을 교부하는 방법 3. 주식매수선택권의 행사가격과 시가와의 차액을 현금 또는 자기주식으로 교부하는 방법 ⑧ 주식매수선택권을 부여받은 자는 제1항의 결의일부터 2년 이상 재임 또는 재직한 날부터 부여시에 주주총회 또는 이사회 결의로 정하는 기간 동안 권리를 행사할 수 있다. 다만, 제1항의 결의일로부터 2년 내에 사망하거나 그 밖에 본인의 책임이 아닌 사유로 퇴임 또는 퇴직한 자는 그 행사기간 동안 주식매수선택권을 행사할 수 있다. ⑨ 주식매수선택권의 행사로 인하여 발행한 신주에 대한 이익의 배당에 관하여는 제12조의 규정을 준용한다. |
6. 배당에 관한 사항
|
제12조(신주의 배당기산일) 본 회사가 유상증자, 무상증자 및 주식배당에 의하여 발행한 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전 영업연도 말에 발행된 것으로 본다. 제55조(이익배당) ① 이익배당은 금전 또는 금전 외의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. ③ 제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익배당은 주주총회의 결의로 정한다.
제56조(배당금지급청구권의 소멸시효) ① 배당금의 지급청구권은 5년간 이를 행사하지 아니하면 소멸시효가 완성한다. 미지급 배당금에는 이자를 부하지 아니한다. ② 제1항의 시효의 완성으로 인한 배당금은 본 회사에 귀속한다. |
III. 투자위험요소
당사가 영위하는 사업의 내용을 이해하기 위하여 개념 정리가 필요한 용어의 정의는 다음과 같습니다.
| [주요 용어 정의] |
| 용어 | 정의 |
| 고형암 | 혈액암을 제외한 고형의 종양을 통틀어서 일컫는 말 |
| 로열티 | 특정한 권리를 이용하는 이용자가 권리를 가진 사람에게 지불하는 대가를 의미하며, 여기서 말하는 권리는 지적재산권에 속하는 특허권, 저작권, 상표권 등을 말함. 즉, 의약품이 시장에 시판되면 판매되는 금액의 일정 부분을 지급하는 것을 의미함 |
| 마일스톤 | 프로젝트 진행과정에서 일정 기준을 마련하고 그 기준을 달성하였을 때 지급되는 금액 |
| 말초혈액세포 | 말초혈액세포는 말초 혈액에 포함된 백혈구 중 하나의 둥근 핵으로 구성된 세포로, 말초혈액단핵구(PBMC)라 불림. T 세포, B 세포, NK 세포, 단핵구(monocyte) 등이 포함되며 면역학 연구를 함에 있어 자주 사용됨 |
| 면역관문분자 (immune checkpoint, ICP) |
암세포가 면역을 회피하는 기전으로서, T 세포에 그 발현을 유도하여 세포 기능을 떨어트리는 분자 |
| 면역관문억제제 (immune checkpoint inhibitor, ICI) |
면역관문분자를 막아, T 세포의 기능을 정상으로 회복하게 하여 항암 효능을 나타내게 하는 약물 |
| 면역 관련 이상반응 (immune related adverse events, irAE) |
면역항암제에 동반되는 다양한 면역관련 이상반응으로, 이전 세포독성항암제에는 없었던 부작용. 발진(rash), 주입 관련 반응(infusion-related reaction), 설사(diarrhea), 장염(colitis) 및 내분비계의 변화 등이 있음 |
| 면역글로불린 E (immunoglobulin, IgE) |
IgE는 포유류에서만 발견되는 항체 개별형으로, 단량체로 존재. 중쇄 두 개와 경쇄 두 개로 구성되며, 일반적인 항체의 형태인 Y형으로 배열됨. 알레르기 항원을 포획하며, 조직에 있는 관련 염증세포와 결합하여 히스타민 등의 방출을 촉진 |
| 면역글로불린 G4 (immunoglobulin, IgG4) |
IgG4는 IgG의 아형으로, Fc 감마 수용체에 대한 결합력이 낮아 세포독성이 없음. 따라서 IgG4 형태의 항체의약품은 세포를 제거하지 않고, 그 기능을 차단하는 역할을 수행함 |
| 면역매개 부작용 | 인체의 면역체계가 활발해지면서 면역세포가 정상세포를 공격하여 나타나는 부작용. 피부염, 간염, 폐렴, 대장염, 내분비병증 등의 증상으로 나타나며 대개는 일시적으로 가볍게 나타나지만 간혹 심각하거나 치명적일 수 있음 |
| 면역원성 (immunogenicity) |
고분자의 단백질 의약품이 체내에 유입되었을 때 면역반응을 유발하는 성질 |
| 면역치료 (immunotherapy) |
인체 내 면역계를 조절하여 그 기능을 증강시킴으로써 각종 치료에 필요한 면역력을 극대화시키는 치료 요법 |
| 면역항암제 | 암 환자의 면역력을 키워 암과 싸우는 힘을 키워주는 치료제 |
| 목표제품특성 (target product profile; TPP) |
경쟁 제품이나 기존 제품과 비교하여 분석한 개발 대상 제품의 잠재성에 대한 상세 사항 |
| 미충족 의료수요 (unmet medical needs) |
질환의 진단이나 치료를 현존하는 치료법으로 치료할 수 없는 상태 |
| 박스형 경고문 (Boxed Warning) |
미국 FDA에서 Black Box Warning 혹은 Boxed Warning이라는 용어를 사용하여 의약사가 환자를 관리할 때 최우선적으로 염두에 둬야 할 사항을 정리한 것 |
| 보체매개 세포독성 (complement dependent cytotoxicity, CDC) |
CDC 작용은 항체가 보체와 작용하여 항원을 제거하는 작용으로, 먼저 항체가 병원성 항원을 인식하여 결합하면 C1q와 같은 보체가 항체의 Fc와 Hinge를 인식하고 다른 보체들을 불러들여 막 공격 복합체(membrane attack complex; MAC)를 형성하여 항원을 제거함 |
| 부분관해 (partial response; PR) |
항암치료 이전보다 30%이상 종양이 줄어드는 것을 의미함. |
| 비임상 시험 (pre-clinical study, non-clinical study) |
임상 시험의 이전 과정에서 행하는 시험으로, 신약이 실험 대상의 체내에 투여되었을 때 어떤 반응을 일으키는지, 그 효능과 안전성을 동물모델에서 검증하는 시험 절차 |
| 비만세포 (mast cell) | 알레르기의 주요인이 되는 면역 세포로, 비만 세포의 표면에는 IgE 항체가 붙을 수 있는 표면 인자인 Fc 수용체 FcεRI가 있음 |
| 비알콜성지방간염 (non alcoholic steatohepatitis, NASH) |
통칭 NASH는 음주나 이차 원인인자(hepatitis virus감염)가 배제된 상태에서 지방간(steatosis)과 간염증(hepatic inflammation) 및 간섬유화(fibrosis)가 동반된 질환을 의미 |
| 병용용법 (combination therapy) |
한가지 이상의 약물을 동시에 투여해서 치료하는 방법 |
| 사이토카인 (cytokine) | 면역 세포가 분비하는 단백질의 일종으로, 세포로부터 분비된 후 다른 세포나 분비한 세포 자신에게 영향을 줄 수 있는 매개 물질로 작용 |
| 사이토카인 분비 증후군 (cytokine release syndrome) |
사이토카인 방출 증후군 또는 심한 경우 사이토카인 폭풍(cytokine storm)은 감염이나 특정 약물 등 다양한 요인에 의해 유발될 수 있는 전신염증반응의 일종임. 많은 수의 백혈구가 활성화되고 염증성 사이토카인을 방출할 때 발생하며, 일부 단클론항체 약물을 포함한 면역항암제의 부작용으로 나타날 수 있음 |
| 생체 표지자 (Biomarker) |
단백질이나 DNA, RNA, 대사물질 등의 생체 물질로 생물학적 과정 및 질병 발병 과정으로 인한 몸의 변화를 알아낼 수 있는 지표를 의미함. |
| 세포독성 T 세포 (CD8+ T cell) |
세포독성 T세포는 그랜자임(granzyme)이나 퍼포린(perforin)과 같은 세포독성물질을 분비하여 바이러스에 감염된 세포나 종양 세포 등을 죽이는 세포로서 세포 표면에 CD8 단백질을 가지고 있기 때문에 CD8+ T세포라고도 함 |
| 세포독성항암제 | 빠르게 성장하는 세포를 공격하는 항암제. 특히 암세포와 머리카락 위장관세포를 공격함 |
| 신약 개발 단계 | 일반적으로는 '연구→ 비임상→ 임상 1 상→ 임상 2 상→ 임상 3 상→ 품목 허가→ 출시'의 단계를 따름 |
| 아나필락시스 (anaphylaxis) |
특정 물질이 몸 속에 들어간 후 몇 분 안에 나타나며, 위급한 상황을 초래하여 사망에 이르게 할 수 있는 급성 알레르기 반응으로, 항원과 면역글로불린 E가 매개하는 급격한 항원-항체 반응으로 일어남 |
| 약동력학 (pharmacokinetics) |
약물의 흡수, 분포, 대사, 배설과정을 동역학적 관점에서 해석하고 예측하고자 하는 약물학의 세부 학문 |
| 약동학 (pharmacokinetics; PK) |
약동학은 약이 몸 안으로 흡수되고, 분포되었다가 대사, 배설을 통해 몸 밖으로 나갈 때까지 혈액과 각 조직에서 발견되는 약의 농도가 시간에 따라 쉼없이 변화하는(즉, 움직이는) 과정을 설명하는 방법으로, 인체가 약에 대해서 어떻게 처리하는 가에 대해 연구하는 학문 |
| 약력학 (pharmacodynamics; PD) |
생체에 대한 약물의 생리학적 및 생화학적 작용과 그 작용기전, 즉 약물이 일으키는 생체의 반응을 주로 연구하는 학문 |
| 오픈 이노베이션 (Open-Innovation) |
제약사의 신약 연구개발(R&D) 과정에서 기업 자체의 역량에만 의존하지 않고, 외부기관ㆍ기업과 기술을 공유하거나 협업하는 방식 |
| 유전자 치료제 | 인체 내에 다양한 형태와 방법으로 유전자를 전달하여 이로부터 생성되는 단백질에 의한 질병의 치료와 예방을 하는 의약품 |
| 유효성 (proof-of-concept) |
환자를 통해서 약의 효능을 확인하는 것으로 약의 기전에 의한 제품의 적합성을 확인함 |
| 융합단백질 (fusion protein) |
단일 약물을 형성하기 위해 바람직한 면역 조절 및 질병 대항 특성을 갖춘 두 개의 서로 다른 단백질이 결합되거나 “융합”되어 실험실에서 생산되는 재조합 단백질. 환자의 면역 반응 조절과 질병 치료의 목적으로 신약개발에 사용되는 기술 |
| 인터류킨 2 (interleukin 2, IL-2) |
T 세포와 NK 세포 등의 활성화와 증식을 통하여 항암 면역반응을 증진시킬 수 있는 매개 물질. 조절 T 세포에 결합할 경우 면역반응을 떨어트리는 반작용을 보임 |
| 임상 시험 | 한정된 수의 건강한 지원자를 대상으로 안전성에 중점을 두고 투여량, 약리 작용, 체내의 흡수/분포/대사/배설을 조사하는 시험 |
| 임상1상시험 | 실제 사람에게도 투여해 부작용이 없는지 처음으로 확인하는 단계로, 건강한 지원자 또는 약물군에 따른 적응환자를 대상으로 내약성 부작용 및 약물의 체내 작용상태 등 안전성 확인함 |
| 임상2상시험 | 임상 1상을 통해 안전성이 확인된 후보물질의 효능을 본격적으로 알아보는 단계로, 대상질환 가운데 조건에 부합하는 환자를 대상으로 단기 투약에 따른 부작용 및 예상 적응증에 대한 효과를 탐색함 |
| 임상3상시험 | 신약허가를 받기 위한 최종 단계로, 위약 대조실험과 함께 임상2상보다 훨씬 광범위한 임상시험을 함으로써 임상2상에서 나타난 약효가 환자의 심리적 효과(플라시보 효과)로 인한 것인지, 아직 드러나지 않는 부작용은 없는지를 판단하는 단계. 치료대상이 되는 질병에 대한 시험약의 유효성과 안전성에 대해 통계적인 검증을 통해 약물에 대한 최종평가를 내리고, 효능과 효과, 용법, 용량, 사용상의 주의사항 등을 결정함 |
| 자가항체 | 자기 자신의 체성분에 대한 특이적으로 반응하여 면역체계에 의해 생성되는 항체 |
| 자연살해세포 (NK세포, NK cell) |
바이러스에 감염된 세포나 암세포를 직접 파괴하는 면역세포로, 항원제시세포에 의한 항원인식 과정 없이 세포용해작용을 일으키는 작은 림프구 모양의 세포 |
| 작용기전 (mechanism of action, MOA) |
약이 어떤 과정을 거쳐서 효과를 나타내는지를 설명하는 것 |
| 전용실시권 | 특허 발명을 일정 범위 내에서 독점적으로 실시할 수 있는 권리. 특허권자와 실시권자 간에 전용 실시권 설정 계약을 체결하고 이를 특허청에 등록함으로써 발생하며, 전용 실시권자는 설정 계약의 범위 내에서 특허 발명을 독점적ㆍ배타적으로 실시할 수 있음 |
| 조절 T 세포 (regulatory T cell, Treg) |
면역계를 조절하는T 세포의 아형(subtype) 집단으로, 자가항원에 대한 관용(tolerance)을 유지하고 자가면역 질병을 억제함 |
|
종양미세환경 (tumor microenvironment) |
종양 내 암세포, 암의 형성 및 진행에 직ㆍ간접적으로 영향을 미치는 주변 조직세포(섬유아세포, 혈관세포 등), 면역세포 및 이를 구성하고 있는 세포외기질물질 (Extracellular Matrix)을 총칭하는 개념 |
| 중개연구 (translational research, 또는 임상이행연구) |
기초과학 지식이나 연구결과를 실제 임상연구에 적용해 보다 나은 치료법을 개발하거나, 임상 연구를 통해 알게 된 사실을 바탕으로 다시 기초과학 연구를 진행하는 양방향 연구 |
| 투약관련 이상사례 (treatment-related adverse event; TRAE) |
의약품등의 투여ㆍ사용 중 발생한 바람직하지 않고 의도되지 아니한 징후(sign, 예 ; 실험실적 검사치의 이상), 증상(symptom) 또는 질병을 말하며, 해당 의약품등과 반드시 인과관계를 가져야 하는 것은 아님 |
| 표적항암제 | 특정 암세포의 특징적인 표면 (혹은 내부) 타깃을 찾아가도록 만들어진 항암제 |
| 항체 Fc 영역 (crystallization fragment, Fc) |
항체는 항원 결합 부위 Fab(antigen binding fragment)와 불변 영역으로 이루어진 Fc를 경첩 부위(Hinge)가 연결하는 형태로, Fab 영역이 항원을 인식하여 결합하면 항체의 Fc 영역이 면역 세포에 존재하는 다양한 수용체와 결합하여 인체 내에서 면역 반응을 일으켜 항원을 제거함 |
| 항체 의약품 | 항원에 높은 결합력을 보이는 항체를 이용하여 개발되는 바이오 의약품의 일종으로 세포막에 존재하거나 세포 밖으로 분비된 표적 단백질과 결합하여 약효를 나타냄 |
| 후보물질 | 세포실험, 동물 실험 등을 통해 효과가 기존약물에 비해 뛰어나 신약으로서 개발 가능한 물질을 말함 |
| 후천 면역 | 질병에 걸렸거나 예방 접종 등을 통해서 항원에 노출된 후 얻어지는 면역을 말한다. 항원 특이적으로 일어나며, 주로 항체를 형성하는 B림프구와 항원을 공격하는 T림프구에 의해 매개되는 면역임 |
| 효과 T 세포 (effector T cell, Teff cell) |
인간이 각종 바이러스, 세균 등의 외부 항원에 노출되거나, 암에 걸리면 항원 미접촉 T 세포(naive T cell)가 세포분열 및 분화를 시작하여 대량의 효과 T 세포(effector T cell)가 생성됨 |
| 혈관내피성장인자 (vascular endothelial growth factor, VEGF) |
혈관내피세포에 작용하여 세포를 늘리거나 혈관 신생을 촉진하는 분비물질로, 세포분열을 시키며 혈관 신생에 도움을 주나, 혈관이 비정상적으로 생성되는 암세포나 노인성 황반 변성, 염증성 질환을 악화시킬 수 있음 |
| 혈관누수증후군 | 혈액 바깥으로 혈장액과 혈장 단백질이 새어나가는희귀질환 |
| 히스타민 (histamine) |
신체가 빠른 방어 행위를 하기 위하여 분비하는 물질로, 상처 부위가 부어오르며 통증을 느끼게 되는 염증반응(inflammation)이 일어나게 하는 물질. 호염구, 비만세포 등에서 주로 분비됨 |
| 항체매개 세포독성 (antibody-dependent cellular cytotoxicity, ADCC) |
항체가 세포와 작용하여 항원을 제거하는 작용으로, 대식세포(macrophage), 호중구(neutrophil), NK 세포가 Fc 수용체를 통하여 항체의 Fc 영역을 인식하여 항체가 결합한 특이적으로 파괴하는 현상 |
| CAR-T 세포치료제 | T세포의 표면에 존재하는 수용체 (TCR) 대신 항원을 인식할 수 항체를 도입 후, 항체가 항원을 인식하면 T세포가 증식을 통하여 암세포를 죽이도록 고안한 유전자 재조합 T 세포치료제 |
| CDA (Confidential Disclosure Agreement) |
NDA(Non-Disclosure Agreement), 비밀유지계약서 |
| CD80 (Cluster of Differentiation 80) |
항원을 인식하는 antigen presenting cell 표면에 발현하여 T 세포의 CTLA-4 또는 CD28과결합하여 T 세포의 활성 또는 저해에 관여하는 분자, B7-1이라고도 칭함 |
| CDMO (Contract Development & Manufacturing Organization) |
약품의 개발과 제조 서비스를 동시에 제공하는 회사 |
| CHO 세포 (Chinese Hamster Ovary) |
연구개발 및 치료 목적용 유전자 재조합 단백질을 생산하는 포유류 세포 |
| GCP (Good Clinical Practice) |
사람을 대상으로 하는 임상시험을 설계, 수행, 기록 및 보고하는 데 관한 국제적으로 통용되는 윤리적, 과학적 기준 |
| GLP (Good Laboratory Practice, 비임상시험규정) |
의약품, 화학품 등의 안전성 평가를 위하여 실시하는 각종 독성시험의 신뢰성을 보증하기 위하여 인구인력, 실험시설ㆍ장비, 시험방법 등 시험의 전과정에 관련되는 모든 사항을 조직적, 체계적으로 관리하는 규정 |
| CMC (Chemistry, Manufacturing and Control) |
화학 (Chemistry), 제조(Manufacturing), 품질(Control)의 약어로 의약품 개발 과정에서 원료 및 완제의 품질과 연관된 공정개발(process development)과 품질관리(quality control) 부문에서 핵심적인 역할을 담당하는 부서를 의미 |
| CMO (Contract Manufacturing Organization) |
의약품 및 기타 원료물질 등의 제조를 대행하는 전문기업 |
| CRO (Contract Research Organization 혹은 Clinical Research Organization) |
임상시험과 관련된 의뢰자의 임무나 역할의 일부 또는 전부를 대행하기 위하여 의뢰한 자로부터 계약에 의해 위임받은 개인이나 기관, 임상시험수탁전문기관 |
| GI-SMART™ | 최적의 이중융합단백질 제작을 위한 고효율 스크리닝과 후보물질 생산, 배양, 정제가 가능한 당사의 플랫폼 기반기술 |
| FcεRI | Fc 수용체의 일종으로 비만세포 및 호염기성 세포에 발현해 면역글로불린 E와 결합, 알레르기 반응을 매개함 |
| Fc 감마 수용체 (Fc gamma receptor, FcγR) |
면역글로불린, 항체의약품의 Fc 영역과 결합하는 수용체로, 대식세포(macrophage), 호중구(neutrophil), NK 세포 등에 발현 |
| FDA (Food and Drug Administration) |
FDA는 미국 보건부의 산하기관으로 식품과 의약품에 대한 관리 규제를 담당하는 기관 |
| First-in-class | 혁신 신약, 혁신 의약품이라 부르며, 기존의 치료제가 없는 질병의 작용기전을 밝히고 질환을 고치는 신약임. 특정 질환에 대한 약의 효능이 기존에 나온 여타 약물과 구별됨 |
| GMP (Good Manufacturing Practice) |
식품ㆍ의약품의 안정성과 유효성을 품질면에서 보증하는 기본 조건으로서, 품질이 고도화된 우수 식품ㆍ의약품을 제조하기 위한 여러 요건을 구체화한 것으로 원료의 입고에서부터 출고에 이르기까지 품질관리의 전반에 있어 지켜야 할 규범임. 미국은 cGMP, 유럽은 EU-GMP, 한국은 kGMP 기준을 가지고 있음 |
| IND (Investigational New Drug Application, 임상시험 계획 승인 신청) |
인체를 대상으로 한 안전성ㆍ유효성 자료 수집을 목적으로 해당 의약품을 사용하여 임상시험을 실시하고자 하는 자가 식약처장의 승인을 신청하는 과정 |
| NDA/BLA | 신약허가신청(New Drug Application)과 바이오의약품허가신청(Biological License Application) |
| GLP Tox (GLP toxicology) |
비임상 독성실험, GLP 인증 기관에서 수행한 독성 시험 평가 |
| T 세포 (T 림프구, T cell) |
흉선에서 유래하는 림프구의 일종으로 세포성 면역을 담당. 암이나 바이러스에 감염된 세포를 제거하거나, 이를 보조하기 위한 매개 물질인 사이토카인 등을 생성하며, 기억능력을 가짐. 또한 면역 조절 기능을 가진 세포 아형이 존재 |
| VEGF inhibitor (혈관내피성장인자저해제) |
혈관내피세포에 작용하여 혈관 신생을 촉진하는 혈관내피성장인자(VEGF)를 타깃으로 하는 표적치료제 |
| 페길화 | 폴리에틸렌글리콜(PEG)를 약효를 갖는 활성 성분인 단백질 등에 결합시켜 용해도, 반감기, 안정성 등 약물의 물성 및 약동학을 개선하는 기술 |
| B세포 | 백혈구의 일종으로 항체를 만드는 세포 |
| 호산구(Eosinophil) |
백혈구의 일종으로 주로 알레르기 염증 및 기생충 감염 등에 반응하여 증가됨 |
| CD73(ecto-5'-nucleotidase) |
아데노신 모노포스페이트(AMP)를 아데노신(adenosine)으로 가수분해하는 세포막 효소 |
1. 사업위험
|
가. 국내외 경기변동에 따른 위험 국제통화기금(IMF)이 2024년 10월 발표한 "World Economic Outlook"에 따르면 세계 경제성장률 전망치는 2024년 3.2%, 2025년 3.2%로 전망됩니다. IMF에 따르면 아시아 지역의 수출 증가 등 세계 무역 회복의 영향으로 세계 경제가 양호한 성장세를 보일 것으로 전망하였습니다. IMF는 지난 7월 전망에 비해 세계 경제 하방조정 위험요인이 보다 확대된 것으로 평가하였습니다. 상방조정 가능요인으로는 주요 선진국에서의 투자 회복과 구조개혁 모멘텀 확산에 의한 잠재성장률 제고 등을 제시하였습니다. 반면, 그간 긴축적 통화정책의 시차 효과에 따른 성장·고용에의 부정적 영향, 중국 부동산 부문 위축 지속, 전세계적인 보호무역주의 강화 및 지정학점 위기 심화에 따른 원자재 가격 상승 등을 하방조정 위험요인으로 지적하였습니다. 한편, 한국은행이 2024년 11월 발표한 경제전망보고서에 따르면, 국내 경제성장률은 2024년과 2025년에 각각 2.2%, 1.9% 수준으로 전망됩니다. |
(1) 글로벌 경기 동향
국제통화기금(IMF)이 2024년 10월 발표한 "World Economic Outlook"에 따르면, 2024년 세계 경제성장률 전망치는 2024년 07월 전망치와 동일한 3.2%, 2025년 세계 경제성장률 전망치는 2024년 07월의 2025년 전망치에서 0.1%p. 하향조정된 3.2%로 전망됩니다. IMF에 따르면 아시아 지역의 수출 증가 등 세계 무역 회복의 영향으로 세계 경제가 양호한 성장세를 보일 것으로 내다보았습니다.
2024년 10월 IMF가 제시한 세계 경제성장률 전망치는 다음과 같습니다.
| [세계 경제성장률 전망치] |
| (단위: %, %p.) |
| 구 분 | 2023년 | 2024년(E) | 2025년(E) | ||||
| 2024년 7월 전망 |
2024년 10월 전망 |
조정폭 | 2024년 7월 전망 |
2024년 10월 전망 |
조정폭 | ||
| (A) | (B) | (B-A) | (C) | (D) | (D-C) | ||
| 세계 | 3.3 | 3.2 | 3.2 | - | 3.3 | 3.2 | -0.1 |
| 선진국 | 1.7 | 1.7 | 1.8 | +0.1 | 1.8 | 1.8 | - |
| 신흥개도국 | 4.4 | 4.3 | 4.2 | -0.1 | 4.3 | 4.2 | -0.1 |
| 미국 | 2.9 | 2.6 | 2.8 | +0.2 | 1.9 | 2.2 | +0.3 |
| 유로존 | 0.4 | 0.9 | 0.8 | -0.1 | 1.5 | 1.2 | -0.3 |
| 한국 | 1.4 | 2.5 | 2.5 | - | 2.2 | 2.2 | - |
| 일본 | 1.7 | 0.7 | 0.3 | -0.4 | 1.0 | 1.1 | +0.1 |
| 중국 | 5.2 | 5.0 | 4.8 | -0.2 | 4.5 | 4.5 | - |
| 인도 | 8.2 | 7.0 | 7.0 | - | 6.5 | 6.5 | - |
| 러시아 | 3.6 | 3.2 | 3.6 | +0.4 | 1.5 | 1.3 | -0.2 |
| 출처: | IMF World Economic Outlook(2024.10) |
IMF는 지난 7월 전망에 비해 세계 경제 하방조정 위험요인이 보다 확대된 것으로 평가하였습니다. 상방조정 가능요인으로는 주요 선진국에서의 투자 회복과 구조개혁 모멘텀 확산에 의한 잠재성장률 제고 등을 제시하였습니다. 반면, 그간 긴축적 통화정책의 시차 효과에 따른 성장·고용에의 부정적 영향, 중국 부동산 부문 위축 지속, 전세계적인 보호무역주의 강화 및 지정학점 위기 심화에 따른 원자재 가격 상승 등을 하방조정 위험요인으로 지적하였습니다.
또한 여전히 미국과 중국을 비롯한 주요국 간의 경제관계 악화 및 무역갈등, 중국 및 기타 주요 신흥시장의 경제성장 둔화, 유럽 및 중남미의 경제 및 정치 상황 악화, 여러 중동 지역에서의 지정학적 및 사회적 불안정성이 지속되고있습니다. 뿐만 아니라 최근에는 이스라엘-이란 및 러시아-우크라이나 전쟁으로 인한 글로벌 공급망 교란에 따른 수급 문제, 세계 교역량의 11%가 지나는 관문인 홍해에서 상선에 대한 공격, 이스라엘-하마스 전쟁에서 비롯된 중동지역의 전쟁 확산 등은 원자재 및 물류 가격 상승으로 이어져 인플레이션을 지속시킬 가능성이 있으며, 이로 인해 글로벌 경제의 불확실성을 지속적으로 높이고 있습니다.
(2) 국내 경기 동향
한국은행이 2024년 11월 발표한 경제전망보고서에 따르면 국내 경제성장률은 2023년 연간 1.4%를 기록하였고, 2024년 상반기 2.8%, 하반기 1.6%, 연간 2.2%를 전망하였으며, 2024년 연간 전망치의 경우 2024년 8월 전망치 2.4% 대비 0.2%p. 하락하였습니다. 또한 2025년의 경우, 상반기 1.4%, 하반기 2.3%, 연간 1.9%를 전망하였으며, 2025년 연간 전망치의 경우 2024년 8월 전망치 2.1% 대비 0.2%p. 하락하였습니다.
한국은행이 발표한 국내 경기의 대외여건을 보면, 디스인플레이션 및 금리인하 사이클의 진전에도 불구하고 미국 대선 이후 주요국 경제정책을 둘러싼 불확실성 증대로 성장으로 하방 리스크가 높아진 것으로 평가했습니다. 또한 대내적으로는 주가 하락 등 금융시장 변동성이 확대된 가운데 임금과 재정지출이 당초 예상을 밑돌면서 성장의 하방압력으로 작용할 것으로 판단하고 있습니다. 또한 향후 전망경로 상에는 반도체 경기, 글로벌 지정학 및 통상환경 등과 관련한 불확실성이 높으며, 물가의 경우 기업의 비용압력 확대 등도 리스크 요인으로 잠재하고 있다고 분석하였습니다.
| [국내 주요 거시경제지표 전망] |
| (단위 : %) |
| 구분 | 2023 연간 |
2024(E) | 2025(E) | ||||
| 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | ||
| GDP | 1.4 | 2.8 | 1.6 | 2.2 | 1.4 | 2.3 | 1.9 |
| 민간소비 | 1.8 | 1.0 | 1.4 | 1.2 | 1.8 | 2.3 | 2.0 |
| 건설투자 | 1.5 | 0.4 | -2.9 | -1.3 | -3.2 | 0.5 | -1.3 |
| 설비투자 | 1.1 | -1.8 | 4.9 | 1.5 | 5.7 | 0.5 | 3.0 |
| 지식재산생산물투자 | 1.7 | 1.5 | -0.1 | 0.7 | 2.7 | 5.0 | 3.9 |
| 재화수출 | 2.9 | 8.4 | 4.3 | 6.3 | 1.4 | 1.7 | 1.5 |
| 재화수입 | -0.3 | -1.3 | 3.6 | 1.1 | 3.0 | 0.9 | 1.9 |
| 출처: | 한국은행 경제전망보고서 (2024년 11월) |
세부적으로, 민간소비는 물가 안정세와 명목임금 상승에 따른 실질 소비여력 확충, 금융여건 완화 등에 힘입어 회복흐름을 이어갈 전망이나, 높은 원리금 상환부담, 취약계층의 소비여력 개선 지연, 일부 대기업의 고용 관련 불확실성 증대 등이 제약요인으로 작용하고 있습니다. 건설투자의 경우 주거용, 상업용 건물을 중심으로 공사물량이 줄어듦에 따라 부진할 전망이나, 2025년 하반기 이후에는 대규모 공공사업 진척 등에 힘입어 환만한 회복세를 보일 것으로 예상됩니다. 설비투자의 경우, AI 반도체 관련 견조한 투자수요, 글로벌 통화긴축 완화등에 힘입어 증가 흐름을 이어갈 것으로 예상되나, 미국 등 주요국 경제정책을 둘러싼 불확실성 증대, 비IT 부문의 회복 지연 등은 회복 속도를 제약할 수 있습니다. 재화수출은 AI 선도기업들이 큰 폭의 인프라 투자를 이어가는 데 힘입어 고성능 반도체를 중심으로 증가할 전망이나, 중국의 반도체.화학제품.철강 공급 확대, 미국의 보호무역 강화 등이 우리 수출 증가를 제약할 것으로 전망됩니다.
당사가 주력사업으로 영위하고 있는 사업은 국내외 거시경제의 직·간접적인 영향을 받고 있으며, 고금리, 고환율, 저성장 등에 따른 글로벌 경기침체로 인해 관련 산업에 대한 연구개발 투자가 위축되거나 실적이 악화될 수 있습니다. 또한 현재 금융시장 불안요인 완전히 해소되지 않은 상황에서, 신용 스프레드 상승 등이 당사 재무 상황에 추가적인 위험요인으로 작용할 위험이 있습니다. 이러한 거시경제의 불확실성은 국내외 경기 전반에 영향을 미칠 수 있으며, 당사가 영위하는 사업 및 실적에도 부정적인 요인으로 작용할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 나. 신약개발 사업 고유 특성에 따른 위험 당사는 융합 단백질을 기반으로 차세대 면역치료제를 연구 개발하는 신약 연구개발 전문회사 입니다. 당사가 영위하고 있는 신약 개발 사업은 사업화 성공 시 특허권 및 독점판매권을 통해 일정기간 배타적 수익을 보장받을 수 있는 고부가가치 사업입니다. 하지만 그만큼 시판 허가를 받기까지 규제 당국이 제시하는 엄격한 절차에 따라 비임상 독성 시험, 임상시험, 시판 승인 등 여러 까다로운 단계를 거쳐야 합니다. 이런 이유로 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 오랜 시간과 천문학적인 비용이 요구되지만 그럼에도 불구하고 상업화까지 도달하는 비율이 매우 낮습니다. 당사가 변수들을 미리 찾아내어 극복하지 못 할 경우, 지출했던 연구개발 비용 및 시간 등의 큰 손실을 발생할 수 있습니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공확률이 매우 낮은, 대표적인 고위험, 고수익, 장기투자(High Risk, High Return, Long Term Investment) 사업 입니다. 따라서 당사는 신약 연구개발 사업의 기간 및 비용의 위험을 줄이고 효율성을 극대화하기 위해, 구조 안정성과 생산성이 향상된 이중융합단백질을 지속적으로 발굴하는 GI-SMART™ 플랫폼 기술을 정립하고, 초기 개발단계에서부터 경쟁력 있는 목표제품특성을 수립하여 이에 부합하는 중개연구를 수행하는 신약개발 전략을 수립하고 있습니다. 또한 전임상 또는 초기 임상 단계에서의 기술이전(Licensing out, L/O) 및 특정 적응증 직접 개발을 통해 수익을 창출하는 사업화 전략을 수립하고 있습니다. 그 결과 당사는 설립 이후 핵심 파이프라인인 GI-101(면역항암제)와 GI-301(알레르기 치료제)의 기술이전을 성사시켰습니다. 이후 핵심 파이프라인 GI-101, GI-102 및 GI-301은 현재 임상 단계를 진행중이며, GI-108은 2024년 12월 11일 국내 식약처 IND 승인을 획득하여 임상 1/2a상의 시작을 앞두고 있습니다. 이 외에도 GI-10N(면역항암제) 시리즈, GI-20N(대사질환 치료제) 시리즈, GI-30N(알레르기질환 치료제) 시리즈 등 다수의 후속 파이프라인을 확보하고 있습니다. 한편, 당사는 대사질환치료제 및 뇌질환치료제로써 GI-210을 개발하고 있었으나, 동일 시장내 경쟁력 있는 블록버스터 약물의 시장 확대에 따른 글로벌 경쟁력 감소와 당사의 임상 단계 파이프라인 (GI-101/GI-102, GI-301) 및 후속 파이프라인 (GI-128, GI-213)의 우선적 개발 전략에 따라 해당 파이프라인의 개발을 현재 중단하였습니다. 이처럼 당사의 신약개발 전략 및 사업화, 판매 전략에도 불구하고, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인 개발 우선순위가 변경되거나 파이프라인의 연구개발 진행이 지연 또는 추가적인 연구개발 중단이 발생할 수 있으며, 이로 인해 당사의 성장성에 큰 제약이 발생할 수 있습니다. 또한 예기치 못한 사유로 기술이전 계약체결에 실패하게 되거나, 기존에 체결한 기술이전계약에 따른 마일스톤을 달성하지 못할 경우, 연구개발에 투자한 자금을 회수할 수 없게 되어 당사의 사업계획과 수익성, 재무구조 등에 부정적인 영향을 미칠 수 있습니다. |
당사는 융합 단백질을 기반으로 차세대 면역치료제를 연구 개발하는 신약 연구개발 전문회사입니다. 신약개발 사업은 사업화에 성공 시 통상적으로 특허권에 의해 일정기간 동안 독점권으로 보호받게 되며, 시판 승인 후 일정기간 동안 독점 판매기간을 인정받을 수도 있습니다. 대부분의 국가에서 특허 존속기간은 출원 후 20년이며, 특허의 존속기간과 관계없이 신약의 경우, 미국은 시판 승인 후 5년 이상의 시장독점권, EU는 10년의 시장독점권, 국내는 6년의 시장독점권을 보장받을 수 있습니다. 이처럼 특허권 및 독점판매권(시장독점권)을 통해 일정기간 배타적 수익을 보장받을 수 있기 때문에 글로벌 블록버스터급 신약 개발에 성공 시 막대한 수익을 창출할 수 있는 고부가가치 사업입니다.
그러나, 신약 개발 과정은 후보물질의 유효성과 안전성을 평가하고 이에 대한 근거를 마련하기 위한 중요한 과정으로 관련 규정과 절차를 반드시 준수해야합니다. 먼저, 타겟 질환에 대해 약리적인 효과가 있을 것으로 예상되는 후보물질 탐색 및 발굴을 시작으로, 동물을 대상으로 하는 전임상 연구(preclinical study)와 사람을 대상으로 하는 임상 연구(clinical study)를 통해 후보물질의 안전성과 유효성에 대한 자료를 분석하여, 최종적으로는 규제 당국으로부터 자료의 적합성 심사를 통해 의약품 품목 허가를 받아야 합니다. 또한, 제품이 안전하고 일정한 품질 수준을 유지한 채 생산되어야 하기에 공정개발 및 검증이 동시에 성공적으로 진행되어야 합니다.
특히, 일반인 또는 환자를 대상으로 하는 임상시험을 진행하고자 할 때에는 효능과 안전성에 대한 각 국가의 정부규제가 엄격하여, 임상시험 이전 단계부터 엄격한 규제에 의해 축적된 다양한 데이터를 각 국가의 규제 당국에 제출하여야 합니다. 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 또한, 신약허가신청(NDA) 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 관리 규정을 따라야 합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공확률이 매우 낮은, 대표적인 고위험, 고수익, 장기투자(High Risk, High Return, Long Term Investment) 사업입니다.
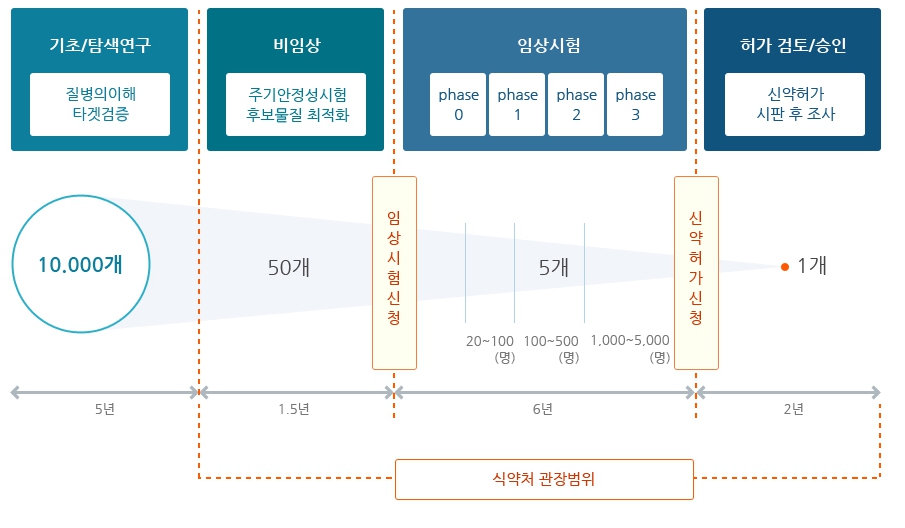 |
|
신약 개발 과정 |
| 출처: | 의약품안전나라 의약품통합정보시스템 |
의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 전임상시험은 기초탐색 과정을 거쳐 도출된 신약 후보물질에 대해 동물을 대상으로 실시하는 단계로, 후보물질의 효능보다는 안전성을 위주로 진행됩니다.
임상시험은 일반적으로 3단계로 구분됩니다. 임상 1상 시험은 실제 사람에게도 투여해 안전성을 처음으로 확인하는 단계입니다. 임상 2상 시험은 1상을 통해 안전성이 확인된 후보물질의 효능을 본격적으로 알아보는 단계로, 대상질환 가운데 조건에 부합하는 환자를 대상으로 단기 투약에 따른 부작용 및 예상 적응증에 대한 효과를 탐색하게 됩니다. 임상 3상 시험은 신약허가를 받기 위한 실질적인 최종 단계로, 치료대상이 되는 질병에 대한 시험약의 유효성과 안전성의 통계적인 검증을 통해 약물에 대한 최종평가를 내립니다. 전체 의약품의 임상 단계별 성공률은 임상 1상 ⇒ 임상 2상은 52.0%, 임상 2상 ⇒ 임상 3상은 28.9%, 임상 3상 ⇒ NDA는 57.8%, 허가심사신청 ⇒ 허가승인은 90.6% 수준이며, 임상 1상 ⇒ 허가승인까지의 성공률은 7.9% 수준으로 알려져 있습니다.
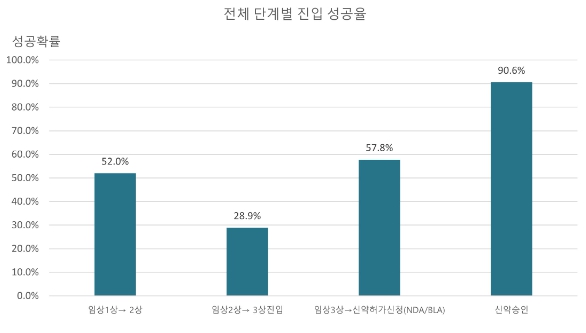 |
|
신약 임상단계별 성공률 |
| 출처: | Clinical Development Success Rates and Contributing Factors 2011~2020, Informa |
항암제의 경우, 윤리적인 이유로 임상 1상부터 환자를 대상으로 임상시험을 진행하여 약물의 안전성, 내약성 및 유효성을 확인합니다. 일반적으로 건강한 피험자들을 대상으로 임상 1상 시험을 진행하는 다른 치료제들과는 달리 항암제의 경우 표준치료법에 반응하지 않는 암환자들을 대상으로 진행하기 때문에 환자 모집에 어려움을 겪을 수 있으며, 피험자들이 임상이 완료되기 전에 암의 진행이나 약물 부작용으로 사망하여 임상시험이 일시적으로 중단되거나 피험자를 추가 모집해야 되는 일이 생길 수 있습니다. 이에 따라 임상시험의 진행이 예상보다 지연되는 경우가 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
또한, 항암제는 다른 질환에 대한 치료제들에 비해 성공률이 다소 낮은 것으로 보고되어 있습니다. 비항암제의 경우, 임상 1상 진입부터 최종 승인까지의 9.3%의 성공률을 보이나, 항암제는 약 절반 정도인 5.3%의 성공률을 보이며 상대적으로 개발 실패 위험이 더 클 것으로 추정됩니다.
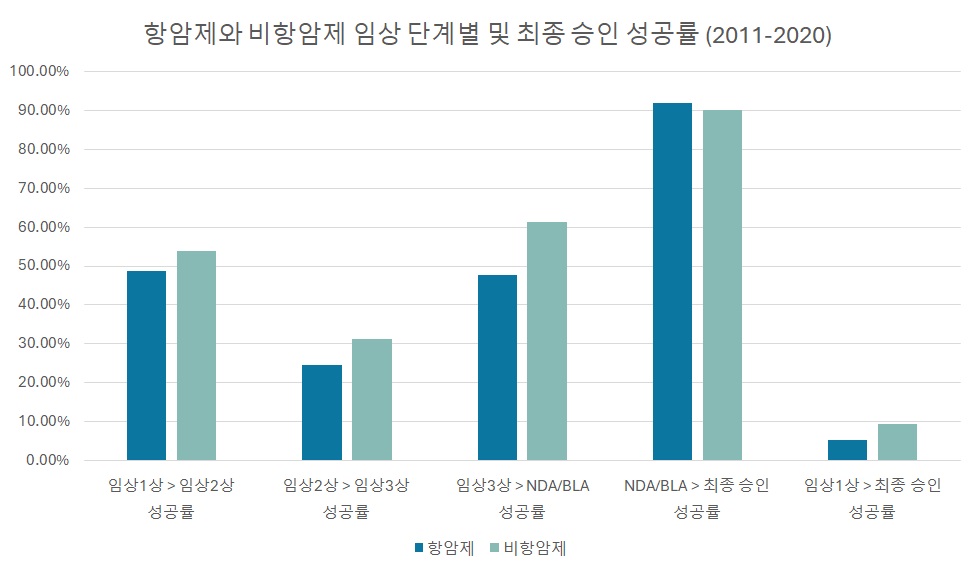 |
|
항암제와 비항암제 임상 단계별 및 최종 승인 성공률 |
| 출처: | Clinical Development Success Rates and Contributing Factors 2011~2020, Informa |
따라서 당사는 신약 연구개발 사업의 기간 및 비용의 위험을 줄이고 효율성을 극대화하기 위해 전임상 또는 초기 임상까지 진행하고, 이후 후기 임상 개발 및 상업화 단계는 전문적인 해외 또는 국내 대형 제약사에 기술이전(Licensing out, L/O)하여 수익을 창출하는 한편, 당사는 일부 적응증은 직접 개발하는 사업화 전략을 수립하고 있습니다. 이러한 기술이전 추진 노력의 결과로 설립 3년 내에 핵심 파이프라인인 GI-101(면역항암제)은 전임상 단계에서 중국 심시어(Simcere Pharmaceutical Co., Ltd.)에 총 계약금액 7억 9,000만 달러(중국지역 판권) 규모의 기술 수출 성과를 거두었습으며, GI-301(알레르기 치료제) 역시 전임상 단계에서 (주)유한양행에 1조 4,090억원(일본 제외 글로벌 판권)의 규모의 기술이전을 성사시켰습니다. 이후 2023년 10월에는 GI-301의 우수한 국내 전임상 및 임상 1a상 데이터를 바탕으로, GI-301에 대한 일본 내 전용실시권을 일본 마루호(Maruho Co., Ltd.)에 2억 2,100만 달러 규모로 기술이전하는 계약을 추가로 체결하여 상업화 역량을 보유하고 있음을 다시 한번 입증하였습니다.
이 같은 전임상~임상 1a상 단계에서의 대규모 기술이전 실적은 '중개연구'를 중시하는 당사의 신약개발 전략에서 비롯됩니다. 중개연구(Translational research, 또는 임상이행연구)란 기초과학 지식이나 연구결과를 실제 임상연구에 적용해 보다 나은 치료법을 개발하거나, 임상 연구를 통해 알게 된 사실을 바탕으로 다시 기초과학 연구를 진행하는 양방향 연구를 의미합니다.
성공적인 중개연구를 위해서는 기초과학 연구 및 임상 연구에 양측에 관한 전적인 이해가 수반되어야 합니다. 이러한 점에서 당사는 기초과학 및 임상, 사업화에 이르는 다학제간 전문 인력들로 효율적인 조직을 운영중이며, 개발 초기인 실험실 연구단계부터 개발가능성(feasibility)과 임상적 의의가 있는 최상의 조건을 파악하여 임상시험에 반영되도록 모든 단계에 적용하고, 최종단계인 임상디자인에 임상시험의 성공과 상용화의 가능성을 높이는 프로토콜 강화 과정을 반영하고 있습니다.
기초과학 측면에서, 당사는 세계적인 면역학자이자 창업자인 장명호 사장을 필두로 다수의 기초과학, 생명공학 전공자들과 함께 구조 안정성과 생산성이 향상된 이중융합단백질을 발굴하는 GI-SMART™ 플랫폼 기반 기술을 확립했으며, 당사 고유의 공정개발 기술을 이용해 다양한 다중표적 융합단백질 치료제를 고품질, 고효율로 생산하고 있습니다.
구체적으로 당사의 GI-SMART™ 플랫폼 기술의 경우, 다양한 단백질 및 항체를 이용하여 최적의 안정성과 활성을 가지는 신규 이중융합단백질을 발굴하고 생산하는 고효율 스크리닝 시스템(high throughput screening system)입니다. 해당 기술은 SMART-Selex™ 기술과 SMART-cLego™ 기술 두 가지로 구성되어 있습니다. 단백질 의약품은 단백질 구조의 디자인부터 시작되며 그 디자인을 바탕으로 단백질 샘플을 만들고 약물 효력 시험을 통해 가능성을 확인합니다. 하지만, 단백질 샘플이 추후 공정 개발 및 GMP 생산까지 완료한 후 FDA 및 식약처 등 기관에 임상 신청을 하기까지는 생산의 일관성 및 대량 생산 가능성 등의 품질 문제를 해결해야 합니다. 특히, 논문 정보 등을 통해 이론적으로 구상한 표적 단백질은 우리가 생각했던대로 생산이 안되거나, 원치않는 불순물이 포함되어 정제하기 어려운 까다로운 품질 이슈들이 발생할 수 있습니다. 현재까지도 어떻게 단백질 구조를 디자인해야 이 문제들이 나오지 않게 하는 방법을 모르기에 디자인부터 생산까지 해봐야 그 유효성이 검증 가능하며 이 부분을 효율화하는 것이 GI-SMART™ 플랫폼 기술입니다.
 |
|
GI-SMART™ 플랫폼 |
(i) SMART-Selex™ 기술
SMART-Selex™ 기술은 이중융합단백질 구성요소인 Fc 도메인(crystallized fragment domain; Fc domain), 힌지(hinge), 링커(linker)의 24,190개 아미노산 서열 라이브러리 조합을 통해 품질 이슈를 유발하는 단백질 구조의 문제점을 해결하기 위한 이중융합단백질구조 안정화를 수립하는 기술입니다. 자사는 항체 단백질에서 생체 내 반감기를 높이는 역할을 하는 Fc 도메인 부분에 다양한 의약적 효과를 보일거라 예상하는 다른 단백질 도메인들을 연결한 다중 표적 Fc-융합 단백질을 생산합니다. 이를 위해, 아래 그림과 같이 품질 이슈를 극복하는 방법으로 단백질의 3차원 구조적 안정성에 기여하는 Fc 도메인 위의 링커(41개 N-term variant linkers)와 다양한 Fc 도메인 (10개 Fc body variants) 그리고 그 밑의 링커(59개 C-term variant linkers)들에 대한 아미노산 서열을 수집하였고 이를 바탕으로 다양한 조합 구조들에 대한 단백질 3차원 모델링을 할 수 있습니다. 하지만, 이 다양한 조합 구조들은 단지 아미노산 서열들의 조합일 뿐이기에 실제 단백질 샘플을 만들 수 있는 발현벡터들이 필요한데, 이 때 필요한 기술이 SMART-cLego™ 기술입니다.
 |
|
SMART_Selex™ 기술 |
(ii) SMART-cLego™ 기술
SMART-cLego™ 기술은 다양한 종류의 발현벡터 및 이중융합단백질 생산을 저비용 고효율로 할 수 있게 하는 기술입니다. 당사는 이를 통해 타깃부터 선도물질 최적화까지 생산성과 구조적 안정성이 뛰어난 신규 이중융합단백질의 원스톱(one-stop) 조기 발굴이 가능합니다. 앞서 언급한 각 linker 및 Fc 도메인의 서열의 조합은 24,190개의 조합을 효율적으로 구성하기 위해서, 단편적으로 보유한 SMART-Selex의 아미노산 서열에 대한 DNA 서열들과 내부에 보유하지 않아 외부에서 합성한 DNA 서열들을 순서에 맞게 조립해야 하며 이를 '클로닝' 과정이라고 합니다. 당사는 내부에 보유하고 있지 않은 DNA 서열들과 기보유한 DNA 서열들을 한치의 오차도 없이 순서에 맞게 조립할 수 있는 실험법을 최적화함을 통해 다양한 조합의 단백질 구조들에 대한 단백질 샘플을 타사보다 값싸게 짧은 시간 안에 제조할 수 있습니다.
 |
|
SMART-cLego™를 통한 발현벡터 제조 모식도 |
당사는 자체적으로 SMART-cLego™를 바탕으로 추론한 발현벡터 제조 및 비용을 분석하였을 때 아래 그림과 같이 외부 업체를 사용한 경우 대비 우수한 제조 경쟁력을 확보하고 있다고 판단하고 있습니다.
 |
|
SMART-cLego™와 외부 업체 효율성 비교 |
또한 임상 및 기술사업화 전문인력을 주축으로, 전략적으로 초기 개발단계에서부터 경쟁력 있는 목표제품특성(Target Product Profile, TPP)를 수립하고, 이에 부합하도록 경쟁 약물과 차별화되는 중개연구를 수행하고 있습니다. 즉, 본격적인 데이터 생성 이전에 대상 물질의 적응증 선정, 미충족 의료수요(Unmet medical needs)를 충족시키기 위한 타깃 선정, 개발 트렌드 분석 및 경쟁 제품 대비 차별화 전략 수립, 효능 증대 및 안전성 개선 등의 목표 성능을 설정하고 이에 대한 평가 계획을 확립하여 개발 과정 전체를 한 눈에 조망함으로써, 초기 전임상 단계에서부터 유효하고 차별성 있는 데이터를 효율적으로 조기에 확보하고 있습니다.
위와 같은 경쟁력 있는 목표제품특성 설정은 신약개발 초기 단계에서부터 개발물질의 임상적 효용성을 예측 가능하게 하고, 기존 표준 치료법 대비 경쟁력 확보를 위한 임상개발 전략 수립을 가능케 합니다. 그 결과, 당사의 핵심 파이프라인인 GI-101, GI-102(면역항암제) 및 GI-301(알레르기 치료제) 등은 현재 전임상 시험을 마치고 임상 단계를 진행중이며, GI-108의 경우 전임상 완료 후 2024년 12월 11일 국내 식약처 IND 승인을 획득하여 임상 1/2a상의 시작을 앞두고 있습니다.
또한, 단일 단백질과 이중융합단백질에 관계 없이 모두 단백질 기반 신약 물질은 제조 시 온도, 보관 방법 등 물리적인 이유로 인해 변성이 없는 안정적인 물질을 일관적으로 생산하는 것이 어려운 실정입니다. 동사는 단일 단백질과 달리, 치료제에 표적 세포와 결합하는 항체 기능과 함께 면역 활성(GI-101/102, GI-108), 세포 독성 제거(GI-301) 등의 추가적인 기능을 더해 치료 효과를 개선하고자 하는 이중융합단백질을 제조하며, 당사는 제조 과정 중 변성이 없는 물질의 생산의 확률을 높여 생산 과정의 구조 안정성을 높이고 시행착오의 감소로 인한 생산성의 향상, 생산 비용의 효율화를 도출한 GI-SMART™ 플랫폼 기반 기술을 이중융합단백질의 발굴에 활용하여 GI-128 등의 GI-10N(면역항암제) 시리즈, GI-213 등의 GI-20N(대사질환 치료제) 시리즈, GI-305 등의 GI-30N(알레르기질환 치료제) 시리즈 등 다수의 후속 파이프라인을 지속적으로 도출하여 연구개발을 수행하고 있습니다.
본 공시서류 제출일 현재 당사가 연구 개발을 진행 중인 파이프라인의 현황은 아래와 같습니다.
| [당사 주요 신약 파이프라인 현황] |
| 파이프라인 | 임상 단계 (국가) | 현재 단계 | 환자 등록 진행현황 |
환자 모집 계획 | 목표 환자 대비 모집 환자 수 | 약물 용량 단계 | 예상 환자등록 종료 시점 |
예상 전체 임상 종료 시점 |
|---|---|---|---|---|---|---|---|---|
| GI-102 | 1상 (한국, 미국) |
정맥 투여 제형 용량 증량 단계 |
등록 완료 | 최대 52명 | 54명 |
0.45 mg/kg (top dose level) |
완료 | 2026년 2분기 (치료기간1년 가정) |
| 2a상 (한국, 미국) |
정맥 투여 제형 용량 확장 단계 |
등록 전 | 약 40명 | 0명 | 0.24, 0.45 mg/kg 비교 예정 | 2025년 2분기 | ||
| 1b/2a상 (한국, 미국) |
피하 투여 제형 용량 증량/확장 단계 |
등록 중 | 최대 46명 | 2명 투약 완료 |
0.12, 0.24 mg/kg (1st dose level) |
2025년 2분기 | ||
| 2상 (한국, 미국) |
ADC 및 화학항암제 병용 | 등록 전 | 약 80명 | 0명 | Safety run-in 이후 병용 2상 임상용량 투약 예정 |
2025년 2분기 | ||
| 2상 (한국, 미국) |
면역항암제(키트루다) 병용 |
등록 중 |
약 80명 | 2명 투약 완료 | Safety run-in 이후 병용 2상 임상용상투약 예정 |
2025년 2분기 | ||
|
GI-101/ GI-101A (정맥주사 제형) |
1/2상 (한국, 미국) |
GI-101 - 단일요법 용량/증량 확장 - 면역항암제(키트루다) 병용 - 표적항암제(렌비마) 병용 |
등록 완료 | - | - |
0.3 mg/kg (top dose; 2명 투약 진행중) |
완료 | 2026년 2분기 (치료기간 1년 가정) |
| 1/2상 (한국, 미국) |
GI-101A 단일요법 용량 증량/확장 |
등록 중 | 최대 52명 | 30명 |
0.3 mg/kg (top dose) |
2024년 4분기 | ||
| 1/2상 (한국, 미국) |
GI-101A 면역항암제(키트루다) 병용 |
등록 중 | 최대 52명 | 28명 |
0.2 mg/kg (3rd dose level) |
2024년 4분기 | ||
|
GI-301 |
임상1a상(한국) 임상1b상(한국) |
임상 1a상: 단회 투여 임상 1b상: 단회/다회 투여 |
등록 완료 (일부 시험 완료) |
- | - | 0.75~4 mg/kg | 완료 | - |
|
GI-108 (정맥주사 제형) |
임상1/2a상 (한국) |
단일 요법 용량 증량/확장 |
임상 1/2a상 IND 승인 완료 |
약 76명 | 0명 |
0.1 mg/kg (1st dose level) |
2025년 3분기 | 2026년 3분기 |
| 출처: | 당사 제공 |
| 주1) | GI-301 임상의 경우 국가별로 파트너사에서 직접 임상을 진행하고 있으며, 비밀유지계약 조건에 따라 해당 내용은 기재하지 않았습니다. |
 |
|
전체 파이프라인 연구개발 현황 |
| 출처: | 당사 제공 |
당사가 진행 중인 임상 단계에서 환자 모집이 장기화될 경우, 임상시험 일정이 지연될 가능성이 있습니다. 통상적으로 환자 모집에 가장 중요한 역할을 미치는 인자는 약효로, 충분한 항암 활성이 없는 경우 임상시험 환자 등록에 어려움이 있을 수 있습니다. 다만, 당사는 강력한 항암 활성을 바탕으로 목표 환자 대비 충분한 수의 기관을 통해 국내와 미국에서 환자를 등록 중이며, 현재까지 초기 임상임에도 불구하고 매우 활발히 환자가 등록되고 있습니다. 그럼에도 불구하고 발생할 수 있는 환자 모집의 지연을 미연에 방지하기 위해 아래와 같은 방안 역시 수립하고 있습니다.
i) 환자 모집 가속화
GI-102 임상시험은 한국과 미국에서 동시에 환자 모집이 이루어지고 있으며, 비교적 빠른 속도로 환자가 모집되고 있다고 당사는 판단하고 있습니다. 당사는 환자 모집을 가속화하기 위해 월 1회 이상 적극적으로 연구자들과 최신의 데이터를 교류하며 환자 등록을 독려하고 있습니다. 또한, 기존 기관에서 환자 모집 지연이 발생할 경우를 대비하여 기존 기관의 환자 모집 상황을 면밀히 모니터링하며, 지연이 예상되는 경우 신속히 대응할 수 있도록 신규 기관 선정을 대비하고 있습니다. 신규 기관은 한국, 미국뿐만 아니라 호주에도 개설할 계획으로, 이를 통해 환자 모집의 범위를 확장하고 등록 속도를 높이고자 합니다.
ii) Adaptive design 적극 활용
당사가 진행하는 임상시험은 Adaptive design 방식을 채택하고 있으며, 이는 임상시험의 진행 중에도 환자 모집과 데이터 분석 결과에 따라 시험 설계를 유연하게 조정할 수 있는 혁신적인 방법론을 의미합니다. Adaptive design은 전통적인 고정 설계 방식과 달리, 시험 중간에 얻어진 데이터를 바탕으로 시험 방향을 조정하여 효율성과 효과성을 극대화할 수 있으며, 이를 통해 환자 모집 속도나 데이터 수집 상황이 목표와 다소 차이가 발생하더라도 설계 변경을 통해 시험의 성공 가능성을 높일 수 있다는 장점을 보유하고 있습니다. 또한, Adaptive design은 환자 모집 상태와 데이터 분석 결과를 바탕으로 실시간으로 시험 진행 상황을 조율할 수 있도록 설계되어 있습니다. 이는 시험 일정의 유연성을 확보하고 중요한 마일스톤을 준수하도록 설계를 조정하여 임상 일정이 차질 없이 진행될 수 있도록 하는 기능을 하고 있습니다. 이러한 유연성과 효율성은 임상시험의 성공 가능성을 높이는 동시에, 신약 개발 과정에서 발생할 수 있는 잠재적인 지연 요인을 효과적으로 관리하기에 용이한 것으로 당사는 판단하고 있습니다.
당사의 4개의 핵심 파이프라인 별 세부내용은 다음과 같습니다.
(1) GI-101
| 구분 | 바이오 신약 |
| 적응증 | 고형암 |
| 작용기전 |
ㆍGI-101은 CD80에 의해서 면역관문인 CTLA-4와 PD-L1의 작용을 억제해 체내 면역 작용을 재활성화 시킴 (*)TPP: GI-101 단독/방사선과 병용요법/VEGF 억제제와 병용요법/면역관문억제제와 병용요법 |
| 제품의 특성 |
ㆍGI-101은 GI-SMART™기술을 이용해 최초로 제작된 이중융합 단백질로 CTLA-4의 및 PD-L1의 저해와 IL-2 수용체의 자극을 통한 복합적인 면역활성 효과를 나타낼 수 있는 세계 최초의 first-in-class 신약 ㆍ높은 제품 안정성과 고생산성 및 고순도의 안정된 생산 공정(CDMO) 확보 및 역량 활용 ㆍ원숭이 및 랫트를 이용한 독성 실험에서 안전성 확인 |
| 진행경과 |
ㆍ한국 임상1/2상 IND(임상시험계획) 승인(2021년 04월) ㆍ미국 임상1/2상 IND(임상시험계획) 승인(2021년 06월) ㆍ미국 임상1/2상 IND(임상시험계획) 변경 승인(2023년 05월) |
| 향후계획 |
ㆍ기술이전 상대방 심시어(Simcere Pharmaceutical)에서 중국임상 진행 ㆍ글로벌 제약사와 라이선스 아웃 계약 추진 (중국 제외 전세계 판권) |
| 경쟁제품 | ㆍ앨커미스(Alkermes)의 Nemvaleukin alfa: 임상 3상 진행 중 ㆍ이노벤트(Innovent)의 IBI363: 임상 2상 진행 중 |
| 관련논문 등 |
ㆍGI101, A novel CD80-IgG4-IL2 variant bispecific protein, inhibits tumor growth and induces anti-tumor ㆍComprehensive preclinical study on GI-101, a novel CD80-IgG4-IL2 variant protein, as a therapeutic ㆍPreliminary results of GII-101-P101 (Keynote-B59): GI-101 (CD80-IgG4 Fc-IL2v) as a single agent and in combination with pembrolizumab in patients with advanced and/or metastatic solid tumors(SITC 2022) ㆍPopulation Pharmacokinetic-Pharmacodynamic Modeling to Inform Optimal Dosing Strategies for GI-101, a Novel Fusion Protein, Targeting IL2βγR and CTLA4 ㆍKeynote-B59: Dose escalation of a phase 1/2 first-in-human, open-label study of GI-101, a novel immunocytokine combining CD80-IL2v, in combination with pembrolizumab in advanced solid tumors (SITC 2023) |
| 시장규모 | 전세계 면역항암제 시장규모: US$450억(2021년) → US$1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
| 기타사항 | ㆍ2019년 11월 전임상 단계에서 심시어(Simcere Pharmaceutical) 중국지역 기술이전(심시어: 중국 정부 지정 중개의학 및 혁신 신약 개발의 중심 연구소, 홍콩시장 상장사) ㆍGI-101 물질 및 용도 특허 등록(한국, 미국 등) ㆍ키트루다 병용 임상을 위한 MSD사의 무상공급 지원 ㆍKDDF 임상 70억원 과제 선정 |
GI-101의 임상 진행 경과의 경우, 당사는 임상 1/2상 과정 중 미국과 한국에서 각각 2023년 05월 10일, 2023년 06월 28일에 진행성 또는 전이성 고형암 환자를 대상으로 한 GI-101의 단일 요법 및 펨브롤리주맙, 렌바티닙 또는 국소 방사선 병용 요법의 안전성, 내약성, 약동학 및 치료효과를 평가하기 위한 제1/2상 임상시험(Keynote-B59) 임상시험계획의 변경승인을 획득하였습니다. 이는 새로운 GI-101의 원료의약품 제조 공정을 도입함에 따라 새로운 공정으로 생산된 GI-101의 용량 증량 및 확장 코호트 추가, GI-101 원료의약품 및 완제의약품 기준 및 시험방법의 추가, 단위 변경에 따른 원료약품 및 그 분량을 변경하기 위함이었습니다. 당사는 임상 1/2상을 통해 (1) 용량 증량/최적화 단계에서 GI-101의 단일 요법 또는 펨브롤리주맙, 렌바티닙 또는 국소 방사선과 병용한 GI-101의 안전성 및 내약성을 평가하고 최대내약용량 및 권장 제2상 용량을 정의하며, (2) 용량 확장 단계에서는 GI-101의 단일 요법 및 펨브롤리주맙, 렌바티닙 또는 국소 방사선과 병용한 GI-101의 항종양 활성을 평가할 예정입니다.
(2) GI-102
| 구분 | 바이오 신약 |
| 적응증 | 고형암 |
| 작용기전 | 종양미세환경에서 조절 T 세포를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진함 |
| 제품의특성 | 종양미세환경에서 항암작용에 저해가 되는 조절 T 세포의 증식을 최소화하며 활성을 억제하고, 반면에 항암활성을 갖는 효과 T 세포와 자연살해(NK) 세포의증식 및 활성은 촉진함으로써 다양한 고형암의 효과적인 치료제로 사용 |
| 진행경과 | ㆍ한국 임상 1/2상 IND 승인(2023년 02월) ㆍ미국 임상 1/2상 IND 승인(2023년 01월) ㆍ한국 및 미국 임상 1/2상 진행 중 ㆍ한국 임상 1/2상 IND 변경 승인(2024년 10월) ㆍ미국 임상 1/2상 IND 변경 승인(2024년 11월) |
| 향후계획 | ㆍ글로벌 제약사와 라이센스 아웃 계약 추진 |
| 경쟁제품 | ㆍ앨커미스(Alkermes)의 Nemvaleukin alfa: 임상 3상 진행 중 ㆍ이노벤트(Innovent)의 IBI363: 임상 2상 진행 중 |
| 관련논문 등 | - |
| 시장규모 | 전세계 면역항암제 시장규모: US$450억(2021년) → US$1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
| 기타사항 | ㆍ미국 특허 등록 ㆍ정맥/피하주사제형으로 개발 ㆍ키트루다 병용 임상을 위한 MSD사의 무상공급 지원 |
GI-102의 임상 진행 경과의 경우, 당사는 임상 1/2상 과정 중 미국과 한국에서 각각 2024년 05월 25일, 2024년 10월 08일에 진행성 또는 전이성 고형암 시험대상자를 대상으로 한 CD80-IgG4 Fc-IL-2v 이중특이적 융합 단백질인 GI-102의 단일 요법 및 기존 항암 치료 또는 펨브롤리주맙 병용 요법의 안전성, 내약성, 약동학 및 치료효과를 평가하기 위한 1/2상 임상시험 임상시험계획의 변경승인을 획득하였습니다. 이는 GI-102의 임상시험단계를 1/2a상에서 1/2상으로 변경하고, GI-102의 단일 피하 주사 요법 또는 기승인 항암치료 또는 펨브롤리주맙과의 병용을 포함하는 방식으로 임상시험 디자인을 변경하며, GI-102의 품질평가에 따른 유효기간을 24개월에서 36개월로 연장 신청하기 위함이었습니다. 당사는 임상 1/2상을 통해 (1) 파트A 및 파트B 용량 증량 단계에서 GI-102의 최대내약용량 및 권장 제2상 용량을 정의하기 위한 GI-102 단독 정맥 주입 요법 또는 피하 주사 요법의 안전성 및 내약성을 평가하고, (2) 파트 A 용량 최적화 단계, 파트 B 용량 확장 단계, 파트 C 및 파트 D에 걸쳐 GI-102의 단독 정맥 주입 요법 또는 피하 주사 요법, 또는 GI-102의 정맥 주입 요법과 기존 항암 요법 또는 펨브롤리주맙과 병용 시 항종양 활성을 평가할 예정입니다.
또한, GI-102은 임상 1/2상 과정 중 미국에서 2024년 10월 20일 GI-102의 단독 요법 및 기존 항암 치료 또는 펨브롤리주맙 또는 트라스투주맙데룩스테칸 병용요법의 안전성, 내약성, 약동학 및 항종양 효과를 평가하기 위한 1/2상 임상시험계획 변경승인을 획득하였습니다. 이는 GI-102와 트라스투주맙데룩스테칸(엔허투주®; Antibody-drug conjugate; ADC; 항체-약물 접합체) 병용요법 코호트를 파트 C에 추가하기 위함이었습니다. 당사는 (1) 파트 A 및 파트 B 용량 증량 단계에서 GI-102의 최대내약용량 및 권장 2상 용량을 정의하기 위해 GI-102 단독 정맥 주입 요법 또는 단독 피하주사 요법의 안전성 및 내약성을 평가하고, (2) 파트 A 용량 최적화 단계, 파트 B 용량 확장 단계, 파트 C 및 파트 D에 걸쳐 GI-102의 단독 정맥 주입 요법 또는 단독 피하 주사 요법의 항종양 활성 평가 및 기존 항암 치료 또는 트라스투주맙데룩스테칸 또는 펨브롤리주맙과 병용한 GI-102 의 항종양 활성을 평가할 예정입니다. 해당 변경 건인 GI-102와 트라스투주맙데룩스테칸 병용요법은 미국(Mayo Clinic, Cleveland Clinic, Memorial Sloan Kettering Cancer Center를 포함한 총 5개 병원)에서만 진행할 예정입니다.
구체적으로, 파트 A는 GI-102를 정맥주사로 단독 투여하는 시험 단계로, 약물이 환자에게 작용하기 적합한 최적의 용량을 탐색하기 위한 용량 증량 단계와 용량 최적화 단계로 구성되어 있습니다. 용량 증량 단계에서 최대 내약 용량과 다음 단계에서 사용하기 적합한 권장 용량을 탐색한 후, 용량 최적화 단계에서는 이전 면역항암제 치료로 효과를 보지 못한 흑색종 환자들을 대상으로 약물의 안전성, 부작용, 체내에서의 약물 처리 방식(약동학), 약물의 효과(항종양 활성) 등을 평가하며 권장 용량을 최적화합니다. 파트 B는 GI-102를 피하주사(피부 아래에 주사)로 단독 투여하는 단계로 파트 A와 같이 용량 증량 단계와 용량 최적화 단계로 구성되며, 용량 증량 단계에서 적합한 권장 용량을 탐색한 후 이전 면역항암제 치료로 효과를 보지 못한 고형암 환자를 대상으로 권장 용량을 최적화합니다. 파트 C는 GI-102를 정맥주사로 투여하면서 항암화학요법 또는 트라스투주맙데룩스테칸(엔허투®)과 함께 사용하는 병용요법에 대한 임상시험으로, GI-102와 다른 약물 조합의 특정 암에 대한 효과와 부작용을 확인하는 단계입니다. 이 단계에서는 특정 암 종류(적응증)에 따라 4개의 그룹(코호트)으로 나뉘어 각기 다른 조합과 효과를 평가하며, 각 코호트는 특정 암 환자들을 대상으로 GI-102 병용요법의 안전성, 내약성, 항암 효과를 평가합니다. 먼저 안전성 준비기간을 통해 GI-102와 함께 사용하는 약물 조합이 안전한지 먼저 확인한 이후, 본격적으로 환자를 등록하고 치료하는 순으로 진행됩니다.
| [파트 C 코호트별 계획] |
| 코호트 C1 | - 1차 치료 경험이 없는 연부조직육종 대상자에 대해 GI-102 + Doxorubicin 병용요법의 항종양 활성과 안전성 및 내약성 평가 |
| 코호트 C2 | - 1차 이상 이전 치료를 받았던 백금 저항성 상피성 난소암, 난관암 또는 원발성 복막암 환자에서 GI-102와 주 1회 Paclitaxel, 주 2회 Bevacizumab 병용요법의 항종양 활성과 안전성 및 내약성 평가 - 코호트 C1의 안전성 준비기간을 통해 GI-102와 화학항암제의 병용에 대한 안전성을 확인한 후 식품의약품안전처의 변경 승인을 통해 한국에서 등록 시작 |
| 코호트 C3 | - 1차 이상 이전 치료를 받았던 HER2 음성 유방암 환자에서 GI-102와 Eribulin 병용 요법의 항종양 활성과 안전성 및 내약성 평가 - 코호트 C1의 안전성 준비기간을 통해 GI-102와 화학항암제의 병용에 대한 안전성을 확인한 이후 식품의약품안전처의 변경 승인을 통해 한국에서 등록 시작 |
| 코호트 C4 | - 1차 이상 이전 치료를 받았던 HER2 발현 절제 불가능 또는 전이성 고형암(IHC3+ 발현 방광암환자 10명과 IHC3+ 발현 전이성 직장암 환자 10명을 포함) 환자에서 GI-102와 T-DXd 병용요법의 항종양 활성과 안전성 및 내약성 평가 - 코호트 C4는 미국에서만 진행 |
파트 D는 GI-102와 펨브롤리주맙(키트루다®)을 함께 사용하는 병용요법을 평가하는 단계로, 기존 면약항암제 치료로 효과를 보지 못한 환자를 대상으로 새로운 병용 치료법의 가능성을 탐구하기 위해 암의 종류와 환자 특성에 따라 4개의 코호트로 나뉘어 각기 다른 조합과 효과를 평가합니다. 먼저 GI-102와 펨브롤리주맙 병용요법의 적합한 권장 용량을 확인한 후, 특정 암 환자 그룹에서의 치료 효과와 부작용을 확인하는 순으로 진행됩니다.
| [파트 D 코호트별 계획] |
| 코호트 D1 | - 모든 이용 가능한 표준치료에 실패한 고형암 환자에 대해 GI-102 + 펨브롤리주맙 병용요법의 권장 제2상 용량, 항종양 활성과 안전성 및 내약성 평가 |
| 코호트 D2 | - 1차 이상 이전 CPI 치료 불응성 흑색종 환자에서 GI-102 + 펨브롤리주맙 병용요법의 항종양 활성과 안전성 및 내약성 평가 |
| 코호트 D3 | - 1차 이상 이전 CPI 치료 불응성 간세포암 환자에서 GI-102 + 펨브롤리주맙 병용요법의 항종양 활성과 안전성 및 내약성 평가 |
| 코호트 D4 | - 1차 이상 이전 CPI 치료 불응성 신세포암 환자에서GI-102+ 펨브롤리주맙 병용요법의 항종양 활성과 안전성 및 내약성 평가 |
(3) GI-301
| 구분 | 바이오 신약 |
| 적응증 | 알레르기 질환(아토피 피부염, 알레르기 비염, 천식 등) |
| 작용기전 |
ㆍ알레르기 질환을 유발하는 핵심인자인 IgE에 높은 결합력으로 부착하여, 체내 IgE 수용체와의 결합을 방해함 ㆍGI-301은 IgE와의 결합에 있어 오말리주맙에 비해 약 70배 강력한 결합력을 보이며 결합 후 해리가 잘 일어나지 않아, 졸레어® 대비 더 적은 양으로 더 오랜 약물 효과 지속기간을 가질 수 있음 ㆍIgE와 CD23(FcεRII)의 결합을 졸레어®와 동등하게 효과적으로 차단한다는 것을 확인 ㆍ원숭이, 개, 마우스 등 여러 동물 군의 IgE에도 결합력 보유 ㆍ만성 특발성 두드러기 환자의 혈청에서 IgE를 효과적으로 감소시킴 |
| 제품의 특성 | ㆍGI-301은 인간 IgE에 높은 결합 친화력을 가지는 Fcε RI α사슬의 ECD를 이용해, 생체 내 내재성(endogenouse) Fcε RI와 IgE의 결합을 효과적으로 저해하여 IgE에 의해 매개되는 알레르기 질환을 효과적으로 타깃함 ㆍIgE에 대한 결합력이 졸레어® 보다 약 70배 이상 높고 결합이 지속적으로 유지되어 비만세포의 탈과립억제 능력이 탁월함 ㆍ원숭이 실험에서 기저 IgE 레벨이 1,000 IU/ml이상인 개체에서도 단회투여 후 약 7일 동안 IgE를 완전히 억제함 ㆍIgE의 Fcε RI 결합을 방해할 뿐만 아니라, Fcε RI에 대한 자가항체의 기능을 저해함으로써 만성 특발성 두드러기 환자에서 비만세포의 탈과립 방지 가능 ㆍ부작용 우려 낮음 |
| 진행경과 |
ㆍ한국 임상 1a상 단회투여 완료, 임상 1b상(다회투여) 환자 등록 종료, 임상 1b상(단회투여, 만성특발성 두드러기 및 아토피 피부염) 완료 (※ 임상시험 주체: (주)유한양행) |
| 향후계획 | 제3자 기술이전(sub-license) 추진: (주)유한양행이 GI-301의 글로벌 사업권을 제3자에 이전시 제3자 기술이전 조항에 따라, 수익금의 50%를 당사가 수령 |
| 경쟁제품 | ㆍ로슈(Roche)/노바티스(Novartis)의 졸레어®(오말리주맙): 2003년 FDA 승인 ㆍ사노피(Sanofi)의 듀피젠트®(두필루맙):2017년 FDA 승인 |
| 관련논문 등 |
ㆍThe Novel Long-Acting IgE Trap-Fc Fusion Protein GI301 Elicits Therapeutic Synergy In Combination with Probiotics ㆍGI-301: a novel long-acting IgE Trap-Fc fusion protein for IgE-mediated allergic diseases (UCARE CONFERENCE 2019) ㆍCombined IgE neutralization and Bifidobacterium longum supplementation reduces the allergic response ㆍSafety, Tolerability, Pharmacokinetics, and pharmacodynamics of YH35324, a novel Long-Acting High-Affinity IgETrap-Fc protein in subjects with Atopy: Results from the First-in-Human study (International Immunopharmacology 2024) ㆍResearch Therapeutic efficacy of YH35324 on FcεRIα-mediated mast cell/basophil activation (Allergy, Asthma and Immunology 2024) ㆍSafety, Tolerability, Pharmacokinetics, and Pharmacodynamics of YH35324, a Novel Long-Acting High-Affinity IgE Trap-Fc protein in Subjects with Atopy: Results from the First-in-Human Study (EAACI 2023) ㆍSafety, Tolerability, Pharmacokinetics, and Pharmacodynamics of YH35324, a Novel Long-Acting High-Affinity IgE Trap-Fc Fusion Protein, in Atopic Subjects with a Total IgE > 700 IU/mL (AAAAI 2024) |
| 시장규모 | 전세계 알레르기 치료제(천식, 만성 두드러기, 아토피 피부염, 땅콩 알레르기, 알레르기 비염) 시장규모: US$247억(2021년) → US$398억(2027년) ※ 출처: Asthma Global Drug Forecast and Market Analysis to 2029; Chronic urticaria_AnnualSalesandForecast; Atopic Dermatitis AD 68 Market Analysis and Sales Forecast; Peanut Allergy Opportunity Analysis and Forecast 2027; Allergic Rhinitis Immunotherapy Opportunity Analysis and Forecast 2028 (GlobalData) |
| 기타사항 | ㆍ2020년 07월 전임상단계에서 (주)유한양행 글로벌(일본 제외) 기술이전 ㆍ2023년 10월 임상 1상 단계에서 일본 마루호에 기술이전 (일본 지역) ㆍ물질 및 용도 특허 등록(한국, 일본 등) |
GI-301은 기술이전 이후 국가별로 파트너사 (주)유한양행, 마루호(Maruho) 사서 직접 임상을 진행하고 있습니다. (주)유한양행이 진행 중인 한국 임상시험의 경우 임상 1a상 단회투여 완료 및 임상 1b상(단회/다회 투여) 단계를 진행하고 있습니다. 일본 임상시험의 경우 마루호(Maruho)사에서 진행 중이며, 일본 내 임상 1상이 면제되어 임상 2상 IND 제출 준비 중인 상태입니다. 일본 내 임상 1상이 면제된 주요 배경은 PMDA(Pharmaceuticals and Medical Devices Agency)와의 미팅을 통해 일본 내 자국인 대상의 임상 1상을 면제 받았으며, 이는 1) 최근 일본 내 임상 1상 규제 완화 및 2) (주)유한양행에서 수행한 1상 임상시험의 결과 인종적 배경이 유사한 한국인 임상 시험이 다수의 환자에서 진행된 점, 해당 임상 과정에서 안전성과 내약성 측면에서 문제가 없었음에 기인하였습니다.
(4) GI-108
| 구분 | 바이오 신약 |
| 적응증 | 고형암 |
| 작용기전 | 대사면역에 관여하는 CD73를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진함 |
| 제품의특성 | 종양미세환경의 암세포와 면역세포에 발현하여 항암작용에 저해가 되는 대사면역 표적인 CD73를 제어하여 효과 T 세포 및 NK 세포의 활성을 회복하고, 항암활성을 갖는 효과 T 세포와 NK 세포의 증식 및활성은 촉진함으로써 다양한 고형암의효과적인 치료제로 사용 |
| 진행경과 | ㆍ한국 임상 1/2a상 IND 승인 (2024년 12월) |
| 향후계획 | ㆍ임상 1/2상 진행 ㆍ글로벌 제약사와 라이센스 아웃 계약 추진 |
| 경쟁제품 | ㆍ앨커미스(Alkermes)의 Nemvaleukin alfa: 임상 3상 진행 중 ㆍ아스트라제네카(AstraZeneca)의 올레클루맙(oleclumab): 임상 3상 진행중 |
| 관련논문 등 | ㆍA first-in-human, open-label, multicenter, phase 1/2a, dose escalation and expansion study of GI-108, a novel immunocytokine combining anti-CD73-IL2v, in patients with advanced or metastatic solid tumors (SITC 2024) |
| 시장규모 | 전세계 면역항암제 시장규모: $450억(2021년) → $1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
| 기타사항 | ㆍKDDF 전임상 20억원 과제 선정 ㆍ메디라마와 임상공동개발 (개발 비용 공동 부담 및 수익 분배) ㆍ한국 특허 출원 |
GI-108의 임상 진행 경과의 경우, 당사는 2024년 12월 11일 한국에서 진행성 또는 전이성 고형암 시험대상자를 대상으로 anti-CD73-IgG4 Fc-IL-2v 이중특이적 융합 단백질인 GI-108 단일 요법의 안전성, 내약성, 약동학 및 치료효과를 평가하기 위한 1/2a상 임상시험계획의 승인을 획득하였습니다. 당사는 1/2a상을 통해 GI-108 단일 요법의 안전성, 내약성, 약동학 및 항종양 효과를 평가할 예정입니다. 구체적으로, (1) 용량 증량 단계에서 GI-108 단독요법의 최대내약용량(MTD) 및/또는 권장 제2상 용량(RP2D)을 정의하고 안전성 및 내약성을 평가하고, (2) 용량 확장 단계에서는 GI-108 단독 요법의 항종양 활성을 평가할 예정입니다.
당사는 상기한 핵심 파이프라인 외 GI-SMART™ 플랫폼 기반 기술을 활용하여 다수의 후속 파이프라인을 지속 개발 중이며, 그 중 대표적인 후속 파이프라인은 GI-10N(면역항암제) 시리즈 중 면역항암제 GI-128과 GI-20N(대사질환 치료제) 시리즈 중 기존 비만 치료제와 차별화된 작용기전을 통해 미충족 의료 수요인 근육량 감속를 극복하고자 하는 차세대 비만치료제 GI-213이며 파이프라인 별 세부내용은 아래와 같습니다.
(1) GI-128
| 구분 | 바이오 신약 |
| 적응증 | 고형암 (암 미세환경 내 대식세포 고분포 암종) |
| 작용기전 | ㆍPD-L1 항체: PD-1/PD-L1 신호전달 저해를 통한 종양내 탈진화된 항암면역세포(CD8+ T 세포/NK 세포)의 활성 회복 및 종양세포 타겟팅을 통한 PD-L1 양성종양 세포와 대식세포의 접촉증가 ㆍXXX 항체: XXX 신호전달 저해로 인한 대식세포 항암 활성 증가 및 CD8+ T 세포 및 NK 세포 항암면역 활성 증대 |
| 제품의특성 | PD-L1 항체와 XXX 다중표적항체를 조합한 First-in-class Macrophage engager로, 적응면역(Adaptive immunity)과 내재면역(innate immunity)을 동시적으로 활성화시킴으로써 대식세포 고분포 고형암의 효과적인 치료제로 사용 |
| 진행경과 | 후보물질 도출 |
| 향후계획 | ㆍ2025년 3분기까지 최종후보물질 도출 ㆍ2027년 2분기까지 전임상시험 ㆍ2027년 3분기까지 임상 1/2상 IND 신청 |
| 경쟁제품 | ㆍBoehringer Ingelheim의 BI-770371 SIRPa 항체 : 임상 1상 진행 ㆍAstellas-Elpiscience의 ES-109 PD-L1/SIRP 이중융합항체 : 비임상 진행 |
| 관련논문 등 | - |
| 시장규모 | 전세계 면역항암제 시장규모: US$450억(2021년) → US$1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
| 기타사항 | ㆍ한국 특허 출원 |
| 주1) | 전략적 목적에 따라 영업기밀에 해당하는 세부내용은 기재하지 않았습니다. |
(2) GI-213
| 구분 | 바이오 신약 |
| 적응증 | 비만 |
| 작용기전 | ㆍXXX : 근육량 증가 및 지방분해 촉진 ㆍYYY : 에너지 소비량 증가 및 지방분해 촉진 |
| 제품의특성 | ㆍ기존 GLP-1 인크레틴 계열 약물의 한계인 근육량 감소 극복 ㆍ식욕억제 기전이 아닌 에너지소비량 증가와 지방분해 촉진을 통한 장기 복용에 따른 미미한 체중 감소효과 극복 및 복용 중단 후 체중 회복의 한계 극복 |
| 진행경과 | 유효-선도물질 도출 |
| 향후계획 | ㆍ2025년 4분기까지 최종후보물질 도출 ㆍ2027년 3분기까지 전임상시험 ㆍ2027년 4분기까지 임상 1/2상 IND 신청 |
| 경쟁제품 | ㆍ노보노디스크(Novo Nordisk)의 위고비(Wegovy) : 2021년 FDA 승인 ㆍ일라이 릴리(Eli Lilly)의 젭바운드(Zepbound) : 2023년 FDA 승인 |
| 관련논문 등 | - |
| 시장규모 | 전세계 비만치료제 시장규모: $240억(2023년) → $1,300억(2028년) ※ 출처: IQVIA (아이큐비아) |
| 기타사항 | ㆍ한국 특허 출원 |
| 주1) | 전략적 목적에 따라 영업기밀에 해당하는 세부내용은 기재하지 않았습니다. |
당사는 향후 연구개발 파이프라인별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 국가별 대형 제약사 등을 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류를 통해 기술 이전에 필요한 임상 개발 및 허가 자료들을 확충하여 추가적인 기술 이전 계약 체결에 대한 가능성을 높이고, 조속한 사업성을 확보하고자 합니다.
한편, 당사는 대사질환치료제 및 뇌질환치료제로써 GI-210을 개발하고 있었으나, 동일 시장내 경쟁력 있는 블록버스터 약물의 시장 확대에 따른 글로벌 경쟁력 감소와 당사의 임상 단계 파이프라인 (GI-101/GI-102, GI-301) 및 후속 파이프라인 (GI-128, GI-213)의 우선적 개발 전략에 따라 해당 파이프라인의 개발을 현재 중단하였습니다.
이처럼 당사의 신약개발 전략 및 사업화, 판매 전략에도 불구하고, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인 개발 우선순위가 변경되거나 파이프라인의 연구개발 진행이 지연 또는 추가적인 연구개발 중단이 발생할 수 있으며, 이로 인해 당사의 성장성에 큰 제약이 발생할 수 있습니다. 또한 예기치 못한 사유로 기술이전 계약체결에 실패하게 되거나, 기존에 체결한 기술이전계약에 따른 마일스톤을 달성하지 못할 경우, 연구개발에 투자한 자금을 회수할 수 없게 되어 당사의 사업계획과 수익성, 재무구조 등에 부정적인 영향을 미칠 수 있습니다.
|
다. 기술이전 지연 및 실패에 따른 위험 당사와 같은 다수의 신약 개발 기업들은 신약 개발사업이 태생적으로 부담하고 있는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간 등의 리스크를 감소 또는 분산시키기 위하여, 개발 초기단계에서 국내외 대형제약사에 기술이전함으로써 조기에 수익을 시현하는 전략을 추구하고 있습니다. 당사는 기존 기술이전 파이프라인의 계약 대상지역 외 추가적인 기술이전 추진을 비롯하여 차기 후보물질 파이프라인의 기술이전을 활성화하기 위해 국내외 제약회사를 대상으로 글로벌 학회, 전시회 및 비즈니스 파트너링 등 기술 교류의 장을 통해 지속적으로 연구개발사항을 업데이트하며 적극적인 교류활동을 진행하며, 다수의 해외 파트너사들과 CDA를 맺고 기술이전을 위한 활동을 유지해 나가고 있습니다. |
신약을 출시하기 위해서는 전임상(비임상), 임상 1상~3상 및 규제 당국의 허가 단계를 모두 통과해야 하기 때문에 오랜 시간이 소요됩니다. 또한, 전임상 개발비용 대비 임상 1상은 3배, 임상 2상은 8배, 임상 3상은 30배 비용이 소요되는 등 임상 단계별로 비용 리스크가 커집니다.
 |
|
개발단계별 신약개발비용 |
| 출처: | Paul, S.M. et al. (2010) How to improve R&D productivity: The pharmaceutical industry’s grand challenge. Nature Review Drug Discovery. 9(3), 203-214; Eli Lilly Study (2010) |
신약개발 과정은 비임상, 임상 1상 ~ 임상 3상이라는 오랜 시간과 많은 비용을 요구하는 과정을 거쳐야 하는 것은 물론 높은 임상 실패율로 인하여 리스크가 높습니다. 당사와 같은 다수의 바이오벤처 기업들은 신약 개발사업이 태생적으로 부담하고 있는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간 등의 리스크를 감소 또는 분산시키기 위하여, 개발 초기단계에서 국내외 대형제약사에 기술이전함으로써 조기에 수익을 시현하는 전략을 추구하고 있습니다.
또한 국내외 대형 제약사 역시 성공확률이 높은 약제에 선택과 집중을 통해 최상의 결과를 얻고자 사내 연구개발에만 의존하지 않고 외부에서 신약 개발의 기회를 찾는 오픈 이노베이션(open innovation) 전략을 적극적으로 추진하는 추세에 있습니다.
BIO Industry Analysis에 따르면, 제약ㆍ바이오 기업 간에 2022년 기준 총 207건의 기술 거래가 이루어졌으며, 이 중 전임상 단계에서의 기술이전은 139건으로 전체의 67%를 차지하고 있습니다. 총 계약규모 측면에서도 전체 1,684억 달러 중 전임상 단계에서의 계약이 1,212억 달러로 전체의 72%를 차지하며, 전임상 단계의 기술이전이 가장 활발하게 이루어지고 있다는 것을 확인할 수 있습니다. 다만, 계약금(upfront) 규모에서는 전체 123억 달러 중 전임상 단계에서의 계약은 51억 달러로 41%에 그치며, 개발 초기 단계에서 기술이전된 만큼 계약금 규모는 적게 책정된다는 것을 확인할 수 있습니다(출처: Emerging Therapeutic Company Investment and Deal Trends, BIO).
당사 역시 전임상/초기임상 단계 기술이전 사업화 전략을 추구하고 있습니다. 당사는 전임상 단계에서의 대규모 기술이전을 성공시키기 위하여 경쟁력 있는 목표제품특성 수립을 통해 얻은 실험 데이터들을 확보하여 기술 도입자(licensee)에게 신뢰성 있게 해석 및 제시하고 있습니다. 특히 기술 협상 단계에서 개발 기간을 단축시킬 수 있는 효율적이고 스마트한 임상 디자인 전략, 시판 이후의 독점판매기간을 최대로 확보하기 위한 특허 전략 등을 제시함으로써, 전임상 단계임에도 불구하고 높은 성공 가능성 함께 시장성 측면에서 매우 매력적인 신약 후보물질임을 어필하며 강력한 교섭력을 바탕으로 해당 후보물질에 대해 높은 가치를 인정받으며 성공적으로 기술이전을 수행하고 있습니다.
그 결과, 핵심 파이프라인인 GI-101(면역항암제)은 2019년 11월 전임상 단계에서 중국 심시어(Simcere Pharmaceutical Co., Ltd.)사에 총 계약금액 7억 9,000만 달러(중국지역 판권) 규모의 기술 수출 성과를 거두었으며, GI-301(알레르기 치료제) 역시 2020년 7월 전임상 단계에서 ㈜유한양행에 1조 4,090억원(일본 제외 글로벌 판권)의 규모의 기술이전을 성사시켰습니다. 또한 GI-301은 2023년 10월 일본 판권 또한 임상 1a상 단계에서 마루호(Maruho Co., Ltd.)사에 총 계약금액 2억 2,100만 달러 규모의 기술이전 성과를 거두었습니다. 특히 마루호(Maruho Co., Ltd.)사 대상 기술이전의 경우, 일본 내 임상 1상이 면제되어 (주)유한양행이 진행 중인 국내 임상 1상의 데이터를 기반으로 일본 내 임상 2상 IND 제출을 준비 중에 있습니다. 구체적으로, 마루호는 일본에서 의약품, 의료기기, 재생의료제품의 허가와 심사를 담당하는 기관인 PMDA(Pharmaceuticals and Medical Devices Agency)와의 미팅을 통해 일본 내 자국인 대상의 임상 1상을 면제 받았으며, 이는 1) 최근 일본 내 임상 1상 규제 완화 및 2) (주)유한양행에서 수행한 1상 임상시험의 결과 인종적 배경이 유사한 한국인 임상 시험이 다수의 환자에서 진행되었던 점, 또한 그 임상 과정에서 안전성과 내약성 측면에서 문제가 없었음에 기인하였습니다.
| [당사 주요 기술이전(L/O) 실적] |
| 품목 | 계약 상대방 | 대상 지역 | 계약내용 | 계약 체결일 | 계약 종료일 |
총 계약 금액 (경상기술료 별도) |
수취 금액 | 진행 단계 |
| GI-101 | Simcere Pharmaceutical Co., Ltd. |
중국, 홍콩, 마카오, 대만 |
독점적 개발 및 상업화 권리 |
2019.11.28 | 특허 만료일 |
총 7억 9,000만USD (계약금 및 개발, 상업화 마일스톤 포함) |
양사 합의하에 비공개 |
Pre-IND (중국) |
| GI-301 | ㈜유한양행 |
전세계 (일본 제외) |
전용실시권 | 2020.07.01 | 특허 만료일 |
총 1조 4,090억원 (계약금 200억원 및 개발, 상업화 마일스톤 포함) |
200억원 | 임상1상 (대한민국) |
| GI-301 | Maruho Co., Ltd. |
일본 | 전용실시권 | 2023.10.16 | 로열티 만료일 (특허만료일 또는 첫 판매 후 12년 중 나중에 도래하는 시점) |
총 2억 2,100만USD (계약금 및 개발, 상업화 마일스톤 포함) |
양사 합의하에 비공개 |
임상 1상 waived(면제) (일본) |
| 출처: | 당사 제공 |
당사는 GI-101의 중화권 외 대상지역에 대한 기술이전과 같은 기존 기술이전 파이프라인의 계약 대상지역 외 추가적인 기술이전 추진을 비롯하여, 차기 후보물질 파이프라인의 기술이전을 활성화하기 위해 국내외 제약회사를 대상으로 글로벌 학회, 전시회 및 비즈니스 파트너링 등 기술 교류의 장을 통해 지속적으로 연구개발사항을 업데이트하며 적극적인 교류활동을 진행하고 있습니다. 당사는 성공적인 기술이전을 위해 현재 시장규모(잠재력 및 환자 수), 경쟁약물의 개발 단계, 파트너사와의 전략적 적합성 등을 내부적으로 업데이트하여 파트너사들의 미충족 요구를 채워 줄 수 있는 관점에서 지속적이고 긴밀한 접촉을 진행해 관심을 유지합니다. 현재 당사는 다수의 해외 파트너사들과 CDA(Confidential Disclosure Agreement, 비밀유지계약)를 맺고 기술이전을 위한 활동을 유지해 나가고 있습니다.
GI-101 및 GI-102 중화권 외 대상지역에 대한 기술이전 관련하여, 당사는 라이선스 아웃과 자체 개발 동시 진행을 목표로 GI-101/GI-102 개발을 진행하고 있습니다. 현재 글로벌 제약사와 라이선스 아웃 논의를 활발히 진행되고 있으며, 2025년 1월 참가한 JP모건 헬스케어 콘퍼런스 행사기간 중 다수의 글로벌 제약사와 주력 파이프라인 GI-101A 와 GI-102의 T세포 기반 치료제와 병용을 통한 혈액암 기술이전, 피하주사(SC) 제형 임상 결과확보에 따른 고형암 기술이전 논의를 진행하였습니다. 또한, 당사는 금번 JP모건 헬스케어 콘퍼런스를 통해 글로벌 제약사와 췌장암에 대한 GI-102의 ADC병용요법의 공동개발을 위한 MOU를 체결하였습니다. 다만, 본 협약체결로 기술이전의 가능성을 제고하는 효과는 있지만, 반드시 기술이전으로 이어질 수 있음을 전제로 하지는 않습니다. 자체 개발로는 전이성 흑색종에서 자체 개발을 목표로 하고 있습니다. 아래 그림에 제시된 바와 같이 GI-102는 단독요법만으로 전이성 흑색종에서 현재 가용 가능한 모든 표준치료 요법에 비해 압도적 항암 활성을 나타내었습니다.
 |
|
GI-102 전이성 흑색종 대상 단독요법 결과 |
| 출처: | 당사 제공 |
현재 면역항암제에 불응하는 전이성 흑색종의 표준치료는 국가별로 상이하지만, 미국에서는 옵두알라그(니볼루맙+렐라틀리맙), 국내에서는 화학항암제(다카르바진)이 사용되고 있습니다. 현재 다카르바진과 옵두알라그의 치료 효과는 아래와 같으며, 옵두알라그의 경우 두 가지 약제를 병용함에도 불구하고 ORR(Objective Response Rate, 객관적 반응률)이 9-12%, 다카르바진의 경우 10-11%에 불과한 반면 GI-102는 단독요법임에도 불구하고 25%의 ORR을 보이고 있습니다. 또한 GI-102는 질병 진행 및 환자의 생존과 깊은 연관성을 가지는 DCR(Disease Control Rate, 질병조절율) 및 무진행 생존 기간 측면에서도 옵두알라그나 다카르바진에 비해 현저히 높은 반응률을 보이고 있습니다.
 |
|
기존 치료제와 GI-102의 항암 활성 비교 |
| 출처: | 당사 제공 |
2023년 미국 FDA는 면역항암제 불응성 흑색종에 대해 Lifileucel(tumor-infiltrating lymphocyte)이라는 세포치료제를 가속승인 하였으며 해당 치료제는 현재 표준치료제에 비해 더 높은 ORR 및 무진행 생존기간을 보인 바 있습니다. 다만, Lifileucel은 환자가 종양생검을 한 후 한달 이상 대기하며 환자의 종양을 살상할 수 있는 T세포를 외부에서 주입하는 방식으로, 환자가 치료 전후 각각 림프구제거술(lymphodepletion)을 수행하고 프로류킨(IL-2)을 투약받는 과정에서 3등급 및 4등급(생명 위협) 혈액학적 이상반응이 100% 환자에서 발생한 바 있는 위험한 약제로 평가되고 있습니다. 이에 따라 Lifileucel은 가속승인을 받긴 하였으나 실제로 임상에서는 거의 사용되지 못하고 있는 상황입니다.
위와 같이 면역항암제 불응성 흑색종에서 표준 치료가 보이는 질병조절률은 40%(옵두알라그)에 불과하기에 당사는 GI-102의 DCR 83.3%는 임상적으로 큰 의미를 가진다고 판단하고 있습니다. 해당 질병 조절율은 단독요법 데이터의 수치로서 당사는 GI-102를 키트루다와 같은 PD-1 항체와 병용할 경우 조절율이 더욱 증가할 것으로 판단하고 있습니다. 면역항암제는 약물의 내재적인 특상 ORR이 높은 약제에 속하기보다는 무진행 생존기간, 전체 생존기간을 증가시키는 약제로 간주되기에 ORR 자체는 높지 않은 경우가 일반적입니다. 일례로, 현재 전세계적으로 50조 이상의 수익을 기록 중인 키트루다의 경우 1상 임상시험에서 ORR은 17.7%에 불과하였으나, 현재는 시판되며 수많은 적응증에서 암환자들의 전체 생존기간을 증가시키고 있습니다.
한편, 안정 병변(Stable Disease, SD)은 종양의 크기가 이전과 비교했을 때 -30% 이상 감소하지 않고 +20% 이하로 증가한 상태를 의미하며, 항암치료에서중요한 치료 반응으로 간주됩니다. 이때 SD로 유지되는 기간인 질병이 진행하기까지 걸리는 시간(무진행 생존기간)이 임상적으로 매우 중요합니다. 이는 무진행 생존기간의 연장이 전체 생존기간의 연장과 밀접하게 연관되며 전체 생존기간의 대리 지표로 사용되기 때문입니다. 즉, SD로 유지되는 기간이 매우 중요하며, 현재 GI-102의 경우 ORR을 보인 환자를 포함한 무진행 생존기간은 4.1개월로 이는 국내 표준치료요법 다카르바진 2.6개월, 미국의 표준치료제 옵두알라그 3.2개월에 비해 현저히 증가한 수치입니다. 결론적으로, GI-102는 ORR, DCR, 무진행 생존 기간 등 다방면에서 현재 가용 가능한 표준치료 요법에 비해 단독요법으로서 우위를 가진다고 당사는 판단하고 있으며 이러한 항암 활성은 병용요법 개발시 더욱 증가할 것으로 사료됩니다.
이와 같은 고무적 단독요법 항암 활성에 힘입어 GI-102 + 키트루다 병용요법을 전이성 흑색종에서 직접 상용화 하고자 하는 전이성 흑색종 자체 개발과는 별도로, 흑색종 이외의 적응증에 대해서는 현 시점에서 1/2상 결과를 바탕으로 라이선스 아웃이 안될 경우 지속적으로 라이선스 아웃을 시도할 계획입니다. GI-101/GI-102는 기전 상 범용적으로 사용될 수 있는 약제로, 이 약제를 기본 플랫폼으로 하여 적응증별 또는 병용약제별 deal을 하는 계획도 가지고 있습니다.
구체적인 전이성 흑색종 자체 개발 계획은 아래와 같으며, 임상 1/2상, 임상 2/3상 결과를 바탕으로 한국/미국의 조건부 허가 신청 또는 가속승인을 목표로 하고 있습니다.
 |
|
GI-102 전이성 흑색종 대상 자체 개발 계획 |
그러나, 기술이전은 파트너사의 전략 및 성향, 제3자와의 계약관계 또는 기술이전 시점의 시장 상황, 당사의 임상 성과 등에 의해 그 성패가 좌우될 수 있습니다. 따라서 당사의 계획과 달리 당사가 보유한 파이프라인의 향후 기술개발이 지연되거나 중단되어 추가 기술이전이 발생하지 않거나, 기술개발이 성공해도 잠재 기술이전 파트너사와의 협의가 원활하지 않아 기술이전 계약이 지연되거나 실패할 수 있습니다. 나아가, 기술이전 이후에도 기술이전 파트너사의 임상개발이 지연 혹은 실패하거나, 규제기관의 품목허가 혹은 판매승인이 실패할 경우에는 당사의 수익성이 악화되거나 사업에 부정적 영향이 생길 수 있습니다. 당사의 경우에도 2023년 영업수익이 상장 당시 추정치 10,896 백만원 대비 5,319백만원으로 하회하였습니다. 예측치와 실적치의 괴리율은 제품 상용화까지 막대한 R&D 비용이 투입되는 제약바이오 및 헬스케어 산업의 기업가치에 부정적인 영향을 주는 금리인상의 영향과 더불어, 2022년부터 시작된 글로벌 통화긴축이 지속됨에 따라 추정에 사용된 할인율 및 글로벌 기술이전 사례 규모의 변동, 지정학적 갈등의 심화 등 외부요인에 영향을 받아 발생하였습니다. 또한, 당사의 2024년 3분기 영업수익이 상장 당시 추정치 111,482백만원 대비 24백만원으로 하회하였습니다. 해당 예측치와 실적치의 괴리율은 2024년 2월 시작되어 현재까지도 진행 중인 전공의 파업 사태로 인해 임상진행과 관련한 직접적 타격에 기인하였습니다. 구체적으로, 전공의 부족으로 인해 임상참여 의료진이 전공의 진료 대체 등으로 인해 임상연구 참여도 감소, 상급종합 병원의 환자가 감소함으로써 환자 모집 어려움 등 외부적 상황의 발생으로 인해 전반적 임상 속도가 현저히 감소하여 임상 결과 업데이트가 지연되었습니다. 이외 같이 당사가 기술이전을 한 이후 사전에 예상하지 못하는 외부적 요인에 의한 마일스톤의 수령과 이로 인한 영업수익의 실현이 지연될 수 있는 점을 투자자께서 유의하시기 바랍니다.
|
라. 기술이전 파트너사 관련 위험 그러나 이 같은 기술이전 파트너사의 연구개발 역량에도 불구하고, 당사가 통제할 수 없는 기술이전 파트너사의 임상진행 능력, 네트워크, 자금력 등 내부적인 이벤트 등의 변수로 임상 진행 지연 또는 중단해야 하는 가능성도 존재하며, 이에 따라 해당 계약이 중도에 해지되거나 계약 금액이 하향 조정될 가능성도 있습니다. 이러한 경우 기 수령한 계약금을 제외한 나머지 마일스톤 및 로열티 등을 추가로 수령할 수 없을 가능성이 존재하며, 기존 예상하는 수익을 실현하지 못하여 당사의 수익성 및 재무적 안정성에 부정적인 영향을 미칠 수 있습니다. 또한 기술이전 파트너사의 수익성 및 재무적인 안정성의 불확실성도 존재한다는 점을 투자자께서는 유의하여 투자하시기 바랍니다. |
신약 라이선스 계약은 대부분 마일스톤 방식으로 이뤄지며, 주로 계약 체결 후 받는 확정된 계약금(Upfront Payment)과 향후 약물의 개발단계(전임상, 1상, 2상, 3상) 또는 규제기관 허가 등 개발 단계별 성취도에 따라 받는 개발 마일스톤(Development Milestone) 등으로 구성됩니다. 제품 상용화 이후에는 마일스톤과 별개로 판매액의 일정비율에 해당하는 로열티를 받게 됩니다. 마일스톤의 개발 마일스톤 세부내역 및 판매 로열티율은 치열한 시장 경쟁 상황 등을 고려해 계약 당사자들간 협의에 따라 공개하지 않는 것이 일반적입니다.
| [기술이전에 따른 계약 수익구조] |
| 구분 | 내용 | |
|---|---|---|
| 총 계약금액 |
계약금 (Upfront Payment) |
계약 체결 직후 또는 일정기간 내에 받게 되는 금액 |
|
개발 마일스톤 (Development Milestone) |
전임상, 임상(1상, 2상, 3상 진입 단계별), 허가신청, 허가완료, 시판 등 개발 단계별로 성공시 받게 되는 금액 |
|
| 상업화 마일스톤 (Sales Milestone) |
목표하는 매출에 도달하였을 경우 받게 되는 금액 | |
| 로열티(Royalty) |
기술 이전으로 제품의 매출에 따라 받게 되는 금액 (통상 매출액 대비 비율로 책정) |
|
| 출처: 금융감독원 보도자료 ("제약바이오 기업의 공시실태 및 투자자 보호 방안") |
당사는 증권신고서 제출일 현재까지 3건의 대규모 기술 이전을 완료하였습니다(관계사 기술이전 제외). 이에 따라 이후 임상단계 진전 및 허가에 따른 단계별 마일스톤, 특정 금액 이상의 매출 발생시 판매 마일스톤, 신약 발매 후 매출액의 일정 비율에 대한 로열티 등을 수취하게 됩니다.
| [당사 주요 기술이전(L/O) 실적] |
| 품목 | 계약 상대방 | 대상 지역 | 계약내용 | 계약 체결일 | 계약 종료일 |
총 계약 금액 (경상기술료 별도) |
수취 금액 | 진행 단계 |
| GI-101 | Simcere Pharmaceutical Co., Ltd. |
중국, 홍콩, 마카오, 대만 |
독점적 개발 및 상업화 권리 |
2019.11.28 | 특허 만료일 |
총 7억 9,000만USD (계약금 및 개발, 상업화 마일스톤 포함) |
양사 합의하에 비공개 |
Pre-IND (중국) |
| GI-301 | ㈜유한양행 |
전세계 (일본 제외) |
전용실시권 | 2020.07.01 | 특허 만료일 |
총 1조 4,090억원 (계약금 200억원 및 개발, 상업화 마일스톤 포함) |
200억원 | 임상1상 (대한민국) |
| GI-301 | Maruho Co., Ltd. |
일본 | 전용실시권 | 2023.10.16 | 로열티 만료일 (특허만료일 또는 첫 판매 후 12년 중 나중에 도래하는 시점) |
총 2억 2,100만USD (계약금 및 개발, 상업화 마일스톤 포함) |
양사 합의하에 비공개 |
임상 1상 waived(면제) (일본) |
| 출처: | 당사 제공 |
당사의 면역항암제 파이프라인 GI-101의 중국지역 개발 및 상업화 전용실시권을 총 계약규모 7억 9,000만 달러에 도입한 심시어(Simcere)사는 1995년 설립되어 현재 중국 난징에 본사를 둔 연구개발(R&D) 중심의 제약기업으로, '중국 10대 혁신 제약 기업' 및 '중국 100대 제약 제조 기업'으로 인정받고 있습니다(출처: Healthcare Executive Magazine, 2022.09). 난징과 상하이 소재 혁신신약 연구센터는 중국 정부로부터 '중개의학 및 혁신신약 개발의 중심 연구소'로 지정받았으며, 또한 중국 의약품시장 내 리딩품목을 다수 보유하면서 신약 개발과 마케팅, 영업 역량이 모두 뛰어나다고 평가받고 있습니다. 중국 제약바이오기업 중 2007년 미국 뉴욕증권거래소(NYSE)에 상장된 첫 회사이며, 2020년 홍콩 증권거래소(HKEX)에 재상장되었습니다(출처: 심시어사 홈페이지).
특히, 심시어사는 Amgen, BMS, Daiichi Sankyo 등 글로벌 제약사들과 전략적 파트너십을 구축하고 활발한 오픈이노베이션을 진행 중이라는 점에서 글로벌 진출역량도 풍부하다고 알려져 있으며, 최근 종양, 신경질환, 염증 및 면역질환을 R&D 중점분야로 선정하고 투자강도를 높이고 있습니다. 매출액에서 신약 연구에 사용되는 R&D 투자금 비율을 두 자리까지 올려 2023년 기준 매출액 대비 R&D 투자금이 23.7% 수준이며, 2018년에는 세포 및 유전자 치료제 등 혁신신약 개발에 대한 집중도를 높이려는 취지에서 미국 보스톤에 심시어 보스턴 R&D 센터를 설립했습니다(출처: 심시어사 홈페이지).
당사와의 기술 라이센스 계약은 이러한 심시어사의 항암면역치료 개발에 대한 중요성 인식과 함께 혁신신약 연구개발에 대한 요구 및 오픈 이노베이션 전략과도 부합하는 것으로 판단됩니다. 당사는 GI-101을 전임상 개발단계에서 심시어사에 기술이전 하였으며, 이후 개발 단계를 끌어올려 현재 국내 및 미국에서 임상 1/2상을 진행중이며, 이를 바탕으로 심시어사는 중국 임상 진입을 위한 Pre-IND 진행단계에 있습니다.
한편, 당사의 알레르기치료제 파이프라인 GI-301의 공동연구 및 글로벌(일본 제외) 개발 및 상업화 전용실시권을 총계약규모 1조 4,090억원에 도입한 ㈜유한양행은 1926년에 설립되어 100년 기업에 도전하는 국내 전통 제약 및 화학 업체로, 1962년 11월에 KRX 유가증권시장에 상장하였습니다. 한국능률협회가 선정하는 '2022년 한국에서 가장 존경받는 기업'에서 19년 연속 제약 산업 부문 1위, All Star 30 대 기업 중 4위를 차지하였습니다. 또한 글로벌 수준의 CDMO(위탁개발생산) 역량을 인정받아, PHARMA TECH OUTLOOK에서 발표한 '2021 아시아태평양 지역 10대 CMO(APAC Top 10 CMOs)' 중 하나로 선정되었습니다(출처: 유한양행사 홈페이지).
특히 유한양행은 최근 제약ㆍ바이오 업계에서 가장 활발한 오픈 이노베이션 전략을 펼치고 있는 업체로, 지난 2015년부터 오픈 이노베이션을 핵심 미래 성장 전략 가운데 하나로 삼고 적극 추진한 결과, 2021년 기준 2015년 대비 21개 늘어난 30개의 혁신신약 후보물질을 보유하고 있으며, 이 중 절반 이상이 오픈 이노베이션의 결과물입니다. 유한양행은 글로벌 다국적사들과의 긴밀한 협력을 통하여 다양한 파이프라인을 확보하고 짧은 기간에 신약개발역량을 빠르게 끌어올림으로써, 2018년 7월 이래 최근 3년 간 총 5건, 총 4조원 규모의 기술 수출 성과를 이뤄냈습니다(출처: 유한양행사 홈페이지). 당사는 GI-301을 전임상 개발단계에서 유한양행에 기술이전 하였으며, 이후 양사간 공동연구를 통해 개발단계를 끌어올려 현재는 국내 임상 1상을 진행중입니다.
또한, GI-301의 일본지역 내 개발 및 상업화 전용실시권을 총 계약규모 2억 2,100만 달러에 도입한 마루호(Maruho)사는 1915년에 설립되어 108년의 역사를 보유하고 있는 일본 전통 피부과 분야 선도 업체입니다. 마루호사가 보유한 의약품 중 피부과 질환 약물의 비중은 약 96% 수준이며, 2023년 기준 일본 피부과 처방의약품 시장의 시장점유율 38%를 보유 중입니다. 이에 더해 마루호사는 일본 피부과 의사들이 선정한 신뢰도 1위 기업으로도 8년 연속 선정되고 있습니다. (출처: IQVIA, INTAGE Healthcare Inc.)
 |
|
일본 피부과 의약품 내 마루호 점유율 및 피부과 의사 신뢰도 조사 |
| 출처: | IQVIA(2023), INTAGE Healthcare Inc.(2022) |
그러나 이 같은 기술이전 이후 개발 단계 진전 및 기술이전 파트너사의 연구개발 역량에도 불구하고, 당사가 통제할 수 없는 기술이전 파트너사의 임상진행 능력, 네트워크, 자금력 등 내부적인 이벤트 등의 변수로 임상 진행 지연 또는 중단해야 하는 가능성도 존재하며, 기술이전 파트너사의 계열사, 협력업체 및 기타 제3자에게 기술 양도 또는 전용실시권 재실시되어 기술이전 파트너 대상 및 임상개발 주체 등이 변경될 가능성도 존재합니다. 이에 따라 해당 계약이 중도에 해지되거나 변경 또는 계약 금액이 하향 조정될 가능성도 있습니다. 이러한 경우 기 수령한 계약금을 제외한 나머지 마일스톤 및 로열티 등을 추가로 수령할 수 없을 가능성이 존재하며, 기존 예상하는 수익을 실현하지 못하여 당사의 수익성 및 재무적 안정성에 부정적인 영향을 미칠 수 있습니다. 또한 기술이전 파트너사의 수익성 및 재무적인 안정성의 불확실성도 존재한다는 점을 투자자께서는 유의하여 투자하시기 바랍니다.
참고로, 심시어(Simcere Pharmaceutical Co., Ltd.)의 회사 개요 및 재무정보를 바탕으로 산출한 재무안정성 지표는 다음과 같습니다.
| [심시어 회사개요] |
| 구분 | Simcere Pharmaceutical Co., Ltd. |
| 상장일 | 2020 (HKEX) |
| 설립연도 | 1995 |
| 직원수 | 7,832명 |
| 시가총액 주1) | 3조 119억원 |
| 주요제품 | - 고형암, 난소암, 아토피 피부염, 천식, 불면증, COVID-19 등을 아우르는 파이프라인을 보유하고 있으며 총 69개의 후보물질을 연구개발 진행 중 |
| 최근 기술이전 |
- 2023년 11월 Connect Biopharma로부터 천식 치료제 Rademikibart를 License-In (계약금 US$21M, 총규모 US$120M) - 2022년 10월 Almirall에게 아토피 피부염 치료제 SIM0278를 License-Out |
| 주1) | 2024년 11월 27일 종가 기준 (환율: 178.44원/HKD) |
| [심시어 주요 재무안정성 지표] |
| (단위: 천 RMB) |
| 구 분 | 2024년 상반기 (FY 2024 1H) |
2023년 (FY 2023) |
2022년 (FY 2022) |
2021년 (FY 2021) |
|---|---|---|---|---|
| 매출액 | 3,133.5 | 6,607.8 | 6,324.1 | 4,999.7 |
| 영업이익 | 582.7 | 710.8 | 606.3 | 233.3 |
| (지배주주)당기순이익 | 456.6 | 714.8 | 930.9 | 1,507.1 |
| 자산총계 | 11,713.2 | 10,853.7 | 10,789.0 | 10,161.1 |
| 부채총계 | 4,804.4 | 3,630.9 | 3,641.2 | 3,698.4 |
| 자본금 | 3,173.8 | 3,173.8 | 3,081.1 | 3,002.9 |
| 자기자본 | 6,908.7 | 7,222.7 | 7,147.8 | 6,462.8 |
| 부채비율(%) | 69.5% | 50.3% | 50.9% | 57.2% |
| 자본 잠식률(%) | -117.7% | -127.6% | -132.0% | -115.2% |
| 영업활동으로 인한 현금흐름 | 862.7 | 151.1 | 1,354.1 | -202.0 |
| 주1) |
재무안정성 지표에 사용한 재무비율 산출식은 하기와 같습니다.
|
||||||
| 주2 | 심시어의 경우 반기 및 연간 재무제표만 발표하며, 분기 재무제표는 공개되지 않았습니다. |
(주)유한양행의 회사 개요 및 재무정보를 바탕으로 산출한 재무안정성 지표는 다음과 같습니다.
| [유한양행 회사개요] |
| 구분 | (주)유한양행 |
| 상장일 | 1962 (KOSPI) |
| 설립연도 | 1926 |
| 직원수 | 2,109명 |
| 시가총액 | 9조 5,208억원 |
| 주요제품 | - 동사가 유한양행에게 L/O한 알레르기 치료제 YH35324(당사명 GI-301) 외 EGFR 돌연변이 비소세포폐암, 퇴행성 디스크, 위마비증, MASH(대사이상관련 지방간염), 고형암 등을 대상으로 한 11개의 핵심 파이프라인 개발 진행 중 |
| 주요 기술이전 |
- 2024년 7월 (주)유빅스테라퓨틱스로부터 전립선 치료제 UBX-103를 License-In - 2022년 10월 Boehringer Ingelheim에게 MASH 치료제 BI 3006337를 License-Out |
| [유한양행 주요 재무안정성 지표] |
| (단위: 십억원) |
| 구 분 | 2024년 3분기 (FY 2024 3Q) |
2023년 (FY 2023) |
2022년 (FY 2022) |
2021년 (FY 2021) |
|---|---|---|---|---|
| 매출액 | 1,571.7 | 1,859.0 | 1,775.8 | 1,687.8 |
| 영업이익 | 66.7 | 56.8 | 36.0 | 48.6 |
| (지배주주)당기순이익 | 78.3 | 134.0 | 90.6 | 99.1 |
| 자산총계 | 2,925.7 | 2,814.1 | 2,472.7 | 2,463.8 |
| 부채총계 | 751.2 | 712.3 | 464.9 | 527.9 |
| 자본금 | 81.4 | 77.8 | 74.4 | 71.2 |
| 자기자본 | 2,174.6 | 2,101.7 | 2,007.8 | 1,935.9 |
| 부채비율(%) | 34.5% | 33.9% | 23.2% | 27.3% |
| 자본 잠식률(%) | -2,571.8% | -2,600.8% | -2,598.2% | -2,620.7% |
| 영업활동으로 인한 현금흐름 | 1.1 | 144.1 | 99.5 | 99.0 |
| 주1) |
재무안정성 지표에 사용한 재무비율 산출식은 하기와 같습니다.
|
마루호(Maruho Co., Ltd.)의 회사 개요 및 재무정보를 바탕으로 산출한 재무안정성 지표는 다음과 같습니다.
| [마루호 회사개요] |
| 구분 | Maruho Co., Ltd. |
| 상장일 | 비상장 |
| 설립연도 | 1915 |
| 직원수 | 1,566명 |
| 시가총액 | - |
| 주요제품 | - 동사가 마루호에게 L/O한 알레르기 치료제 GI-301 외 아토피 피부염, 결절성 양진, 여드름, 액취증 등을 대상으로 한 7개의 핵심 파이프라인 개발 진행 중 |
| 최근 기술이전 |
- 2024년 1월 AOBiome Therapeutics로부터 아토피 피부염 치료제 B244를 License-In |
| [마루호 주요 재무안정성 지표] |
| (단위: 백만 Yen) |
| 구 분 | 2023년 9월 (FY 2023) |
2022년 9월 (FY 2022) |
2021년 9월 (FY 2021) |
2020년 9월 (FY 2020) |
|---|---|---|---|---|
| 매출액 | 96,184 | 95,390 | 96,754 | 88,954 |
| 영업이익 | 6,227 | 16,431 | 21,942 | 12,333 |
| (지배주주)당기순이익 | 3,866 | 7,972 | 14,902 | 6,318 |
| 자산총계 | 181,451 | 177,219 | 164,257 | 151,394 |
| 부채총계 | 24,731 | 24,724 | 21,400 | 23,569 |
| 자본금 | 382 | 382 | 382 | 382 |
| 자기자본 | 156,720 | 152,495 | 142,857 | 127,825 |
| 부채비율(%) | 15.8% | 16.2% | 15.0% | 18.4% |
| 자본 잠식률(%) | -40,926.2% | -39,820.2% | -37,297.1% | -33,362.0% |
| 영업활동으로 인한 현금흐름 | -1,732 | 16,651 | 18,063 | 20,042 |
| 주1) |
재무안정성 지표에 사용한 재무비율 산출식은 하기와 같습니다.
|
||||||
| 주2 | 마루호의 경우 연간 재무제표만 발표하며, 결산월은 9월입니다. |
|
마. 목표시장 침체 위험 최근 암 치료는 기존 화학 및 표적항암제에서 면역항암제로 이른바 '패러다임 전환(paradigm shift)'이 이루어지고 있으며, 이에 따라 글로벌 면역항암제 시장은 2021년 450억 달러의 규모에서 2027년까지 연평균 21.2%의 고성장을 나타낼 것으로 전망됩니다. 한편, 산업화, 서구화 등 생활 환경의 변화로 인한 알레르기 질환 발병률 증가와 함께 알레르기에 관한 관심 및 인식의 확대, 지속적인 치료제 개발 및 출시 등은 알레르기 시장 성장을 빠르게 성장시키고 있습니다. 글로벌 주요 7개국의 천식 치료제 시장규모는 2019년 98억 달러에서, 2029년 112억 달러에 이를 것으로 전망되며, 글로벌 주요 7개국 아토피 피부염 치료제 시장 규모는 2020년 약 64억 달러에서 연평균 10.6% 성장하여 2030년에는 175억 달러에 이를 것으로 전망되고, 주요 8개국 땅콩 알레르기 치료제 시장은 2017년 2,600만 달러 규모에서 연평균 111%의 폭발적인 성장을 보이며 2027년 45억 달러 시장을 형성할 것으로 예측됩니다. 한편, 모든 암종에서 암이 증식 및 전이를 일으키는 과정에서 특이적인 대사과정을 거치기 때문에, 많은 연구진들이 대사면역항암제가 3세대에 해당하는 면역항암제의 뒤를 잇는 4세대 차세대 항암제로 부각될 것으로 기대하고 있습니다. 2020년에 보고된 GlobalData와 2022년 보고된 EvaluatePharma의 자료에 따르면, CD73 저해제를 포함한 대사면역항암제 글로벌 시장의 2021년부터 2028년까지 연평균성장률 181%의 폭발적인 성장으로 보일 것으로 예측되고 있습니다. 상기에서 살펴본 바와 같이, 당사의 주요 파이프라인이 속한 면역항암제 시장, 알레르기 치료제 시장 및 대사면역항암제 시장은 중장기적으로 지속적인 높은 성장세가 예상되나, 그럼에도 불구하고 예기치 못한 상황으로 인한 의료기관 이용 및 의약품 공급 제한, 보험급여 정책 축소, 시장 및 경기 불황 등으로 인한 제품 수요 감소 및 가격의 하락 등으로 목표 시장 및 전방 시장의 성장성이 예상보다 낮아질 수 있으며, 이 경우 당사의 임상 진행 및 사업화에 부정적인 영향을 미칠 수 있습니다. |
당사는 구조 안정성과 생산성이 향상된 이중융합단백질을 발굴하는 GI-SMART™ 플랫폼 기반 기술을 활용하여 GI-10N(면역항암제) 시리즈, GI-20N(대사질환 치료제) 시리즈, GI-30N(알레르기질환 치료제) 시리즈 등 다수의 신약 파이프라인을 지속적으로 도출하여 연구개발을 수행하고 있습니다. 그 중에서도 현재 임상 단계에 진입한 주요 파이프라인으로는 GI-101(면역항암제)와 GI-301(알레르기 치료제)가 있으며, 후속 핵심 파이프라인으로 2024년 12월 국내 식약처의 IND 승인을 획득하여 한국 임상 1/2a상의 시작을 앞두고 있는 GI-108(대사면역항암제)가 있습니다. 각 파이프라인 별 시장 현황 및 향후 전망은 아래와 같습니다.
(1) 면역항암제 시장
항암제 시장은 암환자의 생존율을 높이고 삶의 질을 개선시키기 위한 미충족 의료 수요가 여전히 높은 분야로, 암환자의 증가와 더불어 면역항암제를 포함한 다양한 항암제 시장의 성장에 힘입어 2019년 기준 1,454억달러에서 2026년 3,112억달러로 규모로 연평균 11.5%의 높은 성장세를 나타낼 것으로 전망되고 있습니다 (출처: World Preview 2020, Outlook to 2026, EvaluatePharma 2020).
그 중에서도 3세대 항암제인 면역항암제 시장은 2021년 450억 달러의 시장규모를 이루었으며, 연평균 21.2%의 지속적인 고속성장으로 2027년에는 1,400억달러에 이를 것으로 전망되고 있습니다(출처: GlobalData, 2022).
| [글로벌 면역항암제 시장규모 현황 및 전망(2021-2027)] |
 |
|
글로벌 면역항암제 시장규모 현황 및 전망 (2021_2027) |
| 출처: Thematic Research Immuno-Oncology, GlobalData, 2022.05 |
특히 면역항암제 시장에서도 면역관문억제제는 가장 성공적인 사례로, GlobalData에 따르면, 현재까지 승인된 7가지 면역관문억제제의 글로벌 시장규모는 2019년 기준 239억 달러로 2018년 대비 36.8% 성장하였으며, 기 승인 약물의 성장성 및 신규 승인 예정 약물의 매출 추이 등을 고려 시 향후 2025 년까지 연평균 14.7 %로 고성장해 글로벌 시장규모 544억 달러에 이를 것으로 전망되고 있습니다(출처: GlobalData 2020.03).
| [글로벌 면역관문억제제 시장 규모 현황 및 전망] |
 |
|
글로벌 면역관문억제제 시장 규모 현황 및 전망 |
| 출처: | Immuno-oncology: Focus on Developments and Opportunities in Immune Checkpoint Modulators, GlobalData, 2020.03 |
면역관문억제제 중에서도 전세계 매출 1위를 차지하는 MSD의 키트루다®는 흑색종을 대상으로 최초 승인을 획득한 이래 비소세포페암, 두경부암, 호지킨 림프종, 방광암 등 10여개 이상의 다양한 암 적응증에 대부분 1차 치료제로 승인되면서, 2019년 처음으로 단일품목 매출 100억 달러를 넘었으며, 다른 항암제를 넘어서 글로벌 의약품 매출 1위 품목이 되었습니다. EvaluatePharma의 World Preview 2020 자료에 따르면, 키트루다®는 2026년 249억 달러의 매출이 전망되는 바, 여전히 글로벌 매출 1위 품목에 이름을 올릴 것으로 예상되고 있습니다(출처: World Preview 2020, EvaluatePharma).
이처럼 면역관문억제제를 포함한 글로벌 면역항암제 시장은 매우 성장성이 높은 시장이며, 기존 제제들의 적응증 확대, 병용요법 및 수술 전/후 보조요법으로 적용 방식 확대, 신규 면역항암제의 출시 등으로 인해 지속적으로 고성장할 것으로 전망되며, 경쟁력 있는 제품이 출시될 경우 높은 수익 기대가 가능합니다.
(2) 알레르기 치료제 시장
알레르기(allergy)란 면역계가 일반적으로 우리 몸에 해롭지 않은 특정 물질에 대해 불필요한 면역반응을 과도하게 일으켜 나타나는 질환으로, 천식, 알레르기 비염, 식품 알레르기, 아토피 피부염, 두드러기 등이 알레르기 질환에 속합니다. 산업화, 서구화된 현대사회에서 생활환경 변화 등으로 알레르기 질환이 급증하고 있으며, 유병률이 높은 만성 염증성 질환으로 사회 경제적인 비용과 질병 부담이 높은 질환입니다. 대표적인 알레르기 질환별 치료제 시장은 아래와 같은 성장세를 보이고 있습니다.
[천식 치료제]
천식, 만성 폐쇄성 폐질환 등 호흡기관에 영향을 미치는 만성 알레르기성 질환은 세계보건기구(WHO)에서 분류한 4대 주요 만성 질환에 포함될 만큼 질병 부담이 큰 질환입니다. 2000년 세계보건기구 보고에 따르면, 세계 인구의 약 10%가 천식을 앓고 있으며 십년마다 약 50%씩 증가하는 경향을 보인다고 합니다.
GlobalData 분석에 따르면 글로벌 주요 7개국의 천식 치료제 시장규모는 2019년 98억 달러에서, 2029년 112억 달러에 이를 것으로 전망됩니다. 글로벌 천식 시장에서 70% 이상을 차지하고 있는 미국의 2019년 천식 치료제 시장의 규모는 2019년 70억 달러(71% 점유)이며, 2029년에는 81억 달러 규모(72% 점유)로 확대될 것으로 예상됩니다(출처: GlobalData 2020.12).
| [주요 7개국 천식 치료제 시장규모 현황 및 전망] |
 |
|
글로벌 주요 7개국 천식치료제 시장규모 현황 및 전망 |
| 출처: Asthma - Global Drug Forecast and Market Analysis to 2029, GlobalData, 2020.12 |
[아토피 피부염 치료제]
아토피 피부염은 심한 가려움증과 염증을 동반하는 민성피부질환으로 유병률이 어린이 10~20%, 어른은 1~3%으로 높은 편이며 (출처: Silverberg J., Dermatologic Clinics 2017, 35(3): 283-289), 복잡한 발생 원인으로 인해 환자의 유형 구분에 따라 각기 다른 치료방법이 필요합니다. 이에 따라 현재 시장이 커버하지 못하는 심각한 난치성 아토피 환자에 대한 미충족 수요로 인한 새로운 시장 창출의 기회가 큰 분야입니다.
GlobalData(2022.10) 보고에 따르면, 글로벌 주요 7개국 아토피 피부염 치료제 시장 규모는 2020년 약 64억 달러를 기록했으며, 2030년에는 175억 달러 규모로 연간 10.6%의 성장률을 보이며 지속적으로 성장할 것으로 예상됩니다(출처: GlobalData 2022.10).
| [주요 7개국 아토피 치료제 시장규모 현황 및 전망] |
 |
|
글로벌 주요 7개국 아토피 피부염 치료제 시장규모 현황 및 전망 |
| 출처: | Atopic Dermatitis: Seven-Market Drug Forecast and Market Analysis Update, GlobalData, 2022.10 |
[음식물 알레르기 치료제]
음식물 알레르기에 대한 경각심 증가, 유아들의 안전성에 대한 인식, 그리고 증가하는 음식물 알레르기 사례 등을 이유로, 향후 알레르기 시장에서 가장 잠재적 성장성이 클 것으로 생각되는 분야는 음식물 알레르기 시장으로 여겨집니다. 특히, 땅콩 알레르기는 단 몇 분 내에 두드러기, 가려움증, 호흡곤란, 메스꺼움 등의 증상을 유발하고, 심할 경우 급성 호흡곤란, 혈압 감소 등의 증상이 나타나는 '아나필락시스'가 발생할 수 있는 질환입니다.
2018년 보고된 GlobalData 자료에 따르면, 주요 8개국 땅콩 알레르기 치료제 시장은 2017년 2,600만 달러 규모에서 연평균 111%의 폭발적인 성장을 보이며 2027년 45억 달러 시장을 형성할 것으로 예측되고 있습니다(출처: GlobalData, 2018.06). 시장에서 가장 큰 비중을 차지하는 지역은 미국으로 전 세계 시장의 약 88%를 점유하고 있습니다.
| [땅콩 알레르기 치료제 시장규모 현황 및 전망] |
 |
|
글로벌 땅콩 알레르기 치료제 시장규모 |
| 출처: Peanut Allergy: A Bright Future with Room to Grow, GlobalData, 2018.06 |
(3) 대사면역항암제 시장
대사항암제(metabolic anticancer drug)는 암세포의 대사를 조절하는 기전을 통해 암세포를 사멸시키는 항암제입니다. 2000년 암의 특징에 대하여 가장 잘 기술한 것으로 알려진 리뷰논문인 'Hallmarks of cancer'에서 나왔던 암의 6가지 특성(세포의 증식, 성장억제 회피 기전, 세포사멸 억제 기전, 무한 복제 능력, 신생혈관형성, 전이 및 침윤 특성)에서 11년이 지난 2011년 'Hallmarks of cancer : the next generation'에 2가지의 원칙이 추가되었으며 그 특징은 면역체계의 회피(avoiding immune destruction) 및 암세포의 비정상적 대사(deregulating cellular energetics), 즉 암대사(cancer metabolism)입니다(출처: Hanahan D, Weinberg RA. 'Hallmarks of cancer: the next generation'. Cell, 2011 Mar.). 모든 암종에서 암이 증식 및 전이를 일으키는 과정에서 특이적인 대사과정을 거치기 때문에, 많은 연구진들이 대사면역항암제가 3세대에 해당하는 면역항암제의 뒤를 잇는 4세대 차세대 항암제로 부각될 것으로 기대하고 있습니다. 2020년에 보고된 GlobalData와 2022년 보고된 EvaluatePharma의 자료에 따르면, CD73 저해제를 포함한 대사면역항암제 글로벌 시장의 2021년부터 2028년까지 연평균성장률 181%의 폭발적인 성장으로 보일 것으로 예측되고 있습니다.
상기에서 살펴본 바와 같이, 당사의 주요 파이프라인이 속한 면역항암제 시장 및 알레르기 치료제 시장, 대사면역항암제 시장은 중장기적으로 지속적인 높은 성장세가 예상되나, 그럼에도 불구하고 예기치 못한 상황으로 인한 의료기관 이용 및 의약품 공급 제한, 보험급여 정책 축소, 시장 및 경기 불황 등으로 인한 제품 수요 감소 및 가격의 하락 등으로 목표 시장 및 전방 시장의 성장성이 예상보다 낮아질 수 있으며, 이 경우, 당사의 임상 진행 및 사업화에 부정적인 영향을 미칠 수 있습니다.
|
바. 목표시장 내 경쟁 심화에 따른 위험 |
당사는 구조 안정성과 생산성이 향상된 이중융합단백질을 발굴하는 GI-SMART™ 플랫폼 기반 기술을 활용하여 GI-10N(면역항암제) 시리즈, GI-20N(대사질환 치료제) 시리즈, GI-30N(알레르기질환 치료제) 시리즈 등 다수의 신약 파이프라인을 지속적으로 도출하여 연구개발을 수행하고 있습니다. 그 중에서도 현재 임상 단계에 진입한 주요 파이프라인으로는 GI-101(면역항암제)와 GI-301(알레르기 치료제)가 있으며, 후속 핵심 파이프라인으로 2024년 12월 국내 식약처의 IND 승인을 획득하여 한국 임상 1/2a상의 시작을 앞두고 있는 GI-108(대사면역항암제)가 있습니다. 각 파이프라인의 시장 내 경쟁 현황 및 당사 제품의 경쟁력은 아래와 같습니다.
(1) 면역항암제 시장
3세대 항암제인 면역항암제는 인체의 면역세포가 암세포를 제거하도록 유도하며, 이 과정에서 후천적인 학습이 가능한 면역계의 특성(후천면역 또는 획득면역)을 이용합니다(출처: Axel Hoos, Nature reviews, 2016). 즉, 암세포를 한번 인식한 면역세포는 특이적(specificity)으로 그 인식 과정을 기억(memory)할 수 있어, 장기적인 치료 효능과 함께 다른 조직으로 이동(전이)된 암에 대한 억제 효능도 함께 기대할 수 있게 되었습니다(출처: Antoni Ribas et al., Science, 2018; Suzanne L Topalian et al., Cancer cell, 2015). 또한 우리 몸의 면역체계를 이용하므로 독성 물질을 이용하는 기존 치료제와 비교하여, 낮은 부작용을 특징으로 나타내므로 기존 항암치료제의 패러다임을 바꾸는 혁신적인 치료제로서 각광받고 있습니다(출처: Gregory K. Pnnock et al., The Oncologist, 2015).
면역항암제 시장은 면역관문억제제, 면역세포치료제, 인터류킨제제 등 다양한 기전의 치료제가 출시되어 있습니다. 그 중에서도 메인스트림은 면역관문억제제(immune checkpoint inhibitors; ICIs)로서, 이는 면역세포에 발현하여 세포의 기능을 낮추는 면역관문분자(immune checkpoint molecules)인 CTLA-4, PD-1, PD-L1 등과 결합하는 항체의약품입니다(출처: Drew M. Pardoll et al., Nature reviews cancer, 2012). 2011년 브리스톨마이어스스큅(BMS) 사가 출시한 여보이®라고 하는 CTLA-4에 대한 항체을 비롯하여, 면역관문분자 PD-1에 대한 항체인 옵디보®와 키트루다®, PD-L1에 대한 항체인 티센트릭®과 임핀지® 등이 있습니다(출처: Elisa Gonzalez-Rodriguez et al., The Oncologist, 2016). 현재 여러 글로벌 제약 회사와 바이오텍 기업들이 앞다투어 면역관문억제제 기반의 항체와 이중항체를 포함한 새로운 면역항암제 개발을 진행하고 있으며, 2023년 의약품 매출 규모 상위 15위 의약품 안에 항 PD-1 항체인 옵디보®과 키트루다®가 위치하여, 면역항암제는 항암제 시장의 실질적인 대세로 자리 매김하고 있습니다.
| [2023년 매출 기준 글로벌 상위 15개 치료제] |
| (단위: 백만 달러) |
| 순위 | 치료제명 | 제조사 | 2023년 매출 | 2022년 매출 | 매출성장률 | 기저질환 |
|---|---|---|---|---|---|---|
| 1 | Keytruda (pembrolizumab) | Merck | 25,011 | 20,937 | 19.46% | 고형암 |
| 2 | Comirnaty (tozinameran) | Pfizer, BioNTech | 15,305 | 55,913 | -72.63% | 코로나19 |
| 3 | Humira (adalimumab) | AbbVie | 14,404 | 21,237 | -32.17% | 류마티스 관절염, 건선성 관절염, 강직성 척추염, 크론병 등 |
| 4 | Ozempic (semaglutide) | Novo Nordisk | 13,892 | 10,060 | 38.09% | 제2형 당뇨병 |
| 5 | Eylea (aflibercept) | Regeneron, Bayer | 12,876 | 13,031 | -1.19% | 황반변성 |
| 6 | Eliquis | Bristol Myers Squibb | 12,206 | 11,789 | 3.54% | 항응고제 |
| 7 | Biktarvy (bictegravir/emtricitabine /tenofovir alafenamide) |
Gilead Sciences, Inc. | 11,850 | 10,390 | 14.05% | HIV-1 |
| 8 | Dupixent (dupilumab)* | Sanofi | 11,590 | 8,736 | 32.67% | 아토피 피부염, 천식 등 |
| 9 | Stelara (ustekinumab) | Johnson & Johnson | 10,858 | 9,723 | 11.67% | 건선성 관절염, 크론병, 궤양성 대장염 등 |
| 10 | Darzalex (daratumumab) & Darzalex Faspro (daratumumab and hyaluronidase-fihj) |
Johnson & Johnson | 9,744 | 7,977 | 22.15% | 다발성 골수종 |
| 11 | Opdivo (nivolumab) | Bristol-Myers Squibb | 9,009 | 8,249 | 9.21% | 고형암 |
| 12 | Trikafta/Kaftrio | Vertex Pharmaceuticals | 8,945 | 7,687 | 16.37% | 낭포성 섬유증 |
| 13 | Gardasil/Gardasil 9 | Merck | 8,886 | 6,897 | 28.84% | 인유두종 바이러스 예방 |
| 14 | JARDIANCE family | Boehringer Ingelheim | 8,120 | 6,415 | 26.58% | 제2형 당뇨병, 만성 심부전, 만성 신장 질환 |
| 15 | Skyrizi (risankizumab-rzaa) | AbbVie | 7,763 | 5,165 | 50.30% | 판상 건선, 건선성 관절염, 크론병 |
| 출처: | Drug Discovery & Development, Best-selling pharmaceuticals of 2023, 2024 |
최근의 면역항암제 연구개발 트렌드의 초점은 어떤 환자가 면역관문억제제에 반응하는지, 반응하는 환자 수를 어떻게 끌어 올릴 수 있는지에 집중되고 있으며, 특히 반응하는 환자 수를 끌어올리기 위해 다양한 방식으로 병용요법이 진행 중입니다. 병용투여 요법은 각기 다른 항암효과를 가진 치료 타깃에 대한 치료제들의 효능을 극대화할 수 있어 항암 효능의 상승효과(synergic effect)를 기대할 수 있습니다. 이에 기존의 치료 방법 중 화학항암제를 활용하는 방식에서부터 표적항암제 혹은 다른 면역관문억제제, 그 외 다양한 치료제와의 최적의 조합 연구가 활발히 진행되고 있습니다(출처: Lorenzo Galluzzi et al., Nataure reviews clinical oncology., 2020). 이 중에서도 PD-1에 대한 항체인 키트루다® 및 옵디보®를 중심으로 병용 요법에 대한 임상이 가장 활발하게 진행 중이며(출처: Jeffrey Weber et al.,The New England Journal of Medicine, 2017), 이들 항 PD-1 항체의 단독 투여로 부족한 항암 효과에 대해 자체 개발한 항체와 병용할 수 있는 적합한 파트너를 물색하는 방향으로 진행되고 있습니다. PD-1/PD-L1을 타깃으로 하는 면역관문억제제의 경우 총 4,400건의 단독 또는 병용 임상시험(2020년 9월)이 진행되고 있고, 이 중 병용임상시험은 총 3,498건에 이릅니다. 키트루다®의 임상시험의 경우 단일요법이 2017년과 2020년에 각각 160건과 262건인 반면, 병용요법은 2017년과 2020년에 각각 397건과 937건으로 단일요법 대비 각 2.5배와 3.6배로 크게 증가했습니다(출처: Upadhaya, S. et al. Nature Reviews Drug Discovery, 2021).
| [항암제 병용투여 현황] |
 |
|
면역항암제 중심 병용투여 조합 대상 현황 |
| 출처: Upadhaya, S. et al. Nature Reviews Drug Discovery (2021) 20:168-169 |
지금까지는 보다 명확한 타깃을 발굴하여 이를 대규모 임상을 통해 입증하고 그 결과를 토대로 허가를 만들어냈던 단독요법 중심이었으나, 이제는 초기 면역항암제 개발 열기를 지나 병용요법의 개발이 본격적으로 면역항암 치료의 제2 라운드에 돌입했다고 할 수 있습니다.
따라서, 결과적으로 연구개발 및 임상 단계 수준의 다양한 면역항암제의 출시가 예상되나, 경쟁 강화로 이어지기보다는 기존 제품과의 상호보완적인 관계 구축 및 병용을 통한 시너지 향상으로 이어질 것으로 예상됩니다. 시장 역시, 기존의 시장의 규모가 유지되면서 기존 치료제와 면역항암제간 점유율 경쟁으로 이어지기보다는, 기존의 항암 치료제 시장의 부가적인 시장 창출로 연계될 것으로 판단됩니다. 따라서 면역항암제 주도의 시장 경쟁판도가 급격하게 변동될 가능성은 낮을 것으로 사료됩니다.
실제 GI-101의 임상개발 관련, 당사는 2020년 7월 미국 MSD사와 면역항암제 병용요법 임상을 위한 협약을 체결하고, MSD로부터 약 200명의 환자들에 대한 키트루다®를 무상으로 지원받는 공동 임상을 현재 진행 중에 있습니다. 또한 당사는 2021년 12월 아스트라제네카사와 GI-101과 항 PD-L1 항체인 임핀지®와의 이제(doublet) 병용요법 및 GI-101, 임핀지® 그리고 화학항암제와의 삼제(triplet) 병용요법에 대해 공동임상 및 임핀지® 무상공급 계약을 체결한 바 있으나(출처: 지아이이노베이션사 홈페이지), 본 공시서류 제출일 전일 현재 기준 당사의 인력 및 재원 등을 고려하여 전세계 매출 1위인 키트루다® 병용 임상에 집중하고자 아스트라제네카와의 임상은 진행하지 않고 있습니다. 이와 같이 당사에서 개발 중인 GI-101은 면역관문억제제 이외에도 화학항암제, 표적치료제 및 방사선 치료와의 병용요법과 같은 다양한 병용요법으로 사용성 확장이 가능하여 다른 글로벌 제약사들과도 경쟁구도보다 협력관계로서 상생할 수 있는 가능성을 가지고 있기 때문에 기술이전의 가능성 또한 높을 것으로 예상하고 있습니다.
한편, 당사의 GI-101은 CD80(CTLA-4를 타깃)과 IL-2 변이체(IL-2 수용체를 타깃)를 포함하는 이중융합단백질로서, 기전적으로 면역관문 단백질인 CTLA-4 및 인터류킨 단백질 IL-2와 관련되어 있습니다. 현존하는 약물 중 당사의 GI-101과 같이 CTLA-4 및 IL-2 수용체를 동시에 타깃하는 단일 약물은 전무하지만, CTLA-4 또는 IL-2 수용체 각각을 타깃하여 이미 출시되었거나 현재 임상 개발 중인 약물들은 아래와 같이 존재합니다.
| [CTLA-4 및 IL-2 제제 개발 현황] |
| 타깃 | 제품명(또는 성분명) /특성 |
개발사 | 요법 및 허가 /적응증 |
개발 현황 |
| CTLA-4 |
여보이® /항 CTLA-4 항체 |
비엠에스 (BMS) |
단독 및 병용 요법/고형암 | 2011년 승인 및 출시 |
|
임주도® /항 CTLA-4 항체 |
아스트라제네카 (AstraZeneca) |
임주도® + 임핀지® |
2022년 허가 및 출시 | |
| IL-2 (1세대) |
프로류킨® /야생형 IL-2 |
노바티스 (Novartis) |
단독 요법 /전이성 신세포암 전이성 흑색종 |
1992년 승인 및 출시 |
| IL-2 (2세대) |
넴발류킨 알파 /IL-2 융합단백질 |
앨커미스 (Alkermes) |
Nemvaleukin alfa + 키트루다®/불응성 난소암 |
임상3상 진행 중 |
| IBI363 | 이노벤트 (Innovent) |
IBI363 + bevacizumab IBI363 + 화학항암제 |
임상2상 진행 중 |
|
|
RG7461 (simlukafusp alfa) /항 FAP-IL2 변이체 |
로슈 (Roche) |
RG7461 + 티센트릭®/고형암 |
임상2상 종료 후, 개발중단 |
|
| RG7461 + 티센트릭® ± 아바스틴® /신장암 1차치료제 |
임상1b상 종료 후, 개발중단 |
|||
| RG6279 /항 PD-1-IL2 변이체 |
로슈 (Roche) |
단독 및 티센트릭®병용 요법 /고형암 |
임상1/2상 진행 중 | |
|
SAR444245 /페길화 IL-2 |
사노피 (Sanofi) |
SAR444245 /소화기계암 |
임상2상 중단 및 신규 임상 1/2상 계획 |
| 출처: | 각 사 홈페이지, 보도자료 |
먼저, CTLA-4를 타깃하는 기전의 치료제로는 항 CTLA-4 항체인 BMS사의 여보이®(Yevoy, 성분명: 이필리무맙(ipilimumab))와 아스트라제네카(AstraZeneca)의 임주도®(Imjudo, 성분명: 트레멜리무맙(tremelimumab))가 시장에 출시되어 있습니다.
여보이®는 2011년 FDA로부터 흑색종 치료제로 허가 받은 후 전이암, 신장암 그리고대장암까지 치료제 용법을 확장하였습니다. 또한 신세포암에서는 여보이®와 옵디보®(Opdivo, 성분명: 니볼루맙(nivolumab))의 병용요법으로 허가를 받아 사용하고 있습니다. 하지만, 여보이®는 T 세포 활성화 및 증식으로 인하여 중증 및 사망을 초래하는 이상사례들이 보고된 바 있습니다. 뿐만 아니라 면역매개 반응들로 인해 소장대장염, 간염, 피부염(독성표피괴사를 포함), 신경병증 및 내분비병증 등과 같은 중증반응이 나타날 수 있다는 우려사항이 있는 약물입니다(출처: Leslie A Fecher et al., Oncologist, 2013).
임주도®는 여보이® 대비 반감기 증가 및 구조상 면역글로불린 타입 변경(IgG1 대신 IgG2)으로 기존의 면역매개 부작용을 감소시키는 전략으로 개발한 약물입니다(출처: Ahmad A Tarhini et al., Immunotherapy, 2013). 특히, 여보이®의 경우 항체 의존성 보체 매개 세포 독성(antibody-dependent complement-mediated cytotoxicity; CDC)과 항체 의존성 세포 독성(antibody-dependent cellular cytotoxicity; ADCC)을 나타내는 반면, 임주도®는 CDC는 제거하고 ADCC만 가지고 있어 여보이®가 가지고 있는 부작용의 문제를 해결할 것으로 기대되었습니다. 임주도®의 임상 결과, 여보이®에 비해 뇌하수체염 발생 빈도가 낮아지긴 하였습니다만, 여전히 뇌하수체염 발생을 비롯한 부작용들이 보고되고 있으며 이는 ADCC의 기능이 여전히 임주도®에 남아 있는 것이 문제점으로 지적되고 있습니다(출처: Filipe Martins et al., Nature Reviews Clinical Oncology, 2019). 따라서 임주도®의 경우, 항 PD-L1항체 약물인 임핀지®(성분명: 더발루맙(durvalumab))와의 병용요법에 대해 2022년 10월 미국 FDA로부터 절제수술 불가성 간세포암종에 대한 1차 치료제로 승인을 받았습니다. 다만, 그 투약방법이 임핀지® 1500mg과 임주도® 300mg을 1회 투여한 후 4주마다 정기적인 간격으로 임핀지®만을 추가 투여하는 STRIDE(Single Tremelimumab Regular Interval Durvalumab) 전략으로 여전히 CTLA-4 항체인 임주도®의 투약은 제한되어 있습니다(출처: 임주도® FDA 의약품 라벨). 또한 임주도®의 FDA 의약품 라벨에는 여보이®와 유사하게 면역매개 폐렴, 면역매개 대장염, 면역매개 간염, 면역매개 내분비병증, 면역매개 피부과 이상반응, 신기능장애를 동반한 면역매개 신장염 및 면역매개 췌장염 등과 같은 약물이상반응(adverse reactions)에 대한 경고가 표기되어 있습니다.
여보이®나 임주도®와 같은 의약품은 동일한 CTLA-4를 타깃으로 한다는 점에서 동사의 GI-101과 GI-102를 개발 및 사업화 하는 데에 있어서 위험요소로 여겨질 수 있습니다. 하지만 동사의 GI-101과 GI-102는 CDC 뿐만 아니라 ADCC도 완전히 제거한 형태로 개발되어 있으며, 현재 진행 중인 중간 임상 결과 여보이®나 임주도®가 보이는 심각한 부작용은 관찰되지 않아, 보다 안전하게 환자들이 투약 받을 수 있는 약물로 개발될 것으로 예상됩니다.
또한, GI-101의 경우, 여보이®나 임주도®와 같이 CTLA-4를 타깃하는 CD80 부분 만으로 구성된 것이 아니라 IL-2 변이체를 포함하고 있는 이중융합단백질로서, 여보이®나 임주도®와 같은 항 CTLA-4 단일 항체와는 다른 약력학(pharmacodynamics) 반응을 보여주고 있습니다. 여보이®와 임주도®는 약물이상반응 중 하나로 림프구 감소 현상이 나타나고 있는데(출처: 여보이®, 임주도® FDA 의약품 라벨), 이는 항암 면역 반응을 제한할 수 있습니다. 하지만 GI-101과 GI-102는 CTLA-4를 타깃할 뿐만 아니라, IL-2 변이체를 포함하고 있는 이중융합단백질이기 때문에 여보이® 및 임주도®와는 달리 림프구의 증가를 유도하여 항암 면역 반응을 극대화할 수 있는 명확한 약력학적인 차별점을 가지고 있습니다(하기 그림 참고). GII-101-P101(Keynote-B59) 임상시험에서 GI-101을 투약한 결과, GI-101의 경우 경쟁약물의 수준을 초과하는 약 3.5배의 림프구 증식 데이터를 보였습니다. GI-101은 2개의 아미노산 변이체로 만들어져 IL-2 알파 수용체 결합력을 약화시킨 형태로 디자인된 반면, GI-102는 3개의 아미노산 변이체로 만들어져 IL-2 알파 수용체 결합력을 완전히 제거시킨 형태로 개발되었습니다. 알파 수용체 결합력이 약할수록 항암 활성을 저해하는 조절 T 세포가 감소됨에 따라 GI-102는 GII-102-P101(Keynote-G09) 임상시험에서 0.45 mg/kg 투여 시 약 6배에 달하는 림프구 증식 데이터를 보였습니다.
 |
|
GI-101 투약 후 림프구 증식 데이터 |
| 출처: | 당사 GII-101-P101(Keynote-B59) 임상시험 결과 |
 |
|
GI-102 투약 후 림프구 증식 데이터 |
| 출처: | 당사 GII-102-P101(Keynote-G09) 임상시험 결과 |
실제 임주도®(항 CTLA-4 항체)와 임핀지®(항 PD-L1 항체)의 개발사인 아스트라제네카가 2021년 12월 당사의 GI-101과 임핀지®와의 병용을 위한 공동임상개발 및 임핀지® 무상공급 계약을 맺은 점은, 당사의 GI-101이 자신들이 개발한 임주도®와는 다른 약물학적 기전과 특장점을 지니고 있음을 간접적으로 보여주는 예라고 여겨집니다. 이처럼 GI-101은 여보이® 및 임주도®와 CTLA-4라는 동일 타깃을 표적하고 있기는 하나 CDC 및 ADCC에 의한 부작용이 없으며, CTLA-4라는 타깃 외에도 IL-2를 동시에 타깃하여 림프구 증가를 유도하는 것으로 나타나는 바, 경쟁 우위에 있을 것으로 예상됩니다.
한편, IL-2 수용체를 타깃하는 치료제와 관련하여, IL-2는 이미 항암치료제로 상용화 되어 있는 유일한 사이토카인(cytokine)으로서 프로류킨®(Proleukin, 성분명: 알데스류킨(aldesleukin))이라는 상표명으로 1992년 FDA로부터 전이성 피부암 및 신장암 치료에 대해 승인을 받아 사용되어 왔습니다(※ 출처: Seyed Hamidreza Mahmoudpouret al., Scientific Reports, 2019). 프로류킨®은 항암 면역 반응에 중요한 T 세포 및 자연살해세포의 활성을 증가시키지만, 짧은 체내 반감기와 항암 면역반응을 억제하는 조절 T세포의 증가를 유도하는 단점을 가지고 있습니다. 이에 따라 최근 프로류킨®의 단점들을 보완하는 전략으로 IL-2 수용체에 대한 결합력을 감소시킨 2세대 IL-2 변이체들이 개발 중에 있습니다(※ 출처: Rosmely Hernandez et al., Nature Reviews Immunology, 2022).
그 중 임상개발 단계의 경쟁 파이프라인으로는 앨커미스(Alkermes)의 넴발류킨 알파(nemvaleukin alfa), 사노피(Sanofi)의 SAR444245, 로슈(Roche)의 RG6279가 있습니다. 특히, 이들 IL-2 변이체들은 기존 IL-2 제제의 미충족 수요를 해결하는 시장 내 기대감으로 인해 임상개발 단계에서의 공동 연구 및 인수합병이 활발히 진행되고 있습니다.
특히, 글로벌 제약사인 사노피는 면역항암제 파이프라인 강화 목적으로, pegenzileukin(THOR-707;SAR444245) 파이프라인을 보유하고 있는 신톡스(Synthorx)사를 2019년 25 억 달러에 인수했습니다. SAR444245는 차세대 페길화 IL-2로서 현재 임상2상 용량을 새롭게 설정하는 신규 임상 1/2상을 진행하는 것으로 공표한 바가 있으나(출처: 사노피사 홈페이지), 이후 개발 과정에 대해 상세 업데이트된 내역은 확인되지 않았습니다. 다만, 사노피는 2022년 12월, 프랑스 제약사 이네이트파마(Innate Pharma)로부터 전임상 단계의 개발 초기에 있는 NK세포 활성 및 암표적형 IL-2 변이체 제제를 도입하면서 반환의무 없는 선급금 25백만 유로 및 총 13.5억 유로에 달하는 계약을 추가로 체결하면서 IL-2 변이체 개발에 대한 지속적인 의지를 드러낸 바 있습니다(출처: 사노피사 홈페이지).
현재 전세계에서 임상개발 단계가 가장 앞서 있는 IL-2 제제는 미국 앨커미스(Alkermes)의 넴발류킨 알파(nemvaleukin alfa)로 임상 3상을 진행중입니다. 넴발류킨 알파는 IL-2 융합단백질 변이체로서 항암 면역 반응에 중요한 세포독성 T세포 및 자연살해세포의 활성을 증가시키고, 항암 면역반응을 억제하는 조절 T세포의 증가를 최소화하여 항암활성을 기대하는 약물입니다. 앨커미스는 백금 저항성 상피성 난소암, 난관암, 또는 원발성 복막암이 있는 시험대상자에서 넴발류킨 알파와 키트루다®의 병용요법을 시험자 선정 화학요법과 비교하는 제3상, 다기관, 공개, 무작위배정 임상시험을 진행 중입니다. 하지만 넴발류킨 알파의 임상 2상 용량은 0.006 mg/kg로 프로류킨®의 임상용량인 0.037 mg/kg에 비해서 16% 밖에 미치지 않는 적은 양이 환자에게 투약되어 약물의 효과가 제한적으로 나타날 가능성이 높습니다. 또한, 약물을 5일 연속으로 환자에게 투약해야 하는 불편이 있어 이러한 점은 프로류킨®의 단점을 전혀 개선시키지 못했습니다. 그리고 앨커미스의 발표자료에 따르면, 다양한 3/4등급 투약관련 이상사례(grade 3/4 treatment-related adverse event; grade 3/4 TRAE)들이 보고되고 있으며(출처: 앨커미스 발표자료, 2021 American Society of Clinical Oncology (ASCO)) 이로 인한 투약 중단 사례도 나타나고 있습니다.
하지만 당사의 GI-101은 임상 2상 용량은 0.3 mg/kg로 물질 안에 포함되어 있는 IL-2의 용량을 따져보더라도 약 10배가 많은 양이 투약되어 충분한 효과를 나타낼 것으로 예상되고 있습니다. 또한, GI-101은 3주 간격으로 투약을 받기 때문에 병용투여의 파트너가 되는 다양한 기존 면역항암제와 투약일정을 일치시킬 수 있어 환자의 투약 순응도를 높일 수 있습니다. GI-102의 경우 현재 진행 중인 임상 1/2상의 용량 증량 단계(0.06-0.45 mg/kg) 중 0.45 mg/kg까지 용량 제한 독성(DLT, Dose-Limiting Toxicity)이 관찰되지 않았습니다. GI-102 또한 매 3주 간격으로 투약을 받기 때문에 병용투여의 파트너가 되는 다양한 기존 면역항암제와 투약일정을 일치시킬 수 있어 환자의 투약 순응도를 높일 수 있습니다. 넴발류킨 알파 및 IBI363의 개발 상황 진전에 따라 GI-101/102 개발의 위험요소로 작용할 수 있으나, 넴발류킨 알파 또는 IBI363 역시 기존 임상에서 실패를 겪고 있는 단순 지속형 IL-2와 유사한 형태로 여겨지고 있습니다. 특히, 넴발류킨 알파의 경우 기존에 실패를 겪었던 BMS사의 NKTR-214와 마찬가지로 단독요법 초기에 모든 암종을 대상(All-comer)으로 하는 용량 증량 단계에서는 부분관해(partial response; PR: 병변의 크기가 30%이상 감소) 사례가 없었던 반면(출처: 앨커미스 발표자료, 2019 Society for Immunotherapy of Cancer(SITC) Meeting), 당사의 GI-101과 GI-102 모두 단독요법 용량 증량 단계에서 부분관해 사례가 관찰되었습니다. 구체적으로, 현재 진행 중인 GI-101의 임상 1/2상 결과, GI-101 단독요법만으로도 면역항암제 불응 환자에서 부분관해(partial response; PR) 및 표준치료 실패 환자에서 완전관해(complete response; CR)가 관찰되었을 뿐만 아니라, 특히 완전관해 환자의 경우 12개월 이상 완전관해를 유지하며 지속적 항암 활성을 보여주었습니다. 또한, GI-101의 제형을 개선하여 투여 후 시간에 따른 약물의 체내 농도를 의미하는 PK(Pharmacokinetics, 약동학) 프로필을 증가시키고 안정적 생산을 가능하게 한 GI-101A의 임상 1/2상 과정 중 키트루다®(Keytruda, 성분명: 펨브롤리주맙(pembrolizumab)) 병용요법에서 역시 면역항암제 불응 췌장암 환자를 대상으로 부분관해(PR)가 관찰되었습니다. 한편, 현재 진행 중인 GI-102의 임상 1상 중간 결과, 용량 증량 단계에서 GI-102는 단독요법만으로도 면역항암제 치료 후 재발한 전이성 흑색종 환자 7 명 중 3명에서 부분관해를 나타내어 고무적 임상 결과를 보여주고 있습니다. 당사는 이러한 임상 과정 중의 데이터를 통해 제3세대 IL-2제제인 면역세포 및 암세포 표적형 IL-2변이체로서 기전적인 차별점을 가지고 있는 GI-101/102가 효능과 부작용의 측면에서 강점이 있을 것으로 예상하고 있습니다.
 |
|
GI-101A + 키트루다 병용요법 부분관해 사례 |
| 출처: | 당사 GII-101-P101(Keynote-B59) 임상시험 결과 |
 |
|
GI-102 단독요법 부분관해 사례 |
| 출처: | 당사 GII-102-P101(Keynote-G09) 임상시험 결과 |
또한, 지속적으로 IL-2 변이체 개발을 이어오고 있던 글로벌 제약사 로슈는 암표적형 항 FAP/IL-2 제제인 RG7461의 개발 실패 이후, 곧바로 항 PD-1항체/IL-2 제제인 RG6279의 임상개발을 연이어 시작했습니다. 이에 더해, 로슈는 자사 항 PD-1항체/IL-2 파이프라인 강화를 위해 2022년 9월, 항암제 개발사인 굿 테라퓨틱스(Good Therapeutics)를 인수합병 했습니다. 로슈는 미국 시애틀 소재 비상장제약사인 굿 테라퓨틱스를 인수하는 조건으로 모든 주식을 2.5억달러의 규모로 현금 인수하고 향후 개발에 따른 마일스톤을 추가지급하기로 하였습니다. 해당 인수합병 계약을 통해서 로슈가 도입한 전임상 개발 초기 단계의 항PD-1항체/IL-2 제제는 키트루다®나 옵디보®와 같은 항 PD-1 항체 부분이 적용되어 있어, 해당 물질이 T세포에 결합하는 경우에만 IL-2가 작동하게 하는 조건부 활성(Conditionally Active Drug Technology) 기술이 적용되어 있습니다(출처: AACR, 2021). 이러한 작용 기전은 넥타의 NKTR-214나 사노피의 SAR444245와 같은 단순 지속형(long-acting) IL-2 변이체의 단점을 보완해, 기존 IL-2 약물 들에서 우려가 있었던 혈관누수증후군, 사이토카인분비증후군과 같은 전신 부작용 등의 한계를 극복할 수 있다고 기대하고 있습니다.
하지만 항 PD-1 항체 약물의 경우, 항암 활성을 나타내는 효과 T세포의 활성은 촉진시킬 수 있으나, 항암 활성에 방해가 되는 조절 T세포의 활성 또한 가져온다는 단점을 극복하지는 못했습니다. 이와 더불어 항 PD-1 항체 약물은 다양한 암종의 약 10 ~ 29.4% 환자에서 투약 후 암이 급속도로 악화되는 급성진행현상(hyperprogressive disease)이 발생되는 문제를 가지고 있습니다(출처: Takahiro Kamada et al., PNAS, 2019; Chang Gon Kim et al., Journal of Hepatology, 2021). 이러한 현상이 발생하는 원인으로는 항 PD-1 항체 등의 치료 후, 환자에서 조절 T세포가 늘어나거나, 림프구가 제대로 증식되지 않는 등의 이유로 호중구/림프구의 비율이 높아지는 경우에 발생하는 것으로 보고 되었습니다. 특히, 급성 진행현상이 일어나는 간암 환자의 경우, 항 PD-1 항체 등의 치료 후, 암성장률이 오히려 4배 이상 증가하고 해당 환자 들의 전체 생존 기간이 59일에 불과할 정도로 매우 나쁜 예후를 보여주게 됩니다(출처: Chang Gon Kim et al., Journal of Hepatology, 2021). 따라서 로슈가 개발하려고 하는 'PD-1 반응형 IL-2'인 RG6279 역시 이러한 위험성이 있을 것으로 판단됩니다. 하지만 당사가 개발하는 GI-101/102의 경우, CD80/IL2v 간의 이중융합단백질의 구조를 가짐으로써 CD80 부분이 조절 T세포의 기능을 억제할 뿐만 아니라, IL-2 변이체가 림프구의 증식을 도와주기 때문에 급성진행현상이 일어나지 않는 안전한 약물로 개발될 수 있을 것으로 예상됩니다.
 |
|
RG6279와 GI-101, 102의 기전 비교 |
| 출처: | 당사 제공 |
여기에 더해, 2023년 1월 아이오반스(Iovance Biotherapeutics)가 재조합 야생형(wild type) IL-2 제제인 프로류킨®의 판권을 2억 840만 유로에 사들이는 계약을 체결하였습니다(출처: Clinigen 사 홈페이지). 아이오반스는 이번 인수를 통해 종양침투림프구 세포치료제와 병용요법으로 진행하고 있는 기존 임상시험에 필요한 프로류킨®을 안정적으로 확보하고 약물가격과 임상비용 등을 낮출 수 있을 것으로 기대하고 있습니다. 현재 많은 글로벌 제약사들이 효과가 제한되어 있고 부작용이 심각한 야생형 IL-2인 프로류킨®의 한계를 극복하기 위해 다양한 IL-2 변이체를 개발하고 있는 상황에서도 기존의 야생형 IL-2 제제에 관한 계약의 성사가 의미하는 바는 여전히 시장 내 IL-2 제제의 필요성 및 지속적 개발의 중요성이 높음을 반증하는 것으로 여겨집니다.
이처럼 글로벌 제약사들 간에 IL-2 제제 개발에 대한 경쟁이 지속적으로 심화되고 있으나, 해당 파이프라인들의 공동 임상개발 및 기술이전, 인수합병 사례들을 살펴볼 때, 선택적인 효과 T세포의 활성화가 가능한 IL-2 변이체의 면역항암제로의 효용 가능성에 대해 기술 및 시장 측면에서의 기대가 매우 큰 것으로 판단되며, 이는 당사 파이프라인 가치에도 긍정적인 영향을 미칠 것으로 예상합니다.
정리하자면, 당사의 GI-101과 GI-102는 기존 글로벌 제약사들이 개발에 어려움을 겪고 있는 단순 지속형 IL-2와 달리 CD80(CTLA-4를 타깃)의 부분이 추가적으로 결합되어 있는 이중융합단백질로써, 기존 IL-2 치료제들이 가지고 있던 다양한 부작용 및 미약한 항암 효능을 극복할 수 있는 차별화된 치료제입니다. 즉, (i) CTLA-4의 저해와 동시에 (ii) T세포 및 NK세포 활성과 증식을 위한 IL-2 수용체 자극의 2가지 면역활성 효과를 동시에 나타내며, 또한 최근 주요한 IL-2 변이체 개발 트렌드인 (iii) 면역세포 및 암조직을 타깃할 수 있는 세계 최초의 first-in-class 신약으로 기대되고 있습니다.
 |
|
GI-101 및 GI-102의 구조 및 특성 |
| 출처: | 당사 제공 |
다만, 상술한 GI-101과 GI-102의 경쟁력에도 불구하고, 향후 동일한 기전 내 신규 경쟁업체의 진입 증가, 당사 대비 임상 단계가 앞서나가고 있는 다른 기전 경쟁 약물들의 임상 성공 및 시판 승인 등이 발생 및 증가할 경우, 당사 제품의 시판 후 시장점유율 등에 부정적인 영향을 미칠 수 있습니다.
(2) 알레르기 치료제 시장
알레르기 치료에는 주로 약물치료제와 면역치료제가 사용되고 있습니다. 약물치료제는 알레르기 증상을 완화시키는 것을 목적으로 하며, 알레르기의 주요 체내 매개체인 히스타민의 작용을 억제하는 항 히스타민제(지르텍®, 알레그라®, 세티리진® 등)와 면역억제 및 항염증 효과가 있어 천식 등 다양한 질환에 사용되고 있는 스테로이드제가 있습니다. 그러나 일부 환자는 이러한 치료로 증상이 조절되지 않아 전신 스테로이드를 반복적으로 사용하게 되며, 그에 따른 스테로이드 부작용이 치료의 부담으로 작용하고 있습니다.
한편, 면역치료제의 원리는 몸에 미량의 알레르기 항원을 장기간에 걸쳐 조금씩 투여해서 면역 체계가 더 이상 특정 알레르기 항원에 과민 반응하지 않게 만들어주는 것입니다. 증상의 완화는 물론 완치의 효과를 볼 수 있으나, 치료 기간이 2-3년 이상 걸리고 비용이 고가이며 한달에 2-4회 주사를 맞아야 하는 등의 어려움이 있습니다. 특히, 22년 11월 네슬레(Nestle)사가 탈감작 요법을 이용한 땅콩 알레르기약인 팔포지아(Palforzia)의 실패를 공식적으로 인정함으로써 해당 요법의 낮은 성공 가능성을 대변해 주었습니다
최근 이에 대한 대안으로서 특정 생체표지자(biomarker)를 타깃하는 다양한 생물학적 제제가 개발되고 임상에 적용됨에 따라 생물학적 제제에 대한 관심이 증가하고 있습니다. 대표적으로 현재 시판 중인 항알레르기 생물학적 치료제로는 IgE를 타깃하는 졸레어®(Xolair, 성분명: 오말리주맙(Omalizumab)) 이외에도, IL(인터류킨류)를 타깃하는 듀피젠트®(Dupixent, 성분명: 두필루맙(dupilumab)), 싱케어®(Cinqair, 성분명: 레슬리주맙(reslizumab)) 등이 있습니다. 그 외 아토피 치료제인 일라이 릴리(Eli Lilly)사의 레브리키주맙(lebrikizumab)이 2023년 EU 및 2024년 FDA에서 허가를 득해 엡글리스®(Ebglyss)로 출시하였습니다. 또한 임상 개발 중인 치료제로서 리겔리주맙(ligelizumab, QGE031)을 이용한 식품 알레르기에 대한 임상 3상이 진행되고 있으며, 천식 치료제인 테제페루맙(tezepelumab) 등이 후기 임상 진행 중입니다.
| [항알레르기 생물학적 제제 승인 및 개발 현황] |
| 타깃 | 제품명(또는 성분명) /특성 |
업체명 | 적응증 | 개발 현황 |
| IgE |
졸레어®(오말리주맙) /항 IgE 항체 |
로슈/ 노바티스 |
만12세 이상 중증 천식 환자 |
2003년 승인 및 출시 |
|
리겔리주맙 /항 IgE 항체 |
노바티스 | 만성 특발성 두드러기 /식품(땅콩) 알레르기 환자 |
임상 3상 완료 후, 1차 평가변수 |
|
| IL-4Rα |
듀피젠트® /항 IL-4Rα항체 (IL-4/IL-13 억제) |
사노피/ 리제네론 |
만 12세 이상 아토피환자 |
2017년 승인 및 출시 |
| IL-5 |
싱케어® /항 IL-5 항체 |
테바 |
만18세 이상 중증 천식 환자 |
2017년 승인 및 출시 |
| IL-5 | 누칼라®(메폴리주맙) /항 IL-5 항체 |
글락소스미스클라인 (GSK) |
중증 호산구성 천식 치료 |
2016년 승인 및 출시 |
| IL-5 | 파센라®(벤랄리주맙) /항 IL-5 항체 |
아스트라제네카 | 12세 이상의 중증 호산구 천식 환자 |
2017년 승인 및 출시 |
| IL-13 |
엡글리스®(레브리키주맙) /항 IL-13 항체 |
릴리 |
12세이상 중등증 내지 |
2023년 EU 허가, 2024년 FDA 허가 |
| TSLP |
테제펠루맙 /항 TSLP 항체 |
암젠/ 아스트라제네카 |
중증 천식치료 | 2021년 승인 및 출시 |
| 출처: | 각 사 홈페이지, 보도자료 |
이 중에서도 당사의 GI-301과 동일한 IgE 타깃으로 출시 및 개발 중으로 직접 경쟁이 예상되는 제품은 항 IgE 항체 약물인 졸레어®와 리겔리주맙입니다. 현재 항 IgE 항체로서는, 로슈(Roche)/노바티스(Novartis)사가 2003년 출시한 졸레어®가 대표적인 약물로 사용되고 있습니다. 이 제품은 초기에 알레르기성 천식 치료 용도로 쓰이다가 항히스타민제와 스테로이드제로도 낫지 않는 중증 만성 특발성 두드러기 치료제로 사용 영역이 확대되면서 글로벌 알레르기 시장의 18%를 차지하고 있으며 연매출은 37억 달러(2022년 기준)에 달하는 블록버스터 약물입니다. 그러나 (i) 높은 IgE 레벨의 환자들에 효과가 없고, (ii) 자가항체를 가진 환자 들에도 효과가 없으며(출처: Ramit Maoz-Segal et al., World allergy organization journal, 2020), 또한 (iii) 아나필락시스 부작용의 위험성과 같은 의학적 미충족 수요가 명확한 제품으로 이를 대체할 수 있는 개선된 항 IgE 표적 치료제 개발이 요구되고 있는 상황입니다.
졸레어®는 항 IgE 항체임에도 불구하고 기저(baseline) 혈청 IgE 수치가 높은 환자에게는 사용이 제한되는 경우가 있습니다. 특히, 졸레어®의 승인 적응증인 알레르기성 천식의 경우, 12세 이상의 청소년 및 성인에게 졸레어®를 투약 시 기저 혈청 IgE 수치가 700 IU/mL 이상인 환자에게는 충분한 임상결과 부족으로 투약이 추천되지 않습니다(출처: 졸레어® 미국 FDA 의약품 라벨). 일례로, 소아 아토피 피부염의 약 80%에 달하는 외인성 아토피 피부염의 경우, IgE 수치가 20,000 IU/mL 이상인 극단적으로 높은 수치를 보이는 것을 특징을 하고 있는데(출처: Andreas Wollenberg et al., World Allergy Organization Journal, 2021), 이와 같은 적응증은 졸레어®가 승인받기 어려울 것으로 여겨지고 있습니다. 당사 전임상 실험 결과에 따르면, 졸레어®는 높은 기저 혈청 IgE 수치(평균 1,777 IU/mL)를 나타내는 원숭이에 단회 투여 시, 혈청 IgE 수치를 유의미하게 제어하지 못하였습니다. 하지만 당사의 GI-301은 졸레어® 투여군보다 기저 혈청 IgE 수치(평균 3,343 IU/mL)가 더 높았음에도 불구하고, 단회 투여에 의해서 약 일주일간 효과적으로 혈청 IgE 수치를 제어할 수 있음을 증명하였습니다. 또한, 임상적으로 항 IgE 약물에 의해 혈청내 IgE 수치가 25 ng/mL이하로 억제되는 경우, 유의미한 알레르기 억제 반응이 일어났다고 판단합니다(출처: Xolair INN, 2005 European Medicines Agency (EMEA)). GI-301은 임상 1상에서는 기저 혈청 IgE 수치가 30-700 IU/mL로 비교적 낮은 환자군에서 단회 투여 시 평균 18.5일까지 혈청 IgE 수치를 25 ng/mL 미만으로 제어하였으며, 기저 혈청 IgE 수치가 700 IU/mL 이상으로 비교적 높은 환자군 또한 단회 투여 시 평균 15일까지 혈청 IgE 수치를 25 ng/mL 미만으로 제어하였습니다. 졸레어®의 경우 두 환자군 모두에서 GI-301 대비 낮은 혈중 IgE 수치 억제능을 보였으며 그 지속기간도 더 짧게 나타났습니다. 이와 같이 전임상과 임상을 거치며 확인되고 있는 당사 GI-301의 우수한 효과를 바탕으로, GI-301은 현재 임상 1상 단계임에도 불구하고 약물의 안정성 입증 뿐만 아니라 기존 항 IgE 항체 치료제인 졸레어® 대비 효능 우위를 증명하는 데에 중점을 두고 있습니다. 졸레어®가 승인을 받은 적응증은 물론이며 승인받지 못한 알레르기 질환 적응증까지 확장할 수 있을 것으로 기대하고 있습니다.
 |
|
전임상 및 임상 1상 중 GI-301과 졸레어의 투약 후 혈청 내 IgE 변화 |
| 출처: | 당사 실험결과 |
졸레어®는 알레르기성 천식이나 비용종을 동반한 만성 비부비동염을 적응증으로도 승인을 받았지만 특히 만성 특발성 두드러기 분야에서는 환자들에게 거의 유일한 치료옵션으로 되어 있습니다. 만성 특발성 두드러기는 통증 및 가려움증을 동반한 두드러기가 6주 이상 거의 매일 악화와 호전을 반복하는 피부질환으로 환자 삶의 질을 심각하게 저하시키지만 아직 뚜렷한 원인은 알려져 있지 않습니다. 따라서 H1항히스타민제를 주로 대증치료제로 사용하고 있으나, 환자들의 절반 이상은 항히스타민제 투여에도 증상이 지속되고 있으며, 항히스타민제로도 증상이 조절되지 않는 환자들에게 최대 4배까지 용량을 늘릴 수 있도록 권고하고 있습니다(출처: David A Khan et al., UpToDate, 2021). 이러한 항히스타민제의 증량에도 불구하고 증상이 유지되는 만성 특발성 두드러기 환자들을 대상으로 추가치료 요법으로 사용되도록 졸레어®가 승인되어 있습니다. 하지만 이러한 만성 특발성 두드러기 환자의 30~40%에서 고친화성 IgE 수용체(FcεRIα)에 대한 자가항체가 존재함이 밝혀져 있으며, 일반적으로 자가항체가 있는 경우에 더 만성적인 경과를 취하는 것으로 알려져 있습니다(출처: 예영민 et al., AARD, 2015, Olguta Anca Orzan et al., Medicina, 2022). 하지만 졸레어®는 이러한 자가항체를 결합하여 중화하는 능력이 없어 승인받은 적응증임에도 불구하고 자가항체를 보유하고 있는 만성 특발성 두드러기 환자들에 대한 치료 반응성이 떨어져 있습니다. 하지만 GI-301은 약물의 기전상 졸레어®와 같은 항 IgE 항체와 달리, 비만세포를 활성화시키는 자가항체인 항 FcεRI 항체와도 결합해 그 작용을 억제함으로써, 만성 특발성 두드러기 증상을 억제할 수 있습니다.
또한, 졸레어®는 미국 FDA 의약품 라벨에 박스형 경고문(Boxed Warning)이 표기되어 있습니다. 'Black Box Warning(BBW)'이라고 불리는 박스형 경고문은 미국 FDA에서 약물에 대한 심각한 약물유해반응 또는 주의사항에 대해 경고하는 글입니다. 보통 시판 후 추가되기 때문에 의료진에게 약물 안전성과 관련하여 제공되는 최신 정보이고, 주의깊게 인식되어야 하는 정보입니다(출처: 이정은, 이화여자대학교 임상보건과학대학원, 2011). 졸레어®는 투약 후, 기관지 경련, 저혈압, 실신, 두드러기, 인후 또는 혀의 혈관 부종 증상으로 나타나는 아나필락시스의 발생 가능성 때문에 의약품 라벨에 박스형 경고문이 표기되었습니다. 특히 졸레어® 투약에 의한 아나필락시스는 첫 투약 후에도 발생하지만 치료 시작 1년 정도 경과한 후에도 발생하기도 하며, 환자의 생명을 위협할 수 있으므로 이에 대한 적절한 조치를 준비하도록 되어 있습니다(출처: 졸레어® 미국 FDA 의약품 라벨). 이와 같은 영향으로 졸레어®는 아직 6세 이하의 소아에게 투약은 제한되어 있습니다. 졸레어®의 미충족 의료 수요를 충족시키기 위해 당사의 GI-301은 항체 의존성 보체 매개 세포 독성(antibody-dependent complement-mediated cytotoxicity; CDC)과 항체 의존성 세포 독성(antibody-dependent cellular cytotoxicity; ADCC)을 제거한 형태로 개발하였으며, 이로써 성인환자 뿐만 아니라 소아환자 들까지도 안전하게 투약 받을 수 있을 것으로 기대됩니다.
주사 제형의 측면에서 보면, 일반적으로 의료현장에서는 편리성에 주목해 자가주사 방식의 피하주사 제형에 대한 수요가 높습니다. 정맥주사는 다량의 약물을 투여해 장기간 혈중농도를 일정하게 유지시킬 수 있다는 장점이 있지만 피하주사 제형에 비해 환자의 불편함과 비용, 투약시간 면에서는 단점으로 꼽히고 있습니다. 따라서 입원이 불필요한 외래환자들의 경우 환자의 편의성을 증대시키기 위해 약물전달 방식으로 피하주사 제형을 선호하고 있습니다. 특히 최근에는 환자들의 삶의 질 향상을 위해 일상생활 비중도 치료과정에서 중요한 가치로 받아들여지고 있어 최대한 빠르게 투여하기 위한 피하주사방식으로 제형변경이 이뤄지고 있는 추세입니다(출처: Aaron C. Anselmo et al., Nature Reviews Drug Discovery, 2019). 졸레어®는 현재 정맥주사와 피하주사 방식의 두가지 제형 모두 유통 중이어서 주사 제형의 측면에서 시장의 수요를 충족하고 있는 상황입니다. 당사의 GI-301은 초기 임상개발 단계에서부터 이미 피하주사 제형으로 개발하여 상기와 같은 시장의 수요를 충족시킬 수 있는 방향으로 개발되고 있습니다. 또한, 현재 4주 제형 뿐만 아니라 8주 제형으로의 개발가능성을 감안하여 (주)유한양행에서 임상 진행 중에 있어 보다 우수한 투약의 편의성을 가질 것으로 예상됩니다.
한편, 졸레어®의 특허만료가 다가옴에 따라 노바티스(Novartis)사는 졸레어®의 기능을 개선하고 적응증을 확대한 후속약물로서 차세대 항 IgE 항체인 리겔리주맙(ligelizumab)을 연구 개발하여 21년 1월에 FDA로부터 만성 특발성 두드러기 치료제로 혁신치료제(Breakthrough Therapy) 지정을 받았습니다.리겔리주맙은 졸레어®에 비하여 IgE와 결합 친화력을 증가시킨 약물로 6주 이상 지속되는 만성 특발성 두드러기의 주 원인인 IgE와 FcεRI 결합을 억제하는데 더 효과적이며 투여용량 또한 줄일 수 있는 것으로 알려졌습니다. 하지만 2021년 12월 리겔리주맙은 만성 특발성 두드러기를 적응증으로 한 임상 3상에서 표준치료제인 졸레어® 대비 우월성(superiority) 입증에 실패해 임상이 중단되었습니다. 구체적으로 이는 리겔리주맙이 졸레어® 대비 결합력이 향상된 aIg-E 항체 약물로 개발되었음에도 IgE에 대한 해리(dissociation, 분리) 정도가 빨라 혈중 유리(free) IgE 수준이 빠르게 기저 수준으로 되돌아올 뿐만 아니라, 졸레어®의 단점으로 지적되는 높은 IgE 레벨에 대한 리겔리주맙의 저해 능력이 오히려 졸레어®보다 좋지 않은 등 우월성 입증에 실패했기 때문입니다. 또한, 2024년 1월에는 리겔리주맙을 이용한 식품 알레르기에 대한 임상 3상이 중단되었습니다만, 2024년 2월 졸레어®가 식품 알레르기 반응을 사전에 감소시킬 수 있는 약물로 FDA의 승인을 받았습니다.
 |
|
리겔리주맙의 임상 결과 |
| 출처: | 당사 제공 |
반면, 당사가 개발한 GI-301의 경우 임상 1상 단계에서 IgE에 대한 결합력과 중화능 모두 졸레어® 대비 우수한 것으로 측정되었습니다. 아래 그림을 보면, 졸레어®의 경우 시간이 경과함에 따라 IgE의 결합력이 감소하는 반면, GI-301의 경우 시간이 경과함에도 IgE 결합력이 약 70배 높게 유지되고 있음을 확인할 수 있습니다. 또한, GI-301은 보통 수준(IgE 30-700 IU/mL)과 높은 수준의 IgE 레벨(IgE > 700 IU/mL)의 시험군에서 모두 우수한 유리(free) IgE 억제 능력을 확인하였기 때문에 리겔리주맙과 같은 임상 실패를 겪지는 않을 것으로 예상하고 있습니다.
 |
|
GI-301과 졸레어의 IgE 결합력 비교 |
| 출처: | 당사 실험결과 |
또한, 인체 내에서 IgE의 결합 수용체는 FcεRI 외에 CD23도 존재하고 있으나, 리겔리주맙은 만성 특발성 두드러기를 유발하는 IgE과 FcεRI 간의 결합과 관련된 부분만 졸레어® 대비 우수하게 제어하고, IgE와 CD23((FcεRII) 간의 결합에 대해서는 졸레어® 대비 억제 능력이 떨어지는 것으로 보고되었습니다. 이와 같은 기전적 연구는 특히 알레르기 천식 환자에서 규명이 되었습니다(출처: Jordis Trischler, Ligelizumab treatment for severe asthma: learnings from the clinical development programme, 2021).
 |
|
졸레어와 리겔리주맙의 메커니즘 차이 |
| 출처: | 당사 제공 |
일반적인 유리 IgE는 대식세포에 존재하는 FcεRIa에 대해 강한 결합을 하며, CD23에 대해서는 비교적 약하게 결합합니다. 그러나 항원제시세포에서 세포 표면에 존재하는 CD23은 응집화되어 IgE와의 결합력이 강해지며, 이러한 IgE와 CD23 간의 결합은 B세포의 IgE 생성을 촉진합니다. 이로 인해 IgE와 CD23 간의 결합을 효율적으로 억제하지 못한다면 약효는 감소될 수 있습니다. 반면, GI-301은 유리 IgE 중화 능력뿐 아니라 IgE와 CD23 간의 기존 결합을 제거하고 새로운 결합 또한 억제하는 효과를 확인하였습니다. 이는 리겔리주맙의 실패에도 GI-301에 대한 기대감을 가질 수 있는 요인이 되고 있습니다.
 |
|
GI-301의 IgE-CD23 간 결합 억제능력 |
| 출처: | 당사 실험결과 |
추가적으로, 졸레어®의 자가항체를 보유하고 있는 만성 특발성 두드러기 환자들에 대한 치료 반응성이 떨어지는 문제를 리겔리주맙 또한 지니고 있으나, GI-301은 약물 디자인 시기에 이미 자가항체에 대한 저해능을 감안하여 제작되었기 때문에 졸레어®와 리겔리주맙 대비 우수한 효능을 나타낼 수 있을 것으로 판단하고 있습니다.
졸레어® 외 현재 시판 중인 항알레르기 생물학적 치료제로는 듀피젠트®와 싱케어®가 있습니다. 먼저, 사노피(Sanofi)와 리제네론(Regeneron)이 공동 개발한 천식 및 아토피 피부염 치료제 듀피젠트®는 중증 아토피 환자에게 효과가 클 것으로 기대되는 신약이며, 인터류킨 4 수용체(IL-4Rα) 차단을 통해 아토피 및 알레르기 질환에 관여하는 인터류킨 4(IL-4)와 인터류킨 13(IL-13)의 신호전달을 조절함으로써 알레르기 증상을 완화시킵니다(출처: Jennifer D Hamilton et al., ImmunoTherapy, 2015). 듀피젠트®은 아토피 피부염 환자들 뿐만 아니라 조절이 안되는 지속적인 소아 천식환자들에게서 효과, 호산구성 식도염, 식품ㆍ환경 알레르기, 만성 폐쇄성 폐질환(COPD) 및 기타 각종 피부질환 등 2형 염증에 의해 촉발되는 다른 질환들에도 적응증이 확장되고 있습니다. 듀피젠트®의 연간 치료제 가격은 3만 7,000달러로 알려져 있으며 2023년 매출은 116억 달러입니다. 약물의 우수성과 광범위한 적응증에 효과적이어서 글로벌 알레르기 시장에서 급속한 신장세를 올리고 있으며 높은 점유율을 차지하지만, 상대적으로 타 제품에 비해 높은 비용이 들며 복잡한 발병원인에 따른 미충족 수요가 여전히 존재하며, 특히 약물의 부작용으로 결막염을 유발하고 있습니다(출처: Alison D Treister et al., JAMA Dermatol, 2018). 테바(TEVA)사의 싱케어®는 호산구의 성숙ㆍ생존ㆍ활성에 작용하는 사이토카인인 인터류킨 5(IL-5)를 타깃으로 하는 단일클론항체 약물로 천식에 효과적인 약물입니다. 싱케어®는 IL-5에 특이적으로 결합하여 호산구의 분화, 성숙 및 활성화를 감소시킵니다. 이에 따라 중증 호산구성 천식환자에서 악화율을 줄이고 폐 기능 및 천식을 개선합니다. 가장 흔한 부작용으로는 천식 악화 증상, 비인두염, 상부 호흡기감염, 부비동염, 인플루엔자 및 두통 등이 발생합니다(출처: 테바 홈페이지).
추가로 IL-5를 표적으로 항체로 허가받은 제품으로는 글락소스미스클라인(GSK)사의중증 천식치료제인 누칼라®(Nucala, 성분명: 메폴리주맙(mepolizumab))과 IL-5 수용체(IL-5Rα)를 표적하는 항체의약품인 파센라®(Fasenra, 성분명: 벤랄리주맙(benralizumab)) 등이 있습니다. 특히, 파센라®는 아스트라제네카의 차기 알레르기 주력약물로서, 천식악화와 비인두염 발생률을 최대 51%까지 낮추고 폐기능 개선효과를 입증한 약물로서 향후 IL-5 타깃 제제인 싱케어® 및 누칼라®와 시장에서 경쟁할 것으로 예상됩니다(출처: GSK, 아스트라제네카 홈페이지). 한편, 릴리(Lilly)가 개발한 아토피피부염 치료제 레브리키주맙(lebrikizumab)은 IL-13에 대한 친화도를 높이도록 고안된 단클론항체로서, 가려움증, 수면, 전반적인 삶의 질 향상에 효과를 보이고 있으며 2023년 EU와 2024년 FDA에서 승인을 득하였습니다(출처: 일리아 릴리 홈페이지). 또한 암젠과 아스트라제네카가 공동으로 개발 중인 테제펠루맙(tezepelumab)은 천식을 치료하는 인간 단일클론항체로, 기도염증을 유발하는 중요한 기전으로 보고되는 '흉선 기질상 림포포이에틴(thymic stromal lymphopoietin, TSLP)'에 특이적으로 결합을 하며, 천식이 조절되지 않는 중증 환자를 대상으로 출시되었습니다(출처: 암젠, 아스트라제네카 홈페이지).
GI-301은 상기의 사이토카인류를 타깃으로 하는 제품 대비 상위 신호 체계인 IgE를 저해함으로써, 하위 신호 체계인 알레르기 유발 사이토카인들의 분비 역시 저해할 수 있는 장점을 가지고 있습니다. 특히, 주로 단일 사이토카인만을 저해하는 기전의 경쟁 약물과는 달리, GI-301은 IgE를 저해함으로써 하위 신호 단계의 다양한 사이토카인을 전반적으로 저해할 수 있어 다양한 사이토카인 매개 알레르기 질환에 적용 가능할 것으로 예측하고 있습니다.
 |
|
IgE, 사이토카인 및 JAK inhibitor의 기전적 차이 |
| 출처: | Stauber et al., PNAS 2006; Charyah et al., PLOS ONE 2017; 당사 편집 |
당사는 이러한 기존 IgE 및 사이토카인류를 타깃으로 하는 제품 대비 기전적 차별성을 기반으로 생체 내 IgE를 강력하고 효과적으로 제거함으로써 다양한 IgE 매개 알레르기 질환에 적용 가능한 치료제를 개발하는 것을 목표로 하고 있습니다.
그럼에도 불구하고, 알레르기 치료제 시장의 높은 성장성을 보고 많은 다국적 제약바이오 기업들이 자금력 및 기술경쟁력을 바탕으로 임상을 확대하여 속도를 내고 있다는 점은 당사에게 위협요소로 작용할 수 있습니다. 또한 경쟁물질이 GI-301보다 빠르게 임상에 성공하여 시장에 진입할 경우, GI-301의 시장 경쟁력이 약화될수 있습니다. GI-301이 경쟁력을 상실할 경우, 당사 재무상태에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하여 주시기 바랍니다.
(3) 대사면역항암제 시장
최근 3세대에 해당하는 면역항암제에 이어, 아데노신(adenosine) 신호전달체계를 표적으로 하는 4세대 항암제인 대사면역항암제의 개발이 다양한 글로벌 제약사에서 활발하게 이루어지고 있습니다. 특히, 종양미세환경에서 항암활성을 방해하는 아데노신의 생성을 억제하기 위한 방법으로 항 CD73 항체, 항 A2AR 항체 및 표적항암제 등의 개발이 활발하게 이루어지고 있습니다. CD73은 종양 미세환경 내 대사면역 억제물질인 아데노신을 생성해 암세포의 면역활성을 억제하고 약물 저항성을 높이는 것으로 알려져 있습니다. 구체적으로, 항암요법을 통해 암세포가 사멸하면 죽은 암세포의 밖으로 ATP(Adenosine TriPhosphate, 아데노신삼인산)가 방출됩니다. ATP는 면역억제 세포의 표면에서 높은 발현을 보이는 단백질인 세포의 에너지원인 CD39에 의해 분해되어 AMP(Adenosine MonoPhosphate, 아데노신 일인산)로 변환되며, AMP는 다시 암세포와 면역세포에 발현해 AMP를 아데노신으로 만드는 세포막 효소인 CD73에 의해 아데노신으로 변환됩니다. 아데노신은 세포 내부에 있을 때는 에너지 대사와 핵산 합성에 꼭 필요한 물질로 작용하지만 세포 울타리 밖, 즉 세포 외부에서는 아데노신 수용체를 이용한 세포 간 신호전달을 통해 전혀 뜻밖의 면역억제 활동을 합니다. 아데노신은 T세포, NK세포 등 다양한 면역세포에 설치된 A2AR(A2A adenosine Receptor, A2A 아데노신 수용체)와 A2BR(A2B adenosine Receptor, A2B 아데노신 수용체)라는 수용체와 접촉하며, 이는 T세포를 면역 억제 작용을 하는 조절 T세포로 분화되도록 유도하여 종양 상태에서 면역기능이 억제되도록 작용합니다.
따라서, 바이오 회사들은 CD73이 과발현된 종양세포를 표적화하여 AMP의 분해로 인한 아데노신을 억제시킴으로써 종양 매개 면역억제 시스템의 개선을 유도하는 항 CD73 항체를 개발 중에 있습니다. 현존하는 약물 중 당사의 GI-108과 같이 CD73 및 IL-2 수용체를 동시에 타깃하는 단일 약물은 전무하지만, 현재 항 CD73 항체를 개발하고 있는 경쟁사의 대표적인 의약품 후보물질로는 글로벌 제약사인 아스트라제네카(Astrazeneca)의 올레클루맙(oleclumab; MEDI9447), BMS(Bristol Myers Squibb)의 BMS-986179, I-MAB의 우릴레들리맙(uliledlimab; TJ004309), Corvus Pharmaceuticals의 무파도리맙(Mupadolimab; CPI-006) 등이 있습니다.
| [항 CD73 제제 개발 현황] |
| 제품명(또는 성분명) /특성 |
개발사 | 요법 및 허가 /적응증 |
개발 현황 |
| Oleclumab / 항 CD73 항체 |
아스트라제네카 (AstraZeneca) |
Oleclumab+임핀지®/ 비소세포성폐암 |
임상3상 진행 중 |
| Uliledlimab / 항 CD73 항체 |
I-Mab | Uliledlimab+록토르지®/ 비소세포성폐암 |
임상2상 진행 중 |
| BMS-986179 / 항 CD73 항체 |
BMS | 단독 및 옵디보® 병용/ 전이성대장암 및 난소암, 고형암 |
임상1/2상 종료 |
| Mupadolimab (CPI-006) /항 CD73 항체 | Corvus | 단독/ 구인두암, 두경부암 및 췌장암, 대장암 및 삼중음성유방암을 포함하는 고형암 |
임상2상 진행 중 |
| Quemliclustat / CD73 저해제 |
Arcus | Quemliclustat+gemcitabine/nab-paclitaxel/ 전이성 췌관선암 |
임상2상 완료 및 임상3상 계획 중 |
| 출처: | 각 사 홈페이지, 보도자료 |
글로벌 제약사 아스트라제네카가 개발한 항 CD73 항체인 올레클루맙(oleclumab)은 미국암연구학회(American Association for Cancer Research, AACR) 2022 연례학술회의에서 절제 가능한 조기 비소세포폐암 환자의 수술 전 보조요법으로 아스트라제네카가 개발한 항 PD-L1 항체인 임핀지®단독요법과 항 CD73 항체 올레클루맙 병용요법을 비교한 무작위 배정, 레이블 공개 임상 2상 NeoCOAST 연구 결과를 공개하였는데, 연구 결과 주요병리학적 반응률은 올레클루맙 병용요법군이 19.0%로 임핀지 단독요법군(11.1%)보다 높아 기대감을 높였습니다. 특히, 면역치료제에 대한 반응이 낮은 PD-L1 저발현 환자에서 올레클루맙 병용요법군의 12개월 무진행생존비율이 62.6%로, 임핀지® 단독요법군의 33.9%보다 약 두 배 높은 생존률을 보인 바 있습니다. 이를 기반으로 2022년 초부터 절제 불가능한 3기 비소세포폐암(NSCLC) 환자에서 임핀지®와 oleclumab의 병용 요법 임상 3상을 진행 중에 있습니다.
아이맙바이오파마(I-Mab Biopharma)가 개발한 항 CD73 항체인 우릴레들리맙(uliledlimab)은 최근 ASCO 2023에서 발표된 우릴레들리맙+록토르지® 병용요법에 대한 1b/2상 임상 데이터를 통해 다양한 PD-L1 및 CD73 발현 수준을 보이는 환자 중 31.3%의 객관적 반응률(ORR)을 입증했습니다. 특히, CD73 발현이 높은 환자는 PD-L1 발현이 특정 역치 이상인 환자의 경우 63%로 더 높은 ORR을 나타냈습니다. 이는 CD73 발현이 NSCLC 환자의 효능을 개선하기 위한 치료 결정을 안내하는 예측 바이오마커 역할을 할 수 있음을 시사합니다. 최근 우릴레들리맙의 중국 지역 개발 및 판매 권리는 2024년 9월에 Sanofi에 인수되었습니다.
Arcus사가 저분자 치료제로 개발중인 CD73 저해제 quemliclustat은 앞서 치료를 받은 적이 없는 전이성 췌관선암 환자들을 대상으로 진행한 임상 1/1b상에서 기존 화학치료제와 병용요법으로 투여 시 환자의 사망 위험률을 37% 감소시키는 것으로 보고되었습니다. 특히, 역사적 결과 분석에 따르면 특정 화학치료제의 평균생존기간이 9.8개월인 반면, 위 실험에서 quemliclustat과 화학치료제의 병용군에서는 평균생존기간이 약 19.4개월로 나타나 매우 고무적인 항암 효능을 확인되었습니다. 이 외에도 폐암 및 상부 위장관 암에 대한 임상 2상 시험도 현재 Gilead사와 협력하에 진행 중이며, 2025년에는 췌장관암에서 임상 3상 시험이 개시 될 예정입니다. 최근 일본의 Taiho 제약이 quemliclustat의 일본과 특정 아시아 지역에서의 개발 및 판매 권리를 인수하였습니다.
당사는 GI-108을 단독 개발하는 것보다는 타 면역항암제 또는 ADC와 병용 투약하는 것을 임상개발 전략으로 하고 있습니다. 실제 암세포는 다양한 내성 획득 기전을 가지므로 한 가지 기전을 억제하는 약제로는 충분한 치료 효과를 내기 어려운 경우가 많으며, 항암 면역세포를 활성화시킬 수 있는 다양한 약제와 병용하는 것이 반드시 필요합니다. 병용 시 가장 어려운 점은 각각의 약제가 가진 독성으로 병용으로 인해 독성이 증강되는 것인데, GI-108은 원숭이 독성 시험 등을 토대로 하였을 때 안전성과 내약성을 가지고 있는 것으로 판단되며 ADC 등과 병용하여도 무리가 없을 것으로 사료되는 데이터가 도출되어 병용 투약을 임상개발 전략으로 하고 있습니다. 종양미세환경을 구현한 in vitro 실험(생체 내부가 아니라 시험관 내에서 진행하는 실험)에서 기존의 IL-2 제제나 경쟁 항 CD73 항체 치료제의 경우, 림프구의 일종이자 종양세포 등을 사멸시키는 세포 독성 CD8+ T세포의 재활성화 측면에서 효능이 제한적으로 나타나는 것을 확인한 반면, 당사가 개발 중인 GI-108의 항 CD73 항체 절편의 인간 체내 CD73에 대한 효소활성 저해능을 평가하였을 때 경쟁약물인 올레클루맙 대비, 특정 분석물질이 매우 고농도로 존재 시 반응이 억제되는 현상인 Hook Effect 없이 동등한 수용성 CD73 효소활성 저해능을 가짐을 확인하였습니다.(아래 그림 참고. Fc-IL-2v는 면역증강제, Competing Program + Fc-IL-2v는 올레클루맙 + 면역증강제를 의미)
 |
|
GI-108과 올레클루맙 간 CD73 억제능 비교 |
| 출처: | 당사 실험결과 |
 |
|
GI-108의 세포독성 T세포 증식 데이터 |
| 출처: | 당사 실험결과 |
이러한 당사 후보물질의 경쟁력에도 불구하고, 당사가 개발 중인 후보물질의 임상 시험, 성공 및 시판 허가 시기가 경쟁사 대비 늦어질 위험이 존재합니다. 또한, 동일 시장 내 신규 경쟁 업체의 진입 증가, 의학적 미충족 수요의 변화, 유사 기전의 경쟁제품 연구개발 속도의 증가, 경쟁사 가격 및 마케팅 전략 변화, 당사 연구개발 속도 저하 등 다양한 이유로 인하여 당사 파이프라인의 경쟁력이 약화될 경우, 당사의 재무상태 및 실적에 부정적인 영향을 끼칠 수 있습니다. 뿐만 아니라 기술 수준 향상에 따라 항암제 패러다임이 계속해서 변해왔듯이 향후 시장 환경의 변화, 새로운 치료요법의 등장 등으로 인해 당사의 제품이 글로벌 트렌드에 부합하지 않을 경우 신약 개발 성공 및 수익창출 가능성이 당사의 예상보다 낮아질 가능성이 존재합니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 사. 핵심인력 유출에 따른 위험 본 공시서류 제출일 현재 당사는 박사급 22명, 석사급 30명 등 총 65명의 연구 인력을 보유하고 있습니다. 당사와 같은 신약 연구개발 기업은 관련 분야의 지식 및 경험이 풍부한 전문인력을 통해 핵심 경쟁력 확보가 가능합니다. 이에 따라, 당사는 기존의 우수한 인력의 장기근속을 유도하고 외부의 우수 인력 충원을 통해 핵심 경쟁력을 확보하고자 합리적인 보상체계를 설계하고 직무발명보상제도를 도입하는 등 제도적인 장치를 마련하였으며, 총 14차례에 걸친 주식매수선택권 부여를 통해 임직원의 사기를 고취하는 등 핵심인력의 유지를 위해 다양한 조치를 취하고 있습니다. 이처럼 당사는 주식매수선택권 부여 등을 통해 우수 연구개발인력 확보 및 기존인력의 이탈을 최소화하기 위한 노력을 기울이고 있습니다. 하지만, 당사의 국내외 연구개발 인력과 동등한 경쟁력을 가지고 있는 대체 인력이 풍부하지 않기에 핵심 연구 인력의 유출은 그동안 당사가 개발한 기술과 연관된 노하우 등 잠재적 기술유출을 수반할 위험이 존재합니다. 해당 인력이 이탈 하는 경우, 현재 계획 또는 진행 중인 임상실험이 지연될 수 있으며, 그에 따른 당사 신약후보물질에 대한 상업화가 둔화 될 수 있는 가능성을 배제할 수 없습니다. 또한, 위와 같은 당사의 노력에도 불구하고 핵심 인력 유치에 대한 당사가 영위하고 있는 사업 분야의 기업 간 경쟁 심화 등으로 인하여 핵심인력의 유출 및 기술관련 노하우 등의 기술 유출 위험이 발생할 가능성이 있으며, 당사의 성장성과 수익성 및 연구개발 일정 등에 부정적인 영향이 발생할 위험이 존재합니다. 투자자께서는 이점 유의하시기 바랍니다. |
당사의 본 공시서류 제출일 현재 조직도 및 주요 연구개발 인력 현황은 아래와 같습니다.
| [당사 연구개발조직 현황] |
 |
|
전체 및 연구개발 부문 조직도 |
| 주1) | 초록색으로 표시된 조직이 연구개발조직에 해당합니다. 신약개발 임상전략 총괄 내 3팀, EGS부문, 재무기획실, 인사전략실은 연구개발 조직에 해당하지 않습니다. |
| [연구개발조직별 주요 업무 내역] |
| 조직 구성 | 주요 업무 내용 | 인원 | 겸직인원 | ||
|---|---|---|---|---|---|
| 연구개발 총괄 (CTO) | 플랫폼 및 R&D 연구 총괄 | 1 | - | ||
| SMART 부문 | SMART 플랫폼 및 기술 연구 총괄 | 1 | - | ||
| SMART1팀 | 신규의약품 후보물질 스크리닝 및 초기공정확립 | 4 | - | ||
| SMART2팀 | 유력 후보물질 구조 최적화, 제형개발을 통한 안정성 확립, 고생산 세포주 CHO 제작 | 4 | - | ||
| R&D 부문 | R&D 연구 총괄 | 1 | 1 | ||
| 비임상팀 | 비임상 연구개발, 독성평가 | 3 | - | ||
| 품질평가팀 | 단백질의약품의 이화학적 품질 규격 및 특성 분석 | 4 | 1 | ||
| 공정개발1팀 | 단백질의약품 공정개발, 임상시험용 의약품 생산관리 | 4 | - | ||
| 공정개발2팀 | 단백질의약품 공정개발, 임상시험용 의약품 생산관리 | 3 | - | ||
| QA팀 | R&D품질 및 특허 관리 | 2 | - | ||
| 바이오분석팀 | 단백질의약품의 생물/면역학적 분석 및 생체시료 분석 | 5 | - | ||
| 신약개발 임상전략 총괄 (CSO) | 디스커버리, 중개연구, 임상개발 총괄 |
1 | - | ||
| 디스커버리 부문 | 디스커버리 연구 총괄 | 1 | - | ||
| 디스커버리1팀 | 대사질환치료제 신규타깃발굴, 스크리닝, 비임상 효능평가 | 4 | - | ||
| 디스커버리2팀 | 항암제 및 알레르기 치료제 신규 타깃 발굴, 스크리닝, 비임상 효능평가 | 3 | - | ||
| 임상중개전략 부문 | 임상연구 총괄 | 2 | - | ||
| 임상개발1팀 | 중개연구를 통해 독성 및 효능이 검증된 파이프라인의 글로벌 임상 운영 | 3 | - | ||
| 임상개발2팀 | 중개연구를 통해 독성 및 효능이 검증된 파이프라인의 글로벌 임상 운영 | 3 | - | ||
| 임상PV팀 | 임상시험용 의약품 부작용 모니터링, 안전성 관련자료 작성등을 포함한 약물 감시업무 | 3 | 1 | ||
| 임상전략팀 | 임상개발 전략 수립 및 임상 데이터 분석 | 4 | 1 | ||
| 임상기획팀 | 임상부문장 직속의 임상기획 업무 | 5 | 1 | ||
| 중개연구1팀 | 비임상 단계 개발 후보물질의 약효 평가, 효력 검증 및 약리 기전 연구 진행(GI-102) | 3 | - | ||
| 중개연구2팀 | 비임상 단계 개발 후보물질의 약효 평가, 효력 검증 및 약리 기전 연구 진행(GI-108) | 4 | - | ||
| 총 연구개발 인력 | 63 주1) | 5 주2) | |||
| 주1) | 본 공시서류 제출일 기준 각자 대표이사 2인, 신약개발 임상전략 총괄 내 사업전략팀, IR/PR전략팀, 특허팀 및 ESG부문 2팀, 재무기획실 1팀, 인사전략실 2팀 인력을 제외한 연구개발인력입니다. |
| 주2) | 겸직인원의 경우, 각각 R&D 부분은 연구개발 총괄(CTO), 품질평가팀은 바이오분석팀 인원 1명, 임상PV팀, 임상전략팀은 임상중개전략 부문 인원 1명, 사업전략팀은 바이오분석팀 인원 1명이 겸직 중입니다. |
본 공시서류 제출일 현재 당사는 박사급 22명, 석사급 30명 등 총 65명의 연구 인력을 보유하고 있으며 최근 3개년 및 2024년 3분기 당사의 핵심 연구개발 인력 현황은 다음과 같습니다.
| [최근 3개년 및 2024년 3분기 연구개발 인력 현황] |
| 구분 | 박사 | 석사 | 학사 | 합계 |
| 2021년 | 19명 | 36명 | 12명 | 67명 |
| 2022년 | 20명 | 32명 | 11명 | 63명 |
| 2023년 | 23명 | 31명 | 13명 | 67명 |
| 2024년 3분기 | 22명 | 30명 | 13명 | 65명 |
| [핵심 연구인력 현황] |
| 성명 | 직위 | 담당업무 | 주요경력 | 주요연구실적 |
| 장명호 | 사장 | 신약개발 임상전략 총괄 |
- (주)지아이이노베이션 신약개발 임상전략 총괄 사장, 현재 - (주)프로젠 CSO - (주)제넥신 Scientific Advisor - IBS 수석연구원 - Osaka Univ. 의과대학 부교수 - Osaka Univ. 면역학 박사 |
- 이중융합단백질 신약개발 - 마이크로바이옴 신약개발 (대사질환 및 크론병) - 항바이러스 백신 개발 |
| 조영규 | 부사장 | 연구개발 총괄 및 R&D부문장 |
- (주)지아이이노베이션 연구개발 총괄 및 R&D부문장, 현재 - (주)와이바이오로직스 부사장 - (주)한독 연구위원 - 포항공과대학교 분자면역학 박사 |
- 지속형 융합단백질 개발 - 항체 치료제 개발 - 이중항체 및 이중융합단백질 개발 - 단백질 치료제의 TPP, CMC, 전임상 |
| 고영준 | 부사장 | 임상중개전략부문장 | - (주)지아이이노베이션 임상중개전략부문장, 현재 - 동국대학교 한의학과 조교수 - (주)삼성전자 전문연구원 - 카이스트(KAIST) 의과학 박사 |
- GI-101 비임상 기전 연구 - 외부 연구기관 협업 및 공동연구 관리, 국가 연구과제 관리, 차세대 Pipeline 발굴 - 임상 시험을 위한 IB 작성 - 파트너사 및 투자사 Due Diligence 관련자료 정리 및 관리 |
| 오영민 | 전무 | SMART플랫폼부문장 | - (주)지아이이노베이션 SMART플랫폼부문장, 현재 - (주)제넥신 책임연구원 - (주)대웅제약 책임연구원 - 포항공과대학교 생명과학 박사 |
- 플랫폼 생산세포주 기술개발 - SMART-cLego, Selex 기술개발 - GI-101 이중융합단백질 개발, GI-10N, 20N, 30N 이중융합항체 개발 - 세포치료제 개발 |
| 윤나리 | 전무 | 임상중개전략부문장 | - (주)지아이이노베이션 임상중개전략부문장, 현재 - (주)한미약품 Project Leader - IQVIA 전략 컨설턴트 - 성균관대학교 약학 박사 |
- 단백질 신약 임상개발 전략수립 - 단백질 신약 기술이전 - 당뇨 비만 대사질환 글로벌 임상연구 - 포트폴리오 분석 약가 수립 기업 인수합병 등 전략 컨설팅 |
| 이경화 | 상무 | 비임상팀장 | - (주)지아이이노베이션 비임상팀장, 현재 - 서울대학교 시스템면역의학연구소 기획팀장 - (주)프로셀제약 책임연구원 - 배제대학교 화학 박사 |
- 나노바디 개발, 재조합 단백질치료제 개발 - 항암후보물질 발굴 및 기전 연구 - DNA 손상/회복 연구 - 항산화 단백질 작용기전 연구 |
| 김국환 | 상무 | 디스커버리부문장 | - (주)지아이이노베이션 디스커버리부문장, 현재 - (주)지아이이노베이션 디스커버리팀장 - 연세대학교 의생명과학부 연구조교수 - 부산대학교 분자생물학 박사 |
- 당뇨, 비만 치료제 및 제어 기전 연구 - 비알콜성지방간염 치료제 및 제어 기전 연구 - 자가포식 제어 기전 및 치료제 개발 연구 |
| 김지수 | 이사 | 품질평가팀장 /바이오분석팀장 |
- (주)지아이이노베이션 품질평가팀장/바이오분석팀장, 현재 - (주)삼성바이오에피스 전문 - (주)셀트리온 과장 - 고려대학교 생명공학 박사 |
- 항체 및 재조합 단백질 기반 바이오시밀러 및 신약개발 - 단백질의약품 면역학적, 생물학적 특성, 비임상/임상 약동력학 및 면역원성 분석 - 프로테오믹스 기반 질병/노화 관련 바이오마커 발굴 - 중간엽줄기세포 분화 및 배양액 치료효능 연구 |
| 이우열 | 이사 | 임상기획팀원 | - (주)지아이이노베이션 임상기획팀원, 현재 - 신촌세브란스병원 임상약리학 강사 - 신촌세브란스병원 임상약리학 전공의 - 연세대학교 의과대학 박사 |
- GI-101 국내외 임상시험 약물 감시업무 - GI-101 PK /PD model development and simulation - GI-101 Clinical trial strategy development |
| 김수현 | 이사 | 공정개발1팀장 | - (주)지아이이노베이션 공정개발1팀장, 현재 - 지아이셀 세포제조배양팀팀장 - 삼성바이오로직스 연구원 - 고려대학교 분자생물학 석사 |
- 바이오시밀러 배양공정개발 - 항바이러스 백신 배양공정개발 - 이중융합단백질 배양공정개발 - 세포치료제 배양공정개발 |
| 이우형 | 이사 | 임상기획팀장 | - (주)지아이이노베이션 임상기획팀장, 현재 - IQVIA Singapore 임상연구담당 - 홍콩과기대학교 MBA - 서울대학교 약학대학 박사 |
- 바이오신약 임상수행 및 개발(당뇨, 대사질환) - 백신 및 감염병 임상 수행 - 신생혈관억제화합물 및 항염증 화합물 연구 - 제약/의료기기 상업화 전략 수립 |
| 임신생 | 이사 | QA팀장 |
- (주)지아이이노베이션 QA팀장, 현재 - (주)지아이이노베이션 QC/QA팀장 - 서울대학교 구강악안면외과 연구실 |
- 연구개발 품질시스템 구축 및 관리 - 연구개발 문서 검토 및 관리 - 단백질의약품품질시험법 개발 및 단백질특성분석시험 검토 - 위·수탁 제조 및 품질시험 문서 검토 및 관리 |
당사와 같은 신약 연구개발 기업은 관련 분야의 지식 및 경험이 풍부한 전문인력을 통해 핵심 경쟁력 확보가 가능합니다. 이에 따라, 당사는 기존의 우수한 인력의 장기근속을 유도하고 외부의 우수 인력 충원을 통해 핵심 경쟁력을 확보하고자 합리적인 보상체계를 설계하고 직무발명보상제도를 도입하는 등 제도적인 장치를 마련하였으며, 총 14차례에 걸친 주식매수선택권 부여를 통해 임직원의 사기를 고취하는 등 핵심인력의 유지를 위해 다양한 조치를 취하고 있습니다. 당사의 주식매수선택권 부여 내역은 다음과 같습니다.
| [주식매수선택권 부여 내역] | |||
| (기준일: | 본 공시서류 제출일 전일 | ) | (단위 : 원, 주) |
| 회차 | 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
미행사수량 | 행사기간 | 행사가격 | 의무 보유 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | |||||||||
| 3 주2) |
오영민 외 2인 | 미등기임원 | 2018년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 188,083 | 81,003 | 89,101 | 2020년 03월 29일 ~ 2029년 03월 29일 |
1,433 | 1,433 | O |
| 7 (주2) |
조영규 외 6인 | 미등기임원 등 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 1,150,568 | 906,524 | 997,170 | 2021년 11월 26일 ~ 2029년 03월 29일 |
6,250 | 6,250 | O |
| 7 주2) |
OOO외 11인 | 직원 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 303,810 | 38,396 | 42,233 | 2021년 11월 26일 ~ 2026년 11월 25일 |
6,250 | 6,250 | X |
| 8 | 조영규 외 7인 | 미등기임원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 327,953 | 279,807 | 307,782 | 2022년 03월 30일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 8 | OOO 외 12인 | 직원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 263,248 | 112,795 | 124,067 | 2022년 03월 30일 ~ 2027년 03월 29일 |
9,682 | 9,655 | X |
| 9 | 김국환 외 5인 | 미등기임원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 300,473 | 224,982 | 247,477 | 2022년 10월 05일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 9 | OOO 외 12인 | 직원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 220,021 | 140,484 | 154,524 | 2022년 10월 05일 ~ 2025년 10월 04일 |
9,682 | 9,655 | X |
| 10 | 홍준호 | 등기임원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 263,981 | 239,983 | 263,981 | 2023년 03월 26일 ~ 2029년 03월 29일 |
15,592 | 14,355 | O |
| 10 | OOO 외 5인 | 직원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 122,986 | 109,992 | 120,986 | 2023년 03월 26일 ~ 2026년 03월 25일 |
15,592 | 14,355 | X |
| 11 | 홍준호 | 등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 219,984 | 199,986 | 219,984 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | 김은성 | 미등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 54,995 | 49,996 | 54,995 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | OOO외 7인 | 직원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 137,183 | 111,991 | 123,184 | 2023년 06월 16일 ~ 2026년 06월 15일 |
17,046 | 15,512 | X |
| 12 | 이병건 | 등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 549,962 | 499,966 | 549,962 | 2025년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | 이우열 외 2인 | 미등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 135,986 | 59,995 | 65,993 | 2024년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | OOO외 22인 | 직원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 370,681 | 247,567 | 272,294 | 2024년 03월 03일 ~ 2029년 03월 02일 |
17,046 | 15,512 | X |
| 13 | 이병건 | 등기임원 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 329,976 | 299,979 | 329,976 | 2025년 06월 13일 ~ 2028년 06월 12일 |
11,418 | 11,036 | X |
| 13 | 이우형 외 14인 | 미등기임원 등 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 227,740 | 197,970 | 217,742 | 2025년 06월 13일 ~ 2030년 06월 12일 |
11,418 | 11,036 | X |
| 14 | 임신생 외 11인 |
미등기임원 등 | 2024년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 173,200 | 112,000 | 123,200 | 2026년 03월 29일 ~ 2031년 03월 28일 |
12,720 | 12,071 | X |
| 합계 | - | - | - | - | 5,340,830 | 3,913,416 | 4,304,651 | - | - | - | - | |
| 주1) | 본 공시서류 제출일 전일 기준 당사 주식의 종가는 15,530원 입니다. |
| 주2) | 해당 회차의 경우 유상증자에 의해 주식매수선택권의 행사가격이 조정되지 않습니다. |
| 주3) | 부여받은 자에 기재된 직원수는 주식매수선택권 부여 당시 직원 수입니다. |
| 주4) | 현재 재직 중인 임직원의 관계는 본 공시서류 제출일 전일 현재의 현황을 기재하였습니다. |
| 주5) | 최초부여수량 및 행사가격에는 유ㆍ무상증자 및 주식분할로 인한 조정된 수량과 행사가격을 반영하였습니다. |
| 주6) | 의무보유가 있는 주식매수선택권의 경우 「코스닥시장 상장규정」제26조에 따라 상장일(2023년 03월 30일)로부터 3년 혹은 1년 의무보유 대상입니다. |
| 주7) | 상기 부여된 주식매수선택권 중 취소된 부여물량은 의무적으로 재임 또는 재직하여야 하는 기간에 대한 조건을 갖추지 못하고 퇴직함으로 인해 발생하였습니다. |
상기와 같이, 당사는 주식매수선택권 부여 등을 통해 우수 연구개발인력 확보 및 기존인력의 이탈을 최소화하기 위한 노력을 기울이고 있습니다. 그러나, 당사의 국내외 연구개발 인력과 동등한 경쟁력을 가지고 있는 대체 인력이 풍부하지 않기에 핵심 연구 인력의 유출은 그동안 당사가 개발한 기술과 연관된 노하우 등 잠재적 기술유출을 수반할 위험이 존재합니다. 해당 인력이 이탈하는 경우, 현재 계획 또는 진행 중인 임상실험이 지연될 수 있으며, 그에 따른 당사 신약후보물질에 대한 상업화가 둔화 될 수 있는 가능성을 배제할 수 없습니다. 또한, 위와 같은 당사의 노력에도 불구하고 핵심 인력 유치에 대한 당사가 영위하고 있는 사업 분야의 기업 간 경쟁 심화 등으로 인하여 핵심인력의 유출 및 기술관련 노하우 등의 기술 유출 위험이 발생할 가능성이 있으며, 당사의 성장성과 수익성 및 연구개발 일정 등에 부정적인 영향이 발생할 위험이 존재합니다. 투자자께서는 이점 유의하시기 바랍니다.
| 아. 정책 및 규제 변화에 따른 위험 제약ㆍ바이오산업은 대표적인 미래 성장 산업으로 각국 정부가 적극적인 육성 정책을 시행하고 있습니다. 제약바이오 산업에 대한 전세계적인 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에도 불구하고, 실제 효율적인 정책 지원이 이루어지지 않거나, 세부 과제 추진에 어려움이 생길 수 있습니다. 또한, 우호적인 정책이 시행된다 하더라도 관련 시설 건설 및 가동, 관련 기관 협의, 규제 당국 심사 등의 과정으로 인해 즉각적인 영향을 끼치지 못할 수 있습니다. 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 인해 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않다고 판단될 경우 규제 완화의 범위도 축소될 수 있습니다. 이처럼 정책 지원이 조속히 실행되지 않거나 정부 지원이 축소될 경우, 당사의 신약 개발 일정이 지연될 수 있으며 기술이전 지연, 마일스톤 미달성 등에 따라 매출이 감소할 수 있습니다. 당사는 이러한 정책 및 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 하고 있지만, 그럼에도 불구하고 국내외 정책 등의 변동에 따른 위험이 존재하오니 투자자께서는 이러한 위험에 대해 유의하시기 바랍니다. |
제약바이오산업은 대표적인 미래 성장 산업으로 각국 정부가 적극적인 육성 정책을 시행하는 한편 환자 보호 측면에서 인허가 및 약가 결정에 각국 정부가 엄격하게 개입하는 양면적 특성을 가지고 있습니다.
신약 개발사업은 긴 투자기간과 높은 위험을 수반하지만 신약 개발에 성공할 경우 막대한 가치 창출이 가능하며, 신약 개발을 통해 국민들에게 양질의 의약품을 보급함으로써 국민의 생명연장과 삶의 질 향상이라는 공공적 가치 달성도 가능합니다. 또한, 제약산업계는 양질의 일자리 창출을 선도하고 있습니다. 저성장기조에 따른 제조업계 전반의 고용감축 흐름과는 달리 매년 지속적인 인력 채용으로 제약산업 종사자는 지속 증가하고 있으며, 전세계적으로 제약산업은 제조업은 물론 전 산업 평균 부가가치율을 크게 상회하고 있습니다.
(1) 미국 및 주요 선진국 정책 및 규제
주요 선진국들은 제약사들의 신약 연구개발 및 인허가에 소요되는 막대한 비용 부담을 줄일 수 있도록 다양한 규제장벽을 완화하는 정책 또한 적극적으로 펼치고 있습니다. 대표적으로 최신의 제약바이오 기술들을 위중한 상태에 있는 환자들에게 신속하게 전달할 기회를 제공하기 위해 조건부 신속허가를 제도적으로 정착하려는 노력이 진행되고 있습니다. 미국은 가속 승인(accelerated approval) 제도를 통해 기존의 치료 요법으로는 해결되지 않는 중증질환을 대상으로 신약을 조기에 승인해주는 제도를 운영하고 있으며, 유럽은 미충족 의료수요를 충족하는 일부 의약품에 대해 시판 후 임상적 확증시험 이행을 조건으로 조기 허가하는 조건부 허가(conditional marketing authorization)와 임상적 확증시험이 어려운 희귀 질환을 대상으로 하는 예외적 허가(marketing authorization under exceptional circumstances) 등의 제도가 시행되고 있습니다. 일본은 생명을 위협하거나 중증의 질환을 대상으로 하는 세포치료제를 포함하는 '재생의료 등 제품'에 대하여 조건 기한부 허가 제도를 운영하고 있습니다.
바이오 산업은 위와 같은 정부의 지원을 받음과 동시에 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 바이오 산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업이기 때문에 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 엄격한 규정 및 절차가 적용됩니다.
| [제약ㆍ바이오산업과 관련된 주요법령 및 규제] |
| 국가 | 법규 | 주요내용 |
|---|---|---|
| 국제 | ICH 가이드라인 (국제의약품규제조화위원회) |
- 의약품 허가, 관리 규정의 통일 표준화를 위한 가이드라인. - 미국, 유럽, 일본, 싱가포르, 터키, 대만 등 가입 |
| 미국 | Federal Food, Drug and Cosmetic Act | - 미국 의약품 관련 법 |
| Guidance for Industry, Process Validation: General Principles and Practices (FDA) |
- 의약품의 품질관리 등에 관한 FDA 규정 | |
| 유럽 | DIRECTIVE 2001/83/EC OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL |
- 유럽 의약품 관련 법 * Regulation (EC) No 1394/2007(첨단의약품 규정) * Commission Regulation (EC) No 668/2009(첨단의약품 규정) * Regulation (EC) No 141/2000(희귀의약품 규정) |
| Directive 2003/94/EC OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL |
- 의약품의 품질관리 등에 관한 EMA(유럽의약품청) 규정 |
미국 식품의약품청(Food and Drug Administration, FDA)은 인체 및 동물용 의약품, 생약 제제, 의료기기, 국가 식량 공급, 화장품, 방사선 제품의 안전성, 유효성 및 안전을 보장함으로써 공중보건을 보호하는 기관입니다. FDA는 식품 및 의약품의 유효성을 확보하고 자국민에게 보다 안전하고 비용부담이 적은 제품의 공급을 추진하며, 국민 건강 유지 및 개선을 위해 의약품과 식품 사용에 필요한 정확하고 과학적 기반을 가진 정보를 얻을 수 있도록 도움으로써 공중보건을 증진시키고 있습니다.
임상시험을 위해서는 임상시험계획승인 신청(Investigational New Drug, IND)을 통과하여야 하며, 판매용 및 연구용(비판매용) 두 가지 범주가 있고, 다음과 같은 세 가지 신청 유형이 있습니다.
| [미국 임상시험계획 승인신청(IND) 신청 유형] |
| 구 분 | 내 용 |
|---|---|
| 연구자 임상시험계획 승인신청 |
- 미허가 의약품 또는 신규 적응증/환자군에 대한 허가 의약품의 임상시험을 제안할 경우를 위함 - 임상시험을 개시하고 수행하는 의사가 제출함 - 의사의 직접적 지시 하에 시험용 의약품이 투여 또는 조제됨 |
| 응급상황 사용 임상시험계획 승인신청 |
- CFR312 IND 승인을 위한 시간이 허용되지 않는 상황에서 시험약 사용을 허가할 수 있도록 하기 위함 - 기존의 시험 계획 조건을 충족시키지 못하는 환자를 대상으로 하거나, 또는 허가된 시험 계획서가 존재하지 않을 경우 사용됨 |
| 치료목적 임상시험계획 승인신청 |
- 임상시험이 수행되고 미국 FDA 검토가 진행 중일 때, 임상시험에서 중증 또는 즉각적인 생명을 위협할 수 있는 증상에 대한 전망이 보이는 시험약을 위함 - 중증질환의 경우 임상 3상 이전이라 하더라도 통상 임상2상 이전이 아니라면 해당 의약품을 본 항에 따른 치료용으로 사용 가능함 |
| 출처: | 식품의약품안전처 의약품통합정보시스템 |
IND가 통과되면 허가 받고자 하는 의약품의 분류에 따라 NDA, ANDA, CDER 중 적절한 항목에 따라 절차가 진행됩니다. 신약 후보물질이 IND에서 제3상까지 임상시험이 완료되면, 신약 허가를 받기 위해 신약 허가 심사(New Drug Application, NDA)를 준비하여 FDA에 신청하는 절차가 진행됩니다. 신약 허가 심사는 의약품이 어떻게 체내에서 작용하고 어떻게 제조되는지에 대한 정보를 포함하여 모든 동물 및 인체 데이터와 그 분석을 포함합니다. 신약 허가신청 절차는 아래와 같은 단계를 따릅니다.
| [미국 신약 허가 신청 결과] |
| 구 분 | 내 용 |
|---|---|
| 신약 허가신청 사전회의 (Pre-NDA Meeting) |
- |
| 신약 허가신청서 제출 및 심사 | - 신약 허가가 신청되면 식품의약품청은 해당 신청이 정식으로 제출되어 심사 받을 수 있도록 할지 결정하는 60일의 기간이 주어집니다. 미국 식품의약품청은 완전하지 않은 신청에 대한 정식 제출을 거절할 수 있습니다. - 신약 허가신청이 정식 제출되면, 식품의약품청 심사팀(의사, 화학자, 통계학자, 미생물학자, 약리학자, 다른 전문가들)은 의뢰자가 제출한 시험이, 제안된 용법에서 해당 의약품이 안전하고 유효성이 있음을 나타내는지 평가합니다. 어떤 의약품도 절대적으로 안전하지 않으며 모든 의약품은 부작용이 있으나, “안전하다”라는 의미는 의약품의 유익성이 알려진 위해성을 상회한다는 뜻입니다. - 심사팀은 시험결과를 검토하고, 시험방법 또는 분석의 취약점과 같은 가능한 문제들에 대해 검토합니다. 심사자들은 의뢰자의 결과 및 결론에 동의할지 여부를 결정하거나, 결정을 내리기 위해 필요한 추가 정보가 필요한지 여부를 결정합니다. - 각 심사자는 신청에 대한 결론과 권고사항을 포함한 서면 평가서를 준비합니다. 이러한 평가는 이후 신청 종류에 따라 팀장, 부서장, 실장의 검토를 거칩니다. |
| 의약품 표시기재사항에 대한 심사 | 식품의약품청은 의약품 표시기재사항에 아래 정보가 포함되었는지 여부를 심사합니다. (1) 적응증, 용량, 투여 경로 및 방법, 투여 횟수 및 기간, 관련 경고문, 위험, 금기사항, 부작용, 주의사항 등 사용법에 대한 적절한 정보로서 의약품을 투여하는 법률상 허가된 의료인이 해당 의약품을 안전하게 사용할 수 있고, 광고되거나 표현된 모든 증상을 포함하여 본래 목적에 따라 사용될 수 있도록 하는 자료 (2) 라벨 및 표시기재사항 또는 의약품이 조제된 포장 내 표시된 의약품의 성분과 관련한 정보 |
| 실태조사 | 시설 등에 대한 실태조사는 식품의약품청이 수행하며, 미국의 의약품 제조 및 품질관리기준(GMP)을 따릅니다. |
| 의약품 허가 | - |
| 출처 : 식품의약품안전처("미국 의약품 허가 제도", 2016.06.30) |
한편, 미국을 비롯한 유럽 등 글로벌 선진국에서는 제약·바이오 산업을 국민의 건강을 증진하고 일자리와 고부가가치를 창출하는 핵심 기간산업이자 미래 신성장 동력 산업으로 인지하고, 제약ㆍ바이오 산업에 대한 우호적 정책을 펼치고 있는 상황입니다. 특히 미국 정부의 경우 국가 생명공학 및 바이오제조 이니셔티브(NBBI), 미국의 국가안보각서 및 바이오방어 전략 등을 통해서 생명 공학 및 제조를 위한 연방 투자확대, 기술혁신을 위한 안정적인 데이터 환경 조성 및 미국 바이오 제조 역량 강화를 위한 규제 간소화와 인재 육성 투자 등을 과제로 삼고 제약·바이오 산업을 체계적인국가 전략을 바탕으로 육성시키고 있습니다.
다만, 47대 미국 대선 결과 트럼프 대통령이 당선된 이후 어떠한 정책이 제약바이오 산업에 새로운 영향을 미칠지 불확실한 상황입니다. 트럼프는 제47대 대선 공약인 '아젠다47'을 통해, 약가 인하와 필수의약품 생산 자국화를 언급한 바 있습니다. 특히 약가 인하 정책의 경우, 글로벌 제약사의 수익성 악화로 이어질 수 있어 오픈 이노베이션 R&D 투자를 줄이는 요인으로 작용할 수 있으며, 신약을 통해 기대할 수 있는최대 수익이 감소하며 신약의 가치평가에 불리하게 작용할 수 있습니다. 투자자께서는 이 점 유의하시길 바랍니다.
(2) 국내 정책 및 규제
대한민국 정부는 국민의 건강증진과 일자리를 창출하는 제약 강국으로의 도약을 위하여 제약바이오 산업을 육성하는 데 앞장서고 있습니다. 2023년 3월 29일 보건복지부는 "2023년 제1차 제약산업 육성ㆍ지원 위원회"를 개최하여 "제3차 제약바이오 산업 육성ㆍ지원 5개년 종합계획"을 발표했습니다. 이를 통해 정부는 글로벌 블록버스터 신약 창출을 목표로 2023년-2027년 5년간 민관 R&D 총 25조원 규모의 투자 추진 계획을 발표했습니다.
"제3차 제약산업 육성ㆍ지원 5개년 종합계획"은 "제약산업 육성 및 지원에 관한 특별법" 제4조를 근거로 하여 5년 단위의 중기계획 및 매년 단위의 시행계획이 발표되며 제약산업 발전기반 조성 및 국제 경쟁력 강화를 위한 주요시책을 계획 및 추진하는 것으로서, 그 주요 내용은 아래와 같습니다.
| [제3차 제약바이오 산업 5개년 종합계획 비전 및 목표] |
| 4대 목표 | |
| R&D | 글로벌 신약 창출을 위한 R&D 투자 확대 |
| 인력양성 | 제약바이오 융복합 인재양성 |
| 투자 및수출지원 | 제약바이오산업 투자 및 수출지원 강화 |
| 제도개선 | 글로벌 수준의 규제 혁신 및 공급망 인프라 확대 |
| 10대 추진과제 | |
| R&D | - 글로벌 블록버스터 신약 창출을 위한 전략적 R&D 투자 - 보건안보 및 사회적 요구에 대응하는 R&D 투자 - AI·빅데이터 등 신약 개발의 디지털 전환 촉진 |
| 인력양성 | - 제약바이오산업 핵심인재 - 제약바이오 인력양성 생태계 조성 |
| 투자 및 수출지원 | - 제약바이오 분야 금융지원 강화 및 창업 지원 - 제약바이오산업의 핵심 수출산업화 |
| 제도개선 | - 혁신 신약개발을 위한 제도 지원 - 임상시험 글로벌 3위 달성을 위한 전략적 지원 - 의약품 밸류체인별 인프라 강화 |
| 출처: 보건복지부 |
구체적으로 글로벌 블록버스터 신약 창출을 위한 R&D 투자 확대를 통해 국제적으로 인정 받는 신약 2개를 목표로, 5년간 민·관 합산 총 25조('23~'27년)원의 투자를 추진할 계획입니다. 정부는 신기술 선점 범부처 협의체를 통해 제약바이오 분야 차세대 유망 10대 신기술을 발굴하고 신기술 분야에 대한 R&D를 지원할 계획이며, 산·학·연·병 등 신약개발 주요 주체 간 공동연구를 지원할 수 있는 개방형 혁신 R&D를 신규로 추진할 예정입니다. 또한, 혁신형 제약기업 등을 중심으로 국내 바이오벤처 및 글로벌 제약사 등과의 기술 협력을 지원하고, 연구중심병원 인프라를 활요한 공동연구를 확대하는 한편, 해외 우수 '오픈 이노베이션 플랫폼'의 국내 유치도 추진할 예정에 있습니다.
또한 대한민국 식품의약품안전처 역시 2020년 신속심사과를 신설하여 중증 질환 또는 희귀질환 치료제 등에 대해 심사기간을 단축해 신속한 제품화를 추진하는 신속심사 제도를 시행하고 있습니다. 2022년에는 식약처의 '식의약 규제개선 100대 과제'로서 글로벌 혁신제품 신속심사 지원체계(Global Innovative products on Fast Track, GIFT)를 추가하여, 생명위협질환이나 중대한 질환 치료제 등의 혁신성이 뛰어난 의약품을 빠르게 시장에 출시하고 환자에게 공급할 수 있도록 지원하고 있습니다. GIFT 지정은 생명을 위협하는 암 등 중대한 질환 또는 희귀질환, 감염병 등에 대한 치료제로 기존 치료법이 없거나 기존 치료법 대비 유효성 등이 현저히 개선된 치료제, 그리고 보건복지부가 지정한 혁신형 제약기업이 개발한 신약이 대상이 됩니다. 지원 혜택으로는 GIFT 대상 품목의 경우 심사기간이 일반심사기간의 75%까지 단축이 가능해지게 되고 그 외에도 다음과 같은 지원을 받게 됩니다.
| GIFT 주요 지원 항목 |
|---|
| - 임상개발 초기부터 신속심사 대상 지정 - 안전에 직접 관련없는 일부 자료는 시판 후 제출할 수 있는 근거 규정 활용 - 글로벌 심사기준은 해외와 시차 없이 적용하여 해외 규제기관과 규제 충돌을 방지 - 국내 혁신제품의 허가·심사에 국제조화된 기준을 적용하여 빠른 해외 진출 지원 - 준비된 자료부터 먼저 심사하는 수시 동반심사(rolling review) 적용 - 심사자와 개발사 간 긴밀한 소통을 통한 규제 관련 컨설팅, 심사일정계획 등 밀착지원 |
대한민국 정부는 바이오산업을 6대 미래 산업으로 선정하여 위와 같은 전폭적인 지원을 함과 동시에 엄격한 규정 및 절차를 제시하고 있습니다. 제약 및 신약개발 사업과 관련된 대표적인 국내 법률은 식품의약품안전처 및 보건복지부 소관의「약사법」, 보건복지부 소관의 「국민건강보험법」, 「생명윤리 및 안전에 관한 법률」, 「제약산업 육성 및 지원에 관한 특별법', 「희귀질환관리법」, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」과 식품의약품안전처 소관의 「실험동물에 관한 법률」 등이 있습니다.
| [제약ㆍ바이오산업과 관련된 대한민국의 주요법령 및 규제] |
| 법규 | 주요내용 |
|---|---|
| 약사법 |
- 의약품의 제조, 수입, 특허권의 등재, 판매, 취급 등에 관한 전반적인 규제 - 관련 내용을 위반하는 경우 행정처분(허가 취소 등) 또는 형사처벌(징역 또는 벌금형) 부과 |
| 국민건강보험법 | - 국민의 질병, 부상에 대한 예방, 진단, 치료, 출산 및 건강증진에 대한 보험급여를 실시 |
| 생명윤리 및 안전에 관한 법률 | - 인간과 인체유래물 등을 연구하거나 취급할 때 인간의 존엄과 가치를 침해하거나 인체에 위해를 끼치는 것을 방지하도록 규정 |
| 제약산업 육성 및 지원에 관한 특별법 | - 제약산업 발전기반 조성 및 경쟁력 강화 촉진을 위해 5년 마다 지원 종합계획을 수립하도록 규정 |
| 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 | - 첨단재생의료의 안전성 확보, 기술 혁신, 실용화에 필요한 사항 규정 - 첨단바이오의약품의 품질, 안전성, 유효성 확보, 제품화 지원에 필요한 사항 규정 |
| 생물학적 제제 등의 제조ㆍ판매관리 규칙 |
- 생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품, 유전자재조합의약품, 세포배양의약품, 세포 치료제, 유전자 치료제 및 이와 유사한 제제의 제조 및 판매 관리 규제 |
| 식품ㆍ의약품 분야 시험ㆍ검사 등에 관한 법률 |
- 식품ㆍ의약품분야의 시험ㆍ검사 및 시험ㆍ검사기관의 관리 등에 관한 사항을 규정 |
| 산업기술의 유출방지 및 보호에 관한 법률 |
- 산업기술의 부정한 유출 및 침해 방지 및 보호 규정 |
| 특허법 | - 공동출원, 통상실시권, 특허권 침해 등에 관하여 규정 |
| 실용신안법 | - 특허법에서 규율하지 않는 실용적인 고안을 보호, 장려 |
| 부정경쟁방지 및 영업비밀보호에 관한 법률 |
- 고객사의 영업비밀을 부정하게 사용하거나 공개하는 행위 규제 |
| 하도급거래 공정화에 관한 법률 |
- 위탁받은 사업을 재위탁하는 경우 관한 규제 |
특히, 「약사법」 하위 시행령/시행규칙 중 의약품 등의 안전에 관한 규칙, 의약품 등의 제조업 및 수입자의 시설기준령 시행규칙, 생물학적 제제 등의 제조ㆍ판매관리 규칙, 동물용 의약품등 취급규칙 등과 이의 하위 규정을 준수해야 합니다. 이에 따라, 신약 후보물질의 발굴에서부터 동물을 대상으로 하는 비임상시험, 인체를 대상으로 하는 임상시험, 품목허가에 이르기 까지 임상 승인에 관한 규정, 의약품의 약리 및 독성, 안정성 시험 기준, 임상시험 실시기관 지정에 관한 규정, 품목허가ㆍ심사 등의 규정 등을 반드시 준수하여 진행해야 합니다. 또한 제조 및 판매 단계에서도 제조소 시설 기준, 제조 및 품질관리 규정, 포장 및 공급에 관한 규정, 표시 등에 관한 규정을 준수해야 하며, 사후에도 정기적으로 규제기관으로부터 제품 생산 공정 및 품질관리 전반에 대한 실사 및 관리, 감독을 받게 됩니다. 이러한 규제 및 검증을 통해 제약산업의 선진화 정책을 시현할 수 있지만, 각종 규제 및 절차, 검증 강화로 인한 부담이 높아지는 경우, 당사와 같은 신약 개발 기업에 부정적인 영향을 미칠 수 있습니다.
상기 기재한 바와 같이, 제약바이오 산업에 대한 전세계적인 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에도 불구하고, 실제 효율적인 정책 지원이 이루어지지 않거나, 세부 과제 추진에 어려움이 생길 수 있습니다. 또한, 우호적인 정책이 시행된다 하더라도 관련 시설 건설 및 가동, 관련 기관 협의, 규제 당국 심사 등의 과정으로 인해 즉각적인 영향을 끼치지 못할 수 있습니다. 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 인해 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않다고 판단될 경우 규제 완화의 범위도 축소될 수 있습니다. 당사가 영위하는 바이오 산업에 대한 우호적인 정책 및 규제의 변화는 당사의 사업 전략 및 실적에 부정적인 영향을 끼칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
|
자. 업무 위탁 기관 관련 위험 당사와 같이 신약 개발사업을 영위하고 있는 다수의 바이오벤처 업체는 신약개발의 효율성을 높이고 리스크를 감소시키기 위한 전략으로, 임상시험 전문수탁기관(Contract Research Organization, CRO)을 대상으로 비임상시험 및 임상시험을 위탁 진행하거나, 의약품 생산 전문대행기관(Contract Manufacturing Organization, CMO)을 대상으로 임상시험에 필요한 원료 및 완제 생산을 위탁 진행하고 있습니다. 당사는 자체적인 연구개발 조직이 구축되어 있으나, 신약개발의 효율성 증대, 리스크 감소, 공정성 및 객관성을 갖는 자료 확보를 위해 GLP, GCP 인증 등을 통해 국제적인 신뢰성을 인정받은 국내외 전문 CRO 기관을 활용하며, 삼성바이오로직스, 바이넥스 등과 같은 GMP 인증을 받은 CMO/CDMO 기관을 활용하고 있습니다.
|
당사와 같이 신약 개발사업을 영위하고 있는 다수의 바이오벤처 업체는 신약개발의 효율성을 높이고 리스크를 감소시키기 위한 전략으로, GLP(Good Laboratory Practice) 및 GCP(Good Clinical Practice) 허가를 받은 임상시험 전문수탁기관(Contract Research Organization, CRO)을 대상으로 비임상시험 및 임상시험을 위탁 진행하거나, GMP(Good Manufacturing Practice) 허가를 받은 의약품 생산 전문대행기관(Contract Manufacturing Organization, CMO)을 대상으로 임상시험에 필요한 원료 및 완제 생산을 위탁 진행하고 있습니다.
구체적으로, 신약을 개발하여 임상 단계에 진입하기까지의 의약품 개발 과정은 치료 효과를 보이는 선도 물질의 개발, 최적화 과정을 통한 후보 물질의 개발, 비임상 시험을 진행하기 위한 후보 물질의 생산 및 제조, 동물을 대상으로 한 효능 및 독성 시험 수행, 임상시험용 의약품 생산의 순으로 이루어집니다. 임상 시험을 위한 후보 물질을 선택하는 과정에서 허가기관의 규제에 따라 진행되어야 하는 영장류 등 대동물에서의 약동학 및 독성 시험을 임상시험 수탁기관(Contract Research Organization, CRO)을 통해 수행하고 있습니다. 비임상 CRO의 경우 비임상 단계에서 유효성 평가와 안정성 평가 업무를 주로 합니다.
제약 CRO 사업은 대형 제약기업 중 일부가 연구개발과 임상시험을 포기하게 되고, 기업 규모 축소(downsizing)로 해고된 연구 인력들이 풀서비스(full-service), 니치서비스(niche-service)의 형태로 컨설팅 사업에 뛰어들게 되면서 탄생 및 발전하였습니다. 산업 초기 아웃소싱(outsourcing)은 데이터 관리 및 통계분석 서비스가 주를 이루었으나, 점차 그 영역이 확대되어, 약물 발굴, 신약 개발에서부터 제조, 운송, 상품화에 이르기까지 제약 가치사슬의 전 단계에 걸쳐 서비스를 제공하게 되었습니다.
| [제약 가치사슬에 따른 아웃소싱(outsourcing) 현황] |
 |
|
제약 가치사슬에 따른 아웃소싱 현황 |
| 출처 : CEPTON, 2007 |
CRO는 제약사들의 신약개발 시 들어가는 연구개발 비용 감소와 신약 출시기간 단축이라는 수요에 맞게 발전해왔습니다. 신약 연구와 개발은 후보물질 탐색부터 임상시험까지 오랜 기간이 걸리는 반면, 성공 확률이 낮은 하이리스크-하이리턴(high-risk, high-return) 사업입니다. 이에 따라 대부분의 제약회사들은 높은 리스크와 많은 비용이 들어가는 단계를 자체적으로 진행하기보다는 CRO와 같은 수탁기관과 협업하여 신약을 개발하게 됩니다.
| [CRO 세부분야] |
| 세부분야 | 정의 |
|---|---|
| 임상연구 (Clinical Research Services) |
임상시험관리기준(GCP: Good Clinical Practice)에 따라 비임상시험 통과 이후 단계적으로 인체에 적용해 보는 임상(Clinical)시험의 설계, 수행 및 결과보고를 수행 |
| 조기개발 (Early-phase Development Services) |
우수실험실기준(GLP: Good Laboratory Practice)에 따라 우선적으로 후보물질을 동물에 적용해 유효성과 독성을 평가하는 비임상(Non-Clinical)시험의 설계, 수행 및 결과보고를 수행 |
| 시험기관 (Laboratory Services) |
허가기관에서 제정한 시험법 가이드라인(TG: Test Guideline)에 따라 평가항목을 설정하여 시험의 설계, 수행 및 결과보고를 수행 |
| 컨설팅 (Consulting Services) |
다양한 적응증에 대한 프로토콜 개발을 포함한 개발 전략 수립부터 임상 시험 전반의 과정에 있어 가이드 수립 |
| 데이터관리 (Data Management Service) |
Phase I~III, Medical device 허가용 임상시험과 허가 후 진행하는 Phase IV 임상시험, OS (Observational Study) 및 NIS (Non-Intervention Study) 등의 관찰연구, IIT (Investigator-Initiated Trial: 연구자 주도 임상), PMS (Post-Marketing Study: 시판 후 조사)에 이르기까지 임상 데이터 수집 및 관리 |
당사 역시 의약품 완제품을 판매하지 않고 연구개발단계에서 기술이전을 통하여 사업화하는 바이오벤처로서, SMART 부문, R&D 부문, 디스커버리 부문, 임상 부문, 중개전략 부문으로 구성된 연구개발 조직이 자체적으로 구축되어 있으나, 신약개발의 효율성 증대와 리스크 감소 및 의약품으로써 공정성 및 객관성을 갖는 자료 확보를 위하여 GLP, GCP 인증 등을 통해 국제적인 신뢰성을 인정받은 국내외 전문 CRO 기관을 활용하며, GMP 인증을 받은 CMO/CDMO 기관을 활용하고 있습니다. 당사는 모든 CRO, CMO 기관들과 비밀유지계약서 (Confidential Disclosure Agreement, CDA) 체결과 함께 업무를 위탁함으로써 발생가능한 기술유출의 위험을 최소화하고 있으며, 현재 특수관계에 있는 기관은 없으나 향후 업무 위탁이 필요할 경우 당사 투명경영위원회 심의를 거쳐 진행할 예정입니다."
구체적인 당사의 비임상/임상 관련 주요 CMO, CRO 이용현황은 다음과 같습니다.
| [비임상/임상 관련 주요 CRO, CMO 이용 내역] |
| 분 야 | 협력 네트워크 | 협력의 성격 | 특수관계여부 |
|---|---|---|---|
| 전임상 | C사(미국) | 약물의 독성과 안전성 평가 | X |
| I사(일본) | 약물의 독성과 안전성 평가 | X | |
| L사(미국, 영국) | 약물의 독성과 안전성 평가 | X | |
| A사(이탈리아) | 약물의 독성과 안전성 평가 | X | |
| S사(스위스) | 약물의 동태 분석과 안정성 평가 | X | |
| A사(스페인) | 약물의 독성과 안전성 평가 | X | |
| A사(한국) | 약물의 효력 평가 | X | |
| B사(중국) | 약물의 효력 평가 | X | |
| C사(한국) | 약물의 동태 및 효력 평가 | X | |
| S사(일본) | 약물의 독성과 안전성 평가 | X | |
| H사(한국) | 약물의 효력 평가 | X | |
| N사(한국) | 약물의 효력 평가 | X | |
| Q사(한국) | 약물의 효력과 안전성 평가 | X | |
| I사(미국) | 약물의 안전성 평가 | X | |
| 임상 | S사(한국, 미국) | 임상시험 CRO(임상시험 수탁기관) | X |
| I사(한국, 미국) | 임상시험 CRO(임상시험 수탁기관) 및 PV 업무 수탁 | X | |
| K사(한국) | 임상시험 Academic CRO(임상시험 수탁기관) | X | |
| F사(한국, 미국) | 임상시험용의약품 관리 | X | |
| Z사(한국, 미국) | 임상시험용의약품 관리 | X | |
| S사(한국, 미국) | 임상시험 Central Lab | X | |
| G사(한국, 미국) | 임상시험 Central Lab | X | |
| S사(한국) | 임상시험 Central Lab | X | |
| M사(한국, 미국) | EDC(전자데이터 수집) 및 RTSM(Randomization and Trial supply management) | X | |
| J사(한국) | EDC(전자데이터 수집) system 구축 및 관리 | X | |
| CMC | S사(한국) | 원료의약품(DS: Drug substance)과 완제의약품(DP:drug product)의 위탁생산 | X |
| B사(한국) | 원료의약품(DS: Drug substance)과 완제의약품(DP:drug product)의 위탁생산 | X | |
| C사(한국) | 당단백질 분석 | X | |
| M사(독일) | CHO 생산세포주 라이선스 | X | |
| C사(미국) | MCB 제작 및 보관, MCB 특성분석, virus clearance study | X | |
| B사(미국) | MCB 제작 및 보관, MCB 특성분석, virus clearance study | X |
하지만 당사의 이러한 노력에도 불구하고 생산 및 임상시험 업무를 위탁 수행중인 CMO 및 CRO 기관 자체의 사정으로 인한 의도하지 않은 결과가 발생할 수 있습니다. 위탁 수행 업체 공통적으로는 소속 직원 재배치, 수탁업무 수행능력 부족, 계약상 의무 미준수, 관련 규정 및 절차 미준수, 인력의 파업, 재정적 위기로 인한 파산 등의 상황이 발생할 수 있습니다. 또한, CMO의 경우 제조 공장 강제 폐쇄, 자연 재해, 인공 재해, 규정 미준수, 품질 저하 등으로 인한 생산 일정 지연 또는 생산 중단 상황이 발생할 수 있고, CRO의 경우 임상 결과 분석의 오류 및 임상 결과 도출 지연, 임상시험 과정에서 발생한 부작용에 대한 미흡한 대처 등이 발생할 수 있습니다. 이러한 일이 발생하여 또 다른 위탁 수행 업체와 계약하게 되는 경우 임상시험 또는 제조공정의 반복 수행으로 인한 추가적인 비용, 기간 연장이 요구되며, 이에 따른 상용화 시기가 지연될 수 있습니다. 이와 같이 업무위탁 기관을 활용할 경우 당사가 통제할 수 없는 위험요소들로 인하여 당사의 신약 개발 일정이 지연되거나 연구 결과에 부정적인 영향을 미칠 수 있으며, 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
| 차. 지적재산권 관련 위험 신약 연구개발기업은 특허의 출원 및 등록 관련 제도를 통한 지적재산권의 확보 및 관리가 중요하며, 핵심 원천기술 확보가 기업가치 유지의 핵심적인 요소입니다. 당사 역시 특허권을 포함한 지적재산권을 향후 세계시장에서 경쟁 제약사들 및 기타 후발주자들과 경쟁하기 위하여 요구되는 필수적인 자산으로 여기며, 다수의 국내외 특허권을 확보하고 있습니다. 당사는 글로벌 임상개발을 진행하고 있고 세계시장을 목표로 신약개발에 임하고 있는 만큼, 당사 내부에 별도의 특허팀 조직을 운영중이며, 특허 포트폴리오의 효과적인 관리를 위하여 최선의 노력을 다하고 있습니다. 본 공시서류 제출일 현재 당사가 보유한 핵심기술 및 특허권과 관련한 소송이나 분쟁은 발생하고 있지 않고 있으며, 향후에도 당사가 보유한 특허 및 지적재산권에 대하여 우발요소가 발생할 가능성은 낮다고 판단됩니다. 또한 경쟁사나 외부 제3자가 당사의 특허 등을 모방하여 당사의 기술을 침해할 가능성은 낮다고 판단됩니다. 그러나 상기와 같은 노력에도 불구하고, 출원 국가간 특허법의 차이 및 개정 등으로 심사단계에서 거절, 특허 등록의 지연이 발생하거나 제 3자와의 특허 소송 또는 기타 분쟁이 발생할 경우 당사의 영업활동에 부정적인 영향을 미칠 수 있습니다. |
당사가 개발 중인 신약 파이프라인의 기술이전은 원천 기술 보유자의 물질 특허 등을 사용할수 있는 권리를 이전하는 것으로서, 당사와 같이 기술력과 그를 반영한 지적재산권이 회사의 사업을 영위하는데 있어 큰 비중을 차지하고 있는 신약개발 바이오벤처는 지적재산권 관리가 기업가치 제고의 핵심사안 중 하나입니다. 따라서 당사는 이러한 점을 인지하고 치료제의 연구개발과 더불어 이를 보호하기 위한 특허를 출원 및 등록하고 있습니다. 현재 당사가 보유하고 있는 파이프라인과 관련한 특허의 출원 및 등록 현황은 다음과 같습니다.
| [당사 지적재산권 현황] |
| 번호 | 구분 | 내용 | 대한민국 출원번호 (출원일) |
대한민국 등록번호 (등록일) |
적용제품 (주1) |
출원국 (주2) |
| 1 | 특허 | IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 및 이의 용도 |
KR 10-2019-0113659 (2019년 09월 16일) |
KR 10-2201086 (2021년 01월 05일) |
GI-101 GI-102 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩, 캐나다, 호주, 러시아, 브라질, 이스라엘 , 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
| 2 | 특허 | IgE Fc 수용체의 알파서브유닛의 세포외 도메인, 이를 포함하는 약학적 조성물 및 이의 제조방법 |
KR 10-2019-0002029 (2019년 01월 08일) |
KR 10-2038675 (2019년 10월 24일) |
GI-301 | 대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩, 캐나다, 호주 ,러시아, 브라질, 이스라엘, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
| 3 | 특허 | IgE Fc 수용체의 알파 서브유닛의 세포외 도메인을포함하는 약학적 조성물 |
KR 10-2019-0002037 (2019년 01월 08일) |
KR 10-2038672 (2019년 10월 24일) |
GI-301 | 대한민국, 대만 |
| 4 | 특허 | 프로바이오틱스 및 IgE에 결합능이 있는 폴리펩타이드를 포함하는 조성물 및 이의 용도 |
KR 10-2019-0004610 (2019년 01월 14일) |
KR 10-2038679 (2019년 10월 24일) |
GI-301 | 대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩 , 캐나다, 호주,러시아, 브라질, 이스라엘, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
| 5 | 특허 | 폴리에틸렌이민 및 담즙산으로 구성되는 세포막융합활성을 지닌 양친성 고분자 회합체 |
KR 10-2009-0118416 (2009년 12월 02일) |
KR 10-1128108 (2012년 03월 12일) |
- | 대한민국 |
| 6 | 특허 | IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 및 면역관문 억제제를 포함하는 암 치료용 약학 조성물 |
KR 10-2020-0162168 (2020년 11월 27일) |
KR 10-2400253 (2022년 05월 17일) |
GI-101 GI-102 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩, 캐나다, 호주, 러시아, 브라질, 이스라엘, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
| 7 | 특허 | IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 및 항암제를 포함하는 암 치료용 약학 조성물 |
KR 10-2021-0035517 (2021년 03월 18일) |
KR 10-2440962 (2022년 09월 01일) |
GI-101 GI-102 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 캐나다, 호주, 러시아, 브라질, 이스라엘, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 멕시코, 칠레, 사우디아라비아, 태국, 인도네시아, 베트남, 홍콩 |
| 8 | 특허 | IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질을 포함하는 방사선 치료 증진용 약학적 조성물 |
KR 10-2020-0068456 (2020년 06월 05일) |
KR 10-2373965 (2022년 03월 08일) |
GI-101 GI-102 |
대한민국, 대만, 미국, 유럽, 일본, 중국 |
| 9 | 특허 | IL-2 단백질 및 CD80 단백질 단편 또는 이의 변이체를 포함하는 융합단백질및 이의 용도 |
KR 10-2021-0035067 (2021년 03월 18일) |
- | GI-101 GI-102 |
대한민국, 대만, 미국, 유럽, 중국 |
| 10 | 특허 | IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 제제 |
KR 10-2021-0034747 (2021년 03월 17일) |
KR 10-2604984 (2023년 11월 20일) |
GI-101 GI-102 |
대한민국, 대만, 미국, 유럽, 일본, 중국 |
| 11 | 특허 | IgE Fc 수용체의 알파 서브유닛의 세포외 도메인을 포함하는 시알산 함량이높은 폴리펩티드 이량체 및 이를 포함하는 약학적 조성물 |
KR 10-2020-0083486 (2020년 07월 07일) |
KR 10-2561135 (2023년 07월 25일) |
GI-301 | 대한민국, 미국, 유럽, 일본, 중국, 대만, 캐나다, 호주, 러시아, 브라질, 이스라엘, 홍콩, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
| 12 | 특허 | IgE Fc 수용체의 알파 서브유닛의 세포외 도메인을 포함하는 융합단백질 제제 |
KR 10-2022-0028919 (2022년 03월 07일) |
- | GI-301 | 대한민국, 미국, 유럽, 일본, 중국, 대만, 캐나다, 호주, 러시아, 브라질, 이스라엘, 홍콩, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
| 13 | 특허 | 항 LAG3 항체 및 IL-2를 포함하는 융합단백질 및 이의 용도 |
KR 10-2021-0085076 (2021년 06월 29일) |
KR 10-2313505 (2021년 10월 08일) |
GI-104 | 대한민국, 미국, 유럽, 일본, 중국, 대만 |
| 14 | 특허 | CD80 세포외도메인 및 항 LAG3 항체 단편을 포함하는 융합 단백질 및 이의 용도 |
KR 10-2022-0005131 (2022년 01월 13일) |
KR 10-2461837 (2022년 10월 27일) |
GI-105 | 대한민국 |
| 15 | 특허 | 글루카곤-유사 펩타이드-1 및 인터루킨-1 수용체 길항제를 포함하는 융합단백질 및 이의 용도 |
KR 10-2021-0090377 (2021년 07월 09일) |
KR 10-2352336 (2022년 01월 13일) |
GI-210 | 대한민국, 대만, 미국, 유럽 |
| 16 | 특허 | 글루카곤-유사 펩타이드-1 및 인터루킨-1 수용체 길항제를 포함하는 융합단백질을 포함하는 퇴행성 뇌질환 예방 또는 치료용 약학 조성물 | KR 10-2023-0002186 (2023년 01월 06일) |
- | GI-210 | 대한민국, 미국, 유럽 |
| 17 | 특허 | IgE Fc 수용체 알파서브유닛의 세포외 도메인 및 항-IL-4R 항체를 포함하는융합단백질 및 이의 용도 |
KR 10-2021-0092362 (2021년 07월 14일) |
KR 10-2468170 (2022년 11월 14일) |
GI-305 | 대한민국, 미국, 유럽, 일본, 중국 |
| 18 | 특허 | 항-CD73 항체 및 IL-2를 포함하는 융합단백질 및 이의 용도 |
KR 10-2023-0080204 (2023년 06월 22일) |
- | GI-108 | 대한민국, 미국, 유럽, 일본, 중국, 홍콩, 싱가포르, 뉴질랜드, 멕시코, 인도네시아 |
| 19 | 특허 | 락토바실러스 플란타룸 균주의 병용 요법 및 이를 이용한 암 치료 방법 | KR 10-2023-0125646 (2023년 09월 20일) |
KR 10-2669111 (2024년 05월 21일) |
GI-101 GI-102 |
대한민국 |
| 20 | 특허 | 항 PD-L1 항체를 포함하는 이중융합항체 및 이의 용도 |
KR 10-2024-0143465 (2024년 10월 18일) |
- | GI-128 | 대한민국 |
| 21 | 특허 | XXX을 포함하는 융합단백질 및 이의 용도 |
KR 10-2024-0103596 (2024년 08월 5일) |
- | GI-213 | 대한민국 |
| 22 | 상표 | GI Innovation |
KR 40-2017-0148758 (2017년 11월 22일) |
KR 40-1395669 (2018년 09월 10일) |
- | 대한민국 |
| 23 | 상표 | GII |
KR 40-2017-0148756 (2017년 11월 22일) |
KR 40-1395668 (2018년 09월 10일) |
- | 대한민국 |
| 24 | 상표 | GI 이노베이션 |
KR 40-2017-0148760 (2017년 11월 22일) |
KR 40-1395670 (2018년 09월 10일) |
- | 대한민국 |
| 25 | 상표 | M+ Biologics |
KR 40-2018-0092810 (2018년 07월 06일) |
KR 40-1525929 (2019년 09월 27일) |
- | 대한민국 |
| 26 | 상표 | M+ Biologics |
KR 40-2018-0092811 (2018년 07월 06일) |
KR 40-1492070 (2019년 06월 24일) |
- | 대한민국 |
| 27 | 상표 |
GI-SMARTab 지아이스마탭 |
KR 40-2020-0159846 (2020년 09월 09일) |
KR 40-1775995 (2021년 09월 14일) |
- | 대한민국 |
| 주1) | 미공개 특허의 경우, 지적재산권 보호를 위하여 표에서 제외하였습니다. |
| 주2) | 특허출원 국가 중 특허 등록된 국가는 밑줄 표시하였습니다. |
당사는 2020년 6월 인간항체 서열에 관한 특허권자/출원인인 한국 소재 (주)와이바이오로직스와의 라이선스 인(License-in) 계약을 통해 전세계 대상 다중항체 또는 다중융합단백질에 해당하는 항체서열 4종을 개발하고 사업화 할 수 있는 통상실시권을 확보하였으며, 해당 기술을 활용해 후보물질발굴 단계를 진행하고 있습니다. 또한 2021년 7월 한국 소재 (주)메디라마와 GI-101, GI-102 이외의 후속 면역항암제 의약품 후보물질 GI-10N(GI-108 포함)에 대해 지아이이노베이션이 소유하거나 실시권 허여할 수 있는 항체 서열 2종의 전부 또는 일부를 포함한 다중항체 또는 다중융합단백질을 공동으로 연구ㆍ개발, 상업화하는 공동연구개발 계약을 체결하였습니다.
구체적인 라이선스 인(License-in) 계약 및 공동연구개발 계약 내용은 다음과 같습니다.
| [라이선스 인 계약 내용] |
| 계약상대방 및 회사와의 관계 |
(주)와이바이오로직스 |
| 계약종류 | 라이선스 인(License-in) 계약 |
| 계약일자 | 2020년 06월 22일 |
| 계약대상물 | 면역항암제 후보물질 4개의 항체 서열 |
| 계약목적 | 와이바이오로직스가 보유한 인간 항체 서열의 특허권에 대해 지아이이노베이션에 다중항체 및 다중융합단백질의 개발 및 사업화가 가능한 통상실시권을 부여 |
| 계약금액 |
양사 합의에 의해 비공개 |
| 계약금액의 산정 | 양사 합의에 의해 비공개 |
| 특허 등록번호 특허 출원번호 |
계약체결일 기준 출원 특허 3건, 심사 중 특허 19건, 등록 특허 5건 (세부 특허 정보는 비공개 조건에 따라 공개하지 않음) |
| [공동연구개발 계약 내용] |
| 계약상대방 및 회사와의 관계 |
(주)메디라마 |
| 계약종류 | 공동연구개발 계약 |
| 계약일자 | 2021년 12월 07일 |
| 계약대상물 | 의약품 후보물질 2건 |
| 계약목적 | 항체 서열 2종의 전부 또는 일부를 포함한 다중항체 또는 다중융합단백질의 공동 연구/개발 및 상업화함 |
| 계약금액 |
양사 합의에 의해 비공개 |
| 계약금액의 산정 | 양사 합의에 의해 비공개 |
| 특허 등록번호 특허 출원번호 |
양사 합의에 의해 비공개 |
당사에게 특허권을 포함한 지적재산권은 향후 세계시장에서 경쟁 제약사들 및 기타 후발주자들과 경쟁하기 위하여 요구되는 필수적인 자산입니다. 당사는 글로벌 임상개발을 진행하고 있고 세계시장을 목표로 신약개발에 임하고 있는 만큼, 당사 내부에 별도의 특허팀 조직을 운영중이며, 특허 포트폴리오의 효과적인 관리를 위하여 최선의 노력을 다하고 있습니다. 구체적으로 당사는 특허법, 약사법 등에서 인정되는 제도를 기반으로 당사의 독점적인 판매기간 확보를 통한 경쟁력 확보, 경쟁 제품 시장 진입의 지연, 희귀의약품 지정제도 등을 적극적으로 활용할 예정입니다. 또한, 보유 기술에 대해 공동 연구개발 추진, 기술이전, 경쟁사의 유사 기술 개발 방어 및 진입장벽 구축 등을 위해 지적재산권을 추가적으로 확보하고 보호하는 전략을 수립하고 있습니다.
특허 출원 전략을 잘못 수립하여 적절히 특허권을 보호하지 못하거나, 출원 국가 간 특허법의 차이점 및 개정 등으로 심사단계에서 거절, 특허 등록의 지연 등이 발생될 수 있습니다. 이는 당사가 보유하고 있는 지적재산권이 적절히 보호받지 못하는 상황이 발생되어 사업경쟁력이 약화될 수 있는 부분으로 당사의 사업에 부정적인 영향을 미칠 수 있습니다. 당사는 설립 이후 지적재산권과 관련된 분쟁으로부터 권리를 보호받기 위하여 각 분야별(특허, 출원 및 계약관련 법률 자문 등)로 이하와 같은 기관과 자문계약을 체결하여 법률자문 및 지적재산권으로부터 권리를 보호받고 있습니다.
| [최근 사업연도 3개년 특허 및 출원 관련 자문 기관] |
| 사업연도 | 특허법인 | 관련업무 |
|---|---|---|
| 2021년 | S사(한국) | 특허출원 등 (KR 10-2021-0035517, KR 10-2021-0034747 등) |
| S사(미국) | 특허출원 등(US 17/911,891, US 18/008,034 등) | |
| H사(유럽) | 특허출원 등(EP 21770469.1, EP 21817193.2 등) | |
| S사(중국) | 특허출원 등 (CN 202180022048.0, CN 202180039926.X 등) |
|
| A사(일본) | 특허출원 등(JP 2022-552872, JP 2022-574506 등) | |
| 2022년 | S사(한국) | 특허출원 등(KR 10-2022-0028919 등) |
| P사(한국) | 특허출원 등(KR 10-2022-0005131 등) | |
| S사(미국) | 특허출원 등(US 18/549,558 등) | |
| H사(유럽) | 특허출원 등(EP 22767446.2 등) | |
| S사(중국) | 특허출원 등(CN 202280016419.9 등) | |
| A사(일본) | 특허출원 등(JP 2023-555346 등) | |
| 2023년 | S사(한국) | 특허출원 등 (KR 10-2023-0002186, KR 10-2023-0071541 등) |
| P사(한국) | 특허출원 등(KR 10-2023-0080204 등) | |
| S사(미국) | 특허출원 등(US 18/815,390, US 18/727,662 등) | |
| H사(유럽) | 특허출원 등(EP 23827535.8, EP 23737446.7 등) | |
| S사(중국) | 특허출원 등(CN 202380032064.7 등) | |
| A사(일본) | 특허출원 등(JP 2024-551932 등) |
| [최근 사업연도 3개년 계약 관련 자문] |
| 사업연도 | 법무법인 | 관련업무 |
|---|---|---|
| 2021년 | H사 (한국) | 법률 자문 |
| T사 (한국) | 법률 자문 | |
| 2022년 | Y사 (한국) | 법률 자문 |
| T사 (한국) | 법률 자문 | |
| 2023년 | T사 (한국) | 법률 자문 |
| J사 (한국) | 법률 자문 |
본 공시서류 제출일 현재 당사가 보유한 핵심기술 및 특허권과 관련한 소송이나 분쟁은 발생하고 있지 않고 있으며, 향후에도 당사가 보유한 특허 및 지적재산권에 대하여 우발요소가 발생할 가능성은 낮다고 판단됩니다. 또한 경쟁사나 외부 제3자가 당사의 특허 등을 모방하여 당사의 기술을 침해할 가능성은 낮다고 판단됩니다. 그러나 상기와 같은 노력에도 불구하고, 출원 국가간 특허법의 차이 및 개정 등으로 심사단계에서 거절, 특허 등록의 지연이 발생하거나 제 3자와의 특허 소송 또는 기타 분쟁 등 당사가 예상하기 어려운 측면에서 특허에 대한 소송 및 분쟁이 발생할 경우 당사의 영업활동 및 손익에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하기기 바랍니다.
2. 회사위험
| [개별 기준 주요 재무상황 총괄표] |
| (단위: 백만원, 배, %) |
| 구분 | 2024년 3분기 (제8기 3분기) |
2023년 3분기 (제7기 3분기) |
2023년 (제7기) |
2022년 (제6기) |
2021년 (제5기) |
비 고 |
|---|---|---|---|---|---|---|
| 외부감사인 | 삼일회계법인 | 삼일회계법인 | 삼일회계법인 | 이촌회계법인 | 삼덕회계법인 | - |
| 감사의견 | 해당없음 | 해당없음 | 적정 | 적정 | 적정 | - |
| 자산총계 | 64,818 | 91,225 | 81,340 | 106,335 | 179,868 | - |
| 유동자산 | 31,784 | 56,953 | 48,195 | 72,862 | 134,197 | - |
| 비유동자산 | 33,034 | 34,272 | 33,145 | 33,473 | 45,670 | - |
| 부채총계 | 17,245 | 8,452 | 9,636 | 10,688 | 9,437 | - |
| 유동부채 | 4,641 | 4,201 | 5,796 | 6,632 | 5,243 | - |
| 비유동부채 | 12,605 | 4,251 | 3,841 | 4,057 | 4,194 | - |
| 자본총계 | 47,573 | 82,773 | 71,704 | 95,646 | 170,431 | - |
| 자본금 | 22,540 | 11,027 | 11,035 | 10,002 | 9,986 | - |
| 영업수익(매출액) | 24 | 588 | 5,319 | 3,500 | 5,600 | - |
| 영업비용 | 36,101 | 45,145 | 58,623 | 71,452 | 36,232 | - |
| 영업이익(손실) | -36,077 | -44,557 | -53,305 | -67,952 | -30,632 | - |
| 당기순이익(손실) | -38,829 | -43,910 | -55,495 | -79,833 | -150,742 | - |
| 영업현금흐름 | -30,541 | -35,078 | -41,174 | -62,550 | -26,577 | - |
| 투자현금흐름 | 14,208 | 9,772 | 22,263 | 62,984 | -139,171 | - |
| 재무현금흐름 | 19,990 | 25,104 | 25,109 | -32 | 161,492 | - |
| 기초현금 | 8,543 | 2,346 | 2,346 | 1,944 | 6,201 | - |
| 기말현금 | 12,199 | 2,143 | 8,543 | 2,346 | 1,944 | - |
| 영업이익률 | -1,485.79 | -75.79 | -10.02 | -19.41 | -5.47 | 영업이익 ÷ 영업수익 |
| 당기순이익률 | -1,599.12 | -74.69 | -10.43 | -22.81 | -26.92 | 당기순이익 ÷ 영업수익 |
| ROA | -0.80 | -0.64 | -0.68 | -0.75 | -0.84 | 당기순이익 ÷ 자산총계 |
| ROE | -1.09 | -0.71 | -0.77 | -0.83 | -0.88 | 당기순이익 ÷ 자본총계 |
| 영업이익 성장률 | 적자지속 | 적자지속 | 적자지속 | 적자지속 | 적자지속 | - |
| 당기순이익 성장률 | 적자지속 | 적자지속 | 적자지속 | 적자지속 | 적자지속 | - |
| 자산총계 성장률 | -0.29 | -0.37 | -0.24 | -0.41 | 2.03 | - |
| 부채비율 | 0.36 | 0.10 | 0.13 | 0.11 | 0.06 | 부채총계 ÷ 자본총계 |
| 유동비율 | 6.85 | 13.56 | 8.32 | 10.99 | 25.60 | 유동자산 ÷ 유동부채 |
| 주1) | 2024년 3분기 및 2023년 3분기의 ROA 및 ROE의 경우 당기순이익에 3분의 4를 곱하여(연환산) 산출하였습니다. |
| 주2) | 2023년 3분기 및 2024년 3분기 외부감사인 삼일회계법인은 용역감사만 실시하였으며, 분기 재무제표에 대한 검토는 실시하지 않았습니다. |
| 가. 청약 등에 따른 최대주주 지분율 변동 및 경영권 안정성 관련 위험 본 공시서류 제출일 전일 기준 최대주주인 장명호 사장은 발행주식총수의 6.76%인 3,054,806주를 보유하고 있으며, 특수관계인 21인의 지분을 포함한 최대주주 및 특수관계인은 발행주식총수의 8.36%인 3,759,975주를 보유하고 있습니다. 또한 최대주주 및 특수관계인 21인은 당사 코스닥시장 상장일로부터 3년 동안 의무보유 중에 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 11,644,800주이며, 당사 최대주주인 장명호 사장은 787,646주를 배정 받을 예정입니다. 장명호 사장은 배정주식의 50%를 청약할 예정이며, 청약에 필요한 예상 자금은 개인 보유자금을 활용하여 마련할 예정입니다. 최대주주 장명호 사장의 50% 수준의 청약률 외에, 본 유ㆍ무상증자, 전환우선주 및 전환사채의 전환청구, 주식매수선택권 및 미행사수량의 추후 행사 가능성 등의 이유로 인해 본 공시서류 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사 경영권 위협이 발생할 수 있으며, 본 신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게 될 경우 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자판단 시 이 점 유의하시기 바랍니다. |
본 공시서류 제출일 전일 기준 최대주주인 장명호 사내이사는 발행주식총수의 6.76%인 3,054,806주를 보유하고 있으며, 특수관계인 21인의 지분을 포함한 최대주주 및 특수관계인은 발행주식총수의 8.36%인 3,759,975주를 보유하고 있습니다. 또한 최대주주 및 특수관계인 21인은 당사 코스닥시장 상장일로부터 3년 동안 의무보유 중에 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 11,644,800주이며, 당사 최대주주인 장명호 사내이사는 787,646주를 배정 받을 예정입니다. 장명호 사내이사는 배정주식의 50%를 청약할 예정이며, 청약에 필요한 예상 자금은 개인 보유자금을 활용하여 마련할 예정입니다. 이에 따라 금번 유상증자 이후 당사 최대주주의 지분율은 6.07%로 본 공시서류 제출일 전일 지분율 대비 0.69%p. 하락할 것으로 예상됩니다.
한편, 최대주주를 제외한 당사 특수관계인 21인은 신주배정기준일에 발행주식총수의 1.56%인 705,169주를 보유하였으며, 금번 유상증자를 통해 185,600주를 배정 받았습니다. 특수관계인 21인은 배정주식의 약 40.87%를 청약할 예정이며, 청약에 필요한 예상 자금은 개인 보유자금을 활용하여 마련할 예정입니다. 특수관계인 21인의 실제 청약률이 본 공시서류 및 투자설명서에 기재된 예상 청약률 보다 낮을 수 있으니 투자자분들께서는 투자판단에 참고하시기 바랍니다.
특수관계인 21인의 주식소유현황 및 예상 청약 주수 및 예상 청약률은 다음과 같습니다.
| [최대주주 및 특수관계인 주식소유 현황] | |
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 | 소유주식수 및 지분율 | ||||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 배정주식수 | 예상 청약주식수 | 예상 청약률 | |||
| 장명호 | 최대주주 본인 | 보통주 | 3,054,806 | 6.76% | 787,646 | 393,823 | 50.00% |
| 양윤석 | 최대주주의 친인척 | 보통주 | 139,296 | 0.31% | 35,915 | 18,415 | 51.27% |
| 양경림 | 최대주주의 친인척 | 보통주 | 40,986 | 0.09% | 10,567 | 17,500 | 165.61% |
| 김봉모 | 최대주주의 친인척 | 보통주 | 31,816 | 0.07% | 8,203 | 521 | 6.35% |
| 지형남 | 최대주주의 친인척 | 보통주 | 7,488 | 0.02% | 1,930 | 1,930 | 100.00% |
| 김도연 | 최대주주의 친인척 | 보통주 | 6,000 | 0.01% | 1,547 | 1,547 | 100.00% |
| 장은주 | 최대주주의 친인척 | 보통주 | 5,360 | 0.01% | 1,382 | 1,382 | 100.00% |
| 지동석 | 최대주주의 친인척 | 보통주 | 6,100 | 0.01% | 1,908 | 1,908 | 100.00% |
| 강창훈 | 최대주주의 친인척 | 보통주 | 2,000 | 0.00% | 515 | 0 | 0.00% |
| 오영두 | 최대주주의 친인척 | 보통주 | 1,820 | 0.00% | 469 | 469 | 100.00% |
| 김다슬 | 최대주주의 친인척 | 보통주 | 1,800 | 0.00% | 464 | 0 | 0.00% |
| 지형욱 | 최대주주의 친인척 | 보통주 | 48 | 0.00% | 12 | 1,012 | 8433.33% |
| 오영민 | 발행회사 임원 | 보통주 | 165,458 | 0.37% | 42,661 | 17,000 | 39.85% |
| 이경화 | 발행회사 임원 | 보통주 | 38,773 | 0.09% | 10,899 | 4,300 | 39.45% |
| 윤나리 | 발행회사 임원 | 보통주 | 35,172 | 0.08% | 9,068 | 5,000 | 55.14% |
| 조영규 | 발행회사 임원 | 보통주 | 19,200 | 0.04% | 7,013 | 0 | 0.00% |
| 노은희 | 발행회사 임원 | 보통주 | 646 | 0.00% | 166 | 166 | 100.00% |
| 김국환 | 발행회사 임원 | 보통주 | 1,002 | 0.00% | 103 | 103 | 100.00% |
| 김지수 | 발행회사 임원 | 보통주 | 500 | 0.00% | 773 | 927 | 119.92% |
| 임신생 | 발행회사 임원 | 보통주 | 14,268 | 0.03% | 3,678 | 3,678 | 100.00% |
| 김진만 | 관계회사 임원 | 보통주 | 166,010 | 0.37% | 42,803 | 0 | 0.00% |
| 홍천표 | 관계회사 임원 | 보통주 | 21,426 | 0.05% | 5,524 | 0 | 0.00% |
| 합계 | 보통주 | 3,759,975 | 8.33% | 973,246 | 469,681 | 48.26% | |
| 우선주 | - | - | - | - | - | ||
| 주1) | 지분율의 경우 보통주와 우선주를 합한 발행주식의 총수를 기준으로 기재하였습니다. |
| 출처: | 당사 제공 |
본 공시서류 제출일 전일 기준 당사의 보호예수 현황은 다음과 같습니다.
| [당사 보호예수 현황] | |
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 (주5) |
|---|---|---|---|---|---|---|
| 보통주 | 2,463,040 | 2022년 05월 11일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1) | 45,163,170 |
| 44,192 | 2022년 05월 12일 | (주1) | 45,163,170 | |||
| 864,094 | 2022년 08월 05일 | (주3) | 45,163,170 | |||
| 106,265 | 2022년 10월 19일 | (주3) | 45,163,170 | |||
| 124,963 | 2022년 12월 26일 | (주3) | 45,163,170 | |||
| 421,818 | 2022년 12월 27일 | (주2) | 45,163,170 | |||
| 463,220 | 2022년 12월 27일 | (주3) | 45,163,170 | |||
| 2,133 | 2023년 03월 24일 | (주1) | 45,163,170 | |||
| 9,000 | 2023년 05월 18일 | (주1)(주4) | 45,163,170 | |||
| 3,500 | 2023년 08월 17일 | (주1)(주4) | 45,163,170 | |||
| 2,000 | 2023년 11월 14일 | (주1)(주4) | 45,163,170 | |||
| 2,509,365 | 2024년 01월 22일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주5) | 45,163,170 | |
| 421,818 | (주2)(주5) | 45,163,170 | ||||
| 1,558,542 | (주3)(주5) | 45,163,170 | ||||
| 14,500 | (주1)(주4)(주5) | 45,163,170 | ||||
| 11,800 | 2024년 05월 27일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주4)(주5) | 45,163,170 | |
| 8,289 | 2024년 08월 20일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주4)(주5) | 45,163,170 | |
| 14,500 | 2024년 11월 15일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주4)(주5) | 45,163,170 | |
| 우선주 | 858,371 | 2024년 08월 27일 | 2025년 08월 26일 | 1년 | (주6) | 45,163,170 |
| 주1) | 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제1호) |
| 주2) | 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제3호) |
| 주3) | 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제7호) |
| 주4) | 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제6호) |
| 주5) | 2024년 01월 04일 개최된 이사회 결의에 따라 소유주식 1주당 신주 1주의 비율로 배정 (자기주식 제외)하는 무상증자를 실시하였습니다. |
| 주6) |
증권신고서 제출 면제에 따른 보호예수 (「증권의 발행 및 공시 등에 관한 규정」제2-2조 제2항 제1호) |
| 출처: | 당사 제공 |
| [최대주주 지분율 변동 시뮬레이션 : 유상증자] | |
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %, %p.) |
| 성 명 | 주식의 종류 | 유상증자 전 | 배정 주식수 (예정) |
청약 참여 주식수(예정) |
유상증자 후(예정) | |||
|---|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | 지분율 변동 | ||||
| 장명호 | 의결권 있는 주식 | 3,054,806 | 6.76% | 787,646 | 393,823 | 3,448,629 | 6.07% | -0.69%p. |
| 주1) | 최대주주의 청약 참여 주식수는 배정주식수의 50%이며, 1주 미만의 단수주는 절사하였습니다. |
| 출처: | 당사 제공 |
당사 최대주주인 장명호 사장은 상기 기술한 바와 같이 배정주식의 50%로 청약에 참여할 예정입니다. 이에 따라 최대주주 예상 필요 청약자금은 약 37.6억원이며, 최대주주는 개인 보유자금을 활용해 청약에 참여할 예정입니다. 향후 유상증자 진행 과정에서 당사의 주가가 상승하더라도「(舊) 유가증권 발행 및 공시 등에 관한 규정」에 따라 1차 발행가액 대비 확정 발행가액이 상승할 수 없어 발행가격 상승에 따른 최대주주의 청약자금 부담 증가 가능성은 제한적입니다. 다만, 예기치 못한 상황으로 인해 최대주주의 청약자금 부담 증가로 인하여 청약주식수와 금액에 일부 변동이 발생할 수 있으며, 예상치 못한 상황으로 인한 청약 실패 가능성도 배제할 수 없으니 투자자께서는 투자 판단시 이 점 유의하시기 바랍니다. 전술한 바와 같이 금번 유상증자 이후 당사 최대주주의 지분율은 6.07%로 본 공시서류 제출일 전일 지분율 대비 0.69%p. 하락할 것으로 예상되며, 이는 당사 최대주주의 경영권 등에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
또한, 당사는 금번 유상증자 이후 2025년 04월 03일을 무상증자 신주배정기준일로 하여, 10% 규모의 무상증자를 진행할 예정입니다. 이 경우 최대주주는 344,862주를 무상 배정 받을 예정이며, 지분율은 6.07%로 본 공시서류 제출일 전일 최대주주 지분율 대비 0.69%p. 하락할 예정입니다.
| [최대주주 지분율 변동 시뮬레이션 : 유상증자 + 무상증자] |
|
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %, %p.) |
| 성 명 | 주식의 종류 | 유상증자 후 | 배정 주식수 (예정) |
유ㆍ무상증자 후(예정) | ||
|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | |||
| 장명호 | 의결권 있는 주식 | 3,448,629 | 6.07% | 344,862 | 3,793,491 | 6.07% |
| 주1) | 최대주주의 무상증자 배정 주식수는 유상증자 후 주식수에 무상증자 비율 10%를 곱하여 계산하였으며, 1주 미만의 단수주는 절사하였습니다. |
| 출처: | 당사 제공 |
한편, 당사는 본 공시서류 제출일 전일 현재 기준으로 제8회차 전환우선주와 제1회차 무기명식 이권부 무보증 사모 전환사채(이하 "제1회차 전환사채")를 보유하고 있습니다. 제8회차 전환우선주는 2024년 08월 08일 발행되었으며, 해당 전환우선주는 발행일로부터 1년 이후 시점인 2025년 08월 08일부터 보통주로 전환을 청구할 수 있는 권리를 갖고 있어 금번 유ㆍ무상증자 기간동안 전환청구의 시점은 도래하지 않을 예정입니다. 다만, 전환비율의 경우 우선주 1주당 보통주 1주를 원칙으로 하나 조정사유가 발생할 경우 조정되며, 금번 유ㆍ무상증자는 조정사유에 해당하여 유ㆍ무상증자 이후 전환비율이 변경될 예정입니다. 제8회차 전환우선주의 현황과 조정 전후의 전환비율은 다음과 같습니다.
| [제8회차 전환우선주 현황] | |
| (기준일: 본 공시서류 제출일 전일) | (단위 : 원, 주) |
| 발행일자 | 2024년 08월 08일 | |||
| 주당 발행가액(액면가액) | 11,650 | 500 | ||
| 발행총액(발행주식수) | 10,000,022,150 | 858,371 | ||
| 현재 잔액(현재 주식수) | 10,000,022,150 | 858,371 | ||
| 주식의 내용 |
존속기간(우선주권리의 유효기간) | 2029년 08월 08일 | ||
| 이익배당에 관한 사항 |
액면가액의 연 1.0% (비참가적, 비누적적) |
|||
| 잔여재산분배에 관한 사항 | - | |||
| 상환에 관한 사항 |
상환권자 | 없음 | ||
| 상환조건 | - | |||
| 상환방법 | - | |||
| 상환기간 | - | |||
| 주당 상환가액 | - | |||
| 1년 이내 상환 예정인 경우 |
- | |||
| 전환에 관한 사항 |
전환권자 | 주주 | ||
| 전환조건 (전환비율 변동여부 포함) |
- 전환가격 : 1주당 발행가액 기준 - 전환비율 : 우선주 1주당 보통주 1주 (단, 전환비율은 조정사유 발생시 조정) |
|||
| 발행이후 전환권 행사내역 |
N | |||
| 전환청구기간 | 2025년 08월 08일 ~ 2029년 08월 07일 | |||
| 전환으로 발행할 주식의 종류 |
(주)지아이이노베이션의 기명식 보통주 | |||
| 전환으로 발행할 주식수 |
858,371 | |||
| 의결권에 관한 사항 | - 우선주 : 무의결권부 - 보통주 : 1주당 의결권 1개 |
|||
| 기타 투자 판단에 참고할 사항 (주주간 약정 및 재무약정 사항 등) |
(주1) | |||
| 주1) | 자세한 사항은 2024년 07월 30일 주요사항보고서(유상증자결정) 공시를 참고하시기 바랍니다. |
| 출처: | 당사 제공 |
| [제8회차 전환우선주의 유상증자 후 전환비율 조정] |
|
| (기준일: 본 공시서류 제출일 전일) | (단위 : 원, 주) |
| 구분 | 발행일 | 존속기간 | 전환청구기간 | 전환우선주 주식수 (전환가능 주식수) |
전환대상주식 | 전환가액 | 전환비율 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 유상증자 조정 후 |
무상증자 조정 후 |
조정 전 | 유상증자 조정 후 |
무상증자 조정 후 |
||||||
| 제8회차 전환우선주 |
2024년 08월 08일 | 2029년 08월 08일 | 2025년 08월 08일 ~ 2029년 08월 07일 |
858,371 | 기명식 보통주 | 11,650 | 10,740 | 9,770 | 1: 1.00000 | 1 : 1.08473 | 1 : 1.19243 |
| 주1) | 우선주의 주주가 전환청구를 하기 전에 발행회사가 시가를 하회하는 가격으로 주식을 발행할 경우 전환비율이 조정됩니다. |
| 주2) | 유상증자 조정 후 전환가액 = 조정 전 전환가액 ×{ (기발행주식수 + 신발행주식수 ×1주당 발행가액 ÷ 시가(기준주가)) ÷ (기발행주식수 + 신발행주식수) } |
| 주3) | 무상증자 조정 후 전환가액 = 조정 전 전환가액 x (기 발행주식수) ÷ (기 발행주식수 + 신 발행주식수) |
| 주4) | 조정 후 전환비율 = 최초 발행시 전환가액 / 전환청구 시점의 조정 전환가액 |
| 출처: | 당사 제공 |
| [당사 제8회차 전환우선주 인수계약서 일부] |
|
제6조 전환에 관한 사항 최초의 전환가액은 본건 우선주의 1주당 취득가격이며, 위 산식 중 “기발행주식수”는 당해 조정사유가 발생하기 직전일 현재의 발행주식총수로 하며, 전환사채 또는 신주인수권부사채를 발행할 경우 “신발행주식수”는 당해 전환사채 발행 시 전환가액으로 주식으로 전부 전환되거나 당해 신주인수권부사채 발행 시 행사가액으로 신주인수권이 전부 행사될 경우 발행될 주식의 수로 한다. 또한, 위 산식 중 “1주당 취득가격”은 주식분할, 무상증자, 주식배당의 경우에는 영(0)으로 하고, 전환사채 또는 신주인수권부사채를 발행할 경우에는 당해 사채 발행 시의 전환가액 또는 행사가액으로 한다. 위 산식에서 “시가”라 함은 상장법인의 1주당 발행가격 산정의 기준이 되는 “증권의발행및공시등에 관한규정”에서 정하는 기준주가(유상증자 이외의 경우에는 조정사유 발생 전일을 기산일로 하여 계산한 기준주가)로 하고, 위 산식에 의한 전환가액의 호가단위 미만은 절상한다. 사. 기타 전환주식의 발행, 전환의 청구, 기타 전환에 관한 사항은 상법의 관련규정을 따른다. 단, 전환권을 행사한 주식의 이익의 배당에 관하여는 그 청구를 한 때가 속하는 영업연도의 직전 영업연도말에 전환된 것으로 본다.
차. 전환으로 인한 변경등기: 전환에 따른 변경등기는 전환청구일이 속한 월의 말일로부터 2주 이내에 한다. |
본 공시서류 제출일 전일 현재 제8회차 전환우선주의 잔여 전환가능 주식수는 858,371주입니다. 해당 우선주가 보통주로 전환될 경우 기존주주들의 지분 희석이 발생하게 되며, 최대주주 장명호 사장의 지분율 또한 희석될 수 있습니다. 당사의 제8회차 전환우선주의 경우 상기의 발행 당시 계약서 상 '전환에 관한 사항' 관련 조항에 의거하여 금번 유ㆍ무상증자에 따라 전환가액 하향 조정이 발생할 수 있습니다. 이 경우 유ㆍ무상증자 이후 전환 청구를 통해 발행되는 보통주는 상기 전환비율에 따라 보통주 1,125,897주로 전환될 예정이며, 이는 유ㆍ무상증자 완료 후 총발행주식수의 1.80%에 해당하는 수준입니다.
또한, 당사가 보유 중인 제1회차 전환사채는 2024년 08월 08일 발행되었으며, 해당 전환사채는 만기시점까지 투자자의 전환 청구에 따라 당사의 보통주가 추가로 발행될 옵션인 전환권이 부여된 주식연계채권입니다. 제1회차 전환사채는 발행일로부터 1년 이후 시점인 2025년 08월 08일부터 보통주로 전환을 청구할 수 있는 권리를 갖고 있어 금번 유ㆍ무상증자 기간동안 전환청구의 시점은 도래하지 않을 예정입니다. 다만, 전환가액의 경우, 시가를 하회하는 발행가액으로 주식을 발행하며 해당되며 금번 유ㆍ무상증자에 따라 전환가액 하향 조정이 발생할 수 있습니다. 제1회차 전환사채의 현황과 조정 전후의 전환가액은 다음과 같습니다.
| [제1회차 전환사채 현황 및 전환가액 조정] | |
| (기준일: 본 공시서류 제출일 전일) | (단위: 원, 주) |
| 구분 | 발행일 | 만기일 | 권면 (전자등록) 총액 (백만원) |
전환대상 주식의 종류 |
전환청구 가능기간 |
전환조건 | 미상환사채 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환 비율 |
조정 전 전환가액 |
유상증자 조정 후 전환가액 |
무상증자 조정 후 전환가액 |
권면 (전자등록) 총액 (백만원) |
조정 전 전환가능 주식수 |
유상증자 조정 후 전환가능 주식수 |
무상증자 조정 후 전환가능 주식수 |
||||||
| 제1회 무기명식 전환사채 |
2024년 08월 08일 |
2029년 08월 08일 |
10,000 | 기명식 보통주 | 2025년 08월 08일~ 2029년 07월 08일 |
100 | 11,647 | 10,728 | 9,753 | 10,000 | 858,590 | 932,140 | 1,025,325 |
| 주1) | 자세한 사항은 2024년 07월 30일 주요사항보고서(전환사채권발행결정) 공시를 참고하시기 바랍니다. |
| 주2) | 사채권을 소유한 자가 전환청구를 하기 전에 발행회사가 시가를 하회하는 발행가격으로 주식을 발행할 경우 전환가액이 조정됩니다. |
| 주3) | 유상증자 조정 후 전환가액 = 조정 전 전환가액 ×{ (기발행주식수 + 신발행주식수 ×1주당 발행가액 ÷ 시가(기준주가)) ÷ (기발행주식수 + 신발행주식수) } |
| 주4) | 무상증자 조정 후 전환가액 = 조정 전 전환가액 x (기 발행주식수) ÷ (기 발행주식수 + 신 발행주식수) |
| 출처: | 당사 제공 |
| [당사 제1회차 전환사채 인수계약서 일부] |
|
제3조 사채의 발행조건 (1) 본 사채권을 소유한 자가 전환청구를 하기 전에 발행회사가 시가를 하회하는 발행가액으로 유상증자, 주식배당 및 준비금의 자본전입 등을 함으로써 주식을 발행하거나 또는 시가를 하회하는 전환가액 또는 행사가액으로 전환사채 또는 신주인수권부사채를 발행하는 경우에는 아래와 같이 전환가액을 조정한다. 단, 유.무상증자를 병행 실시하는 경우, 유상증자 1주당발행가액이 조정 전 전환가액을 상회하는 때에는 유상증자에 의한 신발행주식수는 전환가격 조정에 적용하지 아니하고 무상증자에 의한 신발행주식수만을 적용한다. 본호에 따른 전환가격의 조정일은 유상증자, 주식배당, 준비금의 자본전입 등으로 인한 신주발행일 또는 전환사채 및 신주인수권부사채의 발행일로 한다. 조정 후 전환가액 = 조정 전 전환가액 × [{A+(B×C/D)} / (A+B)] A: 기발행주식수 B: 신발행주식수 C: 1주당 발행가액 D: 시가 다만, 위 산식 중 "기발행주식수"는 당해 조정사유가 발생하기 직전일 현재의 발행주식총수로 하며, 전환사채 또는 신주인수권부사채를 발행할 경우 "신발행주식수"는 당해 사채 발행 시 전환가액으로 전부 주식으로 전환되거나 당해 사채 발행 시 행사가액으로 신주인수권이 전부 행사될 경우 발행될 주식의 수로 한다. 또한, 위 산식 중 "1주당 발행가액"은 주식분할, 무상증자, 주식배당의 경우에는 영(0)으로 하고, 전환사채 또는 신주인수권부사채를 발행할 경우에는 당해 사채 발행 시 전환가액 또는 행사가액으로 하며, 위 산식에서 "시가"라 함은 발행가액 산정의 기준이 되는 기준주가 또는 권리락주가(유상증자 이외의 경우에는 조정사유 발생 전일을 기산일로 하여 계산한 기준주가)로 한다. (중략)
|
본 공시서류 제출일 전일 현재 제1회차 전환사채의 잔여 전환가능 주식수는 858,590주입니다. 해당 전환사채가 투자자의 전환권 행사에 의하여 보통주로 전환될 경우 기존주주들의 지분 희석이 발생하게 되며, 최대주주 장명호 사장의 지분율 또한 희석될 수 있습니다. 당사의 제1회차 전환사채의 경우 상기의 발행 당시 계약서 상 '전환가액의 조정' 관련 조항에 의거하여 금번 유ㆍ무상증자에 따라 전환가액 하향 조정이 발생할 수 있습니다. 이 경우 유ㆍ무상증자 이후 전환 청구를 통해 발행되는 보통주는 보통주 1,025,325주로 전환될 예정이며, 이는 유ㆍ무상증자 완료 후 총발행주식수의 1.64%에 해당하는 수준입니다.
결론적으로 금번 유ㆍ무상증자가 완료된 이후 추가로 전환우선주 및 전환사채의 전환청구가 완료될 경우 당사 최대주주인 장명호 사장의 지분율은 5.95%로 본 공시서류 제출일 전일 지분율 대비 0.81%p. 감소할 예정입니다.
| [최대주주 지분율 변동 시뮬레이션 : 유상증자 + 무상증자 + 전환청구] |
|
| (기준일: 본 공시서류 제출일 전일) | (단위 : 주, %, %p.) |
| 성 명 | 주식의 종류 |
유ㆍ무상증자 후 | 전환우선주 전환청구 주식수 (주1, 2) |
전환사채 전환청구 주식수 (주1, 2) |
유ㆍ무상증자 및 전환청구 후 (예정) |
|||
| 주식수 | 지분율 | 주식수 | 지분율 | 지분율 변동(%p.) | ||||
| 장명호 | 의결권 있는 주식 | 3,793,491 | 6.07% | 1,125,897 | 1,025,325 | 3,793,491 | 5.95% | -0.12%p. |
| 주1) | 전환우선주 전환청구 주식수, 전환사채 전환청구 주식수는 확정 발행가액 기준 주식수이며, 향후 실제 전환청구 시점의 주식수는 변동될 수 있습니다. |
| 주2) | 전환청구 주식수의 경우 금번 유ㆍ무상증자로 인한 조정 후 전환가액을 기준으로 산출한 전환비율을 기준으로 계산하였습니다. |
| 출처: | 당사 제공 |
한편, 본 공시서류 제출일 전일 현재 기준 당사가 임직원에게 부여한 주식매수선택권 중 미행사수량은 3,913,416주로, 해당 미행사 주식매수선택권은 본 공시서류 제출일 전일 현재 발행주식총수의 8.67%, 금번 유ㆍ무상증자를 통한 예정 발행주식총수(기발행주식수+ 유상증자 신주+ 무상증자 신주)의 6.26%에 해당하는 수준입니다. 다만, 당사가 부여한 주식매수선택권의 미행사수량은 무상증자에 1:0.1의 비율로 증가하며, 행사가격은 유ㆍ무상증자에 따라 변동됩니다. 무상증자에 따라 증가될 예정인 주식매수선택권의 미행사수량은 4,304,651주이며, 이는 금번 유ㆍ무상증자를 통한 예정 발행주식총수(기발행주식수+ 유상증자 신주+ 무상증자 신주)의 6.89%에 해당하는 수준입니다.
주식매수선택권 중 미행사수량의 행사가능수량 및 행사가격은 하기와 같이 변경될 예정입니다. 유상증자에 따른 행사가격 조정은 미행사 주식매수선택권의 행사 가능성을 높일 수 있으며, 이에 따라 향후 주식매수선택권 행사에 따른 희석효과로 최대주주의 지분율이 소폭 하락할 수 있으니 투자자께서는 투자 판단시 이 점 유의하시기 바랍니다.
| [주식매수선택권 부여 내역] | |||
| (기준일: | 본 공시서류 제출일 전일 | ) | (단위 : 원, 주) |
| 회차 | 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
미행사수량 | 행사기간 | 행사가격 | 의무 보유 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | |||||||||
| 3 주2) |
오영민 외 2인 | 미등기임원 | 2018년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 188,083 | 81,003 | 89,101 | 2020년 03월 29일 ~ 2029년 03월 29일 |
1,433 | 1,433 | O |
| 7 (주2) |
조영규 외 6인 | 미등기임원 등 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 1,150,568 | 906,524 | 997,170 | 2021년 11월 26일 ~ 2029년 03월 29일 |
6,250 | 6,250 | O |
| 7 주2) |
OOO외 11인 | 직원 | 2019년 11월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 303,810 | 38,396 | 42,233 | 2021년 11월 26일 ~ 2026년 11월 25일 |
6,250 | 6,250 | X |
| 8 | 조영규 외 7인 | 미등기임원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 327,953 | 279,807 | 307,782 | 2022년 03월 30일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 8 | OOO 외 12인 | 직원 | 2020년 03월 30일 | 신주발행 / 자기주식 교부 |
보통주 | 263,248 | 112,795 | 124,067 | 2022년 03월 30일 ~ 2027년 03월 29일 |
9,682 | 9,655 | X |
| 9 | 김국환 외 5인 | 미등기임원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 300,473 | 224,982 | 247,477 | 2022년 10월 05일 ~ 2029년 03월 29일 |
9,682 | 9,655 | O |
| 9 | OOO 외 12인 | 직원 | 2020년 10월 05일 | 신주발행 / 자기주식 교부 |
보통주 | 220,021 | 140,484 | 154,524 | 2022년 10월 05일 ~ 2025년 10월 04일 |
9,682 | 9,655 | X |
| 10 | 홍준호 | 등기임원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 263,981 | 239,983 | 263,981 | 2023년 03월 26일 ~ 2029년 03월 29일 |
15,592 | 14,355 | O |
| 10 | OOO 외 5인 | 직원 | 2021년 03월 26일 | 신주발행 / 자기주식 교부 |
보통주 | 122,986 | 109,992 | 120,986 | 2023년 03월 26일 ~ 2026년 03월 25일 |
15,592 | 14,355 | X |
| 11 | 홍준호 | 등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 219,984 | 199,986 | 219,984 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | 김은성 | 미등기임원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 54,995 | 49,996 | 54,995 | 2023년 06월 16일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 11 | OOO외 7인 | 직원 | 2021년 06월 16일 | 신주발행 / 자기주식 교부 |
보통주 | 137,183 | 111,991 | 123,184 | 2023년 06월 16일 ~ 2026년 06월 15일 |
17,046 | 15,512 | X |
| 12 | 이병건 | 등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 549,962 | 499,966 | 549,962 | 2025년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | 이우열 외 2인 | 미등기임원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 135,986 | 59,995 | 65,993 | 2024년 03월 03일 ~ 2029년 03월 29일 |
17,046 | 15,512 | O |
| 12 | OOO외 22인 | 직원 | 2022년 03월 03일 | 신주발행 / 자기주식 교부 |
보통주 | 370,681 | 247,567 | 272,294 | 2024년 03월 03일 ~ 2029년 03월 02일 |
17,046 | 15,512 | X |
| 13 | 이병건 | 등기임원 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 329,976 | 299,979 | 329,976 | 2025년 06월 13일 ~ 2028년 06월 12일 |
11,418 | 11,036 | X |
| 13 | 이우형 외 14인 | 미등기임원 등 | 2023년 06월 13일 | 신주발행 / 자기주식 교부 |
보통주 | 227,740 | 197,970 | 217,742 | 2025년 06월 13일 ~ 2030년 06월 12일 |
11,418 | 11,036 | X |
| 14 | 임신생 외 11인 |
미등기임원 등 | 2024년 03월 29일 | 신주발행 / 자기주식 교부 |
보통주 | 173,200 | 112,000 | 123,200 | 2026년 03월 29일 ~ 2031년 03월 28일 |
12,720 | 12,071 | X |
| 합계 | - | - | - | - | 5,340,830 | 3,913,416 | 4,304,651 | - | - | - | - | |
| 주1) | 본 공시서류 제출일 전일 기준 당사 주식의 종가는 15,530원 입니다. |
| 주2) | 해당 회차의 경우 유상증자에 의해 주식매수선택권의 행사가격이 조정되지 않습니다. |
| 주3) | 부여받은 자에 기재된 직원수는 주식매수선택권 부여 당시 직원 수입니다. |
| 주4) | 현재 재직 중인 임직원의 관계는 작성 본 공시서류 제출일 전일 현재의 현황을 기재하였습니다. |
| 주5) | 최초부여수량 및 행사가격에는 유ㆍ무상증자 및 주식분할로 인한 조정된 수량과 행사가격을 반영하였습니다. |
| 주6) | 의무보유가 있는 주식매수선택권의 경우 「코스닥시장 상장규정」제26조에 따라 상장일(2023년 03월 30일)로부터 3년 혹은 1년 의무보유 대상입니다. |
| 주7) | 상기 부여된 주식매수선택권 중 취소된 부여물량은 의무적으로 재임 또는 재직하여야 하는 기간에 대한 조건을 갖추지 못하고 퇴직함으로 인해 발생하였습니다. |
요약하자면, 당사는 최대주주 장명호 사장의 1) 50% 수준의 청약률, 2) 유ㆍ무상증자, 3) 전환우선주 및 전환사채의 전환청구, 4) 주식매수선택권 및 미행사수량의 추후 행사 가능성 등의 이유로 인해 본 공시서류 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사 경영권 위협이 발생할 수 있으며, 본 신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게 될 경우 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자 판단 시 이 점 유의하시기 바랍니다.
당사는 2023년 상장 당시 경영 안정성 제고를 위해 주요 전략적 투자자 및 재무적 투자자들과 의결권 공동목적보유확약을 체결하여 상장 후 최대 3년 동안 주주총회에서 최대주주와 공동으로 의결권을 행사하기로 합의하였습니다. 본 공시서류 제출일 전일 현재 기준 공동행사 약정으로 최대주주와 의결권을 공동 행사하는 공동보유자의 지분율(최대주주 및 특수관계인 제외)은 의결권 있는 보통주 총 발행주식수의 약 33.7% 입니다. 당사는 해당 공동보유자 보유지분에 최대주주 및 특수관계인이 보유한 8.36%를 더하여 총 42.06%를 확보하였기에 안정적으로 경영권 유지가 가능할 것으로 예상하고 있습니다. 향후 해당 약정 종료 후에도 당사는 공동보유자와의 지속적인 파트너십 유지를 통한 안정적인 경영권 방어를 위해 노력할 예정입니다. 다만, 이러한 약정에도 불구하고 향후 유상증자, 전환사채 발행 등 추가 자금조달 및 기타 사유로 지분율이 추가적으로 감소할 경우 경영권 안정화에 부정적인 영향을 미칠 수 있으니 투자자께서 이 점 유의하시기 바랍니다.
| 나. 성장성 및 수익성 감소에 따른 위험 당사의 매출은 국내외 제약사와의 신약 후보물질 기술이전(License-out) 또는 공동개발에 대한 계약을 체결한 뒤, 개발 단계에 따라 선급금, 단계별 마일스톤 및 제품 출시 이후 판매액의 일정부분에 해당하는 로열티를 중심으로 구성됩니다. 당사의 2021년과 2022년 매출액은 각각 5,600백만원에서 3,500백만원으로 약 38% 감소하였습니다. 이는 계약 상대방인 유한양행이 지급한 GI-301 관련 개발, 상업화 마일스톤에 따른 계약금 금액의 차이에서 기인한 것으로, 임상1상 시험계획(IND) 승인에 따라 약 55억 가량을 수취한 2021년도에 비해 2022년도에는 시험약제공 등으로 매출 약 35억원을 기록하였기 때문입니다. 2023년에는 GI-301을 통한 마루호(Maruho)와 라이센스아웃 계약 체결 및 기타 용역 대금 수령을 통해 전년대비 약 52% 증가한 5,319백만원을 시현하였습니다. 당사는 설립 이후 총 3건(관계사 거래 제외)의 신약 후보물질의 기술이전 및 1건의 공동연구개발 계약을 체결하며 매출을 기록하였으나, 급여, 소모품비, 지급수수료 등 경상연구개발비용이 지속적으로 발생함에 따라 최근 3년 및 2024년 3분기 영업손실 및 당기순손실을 기록하고 있습니다. 당사의 당기순손실은 2021년 150,742백만원, 2022년 79,833백만원, 2023년 55,495백만원, 2024년 3분기 38,829백만원을 기록하였습니다. 2020년 당기순손실에 대비하여 2021년 당기순손실이 약 47.0% 감소하였고, 2022년 당기순손실액 비하여 2023년 당기순손실이 30.5% 감소하였습니다. 또한, 기술이전계약에 따른 마일스톤 수익 발생과 관련된 불확실성이 존재하며 연구개발 과정에서 예상치 못한 실패나, 기술이전 과정에서의 일정 지연 등이 수익성을 악화시킬 수 있습니다. 투자자분들께서는 이 점 유의하시기 바랍니다. |
[성장성]
당사의 매출은 국내외 제약사와의 신약 후보물질 기술이전(License-out) 또는 공동개발에 대한 계약을 체결한 뒤, 개발 단계에 따라 선급금, 단계별 마일스톤 및 제품 출시 이후 판매액의 일정부분에 해당하는 로열티를 중심으로 구성됩니다. 당사의 2021년과 2022년 매출액은 각각 5,600백만원에서 3,500백만원으로 약 38% 감소하였습니다. 이는 계약 상대방인 유한양행이 지급한 GI-301 관련 개발, 상업화 마일스톤에 따른 계약금 금액의 차이에서 기인한 것으로, 임상1상 시험계획(IND) 승인에 따라 약 55억 가량을 수취한 2021년도에 비해 2022년도에는 시험약제공 등으로 매출 약 35억원을 기록하였기 때문입니다. 2023년에는 GI-301을 통한 마루호(Maruho)와 라이센스아웃 계약 체결 및 기타 용역 대금 수령을 통해 전년대비 약 52% 증가한 5,319백만원을 시현하였습니다.
이로써 2023년도의 당사 사업 부문별 매출 비중은 GI-301이 88.9%로 가장 큰 부분을 차지하였고 GI-101은 약 7.5%, 그 외의 용역 등의 매출은 약 3.5%의 비중을 차지하고있었습니다. 2024년도 3분기 매출은 2023년도 매출 대비 5,319백만 원에서 24백만 원으로 약 99.5% 급감하였는데 이는 신규 기술이전이나 공동연구 계약 및 마일스톤 금액 수취분의 부재로 인한 것으로 판단됩니다.
2021년도에는 2020년 유한양행과 체결한 알레르기 질환 치료제 GI-301 관련 라이센스아웃 계약으로부터 마일스톤 금액이 매출로 발생하였습니다. 구체적으로, 2021년 7월 국내 식품의약품안전처로부터 해당 치료제의 임상1상 시험계획(IND) 승인에 따라 1차 계약금 수령액을 제외한 계약금 잔액 중 55억원을 일시 수익 인식하였고, 해당 계약금은 2021년 8월에 일시 수령되었습니다. 또한, 2021년 12월 27일자로 한국에 소재한 메디라마와 의약품 후보물질 2건에 대한 공동연구개발 계약을 체결하여 약 1억원의 반환조건 없는 계약금을 2021년 12월에 일시 수익 인식하였습니다.
2022년에도 2020년 유한양행과 체결한 알레르기 질환 치료제 GI-301 관련 라이센스아웃 계약으로부터 기술이전계약에 따른 첫번째 임상시험약 제공, 분석용 신규세포주 공정 생산 단백질 제공 및 신규 세포주 공정개발 리포트 제출이 완료되어 계약금 35억원을 수령하여 매출이 발생하였습니다.
2023년도에는 일본 마루호(Maruho)와 알레르기 질환 치료제 GI-301 관련 일본 내 개발 및 상업화 권리에 대한 라이센스아웃 계약으로부터 47억원을 수령하여 매출이 발생하였습니다. 또한 핵심파이프라인인 GI-101의 국내 기술이전 마일스톤 달성에 따른 로열티 4억원을 수령하였습니다.
2024년도 3분기에는 주요 파이프라인에 대한 기술수익 및 추가적인 마일스톤 금액 수령분이 부재하여 2024년도 1분기에 발생한 기타 수익으로 2024년 3분기까지 누적 매출액이 약 24백만원 기록하였으며, 이는 2023년 동분기 매출 대비 약 95% 가량 감소한 금액입니다.
다만, 당사는 이미 2019년 11월 중국 제약사 심시어(Simcere Pharmaceutical)와 중국지역 한정 7억9천만 달러 규모의 GI-101 기술이전 계약을 체결하였고 추가로 GI-101과 GI-102의 다양한 적응증을 대상으로 한 임상 2상의 결과가 본격적으로 도출되는 2024년~2025년 이내 글로벌 판권의 기술이전을 계획하고 있습니다. 또한, 유한양행과 체결한 글로벌 기술이전 계약의 경우, 제3자 기술이전(sub-license) 조항에 따라, (주)유한양행이 GI-301의 글로벌 사업권을 제3자에 이전시 수익금의 50%를 당사가 수령하게 되어 있어 이를 통한 추가 수익이 발생할 수 있습니다.
| [사업부문별 매출 현황] |
| (단위 : 백만원,%) |
| 매출유형 | 품 목 | 구분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 | ||||
| 금액 | 비중 | 금액 | 비중 | 금액 | 비중 | 금액 | 비중 | |||
| 기술이전 | GI-101 | 내수 | - | - | 400 | 7.52 | - | - | - | - |
| GI-301 | 내수 | - | - | - | - | 3,500 | 100 | 5,500 | 98.2 | |
| 수출 | - | - | 4,731 | 88.95 | - | - | - | - | ||
| 공동연구 | GI-10N | 내수 | - | - | - | - | - | - | 100 | 1.8 |
| 기타매출 | - | 내수 | 24 | 100 | 188 | 3.53 | - | - | - | - |
| 매출총계 | 24 | 100 | 5,319 | 100 | 3,500 | 100 | 5,600 | 100 | ||
| 매출성장률 | -95.87 | 51.97 | -37.50 | -49.17 | ||||||
|
출처) 당사 정기보고서 및 당사 제시 주1) 2024년 3분기 매출성장률은 전년 3분기 대비 매출성장률입니다. |
[수익성]
당사는 설립 이후 총 3건(관계사 거래 제외)의 신약 후보물질의 기술이전 및 1건의 공동연구개발 계약을 체결하며 매출을 기록하였으나, 급여, 소모품비, 지급수수료 등 경상연구개발비용이 지속적으로 발생함에 따라 최근 3년 및 2024년 3분기 영업손실 및 당기순손실을 기록하고 있습니다. 당사의 당기순손실은 2021년 150,742백만원, 2022년 79,833백만원, 2023년 55,495백만원, 2024년 3분기 38,829백만원을 기록하였습니다. 2020년 당기순손실에 대비하여 2021년 당기순손실이 약 47.0% 감소하였고, 2022년 당기순손실액 비하여 2023년 당기순손실이 30.5% 감소하였습니다.
당사의 주요파이프라인 임상 초기단계 진입에 따라 전임상단계 준비 등의 경상연구개발비가 증가하여 영업비용이 2021년도 36,232백만원에서 2022년 71,452백만원으로 증가하였습니다. 반면 전임상단계에서 임상단계로 진입함에 따라 2023년 영업비용 58,623백만원으로 감소하였으며 2024년도 3분기 영업비용이 36,101백만원으로 2023년도 3분기 45,145백만원 대비 감소하였습니다.
당사의 영업손실은 2021년 30,632백만원(영업이익률 : -5.47%), 2022년 67,952백만원(영업이익률 : -19.41%)을 기록하였으며, 2023년 53,305백만원(영업이익률 : -10.02%), 2024년 3분기 36,077백만원(영업이익률 : -1,485.79%)으로 적자 지속 중에 있습니다. 당사의 손익계산서상 주요 계정 및 수익성 추이는 다음과 같습니다.
| [손익계산서 주요계정 및 수익성 추이 표] |
| (단위 : 백만원) |
| 구 분 | 2024년 3분기 | 2023년 3분기 | 2023년 | 2022년 | 2021년 |
| 영업수익(매출액) | 24 | 588 | 5,319 | 3,500 | 5,600 |
| 영업비용 | 36,101 | 45,145 | 58,623 | 71,452 | 36,232 |
| 영업이익(손실) | -36,077 | -44,557 | -53,305 | -67,952 | -30,632 |
| 금융수익 | 1,063 | 1,886 | 4,828 | 2,000 | 1,512 |
| 금융비용 | 2,552 | 371 | 692 | 4,186 | 101,990 |
| 기타수익 | 39 | 1,400 | 1,401 | 48 | 111 |
| 기타비용 | 5 | 1 | 1 | 16 | 1,459 |
| 지분법손익 | -1,297 | -2,267 | -7,253 | -9,727 | -18,283 |
| 법인세비용차감전순이익(손실) | -38,829 | -43,910 | -55,022 | -79,833 | -150,742 |
| 법인세비용(수익) | - | - | 473 | - | - |
| 당기순이익(손실) | -38,829 | -43,910 | -55,495 | -79,833 | -150,742 |
| 영업이익률 | -1,485.79 | -75.79 | -10.02 | -19.41 | -5.47 |
| 당기순이익률 | -1,599.12 | -74.69 | -10.43 | -22.81 | -26.92 |
|
출처) 당사 정기보고서 및 당사 제시 |
당사의 당기순손실은 2021년 150,742백만원, 2022년 79,833백만원, 2023년 55,495백만원, 2024년 3분기 누적 기준 38,829백만원을 기록하였습니다. 2021년 당기순손실이 98.5% 감소하였고, 2022년에는 47.0%, 2023년 30.5%, 2024년 3분기 전년 동기 대비 11.57% 증가하였습니다. 2021년부터 2024년 3분기까지 평균 영업이익률은 -319.3%, 평균 당기순이익률은 -346.8%를 보였습니다.
2021년에는 영업비용 36,232백만원, 영업손실 30,632백만원을 기록하였으며, 2022년 영업비용 71,452백만원, 영업손실 67,952백만원, 2023년 영업비용 58,623백만원, 영업손실 53,305백만원, 2024년 3분기 영업비용 36,101백만원, 영업손실 36,077백만원을 기록하였습니다.
| [영업비용 내역] |
| (단위:백만원) |
| 구 분 | 2024 3분기 | 2023 3분기 | 2023 | 2022 | 2021 |
| 급여 | 2,743 | 2,872 | 3,758 | 3,810 | 3,162 |
| 퇴직급여 | 329 | 330 | 455 | 603 | 567 |
| 복리후생비 | 769 | 759 | 1,064 | 1,125 | 839 |
| 경상연구개발비 | 25,909 | 30,810 | 40,145 | 56,004 | 23,339 |
| 주식보상비용 | 2,232 | 5,828 | 6,547 | 4,488 | 3,772 |
| 유무형자산감가상각비 | 2,337 | 2,537 | 3,329 | 3,157 | 2,147 |
| 지급수수료 | 946 | 1,036 | 1,519 | 922 | 983 |
| 여비교통비 | 163 | 184 | 407 | 226 | 57 |
| 기타판매비와관리비 | 673 | 788 | 1,398 | 1,118 | 1,366 |
| 합계 | 36,101 | 45,145 | 58,623 | 71,452 | 36,232 |
|
출처) 당사 정기보고서 |
위에서 기술한 바와 같이, 당사의 영업비용 중 가장 큰 비중을 차지하는 경상연구개발비는 손익 구조에 지속적으로 중요한 영향을 미치고 있습니다. 특히, 초기 신약 파이프라인 연구 및 개발 단계에서는 회사 자원이 집중 투입되었으나, 2022년 이후 연구개발비를 꾸준히 감소시키며 비용 효율화를 이루어내고 있습니다. 이러한 변화는 임상 연구 성과에 따라 계약금 수익과 마일스톤 수익이 발생하면서 지속적인 비용구조 개선이 가능해진 결과입니다.
그러나 기술이전계약에 따른 마일스톤 수익 발생과 관련된 불확실성이 존재하며 연구개발 과정에서 예상치 못한 실패나, 기술이전 과정에서의 일정 지연 등이 수익성을 악화시킬 수 있습니다. 투자자분들께서는 이 점 유의하시기 바랍니다.
| 다. 기술성장특례 적용 기업에 따른 이익 미실현 및 수익성 개선 지연 위험 당사는 코스닥시장 상장요건 중 상장주선인이 성장성을 평가하여 추천한 기술성장기업(성장성 기술성장특례)으로 적용 받아 상장예비심사 승인을 득하였습니다. 이후 2023년 03월 신규 상장 당시 상장 공모를 위한 증권신고서 상의 2022년과, 상장 이후 4개년(2023년~2026년)의 경영 실적을 추정하였습니다. 당시 당사는 기 체결된 계약 및 향후 추가적으로 체결 예정인 기술이전 수익만을 추정해, 2024년 흑자전환 후 지속적으로 영업이익을 창출할 것으로 추정하였습니다. 상장 당시 추정 손익 중 영업수익 예측치는 신약후보물질 기술이전에 따른 선급금(Upfront Payment)을 바탕으로 기재하였습니다. 실제로 당사는 2023년 10월 기술이전 계약을 체결하였으나, 예측에 고려되었던 주요요인(증권신고서 제출 당시 글로벌 기술이전 사례 17건의 평균 선급금 비중 및 일부 지역 내 유사제제의 기술이전 사례들의 선급금 비중 평균 등 고려)의 변동 및 글로벌 통화긴축 지속, 지정학적 갈등의 심화 등 외부요인에 영향에 따라 위 손익추정을 달성하지 못하였으나, 여전히 신약 출시 전단계의 연구개발을 활발히 진행하고 있습니다. 향후에도 연구개발에 지속적인 투자를 할 예정이며, 기술이전을 통해 취득하는 계약금과 단계별 마일스톤 등을 통해 일정 규모 이상의 매출이 발생하기 전까지는 손실이 계속될 것으로 예상됩니다. 당사는 기술성장기업으로 아직 사업의 성과가 본격화되지 않았으며, 기술이전을 완료한 파이프라인의 마일스톤 수익발생 지연 및 추가 기술이전계약 체결 지연 등으로 추정치 대비 영업수익이 감소할 가능성이 존재합니다. 이에 따라 재무사항의 예측치와 실적치에 괴리가 발생할 수 있으니 투자자께서는 투자판단 시 이점을 유의하시기 바랍니다. |
당사는 코스닥시장 상장요건 중 상장주선인이 성장성을 평가하여 추천한 기술성장기업(성장성 기술성장특례)으로 적용 받아 상장예비심사 승인을 득하였습니다. 이후 2023년 03월 신규 상장 당시 상장 공모를 위한 증권신고서 상의 2022년과, 상장 이후 4개년(2023년~2026년)의 경영 실적을 추정하였습니다. 당시 당사는 기 체결된 계약 및 향후 추가적으로 체결 예정인 기술이전 수익만을 추정해, 2024년 흑자전환 후 지속적으로 영업이익을 창출할 것으로 추정하였습니다.
| [상장 당시 5개년 추정 요약 손익계산서] |
| (단위: 백만원) |
| 구분 | 2020년 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | 2025년(E) | 2026년(E) |
| 영업수익 | 11,017 | 5,600 | 3,500 | 10,896 | 148,643 | 104,529 | 178,548 |
| 영업비용 | 33,891 | 36,232 | 72,307 | 64,554 | 55,995 | 57,364 | 53,331 |
| 영업이익(손실) | -22,875 | -30,632 | -68,807 | -53,658 | 92,648 | 47,165 | 125,217 |
| 영업외수익 | 1,166 | 2,181 | 3,909 | - | - | - | - |
| 영업외비용 | 54,225 | 122,291 | 1,969 | - | - | - | - |
| 법인세비용차감전순이익(손실) | -75,933 | -150,742 | -66,867 | -53,658 | 92,648 | 47,165 | 125,217 |
| 법인세비용 | - | - | - | - | - | - | - |
| 당기순이익(손실) | -75,933 | -150,742 | -66,867 | -53,658 | 92,648 | 47,165 | 125,217 |
|
출처) 당사 정기보고서 |
상장 당시 추정 손익 중 영업수익 예측치는 신약후보물질 기술이전에 따른 선급금(Upfront Payment)을 바탕으로 기재하였습니다. 실제로 당사는 2023년 10월 기술이전 계약을 체결하였으나, 예측에 고려되었던 주요요인(증권신고서 제출 당시 글로벌 기술이전 사례 17건의 평균 선급금 비중 및 일부 지역 내 유사제제의 기술이전 사례들의 선급금 비중 평균 등 고려)의 변동 및 글로벌 통화긴축 지속, 지정학적 갈등의 심화 등 외부요인에 영향에 따라 위 손익추정을 달성하지 못하였으나, 여전히 신약 출시 전단계의 연구개발을 활발히 진행하고 있습니다. 향후에도 연구개발에 지속적인 투자를 할 예정이며, 기술이전을 통해 취득하는 계약금과 단계별 마일스톤 등을 통해 일정 규모 이상의 매출이 발생하기 전까지는 손실이 계속될 것으로 예상됩니다.
당사의 최근 3개년 매출 추정치와 실제 매출 간 괴리율은 아래와 같습니다.
| (기준 재무제표 : | 별도 | ) | (상장일 : | 2023년 03월 30일 | , 인수인 : | NH투자증권, 하나증권, 삼성증권 | ) | (단위 : 백만원, %) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 예측치 달성 여부 |
괴리율 |
|---|---|---|---|---|---|
| 2022년 | 매출액 | 3,500 | 3,500 | 달성 | 0.00 |
| 영업이익 | -68,807 | -67,952 | 달성 | 1.24 | |
| 당기순이익 | -66,867 | -79,833 | 미달성 | -19.39 | |
| 2023년 | 매출액 | 10,896 | 5,319 | 미달성 | 51.19 |
| 영업이익 | -53,658 | -53,305 | 달성 | 0.66 | |
| 당기순이익 | -53,658 | -55,495 | 미달성 | -3.42 | |
| 2024년 3분기 | 매출액 | 111,482 | 24 | 미달성 | 99.98 |
| 영업이익 | 69,486 | -36,077 | 미달성 | 151.92 | |
| 당기순이익 | 69,486 | -38,829 | 미달성 | 155.88 |
| 주1) 괴리율은 (예측치-실적치)/예측치로 산정된 비율입니다. 주2) 2022년, 2023년, 2024년 예측치는 상장 시 증권신고서에 기재된 예측치입니다. 주3) 2024년 3분기 예측치는 2024년 추정치에 3/4을 곱하여 환산한 수치입니다. 주4) 예측치에서 정하는 매출액/영업이익/당기순이익 등의 지표는 증권신고서 제출시점(2023년 01월 30일)에서 당사가 합리적이라 판단되는 근거를 통하여 작성한 사업계획입니다. 해당 예측치는 실제 당사의 연구개발에 대한 진척도 및 임상결과, 시장의 경쟁상황 등에 따라 현저히 변동될 가능성이 있습니다. |
| [기술이전에 따른 계약 수익구조 구분] |
| 구분 | 내용 | |
|---|---|---|
| 총 계약금액 |
계약금 (Upfront Payment) |
계약 체결 직후 또는 일정기간 내에 받게 되는 금액 |
|
개발 마일스톤 (Development Milestone) |
전임상, 임상(1상, 2상, 3상 진입 단계별), 허가신청, 허가완료, 시판 등 개발 단계별로 성공시 받게 되는 금액 | |
| 상업화 마일스톤 (Sales Milestone) |
목표하는 매출에 도달하였을 경우 받게 되는 금액 | |
| 로열티(Royalty) |
기술 이전으로 제품의 매출에 따라 받게 되는 금액 (통상 매출액 대비 비율로 책정) |
|
| 자료: 금융감독원 보도자료 |
| [상장 당시 주요 파이프라인별 세부 매출 추정 근거] |
| (단위: 백만원) |
| 구분 | 기술이전 | 계약연도 | 기술료구분 | 2022년 | 2023년(E) | 2024년(E) | 2025년(E) | 2026년(E) |
| 계약상대방/지역 | (완료/예정) | |||||||
| GI-101 | 심시어/중국 | 2019년 완료 |
Timeline | 비공개 | ||||
| Upfront | ||||||||
| Milestone | ||||||||
| 미정/글로벌 (중국제외) |
2024년 예상 |
Timeline | 임상 1/2상 | 임상 3상 | ||||
| Upfront | - | - | 계약체결 138,503 |
- | - | |||
| Milestone | - | - | - | 첫번째 적응증 임상 2b/3상 진입 82,389 |
Fast track /break through 지정 82,389 두번째 적응증 임상 2b/3상 진입 82,389 |
|||
| 기술이전 매출추정 소계 | - | - | 138,503 | 82,389 | 164,778 | |||
| GI-301 | 유한양행/글로벌 (일본제외) |
2020년 완료 |
Timeline | 임상 1상 | 임상 1상 종료, 임상2상 진입 |
임상 2상 | ||
| Upfront | 잔여 선급금 3,500 |
- | - | - | - | |||
| Milestone | - | - | 최초 임상 2상 진입 5,500 |
최초 임상 2상 탑라인 결과 6,500 미국 현식 치료제 지정 11,000 |
- | |||
| 미정/일본 | 2023년 예상 |
Timeline | - | - | 임상 2상 | 임상 2상 종료 및 임상 3상 진입 |
||
| Upfront | - | 계약체결 10,896 |
- | - | - | |||
| Milestone | - | 임상 2상 진입 4,640 |
임상 2상 탑라인 결과 확보 4,640 |
임상 3상 진입 13,770 |
||||
| 기술이전 매출추정 소계 | 3,500 | 10,896 | 10,140 | 22,140 | 13,770 | |||
| 주요 파이프라인 기술이전 매출추정 합계 | 3,500 | 10,896 | 148,643 | 104,529 | 178,548 | |||
| 출처) 당사 제시 |
당사의 매출은 기술이전을 통한 계약금 및 마일스톤 수취를 위주로 발생하고 있음에 따라 매출의 발생과 인식이 비정형적으로 나타나는 특징이 있습니다. 또한 기술이전 계약의 특성상 잠재적 사업 파트너사와의 협상 과정에 내재된 여러 변수로 인해 변동폭이 큰 특징이있습니다. 또한 본 매출액 추정에서는 보수적으로 임상 개발 단계에 진입한 면역항암제 GI-101 및 알레르기치료제 GI-301 등 주요 파이프라인 2가지에 한정하여, 기 체결된 계약 및 향후 추가적으로 체결 예정인 기술이전 수익만을 추정하였습니다.
당사는 증권신고서 상 2022년(3차연도) 매출액을 3,500백만원으로 추정 기재하였고, 실적은 3,500백만원으로 괴리율은 0% 입니다. 각 재무사항의 괴리발생의 원인은 아래와 같습니다.
| (단위 : 백만원) |
| 구분 | 예측 - 2022년(3차 연도) | 실적 - 2022년(3차 연도) | ||
|---|---|---|---|---|
| 금액 | 추정근거 | 금액 | 괴리 발생사유 | |
| 매출액 | 3,500 | 2022년에 GI-301이 유한양행과의 계약으로 발생하는 업프론트에 따라, 3,500백만원의 매출액이 발생할 것으로 예측하였습니다. | 3,500 | - |
| 영업이익 | -68,807 | 당초 매출액 3,500백만원이 발생할것을 예상함에 따라 그에 대한 판매비와 관리비 72,307백만원을 제외하고 68,807백만원의 영업손실이 발생할 것으로 예측하였습니다. 연구개발계획에 따른 연구개발비 및 과거 발생한 판관비를 참고하여 물가상승률 및 인원현황 등을 고려하여 추정하였습니다. |
-67,952 | - |
| 당기순이익 | -66,867 | 당사는 2021년 전환우선주가 전부 보통주로 전환됨에 따라 향후 추가적인 손실 발생가능성이 없습니다. 또한 영업외 수익/비용에는 지분법손익 및 당기손익-공정가치금융자산 관련 손익이 포함되어 있으나 합리적 추정이 불가능하여 추정치에서제외하였습니다 | -79,833 | 실제 2022년 당기순손실은 79,833백만원으로, 이는 당초 영업손실 67,952백만원에 금융수익 2,000백만원, 금융비용 4,186백만원, 지분법손실 9,727백만원을 반영하여 나온 금액입니다. 이에 따라 당기순이익과의 차이는 2022년 이익 발생을 가정하여 발생한 괴리율입니다. 주요 원인은 당사가 보유한 관계기업의 지분법손실 반영입니다. |
| 출처) 당사 제시 |
당사는 증권신고서 상 2023년도(4차연도) 매출액을 10,896백만원으로 추정 기재 하였으나, 실적은 5,319 백만원으로 괴리율은 51.19% 입니다. 각 재무사항의 괴리발생 원인은 아래와 같습니다.
| (단위 : 백만원) |
| 구분 | 예측 - 2023년(4차 연도) | 실적 - 2023년(4차 연도) | ||
| 금액 | 추정근거 | 금액 | 괴리 발생사유 | |
| 매출액 | 10,896 | 2023년에 일본 지역 기술이전 계약체결예정에 따라 10,895백만원의 매출액이 발생할 것으로 예측하였습니다. 매출추정의 근거는 계약이 공개된 사례 중 치료분야, 개발단계, 약물 형태가 동사와 유사하며 구매사(Licensee)가 일본 기업인 일본 지역 판권 기술이전 사례 2건을 참고하였습니다. (일본 지역 판권 기술이전 사례 2건의 계약 규모 평균은 약 223백만달러) | 5,319 | 일본 제약사인 마루호와 2023년 10월 GI-301의 일본 내 개발 및 상업화에 대한 전용실시권 계약을 체결하여 받은 선수수익과 매출액에 대한 괴리가 발생하였습니다. 2023년 발생 매출액은 GI-101에서 발생한 400백만원, GI-301에서 발생한 4,730백만원 등으로 구성되어 있습니다. 추정 사항과 같이 실제 당사는 2023년 3분기 중 일본 지역 기술이전 계약을 체결하였습니다. 다만, 금리인상은 제품 상용화까지 막대한 R&D 비용이 투입되는 제약 바이오 및 헬스케어 산업의 기업가치에 부정적인 영향이 있으며, 바이오 회사의 기술이전에 따른 계약금의 규모는 장기의 예측을 반영하므로 금리 변동에 민감도가 크다는 특징이 있습니다. 2022년부터 시작된 글로벌 통화긴축의 강도가 2023년까지 강화됨에 따라 추정에 사용된 할인율 상승 및 글로벌 기술이전 사례 규모의 변동, 지정학적 갈등의 심화 등 외부요인에 영향을 받아 추정 시점과 실제 계약 시점의 계약구조가 변동되어 계약금이 감소하였으나, 마일스톤과 로열티를 포함한 총 계약규모는 추정 시점과 변동이 없습니다. |
| 영업이익 | -53,658 | 당초 매출액 10,896백만원이 발생할것을 예상함에 따라 그에 대한 판매비와 관리비 65,879백만원을 제외하고 53,658백만원의 영업손실이 발생할 것으로 예측하였습니다. 연구개발계획에 따른 연구개발비 및 과거 발생한 판관비를 참고하여 물가상승률 및 인원현황 등을 고려하여 추정하였습니다. |
-53,305 | 판매비와 관리비의 경우 당초 예측치보다 주식보상비용은 증가하였으나, 주요 파이프라인의 본격적인 임상시험 진행에 따른 비임상 비용 축소의 영향으로 경상연구개발비는 감소하여 예측치와 실적치의 소폭 차이가 발생하였습니다. |
| 당기순이익 | -53,658 | 영업외 수익/비용에는 지분법손익 및 당기손익-공정가치금융자산 관련 손익이 포함되어 있으나 합리적 추정이 불가능하여 추정치에서 제외하였습니다. | -55,495 | 실제 2023년 당기순손실은 55,495백만원으로 이는 당초 영업손실 53,305만원에 금융수익 4,828백만원, 금융비용 692백만원, 기타수익 1,401백만원, 기타비용 1백만원, 지분법손실 7,253백만원, 법인세비용 473백만원을 반영하여 나온 금액입니다. 이에 따라 당기순이익과의 차이는 2023년 이익발생을 가정한 부분에 의한 괴리율입니다. 괴리율은 10% 이내로 발생하였습니다. |
| 출처) 당사 제시 |
당사는 증권신고서 상 2024년 (5차연도) 매출액을 148,643백만원으로 추정기재하였으나, 실적은 24백만원으로 2024년 추정치를 3분기로 환산한 수치인 111,482백만원 대비 괴리율은 99.98% 입니다. 각 재무사항의 괴리발생 원인은 아래와 같습니다.
| (단위 : 백만원) |
| 구분 | 예측 - 2024년 3분기 (5차 연도) 주1) |
실적 - 2024년 3분기 (5차 연도) 주2) |
||
| 금액 | 추정근거 | 금액 | 괴리 발생사유 | |
| 매출액 | 111,482 | GI-101의 글로벌 기술이전에 따른 업프론트, GI301의 유한양행 및 일본 계약 임상 2상 진입에 따른 매출발생으로 148,643백만원의 매출을 추정치로 제시하였습니다. 매출 추정의 근거는 GI-101에 대한 중국을제외한 글로벌 기술이전 선급금 138,503백만원과 GI-301에 대한 유한양행/글로벌(일본제외)에서의 임상2상 진입에 따른 마일스톤 수수료 5,500백만원, 그리고 미정/일본에서의 임상 2상 진입에 따른 마일스톤 수수료 4,639백만원으로 총 주요 파이프라인 기술이전 매출추정을 148,643백만원으로 예측하였습니다. |
24 |
추정된 GI-101, GI-301에 대한 매출이 발생하지 않음에 따라 기타매출 24백만원(3분기 기준)만 발생하였습니다. |
| 영업이익 | 69,486 | 당초 매출액 148,643백만원이 발생할것을 예상함에 따라 그에 대한 판매비와 관리비 57,365백만원을 제외하고 92,648백만원의 영업이익이 발생할 것으로 예측하였습니다. 연구개발계획에 따른 연구개발비 및 과거 발생한 판관비를 참고하여 물가상승률 및 인원현황 등을 고려하여 추정하였습니다. |
-36,077 | 판매비와 관리비의 경우 당초 예측치보다 주요 파이프라인 임상시험 진행에 따른 비임상 비용 축소 영향으로 경상연구개발비는 감소하였으나 매출액이 예상치에 크게 하회함에 따라 예측치와 실적치의 괴리율이 발생하였습니다. |
| 당기순이익 | 69,486 | 영업외 수익/비용에는 지분법손익 및 당기손익-공정가치금융자산 관련 손익이 포함되어 있으나 합리적 추정이 불가능하여 추정치에서 제외하였습니다. | -38,829 | 2024년 3분기 당기순손실은 38,829백만원으로, 이는 당초 영업손실 36,077백만원에 금융수익 1,063백만원, 금융비용 2,552백만원, 기타수익 39백만원, 기타비용 5백만원 지분법손실 1,297백만원을 반영하여 나온 금액입니다. 이에 따라 당기순이익에 차이는 2024년 이익발생을 가정한 매출 추정액에서 기인한 괴리율입니다. |
| 출처) 당사 제시 주1) 2024년 3분기 추정치는 2024년 추정치에 3/4을 곱하여 환산한 수치이며, 추정 근거는 2024년 추정치 기준으로 기재하였습니다. 주2) 2024년 3분기 분기보고서상 공시된 수치입니다. |
당사는 관계기업 (주)지아이바이옴 및 (주)메디오젠에 대한 지분법손실을 2022년 9,727백만원, 2023년 7,253백만원, 2024년 3분기 1,297백만원 인식함에 따라 실제 손익이 상장 당시 추정 손익 대비 괴리율이 발생하였습니다. 그럼에도 불구하고, (주)지아이바이옴은 당사의 물질 개발과 관련된 비임상 용역계약을 다수 수행 중이며, 당사에서 개발중인 물질에 대한 이해도가 높아 신속한 파이프라인 개발에 기여하는 파트너사이며, (주)메디오젠이 보유한 마이크로바이옴 중 특정질환에 우수한 효능을 가진 미생물 균주를 당사의 마이크로바이옴 콤보 바이오신약 개발을 위해 협력하고 있으며, (주)메디오젠이 보유한 GMP 제조시설과 CDMO 설비의 향후 활용도 가능한 중요한 파트너사입니다. 이에 당사는 지속적인 지분법손실 발생에도 관계기업을 유지하고 있습니다. 당사의 관계기업 지분법 손실 인식 내역은 다음과 같습니다.
| [관계기업 지분법 손실 내역] |
| (단위: 백만원) |
| 구 분 | 2024년 3분기 | 2023년 | 2022년 | 합계 |
|---|---|---|---|---|
| (주)지아이바이옴 | 615 | -1,264 | -761 | -1,409 |
| (주)메디오젠 | -1,912 | -5,989 | -8,966 | -16,867 |
| 합계 | -1,297 | -7,253 | -9,727 | -18,277 |
| 출처) 당사 제공 |
당사는 지속적인 연구개발을 통한 신규 파이프라인 확보 및 기술이전을 통해 본 공시서류 제출일 전일 현재 당사는 다수의 해외 파트너사들과 CDA를 맺고 기술이전을 위한 활동을 유지해 나가고 있습니다. 당사는 주기적으로 개최되는 JPM conference, BIO international, AACR, ASCO, SITC, PEGS에 참석하여 글로벌 상위 제약사들과 지속적인 논의를 진행하고 있습니다. 또한 주요 임상 결과 업데이트가 있을 때마다 글로벌 제약사와의 비정기적인 화상회의를 통해 결과를 알림으로써 당사 파이프라인에 대한 지속적인 관심을 가질 수 있도록 하고 있습니다. 하지만 당사는 기술성장기업으로 아직 사업의 성과가 본격화되지 않았으며, 상기와 같이 기술이전을 완료한 파이프라인의 마일스톤 수익발생 지연 및 추가 기술이전계약 체결 지연 등으로 추정치 대비 영업수익이 감소할 가능성이 존재합니다. 이에 따라 재무사항의 예측치와 실적치에 괴리가 발생할 수 있으니 투자자께서는 투자 판단 시 이 점을 유의하시기 바랍니다.
| 라. 영업현금흐름 및 유동성 관련 위험 당사는 2024년 3분기 및 최근 3년간 지속적으로 음(-)의 영업활동현금흐름을 보이고 있습니다. 이러한 음(-)의 영업활동 현금흐름을 투자활동현금흐름과 재무활동현금흐름을 통하여 충당하고 있는 상황이며, 2024년 3분기말 당사는 12,199백만원의 현금및현금성자산을 보유하고 있습니다. 당사는 2023년 3월 기업공개를 통해 유입된 자금을 통해 유동비율 831.57%를 기록하였습니다. 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지않도록 대응하고 있으며, 2024년 3분기 기준 별도기준으로 유동비율 684.89% 입니다. 당사의 월별 필수 운영비 보다 실제 운영비가 증가하여 유동성에 위험이 생기는 등, 당사의 영업 성과에 부정적인 영향으로 음(-)의 현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있습니다. |
당사는 2024년 3분기 및 최근 3년간 지속적으로 음(-)의 영업활동현금흐름을 보이고 있습니다. 이러한 음(-)의 영업활동 현금흐름을 투자활동현금흐름과 재무활동현금흐름을 통하여 충당하고 있는 상황이며, 2024년 3분기말 당사는 12,199백만원의 현금및현금성자산을 보유하고 있습니다. 당사의 2024년 3분기 및 최근 3년간 요약 연결 현금흐름 추이는 다음과 같습니다.
| [당사 별도기준 현금흐름 추이] |
| (단위: 백만원) |
| 구 분 | 2024년 3분기 | 2023년 3분기 | 2023년 | 2022년 | 2021년 |
| 영업활동현금흐름 | -30,541 | -35,078 | -41,174 | -62,550 | -26,577 |
| 법인세비용차감전 순이익 | -38,829 | -43,910 | -55,022 | -79,833 | -150,742 |
| 법인세비용차감전 순이익 조정을 위한 가감 | 7,424 | 7,462 | 12,742 | 15,936 | 124,025 |
| 영업활동에서 사용된 현금 | -31,405 | -36,448 | -42,281 | -63,897 | -26,717 |
| 이자의 수취 | 980 | 1,575 | 1,929 | 1,805 | 230 |
| 이자의 지급 | -268 | -235 | -328 | -359 | -249 |
| 기타 | 152 | 29 | -496 | -99 | 160 |
| 투자활동현금흐름 | 14,208 | 9,772 | 22,263 | 62,984 | -139,171 |
| 장단기대여금의 지급 | -9,030 | - | -150 | -330 | - |
| 단기금융상품의 증가 | -27,000 | -114,005 | -120,005 | -135,000 | -154,003 |
| 당기손익공정가치금융자산의 취득 | -12,000 | -7,000 | -12,000 | - | -11,996 |
| 관계기업투자의 증가 | - | - | - | - | -15,000 |
| 단기금융상품의 감소 | 43,000 | 126,005 | 150,005 | 194,003 | 45,000 |
| 당기손익공정가치금융자산의 처분 | 19,443 | 5,053 | 5,053 | 7,044 | 2,043 |
| 기타 | -206 | -281 | -640 | -2,733 | -5,215 |
| 재무활동현금흐름 | 19,990 | 25,104 | 25,109 | -32 | 161,492 |
| 유상증자 | 10,000 | 26,000 | 26,000 | - | 160,297 |
| 전환사채의 발행 | 10,000 | - | - | - | - |
| 기타 | -10 | -896 | -891 | -32 | 1,195 |
| 현금및현금성자산의순증가(감소) | 3,656 | -203 | 6,198 | 402 | -4,256 |
| 기초현금및현금성자산 | 8,543 | 2,346 | 2,346 | 1,944 | 6,201 |
| 기말현금및현금성자산 | 12,199 | 2,143 | 8,543 | 2,346 | 1,944 |
| 출처) 당사 정기보고서 |
당사는 2021년에는 별도기준으로 150,742백만원의 법인세비용차감전 순손실이 발생하였으며, 전환우선주 전환청구에 따른 보통주 전환으로 발생된 당기손익-공정가치금융부채 평가손실 101,631백만원, 관계회사 평가손실로 인하여 발생한 지분법평가손실 18,511백만원, 감가상각비 1,574백만원, 임직원 주식매수선택권 부여와 가득기간 경과로 인한 주식보상비용 3,772백만원, 기타충당부채환입 1,458백만원, 기타유동자산의증가 2,043백만원 등, 현금유출이 없는 손익가감 124,025백만원 등이 발생하면서 총 26,577백만원의 음(-) 영업활동현금흐름이 발생하였고, 투자활동현금흐름의 경우, 단기금융상품의 증가 154,003백만원, 원금보존형 DLB 상품을 포함한 당기손익공정가치금융자산의 취득 11,996백만원, 지분법 주식 추가 취득으로 인한 관계기업투자의 증가 15,000백만원, 단기금융상품의 감소 45,000백만원, 당기손익공정가치금융자산의 처분 2,043백만원 등이 발생하면서 총 139,171백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 2021년 상반기 중 연구개발(임상시험 등) 및 운영비용 등의 운영자금 확보를 위한 유상증자를 통해 160,297백만원의 현금이 유입되어 총161,492백만원의 양(+)의 재무활동현금흐름이 있었습니다. 이에따라 2021년 별도기준 1,944백만원의 현금 및 현금성자산을 보유하고 있습니다.
2022년 별도기준으로 79,833백만원의 법인세비용차감전 순손실이 발생하였으며, 보유 지분상품의 평가손실 발생으로 인해 당기손익-공정가치금융자산평가손실 3,571백만원, 관계회사에 대한 지분법손상차손 9,208백만원, 감가상각비 2,335백만원, 임직원 주식매수선택권 추가 부여와 가득기간 경과로 인한 주식보상비용 4,488백만원, 국가연구과제 정부보조금 수령분 등에 의한 미수금의 증가 3,347백만원, 기타유동자산의증가1,135백만원, 순확정급여부채의 감소 1,183백만원 등 현금유출 없는 손익가감 15,936백만원이 발생하면서 총 62,550백만원의 음(-)영업활동현금흐름이발생하였고, 투자활동현금흐름의 경우 단기금융상품의 증가 135,000백만원, 단기금융상품의 감소 194,003백만원, 당기손익공정가치금융자산의 처분 7,044백만원 등이 발생하면서 총 62,984백만원의 양(+)의 현금흐름이 발생하였습니다. 이에따라, 2022년말 별도기준 2,346백만원의 현금 및 현금성자산을 보유하고 있습니다.
2023년에는 별도기준으로 55,022백만원의 법인세비용차감전 순손실이 발생하였으며, 관계회사 영업손실 발생으로 인한 지분법평가손실 2,054백만원, 관계회사에 대한 지분법손상차손 5,528백만원, 감가상각비 2,295백만원, 주식매수선택권 부여와 가득기간 경과, 행사기간 변경으로 인하여 주식보상비용 6,547백만원, 기타충당부채환입 1,351백만원, 보유 중인 지분상품의 상장으로 인한 당기손익-공정가치금융자산 평가이익 2,592백만원, 국가연구과제 정부보조금 집행 등으로 인한 미수금의감소 3,213백만원, 기타유동자산의감소 2,279백만원, 연구개발비 기간귀속 회계처리에 따른 기타비유동자산의 증가 4,695백만원 등 현금유출이 없는 손익가감 12,742백만원 등이 발생하면서 총41,174백만원의 음(-)의 영업활동현금흐름이 발생하였고, 투자활동현금흐름의 경우, 단기금융상품의 증가 120,005백만원, 원금보존형 DLB 상품 등 금융상품 취득에 따른 당기손익공정가치금융자산의 취득 12,000백만원, 단기금융상품의 감소 150,005백만원, 당기손익공정가치금융자산의 처분 5,053백만원 등이 발생하면서 22,263백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 2023년 3월 코스닥시장 상장에 따른 공모자금을 통해 26,000백만원이 유입되었습니다. 이에따라, 2023년말 별도기준 8,543백만원의 현금 및 현금성자산을 보유하게 되었습니다.
당사는 2024년 3분기에는 별도기준으로 38,829백만원의 법인세비용차감전 순손실이 발생하였으며, 취득한 상환전환우선주의 평가손실 발생으로 인한 당기손익-공정가치금융자산평가손실 1,963백만원, 관계회사 영업손실 발생으로 인한 지분법평가손실 1,297백만원, 감가상각비 1,587백만원, 임직원 주식매수선택권 부여와 가득기간 경과에 따른 주식보상비용 2,232백만원, 기타비유동자산의 감소 1,155백만원, 기타금융부채의 감소 1,082백만원 등 현금유출이 없는 손익가감 7,424백만원이 발생하면서 총 30,541백만원의 음(-)의 영업활동현금흐름이 발생하였고, 투자활동현금흐름의 경우, 관계회사 대여금 지급에 따른 장단기대여금의 지급 9,030백만원, 단기금융상품의 증가 27,000백만원, 원금보존형 금융상품 취득에 따른 당기손익공정가치금융자산의 취득 12,000백만원, 단기금융상품의 감소 43,000백만원, 만기도래 금융상품 처분으로 인한 당기손익공정가치금융자산의 처분 19,443백만원 등이 발생하면서 14,208백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 2024년 8월 운영자금 확보 목적을 위한 유상증자 10,000백만원, 전환사채의 발행 10,000백만원의현금이 유입되면서 2024년 3분기 별도기준 12,199백만원의 현금 및 현금성 자산을 보유하고 있습니다.
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 향후 당사의 지속적인 당기순손실 발생으로 인해 재무안정성은 저하될 수 있습니다. 이에 당사는 2025년 2분기부터 2027년 4분기까지의 자금수지 계획을 수립하고 유동성 관리에 노력하고 있습니다.
당사는 2024년 3분기말 현재 현금및현금성자산 12,199백만원을 확보하고 있음에도 불구하고 금번 유상증자를 진행하고 있습니다. 해당 사유는 글로벌 L/O 계약 체결 후 계약금(upfront payment) 및 개발 마일스톤 수령까지는 일정 기간이 소요되므로, 그 기간 내에 안정적인 운영과 계약 체결 시 자금 유동성 부족으로 인한 리스크를 최소화하고 파트너사와의 유리한 협상력을 확보하기 위함입니다. 뿐만 아니라 향후 수익 창출이 가능한 후속 파이프라인 개발을 가속화하기 위해 금번 유상증자를 추진하게 되었습니다.
아래의 자금수지계획의 영업현금흐름 지출 항목 중 GI-101, GI-102, GI-108, 신규도입과제, 연구개발인건비, 기타판매관리비와 투자현금흐름 지출 항목의 무형자산 취득 지출은 전액 금번 유상증자의 공모자금을 활용하여 지출할 예정입니다. 자세한 공모자금의 활용 목적은 본 공시서류의 '제1부 모집 또는 매출에 관한 사항 - V. 자금의 사용목적' 또는 을 참고하여 주시기 바랍니다. 또한, '제1부 모집 또는 매출에 관한 사항 - III. 투자위험요소 - 3. 기타위험 - 다. 주가하락에 따른 발행금액 감소 위험'에 서술된 바와 같이 주가 하락에 따라 발행금액이 감소할 경우, 기타판매관리비 부분의 지출 항목을 보유 현금 또는 기술이전수익을 통해 충당할 예정이며, 해당 내용은 1차 발행가액과 확정 발행가액이 결정된 후 이를 반영한 발행조건확정 증권신고서의 공시 시 반영할 예정입니다.
| [당사 향후 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2025년 2분기 |
2025년 3분기 |
2025년 4분기 |
2026년 1분기 |
2026년 2분기 |
2026년 3분기 |
2026년 4분기 |
2027년 1분기 |
2027년 2분기 |
2027년 3분기 |
2027년 4분기 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영업현금흐름 | (a)수입 | 기술이전수익(기존 및 신규 L/O)(주1) | 30,000 | - | 39,800 | - | 4,900 | - | 20,000 | 30,000 | 15,000 | 50,000 | - |
| 계 | 30,000 | - | 39,800 | - | 4,900 | - | 20,000 | 30,000 | 15,000 | 50,000 | - | ||
| (b)지출 | 경상연구개발비(주2) | 6,721 | 7,023 | 8,754 | 6,560 | 6,797 | 7,321 | 9,068 | 12,570 | 7,584 | 7,242 | 10,381 | |
| GI-101 임상시험 | 1,482 | 1,355 | 1,249 | 640 | 441 | 631 | 636 | - | - | - | |||
| GI-102 임상시험 |
2,082 | 2,250 | 3,327 | 2,622 | 2,602 | 1,441 | 1,408 | 876 | 875 | 1,927 | 896 | ||
| GI-108 임상시험 |
277 | 210 | 214 | 169 | 158 | 158 | 162 | 191 | 191 | 191 | 1,252 | ||
| 신규도입과제 | 1,372 | 1,698 | 1,815 | 1,585 | 2,049 | 3,543 | 4,642 | 9,908 | 4,920 | 3,524 | 5,894 | ||
| 연구개발인건비 | 1,508 | 1,509 | 2,149 | 1,544 | 1,547 | 1,549 | 2,219 | 1,595 | 1,598 | 1,600 | 2,339 | ||
| 기타판매관리비(주3) | 1,616 | 1,643 | 2,264 | 1,739 | 1,624 | 1,663 | 2,320 | 1,775 | 1,672 | 1,708 | 2,425 | ||
| 계 | 8,338 | 8,666 | 11,018 | 8,300 | 8,421 | 8,983 | 11,388 | 14,346 | 9,256 | 8,950 | 12,806 | ||
| 영업수지(=(a)-(b)) | 21,662 | -8,666 | 28,782 | -8,300 | -3,521 | -8,983 | 8,612 | 15,654 | 5,744 | 41,050 | -12,806 | ||
| 투자현금흐름 | (c)지출 | 무형자산 취득 | 44 | 114 | 10 | 91 | 97 | 47 | 47 | 92 | 98 | 48 | 49 |
| 계 | 44 | 114 | 10 | 91 | 97 | 47 | 47 | 92 | 98 | 48 | 49 | ||
| 투자수지(=-c) | -44 | -114 | -10 | -91 | -97 | -47 | -47 | -92 | -98 | -48 | -49 | ||
| 재무현금흐름 | (d)수입 | 유상증자 | 111,208 | - | - | - | - | - | - | - | - | - | |
| 주식매수선택권 행사 등 | - | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| 계 | 111,208 | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| (e)지출 | 이자비용 | - | - | - | - | - | - | - | - | - | - | ||
| 계 | - | - | - | - | - | - | - | - | - | - | |||
| 재무수지(=(d)-(e)) | 111,208 | - | - | 552 | 552 | 552 | 552 | 552 | 552 | 552 | 552 | ||
| 기초 자금 | 1,000 | 133,826 | 125,047 | 153,819 | 145,981 | 142,915 | 134,437 | 143,554 | 159,668 | 165,866 | 207,420 | ||
| 기말 자금 | 133,826 | 125,047 | 153,819 | 145,981 | 142,915 | 134,437 | 143,554 | 159,668 | 165,866 | 207,420 | 195,117 | ||
| 주1) | 영업수익에는 추가 L/O 에 따른 예상 수익 및 기존에 체결된 기술이전에 따른 후속 마일스톤 등이 포함되어 있습니다. 계획한 기술이전 수익 규모는 파트너사의 전략 및 성향 기술이전 시점의 시장 상황, 당사의 임상 성과 등에 의해 변동될 가능성이 있을 뿐만 아니라 연구개발 과정에서 예상치 못한 실패나 기술이전 과정에서의 일정 지연 등이 발생할 불확실성이 존재합니다. |
| 주2) | 경상연구개발비는 주요 파이프라인 임상연구, 임상시험용 의약품(시료) 생산, 연구인력 인건비, 신규도입과제 비임상연구를 포함한 연구용 소모품비 등이 포함되어 있습니다. |
| 주3) | 기타판매관리비는 사무인력 인건비, 사무실 임차료, 위탁수수료 등 일반 관리비가 포함되어 있습니다. |
| 주4) | 2025년 2분기 기초자금은 당사가 예측한 예측치이며, 해당 금액은 변동될 가능성이 있습니다. |
| 출처: | 당사 제시 |
당사는 각 파이프라인별 글로벌 치료제 기술이전 사례를 통하여 평균 Deal 규모를 추정하였고, 각 파이프라인의 단계별 임상성공확률을 반영하여 보수적인 관점에서 목표 총 Deal 규모를 산정하였습니다. 이후 업계 관행에 따라 계약금(Upfront fee)과 개발 단계별로 나누어 각 총 Deal 규모에서 각 단계별 성공확률을 감안하여 개발 마일스톤(Development Milestone), 상업화 마일스톤(Sales Milestone)을 수령하는 것을 가정하였습니다.
| [임상성공확률(Oncology, 바이오마커가 있을 경우)] |
| 구분 | 성공률 |
|---|---|
| Pre to Phase Ⅰ | 69.00% |
| Phase Ⅰ to Phase Ⅱ | 49.18% |
| Phase Ⅱ to Phase Ⅲ | 40.25% |
| Phase Ⅲ to NDA/BLA | 52.41% |
| NDA/BLA to approval | 97.81% |
| 출처: | Clinical Development Success Rates and Contributing Factors 2011-2020 |
당사가 상술한 자금수지계획의 영업수익에는 추가 L/O 에 따른 예상 수익 및 기존에 체결된 기술이전에 따른 후속 마일스톤 등이 포함되어 있습니다. 또한, 당사는 핵심 파이프라인의 기술이전된 이후 후속 파이프라인 부재할 경우 향후 추가적인 성장성을 보유함에 있어 저해가 발생할 수 있습니다. 이에 따라 당사는 지속적인 신규 파이프라인의 발굴이 필요함을 느끼고 있으며, 당사가 보유한 GI-SMART 플랫폼을 이용하여 저비용으로 발굴된 파이프라인의 개발 초기 단계 기술이전으로 인해 신규 매출을 창출하는 것을 목표로 하고 있습니다. 다만, 계획한 기술이전 수익 규모는 파트너사의 전략 및 성향 기술이전 시점의 시장 상황, 당사의 임상 성과 등에 의해 변동될 가능성이 있을 뿐만 아니라 연구개발 과정에서 예상치 못한 실패나 기술이전 과정에서의 일정 지연 등이 발생할 불확실성이 존재합니다. 따라서 계획과 달리 당사가 예상한 신약 L/O 수익의 발생이 지연되거나 발생하지 않을 수 있습니다. 당사는 현재 시점에서는 이 경우에 대한 구체적인 자금 조달 계획을 보유하고 있지는 않으나, 추후 당사의 유동성 위험이 크게 증가할 경우 당사가 보유하고 있는 자산을 담보로 차입하거나, 추가적인 외부자금조달을 진행함을 고려할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
한편, 당사는 2023년 3월 기업공개를 통해 유입된 자금을 통해 유동비율 831.57%를 기록하였습니다.
| [최근 3년 및 2024년 3분기 별도기준 당사 유동성 관련 비율] |
| 구 분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 | 비 고 |
| 유동비율 | 684.89% | 831.57% | 1098.72% | 2559.77% | 유동자산 / 유동부채 |
| 출처) 당사 정기보고서 |
당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지않도록 대응하고 있으며, 2024년 3분기 기준 별도기준으로 유동비율 684.89% 입니다.
| [월별 필수 운영비] |
| (단위: 백만원) |
| 구분 | 지아이이노베이션 |
| 급여 | 305 |
| 퇴직급여 | 37 |
| 복리후생비 | 85 |
| 경상연구개발비 | 2,879 |
| 주식보상비용 | 248 |
| 유무형자산감가상각비 | 260 |
| 지급수수료 | 105 |
| 여비교통비 | 18 |
| 기타판매비와관리비 | 74 |
| 합계 | 4,011 |
| 출처) 당사 제시 |
투자자들께서는 대내외적 환경이 급격하게 침체되거나 본 공시서류 제출일 기준 당사의 월별 필수 운영비 보다 실제 운영비가 증가하여 유동성에 위험이 생기는 등, 당사의 영업 성과에 부정적인 영향으로 음(-)의 현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있음을 면밀히 검토하시고 투자에 임해주시기 바랍니다.
| 마. 연구개발비 증가에 따른 재무안정성 위험 당사는 원활한 연구개발을 위해 설립 초기부터 수차례 유상증자를 통해 자금을 조달하여 재무안정성 개선을 위해 노력하였습니다. 그러나 높은 판매관리비와 지속적으로 증가하는 연구개발비로 인해 적자가 누적되고 있었으나, 당사가 보유한 주요 파이프라인 GI-101, GI-102, GI-108 등이 전임상단계에서 임상단계로 진입하며, 지급수수료 비용 감소에 따라 2022년 이후 지속적으로 연구개발비용이 감소하고 있습니다. 다만, 당사는 연구개발 파이프라인 확대 및 임상 단계 고도화에 따른 연구개발 비용 증가, 당사가 목표로 하고 있는 기술이전 계약 지연 혹은 (주)유한양행과의 GI-301의 글로벌 기술이전에 계약에 따른 사업권 제3자 이전 수익금(50%)수령 지연 등이 발생할 경우 재무안정성 지표가 악화될 가능성에 노출되어 있습니다. 당사의 조기 기술이전을 위한 글로벌 네트워킹 등 전략적 대응에도 불구하고, 연구개발비지출이 해당 파이프라인의 기술이전 및 상용화로 이루어지지 못할 수 있으며, 예정된 연구개발비지출 보다 실제 사용액이 증가할 수 있습니다. 이러한 경우 당사의 재무안정성이 악화될 위험이 존재하오니 투자자께서는 이점 유의하시기 바랍니다. |
당사는 융합 단백질을 기반으로 차세대 면역치료제를 연구 개발하는 생명공학회사로, 주요 사업모델은 조기 기술이전을 통한 사업화입니다. 당사는 신약 창출의 두 축인 신약개발 임상전략과 연구개발을 분리하여 연구개발 활동을 진행하고 있으며, 박사급 22명, 석사급 30명 등 총 65명의 연구개발 인력을 기반으로 전임상 및 임상 개발을 다양한외부 협력 기관들과 연계해서 진행하고 있습니다.
또한, 당사는 원활한 연구개발을 위해 설립 초기부터 수차례 유상증자를 통해 자금을 조달하여 재무안정성 개선을 위해 노력하였습니다. 그러나 높은 판매관리비와 지속적으로 증가하는 연구개발비로 인해 적자가 누적되고 있었으나, 당사가 보유한 주요 파이프라인 GI-101, GI-102, GI-108 등이 전임상단계에서 임상단계로 진입하며, 지급수수료 비용 감소에 따라 2022년 이후 지속적으로 연구개발비용이 감소하고 있습니다.
| [재무안정성 지표] |
| (단위:백만원) |
| 구 분 | 2024년 3분기 | 2023년 3분기 | 2023년 | 2022년 | 2021년 |
| 자산총계 | 64,818 | 91,225 | 81,340 | 106,335 | 179,868 |
| 부채총계 | 17,245 | 8,452 | 9,636 | 10,688 | 9,437 |
| 자본금 | 22,540 | 11,027 | 11,035 | 10,002 | 9,986 |
| 자본총계 | 47,573 | 82,773 | 71,704 | 95,646 | 170,431 |
| 매출액 | 24 | 588 | 5,319 | 3,500 | 5,600 |
| 영업이익(손실) | -36,077 | -44,557 | -53,305 | -67,952 | -30,632 |
| 당기순이익(손실) | -38,829 | -43,910 | -55,495 | -79,833 | -150,742 |
| 출처) 당사 정기보고서 |
다만, 당사는 연구개발 파이프라인 확대 및 임상 단계 고도화에 따른 연구개발 비용 증가, 당사가 목표로 하고 있는 기술이전 계약 지연 혹은 (주)유한양행과의 GI-301의 글로벌 기술이전에 계약에 따른 사업권 제3자 이전 수익금(50%)수령 지연 등이 발생할 경우 재무안정성 지표가 악화될 가능성에 노출되어 있습니다. 당사의 연구개발 관련 비용 추이는 다음과 같습니다.
| [연구개발비 추이] |
| (단위:백만원) |
| 구분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 | |
| 비용의 성격별 분류 | 인건비 | 4,157 | 5,253 | 5,023 | 3,283 |
| 지급수수료 | 19,128 | 32,824 | 44,447 | 16,586 | |
| 소모품비 | 2,131 | 3,696 | 8,337 | 3,253 | |
| 기타 | 671 | 671 | 600 | 338 | |
| 연구개발비용 합계 | 26,087 | 42,444 | 58,406 | 23,461 | |
| (정부보조금) | -178 | -2,299 | -2,402 | -121 | |
| 보조금 차감 후 금액 | 25,909 | 40,145 | 56,004 | 23,339 | |
| 회계처리내역 | 판매비와 관리비 | 25,909 | 40,145 | 56,004 | 23,339 |
| 제조경비 | - | - | - | - | |
| 개발비(무형자산) | - | - | - | - | |
| 회계처리금액 합계 | 25,909 | 40,145 | 56,004 | 23,339 | |
| 연구개발비 / 매출액 비율 | 10703% | 755% | 1600% | 417% | |
| [연구개발비용합계 ÷당기매출액×100] | |||||
| 출처) 당사 정기보고서 |
당사는 연구개발비를 전액 비용으로 처리하고 있습니다. 2021년 23,339백만원, 2022년 56,004백만원, 2023년 40,145백만원, 2024년 3분기 25,909백만원을 비용으로 처리했습니다. 2022년의 경우 미등기임원을 제외한 전체 임직원은 84명으로 2021년 88명 대비 4명 감소하였음에도 불구하고 핵심 연구인력 충원으로 인해 1인평균 급여액이 58백만원에서 80백만원으로 증가함에 따라 인건비가 3,283백만원에서 5,023백만원으로 증가하였습니다. 또한, 2022년 당사 주요 파이프라인의 초기 임상단계 진입함으로써 각종 시료 비용 및 유전자 변형 설치류 및 영장류 매입 비용 등이 증가하여 지급수수료가 2021년 16,586백만원에서 2022년 44,447백만원까지 증가하며 연구개발비용이 2021년 23,461백만원에서 2022년 58,406백만원으로 증가하였습니다.
한편, 당사의 주요 파이프라인 GI-101, GI-102, GI-301 등이 전임상에서 임상 단계로 진입하며 재료 매입 등 지급수수료 및 소모품비가 감소하여 2023년 연구개발비용 42,444백만원, 2024년 3분기 26,087백만원을 기록하였습니다. 다만 향후에도 당사 신규파이프라인 진척도에 따라 전임상 단계 준비 등에 따른 지급수수료 및 소모품비가 확대되어 연구개발비가 증가할 가능성이 존재합니다.
당사는 연구개발비 충당 및 재무안정성 제고를 위하여 설립 초기부터 조기 기술이전 전략을 추진 중에 있습니다. 당사는 설립 초기부터 글로벌 제약사와의 네트워크 구축을 위해 해외사업개발(Global Business Development, GBD) 인력을 확보하였으며, 이를 통해 기술이전 또는 전략적 제휴를 지속적으로 진행해 왔습니다. 현재까지 Simcere에 당사 파이프라인인 GI-101, 유한양행에 GI-301에 대해 일본지역 제외 글로벌 기술이전을 완료하였으며, 마루호에 GI-301에 대한 일본지역 기술이전을 진행하였습니다. 또한, 글로벌 제약사 MSD와는 키트루다®(Keytruda®)의 무상제공 및 GI-101과 공동임상에 대한 계약을, 글로벌 제약사 아스트라제네카와는 임핀지®(Imfinzi®)의 무상제공 및 GI-101과 공동임상에 대한 계약을 이끌어 내었습니다.
1) 품목: GI-101
ⓛ 심시어(Simcere Pharmaceutical)
| 1. 계약상대방 | 심시어(Simcere Pharmaceutical) / 중국 |
| 2. 계약내용 | 중국지역(홍콩, 마카오, 대만포함)에서의 대상기술에 대한 독점적 개발 및 상업화 권리 |
| 3. 대상지역 | 중국, 홍콩, 마카오, 대만 |
| 4. 계약기간 | 계약체결일: 2019년 11월 28일 계약종료일: 계약일로부터 국가별 청구권이 있는 마지막 특허 만료일 |
| 5. 총 계약금액 | USD 790,000,000 / 경상로열티 별도 |
| 6. 대상기술 | CD80과 IL2v를 포함하는 이중융합단백질 |
| 7. 개발진행경과 | Pre-IND(중국) |
| 8. 기타사항 | - |
② (주)지아이셀
| 1. 계약상대방 | (주)지아이셀 / 한국 |
| 2. 계약내용 |
국내지역에서의 면역세포치료제와 GI-101의 병용투여에 대한 전용실시권에 대한 계약 전세계지역에서의 면역세포치료제의 제조공정에 GI-101의 사용에 대한 전용실시권에 대한 계약 |
| 3. 대상지역 |
면역세포치료제와 GI-101의 병용투여에 대한 전용실시권 (국내) 면역세포치료제의 제조공정에 GI-101의 사용에 대한 전용실시권(전세계) |
| 4. 계약기간 | 계약체결일: 2019년 07월 15일 계약종료일: 계약일로부터 국가별 청구권이 있는 마지막 특허 만료일 |
| 5. 총 계약금액 | 83억원 / 상업화 단계의 마일스톤 별도, 경상로열티 별도 |
| 6. 대상기술 | CD80과 IL2v를 포함하는 이중융합단백질 |
| 7. 개발진행경과 | 임상1상(한국) |
| 8. 기타사항 | - |
2) 품목: GI-301
① (주)유한양행
| 1. 계약상대방 | (주)유한양행 / 한국 |
| 2. 계약내용 | GI-301에 대한 공동연구 및 전세계 지역(일본 제외)에서의 전용실시권 계약 |
| 3. 대상지역 | 일본을 제외한 전세계 지역 |
| 4. 계약기간 | 계약체결일: 2020년 07월 01일 계약종료일: 계약체결일부터 특허의 최종 만료일까지 |
| 5. 총 계약금액 | 14,090억원 / 경상로열티 별도 |
| 6. 대상기술 | 알레르기 질환 치료제 'GI-301' |
| 7. 개발진행경과 | 임상1상(한국) |
| 8. 기타사항 | - |
② 마루호(Maruho)
| 1. 계약상대방 | 마루호(Maruho) / 일본 |
| 2. 계약내용 | GI-301에 대한 일본 내 개발 및 상업화 권리에 대한 전용실시권 계약 |
| 3. 대상지역 | 일본 |
| 4. 계약기간 | 계약체결일: 2023년 10월 16일 계약종료일: 계약체결일부터 로열티 만료일(특허만료일 또는 첫 판매 후 12년 중 나중에 도래하는 시점)까지 |
| 5. 총 계약금액 | USD 221,000,000 / 경상로열티 별도 |
| 6. 대상기술 | 알레르기 질환 치료제 'GI-301' |
| 7. 개발진행경과 | 임상 1상 waived (일본) |
| 8. 기타사항 | - |
| [최근 3개년 및 2024년 3분기 재무안정성 비율] |
| 구 분 | 재 무 비 율 | 2024년 3분기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 안정성 | 유동비율 | 6.85 | 8.32 | 10.99 | 25.60 |
| 부채비율 | 0.36 | 0.13 | 0.11 | 0.06 | |
| 차입금의존도 | 0% | 0% | 0% | 0% | |
| 이자보상비율(배) | -72.50배 | -147.07배 | -174.78배 | -108.78배 | |
| 당좌비율 | 685% | 832% | 1,099% | 2,560% |
| 출처) 당사 정기보고서 |
한편 당사는 코스닥시장 상장요건 중 상장주선인이 성장성을 평가하여 추천한 기술성장기업(성장성 기술성장특례)으로 적용 받아 상장예비심사 승인을 득하였습니다. 이후 2023년 3월 신규 상장 당시 상장 공모를 위한 증권신고서 상에 상장 이후 5개년(2022년~2026년) 당사 주요파이프라인 및 신규파이프라인 등 경상연구개발비 추정하였습니다. 당시 당사는 진행 중인 임상 시험의 일정 내 종료 및 기술이전의 성공을 가정해 2026년부터 주요파이프라인 중 GI-101 및 GI-301 대신 신규파이프라인에 경상연구개발비 사용을 집중할 것으로 추정하였습니다.
| [경상연구개발비: 파이프라인별 추정금액] |
| (단위: 백만원) |
| 구분 | 2021년 | 2022년(E) | 2023년(E) | 2024년(E) | 2025년(E) | 2026년(E) |
|---|---|---|---|---|---|---|
| GI-101 | 9,756 | 13,000 | 7,354 | 8,353 | 8,280 | 140 |
| GI-102 | 2,283 | 16,373 | 7,889 | 8,064 | 9,740 | 6,600 |
| GI-301 | 2,834 | 11,319 | 4,800 | 1,909 | 180 | 120 |
| GI-108 | 537 | 1,370 | 13,988 | 7,558 | 6,600 | 4,740 |
| New-pipeline | 1,769 | 4,425 | 3,147 | 1,773 | 1,816 | 12,263 |
| 연구개발인력 인건비 | 3,245 | 5,197 | 5,539 | 6,085 | 6,425 | 6,733 |
| 공통연구개발비 | 2,915 | 5,686 | 6,455 | 5,761 | 6,108 | 6,108 |
| 합계 | 23,339 | 57,370 | 49,172 | 39,504 | 39,149 | 36,703 |
| 출처) 당사 제시 |
| [경상연구개발비: 파이프라인별 실제 사용금액] |
| (단위: 백만원) |
| 구분 | 2021년 | 2022년 | 2023년 | 2024년 3분기 |
|---|---|---|---|---|
| GI-101 | 9,756 | 15,347 | 5,830 | 4,079 |
| GI-102 | 2,283 | 16,171 | 6,041 | 8,424 |
| GI-301 | 2,834 | 11,319 | 6,296 | 1,072 |
| GI-108 | 537 | 1,598 | 10,588 | 4,478 |
| New-pipeline | 1,769 | 2,388 | 3,157 | 1,277 |
| 연구개발인력 인건비 | 3,245 | 4,994 | 5,253 | 4,157 |
| 공통연구개발비 | 2,915 | 4,186 | 2,980 | 2,421 |
| 합계 | 23,339 | 56,004 | 40,145 | 25,909 |
| 출처) 당사 제시 |
이처럼 당사의 조기 기술이전을 위한 글로벌 네트워킹 등 전략적 대응에도 불구하고, 연구개발비지출이 해당 파이프라인의 기술이전 및 상용화로 이루어지지 못할 수 있으며, 예정된 연구개발비지출 보다 실제 사용액이 증가할 수 있습니다. 이러한 경우 당사의 재무안정성이 악화될 위험이 존재하오니 투자자께서는 이점 유의하시기 바랍니다.
| 바. 관리종목 지정 및 상장폐지 위험 당사는 코스닥시장 상장요건 중 기술성장특례 적용받아 상장한 기업으로서 2023년 03월 30일 코스닥시장에 상장하였습니다. 당사는 코스닥시장 기술성장특례 요건을 기반으로 상장을 추진하기 위해, 2021년 8월 기술평가를 신청하였으며, 2021년 11월 한국거래소가 지정한 2개 전문평가기관(기술보증기금, SCI평가정보)로부터 순서대로 A 등급, BBB 등급을 통보받았습니다. 당사는 외부 전문평가기관으로부터 사전 기술평가를 진행 후 기술성장기업 중 기술평가특례 기준에 부합하여 코스닥시장에 상장하였으며, 본격적인 신약 출시 전 연구개발을 진행함에 따라 손익은 설립 이후 현재까지 지속적인 적자를 나타내고 있습니다. 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도 (상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 5개 사업연도인 2027년말까지, 법인세전이익 요건의 경우 신규상장일이 속하는 사업연도(상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 3개 사업연도인 2025년말까지 해당 요건을 적용 받지 않습니다(영업이익 요건은 유예기간 없이 적용 면제). 하지만 당사의 노력에도 불구하고 사업환경이 급격히 악화되어 해당 요건별 유예기간이 경과한 시점에도 당사의 제품/서비스 매출이 저조하여 재무성과를 나타내지 못할 경우 관리종목으로 지정 또는 상장폐지 요건에 해당할 수 있습니다. |
당사는 코스닥시장 상장요건 중 기술성장특례 적용받아 상장한 기업으로서 2023년 03월 30일 코스닥시장에 상장하였습니다. 당사는 코스닥시장 기술성장특례 요건을 기반으로 상장을 추진하기 위해, 2021년 8월 기술평가를 신청하였으며, 2021년 11월 한국거래소가 지정한 2개 전문평가기관(기술보증기금, SCI평가정보)로부터 순서대로 A 등급, BBB 등급을 통보받았습니다. 당사는 외부 전문평가기관으로부터 사전 기술평가를 진행 후 기술성장기업 중 기술평가특례 기준에 부합하여 코스닥시장 상장에 상장하였으며, 본격적인 신약 출시 전 연구개발을 진행함에 따라 손익은 설립 이후 현재까지 지속적인 적자를 나타내고 있습니다.
| [코스닥시장 상장예비심사 청구기업 유형별 주요 외형요건 비교] |
| 구분 | 일반기업(벤처기업 포함) | 기술성장기업 | ||
|---|---|---|---|---|
| 수익성ㆍ매출액 기준 | 시장평가ㆍ성장성 기준 | 전문평가 (기술/사업모델) |
성장성 추천 | |
| 주식 분산 (택일) 주1) |
① 소액주주 500명 이상 & ⒜ 또는 ⒝ ⒜ 소액주주 25% 미만 소유 시(청구일 기준) : 공모 10% 이상 & 소액주주 지분 25% 이상 ⒝ 소액주주 25% 이상 소유 시(청구일 기준) : 공모 5% 이상(10억원 이상) ② 소액주주 500명 이상 & 공모 10% 이상 & 공모주식수가 일정주식수 이상 주2) ③ 소액주주 500명 & 공모 25% 이상 ④ 소액주주 500명 & 국내외 동시공모 20% 이상 & 국내 공모주식수 30만주 이상 ⑤ 청구일 기준 소액주주 500명 & 모집에 의한 소액주주 지분 25%(또는 10% 이상 & 공모주식수가 일정주식수 이상 주2) |
|||
| 경영성과 및 시장평가 등 (택일) |
① 법인세차감전계속사업이익 20억원[벤처: 10억원] & 시총 90억원 | ① 시총 500억원 & 매출 30억원 & 최근 2사업연도 평균 매출증가율 20% 이상 | ① 자기자본 10억원 ② 시가총액 90억원 |
|
| ② 법인세차감전계속사업이익 20억원[벤처: 10억원] & 자기자본 30억원[벤처: 15억원] | ② 시총 300억원 & 매출액 100억원 이상[벤처: 50억원] | 전문평가기관의 기술 등에 대한 평가를 받고 평가결과가 A등급 이상일 것 | 상장주선인이 성장성을 평가하여 추천한 중소기업일 것 | |
| ③ 법인세차감전계속사업이익 있을것 & 시총 200억원 & 매출액 100억원[벤처: 50억원] | ③ 시총 500억원 & PBR 200% 이상 | |||
| ④ 법인세차감전계속사업이익 50억원 | ④ 시총 1,000억원 이상 | |||
| - | ⑤ 자기자본 250억원 이상 | |||
| 감사 의견 | 최근 사업연도 적정 | |||
| 경영투명성 | 사외이사, 상근감사 충족 | |||
| 기타 요건 | 주식양도 제한이 없을 것 등 | |||
| 주1) 주식 분산 요건은 신규상장 신청일 기준입니다. 주2) 일정 공모주식수: 100만주(자기자본 500~1,000억원), 200만주(자기자본 1,000~2,500억원), 500만주(자기자본 2,500억원 이상) |
상기에서 보듯이 '기술성장기업'으로 청구하는 경우 '일반기업' 및 '벤처기업'에 비해 주요 외형요건이 완화되어 있으며 경영성과 및 이익규모 요건 등에 있어 제한이 없습니다. 해당 기업은 일반적으로 사업의 성과가 본격화 되기 전이므로 안정적인 재무구조 및 수익성을 기록하고 있지 않은 경우가 많습니다.
한편, 「코스닥시장 상장규정」제53조(관리종목)은 매출액, 법인세비용차감전계속사업손실 등 코스닥시장 상장법인으로서의 경영성과 및 재무상태에 미달하는 경우 관리종목을 지정하도록 명시되어 있습니다.
| [코스닥시장 관리종목 지정요건 및 상장폐지요건] |
| 구 분 | 관리종목 지정(「코스닥시장 상장규정」 제53조) | 상장폐지(「코스닥시장 상장규정」 제54조, 제56조) |
|---|---|---|
| 1) 매출액 미달(별도) | 최근 사업연도 30억 원 미만 (지주회사는 연결기준) - 이익미실현기업 또는 기술성장기업은 상장후 5년간 미적용 - 기술성장기업 중 A), B), C) 중 어느 하나에 해당하는 제약·바이오기업은 최근 사업연도 미적용 A) 최근 사업연도 말「제약산업 육성 및 지원에 관한 특별법」에 따른 혁신제약기업이 세칙으로 정한 요건을 충족하는 경우 B) 최근 사업연도의 일평균 시가총액 4,000억 이상이며, 그 금액이 현재의 자본금을 초과하는 기업이 세칙으로 정하는 요건을 충족하는 경우 C) 최근 3사엽언도의 매출액 합계 90억 이상이며, 최근 사업연도의 직전 사업연도의 매출액이 30억 이상인 경우 |
2년 연속 매출액 30억 원 미만 [실질심사] 이익미실현기업 관련 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 2) 법인세비용차감전 계속사업손실(연결) | 최근 3사업연도중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과(&10억원 이상)하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 - 기술성장기업은 상장후 3년간 미적용 |
관리종목 지정후 자기자본50% 이상(&10억원 이상)의 법인세비용차감전계속사업손실 발생 [실질심사] 이익미실현기업 관련, 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 3) 자본잠식 등 | 다음의 어느 하나에 해당하는 경우 A) 최근 사업연도말을 기준으로 자본잠식률 50%이상 B) 최근 사업연도말을 기준으로 자기자본 10억 원 미만 |
가)최근 사업연도말 현재 완전자본잠식의 경우 나)(A) 관리종목 지정후 도래하는 사업연도말 자본잠식률이 50%이상인 경우 다)(B) 관리종목 지정후 도래하는 사업연도말 자기자본이 10억 원 미만인 경우 [실질심사] 사업보고서 또는 반기보고서의 법정제출 기한까지 당해 상장폐지 기준 해당사실을 해소하였음을 입증하는 재무제표 및 이에 대한 감사인(정기재무제표에 대한 감사인과 동일한 감사인에 한함)의 감사보고서를 제출하는 경우 가~다목까지의 규정을 적용하지 않음. |
| 4) 시가총액 미달 | 보통주 시가총액 40억 원 미만 30일간 지속 -천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
관리종목 지정후 90일 기간 경과하는 동안 i) 시가총액 40억 이상으로 10일 이상 계속 ii) 시가총액 40억 이상인 일수가 30일 이상 둘중 하나라도 충족하지 못하면 상장폐지 |
| 5) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않거나, 정기주총에서 재무제표 미승인 or 정기주총 미개최할 경우 | 관리종목 지정법인이 다음 회차에 다음 어느 하나에 해당하는 경우 가)분기, 반기, 사업보고서를 법정제출기한내에 미제출 나)사업보고서의 법정제출기한까지 정기주주총회를 미개최하거나 정기주주총회에서 재무제표 미승인 다)최근 2년간 3회 이상 분기, 반기, 사업보고서 법정제출기한까지 제출하지 아니한 경우 라)법정제출기한까지 사업보고서를 제출하지 아니한 후 법정제출기한의 다음날부터 10일 이내 사업보고서 미제출 |
| 출처) 「코스닥시장 상장규정」 주1) 상기 관리종목 지정기준은 경영성과 및 재무상태와 관련된 지정기준만 표기한 것입니다. 주2) 자본잠식률 = (자본금 - 자기자본) / 자본금 × 100 주3) 관리종목 지정 요건 중 장기영업손실에 대한 규정은 2022년 12월 부로 개정되었습니다. |
관리종목 지정 요건별 당사의 실적 현황은 다음과 같습니다.
| [관리종목 요건별 회사 실적 현황] |
| (단위: 백만원) |
| 관리종목 지정요건 | 요건별 회사 현황 | 관리종목 지정유예 여부 |
항목별 지정유예 종료시점 |
|||
|---|---|---|---|---|---|---|
| 항목 | 사업연도 | 금액 | 해당 | 미해당 | ||
| 최근 사업연도말 매출액 30억 미만 |
최근 사업연도말 매출액(별도) | 2023년 | 5,319 | ● | - | 2027.12.31 |
| 자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생 | 최근 3사업연도 각 법인세차감전 계속사업손익 (연결) |
2023년 | (55,022) 76.74% |
● | - | 2025.12.31 |
| 2022년 | (79,833) 83.47% |
|||||
| 2021년 | (150,742) 88.45% |
|||||
| 최근 사업연도말 자본잠식률 50% 이상 |
최근 사업연도말 자본잠식률 (별도) |
2023년 | 해당 없음 | - | ● | - |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도 (상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 5개 사업연도인 2027년말까지, 법인세전이익 요건의 경우 신규상장일이 속하는 사업연도(상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 3개 사업연도인 2025년말까지 해당 요건을 적용 받지 않습니다(영업이익 요건은 유예기간 없이 적용 면제).
하지만 당사의 노력에도 불구하고 사업환경이 급격히 악화되어 해당 요건별 유예기간이 경과한 시점에도 당사의 제품/서비스 매출이 저조하여 재무성과를 나타내지 못할 경우 관리종목으로 지정 또는 상장폐지 요건에 해당할 수 있습니다.
| 사. 관계회사 사채 보유 및 거래 관련 위험 당사의 관계회사는 (주)지아이셀, (주)지아이바이옴, (주)메디오젠 총 3개사 입니다. 해당 관계회사들은 동사가 개발하고 있는 치료제와 시너지를 일으킬 수 있는 면역세포치료제, 마이크로바이옴 등의 기술을 보유하고 있으며 향후 지속적인 공동연구개발과 협력으로 난치성 질환들에 대한 병용치료 요법을 개발하고자 합니다. 당사는 상장 이후 관계회사, 최대주주, 특수관계인 등 이해관계자 거래 등에 대한 투명성을 제고하기 위하여 본 공시서류 제출일 전일 현재 정관 제46조에 따른 감사위원회 및 내부거래위원회, 보상위원회를 구성하고 있습니다. 또한, 2020년 8월 24일부로 이해관계자와의 거래에 대한 통제 규정을 제정하여 준수하고 있으며, 2022년 12월 이사회결의로 내부거래위원회를 투명경영위원회로 승격하여 투명성을 더욱 강화하였습니다. 이후 이해관계자와의 거래가 있을 경우 투명경영위원회를 통한 사전 승인을 받고 거래를 진행하고 있습니다. 당사는 다수의 관계회사와 긴밀한 관계를 맺고 있습니다. 당사는 최근 3개년간 주요 특수관계자들과 다양한 매입매출거래, 채권/채무 거래, 대여 등 자금거래를 진행하였습니다. 향후에도 유사한 거래가 계속될 경우 관계회사들의 영업환경 악화에 따른 위험이 당사에 전이될 가능성이 있습니다. 따라서 관계기업 영업개황의 변화가 당사의 실적에도 결정적인 영향을 미칠 수 있음을 유의하시기 바랍니다. |
당사의 관계회사는 (주)지아이셀, (주)지아이바이옴, (주)메디오젠 총 3개사 입니다. 해당 관계회사들은 동사가 개발하고 있는 치료제와 시너지를 일으킬 수 있는 면역세포치료제, 마이크로바이옴 등의 기술을 보유하고 있으며 향후 지속적인 공동연구개발과 협력으로 난치성 질환들에 대한 병용치료 요법을 개발하고자 합니다. 본 공시서류 제출일 전일 현재 기준 당사의 관계회사 개요는 다음과 같습니다.
| 기 업 체 명 | 주식회사 지아이셀 | 주식회사 지아이바이옴 | 주식회사 메디오젠 |
|---|---|---|---|
| 대 표 자 | 홍천표 | 양보기 | 홍준호 |
| 설립일자 | 2018.10.18. | 2018.09.13. | 2000.06.17. |
| 법인등록번호 | 110111-6899954 | 110111-6868678 | 110111-1999874 |
| 사업자등록번호 | 250-81-01224 | 196-81-01352 |
본점(제천) : 206-81-27265 지점(충주) : 787-85-01059 |
| 소 재 지 | 경기도 성남시 중원구 갈마치로288번길 14, B동 1553호 |
경기도 성남시 중원구 갈마치로 288번길 14, B동 1567호 |
본점 : 충북 제천시 바이오밸리1로 120 지점 : 충북 충주시 대소원면 메가폴리스3로 17 |
| 업 종(주제품) |
의학 및 약학 연구개발업 (면역세포치료제) |
의학 및 약학 연구개발업 (마이크로바이옴 신약 및 건강기능식품) |
조제건강식품 (유산균원료, 유산균함유 건강기능식품) |
| 관 계 내 용 |
1) 지아이이노베이션 19.0% 2) 장명호 사장 5.1% 3) 홍준호 대표이사 0.5% |
1) 지아이이노베이션 15.2% 2) 장명호 사장 9.33% |
1) 지아이이노베이션 18.3% |
| 출처): 당사 제시 |
당사와 관계회사간 MOU 및 기술이전 계약 등에 따른 공동 연구개발 사항은 다음과 같습니다.
(1) (주)지아이셀
당사는 2019년 7월 관계회사 (주)지아이셀과 GI-101에 관한 전용실시권 계약을 체결하였습니다. 구체적으로, (주)지아이셀에 GI-101과 면역세포치료제의 병용투여에 대한 국내 권리를 이전하였고, 면역세포치료제 제조공정에 GI-101을 부자재(ancillary material)로 사용하는 것에 대한 전세계 권리를 이전하여 해당 연구가 진행되고 있습니다.
이에 (주)지아이셀의 면역세포치료제 배양에 당사의 GI-10N 기술이 사용되고 있으며, 2023년 4월 식약처로부터 (주)지아이셀의 면역세포치료제와 동사 GI-101을 비롯한 면역항암제 파이프라인과의 병용 투여 임상 시험의 임상1상 IND를 승인 받았습니다. 또한, 공동연구를 기반으로 (주)지아이셀의 면역세포 분리 설비 등을 이용하여 실험에 원하는 세포를 분리하여 이를 당사가 보유한 파이프라인의 기전 검증에 활용하는 등 연구개발 활동을 협력하고 있습니다.
(2) (주)지아이바이옴
(주)지아이바이옴의 경우, 당사에서 개발 중인 알레르기치료제, 면역항암제, NASH 치료제와 (주)지아이바이옴에서 발굴 중인 마이크로바이옴을 병용하면 뛰어난 효능 또는 낮은 치료 부작용을 얻을 것으로 예상되어 지속적으로 공동 개발을 모색하고 있습니다. 실제로 식품알레르기 동물모델에서 동사의 핵심 파이프라인인 GI-301과 마이크로바이옴 병용투여에 의한 뛰어난 효능과 낮은 부작용을 검증하여 식품 알레르기에서 유산균 병용 요법의 효능을 입증한 논문을 네이처 커뮤니케이션즈에 게재하였습니다. 또한 공동연구를 기반으로 (주)지아이바이옴이 구축한 국내 최고 수준의 동물실험실을 연간 약 50건 이상의 연구활동에 활용하여 다양한 동사 파이프라인의 독성, 항종양, 효력검증 실험 등에 이용해 빠른 속도의 파이프라인 개발에 박차를 가하고 있습니다.
(3) (주)메디오젠
메디오젠이 보유한 마이크로바이옴 중에서 특정질환에 우수한 효능을 가진 미생물 균주를 평가, 선별하고, 당사의 마이크로바이옴 콤보 바이오신약 개발을 위해 협력하고 있습니다. 메디오젠과 당사는 마이크로바이옴 콤보 단백질치료제의 글로벌 진출을 위해 GMP 제조시설을 구축하는데 공동 협력하였으며, 최근 메디오젠 균주 CDMO 시설을 완공하여 향후 연구개발 활동에 박차를 가할 예정입니다. 또한 당사와 메디오젠의 합작법인인 지아이바이옴을 통해 마이크로바이옴 신약개발에 매진하고 있습니다.
최근 3개년 및 2024년 3분기 특수관계자와의 주요 거래내역은 다음과 같습니다.
| [최근 3개년 및 2024년 3분기 특수관계자 주요 거래내역] |
| (단위: 천원) |
| 법인명 | 관계 | 구 분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | |||
| (주)지아이셀 | 관계회사 | 매출(기술료) |
- | - | 400,000 | 주4) | - | - | - | - |
| 매출(용역 및 기타) |
24,281 | 주1) | 187,899 | 주1) | - | - | - | - | ||
| 기타수익 | 139,225 | 주2) | 15,456 | 주5) | 21,702 | 주5) | - | - | ||
| 기타비용 | - | - | 870 | 주6) | 39,718 | 주3) | 5,235 | 주7) | ||
| (주)지아이바이옴 | 관계회사 | 기타수익 | 31,135 | 주2) | 15,131 | 주5) | 7,130 | 주5) | - | - |
| 기타비용 | 1,851,350 | 주3) | 890,973 | 주3) | 884,504 | 주3) | 418,649 | 주3) | ||
| (주)메디오젠 | 관계회사 | 배당금수익 | - | - | - | - | 141,892 | - | 141,892 | - |
| 주1) | 주식회사 지아이셀과 체결한 세포치료제 병용 전용실시권 계약에 따라 임상시험 수행을 위한 물질을 공급하는데 따른 매출입니다. |
| 주2) | 임대차계약에 따른 리스이자수익과 대여금에 대한 이자수익의 합계 입니다. |
| 주3) | 연구용역에 대한 비용 등 입니다. |
| 주4) | 당사는 주식회사 지아이셀과 세포치료제 병용 전용실시권 계약을 체결하였으며, 기술료 지급조건을 달성함에 따라 수령하였습니다. |
| 주5) | 임대차계약에 따른 리스이자수익 입니다. |
| 주6) | 연구용역 외 발생한 지급수수료입니다 |
| 주7) | 기타소모품 비용 등입니다. |
| 출처: | 당사 정기보고서 |
당사는 상장 이후 관계회사, 최대주주, 특수관계인 등 이해관계자 거래 등에 대한 투명성을 제고하기 위하여 본 공시서류 제출일 전일 현재 정관 제46조에 따른 감사위원회 및 내부거래위원회, 보상위원회를 구성하고 있습니다. 또한, 2020년 8월 24일부로 이해관계자와의 거래에 대한 통제 규정을 제정하여 준수하고 있으며, 2022년 12월 이사회결의로 내부거래위원회를 투명경영위원회로 승격하여 투명성을 더욱 강화하였습니다. 이후 이해관계자와의 거래가 있을 경우 투명경영위원회를 통한 사전 승인을 받고 거래를 진행하고 있습니다. 상세한 내용은 '제2부 발행인에 관한 사항-VI. 이사회 등 회사의 기관에 관한 사항'을 참고하시기 바랍니다.
| [이해관계자와의 거래에 대한 통제 규정] |
|
제4조 (거래의 범위) 이해관계자 거래의 유형을 다음의 각 호와 같다. 1. 매출 / 매입거래 2. 부동산 구입 / 처분 / 임대차 3. 연구개발의 이전 4. 면허 약정 5. 대여와 출자를 포함하는 금융거래 6. 담보 / 보증 7. 용역거래 8. 경영계약 및 기타의 거래 제5조 (거래의 제한 및 절차) 이해관계자와의 거래는 상법 제542조의9 제2항에 해당하는 거래를 제외하고는 원칙적으로 불가하다. 그러나, 불가피하게 그 거래를 행하지 않으면 안 되는 경우에는 거래의 사전에 회사내부 위원회 또는 이사회를 소집하고 그 위원회 또는 이사회에서 위원장 또는 의장이 참석 위원 또는 이사들에게 그 거래의 객관성과 당위성을 자세히 설명하고 참석위원 또는 이사들의 결의를 얻어 그 거래를 집행한다. 제6조 (거래가격의 적정성) 이해관계자와의 모든 거래는 독립된 제3자와의 거래에서 형성된 가격으로 집행되어야 하며, 독립된 제3자와의 거래가격 산정이 어려울 경우 거래의 정당성을 위해 위원회 또는 이사회는 외부평가기관을 지정하고 그 평가를 의뢰하여 거래가격을 결정할 수 있다. |
최근 3개년 및 2024년 3분기 특수관계자와의 채권/채무 및 자금거래 내역은 다음과 같습니다.
| [최근 3개년 및 2024년 3분기 관계회사 채권/채무 내역] |
| (단위: 백만원) |
| 법인명 | 구 분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 | ||||
| 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | ||
|
(주)지아이바이옴 |
채권 | 2,916 | RCPS 리스채권 |
3,236 | RCPS 리스채권 |
292 | 리스채권 | - | - |
| 채무 | 122 | 매입채무 | 53 | 매입채무 | 138 | 매입채무 | 8 | 매입채무 | |
| (주)지아이셀 | 채권 | 259 | 리스채권 | 121 | 리스채권 | 131 | 리스채권 | - | - |
| 출처: | 당사 제시 |
| [최근 3개년 및 2024년 3분기 관계회사 자금거래 내역] |
| (단위: 백만원) |
| 법인명 | 구 분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 | ||||
| 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | ||
|
(주)지아이바이옴 |
자금거래 | 3,000 | 현금대여 | 3,000 | 현금출자 | - | - | - | - |
| (주)지아이셀 | 자금거래 | 6,000 | 현금대여 | - | - | - | - | 15,000 | 현금출자 |
| 출처: | 당사 제시 |
2021년 기준 당사의 관계회사 대상 채무는 (주)지아이바이옴 8백만원이며, 특수관계자에 대한 자금거래내역으로 (주)지아이셀에 대한 현금출자 금액 15,000백만원이 있습니다. 2022년 기준 당사의 관계회사 대상 기타채권은 (주)지아이바이옴 292백만원, (주)지아이셀 131백만원으로 총 423백만원으로 전액 금융리스채권 구성되어 있으며, 기타채무는 (주)지아이바이옴 138백만원입니다. 2023년 기준 당사의 관계회사 대상 기타채권은 (주)지아이바이옴 3,236백만원, (주)지아이셀 121백만원이며, (주)지아이바이옴 대상 기타채권은 236백만원 금융리스채권과 3,000백만원 상환전환우선주로 구성되어 있습니다.
2024년 3분기 기준 당사의 관계회사 대상 기타채권은 (주)지아이바이옴 2,916백만원, (주)지아이셀 259백만원이며, 기타채무는 (주)지아이바이옴 122백만원입니다. 2024년 3분기 기준 당사는 관계회사 대상 신규 현금대여가 발생하였으며 (주)지아이바이옴 3,000백만원, (주)지아이셀 6,000백만원 대여금을 보유하고 있습니다.
(주)지아이바이옴 및 (주)지아이셀은 당사가 개발하고 있는 치료제와 시너지를 일으킬 수 있는 면역세포치료제, 마이크로바이옴 등의 기술을 보유하고 있습니다. 향후 지속적인 공동연구개발 및 협력으로 당사 후보물질과의 병용투여 개발 등 사업적 시너지 강화 및 당사 보유지분의 가치 제고를 목적으로 부족한 운영자금에도 불구하고 각 사에 대여금을 지급하게 되었습니다.
(주)지아이바이옴에게 지급된 대여금 30억원은 주로 2024년 10월 한국 식품의약품안전처에 임상 2상 IND 신청을 완료하고 표준 치료제와의 병용 치료제로 개발 중인 마이크로바이옴 후보 물질 GB-X01의 임상 2상을 위한 연구개발자금과 이와 관련하여 소요되는 R&D 인건비 등의 운영자금 목적으로 사용할 계획입니다. 또한, (주)지아이셀에게 지급된 대여금은 2024년 2월 한국 식품의약품안전처에 당사의 GI-101과의 병용요법에 대한 임상 1/2a상 IND를 제출한 T.O.P. NK®(GIC-102)의 본격적인 임상 진입을 위한 연구개발자금을 비롯하여, Treg, CAR NK, Nano NK등의 비임상 후보물질에 대한 연구개발자금 및 연구개발을 위해 수반되는 기타 R&D 인건비 등의 운영자금 목적으로 사용할 계획입니다.
한편, 당사는 해당 대여금에 대해 2024년 말 기준으로 충당금 평가를 진행할 예정이며, 해당 대여금에 대해 (주)지아이바이옴 및 (주)지아이셀로부터 부동산 담보를 제공 받고 있기 때문에 충당금률은 낮을 것으로 예상됩니다. (주)지아이바이옴 및 (주)지아이셀로부터 제공받은 담보는 다음과 같습니다.
| [담보제공자산] |
| (단위 : 백만원) |
| 담보제공자 | 담보제공자산 | 용도 | 분양면적(평) | 추정 시가 | 선순위 담보 설정 금액 | 2024년 3분기 | 담보권자 | 제공사유 | |
|---|---|---|---|---|---|---|---|---|---|
| 담보설정금액 | 대여금액 | ||||||||
| (주)지아이바이옴 | 부동산 (주1) | 사무실, 동물실험실, 행동분석실 등 | 1,387 | 9,997 | 3,504 | 3,600 | 3,000 | 당사 | 운영자금 |
| (주)지아이셀 | 부동산 (주2) | 사무실, 연구소, 임원실 등 | 878 | 7,202 | 2,400 | 2,400 | 2,000 | 당사 | 운영자금 |
| 부동산 (주3) | 창고, GMP 제조소 및 소모품창고 등 | 821 | 6,216 | - | 4,800 | 4,000 | 당사 | 운영자금 | |
| 합 계 | 3,086 | 23,415 | 5,904 | 10,800 | 9,000 | - | - | ||
| 주1) | 경기도 성남시 중원구 상대원동 5460 성남SKV1타워 지하 1층 등 총 21개 호실로 구성되어 있습니다. |
| 주2) | 경기도 성남시 중원구 상대원동 5460 성남SKV1타워 지하 5층 등 총 14개 호실로 구성되어 있습니다. |
| 주3) | 경기도 성남시 중원구 상대원동 5460 성남SKV1타워 지하 1층 등 총 10개 호실로 구성되어 있습니다. |
| 주4) | 담보자산의 시가의 경우 동일 건물의 실거래가를 기준으로 추정하였습니다. |
| 출처: | 당사 제시 |
이처럼 당사는 다수의 관계회사와 긴밀한 관계를 맺고 있습니다. 당사는 최근 3개년간 주요 특수관계자들과 다양한 매입매출거래, 채권/채무 거래, 대여 등 자금거래를 진행하였습니다. 당사의 관계회사 ㈜지아이바이옴 및 ㈜지아이셀은 질병을 예방하거나 치료할 수 있는 생물학적 제제를 연구 및 개발하는 사업을 영위하고 있습니다. 따라서 관계회사들은 신약 기술개발에 오랜 기간과 많은 투자 비용이 필요한 기술집약적 산업의 고유한 특성을 가지며, 이로 인해 부진한 단기적인 영업 활동에 따른 현금흐름창출능력을 외부자금의 조달을 통해 해소하고 있습니다. 관계회사들에게 지속적인 당기순손실 발생이 발생할 경우 재무안정성이 저하될 수 있으며, 향후에도 유사한 거래가 계속될 경우 관계회사들의 영업환경 악화에 따른 위험이 당사에 전이될 가능성이 있습니다. 따라서 관계기업 영업개황의 변화가 당사의 실적에도 결정적인 영향을 미칠 수 있음을 유의하시기 바랍니다.
|
아. 정부 연구개발 과제 수행 관련 위험 신약 개발에 대한 정부 지원 정책이 축소되거나 효율적으로 이루어지 않는 경우, 그리고 임상 단계에서 적용되는 규정 등의 변화가 일어나는 경우 당사의 임상 개발 일정이 지연되거나 추가적인 비용이 발생하여 당사의 사업에 부정적인 영향을 미칠 수 있다는 점 주의하시기 바랍니다. 특히, 현행 제도상 정부출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제재 조치가 가해질 수 있음을 투자 판단에 참고하시기 바랍니다. |
본 공시서류 제출일 전일 현재 당사의 정부과제 수행 현황은 아래와 같습니다.
| [최근 3개년 및 2024년 3분기 당사 정부과제 현황] |
| (단위: 백만원) |
| 연구과제명 | 주관부서 | 연구기간 | 총 연구개발비 | 기업부담금 | 정부출연금 | 비고 |
| T 세포 기반의 범용 인플루엔자 백신 비임상시험 및 유효성 평가 (주1) | 한국보건산업진흥원 (백신실용화 기술개발사업단) |
2020년 10월 06일 ~ 2023년 06월 30일 |
1,187 (주2) | 111 | 330 | 감염병 예방ㆍ치료 기술 개발사업 |
| 진행성 또는 전이성 고형암 환자를 대상으로 GI-101 단일요법 및 GI-101과 pembrolizumab, lenvatinib 또는 국소 방사선 병용요법의 안전성, 내약성, 약동학 및 치료효과를 평가하기 위한 제1/2상, 공개, 용량증량 및 확장 임상시험 |
재단법인 국가신약개발사업단 |
2022년 03월 01일 ~ 2024년 11월 30일 |
7,000 | 3,500 | 3,500 | 국가신약 개발사업 |
| 대사면역항암 이중융합단백질 GI-108의 비임상 연구 및 IND 승인 | 재단법인 국가신약개발사업단 |
2022년 09월 01일 ~ 2024년 12월 31일 |
2,000 | 1,000 | 1,000 | 국가신약 개발사업 |
| 주1) | 해당 정부과제는 당사가 세부기관으로 참여하여 주관연구기관과 공동개발하는 건으로서 세부기관에 할당된 정부출연금을 기준으로 기재하였습니다. |
| 주2) | 해당 과제는 주관연구기관인 이화여자대학교 산학협력단과 공동개발하는 건으로서 총연구개발비에서 기업부담금, 정부출연금의 차액은 주관연구기관에게 할당된 연구비입니다. |
| 출처: | 당사 정기보고서 |
먼저, 당사의 한국보건산업진흥원 주관으로 진행된 'T 세포 기반의 범용 인플루엔자 백신 비임상시험 및 유효성 평가' 과제는 2020년 10월~2023년 6월 기간동안 당사 파이프라인을 활용하여 T 세포 기반 백신 비임상시험 및 유효성 평가를 목표로 진행되었으며 총 정부출연금 330백만원을 수취하였습니다. 또한, 재단법인 국가신약개발사업단 주관으로 진행되는 GI-101 관련 과제는 단일요법 및 병용요법의 안전성, 내약성, 약동학 및 치료효과 평가를 위한 제1/2상 임상시험 진행을 목표로 2022년 3월~2024년 11월 기간 동안 총 정부출연금 3,500백만원을 지원받아 진행되었습니다. 한편, 재단법인 국가신약개발사업단 주관으로 진행되는 GI-108 관련 과제는 파이프라인의 비임상 연구 및 IND 승인을 목표로 2022년 9월부터 현재까지 진행 중이며, 총 정부출연금 1,000백만원을 수취하였습니다.
3건의 정부과제 중 1) "진행성 또는 전이성 고형암 환자를 대상으로 GI-101 단일요법 및 GI-101과 pembrolizumab, lenvatinib 또는 국소 방사선 병용요법의 안전성, 내약성, 약동학 및 치료효과를 평가하기 위한 제1/2상, 공개, 용량증량 및 확장 임상시험"은 상장 당시 증권신고서 기준의 연구기간은 2023년 12월 31일까지로 예정되었으며, 2) "대사면역항암 이중융합단백질 GI-108의 비임상 연구 및 IND 승인" 연구는 상장 당시 증권신고서 기준의 연구기간이 2024년 08월 31일까지로 예정되었으나, 세부 연구 및 임상 개발 방법 변경에 따라 연구기간이 각각 2024년 11월 30일, 2024년 12월 31일로 연장되었습니다.
신약 개발에 대한 정부 지원 정책이 축소되거나 효율적으로 이루어지 않는 경우, 그리고 임상 단계에서 적용되는 규정 등의 변화가 일어나는 경우 당사의 임상 개발 일정이 지연되거나 추가적인 비용이 발생하여 당사의 사업에 부정적인 영향을 미칠 수 있다는 점 주의하시기 바랍니다.
명확히 하면 1) 정부의 예산 사정, 관련 법령 또는 규정의 개정이나 정부의 정책 변경 등으로 인하여 정부지원금의 조정이 필요한 경우 2) 중앙행정기관의 장이 지정하는 자의 현장실태조사 또는 평가 등의 결과에 따라 조정이 필요한 경우 3) 연구개발비의 절감 또는 연구개발기간 단축 등에 따라 협약이 변경되는 등의 사유 발생할 경우 전부지원금 반환(상환) 대상입니다. 본 공시서류 제출일 전일 현재까지 당사는 과거에 진행하였던 정부과제에서 위 사유에 따른 반환(상환) 경험은 없으며, 현재 진행 중인 연구 과제에서도 반환(상환) 가능성은 현저히 낮은 것으로 판단됩니다. 또한, 현행 제도상 정부출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제받을 수 있습니다. 그럼에도 불구하고 정부과제의 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제재 조치가 가해질 수 있으며, 이에 따라 당사의 실적 개선에 악영향을 미칠 가능성이 있음을 투자 판단에 참고하시기 바랍니다.
| 자. 임원의 겸직에 따른 위험 당사와 이병건 대표이사가 겸직하였던 회사간 이해상충 발생 가능성 역시 매우 낮은 것으로 판단됩니다. 4개사 중 지놈앤컴퍼니를 제외한, 나머지 3개사(크리엑티브헬스, 하플사이언스, 에임드바이오)는 당사가 영위하는 사업과 이해상충이 발생되지 않는 사업을 영위하고 있으며 당사와의 사업적 시너지가 가능할 것으로 판단되었으며, 크리엑티브헬스 및 하플사이언스의 경우 임기만료로 각각 2024년 3월 30일, 2024년 3월 28일자로 겸직이 종료되었습니다. 현재 이병건 대표이사는 에임드바이오 기타비상무이사로만 겸직하고 있으며, 아직까지 당사와 3개사간 거래관계도 존재하지 않습니다. 홍준호 대표이사가 당사의 관계회사인 메디오젠 대표이사를 겸직함으로서 마이크로바이옴을 활용한 단백질치료제 개발 등의 사업적 시너지가 발생할 수 있으며, 아직까지 당사와 메디오젠과의 거래내역은 없습니다. 결과적으로 당사와 당사의 임원이 겸직중인 회사간 거래 관계는 없으며, 이해상충 가능성도 낮은 것으로 확인됩니다. 그럼에도 불구하고, 당사 임원의 겸직으로 인하여 당사의 내부 정보가 유출되거나, 경영의 투명성 및 독립성이 훼손될 위험, 당사 수익성 확보에 있어 유사시 관계회사 경영 자금에 대한 지원 등이 이루어질 수 있습니다. 이런 문제가 현실화 될 경우 당사의 사업성 및 재무상태에 불리한 영향을 끼칠 수 있으니 투자자께서는 이 점 유의하여 주시기 바랍니다. |
본 공시서류 제출일 전일 현재 당사의 임원 겸직현황은 아래와 같습니다.
| [임원 겸직현황] |
| 겸직임원 | 겸직회사 | |||
|---|---|---|---|---|
| 성명 | 직위 | 기업명 | 직위 | 재직기간 |
| 이병건 (주1) |
대표이사 | 에임드바이오 | 기타비상무이사 | 2022.03 ~ 현재 |
| 크리엑티브헬스 | 기타비상무이사 | 2021.03 ~ 2024.03 | ||
| 지놈앤컴퍼니 | 기타비상무이사 | 2021.03 ~ 2023.01 | ||
| 하플사이언스 | 기타비상무이사 | 2021.01 ~ 2024.03 | ||
| 홍준호 | 대표이사 | 메디오젠 | 대표이사 | 2023.09 ~ 현재 |
| 김병철 | 사외이사 | 법무법인위어드바이즈 | 변호사 | 2024.06 ~ 현재 |
| 법무법인위어드바이즈 | 대표변호사 | 2021.03 ~ 2024.05 | ||
| (주)디디아이제이60 위탁관리부동산투자회사 | 대표이사 | 2021.05 ~ 2023.12 | ||
| 김현철 | 사외이사 | 산일전기 | 사외이사 | 2024.01 ~ 현재 |
| 한국IR협의회 | 부회장 | 2019.02 ~ 2022.02 | ||
| 안근용 | 사외이사 | 뷰브레인헬스케어 | CFO/COO | 2022.11 ~ 현재 |
| 민트벤처파트너스 | 파트너 | 2020.08 ~ 2022.11 | ||
| 류양지 | 사외이사 | 법무법인 율촌 | 고문 | 2019.10 ~ 현재 |
| 이우열 (주1) |
미등기임원 | (주)지아이셀 | 미등기임원 | 2021.07 ~ 현재 |
| 주1) | 이우열 이사는 관계사인 지아이셀의 겸직을 수행하고 있으나 미등기임원으로서 해당 겸직이 이사회 등 중요한 경영의사결정에 미칠 영향은 없습니다. |
| 출처: | 당사 정기보고서 및 당사 제시 |
당사의 핵심인력인 이병건 대표이사, 홍준호 대표이사의 겸직 사유 및 이해상충 가능성은 아래와 같습니다.
[이병건 대표이사]
이병건 대표이사는 2022년 3월 3일에 주주총회를 통하여 사내이사로 선임되었으며 당일 이사회를 통하여 대표이사로 선임되었습니다. 선임 당시 4개회사에 기타비상무이사로 겸직을 수행 중이었으며 이 중 당사 관계회사인 지아이바이옴과 사업전략이 유사한 지놈앤컴퍼니의 기타 비상무이사직을 조기사임(2023년 1월 31일) 하였습니다. 또한 크리엑티브헬스 및 하플사이언스의 경우 임기만료로 각각 2024년 3월 30일, 2024년 3월 28일 사임하여 현재 에임드바이오만 겸직을 유지하고 있습니다.
| 회사명 | 주요 사업에 대한 설명 | 당사와의 사업적 예상 시너지 |
|---|---|---|
| 크리엑티브헬스 | 엑셀러레이터: 우수 기술 발굴하여 자금 지원, 대표이사 선정 등 창업 유도 및 육성 | 당사에 필요한 기술 보유 회사와의 공동 협력 기회 |
| 지놈앤컴퍼니 | 마이크로바이옴을 이용한 항암제 및 건강기능식품 개발 | 지아이이노베이션의 관계사인 지아이바이옴과의 이해상충이 우려되어 2023년 1월 조기 겸직해소 |
| 하플사이언스 | 노화로 퇴화된 조직을 재생시키는 항노화 치료제 개발 | 미래 시장인 항노화 분야 공동 협력 기회 |
| 에임드바이오 | 암을 포함한 난치성 뇌질환 치료제 개발 | 자체 개발 항체를 이용한 신규 항암제 공동 개발 기회 |
일반적으로 임원이 다수의 회사에 겸직하고 있을 시, 해당 임원이 경영에 대하여 집중하지 못할 수 있다라는 우려가 존재합니다. 그러나 이병건 대표이사의 경우, 기타비상무이사로 겸직하여, 비상근 근로를 하고 있음으로, 겸직으로 인하여 당사에 대한 경영 집중도를 악화될 가능성은 매우 낮은 것으로 판단됩니다.
지놈앤컴퍼니의 경우에는 이해상충가능성에 대한 우려가 있을 것으로 판단되어, 2023년 01월 조기사임하여 겸직을 해소하였습니다. 지놈앤컴퍼니는 마이크로바이옴 사업을 영위하는 회사로서, 당사의 관계회사이자 마이크로바이옴 사업을 영위하고 있는 지아이바이옴과 사업 영역이 겹치기 때문입니다.
한편 당사와 이병건 대표이사가 겸직하였던 회사간 이해상충 발생 가능성 역시 매우 낮은 것으로 판단됩니다. 상기 4개사 중 지놈앤컴퍼니를 제외한, 나머지 3개사(크리엑티브헬스, 하플사이언스, 에임드바이오)는 상기 표에 기재한 바와 같이 당사가 영위하는 사업과 이해상충이 발생되지 않는 사업을 영위하고 있으며 당사와의 사업적 시너지가 가능할 것으로 판단되었으며, 크리엑티브헬스 및 하플사이언스의 경우 임기만료로 각각 2024년 3월 30일, 2024년 3월 28일자로 겸직이 종료되었습니다. 현재 이병건 대표이사는 에임드바이오 기타비상무이사로만 겸직하고 있으며, 아직까지 당사와 3개사간 거래관계도 존재하지 않습니다.
[홍준호 대표이사]
홍준호 대표이사는 2021년 6월 16일 주주총회를 통하여 사내이사로 선임되었으며 2021년 6월 16일 이사회를 통하여 대표이사로 선임되었습니다. 또한 2023년 03월 13일 이사회 결의에 따라 공동대표이사(이병건, 홍준호)에서 각자대표이사(이병건, 홍준호)로 변경되었으며, 2024년 03월 29일 정기주주총회에서 재선임을 통하여 임기조정하였습니다. 홍준호 대표이사는 2023년 9월 1일 메디오젠의 대표이사로 겸직을 시작하였으며, 당사와의 이해상충 가능성이 낮을 것으로 판단되어 현재까지 겸직을 유지하고 있습니다.
| 회사명 | 주요 사업에 대한 설명 | 당사와의 사업적 예상 시너지 |
|---|---|---|
| 메디오젠 | 마이크로바이옴을 이용한 건강기능식품 개발 및 생산 | 마이크로바이옴 콤보 단백질치료제 개발 협력 |
상기 기재한 바와 같이 홍준호 대표이사가 당사의 관계회사인 메디오젠 대표이사를 겸직함으로서 마이크로바이옴을 활용한 단백질치료제 개발 등의 사업적 시너지가 발생할 수 있으며, 아직까지 당사와 메디오젠과의 거래내역은 없습니다.
위와 같이 결과적으로 당사와 당사의 임원이 겸직 중인 회사간 거래 관계는 없으며, 이해상충 가능성도 낮은 것으로 확인됩니다. 또한, 당사는 상장 이후 관계회사, 최대주주, 특수관계인 등 이해관계자 거래의 투명성 제고와 더불어 임원의 겸직으로한 이해상충을 방지하고자 본 공시서류 제출일 전일 현재 정관 제46조에 따른 감사위원회 및 투명경영위원회, 보상위원회를 구성하고 있습니다. 또한, 2020년 8월 24일부로 이해관계자와의 거래 및 임원 겸직 이행상충 방지에 대한 통제 규정을 제정하여 준수하고 있으며, 2022년 12월 이사회결의로 기존 내부거래위원회를 투명경영위원회로 승격하여 투명성을 더욱 강화하였습니다. 이후 이해관계자와의 거래 및 임원의 겸직이 발생할 경우 투명경영위원회를 통한 사전 승인을 받고 거래를 진행하고 있습니다.
그럼에도 불구하고, 당사 임원의 겸직으로 인하여 당사의 내부 정보가 유출되거나, 경영의 투명성 및 독립성이 훼손될 위험, 당사 수익성 확보에 있어 유사시 관계회사 경영 자금에 대한 지원 등이 이루어질 수 있습니다. 이런 문제가 현실화 될 경우 당사의 사업성 및 재무상태에 불리한 영향을 끼칠 수 있으니 투자자께서는 이 점 유의하여 주시기 바랍니다.
| 차. 분쟁에 따른 우발채무 등에 관한 위험 당사는 증권신고서 작성기준일 현재 당사의 영업에 중대한 영향을 미치는 소송 등의 분쟁 사항은 없습니다. 하지만 향후 당사의 연구개발 파이프라인이 확대되고, 임상 단계가 고도화 및 기술 이전 계약 등이 본격적으로 협의될 경우, 다양한 이해관계자들 간 권리 분쟁 등이 발생할 가능성을 배제할 수 없습니다. 이 경우, 당사 기술과 관련된 특허권 분쟁, 핵심인력 유출입, 임직원 및 관련자가 당사에 중대한 손해를 입히는 경우 등과 관련된 다양한 종류의 분쟁 또는 소송이 발생할 수 있습니다. 소송이나 분쟁, 예상치 못한 법률적 리스크가 발생할 경우 당사의 영업 및 재무구조에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이점 유의하여 투자하시기 바랍니다. |
당사는 증권신고서 작성기준일 현재 당사의 영업에 중대한 영향을 미치는 소송 등의 분쟁 사항은 없습니다. 하지만 향후 당사의 연구개발 파이프라인이 확대되고, 임상 단계가 고도화 및 기술 이전 계약 등이 본격적으로 협의될 경우, 다양한 이해관계자들 간 권리 분쟁 등이 발생할 가능성을 배제할 수 없습니다. 이 경우, 당사 기술과 관련된 특허권 분쟁, 핵심인력 유출입, 임직원 및 관련자가 당사에 중대한 손해를 입히는 경우 등과 관련된 다양한 종류의 분쟁 또는 소송이 발생할 수 있습니다.
법률 분쟁은 통상적으로 장기간에 걸쳐 진행되며, 사안에 따라 매우 큰 규모의 분쟁이 될 경우 큰 규모의 소송비용이 발생할 수 있습니다. 당사는 법률위반으로 인한 리스크를 회피하고자 지속적으로 회사의 영업활동에 관련된 법률검토 및 법률자문을 받고 있으며 담당 임직원에 대한 법률적 내부통제에 힘쓰고 있습니다. 다만, 소송이나 분쟁, 예상치 못한 법률적 리스크가 발생할 경우 당사의 영업 및 재무구조에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이점 유의하여 투자하시기 바랍니다.
| 카. 내부회계관리제도 및 내부통제 관련 위험 당사는 신뢰할 수 있는 회계정보 작성 및 공시를 위하여 회계의 부정과 오류를 예방하고 적시에 발견할 수 있도록 회계시스템을 관리ㆍ통제하며, 회사의 재무제표가 한국채택국제회계기준에 따라 작성, 공시되었는지의 여부에 대한 합리적 확신을 제공하기 위하여 내부회계관리제도를 구축하였습니다. 당사는 상장시 신뢰성 있는 내부회계관리를 위하여 2019년 5월 삼일회계법인의 내부회계관리제도 구축용역을 통해 내부회계관리제도를 구축하였습니다. 또한 2020년 8월 24일 '내부회계관리규정'을 제정하였으며, 2021년 9월 30일부터 삼정회계법인의 내부회계관리제도 고도화 구축용역을 시작하여 2023년까지 2차례 고도화 용역을 완료하였습니다. 신뢰성 있는 내부회계관리 제도 하에 2023년 내부회계감사를 차질없이 수검하였으며 김동휘 CFO를 내부회계관리자로 지정하여 증권신고서 작성일 현재 효율적이고 안정적으로 내부회계관리제도를 운영하고 있습니다. 그럼에도 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 감사한 결과 중요한 취약점이 발견될 시에는 각종 제재사항에 해당할 수 있습니다. 투자자께서는 이점 유의하시어 투자에 임해주시기 바랍니다. |
당사는 신뢰할 수 있는 회계정보 작성 및 공시를 위하여 회계의 부정과 오류를 예방하고 적시에 발견할 수 있도록 회계시스템을 관리ㆍ통제하며, 회사의 재무제표가 한국채택국제회계기준에 따라 작성, 공시되었는지의 여부에 대한 합리적 확신을 제공하기 위하여 내부회계관리제도를 구축하였습니다.
당사는 상장시 신뢰성 있는 내부회계관리를 위하여 2019년 5월 삼일회계법인의 내부회계관리제도 구축용역을 통해 내부회계관리제도를 구축하였습니다. 또한 2020년 8월 24일 '내부회계관리규정'을 제정하였으며, 2021년 9월 30일부터 삼정회계법인의 내부회계관리제도 고도화 구축용역을 시작하여 2023년까지 2차례 고도화 용역을 완료하였습니다. 신뢰성 있는 내부회계관리 제도 하에 2023년 내부회계감사를 차질없이 수검하였으며 김동휘 CFO를 내부회계관리자로 지정하여 증권신고서 작성일 현재 효율적이고 안정적으로 내부회계관리제도를 운영하고 있습니다.
(1) 내부회계관리 담당업무 조직도
| 구분 | 성명 | 근무연수 | 회사내 경력 |
현재 겸임업무 |
|---|---|---|---|---|
| 내부회계관리제도 운영책임자 | 홍준호 | 3년 9개월 |
▶'21.03∼'21.06 ㈜지아이이노베이션 경영대표 ▶'21.06∼현재 ㈜지아이이노베이션 대표이사 |
- |
| 내부회계관리자 | 김동휘 | 3개월 | ▶'24.09~현재 ㈜지아이이노베이션 재무기획실장 | - |
| 내부회계실무자 | 이소윤 | 7년 1개월 | ▶'17.12~현재 ㈜지아이이노베이션 재무부팀장 | - |
| 이광준 | 3년 7개월 | ▶'21.06~현재 ㈜지아이이노베이션 재무부팀장 | - | |
| 지혜원 | 6개월 | ▶'24.07~현재 ㈜지아이이노베이션 재무팀 | - | |
| 조민경 | 1년 6개월 | ▶'23.06~현재 ㈜지아이이노베이션 재무팀 | - |
(2) 내부회계관리자의 인적사항
| 구분 | 성명 | 근속년수 | 주요 경력 |
|---|---|---|---|
| 내부회계관리자 |
김동휘 |
3개월 |
▶연세대학교 경영학 학사 ▶안진회계법인 회계사 ▶하나은행/하나금융지주 재무기획팀 ▶(주)지아이이노베이션 재무기획실장, 현재 |
(3) 내부회계관리자가 보고한 내용
| 사업연도 | 보고일자 | 보고내용 |
|---|---|---|
|
2023년 (제7기) |
2024.02.13 | 내부회계관리제도 운영실태 평가결과, 2024년 2월 13일 현재 당사의 내부회계관리제도는 내부회계관리제도모범규준에 근거하여 볼 때, 중요성의 관점에서 중요한 취약점이 발견되지 아니하였습니다. |
|
2022년 (제6기) |
2023.02.07 | 내부회계관리제도 운영실태 평가결과, 2023년 2월 7일 현재 당사의 내부회계관리제도는 내부회계관리제도모범규준에 근거하여 볼 때, 중요성의 관점에서 중요한 취약점이 발견되지 아니하였습니다. |
|
2021년 (제5기) |
2022.02.07 | 내부회계관리제도 운영실태 평가결과, 2022년 2월 7일 현재 당사의 내부회계관리제도는 내부회계관리제도모범규준에 근거하여 볼 때, 중요성의 관점에서 중요한 취약점이 발견되지 아니하였습니다. |
그럼에도 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 감사한 결과 중요한 취약점이 발견될 시에는 각종 제재사항에 해당할 수 있습니다. 투자자께서는 이점 유의하시어 투자에 임해주시기 바랍니다.
| 타. 금융감독원 공시 위반 관련 위험 당사는 2020년 12월 31일 기준 주주수가 500인 이상이 되어 「자본시장법」제159조제1항 및 동법 시행령 제167조제1항에 따라 사업보고서 제출의무가 발생하였습니다. 당사는 2021년 3월 3일, 당사의 사업보고서 제출대상 법인 해당여부에 대하여 금융감독원에 유선으로 문의하였고, 문의하는 과정에서 사업보고서 제출의무 대상기업에게 주요사항 보고서 제출의무도 발생한다는 사실을 알게 되었습니다. 이에 2021년 2월 26일 운영자금 확보를 위해 ㈜유한양행에 대한 유상증자에 대하여 주요사항보고서를 제출해야 함을 뒤늦게 인지하고 급히 주요사항 보고서를 제출하였으나 2일 지연되었습니다. 한편, 당사는 2018년 7월 17일부터 2020년 3월 14일까지 총 7차례에 걸쳐 연구개발비 및 운영자금 조달을 목적으로 유상증자(전환우선주)를 진행하여 약 910억원을 조달하였습니다. 당시 당사는 유상증자에 참가한 개별 벤처투자조합, 신기술사업투자조합 등을 1인의 투자자로 이해하고 증자를 진행하였습니다. 그런데 당사가 코스닥시장 상장을 준비하는 과정에서 증자에 참여한 조합의 조합원 수를 기준으로 투자자 수를 산정해야 하며, 당사가 진행했던 신주 발행이 자본시장법 상 모집 혹은 간주모집에 해당됨을 인지하였습니다. 위와 같은 사항에 대하여 당사는 상장을 위한 선임된 공동대표주관회사 및 자문 법무법인 검토를 통해 확인하였으며, 2021년 6월 금융감독원에 해당 내용을 자진신고 하였습니다. 당사는 2023년 10월 (1) 주요사항보고서 제출지연에 관한 건은 미조치로 결과를 통보 받았으며, (2) 증권신고서 제출의무 위반의 건은 경고 및 과징금 107백만원을 부과받아 2023년 11월 납부의무를 이행하였습니다. 이후, 당사는 감독기관의 조사에 성실히 응하고 있으며 공시 인력을 확충하고 관련 규정을 정비하는 등 공시 역량 증대를 위해 노력하고 있어 위 위험은 제한적인 것으로 판단됩니다. 그럼에도 향후 이러한 공시 위반 사항이 재발할 경우 과징금 납부 등 당사 재무성과에 부정적인 영향이 발생할 수 있으니 이 점 유의하시기 바랍니다. |
당사는 임직원의 내부정보를 이용한 부당내부거래를 근절하고, 회사 정보의 대외공개창구를 공식적으로 일원화하는 것의 중요성을 인식하고 있습니다. 이에 당사의 모든 공시정보가 관련 법규에 따라 정확하고 공정하게 공시될 수 있도록 함과 아울러 임직원의 불공정거래를 방지하기 위하여 공시관련 업무 및 절차, 공시정보의 관리등에 필요한 사항을 정함을 목적으로 하여 2020년 8월 24일 '공시정보관리규정'을 제정하였습니다.
당사는 위 규정의 목적을 달성하기 위하여 임직원에 대하여 중요정보관리에 대한 지도 교육을 지속적으로 시행하고, 중요정보관리의 중요성 및 내부자거래 규제에 관한 관계법령의 제정 취지를 계속적으로 주지시켜 나갈 계획입니다.
| [공시정보관리규정] |
| 구분 | 내용 |
|---|---|
|
목적 (제1조) |
이 규정은 당사의 모든 공시정보가 관련법규에 따라 정확하고 완전하며 공정하고 시의 적절하게 공시될 수 있도록 함과 아울러 임직원의 불공정거래를 방지하기 위하여 공시관련 업무 및 절차, 공시정보의 관리 등에 필요한 사항을 정함을 목적으로 한다. |
| 제31조(정보의 수집 유지 관리) |
각각의 공시통제조직은 공시정보의 정확성, 완전성, 공정성, 적시성을 확보하기 위하여 담당업무에 관련되는 당사 내.외부의 필요한 정보와 근거자료를 수집, 유지, 관리하여야 한다. 대표이사는 임직원이 전항의 정보를 수집ㆍ유지ㆍ관리하고 관련업무에 활용할 수 있도록 정보관리시스템을 마련하거나 필요한 업무지시를 할 수 있다. |
| 제35조(미공개 중요정보의 관리) |
①대표이사 또는 공시책임자는 다음 각호에 따라 미공개 중요정보가 관리될 수 있도록 필요한 조치를 취하여야 한다. 1. 미공개중요정보를 포함하고 있는 문서는 허용된 임직원만이 사용할 수 있는 안전한 장소에 보관되어야 한다. 2. 임직원은 미공개중요정보를 엘리베이터, 복도 등 타인이 대화내용을 들을 수 있는 장소에서 논의하여서는 안된다. 3. 미공개중요정보를 포함하고 있는 문서는 공개적인 장소에 비치되어서는 안되며, 문서의 폐기시에는 분쇄등 적절한 방법을 통해 문서의 내용을 파악할 수 없도록 폐기되어야 한다. 4. 임직원은 자신이 보유하고 있는 미공개중요정보를 외부뿐만 아니라 회사 내에서도 보안을 유지하여야 한다. 5. 미공개중요정보와 관련한 팩스, 컴퓨터 통신 등에 의한 문서의 전자송신은 보안이 보장된 상태에서만 수행되어야 한다. 6. 미공개중요정보를 포함하고 있는 문서의 불필요한 복사는 가급적 피하고 문서는 회의실 또는 업무 관련 장소에서 신속히 정리되어야 한다. 7. 미공개중요정보를 포함하고 있는 문서 사본의 여분은 분쇄 등의 방법으로 완전하게 파기하여야 한다. ②임직원은 회사의 미공개중요정보를 누설하여서는 안된다. 다만, 거래의 상대방, 법률대리인, 외부감사인 등과 업무상 불가피하게 미공개중요정보를 공유하게 되는 경우, 사전에 공시책임자 또는 공시담당부서장 등에게 문의하여 필요한 한도내에서만 공유토록 하여야 한다. ③임직원이 의도하지 않은 상태에서 미공개중요정보를 누설한 경우에는 지체없이 공시담당부서장에게 이 사실을 통지하여야 한다. ④전 항의 통지를 받은 공시담당부서장은 당해 사실을 공시책임자에게 보고하고 그 지시를 받아 공정공시등 필요한 조치를 하여야 한다. |
당사는 회사의 주요 정보가 공시담당조직에도 공유되어 공시의무사항인지 여부를 적시에 판단할 수 있도록 시스템을 정비하였습니다. 그 이외에 지분변동 공시 및 신고의무 누락을 방지하기 위해 해당 관련자에 대한 교육을 실시하고, 임원 및 대주주의 지분변동 관련 공시의무 준수 확약서를 징구할 계획입니다. 또한, 전체 임직원을 대상으로 정보 관리의 중요성, 공시의무사항 및 위반시 제재 등에 대한 공시 교육과 불공정거래 예방 교육을 지속적으로 실시하고 불공정거래행위 규제 준수 확약서를 징구하여 불공정거래에 대한 사전 방지책을 마련할 계획입니다.
그러나 당사의 이와 같은 노력에도 불구하고 공시 위반이나 불공정거래 등의 발생 가능성을 원천적으로 배제할 수 없으며, '공시정보관리규정' 제정 후 주요사항보고서 제출 지연 및 증권신고서 제출의무 위반하여 위반 경위에 대해 금융감독원에 자진 신고하였습니다.
(1) 주요사항보고서 제출지연에 관한 건
당사는 외부감사대상이지만 비상장법인으로서 2020년도까지 사업보고서 제출의무가 없었습니다. 그러나 2020년 12월 31일 기준 주주수가 500인 이상이 되어 「자본시장법」제159조제1항 및 동법 시행령 제167조제1항에 따라 사업보고서 제출의무가 발생하였습니다.
당사는 사업보고서 제출기한을 한달 앞둔 2021년 3월 3일, 당사의 사업보고서 제출대상 법인 해당여부에 대하여 금융감독원에 유선으로 문의하였고, 익일인 2021년 3월 4일 사업보고서 제출대상임을 확인받았습니다.
금융감독원에 문의하는 과정에서 「자본시장법」제161조제1항 및 동법 시행령 제171조제1항제1호에 따라 사업보고서 제출의무 대상기업에게 주요사항 보고서 제출의무도 발생한다는 사실을 알게 되었습니다. 이에 2021년 2월 26일 운영자금 확보를 위해 ㈜유한양행에 대한 유상증자에 대하여 주요사항보고서를 제출해야 함을 뒤늦게 인지하고 급히 주요사항 보고서를 제출하였으나 2일 지연되었습니다.
당사는 이러한 경위에 대해 금융감독원에 자진 신고를 완료하였습니다.
(2) 증권신고서 제출의무 위반에 관한 건
「자본시장과 금융투자업에 관한 법률」(이하 「자본시장법」)에 따르면, '모집'을 '대통령령으로 정하는 방법에 따라 산출한 50인 이상의 투자자에게 새로 발행되는 증권의 취득의 청약을 권유하는 것(「자본시장법」제9조제7항)'이라 정의하고 있으며 투자자 수는 동법 시행령 제11조에 따라 '청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다(전문가 외 기타 연고자 제외)'고 규정하고 있습니다. 이러한 '모집'에 해당하는 경우「자본시장법」제119조에 따라 증권신고서 제출의무를 지닙니다.
한편, 당사는 2018년 7월 17일부터 2020년 3월 14일까지 총 7차례에 걸쳐 연구개발비 및 운영자금 조달을 목적으로 유상증자(전환우선주)를 진행하여 약 910억원을 조달하였습니다. 당시 당사는 유상증자에 참가한 개별 벤처투자조합, 신기술사업투자조합 등을 1인의 투자자로 이해하고 증자를 진행하였습니다. 그런데 당사가 코스닥시장 상장을 준비하는 과정에서 증자에 참여한 조합의 조합원 수를 기준으로 투자자 수를 산정해야 하며, 당사가 진행했던 신주 발행이 자본시장법 상 모집 혹은 간주모집에 해당됨을 인지하였습니다. 이에 당사는 증권신고서 제출의무 위반 사실을 파악 및 검토하여 2021년 6월 금융감독원에 해당 내용을 자진신고 하였습니다.
(3) 결과
당사는 2023년 10월 (1) 주요사항보고서 제출지연에 관한 건은 미조치로 결과를 통보 받았으며, (2) 증권신고서 제출의무 위반의 건은 경고 및 과징금 107백만원을 부과받아 2023년 11월 납부의무를 이행하였습니다.
| [연도별 기타충당부채 예상액] |
| (단위: 백만원) |
| 구분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 기타충당부채 | - | - | 1,458 | 1,458 |
| 주1) 증권신고서 제출의무 위반에 대한 자진신고에 따라 추정한 과징금 예상액입니다. 출처: 당사 제시 |
| [연도별 실제 과징금액] |
| (단위: 백만원) |
| 구분 | 2024년 3분기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 과징금 지급 내역 | - | 107 | - | - |
| 출처: 당사 제시 |
상기 내용 외 당사는 설립 이후 증권신고서 제출일 현재까지 영업 관련 일체 제반법률 또는 의무 위반으로 제재를 받은 사실이 없습니다.
이후, 당사는 감독기관의 조사에 성실히 응하고 있으며 공시 인력을 확충하고 관련 규정을 정비하는 등 공시 역량 증대를 위해 노력하고 있어 위 위험은 제한적인 것으로 판단됩니다. 그럼에도 향후 이러한 공시 위반 사항이 재발할 경우 과징금 납부 등 당사 재무성과에 부정적인 영향이 발생할 수 있으니 이 점 유의하시기 바랍니다.
추가로, 당사는 2024년 08월 08일 제1회차 무기명식 이권부 무보증 사모 전환사채 발행과 제8회차 전환우선주를 발행하였습니다. 당사와 제1회 전환사채 인수자 및 제8회 전환우선주 인수자 사이에 관계가 없고, 전환사채와 전환우선주 발행 결정 전후 6개월 이내 거래내역 및 계획 또한 존재하지 않습니다. 또한, 당사는 사모 발행 기준의 충족 및 전매 기준에 해당되지 않도록 전환사채의 경우 전자등록을 통해 거래단위를 50단위 미만으로 발행하되 발행 후 1년이내에는 최초 증권 발행시의 거래단위 이상으로 분할되지 않도록 조치를 취하였으며, 전환청구권의 권리행사금지기간을 발행 후 1년 이상으로 정하였습니다. 전환우선주의 경우 전매제한 조치를 위해 주식발행 후 지체없이 예탁결제원에 전자등록한 후 1년간 해당 주식을 인출거나 매각하지 않기로 하는 의무보유등록일로부터의 보호예수 계약을 체결하였습니다.
한편, 당사가 2024년 08월 08일 발행한 제1회 전환사채의 경우 Call Option을 보유하고 있으며, 이는 당사가 해당 사채의 발행일로부터 12개월이 되는 날인 2025년 08월 08일부터 17개월이 되는 날인 2026년 01월 08일까지 매 1개월에 해당되는 날(이하 "매매대금 지급기일")에 해당 사채를 당사 또는 당사가 지정하는 자(이하 "매수인")에게 매도하여 줄 것을 사채권자에게 청구할 수 있으며, 사채권자는 매수인의 청구에 따라 보유하고 있는 해당 사채를 매매대금 지급기일에 매수인에게 매도하여야 한다는 조건을 의미합니다. 단, 매수인은 각 사채권자에 대하여 각 사채권자가 보유하고 있는 해당 사채 권면금액의 10%를 초과하여 매도청구권을 행사할 수 없습니다. 즉, 매수인이 각 사채권자에 대해 매도청구권을 행사할 수 있는 사채 금액은 각 사채권자의 해당 사채 인수금액 총액의 10% 에 해당하는 10억원 이내로 제한됩니다. 단, 최대주주 및 최대주주의 특수관계인이 매수인이 되는 경우, 각 최대주주 등이 매수할 수 있는 해당 사채의 수량은 「증권의 발행 및 공시 등에 관한 규정」 제5-21조 제3항에 따라 해당 사채의 발행 당시 최대주주 및 특수관계인이 보유한 주식 비율을 초과하여 주식을 취득할 수 없습
니다. 관련 규정과 최대주주 및 특수관계인의 Call Option 행사한도는 아래와 같습니다.
| 「증권의 발행 및 공시 등에 관한 규정」 제5-21조(전환사채의 발행제한 및 전환금지기간) ③ 주권상장법인이 최대주주 또는 그의 특수관계인(이하 이 조에서 "최대주주등"이라 한다)에게 전환사채매수선택권을 부여하는 전환사채를 발행하는 경우(주권상장법인이 자신이 발행한 전환사채를 취득한 후 최대주주등에게 매도하는 경우를 포함한다)에는 최대주주등이 전환사채매수선택권의 행사로 각자 발행당시 보유(누구의 명의로든지 자기의 계산으로 소유하는 경우를 말한다)한 주식 비율을 초과하여 주식을 취득할 수 없도록 하는 조건으로 이를 발행하여야 한다. |
| [최대주주 및 특수관계인의 Call Option 행사한도] | |
| (기준일: 2024년 08월 08일) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 | 소유주식수 및 지분율 | Call Option 행사한도 |
|
|---|---|---|---|---|---|
| 주식수 | 지분율 | ||||
| 장명호 | 최대주주 본인 | 보통주 | 3,054,806 | 6.78% | 6.78% |
| 양윤석 | 최대주주의 친인척 | 보통주 | 139,296 | 0.31% | 0.31% |
| 양경림 | 최대주주의 친인척 | 보통주 | 40,986 | 0.09% | 0.09% |
| 김봉모 | 최대주주의 친인척 | 보통주 | 31,816 | 0.07% | 0.07% |
| 지형남 | 최대주주의 친인척 | 보통주 | 7,488 | 0.02% | 0.02% |
| 김도연 | 최대주주의 친인척 | 보통주 | 6,000 | 0.01% | 0.01% |
| 장은주 | 최대주주의 친인척 | 보통주 | 5,360 | 0.01% | 0.01% |
| 지동석 | 최대주주의 친인척 | 보통주 | 6,100 | 0.01% | 0.01% |
| 강창훈 | 최대주주의 친인척 | 보통주 | 2,000 | 0.00% | 0.00% |
| 오영두 | 최대주주의 친인척 | 보통주 | 1,820 | 0.00% | 0.00% |
| 김다슬 | 최대주주의 친인척 | 보통주 | 1,800 | 0.00% | 0.00% |
| 지형욱 | 최대주주의 친인척 | 보통주 | 48 | 0.00% | 0.00% |
| 오영민 | 발행회사 임원 | 보통주 | 165,458 | 0.37% | 0.37% |
| 이경화 | 발행회사 임원 | 보통주 | 38,773 | 0.09% | 0.09% |
| 윤나리 | 발행회사 임원 | 보통주 | 35,172 | 0.08% | 0.08% |
| 조영규 | 발행회사 임원 | 보통주 | 19,200 | 0.04% | 0.04% |
| 노은희 | 발행회사 임원 | 보통주 | 646 | 0.00% | 0.00% |
| 김국환 | 발행회사 임원 | 보통주 | 1,002 | 0.00% | 0.00% |
| 김지수 | 발행회사 임원 | 보통주 | 500 | 0.00% | 0.00% |
| 임신생 | 발행회사 임원 | 보통주 | 14,268 | 0.03% | 0.03% |
| 김진만 | 관계회사 임원 | 보통주 | 166,010 | 0.37% | 0.37% |
| 홍천표 | 관계회사 임원 | 보통주 | 21,426 | 0.05% | 0.05% |
| 합계 | 보통주 | 3,759,975 | 8.34% | 8.34% | |
| 우선주 | - | - | |||
| 주1) | 지분율의 경우 1회차 전환사채 발행 당시 보통주와 우선주(8회차 전환우선주 포함)를 합한 발행주식의 총수를 기준으로 기재하였습니다. |
| 주2) | 특수관계인의 경우 본 공시서류 제출일 전일 현재 당사의 특수관계인으로 등재되어있는 인원을 기준으로 작성하였습니다. |
| 출처: | 당사 제공 |
매수인은 Call Option을 통하여 취득한 전환사채로 전환권을 행사할 경우 최대치인 10% 행사 및 최초 전환가액 기준 당사 보통주 85,859주를 취득할 수 있게 되며, 리픽싱 70% 조정 후에는 최대 122,654주까지 취득할 수 있습니다. 금번 유상증자 및 무상증자에 의한 전환가액 조정 이후를 기준으로 할 경우 Call Option 행사를 통하여 최대치인 10% 행사 기준 당사 보통주 102,532주를 취득할 수 있습니다.
| [1회차 전환사채의 Call Option에 관한 사항] | |
| (기준일: 2024년 08월 08일) | (단위 : 원, 주) |
| 구분 | 제1회 무기명식 전환사채 |
|---|---|
| Call Option 행사자 | 발행회사 또는 발행회사가 지정하는 자 |
| 발행일 | 2024년 08월 08일 |
| 만기일 | 2029년 08월 08일 |
| Call Option 대상 권면(전자등록)총액 (백만원) |
1,000 |
| 전환대상 주식의 종류 | 기명식 보통주 |
| Call Option 행사가능기간 |
2025년 08월 08일~ 2026년 01월 08일 |
| Call Option 비율 | 최대 권면총액의 10% |
| 조정 전 전환가액 | 11,647 |
| 유상증자 조정 후 전환가액 |
10,728 |
| 무상증자 조정 후 전환가액 |
9,753 |
| 조정 전 Call Option 대상 주식수 |
85,859 |
| 유상증자 조정 후 전환가능 주식수 |
93,214 |
| 무상증자 조정 후 전환가능 주식수 |
102,532 |
본 공시서류 제출일 현재 기준 1회차 전환사채의 Call Option을 행사할 매수인은 결정되지 않았습니다. 당사는 2024년 12월 01일부로 신설된 「증권의 발행 및 공시 등에 관한 규정」 제4-4조 제2항 제3호에 의거하여, 당사가 Call Option을 행사할 매수인을 지정하거나, Call Option을 제3자에게 양도한 경우에는 주요사항보고서 공시에 구체적인 행사자, 대가 수수여부(Call Option 제3자 양도시), 지급금액 등을 기재하여 투자자의 예측가능성을 제고할 계획입니다.
|
「증권의 발행 및 공시 등에 관한 규정」 |
이외 제1회 전환사채 및 제8회 전환우선주와 관련한 보다 자세한 사항은 당사에서 금융위(금감원) 전자공시시스템에 공시한 주요사항보고서(전환사채권발행결정)(2024.07.30)과 주요사항보고서(유상증자결정)(2024.07.30)를 참고하시기 바랍니다.
3. 기타위험
| 가. 신주의 환금성 제약 및 주가 변동에 따른 손실 위험 당사의 금번 유상증자로 인한 발행신주는 주금 납입일 이후 코스닥시장에 추가 상장일까지 유동성이 제한될 수 있으며, 추가상장 시점에서 신주발행가액보다 주가의 수준이 낮은 경우 환금성 위험 및 원금 손실의 위험이 있습니다. 본 유상증자 기간동안 주가의 변동이 있을 수 있다는 점, 투자자께서는 유의하여 주시기 바랍니다. |
당사는 코스닥시장 상장법인으로서 이번 유상증자로 발행되는 신주는 코스닥시장에 상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다. 그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 존재하오니, 투자자께서는 이 점 유의하시기 바랍니다.
본 유상증자의 자세한 일정은 본 신고서의 "제1부 모집 또는 매출에 관한 사항 - I. 모집 또는 매출에 관한 일반사항" 중 '1. 공모개요'를 참고하시기 바랍니다.
한편, 당사는 본 유상증자의 원활한 신주인수권증서매매를 위하여 5 거래일간 신주인수권증서를 상장하여 신주인수권증서를 통한 구주주 청약률을 제고할 계획입니다. 또한 신주인수권증서 매매를 희망하는 주주 및 투자자의 경우 대표주관회사인 한국투자증권(주)를 통해 신주인수권증서 매매가 가능합니다.
하지만 신주인수권증서의 원활한 매매 및 청약참여를 위한 노력에도 불구하고 신주인수권증서를 통한 청약이 부진하여 대규모 실권이 발생할 경우, 투자심리에 악영향을 끼쳐 일반공모청약에 부정적 영향을 끼칠 수도 있으며 향후 주가하락 가능성도 배제할 수 없습니다.
또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장 전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다.
| 나. 증자방식, 청약절차에 대한 주의 및 주가하락 위험 당사의 금번 유상증자로 인하여 기발행주식총수 45,163,170주의 25.78%에 해당하는 11,644,800주가 추가로 발행될 예정입니다. 본 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행됨에 따라 일반공모를 거쳐 배정 후에도 미 청약된 잔여주식에 대해서는 대표주관회사가 자기계산으로 잔액인수하게 됩니다. 만약 본 유상증자 청약에서 대량 실권이 발생하여 대표주관회사가 실권주를 인수하게 될 경우 주가에 어떠한 영향을 미칠지는 예상하기 어렵습니다. 다만, 대표주관회사가 당사 주식 인수 후 수익을 확정하기 위해 빠른 시일 내에 인수한 주식을 장내에서 매각하게 된다면 단기적으로 당사 주가에 악영향을 미칠 수 있으며, 대표주관회사가 인수한 주식을 일정 기간 보유하더라도 동 인수 물량이 잠재 매각 물량으로 존재하여 주가 상승에 부담으로 작용할 가능성이 있습니다. 대표주관회사가 최종 실권주를 인수할 경우, 당사는 실권주 인수금액의 15.0%를 추가수수료로 지급하게 됩니다. 이를 고려할 때, 대표주관회사의 실권주 매입단가는 일반청약자들 보다 15.0% 낮은 것과 같은 결과가 초래되어 인수 물량을 단기간에 처분하게 될 소지가 높을 것으로 예상되며 일시적으로 대규모 물량이 출회하여 주가가 하락할 가능성이 있습니다. 실질적으로 유상증자 청약자 및 대표주관회사는 신주상장 2영업일 전부터 입고예정 주식의 매도가 가능합니다. 투자자 여러분께서는 이 점에 유의하시어 투자에 임하시기 바랍니다. |
당사의 금번 유상증자로 인하여 기발행주식총수 45,163,170주의 25.78%에 해당하는 11,644,800주가 추가로 발행될 예정입니다.
| [당사 주가 및 유상증자에 따른 발행주식수 및 가격] |
| 모집예정 주식 종류 | 주식수 및 금액 | 비 고 |
|---|---|---|
| 모집예정주식수 | 11,644,800주 | - |
| 현재 발행주식총수 | 45,163,170주 | 보통주: 44,304,799주 우선주: 858,371주 |
| 확정 발행가액 | 9,550원 | 증자비율 및 할인율 고려 |
| 기산일 종가 | 15,530원 | 2025.03.14 종가 |
금번 유상증자에 따른 모집가액은 (舊)「유가증권의 발행 및 공시등에 대한 규정」 제57조를 일부 준용하여 산출됩니다. 그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 증자에 따른 모집가격 산정시 결정된 1주당 모집가액보다 향후 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실이 발생할 가능성이 있습니다.
당사는 본 유상증자의 원활한 신주인수권증서 매매를 위하여 5거래일간 신주인수권증서를 상장하여 신주인수권증서를 통한 구주주 청약률을 제고할 계획입니다. 하지만 신주인수권증서의 원활한 매매 및 청약참여를 위한 노력에도 불구하고 신주인수권증서를 통한 청약이 부진하여 대규모 실권이 발생할 경우, 투자심리에 악영향을 끼쳐 일반공모청약에 부정적 영향을 끼칠 수 있으며 향후 주가하락 가능성도 배제할 수 없습니다.
또한 금번 유상증자로 인해 추가 발행되는 주식은 보호예수되지 않는 관계로, 일시적인 물량 출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 주권의 상장일은 2025년 04월 10일로 예정되어 있습니다. 금번 유상증자에 따른 모집예정주식 11,644,800주가 향후 코스닥시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가희석화 위험이 발생할 수 있습니다.
한편, 본 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행됨에 따라 일반공모를 거쳐 배정 후에도 미청약된 잔여주식에 대하여는 대표주관회사가 자기계산으로 잔액인수하게 됩니다. 만약 본 유상증자 청약에서 대량 실권이 발생하여 대표주관회사가 실권주를 인수하게 될 경우 주가에 어떠한 영향을 미칠지는 예상하기 어렵습니다. 다만, 대표주관회사가 당사 주식 인수 후 수익을 확정하기 위해 빠른 시일 내에 인수한 주식을 장내에서 매각하게 된다면 단기적으로 당사 주가에 악영향을 미칠 수 있으며, 대표주관회사가 인수한 주식을 일정 기간 보유하더라도 동 인수 물량이 잠재 매각 물량으로 존재하여 주가 상승에 부담으로 작용할 가능성이 있습니다.
대표주관회사가 최종 실권주를 인수할 경우, 당사는 실권주 인수금액의 15.0%를 추가수수료로 지급하게 됩니다. 이를 고려할 때, 대표주관회사의 실권주 매입단가는 일반청약자들 보다 15.0% 낮은 것과 같은 결과가 초래되어 인수 물량을 단기간에 처분하게 될 소지가 높을 것으로 예상되며 일시적으로 대규모 물량이 출회하여 주가가 하락할 가능성이 있습니다. 실질적으로 유상증자 청약자 및 대표주관회사는 신주상장 2영업일 전부터 입고예정 주식의 매도가 가능합니다. 투자자 여러분께서는 이 점에 유의하시어 투자에 임하시기 바랍니다.
| 다. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화 등으로 인하여 금번 유상증자 발행가격이 하락하면서 모집규모가 크게 줄어들 경우, 당사가 계획했던 사업추진 및 자금운용 등에 차질이 빚어지면서 사업실적 및 재무적 안정성에 부정적 영향을 미칠 수 있습니다. 투자자분들은 투자시 이점에 유의하시기 바랍니다. |
금번 유상증자의 확정 발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 합니다. 다만 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은 가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다.(단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
증자 기간 중 주가가 급락하는 경우에도 일반공모 후 최종실권주에 대해서는 그 전부를 대표주관회사가 인수하므로 청약 미달에 따른 위험은 없습니다. 다만, 주가 하락으로 인하여 유상증자 발행총액이 줄어들 가능성이 있으며, 증권신고서 제출일 전일 현재 본 유상증자 이외에 당사가 계획하고 있는 자금조달 일정은 없습니다.
하지만 주식시장의 급격한 상황 악화 등으로 인하여 금번 유상증자 발행가격이 하락하면서 모집규모가 크게 줄어들 경우, 당사가 계획했던 사업추진 및 자금운용 등에 차질이 빚어지면서 사업실적 및 재무적 안정성에 부정적 영향을 미칠 수 있습니다. 투자자분들은 투자시 이 점에 유의하시기 바랍니다. 금번 유상증자를 통한 자금사용목적은 Ⅴ. 자금의 사용목적 부분을 참고하여 주시기 바랍니다.
| 라. 공시서류 정정에 따른 일정 변경 위험 본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. |
「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
| ※「자본시장과 금융투자업에 관한 법률」제120조(신고의 효력발생시기 등) |
|---|
| ① 제119조제1항 및 제2항에 따른 증권의 신고(이하 "증권신고"라 한다)는 그 증권신고서가 금융위원회에 제출되어 수리된 날부터 증권의 종류 또는 거래의 특성 등을 고려하여 총리령으로 정하는 기간이 경과한 날에 그 효력이 발생한다. ② 금융위원회는 증권신고서의 형식을 제대로 갖추지 아니한 경우 또는 그 증권신고서 중 중요사항에 관하여 거짓의 기재 또는 표시가 있거나 중요사항이 기재 또는 표시되지 아니한 경우를 제외하고는 그 수리를 거부하여서는 아니 된다. ③ 제1항의 효력의 발생은 그 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 정부에서 그 증권의 가치를 보증 또는 승인하는 효력을 가지지 아니한다. ④ 증권의 발행인은 증권신고를 철회하고자 하는 경우에는 그 증권신고서에 기재된 증권의 취득 또는 매수의 청약일 전일까지 철회신고서를 금융위원회에 제출하여야 한다 |
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행과정에서 일정이 변경될 수도 있으므로 투자자들께서는 투자시 이러한 점을 감안하시기 바랍니다.
| 마. 분석정보의 한계 및 투자판단 관련 위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있습니다. 본 증권신고서의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단하시기 바랍니다. |
상기 서술한 바와 같이, 당사의 주식가치는 금번 유상증자 실시에 따른 전 과정에서 다양한 영향을 받아 하락할 수 있습니다.
본 증권신고서의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 본 주식을 청약하고자 하는 투자자께서는 투자결정을 하기 전에 본 증권신고서의 상기 투자위험요소 뿐만 아니라 다른 부분 또한 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없습니다. 따라서 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단할 필요가 있습니다.
당사는 상기에 기술된 투자위험요소 외에도 불안정한 경제상황 등에 의하여 직·간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 실제 결과는 현재시점에서의 평가와는 상당히 다를 수 있는 점을 유의하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생할 경우, 당사의 사업환경과 재무상태, 기타 운영결과에 부정적인 영향을 미칠 수 있습니다. 이에 따른 주가 하락으로 투자자께서는 금번 공모 과정에서 취득하게 되는 주식의 투자금액의 일부 또는 전부를 잃을 수 있습니다.
또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 최초에 예측했던 것과 다를 수 있는 점을 유의하시기 바랍니다.
| 바. 집단 소송 제기 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있습니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있습니다. 본 증권신고서 및 투자설명서에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송 사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의 대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다.
| 사. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다. 당사가 진행하는 금번 유상증자가 예기치 못한 사유로 인해 철회될 경우 당사는 자본 확충을 위하여 무상감자 등 주주에게 손실을 끼치는 방안 등을 진행할 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이 점 유의하시기 바랍니다. |
금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사의 잔액인수 방식으로 진행됩니다. 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다.
당사가 진행하는 금번 유상증자가 예기치 못한 사유로 인해 철회될 경우 당사는 자본 확충을 위하여 무상감자 등 주주에게 손실을 끼치는 방안 등을 진행할 수 있습니다. 무상감자는 회사는 주주가 납입한 자본금을 감소시켜 회사가 경영활동을 통해 누적된 결손금을 보전하는 방법으로, 무상감자가 추진될 경우 주주께서는 이로 인해 회사의 주가가 급격히 하락하여 손실이 발생할 수 있으니 이 점 유의하시기 바랍니다.
유상증자 진행 도중 납입일 전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가 하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있으며, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이 점 유의하시기 바랍니다.
| 아. 금융감독기관의 규제 강화에 따른 위험 최근 금융감독기관 등의 상장기업에 대한 관리감독기준은 투자자보호 차원에서 엄격해지고 있는 상황이며, 회사가 관련 규정을 위반할 경우 회사 및 회사가 발행한 주식에 대해 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. |
최근 금융감독기관 등의 상장기업에 대한 관리감독기준은 투자자보호 차원에서 엄격해지고 있는 상황이며, 회사가 관련 규정을 위반할 경우 회사 및 회사가 발행한 주식에 대해 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다.
당사는 현재 주권매매정지, 상장폐지, 관리종목 등의 사유에는 해당하지 않지만, 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성) 제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있으니 투자자들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다.
특히 코스닥시장상장규정 제53조(관리종목), 코스닥시장상장규정 제54조(형식적 상장폐지) 및 제56조(상장적격성 실질심사에 따른 상장폐지) 등의 규정사항에 해당되어 관리종목 지정 및 상장폐지 등이 발생할 위험에 유의하시기 바랍니다.
자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| 자. 차입공매도 유상증자 참여 제한 관련 위험 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률 시행령」일부개정에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우에만 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 투자자께서는 이 점 유의하시기 바랍니다. |
주권상장법인이 유상증자 계획을 공시한 이후 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우 증자참여를 허용하고 있습니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 이와 관련 유상증자 참여가 제한되는 공매도 시점과 증자참여가 허용되는 예외사유를 시행령에서 정하도록 위임하고 있습니다.
시행령에 따르면, 유상증자 계획이 공시된 다음 날(2024년 12월 21일)부터, 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일, 2025년 03월 14일)까지 공매도 한 경우 증자참여가 제한됩니다. (「자본시장과 금융투자업에 관한 법률 시행령」제208조의4제1항)
다만, 다음의 경우 공매도를 통해 발행가격에 부당한 영향을 미쳤다고 보지 않아 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률 시행령」제208조의4제2항).
ⅰ) 마지막 공매도 이후 발행가격 산정 기산일까지 공매도 주문 수량 이상을 증권시장 정규거래시간에 매수(체결일 기준)
ⅱ) 금융위원회가 정하는 기준을 충족한 독립된 거래단위를 운영하는 법인 내에서 공매도를 하지 않은 거래단위가 증자참여
ⅲ) 시장조성 또는 유동성공급을 위한 거래과정에서 공매도
상기 공매도제도 개선 관련 자본시장법 시행령 개정안에 따라, 당사의 주식을 해당 기간 동안 공매도하는 투자자께서는 금번 유상증자 참여가 제한될 수 있음을 유의하시기 바랍니다. 해당 법령과 관련된 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| 차. 재무제표 작성 기준일 이후 재무상황 변동에 따른 위험 본 공시서류 상 재무제표에 관한 사항은 2024년 3분기 재무제표 (K-IFRS 기준) 작성기준일 이후의 변동을 반영하지 않았습니다. 당사는 금번 유상증자를 진행하는 과정에서 투자 의사결정에 중대한 영향을 미칠 것으로 판단되는 변동사항을 향후에도 상세하게 반영하여 공시할 예정입니다. 그럼에도 불구하고, 당사가 중요하지 않다고 판단하여 기재 및 서술을 생략한 사항 중 당사의 기업가치에 영향을 미칠 만한 사건이 없다고 단정할 수는 없어 주기적이고 면밀한 검토가 필요합니다. |
본 공시서류에 기재된 재무제표에 관한 사항과 감사인의 의견에 관한 사항은 2024년 3분기 재무제표 작성기준일 이후의 변동을 반영하지 않았으므로 투자에 유의하시기 바랍니다.동 정보는 당사가 작성한 결산자료로서 외부감사인의 감사결과 수치가 변경될 수 있습니다.
다만, 2024년 12월 02일 특별관계자 장내거래에 따른 특별관계 해소 및 의결권공동행사약정 주식수 변경에 따라 특별관계자의 지분율 47.74%(22,732,512주)에서 46.85%(22,333,794주)로 변경되었습니다. 이외에 당사의 자산, 부채, 현금흐름 또는 손익사항 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다.
당사는 금번 유상증자를 진행하는 과정에서 투자 의사결정에 중대한 영향을 미칠 것으로 판단되는 변동사항을 향후에도 상세하게 반영하여 공시할 예정입니다. 그럼에도 불구하고, 당사가 중요하지 않다고 판단하여 기재 및 서술을 생략한 사항 중 당사의 기업가치에 영향을 미칠 만한 사건이 없다고 단정할 수는 없어 주기적이고 면밀한 검토가 필요합니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 카. 개인종합자산관리계좌(ISA) 납입한도에 따른 청약제한 위험 개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다. |
개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다.
| 타. 기타 투자자 유의사항 당사의 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우, 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 공시서류에 기재된 정보에만 의존하여 투자 판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 유의하시어 투자에 임하시기 바랍니다. |
(1) 금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분들께서는 이 점을 유의하여 주시기 바랍니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
(3) 본 공시서류의 공시심사 과정에서 기재사항은 청약일 이전에 변경될 수 있고, 일부 내용은 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 공시서류상의 일정에 차질을 가져올 수 있습니다. 또한 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다.
(4) 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
(5) 당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점을 유의하여 투자에 임하시기 바랍니다.
(6) 만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다.
(7) 본건 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
(8) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있으니 투자의사를 결정하시는 데 참조하시기 바랍니다.
이와 같이, 본 건 유상증자를 통해 취득한 당사의 주식 가치는 하락할 수 있으며, 본본 공시서류에서 제시된 투자위험요소 및 기타 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 다시 한번 유의하여 주시기 바랍니다.
| ※ 상기 제반사항을 고려하시어 투자자 제위의 현명한 판단을 바랍니다. 투자자는 본건 공모주식에의 투자 여부를 결정함에 있어서 필요한 경우 스스로 별도의 독립된 자문을 받아야 하며, 이에 따른 투자의 결과에 대하여는 투자자가 책임을 부담합니다. |
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 '금융투자회사의 기업실사 모범규준'에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 한국투자증권(주)이며, 발행회사인 (주)지아이이노베이션은 "동사"로 기재였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 증 권 회 사 | |
|---|---|---|
| 회 사 명 | 고 유 번 호 | |
| 대표주관회사 | 한국투자증권(주) | 00160144 |
2. 분석의 개요
대표주관회사인 한국투자증권(주)(이하 "대표주관회사"라 합니다.)는『자본시장과 금융투자업에 관한 법률』제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 2012년 02월 01일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
다만, '모범규준' 제3조 제②항에 따라 발행회사의 재무 및 영업현황, 사업 환경, 투자위험, 인수 형태, 신용평가등급 등을 감안하여 강화하거나, 완화할 수 있으며, 동조 제⑤항에 따르면 금융투자회사의 이사회나 리스크관리위원회의 의사결정을 거쳐 '모범규준'의 내용(실사수준)을 생략하거나 강화 또는 완화 적용할 수 있도록 허용하였는 바, 주관회사는 지분증권의 인수 또는 모집·매출의 주선업무를 수행함에 있어서 지분증권의 특성 및 발행회사의 일정요건 충족여부 등에 따라 기업실사 수준을 완화하여 적용할 수 있도록 규정하고 있습니다.
본 지분증권은 대표주관회사인 한국투자증권(주)의 내부 규정상 기업실사 기준을 적용하여 기업실사 업무를 수행하였습니다.
본 장에 기재된 분석의견은 대표주관회사인 한국투자증권(주)가 기업실사과정을 통해 발행회사인 (주)지아이이노베이션으로부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 주주배정후 실권주 일반공모 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한, 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
3. 기업실사 일정 및 주요 내용
| 일자 | 실사 내용 |
| 2024.11.26 | * 발행회사 초도 방문 - 발행회사의 유상증자 의사 확인 - 자금조달 희망금액 등 발행회사 의견 청취 |
| 2024.11.26 ~ 2024.12.04 |
* 발행회사의 유상증자 방식결정 협의 * 유상증자 일정 협의 및 확정 * 유상증자를 위한 사전 준비사항 및 진행절차 설명 - 발행가 산정 및 세부일정 설명 * 세부 증자관련 논의 - 유상증자 방식 결정 및 대주주 증자 참여 논의 * 유상증자 진행에 대한 질의/응답 * 실사 사전요청자료 송부 |
| 2024.12.04 ~ 2024.12.13 |
* 증자리스크 검토 - 발행시장 상황, 자금조달규모 적정성, 공모가액 희망 할인율 * 발행사와의 협의 - 발행가액 산정방식, 발행일정, 발행규모, 인수수수료 협의 * 기업실사 진행 및 추가자료 요청 - 기업실사 관련 자료요청 및 절차에 대한 설명 - 기업실사 관련 Q&A * 이사회 등 상법 절차 및 정관 등 검토 * 투자위험요소 실사 1) 사업위험관련 실사 - 기존사업 및 신규사업에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 3) 기타위험관련 실사 - 주가 희석화관련 위험 등 체크 * 담당자 인터뷰 - 회사개요, 사업의 내용, 주요 재무적 이슈 확인 - 자금사용 계획 파악 - 향후 사업추진계획 및 발행회사의 비전 검토 - 연구개발 현황 및 임상계획 확인 |
| 2024.12.13 ~ 2025.03.17 |
* 증권신고서 작성 및 조언 * 이사회의사록 등 검토 * 인수계약서 체결 * 증권신고서 인수인의 의견 완료 * 첨부서류 등 검토 * 증권신고서 업데이트 |
4. 기업실사 참여자
| [발행회사] |
| 소속기관 | 성명 | 직위 | 실사업무분장 |
| (주)지아이이노베이션 | 고영준 | 부사장 | 연구 관련 기업 실사 자료 제공 및 대응 |
| 윤나리 | 전무 | 연구 관련 기업 실사 자료 제공 및 대응 | |
| 김국환 | 전무 | 연구 관련 기업 실사 자료 제공 및 대응 | |
| 김동휘 | 상무 | 발행 업무 및 기업 실사 총괄 | |
| 이소윤 | 부팀장 | 발행 업무 및 기업 실사 실무 | |
| 이광준 | 부팀장 | 발행 업무 및 기업 실사 실무 |
| [대표주관회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 한국투자증권(주) | IB2본부 | 김성열 | 본부장 | 기업실사 총괄 | 2024년 11월 26일 ~ 2025년 03월 17일 |
기업금융업무 등 28년 |
| 한국투자증권(주) | ECM1부 | 김현서 | 이사 | 기업실사 책임 | 2024년 11월 26일 ~ 2025년 03월 17일 |
기업금융업무 등 22년 |
| 한국투자증권(주) | ECM1부 | 이윤상 | 팀장 | 기업실사 실무 | 2024년 11월 26일 ~ 2025년 03월 17일 |
기업금융업무 등 14년 |
| 한국투자증권(주) | ECM1부 | 함현중 | 대리 | 기업실사 실무 | 2024년 11월 26일 ~ 2025년 03월 17일 |
기업금융업무 등 4년 |
| 한국투자증권(주) | ECM1부 | 구찬웅 | 주임 | 기업실사 실무 | 2024년 11월 26일 ~ 2025년 03월 17일 |
기업금융업무 등 2년 |
5. 기업실사 세부항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합의견
가. 대표주관회사인 한국투자증권(주)는 (주)지아이이노베이션이 2024년 12월 20일 이사회에서 결의한 보통주식 11,644,800주에 대한 주주배정후 실권주 일반공모 증자를 잔액인수함에 있어 (주)지아이이노베이션에 대하여 다음과 같이 평가합니다.
| 긍정적요인 | ▶ 동사는 전임상 ~ 임상 1/2상 중인 물질을 조기 기술이전(License-out)하여 수익성은 높이고 리스크는 줄이는 사업전략을 구사하고 있습니다. 본 공시서류 제출일 전일 현재 3건(관계회사 대상 기술이전 제외)의 기술이전에 성공한 후 계약금을 수취한 경험이 있으며, 임상 진행 단계별 마일스톤 및 제품 시판에 따른 로열티 수익 등을 기대하고 있습니다. 더불어 동사는 다수의 후속 파이프라인을 개발 중으로 향후 추가적인 기술이전 가능성을 제고하고 있습니다. ▶ 현재 고형암 치료를 위해 허가를 받고 시판 중인 치료제로는 여보이®와 임주도®가 있으나 면역매가 폐렴 등과 같은 약물이상반응의 부작용을 보유하고 있습니다. 반면, 동사의 GI-101과 GI-102는 진행 중인 임상 결과 여보이®와 임주도®가 보이는 심각한 부작용은 보이지 않아 기존 약물이 지니는 미충족 의료 수요를 해결할 치료제가 될 것으로 예상됩니다. 또한, GI-101과 GI-102는 CTLA-4를 타깃하는 CD80 부분 만으로 구성된 것이 아니라 IL-2 변이체를 포함하고 있는 이중융합단백질로서 면역 기능을 수행하는 림프구의 증가를 유도하여 항암 면역반응을 극대화할 수 있는 약력학적인 차별점을 보유하고 있습니다. 이러한 기전적인 차별점은 임상 1/2상 과정에서도 드러나고 있으며, GI-101은 단독요법만으로 면역항암제 불응 환자에서 부분관해 및 표준치료 실패 환자에서 완전관해를, GI-102는 단독요법으로 면역항암제 치료 후 재발한 전이성 흑색종 환자 7 명 중 3명에서 부분관해를 나타내는 고무적인 임상 결과를 보이고 있습니다. ▶ 기존 알레르기 치료제는 높은 IgE 레벨의 환자 및 자가항체를 가진 환자 들에도 효과가 없으며, 아나필락시스 부작용 위험이 있어 의학적 미충족 수요가 명확한 상황입니다. 동사의 GI-301은 기존 치료제와 다른 약물 디자인을 적용하여 아나필락시스 부작용을 제거한 형태로 개발되었습니다. 또한, 동사의 전임상 실험 결과에 따르면, 기존 치료제인 졸레어®는 높은 기저 혈청 IgE 수치를 나타내는 원숭이에 단회 투여 시 혈청 IgE 수치를 유의미하게 제어하지 못하였으나, GI-301은 졸레어® 투여군보다 기저 혈청 IgE 수치(평균 3,343 IU/mL)가 더 높았음에도 불구하고, 단회 투여에 의해서 약 일주일간 효과적으로 혈청 IgE 수치를 제어할 수 있음을 증명하였습니다. 또한 GI-301은 비만세포를 활성화시키는 자가항체와도 결합해 그 작용을 억제하여 만성 특발성 두드러기 증상을 억제할 수 있습니다. 이러한 임상 데이터를 바탕으로 현재 GI-301이 임상 1상 단계임에도 약물의 안정성은 물론 기존 치료제 대비 효능 우위를 증명하는 데에 중점을 두고 있습니다. |
| 부정적요인 | ▶ 신약 개발 사업은 대표적인 고위험, 고부가가치(high risk, high return) 분야이며 임상 성공 가능성은 낮습니다. 동사 또는 파트너사(Licensee)가 임상에 실패할 경우, 기술이전 계약이 중도 해지될 리스크가 존재하며 이에 따라 향후 동사의 재무 안전성이 부정적 영향을 받을 수 있습니다. 특히 기술이전 완료 이후에는 동사가 아닌 파트너사의 역량과 제반 상황에 따라 임상이 지연되거나 실패할 가능성이 존재합니다. ▶ 동사는 기존 면역항암제 및 알레르기 치료제의 미충족 의료 수요를 개선하는 치료제를 개발 중이나, 유사 질환을 대상으로 하는 경쟁 치료제 또한 연구개발이 활발히 진행되고 있습니다. 만약 현재의 의학적 미충족 수요가 변화하거나, 유사 기전의 경쟁제품 연구개발 속도가 증가할 경우 당사 파이프라인의 경쟁력이 약화될 수 있습니다. 이경우 신약 개발의 성공 및 수익의 창출 가능성이 예상보다 낮아질 가능성이 있습니다. ▶ 동사는 기술이전 계약에 따라 최근 3개년간 및 2024년 3분기까지 매출이 지속적으로 발생하고 있으나, 신약 개발을 위한 연구개발에 따라 연구개발비 및 인건비 지출로 지속적인 영업손실을 기록하는 모습을 보이고 있습니다. 동사는 후보물질 발굴, 임상진행 등 향후에도 지속적인 연구개발에 따라 영업비용이 증가할 가능성이 높은 가운데, 이미 기술이전을 완료한 파이프라인의 마일스톤 수익 발생 지연 및 추가 기술이전계약 체결 지연 등으로 영업수익이 감소할 경우 동사 수익성 및 재무안정성에 부정적으로 작용할 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 운영으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 (주)지아이이노베이션이 제출한 자료와 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 실사를 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수 변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 대표주관회사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2025년 03월 17일 |
| 대표주관회사 : 한국투자증권 주식회사 |
| 대표이사 김 성 환 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
| (단위: 원) |
| 구 분 | 금 액 |
|---|---|
| 모집 또는 매출총액(1) | 111,207,840,000 |
| 발행제비용(2) | 1,790,000,000 |
| 순 수 입 금 [ (1)-(2) ] | 109,417,840,000 |
| 주1) | 상기 금액은 확정 발행가액을 기준으로 산정한 금액입니다. |
| 주2) | 상기 모집총액은 하단에 기재된 유상증자 자금사용의 우선순위에 따라 사용할 예정입니다. |
| 주3) | 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. |
나. 발행제비용의 내역
| (단위 : 원) |
| 구분 | 금액 | 지급일자 | 비고 |
|---|---|---|---|
| 발행분담금 | 20,017,410 | 신고서제출일 | 모집총액의 0.018% (10원 미만 절사) |
| 인수수수료 | 1,668,117,600 | 납입일로부터 3영업일 이내 |
기본수수료: 최종 모집금액의 1.5% 실권수수료: 15.0%(실권수수료 미포함) |
| 표준코드발급수수료 | 10,000 | 표준코드발급 신청일 | 신주인수권증서(R) 건당 10,000원 |
| 보통주 추가상장수수료 |
13,150,000 | 신주상장일 | 910만원+1,000억원 초과금액의 10억원당 5만원(코스닥시장상장규정 시행세칙 별표 14) |
| 주식발행등록수수료 (신주인수권 및 주권) |
1,000,000 | - | 1,000주당 300원 (주식 및 신주인수권증서 각각 별도 징수, 수수료 건당 상한 50만원 및 하한 4천원)(주식·사채 등의 전자등록업무규정 시행세칙 별표) |
| 등록면허세 | 23,289,600 | 등기일 | 증자 자본금의 0.40% (지방세법 제28조, 10원 미만 절사) |
| 지방교육세 | 4,657,920 | 등기일 | 등록면허세의 20%(지방세법 제151조, 10원 미만 절사) |
| 기타비용 | 59,757,470 | - | 투자설명서, 통지서 인쇄 및 발송비 등 |
| 합계 | 1,790,000,000 | - | - |
| 주1) 상기 금액은 확정 발행가액 및 기산일 종가를 기준으로 산정한 금액입니다. 주2) 금번 유상증자 결과 대표주관회사가 최종 실권주를 인수할 경우 당사는 실권주 인수금액의 15.0%를 추가수수료 지급하게됩니다. 주3) 실제 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가기준으로 산정되며, 유관기관 정책 등에 따라 변동될 수 있습니다. 주4) 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사가 금번 보통주 유상증자를 통해 조달 예정인 자금 111,207,840,000원은 운영자금(GI-101, GI-102, GI-108 임상, 신규도입과제, 연구개발 인건비 등 연구개발자금, 사무인력 인건비 등 필수 운영자금)으로 사용할 계획입니다.
| [자금의 사용목적] |
| (기준일 : | 2025년 02월 10일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 111,208 | - | - | - | 111,208 |
나. 자금의 세부 사용 내역
당사는 금번 주주배정 후 실권주 일반공모 유상증자를 통한 납입자금에 대해서 아래와 같은 우선순위로 사용할 예정입니다.
| [자금사용 우선순위] |
| (단위: 백만원) |
| 구 분 | 목 적 | 자금 사용 시기 | 사용내역 | 금 액 | 우선순위 |
|---|---|---|---|---|---|
| 운영자금 | R&D 연구개발자금 | 2025년 2분기 ~ 2027년 4분기 |
GI-101/GI-102/GI-108 임상시험 비용 | 29,913 | 1순위 |
| 2025년 2분기 ~ 2027년 4분기 |
신규후보물질 개발을 위한 비임상 연구 관련 비용 및 연구개발인력 인건비를 포함한 연구개발자금 |
60,845 | 2순위 | ||
| 인건비 및 일반 관리 |
2025년 2분기 ~ 2027년 4분기 |
사무인력 인건비, 관리비 등 필수 운영자금 | 20,450 | 3순위 | |
| 총 계 | 111,208 | - | |||
| 출처: 당사 제시 |
본 공시서류 '제1부 모집 또는 매출에 관한 사항 - III. 투자위험요소 - 2. 회사위험 - 라. 영업현금흐름 및 유동성 관련 위험'에 기재된 자금수지계획의 영업현금흐름 지출 항목 중 GI-101, GI-102, GI-108, 신규도입과제, 연구개발인건비, 기타판매관리비와 투자현금흐름 지출 항목의 무형자산 취득 지출은 전액 금번 유상증자의 공모자금을 활용하여 지출할 예정입니다. 본 유상증자의 진행과정에서 주가 하락에 따라 발행금액이 감소할 경우, 기타판매관리비 부분의 지출 항목을 보유 현금 또는 기술이전수익을 통해 충당할 예정이며, 해당 내용은 1차 발행가액과 확정 발행가액이 결정된 후 이를 반영한 발행조건확정 증권신고서의 공시 시 반영할 예정입니다.
(1) 운영자금 - R&D 연구개발자금
당사는 금번 유상증자를 통하여 모집되는 자금 중 일부를 GI-101, GI-102, GI-108 파이프라인 임상개발 등에 29,913백만원, 신규도입과제 및 기타 연구개발자금으로 60,845백만원을 사용할 예정입니다.
1) GI-101/102
GI-101은 CD80(CTLA-4를 타깃)과 IL-2 변이체(IL-2 수용체를 타깃)를 포함하는 이중융합단백질 면역항암제로서 현재 한국 및 미국에서 임상 1/2상을 진행 중에 있습니다. 2020년 7월 미국 MSD사와 면역항암제 병용요법 임상을 위한 협약을 체결하고, 전세계 매출 1위인 키트루다® 제조사 MSD로부터 약 200명의 환자에 대한 키트루다®를 무상으로 지원받는 공동 임상을 진행 중에 있습니다. GI-101은 면역관문억제제 이외에도 화학항암제, 표적치료제 및 방사선 치료와의 병용요법과 같은 다양한 병용요법으로 사용성 확장이 가능하여 다른 글로벌 제약사들과도 경쟁구도보다 협력관계로서 상생할 수 있는 가능성을 가지고 있기 때문에 기술이전의 가능성 또한 높을 것으로 예상하고 있습니다. 현재 GI-101 단일요법 용량/증량 확장을 위한 환자 등록은 완료되어 환자에게 투약 진행 중이며, 병용요법 용량/증량 확장을 위한 환자는 등록은 2024년 4분기 내에 완료될 예정입니다. 환자 등록이 완료된 이후 모집 환자에게 3주 간격으로 투약을 진행할 예정이며 이 과정에서 발생하는 개발 계획에 따른 임상시료생산 비용은 2026년 2분기까지, CRO 비용 등 직접 임상시험에 소요되는 비용은 2026년 4분기까지 발생할 것으로 예측됩니다.
GI-102는 종양미세환경에서 조절 T 세포를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진하는 면역항암제로서 현재 한국 및 미국에서 임상 1/2상을 진행 중에 있습니다. 또한, GI-101과 마찬가지로 MSD로부터 키트루다®를 무상으로 지원받아 임상을 진행 중에 있습니다. 현재 한국 및 미국 임상 1상의 경우 정맥 투여 제형 용량 증량 단계는 환자 등록을 완료하였고, 정맥 투여 제형 용량 확장 단계(한국, 미국 임상 2a상)/피하 투여 제형 용량 증량 및 확장(한국, 미국 임상 1b, 2a상)/ADC 및 화학항암제, 면역항암제 병용투여(한국, 미국 임상 2상) 단계의 환자 등록은 2025년 2분기 내에 완료될 예정입니다. 환자 등록이 완료된 이후 모집 환자에게 3주 간격으로 투약을 진행할 예정이며 이 과정에서 발생하는 개발 계획에 따른 임상시료생산 비용은 2027년 4분기까지, CRO 비용 등 직접 임상시험에 소요되는 비용은 2027년 4분기까지 발생할 것으로 예측됩니다.
현재 당사가 계획중인 GI-101 및 GI-102의 한국 및 미국 임상 1/2상 진행 및 임상시료생산을 위해 2025년 11,747백만원, 2026년 10,420백만원, 2027년 4,573백만원의 비용이 필요할 것으로 예상됩니다.
| [GI-101/102 연구개발비용 지출 관련 상세 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | |||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | ||||
| GI-101 | 고형암면역항암제 | 임상1/2상 비용 | 1,380 | 1,285 | 1,157 | 3,822 | 630 | 431 | 631 | 636 | 2,328 | - | - | - | - | - | 6,150 |
| 임상시료생산 등 | 103 | 71 | 92 | 266 | 10 | 10 | - | - | 20 | - | - | - | - | - | 286 | ||
| GI-102 | 임상1/2상 비용 | 1,962 | 2,172 | 3,221 | 7,355 | 2,621 | 2,581 | 1,441 | 1,391 | 8,034 | 797 | 797 | 716 | 817 | 3,208 | 18,597 | |
| 임상시료생산 등 | 120 | 78 | 106 | 304 | - | 20 | - | 18 | 38 | 78 | 78 | 1,130 | 79 | 1,365 | 1,707 | ||
| 합계 | 3,565 | 3,606 | 4,576 | 11,747 | 3,261 | 3,042 | 2,072 | 2,045 | 10,420 | 875 | 875 | 1,846 | 896 | 4,573 | 26,740 | ||
2) GI-108
GI-108은 대사면역에 관여하는 CD73를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진하는 대사면역항암제로, 전임상 시험 단계를 마치고 2024년 12월 11일 국내 식약처 IND 승인을 획득하여 국내 임상 1/2a상의 시작을 앞두고 있습니다. 2025년 3분기까지 단일 요법 용량 증량 및 확장 단계를 위한 환자 등록을 마무리할 예정입니다. 환자 등록이 완료된 이후 본격적인 임상 1/2a상을 진행하는 과정에서 발생하는 개발 계획에 따른 임상시료생산 비용은 2027년 4분기까지, CRO 비용 등 직접 임상시험에 소요되는 비용은 2027년 4분기까지 발생할 것으로 예측됩니다.
현재 당사가 계획중인 GI-108의 한국 임상 1/2a상 진행 및 임상시료생산을 위해 2025년 702백만원, 2026년 646백만원, 2027년 1,825백만원의 비용이 필요할 것으로 예상됩니다.
| [GI-108 연구개발비용 지출 관련 상세 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | |||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | ||||
| GI-108 | 고형암면역항암제 | 임상 1/2a상 비용 | 205 | 158 | 158 | 521 | 158 | 158 | 158 | 158 | 632 | 158 | 158 | 158 | 168 | 642 | 1,795 |
| 임상시료생산 등 | 73 | 52 | 56 | 181 | 10 | - | - | 4 | 14 | 33 | 33 | 33 | 1,084 | 1,183 | 1,378 | ||
| 합계 | 278 | 210 | 214 | 702 | 168 | 158 | 158 | 162 | 646 | 191 | 191 | 191 | 1,252 | 1,825 | 3,173 | ||
3) 임상개발 외 연구개발자금
당사는 글로벌 기업들의 수요에 맞는 과제를 선정하고 전임상 개발 및 임상 개발을 통해 과제 가치를 제고하고, 글로벌 네트워크를 갖춘 사업개발 역량으로 기술 수출의 매출을 달성한 성공이력을 가지고 있습니다. 현재 당사가 개발 추진 중인 GI-10N, GI-20N 및 GI-30N 과제 역시 글로벌 수요에 맞는 과제를 탐색 및 선정하여 도입한 것으로, 진행 중인 임상개발의 성과에 따라 기술 수출이 진행되면, 지속적인 파이프라인의 확보를 위해서 후속과제의 도입을 병행하여 추진해야 합니다.
2025년 2분기부터 2027년 4분기까지 총 3개의 과제의 도입 혹은 전임상 진행을 목표로하고 있으며, 확보한 과제들의 비임상 개발 및 임상시험의약품 생산에 약 40,951백만원이 소요될 것으로 예상하여 비용을 확보하려 합니다.
또한, 연구개발인력의 인건비, 무형자산 취득비용 등으로 2025년 5,334백만원, 2026년 7,141백만원, 2027년 7,419백만원을 지출할 예정입니다.
| [임상개발 외 연구개발자금 관련 사용 계획] |
| (단위 : 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | |||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | ||||
| 연구개발자금 | 신규도입과제 | 비임상연구 | 20 | 562 | 700 | 1,282 | 617 | 1,001 | 2,522 | 3,422 | 7,562 | 8,927 | 3,859 | 2,490 | 4,641 | 19,917 | 28,761 |
| 연구용 소모품비 및 기타 주1) |
1,352 | 1,136 | 1,115 | 3,603 | 968 | 1,048 | 1,021 | 1,221 | 4,258 | 981 | 1,061 | 1,034 | 1,253 | 4,329 | 12,190 | ||
| 소계 | 1,372 | 1,698 | 1,815 | 4,885 | 1,585 | 2,049 | 3,543 | 4,643 | 11,820 | 9,908 | 4,920 | 3,524 | 5,894 | 24,246 | 40,951 | ||
| 연구개발 | 인건비 | 1,508 | 1,509 | 2,149 | 5,166 | 1,544 | 1,547 | 1,549 | 2,219 | 6,859 | 1,595 | 1,598 | 1,600 | 2,339 | 7,132 | 19,157 | |
| 무형자산 취득비용(특허 등) |
44 | 114 | 10 | 168 | 91 | 97 | 47 | 47 | 282 | 92 | 98 | 48 | 49 | 287 | 737 | ||
| 소계 | 1,552 | 1,623 | 2,159 | 5,334 | 1,635 | 1,644 | 1,596 | 2,266 | 7,141 | 1,687 | 1,696 | 1,648 | 2,388 | 7,419 | 19,984 | ||
| 합계 | 2,924 | 3,321 | 3,974 | 10,219 | 3,220 | 3,693 | 5,139 | 6,909 | 18,961 | 11,593 | 6,616 | 5,172 | 8,282 | 31,665 | 60,845 | ||
| 주1) 신규도입과제 기타비용은 연구용 시약 등으로 구성되어 있습니다. |
(2) 운영자금 - 인건비 및 관리비
당사는 사무인력 인건비 및 기타 관리비 등 필수운영자금에 2025년 5,523백만원, 2026년 7,347백만원, 2027년 7,580백만원 지출할 예정입니다. 기타 관리비에는 사무실 및 연구소 임차료, 위탁수수료, 사무용품 및 소모품 등이 포함되어 있습니다.
| [필수운영자금 사용 계획] |
| (단위: 백만원) |
| 세부 내용 | 연도별 사용 계획 | 합계 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2025년 | 2026년 | 2027년 | ||||||||||||||
| 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | 1Q | 2Q | 3Q | 4Q | 소계 | |||
| 운영자금 | 사무인력 인건비 및 기타 관리비 | 1,616 | 1,643 | 2,264 | 5,523 | 1,740 | 1,624 | 1,663 | 2,320 | 7,347 | 1,775 | 1,672 | 1,708 | 2,425 | 7,580 | 20,450 |
다. 자금의 운용 계획
당사가 금번 유상증자를 통해 조달한 자금 중 일부 자금은 조달시기와 사용시기가 다소 차이가 있을 수 있습니다. 이에 조달로부터 사용시까지 미사용 자금에 대해서는 자금 사용시점 및 금리에 따라 적격금융기관의 수시입출금 예금, 정기예금 등 금융상품 또는 AA등급대(A1등급대) 이상의 단기금융상품으로 운용할 예정입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
1. 시장조성에 관한 사항
당사는 증권신고서 제출일 현재 해당사항이 없습니다.
2. 안정조작에 관한 사항
당사는 증권신고서 제출일 현재 해당사항이 없습니다.
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 개황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
(1) 연결대상회사
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | - | - | - | - | - |
| 합계 | - | - | - | - | - |
※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조
(2) 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
나. 회사의 법적ㆍ상업적 명칭
당사의 명칭은 '주식회사 지아이이노베이션'이며 영문으로는 'GI Innovation Inc.' 라고 표기합니다. 단, 약식으로 표기할 경우에는 (주)지아이이노베이션으로 표기합니다.
다. 설립일자
당사는 2017년 07월 19일에 설립되었으며 2023년 03월 30일 코스닥시장에 기업공개를 실시하였습니다. 당사는 융합단백질을 이용한 의약품 연구개발 및 개발한 신기술의 사용권대여 및 양도업 등을 주요사업으로 영위하고 있습니다.
라. 본사의 주소, 전화번호, 홈페이지 주소
| 구분 | 내용 |
|---|---|
| 주소 | 서울특별시 송파구 송파대로 167, 에이동 1116호(문정동, 문정역테라타워) |
| 전화번호 | 02-404-2003 |
| 홈페이지 | http://www.gi-innovation.com |
마. 중소기업 등 해당 여부
중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
※ 당사는 보고서 작성기준일 현재 「중소기업기본법」제2조에 의한 중소기업에 해당됩니다.
 |
|
중소기업확인서 |
※ 당사는 보고서 작성기준일 현재「벤처기업육성에관한특별조치법」제25조에 따라 벤처기업에 해당됩니다.
 |
|
벤처기업확인서 |
바. 주요 사업의 내용 및 향후 추진하려는 신규사업
당사는 융합단백질을 이용한 신약 후보물질을 개발하는 연구개발 전문기업으로 신약후보물질을 비임상이나 초기 임상단계에서 기술이전(License-Out, L/O)하는 사업을영위하고 있습니다. 따라서 완제품(시판 시약)을 생산하고 있지 않으며, 보고서 작성대상기간 중 발생한 당사의 매출은 대부분 신약 후보물질 기술이전에서 발생하였습니다. 기타 상세한 내용은 'Ⅱ.사업의 내용'을 참조하시기 바랍니다.
사. 신용평가에 관한 사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
아. 회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 코스닥시장 상장 | 2023년 03월 30일 | 기술성장기업의 코스닥시장 상장 |
2. 회사의 연혁
가. 회사의 본점 소재지 및 그 변경
당사의 본점 소재지는 서울특별시 송파구 송파대로 167, 에이동 1116호(문정동)이며,최근 5사업연도 중 본점 소재지의 변경은 없습니다.
나. 경영진 및 감사의 중요한 변동
보고서 작성기준일 현재 당사의 이사회는 사내이사 3인(이병건, 홍준호, 장명호)과 사외이사 4인(김병철, 안근용, 김현철, 류양지) 총 7인의 이사로 구성되어 있으며,
보고서 작성기준일 이후부터 보고서 제출일 현재까지 변동사항은 없습니다.
최근 5사업연도의 경영진 및 감사의 중요한 변동내역은 다음과 같습니다.
| (기준일 : 본 공시서류 제출일 전일 현재) |
| 변동일자 | 주주총회종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2020년 04월 16일 | - | 대표이사 장명호 | - | - |
| 2020년 05월 07일 | 임시 | 사외이사 이은직 사외이사 류종우 |
- | - |
| 2020년 10월 05일 | 임시 | 사외이사 김병철 | - | 사외이사 류종우 |
| 2021년 03월 26일 | 정기 | 사외이사 정호연 | 대표이사 장명호 | 감사 박상훈 |
| 2021년 06월 16일 | 임시 | 대표이사 홍준호 | - | 대표이사 장명호 |
| 2021년 07월 15일 | - | - | - | 대표이사 남수연 |
| 2022년 03월 03일 | 임시 | 대표이사 이병건 사내이사 남수연 사외이사 김현철 사외이사 유규창 사외이사 안근용 |
- | 사내이사 조영규 사내이사 오영민 사내이사 김진만 사외이사 정호연 사외이사 이은직 |
| 2022년 09월 01일 | 임시 | 사외이사 류양지 | - | - |
| 2023년 03월 31일 | 정기 | - | 사외이사 김병철 사외이사 안근용 |
사외이사 김병철 사외이사 안근용 |
| 2024년 03월 29일 | 정기 | - | 사내이사 장명호 대표이사 홍준호 사외이사 안근용 사외이사 김현철 사외이사 류양지 |
사내이사 장명호 대표이사 홍준호 사외이사 안근용 사외이사 김현철 사외이사 류양지 사외이사 유규창 |
| 2024년 03월 31일 | - | - | - | 사내이사 남수연 |
※ 변동일자는 법인등기부등본의 변동일자를 기재하였습니다.
※ 2024년 03월 13일 이사회 결의에 따라 공동대표이사(이병건, 홍준호)에서 각자대표이사(이병건, 홍준호)로 변경되었습니다.
※ 2024년 등기이사 변동내역
| 구분 | 성명 | 비고 |
|---|---|---|
| 사내이사 | 장명호 | 중임 |
| 홍준호 | 임기조정을 위한 중도퇴임 후 재선임 | |
| 남수연 | 자진사임 | |
| 사외이사 | 안근용 | 중임 |
| 김현철 | 중임 | |
| 류양지 | 임기조정을 위한 중도퇴임 후 재선임 | |
| 유규창 | 임기만료에 따른 사임 |
다. 최대주주의 변동
당사의 최대주주는 장명호이며, 최근 3사업연도 중 최대주주의 변동사항은 없습니다.
라. 상호의 변경
당사의 상호는 '주식회사 지아이이노베이션'이며, 최근 3사업연도 중 상호의 변경은 없습니다.
마. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행중인 경우 그 내용과 결과
당사는 보고서 작성기준일 현재 해당사항 없습니다.
바. 회사가 합병 등을 한 경우 그 내용
당사는 보고서 작성기준일 현재 해당사항 없습니다.
사. 회사의 업종 또는 주된 사업의 변화
당사는 보고서 작성기준일 현재 해당사항 없습니다.
아. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
| 변동일자 | 내용 |
|---|---|
|
2020년 03월 |
309억원 시리즈C 투자 유치 |
|
2020년 06월 |
(주)와이바이오로직스와 면역항암제 후보물질 이전 계약 체결 |
|
2020년 07월 |
유한양행 1.4조원 규모 알레르기 치료제 GI-301 기술 이전(일본 제외 전세계 지역) |
|
2020년 07월 |
글로벌 제약사 MSD와 면역항암제 GI-101 키트루다 공동임상 협약 |
|
2020년 10월 |
GI-101 과학기술정보통신부 '2020 국가연구개발 우수성과 100선' 선정 |
|
2021년 04월 |
GI-101 한국 임상 1/2상 IND 승인 |
|
2021년 04월 |
ISO27001 인증 |
|
2021년 06월 |
448억원 SI 투자자, 1,155억원 FI 투자자 Pre-IPO 투자 유치 |
|
2021년 06월 |
GI-101 미국FDA 임상 1/2상 IND 승인 |
|
2021년 07월 |
GI-301 한국 임상 1상 IND 승인 |
|
2021년 11월 |
독일 머크와 바이오 신약 개발 위한 MOU 체결 |
|
2021년 12월 |
아스트라제네카와 면역항암제 GI-101 임핀지® 병용 연구를 위한 임상 협력 체결 |
|
2021년 12월 |
지식재산 경영인증 |
|
2022년 01월 |
대한민국 우수특허 대상 |
| 2022년 05월 | 국가신약개발사업단 최대70억원 규모 신약임상개발과제 선정 |
| 2022년 06월 | GI-101 美 물질 특허 등록 |
| 2022년 08월 | GI-301 물질특허 日 등록 |
| 2022년 09월 | 국가신약개발사업단 최대20억원 규모 비임상 지원과제 선정 |
| 2022년 10월 | GI-101의 메르켈 세포암, 美FDA 희귀의약품 지정 |
| 2023년 01월 | GI-102 미국 FDA 임상 1/2a IND 승인 |
|
2023년 01월 |
혁신형 제약기업 선정 |
| 2023년 02월 | GI-102 한국 식약처 임상 1/2a상 IND 승인 |
| 2023년 03월 | 코스닥 상장 |
| 2023년 05월 | GI-101 미국 FDA 임상 1/2상 IND 변경승인 |
| 2023년 06월 | GI-101 한국 식약처 임상 1/2상 IND 변경승인 |
| 2023년 10월 | GI-301, 일본 마루호 약 221백만달러 규모 기술이전 |
| 2023년 11월 | GI-101, GI-102 블록버스터 항암제들과 병용요법 美 특허 등록 |
| 2023년 11월 | 혁신형 제약기업 보건복지부장관 수상 |
| 2024년 02월 | GI-301 제25회 대한민국신약개발상(KNDA)의 기술수출상 수상 |
| 2024년 03월 | GI-101A 및 GI-102 유럽 물질특허 등록 |
| 2024년 05월 | GI-102 미국 FDA 임상 1/2상 IND 변경승인 |
| 2024년 06월 | GI-102의 진행성 및 전이성 육종, 美 FDA 희귀의약품 지정 |
| 2024년 07월 | GI-101A 및 GI-102 중국 물질특허 등록 |
| 2024년 08월 | 글로벌 제약사 MSD와 GI-102, 키트루다 병용임상 협력 위한 공급 계약 체결 |
3. 자본금 변동사항
가. 자본금 변동추이
최근 5사업연도의 자본금 변동추이는 다음과 같습니다.
| (단위 : 원, 주) |
| 종류 | 구분 | 제08기 (2024년 3분기) |
제07기 (2023년 말) |
제06기 (2022년 말) |
제05기 (2021년 말) |
제04기 (2020년 말) |
|---|---|---|---|---|---|---|
| 보통주 (주1) |
발행주식총수 | 44,217,811 | 22,070,300 | 20,004,200 | 19,972,833 | 7,936,622 |
| 액면금액 | 500 | 500 | 500 | 500 | 500 | |
| 자본금 | 22,110,405,500 | 11,035,150,000 | 10,002,100,000 | 9,986,416,500 | 3,968,311,000 | |
| 우선주 (주2) |
발행주식총수 | 858,371 | - | - | - | 7,253,291 |
| 액면금액 | 500 | - | - | - | 500 | |
| 자본금 | 429,185,500 | - | - | - | - | |
| 기타 | 발행주식총수 | - | - | - | - | - |
| 액면금액 | - | - | - | - | - | |
| 자본금 | - | - | - | - | - | |
| 합계 | 자본금 | 22,539,591,000 | 11,035,150,000 | 10,002,100,000 | 9,986,416,500 | 3,968,311,000 |
(주1) 소유주식 1주당 신주 1주의 비율로 배정하는 무상증자를 실시하였습니다.
(주2) 우선주 종류는 전환우선주입니다.
4. 주식의 총수 등
가. 주식의 총수 현황
본 공시서류 제출일 전일 현재 당사가 발행한 기명식 보통주식(이하 "보통주")는 44,304,799 주이며, 기명식 전환우선주식(이하 "우선주")는 858,371 주입니다.
| (기준일 : | 본 공시서류 제출일 전일 현재 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | - | - | 100,000,000 | (주1) | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 44,307,799 | 9,203,257 | 53,511,056 | (주2) | |
| Ⅲ. 현재까지 감소한 주식의 총수 | 3,000 | 8,344,886 | 8,347,886 | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | 3,000 | 8,344,886 | 8,347,886 | (주3), (주4) | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 44,304,799 | 858,371 | 45,163,170 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 44,304,799 | 858,371 | 45,163,170 | - | |
(주1) 정관에 따라 회사가 발행할 주식의 총수는 100,000,000 주이며, 발행할 종류주식의 수는 발행주식총수의 100분의 50 범위 내로 하고 있습니다.
(주2) 소유주식 1주당 신주 1주의 비율로 배정하는 무상증자를 실시하였습니다.
(주3) 보고서 작성기준일 현재까지 발행된 우선주 중 8,344,886주는 보통주로 전환되었습니다.
(주4) 2024년 04월 03일 이사회에서 상법 제343조 제1항 단서조항 및 당사 정관 제15조 규정에 근거하여 최대주주의 특수관계인으로부터 무상증여 방식으로 취득한 자기주식 소각을 결의하여 2024년 04월 09일자로 소각하였습니다.
나. 자기주식 취득 및 처분 현황
| (기준일 : | 본 공시서류 제출일 전일 현재 | ) | (단위 : 주) |
| 취득방법 | 주식의 종류 | 기초수량 | 변동 수량 | 기말수량 | 비고 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 취득(+) | 처분(-) | 소각(-) | |||||||
| 배당 가능 이익 범위 이내 취득 |
직접 취득 |
장내 직접 취득 |
- | - | - | - | - | - | |
| - | - | - | - | - | - | ||||
| 장외 직접 취득 |
- | - | - | - | - | - | |||
| - | - | - | - | - | - | ||||
| 공개매수 | - | - | - | - | - | - | |||
| - | - | - | - | - | - | ||||
| 소계(a) | - | - | - | - | - | - | |||
| - | - | - | - | - | - | ||||
| 신탁 계약에 의한 취득 |
수탁자 보유물량 | - | - | - | - | - | - | ||
| - | - | - | - | - | - | ||||
| 현물보유물량 | - | - | - | - | - | - | |||
| - | - | - | - | - | - | ||||
| 소계(b) | - | - | - | - | - | - | |||
| - | - | - | - | - | - | ||||
| 기타 취득(c) | 보통주 | 3,000 | - | - | 3,000 | - | (주1) | ||
| - | - | - | - | - | - | ||||
| 총 계(a+b+c) | 보통주 | 3,000 | - | - | 3,000 | - | |||
| - | - | - | - | - | - | ||||
(주1) 2024년 04월 03일 이사회에서 상법 제343조 제1항 단서조항 및 당사 정관 제15조 규정에 근거하여 최대주주의 특수관계인으로부터 무상증여 방식으로 취득한 자기주식 소각을 결의하였고, 해당 자기주식은 2024년 04월 09일자로 소각되었습니다.
다. 자기주식 직접 취득ㆍ처분 이행현황
| (기준일 : | 본 공시서류 제출일 전일 현재 | ) | (단위 : 주, %) |
| 구 분 | 취득(처분)예상기간 | 예정수량 (A) |
이행수량 (B) |
이행률 (B/A) |
결과 보고일 |
|
|---|---|---|---|---|---|---|
| 시작일 | 종료일 | |||||
| 직접 취득(주1) | 2022년 04월 06일 | 2022년 04월 06일 | 3,000 | 3,000 | 100 | - |
(주1) 해당 자기주식은 당사 직원(최대주주 및 특수관계인)에게 2018년 10월 부여되어 2020년 10월에 행사 완료된 주식매수선택권입니다. 당사의 코스닥시장 상장 과정에서 해당 주주는 주주효익제고 목적으로 보유주식을 무상으로 회사 측에 증여하였으며, 이에 따라 당사는 반대급부 없는 방식으로 해당 주식을 취득하였습니다.
(주2) 취득 시점 기준 비상장법인으로 결과보고 대상이 아닙니다.
※ 2024년 04월 03일 이사회에서 상법 제343조 제1항 단서조항 및 당사 정관 제15조 규정에 근거하여 최대주주의 특수관계인으로부터 무상증여 방식으로 취득한 자기주식 소각을 결의하였고, 해당 자기주식은 2024년 04월 09일자로 소각되었습니다.
라. 종류주식(전환우선주) 발행현황
보고서 작성기준일 현재 당사가 보유하고 있는 종류주식의 상세내역은 다음과 같습니다.
| (단위 : 원) |
| 발행일자 | 2024년 08월 08일 | |||
| 주당 발행가액(액면가액) | 11,650 | 500 | ||
| 발행총액(발행주식수) | 10,000,022,150 | 858,371 | ||
| 현재 잔액(현재 주식수) | 10,000,022,150 | 858,371 | ||
| 주식의 내용 |
존속기간(우선주권리의 유효기간) | 2029년 08월 08일 | ||
| 이익배당에 관한 사항 |
1. 본건 우선주는 비참가적, 비누적적 우선주로서 액면가액 기준 매년 최저 연 1.0%의 현금배당을 발행회사가 발행하는 모든 보통주에 우선하여 배당하고, 보통주의 배당률이 본건 우선주의 배당률을 초과할 경우에는 초과하는 부분에 대하여 보통주식과 동일한 배당률로 참가하여 배당되지 아니한다. 2. 본건 우선주는 비누적적 우선주로 인수인은 본건 우선주를 보유하는 동안 어느 해에 우선적 배당을 받지 못한 경우 그 배당 받지 못한 부분을 다음 사업연도의 배당 시에 부족 우선배당액이 누적되어 배당되지 아니한다. 3. 발행회사가 현금배당 대신 주식배당을 실시하는 경우에도 본조 제1항 내지 제2항과 같은 방법으로 배당하고, 보통주식에 배정하는 주식과 동일한 주식으로 주식배당을 한다. 4. 배당결의가 있기 전에 본건 우선주를 보통주로 전환청구한 경우에는, 인수인은 발행회사에 미지급배당금의 지급청구를 할 수 없다. |
|||
| 잔여재산분배에 관한 사항 | - | |||
| 상환에 관한 사항 |
상환권자 | 없음 | ||
| 상환조건 | - | |||
| 상환방법 | - | |||
| 상환기간 | - | |||
| 주당 상환가액 | - | |||
| 1년 이내 상환 예정인 경우 |
- | |||
| 전환에 관한 사항 |
전환권자 | 주주 | ||
| 전환조건 (전환비율 변동여부 포함) |
- 전환가격 : 1주당 발행가액 기준 - 전환비율 : 우선주 1주당 보통주 1주 (단, 전환비율은 조정사유 발생시 조정) |
|||
| 발행이후 전환권 행사내역 |
N | |||
| 전환청구기간 | 2025년 08월 08일 ~ 2029년 08월 07일 | |||
| 전환으로 발행할 주식의 종류 |
(주)지아이이노베이션의 기명식 보통주 | |||
| 전환으로 발행할 주식수 |
858,371 | |||
| 의결권에 관한 사항 | 무의결권부 (다만 발행회사가 본 계약서 제4조 1항에 따른 우선배당을 하지 아니한다는 결의를 하는 경우에는 그 결의가 있는 총회의 다음총회부터 그 우선적 배당을 한다는 결의가 있는 총회의 종료 시까지 본건 우선주 일(1)주당 보통주와 동일하게 일(1)개의 의결권이 있는 것으로 본다.) | |||
| 기타 투자 판단에 참고할 사항 (주주간 약정 및 재무약정 사항 등) |
(주1) | |||
(주1) 자세한 사항은 2024년 07월 30일 주요사항보고서(유상증자결정) 공시를 참고하시기 바랍니다.
5. 정관에 관한 사항
가. 최근 개정일
당사의 최근 정관 개정일은 제07기 정기 주주총회 (2024년 03월 29일)입니다.
나. 변동 이력
최근 3사업연도의 정관 변동 이력은 다음과 같습니다.
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2024년 03월 29일 | 제07기 정기주주총회 | 제13조(주식매수선택권) ⑩ 주식매수선택권의 내용, 행사가격 등 주식매수선택권의 조건은 관련 법령 및 정관이 정하는 바에 따라 주주총회의 특별결의 또는 이사회 결의로 정하되, 관련 법령 및 정관에서 주주총회 또는 이사회의 결의사항으로 규정하지 않은 사항은 이사회 또는 이사회로부터 위임받은 위원회에서 결정할 수 있다. |
주식매수선택권 관련 조문 신설 |
|
제42조(이사의 보수와 퇴직금) ② 이사의 퇴직금의 지급은 주주총회 결의를 거친 임원퇴직금지급규정에 의하며, 이사의 보수에 대한 주주총회 승인 금액에서 제외한다. ③ 이사의 주식매수선택권은 이 정관 제13조에 의한 주주총회 또는 이사회(또는 이사회로부터 위임받은 위원회) 결의 및 그 결의를 거친 주식매수선택권 계약에 의하며, 이사의 보수에 대한 주주총회 승인 금액에서 제외된다. |
이사의 보수와 퇴직금 관련 조문 정비 및 신설 | ||
| 제43조(이사회의 구성과 소집) ③ 이사회를 소집하는 이사는 회일을 정하여 늦어도 24시간 전에 각 이사에게 구두, 서면, 전자우편, 팩스, 문자메시지 등의 수단으로 통지하여 소집한다. 그러나 이사 전원의 동의가 있을 때에는 소집절차를 생략할 수 있다. |
이사회 구성과 소집 관련 조문 정비 | ||
| 제43조의2(이사회 내 위원회) ⑤ 위원회를 소집할 경우 위원회 소집일을 정하여 늦어도 24시간 전에 각 위원에게 구두, 서면, 전자우편, 팩스, 문자메시지 등의 수단으로 소집통지를 발송하여야 한다. 단, 집행위원회를 소집할 경우 소집일 3영업일 전에 소집통지를 발송한다(삭제). 위원회는 위원 전원의 동의가 있는 때에는 소집절차 없이 언제든지 회의를 열 수 있다. 기타 위원회 소집 및 개최에 관하여는 관련 사규 및 각 이사회 내 위원회 규정에서 정한 바에 따른다. |
이사회 내 위원회 관련 조문 정비 | ||
|
제52조(재무제표, 영업보고서의 작성비치 등) ⑥ 본조 제5항에도 불구하고, 본 회사는 다음 각 호의 요건을 모두 충족한 경우에는 이사회의 결의로 상법 제447조의 각 서류를 승인할 수 있다. 1. 상법 제447조의 각 서류가 법령 및 정관에 따라 회사의 재무상태 및 경영성과를 적정하게 표시하고 있다는 외부감사인의 의견이 있을 때 2. 감사위원 전원의 동의가 있을 때 ⑦ 본조 제6항에 따라 이사회가 승인한 경우에는 대표이사는 상법 제447조의 각 서류의 내용을 주주총회에 보고하여야 한다. ⑨ 대표이사는 상법 제447조의 각 서류에 대한 주주총회의 승인 또는 본조 제6항에 의한 이사회의 승인을 얻은 때에는 지체없이 대차대조표와 외부감사인의 감사의견을 공고하여야 한다. |
재무제표, 영업보고서의 작성비치 등 관련 조문 정비 및 신설 | ||
| 2023년 03월 31일 | 제06기 정기주주총회 | 제2조(목적) 10. 부동산 매매 및 임대업, 전대업 |
전대수익에 대한 부가가치세신고 목적 조문 정비 |
|
제32조(의결권의 불통일 행사) |
전자문서 통지 방식 조문 정비 | ||
| 제33조(의결권의 대리행사) 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있으며, 이 경우 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다. |
상장사 표준정관 준용을 위한 조문 정비 | ||
|
제43조의2(이사회 내 위원회) 2. 투명경영위원회 3. 보상위원회 4. 기타 이사회가 필요하다고 인정하는 위원회 |
이사회 내 위원회 조문 정비 | ||
| 제6장 감사위원회 | 감사위원회로 제목 수정 | ||
| 제53조(외부감사인의 선임) 본 회사는 주식회사 등의 외부감사에 관한 법률의 규정에 의하여 감사위원회가 선정한 외부감사인을 선임하며 그 사실을 선임한 이후에 소집되는 정기총회에 보고하거나 주식회사 등의 외부감사에 관한 법률 시행령에서 정하는 바에 따라 주주에게 통지 또는 공고하여야 한다. |
감사위원회가 설치된 경우에 적용되는 법령에 맞게 조문 정비 | ||
| 2022년 03월 03일 | 제06기 임시주주총회 | 제37조(이사의 임기) ① 이사의 임기는 취임후 3년 이내로 한다. 그러나 그 임기가 최종의 결산기 종료후 당해 결산기에 관한 정기주주총회 전에 만료될 경우에는 그 총회의 종결시까지 그 임기를 연장한다. |
상법 취지에 맞게 조문 정비 |
다. 사업목적 현황
보고서 작성기준일 현재 당사의 사업목적 현황은 다음과 같습니다.
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| 1 | 의약품, 수의약품, 의약품의 개발 및 제조, 도소매 무역업 | 영위 |
| 2 | 건강기능식품의 개발 및 제조, 도소매, 무역업 | 미영위 |
| 3 | 화장품 개발 및 제조, 도소매, 무역업 | 미영위 |
| 4 | 개발한 신기술의 사용권 대여 및 양도업 | 영위 |
| 5 | 수입의약품, 수입건강기능식품, 수입화장품의 판매업 및 위탁업 | 미영위 |
| 6 | 동물용 의약품 및 기능성 사료 등의 개발 및 제조, 도소매, 무역업 | 미영위 |
| 7 | 지적재산권 관리업 | 미영위 |
| 8 | 기술 연구 및 연구 용역업 | 영위 |
| 9 | 시장조사, 경영자문, 컨설팅업, 위탁업무 지원 사업 | 영위 |
| 10 | 부동산 매매 및 임대업, 전대업 | 영위 |
| 11 | 각 호에 연관되는 일체의 부대사업, 투자, 수출입업 | 영위 |
라. 사업목적 변경 내용
최근 3사업연도의 사업목적 변경 내용은 다음과 같습니다.
| 구분 | 변경일 | 사업목적 | |
|---|---|---|---|
| 변경 전 | 변경 후 | ||
| 수정 | 2023년 03월 31일 | 10. 부동산 매매 및 임대업 | 10. 부동산 매매 및 임대업, 전대업 |
마. 변경 사유
(1) 변경 취지 및 목적, 필요성
임대 공간 미사용으로 인한 재임대
(2) 사업목적 변경 제안 주체
해당 사업목적 추가는 이사회를 통해 결정되었으며, 제06기 정기 주주총회(2023년 03월 31일)를 통해 승인되었습니다.
(3) 해당 사업목적 변경이 회사의 주된 사업에 미치는 영향 등
해당 신규사업은 회사의 주된 사업현황 목적이 아닌 임대목적 공간의 미사용으로 인한 재임대 개념으로 당사가 기존의 수행중인 사업에 미치는 영향은 없습니다.
바. 정관상 사업목적 추가 현황표
| 구분 | 사업목적 | 추가일자 |
|---|---|---|
| 1 | 10. 부동산 매매 및 임대업, 전대업 | 2023년 03월 31일 |
(1) 그 사업 분야 및 진출 목적
해당 신규사업은 회사의 주된 사업현황 목적이 아닌 임대목적 공간의 미사용으로 인한 재임대 개념으로 주된 사업목적에 해당하지 않습니다.
(2) 시장의 주요 특성ㆍ규모 및 성장성
해당 신규사업은 회사의 주된 사업현황 목적이 아닌 회사 영위에 있어 부수적인 사항으로 해당 사업이 당사에 미치는 영향은 극히 미미할 것으로 판단되어 시장의 주요특성ㆍ규모 및 성장성을 상정하지 않았습니다.
(3) 신규사업과 관련된 투자 및 예상 자금소요액, 투자자금 조달원천, 예상투자회수기간 등
해당 신규사업은 회사의 주된 사업현황 목적이 아닌 회사 영위에 있어 부수적인 사항으로 해당 사업이 당사에 미치는 영향은 극히 미미할 것으로 판단되어 대한 투자 및 예상 자금소요액을 상정하지 않았습니다.
(4) 사업 추진현황
해당 신규사업은 회사의 주된 사업현황 목적이 아닌 회사 영위에 있어 부수적인 사항으로 해당 사업이 당사에 미치는 영향은 극히 미미할 것으로 판단되며, 해당 사업에 대한 조직 및 인력 구성 등 해당사항 없습니다.
(5) 기존 사업과의 연관성
해당 신규사업은 기존 사업과의 연관성이 없습니다.
(6) 주요 위험
해당 신규사업은 해당사항 없습니다.
(7) 향후 추진계획
해당 신규사업은 향후 추진 계획이 없습니다.
(8) 미추진 사유
해당 신규사업은 회사의 주된 사업목적이 아닌 회사 영위에 있어 부수적인 사항으로 해당 사업이 당사에 미치는 영향은 극히 미미할 것으로 판단되어 향후 추진 계획이 없습니다.
II. 사업의 내용
1. 사업의 개요
당사는 융합 단백질을 기반으로 차세대 면역치료제를 연구 개발하는 생명공학회사로핵심 신약파이프라인 ① GI-101/GI-102 면역항암제, ② GI-301 알레르기 치료제, ③ GI-108 대사면역항암제를 비롯한 다양한 면역치료제 신약 파이프라인을 보유하고 있습니다. 당사는 의약/바이오 분야 기초 과학자, 공정개발 전문가, 임상 개발 및 기술이전 전문가 등 바이오 신약 연구개발 및 기술사업화 분야 전문가들로 구성되어 있으며, 이를 바탕으로 융합 단백질 신약 발굴을 위한 플랫폼 기술과 고유의 공정개발 기술, 목표 시장의 미충족 의료 수요에 기반한 임상 개발 역량을 확보하고 있습니다. 당사의 주요 사업모델은 조기 기술이전을 통한 사업화로 자체적인 기술 역량을 기반으로 글로벌 수준의 선도기업 및 연구자들과의 적극적인 협력을 통해 전임상 등 초기 개발 단계에서의 기술이전 실적을 확보해 나아가고 있습니다.
당사는 다양한 단백질 및 항체를 이용하여 최적의 안정성과 활성을 가지는 신규 이중융합단백질을 발굴하고 생산하는 고효율 스크리닝 시스템(high throughput screening system)인 GI-SMART™ 플랫폼 기술을 보유하고 있습니다. 해당 기술은 i) 이중융합단백질 구성요소인 Fc 도메인(crystallized fragment domain; Fc domain), 힌지(hinge), 링커(linker)의 24,190개 아미노산 서열 라이브러리 조합을 통해 이중융합단백질구조 안정화를 수립하는 SMART-Selex™ 기술과 ii) 다양한 종류의 발현벡터 및 이중융합단백질 생산을 저비용 고효율로 할 수 있게 하는 SMART-cLego™ 기술 두 가지로 구성되어 있습니다. 당사는 이를 통해 타깃부터 선도물질 최적화까지 생산성과 구조적 안정성이 뛰어난 신규 이중융합단백질의 원스톱(one-stop) 조기 발굴이 가능합니다.
 |
|
GI-SMART™ 플랫폼 |
당사의 주요 두 파이프라인 모두 한국 또는 미국 식품의약품안전처의 허가 아래 GI-101은 임상 1/2상을, GI-102는 임상 1/2상을, 그리고 GI-301은 임상 1상을 진행하고 있습니다. 특히, 면역항암제 GI-101은 과학기술정보통신부의 '2020 국가연구개발 우수성과 100선'에 선정됨으로써 그 기술력을 인정 받은 바 있으며, 국가신약개발재단(KDDF)으로부터도 총 70억원 규모의 임상과제에 선정되어 임상시험 수행에 지원을 받고 있습니다. 이외에도 당사 플랫폼 기술로 추가 발굴한 신규 대사면역항암제인 GI-108은 KDDF으로부터 총 20억원 규모의 전임상과제에 선정됨으로써 당사의 신약 발굴 능력을 인정받은 바 있습니다.
또한, 당사는 면역치료제 후보군 발굴부터 임상 수행 까지의 역량을 보유한 바이오벤처사로 총 3건의 글로벌 기술이전을 통해 상업화 역량도 입증하였습니다. 전임상 단계의 면역항암제 GI-101을 중국 심시어(Simcere Pharmaceutical)에 7억9천만달러 규모로 기술이전하였고, 알레르기 치료제 GI-301 역시 전임상 단계에서 유한양행에 1조4,090억원 규모로 기술이전하는 성과를 거두었습니다. 또한 2023년 10월 GI-301의 일본 내 개발 및 상업화 권리에 대한 221백만달러 규모의 기술이전 계약을 추가로 체결하여 상업화 역량을 보유하고 있음을 다시 한번 입증했습니다.
당사는 자체적인 후보물질 발굴 및 연구개발 외에도 미국 MSD(Merck & Co., Inc.) 와같은 글로벌 선도기업과 공동임상 계약을 체결하는 등 다양하고 적극적인 협력을 추진하며 글로벌 경쟁력을 확보하고 있습니다. 이러한 개방형 혁신(open innovation)을 통해 글로벌 혁신 신약(first-in-class) 및 최고 신약(best-in-class) 파이프라인을 지속적으로 창출 및 확보하며, 기술이전 및 최종 개발 성공을 통해 글로벌 혁신 제약사로 발돋움하고자 합니다.
2. 주요 제품 및 서비스
당사는 신약 후보물질을 개발하는 연구개발 전문기업으로, 신약 후보물질을 전임상 및 초기 임상 단계에서 기술이전하여 기술료를 통해 수익을 창출하는 사업을 영위하고 있습니다. 따라서 완제품(시판 신약)을 생산하고 있지 않습니다.
설립 이후부터 보고서 작성기준일 현재까지 당사의 주요 매출은 신약 후보물질 기술이전에서 발생하였습니다. 당사는 설립 이후 총 3건(관계사 거래 제외)의 신약 후보물질의 기술이전 및 1건의 공동연구개발 계약을 체결하였습니다.
|
(단위 : 천원, %) |
|
매출유형 |
품 목 |
구분 |
제08기 3분기 (2024년 3분기) |
제07기 (2023년) |
제06기 |
|||
|
금액 |
비중 |
금액 |
비중 |
금액 |
비중 |
|||
| 기술이전 |
GI-101 |
내수 |
- | - | 400,000 | 7.52 |
- |
- |
|
GI-301 |
내수 |
- | - | - | - |
3,500,000 |
100.00 |
|
| GI-301 | 수출 | - | - | 4,730,950 | 88.95 | - | - | |
|
기타매출 |
- |
내수 |
24,281 | 100.00 | 187,899 | 3.53 |
- |
- |
| 합계 | 24,281 | 100.00 | 5,318,849 | 100.00 |
3,500,000 |
100.00 | ||
※ 상기 매출실적(기술이전)과 관련한 자세한 사항은 'Ⅱ. 사업의 내용 - 4. 매출 및 수주현황' 및'Ⅱ. 사업의 내용 - 6. 주요계약 및 연구개발활동 - 가. 주요계약 등' 부분을 참고해주시기 바랍니다.
가. 주요 제품 요약
보고서 작성기준일 현재 당사의 주요 파이프라인의 개발 현황은 아래와 같습니다.
| [주요 파이프라인 개발 현황] |
 |
|
주요 파이프라인 개발 현황 |
(1) 면역항암제 GI-101, GI-102
GI-SMART™ 플랫폼에서 발굴한 이중융합단백질로써 CD80의 세포외도메인과 IL-2 변이체를 결합하여 제작하였으며, 현재 GI-101은 임상1/2상을, GI-102는 임상1/2상을 한국과 미국에서 진행 중에 있습니다. 또한, 2019년 11월 중국 제약사 심시어(Simcere Pharmaceutical)와 7억9천만 달러 규모의 기술이전 계약을 체결하였습니다.
1) 타겟 환자 및 적응증
GI-101과 GI-102는 GI-SMART™ 플랫폼 기술을 이용하여 제작한 이중융합단백질로, CD80 단백질과 IL-2 변이체 단백질 두 가지를 면역글로불린 G4(immunoglobulin G4; IgG4) Fc 부위에 연결한 형태의 이중융합단백질입니다.
GI-101과 GI-102는 하나의 약물에 CD80과 IL-2 변이체 2개의 활성물질을 가지고 있어, ① CTLA-4의 저해와 ② T 세포 활성을 위한 IL-2 수용체 자극의 2가지 면역활성 효과를 동시에 나타낼 수 있는 세계 최초의 first-in-class 신약입니다.
| [GI-101/GI-102의 개요] |
![이미지: [GI-101/GI-102 개요]](gi-101%20%EB%B0%8F%20gi-102%EC%9D%98%20%EA%B0%9C%EC%9A%94.jpg) |
|
[GI-101/GI-102 개요] |
당사는 암-면역 주기의 특성, 면역항암제의 미충족 의료 수요에 기반한 목표제품특성(target product profile; TPP)를 수립하였고, 전임상 단계에서 i) 면역항암제(면역관문억제제) 병용요법, ii) 표적항암제(혈관신생 억제제)와의 병용요법, iii) 방사선치료법과의 병용요법에서의 항암 상승 효능을 이미 확인하였습니다.
이를 바탕으로 GI-101은 현재 고형암을 대상으로 다양한 항암제와의 병용요법을 통해 임상적 효용성을 극대화시키는 데 우선순위를 두고 임상개발을 진행하고 있습니다.
이와 더불어 약동학 및 약력학이 개선된 GI-101A를 성공적으로 도입하여 용량 증량 단계를 통해 임상 2상 권장용량 (recommended phase 2 dose)을 찾고 있습니다.
GI-102는 GI-101과 마찬가지로 IL-2 변이체와 면역관문인 CTLA-4를 저해하는 CD80이 지속형 단백질 형태로 결합되어 있습니다. 다만 GI-102의 IL-2 변이체는 추가적인 아미노산 변형을 통해 조절 T세포에 대한 영향이 더 낮게 나타나며, 암살상 능력이 있는 림프구에서 특이적인 증식능력을 보입니다.
GI-101과 마찬가지로 GI-102는 CD80 절편을 IL-2 변이체에 결합시킴으로써, 표적분포를 통해 안전성 개선 및 항암 효능을 증가한 약물입니다. 이에 따라 현재 면역항암제 GI-102는 표준치료에 실패하여 치료 옵션이 제한적인 고형암 환자들을 대상으로 국내 식약처 및 미국 FDA의 임상 1/2상 승인을 완료하고 순조롭게 임상을 진행하고 있습니다. 특히, 미국 임상시험의 경우 세계적인 암센터로 꼽히는 미국 메이요 클리닉과 클리블랜드 클리닉에서 활발하게 진행되어 높은 수준의 임상 데이터를 기대할 수 있습니다.
올해 1월에 유럽에서 허가를 취득한 티쎈트릭 피하주사 제형을 선두로 어려 주요 글로벌 제약사의 면역항암제들을 피하주사제들의 시장진입이 계획되어 있습니다. 이러한 시장경향에 맞춰 GI-102는 GI-101의 후속 파이프라인으로 제형 변경 없이 정맥 주사와 피하주사가 가능합니다. 이에 따라 피하주사 제형 개발을 포함한 임상 1/2상을 위한 임상시험계획(IND) 변경을 승인받았습니다.
2) 개발 현황 및 경쟁력
당사가 면역항암제로 선두 파이프라인으로 개발 중인 GI-101과 GI-102는 CD80(CTLA-4를 타깃)과 IL-2 변이체(IL-2 수용체를 타깃)를 포함하는 이중융합 단백질로서, 기전적으로 면역관문 단백질인 CTLA-4 및 인터류킨 단백질 IL-2와 관련되어 있습니다.현존하는 약물 중 당사의 GI-101 및 GI-102와 같이 CTLA-4 및 IL-2 수용체를 동시에 타깃하는 단일 약물은 전무하지만, CTLA-4 또는 IL-2 수용체 각각을 타깃하여 임상 개발 중인 약물들은 아래와 같이 존재합니다(※ 출처: 비엠에스, 아스트라제네카, 앨커미스, 로슈, 사노피 홈페이지, 보도자료).
| [CTLA-4 및 IL-2(2세대) 제제 개발 현황] |
|
타깃 |
제품명(또는 성분명) |
개발사 |
요법 및 허가 |
개발 현황 |
|
CTLA-4 |
여보이® /항 CTLA-4 항체 |
비엠에스 (BMS) |
단독 및 병용 요법/고형암 |
2011년 승인 및 출시 |
|
트레멜리무맙 /항 CTLA-4 항체 |
아스트라제네카 (AstraZeneca) |
단독 및 병용 요법/간암 |
2022년 허가 및 출시 |
|
|
IL-2 |
넴발류킨 알파 /IL-2 융합단백질 |
앨커미스 (Alkermes) |
Nemvaleukin alfa |
임상3상 |
|
RG7461 (simlukafusp alfa) /항 FAP-IL2 변이체 |
로슈 (Roche) |
RG7461 |
임상2상 |
|
|
RG7461 |
임상1b상 |
|||
|
RG6279 |
로슈 (Roche) |
단독 및 티센트릭®병용 요법 /고형암 |
임상1/2상 진행 중 |
|
|
SAR444245 /페길화 IL-2 |
사노피 (Sanofi) |
SAR444245 /소화기계암 |
임상2상 |
※ 출처: 각 사 홈페이지, 보도자료
먼저, CTLA-4를 타깃하는 기전의 치료제로는 항 CTLA-4 항체인 BMS사의 여보이®(Yevoy, 성분명: 이필리무맙(ipilimumab))와 아스트라제네카(AstraZeneca)의 트레멜리무맙(tremelimumab)이 있습니다.
여보이®는 2011년 FDA로부터 흑색종 치료제로 허가 받은 후 전이암, 신장암 그리고대장암까지 치료제 용법을 확장하였습니다. 또한 신세포암에서는 여보이®와 옵디보®(Opdivo, 성분명: 니볼루맙(nivolumab))의 병용요법으로 허가를 받아 사용하고 있습니다. 하지만, 여보이®는 T 세포 활성화 및 증식으로 인하여 중증 및 사망을 초래하는 이상사례들이 보고된 바 있습니다. 뿐만 아니라 면역매개 반응들로 인해 소장대장염, 간염, 피부염(독성표피괴사를 포함), 신경병증 및 내분비병증 등과 같은 중증반응이 나타날 수 있다는 우려사항이 있는 약물입니다(※ 출처: Leslie A Fecher et al., Oncologist, 2013).
다른 CTLA-4 항체로는 아스트라제네카의 트레멜리무맙(tremelimumab)이 있으며, 여보이® 대비 반감기 증가 및 면역글로불린 타입 변경(IgG1 대신 IgG2)으로 기존의 면역매개 부작용을 감소시키는 전략으로 개발 중인 약물입니다. 2015년에 FDA로부터 중피종에서 희귀질환 약물로 승인을 받아 임상개발에 박차를 가하고 있으며, 간암을 적응증으로 하여 임핀지®(Imfinzi, 성분명: 더발루맙(durvalumab))와 병용요법으로 미국 FDA 승인을 받았습니다. 추후 여보이®의 대체 약물로 사용될 가능성이 높아 보이지만, 기존의 면역매개 부작용 반응에서의 개선 가능여부는 지속적으로 지켜보아야 할 필요가 있는 약물입니다.
한편, IL-2 수용체를 타깃하는 치료제와 관련하여, IL-2는 이미 항암치료제로 상용화 되어 있는 유일한 사이토카인(cytokine)으로서 프로류킨®(Proleukin, 성분명: 알데스류킨(aldesleukin))이라는 상표명으로 1992년 FDA로부터 전이성 피부암 및 신장암 치료에 대해 승인을 받아 사용되어 왔습니다(※ 출처: Seyed Hamidreza Mahmoudpouret al., Scientific Reports, 2019). 프로류킨®은 항암 면역 반응에 중요한 T 세포 및 자연살해세포의 활성을 증가시키지만, 짧은 체내 반감기와 항암 면역반응을 억제하는 조절 T 세포의 증가를 유도하는 단점을 가지고 있습니다. 이에 따라 최근 프로류킨®의 단점들을 보완하는 전략으로 IL-2α 수용체에 대한 결합력을 감소시킨 2세대 IL-2 변이체들이 개발 중에 있습니다(※ 출처: Rosmely Hernandez et al., Nature Reviews Immunology, 2022).
그 중 임상개발 단계의 경쟁 파이프라인으로는 앨커미스(Alkermes)의 넴발류킨 알파(nemvaleukin alfa), 사노피(Sanofi)의 SAR444245, 로슈(Roche)의 RG6279가 있습니다. 특히, 이들 IL-2 변이체들은 기존 IL-2 제제의 미충족 수요를 해결하는 시장 내 기대감으로 인해 임상개발 단계에서의 공동 연구 및 인수합병이 활발히 진행되고 있습니다.
특히, 다국적 제약사인 사노피는 면역항암제 파이프라인 강화 목적으로, THOR-707(SAR444245) 파이프라인을 보유하고 있는 신톡스(Synthorx) 사를 2019년 25 억 달러에 인수했습니다. SAR444245는 차세대 페길화 IL-2로서 현재 임상2상 용량을 새롭게설정하는 신규 임상 1/2상을 준비 중에 있습니다(※ 출처: 사노피사 홈페이지).
이처럼 IL-2 변이체 파이프라인의 공동 임상개발 및 인수합병 사례들을 살펴볼 때, 선택적인 효과 T 세포의 활성화가 가능한 IL-2 변이체의 면역항암제로의 효용 가능성에대해 기술 및 시장 측면에서의 기대가 매우 큰 것으로 판단되며, 당사 파이프라인 가치에도 긍정적인 영향을 미칠 것으로 예상합니다.
특히, 현재 진행 중인 GI-101의 임상 1/2상 결과, GI-101 단독요법만으로도 면역항암제 불응 환자에서 부분관해(partial response; PR) 및 표준치료 실패 환자에서 완전관해(complete response; CR)가 관찰되었을 뿐만 아니라, 특히 완전관해 환자의 경우 12개월 이상 완전관해를 유지하며 지속적 항암 활성을 보여주었습니다. 또한, 키트루다®(Keytruda, 성분명: 펨브롤리주맙(pembrolizumab)) 병용요법에서 역시 면역항암제 불응 환자를 대상으로 부분관해(PR)가 관찰되었습니다. 이를 통해 GI-101은 기존 항암제의 의학적 미충족 수요를 충족시킬 수 있는 치료제가 될 것으로 기대됩니다. GI-101 제형을 개선한 GI-101A 1/2상 임상시험이 현재 활발히 진행 중이며, 2025년 2분기내 1상 임상시험 결과를 발표할 예정입니다.
현재 진행 중인 GI-102의 임상 1상 중간 결과, GI-102는 단독요법만으로도 면역항암제 치료 후 재발한 전이성 흑색종 환자 7 명 중 3명에서 부분관해를 나타내어 고무적 임상 결과를 보여주고 있습니다. 이를 통해 GI-102는 면역항암제 치료 후 재발된 고형암에서 치료 대안이 될 수 있을 것으로 기대됩니다.
3) 사업화 및 기대효과
암 치료를 위해 한가지 항암제만 처방하던 단일요법에서 현재는 두 가지 또는 그 이상의 항암제를 동시에 혹은 순차적으로 처방하여 암을 치료하는 병용 요법으로 패러다임이 변해왔습니다. 이제는 선택이 아닌 필수 치료요법으로 자리잡고 있기에 전세계 다수의 제약 및 바이오 기업들은 한층 더 우수한 효능을 위해 새로운 항암제와 기존 항암제들 사이의 최적의 병용요법 개발을 위하여 수많은 연구 및 개발을 진행하고있습니다. 미국 MSD 사에서 보유하고 있는 면역관문억제제 키트루다®는 항 PD-1 항체로써 2023년 기준 면역항암제 시장에서 매출 1위 ($250억 달러; 한화 약 34.5조원)라는 기록을 세웠습니다(※ 출처: 머크사 홈페이지). 뿐만 아니라 2017년 국내 면역항암제 허가 1호 제제로 승인받아 국내에서도 사용되어지는 약물이나, 작년 기준으로 키트루다®는 임상연구에서 가장 비용 부담이 많이 드는 제품 1위가 되었습니다.
당사는 2020년 7월과 2024년 8월 미국 MSD사와 각각 GI-101 및 GI-102와 면역항암제 병용요법 임상을 위한 협약을 체결하고, MSD로부터 키트루다®를 무상으로 지원받는 공동 임상을 현재 진행 중에 있습니다. 또한 당사에서 개발 중인 GI-101과 GI-102는 면역관문억제제 이외에도 화학항암제, 항체-약물 접합체(antibody-drug conjugate), 표적치료제, 세포/유전자 치료제 및 방사선 치료와의 병용요법과 같은 다양한 병용요법으로 사용성 확장이 가능하여 다른 글로벌 제약사들과도 경쟁구도 보다 협력관계로서 상생할 수 있는 가능성을 가지고 있기 때문에 기술이전의 가능성 또한 높습니다. GI-102는 정맥주사 제형에 더해 피하주사제형으로도개발되어 환자들의 투약 편의성 또한 증대 시킬 수 있는 장점을 가지고 있습니다.
특히 GI-101과 GI-102는 기존 글로벌 제약사들이 주로 개발하고 있는 단순 지속형 IL-2와 달리 CD80의 부분이 결합되어 있는 이중융합단백질로써, 기존 IL-2 치료제들이 가지고 있던 다양한 부작용 및 미약한 항암 효능을 극복할 수 있는 차별화된 치료제입니다.
당사는 이미 2019년 11월 중국 제약사 심시어(Simcere Pharmaceutical)와 중국지역 한정 7억9천만 달러 규모의 GI-101 기술이전 계약을 체결하였습니다. 추가로 GI-101과 GI-102의 다양한 적응증을 대상으로 한 임상 2상의 결과가 본격적으로 도출되는 2024년~2025년 이내 글로벌 판권의 기술이전을 계획하고 있습니다.
(2) 알레르기 치료제 GI-301
FcεRIα의 세포외도메인을 Fc 영역과 융합한 형태의 재조합 단백질로써, 현재 한국에서 임상 1상을 진행 중에 있습니다. 당사는 2020년 7월 ㈜유한양행과 1조 4,090억원 규모의 글로벌 기술이전 계약을 체결했으며, 2023년 10월 일본 제약사인 마루호와 221백만달러 규모의 GI-301 일본 내 개발 및 상업화에 대한 전용실시권 계약을 추가로 체결했습니다.
1) 타겟 환자 및 적응증
GI-301은 생체 내에 존재하는 고 친화력 IgE 수용체인 FcεRI α 사슬의 서열 일부를 잘라 만든 것으로, 알레르기 원인물질인 IgE를 효과적으로 포획하는 IgE 트랩(trap)으로 작용하여 알레르기 반응을 억제할 수 있습니다. 또한 IgE에 결합할 수 있는 부위를 탐색하여 새롭게 만들어 낸 외부 물질인 기존의 항 IgE 항체들과 비교하여, 생체 내에서 불필요하게 약물에 대한 면역을 유발할 가능성 즉, 면역원성이 낮으며, 안전성이 높습니다. 뿐만 아니라, 항 IgE 항체와 달리, 비만세포를 활성화시키는 자가항체인 항 FcεRI 항체와도 결합해 그 작용을 억제함으로써, 만성 특발성 두드러기 발병을 억제할 수 있습니다.
또한 GI-301의 modified Fc(IgD/IgG4) 부위는 높은 유연성을 갖고 있을 뿐만 아니라 Fc 영역에 의한 세포독성인 항체의존성 세포매개 세포독성(antibody-dependent cellular cytotoxicity; ADCC)과 보체의존성 세포독성(complement-dependent cytotoxicity; CDC) 작용이 없습니다. 그리고 기존의 항 IgE 항체와 달리 IgG-의존적 아나필락시스 발생에 관여하는 FcγRII과 FcγRIII에 대한 결합력이 없어, 아나필락시스 부작용의 발생 가능성이 희박합니다.
| [GI-301 개요] |
![이미지: [GI-301 개요]](gii_gi-301%20%EA%B0%9C%EC%9A%94.jpg) |
|
[GI-301 개요] |
당사는 기존 항 IgE 항체 알레르기 치료제의 미충족 의료 수요에 기반한 목표제품특성(target product profile; TPP)를 수립하였고, 전임상 단계에서 다양한 알레르기 질환 모델 및 환자의 혈청을 이용한 실험에서 기존 치료제 대비 우수성을 이미 확인하였습니다.
이러한 우수한 TPP를 바탕으로 2020년 07월, GI-301의 글로벌 개발 권리(일본 제외)는 유한양행에 기술이전된 바 있으며, 2023년 10월 일본 개발권리는 마루호에 기술이전 되었습니다.
| [GI-301의 졸레어® 대비 효능] |
![이미지: [GI-301 졸레어 대비 우수성]](gii_gi-301%20%EC%98%A4%EB%A7%90%EB%A6%AC%EC%A3%BC%EB%A7%99%20%EB%8C%80%EB%B9%84%20%EC%9A%B0%EC%88%98%EC%84%B1.jpg) |
|
[GI-301 졸레어 대비 우수성] |
GI-301은 현재 임상 1상 단계임에도 불구하고 약물의 안전성 입증 뿐만 아니라, 기존 항 IgE 항체인 졸레어®(Xolair, 성분명: 오말리주맙(omalizumab)) 대비 GI-301의 효능 우위를 증명하는 데에도 중점을 두고 임상개발을 진행하고 있습니다.
2) 개발 현황 및 경쟁력
알레르기 치료에는 주로 약물치료제와 면역치료제가 사용되고 있습니다. 약물치료제는 알레르기 증상을 완화시키는 것을 목적으로 하며, 알레르기의 주요 체내 매개체인 히스타민의 작용을 억제하는 항 히스타민제(지르텍, 알레그라, 세티리진 등)와 면역억제 및 항염증 효과가 있어 천식 등 다양한 질환에 사용되고 있는 스테로이드제가 있습니다. 그러나 일부 환자는 이러한 치료로 증상이 조절되지 않아 전신 스테로이드를 반복적으로 사용하게 되며, 그에 따른 스테로이드 부작용이 치료의 부담으로 작용하고 있습니다.
한편, 면역치료제의 원리는 몸에 미량의 알레르기 항원을 장기간에 걸쳐 조금씩 투여해서 면역 체계가 더 이상 특정 알레르기 항원에 과민 반응하지 않게 만들어주는 것입니다. 증상의 완화는 물론 완치의 효과를 볼 수 있으나, 치료 기간이 2-3년 이상 걸리고 비용이 고가이며 한달에 2-4회 주사를 맞아야 하는 등의 어려움이 있습니다. 특히, 22년 11월 네슬레가 탈감작 요법을 이용한 땅콩 알레르기약인 팔포지아의 실패를공식적으로 인정함으로써 해당 요법의 낮은 성공 가능성을 대변해 주었습니다.
최근 이에 대한 대안으로서 특정 생체표지자(biomarker)를 타깃하는 다양한 생물학적 제제가 개발되고 임상에 적용됨에 따라 생물학적 제제에 대한 관심이 증가하고 있습니다. 대표적으로 현재 시판 중인 항알레르기 생물학적 치료제로는 졸레어®이외에도, 듀피젠트®(Dupixent, 성분명: 두필루맙(dupilumab)), 싱케어®(Cinqair, 성분명: 레슬리주맙(reslizumab)) 등이 있습니다. 그 외 아토피 치료제인 일라이 릴리(Eli Lilly) 사의 레브리키주맙(lebrikizumab)이 2023년EU 및 2024년 FDA에서 허가를 득하였습니다. 또한 임상 개발 중인 치료제로서 리겔리주맙(ligelizumab, QGE031)을 이용한 식품알레르기에 대한 임상 3상이 진행되고 있으며, 천식 치료제인 암젠(Amgen)/아스트라제네카의 테제페루맙(tezepelumab) 등이 후기 임상 진행 중입니다(※ 출처: 사노피, 테바, 노바티스, 일라이 릴리, 암젠, 아스트라제네카 홈페이지, 보도자료).
| [항알레르기 생물학적 제제 승인 및 개발 현황] |
|
타깃 |
제품명(또는 성분명) |
업체명 |
적응증 |
개발 현황 |
|
IgE |
졸레어® /항 IgE 항체 |
로슈/ 노바티스 |
만12세 이상 |
2003년 승인 및 출시 |
|
리겔리주맙 /항 IgE 항체 |
노바티스 |
만성 특발성 |
임상 3상 완료 후, 1차 평가변수 입증 실패 |
|
|
IL-4Rα |
듀피젠트® /항 IL-4Rα항체 (IL-4/IL-13 억제) |
사노피/ 리제네론 |
만 12세 이상 |
2017년 승인 및 출시 |
|
IL-5 |
싱케어® /항 IL-5 항체 |
테바 |
만18세 이상 중증 천식 환자 |
2017년 승인 및 출시 |
|
IL-5 |
누칼라®(메폴리주맙) |
글락소스미스클라인 |
중증 호산구성 |
2016년 승인 및 출시 |
|
IL-5 |
파센라®(벤랄리주맙) |
아스트라제네카 |
12세 이상의 중증 호산구 천식 환자 |
2017년 승인 및 출시 |
|
IL-13 |
엡글리스®(레브리키주맙) /항 IL-13 항체 |
릴리 |
12세이상 중등증 내지 중증 아토피 피부염 환자 |
2023년 EU 허가, 2024년 FDA 허가 |
|
TSLP |
테제펠루맙 /항 TSLP 항체 |
암젠/아스트라제네카 |
중증 천식치료 |
2021년 승인 및 출시 |
※ 출처: 각 사 홈페이지, 보도자료
먼저, 로슈(Roche)와 노바티스(Novartis)가 공동개발한 졸레어®는 항 IgE 항체로써,알레르기에서 기전적으로 중요한 IgE를 감소시킴으로써 증상을 완화시키는 약물로 2003년 FDA으로부터 첫 승인을 받았습니다. 초기에 알레르기성 천식 치료 용도로 쓰였으나, 항히스타민제와 스테로이드로도 낫지 않는 중증 만성 두드러기 치료제로 사용 영역이 확대되었습니다. 글로벌 치료제시장의 18%를 차지하고 있으며 연매출은 32억 달러(2020년 기준)입니다. 그러나 졸레어®는 혈중 IgE 수치가 높은 환자에게서 충분한 치료 효과를 발휘하지 못하는 한계를 가지고 있으며 6세 이하의 소아에게는 사용이 불가능합니다(※ 출처: 졸레어® 미국 FDA 의약품 라벨). 또한 물질특허가 2017년에 만료되어 많은 제약사가 바이오시밀러 개발을 진행하고 있으며 국내기업으로는 셀트리온이 2024년 졸레어® 바이오시밀러의 식약처 및 EU 허가를 득하였습니다.
이와 같은 상황에서 노바티스사는 졸레어®의 기능을 개선하고 적응증을 확대한 후속약물로서 차세대 항 IgE 항체인 리겔리주맙(ligelizumab)을 연구 개발하여 21년 1월에 FDA로부터 만성특발성두드러기 치료제로 혁신치료제(Breakthrough Therapy) 지정을 받았습니다. 리겔리주맙은 졸레어®에 비하여 IgE와 결합 친화력을 증가시킨 약물로 6주 이상 지속되는 만성특발성두드러기의 주 원인인 IgE와 FcεRI 결합을 억제하는데 더 효과적이며 투여용량을 줄일 수 있는 것으로 알려졌습니다. 그러나 2021년12월 만성특발성두드러기 임상 3상에서 표준치료제인 졸레어® 대비 우월성(superiority) 입증에 실패해 임상이 중단되었으며, 또한 2024년 1월 리겔리주맙을 이용한 식품알레르기에 대한 임상 3상이 중단되었습니다. 다만, 2024년 2월 졸레어®가 식품알러지 반응을 사전에 감소시킬 수 있는 약물로 FDA의 승인을 받았습니다.
사노피(Sanofi)와 리제네론(Regeneron)이 공동 개발한 천식 및 아토피 피부염 치료제 두필루맙(두피센트®)은 중증 아토피 환자에게 효과가 클 것으로 기대되는 신약이며, 인터류킨 4 수용체(IL-4Rα) 차단을 통해 아토피 및 알레르기 질환에 관여하는 인터류킨 4(IL-4)와 인터류킨 13(IL-13)의 신호전달을 조절함으로써 알레르기 증상을 완화시킵니다(※ 출처: Jennifer D Hamilton et al., ImmunoTherapy, 2015). 두필루맙은 아토피 피부염 환자들 뿐만 아니라 조절이 안되는 지속적인 소아 천식환자들에게서 효과, 호산구성 식도염, 식품ㆍ환경 알레르기, 만성 폐쇄성 폐질환(COPD) 및 기타 각종 피부질환 등 2형 염증에 의해 촉발되는 다른 질환들에도 적응증이 확장되고 있습니다. 두필루맙의 연간 치료제 가격은 3만 7,000달러로 알려져 있으며 2023년 매출은 116억 달러입니다. 약물의 우수성과 광범위한 적응증에 효과적이어서 글로벌 알레르기시장에서 급속한 신장세를 올리고 있으며 높은 점유율을 차지하지만, 상대적으로 타제품에 비해 높은 비용이 들며 복잡한 발병원인에 따른 미충족 수요가 여전히 존재하며, 특히 약물의 부작용으로 결막염을 유발하고 있습니다(※ 출처: Alison D Treister et al., JAMA Dermatol, 2018).
테바(TEVA)사의 싱케어®는 호산구의 성숙ㆍ생존ㆍ활성에 작용하는 사이토카인인 인터류킨 5(IL-5)를 타깃으로 하는 단일클론항체 약물로 천식에 효과적인 약물입니다. 싱케어®는 IL-5에 특이적으로 결합하여 호산구의 분화, 성숙 및 활성화를 감소시킵니다. 이에 따라 중증 호산구성 천식환자에서 악화율을 줄이고 폐 기능 및 천식을 개선합니다. 가장 흔한 부작용으로는 천식 악화 증상, 비인두염, 상부 호흡기감염, 부비동염, 인플루엔자 및 두통 등이 발생합니다(※ 출처: 테바사 홈페이지).
추가로 IL-5를 표적으로 항체로 허가받은 제품으로는 글락소스미스클라인(GSK)사의중증 천식치료제인 누칼라®(Nucala, 성분명: 메폴리주맙(mepolizumab))과 IL-5 수용체(IL-5Rα)를 표적하는 항체의약품인 파센라®(Fasenra, 성분명: 벤랄리주맙(benralizumab)) 등이 있습니다. 특히, 파센라®는 아스트라제네카의 차기 알레르기 주력약물로서, 천식악화와 비인두염 발생률을 최대 51%까지 낮추고 폐기능 개선효과를 입증한 약물로서 향후 IL-5 타깃 제제인 싱케어® 및 누칼라®와 시장에서 경쟁할 것으로 예상됩니다(※ 출처: GSK사, 아스트라제네카사 홈페이지).
릴리(Lilly)가 개발한 아토피피부염 치료제 레브리키주맙(lebrikizumab)은 IL-13에 대한 친화도를 높이도록 고안된 단클론항체로서, 가려움증, 수면, 전반적인 삶의 질 향상에 효과를 보이고 있으며 2023년 EU와 2024년 FDA에서 승인을 득하였습니다(※ 출처: 일리아 릴리사 홈페이지). 또한 암젠과 아스트라제네카가 공동으로 개발 중인 테제펠루맙(tezepelumab)은 천식을 치료하는 인간 단일클론항체로, 기도염증을 유발하는 중요한 기전으로 보고되는 '흉선 기질상 림포포이에틴(thymic stromal lymphopoietin, TSLP)'에 특이적으로 결합을 하며, 천식이 조절되지 않는 중증 환자를 대상으로 출시되었습니다(※ 출처: 암젠사, 아스트라제네카사 홈페이지).
당사는 이러한 기존 IgE 및 사이토카인류를 타깃으로 하는 제품 대비 기전적 차별성을 기반으로 생체 내 IgE를 강력하고 효과적으로 제거함으로써 다양한 IgE 매개 알레르기 질환에 적용 가능한 치료제를 개발하는 것을 목표로 하고 있습니다.
3) 사업화 및 기대효과
알레르기 반응을 시작하는 핵심 물질은 면역글로불린 E(immunoglobulin E, IgE)로, 특정 알레르기를 유발하는 외부 항원에 대해 IgE가 생성되고, 이 IgE가 우리 몸의 혈액이나 장기 내의 알레르기 관련 면역세포의 특정 수용체에 결합해 이들 세포를 활성화하게 됩니다. 따라서, IgE에 대한 항체를 이용해 IgE가 알레르기 관련 면역세포의 수용체와 결합하는 것을 방해하는 접근법은 알레르기 반응 억제에 매우 유효하게 작용합니다(※ 출처: AAAAI 홈페이지).
현재 항 IgE 항체로서, 로슈(Roche)/노바티스(Novartis) 사가 2003년 출시한 졸레어®가 대표적인 약물로 사용되고 있으나, 이 제품은 i) 높은 IgE 레벨의 환자들에 효과가 없고, ii) 자가항체를 가진 환자들에도 효과가 없으며, 또한 iii) 아나필락시스 부작용의 위험성과 같은 의학적 미충족 수요가 명확한 제품으로 이를 대체할 수 있는 개선된 항 IgE 표적 치료제 개발이 요구되고 있는 상황입니다.
한편, 졸레어®의 특허만료가 다가옴에 따라 노바티스에서 IgE에 대한 결합력이 향상된 항체인 리겔리주맙(ligelizumab)을 임상 시험을 통해 개발되고 있습니다(※ 출처: 노바티스사 홈페이지). 하지만 리겔리주맙은 다양한 적응증에서 이미 임상 실패가 보고되고 있어 졸레어®를 대체할 수 있을지 아직 불확실한 상황입니다.
하지만, GI-301은 다양한 전임상 시험을 통해 기존 항 IgE 항체 치료제의 한계를 극복할 수 있을 것으로 예상되고 있습니다. 이미 이와 같은 결과를 바탕으로 GI-301은 2020년 7월 ㈜유한양행과 1조 4,090억원 규모의 일본 지역을 제외한 글로벌 기술이전 계약을 체결했고, 현재 진행하고 있는 임상 1상 결과를 바탕으로 2023년 10월 일본 제약사인 마루호와 221백만달러 규모의 일본 내 개발 및 상업화에 대한 기술이전 계약을 추가로 체결했습니다. 특히 유한양행과 체결한 글로벌 기술이전 계약의 경우, 제3자 기술이전(sub-license) 조항에 따라, (주)유한양행이 GI-301의 글로벌 사업권을 제3자에 이전시 수익금의 50%를 당사가 수령하게 되어 있어 이를 통한 추가 수익도 기대되고 있습니다.
(3) 대사면역항암제 GI-108
GI-108은 GI-SMART™ 플랫폼에서 발굴한 이중융합단백질로써 항CD73 항체와 IL-2 변이체를 결합하여 제작하였으며, 2024년 9월 한국 식약처에 임상 1상 IND를 제출하였고, 4분기 이내에 승인을 예상하고 있습니다.
1) 타겟 환자 및 적응증
GI-108은 당사의 GI-SMARTabTM기술을 적용해 종양미세환경 제어의 차세대 항암 후보표적으로 알려진 CD73(ecto-5′-nucleotidase, NT5E)에 대한 단일클론항체와 야생형(wild-type) IL-2에서 3개의 아미노산을 교체하여 제작한 IL-2 변이체(IL-2v3) 단백질을 조합한 이중융합단백질(anti-CD73-IgG4Fc-IL-2v3)입니다.
| [GI-108 개요] |
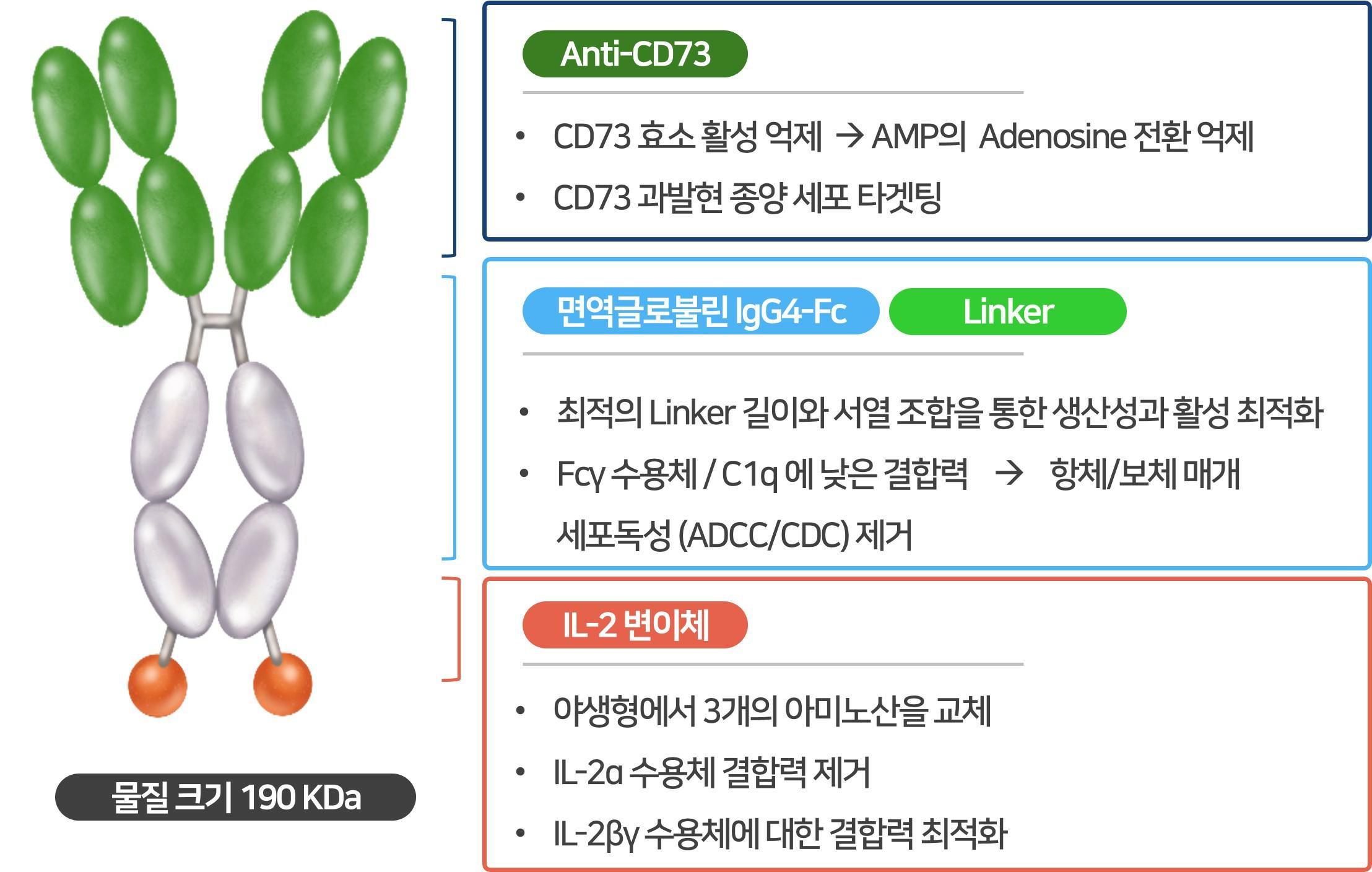 |
|
GI-108 개요 |
2) 개발 현황 및 경쟁력
GI-108은 항CD73 항체와 IL-2 변이체(IL-2 수용체를 타깃)를 포함하는 이중융합 단백질로서, 기전적으로 면역관문 단백질인 CTLA-4 및 인터류킨 단백질 IL-2와 관련되어 있습니다.
최근 아데노신(adenosine) 신호전달체계를 표적으로 하는 제4세대 항암제인 대사면역항암제의 개발이 다양한 글로벌 제약사에서 활발하게 이루어지고 있습니다. 특히, 종양미세환경에서 항암활성을 방해하는 아데노신의 생성을 억제하기 위한 방법으로 항CD73 항체, 항A2AR 항체 및 표적항암제 등의 개발이 활발하게 이루어지고 있습니다.
현존하는 약물 중 당사의 GI-108과 같이 CD73 및 IL-2 수용체를 동시에 타깃하는 단일 약물은 전무하지만, 현재 항 CD73 항체를 개발하고 있는 경쟁사의 대표적인 의약품 후보물질로는 글로벌 제약사인 아스트라제네카(Astrazeneca)의 올레클루맙(oleclumab; MEDI9447), BMS(Bristol Myers Squibb)의 BMS-986179, I-MAB의 우릴레들리맙(uliledlimab; TJ004309), Corvus Pharmaceuticals의 무파도리맙(Mupadolimab; CPI-006) 등이 있습니다.
| [항CD73 제제 개발 현황] |
| 제품명(또는 성분명) /특성 |
개발사 | 요법 및 허가 /적응증 |
개발 현황 |
| Oleclumab /항CD73 항체 |
아스트라제네카 (AstraZeneca) |
Oleclumab+임핀지®/비소세포성폐암 | 임상3상 진행 중 |
| Uliledlimab /항CD73 항체 | I-Mab | Uliledlimab+록토르지®/비소세포성폐암 | 임상2상 진행 중 |
| BMS-986179 /항CD73 항체 | BMS | 단독 및 옵디보® 병용/전이성대장암 및 난소암, 고형암 | 임상1/2상 종료 |
| Mupadolimab (CPI-006) /항CD73 항체 | Corvus | 단독/구인두암, 두경부암 및 췌장암, 대장암 및 삼중음성유방암을 포함하는 고형암 | 임상2상 진행 중 |
| Quemliclustat /CD73 저해제 | Arcus | Quemliclustat+gemcitabine/nab-paclitaxel/전이성 췌관선암 | 임상2상 완료 및 임상3상 계획 중 |
※ 출처: 각 사 홈페이지, 보도자료
글로벌 제약사 아스트라제네카가 개발한 항CD73 항체인 oleclumab은 미국암연구학회(American Association for Cancer Research, AACR) 2022 연례학술회의에서 절제 가능한 조기 비소세포폐암 환자의 수술 전 보조요법으로 아스트라제네카가 개발한 항 PD-L1 항체인 임핀지 단독요법과 항 CD73 항체 올레클루맙 병용요법을 비교한 무작위 배정, 레이블 공개 임상 2상 NeoCOAST 연구 결과를 공개하였는데, 연구 결과 주요병리학적 반응률은 올레클루맙 병용요법군이 19.0%로 임핀지 단독요법군(11.1%)보다 높아 기대감을 높였습니다. 특히, 면역치료제에 대한 반응이 낮은 PD-L1 저발현 환자에서 올레클루맙 병용요법군의 12개월 무진행생존비율이 62.6%로, 임핀지 단독요법군의 33.9%보다 약 두 배 높은 생존률을 보인 바 있습니다. 이를 기반으로 2022년 초부터 절제 불가능한 3기 비소세포폐암(NSCLC) 환자에서 임핀지®와 oleclumab의 병용 요법 임상 3상을 진행 중에 있습니다.
아이맙바이오파마(I-Mab Biopharma)가 개발한 항CD73 항체인 uliledlimab은 최근 ASCO 2023에서 발표된 uliledlimab+록토르지® 병용요법에 대한 1b/2상 임상 데이터를 통해 다양한 PD-L1 및 CD73 발현 수준을 보이는 환자 중 31.3%의 객관적 반응률(ORR)을 입증했습니다. 특히, CD73 발현이 높은 환자는 PD-L1 발현이 특정 역치 이상인 환자의 경우 63%로 더 높은 ORR을 나타냈습니다. 이는 CD73 발현이 NSCLC 환자의 효능을 개선하기 위한 치료 결정을 안내하는 예측 바이오마커 역할을 할 수 있음을 시사합니다. 최근 uliledlimab의 중국 지역 개발 및 판매 권리는 2024년 9월에 Sanofi에 인수되었습니다.
Arcus사가 저분자 치료제로 개발중인 CD73 저해제 quemliclustat은 앞서 치료를 받은 적이 없는 전이성 췌관선암 환자들을 대상으로 진행한 임상 1/1b상에서 기존 화학치료제와 병용요법으로 투여 시 환자의 사망 위험률을 37% 감소시키는 것으로 보고되었습니다. 특히, 역사적 결과 분석에 따르면 특정 화학치료제의 평균생존기간이 9.8개월인 반면, 위 실험에서 quemliclustat과 화학치료제의 병용군에서는 평균생존기간이 약 19.4개월로 나타나 매우 고무적인 항암 효능을 확인되었습니다. 이 외에도 폐암 및 상부 위장관 암에 대한 임상 2상 시험도 현재 Gilead사와 협력하에 진행 중이며, 2025년에는 췌장관암에서 임상 3상 시험이 개시 될 예정입니다. 최근 일본의 Taiho 제약이 quemliclustat의 일본과 특정 아시아 지역에서의 개발 및 판매 권리를 인수하였습니다.
GI-108의 항 CD73 항체 절편의 human CD73에 대한 효소활성 저해능을 평가하였을 때, GI-108이 경쟁약물인 아스트라제네카의 올레클루맙(oleclumab) 대비, hook effect 없이 동등한 수용성 CD73 효소활성 저해능을 가짐을 확인할 수 있었으며, 삼중음성유방암 인간세포주인 MDA-MB-231을 이용한 세포막 CD73 효소활성 저해능도 우수함을 관찰한 바 있습니다.
지금까지 전세계적으로 항CD73 항체와 면역활성 사이토카인을 융합시킨 이중융합 단백질은 GI-108 이 유일한 물질입니다. GI-108의 항CD73 항체절편은 CD73 과발현 암종의 표적화에 기여할 수 있으며, IL-2v3 변이체는 조절 T 세포의 활성을 최대한으로 억제시킴과 동시에 항암면역세포의 활성을 증가시킬수 있어 조절 T 세포 분포가 높은 암종에서 차별적인 치료제가 될 수 있습니다.
3) 사업화 및 기대효과
GI-108의 사업화 및 상용화는 기술이전(라이센싱 아웃) 형태가 될 것이며, 기술이전의 주요 타겟으로 면역 항암치료제 개발 및 판매 점유율이 상위권에 있는 글로벌 제약회사들을 설정하고 있습니다. 임상 1상 IND 승인이 예상되는 2024년 하반기 이후를 기점으로 2025 ~ 2026년경 기술이전을 추진할 계획입니다. 2025~2026년경 임상 1/2상 단계에서의 기술이전을 가정하였을 시, 기술이전 대상 제약기업에 의해 이후 임상이 진행되어 2028년 말~2029년 초에 임상 1/2상이 종료되는 것으로 가정, 2029년 상반기에 임상 3상 진입하여 2032년 하반기부터는 실제 제품의 판매가 개시될 것으로 예상됩니다.
이를 위해 지아이이노베이션은 주요 타겟인 글로벌 제약회사들과의 지속적이고 견고한 네트워크를 구축하고 있으며, 외부 전문가를 적극적으로 활용하고 있습니다. 기존의 유사제제들의 기술이전 및 인수합병 사례를 통해, 면역항암제 시장의 미충족 의료수요(medical unmet needs)를 해결할 수 있는 이중융합단백질 GI-108의 가치는 상당히 높을 것으로 전망됩니다.
나. 주요 제품 등의 가격변동 추이
설립 이후부터 보고서 작성기준일 현재까지 당사의 주요 매출은 당사가 개발한 후보물질에 대한 기술이전 및 마일스톤 등의 수취를 통해 발생되고 있으며, 제품 출시가 완료되어 판매되고 있는 제품은 없습니다. 따라서 제품의 가격변동 추이를 명확히 기재하기는 어려우며, 각 과제별 기술이전에 대한 기대가치는 당사 후보물질의 약효 및 안전성 등에 대한 차별적 장점 보유 여부, 제약사의 수요 정도, 경쟁상태, 시장규모, 예상 시장점유율 등의 다양한 요인에 의하여 결정되므로 쉽게 예측하기는 어렵습니다.
그럼에도 불구하고 기존 기술이전 사례나 최근 시장동향 등을 고려하여 일반적으로 개발단계가 진행될수록 성공확률이 높아지며 계약규모가 기하급수적으로 커질 가능성이 높습니다.
3. 원재료 및 생산설비
가. 원재료 매입에 관한 사항
당사는 연구개발 중심기업으로 원재료 및 부재료 등의 매입이 존재하지 않으나 주요 비용으로는 연구개발에 투여하는 시약 구입 및 임상시험약 제조에 들어가는 재료비, CMO 비용, CRO 등 연구대행 기관에 지불하는 비용 등이 있습니다. 시약 재료비의 경우 그 금액적 중요성이 낮아, 연구소에서 매입 요청 시 구매팀에서는 해당 매입 금액을 경상연구개발비 계정으로 회계처리하고 있습니다. 이에 따라 본 매입에 관한 사항에 기재된 시약재료비는 연구소에서 구매한 경상연구개발비 내 소모품비이며, 외주가공비는 경상연구개발비 내 지급수수료 금액을 바탕으로 기재하였습니다.
|
(단위 : 천원) |
|
매입유형 |
품목 |
구분 |
제08기 3분기 (2024년 3분기) |
제07기 |
제06기 |
|
원재료 |
배양 |
국내 |
189,667 | 202,765 | 2,402,147 |
|
정제 |
국내 |
12,126 | 667,344 | 2,866,130 | |
|
기타 |
국내 |
1,929,377 | 2,826,128 | 3,009,277 | |
|
수입 |
- | - | 59,029 | ||
|
외주가공비 |
국내 |
8,461,870 | 22,857,516 | 30,604,334 | |
|
수입 |
10,666,021 | 9,966,526 | 13,842,372 | ||
| 국고보조금 | (178,072) | (2,275,743) | (2,338,923) | ||
나. 원재료의 제품별 비중
당사 연구목적의 특성상 주요 원재료는 없습니다. 해당 프로젝트별로 다품종 소량구매를 하며, 시약재료비 중 1개의 품목이 10% 이상을 차지하는 시약은 없습니다. 또한 제품을 생산하지 않기 때문에 별도로 시약재료비의 비중을 산출하지 않았습니다. 합성신약의약품 연구개발의 특성 상 다양한 종류의 시약 및 실험 소모품들이 소량씩 투입되므로 파이프라인별 원재료비의 비중을 산출하지 않았습니다.
다. 원재료 가격변동 추이
당사 연구 목적의 특성상 주요 원재료는 없습니다. 해당 프로젝트별로 다품종 소량구매를 하며, 시약재료비 중 1개의 품목이 10% 이상을 차지하는 시약은 없습니다. 합성신약의약품 연구개발의 특성 상 다양한 종류의 시약 및 실험 소모품들이 소량씩 투입되므로 파이프라인별 원재료비의 가격변동추이를 산출하지 않았습니다.
라. 주요 매입처에 관한 사항
당사는 보고서 제출일 현재 생산 및 판매 중인 제품이 없어 원재료 및 부재료의 매입이 존재하지 않습니다.
신약연구개발업의 특성상 매입품목은 다양한 종류의 외주 시험서비스와 시약 및 실험소모품 등이며, 공급의 독과점이나 안전성에는 문제가 없습니다. 당사와 거래를 하고 있는 매입처 중 특수관계자와의 거래에 관한 사항은 'X. 대주주 등과의 거래내용 - 5. 대주주 이외의 이해관계자와의 거래'를 참고해주시기 바랍니다.
4. 매출 및 수주상황
가. 매출개요
당사의 주요 수익 모델은 국내외 제약사들과 당사 보유 파이프라인에 대한 기술이전 및 공동개발에 대한 라이선스 아웃(License-out) 계약을 체결하고 그 과정에서 기술료 선급금 및 마일스톤 달성에 따른 로열티를 수령하도록 체계화되어 있으며, 제품화성공 이후에는 매출액의 일정 부분에 대하여 로열티 수익을 창출하는 구조로 되어 있습니다.
당사의 과거 3개년도 매출액은 아래와 같습니다.
|
(단위 : 천원,%) |
|
매출유형 |
품 목 |
구분 |
제08기 3분기 (2024년 3분기) |
제07기 |
제06기 |
|||
|
금액 |
비중 |
금액 |
비중 |
금액 |
비중 |
|||
|
기술이전 |
GI-101 |
내수 |
- | - | 400,000 | 7.52 |
- |
- |
|
GI-301 |
내수 |
- | - | - | - |
3,500,000 |
100.00 |
|
|
수출 |
- | - | 4,730,950 | 88.95 |
- |
- |
||
| 기타매출 | - |
내수 |
24,281 | 100.00 | 187,899 | 3.53 |
- |
- |
| 합계 | 24,281 | 100.00 | 5,318,849 | 100.00 |
3,500,000 |
100.00 | ||
나. 주요 매출처
설립 이후부터 보고서 작성기준일 현재까지 당사의 매출은 대부분 신약 후보물질 기술이전에서 발생하였습니다. 당사의 매출 구조상 특정 거래처는 없으나, 2020년 7월 (주)유한양행과 체결한 1조 4,090억원 규모의 기술이전 계약을 포함하여 관계사 거래를 제외하고 설립 이후 총 3건의 신약 후보물질에 대한 기술이전 계약을 체결하였습니다.
주요 매출계약에 대한 자세한 사항은 'II. 사업의 내용 - 6. 주요계약 및 연구개발활동 - 가. 주요계약'을 참고해주시기 바랍니다.
다. 판매경로
당사의 매출발생은 기술이전을 통해서 이루어지며, 당사는 라이선스 아웃을 위한 국내외 제약회사를 대상으로 학회, 전시회 및 비즈니스 파트너링 등 기술 교류의 장을 통해 지속적 개발 업데이트와 교류활동을 진행하고 있습니다.
당사는 기술이전 시 다음과 같은 과정을 거치게 됩니다. 당사가 보유한 신약개발 물질에 대한 데이터 및 경쟁사 대비 경쟁력 분석 및 상업화 전략을 수립하며, non-confidential과 confidential 자료를 제작하여 잠재고객의 관심도에 따라 지속적으로 업데이트를 합니다. 잠재 고객군 확보 후 당사의 물질에 대한 관심이 높으면 confidential 데이터 패키지를 제공하게 되는데, 이에 앞서 양사간 비밀유지협약(CDA)을 체결하게 됩니다. 이 단계에서는 confidential 데이터 패키지 제공과 함께 데이터 검증에 관한 실사도 진행됩니다. 기술에 대한 실사가 완료되어 기술이전이 더 진전될 경우, 양사는 기술이전에 대한 주요 계약 사항을 협의하게 됩니다. 이후 세부 계약 사항을 조율하고 확정하여 계약 체결을 완료하게 됩니다. 이러한 기술이전 절차를 거쳐 당사에서는 이미 관계사 거래를 제외하고 3건의 기술이전을 성사시킨 바 있으며, 앞으로도 기존 파이프라인 및 차기 후보 파이프라인의 기술이전을 활성화할 계획입니다.
라. 판매전략
당사는 성공적인 기술이전을 위해 현재 시장 규모(잠재력 및 환자 수), 경쟁약물의 개발 단계, 파트너사와의 전략적 적합성 등을 내부적으로 업데이트 하여 파트너사들의 미충족 요구를 채워 줄 수 있는 관점에서 지속적이고 긴밀한 접촉을 진행해 관심을 유지합니다. 현재 당사는 다수의 해외 파트너사들과 CDA를 맺고 기술이전을 위한 활동을 유지해 나가고 있습니다.
(1) 면역항암제
GI-101 및 GI-102의 글로벌 판권(중국 제외) 및 GI-108의 글로벌 판권(중국 포함)에 대한 기술이전의 경우, 당사에서는 현재 전 세계적으로 면역 항암치료제 개발 및 판매 점유율이 상위권에 있는 글로벌 제약회사들을 주된 기술이전 타깃 사로 설정하고 있습니다. 특히 키트루다®나 임핀지®와 같은 면역관문억제제(immune checkpoint inhibitor; ICI)는 기존 치료 효과 대비 우위성을 입증하였지만, 여전히 암환자의 반응률이 평균 약 10~30% 수준임에 따라 최근 임상시험 디자인들은 면역관문억제제와 병용요법 형태로 치료 효과를 증대시키는 전략이 추세입니다. 특히, 당사에서는 GI-101과 GI-102를 병용치료제로서 사용시 면역관문억제제의 효능을 극대화할 수 있음을 입증한 바 다양한 글로벌 제약사에서 관심과 기대를 갖고 기술이전을 진행하고자 논의 중에 있으며, GI-108 또한 비임상단계에서부터 꾸준히 여러 회사들과 논의를 해 오고 있습니다.
특히, 기술이전 대상 선정에 있어 앞에서 언급한 면역관문억제제를 보유한 회사들을 우선 순위로 선별 및 접촉을 진행하여 기술이전의 전략적 적합성을 높이고자 합니다.
| [면역관문억제제 보유 주요 글로벌 제약사] |
![이미지: [면역관문억제제 보유 주요 제약사 요약]](%5B%EB%A9%B4%EC%97%AD%EA%B4%80%EB%AC%B8%EC%96%B5%EC%A0%9C%EC%A0%9C%20%EB%B3%B4%EC%9C%A0%20%EC%A3%BC%EC%9A%94%20%EC%A0%9C%EC%95%BD%EC%82%AC%20%EC%9A%94%EC%95%BD%5D.jpg) |
|
[면역관문억제제 보유 주요 제약사 요약] |
※출처: 당사 분석자료
뿐만 아니라, 현재 면역항암치료제를 개발 중인 글로벌 제약 회사들 중 미충족수요에의해서 GI-101과 GI-102의 병용요법 및 GI-108에 우선 순위를 두고 임상 개발 및 사업화의 전략을 이끌고 갈 글로벌 제약사들을 추가 선별하여 기술이전을 진행할 계획입니다.
(2) 알레르기 치료제
GI-301의 일본시장 판권에 대한 기술이전의 경우, 알레르기 치료제 전체가 아닌 일본 시장만의 특성을 살펴 임상개발 및 자국 내에서의 판매까지 활동 가능한 제약회사들을 주된 기술이전 타깃 사로 설정했습니다. 특히, 꽃가루 비산량이 많은 지역의 특성상 비염치료제 및 안과질환 치료제 그리고 선진국형 질환인 알레르기성 피부염 치료제 등의 약물수요시장이 지속적으로 확대되고 있어, 이를 중심으로 하여 일본에 본사를 두고 있는 제약사를 기술 이전 타깃 회사들로 설정했으며, 파트너링 미팅 뿐만 아니라 지속적인 유/무선으로 교류를 가짐으로써 기술이전에 대한 지속적이고 긴밀한 접촉을 시도했습니다.
특히, 기술도입의 경험이 있는 대기업군의 사업개발 담당자와의 파트너링을 지속하여, 알레르기 치료제에 대한 수요가 있는 일본 내의 로컬 제약사들에 당사의 차별화된 기술을 파트너링 미팅을 통하여 설명했으며, 다수의 일본 지역 파트너사들과 CDA를 맺고 기술이전을 위한 활동을 유지했습니다. 이와 같은 사업개발 활동 및 판매 전략의 성과로, 당사는 피부약 전문 비상장사로 일본 피부 관련 전문의약품 시장 매출의 38%를 차지하고 있는 일본 제약사인 마루호와 2023년 10월 GI-301의 일본 내 개발 및 상업화에 대한 전용실시권 계약을 추가로 체결했습니다.
마. 수주상황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
5. 위험관리 및 파생거래
당사가 노출되어 있는 재무위험 및 이러한 위험이 회사의 미래 성과에 미칠 수 있는 영향은 다음과 같습니다.
|
위험 |
노출 위험 |
측정 |
관리 |
|
시장위험-환율 |
미래 상거래 기능통화 이외의 표시통화를 갖는 금융자산 및 금융부채 |
현금흐름 추정 민감도 분석 |
통화선도 및 통화옵션 |
|
신용위험 |
현금성자산, 채무상품 |
연체율 분석 |
은행예치금 다원화, 신용한도 |
|
신용등급 |
채무상품 투자지침 |
||
|
유동성위험 |
미지급금, 리스부채 |
현금흐름 추정 |
차입한도 유지 |
가. 시장위험
(1) 외환위험
당사는 국제적으로 영업활동을 영위하고 있기 때문에 외환 위험, 특히 주로 미국 달러화와 관련된 환율 변동 위험에 노출돼 있습니다.
보고서 작성기준일 현재 외환 위험에 노출되어 있는 회사의 금융자산ㆍ부채의 내역은 다음과 같습니다.
| (단위 : USD, AUD, 천원) |
| 구분 | 통화 | 당분기말 | 전기말 | ||
| 외화금액 | 원화환산액 | 외화금액 | 원화환산액 | ||
| 미지급금 | USD | 922,938 | 1,217,909 | 491,170 | 633,314 |
| AUD | 440 | 401 | - | - | |
보고서 작성기준일 현재 다른 모든 변수가 일정하고 각 외화에 대한 원화의 환율 10% 변동 시 회사의 세후 이익 및 자본에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 세후 이익에 대한 영향 | 자본에 대한 영향 | |||
| 당분기 | 전기 | 당분기 | 전기 | ||
| USD | 상승시 | (121,791) | (63,331) | (121,791) | (63,331) |
| 하락시 | 121,791 | 63,331 | 121,791 | 63,331 | |
| AUD | 상승시 | (40) | - | (40) | - |
| 하락시 | 40 | - | 40 | - | |
나. 신용 위험
신용위험은 기업 및 개인 고객에 대한 신용거래 및 채권 뿐 아니라 현금성자산, 채무상품의 계약 현금흐름, 예치금 등에서도 발생합니다.
(1) 위험관리
당사는 신용위험을 회사 차원에서 관리합니다. 은행 및 금융기관의 경우 A 신용등급 이상과만 거래합니다.
기업 고객의 경우 외부 신용등급을 확인할 수 있는 경우 동 정보를 사용하고 그 외의 경우에는 내부적으로 고객의 재무상태와 과거 경험 등을 근거로 신용등급을 평가합니다. 고객별 한도는 내부 및 외부 신용등급에 따라 이사회가 정한 한도를 적용합니다. 경영진은 이러한 고객별 한도의 준수 여부를 정기적으로 검토합니다.
당사의 신용위험은 개별 고객, 산업, 지역 등에 대한 유의적인 집중은 없습니다.
당사가 보유하는 채무상품은 모두 낮은 신용위험의 상품에 해당합니다. 이러한 채무상품들에 대해서는 신용등급을 모니터링하여 신용위험의 하락을 평가하고 있습니다.
보고서 작성기준일 및 전기말 현재 신용위험에 노출된 회사의 금융자산은 다음과 같으며, 손상되지 않은 금융자산의 신용위험에 대한 최대 노출정도를 표시하고 있습니다.
| (단위: 천원) |
| 구분 | 당분기말 | 전기말 |
| 현금성자산 | 12,199,224 | 8,543,303 |
| 당기손익-공정가치 측정 금융자산(유동) | 2,246,610 | 9,186,925 |
| 기타유동금융자산 | 12,029,429 | 28,682,741 |
| 기타비유동금융자산 | 9,830,043 | 728,552 |
| 합계 | 36,305,306 | 47,141,521 |
※ 당기손익-공정가치 금융자산 중 지분상품은 신용위험에 대하여 노출되어 있지 않으므로 제외하였습니다.
(2) 금융자산 손상
회사는 기대신용손실 모형이 적용되는 다음의 금융자산을 보유하고 있습니다.
ㆍ상각후원가로 측정하는 기타 금융자산
현금성자산도 손상 규정의 적용대상에 포함되나 식별된 기대신용손실은 유의적이지 않습니다.
보고서 작성기준일 현재 당사의 손실충당금 변동금액 및 잔액은 없습니다.
(3) 당기손익-공정가치 측정 금융자산
당사는 당기손익-공정가치 측정 금융자산에 대한 신용위험에도 노출되어 있습니다. 보고서 작성기준일 현재 당사의 관련 최대노출금액은 해당 장부금액입니다.
다. 유동성 위험
경영진은 예상현금흐름에 기초하여 추정되는 현금 및 현금성자산과 차입금 한도 약정을 모니터링하고 있습니다. 또한 당사의 유동성 위험 관련 정책은 주요 통화별 필요 현금흐름을 추정하여 이를 충족하기 위한 유동성 자산의 현황을 고려하고, 유동성비율을 내부 및 외부 감독 기관 등의 요구사항을 충족하고 자금조달계획을 실행하기 위해 관리합니다. 보고서 작성기준일 현재 당사의 약정된 차입금이 없습니다.
(1) 만기분석
유동성 위험 분석에서는 회사의 다음의 금융부채를 계약상 만기별로 구분하였습니 다.
| (단위: 천원) |
| 당분기말 | 장부금액 | 1년 이하 | 1년~2년 | 2년~5년 | 5년초과 | 합계 |
|---|---|---|---|---|---|---|
| 기타금융부채 | 6,639,723 | 3,559,365 | 901,389 | 2,123,544 | 1,040,908 | 7,625,206 |
| 전환사채 | 8,329,288 | - | 10,000,000 | - | - | 10,000,000 |
| 합계 | 14,969,011 | 3,559,365 | 10,901,389 | 2,123,544 | 1,040,908 | 17,625,206 |
※ 해당 금융부채의 잔존만기별 현금흐름은 할인되지 않은 명목금액으로서 이자지급액을 포함하고 있습니다.
※ 전환사채는 사채권자의 조기상환청구권을 고려한 만기이며, 계약상 만기는 발행일로부터 5년입니다.
| (단위: 천원) |
| 전기말 | 장부금액 | 1년 이하 | 1년~2년 | 2년~5년 | 5년초과 | 합계 |
|---|---|---|---|---|---|---|
| 기타금융부채 | 7,893,827 | 4,615,993 | 853,572 | 2,318,676 | 1,340,717 | 9,128,958 |
※ 해당 금융부채의 잔존만기별 현금흐름은 할인되지 않은 명목금액으로서 이자지급액을 포함하고 있습니다.
라. 자본 위험 관리
당사의 자본 관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본 비용을 절감하기 위해 최적의 자본구조를유지하는 것입니다.
당사는 자본관리지표로 부채비율을 이용하고 있으며 이 비율은 총부채를 총자본으로나누어 산출하고 있으며 총부채 및 총자본은 재무제표의 금액을 기준으로 계산합니다. 회사는 외부적으로 강제된 자기자본규제의 대상은 아닙니다.
보고서 작성기준일 및 전기말 현재 부채비율은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기말 | 전기말 |
|---|---|---|
| 부채 (A) | 17,245,492 | 9,636,201 |
| 자본 (B) | 47,572,831 | 71,704,011 |
| 부채비율 (A/B) | 36.25% | 13.44% |
6. 주요계약 및 연구개발활동
가. 주요계약
(1) 라이선스 아웃 (License-out) 계약
보고서 작성기준일 현재 당사가 체결 중인 라이선스 아웃 계약의 현황은 아래와 같습니다.
|
품목 |
계약 상대방 |
대상 지역 |
계약내용 |
계약 |
계약 |
총 계약 금액 |
수취 금액 |
진행 단계 |
|
GI-101 |
심시어 (Simcere Pharmaceutical) |
중국, 홍콩, |
독점적 개발 및 상업화 권리 |
2019년 |
특허 |
총 7억9천만USD |
비공개 |
Pre-IND (중국) |
|
GI-101 |
(주)지아이셀 |
한국 |
면역세포치료제와의 병용에 한정하여 |
2019년 |
특허 |
총 83억원 |
6억원 |
임상 1상 (한국) |
|
전세계 |
면역세포치료제 제조공정 용도에 대한 |
|||||||
|
GI-301 |
(주)유한양행 |
전세계 (일본 제외) |
전용실시권 |
2020년 |
특허 |
총 1조 4,090억원 |
200억원 |
임상1상 |
| GI-301 | 마루호 (Maruho) |
일본 | 전용실시권 | 2023년 10월 16일 |
로열티 만료일 (특허만료일 또는 첫 판매 후 12년 중 나중에 도래하는 시점) |
총 221백만USD (계약금 및 개발, 상업화 마일스톤 포함) |
비공개 (양사 합의) |
임상 1상 waived (일본) |
1) 품목: GI-101
ⓛ 심시어(Simcere Pharmaceutical)
|
1. 계약상대방 |
심시어(Simcere Pharmaceutical) / 중국 |
|
2. 계약내용 |
중국지역(홍콩, 마카오, 대만포함)에서의 대상기술에 대한 독점적 개발 및 상업화 권리 |
|
3. 대상지역 |
중국, 홍콩, 마카오, 대만 |
|
4. 계약기간 |
계약체결일: 2019년 11월 28일 |
|
5. 총 계약금액 |
USD 790,000,000 / 경상로열티 별도 |
|
6. 대상기술 |
CD80과 IL2v를 포함하는 이중융합단백질 |
|
7. 개발진행경과 |
Pre-IND(중국) |
|
8. 기타사항 |
- |
② (주)지아이셀
|
1. 계약상대방 |
(주)지아이셀 / 한국 |
|
2. 계약내용 |
국내지역에서의 면역세포치료제와 GI-101의 병용투여에 대한 전용실시권에 대한 계약 전세계지역에서의 면역세포치료제의 제조공정에 GI-101의 사용에 대한 전용실시권에 대한 계약 |
|
3. 대상지역 |
면역세포치료제와 GI-101의 병용투여에 대한 전용실시권 (국내) 면역세포치료제의 제조공정에 GI-101의 사용에 대한 전용실시권(전세계) |
|
4. 계약기간 |
계약체결일: 2019년 07월 15일 |
|
5. 총 계약금액 |
83억원 / 상업화 단계의 마일스톤 별도, 경상로열티 별도 |
|
6. 대상기술 |
CD80과 IL2v를 포함하는 이중융합단백질 |
|
7. 개발진행경과 |
임상1상(한국) |
|
8. 기타사항 |
- |
2) 품목: GI-301
① (주)유한양행
|
1. 계약상대방 |
(주)유한양행 / 한국 |
|
2. 계약내용 |
GI-301에 대한 공동연구 및 전세계 지역(일본 제외)에서의 전용실시권 계약 |
|
3. 대상지역 |
일본을 제외한 전세계 지역 |
|
4. 계약기간 |
계약체결일: 2020년 07월 01일 |
|
5. 총 계약금액 |
14,090억원 / 경상로열티 별도 |
|
6. 대상기술 |
알레르기 질환 치료제 'GI-301' |
|
7. 개발진행경과 |
임상1상(한국) |
|
8. 기타사항 |
- |
② 마루호(Maruho)
|
1. 계약상대방 |
마루호(Maruho) / 일본 |
|
2. 계약내용 |
GI-301에 대한 일본 내 개발 및 상업화 권리에 대한 전용실시권 계약 |
|
3. 대상지역 |
일본 |
|
4. 계약기간 |
계약체결일: 2023년 10월 16일 |
|
5. 총 계약금액 |
USD 221,000,000 / 경상로열티 별도 |
|
6. 대상기술 |
알레르기 질환 치료제 'GI-301' |
|
7. 개발진행경과 |
임상 1상 waived (일본) |
|
8. 기타사항 |
- |
(2) 라이선스 인(License-in) 계약
보고서 작성기준일 현재 당사가 체결 중인 라이선스 인 계약의 현황은 아래와 같습니다.
|
기술/제품 명칭 |
계약 상대방 |
대상 지역 |
계약 체결일 |
|
다중항체 또는 다중융합단백질 의약품 |
(주)와이바이오로직스 |
전세계 |
2020년 06월 22일 |
1) 품목: 다중항체 또는 다중융합단백질
① (주)와이바이오로직스
|
1. 계약상대방 |
(주)와이바이오로직스 / 한국 |
|
2. 계약내용 |
인간항체 서열에 관한 특허권자/출원인인 와이바이오로직스가 기술도입자인 지아이이노베이션에다중항체 또는 다중융합단백질을 개발하고 사업화 할 수 있는 통상실시권을 부여 |
|
3. 대상지역 |
전세계 |
|
4. 계약기간 |
계약체결일 : 2020년 06월 22일 계약종료일 : 양사 합의에 의해 비공개 |
|
5. 총 계약금액 |
양사 합의에 의해 계약 규모 비공개 |
|
6. 대상기술 |
항체서열 4종 |
|
7. 개발진행경과 |
후보물질발굴 단계 |
|
8. 기타사항 |
- |
(3) 공동연구개발 계약
보고서 작성기준일 현재 당사가 체결한 주요 공동연구개발 계약의 현황은 아래와 같습니다.
|
품목 |
계약 상대방 |
계약내용 |
계약 체결일 |
|
면역항암제 (GI-10N) |
(주)메디라마 |
항체 서열 2종의 전부 또는 일부를 포함한 다중항체 |
2021년 12월 07일 |
1) 품목: 면역항암제(GI-10N)
① (주)메디라마
|
1. 계약상대방 |
(주)메디라마 / 한국 |
|
2. 계약내용 |
지아이이노베이션이 소유하거나 실시권 허여할 수 있는 항체 서열 2종의 전부 |
|
3. 대상지역 |
- |
|
4. 계약기간 |
계약체결일 : 2021년 12월 07일 계약종료일 : 양사 합의에 의해 비공개 |
|
5. 총 계약금액 |
양사 합의에 의해 계약 규모 비공개 |
|
6. 대상기술 |
의약품 후보물질 2건 |
|
7. 개발진행경과 |
비임상 |
|
8. 기타사항 |
GI-101/GI-102 이외의 후속 면역항암제 파이프라인 (GI-108 포함) |
나. 연구개발활동
(1) 연구개발활동의 개요
당사는 융합단백질을 기반으로 차세대 면역치료제를 연구 개발하는 생명공학회사로 의약/바이오 분야 기초 과학자, 공정개발 전문가, 임상 개발 및 기술이전 전문가 등 바이오 신약 연구개발 및 기술사업화 분야 전문가들로 구성되어 있으며, 이를 바탕으로 융합 단백질 신약 발굴을 위한 플랫폼 기술과 고유의 공정개발 기술, 목표 시장의 미충족 의료 수요에 기반한 임상 개발 역량을 확보하고 있습니다.
(2) 연구개발 담당조직
1) 연구개발 조직 개요
보고서 작성기준일 현재 당사 연구개발 조직은 장명호 사장 총괄의 임상중개전략부문, 디스커버리 부문과 조영규 부사장 총괄의 SMART 플랫폼 부문 및 R&D 부문으로 구성되어 있습니다. 각 부분은 유기적인 협력을 통해 효율적인 연구개발 전략을 수립하고 신속한 기술이전 진행을 가능케 하고 있습니다. 당사의 연구개발조직은 2018년 05월 한국산업기술진흥협회로부터 기업부설연구소로 인증 받아 운영 중에 있습니다.
2) 연구개발 조직 구성
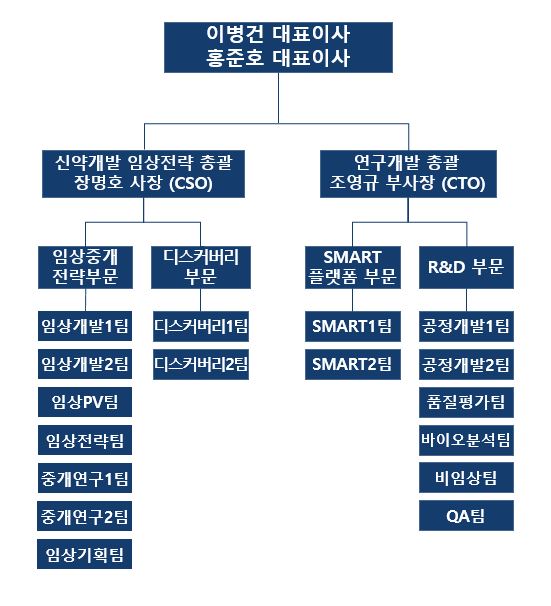 |
|
연구개발부문 조직도 |
3) 연구개발 인력 현황
보고서 작성기준일 현재 당사는 박사급 22명, 석사급 30명 등 총 65명의 연구개발 인력을 보유하고 있으며, 그 현황은 아래와 같습니다.
[연구개발인력 현황]
|
(기준일 : |
2024년 09월 30일) |
(단위: 명) |
|
구분 |
인원 |
|||
|
박사 |
석사 |
학사 |
합계 |
|
|
임상중개전략부문 |
9 | 9 | 8 | 26 |
|
디스커버리부문 |
3 | 5 | 0 | 8 |
|
R&D부문 |
8 | 11 | 3 | 22 |
|
SMART플랫폼부문 |
2 | 5 | 2 | 9 |
|
합계 |
22 | 30 | 13 | 65 |
※ 연구개발조직에 포함되는 인력 중 비연구인력은 제외하였습니다.
4) 주요 연구개발인력현황
보고서 작성기준일 현재 당사의 연구개발을 담당하는 인력 중 임원 (미등기 포함)의 주요 이력은 아래와 같습니다.
|
(기준일 : |
2024년 09월 30일) |
|
성명 |
직위 |
담당업무 |
주요경력 |
주요연구실적 |
| 장명호 | 사장 | 신약개발 임상전략 총괄 |
(주)지아이이노베이션 신약개발 임상전략 총괄 사장, 현재 (주)프로젠 CSO (주)제넥신 Scientific Advisor IBS 수석연구원 Osaka Univ. 의과대학 부교수 Osaka Univ. 면역학 박사 |
이중융합단백질 신약개발 마이크로바이옴 신약개발 (대사질환 및 크론병) 항바이러스 백신 개발 |
| 조영규 | 부사장 | 연구개발 총괄 및 R&D부문장 |
(주)지아이이노베이션 연구개발 총괄 및 R&D부문장, 현재 (주)와이바이오로직스 부사장 (주)한독 연구위원 포항공과대학교 분자면역학 박사 |
지속형 융합단백질 개발 항체 치료제 개발 이중항체 및 이중융합단백질 개발 단백질 치료제의 TPP, CMC, 전임상 |
| 고영준 | 부사장 | 임상중개전략부문장 | (주)지아이이노베이션 임상중개전략부문장, 현재 동국대학교 한의학과 조교수 (주)삼성전자 전문연구원 카이스트(KAIST) 의과학 박사 |
GI-101 비임상 기전 연구 외부 연구기관 협업 및 공동연구 관리, 국가 연구과제 관리, 차세대 Pipeline 발굴 임상 시험을 위한 IB 작성 파트너사 및 투자사 Due Diligence 관련자료 정리 및 관리 |
| 오영민 | 전무 | SMART플랫폼부문장 | (주)지아이이노베이션 SMART플랫폼부문장, 현재 (주)제넥신 책임연구원 (주)대웅제약 책임연구원 포항공과대학교 생명과학 박사 |
플랫폼 생산세포주 기술개발 SMART-cLego, Selex 기술개발 GI-101 이중융합단백질 개발, GI-10N, 20N, 30N 이중융합항체 개발 세포치료제 개발 |
| 윤나리 | 전무 | 임상중개전략부문장 | (주)지아이이노베이션 임상중개전략부문장, 현재 (주)한미약품 Project Leader IQVIA 전략 컨설턴트 성균관대학교 약학 박사 |
단백질 신약 임상개발 전략수립 단백질 신약 기술이전 당뇨 비만 대사질환 글로벌 임상연구 포트폴리오 분석 약가 수립 기업 인수합병 등 전략 컨설팅 |
| 이경화 | 상무 | 비임상팀장 | (주)지아이이노베이션 비임상팀장, 현재 서울대학교 시스템면역의학연구소 기획팀장 (주)프로셀제약 책임연구원 배제대학교 화학 박사 |
나노바디 개발, 재조합 단백질치료제 개발 항암후보물질 발굴 및 기전 연구 DNA 손상/회복 연구 항산화 단백질 작용기전 연구 |
| 김국환 | 상무 | 디스커버리부문장 | (주)지아이이노베이션 디스커버리부문장, 현재 (주)지아이이노베이션 디스커버리팀장 연세대학교 의생명과학부 연구조교수 부산대학교 분자생물학 박사 |
당뇨, 비만 치료제 및 제어 기전 연구 비알콜성지방간염 치료제 및 제어 기전 연구 자가포식 제어 기전 및 치료제 개발 연구 |
| 김지수 | 이사 | 품질평가팀장 /바이오분석팀장 |
(주)지아이이노베이션 품질평가팀장/바이오분석팀장, 현재 (주)삼성바이오에피스 전문 (주)셀트리온 과장 고려대학교 생명공학 박사 |
항체 및 재조합 단백질 기반 바이오시밀러 및 신약개발 단백질의약품 면역학적, 생물학적 특성, 비임상/임상 약동력학 및 면역원성 분석 프로테오믹스 기반 질병/노화 관련 바이오마커 발굴 중간엽줄기세포 분화 및 배양액 치료효능 연구 |
| 이우열 | 이사 | 임상기획팀원 | (주)지아이이노베이션 임상기획팀원, 현재 신촌세브란스병원 임상약리학 강사 신촌세브란스병원 임상약리학 전공의 연세대학교 의과대학 박사 |
GI-101 국내외 임상시험 약물 감시업무 GI-101 PK /PD model development and simulation GI-101 Clinical trial strategy development |
| 김수현 | 이사 | 공정개발1팀장 | (주)지아이이노베이션 공정개발1팀장, 현재 지아이셀 세포제조배양팀팀장 삼성바이오로직스 연구원 고려대학교 분자생물학 석사 |
바이오시밀러 배양공정개발 항바이러스 백신 배양공정개발 이중융합단백질 배양공정개발 세포치료제 배양공정개발 |
| 이우형 | 이사 | 임상기획팀장 | (주)지아이이노베이션 임상기획팀장, 현재 IQVIA Singapore 임상연구담당 홍콩과기대학교(HongKong University of Science and Technology, MBA) 서울대학교 약학대학 박사 |
바이오신약 임상수행 및 개발(당뇨, 대사질환) 백신 및 감염병 임상 수행 신생혈관억제화합물 및 항염증 화합물 연구 제약/의료기기 상업화 전략 수립 |
| 임신생 | 이사 | QA팀장 |
(주)지아이이노베이션 QA팀장, 현재 (주)지아이이노베이션 QC/QA팀장 서울대학교 구강악안면외과 연구실 |
연구개발 품질시스템 구축 및 관리 연구개발 문서 검토 및 관리 단백질의약품품질시험법 개발 및 단백질특성분석시험 검토 위·수탁 제조 및 품질시험 문서 검토 및 관리 |
※ 작성기준일 이후 변동은 'VIII. 임원 및 직원 등에 관한 사항-1. 임원 및 직원 등의 현황-가. 임원 현황-(4) 미등기임원의 변동을 참조하시기 바랍니다.
(3) 연구개발비용
|
(단위 : 천원) |
|
구분 |
제08기 3분기 (2024년 3분기) |
제07기 |
제06기 |
|
|
비용의 |
인건비 |
4,157,304 | 5,253,359 | 5,023,328 |
|
지급수수료 |
19,127,891 | 32,824,042 | 44,446,706 | |
|
소모품비 |
2,131,170 | 3,696,237 | 8,336,583 | |
|
기타 |
670,690 | 670,782 | 599,787 | |
|
연구개발비용 합계 |
26,087,055 | 42,444,420 | 58,406,404 | |
|
(정부보조금) |
(178,072) | (2,299,090) | (2,402,428) | |
|
보조금 차감 후 금액 |
25,908,983 | 40,145,330 | 56,003,976 | |
|
회계처리내역 |
판매비와 관리비 |
25,908,983 | 40,145,330 | 56,003,976 |
|
제조경비 |
- | - | - | |
|
개발비(무형자산) |
- | - | - | |
|
회계처리금액 합계 |
25,908,983 | 40,145,330 | 56,003,976 | |
|
연구개발비 / 매출액 비율 |
10,703% | 755 % | 1,600 % | |
(4) 연구개발 진행 현황 및 향후 계획
보고서 작성기준일 현재 당사가 연구개발 진행 중인 현황은 아래와 같습니다.
| 구분 | 품목 |
적응증 |
현재 진행단계 | 연구시작일 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||
| 바이오 | 신약 | 항암제 |
GI-101 |
임상1/2상(한국) 임상1/2상(미국) |
2021년 04월 / 2023년 06월(변경승인) 2021년 06월 / 2023년 05월(변경승인) |
2017년 | 라이선스 아웃 및 공동개발 |
| 항암제 |
GI-102 |
임상1/2상(한국) 임상1/2상(미국) |
2023년 02월 / 2024년 10월(변경승인) 2023년 01월 |
2019년 | 특허등록 정맥/피하주사제형 |
||
|
항암제 |
GI-108 | 임상1/2상 IND 신청(한국) | - | 2021년 | 공동개발 | ||
| 항암제 |
GI-104 |
후보물질 도출 | - | 2021년 | 특허등록 | ||
|
알레르기치료제 |
GI-301 |
임상1a상(한국) 임상1b상(한국) |
2021년 07월 2022년 08월 |
2018년 | 라이선스 아웃 및 공동개발 | ||
| 알레르기치료제 | GI-305 | 후보물질 도출 | - | 2024년 | 특허등록 | ||
| 항암제 | GI-128 | 후보물질 도출 | - | 2024년 | 특허출원 | ||
| 비만치료제 | GI-213 | 유효-선도후보 도출 | - | 2024년 | 특허출원 | ||
1) GI-101
|
구분 |
바이오 신약 |
|
적응증 |
고형암 |
|
작용기전 |
ㆍGI-101은 CD80에 의해서 면역관문인 CTLA-4의 작용을 억제해 체내 면역 작용을 재활성화 시킴 (*)TPP: GI-101 단독/방사선과 병용요법/VEGF 억제제와 병용요법/면역관문억제제와 병용요법 |
|
제품의 특성 |
ㆍGI-101은 GI-SMART™기술을 이용해 최초로 제작된 이중융합 단백질로 CTLA-4의 저해와 IL-2 수용체의 자극을 통한 ㆍ높은 제품 안정성과 고생산성 및 고순도의 안정된 생산 공정(CDMO) 확보 및 역량 활용 ㆍ원숭이 및 랫트를 이용한 독성 실험에서 안전성 확인 |
|
진행경과 |
ㆍ한국 임상1/2상 IND(임상시험계획) 승인(2021년 04월) ㆍ미국 임상1/2상 IND(임상시험계획) 승인(2021년 06월) ㆍ미국 임상1/2상 IND(임상시험계획) 변경 승인(2023년 05월) |
|
향후계획 |
ㆍ기술이전 상대방 심시어(Simcere Pharmaceutical)에서 중국임상 진행 ㆍ글로벌 제약사와 라이선스 아웃 계약 추진 (중국 제외 전세계 판권) |
|
경쟁제품 |
ㆍ앨커미스(Alkermes)의 Nemvaleukin alfa: 임상 3상 종료 |
| 관련논문 등 |
ㆍGI101, A novel CD80-IgG4-IL2 variant bispecific protein, inhibits tumor growth and induces anti-tumor ㆍComprehensive preclinical study on GI-101, a novel CD80-IgG4-IL2 variant protein, as a therapeutic ㆍPreliminary results of GII-101-P101 (Keynote-B59): GI-101 (CD80-IgG4 Fc-IL2v) as a single agent and in combination with pembrolizumab in patients with advanced and/or metastatic solid tumors(SITC 2022) |
| 시장규모 | 전세계 면역항암제 시장규모: $450억(2021년) → $1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
| 기타사항 | ㆍ2019년11월 전임상 단계에서 심시어(Simcere Pharmaceutical) 중국지역 기술이전(심시어: 중국 정부 지정 중개의학 및 혁신 신약 개발의 중심 연구소, 홍콩시장 상장사) ㆍGI-101 물질 및 용도 특허 등록(한국, 미국 등) ㆍ키트루다 병용 임상을 위한 MSD사의 무상공급 지원 ㆍKDDF 임상 70억원 과제 선정 |
2) GI-102
|
구분 |
바이오 신약 |
|
적응증 |
고형암 |
|
작용기전 |
종양미세환경에서 조절 T 세포를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진함 |
|
제품의특성 |
종양미세환경에서 항암작용에 저해가 되는 조절 T 세포의 증식을 최소화하며 활성을 억제하고, 반면에 항암활성을 갖는 효과 T 세포와 자연살해(NK) 세포의증식 및 활성은 촉진함으로써 다양한 고형암의 효과적인 치료제로 사용 |
|
진행경과 |
ㆍ한국 임상 1/2상 IND 승인(2023년 02월) |
|
향후계획 |
ㆍ글로벌 제약사와 라이센스 아웃 계약 추진 |
|
경쟁제품 |
ㆍ앨커미스(Alkermes)의 Nemvaleukin alfa: 임상 3상 종료 |
|
관련논문 등 |
- |
|
시장규모 |
전세계 면역항암제 시장규모: $450억(2021년) → $1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
|
기타사항 |
ㆍ미국 특허 등록 ㆍ정맥/피하주사제형으로 개발 ㆍ키트루다 병용 임상을 위한 MSD사의 무상공급 지원 |
3) GI-108
|
구분 |
바이오 신약 |
|
적응증 |
고형암 |
|
작용기전 |
대사면역에 관여하는 CD73를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진함 |
|
제품의특성 |
종양미세환경의 암세포와 면역세포에 발현하여 항암작용에 저해가 되는 대사면역 표적인 CD73를 제어하여 효과 T 세포 및 NK 세포의 활성을 회복하고, 항암활성을 갖는 효과 T 세포와 NK 세포의 증식 및활성은 촉진함으로써 다양한 고형암의효과적인 치료제로 사용 |
|
진행경과 |
ㆍ임상 1/2상 IND 신청 완료(2024년 9월) |
|
향후계획 |
ㆍ임상 1/2상 진행 ㆍ글로벌 제약사와 라이센스 아웃 계약 추진 |
|
경쟁제품 |
ㆍ앨커미스(Alkermes)의 Nemvaleukin alfa: 임상 3상 종료 ㆍ아스트라제네카(AstraZeneca)의 올레클루맙(oleclumab): 임상 3상 진행중 |
|
관련논문 등 |
- |
|
시장규모 |
전세계 면역항암제 시장규모: $450억(2021년) → $1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
|
기타사항 |
ㆍKDDF 전임상 20억원 과제 선정 ㆍ메디라마와 임상공동개발 ㆍ한국 특허 출원 |
4) GI-104
|
구분 |
바이오 신약 |
|
적응증 |
고형암 |
|
작용기전 |
면역관문인 LAG-3를 억제하고 효과 T 세포와 자연살해(NK) 세포의 증식과 활성은 촉진함 |
|
제품의특성 |
종양미세환경에서 항암작용에 저해가 되는 면역관문인 LAG-3를 제어하여 효과 T 세포의 활성을 회복하고, 항암활성을 갖는 효과 T 세포와 자연살해(NK) 세포의 증식 및 활성은 촉진함으로써 다양한 고형암의 효과적인 치료제로 사용 |
|
진행경과 |
후보물질 도출 |
|
향후계획 |
ㆍ2024년 4분기까지 생산세포주 및 공정개발 ㆍ2025년 4분기까지 전임상시험 ㆍ2026년 임상 1/2상 IND 신청 |
|
경쟁제품 |
앨커미스(Alkermes)의 Nemvaleukin alfa: 임상 3상 종료 |
|
관련논문 등 |
- |
|
시장규모 |
전세계 면역항암제 시장규모: $450억(2021년) → $1,427억(2027년) ※ 출처: Thematic Research Immuno Oncology (GlobalData) |
|
기타사항 |
한국 특허 등록 |
5) GI-301
|
구분 |
바이오 신약 |
|
적응증 |
알레르기 질환(아토피 피부염, 알레르기 비염, 천식 등) |
|
작용기전 |
ㆍ알레르기 질환을 유발하는 핵심인자인 IgE에 높은 결합력으로 부착하여, 체내 IgE 수용체와의 결합을 방해함 ㆍGI-301은 IgE와의 결합에 있어 오말리주맙에 비해 약 70배 강력한 결합력을 보이며 결합 후 해리가 잘 일어나지 않아, 졸레어® 대비 더 적은 양으로 더 오랜 약물 효과 지속기간을 가질 수 있음 ㆍIgE와 CD23(FcεRII)의 결합을 졸레어®와 동등하게 효과적으로 차단한다는 것을 확인 ㆍ원숭이, 개, 마우스 등 여러 동물 군의 IgE에도 결합력 보유 ㆍ만성 특발성 두드러기 환자의 혈청에서 IgE를 효과적으로 감소시킴 |
|
제품의 특성 |
ㆍGI-301은 인간 IgE에 높은 결합 친화력을 가지는 Fcε RI α사슬의 ECD를 이용해, 생체 내 내재성(endogenouse) Fcε RI와 IgE의 결합을 효과적으로 저해하여 IgE에 의해 매개되는 알레르기 질환을 효과적으로 타깃함 ㆍIgE에 대한 결합력이 졸레어® 보다 약 70배 이상 높고 결합이 지속적으로 유지되어 비만세포의 탈과립억제 능력이 탁월함 ㆍ원숭이 실험에서 기저 IgE 레벨이 1,000 IU/ml이상인 개체에서도 단회투여 후 약 7일 동안 IgE를 완전히 억제함 ㆍIgE의 Fcε RI 결합을 방해할 뿐만 아니라, Fcε RI에 대한 자가항체의 기능을 저해함으로써 만성 특발성 두드러기 환자에서 비만세포의 탈과립 방지 가능 ㆍ부작용 우려 낮음 |
|
진행경과 |
ㆍ한국 임상1a상 완료 및 1b상 IND 승인 (2022년 08월) 및 진행중 ※ 임상시험 주체: 마루호(Maruho) |
|
향후계획 |
제3자 기술이전(sub-license) 추진: (주)유한양행이 GI-301의 글로벌 사업권을 제3자에 이전시 제3자 기술이전 조항에 따라, 수익금의 50%를 당사가 수령 |
|
경쟁제품 |
ㆍ로슈(Roche)/노바티스(Novartis)의 졸레어®(오말리주맙): 2003년 FDA 승인 |
| 관련논문 등 |
ㆍThe Novel Long-Acting IgE Trap-Fc Fusion Protein GI301 Elicits Therapeutic Synergy In Combination with Probiotics ㆍGI-301: a novel long-acting IgE Trap-Fc fusion protein for IgE-mediated allergic diseases (UCARE CONFERENCE 2019) ㆍCombined IgE neutralization and Bifidobacterium longum supplementation reduces the allergic response |
| 시장규모 | 전세계 알레르기 치료제(천식, 만성 두드러기, 아토피 피부염, 땅콩 알레르기, 알레르기 비염) 시장규모: $247억(2021년) → $398억(2027년) ※ 출처: Asthma Global Drug Forecast and Market Analysis to 2029; Chronic urticaria_AnnualSalesandForecast; Atopic Dermatitis AD 68 Market Analysis and Sales Forecast; Peanut Allergy Opportunity Analysis and Forecastst 2027; Allergic Rhinitis Immunotherapy Opportunity Analysis and Forecaststo2028 (GlobalData) |
| 기타사항 | ㆍ2020년 07월 전임상단계에서 유한양행 글로벌(일본 제외) 기술이전 ㆍ2023년10월 임상1상 단계에서 일본 마루호에 기술이전 (일본 지역) ㆍ물질 및 용도 특허 등록(한국, 일본 등) |
6) GI-305
|
구분 |
바이오 신약 |
|
적응증 |
알레르기 질환(아토피 피부염, 알레르기 비염, 천식 등) |
|
작용기전 |
IgE, FcεRIα의 자가항체 및 IL-4Rα 억제 |
|
제품의특성 |
알레르기질환을 매개하는 IgE 및 FcεRIα의 자가항체 억제하는 이중작용을 가짐으로써 기존 IgE 항체 치료제의 의학적 미충적 수요를 충족할 뿐만 아니라, |
|
진행경과 |
후보물질 도출 |
|
향후계획 |
ㆍ2025년 1분기까지 생산세포주 및 공정개발 ㆍ2027년 2분기까지 전임상시험 ㆍ2027년 3분기 임상 1상 IND 신청 |
|
경쟁제품 |
ㆍ로슈(Roche)/노바티스(Novartis)의 졸레어®(오말리주맙): 2003년 FDA 승인 ㆍ사노피(Sanofi)/리제네론(Regeneron)의 듀피젠트®(두필루맙): 2017년 FDA 승인 |
|
관련논문 등 |
- |
|
시장규모 |
전세계 알레르기 치료제(천식, 만성 두드러기, 아토피 피부염, 땅콩 알레르기, 알레르기 비염) 시장규모: $247억(2021년) → $398억(2027년) ※ 출처: Asthma Global Drug Forecast and Market Analysis to 2029; Chronic urticaria_AnnualSalesandForecast; Atopic Dermatitis AD 68 Market Analysis and Sales Forecast; Peanut Allergy Opportunity Analysis and Forecastst 2027; Allergic Rhinitis Immunotherapy Opportunity Analysis and Forecaststo2028 (GlobalData) |
|
기타사항 |
한국 특허 등록 |
(5) 연구개발 완료 실적
당사는 보고서 작성기준일 현재 해당사항 없습니다.
(6) 연구개발활동 및 판매 중단 현황
당사는 대사질환치료제 및 뇌질환치료제로써 GI-210을 개발하고 있었으나, 동일 시장내 경쟁력 있는 블록버스터 약물의 시장 확대에 따른 글로벌 경쟁력 감소와 당사의 임상 단계 파이프라인 (GI-101/GI-102, GI-301) 및 후속 파이프라인 (GI-128, GI-213)의 우선적 개발 전략에 따라 해당 파이프라인의 개발을 현재 중단하였습니다.
(7) 기타 연구개발 실적
당사는 보고서 작성기준일현재 해당사항 없습니다.
(8) 정부과제 수행실적
|
(단위 : 천원) |
|
연구과제명 |
주관부서 |
연구기간 |
정부출연금 |
비고 |
|
T 세포 기반의 범용 인플루엔자 백신 비임상시험 및 유효성 평가 (주1) |
한국보건산업진흥원 |
2020년 10월 06일 |
330,000 |
감염병 예방ㆍ치료 |
|
진행성 또는 전이성 고형암 환자를 대상으로 GI-101 단일요법 및 |
재단법인 국가신약개발사업단 |
2022년 03월 01일 |
3,500,000 |
국가신약 개발사업 |
|
대사면역항암 이중융합단백질 GI-108의 비임상 연구 및 IND 승인 |
재단법인 |
2022년 09월 01일 |
1,000,000 |
국가신약 개발사업 |
(주1) 해당 정부과제는 당사가 세부기관으로 참여하여 주관연구기관과 공동개발하는 건으로서 세부기관에 할당된 정부출연금을 기준으로 기재하였습니다.
7. 기타 참고사항
가. 지적재산권 현황
|
번호 |
구분 |
내용 |
대한민국 출원번호 |
대한민국 등록번호 |
적용제품 |
출원국 |
|
1 |
특허 |
IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 및 |
KR 10-2019-0113659 (2019년 09월 16일) |
KR 10-2201086 (2021년 01월 05일) |
GI-101 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩, 캐나다, 호주, 러시아, 브라질, 이스라엘 , 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
|
2 |
특허 |
IgE Fc 수용체의 알파서브유닛의 세포외 도메인, 이를 |
KR 10-2019-0002029 (2019년 01월 08일) |
KR 10-2038675 (2019년 10월 24일) |
GI-301 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩, 캐나다, 호주 ,러시아, 브라질, 이스라엘, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
|
3 |
특허 |
IgE Fc 수용체의 알파 서브유닛의 세포외 도메인을포함하는 약학적 조성물 |
KR 10-2019-0002037 (2019년 01월 08일) |
KR 10-2038672 (2019년 10월 24일) |
GI-301 |
대한민국, 대만 |
|
4 |
특허 |
프로바이오틱스 및 IgE에 결합능이 있는 폴리펩타이드를 포함하는 조성물 및 이의 용도 |
KR 10-2019-0004610 (2019년 01월 14일) |
KR 10-2038679 (2019년 10월 24일) |
GI-301 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩 , |
|
5 |
특허 |
폴리에틸렌이민 및 담즙산으로 구성되는 세포막융합활성을 지닌 양친성 고분자 회합체 |
KR 10-2009-0118416 (2009년 12월 02일) |
KR 10-1128108 (2012년 03월 12일) |
- |
대한민국 |
|
6 |
특허 |
IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 및 |
KR 10-2020-0162168 (2020년 11월 27일) |
KR 10-2400253 (2022년 05월 17일) |
GI-101 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 홍콩, 캐나다, 호주, 러시아, 브라질, 이스라엘, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
|
7 |
특허 |
IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 및 |
KR 10-2021-0035517 (2021년 03월 18일) |
KR 10-2440962 (2022년 09월 01일) |
GI-101 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 캐나다, 호주, 러시아, 브라질, 이스라엘, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 멕시코, 칠레, 사우디아라비아, 태국, 인도네시아, 베트남, 홍콩 |
|
8 |
특허 |
IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질을 |
KR 10-2020-0068456 (2020년 06월 05일) |
KR 10-2373965 (2022년 03월 08일) |
GI-101 |
대한민국, 대만, 미국, 유럽, 일본, 중국 |
|
9 |
특허 |
IL-2 단백질 및 CD80 단백질 단편 또는 이의 변이체를 |
KR 10-2021-0035067 (2021년 03월 18일) |
- |
GI-101 |
대한민국, 대만, 미국, 유럽, 중국 |
|
10 |
특허 |
IL-2 단백질 및 CD80 단백질을 포함하는 융합단백질 제제 |
KR 10-2021-0034747 (2021년 03월 17일) |
KR 10-2604984 (2023년 11월 20일) |
GI-101 |
대한민국, 대만, 미국, 유럽, 일본, 중국 |
|
11 |
특허 |
IgE Fc 수용체의 알파 서브유닛의 세포외 도메인을 |
KR 10-2020-0083486 (2020년 07월 07일) |
KR 10-2561135 (2023년 07월 25일) |
GI-301 |
대한민국, 미국, 유럽, 일본, 중국, 대만, 캐나다, 호주, 러시아, 브라질, 이스라엘, 홍콩, 인도, 싱가포르, 뉴질랜드, 남아프리카공화국, 말레이시아, 필리핀, 멕시코, 칠레, 페루 |
|
12 |
특허 |
IgE Fc 수용체의 알파 서브유닛의 세포외 도메인을 |
KR 10-2022-0028919 (2022년 03월 07일) |
- |
GI-301 |
대한민국, 미국, 유럽, 일본, 중국, 대만, |
|
13 |
특허 |
항 LAG3 항체 및 IL-2를 포함하는 융합단백질 및 |
KR 10-2021-0085076 (2021년 06월 29일) |
KR 10-2313505 (2021년 10월 08일) |
GI-104 |
대한민국, 미국, 유럽, 일본, 중국, 대만 |
|
14 |
특허 |
CD80 세포외도메인 및 항 LAG3 항체 단편을 포함하는 |
KR 10-2022-0005131 (2022년 01월 13일) |
KR 10-2461837 (2022년 10월 27일) |
GI-105 |
대한민국 |
|
15 |
특허 |
글루카곤-유사 펩타이드-1 및 인터루킨-1 수용체 |
KR 10-2021-0090377 (2021년 07월 09일) |
KR 10-2352336 (2022년 01월 13일) |
GI-210 |
대한민국, 대만, 미국, 유럽 |
| 16 | 특허 | 글루카곤-유사 펩타이드-1 및 인터루킨-1 수용체 길항제를 포함하는 융합단백질을 포함하는 퇴행성 뇌질환 예방 또는 치료용 약학 조성물 | KR 10-2023-0002186 (2023년 01월 06일) |
- | GI-210 | 대한민국, 미국, 유럽 |
|
17 |
특허 |
IgE Fc 수용체 알파서브유닛의 세포외 도메인 및 항-IL-4R 항체를 포함하는융합단백질 및 이의 용도 |
KR 10-2021-0092362 (2021년 07월 14일) |
KR 10-2468170 (2022년 11월 14일) |
GI-305 |
대한민국, 미국, 유럽, 일본, 중국 |
|
18 |
특허 |
항-CD73 항체 및 IL-2를 포함하는 융합단백질 및 이의 용도 |
KR 10-2023-0080204 (2023년 06월 22일) |
- |
GI-108 |
대한민국, 미국, 유럽, 일본, 중국 |
| 19 | 특허 | 락토바실러스 플란타룸 균주의 병용 요법 및 이를 이용한 암 치료 방법 | KR 10-2023-0125646 (2023년 09월 20일) |
KR 10-2669111 (2024년 05월 21일) |
GI-101 GI-102 |
대한민국 |
|
20 |
상표 |
GI Innovation |
KR 40-2017-0148758 (2017년 11월 22일) |
KR 40-1395669 (2018년 09월 10일) |
- |
대한민국 |
|
21 |
상표 |
GII |
KR 40-2017-0148756 (2017년 11월 22일) |
KR 40-1395668 (2018년 09월 10일) |
- |
대한민국 |
|
22 |
상표 |
GI 이노베이션 |
KR 40-2017-0148760 (2017년 11월 22일) |
KR 40-1395670 (2018년 09월 10일) |
- |
대한민국 |
|
23 |
상표 |
M+ Biologics |
KR 40-2018-0092810 (2018년 07월 06일) |
KR 40-1525929 (2019년 09월 27일) |
- |
대한민국 |
| 24 |
상표 |
M+ Biologics |
KR 40-2018-0092811 (2018년 07월 06일) |
KR 40-1492070 (2019년 06월 24일) |
- |
대한민국 |
| 25 |
상표 |
GI-SMARTab 지아이스마탭 |
KR 40-2020-0159846 (2020년 09월 09일) |
KR 40-1775995 (2021년 09월 14일) |
- |
대한민국 |
※ 미공개 특허의 경우, 지적재산권 보호를 위하여 표에서 제외하였습니다.
(주1) 비공개 파이프라인은 GI-20N으로 표기하였습니다.
(주2) 특허출원 국가 중 특허 등록된 국가는 밑줄 표시하였습니다.
III. 재무에 관한 사항
1. 요약재무정보
당사는 기업공시서식 작성기준/지침에 따라 소규모기업(최근 사업연도말 자산총액 1천억원 또는 최근 사업연도 매출액 500억원 미만)에 해당하여 요약재무정보 기재를 생략 합니다.
2. 연결재무제표
보고서 작성기준일 현재 해당사항 없습니다.
3. 연결재무제표 주석
보고서 작성기준일 현재 해당사항 없습니다.
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 8 기 3분기말 2024.09.30 현재 |
|
제 7 기말 2023.12.31 현재 |
|
(단위 : 원) |
|
제 8 기 3분기말 |
제 7 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
31,784,119,325 |
48,194,736,136 |
|
현금및현금성자산 |
12,199,223,577 |
8,543,302,531 |
|
당기손익-공정가치 측정 금융자산 |
5,202,359,781 |
9,186,925,092 |
|
기타금융자산 |
12,029,429,122 |
28,682,741,056 |
|
기타유동자산 |
2,204,712,725 |
1,481,005,817 |
|
당기법인세자산 |
148,394,120 |
300,761,640 |
|
비유동자산 |
33,034,203,898 |
33,145,475,850 |
|
유형자산 |
6,773,385,399 |
8,606,718,135 |
|
무형자산 |
1,487,600,516 |
1,619,200,493 |
|
관계기업투자 |
7,454,496,716 |
8,774,141,154 |
|
당기손익-공정가치 측정 금융자산 |
2,682,536,151 |
7,601,764,700 |
|
기타금융자산 |
9,830,043,234 |
728,552,493 |
|
기타비유동자산 |
4,806,141,882 |
5,815,098,875 |
|
자산총계 |
64,818,323,223 |
81,340,211,986 |
|
부채 |
||
|
유동부채 |
4,640,752,801 |
5,795,635,946 |
|
기타금융부채 |
3,517,692,453 |
4,574,627,027 |
|
기타 유동부채 |
1,123,060,348 |
1,221,008,919 |
|
비유동부채 |
12,604,739,466 |
3,840,564,898 |
|
비유동충당부채 |
434,031,926 |
400,725,711 |
|
순확정급여부채 |
719,388,372 |
58,174,304 |
|
전환사채 |
8,329,288,324 |
0 |
|
기타금융부채 |
3,122,030,844 |
3,319,199,831 |
|
기타 비유동 부채 |
0 |
62,465,052 |
|
부채총계 |
17,245,492,267 |
9,636,200,844 |
|
자본 |
||
|
자본금 |
22,539,591,000 |
11,035,150,000 |
|
주식발행초과금 |
277,603,024,895 |
476,405,207,862 |
|
기타자본항목 |
18,756,607,619 |
16,738,072,903 |
|
기타포괄손익누계액 |
(1,056,041) |
(1,056,041) |
|
이익잉여금(결손금) |
(271,325,336,517) |
(432,473,363,582) |
|
자본총계 |
47,572,830,956 |
71,704,011,142 |
|
자본과부채총계 |
64,818,323,223 |
81,340,211,986 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 8 기 3분기 2024.01.01 부터 2024.09.30 까지 |
|
제 7 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
(단위 : 원) |
|
제 8 기 3분기 |
제 7 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
영업수익 |
24,281,460 |
587,899,455 |
||
|
영업비용 |
13,820,904,713 |
36,101,415,473 |
11,765,909,390 |
45,144,788,547 |
|
영업이익(손실) |
(13,820,904,713) |
(36,077,134,013) |
(11,765,909,390) |
(44,556,889,092) |
|
금융수익 |
385,635,324 |
1,063,317,078 |
562,339,236 |
1,886,166,853 |
|
금융비용 |
175,312,453 |
2,552,454,546 |
145,585,951 |
370,941,179 |
|
기타수익 |
27,798,190 |
38,692,230 |
1,392,264,597 |
1,400,113,021 |
|
기타비용 |
812,266 |
4,749,246 |
3 |
893,574 |
|
지분법손익 |
(644,044,754) |
(1,296,609,194) |
(614,258,584) |
(2,267,063,708) |
|
법인세비용차감전순이익(손실) |
(14,227,640,672) |
(38,828,937,691) |
(10,571,150,095) |
(43,909,507,679) |
|
법인세비용(수익) |
0 |
0 |
0 |
0 |
|
당기순이익(손실) |
(14,227,640,672) |
(38,828,937,691) |
(10,571,150,095) |
(43,909,507,679) |
|
기타포괄손익 |
25,275,217 |
(23,035,244) |
(49,605,861) |
(79,260,194) |
|
후속적으로 당기손익으로 재분류되지 않는 항목 |
25,275,217 |
(23,035,244) |
(49,590,777) |
(79,245,110) |
|
지분법자본변동 |
25,275,217 |
(23,035,244) |
(49,590,777) |
(79,245,110) |
|
후속적으로 당기손익으로 재분류될 수 있는 항목 |
0 |
0 |
(15,084) |
(15,084) |
|
지분법자본변동 |
0 |
0 |
(15,084) |
(15,084) |
|
당기총포괄손익 |
(14,202,365,455) |
(38,851,972,935) |
(10,620,755,956) |
(43,988,767,873) |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(322) |
(879) |
(240) |
(1,025) |
4-3. 자본변동표
|
자본변동표 |
|
제 8 기 3분기 2024.01.01 부터 2024.09.30 까지 |
|
제 7 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
(단위 : 원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
주식발행초과금 |
기타자본항목 |
기타포괄손익누계액 |
결손금 |
자본 합계 |
|
|
2023.01.01 (기초자본) |
10,002,100,000 |
451,805,418,462 |
10,440,676,342 |
(1,078,848) |
(376,600,905,533) |
95,646,210,423 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(43,909,507,679) |
(43,909,507,679) |
|
지분법자본변동 |
0 |
0 |
0 |
(15,084) |
(79,245,110) |
(79,260,194) |
|
유상증자 |
1,000,000,000 |
23,946,914,000 |
0 |
0 |
0 |
24,946,914,000 |
|
무상증자 |
0 |
0 |
0 |
0 |
0 |
0 |
|
주식매수선택권의 행사 |
25,050,000 |
511,525,400 |
(196,413,900) |
0 |
0 |
340,161,500 |
|
전환사채의 발행 |
0 |
0 |
0 |
0 |
0 |
0 |
|
주식보상비용 |
0 |
0 |
5,828,477,483 |
0 |
0 |
5,828,477,483 |
|
결손금 보전 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2023.09.30 (기말자본) |
11,027,150,000 |
476,263,857,862 |
16,072,739,925 |
(1,093,932) |
(420,589,658,322) |
82,772,995,533 |
|
2024.01.01 (기초자본) |
11,035,150,000 |
476,405,207,862 |
16,738,072,903 |
(1,056,041) |
(432,473,363,582) |
71,704,011,142 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(38,828,937,691) |
(38,828,937,691) |
|
지분법자본변동 |
0 |
0 |
0 |
0 |
(23,035,244) |
(23,035,244) |
|
유상증자 |
429,185,500 |
9,517,485,570 |
0 |
0 |
0 |
9,946,671,070 |
|
무상증자 |
11,033,650,000 |
(11,090,547,520) |
0 |
0 |
0 |
(56,897,520) |
|
주식매수선택권의 행사 |
41,605,500 |
718,929,766 |
(213,267,197) |
0 |
0 |
547,268,069 |
|
전환사채의 발행 |
0 |
2,051,949,217 |
0 |
0 |
0 |
2,051,949,217 |
|
주식보상비용 |
0 |
0 |
2,231,801,913 |
0 |
0 |
2,231,801,913 |
|
결손금 보전 |
0 |
(200,000,000,000) |
0 |
0 |
200,000,000,000 |
0 |
|
2024.09.30 (기말자본) |
22,539,591,000 |
277,603,024,895 |
18,756,607,619 |
(1,056,041) |
(271,325,336,517) |
47,572,830,956 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 8 기 3분기 2024.01.01 부터 2024.09.30 까지 |
|
제 7 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
(단위 : 원) |
|
제 8 기 3분기 |
제 7 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(30,541,228,130) |
(35,078,305,671) |
|
영업활동에서 사용된 현금 |
(31,405,280,146) |
(36,447,741,384) |
|
이자의 수취 |
979,553,943 |
1,575,498,318 |
|
이자의 지급 |
(267,869,447) |
(235,205,725) |
|
법인세환급(납부) |
152,367,520 |
29,143,120 |
|
투자활동현금흐름 |
14,207,605,789 |
9,771,829,733 |
|
장단기대여금의 지급 |
(9,030,000,000) |
0 |
|
정기예적금의 취득 |
(25,000,000,000) |
(110,000,000,000) |
|
당기손익공정가치금융자산의 취득 |
(12,000,000,000) |
(7,000,000,000) |
|
유형자산의 취득 |
(16,751,191) |
(564,510,800) |
|
무형자산의 취득 |
0 |
(12,940,000) |
|
임차보증금의 지급 |
(20,268,750) |
(4,000,000) |
|
장단기대여금의 회수 |
111,000,000 |
300,000,000 |
|
정기예적금의 처분 |
43,000,000,000 |
117,000,000,000 |
|
당기손익공정가치금융자산의 처분 |
19,443,358,904 |
5,053,280,533 |
|
임차보증금의 회수 |
13,200,000 |
0 |
|
장기선급금의 지급 |
(292,933,174) |
0 |
|
단기금융상품의 취득 |
(2,000,000,000) |
(4,005,102,757) |
|
단기투자자산의 처분 |
0 |
9,005,102,757 |
|
재무활동현금흐름 |
19,989,543,387 |
25,103,918,710 |
|
유상증자 |
10,000,022,150 |
26,000,000,000 |
|
주식선택권의 행사 |
549,460,069 |
340,161,500 |
|
리스부채의 상환 |
(401,006,476) |
(402,692,175) |
|
신주발행비의 지급 |
(178,718,080) |
(1,053,086,000) |
|
정부보조금의 증가 |
19,785,724 |
219,535,385 |
|
전환사채의 발행 |
10,000,000,000 |
0 |
|
현금및현금성자산의순증가(감소) |
3,655,921,046 |
(202,557,228) |
|
기초현금및현금성자산 |
8,543,302,531 |
2,345,782,249 |
|
기말현금및현금성자산 |
12,199,223,577 |
2,143,225,021 |
5. 재무제표 주석
| 제 8(당)기 3분기 2024년 01월 01월부터 2024년 09월 30일까지 |
| 제 7(전)기 3분기 2023년 01월 01일부터 2023년 09월 30일까지 |
| 주식회사 지아이이노베이션 |
1. 회사의 개요
주식회사 지아이이노베이션(이하 "회사")는 2017년 07월 19일 설립되어 융합단백질을 이용한 신약 연구개발 및 제품화 판매업 그리고 신기술의 사용권 대여 및 양도 등을 주요사업으로 영위하고 있습니다. 당사는 서울특별시 송파구 문정동에 본사와 기술개발을 위한 연구시설을 두고 있습니다.
회사는 2023년 03월 30일 한국거래소가 개설한 코스닥시장에 상장하였으며 수차례의 유ㆍ무상증자, 종류주식 발행을 거쳐 회사의 납입자본금은 2024년 9월 30일 현재 22,540백만원입니다.
2. 중요한 회계정책
다음은 재무제표 작성에 적용된 중요한 회계정책입니다. 이러한 정책은 별도의 언급이 없다면, 표시된 회계기간에 계속적으로 적용됩니다.
2.1 재무제표 작성기준
회사의 2024년 9월 30일로 종료하는 9개월 보고기간에 대한 요약분기재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었습니다. 이 중간재무제표는 연차재무제표에 기재되는 사항이 모두 포함되지 않았으므로 전기말 연차재무제표와 함께 이해해야 합니다.
2.1.1 회사가 채택한 제ㆍ개정 기준서 및 해석서
회사는 2024년 01월 01일로 개시하는 회계기간부터 다음의 제ㆍ개정 기준서 및 해석서를 신규로 적용하였습니다.
(1) 기업회계기준서 제1001호 '재무제표 표시' 개정 - 부채의 유동/비유동 분류, 약정사항이 있는 비유동부채
부채는 보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습 니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기 지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된 경우는 제외됩니다. 또한, 기업이 보고기간말 후에 준수해야하는 약정은 보고기간말에 해당 부채의 분류에 영향을 미치지 않으며, 보고기간 이후 12개월 이내 약정사항을 준수해야하는 부채가 보고기간말 현재 비유동부채로 분류된 경우 보고기간 이후 12개월 이내 부채가 상환될 수 있는 위험에 관한 정보를 공시해야 합니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(2) 기업회계기준서 제1007호 '현금흐름표', 기업회계기준서 제1107호 '금융상품: 공시' 개정 - 공급자금융약정에 대한 정보 공시
공급자금융약정을 적용하는 경우, 재무제표이용자가 공급자금융약정이 기업의 부채와 현금흐름 그리고 유동성위험 익스포저에 미치는 영향을 평가할 수 있도록 공급자금융약정에 대한 정보를 공시해야 합니다. 이 개정내용을 최초로 적용하는 회계연도 내 중간보고기간에는 해당 내용을 공시할 필요가 없다는 경과규정에 따라 중간재무제표에 미치는 영향이 없습니다.
(3) 기업회계기준서 제1116호 ‘리스’ 개정 - 판매후리스에서 생기는 리스부채
판매후리스에서 생기는 리스부채를 후속적으로 측정할 때 판매자-리스이용자가 보유하는 사용권 관련 손익을 인식하지 않는 방식으로 리스료나 수정리스료를 산정합니다. 해당 기준서의 제정이 재무제표에 미치는 중요한 영향은 없습니다.
(4) 기업회계기준서 제1001호 ‘재무제표 표시’ 개정 - '가상자산 공시’
가상자산을 보유하는 경우, 가상자산을 고객을 대신하여 보유하는 경우, 가상자산을 발행한 경우의 추가 공시사항을 규정하고 있습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
2.1.2 회사가 적용하지 않은 제ㆍ개정 기준서 및 해석서
제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
(1) 기업회계기준서 제1021호 ‘환율변동효과’와 기업회계기준서 제1101호 ‘한국채택국제회계기준의 최초채택’ 개정 - 교환가능성 결여
통화의 교환가능성을 평가하고 다른 통화와 교환이 가능하지 않다면 현물환율을 추정하며 관련 정보를 공시하도록 하고 있습니다. 동 개정사항은 2025 년 01 월 01 일 이후 시작하는 회계연도부터 적용되며, 조기적용이 허용됩니다. 회사는 동 개정으로 인한 재무제표의 영향을 검토 중에 있습니다.
2.2 회계정책
요약분기재무제표의 작성에 적용된 유의적 회계정책과 계산방법은 주석 2.1.1에서 설명하는 제ㆍ개정 기준서의 적용으로 인한 변경 및 아래 문단에서 설명하는 사항을 제외하고는 전기 연차재무제표 작성에 적용된 회계정책이나 계산방법과 동일합니다.
2.2.1 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전이익에 적용하여 계산합니다.
3. 중요한 회계추정 및 가정
회사는 미래에 대하여 추정 및 가정을 하고 있습니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에서 합리적으로 예측가능한 미래의 사건과 같은 다른 요소들을 고려하여 이루어집니다. 이러한 회계추정은 실제 결과와 다를 수도있습니다.
요약분기재무제표 작성시 사용된 중요한 회계추정 및 가정은 전기 연차재무제표 작성에 적용된 회계추정 및 가정과 동일합니다.
4. 영업부문 정보
(1) 회사는 기업회계기준서 제1108호(영업부문)에 따른 보고부문이 단일부문(신약사업)으로 기업 전체 수준에서 부문별 정보는 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기 | 전분기 |
| 외부고객으로부터의수익 | 24,281 | 587,899 |
| 영업손실 | 36,077,134 | 44,556,889 |
(2) 당분기와 전분기 중 외부고객으로부터의 창출한 수익의 지역별 구분내역은 다음과 같습니다.
| (단위: 천원) |
| 해당국가 | 당분기 | 전분기 |
| 대한민국 | 24,281 | 587,899 |
(3) 주요 고객에 대한 정보
당분기 및 전분기 중 회사 매출액의 10% 이상을 차지하는 외부 고객과 관련된 정보는 다음과 같습니다.
| (단위: 천원) |
|
구분 |
당분기 | 전분기 |
| 고객1 | 24,281 | 587,899 |
5. 재무위험관리
5.1 재무위험관리요소
회사가 노출되어 있는 재무위험 및 이러한 위험이 회사의 미래 성과에 미칠 수 있는 영향은 다음과 같습니다.
| 위험 | 노출 위험 | 측정 | 관리 |
|
시장위험-환율 |
미래 상거래 기능통화 이외의 표시통화를 갖는금융자산 및 금융부채 |
현금흐름 추정 민감도 분석 |
통화선도 및 통화옵션 |
| 신용위험 | 현금성자산, 채무상품 | 연체율 분석 | 은행예치금 다원화, 신용한도 |
| 신용등급 | 채무상품 투자지침 | ||
| 유동성위험 | 미지급금, 리스부채 | 현금흐름 추정 | 차입한도 유지 |
5.1.1 시장위험
(1) 외환위험
회사는 국제적으로 영업활동을 영위하고 있기 때문에 외환 위험, 특히 주로 미국 달러화와 관련된 환율 변동 위험에 노출돼 있습니다.
당분기말 및 전기말 현재 외환 위험에 노출되어 있는 회사의 금융자산ㆍ부채의 내역은 다음과 같습니다.
| (단위 : USD, AUD, 천원) |
| 구 분 | 통화 | 당분기말 | 전기말 | ||
| 외화금액 | 원화환산액 | 외화금액 | 원화환산액 | ||
| 금융부채 | |||||
| 미지급금 | USD | 922,938 | 1,217,909 | 491,170 | 633,314 |
| AUD | 440 | 401 | - | - | |
당분기말 및 전기말 현재 다른 모든 변수가 일정하고 각 외화에 대한 원화의 환율이 10% 변동 시 회사의 세후 이익 및 자본에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 세후 이익에 대한 영향 | 자본에 대한 영향 | |||
| 당분기 | 전기 | 당분기 | 전기 | ||
| USD | 상승시 | (121,791) | (63,331) | (121,791) | (63,331) |
| 하락시 | 121,791 | 63,331 | 121,791 | 63,331 | |
| AUD | 상승시 | (40) | - | (40) | - |
| 하락시 | 40 | - | 40 | - | |
5.1.2 신용 위험
신용위험은 기업 및 개인 고객에 대한 신용거래 및 채권 뿐 아니라 현금성자산, 채무상품의 계약 현금흐름, 예치금 등에서도 발생합니다.
(1) 위험관리
회사는 신용위험을 회사 차원에서 관리합니다. 은행 및 금융기관의 경우 A 신용등급 이상과만 거래합니다.
기업 고객의 경우 외부 신용등급을 확인할 수 있는 경우 동 정보를 사용하고 그 외의 경우에는 내부적으로 고객의 재무상태와 과거 경험 등을 근거로 신용등급을 평가합니다. 고객별 한도는 내부 및 외부 신용등급에 따라 이사회가 정한 한도를 적용합니다. 경영진은 이러한 고객별 한도의 준수 여부를 정기적으로 검토합니다.
회사의 신용위험은 개별 고객, 산업, 지역 등에 대한 유의적인 집중은 없습니다.
회사가 보유하는 채무상품은 모두 낮은 신용위험의 상품에 해당합니다. 이러한 채무상품들에 대해서는 신용등급을 모니터링하여 신용위험의 하락을 평가하고 있습니다.
당분기말 및 전기말 현재 신용위험에 노출된 회사의 금융자산은 다음과 같으며, 손상되지 않은 금융자산의 신용위험에 대한 최대 노출정도를 표시하고 있습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
| 현금성자산 | 12,199,224 | 8,543,303 |
| 당기손익-공정가치 측정 금융자산(유동) | 2,246,610 | 9,186,925 |
| 기타유동금융자산 | 12,029,429 | 28,682,741 |
| 기타비유동금융자산 | 9,830,043 | 728,552 |
| 합계 | 36,305,306 | 47,141,521 |
(2) 금융자산 손상
회사는 기대신용손실 모형이 적용되는 다음의 금융자산을 보유하고 있습니다.
· 상각후원가로 측정하는 기타 금융자산
현금성자산도 손상 규정의 적용대상에 포함되나 식별된 기대신용손실은 유의적이지 않습니다.
회사의 당분기말 현재 손실충당금 변동금액 및 잔액은 없습니다.
(3) 당기손익-공정가치 측정 금융자산
회사는 당기손익-공정가치 측정 금융자산에 대한 신용위험에도 노출되어 있습니다. 당분기말 현재 회사의 관련 최대노출금액은 해당 장부금액입니다.
5.1.3 유동성 위험
경영진은 예상현금흐름에 기초하여 추정되는 현금 및 현금성자산과 차입금 한도 약정을 모니터링하고 있습니다. 또한 회사의 유동성 위험 관련 정책은 주요 통화별 필요 현금흐름을 추정하여 이를 충족하기 위한 유동성 자산의 현황을 고려하고, 유동성비율을 내부 및 외부 감독 기관 등의 요구사항을 충족하고 자금조달계획을 실행하기 위해 관리합니다. 회사는 당분기말 현재 약정된 차입금이 없습니다.
(1) 만기분석
유동성 위험 분석에서는 회사의 다음의 금융부채를 계약상 만기별로 구분하였습니 다.
| <당분기말> | (단위: 천원) |
| 구 분 | 장부금액 | 1년 이하 | 1년~2년 | 2년~5년 | 5년초과 | 합계 |
| 기타금융부채(주1) | 6,639,723 | 3,559,365 | 901,389 | 2,123,544 | 1,040,908 | 7,625,206 |
| 전환사채(주2) | 8,329,288 | - | 10,000,000 | - | - | 10,000,000 |
| 합계 | 14,969,012 | 3,559,365 | 10,901,389 | 2,123,544 | 1,040,908 | 17,625,206 |
(주1) 해당 금융부채의 잔존만기별 현금흐름은 할인되지 않은 명목금액으로서 이자지급액을 포함하고 있습니다.
(주2) 전환사채는 사채권자의 조기상환청구권을 고려한 만기이며, 계약상 만기는 발행일로부터 5년입니다.
| <전기말> | (단위: 천원) |
| 구 분 | 장부금액 | 1년 이하 | 1년~2년 | 2년~5년 | 5년초과 | 합계 |
| 기타금융부채(주1) | 7,893,827 | 4,615,993 | 853,572 | 2,318,676 | 1,340,717 | 9,128,958 |
(주1) 해당 금융부채의 잔존만기별 현금흐름은 할인되지 않은 명목금액으로서 이자지급액을 포함하고 있습니다.
5.2. 자본 위험 관리
회사의 자본 관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본 비용을 절감하기 위해 최적의 자본구조를유지하는 것입니다.
회사는 자본관리지표로 부채비율을 이용하고 있으며 이 비율은 총부채를 총자본으로나누어 산출하고 있으며 총부채 및 총자본은 재무제표의 금액을 기준으로 계산합니다. 회사는 외부적으로 강제된 자기자본규제의 대상은 아닙니다.
당분기말 및 전기말 현재 부채비율은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
| 부채 (A) | 17,245,492 | 9,636,201 |
| 자본 (B) | 47,572,831 | 71,704,011 |
| 부채비율 (A/B) | 36.25% | 13.44% |
6. 금융상품 공정가치
6.1 금융상품 종류별 공정가치
당분기말 및 전기말 현재 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산 | ||||
| 현금및현금성자산 | 12,199,224 | (주1) | 8,543,303 | (주1) |
| 당기손익-공정가치 측정 금융자산(유동) |
5,202,360 | 5,202,360 | 9,186,925 | 9,186,925 |
| 당기손익-공정가치 측정 금융자산(비유동) |
2,682,536 | 2,682,536 | 7,601,765 | 7,601,765 |
| 기타유동금융자산 | 11,969,080 | (주1) | 28,631,732 | (주1) |
| 기타비유동금융자산 | 9,552,063 | (주1) | 424,432 | (주1) |
| 소계 | 41,605,263 | 54,388,157 | ||
| 금융부채 | ||||
| 기타유동금융부채 | 2,657,976 | (주1) | 3,757,802 | (주1) |
| 기타비유동금융부채 | 434,978 | (주1) | 415,193 | (주1) |
| 전환사채 | 8,329,288 | (주1) | - | - |
| 소계 | 11,422,242 | 4,172,995 | ||
(주1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 서열체계 및 측정방법등 공시에 포함하지 않았습니다.
6.2 공정가치 서열체계
공정가치로 측정되는 금융상품은 공정가치 서열체계에 따라 구분되며 정의된 수준들은 다음과 같습니다.
| - | 측정일에 동일한 자산이나 부채에 대해 접근할 수 있는 활성시장의 (조정하지 않은) 공시가격 (수준 1) |
| - | 수준 1의 공시가격 외에 자산이나 부채에 대해 직접적으로나 간접적으로 관측할 수 있는 투입변수 (수준 2) |
| - | 자산이나 부채에 대한 관측할 수 없는 투입변수 (수준 3) |
공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
| <당분기말> | (단위: 천원) |
| 구분 |
수준 1 |
수준 2 |
수준 3 |
합계 |
|---|---|---|---|---|
| 반복적인 공정가치 측정치 | ||||
| 채무상품 | - | 2,000,000 | - | 2,000,000 |
| 지분증권 | 2,955,750 | - | 2,682,536 | 5,638,286 |
| 파생상품금융자산 | - | - | 246,610 | 246,610 |
| <전기말> | (단위: 천원) |
| 구분 |
수준 1 |
수준 2 |
수준 3 |
합계 |
|---|---|---|---|---|
| 반복적인 공정가치 측정치 | ||||
| 채무상품 | - | 9,186,925 | - | 9,186,925 |
| 지분증권 | 4,601,766 | 2,999,999 | - | 7,601,765 |
6.3 공정가치체계 수준3의 변동내역
재무상태표에 공정가치로 측정하는 금융자산 중 수준3으로 분류된 항목의 당분기 및 전분기 중 공정가치 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | - | - |
| 수준 2로부터의 이동 | 2,999,999 | - |
| 발행 | 246,610 | - |
|
기타비용으로 인식된 손실 |
(317,463) | - |
| 기말 | 2,929,146 | - |
6.4 공정가치 산정에 사용된 가치평가기법 및 투입변수
수준 3으로 분류된 금융상품의 공정가치 측정에 사용된 가치평가기법 및 투입변수는 다음과 같습니다.
|
(단위: 천원) |
|
구분 |
공정가치 | 수준 | 가치평가기법 | 투입변수 | 투입변수 범위 |
관측불가능 투입변수 변동에 대한 공정가치 영향 |
|---|---|---|---|---|---|---|
| 비상장지분증권 | 2,682,536 | 3 | DCF | 할인율 | 16.94% | 할인율 감소시 공정가치 증가 |
| 변동성 | 43.31% | 변동성 증가시 공정가치변동 증가 | ||||
| 파생상품 금융자산 |
246,610 | 3 | 옵션가격결정모형 (Goldman-Sachs) |
할인율 | 12.508%~ 34.291% |
할인율 감소시 공정가치 증가 |
| 변동성 | 68.19% | 변동성 증가시 공정가치변동 증가 |
7. 범주별 금융상품
7.1 금융자산의 범주
|
(단위: 천원) |
| 구분 | 당분기말 | 전기말 | ||||
| 당기손익-공정가치 측정금융자산 |
상각후원가 측정금융자산 |
합계 | 당기손익-공정가치 측정금융자산 | 상각후원가 측정금융자산 |
합계 | |
| 현금및현금성자산 | - | 12,199,224 | 12,199,224 | - | 8,543,303 | 8,543,303 |
| 당기손익-공정가치 측정 금융자산(유동) | 5,202,360 | - | 5,202,360 | 9,186,925 | - | 9,186,925 |
| 당기손익-공정가치 측정 금융자산(비유동) | 2,682,536 | - | 2,682,536 | 7,601,765 | - | 7,601,765 |
| 기타유동금융자산 | - | 11,969,080 | 11,969,080 | - | 28,631,732 | 28,631,732 |
| 기타비유동금융자산 | - | 9,552,063 | 9,552,063 | - | 424,432 | 424,432 |
| 합계 | 7,884,896 | 33,720,367 | 41,605,263 | 16,788,690 | 37,599,467 | 54,388,157 |
7.2 금융부채의 범주
|
(단위: 천원) |
| 구분 | 당분기말 | 전기말 |
| 상각후원가측정 금융부채 |
상각후원가측정 금융부채 |
|
| 기타유동금융부채 | 2,657,976 | 3,757,802 |
| 기타비유동금융부채 | 434,978 | 415,193 |
| 전환사채 | 8,329,288 | - |
| 합계 | 11,422,242 | 4,172,995 |
7.3 금융상품 범주별 순손익
당분기 및 전분기 회사의 범주별 금융상품 순손익 내역은 다음과 같습니다.
|
(단위: 천원) |
| 구분 | 당분기 | 전분기 | ||
| 수익(비용) | 이자수익(비용) | 수익(비용) | 이자수익(비용) | |
| <금융자산> | ||||
| 당기손익-공정가치측정금융자산 | (1,707,045) | - | 208,110 | - |
| 상각후원가측정금융자산 | - | 660,529 | - | 1,586,710 |
| 합계 | (1,707,045) | 660,529 | 208,110 | 1,586,710 |
| <금융부채> | ||||
| 상각후원가측정금융부채 | 32,454 | (229,762) | (17,647) | (261,947) |
| 합계 | 32,454 | (229,762) | (17,647) | (261,947) |
8. 현금및현금성자산
회사의 당분기말 및 전기말 현재 현금및현금성자산의 구성 내역은 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
|
은행예금 |
12,199,224 | 8,543,303 |
9. 당기손익-공정가치측정금융자산
(1) 당분기말 및 전기말 현재 회사의 당기손익-공정가치측정금융자산의 구성 내역은 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 채무상품 | 2,000,000 | 9,186,925 |
| 지분상품 | 5,638,286 | 7,601,765 |
| 파생상품금융자산 | 246,610 | - |
| 합계 | 7,884,896 | 16,788,690 |
(2) 당분기와 전분기 중 당기손익-공정가치측정금융자산의 변동내역은 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | 16,788,690 | 7,143,368 |
| 취득 | 12,246,610 | 7,000,000 |
| 처분 | (19,387,739) | (4,946,320) |
| 공정가치평가 | (1,762,665) | 101,149 |
| 기말 | 7,884,896 | 9,298,197 |
10. 기타금융자산
당분기말 및 전기말 현재 기타금융자산의 구성 내역은 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 유동 | 비유동 | 합계 | 유동 | 비유동 | 합계 | |
| 미수금 (주1) | 577,640 | - | 577,640 | 718,824 | - | 718,824 |
| 미수수익 | 180,840 | - | 180,840 | 530,558 | - | 530,558 |
| 대여금 | 210,000 | 9,090,750 | 9,300,750 | 381,750 | - | 381,750 |
| 정기예적금 | 9,000,000 | - | 9,000,000 | 27,000,000 | - | 27,000,000 |
| 단기투자자산 | 2,000,000 | - | 2,000,000 | - | - | - |
| 임차보증금 | 600 | 735,643 | 736,243 | 600 | 728,575 | 729,175 |
| 현재가치할인차금 | - | (274,330) | (274,330) | - | (304,143) | (304,143) |
| 금융리스채권 | 60,349 | 277,980 | 338,329 | 51,009 | 304,121 | 355,130 |
| 합계 | 12,029,429 | 9,830,043 | 21,859,472 | 28,682,741 | 728,553 | 29,411,294 |
(주1) 국책연구과제 관련하여 납입된 민간부담금이 포함되어 있습니다.
11. 기타자산
당분기말 및 전기말 현재 기타자산의 구성 내역은 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 유동 | 비유동 | 합계 | 유동 | 비유동 | 합계 | |
| 선급금 | - | 1,213,073 | 1,213,073 | - | 1,067,425 | 1,067,425 |
| 선급비용 | 2,204,713 | 3,593,069 | 5,797,782 | 1,481,006 | 4,747,673 | 6,228,679 |
| 합계 | 2,204,713 | 4,806,142 | 7,010,855 | 1,481,006 | 5,815,098 | 7,296,104 |
12. 유형자산
(1) 당분기말 및 전기말 현재 유형자산의 장부금액은 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 기계장치 | 9,741,951 | (6,941,248) | 2,800,703 | 9,734,171 | (5,760,788) | 3,973,383 |
| 공구기구비품 | 364,184 | (247,977) | 116,207 | 355,213 | (204,102) | 151,111 |
| 차량운반구 | 35,411 | (27,587) | 7,824 | 35,411 | (24,525) | 10,886 |
| 시설장치 | 2,843,259 | (2,155,889) | 687,370 | 2,843,259 | (1,796,517) | 1,046,742 |
| 사용권자산 | 5,464,464 | (2,303,183) | 3,161,281 | 5,309,329 | (1,884,733) | 3,424,596 |
| 합계 | 18,449,269 | (11,675,884) | 6,773,385 | 18,277,383 | (9,670,665) | 8,606,718 |
(2) 당분기와 전분기 중 유형자산의 변동내역은 다음과 같습니다.
| <당분기> | (단위: 천원) |
| 구 분 | 기계장치 | 공구기구비품 | 차량운반구 | 건설중인자산 | 시설장치 | 사용권자산 | 합계 |
|---|---|---|---|---|---|---|---|
| 기초 | 3,973,383 | 151,111 | 10,886 | - | 1,046,742 | 3,424,596 | 8,606,718 |
| 취득 및 변경 | 7,780 | 8,971 | - | - | - | 208,623 | 225,374 |
| 처분 | - | - | - | - | - | (812) | (812) |
| 감가상각비 | (1,180,460) | (43,875) | (3,062) | - | (359,372) | (471,126) | (2,057,895) |
| 기말 | 2,800,703 | 116,207 | 7,824 | - | 687,370 | 3,161,281 | 6,773,385 |
| <전분기> | (단위: 천원) |
| 구 분 | 기계장치 | 공구기구비품 | 차량운반구 | 건설중인자산 | 시설장치 | 사용권자산 | 합계 |
|---|---|---|---|---|---|---|---|
| 기초 | 5,333,655 | 173,829 | 15,218 | 153,300 | 1,559,650 | 4,116,991 | 11,352,643 |
| 취득 및 변경 | 8,650 | 35,971 | - | 502,300 | - | 101,925 | 648,846 |
| 처분 | - | (894) | - | - | - | (113,645) | (114,539) |
| 감가상각비 | (1,301,578) | (44,959) | (3,312) | - | (391,649) | (530,058) | (2,271,556) |
| 대체(주1) | 349,000 | - | - | (655,600) | - | - | (306,600) |
| 기말 | 4,389,727 | 163,947 | 11,906 | - | 1,168,001 | 3,575,213 | 9,308,794 |
(주1) 건설중인자산에서 소프트웨어로 306,600천원 대체되었습니다.
13. 사용권자산
(1) 재무상태표에 인식된 금액
리스와 관련해 재무상태표에 인식된 금액은 다음과 같습니다.
| (단위: 천원) |
|
구 분 |
당분기말 |
전기말 |
|---|---|---|
|
사용권자산(주1) |
||
|
부동산 |
2,921,206 | 3,246,793 |
|
차량운반구 |
240,075 | 177,803 |
|
소계 |
3,161,281 | 3,424,596 |
(주1) 재무상태표의 '유형자산' 항목에 포함되었습니다.
| (단위: 천원) |
|
구 분 |
당분기말 |
전기말 |
|---|---|---|
|
리스부채(주1) |
||
|
유동 |
859,716 | 816,825 |
|
비유동 |
2,687,053 | 2,904,007 |
|
합계 |
3,546,769 | 3,720,832 |
(주1) 재무상태표의 '기타금융부채' 항목에 포함되었습니다.
당분기 중 증가된 사용권자산은 209백만원(전기 : 100백만원)입니다.
(2) 손익계산서에 인식된 금액
리스와 관련해서 손익계산서에 인식된 금액은 다음과 같습니다.
| (단위: 천원) |
|
구 분 |
당분기 |
전분기 |
|---|---|---|
|
사용권자산의 감가상각비 |
||
|
부동산 |
423,811 | 484,840 |
|
차량운반구 |
47,315 | 45,218 |
|
합계 |
471,126 | 530,058 |
|
리스부채에 대한 이자비용(금융원가에 포함) |
267,869 | 266,174 |
| 단기리스료(지급임차료에 포함) | 16,611 | 18,276 |
| 단기리스가 아닌 소액자산 리스료(지급임차료에 포함) | 15,515 | 25,460 |
당분기 중 리스의 총 현금유출은 701백만원(전분기 : 682백만원)입니다.
14. 무형자산
(1) 당분기말 및 전기말 현재 무형자산의 장부금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 특허권 | 705,505 | (201,570) | 503,935 | 558,220 | (152,537) | 405,683 |
| 상표권 | 3,467 | (1,840) | 1,627 | 3,467 | (1,580) | 1,887 |
| 라이선스 | 1,065,193 | (603,610) | 461,583 | 1,065,193 | (443,830) | 621,363 |
| 회원권 | 250,000 | - | 250,000 | 250,000 | - | 250,000 |
| 소프트웨어 | 479,133 | (208,678) | 270,455 | 479,133 | (138,866) | 340,267 |
| 합계 | 2,503,298 | (1,015,698) | 1,487,600 | 2,356,013 | (736,813) | 1,619,200 |
(2) 당분기와 전분기 중 무형자산의 변동내역은 다음과 같습니다.
| <당분기> | (단위: 천원) |
| 구 분 | 특허권 | 상표권 | 라이선스 | 회원권 | 소프트웨어 | 합 계 |
|---|---|---|---|---|---|---|
| 기초 | 405,684 | 1,887 | 621,362 | 250,000 | 340,267 | 1,619,200 |
| 대체(주1) | 147,285 | - | - | - | - | 147,285 |
| 무형자산상각비 | (49,034) | (260) | (159,779) | - | (69,812) | (278,885) |
| 기말 | 503,935 | 1,627 | 461,583 | 250,000 | 270,455 | 1,487,600 |
(주1) 장기선급금에서 특허권으로 147,285천원 대체되었습니다.
| <전분기> | (단위: 천원) |
| 구 분 | 특허권 | 상표권 | 라이선스 | 회원권 | 소프트웨어 | 합 계 |
|---|---|---|---|---|---|---|
| 기초 | 339,116 | 2,235 | 834,401 | 250,000 | 115,006 | 1,540,758 |
| 취득 | - | - | - | - | 12,940 | 12,940 |
| 대체(주1) | 40,662 | - | - | - | 306,600 | 347,262 |
| 무형자산상각비 | (34,468) | (261) | (159,779) | - | (70,897) | (265,405) |
| 기말 | 345,310 | 1,974 | 674,622 | 250,000 | 363,649 | 1,635,555 |
(주1) 장기선급금에서 특허권으로 40,662천원, 건설중인자산에서 소프트웨어로 306,600천원 대체되었습니다.
(3) 무형자산상각비는 모두 영업비용에 포함되어 있습니다.
15. 관계기업투자
(1) 당분기말 및 전기말 현재 관계기업투자 현황은 다음과 같습니다.
| (단위: 천원) |
| 회사명 | 업종 | 주사업장 | 결산월 | 당분기말 | 전기말 | ||
|---|---|---|---|---|---|---|---|
| 지분율(%) (주5) |
장부금액 | 지분율(%) (주5) |
장부금액 | ||||
| 주식회사 지아이바이옴(주1)(주4) | 의약 및 약학연구개발 | 한국 | 12월 | 15.05 | 630,134 | 15.05 | 15,136 |
| 주식회사 지아이셀(주2)(주4)(주6) | 의약 및 약학연구개발 | 한국 | 12월 | 28.71 | - | 28.71 | - |
| 주식회사 메디오젠(주3)(주4) | 프로바이오틱스 원료 및 완제품 제조 |
한국 | 12월 | 26.10 | 6,824,363 | 26.10 | 8,759,005 |
| 합계 | 7,454,497 | 8,774,141 | |||||
(주1) 주식회사 지아이바이옴이 발행하고 제3자가 보유하고 있는 의결권 있는 전환우선주를 포함하여 고려한 지분율은 15.2%입니다. 보통주 보유분을 제외한 투자액은 기업회계기준서 제1109호에 따라 당기손익-공정가치로 측정하고 있습니다.
(주2) 주식회사 지아이셀이 발행하고 제3자가 보유하고 있는 의결권 있는 전환우선주를 포함하여 고려한 지분율은 19.0%입니다.
(주3) 주식회사 메디오젠이 발행하고 제3자가 보유하고 있는 의결권 있는 상환전환우선주를 포함하여 고려한 지분율은 18.3%입니다.
(주4) 각 피투자회사가 발행한 전체 주식 중 회사의 지분율은 20% 미만이나, 피투자회사의 재무 또는 영업 정책에 유의적인 영향력을 행사할 수 있어 관계기업으로 분류하였습니다.
(주5) 관계기업이 발행한 주식 중 회사의 소유지분과 관계된 이익에 접근 권한이 있는 보통주만 고려한 지분율입니다.
(주6) 주식회사 지아이셀의 누적손실로 인해 지분법적용투자주식의 장부가액이 영(0) 이하가 되어 지분법적용을 중지하였습니다. 이로 인한 당분기말 및 전기말 현재 미반영손실누계액은 19,204,199천원(전기말: 15,621,792천원), 미반영 지분법자본변동은 80,923천원(전기말: 80,923천원)입니다.
(2) 당분기와 전분기 중 지분법을 적용하는 투자지분의 장부금액 변동은 다음과 같습니다.
| (단위: 천원) |
|
구분 |
당분기 | 전분기 |
|---|---|---|
|
기초 |
8,774,141 | 16,135,840 |
|
지분법손실 |
(1,296,609) | (2,267,064) |
| 기타포괄손익 변동 등 | (23,035) | (79,260) |
| 기말 | 7,454,497 | 13,789,516 |
16. 기타금융부채 및 기타부채
(1) 당분기말 및 전기말 현재 기타금융부채의 구성 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기말 | 전기말 | ||||
| 유동 | 비유동 | 합계 | 유동 | 비유동 | 합계 | |
| 미지급금 | 2,657,976 | 434,978 | 3,092,954 | 3,757,802 | 415,193 | 4,172,995 |
| 금융리스부채 | 859,716 | 2,687,053 | 3,546,769 | 816,825 | 2,904,007 | 3,720,832 |
| 합계 | 3,517,692 | 3,122,031 | 6,639,723 | 4,574,627 | 3,319,200 | 7,893,827 |
(2) 당분기말 및 전기말 현재 기타부채의 구성 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기말 | 전기말 | ||||
| 유동 | 비유동 | 합계 | 유동 | 비유동 | 합계 | |
| 예수금 | - | - | - | 900 | - | 900 |
| 미지급비용 | 706,766 | - | 706,766 | 851,012 | - | 851,012 |
| 연차충당부채 | 353,679 | - | 353,679 | 369,086 | - | 369,086 |
| 선수금 | 150 | - | 150 | 11 | - | 11 |
| 선수수익 | 62,465 | - | 62,465 | - | 62,465 | 62,465 |
| 합계 | 1,123,060 | - | 1,123,060 | 1,221,009 | 62,465 | 1,283,474 |
17. 전환사채
(1) 당분기말과 전기말 현재 전환사채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 발행일 | 만기일 | 연이자율 | 당분기말 | 전기말 |
| 제1회 무기명식 전환사채 | 2024-08-08 | 2029-08-08 | 0.00% | 10,000,000 | - |
| 사채상환할증금 | 1,611,841 | - | |||
| 전환권 조정 | (3,282,553) | - | |||
| 합계 | 8,329,288 | - | |||
(2) 당사가 발행한 전환사채의 발행조건 및 관련 파생상품의 내용은 다음과 같습니다.
1) 당사가 발행한 전환사채의 발행조건은 다음과 같습니다.
| 사채의 명칭 | 제1회 무기명식 전환사채 |
| 액면금액 | 10,000 백만원 |
| 발행가액 | 10,000 백만원 |
| 표면이자율 | 0.0% |
| 보장수익률 | 연복리 3.0% |
| 상환방법 | 전환되지 않거나 조기상환되지 않을 경우 만기일에 액면가액의 116.1184%를 일시 상환 |
| 전환시 발행할 주식의 종류 | 기명식 보통주 |
| 전환청구기간 | 2025.08.08~2029.07.08 |
| 전환가격 | 11,647원 |
| 사채권자에 의한 조기상환청구권 |
사채의 발행일로부터 18개월이 되는 날부터 매3개월에 해당되는날에 조기상환을 청구한 전자등록금액에 조기상환율을 곱한 금액의 전부에 대하여 사채의 만기 전 조기상환을 청구할 수 있는 권리를 보유 |
| 발행자의 매도청구권 | 발행자는 발행일로부터 12개월이 되는 날부터 17개월이 되는 날까지의 기간 동안 사채 권면금액 합계액의 10% 를 한도로 하여 발행회사 또는 발행회사가 지정하는 자에게 매도할 것을 청구할 수 있는 권리를 보유 |
2) 당사가 발행한 전환사채 및 관련 파생상품의 당분기말 현재 세부내역은 다음과 같습니다.
| <당분기말> | (단위: 천원) |
| 구 분 | 금액 |
| 전환사채의 장부금액: | |
| 발행가액 | 10,000,000 |
| 사채상환할증금 | 1,611,841 |
| 전환권조정 | (3,282,553) |
| 장부금액 | 8,329,288 |
| 내재파생상품의 장부금액: | |
| 파생상품금융자산(주1) | 246,610 |
(주1) 전환사채에 내재된 매도청구권은 주계약과의 분리조건을 충족하므로 발행자 및 발행자가 지정하는 제3자에게 부여된 콜옵션을 별도의 파생상품금융자산으로 분류하였습니다.
18. 퇴직급여
회사는 종업원을 위한 퇴직급여제도로서 확정급여제도와 확정기여제도를 운영하고 있습니다.
(1) 당분기와 전분기 중 확정급여제도와 관련하여 손익계산서에 반영된 금액은 다음과 같습니다.
| <당분기> | (단위: 천원) |
| 구분 | 당기근무원가 | 순이자원가 | 합계 |
|---|---|---|---|
| 퇴직급여 | 385,703 | (56,746) | 328,957 |
| 경상연구개발비 | 306,980 | (17,623) | 289,357 |
| 합계 | 692,683 | (74,369) | 618,314 |
| <전분기> | (단위: 천원) |
| 구분 | 당기근무원가 | 순이자원가 | 합계 |
|---|---|---|---|
| 퇴직급여 | 401,286 | (71,262) | 330,024 |
| 경상연구개발비 | 290,031 | (28,239) | 261,792 |
| 합계 | 691,317 | (99,501) | 591,816 |
(2) 순확정급여부채 산정내역
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 확정급여채무의 현재가치 | 3,372,546 | 3,401,244 |
| 사외적립자산의 공정가치 | (2,653,158) | (3,343,070) |
| 재무상태표상 순확정급여부채 | 719,388 | 58,174 |
(3) 확정기여제도와 관련하여 비용으로 인식한 금액은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기 | 전분기 |
|---|---|---|
| 퇴직급여 | 33,209 | - |
| 경상연구개발비 | 91,560 | - |
| 합계 | 124,769 | - |
19. 자본금과 자본잉여금
(1) 당분기말 및 전기말 현재 자본금의 구성내역은 다음과 같습니다.
| 구분 | 당분기말 | 전기말 |
|---|---|---|
| 발행할 주식의 총수 | 100,000,000 주 | 100,000,000 주 |
| 1주당 액면금액 | 500 원 | 500 원 |
| 보통주 발행주식수 | 44,217,811 주 | 22,070,300 주 |
| 우선주 발행주식수 | 858,371 주 | - |
| 보통주자본금 | 22,110,406 천원 | 11,035,150 천원 |
| 우선주자본금 | 429,186 천원 | - |
(2) 당분기와 전분기 중 회사가 발행한 주식 및 이에 따른 자본금과 주식발행초과금의 변동 내역은 다음과 같습니다.
| (단위: 천원,주) |
| 구분 | 보통주 주식수 | 우선주 주식수 | 자본금 | 자본잉여금 (주식발행초과금) |
합계 |
|---|---|---|---|---|---|
| 전기초 | 20,004,200 | - | 10,002,100 | 451,805,418 | 461,807,518 |
| 보통주 발행(주1) | 2,050,100 | - | 1,025,050 | 24,458,440 | 25,483,490 |
| 전분기말 | 22,054,300 | - | 11,027,150 | 476,263,858 | 487,291,008 |
| 당기초 | 22,070,300 | - | 11,035,150 | 476,405,208 | 487,440,358 |
| 무상증자(주2) | 22,067,300 | - | 11,033,650 | (11,090,548) | (56,898) |
| 주식매수선택권 행사 | 83,211 | - | 41,606 | 2,770,879 | 2,812,485 |
| 결손금 보전(주3) | - | - | - | (200,000,000) | (200,000,000) |
| 자기주식소각(주4) | (3,000) | - | - | - | - |
| 우선주 발행(주5) | - | 858,371 | 429,185 | 9,517,486 | 9,946,671 |
| 당분기말 | 44,217,811 | 858,371 | 22,539,591 | 277,603,025 | 300,142,616 |
(주1) 회사는 전분기 중 일반공모로 보통주 2,000,000주, 주식매수선택권행사로 보통주 50,100주를 발행하였습니다.
(주2) 회사는 유통보통주식 1주당 신주1주의 비율로 배정하는 무상증자를 실시하였습니다.
(주3) 당기 중 정기주주총회 의결에 따라 주식발행초과금 200,000백만원을 재원으로 결손금을 보전하였습니다.
(주4) 회사는 무상취득하여 보유하고 있던 자기주식 3,000주를 당분기 중 소각하였습니다.
(주5) 당분기 중 3자배정 유상증자를 통해 전환우선주 858,371주를 발행하였습니다
20. 주식기준보상
(1) 회사의 주주총회 결의에 의거하여 회사의 임직원에게 부여하고 있는 주식선택권의 세부내역은 다음과 같습니다.
| 구 분 | 부여일 | 부여주식수(주1) | 행사가격(주1) | 가득요건 |
| 3-2차 | 2018년 03월 29일 | 28,000주 | 8,600원 | 부여일로부터 4년 이상 재직 |
| 5-2차 | 2018년 10월 01일 | 42,000주 | 6,500원 | 부여일로부터 4년 이상 재직 |
| 6-2차 | 2019년 03월 15일 | 52,500주 | 6,500원 | 부여일로부터 4년 이상 재직 |
| 7-1차 | 2019년 11월 26일 | 426,000주 | 12,500원 | 부여일로부터 2년 이상 재직 |
| 7-2차 | 2019년 11월 26일 | 254,000주 | 12,500원 | 부여일로부터 4년 이상 재직 |
| 8-1차 | 2020년 03월 30일 | 195,500주 | 20,000원 | 부여일로부터 2년 이상 재직 |
| 8-2차 | 2020년 03월 30일 | 80,500주 | 20,000원 | 부여일로부터 4년 이상 재직 |
| 9차 | 2020년 10월 05일 | 242,000주 | 20,000원 | 부여일로부터 2년 이상 재직 |
| 10차 | 2021년 03월 26일 | 201,000주 | 33,000원 | 부여일로부터 2년 이상 재직 |
| 11차 | 2021년 06월 16일 | 188,000주 | 36,200원 | 부여일로부터 2년 이상 재직 |
| 12-1차 | 2022년 03월 03일 | 250,000주 | 36,200원 | 부여일로부터 3년 이상 재직 |
| 12-2차 | 2022년 03월 03일 | 95,200주 | 36,200원 | 부여일로부터 2년 이상 재직 |
| 12-3차 | 2022년 03월 03일 | 142,800주 | 36,200원 | 부여일로부터 4년 이상 재직 |
| 13-1차 | 2023년 06월 13일 | 191,600주 | 22,835원 | 부여일로부터 2년 이상 재직 |
| 13-2차 | 2023년 06월 13일 | 62,400주 | 22,835원 | 부여일로부터 4년 이상 재직 |
| 14-1차 | 2024년 03월 29일 | 64,800주 | 12,720원 | 부여일로부터 2년 이상 재직 |
| 14-2차 | 2024년 03월 29일 | 97,200주 | 12,720원 | 부여일로부터 4년 이상 재직 |
(주1) 주식선택권 최초 부여기준입니다.
(주2) 회사의 기명식 보통주식을 기초자산으로 부여하였습니다.
(주3) 주식선택권의 행사가능기간은 행사가능일로부터 3년간이며, 2023년 03월 31일 정기주주총회 결의에 따른 변경계약으로 일부 임직원의 행사가능기간이 변동되었습니다.
(주4) 회사가 부여한 주식기준보상 거래는 모두 주식결제형 또는 자기주식 교부의 결제방법으로 부여되었습니다.
(2) 당분기와 전기의 주식선택권 수량변동은 다음과 같습니다.
| <당분기> | (단위:주) |
| 구분 | 3-2차 | 5-2차 | 6-2차 | 7-1차 | 7-2차 | 8-1차 | 8-2차 | 9차 | 10차 |
| 기초 미행사 수량 | 47,500 | 4,500 | 3,500 | 350,846 | 142,000 | 172,328 | 59,500 | 196,000 | 176,000 |
| 부여수량 | - | - | - | - | - | - | - | - | - |
| 조정수량(주1) | 47,492 | 4,499 | 3,499 | 350,793 | 141,979 | 172,297 | 59,491 | 195,966 | 175,975 |
| 행사수량 | 10,489 | 8,999 | 6,999 | 14,699 | 8,199 | 19,326 | - | 12,500 | 2,000 |
| 취소수량 | - | - | - | - | - | - | - | - | - |
| 미행사수량 | 84,503 | - | - | 686,940 | 275,780 | 325,299 | 118,991 | 379,466 | 349,975 |
| 구분 | 11차 | 12-1차 | 12-2차 | 12-3차 | 13-1차 | 13-2차 | 14-1차 | 14-2차 | 계 |
| 기초 미행사 수량 | 181,000 | 250,000 | 63,200 | 94,800 | 189,600 | 59,400 | - | - | 1,990,174 |
| 부여수량 | - | - | - | - | - | - | 64,800 | 97,200 | 162,000 |
| 조정수량(주1) | 180,973 | 249,966 | 63,181 | 94,780 | 189,564 | 59,385 | - | - | 1,989,840 |
| 행사수량 | - | - | - | - | - | - | - | - | 83,211 |
| 취소수량 | - | - | - | 8,399 | - | - | 20,000 | 30,000 | 58,399 |
| 미행사수량 | 361,973 | 499,966 | 126,381 | 181,181 | 379,164 | 118,785 | 44,800 | 67,200 | 4,000,404 |
(주1) 2024년 01월 04일 개최된 이사회에서 소유주식 1주당 신주 1주의 비율로 배정 (자기주식 제외)하는 무상증자를 실시하기로 결정하여 최초 부여일 이후 행사되지 않은 주식매수선택권의 수량이 조정되었습니다.
| <전기> | (단위:주) |
| 구분 | 3-2차 | 5-2차 | 6-2차 | 7-1차 | 7-2차 | 8-1차 | 8-2차 | 9차 |
| 기초 미행사 수량 | 60,000 | 28,000 | 24,500 | 359,946 | 149,000 | 172,328 | 73,500 | 196,000 |
| 부여수량 | - | - | - | - | - | - | - | - |
| 행사수량 | 12,500 | 23,500 | 21,000 | 9,100 | - | - | - | - |
| 취소수량 | - | - | - | - | 7,000 | 7,000 | 7,000 | - |
| 미행사수량 | 47,500 | 4,500 | 3,500 | 350,846 | 142,000 | 165,328 | 66,500 | 196,000 |
| 구분 | 10차 | 11차 | 12-1차 | 12-2차 | 12-3차 | 13-1차 | 13-2차 | 계 |
| 기초 미행사 수량 | 176,000 | 181,000 | 250,000 | 89,600 | 134,400 | - | - | 1,894,274 |
| 부여수량 | - | - | - | - | - | 191,600 | 62,400 | 254,000 |
| 행사수량 | - | - | - | - | - | - | - | 66,100 |
| 취소수량 | - | - | - | 26,400 | 39,600 | 2,000 | 3,000 | 92,000 |
| 미행사수량 | 176,000 | 181,000 | 250,000 | 63,200 | 94,800 | 189,600 | 59,400 | 1,990,174 |
(주1) 주식선택권수량은 최초 부여일 이후 발생된 유/무상증자 및 주식매수택권의 행사, 취소, 소멸 및 등의 사유로 변동되었습니다.
(3) 당분기와 전기의 주식선택권 가중평균행사가격은 다음과 같습니다.
| 구분 | 당분기 | 전기 |
| 기초 | 23,057 | 23,878 |
| 부여 | 12,699 | 22,835 |
| 행사 | 6,601 | 6,639 |
| 취소 | 13,309 | 29,595 |
| 기말(주1)(주2) | 11,615 | 23,057 |
(주1) 당기 중 무상증자를 실시하여 미행사 주식매수선택권의 행사가격이 조정되었습니다.
(주2) 당기 중 전환사채 및 전환우선주 발행으로 인하여 행사되지 않은 주식매수선택권의 행사가격이 조정되었습니다.
(4) 회사는 주식선택권의 보상원가를 이항모형을 이용한 공정가치접근법을 적용하여산정했으며, 당분기말 현재 행사되지 않은 주식선택권의 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| 구분 | 3-2차 | 5-2차 | 6-2차 | 7-1차 | 7-2차 | 8-1차 | 8-2차 | 9차 | 10차 |
| 주식선택권의 공정가치(주1) | 2,788원 | 1,493원 | 1,633원 | 1,797원 | 2,143원 | 2,440원 | 3,344원 | 2,979원 | 7,094원 |
| 부여일 주식가격(주2) | 8,143원 | 8,144원 | 8,548원 | 13,588원 | 13,588원 | 18,213원 | 18,213원 | 19,169원 | 35,245원 |
| 주가변동성(주2) | 4.32% | 4.21% | 4.20% | 5.41% | 4.58% | 7.36% | 6.86% | 8.07% | 9.60% |
| 배당수익률(주2) | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% |
| 무위험수익률(주2) | 2.40% | 2.15% | 1.88% | 1.44% | 1.55% | 1.06% | 1.28% | 0.81% | 0.93% |
| 구분 | 11차 | 12-1차 | 12-2차 | 12-3차 | 13-1차 | 13-2차 | 14-1차 | 14-2차 |
| 주식선택권의 공정가치(주1) | 6,300원 | 7,492원 | 6,564원 | 8,383원 | 4,871원 | 5,690원 | 5,700원 | 7,108원 |
| 부여일 주식가격(주2) | 35,245원 | 35,590원 | 35,590원 | 35,590원 | 21,550원 | 21,550원 | 13,120원 | 13,120원 |
| 주가변동성(주2) | 9.14% | 62.73% | 67.73% | 60.08% | 81.25% | 81.25% | 53.56% | 55.01% |
| 배당수익률(주2) | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% |
| 무위험수익률(주2) | 1.16% | 2.21% | 1.95% | 2.35% | 3.51% | 3.53% | 3.32% | 3.34% |
(주1) 무상증자에 따라 주식매수선택권의 공정가치가 조정되었습니다.
(주2) 주식선택권의 최초부여기준입니다.
(5) 당사는 주식기준보상약정과 관련한 주식기준보상비용을 약정용역 제공기간동안 정액법으로 안분하여 비용으로 인식하고 있으나, 부여 시점 이후 행사기간 변경 계약에 따른 행사기간 조정 및 유상증자에 따른 일부 행사가격 조정을 반영하여, 증분공정가치 14백만원(전기 3,305백만원)이 조건변경의 결과로 부여되었습니다.
21. 기타포괄손익누계액
(1) 당분기말 및 전기말 현재 기타포괄손익누계액의 내용은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기말 | 전기말 |
|---|---|---|
| 지분법자본변동 | (1,056) | (1,056) |
(2) 당분기와 전분기 중 기타포괄손익누계액의 변동내용은 다음과 같습니다.
| (단위: 천원) |
| 기간 | 구분 |
기초 |
증감 | 기말 |
|---|---|---|---|---|
| 당분기 | 지분법자본변동 | (1,056) | - | (1,056) |
| 전분기 | 지분법자본변동 | (1,079) | (15) | (1,094) |
22. 결손금
(1) 당분기말 및 전기말 현재 결손금의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 미처리결손금 | 271,325,337 | 432,473,364 |
(2) 당분기와 전분기 중 결손금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | 432,473,364 | 376,600,906 |
| 당기순손실 | 38,828,938 | 43,909,508 |
| 결손금보전(주1) | (200,000,000) | - |
| 지분법자본변동 | 23,035 | 79,244 |
| 기말 | 271,325,337 | 420,589,658 |
(주1) 당기 중 정기주주총회 의결에 따라 주식발행초과금 200,000백만원을 재원으로 결손금을 보전하였습니다.
23. 충당부채
(1) 당분기말 및 전기말 현재 충당부채의 내역은 다음과 같습니다.
| (단위: 천원) |
|
구분 |
당분기말 | 전기말 |
|---|---|---|
| 복구충당부채 | 434,032 | 400,726 |
| 합계 | 434,032 | 400,726 |
(2) 당분기와 전분기 중 충당부채의 변동 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||||
|---|---|---|---|---|---|---|
| 복구충당부채 | 기타충당부채 | 합 계 | 복구충당부채 | 기타충당부채 | 합 계 | |
| 기초 | 400,726 | - | 400,726 | 424,659 | 1,458,000 | 1,882,659 |
| 증가 | 33,306 | - | 33,306 | 25,960 | - | 25,960 |
| 감소 | - | - | - | (50,599) | (1,350,600) | (1,401,199) |
| 기말 | 434,032 | - | 434,032 | 400,020 | 107,400 | 507,420 |
| 유동항목 | - | - | - | - | 107,400 | 107,400 |
| 비유동항목 | 434,032 | - | 434,032 | 400,020 | - | 400,020 |
24. 영업비용
(1) 당분기와 전분기 중 영업비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 1,140,097 | 2,743,360 | 892,785 | 2,872,329 |
| 퇴직급여 | 106,481 | 328,957 | 110,008 | 330,024 |
| 복리후생비 | 247,746 | 768,586 | 256,919 | 758,729 |
| 경상연구개발비 | 10,294,275 | 25,908,983 | 8,530,122 | 30,810,451 |
| 주식보상비용 | 695,791 | 2,231,802 | 583,987 | 5,828,477 |
| 유무형자산감가상각비 | 770,291 | 2,336,780 | 801,414 | 2,536,961 |
| 지급수수료 | 281,790 | 946,386 | 316,634 | 1,035,981 |
| 여비교통비 | 58,574 | 163,172 | 12,234 | 183,831 |
| 기타판매비와관리비 | 225,860 | 673,389 | 261,806 | 788,006 |
| 합계 | 13,820,905 | 36,101,415 | 11,765,909 | 45,144,789 |
(2) 당분기와 전분기 중 비용으로 인식한 경상연구개발비의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급여 | 4,157,304 | 3,879,364 |
| 소모품비 | 2,131,169 | 2,918,299 |
| 지급수수료 | 18,949,819 | 23,508,402 |
| 기타 | 670,691 | 504,386 |
| 합계 | 25,908,983 | 30,810,451 |
25. 금융수익과 금융비용
(1) 당분기와 전분기 중 금융수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | 231,044 | 683,085 | 491,017 | 1,586,709 |
| 당기손익-공정가치금융자산평가이익 | - | 200,814 | 62,649 | 101,149 |
| 당기손익-공정가치금융자산처분이익 | 35,100 | 55,620 | - | 106,961 |
| 외화환산이익 | 17,753 | 17,753 | (41) | - |
| 외환차익 | 101,738 | 106,045 | 8,714 | 91,348 |
| 합계 | 385,635 | 1,063,317 | 562,339 | 1,886,167 |
(2) 당분기와 전분기 중 금융비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 당기손익-공정가치금융자산평가손실 | (120,944) | 1,963,479 | - | - |
| 이자비용 | 296,218 | 497,631 | 99,579 | 261,947 |
| 외환환산손실 | (2,777) | 5 | (3,181) | 1,322 |
| 외환차손 | 2,815 | 91,339 | 49,188 | 107,672 |
| 합계 | 175,312 | 2,552,454 | 145,586 | 370,941 |
26. 기타수익과 기타비용
(1) 당분기와 전분기 중 기타수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 수입수수료 | 27,798 | 38,692 | 38,020 | 42,120 |
| 유형자산처분이익 | - | - | 3,645 | 7,344 |
| 잡이익 | - | - | - | 49 |
| 기타충당부채환입 | - | - | 1,350,600 | 1,350,600 |
| 합계 | 27,798 | 38,692 | 1,392,265 | 1,400,113 |
(2) 당분기 및 전분기 중 기타비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 기부금 | - | 2,500 | - | - |
| 유형자산처분손실 | 812 | 812 | - | 894 |
| 잡손실 | - | 1,437 | - | - |
| 합계 | 812 | 4,749 | - | 894 |
27. 법인세비용 및 이연법인세
법인세비용은 전체 회계연도에 대해서 예상되는 경영진의 가중평균 연간법인세율에 대한 최선의 추정에 기초하여 인식하였습니다. 당사는 일시적차이 및 이월세액공제에 대한 이연법인세자산은 실현가능성이 불확실하여 인식하지 않고 있습니다.
28. 주당순손실
(1) 당분기 및 전분기의 기본주당손실의 내역은 다음과 같습니다.
| (단위: 원) |
| 구 분 | 당분기 | 전분기 |
| 기본주당순손실 | (879) | (1,025) |
(2) 기본주당손실 계산에 사용된 당기순손실과 가중평균유통보통주식수는 다음과 같습니다.
| (단위: 원, 주) |
| 구 분 | 당분기 | 전분기 |
| 당기순손실 | (38,828,937,691) | (43,909,507,679) |
| 가중평균유통보통주식수 | 44,177,997 | 42,839,782 |
| 기본주당순손실 | (879) | (1,025) |
(3) 가중평균유통보통주식수
| <당분기> | (단위: 일, 주) |
| 일자 | 일수 | 주식수 | 적수 | |
| 2024-01-01 | 2024-01-24 | 24 | 44,137,600 | 1,059,302,400 |
| 2024-01-25 | 2024-04-08 | 75 | 44,140,599 | 3,310,544,925 |
| 2024-04-09 | 2024-04-24 | 16 | 44,137,599 | 706,201,584 |
| 2024-04-25 | 2024-07-24 | 91 | 44,196,824 | 4,021,910,984 |
| 2024-07-25 | 2024-09-30 | 68 | 44,217,811 | 3,006,811,148 |
| 가중평균보통주식수 | 44,177,997 | |||
| <전분기> | (단위: 일, 주) |
| 일자 | 일수 | 주식수 | 무상증자 반영 주식수 |
적수 | 무상증자 반영 적수 |
|
| 2023-01-01 | 2023-03-24 | 83 | 20,001,200 | 40,002,400 | 1,660,099,600 | 3,320,199,200 |
| 2023-03-25 | 2023-04-27 | 34 | 22,001,200 | 44,002,400 | 748,040,800 | 1,496,081,600 |
| 2023-04-28 | 2023-07-26 | 90 | 22,045,600 | 44,091,200 | 1,984,104,000 | 3,968,208,000 |
| 2023-07-27 | 2023-09-30 | 66 | 22,051,300 | 44,102,600 | 1,455,385,800 | 2,910,771,600 |
| 가중평균보통주식수 | 21,419,891 | 42,839,782 | ||||
(4) 기본주당순손익은 회사의 보통주당기순손익을 가중평균 유통보통주식수로 나누어 산정하였습니다. 회사가 보유하고 있는 희석성 잠재적보통주로는 전환사채와 전환우선주, 주식매수선택권이 있으나 동 희석성잠재적보통주로 인하여 희석화 효과가 발생하지 않으므로 당기의 희석주당순손실은 기본주당순손실과 동일합니다.
29. 영업활동에서 사용된 현금
(1) 당분기 및 전분기의 영업활동에서 사용된 현금은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 법인세비용차감전 순손실 | (38,828,938) | (43,909,508) |
| 조정 : | ||
| 당기손익-공정가치금융자산평가손실 | 1,963,479 | - |
| 지분법평가손실 | 1,296,609 | 2,584,613 |
| 감가상각비 | 1,586,769 | 1,741,498 |
| 무형자산상각비 | 278,885 | 265,405 |
| 사용권자산감가상각비 | 471,126 | 530,058 |
| 유형자산폐기손실 | - | 894 |
| 사용권자산처분손실 | 812 | - |
| 퇴직급여 | 618,314 | 591,816 |
| 주식보상비용 | 2,231,802 | 5,828,477 |
| 이자수익 | (683,085) | (1,586,709) |
| 사용권자산처분이익 | - | (7,345) |
| 지분법처분이익 | - | (317,549) |
| 기타충당부채환입 | - | (1,350,600) |
| 이자비용 | 497,631 | 261,947 |
| 외화환산이익 | (17,753) | - |
| 외화환산손실 | 5 | 1,322 |
| 당기손익-공정가치금융자산 평가이익 | (200,814) | (101,149) |
| 당기손익-공정가치금융자산 처분이익 | (55,620) | (106,961) |
| 미수금의감소 | 141,184 | 2,819,467 |
| 기타유동자산의감소(증가) | (660,699) | 3,161,465 |
| 기타비유동자산의감소(증가) | 1,154,606 | (5,760,359) |
| 기타금융부채의감소 | (1,082,079) | (428,665) |
| 기타유동부채의감소 | (160,414) | (646,177) |
| 순확정급여부채의증가(감소) | 42,900 | (19,681) |
| 영업활동에서 사용된 현금 | (31,405,280) | (36,447,741) |
(2) 현금흐름표는 간접법에 의해 작성되었으며, 당분기 및 전분기 중 현금의 유입과 유출이 없는 주요한 거래는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 건설중인자산 기계장치 대체 | - | 349,000 |
| 유형자산 취득관련 미지급금의 감소 | - | (17,589) |
| 리스변경으로 인한 사용권자산 증가 | 99,037 | 101,925 |
| 전대리스시 금융리스채권 대체 | 23,649 | (9,855) |
| 장기선급금의 특허/상표권 대체 | 147,285 | 40,662 |
| 주식매입선택권 행사시 주식선택권 대체 | 213,267 | 196,414 |
(3) 재무활동에서 생기는 부채의 조정
| (단위: 천원) |
| 기간 | 구분 | 기초 | 현금흐름변동 | 비현금거래 | 기타(주1) | 기말 |
|---|---|---|---|---|---|---|
| 당분기 | 금융리스부채 | 3,720,832 | (401,007) | 494,813 | (267,869) | 3,546,769 |
| 전분기 | 금융리스부채 | 4,273,255 | (402,692) | 217,934 | (235,205) | 3,853,292 |
(주1) 기타에는 이자비용의 지급액이 포함되어 있습니다.
30. 특수관계자거래
(1) 당분기말과 전기말 현재 회사의 특수관계자 현황은 다음과 같습니다.
| 구 분 | 당분기말 | 전기말 | 비고 |
|---|---|---|---|
| 관계기업 | 주식회사 지아이바이옴 | 주식회사 지아이바이옴 | - |
| 주식회사 지아이셀 | 주식회사 지아이셀 | ||
| 주식회사 메디오젠 | 주식회사 메디오젠 | ||
| 기타 특수관계자(주1) | - | 주식회사 인츠바이오 | 주요 임원이 지배하는 회사 |
(주1) 당분기중 주요 임원이 사임하여 제외되었습니다.
(2) 당분기와 전분기 중 특수관계자와의 주요 거래내역은 다음과 같습니다.
| <당분기> | (단위: 천원) |
| 구분 | 회사의 명칭 | 수익거래 | 비용거래 | |
|---|---|---|---|---|
| 매출등 | 기타수익 | 기타비용 | ||
| 관계기업 | 주식회사 지아이바이옴 | - | 31,135 | 1,851,350 |
| 주식회사 지아이셀 | 24,281 | 139,225 | - | |
| 합 계 | 24,281 | 170,360 | 1,851,350 | |
| <전분기> | (단위: 천원) |
| 구분 | 회사의 명칭 | 수익거래 | 비용거래 | |
|---|---|---|---|---|
| 매출등 | 기타수익 | 기타비용 | ||
| 관계기업 | 주식회사 지아이바이옴 | - | 9,274 | 600,522 |
| 주식회사 지아이셀 | 587,899 | 12,506 | 570 | |
| 합 계 | 587,899 | 21,780 | 601,092 | |
(3) 당분기말 및 전기말 현재 채권ㆍ채무잔액(차입금 및 대여금은 제외)은 다음과 같습니다.
| <당분기말> | (단위: 천원) |
| 구분 | 회사의 명칭 | 채권 | 채무 |
|---|---|---|---|
| 기타채권(주1) | 기타채무 | ||
| 관계기업 | 주식회사 지아이바이옴 | 2,916,009 | 121,908 |
| 주식회사 지아이셀 | 258,910 | - | |
| 합 계 | 3,174,919 | 121,908 | |
(주1) 금융리스채권, 상환전환우선주 등이 포함되어 있습니다.
| <전기말> | (단위: 천원) |
| 구분 | 회사의 명칭 | 채권 | 채무 |
|---|---|---|---|
| 기타채권(주1) | 기타채무 | ||
| 관계기업 | 주식회사 지아이바이옴 | 3,236,187 | 53,431 |
| 주식회사 지아이셀 | 121,499 | 330 | |
| 합 계 | 3,357,686 | 53,761 | |
(주1) 금융리스채권, 상환전환우선주 등이 포함되어 있습니다.
(4) 당분기와 전분기중 특수관계자에 대한 자금 거래내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 회사의 명칭 | 당분기 | 전분기 |
|---|---|---|---|
| 현금대여 | 현금대여 | ||
| 관계기업 | 주식회사 지아이바이옴 | 3,000,000 | - |
| 주식회사 지아이셀 | 6,000,000 | - | |
| 합 계 | 9,000,000 | - | |
(5) 회사는 등기이사 및 기업활동의 계획, 운영 및 통제에 대한 중요한 권한과 책임을가진 등기 임원을 주요 경영진으로 판단하고 있으며, 당분기 및 전분기의 주요 경영진에 대한 보상금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급여 및 기타 단기종업원 급여 | 1,557,950 | 1,418,688 |
| 퇴직급여 | 271,214 | 254,147 |
| 주식기준보상 | 1,433,659 | 3,298,239 |
| 합계 | 3,262,823 | 4,971,074 |
31. 우발상황 및 주요약정사항
(1) 유무형자산 취득약정
당분기말 현재 발생하지 아니한 유형자산의 취득을 위한 약정금액은 없습니다.
(2) 기술이전계약과 관련된 불확실성 및 기타사항
회사의 향후 마일스톤 및 로열티 수익은 임상시험, 관계당국의 허가 등 개발의 성공여부에 따라 달라질 수 있으므로 발생가능성에 불확실성이 내포되어 있습니다.
6. 배당에 관한 사항
가. 배당에 관한 사항
당사 정관에서는 아래와 같이 배당에 관한 사항을 규정하고 있습니다.
| ㆍ제12조(신주의 배당기산일) 본 회사가 유상증자, 무상증자 및 주식배당에 의하여 발행한 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전 영업연도 말에 발행된 것으로 본다. ㆍ제54조 (이익금의 처분) 본 회사는 매사업연도의 처분전 이익잉여금을 다음과 같이 처분한다. 1. 이익준비금 2. 기타의 법정준비금 3. 배당금 4. 임의적립금 5. 기타의 이익잉여금처분액 ㆍ제55조(이익배당) ① 이익배당은 금전 또는 금전 외의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. ③ 제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익배당은 주주총회의 결의로 정한다. ㆍ제56조(배당금지급청구권의 소멸시효) ① 배당금의 지급청구권은 5년간 이를 행사하지 아니하면 소멸시효가 완성한다. 미지급 배당금에는 이자를 부하지 아니한다. ② 제1항의 시효의 완성으로 인한 배당금은 본 회사에 귀속한다. |
나. 주요배당지표
| 구분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제08기 3분기 | 제07기 | 제06기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | -38,829 | -55,495 | -79,833 | |
| (별도)당기순이익(백만원) | - | - | - | |
| (연결)주당순이익(원) | -879 | -1,286 | -1,996 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
※ 전기 및 전전기 '(연결)주당순이익(원)'은 2024년 01월 04일 이사회 결의에 따른 무상증자 효과를 반영하여 재계산하였습니다.
다. 과거배당이력
당사 회사설립 이후 보고서 작성기준일 현재까지 배당을 지급한 이력은 없습니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 증자(감자)현황
최근 3사업연도의 증자(감자) 현황은 다음과 같습니다.
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2022년 01월 05일 | 주식매수선택권행사 | 보통주 | 22,195 | 500 | - | - |
| 2022년 04월 01일 | 주식매수선택권행사 | 보통주 | 7,672 | 500 | - | - |
| 2022년 04월 04일 | 주식매수선택권행사 | 보통주 | 1,500 | 500 | - | - |
| 2023년 03월 25일 | 유상증자(일반공모) | 보통주 | 2,000,000 | 500 | 13,000 | - |
| 2023년 04월 27일 | 주식매수선택권행사 | 보통주 | 44,400 | 500 | - | - |
| 2023년 07월 27일 | 주식매수선택권행사 | 보통주 | 5,700 | 500 | - | - |
| 2023년 10월 26일 | 주식매수선택권행사 | 보통주 | 16,000 | 500 | - | - |
| 2024년 01월 22일 | 무상증자 | 보통주 | 22,067,300 | 500 | - | (주1) |
| 2024년 01월 25일 | 주식매수선택권행사 | 보통주 | 2,999 | 500 | - | - |
| 2024년 04월 25일 | 주식매수선택권행사 | 보통주 | 59,225 | 500 | - | - |
| 2024년 07월 25일 | 주식매수선택권행사 | 보통주 | 20,987 | 500 | - | - |
| 2024년 08월 08일 | 유상증자(제3자배정) | 우선주 | 858,371 | 500 | 11,650 | - |
(주1) 소유주식 1주당 신주 1주의 비율로 배정하는 무상증자를 실시하였습니다.
나. 미상환 전환사채 발행현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록) 총액 |
전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 (원) |
권면(전자등록) 총액 |
전환가능 주식수 |
||||||||
| 제1회 무기명식 전환사채 |
1 | 2024년 08월 08일 | 2029년 08월 08일 | 10,000 | 기명식 보통주 | 2025년 08월 08일~ 2029년 07월 08일 |
100 | 11,647 | 10,000 | 858,590 | (주1) |
| 합 계 | - | - | - | 10,000 | - | - | - | - | 10,000 | 858,590 | - |
(주1) 자세한 사항은 2024년 07월 30일 주요사항보고서(전환사채권발행결정) 공시를 참고하시기 바랍니다.
다. 미상환 신주인수권부사채 등 발행현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
라. 미상환 전환형 조건부자본증권 등 발행현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
| [채무증권의 발행 등과 관련된 사항] |
마. 채무증권 발행실적
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| 지아이이노베이션 | 회사채 | 사모 | 2024년 08월 08일 | 10,000 | 표면이자율 : 0% 만기이자율 : 3% |
- | 2029년 08월 08일 | 미상환 | - |
| 합 계 | - | - | - | 10,000 | - | - | - | - | - |
※ 자세한 사항은 2024년 07월 30일 주요사항보고서(전환사채권발행결정) 공시를 참고하시기 바랍니다.
바. 기업어음증권 미상환 잔액
당사는 보고서 작성기준일 현재 해당사항 없습니다.
기업어음증권 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
사. 단기사채 미상환 잔액
당사는 보고서 작성기준일 현재 해당사항 없습니다.
단기사채 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
아. 회사채 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | 10,000 | - | - | - | - | - | 10,000 | |
| 합계 | - | - | - | - | - | - | - | - | |
(주1) 사채권자의 조기상환청구권을 고려한 만기이며, 계약상 만기는 발행일로부터 5년입니다.
자. 신종자본증권 미상환 잔액
당사는 보고서 작성기준일 현재 해당사항 없습니다.
신종자본증권 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
차. 조건부자본증권 미상환 잔액
당사는 보고서 작성기준일 현재 해당사항 없습니다.
조건부자본증권 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
최근 3사업연도 중 증권의 발행을 통해 조달한 공모자금의 사용내역은 다음과 같습니다.
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 구분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 코스닥시장 상장공모 | - | 2023년 03월 24일 | 임상개발, 연구개발 시설자금, 운영자금 |
24,855 | 임상개발, 연구개발 시설자금, 운영자금 |
24,855 | (주1) |
(주1) 공모를 통해 조달한 자금 전액을 증권신고서에 기재한 자금사용계획에 따라 소진하였습니다.
나. 사모자금의 사용내역
보고서 작성기준일 현재 미사용된 사모자금의 사용내역은 다음과 같습니다.
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 구분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 제3자배정 유상증자 (보통주) |
- | 2021년 03월 19일 | (주1) | 10,000 | (주1) | 10,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 04월 19일 | (주1) | 20,000 | (주1) | 20,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 09일 | (주3) | 9,800 | (주3) | 9,800 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 09일 | (주1) | 5,000 | (주1) | 5,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주2) | 7,000 | (주2) | 7,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주2) | 3,000 | (주2) | 3,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 1,459 | (주1) | 1,459 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 1,541 | (주1) | 1,541 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 495 | (주1) | 495 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 505 | (주1) | 505 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 301 | (주1) | 301 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 7,700 | (주1) | 7,700 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 3,000 | (주1) | 3,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 35,000 | (주1) | 35,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 6,500 | (주1) | 6,500 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 9,050 | (주1) | 9,050 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 9,000 | (주1) | 9,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 11일 | (주1) | 1,000 | (주1) | 1,000 | - |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 28일 | (주1) | 28,000 | (주1) | 25,360 | (주4) |
| 제3자배정 유상증자 (보통주) |
- | 2021년 06월 28일 | (주1) | 2,000 | (주1) | - | (주4) |
| 제3자배정 유상증자 (우선주) |
- | 2024년 08월 08일 | (주2) | 10,000 | (주2) | - | (주4) |
| 전환사채 | 1 | 2024년 08월 08일 | (주2) | 10,000 | (주2) | - | (주4) |
(주1) 운영자금, 연구개발비, 시설투자, 합작회사 및 자회사, 관계사 설립 및 지분투자
(주2) 운영자금 및 연구개발비
(주3) 운영자금 및 연구개발비, 시설투자
(주4) 보고서 작성기준일 현재 미사용자금은 정기예금 등 안정적인 단기금융상품을 활용하여 운용하고 있습니다.
다. 미사용자금의 운용내역
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 수시입출금 | 11,640 | - | - |
| 예ㆍ적금 | 정기예금 | 9,000 | 3개월 ~ 6개월 | 3개월 ~ 6개월 |
| 기타금융상품 | 수익증권 등 | 4,000 | 5개월 ~ 6개월 | 5개월 ~ 6개월 |
| 계 | 24,640 | - | ||
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
나. 대손충당금 설정현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
다. 재고자산 현황 등
당사는 보고서 작성기준일 현재 해당사항 없습니다.
라. 수주계약 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
마. 금융상품의 공정가치평가
(1) 금융상품 종류별 공정가치
보고서 작성기준일 및 전기말 현재 현재 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
|
(단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산 | ||||
| 현금및현금성자산 | 12,199,224 | (주1) | 8,543,303 | (주1) |
| 당기손익-공정가치 측정 금융자산(유동) |
5,202,360 | 5,202,360 | 9,186,925 | 9,186,925 |
| 당기손익-공정가치 측정 금융자산(비유동) |
2,682,536 | 2,682,536 | 7,601,765 | 7,601,765 |
| 기타유동금융자산 | 11,969,080 | (주1) | 28,631,732 | (주1) |
| 기타비유동금융자산 | 9,552,063 | (주1) | 424,432 | (주1) |
| 소계 | 41,605,263 | 54,388,157 | ||
| 금융부채 | ||||
| 기타유동금융부채 | 2,657,976 | (주1) | 3,757,802 | (주1) |
| 기타비유동금융부채 | 434,978 | (주1) | 415,193 | (주1) |
| 전환사채 | 8,329,288 | (주1) | - | |
| 소계 | 11,422,242 | 4,172,995 | ||
(주1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 서열체계 및 측정방법등 공시에 포함하지 않았습니다.
(2) 공정가치 서열체계
1) 공정가치로 측정되는 금융상품은 공정가치 서열체계에 따라 구분되며 정의된 수준들은 다음과 같습니다.
① 측정일에 동일한 자산이나 부채에 대해 접근할 수 있는 활성시장의 (조정하지 않은) 공시가격 (수준 1)
② 수준 1의 공시가격 외에 자산이나 부채에 대해 직접적으로나 간접적으로 관측할 수 있는 투입변수 (수준 2)
③ 자산이나 부채에 대한 관측할 수 없는 투입변수 (수준 3)
2) 공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
|
(단위: 천원) |
|
당분기말 |
수준 1 |
수준 2 |
수준 3 |
합계 |
|---|---|---|---|---|
| 반복적인 공정가치 측정치 | ||||
| 채무상품 | - | 2,000,000 | - | 2,000,000 |
| 지분증권 | 2,955,750 | - | 2,682,536 | 5,638,286 |
| 파생상품금융자산 | - | - | 246,610 | 246,610 |
|
(단위: 천원) |
|
전기말 |
수준 1 |
수준 2 |
수준 3 |
합계 |
|---|---|---|---|---|
| 반복적인 공정가치 측정치 | ||||
| 채무상품 | - | 9,186,925 | - | 9,186,925 |
| 지분증권 | 4,601,766 | 2,999,999 | - | 7,601,765 |
(3) 공정가치체계 수준 3의 변동내역
재무상태표에 공정가치로 측정하는 금융자산 중 수준3으로 분류된 항목의 당분기 및 전분기 중 공정가치 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | - | - |
| 수준 2로부터의 이동 | 2,999,999 | - |
| 발행 | 246,610 | |
|
기타비용으로 인식된 손실 |
(317,463) | - |
| 기말 | 2,929,146 | - |
(4) 공정가치 산정에 사용된 가치평가기법 및 투입변수
수준 3으로 분류된 금융상품의 공정가치 측정에 사용된 가치평가기법 및 투입변수는 다음과 같습니다.
|
(단위: 천원) |
|
구분 |
공정가치 | 수준 | 가치평가기법 | 투입변수 | 투입변수 범위 |
관측불가능 투입변수 변동에 대한 공정가치 영향 |
|---|---|---|---|---|---|---|
| 비상장지분증권 | 2,682,536 | 3 | DCF | 할인율 | 16.94% | 할인율 감소시 공정가치 증가 |
| 변동성 | 43.31% | 변동성 증가시 공정가치변동 증가 | ||||
| 파생상품 금융자산 |
246,610 | 3 | 옵션가격결정모형 (Goldman-Sachs) |
할인율 | 12.508%~ 34.291% |
할인율 감소시 공정가치 증가 |
| 변동성 | 68.19% | 변동성 증가시 공정가치변동 증가 |
바. 유형자산의 공정가치 평가
당사는 최근 3사업연도 중 유형자산 재평가내역이 없습니다.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
가. 회계감사인의 명칭 및 감사의견
| 사업연도 | 감사인 | 감사의견 | 강조사항 등 | 핵심감사사항 |
|---|---|---|---|---|
| 제08기 (당기) |
삼일회계법인 | - | - | - |
| 제07기 (전기) |
삼일회계법인 | 적정 | 해당사항 없음 | 관계기업투자주식에 대한 손상평가 |
| 제06기 (전전기) |
이촌회계법인 | 적정 | 해당사항 없음 | - |
나. 감사용역 체결현황
|
(단위: 천원, 시간) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제08기(당기) | 삼일회계법인 | 반기 재무제표 검토 연간 재무제표 감사 내부회계관리제도 검토 |
90,000 | 900 | 32,000 | 320 |
| 제07기(전기) | 삼일회계법인 | 반기 재무제표 검토 연간 재무제표 감사 내부회계관리제도 감사 |
100,000 | 1,000 | 110,000 | 1,242 |
| 제06기(전전기) | 이촌회계법인 | 분기 재무제표 검토 연간 재무제표 감사 내부회계관리제도 검토 |
120,000 | 941 | 120,000 | 940 |
다. 회계감사인과의 비감사용역 계약체결 현황
|
(단위: 천원) |
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제08기(당기) | - | - | - | - | - |
| 제07기(전기) | 2023년 12월 | 법인세세무조정 | 2023년 12월 ~ 2024년 04월 | 7,000 | 삼일회계법인 |
| 제06기(전전기) | 2022년 12월 | 법인세세무조정 | 2022년 12월 ~ 2023년 04월 | 7,000 | 삼일회계법인 |
※ 제08기(2024년) 사업연도의 회계감사인과 체결한 최근 3사업연도의 비감사용역을 기재하였으며, 제06기(2022년) 비감사용역은 회계감사인으로 감사용역을 체결하지 아니한 사업연도에 수행되었습니다.
라. 내부감사기구가 회계감사인과 논의한 결과
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2024년 03월 20일 |
회사측: 감사위원회 3인 |
서면보고 | 재무제표 감사 및 내부회계관리제도 감사 결과 보고 |
2. 내부통제에 관한 사항
가. 회계감사인의 내부회계관리제도 검토 및 감사의견
| 사업연도 | 회계감사인 | 검토 및 감사의견 | 지적사항 |
| 제08기 3분기(당분기) | 삼일회계법인 | - | - |
| 제07기 (전기) |
삼일회계법인 | 우리의 의견으로는 회사의 내부회계관리제도는 2023년 12월 31일 현재 내부회계관리제도 설계 및 운영 개념체계」에 따라 중요성의 관점에서 효과적으로 설계 및 운영되고 있습니다. | 해당사항 없음 |
| 제06기 (전전기) |
이촌회계법인 | 경영자의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영자의운영실태보고 내용이 중요성의 관점에서 내부회계관리 제도 모범규준의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. |
해당사항 없음 |
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사회 구성 개요
보고서 작성기준일 현재 당사의 이사회는 사내이사 3인(이병건, 홍준호, 장명호)과 사외이사 4인(김병철, 김현철, 안근용, 류양지) 총 7인으로 구성되어 있습니다. 이사회 의장은 이병건 사내이사로 대표이사를 겸직하고 있으며, 기업 운영 및 사업 전반에 대한 이해도가 높아 이사회를 효과적으로 운영 가능하다고 인정되어 의장에 선임되었습니다.
이사회는 법령 또는 정관에서 정한 사항, 주주총회로부터 위임 받은 사항, 회사 경영의 기본 방침 및 업무집행에 관한 주요사항을 의결하며 이사 및 경영진의 직무집행을 감독하고 있습니다. 이사회내 위원회로는 감사위원회, 투명경영위원회, 보상위원회를 설치하여 운영하고 있습니다.
[사외이사 및 그 변동현황]
(기준일 : 2024년 09월 30일)
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 7 | 4 | 3 | - | 1 |
(주1) 2024년 등기이사 변동
| 구분 | 성명 | 비고 |
|---|---|---|
| 사내이사 | 장명호 | 중임 |
| 홍준호 | 임기조정을 위한 중도퇴임 후 재선임 | |
| 남수연 | 자진사임 | |
| 사외이사 | 안근용 | 중임 |
| 김현철 | 중임 | |
| 류양지 | 임기조정을 위한 중도퇴임 후 재선임 | |
| 유규창 | 임기만료에 따른 사임 |
나. 이사회 운영규정
당사의 이사회 규정에서 정하는 이사회 운영에 관한 주요 내용은 아래와 같습니다.
| 구분 | 내용 |
| 제3조(권한) | ① 이사회는 법령 또는 정관에 정하여진 사항, 주주총회로부터 위임받은 사항, 회사경영의 기본방침 및 업무집행에 관한 중요사항을 의결한다. ② 이사회는 이사의 직무의 집행을 감독한다. |
| 제5조(의장) | ① 이사회의 의장은 회사의 정관에 따라 이사회에서 정한다. ② 의장의 직무를 행할 수 없을 때에는 부사장, 전무이사, 상무이사, 의장이 지명한 이사의 순으로 그 직무를 대행한다. |
| 제9조 (소집권자) |
① 이사회는 각 이사가 소집한다. 그러나 이사회의 결의로 소집할 이사를 정한때에는 그러하지 아니하다. ② 제 1 항 단서의 규정에 의하여 소집권자로 지정되지 않은 다른 이사는 소집권자인 이사에게 이사회 소집을 요구할 수 있다. 소집권자인 이사가 정당한 이유없이 이사회 소집을 거절하는 경우에는 다른 이사가 이사회를 소집할 수 있다. |
| 제11조 (결의방법) |
① 이사회의 결의는 법령에 다른 정함이 있는 경우를 제외하고는 이사 과반수의 출석과 출석이사 과반수로 한다. ② 이사회는 이사의 전부 또는 일부가 직접 회의에 출석하지 아니하고 모든 이사가 음성을 동시에 송수신하는 원격 통신수단에 의하여 결의에 참가하는 것을 허용할 수 있으며, 이 경우 당해 이사는 이사회에 직접 출석한 것으로 본다. ③ 이사회의 결의에 관하여 특별한 이해관계가 있는 이사는 의결권을 행사하지 못한다. ④ 제 3 항의 규정에 의하여 의결권을 행사할 수 없는 이사의 수는 출석한 이사의 수에 산입하지 아니한다. |
다. 중요의결사항 등
당분기 중 개최된 이사회 회의 내역은 아래와 같습니다.
| (기준일 : | 2024년 09월 30일 | ) |
| 개최일자 | 의안내용 | 가결여부 | 이사의 성명 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 사내이사 | 사외이사 | ||||||||||
| 이병건 (출석률 100%) |
홍준호 (출석률 100%) |
장명호 (출석률 100%) |
남수연 (출석률 0%) |
김현철 (출석률 100%) |
유규창 (출석률 80%) |
안근용 (출석률 100%) |
김병철 (출석률 93%) |
류양지 (출석률 93%) |
|||
| 찬 반 여 부 | |||||||||||
| 2024년 01월 04일 (1차) |
1. 주식발행초과금 자본전입 (무상증자) 실시의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 |
| 2024년 01월 25일 (2차) |
1. 주식매수선택권 부여 취소의 건 2. 주식매수선택권 부여조건 조정의 건 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
불참 | 찬성 찬성 |
불참 | 찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
| 2024년 02월 02일 (3차) |
1. 타법인 금전대여의 건 | 가결 | 찬성 | 찬성 | 찬성 | 불참 | 찬성 | 찬성 | 찬성 | 불참 | 찬성 |
| 2024년 02월 13일 (4차) |
1. 2023년 (제07기) 재무제표 및 영업보고서 승인의 건 2. 2023년 내부회계관리제도 운영실태 보고의 건 |
가결 - (보고) |
찬성 - (보고) |
찬성 - (보고) |
찬성 - (보고) |
불참 | 찬성 - (보고) |
찬성 - (보고) |
찬성 - (보고) |
찬성 - (보고) |
불참 |
| 2024년 03월 13일 (5차) |
1. 감사위원회의 내부회계관리제도 운영실태 평가 보고의 건 2. 외부 법무법인의 내부통제시스템 검토 및 점검 내용 보고의 건 3. 제07기 (2023 회계연도) 정기주주총회 소집 결정의 건 4. 공동대표이사 규정 해지의 건 |
- (보고) - (보고) 가결 가결 |
- (보고) - (보고) 찬성 찬성 |
- (보고) - (보고) 찬성 찬성 |
- (보고) - (보고) 찬성 찬성 |
불참 | - (보고) - (보고) 찬성 찬성 |
- (보고) - (보고) 찬성 찬성 |
- (보고) - (보고) 찬성 찬성 |
- (보고) - (보고) 찬성 찬성 |
- (보고) - (보고) 찬성 찬성 |
| 2024년 03월 29일 (6차) |
1. 대표이사 선임의 건 2. 감사위원회 위원 선임의 건 3. 보상위원회 위원 선임의 건 4. 투명경영위원회 위원 선임의 건 |
가결 가결 가결 가결 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
불참 | 찬성 찬성 찬성 찬성 |
- (주1) | 찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
| 2024년 04월 03일 (7차) |
1. 자기주식 소각의 건 | 가결 | 찬성 | 찬성 | 찬성 | - (주2) | 찬성 | 찬성 | 찬성 | 찬성 | |
| 2024년 05월 10일 (8차) |
1. 2024년 1분기 실적 보고의 건 2. 주식매수선택권 부여조건 변경의 건 |
- (보고) 가결 |
- (보고) 찬성 |
- (보고) 찬성 |
- (보고) 찬성 |
- (보고) 찬성 |
- (보고) 찬성 |
- (보고) 찬성 |
- (보고) 찬성 |
||
| 2024년 06월 27일 (9차) |
1. 이사겸직 승인의 건 2. 주식매수선택권 부여 취소의 건 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
- (주3) 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
||
| 2024년 07월 29일 (10차) |
1. 제1회 무기명식 이권부 무보증 사모 전환사채 발행의 건 2. 제3자배정 유상증자 (전환주식 발행)의 건 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
||
| 2024년 07월 30일 (11차) |
1. 이사회 결의 취소의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | ||
| 2024년 07월 30일 (12차) |
1. 제1회 무기명식 이권부 무보증 사모 전환사채 발행의 건 2. 제3자배정 유상증자 (전환주식 발행)의 건 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
||
| 2024년 08월 09일 (13차) |
1. 2024년 2분기 실적 보고의 건 2. 외부 법무법인의 내부통제시스템 검토 및 점검 내용 보고의 건 3. 타법인 금전대여의 건 |
-(보고) -(보고) 가결 |
-(보고) -(보고) 찬성 |
-(보고) -(보고) 찬성 |
-(보고) -(보고) 찬성 |
-(보고) -(보고) 찬성 |
-(보고) -(보고) 찬성 |
-(보고) -(보고) 찬성 |
-(보고) -(보고) 찬성 |
||
| 2024년 09월 23일 (14차) |
1. 주식매수선택권 부여조건 조정의 건 2. 인센티브 지급 규정 신설의 건 |
가결 가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
||
(주1) 유규창 사외이사는 임기만료에 따라 2024년 03월 29일 정기주주총회 종료 후 사임하였습니다.
(주2) 남수연 사내이사는 2024년 03월 31일자로 사임하였습니다.
(주3) 상법에 따라 특별한 이해관계가 있는 이사의 의결권은 행사하지 아니하였습니다.
라. 이사회내의 위원회
(1) 이사회내의 위원회 구성 현황
| (기준일 : 2024년 09월 30일) |
| 위원회명 | 구성 | 소속이사명 | 설치목적 및 권한사항 | 비고 |
| 투명경영위원회 | 사외이사 3명 | 김현철(위원장) 김병철, 안근용 |
1. 목적: 회사와 '이해관계자 거래에 대한 통제 규정'의 '이해관계자(최대주주 및 특수관계인, 자회사, 관계회사)'간의 거래('내부거래')에 관한 기본 정책을 수립 |
(주1) |
| 보상위원회 | 사외이사 3명 | 김병철(위원장) 김현철, 류양지 |
1. 목적: 이사의 보수 등의 관한 사항을 결정 |
- |
(주1) 투명경영위원회 위원장 김현철 사외이사는 2024년 03월 29일 이사회에서 투명경영위원회 위원으로 재선임 되었으며, 2024년 05월 31일 투명경영위원회에서 위원장으로 재선임 되었습니다.
(2) 이사회내의 위원회 활동내역
당분기 중 개최된 이사회내의 위원회 활동내역은 아래와 같습니다.
1) 투명경영위원회
| (기준일 : 2024년 09월 30일) |
| 개최일자 | 의안내용 | 가결여부 | 이사의 성명 | ||
|---|---|---|---|---|---|
| 김현철 (출석률 100%) |
김병철 (출석률 100%) |
안근용 (출석률 100%) |
|||
| 2024년 01월 31일 (1차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 02월 02일 (2차) |
1. 관계사 금전대여의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 02월 29일 (3차) |
1. 이사겸직 승인의 건 2. 관계사와의 거래 승인의 건 |
가결 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
| 2024년 03월 11일 (4차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 03월 18일 (5차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 03월 29일 (6차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 04월 30일 (7차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 05월 31일 (8차) |
1. 투명경영위원장 선임의 건 2. 이사겸직 승인의 건 3. 임원 대여금 대여기간 연장의 건 4. 관계사와의 거래 승인의 건 |
가결 |
찬성 -(주1) 찬성 찬성 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
| 2024년 06월 28일 (9차) |
1. 등기임원 및 미등기 임원의 업무상 해외출장내역 및 관련비용 집행내역 보고의 건 2. 임원 대여금 대여기간 연장의 건 3. 관계사와의 거래 승인의 건 |
-(보고) |
-(보고) 찬성 찬성 |
-(보고) 찬성 찬성 |
-(보고) 찬성 찬성 |
| 2024년 07월 31일 (10차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 08월 09일 (11차) |
1. 관계사 금전대여의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 08월 21일 (12차) |
1. 관계사 금전대여의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 08월 30일 (13차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 09월 06일 (14차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 09월 30일 (15차) |
1. 관계사와의 거래 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
(주1) 상법에 따라 특별한 이해관계가 있는 이사의 의결권은 행사하지 아니하였습니다.
2) 보상위원회
| (기준일 : 2024년 09월 30일) |
| 개최일자 | 의안내용 | 가결여부 | 이사의 성명 | ||
|---|---|---|---|---|---|
| 김병철 (출석률 100%) |
김현철 (출석률 100%) |
류양지 (출석률 100%) |
|||
| 2024년 03월 13일 (1차) |
1. 제7기 (2023 회계연도) 이사보수 집행결과 보고 2. 제8기 (2024 회계연도) 이사보수한도 승인의 건 |
- (보고) |
- (보고) 찬성 |
- (보고) 찬성 |
- (보고) 찬성 |
| 2024년 04월 11일 (2차) |
1. 임원 퇴직금 지급 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 08월 21일 (3차) |
1. 임원 인센티브 지급 승인의 건 |
가결 |
찬성 | 찬성 | 찬성 |
| 2024년 09월 23일 (4차) |
1. 인센티브 지급 규정 신설의 건 |
가결 |
찬성 | 찬성 | 찬성 |
마. 이사의 독립성
(1) 이사의 선임
이사는 상법 등 관련 법령상의 절차를 준수하여 주주총회에서 선임하고 있습니다.
주주총회에서 선임할 이사 후보자는 이사회가 추천하여 주주총회의 회의목적 사항으로 확정하고 있습니다.
이사 선임에 있어서는 관련 법령과 정관에 정한 요건의 충족 여부를 확인하고 있습니다. 사외이사 선임에 있어 보고서 작성기준일 현재 사외이사 후보추천위원회를 운영하고 있지 않으나 추천과정에서 면밀한 사전 검토를 통해 법령상 결격사유에 해당되지 않고 회사로부터의 독립성을 갖춘 후보를 추천하고 있으며, 사내이사 선임에 있어서도 다양한 전문성을 바탕으로 이사회 부의 안건에 대한 심도 있는 심의 및 의사결정에 기여할 수 있는 후보들을 추천하고 있습니다.
이러한 절차에 따라 선임된 이사는 다음과 같습니다.
| (기준일 : 2024년 09월 30일) |
| 성명 | 이사회 내 주요역할 |
이사회내 위원회 | 추천인 | 선임배경 | 담당업무 | 회사와의 거래 |
최대주주와의 관계 |
임기만료일 (연임횟수) |
비고 |
| 이병건 | 이사회 의장 | - | 이사회 | 바이오산업에 대한 높은 이해도와 수년간의 경영 경험을 바탕으로 회사를 전문적으로 운영할 것으로 기대 | 대표이사 | 해당없음 | 해당없음 | 2025년 03월 02일 (해당없음) |
(주1) |
| 홍준호 | 사내이사 | - | 이사회 | 바이오산업에 대한 높은 이해도와 수년간의 경영 경험을 바탕으로 회사를 전문적으로 운영할 것으로 기대 | 대표이사 | 해당없음 | 해당없음 | 2027년 03월 28일 (1회) |
(주1)(주2) |
| 장명호 | 사내이사 | - | 이사회 | 회사의 창업자로서 설립 시 부터중요한 의사결정을 수행하여 회사 성장에 기여하였고, 바이오 생명공학 전문가로서 산업 전반에 대한 폭넓은 이해를 바탕으로지속적인 성장에 기여할 것으로판단 | 신약개발 임상전략 총괄 |
해당없음 | 최대주주 본인 | 2027년 03월 28일 (2회) |
(주2) |
| 김병철 | 사외이사 | 보상위원회 위원장 투명경영위원회 위원 |
이사회 | 법무법인 대표 변호사인 법률전문가로서 법률적인 전문성과 행정, 대외협력 등 회사의 조직 운영에 대한 공정한 조언을 제시할 것으로 기대 | 사외이사 | 해당없음 | 해당없음 | 2025년 03월 30일 (1회) |
- |
| 김현철 | 사외이사 | 투명경영위원회 위원장 감사위원회 위원 보상위원회 위원 |
이사회 | 한국거래소를 포함한 금융 분야에서 다년간 근무경험이 있는 재무 전문가로 회사의 재무, 공정거래 등 분야의 전문성 및 독립성 강화에 기여할 것으로 기대 | 사외이사 | 해당없음 | 해당없음 | 2026년 03월 28일 (1회) |
(주2) |
| 안근용 | 사외이사 | 감사위원회 위원장 투명경영위원회 위원 |
이사회 | 회계 전문가(공인회계사)로서 회사의 회계 투명성 제고 기여할 것으로 기대 | 사외이사 | 해당없음 | 해당없음 | 2026년 03월 28일 (2회) |
(주2) |
| 류양지 | 사외이사 | 감사위원회 위원 보상위원회 위원 |
이사회 | 보건,헬스케어산업 분야에 대한 풍부한 경험과 전문성을 바탕으로 해당 분야에 대한 자문 제공 및 관련 정책과 규제 준수에 기여할 것으로 기대 | 사외이사 | 해당없음 | 해당없음 | 2026년 03월 28일 (1회) |
(주2) |
(주1) 2024년 03월 13일 이사회 결의에 따라 공동대표이사(이병건, 홍준호)에서 각자대표이사(이병건, 홍준호)로 변경되었습니다.
(주2) 2024년 등기이사 변동
| 구분 | 성명 | 비고 |
|---|---|---|
| 사내이사 | 장명호 | 중임 |
| 홍준호 | 임기조정을 위한 중도퇴임 후 재선임 | |
| 남수연 | 자진사임 | |
| 사외이사 | 안근용 | 중임 |
| 김현철 | 중임 | |
| 류양지 | 임기조정을 위한 중도퇴임 후 재선임 | |
| 유규창 | 임기만료에 따른 사임 |
바. 사외이사의 전문성
(1) 사외이사 현황
| (기준일 : 2024년 09월 30일) |
| 성명 | 주요경력 | 결격요건 | 회사와의 거래 | 최대주주와의 관계 |
| 김병철 | (주)지아이이노베이션 사외이사, 현재 법무법인위어드바이즈 변호사, 현재 법무법인 세종 변호사 University of Southern California School Of Law 서울대학교 법학 학사 |
해당없음 | 해당없음 | 해당없음 |
| 김현철 | (주)지아이이노베이션 사외이사, 현재 산일전기 주식회사 사외이사, 현재 한국IR협의회 부회장 한국거래소 경영지원본부 상무 경북대학교 경제학 학사 |
해당없음 | 해당없음 | 해당없음 |
| 안근용 | (주)지아이이노베이션 사외이사, 현재 뷰브레인헬스케어 CFO/COO, 현재 민트벤처파트너스 파트너 삼정KPMG 회계사 연세대 천문대기학 학사 |
해당없음 | 해당없음 | 해당없음 |
| 류양지 | (주)지아이이노베이션 사외이사, 현재 법무법인 율촌 고문, 현재 보건복지부 사회서비스정책관 사회서비스정책과장 대통령직속 저출산고령화사회워원회 파견 미래기획과장 서울대학교 사회학 석사 |
해당없음 | 해당없음 | 해당없음 |
(2) 직무수행 지원조직
| (기준일 : 2024년 09월 30일) |
| 부서 | 직원수 | 직위(근속연수) | 주요 활동내역 |
| 재무팀 | 5명 |
상무 1명 (01개월) 프로 2명 (평균 10개월) |
주주총회, 이사회, 이사회내 위원회 운영 지원 사외이사 교육 및 직무수행 지원 이사에게 안건에 관련된 정보 제공 회의 진행을 위한 실무 지원 이사회 및 위원회의 회의내용 기록 |
(3) 사외이사 교육 미실시 내역
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
| 미실시 | 사외이사에 대한 별도의 교육시간을 두고 있지 않으나 회사의 현황 및 이사로서의 의무에 대한 내용은 선임시 또는 필요시 수시로 전달하고 있습니다. |
2. 감사제도에 관한 사항
가. 감사위원회 위원의 인적사항 및 사외이사 여부
당사는 보고서 작성일 기준 현재 3인의 사외이사로 구성된 감사위원회를 운영하고 있습니다. 동 위원회 위원 중 재무전문가는 안근용 위원이며, 관련 법령의 경력 요건을 충족하고 있습니다.
| (기준일 : 2024년 09월 30일) |
| 성명 | 사외이사 여부 |
경력 | 회계ㆍ재무전문가 관련 | ||
|---|---|---|---|---|---|
| 해당 여부 | 전문가 유형 (주1) | 관련 경력 (주2) | |||
| 안근용 | 예 | (주)지아이이노베이션 사외이사, 현재 뷰브레인헬스케어 CFO/COO, 현재 민트벤처파트너스 파트너 삼정KPMG 회계사 연세대 천문대기학 학사 |
해당 | 1호 유형 (공인회계사) |
가립회계법인 회계사 (6년 8개월) |
| 김현철 | 예 | (주)지아이이노베이션 사외이사, 현재 산일전기 주식회사 사외이사, 현재 한국IR협의회 부회장 한국거래소 경영지원본부 상무 경북대학교 경제학 학사 |
- | - | - |
| 류양지 (주3) |
예 | (주)지아이이노베이션 사외이사, 현재 법무법인 율촌 고문, 현재 보건복지부 사회서비스정책관 사회서비스정책과장 대통령직속 저출산고령화사회워원회 파견 미래기획과장 서울대학교 사회학 석사 |
- | - | - |
(주1) 기업공시서식 작성기준 및「상법 시행령」제37조 제2항에 따른 회계ㆍ재무전문가
(주2) 공인회계사 자격을 가진 사람으로서 그 자격과 관련된 업무에 종사한 경력 5년 이상
(주3) 이사회의 추천을 받아 2024년 03월 29일 정기주주총회에서 감사위원으로 선임되었습니다.
나. 감사위원회 위원의 독립성
당사는 관련 법령 및 정관에 따라 위원회의 구성, 운영 및 권한ㆍ책임 등을 감사위원회 규정에 정의하여 감사업무를 수행하고 있습니다.
감사위원회 위원은 모두 사외이사로 구성되어 있으며 안근용 위원은 회계ㆍ재무전문가로 이사회에서 감사위원이 되는 사외이사로 추천되어 주주총회에서 선임되었으며, 김현철 위원과 류양지 위원은 이사회의 추천을 받아 주주총회에서 감사위원으로 선임되었습니다.
감사위원회는 3인 이상의 이사로 구성하고, 사외이사가 위원의 3분의 2 이상이어야 하는 등 관련 법령의 요건을 충족하고 있으며, 당사 및 당사의 최대주주 또는 주요 주주와 감사위원회 활동의 독립성을 저해할 어떠한 관계도 없습니다.
(1) 선출기준 주요내용
| (기준일 : 2024년 09월 30일) |
| 구분 | 선출기준 충족 여부 | 관려 법령 등 |
| 3인의 이사로 구성 | 충족 (3인) | 상법 제415조의 2 제2항 당사 감사위원회규정 제10조 |
| 사외이사가 위원의 3분의 2 이상 | 충족 (전원 사외이사) | 당사 감사위원회규정 제10조 |
| 위원 중 1인 이상은 회계 또는 재무전문가 | 충족 (안근용 위원) | 상법 제542조의 11 제2항 당사 감사위원회규정 제10조 |
| 감사위원회의 대표는 사외이사 | 충족 (안근용 위원) | 상법 제542조의 11 제2항 당사 감사위원회규정 제10조 |
| 그 밖의 결격요건(최대주주의 특수관계자 등) | 충족 (해당사항 없음) | 상법 제542조의 11 제3항 |
(2) 감사위원 선임배경
| 성명 | 선임배경 | 추천인 | 회사와의 관계 | 최대주주 또는 주요주주와의 관계 |
| 안근용 | 회계ㆍ재무전문가(공인회계사)로서 회사의 회계 투명성 제고 기여할 것으로 기대 | 이사회 | 해당사항 없음 | 해당사항 없음 |
| 김현철 | 한국거래소를 포함한 금융 분야에서 다년간 근무경험이 있는 재무 전문가로 회사의 재무, 공정거래 등 분야의 전문성 및 독립성 강화에 기여할 것으로 기대 | 이사회 | 해당사항 없음 | 해당사항 없음 |
| 류양지 | 보건, 헬스케어산업 분야에 대한 풍부한 경험과 전문성을 바탕으로 해당 분야에 대한 자문 제공 및 관련 정책과 규제 준수에 기여할 것으로 기대 |
이사회 | 해당사항 없음 | 해당사항 없음 |
다. 감사위원회의 활동
당분기 중 개최된 감사위원회 활동내역은 아래와 같습니다.
| (기준일 : 2024년 09월 30일) |
| 위원회명 | 개최일자 | 의안내용 | 가결여부 | 이사의 성명 | |||
| 유규창 (출석률 100%) |
김현철 (출석률 100%) |
안근용 (출석률 100%) |
류양지 (출석률 100%) |
||||
| 감사위원회 | 2024년 02월 13일 (1차) |
1. 2024년 (제8기) 외부감사계약 체결의 건 2. 2023년 (제7기) 재무제표 및 영업보고서 보고의 건 3. 2023년 (제7기) 내부회계관리제도 운영실태 보고의 건 |
- (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) |
- (주1) |
| 감사위원회 | 2024년 03월 13일 (2차) |
1. 제7기 (2023 회계연도) 정기주주총회 회의 목적사항 심의의 건 2. 제7기 (2023 회계연도) 감사위원회의 감사보고서 작성의 건 3. 제7기 (2023 회계연도) 내부감시장치 가동현황 보고의 건 4. 제7기 (2023 회계연도) 내부회계관리제도 운영실태 평가의 건 5. 외부 법무법인의 내부통제시스템 검토 및 점검 내용 보고의 건 |
- (보고) - (보고) |
- (보고) - (보고) - (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) - (보고) - (보고) |
|
| 감사위원회 | 2024년 03월 29일 (3차) |
1. 감사위원장 선임의 건 |
가결 |
- (주2) | 찬성 | 찬성 | 찬성 |
| 감사위원회 | 2024년 05월 10일 (4차) |
1. 2024년 1분기 재무제표 보고의 건 2. 내부회계관리제도 평가계획 보고의 건 |
- (보고) - (보고) |
- (보고) - (보고) |
- (보고) - (보고) |
- (보고) - (보고) |
|
| 감사위원회 | 2024년 08월 09일 (5차) |
1. 2024년 2분기 재무제표 보고의 건 2. 내부회계관리제도 설계평가 보고의 건 3. 외부 법무법인의 내부통제시스템 검토 및 점검 내용 보고의 건 |
- (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) |
- (보고) - (보고) - (보고) |
|
(주1) 류양지 사외이사는 2024년 03월 29일 정기주주총회에서 감사위원으로 선임되었습니다.
(주2) 유규창 사외이사는 임기만료에 따라 2024년 03월 29일 정기주주총회 종료 후 사임하였습니다.
라.감사위원회 교육 미실시 내역
| 감사위원회 교육 실시여부 | 감사위원회 교육 미실시 사유 |
|---|---|
| 미실시 | 감사위원회에 대한 별도의 교육시간을 두고 있지 않으나 회사의 현황 및 이사로서의 의무에 대한 내용은 선임시 또는 필요시 수시로 전달하고 있습니다. |
마. 감사위원회 지원조직 현황
| (기준일 : 2024년 09월 30일) |
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 재무팀 | 5 |
상무 1명 (01개월) 프로 2명 (평균 10개월) |
주주총회, 이사회, 이사회내 위원회 운영 지원 사외이사 교육 및 직무수행 지원 이사에게 안건에 관련된 정보 제공 회의 진행을 위한 실무 지원 이사회 및 위원회의 회의내용 기록 |
바. 준법지원인 등 지원조직 현황
당사는「상법」제542조13에 따라 최근 사업연도말 현재 자산총액 5천억원 미만으로보고서 작성기준일 현재 준법지원인 선임 의무가 없습니다. 다만 사외이사 중 1인을을 법률전문가로 선임하고 있으며 필요시 법무법인을 포함한 외부 전문가의 의견을 제공받는 등 준법을 위한 내부절차를 마련하고 있습니다.
3. 주주총회 등에 관한 사항
가. 투표제도 현황
| (기준일 : | 2024년 09월 30일 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 미도입 |
| 실시여부 | - | - | - |
※ 당사는 정관에 따라 집중투표제를 배제하였습니다.
※ 당사는 서면투표제 또는 전자투표제를 채택하고 있지 않습니다.
나. 소수주주권
당사는 보고서 작성대상기간 중 소수주주권이 행사된 경우가 없습니다.
다. 경영권 경쟁
당사는 보고서 작성대상기간 중 회사의 경영지배권에 관하여 경쟁이 있었던 경우가 없습니다.
라. 의결권 현황
본 공시서류 제출일 전일 현재 당사의 의결권을 행사할 수 있는 주식 수는 보통주 44,304,799주 이며, 의결권없는 주식 수는 우선주 858,371 주입니다.
| (기준일 : | 본 공시서류 제출일 전일 현재 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 44,304,799 | (주1) |
| 우선주 | 858,371 | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | 858,371 | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 44,304,799 | - |
| 우선주 | - | - |
(주1) 소유주식 1주당 신주 1주의 비율로 배정하는 무상증자를 실시하였습니다.
마. 주식사무
| 구분 | 내용 |
| 정관상 신주인수권의 내용 | 제11조(신주인수권) ① 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다. ② 본 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 25을 초과하지 않는 범위 내에서 「자본시장과 금융투자업에 관한 법률」제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 「상법」제340조의2, 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4. 「근로복지기본법」제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 발행주식총수의 100분의 25을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 6. 발행주식총수의 100분의 25을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산, 판매, 자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 주권을 증권시장에 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 8. 증권시장 상장을 위한 기업공개업무를 주관한 대표주관회사에게 기업공개 당시 공모주식총수의 100분의 10을 초과하지 않는 범위 내에서 신주를 발행하는 경우 ③ 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. ④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. |
| 결 산 일 | 12월 31일 |
| 정기주주총회 | 사업연도 말일의 다음날부터 3개월 이내 |
| 주권의 종류 |
정관 제9조(주식의 종류) ② 본 회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다. ③ 본 회사의 주권은 1주권, 5주권, 10주권, 50주권, 100주권, 500주권, 1,000주권 및 10,000주권의 8종류로 한다. 다만, 「주식·사채 등의 전자등록에 관한 법률」에 따라 주식 등을 전자등록하는 경우에는 동 항을 삭제한다. ④ 본 회사는 「주식·사채 등의 전자등록에 관한 법률」 제2조 제1호에 따른 주식등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식등을 전자등록 한다. 다만, 본 회사가 법령에 따른 등록의무를 부담하지 않는 주식등의 경우에는 그러하지 아니할 수 있다. |
| 명의개서대리인 | 한국예탁결제원 [부산광역시 남구 문현금융로 40 부산국제금융센터 (BIFC), 051-519-1500] |
| 주주의 특전 | 해당사항 없음 |
| 공고방법 | 회사 인터넷 홈페이지 (http://www.gi-innovation.com) 일간 아시아경제신문 (회사 인터넷 홈페이지 공고불가 시) |
바. 주주총회 의사록 요약
최근 3사업연도의 주주총회 의사록 요약은 다음과 같습니다.
| 해당주총명 | 개최일자 | 목적사항 | 결의내용 | 주요 논의내용 |
| 제07기 정기주주총회 | 2024년 03월 29일 |
제1호 의안: 제7기(2023 회계연도) 재무제표 승인의 건 |
원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 |
- - - - - - - - - - - - - - - - |
| 2023년 임시주주총회 | 2023년 06월 13일 | 제1호 의안 : 주식매수선택권 부여의 건 | 원안대로 승인 | - |
| 제06기 정기주주총회 | 2023년 03월 31일 | 제1호 의안: 재무제표(제6기) 승인의 건(2022년도) 제2호 의안: 임원(이사) 보수한도 승인 및 집행내역 보고의 건 제3호 의안: 임원(사외이사) 선임의 건 제4호 의안: 감사위원이 되는 사외이사 선임의 건 제5호 의안: 임원(감사위원) 선임의 건 제6호 의안: 주식매수선택권의 행사기간 변경의 건 제7호 의안: 정관 일부변경의 건 |
원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 |
- - - - - - - |
| 2022년 임시주주총회 | 2022년 09월 01일 | 제1호 의안: 임원(사외이사) 선임의 건 | 원안대로 승인 | - |
| 제05기 정기주주총회 | 2022년 03월 30일 |
제1호 의안: 재무제표(제5기) 승인의 건 |
원안대로 승인 원안대로 승인 |
- - |
| 2022년 임시주주총회 | 2022년 03월 03일 |
제1호 의안: 정관 변경의 건 |
원안대로 승인 원안대로 승인 원안대로 승인 원안대로 승인 |
- - - - |
VI. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
가. 최대주주 및 특수관계인의 주식소유 현황
본 공시서류 제출일 전일 현재 기준 당사의 최대주주는 장명호이며, 최대주주를 포함한 특수관계인 총 21명은 보통주 기준 8.36%의 지분을 소유하고 있습니다.
| (기준일 : | 본 공시서류 제출일 전일 현재 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 (주3) | 기 말 (주3) | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 장명호 | 최대주주 본인 | 보통주 | 3,054,806 | 6.78 | 3,054,806 | 6.76 | - |
| 양윤석 | 최대주주의 친인척 | 보통주 | 139,296 | 0.31 | 139,296 | 0.31 | - |
| 양경림 | 최대주주의 친인척 | 보통주 | 40,986 | 0.09 | 40,986 | 0.09 | - |
| 김봉모 | 최대주주의 친인척 | 보통주 | 31,816 | 0.07 | 31,816 | 0.07 | - |
| 지형남 | 최대주주의 친인척 | 보통주 | 7,488 | 0.02 | 7,488 | 0.02 | - |
| 김도연 | 최대주주의 친인척 | 보통주 | 6,000 | 0.01 | 6,000 | 0.01 | - |
| 장은주 | 최대주주의 친인척 | 보통주 | 5,360 | 0.01 | 5,360 | 0.01 | - |
| 지동석 | 최대주주의 친인척 | 보통주 | 6,200 | 0.01 | 7,300 | 0.02 | 추가취득 |
| 강창훈 | 최대주주의 친인척 | 보통주 | 2,000 | 0.00 | 2,000 | 0.00 | - |
| 오영두 | 최대주주의 친인척 | 보통주 | 1,820 | 0.00 | 1,820 | 0.00 | - |
| 김다슬 | 최대주주의 친인척 | 보통주 | 1,800 | 0.00 | 1,800 | 0.00 | - |
| 지형욱 | 최대주주의 친인척 | 보통주 | 48 | 0.00 | 48 | 0.00 | - |
| 오영민 | 발행회사 임원 | 보통주 | 165,458 | 0.37 | 165,458 | 0.37 | - |
| 이경화 | 발행회사 임원 | 보통주 | 38,773 | 0.09 | 42,273 | 0.09 | 주식매수선택권 행사 |
| 윤나리 | 발행회사 임원 | 보통주 | 35,172 | 0.08 | 35,172 | 0.08 | - |
| 조영규 | 발행회사 임원 | 보통주 | 19,200 | 0.04 | 27,200 | 0.06 | 주식매수선택권 행사 |
| 노은희 | 발행회사 임원 | 보통주 | 646 | 0.00 | 646 | 0.00 | - |
| 김국환 | 발행회사 임원 | 보통주 | 402 | 0.00 | 402 | 0.00 | - |
| 김지수 | 발행회사 임원 | 보통주 | 500 | 0.00 | 3,000 | 0.01 | 주식매수선택권 행사 |
| 임신생 | 발행회사 임원 | 보통주 | 14,268 | 0.03 | 14,268 | 0.03 | - |
| 김진만 | 관계회사 임원 | 보통주 | 166,010 | 0.37 | 166,010 | 0.37 | - |
| 홍천표 | 관계회사 임원 | 보통주 | 21,426 | 0.05 | 21,426 | 0.05 | - |
| 안인복 | 관계회사 임원 | 보통주 | 1,600 | 0.00 | 0 | 0.00 | 관계회사 임원 퇴임 |
| 계 | 보통주 | 3,761,075 | 8.34 | 3,774,575 | 8.36 | - | |
| 우선주 | 0 | 0.00 | 0 | 0.00 | - | ||
주1) 소유주식 1주당 신주 1주의 비율로 배정하는 무상증자를 실시하였습니다.
주2) 소유주식수 및 지분율은 2024년 09월 30일 주주명부를 기준으로 작성하였습니다.
주3) 기초: 2024년 9월 30일, 기말: 본 공시서류 제출일 전일 현재
나. 최대주주의 주요경력 및 개요
보고서 작성기준일 현재 최대주주와 관련된 사항은 다음과 같습니다.
| 성명 | 주요경력 | |
| 기간 | 내용 | |
| 장명호 | 2017년 07월 ∼ 현재 2016년 07월 ~ 2017년 06월 2016년 07월 ~ 2017년 06월 2013년 03월 ~ 2016년 06월 2007년 07월 ~ 2012년 06월 |
(주)지아이이노베이션 신약개발 임상전략 총괄 사장 (주)프로젠 CSO (주)제넥신 Scientific Advisor IBS 수석연구원 Osaka Univ. 의과대학 부교수 |
2. 최대주주 변동 현황
보고서 작성기준일 현재 당사의 최대주주는 장명호이며, 보고서 작성대상기간 중 변동내역은 없습니다.
3. 주식의 분포
가. 주식 소유현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 장명호 | 3,054,806 | 6.78 | - |
| 국민연금공단 | 2,227,036 | 5.04 | - | |
| 우리사주조합 | - | - | - | |
나. 소액주주현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 구분 | 주주 | 소유주식 | 비고 | ||||
|---|---|---|---|---|---|---|---|
| 소액주주수 | 전체주주수 | 비율(%) | 소액주식수 | 총발행주식수 | 비율(%) | ||
| 소액주주 | 18,739 | 18,762 | 99.88 | 27,533,240 | 44,217,811 | 62.31 | - |
※ 상기 주주현황은 2024년 9월 30일 기준 주주명부상 실명번호를 기준으로 작성하였습니다.
※ 소액주주는 의결권 있는 발행주식 총수의 100분의 1에 미달하는 주식을 소유한 주주를 의미합니다.
4. 주식 및 주식거래실적
당사 주식의 최근 6개월간 주가 및 거래량은 다음과 같습니다.
| (단위 : 원, 주) |
| 구분 | 2024년 04월 | 2024년 05월 | 2024년 06월 | 2024년 07월 | 2024년 08월 | 2024년 09월 | |
|---|---|---|---|---|---|---|---|
| 주가 | 최고 | 14,420 | 13,620 | 11,700 | 12,590 | 14,290 | 13,700 |
| 최저 | 12,400 | 11,570 | 10,180 | 10,300 | 8,970 | 12,220 | |
| 평균 | 13,163 | 12,844 | 10,765 | 11,711 | 10,900 | 12,888 | |
| 거래량 | 최고(일) | 2,260,500 | 3,452,461 | 1,311,897 | 1,473,134 | 2,826,956 | 1,659,160 |
| 최저(일) | 338,326 | 251,493 | 154,633 | 234,262 | 184,932 | 280,354 | |
| 월간 | 17,862,243 | 14,186,026 | 9,043,875 | 15,722,648 | 16,410,602 | 12,354,034 | |
※ 보고서 작성기준일 현재 주가와의 비교가능성을 위하여 'KRX 정보데이터시스템' 수정주가를 기준으로 작성하였습니다.
※ 최고/최저 주가는 해당일자 종가를 기준으로 작성하였으며, 평균주가는 해당일자 종가의 단순 산술평균으로 산출하였습니다.
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원 현황
(1) 등기임원
3분기 보고서 작성기준일 현재 당사의 이사회는 사내이사 3인 (이병건, 홍준호, 장명호)과 사외이사 4인(김병철, 안근용, 김현철, 류양지) 총 7인의 이사로 구성되어 있으며,
보고서 작성기준일 이후부터 보고서 제출일 현재까지 변동사항은 없습니다.
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 장명호 | 남 | 1968년 06월 | 사장 | 사내이사 | 상근 | 사내이사 신약개발 임상전략 총괄 |
(주)지아이이노베이션 신약개발 임상전략 총괄, 현재 (주)프로젠 CSO (주)제넥신 Scientific Advisor IBS 수석연구원 Osaka Univ. 의과대학 부교수 Osaka Univ. 면역학 박사 |
3,054,806 | - | 최대주주 본인 |
2017년 07월 19일 ~ 기준일 현재 |
2027년 03월 28일 |
| 이병건 | 남 | 1956년 11월 | 회장 | 사내이사 | 상근 | 대표이사 이사회 의장 |
(주)지아이이노베이션 대표이사, 현재 SCM생명과학 대표이사 종근당홀딩스 대표이사 녹십자,녹십자홀딩스 대표 Rice Univ. 화학공학 박사 서울대 화학공학 석사 |
- | - | 해당없음 | 2022년 03월 03일 ~ 기준일 현재 |
2025년 03월 02일 |
| 홍준호 | 남 | 1972년 01월 | 사장 | 사내이사 | 상근 | 대표이사 | (주)지아이이노베이션 대표이사, 현재 (주)안연케어 대표이사 (주)인터파크바이오컨버전스 대표이사 (주)인터파크 바이오융합연구소 기획조정실장 안연케어 경영지원실장 (CFO) University of Oregon MBA |
- | - | 해당없음 | 2021년 06월 16일 ~ 기준일 현재 |
2027년 03월 28일 |
| 김병철 | 남 | 1980년 03월 | 사외이사 | 사외이사 | 비상근 | 사외이사 보상위원회 위원장 투명경영위원회 위원 |
(주)지아이이노베이션 사외이사, 현재 법무법인위어드바이즈 변호사, 현재 법무법인 세종 변호사 University of Southern California School Of Law 서울대학교 법학 학사 |
- | - | 해당없음 | 2020년 10월 05일 ~ 기준일 현재 |
2025년 03월 30일 |
| 안근용 | 남 | 1975년 06월 | 사외이사 | 사외이사 | 비상근 | 사외이사 감사위원회 위원장 투명경영위원회 위원 |
(주)지아이이노베이션 사외이사, 현재 뷰브레인헬스케어 CFO/COO, 현재 민트벤처파트너스 파트너 삼정KPMG 회계사 연세대 천문대기학 학사 |
- | - | 해당없음 | 2022년 03월 03일 ~ 기준일 현재 |
2026년 03월 28일 |
| 김현철 | 남 | 1962년 08월 | 사외이사 | 사외이사 | 비상근 | 사외이사 투명경영위원회 위원장 감사위원회 위원 보상위원회 위원 |
(주)지아이이노베이션 사외이사, 현재 산일전기 주식회사 사외이사, 현재 한국IR협의회 부회장 한국거래소 경영지원본부 상무 경북대학교 경제학 학사 |
- | - | 해당없음 | 2022년 03월 03일 ~ 기준일 현재 |
2026년 03월 28일 |
| 류양지 | 여 | 1968년 07월 | 사외이사 | 사외이사 | 비상근 | 사외이사 감사위원회 위원 보상위원회 위원 |
(주)지아이이노베이션 사외이사, 현재 법무법인 율촌 고문, 현재 보건복지부 사회서비스정책관 사회서비스정책과장 대통령직속 저출산고령화사회워원회 파견 미래기획과장 서울대학교 사회학 석사 |
- | - | 해당없음 | 2022년 09월 01일 ~ 기준일 현재 |
2026년 03월 28일 |
(주1) 재직기간은 등기임원으로 선임된 일자입니다.
※ 남수연 사내이사는 2024년 03월 31일자로 사임하였습니다.
※ 유규창 사외이사는 임기만료에 따라 2024년 03월 29일 정기주주총회 종료 후 사임하였습니다.
※ 보고서 작성기준일 이후부터 보고서 제출일 현재까지 등기임원 선임 및 해임은 해당사항 없습니다.
(2) 미등기임원
| (기준일 : 2024년 09월 30일) |
| 성명 | 성별 | 출생년월 | 직위 | 상근여부 | 담당업무 | 주요경력 | 소유주식수(단위: 주) | 최대주주와의 관계 |
재직기간 (주1) |
|
|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||
| 조영규 | 남 | 1969년 01월 | 부사장 | 상근 | 연구개발 총괄 및 R&D부문장 |
(주)지아이이노베이션 연구개발 총괄 및 R&D부문장, 현재 (주)와이바이오로직스 부사장 (주)한독 연구위원 포항공과대학교 분자면역학 박사 |
19,200 | - | 해당없음 | 2019년 09월 02일 ~ 기준일 현재 |
| 고영준 | 남 | 1980년 01월 | 부사장 | 상근 | 임상중개전략부문장 | (주)지아이이노베이션 임상중개전략부문장, 현재 동국대학교 한의학과 조교수 (주)삼성전자 전문연구원 카이스트(KAIST) 의과학 박사 |
- | - | 해당없음 | 2019년 04월 01일 ~ 기준일 현재 |
| 오영민 | 남 | 1978년 03월 | 전무 | 상근 | SMART플랫폼부문장 | (주)지아이이노베이션 SMART플랫폼부문장, 현재 (주)제넥신 책임연구원 (주)대웅제약 책임연구원 포항공과대학교 생명과학 박사 |
165,458 | - | 해당없음 | 2019년 08월 01일 ~ 기준일 현재 |
| 윤나리 | 여 | 1985년 07월 | 전무 | 상근 | 임상중개전략부문장 | (주)지아이이노베이션 임상중개전략부문장, 현재 (주)한미약품 Project Leader IQVIA 전략 컨설턴트 성균관대학교 약학 박사 |
35,172 | - | 해당없음 | 2019년 09월 23일 ~ 기준일 현재 |
| 이경화 | 남 | 1972년 01월 | 상무 | 상근 | 비임상팀장 | (주)지아이이노베이션 비임상팀장, 현재 서울대학교 시스템면역의학연구소 기획팀장 (주)프로셀제약 책임연구원 배제대학교 화학 박사 |
38,773 | - | 해당없음 | 2019년 02월 01일 ~ 기준일 현재 |
| 김국환 | 남 | 1978년 09월 | 상무 | 상근 | 디스커버리부문장 | (주)지아이이노베이션 디스커버리부문장, 현재 (주)지아이이노베이션 디스커버리팀장 연세대학교 의생명과학부 연구조교수 부산대학교 분자생물학 박사 |
402 | - | 해당없음 | 2020년 05월 11일 ~ 기준일 현재 |
| 김은성 | 남 | 1980년 08월 | 상무 | 상근 | 인사전략실장 | (주)지아이이노베이션 인사전략실장, 현재 안연케어 인사팀장 도시바 메디칼 시스템즈 코리아 HR팀 과장 동국대학교 경영학 학사 |
- | - | 해당없음 | 2021년 06월 14일 ~ 기준일 현재 |
| 김동휘 | 남 | 1980년 11월 | 상무 | 상근 | 재무기획실장 | (주)지아이이노베이션 재무기획실장, 현재 하나은행/하나금융지주 재무기획팀 안진회계법인 회계사 연세대학교 경영학 학사 |
- | - | 해당없음 | 2024년 09월 27일 ~ 기준일 현재 |
| 김지수 | 남 | 1983년 01월 | 이사 | 상근 | 품질평가팀장 /바이오분석팀장 |
(주)지아이이노베이션 품질평가팀장/바이오분석팀장, 현재 (주)삼성바이오에피스 전문 (주)셀트리온 과장 고려대학교 생명공학 박사 |
500 | - | 해당없음 | 2020년 09월 01일 ~ 기준일 현재 |
| 이우열 | 남 | 1979년 10월 | 이사 | 상근 | 임상기획팀원 | (주)지아이이노베이션 임상기획팀원, 현재 신촌세브란스병원 임상약리학 강사 신촌세브란스병원 임상약리학 전공의 연세대학교 의과대학 박사 |
- | - | 해당없음 | 2021년 07월 19일 ~ 기준일 현재 |
| 노은희 | 여 | 1981년 02월 | 이사 | 상근 | IR/PR팀장 | (주)지아이이노베이션 IR/PR팀장, 현재 이투데이 유통바이오부 기자 브릿지경제 기자 성균관대학교대학원 공연예술학 석사 |
646 | - | 해당없음 | 2023년 01월 01일 ~ 기준일 현재 |
| 김수현 | 남 | 1983년 01월 | 이사 | 상근 | 공정개발1팀장 | (주)지아이이노베이션 공정개발1팀장, 현재 지아이셀 세포제조배양팀팀장 삼성바이오로직스 연구원 고려대학교 분자생물학 석사 |
- | - | 해당없음 | 2023년 04월 01일 ~ 기준일 현재 |
| 이우형 | 남 | 1983년 09월 | 이사 | 상근 | 임상기획팀장 | (주)지아이이노베이션 임상기획팀장, 현재 IQVIA Singapore 임상연구담당 홍콩과기대학교(HongKong University of Science and Technology, MBA) 서울대학교 약학대학 박사 |
- | - | 해당없음 | 2023년 05월 15일 ~ 기준일 현재 |
| 임신생 | 여 | 1978년 06월 | 이사 | 상근 | QA팀장 |
(주)지아이이노베이션 QA팀장, 현재 (주)지아이이노베이션 QC/QA팀장 서울대학교 구강악안면외과 연구실 |
14,268 | - | 해당없음 | 2024년 01월 01일 ~ 기준일 현재 |
(주1) 재직기간은 임원으로 선임된 일자입니다.
(3) 임원 겸직현황
| (기준일 : 2024년 09월 30일) |
| 겸직임원 | 겸직회사 | ||
|---|---|---|---|
| 성명 | 직위 | 기업명 | 직위 |
| 이병건 | 대표이사 |
에임드바이오 |
기타비상무이사 |
| 홍준호 | 대표이사 |
메디오젠 |
대표이사 |
| 김병철 | 사외이사 |
법무법인위어드바이즈 |
변호사 |
| 김현철 | 사외이사 | 산일전기 | 사외이사 |
| 안근용 | 사외이사 |
뷰브레인헬스케어 |
CFO/COO |
| 류양지 | 사외이사 |
법무법인 율촌 |
고문 |
| 이우열 | 미등기임원 |
(주)지아이셀 |
미등기임원 |
나. 직원 등 현황
기업공시서식 작성기준/지침에 따라 기재를 생략하였습니다.
1. 미등기임원 보수 현황
기업공시서식 작성기준/지침에 따라 기재를 생략하였습니다.
2. 임원의 보수 등
가. 주주총회 승인금액
| (기준일 : 2024년 09월 30일) | (단위 : 천원) |
| 구분 | 인원수 (주1) | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 사내이사 및 사외이사 | 7 | 5,000,000 | - |
※ 인원수는 2024년 09월 30일 기준으로 기재하였습니다.
※ 주주총회 승인금액은 제07기 정기주주총회에서 승인받은 이사(9명, 주주총회 이후 사임 이사 포함)의 보수 한도입니다.
나. 보수지급금액
기업공시서식 작성기준/지침에 따라 기재를 생략하였습니다.
VIII. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
당사는 보고서 작성기준일 현재 해당사항 없습니다.
| (기준일 : | 본 공시서류 제출일 전일 현재 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| - | - | - | - |
※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조
2. 타법인출자 현황(요약)
당사는 기업공시서식 작성기준/지침에 따른 소규모기업(최근 사업연도말 자산총액 1천억원 또는 최근 사업연도 매출액 500억원 미만)에 해당하여 '타법인출자 현황(요약)'의 기재를 생략하였습니다.
IX. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여 등
당사는 보고서 작성기준일 현재 해당사항 없습니다.
2. 대주주와의 자산양수도 등
당사는 보고서 작성기준일 현재 해당사항 없습니다.
3. 대주주와의 영업거래
당사는 보고서 작성기준일 현재 해당사항 없습니다.
4. 대주주에 대한 주식기준보상 거래
당사는 보고서 작성기준일 현재 해당사항 없습니다.
5. 대주주 이외의 이해관계자와의 거래
가. 당분기말과 전기말 현재 회사의 특수관계자 현황
| 구분 | 당분기말 | 전기말 | 비고 |
|---|---|---|---|
| 관계기업 | 주식회사 지아이바이옴 | 주식회사 지아이바이옴 | - |
| 주식회사 지아이셀 | 주식회사 지아이셀 | ||
| 주식회사 메디오젠 | 주식회사 메디오젠 | ||
| 기타 특수관계자 (주1) | - | 주식회사 인츠바이오 | 주요 임원이 지배하는 회사 |
(주1) 당분기중 주요 임원이 사임하여 제외되었습니다.
나. 당분기와 전분기 중 특수관계자와의 주요 거래내역
(1) 수익ㆍ비용거래
| <당분기> | (단위: 천원) |
| 구분 | 회사의 명칭 | 수익거래 | 비용거래 | |
|---|---|---|---|---|
| 매출 | 기타수익 | 기타비용 | ||
| 관계기업 | 주식회사 지아이바이옴 | - | 31,135 | 1,851,350 |
| 주식회사 지아이셀 | 24,281 | 139,225 | - | |
| 합계 | 24,281 | 170,360 | 1,851,350 | |
| <전분기> | (단위: 천원) |
| 구분 | 회사의 명칭 | 수익거래 | 비용거래 | |
|---|---|---|---|---|
| 매출 | 기타수익 | 기타비용 | ||
| 관계기업 | 주식회사 지아이바이옴 | - | 9,274 | 600,522 |
| 주식회사 지아이셀 | 587,899 | 12,506 | 570 | |
| 합계 | 587,899 | 21,780 | 601,092 | |
(2) 채권ㆍ채무잔액(차입금 및 대여금 제외)
| <당분기말> | (단위: 천원) |
| 구분 | 회사의 명칭 | 채권 | 채무 |
|---|---|---|---|
| 기타채권(주1) | 기타채무 | ||
| 관계기업 | 주식회사 지아이바이옴 | 2,916,009 | 121,908 |
| 주식회사 지아이셀 | 258,910 | - | |
| 합계 | 3,174,919 | 121,908 | |
(주1) 금융리스채권, 상환전환우선주 등이 포함되어 있습니다.
| <전기말> | (단위: 천원) |
| 구분 | 회사의 명칭 | 채권 | 채무 |
|---|---|---|---|
| 기타채권(주1) | 기타채무 | ||
| 관계기업 | 주식회사 지아이바이옴 | 3,236,187 | 53,431 |
| 주식회사 지아이셀 | 121,499 | 330 | |
| 합계 | 3,357,686 | 53,761 | |
(주1) 금융리스채권, 상환전환우선주 등이 포함되어 있습니다.
(3) 출자ㆍ대여거래
| (단위: 천원) |
| 구분 | 회사의 명칭 | 당분기 | 전분기 |
|---|---|---|---|
| 현금대여 | 현금대여 | ||
| 관계기업 | 주식회사 지아이바이옴 | 3,000,000 | - |
| 주식회사 지아이셀 | 6,000,000 | - | |
| 합계 | 9,000,000 | - | |
(4) 주요 경영진 보상금액
| (단위: 천원) |
| 구분 | 당분기 | 전분기 |
|---|---|---|
| 급여 및 기타 단기종업원 급여 | 1,557,950 | 1,418,688 |
| 퇴직급여 | 271,214 | 254,147 |
| 주식기준보상 | 1,433,659 | 3,298,239 |
| 합계 | 3,262,823 | 4,971,074 |
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
2. 우발부채 등에 관한 사항
가. 중요한 소송사건
당사는 보고서 작성기준일 현재 해당사항 없습니다.
나. 견질 또는 담보용 어음ㆍ수표 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
다. 채무보증 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
라. 채무인수약정 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
마. 그 밖의 우발채무 등
당사는 보고서 작성기준일 현재 해당사항 없습니다.
3. 제재 등과 관련된 사항
가. 제재현황
(1) 주요사항보고서 제출지연에 관한 건
당사는 외부감사대상이지만 비상장법인으로서 2020년도까지 사업보고서 제출의무가 없었습니다. 그러나 2020년 12월 31일 기준 주주수가 500인 이상이 되어「자본시장법」제159조제1항 및 동법 시행령 제167조제1항에 따라 사업보고서 제출의무가 발생하였습니다.
당사는 사업보고서 제출기한을 한달 앞둔 2021년 03월 03일, 당사의 사업보고서 제출대상 법인 해당여부에 대하여 금융감독원에 유선으로 문의하였고, 익일인 2021년 03월 04일 사업보고서 제출대상임을 확인받았습니다.
금융감독원에 문의하는 과정에서「자본시장법」제161조제1항 및 동법 시행령 제171조제1항제1호에 따라 사업보고서 제출의무 대상기업에게 주요사항 보고서 제출의무도 발생한다는 사실을 알게 되었습니다. 이에 2021년 02월 26일 운영자금 확보를 위해 (주)유한양행에 대한 유상증자에 대하여 주요사항보고서를 제출해야 함을 뒤늦게 인지하고 급히 주요사항 보고서를 제출하였으나 2일 지연되었습니다.
당사는 이러한 경위에 대해 금융감독원에 2021년 03월 자진 신고를 완료하였습니다.
(2) 증권신고서 제출의무 위반에 관한 건
「자본시장과 금융투자업에 관한 법률」(이하「자본시장법」)에 따르면, '모집'을 '대통령령으로 정하는 방법에 따라 산출한 50인 이상의 투자자에게 새로 발행되는 증권의 취득의 청약을 권유하는 것(「자본시장법」제9조제7항)'이라 정의하고 있으며 투자자 수는 동법 시행령 제11조에 따라 '청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다(전문가 외 기타 연고자 제외)'고 규정하고 있습니다. 이러한 '모집'에 해당하는 경우「자본시장법」제119조에 따라 증권신고서 제출의무를 지닙니다.
한편, 당사는 2018년 07월 17일부터 2020년 03월 14일까지 총 7차례에 걸쳐 연구개발비 및 운영자금 조달을 목적으로 유상증자(전환우선주)를 진행하여 약 910억원을 조달하였습니다. 당시 당사는 유상증자에 참가한 개별 벤처투자조합, 신기술사업투자조합 등을 1인의 투자자로 이해하고 증자를 진행하였습니다. 그런데 당사가 코스닥시장 상장을 준비하는 과정에서 증자에 참여한 조합의 조합원 수를 기준으로 투자자 수를 산정해야 하며, 당사가 진행했던 신주 발행이「자본시장법」상 모집 혹은 간주모집에 해당됨을 인지하였습니다. 이에 당사는 증권신고서 제출의무 위반 사실을 파악 및 검토하여 2021년 06월 금융감독원에 해당 내용을 자진신고 하였습니다.
(3) 결과
당사는 2023년 10월 (1)주요사항보고서 제출지연에 관한 건은 미조치로 결과를 통보 받았으며, (2)증권신고서 제출의무 위반의 건은 경고 및 과징금 107백만원을 부과받아 2023년 11월 납부의무를 이행하였습니다.
나. 한국거래소 등으로부터 받은 제재
(1) 제재에 관한 사항
당사는 보고서 작성기준일 현재 해당사항 없습니다. 다만, 당사는 코스닥시장 상장 심사과정에서 상장일로부터 3년간 법률 위반의 발생으로 내부통제 위험의 증가 및 이로 인한 잠재적인 주주 가치 훼손을 미연에 방지할 목적으로 외부 법무법인과 법률자문 용역 계약을 체결하고 내부통제시스템 검토 및 점검 내용을 정기적으로(반기별로) 공시할 것을 한국거래소와 확약하였습니다.
이 확약에 따라, 당사는 상장 이후 반기보고서 및 사업보고서 내 반기별로 수행한 법률 자문 검토 내역을 『 XI. 그 밖에 투자자 보호를 위하여 필요한 사항』에 공시할 예정입니다. 만약 검토 결과 법률 위반 사항이 발생한 경우 위반 내역에 대한 (1) 세부 경위와 (2) 그 조치 내역 그리고 (3) 해당 위반 내역이 다시 발생하지 않도록 하는 향후 계획에 대한 내용을 성실히 기재할 것입니다.
(2) 이행 상황
당사는 코스닥시장 상장 심사과정에서 한국거래소와 확약한 바에 따라 외부 법무법인과 내부통제시스템 검토용역을 수행하였습니다. 외부 법무법인으로부터 제공받은 내부통제시스템 검토보고서는 이사회와 감사위원회에 보고되었으며, 이사회와 감사위원회 검토 결과 법률 위반 등 중대한 사항은 확인되지 않았습니다.
|
[이행 내역] |
| 보고기준일 | 보고일자 | 보고대상 |
|---|---|---|
| 2023년 12월 31일 | 2024년 03월 13일 | 이사회, 감사위원회 |
| 2024년 06월 30일 | 2024년 08월 09일 | 이사회, 감사위원회 |
|
[용역의 범위와 기간] |
|
용역 범위 |
1. 반기별 내부통제시스템 운영상태 점검 및 검토보고서 작성 |
|
용역 기간 |
한국거래소 상장일로부터 3년간 반기당 1회 |
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
나. 중소기업기준 검토표
 |
|
중소기업 등 기준검토표_1 |
 |
|
중소기업 등 기준검토표_2 |
다. 외국지주회사의 자회사 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
라. 법적위험 변동사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
마. 금융회사의 예금자 보호 등에 관한 사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
바. 기업인수목적회사의 요건 충족 여부
당사는 보고서 작성기준일 현재 해당사항 없습니다.
사. 기업인수목적회사의 금융투자업자의 역할 및 의무
당사는 보고서 작성기준일 현재 해당사항 없습니다.
아. 합병등의 사후정보
당사는 보고서 작성기준일 현재 해당사항 없습니다.
자. 녹색경영
당사는 보고서 작성기준일 현재 해당사항 없습니다.
차. 정부의 인증 및 그 취소에 관한 사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
카. 조건부자본증권의 전환, 채무재조정 사유 등의 변동현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
타. 보호예수 현황
| (기준일 : | 본 공시서류 제출일 전일 현재 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 (주5) |
|---|---|---|---|---|---|---|
| 보통주 | 2,463,040 | 2022년 05월 11일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1) | 45,163,170 |
| 44,192 | 2022년 05월 12일 | (주1) | 45,163,170 | |||
| 864,094 | 2022년 08월 05일 | (주3) | 45,163,170 | |||
| 106,265 | 2022년 10월 19일 | (주3) | 45,163,170 | |||
| 124,963 | 2022년 12월 26일 | (주3) | 45,163,170 | |||
| 421,818 | 2022년 12월 27일 | (주2) | 45,163,170 | |||
| 463,220 | 2022년 12월 27일 | (주3) | 45,163,170 | |||
| 2,133 | 2023년 03월 24일 | (주1) | 45,163,170 | |||
| 9,000 | 2023년 05월 18일 | (주1)(주4) | 45,163,170 | |||
| 3,500 | 2023년 08월 17일 | (주1)(주4) | 45,163,170 | |||
| 2,000 | 2023년 11월 14일 | (주1)(주4) | 45,163,170 | |||
| 2,509,365 | 2024년 01월 22일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주5) | 45,163,170 | |
| 421,818 | (주2)(주5) | 45,163,170 | ||||
| 1,558,542 | (주3)(주5) | 45,163,170 | ||||
| 14,500 | (주1)(주4)(주5) | 45,163,170 | ||||
| 11,800 | 2024년 05월 27일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주4)(주5) | 45,163,170 | |
| 8,289 | 2024년 08월 20일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주4)(주5) | 45,163,170 | |
| 우선주 | 858,371 | 2024년 08월 27일 | 2025년 08월 26일 | 1년 | (주6) | 45,163,170 |
| 보통주 | 14,500 | 2024년 11월 15일 | 2026년 03월 30일 | 상장일로부터 3년 | (주1)(주4)(주5) | 45,163,170 |
(주1) 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제1호)
(주2) 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제3호)
(주3) 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제7호)
(주4) 최대주주 등 보호예수 필요주주(「코스닥시장 상장규정」제26조 제1항 제6호)
(주5) 2024년 01월 04일 개최된 이사회 결의에 따라 소유주식 1주당 신주 1주의 비율로 배정 (자기주식 제외)하는 무상증자를 실시하였습니다.
(주6) 증권신고서 제출 면제에 따른 보호예수 (「증권의발행및공시등에관한규정」제2-2조 제2항 제1호)
파. 상장기업의 재무사항 비교표
| (기준 재무제표 : | 개별 | ) | (상장일 : | 2023년 03월 30일 | , 인수인 : | NH투자증권 하나증권 삼성증권 |
) | (단위 : 백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 예측치 달성 여부 | 괴리율 (주2) |
|---|---|---|---|---|---|
| 2022년 | 영업수익 | 3,500 | 3,500 | 달성 | 해당 없음 |
| 영업이익(손실) | (68,807) | (67,952) | 달성 | 해당 없음 | |
| 당기순이익(손실) | (66,867) | (79,833) | 미달성 | 19.4% | |
| 2023년 | 영업수익 | 10,896 | 5,318 | 미달성 | 51.2% |
| 영업이익(손실) | (53,658) | (53,305) | 달성 | 해당 없음 | |
| 당기순이익(손실) | (53,658) | (55,495) | 미달성 | 3.4% | |
| 2024년 (주1) |
영업수익 | 148,643 | - | - | - |
| 영업이익(손실) | 92,648 | - | - | - | |
| 당기순이익(손실) | 92,648 | - | - | - |
※ 당사는 2023년 3월 30일 코스닥시장에 '기술특례상장'하였습니다.
(주1) 2024년 실적치, 예측치 달성 여부 및 괴리율에 대한 정보는 사업보고서에 기재할 예정입니다.
(주2) 괴리율은 (예측치-실적치)/예측치로 산정된 비율이며, 기업공시서식 작성기준 제11-4-13조의 작성지침에 의거 괴리율이 10%이상인 항목에 대해서는 아래와 같이 발생원인을 별도 기재하였습니다.
예측치와 실적치에 대한 차이 분석 내용은 다음과 같습니다.
① 영업수익: 당사는 증권신고서상 2023년(1차연도) 영업수익을 109억원으로 추정 기재하였으나, 실적은 53억원으로 괴리율은 51.2%입니다. 당사는 신약 연구개발 및 사업화, 관련 연구서비스를 제공하는 신약개발 단일 사업부문으로 구성되어 있으며, 해당 예측치는 신약후보물질 기술이전에 따른 선급금(Upfront Payment)을 바탕으로 기재하였습니다. 실제 당사는 2023년 10월 기술이전 계약을 체결하였으나, 증권신고서 제출 당시 선급금(Upfront Payment) 예측에 고려되었던 주요요인(주1)의 변동으로 인하여 괴리가 발생하였습니다.
(주1) 선급금(Upfront Payment) 비중 산정과 관련하여 고려한 사항(2023년 03월 투자설명서 기재)
ㆍ2010년 이후 비임상 또는 임상 1상 단계에서 체결된 알레르기 치료제 및 백신 형태의 약물들의 글로벌 기술이전 사례 17건의 평균 선급금 비중
ㆍ구매사가 일본인 2가지 유사제제의 기술이전 사례들의 선급금 비중 평균
② 당기순이익(손실): 당사는 증권신고서상 2022년 당기순손실을 (-)669억원으로 추정 기재하였으나, 실적은 (-)798억원으로 괴리율은 19.4%입니다. 괴리 발생 원인은 당사가 보유한 관계기업의 지분법 손실 반영입니다.
하. 매출액 미달에 대한 관리종목 지정유예 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|
| 사업연도 | 매출금액 | 해당여부 | 사유 | 종료시점 | |
| 2023년 | 5,318 | 미해당 | 해당 | 코스닥시장 상장규정 |
2027년 12월 31일 |
※ 당사는 코스닥시장 상장규정 제2조 제31항에서 정하는 기술성장기업으로서 2023년 03월 30일 코스닥시장에 상장하였습니다.「코스닥시장 상장규정」 제53조(관리종목) 제1항 제1호(매출액 미달)에 따라, 신규상장일(기업인수목적회사의 합병상장인 경우 합병상장일로 한다)이 속한 사업연도를 포함하여 연속하는 5개 사업연도까지는 해당 요건을 적용받지 않습니다.
거. 계속사업손실에 대한 관리종목 지정유예 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, %) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | ||||
|---|---|---|---|---|---|---|
| 사업연도 | 법인세 차감전 계속사업손익(A) |
자기자본금액 (B) |
비율(A/B) | 해당 여부 |
종료 시점 |
|
| 2021년 | -150,742 | 170,431 | -88.4 | 해당 | 해당 | 2026년 12월 31일 |
| 2022년 | -79,833 | 95,646 | -83.4 | |||
| 2023년 | -55,022 | 71,704 | -76.7 | |||
※ 당사는 코스닥시장 상장규정 제2조 제31항에서 정하는 기술성장기업으로서 2023년 03월 30일 코스닥시장에 상장하였습니다.「코스닥시장 상장규정」 제53조(관리종목) 제1항 제2호(법인세비용차감전계속사업손실 발생)에 따라, '자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생' 요건 적용시 2025년 12월 31일까지는 손실이 발생한 사업연도에서 제외됩니다. 따라서, 2025년 12월 31일이후 2개 사업연도가 추가 경과된 2027년 12월 31일부터 동 요건에 따른 관리종목 지정 여부를 판단하게 됩니다.
XI. 상세표
1. 연결대상 종속회사 현황(상세)
당사는 보고서 작성기준일 현재 해당사항 없습니다.
| (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - |
2. 계열회사 현황(상세)
당사는 보고서 작성기준일 현재 해당사항 없습니다.
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | - | - | - |
| - | - |
3. 타법인출자 현황(상세)
당사는 기업공시서식 작성기준/지침에 따른 소규모기업(최근 사업연도말 자산총액 1천억원 또는 최근 사업연도 매출액 500억원 미만)에 해당하여 '타법인출자 현황(상세)'의 기재를 생략하였습니다.
【 전문가의 확인 】
1. 전문가의 확인
보고서 작성 기준일 현재 해당사항이 없습니다.
2. 전문가와의 이해관계
보고서 작성 기준일 현재 해당사항이 없습니다.