 |
|
대표이사 등의 확인ㆍ서명_차백신연구소 |
분 기 보 고 서
(제 25 기)
| 사업연도 | 2024년 01월 01일 | 부터 |
| 2024년 09월 30일 | 까지 |
| 금융위원회 | |
| 한국거래소 귀중 | 2024년 11월 13일 |
| 제출대상법인 유형 : | 주권상장법인 |
| 면제사유발생 : | 해당사항 없음 |
| 회 사 명 : | 주식회사 차백신연구소 |
| 대 표 이 사 : | 염정선 |
| 본 점 소 재 지 : |
경기도 성남시 중원구 둔촌대로 560, 406, 407호(상대원동, 벽산테크노피아) |
| (전 화) 031-881-7327 | |
| (홈페이지) http://www.chavaccine.com/ | |
| 작 성 책 임 자 : | (직 책) CFO (성 명) 김주황 |
| (전 화) 031-881-7327 | |
【 대표이사 등의 확인 】
 |
|
대표이사 등의 확인ㆍ서명_차백신연구소 |
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 개황
(1) 연결대상 종속회사 현황(요약)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | - | - | - | - | - |
| 합계 | - | - | - | - | - |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조 |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
(2) 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 회사의 법적, 상업적 명칭
당사의 명칭은 "주식회사 차백신연구소"라 하며,
영문으로는 CHA Vaccine Research Institute 라 표기합니다.
다. 설립일자 및 존속기한
당사는 2000년 06월 09일에 설립되었습니다. 또한, 당사는 별도의 존속기한을 정하고 있지 않습니다.
라. 본사의 주소, 전화번호, 홈페이지 주소
| 구분 | 내용 |
|---|---|
| 주소 | 경기도 성남시 중원구 둔촌대로 560, 406호, 407호 |
| 전화번호 | 031-881-7327 |
| 홈페이지 | http://www.chavaccine.com/ |
마. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
※ 당사는 본 보고서 작성 기준일 현재 중소기업기본법 제2조에 의거 중소기업에 해당됩니다.
※ 당사는 본 보고서 작성 기준일 현재 벤처기업육성에 관한 특별조치법 제2조의2 규정에 의거 벤처기업에 해당됩니다.
 |
|
중소기업 확인서 |
 |
|
벤처기업확인서-차백신연구소 |
| 기관명 | 확인유형 | 유효기간 | 발행번호 |
|---|---|---|---|
| 벤처기업확인기관 | 벤처투자유형 | 2022.12.06 ~2025.12.05 | 20221110010014 |
바. 대한민국에 대리인이 있는 경우에는 이름(대표자), 주소 및 연락처
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
사. 주요 사업의 내용 및 향후 추진하려는 신규사업에 관한 간략한 설명
차백신연구소는 독자적으로 개발한 면역증강 플랫폼 기술을 활용하여 차세대 백신과 면역치료제를 개발하는 바이오 벤처 회사입니다.
면역증강기술을 적용하면, 기존 백신의 효능을 개선한 프리미엄 백신, 기존에 없는 백신을 개발하는 신규 백신, 그리고 만성질환을 치료할 수 있는 치료 백신 등 다양한 백신과 면역치료제 개발이 가능합니다.
현재 차백신연구소는 일반적으로 알려진 백신을 개발하는 것이 아니라 Unmet medical needs에 기반하여 수요가 있고, 시장규모가 큰 First-in class 위주의 바이오 신약을 개발하고 있습니다.
주요 파이프라인은, 완치 치료제가 없는 만성 B형 간염 치료백신, 효능이 개선된 3세대 B형 간염 예방백신 그리고 재조합 대상포진 백신이 임상단계에 있습니다.
그 외에 암의 재발을 방지하고 항암 치료 효능을 극대화할 수 있는 항암백신 및 항암면역치료제 등을 개발하여 파이프라인을 확장하고 있습니다.
기타 자세한 사항은 동 공시서류의 "Ⅱ. 사업의 내용"을 참조하시기 바랍니다.
[정관에 기재된 목적사업]
| 목적사업 | 비고 |
|---|---|
| 1. 생물학적 제제 및 관련된 진단제 개발, 제조, 판매 및 수출입 업무 2. 백신류 및 관련된 진단제 개발, 제조, 판매 및 수출입 업무 3. 생물공학 분야의 첨단제품 개발 및 수출입 업무 4. 임대사업(부동산) 5. 전 각호에 부대되는 사업 |
- |
아. 신용평가에 관한 사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
자. 「상법」 제290조에 따른 변태설립사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
차. 회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 코스닥시장 상장 | 2021.10.22 | 기술성장기업의 코스닥시장 상장 |
2. 회사의 연혁
가. 회사의 본점소재지 및 그 변경
당사는 공시 대상 기간 중 본점소재지 변경 내역이 없습니다.
나. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2020.03.24 | 정기주총 | 기타비상무이사 박민식 감사 김창호 |
대표이사 염정선 사내이사 윤경욱(*1) 사내이사 고정재 |
감사 정광회 |
| 2020.09.28 | 임시주총 | 사외이사 김상훈(*3) 사외이사 김우희(*3) 감사 김승래 |
- | 감사 김창호(*2) |
| 2021.03.24 | 정기주총 | 기타비상무이사 신동철 사외이사 김우경(*4) 사외이사 오대규 |
- | - |
| 2022.03.28 | 정기주총 | 사외이사 백용하 | 사내이사 조정기 | - |
| 2023.03.27 | 정기주총 | - | 대표이사 염정선 사내이사 고정재 기타비상무이사 박민식(*6) 감사 김승래 |
- |
| 2024.03.24 | - | - | - | 기타비상무이사 신동철(*5) 사외이사 오대규(*5) |
※ 최근 5사업연도 경영진 변동 내역입니다.
(*1) 2020년 08월 01일, 사내이사 윤경욱은 일신상의 이유로 사임하였습니다.
(*2) 2020년 09월 28일, 감사 김창호는 일신상의 이유로 사임하였습니다.
(*3) 2021년 03월 24일, 사외이사 김상훈, 사외이사 김우희는 일신상의 이유로 사임하였습니다.
(*4) 2021년 04월 05일, 사외이사 김우경은 일신상의 이유로 사임하였습니다.
(*5) 2024년 03월 24일, 기타비상무이사 신동철, 사외이사 오대규는 임기가 만료되었습니다.
(*6) 2024년 03월 24일, 기타비상무이사 박민식은 일신상의 이유로 사임하였습니다.
다. 최대주주의 변동
당사는 공시 대상 기간 중 최대주주 변동 내역이 없습니다.
라. 상호의 변경
당사는 공시 대상 기간 중 상호 변경 내역이 없습니다.
마. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행중인 경우 그 내용과 결과
당사는 공시 대상 기간 중 해당 내역이 없습니다.
바. 회사가 합병 등을 한 경우 그 내용
당사는 공시 대상 기간 중 합병 내역이 없습니다.
사. 회사의 업종 또는 주된 사업의 변화
당사는 공시 대상 기간 중 해당 내역이 없습니다.
아. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
| 일자 | 경영활동과 관련된 중요한 사실의 발생 | 비고 |
|---|---|---|
|
2020.04.01 |
면역증강제 Lipo-pam 기술 특허 등록 |
- |
|
2020.08.01 |
정부과제 선정(보건복지부): 면역증강제를 포함하는 신규 재조합 노로바이러스 백신플랫폼 개발 |
- |
|
2020.08.01 |
정부과제 선정(보건복지부): 호흡기 바이러스 백신 개발을 위한 신개념 면역증강제 플랫폼 기술 개발 |
- |
|
2020.12.28 |
투자유치(전환사채 230억. 인터베스트 및 하일랜드에쿼티파트너스) |
- |
| 2021.02.07 | 정부과제 선정(보건복지부): 새로운 백일해 유전자 재조합 단백질 항원 기반 신규 플랫폼 백일해 백신 개발 | - |
|
2021.02.26 |
기술이전계약(Aston Sci.): 2,031억 규모 |
- |
|
2021.04.19 |
정부과제 선정(산업자원부): 차세대 아쥬번트를 활용하여 면역관문억제제의 한계를 극복하는 개량형 의약품 개발 |
- |
|
2021.06.02 |
B형 간염 예방백신 (CVI-HBV-002)의 임상시험계획승인(IND) |
- |
|
2021.08.17 |
B형 간염 치료백신의 병용 투여 요법 국내 특허 등록 |
- |
|
2021.10.22 |
IPO(기업공개)완료에 의한 코스닥시장 신규상장 |
- |
| 2022.04.01 |
정부과제 선정(보건복지부): 신종코로나와 인플루엔자 혼합 프리미엄 백신의 후보물질 개발 |
- |
| 2022.04.01 |
정부과제 선정(보건복지부): 재조합 수두 백신 마이크로니들의 항원 생산 및 분석법 개발 |
- |
| 2022.04.11 |
과제 선정(RIGHT FUND): Development of sublingual COVID-19 subunit vaccine |
- |
| 2022.05.01 |
정부과제 선정(보건복지부): 변이에 신속대응 가능한 박테리오파지 기반 백신 플랫폼 개발 |
- |
|
2022.05.10 |
재조합 대상포진 백신 (CVI-VZV-001)의 임상시험계획승인(IND) 신청(임상 1상) |
- |
| 2022.05.27 | 정부과제 선정(보건복지부): 신규 면역증강제를 이용한 범용 노로바이러스 다가 백신의 후보물질 개발 | - |
| 2022.12.05 | 재조합 대상포진 백신 (CVI-VZV-001)의 임상시험계획승인(IND) 완료(임상 1상) | - |
| 2023.02.24 | 재조합 대상포진 백신 (CVI-VZV-001)의 1상 임상시험 진행 중 | - |
| 2023.11.17 | 투자유치(전환사채 100억. 타임폴리오자산운용 등) | - |
| 2024.03.27 | B형 간염 예방백신 (CVI-HBV-002)의 1상 임상시험 완료 | - |
| 2024.09.01 |
정부과제 선정(보건복지부): 안전하고 효과적인 차세대 일본뇌염 재조합 단백질 백신 개발을 위한 후보물질 발굴 |
- |
3. 자본금 변동사항
가. 자본금 변동추이
| (단위 : 원, 주) |
| 종류 | 구분 |
25기 |
24기 |
23기 |
22기 |
21기 |
|---|---|---|---|---|---|---|
| 보통주 | 발행주식총수 | 26,824,748 |
26,732,079 |
26,429,162 |
26,429,162 |
22,388,253 |
| 액면금액 |
500 |
500 |
500 |
500 |
500 |
|
| 자본금 | 13,412,374,000 |
13,366,039,500 |
13,214,581,000 |
13,214,581,000 |
11,194,126,500 |
|
| 우선주 | 발행주식총수 |
- |
- |
- |
- |
- |
| 액면금액 |
- |
- |
- |
- |
- |
|
| 자본금 |
- |
- |
- |
- |
- |
|
| 기타 | 발행주식총수 |
- |
- |
- |
- |
- |
| 액면금액 |
- |
- |
- |
- |
- |
|
| 자본금 |
- |
- |
- |
- |
- |
|
| 합계 | 자본금 | 13,412,374,000 |
13,366,039,500 |
13,214,581,000 |
13,214,581,000 |
11,194,126,500 |
※ 2021년 10월, IPO(기업공개)에 의한 증자로 발행주식총수 및 자본금이 증가하였습니다.
※ 2023년과 2024년 발행주식총수 및 자본금 변동은 주식매수선택권 행사에 의하여 증가하였습니다.
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
|
보통주 |
우선주 |
합계 | |||
| Ⅰ. 발행할 주식의 총수 |
- |
- |
50,000,000 |
- |
|
| Ⅱ. 현재까지 발행한 주식의 총수 | 26,824,748 |
4,600,687 |
31,425,435 |
- |
|
| Ⅲ. 현재까지 감소한 주식의 총수 |
- |
4,600,687 |
4,600,687 |
- |
|
| 1. 감자 |
- |
- |
- |
- |
|
| 2. 이익소각 |
- |
- |
- |
- |
|
| 3. 상환주식의 상환 |
- |
- |
- |
- |
|
| 4. 기타 |
- |
4,600,687 |
4,600,687 |
(*1) |
|
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 26,824,748 |
- |
26,824,748 |
- |
|
| Ⅴ. 자기주식수 |
- |
- |
- |
- |
|
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 26,824,748 |
- |
26,824,748 |
- |
|
(*1) 당사가 기발행한 전환상환우선주(RCPS)는 2020년 12월 전량(4,600,687주) 보통주로 전환되었습니다.
나. 자기주식 취득 및 처분 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 취득방법 | 주식의 종류 | 기초수량 | 변동 수량 | 기말수량 | 비고 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 취득(+) | 처분(-) | 소각(-) | |||||||
| 배당 가능 이익 범위 이내 취득 |
직접 취득 |
장내 직접 취득 |
- | - | - | - | - | - | - |
| - | - | - | - | - | - | - | |||
| 장외 직접 취득 |
- | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 공개매수 | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 소계(a) | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 신탁 계약에 의한 취득 |
수탁자 보유물량 | - | - | - | - | - | - | - | |
| - | - | - | - | - | - | - | |||
| 현물보유물량 | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 소계(b) | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 기타 취득(c) | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 총 계(a+b+c) | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
※ 당사는 공시 대상 기간 중 해당 내역이 없습니다.
5. 정관에 관한 사항
가. 정관의 최근 개정일
당사의 최근 정관개정일은 2023년 3월 27일입니다.
나. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2023년 03월 27일 | 제23기 정기주주총회 | - 전환사채의 발행 및 신주인수권부사채의 발행 - 이사 및 감사의 선임 |
- 사채 한도 상향 - 상법개정에 따른 조문 정비 |
| 2020년 09월 28일 | 제21기 임시주주총회 | - 주식 등의 전자등록 - 신주인수권 - 주식매수선택권 - 우리사주매수선택권 - 명의개서대리인 - 주주명부 - 사채 발행 관련 사항 - 주주총회 소집 및 개최에 관한 사항 - 이사 및 감사 관한 사항 - 재무제표 작성에 관한 사항 - 분기배당에 관한 사항 추가 - 외부감사인 선임의 관한 사항 추가 |
- 문구정비 -『주식ㆍ사채 등의 전자등록에 관한 법률』시행 따른 변경사항 반영 - 상장 시 신주 모집 고려 - 사채 발행 근거 확보 및 한도 상향 - 코스닥 상장사 표준정관 내용 반영 - 분기배당 실시 근거 확보 - 상장법인의 외부감사인 선임 의무 고려 |
다. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
|
1 |
생물학적 제제 및 관련된 진단제 개발, 제조, 판매 및 수출입 업무 |
영위 |
|
2 |
백신류 및 관련된 진단제 개발, 제조, 판매 및 수출입 업무 |
영위 |
|
3 |
생물공학 분야의 첨단제품 개발 및 수출입 업무 |
영위 |
|
4 |
임대사업(부동산) |
미영위 |
|
5 |
전 각호에 부대되는 사업 |
영위 |
II. 사업의 내용
당사가 영위하는 사업의 내용을 이해하기 위한 주요용어의 설명은 다음 표와 같습니다.
[주요 용어 설명]
|
용어 |
설명 |
|---|---|
|
내약성 (tolerability) |
약물을 투여했을 때 환자 또는 임상피험자가 부작용이나 불편감을 견뎌낼 수 있는 정도 |
|
리간드 (ligand) |
수용체에 특이적으로 결합하는 물질 |
|
리포좀 (liposome) |
인지질과 콜레스테롤로 이루어진 미세한 이중막 구 |
|
리포펩티드 (lipopeptide) |
지질과 아미노산의 복합체 또는 복합 화합물 |
|
만노스결합형렉틴 (MBL; Mannose-Binding Lectine) |
다당류인 만노스와 특정 당 분자와 특이적으로 결합하는 단백질인 렉틴으로 |
|
면역관문억제제 (ICI; Immune Checkpoint Inhibitor) |
체내 면역세포의 면역기능을 활성화시켜 항암효과를 나타내는 항암제 |
|
면역관용 (immunological tolerance) |
특정항원에 대해 면역계가 반응하지 않는 것 |
|
면역원성 (immunogenicity) |
면역반응을 자극하는 항원의 강도 |
|
면역증강제 (adjuvant) |
면역증강 및 항원전달 기능을 통해 항원에 대한 면역반응을 증진하는 물질 |
|
바이러스 유사 파티클 (VLP; Virus Like Particle) |
면역계가 외래 에피토프로 인식하는 바이러스 구조단백질 분자들로 구성된 작은 입자 |
|
벡터 (vector) |
원하는 유전자를 재조합하여 운반하는 DNA 분자 |
|
병원체 (pathogen) |
숙주 내로 감염되어 질병을 일으키는 미생물 등 |
|
불활화 백신 또는 사백신 (inactivated vaccine) |
가열, 화학약품 등으로 면역원성을 잃지 않고 불활성된 병원성을 가지는 백신 |
|
사이토카인 (cytokine) |
면역세포에서 분비되어 신호전달을 자극하는 단백질 |
|
선천면역 (innate immunity) |
외부물질 감염 전부터 유전적 요인이나 생리적 결과에 의해 자연적으로 가지고 있는 즉각적 면역체계 |
|
세포성 면역반응 (cellular immune response) |
항체가 관여하지 않고 면역세포가 작용하여 나타나는 면역반응 |
|
세포주 (cell line) |
생체 밖에서 세포 배양을 통해 계속 분열 증식이 가능하고 유전적으로 동일한 세포군 |
|
수지상세포 (DC; dendritic cell) |
포유동물 면역계에서 병원체를 포식 분해하여 항원을 T림프구에 제시하는 항원제시세포 중 하나 |
|
아미노산 (amino acid) |
염기성 아미노산과 산성 카복시기를 가진 유기화합물로 펩타이드 및 단백질을 구성하는 물질 |
|
안전성 (safety) |
안전하거나 안전을 보장하는 성질 |
|
안정성 (stability) |
바뀌어 달라지지 아니하고 일정한 상태를 유지하는 성질 |
|
약독화 생백신 (attenuated live vaccine) |
살아있으나 약화된 병원체를 포함하는 백신 |
|
에피토프 (epitope) |
항체나 T세포의 수용체와 결합하는 항원 분자의 특정 부위(항원결정기) |
|
역전사 억제제 (reverse transcriptase inhibitor) |
RNA을 주형으로 하여 DNA를 합성하는 역전사 과정에서 사용되는 효소 단백질의 작용을 저해하는 물질 |
|
전사 (transcription) |
DNA의 단일 가닥을 주형으로 RNA가 합성되는 과정 |
|
중화항체 (neutralizing antibody) |
바이러스나 독소, 효소 등의 생리활성 물질 등에 결합하여 이들의 병원성이나 생물학적 활성을 저해하는 항체 |
|
체액성 면역반응 (humoral immune response) |
외부 물질의 자극을 받아 활성화된 B림프구에서 생성한 면역 물질인 항체에 의한 면역반응 |
|
패턴인식수용체 (PRR; Pattern Recognition Receptor) |
병원성 세균 및 바이러스에만 존재하는 특이적 패턴을 인식하는 숙주의 수용체 |
|
펩타이드 (peptide) |
아미노산이 펩타이드 결합으로 연결된 중합체 |
|
플라스미드 (plasmid) |
세균의 세포 내에 염색체와는 별개로 존재하면서 독자적으로 증식할 수 있는 DNA로 |
|
항원 (antigen) |
면역반응을 유도하여 항체를 생성하게 하는 단백성 물질 |
|
항원제시세포 (APC; Antigen Presenting Cell) |
항원의 포식, 분해 등 처리를 통해 자신의 세포표면에 항원을 제시하고 T세포가 인식하도록 하는 세포 |
|
항체 (antibody) |
항원의 자극에 의해 B세포에서 생성되어 항원에 특이적으로 결합하는 단백질 |
|
항체역가 (antibody titer) |
특정 항원에 대한 항체의 정도 |
|
핵산 (nucleic acid) |
유전물질로 DNA와 RNA 두 가지 유형 포함 |
|
후천/적응/획득 면역 (adaptive immunity) |
항원에 의해 얻어지는 면역체계 |
|
Apoptosis (세포자살/세포자연사) |
외부의 피해로 인한 것이 아니며 생명유지가 목적인 세포형태와 내부의 생화학적 변화를 통한 세포의 자살 |
|
B cell (B세포) |
골수에서 유래되며 항체를 생성하여 체액성 면역반응에 관여하는 림프구 |
|
DNA (deoxyribonucleic acid) |
5탄당 deoxyribose, 인산, 염기로 이루어진 nucleotide로 구성된 선형 이중가닥 중합체 유전물질로, |
|
ELISA (enzyme-linked immunosorbent assay) |
효소표지항체의 항원-항체반응을 이용한 면역측정법 |
|
ELISPOT(enzyme-linked immuno-spot assay) |
고착화효소항체법에 의한 항체 또는 사이토카인을 생산하는 세포의 수 측정법 |
|
FAMA assay (막항원 형광항체 측정법) |
형광항체를 이용하여 특정 항원에 대한 항체가를 측정하는 방법 |
|
IFN (interferon, 인터페론) |
사이토카인의 한 종류로 병원성 미생물의 감염과 증식을 저지하는 당단백질 |
|
IgG 항체 |
5종의 면역글로불린(항체)중 혈액 내 가장 많이 존재하며 체내에 들어온 병원체에 대한 특이적 면역반응을 나타냄 |
|
IL (interleukin, 인터루킨) |
신호전달 자극 단백질인 사이토카인의 한 종류로 주로 백혈구를 포함하는 세포에서 분비되어 |
|
RNA (ribonucleic acid) |
5탄당 ribose, 인산, 염기로 이루어진 nucleotide로 구성된 선형 단일가닥 중합체 유전물질로, |
|
Seroconversion (혈전전환, 혈청변환) |
항원이 소실하여 항원에 대한 특이항체가 생산되는 것 |
|
Seroprotection (혈청방어율) |
항원 특이적 항체가 유도하는 면역반응의 정도 |
|
Tg mouse (transgenic mouse) |
유전자 재조합 기술을 통해 원하는 외래 유전자를 도입한 형질전환마우스 |
|
Th cell(helper T cell) |
사이토카인을 분비하여 다른 면역세포의 기능을 조절하거나 억제하는 것을 돕는 T세포 |
|
TLR(Toll-like receptor) |
병원체와 그 구성 성분의 특이한 패턴을 인식하여 선천성 면역반응을 일으키는 대표적인 표면수용체 |
|
TNF (Tumor Necrosis Factor, 종양괴사인자) |
염증반응과 관련된 세포 신호전달 단백질로 급성기 반응을 유도하는 사이토카인 |
|
T cell (T세포) |
흉선에서 유래되며 세포성 면역반응에 관여하는 림프구 |
1. 사업의 개요
가. 사업의 내용 요약
(1) 차세대 백신, 면역치료제를 개발하는 신약 개발회사
당사는 자체 개발한 면역증강 플랫폼기술(Adjuvant platform)을 활용하여 차세대 백신 및 면역치료제를 개발하는 바이오 벤처회사입니다. 면역증강제(Adjuvant)란 면역증강 및 항원전달 기능을 통해 백신 항원에 대한 면역반응을 증진하는 물질을 의미합니다. 면역증강 기술을 활용한 개발 타겟은 기존 백신 타겟인 병원성 미생물에 의한 감염성 질환뿐만 아니라 만성간염, 암 등 만성질환에 대한 치료백신으로 확대가 가능하며, 당사는 성인용 백신, 프리미엄 백신, 면역치료제 개발에 집중하고 있습니다.
(2) TLR 리간드에 기반한 강력한 신규 면역증강제 L-pampo®, Lipo-pam®
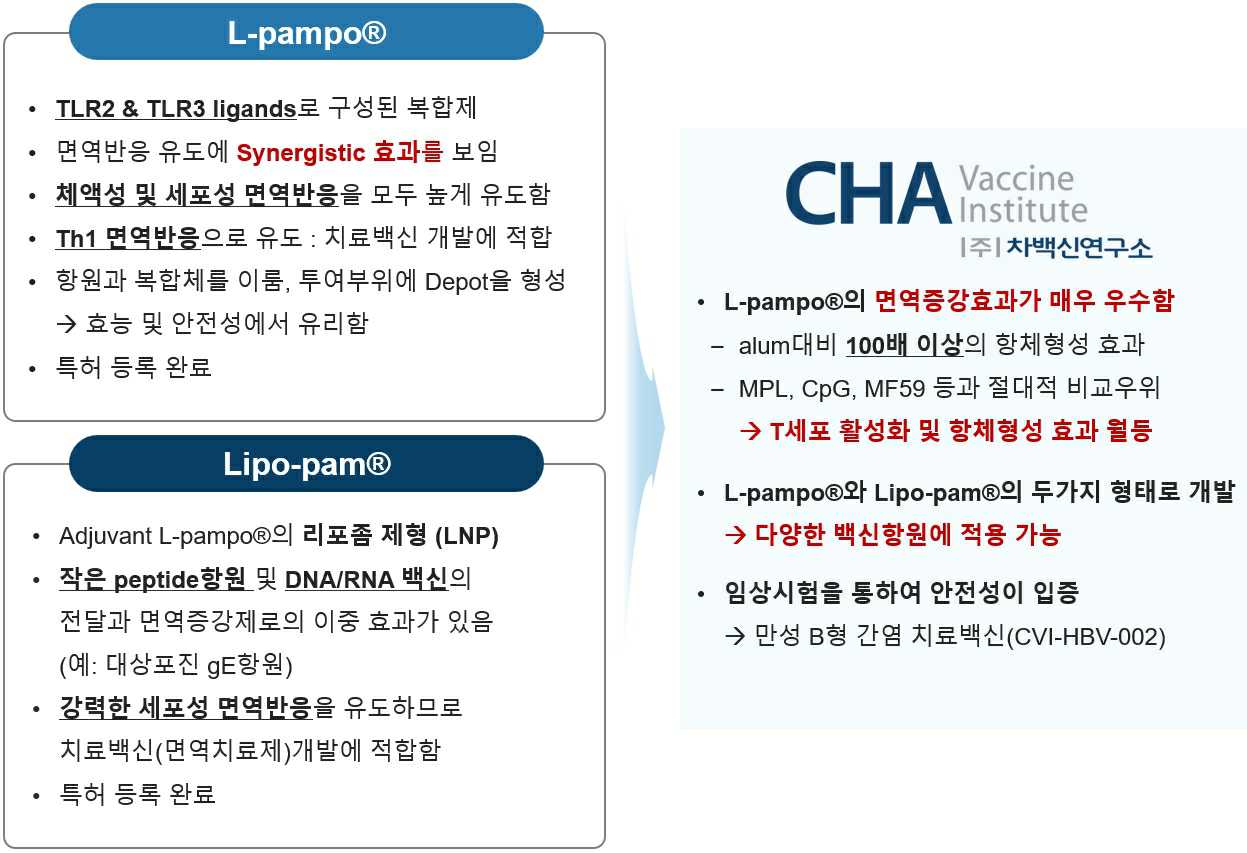
당사의 면역증강 플랫폼은 TLR2 & TLR3 리간드 복합체인 면역증강제 L-pampo®와 리포좀 제형의 면역증강제인 Lipo-pam®으로 구성됩니다. 면역증강제 L-pampo®는 개별 면역증강물질 대비 강력한 상승작용 효과(Synergistic effect)를 보여, T세포의 활성을 높인 세포성 면역반응과 항체 생성을 활성화하는 체액성 면역반응을 동시에 높게 유도합니다. 대표적인 면역증강제 alum 대비 100배 이상의 항체형성 효과를 보이며, 다른 면역증강제와 비교하여도 T 세포 활성화 및 항체 형성 효과가 우수합니다. 리포좀 제형의 면역증강제인 Lipo-pam®은 면역증강 효과와 항원 전달효과를 동시에 갖는 면역증강제로 항원의 크기가 작은 peptide항원이나 DNA/RNA백신에 적용이 가능하며 강력한 세포성 면역반응을 유도할 수 있어 치료백신 개발에 적합합니다.
(3) 면역증강플랫폼을 활용한 파이프라인 확장성
당사는 면역증강플랫폼(L-pampo®, Lipo-pam®)을 기반으로 다양한 감염성 질환의 예방 및 치료 백신을 개발하고 있으며, 암과 같은 만성질환의 치료백신으로 개발영역을 확대하고 있습니다. 개발 중인 주력제품은 만성 B형 간염 치료백신과 효능이 개선된 예방백신, 재조합 대상포진 백신입니다. 또한 기존 독감 백신의 효능을 개선한 노인용 독감 백신, 상용화가 불가능했던 노로바이러스 백신, 암의 재발을 방지하고 다른 치료제와 병용요법으로 치료효능을 극대화할 수 있는 항암백신 등으로 파이프라인을 확장하고 있습니다.
(4) 대한민국 백신 개발의 전통과 역사를 기반으로 한 R&D 전문성
당사는 녹십자가 출연한 비영리 연구재단법인인 "목암생명과학연구소"의 소장을 역임한 문홍모 박사와 염정선 대표가 설립한 바이오 벤처기업으로 2000년 설립되었으며, 2011년 최대주주가 ㈜차바이오텍으로 변경되면서 차병원/차바이오그룹에 편입되었습니다. 설립자인 문홍모 박사는 B형 간염 백신개발에 선구자로 1세대 B형 간염 백신을 개발하였고 녹십자의 2세대 재조합 B형 간염 백신 개발에 큰 공헌을 하였으며, B형 간염 백신 연구를 확장하여 당사의 B형 간염 치료백신 개발을 주도하였습니다. 그리고 현 대표이사인 염정선 박사는 목암생명과학연구소에서 헬리코박터 파이로리 백신과 경구용 면역증강제 개발을 담당하여, 관련 특허를 다수 출원하였고, 많은 연구 성과를 가지고 있습니다. 이러한 연구 성과를 바탕으로 설립 당시의 핵심인력이 현재까지 20년 이상 당사의 신규 면역증강제 개발과 이를 활용한 백신 개발에 집중하고 있습니다.
(5) 우수한 연구성과
면역증강 플랫폼 기술과 관련하여 당사에서는 L-pampo® 관련 특허와 Lipo-pam® 관련 특허 등을 보유하고 있습니다. 한국발명진흥회의 특허분석평가시스템 기반 ‘특허평가등급 KEV(KeyValue)’를 활용하여 국내외 경쟁사들의 면역증강제 유효특허의 등급을 조사 및 분석한 결과, 전체 9개 등급 중 가장 높은 S등급 특허를 보유하여 면역증강기술에 있어 우월한 위치를 확보하고 있음을 확인하였습니다. 또한 당사는 다수의 정부출연 개발과제를 성공적으로 수행하였습니다. 설립 초기 B형 간염 백신 관련 정부과제를 시작으로 하여 대상포진 백신 등으로 그 범위를 확대하였으며, 최근 면역관문억제제의 한계를 극복하는 면역항암치료제의 개발, 신개념 면역증강제 플랫폼 개발 등 정부과제를 수주하여 개발을 진행하고 있습니다.
나. 회사의 현황
(1) 사업영역
당사는 독자적으로 개발한 면역증강 플랫폼 기술(Adjuvant platform)을 활용하여 만성 B형 간염 치료백신, B형 간염 예방백신, 대상포진 백신과 같은 감염성 질환의 예방 및 치료를 위한 차세대 백신과 다양한 난치성 암을 치료하는 항암면역치료제를 개발하고 있습니다.
(가) 백신 면역증강제(Adjuvant)플랫폼
1) 면역증강제의 정의 및 필요성
면역증강제(adjuvant)란 백신항원의 면역원성을 증가시킬 수 있는 백신 첨가물로 효능이 우수한 백신개발에 필수적인 기술입니다. 면역증강제는 백신 항원과 함께 사용하여 백신항원에 대한 면역반응을 증진(증가, 가속화, 지속화, 표적화)시키거나 백신 효능에 적합한 방향 (Th2반응 또는 Th1반응, 체액성 면역반응 또는 세포성 면역반응)으로 면역반응을 조절할 수 있습니다. 면역증강제는 기존 백신을 개량하거나 개발이 어려웠던 신규백신 개발을 위한 핵심적인 요소로 활용되고 있으며, 백신 분야는 예방을 넘어 만성질환을 치료할 수 있는 치료용 백신까지 확장되고 있습니다.
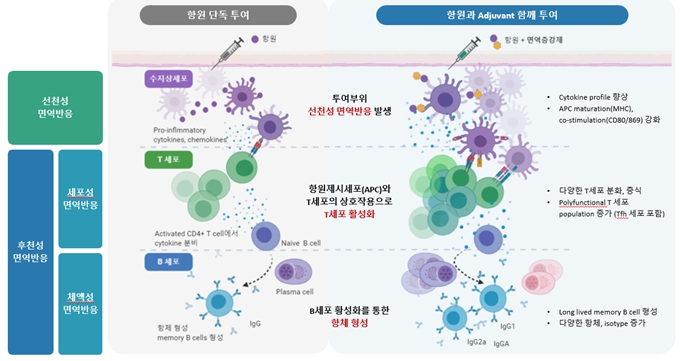 |
|
면역증강제 Mode of Action |
자료: Alberta Di Pasquale et al.(2015), Vaccines 2015, 3(2), 320-343참고 및 재가공
2) 면역증강제의 기능
면역증강제는 그 자체가 면역체계를 자극하여 백신 항원에 대한 면역반응을 일으키는 역할을 하거나 백신항원을 안정적으로 전달하는 역할을 하여 백신항원에 대한 면역반응을 증가 및 조절하거나, 방어 효과 유지기간을 연장하는 등 백신의 임상적 유효성을 증진 및 개선하는 것이 주요 기능이며, 면역증강제 그 자체로 면역치료제를 개발할 수 있는 플랫폼 기술입니다.
면역증강제의 주요 기능인 면역반응 증진을 통해 (1) 백신 접종 횟수를 최소화하여 투여 편의성을 개선하고 접종률을 확대하는 효과를 얻을 수 있습니다. 또한 (2) 백신의 항원양 감소가 가능하며, 이를 통해 생산가를 절감하거나 outbreak시 백신 보급율을 증대할 수 있습니다. (3) 여행자용 백신 및 Bio-defense (생물방어) 백신과 같이 빠른 방어효과가 필요한 백신의 경우, 면역증강제는 백신의 방어효과를 빠르게 유도할 수 있습니다. (4) 면역증강제의 T세포 활성화를 포함한 세포성 면역반응 유도 기능은 치료용 백신과 면역치료제의 개발에 활용될 수 있습니다. (5) 면역증강제는 Th세포(helper T세포)의 면역반응을 조절하기도 하는데, Th1 면역반응 유도 기능을 통해 새로운 T세포 백신을 개발할 수 있습니다. (6) 돌연변이를 일으킨 병원체에 의해 백신의 효능이 감소하는 경우, 면역증강제를 사용함으로써 변이주에 대한 백신 반응성 및 효과를 확장할 수 있습니다. (7) 고령자 등 면역력이 약화된 사람에서는 백신 효능이 낮을 수 있는데, 백신에 면역증강제를 더하여 백신 효과의 개선이 가능합니다.
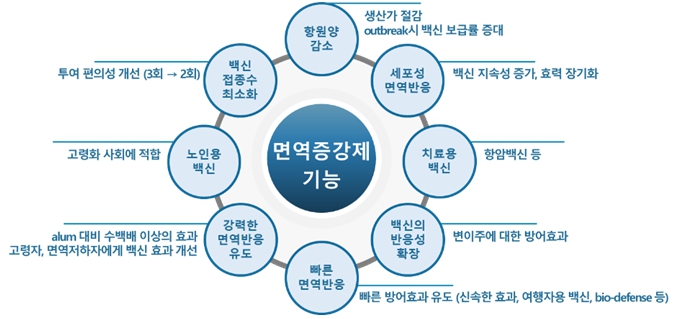 |
|
Potential Benefits of Adjuvants |
자료: Steven G Reed, et al., (2013), Nature Medicine 19(12):1597-1608 재가공
3) 면역증강제의 개발 동향 및 허가 사례
백신에 처음 사용된 면역증강제는 알루미늄 염으로 1920년대에 도입된 후 지금까지 많은 백신에 사용되고 있으며, 면역증강 효능과 내약성이 입증되었습니다. 그러나 알루미늄 염은 항체 유도활성은 우수한 반면에 세포성 면역반응을 잘 유도하지 못하는 단점이 있어 이를 보완하는 새로운 면역증강제가 필요하여 다양한 면역증강제의 개발이 진행 중입니다.
현재까지 상용화된 백신에 포함된 면역증강제는 알루미늄 염, oil-in-water emulsion 형태인 MF59 과 AS03, 그리고 TLR4 작용체를 주성분으로 하는 AS04 및 AS01, TLR9 작용체인 CpG 등이 있으며, 알루미늄 염과 AS03 및 MF59을 제외하고는 모두 선천성 면역기작을 기반으로 하는 TLR기반의 면역증강제에 해당됩니다. 이러한 면역증강제 개발로 이전에 개발이 어려웠던 백신의 개발이 가속화되고 있으며, 백신 타겟이 감염성 질환의 예방에서 만성질환의 치료로 확대되고 있습니다.
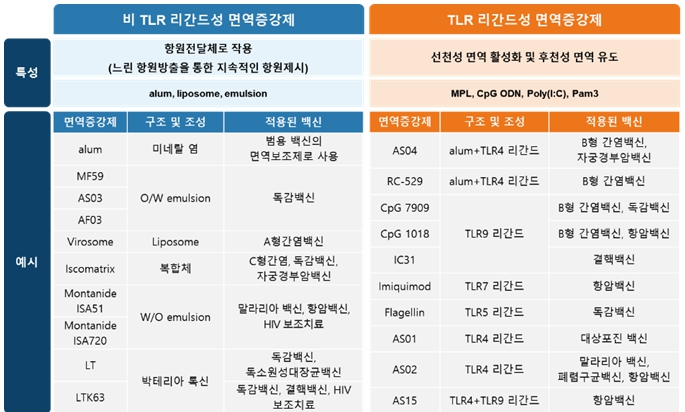 |
|
면역증강제의 종류 |
면역증강제가 적용된 신약 중 현재까지 임상을 거쳐 상용화가 완료되어 활발하게 사용 중인 사례는 다음과 같습니다. Emulsion 제형인 MF59 과 AS03 은 독감백신에 적용되어 각각 노인용 독감백신 (Fluad)과 판데믹플루 백신 (Prepandrix)으로 허가되었습니다. TLR4 작용체 MPL을 포함하는 AS04는 기존 B형 간염 예방백신에 추가되어 기능이 개선된 투석환자용 B형 간염 예방백신 (Fendrix)으로 개량되었고, 자궁경부암 예방을 위한 HPV백신 (Cervarix)에 적용되었습니다. 면역증강제 MPL과 QS21로 구성된 AS01을 활용하여 기존 대상포진 백신을 대체하는 신규 재조합 대상포진 백신 (Shingrix)이 허가되었습니다. TLR9 작용체인 CpG는 기존 B형 간염 예방백신의 투여횟수를 3회에서 2회로 줄여서 편의성을 개선한 B형 간염 예방백신 (Heplisav-B) 개발에 사용되었습니다.
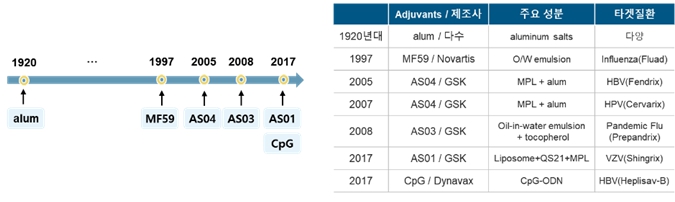 |
|
면역증강제의 허가사례 |
4) ㈜차백신연구소의 면역증강제
① L-pampo®: TLR2/TLR3 리간드의 복합체
당사가 자체 개발한 신규 면역증강제 L-pampo®는 TLR2 리간드와 TLR3 리간드로 구성된 복합체입니다. 면역세포에서 사이토카인을 유도하는 in vitro 세포활성을 통해 L-pampo®가 다른 면역증강제보다 우수한 선천성 면역반응을 유도할 수 있음을 확인하였습니다. TLR2와 TLR3 signaling의 synergistic한 활성화를 통해 선천성 면역반응이 더 강하게 유도되면, T세포와 B세포 활성이 촉진되는 후천성 면역시스템이 더 빠르고 효과적으로 작동합니다.
② Lipo-pam®: Liposome 제형의 면역증강제
백신 면역증강제의 개발에 있어 항원 특이적 면역반응을 이끌어내기 위하여 Toll-like receptor를 타겟으로 하는 특정 리간드의 사용, pathogen 같은 파티클 형태의 항원 사용, 투여부위에 depot 형성 등을 고려하여 항원 특이적 면역증강/조절 기능과 항원 전달 기능을 모두 갖도록 개발하는 것이 매우 중요합니다. 따라서 TLR 리간드인 L-pampo®를 파티클 형태인 리포좀 제형으로 개발하여 면역증강/조절 기능과 항원 전달 기능을 모두 갖는 면역증강제 Lipo-pam®을 개발하였습니다. 파티클 형태로 항원을 전달할 수 있는 기능이 추가된 Lipo-pam®은 펩타이드나 RNA와 같은 형태의 항원을 안정적으로 전달하면서 면역증강 효과를 유도할 수 있습니다.
또한 Lipo-pam®은 면역증강물질을 내부에 포함하는 단순한 리포좀 형태가 아니라 TLR2 리간드가 lipid bilayer에 삽입된 리포좀 형태에 TLR3 리간드가 추가적으로 표면에 결합된 독특한 형태의 면역증강제로 인체 내 면역세포와 접촉하여 면역증강활성을 유도하는데 매우 적합한 특성을 갖습니다.
 |
|
㈜차백신연구소의 자체 면역증강제 L-pampo®와 Lipo-pam® |
③ 면역증강 플랫폼의 적용 및 확장성
당사 면역증강 플랫폼인 L-pampo®와 Lipo-pam®은 면역증강 효과가 매우 우수할 뿐 아니라 백신타겟에 따라 요구되는 효과적인 면역반응 (예를 들면 체액성 또는 세포성 면역반응으로 조절)을 유도할 수 있으며, 백신 항원에 따라 필요한 경우 운반체 역할도 할 수 있어서 다양한 백신에 적용할 수 있는 확장성이 있습니다.
 |
|
면역증강제 플랫폼의 적용 및 확장성 |
현재 임상시험을 진행 중이거나 임상시험 승인신청 중인 B형 간염 예방 및 치료백신, 대상포진 백신, H7N9 판데믹 조류독감 백신 외에도 연구 단계에 있는 COVID-19 백신, 펩타이드 항암백신, mRNA 백신, 노인용 독감 백신, 노로 바이러스 백신, 백일해 백신 등 다양한 백신에 적용이 가능함을 확인하였습니다. 또한, 당사는 경쟁력 있는 면역증강제 L-pampo®와 Lipo-pam®을 활용하여 신규 백신 타겟에 대한 항원 개발사와 협업을 통하여 지속적으로 백신 파이프라인을 확장해 나가고 있습니다.
(나) 만성 B형 간염 치료백신 CVI-HBV-002
1) 만성 B형 간염 개요
① 만성 B형 간염의 원인 및 증상
만성 B형 간염의 원인은 B형 간염 바이러스(Hepatitis B virus, HBV)로 인한 감염이 지속되는 것으로 혈청내 HBsAg이 6개월 이상 양성인 경우를 만성 B형 간염으로 정의합니다. 만성 B형 간염은 간경변, 간암으로 진행될 위험이 높아 치료가 필요합니다.
② 글로벌 만성 B형 간염 환자의 분포 및 사회적 비용
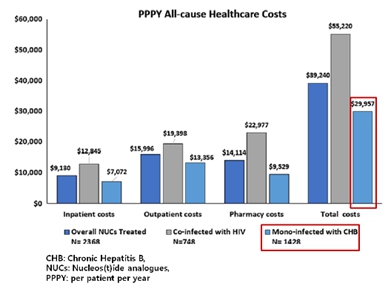
WHO에 따르면 2019년 기준 전세계적으로 20억 명 이상이 B형 간염 바이러스에 감염된 적이 있을 것으로 예상되며 이 중 약 2억 5천 7백만 명이 만성 B형 간염 환자로 추정됩니다. 특히 중국에 약 7천 4백 6십만 명, 인도에 약 1천 7백 5십만 명 등 아시아 태평양 지역에 만성 B형 간염 바이러스 보유자가 많이 분포하는 것으로 추정됩니다.
또한 만성 B형 간염 치료 및 관리에 들어가는 비용으로는 외래 진료비만 1인 당 연간 약 1만 3천달러 이상으로 약제비 등을 합하면 미국에서 연간 만성 B형 간염 환자 1명 당 소요되는 healthcare total costs는 약 3만 달러에 이르는 것으로 알려져 있습니다.
 |
|
만성 B형 간염 환자 1인 당 연간 Healthcare Costs |
자료: Evaluating the Effect of Standard of Care Treatment on burden of chronic hepatitis B. AdvTher,2019
③ 국내 만성 B형 간염 환자의 분포 및 사회적 비용
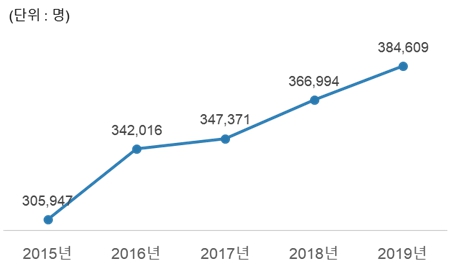
국내 10세 이상 인구에서 B형 간염 표면항원 보유율은 3%로, 만성 감염자는 약 150만명(질병관리본부, 2018) 이상으로 추산됩니다. 1980년대 초부터 신생아 예방접종 사업, 주산기 감염 예방사업 등을 실시함으로써 B형 간염 바이러스 감염률은 점차 낮아지고 있으나 의료통계정보에 따르면 연도별 국내 만성 B형 간염 진료 환자수는 점차 증가하여 2019년 기준 2015년 대비 약 26% 증가한 384,609명이 진료를 받은 것으로 추산됩니다.
 |
|
국내 만성 B형 간염 연도별 진료환자수 |
자료: 국민건강보험공단
진료환자수가 늘어남에 따라 요양급여비용 총액도 2015년 약 100억원에서 2019년 약 150억 원으로 지속적인 증가세를 보이고 있습니다.
질병관리청에서 발표한 'B형 간염 코호트 해외 연구동향'에 따르면 만성 B형 간염의 진료를 위해 한 해 약 3천억 원의 직접 진료비가 소요됩니다. 생산성 손실 비용과 같은 간접비까지 고려하면 2조원에 육박하여 만성 B형 간염의 치료 및 관리를 위해서는 많은 사회적 비용이 필요합니다.
④ 글로벌 만성 B형 간염 치료백신 시장규모
Global Data는 2014년 24억 달러였던 글로벌 만성 B형 간염 치료백신 시장규모가 연평균 2.4% 성장하여 2024년에는 약 30억 달러에 이를 것으로 전망하였습니다.
 |
|
Global chronic hepatitis B therapeutics market |
자료: Global Data 2016
⑤ 만성 B형 간염의 치료 및 한계
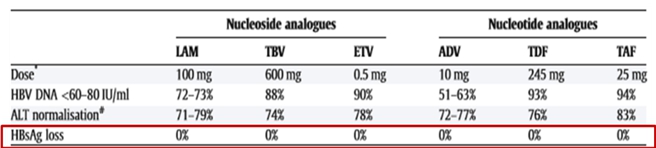
만성 B형 간염 치료를 위해 B형 간염 바이러스의 증식을 억제하는 reverse transcriptase inhibitor인 ETV(Entecavir), TDF(Tenofovir disoproxil fumarate), TAF(Tenofovir alafenamide) 등과 같은 다양한 항바이러스제들이 권고되고 있습니다. 하지만 이러한 항바이러스제들의 경우 B형 간염 바이러스 증식은 효과적으로 억제할 수 있지만 B형 간염 바이러스를 완전히 제거할 수 있는 치료제는 아닙니다. 따라서 만성 B형 간염 환자들은 완치(functional cure)의 지표인 HBsAg 소실이 일어나지 않아 부득이하게 장기간 항바이러스제 복용을 지속할 수밖에 없습니다.
 |
|
기존 항바이러스제의 한계 (1) |
한편 만성 B형 간염 환자들이 장기간 항바이러스제를 복용할 경우 항바이러스제에 대한 내성이 발생하는 문제가 있습니다. 그러나 항바이러스제 투여를 중단하면 잔류 바이러스가 다시 증식하여 체내 바이러스 수치가 증가하는 리바운드 문제가 있기 때문에 항바이러스제 치료를 중단하는 것도 쉽지 않습니다. 따라서 바이러스를 제거하여 완치를 일으킬 수 있는 혁신적인 치료제의 개발이 매우 필요한 상황입니다.
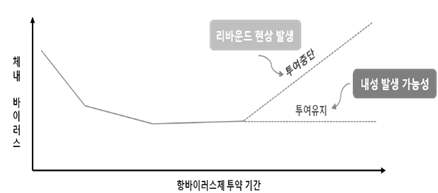 |
|
기존 항바이러스제의 한계 (2) |
2) 만성 B형 간염 치료백신 CVI-HBV-002
만성 B형 간염의 근본적인 치료를 위하여 면역치료기전을 갖는 B형 간염 치료백신을 개발하였습니다. 만성 B형 간염 환자는 B형 간염 바이러스에 감염되어 있으나 이를 제거를 위한 면역반응이 충분히 유도되지 않는 면역관용 상태에 있습니다. 이를 극복하기 위하여 치료백신 CVI-HBV-002는 preS 항원과 HBs 항원을 모두 포함하고 면역원성이 높은 재조합 L-HBsAg 표면항원과 강력한 면역증강제 L-pampo®로 구성됩니다. CVI-HBV-002에 의해 바이러스 특이적인 T세포가 활성화되고 사이토카인 분비 등을 통하여 체액성 및 세포성 면역반응을 포함한 적응면역반응이 더욱 강력하게 유도하여 궁극적으로 감염된 바이러스를 제거하게 됩니다.
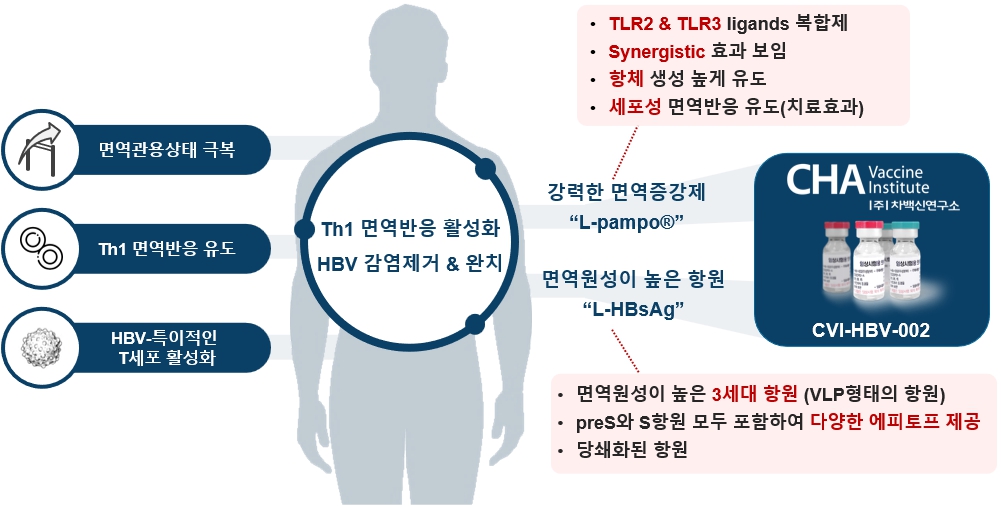 |
|
만성 B형 간염 치료백신 CVI-HBV-002의 특징 |
① 3세대 항원 L-HBsAg의 우수성
L-HBsAg은 표면항원 유전자 전체가 CHO 세포에서 재조합 단백질로 발현되면 HBs 항원으로 이루어진 파티클 표면에 preS 항원이 노출된 바이러스 유사 파티클(VLP, Virus Like Particle)을 이루게 됩니다. 바이러스 보유자의 혈청에서 분리한 1세대 백신항원은 S 단백질과 preS 단백질로 구성된 천연 바이러스 파티클 구조를 가지고 있어 효능면에서는 우수하나 바이러스 감염의 위험이 있었습니다. 2세대 항원 (HBsAg)은 B형 간염 바이러스의 표면항원 중 S 단백질만을 효모에서 재조합 단백질로 발현시킨 것으로 안전성은 개선되었으나 preS 단백질은 포함하지 않아서 1세대 백신 항원 대비 면역원성이 떨어졌습니다. 3세대 항원인 L-HBsAg은 유전자 재조합기술로 생산한 재조합 항원이므로 바이러스 감염의 우려가 없고, S 단백질과 preS 단백질을 포함하고 있어 1세대 항원과 유사한 효능을 가지고 있습니다. 또한 CHO 세포에서 발현하므로 적절한 당쇄구조를 표면에 포함하게 되어 면역원성이 높습니다.
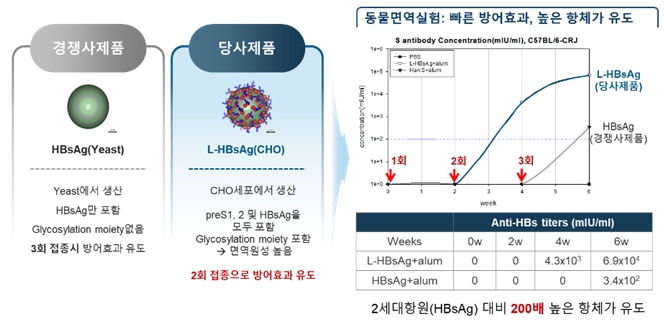 |
|
기존 2세대 항원 대비 3세대 항원 L-HBsAg의 우수성 및 항체가 유도 결과 |
preS 항원을 포함한 3세대 항원은 preS 항원이 HBs 항원의 면역원성을 증가시킬 뿐 아니라, preS항체가 유도되면 바이러스 감염에 대한 방어효과를 높일 수 있는 역할을 하여 1~2세대 항원보다 우수합니다.
당사는 L-HBsAg이 기존 2세대 항원보다 우수한 면역원성을 가지는 것을 확인하기 위해 2세대 항원과 L-HBsAg를 사용하여 마우스에 면역한 후 anti-HBs titer를 분석하는 동물면역실험을 수행하였습니다. 그 결과 기존 2세대 항원 대비 L-HBsAg이 200배 이상 높은 항체가를 유도할 뿐 아니라 2회 투여만으로도 기존 2세대 항원을 3번 투여한 경우보다 충분한 방어 효과를 유도할 수 있음을 확인하였습니다.
② 만성 B형 간염 치료백신 CVI-HBV-002의 비임상효력시험
HBsAg/HLA-A2 double transgenic 마우스모델에서 B형 간염 치료백신 CVI-HBV-002의 효능실험을 수행하였습니다. 이 모델은 간세포에서 HBsAg을 파티클 형태로 발현하여 혈액으로 분비하지만 HBsAg에 대한 면역반응은 유도하지 않기 때문에 HBV 특이적인 면역세포들이 면역관용상태 또는 면역저하상태에 있는 만성 B형 간염 바이러스 보유자와 유사한 모델로 알려져 있습니다.
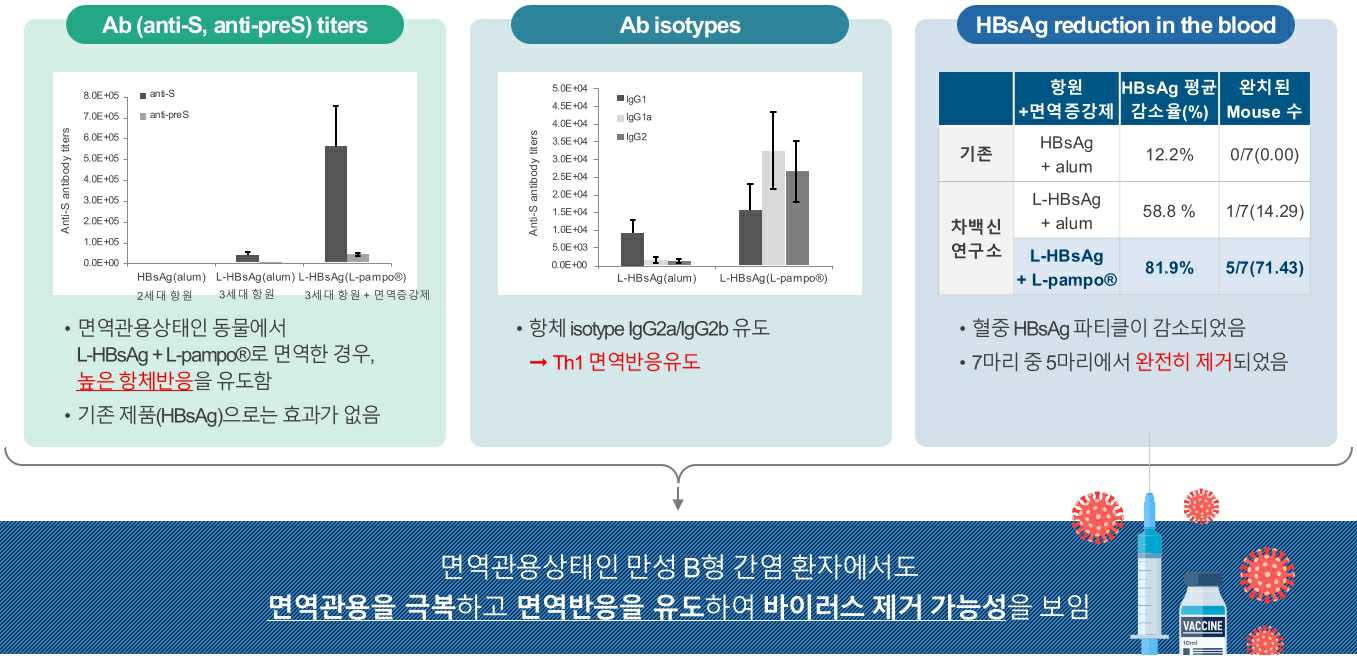 |
|
만성 B형 간염 치료백신 CVI-HBV-002의 비임상 효력시험 |
[HBs 항체 및 preS 항체 분석 결과]
면역관용 모델인 Tg마우스에서 2세대 B형 간염 예방백신 (L-HBsAg + alum)은 항체를 유도하지 못하였습니다. 반면에, B형 간염 치료백신 CVI-HBV-002 (L-HBsAg + L-pampo®)를 투여한 군에서는 HBs 항체와 preS에 대한 항체가 모두 유도되는 것을 확인하였습니다.
또한, HBs 항체 isotype 분석 결과, L-pampo®를 면역증강제로 사용한 CVI-HBV-002에 의해 형성된 HBs 항체는 IgG2a와 IgG2b가 IgG1보다 높아 IgG2 type으로 isotype switching이 일어났음을 확인할 수 있었습니다.
[혈중 HBsAg 제거효과]
면역증강제 L-pampo®를 사용한 B형 간염 치료백신 CVI-HBV-002를 투여하였을 때 혈액내 HBsAg 파티클의 농도가 큰 폭으로 감소하는 것이 관찰되었고, 특히 마우스 7마리 중 5마리에서 혈액 내 HBsAg 파티클이 완전히 제거되었습니다.
이러한 결과로부터 B형 간염 치료백신 CVI-HBV-002는 만성 B형 바이러스 보유자에서 면역관용을 해소하고 면역반응을 유도함으로써 HBV 바이러스를 제거하여 궁극적으로 B형 간염을 치료할 수 있을 것으로 기대됩니다.
③ 만성 B형 간염 치료백신 CVI-HBV-002 연구논문 게재
3세대 B형 간염 항원과 신규 면역증강제 L-pampo®를 포함한 B형 간염 치료백신의 동물면역실험 결과와 치료백신 개발 가능성을 CVI저널에 발표하였습니다.(JS Yum et al., Clin Vaccine Immunol. 2012 Feb;19(2):120-7).
 |
|
만성 B형 간염 치료백신 CVI-HBV-002 연구논문 |
④ 만성 B형 간염 치료백신 CVI-HBV-002 임상시험 진행 현황
당사는 동물모델 단회투여, 반복투여, 생식발생 독성시험을 통해 CVI-HBV-002의 독성 문제가 없음을 확인하였으며, 임상 대상자 총 53명을 대상으로 임상시험 1/2a상을 2017년 완료하여 안전성을 확인하였습니다. 또한 임상시험 1/2a상의 장기추적 결과, T세포의 활성과 HBsAg 감소 효과가 확인되어 지속성도 탁월한 것으로 나타났습니다.
만성 B형 간염 치료백신은 아직 허가된 제품이 없으며, 당사의 CVI-HBV-002는 2019년 12월 말에 임상시험 2b 상을 개시하여 개발단계에서 가장 앞서 있습니다. 현재 삼성서울병원, 서울대학교병원, 서울아산병원 등 9개 기관에서 임상 진행 중에 있습니다.
(다) B형 간염 예방백신 CVI-HBV-001, CVI-HBV-002
1) 글로벌 B형 간염 예방백신 시장규모
WISEGUY RESEARCH CONSULTANTS는 2016년 14억 달러였던 글로벌 B형 간염 예방백신 시장규모가 연평균 3.5% 성장하여 2025년에는 약 19억 달러에 이를 것으로 전망하였습니다.
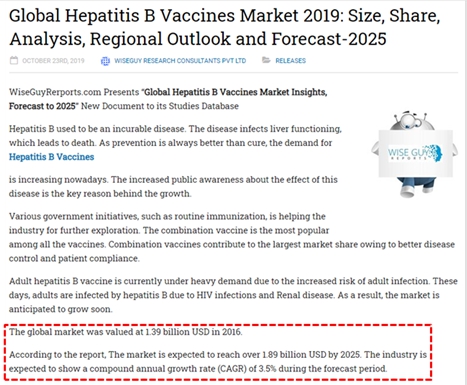 |
|
Global Hepatitis B vaccines Market 2019 |
자료: WISEGUY RESEARCH CONSULTANTS
2) B형 간염 예방백신의 Unmet Medical Needs
B형 간염 예방백신은 현재 2세대 백신이 사용되고 있습니다. 2세대 백신은 기존 1세대 백신에 비해 안전성이 높으나 효능이 저하되는 문제가 있습니다. 이로 인해 우수한 효능 및 높은 안전성을 가지고 있는 3세대 백신으로 B형 간염 예방백신 접종 패러다임이 대체되고 있는 상황입니다.
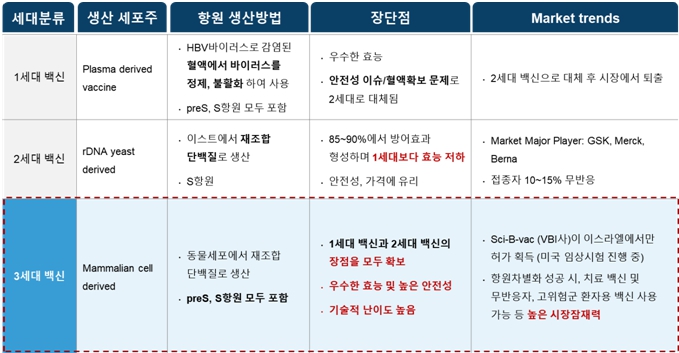 |
|
B형 간염 예방백신의 종류 |
현재 국내외에서 사용하고 있는 2세대 B형 간염 예방 백신이 충분한 방어효과가 유도되기 위해서는 6개월간 총 3회 접종이 필수적입니다. 접종횟수가 많고, 접종 기간이 길기 때문에 3차 접종까지 완료하지 못하는 경우가 빈번하며, 이에 따라 방어효과가 제대로 유도되지 못하는 경우가 발생합니다. 따라서 백신의 접종횟수를 줄여서 편의성을 높이고, 방어효과를 올릴 수 있는 백신 효능의 개선이 필요합니다. 또한 3회 접종을 완료하더라도 항체가 생성되지 않는 무반응자가 5-15% 존재하며, 일부 고위험군에서 방어효과를 유도하기 위해서는 효능이 개선된 백신이 요구됩니다.
백신의 효능을 높이는 방법은 백신항원의 면역원성을 높이거나 보다 효과적인 면역증강제를 사용하는 방법이 있으며, 당사에서는 백신 항원의 면역원성을 높인 3세대 항원을 개발하였고, 면역증강제를 도입하여 백신 효능을 개선하였습니다.
 |
|
B형 간염 예방백신의 Unmet Medical Needs |
자료: Hepatitis B Foundation
3) B형 간염 예방백신 CVI-HBV-001, CVI-HBV-002
① B형 간염 예방백신 개발 전략
당사에서는 B형 간염 예방백신을 2가지 형태로 개발하고 있습니다. 3세대 B형 간염 항원인 L-HBsAg에 면역증강제 alum을 포함한 CVI-HBV-001과 면역증강제 L-pampo®를 포함한 CVI-HBV-002를 개발하여 질환과 대상군의 목적에 적합하게 예방백신 및 치료백신으로 개발을 진행하고 있으며, 이에 대한 특허를 확보하고 있습니다.
B형 간염 예방백신 CVI-HBV-001은 3세대 항원 L-HBsAg과 면역증강제 alum을 포함하는 백신으로 항원의 면역원성을 개선하여 접종횟수를 줄일 수 있음을 확인하였고, 면역증강제로 alum을 사용하므로 투여대상에 제약이 없이 영유아용 및 성인용 프리미엄 백신으로 개발이 가능합니다.
3세대 항원 L-HBsAg과 면역증강제 L-pampo®를 포함하는 CVI-HBV-002는 현재 만성 B형 간염 환자를 대상으로 치료백신 임상시험을 진행 중이며, 예방목적으로는 성인용 2 도스 백신 및 무반응자군에서 방어효과를 유도할 수 있는 백신으로 개발 가능성이 있습니다.
[당사의 2가지 B형 간염 백신 제형]
|
|
CVI-HBV-001 |
CVI-HBV-002 |
|---|---|---|
|
용도 |
개선된 B형 간염 예방백신 |
만성 B형 간염 치료백신 개선된 B형 간염 예방백신 |
|
항원 |
preS, S를 포함하는 3세대 항원 L-HBsAg |
preS, S를 포함하는 3세대 항원 L-HBsAg |
|
면역증강제 |
alum |
L-pampo® |
|
대상 |
영유아, 성인 |
성인 |
|
경쟁력 |
- 면역증강제 alum 사용을 통해 전연령층 사용가능 (신생아용 프리미엄 백신 개발) - 면역원성이 개선된 3세대 항원 포함 - 기존 제2세대 백신 대비 효능 우수 (임상 결과 보유) |
- 면역증강제 L-pampo®를 포함하여 강력한 면역반응 유도 가능 - 세포성 면역반응: 치료백신 - 체액성 면역반응: 무반응자용 예방백신 - 면역원성이 개선된 3세대 항원 포함 - 백신 효능 극대화 (2dose 백신, 무반응자용 백신 개발) |
② B형 간염 예방백신 CVI-HBV-001의 임상시험 결과
B형 간염 예방백신 CVI-HBV-001의 반응성(reactogenicity)과 안전성(safety) 그리고 면역원성(immunogenicity)을 평가하기 위한 1/2a상 임상시험을 완료하였습니다. 백신 1차 투여 후에 항체 유도에 있어 boosting 효과가 나타나지 않았던 대상자(무반응자)들에게 CVI-HBV-001을 추가 투여한 결과, 방어효과가 유도됨을 확인하였습니다.
이를 통해 기존 백신으로는 방어효과가 유도되지 않는 무반응자를 위한 예방백신 개발 가능성을 확인하였고, 3세대 항원과 면역증강제 L-pampo®를 포함한 CVI-HBV-002로 무반응자 대상 프리미엄 예방백신 개발을 추진하고 있습니다.
③ 프리미엄 예방백신 CVI-HBV-002의 임상시험 결과
CVI-HBV-002는 pre-S와 S항원을 모두 포함하는 3세대 백신항원과 강력한 면역증강제 L-pampo®로 구성되어 있어 기존 2세대 예방백신보다 백신 효능이 월등히 우수합니다. 기존 예방백신은 일반인의 경우 3회 투여를 하여야만 항체가 형성되지만 항체가 형성되지 않아 방어효과가 유도되지 않는 성인 무반응자도 존재합니다. 당사가 개발중인 프리미엄 예방백신 CVI-HBV-002 는 일반 성인에서 2회 투여만으로 방어항체가 형성되고 무반응자에서도 항체가 형성되어 방어효과를 유도하였습니다. 이러한 임상시험 결과를 기반으로 프리미엄 B형 간염 예방백신 개발을 추진하고 있습니다.
임상시험 결과 1차 지표인 혈청 방어율 평가에서 1차 투여 후 29명 중 28명인 92.86%에서 혈청 방어율을 보였으며, 2차 투여와 3차 투여, 그리고 48주 후 시험대상자 29명 전원에게서 혈청 방어율을 획득한 것을 확인하였습니다. 임상 1상 결과를 바탕으로 국내를 포함한 2~4개국을 대상으로 글로벌 임상 2상을 추진할 계획입니다.
(라) 대상포진 백신 CVI-VZV-001
1) 대상포진 개요
① 대상포진과 PHN(포진후 신경통)
대상포진(herpes zoster, shingles)은 수두-대상포진 바이러스(varicella zoster virus, VZV)에 의한 질병으로 수포를 동반한 발진이 몸의 한 쪽에 띠 모양으로 나타나는 것이 특징입니다. 어릴 때 수두-대상포진 바이러스에 감염되면 전신 발진이 특징인 수두를 일으키고, 수두가 완치된 후에도 바이러스는 없어지지 않고 신경절 등에 잠복감염 상태로 있다가 면역력이 저하되면 재활성화되어 대상포진을 일으키게 됩니다.
면역력감소의 원인은 고령, 스트레스, 외상, 악성종양, 감염 그리고 항암치료나 장기이식 등으로 인한 면역억제제 투여 등과 같은 면역저하상태 등이 있으며 이에 따라 대상포진은 50세 이상 성인 특히, 고령층에서 발병률이 높습니다.
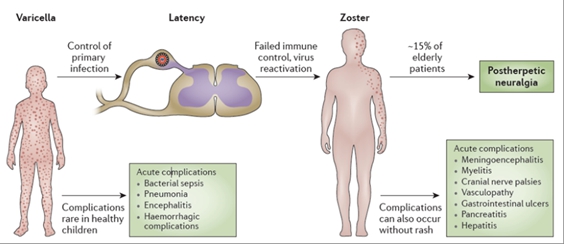 |
|
Varicella Zoster Virus 감염의 여러 단계 |
자료: 임상진료지침정보센터, 2015 Nature Reviews vol.1
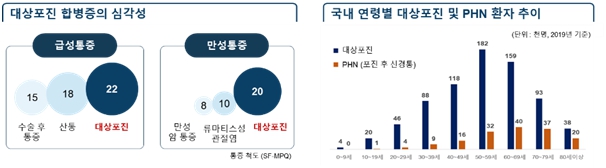
대상포진은 수포가 발생한 부위에 극심한 통증을 유발하게 되는데 의학적 통증 척도(SF-MPQ)에 따르면 대상포진은 통증 22점으로 수술 후 통증(15점), 산통(18점)보다 심하며, 환자의 96%는 급성통증을 경험하게 됩니다. 보통 2주 정도 지나면 회복되어 증상이 좋아지나, 피부병변 발생 3~6개월 후에도 통증이 수개월 또는 수년 동안 남아있는 경우가 있는데 이를 '포진후 신경통(postherpetic neuralgia, PHN)'이라 하며 조절이 매우 힘든 심각한 합병증입니다. 고연령은 대상포진 합병증인 PHN으로 진행되는 주요 요인으로 작용합니다. 그 외에도 급성기 통증과 발진이 심했던 경우나 면역저하자(암환자 등)에 발생한 경우에 PHN으로 진전될 가능성이 높습니다.
 |
|
대상포진의 통증 척도(SF-MPQ) 및 연령별 대상포진과 포진후 신경통(PHN) 환자 추이 |
자료: 헬스조선뉴스 자료 재가공, 건강보험심사평가원
② 글로벌 대상포진 환자 분포
임상진료지침정보센터 자료에 따르면 대상포진 발병 비율은 건강한 사람 1천명당 1.2~3.4명인 반면, 65세 이후에는 1천명당 3.9~11.8명으로 증가하여 PHN의 발병위험이 고령 환자에서 높다고 보고되었습니다(대상포진 및 PHN 발병률 조사 연구 49건 분석 결과). 이에 따라 다수 국가에서 50세 이상 성인을 대상으로 대상포진 예방백신 접종을 필수로 규정하거나 권고하고 있습니다.
③ 국내 대상포진 및 PHN 환자 분포
[대상포진 환자]
국내 대상포진의 발병 비율은 건강한 사람 1천명당 5.1 ~ 12명으로 전 세계 평균에 비하여 높은 편입니다. 건강보험심사평가원의 자료에 따르면, 국내 대상포진 진료인원은 2014년 약 65만 명에서 2016년 약 69만 명, 2019년에는 약 74만 명으로 증가하여 연평균 증가율이 약 3%에 달하는 것으로 조사되었습니다. 대상포진 질환 건강보험 진료비용은 2014년 1,170억원에서 2019년 1,687억 원으로 늘어 연평균 7.6% 증가하고 있습니다. 따라서, 대상포진 환자의 급증으로 인한 의료비용의 증가를 막기 위해서는 예방백신 투여로 발병 예방이 중요합니다.
대상포진 발병의 연령별 분포는 2003년~2010년 사이의 조사에서는 60대가 가장 많고, 70대, 50대의 순으로 조사되었으나 발병 연령이 점차 낮아져서 2019년의 조사에서는 50대, 60대, 40대, 30대 및 70대의 순으로 환자수가 많은 것으로 조사되었습니다. 최근에는 젊은 층에서도 발병률이 높아져 20~30대 환자의 비율이 빠른 속도로 증가하고 있는 것으로 조사되었습니다.
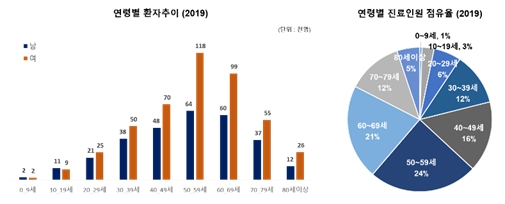 |
|
국내 연령별 대상포진 환자 추이 |
자료: 건강보험심사평가원
[국내 PHN 환자]
대상포진 환자 중에서 만성통증인 PHN으로 진행되는 주 원인은 60세 이상 고령, 기저질환, 면역력 저하, 대상포진 발생 초기에 통증이 매우 심하고 오래 지속된 경우 등이 있습니다.
연도별 PHN의 발병비율은 인구 천명당 2014년에 2.7명이었으나 2019년에는 3명을 넘어섰습니다. 건강보험심사평가원의 자료에 따르면 국내 PHN 진료인원은 2014년 약 13만명이었으나 2018년 15만명, 2019년 16만명으로 점차 증가하는 것으로 조사되었습니다. PHN 질환 건강보험 진료비용은 2014년 246억원에서 2019년 356억 원으로 늘어 연평균 7.6% 증가하고 있습니다. 따라서, PHN 환자의 급증으로 인한 의료비용의 증가를 막기 위해서는 PHN의 예방과 치료가 매우 중요합니다.
2019년 PHN 발병의 연령별 분포는 40대에서 일부 발생하지만, 50대부터 확연히 증가세를 보여 60대 이상은 50%이상의 발병률을 보입니다. 또한 환자 수는 60대, 70대, 50대 및 80대 순으로 많은 것이 조사되었습니다.
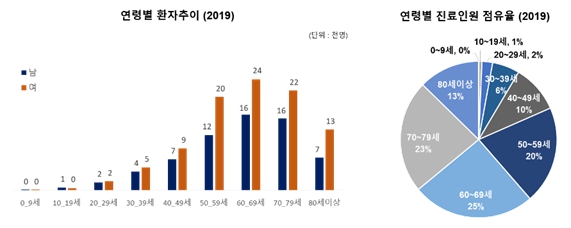 |
|
국내 연령별 PHN 환자 추이 |
자료: 건강보험심사평가원
④ 글로벌 대상포진 시장규모
대상포진 백신 시장을 장악하고 있는 GSK Shingrix의 2020년 매출규모는 약 20억 파운드이며, 향후 향상된 효능과 높은 안전성을 겸비한 제품이 출시될 경우, 대상포진 백신 시장은 매우 빠르게 성장할 것으로 예상됩니다.
 |
|
GSK annual report 2020 |
자료: GSK annual report 2020
⑤ 포진후 신경통(PHN) 치료 및 한계
현재 대상포진의 치료에는 acyclovir, famciclovir 등 항바이러스제를 사용하고 있습니다. 합병증인 PHN의 치료는 국소마취제, 마약성 진통제 등을 활용하여 통증완화 등 진통효과에만 집중되고 있어 근본적인 치료방법이 아니며, 완전한 치료제는 없는 상황입니다. 또한 침습적 시술 등을 통한 통증 치료가 시행되기도 하지만 효과가 제한되어 있습니다.
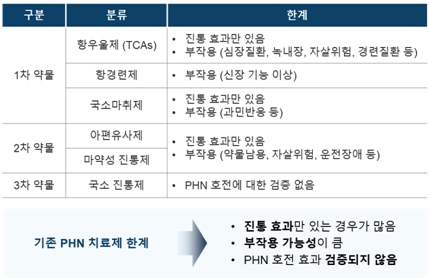 |
|
포진 후 신경통(PHN)의 치료와 한계 |
자료: 임상진료지침정보센터
2) 대상포진 백신 CVI-VZV-001
당사의 대상포진 백신CVI-VZV-001은 재조합 gE항원과 리포좀 형태의 면역증강제 Lipo-pam®으로 구성되어 있습니다.
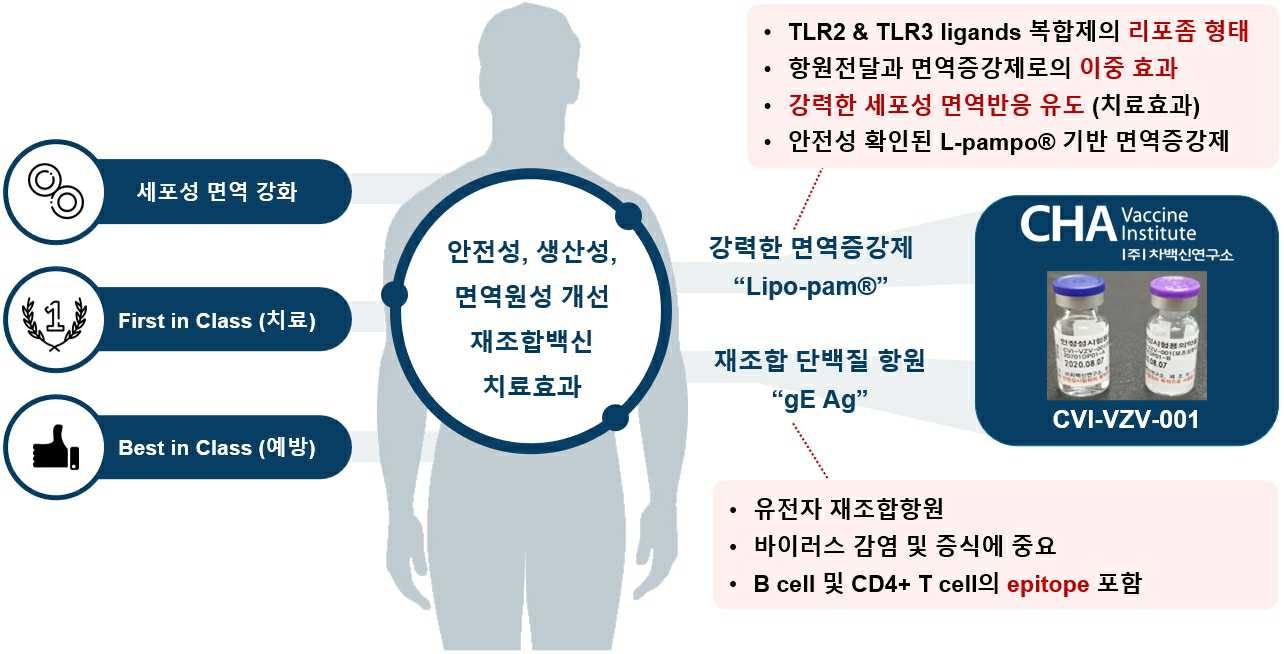 |
|
재조합 대상포진 백신 CVI-VZV-001 |
상용화된 대상포진 백신과 효능을 비교한 동물면역실험에서 CVI-VZV-001의 우수한 효능을 확인하였습니다. 약독화 생백신인 Zostavax에 대비하여 CVI-VZV-001이 세포성 면역반응의 지표인 IFN-γ ELISPOT을 높게 유도하였고 cytokine IFN-γ, TNF-α, lL-2를 모두 분비하는 polyfunctional CD4+ T cell 유도능이 우수하였습니다. 면역증강제 AS01을 포함한 재조합 백신인 Shingrix와 비교하여 동등 이상의 효능을 보였으며, cytokine IFN-γ, TNF-α, lL-2를 모두 분비하는 polyfunctional T cell을 유도하는 효능이 월등하였습니다.
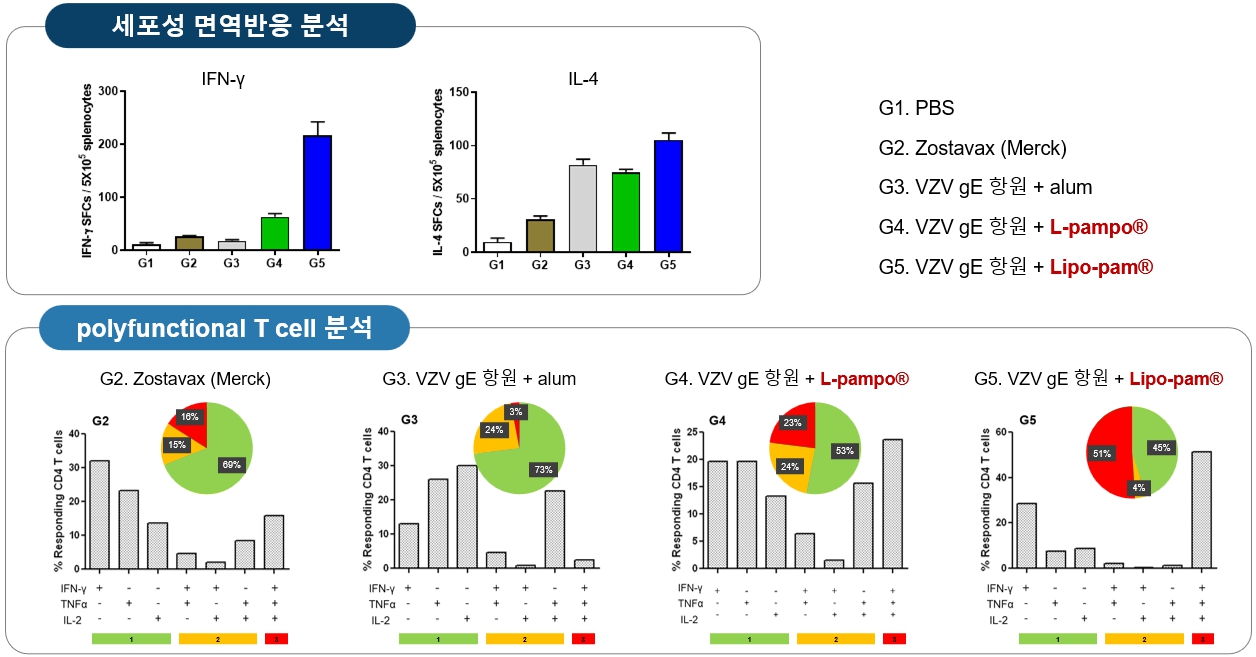 |
|
상용화된 약독화 생백신(Zostavax, Merck社)과의 효능 비교 |
※ 자체실험결과
GSK의 Shingrix는 임상연구를 통해 대상포진 예방 효과가 약독화 생백신에 비해 월등하게 높음이 확인되었으나 면역증강제(AS01)에 의한 부작용 (통증, 근육통, 피로, Flu-like symptom)이 큰 것으로 보고되었습니다.
반면에, CVI-VZV-001에 포함된 면역증강제 Lipo-pam®의 면역증강물질인 L-pampo®는 B형 간염 치료백신(CVI-HBV-002)의 임상시험을 통해 안전성이 입증되었고, 면역증강제에 의한 중대 이상반응이 보고되지 않았습니다. 따라서 CVI-VZV-001은 향상된 효능을 보이면서 부작용은 최소화할 수 있는 백신으로 개발이 가능할 것으로 예상됩니다.
CVI-VZV-001는 세포/동물모델 독성시험을 완료하여 독성 문제가 없음을 확인하였습니다.
본 보고서 작성 기준일 현재 해당 백신의 임상시험 관련 진행상황은 아래와 같습니다.
| 구분 | 내용 |
|---|---|
| 임상시험 단계 | 제1상 임상시험 진행 중 |
| 임상시험계획(IND) 승인 신청일 | 2021.08.31 |
| 임상시험계획(IND) 승인 취하일 | 2022.02.21 |
| 임상시험계획(IND) 승인 재신청일 | 2022.05.10 |
| 임상시험계획(IND) 승인일 | 2022.12.05 |
| 임상시험계획(IND) 변경승인 신청일 |
2023.08.01 |
| 임상시험계획(IND) 변경 승인일 | 2023.10.13 |
|
임상시험 대상자 투여 완료일 |
2024.02.16 |
| 임상시험계획승인(IND) 승인기관 | 한국 식품의약품안전처 |
(2) 사업 영역의 확장성
만성 B형 간염 치료백신, B형 간염 예방백신, 대상포진 백신과 같은 감염성 질환의 예방 및 치료백신 제품뿐만 아니라 암의 면역치료 분야로 사업을 확장하고 있습니다.
(가) 항암백신
1) 항암백신 개요
① 면역치료제의 중요성
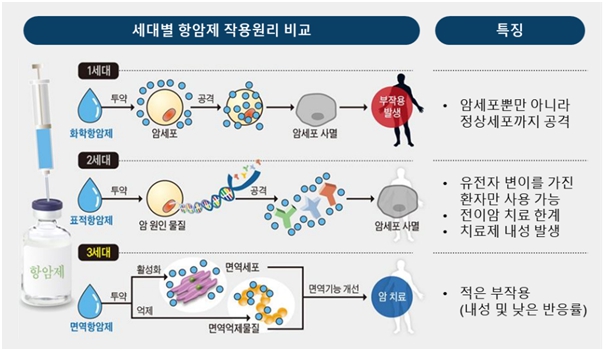
항암제는 1세대 화학항암제, 2세대 표적항암제, 3세대 면역항암제로 구분되며 항암치료 분야에서 정상세포 손상, 내성 등의 한계가 존재하는 1세대와 2세대 항암제보다 효과가 높고 부작용이 적은 3세대 면역항암제의 중요성이 부각되고 있습니다.
면역치료(immunotherapy) 종류는 단일클론항체, 면역조절제, 항암백신, 면역관문억제제, 항암 T세포 치료제로 구분됩니다.
 |
|
세대별 항암제 |
자료: 한국일보 그림 재가공 / 국내외 항암제 개발 동향 및 시사점 (2019)
 |
|
면역치료의 종류 |
② 항암백신의 정의 및 중요성
항암백신은 암항원과 면역증강제로 구성되며, 암항원을 항원제시세포(APC)가 인식하게 되고 종양 특이적 T cell의 분화 및 증식을 유도하며 면역증강제를 통해 이러한 면역반응이 강력하게 활성화됩니다. 활성화된 T cell이 암항원을 발현하는 암세포를 인식하고 결합하여 파괴함으로써 항암효과를 나타냅니다.
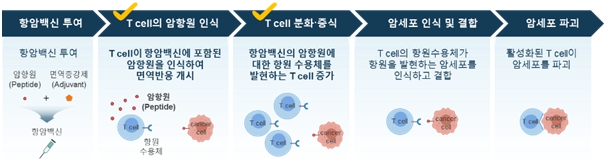 |
|
항암백신의 작용기작 |
항암백신은 cytotoxic T cell 분화 증식을 포함한 암항원 특이적 면역반응을 일으켜 암세포를 파괴하여 암의 진행을 늦출 뿐만 아니라 암항원에 대한 면역 메모리를 통해 암의 재발을 방지하고, 독성이 낮아 다른 항암치료 또는 면역치료와 병용치료가 가능하여 치료효능을 극대화할 수 있다는 장점이 있어 암 면역치료(immunotherapy) 분야에서의 중요도가 확대되고 있습니다.
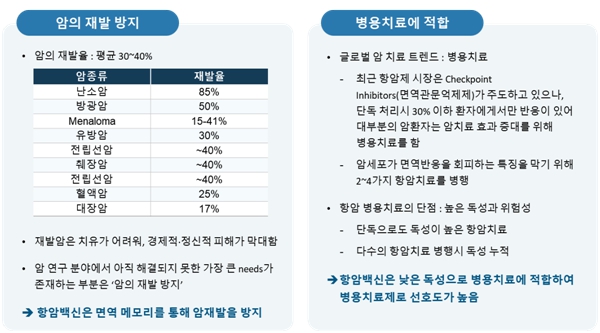 |
|
항암백신의 장점 |
③ 항암백신의 종류와 장단점
항암백신은 종양 항원을 기반으로 사용하거나 종양 세포 자체를 항원으로 사용하여 종양 세포 특이적인 면역 반응을 유도합니다. 이러한 항암 백신의 종류로는 펩타이드 기반 백신, 핵산(DNA/mRNA) 기반 백신, 바이러스 벡터 기반 백신, 종양 세포 백신 등이 있습니다.
 |
|
항암백신의 종류와 장단점 |
종양 항원 에피토프의 아미노산을 합성한 펩타이드기반 백신은 가격이 저렴하고 생산이 용이하다는 장점이 있는 반면에 면역효능이 약하다는 단점이 있습니다. 다양한 암항원에 대한 펩타이드조합 및 강력한 면역증강제와의 병용하는 방법을 통해 낮은 면역효능의 한계를 극복할 수 있습니다.
암세포 특이적 항원을 코딩하는 핵산(DNA/mRNA) 기반 백신은 가격이 저렴하고 생산이 용이하다는 장점을 가지고 있지만 임상에서 전달 효율이 낮아 면역효능이 낮다는 단점이 있습니다. 이를 극복하기 위해 효과적으로 체내에 유전자를 전달할 수 있는 전달체의 개발이 연구되고 있습니다.
바이러스 벡터 기반 백신은 아데노바이러스 등의 바이러스 벡터를 운반체로 하며, 면역 효능이 높지만 부작용이 심하며 바이러스 벡터 자체에 대한 면역반응이 유도될 수 있다는 단점을 가지고 있습니다.
환자로부터 분리한 암세포를 사멸하여 투여하는 종양 세포 백신은 다양한 암항원에 대한 면역이 유도된다는 장점을 가지고 있지만 낮은 면역효능과 안전성이 낮다는 단점을 가지고 있습니다.
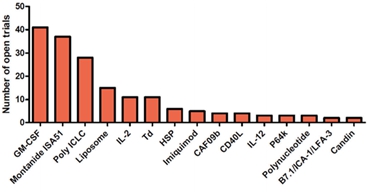
④ 펩타이드 항암백신 개발 현황 및 한계
다양한 펩타이드 항원과 GM-CSF, Montanide ISA 51, Poly ICLC 등의 면역증강제로 구성된 펩타이드 항암백신의 임상시험이 현재 다수 진행 중에 있지만 임상시험에서 효능이 충분하지 않아 개발을 중단하거나 상용화되지 못하는 등 개발이 미진한 상황입니다.
 |
|
펩타이드 항암백신의 개발 동향 1 |
 |
|
펩타이드 항암백신의 개발 동향 2 |
자료: Cancer Vaccines: Adjuvant Potency, Importance of Age, Lifestyle, and Treatments, Front. Immunol., 17 February 2021
많은 펩타이드 항암백신 파이프라인들은 다수의 임상시도에도 불구하고 단일표적/다중표적 펩타이드 백신 제형의 한계와 GM-CSF, Montanide ISA 51, Poly ICLC 등 면역증강제의 낮은 효능으로 인하여 실패하고 있습니다.
따라서 암항원에 대한 세포성 면역 반응을 충분하게 유도할 수 있는 강력한 면역증강제와 멀티표적의 펩타이드 항원을 함께 사용하는 것이 성공적인 펩타이드 항암 백신 개발에 필수적입니다.
2) 당사 항암백신 개발 전략 및 효능
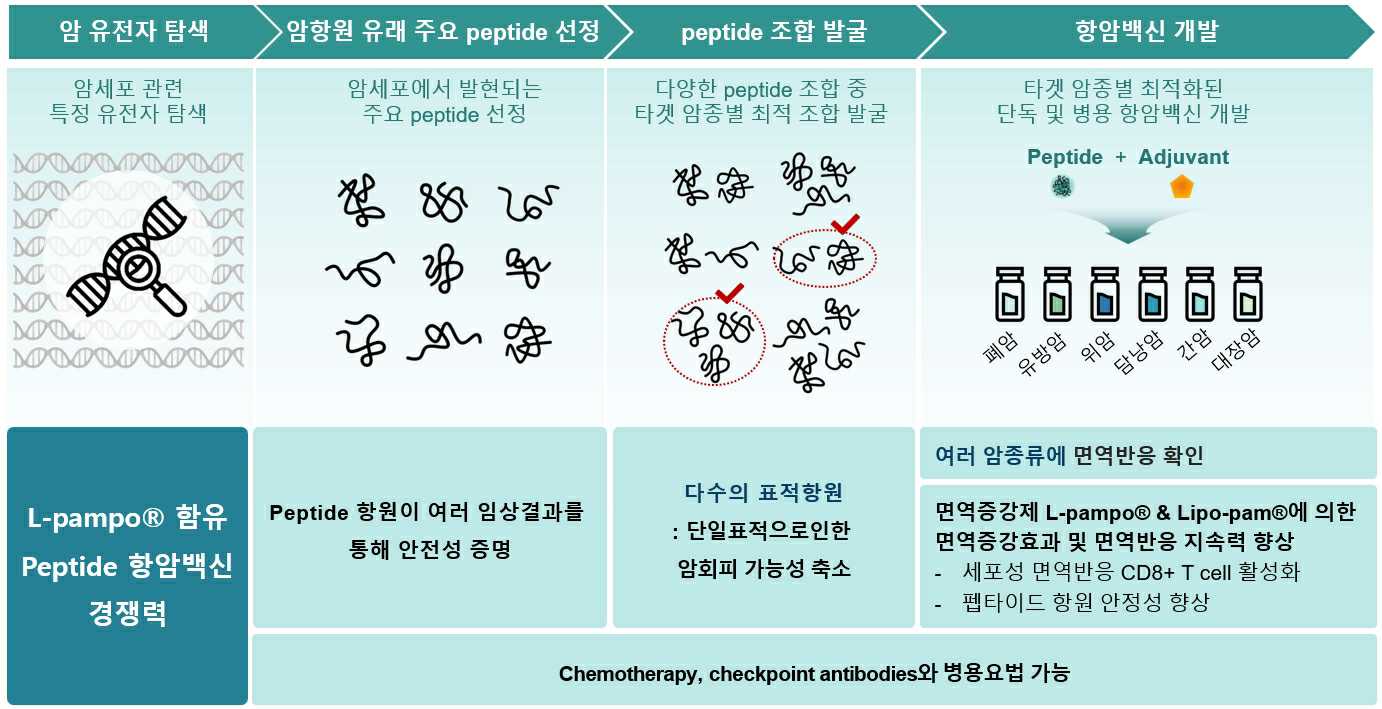
① 타겟암종별 최적화된 항암백신의 개발 전략
당사는 돌연변이에 의해 발현된 암항원에서 유래한 주요 펩타이드 조합 중 타겟 암종별 최적 조합을 발굴하여 펩타이드 항암백신을 개발하고 있습니다. 다양한 펩타이드 항원을 조합하여 사용하므로 단일표적에 대한 암회피 가능성을 줄일 수 있고, 면역증강제 L-pampo® (또는 Lipo-pam®)는 암 특이적 세포성 면역 반응을 활성화하고, 유도된 면역반응을 지속시키는 장점이 있습니다.
 |
|
타겟암종별 최적화된 항암백신의 개발 과정 |
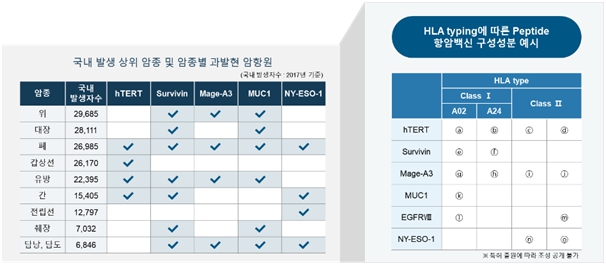
② 멀티 펩타이드 선정 및 항암백신 개발
당사에서는 hTERT, Survivin, Mage-A3, MUC1, NY-ESO-1, EGFRvIII 와 같은 다양한 종양항원에 대해 공통적으로 발현되는 다가의 펩타이드를 구성하고 여기에 면역 증강 효과가 뛰어난 L-pampo®를 활용한 다양한 제형을 추가하면 매우 효과 높은 바이오마커 기반의 혁신 항암신약을 개발할 수 있습니다. 이는 초기 임상에서 면역반응군(Immune-responder)을 검사하여 후기 임상에 적용할 계획으로 높은 임상 성공률과 빠른 상용화 및 조기 기술이전을 기대할 수 있습니다.
 |
|
펩타이드 항암백신 개발 전략 (암종별 과발현 암항원 면역증강제 L-pampo®) |
자료: 보건복지부 2017년 국가암등록통계
③ 펩타이드 항암백신에 대한 면역증강제 L-pampo®의 면역증강 효과
펩타이드 항암백신 전문 개발사인 애스톤사이언스는 유방암 관련하여 Th1 세포 특이적인 종양 공통 항원 단백질로부터 사람 면역세포를 이용한 스크리닝을 통하여 2종의 암 특이 펩타이드 항원을 개발하였습니다. 그러나 펩타이드 단독으로는 체내 안정성 및 항암 효과가 충분하지 않아서 당사의 면역증강제 L-pampo® 또는 상업적으로 판매/임상 중이며 기존 항암백신 연구에 많이 사용되는 면역증강제를 혼합한 항암백신으로 동물모델에서의 면역반응 유도 효과를 비교하였습니다.
이를 통해 당사 면역증강제 L-pampo®가 세포성 면역반응을 월등히 높게 유도하고 펩타이드 항암백신의 효과를 극대화할 수 있는 면역증강제임을 확인하였습니다. 당사 면역증강제 L-pampo®의 다른 면역증강제 대비 매우 우수한 동물실험 결과를 기반으로 애스톤사이언스와 총 2,031억원 계약규모의 기술이전 계약을 체결하였습니다.
또한 L-pampo®를 포함한 항암백신 및 면역관문억제제를 각각 또는 병용투여하여 면역유도 효능을 평가하였습니다. 이를 통해 L-pampo®를 포함한 항암백신이 T cell 생성능을 증가시키고 유의성 있게 암 성장 억제 및 생존율을 증가시키며, 면역관문억제제와의 병용투여에 의해 암 치료 효과를 향상시킬 수 있음을 확인하였습니다.
(나) 면역항암치료제
1) 면역항암치료제 개요
① 면역관문억제제 정의 및 허가제품
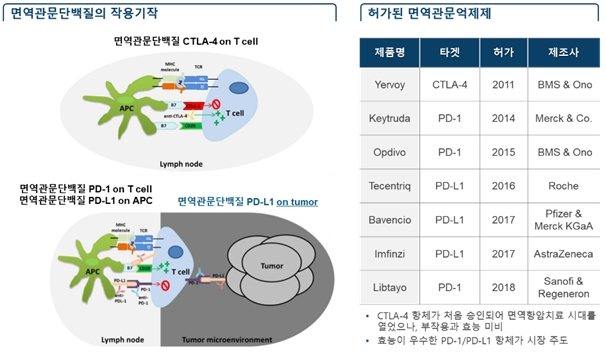
CTLA-4, PD-1, PD-L1 등의 면역관문단백질(Immune checkpoint protein)은 면역세포의 분화, 증식, 활성을 억제하는 기능을 하는데, 특정 면역관문단백질들은 암세포에서도 발현되어 암 특이적 T 세포를 비활성화시킴으로써 암세포가 면역시스템 공격을 회피하게 됩니다.
면역항암제 중 면역관문억제제(Immune checkpoint inhibitor)는 암세포에 발현된 면역관문단백질의 면역회피 기능을 억제하고 면역반응을 다시 활성화시켜 암세포를 제거할 수 있도록 합니다. 2011년 BMS의 Yervoy 허가를 시작으로 현재까지 총 7개의 면역관문억제제가 허가되었습니다. 최근 항암제 분야에서 면역관문억제제가 주도해 나가고 있습니다.
 |
|
면역관문단백질의 작용기작(왼쪽) 및 허가된 면역관문억제제(오른쪽) |
② 면역관문억제제의 한계
면역관문억제제 치료에 대한 내성을 보이는 암환자들은 치료 반응이 전혀 없이 종양이 커지는 일차내성, 치료 반응이 늦지만 궁극적으로 종양이 커지는 적응내성, 초기에 치료 반응이 나타나 종양 크기가 줄어들지만 감소세가 유지되지 못하고 다시 종양 크기가 커지는 획득내성의 내성 패턴을 보입니다. 내성 등의 이유로 면역관문억제제는 암종이나 환자에 따라 항암효과가 다르게 나타나며, 단독 치료 시 환자의 30%에서만 강한 효과를 보이고 나머지 70%의 환자에게서는 치료 효과가 낮습니다.
 |
|
치료제에 대한 내성의 종류 |
③ 면역관문억제제의 효능 개선방안
면역관문단백질의 발현에 차이가 있는 경우, 바이오마커를 통해 치료 반응자와 무반응자를 구분하고 반응이 있을 것으로 예상되는 면역관문억제제를 선택함으로써 치료 효과를 높일 수 있습니다.
암항원의 제시 정도가 약한 경우, 암항원 노출 증가를 통한 암 특이적 면역반응을 개선, 저면역원성에서 고면역원성으로의 암 미세환경 리모델링을 통한 반응률 향상 등의 방법으로 면역관문억제제의 한계를 극복할 수 있습니다.
 |
|
면역관문억제제 한계 극복 방안 |
④ 면역관문억제제 병용요법
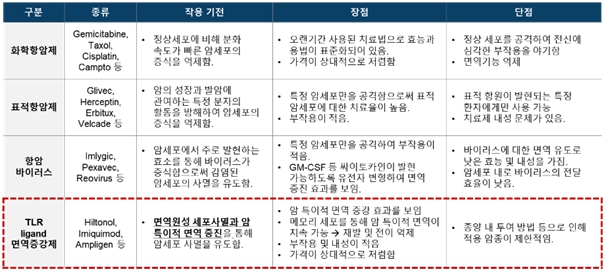
면역관문억제제의 한계를 극복하기 위해 화학항암제, 표적항암제, 항암바이러스, 면역증강제 등 다양한 항암기전을 갖는 치료제들을 병용적으로 사용하는 임상시험이 많이 증가되고 있습니다.
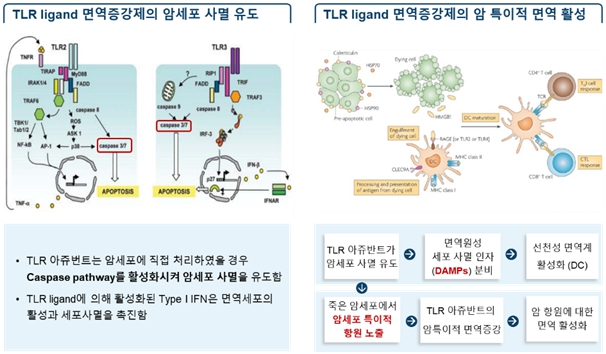
면역관문억제제와 TLR 리간드 면역증강제를 병용투여 하는 경우, 면역관문억제제의 한계를 극복하고 항암효과를 극대화할 수 있습니다. 대부분의 면역세포에서 발현된다고 알려져 있는 TLR이 암세포에서도 발현되고 있으며, TLR 리간드 면역증강제는 암세포 사멸을 유도하여 암항원뿐만 아니라 DAMPs 등의 세포 사멸 인자들을 분비하여 종양 특이적인 면역활성을 유도함으로써 강력한 항암치료효능을 나타냅니다.
또한 TLR 리간드 면역증강제는 메모리 면역세포를 통해 지속적인 암 특이적 면역을 유도하여 암의 재발 및 전이를 억제하고 부작용 및 내성이 적다는 장점이 있습니다.
 |
|
면역관문억제제와 병용약물의 종류 및 장단점 |
 |
|
TLR 리간드 면역증강제의 암세포 사멸 유도 및 암 특이적 면역 활성 |
자료: Eur J Immunol, 2007, 37:3311-3318 /Nature Reviews Immunology, 2009, 9:353-363
2) 당사 면역항암치료제 개발 전략 및 효능
① 면역증강제 L-pampo®와 면역관문억제제 병용투여
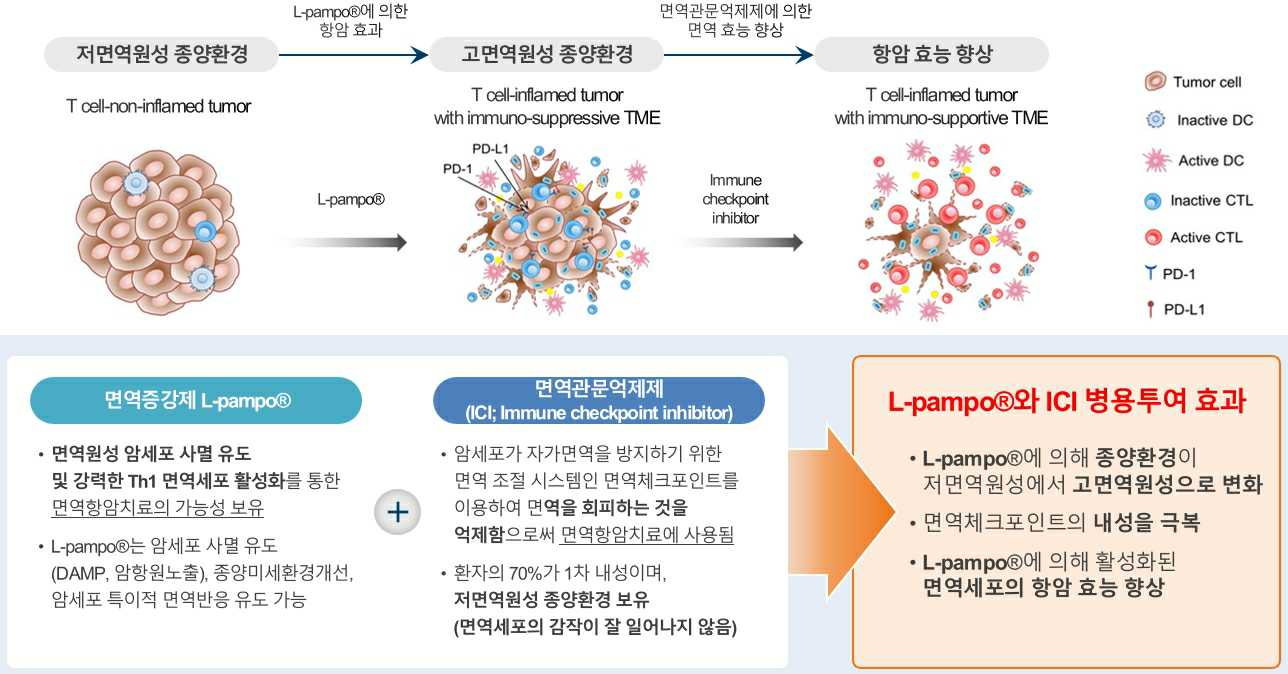
치료 초기에 치료반응이 나타나지 않고 질병이 진행하는 일차 내성을 보이는 환자의 경우, 항원제시 및 T세포 감작이 잘 일어나지 않는 저면역원성 종양에 해당됩니다. 내성 극복을 위해 고면역원성 종양환경으로의 전환이 필요하며, TLR 리간드가 종양환경을 고면역원성으로 변화시키며 면역원성을 증강시키는 역할을 합니다. TLR 리간드는 항암 면역치료의 효과를 증강시킬 수 있습니다.
따라서 TLR 리간드 복합체인 L-pampo®에 의한 면역원성 세포 사멸유도, 강력한 Th1반응을 통한 면역세포 활성화, 고면역원성으로의 종양환경 전환을 통해 면역관문억제제의 한계인 암세포의 면역회피를 극복하여 임상에서 항암 효능을 향상시킬 수 있을 것으로 기대됩니다.
마우스 대장암 모델에서 면역증강제 L-pampo®를 종양 내 투여하여 종양세포 사멸과 종양내 미세환경을 고면역원성으로 리모델링 할 수 있음을 확인하였습니다. 이러한 결과를 바탕으로 산업통상자원부 바이오산업핵심기술개발사업 중 면역치료제 효과 증대 목적 병용투여요법 최적화 기술과 제품 개발분야에 과제가 선정되어 TLR 계열 면역증강제 L-pampo®를 이용한 면역항암제 개발을 가속화하고 있습니다.
 |
|
면역증강제 L-pampo®와 면역관문억제제 병용투여시 예상 효과 |
자료: HJ Chon et al., Clinical cancer research, 2018 모식도 그림 재가공
② 동물모델에서 면역증강제 L-pampo® 항암 효능 확인
당사의 면역증강제 L-pampo®를 단독 또는 면역관문억제제와 병용투여한 동물 실험 결과, 종양 성장을 억제하였으며 CD8+ T cell 증가와 Treg cell 감소가 관찰되었습니다. 이를 통해 종양 내 L-pampo®가 종양 미세환경을 고면역원성으로 리모델링하여 항암 면역반응을 유도하고 암세포를 사멸함을 확인하였습니다.
(3) 사업화 전략
당사는 독자 개발한 면역증강제 플랫폼을 활용하여 미충족 수요가 높은 감염성 질환 및 항암 분야에 대한 치료 및 예방백신 파이프라인을 개발하고 있으며, 개별 백신 파이프라인에 대한 기술이전뿐만 아니라 면역증강제 복합 신약 공동 개발 등 유연한 방식으로 기술 사업화를 계획하고 있습니다.
당사의 파이프라인 중 가장 앞선, 2b상 임상시험 단계의 만성 B형 간염 치료백신 CVI-HBV-002은 만성 B형 간염 환자에서 기능적 완치(functional cure: HBsAg의 seroclearance)라는 최종 치료 목적을 달성하기 위한 병용치료 타겟으로 높은 잠재력을 갖고 있습니다. 따라서 항바이러스 신약이나 면역치료제를 개발하는 글로벌 제약사 및 바이오텍과 기술이전 또는 공동 연구개발 논의를 활발히 진행하고 있습니다.
 |
|
만성 B형 간염 치료백신 사업화 전략 |
시판 중인 기존 대상포진 예방백신의 임상 결과 및 당사의 비임상 효력 시험 결과를 기반으로 당사의 두번째 주력 파이프라인인 대상포진 백신 CVI-VZV-001이 대상포진을 예방하고 포진후 신경통(Postherpetic Neuralgia; PHN)으로 진전을 막는 강력한 잠재력을 가질 것으로 판단되고 있습니다. 이를 바탕으로 효과적인 면역증강제를 통해 낮은 효과를 개선하고자 하는 약독화 백신을 가진 글로벌 제약사와, 재조합 백신의 심각한 통증 부작용을 줄이고 효과 및 안전성이 개선된 예방백신을 개발하고자 하는 글로벌 제약사와 기술이전 또는 공동 연구개발 논의를 활발히 진행하고 있습니다.
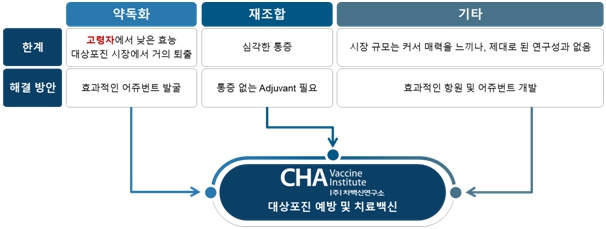 |
|
대상포진 백신 사업화 전략 |
(4) ㈜차백신연구소 경쟁력
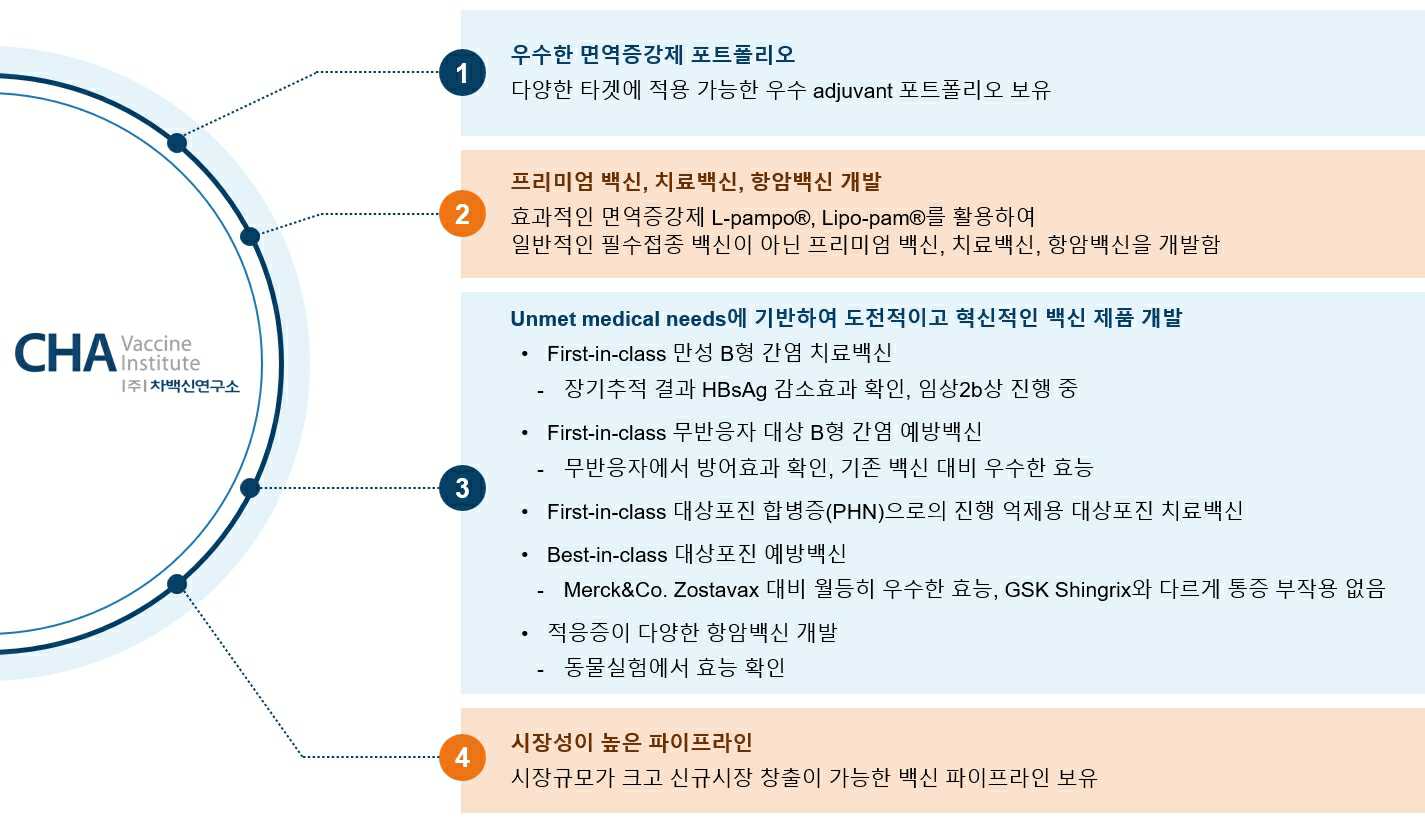 |
|
차백신연구소 경쟁력 |
당사가 자체 개발한 효과적인 면역증강제 L-pampo®, 리포좀 형태의 면역증강제 Lipo-pam®은 백신 타겟에 따라 요구되는 효과적인 면역반응(예를 들면 체액성 또는 세포성 면역반응으로 조절)을 유도할 수 있으며, 백신 항원에 따라 필요한 경우 운반체 역할도 할 수 있어 다양한 백신에 적용이 가능합니다. 당사는 우수한 면역증강제 플랫폼을 기반으로 일반적인 필수접종 백신이 아닌 프리미엄 백신, 예방이 아닌 질병을 치료를 목적으로 하는 치료백신, 난치성 암을 치료하는 항암백신을 개발하고 있습니다.
당사는 아직 허가된 제품이 없는 만성 B형 간염 치료백신을 개발하고 있으며, 임상에서의 장기추적을 통해 HBsAg 감소 효과가 확인되었고 현재 임상시험 2b상 진행 중에 있습니다. 기존 2세대 B형 간염 예방백신은 접종 횟수가 많고 기간이 길고 고위험군 및 무반응자에게서 방어효과가 유도되지 않는 한계가 있으며, 이를 극복하는 B형 간염 예방백신을 개발하고 임상시험 1상 진행 중에 있습니다. 대상포진 합병증인 PHN으로 진전을 억제하는 대상포진 치료백신과 향상된 효능과 통증 부작용이 없는 대상포진 예방백신을 개발하고 있습니다. 이와 같이 unmet medical needs을 충족시키는 도전적이고 혁신적인 first-in-class, best-in-class 백신 제품을 개발하고 있습니다.
또한 개발중인 백신 파이프라인은 시장규모가 크고 신규시장 창출이 가능하므로 시장성에서도 경쟁력을 갖추고 있습니다.
다. 경쟁 현황
(1) 만성 B형 간염 치료백신
(가) 만성 B형 간염 치료제 기전 및 개발 동향
현재 만성 B형 간염의 표준치료제인 Entecavir, Tenofovir disoproxil fumarate, Tenofovir alafenamide, Besifovir 등은 핵산유도체(nucleot(s)ide analog)로서 B형 간염 바이러스의 pregenomic RNA가 DNA로 전환되는 과정에 작용하여 정상적인 DNA가 만들어지는 것을 방해하는 reverse transcriptase inhibitor입니다.
하지만 현재 사용중인 항바이러스제 치료는 완치가 어려워 최근에는 새로운 기전의 항바이러스제가 개발되고 있으며, 다른 한편으로는 환자들의 약화된 면역세포들을 활성화시켜 HBsAg의 감소를 이끄는 전략의 면역치료제들이 개발되고 있습니다. 현재 개발중인 항바이러스제의 종류로는 바이러스의 mRNA와 결합하여 작은 단위로 분해하여 단백질 합성을 저해하는 RNA interference와 유전 물질을 감싸는 capsid를 정상적으로 만들지 못하게 하는 capsid inhibitor 등이 있습니다.
또한 개발중인 면역치료제로는 사이토카인, 선천면역(innate immunity)을 활성화하는 Toll-like receptor 리간드 등과 항원을 투여하여 적응면역(adaptive immunity)을 조절하는 치료백신 등이 있습니다.
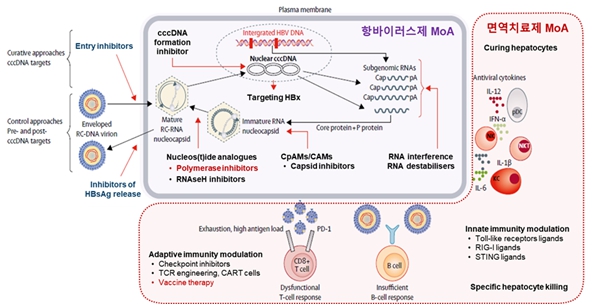 |
|
만성 B형 간염 치료제의 기전 |
(나) 만성 B형 간염 치료백신 개발의 필요성
기존 항바이러스제의 치료 한계와 만성 B형 간염 환자에서 B형 간염 바이러스 특이적 T세포 활성이 낮아져 있어 바이러스 수치가 다시 증가하는 리바운드 문제를 해결하기 위해 최근 만성 B형 간염 치료를 위한 면역치료제 개발이 활발하게 이루어지고 있습니다.
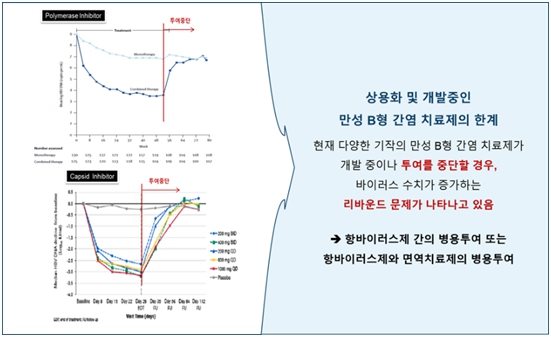 |
|
상용화 및 개발중인 만성 B형 간염치료제의 한계 (리바운드 현상) |
자료: Dr. Harry LA Janssen et al., Lancet 2005; 365: 123-29
당사가 개발하고 있는 치료백신 CVI-HBV-002는 면역원성이 우수한 L-HBsAg과 강력한 면역증강제를 함께 투여해 줌으로써 환자들의 면역관용을 해소하고, T세포를 활성화하여 B형 간염 바이러스에 대한 적응면역을 유도하고 이를 통하여 바이러스를 제거하는 것을 목표로 합니다.
(다) 만성 B형 간염 치료백신 경쟁 현황
만성 B형 간염 치료백신은 아직 허가된 제품이 없으며, 당사의 CVI-HBV-002는 2b상 임상시험 진행 중으로 개발단계에서 앞서 있습니다. Altimmune과 Tasly에서 2상 임상시험, Brii Bioscience에서 1b/2a상 임상시험, GSK, Vaccitech, AiCuris, Inovio 등에서 임상 1상을 진행중이나 대부분의 치료백신들은 낮은 유효성으로 인해 진행이 미진한 상황입니다
(2) B형 간염 예방백신
(가) 전통적인 B형 간염 예방백신
대표적인 B형 간염 예방백신인 GSK의 Engerix-B는 2세대 재조합 항원 (HBsAg)과면역증강제 alum으로 구성되어 있습니다. Engerix-B를 포함한 대부분의 B형 간염 예방백신은 첫 접종, 1개월 후 두 번째 접종, 5개월 후 마지막 접종하는 일정(0, 1, 6월)으로 총 3회 접종하여야 방어효과가 유도됩니다. 6개월에 걸친 3회 접종은 접종횟수가 많고, 접종 기간이 길기 때문에 3차 접종까지 완료하지 못하는 경우가 발생하여 백신의 편의성이 낮은 편입니다.
[해외 대표적인 B형 간염 예방백신]
|
Conventional Recombinant Vaccine |
||
|---|---|---|
|
Product (개발사) |
Engerix-B (GSK) |
Recombivax HB (Merck & Co.) |
|
Antigen |
HBsAg |
HBsAg |
|
Adjuvant |
Alum (Aluminum hydroxide) |
Alum (Aluminum hydroxyphosphate sulfate) |
|
허가년도 |
1989(US) |
1986(US) |
|
허가대상 |
소아, 성인 |
소아, 성인 |
|
용법 용량 |
*소아~19세: 10μg/dose*3회(0, 1개월, 6개월) *20세 이상: 20μg/dose*3회(0, 1개월, 6개월) *4회(0, m1, m2, m6): 투석 환자 |
*소아~19세: 5μg/dose*3회(0, 1개월, 6개월) *20세 이상: 10μg/dose*3회(0, 1개월, 6개월) |
국내는 신생아 예방접종 사업을 실시함에 따라 해마다 영유아의 97% 이상이 B형 간염 예방접종을 완료하고 있습니다. 2013년 기준, 국내 B형 간염 예방백신 시장점유율은 헤파박스가 60%, 유박스비주가 30%, 헤파뮨주가 10%를 보였습니다. 2021년 현재 국내 기업이 허가 받은 B형 간염 예방백신은 SK바이오사이언스의 헤파뮨주, ㈜LG화학의 유박스비주 밖에 없습니다. 국내 제품 역시 2세대 재조합 항원 (HBsAg)과 alum을 포함한 2세대 재조합 백신으로 성인의 경우 20μg/dose, 신생아 및 유, 소아의 경우 10μg/dose로 총 3회(0, 1, 6월)에 걸쳐 접종을 완료합니다.
[국내 B형 간염 예방백신]
|
Conventional Recombinant Vaccine |
|||
|---|---|---|---|
|
Product |
Euvax-B |
Hepamune (SK Bioscience) |
Hepamune Prefilled Syringe |
|
Antigen |
HBsAg |
||
|
Adjuvant |
Alum |
||
|
허가년도 |
1995(국내) |
1998(국내) |
2012(국내) |
|
허가대상 |
신생아 및 유·소아 성인 |
성인 |
|
|
용법 용량 |
성인: 20μg/dose*3회(0, 1개월, 6개월) |
20μg/dose*3회(0, 1개월, 6개월) |
|
(나) 효능이 개선된 B형 간염 예방백신
백신항원의 면역원성을 개선한 사례로 VBI의 Sci-B-Vac이 있습니다. preS 항원이 포함된 3세대 재조합 항원과 기존 면역증강제인 alum을 포함하고 있으며, 접종횟수는 3회로 개선되지 않았습니다. 임상시험을 통해 고위험군에서 기존 2세대 예방백신 대비 방어효과를 높게 유도함이 확인되었습니다.
면역증강제를 사용하여 백신 효능을 개선한 사례로 GSK의 Fendrix와 Dynavax의 Heplisav-B가 있습니다. 2005년 유럽에서 승인받은 Fendrix는 기존 2세대 항원에 신규 면역증강제 AS04(MPL+alum)를 포함하는 개량형 B형 간염 예방백신으로, 15세 이상 신장질환자(혈액 투석환자)용으로 허가 받았습니다. 2017년 미국에서 허가 받은 Heplisav-B는 기존 2세대 항원에 신규 면역증강제 CpG ODN을 사용하여 2회 접종만으로 방어효과를 올릴 수 있는 성인용 백신입니다. Fendrix가 고위험군에서만 허가를 받은 반면에 Heplisav-B는 일반 성인용 백신으로 허가를 받았습니다. 따라서 Heplisav-B의 2018년 매출 US$3.6 million에서 2019년 매출 US$34.6 million로 성장세를 보이는 등 향후 시장점유율이 높아질 것으로 예상됩니다.
자체 개발한 3세대 항원 L-HBsAg과 면역증강제 L-pampo®를 포함하는 CVI-HBV-002는 면역원성을 개선하고 효능을 높여 성인용 2도스 백신 및 무반응자용 백신으로 개발되고 있습니다. 3세대 항원 L-HBsAg과 면역증강제 alum을 포함하는 CVI-HBV-001은 안전하고 효능이 높은 영유아 및 성인용 백신으로 개발하고 있습니다.
 |
|
효능이 개선된 B형 간염 예방백신 |
(3) 대상포진 백신
당사의 CVI-VZV-001는 재조합 단백질 항원과 강력한 면역증강제 Lipo-pam®로 구성되어 안전성 및 면역원성이 개선되고 우수한 효능을 보이는 재조합 백신으로 개발하고 있습니다.
 |
|
허가된 대상포진 예방백신 |
(가) 약독화 생백신
약독화 생백신은 병원체의 병원성을 반복 계대 배양이나 다른 처리로 약화시키고 면역원성만 지니게 한 백신으로 수두백신과 동일한 바이러스주인 VZV Oka strain을 고농도로 포함합니다. 약독화 생백신의 생산을 위해서는 바이러스의 활성을 유지한 상태로 고농도 바이러스를 제조해야 하므로 단순 농축 공정이 아닌 고농도 배양 공정이 요구되며, 이러한 생산 과정의 어려움 때문에 원활한 제품의 생산 및 공급에 어려움이 있습니다. 또한, 살아있는 바이러스가 포함된 생백신이기 때문에 일부 제한적으로 사용될 수 있습니다.
상용화된 제품은 2006년 승인된 Zostavax (Merck & Co.)와 2017년 말 국내에서 허가 받은 SK바이오사이언스의 Skyzoster가 있습니다.
(나) 재조합 백신
약독화 생백신은 백신효능이 전반적으로 충분하지 못하고, 특히 고령자에서 효능이 거의 없을 뿐 아니라 투여 대상에 제약이 있다는 점에서 안전성과 면역원성이 개선된 새로운 형태의 백신 개발이 필요합니다. 이러한 대안의 하나인 재조합 백신은 바이러스의 일부를 유전자 재조합 기술로 생산한 항원과 면역증강제를 사용함으로써 약독화 생백신 대비 안전성 및 면역원성의 개선이 가능합니다. 특히, 세포성 면역반응을 더욱 증가시킬 수 있는 면역증강제를 사용함으로써 생백신보다 우수한 효능이 기대됩니다.
상용화된 제품은 2017년 승인된 GSK의 Shingrix가 있으며, Shingrix는 재조합 gE항원과 세포성 면역반응을 유도할 수 있는 면역증강제 AS01을 사용함으로써 Zostavax에 비해 효능이 우수함이 입증되었습니다.
[Shingrix(GSK)의 특성 및 효과]
Shingrix는 수두-대상포진 바이러스의 표면항원 중 하나인 당단백질 glycoprotein E (gE)의 일부를 동물세포에서 발현한 재조합 gE 항원과 면역증강제 AS01을 포함한 재조합 대상포진 백신입니다. 2017년 10월에 미국과 캐나다에서 50세 이상 성인들의 대상포진을 예방하는 용도로 허가를 취득하였고, 이와 함께, EU(2018), 호주(2018) 및 일본(2018), 중국(2019, 조건부허가)에서 허가 받았습니다.
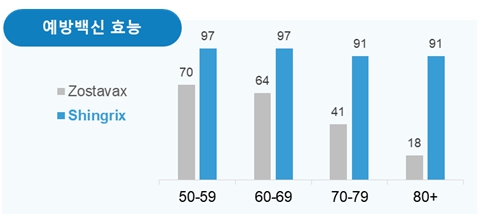
Shingrix는 2015년 발표된 임상시험 결과에서 50~59세에서 대상포진의 발병위험을 96.6% 감소시킨다고 보고되었으며, 15,000명 이상의 대규모 임상시험을 통해 60~69세에서는 97.4%, 70세 이상에서는 91.3%, 80세 이상에서 91.4%의 방어효과를 보여 모든 연령에서 고르게 백신효능이 있음이 보고되었습니다. 또한, '포진 후 신경통 (PHN)'에 대해서도 50세 이상에서 91.2%, 70대 이상에서 88.8%의 예방효과가 있음이 보고되었습니다.
 |
|
연령별 Shingrix의 백신 효능 |
자료: Cunningham ALet al., N Engl J Med. 2016;375(11):1019-1032
또한, 살아있는 바이러스가 아닌 재조합 단백질을 항원으로 사용하기 때문에 약독화 생백신과는 달리 면역력이 크게 약화된 환자에도 사용이 가능함을 여러 임상시험을 통해 확인하였습니다.
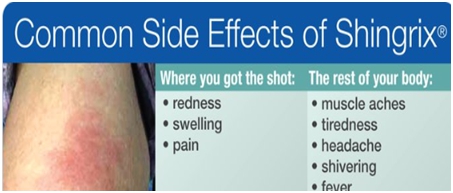
[Shingrix(GSK)의 한계점]
Shingrix는 우수한 효과에도 불구하고, 면역증강제 AS01에 포함되어 있는 면역증강물질 QS21로 인하여 접종 후 심한 통증 및 Flu-like symptom을 유발하는 문제가 있는 것으로 알려져 있습니다. 미국 CDC 바이러스성 질병 부서(Division of Viral Disease)의 의료 책임자인 Dr. Kathleen Dooling는 Shingrix가 신규 면역증강제(AS01)의 사용에 따른 발열 및 근육통 등의 증상으로 인해 투여 후 1-2일간 일상생활이 어려울 수 있음을 경고하였습니다.
 |
|
Shingrix의 극심한 부작용 |
자료: 미국 질병관리본부 CDC (Centers for Disease Control and Prevention)
2. 주요 제품 및 서비스
가. 주요 제품 및 서비스 관련 매출
| (기준일 : 2024년 09월 30일) | (단위: 천원) |
| 구분 | 명칭 | 사용용도 | 매출액 | 비율 |
|---|---|---|---|---|
|
제품매출 |
Enzyme (G6PDH)수출 |
연구용 시약 |
370,658 | 100.00 |
나. 주요파이프라인에 관한 사항
당사는 면역원성이 개선된 항원과 자체 개발한 면역증강제 플랫폼 기술로 구성된 First-in-Class 또는 Best-in-Class 백신 신약을 개발하고 있으며 항암 치료분야로 확장하여 당사 면역증강제를 적용한 펩타이드 항암 치료백신과 항암 면역치료제도 개발을 하고 있습니다.
각 파이프라인별 초기 임상을 진행하여 우수한 임상 결과를 통해 글로벌 제약사와 기술이전을 진행할 계획입니다.
[㈜차백신연구소 플랫폼 경쟁력 및 개발단계]
|
플랫폼 |
경쟁력 |
개발단계 |
|---|---|---|
|
Adjuvant |
- 자체 개발한 고유 플랫폼 기술 확보 - 다른 면역증강제 대비 우수한 효능 - 다양한 개발타겟에 적용할 수 있는 확장성 |
L-pampo®과 Lipo-pam® 개발완료 개량된 면역증강제 개발중 |
[㈜차백신연구소 주요 파이프라인 경쟁력 및 개발단계]
|
파이프라인 |
경쟁력 |
개발단계 |
|---|---|---|
|
만성 B형 간염 치료백신 |
- First-in-class 바이오 신약으로 경쟁제품 대비 앞선 개발 단계의 경쟁우위 보유 - 동물모델에서 완치 가능성 확인 - 임상시험 1/2a상에서 경쟁제품 대비 우수한 효능 확인 - 임상시험 1/2a상 완료 후 진행된 장기추적결과, 99%이상 항원 감소 결과 확인 |
2b상 임상시험 진행 중 |
|
B형 간염 예방백신 |
- 면역증강제alum과 L-pampo®를 각각 포함한 2가지 제형으로 개발하여 백신 대상군이 넓음 - 효능 및 편의성 개선 (2회 접종 백신) - 무반응자군에서 방어효과 유도 확인 |
- CVI-HBV-001: 1/2a상 임상시험 완료 - CVI-HBV-002: 1상 임상시험 완료 |
|
재조합 대상포진 백신 |
- 상용 백신 대비 경쟁력: 효능 및 안정성에서 우월 |
1상 임상시험 진행 중 |
다. 주요 제품 등의 가격변동 추이
당사는 본 보고서 작성 기준일 현재 연구개발 및 임상을 진행중인 회사로 생산 및 판매하고 있는 제품이 없어 가격변동 추이를 기재하지 않았습니다.
다만 당사가 개발중인 백신은 필수접종 백신이 아닌 프리미엄 백신으로 가격결정에 있어 고가정책이 가능합니다. 항원 및 면역증강제의 생산 원가는 판매가격의 작은 부분을 차지하므로 수익성은 매우 높을 것으로 예상됩니다.
3. 원재료 및 생산설비
가. 원재료에 관한 사항
(1) 주요 원재료 매입 현황
당사의 주요 영업활동은 백신 연구개발로서 제품 제조를 위한 별도의 원재료에 대한 매입은 없습니다. 다만 연구개발 단계에 필요한 연구용 시약 등 제조를 위한 원재료의 매입 활동은 있습니다. 연도별로 연구용 시약 제조에 사용된 원재료는 다음과 같습니다.
| (단위 : 천원) |
|
매입유형 |
품 목 |
구 분 |
2024년 3분기 (제25기) |
2023년도 (제24기) |
2022년도 (제23기) |
비고 |
|---|---|---|---|---|---|---|
|
소모품/시약 |
연구용 시약 및 소모품 |
국 내 |
314,036 | 1,225,680 | 1,092,518 |
- |
|
수 입 |
- | - | - |
- |
||
|
합 계 |
314,036 | 1,225,680 | 1,092,518 |
- |
(2) 주요 원재료의 제품별 비중
당사는 자체 보유 면역증강기술을 기반으로 만성질환의 치료백신, 프리미엄 백신, 항암백신, 면역치료제를 개발하고 공동연구 또는 기술이전을 사업화 모델로 하고 있어 제품 제조를 위한 원재료의 비중은 해당사항이 없습니다.
(3) 주요 원재료 가격변동추이
당사는 연구개발 목적 및 단계에 따라 연구용 시약 및 소모품 등을 구매하기 때문에 원재료 가격변동 추이 산정에 어려움이 있습니다. 다만, 연구용 시약 및 소모품, 임상용 의약품 등의 특성상 가격변동폭이 크지는 않습니다.
(4) 주요 매입처에 관한 사항
| (단위 : 천원) |
|
품 목 |
구 입 처 |
2024년 3분기 (제25기) |
2023년도 (제24기) |
2022년도 (제23기) |
결제조건 |
|
|---|---|---|---|---|---|---|
|
연구용 시약 및 소모품 |
국내 |
엘바이오㈜ |
314,036 | 1,225,680 | 1,092,518 |
현금/익월 |
※ 연구용 시약 및 소모품비용은 손익계산서의 경상연구개발비(정부보조금 수취분 차감)로 분류하고 있습니다.
나. 생산설비에 관한 사항
당사의 주요 영업활동은 신약연구개발로서 제품 제조를 위한 별도의 생산 및 생산설비에 관한 해당사항이 없습니다.
현재 당사는 원료 및 임상용의약품의 제조/위수탁 업무를 GMP인증 CMO기업인 ㈜팬젠 및 ㈜한국백신 등에 의뢰하여 생산하고 있으며, 이들 업체와 전략적 파트너쉽 관계를 형성하고 있습니다.
(1) 주요 사업장 현황
| 구분 | 소재지 |
|---|---|
| 본점 및 연구소 | 경기도 성남시 중원구 둔촌대로 560, 406호, 407호 (상대원동, 벽산테크노피아) |
(2) 주요 시설 및 설비 현황
| (단위 : 천원) |
| 구 분 | 토지 | 건물 | 기계장치 | 기계장치 (보조금) |
비품 | 시설장치 | 사용권자산 (부동산) |
사용권자산 (차량운반구) |
합 계 |
|---|---|---|---|---|---|---|---|---|---|
| 당기초 |
95,089 |
187,078 |
922,508 |
(33,262) |
73,995 |
47,879 |
332,059 |
18,833 |
1,644,179 |
| 취득 | 173,700 | 5,511 | 179,211 | ||||||
| 감가상각 등 | (7,550) | (242,463) | 5,252 | (20,049) | (7,036) | (124,522) | (5,845) | (402,213) | |
| 당기말 | 95,089 | 179,528 | 853,745 | (28,011) | 59,458 | 40,843 | 207,537 | 12,988 | 1,421,177 |
(3) 시설 및 설비 투자계획
당사는 신약개발을 하는 전문 기업으로서 대량 생산을 위한 특별한 설비를 필요로 하지 않아, 본 보고서 작성 기준일 현재 진행 중인 설비 투자 및 향후 1년 이내에 투자를 개시하기로 결정한 사항이 없습니다.
4. 매출 및 수주상황
가. 매출실적
| (단위 : 천원) |
| 사업부문 | 매출유형 | 품목 | 2024년 3분기 (제25기) |
2023년도 (제24기) |
2022년도 (제23기) |
|
|---|---|---|---|---|---|---|
| 공통부문 |
연구용 시약 |
Enzyme (G6PDH)수출 |
내수 | - | - | - |
| 수출 | 370,658 | 294,124 |
179,485 |
|||
| 합계 | 370,658 | 294,124 |
179,485 |
|||
나. 매출원가
| (단위 : 천원) |
| 매출유형 | 품목 | 2024년 3분기 (제25기) |
2023년도 (제24기) |
2022년도 (제23기) |
|||
|---|---|---|---|---|---|---|---|
| 금액 | 원가율 | 금액 | 원가율 | 금액 | 원가율 | ||
|
연구용 시약 |
Enzyme (G6PDH)수출 |
23,927 | 6.46% | 34,503 | 11.73% | 18,995 | 10.58% |
다. 수출 현황
| (단위 : 천원) |
|
매출유형 |
품 목 |
2024년 3분기 (제25기) |
2023년도 (제24기) |
2022년도 (제23기) |
|||
|---|---|---|---|---|---|---|---|
|
수출국 |
수출액 |
수출국 |
수출액 |
수출국 |
수출액 |
||
|
연구용 시약 |
Enzyme (G6PDH) |
미국 | 370,658 |
미국 |
294,124 |
미국 |
179,485 |
라. 주요 매출처 등 현황
| (단위 : 천원) |
|
매출유형 |
품 목 |
매 출 처 |
2024년 3분기 (제25기) |
2023년도 (제24기) |
2022년도 (제23기) |
|||
|---|---|---|---|---|---|---|---|---|
| 금액 | 비중 | 금액 | 비중 | 금액 | 비중 | |||
| 연구용 시약 |
Enzyme(G6PDH) |
ARK Inc. |
370,658 |
100.00% |
294,124 |
100.00% |
179,485 |
100.00% |
마. 판매경로
당사는 국내 및 해외기관과의 공동임상 및 사업화 파트너링을 통해 전세계를 대상으로 사업화를 추진하고 있습니다. 현재 개발제품을 국내 및 해외시장에서 직접 판매하기 보다는 제품에 대한 기술이전을 통해 파트너사가 임상 개발 및 허가를 진행하여 시장에 진출하는 전략을 취하고 있습니다.
당사는 사내 기술이전 전담부서인 BD실을 운영하고 있으며, 차바이오그룹의 종합연구원과 차백신연구소의 R&D기획실과의 협력을 통해 기술이전 관련 업무를 진행하고 있습니다. 당사의 BD실은 주요 학회 및 파트너링 컨퍼런스 등을 통해 임상/허가/상업화 역량이 있는 글로벌 제약사와의 파트너링 추진 및 당사의 파이프라인에 대한 홍보를 활발히 하고 있습니다.
매출은 모두 각 파이프라인별 기술이전에 따른 업프론트, 마일스톤, 로열티 등으로 구성됩니다.
아래는 잠재고객 다양성 확보를 위한 당사의 활동 내역입니다.
당사는 글로벌 백신 및 mRNA 학회(World Vaccine Congress Washington, World Vaccine Congress Europe, Annual International Congress of Vaccine, Immunization & Vaccine Summit, InnoVax Forum, World Vaccine & Immunotherapy Congress West Coast, International mRNA Health Conference, TIDES USA 등) 및 파트너링 컨퍼런스(BIO, BIO Partnering at JPM, Bio-Europe, Bio-Europe Spring, ChinaBio, Bio Korea 등)에 참가하여 연사, 포스터 발표 또는 파트너링 미팅을 통해 당사 연구를 소개하며 다양한 잠재고객을 확보하고 있습니다.
바. 수주상황
당사는 애스톤사이언스에 HSP-90 특정 epitope 기반 암 치료 백신의 면역증강제로써 L-pampo® 개발 및 상업화 권리에 대한 기술이전 계약을 체결하였습니다. 본 건 기술이전 계약은 계약금, 임상 단계 별 마일스톤, 로열티 매출 등 총 약 2,031억원 규모입니다.
5. 위험관리 및 파생거래
가. 시장위험과 위험관리
당사는 금리위험, 가격위험, 환위험 등 다양한 시장위험에 노출되어 있습니다. 당사는 이러한 위험요소들을 관리하기 위하여 각각의 위험요인에 대해 면밀하게 모니터링하고 대응하는 위험관리 정책을 운용하고 있습니다. 이에 대한 자세한 사항은 III. 재무에 관한 사항 - 5. 재무제표 주석을 참조하시기 바랍니다.
나. 파생상품 및 풋백옵션 등 거래 현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
6. 주요계약 및 연구개발활동
가. 경영상의 주요계약
(1) 라이센스아웃(License-out) 계약
본 보고서 작성 기준일 현재 당사가 체결 중인 라이센스아웃(License-out) 계약의 현황은 다음과 같습니다.
[라이센스아웃 계약 총괄표]
| (단위 : 백만원) |
| 품 목 | 계약상대방 | 대상지역 | 계약체결일 | 계약종료일 | 총계약금액 | 수취금액 | 진행단계 |
|---|---|---|---|---|---|---|---|
| L-pampo® | Aston Science (애스톤사이언스) |
글로벌 | 2021년 02월 26일 | 계약제품의 신규특허 만료일 | 203,100 | 500 | 계약체결후 개발 진행중 |
(가) 품목 : 면역증강제 L-pampo®
| 1. 계약상대방 |
(주)애스톤사이언스 (Aston Sci. Inc) (한국) |
| 2. 계약내용 |
애스톤사이언스가 독성시험 및 임상을 수행하며 상업화를 하는데 필요한 면역증강제를 당사가 독점으로 공급 |
| 3. 대상지역 |
전세계 |
| 4. 계약기간 |
계약체결일: 2021.02.26 |
| 5. 총계약금액 |
2,031억원 규모 |
| 6. 수취금액 |
<반환의무 없는 금액> |
| 7. 계약조건 |
계약금(Upfront Payment): 25억원 - 임상 1상/임상 2상 시험용 면역증강제 제공시(20억원) 개발 마일스톤(Milestone): 35억원 - 임상 3상 시험용 면역증강제 제공시(30억원)
이익의 공유: 임상 3상 시험 진입 전 Aston이 계약 제품을 양도하는 경우 - Aston이 양수인으로부터 수취하는 금액(계약금, 마일스톤, 로열티 등 포함)의 20%
Aston이 임상 3상 시험을 수행한 경우 - 국내 품목 허가시(20억) - 해외 품목 허가시(100억) - Aston이 해외 판권을 L/O 시(Aston이 수취하는 Upfront의 20%, 최대 400억원) ▶ Aston이 L/O 후 수취하는 Net Royalty의 7.5% ▶ Aston의 누적 Royalty 1,000억 달성 시(100억원) ▶ Aston의 누적 Royalty 5,000억 달성 시(300억원) |
| 8. 회계처리방법 |
계약금(Upfront)는 수령 후 즉시 수익 인식 |
| 9. 대상기술 |
자체 개발한 면역증강제 L-pampo® (애스톤사이언스가 개발한 AST-021p 및 AST-023을 포함한 HSP 90의 항원에 한함) |
| 10. 개발진행경과 |
<거래상대방> - 당사의 면역증강제 L-pampo®와 애스톤사이언스의 AST-021p의 병합요법 임상(임상 1/2상)을 위한 전임상 연구 종료 (L-pampo® + AST-021p) (애스톤사이언스-고려대 공동연구) - 병합요법 임상을 위한 GLP 독성연구를 위한 formulation 연구 진행 중 (차백신연구소 주도) - 현재 애스톤사이언스는 AST-021p의 단독 요법으로 임상 1상을 진행 중 <회사> - 당사는 본 계약과 관련하여 진행하고 있는 임상시험 없음(단, 만성B형 간염 치료백신, B형간염 예방백신에 대한 임상시험을 별도로 진행 중이며, 세부 내용은 [라.연구개발실적]을 참조) |
| 11. 기타사항 | - |
(2) 라이센스인(License-in) 계약
- 해당사항 없음
(3) 기술제휴계약
- 해당사항 없음
(4) 판매계약
- 해당사항 없음
(5) 기타계약
|
품 목 |
계약상대방 |
계약목적 |
계약체결일 |
계약종료일 |
계약금액 |
수수(지급)방법 |
진행경과 등 비고 |
|---|---|---|---|---|---|---|---|
|
위탁생산 |
Bachem Japan K.K. |
면역증강제 원료의약품 위탁생산 |
2021.12.23 |
5년 |
- |
계약상 지급 조건 |
진행중 |
| 위탁생산 | ㈜팬젠 | 원료의약품 위탁생산 | 2023.01.11 | 1년 | - | 계약상 지급 조건 | 완료 |
| 위탁생산 |
동물세포실증지원센터 |
면역항암제 위탁 생산(전임상) |
2023.12.19 |
5년 |
- |
계약상 지급 조건 |
진행중 |
| 위탁생산 |
Biosynth GmbH |
면역증강제 원료의약품 위탁생산 |
2023.12.20 |
완료일 |
- |
계약상 지급 조건 |
진행중 |
| 위탁시험 | ㈜몰림 | 면역증강제 분포 확인시험 | 2024.08.19 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 업무협력 | ㈜에스티팜 | mRNA 치료제 개발을 위한 업무협력 | 2024.05.28 | 완료일 | - | 계약상 지급 조건 | 진행중 |
| 임상시험 |
중앙대병원 |
B형간염 치료백신 2b 상 임상시험 |
2019.12.26 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 임상시험 |
서울대학교병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.01.03 |
완료일 | - | 계약상 지급 조건 | 진행중 |
| 임상시험 |
서울아산병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.01.03 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 임상시험 |
고려대학교구로병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.01.21 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 임상시험 |
연세대학교세브란스병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.01.23 |
완료일 | - | 계약상 지급 조건 | 진행중 |
| 임상시험 |
분당차병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.01.29 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 임상시험 |
순천향대병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.01.31 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 임상시험 |
삼성서울병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.03.05 |
완료일 | - | 계약상 지급 조건 | 진행중 |
| 임상시험 |
은평성모병원 |
B형간염 치료백신 2b 상 임상시험 |
2020.03.10 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 임상시험 |
㈜서울CRO |
B형간염 치료백신 2b 임상시험 업무위탁 |
2019.05.09 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
| 임상시험 |
㈜메디트리 |
B형간염 치료백신 임상평가 검체 수거, 운송, 검사 |
2019.11.21 |
완료일 | - | 계약상 지급 조건 | 진행중 |
| 임상시험 |
클립스㈜ |
대상포진백신 1상 임상시험 업무위탁 |
2021.06.30 |
완료일 |
- | 계약상 지급 조건 | 진행중 |
|
임상시험 |
분당차병원 |
B형간염 예방백신 1상 임상시험 |
2021.07.30 |
2024.03.27 |
- |
계약상 지급 조건 |
완료 |
|
임상시험 |
㈜메디트리 |
대상포진 백신 임상평가 검체 수거, 운송, 검사 |
2022.06.30 |
완료일 |
- |
계약상 지급 조건 |
진행중 |
| 임상시험 | 은평성모병원 | 대상포진백신 1상 임상시험 | 2023.02.08 |
완료일 |
- |
계약상 지급 조건 |
진행중 |
| 임상시험 | 분당차병원 | 대상포진백신 1상 임상시험 | 2023.02.24 |
완료일 |
- |
계약상 지급 조건 |
진행중 |
※ 임상시험(임상기관, CRO)의 계약금액 등은 영업기밀에 해당되므로 계약 세부내용을 기재하지 않았습니다.
나. 연구개발활동
(1) 연구개발활동의 개요
당사는 독자적으로 개발한 면역증강 플랫폼 기술을 바탕으로 프리미엄 예방백신, 치료백신 및 면역치료제를 연구개발하고 있으며 성공적인 상용화를 위한 노력을 기울이고 있습니다.
(2) 연구개발 담당조직
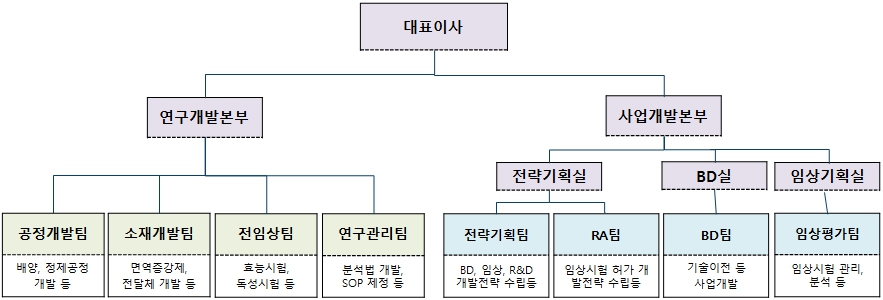
(가) 연구개발 조직 개요
당사의 R&D연구소 산하 연구개발 담당 조직은 총 4개팀(공정개발팀, 소재개발팀, 전임상팀, 연구관리팀)으로 구성되어 있으며, 별도로 사업개발본부(전략기획팀, RA팀, BD팀, 임상기획팀)을 운영하고 있습니다.
[연구개발 조직 구성]
| 연구소 |
팀 |
주요 업무 |
|---|---|---|
|
연구개발본부 |
공정개발팀 |
상업화를 위한 scale-up연구 - 세포주 개발 - 배양공정 개발 - 정제공정 개발 - 공정 관련 분석법 개발 GMP 생산 및 상업화를 위한 manufacturing science 등 |
|
소재개발팀 |
면역증강제 개발 및 분석 - 신규 면역증강물질 개발 - 면역증강제 제형 개발 - 면역증강제 제형의 분석법 개발 등 |
|
|
전임상팀 |
면역증강제, 백신, 면역항암치료제의 기전연구 in vitro 및 동물에서의 효능시험 면역증강제 및 임상 진입 의약품의 비임상독성시험 디자인 비임상 효능 및 독성 시험결과 검토 비임상시험 담당 협력업체의 일정 관리 등 |
|
|
연구관리팀 |
외부 협력기관 관리(기관선정, 계약 등), 장비 및 원자재 등의 구매 및 관리 각종 효능 분석 시험법 개발, 시험법의 검증 및 SOP 제정 정부과제 신청 및 관리, Data integrity 등 |
|
| 사업개발본부 | 전략기획팀 | 임상 및 R&D 과제 개발 전략수립 내외부 시장 및 트렌드 분석을 통한 신사업 개발 등 |
| RA팀 | 의약품 임상시험 및 허가를 위한 개발 전략 수립 개발 프로젝트 진행 및 일정 관리 국내외 규제 모니터링 및 대관업무 등 |
|
|
BD팀 |
시장 및 경쟁 분석(Market Intelligence) 국내외 공동연구 및 라이센스 아웃 파트너 발굴 글로벌 학회 및 파트너링 컨퍼런스 참가 및 파트너 발굴 회사 홍보 및 기술실사(Due Diligence) 업무 관리 등 |
|
|
임상평가팀 |
경쟁제품 관련 임상개발 학술 조사 임상개발 기획 및 계획 수립 임상연구 안전 및 품질 관리 임상 데이터 관리 및 통계 임상 연구 예산 관리 및 집행 제품 허가신청 및 식약처 대응 등 |
[연구개발 조직도]
 |
|
연구개발 조직도 |
(나) 연구개발 인력 현황
본 보고서 작성 기준일 현재 당사는 박사급 9명, 석사급 25명 등 총 37명의 연구 인력을 보유하고 있으며 그 현황은 다음과 같습니다.
[연구개발 인력 현황]
| 구분 |
박사 |
석사 |
학사 |
합계 |
|---|---|---|---|---|
| 연구개발본부 | 6 | 17 | 3 | 26 |
| 사업개발본부 | 3 | 8 | - | 11 |
| 합계 | 9 | 25 | 3 | 37 |
※ 대표이사 염정선은 연구개발본부에 포함하였습니다.
(다) 핵심 연구인력
당사의 핵심 연구인력은 염정선 대표이사를 비롯하여, R&D연구소장인 안병철 상무, 부연구소장인 전은영 상무 등입니다.
[핵심 연구인력 현황]
|
직위 |
성명 |
담당업무 |
주요경력, 학력 등 |
주요 연구실적 |
|---|---|---|---|---|
|
대표이사 |
염정선 |
경영 및 R&D 업무 총괄 |
[주요경력] 1992.06~1993.05 서울대 분자미생물학연구센터 연수연구원 [학력] 1985.02 서울대학교 미생물학 학사 1992.05 미. Syracuse Univ 분자생물학 박사 [기타] 2012.08~2014.07 식약처 중앙약사심의위원회 전문가위원 2013.11~현재 백신협의체 기업위원 2016.01~2016.12 면역학회 학술위원 |
- 재조합 항원개발 (만성 B형 간염 치료백신, B형 간염 예방백신, 대상포진 백신) - 헬리코박터 파이로리 백신 개발 - 학술 논문 16건 - 특허 출원/등록 58건 |
|
연구소 소장 |
안병철 상무 |
정부과제, 연구소 개발 프로젝트 및 |
[주요경력] 1997.04~2000.09 목암생명과학연구소 선임연구원 [학력] 1995.02 충북대학교 생화학 학사 1987.02 충북대학교 생화학 석사 2007.08 연세대학교 생물소재공학협동과 박사 |
- 재조합 항원 및 면역증강 플랫폼 개발 (만성 B형 간염 치료백신, B형 간염 예방백신, - 특허 출원/등록 52건 |
|
연구소 부소장 |
전은영 상무 |
프로젝트 별 면역학적 기전연구 및 |
[주요경력] 1996.12~2004.07 목암생명과학연구소 연구원 [학력] 1997.02 서울대학교 석사 생명과학 |
- Harvard Chan Research Scientist Association Award (2020) - Best Poster Award. Immunology and Infectious Diseases Retreat (2016) - 특허 출원/등록 1건 |
| 사업개발본부장 | 정시영 전무 |
사업개발 총괄 |
[주요경력] 1999.12~2005.06 한미약품 [학력] 1997.02 영남대학교 약학 학사 2012.02 영남대학교 약학대학 박사 |
- 다수의 신제품 및 제제연구를 통한 특허 획득 및 제품 출시 - 신약, Generic, 바이오 의약품, 의료기기등 다양한 분야의 임상시험 수행 - Global 진출 Project에 대한 Global RA 업무 추진 및 Global L/O 업무 수행 - Global deal을 통한 다양한 Global Business development 업무 수행 |
다. 연구개발비용
당사의 최근 3년간 연구개발비용은 다음과 같습니다.
당사는 일반적으로 신약 개발 프로젝트가 임상 3상부터 발생한 지출을 무형자산으로 인식하고, 이전 단계에서 발생한 지출은 당기비용으로 회계처리하고 있습니다.
[연구개발비용 현황 (별도재무제표 기준)]
| (단위 : 천원, %) |
|
구 분 |
제25기 3분기 | 제24기 | 제23기 |
비 고 |
|
|---|---|---|---|---|---|
|
비용의 성격별 분류 |
원재료비 |
635,486 |
1,519,262 |
1,533,802 |
- |
|
인건비 |
2,732,377 |
3,152,176 |
2,334,764 |
- | |
| 감가상각비 | - |
- |
- |
- | |
|
위탁용역비 |
1,306,637 |
1,341,056 |
1,731,066 |
- | |
|
기타 |
108,323 |
34,641 |
(22,706) |
- | |
|
연구개발비용 합계 |
4,782,824 |
6,047,135 |
5,576,926 |
- | |
| (정부보조금) | (738,002) |
(2,063,959) |
(1,702,577) |
- | |
| 보조금 차감 후 금액 | 4,044,822 |
3,983,176 |
3,874,348 |
- | |
|
회계처리 |
판매비와 관리비 | 4,020,895 |
3,948,673 |
3,855,353 |
- |
| 제조경비 | 23,927 |
34,503 |
18,995 |
- | |
| 개발비(무형자산) | - |
- |
- |
- | |
| 회계처리금액 계 | 4,044,822 |
3,983,176 |
3,874,348 |
- | |
|
연구개발비 / 매출액 비율 [연구개발비용합계÷당기매출액×100] |
1,290% |
2,056% |
2,159% |
- | |
※ 매출액 대비 연구개발비 비율은 정부보조금 차감 전 연구개발비용을 기준으로 산정하였습니다.
라. 연구개발실적
(1) 연구개발 진행 현황 및 향후계획
본 보고서 작성 기준일 현재 당사가 연구개발 진행 중인 신약 현황은 다음과 같습니다.
[연구개발 진행 총괄표]
| 구분 | 품목 | 적응증 | 연구시작일 | 현재 진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||
| 바이오 | 신약 | CVI-HBV-002 |
만성 B형 간염 치료백신 |
2002년 |
2b상 임상시험 진행 중 (한국) |
2019.10 |
- |
|
B형 간염 예방백신 |
2002년 |
1상 임상시험 완료 (한국) |
2021.06 | - | |||
|
CVI-HBV-001 |
B형 간염 예방백신 |
2002년 |
1/2a상 임상시험 완료 (한국) |
2012.08 |
- |
||
|
CVI-VZV-001 |
대상포진 백신 |
2015년 |
1상 임상시험 진행 중 (한국) |
2022.12 |
- | ||
| CVI-Flu-002 | 조류독감 백신 | 2016년 |
1상 임상시험계획 승인 (한국) |
2020.02 | 일양약품 공동개발 | ||
| CVI-CT-001 | 면역항암치료제 | 2020년 |
1상 임상시험 계획 (한국 등) |
준비 중 | - | ||
| CVI-CV-001 | 펩타이드 항암백신 | 2020년 |
1상 임상시험 계획 (한국 등) |
준비 중 | - | ||
|
L-pampo® |
항암백신 면역증강제 |
2019년 |
전임상 단계 (한국) |
준비 중 |
라이센스아웃 (2021.02) |
||
(가) 품목: 만성 B형 간염 치료백신 CVI-HBV-002
|
구분 |
바이오 신약 |
|
적응증 |
만성 B형 간염 치료백신 |
|
작용기전 |
- 만성 B형 간염 환자는 B형 간염 바이러스(HBV)를 제거하기 위한 면역반응이 충분히 유도되지 않는 면역관용 상태에 있음 - 면역원성이 높은 3세대 항원(L-HBsAg)와 면역증강제 L-pampo®가 높은 항체가, 강력한 Th1 면역반응과 같은 HBV 특이적 면역반응을 높게 유도하여 바이러스를 제거함으로써 치료효과를 나타냄 |
|
제품의 특성 |
◆ 구성 - 항원: 3세대 재조합 항원 L-HBsAg (preS1, preS2, S 항원을 모두 포함) - 면역증강제: TLR2 리간드와 TLR3 리간드의 복합체 L-pampo® ◆ 특징 - 기존 2세대 항원 대비 3세대 재조합 항원(L-HBsAg)이 200배 이상 높은 항체가를 유도 - 전임상 효력시험 결과, 마우스 7마리 중 5마리에서 혈액 내 HBsAg 파티클이 완전히 제거되었음 - 면역관용 해소 및 면역반응 유도를 통해 HBV 바이러스를 제거하여 만성 B형 간염 완치가 가능할 것으로 기대 |
|
진행경과 |
◆ 제형개발 |
|
향후계획 |
- 2025년 3상 임상시험 예상 - 2b상 임상시험 결과 기반으로 L/O 예정 |
|
경쟁제품 |
◆ 허가된 만성 B형 간염 치료제는 없음 - B형 간염 바이러스의 증식을 억제하는 다양한 항바이러스제들(TBV, ETV, TDF, TAF 등)이 권고되고 있음 |
|
관련논문 |
- 신규면역증강제 L-pampo®에 의해 유도되는 B형 간염 치료백신의 면역반응 기전을 Scientific Reports에 발표 (BR Lee et al., Scientific Reports, 2016 Sep. 1; 6: 32526) |
|
시장규모 |
- B형 간염 치료제 시장은 2014년 약 24억 달러였으며 2024년 약 30.6억 달러까지 증가 전망(Global Data 2016) |
|
기타사항 |
◆ 관련 특허 - 1/2a 임상시험 결과를 근거로 한 병용투여에 대한 대한민국, 호주, EU 특허 등록(자세한 내용은 7. 기타 참고사항 - 나. 특허권 현황 참조) |
(나) 품목: B형 간염 예방백신 CVI-HBV-002
|
구분 |
바이오 신약 |
|
적응증 |
무반응자용 B형 간염 예방백신 |
|
작용기전 |
- 면역원성이 높은 3세대 항원(L-HBsAg)와 면역증강제 L-pampo®가 높은 항체가를 유도하고 기억세포를 형성하여 B형 간염 바이러스(HBV)의 침입에 빠르게 반응하고 간염을 예방 |
|
제품의 특성 |
◆ 구성 - 항원: 3세대 재조합 항원 L-HBsAg (preS1, preS2, S 항원을 모두 포함) - 면역증강제: TLR2 리간드와 TLR3 리간드의 복합체 L-pampo® ◆ 특징 - 면역증강제 L-pampo®를 포함하여 강력한 면역반응 유도 가능 - 면역원성이 개선된 3세대 항원 포함 - 백신 효능 극대화 (2 dose 백신, 무반응자용 백신 개발 가능 예상) |
|
진행경과 |
◆ 임상시험 진행 현황 - 1상 임상시험 (완료) ·1상 임상시험 승인일: 2021년 6월 ·1상 임상시험 시작일: 2021년 8월 ·1상 임상시험 종료일: 2024년 3월 ·임상시험 진행국가: 한국 |
|
향후계획 |
- 2024년 3분기 FDA pre-IND 미팅 예상 - 2024년~2025년 2상 임상시험 예상 - 2027년 3상 임상시험 예상 - 임상시험 1상, 2상 결과를 기반으로 L/O 추진 |
|
경쟁제품 |
◆ 면역증강제가 개선된 경쟁사 제품 (2세대 항원 + 개선된 면역증강제) - Fendrix (GSK) - Heplisav-B (Dynavax) ◆ 항원이 개선된 경쟁사 제품 (3세대 항원 + alum) - Sci-B-Vac (VBI Vaccines) ◆ 차세대 B형 간염 예방백신 중 당사 제품만 유일하게 항원과 면역증강제 모두 개선되어 있어 경쟁우위에 있음 |
|
관련논문 |
- 3세대 B형 간염 항원의 생산 세포주 개발 방법 및 2세대 B형 간염 항원과 3세대 B형 간염 항원의 효능을 비교한 동물면역실험 결과를 CVI저널에 발표 (JS Yum et al., Clin Vaccine Immunol. 2012 Feb;19(2):120-7) |
|
시장규모 |
- 2016년 B형 간염 예방 백신 시장 $1.38B, 2025년 $1.89B로 추정(WISEGUY RESEARCH 2019) |
|
기타사항 |
- |
(다) 품목: B형 간염 예방백신 CVI-HBV-001
|
구분 |
바이오 신약 |
|
적응증 |
영유아용 B형 간염 프리미엄 예방백신 |
|
작용기전 |
- 면역원성이 높은 3세대 항원(L-HBsAg)와 면역증강제 alum이 높은 항체가를 유도하고 기억세포를 형성하여 B형 간염 바이러스(HBV)의 침입에 빠르게 반응하고 간염을 예방 |
|
제품의 특성 |
◆ 구성 - 항원: 3세대 재조합 항원 L-HBsAg (preS1, preS2, S 항원을 모두 포함) - 면역증강제: alum ◆ 특징 - 면역증강제 alum 사용을 통해 전연령층 사용가능 (영유아용 프리미엄 백신 개발) - 면역원성이 개선된 3세대 항원 포함 - 기존 2세대 백신 대비 효능 우수 (임상 결과 보유) |
|
진행경과 |
◆ 임상시험 진행 현황 - 1/2a상 임상시험 (완료) ·1/2a상 임상시험 시작일: 2012년 12월 ·1/2a상 임상시험 종료일: 2015년 5월 ·임상시험 진행국가: 한국 ·임상시험 결과 . 무반응자(7명 중 5명, 71%)에서 방어효과 유도 . 기존 B형 간염 백신에 대한 무반응자에게서 더 높은 방어효과 기대 |
|
향후계획 |
- 라이선스 아웃 및 해외 파트너사 공동 개발 추진 예정 |
|
경쟁제품 |
◆ 해외 B형 간염 예방백신 (2세대 재조합 항원 + alum) - Engerix-B (GSK) - Recombivax HB (Merck & Co.) ◆ 국내 B형 간염 예방백신 (2세대 재조합 항원 + alum) - Euvax-B (LG화학) - Hepamune (SK바이오사이언스) - Hepamune Prefilled Syringe (SK바이오사이언스) |
|
관련논문 |
- 3세대 B형 간염 항원의 생산 세포주 개발 방법 및 2세대 B형 간염 항원과 3세대 B형 간염 항원의 효능을 비교한 동물면역실험 결과를 CVI저널에 발표 (JS Yum et al., Clin Vaccine Immunol. 2012 Feb;19(2):120-7) |
|
시장규모 |
- 2016년 B형 간염 예방백신 시장 $1.38B, 2025년 $1.89B로 추정(WISEGUY RESEARCH 2019) |
|
기타사항 |
- |
(라) 품목: 재조합 대상포진 백신 CVI-VZV-001
|
구분 |
바이오 신약 |
|
적응증 |
대상포진 |
|
작용기전 |
- 수두-대상포진 바이러스(VZV)에 대한 중화항체를 높게 유도할 뿐만 아니라 VZV 항원 특이적인 세포성 면역반응을 강하게 유도함으로써 면역력의 저하로 인한 대상포진의 발병을 예방 - 대상포진 발병 시, 바이러스에 대하여 강한 세포성 면역반응을 유도하여 바이러스 증식을 억제하고 신경절염 및 신경세포의 감염과 손상을 줄이며, 궁극적으로 '포진 후 신경통(PHN)'으로의 진전을 억제 |
|
제품의 특성 |
◆ 구성 |
|
진행경과 |
◆ 제형개발 - 재조합 gE 항원 및 리포좀 형태의 면역증강제 Lipo-pam® 개발 완료 ◆ 전임상시험 결과 - 약독화 생백신 Zostavax(Merck & Co.)와의 동물면역실험 결과, Zostavax(Merck & Co.)대비 월등한 효능 확인 - 재조합 백신 Shingrix(GSK)와의 동물면역실험 결과 동등 이상의 효능 확인 - 세포/동물모델 독성시험(유전독성, 반복투여, 안전성약리, 생식발)결과 독성문제 없음 확인 ◆ 임상시험 진행 계획 - 1상 임상시험 (진행 중) ·1상 임상시험계획 승인일: 2022년 12월 ·1상 임상시험계획 변경승인일: 2023년 10월 ·1상 임상시험 종료일: 2025년 3분기 (예상) ·임상시험 진행국가: 한국 |
|
향후계획 |
◆ 대상포진 예방백신 - 2025년 2상 임상시험 - 2027년 3상 임상시험 - 임상시험 1상, 2상 결과를 기반으로 L/O 추진 |
|
경쟁제품 |
◆ 약독화 생백신 - Zostavax(Merck & Co): 2006년 허가 - Skyzoster(SK 바이오사이언스社): 2017년 허가 ◆ 재조합 백신 - Shingrix(GSK): 2017년 허가 |
|
관련논문 |
- 면역증강제 Lipo-pam®을 사용한 재조합 대상포진 백신의 효능과 안전성을 Shingrix와 비교한 동물면역실험 결과를 NPJ Vaccines 저널에 발표 (Eunyoung Chun et al., NPJ Vaccines. 2024 Aug 9(1):150 |
|
시장규모 |
- 2017년 $0.78B, 2024년 $1.8B로 추정 (GlobalData, 2017년 발표) - GSK Shingrix의 2020년 매출규모 약 $2.6B (GSK annual report 2020, 2017년 시장 출시후 대상포진 백신 시장 장악) |
|
기타사항 |
- |
(마) 조류독감 백신 CVI-Flu-002
|
구분 |
바이오 신약 |
|
적응증 |
H7N9 조류독감 |
|
작용기전 |
- T cell이 HA항원을 인식하여 면역반응을 활성화되고 면역증강제 L-pampo®가 체액성 면역반응을 강하게 유도함으로써 H7N9 인플루엔자 바이러스의 감염을 예방 |
|
제품의 특성 |
◆ 구성 - 항원: 유정란 유래의 정제된 불활화 분할 H7N9 백신 항원 - 면역증강제: TLR2 리간드와 TLR3 리간드의 복합체 L-pampo® ◆ 특징 - Outbreak 대비 비축용 백신 - H7을 포함하는 인플루엔자 바이러스는 낮은 면역원성으로 인해 백신 개발이 어려워 면역증강제가 반드시 필요함 - 우수한 방어효과(HI 역가, IgG GMT, 폐조직의 바이러스역가) 및 세포성 면역반응 유도 |
|
진행경과 |
◆ 제형개발 - HA항원(일양약품 생산) 및 강력한 면역증강제 L-pampo® 개발 완료 ◆ 전임상시험 결과 - 체액성 면역반응 분석 결과: 상용화된 면역증강제 Addavax 투여군에 비해 더 높은 항체가 유도 - 공격 접종 후 바이러스 역가 분석 결과 : 항원 단독 및 상용화된 면역증강제 Addavax 대비 공격접종에 대한 높은 방어 효과를 나타냄 - 독성시험 결과 독성소견은 발견되지 않음 ◆ 임상시험 진행 계획 - 1상 임상시험계획 승인 ·1상 임상시험계획 승인일: 2020년 2월 ·임상시험 진행국가: 한국 |
|
향후계획 |
- 본 백신은 Outbreak 대비 비축용 백신으로 필요시 임상시험을 진행할 계획임 |
|
경쟁제품 |
- 허가된 제품 없음 |
|
관련논문 |
- |
|
시장규모 |
- 글로벌 시장규모: 2020년 US$ 391.7 million, 2025년 US$ 735.2 million으로 추정(Market reports world) |
|
기타사항 |
- 일양약품 공동개발 |
(바) 면역항암치료제 CVI-CT-001
|
구분 |
바이오 신약 |
|
적응증 |
면역관문억제제 내성 극복 항암치료 |
|
작용기전 |
- 면역항암치료제 CVI-CT-001은 암세포에서 caspase pathway를 활성화시키고 apoptosis를 유도하여 암세포를 사멸함 - 암세포 사멸을 통해 노출된 항원에 대한 면역반응을 촉진하여 면역항암치료 효능 증대 - 암세포 사멸을 유도하고 종양특이적 면역반응을 촉진함으로써 종양미세환경을 개선하여 면역관문억제제의 내성을 극복하고 치료효과를 나타냄 |
|
제품의 특성 |
◆ 구성 - TLR2/3 리간드 복합체인 면역증강제 L-pampo® ◆ 특징 - 임상을 통해 안전성이 확인된 L-pampo® - TLR 리간드성 면역증강제 L-pampo® 자체의 항암기능(면역원성 암세포 사멸 유도, 강력한 Th1 면역세포 활성화) 활용 - 종양환경을 저면역원성에서 고면역원성으로 변화시켜 면역관문억제제의 내성을 극복할 수 있는 병용 면역항암치료제 |
|
진행경과 |
◆ 제형개발 |
|
향후계획 |
- 전임상시험 검증 후 1상 임상시험 진행 계획 - 2024년~2025년 1상 임상시험 IND 제출 예상 - 2025년 1상 임상시험 예상 |
|
경쟁제품 |
- TLR 리간드성 면역증강제(Hiltonol, Ampligen, Aldara 등)의 단독 또는 병용 면역항암치료 임상시험이 국외에서는 활발히 진행 중이나 국내에서는 개발이 전무함 |
|
관련논문 |
- 당사 L-pampo®가 암세포 사멸을 유도하고, 종양 미세환경내에서 선천성 및 적응성 항종양 면역을 개선하여 면역관문억제제의 효능을 향상시킨다는 실험결과를 JITC저널에 발표 (Won Suk Lee et al., Journal of ImmunoTherapy of Cancer. 2022 Jun;10(6):e004799) |
|
시장규모 |
- 글로벌 면역항암제 시장 규모: 2020년 $85.6B, 2030년 $309.7B 예상 (allied market research) |
|
기타사항 |
- 산업통상자원부 바이오산업핵심기술개발사업 정부과제 수주 |
(사) 펩타이드 항암백신 CVI-CV-001
|
구분 |
바이오 신약 |
|
적응증 |
항암치료 |
|
작용기전 |
- T cell이 항암백신에 포함된 펩타이드 암항원을 인식하고 종양특이적 면역반응을 유도하여 암세포를 파괴함 - 항암백신에 포함된 면역증강제가 종양특이적 세포성 면역반응을 활성화하고 유도된 면역반응을 지속시킴 |
|
제품의 특성 |
◆ 구성 - 항원: 다양한 암종에서 공통적으로 과발현되는 펩타이드 암항원을 조합하여 타겟 암종별 최적화된 멀티 펩타이드 항원 - 면역증강제: TLR2 리간드와 TLR3 리간드의 복합체 L-pampo® ◆ 특징 - cytotoxic T cell 분화 증식을 포함한 암항원 특이적 면역반응을 일으켜 암세포를 파괴하고 암 진행을 늦춤 - 면역회피 기작에 의해 효능이 불충분한 단일표적 펩타이드의 한계를 극복할 수 있음 - 암항원에 대한 면역메모리를 통해 재발방지에 효과적 - 글로벌 암 치료 트렌드는 병용치료인데, 항암백신은 낮은 독성으로 병용치료에 적합함 |
|
진행경과 |
◆ 제형개발 - 다양한 암종에 효과적인 종양 연관 항원 유래 멀티 펩타이드 항원 개발 진행 중 - 타겟 암종별 최적화된 멀티 펩타이드 항암백신의 면역효능과 항암효과를 증대시키는 면역증강제 제형개발 진행 중 ◆ 동물모델 실험결과 - OVA 항원과 면역증강제 L-pampo®로 구성된 항암백신의 단독투여 또는 면역관문억제제와 병용투여에서 Polyfunctional CD8+ T cell 유도 효과와 tumor suppression 효과 확인 |
|
향후계획 |
- 전임상시험 검증 후 1상 임상시험 진행 계획 |
|
경쟁제품 |
- 현재 시판 허가 받은 제품으로는 RIAVAX(GemVax & KAEL)가 있음 - 다양한 펩타이드 항암백신의 임상시험이 다수 진행 중이나 효능 불충분으로 개발 중단, 상용화 포기 등 개발이 미진함 |
|
관련논문 |
- |
|
시장규모 |
- 글로벌 항암백신 시장규모: 2019년 $4.2B, 2026년 $12B 예상 (allied market research) |
|
기타사항 |
- |
(아) 항암백신 면역증강제 L-pampo®
|
구분 |
바이오 신약 |
|
적응증 |
항암치료 |
|
작용기전 |
- T cell이 항암백신에 포함된 펩타이드 항원(HSP90 epitope)을 인식하고 암세포에 강력한 면역반응을 유도하는 Th1가 선택적으로 활성화됨 - 항암백신에 포함된 면역증강제가 종양특이적 세포성 면역반응을 활성화하고 유도된 면역반응을 지속시킴 |
|
제품의 특성 |
◆ 구성 - 병용하는 항원: HSP90 epitope (HSP90 : 암세포에 의해 발생하는 특이 단백질) - 면역증강제: TLR2 리간드와 TLR3 리간드의 복합체 L-pampo® ◆ 특징 - 다양한 암종 환자의 수술 후 재발 방지와 표준 치료가 불가능한 말기 암 환자에게 최적의 치료법 - 안전성과 약효면에서 기존 암 치료제와 차별화된 암 치료 옵션 |
|
진행경과 |
◆ 동물모델 실험결과 - FBV 마우스 모델에서 상용 또는 임상 중인 면역증강제와 효능을 비교한 결과, L-pampo®가 항원 특이적 T cell 유도 및 IFN-γ 분비 촉진에 우월성을 보임 - 형질전환 마우스 모델에서 항원 HSP90 epitope와 면역증강제 L-pampo®로 구성된 펩타이드 항암백신의 tumor suppression 효과를 확인함 |
|
향후계획 |
- Formulation 연구와 병합 제제 독성연구 검증 후 1/2상 임상시험 진행 계획 |
|
경쟁제품 |
- |
|
관련논문 |
- 2021 SITC annual conference에서 전임상 결과 발표 |
|
시장규모 |
- 글로벌 항암백신 시장규모: 2019년 $4.2B, 2026년 $12B 예상 (allied market research) |
|
기타사항 |
- 애스톤사이언스에 라이선스 아웃 (L-pampo®가 AST-021p 및 AST-023의 면역증강제로 사용) |
(2) 연구개발 완료 실적
- 해당사항 없음
(3) 연구개발활동 및 판매 중단 현황
- 해당사항 없음
(4) 기타 연구개발 실적 (국책 과제 및 공동 연구 실적)
|
과제명 |
주관부서 |
참여기간 |
총 연구비 |
결과 |
|---|---|---|---|---|
|
신규 재조합 노로바이러스 백신 플랫폼 기술개발 |
보건복지부 |
2020.10 ~ 2022.03 |
9억 3천만원 |
수행완료 |
|
신개념 면역증강제 플랫폼 기술 개발 |
보건복지부 |
2020.10 ~ 2022.03 |
10억원 |
수행완료 |
|
새로운 백일해 유전자 재조합 단백질 항원 기반 신규 플랫폼 백일해 백신개발 |
보건복지부 |
2021.01 ~ 2022.06 |
8억 5천만원 |
수행완료 |
|
차세대 아쥬번트를 활용하여 면역관문억제제의 한계를 극복하는 개량형 의약품 개발 |
산업통상자원부 |
2021.04 ~ 2024.12 |
43억원 |
수행중 |
|
Development of sublingual COVID-19 subunit vaccine |
RIGHT FUND |
2022.04 ~ 2023.06 |
5억원 |
수행완료 |
|
신종코로나와 인플루엔자 혼합 프리미엄 백신의 후보물질 개발 |
보건복지부 |
2022.04 ~ 2024.12 |
22억원 |
수행중 |
|
재조합 수두 백신 마이크로니들의 항원 생산 및 분석법 개발 |
보건복지부 |
2022.04 ~ 2024.12 |
14억원 |
수행중 |
|
변이에 신속대응 가능한 박테리오파지 기반 백신 플랫폼 개발 |
보건복지부 |
2022.05 ~ 2024.12 |
21억 4천만원 |
수행중 |
| 신규 면역증강제를 이용한 범용 노로바이러스 다가 백신의 후보물질 개발 |
보건복지부 |
2022.07 ~ 2023.12 |
14억 1천만원 | 수행완료 |
| 안전하고 효과적인 차세대 일본뇌염 재조합 단백질 백신 개발을 위한 후보물질 발굴 | 보건복지부 | 2024.09 ~ 2026.12 | 14억 3천만원 | 수행중 |
|
합계 |
161억 6천만원 | |||
7. 기타 참고사항
가. 상표권 현황
당사는 당사 제품이나 서비스의 고유한 상표권을 관리하기 위하여, 고유한 상표권에 대한 악의적인 사용 및 무분별한 도용 등에 대비하고, 필요한 경우 법무조직을 통해 상표권 불사용 취소심판, 선사용권 제도, 부정 목적 상표권 출원의 등록 거절 등 다양한 제도를 활용하여 당사의 상표권을 보호하고 있습니다.
보유 상표권 상세 리스트는 아래와 같습니다.
| 번호 | 분류 | 국/내외구분 (국가) |
상표명칭 | 등록번호 (등록일) |
비고 |
|---|---|---|---|---|---|
| 1 | 제05류 (의약품, 시약 등) |
국외 (호주) |
Lipo-pam | 2201777 (2021.11.01) |
- |
| 2 | 제05류 (의약품, 시약 등) |
국외 (호주) |
L-pampo | 2201779 (2021.11.01) |
- |
| 3 | 제05류 (의약품, 시약 등) |
국내 (대한민국) |
Lipo-pam | 40-1914607 (2022.09.27) |
- |
| 4 | 제05류 (의약품, 시약 등) |
국내 (대한민국) |
L-pampo | 40-1914590 (2022.09.29) |
- |
| 5 | 제05류 (의약품, 시약 등) |
국외 (일본) |
Lipo-pam | 1606633 (2023.01.27) |
- |
| 6 | 제05류 (의약품, 시약 등) |
국외 (일본) |
L-pampo | 1606638 (2023.01.27) |
- |
| 7 | 제05류 (의약품, 시약 등) |
국외 (미국) |
Lipo-pam | 6,993,671 (2023.03.07) |
- |
| 8 | 제05류 (의약품, 시약 등) |
국외 (미국) |
L-pampo | 6,993,672 (2023.03.07) |
- |
|
9 |
제05류 |
국외 (중국) |
Lipo-pam |
G1606633 (2023.09.27) |
- |
|
10 |
제05류 |
국외 (중국) |
L-pampo |
G1606638 (2023.09.27) |
- |
나. 특허권 현황
당사는 2000년 06월 설립 후 2003년 6월 처음 특허를 출원하기 시작하였으며, 이후 지속적인 연구개발을 통하여 현재 국내외 총 42개의 특허가 등록되었습니다. 당사의 특허는 면역증강제(Adjuvant), MBL(Mannose-Binding Lectine), 표면+코어 항원포함 HBV 복합백신, HBV 백신 대량 생산방법, 변형된 HBV pre-S 단백질의 15개 그룹으로 분류 및 관리하고 있습니다. 15개 그룹으로 구분된 차백신연구소의 보유 특허 상세 리스트는 아래와 같습니다.
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
적용제품 |
국가 |
|---|---|---|---|---|---|---|
|
1 |
리포펩타이드와 폴리(I:C)를 아쥬반트로 포함하는 강력한 백신조성물 |
차백신연구소 |
'07.12.07 |
'09.05.27 |
L-pampo® |
국내 |
|
2 |
'08.12.05 |
'12.07.10 |
미국 |
|||
|
3 |
'08.11.20 |
'14.08.20 |
EU |
|||
|
4 |
'08.11.20 |
'14.06.03 |
캐나다 |
|||
|
5 |
'08.11.21 |
'13.04.17 |
중국 |
|||
|
6 |
'08.11.20 |
'14.02.28 |
일본 |
|||
|
7 |
'08.11.20 |
'16.12.30 |
인도 |
|||
|
8 |
'08.11.20 |
'12.01.05 |
호주 |
|||
|
9 |
'08.11.20 |
'13.08.23 |
홍콩 |
|||
|
10 |
리포펩타이드와 폴리(I:C)를 포함하는 아쥬반트 및 |
차백신연구소 |
'13.03.29 |
'15.03.05 |
국내 |
|
|
11 |
리포펩티드가 삽입된 리포좀을 유효성분으로 포함하는 백신 아쥬반트 및 이의 용도 |
차백신연구소 |
'17.08.16 |
- |
Lipo-pam® |
국내 |
|
12 |
'18.01.16 |
'20.04.01 |
국내(우선권) |
|||
|
13 |
'18.08.10 |
- |
PCT |
|||
|
14 |
'20.02.12 |
'23.07.25 |
캐나다 |
|||
|
15 |
'20.02.14 |
'23.03.28 |
미국 |
|||
|
16 |
'20.02.14 |
'22.05.27 |
일본 |
|||
|
17 |
'20.02.14 |
- |
중국 |
|||
|
18 |
'20.02.19 |
'22.02.03 |
호주 |
|||
|
19 |
'20.03.16 |
- |
유럽 |
|||
|
20 |
에멀전 제형의 면역증강제 조성물 및 이의 제조 방법 |
차백신연구소 |
'22.09.05 |
- |
국내 |
|
|
21 |
'23.08.31 |
- |
PCT |
|||
|
22 |
콜로이드 금의 아쥬반트로의 사용 |
차백신연구소 |
'06.06.23 |
'08.06.03 |
기타 |
국내 |
|
23 |
보강제 및 HBV 백신 성분 B형 간염 바이러스의 pre S단백질 |
차백신연구소 |
'03.11.24 |
'06.06.01 |
HBV |
국내 |
|
24 |
'02.05.02 |
'04.02.25 |
EU |
|||
|
25 |
'03.02.10 |
'07.12.19 |
중국 |
|||
|
26 |
헤파티티스 B 바이러스 백신을 대량으로 생산하는 방법 |
차백신연구소 |
'03.08.26 |
'06.07.31 |
국내 |
|
|
27 |
HBV 백신 및 그의 제조 방법 |
차백신연구소 |
'07.01.31 |
'08.06.03 |
HBV |
국내 |
|
28 |
'08.09.18 |
'12.07.10 |
미국 |
|||
|
29 |
'08.01.28 |
'14.11.19 |
EU |
|||
|
30 |
'08.01.28 |
'14.08.19 |
캐나다 |
|||
|
31 |
'08.01.28 |
'12.08.12 |
중국 |
|||
|
32 |
'12.04.09 |
'15.01.28 |
||||
|
33 |
'08.01.28 |
'12.10.05 |
일본 |
|||
|
34 |
'08.01.28 |
'16.07.10 |
인도 |
|||
|
35 |
'10.09.20 | '17.06.09 |
홍콩 |
|||
|
36 |
경구용 항바이러스제 및 리포펩타이드와 폴리(I:C) 아쥬반트를 포함한 |
차백신연구소 |
'20.11.18 |
'21.08.17 |
국내 |
|
|
37 |
'21.09.29 |
- |
PCT |
|||
|
38 |
'23.05.15 |
- |
미국 |
|||
|
39 |
'23.06.15 |
- |
EU |
|||
|
40 |
'23.05.01 |
'24.01.18 |
호주 |
|||
|
41 |
'23.05.17 |
- |
중국 |
|||
|
42 |
'23.05.09 |
'24.09.12 |
멕시코 |
|||
|
43 |
'23.05.03 |
- |
브라질 |
|||
|
44 |
'23.10.19 |
- |
홍콩 |
|||
|
45 |
리포펩타이드와 폴리(I:C)아쥬반트를 포함하는 재조합 코로나-19 백신 조성물 |
차백신연구소 |
'20.11.09 |
- |
COVID-19 |
국내 |
|
46 |
'21.11.08 |
- |
국내(우선권) |
|||
|
47 |
'21.11.08 |
- |
PCT |
|||
|
48 |
'23.05.08 |
- |
미국 |
|||
|
49 |
'23.05.05 |
- |
베트남 |
|||
|
50 |
'23.05.17 |
- |
인도네시아 |
|||
|
51 |
'23.05.08 |
- |
태국 |
|||
|
52 |
고분자형 만노스 결합형 렉틴의 대량 생산방법 및 |
차백신연구소 |
'03.06.24 |
'07.08.30 |
MBL |
국내 |
|
53 |
Methods for overexpression of high molecular form of mannose binding lectin and |
차백신연구소 |
'03.08.15 |
'06.11.14 |
미국 |
|
|
54 |
고분자형 만노스 결합형렉틴의 대량생산방법 |
차백신연구소 |
'03.08.01 |
'06.09.20 |
중국 |
|
|
55 |
'04.10.28 |
'09.03.27 |
러시아 |
|||
|
56 |
'04.10.28 |
'11.03.30 |
EU |
|||
|
57 |
'04.10.28 |
'12.01.03 |
멕시코 |
|||
|
58 |
'07.04.27 |
- |
브라질 |
|||
|
59 |
'04.10.28 |
'10.12.03 |
인도 |
|||
|
60 |
'04.10.28 |
'10.09.24 |
일본 |
|||
|
61 |
'04.10.28 |
'11.03.30 |
터키 |
|||
|
62 |
분무건조 고분자형 만노스 결합형 렉틴 조성물 및 그의 제조방법 |
차백신연구소 |
'05.12.30 |
'07.10.19 |
MBL |
국내 |
|
63 |
'06.05.18 |
'12.05.08 |
미국 |
|||
|
64 |
'07.05.30 |
- |
EU |
|||
|
65 |
'07.07.02 |
'11.03.09 |
중국 |
|||
|
66 |
'05.12.30 |
'11.07.01 |
인도 |
|||
|
67 |
재조합 만노스 결합형 렉틴을 유효성분으로 포함하는 |
차백신연구소 |
'20.11.25 |
- |
국내 |
|
|
68 |
리포펩타이드와 폴리(I:C) 아쥬번트를 유효성분으로 포함하는 면역항암치료제 조성물 |
차백신연구소 |
'21.05.24 |
- |
면역항암제 |
국내 |
|
69 |
'22.05.24 |
- |
국내(우선권) |
|||
|
70 |
'22.09.26 |
- |
PCT |
|||
|
71 |
리포펩타이드와 폴리(I:C) 아쥬번트를 이용하는 면역항암치료제 조성물 |
차백신연구소 |
'22.05.24 |
- |
대한민국 |
|
|
72 |
'22.05.24 |
- |
PCT |
|||
|
73 |
'23.11.21 |
- |
미국 |
|||
|
74 |
'23.11.22 |
- |
호주 |
|||
|
75 |
'23.11.24 |
- |
중국 |
|||
|
76 |
'23.11.24 |
- |
유럽 |
|||
|
77 |
'23.11.22 |
- |
멕시코 |
|||
|
78 |
'23.11.22 |
- |
브라질 |
|||
|
79 |
'23.11.21 |
- |
캐나다 |
|||
|
80 |
'23.11.21 |
'24.07.23 |
일본 |
|||
|
81 |
'23.11.28 |
- |
러시아 |
|||
|
82 |
'23.11.21 |
- |
뉴질랜드 |
|||
|
83 |
'23.12.01 |
- |
인도네시아 |
|||
|
84 |
'23.12.11 |
- |
인도 |
|||
|
85 |
종양 연관 항원으로부터 유래된 펩타이드 및 리포펩타이드와 면역활성화물질로 구성되는 아쥬번트를 포함하는 항암 백신 조성물 |
차백신연구소 |
'21.09.24 |
- |
항암 백신 |
국내 |
|
86 |
'22.09.26 |
- |
국내(우선권) |
|||
|
87 |
'22.09.26 |
- |
PCT |
|||
|
88 |
'24.03.22 |
- |
미국 |
|||
|
89 |
'24.03.22 |
- |
일본 |
|||
|
90 |
'24.03.25 |
- |
중국 |
|||
| 91 | '24.04.24 | - | EU | |||
| 92 |
HSP90 항원성 펩타이드를 포함하는 항암용 백신 조성물 |
차백신연구소 애스톤사이언스 |
'21.09.29 |
'22.03.11 |
국내 |
|
| 93 |
HSP90 항원성 펩타이드를 포함하는 항암용 백신 조성물 및 이의 용도 |
차백신연구소 애스톤사이언스 |
'22.09.28 |
- |
PCT |
|
| 94 |
면역증강제 및 핵산을 양이온성 리포좀과 혼합하여 제형화한 리포플렉스 |
차백신연구소 |
'23.10.26 |
- |
전달체 기술 |
국내 |
| 95 | 양이온성 리포좀을 포함하는 핵산 전달용 조성물 및 그의 용도 | 차백신연구소 | '24.09.27 | - | PCT |
다. 신약 산업 관련 법령 및 정부 규제
새로운 의약품이 환자에게 판매되기 위해서는 신약후보 물질의 발굴에서부터 동물을 대상으로 하는 전임상 시험, 인체를 대상으로 하는 임상시험, 시판 승인이라는 단계를 모두 거쳐야 하며, 제품의 개발부터 판매까지의 전 과정을 각 국가의 규제 당국이 매우 엄격히 규제하고 있습니다.
특히 인체를 시험대상으로 하는 임상시험은 각 국가의 정부 규제가 매우 엄격합니다. 임상시험 이전 단계부터 여러가지 축적 데이터를 제출하여야 하며, 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고된다면 진행 중이던 임상시험이 중단되거나 철회될 수 있습니다. 또한 임상시험을 성공적으로 마치고 시판 승인을 받은 신약을 생산 및 판매하는 과정에서도 규제당국이 제시하는 규정을 준수해야 합니다.
라. 시장 여건 및 영업의 개황
(1) 산업의 특성
(가) 백신 패러다임의 전환
과거백신은 병원균 자체를 사용하여 질병의 예방을 목적으로 하는 영유아 대상의 공공백신 중심이었으나, 현재는 면역증강기술을 활용하여 성인 및 노인까지 그 대상을 확대하는 고가의 프리미엄 백신으로 발전하였고, 향후 백신의 활용범위는 예방이 아닌 치료목적으로까지 확대되는 패러다임의 전환이 이루어 지고 있습니다.
 |
|
백신 패러다임의 전환 |
이러한 패러다임 변화의 중심에는 면역증강제의 등장이 있습니다. 면역증강제는 1920년대 alum의 허가 이후 1997년 Novartis의 MF59가 허가되기까지 약 80년간 새로운 면역증강 물질의 허가가 없었으며, 이후에도 GSK와 Dynavax 등 극히 일부의 회사만 허가를 받았을 정도로 개발이 어려운 물질입니다.
약독화 백신, 불활화 백신 등 기존의 백신은 항체를 유도하는 예방백신으로 면역원성은 높지만 안전성이 낮아 이를 개선하기 위해 정제된 재조합 항원이 사용되었습니다. 그러나 재조합 항원만으로는 면역원성이 낮아 충분한 방어효과를 얻을 수 없어, 재조합 항원과 면역증강제로 구성된 차세대 백신이 등장하였으며 면역증강제를 통해 면역증강 및 면역조절이 가능하여 예방백신뿐만 아니라 치료백신으로도 개발이 가능합니다. 차세대 백신에서 면역원성과 안전성을 모두 확보하고 체액성 및 세포성 면역반응을 유도하기 위해서는 효과적인 면역증강제가 매우 중요합니다.
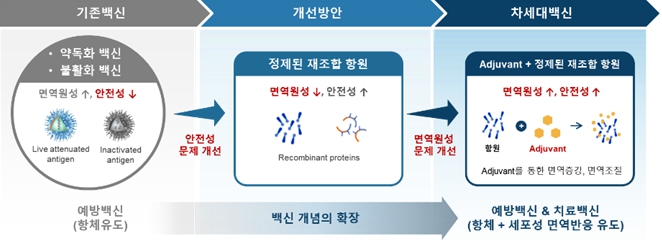 |
|
백신 개념의 확장 |
새로운 백신과 같은 신약을 개발하기 위해서는 기초연구부터 허가과정까지 의학, 약학, 화학, 생물학 등 제반 학문이 유기적으로 결합되어야 하며 짧게는 수년에서 길게는 15년 이상의 개발 기간이 소요되므로 그 어떤 산업 보다 연구개발 비중이 높고 천문학적인 연구개발 비용이 투입됩니다. 2016년 기준으로 Roche는 114.2억 달러(매출액 대비 22.8%), Pfizer는 78.7억 달러(14.8%), MSD는 71.9억 달러(18%), BMS는 49.4억 달러(25.4%)를 각각 연구개발 비용으로 쏟아 붓고 있으며 글로벌 신약 연구개발 규모도 점진적으로 증가하여 2022년에는 200조원에 이를 것으로 전망됩니다. 이와 관련한 글로벌 제약사들은 하나의 블록버스터급 신약이 출시되었을 때 해당 회사와 시장에 대한 파급력이 엄청나기 때문에 지속적으로 연구개발에 대한 투자를 증가시키는 추세입니다.
(나) 의약품 산업 및 신약개발의 특성
1) 신약개발 특성: High Risk, High Return
신약개발은 후보물질 탐색부터 신약 승인까지 15년 이상의 오랜 기간과 높은 비용이 소요되며, 개발 성공 가능성은 평균 0.01%로 통상 10,000개의 후보 물질 가운데 최종 신약승인을 통과하는 약물은 단 한 개에 불과할 정도로 임상 실패에 대한 리스크가 존재합니다. 시판승인 획득 후 특허권을 통한 자체적 권리보호 조치 및 허용된 독점 판매 기간 등을 인정받아 신약 가격결정권 행사가 가능하므로 높은 부가가치 창출 및 안정적인 사업을 영위할 수 있다는 장점이 있어, 고비용 고위험군의 산업임에도 불구하고 계속해서 신약개발 시도가 이루어지고 있습니다.
일반적으로 제약업계에서 단일 제품으로 연매출 10억 달러 이상을 기록하는 의약품을 ‘블록버스터 의약품’이라고 하며 대부분 ‘신약’입니다. 블록버스터 의약품은 개발하는데 많은 시간과 비용이 소요되지만 개발 후 제품화하였을 때 높은 수준의 수익성 실현이 가능합니다.
대표적인 블록버스터 의약품이라고 할 수 있는 Pfizer의 고지혈증 치료제인 '리피토(Lipitor)'는 10여년간 9억달러 이상의 개발비를 투입하여 1999년 출시 이래 2006년 단일 제품으로 137억 달러의 매출을 기록하였고, 2009년 특허가 만료되었음에도 1,370억 달러 이상 수익을 창출하면서 여전히 고지혈증 치료제의 대명사로 자리매김하고 있습니다. 2015년 글로벌 의약품 매출액 1위인 AbbVie의 류머티스 관절염 치료제인 '휴미라(Humira)' 역시 141억 달러의 매출액을 기록하였습니다.
이와 같이 의약품 산업은 하나의 제품만으로도 연간 수 조원의 매출과 수년간 독점적인 지위를 장악하고 사업을 영위할 수 있는 산업이며, 신약개발은 대표적인 “High Risk, High Return”의 속성을 나타내는 분야로 실패에 대한 리스크는 크지만 성공 시에 높은 부가가치를 창출할 수 있습니다. 리스크를 감안하고서도 높은 비용을 투자해야 하는 신약개발의 특수성으로 인해 제약 및 신약개발 산업은 높은 진입 장벽이 견고하게 존재하며, 기술 집약도가 높고 이로써 엄청난 고부가가치를 창출하는 대표적인 지식산업입니다.
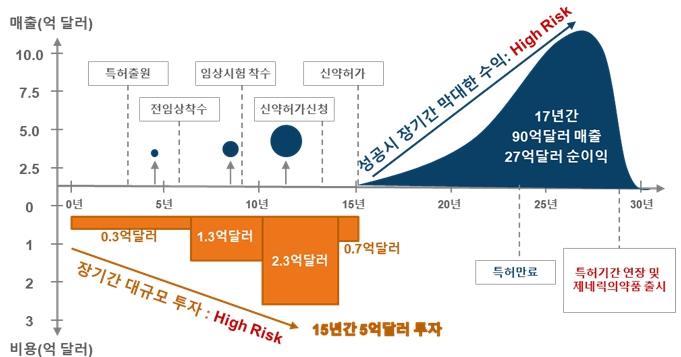 |
|
신약개발 특성 High Risk, High Return |
자료: 생명공학정책연구센터
2) 의약품 산업에서의 성공요소: 협력 및 연구인력
의약품 산업에서는 첨단 및 복합기술을 활용하고 제품개발 단계가 다단계로 이루어져 있어 다양한 혁신주체간의 협력 및 역할 분담이 필수입니다. 기초연구를 담당하는 대학, 공공 연구기관과 함께 중소 벤처기업, 중견 및 다국적 대형 제약기업, 임상병원 등 다양한 분야 주체간 협력이 필요하므로 국내뿐 아니라 범세계적인 협력/연계 관계의 활성화가 경쟁력 확보에 매우 중요합니다. 또한 무형가치 투입으로 고부가가치를 창출하는 지식산업으로서 연구인력의 역량이 매우 중요한 성공 요소입니다.
(2) 산업의 성장성
BIS Research의 보고서에 따르면, 글로벌 백신 시장 규모는 2017년 335.7억 달러(약 39.5조원)에서 연평균 11%로 성장하여 2028년 1,035.7억 달러(약 122조원)규모에 달할 것으로 전망하고 있습니다. 세계 인구의 빠른 고령화와 감염성 질환의 증가, 블록버스터 백신 출현, 새로운 연구 및 제조 기술, 신규 자금 조달 기회 등이 글로벌 백신 시장의 성장을 촉진하여 왔습니다. 또한 국가 예방접종사업을 통하여 백신에 대한 인식이 높아지고, 개발도상국뿐만 아니라 선진국에서의 백신 도입률 증가는 전세계 백신 산업의 성장동력이 되고 있습니다.
 |
|
글로벌 백신 시장 현황(2017년) 및 전망(2018~2028년) |
자료: BIS Research(2018.11) Global Vaccine Market - Analysis and Forecast: 2018 to 2028, 글로벌 백신 시장현황 및 전망 (2019, BioINdustry생명공학정책연구센터)
(3) 경기변동의 특성
의약품인 백신은 인간의 생명과 건강, 보건에 직결된 제품으로 경기변동에 크게 영향을 받지 않는 특성이 있습니다. 백신 시장의 수요자들은 제품의 효능 및 안전성을 우선적으로 고려하므로 일반 소비재 제품에 비해 경기변동의 영향이 적습니다.
(4) 계절성
계절에 따라 발생률이 다른 독감 등 계절성 감염질환에 대한 백신과 판데믹 상황에 의한 백신 등을 제외하고는 계절적 영향이 미미합니다.
마. 사업부문별 손익 현황
| (단위 : 천원, %) |
| 부문 | 구분 | 2024년 3분기 | 2023년 | 2022년 | |||
|---|---|---|---|---|---|---|---|
| 금액 | 비중 | 금액 | 비중 | 금액 | 비중 | ||
| 공통부문 | 매출액 | 370,658 |
100.00 |
294,124 |
100.00 |
179,485 |
100.00 |
| 영업손익 | (5,517,897) |
100.00 |
(6,419,347) |
100.00 |
(6,469,262) |
100.00 | |
| 총자산 | 51,027,393 |
100.00 |
45,119,113 |
100.00 |
61,068,792 |
100.00 | |
※ 당사는 신약개발 사업을 영위하고 있으며, 그 외에 다른 사업은 존재하지 않습니다.
바. 신규사업 추진에 관한 사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
III. 재무에 관한 사항
1. 요약재무정보
당사의 재무제표는 한국채택국제회계기준(K-IFRS)에 따라 작성되었으며, 제25(당)기 3분기 재무제표는 외부감사인으로부터 검토를 받지 않은 재무제표입니다.
또한, 제24기 재무제표는 외부감사인(한울회계법인)의 감사를 받은 재무제표이고, 제23기 재무제표는 외부감사인(한울회계법인)의 감사를 받은 재무제표입니다.
| (단위 : 원) |
|
구 분 |
제25기 3분기말 |
제24기 전기말 |
제23기 전전기말 |
|---|---|---|---|
|
[유동자산] |
48,506,123,193 |
42,485,859,393 |
58,917,220,083 |
|
현금및현금성자산 |
12,003,412,645 |
5,906,120,000 |
2,386,315,374 |
|
단기금융상품 |
25,990,000,000 |
32,990,000,000 |
55,377,000,046 |
|
매출채권및기타채권 |
1,023,708,095 |
453,869,384 |
607,804,944 |
| 파생상품자산 | 6,024,451,356 |
1,003,409,491 |
|
|
기타유동자산 |
3,464,551,097 |
2,132,460,518 |
546,099,719 |
|
[비유동자산] |
2,521,269,888 |
2,633,253,540 |
2,151,572,367 |
|
당기손익-공정가치측정금융자산 |
674,596,072 |
674,596,072 |
440,000,000 |
|
유형자산 |
1,421,177,487 |
1,644,178,587 |
1,542,582,561 |
|
무형자산 |
99,142,200 |
43,579,068 |
39,908,442 |
|
기타비유동자산 |
324,560,009 |
269,105,693 |
127,287,244 |
|
기타채권 |
1,794,120 |
1,794,120 |
1,794,120 |
|
자산총계 |
51,027,393,081 |
45,119,112,933 |
61,068,792,450 |
|
[유동부채] |
807,141,183 |
810,184,714 |
26,789,224,255 |
|
[비유동부채] |
17,530,889,946 |
8,891,976,379 |
913,966,529 |
|
부채총계 |
18,338,031,129 |
9,702,161,093 |
27,703,190,784 |
|
[자본금] |
13,412,374,000 |
13,366,039,500 |
13,214,581,000 |
|
[자본잉여금] |
80,184,735,710 |
76,781,934,115 |
72,575,759,799 |
|
[자본조정] |
522,316,571 |
725,678,042 |
1,189,992,460 |
|
[결손금] |
61,430,064,329 |
55,456,699,817 |
53,614,731,593 |
|
자본총계 |
32,689,361,952 |
35,416,951,840 |
33,365,601,666 |
|
매출액 |
370,658,340 |
294,124,200 |
179,484,500 |
|
영업이익(손실) |
(5,517,896,905) |
(6,419,346,568) |
(6,469,261,798) |
|
법인세비용차감전순이익(손실) |
(6,004,445,999) |
(2,103,269,702) |
(6,715,163,612) |
|
당기순이익(손실) |
(6,004,445,999) |
(1,749,497,491) |
(6,715,163,612) |
|
기타포괄손익 |
31,081,487 |
(92,470,733) |
21,407,236 |
|
총포괄손익 |
(5,973,364,512) |
(1,841,968,224) |
(6,693,756,376) |
|
기본주당손익(손실) |
(224) |
(66) |
(254) |
| 희석주당손익(손실) | (224) |
(66) |
(254) |
2. 연결재무제표
당사는 본 보고서 작성 기준일 현재 연결대상 종속회사가 없으므로 연결재무제표를 작성하지 않습니다.
3. 연결재무제표 주석
당사는 본 보고서 작성 기준일 현재 연결대상 종속회사가 없으므로 연결재무제표 주석을 작성하지 않습니다.
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 25 기 3분기말 2024.09.30 현재 |
|
제 24 기말 2023.12.31 현재 |
|
(단위 : 원) |
|
제 25 기 3분기말 |
제 24 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
48,506,123,193 |
42,485,859,393 |
|
현금및현금성자산 |
12,003,412,645 |
5,906,120,000 |
|
단기금융상품 |
25,990,000,000 |
32,990,000,000 |
|
매출채권 및 기타유동채권 |
1,023,708,095 |
453,869,384 |
|
파생상품자산 |
6,024,451,356 |
1,003,409,491 |
|
기타유동자산 |
3,464,551,097 |
2,132,460,518 |
|
비유동자산 |
2,521,269,888 |
2,633,253,540 |
|
당기손익-공정가치 측정 금융자산 |
674,596,072 |
674,596,072 |
|
유형자산 |
1,421,177,487 |
1,644,178,587 |
|
무형자산 |
99,142,200 |
43,579,068 |
|
기타비유동자산 |
324,560,009 |
269,105,693 |
|
기타채권 |
1,794,120 |
1,794,120 |
|
자산총계 |
51,027,393,081 |
45,119,112,933 |
|
부채 |
||
|
유동부채 |
807,141,183 |
810,184,714 |
|
매입채무 및 기타채무 |
691,103,617 |
747,000,478 |
|
기타 유동부채 |
116,037,566 |
63,184,236 |
|
비유동부채 |
17,530,889,946 |
8,891,976,379 |
|
장기기타채무 |
199,991,623 |
188,645,564 |
|
확정급여부채 |
1,289,435,413 |
1,203,077,591 |
|
장기종업원부채 |
61,950,998 |
53,056,088 |
|
파생상품부채 |
6,891,101,370 |
3,471,880,061 |
|
전환사채 |
9,088,410,542 |
3,975,317,075 |
|
부채총계 |
18,338,031,129 |
9,702,161,093 |
|
자본 |
||
|
자본금 |
13,412,374,000 |
13,366,039,500 |
|
자본잉여금 |
80,184,735,710 |
76,781,934,115 |
|
자본조정 |
522,316,571 |
725,678,042 |
|
이익잉여금(결손금) |
(61,430,064,329) |
(55,456,699,817) |
|
자본총계 |
32,689,361,952 |
35,416,951,840 |
|
자본과부채총계 |
51,027,393,081 |
45,119,112,933 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 25 기 3분기 2024.01.01 부터 2024.09.30 까지 |
|
제 24 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
(단위 : 원) |
|
제 25 기 3분기 |
제 24 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출액 |
370,658,340 |
294,124,200 |
||
|
매출원가 |
23,926,911 |
34,502,667 |
||
|
매출총이익 |
346,731,429 |
259,621,533 |
||
|
판매비와관리비 |
1,905,322,472 |
5,864,628,334 |
1,982,119,668 |
5,049,647,053 |
|
영업이익(손실) |
(1,905,322,472) |
(5,517,896,905) |
(1,982,119,668) |
(4,790,025,520) |
|
기타영업외수익 |
2,284 |
8,410,616 |
6,883,241 |
18,256,726 |
|
기타영업외비용 |
7 |
688,735 |
9 |
15 |
|
금융수익 |
352,806,428 |
1,071,716,889 |
598,767,405 |
3,345,193,520 |
|
금융비용 |
321,765,025 |
1,565,987,864 |
695,114,412 |
2,067,214,313 |
|
법인세비용차감전순이익(손실) |
(1,874,278,792) |
(6,004,445,999) |
(2,071,583,443) |
(3,493,789,602) |
|
당기순이익(손실) |
(1,874,278,792) |
(6,004,445,999) |
(2,071,583,443) |
(3,493,789,602) |
|
기타포괄손익 |
10,360,496 |
31,081,487 |
17,202,360 |
(33,310,977) |
|
후속기간에 당기손익으로 재분류되지 않는항목 |
10,360,496 |
31,081,487 |
17,202,360 |
(33,310,977) |
|
순확정급여부채의 재측정요소 |
10,360,496 |
31,081,487 |
17,202,360 |
(33,310,977) |
|
총포괄손익 |
(1,863,918,296) |
(5,973,364,512) |
(2,054,381,083) |
(3,527,100,579) |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(70.00) |
(224.00) |
(78.00) |
(131.00) |
|
희석주당이익(손실) (단위 : 원) |
(70.00) |
(224.00) |
(78.00) |
(131.00) |
4-3. 자본변동표
|
자본변동표 |
|
제 25 기 3분기 2024.01.01 부터 2024.09.30 까지 |
|
제 24 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
(단위 : 원) |
|
자본 |
|||||
|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
자본조정 |
이익잉여금 |
자본 합계 |
|
|
2023.01.01 (기초자본) |
13,214,581,000 |
72,575,759,799 |
1,189,992,460 |
(53,614,731,593) |
33,365,601,666 |
|
당기순이익(손실) |
(3,493,789,602) |
(3,493,789,602) |
|||
|
순확정급여부채의 재측정요소 |
(33,310,977) |
(33,310,977) |
|||
|
주식보상비용 |
194,812,090 |
194,812,090 |
|||
|
주식매수선택권 소멸 |
80,845,963 |
(80,845,963) |
|||
|
주식매수선택권 행사 |
123,500,000 |
759,809,500 |
(449,392,000) |
433,917,500 |
|
|
전환사채 발행 |
|||||
|
2023.09.30 (기말자본) |
13,338,081,000 |
73,416,415,262 |
854,566,587 |
(57,141,832,172) |
30,467,230,677 |
|
2024.01.01 (기초자본) |
13,366,039,500 |
76,781,934,115 |
725,678,042 |
(55,456,699,817) |
35,416,951,840 |
|
당기순이익(손실) |
(6,004,445,999) |
(6,004,445,999) |
|||
|
순확정급여부채의 재측정요소 |
31,081,487 |
31,081,487 |
|||
|
주식보상비용 |
40,883,452 |
40,883,452 |
|||
|
주식매수선택권 소멸 |
9,739,436 |
(9,739,436) |
|||
|
주식매수선택권 행사 |
46,334,500 |
388,070,527 |
(234,505,487) |
199,899,540 |
|
|
전환사채 발행 |
3,004,991,632 |
3,004,991,632 |
|||
|
2024.09.30 (기말자본) |
13,412,374,000 |
80,184,735,710 |
522,316,571 |
(61,430,064,329) |
32,689,361,952 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 25 기 3분기 2024.01.01 부터 2024.09.30 까지 |
|
제 24 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
(단위 : 원) |
|
제 25 기 3분기 |
제 24 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(5,696,089,910) |
(4,818,282,781) |
|
당기순이익(손실) |
(6,004,445,999) |
(3,493,789,602) |
|
영업활동 현금 중 수익ㆍ비용의 조정 |
1,254,374,689 |
(433,060,386) |
|
영업활동 현금 중 자산부채의 변동 |
(1,699,070,630) |
(1,204,754,821) |
|
이자의 수취 |
426,230,320 |
281,960,998 |
|
법인세납부(환급) |
(326,821,710) |
(31,361,030) |
|
투자활동현금흐름 |
1,820,789,091 |
7,925,671,305 |
|
단기금융상품의감소 |
7,000,000,000 |
18,185,510,958 |
|
단기금융상품의취득 |
(10,000,000,000) |
|
|
장기금융상품의 취득 |
25,000,000 |
|
|
당기손익-공정가치측정금융자산(유동)의 증감 |
(5,000,000,000) |
|
|
유형자산의 취득 |
(179,210,909) |
(272,634,400) |
|
무형자산의 취득 |
(12,205,253) |
|
|
재무활동현금흐름 |
9,972,593,464 |
215,345,854 |
|
주식매수선택권 행사 |
199,899,540 |
433,917,500 |
|
전환사채 발행 |
10,000,000,000 |
|
|
리스부채의 증가(감소) |
(227,306,076) |
(218,571,646) |
|
현금및현금성자산의 증감 |
6,097,292,645 |
3,322,734,378 |
|
기초 현금및현금성자산 |
5,906,120,000 |
2,386,315,374 |
|
기말 현금및현금성자산 |
12,003,412,645 |
5,709,049,752 |
5. 재무제표 주석
| 제 25(당)기 3분기말 2024년 9월 30일 현재 |
| 제 24(전)기 기말 2023년 12월 31일 현재 |
| 주식회사 차백신연구소 |
1. 회사의 개요
주식회사 차백신연구소(이하, "당사")는 백신류 및 진단시약의 개발 및 제조 등을 주요 사업 목적으로 하여 2000년 6월 9일 주식회사 두비엘의 사명으로 설립되었으며, 2011년 3월 24일 주식회사 두비엘에서 주식회사 차백신연구소로 상호를 변경하였습
니다.
한편, 당사는 경기도 성남시 둔촌대로 560 벽산테크노피아 406호에 본사를 두고 있
으며, 설립일 이후 수차의 증자를 거쳐 보고기간말 현재 납입자본금은 13,412백만원입니다. 당사는 2021년 10월 22일 코스닥시장에 상장되었으며, 보고기간말 현재 당사의 주요 주주는 다음과 같습니다.
당분기말 현재 당사의 주요 주주는 다음과 같습니다.
| (단위 : 주) | ||
|---|---|---|
| 구 분 | 소유주식수 | 지분율 |
| (주)차바이오텍 | 10,289,296 | 38.36% |
| (주)차메디텍 | 192,864 | 0.72% |
| 기타 | 16,342,588 | 60.92% |
| 합 계 | 26,824,748 | 100.00% |
2. 중요한 회계정책
2.1 재무제표 작성 기준
당사의 2024년 9월 30일로 종료하는 9개월 보고기간에 대한 분기재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었습니다. 이 중간재무제표는 연차재무제표에 기재되는 사항이 모두 포함되지 않았으므로 전기말 연차재무제표와 함께이해해야 합니다.
분기재무제표의 작성에 적용된 중요한 회계정책은 아래에서 설명하는 기준서나 해석서의 도입과 관련된 영향을 제외하고는 2023년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다.
2.1.1 당사가 채택한 제ㆍ개정 기준서 및 해석서
당사는 2024년 1월 1일로 개시하는 회계기간부터 다음의 제ㆍ개정 기준서 및 해석서를 신규로 적용하였습니다.
(1) 기업회계기준서 제1001호 '재무제표 표시' 개정 - 부채의 유동/비유동 분류, 약정사항이 있는 비유동부채
보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습 니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된경우는 제외됩니다. 또한, 기업이 보고기간말 후에 준수해야하는 약정은 보고기간말에 해당 부채의 분류에 영향을 미치지 않으며, 보고기간 이후 12개월 이내 약정사항을 준수해야하는 부채가 보고기간말 현재 비유동부채로 분류된 경우 보고기간 이후 12개월 이내 부채가 상환될 수 있는 위험에 관한 정보를 공시해야 합니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(2) 기업회계기준서 제1007호 '현금흐름표', 기업회계기준서 제1107호 '금융상품: 공시' 개정 - 공급자금융약정에 대한 정보 공시
공급자금융약정을 적용하는 경우, 재무제표이용자가 공급자금융약정이 기업의 부채와 현금흐름 그리고 유동성위험 익스포저에 미치는 영향을 평가할 수 있도록 공급자금융약정에 대한 정보를 공시해야 합니다. 이 개정내용을 최초로 적용하는 회계연도 내 중간보고기간에는 해당 내용을 공시할 필요가 없다는 경과규정에 따라 중간재무제표에 미치는 영향이 없습니다.
(3) 기업회계기준서 제1116호 '리스' 개정 - 판매후리스에서 생기는 리스부채
판매후리스에서 생기는 리스부채를 후속적으로 측정할 때 판매자-리스이용자가 보유하는 사용권 관련 손익을 인식하지 않는 방식으로 리스료나 수정리스료를 산정합니다. 해당 기준서의 제정이 재무제표에 미치는 중요한 영향은 없습니다.
(4) 기업회계기준서 제1001호 '재무제표 표시' 개정 - '가상자산 공시'
가상자산을 보유하는 경우, 가상자산을 고객을 대신하여 보유하는 경우, 가상자산을 발행한 경우의 추가 공시사항을 규정하고 있습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
2.1.2 당사가 적용하지 않은 제ㆍ개정 기준서 및 해석서
제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
(1) 기업회계기준서 제1021호 '환율변동효과'와 기업회계기준서 제1101호 '한국채택국제회계기준의 최초채택' 개정 - 교환가능성 결여
통화의 교환가능성을 평가하고 다른 통화와 교환이 가능하지 않다면 현물환율을 추정하며 관련 정보를 공시하도록 하고 있습니다. 동 개정사항은 2025년 1월 1일 이후 시작하는 회계연도부터 적용되며, 조기적용이 허용됩니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
2.2 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전이익에 적용하여 계산합니다.
3. 중요한 회계추정 및 가정
당사는 미래에 대하여 추정 및 가정을 하고 있습니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에서 합리적으로 예측 가능한 미래의 사건과 같은 다른 요소들을 고려하여 이루어집니다. 이러한 회계추정은 실제 결과와 다를 수도 있습니다.
분기재무제표 작성시 사용된 중요한 회계추정 및 가정은 법인세 비용을 결정하는데 사용된 추정의 방법을 제외하고는 전기 재무제표 작성에 적용된 회계추정 및 가정과 동일합니다.
4. 현금및현금성자산
당분기말 및 전기말 현재 현금및현금성자산의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 보유현금 | 142 | - |
| 요구불예금 등 | 12,003,271 | 5,906,120 |
| 합 계 | 12,003,413 | 5,906,120 |
5. 단기금융상품 및 당기손익-공정가치측정금융자산
(1) 당분기말 및 전기말 현재 단기금융상품의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 정기예적금(*) | 25,990,000 | 32,990,000 |
(*) 당분기말 및 전기말 현재 당사의 정기예적금 990,000천원이 당사 직원의 우리사주취득 자금 관련 담보로 제공되어있습니다.
(2) 당분기말 및 전기말 현재 당기손익-공정가치측정금융자산(비유동)의 구성내역은 다음과 같습니다.
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 주식수(출자좌수) | 당분기말 | 전기말 |
| 시장성없는 지분증권: | |||
| 케이비-솔리더스 헬스케어 투자조합 | 715주 | 674,596 | 674,596 |
(3) 당분기와 전기 중 당기손익-공정가치측정금융자산(비유동)의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 기초 | 674,596 | 440,000 |
| 취득 | - | 300,000 |
| 기타(출자금 감액 등) | - | (25,000) |
| 평가 | - | (40,404) |
| 기말 | 674,596 | 674,596 |
6. 매출채권및기타채권
당분기말 및 전기말 현재 매출채권및기타채권의 구성내역은 다음과 같습니다.
| (단위:천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 유동자산: | ||
| 미수금 | 173,043 | 223,542 |
| 미수수익 | 850,665 | 230,327 |
| 소 계 | 1,023,708 | 453,869 |
| 비유동자산: | ||
| 보증금 | 1,794 | 1,794 |
| 소 계 | 1,794 | 1,794 |
| 합 계 | 1,025,502 | 455,663 |
7. 기타자산
당분기말 및 전기말 현재 기타자산의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 |
당분기말 |
전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 선급금 | 3,313,384 | 324,560 | 1,646,540 | 269,106 |
| 선급비용 | 86,301 | - | 94,232 | - |
| 선급법인세 | 64,866 | - | 391,688 | - |
| 합 계 | 3,464,551 | 324,560 | 2,132,460 | 269,106 |
8. 유형자산
(1) 당분기말 및 전기말 현재 유형자산 장부금액의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||||||
| 취득원가 | 상각누계액 | 정부보조금 | 장부금액 | 취득원가 | 상각누계액 | 정부보조금 | 장부금액 | |
| 토지 | 95,089 | - | - | 95,089 | 95,089 | - | - | 95,089 |
| 건물 | 402,679 | (223,151) | - | 179,528 | 402,679 | (215,601) | - | 187,078 |
| 기계장치 | 1,908,612 | (1,054,867) | (28,011) | 825,734 | 1,734,912 | (812,404) | (33,262) | 889,246 |
| 비품 | 203,887 | (144,429) | - | 59,458 | 198,376 | (124,381) | - | 73,995 |
| 시설장치 | 156,555 | (115,711) | - | 40,843 | 156,555 | (108,676) | - | 47,879 |
| 사용권자산 | 355,438 | (134,913) | - | 220,525 | 355,438 | (4,546) | - | 350,892 |
| 합 계 | 3,122,260 | (1,673,071) | (28,011) | 1,421,177 | 2,943,049 | (1,265,608) | (33,262) | 1,644,179 |
(2) 당분기와 전기 중 유형자산 장부금액의 변동내역은 다음과 같습니다.
① 당분기
| (단위: 천원) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 토지 | 건물 | 기계장치 | 기계장치 (국고보조금) |
비품 | 시설장치 | 사용권자산 | 합 계 | |
| 부동산 | 차량운반구 | ||||||||
| 기초 | 95,089 | 187,078 | 922,508 | (33,262) | 73,995 | 47,879 | 332,059 | 18,833 | 1,644,179 |
| 취득 | - | - | 173,700 | - | 5,511 | - | - | - | 179,211 |
| 처분 | - | - | - | - | - | - | - | - | - |
| 감가상각 | - | (7,550) | (242,463) | 5,252 | (20,049) | (7,036) | (124,522) | (5,845) | (402,213) |
| 기말 | 95,089 | 179,528 | 853,745 | (28,011) | 59,458 | 40,843 | 207,537 | 12,988 | 1,421,177 |
② 전기
| (단위: 천원) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 토지 | 건물 | 기계장치 | 기계장치 (국고보조금) |
비품 | 시설장치 | 사용권자산 | 합 계 | |
| 부동산 | 차량운반구 | ||||||||
| 기초 | 95,089 | 197,145 | 936,847 | - | 70,853 | 57,259 | 170,904 | 14,486 | 1,542,583 |
| 취득 | - | - | 284,658 | (35,013) | 28,930 | - | 332,059 | 23,379 | 634,013 |
| 처분 등 | - | - | - | - | - | - | (7,645) | - | (7,645) |
| 감가상각 | - | (10,067) | (298,997) | 1,751 | (25,787) | (9,381) | (163,259) | (19,032) | (524,772) |
| 기말 | 95,089 | 187,078 | 922,508 | (33,262) | 73,995 | 47,879 | 332,059 | 18,833 | 1,644,179 |
9. 무형자산
(1) 당분기말 및 전기말 현재 무형자산 장부금액의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 |
당분기말 |
전기말 | ||||
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 특허권 | 253,444 | (154,302) | 99,142 | 181,920 | (138,341) | 43,579 |
(2) 당분기와 전기 중 무형자산 장부금액의 변동내역은 다음과 같습니다.
① 당분기
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 대체 | 기말 |
| 특허권 | 43,579 | - | (15,962) | 71,525 | 99,142 |
② 전기
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 대체 | 기말 |
| 특허권 | 39,908 | - | (8,535) | 12,205 | 43,579 |
(3) 무형자산상각비는 전액 판매비와관리비에 계상되었습니다.
(4) 비용으로 인식한 경상연구개발비 지출의 총액은 4,021백만원(전분기: 2,995백만원)입니다.
10. 매입채무및기타채무, 기타부채
(1) 당분기말 및 전기말 현재 매입채무및기타채무의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 |
당분기말 |
전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 미지급금 | 370,646 | - | 437,344 | - |
| 미지급비용 | 141,361 | - | 146,735 | - |
| 리스부채 | 179,096 | 199,992 | 162,921 | 188,646 |
| 합 계 | 691,103 | 199,992 | 747,000 | 188,646 |
(2) 당분기말 및 전기말 현재 기타부채의 구성내역은 다음과 같습니다.
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 |
당분기말 |
전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 예수금 | 68,038 | - | 63,183 | - |
| 선수금 | 48,000 | - | - | - |
| 합 계 | 116,038 | - | 63,183 | - |
(3) 당분기말 및 전기말 현재 리스부채의 세부내역은 다음과 같습니다.
① 당분기말
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 이자율 | 총장부금액 | 현재가치할인차금 | 순장부금액 |
| 차량 | 12.88% | 15,727 | (1,641) | 14,086 |
| 건물 | 12.68% | 400,416 | (35,414) | 365,002 |
| 합 계 | 416,143 | (37,055) | 379,088 | |
② 전기말
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 이자율 | 총장부금액 | 현재가치할인차금 | 순장부금액 |
| 차량 | 12.88% | 22,805 | (3,297) | 19,508 |
| 건물 | 12.68% | 400,416 | (68,357) | 332,059 |
| 합 계 | 423,221 | (71,654) | 351,567 | |
(4) 당분기와 전기 중 현재 리스부채의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전기 |
| 기초 | 351,567 | 397,740 |
| 신규발생 | - | 355,438 |
| 이자비용 | 34,598 | 28,863 |
| 상환 | (7,077) | (422,830) |
| 기타증감 | - | (7,645) |
| 기말 | 379,088 | 351,567 |
(5) 당분기말 현재 리스부채의 연도별 상환계획은 다음과 같습니다.
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 2024년 | 2025년 | 2026년 |
| 리스부채 | 190,442 | 184,837 | 3,808 |
(6) 당분기 중 리스와 관련된 총 현금유출은 227,306천원(전분기: 218,572천원)이며, 비용으로 인식한 소액리스 지출의 총액은 9,877천원(전분기: 13,919천원)입니다.
11. 전환사채
(1) 당분기말 및 전기말 현재 전환사채의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 액면금액 | - | 20,000,000 | - | 10,000,000 |
| 상환할증금 | - | 3,223,683 | - | 1,611,841 |
| 전환권조정 | - | (14,135,272) | - | (7,636,524) |
| 합 계 | - | 9,088,411 | - | 3,975,317 |
(2) 당분기 및 전기 중 전환사채의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전기 |
| 기 초 | 3,975,317 | 23,240,282 |
| 이자비용 | 771,516 | 2,601,889 |
| 발행 | 4,341,578 | 3,870,786 |
| 상환(*1) | - | (23,448,767) |
| 기타(*1) | - | (2,288,873) |
| 기 말 | 9,088,411 | 3,975,317 |
(*1) 전기 중 CB2회 및 CB3회에 대하여 채권자와의 조건 변경에 따라 채무조정이익을 인식하였으며, 이후 전량 재매입소각하였습니다.
(3) 당분기말 현재 발행된 전환사채의 발행조건은 다음과 같습니다.
|
구 분 |
CB 4회 | CB 5회 | |
|---|---|---|---|
|
사채발행총액 |
10,000,000,000원 | 10,000,000,000원 | |
| 차입처 | 제4회 무기명식 이권부 무보증 사모 전환사채 | 제5회 무기명식 이권부 무보증 사모 전환사채 | |
| 주당발행금액 | 5,470원 | 4,622원 | |
| 만기일 | 2028년 11월17일 | 2029년 09월05일 | |
| 만기이자율/표면이자율 | 3% / 0% | 3% / 0% | |
| 만기상환수익률 | 116.12% | 116.12% | |
| 발행일 | 2023년 11월17일 | 2024년 09월05일 | |
| 투자자의 상환청구권 | 청구기간 | 발행시점 부터 1년10개월 이후 | 발행시점 부터 1년10개월 이후 |
| 청구금액 | 발행가액+연복리3.0% | 발행가액+연복리3.0% | |
| 청구범위 | 전부 또는 일부 | 전부 또는 일부 | |
| 투자자의 전환청구권 (*1) | 전환청구기간 | 발행시점 1년 이후 | 발행시점 1년 이후 |
| 전환비율 | 사채 권면금액을 전환가액으로 나눈 주식수의 100% | 사채 권면금액을 전환가액으로 나눈 주식수의 100% | |
| 전환가격 | 5,470원 | 4,622원 | |
| 전환가액 조정 | N/A | N/A | |
| 기한상실의 이유 | 발행회사가 거래계약서상의 의무를 위반하는 등의 사유 발생시 | 발행회사가 거래계약서상의 의무를 위반하는 등의 사유 발생시 | |
| 매도청구권(Call Option) (*2) | 발행회사 또는 발행회사가 지정하는 자(이하 "제3자" 라 한다)는 2024년 11월 17일부터 2025년 11월 17일까지(이하 "매도청구권 행사기간" 이라 한다) 권면금액의 전부 또는 일부에 대하여 매도(조기상환을 포함하며, 이하 같음)를 청구할 수 있는 권리(이하 "매도청구권" 이라 한다)를 가진다. | 발행회사 또는 발행회사가 지정하는 자(이하 "제3자" 라 한다)는 2025년 09월 05일부터 2026년 09월 05일까지(이하 "매도청구권 행사기간" 이라 한다) 권면금액의 전부 또는 일부에 대하여 매도(조기상환을 포함하며, 이하 같음)를 청구할 수 있는 권리(이하 "매도청구권" 이라 한다)를 가진다. | |
(*1) 동 전환사채의 전환권은 전환권 행사로 발행될 주식수가 확정됨에 따라 자본으로 분류됐습니다.
(*2) 당분기말 현재 당사는 해당 콜옵션에 대해 제3자를 지정(양도)하지 않았습니다.
(4) 당분기말 및 전기말 현재 파생상품부채의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 비유동금융부채 : | ||
| 전환사채의 내재파생부채(*1) | 6,891,101 | 3,471,880 |
(*1) 당사는 상기 풋옵션의 경제적 특성과 위험이 주계약과 밀접하게 관련되지 않음에 따라, 주계약과 분리하여 파생상품부채로 분류하고 후속기간의 공정가치 변동은 당기손익으로 회계처리 하고 있습니다.
(5) 당분기말 및 전기말 현재 파생상품자산의 내역은 다음과 같습니다.
|
(단위: 천원) |
||
|
구 분 |
당분기말 | 전기말 |
| 유동금융자산 : | ||
| 매도청구권(*1) | 1,009,326 | 1,003,409 |
| 당기손익-공정가치측정금융자산 | 5,015,125 | - |
(*1) 당사는 상기 "발행자 또는 발행자가 지정하는 제3자의 매도청구권(콜옵션)"을 "전환사채 콜옵션 회계처리에 대한 감독지침"에 따라 별도의 파생상품자산으로 구분 반영하였습니다.
12. 종업원급여부채
(1) 당분기말 및 전기말 현재 종업원급여 관련부채의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
|
구 분 |
당분기말 | 전기말 |
|
확정급여채무의 현재가치 |
1,289,435 | 1,203,078 |
|
사외적립자산의 공정가치 |
- | - |
|
재무상태표상 순확정급여부채 |
1,289,435 | 1,203,078 |
| 장기종업원급여부채 | 61,951 | 53,056 |
(2) 당분기와 전기 중 확정급여부채의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전기 |
| 기초잔액 | 1,203,078 | 882,348 |
| 당기근무원가 | 257,996 | 255,299 |
| 이자원가 | 26,402 | 28,029 |
| 보험수리적손익: | ||
| - 인구통계적가정 | (3,453) | - |
| - 재무적가정 | 59,276 | 56,509 |
| - 경험적조정 | (86,905) | 35,963 |
| 퇴직급여 지급액 | (166,959) | (55,070) |
| 기말잔액 | 1,289,435 | 1,203,078 |
(3) 당분기와 전기 중 장기종업원급여부채의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전기 |
| 기초잔액 | 53,056 | 15,087 |
| 당기근무원가 | 11,357 | 3,841 |
| 이자원가 | 1,565 | 810 |
| 보험수리적손익: | - | |
| - 인구통계적가정 | (2,338) | |
| - 재무적가정 | 1,528 | 3,838 |
| - 기타 | (3,217) | 40,097 |
| 지급액 | - | (10,616) |
| 기말잔액 | 61,951 | 53,056 |
13. 자본금 및 자본잉여금
(1) 당분기말 및 전기말 현재 자본금의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 발행할 주식의 총수 | 50,000,000주 | 50,000,000주 |
| 1주당 액면금액 | 500원 | 500원 |
| 발행한 주식의 수(*) | 26,824,748주 | 26,732,079주 |
| 보통주 자본금 | 13,412,374 | 13,366,040 |
(*) 당분기말 현재 당사의 발행주식수 중 상법에 의하여 의결권이 제한돼 있는 주식수는 없습니다.
(2) 당분기말 및 전기말 현재 자본잉여금의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 주식발행초과금: | 62,177,771 | 61,789,701 |
| 기타자본잉여금: | 18,006,964 | 14,992,233 |
| -전환권대가 | 6,224,676 | 3,219,684 |
| -전환사채상환손익 | 11,740,049 | 11,740,049 |
| -주식매수선택권(행사기간종료) | 42,239 | 32,500 |
| 합 계 | 80,184,735 | 76,781,934 |
(3) 당분기와 전기 중 발행한 주식수의 변동과 자본금 및 자본잉여금의 변동내역은 다음과 같습니다.
| (단위: 천원) | |||
|---|---|---|---|
|
구 분 |
주식수 |
자본금 |
자본잉여금 |
| 전기초 | 26,429,162주 | 13,214,581 | 72,575,760 |
| 주식매수선택권 행사 | 302,917주 | 151,459 | 1,002,769 |
| 주식매수선택권 소멸 | - | - | (16,280) |
| 전환사채 발행 | - | - | 3,219,684 |
| 전기말 | 26,732,079주 | 13,366,040 | 76,781,934 |
| 당기초 | 26,732,079주 | 13,366,040 | 76,781,934 |
| 주식매수선택권 행사 | 92,669주 | 46,335 | 388,071 |
| 주식매수선택권 소멸 | - | - | 9,739 |
| 전환사채 발행 | - | - | 3,004,992 |
| 당분기말 | 26,824,748주 | 13,412,374 | 80,184,736 |
14. 주식기준보상
당사는 설립ㆍ경영ㆍ기술혁신 등에 기여하거나 기여할 수 있는 임직원 등을 대상으로 주식선택권을 주주총회 특별결의에 의하여 부여하였습니다.
(1) 당사가 부여한 주식선택권에 관한 주요사항은 다음과 같습니다.
| 구 분 | 제3회차 | 제4회차 | 제5회차 | 제6회차 |
|---|---|---|---|---|
| 권리부여일 | 2020.03.24 | 2020.09.28 | 2023.03.27 | 2024.03.28 |
| 부여주식수 | 440,000주 | 119,000주 | 80,000주 | 20,000주 |
| 부여주식의 종류 | 기명식 보통주 | 기명식 보통주 | 기명식 보통주 | 기명식 보통주 |
| 행사가격 | 2,170원 | 2,170원 | 5,756원 | 5,111원 |
| 약정용역제공기간 | 3년 | 3년 | 3년 | 3년 |
| 행사가능기간 | 2023.03.24~2028.03.23 | 2023.09.28~2028.09.27 | 2026.03.27~2031.03.26 | 2027.03.28~2032.03.27 |
(2) 당사는 주식선택권의 보상원가를 이항모형을 적용하여 산정하였으며, 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| 구 분 | 제3회차 | 제4회차 | 제5회차 | 제6회차 |
|---|---|---|---|---|
| 무위험이자율 | 1.63% | 1.31% | 3.24% | 3.42% |
| 기대주가변동성 | 51.20% | 56.90% | 52.50% | 46.60% |
| 존속기간 | 8년 | 8년 | 8년 | 8년 |
| 부여일의 공정가치 | 2,296원 | 2,923원 | 3,159원 | 2,812원 |
| 부여일의 주식가격 | 3,533원 | 4,169원 | 5,390원 | 5,060원 |
(3) 미행사 주식선택권의 변동
당분기말 및 전기말 현재 행사되지 않은 주식선택권의 수량과 가중평균행사가격은 다음과 같습니다.
| (단위: 주,원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 수량 | 가중평균행사가격 | 수량 | 가중평균행사가격 | |
| 기초 미행사분 | 349,083 | 2,878 | 607,000 | 2,008 |
| 기중 부여 | 20,000 | 5,111 | 80,000 | 5,756 |
| 기중 상실 | (23,332) | 5,244 | (35,000) | 2,170 |
| 기중 행사 | (92,669) | 2,170 | (302,917) | 1,839 |
| 기말 미행사분 | 253,082 | 3,253 | 349,083 | 2,878 |
(4) 당분기와 전기 중 주식선택권의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전기 |
| 기초금액 | 725,678 | 1,189,992 |
| 증가(당기비용인식액) | 40,883 | 216,045 |
| 주식선택권 소멸 | (9,739) | (80,846) |
| 주식선택권 행사 | (234,505) | (599,514) |
| 기말금액(*1) | 522,317 | 725,678 |
(*1) 자본조정으로 계상되어 있습니다.
(5) 당분기 및 전기 중 주식기준보상과 관련하여 발생한 보상원가의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전기 |
| 기인식한 주식보상비용 | 1,535,663 | 1,222,492 |
| 당기에 인식한 주식보상비용 | 40,883 | 216,045 |
| 당기에 소멸한 주식보상비용 | (9,739) | (97,126) |
| 잔여 주식보상비용 | 140,505 | 188,328 |
| 총 주식보상비용 | 1,707,312 | 1,529,740 |
15. 결손금
당분기말 및 전기말 현재 결손금의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
|
구 분 |
당분기말 |
전기말 |
|
미처리결손금 |
61,430,064 | 55,456,700 |
16. 매출액
당사의 주요 매출은 백신류 및 연구용 시약의 제조 및 판매 입니다.
(1) 당사는 매출과 관련해 포괄손익계산서에 다음 금액을 인식하였습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
|
구 분 |
당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 고객과의 계약에서 생기는 수익 | - | 370,658 | - | 294,124 |
| 기타 | - | - | - | - |
| 합 계 | - | 370,658 | - | 294,124 |
(2) 당사의 매출액을 주요 지리적시장, 주요 제품과 서비스계열 및 수익인식 시기에 따라 구분한 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 주요 지리적 시장 | ||||
| 국내 | - | - | - | - |
| 해외 | - | 370,658 | - | 294,124 |
| 합 계 | - | 370,658 | - | 294,124 |
| 주요 제품과 서비스계열 | ||||
| 연구용 시약판매 | - | 370,658 | - | 294,124 |
| 합 계 | - | 370,658 | - | 294,124 |
|
수익인식 시기 |
||||
|
한 시점에 이행 |
- | 370,658 | - | 294,124 |
|
기간에 걸쳐 이행 |
- | - | - | - |
|
합 계 |
- | 370,658 | - | 294,124 |
| 고객과의 계약에서 생기는 수익 | 370,658 | - | 294,124 | |
| 기타 | - | - | - | - |
| 합 계 | - | 370,658 | - | 294,124 |
17. 비용의 성격별 분류
당분기와 전분기 중 발생한 비용의 성격별 분류내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
|
구 분 |
당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 993,430 | 3,026,404 | 886,421 | 2,664,760 |
| 퇴직급여(장기종업원급여포함) | 97,764 | 293,293 | 74,290 | 246,821 |
| 경상연구개발비 | 458,071 | 1,312,444 | 628,019 | 735,820 |
| 감가상각비 | 134,179 | 402,212 | 133,132 | 394,219 |
| 무형자산상각비 | 3,661 | 15,962 | 2,215 | 6,397 |
| 지급수수료 | 108,603 | 358,134 | 101,222 | 405,628 |
| 주식보상비용 | 20,650 | 40,883 | 46,219 | 194,812 |
| 기타 | 88,964 | 439,223 | 110,601 | 435,693 |
| 매출원가 및 판매비와관리비 합계 | 1,905,322 | 5,888,555 | 1,982,119 | 5,084,150 |
18. 판매비와관리비
당분기와 전분기 중 판매비와관리비의 세부내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
|
구 분 |
당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 156,253 | 494,168 | 162,829 | 520,474 |
| 퇴직급여 | 17,439 | 52,318 | 15,698 | 46,607 |
| 복리후생비 | 38,841 | 131,899 | 28,531 | 118,484 |
| 여비교통비 | 16,241 | 166,467 | 27,831 | 155,702 |
| 접대비 | 16,140 | 60,523 | 38,510 | 97,405 |
| 감가상각비 | 134,179 | 402,212 | 133,132 | 394,219 |
| 지급임차료 | 5,465 | 22,230 | 5,161 | 15,755 |
| 보험료 | 5,981 | 16,209 | 6,135 | 21,505 |
| 경상연구개발비 | 1,361,122 | 4,020,895 | 1,396,462 | 2,994,847 |
| 운반비 | 1,413 | 4,167 | 1,085 | 2,840 |
| 교육훈련비 | 2,912 | 9,253 | 1,786 | 12,124 |
| 지급수수료 | 108,603 | 358,134 | 101,222 | 405,628 |
| 무형자산상각비 | 3,661 | 15,962 | 2,215 | 6,397 |
| 주식보상비용 | 20,650 | 40,883 | 46,219 | 194,812 |
| 건물관리비 | 3,801 | 13,117 | 4,065 | 11,856 |
| 기타 | 12,622 | 56,191 | 11,239 | 50,992 |
| 합 계 | 1,905,323 | 5,864,628 | 1,982,120 | 5,049,647 |
19. 기타영업외수익 및 기타영업외비용
당분기와 전분기 중 기타영업외수익 및 기타영업외비용의 세부내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 기타영업외수익: | ||||
| 잡이익 | 2 | 8,411 | 6,883 | 18,257 |
| 합 계 | 2 | 8,411 | 6,883 | 18,257 |
| 기타영업외비용: | ||||
| 잡손실 | - | 689 | - | - |
| 합 계 | - | 689 | - | - |
20. 금융수익 및 금융비용
당분기와 전분기 중 금융수익 및 금융비용의 세부내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 금융수익: | ||||
| 이자수익 | 337,681 | 1,046,568 | 551,301 | 1,653,594 |
| 파생상품평가이익 | - | - | - | 1,550,465 |
| 단기금융상품평가이익 | - | - | (61,047) | 29,953 |
| 단기금융상품처분이익 | - | - | 108,511 | 108,511 |
| 당기손익-공정가치측정금융자산 평가이익 | 15,125 | 15,125 | ||
| 외환차익 | - | 7,753 | 2 | 2,669 |
| 외화환산이익 | - | 2,271 | - | - |
| 합 계 | 352,806 | 1,071,717 | 598,767 | 3,345,192 |
| 금융비용: | ||||
| 이자비용 | 321,765 | 806,114 | 695,114 | 2,067,214 |
| 파생상품평가손실 | - | 759,874 | - | - |
| 합 계 | 321,765 | 1,565,988 | 695,114 | 2,067,214 |
21. 현금흐름표
(1) 당분기와 전분기의 영업활동 중 수익ㆍ비용의 조정 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
|
구 분 |
당분기 | 전분기 |
| 이자비용 | 806,114 | 2,067,214 |
| 퇴직급여(장기종업원급여 포함) | 293,293 | 246,821 |
| 감가상각비 | 402,212 | 394,219 |
| 무형자산상각비 | 15,962 | 6,397 |
| 주식보상비용 | 40,883 | 194,812 |
| 파생상품평가손실 | 759,874 | - |
| 이자수익 | (1,046,568) | (1,653,594) |
| 파생상품평가이익 | (15,125) | (1,550,465) |
| 단기금융상품평가이익 | - | (29,953) |
| 외화환산이익 | (2,270) | - |
| 단기금융상품처분이익 | - | (108,511) |
| 합 계 | 1,254,375 | (433,060) |
(2) 당분기와 전분기의 영업활동으로 인한 자산ㆍ부채의 변동내용은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 매출채권의 감소 | 2,270 | - |
| 미수금의 증가 | 50,499 | (9,796) |
| 선급금의 증가 | (1,793,822) | (900,802) |
| 선급비용의 감소(증가) | 7,931 | 16,854 |
| 미지급금의 증가(감소) | 153,530 | (423,977) |
| 선수금의 증가(감소) | 47,999 | 128,396 |
| 예수금의 증가 | 4,854 | 9,552 |
| 미지급비용의 증가(감소) | (5,373) | 33,872 |
| 퇴직금의 지급 | (166,959) | (48,237) |
| 장기종업원급여의 지급 | - | (10,616) |
| 합 계 | (1,699,071) | (1,204,754) |
(3) 당분기와 전분기 중 현금의 유입과 유출이 없는 중요한 거래는 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
|
구 분 |
당분기 | 전분기 |
| 리스부채의 유동성대체 | (11,346) | 18,397 |
| 선급금의 특허권 대체 | 71,525 | - |
| 주식매수선택권 행사분 계정대체 | 234,505 | - |
22. 우발채무 및 약정사항
(1) 당분기말 현재 당사가 타인으로부터 제공받은 담보 및 지급보증내역은 다음과 같습니다.
| (단위 : 천원) |
| 제공자 | 내용 | 제공금액 | 담보권자 |
|---|---|---|---|
| 서울보증보험 | 계약보증보험 | 12,696 | 한국보건산업진흥원 |
| 지급보증보험 | 130,838 | 한국원자력의학원, 한국보건산업진흥원 |
(2) 당분기말 현재 당사가 특수관계자를 포함하여 타인으로부터 제공받은 지급보증의 내역은 없습니다.
(3) 당분기말 현재 당사의 정기예적금 990,000천원이 당사 직원의 우리사주 취득 자금 관련 담보로 제공되어 있습니다.
(4) 당분기말 현재 진행 중인 중요한 소송 내역은 없습니다.
23. 특수관계자거래
(1) 당분기말 및 전기말 현재 당사의 특수관계자 현황은 다음과 같습니다.
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 지배기업 | (주)차바이오텍 | (주)차바이오텍 |
| 기타의 특수관계자 |
(주)차케어스, (주)차바이오에프앤씨, 엘바이오(주), CHA 의과대학교 분당차병원, CHA 의과대학교, CHA 의과대학교 산학협력단, 차움의원, (주)차메디텍, (주)서울CRO, 성광의료재단 차움건진의원, 케이비-솔리더스 헬스케어 투자조합, (주)CMG제약, 일산차병원, Matica Bio 등 | (주)차케어스, (주)차바이오에프앤씨, 엘바이오(주), CHA 의과대학교 분당차병원, CHA 의과대학교, CHA 의과대학교 산학협력단, 차움의원, (주)차메디텍, (주)서울CRO, 성광의료재단 차움건진의원, 케이비-솔리더스 헬스케어 투자조합, (주)CMG제약, 일산차병원 등 |
(2) 당분기와 전분기 중 특수관계자와의 주요 거래내역은 다음과 같습니다.
① 매출 및 매입거래 등
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 특수관계자명 | 거래내용 | 당분기 | 전분기 |
| 지배기업 | (주)차바이오텍 | 기타비용 | 45,386 | 49,512 |
| 이자비용 | 32,943 | 21,019 | ||
| 리스(사용권자산 변동) | - | (7,645) | ||
| 기타의특수관계자 | (주)차케어스 | 기타비용 | 18,248 | 23,208 |
| (주)차바이오에프앤씨 | 기타비용 | 3,036 | 6,900 | |
| 엘바이오(주) | 경상연구개발비 | 314,036 | 871,807 | |
| 기타비용 | - | 264 | ||
| 유형자산 취득 | 28,800 | 90,500 | ||
| (주)CMG제약 | 기타비용 | 1,818 | 909 | |
| CHA 의과대학교 분당차병원 | 기타비용 | 170 | 420 | |
| 경상연구개발비 | 27,755 | 46,168 | ||
| CHA 의과대학교 | 경상연구개발비 | 16,895 | 15,471 | |
| 기타비용 | 3,600 | 6,600 | ||
| (주)서울CRO | 경상연구개발비 | 48,950 | 6,830 | |
| 차움의원 | 기타비용 | 273 | 2,091 | |
| 일산차병원 | 기타비용 | 204 | - | |
| 성광의료재단 차움건진의원 | 기타비용 | 2 | 3 | |
| 차의과학대학교부속구미차병원 | 기타비용 | 227 | ||
| Matica Bio | 기타비용 | 8,156 | ||
② 자금거래
- 당분기
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 특수관계자명 | 거래내용 | 자금유입 | 자금유출 |
| 지배기업 | (주)차바이오텍 | 리스료의 지급 | - | (220,229) |
- 전분기
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 특수관계자명 | 거래내용 | 자금유입 | 자금유출 |
| 지배기업 | (주)차바이오텍 | 리스료의 지급 | - | (220,229) |
| 기타의특수관계자 | 케이비-솔리더스 헬스케어 투자조헙 | 출자금의 환급 | 25,000 | - |
(3) 당분기말 및 전기말 현재 특수관계자에 대한 채권 및 채무의 내역은 다음과 같습니다.
① 당분기말
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 미지급금 | 리스부채 |
| (주)차바이오텍 | 5,115 | 365,002 |
| (주)차케어스 | 3,951 | - |
| 엘바이오(주) | 12,680 | - |
| (주)서울CRO | 73 | - |
| 합 계 | 21,819 | 365,002 |
② 전기말
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 미지급금 | 리스부채 |
| (주)차바이오텍 | 203,464 | 332,059 |
| CHA 의과대학교 | 100 | - |
| (주)차바이오에프앤씨 | 523 | - |
| (주)차케어스 | 1,222 | - |
| 엘바이오(주) | 17,392 | - |
| CHA 의과대학교 분당차병원 | 17,217 | - |
| 일산차병원 | 36 | - |
| 합 계 | 239,954 | 332,059 |
(4) 당분기말 현재 당사가 특수관계자를 위하여 제공하고 있는 담보 및 보증은 없습니다.
(5) 당분기말 현재 당사가 특수관계자로부터 제공받고 있는 담보 및 보증 내역은 없습니다.
(6) 주요 경영진에 대한 보상
주요 경영진은 이사(등기 및 비등기), 이사회의 구성원, 재무책임자 및 내부감사 책임자를 포함하고 있습니다. 종업원 용역의 대가로서 주요 경영진에게 지급됐거나 지급될 보상금액은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
|
구 분 |
당분기 | 전분기 |
|
급여 및 기타단기급여 |
1,250,350 | 1,021,412 |
|
퇴직급여 |
103,480 | 78,166 |
| 주식보상비용 | 35,571 | 144,378 |
|
합 계 |
1,389,401 | 1,243,956 |
24. 금융상품의 범주별분류
(1) 당분기말 및 전기말 현재 금융자산과 금융부채의 범주별 분류는 다음과 같습니다.
① 당분기말
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 |
상각후원가 |
당기손익-공정가치 |
상각후원가 측정 금융부채 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 금융자산: | |||||
| 현금및현금성자산 | 12,003,413 | - | - | - | 12,003,413 |
| 매출채권및기타채권(*1) | 899,593 | - | - | - | 899,593 |
| 단기금융상품 | 25,990,000 | - | - | - | 25,990,000 |
| 당기손익-공정가치측정금융자산 | - | 674,596 | - | - | 674,596 |
| 파생상품자산 | - | 6,024,451 | - | - | 6,024,451 |
| 기타채권 | 1,794 | - | - | - | 1,794 |
| 합 계 | 38,894,800 | 6,699,047 | - | - | 45,593,847 |
| 금융부채: | |||||
| 매입채무및기타채무(*2) | - | - | 749,734 | - | 749,734 |
| 전환사채 | - | - | 9,088,411 | - | 9,088,411 |
| 파생상품부채 | - | - | - | 6,891,101 | 6,891,101 |
| 합 계 | - | - | 9,838,145 | 6,891,101 | 16,729,246 |
(*1) 부가세 환급금을 제외하였습니다.
(*2) 인건비 미지급비용을 제외하였습니다.
② 전기말
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 |
상각후원가 |
당기손익-공정가치 |
상각후원가 측정 금융부채 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 금융자산: | |||||
| 현금및현금성자산 | 5,906,120 | - | - | - | 5,906,120 |
| 매출채권및기타채권(*1) | 249,321 | - | - | - | 249,321 |
| 단기금융상품 | 32,990,000 | - | - | - | 32,990,000 |
| 당기손익-공정가치측정금융자산 | - | 674,596 | - | - | 674,596 |
| 파생상품자산 | - | 1,003,409 | - | - | 1,003,409 |
| 기타채권 | 1,794 | - | - | - | 1,794 |
| 합 계 | 39,147,235 | 1,678,006 | - | - | 40,825,241 |
| 금융부채: | |||||
| 매입채무및기타채무(*2) | - | - | 788,911 | - | 788,911 |
| 전환사채 | - | - | 3,975,317 | - | 3,975,317 |
| 파생상품부채 | - | - | - | 3,471,880 | 3,471,880 |
| 합 계 | - | - | 4,764,228 | 3,471,880 | 8,236,108 |
(*1) 부가세 환급금을 제외하였습니다.
(*2) 인건비 미지급비용을 제외하였습니다.
(2) 당분기 및 전분기 중 발생한 금융상품 범주별 순손익은 다음과 같습니다.
① 당분기
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 |
상각후원가 측정 |
상각후원가 측정 금융부채 |
당기손익-공정가치 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 이자수익 | 1,046,568 | - | - | - | 1,046,568 |
| 이자비용 | - | (806,114) | - | - | (806,114) |
| 파생상품평가손익 | - | - | (600,629) | (144,120) | (744,749) |
| 외화환산손익 | 2,270 | - | - | - | 2,270 |
| 외환차손익 | 7,753 | - | - | - | 7,753 |
| 합 계 | 1,056,591 | (806,114) | (600,629) | (144,120) | (494,272) |
② 전분기
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 |
상각후원가 측정 |
상각후원가 측정 금융부채 |
당기손익-공정가치 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 이자수익 | 1,653,594 | - | - | - | 1,653,594 |
| 이자비용 | - | (2,067,214) | - | - | (2,067,214) |
| 파생상품평가손익 | 29,953 | - | - | 1,550,465 | 1,580,418 |
| 처분손익 | 108,511 | - | 108,511 | ||
| 외환차손익 | - | 2,669 | - | - | 2,669 |
| 합 계 | 1,792,058 | (2,064,545) | - | 1,550,465 | 1,277,978 |
25. 위험관리
(1) 자본위험관리
당사의 자본 관리 정책은 투자자와 채권자, 시장의 신뢰 및 사업의 향후 발전을 위해 건전한 자본을 유지하는 것입니다. 경영진은 보통주 주주에 대한 배당의 수준과 자본수익률을 감독하고 있습니다.
당사는 조정된 자본과 조정된 부채의 비율을 사용하여 자본을 감독하고 있습니다. 당사의 당분기말과 전기말의 조정부채비율은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 부채총계 | 18,338,031 | 9,702,161 |
| 차감 : 현금및현금성자산 | (12,003,413) | (5,906,120) |
| 조정 부채 | 6,334,618 | 3,796,041 |
| 자본 총계 | 32,689,362 | 35,416,952 |
| 조정 부채 비율 | 19.38% | 10.72% |
(2) 금융위험관리
1) 위험관리체계
위험관리는 이사회에서 승인한 정책에 따라 재무부서의 주관으로 이루어지고 있습니다. 재무부서는 영업부서들과의 긴밀한 협조하에 재무위험을 식별하고 평가하고 관리합니다. 이사회는 전반적인 위험관리에 대한 원칙과 외환위험, 이자율 위험, 신용 위험, 파생금융상품과 비파생금융상품의 이용 및 유동성을 초과하는 투자와 같은 특정 분야에 관한 정책을 문서화하여 제공하고 있습니다.
2) 신용위험
신용위험은 기업 및 개인 고객에 대한 신용거래 및 채권 뿐 아니라 현금성자산, 채무상품의 계약 현금흐름, 유리한 파생상품 및 예치금 등에서도 발생합니다. 당사의 신용위험은 개별 고객, 산업, 지역 등에 대한 유의적인 집중은 없습니다. 당사가 보유하는 채무상품은 모두 낮은 신용위험의 상품에 해당합니다. 이러한 채무상품들에 대해서는 신용등급을 모니터링하여 신용위험의 하락을 평가하고 있습니다.
3) 유동성 위험
당사는 미사용 차입금 한도를 적정 수준으로 유지하고, 영업 자금 수요를 충족시키기위해 차입금 한도나 약정을 위반하는 일이 없도록 유동성에 대한 예측을 항시 모니터링하고 있습니다.
경영진은 예상현금흐름에 기초하여 추정되는 현금 및 현금성자산과 차입금 한도 약정을 모니터링하고 있습니다. 이러한 추정은 당사가 설정한 관행과 한도에 따라 각 영업회사의 지역별로 관리됩니다. 이러한 한도는 각 회사가 속한 지역 시장의 유동성상황을 고려하여 달리 책정됩니다. 또한 당사의 유동성 위험 관련 정책은 주요 통화별 필요 현금흐름을 추정하여 이를 충족하기 위한 유동성 자산의 현황을 고려하고, 유동성 비율을 내부 및 외부 감독 기관 등의 요구사항을 충족하고 자금조달계획을 실행하기 위해 관리합니다. 당사는 보고기간말 현재 차입금 한도 약정은 없습니다.
당분기말 및 전기말 현재 당사의 금융부채의 잔존계약 만기에 따른 만기분석내역은 다음과 같습니다. 유동성 위험분석에 포함된 금액은 할인되지 않은 현금흐름입니다.
① 당분기말
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 1년 이내 |
1년초과 |
2년 초과 |
합계 |
| 미지급금 | 370,646 | - | - | 370,646 |
| 미지급비용 | 141,361 | - | - | 141,361 |
| 리스부채 | 209,644 | 206,499 | - | 416,143 |
| 전환사채(*) | - | 21,231,960 | - | 21,231,960 |
| 합 계 | 721,651 | 21,438,459 | - | 22,160,110 |
(*) 전환사채의 조기상환권이 청구 가능한 가장 빠른 시기에 행사됨을 가정하였습니다.
② 전기말
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 1년 이내 |
1년초과 |
2년 초과 |
합계 |
| 미지급금 | 437,344 | - | - | 437,344 |
| 미지급비용 | 146,735 | - | - | 146,735 |
| 리스부채 | 209,644 | 209,644 | 3,932 | 423,220 |
| 전환사채 | - | 10,615,980 | - | 10,615,980 |
| 합 계 | 793,723 | 10,825,624 | 3,932 | 11,623,279 |
(3) 공정가치
① 공정가치 서열체계를 포함한 금융자산과 금융부채의 장부금액과 공정가치는 다음과 같습니다.
장부금액이 공정가치의 합리적인 근사치에 해당하여 공정가치를 측정하지 않은 금융자산과 금융부채에 대한 공정가치는 포함되어 있지 않습니다. 보고기간 중 각 공정가치 서열체계 수준 간 이동내역은 없습니다.
- 당분기말
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 |
장부금액 |
수준1 | 수준2 | 수준3 | 합 계 |
| 공정가치로 측정되는 금융자산: | |||||
| 당기손익인식금융자산 | 674,596 | - | - | 674,596 | 674,596 |
| 파생상품자산 | 6,024,451 | - | 5,015,125 | 1,009,326 | 6,024,451 |
| 공정가치로 측정되는 금융부채: | |||||
| 파생상품부채 | 6,891,101 | - | - | 6,891,101 | 6,891,101 |
- 전기말
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 |
장부금액 |
수준1 | 수준2 | 수준3 | 합 계 |
| 공정가치로 측정되는 금융자산: | |||||
| 당기손익인식금융자산 | 674,596 | - | - | 674,596 | 674,596 |
| 파생상품자산 | 1,003,409 | - | - | 1,003,409 | 1,003,409 |
| 공정가치로 측정되는 금융부채: | |||||
| 파생상품부채 | 3,471,880 | - | - | 3,471,880 | 3,471,880 |
② 가치평가기법과 유의적이지만 관측가능하지 않은 투입변수
수준2와 수준3의 공정가치 측정을 위해 사용된 평가기법과 유의적이지만 관측가능하지 않은 투입변수는 다음과 같습니다.
|
구 분 |
평가기법 |
유의적이지만 관측가능하지 않은 투입변수 |
공정가치측정과 유의적이지만 관측가능하지 않은 투입변수간 상호관계 |
|---|---|---|---|
| 당기손익인식금융자산 | 순자산가치법 | 순자산가치 | - |
| 파생상품자산 | TF모형 | 주가변동성,할인율 |
추정된 공정가치는 다음에 따라 증가(감소)됩니다. - 주가변동성이 높아지는 증가 - 할인율이 낮아지는(높아지는) 경우 |
| 파생상품부채 |
BDT모형 |
할인율 |
추정된 공정가치는 다음에 따라 증가(감소)됩니다. - 할인율이 낮아지는(높아지는) 경우 |
③ 당분기와 전기 중 수준3 공정가치의 변동내역은 다음과 같습니다.
- 당분기
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 증감 | 평가손익 | 기말 |
| 당기손익인식금융자산 | 674,596 | - | - | 674,596 |
| 파생상품자산 | 1,003,409 | 621,670 | (615,753) | 1,009,326 |
| 파생상품부채 | 3,471,880 | 3,275,101 | 144,120 | 6,891,101 |
- 전기
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 증감 | 평가손익 | 기말 |
| 당기손익인식금융자산 | - | 715,000 | (40,404) | 674,596 |
| 파생상품자산 | - | 885,832 | 117,577 | 1,003,409 |
| 파생상품부채 | 2,290,263 | 3,441,589 | (2,259,972) | 3,471,880 |
26. 주당손익
(1) 당분기와 전분기의 기본주당이익(손실)의 계산내역은 다음과 같습니다.
| (단위 : 원,주) |
| 구분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 보통주당기순이익(손실) | (1,874,278,792) | (6,004,445,999) | (2,071,583,443) | (3,493,789,602) |
| 가중평균유통보통주식수 | 26,824,748 | 26,791,314 | 26,676,162 | 26,581,631 |
| 기본주당이익(손실) | (70) | (224) | (78) | (131) |
(2) 가중평균유통보통주식수의 산정내역은 다음과 같습니다.
① 당분기
| 구분 | 날짜 | 주식수 | 가중치 | 적수 |
|---|---|---|---|---|
| 기초 | 2024-01-01 | 26,732,079 | 274 | 7,324,589,646 |
| 주식매수선택권 행사 | 2024-04-01 | 84,669 | 183 | 15,494,427 |
| 주식매수선택권 행사 | 2024-07-01 | 8,000 | 92 | 736,000 |
| 소계 | 7,340,820,073 | |||
| 일수 | 274 | |||
| 가중평균유통보통주식수 | 26,791,314 | |||
② 전분기
| 구분 | 날짜 | 주식수 | 가중치 | 적수 |
|---|---|---|---|---|
| 기초 | 2023-01-01 | 26,429,162 | 273 | 7,215,161,226 |
| 주식매수선택권 행사 | 2023-03-28 | 60,000 | 187 | 11,220,000 |
| 주식매수선택권 행사 | 2023-03-31 | 143,000 | 184 | 26,312,000 |
| 주식매수선택권 행사 | 2023-06-30 | 44,000 | 93 | 4,092,000 |
| 소계 | 7,256,785,226 | |||
| 일수 | 273 | |||
| 가중평균유통보통주식수 | 26,581,631 | |||
(3) 당분기, 전분기는 희석효과가 없음에 따라 희석주당순이익은 기본주당순이익과 동일합니다.
6. 배당에 관한 사항
가. 배당에 관한 사항
당사의 정관에 기재된 배당에 관한 사항은 다음과 같습니다.
| 정관규정 | 내용 |
|---|---|
|
제10조의4 |
회사가 유상증자, 무상증자 및 주식배당에 의하여 신주를 발행하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업 연도 직전영업 연도 말에 발행된 것으로 본다. |
| 제44조 (이익금의 처분) |
회사는 매 사업년도말의 처분전 이익잉여금을 다음과 같이 처분한다. 1. 이익준비금 2. 기타의 법정적립금 3. 배당금 4. 임의적립금 |
|
제45조 |
① 이익배당은 금전 또는 금전 외의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. ③ 제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익배당은 주주총회의 결의로 정한다. |
|
제45조의2 |
① 회사는 이사회의 결의로 사업연도 개시일부터 3월·6월 및 9월의 말일(이하 “분기배당 기준일”이라 한다)의 주주에게 자본시장과 금융투자업에 관한 법률 제165조의12에 따라 분기배당을 할 수 있다. ② 제1항의 이사회 결의는 분기배당 기준일 이후 45일 내에 하여야 한다. ③ 분기배당은 직전 결산기의 대차대조표상의 순자산액에서 다음 각호의 금액을 공제한 액을 한도로 한다. 1. 직전결산기의 자본금의 액 2. 직전결산기까지 적립된 자본준비금과 이익준비금의 합계액 3. 직전결산기의 정기주주총회에서 이익배당하기로 정한 금액 4. 직전결산기까지 정관의 규정 또는 주주총회의 결의에 의하여 특정목적을 위해 적립한 임의준비금 5. 상법 시행령 제19조에서 정한 미실현이익 6. 분기배당에 따라 당해 결산기에 적립하여야 할 이익준비금의 합계액 ④ 사업연도 개시일 이후 분기배당 기준일 이전에 신주를 발행한 경우(준비금의 자본전입, 주식배당, 전환사채의 전환청구, 신주인수권부사채의 신주인수권 행사에 의한 경우를 포함한다)에는 분기배당에 관해서는 당해 신주는 직전사업연도 말에 발행된 것으로 본다. 다만, 분기배당 기준일 후에 발행된 신주에 대하여는 최근 분기배당 기준일 직후에 발행된 것으로 본다. ⑤ 제8조의2 내지 제8조의4의 종류주식에 대한 분기배당은 보통주식과 동일한 배당률을 적용한다. |
|
제46조 |
① 배당금의 지급청구권은 5년간 이를 행사하지 아니하면 소멸시효가 완성된다. ② 제1항의 시효의 완성으로 인한 배당금은 이 회사에 귀속한다. |
나. 최근 3사업연도 배당에 관한 사항
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제25기 3분기 | 제24기 | 제23기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | -6,004 | -1,749 | -6,715 | |
| (별도)당기순이익(백만원) | - | - | - | |
| (연결)주당순이익(원) | -224 | -66 | -254 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | 보통주 | - | - | - |
| 우선주 | - | - | - | |
| 주식배당수익률(%) | 보통주 | - | - | - |
| 우선주 | - | - | - | |
| 주당 현금배당금(원) | 보통주 | - | - | - |
| 우선주 | - | - | - | |
| 주당 주식배당(주) | 보통주 | - | - | - |
| 우선주 | - | - | - | |
다. 과거 배당 이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 증자(감자)현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2021년 10월 16일 | - | 보통주 | 4,040,909 | 500 | 11,000 | (*1) |
| 2023년 03월 28일 | 주식매수선택권행사 | 보통주 | 60,000 | 500 | 500 | - |
| 2023년 03월 31일 | 주식매수선택권행사 | 보통주 | 143,000 | 500 | 2,170 | - |
| 2023년 06월 30일 | 주식매수선택권행사 | 보통주 | 44,000 | 500 | 2,170 | - |
| 2023년 10월 04일 | 주식매수선택권행사 | 보통주 | 55,917 | 500 | 2,170 | - |
| 2024년 04월 01일 | 주식매수선택권행사 | 보통주 | 84,669 | 500 | 2,170 | - |
| 2024년 07월 01일 | 주식매수선택권행사 | 보통주 | 8,000 | 500 | 2,170 | - |
(*1) 2021년 10월 16일 주식발행 내용은 IPO(기업공개)에 의한 증자로 발행된 주식입니다.
나. 미상환 전환사채 발행현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
|
제4회 무기명 |
4 | 2023.11.17 | 2028.11.17 | 10,000,000,000 | 기명식 보통주 | 2024.11.17 ~ 2028.10.17 | 100 |
5,470 |
10,000,000,000 | 1,828,150 | - |
|
제5회 무기명 |
5 | 2024.09.05 | 2029.09.05 | 10,000,000,000 | 기명식 보통주 | 2025.09.05 ~ 2029.08.05 | 100 | 4,622 | 10,000,000,000 | 2,163,565 | - |
| 합 계 | - | - | - | 20,000,000,000 | - | - | - | - | 20,000,000,000 | 3,991,715 | - |
다. 미상환 신주인수권부사채 등 발행현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 행사대상 주식의 종류 |
신주인수권 행사가능기간 | 행사조건 | 미상환 사채 |
미행사 신주 인수권 |
비고 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사비율 (%) |
행사가액 | 권면(전자등록)총액 | 행사가능주식수 | ||||||||
| - | - | - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - | - | - |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
라. 미상환 전환형 조건부자본증권 발행현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, 주) |
| 구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 주식 전환의 사유 |
주식 전환의 범위 |
전환가액 | 주식전환으로 인하여 발행할 주식 |
비고 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 종류 | 수 | |||||||||
| - | - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - | - |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
| [채무증권의 발행 등과 관련된 사항] |
가. 채무증권 발행실적
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 기업어음증권 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
다. 단기사채 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
라. 회사채 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | 20,000 | - | - | 20,000 | |
| 합계 | - | - | - | - | 20,000 | - | - | 20,000 | |
마. 신종자본증권 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
바. 조건부자본증권 미상환 잔액
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 기업공개(코스닥시장상장) | - | 2021년 10월 15일 | 임상 및 연구개발 자금 | 28,451 |
임상 및 연구개발 자금 |
10,104 | (*1) |
| 기업공개(코스닥시장상장) | - | 2021년 10월 15일 | 운영자금(인건비 및 기타운영자금) | 15,999 | 운영자금(인건비 및 기타운영자금) | 15,999 | (*1) |
(*1) 기업공개 완료에 의한 전체 조달금액은 44,450백만원(상장주선인의 의무인수금액 포함)으로, 5개년의 사업계획을 바탕으로 산출되었습니다. 2021년 10월 기업공개로 인한 공모 이후 본 보고서 작성기준일까지 사용한 금액은 26,103백만원입니다. 향후 파이프라인 확대와 임상진행 및 운영자금으로 사용되어질 계획입니다.
나. 사모자금의 사용내역
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 전환사채 | 4회차 | 2023년 11월 17일 | 운영자금 | 10,000 | 운영자금 | 5,209 | (*1) |
| 전환사채 | 5회차 | 2024년 09월 05일 | 운영자금 | 10,000 | 운영자금 | - | (*1) |
(*1) 향후 파이프라인 확대와 임상진행 및 운영자금으로 사용되어질 계획입니다.
다. 미사용자금의 운용내역
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 |
정기예금(우리은행) |
7,000 |
2023년 10월 ~ 2024년 10월 |
12개월 |
| 예ㆍ적금 |
정기예금(우리은행) |
5,000 | 2023년 11월 ~ 2024년 11월 |
11개월 |
| 예ㆍ적금 |
정기예금(우리은행) |
10,000 | 2023년 12월 ~ 2024년 12월 |
10개월 |
| 예ㆍ적금 | 원화RP매수 ( NH투자증권 ) | 5,000 | 2024년 07월 ~ 2024년 10월 | 3개월 |
| 예ㆍ적금 |
정기예금(우리은행) |
1,000 | 2024년 08월 ~ 2024년 11월 |
2개월 |
| 예ㆍ적금 | 정기예금(우리은행) | 2,000 | 2024년 09월 ~ 2024년 12월 | 1개월 |
| 예ㆍ적금 | 정기예금(우리은행) | 3,000 | 2024년 09월 ~ 2025년 03월 | 1개월 |
| 예ㆍ적금 |
우리은행 MMDA 등 |
138 | - | - |
| 계 | 33,138 | - | ||
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
(1) 재무제표를 재작성한 경우 재작성 사유, 내용 및 재무제표에 미치는 영향
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
(2) 합병, 분할, 자산양수도, 영업양수도
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
(3) 자산유동화와 관련한 자산매각의 회계처리 및 우발채무 등에 관한 사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
(4) 기타 재무제표 이용에 유의하여야 할 사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 대손충당금 설정현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
다. 재고자산 현황 등
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
라. 수주계약 현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
마. 공정가치평가 내역
당사는 금리위험, 가격위험, 환위험 등 다양한 시장위험에 노출되어 있습니다. 당사는 이러한 위험요소들을 관리하기 위하여 각각의 위험요인에 대해 면밀하게 모니터링하고 대응하는 위험관리 정책을 운용하고 있습니다. 이에 대한 자세한 사항은 III. 재무에 관한 사항 - 5. 재무제표 주석을 참조하시기 바랍니다.
IV. 이사의 경영진단 및 분석의견
※ 기업공시서식 작성기준에 따라, 분/반기 보고서의 경우에는 본 항목을 기재하지 않습니다.
V. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
가. 회계감사인의 감사의견 등
(1) 회계감사인의 명칭 및 감사의견
| 사업연도 | 감사인 | 감사의견 | 강조사항 등 | 핵심감사사항 |
|---|---|---|---|---|
| 제25기 (당기) | 서우회계법인 | - | - | - |
| 제24기 (전기) | 한울회계법인 | 적정 | - | (*1) |
| 제23기 (전전기) | 한울회계법인 | 적정 | - | (*2) |
|
(*1) 제24기 핵심감사사항 재무제표 주석26에 기술되어 있는 바와 같이, 2023년 12월 31일 현재 공정가치 수준3으로 분류되는 파생상품부채는 3,472백만원, 파생상품자산은 1,003백만원이며, 당기에 인식한 파생상품평가손익은 2,378백만원입니다. 공정가치 수준 3으로 분류한 금융상품은 재무제표 주석26에서 기술되어 있는 바와 같이, 다양한 평가기법과 변수들을 사용합니다. 이 때 경영진이 평가기법 및 관측가능하지 않은 투입변수를 어떻게 결정하는지에 따라 측정결과가 유의적으로 변동하게되므로 회계추정의 불확실성이 존재합니다. 공정가치 수준3으로 분류되는 상품의 경우 그 특성 상 평가기법이 복잡하고, 투입변수 및 가정 등에 경영진의 추정과 판단이 포함되는 점을 고려하여 핵심감사사항으로 선정하였습니다
- 회사 경영진의 외부전문가 활용을 포함한 공정가치 측정프로세스와 관련된 내부통제에 대한 이해 및 평가 - 회사가 고용한 외부전문가의 적격성, 독립성 검토 - 평가에 사용되는 주요 변수의 합리성 검토 |
|
(*2) 제23기 핵심감사사항 핵심감사사항은 우리의 전문가적 판단에 따라 당기 재무제표감사에서 가장 유의적인사항들입니다. 해당 사항들은 재무제표 전체에 대한 감사의 관점에서 우리의 의견형성 시 다루어졌으며, 우리는 이런 사항에 대하여 별도의 의견을 제공하지는 않습니다. 재무제표 주석26에 기술되어 있는 바와 같이, 2022년 12월 31일 현재 공정가치 수준3으로 분류되는 파생상품부채는 2,290백만원이며, 당기에 인식한 파생상품평가손익은1,109백만원입니다. 공정가치 수준 3으로 분류한 금융상품은 재무제표 주석26에서 기술되어 있는 바와 같이, 다양한 평가기법과 변수들을 사용합니다. 이 때 경영진이 평가기법 및 관측가능하지 않은 투입변수를 어떻게 결정하는지에 따라 측정결과가 유의적으로 변동하게되므로 회계추정의 불확실성이 존재합니다. 공정가치 수준3으로 분류되는 상품의 경우 그 특성 상 평가기법이 복잡하고, 투입변수 및 가정 등에 경영진의 추정과 판단이 포함되는 점을 고려하여 핵심감사사항으로 선정하였습니다
- 회사 경영진의 외부전문가 활용을 포함한 공정가치 측정프로세스와 관련된 내부통제에 대한 이해 및 평가 - 회사가 고용한 외부전문가의 적격성, 독립성 검토 - 평가에 사용되는 주요 변수의 합리성 검토 |
(2) 감사용역 체결현황
| (단위 : 백만원) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제25기 (당기) | 서우회계법인 | 회계감사 | 65 | 671 | - | 175 |
| 제24기 (전기) | 한울회계법인 | 회계감사 | 72 | 655 | 72 | 655 (총소요시간) 655 (감사) |
| 제23기 (전전기) | 한울회계법인 | 회계감사 | 63 | 667 | 63 | 667 (총소요시간) 667 (감사) |
(3) 회계감사인과의 비감사용역 계약체결 현황
| (단위 : 백만원) |
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제25기 (당기) | - | - | - | - | - |
| 제24기 (전기) | 2023.02.02 2023.11.10 |
법인세 및 지방세 관련 세무조정 법인세 및 지방세 관련 세무조정 |
23.02~23.03 24.02~24.03 |
8 8 |
한울회계법인 한울회계법인 |
| 제23기 (전전기) | 2022.02.16 | 법인세 및 지방세 관련 세무조정 | 22.02~22.03 | 5 | 한울회계법인 |
(4) 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 내부감사기구가 회계감사인과 논의한 결과
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| - | - | - | - | - |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 회계감사인의 변경
| 회계연도 | 기존 감사인 | 변경 감사인 | 변경사유 |
|---|---|---|---|
| 2021 | 삼정회계법인 | 호연회계법인 | 지정감사 종료 후 자유선임에 따른 변경 |
| 2021 | 호연회계법인 | 한울회계법인 | 코스닥시장 상장에 따른 상장사 가능 감사인으로의 변경 |
| 2024 | 한울회계법인 | 서우회계법인 | 감사 계약기간 만료(3개 사업년도)에 따른 신규 감사인 선정 |
2. 내부통제에 관한 사항
가. 내부회계관리자가 제시한 내부회계관리제도의 문제점 또는 개선방안
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 회계감사인의 내부회계관리제도에 대한 의견
| 사업연도 | 감사인 | 감사의견 및 검토의견 | 지적사항 |
|---|---|---|---|
| 제25기 (당기) |
서우회계법인 | - | - |
| 제24기 (전기) |
한울회계법인 | [검토의견] 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의 운영실태보고 내용이 중요성의 관점에서 '내부회계관리제도 평가 및 보고 모범규준’의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제23기 (전전기) |
한울회계법인 | [검토의견] 경영자의 운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 ‘중소기업에 대한 적용’의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
다. 회계감사인의 내부회계관리제도를 제외한 내부통제구조의 평가내용
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
VI. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사회의 구성 개요
(1) 이사의 수 및 이사회의 구성현황
본 보고서 작성 기준일 현재, 당사의 이사회는 사내이사 3인, 사외이사 1인으로 총 4인의 이사로 구성되어 있으며, 의장은 대표이사인 염정선이 수행하고 있습니다.
이사회는 법령 또는 정관에 정하여진 사항, 주주총회로부터 위임받은 사항, 회사경영의 기본방침 및 업무집행에 관한 중요사항을 의결하며 이사 및 경영진의 직무의 집행을 감독하고 있습니다.
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 4 | 1 | - | - | - |
(2) 이사회의 운영 규정
| 조항 | 내용 |
|---|---|
| 제3조 권한 |
1. 이사회는 법령 또는 정관에 정하여진 사항, 주주총회로부터 위임받은 사항, 본 규정 제12조에 열거한 업무집행에 관한 사항, 기타 회사경영의 기본방침 및 업무집행에 관한 중요사항을 의결한다. 2. 본 규정에서 이사회의 결의사항으로 정하여지지 않은 업무집행에 관한 사항은 대표이사에게 일임한다. 3. 이사회는 이사의 직무의 집행을 감독한다. |
| 제4조 구성 |
1. 이사회는 이사 전원으로 구성하며, 법령 및 정관에 의하여 선임된 사외이사를 포함한다. 2. 이사회의 구성원은 3인 이상으로 한다. |
| 제5조 의장 |
1. 이사회의 의장은 대표이사로 한다. 2. 대표이사가 궐위되거나 사고로 인하여 의장의 직무를 행할 수 없을 때에는 이사회 구성원인 이사 중 대표이사가 아닌 사장, 부사장, 전무이사, 상무이사, 대표이사가 지명한 이사의 순으로 그 직무를 대행한다. |
| 제11조 결의방법 |
1. 이사회의 결의는 법령에 다른 정함이 있는 경우를 제외하고는 재적 이사 과반수의 출석과 출석이사 과반수로 한다. 2. 이사회는 이사의 전부 또는 일부가 직접 회의에 출석하지 아니하고 모든 이사가 음성을 동시에 송, 수신하는 원격통신수단에 의하여 결의에 참가하는 것을 허용할 수 있으며, 이 경우 당해 이사는 이사회에 직접 출석한 것으로 본다. 3. 이사회의 결의에 관하여 특별한 이해관계가 있는 이사는 의결권을 행사하지 못한다. 4. 본 조 제3항의 규정에 의하여 의결권을 행사할 수 없는 이사의 수는 출석한 이사의 수에 산입하지 아니한다. |
| 제12조 부의사항 |
1. 이사회에 부의할 사항은 다음과 같다. (1) 주주총회에 관한 사항 1) 주주총회의 소집 2) 영업보고서의 승인 3) 재무제표의 승인 4) 정관의 변경 5) 자본의 감소 6) 회사의 해산, 합병, 분할합병, 회사의 계속 7) 주식의 소각 8) 회사의 영업 전부 또는 중요한 일부의 양도 및 다른 회사의 영업 전부의 양수 9) 영업 전부의 임대 또는 경영위임, 타인과 영업의 손익 전부를 같이하는 계약, 기타 이에 준할 계약의 체결이나 변경 또는 해약 10) 이사, 감사의 선임 및 해임 11) 주식의 액면미달발행 12) 이사의 회사에 대한 책임의 면제 13) 주식배당 결정 14) 주식매수선택권의 부여 15) 이사, 감사의 보수 16) 회사의 최대주주 및 특수관계인과의 거래의 승인 및 주주총회에의 보고 17) 기타 주주총회에 부의할 의안 (2) 경영에 관한 사항 1) 회사경영의 기본방침의 결정 및 변경 2) 신규사업 또는 신제품의 개발 3) 자금계획 및 기본예산운용 4) 대표이사의 선임 및 해임 5) 사장, 부사장, 전무이사, 상무이사, 이사의 선임 및 해임 6) 공동대표이사의 결정 7) 이사회 내 위원회의 설치, 운영 및 폐지 8) 이사회 내 위원회의 선임 및 해임 9) 이사회 내 위원회의 결의사항에 대한 재결의 10) 지배인의 선임 및 해임 11) 임직원의 채용계획 및 훈련의 기본방침 12) 임직원의 급여체계, 상여 및 후생제도 13) 노조정책에 관한 중요사항 14) 회사 조직에 관련된 규정의 제정 및 개폐 15) 사규, 사칙의 규정 및 개폐 16) 지점, 공장, 사무소의 설치 이전 또는 폐지 17) 간이합병, 간이분할합병, 소규모합병 및 소규모분할합병의 결정 18) 흡수합병 또는 신설합병의 보고 (3) 재무에 관한 사항 1) 투자에 관한 사항 2) [전년도 자산총계의 10%] 이상의 중요한 계약의 체결 3) [전년도 자산총계의 10%] 이상의 중요한 재산의 취득 및 처분 4) 결손의 처분 5) [전년도 자산총계의 10%] 이상의 중요시설의 신설 및 개폐 6) 신주의 발행 7) 사채의 모집 8) 준비금의 자본전입 9) 전환사채의 발행 10) 신주인수권부사채의 발행 11) [전년도 자산총계의 10%] 이상의 자금차입 및 [전년도 자산총계의 10%] 이상의 채무보증을 포함한 보증행위 12) [전년도 자산총계의 10%] 이상의 재산에 대한 저당권, 질권의 설정 (4) 이사에 관한 사항 1) 이사와 회사간 거래의 승인 2) 타회사의 임직원 겸임 (5) 기 타 1) 중요한 소송의 제기 2) 주식매수선택권 부여의 취소 3) 기타 법령 또는 정관에 정하여진 사항, 주주총회에서 위임받은 사항 및 대표이사가 필요하다고 인정하는 사항
(1) 이사회 내 위원회에 위임한 사항의 처리결과 (2) 이사가 법령 또는 정관에 위반한 행위를 하거나 그 행위를 할 염려가 있다고 감사가 인정한 사항 (3) 기타 경영상 중요한 업무집행에 관한 사항 |
| 제17조 의사록 |
1. 이사회의 의사에 관하여는 의사록을 작성한다. 2. 의사록에는 의사의 안건, 경과요령, 그 결과, 반대하는 자와 그 반대이유를 기재하고 출석한 이사 및 감사가 기명날인 또는 서명한다. 3. 주주는 영업시간 내에 이사회 의사록의 열람 또는 등사를 청구할 수 있다. 4. 회사는 본 조 제3항의 청구에 대하여 이유를 붙여 이를 거절할 수 있다. 이 경우 주주는 법원의 허가를 얻어 이사회 의사록을 열람 또는 등사할 수 있다. |
나. 중요의결사항 등
| 구분 | 일 자 | 주요안건 | 가결 여부 |
사내이사 | 기타비상무이사 | 사외이사 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 염정선 | 고정재 | 조정기 | 박민식 | 신동철 | 오대규 | 백용하 | ||||
| 출석률 100% |
출석률 100% |
출석률 100% |
출석률 50% |
출석률 50% |
출석률 50% |
출석률 100% |
||||
| 찬 반 여 부 | ||||||||||
| 1 | 2024.02.14 | [보고안건] 1. 대표이사의 [내부회계관리제도 설계 및 운영실태] 보고의 건 2. 감사의 [내부회계관리제도 운영실태 평가] 보고의 건 [부의안건] 1. 영업보고서, 제24기(2023년 01월 01일부터 2023년 12월 31일까지) 재무제표 승인의 건 |
가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 |
| 2 | 2024.03.13 | 1. 제24기 정기주주총회 소집의 건 | 가결 | 찬성 | 찬성 | 찬성 | - | - | - | 찬성 |
| 3 | 2024.09.04 | 1. 전환사채 발행의 건 | 가결 | 찬성 | 찬성 | 찬성 | - | - | - | 찬성 |
| 4 | 2024.09.26 | 1. 당사 직원들의 우리사주 계속 보유를 위한 예금담보 제공 기간 연장의 건 | 가결 | 찬성 | 찬성 | 찬성 | - | - | - | 찬성 |
※ 사외이사 오대규, 기타비상무이사 박민식/신동철은 2024년 3월 24일 임기만료 및 사임하였습니다.
다. 이사회내 위원회
당사는 본 보고서 작성 기준일 현재 이사회 내 위원회가 없습니다.
라. 이사의 독립성
이사는 주주총회에서 선임하며 주주총회에서 선임할 이사 후보자는 이사회나 주주제안을 통해 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다. 또한 독립성을 확보하기 위해 주주총회 전 이사 후보의 인적사항 등을 외부에 공시하고 있습니다.
| 직명 | 성명 | 임기 (연임횟수) |
선임배경 | 추천인 | 담당업무 | 회사와의 거래 |
최대주주와의 관계 |
|---|---|---|---|---|---|---|---|
| 사내이사 | 염정선 | '14.03~'26.03 (3회) |
회사의 주사업과 관련한 핵심 역량을 갖춘 바이오 전문가 | 이사회 | 경영총괄 | - | - |
| 사내이사 | 조정기 | '19.03~'25.03 (1회) |
전략기획 및 재무 전문가 | 이사회 | CFO | - | - |
| 사내이사 | 고정재 | '17.03~'26.03 (2회) |
회사의 주사업과 관련한 연구개발 전문가 | 이사회 | 연구개발 | - | - |
| 사외이사 | 백용하 | '22.03~'25.03 | 법률 전문가 | 이사회 | 자문 | - | - |
※ 자세한 사항은 Ⅷ. 임원 및 직원 등에 관한 사항을 참고하여 주십시오.
마. 사외이사의 전문성
(1) 사외이사 지원조직 현황
당사는 사외이사의 직무수행을 위한 별도의 지원조직은 없으나, 사외이사가 이사회에서 전문적인 직무수행이 가능하도록 당사의 경영지원팀이 보조하고 있습니다. 이사회 개최 전에 해당 안건 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고 있으며, 기타 사내 주요 현안에 대해서도 수시로 정보를 제공하고 있습니다.
또한 당사는 대주주 등의 독단적인 경영과 이로 인한 소액주주의 이익이 침해 받지 않도록 이사회 운영규정 및 이해관계자와의 거래에 대한 통제 규정을 제정하여 성실히 준수하고 있습니다.
(2) 사외이사 교육실시 현황
| 교육일자 | 교육실시주체 | 참석 사외이사 | 불참시 사유 | 주요 교육내용 |
|---|---|---|---|---|
| 2024년 06월 25일 | 경영관리팀 | 백용하 | - | - 코스닥상장법인의 내부정보관리규정 - 미공개 중요정보(내부정보) 이용금지 - 단기매매차익 반환 제도 |
2. 감사제도에 관한 사항
가. 감사위원회
당사는 최근 사업연도말 자산총액 2조원 이상의 대형 상장법인이 아니므로 감사위원회를 설치하여야 할 의무가 없으며, 주주총회 결의에 의해 선임된 비상근 감사 1인이 감사업무를 수행하고 있습니다.
나. 감사
당사는 현재 감사 선출에 대한 별도의 기준을 운영하고 있지 않으나, 법령 및 정관에서 정한 사항을 모두 준수하며, 결격사유가 없는 이 중 이사회의 엄격한 심사를 거친 후 추천된 이를 주주총회에서 선임하고 있습니다.
(1) 감사의 인적사항
| 성 명 | 주요 경력 | 임기 (연임횟수) |
결격요건여부 | 최대주주등과의 이해관계 |
|---|---|---|---|---|
| 김승래 (1958.06) |
- 77.03~11.12 국세청(서울지방국세청 조사1국 조사팀장) - 14.06~현재 세무법인 케이파트너즈 대표세무사 - 20.09~현재 ㈜차백신연구소 감사 |
'20.09~'26.03 (1회) |
부 | 없음 |
(2) 감사의 독립성
선임된 감사는 이사회에 참석하여 독립적으로 이사의 업무를 감독할 수 있으며, 제반업무와 관련하여 관련 장부 및 관계서류 제출을 해당부서에 요구할 수 있습니다. 또한, 필요시 자회사로부터 영업에 관한 사항을 보고 받을 수 있으며, 적절한 방법으로 경영정보에 접근할 수 있습니다. 감사의 인적 사항에 대해서는 Ⅷ. 임원 및 직원 등에 관한 사항을 참조하시기 바랍니다.
[감사 규정]
| 조항 | 내용 |
|---|---|
| 제8조 감사의 의무 |
감사는 직무수행에 있어 다음 각 호의 사항을 준수하여야 한다. 1. 감사는 법령, 정관, 제반 규정에 따라 사실과 증거에 의하여 공정하게 직무를 수행하여야 한다. 2. 감사는 감사를 실시함에 있어 피감사부서의 업무활동기능을 저해하지 않도록 주의해야 한다. 3. 감사는 재임시 및 퇴임 후에도 직무수행상 취득한 기밀을 누설하거나 도용해서는 아니 된다. |
| 제9조 감사의 권한 |
감사는 다음 각 호의 권한을 가진다. 1. 제 장부, 증빙서, 물품 및 관계서류의 제출요구 2. 창고, 금고, 장부 및 물품의 봉인 및 보관 3. 관계자의 출석 및 답변요구 4. 기타 감사의 직무수행에 필요한 사항의 요구 |
(3) 감사의 주요 활동 내용
| 구분 | 일 자 | 주요안건 | 가결여부 | 비고 |
|---|---|---|---|---|
| 1 | 2024.02.14 | [보고안건] 1. 대표이사의 [내부회계관리제도 설계 및 운영실태] 보고의 건 2. 감사의 [내부회계관리제도 운영실태 평가] 보고의 건 [부의안건] 1. 영업보고서, 제24기(2023년 01월 01일부터 2023년 12월 31일까지) 재무제표 승인의 건 |
가결 | 참석 |
| 2 | 2024.03.13 | 1. 제24기 정기주주총회 소집의 건 | 가결 | 참석 |
| 3 | 2024.09.04 | 1. 전환사채 발행의 건 | 가결 | 참석 |
| 4 | 2024.09.26 | 1. 당사 직원들의 우리사주 계속 보유를 위한 예금담보 제공 기간 연장의 건 | 가결 | 참석 |
(4) 감사 교육실시 현황
| 교육일자 | 교육실시주체 | 주요 교육내용 |
|---|---|---|
| 2024년 06월 25일 | 경영관리팀 | - 코스닥상장법인의 내부정보관리규정 - 미공개 중요정보(내부정보) 이용금지 - 단기매매차익 반환 제도 |
(5) 감사 지원조직 현황
당사는 본 보고서 작성 기준일 현재 별도의 감사 지원조직은 없으나 당사의 경영지원팀이 감사의 전문적인 직무수행이 가능하도록 보조하고 있습니다.
(6) 준법지원인 등 지원조직 현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
3. 주주총회 등에 관한 사항
가. 투표제도 현황
| (기준일 : | 2024년 09월 30일 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 미도입 |
| 실시여부 | - | - | - |
나. 소수주주권
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
다. 경영권 경쟁
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
라. 의결권 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 26,824,748 | - |
| 우선주 | - | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 26,824,748 | - |
| 우선주 | - | - |
마. 주식사무
|
정관 |
① 이 회사의 주주는 신주 발행에 있어서 그가 소유한 주식수에 비례하여 신주의 배정을 받을 권리를 가진다. ② 이사회는 제1항의 본문의 규정에 불구하고 다음 각 호의 경우에는 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다. 본 항 제2호 내지 제7호에 의하여 발행한 신주는 모두 합하여 발행주식 총수의 100분의 20을 초과할 수 없다. 1. 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 2. 우리사주조합원에게 주식을 우선배정하는 경우 3. 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 4. 사업상 중요한 기술도입, 연구개발, 생산·판매·자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 5. 회사가 경영상 필요로 외국인투자촉진법에 의한 외국인투자를 위하여 신주를 발행하는 경우 6. 회사의 경영상 신규영업의 진출 및 사업목적의 확대 등을 위하여 자금이 필요한 경우 이러한 자금의 조달을 위하여 국내외 개인 또는 법인 투자자에게 신주를 발행하는 경우 7. 회사가 경영상 또는 기술도입을 필요로 국내외 합작 또는 제휴법인에게 신주를 발행하는 경우 8. 『상법』제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 9. 주권을 신규로 코스닥시장에 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 10. 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 『자본시장과 금융투자업에 관한 법률』 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 ③ 관련 법령이나 계약에서 정한 바에 따르는 경우를 제외하고, 제2항 각호의 방식에 의해 신주를 발행할 경우에는 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. ④ 제1항 및 제2항의 규정에도 불구하고 회사가 독점규제 및 공정거래에 관한 법률상 지주회사로 전환하기 위하여, 다른 회사를 독점규제 및 공정거래에 관한 법률상의 지주회사의 자회사로 만들기 위하여 또는 자회사의 주식을 추가로 취득하기 위하여 다른 회사의 주식을 현물로 출자 받는 경우에는 당해 주식을 소유한 자에게 이사회 결의에 의해 신주를 배정할 수 있다. ⑤ 주주가 신주인수권을 포기 또는 상실하거나 신주배정에서 단주가 발생하는 경우는 그 처리방법은 이사회의 결의로 정한다. |
||
|
결 산 일 |
12월 31일 |
정기주주총회 |
매 사업연도 종료 후 3월 이내에 소집 |
|
주주명부폐쇄시기 |
이사회의 별도 결정 | ||
|
주권의 종류 |
전자주권 발행으로 해당사항 없음 | ||
|
명의개서대리인 |
하나은행 증권대행부 |
||
| 주주의 특전 | - | ||
| 공고게재홈페이지 | www.chavaccine.com | 공고게재신문 | 서울경제신문 |
바. 주주총회 의사록 요약
|
개최일자 |
의안내용 |
결의내용 |
|---|---|---|
| 제24기 정기주주총회 (2024.03.28) |
제1호 의안: 제24기(2023.01.01~2023.12.31) 재무제표 승인의 건 제2호 의안: 이사보수한도 승인의 건 제3호 의안: 감사보수한도 승인의 건 제4호 의안: 주식매수선택권 부여의 건 |
가결 가결 가결 가결 |
| 제23기 정기주주총회 (2023.03.27) |
제1호 의안: 제23기(2022.01.01~2022.12.31) 재무제표 승인의 건 제2호 의안: 정관 일부 변경의 건 제3호 의안: 이사 선임의 건 제4호 의안: 감사 김승래 선임의 건 제5호 의안: 이사보수한도 승인의 건 제6호 의안: 감사보수한도 승인의 건 제7호 의안: 주식매수선택권 부여의 건 |
가결 가결 가결 가결 가결 가결 가결 |
| 제22기 정기주주총회 (2022.03.28) |
제1호 의안: 제22기 재무제표 승인의 건 제2호 의안: 이사 선임의 건 제3호 의안: 이사 보수 한도액 승인의 건 제4호 의안: 감사 보수 한도액 승인의 건 |
가결 가결 가결 가결 |
VII. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
|
㈜차바이오텍 |
본인 |
보통주 |
10,289,296 |
38.49 |
10,289,296 |
38.36 | - |
|
㈜차메디텍 |
특수관계인 | 보통주 |
192,864 |
0.72 |
192,864 |
0.72 |
- |
|
염정선 |
특수관계인 | 보통주 |
145,585 |
0.54 |
145,585 |
0.54 |
- |
| 조정기 | 특수관계인 | 보통주 | 60,000 | 0.22 | 110,000 | 0.41 | - |
|
안병철 |
특수관계인 | 보통주 |
73,993 |
0.28 |
73,993 |
0.28 | - |
| 고정재 | 특수관계인 | 보통주 | 29,983 | 0.11 | 56,650 | 0.21 | - |
| 계 | 보통주 | 10,791,721 | 40.36 | 10,868,388 | 40.52 | - | |
| 우선주 | - | - | - | - | - | ||
2. 최대주주의 주요경력 및 개요
가. 최대주주(법인 또는 단체)의 기본정보
| 명 칭 | 출자자수 (명) |
대표이사 (대표조합원) |
업무집행자 (업무집행조합원) |
최대주주 (최대출자자) |
|||
|---|---|---|---|---|---|---|---|
| 성명 | 지분(%) | 성명 | 지분(%) | 성명 | 지분(%) | ||
| (주)차바이오텍 | 48,074 | 오상훈 | 0.05 | - | - | 차광렬 | 30.06 |
| - | - | - | - | - | - | ||
나. 법인 또는 단체의 대표이사, 업무집행자, 최대주주의 변동내역
| 변동일 | 대표이사 (대표조합원) |
업무집행자 (업무집행조합원) |
최대주주 (최대출자자) |
|||
|---|---|---|---|---|---|---|
| 성명 | 지분(%) | 성명 | 지분(%) | 성명 | 지분(%) | |
| 2024년 05월 16일 | 오상훈 | 0.05 | - | - | 차광렬 | 30.09 |
| 2024년 05월 31일 | 오상훈 | 0.05 | - | - | 차광렬 | 30.06 |
다. 최대주주(법인 또는 단체)의 최근 결산기 재무현황
| (단위 : 백만원) |
| 구 분 | |
|---|---|
| 법인 또는 단체의 명칭 | (주)차바이오텍 |
| 자산총계 | 1,725,570 |
| 부채총계 | 1,069,236 |
| 자본총계 | 656,334 |
| 매출액 | 953,951 |
| 영업이익 | -9,567 |
| 당기순이익 | -5,560 |
※ 상기 재무현황은 차바이오텍의 '2023년도 감사보고서’에 기재된 2023년 12월 31일 기준 연결재무제표로 기재하였습니다.
라. 사업현황 등 회사 경영 안정성에 영향을 미칠 수 있는 주요 내용
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
마. 최대주주 변동내역
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| - | - | - | - | - | - |
※ 공시대상기간동안 최대주주의 변동내역이 없습니다.
3. 주식의 분포
가. 주식 소유현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | ㈜차바이오텍 |
10,289,296 |
38.36 | - |
| - | - | - | - | |
| 우리사주조합 | 55,856 | 0.21 | - | |
나. 소액주주현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 21,217 | 21,219 | 99.99 | 16,073,572 | 26,824,748 | 59.92 | - |
4. 주가 및 주식거래실적
| (단위 : 원, 주) |
| 구 분 | '24.04 | '24.05 | '24.06 | '24.07 | '24.08 | '24.09 | |
|---|---|---|---|---|---|---|---|
| 보통주 | 최고 주가 | 5,260 | 4,990 | 4,880 | 4,710 | 5,120 | 4,400 |
| 최저 주가 | 4,515 | 4,645 | 4,660 | 4,490 | 4,015 | 3,955 | |
| 평균 주가 | 4,859 | 4,808 | 4,758 | 4,572 | 4,595 | 4,160 | |
| 최고 일거래량 | 9,520,590 | 163,742 | 909,949 | 183,319 | 4,476,875 | 149,212 | |
| 최저 일거래량 | 46,195 | 27,131 | 35,606 | 23,172 | 40,328 | 19,943 | |
| 월간거래량 | 13,104,384 | 1,457,926 | 3,873,620 | 1,394,900 | 10,171,400 | 1,001,666 | |
VIII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원의 현황
(1) 임원 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 염정선 | 여 | 1962년 04월 | 대표 이사 |
사내이사 | 상근 | 경영총괄 |
- 85.02 서울대 미생물학과 - 92.05 미 Syracuse University 분자생물학 박사 - 92.06~93.05 서울대 분자미생물학연구센터 연수연구원 - 93.06~00.09 목암생명공학연구소 책임연구원 - 00.10~현재 ㈜차백신연구소 대표이사 |
145,585 | - | - | 286개월 | 2026년 03월 27일 |
| 조정기 | 남 | 1970년 03월 | 사장 | 사내이사 | 상근 | CFO |
- 95.08 서울대 동물자원학과(부전공 경영학) - 08.02 고려대 경영대학원(MBA) - 18.02 호서대 융합공학 박사 - 03.11~09.11 코오롱 그룹 구조조정본부 - 09.11~13.05 SK가스, SK차이나 홀딩스 - 13.05~16.04 대길환경산업 대표이사 - 16.07~18.05 바이오인프라생명과학 전무 - 18.05~19.01 차바이오그룹 기획본부 사장 - 19.01~현재 ㈜차백신연구소 사내이사 |
110,000 | - | - | 67개월 | 2025년 03월 27일 |
| 고정재 | 남 | 1954년 10월 | 사내 이사 |
사내이사 | 상근 | 연구개발 |
- 87.02 건국대 축산학 학사/석사 - 94.02 건국대 축산학 박사 - 86.12~03.07 차병원 여성의학연구소 - 97.03~99.03 포천중문의과대학교 생리학실 조교수 - 99.04~04.02 성광의료재단 - 01.01~12.12 차바이오메드 대표이사 - 01.03~18.12 차의과학대학교 기초의학연구소장 - 09.02~현재 차병원그룹 종합연구원 부원장 - 17.03~현재 ㈜차백신연구소 사내이사 |
56,650 | - | - | 89개월 | 2026년 03월 27일 |
| 백용하 | 남 | 1968년 05월 | 사외 이사 |
사외이사 | 비상근 | 자문 | - 92.02 서울대 사법학과 - 10.08~11.08 울산지방검찰청 부장검사 - 11.09~12.06 춘천지방검찰청 영월지청장 - 12.07~13.03 인천지방검찰청 부천지청 부장검사 - 13.04~13.12 의정부지방검찰청 고양지청 부장검사 - 14.01~15.01 서울중앙지방검찰청 부장검사 - 15.02~15.12 춘천지방검찰청 부장검사 - 16.01~17.07 수원지방검찰청 부부장검사 - 17.08~18.08 수원지방검찰청 성남지청 차장검사 - 18.09~현재 법무법인 다담 대표변호사 - 22.03~현재 ㈜차백신연구소 사외이사 |
- | - | - | 31개월 | 2025년 03월 27일 |
| 김승래 | 남 | 1958년 06월 | 감사 | 감사 | 비상근 | - |
- 77.03~11.12 국세청(서울지방국세청 조사1국 조사팀장) - 14.06~현재 세무법인 케이파트너즈 대표세무사 - 20.09~현재 ㈜차백신연구소 감사 |
- | - | - | 47개월 | 2026년 03월 27일 |
| 이대희 | 남 | 1969년 09월 | 전무 | 미등기 | 상근 | CMO | - 94.02 연세대 의대 - 02.02 연세대 보건학 석사 - 07.02 연세대 경영학 박사 - 2003~2005 Handok-Aventis - 2005~2006 Handok Pharmaceuticals - 2007~2009 Janssen Korea - 2009~2016 Bristol-Myers Squibb - 2016~2019 Boehringer-Ingelheim - 2019~현재 Dongwha Pharmaceuticals - 22.03~현재 ㈜차백신연구소 전무 |
- | - | - | 31개월 | - |
| 정시영 | 남 | 1975년 10월 | 전무 | 미등기 | 상근 | 전략기획 | - 97.02 영남대 약학과 학사 - 12.02 영남대 약학대학 석사/박사 - 99.12~05.06 한미약품 제제연구센터 - 05.06~09.07 LG 생명과학 임상개발팀 - 09.07~17.02 한미약품 이사 - 17.02~20.06 휴젤(주) 실장 - 20.07~22.12 (주)에스엔바이오사이언스 부사장 |
- | - | - | 23개월 | - |
| 안병철 | 남 | 1970년 09월 | 상무 | 미등기 | 상근 | 연구개발 |
- 95.02 충북대 생화학과 학사/석사 - 07.02 연세대 생물소재공학 박사 - 97.04~00.09 목암생명공학연구소 선임연구원 - 00.10~현재 ㈜차백신연구소 R&D연구소장 |
73,993 | - | - | 286개월 | - |
| 전은영 | 여 | 1972년 02월 | 상무 | 미등기 | 상근 | 연구개발 |
- 94.02 이화여대 생물학 - 97.02 서울대 미생물학 석사 - 08.02 서울대 의학과 박사 - 96.12~04.07 목암생명공학연구소 - 08.07~09.12 서울대학교병원 - 10.03~20.12 Harvard T.H. Chan School of Public Health - 21.01~현재 ㈜차백신연구소 R&D연구부소장 |
- | - | - | 43개월 | - |
※ 2024년 03월 24일, 기타비상무이사 신동철, 사외이사 오대규는 임기가 만료되었습니다.
※ 2024년 03월 24일, 기타비상무이사 박민식은 일신상의 이유로 사임하였습니다.
나. 직원 등의 현황
(1) 직원 등 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 전사 | 남 | 19 | - | - | - | 19 | 4.2 | 1,153 | 57 | - | - | - | - |
| 전사 | 여 | 32 | - | - | - | 32 | 3.0 | 1,439 | 44 | - | |||
| 합 계 | 51 | - | - | - | 51 | 3.4 | 2,592 | 50 | - | ||||
※ 직원수는 본 보고서 작성기준일 현재 재직자 수이며, 등기 임원은 제외한 숫자입니다.
(2) 미등기임원 보수 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 7 | 592 | 73 | - |
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
1. 주주총회 승인금액
| (단위 : 백만원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 4 | 2,000 | - |
| 감사 | 1 | 150 | - |
※ 상기 주주총회 승인금액은 주주총회 당시의 사내이사(3명)와 사외이사(1명)를 포함한 등기이사의 총 보수한도입니다.
2. 보수지급금액
2-1. 이사ㆍ감사 전체
| (단위 : 백만원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 8 | 659 | 121 | - |
※ 상기 '인원수'와 '보수총액'은 2024년 03월 24일에 퇴임한 기타비상무이사 신동철/박민식, 사외이사 오대규의 보수액을 포함하여 기재하였습니다.
2-2. 유형별
| (단위 : 백만원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
5 |
638 | 195 | - |
| 사외이사 (감사위원회 위원 제외) |
2 |
12 | 9 | - |
| 감사위원회 위원 |
- |
- | - | - |
| 감사 |
1 |
9 | 9 | - |
※ 상기 '인원수'와 '보수총액'은 2024년 03월 24일에 퇴임한 기타비상무이사 신동철/박민식, 사외이사 오대규의 보수액을 포함하여 기재하였습니다.
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
※ 본 보고서 작성 기준일 현재 해당사항이 없습니다.
2. 산정기준 및 방법
| (단위 : 백만원) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
※ 본 보고서 작성 기준일 현재 해당사항이 없습니다.
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
※ 본 보고서 작성 기준일 현재 해당사항이 없습니다.
2. 산정기준 및 방법
| (단위 : 백만원) |
| 이름 | 보수의 종류 | 총액 | 산정기준 및 방법 | |
|---|---|---|---|---|
| - | 근로소득 | 급여 | - | - |
| 상여 | - | - | ||
| 주식매수선택권 행사이익 |
- | - | ||
| 기타 근로소득 | - | - | ||
| 퇴직소득 | - | - | ||
| 기타소득 | - | - | ||
※ 본 보고서 작성 기준일 현재 해당사항이 없습니다.
<주식매수선택권의 부여 및 행사현황>
가. 주식매수선택권 공정가치 총액
| (단위 : 백만원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
3 | 401 | - |
| 사외이사 (감사위원회 위원 제외) |
- | - | - |
| 감사위원회 위원 또는 감사 | - | - | - |
| 업무집행지시자 등 | - | - | - |
| 계 | 3 | 401 | - |
※ 인원수는 공시서류작성기준일 현재 재임 중인 이사·감사·「상법」 제401조의2의 규정에 따른 업무집행지시자 외에 공시서류작성기준일이 속하는 사업연도의 개시일부터 공시서류작성기준일까지의 기간 동안 퇴직한 이사·감사·「상법」제401조의2의 규정에 따른 업무집행지시자를 포함하여 기재하였습니다.
※ 공정가치 산출방법에 대한 자세한 사항은 III. 재무에 관한 사항 - 5. 재무제표 주석을 참조하시기 바랍니다.
나. 주식매수선택권의 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 염정선 | 등기임원 | 2020년 03월 24일 | (*1) | 보통주 | 110,000 | - | - | - | - | 110,000 | 2023.03.24~2028.03.23 | 2,170 | X | - |
| 조정기 | 등기임원 | 2020년 03월 24일 | (*1) | 보통주 | 110,000 | 50,000 | - | 110,000 | - | - | 2023.03.24~2028.03.23 | 2,170 | X | - |
| 직원 11명 | 직원 | 2020년 03월 24일 | (*1) | 보통주 | 186,000 | - | - | 122,250 | 32,000 | 31,750 | 2023.03.24~2028.03.23 | 2,170 | X | - |
| 고정재 | 등기임원 | 2020년 09월 28일 | (*1) | 보통주 | 80,000 | 26,667 | - | 53,334 | - | 26,666 | 2023.09.28~2028.09.27 | 2,170 | X | - |
| 강현구 | 미등기임원 | 2020년 09월 28일 | (*1) | 보통주 | 10,000 | 3,334 | - | 6,668 | 3,332 | - | 2023.09.28~2028.09.27 | 2,170 | X | - |
| 직원 6명 | 직원 | 2020년 09월 28일 | (*1) | 보통주 | 29,000 | 4,668 | - | 9,334 | 15,000 | 4,666 | 2023.09.28~2028.09.27 | 2,170 | X | - |
| 정시영 | 미등기임원 | 2023년 03월 27일 | (*1) | 보통주 | 25,000 | - | - | - | - | 25,000 | 2026.03.27~2031.03.26 | 5,756 | X | - |
| 전은영 | 미등기임원 | 2023년 03월 27일 | (*1) | 보통주 | 20,000 | - | - | - | - | 20,000 | 2026.03.27~2031.03.26 | 5,756 | X | - |
| 최자훈 | 미등기임원 | 2023년 03월 27일 | (*1) | 보통주 | 20,000 | - | - | - | 20,000 | - | 2026.03.27~2031.03.26 | 5,756 | X | - |
| 직원 1명 | 직원 | 2023년 03월 27일 | (*1) | 보통주 | 15,000 | - | - | - | - | 15,000 | 2026.03.27~2031.03.26 | 5,756 | X | - |
| 직원 1명 | 직원 | 2024년 03월 28일 | (*1) | 보통주 | 20,000 | - | - | - | - | 20,000 | 2027.03.28~2032.03.27 | 5,111 | X | - |
| 합계 | - | - | - | 보통주 | 625,000 | 84,669 | - | 301,586 | 70,332 | 253,082 | - | - | X | - |
(*1) 신주교부, 자기주식교부, 차액보상형 중 회사가 정하는 방식이며 현재까지 행사된 수량은 모두 신주교부형입니다.
※ 공시서류작성기준일(2024년 09월 30일) 현재 종가 : 4,155 원
IX. 계열회사 등에 관한 사항
1. 계열회사의 현황
당사는 차바이오텍 계열회사입니다. 본 보고서 작성 기준일 현재, 차바이오그룹에는 11개의 계열회사가 있으며, 이 중 상장사는 3개사, 비상장사는 8개사입니다.
가. 계열회사 현황(요약)
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| 차바이오그룹 | 3 | 8 | 11 |
| ※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조 |
나. 타법인출자 현황(요약)
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | - | - | - | - | - | - |
| 일반투자 | - | 1 | 1 | 675 | - | - | 675 |
| 단순투자 | - | - | - | - | - | - | - |
| 계 | - | - | - | - | - | - | - |
| ※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조 |
X. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여 등
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
3. 대주주 등과의 영업거래 등
가. 대주주 등과의 채권ㆍ채무의 내역
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 특수관계자명 | 미지급금 | 리스부채 |
| 지배기업 |
(주)차바이오텍 |
5,115 | 365,002 |
| 기타의특수관계자 | 엘바이오(주) | 12,680 | |
|
기타의특수관계자 |
(주)차케어스 | 3,951 | |
| 기타의특수관계자 | (주)서울CRO | 73 | |
| 합 계 | 21,819 | 365,002 | |
나. 대주주 등과의 자금거래 내역
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
다. 대주주 등과의 영업거래
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 특수관계자명 | 거래내용 |
당기 |
전기 |
| 지배기업 | (주)차바이오텍 | 기타비용 | 45,386 | 58,877 |
| 이자비용 | 32,943 | 26,456 | ||
| 리스계약(사용권자산 변동) | 324,414 | |||
| 기타의특수관계자 | (주)차케어스 | 기타비용 | 18,248 | 27,911 |
| (주)차바이오에프앤씨 | 기타비용 | 3,036 | 7,375 | |
| 엘바이오(주) | 경상연구개발비 | 314,036 | 1,225,680 | |
| 기타비용 | 264 | |||
| 유형자산 취득 | 28,800 | 90,500 | ||
| (주)CMG제약 | 기타비용 | 1,818 | 2,727 | |
| CHA 의과대학교 분당차병원 | 기타비용 | 170 | 585 | |
| 경상연구개발비 | 27,755 | 63,220 | ||
| CHA 의과대학교 | 경상연구개발비 | 16,895 | 35,451 | |
| 기타비용 | 3,600 | 7,800 | ||
| (주)서울CRO | 경상연구개발비 | 48,950 | 39,973 | |
| 차움의원 | 기타비용 | 273 | 2,273 | |
| 일산차병원 | 기타비용 | 204 | 36 | |
|
성광의료재단 차움건진의원 |
기타비용 |
2 | 3 | |
| 차의과학대학교부속구미차병원 | 기타비용 | 227 | ||
| Matica Bio | 기타비용 | 8,156 | ||
라. 대주주에 대한 주식기준보상 거래
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
XI. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
2. 우발부채 등에 관한 사항
가. 중요한 소송사건
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 견질 또는 담보용 어음ㆍ수표현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
다. 채무보증 현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
라. 채무인수약정 현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
마. 그 밖의 우발채무 등
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
3. 제재 등과 관련된 사항
가. 제재현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 한국거래소 등으로부터 받은 제재
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
다. 단기매매차익의 발생 및 반환에 관한 사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 중소기업기준 검토표
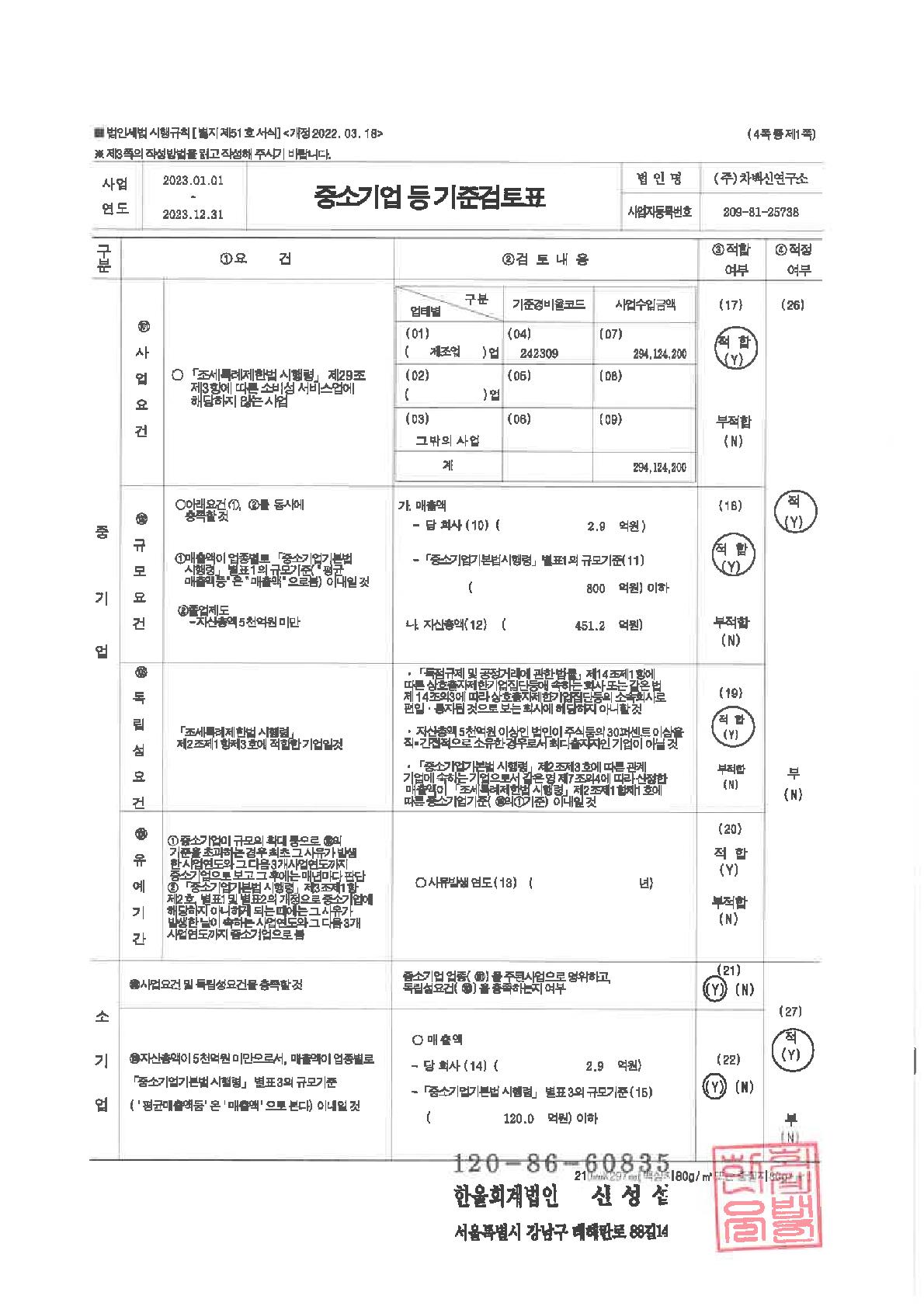 |
|
2023년도 중소기업 등 기준검토표_1 |
 |
|
2023년도 중소기업 등 기준검토표_2 |
다. 합병등의 사후정보
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
라. 정부의 인증 및 그 취소에 관한 사항
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
마. 조건부자본증권의 전환·채무재조정 사유등의 변동현황
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
바. 보호예수 현황
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 |
|---|---|---|---|---|---|---|
| 보통주 | 10,667,738 | 2021년 10월 22일 | 2024년 10월 21일 | 3년 | 한국거래소 상장규정에 따른 보호예수 및 자발적 보호예수 |
26,824,748 |
※ 상기 보호예수 현황은 본 보고서 작성기준일 현재 보호예수 기간이 종료되지 않은 주식이며, 보고서 제출일 현재 보호예수기간 종료에 의해 모두 해제되었습니다.
사. 상장기업의 재무사항 비교표
| (기준 재무제표 : | 개별 | ) | (상장일 : | 2021년 10월 22일 | , 인수인 : | 삼성증권 | ) | (단위 : 백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 예측치 달성 여부 |
괴리율 |
|---|---|---|---|---|---|
| 2021년 | 매출액 | 600 | 500 | 미달성 | 16.67 |
| 영업이익 | -8,835 | -6,084 | 달성 | - | |
| 당기순이익 | -8,717 | -18,420 | 미달성 | 111.31 | |
| 2022년 | 매출액 | 600 | 179 | 미달성 | 70.17 |
| 영업이익 | -8,547 | -6,469 | 달성 | - | |
| 당기순이익 | -8,008 | -6,715 | 달성 | - | |
| 2023년 | 매출액 | 32,100 |
294 |
미달성 | 99.08 |
| 영업이익 | 23,691 |
-6,419 |
미달성 | 127.09 | |
| 당기순이익 | 24,140 |
-1,749 |
미달성 | 107.25 |
※ 2024년도는 보고서 작성 기준일 현재 아직 기말이 도래하지 않아 하단 표에 표기하였습니다.
실적치는 당분기말(2024.09.30) 기준의 재무제표이며, 예측치 달성 여부 및 괴리율은 2024년도 기말 재무제표가 확정된 후 기재할 예정입니다.
| 추정대상 | 계정과목 | 예측치 | 실적치 | 예측치 달성 여부 |
괴리율 |
|---|---|---|---|---|---|
| 2024년 | 매출액 | 108,100 | 371 | - | - |
| 영업이익 | 92,795 | (5,518) | - | - | |
| 당기순이익 | 93,159 | (6,004) | - | - |
아. 매출액 미달에 대한 관리종목 지정유예 현황
(최근 사업연도 매출액 30억원 미만)
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|
| 사업연도 | 매출금액 | 해당여부 | 사유 | 종료시점 | |
| 2023년 | 294 | 해당 | 해당 | 상장연도 이후 5개 사업연도 동안 유예 | 2026.12.31 |
※ 당사는 기술성장기업으로 2021년 10월 22일 코스닥 시장에 상장하였습니다.
매출액 요건의 경우, 신규상장일이 속하는 사업연도를 포함하는 연속하는 5개 사업연도(상장일부터 상장일이 속한 사엽연도의 말일까지의 기간이 3월 미만인 경우에는 그 다음 사업연도)까지 지정 유예되며, 2027년부터 대상이 됩니다. <코스닥시장 상장규정 제53조제1항제1호>
자. 계속사업손실에 대한 관리종목 지정유예 현황
(자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속 사업손실 발생)
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, %) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | ||||
|---|---|---|---|---|---|---|
| 사업연도 | 법인세 차감전 계속사업손익(A) |
자기자본금액 (B) |
비율(A/B) | 해당 여부 |
종료 시점 |
|
| 2021년 | -18,420 | 39,615 | -46.4 | 미해당 | 해당 | 2024.12.31 |
| 2022년 | -6,715 | 33,366 | -20.1 | |||
| 2023년 |
-2,103 |
35,417 |
-5.9 |
|||
※ 당사는 기술성장기업으로 2021년 10월 22일 코스닥 시장에 상장하였습니다.
법인세비용차감전계속사업손실 요건은 신규상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도 동안 해당 요건을 적용받지 않게 됩니다. 2025년부터 해당 요건을 적용받게 될 예정입니다. <코스닥시장 상장규정 제53조제1항제2호>
XII. 상세표
1. 연결대상 종속회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - |
※ 당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
2. 계열회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | 3 |
(주)차바이오텍 |
134511-0065662 |
|
(주)CMG제약 |
135011-0115846 |
||
|
(주)차백신연구소 |
110111-1992670 |
||
| 비상장 | 8 |
(주)차헬스케어 |
110111-5203809 |
|
(주)차메디텍 |
160111-0353401 |
||
|
(주)차케어스 |
110111-2066002 |
||
|
(주)서울씨알오 |
110111-4077718 |
||
|
(주)솔리더스인베스트먼트 |
110111-4631283 |
||
|
(주)차바이오랩 |
131111-0523372 |
||
|
2014솔리더스 성장사다리 |
220-80-09494 |
||
|
Matica Holdings, INC(*2) |
- |
(*1) 2014솔리더스 성장사다리 스타트업 펀드는 비영리조합으로서 법인등록번호가 존재하지 않아 고유번호를 기재하였습니다.
(*2) Matica Holdings, INC는 해외법인입니다.
[계통도]
 |
|
계통도(2024.09.30) |
[회사와 계열회사간 임원 겸직현황]
당사는 본 보고서 작성 기준일 현재 해당사항이 없습니다.
3. 타법인출자 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2024년 09월 30일 | ) | (단위 : 백만원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| 케이비-솔리더스 헬스케어 투자조합 |
비상장 | 2022년 03월 11일 | 일반투자 | 40 | 715 |
1.52 |
675 |
- | - | - | 715 |
1.52 |
675 |
44,875 |
-1,344 |
| 합 계 | 715 |
- |
675 | - | - | - | 715 |
- |
675 | - | - | ||||
【 전문가의 확인 】
1. 전문가의 확인
2. 전문가와의 이해관계