 |
|
소재에 따른 의약품 분류 및 압타머의 위치 |
정 정 신 고 (보고)
| 2024년 09월 19일 |
1. 정정대상 공시서류 : 증권신고서(지분증권)
2. 정정대상 공시서류의 최초제출일 : 2024년 08월 27일
3. 정정사항
| 항 목 | 정정요구ㆍ명령 관련 여부 |
정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|---|
| ※ 단순 오타 및 표현 수정 등은 별도의 색깔표시 없이 정정하였습니다. ※ 요약정보에는 본문의 정정사항을 반영하였으며, 정오표를 별도로 기재하지 않았습니다. ※ 일정변경에 따른 [제1부 모집 또는 매출에 관한 일반사항 - I. 모집 또는 매출에 관한 일반사항]의 경우, 정오표에 반영된 일정 및 기타 일정변경에 관한 사항을 본문에 직접 정정하였으니 참고하시기 바랍니다. ※ 금번 정정사항은 금융감독원의 정정제출 요구에 따른 기재정정으로, 정정사항 확인의 편의를 위해 정정사항은 '굵은 파란색 글씨체'를 사용하여 기재하였습니다 |
||||
| 제1부 모집 또는 매출에 관한 사항 | ||||
| 공통 정정사항 | 부 | 일정변경 | (주1) 정정 전 | (주1) 정정 후 |
| III. 투자위험요소 - 1. 사업위험 | ||||
| 가. 압타머 산업 성장 지연에 따른 위험 | 여 | 기재정정 | (주2) 정정 전 | (주2) 정정 후 |
| 나. 신약 개발사업의 특성에 따른 위험 | 부 | 기재정정 | (주3) 정정 전 | (주3) 정정 후 |
| 다. 신약 임상시험 실패에 따른 위험 | 여 | 기재정정 | (주4) 정정 전 | (주4) 정정 후 |
| 라. 기술이전 지연 및 실패에 따른 위험 | 여 | 기재정정 | (주5) 정정 전 | (주5) 정정 후 |
| 마. 신약 목표 시장 내 경쟁 심화 위험 | 여 | 기재정정 | (주6) 정정 전 | (주6) 정정 후 |
| 바. 신규 시장으로써 암 조기진단 산업의 특성에 따른 위험 | 여 | 기재정정 | (주7) 정정 전 | (주7) 정정 후 |
| 사. 폐암 조기진단 제품에 대한 경쟁 상황의 변화에 따른 목표 시장 점유율 감소 | 여 | 기재정정 | (주8) 정정 전 | (주8) 정정 후 |
| 아. 각 국가의 정책 및 규제 변화에 따른 위험 | 여 | 기재정정 | (주9) 정정 전 | (주9) 정정 후 |
| 자. 글로벌 경기변동에 따른 위험 | 여 | 기재정정 | (주10) 정정 전 | (주10) 정정 후 |
| 차. 핵심 연구개발인력 유출 위험 | 여 | 기재정정 | (주11) 정정 전 | (주11) 정정 후 |
| 타. CRO 산업의 성장 둔화에 따른 위험 | 여 | 기재정정 | (주12) 정정 전 | (주12) 정정 후 |
| III. 투자위험요소 - 2. 회사위험 | ||||
| 가. 매출부진 및 지속적 손실 발생 위험 | 여 | 기재정정 | (주13) 정정 전 | (주13) 정정 후 |
| 나. 재무안정성 악화 위험 | 여 | 기재정정 | (주14) 정정 전 | (주14) 정정 후 |
| 다. 현금흐름 악화 및 유동성 부족에 따른 재무불안정성 위험 | 여 | 기재정정 | (주15) 정정 전 | (주15) 정정 후 |
| 라. (주)인터내셔널사이언티픽스탠다드 관련 위험 | 여 | 기재정정 | (주16) 정정 전 | (주16) 정정 후 |
| 마. 잦은 자금조달 관련 위험 | 여 | 기재정정 | (주17) 정정 전 | (주17) 정정 후 |
| 바. 구주매각 및 청약 등에 따른 최대주주 지분율 변동 및 경영권 안정성 관련 위험 | 여 | 기재정정 | (주18) 정정 전 | (주18) 정정 후 |
| 차. 관리종목 지정 및 상장폐지 위험 | 여 | 기재정정 | (주19) 정정 전 | (주19) 정정 후 |
| IV. 인수인의 의견(분석기관의 평가의견) | 부 | 기재정정 | (주20) 정정 전 | (주20) 정정 후 |
| V. 자금의 사용목적 - 2. 자금의 사용목적 | 여 | 기재정정 | (주21) 정정 전 | (주21) 정정 후 |
(주1) 정정 전
■ 공모 일정 등에 관한 사항
당사는 2024년 08월 26일 최초 이사회를 통해 유상증자를 결의하였습니다. 세부 일정은 다음과 같습니다.
| [(주)압타머사이언스 주주배정 후 실권주 일반공모 유상증자 주요일정] |
| 일자 | 업무내용 | 비고 |
|---|---|---|
| 2024-08-26 | 이사회 결의 및 주요사항보고서 제출 | - |
| 2024-08-26 | 신주발행 및 기준일 최초 공고 | 당사 인터넷 홈페이지 (http://www.aptsci.com) |
| 2024-08-27 | 증권신고서(예비투자설명서) 제출 | - |
| 2024-09-10 | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2024-09-12 | 권리락 | - |
| 2024-09-13 | 신주배정 기준일(주주확정) | - |
| 2024-09-30 | 신주배정 통지 | - |
| 2024-10-08 | 신주인수권증서 상장 및 거래 | 5거래일 이상 거래 |
| 2024-10-15 | 신주인수권증서 상장폐지 | 구주주 청약초일 5거래일 전 |
| 2024-10-21 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2024-10-22 | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.aptsci.com) 금융감독원 전자공시시스템 (http://dart.fss.or.kr) |
| 2024-10-24 ~ 2024-10-25 |
구주주 청약 및 초과청약 | - |
| 2024-10-29 ~ 2024-10-30 |
일반공모 청약 공고 및 청약접수 | 당사 인터넷 홈페이지 (http://www.aptsci.com) (주)BNK투자증권 홈페이지 (http://www.bnkfn.com) SK증권(주) 홈페이지 (http://www.sks.co.kr) (주)상상인증권 홈페이지 (http://www.sangsanginib.com) |
| 2024-10-31 | 환불 및 배정 공고 | (주)BNK투자증권 홈페이지 (http://www.bnkfn.com) SK증권(주) 홈페이지 (http://www.sks.co.kr) (주)상상인증권 홈페이지 (http://www.sangsanginib.com) |
| 2024-11-01 | 주금 납입일 | - |
| 2024-11-13 | 신주유통 및 상장예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 상기 일정이 변경될 수 있습니다. 또한, 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주 상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
(주1) 정정 후
■ 공모 일정 등에 관한 사항
당사는 2024년 08월 26일, 2024년 09월 10일, 2024년 09월 19일 이사회를 통해 유상증자를 결의하였습니다. 세부 일정은 다음과 같습니다.
| [(주)압타머사이언스 주주배정 후 실권주 일반공모 유상증자 주요일정] |
| 일자 | 업무내용 | 비고 |
|---|---|---|
| 2024-08-26 | 이사회 결의 및 주요사항보고서 제출 | - |
| 2024-08-26 | 신주발행 및 기준일 최초 공고 | 당사 인터넷 홈페이지 (http://www.aptsci.com) |
| 2024-08-27 | 증권신고서(예비투자설명서) 제출 | - |
| 2024-09-10 | (정정) 이사회 결의 | - |
| 2024-09-19 | (정정) 이사회 결의 | - |
| 2024-09-19 | (정정) 증권신고서 제출 | - |
| 2024-10-25 | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2024-10-29 | 권리락 | - |
| 2024-10-30 | 신주배정 기준일(주주확정) | - |
| 2024-11-11 | 신주배정 통지 | - |
| 2024-11-18 | 신주인수권증서 상장 및 거래 | 5거래일 이상 거래 |
| 2024-11-22 | 신주인수권증서 상장폐지 | 구주주 청약초일 5거래일 전 |
| 2024-11-28 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2024-11-29 | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.aptsci.com) 금융감독원 전자공시시스템 (http://dart.fss.or.kr) |
| 2024-12-03 ~ 2024-12-04 |
구주주 청약 및 초과청약 | - |
| 2024-12-09 ~ 2024-12-10 |
일반공모 청약 공고 및 청약접수 | 당사 인터넷 홈페이지 (http://www.aptsci.com) (주)BNK투자증권 홈페이지 (http://www.bnkfn.com) SK증권(주) 홈페이지 (http://www.sks.co.kr) (주)상상인증권 홈페이지 (http://www.sangsanginib.com) |
| 2024-12-12 | 환불 및 배정 공고 | (주)BNK투자증권 홈페이지 (http://www.bnkfn.com) SK증권(주) 홈페이지 (http://www.sks.co.kr) (주)상상인증권 홈페이지 (http://www.sangsanginib.com) |
| 2024-12-12 | 주금 납입일 | - |
| 2024-12-24 | 신주유통 및 상장예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 상기 일정이 변경될 수 있습니다. 또한, 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주 상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
(주2) 정정 전
| 가. 압타머 산업 성장 지연에 따른 위험 당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 현재 사용되고 있는 항체 의약품과 같은 단백질 및 유전체 기반 바이오 소재로는 개발이 어려운 압타머 신약 및 진단 제품을 개발하는 사업을 영위하고 있습니다. 압타머 신약 및 진단 제품은 항체 의약품의 미충족 수요를 충족할 대안으로 앞으로 압타머 관련 산업이 크게 확대될 전망입니다. 하지만 당사가 영위하고자 하는 압타머를 활용한 진단 및 치료제 시장의 규모는 원천 기술 개발사의 초기 폐쇄적인 특허 운영으로 인해 아직 성장 단계입니다. 따라서 향후 압타머 관련 기술 개발이 지연되거나 관련 제품의 상용화가 어려워질 경우, 영업환경 및 경쟁환경의 변화에 따라 압타머 산업의 시장 규모가 축소되거나 성장률이 둔화될 수 있으며 이는 당사의 경영 실적에 부정적인 영향을 미칠 수 있습니다. |
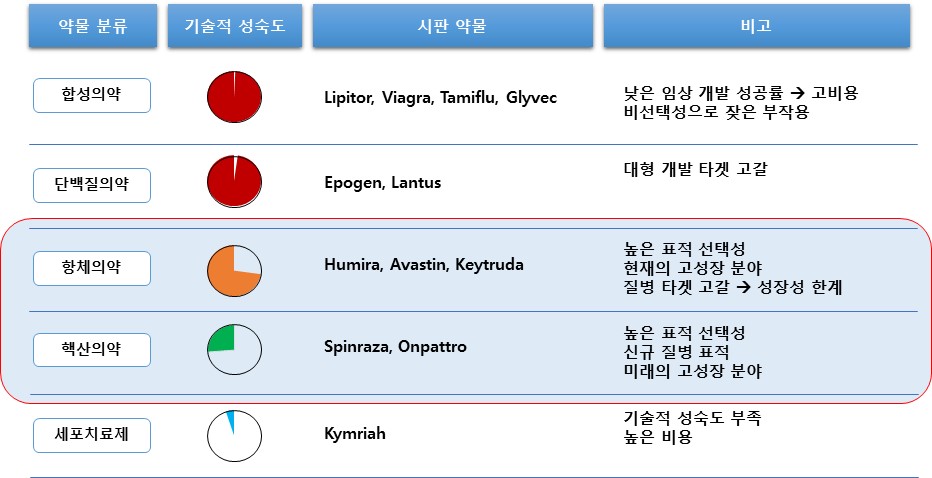
당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 현재 사용되고 있는항체 의약품과 같은 단백질 및 유전체 기반 바이오 소재로는 개발이 어려운 압타머 신약 및 진단 제품을 개발하는 사업을 영위하고 있습니다.
압타머는 3차원적 구조의 다양성으로 표적 분자에 대한 특이적 결합이 가능한 단일 가닥 올리고 핵산 물질로서 표적 치료제 및 약물전달, 바이오 이미징, 진단제 등 다양한 분야의 활용에 적합하여 전 세계의 많은 제약기업 및 연구기관들의 주목을 받고 있습니다.
현재 바이오 의약품 시장에서 항체 기술이 높은 표적성으로 시장을 주도하고 있지만, 크기및 단백질 물성에서 오는 한계 때문에 의약품 개발을 위한 표적은 고갈되어 가고 있으며, 이후 개발된 핵산 의약품은 의약품으로서의 높은 가능성을 가지지만 아직 기술적 성숙이 필요한 상황입니다. 압타머는 항체의 물성과 크기로 인해 생기는 한계를 극복할 수 있고, 핵산 의약품의 장점을 그대로 활용할 수 있어서 항체와 핵산 의약품의 약점을 보완할 수 있는 의약품 소재로 평가받고 있습니다.
| [소재에 따른 의약품 분류 및 압타머의 위치] |
 |
|
소재에 따른 의약품 분류 및 압타머의 위치 |
| (출처 : 당사 제시) |
항체 기술의 부작용 문제는 30년 이상의 오랜 기간 연구를 통하여 상당 부분 보완되었으나, 여전히 미해결 문제가 많습니다. 항체 물질의 크기로 인해 고형암에서 낮은 투과율로 치료 효과가 낮고, 완전 인간항체라도 여전히 면역원성에 대한 우려가 있으며, 복잡한 제조공정으로 가격이 비싸고 높은 batch variation이 문제가 됩니다.
이러한 항체의 문제를 해결할 수 있는 기술로 압타머 기술이 1990년에 소개되었으며 압타머는 기능적으로 항체와 마찬가지로 표적 분자에 선택적으로 결합해 화학 항체라고도 불리는 핵산계(DNA/RNA) 물질입니다. 치료제 소재로서 압타머는 핵산 물질로 항체와 달리 면역원성이 낮고 항체 대비 1/5-1/10의 작은 크기로 높은 조직 투과성을 보이며, 표적과 3차원 공간 인식을 통해 결합함으로써 높은 표적 선택성과 결합력을 가지고 있습니다. 생물학적으로 생산되는 항체 조각 기술, 비항체 단백질 결합체 기술과 달리 화학적으로 합성되기에 제조 공정상 야기되는 잔류 단백질 등의 문제도 없어 제조공정에서의 우위가 있습니다.
| [항체와 압타머의 기본 특성 비교] |
|
구분 |
항체 |
압타머 |
|
구성 물질 |
단백질 |
핵산 (DNA/RNA) |
|
크기 (kDa) |
~150 |
~20 |
|
표적 결합 방식 |
서열 인식 |
3차원 공간 인식 |
|
조직 투과성 |
낮음 |
양호 |
| (출처 : 당사 제시) |
이처럼 항체를 대체할 차세대 소재의 기대감으로 글로벌 압타머 시장은 2022년 17억 달러 규모로 평가되었으며, 연평균 16.5% 성장하여 2031년 70억 달러에 다다를 것으로 전망됩니다.
| [글로벌 압타머 시장 규모] |
 |
|
글로벌 압타머 시장 규모 |
| (출처 : Aptamer Market, Transparency Market Research 2023.11.) |
미국 SomaLogic사가 개발한 2세대 변형 핵산 압타머 기술은 기술 혁신에 대한 수요는 충족시켰지만 SomaLogic사가 타 연구진에게 압타머를 미제공하는 등의 독점적이며 폐쇄적인 특허상황은 연구자들에게도 매우 제한적인 후속 연구 기회가 제공되는 상황을 초래하였습니다. 이는 결과적으로 최초 기술 개발 이후의 30여년간의 기간에 비해 최근까지도 압타머 기술이 바이오 시장의 주류로 자리 잡지 못하게 된 주된 원인으로 판단되고 있습니다.
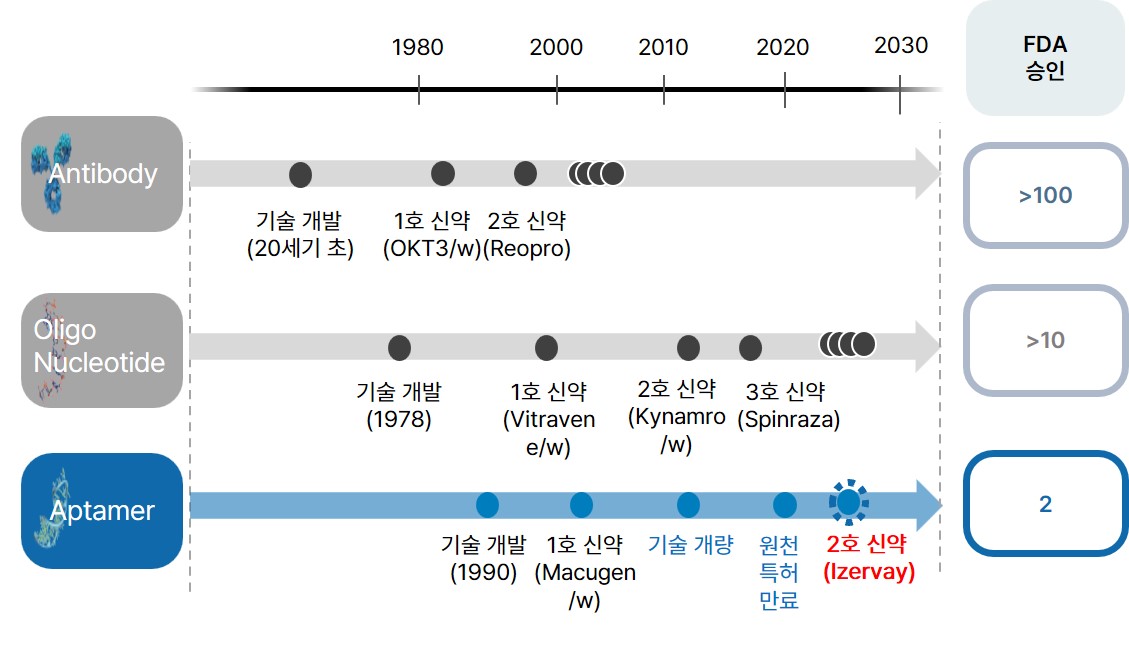
| [압타머 및 바이오 신약 승인 연혁] |
 |
|
압타머 및 바이오 신약 승인 연혁 |
| (출처 : 당사 제시) |
한편, 2010년 압타머 발굴 원천기술 특허가 만료되었고, 2023년 마침내 두번째 압타머 신약으로 FDA 승인을 획득한 노인성 황반변성 치료제인 아이베릭사의 Izervay의 출시와 글로벌 제약사 아스텔라스의 인수합병(59억 달러)은 본격적인 압타머 기반 제품 개발에 대한 시장의 관심 증대의 계기가 되었고, 새로운 치료제 및 제품 출시의 시발점이 될 것으로 예상되고 있습니다.
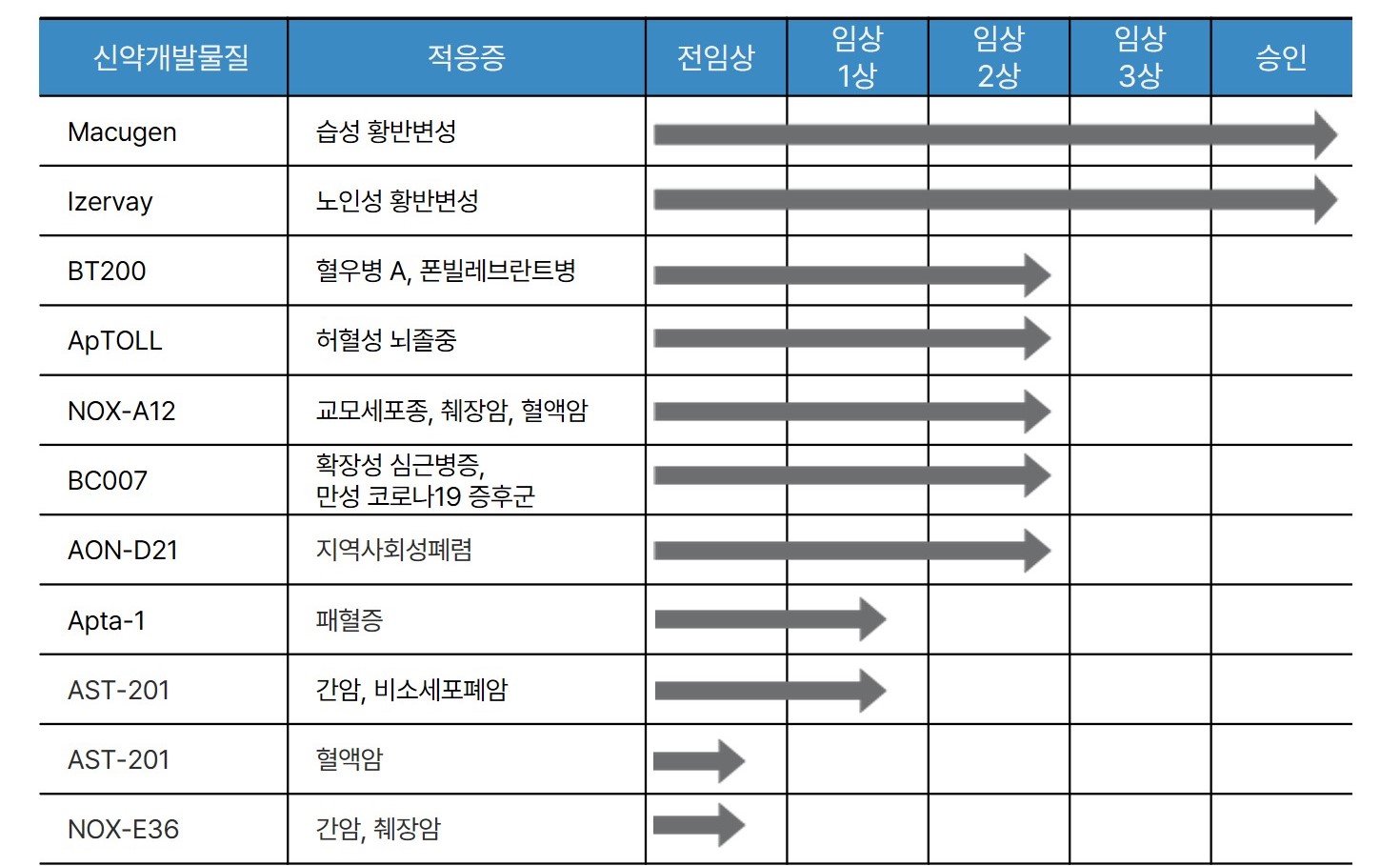
| [글로벌 압타머 치료제 임상 진행 현황] |
 |
|
글로벌 압타머 치료제 파이프라인 |
| (출처: 당사 제시) |
그러나 현재까지도 압타머 산업은 원천 특허 공개 직후 아직 압타머 기반 진단 제품과 신약 제품의 본격적인 출시가 이루어지지 않은 초기 형성 단계의 시장으로서 항체 의약품 등 기타 의약품 시장에 비해 아직 시장 규모가 크지 않으며, 향후 추정치에 대한 실제 시장형성에 대한 불확실성이 존재합니다. 또한 향후 관련 기술 개발 및 상용화가 지연될 경우, 미래 시장의 규모가 예상보다 낮을 수 있습니다. 이러한 경우, 당사의 영업 실적에 부정적인 영향을 미칠 수 있습니다.
(주2) 정정 후
| [용어의 정의] |
| 용어 | 정의 |
|---|---|
| 의약품(Medicine) | 사람, 동물의 질병 진단, 치료, 예방목적으로 사용되는 물품으로 기구,기계 장치가 아닌 것 |
| 바이오의약품(Biologics) | 사람이나 다른 생물체에서 유래된 세포, 조직, 호르몬 등을 이용해 유전자 재조합 또는 세포 배양기술을 통해 개발한 의약품 |
| 압타머(Aptamer) | 압타머는 3차원적 형태를 이루어 표적 물질에 특이적으로 결합하는 단일 가닥 올리고 핵산 물질이며 표적의 3차원적인 형태를 인식해 결합하는 특징을 가짐. 또한 생물학적 생산이 아닌 화학적 합성으로 생산하기 때문에 배치 재현성이 높고, 물질 안정성 (stability)도 우수하며, 제조가격도 저렴하고, 생체 내 면역원성 (immunogenicity)도 보고된 바가 없는 안전성도 우수한 바이오 소재 |
| 압타머 발굴(SELEX) | SELEX란 Systematic Evolution of Ligands by EXponential enrichment의 약자로, 다양한 핵산 라이브러리와 표적 분자와의 반복적인 결합 후 결합하지않은 핵산 라이브러리를 제거하고 표적 분자에 특이적으로 결합하는 것들만 선택적으로 선별하여 매우 우수한 결합력과 특이성을 보이는 압타머를 발굴할 수 있는 기술 |
| 압타머 합성(Aptamer synthesis) | 압타머는 항체와 달리 화학적 합성으로 생체 외에서 생산하며, 다양한 화학적 변형 등이 용이. 또한, 높은 생산 재현성 (Low lot-to-lot variation)과 품질 관리가 가능하여 낮은 생산단가로 생산 가능 |
| 압타머-약물 접합체(ApDC, Aptamer-Drug Conjugate) | 압타머 기반 표적약물전달을 위해 압타머 말단에 화학적 결합을 통해 약물을 접합하거나, 압타머 서열 내에 약물을 직접 내재화한 형태 |
| ELOHA 시험법(Enzyme-Linked Oligonucleotide Hybridization Assay) | 압타머 및 압타머-약물 접합체의 생체시료 분석법 |
| 신약(New drug) | 화학구조나 본질 조성이 전혀 새로운 신물질의약품 또는 신물질을 유효성분으로 함유한 복합제제 의약품 |
| 병행투여/병용투여(Combination therapy/treatment) | 두 가지 이상의 의약품을 동시에 혹은 연속적으로 투여하는 치료 방법. |
| 미국 식품의약국(FDA, Food and Drug Administration) | 미국에서 식품과 의약품의 인허가를 주관하는 정부 기관. 1931년 설립되었으며, 의약품의 인허가 및 규제, 화장품, 식품 그리고 의료 기기 등에 대한 허가와 규제를 담당하고 있음. 국내에는 이와 유사한 기관으로 식품의약품안전처가 있음. |
| 유럽 의약품기구(EMA, European Medicines Agency) | 유럽 의약품의 평가 및 감독을 하는 유럽 연합의 기관 |
| 파이프라인(Pipeline) | 신약 개발 계획을 뜻하는 말로 주로 연구 개발 단계에 있는 품목을 말함 |
| 마일스톤(Milestone) | 신약 라이선스 계약은 대부분 마일스톤 방식으로 이루어지며, 계약 체결 후 받는 <계약금>, 개발 단계별 성취도에 따라 받는 <단계별 기술료>로 구성됨. 제품 상용화 이후에는 마일스톤과 별개로 판매액 일정비율의 <로열티>를 받음. 마일스톤의 단계별 기술료 세부내역은 치열한 시장 경쟁 상황 등을 고려해 계약 당사자들간 협의에 따라 통상적으로 비공개로 함. ① 확정된 계약금 - 계약 체결 직후 또는 일정기간 내에 받게되는 금액. ② 단계별 기술료 - 전임상 → 임상 → 허가신청 → 허가완료 등 개발 단계별로 성공시에 받게 되는 금액. 개발 종료 시점까지 수년에 걸쳐 나누어 받게 되며, 도중에 여건이 나빠지거나 임상에 실패하여 더 이상 개발하지 않을 경우 일정 금액을 받지 못할 수 있음. ③ 로열티 - 기술 이전으로 생산된 제품의 매출에 따라 받게 되는 금액. 대개 로열티는 매출액 대비 비율로 책정되는데, 로열티를 어느 정도로 할 것인가는 당사자의 협의에 의하는 문제로서 일률적인 기준은 없음. |
| 비밀 유지 계약서(CDA, Confidential Disclosure Agreement) | 이해 당사자 간 체결되는 비밀유지계약으로 제 3자에게 이해 당사자의 비밀을 노출하지 않겠다는 내용의 약정 |
| 물질 이전 계약서(MTA, Material Transfer Agreement) | 이해 당사자 간 체결되는 물질 이전 계약으로 해당 물질에 대한 검증을 목적으로 체결되는 계약 |
| 미충족 의학적 수요(Unmet medical needs) | 치료가 필요한 환자 및 증상은 존재하지만 해당하는 적합한 치료법이 개발되지 못한 영역 |
| IND(Investigational New Drug Application) | 임상시험계획신청, 동물실험에서 의약품의 효과와 독성을 확인한 후에 사람에게 임상시험을 하기위해 진행하는 절차. 의사의 엄중한 감시 아래 투약하고, 여러 단계의 임상을 통해서 유효성과 안전성이 최종 확인되면 NDA 신청하게됨 |
| NDA(New Drug Application) | 신약허가신청, 연구개발부터 동물시험까지 비임상시험결과와 인체를 대상으로 하는 임상시험결과 및 제조까지를 종합하여 식품의약품안전처에 의약품허가를 신청하는 절차 |
| 세포독성(Cytotoxicity) | 물질이 세포의 효소, 구조를 이루는 성분에 영향을 미쳐 세포를 죽일 수 있는 경우 또는 세포의 염색체나 유전자(즉, DNA)의 변형을 유발하는 것 |
| 안전성(Safety) | 신약후보물질이 사람이 복용하였을 때 독성이나 심각한 부작용이 없음을 입증하기 위해 실험동물을 통한 안전성 시험이 필수임. 신약개발에서 안전성 평가는 과학적인 임상시험을 위한 기초자료 확보에 목적을 두고 사람한테 일어날수 있는 부작용과 독성 반응의 예측, 초기투여용량 설정, 회복성 여부 등을 시험함 |
| 생물학적 안전성 평가(Biologiccal safety assessment) | 원재료 특성분석, 생물학적 안전성 시험 성적서, 관련 문헌 및 임상 보고 등을 통한 종합적인 생물학적 안전성 평가로, 인체에 접촉되는 모든 의료기기에 적용될 정도로 의료기기의 안전성 확보에 절대적인 영향을 미침 |
| 객관적 반응률(Objective Response Rate) | 사전에 정의된 최소한의 기간동안, 사전에 정의된 양 이상의 종양감소를 보인 환지의 비율 |
| 안정성(Stability) | 의약품 또는 의료기기가 실제로 취급되는 상황을 생각하여 빛, 열, 온도, pH 등의 영향에 얼마나 안정한가를 알아보는 시험. 약물 또는 화합물이 화학변화를 쉽게 일으키지 않거나 반응속도가 느려 일정 기간동안 일정한 상태를 유지하는 성질 |
| 비임상시험(Non-clinical study) | 사람을 대상으로 하지 않는 생의학 시험으로 동물에서의 독성과 유효성 시험임 |
| 최소 유효 용량 (MED, Minimum Effective Dose) | 약물이 효능을 나타내기 위한 최소의 용량 |
| 최대 내성 용량 (MTD, Maximum Tolerated Dose) | 약물이 독성을 나타내지 않는 최대의 용량 |
| 약물동태학(PK, Pharmacokinetics) | 체내에 투여된 약물에 대해 인체가 그 약물에 어떤 영향을 어떻게 미치는지 흡수, 대사, 배설로 변하는 수치적 해석? |
| 약물동역학(PD,Pharmacodynamics) | 체내에 투여된 약물에 의해 인체가 받는 영향으로 약물의 용량과 생체 반응 관계를 생리적, 생화학적 작용과 효과면에서 해석 |
| 이종 이식 모델 (Xenograft model) | 인간의 세포/암 등에 대한 효능, 영향을 평가하기 위해 인간의 세포/암등을 동물에 이식해 제작한 모델 |
| CRO(Contract Research Organization) | 신약개발을 하는 과정에서 제약기업의 임상시험 관리를 대행해 주는 기관을 총칭함. CRO는 단순한 데이터 관리 및 통계분석 서비스에서 최근 약물 발굴·신약개발·제조·운송·상품화까지 제약 산업 전 단계에 걸쳐 서비스를 제공하는 영역에까지 확대하고 있음. |
| CMO(Contract Manufacturing Organization) | 제약업계에서 많이 사용되는 용어로 의약품을 대행 생산하도록 아웃소싱을 맡기는 것을 뜻함. 전자업계 OEM이나 반도체 파운드리와 유사한 개념임. |
| 비임상시험관리기준 (GLP, Good Laboratory Practice) | 의약품, 화학품 등의 안전성 평가를 위하여 실시하는 각종 독성시험의 신뢰성을 보증하기 위하여 연구인력, 시험시설, 장비, 시험 방법 등 시험의 전 과정에 관련된 모든 사항을 조직적, 체계적으로 관리하는 규정 |
| 화학, 제조 및 품질관리 (CMC, Chemistry, Manufacturing and Controls) | 의약품 개발과정에서 의약품의 품질과 연관된 연구개발 및 제조공정이 일관성 있게 조절 및 관리되고 있음을 문서화 하여 입증하는 것 |
| 최신 우수 의약품 제조 품질관리 기준(cGMP, current good manufacturing practice) | FDA (미국 식품의약국) 가 만든 가장 높은 수준의 GMP로서 의약품 제조를 위해 공장에서 원료의 구매부터 제조, 출하 등에 이르는 모든 과정에 필요한 관리 기준을 규정한 것 |
| 전임상 단계(Pre-clinical) | 의약품 개발 과정 중 새롭게 개발한 약물 후보물질을 사람에게 사용하기 전에 동물에게 적용하여 부작용이나 독성, 효과 등을 알아보는 시험단계 |
| 임상 1상(Phase 1) | 비임상시험(동물을 상대로 한 실험)을 거친 신약을 사람에서 처음으로 평가하는 과정. 비교적 제한된 수의 대상자(약 20-80명)에게 투여되며 약의 종류에 따라 다르지만 대개 건강한 성인을 대상으로 진행함. 안전성을 검토하여 안전용량의 범위를 확인하게 됨. 또한 약물의 체내에서의 흡수, 분포, 대사, 배설에 대한 자료를 수집함 |
| 임상 2상a(Phase 2a) | 임상시험에 사용되는 의약품의 안전성과 유효성을 증명하기 위하여 해당약물의 약동, 약력, 약리, 임상적 효과를 확인하고 이상반응 등을 평가하기 위하여 사람을 대상으로 실시하는 시험 또는 연구로 사람을 피시험자로 하는 것이기 때문에 윤리적인 배려와 함께 과학적인 방법으로 진행됨 |
| 임상 2상b(Phase 2b) | 임상 2a의 결과에 따라 설계된 용량을 가지고 다시 환자에 투여, 어느 만큼의 용량이 가장 효과가 있을지 적정 투여 용량의 범위를 정하는 과정 |
| 임상 3상(Phase 3) | 제 2상 임상시험에서 확인된 사항들을 종합적으로 판단하여 유용성이 인정될 때 대상질환 중 조건에 부합되는 다수 환자를 대상으로 효능효과, 용법용량, 사용상의 주의사항 등 전반적인 안전성, 유효성을 확인하여 의약품으로서의 유용성을 결정하는 시험 |
| 정맥 주사(IV injection, Intravenous injection) | 정맥에 주사하는 기법 |
| 피하 주사(SC injection, Subcutaneous injection) | 피하 지방에 주사하는 기법 |
| 혈액-뇌 장벽 (BBB, Blood-Brain Barrier) | 뇌외 혈액을 격리시키는 혈관 장벽으로 뇌 모세혈관 내피 세포의 밀착연접 (tight junction)을 형성하여 고분자와 친수성 물질의 통과를 방해 |
| 체외진단검사(IVD, In Vitro Diagnostics) | 질병의 확진 및 예후, 건강상태 판정, 질병 치료효과 판정, 예방 등의 목적으로 혈액, 체액, 조직 등 인체에서 유래한 물질을 이용해 신체 밖에서 신속하게 진단하는 기술 |
| 체외진단 다지표 검사(IVDMIA, In Vitro Diagnostic Multivariate Index Assay) | 환자의 질병이나 상태를 진단하거나 질병의 치료, 완화, 처치, 예방, 예후, 예측을 위하여 해석 함수를 사용하는 다지표 진단 방법. 해석 함수는 다양한 지표 (수치)들을 결합하여 환자 특이적인 결과 (위험군 분류, 점수, 인덱스 등)를 도출 |
| 현장 검사(POC, Point-Of-Care) | 피검자 및 환자와 가까운 위치에서 원심분리 등 샘플 사전가공을 거치지 않고, 신속하게 시행해 진료 및 치료에 활용할 수 있는 임상병리 검사방식 또는 키트 |
| 임상적 검증(Clinical validation) | 민감도, 특이도 등의 정보에 따라 진단 성능을 정확하게 예측하기 위한 검증 |
| 임상적 유효성(Clinical efficacy) | 체외진단 다지표 검사 (IVDMIA)를 이용하여 바이오마커에 대해 수행한 시험이 환자의 질병 상태에 대한 판단 근거를 제공할 수 있는 성능 |
| 임상적 민감도(Clinical sensitivity) | 특정 질환을 가지고 있는 사람 중 검사 결과가 양성으로 나오는 비율 |
| 임상적 특이도(Clinical specificity) | 특정 질환을 가지고 있지 않은 사람 중 검사 결과가 음성으로 나오는 비율 |
| 위양성(FP, False Positive) | 질병이나 증상이 없는 음성 환자나 음성 검사대상물에서 양성으로 나온 검사 결과 |
| 위음성(FN, False Negative) | 질병이나 증상이 있는 양성 환자나 양성 검사대상물에서 음성으로 나온 검사 결과 |
| RNA | 리보핵산. 핵산의 일종이며, 주로 생물체의 유전 정보를 담은 유전물질. DNA를 주형으로 합성되며, 유전 정보의 전달, 유전자 발현 조절 등의 역할을 수행함 |
| 선별검사(Screening test) | 해당 질환의 고위험군을 조기에 발견하여 추가적인 관찰이나 직접적 예방 활동을 하기 위한 검사 |
| 예후(Prognosis) | 환자의 상태나 질병의 결과에 대한 예측 |
| 조기진단(Early diagnosis) | 특정 질환으로 확인되지 않은 사람을 대상으로 질환에 걸렸는지 또는 위험성이 있는지 미리 진단하여 어떤 검사 또는 치료법을 사용할 것인지 결정하기 위한 목적의 진단 |
| 모니터링(Monitoring) | 수술 이후나 항암치료 후에 재발이 일어났는지, 치료 효과가 있는지를 추적하는 진단 |
| 비침습적 진단(Non-invasive diagnosis) | 사람의 몸속으로 침투하지 않고 몸 밖으로 흘러나오는 또는 몸 밖에서 채취가 가능한 혈액, 가래, 대변 및 소변 등의 체액을 이용한 진단 행위 |
| 신의료기술 | 신의료기술평가사업본부 (NECA) 평가 결과 안전성 및 유효성이 인정된 진료행위로 건강보험심사평가원에서 급여/비급여로 결정되지 않은 의료기술 |
| 체외진단 의료기기 선진입 후평가 제도 | 식약처 의료기기 허가를 취득한 이후 건강보험 등재 절차로 바로 진입할 수 있도록 개선하고, 1~5년 판매후 신의료기술평가를 시행하는 제도로 2019년 4월 감염병 체외진단검사에 대해 시범사업이 진행되고 있으며, 2021년 체외진단 검사로 확대될 예정임. |
| 실험실개발테스트(LDT, Laboratory Developed Test) | 임상 검사실에서 자체적으로 개발한 체외진단검사를 환자들에게 제공할 수 있도록 하는 제도 |
| 독립진단실험실(ICL, Independent Clinical Laboratory) | 실험실개발테스트와 같은 개념으로 중국을 비롯한 동남아시아에서 환자들에게 제공할 수 있도록 하는 제도 |
| 정밀의료 | 환자마자 다른 유전정보, 환경적 요인, 생활습관 등 다양한 정보를 포괄적으로 이용하여 분자 수준에서 종합적으로 분석한 후 개인별 최적의 맞춤형 의료(예방, 진단, 치료)를 제공하는 차세대 의료 패러다임 |
| 검체 | 검사 대상(인체)으로부터 체취된 검사에 필요한 재료(혈액, 체액, 조직 등) |
| 바이오마커 | 세포나 혈관, 단백질이나 DNA, RNA 등을 이용해 체내 변화를 알아낼 수 있는 지표로 생명체의 정상 또는 병리적인 상태, 약물에 대한 반응 정도 등을 객관적으로 측정 가능함 |
| 분자진단 | 대표적인 체외진단 기법으로, 인체나 바이러스 등의 유전자 정보를 담고 있는 DNA, RNA의 분자 수준 변화를 검출해 질병 등을 진단하는 검사방법 |
| 예후진단 | 환자의 검체로부터 예후관련 유전자를 분석하여 병의 경과 및 진행, 회복에 대해 정보를 알기 위한 진단 방법 |
| 동반진단 | 환자의 검체로부터 특정 바이오마커 보유 여부를 분석하여 특정 치료제에 대해 안정성과 효율성이 입증된 환자군을 선별하는 진단 방법 |
| GMP | Good manufacturing practice의 약칭. 식품·의약품의 안정성과 유효성을 품질면에서 보증하는 기본 조건으로서의 우수식품·의약품의 제조·관리기준 |
| 신의료기술 | 안정성과 유효성이 평가되지 아니한 새로운 의료기술로서 보건복지부장관이 평가가 필요하다고 인정한 의료기술 |
| 예후예측 유전자 | 예후란 병의 경과나 결과를 미리 예상하는 것을 의미하며 암의 경우 보통 5년 또는 10년 생존율로 판단됨. 예후예측 유전자는 유전자의 발현량 또는 돌연변이 여부에 따라 질병의 예후를 판단할 수 있는 척도로 사용되는 유전자를 지칭함 |
| 표준유전자 | 외부 조건에 상관없이 대부분의 세포에서 일정한 발현값을 보이는 유전자. 유전자 발현값을 사용하는 검사에서 표준유전자는 다른 유전자의 발현값의 발현 기준으로 사용됨 |
| 위험비(HR) | 시간이 지남에 따라 한 집단의 특정한 사건(예: 재발)이 다른 군에 비해 얼마나 자주 일어나는지를 상대적으로 나타내는 수치 |
| 돌연변이 빈도(mutation index) | 특정 돌연변이의 존재 유무 및 정량적 정도를 의미하며 야생형(wild type) 대비 돌연변이의 빈도로 제시됨 |
| NCCN | National Comprehensive Cancer Network의 약칭. 미국 내 암 치료 분야의 32개(2023.01 기준) 주요 암센터로 구성된 비영리 연합체로 암 종별로 제공하는 치료 가이드라인은 국제 암 표준진료지침으로 활용됨 |
| 민감도(Sensitivity) | 특이도와 함께 검사의 정확도를 측정하는 지표 중 하나로 어떤 질병이 있는 상태에서 검사를 통해 그 질병을 얼마나 정확하게 찾아내는지 정도를 수치화한 값 |
| 생검 / 액체생검 | 생검은 생체검사의 준말. 일반적으로 조직생검을 말하며, 환자의 병이 있는 부위의 조직 일부를 잘라내어 병리조직학적으로 검사하는 방법을 뜻함. 액체생검은 혈액 등 체액 속 암 세포가 깨지면서 생기는 미량의 DNA 조작을 찾아 유전적으로 검사하는 방법을 뜻함 |
| Macrodissection | 검체에서 특정 조직(예: 암세포)의 비율을 높이기 위해 사용되는 방법으로 특정 조직 외 주변 조직을 제거하는 방법 중 하나 |
| PMS | Post Market Surveillance의 약칭. 신개발의료기기, 희소의료기기 등에 대하여 시판 이후 일정기간 동안 안전성 및 유효성 등에 관한 정보를 수집, 검토, 확인 또는 검증하는 제도 |
| 중합효소연쇄반응(PCR) | DNA (데옥시리보 핵산)를 증폭시키는 기술로, 일반 분석기기로 감지할 수 없는 극미량의 DNA 조각을 증폭하거나 압타머 발굴에서 표적 분자에 특이적으로 결합하는 핵산 라이브러리를 증폭할 때 사용 |
| 표적 분자(Target molecule) | 단백질, 저분자 화합물, 탄수화물, 그리고 독소 등이 대표적인 표적 분자로서 진단 제품 또는 치료제 개발 시 표적 바이오마커가 표적 분자에 해당 |
| 변형핵산(Modified nucleoside) | 핵산 서열의 특정 염기 (base)에 소수성 분자 (hydrophobic moiety)를 도입하여 핵산 라이브러리의 다양성 및 소수성을 증가시키고, 이로 인해 표적 분자내 소수성 부분과의 결합이 획기적으로 개선된 압타머를 높은 성공률로 발굴할 수 있는 기반 물질 |
| 해리상수(Dissociation constant, Kd) | 압타머 성능을 확인하기 위한 척도로서 압타머가 표적 분자와 얼마나 강하게 결합하는지를 확인할 수 있는 지표로 값이 낮을수록 높은 결합력을 의미 |
| 플랫폼 기술(Platform technology) | 진단제 및 치료제 개발에 있어 우수한 압타머를 발굴하고 제품화를 위한 핵심 분석, 기반기술을 의미. 다양한 질환 분야에 적용할 수 있으며, 지속적인기술개발을 통해 높은 부가가치를 창출하는 기술 |
| 알로스테리 결합(Allosteric binding) | 세포막 수용체 상의 기존 리간드 결합 위치가 아닌 다른 위치에 결합하여 수용체의 활성을 조절하는 결합 방식 |
| 민감제(Sensitizer) | 자신의 활성과 관계없이 내재적 인자/호르몬의 활성을 도와 효능을 향상 시키는 물질 |
| 인슐린 저항성(Insulin resistance) | 세포가 체내에서 정상적으로 분비되는 인슐린에 반응하지 못하는 병리학적 상태 |
| 인슐린 민감제(Insulin sensitizer) | 세포막 인슐린 수용체에 결합하여 자체적으로는 활성이 없으나 수용체의 인슐린 민감성을 증진하는 물질 |
| 표적 외 작용에 따른 부작용(Off-target side effect) | 약물이 체내의 특정 표적 이외에 다른 곳에 비특이적으로 작용하여 나타나는 부작용 |
| 작용기전(MOA, Mode Of Action) | 약물이 유효성을 나타내는 분자생물학 및 생화학적, 세포생물학적 작용 메커니즘 |
| 아고니스트(Agonist) | 생체작용물질의 수용체에 결합하여 그 물질과 같은 또는 유사한 작용을 하는 물질 |
| 당화혈색소(HbA1c) | 적혈구에 포함된 혈색소가 포도당과 결합하여 생성되며, 높은 혈중 포도당 상태에 혈색소가 장기간 노출되면 증가하여 당뇨병의 진단기준으로 활용됨 |
| 1형 당뇨(Type 1 diabetes) | 인슐린 의존형 당뇨병으로 췌장 베타세포의 파괴로 인해 정상적인 인슐린 분비가 되지 않는 당뇨병 |
| 2형 당뇨(Type 2 diabetes) | 인슐린 비의존형 당뇨병으로 인슐린은 정상적으로 분비되지만, 세포가 인슐린에 적절하게 반응하지 못하거나 병의 진행에 따라 인슐린이 부족하여 발생하는 당뇨병 |
| (출처 : 당사 제시) |
| 가. 압타머 산업 성장 지연에 따른 위험 당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 현재 사용되고 있는 항체 의약품과 같은 단백질 및 유전체 기반 바이오 소재로는 개발이 어려운 압타머 신약 및 진단 제품을 개발하는 사업을 영위하고 있습니다. 압타머 신약 및 진단 제품은 항체 의약품의 미충족 수요를 충족할 대안으로 앞으로 압타머 관련 산업이 크게 확대될 전망입니다. 하지만 당사가 영위하고자 하는 압타머를 활용한 진단 및 치료제 시장의 규모는 원천 기술 개발사의 초기 폐쇄적인 특허 운영으로 인해 아직 성장 단계입니다. 압타머 기술의 주요한 한계점은 1) 핵산분해효소 취약성 2) 항체 대비 짧은 체내 반감기와 높은 약물 청소율 3) 구조적 다양성의 한계 가 있습니다. 당사에서는 변형된 뉴클레오티드를 적용한 SELEX를 통해 구조적 다양성을 확대하여 압타머의 표적 결합력, 발굴성공율이 대폭 개선된 고성능 압타머를 약물개발에 활용하고 있으며, 화학적 변형을 도입한 최적화를 통해 위에서 제시한 핵산분해효소에 대한 안정성도 동시에 개선하여 안정성 높은 압타머를 활용하고 있습니다. 압타머 기술 기반 승인 신약으로는 Macugen(Pfizer, 2004)과 Izervay(Astellas, 2023) 두 종이 있고, 이중 Macugen는 보다 효과적인 신약 출시로 인해 현재는 시장에서 판매중단이 되었습니다. Macugen과 Izervay은 황반변성에 대한 신약으로 현재까지 암 치료에 승인된 압타머는 없습니다 따라서 향후 압타머 관련 기술 개발이 지연되거나 관련 제품의 상용화가 어려워질 경우, 영업환경 및 경쟁환경의 변화에 따라 압타머 산업의 시장 규모가 축소되거나 성장률이 둔화될 수 있으며 이는 당사의 경영 실적에 부정적인 영향을 미칠 수 있습니다. |
당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 현재 사용되고 있는항체 의약품과 같은 단백질 및 유전체 기반 바이오 소재로는 개발이 어려운 압타머 신약 및 진단 제품을 개발하는 사업을 영위하고 있습니다.
압타머는 3차원적 구조의 다양성으로 표적 분자에 대한 특이적 결합이 가능한 단일 가닥 올리고 핵산 물질로서 표적 치료제 및 약물전달, 바이오 이미징, 진단제 등 다양한 분야의 활용에 적합하여 전 세계의 많은 제약기업 및 연구기관들의 주목을 받고 있습니다.
현재 바이오 의약품 시장에서 항체 기술이 높은 표적성으로 시장을 주도하고 있지만, 크기및 단백질 물성에서 오는 한계 때문에 의약품 개발을 위한 표적은 고갈되어 가고 있으며, 이후 개발된 핵산 의약품은 의약품으로서의 높은 가능성을 가지지만 아직 기술적 성숙이 필요한 상황입니다. 압타머는 항체의 물성과 크기로 인해 생기는 한계를 극복할 수 있고, 핵산 의약품의 장점을 그대로 활용할 수 있어서 항체와 핵산 의약품의 약점을 보완할 수 있는 의약품 소재로 평가받고 있습니다.
| [소재에 따른 의약품 분류 및 압타머의 위치] |
 |
|
소재에 따른 의약품 분류 및 압타머의 위치 |
| (출처 : 당사 제시) |
항체 기술의 부작용 문제는 30년 이상의 오랜 기간 연구를 통하여 상당 부분 보완되었으나, 여전히 미해결 문제가 많습니다. 항체 물질의 크기로 인해 고형암에서 낮은 투과율로 치료 효과가 낮고, 완전 인간항체라도 여전히 면역원성에 대한 우려가 있으며, 복잡한 제조공정으로 가격이 비싸고 높은 배치변이(batch variation)가 문제가 됩니다.
압타머 기술은 1990년에 처음 소개되었으며 압타머는 기능적으로 항체와 마찬가지로 표적 분자에 선택적으로 결합해 화학 항체라고도 불리는 핵산계(DNA/RNA) 물질3입니다. 치료제 소재로서 압타머는 핵산 물질로 항체와 달리 면역원성이 낮고 항체 대비 1/5-1/10의 작은 크기로 높은 조직 투과성을 보이며, 표적과 3차원 공간 인식을 통해 결합함으로써 높은 표적 선택성과 결합력을 가지고 있습니다. 생물학적으로 생산되는 항체 조각 기술, 비항체 단백질 결합체 기술과 달리 화학적으로 합성되기에제어가 용이한 제조공정과 생산된 물질의 배치 변이의 우려가 없고, 온도 및 주변 환경변화에 매우 안정적인 물성을 가지고 있어 운반 및 보관이 용이합니다.
| [항체와 압타머의 기본 특성 비교] |
|
구분 |
항체 |
압타머 |
|
구성 물질 |
단백질 |
핵산 (DNA/RNA) |
|
크기 (kDa) |
~150 |
~20 |
|
표적 결합 방식 |
서열 인식 |
3차원 공간 인식 |
|
조직 투과성 |
낮음 |
양호 |
| (출처 : 당사 제시) |
이처럼 항체를 대체할 차세대 소재의 기대감으로 글로벌 압타머 시장은 2022년 17억 달러 규모로 평가되었으며, 연평균 16.5% 성장하여 2031년 70억 달러에 다다를 것으로 전망됩니다.
| [글로벌 압타머 시장 규모] |
 |
|
글로벌 압타머 시장 규모 |
| (출처 : Aptamer Market, Transparency Market Research 2023.11.) |
미국 SomaLogic사가 개발한 2세대 변형 핵산 압타머 기술은 기술 혁신에 대한 수요는 충족시켰지만 SomaLogic사가 타 연구진에게 압타머를 미제공하는 등의 독점적이며 폐쇄적인 특허상황은 연구자들에게도 매우 제한적인 후속 연구 기회가 제공되는 상황을 초래하였습니다. 이는 결과적으로 최초 기술 개발 이후의 30여년간의 기간에 비해 최근까지도 압타머 기술이 바이오 시장의 주류로 자리 잡지 못하게 된 주된 원인으로 판단되고 있습니다.
[압타머 기술의 한계점]
항체 치료제는 인체가 세균, 바이러스 등 외부 물질에 감염된 후 이에 대항해 만들어낸 항체 중 특정 병원체를 무력화할 수 있는 물질을 선별해 만든 치료제입니다. 항체는 최초 발견 이후 1세기가 지났으며 1986년 단일항체가 FDA 첫 승인을 획득한 이후로 100개 이상의 치료제가 출시되었습니다. 오랜 기간 동안 연구를 거쳐 많은 데이터를 확보하고 있으며, 표적에 대한 높은 결합력, 체내 안전성, 장기간 체내에 남아 지속적인 치료 효과를 제공할 수 있다는 점이 항체의 강점으로 꼽힙니다.
항체와 압타머는 모두 특정 타겟에 특이적으로 결합하여 비표적 효과의 가능성을 줄이고 치료 효과를 높일 수 있습니다. 또한 화학 요법 및 표적 소분자 약물보다 독성과 부작용이 적습니다.
| [항체와 비교한 압타머의 강점과 약점] |
| 항목 |
압타머 |
항체 |
| 구성단위 |
뉴클레오티드 |
아미노산 |
| 물질 |
핵산(단일가닥 DNA 또는 RNA) |
단백질(2 경쇄와 2 중쇄) |
| 분자량 |
6~30kDa(20~100nt) | 150~180kDa |
| 2차 구조
|
Stem, loop | a-Helix, b-sheet |
| 표적 결합패턴 |
표적분자 표면의 3차 구조인식 |
표적분자의 에피토프 인식 |
| 표적 결합력 |
높음 |
높음 |
| 표적 특이성 |
높음 |
높음 |
| 표적 범위 |
넓음(저분자 유/무기 화합물부터 핵산, 펩타이드, 단백질, 세포 등) |
면역원성 분자 제한적(단백질) |
| 발굴 |
in vitro SELEX 기법
~2-8주 소요
|
In vivo 생물학적 시스템 적용
~6개월 소요
|
| 생산 |
고체상 지지체 화학합성 제어 가능한 공정(낮은 오염위험) 낮은 생산비용 낮은 배치 변동성 |
동물 또는 세포 기반 생산 높은 오염위험 높은 생산비용 높은 배치 변동성 |
| 물리화학적 물질 안정성 |
높음(긴 보관기간) 온도변화에 대한 높은 안정성 화학적 변형 용이(내부적 변형 및 기능기 접합) |
낮음 온도 및 환경변화에 민감 제한적 화학적 변형(활성 및 구조변형 유발) |
| 약동력학적 특성 |
빠른 조직 투과 짧은 반감기 빠른 체외 배출 |
느린 조직 투과 긴 반감기 느린 체외 배출 |
| 면역원성 |
낮음 |
높음 |
| (출처:당사 제시) |
압타머 기술의 주요한 한계점은 다음과 같습니다.
1) 핵산분해효소 취약성 (Susceptible to neclease degradation)
압타머의 유리한 특징에도 불구하고, 치료적 응용을 위한 압타머를 개발하기 위해서 몇 가지 주목할 만한 한계를 고려해야 합니다. 압타머는 뉴클레오타이드로 구성되어 있기 때문에, 생체 내 또는 시험관 내 조직 배양 환경에서 핵산분해효소에 의한 분해에 취약합니다.
2) 항체 대비 짧은 체내 반감기와 높은 약물 청소율 (High clearance rate)
압타머는 일반적으로 약 10~30kDa의 크기를 갖는데, 이는 단클론항체보다 대략 10배 정도 작습니다. 결과적으로 혈액 순환계에 투여된 압타머는 항체 대비 반감기가 짧고 체외로 배출되는 속도가 빠릅니다. 그러나 이 특성은 압타머의 사용 목적에 따라 달라지므로 본질적으로 부정적인 특성은 아닙니다. 예를 들어, 항체 기반 약물전달 기술인 ADC의 개발과정에서 가장 큰 과제는 용량제한독성(Dose-limiting Toxicity)와 그에 기인한 좁은 치료용량계수(Therapeutic Window)입니다. 세포독성 약물의 선택적 전달을 위해 세포 표면 단백질을 표적으로 하는 압타머는 종양 등의 표적으로 빠르게 침투하는 반면에 신장을 통한 체외 배출도 신속하게 이루어 질 수 있어 독성을 최소화하고 치료용량계수를 넓힐 수 있는 충분한 잠재성을 가지고 있습니다. 이러한 특성은 압타머와 유사한 작은 약물전달 플랫폼(펩타이드 등)을 기반으로 한 약물전달 기술에서 공통적으로 항체와 차별성을 갖는 포인트로 강조되고 있습니다.
3) 구조적 다양성의 한계 (Limited building block diversity)
20개의 아미노산으로 구성된 항체와 달리 압타머는 4개의 뉴클레오티드(A, T, G, C)로 구성됩니다. DNA 또는 RNA 염기서열을 구성하는 뉴클레오티드의 비교적 간단한 화학 구조는 압타머가 표적과 상호 작용을 촉발하는 구조적 다양성이 제한적임을 의미합니다.
새로운 모달리티의 신약 개발 도입과 연구실에서 개발한 기술을 임상으로 연결하는 데는 오랜 시간과 비용이 필요합니다. 상기 언급한 제약으로 인해 압타머가 처음 개발되었을 때 보였던 잠재력을 실현하지 못한 것도 사실입니다. 첫 번째 SELEX 기술 개발 이후 여러 압타머가 선택되어 진단 및 치료 기술 모두에서 성공적으로 적용되었지만, 지금까지 암 치료에 승인된 압타머는 없습니다. 그럼에도 불구하고 전 세계 연구자들은 이러한 장애물을 극복하기 위해 노력하고 있습니다. 당사에서는 변형된 뉴클레오티드를 적용한 SELEX를 통해 구조적 다양성을 확대하여 압타머의 표적 결합력, 발굴성공율이 대폭 개선된 고성능 압타머를 약물개발에 활용하고 있으며, 화학적 변형을 도입한 최적화를 통해 위에서 제시한 핵산분해효소에 대한 안정성도 동시에 개선하여 안정성 높은 압타머를 활용하고 있습니다.
전 세계 연구자들은 이러한 장애물을 극복하기 위해 노력하고 있습니다. 당사에서는 변형된 뉴클레오티드를 적용한 SELEX를 통해 구조적 다양성을 확대하여 압타머의 표적 결합력, 발굴성공율이 대폭 개선된 고성능 압타머를 약물개발에 활용하고 있으며, 화학적 변형을 도입한 최적화를 통해 위에서 제시한 핵산분해효소에 대한 안정성도 동시에 개선하여 안정성 높은 압타머를 활용하고 있습니다.
초기 압타머 기술은 in vitro 평가에서 나타나는 우수한 표적 결합력과 선택성에도 불구하고 생체 내에서 빠르게 분해되어 사라지기 때문에 동물모델 등 in vivo 실험에서는 좋은 결과를 얻지 못했습니다. 또한, 항체 대비 짧은 반감기를 보이는 약동력학적 특성이 비경구로 전신투여되는 약물의 개발에는 적합하지 않다는 인식으로 인해 초기에는 국소투여가 필요한 질환(안과질환 등)을 중심으로 압타머 기반 약물개발이 진행되어 왔습니다. 그러나, 그동안 압타머를 포함한 올리고뉴클레오티드 물질들의 약물로서의 잠재성을 실현시키기 위해 약동력학적 특성을 개선하기 위한 기술개발(pegylation 등), 핵산분해효소에 대한 저항성을 높이기 위한 기술개발(뉴클레오티드의 화학적 변형체 도입 등)이 꾸준히 진행되어 왔고, 실제 압타머와 동일 구조계열의 올리고뉴클레이티드 물질인 siRNA, ASO 핵산의약품의 개발에 활발히 적용되고 있습니다. 압타머도 관련 기술들의 도입으로 안정성을 높이고, 기능기의 접합(pegylation 등)을 통해 반감기가 개선된 물질들을 기반으로 국소질환 뿐만 아니라 항암 등 다양한 적응증에 대한 개발이 이루어지고 있습니다.
| [압타머 및 바이오 신약 승인 연혁] |
 |
|
압타머 및 바이오 신약 승인 연혁 |
| (출처 : 당사 제시) |
한편, 2010년 압타머 발굴 원천기술 특허가 만료되었고, 2023년 마침내 두번째 압타머 신약으로 FDA 승인을 획득한 노인성 황반변성 치료제인 아이베릭사의 Izervay의 출시와 글로벌 제약사 아스텔라스의 인수합병(59억 달러)은 본격적인 압타머 기반 제품 개발에 대한 시장의 관심 증대의 계기가 되었고, 새로운 치료제 및 제품 출시의 시발점이 될 것으로 예상되고 있습니다.
| [글로벌 압타머 치료제 임상 진행 현황] |
| 번호 | 개발사 (국가) |
2023년 매출기준 세계 20위 제약사 여부 |
신약 후보물질 | 적응증 | 단계 | 기타 | |
|---|---|---|---|---|---|---|---|
| 1 | Gilead Sciences, Inc. (미국) |
여 | Macugen | Pegaptanib sodium | 습성 황반변성 | 시판허가 | FDA 2004년 9월 승인 2000년 Gilead Sciences가 Eyetech에 L/O ($32m) Eyetech, Pfizer 공동 개발 |
| 2 | IVERIC Bio (미국) |
부 | Izervay (Zimura) |
Avacincaptad pegol sodium | 노인성 황반변성 | 시판허가 | FDA 2023년 8월 승인 2023년 7월 IVERIC Bio가 Astellas Pharma에 M&A. |
| 3 | Guardian Therapeutics (미국) |
부 | BT200 | Rondoraptivon pegol | 혈우병 A | 2상 | - |
| 폰빌레브란트병 | 2상 | - | |||||
| 4 | aptaTargets (스페인) |
부 | ApTOLL | TLR4 antagonists | 급성 허혈성 뇌졸중 | 1b/2a상 | - |
| COVID-19 | 1상 | - | |||||
| 5 | TME Pharma (독일) |
부 | NOX-A12 | Olaptesed Pegol | 교모세포종 | 2상 | - |
| 췌장암, 대장암 | 2상 | - | |||||
| 혈액암(다발성골수종, 만성림프구성백혈병) | 2상 | - | |||||
| NOX-E36 | Emapticap Pegol | 간암, 췌장암 | 비임상 | - | |||
| 6 | Berlin Cures (독일) |
부 | BC007 | - | 확장성 심근병증 | 2상 | - |
| 만성 코로나19 증후군 | 2상 | - | |||||
| 녹내장 | 2상 | - | |||||
| 7 | APTARION Biotech (독일) |
부 | AON-D21 | C5a inhibitors | 지역사회성폐렴 | 2상 | - |
| AON-S08 | IL-8 inhibitors | N/D | 비임상 | - | |||
| 8 | Basking Biosciences (미국) |
부 | BB-031 | - | 급성 허혈성 뇌졸중 | 2상 | - |
| 9 | Aptahem (스웨덴) |
부 | Apta-1 | Immunostimulants | 패혈증 | 1상 | - |
| 10 | AptaBio (한국) |
부 | Apta-16 | - | 혈액암(급성골수성백혈병) | 1상 | - |
| 11 | Aptamer Sciences (한국) |
부 | AST-201 | - | 간암, 비소세포폐암 | 1상 | - |
| AST-202 | - | 면역항암제, 혈액암 | 비임상 | - | |||
| AST-203 | - | 췌장암 | 비임상 | - | |||
| (출처:당사 제시) |
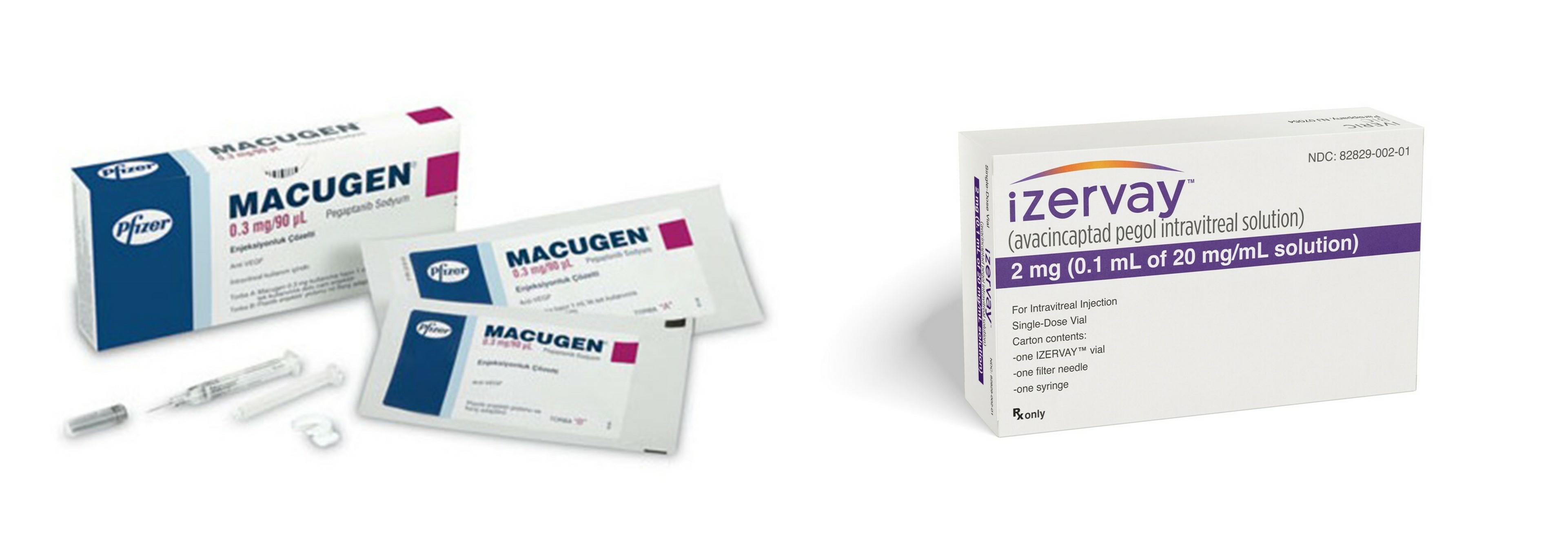
압타머 기술 기반 승인 신약으로는 Macugen(Pfizer, 2004)과 Izervay(Astellas, 2023) 두 종이 있습니다. Macugen은 FDA 승인된 첫번째 압타머 신약으로 혈관내피성장인자(VEGF)의 선택적 억제제로 습성 연령관련 황반변성(wetAMD) 치료제입니다. 좀더 효과적인 VEGF 억제제의 출시(Lucentis 및 Avastin) 에 따른 매출 감소로 현재는 시장에서 판매중단이 되었습니다. 2023년 두 번째 압타머 신약으로 FDA 승인을 득한 Izervay는 complement protein C5의 억제제로 황반변성 지도모양위축(Geographic atrophy, GA)의 치료제입니다. 매출은 2023년 9월 출시 이후 121억엔(한화 약 1,147억원)으로 연간 예측치를 상회하였고, 2024년 4분기 예상 시장 점유율은 경쟁제품 대비 25%로 추정되고 있습니다.
| [압타머 기반의 FDA 허가 신약] |
 |
|
압타머 FDA 허가 신약 2종 |
| (출처: 당사 제시) |
항체는 항암, 약물전달, 자가면역질환 영역에서 많은 약물개발의 성공사례로 인해 치료제 개발의 대세로 자리잡고 지속적으로 성장하고 있습니다. 그에 따른 교육, 투자, 기술적 인프라도 잘 갖추어져 있습니다. 반면, 압타머는 아직까지는 emerging 기술로 개발경로가 덜 탐색되어 있어 주목도가 낮고, R&D의 투자도 매우 부족한 현실입니다.
새로운 모달리티의 신약 개발 도입과 연구실에서 개발한 기술을 임상으로 연결하는 데는 오랜 시간과 비용이 필요합니다. 상기 언급한 제약으로 인해 압타머가 처음 개발되었을 때 보였던 잠재력을 실현하지 못한 것도 사실입니다. 첫 번째 SELEX 기술 개발 이후 여러 압타머가 선택되어 진단 및 치료 기술 모두에서 성공적으로 적용되었지만, 지금까지 암 치료에 승인된 압타머는 없습니다.
그러나 현재까지도 압타머 산업은 원천 특허 공개 직후 아직 압타머 기반 진단 제품과 신약 제품의 본격적인 출시가 이루어지지 않은 초기 형성 단계의 시장으로서 항체 의약품 등 기타 의약품 시장에 비해 아직 시장 규모가 크지 않으며, 향후 추정치에 대한 실제 시장형성에 대한 불확실성이 존재합니다. 또한 향후 관련 기술 개발 및 상용화가 지연될 경우, 미래 시장의 규모가 예상보다 낮을 수 있습니다. 이러한 경우, 당사의 영업 실적에 부정적인 영향을 미칠 수 있습니다.
(주3) 정정 전
| 나. 신약 개발사업의 특성에 따른 위험 신약개발은 후보물질의 발굴에서부터 완제의약품의 시장 판매까지 통상적으로 10년 이상의 긴 시간과 막대한 개발자금이 소요되며, 개발 과정에서 임상시험을 통하여 의약품의 안전성과 효능을 충분히 입증하여야 하는 고비용 고위험군의 산업으로 신약 개발이 성공하게 되면 특허권에 의해 독점 판매권을 보장받을 수 있는 고수익 산업이기도 합니다. 당사는 이러한 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 특히, 또한 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고, 조속한 사업성을 확보하고자 합니다. 하지만 신약개발의 특성상 임상시험 단계에서 예상치 못한 부작용 발생, 효능 입증 실패 등으로 치료제 개발에 실패할 수 있는 위험이 존재하며 이 경우 각 임상 시험 단계에서 기술이전 계약체결에 실패하게 될 수 있습니다. 또한, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인의 연구개발 진행이 지연 또는 중단될 수 있으며, 이로 인해 당사의 성장성 및 수익성에 부정적인 영향을 미칠 수 있습니다. |
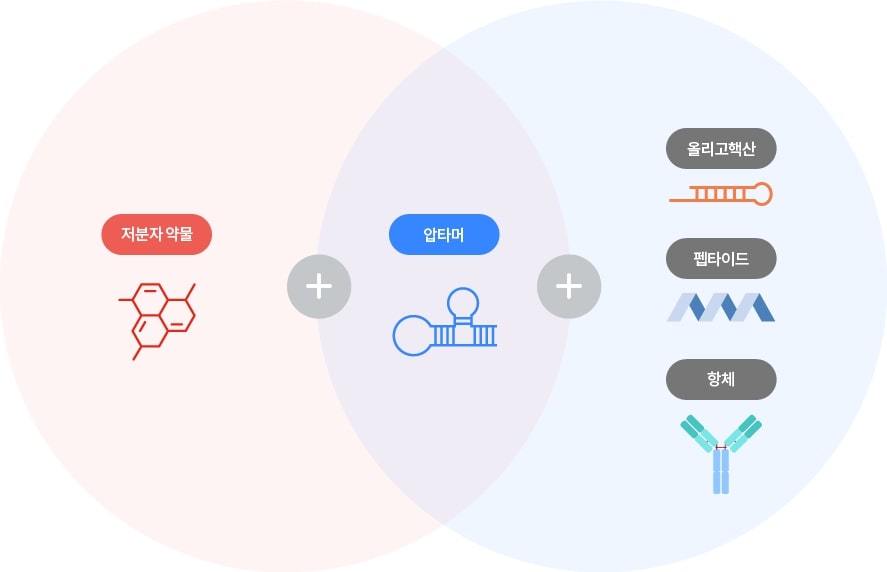
신약개발은 후보물질의 발굴에서부터 완제의약품의 시장 판매까지 통상적으로 10년 이상의 긴 시간과 막대한 개발자금이 소요되며, 개발 과정에서 임상시험을 통하여 의약품의 안전성과 효능을 충분히 입증하여야 하는 고비용 고위험군의 산업으로 신약 개발이 성공하게 되면 특허권에 의해 독점 판매권을 보장받을 수 있는 고수익 산업이기도 합니다.
| [압타머 신약 개발 플랫폼] |
 |
|
압타머 신약 개발 플랫폼 |
| (출처 : 당사 제시) |
당사는 신약 표적에 대한 선도물질을 발굴하고 최적화하는 단계를 거쳐 개발 후보 물질을 도출하는 당사 고유의 압타머 신약 개발 시스템을 개발하였습니다. 신약 개발 기술 플랫폼인 AlloMAp 플랫폼과 BiFAp 플랫폼을 기반으로 고형암 치료제, 혈액암 치료제 등 혁신 신약을 연구개발하고 있습니다. 그러나 하나의 글로벌 신약 창출을 위해 오랜 시간과 막대한 비용을 투자해야 하며, 성공확률도 매우 낮다는 것이 신약개발의 높은 진입장벽으로 작용합니다.
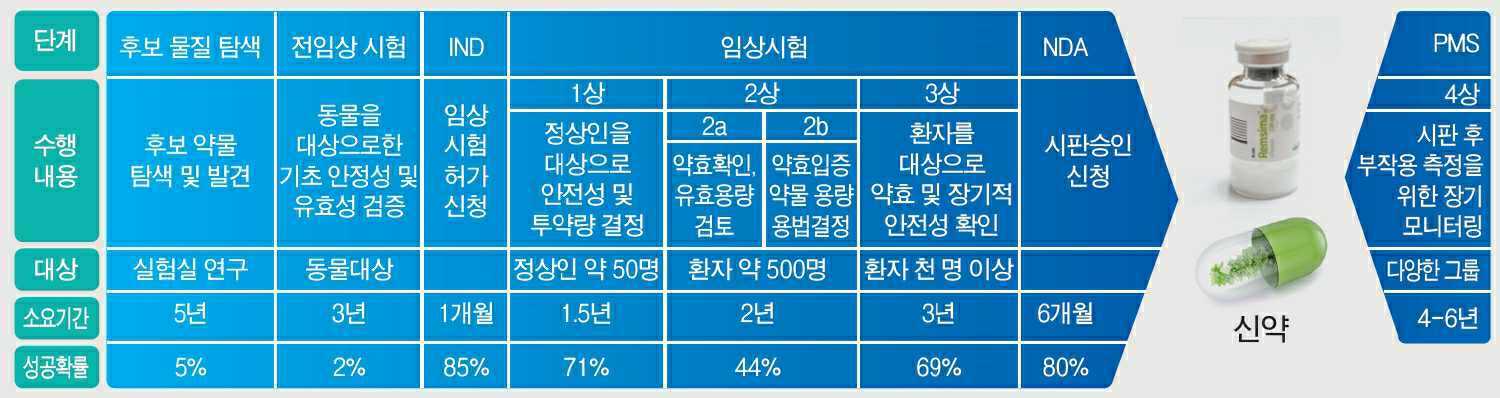
| [신약 개발 및 승인 프로세스] |
 |
|
신약개발 프로세스 |
| (출처 : 글로벌 제약시장 임상 파이프라인 분석(한국바이오경제연구센터, 2017년)) |
한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이 과정에서는 신약의 효능이나 작용기전을 기반으로 신약개발 대상물질을 선정합니다. 유효물질(hit compound), 선도물질(lead compound)을 거쳐 신약 후보물질이 선정되면 후보물질의 안정성과 효과를 확인하기 위해 동물 모델을 대상으로 전임상시험(pre-clinical trial)을 진행합니다. 전임상시험을 통해 후보물질의 효과와 안전성을 검증하면 허기가관에 임상시험 허가신청(IND : Investigational New Drug Application)을 하고, 사람을 대상으로 약물의 효과의 부작용을 확인하는 임상시험(clinical trial)을 수행합니다. 임상시험을 마친 후에는 식약처에 임상시험 결과를 제출하게 되는데, 이를 신약 허가신청(NDA : New Drug Application)이라고 합니다.
당사는 이러한 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 특히, 또한 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고, 조속한 사업성을 확보하고자 합니다.
하지만 신약개발의 특성상 임상시험 단계에서 예상치 못한 부작용 발생, 효능 입증 실패 등으로 치료제 개발에 실패할 수 있는 위험이 존재하며 이 경우 각 임상 시험 단계에서 기술이전 계약체결에 실패하게 될 수 있습니다. 또한, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인의 연구개발 진행이 지연 또는 중단될 수 있으며, 이로 인해 당사의 성장성 및 수익성에 부정적인 영향을 미칠 수 있습니다.
(주3) 정정 후
| 나. 신약 개발사업의 특성에 따른 위험 신약개발은 후보물질의 발굴에서부터 완제의약품의 시장 판매까지 통상적으로 10년 이상의 긴 시간과 막대한 개발자금이 소요되며, 개발 과정에서 임상시험을 통하여 의약품의 안전성과 효능을 충분히 입증하여야 하는 고비용 고위험군의 산업으로 신약 개발이 성공하게 되면 특허권에 의해 독점 판매권을 보장받을 수 있는 고수익 산업이기도 합니다. 당사는 이러한 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 특히, 또한 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고, 조속한 사업성을 확보하고자 합니다. 하지만 신약개발의 특성상 임상시험 단계에서 예상치 못한 부작용 발생, 효능 입증 실패 등으로 치료제 개발에 실패할 수 있는 위험이 존재하며 이 경우 각 임상 시험 단계에서 기술이전 계약체결에 실패하게 될 수 있습니다. 또한, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인의 연구개발 진행이 지연 또는 중단될 수 있으며, 이로 인해 당사의 성장성 및 수익성에 부정적인 영향을 미칠 수 있습니다. |
신약개발은 후보물질의 발굴에서부터 완제의약품의 시장 판매까지 통상적으로 10년 이상의 긴 시간과 막대한 개발자금이 소요되며, 개발 과정에서 임상시험을 통하여 의약품의 안전성과 효능을 충분히 입증하여야 하는 고비용 고위험군의 산업으로 신약 개발이 성공하게 되면 특허권에 의해 독점 판매권을 보장받을 수 있는 고수익 산업이기도 합니다.
| [압타머 신약 개발 플랫폼] |
 |
|
압타머 신약 개발 플랫폼 |
| (출처 : 당사 제시) |
당사는 압타머 발굴에서부터 최적화 단계를 거쳐 개발 후보물질을 도출하고 이를 임상단계까지 진입시킬 수 있는, 즉 후기 임상을 제외한 신약개발 전주기에 걸친 추진 및 협력 체계를 구축했습니다. 신약 개발 기술 플랫폼인 압타머-약물접합체(ApDC®) 플랫폼을 기반으로 고형암 치료제, 혈액암 치료제 등 혁신 신약을 연구개발하고 있습니다. 그러나 하나의 글로벌 신약 창출을 위해 오랜 시간과 막대한 비용을 투자해야 하며, 성공확률도 매우 낮다는 것이 신약개발의 높은 진입장벽으로 작용합니다.
| [신약 개발 및 승인 프로세스] |
 |
|
신약개발 프로세스 |
| (출처 : 글로벌 제약시장 임상 파이프라인 분석(한국바이오경제연구센터, 2017년)) |
한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이 과정에서는 신약의 효능이나 작용기전을 기반으로 신약개발 대상물질을 선정합니다. 유효물질(hit compound), 선도물질(lead compound)을 거쳐 신약 후보물질이 선정되면 후보물질의 안정성과 효과를 확인하기 위해 동물 모델을 대상으로 전임상시험(pre-clinical trial)을 진행합니다. 전임상시험을 통해 후보물질의 효과와 안전성을 검증하면 규제기관에 임상시험 허가신청(IND : Investigational New Drug Application)을 하고, 사람을 대상으로 약물의 효과의 부작용을 확인하는 임상시험(clinical trial)을 수행합니다. 임상시험을 마친 후에는 규제기관에 임상시험 결과를 제출하게 되는데, 이를 신약 허가신청(NDA : New Drug Application)이라고 합니다.
당사는 이러한 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 또한, 전임상 또는 초기 임상단계에서의 조기 기술이전 또는 이를 전제로 한 공동연구개발 파트너링도 적극적으로 추진하고 있습니다. 특히, 또한 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고, 조속한 사업성을 확보하고자 합니다.
하지만 신약개발의 특성상 임상시험 단계에서 예상치 못한 부작용 발생, 효능 입증 실패 등으로 치료제 개발에 실패할 수 있는 위험이 존재하며 이 경우 각 임상 시험 단계에서 기술이전 계약체결에 실패하게 될 수 있습니다. 또한, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인의 연구개발 진행이 지연 또는 중단될 수 있으며, 이로 인해 당사의 성장성 및 수익성에 부정적인 영향을 미칠 수 있습니다.
(주4) 정정 전
|
다. 신약 임상시험 실패에 따른 위험 의약품 산업은 국민의 건강과 직결되는 규제산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 등 전 과정을 엄격히 국가에서 규제하고 있습니다. 의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 이러한 단계를 거치는 과정에 각 나라의 엄격한 규제와 지침을 준수해야 하며, 각 임상 단계마다 유의한 실험 결과를 도출하여 약물의 효능과 안정성을 충분히 입증하여야 다음 단계의 임상 진행 및 허가가 가능합니다. |
의약품 산업은 국민의 건강과 직결되는 규제산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 등 전 과정을 엄격히 국가에서 규제하고 있습니다. 의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 이러한 단계를 거치는 과정에 한국식품의약품안전처(MFDS) 혹은 미국식품의약국(FDA) 등 각 나라의 엄격한 규제과 지침을 준수해야 합니다. 또한, 각 임상 단계별마다 유의한 실험 결과를 도출하여 약물의 효능과 안전성을 충분히 입증하여야 다음 단계의 임상 시험 진행 및 허가가 가능합니다.
신약개발의 단계는 임상 시험에 진입하기 전 실험실에서 목표 유전자 발견 및 약물 후보물질 발굴로부터 시작됩니다. 특정한 질병의 원인이 되는 목표 단백질 등을 규명하여 약물의타겟으로 정한 후 이에 적합한 치료용 후보 물질을 발굴해야 합니다.
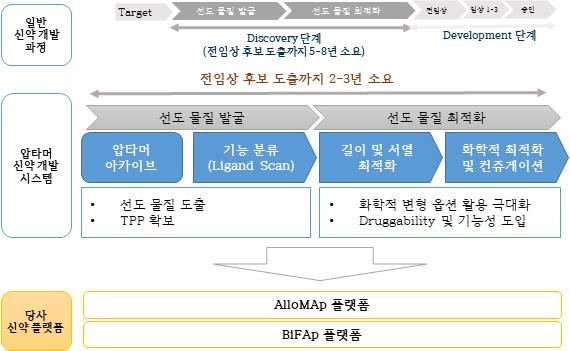
당사가 개발한 AlloMAp과 BiFAp의 압타머 신약개발 플랫폼은 신약 표적에 대한 선도물질을 발굴하고 최적화하는 단계를 거쳐 개발 후보 물질을 도출하는 당사 고유의 압타머 신약개발 시스템입니다. 당사 압타머 라이브러리를 통해 결합력이 뛰어난 압타머를 발굴해내는 기술로 일반 신약 개발 프로세스에서 5년에서 7년이 소요되는 과정을 3년 내에 전임상 후보 물질을 발굴하고 있는 기술입니다.
| [당사 운용 압타머 신약 발굴 시스템 및 신약 플랫폼] |
 |
|
당사 운용 압타머 신약 발굴 시스템 및 신약 플랫폼 |
| (출처 : 당사 자료) |
그 이후의 본격적인 임상시험(Clinical Trial)은 크게 전임상과 임상으로 구분되며, 임상은 신약 시판 허가 전 3단계와 시판 후 임상시험까지를 포함해 총 4단계로 나눌 수 있습니다. 전임상 시험은 기초탐색 과정을 거쳐 도출된 신약 후보물질에 대해 동물을 대상으로 실시하는 단계로, 후보물질의 효능보다는 안전성을 위주로 진행됩니다. 그 다음 임상1상 시험은 실제 사람에게도 투여해 부작용이 없는지 안전성을 처음으로 확인하는 단계입니다. 임상2상 시험은 1상을 통해 안전성이 확인된 후보물질의 효능을 본격적으로 알아보는 단계로, 대상질환 가운데 조건에 부합하는 환자를 대상으로 단기 투약에 따른 부작용 및 예상 적응증에 대한 효과를 탐색하게 됩니다. 임상3상 시험은 신약허가를 받기 위한 최종 단계로, 치료대상이 되는 질병에 대한 시험약의 유효성과 안전성에 대해 통계적인 검증을 통해약물에 대한 최종평가를 내립니다. 마지막 임상 4상은 신약허가를 받고 시판을 시작한 이후 추가적인 적응증이나 부작용 등을 검사하기 위해 이뤄지는 시험입니다.
|
[임상 평가 단계] |
|
구분 |
피험자수 |
검토사항 |
목적 |
|---|---|---|---|
|
제1상 |
비교적 건강한 사람 대상 20~100명 |
주로 안전성 |
- 안전 용량 범위 확인 |
|
제2상 |
통상 100-200여명의 환자 대상(질환에 따라 상이) |
단기 유효성 및 안전성 검토 |
- 약효 입증 |
|
제3상 |
수백~수천명 환자 |
안전성 확립 및 유효성 재확인 |
- 충분한 환자에서 유효성 및 안전성 확립 |
|
제4상 |
- |
- 약물의 유해반응(부작용) 빈도에 대한 추가 정보 획득(시판 후 안전성 조사, Post Marketing Surveillance) |
|
| (출처 : 당사 자료) |
이러한 각 임상 단계별 성공률은 단계마다 상이하며, 최종 허가 승인까지의 성공 확률은 약 8% 정도로 조사되었습니다. 각 임상단계별로는 임상1상은 52.0%, 임상2상은 28.9%, 임상3상은 57.8%로 나타났습니다. 당사의 사업 계획은 전임상 혹은 1상에서 2상 초기 단계까지 개발 후 라이센스 아웃하는 것이 목표이기 때문에 임상 2상까지의 단계를 진행하는 도중에 실패할 경우 당사에 부정적인 영향을 미칠 수 있습니다.
| [신약개발 성공확률 현황 (미국 FDA, 2011년~2020년] |
| 구분 | 임상1상 | 임상2상 | 임상3상 | NDA/BLA |
| NDA/BLA(까지) | 7.9% | 15.1% | 52.4% | 90.6% |
| 차상위단계(까지) | 52.0% | 28.9% | 57.8% | 90.6% |
| 소요기간 | 2.3년 | 3.6년 | 3.3년 | 1.3년 |
|
(출처 : Clinical Development Success Rates and Contributing Factors 2011-2020(2021)) 주2) BLA(Biologic License Application) : 바이오의약품의 신약 승인단계 |
2상까지의 임상 단계를 거치면서 전임상 단계에서의 안전성 및 효능 검증과 각 임상 단계에서의 부작용과 효능에 대한 검증을 모두 통과해야만 최종 허가를 득할 수 있습니다. 그렇기 때문에 전 단계에서 유효한 결과를 얻었다 하더라도 각 임상 단계에서 유효성이나 안전성 입증이 미흡하면 임상 실패의 위험이 존재합니다.
당사가 개발 진행 중인 파이프라인들도 관련 규정에서 정한 임상 단계를 성공적으로 수행하여야 하며 향후 당사의 신약 파이프라인 임상 계획은 다음과 같습니다. 그러나 이러한 임상 계획에도 불구하고 임상 초기 단계에서 안전성 혹은 효능 이슈가 발생되어 추가 개발이 불가해지거나 유효성 입증에 실패할 수 있습니다.
|
[당사 신약 파이프라인 임상진행 계획] |
|
파이프라인 |
표적질병 |
개발단계 |
임상 진행 계획 |
|
AST-201 |
고형암 (간세포암, 비소세포폐암, 췌담도암) |
임상1상 | - 2024년 3분기 식약처 IND 승인(예상), 4분기 국내 다기관임상 시작 - 2025년 PoC 데이터 입고 - 2026년 최종결과보고서 수령 |
| AST-202 (혈액암치료제) |
혈액암 (림프종) |
전임상 | - 2024~25년 전임상 시험 - 2026년 임상1상 진입 |
|
AST-203 (고형암 치료제) |
고형암 (췌장암, 비소세포폐암) |
전임상 | - 2025~26년 전임상 시험 - 2026년 임상1상 진입 |
| (출처 : 당사 자료) |
한편, 당사는 간암 치료제(AST-201) 및 혈액암 치료제(AST-202) 등의 신약 파이프라인을 개발 중이나, 신고서 제출일 현재 당사가 체결한 라이센스 아웃(License-Out) 계약 사항은 없습니다. 이러한 임상 계획에도 불구하고 임상 초기 단계에서 안전성 이슈가 발생되어 추가 개발이 불가해지거나 유효성 입증에 실패할 수 있으며, 이는 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
(주4) 정정 후
|
다. 신약 임상시험 실패에 따른 위험 의약품 산업은 국민의 건강과 직결되는 규제산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 등 전 과정을 엄격히 국가에서 규제하고 있습니다. 의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 이러한 단계를 거치는 과정에 각 나라의 엄격한 규제와 지침을 준수해야 하며, 각 임상 단계마다 유의한 실험 결과를 도출하여 약물의 효능과 안정성을 충분히 입증하여야 다음 단계의 임상 진행 및 허가가 가능합니다. |
의약품 산업은 국민의 건강과 직결되는 규제산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 등 전 과정을 엄격히 국가에서 규제하고 있습니다. 의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 이러한 단계를 거치는 과정에 한국식품의약품안전처(MFDS) 혹은 미국식품의약국(FDA) 등 각 나라의 엄격한 규제과 지침을 준수해야 합니다. 또한, 각 임상 단계별마다 유의한 실험 결과를 도출하여 약물의 효능과 안전성을 충분히 입증하여야 다음 단계의 임상 시험 진행 및 허가가 가능합니다.
신약개발의 단계는 임상 시험에 진입하기 전 실험실에서 목표 유전자 발견 및 약물 후보물질 발굴로부터 시작됩니다. 특정한 질병의 원인이 되는 목표 단백질 등을 규명하여 약물의타겟으로 정한 후 이에 적합한 치료용 후보 물질을 발굴해야 합니다.
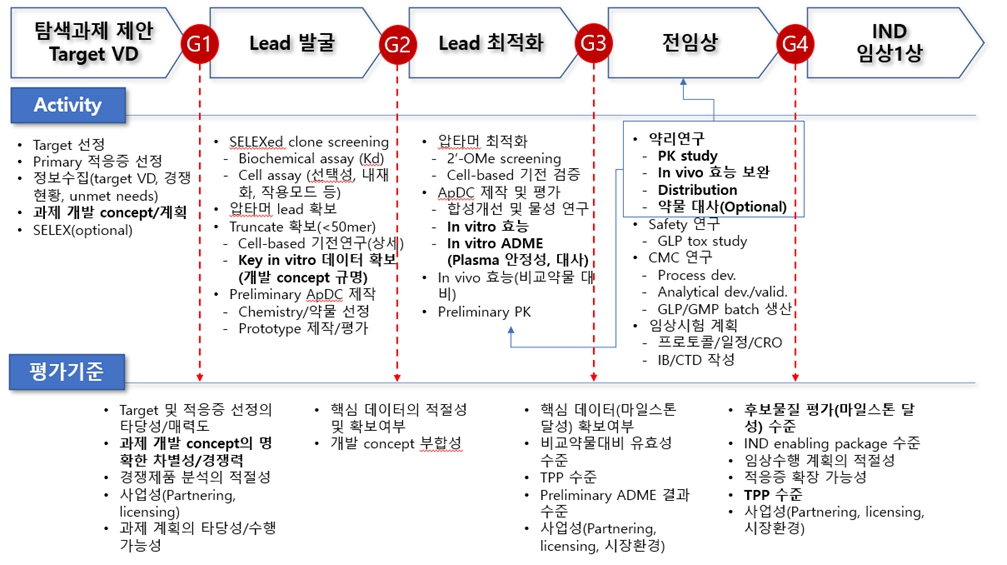
당사가 개발한 ApDC® 신약개발 플랫폼은 신약 표적에 대한 선도물질을 발굴하고 최적화하는 단계를 거쳐 개발 후보 물질을 도출하는 당사 고유의 압타머 신약개발 시스템입니다. 당사 압타머 라이브러리를 통해 결합력이 뛰어난 압타머를 발굴해내는 기술로 일반 신약 개발 프로세스에서 5년에서 7년이 소요되는 과정을 3년 내에 전임상 후보 물질을 발굴하고 있는 기술입니다.
| [당사 운용 압타머 신약 발굴 시스템 및 신약 플랫폼] |
 |
|
압타머 신약 발굴시스템 |
| (출처 : 당사 자료) |
[압타머 신약개발 플랫폼]
| 기술명 | 압타머 기반 신약 개발 기술 (Aptamer Drug Discovery System)
|
|
기술의 목적 |
- 신약 표적에 대한 선도물질을 발굴하고 축적된 노하우를 기반으로 한 최적 단계를 거쳐
개발 후보 물질을 도출하는 당사 고유의 압타머 치료제 개발 시스템 - 일반 치료제 개발 프로세스 5년에서 7년 소요되는 후보물질 도출 과정을 3년 내에 전임상
후보물질 발굴 - ApDC® 항암제와 키메릭 압타머를 포함한 2개의 압타머 복합체(BiFAp) 신약 개발 플랫폼을
운용 |
|
기술의 내용 |
-변형핵산 기반 압타머 아카이브의 다양성으로부터 세포막 수용체 단백질에 대하여 특이적인 선택성과 강한 결합력을 가진 선도물질을 선별하고, 최적화를 통해 약물 가능성
(druggability)을 갖는 전임상 후보 물질을 도출하는 기술 |
|
기술의 경쟁력 |
- 발굴 초기 단계에서부터 압타머의 작용기능 선별을 통한 개발 기간 단축 - 압타머 물성의 경쟁력을 바탕으로 강력한 druggability 확보와 약물전달 전략 확보
- 단계별 최적화 과정을 통해 결과물 보호를 위한 강력한 특허 전략 확보 |
|
기술의 연속성 |
- 기확보된 세포막 수용체에 대한 압타머 서열 아카이브 정보와 선도 물질 선별특화 기술을
기반으로 연속적인 파이프라인 확보 가능 - 압타머 물질 합성 역량 및 기능성 분자 모듈화 도입 전략으로 기술의 연속성 및 확장성
확보 |
압타머는 SELEX(Systematic Evolution of Ligands by EXponential enrichment) 과정을 통해 발굴되며, 그 중심 원리는 무작위적으로 존재하는 핵산 라이브러리 중에서 표적 물질에 대한 결합력이 존재하는 개체들만을 선별하여 그 비중을 높이는 방식입니다. 압타머 발굴 과정은 ① DNA 합성 및 in vitro transcription(RNA인 경우)을 이용하여 다양한 서열을 가지는 핵산 라이브러리 제조(copy 수: 10의 14~15승), ② 핵산 구조체 라이브러리 안에 있는 다양한 핵산 구조체들 (압타머 후보 분자들)은 다양한 표적물질과 결합할 수 있는 능력을 가지고 있고 따라서 다음 과정으로 원하는 표적분자와 결합할 수 있는 핵산 구조체만을 선별하는 과정, ③ 결합하지 않은 핵산 구조체는 세척과정을 통해 제거되고 표적분자에 결합하는 것만을 선택적으로 얻는 과정, ④ 마지막으로 표적분자로부터 핵산 구조체를 분리(elution)시키고, ⑤ 그 핵산을 PCR을 통하여 증폭시켜 핵산 선별된 핵산 pool을 얻는 과정으로 이루어져 있습니다. 그리고 이 ②~⑤ 과정들을 8번 정도 반복함으로써 최종적으로 선별된 개체들은 표적 결합력이 매우 높은 특성을 지닙니다.
| [표적 단백질에 특이적으로 결합하는 압타머 발굴 SELEX 모식도] |
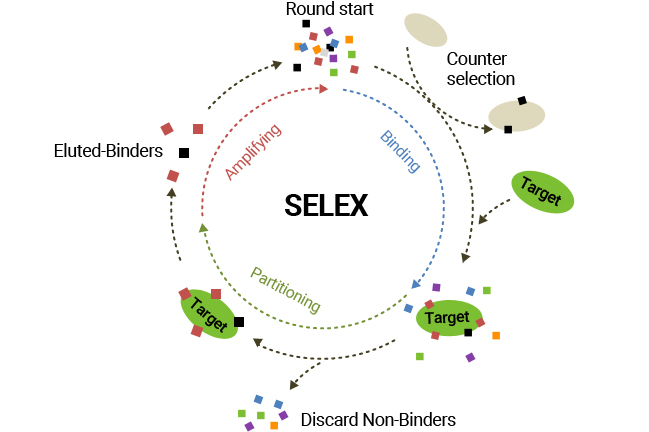 |
|
압타머 SELEX 과정 모식도 |
| (출처 : 당사 제시) |
SELEX 과정을 모니터링할 수 있는 기법으로서 SELEX의 단계 마다 압타머가 잘 선별되고 있는가를 확인하는 것은 최종적으로 성공적인 압타머를 만드는데 매우 중요한 요소 기술입니다. 당사는 실시간 중합효소반응(Real-time PCR)과 Cot assay기법을 통하여 SELEX 공정을 최적화하였습니다.
당사는 SELEX를 위한 핵산 라이브러리 제작과정에서 핵심(core) 염기서열의 수를 40mer까지 확장하고, 라이브러리에 염기 변형체를 도입함으로써 구조적 다양성을 확대하는 한편, 표적 단백질의 소수성 부위와의 상호작용을 증가시키고, SELEX 과정에 음전하 경쟁자(Dextran sulfate)를 도입하여 핵산의 음전하에 의한 비특이적 결합을 최소화하였습니다. 이를 통해서 표적 단백질에 대한 압타머 발굴 효율을 높이고, 표적 특이성과 결합력이 우수한 압타머를 발굴하고 있습니다.
| [변형핵산을 이용한 압타머 발굴] |
 |
|
변형핵산을 이용한 압타머 발굴 |
| (출처 : 당사 제시) |
표적 단백질에 대해 SELEX 선별 라운드를 8회 반복 진행하여 표적 단백질에 특이적으로 결합하는 압타머 pool을 얻고, 이후 차세대 염기서열 분석(Next Generation Sequencing)법을 통해 pool 내 클론(clone)들의 염기서열을 분석합니다.
NGS 분석결과를 바탕으로 압타머 core 부분의 염기서열을 기준으로 서열이 유사한 압타머들끼리 그룹을 지어 분류하고(sequence alignment), 염기서열이 서로 간에 상이하며 pool내에 다수 존재하는 압타머를 선별합니다. 당사에서는 이러한 SELEX 과정을 통해 GPC3, CD25, Trop2, PD-L1, EGFR 등 약 230종의 표적단백질에 대한 압타머를 발굴하였고, 각 압타머들의 표적결합, 세포결합, 표적활성에 미치는 영향 등의 연구를 통해 표적 특이성을 입증하고 있습니다.
[압타머 기술 한계점 극복 방안]
앞서 기술된 ApDC®플랫폼의 특장점 및 차별화 포인트와 당사가 보유한 다양한 세포막 단백질 표적 압타머 라이브러리를 바탕으로 저분자 약물의 표적전달을 통한 ADC의 미충족 과제를 해결할 수 있는 차세대 약물전달 기술의 개발(AST-201, AST-202, AST-203)뿐만 아니라, 면역활성화 분자, siRNA나 ASO 등의 올리고뉴클레오티드, 펩타이드/단백질, 치료용 방사성핵종의 표적전달 등 다양한 유형의 ApDC®개발로 플랫폼의 적용 영역을 확대하고 있습니다.
실제 3차원으로 배양된 종양 spheroid에서 항체 대비 최대 6.7배 높은 조직침투율을 보였으며, 종양동물모델을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 또한 ApDC® 플랫폼에는 당사가 자체적으로 개발해 특허출원한 분지형 링커(BLinker)-페이로드가 적용되는데, 이를 통해 압타머에 탑재할 수 있는 약물의 수를 증가시킬 수 있을 뿐만 아니라, 컨주게이트의 양친매성을 극대화해 자가중합을 통한 구형 나노미셀(spherical nanomicelle)을 형성합니다. 실제 BLinker를 적용해 제작된 압타머-약물 컨주게이트는 높은 혈장 안정성을 보여 탑재된 약물의 혈액 내 방출을 최소화할 수 있었으며, 이에 따른 약동력학적 프로파일이 크게 개선되었음이 실험적으로 증명되었습니다. 또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다.
| [ApDC® 플랫폼의 차별성] |
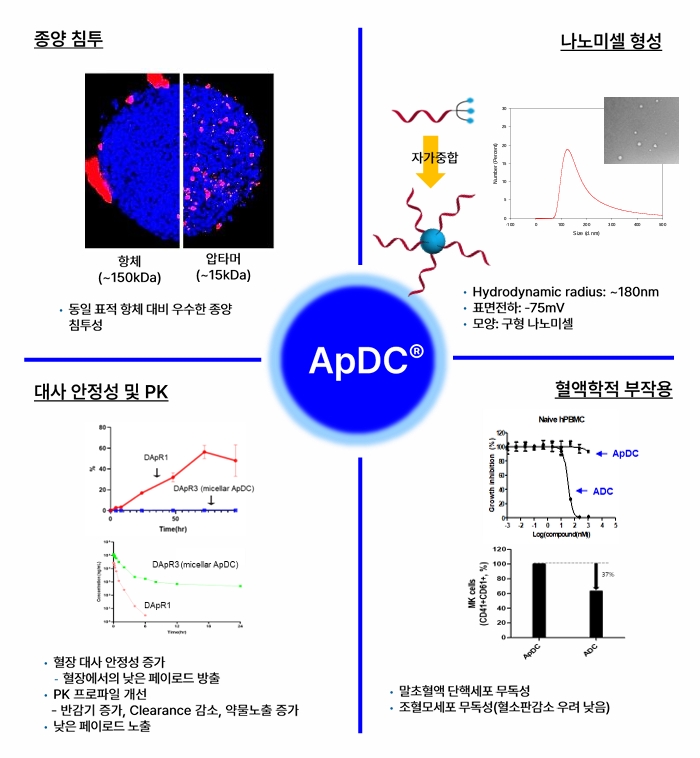 |
|
ApDC® 플랫폼의 차별성 |
| (출처 : 당사 제시) |
그 이후의 본격적인 임상시험(Clinical Trial)은 크게 전임상과 임상으로 구분되며, 임상은 신약 시판 허가 전 3단계와 시판 후 임상시험까지를 포함해 총 4단계로 나눌 수 있습니다. 전임상 시험은 기초탐색 과정을 거쳐 도출된 신약 후보물질에 대해 동물을 대상으로 실시하는 단계로, 후보물질의 효능보다는 안전성을 위주로 진행됩니다. 그 다음 임상1상 시험은 실제 사람에게도 투여해 부작용이 없는지 안전성을 처음으로 확인하는 단계입니다. 임상2상 시험은 1상을 통해 안전성이 확인된 후보물질의 효능을 본격적으로 알아보는 단계로, 대상질환 가운데 조건에 부합하는 환자를 대상으로 단기 투약에 따른 부작용 및 예상 적응증에 대한 효과를 탐색하게 됩니다. 임상3상 시험은 신약허가를 받기 위한 최종 단계로, 치료대상이 되는 질병에 대한 시험약의 유효성과 안전성에 대해 통계적인 검증을 통해약물에 대한 최종평가를 내립니다. 마지막 임상 4상은 신약허가를 받고 시판을 시작한 이후 추가적인 적응증이나 부작용 등을 검사하기 위해 이뤄지는 시험입니다.
|
[임상 평가 단계] |
|
구분 |
피험자수 |
검토사항 |
목적 |
|---|---|---|---|
|
제1상 |
비교적 건강한 사람 대상 20~100명 |
주로 안전성 |
- 안전 용량 범위 확인 |
|
제2상 |
통상 100-200여명의 환자 대상(질환에 따라 상이) |
단기 유효성 및 안전성 검토 |
- 약효 입증 |
|
제3상 |
수백~수천명 환자 |
안전성 확립 및 유효성 재확인 |
- 충분한 환자에서 유효성 및 안전성 확립 |
|
제4상 |
- |
- 약물의 유해반응(부작용) 빈도에 대한 추가 정보 획득(시판 후 안전성 조사, Post Marketing Surveillance) |
|
| (출처 : 당사 자료) |
이러한 각 임상 단계별 성공률은 단계마다 상이하며, 최종 허가 승인까지의 성공 확률은 약 8% 정도로 조사되었습니다. 각 임상단계별로는 임상1상은 52.0%, 임상2상은 28.9%, 임상3상은 57.8%로 나타났습니다. 당사의 사업 계획은 전임상 혹은 1상에서 2상 초기 단계 전후로 공동개발 및 기술이전하는 것이 목표이기 때문에 임상 2상까지의 단계를 진행하는 도중에 실패할 경우 당사에 부정적인 영향을 미칠 수 있습니다. 또한, 기술이전 이후에도 후속 개발결과에 따라 기술이 반환될 위험도 존재합니다.
| [신약개발 성공확률 현황 (미국 FDA, 2011년~2020년] |
| 구분 | 임상1상 | 임상2상 | 임상3상 | NDA/BLA |
| NDA/BLA(까지) | 7.9% | 15.1% | 52.4% | 90.6% |
| 차상위단계(까지) | 52.0% | 28.9% | 57.8% | 90.6% |
| 소요기간 | 2.3년 | 3.6년 | 3.3년 | 1.3년 |
|
(출처 : Clinical Development Success Rates and Contributing Factors 2011-2020(2021)) 주2) BLA(Biologic License Application) : 바이오의약품의 신약 승인단계 |
2상까지의 임상 단계를 거치면서 전임상 단계에서의 안전성 및 효능 검증과 각 임상 단계에서의 부작용과 효능에 대한 검증을 모두 통과해야만 최종 허가를 득할 수 있습니다. 그렇기 때문에 전 단계에서 유효한 결과를 얻었다 하더라도 각 임상 단계에서 유효성이나 안전성 입증이 미흡하면 임상 실패의 위험이 존재합니다.
당사가 개발 진행 중인 파이프라인들도 관련 규정에서 정한 임상 단계를 성공적으로 수행하여야 하며 향후 당사의 신약 파이프라인 임상 계획은 다음과 같습니다. 그러나 이러한 임상 계획에도 불구하고 임상 초기 단계에서 안전성 혹은 효능 이슈가 발생되어 추가 개발이 불가해지거나 유효성 입증에 실패할 수 있습니다.
|
[당사 신약 파이프라인 임상진행 계획] |
|
파이프라인 |
표적질병 |
개발단계 |
임상 진행 계획 |
|
AST-201 |
고형암 (간세포암, 비소세포폐암, 췌담도암) |
임상1상 | - 2024년 1분기 식약처 IND 승인신청(공시) - 2024년 4분기 식약처 IND 승인(예상), 4분기 국내 다기관임상 시작 - 2025~26년 PoC 데이터 입고 - 2027년 최종결과보고서 수령 |
| AST-202 (면역항암제/혈액암치료제) |
혈액암 (림프종, 백혈병) |
전임상 | - 2024~26년 전임상 시험 - 2027년 임상1상 진입 |
|
AST-203 (고형암 치료제) |
고형암 (췌장암, 비소세포폐암) |
전임상 | - 2025~26년 전임상 시험 - 2027년 임상1상 진입 |
| (출처 : 당사 자료) |
[파이프라인별 구체적인 계획]
당사의 신약개발 사업은 압타머를 기반으로 한 약물전달 플랫폼(Aptamer-drug conjugate)를 바탕으로 표적 약물전달을 할 수 있는 항암 신약개발에 초점을 맞추고 있습니다. 주요 신약개발 파이프라인과 진행현황은 다음과 같습니다.
| [ApDC 파이프라인별 진행 현황] |
| 파이프라인 |
약물유형 |
표적 |
적응증 |
약물 대 압타머 비율 (DApR, 주1) | 약물 (Payload, 주2) |
접합 방식 (주3) |
진행단계 |
임상수행국가 |
누적투자비용(백만원, 주4) |
| AST-201 | Drug incorporate | GPC3 |
고형암 (간암, 폐암)
|
3 | 젬시타빈 | ApDC 내재화 | IND 신청
|
한국 |
13,270 |
| AST-202 | Drug conjugate | CD25 |
혈액암 (T세포 림프종, 급성골수성 백혈병)
|
3 | MMAE | BLinker(분지형 링커) | 전임상 |
- | 641 |
| AST-203 | Drug conjugate | Trop2 |
고형암 (췌장암, 폐암)
|
3 | MMAE | BLinker(분지형 링커) | 전임상 |
- | - |
| (출처 : 당사 제시) (주1) ADC 및 ApDC를 평가하는 데 사용되는 중요한 매개변수 중 하나로, 약물 대 항체/압타머 비율을 가리킵니다. 이는 ADC 및 ApDC의 효능과 치료 지수를 결정하며, 이 단계를 제어하는 것은 ADC 및 ApDC의 품질에 중요합니다. 1세대 ADC의 약물 결합 방식은 항체와 약물 간의 비율을 정확하게 조절하지 못하여 약물 대 항체의 평균 비율에 맞춰 약물이 생산 및 정제됩니다. 이로 인해 치료 효과의 불균형과 부작용 발생 가능성이 증가할 수 있으며, 품질관리가 어렵습니다. 2세대 ADC는 항체의 특정 위치에 약물을 선택적으로 결합시켜 약물 대 항체 비율을 조절하는 다양한 기술이 적용되고 있습니다. (주2) 약물(payload)은 항암작용을 하는 독성물질로 미세소관 파괴 약물과 DNA 변형 약물이 주로 사용됩니다. ADC의 경우 항체, ApDC의 경우 압타머에 의해 암세포 표면의 표적 항원에 결합한 후 세포 내로 유입되며, 항체 또는 압타머는 세포 소기관인 리소좀(Lysosome)에서 분해되고 페이로드는 세포질로 방출되어 약물의 표적에 작용함으로써 암세포를 사멸시킵니다. 초기 ADC에는 DM-1, DM-4 등이 사용되었으며, 이후에는 MMAE, MMAF 등이 적용되었습니다. 최근에는 신규 페이로드를 적용하기 위한 시도가 활발하게 이루어지고 있습니다. (주3) 링커는 항체와 약물을 연결하는 역할을 하며, 접합 방식에 따라 cleavable linker와 non-cleavable linker로 구분됩니다. non-cleavable linker는 혈중에서 분해되지 않아 안정적이라는 장점이 있으나, 리소좀에 의해 분해되지 않으면 작용이 일어나지 않는다는 단점이 있습니다. Cleavable linker는 암세포의 pH, 효소 등에 의해 절단됩니다. 당사의 BLinker 기술은 효소에 의한 cleavage linker의 일종입니다. (주4) 상기 누적투자비용은 연구원 인건비와 회사의 판관비를 제외하고 해당 파이프라인에 사용된 직접비를 기준으로 하였습니다. 총 개발 비용은 현 시점에서 산정하기 어려우나, 국내 ADC 개발기업인 리가켐바이오(2024)에서도 임상 1~2상 진입 파이프라인 5개 이상의 개발에 예산 5000~6000억원을 편성한 바 있습니다. 이처럼 치료 범주, 임상 단계, 임상 국가 등에 따라 차이가 있겠으나, 기본적으로 ADC를 비롯한 ApDC의 개발에는 수백억 규모가 드는 것으로 볼 수 있습니다. |
1) 고형암 치료제
AST-201
| 구분 |
표적 약물전달 항암제 |
| 적응증 |
고형암(GPC3-양성) 주요 암종: 간암(HCC), 폐암(NSCLC) |
| 작용기전 |
종양 표면 GPC3 결합과 그에 따른 세포 내재화, 리소좀에서의 분해를 통해 활성 젬시타빈 방출 |
| 제품특성 |
-
간암을 포함한 GPC3-양성 종양에 선택적인 약물전달
-
젬시타빈을 압타머 서열 내에 내재화함으로써 (1) 젬시타빈에 대한 종양 약물 내성 기전 극복, (2) 제조공정 및 CMC의 단순화
-
압타머의 높은 조직 투과력과 신장을 통한 신속한 배출로 부작용 최소화 및 넓은 치료용량계수 확보 기대
-
면역항암제와의 병용 시너지 효과 기대
|
| 진행경과 |
-
임상용 원료 및 완제의약품 GMP 생산완료
-
전임상 GLP 독성시험(설치류, 비설치류) 완료
-
IND 신청완료(MFDS)
|
| 향후계획 |
-
임상1a/b상 시험개시(2024. 4Q), 국내 4개 site
|
| 경쟁제품 |
-
Sorafenib, Lenvatinib, Atezolizumab/bevacizumab |
| 관련논문등 |
-
YL Cho et al. Pharmaceutics, 2020, 12, 985 -
글리피칸3 특이적 압타머 복합체 및 이의 용도
- 대한민국 특허등록(2020): 10-2154683 - PCT 출원(2020): PCT/KR2020/015536
- 중국 특허등록 결정, 미국/유럽/일본 심사 중 |
| 시장규모 |
글로벌 간암치료제 시장은 2019년 기준 17.3억 달러에서 CAGR 20.2%로 성장하여 2027년까지 73.8억 달러 시장 예상 (출처: Fortune Business Insight 시장보고서) |
AST-201은 종양 특이적으로 발현하는 글리피칸3(GPC3)를 표적으로 하는 표적 항암치료제입니다. GPC3 특이적인 압타머에 항암제인 젬시타빈(gemcitabine)을 내재화한 형태로, 별도의 약물접합 과정없이 압타머 합성과정에서 서열 내에 내재화하여 종양의 젬시타빈 약물저항성 기전을 회피하면서 효과적으로 약물이 표적으로 전달되도록 디자인되었습니다.
GPC3는 간암(HCC, >70%), 비소세포폐암(NSCLC, >50%) 등에서 과발현이 보고되어 있고 성인의 정상세포에서의 조직별 발현은 없는 것으로 알려져 있습니다. 특히 간암에서는 전암성 병변(간경화)과 간암을 효과적으로 구분할 수 있는 바이오마커로 GPC3 발현 정도와 생존율 및 예후 간의 상관관계가 높은 것으로도 보고되고 있습니다. 특히, 최근 연구결과에 따르면 GPC3 발현이 높을수록 간암 1차 치료제인 아테졸리주맙-베바시주맙 병용요법의 임상 반응률이 현저히 떨어지는 것으로 보고되면서 GPC3는 간암치료제 개발에서 매우 중요한 표적으로 부각되고 있고, 항체 및 CAR-T 세포치료제 등 다양한 치료제 개발의 핵심 표적이 되고 있습니다.
AST-201은 GPC3-양성 종양에 선택적으로 결합하여 수용체-매개 내포작용(receptor-mediated endocytosis)를 통해 세포 내로 들어갑니다. 이후, 세포 내 분해소기관인 리소좀으로 이동하여 분해되면서 탑재되어 있던 젬시타빈을 세포 내로 방출하고 방출된 젬시타빈은 핵으로 이동해 DNA합성을 저해함으로써 종양세포를 죽이게 됩니다.
이러한 기본적인 약물전달 과정과 더불어 앞서 기술한 바와 같이 젬시타빈 내성과 관련된 주요 작용들에 대한 극복 기전 또한 규명되었습니다. 잘 알려진 전신투여 항암제인 젬시타빈은 종양의 젬시타빈 특이적 약물저항 기작으로 인해 여타 화학항암제와 마찬가지로 사용에 제한을 받고 있습니다. 주요 저항 기전으로는 ① CDA(cytidine deaminase)에 의한 젬시타빈 비활성화, ② NT(nucleoside transporter)의 변이로 인한 약물유입 저해, ③ 세포 내 dCK(deoxycytidine kinase)에 의한 젬시타빈 활성화의 속도저해가 있습니다. AST-201은 젬시타빈을 압타머 서열내에 직접 내재화함으로써 3가지 주요 저항 기전들로부터 보호되고 일부 경로를 우회할 수 있도록 설계되어 젬시타빈의 약물활성을 담보할 수 있습니다.
| [AST-201 작용 기전 및 장단점] |
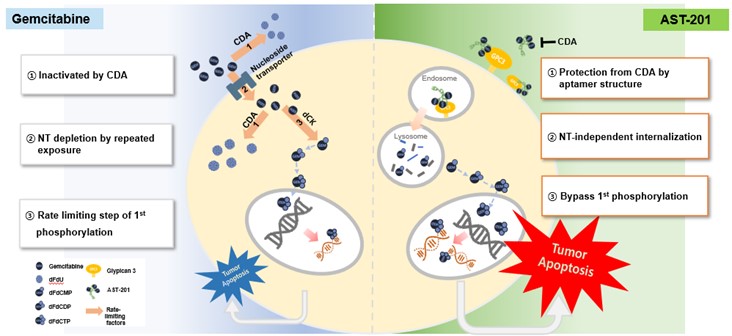 |
|
AST-201 작용기전 |
| 강점 | 한계 |
|
1)
전암성 병변인 간염, 간경화를 구분할 수 있는 선택성 높은 표적에 대한 약물전달 치료제
2) 젬시타빈에 대한 종양 저항성 기전 극복
3)
체내 물질대사의 핵심장기이나 종양으로 인해 약화된 간조직으로 인해 높은 potency의 항암제의 적용이 어려움. AST-201은 상대적으로 potency가 약한 젬시타빈을 표적 전달함으로써 간조직의 부담을 줄일 수 있는 약물전달치료제
4) 별도의 약물접합 과정이 배재되고 약물이 내재된 형태로 만들어지는 제조공정
|
1)
젬시타빈 자체의 potency 한계로 인해 AST-201의 높은 투여용량
2)
단독요법의 효능 한계 가능성 및 그에 따른 면역항암제 병용투여 필요성
3)
간암, 폐암 등 일부 암종에 제한된 적응증
|
| (출처 : 당사 자료) |
2) 면역항암제/혈액암 치료제 AST-202
| 구분 |
표적 약물전달 항암제 |
| 적응증 |
혈액암(CD25-양성) 주요 암종: T 세포 림프종(TCL), 급성골수성 백혈병(AML) |
| 작용기전 |
-
종양 표면 CD25 결합과 그에 따른 세포 내재화, 리소좀에서의 분해를 통해 세포분열 억제 약물인 MMAE 방출
-
종양 주변 환경 내 비율이 높은 종양면역억제 세포인 Treg의 선택적 불활성화 및 사멸
|
| 제품특성 |
-
CD25 선택적 압타머-약물 접합체
-
CD25-양성 세포 선택적 사멸 유도
-
BLlinker(분지형 링커기술, 특허출원) 활용한 다수의 약물도입으로 개선된 안정성 및 약동력학적 프로파일, 향상된 유효성
-
낮은 혈액학적 부작용(경쟁 ADC 대비 안전)
-
선택적 Treg 불활성화와 사멸 유도 및 이를 통한 항종양 면역 활성 증대
-
신속한 종양 표적화와 투과성, 빠른 체내 배출 특성을 활용함으로써 장기적인 Treg 소실로 인한 자가면역 등 부작용 및 비특이적 독성 최소화
-
높은 종양조직 투과성 및 빠른 종양세포 내재화률
-
면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대
|
| 진행경과 |
-
혈액암 동물모델에서의 종양성장 억제 및 완전관해 효과 확인
-
혈액암 동물모델 생존률 평가에서 대조군 대비 AST-202 투여군의 월등히 우수한 생존률 확인
-
ELOHA assay 기반 생체시료분석법 개발 완료
-
In vitro 대사안정성 및 설치류 렛트 PK 분석 완료
|
| 향후계획 |
-
In vivo 효능평가(추가 혈액암, 경쟁약물 비교 평가, 고형암, 단독투여 및 면역관문억제제 병용투여)
-
CMC 공정개발 및 전임상 GLP 독성 평가(2025)
|
| 경쟁제품 |
-
CD25 표적 치료제 약물 없음
-
개발 중인 파이프라인: ADC therapeutics의 ADCT-301(ADC, 임상2상)
-
혈액암 ADC: Adcetris (brentuximab vedotin)
|
| 관련논문등 |
-
JH Kang et al. AACR, 2022 -
D Lee et al. SITC, 2023 -
CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용
- 대한민국 특허 출원(2023): 10-2023-0149904 - PCT 출원(2023): PCT/KR2023/017344
|
| 시장규모 |
- 글로벌 면역항암제 시장 2023년 기준 7300억 원, 4년새 3배 성장(출처: IQVIA 시장보고서)
-
글로벌 비호지킨림프종 시장은 2022년 73억 달러, CAGR 8.2%, 2030년 135억 달러 예상(출처: DataM Intelligence 시장보고서)
-
글로벌 급성골수성백혈병 시장은 2023~2030년 CAGR 11.3% 성장(출처: Data Bridge Market Research 시장보고서)
-
혈액암 치료제 ADC인 Adcetris의 연간 매출은 2022년 기준 14.8억 달러(출처: Biopharma PEG article)
|
| 기타 |
-
국가신약개발사업 신약기반 확충 연구과제 수행
|
AST-202는 T세포 림프종, 급성골수성백혈병에서 특징적으로 과발현되는 CD25 단백질을 표적으로 하는 ApDC
®입니다. CD25-양성세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술(BLinker)을 적용 압타머에 3개의 약물이 접합되도록 설계되어 약효가 개선됨과 더불어 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
CD25는 IL-2 수용체의 구성 단백질로 IL-2alpha로도 알려져 있습니다. 면역조절세포인 조절T세포(regulatory T cell, Treg)에 높게 발현되어 있어 Treg 활성에 관여하는 단백질입니다. 더불어 다양한 혈액암에서도 과발현이 되어 있으며, 특히 T 세포 림프종과 급성골수성 백혈병에서 높은 발현이 관찰었고, 해당 암의 예후 및 재발과 밀접한 관련이 있는 것으로 보고되고 있습니다.
AST-202는 CD25-양성 종양에 선택적으로 결합하여 수용체-매개 내포작용(receptor-mediated endocytosis)를 통해 세포 내로 들어갑니다. 이후, 세포 내 분해소기관인 리소좀으로 이동하여 효소분해 특이적인 링커부분이 잘리면서 세포분열 억제약물 MMAE가 방출됩니다. 방출된 MMAE는 직접 전달된 세포의 사멸을 유도할 뿐만 아니라, 세포막을 통해 이동하여 주변 세포까지 분열억제 및 사멸 효과를 보입니다. 이러한 효과를 바이스탠더 효과(bystander effect)라 하고 이종(異種)의 세포들로 구성된 종양의 보다 효과적인 제거를 유도할 수 있습니다.
| [AST-202의 작용 기전] |
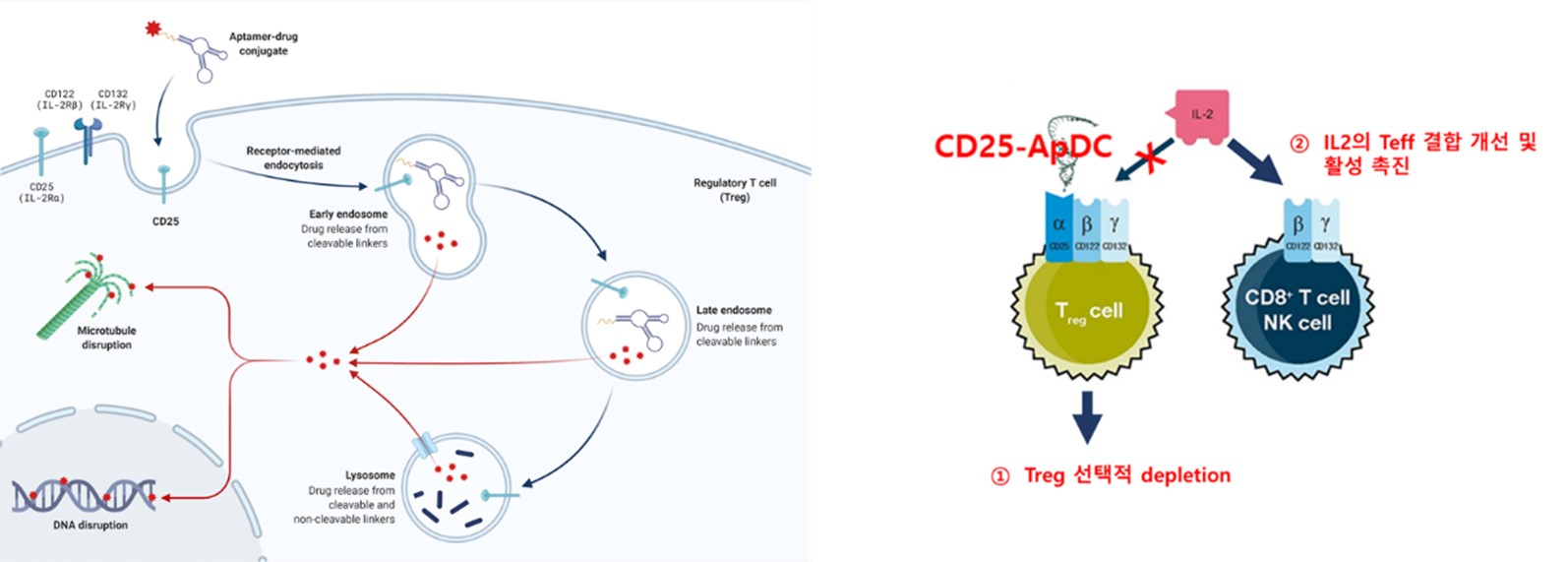 |
|
AST-202 작용기전 |
| (출처 : 당사 자료) |
국가신약개발과제 연구 수행을 통해 표적과의 높은 특이성과 빠른 세포 내재화 속도가 규명되었고, 당사 고유의 분지형 링커(Blinker)를 이용하여 압타머-약물 비율 조절하는 등 물질 자체의 최적화가 완료되었습니다. In-vitro에서 우수한 표적 결합, 약물전달 및 CD25-양성인 종양세포 및 조절 T 세포(Treg)의 선택적 depletion의 효과를 확인하였습니다. 또한, 1차적으로 혈액암의 동물모델에서 진행된 유효성 평가에서 주2회/2주 투약만으로 종양이 완전히 사라지는 용량군을 확인했으며, 투약 중단 이후 회복기간에도 종양 재성장이 관찰되지않는 우수한 효과가 확인되었습니다. 추가적인 시험을 통해 종양성장억제 효과의 최소 유효용량, 투여빈도 등을 확인하였습니다. 종양모델에서의 생존률 시험에서도 AST-202 투여군의 생존률이 극적으로 개선되는 효과가 확인되었습니다. 해당 연구결과는 미국암연구학회 연례학술대회(AACR 2023) 초록발표, 미국면역항암학회(SITC 2023)에서 포스터발표를 통해 공개된 바 있습니다.
현재는 후보물질을 확정하고 전임상 진입단계에 있습니다. 압타머의 예비독성 평가에서 hERG 시험/복귀돌연변이 시험/염색체이상반응 시험에서 모두 음성의 결과를 얻어 심장 및 유전독성의 가능성이 매우 낮은 물질임을 확인했습니다. 또한, 자체 개발한 ELOHA 시험법의 생체시료분석법이 개발되었고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)가 완료되었습니다. 더불어, 추가적인 혈액암 동물모델 평가를 통해 독성대비 유효용량범위 평가, 비교약물(Adcetris) 대비 효능 평가 등을 위한 시험이 진행 중에 있습니다.
| [비임상 시험에서 확인한 AST-202의 유효성] |
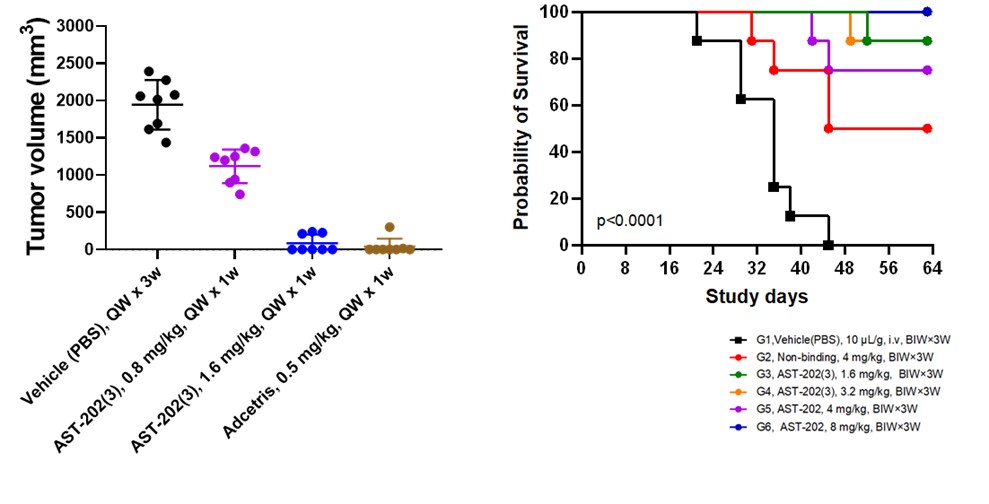 |
|
AST-202의 in vivo 유효성 |
| (출처 : 당사 자료) |
| [AST-202의 세부개발 일정] |
| 예상 시기 | 2024년 | 2025년 | 2026년 | 2027년 |
| 개발단계 |
후보물질 |
전임상 |
임상 1상 |
|
| 세부개발 항목 |
압타머 화학적 최적화
압타머-약물 conjugation
In vivo 유효성 평가
예비 독성 평가
|
약리연구
CMC 연구
임상시험 계획수립 및 자료작
성
|
||
| 단계별 목표 (주요 매개변수) |
후보물질 확정 - 후보물질군 확보 - 작용기전 규명 - In vitro 활성 및 in vivo 유효성 확인 - In vivo PK 충족 - 예비독성(안전성 확인, hERG, 유전독성, 단회독성) - 물리화학적 특성 파악 및 합성공정 확보 |
IND 승인 - 유효성평가 - Non-GLP와 GLP 독성평가(STD10 설정) - 흡수/분포/대사/배출 분석결과 확보 - 비임상시료생산/원료의약품/완제의약품 GMP 생산완료 |
임상진입 - 안전성, 내약성 평가 - 약동학적 특성 평가 - 약력학적 특성 평가 |
|
| 현재 진행현황 |
후보물질 확정 약물의 항종양 유효성은 확인됨 약물 차별화 포인트 확보를 위한 추가적인 in vivo 모델 평가 계획 |
|||
| (출처 : 당사 자료) |
앞서 언급한 여러 가능성에도 불구하고 현 시점에는 다음과 같은 한계점이 존재합니다.
① In vitro 조직배양에서 확인된 종양투과성과 이소이종 종양이식 모델에서 확인된 항종양 효과가 실제 복잡한 in vivo 종양 미세환경(특히, 항체 기반 면역항암제의 효과가 성공적이지 못한 췌장암, 대장암 등의 종양조직) 내에서의 재현여부
②
혈구세포들에 대한 in vitro 독성 평가에서는 ADC 대비 안전함을 확인했으나, 기타 주요 조직별 비특이적인 부작용에 대한 불확실성. 추후 독성연구 등을 통해 규명
③ 압타머를 기반으로 한 새로운 표적 약물전달 플랫폼으로서 표적결합 및 약물전달의 표준 기술로 많은 임상적 결과들이 축적된 항체와의 경쟁
3) 고형암 치료제 AST-203
| 구분 |
표적 약물전달 항암제 |
| 적응증 |
고형암(Trop2-양성) 주요 암종: 췌장암, 폐암, 유방암 |
| 작용기전 |
-
종양 표면 Trop2 결합과 그에 따른 세포 내재화, 리소좀에서의 분해를 통해 세포분열 억제 약물인 MMAE 방출
-
Bystander 효과
|
| 제품특성 |
-
Trop2 선택적 압타머-약물 접합체
-
Trop2-양성세포 선택적 사멸 유도
-
BLlinker(분지형 링커기술, 특허출원)를 활용한 다수의 약물도입으로 개선된 안정성 및 약동력학적 프로파일, 향상된 유효성
-
낮은 혈액학적 부작용 (경쟁 ADC 대비 안전)
-
신속한 종양 표적화와 투과성, 빠른 체내 배출 특성을 활용함으로써 항종양 효과는 높이고, 장기적인 약물의 노출을 최소화하여 용량제한독성을 개선하고 넓은 치료용량계수 확보
-
높은 종양조직 투과성 및 빠른 종양세포 내재화률
-
면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대
|
| 진행경과 |
-
Trop2 압타머의 표적 선택성, 세포 선택성 확인
-
ApDC®의 최적화 및 in vitro 활성/기전 평가 완료
-
3차원 종양배양 조건에서 ApDC®의 항체대비 우수한 투과성 및 그에 따른 종양사멸 효과 확인
-
microPET 분석을 통한 동물모델에서의 종양 표적화 및 전반적인 조직분포 확인
-
췌장암 동물모델에서의 경쟁약물 ADC인 Trodelvy 대비 우수한 종양성장 억제 효과 확인
|
| 향후계획 |
-
In vivo 효능평가(비소세포 폐암 모델, 동소이식 췌장암 모델)
-
ApDC®의 물리화학적 특성, 생체시료분석법 개발, 약동력학적 분석
-
비임상 후보물질 확보(2025. 1Q)
|
| 경쟁제품 |
-
Trodelvy(Trop2 ADC, FDA 승인): 삼중음성 유방암 치료제로 승인받은 이후 지속적으로 적응증 확장(폐암, 요로상피암 등) 중
-
개발 중인 파이프라인: Daiichi Sankyo의 DS1062(Trop2 ADC, 임상3상), 리가켐의 LCB84(Trop2 ADC, 전임상)
|
| 관련논문등 |
-
치료용 담체로서 항 Trop2 압타머
- 대한민국 특허 출원(2024): 10-2024-0093233 |
| 시장규모 |
-
글로벌 ADC 시장은 2023년 기준 100억 달러 상회(출처: Biopharma PEG article)
-
Trodelvy 단일 품목의 연 기준 2023 매출은 11억 달러(출처: Gilead Sciences 2023 운영보고서)
|
AST-203은 다양한 암종에서 과발현되어 있고, 특히 최근 가장 주목받고 있는 ADC 표적인 Trop2 단백질을 표적으로 하는 ApDC
®입니다. Trop2-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 신속한 세포사멸을 유도합니다.
당사 고유의 분지형 링커(Blinker)기술을 적용 압타머에 3개의 약물이 접합되도록 설계되어 약효가 개선되었고 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다. 더불어, 3차원으로 배양된 Trop2-양성 종양 스페로이드(spheroid)에서 항체 대비 최대 6.7배 높은 조직침투율을 보였으며, Trop2-양성 종양 동물모델(췌장암)을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 더욱이 동일 표적에 대한 승인된 ADC인 트로델비(Trodelvy)와 동물모델에서의 효능비교 실험에서 상대적으로 우수한 종양성장 억제효과가 관찰되었습니다.
또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다.
앞서 기술한 바와 같이 Trop2는 ADC 개발이 활발히 이루어지고 있는 표적입니다. 기 승인된 트로델비를 비롯해 다이이찌산쿄의 DS-1062, 머크의 MK-2870 등이 후기 임상을 마쳤거나 진행 중인 만큼 많은 주목을 받고 있는 종양 바이오마커입니다.
당사가 목표로 하는 주요 적응증으로는 Trop2-발현이 높으나 ADC 치료제 개발의 난항을 겪고 있는 췌장암과 비소세포폐암입니다. ApDC가 보이는 우수한 종양침투능, 상대적으로 낮은 부작용 가능성 등은 ADC 개발이 어려운 난치성 암에 대한 미충족 수요를 해결할 수 있는 대안이 될 수 있을 것입니다.
AST-203의 기본적인 작용기전은 상기 기술된 다른 ApDC와 유사한 기전을 따릅니다. Trop2-양성 종양에 선택적으로 결합하여 수용체-매개 내포작용(receptor-mediated endocytosis)를 통해 세포 내로 들어가 세포 내 분해소기관인 리소좀으로 이동하여 효소분해 특이적인 링커부분이 잘리면서 세포분열 억제약물 MMAE가 방출되어 세포사멸을 유도하고, 바이스탠더 효과(bystandereffect)도 확인되었습니다.
물질 최적화 과정을 거쳐 현재는 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 다양한 모델에서의 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법이 개발되었고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다.
1차적으로 췌장암의 동물모델에서 진행된 유효성 평가에서 용량의존적인 항종양 효과가 확인되었으며, 비교약물로 사용된 동일 표적의 기 승인 ADC인 트로델비와의 효능비교에서도 상대적으로 우수한 항종양 효과를 확인하였습니다
| [비임상 시험에서 확인한 AST-203의 유효성] |
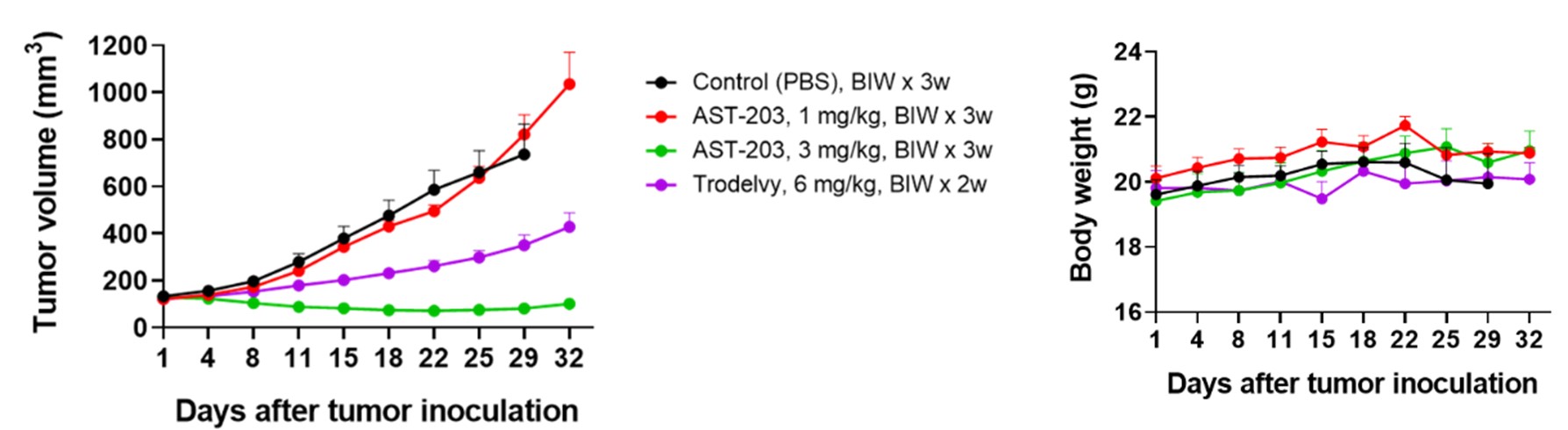 |
|
AST-203의 in vivo 유효성 |
| (출처 : 당사 자료) |
| [AST-203의 세부개발 일정] |
| 예상 시기 | 2024년 | 2025년 | 2026년 | 2027년 |
| 개발단계 |
후보물질 |
전임상 |
임상 1상 |
|
| 세부개발 항목 |
압타머 화학적 최적화
압타머-약물 conjugation
In vivo 유효성 평가
예비 독성 평가
|
약리연구
CMC 연구
임상시험 계획수립 및 자료작
성
|
||
| 단계별 목표 (주요 매개변수) |
후보물질 확정 - 후보물질군 확보 - 작용기전 규명 - In vitro 활성 및 in vivo 유효성 확인 - In vivo PK 충족 - 예비독성(안전성 확인, hERG, 유전독성, 단회독성) - 물리화학적 특성 파악 및 합성공정 확보 |
IND 승인 - 유효성평가 - Non-GLP와 GLP 독성평가(STD10 설정) - 흡수/분포/대사/배출 분석결과 확보 - 비임상시료생산/원료의약품/완제의약품 GMP 생산완료 |
임상진입 - 안전성, 내약성 평가 - 약동학적 특성 평가 - 약력학적 특성 평가 |
|
| 현재 진행현황 |
후보물질 확정 약물의 항종양 유효성은 확인됨 약물 차별화 포인트 확보를 위한 추가적인 in vivo 모델 평가 계획 |
|||
| (출처 : 당사 자료) |
앞서 언급한 여러 가능성에도 불구하고 현 시점에는 다음과 같은 한계점이 존재합니다.
①
In vitro 조직배양에서 확인된 종양투과성과 이소이종 종양이식 모델에서 확인된 항종양 효과가 실제 복잡한 in vivo 종양 미세환경(특히, 항체 기반 면역항암제의 효과가 성공적이지 못한 췌장암, 대장암 등의 종양조직) 내에서의 재현여부
②
혈구세포들에 대한 in vitro 독성 평가에서는 ADC 대비 안전함을 확인했으나, 기타 주요 조직별 비특이적인 부작용에 대한 불확실성. 추후 독성연구 등을 통해 규명
③ 압타머를 기반으로 한 새로운 표적 약물전달 플랫폼으로서 표적결합 및 약물전달의 표준 기술로 많은 임상적 결과들이 축적된 항체와의 경쟁
[기술이전 추진 현황 및 예상 시기]
당사는 2024년 3월 '압타머-약물접합체(ApDC) 고형암 치료제 AST-201의 국내 1상 임상시험 IND 승인 신청'을 진행하고 공시한 바 있습니다. 이에 2024년 4월 식품의약품안전처(MFDS)의 자료보완 요구를 수령하였고, 증권신고서 제출일 현재 보완자료 대응을 계속하고 있습니다. 당사는 자료보완 기한인 2024년 10월까지 자료제출을 완료하고 승인 획득을 목표하고 있습니다.
| [투자판단 관련 주요경영사항(임상시험 계획 승인신청)(2024.03.12.)] |
| 투자 유의사항 | - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. - 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. - 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | 압타머-약물접합체(ApDC) 고형암 치료제 AST-201의 국내 1상 임상시험 IND 승인 신청 | |
| 2. 주요내용 | 1) 임상시험명칭 | GPC3 양성인 진행성 고형암 환자에서 AST-201 투여 시의 내약성, 안전성 및 약동학적 특성을 평가하기 위한 다기관, 공개, 용량 증량 및 확장, 제1상 임상시험 |
| 2) 임상시험단계 | 한국 MFDS 임상시험 제 1상 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 한국 | |
| 5) 임상시험실시기관 | 한국 내 4개 병원 | |
| 6) 대상질환 | GPC3 양성인 진행성 고형암 (advanced solid tumor) |
|
| 7) 신청일 | 2024-03-12 | |
| 8) 임상시험목적 | 일차 목적으로 GPC3 양성인 진행성 고형암 환자에서 AST-201 투여 시의 내약성 및 안전성을 평가하여 최대내약용량(MTD)을 확인하고, 제2상 권장용량(RP2D)를 결정하고자 함. 이차 목적으로는 AST-201 투여 시의 약동학적 특성 및 예비 항종양 활성을 평가하기 위함. | |
| 9) 임상시험방법 | - 디자인: 다기관, 공개, 용량 증량 및 확장 1상 임상시험 - 대상자: GPC3 양성 진행성 고형암 환자 - 대상자수: 제1a상 (최대 30명) 제1b상 (1a상 종료 후 결정) - 투여방법: 각 코호트별 정해진 용량으로 각 28일 주기에서 1일, 8일, 15일째에 투여 - 1차 평가: 안전성, 내약성 - 2차 평가: 약동학적 평가, 예비 유효성 평가 |
|
| 10) 임상시험기간 | 임상시험 승인일로부터 36개월 | |
| 11) 목표 시험대상자 수 | 최대 70명 | |
| 3. 사실발생(확인)일 | 2024-03-12 | |
| 4. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 사실발생(확인)은 한국 식품의약품안전처(MFDS)에 임상시험계획 승인 신청을 접수한 날짜입니다. - 추후 임상시험계획 승인 시 관련 공시를 즉시 제출하겠습니다. |
||
| ※ 관련공시 | - | |
| (출처 : 전자공시시스템) |
AST-201은 주요 적응증 간암을 고려하여 간암환자가 많은 중국 기업 대상으로 기술이전을 목표하고 있고, 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안하였습니다. 다만 현재 임상 IND 진입시점이어서 1상 임상결과를 확인한 이후에 판단하겠다는 기업이 대다수입니다. AST-201은 2025년 임상 1a상 POC 데이터를 기반으로 물질의 안전성과 예비 효능이 확인되는 시점에 기술이전 논의가 본격적으로 진행될 것으로 예상됩니다. 회사에서 예상한 바대로, 젬시타빈 허가 용량의 5% 투여시 동등한 치료 효과를 확인하고 내약성도 충분히 입증된다면 그동안 접촉해온 기업들과 기술이전 논의를 빠르게 진전시킬 수 있겠지만, 그렇지 않은 경우에는 1b상 결과확인까지 요구되어 2026년까지 시간이 더 소요될 수 있습니다.
대외변수로 의정갈등으로 인한 대형병원 휴진 등으로 임상시험 다수가 중단 또는 지연되고 있습니다. 한국임상시험참여포털 등에 따르면 지난 2월 20일 전공의 집단사직 이후 4개월간 식품의약품안전처 허가를 받은 임상시험은 총 328건이며, 지난해 같은 기간 428건과 비교해 30% 이상 감소했습니다. 대학병원의 교수진도 파업에 참여하거나 사직하는 경우가 발생하면서 연구윤리심의위원회(IRB) 심사와 대상환자 모집 등 병원내 임상 과정에도 제동이 걸리고 있습니다.
| [의정갈등으로 인한 임상연구 지연] |
 |
|
의정갈등으로 인한 임상연구 지연 보도내역(2024.06) |
| (출처 : 동아사이언스, 2024.06) |
당사는 임상시험의 지연으로 인한 위험에 대응하기 위해 글로벌 임상시험 병행도 고려하고 있습니다. 대상 국가로는 호주를 유력하게 검토하고 있으며, 호주는 AST-201의 목표환자 중 한 군인 폐암환자가 많이 있으며 다양한 인종이 분포하여 환자모집에 적합할 것으로 판단하였습니다.
후속 파이프라인인 AST-202 및 AST-203은 전임상 및 CMC 결과에 따라 임상 진입 시기를 결정할 수 있습니다. 전임상 단계에서 구체적인 효능과 안전성 지표를 확인하여 임상진입 전인 2025~26년 중 기술이전을 추진하는 것을 우선하나, 공동개발 파트너를 찾지 못할 경우 시장성을 검토하여 자체적으로 임상 1상에 진입하는 방안도 고려할 것입니다. 하지만 전임상 단계에서 기술이전에 충분한 데이터를 확보할 수 있을지 여부가 불분명하고, 객관적인 근거자료를 확보하는 외부 CRO 및 CMO의 역량과 난이도에 따라 계약 시기는 지연될 수 있습니다.
상기와 같이 당사는 간암 치료제(AST-201) 및 혈액암 치료제(AST-202) 등의 신약 파이프라인을 개발 중이나, 신고서 제출일 현재 당사가 체결한 라이센스 아웃(License-Out) 계약 사항은 없습니다. 이러한 임상 계획에도 불구하고 임상 초기 단계에서 안전성 이슈가 발생되어 추가 개발이 불가해지거나 유효성 입증에 실패할 수 있으며, 이는 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
(주5) 정정 전
| 라. 기술이전 지연 및 실패에 따른 위험 당사와 같은 바이오벤처는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 분산하기 위하여 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 구축하고 있습니다. 국내외 대형 제약사 또한 대규모 개발비용을 감수하고 성공확률이 높은 약제로의 선택과 집중을 통해 최상의 결과를 얻고자 내외부의 파이프라인을 다양화해 연구개발하는 전략을 취하고 있습니다. 당사는 전임상 또는 임상 초기 단계에서 각 적응증에 전문성을 가진 국내외 제약 및 바이오 회사와의 기술이전을 통해 시장의 미충족 수요 및 허가기관의 규정에 최적화된 임상을 설계 및 수행하여 시판 허가 가능성 및 매출을 극대화하고, 여기서 발생하는 마일스톤과 로열티를 통해 추가적인 연구를 위한 탄탄한 자금 구조를 확보하는 사업모델을 추구하고 있습니다. 항암제를 포함해 플랫폼 기반 신약개발에 니즈를 가진 다수의 제약 및 바이오 회사와 기술 이전에 대한 활발한 논의 또한 진행 중에 있습니다. 현재는 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 추가적인 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법을 개발하였고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다. 그러나 상기와 같은 당사의 노력에도 불구하고 글로벌 제약사들의 사업 전략 변동, 글로벌제약 산업의 침체 및 경쟁 치료제의 개발 등으로 인해 신규 기술이전 계약 체결에 실패할 수 있습니다. 글로벌 제약사로의 신규 기술이전 계약의 지연 및 실패할 경우 당사의 재무안정성과 현재 당사가 목표로 하는 영업실적에 부정적인 영향이 있을 수 있습니다. |
바이오 산업은 연구개발부터 신약 개발의 임상 성공 및 제품 상용화 단계에 이르기까지 막대한 연구개발 비용과 10년 이상의 기간이 소요되는 기술, 자본 집약적 산업입니다. 신약을 출시하기 위해서는 전임상(비임상), 임상 1~3상 및 규제 당국의 허가 단계를 모두 통과해야 하기 때문에 평균 10~15년 정도의 장기간과 1~2조원 수준의 막대한 개발 비용이 소요됩니다.
당사와 같은 바이오벤처는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 분산하기 위하여 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 구축하고 있습니다. 국내외 대형 제약사 또한 대규모 개발비용을 감수하고 성공확률이 높은 약제로의 선택과 집중을 통해 최상의 결과를 얻고자 내외부의 파이프라인을 다양화해 연구개발하는 전략을 취하고 있습니다.
최근 R&D 투자 효율성 하락으로 글로벌 제약기업들의 R&D 지출액 증가율이 둔화될 것으로 전망되고 있습니다. 의약품 산업은 연구개발에서부터 신약개발 성공과 제품 상용화 생산에 이르기까지 높은 R&D 비용과 10년 이상의 기간이 소요되는 기술, 자본집약적 산업이지만, 2000년 이후 글로벌 제약기업들의 투자 효율성(ROIC, 투자자본 수익률) 감소세를 보이고 있습니다. 글로벌 대형 제약기업들이 신약 1개 당 시판을 위해 드는 비용이 2010년 11.9억 달러에서 2018년 21.7억 달러, 2023년 23억달러로 급증하였습니다. 이는 각국 정부의 약가인하 유도 정책, 신약개발 비용 및 기간 증가, 경쟁 심화 등에 기인합니다.
| [글로벌 20대 제약기업들의 후기 파이프라인 ROIC 추이] |
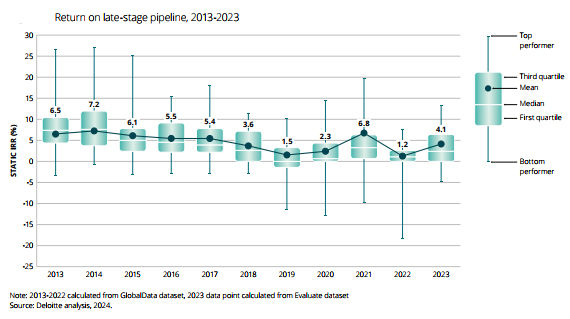 |
|
ROIC 추이 |
| (출처 : Deloitte(Measuring the return from pharmaceutical innovation, 2024년 04월)) |
Deloitte 연례 연구 결과에 따르면 글로벌 20대 제약기업의 R&D 수익률은 2014년 7.2%에서 2022년 1.2%로 최저치를 기록하며 하향추세에 있었으나 2023년 4.1%로 반등하였습니다. 이는 신약 출시 비용은 지속적으로 증가했으나, 신약 당 예상되는 피크 판매액은 2010년대 대비 70%수준으로 감소하였기 때문입니다. 다만 전문화된 바이오제약 기업들은 높은 개발 비용에도 불구 높은 파이프라인 가치를 보유하고 있어, 대기업들을 능가하는 수익률을 기대할 수 있습니다.
| [글로벌 20대 제약기업들의 R&D비용 및 파이프라인 당 peak sales 추이] |
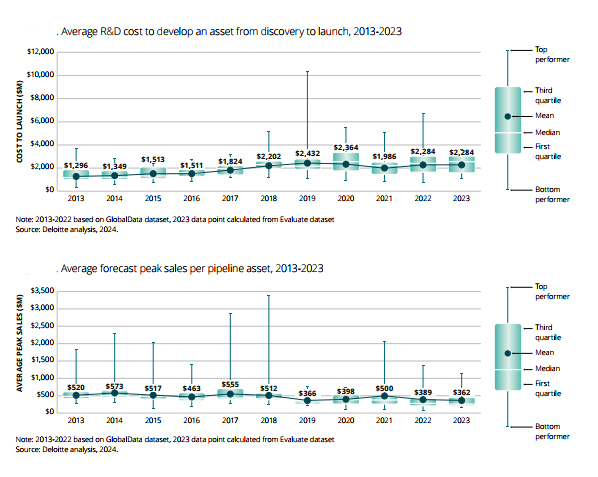 |
|
R&D Cost & Peak Sales per Pipeline |
| (출처 : Deloitte(Measuring the return from pharmaceutical innovation, 2024년 04월)) |
신약 출시까지 소요되는 비용이 지속적으로 증가함에 따라, 전 세계적으로 제약사들의 기술이전 사례가 증가하고 있습니다. 2022년 02월 BIO(Biotechnology Innovation Organization)이 발간한 보고서에 따르면, 2011년부터 2021년 3분기까지 전세계 제약바이오 벤처회사의 기술이전 딜(계약금 규모 1천만 달러 이상)을 분석한 결과 거래건수는 2011년 109건에서 2020년 238건으로 증가하였으며, 계약금(upfront) 규모는 2011년 34억 달러에서 2020년 162억 달러로 증가하였습니다. 해당기간 중 발생한 기술이전 딜 중 매년 평균 55.3%가 전임상 단계에서 체결되었으며, 계약금(upfront) 규모는 평균 23억 달러였습니다. 이러한 사실로 비추어볼 때 신약 후보물질의 안전성과 효능이 임상 단계에서 완전히 입증되기 전이라 하더라도, 그 잠재력만으로도 높은 가치를 인정받고 수익으로 이어질 수 있음을 알수 있습니다.
한편, 2023년 한해 질환분야에서는 항암치료제가 총 861억 달러의 거래금액으로 가장 컸으며, 두 번째 신경계질환 211억 달러와 세 번째 심혈관계질환 103억 달러와도 큰 격차를 보였습니다. 모달리티로는 바이오의약품에 대한 거래가 803억 달러로 가장 컸습니다. 특히 모달리티에 있어 ADC에 대한 라이센싱 거래금액은 크게 상승한 반면에, 세포· 유전자치료제는 하락하는 양상을 보였습니다. 대형 제약사들은 투자에 대한 리스크 완화 차원에서 세포유전자치료제 보다는 ADC를 보다 검증된 기술로 보고 있습니다. 대형 제약사들의 디-리스크(de-risk) 전략은 신약개발 단계별 거래 현황에서도 나타나고 있습니다. 2023년 한해 대형 제약사들은 기술거래 투자에 대한 리스크를 완화하기 위해 개발 초기 단계보다는 중후기 단계의 거래로 전환하기 시작했습니다. 바이오제약사들의 R&D 라이선스 계약을 개발 단계별로 보면, 초기 후보물질발굴 (Discovery) 단계에서의 거래는 2022년 84건이었으나 2023년은 51건으로 크게 감소하였고, 비임상 단계 또한 2022년 12건에서 2023년 10건으로 소폭 감소했습니다. 반면, 임상 1상에서의 거래는 2022년 8건에서 2023년 15건으로 크게 증가했고, 임상 2상 및 3상에서의 거래 비중도 소폭 증가했습니다.
| [임상단계별 빅 파마 라이센스 계약 거래 추이] |
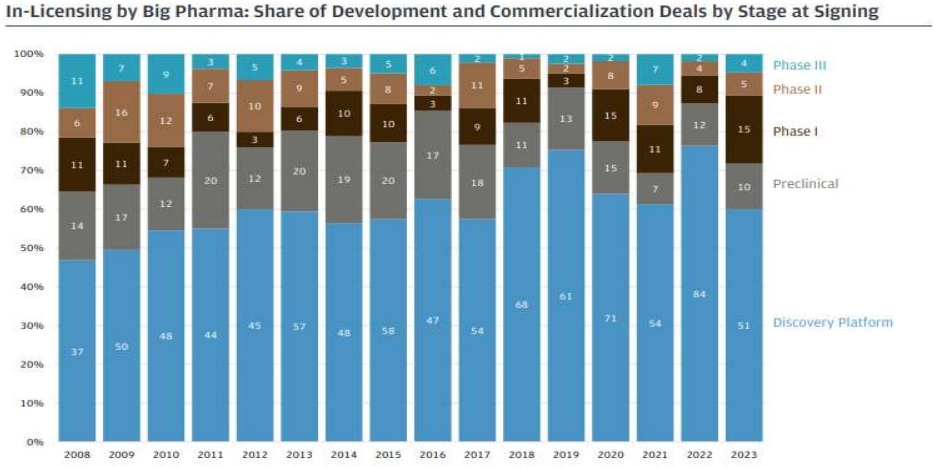 |
|
빅 파마 라이센스 계약 거래 |
| (출처 : 2023 Annual Biopharma Licensing and Venture Report, J.P Morgan, 2023.12) |
당사는 전임상 또는 임상 초기 단계에서 각 적응증에 전문성을 가진 국내외 제약 및 바이오 회사와의 기술이전을 통해 시장의 미충족 수요 및 허가기관의 규정에 최적화된 임상을 설계 및 수행하여 시판 허가 가능성 및 매출을 극대화하고, 여기서 발생하는 마일스톤과 로열티를 통해 추가적인 연구를 위한 탄탄한 자금 구조를 확보하는 사업모델을 추구하고 있습니다. 항암제를 포함해 플랫폼 기반 신약개발에 니즈를 가진 다수의 제약 및 바이오 회사와 기술 이전에 대한 활발한 논의 또한 진행 중에 있습니다.
현재는 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 추가적인 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법을 개발하였고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다.
그러나 상기와 같은 당사의 노력에도 불구하고 글로벌 제약사들의 사업 전략 변동, 글로벌제약 산업의 침체 및 경쟁 치료제의 개발 등으로 인해 신규 기술이전 계약 체결에 실패할 수 있습니다. 글로벌 제약사로의 신규 기술이전 계약의 지연 및 실패할 경우 당사의 재무안정성과 현재 당사가 목표로 하는 영업실적에 부정적인 영향이 있을 수 있습니다.
(주5) 정정 후
| 라. 기술이전 지연 및 실패에 따른 위험 당사와 같은 바이오벤처는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 분산하기 위하여 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 구축하고 있습니다. 국내외 대형 제약사 또한 대규모 개발비용을 감수하고 성공확률이 높은 약제로의 선택과 집중을 통해 최상의 결과를 얻고자 내외부의 파이프라인을 다양화해 연구개발하는 전략을 취하고 있습니다. 당사는 전임상 또는 임상 초기 단계에서 각 적응증에 전문성을 가진 국내외 제약 및 바이오 회사와의 기술이전을 통해 시장의 미충족 수요 및 허가기관의 규정에 최적화된 임상을 설계 및 수행하여 시판 허가 가능성 및 매출을 극대화하고, 여기서 발생하는 마일스톤과 로열티를 통해 추가적인 연구를 위한 탄탄한 자금 구조를 확보하는 사업모델을 추구하고 있습니다. 항암제를 포함해 플랫폼 기반 신약개발에 니즈를 가진 다수의 제약 및 바이오 회사와 기술 이전에 대한 활발한 논의 또한 진행 중에 있습니다. 현재는 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 추가적인 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법을 개발하였고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다. 압타머 기술 개발사 및 기술이전 사례는 전세계적으로 많지 않으며, 기술이전의 대표적인 사례는 Gilead Sciences, Inc.의 Macugen L/O이고, 압타머 기술개발사 M&A 사례는 아이베릭바이오(Iveric Bio) M&A이 대표적입니다. 당사는 2024년 1월 이후로 총 6건의 비밀유지계약을 체결하고 기술검토를 진행중이나, 현재까지 계약체결이 이루어진 사실은 없습니다. 그러나 상기와 같은 당사의 노력에도 불구하고 글로벌 제약사들의 사업 전략 변동, 글로벌제약 산업의 침체 및 경쟁 치료제의 개발 등으로 인해 신규 기술이전 계약 체결에 실패할 수 있습니다. 글로벌 제약사로의 신규 기술이전 계약의 지연 및 실패할 경우 당사의 재무안정성과 현재 당사가 목표로 하는 영업실적에 부정적인 영향이 있을 수 있습니다. |
바이오 산업은 연구개발부터 신약 개발의 임상 성공 및 제품 상용화 단계에 이르기까지 막대한 연구개발 비용과 10년 이상의 기간이 소요되는 기술, 자본 집약적 산업입니다. 신약을 출시하기 위해서는 전임상(비임상), 임상 1~3상 및 규제 당국의 허가 단계를 모두 통과해야 하기 때문에 평균 10~15년 정도의 장기간과 1~2조원 수준의 막대한 개발 비용이 소요됩니다.
당사와 같은 바이오벤처는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 분산하기 위하여 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 구축하고 있습니다. 국내외 대형 제약사 또한 대규모 개발비용을 감수하고 성공확률이 높은 약제로의 선택과 집중을 통해 최상의 결과를 얻고자 내외부의 파이프라인을 다양화해 연구개발하는 전략을 취하고 있습니다.
최근 R&D 투자 효율성 하락으로 글로벌 제약기업들의 R&D 지출액 증가율이 둔화될 것으로 전망되고 있습니다. 의약품 산업은 연구개발에서부터 신약개발 성공과 제품 상용화 생산에 이르기까지 높은 R&D 비용과 10년 이상의 기간이 소요되는 기술, 자본집약적 산업이지만, 2000년 이후 글로벌 제약기업들의 투자 효율성(ROIC, 투자자본 수익률) 감소세를 보이고 있습니다. 글로벌 대형 제약기업들이 신약 1개 당 시판을 위해 드는 비용이 2010년 11.9억 달러에서 2018년 21.7억 달러, 2023년 23억달러로 급증하였습니다. 이는 각국 정부의 약가인하 유도 정책, 신약개발 비용 및 기간 증가, 경쟁 심화 등에 기인합니다.
| [글로벌 20대 제약기업들의 후기 파이프라인 ROIC 추이] |
 |
|
ROIC 추이 |
| (출처 : Deloitte(Measuring the return from pharmaceutical innovation, 2024년 04월)) |
Deloitte 연례 연구 결과에 따르면 글로벌 20대 제약기업의 R&D 수익률은 2014년 7.2%에서 2022년 1.2%로 최저치를 기록하며 하향추세에 있었으나 2023년 4.1%로 반등하였습니다. 이는 신약 출시 비용은 지속적으로 증가했으나, 신약 당 예상되는 피크 판매액은 2010년대 대비 70%수준으로 감소하였기 때문입니다. 다만 전문화된 바이오제약 기업들은 높은 개발 비용에도 불구 높은 파이프라인 가치를 보유하고 있어, 대기업들을 능가하는 수익률을 기대할 수 있습니다.
| [글로벌 20대 제약기업들의 R&D비용 및 파이프라인 당 peak sales 추이] |
 |
|
R&D Cost & Peak Sales per Pipeline |
| (출처 : Deloitte(Measuring the return from pharmaceutical innovation, 2024년 04월)) |
신약 출시까지 소요되는 비용이 지속적으로 증가함에 따라, 전 세계적으로 제약사들의 기술이전 사례가 증가하고 있습니다. 2022년 02월 BIO(Biotechnology Innovation Organization)이 발간한 보고서에 따르면, 2011년부터 2021년 3분기까지 전세계 제약바이오 벤처회사의 기술이전 딜(계약금 규모 1천만 달러 이상)을 분석한 결과 거래건수는 2011년 109건에서 2020년 238건으로 증가하였으며, 계약금(upfront) 규모는 2011년 34억 달러에서 2020년 162억 달러로 증가하였습니다. 해당기간 중 발생한 기술이전 딜 중 매년 평균 55.3%가 전임상 단계에서 체결되었으며, 계약금(upfront) 규모는 평균 23억 달러였습니다. 이러한 사실로 비추어볼 때 신약 후보물질의 안전성과 효능이 임상 단계에서 완전히 입증되기 전이라 하더라도, 그 잠재력만으로도 높은 가치를 인정받고 수익으로 이어질 수 있음을 알수 있습니다.
한편, 2023년 한해 질환분야에서는 항암치료제가 총 861억 달러의 거래금액으로 가장 컸으며, 두 번째 신경계질환 211억 달러와 세 번째 심혈관계질환 103억 달러와도 큰 격차를 보였습니다. 모달리티로는 바이오의약품에 대한 거래가 803억 달러로 가장 컸습니다. 특히 모달리티에 있어 ADC에 대한 라이센싱 거래금액은 크게 상승한 반면에, 세포· 유전자치료제는 하락하는 양상을 보였습니다. 대형 제약사들은 투자에 대한 리스크 완화 차원에서 세포유전자치료제 보다는 ADC를 보다 검증된 기술로 보고 있습니다. 대형 제약사들의 디-리스크(de-risk) 전략은 신약개발 단계별 거래 현황에서도 나타나고 있습니다. 2023년 한해 대형 제약사들은 기술거래 투자에 대한 리스크를 완화하기 위해 개발 초기 단계보다는 중후기 단계의 거래로 전환하기 시작했습니다. 바이오제약사들의 R&D 라이선스 계약을 개발 단계별로 보면, 초기 후보물질발굴 (Discovery) 단계에서의 거래는 2022년 84건이었으나 2023년은 51건으로 크게 감소하였고, 비임상 단계 또한 2022년 12건에서 2023년 10건으로 소폭 감소했습니다. 반면, 임상 1상에서의 거래는 2022년 8건에서 2023년 15건으로 크게 증가했고, 임상 2상 및 3상에서의 거래 비중도 소폭 증가했습니다.
| [임상단계별 빅 파마 라이센스 계약 거래 추이] |
 |
|
빅 파마 라이센스 계약 거래 |
| (출처 : 2023 Annual Biopharma Licensing and Venture Report, J.P Morgan, 2023.12) |
[압타머 기술이전 사례]
압타머 기술 개발사 및 기술이전 사례는 전세계적으로 많지 않으며, 기술이전의 대표적인 사례는 Gilead Sciences, Inc.의 Macugen L/O이고, 압타머 기술개발사 M&A 사례는 아이베릭바이오(Iveric Bio) M&A이 대표적입니다.
Gilead Sciences, Inc.는 황반변성(AMD)과 당뇨병성 망막병증 치료를 위한 NX 1838(현제품명 Macugen)를 초기 임상 단계에서 Eyetech Pharmaceuticals에 Licence Out을 한 사례가 있습니다. Eyetech Pharmaceuticals은 Gilead Sciences, Inc.에 700백만 달러의 선불 라이센스 비용을 지불하였고, 마일스톤별 최대 2,500백만달러를 지급하며, 향후 모든 연구개발 비용을 부담하는 계약을 체결하였습니다. 이후 연구계발을 지속하였고 Macugen이 2004년 12월 FDA 승인을 받았으나, 2005년 11월 Eyetech Pharmaceuticals는 OSI Pharmaceuticals에 인수되었습니다. 이후 2012년 다시 Bausch Health(당시 Valeant Pharmaceuticals)가 Eyetech Pharmaceuticals를 인수하였고, 현재는 Bausch Health는 미국에서 Macugen을 제조하고 판매할 독점권을 보유하고 있으며 Pfizer Inc.는 전 세계에서 Macugen을 제조하고 판매할 독점권을 보유하고 있습니다.
압타머 기술개발사 M&A 사례는 FDA 승인받은 2호 압타머 신약 아이저베이(iZervay)의 개발사 아이베릭바이오(Iveric Bio)가 2023년 7월 일본 아스텔라스제약(Astellas Pharma)에 59억 달러(약 7조8000억원)에 인수된 사례가 대표적입니다.
| [Iveric Bio의 기업 개요 및 주요 파이프라인] |
| 기업명 | IVERIC BIO Inc. (NASDAQ: ISEE) |
| 주소 | Parsippany, New Jersey, United States |
| 임직원 수 (2023년 5월) | 260명 (사업화 90명, 연구개발 60명) |
| 임상단계 물질 | 작용 기전 / 모달리티 | 타겟 적응증 | 단계 |
| Avacinacaptad Pegol (ACP) |
C5 저해제 / RNA 압타머 | 노인성 황반변성(AMD)으로 인한 지도형 위축(GA) | 미국 FDA 승인 (2023.08) |
| 스타가르트병 (상염색체 열성으로 유전되는 망막 질환) |
임상 2상 |
| (출처 : Astellas Pharma, Acquisition of Iveric Bio, 2023.05) |
그외 글로벌 빅파마와 압타머 기술 보유사의 공동연구가 이뤄지고 있습니다. 소마로직(SomaLogic) 사는 2011년부터 노바티스(Norvatis) 사와 단백질학 연구제휴를 체결하고 바이오마커와 신약 타깃의 발굴 및 검증, 그에 대한 동반진단을 개발해왔습니다. 해당 연구는 SOMAmer(Slow Off-rate Modified Aptamer) 시약을 바탕으로 한 약 7천 개 단백질을 동시에 분석할 수 있는 SomaScan® 플랫폼 개발로 이어졌으며, 2024년 7월 4.1버전을 출시하였습니다. 압타머그룹(AptamerGroup) 사는 2024년 7월 아스트라제네카(AstraZeneca) 사와 섬유화 간세포를 대상으로 siRNA 표적 전달을 위한 압타머운반체 개발계약을 체결한 바 있습니다.
2024년 9월 기준으로 FDA 승인 받은 ADC 약물 13건이 시장에 출시되었고, 글로벌 빅파마를 포함해 전세계 기업들이 신규 ADC 개발에 참여하고 있습니다. 표적치료제 개발기술의 다각화가 요구되는 시점에서 압타머는 ADC의 대체기술로 높은 관심을 받고 있으나, 임상에 진입한 압타머 치료제는 아직까지 20건 이내로 압타머 기술의 진보는 시간이 더 걸릴 수 있습니다.
당사는 전임상 또는 임상 초기 단계에서 각 적응증에 전문성을 가진 국내외 제약 및 바이오 회사와의 기술이전을 통해 시장의 미충족 수요 및 허가기관의 규정에 최적화된 임상을 설계 및 수행하여 시판 허가 가능성 및 매출을 극대화하고, 여기서 발생하는 마일스톤과 로열티를 통해 추가적인 연구를 위한 탄탄한 자금 구조를 확보하는 사업모델을 추구하고 있습니다. 항암제를 포함해 플랫폼 기반 신약개발에 니즈를 가진 다수의 제약 및 바이오 회사와 기술 이전에 대한 활발한 논의 또한 진행 중에 있습니다.
현재는 임상시험승인 신청이 된 AST-201 외에 AST-202, AST-203 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 추가적인 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법을 개발하였고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다.
[당사의 기술이전 현황]
당사는 2024년 3월 '압타머-약물접합체(ApDC) 고형암 치료제 AST-201의 국내 1상 임상시험 IND 승인 신청'을 진행하고 공시한 바 있습니다. 이에 2024년 4월 식품의약품안전처(MFDS)의 자료보완 요구를 수령하였고, 증권신고서 제출일 현재 보완자료 대응을 계속하고 있습니다. 당사는 자료보완 기한인 2024년 10월까지 자료제출을 완료하고 승인 획득을 목표하고 있습니다.
AST-201은 주요 적응증 간암을 고려하여 간암환자가 많은 중국 기업 대상으로 기술이전을 목표하고 있고, 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안하였습니다. 다만 현재 임상 IND 진입시점이어서 1상 임상결과를 확인한 이후에 판단하겠다는 기업이 대다수입니다. AST-201은 2025년 임상 1a상 POC 데이터를 기반으로 물질의 안전성과 예비 효능이 확인되는 시점에 기술이전 논의가 본격적으로 진행될 것으로 예상됩니다. 회사에서 예상한 바대로, 젬시타빈 허가 용량의 5% 투여시 동등한 치료 효과를 확인하고 내약성도 충분히 입증된다면 그동안 접촉해온 기업들과 기술이전 논의를 빠르게 진전시킬 수 있겠지만, 그렇지 않은 경우에는 1b상 결과확인까지 요구되어 2026년까지 시간이 더 소요될 수 있습니다.
후속 파이프라인인 AST-202 및 AST-203은 전임상 및 CMC 결과에 따라 임상 진입 시기를 결정할 수 있습니다. 전임상 단계에서 구체적인 효능과 안전성 지표를 확인하여 임상진입 전인 2025~26년 중 기술이전을 추진하는 것을 우선하나, 공동개발 파트너를 찾지 못할 경우 시장성을 검토하여 자체적으로 임상 1상에 진입하는 방안도 고려할 것입니다. 하지만 전임상 단계에서 기술이전에 충분한 데이터를 확보할 수 있을지 여부가 불분명하고, 객관적인 근거자료를 확보하는 외부 CRO 및 CMO의 역량과 난이도에 따라 계약 시기는 지연될 수 있습니다.
2024년 9월 현재 당사는 국내외 제약·바이오 기업들과 비밀유지계약을 체결하고 기술 및 제품에 대한 기술검토를 진행 중에 있습니다. 그 가운데 기술검토를 위한 MTA 계약 등 활발한 논의가 진행되고 있는 항목은 다음과 같습니다.
| [사업개발 추진현황] |
| 파이프라인 | 계약 형태 | 계약회사 | 예상 시점 |
| AST-203 | 물질이전계약(MTA) 및 공동개발 | 국내 K사 | 2024년 4분기 |
| AST-203, ApDC® 플랫폼 기술 | 물질이전계약(MTA) 및 공동개발 | 국내 C사 | 2025년 상반기 |
| AST-201 | 기술이전 | 중국 C사 | 2025년 상반기 |
| (출처 : 당사 제시) |
AST-201은 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안한 바 있으며, CDMO 협력사인 Asymcem, Wuxi 사와의 네트워크도 활용 가능할 것입니다. 또한 2024년 9월 AST-201의 물질특허가 중국 및 일본 특허청에 등록결정이 되어 기술이전에도 긍정적 영향을 미칠 수 있습니다. 당사는 2024년 1월 이후로 총 6건의 비밀유지계약을 체결하고 기술검토를 진행중이나, 현재까지 계약체결이 이루어진 사실은 없습니다.
그러나 상기와 같은 당사의 노력에도 불구하고 글로벌 제약사들의 사업 전략 변동, 글로벌제약 산업의 침체 및 경쟁 치료제의 개발 등으로 인해 신규 기술이전 계약 체결에 실패할 수 있습니다. 글로벌 제약사로의 신규 기술이전 계약의 지연 및 실패할 경우 당사의 재무안정성과 현재 당사가 목표로 하는 영업실적에 부정적인 영향이 있을 수 있습니다.
(주6) 정정 전
|
마. 신약 목표 시장 내 경쟁 심화 위험 당사는 고형암 치료제, 혈액암 치료제 등을 주요 파이프라인으로 개발하고 있으며 이처럼의학적 미충족 수요가 높은 시장을 전략적으로 목표하며 혁신신약을 연구개발하고 있습니다. 이에 대해 당사는 파이프라인별로 경쟁사 및 경쟁제품, 작용기전, 성능 등의 파이프라인 동향을 면밀하게 분석한 후 당사의 경쟁우위요소를 바탕으로 사업전략을 수립하고 있습니다. 하지만 당사의 이러한 노력에도 불구하고 동일 파이프라인 내 신규 경쟁업체의 진입 증가, 의학적 미충족 수요의 변화, 경쟁사의 가격정책 및 마케팅전략 변화, 새로운 치료제의 등장, 당사 파이프라인의 연구개발 속도 저하 등의 사유로 인해 당사 파이프라인의 시장경쟁력이 약화되는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다. |
당사는 압타머 기반의 고형암 치료제, 혈액암 치료제 등을 주요 파이프라인으로 개발하고 있습니다. 당사는 기존 치료제와 ADC의 제약으로 인해 의학적 미충족 수요가 높은 질환 시장을 목표 시장으로 선정하여 혁신신약에 도전하는 약물을 개발하고 있습니다.
그러나 향후 동일한 질병 치료제를 개발하는 신규 경쟁업체의 진입 증가, 당사 대비 임상 단계가 앞서 나가고 있는 경쟁 약물들의 임상 성공 및 시판 승인 등이 발생 및 증가할 경우, 당사 제품의 시판 후 시장점유율 등에 부정적인 영향을 미칠 수 있습니다. 당사가 파악한각 파이프라인별의 경쟁현황은 아래와 같습니다.
[간암 치료제 AST-201]
AST-201은 GPC3를 표적으로 하는 선택적 간암 치료제로 젬시타빈을 내재화하여 높은 치료 효율과 안전성을 확보하고 있습니다. 압타머 기반 물질의 우수한 조직 투과성, 높은 효능을 바탕으로 선택적 결합에 의해 기존 항암제에 기인한 부작용을 최소화시키는 효능을 지니고 있습니다.
1) 경쟁 상황
기존 승인된 간암 치료제는 VEGF 수용체 저해제인 Sorafenib (제품명: Nexavar)가 대부분의 시장을 차지하며, 재발된 간암에 대해 1차 치료제로 사용되고 있습니다. 최근 승인된 Ramucirumab (제품명: Cyramza)는 VEGFR2 표적 항체 약물로 Sorafenib 치료 이후 사용되는 2차 치료제로 사용되고 있습니다.
Sorafenib과 Ramucirumab 모두 신혈관 형성 억제 효능을 가지는 약물로써 간암 특이성보다 전이에 의한 신규 암 생성 억제가 주요 작용기전으로 작용합니다. Sorafenib의 경우 유럽과 미국에서 수행한 임상 시험 SHARP trial (Bayer, NCT00105443)에서 플라시보의 7.9개월의 전체 생존 (Overall Survival)을 10.7개월로 개선시킴으로 효력을 입증하였고, 중국,한국, 대만에서 실시한 AP trial (Bayer사, NCT00492752)에서는 플라시보의 4.2개월의 전체 생존을 6.5개월로 개선시키는 효력을 입증하였습니다. Ramcirumab의 경우 REACH-2 trial (Eli Lilly사, NCT02435433)에서 플라시보의 7.3개월의 전체 생존 대비 8.5개월로 1.2개월만큼 개선시킴으로써 효능을 증명하여 2차 치료제로 승인 받았습니다.
최근 각광받는 면역관문억제 항체인 Nivolumab (BMS사, Brystol-Myers Squibb)는 간암 치료제 3상시험 (CheckMate-459, NCT02576509)에서 Sorafenib 대비 개선점을 증명하지 못하여 실패하였습니다. 최근 BMS는 비항체 단백질 결합체 플랫폼인 Adnectin을 이용한 GPC3 표적 약물 결합체를 개발하였으나 아직 초기 단계입니다. 국내 신약업체 신라젠의 펙사벡 (Pexa-Vec)은 바이러스 기반 면역 활성 기전을 가지는 것으로 개발되었으나 최근 3상 시험 PHOCUS (NCT02562755)에서 효능을 보이지 못하여 조기 중단되었습니다.
| [경쟁 개발약물] |
|
개발약물 |
회사 |
물질 유형 |
작용기전 |
개발 단계 |
비고 |
|---|---|---|---|---|---|
|
Sorafenib |
Bayer |
저분자화합물 |
VEGFR1, VEGFR2, PDGFR inhibitor 신혈관 형성억제 |
1차 치료제 |
전체 생존 3개월 개선 |
|
Ramucirumab |
Eli Lilly |
단일클론항체 |
VEGFR2 저해 신혈관 형성억제 |
2차 치료제 |
전체 생존 1.2개월 개선 |
|
Nivolumab |
BMS |
단일클론항체 |
PD1 표적 면역관문억제 |
임상 3상 |
실패 |
|
Pexa-Vec |
신라젠 |
항암바이러스 |
GM-CSF 유전자를 통한 면역 반응 |
임상 3상 |
실패 |
|
GPC3-Adnectin |
BMS |
비항체 단백질 결합체 |
GPC3 표적 약물 전달 |
비임상 |
초기 단계 |
| (출처 : 당사 제시) |
2) 비교우위 사항
AST-201은 간암 세포에 특이적인 세포막 단백질인 GPC3에 선택적인 결합을 통해 약물 전달을 하므로 BiFAp 형태로 내제된 젬시타빈의 효능을 보호하고 간암 세포로의 효과적인전달 작용이 가능합니다. 기존 젬시타빈 저항성의 형성 기전을 완전히 우회하는 GPC3 경유 세포 내재화는 치료 후 저항성에 의한 치료 효과 저하 가능성을 낮춥니다. 항체나 비항체 단백질 결합체와는 달리 핵산 기반 물질로 우수한 조직 투과성을 확보하여 간암과 같은 고형암을 효과적으로 치료 가능하며 GPC3는 검증된 간암 세포 특이적 세포막 표지자로서 비선택적 약물 전달에 의한 부작용을 최소화 합니다. 또한, AST-201의 충분한 혈액 내 안정성 (반감기 50시간 이상)은 정상 조직에서의 약물 노출을 최소화하며, 단일 공정으로 제조 가능하여 품질 관리 및 대량생산 측면에서의 용이성을 확보하고 있습니다.
| [AST-201의 작용 기전] |
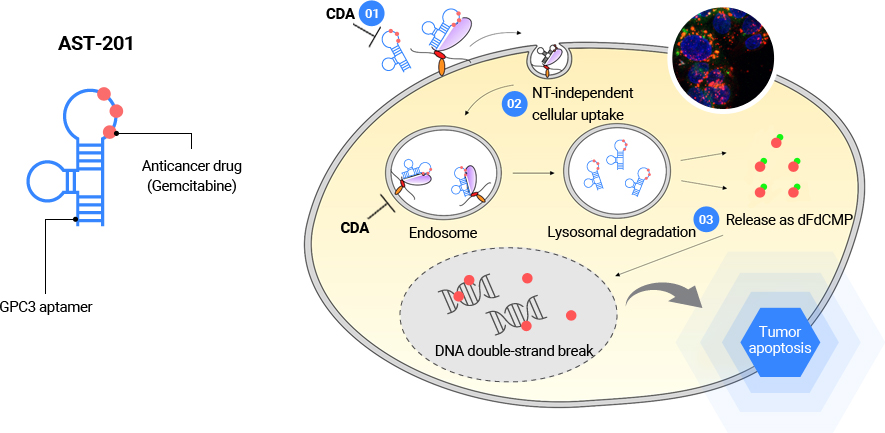 |
|
AST-201 구조 및 작용 기전 |
| (출처 : 당사 제시) |
[혈액암 치료제 AST-202]
AST-202 또한 이러한 기조하에서 개발된 파이프라인으로 T 세포 림프종, 급성골수성 백혈병에서 특징적으로 과발현되고 있는 CD25 단백질을 표적으로 하는 ApDC®입니다. CD25-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술을 적용 압타머에 3개의 약물이 접합되도록 디자인되어 potency가 개선됨과 더불어 나노미셀의 고차구조를 형성함으로써 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
| [AST-202의 작용 개요] |
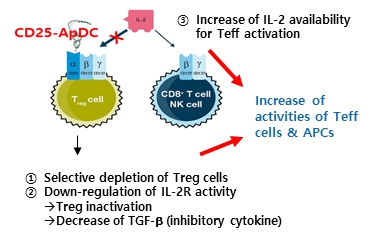 |
|
AST-202의 작용개요 |
| (출처 : 당사 제시) |
또한 압타머는 항체 대비 종양 조직 투과성이 우수하므로 종양 내 침투된 Treg 도달 및 약물활성이 좋을 것으로 예상되고, 더불어 면역관문억제제(PD-1/PD-L1) 병용투여를 통해 기존 면역항암제의 반응률 개선 효과 및 시너지효과가 기대되며, CD25의 종양 발현율이 높은 lymphoma, leukemia 등의 혈액암으로 적응증 확대도 기대할 수 있습니다.
[췌장암 치료제 AST-203]
AST-203도 당사의 압타머-약물 접합체(ApDC®) 플랫폼을 기반으로 개발되었습니다. 다양한 암종에서 과발현되어 있고, 특히 최근 가장 주목받고 있는 ADC 표적인 Trop2 단백질을 표적으로 하는 ApDC®입니다. Trop2-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 신속한 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술을 적용 압타머에 3개의 약물이 접합되도록 디자인되어 potency가 개선됨과 더불어 나노미셀의 고차구조를 형성함으로써 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
더불어, 3차원으로 배양된 Trop2-양성 종양 spheroid에서 항체 대비 최대 6.7배 높은 조직침투율을 보였으며, Trop2-양성 종양 동물모델(췌장암)을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 더불어, 동일 표적에 대한 승인된 ADC인 Trodelvy와 동물모델에서의 효능비교 실험에서 상대적으로 우수한 종양성장 억제효과가 관찰되었습니다. 또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다. 높은 Trop2 발현율을 보이는 다양한 고형암에 대한 표적약물전달 치료제입니다. 주요 적응증으로는 Trop2-발현이 높으나 ADC 치료제 개발의 난항을 겪고 있는 췌장암과 비소세포폐암입니다. ApDC가 보이는 우수한 종양침투능, 상대적으로 낮은 부작용 가능성 등은 ADC 개발이 어려운 난치성 암에 대한 미충족 수요를 해결할 수 있는 대안이 될 수 있을 것입니다.
하지만 당사 후보물질의 이러한 장점에도 불구하고 당사가 개발중인 파이프라인의 진행단계는 초기 단계로 제품 판매 허가시점이 경쟁사 대비 늦어질 수 있는 위험이 존재합니다. 또한 동일 치료제 시장 내 신규 경쟁업체의 진입 증가, 의학적 미충족 수요의 변화, 현재 경쟁제품의 연구개발 속도의 증가, 경쟁사의 가격정책 및 마케팅전략 변화, 새로운 기전의 치료제의 등장, 당사 파이프라인의 연구개발 속도 저하 등의 이유로 인해 당사 파이프라인의 시장경쟁력이 약화되는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
(주6) 정정 후
|
마. 신약 목표 시장 내 경쟁 심화 위험 당사는 고형암 치료제, 혈액암 치료제 등을 주요 파이프라인으로 개발하고 있으며 이처럼의학적 미충족 수요가 높은 시장을 전략적으로 목표하며 혁신신약을 연구개발하고 있습니다. 이에 대해 당사는 파이프라인별로 경쟁사 및 경쟁제품, 작용기전, 성능 등의 파이프라인 동향을 면밀하게 분석한 후 당사의 경쟁우위요소를 바탕으로 사업전략을 수립하고 있습니다. 하지만 당사의 이러한 노력에도 불구하고 동일 파이프라인 내 신규 경쟁업체의 진입 증가, 의학적 미충족 수요의 변화, 경쟁사의 가격정책 및 마케팅전략 변화, 새로운 치료제의 등장, 당사 파이프라인의 연구개발 속도 저하 등의 사유로 인해 당사 파이프라인의 시장경쟁력이 약화되는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다. |
당사는 압타머 기반의 고형암 치료제, 혈액암 치료제 등을 주요 파이프라인으로 개발하고 있습니다. 당사는 기존 치료제와 ADC의 제약으로 인해 의학적 미충족 수요가 높은 질환 시장을 목표 시장으로 선정하여 혁신신약에 도전하는 약물을 개발하고 있습니다.
그러나 향후 동일한 질병 치료제를 개발하는 신규 경쟁업체의 진입 증가, 당사 대비 임상 단계가 앞서 나가고 있는 경쟁 약물들의 임상 성공 및 시판 승인 등이 발생 및 증가할 경우, 당사 제품의 경쟁력 및 사업성 등에 부정적인 영향을 미칠 수 있습니다. 당사가 파악한 각 파이프라인별의 경쟁현황은 아래와 같습니다.
[간암 치료제 AST-201]
AST-201은 글리피칸-3(GPC3)를 표적으로 하는 선택적 간암 치료제로 젬시타빈을 내재화하여 높은 치료 효율과 안전성을 확보하고 있습니다. 압타머 기반 물질의 우수한 조직 투과성, 높은 효능을 바탕으로 선택적 결합에 의해 기존 항암제에 기인한 부작용을 최소화시키는 효능을 지니고 있습니다.
1) 경쟁 상황
간암 환자에 대한 표준 치료제는 과거 소라페닙(제품명: 넥사바), 렌바티닙(제품명: 렌비마)과 같은 티로신키나아제(TK) 억제제가 주로 사용되었으나, 베바시주맙(제품명: 아바스틴)-아테졸리주맙(제품명: 티센트릭) 병용 또는 더발루맙(제품명: 임핀지)-트리멜리무맙(제품명: 임주도) 병용요법의 간세포암 1차 치료제 승인 이후 이들이 더 많이 처방되고 있습니다. 현재 간세포암 진료 가이드라인은 아래와 같습니다.
| [2022 간세포암종 진료 가이드라인] |
 |
|
간세포암종 진료 가이드라인 |
| (출처 : 대한간암학회, 국립암센터 2022) |
간세포암 환자 대상 IMBrave 150 연구에서 베바시주맙-아테졸리주맙 병용요법을 투여한 환자군의 전체생존기간 중간값(median OS)은 19.2개월로 소라페닙 투여군 13.4개월 대비 유의한 증가를 확인했습니다.
| [간세포암 병용투여 임상결과] |
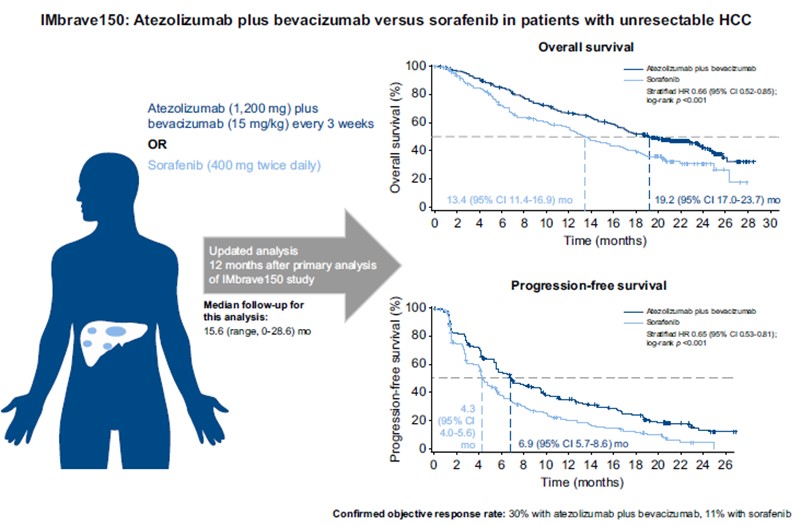 |
|
베바시주맙-아테졸리주맙 병용임상결과 |
| (출처 : Cheng Al, et al. J Hepatol 2022) |
또한 HIMALAYA 연구에서는 더발루맙-트리멜리무맙 병용요법을 투여한 환자군의 생존 중간값(median OS)은 16.4개월로 소라페닙 투여군 13.8개월 대비 유의한 증가를 확인했습니다. 그 밖에 간세포암 1차 치료제로 사용 가능한 약물들의 임상 시험 결과는 아래와 같습니다.
| [간세포암 1차 치료제의 임상결과] |
| 제
품명 |
회사 | 중간 생존값 (
개월
)
|
적응증 |
투여 방법 |
| Avastin-Tcentriq |
Roche |
19.2 |
간세포암 |
정맥주사, 3주 간격 병용투여 |
| Imjudo-Imfinzi |
AstraZeneca |
16.4 |
간세포암, 비소세포폐암 |
정맥주사, 병용투여 후 4주간격으로 임핀지 지속투여 |
| Lenvima |
Eisai |
11.5 |
간세포암, 갑상선암 등 |
1일 1회 경구복용 |
| Nexavar |
Bayer |
12.3 |
간세포암, 갑상선암 등 |
1일 2회 경구복용 |
| Keytruda |
MSD |
14.6 |
간세포암, 흑색종 등 |
정맥주사, 3주 간격 투여 |
| Opdivo |
BMS |
16.4 |
간세포암, 흑색종 등 |
정맥주사, 3주 간격 투여 |
| (출처 : 당사 제시) |
GPC3를 타겟으로 승인된 약물은 아직 없으며, 개발 중에 있는 약물은 아래 표와 같습니다.
| [GPC3 타겟 개발 중인 약물 목록] |
| 신약 후보물질 | 회사명 | 모달리티 | 단계 |
| GC33 |
Roche |
항체 |
2상 |
| CM350 |
Keymed Biosciences |
이중항체 | 1/2상 |
| CMD011 |
Shimai Pharmaceutical |
이중항체 | 1/2상 |
| SAR444200 |
Sanofi |
이중항체 | 1/2상 |
| ERY974 |
Chugai Pharmaceutical |
이중항체 | 1상 |
| BOS-342 |
BOSTON Pharmaceuticals |
이중항체 | 1상 |
| CT011 |
CARsgen Therapeutics |
CAR T |
1상 |
| BOXR1030 |
Sotio Biotech |
CAR T |
1상 |
| AZD5851 |
AstraZeneca |
CAR T |
1상 |
| Ori-C101 |
OriCell Therapeutics |
CAR T |
1/2상 |
| TAK-102 |
Takeda |
CAR T |
1상 |
| JWATM204 |
JW Therapeutics |
CAR T |
1상 |
| EU307 |
Eutilex |
CAR T |
1상 |
| IM83 |
Immunochina |
CAR T |
1상 |
| LB2101 |
Legend Biotech |
CAR T |
1상 |
| SENTI-301A |
SENTI BIO |
CAR NK |
1상 |
| (출처 : 당사 제시) |
2) 비교우위 사항
간세포암 환자에 가장 많이 처방되고 있는 옵션인 베바시주맙-아테졸리주맙 병용요법은 IMBrave 150 연구에서 소라페닙 대비 전체생존기간 중간값을 6개월 정도 유의하게 증가시켰습니다. 해당 임상연구의 Sub-group 분석 가운데 GPC3가 높은 환자군과 낮은 환자군 비교 결과 GPC3가 낮은 환자군은 원래의 결과와 유사하게 베바시주맙-아테졸리주맙 병용요법이 통계적으로 유의한 차이를 나타냈으나 GPC3가 높은 환자군에서는 그 차이가 유의하지 않게 나타났습니다. 즉, GPC3가 높은 환자군은 여전히 베바시주맙-아테졸리주맙 병용요법의 치료 효과가 떨어지고 있어 의학적 미충족 수요가 높은 환자군입니다. AST-201은 GPC3를 타겟으로 개발하는 약물로서 임상적으로 이들 환자군에 더 높은 효과를 보일 가능성이 있습니다.
| [GPC3 발현 여부에 따른 병용투여 효과] |
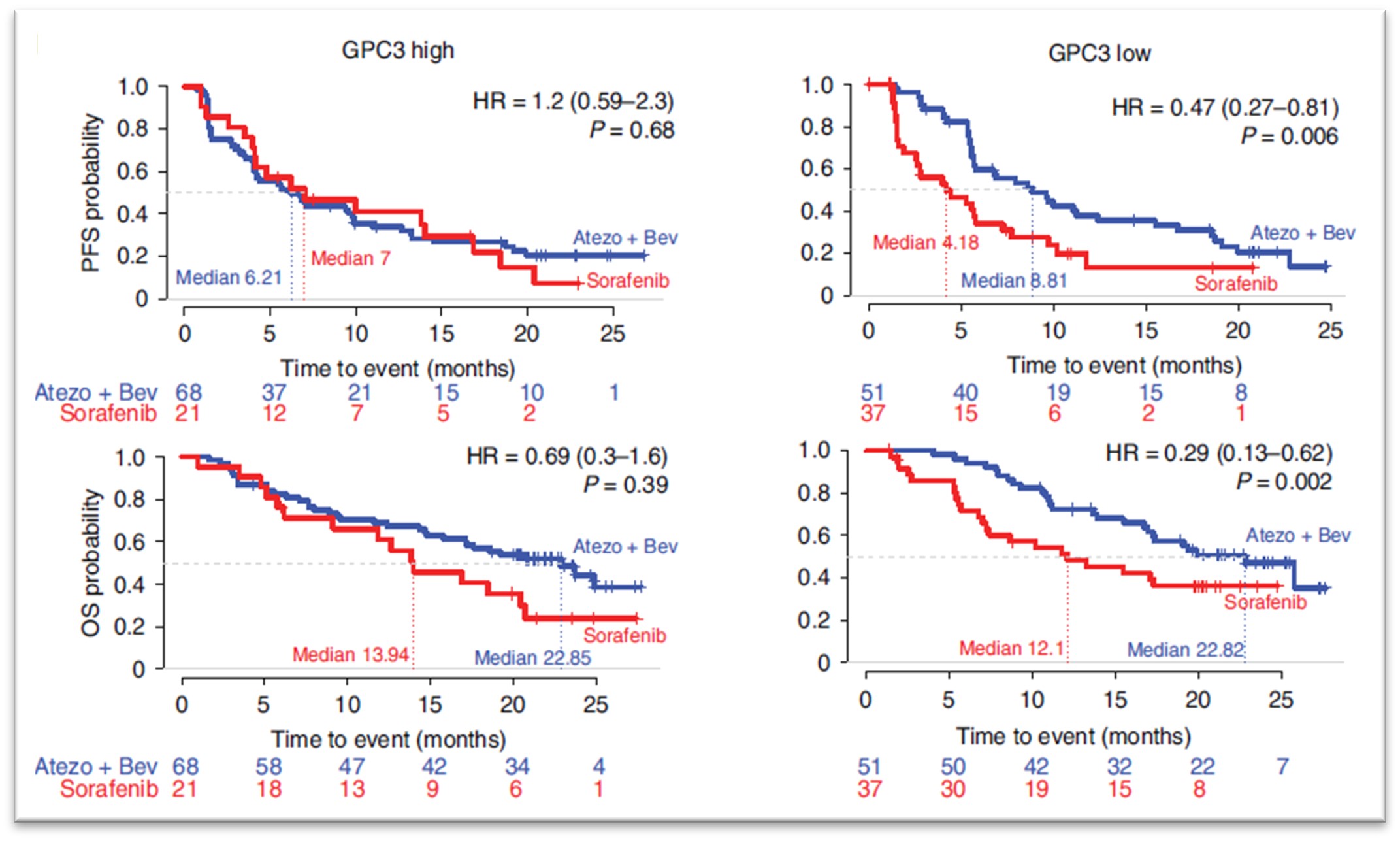 |
|
GPC3 발현 정도에 따른 병용투여 연구결과 |
| (출처 : 당사 제시) |
최근 간세포암 치료제 개발 방향은 면역항암제(PD-1 또는 PDL-1 억제제) 병용요법을 고려하고 있으며, 이전 티로신키나아제(TK) 억제제 단독요법보다 임상 효과(전체생존기간 중간값)가 큰 폭으로 증가했습니다. 이에 다른 후발주자들은 유효성 지표인 전체생존기간 중간값을 높이기 위하여 다양한 면역항암제 병용요법을 개발하고 있으며, AST-201 임상개발 시에도 경쟁력을 가지기 위하여 더 높은 임상 성공의 지표가 요구되고 있습니다.
AST-201은 간암 세포에 특이적인 세포막 단백질인 GPC3에 선택적인 결합을 통해 약물 전달을 하므로 압타머 서열 내에 내재화된 형태로 젬시타빈의 활성을 보호하고 간암 세포로의 효과적인 전달 작용이 가능합니다. 기존 젬시타빈 저항성의 형성 기전을 완전히 우회하는 GPC3 경유 세포 내재화는 치료 후 저항성에 의한 치료 효과 저하 가능성을 낮춥니다. 항체나 비항체 단백질 결합체와는 달리 핵산 기반 물질로 우수한 조직 투과성을 확보하여 간암과 같은 고형암을 효과적으로 치료 가능하며 GPC3는 검증된 간암 세포 특이적 세포막 표지자로서 비선택적 약물 전달에 의한 부작용을 최소화 합니다. 또한, AST-201의 충분한 혈액 내 안정성(반감기 50시간 이상)은 정상 조직에서의 약물 노출을 최소화하며, 단일 공정으로 제조 가능하여 품질 관리 및 대량생산 측면에서의 용이성을 확보하고 있습니다.
| [AST-201의 작용 기전] |
 |
|
AST-201 구조 및 작용 기전 |
| (출처 : 당사 제시) |
3) 시장 규모
간암 발생이 지속해 증가하고 다른 장기로의 전이율이 높은 만큼, 조기진단 및 치료제 개발 필요성이 높아지고 있어 관련 시장 규모는 지속해 확대할 것으로 전망됩니다.
미국 국립암연구소의 SEER(Surveillance, Epidemiology, and End Results) 프로그램에 따르면, 2023년 미국에서 4만 1,210명의 간암 및 간 내 담관암이 새로 진단되고 약 2만 9,380명이 원발성 성인 간암으로 사망한 것으로 예측됩니다. 5년 상대 생존율은 21.6%에 불과합니다.
우리나라 간암 발생률은 다른 선진국 비교했을 때 월등하게 높은 수준으로, 매년 국내에선 약 1만 2,000명의 간암 환자가 새롭게 진단되며 암으로 인한 사망 원인 2위를 차지하고 있습니다. 국민건강보험공단이 분석한 결과에 따르면, 간세포암 환자가 2022년 6만 4525명으로 집계되었으며 5년전 5만 9040명보다 9.3% 증가하였습니다. 간세포암은 간암 유형별 진료인원 8만 853명 중 79.8%를 차지하며, 성별로 보면 77%(4만9677명)가 남성환자였습니다.
| [국내 간암 유형별 진료인원 수] |
 |
|
2021년 간암 유형별 진료인원 수 |
| (출처 : 국민건강보험공단, 2022) |
야후 파이낸스의 시장 리포트에 따르면 글로벌 간암 치료제 시장 규모는 2022년 약 24억 달러(약 3조2000억원)에서 연평균 18.6% 성장해 2030년 약 93억 달러(약 12조5000억원)에 달할 전망입니다. 2023년 기준으로 간암 1차 치료제 시장은 로슈 52%, 아스트라제네카 25%, 기타 23%로 분할하고 있습니다.
| [글로벌 간암 치료제 시장 점유율] |
 |
|
글로벌 간암 1차 치료제 시장 현황 2023 |
| (출처 : IQVIA) |
[면역항암제/혈액암 치료제 AST-202]
AST-202는 T세포림프종과 급성골수성백혈병 치료를 위해 개발된 혈액암 치료제 파이프라인입니다. 당사의 독자적인 분지형 링커 기술을 적용해, 압타머에 3개의 약물을 접합하는 ApDC® 플랫폼을 기반으로 설계되었습니다. 글리벡 출시 이후 혈액암 생존율이 90% 이상으로 향상되었지만, 일부 난치성 혈액암의 생존율은 여전히 30%에 머무르고 있습니다. AST-202는 미충족 수요가 높은 혈액암에서 높은 발현률을 보이는 CD25를 표적으로 삼아 개발되었습니다. 경쟁 약물인 애드세트리스(Adcetris)와 비교했을 때 더욱 우수한 종양 억제 효과를 입증하였으며, 현재 CD25를 표적으로 하는 승인된 치료제는 없으며 개발 중인 약물들은 다음과 같습니다.
| [T세포림프종의 ADC 치료제의 임상결과] |
| 제
품명 |
회사 | 5년 무진행 생존기간 (
개월
)
|
적응증 |
투여 방법 |
| Adcetris |
Takeda | 62.3 |
T세포림프종 |
정맥주사, 3주 간격 투여 |
| (출처 : 각 회사) |
| [급성골수성백혈병의 치료제의 임상결과] |
| 제
품명 |
회사 | 중간 생존값 (
개월
)
|
적응증 |
투여 방법 |
| Xostapa | Astellas | 9.3 |
FLT3 변이 양성인 재발 또는 불응성 급성골수성백혈병 | 1일 1회 경구복용 |
| Venclexta | Abbvie | 14.7 | 만 75세 이상 또는 집중 유도화학요법에 적합하지 않은 급성골수성백혈병 | 1일 1회 경구복용 |
| Mylotarg | Pfizer | 17.3 | 새로 진단된 CD33 양성 급성골수성백혈병 | 정맥주사 |
| Onureg | BMS | 24.7 | 급성골수성백혈병 | 1일 1회 경구복용 |
| Vyxeos | Jazz Pharma | 9.6 | 새로 진단된 치료 관련 또는 골수이형성증 관련 변화를 동반하는 급성골수성백혈병 | 정맥주사, 2일 간격으로 3회 투여 |
| (출처 : 각 회사) |
| [CD25 타겟의 구조] |
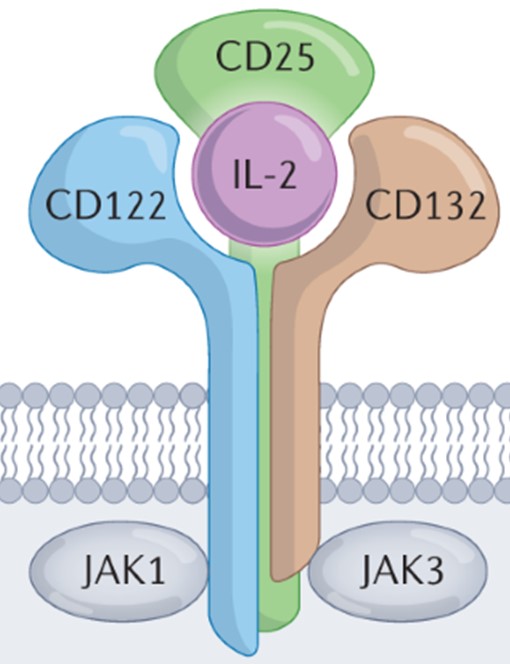 |
|
CD25 타겟구조 |
| (출처 : 당사 제시) |
| [CD25 타겟 개발 중인 약물 목록] |
| 신약 후보물질 | 회사명 | 모달리티 | 단계 |
| AU-007 | Aulos Bioscience |
항체 |
1/2 |
| RM-1995 | Rakuten Medical |
항체 |
1 |
| BA1106 | Shandong Boan Biotechnolog |
항체 |
1 |
| (출처 : 당사 제시) |
혈액암은 림프종, 백혈병, 다발성골수종 등으로 세분화되며 전세계적으로 매년 124만 명의 환자가 발생하고 있습니다. 주로 미국, 서유럽, 오세아니아 등 백인종에서 많이 발생하고 있습니다.
| [국가별 혈액암 발생비율] |
 |
|
글로벌 혈액암 발병비율 |
 |
|
국가별 논호지킨림프종 발생비율 |
| (출처 : GLOBOCAN 2018, Zhang et al Blood Cancer J 2023) |
림프종은 크게 호지킨림프종과 비호지킨림프종으로 구분됩니다. WHO통계에 따르면 2020년 기준 림프종 신규 발병자는 627,439명, 이중 호지킨림프종과 비호지킨림프종 발병비율은 각각 13% 및 87%입니다. NK-T세포 림프종(NK-T cell lymphoma)은 비호지킨림프종의 한 종류로, 림프절 이외의 림프 조직에서 발생하는 NK세포 및 T세포 계열의 림프종입니다. 미국, 유럽보다 한국을 비롯한 아시아 국가에서 비교적 흔히 발견되고 주로 코, 구개, 상기도, 위장관 그리고 피부를 침범하며 진행이 빠른 림프종에 속합니다.
NK/T세포 림프종 환자 비율이 가장 높은 지역은 중국(32.5%), 일본(24.9%), 한국(22.0%) 등 입니다. WHO통계에 따르면 2020년 기준 한국의 림프종 신규 발병자는 5,775명이며, 이중 호지킨림프종과 비호지킨림프종 발병자는 각각 344명 및 5,431명으로 집계되었습니다. 비율로 보면 국내 비호지킨림프종 발병 비율이 94% 수준으로 글로벌 기준 대비 높습니다. 건강보험심사평가원 보건의료빅데이터 개방시스템에 따르면 국내 NK/T세포 림프종(C86) 환자는 2018년 기준 1,681명으로, 지난 5년간 연평균 10.6%의 성장률로 환자 수가 증가하고 있습니다.
노바원어드바이저 보고서에 따르면 2023년 기준 글로벌 T세포 림프종 시장은 약 28억5000만 달러(약 3조8000억원)로 추정되며 연평균 8.85% 성장하여 2033년까지 약 66억 5000만 달러(약 9조원)에 달할 것으로 추산됩니다.
| [글로벌 T세포 림프종 치료제 시장] |
 |
|
T-Cell Lymphoma Market Size |
| (출처 : Nova One Advisor, 2024) |
압타머는 항체 대비 종양 조직 투과성이 우수하므로 종양 내 침투된 Treg 도달 및 약물활성이 좋을 것으로 예상되고, 더불어 면역관문억제제(PD-1/PD-L1) 병용투여를 통해 기존 면역항암제의 반응률 개선 효과 및 시너지효과가 기대되며, CD25의 종양 발현율이 높은 림프종, 백혈병 등의 혈액암으로 적응증 확대도 기대할 수 있습니다.
[췌장암 치료제 AST-203]
췌장암은 50대 이상의 고령 남성에게 주로 발생하며, 70세 이상이 되면 1년 사이에 약 1,000명당 1명의 비율로 발생하는 등 고령층에게 발생빈도가 매우 높은 질환입니다. 췌장암은 국내에서 성별에 따라 여성에서는 8위, 남성에서는 10위로 나타났습니다. 2020년 식약처에 의하면 췌장암은 10대 주요 암 중에서 발병비율이 9위로 낮은 편에 속하나, 조기 진단이 어려우며 확인이 되었을 때는 이미 원격전이가 되어 근치적 절제가 불가능해진 경우가 많은 등 치명률이 높습니다.
| [국내 췌장암 발생 현황 및 비율] |
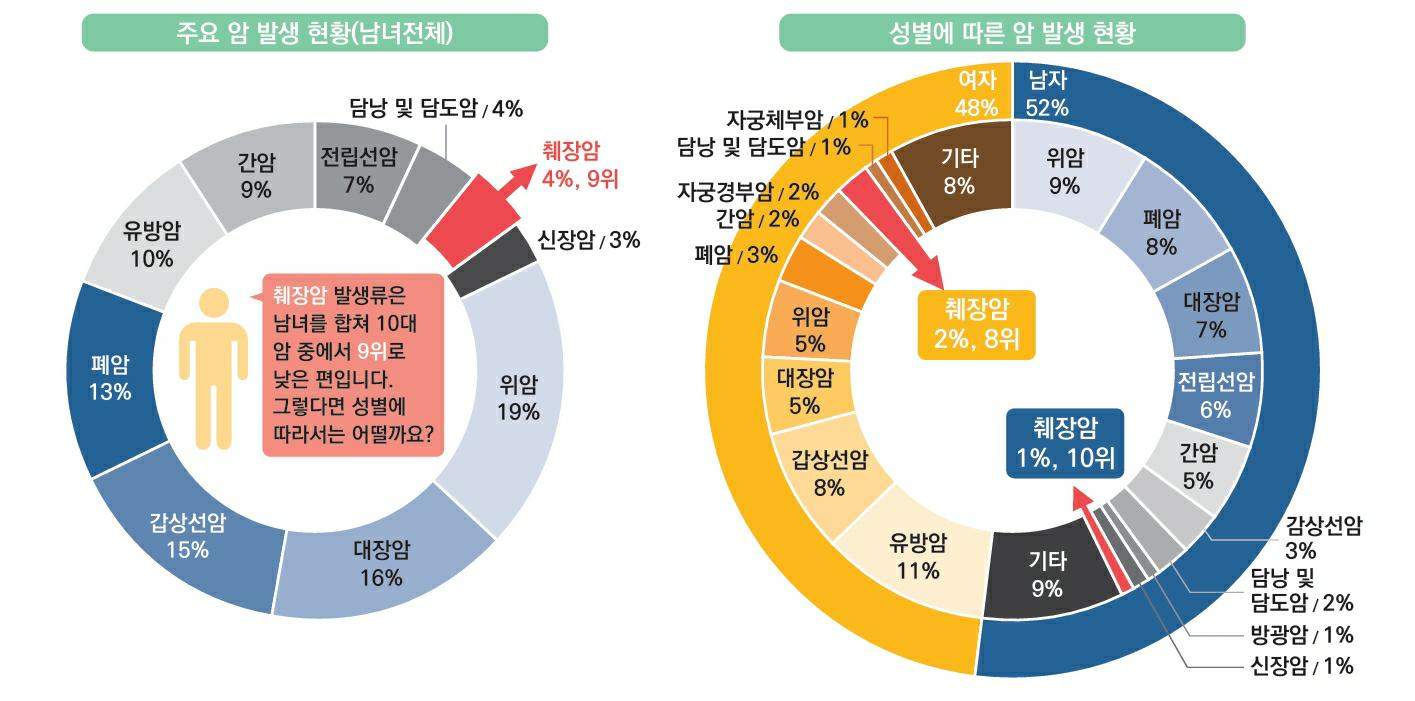 |
|
췌장암의 발생 비율 |
| (출처 : 식품의약품안전처, 2020) |
국내외 주요 글로벌 제약기업은 몇몇 후기 파이프라인 약품의 실패로 인해 시장이 다소 위축된 상황인데, 이는 췌장암이 다른 암 환경에서 좋은 성과를 거둔 대부분의 단일 표적제들을 통한 치료 효과가 매우 적은 것에 기인한 현상입니다. 췌장암 치료제는 크게 전반적인 생존률 향상 및 효과적인 2차 치료 옵션, 기존 치료법을 능가하는 개선된 안전성과 내성에 대한 수요가 존재하는 시장입니다.
| [췌장암의 1차 치료제의 임상결과] |
| 제
품명 |
회사 | 중간 생존값 (
개월
)
|
적응증 |
투여 방법 |
| Folfirinox (5-FU, Irinotecan, Leucovorin, Oxaliplatin) |
- | 11.1 | 진행성 및 전이성 췌장암 | 정맥주사, 2주 간격 투여 |
| Gemcitabine-Abraxane | Celgene | 8.5 | 진행성 및 전이성 췌장암 | 정맥주사, 1주 간격 병용투여 |
| Onivyde | Ipsen | 6.1 | 새로 진단된 CD33 양성 급성골수성백혈병 | 정맥주사 |
| (출처 : 당사 제시) |
췌장암 치료제 세계시장은 2018년 기준 약 1,685백만 달러(약 2.1조 원) 규모에서 연평균 1.7% 감소하여 2028년에는 약 1,414백만 달러(약 1.8조 원) 규모로 시장이 축소될 것으로 전망되었습니다. 췌장암 치료제의 시장 성장을 제약하는 주요 요인으로는 Abraxane과 같은 기존 브랜드 의약에 대한 제네릭 의약의 매출이 증가하고 있다는 점과 유망 신약인 Abraxane이 적응증 확대에 실패한 점, 후기 임상에 유망할 것으로 기대되었던 주요 파이프라인 의약들이 임상시험에 실패한 점 등으로 분석됩니다. 한국과학기술정보연구원 리포트에 따르면 2018년 기준 췌장암 치료제 국내시장은 27백만 달러(약 330억 원) 규모로 추정됩니다.
하지만 당사 후보물질의 이러한 장점에도 불구하고 당사가 개발중인 파이프라인의 진행단계는 초기 단계로 제품 판매 허가시점이 경쟁사 대비 늦어질 수 있는 위험이 존재합니다. 또한 동일 치료제 시장 내 신규 경쟁업체의 진입 증가, 의학적 미충족 수요의 변화, 현재 경쟁제품의 연구개발 속도의 증가, 경쟁사의 가격정책 및 마케팅전략 변화, 새로운 기전의 치료제의 등장, 당사 파이프라인의 연구개발 속도 저하 등의 이유로 인해 당사 파이프라인의 시장경쟁력이 약화되는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
(주7) 정정 전
|
바. 신규 시장으로써 암 조기진단 산업의 특성에 따른 위험 당사가 영위하고 있는 액체 생검을 활용한 암 조기진단 시장은 그 동안 축적된 과학지식의 부족과 검사 기술의 부재로 인하여 최근(2014년)에야 미국에서부터 열리기 시작한 대규모 신흥시장(Emerging market)으로 국제적으로 경쟁사가 소수로 제한되어 있어 현재로서는 글로벌시장에서도 높은 경쟁력과 독점력을 가질 수 있는 산업분야입니다. 그럼에도 불구하고, 암 조기 검진 시장은 아직까지 활성화 되지 않은 새로운 시장으로 정부 정책 변화, 치료제나 다른 검진 방법의 기술 개발 등의 다양한 이유로 시장의 성장세가 저조하거나 위축되는 경우 당사의 영업 활동 및 수익성에 부정적인 영향을 줄 수 있습니다. |
전 세계 모든 국가가 고령화 사회에 진입하고 식습관의 변화 등으로 암을 포함한 다양한 질병이 증가하여 정부에서 지출하는 보건의료 비용이 급격히 증가하고 있어 국가 보건의료 예산부족 해결이 글로벌 이슈로 부각되고 있습니다. 보건의료시장에서 특히, 높은 사망원인이 되는 중증질환 중 암의 경우, 발병률이 매년 크게 증가하고 있으며, 그 결과 암으로 인한 치료 및 사망에 대한 천문학적인 사회적 비용의 지출이 요구되고 있습니다.
특히, 암은 전체 사망의 27%를 차지하여 전세계적으로는 두번째로 높은 사망 원인이며, 선진국을 포함한 국내에서는 사망원인 1순위를 기록하고 있습니다. 또한 인구의 노령화, 흡연 등의 발암 물질에의 노출 증가, 식이섬유 섭취 감소, 동물성 지방 섭취 증가 등의 식이습관 변화로 암 발생이 계속 증가하고 있는 추세입니다. 암은 상당히 진행될 때까지 증상이 없을 수 있으며, 암이 진행되어 나타나는 증상들도 이전에 경험해 오던 증상들과 비슷하여 치료 시기를 놓치는 경우가 많습니다. 증상을 느끼고 병원을 찾을 때는 이미 수술로 제거할 수 없을 만큼 암이 커져 있거나 다른 조직으로 전이 가능성이 높아 완치율이 상당히 낮은 질병으로 알려져 있습니다.
암의 조기 검진은 일반적으로 신체적 이상이나 증상이 없고 스스로 건강하다고 생각될 때, 검사를 받음으로써 병을 조기에 발견하여 치료하고자 하는 것으로, 검진을 통하여 암을 조기에 발견하여 치료할 수 있다면 적은 비용으로 완치율을 크게 높일 수 있습니다. 이런 이유로 미국을 비롯한 선진국들은 환자의 삶의 질 향상과 암의 효과적이고 효율적인 치료를 위해 발병 후 치료 중심에서 조기진단을 통한 예방의학으로 암치료 패러다임의 전환을 통해 대응하고 있습니다.
| [암 조기 진단의 효과성과 효율성] |
 |
|
암 조기 진단의 효과성과 효율성 |
| (출처 : cancer research UK, 2017) |
현재 암을 진단하는 표준 방법은 조직생검(Tissue biopsy)으로, 이는 내시경이나 바늘 등의 도구를 이용해 인체에 침습적으로 시행하므로 여타 방법에 비해 그 정확성은 높지만 침습의 위험부담이 있고, 종양 조직간 혹은 종양 조직 내 생물학적 특성이 다르게 나타날 수 있어 일부 조직 생검으로부터 얻은 정보가 적절한 치료를 하기에 정확도가 불충분 할 수 있습니다. 이에 더해 조직 생검은 상대적으로 고가이며 종양의 위치, 크기 및 환자 상태에 따라 진단이 불가능하거나 단기간내 반복적인 진단은 어렵다고 알려져 있습니다.
액체 생검(Liquid biopsy)의 경우 환자의 체액(혈액, 분뇨나 대변 등)에 포함되어있는 암 조직의 정보를 암의 진단이나 치료에 활용하는 방법으로 조직 생검에 비해 최소 침습을 통해 적은 비용으로 반복적인 검사가 가능하며 암과 관련한 다양한 정보를 획득할 수 있다는측면에서 조직 생검의 단점을 극복하고자 대안으로 제시되는 방법으로 그 시장규모는 점차 확대될 전망입니다.
| [액체생검 시장에서 암진단의 영역 성장] |
 |
|
액체생검 시장에서 암진단의 영역 성장 |
| (출처 : Exact science annual report, 2017) |
한편, 아래 그림에서 보는 바와 같이 암의 초기 단계에서는 종양의 크기가 작아 일반적으로 통증 등의 이상 징후가 없는 무증상 일반인이나 고위험군으로 분류될 수 있는 대다수의 사람들이 검진 대상인 반면, 암의 확진 이후 치료제 선택이나 재발 여부를 모니터링하는 기존 시장은 암 환자를 대상으로 하므로 그 시장의 성격과 규모가 다르다고 할 수 있습니다.
암의 초기 단계에서는 CT나 MRI 등의 이미지 분석을 통한 과거의 조직 생검의 방법으로는 정확한 진단이 거의 불가능한 것으로 알려져 있습니다. 액체 생검의 경우에도 여러 체액 속에 포함된 다양한 정보 중 어떤 정보가 특정 암과 연관이 있는지, 관련성을 확인하더라도 초기 단계에서 극미량으로 존재하는 암 관련 정보를 조기에 검출할 수 있는 방법 등에 대한 연구가 최근에서야 활발히 진행되고 있는 상황입니다.
| [암의 진행단계별 암진단 시장의 영역] |
 |
|
암의 진행단계별 암진단 시장의 영역 |
| (출처 : 당사 제시) |
또한, 현재 진행되고 있는 액체 생검을 통한 암 조기 검진 시장은 당사가 영위하고 있는 폐암을 포함해 대부분의 암종에서 그 기술력의 부족으로 낮은 민감도로 인한 무용성이나 높은 위양성으로 인한 불필요한 불안감 및 의료 비용의 지출을 야기하고 있어 이를 보완할 수 있는 진단 방법이 필요한 실정입니다. 따라서, 암 조기 검진 시장은 향후 사용 목적에 맞는 유의미한 성능을 갖춘 제품을 개발하는 데 고도의 기술력, 시간 및 비용이 소요될 것으로 예상됩니다.
이러한 장점을 갖는 암 조기진단 시장은 그 동안 축적된 과학지식의 부족과 검사 기술의 부재로 인하여 최근(2014년)에야 미국에서부터 열리기 시작한 대규모 신흥시장(Emerging market)으로 건강과 관련된 산업이므로 경기변동에 따른 영향을 크지 받지 않는 산업이며, 암은 주로 식생활 습관이나 고령화에 의해 나타나는 질병이므로 계절적 요인의 영향도 받는다고 할 수 없습니다. 또한 국제적으로 경쟁사가 소수로 제한되어 있어 현재로서는 글로벌시장에서도 높은 경쟁력과 독점력을 가질 수 있는 산업분야입니다.
그럼에도 불구하고, 당사가 영위하고 있는 액체 생검을 활용한 암 조기 검진 시장은 아직까지 활성화 되지 않은 새로운 시장으로 정부 정책 변화, 치료제나 다른 검진 방법의 기술 개발 등의 다양한 이유로 시장의 성장세가 저조하거나 위축되는 경우 당사의 영업 활동 및 수익성에 부정적인 영향을 줄 수 있습니다.
(주7) 정정 후
|
바. 신규 시장으로써 암 조기진단 산업의 특성에 따른 위험 당사가 영위하고 있는 액체 생검을 활용한 암 조기진단 시장은 그 동안 축적된 과학지식의 부족과 검사 기술의 부재로 인하여 최근(2014년)에야 미국에서부터 열리기 시작한 대규모 신흥시장(Emerging market)으로 국제적으로 경쟁사가 소수로 제한되어 있어 현재로서는 글로벌시장에서도 높은 경쟁력과 독점력을 가질 수 있는 산업분야입니다. 그럼에도 불구하고, 암 조기 검진 시장은 아직까지 활성화 되지 않은 새로운 시장으로 정부 정책 변화, 치료제나 다른 검진 방법의 기술 개발 등의 다양한 이유로 시장의 성장세가 저조하거나 위축되는 경우 당사의 영업 활동 및 수익성에 부정적인 영향을 줄 수 있습니다. |
전 세계 모든 국가가 고령화 사회에 진입하고 식습관의 변화 등으로 암을 포함한 다양한 질병이 증가하여 정부에서 지출하는 보건의료 비용이 급격히 증가하고 있어 국가 보건의료 예산부족 해결이 글로벌 이슈로 부각되고 있습니다. 보건의료시장에서 특히, 높은 사망원인이 되는 중증질환 중 암의 경우, 발병률이 매년 크게 증가하고 있으며, 그 결과 암으로 인한 치료 및 사망에 대한 천문학적인 사회적 비용의 지출이 요구되고 있습니다.
특히, 암은 전체 사망의 27%를 차지하여 전세계적으로는 두번째로 높은 사망 원인이며, 선진국을 포함한 국내에서는 사망원인 1순위를 기록하고 있습니다. 또한 인구의 노령화, 흡연 등의 발암 물질에의 노출 증가, 식이섬유 섭취 감소, 동물성 지방 섭취 증가 등의 식이습관 변화로 암 발생이 계속 증가하고 있는 추세입니다. 암은 상당히 진행될 때까지 증상이 없을 수 있으며, 암이 진행되어 나타나는 증상들도 이전에 경험해 오던 증상들과 비슷하여 치료 시기를 놓치는 경우가 많습니다. 증상을 느끼고 병원을 찾을 때는 이미 수술로 제거할 수 없을 만큼 암이 커져 있거나 다른 조직으로 전이 가능성이 높아 완치율이 상당히 낮은 질병으로 알려져 있습니다.
암의 조기 검진은 일반적으로 신체적 이상이나 증상이 없고 스스로 건강하다고 생각될 때, 검사를 받음으로써 병을 조기에 발견하여 치료하고자 하는 것으로, 검진을 통하여 암을 조기에 발견하여 치료할 수 있다면 적은 비용으로 완치율을 크게 높일 수 있습니다. 이런 이유로 미국을 비롯한 선진국들은 환자의 삶의 질 향상과 암의 효과적이고 효율적인 치료를 위해 발병 후 치료 중심에서 조기진단을 통한 예방의학으로 암치료 패러다임의 전환을 통해 대응하고 있습니다.
| [암 조기 진단의 효과성과 효율성] |
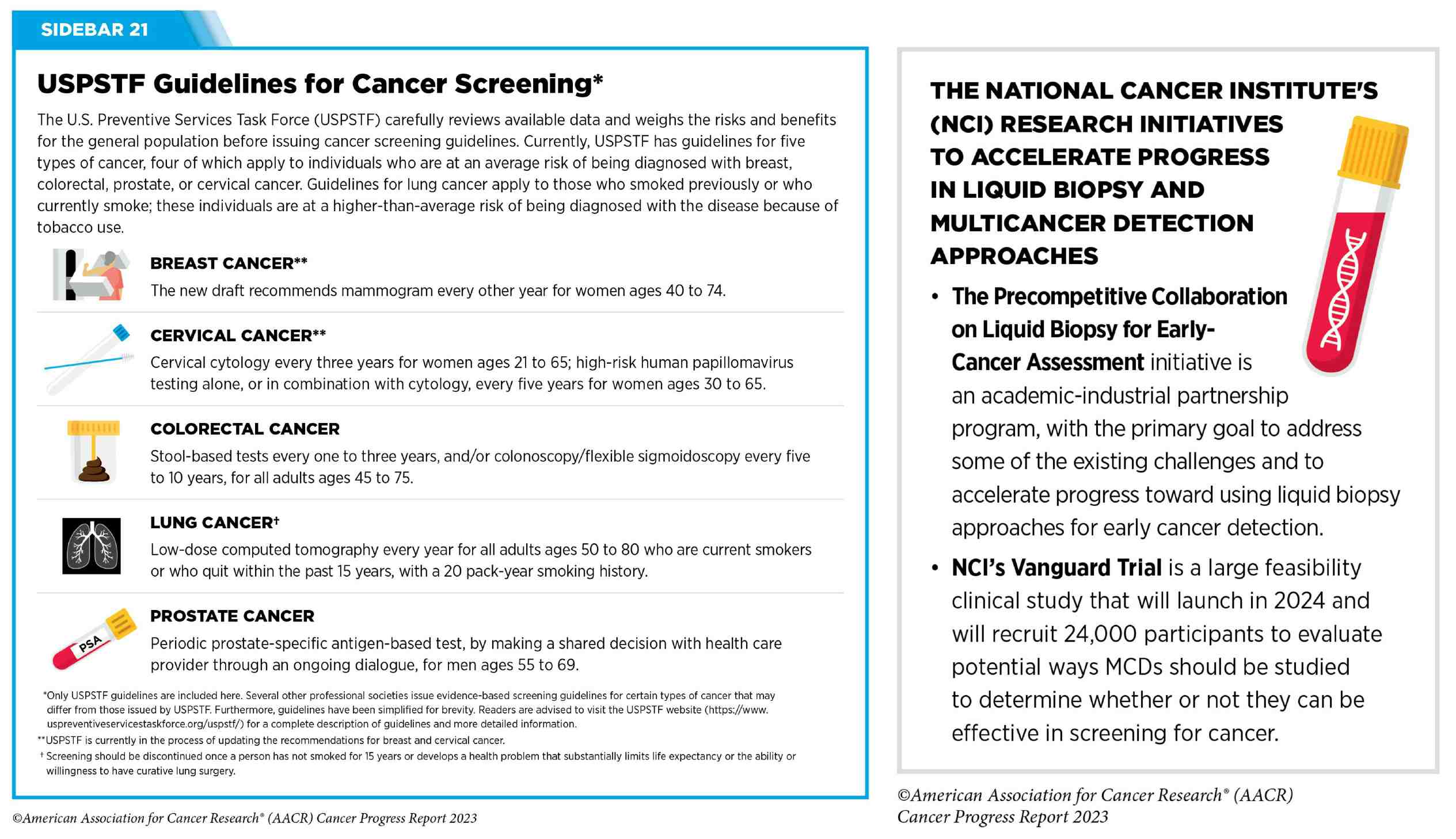 |
|
Screening for early detection, AACR 2023 |
| (출처 : Cancer Progress Report, AACR 2023) |
현재 암을 진단하는 표준 방법은 조직생검(Tissue biopsy)으로, 이는 내시경이나 바늘 등의 도구를 이용해 인체에 침습적으로 시행하므로 여타 방법에 비해 그 정확성은 높지만 침습의 위험부담이 있고, 종양 조직간 혹은 종양 조직 내 생물학적 특성이 다르게 나타날 수 있어 일부 조직 생검으로부터 얻은 정보가 적절한 치료를 하기에 정확도가 불충분 할 수 있습니다. 이에 더해 조직 생검은 상대적으로 고가이며 종양의 위치, 크기 및 환자 상태에 따라 진단이 불가능하거나 단기간내 반복적인 진단은 어렵다고 알려져 있습니다.
한편, 아래 그림에서 보는 바와 같이 암의 초기 단계에서는 종양의 크기가 작아 일반적으로 통증 등의 이상 징후가 없는 무증상 일반인이나 고위험군으로 분류될 수 있는 대다수의 사람들이 검진 대상인 반면, 암의 확진 이후 치료제 선택이나 재발 여부를 모니터링하는 기존 시장은 암 환자를 대상으로 하므로 그 시장의 성격과 규모가 다르다고 할 수 있습니다.
암의 초기 단계에서는 CT나 MRI 등의 이미지 분석을 통한 과거의 조직 생검의 방법으로는 정확한 진단이 거의 불가능한 것으로 알려져 있습니다. 액체 생검의 경우에도 여러 체액 속에 포함된 다양한 정보 중 어떤 정보가 특정 암과 연관이 있는지, 관련성을 확인하더라도 초기 단계에서 극미량으로 존재하는 암 관련 정보를 조기에 검출할 수 있는 방법 등에 대한 연구가 최근에서야 활발히 진행되고 있는 상황입니다.
| [암의 진행단계별 암진단 시장의 영역] |
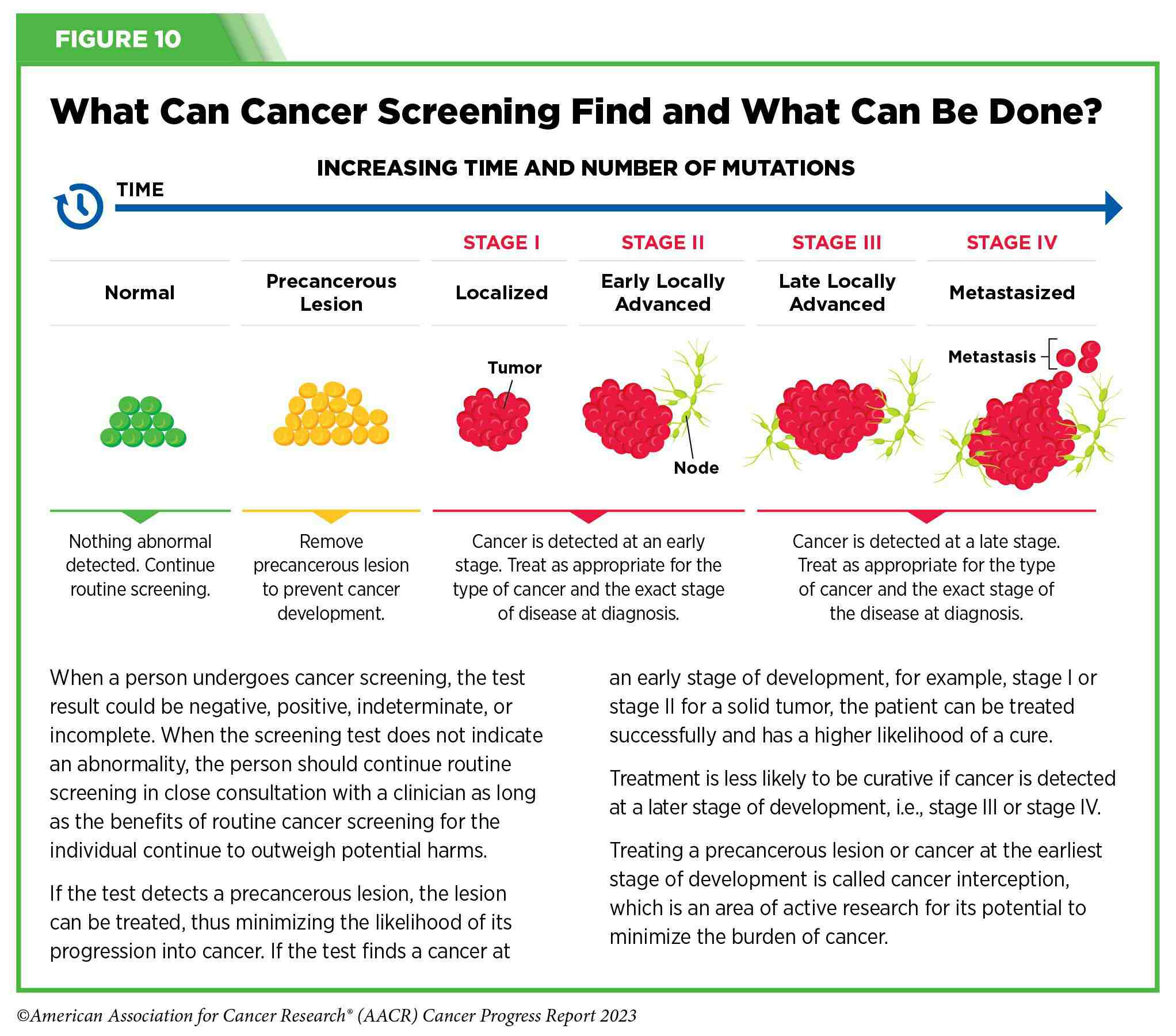 |
|
암의 진행 단계 |
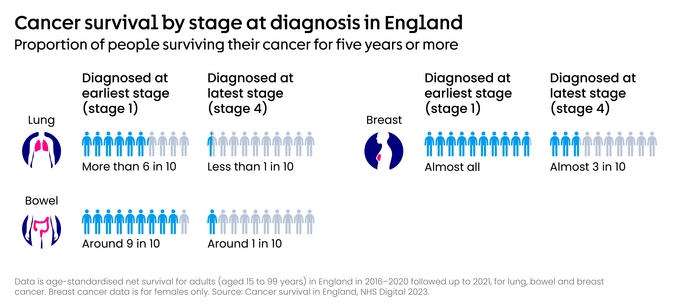 |
|
Cancer survival by stage at diagnosis in England |
| (출처 : Cancer Progress Report, AACR 2023) (출처 : Cancer survival statistics, Cancer Research UK 2023) |
고령화 사회 진입으로 만성질환과 암을 중심으로 질병 발생이 증가함에 따라 선진국들은 보건의료비 지출을 줄이기 위하여 기존 치료를 중심으로 한 보건의료 정책이 질병의 조기진단, 예방과 관리 중심으로 변화하고 있습니다. 이에 따라 의료기기 시장에서 체외진단기기 시장이 급성장하고 있으며, 글로벌 시장조사기관 NovaOneAdvisor에 따르면 2024년에는 817억 달러에서 매년 4.5%씩 성장하여 2033년에는 1,214억 달러에 이를 것으로 전망하고 있습니다.
체외진단은 (In Vitro Diagnostics, IVD)은 질병 진단과 예후 판정, 건강상태의 평가, 질병의 치료 효과 판정, 예방 등의 목적으로 인체로부터 채취한 검체 (혈액, 객담, 타액, 소변, 대변, 세포)를 이용하며 내분비질환, 암, 감염성질환, 면역질환, 심장질환, 전해질, 마약, 소변, 임신, 당뇨 등의 항목을 주로 검사합니다. 현재 의료 패러다임 변화를 충족시키기 위해서는 현재의 검사법들이 가지고 있는 한계점 (진단성능, 편의성 등)을 극복하고 적합한 고성능 바이오마커와 액체생검 (Liquid Biopsy)에 필요한 분자진단 기술개발이 요구되고 있는 상황입니다.
X-ray를 포함하여 CT, PET, MRI 등 이미지 분석을 통한 진단기술은 시간과 비용이 많이 들어가며, 조기진단에 대하여 정확도가 떨어져 특별한 증상이 없는 환자의 경우 방사선 노출, 조영제 등의 부작용으로 실행에 한계가 있습니다.
대표적인 질환인 암 진단에서 조직검사를 통한 침습적인 방법은 환자에게 위험 부담이 크고, 이미 암 조직이 형성된 후 진단함으로서 조기진단에 적용하기에는 부적합합니다.
액체 생검(Liquid biopsy)의 경우 환자의 체액(혈액, 분뇨나 대변 등)에 포함되어있는 암 조직의 정보를 암의 진단이나 치료에 활용하는 방법으로 조직 생검에 비해 최소 침습을 통해 적은 비용으로 반복적인 검사가 가능하며 암과 관련한 다양한 정보를 획득할 수 있다는 측면에서 조직 생검의 단점을 극복하고자 대안으로 제시되는 방법으로 그 시장규모는 점차 확대될 전망입니다.
| [액체생검 시장에서 암진단의 영역 성장] |
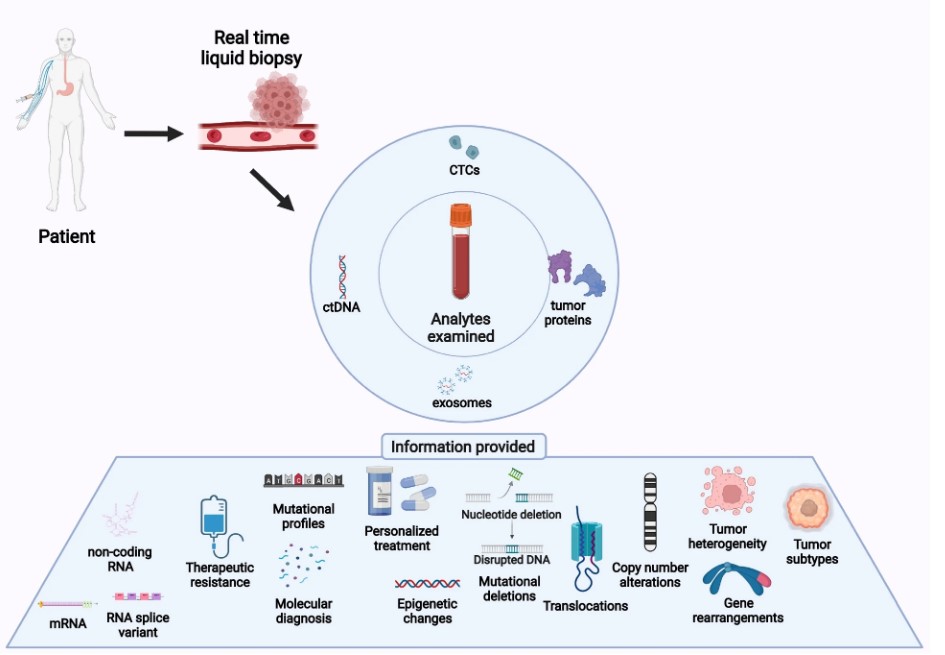 |
|
Entities analyzed in liquid biopsies and their applications |
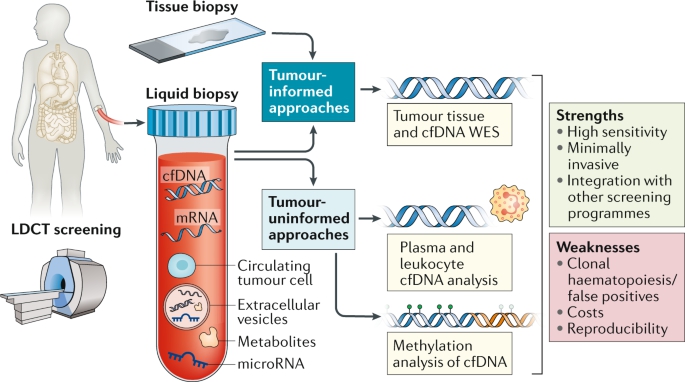 |
|
Liquid biopsy for early stage lung cancer |
| (출처 : Liquid biopsy, Molecular Cancer 2022) (출처 : Nature reviews clinical oncology 2020) |
또한, 현재 진행되고 있는 액체 생검을 통한 암 조기 검진 시장은 당사가 영위하고 있는 폐암을 포함해 대부분의 암종에서 그 기술력의 부족으로 낮은 민감도로 인한 무용성이나 높은 위양성으로 인한 불필요한 불안감 및 의료 비용의 지출을 야기하고 있어 이를 보완할 수 있는 진단 방법이 필요한 실정입니다. 따라서, 암 조기 검진 시장은 향후 사용 목적에 맞는 유의미한 성능을 갖춘 제품을 개발하는 데 고도의 기술력, 시간 및 비용이 소요될 것으로 예상됩니다.
이러한 장점을 갖는 암 조기진단 시장은 그 동안 축적된 과학지식의 부족과 검사 기술의 부재로 인하여 2010년 중반부터 미국에서부터 열리기 시작한 대규모 신흥시장(Emerging market)으로 건강과 관련된 산업이므로 경기변동에 따른 영향을 크지 받지 않는 산업이며, 암은 주로 식생활 습관이나 고령화에 의해 나타나는 질병이므로 계절적 요인의 영향도 받는다고 할 수 없습니다. 또한 국제적으로 경쟁사가 소수로 제한되어 있어 현재로서는 글로벌시장에서도 높은 경쟁력과 독점력을 가질 수 있는 산업분야입니다.
엑스레이(X-ray)를 포함하여 CT, PET, MRI 등 이미지 분석을 통한 영상진단기술은 다양한 암 등을 진단하는데 있어 표준기술(Gold Standard)로서 사용되고 있습니다. 영상진단은 혈액을 이용한 비침습적인 방법보다 시간과 비용이 많이 들어가고, 조기진단에 대하여 정확도가 떨어지며, 특별한 증상이 없는 환자의 경우 방사선 노출, 조영제 등의 부작용으로 실행에 한계가 있습니다. 그럼에도 병원과 의료진에 자리잡은 영상진단기술을 액체생검 방식이 대체하기까지는 상당한 시간이 걸릴 것으로 예측됩니다.
현재까지 액체생검이 기존의 원칙으로 자리하고 있던 조직생검과 성공적으로 양립할 수 있음을 보인 시장은 사실상 미국시장이 유일하다고 판단됩니다. 대표적인 사례는 Guardant 사의 Guardant 360으로 Guardant 360은 진행성 고형암을 대상으로 하는 액체생검 검사로서 2020년 FDA 허가에 최초로 성공한 사례입니다. 아래의 자료로 Guardant 360의 2018년부터 2023년까지의 연검사 건수를 확인할 수 있습니다. 검사 건수 기준 2018년 29천건에서 2022년 173천건으로 연평균 43% 증가하였음을 통해 시장진출이 성공적이었음을 확인할 수 있습니다. Guardant 사에서는 현재 대표적인 고형암인 비소세포폐암, 유방암, 대장암에 있어 전체 경우의 15~21%에 Guardant 360이 도입되었다고 제시한 바 있습니다.
| [Guardant 360 검사 건수] |
 |
|
guardant360 |
| (출처 : Guardant, J.P. Morgan Healthcare Conference Presentation, 2024.01) |
Natera 사의 Signatera는 미국 식품의약국(FDA)의 의료기기 사전허가(PMA)를 받지 않은 LDT(laboratory developed test) 제품으로 판매되고 있으며, PMA를 받지 않았기 때문에 보험적용이 제한적인 상황이나 시장에 성공적으로 진입하고 있음을 알 수 있습니다.
| [Signatera 검사 건수] |
 |
|
Signatera oncology tests, clinical tests processed |
| (출처 : Natera, 2024 Q2 Earnings Presentation, 2024.08)
|
2024년 반기 기준 Signatera 검사 건수는 118천건으로 2024년 1분기 대비 13천건을 증가하여 높은 실적을 기록하였습니다. 2023년 연간성장율은 2022년 대비 73.5%를 기록하였고, 2024년 반기까지 높은 성장율을 유지하고 있습니다. Natera社는 대장암과 유방암, 근육 침습성 방광염, 면역요법 모니터링 등 Signatera의 핵심적응증에서 새로운 적응증을 지속적으로 추가하고 있습니다.
Grail 사의 Galleri 역시 LDT(laboratory developed test) 제품으로 그럼에도 불구하고 2021년 중기에 미국에 출시한 이후 2024년 반기까지 총 215,000개를 시판한 상태이고, Grail 사의 올해 2분기 매출은 3200만달러로 전년 대비 43% 증가했습니다. Grail 사는 3만5000여명을 대상으로 한 Galleri의 PATHFINDER 2 허가임상의 지원자 모집을 완료한 상태이며, 오는 2026년 상반기에 Galleri의 PMA 제출을 완료할 수 있을 것으로 예상하고 있습니다.
이와 같이 유사 제품의 성공적인 상업화 및 그 성장세에도 불구하고 현재 당사가 주목표로 하고 있는 미국 이외의 지역에서는 아직 관련 시장이 성숙하지 않았기에 유사한 성장세를 보이지 못할 수 있는 점 투자자 분들께서는 유의하시기 바랍니다.
암 조기 진단 시장에서 경쟁 제품 대비 경쟁력 확보를 위해서는 높은 임상성능, 검사의 간편성, 높은 순응도 그리고 비용 등이 가장 중요한 요소들입니다. 당사의 제품은 고감도 압타머와 최적화된 체외진단 다지표 기술을 활용하여 모방하기 어려우며 기술적 및 사업적 진입장벽이 높다고 할 수 있습니다. 이
처럼 폐암 진단 시장은 미충족 의료 수요가 높지만, 다양한 발병 원인으로 인해 바이오마커를 특정하기 어려워 진단하는 것이 쉽지 않습니다. 현재 임상시험을 통해 국가별 식약처로부터 품목승인을 받는 것은 더욱 어려운 상황입니다.
| [폐암의 액체 생검 시장 성장추세] |
 |
|
Lung cancer liquid biopsy market 2023-3033 |
| (출처 : Lung cancer biopsy market, 2024.05) |
폐암 조기진단 방식에는 X-Ray, Chest CT, Low-Dose CT와 같은 영상장비를 활용한 진단, 혈액을 이용한 단일종양표지자(CEA, Cyfra21-1) 및 다지표진단, 객담을 이용한 진단, 기관지내시경을 이용한 진단이 있습니다. 이중 현재 폐암을 조기진단하는데 가장 많이 사용하는 진단 방식은 Chest CT와 Low-Dose CT의 영상진단 방식입니다.
그외 기관지 내시경이나 객담검사등이 활용되고 있으며 2019년부터 정부가 지원하는 폐암 검진 사업으로 30갑년 이상 흡연력이 있는 만 54세∼74세 고위험군에 대해 2년마다 LDCT 검사를 시행하는 등 다양한 검진 방법이 활용되고 있습니다.
| [국내 시행중인 폐암 검사 방법] |
| 검사 방법 | 상세 |
|
흉부 X-ray (Chest X-ray) |
가장 먼저 사용되는 검사법. 간단하게 폐에 혹이 생겼는지 여부 판단 가능. 보통 5mm 이상이 되어야 발견되고 심장 뒤쪽, 뼈와 겹치는 부위 등은 위치에 따라 보이지 않을 수 있음 |
|
저선량 CT (Low Dose Computed tomography) |
보다 정교한 검사법. 폐나 림프절 그리고 다른 기관에 대한 해상도가 높기 때문에 암의 원발 부위 및 림프절 침범 등 병의 진행 정도 파악에 도움. 폐암의 발견 및 병기 판정에 필수 |
|
객담 세포진 검사 (Sputum examination) |
가래에 섞인 세포 속에서 암세포를 발견해 내는 검사법. 가능한 한 이른 아침에 가래를 용기에 넣어 마르지 않게 한 후 제출. 매번 암세포가 섞여 있는 것이 아니기 때문에 3회 정도 검사 필요 |
|
기관지 내시경 검사 (Bronchoscopy) |
기관지 내시경을 통하여, 기관지 내 암조직의 침범 여부 확인. 떼어낸 조직을 검사하여 암 확진 가능. 암의 진단뿐만 아니라 암의 기관지 침범 정도를 확인하여 수술 등 치료 계획을 세우는데 도움을 줌 |
|
경피적 미세침흡인세포검사 (Percutaneous microimmune aspiration cell examination) |
국소마취를 한 후에 피부를 통해서 폐암에 바늘을 찔러 폐암의 조직이나 세포를 얻어서 하는 조직검사. 실제로 폐암 유무를 판명해 낼 수 있는 검사 |
| 병기 판정을 위한 추가 검사 |
폐암으로 확진된 환자에게 치료를 시작하기 전에 병기 판정을 위하여 추가로 시행하는 검사 - 전신 골스캔, 뇌 자기공명영상 (MRI) - 전신 양전자방출단층촬영 (PET) - 종격동 내시경, 초음파 기관지 내시경 |
|
종양마커 검사법 (CEA, Cyfra21-1, NSE, SCCA, SLX, proGRP ) |
한 종류의 종양 마커를 정성/정량 분석하여 진단하는 검사법 (비소세포성암 진단: CEA, Cyfra21-1 / 편평상피암 진단: Cyfra21-1 / 소페성폐암 진단:proGRP) |
| (출처 : 당사 제시) |
하지만, 영상진단인 Chest CT와 Low-Dose CT의 경우 96.4%의 높은 위양성률과 방사선 노출에 따른 부작용이 우려되고 있어, 혈액을 이용한 진단에 대한 요구가 지속적으로 커지고 있는 상황입니다.
이러한 시장 상황을 배경으로 당사는 편의성과 유효성 모두를 충족시킬 수 있는 액체생검을 통한 조기 암 진단의 수요가 있을 것으로 예상하고 2016년 식약처 확증 임상시험 계획 승인에 따라 7종의 바이오마커를 이용하여 정상인 200명, 폐암환자 200명을 대상으로 임상시료들을 분석하여 민감도 68.5%, 특이도 83.0% (나이 55세 이상, 흡연력 30갑년 이상 고위험군의 경우는 민감도 73.3%, 특이도 90.5%)의 결과를 얻어 높은 성능의 진단 결과를 확인함으로써 2017년 9월에 식약처로 부터 품목허가를 승인받았습니다.
| [AptoDetect™-Lung 제품 구성] |
 |
|
ADL 제품구성(A-B set) |
| 구분 | AptoDetect™-Lung PCR (
폐암 조기진단)
|
| 적응증 | 폐암 조기진단 |
| 작용기전 | 폐암 특이적 바이오마커 5종 이하 단백질을 혈액에서 측정하여 위험도 제공 |
| 제품의 특성 |
- 정상인 및 폐암 발병 고위험군 대상 조기진단 정보 제공 1그룹: 정상인 대상 폐암 선별 검사
2그룹: 폐 결절이 발견된 환자 대상 폐암 선별 검사
- 혈액에서 5종이하 단백질 측정, 알고리즘을 통한 점수화 (score 0~10)
- 폐암 진단 가이드 및 폐암 위험도 정보 제공
- 극미량의 검체시료로 분석 가능 (혈청, 5μl)
|
| 진행경과 |
- 폐암 특이적 마커를 포함한 classifier 확정 - 임상시료 분석을 통한 알고리즘 진단 성능 확보 이후 최적화 진행
- 기존 알고리즘 개선 및 최적화 진행 중
- 식약처 수출용 품목허가 획득 (2024.03) |
| 향후계획 |
- 인도, 중국 현지 임상진행 및 품목허가 획득
- 동남아시아 국가 진출 및 판매 |
| 경쟁제품 | - EarlyCDT®-Lung (7종 자가항체 측정), Epi-prolung® (2종 DNA 메틸화 측정) 등 경쟁제품 대비 정확도/검사시간에서 강점보유
|
| 관련논문 등 | - Clinical Validation of a Protein Biomarker Panel for Non-Small Cell Lung cancer. J Korean Med Sci. (2018) 33(53):e342 - Development of a Protein Biomarker Panel to Detect Non Small-Cell Lung Cancer in Korea, Clin Lung Cancer. (2017) Mar;18(2):e99-e107. - Validation of a blood protein signature for non-small cell lung cancer, Clin Proteomics. 2014; 11(1): 32 - Unlocking biomarker discovery: large scale application of aptamer proteomic technology for early detection of lung cancer, PloS ONE. (2010) Dec; 5(12): e15003 |
| 기타사항 |
AptoDetectTM-Lung
제품과 동일한 AptoMIA 기술을 활용해 PCR버전 개발
- Luminex 장비가 아닌 장비 보급이 상대적으로 쉬운 PCR 장비를 활용
- 바이오마커수: 7종에서 5종으로 줄여 1개의 웰(well)에서 분석 가능
- 국내 식약처 허가 목적보다는 해외 수출용 목적으로 개발 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
의 검사과정은 다음과 같습니다. ① 폐 결절이 발결된 환자의 혈액 (Serum)을 이용하여,
② 혈액 내 7종 단백질과 압타머가 결합하여 단백질 농도를 압타머 농도로 변환하고,
③ 비드 마이크로어레이 법 (Liquid bead microarray)을 이용하여 압타머 농도를 측정하게 됩니다. 그리고
④ 진단 알고리즘을 통해 폐암 위험도 정보를 0~10점으로 산출하게 되며, 5점 미만은 저위험, 5점이상은 고위험으로 판단합니다.
| [AptoDetect™-Lung 검사 및 분석 과정] |
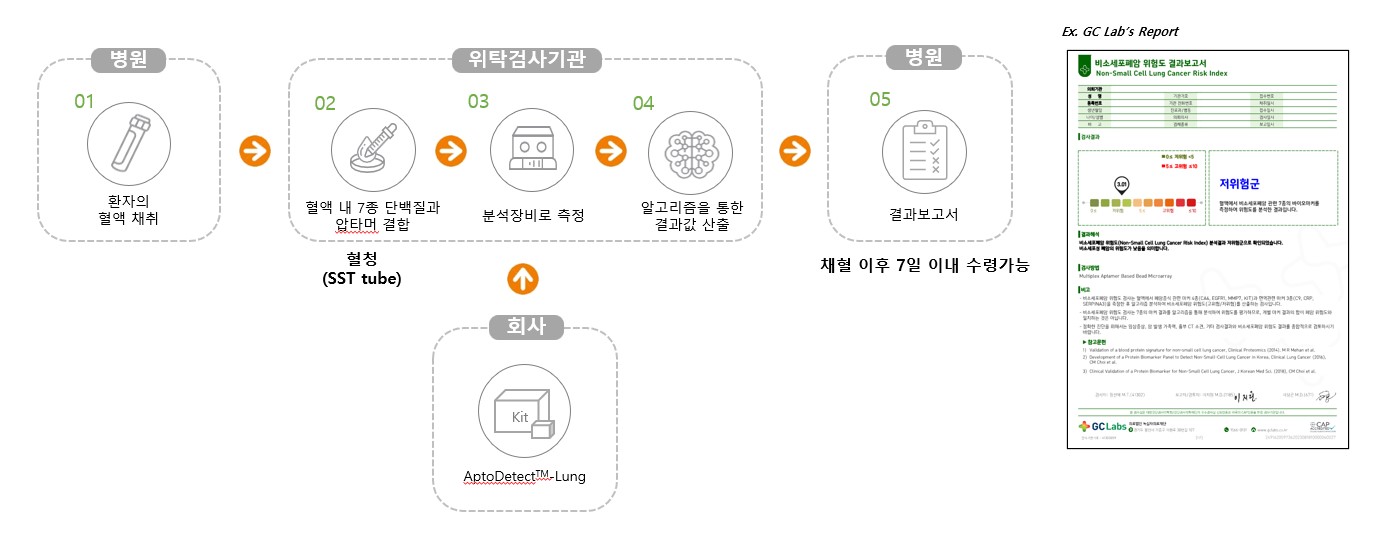 |
|
비소세포폐암 위험도 검사 수행절차 |
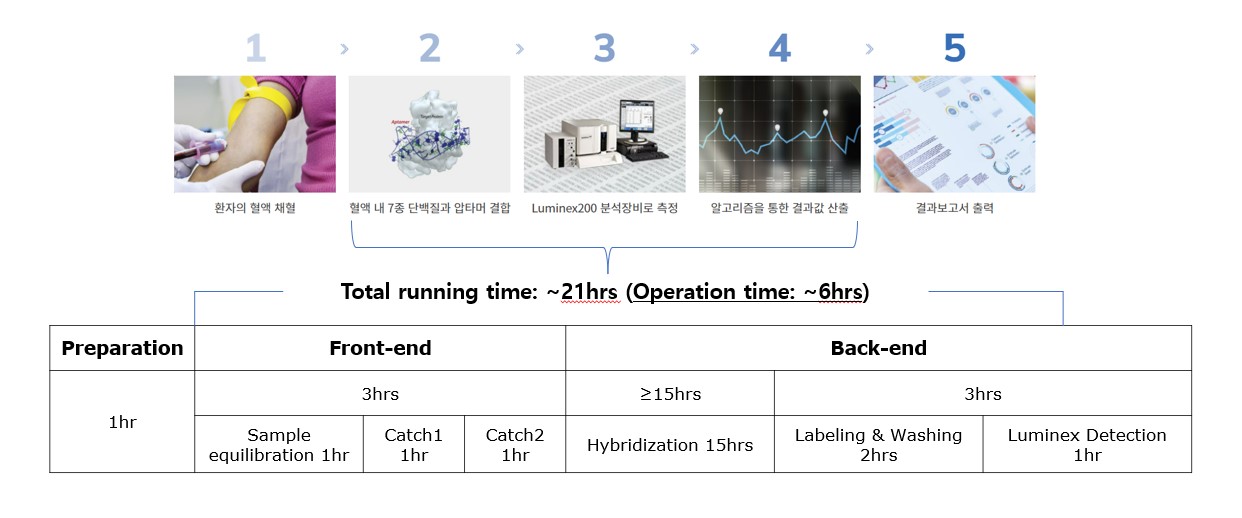 |
|
ADL 분석과정 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
은 하나의 키트에 ALUC-1024 (16 테스트/키트), ALUC-1048 (40 테스트/키트), ALUC-1096 (88 테스트/키트) 3가지로 구성되어 있으며, 당일 검사하면 익일 오전에 결과를 확인할 수 있게 됩니다. 현재는 수탁의료기관 1곳에서 검사를 진행하고 있으며, 일주일에 1번 매주 화요일 1주일간 확보된 혈액 검체를 사용하여 검사를 진행하고 있습니다. 분석이 완료되면, 해당 검사 결과는 보고서를 통해 의뢰한 각 병원으로 전달됩니다.
AptoDetect™-Lung은 보건복지부 평가 유예 신의료기술에 선정(보건복지부 고시 제 2022-174호)되어 비급여로 병원에서 사용이 가능하게 되었습니다. 이에 따라 상급종합병원 4곳에서 비급여 코드를 확보하고 처방을 시작하였으며, 다기관 임상을 통해 2023년 6월 이후 1500건의 실증사례를 쌓았습니다. 평가 유예 신의료기술 제도는 2년간 유효하여 2024년 기한이 종료될 예정이나, 2024년 4월에 발표된 제2차 국민건강보험 종합계획 시행계획에 따라, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 시행될 예정입니다. 개선안의 시행에 따라, 당사의 AptoDetect™-Lung
제품은 2026년까지 2년간 추가적으로 비급여로 병원에서 사용 가능할 것으로 예상하고 있습니다. 다만, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 올해 내 시행되지 않을 경우, 비급여 처방이 일시적으로 중단될 수 있는 위험이 존재합니다.
그외 해외시장 진출을 위해 qPCR 방식의 제품인 AptoDetect™-Lung PCR 7의 수출용 품목허가를 획득하였으며(2024년 3월), 인도 의료기기 유통사와 현지 생산시설 구축 및 인허가 추진을 위한 MOU를 체결하였습니다(2024년 5월). 현재는 인도 중앙의약품표준관리국(CDSCO) 인증병원에 임상 IRB를 제출하였으며, 승인받은 이후 임상연구를 진행할 계획입니다.
그밖에 중국, 베트남 기업에 AptoDetect™-Lung PCR 7 도입을 제안하고 검토결과를 기다리고 있으며, 미국 시장의 경우 CLIA 연구실을 확보한 기업과 협업하여 LDT 서비스 형태로 진출을 논의하고 있습니다.
당사가 영위하고 있는 액체 생검을 활용한 암 조기 검진 시장은 아직까지 활성화 되지 않은 새로운 시장으로 정부 정책 변화, 치료제나 다른 검진 방법의 기술 개발 등의 다양한 이유로 시장의 성장세가 저조하거나 위축되는 경우 당사의 영업 활동 및 수익성에 부정적인 영향을 줄 수 있습니다.
(주8) 정정 전
| 사. 폐암 조기진단 제품에 대한 경쟁 상황의 변화에 따른 목표 시장 점유율 감소 폐암 조기 진단 시장에서 경쟁 제품 대비 경쟁력 확보를 위해서는 높은 임상성능, 검사의 간편성, 높은 순응도 그리고 비용 등이 가장 중요한 요소들입니다. 당사의 제품은 고감도 압타머와 최적화된 체외진단 다지표 기술을 활용하여 모방하기 어려우며 기술적 및 사업적 진입장벽이 높다고 할 수 있습니다. 당사는 높은 경쟁력 유지를 위해 지속적인 연구개발을 하고 있으나 , LDCT등의 현재 진단 기술이 발전함으로써 현재 단점을 보완하거나 국내외적으로 당사 제품보다 우수한 경쟁력을 가진 새로운 제품이 출현하는 경우, 이들과 경쟁해야 하므로 목표시장에서 점유율이 축소되어 당사의 수익성 및 매출에 부정적인 영향을 미칠 수 있습니다. 또한, 당사가 보유하고 있는 일부 압타머 관련 기술자산 및 특허는 라이선스 계약등을 통하여 취득한 것입니다. 당사는 포항공대 산학협력단 및 현대아산병원과 체결한 라이선스 계약에 따라 수익이 발생하게 되면 매출액의 일부를 경상기술료로 Licensor에게 배분해야 하기 때문에 이와 같은 수익 배분의무는 당사의 향후 수익성에 부정적인 영향을 미칠 수 있습니다. |
폐암은 전 세계적으로 매년 200만 명이 발병하고, 180만 명이 매년 사망하는 사망률 1위 암으로, 우리나라에서는 매년 약 2만 명이 신규 발생하고 있습니다. Research And Market (2023)에 의하면 폐암 진단 시장 규모는 전 세계 기준 2022년에 23.3억 달러로 추산되며, 매년 8.2% 성장하여 2030년 43.6억 달러로 증가할 것으로 예상됩니다.
| [전 세계 암종별 발생률] |
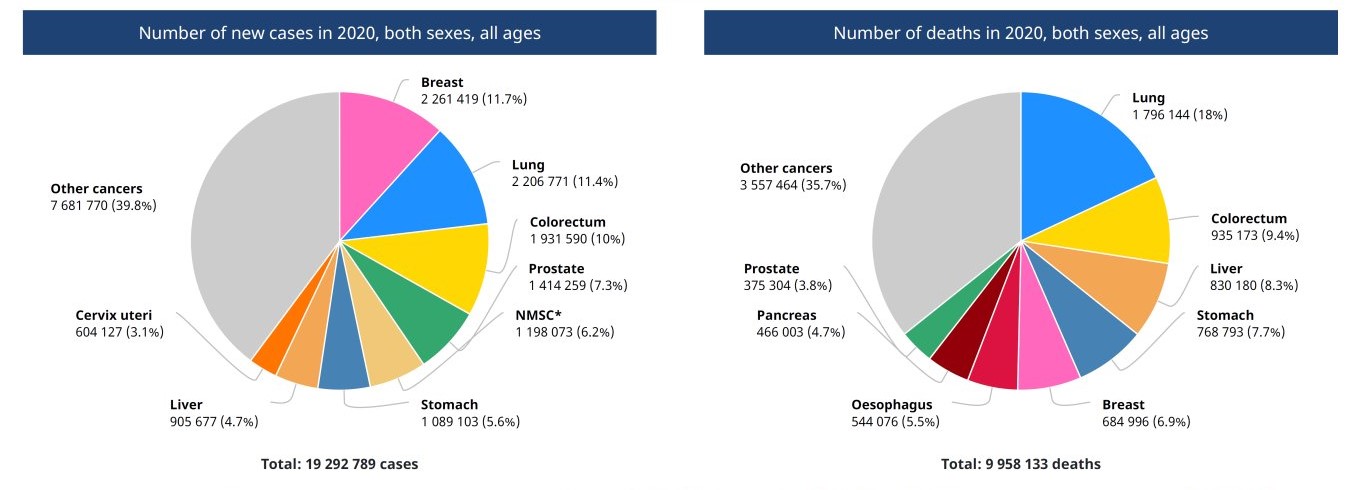 |
|
전 세계 암종별 발생률(2020) |
| (출처: Global Cancer Observatory, 2023) |
특히 폐암은 자각증세가 없어 예후가 매우 나쁜 암으로써 4기에 진단시 진단 후 5년 생존율이 10% 미만이지만, 수술이 가능한 조기단계 발견 시 5년 생존율이 60% 이상 까지 상승하기에 조기진단에 대한 수요는 지속해서 증가할 것으로 예상됩니다. 이처럼 폐암의 5년 생존율이 낮은 원인은 폐암을 초기에 진단할 수 있는 마땅한 진단기술이 없기 때문이며, 액체 생검을 통한 조기 진단이 가장 필요한 영역으로 볼 수 있습니다.
| [폐암 진단시 생존율 비교] |
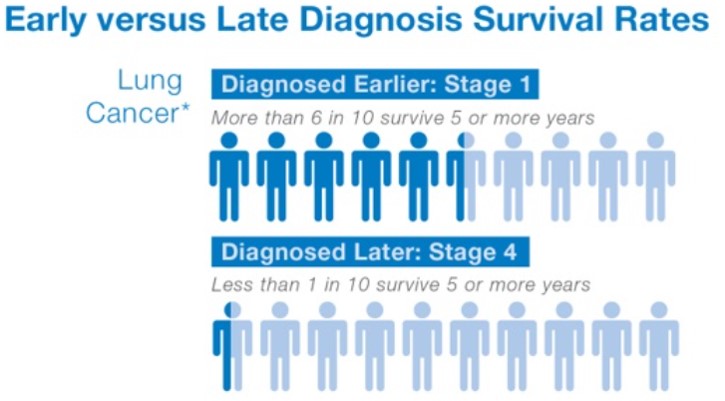 |
|
폐암 조기진단시 생존율 비교 |
| (출처 : st, Elizabeth healthcare / verifiedmarketresearch.com, 2019) |
| [암종별 액체 생검 시장 성장추세] |
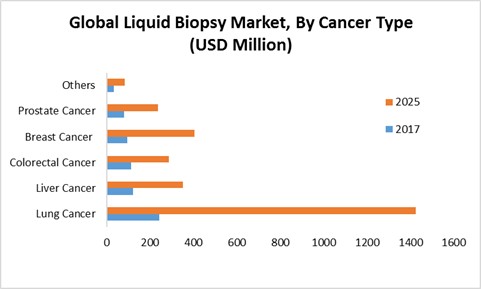 |
|
암종별 액체 생검 시장 성장추세 |
| (출처 : st, Elizabeth healthcare / verifiedmarketresearch.com, 2019) |
기존에 사용되는 폐암 진단 방법 중 가장 대중적으로 사용되는 진단방법인 이미징 (X-ray,CT 등)은 진단 정확도가 낮고 고비용이며, 방사선 노출, 조영제 부작용의 위험이 존재할 수 있습니다. 그외 기관지 내시경이나 객담검사등이 활용되고 있으며 최근에는 국가 차원 의 검진지원사업이 추진되면서 2019년부터 정부가 지원하는 폐암 검진 사업으로 30 갑년 이상 흡연력이 있는 만 54세∼74세 고위험군에 대해 2년마다 LDCT (저선량 흉부 CT - Low-Dose Computed Tomography) 검사를 시행하는 등 다양한 검진 방법이 활용되고 있습니다.
이러한 시장 상황을 배경으로 당사는 편의성과 유효성 모두를 충족시킬 수 있는 액체생검을 통한 조기 암진단의 수요가 있을 것으로 예상하고 2016년 식약처 확증 임상시험 계획 승인에 따라 7종의 바이오마커를 이용하여 정상인 200명, 폐암환자 200명을 대상으로 임상시료들을 분석하여 민감도 68.5%, 특이도 83.0% (나이 55세 이상, 흡연력 30갑년 이상 고위험군의 경우는 민감도 73.3%, 특이도 90.5%)의 결과를 얻어 높은 성능의 진단 결과를확인함으로써 2017년 9월에 식약처로 부터 품목허가를 승인받았습니다.
당사의 주력제품인 폐암 조기진단 제품(AptoDetect™-Lung)의 경우, X-ray나 LDCT(저선량 CT) 등 기존에 주로 사용되던 검사법 등이 1차 경쟁자가 될 수 있으나, 이들은 정확도가 떨어지거나 높은 위양성 등 성능이 미흡한 문제점들이 존재합니다. 특히, 향후 확대될 것으로 예상되는 국가암검진 사업의 LDCT와 관련해 LDCT상 폐결절이 발견된 대상자를 상대로 당사의 폐암 조기 진단 제품을 통해 폐암 위험도 정보를 제공하여 불필요한 후속검사를 줄일 수 있을 것으로 예상됩니다.
한편, 당사가 파악한 바에 따르면 국내에 폐암조기진단 제품을 허가 받은 곳은 당사가 유일하며 국제적으로 폐암 조기진단 제품을 개발한 회사는 영국의 온크이뮨(Oncimmune)과 독일의 에피지노믹스(Epigenomics)로 각사의 제품을 비교하면 아래와 같습니다.
| [당사 제품과 경쟁 제품과의 비교] |
|
구분 (*) |
㈜압타머사이언스 |
Oncimmune사 |
Epigenomics사 |
|
검체 사용량 |
5 μl (serum) |
20 μl (serum /plasma) |
3.5 mL (plasma) |
|
포장단위 |
88 테스트/키트, 40 테스트/키트 |
10 테스트/키트 |
32 테스트/키트 |
|
성능(민감도/특이도) |
75% / 92% |
41% / 91% |
67% / 90% |
|
인허가 |
국내 허가(2017) CE(2018) |
국내 없음 CE(2017) |
국내 없음 CE(2017) |
| (출처 : 당사 제시) (*) 2024년 8월 14일 국내 (주)지노믹트리사가 폐암 진단용 체외분자진단제품의 탐색임상시험을 진행 중이라는 사실을 공시했으며, 증권신고서 제출일 현재 제품 품목허가 여부는 확인할 수 없습니다. |
Oncimmnue사에서 개발한 EarlyCDT-Lung은 41%의 낮은 민감도 성능에도 불구하고 지난 5년간 미국의 의료보험(Medicare, Part B)의 지원을 받아 임상 검사실에서 자체 개발한 체외진단검사를 환자들에게 제공할 수 있는 제도인 LDT(Lab Developed Tests) 형태로 사업을 수행하여 왔습니다. 이와 비교하여 당사는 높은 임상 성능, 사용 편의성과 검사 속도 등으로 미국시장에서 경쟁할 수 있을 것으로 기대하고 있습니다. Epigenomics사는 혈액 기반 DNA 메틸화 마커를 검사를 폐암 조기진단 제품으로 CE 승인을 받았으나 임상성능(67%, 90%)이 당사가 동등 내지 우위에 있습니다.
그외 시장의 성장성을 예측하고 다양한 분야에서 암 조기진단 분야로의 진출을 확대하고 있는바, 최근 Grail, Gaurdant health, Freenome 등의 회사들에서 혈액을 이용한 NGS 기반의 암 조기진단 방법이 시도되고 있으나 암 특이성과 민감도가 당사 제품에 비해 현저히 떨어지는 결과로 현재로서는 주요경쟁 제품은 아니라고 판단하고 있습니다. 또한, CTC(혈액내 순환 종양세포)를 이용한 진단기술이 소개되고 있으나 아직 유효성을 입증한 자료는 부족한 상태로 알려저 있습니다.
암 조기 진단 시장에서 경쟁 제품 대비 경쟁력 확보를 위해서는 높은 임상성능, 검사의 간편성, 높은 순응도 그리고 비용 등이 가장 중요한 요소들입니다. 당사의 제품은 고감도 압타머와 최적화된 체외진단 다지표 기술을 활용하여 모방하기 어려우며 기술적 및 사업적 진입장벽이 높다고 할 수 있습니다.
다만, 당사는 높은 경쟁력 유지를 위해 지속적인 연구개발을 하고 있으나, LDCT 등의 현재 진단 기술이 발전함으로써 현재 단점을 보완하거나 국내외적으로 당사 제품보다 우수한 경쟁력을 가진 새로운 제품이 출현하는 경우, 이들과 경쟁해야 하므로 목표시장에서 점유율이 축소되어 당사의 수익성 및 매출에 부정적인 영향을 미칠 수 있습니다.
당사가 보유하고 있는 일부 압타머 관련 기술자산 및 특허는 라이선스 계약 등을 통하여 취득한 것입니다. 당사는 포항공대 산학협력단과 체결한 압타머를 이용한 연구용 시약 및 분석법(Aptamer sandwich Assay)의 상업적 제공에 대한 라이선스 계약에 따라 관련 매출에 대하여 연순판매액의 6%를 경상기술료로 지급하고 있습니다. 또한, 포항공대 산학협력단과 체결한 폐암IVD 라이선스 계약에 따라 제품 순판매액의 12%(한국 내) ~ 7%(아시아 12개국), 서울아산병원과 체결한 기술이전 계약(폐암진단키트 개발 노하우)에 의해 폐암IVD의 한국내 매출액의 1%를 기술료로 지급해야 합니다. 라이선스 계약 관련 내용은 『제2부 발행인에 관한 사항 - Ⅱ. 사업의 내용 - 9. 경영상의 주요계약』 부분을 참고해주시기 바랍니다. 이와 같은 수익 배분의무는 당사의 향후 수익성에 부정적인 영향을 미칠 수 있습니다.
(주8) 정정 후
| 사. 폐암 조기진단 제품에 대한 경쟁 상황의 변화에 따른 목표 시장 점유율 감소 폐암 조기 진단 시장에서 경쟁 제품 대비 경쟁력 확보를 위해서는 높은 임상성능, 검사의 간편성, 높은 순응도 그리고 비용 등이 가장 중요한 요소들입니다. 당사의 제품은 고감도 압타머와 최적화된 체외진단 다지표 기술을 활용하여 모방하기 어려우며 기술적 및 사업적 진입장벽이 높다고 할 수 있습니다. 당사는 높은 경쟁력 유지를 위해 지속적인 연구개발을 하고 있으나 , LDCT등의 현재 진단 기술이 발전함으로써 현재 단점을 보완하거나 국내외적으로 당사 제품보다 우수한 경쟁력을 가진 새로운 제품이 출현하는 경우, 이들과 경쟁해야 하므로 목표시장에서 점유율이 축소되어 당사의 수익성 및 매출에 부정적인 영향을 미칠 수 있습니다. 또한, 당사가 보유하고 있는 일부 압타머 관련 기술자산 및 특허는 라이선스 계약등을 통하여 취득한 것입니다. 당사는 포항공대 산학협력단 및 현대아산병원과 체결한 라이선스 계약에 따라 수익이 발생하게 되면 매출액의 일부를 경상기술료로 Licensor에게 배분해야 하기 때문에 이와 같은 수익 배분의무는 당사의 향후 수익성에 부정적인 영향을 미칠 수 있습니다. |
폐암은 전 세계적으로 매년 200만 명이 발병하고, 180만 명이 매년 사망하는 사망률 1위 암으로, 우리나라에서는 매년 약 2만 명이 신규 발생하고 있습니다. Research And Market(2023)에 의하면 폐암 진단 시장 규모는 전 세계 기준 2022년에 23.3억 달러(약 3조1000억원)로 추산되며, 매년 8.2% 성장하여 2030년 43.6억 달러(약 5조8000억원)로 증가할 것으로 예상됩니다.
| [전 세계 암종별 발생률] |
 |
|
전 세계 암종별 발생률(2020) |
| (출처: Global Cancer Observatory, 2023) |
국내의 경우 국립암센터에서 보고한 2022년 주요암 사망 분율에 따르면, 전체 사망자 약 37.3만명의 22.4%인 약 8.3만명이 암으로 사망했으며 이들 중 폐암 사망자는 22.3%인 약 1.9만명입니다. 국내 암 사망자수에서도 폐암이 1위를 차지하고 있습니다.
폐암의 가장 큰 발병 원인으로는 흡연이 대표적인데, 최근에는 비흡연자에게서도 폐암 발병률이 증가하고 있습니다. 특히, 미세먼지는 1급 발암물질로 분류되었으며, 갈수록 악화되는 대기오염은 조기사망에 이를 만큼 심각한 폐질환의 원인으로 대두되고 있습니다. 조리시 발생하는 요리매연(cooking fume)으로 인한 여성 폐암 발병률 또한 증가하는 추세입니다.
특히 폐암은 자각증세가 없어 예후가 매우 나쁜 암으로써 4기에 진단시 진단 후 5년 생존율이 10% 미만이지만, 수술이 가능한 조기단계 발견 시 5년 생존율이 60% 이상 까지 상승하기에 조기진단에 대한 수요는 지속해서 증가할 것으로 예상됩니다. 이처럼 폐암의 5년 생존율이 낮은 원인은 폐암을 초기에 진단할 수 있는 마땅한 진단기술이 없기 때문이며, 액체 생검을 통한 조기 진단이 가장 필요한 영역으로 볼 수 있습니다.
당사의 주력제품인 폐암 조기진단 제품(AptoDetect™-Lung)의 경우, X-ray나 LDCT(저선량 CT) 등 기존에 주로 사용되던 검사법 등이 1차 경쟁자가 될 수 있으나, 이들은 정확도가 떨어지거나 높은 위양성 등 성능이 미흡한 문제점들이 존재합니다. 특히, 향후 확대될 것으로 예상되는 국가암검진 사업의 LDCT와 관련해 LDCT상 폐결절이 발견된 대상자를 상대로 당사의 폐암 조기 진단 제품을 통해 폐암 위험도 정보를 제공하여 불필요한 후속검사를 줄일 수 있을 것으로 예상됩니다.
| [폐암 진단시 생존율 비교] |
 |
|
Lung cancer stage at diagnosis |
| (출처 : Impact of lung cancer screening on stage migration, Cancer 2024) |
폐암을 진단하는 단계는 크게 4가지로 나눌 수 있습니다.
① 고위험군을 포함하는 스크리닝(screening),
② 폐 결절 환자의 진단보조,
③ 수술 후 치료를 위한 동반진단, ④ 수술 후 모니터링으로 구분할 수 있으며, 주로 스크리닝과 폐 결절 환자의 진단보조, 수술 후 치료를 위한 동반진단이 주된 시장을 형성하고 있습니다.
첫째, 고위험군 포함 스크리닝 시장은 가장 큰 진단 시장을 형성할 것으로 예상되지만, 그만큼 국가별 식약처의 품목허가를 받는 것은 어려운 것이 현실입니다. 중국 Hanzhou Kaibao Biotechnology사의 The 7-AABs panel 검사가 2020년 중국 NMPA(국가약품감독관리국)로부터 승인을 받은 것이 전부이며, 현재까지 국내외 식약처로부터 품목허가를 받은 제품은 없는 상황입니다.
식약처 품목허가를 받지 않았지만, LDT 형태로 서비스를 진행하고 있는 회사는 다음과 같습니다. 영국의 Oncimmune사의 EarlyCDT-Lung과 미국 Genesys Biolabs의 PAULA’s TEST, 미국 Grail사의 Galleri, 미국 Natera사의 Signatera for Lung Cancer 등이 있습니다. 국내에서는 식약처 품목허가를 받지 않았지만 건강검진 목적으로 사용 중인 아이엠비디엑스사의 캔서파인드 등이 있습니다. 이외에도 바이오마커인 자가항체, ctDNA, Protein, CTC 분석 등을 사용하여 스크리닝 목적으로 폐암을 진단하는 회사 등이 있습니다.
| [폐암 스크리닝 시장 주요제품] |
| 구분 | 제품명 | 회사명/국가 | 현황 | 사용목적 | 적용 기술 |
| Protein | AptoDetect™-Lung / PCR 7 |
압타머사이언스 (한국) |
식약처 허가 (상급종합병원 비급여 처방, 검진센터 서비스) 수출용 품목허가 (PCR) |
폐결절 환자 진단 보조 / 고위험군 스크리닝 |
단백질 측정, 진단 알고리즘 |
| i-Finder LC |
바이오인프라생명과학 (한국) |
임상 중 / 서비스 중 |
스크리닝 | 단백질 측정 | |
| OncoCatch-S |
이원다이애그노믹스 (한국) |
임상 중 | 스크리닝 | 제한효소법, DNA 메틸레이션 |
|
| Aabs | EarlyCDT-Lung |
Oncimmune (영국) |
LDT (서비스 중) |
고위험군 스크리닝 |
자가항체 측정, 진단 알고리즘 |
| PAULA’s TEST | Genesys Biolabs (미국) |
LDT (서비스 중) |
고위험군 스크리닝 | 항원, 자가항체 측정 |
|
| The 7-AABs panel2 |
Hanzhou Kaibao Biotechnology (중국 |
2020 NMPA 승인 (서비스 중) |
고위험군 스크리닝 + 폐결절 환자 진단보조 |
자가항체 측정, 진단 알고리즘 |
|
|
ctDNA / cfDNA |
SHIELD Lung | Guardant Health (미국) |
FDA 허가용 임상중 (25년 완료 계획) |
스크리닝 | ctDNA 측정 |
| Galleri | Grail (미국) |
LDT (서비스 중) |
다수 암종 스크리닝 | cfDNA 측정 |
|
| Firstlook Lung |
Delfi Diagnostics (미국) |
LDT (서비스 중) |
스크리닝 |
cfDNA pattern 분석, AI 기반 |
|
| Cancerseek |
Thrive / Exact Sciences |
FDA 승인 |
8가지 암 Screening |
ctDNA 측정/ 단백질 측정 |
|
|
AlphaLiquid® Screening (캔서파인드TM) |
IMBdx (한국) |
검진센터 서비스 중 | 스크리닝 | 암 관련 유전자 검사 | |
|
ai-CANCERCH (아이캔서치) |
GC지놈 (한국) |
검진센터 서비스 중 | 6가지 암 스크리닝 | ctDNA 분석, AI 알고리즘 |
|
| 유기화합물 | Cancerbox | 씨디바이오 (한국) |
식약처 허가진행중 | 스크리닝 |
유기 화합물 (VOCs) 측정 |
| (출처 : 당사 제시) |
둘째, 폐 결절 환자의 진단보조는 X-Ray, ChestCT, Low-Dose CT (LDCT)를 통해 폐 결절이 발견된 환자를 대상으로 진단하는 시장입니다. 현재 국내 식약처 허가를 받은 제품은 당사의 AptoDetectTM-Lung
이 유일합니다. 국내외 여러 기업들이 해당 시장에 진출하고자 임상시험을 진행하고 있으나, 현재까지 당사외에 승인을 받은 기업은 없습니다.
셋째,
수술 후 치료를 위한 동반진단은 폐암 치료제 적응증 여부를 확인하기 위한 진단으로 사용되고 있습니다. 동반진단이란 특정 환자의 치료에 의약품을 사용하기 위해 약물의 반응성 및 안전성을 미리 예측하기 위한 검사입니다. 동반진단 시장은 일반 스크리닝 시장보다 작으며, 한정된 대상에게만 활용되는 까닭입니다. 스위스 Roche 진단의 Cobas EGFR Mutation Test가 대표적이며, 국내에서는 HLB파나진사의 PANAMutyper™ R EGFR
과 젠큐릭스사의 GenesWell ddEGFR Mutation test 동반진단 키트가 있습니다. 이외에도 KRAS, BRAF, ROS1 등의 바이오마커를 진단하여 치료제 적응증 여부를 판단하고 있습니다. 시장 규모는 첫번째와 두번째보다 작지만, 치료제를 처방하기 위해서는 반드시 사전 검사가 필요한 만큼 꾸준히 성장하고 있습니다.
| [폐암 동반진단 시장 주요제품] |
| 동반진단방법 | 바이오마커 | 동반진단기기 | 회사명 |
|
면역조직화학염색법 (IHC) |
ALK | ALK CDx |
Ventana Medical System |
| PD-L1 | PD-L1 IHC (22C3, 28-8) PharmDx |
Dako North America |
|
| Ventana PD-LI (SP142, SP263) assay |
Ventana Medical System, 한국로슈진단 |
||
| 중합효소연쇄반응법 (PCR) |
KRAS |
Therascreen KRAS RGQ PCR Kit |
Qiagen Manchester |
| EGFR |
Therascreen EGFR RGQ PCR Kit |
||
|
THxIDTM BRAF Kit Cobas EGFR Mutation Test |
Roche Molecular Systems |
||
|
GenesWell ddEGFR Mutation Test,
|
젠큐릭스 | ||
| PNAClampTM |
HLB파나진 | ||
| c-MET | Droplex cMET Exon 14 skipping
|
젠큐릭스 | |
| NGS | EGFR, ALK, BRAF, MET | FoundationOne CDx (F1 CDx) |
Foundation Medicine |
| EGFR, ALK, BRAF, RET, ROS1 | Oncomine Dx |
Life Technologies |
|
|
90genes/cfDNA |
Guardant360® CDx |
Guardant Health | |
| 현장혼성화법(ISH) |
ALK |
Vysis ALK Break Apart FISH |
Abbott Molecular |
|
액상생검 (Liquid Biopsy) |
PD-L1 | CTC PD-L1 Detection | 싸이토젠 |
| (출처 : 당사 제시) |
| [당사의 폐암조기진단키트와 경쟁제품 비교] |
| 구분
|
압타머사이언스
|
아이엠비디엑스
|
|
| 제품명 |
AptoDetect™-Lung (압토디텍트 렁)
|
CancerFind™ (캔서파인드)
|
|
| 품목명 |
종양표지자면역검사시약 (K02080.01) |
종양관련유전자검사시약 (N02030.01) |
|
| 사용목적 |
폐 결절 환자를 대상으로 폐암의 위험도를 0~10점으로 제공 |
암 특이적인 패턴 선별 등 4대기술을 적용하여 8개 암종 예측정보 제공 |
|
|
식약처 허가번호 |
체외제허 17-748호 (3등급 의료기기)
|
없음 |
|
| 분석검체 |
혈액 내 7개 단백질 (C9, CA6, EGFR1, MMP7, SERPINA3, Kit, CRP) |
혈액 내 ctDNA (마커 비공개)
|
|
| 검체사용량 |
Serum 5ul |
10mL (Serum or Plasma 비공개)
|
|
| 분석장비 |
Luminex200 system (미국 Luminex社)
|
NGS (제조사 비공개)
|
|
| 병원 |
처방 |
서울아산병원, 경희의료원 |
없음 |
| 건강검진 |
분당차병원 및 일부 의원 |
하나로의료재단, 효산의료재단 등 |
|
| 검사가 |
24만원 이내 |
120만원 이내 |
|
| 비고 |
평가 유예 신의료기술 (보건복지부 2022-174호)
|
AlphaLiquid 100 수출용 품목허가, 체외제허22-227호
|
|
| (출처 : 당사 제시, 아이엠비디엑스 사업보고서) |
넷째, 수술 후 모니터링 시장은 국내외 기업들이 임상시험을 진행하고 있지만, 아직까지 승인을 받은 기업은 없습니다. 미국 Natera 사의 Signatera for Lung Cancer는 현재 LDT 서비스로 진행 중이며, 디앤피바이오텍의 DNP Lung은 임상시험을 진행하고 있습니다.
이와 같이 폐암 진단 시장은 미충족 의료 수요가 높지만, 다양한 발병 원인으로 인해 바이오마커를 특정하기 어려워 진단하는 것이 쉽지 않습니다. 현재 임상시험을 통해 국가별 식약처로부터 품목승인을 받는 것은 더욱 어려운 상황입니다.
| [폐암의 액체 생검 시장 성장추세] |
 |
|
Lung cancer liquid biopsy market 2023-3033 |
| (출처 : Lung cancer biopsy market, 2024.05) |
이러한 시장 상황을 배경으로 당사는 편의성과 유효성 모두를 충족시킬 수 있는 액체생검을 통한 조기 암 진단의 수요가 있을 것으로 예상하고 2016년 식약처 확증 임상시험 계획 승인에 따라 7종의 바이오마커를 이용하여 정상인 200명, 폐암환자 200명을 대상으로 임상시료들을 분석하여 민감도 68.5%, 특이도 83.0% (나이 55세 이상, 흡연력 30갑년 이상 고위험군의 경우는 민감도 73.3%, 특이도 90.5%)의 결과를 얻어 높은 성능의 진단 결과를 확인함으로써 2017년 9월에 식약처로 부터 품목허가를 승인받았습니다.
| [AptoDetect™-Lung 제품 구성] |
 |
|
ADL 제품구성(A-B set) |
| 구분 | AptoDetect™-Lung PCR (
폐암 조기진단)
|
| 적응증 | 폐암 조기진단 |
| 작용기전 | 폐암 특이적 바이오마커 5종 이하 단백질을 혈액에서 측정하여 위험도 제공 |
| 제품의 특성 |
- 정상인 및 폐암 발병 고위험군 대상 조기진단 정보 제공 1그룹: 정상인 대상 폐암 선별 검사
2그룹: 폐 결절이 발견된 환자 대상 폐암 선별 검사
- 혈액에서 5종이하 단백질 측정, 알고리즘을 통한 점수화 (score 0~10)
- 폐암 진단 가이드 및 폐암 위험도 정보 제공
- 극미량의 검체시료로 분석 가능 (혈청, 5μl)
|
| 진행경과 |
- 폐암 특이적 마커를 포함한 classifier 확정 - 임상시료 분석을 통한 알고리즘 진단 성능 확보 이후 최적화 진행
- 기존 알고리즘 개선 및 최적화 진행 중
- 식약처 수출용 품목허가 획득 (2024.03) |
| 향후계획 |
- 인도, 중국 현지 임상진행 및 품목허가 획득
- 동남아시아 국가 진출 및 판매 |
| 경쟁제품 | - EarlyCDT®-Lung (7종 자가항체 측정), Epi-prolung® (2종 DNA 메틸화 측정) 등 경쟁제품 대비 정확도/검사시간에서 강점보유
|
| 관련논문 등 | - Clinical Validation of a Protein Biomarker Panel for Non-Small Cell Lung cancer. J Korean Med Sci. (2018) 33(53):e342 - Development of a Protein Biomarker Panel to Detect Non Small-Cell Lung Cancer in Korea, Clin Lung Cancer. (2017) Mar;18(2):e99-e107. - Validation of a blood protein signature for non-small cell lung cancer, Clin Proteomics. 2014; 11(1): 32 - Unlocking biomarker discovery: large scale application of aptamer proteomic technology for early detection of lung cancer, PloS ONE. (2010) Dec; 5(12): e15003 |
| 기타사항 |
AptoDetectTM-Lung
제품과 동일한 AptoMIA 기술을 활용해 PCR버전 개발
- Luminex 장비가 아닌 장비 보급이 상대적으로 쉬운 PCR 장비를 활용
- 바이오마커수: 7종에서 5종으로 줄여 1개의 웰(well)에서 분석 가능
- 국내 식약처 허가 목적보다는 해외 수출용 목적으로 개발 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
의 검사과정은 다음과 같습니다. ① 폐 결절이 발결된 환자의 혈액 (Serum)을 이용하여,
② 혈액 내 7종 단백질과 압타머가 결합하여 단백질 농도를 압타머 농도로 변환하고,
③ 비드 마이크로어레이 법 (Liquid bead microarray)을 이용하여 압타머 농도를 측정하게 됩니다. 그리고
④ 진단 알고리즘을 통해 폐암 위험도 정보를 0~10점으로 산출하게 되며, 5점 미만은 저위험, 5점이상은 고위험으로 판단합니다.
| [AptoDetect™-Lung 검사 및 분석 과정] |
 |
|
비소세포폐암 위험도 검사 수행절차 |
 |
|
ADL 분석과정 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
은 하나의 키트에 ALUC-1024 (16 테스트/키트), ALUC-1048 (40 테스트/키트), ALUC-1096 (88 테스트/키트) 3가지로 구성되어 있으며, 당일 검사하면 익일 오전에 결과를 확인할 수 있게 됩니다. 현재는 수탁의료기관 1곳에서 검사를 진행하고 있으며, 일주일에 1번 매주 화요일 1주일간 확보된 혈액 검체를 사용하여 검사를 진행하고 있습니다. 분석이 완료되면, 해당 검사 결과는 보고서를 통해 의뢰한 각 병원으로 전달됩니다.
AptoDetect™-Lung은 보건복지부 평가 유예 신의료기술에 선정(보건복지부 고시 제 2022-174호)되어 비급여로 병원에서 사용이 가능하게 되었습니다. 이에 따라 상급종합병원 4곳에서 비급여 코드를 확보하고 처방을 시작하였습니다. 평가 유예 신의료기술 제도는 2년간 유효하여 2024년 기한이 종료될 예정이나, 2024년 4월에 발표된 제2차 국민건강보험 종합계획 시행계획에 따라, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 시행될 예정입니다. 개선안의 시행에 따라, 당사의 AptoDetect™-Lung
제품은 2026년까지 2년간 추가적으로 비급여로 병원에서 사용 가능할 것으로 예상하고 있습니다. 다만, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 올해 내 시행되지 않을 경우, 비급여 처방이 일시적으로 중단될 수 있는 위험이 존재합니다.
AptoDetect™-Lung
제품은 2가지 방식으로 매출이 발생하고 있습니다. 첫째는 위에서 언급했던 평가 유예 신의료기술 적용에 따라 비급여 처방을 받아 검사가 진행되는 경우이고, 다른 하나는 건강검진 목적으로 검사를 진행하는 경우입니다.
건강검진 목적으로는 흡연자, 간접흡연, 미세먼지, 조리흄 등으로 인해 본인이 검사를 희망하는 정상인을 대상으로 진행하고 있으며, 현재는 분당차병원의 폐정밀 항목을 통해 검사가 시행되고 있습니다. 해당 검사는 2024년 7월에 최초 시행되었습니다.
당사는 최근 3년간 제품 매출이 부진했던 이유를 다음과 같이 분석하고 있습니다. ① 평가 유예 신의료기술이 당사 예상보다 늦게 시작된 점, ② 3차 상급종합병원 내 비급여 코드 확보에 많은 기간이 소요된 점, ③ 현재 진행 중인 다기관 임상시험 병원이 국내 주요 병원으로 비급여 처방을 통한 매출보다 임상검체 확보에 중점을 두고 있는 점, ④ 2024년 건강검진 시장에 진출하고자 했으나, 의료상황이 급변하며 건강검진 목적의 검사를 확보하고자 했던 병원에서의 도입이 지연된 점 등입다.
결과적으로 가장 큰 원인이 초기 시장 진입 전략(Market access strategy) 수립시 급여시장 진입만을 목표로 하고 건강검진시장을 뒤늦게 준비한 것입니다. 이러한 시장진입시 준비가 충분치 않았던 사유로 인해 기대했던 매출이 발생하기까지 예상보다 오랜 기간이 걸리고 있으며, 이에 따른 진단사업 본격화까지 사업화 지연, 수탁기관과의 계약관계로 인한 매출 지연 등의 위험이 존재합니다.
또한, 당사는 높은 경쟁력 유지를 위해 지속적인 연구개발을 하고 있으나, LDCT 등의 현재 진단 기술이 발전함으로써 현재 단점을 보완하거나 국내외적으로 당사 제품보다 우수한 경쟁력을 가진 새로운 제품이 출현하는 경우, 이들과 경쟁해야 하므로 목표시장에서 점유율이 축소되어 당사의 수익성 및 매출에 부정적인 영향을 미칠 수 있습니다.
(주9) 정정 전
| 아. 각 국가의 정책 및 규제 변화에 따른 위험 세계 주요국에서는 최근 글로벌 보건위기를 극복한 이후에 제약 바이오 산업을 미래 핵심 산업으로 인식하고 자국산업 경쟁력 강화, 의약품 공급망 안정, 국제협력 강화 등을 중점으로 지원 및 육성 전략을 수립하고 제약 바이오산업의 고도화를 통해 글로벌 기술 패권을 확보하려 하고 있으며, 우리나라도 2013년 이후 5년 주기로 이러한 각국의 생명공학 관련 정책 및 글로벌 기술산업의 변화를 파악하고 제약 바이오 산업 지원 육성 전략을 발표하고 추진하고 있습니다. 그러나, 정책지원이 조속히 실행되지 않거나, 정부 지원이 축소될 가능성이 있습니다. 정책 혹은 규제의 변동에 따라 당사의 신약 개발 일정이 지연될 수 있으며, 기술이전 지연, 마일스톤 미달성 등에 따라 매출이 감소할 수 있습니다. 당사는 이러한 바이오 제약 산업의 글로벌 주요국의 정책과 지원 내용을 면밀히 파악하고 리스크를 최소화하고 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 하고 있지만, 그럼에도 불구하고 국내외 정책 등의 변동에 따른 위험이 존재하오니 투자자께서는 이러한 위험에 대해 유의하시기 바랍니다. |
제약바이오산업은 미래 성장 산업으로 각국 정부가 육성 정책을 시행하는 동시에, 환자 보호를 위해 인허가 및 약가 결정에 엄격하게 개입하는 특성을 가지고 있습니다. 신약 개발은 긴 투자 기간과 높은 위험을 수반하지만, 성공시 막대한 가치 창출과 공공적 가치를 달성할 수 있습니다. 이를 통해 국민에게 양질의 의약품을 제공하고, 삶의 질 향상에 기여할 수 있습니다. 또한, 제약산업은 지속적인 인력 채용을 통해 양질의 일자리 창출을 선도하고 있으며, 전 산업 평균 부가가치율을 크게 상회하고 있습니다.
대외경제정책연구원에서 2024년 3월 발표한 '제약바이오 산업분야 글로벌 기술패권 경쟁현황과 우리 나라의 대응' 보고서에 의하면, 글로벌 보건위기로 제약바이오 산업의 전략적 가치에 대한 인식이 이루어졌으며, 해당 산업 육성 및 지원을 위한 국가 차원의 투자가 활발해지고 있습니다.
미국의 '국가 생명공학 및 바이오 제조 이니셔티브' 행정명령(2022년 9월), EU의 '생명공학 및 바이오 제조 이니셔티브' (2024년 3월), 중국의 '14차 5개년 바이오 경제발전 계획'(2022년 5월) 등은 필수 의약품 및 바이오 산업 관련 자국내 생산기반 확충이 목적입니다. 우리 나라 역시 2023년 3월 '제3차 제약바이오 산업 육성 지원 종합계획(2023-2027)' 마련하고 2023년 5월 제약바이오 산업을 국가첨단전략산업으로 지정하는 등 해당 산업에 대한 지원을 확대하고 있습니다.
| [미국 생명공학 및 바이오 제조 이니셔티브의 추진목표별 주요 내용] |
| 추진목표 |
주요 내용 |
| 국내 바이오 제조역량 강화 |
-자국내 인프라 부족으로 인한 제조설비의 해외 이전을 막기 위해 지원책 제공
|
| 바이오 기반 제품에 대한 시장 기회 확대 |
-공공조달 기준에 바이오 선호 프로그램(BioPreferred Program)을 추가하여 석유기반 제품에 대한 대안 제시
|
| 전 사회적 도전과제 해소를 위한 연구개발 지원 |
-전 사회적 도전과제 해소를 위한 연구개발 사례로 코로나19 팬데믹 기간 동안 최초의 mRNA백신 개발 제시
|
| 연방 데이터에 대한 접근성 향상 |
-생명공학과 대규모 컴퓨팅 및 인공지능 등을 결합하여 바이오 경제 성장 기반 확충
|
| 숙련 인력 양성 |
-생명공학 및 바이오 제조 분야 교육 훈련 기회 확대
|
| 생명공학 제품에 대한 규제 간소화 |
-생명공학 제품에 대한 규제 절차의 명확성 및 효율성 개선
|
| 바이오 안전 및 바이오 안보 강화 |
-바이오 안전(Biosafety) 관련 응용 연구에 대한 투자 활성화
|
| 생명공학 생태계 보호 |
-바이오 데이터에 대한 개인정보 보호 표준 및 관행 개선
|
| 국제협력 |
-기후변화, 보건안보 등 글로벌 도전과제 해결을 위해 생명공학 및 바이오 제조 활용
|
| (출처: 대외경제정책연구원 “제약 바이오산업 분야 글로벌 기술패권 경쟁현황과 우리나라의 대응” 보고서 내용 발췌, US White House(2022.9.12), “FACT SHEET: President Biden to Launch a National Biotechnology and Biomanufacturing Initiative”) |
미국 바이든 행정부는 취임 한달 후부터 의약품 및 보건산업 분야의 안정적인 공급망 구축을 목표로 실태 점검 및 정책 제안 보고서를 지속적으로 작성 발표하고 있으며, 지정학적 및 자연재해 위험 노출, 공급망 모니터링 미흡 등을 해소하기 위해 재고 비축, 리쇼어링/프렌드 쇼어링 지원, 의약품 관련 데이터 수집 강화, 동맥구과의 협력 확대 등을 정책 과제로 제시하고 있습니다.
후속 조치로 총 20억 달러 규모의 예산을 투입하여 바이오산업 제조인프라 (10억 달러)와 생명과학 바이오 제품 및 재료 분야 연구개발 (1.8억 달러), 필수의약품 생산 및 원료의약품 제조역량(0.4억 달러) 등을 지원하는 정책을 밝혔습니다.
유럽은 EU 집행위원회에서 미국의 바이오이니셔티브에 대응하는 바이오제약산업에서 유럽의 리더십 확보를 위해 규제 완화, 새로운 치료법 및 맞춤형 개발, 임상시험 환경 조성, 재원 조달 등의 과제를 제시하였고 신기술에 대한 세제지원, 규제 완화, 유럽투자은행(EIB)를 활용한 자금조달, 다국가 프로젝트 추진 등의 내용이 포함되었습니다. 아울러 의료 위기 대응 자금지원 확대, 인력양성 및 사이버개발 지원을 위한 기술 클러스터 조성, 핵심사업, 기술 및 산업공정 발굴 및 지원등의 필요성이 강조되고 있습니다. 또한 EU 집행위는 'EU바이오 제조법 (EU Biomanufacturing Act)'을 제정하여 생명공학 기반 제품 수요 확대 및 지식재산권 보호 강화를 추진하고 있습니다.
중국은 2015년 '중국제조 2025'추진을 통해 기존 제네릭 의약품 위주 성장전략에서 첨단 바이오 기술 및 고성능 의료기기 분야 집중 육성으로 정책의 초점을 전환해 오고 있습니다. 2020년 10월에 발표된 '제14차 5개년 규획(2021-2025)'에서 바이오 기술을 9대 전략적 신흥산업으로 지정하여 인프라 구축 및 산업 고도화에 투자하기로 하였으며, 2022년 5월에 '바이오 경제발전 5개년 계획'에서 구체적 내용을 밝혔습니다.
바이오 경제 부가가치 향상, 바이오 산업 R&D투자를 통한 기술혁신, 바이오 기술시장 거래 활성화를 위한 규제개혁, 바이오 경제 시범구역 지정 등을 제시하였습니다. 이에 의약품, 백신, 진단 및 치료 기술 등을 포괄하는 바이오 의약분야가 바이오 경제 4대 핵심 분야 중 하나로 포함되었으며, 베이징-텐진-허베이, 양쯔강 삼각주- 광동-홍콩-마카오, 청두-충칭 등이 바이오 경제 시범구역 건설을 추진한다고 밝혔습니다.
우리나라는 '제약산업 육성 및 지원에 관한 특별법'에 따라 2013년부터 5년 주기로 제약산업 육성 지원 종합계획을 마련해 왔으며, 2023년 3월 '제3차 제약바이오 산업육성 지원 종합계획(2023-2027)'을 발표하였습니다. 이 계획에서 글로벌 블록버스터급 신약 2개 개발, 글로벌 50대 제약사 3개 육성, 의약품 수출 2배 달성, 제약바이오 산업 일자리 누적 15만개 창출, 임상시험 글로벌 3위 달성 등의 목표를 제시하였으며, 이를 위해 R&D확대, 수출지원, 인력양성, 제도인프라 개선의 4대 전략을 추진한다고 발표하였습니다.
정부 R&D투자 1조원, 민간투자 5조3,300억원까지 확대를 통해 글로벌 신약개발 가속화, 유전자 변형 세포 치료제, CAR-T 등 신기술 분야, 신변종 감영병 대응을 위한 치룟제 신속개발 체계 구축, 신약개발 디지털 전환, 의약품 수출액 160억 달러 달성, 제약바이오 소부장 국산화 지원이 포함되었습니다.
| [제3차 제약바이오 육성 지원 종합계획 세부과제 목록] |
| 추진 목표 |
||
|
- 블록버스터급(연매출 1조 원 이상) 신약 창출: '22년 0개 → '27년 2개
- 글로벌 50대 제약사(연매출 3조 원 이상): '22년 0개 → '27년 3개
- 의약품 수출 2배 달성: '22년 81억 달러 → '27년 160억 달러
- 제약바이오 산업 양질의 일자리 창출: '21년 12만 개 → '27년 15만 개(누적)
- 임상시험 글로벌 3위 달성: '21년 6위 → '27년 3위
|
||
| 4대전략 |
10대중점과제 |
세부과제 |
|
R&D 강화 |
글로벌 블록버스터 신약 창출을 위한 전략적 R&D투자 |
-신약개발 민관 R&D투자 대폭 확대
-초격차 기술확보를 통한 First Mover 전략 수립
-개방형 혁신 활성화를 위한 R&D 투자 지원
|
| 보건안보 및 사회적 요구에 대응하는 R&D투자 |
-고령화 대응 및 희귀 난치 질환 극복 R&D지원
-백신개발 역량강화릉 통한 백신 주권 확립
-신변종 감염병 대응을 위한 치료제 신속개발체계 구축
|
|
| AI빅데이터 등 신약개발의 디지털 전환촉진
|
-AI활용으로 신약개발 가속화 및 성공가능성 제고
-빅데이터 기반 신약개발 생태계 조성
|
|
|
수출 지원 |
제약바이오분야 금융지원 강화 및 창업지원 |
-메가펀드 조성을 통한 혁신신약 글로벌 지출가속화
-정책금융 투자연계 강화
-벤처창업기업 Scale-up을 위한 전주기 지원
|
| 제약바이오 산업의 핵심 수출산업화 |
-미국 행정명령 대응 및 R2R협력 강화
-수출역량 제고를 위한 맞춤형 지원 강화
-전략국가별 시장진출 지원체계 강화
|
|
|
인력 양성 |
제약바이오 산업 핵심인재 양성 |
-제약바이오 생산공정 전문인력 양성
-임상 규제과학 전문인력 양성
-디지털 바이오 융복합 전문인력 양성
|
| 제약바이오 인력양성 생태계조성 |
-아카데미 중심 핵심 전문인력 양성체계 구축
-기업-인재 매칭을 통한 적정 인재 적시투입
-글로벌 인재양성을 위한 기반구축
-국가전략산업으로의 육성을 위한 인재양성 거버넌스 구축
|
|
|
제도 인프라 개선 |
혁신 신약개발을 위한 제도 지원 |
-제약바이오 거버넌스 확립 및 규제혁신 기반 구축
-신속한 연구개발 및 제품화를 위한 허가절차 개선
-신약가치 적정보상을 위한 약가결정 및 관리제도 보완
-혁신형 제약기업 인증제도 리뉴얼
-첨단의료복합단지의 기업지원강화 및 규제개선
|
| 임상시험 글로벌 3위 달성을 위한 전략적 지원 |
-임상시험 지원제도 개선 및 인프라 확대
-임상시험 신기술 개발을 통한 첨단분산형 임상시험 체계 구축
|
|
| 의약품 밸류체인별 인프라 강화 |
-원료의약품 자급률 제고를 위한 제도적 지원강화
-제약바이오 소부장 국산화 지원
-글로벌 생산 허브 도약을 위한 제조생산 혁신
|
|
| (출처: '제3차 제약바이오 산업 육성 지원 종합계획(안)') |
이와 같이 국내 뿐만 아니라 최근 글로벌 주요국의 제약 바이오 산업 지원 및 육성 정책은 대체로 자국산업 경쟁력 강화, 의약품 공급망 안정, 국제협력 강화 등의 내용을 포함하고 있어, 당사는 이러한 바이오 제약 산업의 글로벌 주요국의 정책과 지원 내용을 면밀히 파악하고 리스크를 최소화하고 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 하고 있습니다.
그럼에도 불구하고 국내외 정책 등의 변동에 따른 위험이 존재합니다. 따라서, 상기 언급된 제약 및 신약개발 산업에 대한 국내외 국가의 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에 따라 바이오 산업을 육성하려는 움직임에도 불구하고, 정책 혹은 규제의 변동에 따라 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 이러한 불확실성은 신약 개발 및 상용화 과정에서 불확실성을 증가시킬 수 있습니다. 이러한 정책 및 규제 변동의 가능성은 당사의 사업 전략과 신약 개발에 부정적인 영향을 줄 수 있습니다.
(주9) 정정 후
| 아. 각 국가의 정책 및 규제 변화에 따른 위험 세계 주요국에서는 최근 글로벌 보건위기를 극복한 이후에 제약 바이오 산업을 미래 핵심 산업으로 인식하고 자국산업 경쟁력 강화, 의약품 공급망 안정, 국제협력 강화 등을 중점으로 지원 및 육성 전략을 수립하고 제약 바이오산업의 고도화를 통해 글로벌 기술 패권을 확보하려 하고 있으며, 우리나라도 2013년 이후 5년 주기로 이러한 각국의 생명공학 관련 정책 및 글로벌 기술산업의 변화를 파악하고 제약 바이오 산업 지원 육성 전략을 발표하고 추진하고 있습니다. 그러나, 정책지원이 조속히 실행되지 않거나, 정부 지원이 축소될 가능성이 있습니다. 정책 혹은 규제의 변동에 따라 당사의 신약 개발 일정이 지연될 수 있으며, 기술이전 지연, 마일스톤 미달성 등에 따라 매출이 감소할 수 있습니다. 당사는 이러한 바이오 제약 산업의 글로벌 주요국의 정책과 지원 내용을 면밀히 파악하고 리스크를 최소화하고 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 하고 있지만, 그럼에도 불구하고 국내외 정책 등의 변동에 따른 위험이 존재하오니 투자자께서는 이러한 위험에 대해 유의하시기 바랍니다. |
제약바이오산업은 미래 성장 산업으로 각국 정부가 육성 정책을 시행하는 동시에, 환자 보호를 위해 인허가 및 약가 결정에 엄격하게 개입하는 특성을 가지고 있습니다. 신약 개발은 긴 투자 기간과 높은 위험을 수반하지만, 성공시 막대한 가치 창출과 공공적 가치를 달성할 수 있습니다. 이를 통해 국민에게 양질의 의약품을 제공하고, 삶의 질 향상에 기여할 수 있습니다. 또한, 제약산업은 지속적인 인력 채용을 통해 양질의 일자리 창출을 선도하고 있으며, 전 산업 평균 부가가치율을 크게 상회하고 있습니다.
대외경제정책연구원에서 2024년 3월 발표한 '제약바이오 산업분야 글로벌 기술패권 경쟁현황과 우리 나라의 대응' 보고서에 의하면, 글로벌 보건위기로 제약바이오 산업의 전략적 가치에 대한 인식이 이루어졌으며, 해당 산업 육성 및 지원을 위한 국가 차원의 투자가 활발해지고 있습니다.
미국의 '국가 생명공학 및 바이오 제조 이니셔티브' 행정명령(2022년 9월), EU의 '생명공학 및 바이오 제조 이니셔티브' (2024년 3월), 중국의 '14차 5개년 바이오 경제발전 계획'(2022년 5월) 등은 필수 의약품 및 바이오 산업 관련 자국내 생산기반 확충이 목적입니다. 우리 나라 역시 2023년 3월 '제3차 제약바이오 산업 육성 지원 종합계획(2023-2027)'을 마련하고 2023년 5월 제약바이오 산업을 국가첨단전략산업으로 지정하는 등 해당 산업에 대한 지원을 확대하고 있습니다.
| [미국 생명공학 및 바이오 제조 이니셔티브의 추진목표별 주요 내용] |
| 추진목표 |
주요 내용 |
| 국내 바이오 제조역량 강화 |
-자국내 인프라 부족으로 인한 제조설비의 해외 이전을 막기 위해 지원책 제공
|
| 바이오 기반 제품에 대한 시장 기회 확대 |
-공공조달 기준에 바이오 선호 프로그램(BioPreferred Program)을 추가하여 석유기반 제품에 대한 대안 제시
|
| 전 사회적 도전과제 해소를 위한 연구개발 지원 |
-전 사회적 도전과제 해소를 위한 연구개발 사례로 코로나19 팬데믹 기간 동안 최초의 mRNA백신 개발 제시
|
| 연방 데이터에 대한 접근성 향상 |
-생명공학과 대규모 컴퓨팅 및 인공지능 등을 결합하여 바이오 경제 성장 기반 확충
|
| 숙련 인력 양성 |
-생명공학 및 바이오 제조 분야 교육 훈련 기회 확대
|
| 생명공학 제품에 대한 규제 간소화 |
-생명공학 제품에 대한 규제 절차의 명확성 및 효율성 개선
|
| 바이오 안전 및 바이오 안보 강화 |
-바이오 안전(Biosafety) 관련 응용 연구에 대한 투자 활성화
|
| 생명공학 생태계 보호 |
-바이오 데이터에 대한 개인정보 보호 표준 및 관행 개선
|
| 국제협력 |
-기후변화, 보건안보 등 글로벌 도전과제 해결을 위해 생명공학 및 바이오 제조 활용
|
| (출처: 대외경제정책연구원 “제약 바이오산업 분야 글로벌 기술패권 경쟁현황과 우리나라의 대응” 보고서 내용 발췌, US White House(2022.9.12), “FACT SHEET: President Biden to Launch a National Biotechnology and Biomanufacturing Initiative”) |
미국 바이든 행정부는 취임 한달 후부터 의약품 및 보건산업 분야의 안정적인 공급망 구축을 목표로 실태 점검 및 정책 제안 보고서를 지속적으로 작성 발표하고 있으며, 지정학적 및 자연재해 위험 노출, 공급망 모니터링 미흡 등을 해소하기 위해 재고 비축, 리쇼어링/프렌드 쇼어링 지원, 의약품 관련 데이터 수집 강화, 동맥구과의 협력 확대 등을 정책 과제로 제시하고 있습니다.
후속 조치로 총 20억 달러 규모의 예산을 투입하여 바이오산업 제조인프라 (10억 달러)와 생명과학 바이오 제품 및 재료 분야 연구개발 (1.8억 달러), 필수의약품 생산 및 원료의약품 제조역량(0.4억 달러) 등을 지원하는 정책을 밝혔습니다.
유럽은 EU 집행위원회에서 미국의 바이오이니셔티브에 대응하는 바이오제약산업에서 유럽의 리더십 확보를 위해 규제 완화, 새로운 치료법 및 맞춤형 개발, 임상시험 환경 조성, 재원 조달 등의 과제를 제시하였고 신기술에 대한 세제지원, 규제 완화, 유럽투자은행(EIB)를 활용한 자금조달, 다국가 프로젝트 추진 등의 내용이 포함되었습니다. 아울러 의료 위기 대응 자금지원 확대, 인력양성 및 사이버개발 지원을 위한 기술 클러스터 조성, 핵심사업, 기술 및 산업공정 발굴 및 지원등의 필요성이 강조되고 있습니다. 또한 EU 집행위는 'EU바이오 제조법 (EU Biomanufacturing Act)'을 제정하여 생명공학 기반 제품 수요 확대 및 지식재산권 보호 강화를 추진하고 있습니다.
중국은 2015년 '중국제조 2025'추진을 통해 기존 제네릭 의약품 위주 성장전략에서 첨단 바이오 기술 및 고성능 의료기기 분야 집중 육성으로 정책의 초점을 전환해 오고 있습니다. 2020년 10월에 발표된 '제14차 5개년 규획(2021-2025)'에서 바이오 기술을 9대 전략적 신흥산업으로 지정하여 인프라 구축 및 산업 고도화에 투자하기로 하였으며, 2022년 5월에 '바이오 경제발전 5개년 계획'에서 구체적 내용을 밝혔습니다.
바이오 경제 부가가치 향상, 바이오 산업 R&D투자를 통한 기술혁신, 바이오 기술시장 거래 활성화를 위한 규제개혁, 바이오 경제 시범구역 지정 등을 제시하였습니다. 이에 의약품, 백신, 진단 및 치료 기술 등을 포괄하는 바이오 의약분야가 바이오 경제 4대 핵심 분야 중 하나로 포함되었으며, 베이징-텐진-허베이, 양쯔강 삼각주- 광동-홍콩-마카오, 청두-충칭 등이 바이오 경제 시범구역 건설을 추진한다고 밝혔습니다.
우리나라는 '제약산업 육성 및 지원에 관한 특별법'에 따라 2013년부터 5년 주기로 제약산업 육성 지원 종합계획을 마련해 왔으며, 2023년 3월 '제3차 제약바이오 산업육성 지원 종합계획(2023-2027)'을 발표하였습니다. 이 계획에서 글로벌 블록버스터급 신약 2개 개발, 글로벌 50대 제약사 3개 육성, 의약품 수출 2배 달성, 제약바이오 산업 일자리 누적 15만개 창출, 임상시험 글로벌 3위 달성 등의 목표를 제시하였으며, 이를 위해 R&D확대, 수출지원, 인력양성, 제도인프라 개선의 4대 전략을 추진한다고 발표하였습니다.
정부 R&D투자 1조원, 민간투자 5조3,300억원까지 확대를 통해 글로벌 신약개발 가속화, 유전자 변형 세포 치료제, CAR-T 등 신기술 분야, 신변종 감염병 대응을 위한 치료제 신속개발 체계 구축, 신약개발 디지털 전환, 의약품 수출액 160억 달러 달성, 제약바이오 소부장 국산화 지원이 포함되었습니다.
| [제3차 제약바이오 육성 지원 종합계획 세부과제 목록] |
| 추진 목표 |
||
|
- 블록버스터급(연매출 1조 원 이상) 신약 창출: '22년 0개 → '27년 2개
- 글로벌 50대 제약사(연매출 3조 원 이상): '22년 0개 → '27년 3개
- 의약품 수출 2배 달성: '22년 81억 달러 → '27년 160억 달러
- 제약바이오 산업 양질의 일자리 창출: '21년 12만 개 → '27년 15만 개(누적)
- 임상시험 글로벌 3위 달성: '21년 6위 → '27년 3위
|
||
| 4대전략 |
10대중점과제 |
세부과제 |
|
R&D 강화 |
글로벌 블록버스터 신약 창출을 위한 전략적 R&D투자 |
-신약개발 민관 R&D투자 대폭 확대
-초격차 기술확보를 통한 First Mover 전략 수립
-개방형 혁신 활성화를 위한 R&D 투자 지원
|
| 보건안보 및 사회적 요구에 대응하는 R&D투자 |
-고령화 대응 및 희귀 난치 질환 극복 R&D지원
-백신개발 역량강화릉 통한 백신 주권 확립
-신변종 감염병 대응을 위한 치료제 신속개발체계 구축
|
|
| AI빅데이터 등 신약개발의 디지털 전환촉진
|
-AI활용으로 신약개발 가속화 및 성공가능성 제고
-빅데이터 기반 신약개발 생태계 조성
|
|
|
수출 지원 |
제약바이오분야 금융지원 강화 및 창업지원 |
-메가펀드 조성을 통한 혁신신약 글로벌 지출가속화
-정책금융 투자연계 강화
-벤처창업기업 Scale-up을 위한 전주기 지원
|
| 제약바이오 산업의 핵심 수출산업화 |
-미국 행정명령 대응 및 R2R협력 강화
-수출역량 제고를 위한 맞춤형 지원 강화
-전략국가별 시장진출 지원체계 강화
|
|
|
인력 양성 |
제약바이오 산업 핵심인재 양성 |
-제약바이오 생산공정 전문인력 양성
-임상 규제과학 전문인력 양성
-디지털 바이오 융복합 전문인력 양성
|
| 제약바이오 인력양성 생태계조성 |
-아카데미 중심 핵심 전문인력 양성체계 구축
-기업-인재 매칭을 통한 적정 인재 적시투입
-글로벌 인재양성을 위한 기반구축
-국가전략산업으로의 육성을 위한 인재양성 거버넌스 구축
|
|
|
제도 인프라 개선 |
혁신 신약개발을 위한 제도 지원 |
-제약바이오 거버넌스 확립 및 규제혁신 기반 구축
-신속한 연구개발 및 제품화를 위한 허가절차 개선
-신약가치 적정보상을 위한 약가결정 및 관리제도 보완
-혁신형 제약기업 인증제도 리뉴얼
-첨단의료복합단지의 기업지원강화 및 규제개선
|
| 임상시험 글로벌 3위 달성을 위한 전략적 지원 |
-임상시험 지원제도 개선 및 인프라 확대
-임상시험 신기술 개발을 통한 첨단분산형 임상시험 체계 구축
|
|
| 의약품 밸류체인별 인프라 강화 |
-원료의약품 자급률 제고를 위한 제도적 지원강화
-제약바이오 소부장 국산화 지원
-글로벌 생산 허브 도약을 위한 제조생산 혁신
|
|
| (출처: '제3차 제약바이오 산업 육성 지원 종합계획(안)') |
정부는 성공시 경제적 파급효과가 클 것으로 기대되는 글로벌 신약개발을 포함한 첨단바이오 분야를 인공지능(AI), 양자와 함께 3대 게임체인저로 지정하여 투자를 강화할 계획입니다. 특히 첨단바이오 분야 선도국으로 도약하기 위한 국가 전략으로서 2024년 4월 첨단바이오 이니셔티브를 수립한 바 있고, 이를 바탕으로 첨단바이오 분야에 2025년 약 2.1조원 규모(2024년 약 1.8조원)의 정부 연구개발(R&D) 예산을 편성하여 다부처 협업을 기반으로 한 첨단재생의료, 데이터·인공지능 융합, 팬데믹 대비 감염병 대응 역량 강화 등에 대한 정부 연구개발(R&D) 투자를 강화하였습니다. 아울러, 바이오 분야에 디지털 기술이 활용되는 바이오 대전환기 흐름에 맞춰 신약개발 분야에 인공지능 기술과 데이터를 활용하여 신약개발 기간을 단축하고, 성공률을 높이기 위한 지원도 지속할 계획입니다. 부처간 칸막이 없이 기초연구, 물질탐색·발굴부터 임상, 사업화까지 신약개발 전주기에 대한 산·학·연·병 대상 연구개발 과제를 지원하며, 연구 주체 간 연계, 공동연구, 국내외 네트워크 구축 등을 통한 협력을 지향합니다. 또한, 신약 관련 인프라와 유기적으로 촘촘히 연계하여 연구 컨설팅, 사업화, 화학·제조·품질관리(CMC), 기술이전 계약 지원 등을 통해 각 단계별 신약개발의 성공률을 높여나갈 계획입니다.
이와 같이 국내 뿐만 아니라 최근 글로벌 주요국의 제약 바이오 산업 지원 및 육성 정책은 대체로 자국산업 경쟁력 강화, 의약품 공급망 안정, 국제협력 강화 등의 내용을 포함하고 있어, 당사는 이러한 바이오 제약 산업의 글로벌 주요국의 정책과 지원 내용을 면밀히 파악하고 리스크를 최소화하고 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 하고 있습니다.
[규제당국과 학계 동향]
한국FDC규제과학회 발표에 따르면, 우리나라 의약품의 접근성이 떨어지는 주요 이슈로 ① 의약품 도입 지연(drug lag) ② 제네릭의약품의 경쟁 제한, 시장진입과 동등성 인식 ③ 의약품 공급 부족(shortage) 등을 꼽았습니다. 2011~2019년까지 미국, 유럽, 일본에서 허가 받은 신약 365개 중 한국에서 환자가 쓸 수 있는 약은 35%에 불과한 128개이며, 이는 미국, 캐나다, 프랑스 같은 의약 선진국인 A7 국가 평균인 200개에 크게 못 미친다는 지적입니다. 항암제의 경우 A7 국가 평균이 69%인 것에 반해 한국은 45%에 불과하며, Lichtenberg의 연구에서 2005년 이후 출시된 의약품의 국가별 판매 비율로 측정한 우리나라의 신약 접근성은 31개국 가운데 19위에 머물렀습니다.
이러한 문제를 해결하기 위해 우리나라 규제당국은 ① 조건부 허가제도 ② 신속심사제도 ③ GIFT(Global Innovative products on Fast Track, 글로벌 혁신제품 신속심사) 등을 신설하고 있습니다. 신속심사, 신속허가는 신약 심사 기간을 단축시켜 중증 환자의 치료제 조기접근을 가능하게 하는 긍정적인 효과를 기대할 수 있습니다. 그러나 긍정적인 측면만 있는 것은 아니며, 근거의 불확실성 증가는 환자의 위험 노출 가능성을 증가시키고 건강보험 급여 의사결정에 어려움을 야기할 수 있습니다. 특히 조건부 허가의 경우 국내 제약사의 신뢰를 저해할 수 있다는 단점이 존재합니다. 실제로 2012~2021년까지 조건부 허가된 35품목 중 정기보고를 제출한 품목은 20%인 7개 품목 밖에 되지 않았습니다. 35품목 중 국내 개발 신약은 10개에 불과한데, 이중 조건부 허가를 받고 임상 미제출한 국내 개발 신약은 8개, 허가를 철회한 품목은 2개로, 조건부 허가 신약은 사실상 없는 셈입니다. 특히 국내 신약의 경우 식약처가 최초의 의사결정을 하게 되는데, 조건부 허가를 통해 근거가 불투명하거나 허가 처리가 명확하게 끝맺음이 이뤄지고 있지 않아 국산 신약의 검토를 강화할 것으로 예상됩니다.
| [일반적인 품목허가 심사와 수시 동반 심사 비교] |
 |
|
일반적인 품목허가 심사와 수시 동반 심사(Rolling review) 비교 |
| (출처 : 식품의약품안전처, 의약품 신속심사 보고서, 2022.09) |
[암 관련 정책 및 규제]
미국의 바이든 행정부는 보건 및 의료 분야의 공공성 및 연구경쟁력 강화를 핵심으로 하는 과학 친화적 정책을 발표하였습니다. 특히, 바이든 미합중국대통령은 오바마 재임기간 중에 '암 정복 프로젝트(Cancer
Moonshot Initiative)'의 최고책임자로서 암 정복을 위한 연구지원을 추진한 바 있습니다. 이 암 정복 프로젝트에는 지난 4년간 약 12억 달러의 예산이 투입되었으며, 총 240개 이상의 연구 프로젝트를 지원하고 있습니다. 암 정복 프로젝트의 지원 연구 분야 8가지(① 암 예방 및 백신 개발, ② 암 조기 진단, ③ 면역항암제 및 병용요법 개발, ④ 종양과 주위 세포 게놈분석, ⑤ 데이터 공유 강화, ⑥ 전문 종양센터, ⑦ 소아암, ⑧ 기타 특수 연구)로 나누어지고, 향후에도 이 프로젝트는 종양 지표 개발, 데이터에 기반한 환자 맞춤형 항암치료, 백신 개발을 통한 암 극복 토대 마련 등을 목표로 예방검진 및 진단방법의 확대, 국가 간 데이터 표준화 및 공유, 환자중심 네트워크 운영 등을 지속적으로 추진해 나갈 예정입니다. 이러한 바이든 행정부의 바이오헬스 정책 방향에 따라 글로벌 항암제 시장 규모는 확대될 전망으로 이는 우리나라 항암제 시장에도 긍정적인 영향을 끼칠 것으로 보입니다.
우리나라는 국내 사망원인 1위를 차지하는 암 질환으로 인한 고통과 피해 및 사회적 부담을 줄이고,
국민건강을 증진시키기 위해 종합적인 암관리정책을 3차에 걸쳐 추진하여 왔습니다. 2021년 3월에는 ① 고품질 암데이터 구축 및 확산, ② 예방 가능한 암 발생 감소, ③ 암 치료·돌봄 격차 완화를 주요 목표로
하는 제4차 암관리종합계획(`21∼`25)을 수립하였습니다. 제4차 암관리종합계획에 따라 10개 분야(실험동물, 유전체분석, 단백체분석, 생물정보분석, 의학통계분석, 동물분자영상, 유세포분석, 현미경영상, 그래픽지원, 바이오뱅크)165종 암 연구지원서비스를 외부에 개방될 예정으로 항암제 연구에 도움이 될 것으로 예상됩니다.
| [제4차 암관리종합계획 추진전략] |
| 추진 목표 |
||
|
- 고품질 암데이터 구축 및 확산: 약
300만 명(전체 암환자 70%) 규모의 암 빅데이터 구축 - 예방 가능한 암 발생 감소: 75세
미만 신규 암환자(위, 대장, 간, 자궁경부) 20% 이상 (年 5.6만 → 4.5만) 감소 - 암 치료·돌봄 격차 완화: 완
치된 암생존자 중 돌봄지원 2배 이상 (0.7만→1.8만) 확대 |
||
| 추진 전략 |
중점과제 |
세부과제 |
| 암 빅데이터 활성화 | 암데이터 활용 인프라 조성 | -국가암데이터(K-Cancer DW) 구축 -국가암데이터센터 운영 -안전한 암데이터 공유·개방 활성화 |
| 암등록·감시체계 개선 | -빅데이터를 통한 암 감시체계 구축 -암등록통계 관리체계 개선 |
|
| 데이터 기반 공익적 암 연구 확대 | -암 예방 및 항암신약 관련 연구 -개방형 암 연구 인프라 -AI 등 첨단기술 관련 연구 |
|
|
암 예방·검진 고도화 |
예방 가능한 암 위험 해소 | -예방 가능한 암종별 조기개입 강화 -암 발생 고위험군 집중 관리 |
| 양질의 암검진 실시 | -과학적 근거에 기반한 암검진사업 개선 -암건진 질적 수준 제고 |
|
| 지식·정보(발암요인 등) 기반 암 예방 실천 | -정확한 암 지식·정보 확산 -발암요인 관리체계 구축 -정보에 기반한 생활 속 암 예방 실천 |
|
|
암 치료·대응 내실화 |
효율적인 암 치료·보장 강화 | -의료비 지원 효율성 제고 -암 치료의 질 관리 강화 |
| 희귀·난치암의 공적 책임 제고 | -공공 부문 중심의 임상연구 활성화 -임상연구 개방형 플랫폼 구축 -국제 네트워크 통한 연구기반 확장 |
|
| 미래 위험(감염병, 인구구조 변화) 대응 | -감염병 유행 시기 단기적 조치 실시 -신종 감염병 유행 대비 중장기 방안 수립 -인구구조 변화에 따른 연령별 암관리 강화 |
|
| 균등한 암관리 기반 구축 | 중앙-지방 암관리 역량 향상 | -국립암센터 위상 강화 -지역암센터 역량 향상 -암관리 거버넌스 개편 |
| 지역사회 중심의 맞춤형 돌봄·지원 | -암생존자의 건강한 사회복귀 지원 -취약계층 맞춤형 지원 |
|
| (출처: '제4차 암관리 종합계획 2021-2025, 2021.03) |
상기의 직접적인 지원 쟁책 외에도 주요 선진국들은 제약사들의 신약 연구개발 및 인허가에 소요되는 막대한 비용 부담을 줄일 수 있도록 다양한 규제장벽을 완화하는 정책 또한 적극적으로 펼치고 있습니다. 대표적으로 최신의 제약·바이오 기술들을 위중한 상태에 있는 환자들에게 신속하게 전달할 기회를 제공하기 위해 조건부 신속허가를 제도적으로 정착하려는 노력이 진행되고 있습니다. 미국은 가속 승인(accelerated approval) 제도를 통해 기존의 치료 요법으로는 해결되지 않는 중증질환을 대상으로 신약을 조기에 승인해주는 제도를 운영하고 있으며, 유럽은 미충족 의료수요를 충족하는 일부 의약품에 대해 시판 후 임상적 확증시험 이행을 조건으로 조기 허가하는 조건부허가(conditional marketing authorization)와 임상적 확증시험이 어려운 희귀 질환을 대상으로 하는 예외적 허가(marketing authorization under exceptional circumstances) 등의 제도가 시행되고 있습니다. 일본은 생명을 위협하거나 중증의 질환을 대상으로 하는 세포치료제를 포함하는 '재생의료 등 제품'에 대하여 조건 기한부 허가 제도를 운영하고 있습니다.
대한민국 식품의약품안전처 역시 2020년 신속심사과를 신설하여 중증 질환 또는 희귀질환 치료제 등에 대해 심사기간을 단축해 신속한 제품화를 추진하는 신속심사 제도를 시행하고 있습니다. 2022년에는 식약처의 ‘식의약 규제개선 100대 과제’로서 글로벌 혁신제품 신속심사 지원체계(Global Innovative products on Fast Track, GIFT)를 추가하여, 생명위협질환이나 중대한 질환 치료제 등의 혁신성이 뛰어난 의약품을 빠르게 시장에 출시하고 환자에게 공급할 수 있도록 지원하고 있습니다.
GIFT 지정은 생명을 위협하는 암 등 중대한 질환 또는 희귀질환, 감염병 등에 대한 치료제로 기존 치료법이 없거나 기존 치료법 대비 유효성 등이 현저히 개선된 치료제, 그리고 보건복지부가 지정한 혁신형 제약기업이 개발한 신약이 대상이 됩니다. 지원 혜택으로는 GIFT 대상 품목의 경우 심사기간이 일반심사기간의 75%까지 단축이 가능해지게 되고 그 외에도 다음과 같은 지원을 받게 됩니다.
| GIFT 주요 지원 항목 |
|---|
| - 임상개발 초기부터 신속심사 대상 지정 - 안전에 직접 관련없는 일부 자료는 시판 후 제출할 수 있는 근거 규정 활용 - 글로벌 심사기준은 해외와 시차 없이 적용하여 해외 규제기관과 규제 충돌을 방지 - 국내 혁신제품의 허가·심사에 국제조화된 기준을 적용하여 빠른 해외 진출 지원 - 준비된 자료부터 먼저 심사하는 수시 동반심사(rolling review) 적용 - 심사자와 개발사 간 긴밀한 소통을 통한 규제 관련 컨설팅, 심사일정계획 등 밀착지원 |
당사가 개발 목표로 하는 품목들은 신속심사 대상이 될 가능성은 매우 높습니다. 하지만 당사는 임상 진입 전 단계에서 신약 후보물질을 조기 기술이전을 하거나 파트너 기업과 공동연구개발을 하는 것을 현재 사업 모델로 하여 직접 임상개발을 하지는 않을 것이므로, GIFT를 포함한 신속심사 제도에 의한 직접적인 수혜는 받지 않을 것으로 예상됩니다. 그러나 이러한 제도를 통해 기술이전또는 공동연구개발 파트너가 수행하는 임상개발 기간이 단축될 수 있으며, 이럴 경우 당사의 수익 실현이 계획보다 앞당겨질 수 있습니다.
그럼에도 불구하고 국내외 정책 등의 변동에 따른 위험이 존재합니다. 따라서, 상기 언급된 제약 및 신약개발 산업에 대한 국내외 국가의 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에 따라 바이오 산업을 육성하려는 움직임에도 불구하고, 정책 혹은 규제의 변동에 따라 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 이러한 불확실성은 신약 개발 및 상용화 과정에서 불확실성을 증가시킬 수 있습니다. 이러한 정책 및 규제 변동의 가능성은 당사의 사업 전략과 신약 개발에 부정적인 영향을 줄 수 있습니다.
(주10) 정정 전
| 자. 글로벌 경기변동에 따른 위험 2024년 07월 국제통화기금(IMF)에서 발표한 '세계경제전망(World Economic Outlook)'에 따르면 세계 경제 성장률은 2024년 3.2%, 2025년 3.3%를 기록할 전망입니다. 2024년 전망치의 경우 지난 4월과 동일한 3.2%로 전망하였으며, 2025년 전망치는 지난 04월 전망치보다 0.1%p 상향 조정하였습니다. 국제통화기금(IMF)은 '24년 세계 성장률에 대해 상·하방 요인이 균형을 이루고 있는 것으로 평가하였습니다. 성장을 높일 상방 요인으로는 성공적인 구조 개혁을 통한 생산성 증가, 다자 간 협력 강화를 통한 무역 확대 등을 제시하였습니다. 반면, 지정학적 갈등에 따른 물가 상승 및 그에 따른 고금리 상황 지속, 선거 결과에 따른 정책 급변 및 재정적자·부채 확대 등을 성장을 제약할 우려가 있는 하방 요인으로 지적하고 있습니다. 한국은행이 2024년 05월 발간한 '경제전망보고서'에 따르면, 2024년 국내 경제 성장률은 2.5%, 2025년 국내 경제 성장률은 2.1%를 기록하며 국내 경제는 소폭 성장할 것으로 전망하였습니다. 2023년 하반기부터 이어져온 수출 중심의 회복세가 보다 뚜렷해지면서 이에 따른 파급효과가 점차 소비 등 내수로 이어지고, 물가 둔화, 기업 수익성 증가 등에 따라 가계 소득여건 개선에 힘입어 하반기부터 내수 회복세가 뚜렷해질 전망입니다. 국내 성장 동력에 영향을 미치는 주요국의 성장흐름과 물가흐름, 통화정책 기조 변화, 유가 등 원자재 가격의 변 동, IT경기의 확장 속도, 중국경제의 향방, 지정학적 갈등 양상 등이 존재합니다. 상기와 같이 국내외 경기는 완만한 개선 흐름을 이어가고 있는 것으로 보이나, 소비 및 금융 시장 심리 악화, 설비투자 및 수출 부진, 주요 원자재 가격의 변동, 지정학적 리스크 심화 등 대내외적 악재로 인해 경기 전반의 회복이 지연되는 경우 당사의 실적 또한 악화될 수 있으니, 투자자께서는 이 점을 유의하시기 바랍니다. |
2024년 7월 국제통화기금(IMF)이 발표한 '세계 경제전망(World Economic Outlook)'에 따르면,
아시아 지역의 수출 증가 등 세계 무역 회복의 영향으로 세계 경제가 양호한 성장세를 보일 것으로 내다보면서, '24년 세계경제 성장률을 지난 4월과 동일한 3.2%로 전망하였습니다.
국제통화기금은 '24년 세계 성장률에 대해 상하방 요인이 균형을 이루고 있는 것으로 평가하였습니다. 성장을 높일 상방 요인으로는 성공적인 구조 개혁을 통한 생산성 증가, 다자간 협력 강화를 통한 무역 확대 등을 제시하였습니다. 반면, 지정학적 갈등에 따른 물가 상승 및 그에 따른 고금리 상황 지속, 선거 결과에 따른 정책 급변 및 재정적자·부채 확대 등을 성장을 제약할 우려가 있는 하방 요인으로 지적하였습니다. 또한, 국제통화기금은 통화정책과 관련하여 물가 상승 위험(인플레 리스크) 상존시 금리 조기 인하를 자제하고 필요시 추가 인상 가능성도 고려해야 하며, 물가 안정 에 대한 명확한 데이터가 뒷받침될 경우에 점진적으로 금리를 인하할 것을 권고하였다.
선진국 그룹(미국, 영국, 독일, 프랑스, 이탈리아, 스페인, 캐나다, 일본, 우리나라 등 41개국)의 '24년 성장률은 지난 전망과 동일하게 1.7%로 전망하였습니다. 국가별로 보면, 미국(2.6%) 성장률은 예상을 밑도는 1분기 실적에 따라 하향 조정한 반면, 프랑스(0.9%), 영국(0.7%), 스페인(2.4%) 등 유럽 국가들의 성장률은 실질 임금 상승, 금융 여건 개선 등에 따라 반등할 것으로 전망하였습니다. 일본(0.7%)은 지난 1분기 일부 자동차 업체 출하 정지 등 일시적 생산 차질을 감안해 성장세 둔화를 예상하고 있습니다.
한편, 국제통화기금은 '24년 우리나라 성장률을 2.5%로 전망하며, 지난 전망 대비 0.2%p 상향 조정하였습니다. 이는 정부, 한국은행 등 국내외 주요 기관의 전망치와 유사하고, 주요 선진국 중에서도 높은 수준입니다.
| [국제통화기금 세계 경제성장전망치(2024년 7월)] |
| (단위 : %, %p) |
| 구분 | '23년 | '24년 | '25년 | ||||
|---|---|---|---|---|---|---|---|
|
'24.4월 |
'24.7월 |
조정폭 (B-A) |
'24.4월 |
'24.7월 |
조정폭 (D-C) |
||
| 세계 | 3.3 | 3.2 | 3.2 | 0.0 | 3.2 | 3.3 | +0.1 |
| 선진국 | 1.7 | 1.7 | 1.7 | 0.0 | 1.8 | 1.8 | 0.0 |
| 미국 | 2.5 | 2.7 | 2.6 | △0.1 |
1.9 | 1.9 | 0.0 |
| 유로존 | 0.5 | 0.8 | 0.9 | +0.1 | 1.5 | 1.5 | 0.0 |
| 독일 |
△0.2 |
0.2 | 0.2 | 0.0 | 1.3 | 1.3 | 0.0 |
| 프랑스 |
1.1 | 0.7 | 0.9 | +0.2 | 1.4 | 1.3 | △0.1 |
| 이탈리아 |
0.9 | 0.7 | 0.7 | 0.0 | 0.7 | 0.9 | +0.2 |
| 스페인 |
2.5 | 1.9 | 2.4 | +0.5 | 2.1 | 2.1 | 0.0 |
| 일본 | 1.9 | 0.9 | 0.7 | △0.2 |
1.0 | 1.0 | 0.0 |
| 영국 | 0.1 | 0.5 | 0.7 | +0.2 | 1.5 | 1.5 | 0.0 |
| 캐나다 | 1.2 | 1.2 | 1.3 | +0.1 | 2.3 | 2.4 | +0.1 |
| 한국 | 1.4 | 2.3 | 2.5 | +0.2 | 2.3 | 2.2 | △0.1 |
| 호주 | 2.0 | 1.5 | 1.4 | △0.1 |
2.0 | 2.0 | 0.0 |
| 기타 선진국 | 1.8 | 2.0 | 2.0 | 0.0 | 2.4 | 2.2 | △0.2 |
| 신흥개도국 | 4.4 | 4.2 | 4.3 | +0.1 | 4.2 | 4.3 | +0.1 |
| 중국 | 5.2 | 4.6 | 5.0 | +0.4 | 4.1 | 4.5 | +0.4 |
| 인도 | 8.2 | 6.8 | 7.0 | +0.2 | 6.5 | 6.5 | 0.0 |
| 러시아 | 3.6 | 3.2 | 3.2 | 0.0 | 1.8 | 1.5 | △0.3 |
| 브라질 | 2.9 | 2.2 | 2.1 | △0.1 |
2.1 | 2.4 | +0.3 |
| 멕시코 | 3.2 | 2.4 | 2.2 | △0.2 |
1.4 | 1.6 | +0.2 |
| 사우디 | △0.8 |
2.6 | 1.7 | △0.9 |
6.0 | 4.7 | △1.3 |
| 남아공 | 0.7 | 0.9 | 0.9 | 0.0 | 1.2 | 1.2 | 0.0 |
| (출처 : 국제통화기금 (World Economic Outlook, 2024.07)) |
한국은행은 매 3개월마다 발표하는 경제전망보고서를 통해 국내 경제성장률을 전망하고 있으며, 2024년 05월 한국은행 경제전망보고서에서는 국내 경제성장률을 2024년 2.5%, 2025년 2.1%로 예상하고 있습니다. 한국은행은 수출 중심의 회복세가 보다 뚜렷해지면서 이에 따른 파급효과가 점차 소비 등 내수로 이어질 것이며, 물가 둔화, 기업 수익성 증가 등에 따라 가계 소득여건 개선에 힘입어 하반기부터 내수 회복세가 뚜렷해질 것으로 전망하였습니다. 향후 AI 수요 확산, 글로벌 제조업경기 회복 등에 힘입은 양호한 수출이 경기 개선흐름을 견인할 것으로 예상되며, 이에 따른 올해 소비 등의 내수세 회복이 예상되나, 금년 상향조정의 기저효과가 일부 작용하여 2025년은 당초 2월 예상보다 다소 하향 조정된 2.1% 성장할 것으로 전망하였습니다.
| [국내 경제 성장률 추이] |
| (단위: %) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 | 2024년(E) | 2025년(E) |
| GDP | (-)0.7 | 4.1 | 2.6 | 1.4 | 2.5 | 2.1 |
| (출처 : 한국은행 경제전망 보고서 (2024년 05월)) | |
| 주) | 2024년, 2025년 수치는 한국은행 전망치입니다. |
민간 소비의 경우 양호한 기상 여건, 휴대폰 조기 출시 등으로 각각 의복(준내구재), 차량연료(비내구재), 통신기기(내구재)를 중심으로 증가폭이 상당폭 확대되었으나, 이러한 일시적 요인이 해소됨에 따라 증가세가 둔화된 뒤 완만한 회복흐름을 이어갈 것으로 예상됩니다.
설비투자와 지식재산생산물투자는 반도체 첨단공정 및 AI 등 신성장산업 관련 투자를 중심으로 회복세를 보일 전망입니다. 건설투자는 주거용, 상업용 건물을 중심으로 한 입주물량 축소와 신규착공 부진 영향이 지속됨에 따라 상당기간 부진한 모습을 나타낼 것으로 전망됩니다. 재화수출(실질GDP 기준)은 글로벌 IT경기가 회복되고 미국 경제의 강한 성장세에 따른 수입수요 증가로 인해 견조한 흐름을 이어가면서 증가세가 확대될 것으로 예상됩니다.
| [한국은행 국내 주요 거시경제지표 전망] |
| (단위: %) |
| 구 분 | 2023년 | 2024년(E) | 2025년(E) | ||
| 연간 | 상반기 | 하반기 | 연간 | 연간 | |
| GDP | 1.4 | 2.9 | 2.2 | 2.5 | 2.1 |
| 민간소비 | 1.8 | 1.4 | 2.2 | 1.8 | 2.3 |
| 설비투자 | 0.5 | 1.2 | 5.7 | 3.5 | 3.9 |
| 지식재산생산물투자 | 1.6 | 2.2 | 2.6 | 2.4 | 3.3 |
| 건설투자 | 1.3 | (-)1.1 | (-)2.7 | (-)2.0 | (-)1.1 |
| 재화수출 | 3.1 | 7.0 | 3.4 | 5.1 | 3.0 |
| 재화수입 | (-)0.6 | (-)0.8 | 5.6 | 2.4 | 3.1 |
| (출처 : 한국은행 경제전망보고서 (2024년 05월)) | |
| 주) | 전년동기대비 기준입니다. |
위와 같이 설비투자와 수출 중심으로 국내 경기는 개선 및 성장세를 기록할 것으로 전망되나 건설투자 등 내수 회복 모멘텀이 다소 약화되며 경기 성장 둔화 압력으로 작용할 수 있을 것으로 전망됩니다.
다만, 한국은행은 향후 국내 경제의 성장성에 주요국의 성장흐름과 물가흐름, 통화정책 기조 변화, 유가 등 원자재 가격의 변동, IT경기의 확장 속도, 중국경제의 향방, 지정학적 리스크와 관련한 불확실성이 존재함을 언급했습니다. 이처럼 COVID-19 이후 민간소비 회복, 설비투자 확대 등을 통해 양호한 성장세를 보였음에도 불구하고 통화긴축, 인플레이션, 지정학 리스크 등의 불확실성이 존재함에 따라 글로벌 경기 회복의 속도가 더딜 가능성이 있습니다. 국내외 경기 변동은 관광, 항공, 무역 등 경기에 직접적인 영향을 받는 업종 뿐 아니라 대부분의 사업 분야 전반에 부정적인 영향을 미칠 수 있습니다. 또한, 경기 둔화로 인해 증시의 변동성이 높아질 경우, 당사의 영업환경 및 주가 역시 높은 변동성을 보일 가능성이 있으므로 투자자께서는 이 점을 유의하시어 투자에 임하시기 바랍니다.
(주10) 정정 후
| 자. 글로벌 경기변동에 따른 위험 2024년 07월 국제통화기금(IMF)에서 발표한 '세계경제전망(World Economic Outlook)'에 따르면 세계 경제 성장률은 2024년 3.2%, 2025년 3.3%를 기록할 전망입니다. 2024년 전망치의 경우 지난 4월과 동일한 3.2%로 전망하였으며, 2025년 전망치는 지난 04월 전망치보다 0.1%p 상향 조정하였습니다. 국제통화기금(IMF)은 '24년 세계 성장률에 대해 상·하방 요인이 균형을 이루고 있는 것으로 평가하였습니다. 성장을 높일 상방 요인으로는 성공적인 구조 개혁을 통한 생산성 증가, 다자 간 협력 강화를 통한 무역 확대 등을 제시하였습니다. 반면, 지정학적 갈등에 따른 물가 상승 및 그에 따른 고금리 상황 지속, 선거 결과에 따른 정책 급변 및 재정적자·부채 확대 등을 성장을 제약할 우려가 있는 하방 요인으로 지적하고 있습니다. 2024년 08월 발표된 한국은행의 경제전망보고서에서는 한국 경제성장률을 2024년 2.4%, 2025년 2.1% 수준으로 전망하였습니다. 한국은행은 국내경제는 수출이 호조를 지속하고 내수도 당초 경로에는 다소 못 미치지만 회복흐름을 재개하면서 금년과 내년 2%대 초중반 수준의 양호한 성장세를 이어갈 것으로 예상했습니다. 2023년 하반기부터 이어져온 수출 중심의 회복세가 보다 뚜렷해지면서 이에 따른 파급효과가 점차 소비 등 내수로 이어지고, 물가 둔화, 기업 수익성 증가 등에 따라 가계 소득여건 개선에 힘입어 하반기부터 내수 회복세가 뚜렷해질 전망입니다. 국내 성장 동력에 영향을 미치는 주요국의 성장흐름과 물가흐름, 통화정책 기조 변화, 유가 등 원자재 가격의 변 동, IT경기의 확장 속도, 중국경제의 향방, 지정학적 갈등 양상 등이 존재합니다. 상기와 같이 국내외 경기는 완만한 개선 흐름을 이어가고 있는 것으로 보이나, 소비 및 금융 시장 심리 악화, 설비투자 및 수출 부진, 주요 원자재 가격의 변동, 지정학적 리스크 심화 등 대내외적 악재로 인해 경기 전반의 회복이 지연되는 경우 당사의 실적 또한 악화될 수 있으니, 투자자께서는 이 점을 유의하시기 바랍니다. |
2024년 7월 국제통화기금(IMF)이 발표한 '세계 경제전망(World Economic Outlook)'에 따르면,
아시아 지역의 수출 증가 등 세계 무역 회복의 영향으로 세계 경제가 양호한 성장세를 보일 것으로 내다보면서, '24년 세계경제 성장률을 지난 4월과 동일한 3.2%로 전망하였습니다.
국제통화기금은 '24년 세계 성장률에 대해 상하방 요인이 균형을 이루고 있는 것으로 평가하였습니다. 성장을 높일 상방 요인으로는 성공적인 구조 개혁을 통한 생산성 증가, 다자간 협력 강화를 통한 무역 확대 등을 제시하였습니다. 반면, 지정학적 갈등에 따른 물가 상승 및 그에 따른 고금리 상황 지속, 선거 결과에 따른 정책 급변 및 재정적자·부채 확대 등을 성장을 제약할 우려가 있는 하방 요인으로 지적하였습니다. 또한, 국제통화기금은 통화정책과 관련하여 물가 상승 위험(인플레 리스크) 상존시 금리 조기 인하를 자제하고 필요시 추가 인상 가능성도 고려해야 하며, 물가 안정 에 대한 명확한 데이터가 뒷받침될 경우에 점진적으로 금리를 인하할 것을 권고하였다.
선진국 그룹(미국, 영국, 독일, 프랑스, 이탈리아, 스페인, 캐나다, 일본, 우리나라 등 41개국)의 '24년 성장률은 지난 전망과 동일하게 1.7%로 전망하였습니다. 국가별로 보면, 미국(2.6%) 성장률은 예상을 밑도는 1분기 실적에 따라 하향 조정한 반면, 프랑스(0.9%), 영국(0.7%), 스페인(2.4%) 등 유럽 국가들의 성장률은 실질 임금 상승, 금융 여건 개선 등에 따라 반등할 것으로 전망하였습니다. 일본(0.7%)은 지난 1분기 일부 자동차 업체 출하 정지 등 일시적 생산 차질을 감안해 성장세 둔화를 예상하고 있습니다.
한편, 국제통화기금은 '24년 우리나라 성장률을 2.5%로 전망하며, 지난 전망 대비 0.2%p 상향 조정하였습니다. 이는 정부, 한국은행 등 국내외 주요 기관의 전망치와 유사하고, 주요 선진국 중에서도 높은 수준입니다.
| [국제통화기금 세계 경제성장전망치(2024년 7월)] |
| (단위 : %, %p) |
| 구분 | '23년 | '24년 | '25년 | ||||
|---|---|---|---|---|---|---|---|
|
'24.4월 |
'24.7월 |
조정폭 (B-A) |
'24.4월 |
'24.7월 |
조정폭 (D-C) |
||
| 세계 | 3.3 | 3.2 | 3.2 | 0.0 | 3.2 | 3.3 | +0.1 |
| 선진국 | 1.7 | 1.7 | 1.7 | 0.0 | 1.8 | 1.8 | 0.0 |
| 미국 | 2.5 | 2.7 | 2.6 | △0.1 |
1.9 | 1.9 | 0.0 |
| 유로존 | 0.5 | 0.8 | 0.9 | +0.1 | 1.5 | 1.5 | 0.0 |
| 독일 |
△0.2 |
0.2 | 0.2 | 0.0 | 1.3 | 1.3 | 0.0 |
| 프랑스 |
1.1 | 0.7 | 0.9 | +0.2 | 1.4 | 1.3 | △0.1 |
| 이탈리아 |
0.9 | 0.7 | 0.7 | 0.0 | 0.7 | 0.9 | +0.2 |
| 스페인 |
2.5 | 1.9 | 2.4 | +0.5 | 2.1 | 2.1 | 0.0 |
| 일본 | 1.9 | 0.9 | 0.7 | △0.2 |
1.0 | 1.0 | 0.0 |
| 영국 | 0.1 | 0.5 | 0.7 | +0.2 | 1.5 | 1.5 | 0.0 |
| 캐나다 | 1.2 | 1.2 | 1.3 | +0.1 | 2.3 | 2.4 | +0.1 |
| 한국 | 1.4 | 2.3 | 2.5 | +0.2 | 2.3 | 2.2 | △0.1 |
| 호주 | 2.0 | 1.5 | 1.4 | △0.1 |
2.0 | 2.0 | 0.0 |
| 기타 선진국 | 1.8 | 2.0 | 2.0 | 0.0 | 2.4 | 2.2 | △0.2 |
| 신흥개도국 | 4.4 | 4.2 | 4.3 | +0.1 | 4.2 | 4.3 | +0.1 |
| 중국 | 5.2 | 4.6 | 5.0 | +0.4 | 4.1 | 4.5 | +0.4 |
| 인도 | 8.2 | 6.8 | 7.0 | +0.2 | 6.5 | 6.5 | 0.0 |
| 러시아 | 3.6 | 3.2 | 3.2 | 0.0 | 1.8 | 1.5 | △0.3 |
| 브라질 | 2.9 | 2.2 | 2.1 | △0.1 |
2.1 | 2.4 | +0.3 |
| 멕시코 | 3.2 | 2.4 | 2.2 | △0.2 |
1.4 | 1.6 | +0.2 |
| 사우디 | △0.8 |
2.6 | 1.7 | △0.9 |
6.0 | 4.7 | △1.3 |
| 남아공 | 0.7 | 0.9 | 0.9 | 0.0 | 1.2 | 1.2 | 0.0 |
| (출처 : 국제통화기금 (World Economic Outlook, 2024.07)) |
한국은행은 매 3개월마다 발표하는 경제전망보고서를 통해 국내 경제성장률을 전망하고 있으며, 2024년 08월 발표된 한국은행의
경제전망보고서에서는 한국 경제성장률을 2024년 2.4%, 2025년 2.1% 수준으로 전망하였습니다. 한국은행은 국내경제는 수출이 호조를 지속하고 내수도 당초 경로에는 다소 못 미치지만 회복흐름을 재개하면서 금년과 내년 2%대 초중반 수준의 양호한 성장세를 이어갈 것으로 예상했습니다.
| [국내 경제 성장률 추이] |
| (단위: %) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 | 2024년(E) | 2025년(E) |
| GDP | (-)0.7 | 4.1 | 2.6 | 1.4 | 2.4 | 2.1 |
| (출처 : 한국은행 경제전망 보고서 (2024년 08월)) | |
| 주) | 2024년, 2025년 수치는 한국은행 전망치입니다. |
세부적으로 살펴보면, 민간소비의 경우, 기업실적 개선에 힘입은 임금 상승률 확대, 물가상승률 둔화 등으로 가계의 소비여력이 개선되면서 민간소비의 회복속도가 점차 빨라질 것으로 전망하였습니다. 설비투자의 경우, 2024년 상반기 글로벌 제조업경기 둔화로 부진한 모습을 보였으나 하반기에는 기업실적 개선에 따른 투자여력 확대로 인하여 회복세를 보일 것으로 예상하였고, 건설투자 부문은 고금리로 인한 신규착공 위축의 영향이 점차 나타나면서 부진할 흐름을 보일 것으로 예상하였습니다. 반면, 상품수출은 반도체 및 AI 관련 투자가 견조한 흐름을 이어가고 AI 기술 확산도 강화되면서 개선세가 지속될 것으로 전망하였습니다.
이외에 한국은행에서는 최근 국내 경기에 대하여 중국경제의 향방, 주요 선진국 경기흐름 및 미 대선 결과 등의 요인으로 인한 불확실성에 노출되어 있는 상황으로 진단하고 있습니다. 이에 따라 중국경제의 더딘 회복세, 지정학적 리스크 심화 및 이상기후로 인한 정책 불확실성 등이 잠재적인 경기 하방 리스크로 작용할 수 있음을 언급하였습니다.
| [한국은행 국내 주요 거시경제지표 전망] |
| (단위: %) |
| 구 분 | 2023년 | 2024년(E) | 2025년(E) | ||
| 연간 | 상반기 | 하반기 | 연간 | 연간 | |
| GDP | 1.4 | 2.8 | 2.0 | 2.4 | 2.1 |
| 민간소비 | 1.8 | 1.0 | 1.8 | 1.4 | 2.2 |
| 설비투자 | 1.1 | (-)2.3 | 2.6 | 0.2 | 4.3 |
| 지식재산생산물투자 | 1.7 | 1.7 | 2.0 | 1.9 | 3.3 |
| 건설투자 | 1.5 | 0.8 | (-)2.2 | (-)0.8 | (-)0.7 |
| 재화수출 | 2.9 | 8.4 | 5.6 | 6.9 | 2.9 |
| 재화수입 | (-)0.3 | (-)1.4 | 4.6 | 1.6 | 3.6 |
| (출처 : 한국은행 경제전망보고서 (2024년 08월)) | |
| 주) | 전년동기대비 기준입니다. |
위와 같이 설비투자와 수출 중심으로 국내 경기는 개선 및 성장세를 기록할 것으로 전망되나 건설투자 등 내수 회복 모멘텀이 다소 약화되며 경기 성장 둔화 압력으로 작용할 수 있을 것으로 전망됩니다.
다만, 한국은행은 향후 국내 경제의 성장성에 주요국의 성장흐름과 물가흐름, 통화정책 기조 변화, 유가 등 원자재 가격의 변동, IT경기의 확장 속도, 중국경제의 향방, 지정학적 리스크와 관련한 불확실성이 존재함을 언급했습니다. 이처럼 COVID-19 이후 민간소비 회복, 설비투자 확대 등을 통해 양호한 성장세를 보였음에도 불구하고 통화긴축, 인플레이션, 지정학 리스크 등의 불확실성이 존재함에 따라 글로벌 경기 회복의 속도가 더딜 가능성이 있습니다. 국내외 경기 변동은 관광, 항공, 무역 등 경기에 직접적인 영향을 받는 업종 뿐 아니라 대부분의 사업 분야 전반에 부정적인 영향을 미칠 수 있습니다. 또한, 경기 둔화로 인해 증시의 변동성이 높아질 경우, 당사의 영업환경 및 주가 역시 높은 변동성을 보일 가능성이 있으므로 투자자께서는 이 점을 유의하시어 투자에 임하시기 바랍니다.
(주11) 정정 전
| 차. 핵심 연구개발인력 유출 위험 신약개발 사업은 10년 이상의 장기간 및 1조원이 넘는 대규모 자금이 요구되며, 임상 1상에서 판매 승인까지 성공확률이 7.9%에 불과한 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 또한, 신약 연구개발을 진행할 수 있는 지식과 경험을 보유하고 있는 전문 인력의 수는 한정되어 있어, 전문 인력의 확보 여부는 신약 개발의 성패를 좌우하는 회사의 핵심 경쟁력으로 볼 수 있습니다. 따라서 당사는 지속적인 연구개발 투자, 주식매수선택권 부여 등을 통해 우수연구인력의 확보 및 유출 방지를 위해 노력하고 있고, 신약개발 경험이 풍부한 외부전문가를 활용하고 있습니다. 그럼에도 불구하고 연구개발 인력의 유출이 발생할 경우, 당사의 사업 수행 및 기존의 연구개발 활동에 차질이 발생하여 당사의 영업활동 및 장기 성장에 부정적인 영향을 끼칠 수 있습니다. |
신약 개발 사업은 후보물질의 발굴, 임상 시험 진행, 허가, 생산 및 마케팅 등 전 단계에 걸쳐 전문인력을 필요로 합니다. 특히 기존 의약품만으로는 치료가 어려웠던 난치성 질환에 대해 의학적 미충족 수요를 충족시킬 수 있는 신약을 개발하거나 글로벌 시장 가치가 높은 신약을 개발하기 위해서는 해당 분야에 전문 지식과 경험을 갖춘 우수 전문 인력을 확보하는 것이 중요합니다. 그러나 국내 신약 개발 전문가 수는 한정되어 있는 만큼, 분야별 전문 인력 확보 여부는 당사와 같은 바이오 기업의 핵심 경쟁력으로 직결됩니다.
당사는 전문 인력의 확보가 신약 연구개발 사업의 핵심 경쟁력임을 인지하고 우수한 전문 인력을 영입하고자 노력하고 있습니다. 신고서 제출일 현재 연구개발본부 19명, 임상개발팀 1명, ADL사업부 4명으로 총 24명의 연구개발 인력이 재직 중에 있으며, 이 중 87.5%가 석박사 인력입니다. 당사의 연구개발 본부별 인력 및 주요 업무는 다음과 같습니다.
| [연구개발본부별 인력 및 주요 업무] |
| 총괄 | 본부 | 본부 인력 | 주요 업무 |
|
CTO/기술고문 (2명) |
연구개발본부 | 19인 | 신약 연구, 신약 전임상, 임상개발 |
| 임상개발팀 | 1인 | 임상 개발 | |
| ADL사업부 | 4인 |
압토디텍트 렁(AptoDetect™-Lung) 생산 및 임상시험, 판매지원 |
| (출처 : 당사 제시) |
신약 연구개발을 주도하고 있는 핵심연구인력의 담당 업무, 주요 경력 및 주요 연구실적은 다음과 같습니다.
| [핵심 연구개발인력 현황] |
| 직위 | 성명 | 담당업무 | 주요경력 | 연구실적 |
| CTO | 류성호 | 신약 기술 플랫폼 총괄 |
한국과학기술원 생명과학과 (박사 '85) 국립보건원 박사후 연구원 포스텍 교수 ('88~'22) ㈜압타머사이언스 이사 ('11~현재) |
조합기술을 이용한 펩티드 분자다양성 창출 및 응용 AlloMap 플랫폼 기술 개발 및 구축 논문: 국내 60편, 해외 253편 |
| 기술 고문 |
장승기 | 압타머 관련 기술 고문 |
Univ. of NY of Stony Brook 분자생물학 (박사 '89) 포스텍 교수 ('91~'23) 포스텍 생명공학연구센터 센터장 ㈜압타머사이언스 기술고문 ('11~현재) |
C형 간염 바이러스 효능이 있는 압타머 개발 치료백신 개발을 위한 동물모델 확립 및 백신효능 기전연구 논문: 92편, 특허 22건 |
|
상무 이사 |
이대견 |
연구개발 본부장 |
포스텍 생명과학(박사 '09) ㈜와이디생명과학 팀장('15~'17) ㈜압타머사이언스 연구개발본부 본부장('18~현재) |
신약 개발 업무 총괄 전임상 및 임상 업무 (당뇨 및 간암) 논문 20편(SCI), 특허 5건 |
| 팀장 | 안홍선 | 약리독성팀 |
단국대학교 나노바이오의과학과(박사 '14) 바이오톡스텍 연구원('18~21) 제이투에이치바이오텍 연구원('21-23) |
AST-201, AST-202의 전임상 업무 논문 5편, 특허 10건 |
| 팀장 | 강주형 | Discovery팀 | 고려대학교 의과학과(박사 '17) 고려대학교 박사 후 연구원('17) ㈜압타머사이언스 연구개발본부 Discovery팀장('17~현재) |
신규 파이프라인 발굴/개발 연구 (고형암, 면역항암제) |
| 팀장 | 임소령 | CMC팀 | 부산대학교 바이오소재전공(석사 '13) UNIST 화학전공(석사 '16) (주)압타머사이언스 연구개발본부 CMC팀장('16~현재) |
Aptamer-drug conjugate 생산 총괄 |
| 팀장 | 김기중 | 임상개발팀 |
중앙대학교 동물번식육종(박사 '15) 지엔에스바이오 임상총괄팀장 ('16~'19) ㈜대웅제약 임상총괄 ('21~'23) |
19개 연구과제 참여 국내IND 12건, 임상진행 18건 |
| (출처 : 당사 제시) |
상기 연구개발 인력을 통해 당사는 신약 개발 활동에 집중하고 있으며, 매년 매출액 규모를 크게 상회하는 수준의 연구개발비를 집행하고 있습니다. 최근 3년간 당사의 연구개발비용 추이는 다음과 같습니다.
| [연구개발비용 현황] |
| (단위 : 백만원) |
| 구 분 | 2024년도 반기 | 2023년도 | 2022년도 | 2022년도 | |
|---|---|---|---|---|---|
| 자산 처리 | 원재료비 | - | - | - | - |
| 인건비 | - | - | - | - | |
| 감가상각비 | - | - | - | - | |
| 위탁용역비 | - | - | - | - | |
| 기타 | - | - | - | - | |
| 소 계 | - | - | - | - | |
| 비용 처리 | 제조원가 | - | - | - | - |
| 판관비 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 소 계 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 연구개발비용 합계 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 매출액 | 71 | 243 | 358 | 269 | |
| 연구개발비용/매출액 | 2,758% | 3,848% | 1,682% | 655% | |
| (출처 : 정기보고서) |
당사는 제한된 연구개발비 내에서 수익 창출 기여도를 높이기 위한 파이프라인 개발에 집중하고 있습니다. 그러나 신약 연구개발을 통해 가시적인 성과가 나오기까지는 많은 비용과 시간이 소요되는 만큼, 향후 상용화 단계에 이르기까지 지속적으로 연구개발비가 증가할 것으로 예상됩니다. 또한, 우수한 연구인력의 유출을 방지하기 위해 합리적인 보상체계를 구축하는 등 지속적인 인력 투자를 진행할 예정입니다.
당사는 우수한 연구개발 인력 및 주요 임직원의 장기 근속을 유도하고 사기를 진작시키기 위한 주식매수선택권을 부여하고 있습니다. 당사가 현재까지 부여한 주식매수선택권 현황은 다음과 같습니다.
| [연구개발부서 주식매수선택권 부여 현황] |
| (단위 : 주) |
| 부여 받은 자 | 부서 | 부여일 | 부여방법 | 주식의 종류 | 최초 부여 수량 |
| 이대견(상무) | 연구개발본부 | 2022.03.10 | 신주교부 | 보통주 | 20,000 |
| 임소령외2인 | 연구개발본부, ADL사업부 | 2022.03.10 | 신주교부 | 보통주 | 15,000 |
| 강주형외1인 | 연구개발본부, ADL사업부 | 2023.02.28 | 신주교부 | 보통주 | 15,000 |
| OO외1인 | ADL사업부 | 2024.02.14 | 신주교부 | 보통주 | 15,000 |
| (출처 : 당사 제시) |
신약개발 사업은 10년 이상의 장기간 및 1조원이 넘는 대규모 자금이 요구되며, 임상 1상에서 판매 승인까지 성공확률이 7.9%에 불과한 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 또한, 신약 연구개발을 진행할 수 있는 지식과 경험을 보유하고 있는 전문 인력의 수는 한정되어 있어, 전문 인력의 확보 여부는 신약 개발의 성패를 좌우하는 회사의 핵심 경쟁력으로 볼 수 있습니다. 따라서 당사는 지속적인 연구개발 투자, 주식매수선택권 부여 등을 통해 우수연구인력의 확보 및 유출 방지를 위해 노력하고 있고, 신약개발 경험이 풍부한 외부전문가를 활용하고 있습니다. 그럼에도 불구하고 연구개발 인력의 유출이 발생할 경우, 당사의 사업 수행 및 기존의 연구개발 활동에 차질이 발생하여 당사의 영업활동 및 장기 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주11) 정정 후
| 차. 핵심 연구개발인력 유출 위험 신약개발 사업은 10년 이상의 장기간 및 1조원이 넘는 대규모 자금이 요구되며, 임상 1상에서 판매 승인까지 성공확률이 7.9%에 불과한 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 또한, 신약 연구개발을 진행할 수 있는 지식과 경험을 보유하고 있는 전문 인력의 수는 한정되어 있어, 전문 인력의 확보 여부는 신약 개발의 성패를 좌우하는 회사의 핵심 경쟁력으로 볼 수 있으며. 핵심 인력 유출은 바이오의약품 개발에 필요한 기술과 노하우 등의 유출을 수반하여 당사의 사업을 영위하는데 있어 위험요소가 될 수 있습니다. 따라서 당사는 지속적인 연구개발 투자, 주식매수선택권 부여 등을 통해 우수연구인력의 확보 및 유출 방지를 위해 노력하고 있고, 특허 등 지적재산권 확보를 통해 기술에 대한 권리 보호 전략을 취하고 있으며, 신약개발 경험이 풍부한 외부전문가를 활용하고 있습니다. 그럼에도 불구하고 연구개발 인력의 유출이 발생할 경우, 당사의 사업 수행 및 기존의 연구개발 활동에 차질이 발생하여 당사의 영업활동 및 장기 성장에 부정적인 영향을 끼칠 수 있습니다. |
신약 개발 사업은 후보물질의 발굴, 임상 시험 진행, 허가, 생산 및 마케팅 등 전 단계에 걸쳐 전문인력을 필요로 합니다. 특히 기존 의약품만으로는 치료가 어려웠던 난치성 질환에 대해 의학적 미충족 수요를 충족시킬 수 있는 신약을 개발하거나 글로벌 시장 가치가 높은 신약을 개발하기 위해서는 해당 분야에 전문 지식과 경험을 갖춘 우수 전문 인력을 확보하는 것이 중요합니다. 그러나 국내 신약 개발 전문가 수는 한정되어 있는 만큼, 분야별 전문 인력 확보 여부는 당사와 같은 바이오 기업의 핵심 경쟁력으로 직결됩니다.
당사는 혁신 신약 연구 개발에 최적화된 조직 구성으로 각 분야에 오랜 경험을 갖춘 핵심 인재들로 운영되고 있습니다. 본부 및 운영 단위별로 신속하고 정확한 자체 의사 결정으로 효율적인 과제 개발을 진행하고 있으며, 상호 유기적인 협력으로 위험 요소를 점검하고 불필요한 회의 및 행정 절차를 최소화하고 있습니다.
조직별 구성으로는 연구개발본부에서 Discovery, 전임상 및 CMC 부분을 담당하고 있으며, 임상개발팀에서 임상을 진행하고 있습니다. 진단제품 개발은 ADL사업부에서 담당하고 있습니다
 |
|
연구개발인력 조직도(2024.09) |
당사는 전문 인력의 확보가 신약 연구개발 사업의 핵심 경쟁력임을 인지하고 우수한 전문 인력을 영입하고자 노력하고 있습니다. 신고서 제출일 현재 연구개발본부 19명, 임상개발팀 1명, ADL사업부 4명으로 총 24명의 연구개발 인력이 재직 중에 있으며, 이 중 87.5%가 석박사 인력입니다. 당사의 연구개발 본부별 인력 및 주요 업무는 다음과 같습니다.
| [연구개발본부별 인력 및 주요 업무] |
| 총괄 | 본부 | 본부 인력 | 주요 업무 |
|
CTO/기술고문 (2명) |
연구개발본부 | 19인 | 신약 연구, 신약 전임상, 임상개발 |
| 임상개발팀 | 1인 | 임상 개발 | |
| ADL사업부 | 4인 |
압토디텍트 렁(AptoDetect™-Lung) 생산 및 임상시험, 판매지원 |
| (출처 : 당사 제시) |
| [최근 3년 연구개발인력 현황] |
| 구분 | 기초 | 증가 | 감소 | 기말 |
|---|---|---|---|---|
| 2024년 반기 | 27 | - | 3 | 24 |
| 2023년 |
21 | 6 | - | 27 |
| 2022년 | 22 | - | 1 | 21 |
| 2021년 | 25 | - | 3 | 22 |
| (출처 : 당사 제시) |
| [최근 3년 부서별 박석사 인력 현황] |
| 구 분 | 인 원 | ||||
|---|---|---|---|---|---|
| 박 사 | 석 사 | 기 타 | 합 계 | ||
| 2021년 | 연구개발본부 | 6 | 11 | - | 17 |
| 임상개발팀 | |||||
| ADL사업부 | 1 | 2 | 2 | 5 | |
| 2022년 | 연구개발본부 | 2 | 13 | 2 | 17 |
| 임상개발팀 | - | - | - | - | |
| ADL사업부 | - | 2 | 2 | 4 | |
| 2023년 | 연구개발본부 | 6 | 13 | 1 | 20 |
| 임상개발팀 | - | 1 | - | 1 | |
| ADL사업부 | - | 1 | 5 | 6 | |
| 2024년 반기 | 연구개발본부 | 5 | 13 | 1 | 19 |
| 임상개발팀 | 1 | - | - | 1 | |
| ADL사업부 | - | 2 | 2 | 4 | |
| (출처 : 당사 제시) |
신약 연구개발을 주도하고 있는 핵심연구인력의 담당 업무, 주요 경력 및 주요 연구실적은 다음과 같습니다.
| [핵심 연구개발인력 현황] |
| 직위 | 성명 | 담당업무 | 주요경력 | 연구실적 |
| CTO | 류성호 | 신약 기술 플랫폼 총괄 |
한국과학기술원 생명과학과 (박사 '85) 국립보건원 박사후 연구원 포스텍 교수 ('88~'22) ㈜압타머사이언스 이사 ('11~현재) |
조합기술을 이용한 펩티드 분자다양성 창출 및 응용 AlloMap 플랫폼 기술 개발 및 구축 논문: 국내 60편, 해외 253편 |
| 기술 고문 |
장승기 | 압타머 관련 기술 고문 |
Univ. of NY of Stony Brook 분자생물학 (박사 '89) 포스텍 교수 ('91~'23) 포스텍 생명공학연구센터 센터장 ㈜압타머사이언스 기술고문 ('11~현재) |
C형 간염 바이러스 효능이 있는 압타머 개발 치료백신 개발을 위한 동물모델 확립 및 백신효능 기전연구 논문: 92편, 특허 22건 |
|
상무 이사 |
이대견 |
연구개발 본부장 |
포스텍 생명과학(박사 '09) ㈜와이디생명과학 팀장('15~'17) ㈜압타머사이언스 연구개발본부 본부장('18~현재) |
신약 개발 업무 총괄 논문 20편(SCI), 특허 5건 - 보건복지부 과제: 압타머 A48ms를 이용한 인슐린 수용체 표적 당뇨치료제의 비임상개발 연구개발 책임(2020~2022)
- 국가신약개발 사업단 과제: CD25 표적 압타머-약물접합체를 이용한 조절 T세포 선택적 억제/사멸 기전의 면역항암제용 선도물질 도출 연구개발 책임(2022~2024)
|
| 팀장 | 안홍선 | 약리독성팀 |
단국대학교 나노바이오의과학과(박사 '14) 바이오톡스텍 연구원('18~21) 제이투에이치바이오텍 연구원('21-23) |
AST-201, AST-202의 전임상 업무 논문 5편, 특허 10건 - Preparing method of nerve conduits including cells, US 10,758,646 B2 (2020.09.01) - Neurotrophic factor carrier, method for producing the same, and method for regenerating a nerve using the same, US 11,040,125 B2 (2021.06.22) - 신경도관 제조방법, 10-2041231 (2019.11.07)
- 세포를 포함하는 신경도관 제조방법, 10-1952946 (2019.02.28)
- 신경재생인자 전달체, 이의 제조방법 및 이를 이용한 신경 재생 방법, 10-2041775 (2019.11.07) - Nanotherapeutics of PTEN Inhibitor with Mesoporous Silica Nanocarrier Effective for Axonal Outgrowth of Adult Neurons /2016.08.29 (공동저자)
- Carbon-nanotube-interfaced glass fiber scaffold for regeneration of transected sciatic nerve /2014.11.13 (
제 1저자)
- Therapeutic Potential of Induced Neural Stem Cells for Spinal Cord Injury /014.10.07 (공동저자)
- Expression, cDNA cloning, and characterization of the antibacterial peptide cecropin D from Agrius convolvuli /2013.01.21 (제 1저자)
- Phosphate glass fibres promote neurite outgrowth and early regeneration in a peripheral nerve injury model /2012.08.27 (공동저자) |
| 팀장 | 강주형 | Discovery팀 | 고려대학교 의과학과(박사 '17) 고려대학교 박사 후 연구원('17) ㈜압타머사이언스 연구개발본부 Discovery팀장('17~현재) |
신규 파이프라인 발굴/개발 연구 (고형암, 면역항암제) - 압타머를 이용한 다중(multiplex) PCR 방법 (2020.11.05)
논문 실적 - Lipopolysaccharide regulates thymic stromal lymphopoietin expression via TLR4/MAPK/Akt/NF-κB-signaling pathways in nasal fibroblasts: differential inhibitory effects of macrolide and corticosteroid (제 1저자)
- TGF-beta1 Activates Nasal Fibroblasts through the Induction of Endoplasmic Reticulum Stress (제 1저자)
- Chemical Chaperone of Endoplasmic Reticulum Stress Inhibits Epithelial-Mesenchymal Transition Induced by TGF-β
1 in Airway Epithelium via the c-Src Pathway (제 1저자)
- Diesel Exhaust Particles Enhance MUC4 Expression in NCI-H292 Cells and Nasal Epithelial Cells via the p38/CREB Pathway (
제 1저자)
- In Vivo Evaluation of 68Ga-Labeled NOTA-EGFRvIII Aptamer in EGFRvIII-Positive Glioblastoma Xenografted Model (공동저자)
국가연구개발사업 실적 - 만성 비부비동염의 발병기전연구와 치료제 후보물질 개발연구, 연구원 (2011-2012)
- 비용의 발생과정에 따른 IL-32의 역할규명과 기전연구, 연구원 (2013-2014)
- 비용종 발생 기전에서 EMT(상피-간엽세포 변화)의 역할규명 및 새로운 치료제 개발, 연구원 (2013-2014)
- 압타머를 이용한 당뇨망막병증 신속 다지표진단 기술개발 및 시제품 제작, 연구원 (2018-2019)
- CD25 표적 압타머-약물 접합체를 이용한 조절 T 세포 선택적 억제/사멸 기전의 면역항암제 선도물질 도출, 연구원 (2022-2024)
|
| 팀장 | 임소령 | CMC팀 | 부산대학교 바이오소재전공(석사 '13) UNIST 화학전공(석사 '16) (주)압타머사이언스 연구개발본부 CMC팀장('16~현재) |
Aptamer-drug conjugate 생산 총괄 - 글리피칸-3 특이적 변형 압타머 및 이의 용도
- 티미딘으로부터 개질된 뉴클레오시드의 제조방법
- 분지형의 효소 절단 가능한 링커-페이로드와 이의 효율적인 제조방법
- 인슐린 수용체 압타머 및 이를 포함하는 당뇨병 치료용 약학적 조성물
- CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용 - Poly(D,L-lactide)를 외부 껍질로 하고 Alginate 또는 Chitosan을 내부 코어로 구성한 이중미립구 담체의 약물방출 특성 (공동저자)
- In Vivo Evaluation of 68Ga-Labeled NOTA-EGFRvIII Aptamer in EGFRvIII-Positive Glioblastoma Xenografted Model (공동저자)
|
| 팀장 | 김기중 | 임상개발팀 |
중앙대학교 동물번식육종(박사 '15) 지엔에스바이오 임상총괄팀장 ('16~'19) ㈜대웅제약 임상총괄 ('21~'23) |
19개 연구과제 참여 국내IND 12건, 임상진행 18건 - Methods that Transduction of Spermatogonial Stem Cells Using Lentiviral Vector and DOGS in Mouse. 논문 실적 - Effective Preparation of Mouse Recipients for Xenogeneic Transplantation of Spermatogonial Stem Cells. Tissue Eng Regen Med 2013(제 1저자)
- Lentiviral Modification of Enriched Populations of Bovine Male Gonocytes. J Anim Sci 2014 (제 1저자)
- Enhancement of In Vitro Culture Efficiency of Mesencymal Stem Cells Derived from Deer Antlers. Tissue Eng Regen Med 2014 (제 1저자)
- Cryopreservation of Putative Pre-pubertal Bovine Spermatogonial Stem Cells by Slow Freezing. Cryobiology 2015 (제 1저자)
- In Vitro Spermatogenesis Using Bovine Testis Tissue Culture Techniques. Tissue Eng Regen Med 2015 (제 1저자) 임상시험 실적 - 비소세포폐암 연구자 임상
- 아토피피부염 임상 1/2상
- 패혈증 임상 1/2상
- COVID-9 임상 2상
- 중추성 사춘기 성조숙증 임상 3상
|
| (출처 : 당사 제시) |
상기 연구개발 인력을 통해 당사는 신약 개발 활동에 집중하고 있으며, 매년 매출액 규모를 크게 상회하는 수준의 연구개발비를 집행하고 있습니다. 최근 3년간 당사의 연구개발비용 추이는 다음과 같습니다.
| [연구개발비용 현황] |
| (단위 : 백만원) |
| 구 분 | 2024년도 반기 | 2023년도 | 2022년도 | 2022년도 | |
|---|---|---|---|---|---|
| 자산 처리 | 원재료비 | - | - | - | - |
| 인건비 | - | - | - | - | |
| 감가상각비 | - | - | - | - | |
| 위탁용역비 | - | - | - | - | |
| 기타 | - | - | - | - | |
| 소 계 | - | - | - | - | |
| 비용 처리 | 제조원가 | - | - | - | - |
| 판관비 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 소 계 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 연구개발비용 합계 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 매출액 | 71 | 243 | 358 | 269 | |
| 연구개발비용/매출액 | 2,758% | 3,848% | 1,682% | 655% | |
| (출처 : 정기보고서) |
당사는 제한된 연구개발비 내에서 수익 창출 기여도를 높이기 위한 파이프라인 개발에 집중하고 있습니다. 그러나 신약 연구개발을 통해 가시적인 성과가 나오기까지는 많은 비용과 시간이 소요되는 만큼, 향후 상용화 단계에 이르기까지 지속적으로 연구개발비가 증가할 것으로 예상됩니다. 또한, 우수한 연구인력의 유출을 방지하기 위해 합리적인 보상체계를 구축하고, 지속적인 인력 투자를 진행할 예정입니다.
| [최근 3년 연구개발인력 현황] |
| 구분 | 기초 | 증가 | 감소 | 기말 |
|---|---|---|---|---|
| 2024년 반기 | 27 | - | 3 | 24 |
| 2023년 |
21 | 6 | - | 27 |
| 2022년 | 22 | - | 1 | 21 |
| 2021년 | 25 | - | 3 | 22 |
| (출처 : 당사 제시) |
당사의 최근 3년간 연구인력 퇴사는 6명으로 2024년 반기말 연구개발인력의 25% 수준이고, 평균 근속연수는 3.5년입니다. 인력유출사유는 건강 악화, 이직으로 인한 퇴사였습니다. ESG행복연구소(2022)에 따르면 제약바이오 업계의 직원 평균 근속연수는 5.25년으로 200대 기업 평균(9.45년)보다 짧았으며, 바이오기업들의 근속연수는 평균 이하에 머문 것으로 나타났습니다. 특히 코로나19 이후 진단키트, 의료기기, 연구개발, CDMO 등을 통해 급성장한 기업들이 차세대 먹거리 발굴을 위해 공격적으로 인력 채용을 늘리면서 고스란히 근속연수에 영향을 미친 것입니다. 당사의 경우 부족한 인력을 충원하기 위해 2023년 인력을 확보하면서 평균 근속연수가 짧아졌습니다.
인력 유입 및 유출에도 불구하고, 대부분의 퇴사자들이 팀원으로 당사의 핵심인력의 유출은 없어 당사의 주요 파이프라인 등 연구개발에 미치는 영향은 없었으며, 현재 업무 연속성 유지를 위해 투자를 유치하고 자금 사정에 맞춰 개발 단계가 빠른 파이프라인 연구에 집중하고 있는 상황입니다. 이에 연구개발인력의 유출을 막기 위해 직무 만족도와 임금, 복지수준을 개선해 나갈 계획이며, 신약을 포함한 다양한 프로젝트 추진 환경 및 기회 제공 등을 계획하고 있습니다.
또한 회사는 조기이직 방지로 5가지 방안(START)을 마련하여 활용하고 있습니다.
| [START 프로그램] |
|---|
| 1) Selection: 고유의 선발 방식을 모색 - 우수인재 채용을 목적으로 업무특성과 직무에 대한 철저한 분석을 통해 직무 적합도를 높이는 선발기준을 찾음 2) Truth: 입사 전 회사와 직무에 대한 충분한 공유 - 현실적인 직무소개로 기대 수준을 조정함. 긍정적이고 부정적인 내용까지 오픈함으로 과도한 기대감을 낮추고 만족감을 제고하여 이직률을 감소시킴 3) Achievement: 입사 초기에 성공적인 프로젝트 경험 - 회사의 주요 프로젝트에 참여시켜 성취감 고취 및 중요한 인재라는 의식 고취. 성공경험을 통해 얻은 희열과 성취감은 업무성과로 이어지는 강한 동기로 작용 4) Route: 성공 경로를 보여줌 - 직무역량 강화를 위한 교육 프로그램과 직무별 성장 경로를 제시. 5) Talk: 끊임없는 소통(커뮤니케이션) - 수평적인 소통방식 운영 및 비공식적인 조직을 활성화하여 임직원 간 소통의의 장을 마련 |
당사는 우수한 연구개발 인력 및 주요 임직원의 장기 근속을 유도하고 사기를 진작시키기 위한 주식매수선택권을 부여하고 있습니다. 당사가 현재까지 부여한 주식매수선택권 현황은 다음과 같습니다.
| [연구개발부서 주식매수선택권 부여 현황] |
| (단위 : 주) |
| 부여 받은 자 | 부서 | 부여일 | 부여방법 | 주식의 종류 | 최초 부여 수량 | 현재 잔여 수량 | 행사가격 | 행사가능일 |
|---|---|---|---|---|---|---|---|---|
| 이대견(상무) | 연구개발본부 | 2022.03.10 | 신주교부 | 보통주 | 20,000 | 40,000 | 6,375 | 2024.03.10 ~2029.03.09 |
| 임소령외2인 | 연구개발본부, ADL사업부 | 2022.03.10 | 신주교부 | 보통주 | 15,000 | 30,000 | 6,375 | 2024.03.10 ~2029.03.09 |
| 강주형외1인 | 연구개발본부, ADL사업부 | 2023.02.28 | 신주교부 | 보통주 | 15,000 | 30,000 | 4,686 | 2025.02.28 ~2030.02.27 |
| OO외1인 | ADL사업부 | 2024.02.14 | 신주교부 | 보통주 | 15,000 | 15,000 | 3,566 | 2026.02.14 ~2031.02.13 |
| (출처 : 당사 제시) |
신약개발 사업은 10년 이상의 장기간 및 1조원이 넘는 대규모 자금이 요구되며, 임상 1상에서 판매 승인까지 성공확률이 7.9%에 불과한 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 또한, 신약 연구개발을 진행할 수 있는 지식과 경험을 보유하고 있는 전문 인력의 수는 한정되어 있어, 전문 인력의 확보 여부는 신약 개발의 성패를 좌우하는 회사의 핵심 경쟁력으로 볼 수 있습니다. 따라서 당사는 지속적인 연구개발 투자, 주식매수선택권 부여 등을 통해 우수연구인력의 확보 및 유출 방지를 위해 노력하고 있고, 신약개발 경험이 풍부한 외부전문가를 활용하고 있습니다. 그럼에도 불구하고 연구개발 인력의 유출이 발생할 경우, 당사의 사업 수행 및 기존의 연구개발 활동에 차질이 발생하여 당사의 영업활동 및 장기 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주12) 정정 전
| 타. CRO 산업의 성장 둔화에 따른 위험 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였고, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.(주)인터내셔널사이언티픽스탠다드가 속한 시장은 제약업계 및 바이오벤처 임상시험 위탁연구을 실시하는 CRO 시장입니다. CRO는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다. 국내 시장 또한 글로벌 CRO 대비 높은 성장률을 보이며 지속적인 성장세를 유지하고있습니다. 최근 5년간 세계 CRO 시장의 연평균 성장률이 9.9%에 그친 데 비해 대한민국의 전체 CRO 시장은 동 기간 연평균 14%의 규모로 증가했습니다.이 외에 주목할 만 한 사항으로는 국내 CRO 업체 중 내자 CRO 업체의 점유율이 있습니다. 국내 CRO시장에서 국내 CRO와 외자 CRO의 시장점유율을 관찰하였을 때, 2014년 국내 CRO의 비중이 33.3%에서 2018년 46.2%으로 증가하였고, 2020년 최초로 내자 CRO의 점유율이 외자 CRO의 점유율을 초과하였습니다. 그러나, 위와 같은 CRO 업계의 성장에도 불구하고 향후 경기 불황 등 거시적 또는 미시적 요인에 의하여 주력 시장의 성장세가 둔화될 경우, 해당 사업부의 영업활동에 부정적 영향을 미칠 수 있습니다. |
2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였고, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.
(주)인터내셔널사이언티픽스탠다드가 속한 시장은 제약업계 및 바이오벤처 임상시험 위탁연구을 실시하는 CRO 시장입니다. CRO는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다.
대형 제약기업 중 일부는 연구개발과 임상시험을 포기하게 되고, 기업 규모 축소(downsizing)로 해고된 연구 인력들이 풀서비스(full-service), 니치서비스(niche-service)의 형태로 컨설팅 사업에 뛰어들게 되면서 제약 CRO 사업이 탄생, 발전하게 되었습니다. 산업 초기 아웃소싱(outsourcing)은 데이터 관리 및 통계분석 서비스가 주를 이루었으나, 점차 그 영역이 확대되어, 약물 발굴, 신약 개발에서부터 제조, 운송, 상품화에 이르기까지 제약 가치사슬의 전 단계에 걸쳐 서비스를 제공하게 되었습니다.
| [제약 가치사슬에 따른 아웃소싱(outsourcing) 현황] |
![이미지: [제약 가치사슬에 따른 아웃소싱(outsourcing) 현황]](%5B%EC%A0%9C%EC%95%BD%20%EA%B0%80%EC%B9%98%EC%82%AC%EC%8A%AC%EC%97%90%20%EB%94%B0%EB%A5%B8%20%EC%95%84%EC%9B%83%EC%86%8C%EC%8B%B1%28outsourcing%29%20%ED%98%84%ED%99%A9%5D.jpg) |
|
[제약 가치사슬에 따른 아웃소싱(outsourcing) 현황] |
| (출처 : CEPTON, 2007) |
개발사는 연구개발을 CRO에 위탁함으로써 신약개발에 드는 비용과 시간을 절감할 수 있으며 CRO는 각각의 특화된 분야에서 전문성과 효율성을 높여 나갈 수 있으므로위탁연구 시장은 지속적으로 성장하고 있으며 또한 다양화 되고 있습니다.
글로벌 CRO 시장은 2018년 기준 452억 8300만달러(약 56조 5585억원)였으나, 연평균7.7%의 성장률을 기록하면서 오는 2024년에는 717억달러(한화 약 89조 5533억원)에 이를 것으로 전망되고 있습니다.
| [글로벌 CRO 시장 전망(2017~2024E)] |
| (단위 : 10억 달러) |
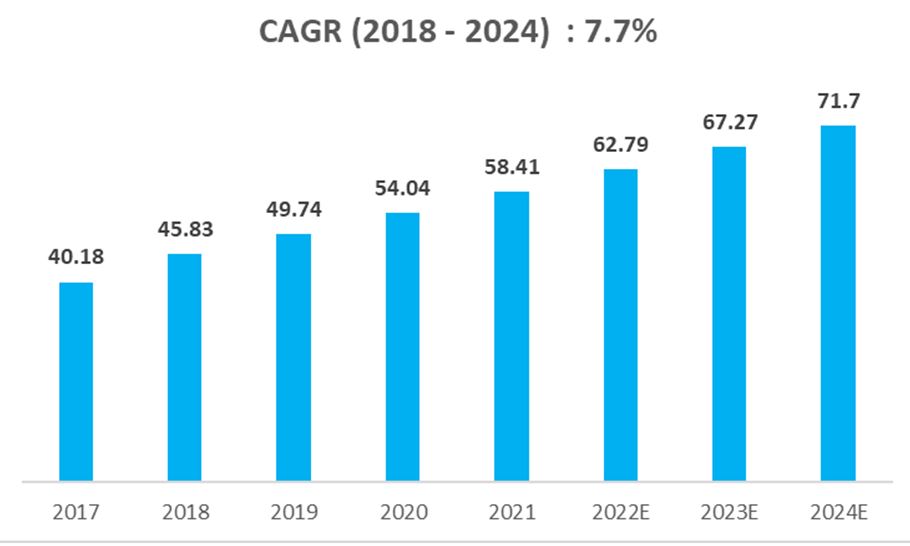 |
|
글로벌 cro 시장 전망(2017 - 2024e |
|
(출처 : Frost&Sullivan, Global CRO Mraket, Forecast to 2024, 글로벌 CRO시장현황 및 전망. 2020.1. 생명공학정책연구센터) |
이러한 성장 전망의 주요 원인으로는 최근 다국적 제약사 및 바이오제약기업들의 신약 개발 비용을 절감을 위한 생산, 개발, 임상, 마케팅, 유통 등의 위탁사(CRO업체 등) Outsourcing 사례의 증가를 꼽을 수 있습니다.
| [아웃소싱 현황] |
 |
|
small-cap 기업의 아웃소싱 현황 |
 |
|
mid-cap 기업의 아웃소싱 현황 |
| 출처: FDA, 이베스트투자증권 리서치센터 |
국내 시장 또한 글로벌 CRO 대비 높은 성장률을 보이며 지속적인 성장세를 유지하고있습니다. 최근 5년간 세계 CRO 시장의 연평균 성장률이 9.9%에 그친 데 비해 대한민국의 전체 CRO 시장은 동 기간 연평균 14%의 규모로 증가했습니다.이 외에 주목할 만 한 사항으로는 국내 CRO 업체 중 내자 CRO 업체의 점유율이 있습니다. 국내 CRO시장에서 국내 CRO와 외자 CRO의 시장점유율을 관찰하였을 때, 2014년 국내 CRO의 비중이 33.3%에서 2018년 46.2%으로 증가하였고, 2020년 최초로 내자 CRO의 점유율이 외자 CRO의 점유율을 초과하였습니다.
| [국내 CRO 매출현황] |
 |
|
국내 cro |
| (출처 : KoNECT, 임상시험 산업 실태조사(2020.12)) |
그러나, 위와 같은 CRO 업계의 성장에도 불구하고 향후 경기 불황 등 거시적 또는 미시적 요인에 의하여 주력 시장의 성장세가 둔화될 경우, 해당 사업부의 영업활동에 부정적 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자에 임하시기 바랍니다.
(주12) 정정 후
| 타. CRO 산업의 성장 둔화에 따른 위험 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였고, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.(주)인터내셔널사이언티픽스탠다드가 속한 시장은 제약업계 및 바이오벤처 임상시험 위탁연구을 실시하는 CRO 시장입니다. CRO는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다. 국내 시장 또한 글로벌 CRO 대비 높은 성장률을 보이며 지속적인 성장세를 유지하고있습니다. 최근 5년간 세계 CRO 시장의 연평균 성장률이 9.9%에 그친 데 비해 대한민국의 전체 CRO 시장은 동 기간 연평균 14%의 규모로 증가했습니다.이 외에 주목할 만 한 사항으로는 국내 CRO 업체 중 내자 CRO 업체의 점유율이 있습니다. 국내 CRO시장에서 국내 CRO와 외자 CRO의 시장점유율을 관찰하였을 때, 2014년 국내 CRO의 비중이 33.3%에서 2018년 46.2%으로 증가하였고, 2020년 최초로 내자 CRO의 점유율이 외자 CRO의 점유율을 초과하였습니다. 그러나, 위와 같은 CRO 업계의 성장에도 불구하고 향후 경기 불황 등 거시적 또는 미시적 요인에 의하여 주력 시장의 성장세가 둔화될 경우, 해당 사업부의 영업활동에 부정적 영향을 미칠 수 있습니다. |
2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였고, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.
(주)인터내셔널사이언티픽스탠다드가 속한 시장은 제약업계 및 바이오벤처 임상시험 위탁연구을 실시하는 CRO 시장입니다. CRO는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다.
대형 제약기업 중 일부는 연구개발과 임상시험을 포기하게 되고, 기업 규모 축소(downsizing)로 해고된 연구 인력들이 풀서비스(full-service), 니치서비스(niche-service)의 형태로 컨설팅 사업에 뛰어들게 되면서 제약 CRO 사업이 탄생, 발전하게 되었습니다. 산업 초기 아웃소싱(outsourcing)은 데이터 관리 및 통계분석 서비스가 주를 이루었으나, 점차 그 영역이 확대되어, 약물 발굴, 신약 개발에서부터 제조, 운송, 상품화에 이르기까지 제약 가치사슬의 전 단계에 걸쳐 서비스를 제공하게 되었습니다.
| [제약 가치사슬에 따른 아웃소싱(outsourcing) 현황] |
![이미지: [제약 가치사슬에 따른 아웃소싱(outsourcing) 현황]](%5B%EC%A0%9C%EC%95%BD%20%EA%B0%80%EC%B9%98%EC%82%AC%EC%8A%AC%EC%97%90%20%EB%94%B0%EB%A5%B8%20%EC%95%84%EC%9B%83%EC%86%8C%EC%8B%B1%28outsourcing%29%20%ED%98%84%ED%99%A9%5D.jpg) |
|
[제약 가치사슬에 따른 아웃소싱(outsourcing) 현황] |
| (출처 : CEPTON, 2007) |
CRO는 제약사들의 신약개발 시 들어가는 연구개발 비용 감소와 신약 출시기간 단축이라는 수요에 맞게 발전해 왔습니다. 신약 연구, 개발은 후보물질 탐색부터 임상시험까지 오랜 기간이 걸리는 반면, 성공 확률이 낮은 하이리스크-하이리턴(high-risk, high-return) 사업입니다. 이에 따라 대부분의 제약회사들은 높은 리스크와 많은 비용이 들어가는 단계를 자체적으로 진행하기 보다는 CRO와 같은 수탁기관과 협업하여 신약을 개발하게 됩니다.
CRO 사업분야는 1) 기술수준이 높고, 2) 기술의 변화속도가 빠르며, 3) 표준의 중요성이 크고, 4) 개발프로세스의 복잡성이 크다는 특징이 있습니다. 따라서 필요로 하는 제약바이오업계의 수요가 매우 큰 반면, 이러한 연구개발서비스를 제공하는 민간부문의 공급 규모는 부족한 상황입니다. 이는 국내 CRO 업체가 2000년대부터 설립되기 시작하였고, 경력을 갖춘 전문인력이 아직 많지 않은 까닭입니다. 정부에서도 2022년 제약산업 육성 ·지원 시행계획을 확정하여 제약산업 전문인력양성에 힘쓰고 있습니다. 결론적으로 CRO 사업분야는 전체 연구개발서비스 자체의 성장가능성이 클 뿐만 아니라, 민간부문을 통한 R&D 서비스산업 활성화의 잠재력 또한 크기 때문에 지속적으로 커질 것으로 예상됩니다.
| [CRO 세부분야] |
| 세부분야 | 정의 |
|---|---|
| 임상연구 (Clinical Research Services) |
임상시험관리기준(GCP: Good Clinical Practice)에 따라 비임상시험 통과 이후 단계적으로 인체에 적용해 보는 임상(Clinical)시험의 설계, 수행 및 결과보고를 수행 |
| 조기개발 (Early-phase Development Services) |
우수실험실기준(GLP: Good Laboratory Practice)에 따라 우선적으로 후보물질을 동물에 적용해 유효성과 독성을 평가하는 비임상(Non-Clinical)시험의 설계, 수행 및 결과보고를 수행 |
| 시험기관 (Laboratory Services) |
허가기관에서 제정한 시험법 가이드라인(TG: Test Guideline)에 따라 평가항목을 설정하여 시험의 설계, 수행 및 결과보고를 수행 |
| 컨설팅 (Consulting Services) |
다양한 적응증에 대한 프로토콜 개발을 포함한 개발 전략 수립부터 임상 시험 전반의 과정에 있어 가이드 수립 |
| 데이터관리 (Data Management Service) |
Phase I~III, Medical device 허가용 임상시험과 허가 후 진행하는 Phase IV 임상시험, OS (Observational Study) 및 NIS (Non-Intervention Study) 등의 관찰연구, IIT (Investigator-Initiated Trial: 연구자 주도 임상), PMS (Post-Marketing Study: 시판 후 조사)에 이르기까지 임상 데이터 수집 및 관리 |
|
(출처 : 당사 제시) |
글로벌 CRO 시장은 2018년 기준 452억 8300만달러(약 56조 5585억원)였으나, 연평균 7.7%의 성장률을 기록하면서 오는 2024년에는 717억달러(한화 약 89조 5533억원)에 이를 것으로 전망되고 있습니다. 코로나19에 따른 신규 의약품의 개발 증가와 더불어 2년여 기간동안의 팬데믹에 따라 비대면/디지털이 사회 전반적으로 확산되며 임상시험에도 영향을 끼쳤으며, 향후 CRO시장은 이 같은 비대면/디지털 전환이 확산되며 오히려 코로나19 이전보다도 높은 성장률을 보일 것으로 예측했습니다. 글로벌 CRO시장 규모는 임상 연구 서비스와 조기 개발 서비스, 전임상 서비스 부분이 성장을 이끌어가며 코로나19 이전보다도 높은 수준에서 지속 성장할 것으로 예상됩니다.
| [글로벌 CRO 시장 전망(2017~2024E)] |
| (단위 : 10억 달러) |
 |
|
글로벌 cro 시장 전망(2017 - 2024e |
|
(출처 : Frost&Sullivan, Global CRO Mraket, Forecast to 2024, 글로벌 CRO시장현황 및 전망. 2020.1. 생명공학정책연구센터) |
| [글로벌 CRO 분야별 규모] |
| (단위 : 백만달러) |
| 구분 | 2020년 | 2025년 | CAGR | |
| 임상 연구 서비스 | 임상1상 | 3,029.2 | 4,159.6 | 6.5% |
| 임상2상 | 9,179.2 | 14,417.3 | 9.5% | |
| 임상3상 | 12,478.1 | 19,815.3 | 9.7% | |
| 임상4상 | 3,968.0 | 6,166.0 | 9.2% | |
| 소계 | 28,654.4 | 44,558.3 | 9.2% | |
| 조기 개발 서비스 | 화학·제조·관리 | 5,439.8 | 7,723.4 | 7.7% |
| 전임상 서비스 | 4,038.2 | 5,889.5 | 13.2% | |
| 디스커버리연구 | 2,449.6 | 3,664.6 | 7.8% | |
| 소계 | 11,927.6 | 17,277.5 | 7.7% | |
| 시험기관 서비스 | 4,294.0 | 7,975.3 | 13.2% | |
| 컨설팅 서비스 | 2,644.5 | 3,465.6 | 5.6% | |
| 데이터관리 서비스 | 252.8 | 492.1 | 14.3% | |
| 합 계 | 47,773.3 | 73,768.8 | 9.1% | |
|
(출처 : 연구개발특구진흥재단, 임상시험 수탁기관(CRO) 서비스 시장, 2021, Frost&Sullivan, Hybridization of Clinical Trial Designs Reviving Global CRO Market, 2020) |
이러한 성장 전망의 주요 원인으로는 최근 다국적 제약사 및 바이오제약기업들의 신약 개발 비용을 절감을 위한 생산, 개발, 임상, 마케팅, 유통 등의 위탁사(CRO업체 등) Outsourcing 사례의 증가를 꼽을 수 있습니다.
| [아웃소싱 현황] |
 |
|
small-cap 기업의 아웃소싱 현황 |
 |
|
mid-cap 기업의 아웃소싱 현황 |
| 출처: FDA, 이베스트투자증권 리서치센터 |
국내 시장 또한 글로벌 CRO 대비 높은 성장률을 보이며 지속적인 성장세를 유지하고있습니다. 최근 5년간 세계 CRO 시장의 연평균 성장률이 9.9%에 그친 데 비해 대한민국의 전체 CRO 시장은 동 기간 연평균 14%의 규모로 증가했습니다.이 외에 주목할 만 한 사항으로는 국내 CRO 업체 중 내자 CRO 업체의 점유율이 있습니다. 국내 CRO시장에서 국내 CRO와 외자 CRO의 시장점유율을 관찰하였을 때, 2014년 국내 CRO의 비중이 33.3%에서 2018년 46.2%으로 증가하였고, 2020년 최초로 내자 CRO의 점유율이 외자 CRO의 점유율을 초과하였습니다.
국내 CRO 시장은 임상 연구 서비스와 조기 개발 서비스를 두 축으로하여 글로벌 CRO 시장 예상 연평균 성장률 9.1%를 상회하는 10.4% 수준으로 지속 성장할 것으로 전망되며, 2020년 기준 임상 연구 서비스의 CRO 시장 비중은 69.8%에서 2027년 66.0%로 소폭 줄어들 것으로 전망되지만 그럼에도 불구하고 여전히 높은 수준의 점유율과 성장률을 보일 것으로 추정됩니다. 국내 CRO 시장 중 임상시험의 경우, 2023년 식약처의 임상시험계획 승인 건수는 783건으로 허가 신청을 앞둔 의약품의 개발이 활발하게 진행되고 있음을 확인할 수 있습니다.
| [국내 CRO 매출현황] |
 |
|
국내 cro |
| (출처 : KoNECT, 임상시험 산업 실태조사(2020.12)) |
| [국내 CRO 분야별 규모] |
| (단위 : 십억원) |
| 구분 | 2020년 (십억원) |
2027년 (십억원) |
CAGR | |
| 임상 연구 서비스 | 임상1상 | 142.3 | 280.6 | 10.2% |
| 임상2상 | 249.3 | 501.5 | 10.5% | |
| 임상3상 | 667.3 | 1,414.80 | 11.3% | |
| 임상4상 | 200.2 | 386.8 | 9.9% | |
| 소계 | 1,259.10 | 2,583.70 | 10.8% | |
| 조기 개발 서비스 | 화학·제조·관리 | 60.9 | 113.6 | 9.3% |
| 전임상 | 78.8 | 151.4 | 9.8% | |
| 디스커버리연구 | 160.8 | 323.4 | 10.5% | |
| 소계 | 300.5 | 588.4 | 10.1% | |
| 시험기관 서비스 | 219.2 | 421.2 | 9.8% | |
| 컨설팅 서비스 | 185.2 | 321.4 | 8.2% | |
| 합 계 | 1,802.70 | 3,914.50 | 11.7% | |
| (출처 : 연구개발특구진흥재단, 임상시험 수탁기관(CRO) 서비스 시장, 2021, The Insight Partners, Asia Pacific Healthcare Contract Research Organizations(CRO), 2020, 키움증권) |
[시장 경쟁상황]
CRO사업은 지식기반 산업으로 고부가가치 산업임과 동시에 전방산업인 제약/바이오산업과의 파트너쉽으로 인식될 만큼 큰 연관성을 가지고 있습니다. 또한, 주요 고객인 제약/바이오 기업 및 연구기관들은 수익성 개선과 신약개발의 비용절감, 신속한 제품화 등을 목적으로 CRO기업에게 전문적으로 위탁을 하고 있으며 이러한 추세는 향후 지속적으로 확대될 것으로 판단됩니다. CRO산업은 특성상 초기투자비용이 높고, 높은 수준의 시험기자재, 숙련된 연구원 등 연구기반 인프라 구축까지 많은 시간과 자원의 소요가 필요하며, 특히 유효성 시장의 경우 관련 실험경험의 유무가 계약과 관련한 중요한 요소가 되는 만큼 진입장벽이 높은 산업적 특성을 가지고 있어 단기적으로 시장의 경쟁관계가 크게 변화되지 않을 것으로 판단됩니다.
국내에 등록된 CRO업체는 약 70개사로, 업무 범위에 따라 크게 △임상 CRO (임상시험 계획, 시험기관 선정, 임상 모니터링, 데이터 관리 등) △분석 CRO (비임상시험, 검체 분석, 분석법 개발 등)로 분류됩니다. 당사는 비임상부터 임상 1상까지 사업영역을 직접적으로 운영하고 있으며 경쟁사의 홈페이지, 사업보고서 및 식약처의 인허가 현황을 바탕으로 경쟁현황을 분석했을 때 다음과 같이 시장에서 경쟁하고 있습니다.
| [국내 CRO 주요 사업영역 현황] |
| 구분 | 기업 | 비임상 | 임상 | ||
| 효능 | 독성(GLP) | 1상/생동분석(GCLP) | 2~4상 | ||
| 동물실험 | 디티앤씨알오 | O | O | O | △ |
| 바이오톡스텍 | △ | O | × | × | |
| 코아스템켐온 | × | O | × | × | |
| 안전성평가연구소 | × | O | × | × | |
| HLB바이오스텝 (구 노터스) |
O | × | × | × | |
| 임상 설계/모니터링 | 드림씨아이에스 | × | × | O | O |
| 에이디엠코리아 | × | × | O | O | |
| 비임상/임상1상 | 바이오인프라 | × | × | O | × |
| 인바이츠바이오코아 |
× | × | O | × | |
| 압타머사이언스 (구 인터내셔널사이언티픽스탠다드) |
x | O | O | × | |
| (출처: 각사 사업보고서) |
1) 비임상 및 효능시장
국내외 비임상시험 모든 과정은 법으로 규정화된 엄격한 허가제도 아래서 관리·운영하고 있습니다. 결국 비임상CRO는 세포 및 동물을 이용하여 신물질의 안전성을 평가하는 사업군으로 정부로부터 GLP 인증을 받은 연구기업(기관)을 의미합니다. 식품의약품안전처 최근 공고일 기준 현재 비임상 시험을 위해 국내 식품의약품안전처로부터 GLP 인증을 받은 비임상 시험 기관은 23개 기관이 있습니다. 국내의 경우 1986년 보건복지부에서 「의약품안전성시험관리기준」을 고시함으로써 의약 품 등의 안전성 평가시험에 대한 GLP적용을 규제하기 시작하였습니다. 이후산업화학물질 및 농약 등 산업 각 분야의 신물질에 대해 GLP적용이 확대실시 되고 있으며, 각 영역마다 주관 정부기관이 해당 GLP규정을 제정하여 관리하고 있습니다.즉, 의약품, 화장품, 식품, 화학 물질 등 허가 관련하여 해당 정부기관에 제출되는 자료는 GLP 인증기관에서 적합하게 수행된 자료만을 인정하도록 법제화되어 있습니다.
비임상시험 중 효능시험은 신약 후보 물질의 효능 여부를 확인하는 시험으로 in vitro(생체 외) 시험과 in vivo(생체 내) 시험으로 구분됩니다. in vitro 시험은 세포와 같은 간단한 마커를 통해 기전을 확인하는 시험이며, in vivo 시험은 적정 동물모델을 선정하여 효능 유무를 평가하는 시험입니다. 효능시험은 신약개발 초기단계에서 가장 중요한 요소로 과거에는 연구자가 직접 진행하거나 대학교 연구소 등에서 진행하였으나, 최근에는 신뢰성 있는 데이터 확보를 위해 외부 전문기관에 의뢰하는 추세입니다.
비임상 안전성(독성)시험은 효능이 확인된 물질의 안전성을 확인하는 시험입니다. 세포 또는 동물을 이용하여 허가기관에서 제정한 시험법 가이드라인(TG: Test Guideline)에 따라 평가항목을 설정하여 시험을 진행하게 됩니다. 비임상 시험은 약물의 특성에 따라 발생할 수 있는 1) 독성 발현여부, 2) 투여 용량에 따른 무해용량 확인, 3) 향후 임상시험 용량 설정할 수 있게 하는 임상시험의 예비시험 성격을 가집니다. 동사는 2014년 비임상시험 실시기관인 GLP 지정을 시작으로 현재까지 의약품의 GLP 인증을 보유하고 있습니다.
효능시험의 경우 허가기관의 GLP 인증이 필요 없는 Non-GLP 시험으로 수행하는 바, 대학교 연구소, 해외 CRO기관 등에 주로 실험을 의뢰하여 경쟁상황 파악에 어려움이 있습니다. 다만, 국내에서는 효능시험 분야의 가장 큰 규모의 서비스를 진행하는 CRO인 HLB바이오스텝(구 노터스)이 연구소, 제약사 자체 시험 등을 제외한 국내 효능시험의 40% 정도를 점유한다고 자체적으로 추정하고 있습니다.
2) 임상 및 분석 서비스 시장
임상시험 중 동사가 주로 수행하는 업체 중 주요 경쟁업체로는 바이오코아, 바이오인프라, 바이오썬텍, 및 한국의약연구소 등이 있으며, 구체적인 시장 조사 자료는 존재하지 않으나 바이오코아와 바이오인프라, 바이오썬텍 등 상위 3개사 및 동사가 국내 생동성 시험 시장의 과반 이상을 점유하고 있는 것으로 추정됩니다. 다만 최근 생동성 시장의 성장은 규제 변화에 의한 특수적 성격을 띄고 있다는 점에서 시장규모에 한계가있을 수밖에 없는 바, 동사는 효능평가와 독성평가와 연계할 수 있는 임상 1상 시장에 주안점을 잡고 점유율을 확보하는 것을 목표로 하고 있습니다.
임상은 사람을 대상으로 한 안전성 및 효능효과 시험으로, 임상 1상은 사람에게 약물을 적용(투여)하여 1) 부작용 유무를 확인하는 안전성과 2) 약물의 혈중 농도를 통하여 내약반응정도를 평가하는 시험입니다. 신물질신약의 1상 임상시험은 최초 임상시험(first in human study) 으로 실시하는 단회투여 용량증가시험 (dose escalation study)부터 몇가지 디자인의 시험을 실시할 수 있습니다. 1상 임상시험은 안전성과 약동학을 평가하는 것이 목적이기 때문에 건강성인을 대상으로 실시하는 것이 보통이나 세포독성 함암제의 경우 말기 암환자를 대상으로 하는 등 의학적 고려에 의해 다른 방법으로 실시될 수도 있습니다.
신물질신약 분석법의 개발에 있어서는 공개된 물성 정보가 없기 때문에 시험의뢰자가 분석법 개발에 필요한 충분한 기초물성 정보를 제공하지 못하는 경우에는 분석법 개발에 필요한 물성 정보를 측정하면서 분석법을 개발해야 합니다. 동사는 2018년 임상시험 검체분석기관인 GCLP 지정 이래 120건 이상의 임상 PK 분석을 수행해 왔으며, 분석법 개발 서비스도 함께 제공하고 있습니다.
그러나, 위와 같은 CRO 업계의 성장에도 불구하고 향후 경기 불황 등 거시적 또는 미시적 요인에 의하여 주력 시장의 성장세가 둔화될 경우, 해당 사업부의 영업활동에 부정적 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자에 임하시기 바랍니다.
(주13) 정정 전
| 가. 매출부진 및 지속적 손실 발생 위험 당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 단백질이나 유전자 소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 바이오기업으로 현재도 동일 사업을 영위하고 있습니다. 주요 파이프라인으로는 AST-201(고형암치료제), AST-202(혈액암치료제), AST-203(고형암 치료제) 등이 있습니다. 당사의 바이오 사업 특성 상 기술이전을 통한 매출 발생까지 오랜 시간이 소요되며, 높은 연구개발비 사용에 의하여 설립 이래 지속적으로 영업손실 및 당기순손실이 발생하고 있는 상황입니다. 당사는 현재 보유하고 있는 주요 파이프라인의 라이선스 아웃을 통한 매출 발생을 위하여 노력하고 있는 상황입니다. 그러나 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 단백질이나 유전자 소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 바이오기업으로 현재도 동일 사업을 영위하고 있습니다. 주요 파이프라인으로는 AST-201(고형암치료제), AST-202(혈액암치료제), AST-203(고형암 치료제) 등이 있습니다. 당사의 바이오 사업 특성 상 기술이전을 통한 매출 발생까지 오랜 시간이 소요되며, 높은 연구개발비 사용에 의하여 설립 이래 지속적으로 영업손실 및 당기순손실이 발생하고 있는 상황입니다. 당사의 최근 3개년 및 2024년 반기 요약 손익계산서는 다음과 같습니다.
| [요약 손익계산서] |
| (단위 : 백만원) |
| 과 목 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 매출액 | 71 | 103 | 243 | 358 | 269 |
| 매출원가 | 12 | 20 | 52 | 72 | 113 |
| 매출총이익 | 59 | 83 | 191 | 287 | 156 |
| 판매비와관리비 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| 영업이익 | -3,628 | -6,837 | -12,207 | -8,320 | -4,067 |
| 법인세비용차감전순이익 | -5,589 | -7,160 | -13,602 | -8,301 | -3,831 |
| 법인세비용 | - | - | - | -1,186 | - |
| 당기순이익 | -5,589 | -7,160 | -13,602 | -7,116 | -3,831 |
| (출처 : 정기보고서) |
[성장성 분석]
당사의 매출액은 2021년 269백만원, 2022년 358백만원을 기록한 이후, 2023년 243백만원으로 매출이 감소하였습니다. 2024년 반기 또한 매출액 71백만원으로 전년 동기 103백만원 대비 감소하였습니다.
당사는 신약개발부문, 진단제품부문, 압타머서비스부문으로 매출을 구분하고 있습니다. 당사의 신약개발부문은 현재까지 매출이 발생하고 있지 않고, 현재 다기능 압타머 플랫폼(BiFAp)을 통하여 항암제 등 first-in-class 치료제를 개발하고 있습니다. 발굴된 치료제의 임상적 유효성(Proof of Concept)을 확보한 후에 글로벌 제약사에게 라이센싱하거나 regional player와 공동개발을 추진하여 수익을 창출하는 사업모델로, 이를 위하여 Bio USA, Bio Europe, ChinaBio 등의 비즈니스 파트너링 미팅에 참가하여 다수의 파트너사와 기술 이전 및 공동개발 협력 등을 논의해 오고 있습니다.
진단제품 부문은 AptoMIA(Aptamer-based Multivariate Index Assay) platform에 기반하여 암 등 조기진단이 어려운 질병을 대상으로 하고 있으며, 세계 최초로 폐암을 조기에 진단할 수 있는 압타머 기반 압토디텍트 렁(AptoDetect™-Lung)을 상용화하였습니다. 혈액에 존재하는 7종의 단백질 바이오마커를 정량적으로 검출하고 알고리즘을 통하여 폐암에 대한 진단정보를 제공하는 기술입니다. 그러나 진단제품 매출은 2022년 3백만원, 2024년 반기 1백만원으로 아직까지 미미한 수준입니다.
압타머 서비스 부문은 압타머 합성 서비스 및 발굴서비스로 구분됩니다. 압타머 서비스를 제공하기 위해서는 고성능의 압타머를 합성 및 발굴할 수 있는 플랫폼 기술을 보유하고 있어야 하며, 당사를 포함하여 소수의 압타머 회사들이 각자 보유하고 있는고유의 압타머 합성 및 발굴 기술을 통해 연구자들에게 서비스를 제공하고 있습니다. 당사는 압타머 플랫폼 기술과 10년 이상 운영해온 결과물로 압타머 아카이브를 보유하고 있습니다. 압타머 아카이브에는 250 여종의 단백질에 특이적인 결합력이 확인된 1,500 여종의 압타머 서열정보 등이 포함되어 있습니다.
압타머 합성 및 발굴에 대한 높은 성공률과 우수한 결합력을 위해 동사는 변형핵산 기반 발굴기술 (변형핵산 라이브러리 제작, 버퍼 조성 구축을 포함한 최적의 PCR 반응조건 구축 등) 구축하여 진입장벽은 높다고 할 수 있습니다. 특히, 당사가 개발을 완료하고 특허 출원한 ViroSELEX를 통하여 기존의 SELEX의 단점을 보완한 차세대 압타머 발굴 기술로서세포막 단백질 바이오마커에 우수한 압타머 확보가 가능합니다. 압타머 서비스 무문 매출은 2021년 269백만원, 2022년 355백만원, 2023년 243백만원, 2024년 반기 71백만원으로 당사 매출의 대부분을 차지하고 있습니다.
| [매출액 내역] |
| (단위 : 천원) |
|
서비스 및 제품명 |
2024년 반기 매출액 |
2023년 반기 매출액 (비율) |
2023년도 매출액 |
2022년도 매출액 |
2021년도 매출액 |
제 품 설 명 |
|---|---|---|---|---|---|---|
|
AST-201 |
- | - | - | - | - | 항암물질 젬시타빈을 내재화하여 GPC3-양성종양(간세포암, 비소세포폐암 등)에 선택적인 항암 효능을 가진 압타머-약물 복합체 |
| AST-202 (혈액암치료제) |
- | - | - | - | - |
1. CD25 발현률이 높은 혈액암(급성골수성백혈병, T 세포 림프종 등)을 직접 타겟하는 압타머-약물 복합체 2. 종양조직에서 조절 T 세포 선택적인 활성조절과 사멸을 유도해서 항종양 면역활성을 높이는 압타머-약물 복합체 |
|
AST-203 (고형암 치료제) |
- | - | - | - | - |
1. Trop2 양성 종양에 선택적인 압타머-약물 복합체 2. ADC 개발에 난항을 격고 있는 췌장암 및 폐암을 주요 적응증으로 개발 |
| 압토디텍트 렁 (AptoDetect™-Lung) |
560 |
- |
- | 2,860 (0.8%) |
- |
혈액에서 7종 단백질을 측정하고 알고리즘
분석을 통하여 폐암 위험도 정보 제공 |
|
올리고 합성 |
63,635 |
95,255 (92.4%) |
215,136 (88.5%) |
319,326 (89.1%) |
183,321 (68.1%) |
압타머 포함 다양한 oligonucleotides 물질에 대한 다양한 형태의 합성 서비스를 제공
|
|
압타머 발굴 |
6,861 |
7,800 (7.6%) |
28,050 (11.5%) |
36,067 (10.1%) |
85,954 (31.9%) |
변형 핵산 라이브러리를 이용한 차세대 압타머 발굴 기술을 기반으로 높은 특이도와 결합력을 가지는 압타머를 발굴해 연구자들에게 제공하는 서비스
|
| 합계 | 71,056 | 103,055 | 243,186 | 358,253 | 269,275 | - |
| (출처 : 정기보고서) |
[수익성 분석]
당사의 최근 3년 및 2024년 반기 수익성을 분석해보면 2021년 4,067백만원, 2022년 8,320백만원, 2023년 12,207백만원, 2024년 반기 3,628백만원의 영업손실이 지속적으로 발생하고 있으며, 2021년 3,831백만원, 2022년 7,116백만원, 2023년 13,602백만원, 2024년 반기 5,589백만원의 당기순손실이 지속적으로 발생하고 있는 상황입니다. 연도별 수익성 추이는 하기와 같습니다.
| [수익성 추이] |
| (단위 : 백만원) |
| 과 목 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 매출액 | 71 | 103 | 243 | 358 | 269 |
| 매출원가 | 12 | 20 | 52 | 72 | 113 |
| 매출총이익 | 59 | 83 | 191 | 287 | 156 |
| 판매비와관리비 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| 영업이익 | -3,628 | -6,837 | -12,207 | -8,320 | -4,067 |
| 금융수익 | 413 | 678 | 1,300 | 639 | 263 |
| 금융비용 | 2,374 | 1,000 | 2,698 | 629 | 44 |
| 기타수익비용 | - | - | 3 | 9 | 17 |
| 법인세비용차감전순이익 | -5,589 | -7,160 | -13,602 | -8,301 | -3,831 |
| 법인세비용 | - | - | - | -1,186 | - |
| 당기순이익 | -5,589 | -7,160 | -13,602 | -7,116 | -3,831 |
| 영업이익률 | 적자 | 적자 | 적자 | 적자 | 적자 |
| 당기순이익률 | 적자 | 적자 | 적자 | 적자 | 적자 |
| (출처 : 정기보고서) |
2021년에는 매출총이익이 156백만원 발생하였고, 판매비와 관리비가 4,224백만원 발생하여 영업손실 4,067백만원을 기록하였습니다. 이자수익으로 인한 금융수익 263백만원이 발생하여 3,831백만원 당기순손실이 발생하였습니다.
2022년에는 매출이 소폭 증가하여 매출총이익이 287백만원 발생하였으나, 경상연구개발비 증가로 인하여 판매비가 관리비가 8,606백만원으로 증가, 8,320백만원 영업손실을 기록하였습니다. 2022년 이전까지 차입금이 존재하지 않아 금융비용이 매우 낮은 편이었으나, 2022년 10월 제1회 사모 전환사채를 발행하면서 금융비용이 발생하기 시작하였습니다. 2022년은 단기금융상품 이자수익으로 인한 금융수익 639백만원, 전환사채로 인한 이자비용 및 파생상품평가손실 629백만원이 발생하여 당기순손실 7,116백만원을 기록하였습니다.
2023년에는 매출 감소로 매출총이익이 191백만원만 발생하였고, 경상연구개발비 증가로 인하여 판매비가 관리비가 12,398백만원으로 증가, 12,207백만원 영업손실을 기록하였습니다. 단기금융상품 이자수익으로 인한 금융수익 1,300백만원, 주가상승으로 인하여 전환사채파생상품평가손실 1,211백만원과 이자비용 1,394백만원으로 금융비용 2,698백만원이 발생하여 당기순손실 13,602백만원을 기록하였습니다.
2024년 반기에는 매출 감소로 매출총이익이 59백만원만 발생하였고, 경상연구개발비 감소로 인하여 판매비가 관리비가 3,688백만원으로 감소하였고, 3,628백만원 영업손실을 기록하였습니다. 주가상승으로 전환사채파생상품평가손실 1,554백만원이 발생하여 금융비용이 2,374백만원으로 증가, 당기순손실 5,589백만원을 기록하였습니다.
당사의 판매비와관리비는 2021년 4,224백만원 이후 2022년 8,606백만원, 2023년 12,398백만원으로 지속적으로 증가하고 있습니다. 판매비와관리비의 증가 원인은 인원증가로 인한 급여 및 기업규모 증가로 인한 기타비용 증가도 있지만 가장 주요한 원인은 경상연구개발비 증가 때문입니다. 경상연구개발비는 2021년 1,763백만원, 2022년 6,025백만원, 2023년 9,359백만원으로 매년 큰폭으로 증가하는 추세입니다. 당사의 경상연구개발비는 신약후보물질의 전임상/임상비용과 연구원 인건비가 가장 큰 비중을 차지합니다. 지난 3년간 경상연구개발비는 고형암 치료제 AST-201의 전임상(2021-22년)과 임상준비비용(2023년), 혈액암 치료제 AST-202의 전임상비용(2023-24년)으로 사용되었으며, 그중에서도 AST-201의 임상시험용 의약품 위탁생산에 약 100억원이 소요되었습니다(Asymchem사 690만 달러, Wuxi STA사 47만 달러). 해당 의약품은 임상 1상 시험을 마칠 때까지 사용하게 되므로, 2025년까지 AST-201 임상으로 인한 대규모 지출은 없을 예정입니다. 이러한 이유로 2024년 반기 경상연구개발비가 1,959백만원으로 전년동기대비 큰폭으로 감소하였습니다.
| [판매비와 관리비 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 급여 | 1,000 | 984 | 1,811 | 1,508 | 1,237 |
| 상각비 | 138 | 151 | 293 | 293 | 436 |
| 경상연구개발비 | 1,959 | 5,360 | 9,359 | 6,025 | 1,763 |
| 기타영업비용 | 591 | 425 | 935 | 780 | 787 |
| 복리후생비 | 117 | 114 | 253 | 210 | 184 |
| 지급수수료 | 260 | 126 | 320 | 285 | 364 |
| 여비교통비 | 50 | 29 | 48 | 22 | 14 |
| 세금과공과 | 48 | 43 | 81 | 81 | 63 |
| 건물관리비 | 42 | 42 | 86 | 83 | 61 |
| 보험료 | 15 | 11 | 22 | 19 | 18 |
| 기타 | 59 | 60 | 124 | 80 | 83 |
| 합 계 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| (출처 : 정기보고서) |
상기 기재한 바와 같이 당사는 연구개발에 대한 지속적인 투자로 인해 영업손실 및 당기순손실 상태가 지속되고 있습니다. 현재 보유하고 있는 주요 파이프라인의 라이선스 아웃을 통한 매출 발생을 위하여 노력하고 있는 상황입니다. 그러나 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주13) 정정 후
| 가. 매출부진 및 지속적 손실 발생 위험 당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 단백질이나 유전자 소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 바이오기업으로 현재도 동일 사업을 영위하고 있습니다. 주요 파이프라인으로는 AST-201(고형암치료제), AST-202(혈액암치료제), AST-203(고형암 치료제) 등이 있습니다. 당사의 바이오 사업 특성 상 기술이전을 통한 매출 발생까지 오랜 시간이 소요되며, 높은 연구개발비 사용에 의하여 설립 이래 지속적으로 영업손실 및 당기순손실이 발생하고 있는 상황입니다. 당사는 현재 보유하고 있는 주요 파이프라인의 라이선스 아웃을 통한 매출 발생을 위하여 노력하고 있는 상황입니다. 그러나 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 단백질이나 유전자 소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 바이오기업으로 현재도 동일 사업을 영위하고 있습니다. 주요 파이프라인으로는 AST-201(고형암치료제), AST-202(혈액암치료제), AST-203(고형암 치료제) 등이 있습니다. 당사의 바이오 사업 특성 상 기술이전을 통한 매출 발생까지 오랜 시간이 소요되며, 높은 연구개발비 사용에 의하여 설립 이래 지속적으로 영업손실 및 당기순손실이 발생하고 있는 상황입니다. 당사의 최근 3개년 및 2024년 반기 요약 손익계산서는 다음과 같습니다.
| [요약 손익계산서] |
| (단위 : 백만원) |
| 과 목 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 매출액 | 71 | 103 | 243 | 358 | 269 |
| 매출원가 | 12 | 20 | 52 | 72 | 113 |
| 매출총이익 | 59 | 83 | 191 | 287 | 156 |
| 판매비와관리비 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| 영업이익 | -3,628 | -6,837 | -12,207 | -8,320 | -4,067 |
| 법인세비용차감전순이익 | -5,589 | -7,160 | -13,602 | -8,301 | -3,831 |
| 법인세비용 | - | - | - | -1,186 | - |
| 당기순이익 | -5,589 | -7,160 | -13,602 | -7,116 | -3,831 |
| (출처 : 정기보고서) |
[성장성 분석]
당사의 매출액은 2021년 269백만원, 2022년 358백만원을 기록한 이후, 2023년 243백만원으로 매출이 감소하였습니다. 2024년 반기 또한 매출액 71백만원으로 전년 동기 103백만원 대비 감소하였습니다.
당사는 신약개발부문, 진단제품부문, 압타머서비스부문으로 매출을 구분하고 있습니다. 당사의 신약개발부문은 현재까지 매출이 발생하고 있지 않고, 현재 다기능 압타머 플랫폼(BiFAp)을 통하여 항암제 등 first-in-class 치료제를 개발하고 있습니다. 발굴된 치료제의 임상적 유효성(Proof of Concept)을 확보한 후에 글로벌 제약사에게 라이센싱하거나 regional player와 공동개발을 추진하여 수익을 창출하는 사업모델로, 이를 위하여 Bio USA, Bio Europe, ChinaBio 등의 비즈니스 파트너링 미팅에 참가하여 다수의 파트너사와 기술 이전 및 공동개발 협력 등을 논의해 오고 있습니다.
진단제품 부문은 AptoMIA(Aptamer-based Multivariate Index Assay) platform에 기반하여 암 등 조기진단이 어려운 질병을 대상으로 하고 있으며, 세계 최초로 폐암을 조기에 진단할 수 있는 압타머 기반 압토디텍트 렁(AptoDetect™-Lung)을 상용화하였습니다. 혈액에 존재하는 7종의 단백질 바이오마커를 정량적으로 검출하고 알고리즘을 통하여 폐암에 대한 진단정보를 제공하는 기술입니다. 그러나 진단제품 매출은 2022년 3백만원, 2024년 반기 1백만원으로 아직까지 미미한 수준입니다.
압타머 서비스 부문은 압타머 합성 서비스 및 발굴서비스로 구분됩니다. 압타머 서비스를 제공하기 위해서는 고성능의 압타머를 합성 및 발굴할 수 있는 플랫폼 기술을 보유하고 있어야 하며, 당사를 포함하여 소수의 압타머 회사들이 각자 보유하고 있는고유의 압타머 합성 및 발굴 기술을 통해 연구자들에게 서비스를 제공하고 있습니다. 당사는 압타머 플랫폼 기술과 10년 이상 운영해온 결과물로 압타머 아카이브를 보유하고 있습니다. 압타머 아카이브에는 250 여종의 단백질에 특이적인 결합력이 확인된 1,500 여종의 압타머 서열정보 등이 포함되어 있습니다.
압타머 합성 및 발굴에 대한 높은 성공률과 우수한 결합력을 위해 동사는 변형핵산 기반 발굴기술 (변형핵산 라이브러리 제작, 버퍼 조성 구축을 포함한 최적의 PCR 반응조건 구축 등) 구축하여 진입장벽은 높다고 할 수 있습니다. 특히, 당사가 개발을 완료하고 특허 출원한 ViroSELEX를 통하여 기존의 SELEX의 단점을 보완한 차세대 압타머 발굴 기술로서세포막 단백질 바이오마커에 우수한 압타머 확보가 가능합니다. 압타머 서비스 무문 매출은 2021년 269백만원, 2022년 355백만원, 2023년 243백만원, 2024년 반기 71백만원으로 당사 매출의 대부분을 차지하고 있습니다.
| [매출액 내역] |
| (단위 : 천원) |
|
서비스 및 제품명 |
2024년 반기 매출액 |
2023년 반기 매출액 (비율) |
2023년도 매출액 |
2022년도 매출액 |
2021년도 매출액 |
제 품 설 명 |
|---|---|---|---|---|---|---|
|
AST-201 |
- | - | - | - | - | 항암물질 젬시타빈을 내재화하여 GPC3-양성종양(간세포암, 비소세포폐암 등)에 선택적인 항암 효능을 가진 압타머-약물 복합체 |
| AST-202 (혈액암치료제) |
- | - | - | - | - |
1. CD25 발현률이 높은 혈액암(급성골수성백혈병, T 세포 림프종 등)을 직접 타겟하는 압타머-약물 복합체 2. 종양조직에서 조절 T 세포 선택적인 활성조절과 사멸을 유도해서 항종양 면역활성을 높이는 압타머-약물 복합체 |
|
AST-203 (고형암 치료제) |
- | - | - | - | - |
1. Trop2 양성 종양에 선택적인 압타머-약물 복합체 2. ADC 개발에 난항을 격고 있는 췌장암 및 폐암을 주요 적응증으로 개발 |
| 압토디텍트 렁 (AptoDetect™-Lung) |
560 |
- |
- | 2,860 (0.8%) |
- |
혈액에서 7종 단백질을 측정하고 알고리즘
분석을 통하여 폐암 위험도 정보 제공 |
|
올리고 합성 |
63,635 |
95,255 (92.4%) |
215,136 (88.5%) |
319,326 (89.1%) |
183,321 (68.1%) |
압타머 포함 다양한 oligonucleotides 물질에 대한 다양한 형태의 합성 서비스를 제공
|
|
압타머 발굴 |
6,861 |
7,800 (7.6%) |
28,050 (11.5%) |
36,067 (10.1%) |
85,954 (31.9%) |
변형 핵산 라이브러리를 이용한 차세대 압타머 발굴 기술을 기반으로 높은 특이도와 결합력을 가지는 압타머를 발굴해 연구자들에게 제공하는 서비스
|
| 합계 | 71,056 | 103,055 | 243,186 | 358,253 | 269,275 | - |
| (출처 : 정기보고서) |
[수익성 분석]
당사의 최근 3년 및 2024년 반기 수익성을 분석해보면 2021년 4,067백만원, 2022년 8,320백만원, 2023년 12,207백만원, 2024년 반기 3,628백만원의 영업손실이 지속적으로 발생하고 있으며, 2021년 3,831백만원, 2022년 7,116백만원, 2023년 13,602백만원, 2024년 반기 5,589백만원의 당기순손실이 지속적으로 발생하고 있는 상황입니다. 연도별 수익성 추이는 하기와 같습니다.
| [수익성 추이] |
| (단위 : 백만원) |
| 과 목 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 매출액 | 71 | 103 | 243 | 358 | 269 |
| 매출원가 | 12 | 20 | 52 | 72 | 113 |
| 매출총이익 | 59 | 83 | 191 | 287 | 156 |
| 판매비와관리비 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| 영업이익 | -3,628 | -6,837 | -12,207 | -8,320 | -4,067 |
| 금융수익 | 413 | 678 | 1,300 | 639 | 263 |
| 금융비용 | 2,374 | 1,000 | 2,698 | 629 | 44 |
| 기타수익비용 | - | - | 3 | 9 | 17 |
| 법인세비용차감전순이익 | -5,589 | -7,160 | -13,602 | -8,301 | -3,831 |
| 법인세비용 | - | - | - | -1,186 | - |
| 당기순이익 | -5,589 | -7,160 | -13,602 | -7,116 | -3,831 |
| 영업이익률 | 적자 | 적자 | 적자 | 적자 | 적자 |
| 당기순이익률 | 적자 | 적자 | 적자 | 적자 | 적자 |
| (출처 : 정기보고서) |
2021년에는 매출총이익이 156백만원 발생하였고, 판매비와 관리비가 4,224백만원 발생하여 영업손실 4,067백만원을 기록하였습니다. 이자수익으로 인한 금융수익 263백만원이 발생하여 3,831백만원 당기순손실이 발생하였습니다.
2022년에는 매출이 소폭 증가하여 매출총이익이 287백만원 발생하였으나, 경상연구개발비 증가로 인하여 판매비가 관리비가 8,606백만원으로 증가, 8,320백만원 영업손실을 기록하였습니다. 2022년 이전까지 차입금이 존재하지 않아 금융비용이 매우 낮은 편이었으나, 2022년 10월 제1회 사모 전환사채를 발행하면서 금융비용이 발생하기 시작하였습니다. 2022년은 단기금융상품 이자수익으로 인한 금융수익 639백만원, 전환사채로 인한 이자비용 및 파생상품평가손실 629백만원이 발생하여 당기순손실 7,116백만원을 기록하였습니다.
2023년에는 매출 감소로 매출총이익이 191백만원만 발생하였고, 경상연구개발비 증가로 인하여 판매비가 관리비가 12,398백만원으로 증가, 12,207백만원 영업손실을 기록하였습니다. 단기금융상품 이자수익으로 인한 금융수익 1,300백만원, 주가상승으로 인하여 전환사채파생상품평가손실 1,211백만원과 이자비용 1,394백만원으로 금융비용 2,698백만원이 발생하여 당기순손실 13,602백만원을 기록하였습니다.
2024년 반기에는 매출 감소로 매출총이익이 59백만원만 발생하였고, 경상연구개발비 감소로 인하여 판매비가 관리비가 3,688백만원으로 감소하였고, 3,628백만원 영업손실을 기록하였습니다. 주가상승으로 전환사채파생상품평가손실 1,554백만원이 발생하여 금융비용이 2,374백만원으로 증가, 당기순손실 5,589백만원을 기록하였습니다.
당사의 판매비와관리비는 2021년 4,224백만원 이후 2022년 8,606백만원, 2023년 12,398백만원으로 지속적으로 증가하고 있습니다. 판매비와관리비의 증가 원인은 인원증가로 인한 급여 및 기업규모 증가로 인한 기타비용 증가도 있지만 가장 주요한 원인은 경상연구개발비 증가 때문입니다. 경상연구개발비는 2021년 1,763백만원, 2022년 6,025백만원, 2023년 9,359백만원으로 매년 큰폭으로 증가하는 추세입니다. 당사의 경상연구개발비는 신약후보물질의 전임상/임상비용과 연구원 인건비가 가장 큰 비중을 차지합니다. 지난 3년간 경상연구개발비는 고형암 치료제 AST-201의 전임상(2021-22년)과 임상준비비용(2023년), 혈액암 치료제 AST-202의 전임상비용(2023-24년)으로 사용되었으며, 그중에서도 AST-201의 임상시험용 의약품 위탁생산에 약 100억원이 소요되었습니다(Asymchem사 690만 달러, Wuxi STA사 47만 달러). 해당 의약품은 임상 1상 시험을 마칠 때까지 사용하게 되므로, 2025년까지 AST-201 임상으로 인한 대규모 지출은 없을 예정입니다. 이러한 이유로 2024년 반기 경상연구개발비가 1,959백만원으로 전년동기대비 큰폭으로 감소하였습니다.
| [판매비와 관리비 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 급여 | 1,000 | 984 | 1,811 | 1,508 | 1,237 |
| 상각비 | 138 | 151 | 293 | 293 | 436 |
| 경상연구개발비 | 1,959 | 5,360 | 9,359 | 6,025 | 1,763 |
| 기타영업비용 | 591 | 425 | 935 | 780 | 787 |
| 복리후생비 | 117 | 114 | 253 | 210 | 184 |
| 지급수수료 | 260 | 126 | 320 | 285 | 364 |
| 여비교통비 | 50 | 29 | 48 | 22 | 14 |
| 세금과공과 | 48 | 43 | 81 | 81 | 63 |
| 건물관리비 | 42 | 42 | 86 | 83 | 61 |
| 보험료 | 15 | 11 | 22 | 19 | 18 |
| 기타 | 59 | 60 | 124 | 80 | 83 |
| 합 계 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| (출처 : 정기보고서) |
[상장당시 재무사항 예측치와 실적치 비교]
당사는 기술성장기업으로 코스닥시장 상장규정 제7조 제2항에서 정하는 신규상장 심사요건 특례를 적용받아 2020년 9월 16일 코스닥시장에 상장되었습니다. 당사는 특례상장기업으로서 코스닥시장 상장을 위한 증권신고서에 미래 제품별 매출액을 추정하여 기재하였는바, 당시 증권신고서에 기재된 최근 3개 사업연도에 대한 재무사항 예측치와 실적치를 비교하면 다음과 같습니다.
| (상장일 : | 2020. 09. 16 | 인수인 : 키움증권) | (단위 :백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 괴리율(%) |
|---|---|---|---|---|
| 2020년 | 매출액 | 1,155 | 229 | 80 |
| 신약개발 | - | - | - | |
| 진단제품 | 581 | - | 100 | |
| 압타머서비스 | 575 | 229 | 60 | |
| 영업이익 | (4,438) | (3,923) | 12 | |
| 당기순이익 | (4,588) | (3,843) | 16 | |
| 2021년 | 매출액 | 9,657 | 269 | 97 |
| 신약개발 | 6,779 | - | 100 | |
| 진단제품 |
2,042 |
- | 100 | |
| 압타머서비스 | 836 | 269 | 68 | |
| 영업이익 | (5,019) | (4,067) | 19 | |
| 당기순이익 | (5,169) | (3,831) | 26 | |
| 2022년 | 매출액 | 35,695 |
358 |
99 |
| 신약개발 | 18,894 | - | 100 | |
| 진단제품 | 15,604 | 3 | 100 | |
| 압타머서비스 | 1,197 | 355 | 70 | |
| 영업이익 | 10,012 |
(8,320) |
183 | |
| 당기순이익 | 9,862 |
(7,116) |
172 | |
| 2023년 | 매출액 | 78,274 | 243 | 100 |
| 신약개발 | 43,072 | - | 100 | |
| 진단제품 | 33,442 | - | 100 | |
| 압타머서비스 | 1,760 | 243 | 86 | |
| 영업이익 | 41,427 | (12,207) | 129 | |
| 당기순이익 | 32,196 | (13,602) | 142 |
| (주1) '괴리율'은 '(예측치-실적치)/예측치'로 산정하여 백분율로 기재하였으며, 예측치는 투자설명서에 기재된 예측치를 반영하였습니다. |
-
매출액
당사는 당시 증권신고서상 3가지 신약 후보물질의 각 적응증에 대한 유사 신약 후보물질의 기술이전 사례, 임상 예정 추진 일정등을 고려하여 다음과 같이 매출 발생시 점 및 매출액을 추정하였습니다.
| [신약 파이프라인별 매출 발생시점 추정] |
| 구분 | 2020년(E) | 2021년(E) | 2022년(E) | 2023년(E) |
|---|---|---|---|---|
| AST-101 (인슐린대체제) |
- | - | - 임상 1상 완료 - 기술이전 계약 체결 - 계약금 수령 |
- |
| AST-102 (인슐린민감제) |
- | - 공동연구 계약 체결 (option agreement fee 수령) - 전임상 완료 - 기술이전 계약 체결 - 계약금 수령 |
- | - 임상1상 완료 - 임상2상 진입 - 마일스톤 수령 |
| AST-201 (간암치료제) |
- | - | - | - 임상2상 완료 - 기술이전 계약 - 계약금 수령 |
| [신약 파이프라인별 매출액 추정] |
| (단위 : 백만원) |
| 구분 | 2020년(E) | 2021년(E) | 2022년(E) | 2023년(E) |
|---|---|---|---|---|
| AST-101 (인슐린대체제) | - | - | 18,894 | - |
| AST-102 (인슐린민감제) | - | 6,779 | - | 8,231 |
| AST-201 (간암치료제) | - | - | - | 34,841 |
| 합계 | - | 6,779 | 18,894 | 43,072 |
(1) AST-101 (인슐린대체제) / AST-102 (인슐린민감제) - 개발 잠정 중단
당사는 AlloMAp 플랫폼을 활용한 First-in-class 당뇨 신약 개발(제1/2형 당뇨의 지속형 인슐린대체제 및 인슐린민감제)을 추진했으며 Johnson & Johnson 사와 제휴(2016년 4분기), Novo Nordisk 사와 MTA(물질이전계약) 체결(2018년 3분기), 범부처신약개발과제에 선정(2019년 1분기)되었습니다. 그러나 비임상 단계에서 산출된 데이터로 후보물질의 경제성평가를 수행한 결과, 인슐린 기반 치료제가 기존 치료제의 대세로 자리잡은 현 시장 상황과 투여주기를 점점 늘려가는 당뇨 치료제 개발 방향성을 고려하여 △주1회 투여 방식으로 제형변화의 필요성 △시장의 경쟁 심화 △GLP-1 수용체작용체의 확대 △인슐린 기반 치료제의 지속적인 단가 인하로 인한 가격경쟁력 확보의 불확실성 등의 요인으로 경쟁력이 높지 않음을 확인하였고, 2022년 3분기 해당 파이프라인의 개발을 잠정 중단하기로 결정하였습니다. 당사의 후보물질은 인슐린 장기투여로 인한 부작용(인슐린 저항성, 심혈관 위험, 체중증가 등)에서 경쟁우위에 있으나, 대사질환 계열 약물의 임상적 유의성을 입증하기 위한 대규모 임상 등 투자비용 대비 기대수익이 충분하지 않았던 까닭입니다. 현 시점에서는 추가적인 제형연구를 통한 약동력학적 특성 개선과 활성평가 연구를 일부 병행 중으로, 임상 단계 진입은 공동개발 파트너사가 정해진 이후에 가능할 것으로 예상됩니다.
(2) AST-201 (간암치료제) - 개발 일정 지연
현재 동사가 개발중인 고형암치료제 AST-201( 바이오마커인 글라이피칸3(GPC3)에 선택적으로 결합하는 표적형 압타머 신약) 으로 2024년 3월 국내 1상 임상시험 IND 승인 신청을 완료하였습니다.
당사의 고형암 치료제 AST-201은 상장 당시 후보물질 단계였으며, 2021~22년 전임상 시험 - 2023년 임상시험용 의약품 위탁생산 - 2024년 현재 식약처 임상시험계획승인(IND)을 신청한 상태입니다. 이는 상장 당시보다 2년 정도 지연된 것으로, 주요 사유는 △코로나19로 인한 임상용 의약품 위탁생산의 지연 및 전임상 독성평가를 위한 위탁시험기관 확보의 어려움 △중국 제약사와의 파트너링 논의지연 등입니다. 현 시점은 식약처 임상승인 신청을 마친 상태로 2024년 10월 중 IND 승인을 예상하고 있습니다. 이에 10월부터 국내 다기관임상(4개 병원)에 착수할 계획이며, 2025년 임상 중간데이터를 확보하여 해외제약사 기술이전계약 체결을 목표하고 있습니다. 당사는 글로벌 기술이전을 목표로 2024년 상반기 China Bio, Bio USA 전시박람회에 참가하였으며, 기술이전을 목표로 사업개발 활동을 진행 중입니다.
AST-201은 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안한 바 있으며, CDMO 협력사인 Asymcem, Wuxi 사와의 네트워크도 활용 가능할 것입니다. 또한 2024년 9월 AST-201의 물질특허가 중국 특허청에 등록결정이 되어 기술이전에도 긍정적 영향을 미칠 수 있습니다.
(3) 진단제품
당사는 당시 증권신고서 상 2020년 하반기부터는 본격적인 매출이 발생될 것으로 예상하였고, 해외시장 진출의 발판을 마련하기 위해 세계 최대 시장인 중국 진출을 위하여 중국 BGT 사와 협력 계약을 체결하고 임상 및 ICL 기반 서비스 사업을 추진한 바 있습니다. 그러나 2020년 중국발 Covid-19가 유행함에 따라 중국시장 진출의 어려움을 겪어 현재는 중단된 상황입니다. 2023년 해외사장 진출의 본격화를 예상하여 투자설명서상 추정 매출 33,442백만원으로 기재하였으나 실적은 0원으로 괴리율은 100%입니다.
괴리 발생 원인으로는 1~2차년도 중국발 코로나19가 유행함에 따라 중국시장 진출의 어려움을 겪었으며, 국내 시장의 경우 코로나19의 영향과 더불어 신의료기술 평가 유예 제도 시행이 지연됨에 따라 임상 활동 또한 지연되었습니다. 3차년도의 평가유예 시행 이후로는 2022년 기말 기존 수탁기관의 계약 종료에 따른 새로운 새로운 수탁기관과의 계약 과정에서 수탁기관 공백에 따른 병원별 비급여 코드 확보에 어려움을 겪었으며, 수탁기관과의 공동 마케팅 활동 또한 어려움을 겪었습니다. 이로 인해 진단제품의 1~3차 년도 괴리율이 100%-100%-100% 발생되었으나 2023년 하반기 새로운 수탁기관과의 계약으로 현재는 비급여 코드를 활발히 확보 중이며, 건강검진 시장 진입과 공동 마케팅 활동에 전념하고 있습니다.
현재는 건강검진센터를 위주로 '비소세포폐암 위험도 검사'의 공급처를 늘리기 위해 병원 연계 검진시장을 진입하고 있으며, 분당차병원 건강검진센터를 시작으로 서비스 채널을 늘려나가고 있습니다. 또한 여러 해외시장 진출을 타진 중이나, 그중에서도 인도가 빠르게 진전 중입니다. 인도 A사와는 지난 2024년 5월 MOU를 체결하고 임상시험 및 인허가를 준비하는 단계입니다. 인도 CEC (Clinical Ethical Committee, 임상윤리위원회)의 승인을 받기 위한 서류를 제출한 상태이며, 빠르면 10월 내 승인여부 결과가 나올 것으로 예상하고 있습니다. 협력사와의 협업이 계획대로 진전된다면 2026년 하반기부터 초도 매출이 발생할 것으로 예상됩니다.
(4) 압타머 서비스
당사가 보유한 카타로그 압타머에 대한 합성 서비스는 설립부터 계속하여 진행하고 있습니다
. 많은 고객으로부터 고품질의 합성 노하우를 인정받아 일반 DNA 올리고뉴클레오타이드 합성 서비스 또한 제공하고 있습니다
. 당사의 합성 생산능력은 수십 mg까지 자체 합성이 가능한 수준으로써 전임상개발 이전단계(동물효능평가)까지를 대상으로 합니다. 전임상 및 임상을 위한 압타머 합성은 Outsourcing이 가능한 업체를 확보하고 있고 내부합성과 동일한 품질로 생산되도록 관리합니다.
당사의 압타머 발굴 서비스는 압타머 플랫폼 기술을 통해 약 8주 정도의 기간이 소요되는 서비스입니다. 1인의 연구원이 한 번의 발굴 진행으로 최대 48개의 표적 분자에 대해 동시에 압타머를 개발할 수 있는 다중 발굴 플랫폼입니다.
- 영업이익
영업이익의 경우 0차년도 예측치 -4,438백만원 실적치 -3,923백만원으로 괴로율 12%, 1차년도 예측치 -5,019백만원 실적치 -4,067 백만원으로 괴리율 19%으로, 주요 괴리 발생원인으로는 매출 괴리율 발생원인에 기인합니다. 또한 국내 시장의 신의료 기술 평가 유예 제도 시행 지연과 해외시장의 코로나19에 의한 해외 임상 지연, 임상개발비의 지출 또한 지연됨에 따라 괴리율이 상대적으로 소폭 발생되었으나, 2차년도의 경우 예측치 10,012백만원 실적치 -8,320백만원 괴리율 183%, 3년차도의 경우 예측치 41,427백만원 실적치 -12,207백만원 괴리율 129%으로 2차년도의 경우 압타머를 이용한 신약개발이라는 특수성의 사유로 지연되었던 CDMO의 발굴로 인한 임상개발비의 지출의 본격화로 1차년도에 비해 괴리율이 대폭 상승하였으며, 3년차도의 경우 2024년 1분기내 IND filing 및 임상1상시험을 앞두고 전 임상단계 연구개발비의 지출금액이 대부분 발생됨에 따라 괴리율이 129% 발생되었습니다.
- 당기순이익
당기순이익의 경우 0차년도 예측치 -4,588백만원 실적치 -3,843백만원으로 괴리율 16%, 1차년도 예측치 -5,169백만원 실적치-3,831백만원으로 괴리율 26%로 상대적으로 괴리율이 낮은 편이었으나, 2년차도의 경우 예측치 9,862백만원 실적치 -7,116백만원으로 괴리율 172% 가 발생되었습니다. 주요 괴리 발생 원인으로는 0, 1차년도의 경우 코로나 유행에 따른 임상지연의 사유로 임상개발비 지출의 이연으로 괴리율이 상대적으로 소폭 발생하였으나 2~3차년도의 경우 추정 매출의 괴리와 제1회 전환사채와 관련된 이자비용과 파생상품 평가손실의 인식으로 괴리율이 대폭 증가하였습니다. 특히 3차년도의 경우 임상 1상 진입전 전임상 단계의 지출의 발생 시점이 도래함에 따라 예측치 32,196백만원 실적치 -13,602백만원으로 142%의 괴리율이 발생되었으며, 제1회 전환사채와 관련된 파생상품평가손실 1,211백만원과 이자비용 1,394백만원으로 금융비용 2,698백만원이 발생하여 손실이 증가 되었습니다.
이처럼 당사가 예측하지 못한 변수들이 발생하면서 추정치와 실제 매출 및 손익은 매우 높은 괴리를 보이고 있습니다. 이는 당사가 상장시 계획한 영업활동이 정상적으로 실행되고 있지 않음을 의미합니다. 투자자께서는 당사의 향후 매출액 및 이익 또한 추정치와 높은 괴리를 보일 수 있음을 유의하시고 투자에 임하시기 바랍니다.
[수익성 개선 계획]
(1) 신약개발의 효율성 강화
당사는 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 당사는 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고 조속한 사업성을 확보하고자 합니다.
한편 기술이전에 따른 단계별 마일스톤 및 시판 로열티 등은 적정 시점에 적정 기준을 통과 하여야만 수취 가능합니다. 만약 파트너사(Licensee)의 임상 진행이나 허가 취득 과정 등에 차질이 발생하는 경우 기술이전 계약이 중도 해지될 리스크가 존재합니다. 또한, 기술이전 지연이나 실패, 파트너사의 연구개발 및 허가취득 지연이나 실패로 인해 당사가 예측하는 수익성 및 재무적인 안정성의 불확실성이 존재한다는 점을 투자자께서는 유의하여 투자하시기 바랍니다.
당사는 신약개발기획 단계에서부터 사업, 생산, 연구개발 부서가 협업하여 과제 완료 시 기술적 목표뿐만 아니라 상업적 목표를 반드시 달성할 수 있도록 단계-관문 체계(Stage Gate System)로 설계하고자 하며 이렇게 되면 매 단계가 완료되기 직전에 엄격한 심사를 거쳐 중간 관문(Gate)을 통과해야만 다음 단계로 진입할 수 있게되고, 이를 달성하지 못할 경우 연구를 중단하거나 추가 연구 기간을 부여받게 되는데 이러한 체계를 효과적으로 운영하여 연구개발 생산성을 높이고자 합니다.
또한 당사는 정기적으로 자금소요 계획을 업데이트하고, 우선순위를 관리하는 등 파이프라인 강화 및 라이선스아웃(L/O)이 계획대로 진행될 수 있도록 유동성 관리에 집중할 계획입니다.
다만, 압타머 기술 기반 승인 신약으로는 Macugen(Pfizer, 2004)과 Izervay(Astellas, 2023) 두 종이 있고, 이중 Macugen는 보다 효과적인 신약 출시로 인해 현재는 시장에서 판매중단이 되었습니다. Macugen과 Izervay은 황반변성에 대한 신약으로 현재까지 암 치료에 승인된 압타머는 없습니다.
압타머 기술 기반 신약에 대한 자세한 사항은 1. 사업위험 - 가. 압타머 산업 성장 지연에 따른 위험을 참고하시기 바랍니다.
(2) 진단제품 사업의 조속한 시장진입 및 원가 절감
당사는 압토디텍트 렁에 대해 국내는 기존과 같이 상급종합병원 처방과 동시에 급여전환을 통한 1,2차 병원에서의 처방 활성화에 주력함과 동시에 연간 600만명에 달하는 국내 기업검진시장에서 빠르게 자리를 잡아가는 것을 목표로 하고 있습니다. 다만 이러한 시장진입시 준비가 충분치 않았던 사유로 인해 기대했던 매출이 발생하기까지 예상보다 오랜 기간이 걸리고 있으며, 이에 따른 진단사업 본격화까지 사업화 지연, 수탁기관과의 계약관계로 인한 매출 지연 등의 위험이 존재합니다. 한편 회사는 해외 진출을 위한 신규 제품 개발을 준비중에 있는데, 기존 제품은 마이크로 비드 기반의 분석법을 사용하는데, 고가의 분석장비인 루미넥스를 필요로 한 반면, 신규 제품은 PCR 진단장비로 분석이 가능하다는 것이 장점으로, 기존 제품은 검사 다음날 수검자가 결과를 받아볼 수 있었지만 PCR 제품은 검사 당일 결과를 확인할 수 있게 됨으로써 해외 진출이 수월해지게 됨에 따랄 이를 마케팅 전략으로 활용할 방침입니다. 당사는 향후 Scale Up 이후에도 원가경쟁력을 확보하기 위한 원가분석 및 원가절감 활동을 계획하고 있으며 이를 위해 중소기업형 ERP 도입을 검토하고자 합니다. 또한 국내 생산제품을 해외로 수출하는 방식도 고려됐지만 생산단가와 국제 물류비용 부담으로 현지 생산방식이 비교우위를 가질 것으로 판단하고 준비을 진행중인 바 이에 대한 다각적인 수익성 검증에 집중할 계획입니다.
당사 진단제품에 대한 자세한 사항은 1. 사업위험 - 사. 폐암 조기진단 제품에 대한 경쟁 상황의 변화에 따른 목표 시장 점유율 감소를 참고하시기 바랍니다.
(3) CRO 사업의 효율적 운용
당사의 CRO사업은 여러 제약바이오 기업과 다양한 프로젝트를 수행해 왔고 특히 바이오의약품 시장의 성장을 예상하고 선제적인 대비를 해온 만큼 국내 기업 주도 신약 개발 프로젝트가 활성화되고 글로벌 기술이전 사례가 많아짐에 따라 이를 뒷받침할 고품질 분석 서비스로 협력을 확대하겠다는 계획을 가지고 있습니다. 한편 CRO사업은 프로젝트가 주를 이루고 있는 만큼 수익성 기반의 선별적인 수주와 인건비, 유지보수비, 유틸리티비 등을 감안한 손익분기점 관리에도 만전을 기하고자 하며 매출 확대와 고객군 확대 과정에서 수반되는 Capex 투자에 대해서도 타당성 검증 및 효율적인 운용을 통해 생산성을 높이는데 주력할 방침입니다.
CRO사업과 관련된 자세한 사항은 2. 회사위험 - 라. (주)인터내셔널사이언티픽스탠다드 관련 위험을 참고하시기 바랍니다.
상기 기재한 바와 같이 당사는 연구개발에 대한 지속적인 투자로 인해 영업손실 및 당기순손실 상태가 지속되고 있습니다. 현재 보유하고 있는 주요 파이프라인의 라이선스 아웃을 통한 매출 발생을 위하여 노력하고 있는 상황입니다. 그러나 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주14) 정정 전
| 나. 재무안정성 악화 위험 당사의 2024년 반기말 연결기준 부채총계는 21,283백만원이며, 부채비율은 216.8%, 차입금의존도는 54.7%입니다. 전환사채, 리스 외에 금융기관 차입금은 없는 상황이며, 최근 3년 지속적인 당기순손실 발생에 의하여 재무구조가 악화되고 있는 상황입니다. 금번 주주배정 후 실권주 일반공모 유상증자가 성공적으로 진행될 경우 당사의 재무안정성 지표는 추가적으로 개선될 것으로 예상하고 있습니다. 그러나 당사의 경우 최근 지속적인 당기순손실이 발생하고 있으며, 향후에도 사업이 흑자전환되지 않아 당기순손실이 지속될 경우 재무안정성이 악화될 가능성이 높습니다. 투자자께서는 당사의 부채상환능력 및 사업의 흑자전환 여부 등에 대하여 유의하여 투자해 주시기 바랍니다. |
당사의 2024년 반기말 연결기준 부채총계는 21,283백만원이며, 부채비율은 216.8%, 차입금의존도는 54.7%입니다. 전환사채, 리스 외에 금융기관 차입금은 없는 상황이며, 최근 3년 지속적인 당기순손실 발생에 의하여 재무구조가 악화되고 있는 상황입니다. 최근 3년 당사의 재무안정성비율 추이는 다음과 같습니다.
| [재무안정성 비율] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 자산 총계 | 31,100 | 32,536 | 45,645 | 33,262 |
| - 유동자산 | 21,061 | 25,034 | 37,964 | 24,815 |
| - 비유동자산 | 10,039 | 7,502 | 7,681 | 8,446 |
| 부채 총계 | 21,283 | 17,057 | 16,423 | 1,800 |
| - 유동부채 | 18,102 | 15,239 | 2,538 | 432 |
| - 비유동부채 | 3,181 | 1,818 | 13,885 | 1,369 |
| 자본 총계 | 9,817 | 15,479 | 29,223 | 31,461 |
| 차입금 총계 | 17,000 | 14,586 | 12,635 | 107 |
| - 단기차입금 | 151 | - | - | - |
| - 유동성 전환사채 | 16,264 | 14,530 | - | - |
| - 유동 리스부채 | 327 | 43 | 46 | 38 |
| - 비유동 전환사채 | - | - | 12,537 | - |
| - 비유동리스부채 | 258 | 12 | 52 | 69 |
| 부채비율 | 216.80% | 110.19% | 56.20% | 5.72% |
| 차입금의존도 | 54.66% | 44.83% | 27.68% | 0.32% |
| 업종평균 부채비율 | - | - | 52.81% | 57.04% |
| 업종평균 차입금의존도 | - | - | 16.77% | 18.28% |
| (출처 : 한국은행, "2022년 기업경영분석", 2023.10., 정기보고서) | |
| 주1: | 부채비율 = 부채총계 / 자본총계 |
| 주2: | 차입금의존도 = 차입금총계 / 자산총계 |
| 주3: | 업종평균 비율은 한국은행이 발간한 2022년 기업경영분석 C21(의료용 물질 및 의약품) 기준으로 작성하였습니다. |
당사의 2021년말 부채비율은 5.7%이었으나, 2022년 10월 제1회 전환사채 165억원을 발행 및 당기순손실 7,116백만원을 기록하면서 2022년 말 부채비율이 56.2%로 크게 증가하였습니다. 2023년은 2022년 대비 부채 및 차입금 총계가 크게 증가하지 않았으나 당기순손실 13,602백만원을 기록하면서 부채비율이 110.2%로 증가하였습니다. 2024년 반기에도 5,589백만원의 당기순손실이 발생하면서 결손금이 64,414백만원으로 누적되며 부채비율이 216.8%로 악화되었습니다.
2024년 반기말 기준 단기차입금 151백만원은 종속회사인 (주)인터내셔널사이언티픽스탠다드의 차입금으로 기존 경영진과 연계된 차입금입니다. 동 차입금의 담보로 매출채권이 제공되어 있고, 2024년 3분기 중 상환될 예정입니다.
2024년 반기말으로 당사는 금융기관으로부터의 차입금은 없는 상태를 유지하고 있습니다. 2024년 반기말 당사의 부채 계정 중 가장 높은 비중을 차지하고 있는 부채는 전환사채로 16,264백만원이며, 실질적인 부채 금액은 1회차 전환사채 16,500백만원입니다. 해당 전환사채의 만기는 2027년 10월 06일까지이며, 전환가액은 4,058원으로 만기까지 전환이 이루어지지 않을 시 상환할 계획에 있습니다.
| [미상환 전환사채 발행 현황] | |||
| (기준일 : | 증권신고서 제출일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| (출처 : 정기보고서) |
당사의 2024년 반기말 연결기준 부채총계는 21,283백만원, 차입금의존도는 54.7%로 금번 주주배정 후 실권주 일반공모 유상증자가 성공적으로 진행될 경우 당사의 재무안정성 지표는 추가적으로 개선될 것으로 예상하고 있습니다. 그러나 당사의 경우 최근 지속적인 당기순손실이 발생하고 있으며, 향후에도 사업이 흑자전환되지 않아 당기순손실이 지속될 경우 재무안정성이 악화될 가능성이 높습니다. 투자자께서는 당사의 부채상환능력 및 사업의 흑자전환 여부 등에 대하여 유의하여 투자해 주시기 바랍니다.
(주14) 정정 후
| 나. 재무안정성 악화 위험 당사의 2024년 반기말 연결기준 부채총계는 21,283백만원이며, 부채비율은 216.8%, 차입금의존도는 54.7%입니다. 전환사채, 리스 외에 금융기관 차입금은 없는 상황이며, 최근 3년 지속적인 당기순손실 발생에 의하여 재무구조가 악화되고 있는 상황입니다. 금번 주주배정 후 실권주 일반공모 유상증자가 성공적으로 진행될 경우 당사의 재무안정성 지표는 추가적으로 개선될 것으로 예상하고 있습니다. 그러나 당사의 경우 최근 지속적인 당기순손실이 발생하고 있으며, 향후에도 사업이 흑자전환되지 않아 당기순손실이 지속될 경우 재무안정성이 악화될 가능성이 높습니다. 투자자께서는 당사의 부채상환능력 및 사업의 흑자전환 여부 등에 대하여 유의하여 투자해 주시기 바랍니다. |
당사의 2024년 반기말 연결기준 부채총계는 21,283백만원이며, 부채비율은 216.8%, 차입금의존도는 54.7%입니다. 전환사채, 리스 외에 금융기관 차입금은 없는 상황이며, 최근 3년 지속적인 당기순손실 발생에 의하여 재무구조가 악화되고 있는 상황입니다. 최근 3년 당사의 재무안정성비율 추이는 다음과 같습니다.
| [재무안정성 비율] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 자산 총계 | 31,100 | 32,536 | 45,645 | 33,262 |
| - 유동자산 | 21,061 | 25,034 | 37,964 | 24,815 |
| - 비유동자산 | 10,039 | 7,502 | 7,681 | 8,446 |
| 부채 총계 | 21,283 | 17,057 | 16,423 | 1,800 |
| - 유동부채 | 18,102 | 15,239 | 2,538 | 432 |
| - 비유동부채 | 3,181 | 1,818 | 13,885 | 1,369 |
| 자본 총계 | 9,817 | 15,479 | 29,223 | 31,461 |
| 차입금 총계 | 17,000 | 14,586 | 12,635 | 107 |
| - 단기차입금 | 151 | - | - | - |
| - 유동성 전환사채 | 16,264 | 14,530 | - | - |
| - 유동 리스부채 | 327 | 43 | 46 | 38 |
| - 비유동 전환사채 | - | - | 12,537 | - |
| - 비유동리스부채 | 258 | 12 | 52 | 69 |
| 부채비율 | 216.80% | 110.19% | 56.20% | 5.72% |
| 차입금의존도 | 54.66% | 44.83% | 27.68% | 0.32% |
| 업종평균 부채비율 | - | - | 52.81% | 57.04% |
| 업종평균 차입금의존도 | - | - | 16.77% | 18.28% |
| (출처 : 한국은행, "2022년 기업경영분석", 2023.10., 정기보고서) | |
| 주1: | 부채비율 = 부채총계 / 자본총계 |
| 주2: | 차입금의존도 = 차입금총계 / 자산총계 |
| 주3: | 업종평균 비율은 한국은행이 발간한 2022년 기업경영분석 C21(의료용 물질 및 의약품) 기준으로 작성하였습니다. |
당사의 2021년말 부채비율은 5.7%이었으나, 2022년 10월 제1회 전환사채 165억원을 발행 및 당기순손실 7,116백만원을 기록하면서 2022년 말 부채비율이 56.2%로 크게 증가하였습니다. 2023년은 2022년 대비 부채 및 차입금 총계가 크게 증가하지 않았으나 당기순손실 13,602백만원을 기록하면서 부채비율이 110.2%로 증가하였습니다. 2024년 반기에도 5,589백만원의 당기순손실이 발생하면서 결손금이 64,414백만원으로 누적되며 부채비율이 216.8%로 악화되었습니다.
2024년 반기말 기준 단기차입금 151백만원은 종속회사인 (주)인터내셔널사이언티픽스탠다드의 차입금으로 기존 경영진과 연계된 차입금입니다. 동 차입금의 담보로 매출채권이 제공되어 있고, 2024년 3분기 중 상환될 예정입니다.
2024년 반기말 기준 당사는 금융기관으로부터의 차입금은 없는 상태를 유지하고 있습니다. 2024년 반기말 당사의 부채 계정 중 가장 높은 비중을 차지하고 있는 부채는 전환사채로 16,264백만원이며, 실질적인 부채 금액은 1회차 전환사채 16,500백만원입니다. 해당 전환사채의 만기는 2027년 10월 06일까지이며, 전환가액은 4,058원으로 만기까지 전환이 이루어지지 않을 시 상환할 계획에 있습니다.
| [미상환 전환사채 발행 현황] | |||
| (기준일 : | 증권신고서 제출일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| (출처 : 정기보고서) |
[제1회 전환사채 관련 사항]
(1) 전환사채 인수자에 관한 사항
당사는 2022년 10월 4일 이사회 결의를 통해 2022년 10월 5일 '주식회사 압타머사이언스 제1회 무기명식 이권부 무보증 사모 전환사채 인수계약서'(이하 인수계약서)를 체결하였고, 2022년 10월 6일 제1회 전환사채 165억원을 발행하였습니다. 당사는 동 내용을 2022년 10월 06일 주요사항보고서를 통해 공사한 바 있습니다. 당사와 당사의 제1회 전환사채 인수자 사이에 관계가 없고, 발행결정 전후 6개월 이내 거래내역 및 계획 또한 존재하지 않습니다. 당사의 제1회 전환사채 인수자는 다음과 같습니다.
| [전환사채 인수자 내역] |
| 발행 대상자명 | 회사 또는 최대주주와의 관계 |
선정경위 | 발행결정 전후 6월이내 거래내역 및 계획 |
발행권면(전자등록) 총액(원) |
비고 |
|---|---|---|---|---|---|
| 주식회사 BNK투자증권 | - | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 3,000,000,000 | - |
|
수성자산운용 주식회사 (투자일임업자의 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 2,000,000,000 | - |
| 에이스수성신기술투자조합 16호 | - | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,000,000,000 | - |
| NH투자증권 주식회사 (본건 펀드1의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 600,000,000 | - |
| NH투자증권 주식회사 (본건 펀드2의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 200,000,000 | - |
| NH투자증권 주식회사 (본건 펀드3의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 300,000,000 | - |
| NH투자증권 주식회사 (본건 펀드4의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 900,000,000 | - |
| NH투자증권 주식회사 (본건 펀드5의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 400,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드6의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드7의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드8의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 100,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드9의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 삼성증권 주식회사 (본건 펀드10의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,500,000,000 | - |
| 삼성증권 주식회사 (본건 펀드11의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 한국투자증권 주식회사 (본건 펀드12의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| NH투자증권 주식회사 (본건 펀드13의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,000,000,000 | - |
| NH투자증권 주식회사 (본건 펀드14의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| NH투자증권 주식회사 (본건 펀드15의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,500,000,000 | - |
| 케이비증권 주식회사 (본건 펀드16의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 엔에이치투자증권 주식회사 (본건 펀드17의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 100,000,000 | - |
| 엔에이치투자증권 주식회사 (본건 펀드18의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 150,000,000 | - |
| 엔에이치투자증권 주식회사 (본건 펀드19의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 250,000,000 | - |
본건 펀드 1: 오라이언명품코스닥벤처일반사모투자신탁제73호
본건 펀드 2: 오라이언명품코스닥벤처일반사모투자신탁제70호
본건 펀드 3: 오라이언명품코스닥벤처일반사모투자신탁제71호
본건 펀드 4 : 오라이언명품코스닥벤처일반사모투자신탁제75호
본건 펀드 5 : 제이씨에셋코스닥벤처일반사모투자신탁6호
본건 펀드 6 : 제이씨에셋코스닥벤처일반사모투자신탁7호
본건 펀드 7 : 제이씨에셋코스닥벤처일반사모투자신탁8호
본건 펀드 8 : 제이씨에셋코스닥벤처일반사모투자신탁10호
본건 펀드 9 : 제이씨에셋코스닥벤처일반사모투자신탁11호
본건 펀드 10 : SP 메자닌 일반 사모투자신탁8호
본건 펀드 11 : SP 메자닌T 전문투자형 사모투자신탁1호
본건 펀드 12 : 레이크 코스닥벤처 일반사모증권투자신탁 제1호(전문투자자)
본건 펀드 13 : 라이언 Blue 코스닥벤처 일반 사모투자신탁 제3호
본건 펀드 14 : QB V1 코스닥벤처 일반 사모투자신탁 제2호
본건 펀드 15 : 리딩코스닥벤처일반사모투자신탁제5호
본건 펀드 16 : 페블즈 코스닥벤처 일반사모 투자신탁 제1호
본건 펀드 17: 타이거 코스닥벤처 메자닌스토리 315 일반 사모투자신탁
본건 펀드 18: 타이거 코스닥벤처 메자닌드리븐 318 일반 사모투자신탁
본건 펀드 19: 타이거 코스닥벤처 위드메자닌 317 일반 사모투자신탁
(2) 조기상환청구권에 관한 사항
인수계약서 제3조 11항에 의거 제1회 전환사채에는 조기상환청구권이 존재합니다. 인수계약서 상 조기상환청구권에 대한 내용은 다음과 같습니다.
| [인수계약서 제3조 11항] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
11. 조기상환청구권(Put Option)에 관한 사항: 본 사채의 사채권자는 본 사채의 발행일로부터 2년이 되는 날(해당일이 영업일이 아닌 경우 그 익영업일을 말함) 및 그 이후 매 3개월에 해당되는 날(이하 “조기상환지급일”이라 한다)에 본 사채의 전부 또는 일부에 대하여 만기 전 조기상환할 것을 청구할 수 있다. 이 경우 발행회사는 본 사채의 전자등록금액과 함께 전자등록금액에 대하여 조기상환지급일까지 조기상환수익율 연 0.0%를 가산한 금액(이하 “조기상환금액”이라 하며, 구체적인 내역은 아래 가.호에 기재된 바와 같다)을 조기상환지급일에 지급하여야 한다. 단, 조기상환지급일이 영업일이 아닌 경우에는 그 다음 영업일에 상환하고 조기상환지급일 이후의 이자는 계산하지 아니한다. 가.
조기상환지급일별 조기상환금액:
2024년 10월 06일: 전자등록금액의 100.0000%,
2025년 01월 06일: 전자등록금액의 100.0000%,
2025년 04월 06일: 전자등록금액의 100.0000%,
2025년 07월 06일: 전자등록금액의 100.0000%,
2025년 10월 06일: 전자등록금액의 100.0000%,
2026년 01월 06일: 전자등록금액의 100.0000%,
2026년 04월 06일: 전자등록금액의 100.0000%,
2026년 07월 06일: 전자등록금액의 100.0000%,
2026년 10월 06일: 전자등록금액의 100.0000%,
2027년 01월 06일: 전자등록금액의 100.0000%,
2027년 04월 06일: 전자등록금액의 100.0000%,
2027년 07월 06일: 전자등록금액의 100.0000%.
나.
조기상환 청구장소: 발행회사의 본점
다.
조기상환 지급장소: 기업은행 판교테크노밸리 지점
라.
조기상환 수익률 및 조기상환청구기간: 사채권자는 조기상환을 청구할 경우, 각 조기상환지급일의 30일 전부터 15일 전까지(이하 “조기상환청구기간”이라 하며, 구체적인 내역은 아래 표와 같다) 조기상환 청구를 하여야 한다. 단, 조기상환청구기간의 종료일이 영업일이 아닌 경우에는 그 다음 영업일까지로 한다.
마. 조기상환 청구절차: 사채권자가 전자증권법 제22조 제2항에 따라 작성되는 고객계좌부에 전자등록된 경우에는 거래하는 계좌관리기관을 통하여 한국예탁결제원에 조기상환을 청구하고 전자증권법 제23조 제2항에 따라 작성되는 자기계좌부에 전자등록된 경우에는 한국예탁결제원에 조기상환을 청구하면 한국예탁결제원이 이를 취합하여 청구장소에 조기상환 청구한다. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1차 조기상환청구기간은 2024년 09월 06일부터 2024년 09월 23일까지로 증권신고서 제출일(2024년 09월 19일) 현재 135억원에 대해 조기상환이 청구되었음을 확인하였습니다. 당사가 자체적으로 전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다.
(3) 의무조항 관련 사항
인수계약서 제3조 22항에 의거 제1회 전환사채에는 발행회사의 기한의 이익 상실에 관한 사유가 기재되어 있고, 해당 여부 및 해당 가능성에 대해 검토한 결과 해당사항이 없고, 향후 해당가능성이 낮은 것으로 판단됩니다.
| [인수계약서 제3조 22항] |
|---|
|
22. 발행회사의 기한의 이익 상실에 관한 사유 가.
발행회사의 (당연) 기한이익 상실사유: 발행회사에 대하여 다음의 항목에 해당하는 사유가 발생한 경우 발행회사는 별도의 독촉, 통지 없이도 본 사채에 관한 기한의 이익을 상실하고 본 사채의 미상환 원금(전자등록금액)과 기한이익의 상실일까지 본 조 제11항에 따른 조기상환수익율을 적용하여 발생한 이자를 지급하기로 하고, 실지급일까지 본 조 제12항에 따른 연체이자를 가산하기로 한다. 이 경우 기한이익 상실의 원인사유가 발생한 날을 지급기일로 본다.
(1)
발행회사가 파산, 회생절차 개시의 신청을 하거나 이에 동의한 경우, 또는 발행회사에게 파산이 선고되거나 회생절차가 개시된 경우
(2)
발행회사에게 존립기간의 만료 등 정관으로 정한 해산사유의 발생, 법원의 해산명령 또는 해산판결, 주주총회의 해산결의가 있는 경우
(3)
발행회사가 휴업 또는 폐업하는 경우 또는 감독관청으로부터 발행회사의 중요한 영업에 대한 영업정지 또는 취소가 있는 경우(다만, 감독기관의 행정처분 등으로 인한 일시적인 영업정지의 경우는 제외한다)
(4)
발행회사에게 은행 당좌거래가 정지되거나 어음교환소의 거래정지 처분이 있는 때 및 채무불이행명부 등재 신청이 있는 때 등 발행회사가 지급불능 또는 지급정지의 상태에 이른 것으로 인정되는 경우
(5)
발행회사의 보통주가 코스닥 시장에서 관리종목 지정 또는 상장 폐지되거나 개장일 기준 20일 이상 연속으로 거래가 중지되는 경우(단, 주권의 병합, 분할, 자본의 감소 등 발행회사의 일정한 회사법적 행위로 인해 관련 법규 및 “한국거래소”의 관련 규정에 따라 의무적으로 일시 거래정지 되는 경우는 제외)
(6)
발행회사가 기업구조조정촉진법에 따라 부실징후기업으로 인정되거나 관리절차(워크아웃) 개시 신청 등 회사 신용에 중대한 영향을 미치는 사유가 발생한 경우(법률의 제정 또는 개정 등으로 인하여 이와 유사한 절차가 개시된 경우를 포함한다.)
(7)
발행회사가 경영임대차, 경영권의 양도,
최대주주의 변경, 위탁경영, 타회사와 합병(단, 발행회사가 존속하는 경우는 제외한다), 분할, 분할합병, 주식의 포괄적 교환 또는 이전, 최근 사업연도말 기준 매출액의 50% 이상을 차지하는 주요한 사업의 양수도 등 기타 회사 조직의 근본적인 변경이 있는 경우. 단, 발행일 이전 기공시된 사항 및 사채권자의 사전 서면동의가 있을 경우는 예외로 한다.
(8)
본 사채의 원금의 일부 또는 전부를 상환하여야 할 의무 또는 기한이 도래한 이자 지급 의무를 불이행하고 05일 이내에 그 지급이 완료되지 아니한 경우
(9)
‘주식회사 등의 외부감사에 관한 법률’에 따른 감사인의
“발행회사”에 대한 감사보고서 또는 반기검토보고서
(내부회계관리제도에 대한 감사 또는 검토 의견 포함)
의견이 “적정”이 아닌 경우
나.
발행회사의 기한이익 상실의 원인사유: 발행회사에 대하여 다음 각 항목에 해당하는 사유가 발생한 경우 사채권자는 발행회사에 대한 서면 통지로써 즉시 본 사채의 전부 또는 일부에 대하여 기한의 이익을 상실시키고 발행회사에 그 미상환 원금의 전부 또는 일부와 그 때까지 발생한 본 조 제11항에 따른 조기상환수익율을 적용하여 발생한 이자 전액을 합산한 금액의 지급을 청구할 수 있다. 이 경우 기한이익 상실 사유가 발생한 날을 지급기일로 본다.
(1)
발행회사가 본 계약에 따른 의무를 위반한 때
(2)
본 사채 이외의 발행회사의 채무 중 지급기일이 도래한 원리금의 지급이 이루어지지 않거나 또는 채무불이행 등으로 인하여 기한이익의 상실 사유가 발생하거나 당해 채무에 관한 담보권이 실행된 경우
(3)
발행회사의 자산의 전부 또는 최근 사업년도말 별도재무제표 기준 총자산의 20% 이상에 압류 명령이 결정되거나 또는 임의 경매가 개시되었을 경우
(4)
발행회사의 자산의 전부 또는 별도재무제표 최근 사업년도말 기준 총자산의 20% 이상에 해당하는 자산에 가압류, 압류명령 또는 체납처분 압류통지가 발송되거나, 기타의 방법에 의한 강제집행개시나 체납처분착수가 있을 때 또는 금전채권 회수를 목적으로 하는 가처분이 선고되고, 90일 이내에 정지되지 않은 경우
(5)
발행회사의 임직원이 발행회사와 관련한 횡령, 배임, 허위지출, 가공지출, 과다지출 등의 면탈행위나 불법행위로 발행회사에 재산상 중대한 손실을 초래하였거나 형사처벌을 받는 경우. 단, 발행일 이전 기공시된 사항에 대하여는 예외로 한다.
(6)
제7조의 발행회사의 진술 및 보장, 기타 본 계약에서 정하고 있는 발행회사가 당사자인 계약서들에서 발행회사가 한 확인(보장)사항의 전부 또는 일부가, 동 확인 시점에서 중요한 점에 있어서 허위인 것으로 판명되거나, 제10조에 특약사항에 따른 발행회사의 의무를 이행하지 아니한 경우
다.
발행회사가 본 항 가호 내지 나호에 따라 본 사채에 관한 기한의 이익을 상실함으로써 지급하여야 할 원리금을 기한 내에 지급하지 않은 경우에는 해당 지급기일 익일부터 실제 지급일까지 본 조 제12항의 이율을 적용한 연체이자를 지급한다. 이 경우 기한이익 상실 사유 및/또는 기한이익 상실의 원인 사유가 발생한 날을 지급기일로 본다.
라.
발행회사는 특정 기한이익 상실사유 및 기한이익 상실의 원인사유(또는 통지서 전달 및/또는 시간 경과 및/또는 확인서 발급 과정과 함께 동 기한이익 상실사유 또는 기한이익상실의 원인사유를 구성할 수 있는 제반 조건, 사태 또는 행위) 발생 사실을 인지하는 즉시 관련 내용을 인수자 또는 사채권자 앞으로 서면 통지하여야 한다.
마. 본 항에 의한 상환청구는 인수자의 발행회사에 대한 기타 손해배상의 청구에 영향을 미치지 아니한다. |
| [기한의 이익 상실 사유 검토 내용] |
| 사 유 | 해당여부 | 비 고 |
|---|---|---|
| (당연) 기한이익 상실사유
|
||
| 발행회사가 파산, 회생절차 개시의 신청을 하거나 이에 동의한 경우, 또는 발행회사에게 파산이 선고되거나 회생절차가 개시된 경우
|
해당사항 없음 | - |
| 발행회사에게 존립기간의 만료 등 정관으로 정한 해산사유의 발생, 법원의 해산명령 또는 해산판결, 주주총회의 해산결의가 있는 경우
|
해당사항 없음 | - |
| 발행회사가 휴업 또는 폐업하는 경우 또는 감독관청으로부터 발행회사의 중요한 영업에 대한 영업정지 또는 취소가 있는 경우(다만, 감독기관의 행정처분 등으로 인한 일시적인 영업정지의 경우는 제외한다)
|
해당사항 없음 | - |
| 발행회사에게 은행 당좌거래가 정지되거나 어음교환소의 거래정지 처분이 있는 때 및 채무불이행명부 등재 신청이 있는 때 등 발행회사가 지급불능 또는 지급정지의 상태에 이른 것으로 인정되는 경우
|
해당사항 없음 | - |
| 발행회사의 보통주가 코스닥 시장에서 관리종목 지정 또는 상장 폐지되거나 개장일 기준 20일 이상 연속으로 거래가 중지되는 경우(단, 주권의 병합, 분할, 자본의 감소 등 발행회사의 일정한 회사법적 행위로 인해 관련 법규 및 “한국거래소”의 관련 규정에 따라 의무적으로 일시 거래정지 되는 경우는 제외)
|
해당사항 없음 | |
| 발행회사가 기업구조조정촉진법에 따라 부실징후기업으로 인정되거나 관리절차(워크아웃) 개시 신청 등 회사 신용에 중대한 영향을 미치는 사유가 발생한 경우(법률의 제정 또는 개정 등으로 인하여 이와 유사한 절차가 개시된 경우를 포함한다.)
|
해당사항 없음 | - |
| 발행회사가 경영임대차, 경영권의 양도, 최대주주의 변경, 위탁경영, 타회사와 합병(단, 발행회사가 존속하는 경우는 제외한다), 분할, 분할합병, 주식의 포괄적 교환 또는 이전, 최근 사업연도말 기준 매출액의 50% 이상을 차지하는 주요한 사업의 양수도 등 기타 회사 조직의 근본적인 변경이 있는 경우. 단, 발행일 이전 기공시된 사항 및 사채권자의 사전 서면동의가 있을 경우는 예외로 한다.
|
해당사항 없음 | 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다를 합병 - 발행회사가 존속하는 경우로 제외 |
| 본 사채의 원금의 일부 또는 전부를 상환하여야 할 의무 또는 기한이 도래한 이자 지급 의무를 불이행하고 05일 이내에 그 지급이 완료되지 아니한 경우
|
해당사항 없음 | - |
| ‘주식회사 등의 외부감사에 관한 법률’에 따른 감사인의“발행회사”에 대한 감사보고서 또는 반기검토보고서(내부회계관리제도에 대한 감사 또는 검토 의견 포함) 의견이 “적정”이 아닌 경우
|
해당사항 없음 | - |
| 기한이익 상실의 원인사유 | ||
| 발행회사가 본 계약에 따른 의무를 위반한 때
|
해당사항 없음 | - |
| 본 사채 이외의 발행회사의 채무 중 지급기일이 도래한 원리금의 지급이 이루어지지 않거나 또는 채무불이행 등으로 인하여 기한이익의 상실 사유가 발생하거나 당해 채무에 관한 담보권이 실행된 경우
|
해당사항 없음 | - |
| 발행회사의 자산의 전부 또는 최근 사업년도말 별도재무제표 기준 총자산의 20% 이상에 압류 명령이 결정되거나 또는 임의 경매가 개시되었을 경우
|
해당사항 없음 | - |
| 발행회사의 자산의 전부 또는 별도재무제표 최근 사업년도말 기준 총자산의 20% 이상에 해당하는 자산에 가압류, 압류명령 또는 체납처분 압류통지가 발송되거나, 기타의 방법에 의한 강제집행개시나 체납처분착수가 있을 때 또는 금전채권 회수를 목적으로 하는 가처분이 선고되고, 90일 이내에 정지되지 않은 경우
|
해당사항 없음 | - |
| 발행회사의 임직원이 발행회사와 관련한 횡령, 배임, 허위지출, 가공지출, 과다지출 등의 면탈행위나 불법행위로 발행회사에 재산상 중대한 손실을 초래하였거나 형사처벌을 받는 경우. 단, 발행일 이전 기공시된 사항에 대하여는 예외로 한다.
|
해당사항 없음 | - |
| 제7조의 발행회사의 진술 및 보장, 기타 본 계약에서 정하고 있는 발행회사가 당사자인 계약서들에서 발행회사가 한 확인(보장)사항의 전부 또는 일부가, 동 확인 시점에서 중요한 점에 있어서 허위인 것으로 판명되거나, 제10조에 특약사항에 따른 발행회사의 의무를 이행하지 아니한 경우
|
해당사항 없음 | - |
[(주)BNK투자증권 이해상충 관련 내용]
자본시장과 금융투자업에 관한 법률(이하“자본시장법”)은 투자매매업자 또는 투자중개업자가 투자자 보호 또는 건전한 거래질서를 해할 우려가 있는 행위를 하여서는 안된다고 규정합니다(자본시장법 제71조 제7호).
| [자본시장과 금융투자업에 관한 법률] |
|---|
|
제71조(불건전 영업행위의 금지)
투자매매업자 또는 투자중개업자는 다음 각 호의 어느 하나에 해당하는 행위를 하여서는 아니 된다. 다만, 투자자 보호 및 건전한 거래질서를 해할 우려가 없는 경우로서 대통령령으로 정하는 경우에는 이를 할 수 있다. 7.
그 밖에 투자자 보호 또는 건전한 거래질서를 해할 우려가 있는 행위로서 대통령령으로 정하는 행위 |
| [자본시장과 금융투자업에 관한 법률 시행령] |
|---|
|
제68조(불건전 영업행위의 금지
) ⑤ 법 제71조제7호에서 “대통령령으로 정하는 행위”란 다음 각 호의 어느 하나에 해당하는 행위를 말한다 4. 증권의 인수업무 또는 모집ㆍ사모ㆍ매출의 주선업무와 관련하여 다음 각 목의 어느 하나에 해당하는 행위 마. 그 밖에 투자자의 보호나 건전한 거래질서를 해칠 염려가 있는 행위로서 금융위원회가 정하여 고시하는 행위 |
| [금융투자업규정] |
|---|
|
제4-19조(불건전한 인수행위의 금지)
영 제68조제5항제4호마목에서 "금융위원회가 정하여 고시하는 행위"란 다음 각 호의 어느 하나에 해당하는 행위를 말한다. 7. 협회가 정하는 이해관계가 있는 자가 발행하는 주식(협회가 정하는 기업공개 또는 장외법인공모를 위하여 발행되는 주식에 한한다) 및 무보증사채권의 인수(모집의 주선을 포함한다. 이하 이 호에서 같다)를 위하여 주관회사의 업무를 수행
하거나 또는 가장 많은 수량을 인수하는 행위 |
| [증권 인수업무 등에 관한 규정] |
|---|
|
제15조(불건전한 인수행위의 금지) ④ 금융투자업규정 제4-19조 제7호에서 "협회가 정하는 이해관계가 있는 자"란 다음 각 호의 어느 하나에 해당하는 관계에 있는 자를 말한다. 다만, 한국거래소, 증권금융회사, 기업인수목적회사는 그러하지 아니하다. 1. 발행회사와 발행회사의 이해관계인이 합하여 금융투자회사의 주식등을 100분의 5 이상 보유하고 있는 경우 2. 금융투자회사가 발행회사의 주식등을 100분의 5 이상 보유하고 있는 경우. 다만 , 발행회사가 다음 각 목의 어느 하나에 해당하는 경우(중소기업창업 지원법 시행령」 제4조 각 호의 어느 하나에 해당하는 업종은 제외한다)에는 발행회사의 주식등을 100분의 10 이상을 보유하고 있는 경우를 말한다.
가.「중소기업기본법」제2조에 따른 중소기업(특수목적기구 및 부동산 관련 법인은 제외한다)
나.「벤처기업 육성에 관한 특별조치법」 제2조 제1항에 따른 벤처기업
다.「중견기업 성장촉진 및 경쟁력 강화에 관한 특별법」 제2조에 따른 중견기업으로서 직전 3개 회계연도의 평균 매출액이 3천억원 미만인 기업 라. 그 밖에 다음의 어느 하나에 해당되는 기업(「독점규제 및 공정거래에 관한 법률」 제14조제1항에 따른 공시대상기업집단에 속하는 기업은 제외한다) 1)「조세특례제한법 시행령」별표7에 따른 신성장ㆍ원천기술을 보유하고 이와 관련한 사업을 영위하는 기업 2) 1개 이상의 기술신용평가기관(「신용정보의 이용 및 보호에 관한 법률」제2조제8의3다목에 따른 기술신용평가업무를 영위하는 신용정보회사를 말한다) 또는 기술전문평가기관(「벤처기업 육성에 관한 특별조치법」, 「기술의 이전 및 사업화 촉진에 관한 법률」 등 관련 법률에 따라 기술평가기관으로 지정된 자를 말한다)이 평가한 기술등급(기업의 기술과 관련된 기술성ㆍ시장성ㆍ사업성 등을 종합적으로 평가한 등급을 말한다)이 기술등급체계상 상위 100분의 50에 해당하는 기업 3. 금융투자회사와 금융투자회사의 이해관계인이 합하여 발행회사의 주식 등을 100분의 10(제15조제4항제2호 단서의 경우에는 100분의 15)이상 보유하고 있는 경우 4. 금융투자회사의 주식등을 100분의 5 이상 보유하고 있는 주주와 발행회사의 주식등을 100분의 5 이상 보유하고 있는 주주가 동일인이거나 이해관계인인 경우. 다만, 그 동일인 또는 이해관계인이 정부 또는 기관투자자인 경우에는 그러하지 아니하다. 5. 금융투자회사의 임원이 발행회사의 주식등을 100분의 1 이상 보유하고 있는 경우 6. 금융투자회사의 임원이 발행회사의 임원이거나 발행회사의 임원이 금융투자회사의 임원인 경우 7. 금융투자회사가 발행회사의 최대주주이거나 발행회사와 제2조
제9호라목의 계열회사 관계에 있는 경우 |
즉, 자본시장법이 투자매매업자 또는 투자중개업자를 제한하는 불건전한 영업행위란, 증권인수업무
등에
관한
규정에서
정하는
이해관계
있는
자가
기업공개
또는
장외법인공모를
목적으로
발행하는
주식을
위하여
주관회사의
업무를
수행하는
일
입니다. 따라서, 자본시장법 및 금융투자업 규정의 반대해석에 의하면, 주관회사의 업무를 하는 주체가 증권인수업무 등에 관한 규정에서 정하는 이해관계 있는 자가 아닐 경우 주관회사로서의 업무 수행은 자본시장법이 제한하는 불건전한 영업행위에 해당하지 않습니다. 설령, 이해관계가 있는 자일지라도 기업공개 또는 장외법인공모를 목적으로 발행하는 주식에 관한 주관업무를 하는 것이 아니라면, 자본시장법이 제한하는 불건전한 영업행위로 판단될 여지가 없는 것으로 판단 됩니다.
또
한, 증권 인수업무 등에 관한 규정 제15조 제4항 제2호 가.목 및 나.목에 따라,
금융투자회사가 중소기업기본법」제2조에 따른 중소기업,「벤처기업 육성에 관한 특별조치법」제2조제1항에 따른 벤처기업이 발행하는 주식의 100분의 10 이상을 보유하고 있는 경우에 금융투자업규정 제4-19조 제7호에서 규정하는 협회가 정하는 이해관계가 있는 자에 해당합니다. 당사는「중소기업기본법」제2조에 따른 중소기업,「벤처기업 육성에 관한 특별조치법」제2조 제1항에 따른 벤처기업 입니다. 당사는 2024.3.20 공시한 사업보고서에서 당사가 중소기업 및 벤처기업에 해당한다는 사실을 밝히고 있습니다.
따라서, 대표주관사인 (주)BNK투자증권이 증권 인수업무 등에 관한 규정에서 정하는 이해관계가 있는 자에 해당하기 위하여는, 당사 주식의 100분의 10이상을 보유하고 있어야 합니다. 당사는 2023년말 기준 보통주 16,980,252주, 우선주 920,000주를 발행하였으며, 발행할 주식의 총수는 50,000,000주 입니다. 대표주관사인 (주)BNK투자증권은 165억 규모의 제1회 전환사채에서 약 10억원(30억원 인수 후 20억원은 제3자에게 매각)만을 인수하였으므로, 전환권을 행사하더라도 당사 주식의 100분의 10이상을 보유할 여지가 없습니다. 따라서, 대표주관사인 (주)BNK투자증권은 증권 인수업무 등에 관한 규정에서 정하는 이해관계가 있는 자로 판단되지 않습니다.
이에, 대표주관사인 (주)BNK투자증권은 증권 인수업무 등에 관한 규정에 정하는 이해관계가 있는 자가 아니므로, 본건 유상증자의 적법한 대표주관사로 참여할 수 있을 것으로 판단 됩니다. 설령 이해관계가 있는 자에 해당할지라도, 본건 유상증자는 기업공개 또는 장외법인공모를 위하여 발행하는 주식을 위한 것이 아니므로, 자본시장법 및 금융투자업 규정에 대한 반대해석에 의하여 대표주관사인 (주)BNK투자증권 본건 유상증자의 적법한 대표주관사로 참여할 수 있는 것으로 판단 됩니다.
그럼에도 불구하고 (주)BNK투자증권이 대표주관회사로서 발행회사의 실사 시,적절한 주의의무 준수를 통해 투자자를 보호할 의무가 있는 것과 동시에 재무적 투자자로서 수익 극대화를 추구해야 하는 이해상충 문제가 발생할 소지가 있다는 의문이 제기될 수 있습니다.
금번 공모 유상증자의 대표주관사인 (주)BNK투자증권은 당사의 전환사채 10억원을 보유 중이며, 전환가격 4,058원으로 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태로, 대표주관사인 (주)BNK투자증권이 보유 중인 전환사채의 전환에 따른 수익 창출은 제한적일 것으로 판단 됩니다. (주)BNK투자증권은 이해 상충 문제를 최소화 하기 위해 보유 중인 사모 전환사채를 금번 공모 유상증자 납입 이후 일정기간 경과 후에 조기상환 또는 전환할 예정으로 해당 사항 고려 시, 이해 상충 문제를 최소화하고 있는 것으로 판단됩니다. 이 점 투자에 참고하시기 바랍니다.
[2024년 반기 이후 발생한 사건]
당사는 2024년 반기 이후 2024년 08월 14일 파생상품거래손실발생, 2024년 08월 24일 합병등종료보고서, 2024년 08월 28일 자산재평가결과를 공시하였습니다.
(1) 2024년 08월 14일 파생상품거래손실발생
당사는 제1회 전환사채와 관련하여 1,555백만원의 파생상품 평가손실을 인식하였고, 이는 2024년 반기 재무제표에 기반영되어 있으며, 현금유출을 초래하지는 않습니다. 관련 공시내용은 다음과 같습니다.
| [파생상품 거래 손실 발생(2024.08.14)] |
| 1. 파생상품 거래계약의 종류 및 내용 | 파생상품(전환사채) 평가손실 발생 | ||
| 2. 손실발생내역 | 손실누계잔액(원)(기신고분 제외) | 1,554,551,409 | |
| 자기자본(원) | 15,478,896,907 | ||
| 자기자본대비(%) | 10.04 | ||
| 대기업해당여부 | 미해당 | ||
| 3. 손실발생 주요원인 | - 주가 변동 등으로 당사가 발행한 전환사채의 전환(행사)가액과 주가간 차이가 발생함에 따라 파생상품평가손실을 인식하였습니다. - 한국채택국제회계기준(K-IFRS)에 따라 전환사채를 공정가치로 평가하여 재무제표에 반영하였으며,실질적으로 현금 유출이 없는 손실입니다. |
||
| 4. 손실발생일자 | 2024-08-14 | ||
| 5. 기타 투자판단에 참고할 사항 | - 상기 2항의 손실발생금액은 2024년(2024.01.01 ~ 2024.06.30)에 발생한 누계금액입니다. - 상기 2항의 손실발생내역 중 '자기자본(원)'은 최근 사업연도 2023년말 자기자본에서 2024년 1월부터 2024년 6월까지의 자본금 및 자본잉여금의 증감액을 반영한 금액입니다. - 상기 4항의 손실발생일자는 제14기(2024년 6월 30일) 재무제표 기준 반기검토보고서 제출일자 입니다. - 상기의 손실은 실현 되어지지 않는 평가손실이며, 현금 유출을 초래하지는 않습니다. |
||
| ※관련공시 | 2024-08-14 반기보고서(일반법인) |
||
| (출처 : 전자공시시스템) |
(2) 2024년 08월 24일 합병등종료보고서
당사는 당사가 지분 100%를 보유하고 있는 ㈜인터내셔널사이언티픽스탠다드 무증자방식에 의하여 1:0의 합병비율로 2024년 08월 23일 소규모합병을 완료(합병기일 2024년 08월 19일)하였습니다. 2024년 반기 기준 당사 연결재무상태표 상 (주)인터내셔널사이언티픽스탠다드의 자산 및 부채가 연결대상 종속회사로 포함되어 있어, 합병이 당사의 재무제표에 미치는 영향은 없습니다. 다만 합병 후 당사는 별도의 연결대상 종속회사가 존재하지 않으며, 2024년 3분기부터 합병 후 개별 재무제표를 기준으로 당사의 재무자료가 공시될 예정입니다.
연결재무상태표 상 인식된 (주)인터내셔널사이언티픽스탠다드의 자산과 부채는 다음과 같습니다.
| [자산 및 부채 내역] |
| (단위 : 천원) |
| 구 분 | 금액 |
|---|---|
| 자산 : | |
| 현금및현금성자산 | 257,629 |
| 매출채권 | 84,205 |
| 선급금 | 18 |
| 선급비용 | 170,834 |
| 당기법인세자산 | 100 |
| 계약자산 | 675,824 |
| 유형자산 | 895,413 |
| 고객관계가치(무형자산) | 851,469 |
| 무형자산 | 4 |
| 임차보증금 | 42,151 |
| 2,977,648 | |
| 부채: | |
| 단기차입금 | 1,651,102 |
| 미지급금 | 397,915 |
| 미지급비용 | 57,362 |
| 계약부채 | 386,699 |
| 리스부채 | 530,534 |
| 기타비유동부채 | 737,612 |
| 이연법인세부채 | 177,957 |
| 합 계 | 3,939,180 |
| 식별가능한 순자산 가액 | (961,533) |
| 비지배지분 | - |
| 영업권 | 961,533 |
| 이전대가 | - |
당사는 ㈜인터내셔널사이언티픽스탠다드의 자산과 부채 승계과정에서 실질적인 매수가액이라할 수 있는 차액에 대한 타당성을 입증하고자 매수가격배분(Purchase Price Allocation)(*) 공정가치 평가를 태일회계법인이 수행하였습니다. 태일회계법인을 통한 잠재적 무형자산의 인식가능성 검토 결과, 고객관계와 관련하여 무형자산이 식별되고 중요성이 있는 것으로 검토되었으며, 고객관계는 다기간초과이익법(Multi-period Excess Earning Method : MEEM)으로 평가하였습니다. 다기간초과이익법은 기여자산의 추정이익에서 원가를 차감하여 적절한 할인율을 사용하여 평가기준일 현재가치로 할인하는 방법입니다.
| (*) K-IFRS에 따르면 사업결합 시에는 취득법(Acquisition method)을 적용하여 회계 처리해야 하며, 취득자는 취득일 현재 피취득자의 자산(과거 인식되지 않은 무형자산 포함)과 인수부채의 공정가치를 측정하고 매수가액을 배부해야 합니다. 취득한 식별 가능한 무형자산은 영업권과 분리하여 인식해야 하며 무형자산은 분리가능성 기준이나 계약적·법적 기준을 충족하는 경우에 식별 가능합니다. 식별 가능하고 가치평가 대상으로 선정된 자산, 부채, 공정가액이 인수자의 지분을 초과하는 금액에 대해서는 영업권으로 인식하며, 인수자의 지분에 미달하는 금액에 대해서는 염가매수차익으로 인식합니다. |
이에 따라 당사는 2024년 반기 기준 고객관계가치 851백만원과 영업권 962백만원을 인식하였습니다. 당사는 고객관계가치를 5년간 감가상각할 예정이나, 매 보고기간말 혹은 손상을 시사하는 징후가 있을 때 회수가능액과 장부금액을 비교하여 손상검사를 수행하여 장부가액의 일부 또는 전액에 대하여 손상을 인식할 수 있습니다.
(3) 2024년 08월 28일 자산재평가결과
당사는 당사가 보유하고 있는 경기도 성남시 분당구 삼평동 625 판교세븐벤처밸리1 제3동 3층 부동산을 재평가하였고, 재평가 결과에 따라 장부가액 6,241백만원의 유형자산을 9,030백만원으로 인식하게 되었습니다. 이에 따라 당사는 자산 및 자본(이연법인세 효과 미고려)이 2,788백만원 증가하는 효과가 있습니다. 관련 공시내용은 다음과 같습니다.
| [자산재평가 결과(2024.08.28)] |
| 1. 재평가 목적물 | 토지 및 건물 | |||
| 2. 재평가 대상 | 경기도 성남시 분당구 삼평동 625 판교세븐벤처밸리1 제3동 3층 | |||
| 3. 재평가 기준일 | 2024-09-30 | |||
| 4. 재평가 내역(단위:원) | 재평가 목적물 | 장부가액 | 재평가금액 | 재평가차액 |
| 유형자산(토지 및 건물) | 6,241,948,846 | 9,030,000,000 | 2,788,051,154 | |
| 합계 | 6,241,948,846 | 9,030,000,000 | 2,788,051,154 | |
| 자산총액 | 31,099,960,909 | |||
| 재평가차액의 자산총액대비 비율(%) | 8.96 | |||
| 대기업여부 | 미해당 | |||
| 5. 회계처리 예정내역 | [자산의 증가] - 유형자산 증가(토지 및 건물) :2,788,051,154원 [자본] - 기타포괄손익누계액의 증가(재평가잉여금): 2,788,051,154원 * 이연법인세 효과는 기말 결산시 산정하여 반영 예정 |
|||
| 6. 평가기관 | (주)에이원감정평가법인 | |||
| 7. 결정(확인)일자 | 2024-08-27 | |||
| 8. 기타 투자판단에 참고할 사항 | 1. 자산재평가의 목적 - K-IFRS(한국채택국제회계기준)에 의거 자산의 실질가치 반영 - 자산 및 자본증대효과를 통한 재무구조 개선 2. 상기 4. 장부가액 및 자산총액은 2024년 6월 30일 연결재무제표 기준입니다. 3. 상기 5. 회계처리 예정내역은 외부회계감사 결과에 따라 변경될 수 있습니다. 4. 상기 7. 결정(확인)일자는 감정평가법인으로부터 감정평가서를 수령한 일자입니다. |
|||
| ※관련공시 | - | |||
| (출처 : 전자공시시스템) |
2024년 반기 이후 발생한 사건이 당사의 재무제표에 미치는 영향은 다음과 같습니다.
| [2024년 반기 이후 발생한 사건이 재무제표에 미치는 영향] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기(연결) | 2024년 08월 14일 파생상품거래손실발생 |
2024년 08월 24일 합병등종료보고서 |
2024년 08월 28일 자산재평가결과 |
사건 반영후 2024년 반기(연결) |
|---|---|---|---|---|---|
| 자산 | 31,100 | - | - | 2,788 | 33,888 |
| 부채 | 21,283 | - | - | - | 21,283 |
| 자본 | 9,817 | - | - | 2,788 | 12,605 |
| 기타 | - | 기반영 | 기반영 | - | - |
| (출처 : 당사 제시) |
[자본잠식 가능성 검토]
2024년 상반기의 당기순이익이 유지되고 상기한 ㈜인터내셔널사이언티픽스탠다드의 무형자산이 전액 손상이 된다는 가정을 하였을 때 당사의 2024년 예상 당기순이익은 -13,536백만원 수준입니다. 금번 유상증자가 예정발행가액으로 완료되고, 상기한 자산재평가결과를 적용하면 2024년 예상 자본금은 15,100백만원, 예상 자기자본은 28,680백만원 수준으로 자본잠식이 이루어지지는 않습니다. 또한 자본잠식이 되기 위해서는 현재 예상되는 당기순이익보다 13,580백만원의 추가 손실이 발생해야 되므로 금번 유상증자가 완료된 경우 자본잠식 가능성은 제한적입니다.
| [2024년 자본잠식 시뮬레이션] |
| (단위 : 백만원) |
| 구 분 | 금 액 | 비고 |
|---|---|---|
| 당기순이익 |
||
| 2024년 반기 당기순이익 |
-5,589 | - |
| 2024년 반기 당기순이익(연환산) |
-11,178 | - 단순 연환산 |
| ㈜인터내셔널사이언티픽스탠다드 2024년 반기 당기순이익 | -545 | - 일회성 수익인 채무면제이익 등 영업외손익 제거 - 2024년 상반기 손익이 유지된다는 가정 |
| ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상 | -1,813 | - 고객관계가치 851백만원과 영업권 962백만원 전액 손상 가정 |
| 2024년 예상 당기순이익 | -13,536 | - |
| 자본금 | ||
| 2024년 반기 자본금 | 8,950 | - |
| 금번 유상증자 증가 자본금 | 6,150 | - 예정발행가액 기준 |
| 2024년말 예상 자본금 | 15,100 | - |
| 자기자본 | ||
| 2024년 반기 자기자본 | 9,817 | - |
| 금번 유상증자 | 24,022 | - 예정발행가액 기준 |
| 자산재평가 | 2,788 | - |
| 당기순이익 | -7,947 | - 2024년 상반기는 기반영 |
| 2024년 예상 자기자본 | 28,680 | - |
| 자본잠식 | ||
| 2024년 예상 자본잠식율 | - | - 해당사항 없음 |
| (출처 : 당사 제시) |
당사의 2024년 반기말 연결기준 부채총계는 21,283백만원, 차입금의존도는 54.7%로 금번 주주배정 후 실권주 일반공모 유상증자가 성공적으로 진행될 경우 당사의 재무안정성 지표는 추가적으로 개선될 것으로 예상하고 있습니다. 그러나 당사의 경우 최근 지속적인 당기순손실이 발생하고 있으며, 향후에도 사업이 흑자전환되지 않아 당기순손실이 지속될 경우 재무안정성이 악화될 가능성이 높습니다. 투자자께서는 당사의 부채상환능력 및 사업의 흑자전환 여부 등에 대하여 유의하여 투자해 주시기 바랍니다.
(주15) 정정 전
| 다. 현금흐름 악화 및 유동성 부족에 따른 재무불안정성 위험 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [현금흐름 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
| 영업활동현금흐름 | -2,816 | -7,335 | -11,236 | -5,776 | -3,474 |
| 영업활동으로 창출된 현금흐름 | -3,363 | -7,728 | -12,213 | -6,114 | -3,665 |
| 이자지급 | 450 | -4 | -6 | -8 | -20 |
| 이자수취 | -3 | 403 | 1,096 | 363 | 247 |
| 법인세환급 | 99 | -6 | -113 | -18 | -36 |
| 투자활동현금흐름 | 2,730 | 7,672 | 11,315 | -10,654 | -58 |
| 단기금융상품의 증감 | 4,000 | 8,000 | 11,679 | -10,300 | 6,999 |
| 유형자산의 취득 | -7 | -295 | -297 | -309 | -7,081 |
| 유형자산의 처분 | - | - | - | - | 1 |
| 무형자산의 취득 | - | -3 | -3 | - | -11 |
| 대여금 증가 | -1,500 | - | - | - | - |
| 사업결합으로 인한 증가 | 258 | - | - | - | - |
| 임차보증금의 증감 | - | - | - | - | 75 |
| 기타자산의증감 | -20 | -31 | -65 | -45 | -41 |
| 재무활동현금흐름 | -26 | -61 | -63 | 16,643 | -121 |
| 주식발행비용 | - | -36 | -16 | - | - |
| 주식선택권의 행사 | - | - | - | 287 | - |
| 전환사채의 증가 | - | - | - | 16,416 | - |
| 미지급금의 증감 | 16 | 18 | 40 | 16 | 10 |
| 리스부채의 상환 | -43 | -43 | -86 | -76 | -131 |
| 기초현금및현금성자산 | 1,237 | 1,222 | 1,222 | 1,009 | 4,663 |
| 기말현금및현금성자산 | 1,126 | 1,498 | 1,237 | 1,222 | 1,009 |
| (출처 : 정기보고서) |
당사는 2021년 38.3억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 34.7억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소로 인하여 70.0억원 현금유입, 유형자산 취득으로 인하여 70.8억원 현금유출로 인하여 0.0억원 현금유출이 발생하였습니다. 재무활동 부문에서는 리스부채 상환으로 인하여 1.2억원의 현금유출이 발생하였습니다.
2022년에는 83.0억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 57.8억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 증가(103.0억원)로 인하여 106.5억원 현금 유출이 발생하였습니다. 재무활동 부문에서는 제1회 전환사채 164.2억원 발행으로 인하여 166.4억원의 양(+)의 현금흐름이 발생, 영업활동 및 투자환동 현금유출을 충당하였습니다.
2023년에는 136.0억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 112.4억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소(116.8억원)으로 인하여 113.2억원 현금유출이 발생하였습니다. 재무활동 부문에서는 미지급금의 증가, 리스부채의 상환으로 0.6억원 현금유출이 발생하였습니다.
2024년 반기 중에는 55.9억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 28.2억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소(40억원), 대여금 15억원이 발생하여 27.3억원의 양(+)의 현금흐름이 발생하였습니다. 재무활동 부문에서는 미지급금의 증가, 리스부채의 상환으로 0.3억원 현금유출이 발생하였습니다. 그 결과 2024년 반기말 기준 당사는 11.3억원의 현금및현금성자산을 보유하고 있습니다.
이처럼 당사는 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있습니다. 사업을 영위하는 과정에서, 투자활동현금흐름은 매년 유출입의 변동이 있으며, 영업활동에서 현금흐름창출능력을 보유하지 못하여, 영업에 필요한 자금은 투자활동 및 재무활동에서 창출하고 있는 상태입니다. 당사는 후보물질발굴부터 임상 진행, 품목허가까지 대규모의 자금이 소요되는 사업을 영위하고 있는 반면에, 라이센스 아웃, 임상성공 및 상품화 성공 등이 이루어지지 않을 경우 영업활동에서 현금흐름을 창출해내기는 어려운 구조를 가지고 있으며, 외부 자금 조달 의존도가 높습니다.
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 향후 당사의 차입금 상환 부담 규모가 증가하고, 재무안정성은 저하될 수 있습니다. 이에 당사는 향후 1년간 자금수지 계획을 수립하고, 유동성 관리에 노력하고 있습니다.
| [당사 향후 1년간 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2024년 3분기 | 2024년 4분기 | 2025년 1분기 | 2025년 2분기 | ||
|---|---|---|---|---|---|---|
| 영업 현금흐름 |
(a)수입 | 매출대금 | 724 | 395 | 1,148 | 2,148 |
| 기타 | 93 | 101 | 0 | 0 | ||
| 계 | 816 | 496 | 1,148 | 2,148 | ||
| (b)지출 | 원재료 등 | 685 | 606 | 929 | 929 | |
| 판매관리비 | 927 | 905 | 1,594 | 1,620 | ||
| 경상연구비 | 2,024 | 926 | 612 | 1,823 | ||
| 계 | 3,636 | 2,438 | 3,135 | 4,372 | ||
| 영업수지(=(a)-(b)) | -2,819 | -1,942 | -1,987 | -2,224 | ||
| 투자 현금흐름 |
(c)수입 | 자산매각 | 99 | - | - | - |
| 계 | 99 | - | - | - | ||
| (d)지출 | 연구개발투자 | 517 | - | - | 600 | |
| 기타 | 15 | - | - | - | ||
| 계 | 532 | - | - | 600 | ||
| 투자수지(=(c)-(d)) | -433 | - | - | -600 | ||
| 재무 현금흐름 |
(e)수입 | 유상증자 | - | 21,000 | - | - |
| 외부차입 등 | - | 5,000 | - | - | ||
| 계 | - | 26,000 | - | - | ||
| (f)지출 | 차입금 상환 | 151 | - | - | - | |
| 이자비용 | - | 63 | - | - | ||
| CB 상환 | - | 16,500 | - | - | ||
| 계 | 151 | 16,563 | - | - | ||
| 재무수지(=(e)-(f)) | -151 | 9,438 | - | - | ||
| 기초 자금 | 19,370 | 15,967 | 23,463 | 21,476 | ||
| 기말 자금 | 15,967 | 23,463 | 21,476 | 18,652 | ||
| (출처 : 당사 제시) |
당사는 향후 1년간 (주)인터내셔널사이언티픽스탠다드 관련 매출을 통해 영업현금흐름이 발생할 것으로 예상하고 있습니다. 단, 현 시점에서 당사가 계획 중인 주요 연구개발비 등을 충당하기에는 그 규모가 부족할 것으로 생각되며, 영업수지상 음(-)의 현금흐름이 발생할 것으로 예상하고 있습니다. 이에 본 유상증자 및 외부차입 등 재무활동을 통해 당사 운영자금 등을 조달하고자 합니다. 단, 재무활동을 통해서도 목표 자금을 조달하지 못한다면 당사에 유동성 위기가 생길 수 있고, 영업활동을 영위해나가는데 상당한 제약이 생길 수 있습니다.
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
(주15) 정정 후
| 다. 현금흐름 악화 및 유동성 부족에 따른 재무불안정성 위험 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [현금흐름 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
| 영업활동현금흐름 | -2,816 | -7,335 | -11,236 | -5,776 | -3,474 |
| 영업활동으로 창출된 현금흐름 | -3,363 | -7,728 | -12,213 | -6,114 | -3,665 |
| 이자지급 | 450 | -4 | -6 | -8 | -20 |
| 이자수취 | -3 | 403 | 1,096 | 363 | 247 |
| 법인세환급 | 99 | -6 | -113 | -18 | -36 |
| 투자활동현금흐름 | 2,730 | 7,672 | 11,315 | -10,654 | -58 |
| 단기금융상품의 증감 | 4,000 | 8,000 | 11,679 | -10,300 | 6,999 |
| 유형자산의 취득 | -7 | -295 | -297 | -309 | -7,081 |
| 유형자산의 처분 | - | - | - | - | 1 |
| 무형자산의 취득 | - | -3 | -3 | - | -11 |
| 대여금 증가 | -1,500 | - | - | - | - |
| 사업결합으로 인한 증가 | 258 | - | - | - | - |
| 임차보증금의 증감 | - | - | - | - | 75 |
| 기타자산의증감 | -20 | -31 | -65 | -45 | -41 |
| 재무활동현금흐름 | -26 | -61 | -63 | 16,643 | -121 |
| 주식발행비용 | - | -36 | -16 | - | - |
| 주식선택권의 행사 | - | - | - | 287 | - |
| 전환사채의 증가 | - | - | - | 16,416 | - |
| 미지급금의 증감 | 16 | 18 | 40 | 16 | 10 |
| 리스부채의 상환 | -43 | -43 | -86 | -76 | -131 |
| 기초현금및현금성자산 | 1,237 | 1,222 | 1,222 | 1,009 | 4,663 |
| 기말현금및현금성자산 | 1,126 | 1,498 | 1,237 | 1,222 | 1,009 |
| (출처 : 정기보고서) |
당사는 2021년 38.3억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 34.7억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소로 인하여 70.0억원 현금유입, 유형자산 취득으로 인하여 70.8억원 현금유출로 인하여 0.0억원 현금유출이 발생하였습니다. 재무활동 부문에서는 리스부채 상환으로 인하여 1.2억원의 현금유출이 발생하였습니다.
2022년에는 83.0억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 57.8억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 증가(103.0억원)로 인하여 106.5억원 현금 유출이 발생하였습니다. 재무활동 부문에서는 제1회 전환사채 164.2억원 발행으로 인하여 166.4억원의 양(+)의 현금흐름이 발생, 영업활동 및 투자환동 현금유출을 충당하였습니다.
2023년에는 136.0억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 112.4억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소(116.8억원)으로 인하여 113.2억원 현금유출이 발생하였습니다. 재무활동 부문에서는 미지급금의 증가, 리스부채의 상환으로 0.6억원 현금유출이 발생하였습니다.
2024년 반기 중에는 55.9억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 28.2억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소(40억원), 대여금 15억원이 발생하여 27.3억원의 양(+)의 현금흐름이 발생하였습니다. 재무활동 부문에서는 미지급금의 증가, 리스부채의 상환으로 0.3억원 현금유출이 발생하였습니다. 그 결과 2024년 반기말 기준 당사는 11.3억원의 현금및현금성자산을 보유하고 있습니다.
이처럼 당사는 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있습니다. 사업을 영위하는 과정에서, 투자활동현금흐름은 매년 유출입의 변동이 있으며, 영업활동에서 현금흐름창출능력을 보유하지 못하여, 영업에 필요한 자금은 투자활동 및 재무활동에서 창출하고 있는 상태입니다. 당사는 후보물질발굴부터 임상 진행, 품목허가까지 대규모의 자금이 소요되는 사업을 영위하고 있는 반면에, 라이센스 아웃, 임상성공 및 상품화 성공 등이 이루어지지 않을 경우 영업활동에서 현금흐름을 창출해내기는 어려운 구조를 가지고 있으며, 외부 자금 조달 의존도가 높습니다.
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 향후 당사의 차입금 상환 부담 규모가 증가하고, 재무안정성은 저하될 수 있습니다. 이에 당사는 향후 2년간 자금수지 계획을 수립하고, 유동성 관리에 노력하고 있습니다.
| [당사 향후 2년간 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2024년 3분기 |
2024년 4분기 |
2025년 1분기 |
2025년 2분기 |
2025년 3분기 |
2025년 4분기 |
2026년 1분기 |
2026년 2분기 |
2026년 3분기 |
2026년 4분기 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영업 현금흐름 |
(a)수입 | 매출대금(신약 외) | 724 | 395 | 1,148 | 2,148 | 1,148 | 1,652 | 2,034 | 2,035 | 3,535 | 2,035 |
| 매출대금(신약L/O) | - | - | - | - | 48,423 (주1) |
19,657 (주2) |
19,657 (주3) |
28,767 (주3) |
||||
| 기타 | 93 | 101 | - | - | - | - | - | - | - | - | ||
| 계 | 816 | 496 | 1,148 | 2,148 | 49,572 | 21,310 | 2,034 | 21,692 | 3,535 | 30,801 | ||
| (b)지출 | 원재료 등 | 685 | 606 | 929 | 929 | 929 | 929 | 1,208 | 1,208 | 1,208 | 1,208 | |
| 판매관리비 | 927 | 905 | 1,594 | 1,620 | 1,648 | 1,658 | 2,244 | 2,234 | 5,144 | 3,784 | ||
| 경상연구비 (주5) |
2,024 | 926 | 612 | 1,823 | 3,285 | 4,009 | 4,443 | 4,461 | 4,461 | 4,461 | ||
| 계 | 3,636 | 2,438 | 3,135 | 4,372 | 5,861 | 6,596 | 7,895 | 7,903 | 10,813 | 9,454 | ||
| 영업수지(=(a)-(b)) | -2,819 | -1,942 | -1,987 | -2,224 | 43,710 | 14,714 | -5,860 | 13,789 | -7,279 | 21,348 | ||
| 투자 현금흐름 |
(c)수입 | 자산매각 | 99 | - | - | - | - | - | - | - | - | - |
| 계 | 99 | - | - | - | - | - | - | - | - | - | ||
| (d)지출 | 연구개발투자 | 517 | - | - | 600 | - | - | - | - | - | - | |
| 기타 | 15 | - | - | - | - | - | - | - | - | - | ||
| 계 | 532 | - | - | 600 | - | - | - | - | - | - | ||
| 투자수지(=(c)-(d)) | -433 | - | - | -600 | - | - | - | - | - | - | ||
| 재무 현금흐름 |
(e)수입 | 유상증자 | - | 23,543 | - | - | - | - | - | - | - | - |
| 외부차입 등 | - | 3,000 | - | - | - | - | - | - | - | - | ||
| 계 | - | 26,543 | - | - | - | - | - | - | - | - | ||
| (f)지출 | 차입금 상환 | 151 | - | 3,000 | - | - | - | - | - | - | - | |
| 이자비용 | - | 38 | - | - | - | - | - | - | - | - | ||
| CB 상환 | - | 13,500 | 3,000 | - | - | - | - | - | - | - | ||
| 계 | 151 | 13,538 | 6,000 | - | - | - | - | - | - | - | ||
| 재무수지(=(e)-(f)) | -151 | 13,005 | -6,000 | - | - | - | - | - | - | - | ||
| 기초 자금 | 19,368 | 15,965 | 27,029 | 19,042 | 16,218 | 59,928 | 74,642 | 68,782 | 82,571 | 75,292 | ||
| 기말 자금 | 15,965 | 27,029 | 19,042 | 16,218 | 59,928 | 74,642 | 68,782 | 82,571 | 75,292 | 96,640 | ||
| (출처 : 당사 제시) (주1) AST-201의 임상1상 POC 데이터 기반 기술이전에 따른 기술료 수익(484억원)을 추정하였습니다. 유사 기술이전 사례를 통한 Deal 규모를 추정하였으며, 향후 기술이전 계약 체결의 불확실성(성공확률)을 반영하여, 보수적인 관점에서 보정률 60%를 가정하여 목표기술이전료(총액)를 산정하였습니다. (주2) AST-202의 전임상 POC 데이터 기반 기술이전에 따른 기술료 수익(197억원)을 추정하였습니다. (주3) AST-203의 전임상 POC 데이터 기반 기술이전에 따른 기술료 수익(197억원)을 추정하였습니다. (주4) AST-202의 임상1상 POC 데이터 기반 기술이전에 따른 기술료 수익(288억원)을 추정하였습니다. (주5) 경상연구개발비는 대부분 연구원의 인건비, 신약 파이프라인의 임상, 임상시험용 의약품 생산, 전임상 등에 사용될 예정입니다. |
[금번 유상증자를 추진하는 사유]
당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있음에도 불구하고 금번 유상증자를 진행하고 있습니다. 당사는 165억원의 미상환 전환사채를 보유하고 있고, 동 전환사채의 전환가액은 4,058원이며 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 당사가 자체적으로 전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다. 당사는 제1회 전환사채를 8,407백만원을 기사용하여 전환사채를 조기상환하기 위해서는 8,407백만원이 추가로 필요하고, 향후 원활한 연구개발을 위해서는 추가자금이 필요하기 때문에 금번 유상증자를 추진하게 되었습니다.
| [채무상환대상] |
| (단위: 백만원) |
| 종목 | 차입처 | 차입금액 | 차입일 | 만기일 | 이자율 |
|---|---|---|---|---|---|
| 전환사채 | 사모 | 16,500 | 2022.10.06 | 2027.10.06 | 0.00% |
| 조기상환청구금액(예정) | 지급기일 | 비고 |
| 13,500 | 2024.10.06 | 1차 조기상환 |
| 3,000 | 2025.01.06 | 2차 조기상환 |
| (출처: 당사 제시) |
[자금 전용 가능성]
| [상장 및 이후 자본시장에서 조달한 자금 내역] |
| (단위: 백만원) |
| 납입일 | 종류 | 사용용도 | 금액 | 실제사용내역 | 잔여금액 |
|---|---|---|---|---|---|
| 2020-09-10 | 코스닥 상장 유상증자(일반공모) | 시설자금 | 3,893 | - | 3,893 |
| 운영자금 | 960 | 84 | 876 | ||
| 기타자금 | 27,012 | 20,506 | 6,506 | ||
| 2022-10-06 | 제1회 사모 전환사채 | 운영자금 | 16,500 | 8,407 | 8,093 |
| 합계 | 48,365 | 28,997 | 19,368 | ||
| (출처 : 정기보고서) |
당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있고, 이 자금의 출처는 코스닥 상장 유상증자 자금 11,275백만원, 제1회 전환사채 자금 8,093백만원으로 구성되어 있습니다. 당사는 2024년 10월 06일 지급되는 1차 조기상환을 지급하기 위해서는 코스닥 상장 유상증자 자금을 일부 전용하여야 합니다. 이후 금번 유상증자가 납입되는데로 전용된 자금을 반납하고, 사용목적에 맞게 운용될 예정입니다.
[외부자금 차입계획 및 계획대로 차입이 되지 않을 경우 대응방안]
당사는
전환사채투자자들에 대한 풋옵션행사 파악 결과 1회차(2024년 10월 6일) 풋옵션 행사 135억원, 2회차(2025년 1월 6일) 풋옵션 행사 30억원이 행사될 것으로 전망이 됩니다. 2024년 잔여기간 자금 수지를 감안컨데 1회차 풋옵션행사에는 무리없이 대처할 수 있으나 이후 자금운용상의 한시적 부족분을 해결하기 위해서는 30억원의 차입금조달이 필요한 상황입니다. 다만 2024년 12월 의도한 유상증자 납입이 이루어지게 된다면 자금수지 개선과 함께 2025년 30억원의 차입금상환을 계획하고 있습니다. 다만 당사가 계획하고 있는 2025년 라이선스아웃 및 CRO사업의 Cash Cow 역할에 차질이 생긴다면 2025년에도 자금수지는 어려움에 직면할 수 있는 만큼 철저한 대응 방안이 강구되어야 합니다.
당사는 향후 1년간 (주)인터내셔널사이언티픽스탠다드 관련 매출을 통해 영업현금흐름이 발생할 것으로 예상하고 있습니다. 단, 현 시점에서 당사가 계획 중인 주요 연구개발비 등을 충당하기에는 그 규모가 부족할 것으로 생각되며, 영업수지상 음(-)의 현금흐름이 발생할 것으로 예상하고 있습니다. 이에 본 유상증자 및 외부차입 등 재무활동을 통해 당사 운영자금 등을 조달하고자 합니다. 단, 재무활동을 통해서도 목표 자금을 조달하지 못한다면 당사에 유동성 위기가 생길 수 있고, 영업활동을 영위해나가는데 상당한 제약이 생길 수 있습니다.
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
(주16) 정정 전
| 라. (주)인터내셔널사이언티픽스탠다드 관련 위험 당사는 (주)인터내셔널사이언티픽스탠다드 지분 100% 취득 후, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 합병 후에는 더 이상 연결대상 종속회사는 존재하지 않습니다. 이에 합병 후 (주)인터내셔널사이언티픽스탠다드의 매출은 당사 개별 재무제표상 매출에 포함됩니다. 당사는 (주)인터내셔널사이언티픽스탠다드 합병을 통해 사업부문 다각화 및 매년 일정수준 매출이 발생하여 당사 재무적 상황이 개선될 수 있을 것으로 기대하고 있습니다.그럼에도 불구하고 (주)인터내셔널사이언티픽스탠다드를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)인터내셔널사이언티픽스탠다드 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다. |
당사는 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였습니다.
| [(주)인터내셔널사이언티픽스탠다드 기업 개요] |
| 구 분 | 내 용 |
|---|---|
| 상호명 |
(주)인터내셔널사이언티픽스탠다드 |
| 소재지 |
강원특별자치도 춘천시 소양강로 32(후평동) |
| 설립일 | 2008.06.25 |
| 대표이사 |
한동일 |
| 법인구분 |
비상장법인 |
| 자본금 | 50.5억원 |
| 사업영역 | 분석서비스(임상영역, 비임상영역, R&D 등) 임상서비스 |
| (출처 : 당사 제시) |
(주)인터내셔널사이언티픽스탠다드는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다. (주)인터내셔널사이언티픽스탠다드의 개별 재무 현황은 다음과 같습니다.
| [개별 재무상태표] |
| (단위 : 백만원) |
| 구분 | 2024년 반기말 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 유동자산 | 1,189 | 752 | 908 | 1,035 |
| 비유동자산 | 938 | 944 | 1,346 | 1,067 |
| 자산총계 | 2,126 | 1,696 | 2,254 | 2,101 |
| 유동부채 | 2,773 | 5,584 | 4,751 | 4,157 |
| 비유동부채 | 988 | 1,442 | 1,478 | 1,222 |
| 부채총계 | 3,761 | 7,025 | 6,228 | 5,379 |
| 자본금 | 5,050 | 5,050 | 5,050 | 5,050 |
| 이익잉여금 | -7,067 | -10,762 | -9,406 | -8,710 |
| 자본총계 | -1,635 | -5,330 | -3,974 | -3,278 |
| (출처 : 당사 제시) |
| [개별 손익계산서] |
| (단위 : 백만원) |
| 구분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 매출액 | 877 | 3,524 | 4,294 | 5,777 |
| 매출원가 | 1,301 | 3,898 | 4,009 | 3,845 |
| 매출총이익 | -424 | -374 | 284 | 1,931 |
| 판매비와관리비 | 121 | 812 | 905 | 647 |
| 영업이익(손실) | -545 | -1,186 | -620 | 1,285 |
| 영업외 수익 | 4,404 | 83 | 109 | 41 |
| 영업외 비용 | 82 | 252 | 185 | 678 |
| 법인세비용차감전 순이익 | 3,777 | -1,356 | -696 | 648 |
| 법인세비용 | - | - | - | - |
| 당기순이익 | 3,777 | -1,356 | -696 | 648 |
| (출처 : 당사 제시) | |
| 주1) | (주)인터내셔널사이언티픽스탠다드 간주취득일은 2024년 6월 30일입니다. 이에 2024년 반기 (주)인터내셔널사이언티픽스탠다드 손익은 당사 연결 손익에 포함되어 있지 않습니다. |
(주)인터내셔널사이언티픽스탠다드의 매출은 2021년부터 2024년까지 지속적으로 감소하고 있었고, 이에 따라 고정비 부담으로 인하여 영업손실 및 당기순손실이 발생하였습니다. 2024년 반기는 37억원의 당기순이익을 실현하였으나, 이는 기존 경영자와 관련된 채무면제이익 44억원에 의한 것입니다.
한편, 당사는 (주)인터내셔널사이언티픽스탠다드 지분 100% 취득 후, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 합병 후에는 더 이상 연결대상 종속회사는 존재하지 않습니다. 이에 합병 후 (주)인터내셔널사이언티픽스탠다드의 매출은 당사 개별 재무제표상 매출에 포함됩니다. 당사는 (주)인터내셔널사이언티픽스탠다드 합병을 통해 사업부문 다각화 및 매년 일정수준 매출이 발생하여 당사 재무적 상황이 개선될 수 있을 것으로 기대하고 있습니다.
그럼에도 불구하고 (주)인터내셔널사이언티픽스탠다드를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)인터내셔널사이언티픽스탠다드 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다.
(주16) 정정 후
| 라. (주)인터내셔널사이언티픽스탠다드 관련 위험 당사는 (주)인터내셔널사이언티픽스탠다드 지분 100% 취득 후, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 합병 후에는 더 이상 연결대상 종속회사는 존재하지 않습니다. 이에 합병 후 (주)인터내셔널사이언티픽스탠다드의 매출은 당사 개별 재무제표상 매출에 포함됩니다. 당사는 (주)인터내셔널사이언티픽스탠다드 합병을 통해 사업부문 다각화 및 매년 일정수준 매출이 발생하여 당사 재무적 상황이 개선될 수 있을 것으로 기대하고 있습니다.그럼에도 불구하고 (주)인터내셔널사이언티픽스탠다드를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)인터내셔널사이언티픽스탠다드 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다. 한편 CRO사업은 당사의 연구개발업과의 단기적인 사업적 시너지 효과를 기대할 수는 없으며, 당사가 합병 후 경영에 참여했을 때 기존의 실적을 달성하지 못할 수도 있습니다. 다만, 중장기적 관점에서는 앞서 기재한 바와 같이, 소규모 합병을 통해 회사의 신약 개발 기술력을 한 단계 끌어 올리고, 기존의 압타머 발굴·합성 서비스에 더해 바이오의약품 분석 서비스까지 사업영역을 넓혀 나가는 사업 방향성을 목표하고 있는 만큼 중장기적인 사업 시너지는 발생할 수 있을 것으로 기대하고 있습니다. 다만 이에 관하여 아직 구체화된 계획은 없으며, 우선적으로 당사는 현 체제 하에서 사업 안정화 및 재무적 상황을 개선하는데에 초점을 두고 있습니다. 또한 당사 기존 조직에서는 CRO사업 부문에 대한 경험과 전문성이 부족하기 때문에 앞서 언급한 바와 같이 전문 인력을 확보하여 활성화하고자 합니다. 다만, 당사의 기존 경영진들은 CRO사업에 대한 전문성과 경험이 상대적으로 부족한 점은 사실이며, 이는 사업 확장의 한계점으로 작용할 수 있는 점에 대하여 유의하여 주시기 바랍니다. |
당사는 신약개발사업의 불확실성 등을 감안 Cach-Cow 사업을 확보하고, 관리종목 리스크 중 매출 리스크에 선제적으로 대응하고자 2023년부터 신규사업 발굴에 노력을 기울여왔습니다. 당사의 신규사업 발굴 기준은 매출이 지속적으로 발생가능하고, 기존 사업과 관련이 있으며, 기존사업과의 시너지 창출이 가능한가 여부였습니다. 다만 신규사업을 발굴하는 과정에서 상당한 재원이 투입이 된다는 점에서 합리적인 의사결정을 위한 사전 대비 과정을 거쳐온 바 있습니다.
당사는 2023년 개발중인 파이프라인에 대한 분석법 개발을 위해 외부 전문 업체를 활용하고자 의사결정 한 바 있으며, 이에 첫번째 파이프라인인 AST-201의 생체시료 분석법 개발을 위해 객관적인 평가 프로세스에 의거 2023년 10월 ㈜인터내셔널사이언티픽스탠다드를 선정하고 진행하게 되었습니다.
㈜인터내셔널사이언티픽스탠다드를 통한 분석법 개발 과정에서 업체의 비교우위 역량을 파악하게 되던 차에 2024년 3월 ㈜인터내셔널사이언티픽스탠다드에 대한 경영권 매각 이슈가 있음을 인지하게 되었고, 양측의 니즈 등을 감안 비밀유지계약을 맺고 재무실사 등 일련을 과정을 거쳐, 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였습니다.
당사와 최대주주 등은 ㈜인터내셔널사이언티픽스탠다드와는 지분 관계를 포함하여 어떠한 연관이 없고, 2023년 개발중인 파이프라인에 대한 분석법 개발 과정에서 상호간 존재를 인식하게 되었습니다.
| [(주)인터내셔널사이언티픽스탠다드 기업 개요] |
| 구 분 | 내 용 |
|---|---|
| 상호명 |
(주)인터내셔널사이언티픽스탠다드 |
| 소재지 |
강원특별자치도 춘천시 소양강로 32(후평동) |
| 설립일 | 2008.06.25 |
| 대표이사 |
한동일 |
| 법인구분 |
비상장법인 |
| 자본금 | 50.5억원 |
| 사업영역 | 분석서비스(임상영역, 비임상영역, R&D 등) 임상서비스 |
| (출처 : 당사 제시) |
㈜인터내셔널사이언티픽스탠다드는 2008년 미국바텔연구소와 ㈜유유제약의 합작투자로 2008년 6월 자본금 50억원으로 설립되어 별도의 유상증자 없이 사업을 영위해왔으며, 2015년 이후는 개인을 통한 누적 차입금 45억원을 통해 운영자금을 조달하여 사업을 영위해온 바 있습니다. 사업의 부침은 있었으나 2021년 7,246백만원의 매출과 1,285백만원의 영업이익을 정점으로 2022년 5,185백만원의 매출과 620백만원의 영업손실, 2023년 3,961백만원의 매출과 1,186백만원의 영업손실을 시현하게 되었는데 이는 2021년 이후 주요 매출 아이템인 생동 분야에서의 경쟁력 상실 및 인건비 포함 고정비 부담 등이 주요 원인이라 할 수 있습니다. 이에 ㈜인터내셔널사이언티픽스탠다드 경영진은 2023년 말 경영권 매각에 대한 의사결정을 하게 되었고 이를 촉진하기 위해 2024년 초 본격적인 사업의 축소 및 인력에 대한 구조조정을 단행해 전체적으로 사업을 슬림화하였고, 경영권 매각의 제약사항이라 할 수 있는 45억원의 누적 차입금 중 39억원에 대한 포기(종결)을 경영권 매각 조건으로 제시된 바 있습니다.
당사의 신규사업 발굴 기조와 ㈜인터내셔널사이언티픽스탠다드의 경영권 매각 의지, 구조조정 단계, 채무면제 이익 등에 대한 공감대가 형성되어 M&A가 진행되었고 현재 안정적인 PMI 과정이 진행중에 있습니다. 또한 ㈜인터내셔얼사이언티픽스탠다드 M&A 관련 실사과정 등을 통해 실질적인 주식가치는 인정하지 않고 자산과 부채를 승계하는 것으로 최종 합의를 하였으며 정정신고서 제출일 현재 누적 차입금 45억원은 전액 상환되었습니다.
| [(주)인터내셔널사이언티픽스탠다드 거래 및 채권채무] |
| (단위 : 천원) |
| 구 분 | 거래내용 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 주요 거래 | 기타비용 | 65,958 | 11,226 | - | - |
| 이자수익 | 5,810 | - | - | - | |
| 채권 | 대여금 | 1,500,000 | - | - | - |
| 미수수익 | 5,810 | - | - | - | |
| 채무 | 미지급금 | 2,365 | - | - | - |
| (주1) 2024년 반기 기타비용은 'AST-201 임상1상환자 검체 분석' 1차 지급분 (50%)입니다. (주2) 2023년의 기타비용은 'AST-202 생체시료 분석법 개발' 1차 지급분(50%)입니다. (출처 : 당사 제시) |
또한 당사는 (주)인터내셔널사이언티픽의 경영활동 정상화를 위해 2024년 상반기 중 4차례의 금전대여를 진행한 바 있습니다. 4차례의 금전대여 공히 계약된 변제기일내 대여 원금을 상환하지 아니하였을 경우 LC장비 모든 권리를 양도하는 조건입니다.
| [(주)인터내셔널사이언티픽스탠다드 대여금] |
| (단위 : 천원) |
| 구분 | 1회차 | 2회차 | 3회차 | 4회차 |
|---|---|---|---|---|
| 시작일자 | 2024.05.27 | 2024.05.27 | 2024.05.29 | 2024.06.11 |
| 종료일자 | 2024.12.31 | 2024.12.31 | 2024.12.31 | 2024.12.31 |
| 대여목적 | 운영자금 지원 | 운영자금 지원 | 운영자금 지원 | 운영자금 지원 |
| 대여금액 | 300,000 | 600,000 | 200,000 | 400,000 |
| 이자율. | 4.6 | 4.6 | 4.6 | 4.6 |
| (출처 : 당사 제시) |
당사는 ㈜인터내셔널사이언티픽스탠다드의 자산과 부채 승계과정에서 실질적인 매수가액이라할 수 있는 차액에 대한 타당성을 입증하고자 매수가격배분(Purchase Price Allocation)(*) 공정가치 평가를 태일회계법인이 수행하였습니다. 태일회계법인을 통한 잠재적 무형자산의 인식가능성 검토 결과, 고객관계와 관련하여 무형자산이 식별되고 중요성이 있는 것으로 검토되었으며, 고객관계는 다기간초과이익법(Multi-period Excess Earning Method : MEEM)으로 평가하였습니다. 다기간초과이익법은 기여자산의 추정이익에서 원가를 차감하여 적절한 할인율을 사용하여 평가기준일 현재가치로 할인하는 방법입니다.
| (*) K-IFRS에 따르면 사업결합 시에는 취득법(Acquisition method)을 적용하여 회계 처리해야 하며, 취득자는 취득일 현재 피취득자의 자산(과거 인식되지 않은 무형자산 포함)과 인수부채의 공정가치를 측정하고 매수가액을 배부해야 합니다. 취득한 식별 가능한 무형자산은 영업권과 분리하여 인식해야 하며 무형자산은 분리가능성 기준이나 계약적·법적 기준을 충족하는 경우에 식별 가능합니다. 식별 가능하고 가치평가 대상으로 선정된 자산, 부채, 공정가액이 인수자의 지분을 초과하는 금액에 대해서는 영업권으로 인식하며, 인수자의 지분에 미달하는 금액에 대해서는 염가매수차익으로 인식합니다. |
이에 따라 당사는 2024년 반기 기준 고객관계가치 851백만원과 영업권 962백만원을 인식하였습니다. 당사는 고객관계가치를 5년간 감가상각할 예정이나, 매 보고기간말 혹은 손상을 시사하는 징후가 있을 때 회수가능액과 장부금액을 비교하여 손상검사를 수행하여 장부가액의 일부 또는 전액에 대하여 손상을 인식할 수 있습니다.
(주)인터내셔널사이언티픽스탠다드는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다. (주)인터내셔널사이언티픽스탠다드의 개별 재무 현황은 다음과 같습니다.
| [개별 재무상태표] |
| (단위 : 백만원) |
| 구분 | 2024년 반기말 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 유동자산 | 1,189 | 752 | 908 | 1,035 |
| 비유동자산 | 938 | 944 | 1,346 | 1,067 |
| 자산총계 | 2,126 | 1,696 | 2,254 | 2,101 |
| 유동부채 | 2,773 | 5,584 | 4,751 | 4,157 |
| 비유동부채 | 988 | 1,442 | 1,478 | 1,222 |
| 부채총계 | 3,761 | 7,025 | 6,228 | 5,379 |
| 자본금 | 5,050 | 5,050 | 5,050 | 5,050 |
| 이익잉여금 | -7,067 | -10,762 | -9,406 | -8,710 |
| 자본총계 | -1,635 | -5,330 | -3,974 | -3,278 |
| (출처 : 당사 제시) |
| [개별 손익계산서] |
| (단위 : 백만원) |
| 구분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 매출액 | 877 | 3,524 | 4,294 | 5,777 |
| 매출원가 | 1,301 | 3,898 | 4,009 | 3,845 |
| 매출총이익 | -424 | -374 | 284 | 1,931 |
| 판매비와관리비 | 121 | 812 | 905 | 647 |
| 영업이익(손실) | -545 | -1,186 | -620 | 1,285 |
| 영업외 수익 | 4,404 | 83 | 109 | 41 |
| 영업외 비용 | 82 | 252 | 185 | 678 |
| 법인세비용차감전 순이익 | 3,777 | -1,356 | -696 | 648 |
| 법인세비용 | - | - | - | - |
| 당기순이익 | 3,777 | -1,356 | -696 | 648 |
| (출처 : 당사 제시) | |
| 주1) | (주)인터내셔널사이언티픽스탠다드 간주취득일은 2024년 6월 30일입니다. 이에 2024년 반기 (주)인터내셔널사이언티픽스탠다드 손익은 당사 연결 손익에 포함되어 있지 않습니다. |
(주)인터내셔널사이언티픽스탠다드의 매출은 2021년부터 2024년까지 지속적으로 감소하고 있었고, 이에 따라 고정비 부담으로 인하여 영업손실 및 당기순손실이 발생하였습니다. 2024년 반기는 37억원의 당기순이익을 실현하였으나, 이는 기존 경영자와 관련된 채무면제이익 44억원에 의한 것입니다.
당사는 M&A 과정에서 첫째 ㈜인터내셔널사이언티픽스탠다드의 고객군에 주목했는데, 고객군은 1억 이상의 대규모 수주가 이루어지는 제약사 수주와 1억 미만의 소규모 수주일 수 있으나 증가속도가 가파른 바이오텍의 수주가 유지가 된다면 충분히 턴어라운드가 가능할 것이라 판단하였습니다. 둘째 ㈜인터내셔널사이언티픽스탠다드의 역량에 주목했는데, 업계내 특화된 강소기업이라는 레퍼런스와 남아있는 핵심인력이 유지가 된다면 이 역시 턴어라운드를 견인할 수 있을 것이라 판단하였습니다.
외부적으로 확인된 재무상태 및 손익추이만을 본다면 M&A의 평가에 이견이 있을 수 있으나, 당사는 2024년 구조조정 및 슬림화 과정을 거쳐 2025년을 위한 빌드업 과정이 차질없이 진행이 된다라면 25억원 ~ 30억원에 해당하는 손익분기점 수준의 매출은 시현할 수 있을 것이란 판단하고 있습니다, 또한 예상대로 매출이 시현이 된다라면 당초 기대한 바 있는 Cash Cow로서의 역할과 관리종목 매출리스크에 대한 해소가 가능할 수 있을 것으로 전망하고 있습니다.
다만 회사가 실질적인 턴어라운드를 위해서는 M&A 이후의 PMI를 전제로한 핵심 인력의 이탈방지와 함께 성장을 주도할 수 있는 전문 인력을 확보가 무엇보다 중요하다고 할 수 있습니다. 회사는 그 일환으로 미국 NIH, 삼성, LG, 미국 소재 CRO 등에서 바이오시밀러 및 대사체 ID 분석을 담당했고 국내 CRO에서 운영책임자로 근무하며 미국 FDA와 다양한 업무를 수행하는 등 26년간 폭넓은 경험을 쌓은 분석 전문가로 꼽히는 양정수박사를 CRO사업총괄로 영입을 하였습니다. 회사는 양정수전무 합류로 ‘바이오의약품 분석 명가’로 거듭날 수 있도록 제반 역량을 강화할 방침이며, 특히 바이오의약품 시장의 성장을 예상하고 선제적인 대비를 해온 만큼 국내 기업 주도 신약 개발 프로젝트가 활성화되고 글로벌 기술이전 사례가 많아짐에 따라 이를 뒷받침할 고품질 분석 서비스로 협력을 확대하겠다는 방침입니다.
또한 국내 대형 비임상 CRO로부터 올리고펩타이드, ADC 및 항체약물과 같은 거대분자 모달리티에 대한 비임상독성시험 대응시 진행 과정을 협업 할 수 있는 프로세스를 구축하기 위한 적극적인 제휴에도 적극적으로 임하고 있는데 이를 통한 안정적인 수익 모델을 구축하고자 하며, 적자 발생 손익 구조를 개선하기 위해 최소한의 마케팅 비용 및 인건비 등으로 최대의 효과를 낼 수 있도록 현재 인력들 개개인의 업무를 지원하되, 무리한 조직 확장계획 또는 자금 투자계획은 세우고 있지 않으며, 최대한 비용 통제를 위한 노력을 할 예정입니다.
참고로 무형자산의 가치를 평가함에 있어 미래 예측기간 동안의 추정손익은 회사의 과거 실적, 사업계획 및 기타 공시된 자료 등을 바탕으로 일정한 가정하에서 산출된 것이므로 미래의 경제적 상황 및 회사의 사업전략, 기타 경영상황의 변화에 따라 향후 실제 경영성과와 차이가 나는 것이 일반적이고, 그 차이는 중대할 수 있습니다. 따라서 가치평가 결과가 그 미래 실제 가치와 동일하거나 유사할 것이라고 확인하거나 보증을 제공하지 아니하므로, 당사의 의사결정시 제반 위험요인을 추가적으로 고려하여야 합니다.
회사는 M&A 이후 사업개발 역량 확보를 통한 수주 활성화를 위해 전문 인력을 확충한 바 있으며, M&A를 통해 재무 안정성을 확보했했고 신약 개발에 필수적인 바이오의약품 분석 패키지를 제공하여 글로벌 경쟁력을 갖춘 분석 CRO로 자리매김할 것을 천명한 바 있습니다. 다만 전방산업의 회복 및 차빌없는 빌드업 과정이 전제되어야 하는 만큼 불활실성을 배제할 수는 없습니다.
한편, 당사는 (주)인터내셔널사이언티픽스탠다드 지분 100% 취득 후, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 합병 후에는 더 이상 연결대상 종속회사는 존재하지 않습니다. 이에 합병 후 (주)인터내셔널사이언티픽스탠다드의 매출은 당사 개별 재무제표상 매출에 포함됩니다. 당사는 (주)인터내셔널사이언티픽스탠다드 합병을 통해 사업부문 다각화 및 매년 일정수준 매출이 발생하여 당사 재무적 상황이 개선될 수 있을 것으로 기대하고 있습니다.
그럼에도 불구하고 (주)인터내셔널사이언티픽스탠다드를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)인터내셔널사이언티픽스탠다드 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다.
한편 CRO사업은 당사의 연구개발업과의 단기적인 사업적 시너지 효과를 기대할 수는 없으며, 당사가 합병 후 경영에 참여했을 때 기존의 실적을 달성하지 못할 수도 있습니다. 다만, 중장기적 관점에서는 앞서 기재한 바와 같이, 소규모 합병을 통해 회사의 신약 개발 기술력을 한 단계 끌어 올리고, 기존의 압타머 발굴·합성 서비스에 더해 바이오의약품 분석 서비스까지 사업영역을 넓혀 나가는 사업 방향성을 목표하고 있는 만큼 중장기적인 사업 시너지는 발생할 수 있을 것으로 기대하고 있습니다. 다만 이에 관하여 아직 구체화된 계획은 없으며, 우선적으로 당사는 현 체제 하에서 사업 안정화 및 재무적 상황을 개선하는데에 초점을 두고 있습니다.
또한 당사 기존 조직에서는 CRO사업 부문에 대한 경험과 전문성이 부족하기 때문에 앞서 언급한 바와 같이 전문 인력을 확보하여 활성화하고자 합니다. 다만, 당사의 기존 경영진들은 CRO사업에 대한 전문성과 경험이 상대적으로 부족한 점은 사실이며, 이는 사업 확장의 한계점으로 작용할 수 있는 점에 대하여 유의하여 주시기 바랍니다.
(주17) 정정 전
| 마. 잦은 자금조달 관련 위험 당사는 2020년 9월 10일 코스닥시장 상장을 통한 유상증자 319억원, 2022년 10월 06일 제1회 사모 전환사채 165억원을 시설자금 및 운영자금 목적으로 자본시장에서 조달하였습니다. 당사는 최근 5년간 연구개발비 등을 사용하기 위해 자본시장을 통해 자금조달을 한 만큼, 주요 파이프라인의 기술이전을 통한 매출 발생이 당사 예상 대비 지연되거나 자금 운용계획을 적정하게 수립하지 못할 경우 향후에도 자본시장을 통한 추가적인 자금조달이 이뤄질 수 있습니다. 또한, 시장 상황으로 인해 추가적인 자금조달이 원활히 이뤄지지 않을 경우 당사는 일시적인 유동성 위험에 처할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2020년 9월 10일 코스닥시장 상장을 통한 유상증자 319억원, 2022년 10월 06일 제1회 사모 전환사채 165억원을 시설자금 및 운영자금 목적으로 자본시장에서 조달하였습니다.
| [상장 및 이후 자본시장에서 조달한 자금 내역] |
| (단위: 백만원) |
| 납입일 | 종류 | 사용용도 | 금액 | 실제사용내역 |
|---|---|---|---|---|
| 2020-09-10 | 코스닥 상장 유상증자(일반공모) | 시설자금 | 3,893 | - |
| 운영자금 | 960 | 84 | ||
| 기타자금 | 27,012 | 20,506 | ||
| 2022-10-06 | 제1회 사모 전환사채 | 운영자금 | 16,500 | 8,407 |
| 합계 | 48,365 | 28,997 | ||
| (출처 : 정기보고서) |
1) 코스닥시장 상장을 통한 유상증자 319억원의 사용내역
2020년 9월 당사는 코스닥시장에 상장하였으며, 당시 공모자금 319억원은 시설자금 39억원, 운영자금 10억원 및 기타자금 270억원의 용도로 사용할 계획이었습니다.
이 중 당사가 상장할 당시 계획했던 기타자금 270억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 합계 |
|---|---|---|---|---|
| AST-101 (당뇨병치료제-인슐린대체제) | - | 1,251 | 5,286 | 6,537 |
| -전임상 시험 | - | 1,000 | - | 1,000 |
| -임상1상 시험 | - | 251 | 5,286 | 5,537 |
| AST-102 (당뇨병치료제-인슐린민감제) | 195 | 455 | 1,251 | 1,901 |
| -선도물질 최적화 | 195 | - | - | 195 |
| -전임상 시험 | - | 455 | - | 455 |
| -추가임상진행비용 | - | - | 1,251 | 1,251 |
| AST-201 (간암치료제) | 217 | 1,949 | 3,628 | 5,794 |
| -전임상 시험 | 217 | 1,000 | - | 1,217 |
| -임상1상 시험 | - | 949 | 3,628 | 4,577 |
| 기타 신규 파이프라인 | 200 | 3,400 | 5,400 | 9,000 |
| 진단제품 임상비용 | 500 | 980 | 2,300 | 3,780 |
| 합 계 | 1,112 | 8,035 | 17,865 | 27,012 |
| (출처 : 증권신고서) |
| [실제 자금사용 내역] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 | 2024년 반기 |
합계 | 차이발생 사유 등 |
|---|---|---|---|---|---|---|---|
| AST-101 (당뇨병치료제-인슐린대체제) | 95 | 431 | 479 | - | - | 1,005 | 2022년 3분기 개발 중단 주1) |
| -전임상 시험 | 95 | 431 | 479 | - | - | 1,005 | |
| AST-102 (당뇨병치료제-인슐린민감제) | 92 | 32 | 90 | - | - | 214 | |
| -선도물질 최적화 | 92 | 32 | 90 | - | - | 214 | |
| AST-201 (간암치료제) | 606 | 136 | 4,348 | 7,209 | 972 | 13,271 | 개발 지연 주2) |
| -전임상 시험 | 606 | 136 | 4,348 | 296 | - | 5,386 | |
| -임상1상 시험 | - | - | - | 6,913 | 972 | 7,885 | |
| 기타 신규 파이프라인 | - | 198 | 308 | 24 | 363 | 893 | - |
| -Covid19 치료제 | - | 198 | 53 | - | - | 252 | |
| -AST-202 선도물질 최적화 | - | - | 255 | 24 | 363 | 641 | |
| 진단제품 임상비용 | 58 | 67 | 27 | 596 | 7 | 755 | - |
| -폐암진단키트 임상비용 | - | - | - | 595 | 6 | 602 | |
| -폐암진단키트 후속모델 개발 | 58 | 67 | 27 | 0 | 1 | 153 | |
| 기타운영자금 | 646 | 818 | 594 | 912 | 1,482 | 4,453 | - |
| 합 계 | 1,497 | 1,682 | 5,845 | 8,741 | 2,824 | 20,590 | - |
| (출처 : 당사 제시) 주1) 당사는 AlloMAp 플랫폼을 활용한 First-in-class 당뇨 신약 개발(제1/2형 당뇨의 지속형 인슐린대체제 및 인슐린민감제)을 추진했으며 Johnson & Johnson 사와 제휴(2016년 4분기), Novo Nordisk 사와 MTA(물질이전계약) 체결(2018년 3분기), 범부처신약개발과제에 선정(2019년 1분기)되었습니다. 그러나 비임상 단계에서 산출된 데이터로 후보물질의 경제성평가를 수행한 결과, 인슐린 기반 치료제가 기존 치료제의 대세로 자리잡은 현 시장 상황과 투여주기를 점점 늘려가는 당뇨 치료제 개발 방향성을 고려하여 △주1회 투여 방식으로 제형변화의 필요성 △시장의 경쟁 심화 △GLP-1 수용체작용체의 확대 △인슐린 기반 치료제의 지속적인 단가 인하로 인한 가격경쟁력 확보의 불확실성 등의 요인으로 경쟁력이 높지 않음을 확인하였고, 2022년 3분기 해당 파이프라인의 개발을 잠정 중단하기로 결정하였습니다. 당사의 후보물질은 인슐린 장기투여로 인한 부작용(인슐린 저항성, 심혈관 위험, 체중증가 등)에서 경쟁우위에 있으나, 대사질환 계열 약물의 임상적 유의성을 입증하기 위한 대규모 임상 등 투자비용 대비 기대수익이 충분하지 않았던 까닭입니다. 현 시점에서는 추가적인 제형연구를 통한 약동력학적 특성 개선과 활성평가 연구를 일부 병행 중으로, 임상 단계 진입은 공동개발 파트너사가 정해진 이후에 가능할 것으로 예상됩니다. 주2) 당사의 고형암 치료제 AST-201은 상장 당시 후보물질 단계였으며, 2021~22년 전임상 시험 - 2023년 임상시험용 의약품 위탁생산 - 2024년 현재 식약처 임상시험계획승인(IND)을 신청한 상태입니다. 이는 상장 당시보다 2년 정도 지연된 것으로, 주요 사유는 △코로나19로 인한 임상용 의약품 위탁생산의 지연 및 전임상 독성평가를 위한 위탁시험기관 확보의 어려움 △중국 제약사와의 파트너링 논의지연 등입니다. 현 시점은 식약처 임상승인 신청을 마친 상태로 2024년 10월 중 IND 승인을 예상하고 있습니다. 이에 10월부터 국내 다기관임상(4개 병원)에 착수할 계획이며, 2025년 2분기 임상 중간데이터를 확보하여 해외제약사 기술이전계약 체결을 목표하고 있습니다. 당사는 글로벌 기술이전을 목표로 2024년 상반기 China Bio, Bio USA 전시박람회에 참가하였으며, 다수의 해외 제약사와 CDA 계약을 맺고 기술검토를 진행하고 있습니다. |
한편, 2020년 9월 당사가 상장할 당시 계획했던 시설자금 39억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 합계 |
|---|---|---|---|
| GMP 시설 증설 (주1) | 1,200 | 1,800 | 3,000 |
| 폐암 IVD 생산 설비 (주2) | 163 | 730 | 893 |
| 합 계 | 1,363 | 2,530 | 3,893 |
| (출처 : 증권신고서) |
시설자금 39억원에 대해서는 신고서 제출일 현재까지 집행되지 않고 있습니다. 당사는 코스닥 시장 상장 당시 GMP 생산 시스템과 IVD 생산 설비의 증설을 계획하고 시설투자자금을 확보하였습니다. 당사의 폐암 조기진단 제품(AptoDetect™-Lung)은 식약처 3등급 체외진단의료기기로서 의료기기 제조 및 품질관리 기준을 인증받은 GMP 시설에서 생산되고 있으며, 현재 구축된 시설의 연간 생산량은 2,970 키트입니다. 회사는 국내 건강검진시장 진입과 해외시장 진출 등 매출이 가시화되는 시점에 맞추어, 연간 10만 키트 규모의 GMP 공장을 증설할 계획을 가지고 있습니다. 신고서 제출일 기준 폐암 조기진단 제품은 상급종합병원(서울아산병원, 경희대의료원 등)과 건강검진센터(분당서울대학교병원, 분당차병원 등)에서 서비스하고 있으며, 판매예상에 따른 GMP 시설이전 시점을 충분히 검토하여 자금을 집행할 계획입니다.
2) 제1회 사모 전환사채 발행 165억원의 사용 내역
당사는 2022년 10월 제1회 사모 전환사채 165억원 발행 당시 연구개발비 및 임상시험비를 위해 운영자금 165억원을 집행할 목적이었습니다. 운영자금 165억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [제1회 사모 전환사채 발행 당시 자금사용목적] |
| (단위 : 백만원) |
| 자금용도 | 세부내역 | 연도별 사용 예정 금액 | |||
|---|---|---|---|---|---|
| '22년 | '23년 | '24년 이후 | 합계 | ||
| 운영자금 | 임상 비용 | 3,889 | 10,392 | 2,219 | 16,500 |
| (출처 : 주요사항보고서) |
| [제1회 사모 전환사채 자금사용 내역] |
| (단위 : 백만원) |
| 자금용도 | 세부내역 | 연도별 사용 금액 | |||
|---|---|---|---|---|---|
| '22년 | '23년 | '24년 이후 | 합계 | ||
| 운영자금 | 임상 비용 | - | 6,863 | 1,544 | 8,407 |
| (출처 : 당사 제시) |
당사는 사모 전환사채 조달금액 중 84억원을 2024년 반기까지 연구개발비 및 임상시험비 등의 운영자금으로 사용하였습니다. 잔여금액은 금융상품에 가입하여 운용되고 있습니다.
| [미사용자금의 운용 내역] | |||
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 보통예금 | 868 | - | 수시입출금 |
| 예ㆍ적금 | 정기예금 | 11,500 | 2023.07 ~ 2024.04 | 9개월 |
| 채권 | 중소기업금융채권 (주1) |
7,000 | 2023.10 ~ 2024.04 | 6개월 |
| 계 | 19,368 | - | ||
| (출처 : 당사 제시) (주1) 금융상품 가입금액에는 전환사채 발행액 중 미사용 자금이 포함되어 있습니다. |
당사는 향후에도 바이오사업을 영위하면서 주요 파이프라인의 연구 개발을 지속하기 위하여 자금조달이 필요한 상황입니다. 금번 주주배정 후 실권주 일반공모를 통한 세부 자금사용 계획에 대해서는 본 증권신고서의 제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
이처럼 당사는 최근 5년간 연구개발비 등을 사용하기 위해 자본시장을 통해 자금조달을 한 만큼, 주요 파이프라인의 기술이전을 통한 매출 발생이 당사 예상 대비 지연되거나 자금 운용계획을 적정하게 수립하지 못할 경우 향후에도 자본시장을 통한 추가적인 자금조달이 이뤄질 수 있습니다. 또한, 시장 상황으로 인해 추가적인 자금조달이 원활히 이뤄지지 않을 경우 당사는 일시적인 유동성 위험에 처할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주17) 정정 후
| 마. 잦은 자금조달 관련 위험 당사는 2020년 9월 10일 코스닥시장 상장을 통한 유상증자 319억원, 2022년 10월 06일 제1회 사모 전환사채 165억원을 시설자금 및 운영자금 목적으로 자본시장에서 조달하였습니다. 당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있음에도 불구하고 금번 유상증자를 진행하고 있습니다. 당사는 165억원의 미상환 전환사채를 보유하고 있고, 동 전환사채의 전환가액은 4,058원이며 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 당사가 자체적으로 전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다. 당사는 제1회 전환사채를 8,407백만원을 기사용하여 전환사채를 조기상환하기 위해서는 8,407백만원이 추가로 필요하고, 향후 원활한 연구개발을 위해서는 추가자금이 필요하기 때문에 금번 유상증자를 추진하게 되었습니다. 당사는 최근 5년간 연구개발비 등을 사용하기 위해 자본시장을 통해 자금조달을 한 만큼, 주요 파이프라인의 기술이전을 통한 매출 발생이 당사 예상 대비 지연되거나 자금 운용계획을 적정하게 수립하지 못할 경우 향후에도 자본시장을 통한 추가적인 자금조달이 이뤄질 수 있습니다. 또한, 시장 상황으로 인해 추가적인 자금조달이 원활히 이뤄지지 않을 경우 당사는 일시적인 유동성 위험에 처할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2020년 9월 10일 코스닥시장 상장을 통한 유상증자 319억원, 2022년 10월 06일 제1회 사모 전환사채 165억원을 시설자금 및 운영자금 목적으로 자본시장에서 조달하였습니다.
| [상장 및 이후 자본시장에서 조달한 자금 내역] |
| (단위: 백만원) |
| 납입일 | 종류 | 사용용도 | 금액 | 실제사용내역 |
|---|---|---|---|---|
| 2020-09-10 | 코스닥 상장 유상증자(일반공모) | 시설자금 | 3,893 | - |
| 운영자금 | 960 | 84 | ||
| 기타자금 | 27,012 | 20,506 | ||
| 2022-10-06 | 제1회 사모 전환사채 | 운영자금 | 16,500 | 8,407 |
| 합계 | 48,365 | 28,997 | ||
| (출처 : 정기보고서) |
1) 코스닥시장 상장을 통한 유상증자 319억원의 사용내역
2020년 9월 당사는 코스닥시장에 상장하였으며, 당시 공모자금 319억원은 시설자금 39억원, 운영자금 10억원 및 기타자금 270억원의 용도로 사용할 계획이었습니다.
이 중 당사가 상장할 당시 계획했던 기타자금 270억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 합계 |
|---|---|---|---|---|
| AST-101 (당뇨병치료제-인슐린대체제) | - | 1,251 | 5,286 | 6,537 |
| -전임상 시험 | - | 1,000 | - | 1,000 |
| -임상1상 시험 | - | 251 | 5,286 | 5,537 |
| AST-102 (당뇨병치료제-인슐린민감제) | 195 | 455 | 1,251 | 1,901 |
| -선도물질 최적화 | 195 | - | - | 195 |
| -전임상 시험 | - | 455 | - | 455 |
| -추가임상진행비용 | - | - | 1,251 | 1,251 |
| AST-201 (간암치료제) | 217 | 1,949 | 3,628 | 5,794 |
| -전임상 시험 | 217 | 1,000 | - | 1,217 |
| -임상1상 시험 | - | 949 | 3,628 | 4,577 |
| 기타 신규 파이프라인 | 200 | 3,400 | 5,400 | 9,000 |
| 진단제품 임상비용 | 500 | 980 | 2,300 | 3,780 |
| 합 계 | 1,112 | 8,035 | 17,865 | 27,012 |
| (출처 : 증권신고서) |
| [실제 자금사용 내역] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 | 2024년 반기 |
합계 | 차이발생 사유 등 |
|---|---|---|---|---|---|---|---|
| AST-101 (당뇨병치료제-인슐린대체제) | 95 | 431 | 479 | - | - | 1,005 | 2022년 3분기 개발 중단 주1) |
| -전임상 시험 | 95 | 431 | 479 | - | - | 1,005 | |
| AST-102 (당뇨병치료제-인슐린민감제) | 92 | 32 | 90 | - | - | 214 | |
| -선도물질 최적화 | 92 | 32 | 90 | - | - | 214 | |
| AST-201 (간암치료제) | 606 | 136 | 4,348 | 7,209 | 972 | 13,271 | 개발 지연 주2) |
| -전임상 시험 | 606 | 136 | 4,348 | 296 | - | 5,386 | |
| -임상1상 시험 (임상시험용의약품 위탁생산 비용) |
- | - | - | 6,913 | 972 | 7,885 | |
| 기타 신규 파이프라인 | - | 198 | 308 | 24 | 363 | 893 | - |
| -Covid19 치료제 | - | 198 | 53 | - | - | 252 | |
| -AST-202 선도물질 최적화 | - | - | 255 | 24 | 363 | 641 | |
| 진단제품 임상비용 | 58 | 67 | 27 | 596 | 7 | 755 | - |
| -폐암진단키트 임상비용 | - | - | - | 595 | 6 | 602 | |
| -폐암진단키트 후속모델 개발 | 58 | 67 | 27 | 0 | 1 | 153 | |
| 기타운영자금 | 646 | 818 | 594 | 912 | 1,482 | 4,453 | - |
| 합 계 | 1,497 | 1,682 | 5,845 | 8,741 | 2,824 | 20,590 | - |
| (출처 : 당사 제시) 주1) 당사는 AlloMAp 플랫폼을 활용한 First-in-class 당뇨 신약 개발(제1/2형 당뇨의 지속형 인슐린대체제 및 인슐린민감제)을 추진했으며 Johnson & Johnson 사와 제휴(2016년 4분기), Novo Nordisk 사와 MTA(물질이전계약) 체결(2018년 3분기), 범부처신약개발과제에 선정(2019년 1분기)되었습니다. 그러나 비임상 단계에서 산출된 데이터로 후보물질의 경제성평가를 수행한 결과, 인슐린 기반 치료제가 기존 치료제의 대세로 자리잡은 현 시장 상황과 투여주기를 점점 늘려가는 당뇨 치료제 개발 방향성을 고려하여 △주1회 투여 방식으로 제형변화의 필요성 △시장의 경쟁 심화 △GLP-1 수용체작용체의 확대 △인슐린 기반 치료제의 지속적인 단가 인하로 인한 가격경쟁력 확보의 불확실성 등의 요인으로 경쟁력이 높지 않음을 확인하였고, 2022년 3분기 해당 파이프라인의 개발을 잠정 중단하기로 결정하였습니다. 당사의 후보물질은 인슐린 장기투여로 인한 부작용(인슐린 저항성, 심혈관 위험, 체중증가 등)에서 경쟁우위에 있으나, 대사질환 계열 약물의 임상적 유의성을 입증하기 위한 대규모 임상 등 투자비용 대비 기대수익이 충분하지 않았던 까닭입니다. 현 시점에서는 추가적인 제형연구를 통한 약동력학적 특성 개선과 활성평가 연구를 일부 병행 중으로, 임상 단계 진입은 공동개발 파트너사가 정해진 이후에 가능할 것으로 예상됩니다. 주2) 당사의 고형암 치료제 AST-201은 상장 당시 후보물질 단계였으며, 2021~22년 전임상 시험 - 2023년 임상시험용 의약품 위탁생산 - 2024년 현재 식약처 임상시험계획승인(IND)을 신청한 상태입니다. 이는 상장 당시보다 2년 정도 지연된 것으로, 주요 사유는 △코로나19로 인한 임상용 의약품 위탁생산의 지연 및 전임상 독성평가를 위한 위탁시험기관 확보의 어려움 △중국 제약사와의 파트너링 논의지연 등입니다. 현 시점은 식약처 임상승인 신청을 마친 상태로 2024년 10월 중 IND 승인을 예상하고 있습니다. 이에 10월부터 국내 다기관임상(4개 병원)에 착수할 계획이며, 2025년 2분기 임상 중간데이터를 확보하여 해외제약사 기술이전계약 체결을 목표하고 있습니다. 당사는 글로벌 기술이전을 목표로 2024년 상반기 China Bio, Bio USA 전시박람회에 참가하였으며, 다수의 해외 제약사와 CDA 계약을 맺고 기술검토를 진행하고 있습니다. |
한편, 2020년 9월 당사가 상장할 당시 계획했던 시설자금 39억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 합계 |
|---|---|---|---|
| GMP 시설 증설 (주1) | 1,200 | 1,800 | 3,000 |
| 폐암 IVD 생산 설비 (주2) | 163 | 730 | 893 |
| 합 계 | 1,363 | 2,530 | 3,893 |
| (출처 : 증권신고서) |
시설자금 39억원에 대해서는 신고서 제출일 현재까지 집행되지 않고 있습니다. 당사는 코스닥 시장 상장 당시 GMP 생산 시스템과 IVD 생산 설비의 증설을 계획하고 시설투자자금을 확보하였습니다. 당사의 폐암 조기진단 제품(AptoDetect™-Lung)은 식약처 3등급 체외진단의료기기로서 의료기기 제조 및 품질관리 기준을 인증받은 GMP 시설에서 생산되고 있으며, 현재 구축된 시설의 연간 생산량은 2,970 키트입니다. 회사는 국내 건강검진시장 진입과 해외시장 진출 등 매출이 가시화되는 시점에 맞추어, 연간 10만 키트 규모의 GMP 공장을 증설할 계획을 가지고 있습니다. 신고서 제출일 기준 폐암 조기진단 제품은 상급종합병원(서울아산병원, 경희대의료원 등)과 건강검진센터(분당서울대학교병원, 분당차병원 등)에서 서비스하고 있으며, 판매예상에 따른 GMP 시설이전 시점을 충분히 검토하여 자금을 집행할 계획입니다.
2) 제1회 사모 전환사채 발행 165억원의 사용 내역
당사는 2022년 10월 제1회 사모 전환사채 165억원 발행 당시 연구개발비 및 임상시험비를 위해 운영자금 165억원을 집행할 목적이었습니다. 운영자금 165억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [제1회 사모 전환사채 발행 당시 자금사용목적] |
| (단위 : 백만원) |
| 자금용도 | 세부내역 | 연도별 사용 예정 금액 | |||
|---|---|---|---|---|---|
| '22년 | '23년 | '24년 이후 | 합계 | ||
| 운영자금 | 임상 비용 | 3,889 | 10,392 | 2,219 | 16,500 |
| (출처 : 주요사항보고서) |
| [제1회 사모 전환사채 자금사용 내역] |
| (단위 : 백만원) |
| 자금용도 | 세부내역 | 연도별 사용 금액 | |||
|---|---|---|---|---|---|
| '22년 | '23년 | '24년 이후 | 합계 | ||
| 운영자금 | 임상 비용 | - | 6,863 | 1,544 | 8,407 |
| (출처 : 당사 제시) |
당사는 사모 전환사채 조달금액 중 84억원을 2024년 반기까지 연구개발비 및 임상시험비 등의 운영자금으로 사용하였습니다. 잔여금액은 금융상품에 가입하여 운용되고 있습니다.
| [미사용자금의 운용 내역] | |||
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 보통예금 | 868 | - | 수시입출금 |
| 예ㆍ적금 | 정기예금 | 11,500 | 2023.07 ~ 2024.04 | 9개월 |
| 채권 | 중소기업금융채권 (주1) |
7,000 | 2023.10 ~ 2024.04 | 6개월 |
| 계 | 19,368 | - | ||
| (출처 : 당사 제시) (주1) 금융상품 가입금액에는 전환사채 발행액 중 미사용 자금이 포함되어 있습니다. |
당사는 향후에도 바이오사업을 영위하면서 주요 파이프라인의 연구 개발을 지속하기 위하여 자금조달이 필요한 상황입니다. 금번 주주배정 후 실권주 일반공모를 통한 세부 자금사용 계획에 대해서는 본 증권신고서의 제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
[금번 유상증자를 추진하는 사유]
당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있음에도 불구하고 금번 유상증자를 진행하고 있습니다. 당사는 165억원의 미상환 전환사채를 보유하고 있고, 동 전환사채의 전환가액은 4,058원이며 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 당사가 자체적으로
전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다. 당사는 제1회 전환사채를 8,407백만원을 기사용하여 전환사채를 조기상환하기 위해서는 8,407백만원이 추가로 필요하고, 향후 원활한 연구개발을 위해서는 추가자금이 필요하기 때문에 금번 유상증자를 추진하게 되었습니다.
| [채무상환대상] |
| (단위: 백만원) |
| 종목 | 차입처 | 차입금액 | 차입일 | 만기일 | 이자율 |
|---|---|---|---|---|---|
| 전환사채 | 사모 | 16,500 | 2022.10.06 | 2027.10.06 | 0.00% |
| 조기상환청구금액(예정) | 지급기일 | 비고 |
| 13,500 | 2024.10.06 | 1차 조기상환 |
| 3,000 | 2025.01.06 | 2차 조기상환 |
| (출처: 당사 제시) |
[AST-201 임상 1상의 자금사용내역]
당사의 고형암 치료제 AST-201은 상장 당시 후보물질 단계였으며, 2021~22년 전임상 시험 -
2023년 임상시험용 의약품 위탁생산
- 2024년 현재 식약처 임상시험계획승인(IND)을 신청한 상태입니다. 이는 상장 당시보다 2년 정도 지연된 것으로, 주요 사유는 △코로나19로 인한 임상용 의약품 위탁생산의 지연 및 전임상 독성평가를 위한 위탁시험기관 확보의 어려움 △중국 제약사와의 파트너링 논의지연 등입니다. 현 시점은 식약처 임상승인 신청을 마친 상태로 2024년 10월 중 IND 승인을 예상하고 있습니다. 이에 10월부터 국내 다기관임상(4개 병원)에 착수할 계획이며, 2025년 2분기 임상 중간데이터를 확보하여 해외제약사 기술이전계약 체결을 목표하고 있습니다.
2023년부터 AST-201의 임상1상 비용이 크게 늘어난 이유는 임상시험용의약품 위탁생산 비용을 '임상 1상 비용'으로 분류했기 때문입니다. 2023년 'AST-201 프로젝트' 69.13억 원의 92% 이상인 63.64억원이 CDMO 업체인 Asymchem 및 Wuxi 직접지급대금이며, 규정상으로도 임상시험용의약품의 수입허가를 받기 위해서는 식약처 IND 승인을 획득해야 하기 때문에 임상1상 비용으로 분류하는 것이 적합하다고 보았습니다. 실제로 여러 바이오기업에서도 임상시료 생산비는 연구비가 아닌 임상비용으로 분류하고 있습니다.
ADC(ApDC®) 임상의 경우 다른 모달리티 대비 많은 비용이 투입됩니다. 통상적으로 동물실험을 포함한 전임상시험을 진행하는데 있어 파이프라인 당 최대 200억원대 후반에서 300억원 정도의 금액이 투입되기 때문에, ADC(ApDC®) 치료제를 개발하는 바이오기업이 독자적으로 임상을 진행하는 것이 현실적으로 어렵습니다. 당사의 경우 지난 2022~23년간 고형암 치료제 AST-201의 전임상, 임상시험용 의약품 위탁생산 및 임상시험 준비에 약 115억원이 소요된 바 있습니다. 또한 후속 파이프라인인 AST-202와 AST-203의 전임상 진입에도 비슷하거나 그보다 약간 적은 수준의 예산이 투입될 것으로 전망됩니다,
이처럼 당사는 최근 5년간 연구개발비 등을 사용하기 위해 자본시장을 통해 자금조달을 한 만큼, 주요 파이프라인의 기술이전을 통한 매출 발생이 당사 예상 대비 지연되거나 자금 운용계획을 적정하게 수립하지 못할 경우 향후에도 자본시장을 통한 추가적인 자금조달이 이뤄질 수 있습니다. 또한, 시장 상황으로 인해 추가적인 자금조달이 원활히 이뤄지지 않을 경우 당사는 일시적인 유동성 위험에 처할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주18) 정정 전
| 바. 구주매각 및 청약 등에 따른 최대주주 지분율 변동 및 경영권 안정성 관련 위험 당사의 최대주주는 한동일 대표이사로 본 증권신고서 제출일 전일 기준 2,810,000주(지분율 15.7%)를 보유하고 있으며, 특수관계인을 포함한 최대주주 및 특수관계인의 보유주식수는 4,894,200주(지분율 27.34%)입니다. 금번 유상증자를 통해 발행 예정인 주식수는12,300,000주이며, 당사 최대주주인 한동일 대표이사는 1,930,866주를 배정 받을 예정입니다. 한동일 대표이사는 배정주식수의 30% 수준에 대해 청약할 예정입니다. 당사 최대주주인 한동일 대표이사는 금번 유상증자 청약자금 마련을 위해, 보유 중인 보통주식 또는 배정받게 될 신주인수권증서 일부를 장내외에 매각할 예정입니다. 다만, 증권신고서 제출일 전일 현재, 매각 수량 및 가격 등이 확정되지 않았으며, 추후 확정되는시점에 본 증권신고서 상에 기재할 예정입니다. 이처럼 유상증자 진행 과정 중 최대주주 보유 보통주 또는 신주인수권증서에 대한 장내외 매각은 최대주주의 지분율 하락을 야기할 수 있으며, 이는 당사 최대주주의 경영권에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점 투자에 유의하시기 바랍니다. 또한, 최대주주 한동일 대표이사의 구주 매각과 30% 수준의 청약률 이외에도 당사는 본 유상증자, 전환사채의 전환청구, 주식매수선택권 미행사 수량의 추후 행사 가능성 등의 이유로 인해 본 증권신고서 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사 경영권 위협이 발생할 수 있으며, 본 증권신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게될 경우, 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자판단 시 이 점 유의하시기 바랍니다. |
당사의 최대주주는 한동일 대표이사로 본 증권신고서 제출일 전일 기준 2,810,000주(지분율 15.7%)를 보유하고 있으며, 특수관계인을 포함한 최대주주 및 특수관계인의보유주식수는 4,894,200주(지분율 27.3%)입니다. 금번 유상증자를 통해 발행 예정인 주식수는 12,300,000주이며, 당사 최대주주인 한동일 대표이사는 1,930,866주를 배정 받을 예정입니다. 한동일 대표이사는 배정주식수의 30% 수준에 대해 청약할 예정입니다.
당사 최대주주인 한동일 대표이사는 30% 이상 청약에 참여할 예정이며, 약 30% 수준으로 가정할 경우, 한동일 대표이사의 예상 청약 주식수는 579,259주입니다. 이에 따른 최대주주 한동일의 예상 필요 청약 자금은 약 11.3억원입니다.
당사 최대주주인 한동일 대표이사는 금번 유상증자 청약자금 마련을 위해, 보유 중인보통주식 또는 배정받게 될 신주인수권증서 일부를 장내외에 매각할 예정입니다. 다만, 증권신고서 제출일 전일 현재, 매각 수량 및 가격 등이 확정되지 않았으며, 추후 확정되는 시점에 본 증권신고서 상에 기재할 예정입니다.
이처럼 유상증자 진행 과정 중 최대주주 보유 보통주 또는 신주인수권증서에 대한 장내외 매각은 최대주주의 지분율 하락을 야기할 수 있으며, 이는 당사 최대주주의 경영권에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점 투자에 유의하시기 바랍니다.
한편 당사는 2022년 10월 06일에 제1회 무기명식 무보증 사모 전환사채(CB)를 발행하였으며, 증권신고서 제출일 전일 현재, 미상환 전환사채의 잔액은 16,500백만원, 전환가액은 4,058원입니다.
| [미상환 전환사채 발행 현황] | |
| (기준일: 증권신고서 제출일 전일) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| (출처: 당사 제시) |
| [전환사채 행사가격 조정 사항] |
|---|
|
(1) "본 사채"를 소유한 자가 전환청구를 하기 전에 발행회사가 시가를 하회하는 발행가액으로 유상증자, 무상증자, 주식배당 및 준비금의 자본전입 등을 함으로써 주식을 발행하거나 또는 시가를 하회하는 전환가액 또는 행사가액으로 전환사채 또는 신주인수권부사채를 발행하는 경우에는 아래와 같이 행사가액을 조정한다. 본 목에 따른 전환가액의 조정일은 유상증자, 무상증자, 주식배당, 준비금의 자본전입 등으로 인한 신주발행일 또는 전환사채 및 신주인수권부사채의 발행일로 한다. 단, 본 사채의 발행일 이전에 부여된 주식매수선택권의 행사로 주식이 발행되는 경우 및 기발행된 주권연계사채의 권리행사로 인한 신주발행은 예외로 한다. 조정 후 전환가격 = 조정 전 전환가격 × [{A+(B×C/D)} / (A+B)] A: 기발행주식수 B: 신발행주식수 C: 1주당 발행가격 D: 시가 |
| (출처 : 당사 제시) |
| [전환사채 본 유상증자 후 행사가격 및 전환가능주식수] |
| 구 분 | 금 액 |
|---|---|
| 조정 전 전환가격 | 4,058원 |
| 기발행주식수 | 17,900,252주 |
| 신발행주식수 | 12,300,000주 |
| 1주당 발행가격 | 1,953원 |
| 시가 | 3,050원 |
| 조정 후 전환가격 | 3,464원 |
| 조정 후 전환가능주식수 | 4,763,279주 |
| (출처: 당사 제시) |
제1회 전환사채(CB)의 전환가액은 금번 유상증자 이후 상기와 같이 하향 조정될 수 있으며, 하향 조정 이후 전환 가능 주식수는 4,763,279주가 될 예정입니다. 이는 유상증자 완료 이후 총 발행주식수 대비 약 16%에 해당하는 대규모 물량입니다. 제1회전환사채(CB)가 향후 보통주로 전환될 경우, 기존 주주들의 지분 희석이 발생하게 되며, 최대주주인 한동일 대표이사의 지분율 또한 희석될 수 있습니다.
한편, 본 증권신고서 제출일 전일 현재 당사가 임직원에게 부여한 주식매수선택권 중미행사수량은 285,000주로, 해당 미행사 주식매수선택권은 증권신고서 제출일 전일 현재 발행주식총수의 1.59%, 예정 발행주식총수(기발행주식수+ 유상증자 신주)의 0.94%에 해당하는 수준입니다. 다만, 당사가 부여한 주식매수선택권의 행사가격은 금번 유상증자에 따라 변동됩니다.
주식매수선택권 중 미행사수량의 행사가능수량 및 행사가격은 하기와 같이 변경될 예정입니다. 유상증자에 따른 행사가격 조정은 미행사 주식매수선택권의 행사 가능성을 높일 수 있으며, 이에 따라 향후 주식매수선택권 행사에 따른 희석효과로 최대주주의 지분율이 소폭 하락할 수 있으니, 투자자께서는 투자 판단 시 이 점 유의하시기 바랍니다.
| [주식매수선택권 미행사 현황] | |
| (기준일: 증권신고서 제출일 전일) | (단위: 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
행사기간 | 미행사수량 | 행사가격 | ||
|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | ||||||
| 이철환 | 등기임원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
40,000 | 40,000 | 4,686 | 3,573 |
| 이대견 | 미등기임원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 40,000 | 40,000 | 6,375 | 4,575 |
| 이조운이외3인 | 직원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 30,000 | 30,000 | 6,375 | 4,575 |
| 강주형외3인 | 직원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
60,000 | 60,000 | 4,686 | 3,573 |
| 이광용 | 미등기임원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
80,000 | 80,000 | 3,566 | 2,910 |
| 김현외2인 | 직원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
35,000 | 35,000 | 3,566 | 2,910 |
| 합 계 | 285,000 | 285,000 | - | - | |||||
| (출처: 당사 제시) |
요약하자면, 당사는 최대주주인 한동일 대표이사의 1) 구주 매각, 2) 30% 수준의 청약률, 3) 유상증자, 4) 전환사채의 전환 청구, 5) 주식매수선택권 미행사 수량의 추후 행사 가능성 등의 이유로 인해, 본 증권신고서 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사의 경영권에 위협이 발생할 수 있으며, 본 증권신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게 될 경우, 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자 판단 시, 이 점 유의하시기 바랍니다.
(주18) 정정 후
| 바. 구주매각 및 청약 등에 따른 최대주주 지분율 변동 및 경영권 안정성 관련 위험 당사의 최대주주는 한동일 대표이사로 본 증권신고서 제출일 전일 기준 2,810,000주(지분율 15.7%)를 보유하고 있으며, 특수관계인을 포함한 최대주주 및 특수관계인의 보유주식수는 4,894,200주(지분율 27.34%)입니다. 금번 유상증자를 통해 발행 예정인 주식수는12,300,000주이며, 당사 최대주주인 한동일 대표이사는 1,930,866주를 배정 받을 예정입니다. 한동일 대표이사는 배정주식수의 30% 수준에 대해 청약할 예정입니다. 당사 최대주주인 한동일 대표이사는 금번 유상증자 청약자금 마련을 위해, 보유 중인 보통주식 또는 배정받게 될 신주인수권증서 일부를 장내외에 매각할 예정입니다. 다만, 증권신고서 제출일 전일 현재, 매각 수량 및 가격 등이 확정되지 않았으며, 추후 확정되는시점에 본 증권신고서 상에 기재할 예정입니다. 이처럼 유상증자 진행 과정 중 최대주주 보유 보통주 또는 신주인수권증서에 대한 장내외 매각은 최대주주의 지분율 하락을 야기할 수 있으며, 이는 당사 최대주주의 경영권에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점 투자에 유의하시기 바랍니다. 한동일 대표이사와 특수관계인이 보유중인 보통주식을 매각하고 배정주식수의 30% 청약을 가정할 경우, 한동일 대표이사의 유상증자 후 지분율은 9.7%로 하락하게 되고 최대주주 등의 지분율은 27.3%에서 17.0%로 하락하게 됩니다. 유상증자 이후 희석이 가능한 제1회 전환사채 및 주식선택권 등을 고려할 경우 한동일 대표이사의 지분율은 8.3%까지 하락하게 되고 최대주주 등 지분율 또한 15.0%로 감소하게 됩니다. 당사는 경영권 위협에 대비하고자 우호적인 기관들을 중심으로 우호지분을 확보하고자 노력하고 있으나, 증권신고서 제출일 현재 공동목적보유확약이 체결된 바는 없습니다. 또한, 최대주주 한동일 대표이사의 구주 매각과 30% 수준의 청약률 이외에도 당사는 본 유상증자, 전환사채의 전환청구, 주식매수선택권 미행사 수량의 추후 행사 가능성 등의 이유로 인해 본 증권신고서 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사 경영권 위협이 발생할 수 있으며, 본 증권신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게될 경우, 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자판단 시 이 점 유의하시기 바랍니다. |
당사의 최대주주는 한동일 대표이사로 본 증권신고서 제출일 전일 기준 2,810,000주(지분율 15.7%)를 보유하고 있으며, 특수관계인을 포함한 최대주주 및 특수관계인의보유주식수는 4,894,200주(지분율 27.3%)입니다. 금번 유상증자를 통해 발행 예정인 주식수는 12,300,000주이며, 당사 최대주주인 한동일 대표이사는 1,930,866주를 배정 받을 예정입니다. 한동일 대표이사는 배정주식수의 30% 수준에 대해 청약할 예정입니다.
당사 최대주주인 한동일 대표이사는 30% 이상 청약에 참여할 예정이며, 약 30% 수준으로 가정할 경우, 한동일 대표이사의 예상 청약 주식수는 579,259주입니다. 이에 따른 최대주주 한동일의 예상 필요 청약 자금은 약 11.3억원입니다.
당사 최대주주인 한동일 대표이사는 금번 유상증자 청약자금 마련을 위해, 보유 중인보통주식 또는 배정받게 될 신주인수권증서 일부를 장내외에 매각할 예정입니다. 다만, 증권신고서 제출일 전일 현재, 매각 수량 및 가격 등이 확정되지 않았으며, 추후 확정되는 시점에 본 증권신고서 상에 기재할 예정입니다.
이처럼 유상증자 진행 과정 중 최대주주 보유 보통주 또는 신주인수권증서에 대한 장내외 매각은 최대주주의 지분율 하락을 야기할 수 있으며, 이는 당사 최대주주의 경영권에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점 투자에 유의하시기 바랍니다.
한편 당사는 2022년 10월 06일에 제1회 무기명식 무보증 사모 전환사채(CB)를 발행하였으며, 증권신고서 제출일 전일 현재, 미상환 전환사채의 잔액은 16,500백만원, 전환가액은 4,058원입니다.
| [미상환 전환사채 발행 현황] | |
| (기준일: 증권신고서 제출일 전일) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| (출처: 당사 제시) |
| [전환사채 행사가격 조정 사항] |
|---|
|
(1) "본 사채"를 소유한 자가 전환청구를 하기 전에 발행회사가 시가를 하회하는 발행가액으로 유상증자, 무상증자, 주식배당 및 준비금의 자본전입 등을 함으로써 주식을 발행하거나 또는 시가를 하회하는 전환가액 또는 행사가액으로 전환사채 또는 신주인수권부사채를 발행하는 경우에는 아래와 같이 행사가액을 조정한다. 본 목에 따른 전환가액의 조정일은 유상증자, 무상증자, 주식배당, 준비금의 자본전입 등으로 인한 신주발행일 또는 전환사채 및 신주인수권부사채의 발행일로 한다. 단, 본 사채의 발행일 이전에 부여된 주식매수선택권의 행사로 주식이 발행되는 경우 및 기발행된 주권연계사채의 권리행사로 인한 신주발행은 예외로 한다. 조정 후 전환가격 = 조정 전 전환가격 × [{A+(B×C/D)} / (A+B)] A: 기발행주식수 B: 신발행주식수 C: 1주당 발행가격 D: 시가 |
| (출처 : 당사 제시) |
| [전환사채 본 유상증자 후 행사가격 및 전환가능주식수] |
| 구 분 | 금 액 |
|---|---|
| 조정 전 전환가격 | 4,058원 |
| 기발행주식수 | 17,900,252주 |
| 신발행주식수 | 12,300,000주 |
| 1주당 발행가격 | 1,953원 |
| 시가 | 3,050원 |
| 조정 후 전환가격 | 3,464원 |
| 조정 후 전환가능주식수 | 4,763,279주 |
| (출처: 당사 제시) |
제1회 전환사채(CB)의 전환가액은 금번 유상증자 이후 상기와 같이 하향 조정될 수 있으며, 하향 조정 이후 전환 가능 주식수는 4,763,279주가 될 예정입니다. 이는 유상증자 완료 이후 총 발행주식수 대비 약 16%에 해당하는 대규모 물량입니다. 제1회전환사채(CB)가 향후 보통주로 전환될 경우, 기존 주주들의 지분 희석이 발생하게 되며, 최대주주인 한동일 대표이사의 지분율 또한 희석될 수 있습니다.
한편, 본 증권신고서 제출일 전일 현재 당사가 임직원에게 부여한 주식매수선택권 중미행사수량은 285,000주로, 해당 미행사 주식매수선택권은 증권신고서 제출일 전일 현재 발행주식총수의 1.59%, 예정 발행주식총수(기발행주식수+ 유상증자 신주)의 0.94%에 해당하는 수준입니다. 다만, 당사가 부여한 주식매수선택권의 행사가격은 금번 유상증자에 따라 변동됩니다.
주식매수선택권 중 미행사수량의 행사가능수량 및 행사가격은 하기와 같이 변경될 예정입니다. 유상증자에 따른 행사가격 조정은 미행사 주식매수선택권의 행사 가능성을 높일 수 있으며, 이에 따라 향후 주식매수선택권 행사에 따른 희석효과로 최대주주의 지분율이 소폭 하락할 수 있으니, 투자자께서는 투자 판단 시 이 점 유의하시기 바랍니다.
| [주식매수선택권 미행사 현황] | |
| (기준일: 증권신고서 제출일 전일) | (단위: 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
행사기간 | 미행사수량 | 행사가격 | ||
|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | ||||||
| 이철환 | 등기임원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
40,000 | 40,000 | 4,686 | 3,573 |
| 이대견 | 미등기임원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 40,000 | 40,000 | 6,375 | 4,575 |
| 이조운이외3인 | 직원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 30,000 | 30,000 | 6,375 | 4,575 |
| 강주형외3인 | 직원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
60,000 | 60,000 | 4,686 | 3,573 |
| 이광용 | 미등기임원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
80,000 | 80,000 | 3,566 | 2,910 |
| 김현외2인 | 직원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
35,000 | 35,000 | 3,566 | 2,910 |
| 합 계 | 285,000 | 285,000 | - | - | |||||
| (출처: 당사 제시) |
[최대주주 등 지분율 시뮬레이션]
당사의 최대주주는 한동일대표로 증권신고서 제출 전일 기준 2,810,000주(15.7%)의 지분을 보유하고 있으며, 최대주주 및 특수관계인 합산시 4,894,000주(지분율 27.3%)를 보유하고 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 12,300,000주이며, 당사 최대주주인 한동일대표는 1,930,866주를 배정 받을 예정이며, 한동일대표는 배정주식의 30% 수준에 대해 참여할 계획입니다. 당사 최대주주의 30% 수준 청약 참여에 따라 최대주주 30% 청약 가정할 경우 예상 청약 주식수는 579,260주이며, 필요 청약 자금은 약 11.3억원(예정발행가액 1,953원 기준)입니다.
한동일대표는 금번 유상증자 청약자금 마련을 위해 금번 유상증자 신주배정기준일(2024년 10월 30일) 이후부터 신주인수권증서 상장 거래 전의 기간 사이에 당시의 시장상황을 고려하여 보유 보통주식 일부를 블록딜(장외대량매매) 방식 등으로 매각할 예정입니다. 이에 따라, 한동일대표는 본 공시서류 제출일 전일 기준 2,810,000주 중 494,597주(발행주식총수 대비 2.6%)를 매각할 예정이며, 매매 일정을 신주인수권증서 상장거래 전으로 계획한 이유는 동 내용을 청약에 참여하는 투자자들이 해당거래를 충분히 인지한 후 신주인수권증서를 거래하도록 하기 위함입니다.
「자본시장법 시행령」 개정에 따라 2024년 7월 24일부터 상장회사의 내부자(임원, 주요주주)가 그 상장회사의 대규모 주식거래(발행주식총수의 1% 이상 또는 50억원 이상 거래) 시 30일 전에 거래목적, 거래금액, 거래기간 등을 공시하도록 의무화되었습니다. 이에 따라 최대주주의 보통주 일부 매각 30일 전에 금융감독원 전자공시시스템을 통해 사전 공시할 예정입니다. 내부자거래 사전 공시는 당사 주가에 부정적인 영향을 끼칠 수 있으니 투자자분들께서는 유의하시기 바랍니다.
본 증권신고서 제출일 현재 주당 구주매각 가액은 확정할 수 없는 사항이며, 이에 따라 필요 청약자금 대비 구주매각 대금 규모를 확정할 수 없는 상황입니다. 이에 더해 유상증자 진행 과정에서 주가 상승으로 인해 예정발행가액 대비 확정발행가액이 변동될 경우 최대주주의 청약자금 부담 증가로 인하여 청약 주식수와 금액에 일부 변동이 발생할 수 있으며, 예기치 못한 상황으로 인한 청약 실패 가능성도 배제할 수 없으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다. 사전공시와 더불어 본 증권신고서 최초 제출 이후 구주매각이 완료된 시점에 구주매각 관련 내용을 반영해 작성한 정정증권신고서가 전자공시시스템(http://www.dart.fss.or.kr)에 공시될 예정이오니 투자자께서는 본 증권신고서 회사위험 사항에 기재된 내용상 변동사항을 확인하시기 바랍니다.
| [유상증자 지분율 변동 시뮬레이션] | |
| (기준일: 증권신고서 제출일 전일) | (단위: 주) |
| 주주명 | 관계 | 현재 | 배정주식수 | 참여주식수 | 매각예정주식수 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|---|
| 보통주 | 지분율 | 보통주 | 지분율 | |||||
| 한동일 | 최대주주 본인 | 2,810,000 | 15.7% | 1,930,866 | 579,259 | 464,597 | 2,924,662 | 9.7% |
| 류성호 | 등기임원 | 1,020,000 | 5.7% | 700,884 | 210,265 | 168,644 | 1,061,621 | 3.5% |
| 이철환 | 등기임원 | 14,000 | 0.1% | 9,620 | 9,620 | - | 23,620 | 0.1% |
| 장승기 | 미등기임원 | 1,020,000 | 5.7% | 700,884 | 210,265 | 168,644 | 1,061,621 | 3.5% |
| 이대견 | 미등기임원 | 22,200 | 0.1% | 15,117 | 15,117 | - | 37,117 | 0.1% |
| 이광용 | 미등기임원 | 8,000 | 0.0% | 5,497 | 5,497 | - | 13,497 | 0.0% |
| 최대주주 등 소계 | 4,894,200 | 27.3% | 3,362,836 | 1,030,869 | 801,885 | 5,122,138 | 17.0% | |
| 발행주식총수 | 17,900,252 | 100.0% | 12,300,000 | 12,300,000 | 30,200,252 | 100.0% | ||
| 주1) 최대주주의 구주매각은 신주배정기준일 이후에 이뤄질 예정입니다. 주2) 최대주주 및 특수관계인은 배정주식수의 30%로 참여주식수를 산정하였고, 매각예정주식수는 신주인수권매각 및 구주 매도에 따른 제비용 등을 고려하지 않았기 때문에 변경 가능성이 있습니다. (출처: 당사 제시) |
유상증자 이후 희석이 가능한 제1회 전환사채 및 주식선택권 등을 고려할 경우 한동일 대표이사의 지분율은 8.3%까지 하락하게 되고 최대주주 등 지분율 또한 15.0%로 감소하게 됩니다.
| [유상증자 지분율 변동 시뮬레이션(희석주식 고려)] | |
| (기준일: 증권신고서 제출일 전일) | (단위: 주) |
| 주주명 | 관계 | 유상증자 후 | 전환사채 | 주식선택권 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|
| 보통주 | 지분율 | 보통주 | 지분율 | ||||
| 한동일 | 최대주주 본인 | 2,924,642 | 9.7& | - | - | 2,924,642 | 8.3% |
| 류성호 | 등기임원 | 1,061,621 | 3.5% | - | - | 1,061,621 | 3.0% |
| 이철환 | 등기임원 | 23,620 | 0.1% | - | 40,000 | 63,620 | 0.2% |
| 장승기 | 미등기임원 | 1,061,621 | 3.5% | - | - | 1,061,621 | 3.0% |
| 이대견 | 미등기임원 | 37,117 | 0.1% | - | 40,000 | 77,117 | 0.2% |
| 이광용 | 미등기임원 | 13,497 | 0.0% | - | 80,000 | 93,497 | 0.3% |
| 최대주주 등 소계 | 5,122,118 | 17.0% | - | 160,000 | 5,282,118 | 15.0% | |
| 발행주식총수 | 30,200,252 | 100.0% | 4,763,279 | 285,000 | 35,248,531 | 100.0% | |
| 주1) 전환사채의 경우 액면전액이 전환될 경우를 가정하였습니다. 전환가액은 유상증자로 인한 변동가액을 적용하였습니다. 주2) 주식선택권 중 일부는 전환기간이 미도래하였음에도 불구하고 전부 전환을 가정하였습니다. (출처: 당사 제시) |
당사는 경영권 위협에 대비하고자 우호적인 기관들을 중심으로 우호지분을 확보하고자 노력하고 있으나, 증권신고서 제출일 현재 공동목적보유확약이 체결된 바는 없습니다.
요약하자면, 당사는 최대주주인 한동일 대표이사의 1) 구주 매각, 2) 30% 수준의 청약률, 3) 유상증자, 4) 전환사채의 전환 청구, 5) 주식매수선택권 미행사 수량의 추후 행사 가능성 등의 이유로 인해, 본 증권신고서 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사의 경영권에 위협이 발생할 수 있으며, 본 증권신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게 될 경우, 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자 판단 시, 이 점 유의하시기 바랍니다.
(주19) 정정 전
| 차. 관리종목 지정 및 상장폐지 위험 당사는 코스닥시장 상장요건 중 전문평가기관의 기술 등에 대한 평가를 받아 기술력과 성장성이 인정되는 기업인 기술성장기업(기술 특례상장)으로서 2020년 09월 16일 코스닥시장에 상장하였습니다. 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도인 2020년도를 포함한 연속하는 5개 사업연도(2024년까지), 법인세비용차감전계속사업손실세전이익 요건의 경우 신규상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도(2022년까지)에 대해서는 해당 요건을 적용받지 않습니다. 당사의 경우 증권신고서 제출일 현재까지 관리종목지정 기준 중 해당사항이 없습니다. 당사는 매출액 요건이 2024년까지 지정유예가 되어 있지만, 2024년말 손실 확대 및 자기자본 감소하여 법인세비용차감전계속사업손실 요건 및 자본잠식율 요건을 충족할 수 있으니 투자자분께서는 이점 유의하시기 바랍니다. |
당사는 코스닥시장 상장요건 중 전문평가기관의 기술 등에 대한 평가를 받아 기술력과 성장성이 인정되는 기업인 기술성장기업(기술 특례상장)으로서 2020년 09월 16일 코스닥시장에 상장하였습니다. 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도인 2020년도를 포함한 연속하는 5개 사업연도(2024년까지), 법인세비용차감전계속사업손실세전이익 요건의 경우 신규상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도(2022년까지)에 대해서는 해당 요건을 적용받지 않습니다.
당사는 기술성장 특례 상장법인으로 영업이익 요건은 없는 상황이나, 매출액 및 법인세비용차감전계손사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 향후 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있으며, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다. 코스닥시장 관리종목 지정 요건 및 상장폐지요건은 다음과 같습니다.
| [코스닥시장 관리종목 지정요건 및 상장폐지요건] |
| 구 분 | 관리종목 지정(「코스닥시장 상장규정」 제53조) | 상장폐지(「코스닥시장 상장규정」 제54조, 제56조) |
| 1) 매출액 미달(별도) | 최근 사업연도 30억 원 미만 (지주회사는 연결기준) - 이익미실현기업 또는 기술성장기업은 상장후 5년간 미적용 - 기술성장기업 중 A), B), C) 중 어느 하나에 해당하는 제약·바이오기업은 최근 사업연도 미적용 A) 최근 사업연도 말「제약산업 육성 및 지원에 관한 특별법」에 따른 혁신제약기업이 세칙으로 정한 요건을 충족하는 경우 B) 최근 사업연도의 일평균 시가총액 4,000억 이상이며, 그 금액이 현재의 자본금을 초과하는 기업이 세칙으로 정하는 요건을 충족하는 경우 C) 최근 3사엽언도의 매출액 합계 90억 이상이며, 최근 사업연도의 직전 사업연도의 매출액이 30억 이상인 경우 |
2년 연속 매출액 30억 원 미만 [실질심사] 이익미실현기업 관련 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 2) 법인세비용차감전 계속사업손실(연결) | 최근 3사업연도중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과(&10억원 이상)하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 - 기술성장기업은 상장후 3년간 미적용 |
관리종목 지정후 자기자본50% 이상(&10억원 이상)의 법인세비용차감전계속사업손실 발생 [실질심사] 이익미실현기업 관련, 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 3) 자본잠식 등 | 다음의 어느 하나에 해당하는 경우 A) 최근 사업연도말을 기준으로 자본잠식률 50%이상 B) 최근 사업연도말을 기준으로 자기자본 10억 원 미만 |
가)최근 사업연도말 현재 완전자본잠식의 경우 나)(A) 관리종목 지정후 도래하는 사업연도말 자본잠식률이 50%이상인 경우 다)(B) 관리종목 지정후 도래하는 사업연도말 자기자본이 10억 원 미만인 경우 [실질심사] 사업보고서 또는 반기보고서의 법정제출 기한까지 당해 상장폐지 기준 해당사실을 해소하였음을 입증하는 재무제표 및 이에 대한 감사인(정기재무제표에 대한 감사인과 동일한 감사인에 한함)의 감사보고서를 제출하는 경우 가~다목까지의 규정을 적용하지 않음. |
| 4) 시가총액 미달 | 보통주 시가총액 40억 원 미만 30일간 지속 -천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
관리종목 지정후 90일 기간 경과하는 동안 i) 시가총액 40억 이상으로 10일 이상 계속 ii) 시가총액 40억 이상인 일수가 30일 이상 둘중 하나라도 충족하지 못하면 상장폐지 |
| 5) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않거나, 정기주총에서 재무제표 미승인 or 정기주총 미개최할 경우 | 관리종목 지정법인이 다음 회차에 다음 어느 하나에 해당하는 경우 가)분기, 반기, 사업보고서를 법정제출기한내에 미제출 나)사업보고서의 법정제출기한까지 정기주주총회를 미개최하거나 정기주주총회에서 재무제표 미승인 다)최근 2년간 3회 이상 분기, 반기, 사업보고서 법정제출기한까지 제출하지 아니한 경우 라)법정제출기한까지 사업보고서를 제출하지 아니한 후 법정제출기한의 다음날부터 10일 이내 사업보고서 미제출 |
| 주1) 상기 관리종목 지정기준은 경영성과 및 재무상태와 관련된 지정기준만 표기한 것입니다. |
| 주2) 자본잠식률 = (자본금 - 자기자본) / 자본금 × 100 |
| 주3) 관리종목 지정 요건 중 장기영업손실에 대한 규정은 2022년 12월 부로 개정되었습니다. |
| (출처 :「코스닥시장 상장규정」) |
관리종목 지정 요건별 당사의 실적 현황은 다음과 같습니다.
| [관리종목 요건별 회사 실적 현황] |
| (단위: 백만원) |
| 관리종목 지정요건 | 요건별 회사 현황 | 관리종목 지정유예 여부 |
항목별 지정유예 종료시점 |
|||
| 항목 | 사업연도 | 금액 | 해당 | 미해당 | ||
| 최근 사업연도말 매출액 30억 미만 |
최근 사업연도말 매출액(별도) | 2023년 | 243 | ● | - | 2024년 |
| 자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생 |
최근 3사업연도 각 법인세차감전 계속사업손익 (연결) |
2023년 | -13,602 (87.87%) |
- | ● | 2022년 |
| 2022년 | -7,116 (28.41%) |
|||||
| 2021년 | -3,831 (12.17%) |
|||||
| 최근 사업연도말 자본잠식률 50% 이상 |
최근 사업연도말 자본잠식률 (별도) |
2023년 | 해당 없음 (-72.95%) |
- | ● | - |
| (출처 : 당사 제시) |
당사의 경우 증권신고서 제출일 현재까지 관리종목지정 기준 중 해당사항이 없습니다. 2024년 말 금번 유상증자가 이루어질 경우 관리조건 요건을 충족가능한 당기순손실 및 법인세차감전계속사업손실 수준은 다음과 같습니다.
| [2024년말 관리조건 요건 충족 가능 기준] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 유상증자 | 2024년말(E) |
|---|---|---|---|
| 자본금 | 8,950 | 6,150 | 15,100 |
| 자본총액 | 9,817 | 24,022 | 33,839 |
| 자본잠식률 50%가 될 수 있는 당기순이익 주1) | -26,289 | ||
| 자기자본 50%인 법인세차감전계속사업손실 주2) | -11,330 | ||
| (출처 : 당사 제시) 주1) 반기순이익을 제외한 금액입니다. 주2) 반기 법인세차감전계속사업손실을 제외한 금액입니다. |
당사는 매출액 요건이 2024년까지 지정유예가 되어 있지만, 2024년말 손실 확대 및 자기자본 감소하여 법인세비용차감전계속사업손실 요건 및 자본잠식율 요건을 충족할 수 있으니 투자자분께서는 이점 유의하시기 바랍니다.
또한, 최근 상장 기업에 대한 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 특히, "코스닥시장 상장규정 제28조(관리종목), 코스닥시장 상장규정 제38조(상장의 폐지) 및 코스닥시장 상장규정 제38조의2(실질심사위원회의 심사 등)"에 유의하시기 바랍니다.
자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융감독법규정보시스템(http://law.fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
(주19) 정정 후
| 차. 관리종목 지정 및 상장폐지 위험 당사는 코스닥시장 상장요건 중 전문평가기관의 기술 등에 대한 평가를 받아 기술력과 성장성이 인정되는 기업인 기술성장기업(기술 특례상장)으로서 2020년 09월 16일 코스닥시장에 상장하였습니다. 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도인 2020년도를 포함한 연속하는 5개 사업연도(2024년까지), 법인세비용차감전계속사업손실세전이익 요건의 경우 신규상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도(2022년까지)에 대해서는 해당 요건을 적용받지 않습니다. 당사의 경우 증권신고서 제출일 현재까지 관리종목지정 기준 중 해당사항이 없습니다. 당사는 매출액 요건이 2024년까지 지정유예가 되어 있지만, 2024년말 손실 확대 및 자기자본 감소하여 법인세비용차감전계속사업손실 요건 및 자본잠식율 요건을 충족할 수 있으니 투자자분께서는 이점 유의하시기 바랍니다. |
당사는 코스닥시장 상장요건 중 전문평가기관의 기술 등에 대한 평가를 받아 기술력과 성장성이 인정되는 기업인 기술성장기업(기술 특례상장)으로서 2020년 09월 16일 코스닥시장에 상장하였습니다. 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도인 2020년도를 포함한 연속하는 5개 사업연도(2024년까지), 법인세비용차감전계속사업손실세전이익 요건의 경우 신규상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도(2022년까지)에 대해서는 해당 요건을 적용받지 않습니다.
당사는 기술성장 특례 상장법인으로 영업이익 요건은 없는 상황이나, 매출액 및 법인세비용차감전계손사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 향후 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있으며, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다. 코스닥시장 관리종목 지정 요건 및 상장폐지요건은 다음과 같습니다.
| [코스닥시장 관리종목 지정 사유 및 퇴출 요건 검토 결과] |
| 구분 | 관리종목 | 상장적격성 실질심사 | 형식적 상장폐지 | |
|---|---|---|---|---|
| 매출액(별도) | 요 건 | 최근 사업연도 30억원 미만(지주회사는 연결 기준) | 관리종목으로 지정된 다음 해에도 매출액 30억원 미달 사유 발생 | - |
| 기술성장기업(우량기업부 기업 제외) 및 이익미실현기업은 상장일 속한 사업연도 포함 5개 사업연도에 미적용 | ||||
| 검토결과 | 2021년 매출액 : 269백만원 (→ 관리종목지정유예) 2022년 매출액 : 358백만원 (→ 관리종목지정유예) 2023년 매출액 : 243백만원 (→ 관리종목지정유예) |
|||
| 해당여부 | 없음 | 없음 | ||
| 법인세비용차감전 계속사업손실 (비지배지분 제외) |
요 건 | 자기자본 50% 초과(&10억원 이상)의 법인세비용차감전계속사업손실이 최근 3년간 2회 이상(& 최근 사업연도 법인세비용차감전계속사업손실 발생) | 관리종목으로 지정된 다음 해에도 자기자본 50% 초과 & 10억원 이상의 법인세비용차감전계속사업손실 발생 | - |
| 기술성장기업(우량기업부 기업 제외) 상장일 속한 사업연도 포함 3개 사업연도 미적용, 이익미실현 기업 상장일 속한 사업연도 포함 5개 사업연도 미적용 | ||||
| 검토결과 | 2021년 법인세비용차감전계속사업손실 : 38억원(손실률 12.17% → 관리종목지정유예) 2022년 법인세비용차감전계속사업손실 : 71억원(손실률 24.34% → 관리종목지정유예) 2023년 법인세비용차감전계속사업손실: 136억원(손실률 87.87% → 1회 해당) |
- | ||
| 해당여부 | 없음 |
없음. | - | |
| 자본잠식(연결) |
요 건 | 최근 사업연도 말 자본잠식률 50% 이상 | 관리종목으로 지정된 다음 해에도 자본잠식률 50% 이상 발생 | 최근 사업연도 전액 자본잠식 |
| 검토결과 | 2023년말 자본금: 90억원 2023년말 자기자본(비지배지분 제외): 155억원 |
- | ||
| 해당여부 | 없음 | 없음 | - | |
| 자기자본 (연결, 비지배지분 제외) |
요 건 | 최근 사업연도 말 자기자본 10억원 미만 | 관리종목으로 지정된 다음 해에도 자기자본 10억원 미만 발생 | - |
| 검토결과 | 2023년말 자기자본(비지배지분 제외): 155억원 |
- | ||
| 해당여부 | 없음. | 없음. | - | |
| 감사의견 | 요 건 | - | - | 최근 사업연도 감사의견 비적정(부적정ㆍ의견거절ㆍ범위제한 한정) |
| 검토결과 | - | - | 2023년 감사의견 : 적정 | |
| 해당여부 | - | - | 없음. | |
| 시가총액 | 요 건 | 시가총액이 40억원 미만인 상태가 연속하여 30일 지속 | - | 관리종목 지정 후 90일 간 “연속 10일 & 누적 30일 이상 시가총액 40억원 이상”의 조건을 미충족 |
| 정기보고서 미제출 | 요 건 | 분기, 반기, 사업보고서를 법정제출기한 내 미제출 | - | 2년간 3회 이상 분기, 반기, 사업보고서를 법정제출기한 내 미제출 |
| 사업보고서 법정제출기한 후 10일 내 미제출 | ||||
| 분기, 반기, 사업보고서 미제출로 관리종목 지정된 상태에서 분기, 반기, 사업보고서를 미제출 | ||||
| 거래량 | 요 건 | 분기 월평균 거래량이 유동주식 수의 1%에 미달 | - | 2분기 연속 |
| 월간 거래량 1만주, 소액주주 300인 이상이 20% 이상 지분 보유 등은 적용 배제3333 | ||||
| 지분분산 | 요 건 | 최근 사업연도 말 기준 소액주주 200인 미만 또는 소액주주의 지분이 20% 미만 | - | 2년 연속 |
| 300인 이상의 소액주주가 유동주식수의 10%이상으로서 100만주 이상 소유하는 경우 제외 | ||||
| 불성실공시 | 요 건 | - | 1년 간 불성실공시 벌점 15점 이상 | - |
| 지배구조 | 요 건 | 사외이사/감사위원회 요건 미충족 | - | 2년 연속 |
| 회생절차/파산신청 | 요 건 | 회생절차 개시 신청 또는 파산신청 | 개시신청 기각, 결정 취소, 회생계획 불인가 등 | - |
| 재무관리 위반 | 요 건 | 변경·추가 상장이 유예된 기간 중에 증권의 발행 및 공시 등에 관한 규정에 따른 재무관리 기준을 위반한 경우 | - | - |
| 기타 상장폐지 사유 | 요 건 | 모든 상장폐지 사유(형식 상장폐지 및 상장적격성 실질심사 대상 결정)가 발생한 경우 관리종목 지정 | - | 최종 부도 또는 은행거래정지 |
| 해산사유(피흡수합병, 파산선고) | ||||
| 정관 등에 주식양도 제한을 두는 경우 | ||||
| 유가증권시장 상장의 경우 | ||||
| 우회상장시 우회상장 관련 규정 위반 시 (심사 종료 전 기업결합 완료 및 의무보유 위반 등) |
||||
| 주1: | 코스닥시장상장규정 제3조(회계처리기준 및 재무제표 적용기준)에 의거하여, 연결재무제표를 기준으로 하는 때에는 당기순손익과 자기자본은 비지배지분을 제외한 금액을 기준으로 함 |
(1) 매출액 미달 여부 검토
코스닥시장 상장규정 제53조 1항 1호에 따라 최근 사업연도의 매출액이 30억 미만일 경우 관리종목으로 지정받게 됩니다. 기술성장기업 특례요건에 의하여 상장일 속한 사업연도 포함 5개 사업연도에 미적용됨에 따라 당사는 2024년까지 동 조건에 의한 지정유예가 되어 있습니다. 당사는 2021년 2.7억원, 2022년 3.6억원, 2023년 2.4억원으로 지속적으로 30억 미만을 기록하였고, ㈜인터내셔널사이언티픽스탠다드의 매출과 합한다고 가정할 경우 2021년 60.5억원, 2022년 46.5억원, 2023년 37.7억원으로 30억원을 초과하게 됩니다. ㈜인터내셔널사이언티픽스탠다드의 매출액이 2024년 반기 8.7억원으로 크게 감소하여 2024년에 매출액이 30억 미만일 기록할 수 있으나 2024년까지 지정유예가 되어 있어 동 조건으로 인하여 관리종목으로 지정되지 않습니다. 2025년에 당사 및 ㈜인터내셔널사이언티픽스탠다드의 매출액 현재 수준이 유지되는 경우 관리종목이 될 가능성이 있습니다.
| [매출액 내역] |
| (단위 : 천원) |
| 구 분 |
2024년 반기 |
2024년 반기 연환산 |
2023년 |
2022년 |
2021년 |
|---|---|---|---|---|---|
| 당 사 | 71 | 142 | 243 | 358 | 269 |
| ㈜인터내셔널사이언티픽스탠다드 | 877 | 1,754 | 3,524 | 4,294 | 5,777 |
| 합 계 | 948 | 1,896 | 3,767 | 4,652 | 6,046 |
| (출처 : 정기보고서) |
(2) 법인세비용차감전순손실 발생 여부 검토
당사는 법인세비용차감전순손실/자기자본이 2021년 12.18%, 2022년 28.41%으로 자기자본의 50%를 넘는 법인세비용차감전순손실이 발생하지 않았으나 2023년은 87,87%로 자기자본의 50%를 넘는 법인세비용차감전순손실이 발생하였습니다. 2024년 반기 법인세비용차감전순손실은 5,589백만원으로 단순 연환산시 법인세비용차감전순손실/자기자본 비율은 113.87%로 50%를 초과하고 관리종목에 지정됩니다.
| [법인세비용차감전순손실 발생 여부 검토] |
| (단위 : 백만원) |
| 구분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 법인세비용차감전순손실 (연결, 비지배지분 제외) |
5,589 | 13,602 | 8,301 | 3,831 |
| 자기자본(연결) |
9,817 | 15,479 | 29,223 | 31,461 |
| 법인세비용차감전순손실/자기자본 | 113.87% | 87.87% | 28.41% | 12.18% |
| 주) 2024년 반기 법인세비용차감전순손실/자기자본의 경우 손실을 연환산하여 계산하였습니다. |
| [2024년 법인세비용차감전순손실 시뮬레이션] |
| (단위 : 백만원) |
| 구 분 | 금 액 | 비고 |
|---|---|---|
| 법인세비용차감전순손실 |
||
| 2024년 반기 법인세비용차감전순손실 |
5,589 | - |
| 2024년 법인세비용차감전순손실(연환산) |
11,178 | - 단순 연환산 |
| ㈜인터내셔널사이언티픽스탠다드 2024년 반기 법인세비용차감전순손실 | 545 | - 일회성 수익인 채무면제이익 등 영업외손익 제거 - 2024년 상반기 손익이 유지된다는 가정 |
| ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상 | 1,813 | - 고객관계가치 851백만원과 영업권 962백만원 전액 손상 가정 (주1) |
| 2024년 예상 법인세비용차감전순손실 | 13,536 | - |
| 자기자본 | ||
| 2024년 반기 자기자본 | 9,817 | - |
| 금번 유상증자 | 24,022 | - 예정발행가액 기준 |
| 자산재평가 | 2,788 | - |
| 당기순이익 | -7,947 | - 2024년 상반기는 기반영 |
| 2024년 예상 자기자본 | 28,680 | - |
| 법인세비용차감전순손실/자기자본 | ||
| 2024년 예상 법인세비용차감전순손실/자기자본 | 47.20% | - |
| 2024년 예상 법인세비용차감전순손실/자기자본 50% 수준인 법인세비용차감전순손실 | 14,340 | - |
| (주1) 무형자산 손상과 관련된 구체적인 사항은 1. 사업위험 - 나. 재무안정성 악화 위험을 참고하시기 바랍니다. (출처 : 당사 제시) |
당사 및 ㈜인터내셔널사이언티픽스탠다드가 상반기 수준의 수익성을 유지하고, ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상된다는 가정에서 금번 유상증자 및 자산재평가로 인하여 예상되는 법인세비용차감전순손실/자기자본은 47.20% 수준으로 관리종목 기준인 50%를 소폭 하회하는 수준입니다. 따라서 당사가 주장하는 매출확대 방안이 미실현되고 연구개발비용과 판매비와 관리비 등 각종 비용이 증가하여 법인세차감전계속사업손실이 확대될 경우 법인세비용차감전순손실/자기자본에 따른 관리종목에 지정 가능성
이 높아질 수 있으니 투자자께서는 이점 유의하시기 바랍니다.
(3) 자본잠식 여부 검토
코스닥시장 상장규정 제53조 1항 4호에 따라 최근 사업연도 말을 기준으로 자본잠식률 50% 이상인 경우 관리종목으로 지정됩니다. 당사는 2024년 반기말 기준으로 자본잠식 상태가 아니므로 자본잠식 요건에 의한 관리종목 지정요건에 해당하지 않습니다. 그러나 최근 3년간 비슷한 수준의 당기순손실이 발생할 경우 자본잠식으로 인한 관리종목 지정 가능성이 있습니다. 다만, 금번 유상증자 조달을 통해 자본을 확충하여, 자본잠식에 의한 관리종목 지정 리스크는 낮출 수 있을 것으로 판단됩니다.
| [자본잠식 여부 검토] | |
| (연결 기준) | (단위 : 백만원) |
| 구분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 자본금 | 8,950 | 8,950 | 4,475 | 4,463 |
| 자기자본 | 9,817 | 15,479 | 29,223 | 31,461 |
| 자본잠식여부 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 |
| 출처: | 당사 제공 |
| [2024년 자본잠식 시뮬레이션] |
| (단위 : 백만원) |
| 구 분 | 금 액 | 비고 |
|---|---|---|
| 당기순이익 |
||
| 2024년 반기 당기순이익 |
-5,589 | - |
| 2024년 반기 당기순이익(연환산) |
-11,178 | - 단순 연환산 |
| ㈜인터내셔널사이언티픽스탠다드 2024년 반기 당기순이익 | -545 | - 일회성 수익인 채무면제이익 등 영업외손익 제거 - 2024년 상반기 손익이 유지된다는 가정 |
| ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상 | -1,813 | - 고객관계가치 851백만원과 영업권 962백만원 전액 손상 가정 (주1) |
| 2024년 예상 당기순이익 | -13,536 | - |
| 자본금 | ||
| 2024년 반기 자본금 | 8,950 | - |
| 금번 유상증자 증가 자본금 | 6,150 | - 예정발행가액 기준 |
| 2024년말 예상 자본금 | 15,100 | - |
| 자기자본 | ||
| 2024년 반기 자기자본 | 9,817 | - |
| 금번 유상증자 | 24,022 | - 예정발행가액 기준 |
| 자산재평가 | 2,788 | - |
| 당기순이익 | -7,947 | - 2024년 상반기는 기반영 |
| 2024년 예상 자기자본 | 28,680 | - |
| 자본잠식 | ||
| 2024년 예상 자본잠식율 | - | - 해당사항 없음 |
| 2024년 예상 50% 자본잠식 수준 당기순이익 | -34,666 | - |
| (주1) 무형자산 손상과 관련된 구체적인 사항은 1. 사업위험 - 나. 재무안정성 악화 위험을 참고하시기 바랍니다.
(출처 : 당사 제시) |
(4) 시가총액 미달여부 검토
코스닥시장 상장규정 제53조 1항 5호에 따라 보통주 시가총액 40억원 미만이 30일간 지속되는 경우 관리종목으로 지정됩니다. 당사의 2023년 시가총액은 최고 90,674백만원, 최저 35,743백만원, 평균 570,612백만원으로 시가총액 40억원 미만을 기록한 바가 없어 관리종목 지정요건에 해당하지 않습니다. 금번 유상증자 전 주식수 기준 시가총액 미달에 해당하기 위해서는 주당 235원 이하로 하락해야 됩니다.
| [시가총액 미달여부 검토] |
| (단위: 백만원) |
| 구분 | 시가총액(최고) | 시가총액(최저) | 시가총액(평균) |
|---|---|---|---|
| 2023년 |
90,674 |
35,743 | 64,337 |
| (출처 : 한국거래소 정보데이터시스템) |
(5) 정기보고서 미제출 여부 검토
코스닥시장 상장규정 제53조 1항 6호에 따라 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 관리종목으로 지정됩니다.
당사는 최근 3년 법정 제출기한 내에 제출하여 왔으며, 향후에도 정기보고서를 법정 제출기한 내에 제출할 예정으로, 관리종목 지정요건에 해당하지 않습니다.
(6) 지배구조 미달 여부 검토
코스닥시장 상장규정 제53조 1항 7호에 따라 최근 사업연도 사업보고서상 A)사외이사의 수가 법에서 정하는 수에 미달 B) 법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 관리종목으로 지정됩니다.
당사는 본 공시서류 제출일 전일 현재 등기임원 6명 중 사내이사 2명, 기타비상무이사 1명, 사외이사 2명, 감사 1명으로 구성되어 있으며, 상법 제542조의 8에 따르면 자산총액 1,000억원 미만의 코스닥 상장 벤처기업은 사외이사 선임 의무가 면제됨에도 사외이사를 선임하고 있습니다. 이에 당사는 지배구조 미달 요건에 의한 관리종목 지정요건에 해당하지 않습니다.
(7) 거래량 미달 여부 검토
코스닥시장 상장규정 제53조 1항 8호에 따라 분기월평균거래량이 유동주식수의 1%에 미달하는 경우 관리종목으로 지정됩니다. 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다.
| 가) 신규 신규상장법인의 경우. 다만, 신규상장일이 속하는 분기에 한정함. 나) 분기의 월평균거래량이 1만주 이상인 경우. 이 경우 보통주식 상장법인이 액면주식을 발행한 때에는 액면가액 5,000원을 기준으로 함. 다) 세칙으로 정하는 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. 이 경우 소액주주가 소유한 주식 수와 소액주주의 수는 최근 사업연도 말을 기준으로 하되, 최근 사업연도 말 이후 주주명부를 폐쇄한 경우에는 그 폐쇄시점 현재를 기준으로 거래소에 제출한 주주명부 및 「주식·사채 등의 전자등록에 관한 법률」에 따른 소유자명세를 기준으로 함. |
당사는 2023년말 기준 소액주주 지분율 64.2%, 소액주주 수 12,962명임에 따라 상기 다) 항목에 해당되어 거래량 미달에 따른 관리종목 지정 요건에 해당되지 않습니다.
(8) 주식분산 미달 여부 검토
코스닥시장 상장규정 제53조 1항 9호에 따라 최근 사업연도말 소액주주가 200인 미만이거나 소액주주지분이 20% 미만일 경우 관리종목으로 지정됩니다.
당사는 2023년말 기준 소액주주 지분율 64.2%, 소액주주 수 12,962명임에 따라 주식분산 미달에 따른 관리종목 지정 요건에 해당되지 않습니다.
(9) 기타사항
코스닥시장 상장규정 제53조 1항 10호에서 13호까지에 따라 회생절차개시신청, 파산신청, 상장폐지사유발생, 재무관리기준 위반 요건에 해당하는 경우 관리종목으로 지정됩니다. 당사는 본 공시서류 제출일 전일 현재 동 관리종목지정요건에 해당하지 않습니다.
관리종목으로 지정될 경우 중요 사유 발생시마다 한국거래소는 일정기간 매매거래정지 명령을 발동할 수 있습니다. 이 외에도 주식의 미수나 신용거래가 금지되며, 미수나 신용거래의 증거금이 되는 대용유가증권으로도 사용할 수 없습니다. 또한, 이러한 관리종목 지정사유 확인 당일 코스닥시장에서의 매매거래는 정지됩니다. 이를 기한 내에 해결하지 못한다면 코스닥시장 상장폐지 사유에 해당하여, 당사 주식은 향후 장내에서 거래가 이루어지지 못할 수 있습니다. 증권신고서 제출일 현재 당사는 관리종목 이슈는 없는 상황이나, 향후에도 당사 손익에 따른 관리종목 발생 가능성에 대해서는 지속적으로 모니터링 할 필요가 있습니다. 투자자께서는 이 점 유의하여 투자해 주시기 바랍니다.
또한, 최근 상장 기업에 대한 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 특히, "코스닥시장 상장규정 제28조(관리종목), 코스닥시장 상장규정 제38조(상장의 폐지) 및 코스닥시장 상장규정 제38조의2(실질심사위원회의 심사 등)"에 유의하시기 바랍니다.
자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융감독법규정보시스템(http://law.fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
(주20) 정정 전
(전략)
|
일자 |
장소 |
기업 실사 내용 |
|---|---|---|
|
2024년 7월 11일 |
대표주관회사 및 |
가) 방식별, 조건별 유상증자 Simulation |
|
2024년 7월 12일 |
대표주관회사 및 |
가) 유상증자 위험요소 검토 |
|
2024년 7월 23일 |
대표주관회사 및 |
가) 유상증자 세부일정협의 |
|
2024년 8월 14일 |
발행회사 본사 |
가) 기업실사 점검항목 세부사항 확인 라) 증권신고서 작성 가이드 및 추가자료 작성 |
4. 기업실사 참여자
| [대표주관회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| (주)BNK투자증권 | 기업금융부 | 안재성 | 상무 | 기업실사 총괄 | 2024년 07월 11일 ~ 2024년 08월 27일 | 기업금융업무 등 19년 |
| (주)BNK투자증권 | 기업금융부 | 하준욱 | 이사 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 08월 27일 | 기업금융업무 등 16년 |
| (주)BNK투자증권 | 기업금융부 | 고승재 | 부장 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 08월 27일 | 기업금융업무 등 16년 |
| (주)BNK투자증권 | 기업금융부 | 문상호 | 차장 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 08월 27일 | 기업금융업무 등 10년 |
| (주)BNK투자증권 | 기업금융부 | 김태훈 | 대리 | 기업실사 및 서류작성 등 | 2024년 07월 11일 ~ 2024년 08월 27일 | 기업금융업무 등 2년 |
| 서율회계법인 | - | 류승영 | 공인회계사 | 합의된 절차에 따른 회계 및 재무실사업무 지원 | 2024년 07월 11일 ~ 2024년 08월 27일 | 공인회계사경력 16년 |
| 서율회계법인 | - | 박주영 | 공인회계사 | 합의된 절차에 따른 회계 및 재무실사업무 지원 | 2024년 07월 11일 ~ 2024년 08월 27일 | 공인회계사경력 16년 |
| [발행회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 |
|---|---|---|---|---|
| (주)압타머사이언스 | 경영지원실 | 이철환 | 상무 | 기업실사 총괄 |
| (주)압타머사이언스 | 전략지원팀 | 정지은 | 팀장 | 기업실사 총괄 및 질의사항 응답 |
| (주)압타머사이언스 | 전략지원팀 | 김혜리 | 과장 | 기업실사 자료 제공 및 질의사항 응답 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 (주)BNK투자증권은 (주)압타머사이언스가 2024년 08월 26일 이사회에서 결의한 기명식 보통주 12,300,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다
| 긍정적 요인 | ▶ 2023년 두번째 압타머 신약으로 FDA 승인을 획득한 노인성 황반변성 치료제인 아이베릭사의 Izervay의 출시, 글로벌 제약사 아스텔라스의 인수합병(59억 달러 규모) 등으로 인해, 압타머 기반 제품 개발에 대해 시장의관심이 증대되고 있어, 관련 시장의 규모 또한 확대될 가능성이 존재합니다. ▶ 동사는 지속적으로 고도화한 기술을 바탕으로 전임상 또는 임상 초기 단계에서 물질을 조기 기술이전(License-out)하여 수익성은 높이고 리스크는 줄이는 사업전략을 구사하고 있습니다. 동사는 간암치료제(AST-201) 및 혈액암치료제(AST-202) 등의 신약 파이프라인을 개발 중이나, 신고서 제출일 현재 동사가 체결한 기술 수출(License-out) 계약 사항은 없습니다. 향후 기술 수출(License-out) 계약이 이루어질 경우, 계약금 수취 및단계별 기술료 수취 등으로 동사 손익에 긍정적인 영향을 미칠 수도 있습니다. |
| 부정적 요인 | ▶ 동사의 전방산업인 압타머 산업은 원천 특허 공개 직후 아직 압타머 기반 진단 제품과 신약 제품의 본격적인 출시가 이루어지지 않은 초기 형성 단계의 시장으로서 항체 의약품 등 기타 의약품 시장에 비해 아직 시장 규모가 크지 않으며, 향후 추정치에 대한 실제 시장 형성에 대한 불확실성이존재합니다. 또한 향후 관련 기술 개발 및 상용화가 지연될 경우, 미래 시장의 규모가 예상보다 낮을 수 있습니다. 이러한 경우, 동사의 영업 실적에 부정적인 영향을 미칠 수 있습니다. ▶ 신약 개발 사업은 대표적인 고위험, 고부가가치(high risk, high return) 분야이며 임상 성공 가능성은 낮습니다. 동사 또는 파트너사가 임상에 실패할 경우, 기술이전 계약이 중도 해지될 리스크가 존재하며, 이에 따라 향후 동사의 재무 안정성이 부정적 영향을 받을 수 있습니다. 특히 기술이전 완료 이후에는 동사가 아닌 파트너사의 역량과 제반 상황에 따라 임상이 지연되거나 실패할 가능성이 존재합니다. ▶ 동사는 연구개발에 대한 지속적인 투자로 인해 영업손실 및 당기순손실 상태가 지속되고 있습니다. 동사는 후보물질 발굴, 임상 진행 등 향후에도 지속적인 연구개발에 따라 영업비용이 증가할 가능성이 높은 가운데신약 개발 관련 매출 발생은 없습니다. 향후 신약 개발 관련 매출이 발생하더라도, 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. ▶ 동사는 2024년 하반기 당기순손실 규모 및 이에 따른 자기자본 감소 규모에 따라 자본잠식률 또는 법인세비용차감전계속사업손실률 등의 요건에 해당하여 관리종목으로 지정될 위험이 존재합니다. ▶ 동사가 계획하고 있는 금번 유상증자와 관련하여 발행예정인 주식수는12,300,000주로 이는 기존 발행주식수의 약 68.71%에 해당하는 대규모 물량입니다. 단기간 내 대규모 유통주식수의 증가는 동사 주가에 부정적 영향을 미칠 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 시설자금 및 운영자금으로 사용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 동사가 제출한 자료와 당사가 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 용역을 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다 하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2024년 08월 27일 |
| 대표주관회사 주식회사 BNK투자증권 |
| 대표이사 신 명 호 |
(주20) 정정 후
(전략)
|
일자 |
장소 |
기업 실사 내용 |
|---|---|---|
|
2024년 7월 11일 |
대표주관회사 및 |
가) 방식별, 조건별 유상증자 Simulation |
|
2024년 7월 12일 |
대표주관회사 및 |
가) 유상증자 위험요소 검토 |
|
2024년 7월 23일 |
대표주관회사 및 |
가) 유상증자 세부일정협의 |
|
2024년 8월 14일 |
발행회사 본사 |
가) 기업실사 점검항목 세부사항 확인 라) 증권신고서 작성 가이드 및 추가자료 작성 |
| 2024년 9월 10일 ~ 9월 19일 | 발행회사 본사 | 금융감독원의 정정신고서 제출 요구에 따른 가) 기업실사 점검항목 확인 나) 주요 투자위험요소 정리 다) 주요 경영진 면담 라) 증권신고서 작성 가이드 및 추가자료 작성 |
4. 기업실사 참여자
| [대표주관회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| (주)BNK투자증권 | 기업금융부 | 안재성 | 상무 | 기업실사 총괄 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 19년 |
| (주)BNK투자증권 | 기업금융부 | 하준욱 | 이사 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 16년 |
| (주)BNK투자증권 | 기업금융부 | 고승재 | 부장 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 16년 |
| (주)BNK투자증권 | 기업금융부 | 문상호 | 차장 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 10년 |
| (주)BNK투자증권 | 기업금융부 | 김태훈 | 대리 | 기업실사 및 서류작성 등 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 2년 |
| 서율회계법인 | - | 류승영 | 공인회계사 | 합의된 절차에 따른 회계 및 재무실사업무 지원 | 2024년 07월 11일 ~ 2024년 09월 19일 |
공인회계사경력 16년 |
| 서율회계법인 | - | 박주영 | 공인회계사 | 합의된 절차에 따른 회계 및 재무실사업무 지원 | 2024년 07월 11일 ~ 2024년 09월 19일 |
공인회계사경력 16년 |
| [발행회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 |
|---|---|---|---|---|
| (주)압타머사이언스 | 경영지원실 | 이철환 | 상무 | 기업실사 총괄 |
| (주)압타머사이언스 | 전략지원팀 | 정지은 | 팀장 | 기업실사 총괄 및 질의사항 응답 |
| (주)압타머사이언스 | 전략지원팀 | 김혜리 | 과장 | 기업실사 자료 제공 및 질의사항 응답 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 (주)BNK투자증권은 (주)압타머사이언스가 2024년 08월 26일, 2024년 9월 10일, 2024년 9월 19일 이사회에서 결의한 기명식 보통주 12,300,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다
| 긍정적 요인 | ▶ 2023년 두번째 압타머 신약으로 FDA 승인을 획득한 노인성 황반변성 치료제인 아이베릭사의 Izervay의 출시, 글로벌 제약사 아스텔라스의 인수합병(59억 달러 규모) 등으로 인해, 압타머 기반 제품 개발에 대해 시장의관심이 증대되고 있어, 관련 시장의 규모 또한 확대될 가능성이 존재합니다. ▶ 동사는 지속적으로 고도화한 기술을 바탕으로 전임상 또는 임상 초기 단계에서 물질을 조기 기술이전(License-out)하여 수익성은 높이고 리스크는 줄이는 사업전략을 구사하고 있습니다. 동사는 간암치료제(AST-201) 및 혈액암치료제(AST-202) 등의 신약 파이프라인을 개발 중이나, 신고서 제출일 현재 동사가 체결한 기술 수출(License-out) 계약 사항은 없습니다. 향후 기술 수출(License-out) 계약이 이루어질 경우, 계약금 수취 및단계별 기술료 수취 등으로 동사 손익에 긍정적인 영향을 미칠 수도 있습니다. |
| 부정적 요인 | ▶ 동사의 전방산업인 압타머 산업은 원천 특허 공개 직후 아직 압타머 기반 진단 제품과 신약 제품의 본격적인 출시가 이루어지지 않은 초기 형성 단계의 시장으로서 항체 의약품 등 기타 의약품 시장에 비해 아직 시장 규모가 크지 않으며, 향후 추정치에 대한 실제 시장 형성에 대한 불확실성이존재합니다. 또한 향후 관련 기술 개발 및 상용화가 지연될 경우, 미래 시장의 규모가 예상보다 낮을 수 있습니다. 이러한 경우, 동사의 영업 실적에 부정적인 영향을 미칠 수 있습니다. ▶ 신약 개발 사업은 대표적인 고위험, 고부가가치(high risk, high return) 분야이며 임상 성공 가능성은 낮습니다. 동사 또는 파트너사가 임상에 실패할 경우, 기술이전 계약이 중도 해지될 리스크가 존재하며, 이에 따라 향후 동사의 재무 안정성이 부정적 영향을 받을 수 있습니다. 특히 기술이전 완료 이후에는 동사가 아닌 파트너사의 역량과 제반 상황에 따라 임상이 지연되거나 실패할 가능성이 존재합니다. ▶ 동사는 연구개발에 대한 지속적인 투자로 인해 영업손실 및 당기순손실 상태가 지속되고 있습니다. 동사는 후보물질 발굴, 임상 진행 등 향후에도 지속적인 연구개발에 따라 영업비용이 증가할 가능성이 높은 가운데신약 개발 관련 매출 발생은 없습니다. 향후 신약 개발 관련 매출이 발생하더라도, 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. ▶ 동사는 2024년 하반기 당기순손실 규모 및 이에 따른 자기자본 감소 규모에 따라 자본잠식률 또는 법인세비용차감전계속사업손실률 등의 요건에 해당하여 관리종목으로 지정될 위험이 존재합니다. ▶ 동사가 계획하고 있는 금번 유상증자와 관련하여 발행예정인 주식수는12,300,000주로 이는 기존 발행주식수의 약 68.71%에 해당하는 대규모 물량입니다. 단기간 내 대규모 유통주식수의 증가는 동사 주가에 부정적 영향을 미칠 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 채무상환자금, 시설자금 및 운영자금으로 사용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 동사가 제출한 자료와 당사가 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 용역을 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다 하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2024년 09월 19일 |
| 대표주관회사 주식회사 BNK투자증권 |
| 대표이사 신 명 호 |
(주21) 정정 전
2. 자금의 사용목적
가. 자금의 사용목적
당사가 금번 유상증자를 통해 조달 예정인 공모자금은 아래와 같이 사용할 예정입니다. 다만, 하기 투자계획은 현 시점에서 예상되는 계획이며, 향후 집행 시점의 경영환경 등을 고려하여 변경될 가능성이 있으므로 절대적인 계획이 아님을 투자자께서는 인지하시기 바랍니다.
| (기준일 : | 2024년 08월 27일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| 3,450 | - | 20,572 | - | - | - | 24,022 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정 시 변경될 수 있습니다. 주2) 금번 발행과 관련된 발행제비용은 보유자금으로 충당할 예정입니다. |
나. 자금의 세부 사용내역
| (단위: 백만원) |
| 구분 | 단계 | 사용(예정) 시기 | 합계 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2024년 | 2025년 | 2026년 | ||||||||||
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||||
| R&D비용 | AST-201 (ApDC 고형암 치료제) |
임상1상 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | 3,640 |
| AST-202 (ApDC 혈액암 치료제) |
전임상 준비 | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 450 | - | 4,970 | |
| AST-203 (TROP2-ApDC) (ApDC 후속 파이프라인) |
후보물질 | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 450 | - | 4,970 | |
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 (연세대학교의료원) |
- | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 | |
| R&D비용 소계 | 310 | 1,290 | 4,550 | 250 | 1,320 | 2,270 | 2,140 | 950 | 900 | 13,980 | ||
| 시설투자비용 | 분석CRO | GLP/GCLP 인증기관 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 3,450 |
| 운영비용 | 급여, 지급수수료 등 판관비 | 460 | 655 | 865 | 660 | 800 | 715 | 650 | 845 | 942 | 6,592 | |
| 총 합계 | 1,020 | 2,345 | 5,815 | 1,310 | 2,520 | 3,385 | 3,190 | 2,195 | 2,242 | 24,022 | ||
| (출처: 당사 제시) |
당사는 금번 유상증자 자금 중 약 13,980백만원을 고형암 치료제(코드명: AST-201)의 임상시험, 혈액암 치료제(코드명: AST-202)과 압타머 기반 후보물질 개발 비용, ApRC플랫폼(방사성의약품 개발 플랫폼) 공동연구비용 등으로 활용할 예정이며, 분석 CRO의 시설투자비용 3,450백만원, 급여, 지급수수료 등 판관비 등 운영자금 6,592백만원을 집행할 계획입니다.
(1) 운영자금 - R&D 연구개발자금
1) AST-201
고형암 치료제 AST-201은 비임상 단계에서 작용기전 및 세포수준에서의 유효성 연구가 완료되었고, 종양 동물모델 평가를 통해 우수한 표적 약물전달 및 종양 억제 효과, 그리고 면역관문억제제와의 병용투어에 의한 시너지 효과를 확인하였습니다. 2024년 3월 12일 국내 식약처에 AST-201 1상 임상시험에 대한 IND 신청을 마쳤으며,2024년 3분기에 승인을 예상하고 있습니다. 임상시험을 위한 연구자 구성(CI: 분당차병원 전홍재 교수), 임상시험 CRO 계약(C&R 리서치)이 완료되었고, 2024년 4분기부터 환자 모집이 본격적으로 시작될 것으로 예상합니다.
또한 AST-201 적응증 확대를 위해 국외 임상을 준비하고 있으며, 2024년 하반기 내IND 승인 획득을 목표로 하고 있습니다. 이에 따라 금번 유상증자 자금 중 3,640백만원원을 임상(국내) 1a상, 임상(국외) 1b상 진행을 위한 비용을 집행할 계획입니다. 2025년에는 임상(국내)1a상에 해당하는 40명 등록 및 분석비용으로, 2026년에는 임상(국외)1b상 30명 등록 및 분석비용 및 임상시험 결과보고 및 정산 비용으로 사용할 계획입니다.
[AST-201 임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-201 임상 | 임상비용 | 280 | 200 | 660 | - | 410 | 400 | 640 | - | 840 | 3,640 |
| 임상약 관리 | 10 | - | 10 | - | 20 | 20 | 20 | - | 10 | ||
| 분석비용 | 20 | - | 30 | - | 40 | - | 30 | - | - | ||
| 소계 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | ||
| (출처: 당사 제시) |
2) AST-202
혈액암 치료제 AST-202는 높은 표적 선택성과 특이성을 보유한 CD25 표적 압타머에 세포독성 약물을 접합함으로써 CD25-양성 종양세포들을 제거하고 종양조직 내 면역활성화를 유도하도록 디자인된 압타머 기반 표적약물전달 치료제입니다. 국가신약개발과제로 선정된 이후 표적과의 높은 특이성과 빠른 세포 내재화 속도가 규명되었고, 압타머-약물 비율 등 물질 자체의 최적화가 완료되었습니다. 혈액암의 동물모델에서 진행된 유효성 평가에서 주2회/2주 투약만으로 종양이 완전히 사라지는 용량군을 확인했으며, 투약 중단 이후 회복기간에도 종양 재성장이 관찰되지 않는 우수한효과가 확인되었습니다. 또한, 혈액암 동물모델의 생존률 평가에서도 AST-202 투여용량 전체군에서 80% 이상의 생존률을 확인했습니다. 2024년 하반기에 후보물질을 확정하고 전임상 단계 진입을 계획하고 있으며, 해당 데이터를 바탕으로 국내외 제약사 대상 기술이전 및 공동연구를 목표로 합니다. 이에 따라 금번 유상증자 자금 중 4,970백만원을 전임상 시험비용으로 집행할 계획입니다.
[AST-202 전임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-202 전임상 | CMC | - | 520 | 1,600 | 100 | 400 | - | 700 | 450 | - | 4,970 |
| GLP 독성 | - | - | 300 | - | - | 900 | - | - | - | ||
| 소계 | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 450 | - | ||
| (출처: 당사 제시) |
3) AST-203 (TROP2-ApDC)
ApDC 후속 파이프라인으로 연구 중인 Trop2 타겟 ApDC(AST-203) 또한 췌장암 동물모델에서 동일 표적에 대한 기허가 ADC(Trodelvy) 대비 2배 우수한 항종양효과와 6.7배 빠른 표적침투력을 확인했습니다. 앞서 작용기전 연구, 종양모델에서의 생체분포 연구 등이 완료되었고, 약동력학적 특성 연구 및 추가적인 동물모델 평가(비소세포 폐암) 등이 신속하게 진행되고 있어 AST-202에 이어 빠르게 전임상단계로 진입할 예정입니다. Trop2는 췌장암을 비롯해 유방암, 폐암, 방광암 등 다수 고형암에서 과발현되는 표적 막단백질로, 다양한 암종으로 확대 가능성이 높습니다. 특허출원한 기술을 바탕으로 후보물질 단계에서 조기 기술이전 및 공동연구를 추진할 계획이며, 4,970백만원을 추가적인 연구 데이터 확보 목적으로 집행할 계획입니다.
[AST-203 전임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-203 전임상 | 연구용역 | - | 520 | 1,600 | 100 | 400 | - | 700 | 450 | - | 4,970 |
| 분석비용 | - | - | 300 | - | - | 900 | - | - | - | ||
| 소계 | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 450 | - | ||
| (출처: 당사 제시) |
4) ApRC 공동연구
당사는 연세대학교의료원 핵의학과 강원준 교수 연구팀과 '방사성동위원소 표적전달기술'을 공동개발하고 있으며, 이를 바탕으로 치료용 방사성의약품 개발을 계획하고 있습니다. 지난 6월 압타머를 활용한 진단용 방사성동위원소 전달플랫폼에 대한 논문이 국제학술지에 등재된 바 있으며, 동일한 기전과 절차를 바탕으로 갈륨(68Ga)을 활용한 치료용 방사성의약품으로 확대해나갈 것입니다. 해당 프로젝트는 국내 기업과의 공동개발 및 국가연구과제를 통해 일부 자금을 확보할 것으로 예상하여, 타 프로젝트보다 소규모로 약 400백만원을 편성하였습니다.
[ApRC 공동개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| ApRC 공동연구 | 연구용역 | - | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 |
| 소계 | - | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | ||
| (출처: 당사 제시) |
ApDC 파이프라인 개발 계획 및 비용 관련 상세 내역은 하기와 같습니다.
[ApDC 파이프라인의 향후 개발 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AST-201 (고형암 치료제) |
임상(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| 임상(국외) | ● | ● | ● | ● | ● | ● | ● | ● | ● | |
| AST-202 (혈액암 치료제) |
전임상(국내) | - | ● | ● | ● | ● | ● | ● | ● | ● |
| AST-203 (고형암 치료제) |
전임상(국내) | - | ● | ● | ● | ● | ● | ● | ● | ● |
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| (출처: 당사 제시) |
5) 압토디텍트 렁(AptoDetect™-Lung)
당사는 3등급 체외진단의료기기로 허가받은 압토디텍트 렁(AptoDetect™-Lung)을 폐암 조기진단 검사제품으로 국내 시장에 진출하였습니다. 다기관 임상시험에 참여 중인 10개 상급종합병원을 포함한 다수의 상급병원에서 비급여 처방을 진행하고 있으며, 폐결절이 발견되지 않은 일반 폐암검진 희망자 대상으로 하는 건강검진시장 진출을 앞두고 있습니다. 자체 영업력 외에도 권역별 병원 네트워크를 갖춘 대리점을 통해 대형병원 및 검진전문병원 대상 영업 마케팅을 수행하고 있습니다. 지난 2024년 1분기에는 해외수출을 위한 qPCR 방식의 압토디텍트 렁 PCR 7을 출시했으며, 인도 동남아시아 미국 등 각국 파트너와 협의하여 해외시장 진출을 준비하고 있습니다.
압토디텍트 렁은 의료기기 제조 및 품질관리 기준을 인증받은 GMP 시설 하에서 자체 생산하고 있으며, 국내 시장 공급용은 포항 GMP시설에서 생산, 인도 및 동남아시아 공급용은 인도 GMP시설에서 생산할 계획입니다.
압토디텍트 렁(AptoDetect™-Lung) 임상 및 PMS 비용으로 720백만원, 압토디텍트 렁(AptoDetect™-Lung) PCR 7의 임상 및 개발비용으로 450백만원, 인건비 및 기타 운영비로 550백만원, 생산 및 GMP 시설 유지비로 540백만원을 사용할 계획입니다. 사업개발 및 사업화 비용 관련 상세 내역은 하기와 같습니다.
[진단 사업 확장 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AptoDetect-Lung | 사업화(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| AptoDetect-Lung PCR 7 |
사업화(국외) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| 품목허가(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● | |
| (출처: 당사 제시) |
[진단 사업 개발 사업화 비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AptoDetect-Lung | 임상비용 | - | - | - | - | - | 90 | - | - | 50 |
| PMS | 140 | - | 220 | - | - | - | - | - | 220 | |
| 소계 | 140 | - | 220 | - | - | 90 | - | - | 270 | |
| AptoDetect-Lung PCR 7 |
임상비용 | - | - | - | - | 150 | - | - | 220 | - |
| 개발비 | 20 | 20 | 20 | 20 | - | - | - | - | - | |
| 소계 | 20 | 20 | 20 | 20 | 150 | - | - | 220 | - | |
| 인건비 및 기타 운영비 | 50 | 60 | 50 | 65 | 75 | 50 | 75 | 50 | 75 | |
| 생산 및 GMP 시설 유지비 | 30 | 50 | 50 | 50 | 50 | 70 | 70 | 100 | 70 | |
| 합계 | 210 | 80 | 290 | 85 | 225 | 140 | 75 | 270 | 345 | |
| (출처: 당사 제시) |
당사는 지난 2024년 5월 GLP인증과 GCLP인증을 보유한 비임상 CRO를 자회사로 인수했으며, 8월 현재 소규모합병을 완료하였습니다. 해당 사업부는 식약처 GLP인증/GCLP 인증을 보유하고 있으며, 분석장비의 유지보수, 신규 서비스 확대를 위한 시설투자 등에 4,850백만원을 사용할 계획입니다.
[분석CRO 사업 확장 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| 비임상CRO | 시설투자 | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| 신규서비스 확대 | - | ● | ● | ● | ● | ● | ● | ● | ● | |
| (출처: 당사 제시) |
[분석CRO 사업 개발 사업화 비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| 비임상CRO | 시설투자 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 |
| 신규서비스 확대 | - | 175 | 175 | 175 | 175 | 175 | 175 | 175 | 175 | |
| 인건비 및 기타 운영비 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 422 | |
| 합계 | 500 | 975 | 975 | 975 | 975 | 975 | 975 | 975 | 997 | |
| (출처: 당사 제시) |
(주21) 정정 후
2. 자금의 사용목적
가. 자금의 사용목적
당사가 금번 유상증자를 통해 조달 예정인 공모자금은 아래와 같이 사용할 예정입니다. 다만, 하기 투자계획은 현 시점에서 예상되는 계획이며, 향후 집행 시점의 경영환경 등을 고려하여 변경될 가능성이 있으므로 절대적인 계획이 아님을 투자자께서는 인지하시기 바랍니다.
| (기준일 : | 2024년 09월 19일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| 3,450 | - | 12,172 | 8,400 | - | - | 24,022 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정 시 변경될 수 있습니다. 주2) 금번 발행과 관련된 발행제비용은 보유자금으로 충당할 예정입니다. 주3) 사채권자의 상환청구가 연기될 경우 채무상환자금을 축소하고 시설자금 및 운영자금을 증가시킬 수 있습니다. |
나. 자금의 세부 사용내역
| (단위: 백만원) |
| 구분 | 단계 | 사용(예정) 시기 | 합계 | 자금사용 우선순위 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2024년 | 2025년 | 2026년 | |||||||||||
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||||
| R&D비용 | AST-201 (ApDC 고형암 치료제) |
임상1상 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | 3,640 | 2순위 |
| AST-202 (ApDC 혈액암 치료제) |
전임상 준비 | - | - | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 4,520 | ||
| AST-203 (TROP2-ApDC) (ApDC 후속 파이프라인) |
후보물질 | - | - | - | - | 520 | 1,900 | 100 | 400 | - | 2,920 | ||
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 (연세대학교의료원) |
- | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 | ||
| R&D비용 소계 | 310 | 250 | 750 | 570 | 2,940 | 2,470 | 1,240 | 1,350 | 1,600 | 11,480 | |||
| 채무상환자금 | 제1회 전환사채 상환 | 8,400 | - | - | - | - | - | - | - | - | 8,400 | 1순위 | |
| 시설투자비용 | 분석CRO | GLP/GCLP 인증기관 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 3,450 | 3순위 |
| 운영비용 | 급여, 지급수수료 등 판관비 | 20 | 160 | 20 | 240 | - | 162 | 90 | - | - | 692 | ||
| 총 합계 | 8,980 | 810 | 1,170 | 1,210 | 3,340 | 3,032 | 1,730 | 1,750 | 2,000 | 24,022 | - | ||
| (출처: 당사 제시) |
당사는 금번 유상증자 자금 중 약 11,480백만원을 고형암 치료제(코드명: AST-201)의 임상시험, 면역항암제/혈액암 치료제(코드명: AST-202)과 압타머 기반 후보물질 개발 비용, ApRC플랫폼(방사성의약품 개발 플랫폼) 공동연구비용 등으로 활용할 예정이며, 분석 CRO의 시설투자비용 3,450백만원, 기타사업 운영비 및 판관비 등 운영자금 692백만원, 채무상환자금 8,400백만원을 집행할 계획입니다. 사채상환자금 84억원은 제1회 전환사채의 1차 조기상환청구권 행사시 지급기일인 2024년 10월 06일 상환자금으로 본 유상증자 납입일 전 IPO시 조달자금 중 미사용분에 대한 선지급분으로 전용될 예정입니다.
(1) 운영자금 - R&D 연구개발자금
1) AST-201
고형암 치료제 AST-201은 비임상 단계에서 작용기전 및 세포수준에서의 유효성 연구가 완료되었고, 종양 동물모델 평가를 통해 우수한 표적 약물전달 및 종양 억제 효과, 그리고 면역관문억제제와의 병용투어에 의한 시너지 효과를 확인하였습니다. 2024년 3월 12일 국내 식약처에 AST-201 1상 임상시험에 대한 IND 신청을 마쳤으며,2024년 3분기에 승인을 예상하고 있습니다. 임상시험을 위한 연구자 구성(CI: 분당차병원 전홍재 교수), 임상시험 CRO 계약(C&R 리서치)이 완료되었고, 2024년 4분기부터 환자 모집이 본격적으로 시작될 것으로 예상합니다.
또한 AST-201 적응증 확대를 위해 국외 임상을 준비하고 있으며, 2024년 하반기 내IND 승인 획득을 목표로 하고 있습니다. 이에 따라 금번 유상증자 자금 중 3,640백만원을 임상(국내) 1a상, 임상(국외) 1b상 진행을 위한 비용을 집행할 계획입니다. 2025년에는 임상(국내)1a상에 해당하는 40명 등록 및 분석비용으로, 2026년에는 임상(국외)1b상 30명 등록 및 분석비용 및 임상시험 결과보고 및 정산 비용으로 사용할 계획입니다.
[AST-201 임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-201 임상 | 임상비용 | 280 | 200 | 660 | - | 410 | 400 | 640 | - | 840 | 3,640 |
| 임상약 관리 | 10 | - | 10 | - | 20 | 20 | 20 | - | 10 | ||
| 분석비용 | 20 | - | 30 | - | 40 | - | 30 | - | - | ||
| 소계 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | ||
| (출처: 당사 제시) |
2) AST-202
면역항암제/혈액암 치료제 AST-202는 높은 표적 선택성과 특이성을 보유한 CD25 표적 압타머에 세포독성 약물을 접합함으로써 CD25-양성 종양세포들을 제거하고 종양조직 내 면역활성화를 유도하도록 디자인된 압타머 기반 표적약물전달 치료제입니다. 국가신약개발과제로 선정된 이후 표적과의 높은 특이성과 빠른 세포 내재화 속도가 규명되었고, 압타머-약물 비율 등 물질 자체의 최적화가 완료되었습니다. 혈액암의 동물모델에서 진행된 유효성 평가에서 주2회/2주 투약만으로 종양이 완전히 사라지는 용량군을 확인했으며, 투약 중단 이후 회복기간에도 종양 재성장이 관찰되지 않는 우수한효과가 확인되었습니다. 또한, 혈액암 동물모델의 생존률 평가에서도 AST-202 투여용량 전체군에서 80% 이상의 생존률을 확인했습니다. 2024년 하반기에 후보물질을 확정하고 전임상 단계 진입을 계획하고 있으며, 해당 데이터를 바탕으로 국내외 제약사 대상 기술이전 및 공동연구를 목표로 합니다. 이에 따라 금번 유상증자 자금 중 4,520백만원을 전임상 시험비용으로 집행할 계획입니다.
[AST-202 전임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-202 전임상 | CMC | - | - | - | 520 | 1,600 | 100 | 400 | - | 700 | 4,520 |
| GLP 독성 | - | - | - | - | 300 | - | - | 900 | - | ||
| 소계 | - | - | - | 520 | 1,900 | 100 | 400 | 900 | 700 | ||
| (출처: 당사 제시) |
3) AST-203 (TROP2-ApDC)
ApDC 후속 파이프라인으로 연구 중인 Trop2 타겟 ApDC(AST-203) 또한 췌장암 동물모델에서 동일 표적에 대한 기허가 ADC(Trodelvy) 대비 2배 우수한 항종양효과와 6.7배 빠른 표적침투력을 확인했습니다. 앞서 작용기전 연구, 종양모델에서의 생체분포 연구 등이 완료되었고, 약동력학적 특성 연구 및 추가적인 동물모델 평가(비소세포 폐암) 등이 신속하게 진행되고 있어 AST-202에 이어 빠르게 전임상단계로 진입할 예정입니다. Trop2는 췌장암을 비롯해 유방암, 폐암, 방광암 등 다수 고형암에서 과발현되는 표적 막단백질로, 다양한 암종으로 확대 가능성이 높습니다. 특허출원한 기술을 바탕으로 후보물질 단계에서 조기 기술이전 및 공동연구를 추진할 계획이며, 2,920백만원을 추가적인 연구 데이터 확보 목적으로 집행할 계획입니다.
[AST-203 전임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-203 전임상 | 연구용역 | - | - | - | - | 520 | 1,600 | 100 | 400 | - | 2,920 |
| 분석비용 | - | - | - | - | - | 300 | - | - | - | ||
| 소계 | - | - | - | - | 520 | 1,900 | 100 | 400 | - | ||
| (출처: 당사 제시) |
4) ApRC 공동연구
당사는 연세대학교의료원 핵의학과 강원준 교수 연구팀과 '방사성동위원소 표적전달기술'을 공동개발하고 있으며, 이를 바탕으로 치료용 방사성의약품 개발을 계획하고 있습니다. 지난 6월 압타머를 활용한 진단용 방사성동위원소 전달플랫폼에 대한 논문이 국제학술지에 등재된 바 있으며, 동일한 기전과 절차를 바탕으로 갈륨(68Ga)을 활용한 치료용 방사성의약품으로 확대해나갈 것입니다. 해당 프로젝트는 국내 기업과의 공동개발 및 국가연구과제를 통해 일부 자금을 확보할 것으로 예상하여, 타 프로젝트보다 소규모로 약 400백만원을 편성하였습니다.
[ApRC 공동개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| ApRC 공동연구 | 연구용역 | - | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 |
| 소계 | - | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | ||
| (출처: 당사 제시) |
ApDC 파이프라인 개발 계획 및 비용 관련 상세 내역은 하기와 같습니다.
[ApDC 파이프라인의 향후 개발 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AST-201 (고형암 치료제) |
임상(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| 임상(국외) | ● | ● | ● | ● | ● | ● | ● | ● | ● | |
| AST-202 (혈액암 치료제) |
전임상(국내) | - | - | - | ● | ● | ● | ● | ● | ● |
| AST-203 (고형암 치료제) |
전임상(국내) | - | - | - | - | ● | ● | ● | ● | ● |
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| (출처: 당사 제시) |
(2) 운영/시설자금 - 체외진단/분석CRO
1) 압토디텍트 렁(AptoDetect™-Lung)
당사는 3등급 체외진단의료기기로 허가받은 압토디텍트 렁(AptoDetect™-Lung)을 폐암 조기진단 검사제품으로 국내 시장에 진출하였습니다. 다기관 임상시험에 참여 중인 10개 상급종합병원을 포함한 다수의 상급병원에서 비급여 처방을 진행하고 있으며, 폐결절이 발견되지 않은 일반 폐암검진 희망자 대상으로 하는 건강검진시장 진출을 앞두고 있습니다. 자체 영업력 외에도 권역별 병원 네트워크를 갖춘 대리점을 통해 대형병원 및 검진전문병원 대상 영업 마케팅을 수행하고 있습니다. 지난 2024년 1분기에는 해외수출을 위한 qPCR 방식의 압토디텍트 렁 PCR 7을 출시했으며, 인도 동남아시아 미국 등 각국 파트너와 협의하여 해외시장 진출을 준비하고 있습니다.
압토디텍트 렁은 의료기기 제조 및 품질관리 기준을 인증받은 GMP 시설 하에서 자체 생산하고 있으며, 국내 시장 공급용은 포항 GMP시설에서 생산, 인도 및 동남아시아 공급용은 인도 GMP시설에서 생산할 계획입니다.
압토디텍트 렁(AptoDetect™-Lung) 임상 및 PMS 비용으로 450백만원, 압토디텍트 렁(AptoDetect™-Lung) PCR 7의 임상 및 개발비용으로 230백만원, 인건비 및 기타 운영비로 450백만원, 생산 및 GMP 시설 유지비로 540백만원을 사용할 계획입니다. 사업개발 및 사업화 비용 관련 상세 내역은 하기와 같습니다.
[진단 사업 확장 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AptoDetect-Lung | 사업화(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| AptoDetect-Lung PCR 7 |
사업화(국외) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| 품목허가(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● | |
| (출처: 당사 제시) |
[진단 사업 개발 사업화 비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AptoDetect-Lung | 임상비용 | - | - | - | - | - | - | 90 | - | - |
| PMS | - | 140 | - | 220 | - | - | - | - | - | |
| 소계 | - | 140 | - | 220 | - | - | 90 | - | - | |
| AptoDetect-Lung PCR 7 |
임상비용 | - | - | - | - | - | 162 | - | - | |
| 개발비 | 20 | 20 | 20 | 20 | - | - | - | - | - | |
| 소계 | 20 | 20 | 20 | 20 | - | 162 | - | - | - | |
| 합계 | 20 | 160 | 20 | 240 | - | 162 | 90 | - | - | |
| (출처: 당사 제시) |
2) 분석CRO
당사는 지난 2024년 5월 GLP인증과 GCLP인증을 보유한 비임상 CRO를 자회사로 인수했으며, 8월 현재 소규모합병을 완료하였습니다. 해당 사업부는 식약처 GLP인증/GCLP 인증을 보유하고 있으며, 분석장비의 유지보수, 노후화장비 교체 등에 3,450백만원을 사용할 계획입니다.
[분석CRO 사업 확장 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| 비임상CRO | 시설투자 | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| (출처: 당사 제시) |
[분석CRO 사업 개발 사업화 비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| 비임상CRO | 시설투자 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 |
| 합계 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | |
| (출처: 당사 제시) |
(3) 채무상환
당사는 165억원의 미상환 전환사채를 보유하고 있습니다. 동 전환사채의 전환가액은 4,058원이고, 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 따라서 조기상환청구일(사채의발행일로부터 2년이 되는날)인 2024년 10월 06일 전환사채 165억원에 대해 조기 상환 청구가 발생할 가능성이 높습니다. 당사는 165억원 중 84억원을 사용하였고, 81억원은 단기금융상품으로 보유하고 있습니다. 전환사채 액면 전액에 대해 조기상환청구가 발생할 경우 단기금융상품 81억원 및 공모자금 중 84억원을 사용할 예정입니다.
사채상환자금 84억원은 제1회 전환사채의 1차 조기상환청구권 행사시 지급기일인 2024년 10월 06일 상환자금으로 본 유상증자 납입일 전 IPO시 조달자금 중 미사용분에 대한 선지급분으로 전용될 예정입니다.
| [채무상환대상] |
| (단위: 백만원) |
| 종목 | 차입처 | 차입금액 | 차입일 | 만기일 | 이자율 |
|---|---|---|---|---|---|
| 전환사채 | 사모 | 16,500 | 2022.10.06 | 2027.10.06 | 0.00% |
| 조기상환청구금액(예정) | 지급기일 | 비고 |
| 13,500 | 2024.10.06 | 1차 조기상환 |
| 3,000 | 2025.01.06 | 2차 조기상환 |
| (출처: 당사 제시) |
다. 유상증자 대금 납입 이후부터 집행 완료 시점까지 관리/집행 통제 방안
당사는 금번 유상증자 납입일부터 예상 집행시기(2024년~2026년)까지 다소 차이가 있고 자금 집행이 장기간에 걸쳐 발생하는 바, 보다 철저한 유상증자 대금 관리 및 집행 통제를 실행할 예정입니다.
CFO는 매일 재무팀 담당자가 전일 실적 및 당일 계획, 잔고증명서(주1회 첨부), 금융상품 운용 현황을 구분하여 작성한 자금일보의 내역이 적정하게 작성되었는지 검토 후 그룹웨어 전자결재를 통해 승인하며, 잔액 차이 발생 시 자금팀 담당자는 차이를 소명하고 CFO는 이를 검토 후 승인합니다. 또한 전결권자는 매월 자금팀 담당자가 월별 입출금 실적, 금융상품 운용 현황을 구분하여 작성한 자금월보의 내역이 적정한지 검토하고, 금융기관으로부터 수령한 잔고증명서와 월보상 잔액이 일치하는 경우 그룹웨어 전자결재를 통해 승인하며, 다만 잔액 차이 발생 시 재무팀 담당자는 차이를 소명하고 전결권자는 이를 검토 후 승인합니다. 법인인감 및 사용인감은 인감사용 및 관리규정에 의거하여, 관리되고 있으며 법인인감은 대표이사가 금고에 보관하고 있고, 각 팀들은 대표이사 보고 후 전략지원팀장을 통하여 날인이 가능합니다. 뿐만 아니라 당사는 별도의 내부통제 관련 부서를 운영하여 위임전결규정 등 내부 규정에 따라 자금관리 및 집행이 이루어지고 있는지 수시로 감사를 진행하고 있습니다. 해당 감사 결과에 대해서는 정기적으로 감사위원회에 보고를 하며 내부통제시스템이 엄격하게 관리될 수 있도록 노력하고 있습니다.
라. 자금 집행의 부족한 자금의 재원마련 등 운용 계획
| [자금사용 우선순위] | |
| (단위: 백만원) | |
| 구분 | 단계 | 사용(예정) 시기 | 합계 | 자금사용 우선순위 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2024년 | 2025년 | 2026년 | |||||||||||
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||||
| R&D비용 | AST-201 (ApDC 고형암 치료제) |
임상1상 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | 3,640 | 2순위 |
| AST-202 (ApDC 혈액암 치료제) |
전임상 준비 | - | - | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 4,520 | ||
| AST-203 (TROP2-ApDC) (ApDC 후속 파이프라인) |
후보물질 | - | - | - | - | 520 | 1,900 | 100 | 400 | - | 2,920 | ||
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 (연세대학교의료원) |
- | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 | ||
| R&D비용 소계 | 310 | 250 | 750 | 570 | 2,940 | 2,470 | 1,240 | 1,350 | 1,600 | 11,480 | |||
| 채무상환자금 | 제1회 전환사채 상환 | 8,400 | - | - | - | - | - | - | - | - | 8,400 | 1순위 | |
| 시설투자비용 | 분석CRO | GLP/GCLP 인증기관 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 3,450 | 3순위 |
| 운영비용 | 급여, 지급수수료 등 판관비 | 20 | 160 | 20 | 240 | - | 162 | 90 | - | - | 692 | ||
| 총 합계 | 8,980 | 810 | 1,170 | 1,210 | 3,340 | 3,032 | 1,730 | 1,750 | 2,000 | 24,022 | - | ||
| (출처: 당사 제시) |
금번 유상증자로 조달된 자금은 상기와 같이 집행할 계획이며, 실제 모집된 자금이 예상보다 부족할 경우에는, 채무상환자금을 우선으로 하며 운영자금은 자체 보유 현금, 차입 등 다양한 조달 방법으로 조달할 예정이나, 증권신고서 제출일 현재 구체적인 사항은 정해지지 않았습니다.
또한, 공모기간 중 당사의 경영실적의 저하 또는 주식시장의 급격한 변동 등에 따라 모집 예정금액의 일부만 청약이 이루어질 경우 청약이 미달하여 대표주관회사 및 인수회사가 잔여주식을 인수하게 된다면 당사는 대표주관회사 및 인수회사에 총 발행금액의 1.5%를 기본 인수수수료로써 지급하는 것과는 별도로 추가적으로 대표주관회사 및 인수회사가 인수하는 잔여주식 인수금액의 19.0%에 해당하는 금액을 실권수수료로 지급하게 됩니다.
이러한 경우에는 금번 유상증자를 통해서 조달하는 자금의 규모가 대표주관회사 및 인수회사에 지급한 실권수수료 만큼 축소될 수 있습니다. 만일, 금번 유상증자 기간 중 당사의 경영 실적의 저하 또는 주식시장의 급격한 변동 등에 따라 최초 모집 예정금액 대비하여 낮은 규모가 조달될 경우 당사가 계획한 자금 사용 목적이 당사의 계획대로 진행되지 않을 수 있으며, 이러한 경우 당사가 계획한 자금운용이 불가능할 수 있습니다. 또한, 당사는 공모자금 유입 후 실제 투자집행 시기까지의 자금보유 기간에는 국내 제1금융권 및 증권사 등 안정성이 높은 금융기관의 상품에 예치할 계획이며, 자금의 사용시기가 도래하여 단기간 내에 자금의 사용이 예상되는 경우에는 적격금융기관의 수시입출금 예금, 정기예금 등 안정성이 높은 금융상품 또는 AA등급대(A1등급대) 이상의 단기금융상품으로 운용할 예정입니다. 만약 금번 유상증자의 공모금액이 당초 계획한 금액에 미달할 경우 부족분은 당사의 자체자금 등을 이용하여 충당할 예정입니다.
만약 금번 유상증자의 공모금액이 당초 계획한 금액에 미달할 경우 부족분은 당사의 자체자금 등을 이용하여 충당할 예정이며, 이밖에도 K-바이오 펀드 등 투자기관을 대상으로 한 투자 유치 활동 및 오픈 이노베이션 차원의 전략적투자자를 대상으로 한 영구 CB 발행 등 다각적인 신규 투자 유치 활동을 병행할 예정이나 현재로서 구체화된 신규 투자 유치 활동은 없습니다. 궁극적으로 회사는 연구개발에 차질이 생기지 않는 것을 최우선 과제로 삼고 자금 관리에 만전을 기할 방침입니다.
【 대표이사 등의 확인 】
 |
|
대표이사등 확인서명_증권신고서(정정)_240919 |
증 권 신 고 서
| ( 지 분 증 권 ) |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2024년 08월 27일 | 증권신고서(지분증권) | 최초 제출 |
| 2024년 09월 19일 | [정정]증권신고서(지분증권) | 1차정정 ("굵은 파란색") |
| 금융위원회 귀중 | 2024년 09월 19일 |
| 회 사 명 : |
주식회사 압타머사이언스 |
| 대 표 이 사 : |
한 동 일 |
| 본 점 소 재 지 : |
경기도 성남시 분당구 판교로 228번길 15 판교세븐벤처밸리 1단지 3동 301호 |
| (전 화) 031-786-0317 | |
| (홈페이지) http://www.aptsci.com | |
| 작 성 책 임 자 : | (직 책) 상무이사 (성 명) 이 철 환 |
| (전 화) 031-786-0317 | |
| 모집 또는 매출 증권의 종류 및 수 : | 기명식 보통주 12,300,000주 | |
| 모집 또는 매출총액 : | 24,021,900,000 | 원 |
| 증권신고서 및 투자설명서 열람장소 |
| 가. 증권신고서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 투자설명서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 :(주)압타머사이언스 → 경기도 성남시 분당구 판교로 228번길 15 판교세븐벤처밸리 1단지 3동 301호 (주)BNK투자증권 → 부산광역시 부산진구 새싹로1 부산은행 부전동 별관4층 SK증권(주) → 서울특별시 영등포구 국제금융로 8길 31 (주)상상인증권 → 서울특별시 영등포구 여의대로 108 |
【 대표이사 등의 확인 】
 |
|
대표이사등 확인서명 |
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 |
가. 압타머 산업 성장 지연에 따른 위험 의약품 산업은 국민의 건강과 직결되는 규제산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 등 전 과정을 엄격히 국가에서 규제하고 있습니다. 의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 마. 신약 목표 시장 내 경쟁 심화 위험 당사는 간암 치료제, 혈액암 치료제 등을 주요 파이프라인으로 개발하고 있으며 이처럼의학적 미충족 수요가 높은 시장을 전략적으로 목표하며 혁신신약을 연구개발하고 있습니다. 이에 대해 당사는 파이프라인별로 경쟁사 및 경쟁제품, 작용기전, 성능 등의 파이프라인 동향을 면밀하게 분석한 후 당사의 경쟁우위요소를 바탕으로 사업전략을 수립하고 있습니다. 하지만 당사의 이러한 노력에도 불구하고 동일 파이프라인 내 신규 경쟁업체의 진입 증가, 의학적 미충족 수요의 변화, 경쟁사의 가격정책 및 마케팅전략 변화, 새로운 치료제의 등장, 당사 파이프라인의 연구개발 속도 저하 등의 사유로 인해 당사 파이프라인의 시장경쟁력이 약화되는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다. 바. 신규 시장으로써 암 조기진단 산업의 특성에 따른 위험 당사가 영위하고 있는 액체 생검을 활용한 암 조기진단 시장은 그 동안 축적된 과학지식의 부족과 검사 기술의 부재로 인하여 최근(2014년)에야 미국에서부터 열리기 시작한 대규모 신흥시장(Emerging market)으로 국제적으로 경쟁사가 소수로 제한되어 있어 현재로서는 글로벌시장에서도 높은 경쟁력과 독점력을 가질 수 있는 산업분야입니다. 그럼에도 불구하고, 암 조기 검진 시장은 아직까지 활성화 되지 않은 새로운 시장으로 정부 정책 변화, 치료제나 다른 검진 방법의 기술 개발 등의 다양한 이유로 시장의 성장세가 저조하거나 위축되는 경우 당사의 영업 활동 및 수익성에 부정적인 영향을 줄 수 있습니다. |
| 회사위험 |
가. 매출부진 및 지속적 손실 발생 위험 당사는 설립 이래 총 7건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하였으며, 현재 진행중인 정부 과제에 대해서도 연구 목적 및 내용 달성을 위해 성실히 수행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔으며, 기술실시 권리를 가진 기술소유권자로서 해당 기술의 사업화를 위해 노력해왔습니다. 따라서 당사는 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
|
| 기타 투자위험 |
가. 인수인의 실권주 인수분 물량 출회에 따른 주가하락 위험 마. 전환사채 및 주식매수선택권 행사에 따른 주가 하락 위험 전환사채 및 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 12,300,000 | 500 | 1,953 | 24,021,900,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | BNK투자증권 | 보통주 | 4,108,200 | 8,023,314,600 | - 대표주관수수료: 5천만원 - 인수수수료: 모집총액의 1.5% 中 33.4% - 실권수수료: 잔액인수금액의 19.0% |
잔액인수 |
| 인수 | SK증권 | 보통주 | 4,095,900 | 7,999,292,700 | - 인수수수료: 모집총액의 1.5% 中 33.3% - 실권수수료: 잔액인수금액의 19.0% |
잔액인수 |
| 인수 | 상상인증권 | 보통주 | 4,095,900 | 7,999,292,700 | - 인수수수료: 모집총액의 1.5% 中 33.3% - 실권수수료: 잔액인수금액의 19.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2024년 12월 03일 ~ 2024년 12월 04일 | 2024년 12월 12일 | 2024년 12월 09일 | 2024년 12월 11일 | 2024년 10월 30일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2024년 08월 27일 | 2024년 11월 28일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 시설자금 | 3,450,000,000 |
| 운영자금 | 12,171,900,000 |
| 채무상환자금 | 8,400,000,000 |
| 발행제비용 | 478,022,440 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | [정정] 주요사항보고서(유상증자결정)-2024.09.19 |
| 【기 타】 | 1) 금번 (주)압타머사이언스의 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 (주)BNK투자증권이며, 인수회사는 SK증권(주) 및 (주)상상인증권입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것입니다. 대표주관회사 및 인수회사는 주주배정후 실권주 일반공모 후 최종실권주를잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 Ⅰ. 5. 인수 등에 관한 사항'을 참고하여 주시기 바랍니다. 3) 상기 모집가액 및 발행제비용은 예정가액으로 산정된 것으로 향후 변경될 수 있습니다. 확정가액은 청약초일 전 제3거래일에 확정되어 익영업일에 회사 인터넷 홈페이지(http://www.aptsci.com)에 공고되고 금융감독원 전자공시시스템에 공시될 예정입니다.. 4) 상기 청약기일은 구주주 청약 일정이며, 일반공모 청약은 2024년 12월 09일 ~ 2024년 12월 10일(2영업일간)입니다. 일반공모 청약공고는 2024년 12월 09일에 당사 및 대표주관회사의 인터넷 홈페이지를 통해 공고할 예정입니다. 5) 「자본시장과 금융투자업에 관한 법률」제180조의4 및 동법 시행령 제208조의4에 의거, 2024년 08월 27일부터 2024년 11월 28일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. 6) 일반공모 청약결과 발생하는 실권주 및 단수주는 공동대표주관회사가 인수비율에 해당하는 수량을 인수할 예정입니다. 7) 「증권 인수업무 등에 관한 규정」 제9조 제2항에 의거 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니할 수 있습니다. 7) 금융감독원에서 본 증권신고서를 심사하는 과정에서 주요사항의 변동으로 인한 기재 내용의 정정 등으로 동 신고서에 기재된 일정이 변경될 수 있습니다. 8) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. 9) 상기 발행제비용은 당사 보유자금으로 지급할 예정입니다. |
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6제2항제1호에 의거, (주)BNK투자증권, SK증권(주) 및 (주)상상인증권과 주주배정 후 실권주 일반공모 잔액 인수 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 12,300,000주를 주주배정 후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위: 원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 12,300,000 | 500 | 1,953 | 24,021,900,000 | 주주배정후 실권주 일반공모 |
| 주1) | 이사회 결의일: 2024년 08월 26일, 2024년 09월 10일, 2024년 09월 19일 |
| 주2) | 1주의 모집가액 및 모집총액은 예정 발행가액 기준으로 한 예정금액이며, 확정되지 않은 금액입니다. |
발행가액은 「증권의 발행 및 공시 등에 관한 규정」 제5-18조에 의거 주주배정 증자시 가격 산정 절차 폐지 및 가격 산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (舊) 「유가증권의 발행 및 공시등에 관한 규정」 제57조의 방식을 일부 준용하여 'Ⅰ. 모집 또는 매출에 관한 일반사항의 3. 공모가격 결정방법'에 기재된 바와 같이 산정할 예정입니다.
■ 예정 발행가액의 산출 근거
금번 유상증자의 예정 발행가액은 최초 이사회결의일 직전 거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며, 할인율은 25%를 적용합니다(단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다).
| 기준주가 X 【 1 - 할인율(25%) 】 | ||
| ▶ 예정 발행가액 | = | ---------------------------------------- |
| 1 + 【유상증자 비율(약 68.7%) X 할인율(25%)】 |
상기 방법에 따라 산정된 예정 발행가액과는 별도로, 당사는 구주주 청약초일전 제3거래일에 확정 발행가액을 산정하여 익영업일에 공시할 예정입니다.
| [예정 발행가액 산정표] |
| (기산일: 2024년 08월 23일) | (단위: 원, 주) |
| 구분 | 일자 | 종가 | 거래량 | 거래대금 |
|---|---|---|---|---|
| 1 | 2024-08-23 | 3,050 | 108,369 | 327,885,050 |
| 2 | 2024-08-22 | 3,075 | 157,974 | 484,414,200 |
| 3 | 2024-08-21 | 3,130 | 272,595 | 888,390,515 |
| 4 | 2024-08-20 | 3,360 | 194,961 | 649,749,715 |
| 5 | 2024-08-19 | 3,425 | 303,693 | 1,046,967,920 |
| 6 | 2024-08-16 | 3,480 | 352,953 | 1,224,782,685 |
| 7 | 2024-08-14 | 3,410 | 418,820 | 1,426,757,975 |
| 8 | 2024-08-13 | 3,370 | 587,984 | 1,970,896,220 |
| 9 | 2024-08-12 | 3,570 | 446,860 | 1,624,500,575 |
| 10 | 2024-08-09 | 3,645 | 775,570 | 2,802,205,385 |
| 11 | 2024-08-08 | 3,700 | 2,693,481 | 10,131,624,335 |
| 12 | 2024-08-07 | 3,820 | 4,561,307 | 16,868,337,940 |
| 13 | 2024-08-06 | 2,940 | 118,683 | 351,588,995 |
| 14 | 2024-08-05 | 2,870 | 253,061 | 771,092,615 |
| 15 | 2024-08-02 | 3,295 | 468,361 | 1,535,713,885 |
| 16 | 2024-08-01 | 3,125 | 858,889 | 2,863,562,705 |
| 17 | 2024-07-31 | 3,130 | 144,957 | 455,302,260 |
| 18 | 2024-07-30 | 3,170 | 819,836 | 2,724,352,660 |
| 19 | 2024-07-29 | 3,150 | 1,536,620 | 5,174,880,955 |
| 20 | 2024-07-26 | 3,100 | 328,420 | 984,703,350 |
| 21 | 2024-07-25 | 2,750 | 30,924 | 84,190,355 |
| 22 | 2024-07-24 | 2,765 | 24,192 | 67,587,075 |
| 1개월 가중산술평균주가(A) | 3,523 | |||
| 1주일 가중산술평균주가(B) | 3,274 | |||
| 기산일 종가(C) | 3,050 | |||
| (A), (B), (C)의 산술평균(D) | 3,282 | [(A)+(B)+(C)]/3 | ||
| 기준주가(E) | 3,050 | Min[(C), (D)] | ||
| 할인율 (F) | 25% | |||
| 유상증자비율 (G) | 68.71% | |||
| 예정 발행가액 | 1,953 | 기준주가 × (1-할인율) / 1 + (유상증자비율 × 할인율 ) (단, 호가 단위 미만은 절상하며, 액면가 미만인 경우에는 액면가로 합니다) |
||
■ 공모 일정 등에 관한 사항
당사는 2024년 08월 26일, 2024년 09월 10일, 2024년 09월 19일 이사회를 통해 유상증자를 결의하였습니다. 세부 일정은 다음과 같습니다.
| [(주)압타머사이언스 주주배정 후 실권주 일반공모 유상증자 주요일정] |
| 일자 | 업무내용 | 비고 |
|---|---|---|
| 2024-08-26 | 이사회 결의 및 주요사항보고서 제출 | - |
| 2024-08-26 | 신주발행 및 기준일 최초 공고 | 당사 인터넷 홈페이지 (http://www.aptsci.com) |
| 2024-08-27 | 증권신고서(예비투자설명서) 제출 | - |
| 2024-09-10 | (정정) 이사회결의 | - |
| 2024-09-19 | (정정) 이사회결의 | - |
| 2024-09-19 | (정정) 증권신고서 제출 | - |
| 2024-10-25 | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2024-10-29 | 권리락 | - |
| 2024-10-30 | 신주배정 기준일(주주확정) | - |
| 2024-11-11 | 신주배정 통지 | - |
| 2024-11-18 | 신주인수권증서 상장 및 거래 | 5거래일 이상 거래 |
| 2024-11-22 | 신주인수권증서 상장폐지 | 구주주 청약초일 5거래일 전 |
| 2024-11-28 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2024-11-29 | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.aptsci.com) 금융감독원 전자공시시스템 (http://dart.fss.or.kr) |
| 2024-12-03 ~ 2024-12-04 |
구주주 청약 및 초과청약 | - |
| 2024-12-09 ~ 2024-12-10 |
일반공모 청약 공고 및 청약접수 | 당사 인터넷 홈페이지 (http://www.aptsci.com) (주)BNK투자증권 홈페이지 (http://www.bnkfn.com) SK증권(주) 홈페이지 (http://www.sks.co.kr) (주)상상인증권 홈페이지 (http://www.sangsanginib.com) |
| 2024-12-11 | 환불 및 배정 공고 | (주)BNK투자증권 홈페이지 (http://www.bnkfn.com) SK증권(주) 홈페이지 (http://www.sks.co.kr) (주)상상인증권 홈페이지 (http://www.sangsanginib.com) |
| 2024-12-12 | 주금 납입일 | - |
| 2024-12-24 | 신주유통 및 상장예정일 | - |
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 상기 일정이 변경될 수 있습니다. 또한, 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주 상장과 동시에 신주가 유통될 예정입니다. |
| 주3) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
2. 공모방법
|
[공모방법: 주주배정 후 실권주 일반공모] |
| 모집대상 | 주식수(%) | 비고 |
|---|---|---|
| 구주주 청약 (신주인수권증서 보유자 청약) |
12,300,000주 (100%) | ▶ 구주 1주당 신주배정비율: 1주당 0.6871411642주 ▶ 신주배정기준일: 2024년 10월 30일 (예정) ▶ 구주주 청약일: 2024년 12월 03일 ~ 04일 (2일간) ▶ 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권 증서가 배정됨) |
| 초과 청약 | - | ▶ 「자본시장과 금융투자업에 관한 법률」제165조의6제2조제2항 에 의거한 초과청약 ▶ 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 ▶ 신주인수권증서 거래를 통한 매매 시 보유자 기준으로 초과청약 가능 |
| 일반모집 청약 (고위험고수익투자신탁등, 벤처기업투자신탁 청약 포함) |
- | ▶ 구주주 및 초과청약 후 발생하는 단수주 및 실권주에 대해 배정됨 ▶ 일반모집 청약일 : 2024년 12월 09일 ~ 12월 10일 |
| 합 계 | 12,300,000주 (100%) | - |
| 주1) | 본 건 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행되며, 구주주의 청약결과 발생하는 실권주 및 단수주에 대해서는 일반투자자에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.6871411642주의 비율로 배정하되, 1주 미만의 단수주는 절사합니다. 다만, 신주배정기준일 현재 신주의 배정비율은 액면병합, 주식관련사채의 권리 행사, 자기주식수의 변동 등으로 인하여 변경될 수 있습니다. |
| 주3) | 신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20.0%)를 곱한 수량을 한도로 초과청약할 수 있습니다. 단, 1주 미만은 절사합니다. ① 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수 ② 신주인수권증서 청약 한도주식수 = 보유한 신주인수권 증서의 수량 ③ 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율 (20.0%) |
| 주4) | "고위험고수익투자신탁등"이란 다음 각 호의 어느 하나에 해당하는 투자신탁 등을 말합니다. (1) 「조세특례제한법」 제91조의15 제1항에 따른 고위험고수익채권투자신탁(이하 "고위험고수익채권투자신탁"이라 함). 다만, 해당 투자신탁 등의 최초 설정일ㆍ설립일이 속하는 분기 또는 그 다음 분기 말일 전 배정하는 경우에는 같은 법 시행령 제93조 제1항 제1호 및 같은 조 제5항에도 불구하고 배정일 직전 영업일의 고위험고수익채권의 보유비율이 같은 법 시행령 제93조 제1항 제1호 각 목의 비율 이상이어야 합니다. (2) 법률 제19328호「조세특례제한법」의 시행일 이전의 제91조의15제1항에 따른 고위험고수익투자신탁(이하 "고위험고수익투자신탁"이라 함)으로서 최초 설정일ㆍ설립일이 2023년 12월 31일 이전인 것을 말합니다. 다만, 해당 투자신탁 등의 설정일ㆍ설립일부터 배정일까지의 기간이 6개월 미만일 경우에는 대통령령 제33499호 같은 법 시행령 시행일 이전의 제93조 제3항 제1호 및 같은 조 제7항에도 불구하고 배정일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 배정일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 배정일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35이상이어야 합니다 |
| 주6) | 구주주 청약(초과청약 포함) 결과 발생한 미청약주식은 다음 각항과 같이 일반에게 공모하되,「증권 인수업무 등에 관한 규정」제9조제2항제3호에 따라 고위험고수익투자신탁등에 일반공모 배정분의 10%를 배정하며, 「증권 인수업무 등에 관한 규정」제9조제2항제4호에 따라 벤처기업투자신탁에 일반공모 배정분의 25%를 배정합니다. 나머지 65%에 해당하는 주식은 개인투자자 및 기관투자자(집합투자업자 포함)에게 구분 없이 배정합니다. 다만, 어떤 그룹에 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. ① 1단계: 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. ② 2단계: 이후 최종 잔여주식은 최고청약자부터 순차적으로 우선 배정하되, 동순위 최대청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다. |
| 주7) | 「증권 인수업무 등에 관한 규정」제9조제2항제3호 및 제6호가목에 따라 고위험고수익투자신탁에 배정하는 주식은 해당 고위험고수익투자신탁의 자산총액의100분의20이내(공모의 방법으로 설정 또는 설립된 고위험고수익투자신탁은100분의10)가 되도록 합니다. 이 경우 자산총액은 고위험고수익투자신탁을 운용하는 기관투자자가 제출한 자료를 기준으로 산정합니다. |
| 주8) | 일반공모를 거쳐 배정 후에도 미 청약된 잔여주식에 대하여는 대표주관회사 및 인수회사가 인수비율에 따라 자기계산으로 인수합니다. |
| 주9) | 단, 「증권 인수업무 등에 관한 규정」제9조제2항에 따라, 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 일반 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자에게 배정하지 아니하고 대표주관회사가 자기계산으로 인수할 수 있습니다. |
| 주10) |
자본시장법 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2024년 08월 27일부터 2024년 11월 28일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
▶ 구주주 1주당 배정비율 산출근거
| 구분 | 상세내역 |
|---|---|
| A. 보통주식 | 16,980,252 |
| B. 우선주식 | 920,000 |
| C. 발행주식총수 (A + B) | 17,900,252 |
| D. 자기주식 + 자기주식신탁 | - |
| E. 자기주식을 제외한 발행주식총수 (C - D) | 17,900,252 |
| F. 유상증자 주식수 | 12,300,000 |
| G. 증자비율 (F / C) | 68.71% |
| H. 우리사주조합 배정 | - |
| I. 구주주 배정 (F - H) | 12,300,000 |
| J. 구주주 1주당 배정비율 (I / E) | 0.6871411642 |
| 주) | 단, 신주배정기준일 이전에 신주의 배정비율은 주식관련사채의 전환, 주식매수선택권의 행사, 자기주식수의 변동 등으로 인하여 변경될 수 있습니다. |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」제5-18조에 의거하여, 주주배정 증자 시 가격산정 절차가 폐지되고 가격산정방식이 자율화되었으나, 당사는 시장 혼란 우려와 기존 관행 등을 종합적으로 감안하여 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정할 예정입니다.
가. 1차 발행가액
신주배정기준일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다(단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다).
▶ 1차 발행가액 = 기준주가 × (1-할인율) / [1 + (증자비율 × 할인율)]
나. 2차 발행가액
구주주 청약초일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다(단, 호가 단위 미만은 호가 단위로 절상하며,그 가액이 액면가액 미만인 경우 액면가액으로 합니다).
▶ 2차 발행가액 = 기준주가 × (1-할인율)
다. 확정 발행가액
1차 발행가액과 2차 발행가액 중 낮은 가액을 확정 발행가액으로 합니다. 다만, 「자본시장과 금융투자업에 관한 법률」제165조의6 및 「증권의 발행 및 공시 등에 관한규정」제5-15조의2 에 의거하여, 1차 발행가액과 2차 발행가액 중 낮은 가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가격보다 낮은 경우에는 청약일전 과거 제3거래일로부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가격을 확정 발행가액으로 결정합니다(단, 호가 단위 미만은 호가 단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다).
▶ 확정 발행가액 = MAX【MIN(1차 발행가액, 2차 발행가액), 청약일전 제3거래일부터 제5거래일까지의 가중산술평균주가의 60%】
※ 일반공모 발행가액은 구주주 청약 시 적용한 확정 발행가액을 동일하게 적용합니다.
라. 모집가액 확정공시에 관한 사항
1차 발행가액은 신주배정기준일 전 제3거래일(2024년 10월 25일)에 결정되어 2024년 10월 28일에 금융감독원 전자공시시스템에 공시될 예정이며, 확정 발행가액은 구주주청약일 전 제3거래일(2024년 11월 28일)에 결정되어 2024년 11월 29일에 금융감독원 전자공시시스템에 공시될 예정이며, 정관에서 정한 당사 인터넷 홈페이지(http://www.aptsci.com)에 공고하여 개별통지에 갈음할 예정입니다. 확정 발행가액 결정에 따라 정정 신고서(증권발행조건확정)이 금융감독원 전자공시시스템에 공시 됩니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위: 주, 원) |
| 항 목 | 내 용 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 12,300,000 | ||||||||||||||||||||||||||||
| 주당 모집가액 또는 매출가액 | 예정가액 | 1,953 | |||||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||||
| 모집총액 또는 매출총액 | 예정가액 | 24,021,900,000 | |||||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||||
| 청 약 단 위 |
(1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수와 초과청약가능 주식수(보유하고 있는 신주인수권증서 1주당 0.2주를 곱하여 산정된 수)로 합니다. 다만, 신주배정기준일 현재 신주배정율은 주식관련사채의 전환, 자기주식수의 변동 등으로 인하여 변경될 수 있습니다(단, 1주 미만은 절사한다).
|
||||||||||||||||||||||||||||
| 청약기일 | 구주주 (신주인수권증서 보유자) |
개시일 | 2024년 12월 03일 |
| 종료일 | 2024년 12월 04일 | ||
| 일반모집 또는 매출 | 개시일 | 2024년 12월 09일 | |
| 종료일 | 2024년 12월 10일 | ||
| 청약 증거금 |
구주주(신주인수권증서 보유자) | 청약금액의 100% | |
| 초 과 청 약 | 청약금액의 100% | ||
| 일반모집 또는 매출 | 청약금액의 100% | ||
| 납입기일 / 환불일 | 2024년 12월 12일 | ||
| 배당기산일(결산일) | 2024년 01월 01일 | ||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
(1) 공고의 일자 및 방법
| 구 분 | 일 자 | 공고 장소 |
|---|---|---|
| 신주발행 및 신주배정기준일(주주확정일)의 공고 |
2024년 09월 11일 | 당사 인터넷 홈페이지(http://www.aptsci.com) |
| 모집 또는 매출가액 확정의 공고 | 2024년 11월 29일 | 당사 인터넷 홈페이지(http://www.aptsci.com) |
| 실권주 일반공모 청약공고 | 2024년 12월 09일 | 당사 인터넷 홈페이지(http://www.aptsci.com) (주)BNK투자증권 인터넷 홈페이지(http://www.bnkfn.co.kr) SK증권(주) 인터넷 홈페이지 (http://www.sks.co.kr) (주)상상인증권 인터넷 홈페이지 (http://www.sangsanginib.com) |
| 실권주 일반공모 배정 및 환불 공고 | 2024년 12월 11일 | (주)BNK투자증권 인터넷 홈페이지(http://www.bnkfn.co.kr) SK증권(주) 인터넷 홈페이지 (http://www.sks.co.kr) (주)상상인증권 인터넷 홈페이지 (http://www.sangsanginib.com) |
| 주) | 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 및 인수회사의 홈페이지에 게시함으로써 개별통지에 갈음합니다. |
(2) 청약방법
① 구주주 청약(신주인수권증서 보유자 청약) : 구주주 중 주권을 증권회사에 예탁한 주주(기존 실질주주)는 주권을 예탁한 증권회사의 본ㆍ지점 및 대표주관회사인 (주)BNK투자증권의 본ㆍ지점에서 청약할 수 있습니다. 다만, 구주주 중 명의개서대리인의 특별계좌에 주식을 가지고 있는 주주(기존 명부주주)의 경우는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 대표주관회사인 (주)BNK투자증권의 본ㆍ지점에서 청약할 수 있습니다. 청약시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출해야 합니다.
| 2019년 9월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 ' 일반 전자등록계좌(증권회사계좌)'로 이전 없이 대표주관회사인 (주)BNK투자증권의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
| 「주식ㆍ사채 등의 전자등록에 관한 법률」 |
|---|
| 제29조(특별계좌의 개설 및 관리) ① 발행인이 제25조부터 제27조까지의 규정에 따라 이미 주권등이 발행된 주식등을 전자등록하는 경우 제25조제1항에 따른 신규 전자등록의 신청을 하기 전에 제27조제1항제2호에 따른 통지를 하지 아니하거나 주권등을 제출하지 아니한 주식등의 소유자 또는 질권자를 위하여 명의개서대행회사, 그 밖에 대통령령으로 정하는 기관(이하 이 조에서 "명의개서대행회사등"이라 한다)에 기준일의 직전 영업일을 기준으로 주주명부등에 기재된 주식등의 소유자 또는 질권자를 명의자로 하는 전자등록계좌(이하 "특별계좌"라 한다)를 개설하여야 한다. ② 제1항에 따라 특별계좌가 개설되는 때에 제22조제2항 또는 제23조제2항에 따라 작성되는 전자등록계좌부(이하 이 조에서 "특별계좌부"라 한다)에 전자등록된 주식등에 대해서는 제30조부터 제32조까지의 규정에 따른 전자등록을 할 수 없다. 다만, 다음 각 호의 어느 하나에 해당하는 경우에는 그러하지 아니하다. 1. 해당 특별계좌의 명의자가 아닌 자가 주식등이 특별계좌부에 전자등록되기 전에 이미 주식등의 소유자 또는 질권자가 된 경우에 그 자가 발행인에게 그 주식등에 관한 권리가 표시된 주권등을 제출(주권등을 제출할 수 없는 경우에는 해당 주권등에 대한 제권판결의 정본·등본을 제출하는 것을 말한다. 이하 제2호 및 제3호에서 같다)하고 그 주식등을 제30조에따라 자기 명의의 전자등록계좌로 계좌간 대체의 전자등록을 하려는 경우(해당 주식등에 질권이 설정된 경우에는 다음 각 목의 어느 하나에 해당하는 경우로 한정한다) 가. 해당 주식등에 설정된 질권이 말소된 경우 나. 해당 주식등의 질권자가 그 주식등을 특별계좌 외의 소유자 명의의 다른 전자등록계좌로 이전하는 것에 동의한 경우 2. 해당 특별계좌의 명의자인 소유자가 발행인에게 전자등록된 주식등에 관한 권리가 표시된 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 다른 전자등록계좌로 이전하려는 경우(해당 주식등에 질권이 설정된 경우에는 제1호 각 목의 어느 하나에 해당하는 경우로 한정한다) 3. 해당 특별계좌의 명의자인 질권자가 발행인에게 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 전자등록계좌로 이전하려는 경우 4. 그 밖에 특별계좌에 전자등록된 주식등의 권리자의 이익을 해칠 우려가 없는 경우로서 대통령령으로 정하는 경우 ③ 누구든지 주식등을 특별계좌로 이전하기 위하여 제30조에 따른 계좌간 대체의 전자등록을 신청할 수 없다. 다만, 제1항에 따라 특별계좌를 개설한 발행인이 대통령령으로 정하는 사유에 따라 신청을 한 경우에는 그러하지 아니하다. ④ 명의개서대행회사등이 발행인을 대행하여 제1항에 따라 특별계좌를 개설하는 경우에는 「금융실명거래 및 비밀보장에 관한 법률」 제3조에도 불구하고 특별계좌부에 소유자 또는질권자로 전자등록될 자의 실지명의를 확인하지 아니할 수 있다. |
② 초과 청약: 신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도 주식수의 20%를 추가로 청약할 수 있습니다. 이때, 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
③ 일반공모 청약: 고위험고수익투자신탁등, 벤처기업투자신탁 및 일반청약자는 '금융실명거래 및 비밀보장에 관한 법률'의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표와 소정의 청약서, 청약증거금을 제시하고 청약합니다. 일반청약자의 청약시, 각 청약처별로 다중청약은 가능하나, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구의 경우 하나의 집합투자기구를 하나의 청약자로 보며, 집합투자기구별로 1건에 한해 청약이 가능합니다(단, 동일한 집합투자기구라도 운용주체(집합투자업자)가 다른 경우에는, 운용주체별로 청약할 수 있음). 고위험고수익투자신탁등 및 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제18호 내지 제20호에 따른 요건을 충족하고, 동 규정 제9조제4항 각호에 해당하지 않음을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
④ 청약은 청약주식의 단위에 따라 할 수 있으며 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 하고, 청약사무취급처는 그 차액을 납입일에 당해 청약자에게 반환하며, 이때 받은 날부터의 이자는 지급하지 않습니다.
⑤ 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」제132조에 따라 투자설명서의 교부가 면제되는 자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다
⑥ 기타
(i) 일반공모 배정을 함에 있어 이중청약이 있는 경우에는 그 청약자의 청약 전부를 청약하지 아니한 것으로 봅니다. 단, 구주주가 신주배정비율에 따라 배정받은 주식을 청약한 후 일반공모에 참여하는 경우에는 금지되는 이중청약이 있는 경우로 보지 않습니다.
(ii) 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 합니다.
(iii) 청약자는 「금융실명거래 및 비밀보장에 관한 법률」에 의거 실지 명의에 의해 청약해야 합니다.
(iv)「자본시장과 금융투자업에 관한 법률」제180조의4 및 「자본시장과 금융투자업에 관한 법률 시행령」제208조의4제1항에 따라 2024년 8월 27일부터 2024년 11월 28일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다.
| ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 |
|---|
|
① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우(매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
⑦ 청약한도
(i) 구주주(신주인수권증서 보유자)의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율인 1주당 0.6871411642주를 곱하여 배정된 신주인수권증서(단, 1주 미만은 절사)와 초과청약가능 주식수(보유하고 있는 신주인수권증서 1주당 0.2주를 곱하여 산정된 수, 단 1주 미만은 절사)를 합한 주식수로 하되, 자기주식 및 주식관련사채의 권리행사 등의 변동으로 인하여 구주주의 1주당 배정 비율은 변동될 수 있습니다.(단, 1주 미만은 절사합니다.)
(ii) 일반공모 청약자의 청약한도는 일반공모 총 공모주식 100% 범위 내로 하며, 청약한도를 초과하는 부분에 대해서는 청약이 없는 것으로 간주합니다.
(3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
(주)BNK투자증권 본ㆍ지점 | 2024년 12월 03일 ~ 2024년 12월 04일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 (주)압타머사이언스의 주식을 예탁하고 있는 당해 증권회사 본ㆍ지점 2) (주)BNK투자증권 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁등 청약 포함) |
1) (주)BNK투자증권 본ㆍ지점 2) SK증권(주) 본ㆍ지점 3) (주)상상인증권 본ㆍ지점 |
2024년 12월 09일 ~ 2024년 12월 10일 |
|
(4) 청약결과 배정방법
① 구주주: 신주배정 기준일(2024년 10월 30일 예정) 18시 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 1주당 0.6871411642주를 곱하여 산정된 배정주식수(단,1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 자기주식수의 변동 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
② 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주가 있는 경우, 실권주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율 : 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다.(단, 초과청약 주식수가 실권주에 미달한 경우 100% 배정)
(i) 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약 한도주식수
(ii) 신주인수권증서청약 한도주식수 = 보유한 신주인수권 증서의 수량
(iii) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 × 초과청약 비율(20%)
③ 일반공모 청약:
상기 구주주청약 및 초과청약 결과 발생한 미청약주식 및 단수주는 다음과 같이 "대표주관회사" 및 "인수회사"가 일반에게 공모하되,「증권 인수업무 등에 관한 규정」제9조 제2항 제3호에 따라 고위험고수익투자신탁등에 공모주식의 10%를 배정하고, 「증권 인수업무 등에 관한 규정」제9조 제2항 제4호에 따라 벤처기업투자신탁에 공모주식의 25%를 배정하며, 나머지 65%에 해당하는 주식은 개인투자자 및 기관투자자에게 구분 없이 배정합니다. 고위험고수익투자신탁등에 대한 공모주식 10%와 벤처기업투자신탁에 대한 공모주식 25%, 개인투자자 및 기관투자자에 대한 공모주식 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 「증권 인수업무 등에 관한 규정」 제9조 제3항에 따라 어느 한 그룹만 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
(i) 일반공모에 관한 배정수량 계산 시, 대표주관회사와 인수회사의 "청약물량"(대표주관회사와 인수회사의 각 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를의미하며, 대표주관회사와 인수회사에 대하여 개별적으로 산정한 청약주식수를 말합니다)에 대해서는 대표주관회사와 인수회사의 "총청약물량"(대표주관회사와 인수회사가 일반공모 방식으로 접수를 받은 "청약물량"의 합을 말합니다)을 "일반공모 배정분" 주식수로 나눈 통합청약경쟁률에 따라 대표주관회사와 인수회사의 각 청약자에 배정하는 방식(이하 "통합배정"이라 합니다)로 합니다.
(ii) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 5사 6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 최대청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사" 및 "인수회사"가 합리적으로 판단하여 배정합니다.
(iii) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 미달하는 경우에는 청약주식수대로 배정하되, 잔여주식은 대표주관회사와 인수회사가 본 건 유상증자를 위한 잔액인수계약서 제2조 제3항에 따라 인수합니다.
(ⅳ) 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항 7호에 의거 일반 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 일반청약자에게 배정하지 아니하고 자기의 계산으로 인수할 수 있습니다.
(5) 투자설명서 교부에 관한 사항
-「자본시장과 금융투자업에 관한 법률」제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 당사 및 대표주관회사 및 인수회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- 금번 유상증자에 청약하고자 하는 투자자께서는 (「자본시장과 금융투자업에 관한 법률」제9조제5항에 규정된 전문투자자 및 동법 시행령 제132조에 따라 투자설명서의 교부가 면제되는 자 제외) 청약하시기 전 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
- 투자설명서 수령거부 의사표시는 서면, 전화, 전신, 팩시밀리, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 가능합니다.
① 투자설명서 교부 방법 및 일시
| 구분 | 교부방법 및 교부일시 | 교부일시 |
|---|---|---|
|
구주주 청약자 |
아래 1), 2), 3)을 병행 1) 우편 송부 2) "대표주관회사"의 본ㆍ지점 교부 3) "대표주관회사"의 홈페이지나 HTS, MTS에서 교부 |
1) 우편송부 시: 구주주 청약 초일 전까지 수취가능 2) "대표주관회사"의 본ㆍ지점: 3) "대표주관회사"의 홈페이지 또는 HTS, MTS 교부: |
|
일반청약자 (고위험고수익 투자신탁 등, |
아래 1), 2)를 병행 1) "대표주관회사" 및 "인수회사"의 2) "대표주관회사" 및 "인수회사"의 |
1) "대표주관회사" 및 "인수회사"의 본ㆍ지점: 일반공모 청약종료일(2024년 12월 10일)까지 2) "대표주관회사" 및 "인수회사"의 홈페이지 또는 HTS, MTS 교부: 청약종료일(2024년 12월 10일)까지 |
| ※ 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다. |
② 확인절차
(i) 우편을 통한 투자설명서 수령시
- 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
- HTS, MTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
- 주주배정 유상증자 경우 유선청약이 가능합니다. 유선상으로 신분확인을 하신 후, 투자설명서 교부 확인을 해주시고 청약을 진행하여 주시기 바랍니다.
(ii) 지점 방문을 통한 투자설명서 수령시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
(iii) 홈페이지 또는 HTS, MTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
③ 기타
(i) 금번 유상증자의 경우, 본 증권신고서의 효력발생 이후 주주명부상 주주분들에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는, 지점방문을 통해 인쇄물을 받으실 수 있으며, 또한 동일한 내용의 투자설명서를 전자문서의 형태로 대표주관회사 및 인수회사의 홈페이지에서 다운로드 받으실 수 있습니다. 한편, 일반공모 청약시 투자자께서는 대표주관회사 및인수회사 본ㆍ지점에 방문하여 투자설명서 인쇄물을 수령하시거나 대표주관회사 및 인수회사의 홈페이지에서 동일한 내용의 투자설명서를 전자문서의 형태로 다운로드 받으시는 2가지 방법으로 투자설명서를 교부받으실 수 있습니다. 다만, 전자문서의 형태로 교부받으실 경우,「자본시장과 금융투자업에 관한 법률」제124조 제1항 각호의 요건을 모두 충족해야만 청약이 가능합니다.
(ii) 구주주 청약 시, 대표주관회사인 (주)BNK투자증권 이외의 증권회사를 이용한 청약 방법은 해당 증권회사의 청약방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
| ※ 관련법규 「자본시장과 금융투자업에 관한 법률」 제9조 (그 밖의 용어의 정의) ⑤ 이 법에서 "전문투자자"란 금융투자상품에 관한 전문성 구비 여부, 소유자산규모 등에 비추어 투자에 따른 위험감수능력이 있는 투자자로서 다음 각 호의 어느 하나에 해당하는 자를 말한다. 다만, 전문투자자 중 대통령령으로 정하는 자가 일반투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우 금융투자업자는 정당한 사유가 있는 경우를 제외하고는 이에 동의하여야 하며, 금융투자업자가 동의한 경우에는 해당 투자자는 일반투자자로 본다. <개정 2009.2.3> 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자 제124조 (정당한 투자설명서의 사용) ① 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외한다)에게 제123조에 적합한 투자설명서(집합투자증권의 경우 투자자가 제123조에 따른 투자설명서의 교부를 별도로 요청하지 아니하는 경우에는 제2항제3호에 따른 간이투자설명서를 말한다. 이하 이 항 및 제132조에서 같다)를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 아니 된다. 이 경우 투자설명서가 제436조에 따른 전자문서의 방법에 따르는 때에는 다음 각 호의 요건을 모두 충족하는 때에 이를 교부한 것으로 본다.<개정 2013.5.28> 1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 "전자문서수신자"라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 「자본시장과 금융투자업에 관한 법률 시행령」 제11조 (증권의 모집·매출) ① 법 제9조제7항 및 제9항에 따라 50인을 산출하는 경우에는 청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다. 다만, 다음 각 호의 어느 하나에 해당하는 자는 합산 대상자에서 제외한다. <개정 2009.10.1, 2010.12.7, 2013.6.21, 2013.8.27> 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 제10조제1항제1호부터 제4호까지의 자 나. 제10조제3항제12호·제13호에 해당하는 자 중 금융위원회가 정하여 고시하는 자 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사·감정인·변호사·변리사·세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주(법 제9조제1항제1호에 따른 최대주주를 말한다. 이하 같다)와 발행주식총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는 그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자 제132조 (투자설명서의 교부가 면제되는 자) 법 제124조제1항 각 호 외의 부분 전단에서 "대통령령으로 정하는 자"란 다음 각 호의 어느 하나에 해당하는 자를 말한다. <개정 2009.7.1, 2013.6.21> 1. 제11조 제1항 제1호 다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화·전신·모사전송, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. |
6) 주권 유통에 관한 사항
- 주권유통개시일: 2024년 12월 24일 (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
7) 청약증거금의 대체 및 반환 등에 관한 사항
- 청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 초과청약 배정 후 발생하는 미배정 주식에 대한 환불금과 일반공모 배정 후 발생하는 미배정 주식에 대한 환불금에 대해서도 무이자로 하며, 미배정주식에 대한 환불금은 2024년 12월 12일 환불될 예정입니다.
8) 주금납입장소: 하나은행 판교금융센터
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2024년 10월 30일 | (주)BNK투자증권 | 00251400 |
1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」제165의6조제3항 및 「증권의 발행 및 공시 등에 관한 규정」제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 9월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 (주)BNK투자증권으로 합니다.
4) 신주인수권증서 매매 등
① 금번 유상증자시 신주인수권증서는 전자증권제도 시행 이후에 발행되고 상장될 예정으로 실물은 발행 되지 않고 전자증권으로 등록발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
② 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
5) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 (주)BNK투자증권의 본ㆍ지점을 통해 해당 신주인수권증서에 기재되어 있는 수량만큼청약할 수 있으며 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
6) 당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2024년 11월 18일부터 2024년 11월 22일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2024년 11월 25일에 상장폐지될 예정입니다(「코스닥시장상장규정」제83조(신주인수권증권 및 신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제85조(신주인수권증권 및 신주인수권증서의 상장폐지)에 따라 주주청약 개시일 5거래일전에 상장폐지되어야 합니다).
|
※ 관련법령 제165조의6(주식의 발행 및 배정 등에 관한 특례) ③ 주권상장법인은 제1항제1호의 방식으로 신주를 배정하는 경우 「상법」 제416조제5호 및 제6호에도 불구하고 주주에게 신주인수권증서를 발행하여야 한다. 이 경우 주주 등의 이익 보호, 공정한 시장질서 유지의 필요성 등을 고려하여 대통령령으로 정하는 방법에 따라 신주인수권증서가 유통될 수 있도록 하여야 한다. 제176조의8(주식의 발행 및 배정에 관한 방법 등) ④ 법 제165조의6제3항 후단에서 "대통령령으로 정하는 방법"이란 다음 각 호의 어느 하나에 해당하는 방법을 말한다. 1. 증권시장에 상장하는 방법 2. 둘 이상의 금융투자업자(주권상장법인과 계열회사의 관계에 있지 아니한 투자매매업자 또는 투자중개업자를 말한다)를 통하여 신주인수권증서의 매매 또는 그 중개ㆍ주선이나 대리업무가 이루어지도록 하는 방법. 이 경우 매매 또는 그 중개ㆍ주선이나 대리업무에 관하여 필요한 세부사항은 금융위원회가 정하여 고시한다.
제83조(신주인수권증권 및 신주인수권증서의 신규상장) ② 신주인수권증권을 신규상장하려면 다음 각 호의 심사요건을 모두 충족하여야 한다. 1. 신주인수권증권의 발행회사의 주식(외국주식예탁증권을 포함한다. 이하 이 장에서 같다)이 코스닥시장에 상장되어 있을 것 2. 신주인수권증권의 발행회사의 상장 주식이 상장신청일 현재 이 규정에 따른 관리종목으로 지정되지 않고, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유에 해당되지 않을 것 3. 신주인수권증권의 발행총수가 1만 증권 이상일 것. 이 경우 해당 증권의 목적인 신주가 액면주식인 경우에는 액면가액 5,000원을 기준으로 한다. 4. 신주인수권증권의 잔존 권리행사기간이 상장신청일 현재 1년 이상일 것 5. 신주인수권부사채권이 모집 또는 매출로 발행되었을 것. 다만, 주주에게 해당 사채권의 인수권이 주어진 경우에는 그러하지 아니하다. ③ 신주인수권증서를 신규상장하려면 다음 각 호의 심사요건을 모두 충족하여야 한다. 1. 신주인수권증서의 발행회사의 주식이 코스닥시장에 상장되어 있을 것 2. 신주인수권증서의 발행회사의 상장 주식이 상장신청일 현재 이 규정에 따른 관리종목으로 지정되지 않고, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유에 해당되지 않을 것 3. 신주인수권의 양도를 허용하고, 신주인수권을 갖는 모든 주주에게 신주인수권증서를 발행하였을 것 4. 신주인수권증서의 발행총수가 1만 증서 이상일 것. 이 경우 해당 증서의 목적인 신주가 액면주식인 경우에는 액면가액 5,000원을 기준으로 한다. 5. 신주인수권증서의 거래 가능 기간이 5일(매매거래일을 기준으로 한다) 이상일 것 제85조(신주인수권증권 및 신주인수권증서의 상장폐지) 1. 신주인수권증권의 목적인 주식이 관리종목으로 지정되거나, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 2. 신주인수권증권의 목적인 주식에 대한 상장폐지 신청으로 해당 주식이 상장폐지되는 경우 3. 신주인수권 행사기간이 만료되거나 행사가 완료된 경우 4. 그 밖에 공익 실현과 투자자 보호를 위하여 거래소가 신주인수권증권의 상장폐지가 필요하다고 인정하는 경우 ② 거래소는 신주인수권증서가 다음 각 호의 어느 하나에 해당하는 경우 해당 신주인수권증서의 상장을 폐지한다. 1. 신주인수권증서의 목적인 주식이 관리종목으로 지정되거나, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 2. 신주인수권증서의 목적인 주식에 대한 상장폐지 신청으로 해당 주식이 상장폐지되는 경우 3. 신주 청약 개시일의 5일(매매거래일을 기준으로 한다) 전이 된 경우. 다만, 신주인수권증서의 유통상황을 고려하여 세칙으로 정하는 경우에는 그 기간 전으로 한다. 4. 그 밖에 공익 실현과 투자자 보호를 위하여 거래소가 신주인수권증서의 상장폐지가 필요하다고 인정하는 경우 |
7) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래관련 사항은 다음과 같습니다.
① 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
② 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 기존 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 |
2024년 11월 18일부터 2024년 11월 22일까지(5거래일간) 거래 |
신주배정통지일(2024년 11월 11일(예정))부터 신주인수권증서의 상장거래 마지막 날 이후 제2영업일(2024년 11월 26일)까지 거래 |
| 주1) | 상장거래: 2024년 11월 18일부터 11월 22일까지(5영업일간) 거래 가능합니다. |
| 주2) | 계좌대체거래 : 2024년 11월 11일(예정)부터 2024년 11월 26일까지 거래 가능합니다. * 신주인수권증서 상장거래의 결제일인 2024년 11월 26일까지 계좌대체(장외거래) 가능하며, 동일이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다. |
| 주3) | 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다. |
③ 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
(i) '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다.
(ii) '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 (주)BNK투자증권의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
1) 본 증권신고서는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자시 이러한 점을 감안하시기 바랍니다.
2) 「자본시장과 금융투자업에 관한 법률」제120조제3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
3) 본 증권신고서에 기재된 내용은 공시서류 제출 전일 현재까지 발생된 것으로 본 신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익상황에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다. 따라서, 주주 및 투자자가 투자의사를 결정함에 있어 유의하여야 할 사항이 본 증권신고서상에 누락되어 있지 않습니다.
4) 금융감독원 전자공시 홈페이지(https://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
5) 본 증권신고서의 예정 모집가액은 확정되어 있는 것은 아니며, 청약일 3거래일 전에 확정발행가액을 산정함으로써 확정될 예정입니다. 또한, 본 증권신고서의 발행예정금액은 추후 주당 발행가액이 확정되는 내용에 따라 변경될 수 있음을 유의하여 주시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
| 대표주관회사 | (주)BNK투자증권 | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 X 인수비율(33.4%) |
대표주관수수료 : 5천만원 인수수수료 : 모집총액의 1.5% 中 33.4% 실권수수료 : 잔액인수금액의 19.0% |
| 인수회사 | SK증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 X 인수비율(33.3%) |
인수수수료 : 모집총액의 1.5% 中 33.3% 실권수수료 : 잔액인수금액의 19.0% |
| 인수회사 | (주)상상인증권 | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 X 인수비율(33.3%) |
인수수수료 : 모집총액의 1.5% 中 33.3% 실권수수료 : 잔액인수금액의 19.0% |
| 주1) | 최종 실권주: 구주주청약(초과청약 포함) 및 일반공모 후 발생한 잔여주식 또는 청약미달주식 |
| 주2) | 모집총액: 최종 발행가액 X 발행주식총수 |
II. 증권의 주요 권리내용
1. 액면금액
|
제6조 (1주의 금액) 당회사가 발행하는 주식 1주의 금액은 금 500원으로 한다. |
2. 주식의 발행 및 배정에 관한 사항
|
제5조(발행예정주식의 총수) 2. 회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다. 2. 회사는 제 1 항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다. ① 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 「자본시장과 금융투자업에 관한 법률」제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 ② 상법」 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 ③ 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 배정하는 경우 ④ 발행주식 총수의 100분의 30을 초과하지 않는 범위 내에서 긴급한 자금 조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 5. 제2항에 따라 주주 외의 자에게 신주를 배정하는 경우 회사는 상법 제416조제1호, 제2호, 제2호의2, 제3호 및 제4호에서 정하는 사항을 그 납입기일의 2주 전까지 주주에게 통지하거나 공고하여야 한다. |
3. 배당에 관한 사항
|
제12조(신주의 동등배당) 회사는 매 사업연도 말의 처분전이익잉여금을 다음과 같이 처분한다. 1. 이익준비금 2. 별도적립금 3. 주주배당금 4. 임의적립금 5. 기타의 이익잉여금처분 제59조 (이익배당) 1. 이익의 배당은 금전과 금전 외의 재산으로 할 수 있다. 2. 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. 3. 전항의 배당은 이사회 결의로 정하는 배당기준일 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. 4. 이익배당은 주주총회의 결의로 정한다. 다만, 제56조제6항에 따라 재무제표를 이사회가 승인하는 경우 이사회 결의로 이익배당을 정한다. 제 60 조 (분기배당) 1. 회사는 사업연도 개시일 부터 3월, 6월 및 9월 말일(이하 “분기배당 기준일”이라 한다) 현재의 주주에게 자본시장과 금융투자업에 관한 법률 제165조의12에 의한 분기배당을 할 수 있다. 2. 제1항의 분기배당은 이사회의 결의로 하되, 그 결의는 제1항의 각 기준일 이후 45일 내에 하여야 한다. 3. 분기배당은 직전결산기의 대차대조표상의 순자산액에서 다음 각호의 금액을 공제한 액을 한도로 한다. ① 직전결산기의 자본금의 액 ② 직전결산기까지 적립된 자본준비금과 이익준비금의 합계액 ③ 직전결산기의 정기주주총회에서 이익배당하기로 정한 금액 ④ 직전결산기까지 정관의 규정 또는 주주총회의 결의에 의하여 특정목적을 위해 적립한 임의준비금 ⑤ 상법 시행령 제19조에서 정한 미실현이익 ⑥ 분기배당에 따라 당해 결산기에 적립하여야 할 이익준비금의 합계액 4. 제1항의 분기배당은 분기배당 기준일 전에 발행한 주식에 대하여 동등배당한다. |
4. 의결권에 관한 사항
|
제28조 (주주의 의결권) 주주의 의결권은 의결권 있는 주식 1주마다 1개로 한다. 제29조 (상호주에 대한 의결권 제한) 당 회사, 모회사 및 자회사 또는 자회사가 다른 회사의 발행주식총수의 10분의 1을 초과하는 주식을 가지고 있는 경우 그 다른 회사가 가지고 있는 당 회사의 주식은 의결권이 없다. 제30조 (의결권의 불통일행사) 1. 2이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회의일의 3일전 회사에 대하여 서면으로 그 뜻과 이유를 통지하여야 한다. 2. 회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 그러나 주주가 주식의 신탁을 인수하였거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니하다. 제31조 (의결권의 대리행사) 1. 주주는 총회에 출석하지 아니하고 서면에 의하여 의결권을 행사할 수 있다. |
III. 투자위험요소
1. 사업위험
| [용어의 정의] |
| 용어 | 정의 |
|---|---|
| 의약품(Medicine) | 사람, 동물의 질병 진단, 치료, 예방목적으로 사용되는 물품으로 기구,기계 장치가 아닌 것 |
| 바이오의약품(Biologics) | 사람이나 다른 생물체에서 유래된 세포, 조직, 호르몬 등을 이용해 유전자 재조합 또는 세포 배양기술을 통해 개발한 의약품 |
| 압타머(Aptamer) | 압타머는 3차원적 형태를 이루어 표적 물질에 특이적으로 결합하는 단일 가닥 올리고 핵산 물질이며 표적의 3차원적인 형태를 인식해 결합하는 특징을 가짐. 또한 생물학적 생산이 아닌 화학적 합성으로 생산하기 때문에 배치 재현성이 높고, 물질 안정성 (stability)도 우수하며, 제조가격도 저렴하고, 생체 내 면역원성 (immunogenicity)도 보고된 바가 없는 안전성도 우수한 바이오 소재 |
| 압타머 발굴(SELEX) | SELEX란 Systematic Evolution of Ligands by EXponential enrichment의 약자로, 다양한 핵산 라이브러리와 표적 분자와의 반복적인 결합 후 결합하지않은 핵산 라이브러리를 제거하고 표적 분자에 특이적으로 결합하는 것들만 선택적으로 선별하여 매우 우수한 결합력과 특이성을 보이는 압타머를 발굴할 수 있는 기술 |
| 압타머 합성(Aptamer synthesis) | 압타머는 항체와 달리 화학적 합성으로 생체 외에서 생산하며, 다양한 화학적 변형 등이 용이. 또한, 높은 생산 재현성 (Low lot-to-lot variation)과 품질 관리가 가능하여 낮은 생산단가로 생산 가능 |
| 압타머-약물 접합체(ApDC, Aptamer-Drug Conjugate) | 압타머 기반 표적약물전달을 위해 압타머 말단에 화학적 결합을 통해 약물을 접합하거나, 압타머 서열 내에 약물을 직접 내재화한 형태 |
| ELOHA 시험법(Enzyme-Linked Oligonucleotide Hybridization Assay) | 압타머 및 압타머-약물 접합체의 생체시료 분석법 |
| 신약(New drug) | 화학구조나 본질 조성이 전혀 새로운 신물질의약품 또는 신물질을 유효성분으로 함유한 복합제제 의약품 |
| 병행투여/병용투여(Combination therapy/treatment) | 두 가지 이상의 의약품을 동시에 혹은 연속적으로 투여하는 치료 방법. |
| 미국 식품의약국(FDA, Food and Drug Administration) | 미국에서 식품과 의약품의 인허가를 주관하는 정부 기관. 1931년 설립되었으며, 의약품의 인허가 및 규제, 화장품, 식품 그리고 의료 기기 등에 대한 허가와 규제를 담당하고 있음. 국내에는 이와 유사한 기관으로 식품의약품안전처가 있음. |
| 유럽 의약품기구(EMA, European Medicines Agency) | 유럽 의약품의 평가 및 감독을 하는 유럽 연합의 기관 |
| 파이프라인(Pipeline) | 신약 개발 계획을 뜻하는 말로 주로 연구 개발 단계에 있는 품목을 말함 |
| 마일스톤(Milestone) | 신약 라이선스 계약은 대부분 마일스톤 방식으로 이루어지며, 계약 체결 후 받는 <계약금>, 개발 단계별 성취도에 따라 받는 <단계별 기술료>로 구성됨. 제품 상용화 이후에는 마일스톤과 별개로 판매액 일정비율의 <로열티>를 받음. 마일스톤의 단계별 기술료 세부내역은 치열한 시장 경쟁 상황 등을 고려해 계약 당사자들간 협의에 따라 통상적으로 비공개로 함. ① 확정된 계약금 - 계약 체결 직후 또는 일정기간 내에 받게되는 금액. ② 단계별 기술료 - 전임상 → 임상 → 허가신청 → 허가완료 등 개발 단계별로 성공시에 받게 되는 금액. 개발 종료 시점까지 수년에 걸쳐 나누어 받게 되며, 도중에 여건이 나빠지거나 임상에 실패하여 더 이상 개발하지 않을 경우 일정 금액을 받지 못할 수 있음. ③ 로열티 - 기술 이전으로 생산된 제품의 매출에 따라 받게 되는 금액. 대개 로열티는 매출액 대비 비율로 책정되는데, 로열티를 어느 정도로 할 것인가는 당사자의 협의에 의하는 문제로서 일률적인 기준은 없음. |
| 비밀 유지 계약서(CDA, Confidential Disclosure Agreement) | 이해 당사자 간 체결되는 비밀유지계약으로 제 3자에게 이해 당사자의 비밀을 노출하지 않겠다는 내용의 약정 |
| 물질 이전 계약서(MTA, Material Transfer Agreement) | 이해 당사자 간 체결되는 물질 이전 계약으로 해당 물질에 대한 검증을 목적으로 체결되는 계약 |
| 미충족 의학적 수요(Unmet medical needs) | 치료가 필요한 환자 및 증상은 존재하지만 해당하는 적합한 치료법이 개발되지 못한 영역 |
| IND(Investigational New Drug Application) | 임상시험계획신청, 동물실험에서 의약품의 효과와 독성을 확인한 후에 사람에게 임상시험을 하기위해 진행하는 절차. 의사의 엄중한 감시 아래 투약하고, 여러 단계의 임상을 통해서 유효성과 안전성이 최종 확인되면 NDA 신청하게됨 |
| NDA(New Drug Application) | 신약허가신청, 연구개발부터 동물시험까지 비임상시험결과와 인체를 대상으로 하는 임상시험결과 및 제조까지를 종합하여 식품의약품안전처에 의약품허가를 신청하는 절차 |
| 세포독성(Cytotoxicity) | 물질이 세포의 효소, 구조를 이루는 성분에 영향을 미쳐 세포를 죽일 수 있는 경우 또는 세포의 염색체나 유전자(즉, DNA)의 변형을 유발하는 것 |
| 안전성(Safety) | 신약후보물질이 사람이 복용하였을 때 독성이나 심각한 부작용이 없음을 입증하기 위해 실험동물을 통한 안전성 시험이 필수임. 신약개발에서 안전성 평가는 과학적인 임상시험을 위한 기초자료 확보에 목적을 두고 사람한테 일어날수 있는 부작용과 독성 반응의 예측, 초기투여용량 설정, 회복성 여부 등을 시험함 |
| 생물학적 안전성 평가(Biologiccal safety assessment) | 원재료 특성분석, 생물학적 안전성 시험 성적서, 관련 문헌 및 임상 보고 등을 통한 종합적인 생물학적 안전성 평가로, 인체에 접촉되는 모든 의료기기에 적용될 정도로 의료기기의 안전성 확보에 절대적인 영향을 미침 |
| 객관적 반응률(Objective Response Rate) | 사전에 정의된 최소한의 기간동안, 사전에 정의된 양 이상의 종양감소를 보인 환지의 비율 |
| 안정성(Stability) | 의약품 또는 의료기기가 실제로 취급되는 상황을 생각하여 빛, 열, 온도, pH 등의 영향에 얼마나 안정한가를 알아보는 시험. 약물 또는 화합물이 화학변화를 쉽게 일으키지 않거나 반응속도가 느려 일정 기간동안 일정한 상태를 유지하는 성질 |
| 비임상시험(Non-clinical study) | 사람을 대상으로 하지 않는 생의학 시험으로 동물에서의 독성과 유효성 시험임 |
| 최소 유효 용량 (MED, Minimum Effective Dose) | 약물이 효능을 나타내기 위한 최소의 용량 |
| 최대 내성 용량 (MTD, Maximum Tolerated Dose) | 약물이 독성을 나타내지 않는 최대의 용량 |
| 약물동태학(PK, Pharmacokinetics) | 체내에 투여된 약물에 대해 인체가 그 약물에 어떤 영향을 어떻게 미치는지 흡수, 대사, 배설로 변하는 수치적 해석? |
| 약물동역학(PD,Pharmacodynamics) | 체내에 투여된 약물에 의해 인체가 받는 영향으로 약물의 용량과 생체 반응 관계를 생리적, 생화학적 작용과 효과면에서 해석 |
| 이종 이식 모델 (Xenograft model) | 인간의 세포/암 등에 대한 효능, 영향을 평가하기 위해 인간의 세포/암등을 동물에 이식해 제작한 모델 |
| CRO(Contract Research Organization) | 신약개발을 하는 과정에서 제약기업의 임상시험 관리를 대행해 주는 기관을 총칭함. CRO는 단순한 데이터 관리 및 통계분석 서비스에서 최근 약물 발굴·신약개발·제조·운송·상품화까지 제약 산업 전 단계에 걸쳐 서비스를 제공하는 영역에까지 확대하고 있음. |
| CMO(Contract Manufacturing Organization) | 제약업계에서 많이 사용되는 용어로 의약품을 대행 생산하도록 아웃소싱을 맡기는 것을 뜻함. 전자업계 OEM이나 반도체 파운드리와 유사한 개념임. |
| 비임상시험관리기준 (GLP, Good Laboratory Practice) | 의약품, 화학품 등의 안전성 평가를 위하여 실시하는 각종 독성시험의 신뢰성을 보증하기 위하여 연구인력, 시험시설, 장비, 시험 방법 등 시험의 전 과정에 관련된 모든 사항을 조직적, 체계적으로 관리하는 규정 |
| 화학, 제조 및 품질관리 (CMC, Chemistry, Manufacturing and Controls) | 의약품 개발과정에서 의약품의 품질과 연관된 연구개발 및 제조공정이 일관성 있게 조절 및 관리되고 있음을 문서화 하여 입증하는 것 |
| 최신 우수 의약품 제조 품질관리 기준(cGMP, current good manufacturing practice) | FDA (미국 식품의약국) 가 만든 가장 높은 수준의 GMP로서 의약품 제조를 위해 공장에서 원료의 구매부터 제조, 출하 등에 이르는 모든 과정에 필요한 관리 기준을 규정한 것 |
| 전임상 단계(Pre-clinical) | 의약품 개발 과정 중 새롭게 개발한 약물 후보물질을 사람에게 사용하기 전에 동물에게 적용하여 부작용이나 독성, 효과 등을 알아보는 시험단계 |
| 임상 1상(Phase 1) | 비임상시험(동물을 상대로 한 실험)을 거친 신약을 사람에서 처음으로 평가하는 과정. 비교적 제한된 수의 대상자(약 20-80명)에게 투여되며 약의 종류에 따라 다르지만 대개 건강한 성인을 대상으로 진행함. 안전성을 검토하여 안전용량의 범위를 확인하게 됨. 또한 약물의 체내에서의 흡수, 분포, 대사, 배설에 대한 자료를 수집함 |
| 임상 2상a(Phase 2a) | 임상시험에 사용되는 의약품의 안전성과 유효성을 증명하기 위하여 해당약물의 약동, 약력, 약리, 임상적 효과를 확인하고 이상반응 등을 평가하기 위하여 사람을 대상으로 실시하는 시험 또는 연구로 사람을 피시험자로 하는 것이기 때문에 윤리적인 배려와 함께 과학적인 방법으로 진행됨 |
| 임상 2상b(Phase 2b) | 임상 2a의 결과에 따라 설계된 용량을 가지고 다시 환자에 투여, 어느 만큼의 용량이 가장 효과가 있을지 적정 투여 용량의 범위를 정하는 과정 |
| 임상 3상(Phase 3) | 제 2상 임상시험에서 확인된 사항들을 종합적으로 판단하여 유용성이 인정될 때 대상질환 중 조건에 부합되는 다수 환자를 대상으로 효능효과, 용법용량, 사용상의 주의사항 등 전반적인 안전성, 유효성을 확인하여 의약품으로서의 유용성을 결정하는 시험 |
| 정맥 주사(IV injection, Intravenous injection) | 정맥에 주사하는 기법 |
| 피하 주사(SC injection, Subcutaneous injection) | 피하 지방에 주사하는 기법 |
| 혈액-뇌 장벽 (BBB, Blood-Brain Barrier) | 뇌외 혈액을 격리시키는 혈관 장벽으로 뇌 모세혈관 내피 세포의 밀착연접 (tight junction)을 형성하여 고분자와 친수성 물질의 통과를 방해 |
| 체외진단검사(IVD, In Vitro Diagnostics) | 질병의 확진 및 예후, 건강상태 판정, 질병 치료효과 판정, 예방 등의 목적으로 혈액, 체액, 조직 등 인체에서 유래한 물질을 이용해 신체 밖에서 신속하게 진단하는 기술 |
| 체외진단 다지표 검사(IVDMIA, In Vitro Diagnostic Multivariate Index Assay) | 환자의 질병이나 상태를 진단하거나 질병의 치료, 완화, 처치, 예방, 예후, 예측을 위하여 해석 함수를 사용하는 다지표 진단 방법. 해석 함수는 다양한 지표 (수치)들을 결합하여 환자 특이적인 결과 (위험군 분류, 점수, 인덱스 등)를 도출 |
| 현장 검사(POC, Point-Of-Care) | 피검자 및 환자와 가까운 위치에서 원심분리 등 샘플 사전가공을 거치지 않고, 신속하게 시행해 진료 및 치료에 활용할 수 있는 임상병리 검사방식 또는 키트 |
| 임상적 검증(Clinical validation) | 민감도, 특이도 등의 정보에 따라 진단 성능을 정확하게 예측하기 위한 검증 |
| 임상적 유효성(Clinical efficacy) | 체외진단 다지표 검사 (IVDMIA)를 이용하여 바이오마커에 대해 수행한 시험이 환자의 질병 상태에 대한 판단 근거를 제공할 수 있는 성능 |
| 임상적 민감도(Clinical sensitivity) | 특정 질환을 가지고 있는 사람 중 검사 결과가 양성으로 나오는 비율 |
| 임상적 특이도(Clinical specificity) | 특정 질환을 가지고 있지 않은 사람 중 검사 결과가 음성으로 나오는 비율 |
| 위양성(FP, False Positive) | 질병이나 증상이 없는 음성 환자나 음성 검사대상물에서 양성으로 나온 검사 결과 |
| 위음성(FN, False Negative) | 질병이나 증상이 있는 양성 환자나 양성 검사대상물에서 음성으로 나온 검사 결과 |
| RNA | 리보핵산. 핵산의 일종이며, 주로 생물체의 유전 정보를 담은 유전물질. DNA를 주형으로 합성되며, 유전 정보의 전달, 유전자 발현 조절 등의 역할을 수행함 |
| 선별검사(Screening test) | 해당 질환의 고위험군을 조기에 발견하여 추가적인 관찰이나 직접적 예방 활동을 하기 위한 검사 |
| 예후(Prognosis) | 환자의 상태나 질병의 결과에 대한 예측 |
| 조기진단(Early diagnosis) | 특정 질환으로 확인되지 않은 사람을 대상으로 질환에 걸렸는지 또는 위험성이 있는지 미리 진단하여 어떤 검사 또는 치료법을 사용할 것인지 결정하기 위한 목적의 진단 |
| 모니터링(Monitoring) | 수술 이후나 항암치료 후에 재발이 일어났는지, 치료 효과가 있는지를 추적하는 진단 |
| 비침습적 진단(Non-invasive diagnosis) | 사람의 몸속으로 침투하지 않고 몸 밖으로 흘러나오는 또는 몸 밖에서 채취가 가능한 혈액, 가래, 대변 및 소변 등의 체액을 이용한 진단 행위 |
| 신의료기술 | 신의료기술평가사업본부 (NECA) 평가 결과 안전성 및 유효성이 인정된 진료행위로 건강보험심사평가원에서 급여/비급여로 결정되지 않은 의료기술 |
| 체외진단 의료기기 선진입 후평가 제도 | 식약처 의료기기 허가를 취득한 이후 건강보험 등재 절차로 바로 진입할 수 있도록 개선하고, 1~5년 판매후 신의료기술평가를 시행하는 제도로 2019년 4월 감염병 체외진단검사에 대해 시범사업이 진행되고 있으며, 2021년 체외진단 검사로 확대될 예정임. |
| 실험실개발테스트(LDT, Laboratory Developed Test) | 임상 검사실에서 자체적으로 개발한 체외진단검사를 환자들에게 제공할 수 있도록 하는 제도 |
| 독립진단실험실(ICL, Independent Clinical Laboratory) | 실험실개발테스트와 같은 개념으로 중국을 비롯한 동남아시아에서 환자들에게 제공할 수 있도록 하는 제도 |
| 정밀의료 | 환자마자 다른 유전정보, 환경적 요인, 생활습관 등 다양한 정보를 포괄적으로 이용하여 분자 수준에서 종합적으로 분석한 후 개인별 최적의 맞춤형 의료(예방, 진단, 치료)를 제공하는 차세대 의료 패러다임 |
| 검체 | 검사 대상(인체)으로부터 체취된 검사에 필요한 재료(혈액, 체액, 조직 등) |
| 바이오마커 | 세포나 혈관, 단백질이나 DNA, RNA 등을 이용해 체내 변화를 알아낼 수 있는 지표로 생명체의 정상 또는 병리적인 상태, 약물에 대한 반응 정도 등을 객관적으로 측정 가능함 |
| 분자진단 | 대표적인 체외진단 기법으로, 인체나 바이러스 등의 유전자 정보를 담고 있는 DNA, RNA의 분자 수준 변화를 검출해 질병 등을 진단하는 검사방법 |
| 예후진단 | 환자의 검체로부터 예후관련 유전자를 분석하여 병의 경과 및 진행, 회복에 대해 정보를 알기 위한 진단 방법 |
| 동반진단 | 환자의 검체로부터 특정 바이오마커 보유 여부를 분석하여 특정 치료제에 대해 안정성과 효율성이 입증된 환자군을 선별하는 진단 방법 |
| GMP | Good manufacturing practice의 약칭. 식품·의약품의 안정성과 유효성을 품질면에서 보증하는 기본 조건으로서의 우수식품·의약품의 제조·관리기준 |
| 신의료기술 | 안정성과 유효성이 평가되지 아니한 새로운 의료기술로서 보건복지부장관이 평가가 필요하다고 인정한 의료기술 |
| 예후예측 유전자 | 예후란 병의 경과나 결과를 미리 예상하는 것을 의미하며 암의 경우 보통 5년 또는 10년 생존율로 판단됨. 예후예측 유전자는 유전자의 발현량 또는 돌연변이 여부에 따라 질병의 예후를 판단할 수 있는 척도로 사용되는 유전자를 지칭함 |
| 표준유전자 | 외부 조건에 상관없이 대부분의 세포에서 일정한 발현값을 보이는 유전자. 유전자 발현값을 사용하는 검사에서 표준유전자는 다른 유전자의 발현값의 발현 기준으로 사용됨 |
| 위험비(HR) | 시간이 지남에 따라 한 집단의 특정한 사건(예: 재발)이 다른 군에 비해 얼마나 자주 일어나는지를 상대적으로 나타내는 수치 |
| 돌연변이 빈도(mutation index) | 특정 돌연변이의 존재 유무 및 정량적 정도를 의미하며 야생형(wild type) 대비 돌연변이의 빈도로 제시됨 |
| NCCN | National Comprehensive Cancer Network의 약칭. 미국 내 암 치료 분야의 32개(2023.01 기준) 주요 암센터로 구성된 비영리 연합체로 암 종별로 제공하는 치료 가이드라인은 국제 암 표준진료지침으로 활용됨 |
| 민감도(Sensitivity) | 특이도와 함께 검사의 정확도를 측정하는 지표 중 하나로 어떤 질병이 있는 상태에서 검사를 통해 그 질병을 얼마나 정확하게 찾아내는지 정도를 수치화한 값 |
| 생검 / 액체생검 | 생검은 생체검사의 준말. 일반적으로 조직생검을 말하며, 환자의 병이 있는 부위의 조직 일부를 잘라내어 병리조직학적으로 검사하는 방법을 뜻함. 액체생검은 혈액 등 체액 속 암 세포가 깨지면서 생기는 미량의 DNA 조작을 찾아 유전적으로 검사하는 방법을 뜻함 |
| Macrodissection | 검체에서 특정 조직(예: 암세포)의 비율을 높이기 위해 사용되는 방법으로 특정 조직 외 주변 조직을 제거하는 방법 중 하나 |
| PMS | Post Market Surveillance의 약칭. 신개발의료기기, 희소의료기기 등에 대하여 시판 이후 일정기간 동안 안전성 및 유효성 등에 관한 정보를 수집, 검토, 확인 또는 검증하는 제도 |
| 중합효소연쇄반응(PCR) | DNA (데옥시리보 핵산)를 증폭시키는 기술로, 일반 분석기기로 감지할 수 없는 극미량의 DNA 조각을 증폭하거나 압타머 발굴에서 표적 분자에 특이적으로 결합하는 핵산 라이브러리를 증폭할 때 사용 |
| 표적 분자(Target molecule) | 단백질, 저분자 화합물, 탄수화물, 그리고 독소 등이 대표적인 표적 분자로서 진단 제품 또는 치료제 개발 시 표적 바이오마커가 표적 분자에 해당 |
| 변형핵산(Modified nucleoside) | 핵산 서열의 특정 염기 (base)에 소수성 분자 (hydrophobic moiety)를 도입하여 핵산 라이브러리의 다양성 및 소수성을 증가시키고, 이로 인해 표적 분자내 소수성 부분과의 결합이 획기적으로 개선된 압타머를 높은 성공률로 발굴할 수 있는 기반 물질 |
| 해리상수(Dissociation constant, Kd) | 압타머 성능을 확인하기 위한 척도로서 압타머가 표적 분자와 얼마나 강하게 결합하는지를 확인할 수 있는 지표로 값이 낮을수록 높은 결합력을 의미 |
| 플랫폼 기술(Platform technology) | 진단제 및 치료제 개발에 있어 우수한 압타머를 발굴하고 제품화를 위한 핵심 분석, 기반기술을 의미. 다양한 질환 분야에 적용할 수 있으며, 지속적인기술개발을 통해 높은 부가가치를 창출하는 기술 |
| 알로스테리 결합(Allosteric binding) | 세포막 수용체 상의 기존 리간드 결합 위치가 아닌 다른 위치에 결합하여 수용체의 활성을 조절하는 결합 방식 |
| 민감제(Sensitizer) | 자신의 활성과 관계없이 내재적 인자/호르몬의 활성을 도와 효능을 향상 시키는 물질 |
| 인슐린 저항성(Insulin resistance) | 세포가 체내에서 정상적으로 분비되는 인슐린에 반응하지 못하는 병리학적 상태 |
| 인슐린 민감제(Insulin sensitizer) | 세포막 인슐린 수용체에 결합하여 자체적으로는 활성이 없으나 수용체의 인슐린 민감성을 증진하는 물질 |
| 표적 외 작용에 따른 부작용(Off-target side effect) | 약물이 체내의 특정 표적 이외에 다른 곳에 비특이적으로 작용하여 나타나는 부작용 |
| 작용기전(MOA, Mode Of Action) | 약물이 유효성을 나타내는 분자생물학 및 생화학적, 세포생물학적 작용 메커니즘 |
| 아고니스트(Agonist) | 생체작용물질의 수용체에 결합하여 그 물질과 같은 또는 유사한 작용을 하는 물질 |
| 당화혈색소(HbA1c) | 적혈구에 포함된 혈색소가 포도당과 결합하여 생성되며, 높은 혈중 포도당 상태에 혈색소가 장기간 노출되면 증가하여 당뇨병의 진단기준으로 활용됨 |
| 1형 당뇨(Type 1 diabetes) | 인슐린 의존형 당뇨병으로 췌장 베타세포의 파괴로 인해 정상적인 인슐린 분비가 되지 않는 당뇨병 |
| 2형 당뇨(Type 2 diabetes) | 인슐린 비의존형 당뇨병으로 인슐린은 정상적으로 분비되지만, 세포가 인슐린에 적절하게 반응하지 못하거나 병의 진행에 따라 인슐린이 부족하여 발생하는 당뇨병 |
| (출처 : 당사 제시) |
| 가. 압타머 산업 성장 지연에 따른 위험 당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 현재 사용되고 있는 항체 의약품과 같은 단백질 및 유전체 기반 바이오 소재로는 개발이 어려운 압타머 신약 및 진단 제품을 개발하는 사업을 영위하고 있습니다. 압타머 신약 및 진단 제품은 항체 의약품의 미충족 수요를 충족할 대안으로 앞으로 압타머 관련 산업이 크게 확대될 전망입니다. 하지만 당사가 영위하고자 하는 압타머를 활용한 진단 및 치료제 시장의 규모는 원천 기술 개발사의 초기 폐쇄적인 특허 운영으로 인해 아직 성장 단계입니다. 압타머 기술의 주요한 한계점은 1) 핵산분해효소 취약성 2) 항체 대비 짧은 체내 반감기와 높은 약물 청소율 3) 구조적 다양성의 한계 가 있습니다. 당사에서는 변형된 뉴클레오티드를 적용한 SELEX를 통해 구조적 다양성을 확대하여 압타머의 표적 결합력, 발굴성공율이 대폭 개선된 고성능 압타머를 약물개발에 활용하고 있으며, 화학적 변형을 도입한 최적화를 통해 위에서 제시한 핵산분해효소에 대한 안정성도 동시에 개선하여 안정성 높은 압타머를 활용하고 있습니다. 압타머 기술 기반 승인 신약으로는 Macugen(Pfizer, 2004)과 Izervay(Astellas, 2023) 두 종이 있고, 이중 Macugen는 보다 효과적인 신약 출시로 인해 현재는 시장에서 판매중단이 되었습니다. Macugen과 Izervay은 황반변성에 대한 신약으로 현재까지 암 치료에 승인된 압타머는 없습니다 따라서 향후 압타머 관련 기술 개발이 지연되거나 관련 제품의 상용화가 어려워질 경우, 영업환경 및 경쟁환경의 변화에 따라 압타머 산업의 시장 규모가 축소되거나 성장률이 둔화될 수 있으며 이는 당사의 경영 실적에 부정적인 영향을 미칠 수 있습니다. |
당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 현재 사용되고 있는항체 의약품과 같은 단백질 및 유전체 기반 바이오 소재로는 개발이 어려운 압타머 신약 및 진단 제품을 개발하는 사업을 영위하고 있습니다.
압타머는 3차원적 구조의 다양성으로 표적 분자에 대한 특이적 결합이 가능한 단일 가닥 올리고 핵산 물질로서 표적 치료제 및 약물전달, 바이오 이미징, 진단제 등 다양한 분야의 활용에 적합하여 전 세계의 많은 제약기업 및 연구기관들의 주목을 받고 있습니다.
현재 바이오 의약품 시장에서 항체 기술이 높은 표적성으로 시장을 주도하고 있지만, 크기및 단백질 물성에서 오는 한계 때문에 의약품 개발을 위한 표적은 고갈되어 가고 있으며, 이후 개발된 핵산 의약품은 의약품으로서의 높은 가능성을 가지지만 아직 기술적 성숙이 필요한 상황입니다. 압타머는 항체의 물성과 크기로 인해 생기는 한계를 극복할 수 있고, 핵산 의약품의 장점을 그대로 활용할 수 있어서 항체와 핵산 의약품의 약점을 보완할 수 있는 의약품 소재로 평가받고 있습니다.
| [소재에 따른 의약품 분류 및 압타머의 위치] |
 |
|
소재에 따른 의약품 분류 및 압타머의 위치 |
| (출처 : 당사 제시) |
항체 기술의 부작용 문제는 30년 이상의 오랜 기간 연구를 통하여 상당 부분 보완되었으나, 여전히 미해결 문제가 많습니다. 항체 물질의 크기로 인해 고형암에서 낮은 투과율로 치료 효과가 낮고, 완전 인간항체라도 여전히 면역원성에 대한 우려가 있으며, 복잡한 제조공정으로 가격이 비싸고 높은 배치변이(batch variation)가 문제가 됩니다.
압타머 기술은 1990년에 처음 소개되었으며 압타머는 기능적으로 항체와 마찬가지로 표적 분자에 선택적으로 결합해 화학 항체라고도 불리는 핵산계(DNA/RNA) 물질3입니다. 치료제 소재로서 압타머는 핵산 물질로 항체와 달리 면역원성이 낮고 항체 대비 1/5-1/10의 작은 크기로 높은 조직 투과성을 보이며, 표적과 3차원 공간 인식을 통해 결합함으로써 높은 표적 선택성과 결합력을 가지고 있습니다. 생물학적으로 생산되는 항체 조각 기술, 비항체 단백질 결합체 기술과 달리 화학적으로 합성되기에제어가 용이한 제조공정과 생산된 물질의 배치 변이의 우려가 없고, 온도 및 주변 환경변화에 매우 안정적인 물성을 가지고 있어 운반 및 보관이 용이합니다.
| [항체와 압타머의 기본 특성 비교] |
|
구분 |
항체 |
압타머 |
|
구성 물질 |
단백질 |
핵산 (DNA/RNA) |
|
크기 (kDa) |
~150 |
~20 |
|
표적 결합 방식 |
서열 인식 |
3차원 공간 인식 |
|
조직 투과성 |
낮음 |
양호 |
| (출처 : 당사 제시) |
이처럼 항체를 대체할 차세대 소재의 기대감으로 글로벌 압타머 시장은 2022년 17억 달러 규모로 평가되었으며, 연평균 16.5% 성장하여 2031년 70억 달러에 다다를 것으로 전망됩니다.
| [글로벌 압타머 시장 규모] |
 |
|
글로벌 압타머 시장 규모 |
| (출처 : Aptamer Market, Transparency Market Research 2023.11.) |
미국 SomaLogic사가 개발한 2세대 변형 핵산 압타머 기술은 기술 혁신에 대한 수요는 충족시켰지만 SomaLogic사가 타 연구진에게 압타머를 미제공하는 등의 독점적이며 폐쇄적인 특허상황은 연구자들에게도 매우 제한적인 후속 연구 기회가 제공되는 상황을 초래하였습니다. 이는 결과적으로 최초 기술 개발 이후의 30여년간의 기간에 비해 최근까지도 압타머 기술이 바이오 시장의 주류로 자리 잡지 못하게 된 주된 원인으로 판단되고 있습니다.
[압타머 기술의 한계점]
항체 치료제는 인체가 세균, 바이러스 등 외부 물질에 감염된 후 이에 대항해 만들어낸 항체 중 특정 병원체를 무력화할 수 있는 물질을 선별해 만든 치료제입니다. 항체는 최초 발견 이후 1세기가 지났으며 1986년 단일항체가 FDA 첫 승인을 획득한 이후로 100개 이상의 치료제가 출시되었습니다. 오랜 기간 동안 연구를 거쳐 많은 데이터를 확보하고 있으며, 표적에 대한 높은 결합력, 체내 안전성, 장기간 체내에 남아 지속적인 치료 효과를 제공할 수 있다는 점이 항체의 강점으로 꼽힙니다.
항체와 압타머는 모두 특정 타겟에 특이적으로 결합하여 비표적 효과의 가능성을 줄이고 치료 효과를 높일 수 있습니다. 또한 화학 요법 및 표적 소분자 약물보다 독성과 부작용이 적습니다.
| [항체와 비교한 압타머의 강점과 약점] |
| 항목 |
압타머 |
항체 |
| 구성단위 |
뉴클레오티드 |
아미노산 |
| 물질 |
핵산(단일가닥 DNA 또는 RNA) |
단백질(2 경쇄와 2 중쇄) |
| 분자량 |
6~30kDa(20~100nt) | 150~180kDa |
| 2차 구조
|
Stem, loop | a-Helix, b-sheet |
| 표적 결합패턴 |
표적분자 표면의 3차 구조인식 |
표적분자의 에피토프 인식 |
| 표적 결합력 |
높음 |
높음 |
| 표적 특이성 |
높음 |
높음 |
| 표적 범위 |
넓음(저분자 유/무기 화합물부터 핵산, 펩타이드, 단백질, 세포 등) |
면역원성 분자 제한적(단백질) |
| 발굴 |
in vitro SELEX 기법
~2-8주 소요
|
In vivo 생물학적 시스템 적용
~6개월 소요
|
| 생산 |
고체상 지지체 화학합성 제어 가능한 공정(낮은 오염위험) 낮은 생산비용 낮은 배치 변동성 |
동물 또는 세포 기반 생산 높은 오염위험 높은 생산비용 높은 배치 변동성 |
| 물리화학적 물질 안정성 |
높음(긴 보관기간) 온도변화에 대한 높은 안정성 화학적 변형 용이(내부적 변형 및 기능기 접합) |
낮음 온도 및 환경변화에 민감 제한적 화학적 변형(활성 및 구조변형 유발) |
| 약동력학적 특성 |
빠른 조직 투과 짧은 반감기 빠른 체외 배출 |
느린 조직 투과 긴 반감기 느린 체외 배출 |
| 면역원성 |
낮음 |
높음 |
| (출처:당사 제시) |
압타머 기술의 주요한 한계점은 다음과 같습니다.
1) 핵산분해효소 취약성 (Susceptible to neclease degradation)
압타머의 유리한 특징에도 불구하고, 치료적 응용을 위한 압타머를 개발하기 위해서 몇 가지 주목할 만한 한계를 고려해야 합니다. 압타머는 뉴클레오타이드로 구성되어 있기 때문에, 생체 내 또는 시험관 내 조직 배양 환경에서 핵산분해효소에 의한 분해에 취약합니다.
2) 항체 대비 짧은 체내 반감기와 높은 약물 청소율 (High clearance rate)
압타머는 일반적으로 약 10~30kDa의 크기를 갖는데, 이는 단클론항체보다 대략 10배 정도 작습니다. 결과적으로 혈액 순환계에 투여된 압타머는 항체 대비 반감기가 짧고 체외로 배출되는 속도가 빠릅니다. 그러나 이 특성은 압타머의 사용 목적에 따라 달라지므로 본질적으로 부정적인 특성은 아닙니다. 예를 들어, 항체 기반 약물전달 기술인 ADC의 개발과정에서 가장 큰 과제는 용량제한독성(Dose-limiting Toxicity)와 그에 기인한 좁은 치료용량계수(Therapeutic Window)입니다. 세포독성 약물의 선택적 전달을 위해 세포 표면 단백질을 표적으로 하는 압타머는 종양 등의 표적으로 빠르게 침투하는 반면에 신장을 통한 체외 배출도 신속하게 이루어 질 수 있어 독성을 최소화하고 치료용량계수를 넓힐 수 있는 충분한 잠재성을 가지고 있습니다. 이러한 특성은 압타머와 유사한 작은 약물전달 플랫폼(펩타이드 등)을 기반으로 한 약물전달 기술에서 공통적으로 항체와 차별성을 갖는 포인트로 강조되고 있습니다.
3) 구조적 다양성의 한계 (Limited building block diversity)
20개의 아미노산으로 구성된 항체와 달리 압타머는 4개의 뉴클레오티드(A, T, G, C)로 구성됩니다. DNA 또는 RNA 염기서열을 구성하는 뉴클레오티드의 비교적 간단한 화학 구조는 압타머가 표적과 상호 작용을 촉발하는 구조적 다양성이 제한적임을 의미합니다.
새로운 모달리티의 신약 개발 도입과 연구실에서 개발한 기술을 임상으로 연결하는 데는 오랜 시간과 비용이 필요합니다. 상기 언급한 제약으로 인해 압타머가 처음 개발되었을 때 보였던 잠재력을 실현하지 못한 것도 사실입니다. 첫 번째 SELEX 기술 개발 이후 여러 압타머가 선택되어 진단 및 치료 기술 모두에서 성공적으로 적용되었지만, 지금까지 암 치료에 승인된 압타머는 없습니다. 그럼에도 불구하고 전 세계 연구자들은 이러한 장애물을 극복하기 위해 노력하고 있습니다. 당사에서는 변형된 뉴클레오티드를 적용한 SELEX를 통해 구조적 다양성을 확대하여 압타머의 표적 결합력, 발굴성공율이 대폭 개선된 고성능 압타머를 약물개발에 활용하고 있으며, 화학적 변형을 도입한 최적화를 통해 위에서 제시한 핵산분해효소에 대한 안정성도 동시에 개선하여 안정성 높은 압타머를 활용하고 있습니다.
전 세계 연구자들은 이러한 장애물을 극복하기 위해 노력하고 있습니다. 당사에서는 변형된 뉴클레오티드를 적용한 SELEX를 통해 구조적 다양성을 확대하여 압타머의 표적 결합력, 발굴성공율이 대폭 개선된 고성능 압타머를 약물개발에 활용하고 있으며, 화학적 변형을 도입한 최적화를 통해 위에서 제시한 핵산분해효소에 대한 안정성도 동시에 개선하여 안정성 높은 압타머를 활용하고 있습니다.
초기 압타머 기술은 in vitro 평가에서 나타나는 우수한 표적 결합력과 선택성에도 불구하고 생체 내에서 빠르게 분해되어 사라지기 때문에 동물모델 등 in vivo 실험에서는 좋은 결과를 얻지 못했습니다. 또한, 항체 대비 짧은 반감기를 보이는 약동력학적 특성이 비경구로 전신투여되는 약물의 개발에는 적합하지 않다는 인식으로 인해 초기에는 국소투여가 필요한 질환(안과질환 등)을 중심으로 압타머 기반 약물개발이 진행되어 왔습니다. 그러나, 그동안 압타머를 포함한 올리고뉴클레오티드 물질들의 약물로서의 잠재성을 실현시키기 위해 약동력학적 특성을 개선하기 위한 기술개발(pegylation 등), 핵산분해효소에 대한 저항성을 높이기 위한 기술개발(뉴클레오티드의 화학적 변형체 도입 등)이 꾸준히 진행되어 왔고, 실제 압타머와 동일 구조계열의 올리고뉴클레이티드 물질인 siRNA, ASO 핵산의약품의 개발에 활발히 적용되고 있습니다. 압타머도 관련 기술들의 도입으로 안정성을 높이고, 기능기의 접합(pegylation 등)을 통해 반감기가 개선된 물질들을 기반으로 국소질환 뿐만 아니라 항암 등 다양한 적응증에 대한 개발이 이루어지고 있습니다.
| [압타머 및 바이오 신약 승인 연혁] |
 |
|
압타머 및 바이오 신약 승인 연혁 |
| (출처 : 당사 제시) |
한편, 2010년 압타머 발굴 원천기술 특허가 만료되었고, 2023년 마침내 두번째 압타머 신약으로 FDA 승인을 획득한 노인성 황반변성 치료제인 아이베릭사의 Izervay의 출시와 글로벌 제약사 아스텔라스의 인수합병(59억 달러)은 본격적인 압타머 기반 제품 개발에 대한 시장의 관심 증대의 계기가 되었고, 새로운 치료제 및 제품 출시의 시발점이 될 것으로 예상되고 있습니다.
| [글로벌 압타머 치료제 임상 진행 현황] |
| 번호 | 개발사 (국가) |
2023년 매출기준 세계 20위 제약사 여부 |
신약 후보물질 | 적응증 | 단계 | 기타 | |
|---|---|---|---|---|---|---|---|
| 1 | Gilead Sciences, Inc. (미국) |
여 | Macugen | Pegaptanib sodium | 습성 황반변성 | 시판허가 | FDA 2004년 9월 승인 2000년 Gilead Sciences가 Eyetech에 L/O ($32m) Eyetech, Pfizer 공동 개발 |
| 2 | IVERIC Bio (미국) |
부 | Izervay (Zimura) |
Avacincaptad pegol sodium | 노인성 황반변성 | 시판허가 | FDA 2023년 8월 승인 2023년 7월 IVERIC Bio가 Astellas Pharma에 M&A. |
| 3 | Guardian Therapeutics (미국) |
부 | BT200 | Rondoraptivon pegol | 혈우병 A | 2상 | - |
| 폰빌레브란트병 | 2상 | - | |||||
| 4 | aptaTargets (스페인) |
부 | ApTOLL | TLR4 antagonists | 급성 허혈성 뇌졸중 | 1b/2a상 | - |
| COVID-19 | 1상 | - | |||||
| 5 | TME Pharma (독일) |
부 | NOX-A12 | Olaptesed Pegol | 교모세포종 | 2상 | - |
| 췌장암, 대장암 | 2상 | - | |||||
| 혈액암(다발성골수종, 만성림프구성백혈병) | 2상 | - | |||||
| NOX-E36 | Emapticap Pegol | 간암, 췌장암 | 비임상 | - | |||
| 6 | Berlin Cures (독일) |
부 | BC007 | - | 확장성 심근병증 | 2상 | - |
| 만성 코로나19 증후군 | 2상 | - | |||||
| 녹내장 | 2상 | - | |||||
| 7 | APTARION Biotech (독일) |
부 | AON-D21 | C5a inhibitors | 지역사회성폐렴 | 2상 | - |
| AON-S08 | IL-8 inhibitors | N/D | 비임상 | - | |||
| 8 | Basking Biosciences (미국) |
부 | BB-031 | - | 급성 허혈성 뇌졸중 | 2상 | - |
| 9 | Aptahem (스웨덴) |
부 | Apta-1 | Immunostimulants | 패혈증 | 1상 | - |
| 10 | AptaBio (한국) |
부 | Apta-16 | - | 혈액암(급성골수성백혈병) | 1상 | - |
| 11 | Aptamer Sciences (한국) |
부 | AST-201 | - | 간암, 비소세포폐암 | 1상 | - |
| AST-202 | - | 면역항암제, 혈액암 | 비임상 | - | |||
| AST-203 | - | 췌장암 | 비임상 | - | |||
| (출처:당사 제시) |
압타머 기술 기반 승인 신약으로는 Macugen(Pfizer, 2004)과 Izervay(Astellas, 2023) 두 종이 있습니다. Macugen은 FDA 승인된 첫번째 압타머 신약으로 혈관내피성장인자(VEGF)의 선택적 억제제로 습성 연령관련 황반변성(wetAMD) 치료제입니다. 좀더 효과적인 VEGF 억제제의 출시(Lucentis 및 Avastin) 에 따른 매출 감소로 현재는 시장에서 판매중단이 되었습니다. 2023년 두 번째 압타머 신약으로 FDA 승인을 득한 Izervay는 complement protein C5의 억제제로 황반변성 지도모양위축(Geographic atrophy, GA)의 치료제입니다. 매출은 2023년 9월 출시 이후 121억엔(한화 약 1,147억원)으로 연간 예측치를 상회하였고, 2024년 4분기 예상 시장 점유율은 경쟁제품 대비 25%로 추정되고 있습니다.
| [압타머 기반의 FDA 허가 신약] |
 |
|
압타머 FDA 허가 신약 2종 |
| (출처: 당사 제시) |
항체는 항암, 약물전달, 자가면역질환 영역에서 많은 약물개발의 성공사례로 인해 치료제 개발의 대세로 자리잡고 지속적으로 성장하고 있습니다. 그에 따른 교육, 투자, 기술적 인프라도 잘 갖추어져 있습니다. 반면, 압타머는 아직까지는 emerging 기술로 개발경로가 덜 탐색되어 있어 주목도가 낮고, R&D의 투자도 매우 부족한 현실입니다.
새로운 모달리티의 신약 개발 도입과 연구실에서 개발한 기술을 임상으로 연결하는 데는 오랜 시간과 비용이 필요합니다. 상기 언급한 제약으로 인해 압타머가 처음 개발되었을 때 보였던 잠재력을 실현하지 못한 것도 사실입니다. 첫 번째 SELEX 기술 개발 이후 여러 압타머가 선택되어 진단 및 치료 기술 모두에서 성공적으로 적용되었지만, 지금까지 암 치료에 승인된 압타머는 없습니다.
그러나 현재까지도 압타머 산업은 원천 특허 공개 직후 아직 압타머 기반 진단 제품과 신약 제품의 본격적인 출시가 이루어지지 않은 초기 형성 단계의 시장으로서 항체 의약품 등 기타 의약품 시장에 비해 아직 시장 규모가 크지 않으며, 향후 추정치에 대한 실제 시장형성에 대한 불확실성이 존재합니다. 또한 향후 관련 기술 개발 및 상용화가 지연될 경우, 미래 시장의 규모가 예상보다 낮을 수 있습니다. 이러한 경우, 당사의 영업 실적에 부정적인 영향을 미칠 수 있습니다.
| 나. 신약 개발사업의 특성에 따른 위험 신약개발은 후보물질의 발굴에서부터 완제의약품의 시장 판매까지 통상적으로 10년 이상의 긴 시간과 막대한 개발자금이 소요되며, 개발 과정에서 임상시험을 통하여 의약품의 안전성과 효능을 충분히 입증하여야 하는 고비용 고위험군의 산업으로 신약 개발이 성공하게 되면 특허권에 의해 독점 판매권을 보장받을 수 있는 고수익 산업이기도 합니다. 당사는 이러한 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 특히, 또한 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고, 조속한 사업성을 확보하고자 합니다. 하지만 신약개발의 특성상 임상시험 단계에서 예상치 못한 부작용 발생, 효능 입증 실패 등으로 치료제 개발에 실패할 수 있는 위험이 존재하며 이 경우 각 임상 시험 단계에서 기술이전 계약체결에 실패하게 될 수 있습니다. 또한, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인의 연구개발 진행이 지연 또는 중단될 수 있으며, 이로 인해 당사의 성장성 및 수익성에 부정적인 영향을 미칠 수 있습니다. |
신약개발은 후보물질의 발굴에서부터 완제의약품의 시장 판매까지 통상적으로 10년 이상의 긴 시간과 막대한 개발자금이 소요되며, 개발 과정에서 임상시험을 통하여 의약품의 안전성과 효능을 충분히 입증하여야 하는 고비용 고위험군의 산업으로 신약 개발이 성공하게 되면 특허권에 의해 독점 판매권을 보장받을 수 있는 고수익 산업이기도 합니다.
| [압타머 신약 개발 플랫폼] |
 |
|
압타머 신약 개발 플랫폼 |
| (출처 : 당사 제시) |
당사는 압타머 발굴에서부터 최적화 단계를 거쳐 개발 후보물질을 도출하고 이를 임상단계까지 진입시킬 수 있는, 즉 후기 임상을 제외한 신약개발 전주기에 걸친 추진 및 협력 체계를 구축했습니다. 신약 개발 기술 플랫폼인 압타머-약물접합체(ApDC®) 플랫폼을 기반으로 고형암 치료제, 혈액암 치료제 등 혁신 신약을 연구개발하고 있습니다. 그러나 하나의 글로벌 신약 창출을 위해 오랜 시간과 막대한 비용을 투자해야 하며, 성공확률도 매우 낮다는 것이 신약개발의 높은 진입장벽으로 작용합니다.
| [신약 개발 및 승인 프로세스] |
 |
|
신약개발 프로세스 |
| (출처 : 글로벌 제약시장 임상 파이프라인 분석(한국바이오경제연구센터, 2017년)) |
한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이 과정에서는 신약의 효능이나 작용기전을 기반으로 신약개발 대상물질을 선정합니다. 유효물질(hit compound), 선도물질(lead compound)을 거쳐 신약 후보물질이 선정되면 후보물질의 안정성과 효과를 확인하기 위해 동물 모델을 대상으로 전임상시험(pre-clinical trial)을 진행합니다. 전임상시험을 통해 후보물질의 효과와 안전성을 검증하면 규제기관에 임상시험 허가신청(IND : Investigational New Drug Application)을 하고, 사람을 대상으로 약물의 효과의 부작용을 확인하는 임상시험(clinical trial)을 수행합니다. 임상시험을 마친 후에는 규제기관에 임상시험 결과를 제출하게 되는데, 이를 신약 허가신청(NDA : New Drug Application)이라고 합니다.
당사는 이러한 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 또한, 전임상 또는 초기 임상단계에서의 조기 기술이전 또는 이를 전제로 한 공동연구개발 파트너링도 적극적으로 추진하고 있습니다. 특히, 또한 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고, 조속한 사업성을 확보하고자 합니다.
하지만 신약개발의 특성상 임상시험 단계에서 예상치 못한 부작용 발생, 효능 입증 실패 등으로 치료제 개발에 실패할 수 있는 위험이 존재하며 이 경우 각 임상 시험 단계에서 기술이전 계약체결에 실패하게 될 수 있습니다. 또한, 당사가 가진 연구인력, 인프라, 자금 등의 한계로 파이프라인의 연구개발 진행이 지연 또는 중단될 수 있으며, 이로 인해 당사의 성장성 및 수익성에 부정적인 영향을 미칠 수 있습니다.
|
다. 신약 임상시험 실패에 따른 위험 의약품 산업은 국민의 건강과 직결되는 규제산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 등 전 과정을 엄격히 국가에서 규제하고 있습니다. 의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 이러한 단계를 거치는 과정에 각 나라의 엄격한 규제와 지침을 준수해야 하며, 각 임상 단계마다 유의한 실험 결과를 도출하여 약물의 효능과 안정성을 충분히 입증하여야 다음 단계의 임상 진행 및 허가가 가능합니다. |
의약품 산업은 국민의 건강과 직결되는 규제산업으로서 제품의 개발에서 임상시험, 인허가 및 제조, 유통 등 전 과정을 엄격히 국가에서 규제하고 있습니다. 의약품의 개발 단계는 인체에 유효한 후보물질 발굴로 시작하여 동물 실험인 전임상시험을 거쳐 사람 대상의 임상 단계를 통과해야 신약 제조 허가를 득할 수 있습니다. 이러한 단계를 거치는 과정에 한국식품의약품안전처(MFDS) 혹은 미국식품의약국(FDA) 등 각 나라의 엄격한 규제과 지침을 준수해야 합니다. 또한, 각 임상 단계별마다 유의한 실험 결과를 도출하여 약물의 효능과 안전성을 충분히 입증하여야 다음 단계의 임상 시험 진행 및 허가가 가능합니다.
신약개발의 단계는 임상 시험에 진입하기 전 실험실에서 목표 유전자 발견 및 약물 후보물질 발굴로부터 시작됩니다. 특정한 질병의 원인이 되는 목표 단백질 등을 규명하여 약물의타겟으로 정한 후 이에 적합한 치료용 후보 물질을 발굴해야 합니다.
당사가 개발한 ApDC® 신약개발 플랫폼은 신약 표적에 대한 선도물질을 발굴하고 최적화하는 단계를 거쳐 개발 후보 물질을 도출하는 당사 고유의 압타머 신약개발 시스템입니다. 당사 압타머 라이브러리를 통해 결합력이 뛰어난 압타머를 발굴해내는 기술로 일반 신약 개발 프로세스에서 5년에서 7년이 소요되는 과정을 3년 내에 전임상 후보 물질을 발굴하고 있는 기술입니다.
| [당사 운용 압타머 신약 발굴 시스템 및 신약 플랫폼] |
 |
|
압타머 신약 발굴시스템 |
| (출처 : 당사 자료) |
[압타머 신약개발 플랫폼]
| 기술명 | 압타머 기반 신약 개발 기술 (Aptamer Drug Discovery System)
|
|
기술의 목적 |
- 신약 표적에 대한 선도물질을 발굴하고 축적된 노하우를 기반으로 한 최적 단계를 거쳐
개발 후보 물질을 도출하는 당사 고유의 압타머 치료제 개발 시스템 - 일반 치료제 개발 프로세스 5년에서 7년 소요되는 후보물질 도출 과정을 3년 내에 전임상
후보물질 발굴 - ApDC® 항암제와 키메릭 압타머를 포함한 2개의 압타머 복합체(BiFAp) 신약 개발 플랫폼을
운용 |
|
기술의 내용 |
-변형핵산 기반 압타머 아카이브의 다양성으로부터 세포막 수용체 단백질에 대하여 특이적인 선택성과 강한 결합력을 가진 선도물질을 선별하고, 최적화를 통해 약물 가능성
(druggability)을 갖는 전임상 후보 물질을 도출하는 기술 |
|
기술의 경쟁력 |
- 발굴 초기 단계에서부터 압타머의 작용기능 선별을 통한 개발 기간 단축 - 압타머 물성의 경쟁력을 바탕으로 강력한 druggability 확보와 약물전달 전략 확보
- 단계별 최적화 과정을 통해 결과물 보호를 위한 강력한 특허 전략 확보 |
|
기술의 연속성 |
- 기확보된 세포막 수용체에 대한 압타머 서열 아카이브 정보와 선도 물질 선별특화 기술을
기반으로 연속적인 파이프라인 확보 가능 - 압타머 물질 합성 역량 및 기능성 분자 모듈화 도입 전략으로 기술의 연속성 및 확장성
확보 |
압타머는 SELEX(Systematic Evolution of Ligands by EXponential enrichment) 과정을 통해 발굴되며, 그 중심 원리는 무작위적으로 존재하는 핵산 라이브러리 중에서 표적 물질에 대한 결합력이 존재하는 개체들만을 선별하여 그 비중을 높이는 방식입니다. 압타머 발굴 과정은 ① DNA 합성 및 in vitro transcription(RNA인 경우)을 이용하여 다양한 서열을 가지는 핵산 라이브러리 제조(copy 수: 10의14~15승), ② 핵산 구조체 라이브러리 안에 있는 다양한 핵산 구조체들 (압타머 후보 분자들)은 다양한 표적물질과 결합할 수 있는 능력을 가지고 있고 따라서 다음 과정으로 원하는 표적분자와 결합할 수 있는 핵산 구조체만을 선별하는 과정, ③ 결합하지 않은 핵산 구조체는 세척과정을 통해 제거되고 표적분자에 결합하는 것만을 선택적으로 얻는 과정, ④ 마지막으로 표적분자로부터 핵산 구조체를 분리(elution)시키고, ⑤ 그 핵산을 PCR을 통하여 증폭시켜 핵산 선별된 핵산 pool을 얻는 과정으로 이루어져 있습니다. 그리고 이 ②~⑤ 과정들을 8번 정도 반복함으로써 최종적으로 선별된 개체들은 표적 결합력이 매우 높은 특성을 지닙니다.
| [표적 단백질에 특이적으로 결합하는 압타머 발굴 SELEX 모식도] |
 |
|
압타머 SELEX 과정 모식도 |
| (출처 : 당사 제시) |
SELEX 과정을 모니터링할 수 있는 기법으로서 SELEX의 단계 마다 압타머가 잘 선별되고 있는가를 확인하는 것은 최종적으로 성공적인 압타머를 만드는데 매우 중요한 요소 기술입니다. 당사는 실시간 중합효소반응(Real-time PCR)과 Cot assay기법을 통하여 SELEX 공정을 최적화하였습니다.
당사는 SELEX를 위한 핵산 라이브러리 제작과정에서 핵심(core) 염기서열의 수를 40mer까지 확장하고, 라이브러리에 염기 변형체를 도입함으로써 구조적 다양성을 확대하는 한편, 표적 단백질의 소수성 부위와의 상호작용을 증가시키고, SELEX 과정에 음전하 경쟁자(Dextran sulfate)를 도입하여 핵산의 음전하에 의한 비특이적 결합을 최소화하였습니다. 이를 통해서 표적 단백질에 대한 압타머 발굴 효율을 높이고, 표적 특이성과 결합력이 우수한 압타머를 발굴하고 있습니다.
| [변형핵산을 이용한 압타머 발굴] |
 |
|
변형핵산을 이용한 압타머 발굴 |
| (출처 : 당사 제시) |
표적 단백질에 대해 SELEX 선별 라운드를 8회 반복 진행하여 표적 단백질에 특이적으로 결합하는 압타머 pool을 얻고, 이후 차세대 염기서열 분석(Next Generation Sequencing)법을 통해 pool 내 클론(clone)들의 염기서열을 분석합니다.
NGS 분석결과를 바탕으로 압타머 core 부분의 염기서열을 기준으로 서열이 유사한 압타머들끼리 그룹을 지어 분류하고(sequence alignment), 염기서열이 서로 간에 상이하며 pool내에 다수 존재하는 압타머를 선별합니다. 당사에서는 이러한 SELEX 과정을 통해 GPC3, CD25, Trop2, PD-L1, EGFR 등 약 230종의 표적단백질에 대한 압타머를 발굴하였고, 각 압타머들의 표적결합, 세포결합, 표적활성에 미치는 영향 등의 연구를 통해 표적 특이성을 입증하고 있습니다.
[압타머 기술 한계점 극복 방안]
앞서 기술된 ApDC®플랫폼의 특장점 및 차별화 포인트와 당사가 보유한 다양한 세포막 단백질 표적 압타머 라이브러리를 바탕으로 저분자 약물의 표적전달을 통한 ADC의 미충족 과제를 해결할 수 있는 차세대 약물전달 기술의 개발(AST-201, AST-202, AST-203)뿐만 아니라, 면역활성화 분자, siRNA나 ASO 등의 올리고뉴클레오티드, 펩타이드/단백질, 치료용 방사성핵종의 표적전달 등 다양한 유형의 ApDC®개발로 플랫폼의 적용 영역을 확대하고 있습니다.
실제 3차원으로 배양된 종양 spheroid에서 항체 대비 최대 6.7배 높은 조직침투율을 보였으며, 종양동물모델을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 또한 ApDC® 플랫폼에는 당사가 자체적으로 개발해 특허출원한 분지형 링커(BLinker)-페이로드가 적용되는데, 이를 통해 압타머에 탑재할 수 있는 약물의 수를 증가시킬 수 있을 뿐만 아니라, 컨주게이트의 양친매성을 극대화해 자가중합을 통한 구형 나노미셀(spherical nanomicelle)을 형성합니다. 실제 BLinker를 적용해 제작된 압타머-약물 컨주게이트는 높은 혈장 안정성을 보여 탑재된 약물의 혈액 내 방출을 최소화할 수 있었으며, 이에 따른 약동력학적 프로파일이 크게 개선되었음이 실험적으로 증명되었습니다. 또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다.
| [ApDC® 플랫폼의 차별성] |
 |
|
ApDC® 플랫폼의 차별성 |
| (출처 : 당사 제시) |
그 이후의 본격적인 임상시험(Clinical Trial)은 크게 전임상과 임상으로 구분되며, 임상은 신약 시판 허가 전 3단계와 시판 후 임상시험까지를 포함해 총 4단계로 나눌 수 있습니다. 전임상 시험은 기초탐색 과정을 거쳐 도출된 신약 후보물질에 대해 동물을 대상으로 실시하는 단계로, 후보물질의 효능보다는 안전성을 위주로 진행됩니다. 그 다음 임상1상 시험은 실제 사람에게도 투여해 부작용이 없는지 안전성을 처음으로 확인하는 단계입니다. 임상2상 시험은 1상을 통해 안전성이 확인된 후보물질의 효능을 본격적으로 알아보는 단계로, 대상질환 가운데 조건에 부합하는 환자를 대상으로 단기 투약에 따른 부작용 및 예상 적응증에 대한 효과를 탐색하게 됩니다. 임상3상 시험은 신약허가를 받기 위한 최종 단계로, 치료대상이 되는 질병에 대한 시험약의 유효성과 안전성에 대해 통계적인 검증을 통해약물에 대한 최종평가를 내립니다. 마지막 임상 4상은 신약허가를 받고 시판을 시작한 이후 추가적인 적응증이나 부작용 등을 검사하기 위해 이뤄지는 시험입니다.
|
[임상 평가 단계] |
|
구분 |
피험자수 |
검토사항 |
목적 |
|---|---|---|---|
|
제1상 |
비교적 건강한 사람 대상 20~100명 |
주로 안전성 |
- 안전 용량 범위 확인 |
|
제2상 |
통상 100-200여명의 환자 대상(질환에 따라 상이) |
단기 유효성 및 안전성 검토 |
- 약효 입증 |
|
제3상 |
수백~수천명 환자 |
안전성 확립 및 유효성 재확인 |
- 충분한 환자에서 유효성 및 안전성 확립 |
|
제4상 |
- |
- 약물의 유해반응(부작용) 빈도에 대한 추가 정보 획득(시판 후 안전성 조사, Post Marketing Surveillance) |
|
| (출처 : 당사 자료) |
이러한 각 임상 단계별 성공률은 단계마다 상이하며, 최종 허가 승인까지의 성공 확률은 약 8% 정도로 조사되었습니다. 각 임상단계별로는 임상1상은 52.0%, 임상2상은 28.9%, 임상3상은 57.8%로 나타났습니다. 당사의 사업 계획은 전임상 혹은 1상에서 2상 초기 단계 전후로 공동개발 및 기술이전하는 것이 목표이기 때문에 임상 2상까지의 단계를 진행하는 도중에 실패할 경우 당사에 부정적인 영향을 미칠 수 있습니다. 또한, 기술이전 이후에도 후속 개발결과에 따라 기술이 반환될 위험도 존재합니다.
| [신약개발 성공확률 현황 (미국 FDA, 2011년~2020년] |
| 구분 | 임상1상 | 임상2상 | 임상3상 | NDA/BLA |
| NDA/BLA(까지) | 7.9% | 15.1% | 52.4% | 90.6% |
| 차상위단계(까지) | 52.0% | 28.9% | 57.8% | 90.6% |
| 소요기간 | 2.3년 | 3.6년 | 3.3년 | 1.3년 |
|
(출처 : Clinical Development Success Rates and Contributing Factors 2011-2020(2021)) 주2) BLA(Biologic License Application) : 바이오의약품의 신약 승인단계 |
2상까지의 임상 단계를 거치면서 전임상 단계에서의 안전성 및 효능 검증과 각 임상 단계에서의 부작용과 효능에 대한 검증을 모두 통과해야만 최종 허가를 득할 수 있습니다. 그렇기 때문에 전 단계에서 유효한 결과를 얻었다 하더라도 각 임상 단계에서 유효성이나 안전성 입증이 미흡하면 임상 실패의 위험이 존재합니다.
당사가 개발 진행 중인 파이프라인들도 관련 규정에서 정한 임상 단계를 성공적으로 수행하여야 하며 향후 당사의 신약 파이프라인 임상 계획은 다음과 같습니다. 그러나 이러한 임상 계획에도 불구하고 임상 초기 단계에서 안전성 혹은 효능 이슈가 발생되어 추가 개발이 불가해지거나 유효성 입증에 실패할 수 있습니다.
|
[당사 신약 파이프라인 임상진행 계획] |
|
파이프라인 |
표적질병 |
개발단계 |
임상 진행 계획 |
|
AST-201 |
고형암 (간세포암, 비소세포폐암, 췌담도암) |
임상1상 | - 2024년 1분기 식약처 IND 승인신청(공시) - 2024년 4분기 식약처 IND 승인(예상), 4분기 국내 다기관임상 시작 - 2025~26년 PoC 데이터 입고 - 2027년 최종결과보고서 수령 |
| AST-202 (면역항암제/혈액암치료제) |
혈액암 (림프종, 백혈병) |
전임상 | - 2024~26년 전임상 시험 - 2027년 임상1상 진입 |
|
AST-203 (고형암 치료제) |
고형암 (췌장암, 비소세포폐암) |
전임상 | - 2025~26년 전임상 시험 - 2027년 임상1상 진입 |
| (출처 : 당사 자료) |
[파이프라인별 구체적인 계획]
당사의 신약개발 사업은 압타머를 기반으로 한 약물전달 플랫폼(Aptamer-drug conjugate)를 바탕으로 표적 약물전달을 할 수 있는 항암 신약개발에 초점을 맞추고 있습니다. 주요 신약개발 파이프라인과 진행현황은 다음과 같습니다.
| [ApDC 파이프라인별 진행 현황] |
| 파이프라인 |
약물유형 |
표적 |
적응증 |
약물 대 압타머 비율 (DApR, 주1) | 약물 (Payload, 주2) |
접합 방식 (주3) |
진행단계 |
임상수행국가 |
누적투자비용(백만원, 주4) |
| AST-201 | Drug incorporate | GPC3 |
고형암 (간암, 폐암)
|
3 | 젬시타빈 | ApDC 내재화 | IND 신청
|
한국 |
13,270 |
| AST-202 | Drug conjugate | CD25 |
혈액암 (T세포 림프종, 급성골수성 백혈병)
|
3 | MMAE | BLinker(분지형 링커) | 전임상 |
- | 641 |
| AST-203 | Drug conjugate | Trop2 |
고형암 (췌장암, 폐암)
|
3 | MMAE | BLinker(분지형 링커) | 전임상 |
- | - |
| (출처 : 당사 제시) (주1) ADC 및 ApDC를 평가하는 데 사용되는 중요한 매개변수 중 하나로, 약물 대 항체/압타머 비율을 가리킵니다. 이는 ADC 및 ApDC의 효능과 치료 지수를 결정하며, 이 단계를 제어하는 것은 ADC 및 ApDC의 품질에 중요합니다. 1세대 ADC의 약물 결합 방식은 항체와 약물 간의 비율을 정확하게 조절하지 못하여 약물 대 항체의 평균 비율에 맞춰 약물이 생산 및 정제됩니다. 이로 인해 치료 효과의 불균형과 부작용 발생 가능성이 증가할 수 있으며, 품질관리가 어렵습니다. 2세대 ADC는 항체의 특정 위치에 약물을 선택적으로 결합시켜 약물 대 항체 비율을 조절하는 다양한 기술이 적용되고 있습니다. (주2) 약물(payload)은 항암작용을 하는 독성물질로 미세소관 파괴 약물과 DNA 변형 약물이 주로 사용됩니다. ADC의 경우 항체, ApDC의 경우 압타머에 의해 암세포 표면의 표적 항원에 결합한 후 세포 내로 유입되며, 항체 또는 압타머는 세포 소기관인 리소좀(Lysosome)에서 분해되고 페이로드는 세포질로 방출되어 약물의 표적에 작용함으로써 암세포를 사멸시킵니다. 초기 ADC에는 DM-1, DM-4 등이 사용되었으며, 이후에는 MMAE, MMAF 등이 적용되었습니다. 최근에는 신규 페이로드를 적용하기 위한 시도가 활발하게 이루어지고 있습니다. (주3) 링커는 항체와 약물을 연결하는 역할을 하며, 접합 방식에 따라 cleavable linker와 non-cleavable linker로 구분됩니다. non-cleavable linker는 혈중에서 분해되지 않아 안정적이라는 장점이 있으나, 리소좀에 의해 분해되지 않으면 작용이 일어나지 않는다는 단점이 있습니다. Cleavable linker는 암세포의 pH, 효소 등에 의해 절단됩니다. 당사의 BLinker 기술은 효소에 의한 cleavage linker의 일종입니다. (주4) 상기 누적투자비용은 연구원 인건비와 회사의 판관비를 제외하고 해당 파이프라인에 사용된 직접비를 기준으로 하였습니다. 총 개발 비용은 현 시점에서 산정하기 어려우나, 국내 ADC 개발기업인 리가켐바이오(2024)에서도 임상 1~2상 진입 파이프라인 5개 이상의 개발에 예산 5000~6000억원을 편성한 바 있습니다. 이처럼 치료 범주, 임상 단계, 임상 국가 등에 따라 차이가 있겠으나, 기본적으로 ADC를 비롯한 ApDC의 개발에는 수백억 규모가 드는 것으로 볼 수 있습니다. |
1) 고형암 치료제
AST-201
| 구분 |
표적 약물전달 항암제 |
| 적응증 |
고형암(GPC3-양성) 주요 암종: 간암(HCC), 폐암(NSCLC) |
| 작용기전 |
종양 표면 GPC3 결합과 그에 따른 세포 내재화, 리소좀에서의 분해를 통해 활성 젬시타빈 방출 |
| 제품특성 |
-
간암을 포함한 GPC3-양성 종양에 선택적인 약물전달
-
젬시타빈을 압타머 서열 내에 내재화함으로써 (1) 젬시타빈에 대한 종양 약물 내성 기전 극복, (2) 제조공정 및 CMC의 단순화
-
압타머의 높은 조직 투과력과 신장을 통한 신속한 배출로 부작용 최소화 및 넓은 치료용량계수 확보 기대
-
면역항암제와의 병용 시너지 효과 기대
|
| 진행경과 |
-
임상용 원료 및 완제의약품 GMP 생산완료
-
전임상 GLP 독성시험(설치류, 비설치류) 완료
-
IND 신청완료(MFDS)
|
| 향후계획 |
-
임상1a/b상 시험개시(2024. 4Q), 국내 4개 site
|
| 경쟁제품 |
-
Sorafenib, Lenvatinib, Atezolizumab/bevacizumab |
| 관련논문등 |
-
YL Cho et al. Pharmaceutics, 2020, 12, 985 -
글리피칸3 특이적 압타머 복합체 및 이의 용도
- 대한민국 특허등록(2020): 10-2154683 - PCT 출원(2020): PCT/KR2020/015536
- 중국 특허등록 결정, 미국/유럽/일본 심사 중 |
| 시장규모 |
글로벌 간암치료제 시장은 2019년 기준 17.3억 달러에서 CAGR 20.2%로 성장하여 2027년까지 73.8억 달러 시장 예상 (출처: Fortune Business Insight 시장보고서) |
AST-201은 종양 특이적으로 발현하는 글리피칸3(GPC3)를 표적으로 하는 표적 항암치료제입니다. GPC3 특이적인 압타머에 항암제인 젬시타빈(gemcitabine)을 내재화한 형태로, 별도의 약물접합 과정없이 압타머 합성과정에서 서열 내에 내재화하여 종양의 젬시타빈 약물저항성 기전을 회피하면서 효과적으로 약물이 표적으로 전달되도록 디자인되었습니다.
GPC3는 간암(HCC, >70%), 비소세포폐암(NSCLC, >50%) 등에서 과발현이 보고되어 있고 성인의 정상세포에서의 조직별 발현은 없는 것으로 알려져 있습니다. 특히 간암에서는 전암성 병변(간경화)과 간암을 효과적으로 구분할 수 있는 바이오마커로 GPC3 발현 정도와 생존율 및 예후 간의 상관관계가 높은 것으로도 보고되고 있습니다. 특히, 최근 연구결과에 따르면 GPC3 발현이 높을수록 간암 1차 치료제인 아테졸리주맙-베바시주맙 병용요법의 임상 반응률이 현저히 떨어지는 것으로 보고되면서 GPC3는 간암치료제 개발에서 매우 중요한 표적으로 부각되고 있고, 항체 및 CAR-T 세포치료제 등 다양한 치료제 개발의 핵심 표적이 되고 있습니다.
AST-201은 GPC3-양성 종양에 선택적으로 결합하여 수용체-매개 내포작용(receptor-mediated endocytosis)를 통해 세포 내로 들어갑니다. 이후, 세포 내 분해소기관인 리소좀으로 이동하여 분해되면서 탑재되어 있던 젬시타빈을 세포 내로 방출하고 방출된 젬시타빈은 핵으로 이동해 DNA합성을 저해함으로써 종양세포를 죽이게 됩니다.
이러한 기본적인 약물전달 과정과 더불어 앞서 기술한 바와 같이 젬시타빈 내성과 관련된 주요 작용들에 대한 극복 기전 또한 규명되었습니다. 잘 알려진 전신투여 항암제인 젬시타빈은 종양의 젬시타빈 특이적 약물저항 기작으로 인해 여타 화학항암제와 마찬가지로 사용에 제한을 받고 있습니다. 주요 저항 기전으로는 ① CDA(cytidine deaminase)에 의한 젬시타빈 비활성화, ② NT(nucleoside transporter)의 변이로 인한 약물유입 저해, ③ 세포 내 dCK(deoxycytidine kinase)에 의한 젬시타빈 활성화의 속도저해가 있습니다. AST-201은 젬시타빈을 압타머 서열내에 직접 내재화함으로써 3가지 주요 저항 기전들로부터 보호되고 일부 경로를 우회할 수 있도록 설계되어 젬시타빈의 약물활성을 담보할 수 있습니다.
| [AST-201 작용 기전 및 장단점] |
 |
|
AST-201 작용기전 |
| 강점 | 한계 |
|
1)
전암성 병변인 간염, 간경화를 구분할 수 있는 선택성 높은 표적에 대한 약물전달 치료제
2) 젬시타빈에 대한 종양 저항성 기전 극복
3)
체내 물질대사의 핵심장기이나 종양으로 인해 약화된 간조직으로 인해 높은 potency의 항암제의 적용이 어려움. AST-201은 상대적으로 potency가 약한 젬시타빈을 표적 전달함으로써 간조직의 부담을 줄일 수 있는 약물전달치료제
4) 별도의 약물접합 과정이 배재되고 약물이 내재된 형태로 만들어지는 제조공정
|
1)
젬시타빈 자체의 potency 한계로 인해 AST-201의 높은 투여용량
2)
단독요법의 효능 한계 가능성 및 그에 따른 면역항암제 병용투여 필요성
3)
간암, 폐암 등 일부 암종에 제한된 적응증
|
| (출처 : 당사 자료) |
2) 면역항암제/혈액암 치료제 AST-202
| 구분 |
표적 약물전달 항암제 |
| 적응증 |
혈액암(CD25-양성) 주요 암종: T 세포 림프종(TCL), 급성골수성 백혈병(AML) |
| 작용기전 |
-
종양 표면 CD25 결합과 그에 따른 세포 내재화, 리소좀에서의 분해를 통해 세포분열 억제 약물인 MMAE 방출
-
종양 주변 환경 내 비율이 높은 종양면역억제 세포인 Treg의 선택적 불활성화 및 사멸
|
| 제품특성 |
-
CD25 선택적 압타머-약물 접합체
-
CD25-양성 세포 선택적 사멸 유도
-
BLlinker(분지형 링커기술, 특허출원) 활용한 다수의 약물도입으로 개선된 안정성 및 약동력학적 프로파일, 향상된 유효성
-
낮은 혈액학적 부작용(경쟁 ADC 대비 안전)
-
선택적 Treg 불활성화와 사멸 유도 및 이를 통한 항종양 면역 활성 증대
-
신속한 종양 표적화와 투과성, 빠른 체내 배출 특성을 활용함으로써 장기적인 Treg 소실로 인한 자가면역 등 부작용 및 비특이적 독성 최소화
-
높은 종양조직 투과성 및 빠른 종양세포 내재화률
-
면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대
|
| 진행경과 |
-
혈액암 동물모델에서의 종양성장 억제 및 완전관해 효과 확인
-
혈액암 동물모델 생존률 평가에서 대조군 대비 AST-202 투여군의 월등히 우수한 생존률 확인
-
ELOHA assay 기반 생체시료분석법 개발 완료
-
In vitro 대사안정성 및 설치류 렛트 PK 분석 완료
|
| 향후계획 |
-
In vivo 효능평가(추가 혈액암, 경쟁약물 비교 평가, 고형암, 단독투여 및 면역관문억제제 병용투여)
-
CMC 공정개발 및 전임상 GLP 독성 평가(2025)
|
| 경쟁제품 |
-
CD25 표적 치료제 약물 없음
-
개발 중인 파이프라인: ADC therapeutics의 ADCT-301(ADC, 임상2상)
-
혈액암 ADC: Adcetris (brentuximab vedotin)
|
| 관련논문등 |
-
JH Kang et al. AACR, 2022 -
D Lee et al. SITC, 2023 -
CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용
- 대한민국 특허 출원(2023): 10-2023-0149904 - PCT 출원(2023): PCT/KR2023/017344
|
| 시장규모 |
- 글로벌 면역항암제 시장 2023년 기준 7300억 원, 4년새 3배 성장(출처: IQVIA 시장보고서)
-
글로벌 비호지킨림프종 시장은 2022년 73억 달러, CAGR 8.2%, 2030년 135억 달러 예상(출처: DataM Intelligence 시장보고서)
-
글로벌 급성골수성백혈병 시장은 2023~2030년 CAGR 11.3% 성장(출처: Data Bridge Market Research 시장보고서)
-
혈액암 치료제 ADC인 Adcetris의 연간 매출은 2022년 기준 14.8억 달러(출처: Biopharma PEG article)
|
| 기타 |
-
국가신약개발사업 신약기반 확충 연구과제 수행
|
AST-202는 T세포 림프종, 급성골수성백혈병에서 특징적으로 과발현되는 CD25 단백질을 표적으로 하는 ApDC
®입니다. CD25-양성세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술(BLinker)을 적용 압타머에 3개의 약물이 접합되도록 설계되어 약효가 개선됨과 더불어 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
CD25는 IL-2 수용체의 구성 단백질로 IL-2alpha로도 알려져 있습니다. 면역조절세포인 조절T세포(regulatory T cell, Treg)에 높게 발현되어 있어 Treg 활성에 관여하는 단백질입니다. 더불어 다양한 혈액암에서도 과발현이 되어 있으며, 특히 T 세포 림프종과 급성골수성 백혈병에서 높은 발현이 관찰었고, 해당 암의 예후 및 재발과 밀접한 관련이 있는 것으로 보고되고 있습니다.
AST-202는 CD25-양성 종양에 선택적으로 결합하여 수용체-매개 내포작용(receptor-mediated endocytosis)를 통해 세포 내로 들어갑니다. 이후, 세포 내 분해소기관인 리소좀으로 이동하여 효소분해 특이적인 링커부분이 잘리면서 세포분열 억제약물 MMAE가 방출됩니다. 방출된 MMAE는 직접 전달된 세포의 사멸을 유도할 뿐만 아니라, 세포막을 통해 이동하여 주변 세포까지 분열억제 및 사멸 효과를 보입니다. 이러한 효과를 바이스탠더 효과(bystander effect)라 하고 이종(異種)의 세포들로 구성된 종양의 보다 효과적인 제거를 유도할 수 있습니다.
| [AST-202의 작용 기전] |
 |
|
AST-202 작용기전 |
| (출처 : 당사 자료) |
국가신약개발과제 연구 수행을 통해 표적과의 높은 특이성과 빠른 세포 내재화 속도가 규명되었고, 당사 고유의 분지형 링커(Blinker)를 이용하여 압타머-약물 비율 조절하는 등 물질 자체의 최적화가 완료되었습니다. In-vitro에서 우수한 표적 결합, 약물전달 및 CD25-양성인 종양세포 및 조절 T 세포(Treg)의 선택적 depletion의 효과를 확인하였습니다. 또한, 1차적으로 혈액암의 동물모델에서 진행된 유효성 평가에서 주2회/2주 투약만으로 종양이 완전히 사라지는 용량군을 확인했으며, 투약 중단 이후 회복기간에도 종양 재성장이 관찰되지않는 우수한 효과가 확인되었습니다. 추가적인 시험을 통해 종양성장억제 효과의 최소 유효용량, 투여빈도 등을 확인하였습니다. 종양모델에서의 생존률 시험에서도 AST-202 투여군의 생존률이 극적으로 개선되는 효과가 확인되었습니다. 해당 연구결과는 미국암연구학회 연례학술대회(AACR 2023) 초록발표, 미국면역항암학회(SITC 2023)에서 포스터발표를 통해 공개된 바 있습니다.
현재는 후보물질을 확정하고 전임상 진입단계에 있습니다. 압타머의 예비독성 평가에서 hERG 시험/복귀돌연변이 시험/염색체이상반응 시험에서 모두 음성의 결과를 얻어 심장 및 유전독성의 가능성이 매우 낮은 물질임을 확인했습니다. 또한, 자체 개발한 ELOHA 시험법의 생체시료분석법이 개발되었고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)가 완료되었습니다. 더불어, 추가적인 혈액암 동물모델 평가를 통해 독성대비 유효용량범위 평가, 비교약물(Adcetris) 대비 효능 평가 등을 위한 시험이 진행 중에 있습니다.
| [비임상 시험에서 확인한 AST-202의 유효성] |
 |
|
AST-202의 in vivo 유효성 |
| (출처 : 당사 자료) |
| [AST-202의 세부개발 일정] |
| 예상 시기 | 2024년 | 2025년 | 2026년 | 2027년 |
| 개발단계 |
후보물질 |
전임상 |
임상 1상 |
|
| 세부개발 항목 |
압타머 화학적 최적화
압타머-약물 conjugation
In vivo 유효성 평가
예비 독성 평가
|
약리연구
CMC 연구
임상시험 계획수립 및 자료작
성
|
||
| 단계별 목표 (주요 매개변수) |
후보물질 확정 - 후보물질군 확보 - 작용기전 규명 - In vitro 활성 및 in vivo 유효성 확인 - In vivo PK 충족 - 예비독성(안전성 확인, hERG, 유전독성, 단회독성) - 물리화학적 특성 파악 및 합성공정 확보 |
IND 승인 - 유효성평가 - Non-GLP와 GLP 독성평가(STD10 설정) - 흡수/분포/대사/배출 분석결과 확보 - 비임상시료생산/원료의약품/완제의약품 GMP 생산완료 |
임상진입 - 안전성, 내약성 평가 - 약동학적 특성 평가 - 약력학적 특성 평가 |
|
| 현재 진행현황 |
후보물질 확정 약물의 항종양 유효성은 확인됨 약물 차별화 포인트 확보를 위한 추가적인 in vivo 모델 평가 계획 |
|||
| (출처 : 당사 자료) |
앞서 언급한 여러 가능성에도 불구하고 현 시점에는 다음과 같은 한계점이 존재합니다.
① In vitro 조직배양에서 확인된 종양투과성과 이소이종 종양이식 모델에서 확인된 항종양 효과가 실제 복잡한 in vivo 종양 미세환경(특히, 항체 기반 면역항암제의 효과가 성공적이지 못한 췌장암, 대장암 등의 종양조직) 내에서의 재현여부
②
혈구세포들에 대한 in vitro 독성 평가에서는 ADC 대비 안전함을 확인했으나, 기타 주요 조직별 비특이적인 부작용에 대한 불확실성. 추후 독성연구 등을 통해 규명
③ 압타머를 기반으로 한 새로운 표적 약물전달 플랫폼으로서 표적결합 및 약물전달의 표준 기술로 많은 임상적 결과들이 축적된 항체와의 경쟁
3) 고형암 치료제 AST-203
| 구분 |
표적 약물전달 항암제 |
| 적응증 |
고형암(Trop2-양성) 주요 암종: 췌장암, 폐암, 유방암 |
| 작용기전 |
-
종양 표면 Trop2 결합과 그에 따른 세포 내재화, 리소좀에서의 분해를 통해 세포분열 억제 약물인 MMAE 방출
-
Bystander 효과
|
| 제품특성 |
-
Trop2 선택적 압타머-약물 접합체
-
Trop2-양성세포 선택적 사멸 유도
-
BLlinker(분지형 링커기술, 특허출원)를 활용한 다수의 약물도입으로 개선된 안정성 및 약동력학적 프로파일, 향상된 유효성
-
낮은 혈액학적 부작용 (경쟁 ADC 대비 안전)
-
신속한 종양 표적화와 투과성, 빠른 체내 배출 특성을 활용함으로써 항종양 효과는 높이고, 장기적인 약물의 노출을 최소화하여 용량제한독성을 개선하고 넓은 치료용량계수 확보
-
높은 종양조직 투과성 및 빠른 종양세포 내재화률
-
면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대
|
| 진행경과 |
-
Trop2 압타머의 표적 선택성, 세포 선택성 확인
-
ApDC®의 최적화 및 in vitro 활성/기전 평가 완료
-
3차원 종양배양 조건에서 ApDC®의 항체대비 우수한 투과성 및 그에 따른 종양사멸 효과 확인
-
microPET 분석을 통한 동물모델에서의 종양 표적화 및 전반적인 조직분포 확인
-
췌장암 동물모델에서의 경쟁약물 ADC인 Trodelvy 대비 우수한 종양성장 억제 효과 확인
|
| 향후계획 |
-
In vivo 효능평가(비소세포 폐암 모델, 동소이식 췌장암 모델)
-
ApDC®의 물리화학적 특성, 생체시료분석법 개발, 약동력학적 분석
-
비임상 후보물질 확보(2025. 1Q)
|
| 경쟁제품 |
-
Trodelvy(Trop2 ADC, FDA 승인): 삼중음성 유방암 치료제로 승인받은 이후 지속적으로 적응증 확장(폐암, 요로상피암 등) 중
-
개발 중인 파이프라인: Daiichi Sankyo의 DS1062(Trop2 ADC, 임상3상), 리가켐의 LCB84(Trop2 ADC, 전임상)
|
| 관련논문등 |
-
치료용 담체로서 항 Trop2 압타머
- 대한민국 특허 출원(2024): 10-2024-0093233 |
| 시장규모 |
-
글로벌 ADC 시장은 2023년 기준 100억 달러 상회(출처: Biopharma PEG article)
-
Trodelvy 단일 품목의 연 기준 2023 매출은 11억 달러(출처: Gilead Sciences 2023 운영보고서)
|
AST-203은 다양한 암종에서 과발현되어 있고, 특히 최근 가장 주목받고 있는 ADC 표적인 Trop2 단백질을 표적으로 하는 ApDC
®입니다. Trop2-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 신속한 세포사멸을 유도합니다.
당사 고유의 분지형 링커(Blinker)기술을 적용 압타머에 3개의 약물이 접합되도록 설계되어 약효가 개선되었고 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다. 더불어, 3차원으로 배양된 Trop2-양성 종양 스페로이드(spheroid)에서 항체 대비 최대 6.7배 높은 조직침투율을 보였으며, Trop2-양성 종양 동물모델(췌장암)을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 더욱이 동일 표적에 대한 승인된 ADC인 트로델비(Trodelvy)와 동물모델에서의 효능비교 실험에서 상대적으로 우수한 종양성장 억제효과가 관찰되었습니다.
또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다.
앞서 기술한 바와 같이 Trop2는 ADC 개발이 활발히 이루어지고 있는 표적입니다. 기 승인된 트로델비를 비롯해 다이이찌산쿄의 DS-1062, 머크의 MK-2870 등이 후기 임상을 마쳤거나 진행 중인 만큼 많은 주목을 받고 있는 종양 바이오마커입니다.
당사가 목표로 하는 주요 적응증으로는 Trop2-발현이 높으나 ADC 치료제 개발의 난항을 겪고 있는 췌장암과 비소세포폐암입니다. ApDC가 보이는 우수한 종양침투능, 상대적으로 낮은 부작용 가능성 등은 ADC 개발이 어려운 난치성 암에 대한 미충족 수요를 해결할 수 있는 대안이 될 수 있을 것입니다.
AST-203의 기본적인 작용기전은 상기 기술된 다른 ApDC와 유사한 기전을 따릅니다. Trop2-양성 종양에 선택적으로 결합하여 수용체-매개 내포작용(receptor-mediated endocytosis)를 통해 세포 내로 들어가 세포 내 분해소기관인 리소좀으로 이동하여 효소분해 특이적인 링커부분이 잘리면서 세포분열 억제약물 MMAE가 방출되어 세포사멸을 유도하고, 바이스탠더 효과(bystandereffect)도 확인되었습니다.
물질 최적화 과정을 거쳐 현재는 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 다양한 모델에서의 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법이 개발되었고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다.
1차적으로 췌장암의 동물모델에서 진행된 유효성 평가에서 용량의존적인 항종양 효과가 확인되었으며, 비교약물로 사용된 동일 표적의 기 승인 ADC인 트로델비와의 효능비교에서도 상대적으로 우수한 항종양 효과를 확인하였습니다
| [비임상 시험에서 확인한 AST-203의 유효성] |
 |
|
AST-203의 in vivo 유효성 |
| (출처 : 당사 자료) |
| [AST-203의 세부개발 일정] |
| 예상 시기 | 2024년 | 2025년 | 2026년 | 2027년 |
| 개발단계 |
후보물질 |
전임상 |
임상 1상 |
|
| 세부개발 항목 |
압타머 화학적 최적화
압타머-약물 conjugation
In vivo 유효성 평가
예비 독성 평가
|
약리연구
CMC 연구
임상시험 계획수립 및 자료작
성
|
||
| 단계별 목표 (주요 매개변수) |
후보물질 확정 - 후보물질군 확보 - 작용기전 규명 - In vitro 활성 및 in vivo 유효성 확인 - In vivo PK 충족 - 예비독성(안전성 확인, hERG, 유전독성, 단회독성) - 물리화학적 특성 파악 및 합성공정 확보 |
IND 승인 - 유효성평가 - Non-GLP와 GLP 독성평가(STD10 설정) - 흡수/분포/대사/배출 분석결과 확보 - 비임상시료생산/원료의약품/완제의약품 GMP 생산완료 |
임상진입 - 안전성, 내약성 평가 - 약동학적 특성 평가 - 약력학적 특성 평가 |
|
| 현재 진행현황 |
후보물질 확정 약물의 항종양 유효성은 확인됨 약물 차별화 포인트 확보를 위한 추가적인 in vivo 모델 평가 계획 |
|||
| (출처 : 당사 자료) |
앞서 언급한 여러 가능성에도 불구하고 현 시점에는 다음과 같은 한계점이 존재합니다.
①
In vitro 조직배양에서 확인된 종양투과성과 이소이종 종양이식 모델에서 확인된 항종양 효과가 실제 복잡한 in vivo 종양 미세환경(특히, 항체 기반 면역항암제의 효과가 성공적이지 못한 췌장암, 대장암 등의 종양조직) 내에서의 재현여부
②
혈구세포들에 대한 in vitro 독성 평가에서는 ADC 대비 안전함을 확인했으나, 기타 주요 조직별 비특이적인 부작용에 대한 불확실성. 추후 독성연구 등을 통해 규명
③ 압타머를 기반으로 한 새로운 표적 약물전달 플랫폼으로서 표적결합 및 약물전달의 표준 기술로 많은 임상적 결과들이 축적된 항체와의 경쟁
[기술이전 추진 현황 및 예상 시기]
당사는 2024년 3월 '압타머-약물접합체(ApDC) 고형암 치료제 AST-201의 국내 1상 임상시험 IND 승인 신청'을 진행하고 공시한 바 있습니다. 이에 2024년 4월 식품의약품안전처(MFDS)의 자료보완 요구를 수령하였고, 증권신고서 제출일 현재 보완자료 대응을 계속하고 있습니다. 당사는 자료보완 기한인 2024년 10월까지 자료제출을 완료하고 승인 획득을 목표하고 있습니다.
| [투자판단 관련 주요경영사항(임상시험 계획 승인신청)(2024.03.12.)] |
| 투자 유의사항 | - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. - 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. - 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | 압타머-약물접합체(ApDC) 고형암 치료제 AST-201의 국내 1상 임상시험 IND 승인 신청 | |
| 2. 주요내용 | 1) 임상시험명칭 | GPC3 양성인 진행성 고형암 환자에서 AST-201 투여 시의 내약성, 안전성 및 약동학적 특성을 평가하기 위한 다기관, 공개, 용량 증량 및 확장, 제1상 임상시험 |
| 2) 임상시험단계 | 한국 MFDS 임상시험 제 1상 | |
| 3) 임상시험승인기관 | 한국 식품의약품안전처(MFDS) | |
| 4) 임상시험실시국가 | 한국 | |
| 5) 임상시험실시기관 | 한국 내 4개 병원 | |
| 6) 대상질환 | GPC3 양성인 진행성 고형암 (advanced solid tumor) |
|
| 7) 신청일 | 2024-03-12 | |
| 8) 임상시험목적 | 일차 목적으로 GPC3 양성인 진행성 고형암 환자에서 AST-201 투여 시의 내약성 및 안전성을 평가하여 최대내약용량(MTD)을 확인하고, 제2상 권장용량(RP2D)를 결정하고자 함. 이차 목적으로는 AST-201 투여 시의 약동학적 특성 및 예비 항종양 활성을 평가하기 위함. | |
| 9) 임상시험방법 | - 디자인: 다기관, 공개, 용량 증량 및 확장 1상 임상시험 - 대상자: GPC3 양성 진행성 고형암 환자 - 대상자수: 제1a상 (최대 30명) 제1b상 (1a상 종료 후 결정) - 투여방법: 각 코호트별 정해진 용량으로 각 28일 주기에서 1일, 8일, 15일째에 투여 - 1차 평가: 안전성, 내약성 - 2차 평가: 약동학적 평가, 예비 유효성 평가 |
|
| 10) 임상시험기간 | 임상시험 승인일로부터 36개월 | |
| 11) 목표 시험대상자 수 | 최대 70명 | |
| 3. 사실발생(확인)일 | 2024-03-12 | |
| 4. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 사실발생(확인)은 한국 식품의약품안전처(MFDS)에 임상시험계획 승인 신청을 접수한 날짜입니다. - 추후 임상시험계획 승인 시 관련 공시를 즉시 제출하겠습니다. |
||
| ※ 관련공시 | - | |
| (출처 : 전자공시시스템) |
AST-201은 주요 적응증 간암을 고려하여 간암환자가 많은 중국 기업 대상으로 기술이전을 목표하고 있고, 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안하였습니다. 다만 현재 임상 IND 진입시점이어서 1상 임상결과를 확인한 이후에 판단하겠다는 기업이 대다수입니다. AST-201은 2025년 임상 1a상 POC 데이터를 기반으로 물질의 안전성과 예비 효능이 확인되는 시점에 기술이전 논의가 본격적으로 진행될 것으로 예상됩니다. 회사에서 예상한 바대로, 젬시타빈 허가 용량의 5% 투여시 동등한 치료 효과를 확인하고 내약성도 충분히 입증된다면 그동안 접촉해온 기업들과 기술이전 논의를 빠르게 진전시킬 수 있겠지만, 그렇지 않은 경우에는 1b상 결과확인까지 요구되어 2026년까지 시간이 더 소요될 수 있습니다.
대외변수로 의정갈등으로 인한 대형병원 휴진 등으로 임상시험 다수가 중단 또는 지연되고 있습니다. 한국임상시험참여포털 등에 따르면 지난 2월 20일 전공의 집단사직 이후 4개월간 식품의약품안전처 허가를 받은 임상시험은 총 328건이며, 지난해 같은 기간 428건과 비교해 30% 이상 감소했습니다. 대학병원의 교수진도 파업에 참여하거나 사직하는 경우가 발생하면서 연구윤리심의위원회(IRB) 심사와 대상환자 모집 등 병원내 임상 과정에도 제동이 걸리고 있습니다.
| [의정갈등으로 인한 임상연구 지연] |
 |
|
의정갈등으로 인한 임상연구 지연 보도내역(2024.06) |
| (출처 : 동아사이언스, 2024.06) |
당사는 임상시험의 지연으로 인한 위험에 대응하기 위해 글로벌 임상시험 병행도 고려하고 있습니다. 대상 국가로는 호주를 유력하게 검토하고 있으며, 호주는 AST-201의 목표환자 중 한 군인 폐암환자가 많이 있으며 다양한 인종이 분포하여 환자모집에 적합할 것으로 판단하였습니다.
후속 파이프라인인 AST-202 및 AST-203은 전임상 및 CMC 결과에 따라 임상 진입 시기를 결정할 수 있습니다. 전임상 단계에서 구체적인 효능과 안전성 지표를 확인하여 임상진입 전인 2025~26년 중 기술이전을 추진하는 것을 우선하나, 공동개발 파트너를 찾지 못할 경우 시장성을 검토하여 자체적으로 임상 1상에 진입하는 방안도 고려할 것입니다. 하지만 전임상 단계에서 기술이전에 충분한 데이터를 확보할 수 있을지 여부가 불분명하고, 객관적인 근거자료를 확보하는 외부 CRO 및 CMO의 역량과 난이도에 따라 계약 시기는 지연될 수 있습니다.
상기와 같이 당사는 간암 치료제(AST-201) 및 혈액암 치료제(AST-202) 등의 신약 파이프라인을 개발 중이나, 신고서 제출일 현재 당사가 체결한 라이센스 아웃(License-Out) 계약 사항은 없습니다. 이러한 임상 계획에도 불구하고 임상 초기 단계에서 안전성 이슈가 발생되어 추가 개발이 불가해지거나 유효성 입증에 실패할 수 있으며, 이는 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
| 라. 기술이전 지연 및 실패에 따른 위험 당사와 같은 바이오벤처는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 분산하기 위하여 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 구축하고 있습니다. 국내외 대형 제약사 또한 대규모 개발비용을 감수하고 성공확률이 높은 약제로의 선택과 집중을 통해 최상의 결과를 얻고자 내외부의 파이프라인을 다양화해 연구개발하는 전략을 취하고 있습니다. 당사는 전임상 또는 임상 초기 단계에서 각 적응증에 전문성을 가진 국내외 제약 및 바이오 회사와의 기술이전을 통해 시장의 미충족 수요 및 허가기관의 규정에 최적화된 임상을 설계 및 수행하여 시판 허가 가능성 및 매출을 극대화하고, 여기서 발생하는 마일스톤과 로열티를 통해 추가적인 연구를 위한 탄탄한 자금 구조를 확보하는 사업모델을 추구하고 있습니다. 항암제를 포함해 플랫폼 기반 신약개발에 니즈를 가진 다수의 제약 및 바이오 회사와 기술 이전에 대한 활발한 논의 또한 진행 중에 있습니다. 현재는 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 추가적인 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법을 개발하였고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다. 압타머 기술 개발사 및 기술이전 사례는 전세계적으로 많지 않으며, 기술이전의 대표적인 사례는 Gilead Sciences, Inc.의 Macugen L/O이고, 압타머 기술개발사 M&A 사례는 아이베릭바이오(Iveric Bio) M&A이 대표적입니다. 당사는 2024년 1월 이후로 총 6건의 비밀유지계약을 체결하고 기술검토를 진행중이나, 현재까지 계약체결이 이루어진 사실은 없습니다. 그러나 상기와 같은 당사의 노력에도 불구하고 글로벌 제약사들의 사업 전략 변동, 글로벌제약 산업의 침체 및 경쟁 치료제의 개발 등으로 인해 신규 기술이전 계약 체결에 실패할 수 있습니다. 글로벌 제약사로의 신규 기술이전 계약의 지연 및 실패할 경우 당사의 재무안정성과 현재 당사가 목표로 하는 영업실적에 부정적인 영향이 있을 수 있습니다. |
바이오 산업은 연구개발부터 신약 개발의 임상 성공 및 제품 상용화 단계에 이르기까지 막대한 연구개발 비용과 10년 이상의 기간이 소요되는 기술, 자본 집약적 산업입니다. 신약을 출시하기 위해서는 전임상(비임상), 임상 1~3상 및 규제 당국의 허가 단계를 모두 통과해야 하기 때문에 평균 10~15년 정도의 장기간과 1~2조원 수준의 막대한 개발 비용이 소요됩니다.
당사와 같은 바이오벤처는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 분산하기 위하여 개발 초기단계에서 기술이전함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 구축하고 있습니다. 국내외 대형 제약사 또한 대규모 개발비용을 감수하고 성공확률이 높은 약제로의 선택과 집중을 통해 최상의 결과를 얻고자 내외부의 파이프라인을 다양화해 연구개발하는 전략을 취하고 있습니다.
최근 R&D 투자 효율성 하락으로 글로벌 제약기업들의 R&D 지출액 증가율이 둔화될 것으로 전망되고 있습니다. 의약품 산업은 연구개발에서부터 신약개발 성공과 제품 상용화 생산에 이르기까지 높은 R&D 비용과 10년 이상의 기간이 소요되는 기술, 자본집약적 산업이지만, 2000년 이후 글로벌 제약기업들의 투자 효율성(ROIC, 투자자본 수익률) 감소세를 보이고 있습니다. 글로벌 대형 제약기업들이 신약 1개 당 시판을 위해 드는 비용이 2010년 11.9억 달러에서 2018년 21.7억 달러, 2023년 23억달러로 급증하였습니다. 이는 각국 정부의 약가인하 유도 정책, 신약개발 비용 및 기간 증가, 경쟁 심화 등에 기인합니다.
| [글로벌 20대 제약기업들의 후기 파이프라인 ROIC 추이] |
 |
|
ROIC 추이 |
| (출처 : Deloitte(Measuring the return from pharmaceutical innovation, 2024년 04월)) |
Deloitte 연례 연구 결과에 따르면 글로벌 20대 제약기업의 R&D 수익률은 2014년 7.2%에서 2022년 1.2%로 최저치를 기록하며 하향추세에 있었으나 2023년 4.1%로 반등하였습니다. 이는 신약 출시 비용은 지속적으로 증가했으나, 신약 당 예상되는 피크 판매액은 2010년대 대비 70%수준으로 감소하였기 때문입니다. 다만 전문화된 바이오제약 기업들은 높은 개발 비용에도 불구 높은 파이프라인 가치를 보유하고 있어, 대기업들을 능가하는 수익률을 기대할 수 있습니다.
| [글로벌 20대 제약기업들의 R&D비용 및 파이프라인 당 peak sales 추이] |
 |
|
R&D Cost & Peak Sales per Pipeline |
| (출처 : Deloitte(Measuring the return from pharmaceutical innovation, 2024년 04월)) |
신약 출시까지 소요되는 비용이 지속적으로 증가함에 따라, 전 세계적으로 제약사들의 기술이전 사례가 증가하고 있습니다. 2022년 02월 BIO(Biotechnology Innovation Organization)이 발간한 보고서에 따르면, 2011년부터 2021년 3분기까지 전세계 제약바이오 벤처회사의 기술이전 딜(계약금 규모 1천만 달러 이상)을 분석한 결과 거래건수는 2011년 109건에서 2020년 238건으로 증가하였으며, 계약금(upfront) 규모는 2011년 34억 달러에서 2020년 162억 달러로 증가하였습니다. 해당기간 중 발생한 기술이전 딜 중 매년 평균 55.3%가 전임상 단계에서 체결되었으며, 계약금(upfront) 규모는 평균 23억 달러였습니다. 이러한 사실로 비추어볼 때 신약 후보물질의 안전성과 효능이 임상 단계에서 완전히 입증되기 전이라 하더라도, 그 잠재력만으로도 높은 가치를 인정받고 수익으로 이어질 수 있음을 알수 있습니다.
한편, 2023년 한해 질환분야에서는 항암치료제가 총 861억 달러의 거래금액으로 가장 컸으며, 두 번째 신경계질환 211억 달러와 세 번째 심혈관계질환 103억 달러와도 큰 격차를 보였습니다. 모달리티로는 바이오의약품에 대한 거래가 803억 달러로 가장 컸습니다. 특히 모달리티에 있어 ADC에 대한 라이센싱 거래금액은 크게 상승한 반면에, 세포· 유전자치료제는 하락하는 양상을 보였습니다. 대형 제약사들은 투자에 대한 리스크 완화 차원에서 세포유전자치료제 보다는 ADC를 보다 검증된 기술로 보고 있습니다. 대형 제약사들의 디-리스크(de-risk) 전략은 신약개발 단계별 거래 현황에서도 나타나고 있습니다. 2023년 한해 대형 제약사들은 기술거래 투자에 대한 리스크를 완화하기 위해 개발 초기 단계보다는 중후기 단계의 거래로 전환하기 시작했습니다. 바이오제약사들의 R&D 라이선스 계약을 개발 단계별로 보면, 초기 후보물질발굴 (Discovery) 단계에서의 거래는 2022년 84건이었으나 2023년은 51건으로 크게 감소하였고, 비임상 단계 또한 2022년 12건에서 2023년 10건으로 소폭 감소했습니다. 반면, 임상 1상에서의 거래는 2022년 8건에서 2023년 15건으로 크게 증가했고, 임상 2상 및 3상에서의 거래 비중도 소폭 증가했습니다.
| [임상단계별 빅 파마 라이센스 계약 거래 추이] |
 |
|
빅 파마 라이센스 계약 거래 |
| (출처 : 2023 Annual Biopharma Licensing and Venture Report, J.P Morgan, 2023.12) |
[압타머 기술이전 사례]
압타머 기술 개발사 및 기술이전 사례는 전세계적으로 많지 않으며, 기술이전의 대표적인 사례는 Gilead Sciences, Inc.의 Macugen L/O이고, 압타머 기술개발사 M&A 사례는 아이베릭바이오(Iveric Bio) M&A이 대표적입니다.
Gilead Sciences, Inc.는 황반변성(AMD)과 당뇨병성 망막병증 치료를 위한 NX 1838(현제품명 Macugen)를 초기 임상 단계에서 Eyetech Pharmaceuticals에 Licence Out을 한 사례가 있습니다. Eyetech Pharmaceuticals은 Gilead Sciences, Inc.에 700백만 달러의 선불 라이센스 비용을 지불하였고, 마일스톤별 최대 2,500백만달러를 지급하며, 향후 모든 연구개발 비용을 부담하는 계약을 체결하였습니다. 이후 연구계발을 지속하였고 Macugen이 2004년 12월 FDA 승인을 받았으나, 2005년 11월 Eyetech Pharmaceuticals는 OSI Pharmaceuticals에 인수되었습니다. 이후 2012년 다시 Bausch Health(당시 Valeant Pharmaceuticals)가 Eyetech Pharmaceuticals를 인수하였고, 현재는 Bausch Health는 미국에서 Macugen을 제조하고 판매할 독점권을 보유하고 있으며 Pfizer Inc.는 전 세계에서 Macugen을 제조하고 판매할 독점권을 보유하고 있습니다.
압타머 기술개발사 M&A 사례는 FDA 승인받은 2호 압타머 신약 아이저베이(iZervay)의 개발사 아이베릭바이오(Iveric Bio)가 2023년 7월 일본 아스텔라스제약(Astellas Pharma)에 59억 달러(약 7조8000억원)에 인수된 사례가 대표적입니다.
| [Iveric Bio의 기업 개요 및 주요 파이프라인] |
| 기업명 | IVERIC BIO Inc. (NASDAQ: ISEE) |
| 주소 | Parsippany, New Jersey, United States |
| 임직원 수 (2023년 5월) | 260명 (사업화 90명, 연구개발 60명) |
| 임상단계 물질 | 작용 기전 / 모달리티 | 타겟 적응증 | 단계 |
| Avacinacaptad Pegol (ACP) |
C5 저해제 / RNA 압타머 | 노인성 황반변성(AMD)으로 인한 지도형 위축(GA) | 미국 FDA 승인 (2023.08) |
| 스타가르트병 (상염색체 열성으로 유전되는 망막 질환) |
임상 2상 |
| (출처 : Astellas Pharma, Acquisition of Iveric Bio, 2023.05) |
그외 글로벌 빅파마와 압타머 기술 보유사의 공동연구가 이뤄지고 있습니다. 소마로직(SomaLogic) 사는 2011년부터 노바티스(Norvatis) 사와 단백질학 연구제휴를 체결하고 바이오마커와 신약 타깃의 발굴 및 검증, 그에 대한 동반진단을 개발해왔습니다. 해당 연구는 SOMAmer(Slow Off-rate Modified Aptamer) 시약을 바탕으로 한 약 7천 개 단백질을 동시에 분석할 수 있는 SomaScan® 플랫폼 개발로 이어졌으며, 2024년 7월 4.1버전을 출시하였습니다. 압타머그룹(AptamerGroup) 사는 2024년 7월 아스트라제네카(AstraZeneca) 사와 섬유화 간세포를 대상으로 siRNA 표적 전달을 위한 압타머운반체 개발계약을 체결한 바 있습니다.
2024년 9월 기준으로 FDA 승인 받은 ADC 약물 13건이 시장에 출시되었고, 글로벌 빅파마를 포함해 전세계 기업들이 신규 ADC 개발에 참여하고 있습니다. 표적치료제 개발기술의 다각화가 요구되는 시점에서 압타머는 ADC의 대체기술로 높은 관심을 받고 있으나, 임상에 진입한 압타머 치료제는 아직까지 20건 이내로 압타머 기술의 진보는 시간이 더 걸릴 수 있습니다.
당사는 전임상 또는 임상 초기 단계에서 각 적응증에 전문성을 가진 국내외 제약 및 바이오 회사와의 기술이전을 통해 시장의 미충족 수요 및 허가기관의 규정에 최적화된 임상을 설계 및 수행하여 시판 허가 가능성 및 매출을 극대화하고, 여기서 발생하는 마일스톤과 로열티를 통해 추가적인 연구를 위한 탄탄한 자금 구조를 확보하는 사업모델을 추구하고 있습니다. 항암제를 포함해 플랫폼 기반 신약개발에 니즈를 가진 다수의 제약 및 바이오 회사와 기술 이전에 대한 활발한 논의 또한 진행 중에 있습니다.
현재는 임상시험승인 신청이 된 AST-201 외에 AST-202, AST-203 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 추가적인 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법을 개발하였고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)를 진행 중에 있습니다.
[당사의 기술이전 현황]
당사는 2024년 3월 '압타머-약물접합체(ApDC) 고형암 치료제 AST-201의 국내 1상 임상시험 IND 승인 신청'을 진행하고 공시한 바 있습니다. 이에 2024년 4월 식품의약품안전처(MFDS)의 자료보완 요구를 수령하였고, 증권신고서 제출일 현재 보완자료 대응을 계속하고 있습니다. 당사는 자료보완 기한인 2024년 10월까지 자료제출을 완료하고 승인 획득을 목표하고 있습니다.
AST-201은 주요 적응증 간암을 고려하여 간암환자가 많은 중국 기업 대상으로 기술이전을 목표하고 있고, 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안하였습니다. 다만 현재 임상 IND 진입시점이어서 1상 임상결과를 확인한 이후에 판단하겠다는 기업이 대다수입니다. AST-201은 2025년 임상 1a상 POC 데이터를 기반으로 물질의 안전성과 예비 효능이 확인되는 시점에 기술이전 논의가 본격적으로 진행될 것으로 예상됩니다. 회사에서 예상한 바대로, 젬시타빈 허가 용량의 5% 투여시 동등한 치료 효과를 확인하고 내약성도 충분히 입증된다면 그동안 접촉해온 기업들과 기술이전 논의를 빠르게 진전시킬 수 있겠지만, 그렇지 않은 경우에는 1b상 결과확인까지 요구되어 2026년까지 시간이 더 소요될 수 있습니다.
후속 파이프라인인 AST-202 및 AST-203은 전임상 및 CMC 결과에 따라 임상 진입 시기를 결정할 수 있습니다. 전임상 단계에서 구체적인 효능과 안전성 지표를 확인하여 임상진입 전인 2025~26년 중 기술이전을 추진하는 것을 우선하나, 공동개발 파트너를 찾지 못할 경우 시장성을 검토하여 자체적으로 임상 1상에 진입하는 방안도 고려할 것입니다. 하지만 전임상 단계에서 기술이전에 충분한 데이터를 확보할 수 있을지 여부가 불분명하고, 객관적인 근거자료를 확보하는 외부 CRO 및 CMO의 역량과 난이도에 따라 계약 시기는 지연될 수 있습니다.
2024년 9월 현재 당사는 국내외 제약·바이오 기업들과 비밀유지계약을 체결하고 기술 및 제품에 대한 기술검토를 진행 중에 있습니다. 그 가운데 기술검토를 위한 MTA 계약 등 활발한 논의가 진행되고 있는 항목은 다음과 같습니다.
| [사업개발 추진현황] |
| 파이프라인 | 계약 형태 | 계약회사 | 예상 시점 |
| AST-203 | 물질이전계약(MTA) 및 공동개발 | 국내 K사 | 2024년 4분기 |
| AST-203, ApDC® 플랫폼 기술 | 물질이전계약(MTA) 및 공동개발 | 국내 C사 | 2025년 상반기 |
| AST-201 | 기술이전 | 중국 C사 | 2025년 상반기 |
| (출처 : 당사 제시) |
AST-201은 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안한 바 있으며, CDMO 협력사인 Asymcem, Wuxi 사와의 네트워크도 활용 가능할 것입니다. 또한 2024년 9월 AST-201의 물질특허가 중국 및 일본 특허청에 등록결정이 되어 기술이전에도 긍정적 영향을 미칠 수 있습니다. 당사는 2024년 1월 이후로 총 6건의 비밀유지계약을 체결하고 기술검토를 진행중이나, 현재까지 계약체결이 이루어진 사실은 없습니다.
그러나 상기와 같은 당사의 노력에도 불구하고 글로벌 제약사들의 사업 전략 변동, 글로벌제약 산업의 침체 및 경쟁 치료제의 개발 등으로 인해 신규 기술이전 계약 체결에 실패할 수 있습니다. 글로벌 제약사로의 신규 기술이전 계약의 지연 및 실패할 경우 당사의 재무안정성과 현재 당사가 목표로 하는 영업실적에 부정적인 영향이 있을 수 있습니다.
|
마. 신약 목표 시장 내 경쟁 심화 위험 당사는 고형암 치료제, 혈액암 치료제 등을 주요 파이프라인으로 개발하고 있으며 이처럼의학적 미충족 수요가 높은 시장을 전략적으로 목표하며 혁신신약을 연구개발하고 있습니다. 이에 대해 당사는 파이프라인별로 경쟁사 및 경쟁제품, 작용기전, 성능 등의 파이프라인 동향을 면밀하게 분석한 후 당사의 경쟁우위요소를 바탕으로 사업전략을 수립하고 있습니다. 하지만 당사의 이러한 노력에도 불구하고 동일 파이프라인 내 신규 경쟁업체의 진입 증가, 의학적 미충족 수요의 변화, 경쟁사의 가격정책 및 마케팅전략 변화, 새로운 치료제의 등장, 당사 파이프라인의 연구개발 속도 저하 등의 사유로 인해 당사 파이프라인의 시장경쟁력이 약화되는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다. |
당사는 압타머 기반의 고형암 치료제, 혈액암 치료제 등을 주요 파이프라인으로 개발하고 있습니다. 당사는 기존 치료제와 ADC의 제약으로 인해 의학적 미충족 수요가 높은 질환 시장을 목표 시장으로 선정하여 혁신신약에 도전하는 약물을 개발하고 있습니다.
그러나 향후 동일한 질병 치료제를 개발하는 신규 경쟁업체의 진입 증가, 당사 대비 임상 단계가 앞서 나가고 있는 경쟁 약물들의 임상 성공 및 시판 승인 등이 발생 및 증가할 경우, 당사 제품의 경쟁력 및 사업성 등에 부정적인 영향을 미칠 수 있습니다. 당사가 파악한 각 파이프라인별의 경쟁현황은 아래와 같습니다.
[간암 치료제 AST-201]
AST-201은 글리피칸-3(GPC3)를 표적으로 하는 선택적 간암 치료제로 젬시타빈을 내재화하여 높은 치료 효율과 안전성을 확보하고 있습니다. 압타머 기반 물질의 우수한 조직 투과성, 높은 효능을 바탕으로 선택적 결합에 의해 기존 항암제에 기인한 부작용을 최소화시키는 효능을 지니고 있습니다.
1) 경쟁 상황
간암 환자에 대한 표준 치료제는 과거 소라페닙(제품명: 넥사바), 렌바티닙(제품명: 렌비마)과 같은 티로신키나아제(TK) 억제제가 주로 사용되었으나, 베바시주맙(제품명: 아바스틴)-아테졸리주맙(제품명: 티센트릭) 병용 또는 더발루맙(제품명: 임핀지)-트리멜리무맙(제품명: 임주도) 병용요법의 간세포암 1차 치료제 승인 이후 이들이 더 많이 처방되고 있습니다. 현재 간세포암 진료 가이드라인은 아래와 같습니다.
| [2022 간세포암종 진료 가이드라인] |
 |
|
간세포암종 진료 가이드라인 |
| (출처 : 대한간암학회, 국립암센터 2022) |
간세포암 환자 대상 IMBrave 150 연구에서 베바시주맙-아테졸리주맙 병용요법을 투여한 환자군의 전체생존기간 중간값(median OS)은 19.2개월로 소라페닙 투여군 13.4개월 대비 유의한 증가를 확인했습니다.
| [간세포암 병용투여 임상결과] |
 |
|
베바시주맙-아테졸리주맙 병용임상결과 |
| (출처 : Cheng Al, et al. J Hepatol 2022) |
또한 HIMALAYA 연구에서는 더발루맙-트리멜리무맙 병용요법을 투여한 환자군의 생존 중간값(median OS)은 16.4개월로 소라페닙 투여군 13.8개월 대비 유의한 증가를 확인했습니다. 그 밖에 간세포암 1차 치료제로 사용 가능한 약물들의 임상 시험 결과는 아래와 같습니다.
| [간세포암 1차 치료제의 임상결과] |
| 제
품명 |
회사 | 중간 생존값 (
개월
)
|
적응증 |
투여 방법 |
| Avastin-Tcentriq |
Roche |
19.2 |
간세포암 |
정맥주사, 3주 간격 병용투여 |
| Imjudo-Imfinzi |
AstraZeneca |
16.4 |
간세포암, 비소세포폐암 |
정맥주사, 병용투여 후 4주간격으로 임핀지 지속투여 |
| Lenvima |
Eisai |
11.5 |
간세포암, 갑상선암 등 |
1일 1회 경구복용 |
| Nexavar |
Bayer |
12.3 |
간세포암, 갑상선암 등 |
1일 2회 경구복용 |
| Keytruda |
MSD |
14.6 |
간세포암, 흑색종 등 |
정맥주사, 3주 간격 투여 |
| Opdivo |
BMS |
16.4 |
간세포암, 흑색종 등 |
정맥주사, 3주 간격 투여 |
| (출처 : 당사 제시) |
GPC3를 타겟으로 승인된 약물은 아직 없으며, 개발 중에 있는 약물은 아래 표와 같습니다.
| [GPC3 타겟 개발 중인 약물 목록] |
| 신약 후보물질 | 회사명 | 모달리티 | 단계 |
| GC33 |
Roche |
항체 |
2상 |
| CM350 |
Keymed Biosciences |
이중항체 | 1/2상 |
| CMD011 |
Shimai Pharmaceutical |
이중항체 | 1/2상 |
| SAR444200 |
Sanofi |
이중항체 | 1/2상 |
| ERY974 |
Chugai Pharmaceutical |
이중항체 | 1상 |
| BOS-342 |
BOSTON Pharmaceuticals |
이중항체 | 1상 |
| CT011 |
CARsgen Therapeutics |
CAR T |
1상 |
| BOXR1030 |
Sotio Biotech |
CAR T |
1상 |
| AZD5851 |
AstraZeneca |
CAR T |
1상 |
| Ori-C101 |
OriCell Therapeutics |
CAR T |
1/2상 |
| TAK-102 |
Takeda |
CAR T |
1상 |
| JWATM204 |
JW Therapeutics |
CAR T |
1상 |
| EU307 |
Eutilex |
CAR T |
1상 |
| IM83 |
Immunochina |
CAR T |
1상 |
| LB2101 |
Legend Biotech |
CAR T |
1상 |
| SENTI-301A |
SENTI BIO |
CAR NK |
1상 |
| (출처 : 당사 제시) |
2) 비교우위 사항
간세포암 환자에 가장 많이 처방되고 있는 옵션인 베바시주맙-아테졸리주맙 병용요법은 IMBrave 150 연구에서 소라페닙 대비 전체생존기간 중간값을 6개월 정도 유의하게 증가시켰습니다. 해당 임상연구의 Sub-group 분석 가운데 GPC3가 높은 환자군과 낮은 환자군 비교 결과 GPC3가 낮은 환자군은 원래의 결과와 유사하게 베바시주맙-아테졸리주맙 병용요법이 통계적으로 유의한 차이를 나타냈으나 GPC3가 높은 환자군에서는 그 차이가 유의하지 않게 나타났습니다. 즉, GPC3가 높은 환자군은 여전히 베바시주맙-아테졸리주맙 병용요법의 치료 효과가 떨어지고 있어 의학적 미충족 수요가 높은 환자군입니다. AST-201은 GPC3를 타겟으로 개발하는 약물로서 임상적으로 이들 환자군에 더 높은 효과를 보일 가능성이 있습니다.
| [GPC3 발현 여부에 따른 병용투여 효과] |
 |
|
GPC3 발현 정도에 따른 병용투여 연구결과 |
| (출처 : 당사 제시) |
최근 간세포암 치료제 개발 방향은 면역항암제(PD-1 또는 PDL-1 억제제) 병용요법을 고려하고 있으며, 이전 티로신키나아제(TK) 억제제 단독요법보다 임상 효과(전체생존기간 중간값)가 큰 폭으로 증가했습니다. 이에 다른 후발주자들은 유효성 지표인 전체생존기간 중간값을 높이기 위하여 다양한 면역항암제 병용요법을 개발하고 있으며, AST-201 임상개발 시에도 경쟁력을 가지기 위하여 더 높은 임상 성공의 지표가 요구되고 있습니다.
AST-201은 간암 세포에 특이적인 세포막 단백질인 GPC3에 선택적인 결합을 통해 약물 전달을 하므로 압타머 서열 내에 내재화된 형태로 젬시타빈의 활성을 보호하고 간암 세포로의 효과적인 전달 작용이 가능합니다. 기존 젬시타빈 저항성의 형성 기전을 완전히 우회하는 GPC3 경유 세포 내재화는 치료 후 저항성에 의한 치료 효과 저하 가능성을 낮춥니다. 항체나 비항체 단백질 결합체와는 달리 핵산 기반 물질로 우수한 조직 투과성을 확보하여 간암과 같은 고형암을 효과적으로 치료 가능하며 GPC3는 검증된 간암 세포 특이적 세포막 표지자로서 비선택적 약물 전달에 의한 부작용을 최소화 합니다. 또한, AST-201의 충분한 혈액 내 안정성(반감기 50시간 이상)은 정상 조직에서의 약물 노출을 최소화하며, 단일 공정으로 제조 가능하여 품질 관리 및 대량생산 측면에서의 용이성을 확보하고 있습니다.
| [AST-201의 작용 기전] |
 |
|
AST-201 구조 및 작용 기전 |
| (출처 : 당사 제시) |
3) 시장 규모
간암 발생이 지속해 증가하고 다른 장기로의 전이율이 높은 만큼, 조기진단 및 치료제 개발 필요성이 높아지고 있어 관련 시장 규모는 지속해 확대할 것으로 전망됩니다.
미국 국립암연구소의 SEER(Surveillance, Epidemiology, and End Results) 프로그램에 따르면, 2023년 미국에서 4만 1,210명의 간암 및 간 내 담관암이 새로 진단되고 약 2만 9,380명이 원발성 성인 간암으로 사망한 것으로 예측됩니다. 5년 상대 생존율은 21.6%에 불과합니다.
우리나라 간암 발생률은 다른 선진국 비교했을 때 월등하게 높은 수준으로, 매년 국내에선 약 1만 2,000명의 간암 환자가 새롭게 진단되며 암으로 인한 사망 원인 2위를 차지하고 있습니다. 국민건강보험공단이 분석한 결과에 따르면, 간세포암 환자가 2022년 6만 4525명으로 집계되었으며 5년전 5만 9040명보다 9.3% 증가하였습니다. 간세포암은 간암 유형별 진료인원 8만 853명 중 79.8%를 차지하며, 성별로 보면 77%(4만9677명)가 남성환자였습니다.
| [국내 간암 유형별 진료인원 수] |
 |
|
2021년 간암 유형별 진료인원 수 |
| (출처 : 국민건강보험공단, 2022) |
야후 파이낸스의 시장 리포트에 따르면 글로벌 간암 치료제 시장 규모는 2022년 약 24억 달러(약 3조2000억원)에서 연평균 18.6% 성장해 2030년 약 93억 달러(약 12조5000억원)에 달할 전망입니다. 2023년 기준으로 간암 1차 치료제 시장은 로슈 52%, 아스트라제네카 25%, 기타 23%로 분할하고 있습니다.
| [글로벌 간암 치료제 시장 점유율] |
 |
|
글로벌 간암 1차 치료제 시장 현황 2023 |
| (출처 : IQVIA) |
[면역항암제/혈액암 치료제 AST-202]
AST-202는 T세포림프종과 급성골수성백혈병 치료를 위해 개발된 혈액암 치료제 파이프라인입니다. 당사의 독자적인 분지형 링커 기술을 적용해, 압타머에 3개의 약물을 접합하는 ApDC® 플랫폼을 기반으로 설계되었습니다. 글리벡 출시 이후 혈액암 생존율이 90% 이상으로 향상되었지만, 일부 난치성 혈액암의 생존율은 여전히 30%에 머무르고 있습니다. AST-202는 미충족 수요가 높은 혈액암에서 높은 발현률을 보이는 CD25를 표적으로 삼아 개발되었습니다. 경쟁 약물인 애드세트리스(Adcetris)와 비교했을 때 더욱 우수한 종양 억제 효과를 입증하였으며, 현재 CD25를 표적으로 하는 승인된 치료제는 없으며 개발 중인 약물들은 다음과 같습니다.
| [T세포림프종의 ADC 치료제의 임상결과] |
| 제
품명 |
회사 | 5년 무진행 생존기간 (
개월
)
|
적응증 |
투여 방법 |
| Adcetris |
Takeda | 62.3 |
T세포림프종 |
정맥주사, 3주 간격 투여 |
| (출처 : 각 회사) |
| [급성골수성백혈병의 치료제의 임상결과] |
| 제
품명 |
회사 | 중간 생존값 (
개월
)
|
적응증 |
투여 방법 |
| Xostapa | Astellas | 9.3 |
FLT3 변이 양성인 재발 또는 불응성 급성골수성백혈병 | 1일 1회 경구복용 |
| Venclexta | Abbvie | 14.7 | 만 75세 이상 또는 집중 유도화학요법에 적합하지 않은 급성골수성백혈병 | 1일 1회 경구복용 |
| Mylotarg | Pfizer | 17.3 | 새로 진단된 CD33 양성 급성골수성백혈병 | 정맥주사 |
| Onureg | BMS | 24.7 | 급성골수성백혈병 | 1일 1회 경구복용 |
| Vyxeos | Jazz Pharma | 9.6 | 새로 진단된 치료 관련 또는 골수이형성증 관련 변화를 동반하는 급성골수성백혈병 | 정맥주사, 2일 간격으로 3회 투여 |
| (출처 : 각 회사) |
| [CD25 타겟의 구조] |
 |
|
CD25 타겟구조 |
| (출처 : 당사 제시) |
| [CD25 타겟 개발 중인 약물 목록] |
| 신약 후보물질 | 회사명 | 모달리티 | 단계 |
| AU-007 | Aulos Bioscience |
항체 |
1/2 |
| RM-1995 | Rakuten Medical |
항체 |
1 |
| BA1106 | Shandong Boan Biotechnolog |
항체 |
1 |
| (출처 : 당사 제시) |
혈액암은 림프종, 백혈병, 다발성골수종 등으로 세분화되며 전세계적으로 매년 124만 명의 환자가 발생하고 있습니다. 주로 미국, 서유럽, 오세아니아 등 백인종에서 많이 발생하고 있습니다.
| [국가별 혈액암 발생비율] |
 |
|
글로벌 혈액암 발병비율 |
 |
|
국가별 논호지킨림프종 발생비율 |
| (출처 : GLOBOCAN 2018, Zhang et al Blood Cancer J 2023) |
림프종은 크게 호지킨림프종과 비호지킨림프종으로 구분됩니다. WHO통계에 따르면 2020년 기준 림프종 신규 발병자는 627,439명, 이중 호지킨림프종과 비호지킨림프종 발병비율은 각각 13% 및 87%입니다. NK-T세포 림프종(NK-T cell lymphoma)은 비호지킨림프종의 한 종류로, 림프절 이외의 림프 조직에서 발생하는 NK세포 및 T세포 계열의 림프종입니다. 미국, 유럽보다 한국을 비롯한 아시아 국가에서 비교적 흔히 발견되고 주로 코, 구개, 상기도, 위장관 그리고 피부를 침범하며 진행이 빠른 림프종에 속합니다.
NK/T세포 림프종 환자 비율이 가장 높은 지역은 중국(32.5%), 일본(24.9%), 한국(22.0%) 등 입니다. WHO통계에 따르면 2020년 기준 한국의 림프종 신규 발병자는 5,775명이며, 이중 호지킨림프종과 비호지킨림프종 발병자는 각각 344명 및 5,431명으로 집계되었습니다. 비율로 보면 국내 비호지킨림프종 발병 비율이 94% 수준으로 글로벌 기준 대비 높습니다. 건강보험심사평가원 보건의료빅데이터 개방시스템에 따르면 국내 NK/T세포 림프종(C86) 환자는 2018년 기준 1,681명으로, 지난 5년간 연평균 10.6%의 성장률로 환자 수가 증가하고 있습니다.
노바원어드바이저 보고서에 따르면 2023년 기준 글로벌 T세포 림프종 시장은 약 28억5000만 달러(약 3조8000억원)로 추정되며 연평균 8.85% 성장하여 2033년까지 약 66억 5000만 달러(약 9조원)에 달할 것으로 추산됩니다.
| [글로벌 T세포 림프종 치료제 시장] |
 |
|
T-Cell Lymphoma Market Size |
| (출처 : Nova One Advisor, 2024) |
압타머는 항체 대비 종양 조직 투과성이 우수하므로 종양 내 침투된 Treg 도달 및 약물활성이 좋을 것으로 예상되고, 더불어 면역관문억제제(PD-1/PD-L1) 병용투여를 통해 기존 면역항암제의 반응률 개선 효과 및 시너지효과가 기대되며, CD25의 종양 발현율이 높은 림프종, 백혈병 등의 혈액암으로 적응증 확대도 기대할 수 있습니다.
[췌장암 치료제 AST-203]
췌장암은 50대 이상의 고령 남성에게 주로 발생하며, 70세 이상이 되면 1년 사이에 약 1,000명당 1명의 비율로 발생하는 등 고령층에게 발생빈도가 매우 높은 질환입니다. 췌장암은 국내에서 성별에 따라 여성에서는 8위, 남성에서는 10위로 나타났습니다. 2020년 식약처에 의하면 췌장암은 10대 주요 암 중에서 발병비율이 9위로 낮은 편에 속하나, 조기 진단이 어려우며 확인이 되었을 때는 이미 원격전이가 되어 근치적 절제가 불가능해진 경우가 많은 등 치명률이 높습니다.
| [국내 췌장암 발생 현황 및 비율] |
 |
|
췌장암의 발생 비율 |
| (출처 : 식품의약품안전처, 2020) |
국내외 주요 글로벌 제약기업은 몇몇 후기 파이프라인 약품의 실패로 인해 시장이 다소 위축된 상황인데, 이는 췌장암이 다른 암 환경에서 좋은 성과를 거둔 대부분의 단일 표적제들을 통한 치료 효과가 매우 적은 것에 기인한 현상입니다. 췌장암 치료제는 크게 전반적인 생존률 향상 및 효과적인 2차 치료 옵션, 기존 치료법을 능가하는 개선된 안전성과 내성에 대한 수요가 존재하는 시장입니다.
| [췌장암의 1차 치료제의 임상결과] |
| 제
품명 |
회사 | 중간 생존값 (
개월
)
|
적응증 |
투여 방법 |
| Folfirinox (5-FU, Irinotecan, Leucovorin, Oxaliplatin) |
- | 11.1 | 진행성 및 전이성 췌장암 | 정맥주사, 2주 간격 투여 |
| Gemcitabine-Abraxane | Celgene | 8.5 | 진행성 및 전이성 췌장암 | 정맥주사, 1주 간격 병용투여 |
| Onivyde | Ipsen | 6.1 | 새로 진단된 CD33 양성 급성골수성백혈병 | 정맥주사 |
| (출처 : 당사 제시) |
췌장암 치료제 세계시장은 2018년 기준 약 1,685백만 달러(약 2.1조 원) 규모에서 연평균 1.7% 감소하여 2028년에는 약 1,414백만 달러(약 1.8조 원) 규모로 시장이 축소될 것으로 전망되었습니다. 췌장암 치료제의 시장 성장을 제약하는 주요 요인으로는 Abraxane과 같은 기존 브랜드 의약에 대한 제네릭 의약의 매출이 증가하고 있다는 점과 유망 신약인 Abraxane이 적응증 확대에 실패한 점, 후기 임상에 유망할 것으로 기대되었던 주요 파이프라인 의약들이 임상시험에 실패한 점 등으로 분석됩니다. 한국과학기술정보연구원 리포트에 따르면 2018년 기준 췌장암 치료제 국내시장은 27백만 달러(약 330억 원) 규모로 추정됩니다.
하지만 당사 후보물질의 이러한 장점에도 불구하고 당사가 개발중인 파이프라인의 진행단계는 초기 단계로 제품 판매 허가시점이 경쟁사 대비 늦어질 수 있는 위험이 존재합니다. 또한 동일 치료제 시장 내 신규 경쟁업체의 진입 증가, 의학적 미충족 수요의 변화, 현재 경쟁제품의 연구개발 속도의 증가, 경쟁사의 가격정책 및 마케팅전략 변화, 새로운 기전의 치료제의 등장, 당사 파이프라인의 연구개발 속도 저하 등의 이유로 인해 당사 파이프라인의 시장경쟁력이 약화되는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
|
바. 신규 시장으로써 암 조기진단 산업의 특성에 따른 위험 당사가 영위하고 있는 액체 생검을 활용한 암 조기진단 시장은 그 동안 축적된 과학지식의 부족과 검사 기술의 부재로 인하여 최근(2014년)에야 미국에서부터 열리기 시작한 대규모 신흥시장(Emerging market)으로 국제적으로 경쟁사가 소수로 제한되어 있어 현재로서는 글로벌시장에서도 높은 경쟁력과 독점력을 가질 수 있는 산업분야입니다. 그럼에도 불구하고, 암 조기 검진 시장은 아직까지 활성화 되지 않은 새로운 시장으로 정부 정책 변화, 치료제나 다른 검진 방법의 기술 개발 등의 다양한 이유로 시장의 성장세가 저조하거나 위축되는 경우 당사의 영업 활동 및 수익성에 부정적인 영향을 줄 수 있습니다. |
전 세계 모든 국가가 고령화 사회에 진입하고 식습관의 변화 등으로 암을 포함한 다양한 질병이 증가하여 정부에서 지출하는 보건의료 비용이 급격히 증가하고 있어 국가 보건의료 예산부족 해결이 글로벌 이슈로 부각되고 있습니다. 보건의료시장에서 특히, 높은 사망원인이 되는 중증질환 중 암의 경우, 발병률이 매년 크게 증가하고 있으며, 그 결과 암으로 인한 치료 및 사망에 대한 천문학적인 사회적 비용의 지출이 요구되고 있습니다.
특히, 암은 전체 사망의 27%를 차지하여 전세계적으로는 두번째로 높은 사망 원인이며, 선진국을 포함한 국내에서는 사망원인 1순위를 기록하고 있습니다. 또한 인구의 노령화, 흡연 등의 발암 물질에의 노출 증가, 식이섬유 섭취 감소, 동물성 지방 섭취 증가 등의 식이습관 변화로 암 발생이 계속 증가하고 있는 추세입니다. 암은 상당히 진행될 때까지 증상이 없을 수 있으며, 암이 진행되어 나타나는 증상들도 이전에 경험해 오던 증상들과 비슷하여 치료 시기를 놓치는 경우가 많습니다. 증상을 느끼고 병원을 찾을 때는 이미 수술로 제거할 수 없을 만큼 암이 커져 있거나 다른 조직으로 전이 가능성이 높아 완치율이 상당히 낮은 질병으로 알려져 있습니다.
암의 조기 검진은 일반적으로 신체적 이상이나 증상이 없고 스스로 건강하다고 생각될 때, 검사를 받음으로써 병을 조기에 발견하여 치료하고자 하는 것으로, 검진을 통하여 암을 조기에 발견하여 치료할 수 있다면 적은 비용으로 완치율을 크게 높일 수 있습니다. 이런 이유로 미국을 비롯한 선진국들은 환자의 삶의 질 향상과 암의 효과적이고 효율적인 치료를 위해 발병 후 치료 중심에서 조기진단을 통한 예방의학으로 암치료 패러다임의 전환을 통해 대응하고 있습니다.
| [암 조기 진단의 효과성과 효율성] |
 |
|
Screening for early detection, AACR 2023 |
| (출처 : Cancer Progress Report, AACR 2023) |
현재 암을 진단하는 표준 방법은 조직생검(Tissue biopsy)으로, 이는 내시경이나 바늘 등의 도구를 이용해 인체에 침습적으로 시행하므로 여타 방법에 비해 그 정확성은 높지만 침습의 위험부담이 있고, 종양 조직간 혹은 종양 조직 내 생물학적 특성이 다르게 나타날 수 있어 일부 조직 생검으로부터 얻은 정보가 적절한 치료를 하기에 정확도가 불충분 할 수 있습니다. 이에 더해 조직 생검은 상대적으로 고가이며 종양의 위치, 크기 및 환자 상태에 따라 진단이 불가능하거나 단기간내 반복적인 진단은 어렵다고 알려져 있습니다.
한편, 아래 그림에서 보는 바와 같이 암의 초기 단계에서는 종양의 크기가 작아 일반적으로 통증 등의 이상 징후가 없는 무증상 일반인이나 고위험군으로 분류될 수 있는 대다수의 사람들이 검진 대상인 반면, 암의 확진 이후 치료제 선택이나 재발 여부를 모니터링하는 기존 시장은 암 환자를 대상으로 하므로 그 시장의 성격과 규모가 다르다고 할 수 있습니다.
암의 초기 단계에서는 CT나 MRI 등의 이미지 분석을 통한 과거의 조직 생검의 방법으로는 정확한 진단이 거의 불가능한 것으로 알려져 있습니다. 액체 생검의 경우에도 여러 체액 속에 포함된 다양한 정보 중 어떤 정보가 특정 암과 연관이 있는지, 관련성을 확인하더라도 초기 단계에서 극미량으로 존재하는 암 관련 정보를 조기에 검출할 수 있는 방법 등에 대한 연구가 최근에서야 활발히 진행되고 있는 상황입니다.
| [암의 진행단계별 암진단 시장의 영역] |
 |
|
암의 진행 단계 |
 |
|
Cancer survival by stage at diagnosis in England |
| (출처 : Cancer Progress Report, AACR 2023) (출처 : Cancer survival statistics, Cancer Research UK 2023) |
고령화 사회 진입으로 만성질환과 암을 중심으로 질병 발생이 증가함에 따라 선진국들은 보건의료비 지출을 줄이기 위하여 기존 치료를 중심으로 한 보건의료 정책이 질병의 조기진단, 예방과 관리 중심으로 변화하고 있습니다. 이에 따라 의료기기 시장에서 체외진단기기 시장이 급성장하고 있으며, 글로벌 시장조사기관 NovaOneAdvisor에 따르면 2024년에는 817억 달러에서 매년 4.5%씩 성장하여 2033년에는 1,214억 달러에 이를 것으로 전망하고 있습니다.
체외진단은 (In Vitro Diagnostics, IVD)은 질병 진단과 예후 판정, 건강상태의 평가, 질병의 치료 효과 판정, 예방 등의 목적으로 인체로부터 채취한 검체 (혈액, 객담, 타액, 소변, 대변, 세포)를 이용하며 내분비질환, 암, 감염성질환, 면역질환, 심장질환, 전해질, 마약, 소변, 임신, 당뇨 등의 항목을 주로 검사합니다. 현재 의료 패러다임 변화를 충족시키기 위해서는 현재의 검사법들이 가지고 있는 한계점 (진단성능, 편의성 등)을 극복하고 적합한 고성능 바이오마커와 액체생검 (Liquid Biopsy)에 필요한 분자진단 기술개발이 요구되고 있는 상황입니다.
X-ray를 포함하여 CT, PET, MRI 등 이미지 분석을 통한 진단기술은 시간과 비용이 많이 들어가며, 조기진단에 대하여 정확도가 떨어져 특별한 증상이 없는 환자의 경우 방사선 노출, 조영제 등의 부작용으로 실행에 한계가 있습니다.
대표적인 질환인 암 진단에서 조직검사를 통한 침습적인 방법은 환자에게 위험 부담이 크고, 이미 암 조직이 형성된 후 진단함으로서 조기진단에 적용하기에는 부적합합니다.
액체 생검(Liquid biopsy)의 경우 환자의 체액(혈액, 분뇨나 대변 등)에 포함되어있는 암 조직의 정보를 암의 진단이나 치료에 활용하는 방법으로 조직 생검에 비해 최소 침습을 통해 적은 비용으로 반복적인 검사가 가능하며 암과 관련한 다양한 정보를 획득할 수 있다는 측면에서 조직 생검의 단점을 극복하고자 대안으로 제시되는 방법으로 그 시장규모는 점차 확대될 전망입니다.
| [액체생검 시장에서 암진단의 영역 성장] |
 |
|
Entities analyzed in liquid biopsies and their applications |
 |
|
Liquid biopsy for early stage lung cancer |
| (출처 : Liquid biopsy, Molecular Cancer 2022) (출처 : Nature reviews clinical oncology 2020) |
또한, 현재 진행되고 있는 액체 생검을 통한 암 조기 검진 시장은 당사가 영위하고 있는 폐암을 포함해 대부분의 암종에서 그 기술력의 부족으로 낮은 민감도로 인한 무용성이나 높은 위양성으로 인한 불필요한 불안감 및 의료 비용의 지출을 야기하고 있어 이를 보완할 수 있는 진단 방법이 필요한 실정입니다. 따라서, 암 조기 검진 시장은 향후 사용 목적에 맞는 유의미한 성능을 갖춘 제품을 개발하는 데 고도의 기술력, 시간 및 비용이 소요될 것으로 예상됩니다.
이러한 장점을 갖는 암 조기진단 시장은 그 동안 축적된 과학지식의 부족과 검사 기술의 부재로 인하여 2010년 중반부터 미국에서부터 열리기 시작한 대규모 신흥시장(Emerging market)으로 건강과 관련된 산업이므로 경기변동에 따른 영향을 크지 받지 않는 산업이며, 암은 주로 식생활 습관이나 고령화에 의해 나타나는 질병이므로 계절적 요인의 영향도 받는다고 할 수 없습니다. 또한 국제적으로 경쟁사가 소수로 제한되어 있어 현재로서는 글로벌시장에서도 높은 경쟁력과 독점력을 가질 수 있는 산업분야입니다.
엑스레이(X-ray)를 포함하여 CT, PET, MRI 등 이미지 분석을 통한 영상진단기술은 다양한 암 등을 진단하는데 있어 표준기술(Gold Standard)로서 사용되고 있습니다. 영상진단은 혈액을 이용한 비침습적인 방법보다 시간과 비용이 많이 들어가고, 조기진단에 대하여 정확도가 떨어지며, 특별한 증상이 없는 환자의 경우 방사선 노출, 조영제 등의 부작용으로 실행에 한계가 있습니다. 그럼에도 병원과 의료진에 자리잡은 영상진단기술을 액체생검 방식이 대체하기까지는 상당한 시간이 걸릴 것으로 예측됩니다.
현재까지 액체생검이 기존의 원칙으로 자리하고 있던 조직생검과 성공적으로 양립할 수 있음을 보인 시장은 사실상 미국시장이 유일하다고 판단됩니다. 대표적인 사례는 Guardant 사의 Guardant 360으로 Guardant 360은 진행성 고형암을 대상으로 하는 액체생검 검사로서 2020년 FDA 허가에 최초로 성공한 사례입니다. 아래의 자료로 Guardant 360의 2018년부터 2023년까지의 연검사 건수를 확인할 수 있습니다. 검사 건수 기준 2018년 29천건에서 2022년 173천건으로 연평균 43% 증가하였음을 통해 시장진출이 성공적이었음을 확인할 수 있습니다. Guardant 사에서는 현재 대표적인 고형암인 비소세포폐암, 유방암, 대장암에 있어 전체 경우의 15~21%에 Guardant 360이 도입되었다고 제시한 바 있습니다.
| [Guardant 360 검사 건수] |
 |
|
guardant360 |
| (출처 : Guardant, J.P. Morgan Healthcare Conference Presentation, 2024.01) |
Natera 사의 Signatera는 미국 식품의약국(FDA)의 의료기기 사전허가(PMA)를 받지 않은 LDT(laboratory developed test) 제품으로 판매되고 있으며, PMA를 받지 않았기 때문에 보험적용이 제한적인 상황이나 시장에 성공적으로 진입하고 있음을 알 수 있습니다.
| [Signatera 검사 건수] |
 |
|
Signatera oncology tests, clinical tests processed |
| (출처 : Natera, 2024 Q2 Earnings Presentation, 2024.08)
|
2024년 반기 기준 Signatera 검사 건수는 118천건으로 2024년 1분기 대비 13천건을 증가하여 높은 실적을 기록하였습니다. 2023년 연간성장율은 2022년 대비 73.5%를 기록하였고, 2024년 반기까지 높은 성장율을 유지하고 있습니다. Natera社는 대장암과 유방암, 근육 침습성 방광염, 면역요법 모니터링 등 Signatera의 핵심적응증에서 새로운 적응증을 지속적으로 추가하고 있습니다.
Grail 사의 Galleri 역시 LDT(laboratory developed test) 제품으로 그럼에도 불구하고 2021년 중기에 미국에 출시한 이후 2024년 반기까지 총 215,000개를 시판한 상태이고, Grail 사의 올해 2분기 매출은 3200만달러로 전년 대비 43% 증가했습니다. Grail 사는 3만5000여명을 대상으로 한 Galleri의 PATHFINDER 2 허가임상의 지원자 모집을 완료한 상태이며, 오는 2026년 상반기에 Galleri의 PMA 제출을 완료할 수 있을 것으로 예상하고 있습니다.
이와 같이 유사 제품의 성공적인 상업화 및 그 성장세에도 불구하고 현재 당사가 주목표로 하고 있는 미국 이외의 지역에서는 아직 관련 시장이 성숙하지 않았기에 유사한 성장세를 보이지 못할 수 있는 점 투자자 분들께서는 유의하시기 바랍니다.
암 조기 진단 시장에서 경쟁 제품 대비 경쟁력 확보를 위해서는 높은 임상성능, 검사의 간편성, 높은 순응도 그리고 비용 등이 가장 중요한 요소들입니다. 당사의 제품은 고감도 압타머와 최적화된 체외진단 다지표 기술을 활용하여 모방하기 어려우며 기술적 및 사업적 진입장벽이 높다고 할 수 있습니다. 이
처럼 폐암 진단 시장은 미충족 의료 수요가 높지만, 다양한 발병 원인으로 인해 바이오마커를 특정하기 어려워 진단하는 것이 쉽지 않습니다. 현재 임상시험을 통해 국가별 식약처로부터 품목승인을 받는 것은 더욱 어려운 상황입니다.
| [폐암의 액체 생검 시장 성장추세] |
 |
|
Lung cancer liquid biopsy market 2023-3033 |
| (출처 : Lung cancer biopsy market, 2024.05) |
폐암 조기진단 방식에는 X-Ray, Chest CT, Low-Dose CT와 같은 영상장비를 활용한 진단, 혈액을 이용한 단일종양표지자(CEA, Cyfra21-1) 및 다지표진단, 객담을 이용한 진단, 기관지내시경을 이용한 진단이 있습니다. 이중 현재 폐암을 조기진단하는데 가장 많이 사용하는 진단 방식은 Chest CT와 Low-Dose CT의 영상진단 방식입니다.
그외 기관지 내시경이나 객담검사등이 활용되고 있으며 2019년부터 정부가 지원하는 폐암 검진 사업으로 30갑년 이상 흡연력이 있는 만 54세∼74세 고위험군에 대해 2년마다 LDCT 검사를 시행하는 등 다양한 검진 방법이 활용되고 있습니다.
| [국내 시행중인 폐암 검사 방법] |
| 검사 방법 | 상세 |
|
흉부 X-ray (Chest X-ray) |
가장 먼저 사용되는 검사법. 간단하게 폐에 혹이 생겼는지 여부 판단 가능. 보통 5mm 이상이 되어야 발견되고 심장 뒤쪽, 뼈와 겹치는 부위 등은 위치에 따라 보이지 않을 수 있음 |
|
저선량 CT (Low Dose Computed tomography) |
보다 정교한 검사법. 폐나 림프절 그리고 다른 기관에 대한 해상도가 높기 때문에 암의 원발 부위 및 림프절 침범 등 병의 진행 정도 파악에 도움. 폐암의 발견 및 병기 판정에 필수 |
|
객담 세포진 검사 (Sputum examination) |
가래에 섞인 세포 속에서 암세포를 발견해 내는 검사법. 가능한 한 이른 아침에 가래를 용기에 넣어 마르지 않게 한 후 제출. 매번 암세포가 섞여 있는 것이 아니기 때문에 3회 정도 검사 필요 |
|
기관지 내시경 검사 (Bronchoscopy) |
기관지 내시경을 통하여, 기관지 내 암조직의 침범 여부 확인. 떼어낸 조직을 검사하여 암 확진 가능. 암의 진단뿐만 아니라 암의 기관지 침범 정도를 확인하여 수술 등 치료 계획을 세우는데 도움을 줌 |
|
경피적 미세침흡인세포검사 (Percutaneous microimmune aspiration cell examination) |
국소마취를 한 후에 피부를 통해서 폐암에 바늘을 찔러 폐암의 조직이나 세포를 얻어서 하는 조직검사. 실제로 폐암 유무를 판명해 낼 수 있는 검사 |
| 병기 판정을 위한 추가 검사 |
폐암으로 확진된 환자에게 치료를 시작하기 전에 병기 판정을 위하여 추가로 시행하는 검사 - 전신 골스캔, 뇌 자기공명영상 (MRI) - 전신 양전자방출단층촬영 (PET) - 종격동 내시경, 초음파 기관지 내시경 |
|
종양마커 검사법 (CEA, Cyfra21-1, NSE, SCCA, SLX, proGRP ) |
한 종류의 종양 마커를 정성/정량 분석하여 진단하는 검사법 (비소세포성암 진단: CEA, Cyfra21-1 / 편평상피암 진단: Cyfra21-1 / 소페성폐암 진단:proGRP) |
| (출처 : 당사 제시) |
하지만, 영상진단인 Chest CT와 Low-Dose CT의 경우 96.4%의 높은 위양성률과 방사선 노출에 따른 부작용이 우려되고 있어, 혈액을 이용한 진단에 대한 요구가 지속적으로 커지고 있는 상황입니다.
이러한 시장 상황을 배경으로 당사는 편의성과 유효성 모두를 충족시킬 수 있는 액체생검을 통한 조기 암 진단의 수요가 있을 것으로 예상하고 2016년 식약처 확증 임상시험 계획 승인에 따라 7종의 바이오마커를 이용하여 정상인 200명, 폐암환자 200명을 대상으로 임상시료들을 분석하여 민감도 68.5%, 특이도 83.0% (나이 55세 이상, 흡연력 30갑년 이상 고위험군의 경우는 민감도 73.3%, 특이도 90.5%)의 결과를 얻어 높은 성능의 진단 결과를 확인함으로써 2017년 9월에 식약처로 부터 품목허가를 승인받았습니다.
| [AptoDetect™-Lung 제품 구성] |
 |
|
ADL 제품구성(A-B set) |
| 구분 | AptoDetect™-Lung PCR (
폐암 조기진단)
|
| 적응증 | 폐암 조기진단 |
| 작용기전 | 폐암 특이적 바이오마커 5종 이하 단백질을 혈액에서 측정하여 위험도 제공 |
| 제품의 특성 |
- 정상인 및 폐암 발병 고위험군 대상 조기진단 정보 제공 1그룹: 정상인 대상 폐암 선별 검사
2그룹: 폐 결절이 발견된 환자 대상 폐암 선별 검사
- 혈액에서 5종이하 단백질 측정, 알고리즘을 통한 점수화 (score 0~10)
- 폐암 진단 가이드 및 폐암 위험도 정보 제공
- 극미량의 검체시료로 분석 가능 (혈청, 5μl)
|
| 진행경과 |
- 폐암 특이적 마커를 포함한 classifier 확정 - 임상시료 분석을 통한 알고리즘 진단 성능 확보 이후 최적화 진행
- 기존 알고리즘 개선 및 최적화 진행 중
- 식약처 수출용 품목허가 획득 (2024.03) |
| 향후계획 |
- 인도, 중국 현지 임상진행 및 품목허가 획득
- 동남아시아 국가 진출 및 판매 |
| 경쟁제품 | - EarlyCDT®-Lung (7종 자가항체 측정), Epi-prolung® (2종 DNA 메틸화 측정) 등 경쟁제품 대비 정확도/검사시간에서 강점보유
|
| 관련논문 등 | - Clinical Validation of a Protein Biomarker Panel for Non-Small Cell Lung cancer. J Korean Med Sci. (2018) 33(53):e342 - Development of a Protein Biomarker Panel to Detect Non Small-Cell Lung Cancer in Korea, Clin Lung Cancer. (2017) Mar;18(2):e99-e107. - Validation of a blood protein signature for non-small cell lung cancer, Clin Proteomics. 2014; 11(1): 32 - Unlocking biomarker discovery: large scale application of aptamer proteomic technology for early detection of lung cancer, PloS ONE. (2010) Dec; 5(12): e15003 |
| 기타사항 |
AptoDetectTM-Lung
제품과 동일한 AptoMIA 기술을 활용해 PCR버전 개발
- Luminex 장비가 아닌 장비 보급이 상대적으로 쉬운 PCR 장비를 활용
- 바이오마커수: 7종에서 5종으로 줄여 1개의 웰(well)에서 분석 가능
- 국내 식약처 허가 목적보다는 해외 수출용 목적으로 개발 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
의 검사과정은 다음과 같습니다. ① 폐 결절이 발결된 환자의 혈액 (Serum)을 이용하여,
② 혈액 내 7종 단백질과 압타머가 결합하여 단백질 농도를 압타머 농도로 변환하고,
③ 비드 마이크로어레이 법 (Liquid bead microarray)을 이용하여 압타머 농도를 측정하게 됩니다. 그리고
④ 진단 알고리즘을 통해 폐암 위험도 정보를 0~10점으로 산출하게 되며, 5점 미만은 저위험, 5점이상은 고위험으로 판단합니다.
| [AptoDetect™-Lung 검사 및 분석 과정] |
 |
|
비소세포폐암 위험도 검사 수행절차 |
 |
|
ADL 분석과정 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
은 하나의 키트에 ALUC-1024 (16 테스트/키트), ALUC-1048 (40 테스트/키트), ALUC-1096 (88 테스트/키트) 3가지로 구성되어 있으며, 당일 검사하면 익일 오전에 결과를 확인할 수 있게 됩니다. 현재는 수탁의료기관 1곳에서 검사를 진행하고 있으며, 일주일에 1번 매주 화요일 1주일간 확보된 혈액 검체를 사용하여 검사를 진행하고 있습니다. 분석이 완료되면, 해당 검사 결과는 보고서를 통해 의뢰한 각 병원으로 전달됩니다.
AptoDetect™-Lung은 보건복지부 평가 유예 신의료기술에 선정(보건복지부 고시 제 2022-174호)되어 비급여로 병원에서 사용이 가능하게 되었습니다. 이에 따라 상급종합병원 4곳에서 비급여 코드를 확보하고 처방을 시작하였으며, 다기관 임상을 통해 2023년 6월 이후 1500건의 실증사례를 쌓았습니다. 평가 유예 신의료기술 제도는 2년간 유효하여 2024년 기한이 종료될 예정이나, 2024년 4월에 발표된 제2차 국민건강보험 종합계획 시행계획에 따라, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 시행될 예정입니다. 개선안의 시행에 따라, 당사의 AptoDetect™-Lung
제품은 2026년까지 2년간 추가적으로 비급여로 병원에서 사용 가능할 것으로 예상하고 있습니다. 다만, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 올해 내 시행되지 않을 경우, 비급여 처방이 일시적으로 중단될 수 있는 위험이 존재합니다.
그외 해외시장 진출을 위해 qPCR 방식의 제품인 AptoDetect™-Lung PCR 7의 수출용 품목허가를 획득하였으며(2024년 3월), 인도 의료기기 유통사와 현지 생산시설 구축 및 인허가 추진을 위한 MOU를 체결하였습니다(2024년 5월). 현재는 인도 중앙의약품표준관리국(CDSCO) 인증병원에 임상 IRB를 제출하였으며, 승인받은 이후 임상연구를 진행할 계획입니다.
그밖에 중국, 베트남 기업에 AptoDetect™-Lung PCR 7 도입을 제안하고 검토결과를 기다리고 있으며, 미국 시장의 경우 CLIA 연구실을 확보한 기업과 협업하여 LDT 서비스 형태로 진출을 논의하고 있습니다.
당사가 영위하고 있는 액체 생검을 활용한 암 조기 검진 시장은 아직까지 활성화 되지 않은 새로운 시장으로 정부 정책 변화, 치료제나 다른 검진 방법의 기술 개발 등의 다양한 이유로 시장의 성장세가 저조하거나 위축되는 경우 당사의 영업 활동 및 수익성에 부정적인 영향을 줄 수 있습니다.
| 사. 폐암 조기진단 제품에 대한 경쟁 상황의 변화에 따른 목표 시장 점유율 감소 폐암 조기 진단 시장에서 경쟁 제품 대비 경쟁력 확보를 위해서는 높은 임상성능, 검사의 간편성, 높은 순응도 그리고 비용 등이 가장 중요한 요소들입니다. 당사의 제품은 고감도 압타머와 최적화된 체외진단 다지표 기술을 활용하여 모방하기 어려우며 기술적 및 사업적 진입장벽이 높다고 할 수 있습니다. 당사는 높은 경쟁력 유지를 위해 지속적인 연구개발을 하고 있으나 , LDCT등의 현재 진단 기술이 발전함으로써 현재 단점을 보완하거나 국내외적으로 당사 제품보다 우수한 경쟁력을 가진 새로운 제품이 출현하는 경우, 이들과 경쟁해야 하므로 목표시장에서 점유율이 축소되어 당사의 수익성 및 매출에 부정적인 영향을 미칠 수 있습니다. 또한, 당사가 보유하고 있는 일부 압타머 관련 기술자산 및 특허는 라이선스 계약등을 통하여 취득한 것입니다. 당사는 포항공대 산학협력단 및 현대아산병원과 체결한 라이선스 계약에 따라 수익이 발생하게 되면 매출액의 일부를 경상기술료로 Licensor에게 배분해야 하기 때문에 이와 같은 수익 배분의무는 당사의 향후 수익성에 부정적인 영향을 미칠 수 있습니다. |
폐암은 전 세계적으로 매년 200만 명이 발병하고, 180만 명이 매년 사망하는 사망률 1위 암으로, 우리나라에서는 매년 약 2만 명이 신규 발생하고 있습니다. Research And Market(2023)에 의하면 폐암 진단 시장 규모는 전 세계 기준 2022년에 23.3억 달러(약 3조1000억원)로 추산되며, 매년 8.2% 성장하여 2030년 43.6억 달러(약 5조8000억원)로 증가할 것으로 예상됩니다.
| [전 세계 암종별 발생률] |
 |
|
전 세계 암종별 발생률(2020) |
| (출처: Global Cancer Observatory, 2023) |
국내의 경우 국립암센터에서 보고한 2022년 주요암 사망 분율에 따르면, 전체 사망자 약 37.3만명의 22.4%인 약 8.3만명이 암으로 사망했으며 이들 중 폐암 사망자는 22.3%인 약 1.9만명입니다. 국내 암 사망자수에서도 폐암이 1위를 차지하고 있습니다.
폐암의 가장 큰 발병 원인으로는 흡연이 대표적인데, 최근에는 비흡연자에게서도 폐암 발병률이 증가하고 있습니다. 특히, 미세먼지는 1급 발암물질로 분류되었으며, 갈수록 악화되는 대기오염은 조기사망에 이를 만큼 심각한 폐질환의 원인으로 대두되고 있습니다. 조리시 발생하는 요리매연(cooking fume)으로 인한 여성 폐암 발병률 또한 증가하는 추세입니다.
특히 폐암은 자각증세가 없어 예후가 매우 나쁜 암으로써 4기에 진단시 진단 후 5년 생존율이 10% 미만이지만, 수술이 가능한 조기단계 발견 시 5년 생존율이 60% 이상 까지 상승하기에 조기진단에 대한 수요는 지속해서 증가할 것으로 예상됩니다. 이처럼 폐암의 5년 생존율이 낮은 원인은 폐암을 초기에 진단할 수 있는 마땅한 진단기술이 없기 때문이며, 액체 생검을 통한 조기 진단이 가장 필요한 영역으로 볼 수 있습니다.
당사의 주력제품인 폐암 조기진단 제품(AptoDetect™-Lung)의 경우, X-ray나 LDCT(저선량 CT) 등 기존에 주로 사용되던 검사법 등이 1차 경쟁자가 될 수 있으나, 이들은 정확도가 떨어지거나 높은 위양성 등 성능이 미흡한 문제점들이 존재합니다. 특히, 향후 확대될 것으로 예상되는 국가암검진 사업의 LDCT와 관련해 LDCT상 폐결절이 발견된 대상자를 상대로 당사의 폐암 조기 진단 제품을 통해 폐암 위험도 정보를 제공하여 불필요한 후속검사를 줄일 수 있을 것으로 예상됩니다.
| [폐암 진단시 생존율 비교] |
 |
|
Lung cancer stage at diagnosis |
| (출처 : Impact of lung cancer screening on stage migration, Cancer 2024) |
폐암을 진단하는 단계는 크게 4가지로 나눌 수 있습니다.
① 고위험군을 포함하는 스크리닝(screening),
② 폐 결절 환자의 진단보조,
③ 수술 후 치료를 위한 동반진단, ④ 수술 후 모니터링으로 구분할 수 있으며, 주로 스크리닝과 폐 결절 환자의 진단보조, 수술 후 치료를 위한 동반진단이 주된 시장을 형성하고 있습니다.
첫째, 고위험군 포함 스크리닝 시장은 가장 큰 진단 시장을 형성할 것으로 예상되지만, 그만큼 국가별 식약처의 품목허가를 받는 것은 어려운 것이 현실입니다. 중국 Hanzhou Kaibao Biotechnology사의 The 7-AABs panel 검사가 2020년 중국 NMPA(국가약품감독관리국)로부터 승인을 받은 것이 전부이며, 현재까지 국내외 식약처로부터 품목허가를 받은 제품은 없는 상황입니다.
식약처 품목허가를 받지 않았지만, LDT 형태로 서비스를 진행하고 있는 회사는 다음과 같습니다. 영국의 Oncimmune사의 EarlyCDT-Lung과 미국 Genesys Biolabs의 PAULA’s TEST, 미국 Grail사의 Galleri, 미국 Natera사의 Signatera for Lung Cancer 등이 있습니다. 국내에서는 식약처 품목허가를 받지 않았지만 건강검진 목적으로 사용 중인 아이엠비디엑스사의 캔서파인드 등이 있습니다. 이외에도 바이오마커인 자가항체, ctDNA, Protein, CTC 분석 등을 사용하여 스크리닝 목적으로 폐암을 진단하는 회사 등이 있습니다.
| [폐암 스크리닝 시장 주요제품] |
| 구분 | 제품명 | 회사명/국가 | 현황 | 사용목적 | 적용 기술 |
| Protein | AptoDetect™-Lung / PCR 7 |
압타머사이언스 (한국) |
식약처 허가 (상급종합병원 비급여 처방, 검진센터 서비스) 수출용 품목허가 (PCR) |
폐결절 환자 진단 보조 / 고위험군 스크리닝 |
단백질 측정, 진단 알고리즘 |
| i-Finder LC |
바이오인프라생명과학 (한국) |
임상 중 / 서비스 중 |
스크리닝 | 단백질 측정 | |
| OncoCatch-S |
이원다이애그노믹스 (한국) |
임상 중 | 스크리닝 | 제한효소법, DNA 메틸레이션 |
|
| Aabs | EarlyCDT-Lung |
Oncimmune (영국) |
LDT (서비스 중) |
고위험군 스크리닝 |
자가항체 측정, 진단 알고리즘 |
| PAULA’s TEST | Genesys Biolabs (미국) |
LDT (서비스 중) |
고위험군 스크리닝 | 항원, 자가항체 측정 |
|
| The 7-AABs panel2 |
Hanzhou Kaibao Biotechnology (중국 |
2020 NMPA 승인 (서비스 중) |
고위험군 스크리닝 + 폐결절 환자 진단보조 |
자가항체 측정, 진단 알고리즘 |
|
|
ctDNA / cfDNA |
SHIELD Lung | Guardant Health (미국) |
FDA 허가용 임상중 (25년 완료 계획) |
스크리닝 | ctDNA 측정 |
| Galleri | Grail (미국) |
LDT (서비스 중) |
다수 암종 스크리닝 | cfDNA 측정 |
|
| Firstlook Lung |
Delfi Diagnostics (미국) |
LDT (서비스 중) |
스크리닝 |
cfDNA pattern 분석, AI 기반 |
|
| Cancerseek |
Thrive / Exact Sciences |
FDA 승인 |
8가지 암 Screening |
ctDNA 측정/ 단백질 측정 |
|
|
AlphaLiquid® Screening (캔서파인드TM) |
IMBdx (한국) |
검진센터 서비스 중 | 스크리닝 | 암 관련 유전자 검사 | |
|
ai-CANCERCH (아이캔서치) |
GC지놈 (한국) |
검진센터 서비스 중 | 6가지 암 스크리닝 | ctDNA 분석, AI 알고리즘 |
|
| 유기화합물 | Cancerbox | 씨디바이오 (한국) |
식약처 허가진행중 | 스크리닝 |
유기 화합물 (VOCs) 측정 |
| (출처 : 당사 제시) |
둘째, 폐 결절 환자의 진단보조는 X-Ray, ChestCT, Low-Dose CT (LDCT)를 통해 폐 결절이 발견된 환자를 대상으로 진단하는 시장입니다. 현재 국내 식약처 허가를 받은 제품은 당사의 AptoDetectTM-Lung
이 유일합니다. 국내외 여러 기업들이 해당 시장에 진출하고자 임상시험을 진행하고 있으나, 현재까지 당사외에 승인을 받은 기업은 없습니다.
셋째,
수술 후 치료를 위한 동반진단은 폐암 치료제 적응증 여부를 확인하기 위한 진단으로 사용되고 있습니다. 동반진단이란 특정 환자의 치료에 의약품을 사용하기 위해 약물의 반응성 및 안전성을 미리 예측하기 위한 검사입니다. 동반진단 시장은 일반 스크리닝 시장보다 작으며, 한정된 대상에게만 활용되는 까닭입니다. 스위스 Roche 진단의 Cobas EGFR Mutation Test가 대표적이며, 국내에서는 HLB파나진사의 PANAMutyper™ R EGFR
과 젠큐릭스사의 GenesWell ddEGFR Mutation test 동반진단 키트가 있습니다. 이외에도 KRAS, BRAF, ROS1 등의 바이오마커를 진단하여 치료제 적응증 여부를 판단하고 있습니다. 시장 규모는 첫번째와 두번째보다 작지만, 치료제를 처방하기 위해서는 반드시 사전 검사가 필요한 만큼 꾸준히 성장하고 있습니다.
| [폐암 동반진단 시장 주요제품] |
| 동반진단방법 | 바이오마커 | 동반진단기기 | 회사명 |
|
면역조직화학염색법 (IHC) |
ALK | ALK CDx |
Ventana Medical System |
| PD-L1 | PD-L1 IHC (22C3, 28-8) PharmDx |
Dako North America |
|
| Ventana PD-LI (SP142, SP263) assay |
Ventana Medical System, 한국로슈진단 |
||
| 중합효소연쇄반응법 (PCR) |
KRAS |
Therascreen KRAS RGQ PCR Kit |
Qiagen Manchester |
| EGFR |
Therascreen EGFR RGQ PCR Kit |
||
|
THxIDTM BRAF Kit Cobas EGFR Mutation Test |
Roche Molecular Systems |
||
|
GenesWell ddEGFR Mutation Test,
|
젠큐릭스 | ||
| PNAClampTM |
HLB파나진 | ||
| c-MET | Droplex cMET Exon 14 skipping
|
젠큐릭스 | |
| NGS | EGFR, ALK, BRAF, MET | FoundationOne CDx (F1 CDx) |
Foundation Medicine |
| EGFR, ALK, BRAF, RET, ROS1 | Oncomine Dx |
Life Technologies |
|
|
90genes/cfDNA |
Guardant360® CDx |
Guardant Health | |
| 현장혼성화법(ISH) |
ALK |
Vysis ALK Break Apart FISH |
Abbott Molecular |
|
액상생검 (Liquid Biopsy) |
PD-L1 | CTC PD-L1 Detection | 싸이토젠 |
| (출처 : 당사 제시) |
| [당사의 폐암조기진단키트와 경쟁제품 비교] |
| 구분
|
압타머사이언스
|
아이엠비디엑스
|
|
| 제품명 |
AptoDetect™-Lung (압토디텍트 렁)
|
CancerFind™ (캔서파인드)
|
|
| 품목명 |
종양표지자면역검사시약 (K02080.01) |
종양관련유전자검사시약 (N02030.01) |
|
| 사용목적 |
폐 결절 환자를 대상으로 폐암의 위험도를 0~10점으로 제공 |
암 특이적인 패턴 선별 등 4대기술을 적용하여 8개 암종 예측정보 제공 |
|
|
식약처 허가번호 |
체외제허 17-748호 (3등급 의료기기)
|
없음 |
|
| 분석검체 |
혈액 내 7개 단백질 (C9, CA6, EGFR1, MMP7, SERPINA3, Kit, CRP) |
혈액 내 ctDNA (마커 비공개)
|
|
| 검체사용량 |
Serum 5ul |
10mL (Serum or Plasma 비공개)
|
|
| 분석장비 |
Luminex200 system (미국 Luminex社)
|
NGS (제조사 비공개)
|
|
| 병원 |
처방 |
서울아산병원, 경희의료원 |
없음 |
| 건강검진 |
분당차병원 및 일부 의원 |
하나로의료재단, 효산의료재단 등 |
|
| 검사가 |
24만원 이내 |
120만원 이내 |
|
| 비고 |
평가 유예 신의료기술 (보건복지부 2022-174호)
|
AlphaLiquid 100 수출용 품목허가, 체외제허22-227호
|
|
| (출처 : 당사 제시, 아이엠비디엑스 사업보고서) |
넷째, 수술 후 모니터링 시장은 국내외 기업들이 임상시험을 진행하고 있지만, 아직까지 승인을 받은 기업은 없습니다. 미국 Natera 사의 Signatera for Lung Cancer는 현재 LDT 서비스로 진행 중이며, 디앤피바이오텍의 DNP Lung은 임상시험을 진행하고 있습니다.
이와 같이 폐암 진단 시장은 미충족 의료 수요가 높지만, 다양한 발병 원인으로 인해 바이오마커를 특정하기 어려워 진단하는 것이 쉽지 않습니다. 현재 임상시험을 통해 국가별 식약처로부터 품목승인을 받는 것은 더욱 어려운 상황입니다.
| [폐암의 액체 생검 시장 성장추세] |
 |
|
Lung cancer liquid biopsy market 2023-3033 |
| (출처 : Lung cancer biopsy market, 2024.05) |
이러한 시장 상황을 배경으로 당사는 편의성과 유효성 모두를 충족시킬 수 있는 액체생검을 통한 조기 암 진단의 수요가 있을 것으로 예상하고 2016년 식약처 확증 임상시험 계획 승인에 따라 7종의 바이오마커를 이용하여 정상인 200명, 폐암환자 200명을 대상으로 임상시료들을 분석하여 민감도 68.5%, 특이도 83.0% (나이 55세 이상, 흡연력 30갑년 이상 고위험군의 경우는 민감도 73.3%, 특이도 90.5%)의 결과를 얻어 높은 성능의 진단 결과를 확인함으로써 2017년 9월에 식약처로 부터 품목허가를 승인받았습니다.
| [AptoDetect™-Lung 제품 구성] |
 |
|
ADL 제품구성(A-B set) |
| 구분 | AptoDetect™-Lung PCR (
폐암 조기진단)
|
| 적응증 | 폐암 조기진단 |
| 작용기전 | 폐암 특이적 바이오마커 5종 이하 단백질을 혈액에서 측정하여 위험도 제공 |
| 제품의 특성 |
- 정상인 및 폐암 발병 고위험군 대상 조기진단 정보 제공 1그룹: 정상인 대상 폐암 선별 검사
2그룹: 폐 결절이 발견된 환자 대상 폐암 선별 검사
- 혈액에서 5종이하 단백질 측정, 알고리즘을 통한 점수화 (score 0~10)
- 폐암 진단 가이드 및 폐암 위험도 정보 제공
- 극미량의 검체시료로 분석 가능 (혈청, 5μl)
|
| 진행경과 |
- 폐암 특이적 마커를 포함한 classifier 확정 - 임상시료 분석을 통한 알고리즘 진단 성능 확보 이후 최적화 진행
- 기존 알고리즘 개선 및 최적화 진행 중
- 식약처 수출용 품목허가 획득 (2024.03) |
| 향후계획 |
- 인도, 중국 현지 임상진행 및 품목허가 획득
- 동남아시아 국가 진출 및 판매 |
| 경쟁제품 | - EarlyCDT®-Lung (7종 자가항체 측정), Epi-prolung® (2종 DNA 메틸화 측정) 등 경쟁제품 대비 정확도/검사시간에서 강점보유
|
| 관련논문 등 | - Clinical Validation of a Protein Biomarker Panel for Non-Small Cell Lung cancer. J Korean Med Sci. (2018) 33(53):e342 - Development of a Protein Biomarker Panel to Detect Non Small-Cell Lung Cancer in Korea, Clin Lung Cancer. (2017) Mar;18(2):e99-e107. - Validation of a blood protein signature for non-small cell lung cancer, Clin Proteomics. 2014; 11(1): 32 - Unlocking biomarker discovery: large scale application of aptamer proteomic technology for early detection of lung cancer, PloS ONE. (2010) Dec; 5(12): e15003 |
| 기타사항 |
AptoDetectTM-Lung
제품과 동일한 AptoMIA 기술을 활용해 PCR버전 개발
- Luminex 장비가 아닌 장비 보급이 상대적으로 쉬운 PCR 장비를 활용
- 바이오마커수: 7종에서 5종으로 줄여 1개의 웰(well)에서 분석 가능
- 국내 식약처 허가 목적보다는 해외 수출용 목적으로 개발 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
의 검사과정은 다음과 같습니다. ① 폐 결절이 발결된 환자의 혈액 (Serum)을 이용하여,
② 혈액 내 7종 단백질과 압타머가 결합하여 단백질 농도를 압타머 농도로 변환하고,
③ 비드 마이크로어레이 법 (Liquid bead microarray)을 이용하여 압타머 농도를 측정하게 됩니다. 그리고
④ 진단 알고리즘을 통해 폐암 위험도 정보를 0~10점으로 산출하게 되며, 5점 미만은 저위험, 5점이상은 고위험으로 판단합니다.
| [AptoDetect™-Lung 검사 및 분석 과정] |
 |
|
비소세포폐암 위험도 검사 수행절차 |
 |
|
ADL 분석과정 |
| (출처 : 당사 제시) |
AptoDetect™-Lung
은 하나의 키트에 ALUC-1024 (16 테스트/키트), ALUC-1048 (40 테스트/키트), ALUC-1096 (88 테스트/키트) 3가지로 구성되어 있으며, 당일 검사하면 익일 오전에 결과를 확인할 수 있게 됩니다. 현재는 수탁의료기관 1곳에서 검사를 진행하고 있으며, 일주일에 1번 매주 화요일 1주일간 확보된 혈액 검체를 사용하여 검사를 진행하고 있습니다. 분석이 완료되면, 해당 검사 결과는 보고서를 통해 의뢰한 각 병원으로 전달됩니다.
AptoDetect™-Lung은 보건복지부 평가 유예 신의료기술에 선정(보건복지부 고시 제 2022-174호)되어 비급여로 병원에서 사용이 가능하게 되었습니다. 이에 따라 상급종합병원 4곳에서 비급여 코드를 확보하고 처방을 시작하였습니다. 평가 유예 신의료기술 제도는 2년간 유효하여 2024년 기한이 종료될 예정이나, 2024년 4월에 발표된 제2차 국민건강보험 종합계획 시행계획에 따라, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 시행될 예정입니다. 개선안의 시행에 따라, 당사의 AptoDetect™-Lung
제품은 2026년까지 2년간 추가적으로 비급여로 병원에서 사용 가능할 것으로 예상하고 있습니다. 다만, 혁신적 의료기기의 선진입 체계 단기 개선(안)이 올해 내 시행되지 않을 경우, 비급여 처방이 일시적으로 중단될 수 있는 위험이 존재합니다.
AptoDetect™-Lung
제품은 2가지 방식으로 매출이 발생하고 있습니다. 첫째는 위에서 언급했던 평가 유예 신의료기술 적용에 따라 비급여 처방을 받아 검사가 진행되는 경우이고, 다른 하나는 건강검진 목적으로 검사를 진행하는 경우입니다.
건강검진 목적으로는 흡연자, 간접흡연, 미세먼지, 조리흄 등으로 인해 본인이 검사를 희망하는 정상인을 대상으로 진행하고 있으며, 현재는 분당차병원의 폐정밀 항목을 통해 검사가 시행되고 있습니다. 해당 검사는 2024년 7월에 최초 시행되었습니다.
당사는 최근 3년간 제품 매출이 부진했던 이유를 다음과 같이 분석하고 있습니다. ① 평가 유예 신의료기술이 당사 예상보다 늦게 시작된 점, ② 3차 상급종합병원 내 비급여 코드 확보에 많은 기간이 소요된 점, ③ 현재 진행 중인 다기관 임상시험 병원이 국내 주요 병원으로 비급여 처방을 통한 매출보다 임상검체 확보에 중점을 두고 있는 점, ④ 2024년 건강검진 시장에 진출하고자 했으나, 의료상황이 급변하며 건강검진 목적의 검사를 확보하고자 했던 병원에서의 도입이 지연된 점 등입다.
결과적으로 가장 큰 원인이 초기 시장 진입 전략(Market access strategy) 수립시 급여시장 진입만을 목표로 하고 건강검진시장을 뒤늦게 준비한 것입니다. 이러한 시장진입시 준비가 충분치 않았던 사유로 인해 기대했던 매출이 발생하기까지 예상보다 오랜 기간이 걸리고 있으며, 이에 따른 진단사업 본격화까지 사업화 지연, 수탁기관과의 계약관계로 인한 매출 지연 등의 위험이 존재합니다.
또한, 당사는 높은 경쟁력 유지를 위해 지속적인 연구개발을 하고 있으나, LDCT 등의 현재 진단 기술이 발전함으로써 현재 단점을 보완하거나 국내외적으로 당사 제품보다 우수한 경쟁력을 가진 새로운 제품이 출현하는 경우, 이들과 경쟁해야 하므로 목표시장에서 점유율이 축소되어 당사의 수익성 및 매출에 부정적인 영향을 미칠 수 있습니다.
| 아. 각 국가의 정책 및 규제 변화에 따른 위험 세계 주요국에서는 최근 글로벌 보건위기를 극복한 이후에 제약 바이오 산업을 미래 핵심 산업으로 인식하고 자국산업 경쟁력 강화, 의약품 공급망 안정, 국제협력 강화 등을 중점으로 지원 및 육성 전략을 수립하고 제약 바이오산업의 고도화를 통해 글로벌 기술 패권을 확보하려 하고 있으며, 우리나라도 2013년 이후 5년 주기로 이러한 각국의 생명공학 관련 정책 및 글로벌 기술산업의 변화를 파악하고 제약 바이오 산업 지원 육성 전략을 발표하고 추진하고 있습니다. 그러나, 정책지원이 조속히 실행되지 않거나, 정부 지원이 축소될 가능성이 있습니다. 정책 혹은 규제의 변동에 따라 당사의 신약 개발 일정이 지연될 수 있으며, 기술이전 지연, 마일스톤 미달성 등에 따라 매출이 감소할 수 있습니다. 당사는 이러한 바이오 제약 산업의 글로벌 주요국의 정책과 지원 내용을 면밀히 파악하고 리스크를 최소화하고 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 하고 있지만, 그럼에도 불구하고 국내외 정책 등의 변동에 따른 위험이 존재하오니 투자자께서는 이러한 위험에 대해 유의하시기 바랍니다. |
제약바이오산업은 미래 성장 산업으로 각국 정부가 육성 정책을 시행하는 동시에, 환자 보호를 위해 인허가 및 약가 결정에 엄격하게 개입하는 특성을 가지고 있습니다. 신약 개발은 긴 투자 기간과 높은 위험을 수반하지만, 성공시 막대한 가치 창출과 공공적 가치를 달성할 수 있습니다. 이를 통해 국민에게 양질의 의약품을 제공하고, 삶의 질 향상에 기여할 수 있습니다. 또한, 제약산업은 지속적인 인력 채용을 통해 양질의 일자리 창출을 선도하고 있으며, 전 산업 평균 부가가치율을 크게 상회하고 있습니다.
대외경제정책연구원에서 2024년 3월 발표한 '제약바이오 산업분야 글로벌 기술패권 경쟁현황과 우리 나라의 대응' 보고서에 의하면, 글로벌 보건위기로 제약바이오 산업의 전략적 가치에 대한 인식이 이루어졌으며, 해당 산업 육성 및 지원을 위한 국가 차원의 투자가 활발해지고 있습니다.
미국의 '국가 생명공학 및 바이오 제조 이니셔티브' 행정명령(2022년 9월), EU의 '생명공학 및 바이오 제조 이니셔티브' (2024년 3월), 중국의 '14차 5개년 바이오 경제발전 계획'(2022년 5월) 등은 필수 의약품 및 바이오 산업 관련 자국내 생산기반 확충이 목적입니다. 우리 나라 역시 2023년 3월 '제3차 제약바이오 산업 육성 지원 종합계획(2023-2027)'을 마련하고 2023년 5월 제약바이오 산업을 국가첨단전략산업으로 지정하는 등 해당 산업에 대한 지원을 확대하고 있습니다.
| [미국 생명공학 및 바이오 제조 이니셔티브의 추진목표별 주요 내용] |
| 추진목표 |
주요 내용 |
| 국내 바이오 제조역량 강화 |
-자국내 인프라 부족으로 인한 제조설비의 해외 이전을 막기 위해 지원책 제공
|
| 바이오 기반 제품에 대한 시장 기회 확대 |
-공공조달 기준에 바이오 선호 프로그램(BioPreferred Program)을 추가하여 석유기반 제품에 대한 대안 제시
|
| 전 사회적 도전과제 해소를 위한 연구개발 지원 |
-전 사회적 도전과제 해소를 위한 연구개발 사례로 코로나19 팬데믹 기간 동안 최초의 mRNA백신 개발 제시
|
| 연방 데이터에 대한 접근성 향상 |
-생명공학과 대규모 컴퓨팅 및 인공지능 등을 결합하여 바이오 경제 성장 기반 확충
|
| 숙련 인력 양성 |
-생명공학 및 바이오 제조 분야 교육 훈련 기회 확대
|
| 생명공학 제품에 대한 규제 간소화 |
-생명공학 제품에 대한 규제 절차의 명확성 및 효율성 개선
|
| 바이오 안전 및 바이오 안보 강화 |
-바이오 안전(Biosafety) 관련 응용 연구에 대한 투자 활성화
|
| 생명공학 생태계 보호 |
-바이오 데이터에 대한 개인정보 보호 표준 및 관행 개선
|
| 국제협력 |
-기후변화, 보건안보 등 글로벌 도전과제 해결을 위해 생명공학 및 바이오 제조 활용
|
| (출처: 대외경제정책연구원 “제약 바이오산업 분야 글로벌 기술패권 경쟁현황과 우리나라의 대응” 보고서 내용 발췌, US White House(2022.9.12), “FACT SHEET: President Biden to Launch a National Biotechnology and Biomanufacturing Initiative”) |
미국 바이든 행정부는 취임 한달 후부터 의약품 및 보건산업 분야의 안정적인 공급망 구축을 목표로 실태 점검 및 정책 제안 보고서를 지속적으로 작성 발표하고 있으며, 지정학적 및 자연재해 위험 노출, 공급망 모니터링 미흡 등을 해소하기 위해 재고 비축, 리쇼어링/프렌드 쇼어링 지원, 의약품 관련 데이터 수집 강화, 동맥구과의 협력 확대 등을 정책 과제로 제시하고 있습니다.
후속 조치로 총 20억 달러 규모의 예산을 투입하여 바이오산업 제조인프라 (10억 달러)와 생명과학 바이오 제품 및 재료 분야 연구개발 (1.8억 달러), 필수의약품 생산 및 원료의약품 제조역량(0.4억 달러) 등을 지원하는 정책을 밝혔습니다.
유럽은 EU 집행위원회에서 미국의 바이오이니셔티브에 대응하는 바이오제약산업에서 유럽의 리더십 확보를 위해 규제 완화, 새로운 치료법 및 맞춤형 개발, 임상시험 환경 조성, 재원 조달 등의 과제를 제시하였고 신기술에 대한 세제지원, 규제 완화, 유럽투자은행(EIB)를 활용한 자금조달, 다국가 프로젝트 추진 등의 내용이 포함되었습니다. 아울러 의료 위기 대응 자금지원 확대, 인력양성 및 사이버개발 지원을 위한 기술 클러스터 조성, 핵심사업, 기술 및 산업공정 발굴 및 지원등의 필요성이 강조되고 있습니다. 또한 EU 집행위는 'EU바이오 제조법 (EU Biomanufacturing Act)'을 제정하여 생명공학 기반 제품 수요 확대 및 지식재산권 보호 강화를 추진하고 있습니다.
중국은 2015년 '중국제조 2025'추진을 통해 기존 제네릭 의약품 위주 성장전략에서 첨단 바이오 기술 및 고성능 의료기기 분야 집중 육성으로 정책의 초점을 전환해 오고 있습니다. 2020년 10월에 발표된 '제14차 5개년 규획(2021-2025)'에서 바이오 기술을 9대 전략적 신흥산업으로 지정하여 인프라 구축 및 산업 고도화에 투자하기로 하였으며, 2022년 5월에 '바이오 경제발전 5개년 계획'에서 구체적 내용을 밝혔습니다.
바이오 경제 부가가치 향상, 바이오 산업 R&D투자를 통한 기술혁신, 바이오 기술시장 거래 활성화를 위한 규제개혁, 바이오 경제 시범구역 지정 등을 제시하였습니다. 이에 의약품, 백신, 진단 및 치료 기술 등을 포괄하는 바이오 의약분야가 바이오 경제 4대 핵심 분야 중 하나로 포함되었으며, 베이징-텐진-허베이, 양쯔강 삼각주- 광동-홍콩-마카오, 청두-충칭 등이 바이오 경제 시범구역 건설을 추진한다고 밝혔습니다.
우리나라는 '제약산업 육성 및 지원에 관한 특별법'에 따라 2013년부터 5년 주기로 제약산업 육성 지원 종합계획을 마련해 왔으며, 2023년 3월 '제3차 제약바이오 산업육성 지원 종합계획(2023-2027)'을 발표하였습니다. 이 계획에서 글로벌 블록버스터급 신약 2개 개발, 글로벌 50대 제약사 3개 육성, 의약품 수출 2배 달성, 제약바이오 산업 일자리 누적 15만개 창출, 임상시험 글로벌 3위 달성 등의 목표를 제시하였으며, 이를 위해 R&D확대, 수출지원, 인력양성, 제도인프라 개선의 4대 전략을 추진한다고 발표하였습니다.
정부 R&D투자 1조원, 민간투자 5조3,300억원까지 확대를 통해 글로벌 신약개발 가속화, 유전자 변형 세포 치료제, CAR-T 등 신기술 분야, 신변종 감염병 대응을 위한 치료제 신속개발 체계 구축, 신약개발 디지털 전환, 의약품 수출액 160억 달러 달성, 제약바이오 소부장 국산화 지원이 포함되었습니다.
| [제3차 제약바이오 육성 지원 종합계획 세부과제 목록] |
| 추진 목표 |
||
|
- 블록버스터급(연매출 1조 원 이상) 신약 창출: '22년 0개 → '27년 2개
- 글로벌 50대 제약사(연매출 3조 원 이상): '22년 0개 → '27년 3개
- 의약품 수출 2배 달성: '22년 81억 달러 → '27년 160억 달러
- 제약바이오 산업 양질의 일자리 창출: '21년 12만 개 → '27년 15만 개(누적)
- 임상시험 글로벌 3위 달성: '21년 6위 → '27년 3위
|
||
| 4대전략 |
10대중점과제 |
세부과제 |
|
R&D 강화 |
글로벌 블록버스터 신약 창출을 위한 전략적 R&D투자 |
-신약개발 민관 R&D투자 대폭 확대
-초격차 기술확보를 통한 First Mover 전략 수립
-개방형 혁신 활성화를 위한 R&D 투자 지원
|
| 보건안보 및 사회적 요구에 대응하는 R&D투자 |
-고령화 대응 및 희귀 난치 질환 극복 R&D지원
-백신개발 역량강화릉 통한 백신 주권 확립
-신변종 감염병 대응을 위한 치료제 신속개발체계 구축
|
|
| AI빅데이터 등 신약개발의 디지털 전환촉진
|
-AI활용으로 신약개발 가속화 및 성공가능성 제고
-빅데이터 기반 신약개발 생태계 조성
|
|
|
수출 지원 |
제약바이오분야 금융지원 강화 및 창업지원 |
-메가펀드 조성을 통한 혁신신약 글로벌 지출가속화
-정책금융 투자연계 강화
-벤처창업기업 Scale-up을 위한 전주기 지원
|
| 제약바이오 산업의 핵심 수출산업화 |
-미국 행정명령 대응 및 R2R협력 강화
-수출역량 제고를 위한 맞춤형 지원 강화
-전략국가별 시장진출 지원체계 강화
|
|
|
인력 양성 |
제약바이오 산업 핵심인재 양성 |
-제약바이오 생산공정 전문인력 양성
-임상 규제과학 전문인력 양성
-디지털 바이오 융복합 전문인력 양성
|
| 제약바이오 인력양성 생태계조성 |
-아카데미 중심 핵심 전문인력 양성체계 구축
-기업-인재 매칭을 통한 적정 인재 적시투입
-글로벌 인재양성을 위한 기반구축
-국가전략산업으로의 육성을 위한 인재양성 거버넌스 구축
|
|
|
제도 인프라 개선 |
혁신 신약개발을 위한 제도 지원 |
-제약바이오 거버넌스 확립 및 규제혁신 기반 구축
-신속한 연구개발 및 제품화를 위한 허가절차 개선
-신약가치 적정보상을 위한 약가결정 및 관리제도 보완
-혁신형 제약기업 인증제도 리뉴얼
-첨단의료복합단지의 기업지원강화 및 규제개선
|
| 임상시험 글로벌 3위 달성을 위한 전략적 지원 |
-임상시험 지원제도 개선 및 인프라 확대
-임상시험 신기술 개발을 통한 첨단분산형 임상시험 체계 구축
|
|
| 의약품 밸류체인별 인프라 강화 |
-원료의약품 자급률 제고를 위한 제도적 지원강화
-제약바이오 소부장 국산화 지원
-글로벌 생산 허브 도약을 위한 제조생산 혁신
|
|
| (출처: '제3차 제약바이오 산업 육성 지원 종합계획(안)') |
정부는 성공시 경제적 파급효과가 클 것으로 기대되는 글로벌 신약개발을 포함한 첨단바이오 분야를 인공지능(AI), 양자와 함께 3대 게임체인저로 지정하여 투자를 강화할 계획입니다. 특히 첨단바이오 분야 선도국으로 도약하기 위한 국가 전략으로서 2024년 4월 첨단바이오 이니셔티브를 수립한 바 있고, 이를 바탕으로 첨단바이오 분야에 2025년 약 2.1조원 규모(2024년 약 1.8조원)의 정부 연구개발(R&D) 예산을 편성하여 다부처 협업을 기반으로 한 첨단재생의료, 데이터·인공지능 융합, 팬데믹 대비 감염병 대응 역량 강화 등에 대한 정부 연구개발(R&D) 투자를 강화하였습니다. 아울러, 바이오 분야에 디지털 기술이 활용되는 바이오 대전환기 흐름에 맞춰 신약개발 분야에 인공지능 기술과 데이터를 활용하여 신약개발 기간을 단축하고, 성공률을 높이기 위한 지원도 지속할 계획입니다. 부처간 칸막이 없이 기초연구, 물질탐색·발굴부터 임상, 사업화까지 신약개발 전주기에 대한 산·학·연·병 대상 연구개발 과제를 지원하며, 연구 주체 간 연계, 공동연구, 국내외 네트워크 구축 등을 통한 협력을 지향합니다. 또한, 신약 관련 인프라와 유기적으로 촘촘히 연계하여 연구 컨설팅, 사업화, 화학·제조·품질관리(CMC), 기술이전 계약 지원 등을 통해 각 단계별 신약개발의 성공률을 높여나갈 계획입니다.
이와 같이 국내 뿐만 아니라 최근 글로벌 주요국의 제약 바이오 산업 지원 및 육성 정책은 대체로 자국산업 경쟁력 강화, 의약품 공급망 안정, 국제협력 강화 등의 내용을 포함하고 있어, 당사는 이러한 바이오 제약 산업의 글로벌 주요국의 정책과 지원 내용을 면밀히 파악하고 리스크를 최소화하고 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 하고 있습니다.
[규제당국과 학계 동향]
한국FDC규제과학회 발표에 따르면, 우리나라 의약품의 접근성이 떨어지는 주요 이슈로 ① 의약품 도입 지연(drug lag) ② 제네릭의약품의 경쟁 제한, 시장진입과 동등성 인식 ③ 의약품 공급 부족(shortage) 등을 꼽았습니다. 2011~2019년까지 미국, 유럽, 일본에서 허가 받은 신약 365개 중 한국에서 환자가 쓸 수 있는 약은 35%에 불과한 128개이며, 이는 미국, 캐나다, 프랑스 같은 의약 선진국인 A7 국가 평균인 200개에 크게 못 미친다는 지적입니다. 항암제의 경우 A7 국가 평균이 69%인 것에 반해 한국은 45%에 불과하며, Lichtenberg의 연구에서 2005년 이후 출시된 의약품의 국가별 판매 비율로 측정한 우리나라의 신약 접근성은 31개국 가운데 19위에 머물렀습니다.
이러한 문제를 해결하기 위해 우리나라 규제당국은 ① 조건부 허가제도 ② 신속심사제도 ③ GIFT(Global Innovative products on Fast Track, 글로벌 혁신제품 신속심사) 등을 신설하고 있습니다. 신속심사, 신속허가는 신약 심사 기간을 단축시켜 중증 환자의 치료제 조기접근을 가능하게 하는 긍정적인 효과를 기대할 수 있습니다. 그러나 긍정적인 측면만 있는 것은 아니며, 근거의 불확실성 증가는 환자의 위험 노출 가능성을 증가시키고 건강보험 급여 의사결정에 어려움을 야기할 수 있습니다. 특히 조건부 허가의 경우 국내 제약사의 신뢰를 저해할 수 있다는 단점이 존재합니다. 실제로 2012~2021년까지 조건부 허가된 35품목 중 정기보고를 제출한 품목은 20%인 7개 품목 밖에 되지 않았습니다. 35품목 중 국내 개발 신약은 10개에 불과한데, 이중 조건부 허가를 받고 임상 미제출한 국내 개발 신약은 8개, 허가를 철회한 품목은 2개로, 조건부 허가 신약은 사실상 없는 셈입니다. 특히 국내 신약의 경우 식약처가 최초의 의사결정을 하게 되는데, 조건부 허가를 통해 근거가 불투명하거나 허가 처리가 명확하게 끝맺음이 이뤄지고 있지 않아 국산 신약의 검토를 강화할 것으로 예상됩니다.
| [일반적인 품목허가 심사와 수시 동반 심사 비교] |
 |
|
일반적인 품목허가 심사와 수시 동반 심사(Rolling review) 비교 |
| (출처 : 식품의약품안전처, 의약품 신속심사 보고서, 2022.09) |
[암 관련 정책 및 규제]
미국의 바이든 행정부는 보건 및 의료 분야의 공공성 및 연구경쟁력 강화를 핵심으로 하는 과학 친화적 정책을 발표하였습니다. 특히, 바이든 미합중국대통령은 오바마 재임기간 중에 '암 정복 프로젝트(Cancer
Moonshot Initiative)'의 최고책임자로서 암 정복을 위한 연구지원을 추진한 바 있습니다. 이 암 정복 프로젝트에는 지난 4년간 약 12억 달러의 예산이 투입되었으며, 총 240개 이상의 연구 프로젝트를 지원하고 있습니다. 암 정복 프로젝트의 지원 연구 분야 8가지(① 암 예방 및 백신 개발, ② 암 조기 진단, ③ 면역항암제 및 병용요법 개발, ④ 종양과 주위 세포 게놈분석, ⑤ 데이터 공유 강화, ⑥ 전문 종양센터, ⑦ 소아암, ⑧ 기타 특수 연구)로 나누어지고, 향후에도 이 프로젝트는 종양 지표 개발, 데이터에 기반한 환자 맞춤형 항암치료, 백신 개발을 통한 암 극복 토대 마련 등을 목표로 예방검진 및 진단방법의 확대, 국가 간 데이터 표준화 및 공유, 환자중심 네트워크 운영 등을 지속적으로 추진해 나갈 예정입니다. 이러한 바이든 행정부의 바이오헬스 정책 방향에 따라 글로벌 항암제 시장 규모는 확대될 전망으로 이는 우리나라 항암제 시장에도 긍정적인 영향을 끼칠 것으로 보입니다.
우리나라는 국내 사망원인 1위를 차지하는 암 질환으로 인한 고통과 피해 및 사회적 부담을 줄이고,
국민건강을 증진시키기 위해 종합적인 암관리정책을 3차에 걸쳐 추진하여 왔습니다. 2021년 3월에는 ① 고품질 암데이터 구축 및 확산, ② 예방 가능한 암 발생 감소, ③ 암 치료·돌봄 격차 완화를 주요 목표로
하는 제4차 암관리종합계획(`21∼`25)을 수립하였습니다. 제4차 암관리종합계획에 따라 10개 분야(실험동물, 유전체분석, 단백체분석, 생물정보분석, 의학통계분석, 동물분자영상, 유세포분석, 현미경영상, 그래픽지원, 바이오뱅크)165종 암 연구지원서비스를 외부에 개방될 예정으로 항암제 연구에 도움이 될 것으로 예상됩니다.
| [제4차 암관리종합계획 추진전략] |
| 추진 목표 |
||
|
- 고품질 암데이터 구축 및 확산: 약
300만 명(전체 암환자 70%) 규모의 암 빅데이터 구축 - 예방 가능한 암 발생 감소: 75세
미만 신규 암환자(위, 대장, 간, 자궁경부) 20% 이상 (年 5.6만 → 4.5만) 감소 - 암 치료·돌봄 격차 완화: 완
치된 암생존자 중 돌봄지원 2배 이상 (0.7만→1.8만) 확대 |
||
| 추진 전략 |
중점과제 |
세부과제 |
| 암 빅데이터 활성화 | 암데이터 활용 인프라 조성 | -국가암데이터(K-Cancer DW) 구축 -국가암데이터센터 운영 -안전한 암데이터 공유·개방 활성화 |
| 암등록·감시체계 개선 | -빅데이터를 통한 암 감시체계 구축 -암등록통계 관리체계 개선 |
|
| 데이터 기반 공익적 암 연구 확대 | -암 예방 및 항암신약 관련 연구 -개방형 암 연구 인프라 -AI 등 첨단기술 관련 연구 |
|
|
암 예방·검진 고도화 |
예방 가능한 암 위험 해소 | -예방 가능한 암종별 조기개입 강화 -암 발생 고위험군 집중 관리 |
| 양질의 암검진 실시 | -과학적 근거에 기반한 암검진사업 개선 -암건진 질적 수준 제고 |
|
| 지식·정보(발암요인 등) 기반 암 예방 실천 | -정확한 암 지식·정보 확산 -발암요인 관리체계 구축 -정보에 기반한 생활 속 암 예방 실천 |
|
|
암 치료·대응 내실화 |
효율적인 암 치료·보장 강화 | -의료비 지원 효율성 제고 -암 치료의 질 관리 강화 |
| 희귀·난치암의 공적 책임 제고 | -공공 부문 중심의 임상연구 활성화 -임상연구 개방형 플랫폼 구축 -국제 네트워크 통한 연구기반 확장 |
|
| 미래 위험(감염병, 인구구조 변화) 대응 | -감염병 유행 시기 단기적 조치 실시 -신종 감염병 유행 대비 중장기 방안 수립 -인구구조 변화에 따른 연령별 암관리 강화 |
|
| 균등한 암관리 기반 구축 | 중앙-지방 암관리 역량 향상 | -국립암센터 위상 강화 -지역암센터 역량 향상 -암관리 거버넌스 개편 |
| 지역사회 중심의 맞춤형 돌봄·지원 | -암생존자의 건강한 사회복귀 지원 -취약계층 맞춤형 지원 |
|
| (출처: '제4차 암관리 종합계획 2021-2025, 2021.03) |
상기의 직접적인 지원 쟁책 외에도 주요 선진국들은 제약사들의 신약 연구개발 및 인허가에 소요되는 막대한 비용 부담을 줄일 수 있도록 다양한 규제장벽을 완화하는 정책 또한 적극적으로 펼치고 있습니다. 대표적으로 최신의 제약·바이오 기술들을 위중한 상태에 있는 환자들에게 신속하게 전달할 기회를 제공하기 위해 조건부 신속허가를 제도적으로 정착하려는 노력이 진행되고 있습니다. 미국은 가속 승인(accelerated approval) 제도를 통해 기존의 치료 요법으로는 해결되지 않는 중증질환을 대상으로 신약을 조기에 승인해주는 제도를 운영하고 있으며, 유럽은 미충족 의료수요를 충족하는 일부 의약품에 대해 시판 후 임상적 확증시험 이행을 조건으로 조기 허가하는 조건부허가(conditional marketing authorization)와 임상적 확증시험이 어려운 희귀 질환을 대상으로 하는 예외적 허가(marketing authorization under exceptional circumstances) 등의 제도가 시행되고 있습니다. 일본은 생명을 위협하거나 중증의 질환을 대상으로 하는 세포치료제를 포함하는 '재생의료 등 제품'에 대하여 조건 기한부 허가 제도를 운영하고 있습니다.
대한민국 식품의약품안전처 역시 2020년 신속심사과를 신설하여 중증 질환 또는 희귀질환 치료제 등에 대해 심사기간을 단축해 신속한 제품화를 추진하는 신속심사 제도를 시행하고 있습니다. 2022년에는 식약처의 ‘식의약 규제개선 100대 과제’로서 글로벌 혁신제품 신속심사 지원체계(Global Innovative products on Fast Track, GIFT)를 추가하여, 생명위협질환이나 중대한 질환 치료제 등의 혁신성이 뛰어난 의약품을 빠르게 시장에 출시하고 환자에게 공급할 수 있도록 지원하고 있습니다.
GIFT 지정은 생명을 위협하는 암 등 중대한 질환 또는 희귀질환, 감염병 등에 대한 치료제로 기존 치료법이 없거나 기존 치료법 대비 유효성 등이 현저히 개선된 치료제, 그리고 보건복지부가 지정한 혁신형 제약기업이 개발한 신약이 대상이 됩니다. 지원 혜택으로는 GIFT 대상 품목의 경우 심사기간이 일반심사기간의 75%까지 단축이 가능해지게 되고 그 외에도 다음과 같은 지원을 받게 됩니다.
| GIFT 주요 지원 항목 |
|---|
| - 임상개발 초기부터 신속심사 대상 지정 - 안전에 직접 관련없는 일부 자료는 시판 후 제출할 수 있는 근거 규정 활용 - 글로벌 심사기준은 해외와 시차 없이 적용하여 해외 규제기관과 규제 충돌을 방지 - 국내 혁신제품의 허가·심사에 국제조화된 기준을 적용하여 빠른 해외 진출 지원 - 준비된 자료부터 먼저 심사하는 수시 동반심사(rolling review) 적용 - 심사자와 개발사 간 긴밀한 소통을 통한 규제 관련 컨설팅, 심사일정계획 등 밀착지원 |
당사가 개발 목표로 하는 품목들은 신속심사 대상이 될 가능성은 매우 높습니다. 하지만 당사는 임상 진입 전 단계에서 신약 후보물질을 조기 기술이전을 하거나 파트너 기업과 공동연구개발을 하는 것을 현재 사업 모델로 하여 직접 임상개발을 하지는 않을 것이므로, GIFT를 포함한 신속심사 제도에 의한 직접적인 수혜는 받지 않을 것으로 예상됩니다. 그러나 이러한 제도를 통해 기술이전또는 공동연구개발 파트너가 수행하는 임상개발 기간이 단축될 수 있으며, 이럴 경우 당사의 수익 실현이 계획보다 앞당겨질 수 있습니다.
그럼에도 불구하고 국내외 정책 등의 변동에 따른 위험이 존재합니다. 따라서, 상기 언급된 제약 및 신약개발 산업에 대한 국내외 국가의 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에 따라 바이오 산업을 육성하려는 움직임에도 불구하고, 정책 혹은 규제의 변동에 따라 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 이러한 불확실성은 신약 개발 및 상용화 과정에서 불확실성을 증가시킬 수 있습니다. 이러한 정책 및 규제 변동의 가능성은 당사의 사업 전략과 신약 개발에 부정적인 영향을 줄 수 있습니다.
| 자. 글로벌 경기변동에 따른 위험 2024년 07월 국제통화기금(IMF)에서 발표한 '세계경제전망(World Economic Outlook)'에 따르면 세계 경제 성장률은 2024년 3.2%, 2025년 3.3%를 기록할 전망입니다. 2024년 전망치의 경우 지난 4월과 동일한 3.2%로 전망하였으며, 2025년 전망치는 지난 04월 전망치보다 0.1%p 상향 조정하였습니다. 국제통화기금(IMF)은 '24년 세계 성장률에 대해 상·하방 요인이 균형을 이루고 있는 것으로 평가하였습니다. 성장을 높일 상방 요인으로는 성공적인 구조 개혁을 통한 생산성 증가, 다자 간 협력 강화를 통한 무역 확대 등을 제시하였습니다. 반면, 지정학적 갈등에 따른 물가 상승 및 그에 따른 고금리 상황 지속, 선거 결과에 따른 정책 급변 및 재정적자·부채 확대 등을 성장을 제약할 우려가 있는 하방 요인으로 지적하고 있습니다. 2024년 08월 발표된 한국은행의 경제전망보고서에서는 한국 경제성장률을 2024년 2.4%, 2025년 2.1% 수준으로 전망하였습니다. 한국은행은 국내경제는 수출이 호조를 지속하고 내수도 당초 경로에는 다소 못 미치지만 회복흐름을 재개하면서 금년과 내년 2%대 초중반 수준의 양호한 성장세를 이어갈 것으로 예상했습니다. 2023년 하반기부터 이어져온 수출 중심의 회복세가 보다 뚜렷해지면서 이에 따른 파급효과가 점차 소비 등 내수로 이어지고, 물가 둔화, 기업 수익성 증가 등에 따라 가계 소득여건 개선에 힘입어 하반기부터 내수 회복세가 뚜렷해질 전망입니다. 국내 성장 동력에 영향을 미치는 주요국의 성장흐름과 물가흐름, 통화정책 기조 변화, 유가 등 원자재 가격의 변 동, IT경기의 확장 속도, 중국경제의 향방, 지정학적 갈등 양상 등이 존재합니다. 상기와 같이 국내외 경기는 완만한 개선 흐름을 이어가고 있는 것으로 보이나, 소비 및 금융 시장 심리 악화, 설비투자 및 수출 부진, 주요 원자재 가격의 변동, 지정학적 리스크 심화 등 대내외적 악재로 인해 경기 전반의 회복이 지연되는 경우 당사의 실적 또한 악화될 수 있으니, 투자자께서는 이 점을 유의하시기 바랍니다. |
2024년 7월 국제통화기금(IMF)이 발표한 '세계 경제전망(World Economic Outlook)'에 따르면,
아시아 지역의 수출 증가 등 세계 무역 회복의 영향으로 세계 경제가 양호한 성장세를 보일 것으로 내다보면서, '24년 세계경제 성장률을 지난 4월과 동일한 3.2%로 전망하였습니다.
국제통화기금은 '24년 세계 성장률에 대해 상하방 요인이 균형을 이루고 있는 것으로 평가하였습니다. 성장을 높일 상방 요인으로는 성공적인 구조 개혁을 통한 생산성 증가, 다자간 협력 강화를 통한 무역 확대 등을 제시하였습니다. 반면, 지정학적 갈등에 따른 물가 상승 및 그에 따른 고금리 상황 지속, 선거 결과에 따른 정책 급변 및 재정적자·부채 확대 등을 성장을 제약할 우려가 있는 하방 요인으로 지적하였습니다. 또한, 국제통화기금은 통화정책과 관련하여 물가 상승 위험(인플레 리스크) 상존시 금리 조기 인하를 자제하고 필요시 추가 인상 가능성도 고려해야 하며, 물가 안정 에 대한 명확한 데이터가 뒷받침될 경우에 점진적으로 금리를 인하할 것을 권고하였다.
선진국 그룹(미국, 영국, 독일, 프랑스, 이탈리아, 스페인, 캐나다, 일본, 우리나라 등 41개국)의 '24년 성장률은 지난 전망과 동일하게 1.7%로 전망하였습니다. 국가별로 보면, 미국(2.6%) 성장률은 예상을 밑도는 1분기 실적에 따라 하향 조정한 반면, 프랑스(0.9%), 영국(0.7%), 스페인(2.4%) 등 유럽 국가들의 성장률은 실질 임금 상승, 금융 여건 개선 등에 따라 반등할 것으로 전망하였습니다. 일본(0.7%)은 지난 1분기 일부 자동차 업체 출하 정지 등 일시적 생산 차질을 감안해 성장세 둔화를 예상하고 있습니다.
한편, 국제통화기금은 '24년 우리나라 성장률을 2.5%로 전망하며, 지난 전망 대비 0.2%p 상향 조정하였습니다. 이는 정부, 한국은행 등 국내외 주요 기관의 전망치와 유사하고, 주요 선진국 중에서도 높은 수준입니다.
| [국제통화기금 세계 경제성장전망치(2024년 7월)] |
| (단위 : %, %p) |
| 구분 | '23년 | '24년 | '25년 | ||||
|---|---|---|---|---|---|---|---|
|
'24.4월 |
'24.7월 |
조정폭 (B-A) |
'24.4월 |
'24.7월 |
조정폭 (D-C) |
||
| 세계 | 3.3 | 3.2 | 3.2 | 0.0 | 3.2 | 3.3 | +0.1 |
| 선진국 | 1.7 | 1.7 | 1.7 | 0.0 | 1.8 | 1.8 | 0.0 |
| 미국 | 2.5 | 2.7 | 2.6 | △0.1 |
1.9 | 1.9 | 0.0 |
| 유로존 | 0.5 | 0.8 | 0.9 | +0.1 | 1.5 | 1.5 | 0.0 |
| 독일 |
△0.2 |
0.2 | 0.2 | 0.0 | 1.3 | 1.3 | 0.0 |
| 프랑스 |
1.1 | 0.7 | 0.9 | +0.2 | 1.4 | 1.3 | △0.1 |
| 이탈리아 |
0.9 | 0.7 | 0.7 | 0.0 | 0.7 | 0.9 | +0.2 |
| 스페인 |
2.5 | 1.9 | 2.4 | +0.5 | 2.1 | 2.1 | 0.0 |
| 일본 | 1.9 | 0.9 | 0.7 | △0.2 |
1.0 | 1.0 | 0.0 |
| 영국 | 0.1 | 0.5 | 0.7 | +0.2 | 1.5 | 1.5 | 0.0 |
| 캐나다 | 1.2 | 1.2 | 1.3 | +0.1 | 2.3 | 2.4 | +0.1 |
| 한국 | 1.4 | 2.3 | 2.5 | +0.2 | 2.3 | 2.2 | △0.1 |
| 호주 | 2.0 | 1.5 | 1.4 | △0.1 |
2.0 | 2.0 | 0.0 |
| 기타 선진국 | 1.8 | 2.0 | 2.0 | 0.0 | 2.4 | 2.2 | △0.2 |
| 신흥개도국 | 4.4 | 4.2 | 4.3 | +0.1 | 4.2 | 4.3 | +0.1 |
| 중국 | 5.2 | 4.6 | 5.0 | +0.4 | 4.1 | 4.5 | +0.4 |
| 인도 | 8.2 | 6.8 | 7.0 | +0.2 | 6.5 | 6.5 | 0.0 |
| 러시아 | 3.6 | 3.2 | 3.2 | 0.0 | 1.8 | 1.5 | △0.3 |
| 브라질 | 2.9 | 2.2 | 2.1 | △0.1 |
2.1 | 2.4 | +0.3 |
| 멕시코 | 3.2 | 2.4 | 2.2 | △0.2 |
1.4 | 1.6 | +0.2 |
| 사우디 | △0.8 |
2.6 | 1.7 | △0.9 |
6.0 | 4.7 | △1.3 |
| 남아공 | 0.7 | 0.9 | 0.9 | 0.0 | 1.2 | 1.2 | 0.0 |
| (출처 : 국제통화기금 (World Economic Outlook, 2024.07)) |
한국은행은 매 3개월마다 발표하는 경제전망보고서를 통해 국내 경제성장률을 전망하고 있으며, 2024년 08월 발표된 한국은행의
경제전망보고서에서는 한국 경제성장률을 2024년 2.4%, 2025년 2.1% 수준으로 전망하였습니다. 한국은행은 국내경제는 수출이 호조를 지속하고 내수도 당초 경로에는 다소 못 미치지만 회복흐름을 재개하면서 금년과 내년 2%대 초중반 수준의 양호한 성장세를 이어갈 것으로 예상했습니다.
| [국내 경제 성장률 추이] |
| (단위: %) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 | 2024년(E) | 2025년(E) |
| GDP | (-)0.7 | 4.1 | 2.6 | 1.4 | 2.4 | 2.1 |
| (출처 : 한국은행 경제전망 보고서 (2024년 08월)) | |
| 주) | 2024년, 2025년 수치는 한국은행 전망치입니다. |
세부적으로 살펴보면, 민간소비의 경우, 기업실적 개선에 힘입은 임금 상승률 확대, 물가상승률 둔화 등으로 가계의 소비여력이 개선되면서 민간소비의 회복속도가 점차 빨라질 것으로 전망하였습니다. 설비투자의 경우, 2024년 상반기 글로벌 제조업경기 둔화로 부진한 모습을 보였으나 하반기에는 기업실적 개선에 따른 투자여력 확대로 인하여 회복세를 보일 것으로 예상하였고, 건설투자 부문은 고금리로 인한 신규착공 위축의 영향이 점차 나타나면서 부진할 흐름을 보일 것으로 예상하였습니다. 반면, 상품수출은 반도체 및 AI 관련 투자가 견조한 흐름을 이어가고 AI 기술 확산도 강화되면서 개선세가 지속될 것으로 전망하였습니다.
이외에 한국은행에서는 최근 국내 경기에 대하여 중국경제의 향방, 주요 선진국 경기흐름 및 미 대선 결과 등의 요인으로 인한 불확실성에 노출되어 있는 상황으로 진단하고 있습니다. 이에 따라 중국경제의 더딘 회복세, 지정학적 리스크 심화 및 이상기후로 인한 정책 불확실성 등이 잠재적인 경기 하방 리스크로 작용할 수 있음을 언급하였습니다.
| [한국은행 국내 주요 거시경제지표 전망] |
| (단위: %) |
| 구 분 | 2023년 | 2024년(E) | 2025년(E) | ||
| 연간 | 상반기 | 하반기 | 연간 | 연간 | |
| GDP | 1.4 | 2.8 | 2.0 | 2.4 | 2.1 |
| 민간소비 | 1.8 | 1.0 | 1.8 | 1.4 | 2.2 |
| 설비투자 | 1.1 | (-)2.3 | 2.6 | 0.2 | 4.3 |
| 지식재산생산물투자 | 1.7 | 1.7 | 2.0 | 1.9 | 3.3 |
| 건설투자 | 1.5 | 0.8 | (-)2.2 | (-)0.8 | (-)0.7 |
| 재화수출 | 2.9 | 8.4 | 5.6 | 6.9 | 2.9 |
| 재화수입 | (-)0.3 | (-)1.4 | 4.6 | 1.6 | 3.6 |
| (출처 : 한국은행 경제전망보고서 (2024년 08월)) | |
| 주) | 전년동기대비 기준입니다. |
위와 같이 설비투자와 수출 중심으로 국내 경기는 개선 및 성장세를 기록할 것으로 전망되나 건설투자 등 내수 회복 모멘텀이 다소 약화되며 경기 성장 둔화 압력으로 작용할 수 있을 것으로 전망됩니다.
다만, 한국은행은 향후 국내 경제의 성장성에 주요국의 성장흐름과 물가흐름, 통화정책 기조 변화, 유가 등 원자재 가격의 변동, IT경기의 확장 속도, 중국경제의 향방, 지정학적 리스크와 관련한 불확실성이 존재함을 언급했습니다. 이처럼 COVID-19 이후 민간소비 회복, 설비투자 확대 등을 통해 양호한 성장세를 보였음에도 불구하고 통화긴축, 인플레이션, 지정학 리스크 등의 불확실성이 존재함에 따라 글로벌 경기 회복의 속도가 더딜 가능성이 있습니다. 국내외 경기 변동은 관광, 항공, 무역 등 경기에 직접적인 영향을 받는 업종 뿐 아니라 대부분의 사업 분야 전반에 부정적인 영향을 미칠 수 있습니다. 또한, 경기 둔화로 인해 증시의 변동성이 높아질 경우, 당사의 영업환경 및 주가 역시 높은 변동성을 보일 가능성이 있으므로 투자자께서는 이 점을 유의하시어 투자에 임하시기 바랍니다.
| 차. 핵심 연구개발인력 유출 위험 신약개발 사업은 10년 이상의 장기간 및 1조원이 넘는 대규모 자금이 요구되며, 임상 1상에서 판매 승인까지 성공확률이 7.9%에 불과한 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 또한, 신약 연구개발을 진행할 수 있는 지식과 경험을 보유하고 있는 전문 인력의 수는 한정되어 있어, 전문 인력의 확보 여부는 신약 개발의 성패를 좌우하는 회사의 핵심 경쟁력으로 볼 수 있으며. 핵심 인력 유출은 바이오의약품 개발에 필요한 기술과 노하우 등의 유출을 수반하여 당사의 사업을 영위하는데 있어 위험요소가 될 수 있습니다. 따라서 당사는 지속적인 연구개발 투자, 주식매수선택권 부여 등을 통해 우수연구인력의 확보 및 유출 방지를 위해 노력하고 있고, 특허 등 지적재산권 확보를 통해 기술에 대한 권리 보호 전략을 취하고 있으며, 신약개발 경험이 풍부한 외부전문가를 활용하고 있습니다. 그럼에도 불구하고 연구개발 인력의 유출이 발생할 경우, 당사의 사업 수행 및 기존의 연구개발 활동에 차질이 발생하여 당사의 영업활동 및 장기 성장에 부정적인 영향을 끼칠 수 있습니다. |
신약 개발 사업은 후보물질의 발굴, 임상 시험 진행, 허가, 생산 및 마케팅 등 전 단계에 걸쳐 전문인력을 필요로 합니다. 특히 기존 의약품만으로는 치료가 어려웠던 난치성 질환에 대해 의학적 미충족 수요를 충족시킬 수 있는 신약을 개발하거나 글로벌 시장 가치가 높은 신약을 개발하기 위해서는 해당 분야에 전문 지식과 경험을 갖춘 우수 전문 인력을 확보하는 것이 중요합니다. 그러나 국내 신약 개발 전문가 수는 한정되어 있는 만큼, 분야별 전문 인력 확보 여부는 당사와 같은 바이오 기업의 핵심 경쟁력으로 직결됩니다.
당사는 혁신 신약 연구 개발에 최적화된 조직 구성으로 각 분야에 오랜 경험을 갖춘 핵심 인재들로 운영되고 있습니다. 본부 및 운영 단위별로 신속하고 정확한 자체 의사 결정으로 효율적인 과제 개발을 진행하고 있으며, 상호 유기적인 협력으로 위험 요소를 점검하고 불필요한 회의 및 행정 절차를 최소화하고 있습니다.
조직별 구성으로는 연구개발본부에서 Discovery, 전임상 및 CMC 부분을 담당하고 있으며, 임상개발팀에서 임상을 진행하고 있습니다. 진단제품 개발은 ADL사업부에서 담당하고 있습니다
 |
|
연구개발인력 조직도(2024.09) |
당사는 전문 인력의 확보가 신약 연구개발 사업의 핵심 경쟁력임을 인지하고 우수한 전문 인력을 영입하고자 노력하고 있습니다. 신고서 제출일 현재 연구개발본부 19명, 임상개발팀 1명, ADL사업부 4명으로 총 24명의 연구개발 인력이 재직 중에 있으며, 이 중 87.5%가 석박사 인력입니다. 당사의 연구개발 본부별 인력 및 주요 업무는 다음과 같습니다.
| [연구개발본부별 인력 및 주요 업무] |
| 총괄 | 본부 | 본부 인력 | 주요 업무 |
|
CTO/기술고문 (2명) |
연구개발본부 | 19인 | 신약 연구, 신약 전임상, 임상개발 |
| 임상개발팀 | 1인 | 임상 개발 | |
| ADL사업부 | 4인 |
압토디텍트 렁(AptoDetect™-Lung) 생산 및 임상시험, 판매지원 |
| (출처 : 당사 제시) |
| [최근 3년 연구개발인력 현황] |
| 구분 | 기초 | 증가 | 감소 | 기말 |
|---|---|---|---|---|
| 2024년 반기 | 27 | - | 3 | 24 |
| 2023년 |
21 | 6 | - | 27 |
| 2022년 | 22 | - | 1 | 21 |
| 2021년 | 25 | - | 3 | 22 |
| (출처 : 당사 제시) |
| [최근 3년 부서별 박석사 인력 현황] |
| 구 분 | 인 원 | ||||
|---|---|---|---|---|---|
| 박 사 | 석 사 | 기 타 | 합 계 | ||
| 2021년 | 연구개발본부 | 6 | 11 | - | 17 |
| 임상개발팀 | |||||
| ADL사업부 | 1 | 2 | 2 | 5 | |
| 2022년 | 연구개발본부 | 2 | 13 | 2 | 17 |
| 임상개발팀 | - | - | - | - | |
| ADL사업부 | - | 2 | 2 | 4 | |
| 2023년 | 연구개발본부 | 6 | 13 | 1 | 20 |
| 임상개발팀 | - | 1 | - | 1 | |
| ADL사업부 | - | 1 | 5 | 6 | |
| 2024년 반기 | 연구개발본부 | 5 | 13 | 1 | 19 |
| 임상개발팀 | 1 | - | - | 1 | |
| ADL사업부 | - | 2 | 2 | 4 | |
| (출처 : 당사 제시) |
신약 연구개발을 주도하고 있는 핵심연구인력의 담당 업무, 주요 경력 및 주요 연구실적은 다음과 같습니다.
| [핵심 연구개발인력 현황] |
| 직위 | 성명 | 담당업무 | 주요경력 | 연구실적 |
| CTO | 류성호 | 신약 기술 플랫폼 총괄 |
한국과학기술원 생명과학과 (박사 '85) 국립보건원 박사후 연구원 포스텍 교수 ('88~'22) ㈜압타머사이언스 이사 ('11~현재) |
조합기술을 이용한 펩티드 분자다양성 창출 및 응용 AlloMap 플랫폼 기술 개발 및 구축 논문: 국내 60편, 해외 253편 |
| 기술 고문 |
장승기 | 압타머 관련 기술 고문 |
Univ. of NY of Stony Brook 분자생물학 (박사 '89) 포스텍 교수 ('91~'23) 포스텍 생명공학연구센터 센터장 ㈜압타머사이언스 기술고문 ('11~현재) |
C형 간염 바이러스 효능이 있는 압타머 개발 치료백신 개발을 위한 동물모델 확립 및 백신효능 기전연구 논문: 92편, 특허 22건 |
|
상무 이사 |
이대견 |
연구개발 본부장 |
포스텍 생명과학(박사 '09) ㈜와이디생명과학 팀장('15~'17) ㈜압타머사이언스 연구개발본부 본부장('18~현재) |
신약 개발 업무 총괄 논문 20편(SCI), 특허 5건 - 보건복지부 과제: 압타머 A48ms를 이용한 인슐린 수용체 표적 당뇨치료제의 비임상개발 연구개발 책임(2020~2022)
- 국가신약개발 사업단 과제: CD25 표적 압타머-약물접합체를 이용한 조절 T세포 선택적 억제/사멸 기전의 면역항암제용 선도물질 도출 연구개발 책임(2022~2024)
|
| 팀장 | 안홍선 | 약리독성팀 |
단국대학교 나노바이오의과학과(박사 '14) 바이오톡스텍 연구원('18~21) 제이투에이치바이오텍 연구원('21-23) |
AST-201, AST-202의 전임상 업무 논문 5편, 특허 10건 - Preparing method of nerve conduits including cells, US 10,758,646 B2 (2020.09.01) - Neurotrophic factor carrier, method for producing the same, and method for regenerating a nerve using the same, US 11,040,125 B2 (2021.06.22) - 신경도관 제조방법, 10-2041231 (2019.11.07)
- 세포를 포함하는 신경도관 제조방법, 10-1952946 (2019.02.28)
- 신경재생인자 전달체, 이의 제조방법 및 이를 이용한 신경 재생 방법, 10-2041775 (2019.11.07) - Nanotherapeutics of PTEN Inhibitor with Mesoporous Silica Nanocarrier Effective for Axonal Outgrowth of Adult Neurons /2016.08.29 (공동저자)
- Carbon-nanotube-interfaced glass fiber scaffold for regeneration of transected sciatic nerve /2014.11.13 (
제 1저자)
- Therapeutic Potential of Induced Neural Stem Cells for Spinal Cord Injury /014.10.07 (공동저자)
- Expression, cDNA cloning, and characterization of the antibacterial peptide cecropin D from Agrius convolvuli /2013.01.21 (제 1저자)
- Phosphate glass fibres promote neurite outgrowth and early regeneration in a peripheral nerve injury model /2012.08.27 (공동저자) |
| 팀장 | 강주형 | Discovery팀 | 고려대학교 의과학과(박사 '17) 고려대학교 박사 후 연구원('17) ㈜압타머사이언스 연구개발본부 Discovery팀장('17~현재) |
신규 파이프라인 발굴/개발 연구 (고형암, 면역항암제) - 압타머를 이용한 다중(multiplex) PCR 방법 (2020.11.05)
논문 실적 - Lipopolysaccharide regulates thymic stromal lymphopoietin expression via TLR4/MAPK/Akt/NF-κB-signaling pathways in nasal fibroblasts: differential inhibitory effects of macrolide and corticosteroid (제 1저자)
- TGF-beta1 Activates Nasal Fibroblasts through the Induction of Endoplasmic Reticulum Stress (제 1저자)
- Chemical Chaperone of Endoplasmic Reticulum Stress Inhibits Epithelial-Mesenchymal Transition Induced by TGF-β
1 in Airway Epithelium via the c-Src Pathway (제 1저자)
- Diesel Exhaust Particles Enhance MUC4 Expression in NCI-H292 Cells and Nasal Epithelial Cells via the p38/CREB Pathway (
제 1저자)
- In Vivo Evaluation of 68Ga-Labeled NOTA-EGFRvIII Aptamer in EGFRvIII-Positive Glioblastoma Xenografted Model (공동저자)
국가연구개발사업 실적 - 만성 비부비동염의 발병기전연구와 치료제 후보물질 개발연구, 연구원 (2011-2012)
- 비용의 발생과정에 따른 IL-32의 역할규명과 기전연구, 연구원 (2013-2014)
- 비용종 발생 기전에서 EMT(상피-간엽세포 변화)의 역할규명 및 새로운 치료제 개발, 연구원 (2013-2014)
- 압타머를 이용한 당뇨망막병증 신속 다지표진단 기술개발 및 시제품 제작, 연구원 (2018-2019)
- CD25 표적 압타머-약물 접합체를 이용한 조절 T 세포 선택적 억제/사멸 기전의 면역항암제 선도물질 도출, 연구원 (2022-2024)
|
| 팀장 | 임소령 | CMC팀 | 부산대학교 바이오소재전공(석사 '13) UNIST 화학전공(석사 '16) (주)압타머사이언스 연구개발본부 CMC팀장('16~현재) |
Aptamer-drug conjugate 생산 총괄 - 글리피칸-3 특이적 변형 압타머 및 이의 용도
- 티미딘으로부터 개질된 뉴클레오시드의 제조방법
- 분지형의 효소 절단 가능한 링커-페이로드와 이의 효율적인 제조방법
- 인슐린 수용체 압타머 및 이를 포함하는 당뇨병 치료용 약학적 조성물
- CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용 - Poly(D,L-lactide)를 외부 껍질로 하고 Alginate 또는 Chitosan을 내부 코어로 구성한 이중미립구 담체의 약물방출 특성 (공동저자)
- In Vivo Evaluation of 68Ga-Labeled NOTA-EGFRvIII Aptamer in EGFRvIII-Positive Glioblastoma Xenografted Model (공동저자)
|
| 팀장 | 김기중 | 임상개발팀 |
중앙대학교 동물번식육종(박사 '15) 지엔에스바이오 임상총괄팀장 ('16~'19) ㈜대웅제약 임상총괄 ('21~'23) |
19개 연구과제 참여 국내IND 12건, 임상진행 18건 - Methods that Transduction of Spermatogonial Stem Cells Using Lentiviral Vector and DOGS in Mouse. 논문 실적 - Effective Preparation of Mouse Recipients for Xenogeneic Transplantation of Spermatogonial Stem Cells. Tissue Eng Regen Med 2013(제 1저자)
- Lentiviral Modification of Enriched Populations of Bovine Male Gonocytes. J Anim Sci 2014 (제 1저자)
- Enhancement of In Vitro Culture Efficiency of Mesencymal Stem Cells Derived from Deer Antlers. Tissue Eng Regen Med 2014 (제 1저자)
- Cryopreservation of Putative Pre-pubertal Bovine Spermatogonial Stem Cells by Slow Freezing. Cryobiology 2015 (제 1저자)
- In Vitro Spermatogenesis Using Bovine Testis Tissue Culture Techniques. Tissue Eng Regen Med 2015 (제 1저자) 임상시험 실적 - 비소세포폐암 연구자 임상
- 아토피피부염 임상 1/2상
- 패혈증 임상 1/2상
- COVID-9 임상 2상
- 중추성 사춘기 성조숙증 임상 3상
|
| (출처 : 당사 제시) |
상기 연구개발 인력을 통해 당사는 신약 개발 활동에 집중하고 있으며, 매년 매출액 규모를 크게 상회하는 수준의 연구개발비를 집행하고 있습니다. 최근 3년간 당사의 연구개발비용 추이는 다음과 같습니다.
| [연구개발비용 현황] |
| (단위 : 백만원) |
| 구 분 | 2024년도 반기 | 2023년도 | 2022년도 | 2022년도 | |
|---|---|---|---|---|---|
| 자산 처리 | 원재료비 | - | - | - | - |
| 인건비 | - | - | - | - | |
| 감가상각비 | - | - | - | - | |
| 위탁용역비 | - | - | - | - | |
| 기타 | - | - | - | - | |
| 소 계 | - | - | - | - | |
| 비용 처리 | 제조원가 | - | - | - | - |
| 판관비 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 소 계 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 연구개발비용 합계 | 1,959 | 9,359 | 6,025 | 1,763 | |
| 매출액 | 71 | 243 | 358 | 269 | |
| 연구개발비용/매출액 | 2,758% | 3,848% | 1,682% | 655% | |
| (출처 : 정기보고서) |
당사는 제한된 연구개발비 내에서 수익 창출 기여도를 높이기 위한 파이프라인 개발에 집중하고 있습니다. 그러나 신약 연구개발을 통해 가시적인 성과가 나오기까지는 많은 비용과 시간이 소요되는 만큼, 향후 상용화 단계에 이르기까지 지속적으로 연구개발비가 증가할 것으로 예상됩니다. 또한, 우수한 연구인력의 유출을 방지하기 위해 합리적인 보상체계를 구축하고, 지속적인 인력 투자를 진행할 예정입니다.
| [최근 3년 연구개발인력 현황] |
| 구분 | 기초 | 증가 | 감소 | 기말 |
|---|---|---|---|---|
| 2024년 반기 | 27 | - | 3 | 24 |
| 2023년 |
21 | 6 | - | 27 |
| 2022년 | 22 | - | 1 | 21 |
| 2021년 | 25 | - | 3 | 22 |
| (출처 : 당사 제시) |
당사의 최근 3년간 연구인력 퇴사는 6명으로 2024년 반기말 연구개발인력의 25% 수준이고, 평균 근속연수는 3.5년입니다. 인력유출사유는 건강 악화, 이직으로 인한 퇴사였습니다. ESG행복연구소(2022)에 따르면 제약바이오 업계의 직원 평균 근속연수는 5.25년으로 200대 기업 평균(9.45년)보다 짧았으며, 바이오기업들의 근속연수는 평균 이하에 머문 것으로 나타났습니다. 특히 코로나19 이후 진단키트, 의료기기, 연구개발, CDMO 등을 통해 급성장한 기업들이 차세대 먹거리 발굴을 위해 공격적으로 인력 채용을 늘리면서 고스란히 근속연수에 영향을 미친 것입니다. 당사의 경우 부족한 인력을 충원하기 위해 2023년 인력을 확보하면서 평균 근속연수가 짧아졌습니다.
인력 유입 및 유출에도 불구하고, 대부분의 퇴사자들이 팀원으로 당사의 핵심인력의 유출은 없어 당사의 주요 파이프라인 등 연구개발에 미치는 영향은 없었으며, 현재 업무 연속성 유지를 위해 투자를 유치하고 자금 사정에 맞춰 개발 단계가 빠른 파이프라인 연구에 집중하고 있는 상황입니다. 이에 연구개발인력의 유출을 막기 위해 직무 만족도와 임금, 복지수준을 개선해 나갈 계획이며, 신약을 포함한 다양한 프로젝트 추진 환경 및 기회 제공 등을 계획하고 있습니다.
또한 회사는 조기이직 방지로 5가지 방안(START)을 마련하여 활용하고 있습니다.
| [START 프로그램] |
|---|
| 1) Selection: 고유의 선발 방식을 모색 - 우수인재 채용을 목적으로 업무특성과 직무에 대한 철저한 분석을 통해 직무 적합도를 높이는 선발기준을 찾음 2) Truth: 입사 전 회사와 직무에 대한 충분한 공유 - 현실적인 직무소개로 기대 수준을 조정함. 긍정적이고 부정적인 내용까지 오픈함으로 과도한 기대감을 낮추고 만족감을 제고하여 이직률을 감소시킴 3) Achievement: 입사 초기에 성공적인 프로젝트 경험 - 회사의 주요 프로젝트에 참여시켜 성취감 고취 및 중요한 인재라는 의식 고취. 성공경험을 통해 얻은 희열과 성취감은 업무성과로 이어지는 강한 동기로 작용 4) Route: 성공 경로를 보여줌 - 직무역량 강화를 위한 교육 프로그램과 직무별 성장 경로를 제시. 5) Talk: 끊임없는 소통(커뮤니케이션) - 수평적인 소통방식 운영 및 비공식적인 조직을 활성화하여 임직원 간 소통의의 장을 마련 |
당사는 우수한 연구개발 인력 및 주요 임직원의 장기 근속을 유도하고 사기를 진작시키기 위한 주식매수선택권을 부여하고 있습니다. 당사가 현재까지 부여한 주식매수선택권 현황은 다음과 같습니다.
| [연구개발부서 주식매수선택권 부여 현황] |
| (단위 : 주) |
| 부여 받은 자 | 부서 | 부여일 | 부여방법 | 주식의 종류 | 최초 부여 수량 | 현재 잔여 수량 | 행사가격 | 행사가능일 |
|---|---|---|---|---|---|---|---|---|
| 이대견(상무) | 연구개발본부 | 2022.03.10 | 신주교부 | 보통주 | 20,000 | 40,000 | 6,375 | 2024.03.10 ~2029.03.09 |
| 임소령외2인 | 연구개발본부, ADL사업부 | 2022.03.10 | 신주교부 | 보통주 | 15,000 | 30,000 | 6,375 | 2024.03.10 ~2029.03.09 |
| 강주형외1인 | 연구개발본부, ADL사업부 | 2023.02.28 | 신주교부 | 보통주 | 15,000 | 30,000 | 4,686 | 2025.02.28 ~2030.02.27 |
| OO외1인 | ADL사업부 | 2024.02.14 | 신주교부 | 보통주 | 15,000 | 15,000 | 3,566 | 2026.02.14 ~2031.02.13 |
| (출처 : 당사 제시) |
신약개발 사업은 10년 이상의 장기간 및 1조원이 넘는 대규모 자금이 요구되며, 임상 1상에서 판매 승인까지 성공확률이 7.9%에 불과한 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 또한, 신약 연구개발을 진행할 수 있는 지식과 경험을 보유하고 있는 전문 인력의 수는 한정되어 있어, 전문 인력의 확보 여부는 신약 개발의 성패를 좌우하는 회사의 핵심 경쟁력으로 볼 수 있습니다. 따라서 당사는 지속적인 연구개발 투자, 주식매수선택권 부여 등을 통해 우수연구인력의 확보 및 유출 방지를 위해 노력하고 있고, 신약개발 경험이 풍부한 외부전문가를 활용하고 있습니다. 그럼에도 불구하고 연구개발 인력의 유출이 발생할 경우, 당사의 사업 수행 및 기존의 연구개발 활동에 차질이 발생하여 당사의 영업활동 및 장기 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 카. 지적재산권 관련 위험 당사는 기술 기반 신약 및 진단키트를 개발하는 바이오 벤처기업으로, 관련 핵심 원천기술과 그에 해당하는 특허 확보가 매우 중요합니다. 지적재산권은 바이오 산업 특성상 오랜 기간과 비용을 소요한 연구 결과를 보호하는 역할로서 사업화에 큰 비중을 차지하고 있는 중대 사안입니다. 당사는 직접 등록 혹은 출원 예정인 특허와 포항공대 산학협력단으로부터 전용실시권을 확보해 당사의 핵심 기술 및 제품에 대한 권리를 보호받을 수 있도록 지속적으로 노력하고 있습니다. 하지만 당사가 권리자인 특허 혹은 포항공대 산학협력단으로부터 전용실시권을 확보한 특허와 관련된 분쟁이 발생할 경우 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다. |
바이오 벤처기업의 경우 관련 기술에 대한 특허 및 동 기술을 시현할 수 있는 핵심 원천기술 확보가 매우 중요합니다. 향후 당사의 상용화 제품에 필요한 기반 기술에 대한 지적재산권의 확보에 실패하거나 소송 및 분쟁이 발생할 경우 이로 인해 당사의 영업 및 손익에 부정적인 영향을 미칠 가능성이 있습니다.
따라서, 당사는 폐암 진단 키트 관련 기술 및 제품과 압타머 신약 개발 기술 등 기술제품에 대해 국내외에 특허를 등록 또는 출원하고 있습니다. 이러한 우선실시권을 확보하거나 특허를 등록 혹은 출원한 제품에 대하여는 배타적인 권리를 확보하여 후발 경쟁사로부터의 진입장벽을 형성하고 있습니다.
당사의 지적재산권은 당사가 직접 출원한 특허와 포항공대 산학협력단과의 계약 내용을 바탕으로 확보한 우선실시권 두 가지로 구분할 수 있습니다. 해당 우선실시권은 권리자인 포항공대에서 이미 출원한 또는 향후 출원할 압타머 기술 관련 특허에 대하여 당사가 배타적 실시권 행사를 선택할 수 있는 옵션 권리(전용시행권의 근권리)로서 당사의 권리 포기 없이 포항공대산학협력단의 제3자에 대한 특허실시권 이전이 불가능합니다.
당사는 포항공대 보유 압타머 기술자산에 대한 우선 실시권을 확보해 해당 기술을 기반으로 파이프라인을 개발 연구해오고 있으며 이와 더불어 당사에서 자체적으로 출원한 특허들을 통해 파이프라인과 원천기술을 보호하고 있습니다.
| [포항공대에서 개발되어 우선실시권을 확보한 특허] |
| 번호 | 특허명 | 특허권자 | 출원번호 (출원일) |
등록번호 (등록일) |
국가 | 존속기간 만료일 |
| 1 | 생물약제인 것의 지속형 포뮬레이션 (Long acting formulation of biopharmaceutical) |
포항공대 산학협력단 |
12422950 (2009.04.13) |
US8247493 B2 (2012.08.21) |
미국 | 2029.05.23 |
| 2 | 압타머를 이용한 Sandwich 형태의 어세이 (Aptamer Sandwich assays) |
포항공대 산학협력단 |
13092209 (2011.04.22) |
US8785132 B2 (2014.07.22) |
미국 | 2032.04.13 |
| 3 |
아미노링커 올리고 뉴클레오타이드의 제조방법 (Method of preparing 5'-amino-linker oligonucleotides derivatives) |
포항공대 산학협력단 |
12559666 (2009.09.15) |
US8124756 B2 (2012.02.28) |
미국 | 2029.10.27 |
| 4 | C형 간염바이러스의 표면 단백질 E2에 대한 압타머 및 이의용도 (Aptamer for envelope protein E2 of Hepatitis C Virus and uses thereof) |
포항공대 산학협력단 |
1020130048749 (2013.04.30) |
10-1480495 (2015.01.02) |
한국 | 2033.04.30 |
| 5 |
인슐린 수용체 압타머 및 이를 포함하는 약학적 조성물 (Aptamer against insulin receptor containing the same) |
포항공대 산학협력단 |
1020160094621 (2016.07.26) |
10-1881500 (2018.07.18) |
한국 | 2036.07.26 |
| (출처 : 정기보고서) |
| [출원한 특허권] |
| 번호 | 구분 | 내용 | 권리자 | 출원일 | 등록일 | 적용제품 | 국가 |
| 1 | 특허권 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 | 2015.09.11 | - | 폐암 조기 진단 제품 |
PCT |
| 2 |
백혈구에 선택적으로 결합하는 압타머 및 이의 용도 |
㈜압타머사이언스 | 2017.04.26 | 2019.06.20 | - | 한국 | |
| 3 |
인플루엔자 H3N2 아형에 결합하는 압타머 및 이의 용도 |
㈜압타머사이언스/포항공대 산학협력단 |
2017.08.23 |
11항 대리 특허에 통합됨 |
- | 미국 | |
| 4 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 | 2018.03.08 | 2023.01.06 | 폐암 조기 진단 제품 |
싱가 포르 |
|
| 5 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 | 2018.03.12 | 2020.02.11 | 폐암 조기 진단 제품 |
한국 | |
| 6 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 | 2018.03.12 | 2021.12.10 | 폐암 조기 진단 제품 |
중국 | |
| 7 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 | 2018.03.12 | 2021.03.23 | 폐암 조기 진단 제품 |
일본 | |
| 8 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 | 2018.03.12 | - | 폐암 조기 진단 제품 |
인도 | |
| 9 |
인슐린 수용체 압타머 및 이를 포함하는 당뇨병 치료용 약학적 조성물 |
㈜압타머사이언스 | 2018.05.10 | - |
당뇨 치료제 |
PCT | |
| 10 |
대리 바이러스를 이용한 압타머 제조 방법 |
㈜압타머사이언스/포항공대 산학협력단 |
2018.08.22 | 2021.07.05 | - | 한국 | |
| 11 | METHOD FOR PREPARING APTAMER USING SURROGATE VIRUS |
㈜압타머사이언스/포항공대 산학협력단 |
2018.08.22 | - | - | PCT | |
| 12 | 압타머를 이용한 다중(multiplex) PCR 방법 |
㈜압타머사이언스 | 2019.02.01 | 2020.11.05 | - | 한국 | |
| 13 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 | 2019.11.08 | 2020.09.04 | 간암 치료제 |
한국 | |
| 14 | 압타머를 이용한 다중(multiplex) PCR 방법 |
㈜압타머사이언스 | 2019.12.09 | - | - | PCT | |
| 15 |
인슐린 수용체 압타머 및 이를 포함하는 당뇨병 치료용 약학적 조성물 |
㈜압타머사이언스 | 2020.02.19 | - | 당뇨 치료제 |
미국 | |
| 16 |
Allosteric enhancer IR-A43 increases insulin binding by stabilizing hotspot of the insulin receptor |
㈜압타머사이언스 | 2020.03.20 | - | 당뇨 치료제 |
미국 | |
| 17 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 | 2020.11.06 | - | 간암 치료제 |
PCT | |
| 18 |
Insulin receptor-specific aptamer and use thereof |
㈜압타머사이언스 | 2021.03.26 | - | 당뇨 치료제 |
PCT | |
| 19 | 신종 코로나바이러스 특이적 압타머 및 이의 이용 |
㈜압타머사이언스 | 2021.04.22 | - | 항원 진단 |
한국 | |
| 20 |
혈액-뇌 장벽 침투 압타머 및 이의 이용 |
㈜압타머사이언스 | 2021.06.24 | - | BBB 셔틀 |
한국 | |
| 21 |
혈액-뇌 장벽 침투 압타머 및 이의 이용 |
㈜압타머사이언스 | 2021.06.29 | - | BBB 셔틀 |
PCT | |
|
압타머를 이용한 다중 (multiplex) PCR 방법 |
㈜압타머사이언스 | 2021.07.30 | - | - | 미국 | ||
|
인슐린 수용체 특이적 압타머 및 이의 이용 |
㈜압타머사이언스 /포항공과대학교 산학협력단 |
2022.03.03 | - |
당뇨 치료제 |
한국 | ||
|
EGFRvIII 특이적 압타머 및 이의 용도 |
㈜압타머사이언스 | 2022.03.18 | - | GBM 진단/치료 |
한국 | ||
| 25 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 | 2022.05.05 | - | 간암 치료제 |
미국 | |
| 26 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 | 2022.05.06 | - | 간암 치료제 |
일본 | |
| 27 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 | 2022.05.24 | - | 간암 치료제 |
유럽 | |
| 28 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 | 2022.06.20 | - | 간암 치료제 |
중국 | |
| 29 | 방사선 내성 암 바이오 마커에 특이적으로 결합하는 압타머 및 이의 용도 | ㈜압타머사이언스 /한국원자력의학원 |
2022.12.16 | - | 진단 | 한국 | |
| 30 |
BLOOD-BRAIN BARRIER PENETRATING APTAMER AND USE THEREOF |
㈜압타머사이언스 | 2022.12.22 | - | BBB셔틀 | 유럽 | |
| 31 |
BLOOD-BRAIN BARRIER PENETRATING APTAMER AND USE THEREOF |
㈜압타머사이언스 | 2022.12.23 | - | BBB셔틀 | 일본 | |
| 32 |
BLOOD-BRAIN BARRIER PENETRATING APTAMER AND USE THEREOF |
㈜압타머사이언스 | 2022.12.23 | - | BBB셔틀 | 미국 | |
| 33 |
혈액-뇌 장벽 침투 압타머 및 이의 이용 |
㈜압타머사이언스 | 2023.02.20 | - | BBB셔틀 | 중국 | |
| 34 | 인슐린 수용체 특이적 압타머 및 이의 이용 |
㈜압타머사이언스 /포항공과대학교 산학협력단 |
2023.03.03 | - |
당뇨 치료제 |
PCT | |
| 35 | 티미딘으로부터 개질된 뉴클레오시드의 제조방법 |
㈜압타머사이언스 | 2023.03.09 | - | - | 한국 | |
| 36 | EGFRvIII 특이적 압타머 및 이의 용도 |
㈜압타머사이언스 | 2023.03.17 | - | GBM 진단/치료 |
PCT | |
| 37 |
CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용 |
㈜압타머사이언스 | 2023.06.16 | - |
혈액암 치료제 |
한국 | |
| 38 |
CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용 |
㈜압타머사이언스 | 2023.11.02 | - |
혈액암 치료제 |
PCT | |
| 39 | 티미딘으로부터 개질된 뉴클레오시드의 제조방법 |
㈜압타머사이언스 | 2023.11.02 | - | - | PCT | |
| 40 | 분지형의 효소 절단 가능한 링커-페이로드와 이의 효율적인 제조방법 | ㈜압타머사이언스 | 2023.12.26 | - | 링커 -페이로드 |
한국 | |
| 41 | 글리피칸-3 특이적 변형 압타머 및 이의 용도 |
㈜압타머사이언스 | 2024.01.26 | - | 간암 치료제 |
한국 | |
| 42 | 치료용 담체로서 항 Trop2 압타머 |
㈜압타머사이언스 | 2024.07.15 | - | 췌장암 치료제 |
한국 |
| (출처 : 정기보고서) |
| 【당사가 출원한 상표권】 |
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
적용제품 |
출원국 |
||
|---|---|---|---|---|---|---|---|---|
|
1 |
압타머 사이언스 |
㈜압타머 사이언스 |
2018.10.05 |
2019.06.13 |
전체제품 | 한국 | ||
|
2 |
Aptamer Sciences |
㈜압타머 사이언스 |
2018.10.05 |
2019.06.13 |
한국 | |||
|
3 |
|
㈜압타머 사이언스 |
2019.02.01 |
2019.12.26 |
한국 | |||
|
4 |
AptoDetect |
㈜압타머 사이언스 |
2018.10.15 |
2019.9.05 |
폐암 조기 진단 제품 |
한국 | ||
|
5 |
AptoDetect |
㈜압타머 사이언스 |
2018.10.12 |
2019.6.28 |
중국 |
|||
| 6 |
AptoDetect |
㈜압타머 사이언스 |
2018.10.23 |
심사통과 |
인도네시아 |
|||
| 7 |
AptoDetect |
㈜압타머 사이언스 |
2018.10.17 |
2019.12.06 |
일본 |
|||
| 8 |
AptoDetect |
㈜압타머 사이언스 |
2018.10.19 |
2019.9.05 |
싱가포르 |
|||
| 9 |
|
㈜압타머 사이언스 |
2019.09.10 |
2020.03.07 |
전체제품 |
중국 |
||
| 10 | ApDC® | ㈜압타머사이언스 | 2024.01.31 | - | 치료제 | 한국 | ||
| 11 | ApRC | ㈜압타머사이언스 | 2024.06.12 | - | 치료제 | 한국 |
| (출처 : 정기보고서) |
다만, 바이오 산업과 같은 기술집약적인 산업에서는 전세계적으로 특허등록을 위한 경쟁이 치열하게 전개되고 있습니다. 따라서, 향후 당사가 전혀 예상할 수 없는 제3자로부터 당사가 소유하고 있는 기술제품 특허에 대한 소송 및 분쟁이 발생할 수도 있으며 이로 인해 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다.
| 타. CRO 산업의 성장 둔화에 따른 위험 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였고, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.(주)인터내셔널사이언티픽스탠다드가 속한 시장은 제약업계 및 바이오벤처 임상시험 위탁연구을 실시하는 CRO 시장입니다. CRO는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다. 국내 시장 또한 글로벌 CRO 대비 높은 성장률을 보이며 지속적인 성장세를 유지하고있습니다. 최근 5년간 세계 CRO 시장의 연평균 성장률이 9.9%에 그친 데 비해 대한민국의 전체 CRO 시장은 동 기간 연평균 14%의 규모로 증가했습니다.이 외에 주목할 만 한 사항으로는 국내 CRO 업체 중 내자 CRO 업체의 점유율이 있습니다. 국내 CRO시장에서 국내 CRO와 외자 CRO의 시장점유율을 관찰하였을 때, 2014년 국내 CRO의 비중이 33.3%에서 2018년 46.2%으로 증가하였고, 2020년 최초로 내자 CRO의 점유율이 외자 CRO의 점유율을 초과하였습니다. 그러나, 위와 같은 CRO 업계의 성장에도 불구하고 향후 경기 불황 등 거시적 또는 미시적 요인에 의하여 주력 시장의 성장세가 둔화될 경우, 해당 사업부의 영업활동에 부정적 영향을 미칠 수 있습니다. |
2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였고, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.
(주)인터내셔널사이언티픽스탠다드가 속한 시장은 제약업계 및 바이오벤처 임상시험 위탁연구을 실시하는 CRO 시장입니다. CRO는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다.
대형 제약기업 중 일부는 연구개발과 임상시험을 포기하게 되고, 기업 규모 축소(downsizing)로 해고된 연구 인력들이 풀서비스(full-service), 니치서비스(niche-service)의 형태로 컨설팅 사업에 뛰어들게 되면서 제약 CRO 사업이 탄생, 발전하게 되었습니다. 산업 초기 아웃소싱(outsourcing)은 데이터 관리 및 통계분석 서비스가 주를 이루었으나, 점차 그 영역이 확대되어, 약물 발굴, 신약 개발에서부터 제조, 운송, 상품화에 이르기까지 제약 가치사슬의 전 단계에 걸쳐 서비스를 제공하게 되었습니다.
| [제약 가치사슬에 따른 아웃소싱(outsourcing) 현황] |
![이미지: [제약 가치사슬에 따른 아웃소싱(outsourcing) 현황]](%5B%EC%A0%9C%EC%95%BD%20%EA%B0%80%EC%B9%98%EC%82%AC%EC%8A%AC%EC%97%90%20%EB%94%B0%EB%A5%B8%20%EC%95%84%EC%9B%83%EC%86%8C%EC%8B%B1%28outsourcing%29%20%ED%98%84%ED%99%A9%5D.jpg) |
|
[제약 가치사슬에 따른 아웃소싱(outsourcing) 현황] |
| (출처 : CEPTON, 2007) |
CRO는 제약사들의 신약개발 시 들어가는 연구개발 비용 감소와 신약 출시기간 단축이라는 수요에 맞게 발전해 왔습니다. 신약 연구, 개발은 후보물질 탐색부터 임상시험까지 오랜 기간이 걸리는 반면, 성공 확률이 낮은 하이리스크-하이리턴(high-risk, high-return) 사업입니다. 이에 따라 대부분의 제약회사들은 높은 리스크와 많은 비용이 들어가는 단계를 자체적으로 진행하기 보다는 CRO와 같은 수탁기관과 협업하여 신약을 개발하게 됩니다.
CRO 사업분야는 1) 기술수준이 높고, 2) 기술의 변화속도가 빠르며, 3) 표준의 중요성이 크고, 4) 개발프로세스의 복잡성이 크다는 특징이 있습니다. 따라서 필요로 하는 제약바이오업계의 수요가 매우 큰 반면, 이러한 연구개발서비스를 제공하는 민간부문의 공급 규모는 부족한 상황입니다. 이는 국내 CRO 업체가 2000년대부터 설립되기 시작하였고, 경력을 갖춘 전문인력이 아직 많지 않은 까닭입니다. 정부에서도 2022년 제약산업 육성 ·지원 시행계획을 확정하여 제약산업 전문인력양성에 힘쓰고 있습니다. 결론적으로 CRO 사업분야는 전체 연구개발서비스 자체의 성장가능성이 클 뿐만 아니라, 민간부문을 통한 R&D 서비스산업 활성화의 잠재력 또한 크기 때문에 지속적으로 커질 것으로 예상됩니다.
| [CRO 세부분야] |
| 세부분야 | 정의 |
|---|---|
| 임상연구 (Clinical Research Services) |
임상시험관리기준(GCP: Good Clinical Practice)에 따라 비임상시험 통과 이후 단계적으로 인체에 적용해 보는 임상(Clinical)시험의 설계, 수행 및 결과보고를 수행 |
| 조기개발 (Early-phase Development Services) |
우수실험실기준(GLP: Good Laboratory Practice)에 따라 우선적으로 후보물질을 동물에 적용해 유효성과 독성을 평가하는 비임상(Non-Clinical)시험의 설계, 수행 및 결과보고를 수행 |
| 시험기관 (Laboratory Services) |
허가기관에서 제정한 시험법 가이드라인(TG: Test Guideline)에 따라 평가항목을 설정하여 시험의 설계, 수행 및 결과보고를 수행 |
| 컨설팅 (Consulting Services) |
다양한 적응증에 대한 프로토콜 개발을 포함한 개발 전략 수립부터 임상 시험 전반의 과정에 있어 가이드 수립 |
| 데이터관리 (Data Management Service) |
Phase I~III, Medical device 허가용 임상시험과 허가 후 진행하는 Phase IV 임상시험, OS (Observational Study) 및 NIS (Non-Intervention Study) 등의 관찰연구, IIT (Investigator-Initiated Trial: 연구자 주도 임상), PMS (Post-Marketing Study: 시판 후 조사)에 이르기까지 임상 데이터 수집 및 관리 |
|
(출처 : 당사 제시) |
글로벌 CRO 시장은 2018년 기준 452억 8300만달러(약 56조 5585억원)였으나, 연평균 7.7%의 성장률을 기록하면서 오는 2024년에는 717억달러(한화 약 89조 5533억원)에 이를 것으로 전망되고 있습니다. 코로나19에 따른 신규 의약품의 개발 증가와 더불어 2년여 기간동안의 팬데믹에 따라 비대면/디지털이 사회 전반적으로 확산되며 임상시험에도 영향을 끼쳤으며, 향후 CRO시장은 이 같은 비대면/디지털 전환이 확산되며 오히려 코로나19 이전보다도 높은 성장률을 보일 것으로 예측했습니다. 글로벌 CRO시장 규모는 임상 연구 서비스와 조기 개발 서비스, 전임상 서비스 부분이 성장을 이끌어가며 코로나19 이전보다도 높은 수준에서 지속 성장할 것으로 예상됩니다.
| [글로벌 CRO 시장 전망(2017~2024E)] |
| (단위 : 10억 달러) |
 |
|
글로벌 cro 시장 전망(2017 - 2024e |
|
(출처 : Frost&Sullivan, Global CRO Mraket, Forecast to 2024, 글로벌 CRO시장현황 및 전망. 2020.1. 생명공학정책연구센터) |
| [글로벌 CRO 분야별 규모] |
| (단위 : 백만달러) |
| 구분 | 2020년 | 2025년 | CAGR | |
| 임상 연구 서비스 | 임상1상 | 3,029.2 | 4,159.6 | 6.5% |
| 임상2상 | 9,179.2 | 14,417.3 | 9.5% | |
| 임상3상 | 12,478.1 | 19,815.3 | 9.7% | |
| 임상4상 | 3,968.0 | 6,166.0 | 9.2% | |
| 소계 | 28,654.4 | 44,558.3 | 9.2% | |
| 조기 개발 서비스 | 화학·제조·관리 | 5,439.8 | 7,723.4 | 7.7% |
| 전임상 서비스 | 4,038.2 | 5,889.5 | 13.2% | |
| 디스커버리연구 | 2,449.6 | 3,664.6 | 7.8% | |
| 소계 | 11,927.6 | 17,277.5 | 7.7% | |
| 시험기관 서비스 | 4,294.0 | 7,975.3 | 13.2% | |
| 컨설팅 서비스 | 2,644.5 | 3,465.6 | 5.6% | |
| 데이터관리 서비스 | 252.8 | 492.1 | 14.3% | |
| 합 계 | 47,773.3 | 73,768.8 | 9.1% | |
|
(출처 : 연구개발특구진흥재단, 임상시험 수탁기관(CRO) 서비스 시장, 2021, Frost&Sullivan, Hybridization of Clinical Trial Designs Reviving Global CRO Market, 2020) |
이러한 성장 전망의 주요 원인으로는 최근 다국적 제약사 및 바이오제약기업들의 신약 개발 비용을 절감을 위한 생산, 개발, 임상, 마케팅, 유통 등의 위탁사(CRO업체 등) Outsourcing 사례의 증가를 꼽을 수 있습니다.
| [아웃소싱 현황] |
 |
|
small-cap 기업의 아웃소싱 현황 |
 |
|
mid-cap 기업의 아웃소싱 현황 |
| 출처: FDA, 이베스트투자증권 리서치센터 |
국내 시장 또한 글로벌 CRO 대비 높은 성장률을 보이며 지속적인 성장세를 유지하고있습니다. 최근 5년간 세계 CRO 시장의 연평균 성장률이 9.9%에 그친 데 비해 대한민국의 전체 CRO 시장은 동 기간 연평균 14%의 규모로 증가했습니다.이 외에 주목할 만 한 사항으로는 국내 CRO 업체 중 내자 CRO 업체의 점유율이 있습니다. 국내 CRO시장에서 국내 CRO와 외자 CRO의 시장점유율을 관찰하였을 때, 2014년 국내 CRO의 비중이 33.3%에서 2018년 46.2%으로 증가하였고, 2020년 최초로 내자 CRO의 점유율이 외자 CRO의 점유율을 초과하였습니다.
국내 CRO 시장은 임상 연구 서비스와 조기 개발 서비스를 두 축으로하여 글로벌 CRO 시장 예상 연평균 성장률 9.1%를 상회하는 10.4% 수준으로 지속 성장할 것으로 전망되며, 2020년 기준 임상 연구 서비스의 CRO 시장 비중은 69.8%에서 2027년 66.0%로 소폭 줄어들 것으로 전망되지만 그럼에도 불구하고 여전히 높은 수준의 점유율과 성장률을 보일 것으로 추정됩니다. 국내 CRO 시장 중 임상시험의 경우, 2023년 식약처의 임상시험계획 승인 건수는 783건으로 허가 신청을 앞둔 의약품의 개발이 활발하게 진행되고 있음을 확인할 수 있습니다.
| [국내 CRO 매출현황] |
 |
|
국내 cro |
| (출처 : KoNECT, 임상시험 산업 실태조사(2020.12)) |
| [국내 CRO 분야별 규모] |
| (단위 : 십억원) |
| 구분 | 2020년 (십억원) |
2027년 (십억원) |
CAGR | |
| 임상 연구 서비스 | 임상1상 | 142.3 | 280.6 | 10.2% |
| 임상2상 | 249.3 | 501.5 | 10.5% | |
| 임상3상 | 667.3 | 1,414.80 | 11.3% | |
| 임상4상 | 200.2 | 386.8 | 9.9% | |
| 소계 | 1,259.10 | 2,583.70 | 10.8% | |
| 조기 개발 서비스 | 화학·제조·관리 | 60.9 | 113.6 | 9.3% |
| 전임상 | 78.8 | 151.4 | 9.8% | |
| 디스커버리연구 | 160.8 | 323.4 | 10.5% | |
| 소계 | 300.5 | 588.4 | 10.1% | |
| 시험기관 서비스 | 219.2 | 421.2 | 9.8% | |
| 컨설팅 서비스 | 185.2 | 321.4 | 8.2% | |
| 합 계 | 1,802.70 | 3,914.50 | 11.7% | |
| (출처 : 연구개발특구진흥재단, 임상시험 수탁기관(CRO) 서비스 시장, 2021, The Insight Partners, Asia Pacific Healthcare Contract Research Organizations(CRO), 2020, 키움증권) |
[시장 경쟁상황]
CRO사업은 지식기반 산업으로 고부가가치 산업임과 동시에 전방산업인 제약/바이오산업과의 파트너쉽으로 인식될 만큼 큰 연관성을 가지고 있습니다. 또한, 주요 고객인 제약/바이오 기업 및 연구기관들은 수익성 개선과 신약개발의 비용절감, 신속한 제품화 등을 목적으로 CRO기업에게 전문적으로 위탁을 하고 있으며 이러한 추세는 향후 지속적으로 확대될 것으로 판단됩니다. CRO산업은 특성상 초기투자비용이 높고, 높은 수준의 시험기자재, 숙련된 연구원 등 연구기반 인프라 구축까지 많은 시간과 자원의 소요가 필요하며, 특히 유효성 시장의 경우 관련 실험경험의 유무가 계약과 관련한 중요한 요소가 되는 만큼 진입장벽이 높은 산업적 특성을 가지고 있어 단기적으로 시장의 경쟁관계가 크게 변화되지 않을 것으로 판단됩니다.
국내에 등록된 CRO업체는 약 70개사로, 업무 범위에 따라 크게 △임상 CRO (임상시험 계획, 시험기관 선정, 임상 모니터링, 데이터 관리 등) △분석 CRO (비임상시험, 검체 분석, 분석법 개발 등)로 분류됩니다. 당사는 비임상부터 임상 1상까지 사업영역을 직접적으로 운영하고 있으며 경쟁사의 홈페이지, 사업보고서 및 식약처의 인허가 현황을 바탕으로 경쟁현황을 분석했을 때 다음과 같이 시장에서 경쟁하고 있습니다.
| [국내 CRO 주요 사업영역 현황] |
| 구분 | 기업 | 비임상 | 임상 | ||
| 효능 | 독성(GLP) | 1상/생동분석(GCLP) | 2~4상 | ||
| 동물실험 | 디티앤씨알오 | O | O | O | △ |
| 바이오톡스텍 | △ | O | × | × | |
| 코아스템켐온 | × | O | × | × | |
| 안전성평가연구소 | × | O | × | × | |
| HLB바이오스텝 (구 노터스) |
O | × | × | × | |
| 임상 설계/모니터링 | 드림씨아이에스 | × | × | O | O |
| 에이디엠코리아 | × | × | O | O | |
| 비임상/임상1상 | 바이오인프라 | × | × | O | × |
| 인바이츠바이오코아 |
× | × | O | × | |
| 압타머사이언스 (구 인터내셔널사이언티픽스탠다드) |
x | O | O | × | |
| (출처: 각사 사업보고서) |
1) 비임상 및 효능시장
국내외 비임상시험 모든 과정은 법으로 규정화된 엄격한 허가제도 아래서 관리·운영하고 있습니다. 결국 비임상CRO는 세포 및 동물을 이용하여 신물질의 안전성을 평가하는 사업군으로 정부로부터 GLP 인증을 받은 연구기업(기관)을 의미합니다. 식품의약품안전처 최근 공고일 기준 현재 비임상 시험을 위해 국내 식품의약품안전처로부터 GLP 인증을 받은 비임상 시험 기관은 23개 기관이 있습니다. 국내의 경우 1986년 보건복지부에서 「의약품안전성시험관리기준」을 고시함으로써 의약 품 등의 안전성 평가시험에 대한 GLP적용을 규제하기 시작하였습니다. 이후산업화학물질 및 농약 등 산업 각 분야의 신물질에 대해 GLP적용이 확대실시 되고 있으며, 각 영역마다 주관 정부기관이 해당 GLP규정을 제정하여 관리하고 있습니다.즉, 의약품, 화장품, 식품, 화학 물질 등 허가 관련하여 해당 정부기관에 제출되는 자료는 GLP 인증기관에서 적합하게 수행된 자료만을 인정하도록 법제화되어 있습니다.
비임상시험 중 효능시험은 신약 후보 물질의 효능 여부를 확인하는 시험으로 in vitro(생체 외) 시험과 in vivo(생체 내) 시험으로 구분됩니다. in vitro 시험은 세포와 같은 간단한 마커를 통해 기전을 확인하는 시험이며, in vivo 시험은 적정 동물모델을 선정하여 효능 유무를 평가하는 시험입니다. 효능시험은 신약개발 초기단계에서 가장 중요한 요소로 과거에는 연구자가 직접 진행하거나 대학교 연구소 등에서 진행하였으나, 최근에는 신뢰성 있는 데이터 확보를 위해 외부 전문기관에 의뢰하는 추세입니다.
비임상 안전성(독성)시험은 효능이 확인된 물질의 안전성을 확인하는 시험입니다. 세포 또는 동물을 이용하여 허가기관에서 제정한 시험법 가이드라인(TG: Test Guideline)에 따라 평가항목을 설정하여 시험을 진행하게 됩니다. 비임상 시험은 약물의 특성에 따라 발생할 수 있는 1) 독성 발현여부, 2) 투여 용량에 따른 무해용량 확인, 3) 향후 임상시험 용량 설정할 수 있게 하는 임상시험의 예비시험 성격을 가집니다. 동사는 2014년 비임상시험 실시기관인 GLP 지정을 시작으로 현재까지 의약품의 GLP 인증을 보유하고 있습니다.
효능시험의 경우 허가기관의 GLP 인증이 필요 없는 Non-GLP 시험으로 수행하는 바, 대학교 연구소, 해외 CRO기관 등에 주로 실험을 의뢰하여 경쟁상황 파악에 어려움이 있습니다. 다만, 국내에서는 효능시험 분야의 가장 큰 규모의 서비스를 진행하는 CRO인 HLB바이오스텝(구 노터스)이 연구소, 제약사 자체 시험 등을 제외한 국내 효능시험의 40% 정도를 점유한다고 자체적으로 추정하고 있습니다.
2) 임상 및 분석 서비스 시장
임상시험 중 동사가 주로 수행하는 업체 중 주요 경쟁업체로는 바이오코아, 바이오인프라, 바이오썬텍, 및 한국의약연구소 등이 있으며, 구체적인 시장 조사 자료는 존재하지 않으나 바이오코아와 바이오인프라, 바이오썬텍 등 상위 3개사 및 동사가 국내 생동성 시험 시장의 과반 이상을 점유하고 있는 것으로 추정됩니다. 다만 최근 생동성 시장의 성장은 규제 변화에 의한 특수적 성격을 띄고 있다는 점에서 시장규모에 한계가있을 수밖에 없는 바, 동사는 효능평가와 독성평가와 연계할 수 있는 임상 1상 시장에 주안점을 잡고 점유율을 확보하는 것을 목표로 하고 있습니다.
임상은 사람을 대상으로 한 안전성 및 효능효과 시험으로, 임상 1상은 사람에게 약물을 적용(투여)하여 1) 부작용 유무를 확인하는 안전성과 2) 약물의 혈중 농도를 통하여 내약반응정도를 평가하는 시험입니다. 신물질신약의 1상 임상시험은 최초 임상시험(first in human study) 으로 실시하는 단회투여 용량증가시험 (dose escalation study)부터 몇가지 디자인의 시험을 실시할 수 있습니다. 1상 임상시험은 안전성과 약동학을 평가하는 것이 목적이기 때문에 건강성인을 대상으로 실시하는 것이 보통이나 세포독성 함암제의 경우 말기 암환자를 대상으로 하는 등 의학적 고려에 의해 다른 방법으로 실시될 수도 있습니다.
신물질신약 분석법의 개발에 있어서는 공개된 물성 정보가 없기 때문에 시험의뢰자가 분석법 개발에 필요한 충분한 기초물성 정보를 제공하지 못하는 경우에는 분석법 개발에 필요한 물성 정보를 측정하면서 분석법을 개발해야 합니다. 동사는 2018년 임상시험 검체분석기관인 GCLP 지정 이래 120건 이상의 임상 PK 분석을 수행해 왔으며, 분석법 개발 서비스도 함께 제공하고 있습니다.
그러나, 위와 같은 CRO 업계의 성장에도 불구하고 향후 경기 불황 등 거시적 또는 미시적 요인에 의하여 주력 시장의 성장세가 둔화될 경우, 해당 사업부의 영업활동에 부정적 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자에 임하시기 바랍니다.
2. 회사위험
| [투자자 주의사항] |
|---|
| ■ 당사는 2021년부터 2023년까지 별도의 연결대상 종속회사를 보유한 바 없으나, 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득함에 따라, 2024년 반기에는 (주)인터내셔널사이언티픽스탠다드를 당사의 연결대상 종속회사로 인식하였습니다. ■ 이에, 본 증권신고서는 2021년부터 2023년까지는 개별 재무제표를 기준으로 작성하였으며, 2024년 반기는 연결 재무제표를 기준으로 작성하였습니다. ■ (주)인터내셔널사이언티픽스탠다드 간주취득일은 2024년 6월 30일입니다. 이에, 2024년 반기말 기준 당사 연결재무상태표상에는 (주)인터내셔널사이언티픽스탠다드의 자산 및 부채가 연결대상 종속회사로서 포함되어 있으나, 연결손익계산서상에는 2024년 반기에 발생한 (주)인터내셔널사이언티픽스탠다드 별도 매출 및 손익은 간주취득일 이전 손익에 해당되므로 포함되어 있지 않습니다. ■ 한편, 당사는 2024년 6월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 이에 합병 후 당사는 별도의 연결대상 종속회사가 존재하지 않으며, 2024년 3분기부터 합병 후 개별 재무제표를 기준으로 당사의 재무자료가 공시될 예정입니다. ■ 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| 가. 매출부진 및 지속적 손실 발생 위험 당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 단백질이나 유전자 소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 바이오기업으로 현재도 동일 사업을 영위하고 있습니다. 주요 파이프라인으로는 AST-201(고형암치료제), AST-202(혈액암치료제), AST-203(고형암 치료제) 등이 있습니다. 당사의 바이오 사업 특성 상 기술이전을 통한 매출 발생까지 오랜 시간이 소요되며, 높은 연구개발비 사용에 의하여 설립 이래 지속적으로 영업손실 및 당기순손실이 발생하고 있는 상황입니다. 당사는 현재 보유하고 있는 주요 파이프라인의 라이선스 아웃을 통한 매출 발생을 위하여 노력하고 있는 상황입니다. 그러나 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 단백질이나 유전자 소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 바이오기업으로 현재도 동일 사업을 영위하고 있습니다. 주요 파이프라인으로는 AST-201(고형암치료제), AST-202(혈액암치료제), AST-203(고형암 치료제) 등이 있습니다. 당사의 바이오 사업 특성 상 기술이전을 통한 매출 발생까지 오랜 시간이 소요되며, 높은 연구개발비 사용에 의하여 설립 이래 지속적으로 영업손실 및 당기순손실이 발생하고 있는 상황입니다. 당사의 최근 3개년 및 2024년 반기 요약 손익계산서는 다음과 같습니다.
| [요약 손익계산서] |
| (단위 : 백만원) |
| 과 목 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 매출액 | 71 | 103 | 243 | 358 | 269 |
| 매출원가 | 12 | 20 | 52 | 72 | 113 |
| 매출총이익 | 59 | 83 | 191 | 287 | 156 |
| 판매비와관리비 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| 영업이익 | -3,628 | -6,837 | -12,207 | -8,320 | -4,067 |
| 법인세비용차감전순이익 | -5,589 | -7,160 | -13,602 | -8,301 | -3,831 |
| 법인세비용 | - | - | - | -1,186 | - |
| 당기순이익 | -5,589 | -7,160 | -13,602 | -7,116 | -3,831 |
| (출처 : 정기보고서) |
[성장성 분석]
당사의 매출액은 2021년 269백만원, 2022년 358백만원을 기록한 이후, 2023년 243백만원으로 매출이 감소하였습니다. 2024년 반기 또한 매출액 71백만원으로 전년 동기 103백만원 대비 감소하였습니다.
당사는 신약개발부문, 진단제품부문, 압타머서비스부문으로 매출을 구분하고 있습니다. 당사의 신약개발부문은 현재까지 매출이 발생하고 있지 않고, 현재 다기능 압타머 플랫폼(BiFAp)을 통하여 항암제 등 first-in-class 치료제를 개발하고 있습니다. 발굴된 치료제의 임상적 유효성(Proof of Concept)을 확보한 후에 글로벌 제약사에게 라이센싱하거나 regional player와 공동개발을 추진하여 수익을 창출하는 사업모델로, 이를 위하여 Bio USA, Bio Europe, ChinaBio 등의 비즈니스 파트너링 미팅에 참가하여 다수의 파트너사와 기술 이전 및 공동개발 협력 등을 논의해 오고 있습니다.
진단제품 부문은 AptoMIA(Aptamer-based Multivariate Index Assay) platform에 기반하여 암 등 조기진단이 어려운 질병을 대상으로 하고 있으며, 세계 최초로 폐암을 조기에 진단할 수 있는 압타머 기반 압토디텍트 렁(AptoDetect™-Lung)을 상용화하였습니다. 혈액에 존재하는 7종의 단백질 바이오마커를 정량적으로 검출하고 알고리즘을 통하여 폐암에 대한 진단정보를 제공하는 기술입니다. 그러나 진단제품 매출은 2022년 3백만원, 2024년 반기 1백만원으로 아직까지 미미한 수준입니다.
압타머 서비스 부문은 압타머 합성 서비스 및 발굴서비스로 구분됩니다. 압타머 서비스를 제공하기 위해서는 고성능의 압타머를 합성 및 발굴할 수 있는 플랫폼 기술을 보유하고 있어야 하며, 당사를 포함하여 소수의 압타머 회사들이 각자 보유하고 있는고유의 압타머 합성 및 발굴 기술을 통해 연구자들에게 서비스를 제공하고 있습니다. 당사는 압타머 플랫폼 기술과 10년 이상 운영해온 결과물로 압타머 아카이브를 보유하고 있습니다. 압타머 아카이브에는 250 여종의 단백질에 특이적인 결합력이 확인된 1,500 여종의 압타머 서열정보 등이 포함되어 있습니다.
압타머 합성 및 발굴에 대한 높은 성공률과 우수한 결합력을 위해 동사는 변형핵산 기반 발굴기술 (변형핵산 라이브러리 제작, 버퍼 조성 구축을 포함한 최적의 PCR 반응조건 구축 등) 구축하여 진입장벽은 높다고 할 수 있습니다. 특히, 당사가 개발을 완료하고 특허 출원한 ViroSELEX를 통하여 기존의 SELEX의 단점을 보완한 차세대 압타머 발굴 기술로서세포막 단백질 바이오마커에 우수한 압타머 확보가 가능합니다. 압타머 서비스 무문 매출은 2021년 269백만원, 2022년 355백만원, 2023년 243백만원, 2024년 반기 71백만원으로 당사 매출의 대부분을 차지하고 있습니다.
| [매출액 내역] |
| (단위 : 천원) |
|
서비스 및 제품명 |
2024년 반기 매출액 |
2023년 반기 매출액 (비율) |
2023년도 매출액 |
2022년도 매출액 |
2021년도 매출액 |
제 품 설 명 |
|---|---|---|---|---|---|---|
|
AST-201 |
- | - | - | - | - | 항암물질 젬시타빈을 내재화하여 GPC3-양성종양(간세포암, 비소세포폐암 등)에 선택적인 항암 효능을 가진 압타머-약물 복합체 |
| AST-202 (혈액암치료제) |
- | - | - | - | - |
1. CD25 발현률이 높은 혈액암(급성골수성백혈병, T 세포 림프종 등)을 직접 타겟하는 압타머-약물 복합체 2. 종양조직에서 조절 T 세포 선택적인 활성조절과 사멸을 유도해서 항종양 면역활성을 높이는 압타머-약물 복합체 |
|
AST-203 (고형암 치료제) |
- | - | - | - | - |
1. Trop2 양성 종양에 선택적인 압타머-약물 복합체 2. ADC 개발에 난항을 격고 있는 췌장암 및 폐암을 주요 적응증으로 개발 |
| 압토디텍트 렁 (AptoDetect™-Lung) |
560 |
- |
- | 2,860 (0.8%) |
- |
혈액에서 7종 단백질을 측정하고 알고리즘
분석을 통하여 폐암 위험도 정보 제공 |
|
올리고 합성 |
63,635 |
95,255 (92.4%) |
215,136 (88.5%) |
319,326 (89.1%) |
183,321 (68.1%) |
압타머 포함 다양한 oligonucleotides 물질에 대한 다양한 형태의 합성 서비스를 제공
|
|
압타머 발굴 |
6,861 |
7,800 (7.6%) |
28,050 (11.5%) |
36,067 (10.1%) |
85,954 (31.9%) |
변형 핵산 라이브러리를 이용한 차세대 압타머 발굴 기술을 기반으로 높은 특이도와 결합력을 가지는 압타머를 발굴해 연구자들에게 제공하는 서비스
|
| 합계 | 71,056 | 103,055 | 243,186 | 358,253 | 269,275 | - |
| (출처 : 정기보고서) |
[수익성 분석]
당사의 최근 3년 및 2024년 반기 수익성을 분석해보면 2021년 4,067백만원, 2022년 8,320백만원, 2023년 12,207백만원, 2024년 반기 3,628백만원의 영업손실이 지속적으로 발생하고 있으며, 2021년 3,831백만원, 2022년 7,116백만원, 2023년 13,602백만원, 2024년 반기 5,589백만원의 당기순손실이 지속적으로 발생하고 있는 상황입니다. 연도별 수익성 추이는 하기와 같습니다.
| [수익성 추이] |
| (단위 : 백만원) |
| 과 목 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 매출액 | 71 | 103 | 243 | 358 | 269 |
| 매출원가 | 12 | 20 | 52 | 72 | 113 |
| 매출총이익 | 59 | 83 | 191 | 287 | 156 |
| 판매비와관리비 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| 영업이익 | -3,628 | -6,837 | -12,207 | -8,320 | -4,067 |
| 금융수익 | 413 | 678 | 1,300 | 639 | 263 |
| 금융비용 | 2,374 | 1,000 | 2,698 | 629 | 44 |
| 기타수익비용 | - | - | 3 | 9 | 17 |
| 법인세비용차감전순이익 | -5,589 | -7,160 | -13,602 | -8,301 | -3,831 |
| 법인세비용 | - | - | - | -1,186 | - |
| 당기순이익 | -5,589 | -7,160 | -13,602 | -7,116 | -3,831 |
| 영업이익률 | 적자 | 적자 | 적자 | 적자 | 적자 |
| 당기순이익률 | 적자 | 적자 | 적자 | 적자 | 적자 |
| (출처 : 정기보고서) |
2021년에는 매출총이익이 156백만원 발생하였고, 판매비와 관리비가 4,224백만원 발생하여 영업손실 4,067백만원을 기록하였습니다. 이자수익으로 인한 금융수익 263백만원이 발생하여 3,831백만원 당기순손실이 발생하였습니다.
2022년에는 매출이 소폭 증가하여 매출총이익이 287백만원 발생하였으나, 경상연구개발비 증가로 인하여 판매비가 관리비가 8,606백만원으로 증가, 8,320백만원 영업손실을 기록하였습니다. 2022년 이전까지 차입금이 존재하지 않아 금융비용이 매우 낮은 편이었으나, 2022년 10월 제1회 사모 전환사채를 발행하면서 금융비용이 발생하기 시작하였습니다. 2022년은 단기금융상품 이자수익으로 인한 금융수익 639백만원, 전환사채로 인한 이자비용 및 파생상품평가손실 629백만원이 발생하여 당기순손실 7,116백만원을 기록하였습니다.
2023년에는 매출 감소로 매출총이익이 191백만원만 발생하였고, 경상연구개발비 증가로 인하여 판매비가 관리비가 12,398백만원으로 증가, 12,207백만원 영업손실을 기록하였습니다. 단기금융상품 이자수익으로 인한 금융수익 1,300백만원, 주가상승으로 인하여 전환사채파생상품평가손실 1,211백만원과 이자비용 1,394백만원으로 금융비용 2,698백만원이 발생하여 당기순손실 13,602백만원을 기록하였습니다.
2024년 반기에는 매출 감소로 매출총이익이 59백만원만 발생하였고, 경상연구개발비 감소로 인하여 판매비가 관리비가 3,688백만원으로 감소하였고, 3,628백만원 영업손실을 기록하였습니다. 주가상승으로 전환사채파생상품평가손실 1,554백만원이 발생하여 금융비용이 2,374백만원으로 증가, 당기순손실 5,589백만원을 기록하였습니다.
당사의 판매비와관리비는 2021년 4,224백만원 이후 2022년 8,606백만원, 2023년 12,398백만원으로 지속적으로 증가하고 있습니다. 판매비와관리비의 증가 원인은 인원증가로 인한 급여 및 기업규모 증가로 인한 기타비용 증가도 있지만 가장 주요한 원인은 경상연구개발비 증가 때문입니다. 경상연구개발비는 2021년 1,763백만원, 2022년 6,025백만원, 2023년 9,359백만원으로 매년 큰폭으로 증가하는 추세입니다. 당사의 경상연구개발비는 신약후보물질의 전임상/임상비용과 연구원 인건비가 가장 큰 비중을 차지합니다. 지난 3년간 경상연구개발비는 고형암 치료제 AST-201의 전임상(2021-22년)과 임상준비비용(2023년), 혈액암 치료제 AST-202의 전임상비용(2023-24년)으로 사용되었으며, 그중에서도 AST-201의 임상시험용 의약품 위탁생산에 약 100억원이 소요되었습니다(Asymchem사 690만 달러, Wuxi STA사 47만 달러). 해당 의약품은 임상 1상 시험을 마칠 때까지 사용하게 되므로, 2025년까지 AST-201 임상으로 인한 대규모 지출은 없을 예정입니다. 이러한 이유로 2024년 반기 경상연구개발비가 1,959백만원으로 전년동기대비 큰폭으로 감소하였습니다.
| [판매비와 관리비 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 급여 | 1,000 | 984 | 1,811 | 1,508 | 1,237 |
| 상각비 | 138 | 151 | 293 | 293 | 436 |
| 경상연구개발비 | 1,959 | 5,360 | 9,359 | 6,025 | 1,763 |
| 기타영업비용 | 591 | 425 | 935 | 780 | 787 |
| 복리후생비 | 117 | 114 | 253 | 210 | 184 |
| 지급수수료 | 260 | 126 | 320 | 285 | 364 |
| 여비교통비 | 50 | 29 | 48 | 22 | 14 |
| 세금과공과 | 48 | 43 | 81 | 81 | 63 |
| 건물관리비 | 42 | 42 | 86 | 83 | 61 |
| 보험료 | 15 | 11 | 22 | 19 | 18 |
| 기타 | 59 | 60 | 124 | 80 | 83 |
| 합 계 | 3,688 | 6,921 | 12,398 | 8,606 | 4,224 |
| (출처 : 정기보고서) |
[상장당시 재무사항 예측치와 실적치 비교]
당사는 기술성장기업으로 코스닥시장 상장규정 제7조 제2항에서 정하는 신규상장 심사요건 특례를 적용받아 2020년 9월 16일 코스닥시장에 상장되었습니다. 당사는 특례상장기업으로서 코스닥시장 상장을 위한 증권신고서에 미래 제품별 매출액을 추정하여 기재하였는바, 당시 증권신고서에 기재된 최근 3개 사업연도에 대한 재무사항 예측치와 실적치를 비교하면 다음과 같습니다.
| (상장일 : | 2020. 09. 16 | 인수인 : 키움증권) | (단위 :백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 괴리율(%) |
|---|---|---|---|---|
| 2020년 | 매출액 | 1,155 | 229 | 80 |
| 신약개발 | - | - | - | |
| 진단제품 | 581 | - | 100 | |
| 압타머서비스 | 575 | 229 | 60 | |
| 영업이익 | (4,438) | (3,923) | 12 | |
| 당기순이익 | (4,588) | (3,843) | 16 | |
| 2021년 | 매출액 | 9,657 | 269 | 97 |
| 신약개발 | 6,779 | - | 100 | |
| 진단제품 |
2,042 |
- | 100 | |
| 압타머서비스 | 836 | 269 | 68 | |
| 영업이익 | (5,019) | (4,067) | 19 | |
| 당기순이익 | (5,169) | (3,831) | 26 | |
| 2022년 | 매출액 | 35,695 |
358 |
99 |
| 신약개발 | 18,894 | - | 100 | |
| 진단제품 | 15,604 | 3 | 100 | |
| 압타머서비스 | 1,197 | 355 | 70 | |
| 영업이익 | 10,012 |
(8,320) |
183 | |
| 당기순이익 | 9,862 |
(7,116) |
172 | |
| 2023년 | 매출액 | 78,274 | 243 | 100 |
| 신약개발 | 43,072 | - | 100 | |
| 진단제품 | 33,442 | - | 100 | |
| 압타머서비스 | 1,760 | 243 | 86 | |
| 영업이익 | 41,427 | (12,207) | 129 | |
| 당기순이익 | 32,196 | (13,602) | 142 |
| (주1) '괴리율'은 '(예측치-실적치)/예측치'로 산정하여 백분율로 기재하였으며, 예측치는 투자설명서에 기재된 예측치를 반영하였습니다. |
-
매출액
당사는 당시 증권신고서상 3가지 신약 후보물질의 각 적응증에 대한 유사 신약 후보물질의 기술이전 사례, 임상 예정 추진 일정등을 고려하여 다음과 같이 매출 발생시 점 및 매출액을 추정하였습니다.
| [신약 파이프라인별 매출 발생시점 추정] |
| 구분 | 2020년(E) | 2021년(E) | 2022년(E) | 2023년(E) |
|---|---|---|---|---|
| AST-101 (인슐린대체제) |
- | - | - 임상 1상 완료 - 기술이전 계약 체결 - 계약금 수령 |
- |
| AST-102 (인슐린민감제) |
- | - 공동연구 계약 체결 (option agreement fee 수령) - 전임상 완료 - 기술이전 계약 체결 - 계약금 수령 |
- | - 임상1상 완료 - 임상2상 진입 - 마일스톤 수령 |
| AST-201 (간암치료제) |
- | - | - | - 임상2상 완료 - 기술이전 계약 - 계약금 수령 |
| [신약 파이프라인별 매출액 추정] |
| (단위 : 백만원) |
| 구분 | 2020년(E) | 2021년(E) | 2022년(E) | 2023년(E) |
|---|---|---|---|---|
| AST-101 (인슐린대체제) | - | - | 18,894 | - |
| AST-102 (인슐린민감제) | - | 6,779 | - | 8,231 |
| AST-201 (간암치료제) | - | - | - | 34,841 |
| 합계 | - | 6,779 | 18,894 | 43,072 |
(1) AST-101 (인슐린대체제) / AST-102 (인슐린민감제) - 개발 잠정 중단
당사는 AlloMAp 플랫폼을 활용한 First-in-class 당뇨 신약 개발(제1/2형 당뇨의 지속형 인슐린대체제 및 인슐린민감제)을 추진했으며 Johnson & Johnson 사와 제휴(2016년 4분기), Novo Nordisk 사와 MTA(물질이전계약) 체결(2018년 3분기), 범부처신약개발과제에 선정(2019년 1분기)되었습니다. 그러나 비임상 단계에서 산출된 데이터로 후보물질의 경제성평가를 수행한 결과, 인슐린 기반 치료제가 기존 치료제의 대세로 자리잡은 현 시장 상황과 투여주기를 점점 늘려가는 당뇨 치료제 개발 방향성을 고려하여 △주1회 투여 방식으로 제형변화의 필요성 △시장의 경쟁 심화 △GLP-1 수용체작용체의 확대 △인슐린 기반 치료제의 지속적인 단가 인하로 인한 가격경쟁력 확보의 불확실성 등의 요인으로 경쟁력이 높지 않음을 확인하였고, 2022년 3분기 해당 파이프라인의 개발을 잠정 중단하기로 결정하였습니다. 당사의 후보물질은 인슐린 장기투여로 인한 부작용(인슐린 저항성, 심혈관 위험, 체중증가 등)에서 경쟁우위에 있으나, 대사질환 계열 약물의 임상적 유의성을 입증하기 위한 대규모 임상 등 투자비용 대비 기대수익이 충분하지 않았던 까닭입니다. 현 시점에서는 추가적인 제형연구를 통한 약동력학적 특성 개선과 활성평가 연구를 일부 병행 중으로, 임상 단계 진입은 공동개발 파트너사가 정해진 이후에 가능할 것으로 예상됩니다.
(2) AST-201 (간암치료제) - 개발 일정 지연
현재 동사가 개발중인 고형암치료제 AST-201( 바이오마커인 글라이피칸3(GPC3)에 선택적으로 결합하는 표적형 압타머 신약) 으로 2024년 3월 국내 1상 임상시험 IND 승인 신청을 완료하였습니다.
당사의 고형암 치료제 AST-201은 상장 당시 후보물질 단계였으며, 2021~22년 전임상 시험 - 2023년 임상시험용 의약품 위탁생산 - 2024년 현재 식약처 임상시험계획승인(IND)을 신청한 상태입니다. 이는 상장 당시보다 2년 정도 지연된 것으로, 주요 사유는 △코로나19로 인한 임상용 의약품 위탁생산의 지연 및 전임상 독성평가를 위한 위탁시험기관 확보의 어려움 △중국 제약사와의 파트너링 논의지연 등입니다. 현 시점은 식약처 임상승인 신청을 마친 상태로 2024년 10월 중 IND 승인을 예상하고 있습니다. 이에 10월부터 국내 다기관임상(4개 병원)에 착수할 계획이며, 2025년 임상 중간데이터를 확보하여 해외제약사 기술이전계약 체결을 목표하고 있습니다. 당사는 글로벌 기술이전을 목표로 2024년 상반기 China Bio, Bio USA 전시박람회에 참가하였으며, 기술이전을 목표로 사업개발 활동을 진행 중입니다.
AST-201은 중국 현지에 있는 BD 전문 에이전트 Y사를 통해 중국 제약바이오 기업 80여 개사에 제안한 바 있으며, CDMO 협력사인 Asymcem, Wuxi 사와의 네트워크도 활용 가능할 것입니다. 또한 2024년 9월 AST-201의 물질특허가 중국 특허청에 등록결정이 되어 기술이전에도 긍정적 영향을 미칠 수 있습니다.
(3) 진단제품
당사는 당시 증권신고서 상 2020년 하반기부터는 본격적인 매출이 발생될 것으로 예상하였고, 해외시장 진출의 발판을 마련하기 위해 세계 최대 시장인 중국 진출을 위하여 중국 BGT 사와 협력 계약을 체결하고 임상 및 ICL 기반 서비스 사업을 추진한 바 있습니다. 그러나 2020년 중국발 Covid-19가 유행함에 따라 중국시장 진출의 어려움을 겪어 현재는 중단된 상황입니다. 2023년 해외사장 진출의 본격화를 예상하여 투자설명서상 추정 매출 33,442백만원으로 기재하였으나 실적은 0원으로 괴리율은 100%입니다.
괴리 발생 원인으로는 1~2차년도 중국발 코로나19가 유행함에 따라 중국시장 진출의 어려움을 겪었으며, 국내 시장의 경우 코로나19의 영향과 더불어 신의료기술 평가 유예 제도 시행이 지연됨에 따라 임상 활동 또한 지연되었습니다. 3차년도의 평가유예 시행 이후로는 2022년 기말 기존 수탁기관의 계약 종료에 따른 새로운 새로운 수탁기관과의 계약 과정에서 수탁기관 공백에 따른 병원별 비급여 코드 확보에 어려움을 겪었으며, 수탁기관과의 공동 마케팅 활동 또한 어려움을 겪었습니다. 이로 인해 진단제품의 1~3차 년도 괴리율이 100%-100%-100% 발생되었으나 2023년 하반기 새로운 수탁기관과의 계약으로 현재는 비급여 코드를 활발히 확보 중이며, 건강검진 시장 진입과 공동 마케팅 활동에 전념하고 있습니다.
현재는 건강검진센터를 위주로 '비소세포폐암 위험도 검사'의 공급처를 늘리기 위해 병원 연계 검진시장을 진입하고 있으며, 분당차병원 건강검진센터를 시작으로 서비스 채널을 늘려나가고 있습니다. 또한 여러 해외시장 진출을 타진 중이나, 그중에서도 인도가 빠르게 진전 중입니다. 인도 A사와는 지난 2024년 5월 MOU를 체결하고 임상시험 및 인허가를 준비하는 단계입니다. 인도 CEC (Clinical Ethical Committee, 임상윤리위원회)의 승인을 받기 위한 서류를 제출한 상태이며, 빠르면 10월 내 승인여부 결과가 나올 것으로 예상하고 있습니다. 협력사와의 협업이 계획대로 진전된다면 2026년 하반기부터 초도 매출이 발생할 것으로 예상됩니다.
(4) 압타머 서비스
당사가 보유한 카타로그 압타머에 대한 합성 서비스는 설립부터 계속하여 진행하고 있습니다
. 많은 고객으로부터 고품질의 합성 노하우를 인정받아 일반 DNA 올리고뉴클레오타이드 합성 서비스 또한 제공하고 있습니다
. 당사의 합성 생산능력은 수십 mg까지 자체 합성이 가능한 수준으로써 전임상개발 이전단계(동물효능평가)까지를 대상으로 합니다. 전임상 및 임상을 위한 압타머 합성은 Outsourcing이 가능한 업체를 확보하고 있고 내부합성과 동일한 품질로 생산되도록 관리합니다.
당사의 압타머 발굴 서비스는 압타머 플랫폼 기술을 통해 약 8주 정도의 기간이 소요되는 서비스입니다. 1인의 연구원이 한 번의 발굴 진행으로 최대 48개의 표적 분자에 대해 동시에 압타머를 개발할 수 있는 다중 발굴 플랫폼입니다.
- 영업이익
영업이익의 경우 0차년도 예측치 -4,438백만원 실적치 -3,923백만원으로 괴로율 12%, 1차년도 예측치 -5,019백만원 실적치 -4,067 백만원으로 괴리율 19%으로, 주요 괴리 발생원인으로는 매출 괴리율 발생원인에 기인합니다. 또한 국내 시장의 신의료 기술 평가 유예 제도 시행 지연과 해외시장의 코로나19에 의한 해외 임상 지연, 임상개발비의 지출 또한 지연됨에 따라 괴리율이 상대적으로 소폭 발생되었으나, 2차년도의 경우 예측치 10,012백만원 실적치 -8,320백만원 괴리율 183%, 3년차도의 경우 예측치 41,427백만원 실적치 -12,207백만원 괴리율 129%으로 2차년도의 경우 압타머를 이용한 신약개발이라는 특수성의 사유로 지연되었던 CDMO의 발굴로 인한 임상개발비의 지출의 본격화로 1차년도에 비해 괴리율이 대폭 상승하였으며, 3년차도의 경우 2024년 1분기내 IND filing 및 임상1상시험을 앞두고 전 임상단계 연구개발비의 지출금액이 대부분 발생됨에 따라 괴리율이 129% 발생되었습니다.
- 당기순이익
당기순이익의 경우 0차년도 예측치 -4,588백만원 실적치 -3,843백만원으로 괴리율 16%, 1차년도 예측치 -5,169백만원 실적치-3,831백만원으로 괴리율 26%로 상대적으로 괴리율이 낮은 편이었으나, 2년차도의 경우 예측치 9,862백만원 실적치 -7,116백만원으로 괴리율 172% 가 발생되었습니다. 주요 괴리 발생 원인으로는 0, 1차년도의 경우 코로나 유행에 따른 임상지연의 사유로 임상개발비 지출의 이연으로 괴리율이 상대적으로 소폭 발생하였으나 2~3차년도의 경우 추정 매출의 괴리와 제1회 전환사채와 관련된 이자비용과 파생상품 평가손실의 인식으로 괴리율이 대폭 증가하였습니다. 특히 3차년도의 경우 임상 1상 진입전 전임상 단계의 지출의 발생 시점이 도래함에 따라 예측치 32,196백만원 실적치 -13,602백만원으로 142%의 괴리율이 발생되었으며, 제1회 전환사채와 관련된 파생상품평가손실 1,211백만원과 이자비용 1,394백만원으로 금융비용 2,698백만원이 발생하여 손실이 증가 되었습니다.
이처럼 당사가 예측하지 못한 변수들이 발생하면서 추정치와 실제 매출 및 손익은 매우 높은 괴리를 보이고 있습니다. 이는 당사가 상장시 계획한 영업활동이 정상적으로 실행되고 있지 않음을 의미합니다. 투자자께서는 당사의 향후 매출액 및 이익 또한 추정치와 높은 괴리를 보일 수 있음을 유의하시고 투자에 임하시기 바랍니다.
[수익성 개선 계획]
(1) 신약개발의 효율성 강화
당사는 신약개발 사업의 기간 및 비용의 위험을 줄이고자 신약후보물질 과제들을 전임상 또는 초기 임상 단계까지 진행하고, 이후 임상 개발 및 상업화 단계는 글로벌 빅파마 또는 국내 제약사에 기술 수출(Licensing out, L/O)을 통해 진행하는 사업구조를 계획하고 있습니다. 당사는 과제별로 해당 적응증의 치료제 개발 및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 대형 제약 회사, 바이오회사들 중심으로 후보사들을 접촉할 계획이며, 이들 회사들과의 지속적 교류을 통해 기술 수출에 필요한 임상 개발 및 허가 자료들을 확충하여 기술 수출 및 계약 체결에 대한 가능성을 높이고 조속한 사업성을 확보하고자 합니다.
한편 기술이전에 따른 단계별 마일스톤 및 시판 로열티 등은 적정 시점에 적정 기준을 통과 하여야만 수취 가능합니다. 만약 파트너사(Licensee)의 임상 진행이나 허가 취득 과정 등에 차질이 발생하는 경우 기술이전 계약이 중도 해지될 리스크가 존재합니다. 또한, 기술이전 지연이나 실패, 파트너사의 연구개발 및 허가취득 지연이나 실패로 인해 당사가 예측하는 수익성 및 재무적인 안정성의 불확실성이 존재한다는 점을 투자자께서는 유의하여 투자하시기 바랍니다.
당사는 신약개발기획 단계에서부터 사업, 생산, 연구개발 부서가 협업하여 과제 완료 시 기술적 목표뿐만 아니라 상업적 목표를 반드시 달성할 수 있도록 단계-관문 체계(Stage Gate System)로 설계하고자 하며 이렇게 되면 매 단계가 완료되기 직전에 엄격한 심사를 거쳐 중간 관문(Gate)을 통과해야만 다음 단계로 진입할 수 있게되고, 이를 달성하지 못할 경우 연구를 중단하거나 추가 연구 기간을 부여받게 되는데 이러한 체계를 효과적으로 운영하여 연구개발 생산성을 높이고자 합니다.
또한 당사는 정기적으로 자금소요 계획을 업데이트하고, 우선순위를 관리하는 등 파이프라인 강화 및 라이선스아웃(L/O)이 계획대로 진행될 수 있도록 유동성 관리에 집중할 계획입니다.
다만, 압타머 기술 기반 승인 신약으로는 Macugen(Pfizer, 2004)과 Izervay(Astellas, 2023) 두 종이 있고, 이중 Macugen는 보다 효과적인 신약 출시로 인해 현재는 시장에서 판매중단이 되었습니다. Macugen과 Izervay은 황반변성에 대한 신약으로 현재까지 암 치료에 승인된 압타머는 없습니다.
압타머 기술 기반 신약에 대한 자세한 사항은 1. 사업위험 - 가. 압타머 산업 성장 지연에 따른 위험을 참고하시기 바랍니다.
(2) 진단제품 사업의 조속한 시장진입 및 원가 절감
당사는 압토디텍트 렁에 대해 국내는 기존과 같이 상급종합병원 처방과 동시에 급여전환을 통한 1,2차 병원에서의 처방 활성화에 주력함과 동시에 연간 600만명에 달하는 국내 기업검진시장에서 빠르게 자리를 잡아가는 것을 목표로 하고 있습니다. 다만 이러한 시장진입시 준비가 충분치 않았던 사유로 인해 기대했던 매출이 발생하기까지 예상보다 오랜 기간이 걸리고 있으며, 이에 따른 진단사업 본격화까지 사업화 지연, 수탁기관과의 계약관계로 인한 매출 지연 등의 위험이 존재합니다. 한편 회사는 해외 진출을 위한 신규 제품 개발을 준비중에 있는데, 기존 제품은 마이크로 비드 기반의 분석법을 사용하는데, 고가의 분석장비인 루미넥스를 필요로 한 반면, 신규 제품은 PCR 진단장비로 분석이 가능하다는 것이 장점으로, 기존 제품은 검사 다음날 수검자가 결과를 받아볼 수 있었지만 PCR 제품은 검사 당일 결과를 확인할 수 있게 됨으로써 해외 진출이 수월해지게 됨에 따랄 이를 마케팅 전략으로 활용할 방침입니다. 당사는 향후 Scale Up 이후에도 원가경쟁력을 확보하기 위한 원가분석 및 원가절감 활동을 계획하고 있으며 이를 위해 중소기업형 ERP 도입을 검토하고자 합니다. 또한 국내 생산제품을 해외로 수출하는 방식도 고려됐지만 생산단가와 국제 물류비용 부담으로 현지 생산방식이 비교우위를 가질 것으로 판단하고 준비을 진행중인 바 이에 대한 다각적인 수익성 검증에 집중할 계획입니다.
당사 진단제품에 대한 자세한 사항은 1. 사업위험 - 사. 폐암 조기진단 제품에 대한 경쟁 상황의 변화에 따른 목표 시장 점유율 감소를 참고하시기 바랍니다.
(3) CRO 사업의 효율적 운용
당사의 CRO사업은 여러 제약바이오 기업과 다양한 프로젝트를 수행해 왔고 특히 바이오의약품 시장의 성장을 예상하고 선제적인 대비를 해온 만큼 국내 기업 주도 신약 개발 프로젝트가 활성화되고 글로벌 기술이전 사례가 많아짐에 따라 이를 뒷받침할 고품질 분석 서비스로 협력을 확대하겠다는 계획을 가지고 있습니다. 한편 CRO사업은 프로젝트가 주를 이루고 있는 만큼 수익성 기반의 선별적인 수주와 인건비, 유지보수비, 유틸리티비 등을 감안한 손익분기점 관리에도 만전을 기하고자 하며 매출 확대와 고객군 확대 과정에서 수반되는 Capex 투자에 대해서도 타당성 검증 및 효율적인 운용을 통해 생산성을 높이는데 주력할 방침입니다.
CRO사업과 관련된 자세한 사항은 2. 회사위험 - 라. (주)인터내셔널사이언티픽스탠다드 관련 위험을 참고하시기 바랍니다.
상기 기재한 바와 같이 당사는 연구개발에 대한 지속적인 투자로 인해 영업손실 및 당기순손실 상태가 지속되고 있습니다. 현재 보유하고 있는 주요 파이프라인의 라이선스 아웃을 통한 매출 발생을 위하여 노력하고 있는 상황입니다. 그러나 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 나. 재무안정성 악화 위험 당사의 2024년 반기말 연결기준 부채총계는 21,283백만원이며, 부채비율은 216.8%, 차입금의존도는 54.7%입니다. 전환사채, 리스 외에 금융기관 차입금은 없는 상황이며, 최근 3년 지속적인 당기순손실 발생에 의하여 재무구조가 악화되고 있는 상황입니다. 금번 주주배정 후 실권주 일반공모 유상증자가 성공적으로 진행될 경우 당사의 재무안정성 지표는 추가적으로 개선될 것으로 예상하고 있습니다. 그러나 당사의 경우 최근 지속적인 당기순손실이 발생하고 있으며, 향후에도 사업이 흑자전환되지 않아 당기순손실이 지속될 경우 재무안정성이 악화될 가능성이 높습니다. 투자자께서는 당사의 부채상환능력 및 사업의 흑자전환 여부 등에 대하여 유의하여 투자해 주시기 바랍니다. |
당사의 2024년 반기말 연결기준 부채총계는 21,283백만원이며, 부채비율은 216.8%, 차입금의존도는 54.7%입니다. 전환사채, 리스 외에 금융기관 차입금은 없는 상황이며, 최근 3년 지속적인 당기순손실 발생에 의하여 재무구조가 악화되고 있는 상황입니다. 최근 3년 당사의 재무안정성비율 추이는 다음과 같습니다.
| [재무안정성 비율] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 자산 총계 | 31,100 | 32,536 | 45,645 | 33,262 |
| - 유동자산 | 21,061 | 25,034 | 37,964 | 24,815 |
| - 비유동자산 | 10,039 | 7,502 | 7,681 | 8,446 |
| 부채 총계 | 21,283 | 17,057 | 16,423 | 1,800 |
| - 유동부채 | 18,102 | 15,239 | 2,538 | 432 |
| - 비유동부채 | 3,181 | 1,818 | 13,885 | 1,369 |
| 자본 총계 | 9,817 | 15,479 | 29,223 | 31,461 |
| 차입금 총계 | 17,000 | 14,586 | 12,635 | 107 |
| - 단기차입금 | 151 | - | - | - |
| - 유동성 전환사채 | 16,264 | 14,530 | - | - |
| - 유동 리스부채 | 327 | 43 | 46 | 38 |
| - 비유동 전환사채 | - | - | 12,537 | - |
| - 비유동리스부채 | 258 | 12 | 52 | 69 |
| 부채비율 | 216.80% | 110.19% | 56.20% | 5.72% |
| 차입금의존도 | 54.66% | 44.83% | 27.68% | 0.32% |
| 업종평균 부채비율 | - | - | 52.81% | 57.04% |
| 업종평균 차입금의존도 | - | - | 16.77% | 18.28% |
| (출처 : 한국은행, "2022년 기업경영분석", 2023.10., 정기보고서) | |
| 주1: | 부채비율 = 부채총계 / 자본총계 |
| 주2: | 차입금의존도 = 차입금총계 / 자산총계 |
| 주3: | 업종평균 비율은 한국은행이 발간한 2022년 기업경영분석 C21(의료용 물질 및 의약품) 기준으로 작성하였습니다. |
당사의 2021년말 부채비율은 5.7%이었으나, 2022년 10월 제1회 전환사채 165억원을 발행 및 당기순손실 7,116백만원을 기록하면서 2022년 말 부채비율이 56.2%로 크게 증가하였습니다. 2023년은 2022년 대비 부채 및 차입금 총계가 크게 증가하지 않았으나 당기순손실 13,602백만원을 기록하면서 부채비율이 110.2%로 증가하였습니다. 2024년 반기에도 5,589백만원의 당기순손실이 발생하면서 결손금이 64,414백만원으로 누적되며 부채비율이 216.8%로 악화되었습니다.
2024년 반기말 기준 단기차입금 151백만원은 종속회사인 (주)인터내셔널사이언티픽스탠다드의 차입금으로 기존 경영진과 연계된 차입금입니다. 동 차입금의 담보로 매출채권이 제공되어 있고, 2024년 3분기 중 상환될 예정입니다.
2024년 반기말 기준 당사는 금융기관으로부터의 차입금은 없는 상태를 유지하고 있습니다. 2024년 반기말 당사의 부채 계정 중 가장 높은 비중을 차지하고 있는 부채는 전환사채로 16,264백만원이며, 실질적인 부채 금액은 1회차 전환사채 16,500백만원입니다. 해당 전환사채의 만기는 2027년 10월 06일까지이며, 전환가액은 4,058원으로 만기까지 전환이 이루어지지 않을 시 상환할 계획에 있습니다.
| [미상환 전환사채 발행 현황] | |||
| (기준일 : | 증권신고서 제출일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| (출처 : 정기보고서) |
[제1회 전환사채 관련 사항]
(1) 전환사채 인수자에 관한 사항
당사는 2022년 10월 4일 이사회 결의를 통해 2022년 10월 5일 '주식회사 압타머사이언스 제1회 무기명식 이권부 무보증 사모 전환사채 인수계약서'(이하 인수계약서)를 체결하였고, 2022년 10월 6일 제1회 전환사채 165억원을 발행하였습니다. 당사는 동 내용을 2022년 10월 06일 주요사항보고서를 통해 공사한 바 있습니다. 당사와 당사의 제1회 전환사채 인수자 사이에 관계가 없고, 발행결정 전후 6개월 이내 거래내역 및 계획 또한 존재하지 않습니다. 당사의 제1회 전환사채 인수자는 다음과 같습니다.
| [전환사채 인수자 내역] |
| 발행 대상자명 | 회사 또는 최대주주와의 관계 |
선정경위 | 발행결정 전후 6월이내 거래내역 및 계획 |
발행권면(전자등록) 총액(원) |
비고 |
|---|---|---|---|---|---|
| 주식회사 BNK투자증권 | - | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 3,000,000,000 | - |
|
수성자산운용 주식회사 (투자일임업자의 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 2,000,000,000 | - |
| 에이스수성신기술투자조합 16호 | - | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,000,000,000 | - |
| NH투자증권 주식회사 (본건 펀드1의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 600,000,000 | - |
| NH투자증권 주식회사 (본건 펀드2의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 200,000,000 | - |
| NH투자증권 주식회사 (본건 펀드3의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 300,000,000 | - |
| NH투자증권 주식회사 (본건 펀드4의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 900,000,000 | - |
| NH투자증권 주식회사 (본건 펀드5의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 400,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드6의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드7의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드8의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 100,000,000 | - |
| 한국증권금융 주식회사 (본건 펀드9의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 삼성증권 주식회사 (본건 펀드10의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,500,000,000 | - |
| 삼성증권 주식회사 (본건 펀드11의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 한국투자증권 주식회사 (본건 펀드12의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| NH투자증권 주식회사 (본건 펀드13의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,000,000,000 | - |
| NH투자증권 주식회사 (본건 펀드14의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| NH투자증권 주식회사 (본건 펀드15의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 1,500,000,000 | - |
| 케이비증권 주식회사 (본건 펀드16의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 500,000,000 | - |
| 엔에이치투자증권 주식회사 (본건 펀드17의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 100,000,000 | - |
| 엔에이치투자증권 주식회사 (본건 펀드18의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 150,000,000 | - |
| 엔에이치투자증권 주식회사 (본건 펀드19의 신탁업자 지위에서) |
- | 회사 경영상 필요자금을 신속히 조달하기 위해 납입능력 및 투자시기 등으로 고려하여 선정 |
- | 250,000,000 | - |
본건 펀드 1: 오라이언명품코스닥벤처일반사모투자신탁제73호
본건 펀드 2: 오라이언명품코스닥벤처일반사모투자신탁제70호
본건 펀드 3: 오라이언명품코스닥벤처일반사모투자신탁제71호
본건 펀드 4 : 오라이언명품코스닥벤처일반사모투자신탁제75호
본건 펀드 5 : 제이씨에셋코스닥벤처일반사모투자신탁6호
본건 펀드 6 : 제이씨에셋코스닥벤처일반사모투자신탁7호
본건 펀드 7 : 제이씨에셋코스닥벤처일반사모투자신탁8호
본건 펀드 8 : 제이씨에셋코스닥벤처일반사모투자신탁10호
본건 펀드 9 : 제이씨에셋코스닥벤처일반사모투자신탁11호
본건 펀드 10 : SP 메자닌 일반 사모투자신탁8호
본건 펀드 11 : SP 메자닌T 전문투자형 사모투자신탁1호
본건 펀드 12 : 레이크 코스닥벤처 일반사모증권투자신탁 제1호(전문투자자)
본건 펀드 13 : 라이언 Blue 코스닥벤처 일반 사모투자신탁 제3호
본건 펀드 14 : QB V1 코스닥벤처 일반 사모투자신탁 제2호
본건 펀드 15 : 리딩코스닥벤처일반사모투자신탁제5호
본건 펀드 16 : 페블즈 코스닥벤처 일반사모 투자신탁 제1호
본건 펀드 17: 타이거 코스닥벤처 메자닌스토리 315 일반 사모투자신탁
본건 펀드 18: 타이거 코스닥벤처 메자닌드리븐 318 일반 사모투자신탁
본건 펀드 19: 타이거 코스닥벤처 위드메자닌 317 일반 사모투자신탁
(2) 조기상환청구권에 관한 사항
인수계약서 제3조 11항에 의거 제1회 전환사채에는 조기상환청구권이 존재합니다. 인수계약서 상 조기상환청구권에 대한 내용은 다음과 같습니다.
| [인수계약서 제3조 11항] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
11. 조기상환청구권(Put Option)에 관한 사항: 본 사채의 사채권자는 본 사채의 발행일로부터 2년이 되는 날(해당일이 영업일이 아닌 경우 그 익영업일을 말함) 및 그 이후 매 3개월에 해당되는 날(이하 “조기상환지급일”이라 한다)에 본 사채의 전부 또는 일부에 대하여 만기 전 조기상환할 것을 청구할 수 있다. 이 경우 발행회사는 본 사채의 전자등록금액과 함께 전자등록금액에 대하여 조기상환지급일까지 조기상환수익율 연 0.0%를 가산한 금액(이하 “조기상환금액”이라 하며, 구체적인 내역은 아래 가.호에 기재된 바와 같다)을 조기상환지급일에 지급하여야 한다. 단, 조기상환지급일이 영업일이 아닌 경우에는 그 다음 영업일에 상환하고 조기상환지급일 이후의 이자는 계산하지 아니한다. 가.
조기상환지급일별 조기상환금액:
2024년 10월 06일: 전자등록금액의 100.0000%,
2025년 01월 06일: 전자등록금액의 100.0000%,
2025년 04월 06일: 전자등록금액의 100.0000%,
2025년 07월 06일: 전자등록금액의 100.0000%,
2025년 10월 06일: 전자등록금액의 100.0000%,
2026년 01월 06일: 전자등록금액의 100.0000%,
2026년 04월 06일: 전자등록금액의 100.0000%,
2026년 07월 06일: 전자등록금액의 100.0000%,
2026년 10월 06일: 전자등록금액의 100.0000%,
2027년 01월 06일: 전자등록금액의 100.0000%,
2027년 04월 06일: 전자등록금액의 100.0000%,
2027년 07월 06일: 전자등록금액의 100.0000%.
나.
조기상환 청구장소: 발행회사의 본점
다.
조기상환 지급장소: 기업은행 판교테크노밸리 지점
라.
조기상환 수익률 및 조기상환청구기간: 사채권자는 조기상환을 청구할 경우, 각 조기상환지급일의 30일 전부터 15일 전까지(이하 “조기상환청구기간”이라 하며, 구체적인 내역은 아래 표와 같다) 조기상환 청구를 하여야 한다. 단, 조기상환청구기간의 종료일이 영업일이 아닌 경우에는 그 다음 영업일까지로 한다.
마. 조기상환 청구절차: 사채권자가 전자증권법 제22조 제2항에 따라 작성되는 고객계좌부에 전자등록된 경우에는 거래하는 계좌관리기관을 통하여 한국예탁결제원에 조기상환을 청구하고 전자증권법 제23조 제2항에 따라 작성되는 자기계좌부에 전자등록된 경우에는 한국예탁결제원에 조기상환을 청구하면 한국예탁결제원이 이를 취합하여 청구장소에 조기상환 청구한다. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1차 조기상환청구기간은 2024년 09월 06일부터 2024년 09월 23일까지로 증권신고서 제출일(2024년 09월 19일) 현재 135억원에 대해 조기상환이 청구되었음을 확인하였습니다. 당사가 자체적으로 전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다.
(3) 의무조항 관련 사항
인수계약서 제3조 22항에 의거 제1회 전환사채에는 발행회사의 기한의 이익 상실에 관한 사유가 기재되어 있고, 해당 여부 및 해당 가능성에 대해 검토한 결과 해당사항이 없고, 향후 해당가능성이 낮은 것으로 판단됩니다.
| [인수계약서 제3조 22항] |
|---|
|
22. 발행회사의 기한의 이익 상실에 관한 사유 가.
발행회사의 (당연) 기한이익 상실사유: 발행회사에 대하여 다음의 항목에 해당하는 사유가 발생한 경우 발행회사는 별도의 독촉, 통지 없이도 본 사채에 관한 기한의 이익을 상실하고 본 사채의 미상환 원금(전자등록금액)과 기한이익의 상실일까지 본 조 제11항에 따른 조기상환수익율을 적용하여 발생한 이자를 지급하기로 하고, 실지급일까지 본 조 제12항에 따른 연체이자를 가산하기로 한다. 이 경우 기한이익 상실의 원인사유가 발생한 날을 지급기일로 본다.
(1)
발행회사가 파산, 회생절차 개시의 신청을 하거나 이에 동의한 경우, 또는 발행회사에게 파산이 선고되거나 회생절차가 개시된 경우
(2)
발행회사에게 존립기간의 만료 등 정관으로 정한 해산사유의 발생, 법원의 해산명령 또는 해산판결, 주주총회의 해산결의가 있는 경우
(3)
발행회사가 휴업 또는 폐업하는 경우 또는 감독관청으로부터 발행회사의 중요한 영업에 대한 영업정지 또는 취소가 있는 경우(다만, 감독기관의 행정처분 등으로 인한 일시적인 영업정지의 경우는 제외한다)
(4)
발행회사에게 은행 당좌거래가 정지되거나 어음교환소의 거래정지 처분이 있는 때 및 채무불이행명부 등재 신청이 있는 때 등 발행회사가 지급불능 또는 지급정지의 상태에 이른 것으로 인정되는 경우
(5)
발행회사의 보통주가 코스닥 시장에서 관리종목 지정 또는 상장 폐지되거나 개장일 기준 20일 이상 연속으로 거래가 중지되는 경우(단, 주권의 병합, 분할, 자본의 감소 등 발행회사의 일정한 회사법적 행위로 인해 관련 법규 및 “한국거래소”의 관련 규정에 따라 의무적으로 일시 거래정지 되는 경우는 제외)
(6)
발행회사가 기업구조조정촉진법에 따라 부실징후기업으로 인정되거나 관리절차(워크아웃) 개시 신청 등 회사 신용에 중대한 영향을 미치는 사유가 발생한 경우(법률의 제정 또는 개정 등으로 인하여 이와 유사한 절차가 개시된 경우를 포함한다.)
(7)
발행회사가 경영임대차, 경영권의 양도,
최대주주의 변경, 위탁경영, 타회사와 합병(단, 발행회사가 존속하는 경우는 제외한다), 분할, 분할합병, 주식의 포괄적 교환 또는 이전, 최근 사업연도말 기준 매출액의 50% 이상을 차지하는 주요한 사업의 양수도 등 기타 회사 조직의 근본적인 변경이 있는 경우. 단, 발행일 이전 기공시된 사항 및 사채권자의 사전 서면동의가 있을 경우는 예외로 한다.
(8)
본 사채의 원금의 일부 또는 전부를 상환하여야 할 의무 또는 기한이 도래한 이자 지급 의무를 불이행하고 05일 이내에 그 지급이 완료되지 아니한 경우
(9)
‘주식회사 등의 외부감사에 관한 법률’에 따른 감사인의
“발행회사”에 대한 감사보고서 또는 반기검토보고서
(내부회계관리제도에 대한 감사 또는 검토 의견 포함)
의견이 “적정”이 아닌 경우
나.
발행회사의 기한이익 상실의 원인사유: 발행회사에 대하여 다음 각 항목에 해당하는 사유가 발생한 경우 사채권자는 발행회사에 대한 서면 통지로써 즉시 본 사채의 전부 또는 일부에 대하여 기한의 이익을 상실시키고 발행회사에 그 미상환 원금의 전부 또는 일부와 그 때까지 발생한 본 조 제11항에 따른 조기상환수익율을 적용하여 발생한 이자 전액을 합산한 금액의 지급을 청구할 수 있다. 이 경우 기한이익 상실 사유가 발생한 날을 지급기일로 본다.
(1)
발행회사가 본 계약에 따른 의무를 위반한 때
(2)
본 사채 이외의 발행회사의 채무 중 지급기일이 도래한 원리금의 지급이 이루어지지 않거나 또는 채무불이행 등으로 인하여 기한이익의 상실 사유가 발생하거나 당해 채무에 관한 담보권이 실행된 경우
(3)
발행회사의 자산의 전부 또는 최근 사업년도말 별도재무제표 기준 총자산의 20% 이상에 압류 명령이 결정되거나 또는 임의 경매가 개시되었을 경우
(4)
발행회사의 자산의 전부 또는 별도재무제표 최근 사업년도말 기준 총자산의 20% 이상에 해당하는 자산에 가압류, 압류명령 또는 체납처분 압류통지가 발송되거나, 기타의 방법에 의한 강제집행개시나 체납처분착수가 있을 때 또는 금전채권 회수를 목적으로 하는 가처분이 선고되고, 90일 이내에 정지되지 않은 경우
(5)
발행회사의 임직원이 발행회사와 관련한 횡령, 배임, 허위지출, 가공지출, 과다지출 등의 면탈행위나 불법행위로 발행회사에 재산상 중대한 손실을 초래하였거나 형사처벌을 받는 경우. 단, 발행일 이전 기공시된 사항에 대하여는 예외로 한다.
(6)
제7조의 발행회사의 진술 및 보장, 기타 본 계약에서 정하고 있는 발행회사가 당사자인 계약서들에서 발행회사가 한 확인(보장)사항의 전부 또는 일부가, 동 확인 시점에서 중요한 점에 있어서 허위인 것으로 판명되거나, 제10조에 특약사항에 따른 발행회사의 의무를 이행하지 아니한 경우
다.
발행회사가 본 항 가호 내지 나호에 따라 본 사채에 관한 기한의 이익을 상실함으로써 지급하여야 할 원리금을 기한 내에 지급하지 않은 경우에는 해당 지급기일 익일부터 실제 지급일까지 본 조 제12항의 이율을 적용한 연체이자를 지급한다. 이 경우 기한이익 상실 사유 및/또는 기한이익 상실의 원인 사유가 발생한 날을 지급기일로 본다.
라.
발행회사는 특정 기한이익 상실사유 및 기한이익 상실의 원인사유(또는 통지서 전달 및/또는 시간 경과 및/또는 확인서 발급 과정과 함께 동 기한이익 상실사유 또는 기한이익상실의 원인사유를 구성할 수 있는 제반 조건, 사태 또는 행위) 발생 사실을 인지하는 즉시 관련 내용을 인수자 또는 사채권자 앞으로 서면 통지하여야 한다.
마. 본 항에 의한 상환청구는 인수자의 발행회사에 대한 기타 손해배상의 청구에 영향을 미치지 아니한다. |
| [기한의 이익 상실 사유 검토 내용] |
| 사 유 | 해당여부 | 비 고 |
|---|---|---|
| (당연) 기한이익 상실사유
|
||
| 발행회사가 파산, 회생절차 개시의 신청을 하거나 이에 동의한 경우, 또는 발행회사에게 파산이 선고되거나 회생절차가 개시된 경우
|
해당사항 없음 | - |
| 발행회사에게 존립기간의 만료 등 정관으로 정한 해산사유의 발생, 법원의 해산명령 또는 해산판결, 주주총회의 해산결의가 있는 경우
|
해당사항 없음 | - |
| 발행회사가 휴업 또는 폐업하는 경우 또는 감독관청으로부터 발행회사의 중요한 영업에 대한 영업정지 또는 취소가 있는 경우(다만, 감독기관의 행정처분 등으로 인한 일시적인 영업정지의 경우는 제외한다)
|
해당사항 없음 | - |
| 발행회사에게 은행 당좌거래가 정지되거나 어음교환소의 거래정지 처분이 있는 때 및 채무불이행명부 등재 신청이 있는 때 등 발행회사가 지급불능 또는 지급정지의 상태에 이른 것으로 인정되는 경우
|
해당사항 없음 | - |
| 발행회사의 보통주가 코스닥 시장에서 관리종목 지정 또는 상장 폐지되거나 개장일 기준 20일 이상 연속으로 거래가 중지되는 경우(단, 주권의 병합, 분할, 자본의 감소 등 발행회사의 일정한 회사법적 행위로 인해 관련 법규 및 “한국거래소”의 관련 규정에 따라 의무적으로 일시 거래정지 되는 경우는 제외)
|
해당사항 없음 | |
| 발행회사가 기업구조조정촉진법에 따라 부실징후기업으로 인정되거나 관리절차(워크아웃) 개시 신청 등 회사 신용에 중대한 영향을 미치는 사유가 발생한 경우(법률의 제정 또는 개정 등으로 인하여 이와 유사한 절차가 개시된 경우를 포함한다.)
|
해당사항 없음 | - |
| 발행회사가 경영임대차, 경영권의 양도, 최대주주의 변경, 위탁경영, 타회사와 합병(단, 발행회사가 존속하는 경우는 제외한다), 분할, 분할합병, 주식의 포괄적 교환 또는 이전, 최근 사업연도말 기준 매출액의 50% 이상을 차지하는 주요한 사업의 양수도 등 기타 회사 조직의 근본적인 변경이 있는 경우. 단, 발행일 이전 기공시된 사항 및 사채권자의 사전 서면동의가 있을 경우는 예외로 한다.
|
해당사항 없음 | 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다를 합병 - 발행회사가 존속하는 경우로 제외 |
| 본 사채의 원금의 일부 또는 전부를 상환하여야 할 의무 또는 기한이 도래한 이자 지급 의무를 불이행하고 05일 이내에 그 지급이 완료되지 아니한 경우
|
해당사항 없음 | - |
| ‘주식회사 등의 외부감사에 관한 법률’에 따른 감사인의“발행회사”에 대한 감사보고서 또는 반기검토보고서(내부회계관리제도에 대한 감사 또는 검토 의견 포함) 의견이 “적정”이 아닌 경우
|
해당사항 없음 | - |
| 기한이익 상실의 원인사유 | ||
| 발행회사가 본 계약에 따른 의무를 위반한 때
|
해당사항 없음 | - |
| 본 사채 이외의 발행회사의 채무 중 지급기일이 도래한 원리금의 지급이 이루어지지 않거나 또는 채무불이행 등으로 인하여 기한이익의 상실 사유가 발생하거나 당해 채무에 관한 담보권이 실행된 경우
|
해당사항 없음 | - |
| 발행회사의 자산의 전부 또는 최근 사업년도말 별도재무제표 기준 총자산의 20% 이상에 압류 명령이 결정되거나 또는 임의 경매가 개시되었을 경우
|
해당사항 없음 | - |
| 발행회사의 자산의 전부 또는 별도재무제표 최근 사업년도말 기준 총자산의 20% 이상에 해당하는 자산에 가압류, 압류명령 또는 체납처분 압류통지가 발송되거나, 기타의 방법에 의한 강제집행개시나 체납처분착수가 있을 때 또는 금전채권 회수를 목적으로 하는 가처분이 선고되고, 90일 이내에 정지되지 않은 경우
|
해당사항 없음 | - |
| 발행회사의 임직원이 발행회사와 관련한 횡령, 배임, 허위지출, 가공지출, 과다지출 등의 면탈행위나 불법행위로 발행회사에 재산상 중대한 손실을 초래하였거나 형사처벌을 받는 경우. 단, 발행일 이전 기공시된 사항에 대하여는 예외로 한다.
|
해당사항 없음 | - |
| 제7조의 발행회사의 진술 및 보장, 기타 본 계약에서 정하고 있는 발행회사가 당사자인 계약서들에서 발행회사가 한 확인(보장)사항의 전부 또는 일부가, 동 확인 시점에서 중요한 점에 있어서 허위인 것으로 판명되거나, 제10조에 특약사항에 따른 발행회사의 의무를 이행하지 아니한 경우
|
해당사항 없음 | - |
[(주)BNK투자증권 이해상충 관련 내용]
자본시장과 금융투자업에 관한 법률(이하“자본시장법”)은 투자매매업자 또는 투자중개업자가 투자자 보호 또는 건전한 거래질서를 해할 우려가 있는 행위를 하여서는 안된다고 규정합니다(자본시장법 제71조 제7호).
| [자본시장과 금융투자업에 관한 법률] |
|---|
|
제71조(불건전 영업행위의 금지)
투자매매업자 또는 투자중개업자는 다음 각 호의 어느 하나에 해당하는 행위를 하여서는 아니 된다. 다만, 투자자 보호 및 건전한 거래질서를 해할 우려가 없는 경우로서 대통령령으로 정하는 경우에는 이를 할 수 있다. 7.
그 밖에 투자자 보호 또는 건전한 거래질서를 해할 우려가 있는 행위로서 대통령령으로 정하는 행위 |
| [자본시장과 금융투자업에 관한 법률 시행령] |
|---|
|
제68조(불건전 영업행위의 금지
) ⑤ 법 제71조제7호에서 “대통령령으로 정하는 행위”란 다음 각 호의 어느 하나에 해당하는 행위를 말한다 4. 증권의 인수업무 또는 모집ㆍ사모ㆍ매출의 주선업무와 관련하여 다음 각 목의 어느 하나에 해당하는 행위 마. 그 밖에 투자자의 보호나 건전한 거래질서를 해칠 염려가 있는 행위로서 금융위원회가 정하여 고시하는 행위 |
| [금융투자업규정] |
|---|
|
제4-19조(불건전한 인수행위의 금지)
영 제68조제5항제4호마목에서 "금융위원회가 정하여 고시하는 행위"란 다음 각 호의 어느 하나에 해당하는 행위를 말한다. 7. 협회가 정하는 이해관계가 있는 자가 발행하는 주식(협회가 정하는 기업공개 또는 장외법인공모를 위하여 발행되는 주식에 한한다) 및 무보증사채권의 인수(모집의 주선을 포함한다. 이하 이 호에서 같다)를 위하여 주관회사의 업무를 수행
하거나 또는 가장 많은 수량을 인수하는 행위 |
| [증권 인수업무 등에 관한 규정] |
|---|
|
제15조(불건전한 인수행위의 금지) ④ 금융투자업규정 제4-19조 제7호에서 "협회가 정하는 이해관계가 있는 자"란 다음 각 호의 어느 하나에 해당하는 관계에 있는 자를 말한다. 다만, 한국거래소, 증권금융회사, 기업인수목적회사는 그러하지 아니하다. 1. 발행회사와 발행회사의 이해관계인이 합하여 금융투자회사의 주식등을 100분의 5 이상 보유하고 있는 경우 2. 금융투자회사가 발행회사의 주식등을 100분의 5 이상 보유하고 있는 경우. 다만 , 발행회사가 다음 각 목의 어느 하나에 해당하는 경우(중소기업창업 지원법 시행령」 제4조 각 호의 어느 하나에 해당하는 업종은 제외한다)에는 발행회사의 주식등을 100분의 10 이상을 보유하고 있는 경우를 말한다.
가.「중소기업기본법」제2조에 따른 중소기업(특수목적기구 및 부동산 관련 법인은 제외한다)
나.「벤처기업 육성에 관한 특별조치법」 제2조 제1항에 따른 벤처기업
다.「중견기업 성장촉진 및 경쟁력 강화에 관한 특별법」 제2조에 따른 중견기업으로서 직전 3개 회계연도의 평균 매출액이 3천억원 미만인 기업 라. 그 밖에 다음의 어느 하나에 해당되는 기업(「독점규제 및 공정거래에 관한 법률」 제14조제1항에 따른 공시대상기업집단에 속하는 기업은 제외한다) 1)「조세특례제한법 시행령」별표7에 따른 신성장ㆍ원천기술을 보유하고 이와 관련한 사업을 영위하는 기업 2) 1개 이상의 기술신용평가기관(「신용정보의 이용 및 보호에 관한 법률」제2조제8의3다목에 따른 기술신용평가업무를 영위하는 신용정보회사를 말한다) 또는 기술전문평가기관(「벤처기업 육성에 관한 특별조치법」, 「기술의 이전 및 사업화 촉진에 관한 법률」 등 관련 법률에 따라 기술평가기관으로 지정된 자를 말한다)이 평가한 기술등급(기업의 기술과 관련된 기술성ㆍ시장성ㆍ사업성 등을 종합적으로 평가한 등급을 말한다)이 기술등급체계상 상위 100분의 50에 해당하는 기업 3. 금융투자회사와 금융투자회사의 이해관계인이 합하여 발행회사의 주식 등을 100분의 10(제15조제4항제2호 단서의 경우에는 100분의 15)이상 보유하고 있는 경우 4. 금융투자회사의 주식등을 100분의 5 이상 보유하고 있는 주주와 발행회사의 주식등을 100분의 5 이상 보유하고 있는 주주가 동일인이거나 이해관계인인 경우. 다만, 그 동일인 또는 이해관계인이 정부 또는 기관투자자인 경우에는 그러하지 아니하다. 5. 금융투자회사의 임원이 발행회사의 주식등을 100분의 1 이상 보유하고 있는 경우 6. 금융투자회사의 임원이 발행회사의 임원이거나 발행회사의 임원이 금융투자회사의 임원인 경우 7. 금융투자회사가 발행회사의 최대주주이거나 발행회사와 제2조
제9호라목의 계열회사 관계에 있는 경우 |
즉, 자본시장법이 투자매매업자 또는 투자중개업자를 제한하는 불건전한 영업행위란, 증권인수업무
등에
관한
규정에서
정하는
이해관계
있는
자가
기업공개
또는
장외법인공모를
목적으로
발행하는
주식을
위하여
주관회사의
업무를
수행하는
일
입니다. 따라서, 자본시장법 및 금융투자업 규정의 반대해석에 의하면, 주관회사의 업무를 하는 주체가 증권인수업무 등에 관한 규정에서 정하는 이해관계 있는 자가 아닐 경우 주관회사로서의 업무 수행은 자본시장법이 제한하는 불건전한 영업행위에 해당하지 않습니다. 설령, 이해관계가 있는 자일지라도 기업공개 또는 장외법인공모를 목적으로 발행하는 주식에 관한 주관업무를 하는 것이 아니라면, 자본시장법이 제한하는 불건전한 영업행위로 판단될 여지가 없는 것으로 판단 됩니다.
또
한, 증권 인수업무 등에 관한 규정 제15조 제4항 제2호 가.목 및 나.목에 따라,
금융투자회사가 중소기업기본법」제2조에 따른 중소기업,「벤처기업 육성에 관한 특별조치법」제2조제1항에 따른 벤처기업이 발행하는 주식의 100분의 10 이상을 보유하고 있는 경우에 금융투자업규정 제4-19조 제7호에서 규정하는 협회가 정하는 이해관계가 있는 자에 해당합니다. 당사는「중소기업기본법」제2조에 따른 중소기업,「벤처기업 육성에 관한 특별조치법」제2조 제1항에 따른 벤처기업 입니다. 당사는 2024.3.20 공시한 사업보고서에서 당사가 중소기업 및 벤처기업에 해당한다는 사실을 밝히고 있습니다.
따라서, 대표주관사인 (주)BNK투자증권이 증권 인수업무 등에 관한 규정에서 정하는 이해관계가 있는 자에 해당하기 위하여는, 당사 주식의 100분의 10이상을 보유하고 있어야 합니다. 당사는 2023년말 기준 보통주 16,980,252주, 우선주 920,000주를 발행하였으며, 발행할 주식의 총수는 50,000,000주 입니다. 대표주관사인 (주)BNK투자증권은 165억 규모의 제1회 전환사채에서 약 10억원(30억원 인수 후 20억원은 제3자에게 매각)만을 인수하였으므로, 전환권을 행사하더라도 당사 주식의 100분의 10이상을 보유할 여지가 없습니다. 따라서, 대표주관사인 (주)BNK투자증권은 증권 인수업무 등에 관한 규정에서 정하는 이해관계가 있는 자로 판단되지 않습니다.
이에, 대표주관사인 (주)BNK투자증권은 증권 인수업무 등에 관한 규정에 정하는 이해관계가 있는 자가 아니므로, 본건 유상증자의 적법한 대표주관사로 참여할 수 있을 것으로 판단 됩니다. 설령 이해관계가 있는 자에 해당할지라도, 본건 유상증자는 기업공개 또는 장외법인공모를 위하여 발행하는 주식을 위한 것이 아니므로, 자본시장법 및 금융투자업 규정에 대한 반대해석에 의하여 대표주관사인 (주)BNK투자증권 본건 유상증자의 적법한 대표주관사로 참여할 수 있는 것으로 판단 됩니다.
그럼에도 불구하고 (주)BNK투자증권이 대표주관회사로서 발행회사의 실사 시,적절한 주의의무 준수를 통해 투자자를 보호할 의무가 있는 것과 동시에 재무적 투자자로서 수익 극대화를 추구해야 하는 이해상충 문제가 발생할 소지가 있다는 의문이 제기될 수 있습니다.
금번 공모 유상증자의 대표주관사인 (주)BNK투자증권은 당사의 전환사채 10억원을 보유 중이며, 전환가격 4,058원으로 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태로, 대표주관사인 (주)BNK투자증권이 보유 중인 전환사채의 전환에 따른 수익 창출은 제한적일 것으로 판단 됩니다. (주)BNK투자증권은 이해 상충 문제를 최소화 하기 위해 보유 중인 사모 전환사채를 금번 공모 유상증자 납입 이후 일정기간 경과 후에 조기상환 또는 전환할 예정으로 해당 사항 고려 시, 이해 상충 문제를 최소화하고 있는 것으로 판단됩니다. 이 점 투자에 참고하시기 바랍니다.
[2024년 반기 이후 발생한 사건]
당사는 2024년 반기 이후 2024년 08월 14일 파생상품거래손실발생, 2024년 08월 24일 합병등종료보고서, 2024년 08월 28일 자산재평가결과를 공시하였습니다.
(1) 2024년 08월 14일 파생상품거래손실발생
당사는 제1회 전환사채와 관련하여 1,555백만원의 파생상품 평가손실을 인식하였고, 이는 2024년 반기 재무제표에 기반영되어 있으며, 현금유출을 초래하지는 않습니다. 관련 공시내용은 다음과 같습니다.
| [파생상품 거래 손실 발생(2024.08.14)] |
| 1. 파생상품 거래계약의 종류 및 내용 | 파생상품(전환사채) 평가손실 발생 | ||
| 2. 손실발생내역 | 손실누계잔액(원)(기신고분 제외) | 1,554,551,409 | |
| 자기자본(원) | 15,478,896,907 | ||
| 자기자본대비(%) | 10.04 | ||
| 대기업해당여부 | 미해당 | ||
| 3. 손실발생 주요원인 | - 주가 변동 등으로 당사가 발행한 전환사채의 전환(행사)가액과 주가간 차이가 발생함에 따라 파생상품평가손실을 인식하였습니다. - 한국채택국제회계기준(K-IFRS)에 따라 전환사채를 공정가치로 평가하여 재무제표에 반영하였으며,실질적으로 현금 유출이 없는 손실입니다. |
||
| 4. 손실발생일자 | 2024-08-14 | ||
| 5. 기타 투자판단에 참고할 사항 | - 상기 2항의 손실발생금액은 2024년(2024.01.01 ~ 2024.06.30)에 발생한 누계금액입니다. - 상기 2항의 손실발생내역 중 '자기자본(원)'은 최근 사업연도 2023년말 자기자본에서 2024년 1월부터 2024년 6월까지의 자본금 및 자본잉여금의 증감액을 반영한 금액입니다. - 상기 4항의 손실발생일자는 제14기(2024년 6월 30일) 재무제표 기준 반기검토보고서 제출일자 입니다. - 상기의 손실은 실현 되어지지 않는 평가손실이며, 현금 유출을 초래하지는 않습니다. |
||
| ※관련공시 | 2024-08-14 반기보고서(일반법인) |
||
| (출처 : 전자공시시스템) |
(2) 2024년 08월 24일 합병등종료보고서
당사는 당사가 지분 100%를 보유하고 있는 ㈜인터내셔널사이언티픽스탠다드 무증자방식에 의하여 1:0의 합병비율로 2024년 08월 23일 소규모합병을 완료(합병기일 2024년 08월 19일)하였습니다. 2024년 반기 기준 당사 연결재무상태표 상 (주)인터내셔널사이언티픽스탠다드의 자산 및 부채가 연결대상 종속회사로 포함되어 있어, 합병이 당사의 재무제표에 미치는 영향은 없습니다. 다만 합병 후 당사는 별도의 연결대상 종속회사가 존재하지 않으며, 2024년 3분기부터 합병 후 개별 재무제표를 기준으로 당사의 재무자료가 공시될 예정입니다.
연결재무상태표 상 인식된 (주)인터내셔널사이언티픽스탠다드의 자산과 부채는 다음과 같습니다.
| [자산 및 부채 내역] |
| (단위 : 천원) |
| 구 분 | 금액 |
|---|---|
| 자산 : | |
| 현금및현금성자산 | 257,629 |
| 매출채권 | 84,205 |
| 선급금 | 18 |
| 선급비용 | 170,834 |
| 당기법인세자산 | 100 |
| 계약자산 | 675,824 |
| 유형자산 | 895,413 |
| 고객관계가치(무형자산) | 851,469 |
| 무형자산 | 4 |
| 임차보증금 | 42,151 |
| 2,977,648 | |
| 부채: | |
| 단기차입금 | 1,651,102 |
| 미지급금 | 397,915 |
| 미지급비용 | 57,362 |
| 계약부채 | 386,699 |
| 리스부채 | 530,534 |
| 기타비유동부채 | 737,612 |
| 이연법인세부채 | 177,957 |
| 합 계 | 3,939,180 |
| 식별가능한 순자산 가액 | (961,533) |
| 비지배지분 | - |
| 영업권 | 961,533 |
| 이전대가 | - |
당사는 ㈜인터내셔널사이언티픽스탠다드의 자산과 부채 승계과정에서 실질적인 매수가액이라할 수 있는 차액에 대한 타당성을 입증하고자 매수가격배분(Purchase Price Allocation)(*) 공정가치 평가를 태일회계법인이 수행하였습니다. 태일회계법인을 통한 잠재적 무형자산의 인식가능성 검토 결과, 고객관계와 관련하여 무형자산이 식별되고 중요성이 있는 것으로 검토되었으며, 고객관계는 다기간초과이익법(Multi-period Excess Earning Method : MEEM)으로 평가하였습니다. 다기간초과이익법은 기여자산의 추정이익에서 원가를 차감하여 적절한 할인율을 사용하여 평가기준일 현재가치로 할인하는 방법입니다.
| (*) K-IFRS에 따르면 사업결합 시에는 취득법(Acquisition method)을 적용하여 회계 처리해야 하며, 취득자는 취득일 현재 피취득자의 자산(과거 인식되지 않은 무형자산 포함)과 인수부채의 공정가치를 측정하고 매수가액을 배부해야 합니다. 취득한 식별 가능한 무형자산은 영업권과 분리하여 인식해야 하며 무형자산은 분리가능성 기준이나 계약적·법적 기준을 충족하는 경우에 식별 가능합니다. 식별 가능하고 가치평가 대상으로 선정된 자산, 부채, 공정가액이 인수자의 지분을 초과하는 금액에 대해서는 영업권으로 인식하며, 인수자의 지분에 미달하는 금액에 대해서는 염가매수차익으로 인식합니다. |
이에 따라 당사는 2024년 반기 기준 고객관계가치 851백만원과 영업권 962백만원을 인식하였습니다. 당사는 고객관계가치를 5년간 감가상각할 예정이나, 매 보고기간말 혹은 손상을 시사하는 징후가 있을 때 회수가능액과 장부금액을 비교하여 손상검사를 수행하여 장부가액의 일부 또는 전액에 대하여 손상을 인식할 수 있습니다.
(3) 2024년 08월 28일 자산재평가결과
당사는 당사가 보유하고 있는 경기도 성남시 분당구 삼평동 625 판교세븐벤처밸리1 제3동 3층 부동산을 재평가하였고, 재평가 결과에 따라 장부가액 6,241백만원의 유형자산을 9,030백만원으로 인식하게 되었습니다. 이에 따라 당사는 자산 및 자본(이연법인세 효과 미고려)이 2,788백만원 증가하는 효과가 있습니다. 관련 공시내용은 다음과 같습니다.
| [자산재평가 결과(2024.08.28)] |
| 1. 재평가 목적물 | 토지 및 건물 | |||
| 2. 재평가 대상 | 경기도 성남시 분당구 삼평동 625 판교세븐벤처밸리1 제3동 3층 | |||
| 3. 재평가 기준일 | 2024-09-30 | |||
| 4. 재평가 내역(단위:원) | 재평가 목적물 | 장부가액 | 재평가금액 | 재평가차액 |
| 유형자산(토지 및 건물) | 6,241,948,846 | 9,030,000,000 | 2,788,051,154 | |
| 합계 | 6,241,948,846 | 9,030,000,000 | 2,788,051,154 | |
| 자산총액 | 31,099,960,909 | |||
| 재평가차액의 자산총액대비 비율(%) | 8.96 | |||
| 대기업여부 | 미해당 | |||
| 5. 회계처리 예정내역 | [자산의 증가] - 유형자산 증가(토지 및 건물) :2,788,051,154원 [자본] - 기타포괄손익누계액의 증가(재평가잉여금): 2,788,051,154원 * 이연법인세 효과는 기말 결산시 산정하여 반영 예정 |
|||
| 6. 평가기관 | (주)에이원감정평가법인 | |||
| 7. 결정(확인)일자 | 2024-08-27 | |||
| 8. 기타 투자판단에 참고할 사항 | 1. 자산재평가의 목적 - K-IFRS(한국채택국제회계기준)에 의거 자산의 실질가치 반영 - 자산 및 자본증대효과를 통한 재무구조 개선 2. 상기 4. 장부가액 및 자산총액은 2024년 6월 30일 연결재무제표 기준입니다. 3. 상기 5. 회계처리 예정내역은 외부회계감사 결과에 따라 변경될 수 있습니다. 4. 상기 7. 결정(확인)일자는 감정평가법인으로부터 감정평가서를 수령한 일자입니다. |
|||
| ※관련공시 | - | |||
| (출처 : 전자공시시스템) |
2024년 반기 이후 발생한 사건이 당사의 재무제표에 미치는 영향은 다음과 같습니다.
| [2024년 반기 이후 발생한 사건이 재무제표에 미치는 영향] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기(연결) | 2024년 08월 14일 파생상품거래손실발생 |
2024년 08월 24일 합병등종료보고서 |
2024년 08월 28일 자산재평가결과 |
사건 반영후 2024년 반기(연결) |
|---|---|---|---|---|---|
| 자산 | 31,100 | - | - | 2,788 | 33,888 |
| 부채 | 21,283 | - | - | - | 21,283 |
| 자본 | 9,817 | - | - | 2,788 | 12,605 |
| 기타 | - | 기반영 | 기반영 | - | - |
| (출처 : 당사 제시) |
[자본잠식 가능성 검토]
2024년 상반기의 당기순이익이 유지되고 상기한 ㈜인터내셔널사이언티픽스탠다드의 무형자산이 전액 손상이 된다는 가정을 하였을 때 당사의 2024년 예상 당기순이익은 -13,536백만원 수준입니다. 금번 유상증자가 예정발행가액으로 완료되고, 상기한 자산재평가결과를 적용하면 2024년 예상 자본금은 15,100백만원, 예상 자기자본은 28,680백만원 수준으로 자본잠식이 이루어지지는 않습니다. 또한 자본잠식이 되기 위해서는 현재 예상되는 당기순이익보다 13,580백만원의 추가 손실이 발생해야 되므로 금번 유상증자가 완료된 경우 자본잠식 가능성은 제한적입니다.
| [2024년 자본잠식 시뮬레이션] |
| (단위 : 백만원) |
| 구 분 | 금 액 | 비고 |
|---|---|---|
| 당기순이익 |
||
| 2024년 반기 당기순이익 |
-5,589 | - |
| 2024년 반기 당기순이익(연환산) |
-11,178 | - 단순 연환산 |
| ㈜인터내셔널사이언티픽스탠다드 2024년 반기 당기순이익 | -545 | - 일회성 수익인 채무면제이익 등 영업외손익 제거 - 2024년 상반기 손익이 유지된다는 가정 |
| ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상 | -1,813 | - 고객관계가치 851백만원과 영업권 962백만원 전액 손상 가정 |
| 2024년 예상 당기순이익 | -13,536 | - |
| 자본금 | ||
| 2024년 반기 자본금 | 8,950 | - |
| 금번 유상증자 증가 자본금 | 6,150 | - 예정발행가액 기준 |
| 2024년말 예상 자본금 | 15,100 | - |
| 자기자본 | ||
| 2024년 반기 자기자본 | 9,817 | - |
| 금번 유상증자 | 24,022 | - 예정발행가액 기준 |
| 자산재평가 | 2,788 | - |
| 당기순이익 | -7,947 | - 2024년 상반기는 기반영 |
| 2024년 예상 자기자본 | 28,680 | - |
| 자본잠식 | ||
| 2024년 예상 자본잠식율 | - | - 해당사항 없음 |
| (출처 : 당사 제시) |
당사의 2024년 반기말 연결기준 부채총계는 21,283백만원, 차입금의존도는 54.7%로 금번 주주배정 후 실권주 일반공모 유상증자가 성공적으로 진행될 경우 당사의 재무안정성 지표는 추가적으로 개선될 것으로 예상하고 있습니다. 그러나 당사의 경우 최근 지속적인 당기순손실이 발생하고 있으며, 향후에도 사업이 흑자전환되지 않아 당기순손실이 지속될 경우 재무안정성이 악화될 가능성이 높습니다. 투자자께서는 당사의 부채상환능력 및 사업의 흑자전환 여부 등에 대하여 유의하여 투자해 주시기 바랍니다.
| 다. 현금흐름 악화 및 유동성 부족에 따른 재무불안정성 위험 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [현금흐름 내역] |
| (단위 : 백만원) |
| 구 분 | 2024년 반기 | 2023년 반기 | 2023년 | 2022년 | 2021년 |
| 영업활동현금흐름 | -2,816 | -7,335 | -11,236 | -5,776 | -3,474 |
| 영업활동으로 창출된 현금흐름 | -3,363 | -7,728 | -12,213 | -6,114 | -3,665 |
| 이자지급 | 450 | -4 | -6 | -8 | -20 |
| 이자수취 | -3 | 403 | 1,096 | 363 | 247 |
| 법인세환급 | 99 | -6 | -113 | -18 | -36 |
| 투자활동현금흐름 | 2,730 | 7,672 | 11,315 | -10,654 | -58 |
| 단기금융상품의 증감 | 4,000 | 8,000 | 11,679 | -10,300 | 6,999 |
| 유형자산의 취득 | -7 | -295 | -297 | -309 | -7,081 |
| 유형자산의 처분 | - | - | - | - | 1 |
| 무형자산의 취득 | - | -3 | -3 | - | -11 |
| 대여금 증가 | -1,500 | - | - | - | - |
| 사업결합으로 인한 증가 | 258 | - | - | - | - |
| 임차보증금의 증감 | - | - | - | - | 75 |
| 기타자산의증감 | -20 | -31 | -65 | -45 | -41 |
| 재무활동현금흐름 | -26 | -61 | -63 | 16,643 | -121 |
| 주식발행비용 | - | -36 | -16 | - | - |
| 주식선택권의 행사 | - | - | - | 287 | - |
| 전환사채의 증가 | - | - | - | 16,416 | - |
| 미지급금의 증감 | 16 | 18 | 40 | 16 | 10 |
| 리스부채의 상환 | -43 | -43 | -86 | -76 | -131 |
| 기초현금및현금성자산 | 1,237 | 1,222 | 1,222 | 1,009 | 4,663 |
| 기말현금및현금성자산 | 1,126 | 1,498 | 1,237 | 1,222 | 1,009 |
| (출처 : 정기보고서) |
당사는 2021년 38.3억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 34.7억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소로 인하여 70.0억원 현금유입, 유형자산 취득으로 인하여 70.8억원 현금유출로 인하여 0.0억원 현금유출이 발생하였습니다. 재무활동 부문에서는 리스부채 상환으로 인하여 1.2억원의 현금유출이 발생하였습니다.
2022년에는 83.0억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 57.8억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 증가(103.0억원)로 인하여 106.5억원 현금 유출이 발생하였습니다. 재무활동 부문에서는 제1회 전환사채 164.2억원 발행으로 인하여 166.4억원의 양(+)의 현금흐름이 발생, 영업활동 및 투자환동 현금유출을 충당하였습니다.
2023년에는 136.0억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 112.4억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소(116.8억원)으로 인하여 113.2억원 현금유출이 발생하였습니다. 재무활동 부문에서는 미지급금의 증가, 리스부채의 상환으로 0.6억원 현금유출이 발생하였습니다.
2024년 반기 중에는 55.9억원의 법인세비용차감전순손실이 발생하였으며, 이 중 감가상각비, 주가 변동에 따른 전환사채 관련 파생상품평가손익 등 현금유출입 없는 손익 및 영업활동 관련 자산/부채 조정 효과를 반영한 결과 총 28.2억원의 음(-)의 영업활동으로 인한 현금흐름이 발생한 것으로 집계되었습니다. 투자활동 부문에서는 단기금융상품 감소(40억원), 대여금 15억원이 발생하여 27.3억원의 양(+)의 현금흐름이 발생하였습니다. 재무활동 부문에서는 미지급금의 증가, 리스부채의 상환으로 0.3억원 현금유출이 발생하였습니다. 그 결과 2024년 반기말 기준 당사는 11.3억원의 현금및현금성자산을 보유하고 있습니다.
이처럼 당사는 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있습니다. 사업을 영위하는 과정에서, 투자활동현금흐름은 매년 유출입의 변동이 있으며, 영업활동에서 현금흐름창출능력을 보유하지 못하여, 영업에 필요한 자금은 투자활동 및 재무활동에서 창출하고 있는 상태입니다. 당사는 후보물질발굴부터 임상 진행, 품목허가까지 대규모의 자금이 소요되는 사업을 영위하고 있는 반면에, 라이센스 아웃, 임상성공 및 상품화 성공 등이 이루어지지 않을 경우 영업활동에서 현금흐름을 창출해내기는 어려운 구조를 가지고 있으며, 외부 자금 조달 의존도가 높습니다.
상기와 같이, 당사는 영업활동을 통한 현금흐름창출능력이 부진하기 때문에 외부자금 조달에 의존하고 있으며, 향후 당사의 차입금 상환 부담 규모가 증가하고, 재무안정성은 저하될 수 있습니다. 이에 당사는 향후 2년간 자금수지 계획을 수립하고, 유동성 관리에 노력하고 있습니다.
| [당사 향후 2년간 자금수지계획] |
| (단위: 백만원) |
| 구분 | 2024년 3분기 |
2024년 4분기 |
2025년 1분기 |
2025년 2분기 |
2025년 3분기 |
2025년 4분기 |
2026년 1분기 |
2026년 2분기 |
2026년 3분기 |
2026년 4분기 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영업 현금흐름 |
(a)수입 | 매출대금(신약 외) | 724 | 395 | 1,148 | 2,148 | 1,148 | 1,652 | 2,034 | 2,035 | 3,535 | 2,035 |
| 매출대금(신약L/O) | - | - | - | - | 48,423 (주1) |
19,657 (주2) |
19,657 (주3) |
28,767 (주3) |
||||
| 기타 | 93 | 101 | - | - | - | - | - | - | - | - | ||
| 계 | 816 | 496 | 1,148 | 2,148 | 49,572 | 21,310 | 2,034 | 21,692 | 3,535 | 30,801 | ||
| (b)지출 | 원재료 등 | 685 | 606 | 929 | 929 | 929 | 929 | 1,208 | 1,208 | 1,208 | 1,208 | |
| 판매관리비 | 927 | 905 | 1,594 | 1,620 | 1,648 | 1,658 | 2,244 | 2,234 | 5,144 | 3,784 | ||
| 경상연구비 (주5) |
2,024 | 926 | 612 | 1,823 | 3,285 | 4,009 | 4,443 | 4,461 | 4,461 | 4,461 | ||
| 계 | 3,636 | 2,438 | 3,135 | 4,372 | 5,861 | 6,596 | 7,895 | 7,903 | 10,813 | 9,454 | ||
| 영업수지(=(a)-(b)) | -2,819 | -1,942 | -1,987 | -2,224 | 43,710 | 14,714 | -5,860 | 13,789 | -7,279 | 21,348 | ||
| 투자 현금흐름 |
(c)수입 | 자산매각 | 99 | - | - | - | - | - | - | - | - | - |
| 계 | 99 | - | - | - | - | - | - | - | - | - | ||
| (d)지출 | 연구개발투자 | 517 | - | - | 600 | - | - | - | - | - | - | |
| 기타 | 15 | - | - | - | - | - | - | - | - | - | ||
| 계 | 532 | - | - | 600 | - | - | - | - | - | - | ||
| 투자수지(=(c)-(d)) | -433 | - | - | -600 | - | - | - | - | - | - | ||
| 재무 현금흐름 |
(e)수입 | 유상증자 | - | 23,543 | - | - | - | - | - | - | - | - |
| 외부차입 등 | - | 3,000 | - | - | - | - | - | - | - | - | ||
| 계 | - | 26,543 | - | - | - | - | - | - | - | - | ||
| (f)지출 | 차입금 상환 | 151 | - | 3,000 | - | - | - | - | - | - | - | |
| 이자비용 | - | 38 | - | - | - | - | - | - | - | - | ||
| CB 상환 | - | 13,500 | 3,000 | - | - | - | - | - | - | - | ||
| 계 | 151 | 13,538 | 6,000 | - | - | - | - | - | - | - | ||
| 재무수지(=(e)-(f)) | -151 | 13,005 | -6,000 | - | - | - | - | - | - | - | ||
| 기초 자금 | 19,368 | 15,965 | 27,029 | 19,042 | 16,218 | 59,928 | 74,642 | 68,782 | 82,571 | 75,292 | ||
| 기말 자금 | 15,965 | 27,029 | 19,042 | 16,218 | 59,928 | 74,642 | 68,782 | 82,571 | 75,292 | 96,640 | ||
| (출처 : 당사 제시) (주1) AST-201의 임상1상 POC 데이터 기반 기술이전에 따른 기술료 수익(484억원)을 추정하였습니다. 유사 기술이전 사례를 통한 Deal 규모를 추정하였으며, 향후 기술이전 계약 체결의 불확실성(성공확률)을 반영하여, 보수적인 관점에서 보정률 60%를 가정하여 목표기술이전료(총액)를 산정하였습니다. (주2) AST-202의 전임상 POC 데이터 기반 기술이전에 따른 기술료 수익(197억원)을 추정하였습니다. (주3) AST-203의 전임상 POC 데이터 기반 기술이전에 따른 기술료 수익(197억원)을 추정하였습니다. (주4) AST-202의 임상1상 POC 데이터 기반 기술이전에 따른 기술료 수익(288억원)을 추정하였습니다. (주5) 경상연구개발비는 대부분 연구원의 인건비, 신약 파이프라인의 임상, 임상시험용 의약품 생산, 전임상 등에 사용될 예정입니다. |
[금번 유상증자를 추진하는 사유]
당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있음에도 불구하고 금번 유상증자를 진행하고 있습니다. 당사는 165억원의 미상환 전환사채를 보유하고 있고, 동 전환사채의 전환가액은 4,058원이며 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 당사가 자체적으로 전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다. 당사는 제1회 전환사채를 8,407백만원을 기사용하여 전환사채를 조기상환하기 위해서는 8,407백만원이 추가로 필요하고, 향후 원활한 연구개발을 위해서는 추가자금이 필요하기 때문에 금번 유상증자를 추진하게 되었습니다.
| [채무상환대상] |
| (단위: 백만원) |
| 종목 | 차입처 | 차입금액 | 차입일 | 만기일 | 이자율 |
|---|---|---|---|---|---|
| 전환사채 | 사모 | 16,500 | 2022.10.06 | 2027.10.06 | 0.00% |
| 조기상환청구금액(예정) | 지급기일 | 비고 |
| 13,500 | 2024.10.06 | 1차 조기상환 |
| 3,000 | 2025.01.06 | 2차 조기상환 |
| (출처: 당사 제시) |
[자금 전용 가능성]
| [상장 및 이후 자본시장에서 조달한 자금 내역] |
| (단위: 백만원) |
| 납입일 | 종류 | 사용용도 | 금액 | 실제사용내역 | 잔여금액 |
|---|---|---|---|---|---|
| 2020-09-10 | 코스닥 상장 유상증자(일반공모) | 시설자금 | 3,893 | - | 3,893 |
| 운영자금 | 960 | 84 | 876 | ||
| 기타자금 | 27,012 | 20,506 | 6,506 | ||
| 2022-10-06 | 제1회 사모 전환사채 | 운영자금 | 16,500 | 8,407 | 8,093 |
| 합계 | 48,365 | 28,997 | 19,368 | ||
| (출처 : 정기보고서) |
당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있고, 이 자금의 출처는 코스닥 상장 유상증자 자금 11,275백만원, 제1회 전환사채 자금 8,093백만원으로 구성되어 있습니다. 당사는 2024년 10월 06일 지급되는 1차 조기상환을 지급하기 위해서는 코스닥 상장 유상증자 자금을 일부 전용하여야 합니다. 이후 금번 유상증자가 납입되는데로 전용된 자금을 반납하고, 사용목적에 맞게 운용될 예정입니다.
[외부자금 차입계획 및 계획대로 차입이 되지 않을 경우 대응방안]
당사는
전환사채투자자들에 대한 풋옵션행사 파악 결과 1회차(2024년 10월 6일) 풋옵션 행사 135억원, 2회차(2025년 1월 6일) 풋옵션 행사 30억원이 행사될 것으로 전망이 됩니다. 2024년 잔여기간 자금 수지를 감안컨데 1회차 풋옵션행사에는 무리없이 대처할 수 있으나 이후 자금운용상의 한시적 부족분을 해결하기 위해서는 30억원의 차입금조달이 필요한 상황입니다. 다만 2024년 12월 의도한 유상증자 납입이 이루어지게 된다면 자금수지 개선과 함께 2025년 30억원의 차입금상환을 계획하고 있습니다. 다만 당사가 계획하고 있는 2025년 라이선스아웃 및 CRO사업의 Cash Cow 역할에 차질이 생긴다면 2025년에도 자금수지는 어려움에 직면할 수 있는 만큼 철저한 대응 방안이 강구되어야 합니다.
당사는 향후 1년간 (주)인터내셔널사이언티픽스탠다드 관련 매출을 통해 영업현금흐름이 발생할 것으로 예상하고 있습니다. 단, 현 시점에서 당사가 계획 중인 주요 연구개발비 등을 충당하기에는 그 규모가 부족할 것으로 생각되며, 영업수지상 음(-)의 현금흐름이 발생할 것으로 예상하고 있습니다. 이에 본 유상증자 및 외부차입 등 재무활동을 통해 당사 운영자금 등을 조달하고자 합니다. 단, 재무활동을 통해서도 목표 자금을 조달하지 못한다면 당사에 유동성 위기가 생길 수 있고, 영업활동을 영위해나가는데 상당한 제약이 생길 수 있습니다.
이처럼 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 지속적으로 음(-)의 영업활동현금흐름이 발생하고 있기 때문에 근본적인 영업 실적이 개선되지 않을 경우 영업현금 창출능력이 부족하여, 지속적으로 외부 자금 조달에 의존해야 합니다. 그러나 대내외적 환경, 회사 재무상태 등에 따라 외부 자금 조달마저 불가능해질 수 있으며, 이는 당사의 유동성 위기로 연결될 수 있습니다. 또한 외부 자금 조달이 어려울 경우 당사는 계획 중인 파이프라인 연구개발을 영위하는 데에 상당한 제약이 생길 수 있고, 향후 당사의 존속능력에 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 라. (주)인터내셔널사이언티픽스탠다드 관련 위험 당사는 (주)인터내셔널사이언티픽스탠다드 지분 100% 취득 후, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 합병 후에는 더 이상 연결대상 종속회사는 존재하지 않습니다. 이에 합병 후 (주)인터내셔널사이언티픽스탠다드의 매출은 당사 개별 재무제표상 매출에 포함됩니다. 당사는 (주)인터내셔널사이언티픽스탠다드 합병을 통해 사업부문 다각화 및 매년 일정수준 매출이 발생하여 당사 재무적 상황이 개선될 수 있을 것으로 기대하고 있습니다.그럼에도 불구하고 (주)인터내셔널사이언티픽스탠다드를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)인터내셔널사이언티픽스탠다드 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다. 한편 CRO사업은 당사의 연구개발업과의 단기적인 사업적 시너지 효과를 기대할 수는 없으며, 당사가 합병 후 경영에 참여했을 때 기존의 실적을 달성하지 못할 수도 있습니다. 다만, 중장기적 관점에서는 앞서 기재한 바와 같이, 소규모 합병을 통해 회사의 신약 개발 기술력을 한 단계 끌어 올리고, 기존의 압타머 발굴·합성 서비스에 더해 바이오의약품 분석 서비스까지 사업영역을 넓혀 나가는 사업 방향성을 목표하고 있는 만큼 중장기적인 사업 시너지는 발생할 수 있을 것으로 기대하고 있습니다. 다만 이에 관하여 아직 구체화된 계획은 없으며, 우선적으로 당사는 현 체제 하에서 사업 안정화 및 재무적 상황을 개선하는데에 초점을 두고 있습니다. 또한 당사 기존 조직에서는 CRO사업 부문에 대한 경험과 전문성이 부족하기 때문에 앞서 언급한 바와 같이 전문 인력을 확보하여 활성화하고자 합니다. 다만, 당사의 기존 경영진들은 CRO사업에 대한 전문성과 경험이 상대적으로 부족한 점은 사실이며, 이는 사업 확장의 한계점으로 작용할 수 있는 점에 대하여 유의하여 주시기 바랍니다. |
당사는 신약개발사업의 불확실성 등을 감안 Cach-Cow 사업을 확보하고, 관리종목 리스크 중 매출 리스크에 선제적으로 대응하고자 2023년부터 신규사업 발굴에 노력을 기울여왔습니다. 당사의 신규사업 발굴 기준은 매출이 지속적으로 발생가능하고, 기존 사업과 관련이 있으며, 기존사업과의 시너지 창출이 가능한가 여부였습니다. 다만 신규사업을 발굴하는 과정에서 상당한 재원이 투입이 된다는 점에서 합리적인 의사결정을 위한 사전 대비 과정을 거쳐온 바 있습니다.
당사는 2023년 개발중인 파이프라인에 대한 분석법 개발을 위해 외부 전문 업체를 활용하고자 의사결정 한 바 있으며, 이에 첫번째 파이프라인인 AST-201의 생체시료 분석법 개발을 위해 객관적인 평가 프로세스에 의거 2023년 10월 ㈜인터내셔널사이언티픽스탠다드를 선정하고 진행하게 되었습니다.
㈜인터내셔널사이언티픽스탠다드를 통한 분석법 개발 과정에서 업체의 비교우위 역량을 파악하게 되던 차에 2024년 3월 ㈜인터내셔널사이언티픽스탠다드에 대한 경영권 매각 이슈가 있음을 인지하게 되었고, 양측의 니즈 등을 감안 비밀유지계약을 맺고 재무실사 등 일련을 과정을 거쳐, 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득하였습니다.
당사와 최대주주 등은 ㈜인터내셔널사이언티픽스탠다드와는 지분 관계를 포함하여 어떠한 연관이 없고, 2023년 개발중인 파이프라인에 대한 분석법 개발 과정에서 상호간 존재를 인식하게 되었습니다.
| [(주)인터내셔널사이언티픽스탠다드 기업 개요] |
| 구 분 | 내 용 |
|---|---|
| 상호명 |
(주)인터내셔널사이언티픽스탠다드 |
| 소재지 |
강원특별자치도 춘천시 소양강로 32(후평동) |
| 설립일 | 2008.06.25 |
| 대표이사 |
한동일 |
| 법인구분 |
비상장법인 |
| 자본금 | 50.5억원 |
| 사업영역 | 분석서비스(임상영역, 비임상영역, R&D 등) 임상서비스 |
| (출처 : 당사 제시) |
㈜인터내셔널사이언티픽스탠다드는 2008년 미국바텔연구소와 ㈜유유제약의 합작투자로 2008년 6월 자본금 50억원으로 설립되어 별도의 유상증자 없이 사업을 영위해왔으며, 2015년 이후는 개인을 통한 누적 차입금 45억원을 통해 운영자금을 조달하여 사업을 영위해온 바 있습니다. 사업의 부침은 있었으나 2021년 7,246백만원의 매출과 1,285백만원의 영업이익을 정점으로 2022년 5,185백만원의 매출과 620백만원의 영업손실, 2023년 3,961백만원의 매출과 1,186백만원의 영업손실을 시현하게 되었는데 이는 2021년 이후 주요 매출 아이템인 생동 분야에서의 경쟁력 상실 및 인건비 포함 고정비 부담 등이 주요 원인이라 할 수 있습니다. 이에 ㈜인터내셔널사이언티픽스탠다드 경영진은 2023년 말 경영권 매각에 대한 의사결정을 하게 되었고 이를 촉진하기 위해 2024년 초 본격적인 사업의 축소 및 인력에 대한 구조조정을 단행해 전체적으로 사업을 슬림화하였고, 경영권 매각의 제약사항이라 할 수 있는 45억원의 누적 차입금 중 39억원에 대한 포기(종결)을 경영권 매각 조건으로 제시된 바 있습니다.
당사의 신규사업 발굴 기조와 ㈜인터내셔널사이언티픽스탠다드의 경영권 매각 의지, 구조조정 단계, 채무면제 이익 등에 대한 공감대가 형성되어 M&A가 진행되었고 현재 안정적인 PMI 과정이 진행중에 있습니다. 또한 ㈜인터내셔얼사이언티픽스탠다드 M&A 관련 실사과정 등을 통해 실질적인 주식가치는 인정하지 않고 자산과 부채를 승계하는 것으로 최종 합의를 하였으며 정정신고서 제출일 현재 누적 차입금 45억원은 전액 상환되었습니다.
| [(주)인터내셔널사이언티픽스탠다드 거래 및 채권채무] |
| (단위 : 천원) |
| 구 분 | 거래내용 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|
| 주요 거래 | 기타비용 | 65,958 | 11,226 | - | - |
| 이자수익 | 5,810 | - | - | - | |
| 채권 | 대여금 | 1,500,000 | - | - | - |
| 미수수익 | 5,810 | - | - | - | |
| 채무 | 미지급금 | 2,365 | - | - | - |
| (주1) 2024년 반기 기타비용은 'AST-201 임상1상환자 검체 분석' 1차 지급분 (50%)입니다. (주2) 2023년의 기타비용은 'AST-202 생체시료 분석법 개발' 1차 지급분(50%)입니다. (출처 : 당사 제시) |
또한 당사는 (주)인터내셔널사이언티픽의 경영활동 정상화를 위해 2024년 상반기 중 4차례의 금전대여를 진행한 바 있습니다. 4차례의 금전대여 공히 계약된 변제기일내 대여 원금을 상환하지 아니하였을 경우 LC장비 모든 권리를 양도하는 조건입니다.
| [(주)인터내셔널사이언티픽스탠다드 대여금] |
| (단위 : 천원) |
| 구분 | 1회차 | 2회차 | 3회차 | 4회차 |
|---|---|---|---|---|
| 시작일자 | 2024.05.27 | 2024.05.27 | 2024.05.29 | 2024.06.11 |
| 종료일자 | 2024.12.31 | 2024.12.31 | 2024.12.31 | 2024.12.31 |
| 대여목적 | 운영자금 지원 | 운영자금 지원 | 운영자금 지원 | 운영자금 지원 |
| 대여금액 | 300,000 | 600,000 | 200,000 | 400,000 |
| 이자율. | 4.6 | 4.6 | 4.6 | 4.6 |
| (출처 : 당사 제시) |
당사는 ㈜인터내셔널사이언티픽스탠다드의 자산과 부채 승계과정에서 실질적인 매수가액이라할 수 있는 차액에 대한 타당성을 입증하고자 매수가격배분(Purchase Price Allocation)(*) 공정가치 평가를 태일회계법인이 수행하였습니다. 태일회계법인을 통한 잠재적 무형자산의 인식가능성 검토 결과, 고객관계와 관련하여 무형자산이 식별되고 중요성이 있는 것으로 검토되었으며, 고객관계는 다기간초과이익법(Multi-period Excess Earning Method : MEEM)으로 평가하였습니다. 다기간초과이익법은 기여자산의 추정이익에서 원가를 차감하여 적절한 할인율을 사용하여 평가기준일 현재가치로 할인하는 방법입니다.
| (*) K-IFRS에 따르면 사업결합 시에는 취득법(Acquisition method)을 적용하여 회계 처리해야 하며, 취득자는 취득일 현재 피취득자의 자산(과거 인식되지 않은 무형자산 포함)과 인수부채의 공정가치를 측정하고 매수가액을 배부해야 합니다. 취득한 식별 가능한 무형자산은 영업권과 분리하여 인식해야 하며 무형자산은 분리가능성 기준이나 계약적·법적 기준을 충족하는 경우에 식별 가능합니다. 식별 가능하고 가치평가 대상으로 선정된 자산, 부채, 공정가액이 인수자의 지분을 초과하는 금액에 대해서는 영업권으로 인식하며, 인수자의 지분에 미달하는 금액에 대해서는 염가매수차익으로 인식합니다. |
이에 따라 당사는 2024년 반기 기준 고객관계가치 851백만원과 영업권 962백만원을 인식하였습니다. 당사는 고객관계가치를 5년간 감가상각할 예정이나, 매 보고기간말 혹은 손상을 시사하는 징후가 있을 때 회수가능액과 장부금액을 비교하여 손상검사를 수행하여 장부가액의 일부 또는 전액에 대하여 손상을 인식할 수 있습니다.
(주)인터내셔널사이언티픽스탠다드는 의약품 연구개발의 모든 단계에서 개발사의 의뢰를 받아 연구개발을 대행하는 위탁연구기관입니다. (주)인터내셔널사이언티픽스탠다드의 개별 재무 현황은 다음과 같습니다.
| [개별 재무상태표] |
| (단위 : 백만원) |
| 구분 | 2024년 반기말 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 유동자산 | 1,189 | 752 | 908 | 1,035 |
| 비유동자산 | 938 | 944 | 1,346 | 1,067 |
| 자산총계 | 2,126 | 1,696 | 2,254 | 2,101 |
| 유동부채 | 2,773 | 5,584 | 4,751 | 4,157 |
| 비유동부채 | 988 | 1,442 | 1,478 | 1,222 |
| 부채총계 | 3,761 | 7,025 | 6,228 | 5,379 |
| 자본금 | 5,050 | 5,050 | 5,050 | 5,050 |
| 이익잉여금 | -7,067 | -10,762 | -9,406 | -8,710 |
| 자본총계 | -1,635 | -5,330 | -3,974 | -3,278 |
| (출처 : 당사 제시) |
| [개별 손익계산서] |
| (단위 : 백만원) |
| 구분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 매출액 | 877 | 3,524 | 4,294 | 5,777 |
| 매출원가 | 1,301 | 3,898 | 4,009 | 3,845 |
| 매출총이익 | -424 | -374 | 284 | 1,931 |
| 판매비와관리비 | 121 | 812 | 905 | 647 |
| 영업이익(손실) | -545 | -1,186 | -620 | 1,285 |
| 영업외 수익 | 4,404 | 83 | 109 | 41 |
| 영업외 비용 | 82 | 252 | 185 | 678 |
| 법인세비용차감전 순이익 | 3,777 | -1,356 | -696 | 648 |
| 법인세비용 | - | - | - | - |
| 당기순이익 | 3,777 | -1,356 | -696 | 648 |
| (출처 : 당사 제시) | |
| 주1) | (주)인터내셔널사이언티픽스탠다드 간주취득일은 2024년 6월 30일입니다. 이에 2024년 반기 (주)인터내셔널사이언티픽스탠다드 손익은 당사 연결 손익에 포함되어 있지 않습니다. |
(주)인터내셔널사이언티픽스탠다드의 매출은 2021년부터 2024년까지 지속적으로 감소하고 있었고, 이에 따라 고정비 부담으로 인하여 영업손실 및 당기순손실이 발생하였습니다. 2024년 반기는 37억원의 당기순이익을 실현하였으나, 이는 기존 경영자와 관련된 채무면제이익 44억원에 의한 것입니다.
당사는 M&A 과정에서 첫째 ㈜인터내셔널사이언티픽스탠다드의 고객군에 주목했는데, 고객군은 1억 이상의 대규모 수주가 이루어지는 제약사 수주와 1억 미만의 소규모 수주일 수 있으나 증가속도가 가파른 바이오텍의 수주가 유지가 된다면 충분히 턴어라운드가 가능할 것이라 판단하였습니다. 둘째 ㈜인터내셔널사이언티픽스탠다드의 역량에 주목했는데, 업계내 특화된 강소기업이라는 레퍼런스와 남아있는 핵심인력이 유지가 된다면 이 역시 턴어라운드를 견인할 수 있을 것이라 판단하였습니다.
외부적으로 확인된 재무상태 및 손익추이만을 본다면 M&A의 평가에 이견이 있을 수 있으나, 당사는 2024년 구조조정 및 슬림화 과정을 거쳐 2025년을 위한 빌드업 과정이 차질없이 진행이 된다라면 25억원 ~ 30억원에 해당하는 손익분기점 수준의 매출은 시현할 수 있을 것이란 판단하고 있습니다, 또한 예상대로 매출이 시현이 된다라면 당초 기대한 바 있는 Cash Cow로서의 역할과 관리종목 매출리스크에 대한 해소가 가능할 수 있을 것으로 전망하고 있습니다.
다만 회사가 실질적인 턴어라운드를 위해서는 M&A 이후의 PMI를 전제로한 핵심 인력의 이탈방지와 함께 성장을 주도할 수 있는 전문 인력을 확보가 무엇보다 중요하다고 할 수 있습니다. 회사는 그 일환으로 미국 NIH, 삼성, LG, 미국 소재 CRO 등에서 바이오시밀러 및 대사체 ID 분석을 담당했고 국내 CRO에서 운영책임자로 근무하며 미국 FDA와 다양한 업무를 수행하는 등 26년간 폭넓은 경험을 쌓은 분석 전문가로 꼽히는 양정수박사를 CRO사업총괄로 영입을 하였습니다. 회사는 양정수전무 합류로 ‘바이오의약품 분석 명가’로 거듭날 수 있도록 제반 역량을 강화할 방침이며, 특히 바이오의약품 시장의 성장을 예상하고 선제적인 대비를 해온 만큼 국내 기업 주도 신약 개발 프로젝트가 활성화되고 글로벌 기술이전 사례가 많아짐에 따라 이를 뒷받침할 고품질 분석 서비스로 협력을 확대하겠다는 방침입니다.
또한 국내 대형 비임상 CRO로부터 올리고펩타이드, ADC 및 항체약물과 같은 거대분자 모달리티에 대한 비임상독성시험 대응시 진행 과정을 협업 할 수 있는 프로세스를 구축하기 위한 적극적인 제휴에도 적극적으로 임하고 있는데 이를 통한 안정적인 수익 모델을 구축하고자 하며, 적자 발생 손익 구조를 개선하기 위해 최소한의 마케팅 비용 및 인건비 등으로 최대의 효과를 낼 수 있도록 현재 인력들 개개인의 업무를 지원하되, 무리한 조직 확장계획 또는 자금 투자계획은 세우고 있지 않으며, 최대한 비용 통제를 위한 노력을 할 예정입니다.
참고로 무형자산의 가치를 평가함에 있어 미래 예측기간 동안의 추정손익은 회사의 과거 실적, 사업계획 및 기타 공시된 자료 등을 바탕으로 일정한 가정하에서 산출된 것이므로 미래의 경제적 상황 및 회사의 사업전략, 기타 경영상황의 변화에 따라 향후 실제 경영성과와 차이가 나는 것이 일반적이고, 그 차이는 중대할 수 있습니다. 따라서 가치평가 결과가 그 미래 실제 가치와 동일하거나 유사할 것이라고 확인하거나 보증을 제공하지 아니하므로, 당사의 의사결정시 제반 위험요인을 추가적으로 고려하여야 합니다.
회사는 M&A 이후 사업개발 역량 확보를 통한 수주 활성화를 위해 전문 인력을 확충한 바 있으며, M&A를 통해 재무 안정성을 확보했했고 신약 개발에 필수적인 바이오의약품 분석 패키지를 제공하여 글로벌 경쟁력을 갖춘 분석 CRO로 자리매김할 것을 천명한 바 있습니다. 다만 전방산업의 회복 및 차빌없는 빌드업 과정이 전제되어야 하는 만큼 불활실성을 배제할 수는 없습니다.
한편, 당사는 (주)인터내셔널사이언티픽스탠다드 지분 100% 취득 후, 2024년 06월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 합병 후에는 더 이상 연결대상 종속회사는 존재하지 않습니다. 이에 합병 후 (주)인터내셔널사이언티픽스탠다드의 매출은 당사 개별 재무제표상 매출에 포함됩니다. 당사는 (주)인터내셔널사이언티픽스탠다드 합병을 통해 사업부문 다각화 및 매년 일정수준 매출이 발생하여 당사 재무적 상황이 개선될 수 있을 것으로 기대하고 있습니다.
그럼에도 불구하고 (주)인터내셔널사이언티픽스탠다드를 합병함으로써 당사가 기대했던 사업다각화 및 매출 안정성 확보 기대에 비해, (주)인터내셔널사이언티픽스탠다드 관련 사업 부문의 손익이 개선되지 않을 경우 오히려 당사에 재무적 악영향을 미치게 될 수 있습니다. 특히 당사는 기존에 추진해오던 연구개발업의 성과가 아직 부진한 상황이며, 이러한 상황 하에서 신규 사업에 진출한 셈이기 때문에 신규 사업에서 손익 개선이 되지 않을 경우, 오히려 당사의 계속기업으로서의 존속 능력은 더욱 저하될 수 있습니다.
한편 CRO사업은 당사의 연구개발업과의 단기적인 사업적 시너지 효과를 기대할 수는 없으며, 당사가 합병 후 경영에 참여했을 때 기존의 실적을 달성하지 못할 수도 있습니다. 다만, 중장기적 관점에서는 앞서 기재한 바와 같이, 소규모 합병을 통해 회사의 신약 개발 기술력을 한 단계 끌어 올리고, 기존의 압타머 발굴·합성 서비스에 더해 바이오의약품 분석 서비스까지 사업영역을 넓혀 나가는 사업 방향성을 목표하고 있는 만큼 중장기적인 사업 시너지는 발생할 수 있을 것으로 기대하고 있습니다. 다만 이에 관하여 아직 구체화된 계획은 없으며, 우선적으로 당사는 현 체제 하에서 사업 안정화 및 재무적 상황을 개선하는데에 초점을 두고 있습니다.
또한 당사 기존 조직에서는 CRO사업 부문에 대한 경험과 전문성이 부족하기 때문에 앞서 언급한 바와 같이 전문 인력을 확보하여 활성화하고자 합니다. 다만, 당사의 기존 경영진들은 CRO사업에 대한 전문성과 경험이 상대적으로 부족한 점은 사실이며, 이는 사업 확장의 한계점으로 작용할 수 있는 점에 대하여 유의하여 주시기 바랍니다.
| 마. 잦은 자금조달 관련 위험 당사는 2020년 9월 10일 코스닥시장 상장을 통한 유상증자 319억원, 2022년 10월 06일 제1회 사모 전환사채 165억원을 시설자금 및 운영자금 목적으로 자본시장에서 조달하였습니다. 당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있음에도 불구하고 금번 유상증자를 진행하고 있습니다. 당사는 165억원의 미상환 전환사채를 보유하고 있고, 동 전환사채의 전환가액은 4,058원이며 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 당사가 자체적으로 전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다. 당사는 제1회 전환사채를 8,407백만원을 기사용하여 전환사채를 조기상환하기 위해서는 8,407백만원이 추가로 필요하고, 향후 원활한 연구개발을 위해서는 추가자금이 필요하기 때문에 금번 유상증자를 추진하게 되었습니다. 당사는 최근 5년간 연구개발비 등을 사용하기 위해 자본시장을 통해 자금조달을 한 만큼, 주요 파이프라인의 기술이전을 통한 매출 발생이 당사 예상 대비 지연되거나 자금 운용계획을 적정하게 수립하지 못할 경우 향후에도 자본시장을 통한 추가적인 자금조달이 이뤄질 수 있습니다. 또한, 시장 상황으로 인해 추가적인 자금조달이 원활히 이뤄지지 않을 경우 당사는 일시적인 유동성 위험에 처할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2020년 9월 10일 코스닥시장 상장을 통한 유상증자 319억원, 2022년 10월 06일 제1회 사모 전환사채 165억원을 시설자금 및 운영자금 목적으로 자본시장에서 조달하였습니다.
| [상장 및 이후 자본시장에서 조달한 자금 내역] |
| (단위: 백만원) |
| 납입일 | 종류 | 사용용도 | 금액 | 실제사용내역 |
|---|---|---|---|---|
| 2020-09-10 | 코스닥 상장 유상증자(일반공모) | 시설자금 | 3,893 | - |
| 운영자금 | 960 | 84 | ||
| 기타자금 | 27,012 | 20,506 | ||
| 2022-10-06 | 제1회 사모 전환사채 | 운영자금 | 16,500 | 8,407 |
| 합계 | 48,365 | 28,997 | ||
| (출처 : 정기보고서) |
1) 코스닥시장 상장을 통한 유상증자 319억원의 사용내역
2020년 9월 당사는 코스닥시장에 상장하였으며, 당시 공모자금 319억원은 시설자금 39억원, 운영자금 10억원 및 기타자금 270억원의 용도로 사용할 계획이었습니다.
이 중 당사가 상장할 당시 계획했던 기타자금 270억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 합계 |
|---|---|---|---|---|
| AST-101 (당뇨병치료제-인슐린대체제) | - | 1,251 | 5,286 | 6,537 |
| -전임상 시험 | - | 1,000 | - | 1,000 |
| -임상1상 시험 | - | 251 | 5,286 | 5,537 |
| AST-102 (당뇨병치료제-인슐린민감제) | 195 | 455 | 1,251 | 1,901 |
| -선도물질 최적화 | 195 | - | - | 195 |
| -전임상 시험 | - | 455 | - | 455 |
| -추가임상진행비용 | - | - | 1,251 | 1,251 |
| AST-201 (간암치료제) | 217 | 1,949 | 3,628 | 5,794 |
| -전임상 시험 | 217 | 1,000 | - | 1,217 |
| -임상1상 시험 | - | 949 | 3,628 | 4,577 |
| 기타 신규 파이프라인 | 200 | 3,400 | 5,400 | 9,000 |
| 진단제품 임상비용 | 500 | 980 | 2,300 | 3,780 |
| 합 계 | 1,112 | 8,035 | 17,865 | 27,012 |
| (출처 : 증권신고서) |
| [실제 자금사용 내역] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 | 2024년 반기 |
합계 | 차이발생 사유 등 |
|---|---|---|---|---|---|---|---|
| AST-101 (당뇨병치료제-인슐린대체제) | 95 | 431 | 479 | - | - | 1,005 | 2022년 3분기 개발 중단 주1) |
| -전임상 시험 | 95 | 431 | 479 | - | - | 1,005 | |
| AST-102 (당뇨병치료제-인슐린민감제) | 92 | 32 | 90 | - | - | 214 | |
| -선도물질 최적화 | 92 | 32 | 90 | - | - | 214 | |
| AST-201 (간암치료제) | 606 | 136 | 4,348 | 7,209 | 972 | 13,271 | 개발 지연 주2) |
| -전임상 시험 | 606 | 136 | 4,348 | 296 | - | 5,386 | |
| -임상1상 시험 (임상시험용의약품 위탁생산 비용) |
- | - | - | 6,913 | 972 | 7,885 | |
| 기타 신규 파이프라인 | - | 198 | 308 | 24 | 363 | 893 | - |
| -Covid19 치료제 | - | 198 | 53 | - | - | 252 | |
| -AST-202 선도물질 최적화 | - | - | 255 | 24 | 363 | 641 | |
| 진단제품 임상비용 | 58 | 67 | 27 | 596 | 7 | 755 | - |
| -폐암진단키트 임상비용 | - | - | - | 595 | 6 | 602 | |
| -폐암진단키트 후속모델 개발 | 58 | 67 | 27 | 0 | 1 | 153 | |
| 기타운영자금 | 646 | 818 | 594 | 912 | 1,482 | 4,453 | - |
| 합 계 | 1,497 | 1,682 | 5,845 | 8,741 | 2,824 | 20,590 | - |
| (출처 : 당사 제시) 주1) 당사는 AlloMAp 플랫폼을 활용한 First-in-class 당뇨 신약 개발(제1/2형 당뇨의 지속형 인슐린대체제 및 인슐린민감제)을 추진했으며 Johnson & Johnson 사와 제휴(2016년 4분기), Novo Nordisk 사와 MTA(물질이전계약) 체결(2018년 3분기), 범부처신약개발과제에 선정(2019년 1분기)되었습니다. 그러나 비임상 단계에서 산출된 데이터로 후보물질의 경제성평가를 수행한 결과, 인슐린 기반 치료제가 기존 치료제의 대세로 자리잡은 현 시장 상황과 투여주기를 점점 늘려가는 당뇨 치료제 개발 방향성을 고려하여 △주1회 투여 방식으로 제형변화의 필요성 △시장의 경쟁 심화 △GLP-1 수용체작용체의 확대 △인슐린 기반 치료제의 지속적인 단가 인하로 인한 가격경쟁력 확보의 불확실성 등의 요인으로 경쟁력이 높지 않음을 확인하였고, 2022년 3분기 해당 파이프라인의 개발을 잠정 중단하기로 결정하였습니다. 당사의 후보물질은 인슐린 장기투여로 인한 부작용(인슐린 저항성, 심혈관 위험, 체중증가 등)에서 경쟁우위에 있으나, 대사질환 계열 약물의 임상적 유의성을 입증하기 위한 대규모 임상 등 투자비용 대비 기대수익이 충분하지 않았던 까닭입니다. 현 시점에서는 추가적인 제형연구를 통한 약동력학적 특성 개선과 활성평가 연구를 일부 병행 중으로, 임상 단계 진입은 공동개발 파트너사가 정해진 이후에 가능할 것으로 예상됩니다. 주2) 당사의 고형암 치료제 AST-201은 상장 당시 후보물질 단계였으며, 2021~22년 전임상 시험 - 2023년 임상시험용 의약품 위탁생산 - 2024년 현재 식약처 임상시험계획승인(IND)을 신청한 상태입니다. 이는 상장 당시보다 2년 정도 지연된 것으로, 주요 사유는 △코로나19로 인한 임상용 의약품 위탁생산의 지연 및 전임상 독성평가를 위한 위탁시험기관 확보의 어려움 △중국 제약사와의 파트너링 논의지연 등입니다. 현 시점은 식약처 임상승인 신청을 마친 상태로 2024년 10월 중 IND 승인을 예상하고 있습니다. 이에 10월부터 국내 다기관임상(4개 병원)에 착수할 계획이며, 2025년 2분기 임상 중간데이터를 확보하여 해외제약사 기술이전계약 체결을 목표하고 있습니다. 당사는 글로벌 기술이전을 목표로 2024년 상반기 China Bio, Bio USA 전시박람회에 참가하였으며, 다수의 해외 제약사와 CDA 계약을 맺고 기술검토를 진행하고 있습니다. |
한편, 2020년 9월 당사가 상장할 당시 계획했던 시설자금 39억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [상장 당시 자금사용목적] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 합계 |
|---|---|---|---|
| GMP 시설 증설 (주1) | 1,200 | 1,800 | 3,000 |
| 폐암 IVD 생산 설비 (주2) | 163 | 730 | 893 |
| 합 계 | 1,363 | 2,530 | 3,893 |
| (출처 : 증권신고서) |
시설자금 39억원에 대해서는 신고서 제출일 현재까지 집행되지 않고 있습니다. 당사는 코스닥 시장 상장 당시 GMP 생산 시스템과 IVD 생산 설비의 증설을 계획하고 시설투자자금을 확보하였습니다. 당사의 폐암 조기진단 제품(AptoDetect™-Lung)은 식약처 3등급 체외진단의료기기로서 의료기기 제조 및 품질관리 기준을 인증받은 GMP 시설에서 생산되고 있으며, 현재 구축된 시설의 연간 생산량은 2,970 키트입니다. 회사는 국내 건강검진시장 진입과 해외시장 진출 등 매출이 가시화되는 시점에 맞추어, 연간 10만 키트 규모의 GMP 공장을 증설할 계획을 가지고 있습니다. 신고서 제출일 기준 폐암 조기진단 제품은 상급종합병원(서울아산병원, 경희대의료원 등)과 건강검진센터(분당서울대학교병원, 분당차병원 등)에서 서비스하고 있으며, 판매예상에 따른 GMP 시설이전 시점을 충분히 검토하여 자금을 집행할 계획입니다.
2) 제1회 사모 전환사채 발행 165억원의 사용 내역
당사는 2022년 10월 제1회 사모 전환사채 165억원 발행 당시 연구개발비 및 임상시험비를 위해 운영자금 165억원을 집행할 목적이었습니다. 운영자금 165억원에 대한 자금사용목적 및 실제 사용내역은 다음과 같습니다.
| [제1회 사모 전환사채 발행 당시 자금사용목적] |
| (단위 : 백만원) |
| 자금용도 | 세부내역 | 연도별 사용 예정 금액 | |||
|---|---|---|---|---|---|
| '22년 | '23년 | '24년 이후 | 합계 | ||
| 운영자금 | 임상 비용 | 3,889 | 10,392 | 2,219 | 16,500 |
| (출처 : 주요사항보고서) |
| [제1회 사모 전환사채 자금사용 내역] |
| (단위 : 백만원) |
| 자금용도 | 세부내역 | 연도별 사용 금액 | |||
|---|---|---|---|---|---|
| '22년 | '23년 | '24년 이후 | 합계 | ||
| 운영자금 | 임상 비용 | - | 6,863 | 1,544 | 8,407 |
| (출처 : 당사 제시) |
당사는 사모 전환사채 조달금액 중 84억원을 2024년 반기까지 연구개발비 및 임상시험비 등의 운영자금으로 사용하였습니다. 잔여금액은 금융상품에 가입하여 운용되고 있습니다.
| [미사용자금의 운용 내역] | |||
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 보통예금 | 868 | - | 수시입출금 |
| 예ㆍ적금 | 정기예금 | 11,500 | 2023.07 ~ 2024.04 | 9개월 |
| 채권 | 중소기업금융채권 (주1) |
7,000 | 2023.10 ~ 2024.04 | 6개월 |
| 계 | 19,368 | - | ||
| (출처 : 당사 제시) (주1) 금융상품 가입금액에는 전환사채 발행액 중 미사용 자금이 포함되어 있습니다. |
당사는 향후에도 바이오사업을 영위하면서 주요 파이프라인의 연구 개발을 지속하기 위하여 자금조달이 필요한 상황입니다. 금번 주주배정 후 실권주 일반공모를 통한 세부 자금사용 계획에 대해서는 본 증권신고서의 제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
[금번 유상증자를 추진하는 사유]
당사는 2024년 반기말 현재 미사용운용자금 19,368백만원을 확보하고 있음에도 불구하고 금번 유상증자를 진행하고 있습니다. 당사는 165억원의 미상환 전환사채를 보유하고 있고, 동 전환사채의 전환가액은 4,058원이며 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 당사가 자체적으로
전환사채 인수자들에 대한 조기상환권 행사 가능성을 파악한 결과 1회차(2024년 10월 6일) 조기상환권 135억원, 2회차(2025년 1월 6일) 조기상환권 30억원이 행사될 것으로 전망이 됩니다. 당사는 제1회 전환사채를 8,407백만원을 기사용하여 전환사채를 조기상환하기 위해서는 8,407백만원이 추가로 필요하고, 향후 원활한 연구개발을 위해서는 추가자금이 필요하기 때문에 금번 유상증자를 추진하게 되었습니다.
| [채무상환대상] |
| (단위: 백만원) |
| 종목 | 차입처 | 차입금액 | 차입일 | 만기일 | 이자율 |
|---|---|---|---|---|---|
| 전환사채 | 사모 | 16,500 | 2022.10.06 | 2027.10.06 | 0.00% |
| 조기상환청구금액(예정) | 지급기일 | 비고 |
| 13,500 | 2024.10.06 | 1차 조기상환 |
| 3,000 | 2025.01.06 | 2차 조기상환 |
| (출처: 당사 제시) |
[AST-201 임상 1상의 자금사용내역]
당사의 고형암 치료제 AST-201은 상장 당시 후보물질 단계였으며, 2021~22년 전임상 시험 -
2023년 임상시험용 의약품 위탁생산
- 2024년 현재 식약처 임상시험계획승인(IND)을 신청한 상태입니다. 이는 상장 당시보다 2년 정도 지연된 것으로, 주요 사유는 △코로나19로 인한 임상용 의약품 위탁생산의 지연 및 전임상 독성평가를 위한 위탁시험기관 확보의 어려움 △중국 제약사와의 파트너링 논의지연 등입니다. 현 시점은 식약처 임상승인 신청을 마친 상태로 2024년 10월 중 IND 승인을 예상하고 있습니다. 이에 10월부터 국내 다기관임상(4개 병원)에 착수할 계획이며, 2025년 2분기 임상 중간데이터를 확보하여 해외제약사 기술이전계약 체결을 목표하고 있습니다.
2023년부터 AST-201의 임상1상 비용이 크게 늘어난 이유는 임상시험용의약품 위탁생산 비용을 '임상 1상 비용'으로 분류했기 때문입니다. 2023년 'AST-201 프로젝트' 69.13억 원의 92% 이상인 63.64억원이 CDMO 업체인 Asymchem 및 Wuxi 직접지급대금이며, 규정상으로도 임상시험용의약품의 수입허가를 받기 위해서는 식약처 IND 승인을 획득해야 하기 때문에 임상1상 비용으로 분류하는 것이 적합하다고 보았습니다. 실제로 여러 바이오기업에서도 임상시료 생산비는 연구비가 아닌 임상비용으로 분류하고 있습니다.
ADC(ApDC®) 임상의 경우 다른 모달리티 대비 많은 비용이 투입됩니다. 통상적으로 동물실험을 포함한 전임상시험을 진행하는데 있어 파이프라인 당 최대 200억원대 후반에서 300억원 정도의 금액이 투입되기 때문에, ADC(ApDC®) 치료제를 개발하는 바이오기업이 독자적으로 임상을 진행하는 것이 현실적으로 어렵습니다. 당사의 경우 지난 2022~23년간 고형암 치료제 AST-201의 전임상, 임상시험용 의약품 위탁생산 및 임상시험 준비에 약 115억원이 소요된 바 있습니다. 또한 후속 파이프라인인 AST-202와 AST-203의 전임상 진입에도 비슷하거나 그보다 약간 적은 수준의 예산이 투입될 것으로 전망됩니다,
이처럼 당사는 최근 5년간 연구개발비 등을 사용하기 위해 자본시장을 통해 자금조달을 한 만큼, 주요 파이프라인의 기술이전을 통한 매출 발생이 당사 예상 대비 지연되거나 자금 운용계획을 적정하게 수립하지 못할 경우 향후에도 자본시장을 통한 추가적인 자금조달이 이뤄질 수 있습니다. 또한, 시장 상황으로 인해 추가적인 자금조달이 원활히 이뤄지지 않을 경우 당사는 일시적인 유동성 위험에 처할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 바. 구주매각 및 청약 등에 따른 최대주주 지분율 변동 및 경영권 안정성 관련 위험 당사의 최대주주는 한동일 대표이사로 본 증권신고서 제출일 전일 기준 2,810,000주(지분율 15.7%)를 보유하고 있으며, 특수관계인을 포함한 최대주주 및 특수관계인의 보유주식수는 4,894,200주(지분율 27.34%)입니다. 금번 유상증자를 통해 발행 예정인 주식수는12,300,000주이며, 당사 최대주주인 한동일 대표이사는 1,930,866주를 배정 받을 예정입니다. 한동일 대표이사는 배정주식수의 30% 수준에 대해 청약할 예정입니다. 당사 최대주주인 한동일 대표이사는 금번 유상증자 청약자금 마련을 위해, 보유 중인 보통주식 또는 배정받게 될 신주인수권증서 일부를 장내외에 매각할 예정입니다. 다만, 증권신고서 제출일 전일 현재, 매각 수량 및 가격 등이 확정되지 않았으며, 추후 확정되는시점에 본 증권신고서 상에 기재할 예정입니다. 이처럼 유상증자 진행 과정 중 최대주주 보유 보통주 또는 신주인수권증서에 대한 장내외 매각은 최대주주의 지분율 하락을 야기할 수 있으며, 이는 당사 최대주주의 경영권에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점 투자에 유의하시기 바랍니다. 한동일 대표이사와 특수관계인이 보유중인 보통주식을 매각하고 배정주식수의 30% 청약을 가정할 경우, 한동일 대표이사의 유상증자 후 지분율은 9.7%로 하락하게 되고 최대주주 등의 지분율은 27.3%에서 17.0%로 하락하게 됩니다. 유상증자 이후 희석이 가능한 제1회 전환사채 및 주식선택권 등을 고려할 경우 한동일 대표이사의 지분율은 8.3%까지 하락하게 되고 최대주주 등 지분율 또한 15.0%로 감소하게 됩니다. 당사는 경영권 위협에 대비하고자 우호적인 기관들을 중심으로 우호지분을 확보하고자 노력하고 있으나, 증권신고서 제출일 현재 공동목적보유확약이 체결된 바는 없습니다. 또한, 최대주주 한동일 대표이사의 구주 매각과 30% 수준의 청약률 이외에도 당사는 본 유상증자, 전환사채의 전환청구, 주식매수선택권 미행사 수량의 추후 행사 가능성 등의 이유로 인해 본 증권신고서 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사 경영권 위협이 발생할 수 있으며, 본 증권신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게될 경우, 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자판단 시 이 점 유의하시기 바랍니다. |
당사의 최대주주는 한동일 대표이사로 본 증권신고서 제출일 전일 기준 2,810,000주(지분율 15.7%)를 보유하고 있으며, 특수관계인을 포함한 최대주주 및 특수관계인의보유주식수는 4,894,200주(지분율 27.3%)입니다. 금번 유상증자를 통해 발행 예정인 주식수는 12,300,000주이며, 당사 최대주주인 한동일 대표이사는 1,930,866주를 배정 받을 예정입니다. 한동일 대표이사는 배정주식수의 30% 수준에 대해 청약할 예정입니다.
당사 최대주주인 한동일 대표이사는 30% 이상 청약에 참여할 예정이며, 약 30% 수준으로 가정할 경우, 한동일 대표이사의 예상 청약 주식수는 579,259주입니다. 이에 따른 최대주주 한동일의 예상 필요 청약 자금은 약 11.3억원입니다.
당사 최대주주인 한동일 대표이사는 금번 유상증자 청약자금 마련을 위해, 보유 중인보통주식 또는 배정받게 될 신주인수권증서 일부를 장내외에 매각할 예정입니다. 다만, 증권신고서 제출일 전일 현재, 매각 수량 및 가격 등이 확정되지 않았으며, 추후 확정되는 시점에 본 증권신고서 상에 기재할 예정입니다.
이처럼 유상증자 진행 과정 중 최대주주 보유 보통주 또는 신주인수권증서에 대한 장내외 매각은 최대주주의 지분율 하락을 야기할 수 있으며, 이는 당사 최대주주의 경영권에도 부정적 영향을 미칠 수 있습니다. 투자자 여러분들께서는 이 점 투자에 유의하시기 바랍니다.
한편 당사는 2022년 10월 06일에 제1회 무기명식 무보증 사모 전환사채(CB)를 발행하였으며, 증권신고서 제출일 전일 현재, 미상환 전환사채의 잔액은 16,500백만원, 전환가액은 4,058원입니다.
| [미상환 전환사채 발행 현황] | |
| (기준일: 증권신고서 제출일 전일) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| (출처: 당사 제시) |
| [전환사채 행사가격 조정 사항] |
|---|
|
(1) "본 사채"를 소유한 자가 전환청구를 하기 전에 발행회사가 시가를 하회하는 발행가액으로 유상증자, 무상증자, 주식배당 및 준비금의 자본전입 등을 함으로써 주식을 발행하거나 또는 시가를 하회하는 전환가액 또는 행사가액으로 전환사채 또는 신주인수권부사채를 발행하는 경우에는 아래와 같이 행사가액을 조정한다. 본 목에 따른 전환가액의 조정일은 유상증자, 무상증자, 주식배당, 준비금의 자본전입 등으로 인한 신주발행일 또는 전환사채 및 신주인수권부사채의 발행일로 한다. 단, 본 사채의 발행일 이전에 부여된 주식매수선택권의 행사로 주식이 발행되는 경우 및 기발행된 주권연계사채의 권리행사로 인한 신주발행은 예외로 한다. 조정 후 전환가격 = 조정 전 전환가격 × [{A+(B×C/D)} / (A+B)] A: 기발행주식수 B: 신발행주식수 C: 1주당 발행가격 D: 시가 |
| (출처 : 당사 제시) |
| [전환사채 본 유상증자 후 행사가격 및 전환가능주식수] |
| 구 분 | 금 액 |
|---|---|
| 조정 전 전환가격 | 4,058원 |
| 기발행주식수 | 17,900,252주 |
| 신발행주식수 | 12,300,000주 |
| 1주당 발행가격 | 1,953원 |
| 시가 | 3,050원 |
| 조정 후 전환가격 | 3,464원 |
| 조정 후 전환가능주식수 | 4,763,279주 |
| (출처: 당사 제시) |
제1회 전환사채(CB)의 전환가액은 금번 유상증자 이후 상기와 같이 하향 조정될 수 있으며, 하향 조정 이후 전환 가능 주식수는 4,763,279주가 될 예정입니다. 이는 유상증자 완료 이후 총 발행주식수 대비 약 16%에 해당하는 대규모 물량입니다. 제1회전환사채(CB)가 향후 보통주로 전환될 경우, 기존 주주들의 지분 희석이 발생하게 되며, 최대주주인 한동일 대표이사의 지분율 또한 희석될 수 있습니다.
한편, 본 증권신고서 제출일 전일 현재 당사가 임직원에게 부여한 주식매수선택권 중미행사수량은 285,000주로, 해당 미행사 주식매수선택권은 증권신고서 제출일 전일 현재 발행주식총수의 1.59%, 예정 발행주식총수(기발행주식수+ 유상증자 신주)의 0.94%에 해당하는 수준입니다. 다만, 당사가 부여한 주식매수선택권의 행사가격은 금번 유상증자에 따라 변동됩니다.
주식매수선택권 중 미행사수량의 행사가능수량 및 행사가격은 하기와 같이 변경될 예정입니다. 유상증자에 따른 행사가격 조정은 미행사 주식매수선택권의 행사 가능성을 높일 수 있으며, 이에 따라 향후 주식매수선택권 행사에 따른 희석효과로 최대주주의 지분율이 소폭 하락할 수 있으니, 투자자께서는 투자 판단 시 이 점 유의하시기 바랍니다.
| [주식매수선택권 미행사 현황] | |
| (기준일: 증권신고서 제출일 전일) | (단위: 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
행사기간 | 미행사수량 | 행사가격 | ||
|---|---|---|---|---|---|---|---|---|---|
| 조정 전 | 조정 후 | 조정 전 | 조정 후 | ||||||
| 이철환 | 등기임원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
40,000 | 40,000 | 4,686 | 3,573 |
| 이대견 | 미등기임원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 40,000 | 40,000 | 6,375 | 4,575 |
| 이조운이외3인 | 직원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 30,000 | 30,000 | 6,375 | 4,575 |
| 강주형외3인 | 직원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
60,000 | 60,000 | 4,686 | 3,573 |
| 이광용 | 미등기임원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
80,000 | 80,000 | 3,566 | 2,910 |
| 김현외2인 | 직원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
35,000 | 35,000 | 3,566 | 2,910 |
| 합 계 | 285,000 | 285,000 | - | - | |||||
| (출처: 당사 제시) |
[최대주주 등 지분율 시뮬레이션]
당사의 최대주주는 한동일대표로 증권신고서 제출 전일 기준 2,810,000주(15.7%)의 지분을 보유하고 있으며, 최대주주 및 특수관계인 합산시 4,894,000주(지분율 27.3%)를 보유하고 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 12,300,000주이며, 당사 최대주주인 한동일대표는 1,930,866주를 배정 받을 예정이며, 한동일대표는 배정주식의 30% 수준에 대해 참여할 계획입니다. 당사 최대주주의 30% 수준 청약 참여에 따라 최대주주 30% 청약 가정할 경우 예상 청약 주식수는 579,260주이며, 필요 청약 자금은 약 11.3억원(예정발행가액 1,953원 기준)입니다.
한동일대표는 금번 유상증자 청약자금 마련을 위해 금번 유상증자 신주배정기준일(2024년 10월 30일) 이후부터 신주인수권증서 상장 거래 전의 기간 사이에 당시의 시장상황을 고려하여 보유 보통주식 일부를 블록딜(장외대량매매) 방식 등으로 매각할 예정입니다. 이에 따라, 한동일대표는 본 공시서류 제출일 전일 기준 2,810,000주 중 494,597주(발행주식총수 대비 2.6%)를 매각할 예정이며, 매매 일정을 신주인수권증서 상장거래 전으로 계획한 이유는 동 내용을 청약에 참여하는 투자자들이 해당거래를 충분히 인지한 후 신주인수권증서를 거래하도록 하기 위함입니다.
「자본시장법 시행령」 개정에 따라 2024년 7월 24일부터 상장회사의 내부자(임원, 주요주주)가 그 상장회사의 대규모 주식거래(발행주식총수의 1% 이상 또는 50억원 이상 거래) 시 30일 전에 거래목적, 거래금액, 거래기간 등을 공시하도록 의무화되었습니다. 이에 따라 최대주주의 보통주 일부 매각 30일 전에 금융감독원 전자공시시스템을 통해 사전 공시할 예정입니다. 내부자거래 사전 공시는 당사 주가에 부정적인 영향을 끼칠 수 있으니 투자자분들께서는 유의하시기 바랍니다.
본 증권신고서 제출일 현재 주당 구주매각 가액은 확정할 수 없는 사항이며, 이에 따라 필요 청약자금 대비 구주매각 대금 규모를 확정할 수 없는 상황입니다. 이에 더해 유상증자 진행 과정에서 주가 상승으로 인해 예정발행가액 대비 확정발행가액이 변동될 경우 최대주주의 청약자금 부담 증가로 인하여 청약 주식수와 금액에 일부 변동이 발생할 수 있으며, 예기치 못한 상황으로 인한 청약 실패 가능성도 배제할 수 없으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다. 사전공시와 더불어 본 증권신고서 최초 제출 이후 구주매각이 완료된 시점에 구주매각 관련 내용을 반영해 작성한 정정증권신고서가 전자공시시스템(http://www.dart.fss.or.kr)에 공시될 예정이오니 투자자께서는 본 증권신고서 회사위험 사항에 기재된 내용상 변동사항을 확인하시기 바랍니다.
| [유상증자 지분율 변동 시뮬레이션] | |
| (기준일: 증권신고서 제출일 전일) | (단위: 주) |
| 주주명 | 관계 | 현재 | 배정주식수 | 참여주식수 | 매각예정주식수 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|---|
| 보통주 | 지분율 | 보통주 | 지분율 | |||||
| 한동일 | 최대주주 본인 | 2,810,000 | 15.7% | 1,930,866 | 579,259 | 464,597 | 2,924,662 | 9.7% |
| 류성호 | 등기임원 | 1,020,000 | 5.7% | 700,884 | 210,265 | 168,644 | 1,061,621 | 3.5% |
| 이철환 | 등기임원 | 14,000 | 0.1% | 9,620 | 9,620 | - | 23,620 | 0.1% |
| 장승기 | 미등기임원 | 1,020,000 | 5.7% | 700,884 | 210,265 | 168,644 | 1,061,621 | 3.5% |
| 이대견 | 미등기임원 | 22,200 | 0.1% | 15,117 | 15,117 | - | 37,117 | 0.1% |
| 이광용 | 미등기임원 | 8,000 | 0.0% | 5,497 | 5,497 | - | 13,497 | 0.0% |
| 최대주주 등 소계 | 4,894,200 | 27.3% | 3,362,836 | 1,030,869 | 801,885 | 5,122,138 | 17.0% | |
| 발행주식총수 | 17,900,252 | 100.0% | 12,300,000 | 12,300,000 | 30,200,252 | 100.0% | ||
| 주1) 최대주주의 구주매각은 신주배정기준일 이후에 이뤄질 예정입니다. 주2) 최대주주 및 특수관계인은 배정주식수의 30%로 참여주식수를 산정하였고, 매각예정주식수는 신주인수권매각 및 구주 매도에 따른 제비용 등을 고려하지 않았기 때문에 변경 가능성이 있습니다. (출처: 당사 제시) |
유상증자 이후 희석이 가능한 제1회 전환사채 및 주식선택권 등을 고려할 경우 한동일 대표이사의 지분율은 8.3%까지 하락하게 되고 최대주주 등 지분율 또한 15.0%로 감소하게 됩니다.
| [유상증자 지분율 변동 시뮬레이션(희석주식 고려)] | |
| (기준일: 증권신고서 제출일 전일) | (단위: 주) |
| 주주명 | 관계 | 유상증자 후 | 전환사채 | 주식선택권 | 유상증자 후 | ||
|---|---|---|---|---|---|---|---|
| 보통주 | 지분율 | 보통주 | 지분율 | ||||
| 한동일 | 최대주주 본인 | 2,924,642 | 9.7& | - | - | 2,924,642 | 8.3% |
| 류성호 | 등기임원 | 1,061,621 | 3.5% | - | - | 1,061,621 | 3.0% |
| 이철환 | 등기임원 | 23,620 | 0.1% | - | 40,000 | 63,620 | 0.2% |
| 장승기 | 미등기임원 | 1,061,621 | 3.5% | - | - | 1,061,621 | 3.0% |
| 이대견 | 미등기임원 | 37,117 | 0.1% | - | 40,000 | 77,117 | 0.2% |
| 이광용 | 미등기임원 | 13,497 | 0.0% | - | 80,000 | 93,497 | 0.3% |
| 최대주주 등 소계 | 5,122,118 | 17.0% | - | 160,000 | 5,282,118 | 15.0% | |
| 발행주식총수 | 30,200,252 | 100.0% | 4,763,279 | 285,000 | 35,248,531 | 100.0% | |
| 주1) 전환사채의 경우 액면전액이 전환될 경우를 가정하였습니다. 전환가액은 유상증자로 인한 변동가액을 적용하였습니다. 주2) 주식선택권 중 일부는 전환기간이 미도래하였음에도 불구하고 전부 전환을 가정하였습니다. (출처: 당사 제시) |
당사는 경영권 위협에 대비하고자 우호적인 기관들을 중심으로 우호지분을 확보하고자 노력하고 있으나, 증권신고서 제출일 현재 공동목적보유확약이 체결된 바는 없습니다.
요약하자면, 당사는 최대주주인 한동일 대표이사의 1) 구주 매각, 2) 30% 수준의 청약률, 3) 유상증자, 4) 전환사채의 전환 청구, 5) 주식매수선택권 미행사 수량의 추후 행사 가능성 등의 이유로 인해, 본 증권신고서 제출일 전일 현재 최대주주의 지분율 대비 지분율이 하락할 수 있습니다. 최대주주의 지분율 하락으로 향후 당사의 경영권에 위협이 발생할 수 있으며, 본 증권신고서에 기재된 최대주주의 예정 청약률 대비 청약 참여율이 예상보다 낮아지게 될 경우, 지분율 하락의 수준이 확대될 수 있으니 투자자께서는 투자 판단 시, 이 점 유의하시기 바랍니다.
|
사. 정부 연구개발 과제 수행 관련 위험 당사는 설립 이래 총 7건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하였으며, 현재 진행중인 정부 과제에 대해서도 연구 목적 및 내용 달성을 위해 성실히 수행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔으며, 기술실시 권리를 가진 기술소유권자로서 해당 기술의 사업화를 위해 노력해왔습니다. 따라서 당사는 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
|
당사는 설립 이래 총 7건의 정부과제를 주관기관 또는 참여기관으로서 성공적으로 수행였고 현재 진행중인 정부 과제에 대해서도 연구 목적 및 내용 달성을 위해 성실히 수행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔습니다. 또한, 지속적이고 책임감있는 연구개발을 위해 협약된 사업의 종료 후 정부납부기술료를 납부하거나 청년고용을 통한 기술료 감면 혜택을 받아 기술실시 권리를 온전히 확보하고 있으며, 기술소유권자로서 해당 기술의 사업화를 위해 적극적으로 노력해왔습니다. 현재 진행중인 정부과제 또한, 협약 종료 후 제품화 및 기술이전 등 관련 매출의 발생 시 일정금액의 정부납부기술료를 제외한 금액이 당사의 이익으로 연결되는 만큼 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
| [설립 이후 당사가 수행한 정부 연구개발과제 현황] |
| (단위: 백만원) |
| 순번 | 주관부처 | 계약상대방 | 계약일 | 계약명칭 | 관련 파이프라인 |
계약기간 | 성과 | 비고 |
|---|---|---|---|---|---|---|---|---|
| 1 | 중소기업청 | 대구·경북지방 중소기업청 |
2013.06 | 압타머를 이용한 표적 암세포 및 혈관내피세포 분리기술개발 및 kit 제품 개발 | - | 2013.06 ~ 2014.05 | 참여기관 | 종료 |
| 2 | 보건복지부 | 보건산업진흥원 | 2014.03 | 압타머 기반 신종인플루엔자 바이러스 실시간 진단 기술개발 연구 | - | 2014.03 ~ 2016.10 | 주관기관 | 종료 |
| 3 | 범부처신약개발사업단 | 범부처신약개발사업단 | 2016.12 | 선택적 인슐린 수용체 아고니스트 압타머 개발 | AST-101 | 2016.12 ~ 2018.06 | 주관기관 | 종료 |
| 4 | 범부처신약개발사업단 | 범부처신약개발사업단 | 2019.01 | 선택적 인슐린 수용체 아고니스트 개발 | AST-101 | 2019.01 ~ 2019.09 | 주관기관 | 종료 |
| 5 | 보건복지부 | 보건산업진흥원 | 2020.04 | 압타머 A48ms를 이용한 인슐린 수용체 표적 당뇨 치료제 비임상 개발 | AST-101 | 2020.04 ~ 2022.12 | 주관기관 | 종료 |
| 6 | 보건복지부 | 보건산업진흥원 | 2021.05 | Covid-19 중화압타머 치료제 개발 | - | 2021.05 ~ 2022.05 | 주관기관 | 종료 |
| 7 | 국가신약개발재단 | 국가신약개발재단 | 2022.08 | CD25 표적 압타머-약물 접합체를 이용한 조절 T 세포 선택적 억제/사멸 기전의 면역항암제용 선도물질 도출 | AST-202 | 2022.08 ~ 2024.07 | 주관기관 | 진행중 |
| (출처 : 당사 제시) |
당사는 정부 차원에서 신약 연구개발의 중요성을 감안하여, 다양한 정부과제를 통해 연구개발비 지원을 지속적으로 확대하고 있으므로, 당사는 이에 적극적으로 참여함으로써 향후 신규 사업의 추진에 있어서 객관적인 평가와 공신력을 획득하고 정부의 연구개발 진도 관리에 따라 과제의 성공 가능성을 높일 계획입니다.
한편, 정부보조금의 반환 조건은 연구개발 과제의 수행계획에 따라 집행한 예산의 잔액과 연구과제 회계감사에 따른 불인정 금액 및 최종 평가시 실패 과제, 국가연구개발혁신법 제32조(부정행위 등에 대한 제재 처분)에 해당하는 경우 반환을 하게 되며, 연구과제 회계감사와 과제 종료 후 3개월 이내 사용실적 보고서 제출 후 반환 여부가 결정됩니다. 다만, 현재까지 당사는 연구개발 과제에 대해 성실하게 수행해 왔으며, 상기 사유로 인해 정부보조금을 반환한 적은 없습니다.
당사가 참여한 상기 도표상 1번 내지 6번까지의 연구개발과제는 모두 종료되었으며, 현재 CD25 표적 압타머-약물 접합체를 이용한 조절 T 세포 선택적 억제/사멸 기전의 면역항암제용 선도물질 도출 과제는 진행 중입니다. 당사는 연구개발 과제를 충실히 수행하고자 배정된 예산을 연구 과제의 목적에 부합하게 집행하였으며 잔여 예산은 없습니다. 당사는 이와 관련하여, 추후 정부보조금 반환 사유에 해당될 가능성은 제한적일 것으로 예상하고 있습니다.
하지만 향후 당사의 신약개발 파이프라인에 대한 국책과제 추가 선정의 불확실성, 현재 진행중인 과제의 실패에 따른 과제 참여의 제한, 정부의 정책 변화에 따른 국고보조금의 감소 등은 지속적으로 자금이 투입되어야 하는 당사의 연구개발활동에 부정적인 영향을 미칠 수 있습니다. 특히, 현행 제도 상 정부 출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제 받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제제 조치가 가해질 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 아. 내부회계관리제도 및 내부통제 관련 위험 당사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 검토한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 코스닥 상장법인으로「주식회사 등의 외부감사에 관한 법률」(이하 '외감법')에 따라 신뢰할 수 있는 회계정보의 작성과 공시를 위해 내부회계관리규정 및 내부회계관리제도를 갖추고 있어야 합니다. 또한, 외부감사인은 당사의 내부회계관리제도 운영실태를 검토를 진행하여야 하며, 해당 결과는 감사보고서에 표명하도록 되어 있습니다. 최근 사업연도 기준 당사 외부감사인의 내부회계관리제도 검토 의견은 아래와 같습니다.
| [내부회계관리제도 검토의견] |
| 사업연도 | 감사인 | 감사의견 및 검토 의견 | 지적사항 |
|---|---|---|---|
| 제13기 (2023년) |
삼덕회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 '내부회계관리제도 평가 및 보고 모범규준' 제4장 '중소기업에 대한 적용'에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제12기 (2022년) |
삼덕회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 '내부회계관리제도 평가 및 보고 모범규준' 제4장 '중소기업에 대한 적용'에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제11기 (2021년) |
삼덕회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 '내부회계관리제도 평가 및 보고 모범규준' 제4장 '중소기업에 대한 적용'에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| (출처 : 감사보고서) |
당사는 내부회계관리제도 규정을 제정하여 2019년 08월 01일 이사회 보고를 완료하였습니다. 당사는 재무활동 건전성 및 타당성을 검토하고 내부회계관리제도 운영실태를 평가하며, 현 내부회계관리제도를 철저히 운영하여 외부감사인의 내부회계관리제도에 대한 의견을 받고 있습니다.
다만, 내부회계관리를 철저히 운영함에도 불구하고 회계처리 위반, 혹은 관련 임직원의 배임 및 횡령 등 발생으로 내부회계관리가 적절하게 운영되지 않을 경우 과태료 등의 법적 제재가 부과될 수 있습니다. 과태료 부과 시 법정최고금액에 과태료 예정금액 산정표에 따른 비율을 적용하여 예정금액을 산정하고, 가증, 감경하여 최종 과태료부과금액을 결정하고 있습니다.
특히, 이사 등 내부회계관리제도 운영 관련자가 회계정보를 내부회계관리제도에 의하지 아니하고 위조, 변조, 훼손 또는 파기한 사실이 확인되는 경우, 5년 이하의 징역 또는 5천만원 이하의 벌금이 부과될 수 있습니다.
또한, 코스닥시장 상장규정에 따라 내부회계관리제도 비적정 시 투자주의환기종목에 지정될 수 있으며(「코스닥시장 상장규정」제52조), 2년 연속 내부회계관리제도 비적정 의견을 받는 경우 상장적격성 실질심사에 따른 상장폐지 요건에 해당할 수 있습니다(「코스닥시장 상장규정」제56조).
종합적으로 당사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 검토한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 자. 특수관계자 거래 관련 위험 당사는 특수관계자와의 거래시 이사회 운영 규정 제10조에 따라 사전에 이사회 결의를 거쳐야 하며, 내부회계 관리 규정 등 당사 내부통제기준에 따라 거래 투명성을 확보하는 등 절차를 준수하고 있습니다. 향후에도 특수관계자와의 거래가 발생하게 될 경우 특수관계자에 대한 부당한 이익 제공 등에 해당하지 않는 범위에서 거래가 진행되도록 사전에 내부 규정에 따른 관련 절차를 준수할 예정입니다. 만일 특수관계자와의 거래 조건 등이 제3자와의 거래와 비교하여 적정성이 유지되지 않을 경우 이는 주주의 이익을 침해하는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
최근 3개년간 당사와 거래 또는 채권/채무 잔액이 있는 특수관계자 및 주요 거래 내용은 다음과 같습니다.
| 구 분 | 내용 |
| 기타특수관계자 | 임직원, 포항공과대학교 산학협력단 |
| [특수관계자와의 주요 거래 내용] |
| (단위 : 천원) |
| 구 분 | 내용 | 2024년 1분기 | 2023년 1분기 | 2023년 | 2022년 | 2021년 | |
|---|---|---|---|---|---|---|---|
| 포항공과대학교 산학협력단 |
매출 등 | 합성매출 | 2,336 | 39,455 | 42,397 | 65,864 | 67,827 |
| 매입 등 | 지급수수료 | 442 | 1,322 | 1,624 | -2,626 | 5,336 | |
| 경상연구개발비 | 2,760 | 2,323 | 6,290 | 4,590 | 25,720 | ||
| (출처 : 정기보고서) |
| [특수관계자와의 채권채무잔액] |
| (단위 : 천원) |
| 구 분 | 내용 | 2024년 1분기 | 2023년 1분기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|---|---|
| 포항공과대학교 산학협력단 |
외상매출금 | - | 264 | - | - | - |
| 미지급금 | - | - | 264 | - | - | |
| 미지급비용 | 476 | 1,624 | 1,624 | 4,092 | 16,720 |
| (출처 : 정기보고서) |
포항공과대학교 산학협력단은 당사의 주주(보통주식 368,000주, 우선주식 920,000주)로 압타머합성서비스 매출이 지속적으로 발생하고 있고, 하기의 라이센스인 계약으로 인하여 지급수수료가 발생하고 있습니다.
| [포항공과대학교 산학협력단 라이센스인 계약] |
| (단위 : 백만원) |
| 품목 | 계약상대방 | 대상지역 | 계약체결일 | 계약종료일 | 총 계약금액 | 지급금액 | 수익배분 |
|---|---|---|---|---|---|---|---|
| 압타머 관련 기술자산 및 특허 | 포항공과 대학교 산학협력단 |
전세계 | 2010.05.17 | 영구존속(단,특허는 존속기간 만료일) |
600 | 600 | - |
| IVD - 한국 내 | 한국 내 | 2013.07.31 | 2021.07.30 (주1) |
- | - | 라이선스된 IVD제품의 순판매액의 12% |
|
| IVD - 아시아 12개국 |
중국, 일본, 싱가포르, 인도, 대만, 인도네시아, 태국, 베트남, 말레이시아, 라오스,캄보디아, 필리핀 |
2016.01.25 | 2021.01.24 (주1) |
- | - | 라이선스된 IVD제품의 순판매액의 7% |
|
| 시약 | 전세계 | 2011.06.07 | 2022.06.06 (주1) |
20 | 20 | 연 순판매액의 6% | |
| Aptamer Sandwich Assay 기술 |
미국 | 2014.06.11 |
2022.06.11 (주1) |
- | - | 기술적용제품 총 매출액의 6% |
| (출처 : 당사 제시) 주1) 계약종료일은 상호합의 하에 3년마다 자동연장되는 계약입니다. |
당사는 특수관계자와의 거래시 이사회 운영 규정 제10조에 따라 사전에 이사회 결의를 거쳐야 하며, 내부회계 관리 규정 등 당사 내부통제기준에 따라 거래 투명성을 확보하는 등 절차를 준수하고 있습니다. 향후에도 특수관계자와의 거래가 발생하게 될 경우 특수관계자에 대한 부당한 이익 제공 등에 해당하지 않는 범위에서 거래가 진행되도록 사전에 내부 규정에 따른 관련 절차를 준수할 예정입니다. 만일 특수관계자와의 거래 조건 등이 제3자와의 거래와 비교하여 적정성이 유지되지 않을 경우 이는 주주의 이익을 침해하는 결과를 초래할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 차. 관리종목 지정 및 상장폐지 위험 당사는 코스닥시장 상장요건 중 전문평가기관의 기술 등에 대한 평가를 받아 기술력과 성장성이 인정되는 기업인 기술성장기업(기술 특례상장)으로서 2020년 09월 16일 코스닥시장에 상장하였습니다. 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도인 2020년도를 포함한 연속하는 5개 사업연도(2024년까지), 법인세비용차감전계속사업손실세전이익 요건의 경우 신규상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도(2022년까지)에 대해서는 해당 요건을 적용받지 않습니다. 당사의 경우 증권신고서 제출일 현재까지 관리종목지정 기준 중 해당사항이 없습니다. 당사는 매출액 요건이 2024년까지 지정유예가 되어 있지만, 2024년말 손실 확대 및 자기자본 감소하여 법인세비용차감전계속사업손실 요건 및 자본잠식율 요건을 충족할 수 있으니 투자자분께서는 이점 유의하시기 바랍니다. |
당사는 코스닥시장 상장요건 중 전문평가기관의 기술 등에 대한 평가를 받아 기술력과 성장성이 인정되는 기업인 기술성장기업(기술 특례상장)으로서 2020년 09월 16일 코스닥시장에 상장하였습니다. 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도인 2020년도를 포함한 연속하는 5개 사업연도(2024년까지), 법인세비용차감전계속사업손실세전이익 요건의 경우 신규상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도(2022년까지)에 대해서는 해당 요건을 적용받지 않습니다.
당사는 기술성장 특례 상장법인으로 영업이익 요건은 없는 상황이나, 매출액 및 법인세비용차감전계손사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 향후 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있으며, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다. 코스닥시장 관리종목 지정 요건 및 상장폐지요건은 다음과 같습니다.
| [코스닥시장 관리종목 지정 사유 및 퇴출 요건 검토 결과] |
| 구분 | 관리종목 | 상장적격성 실질심사 | 형식적 상장폐지 | |
|---|---|---|---|---|
| 매출액(별도) | 요 건 | 최근 사업연도 30억원 미만(지주회사는 연결 기준) | 관리종목으로 지정된 다음 해에도 매출액 30억원 미달 사유 발생 | - |
| 기술성장기업(우량기업부 기업 제외) 및 이익미실현기업은 상장일 속한 사업연도 포함 5개 사업연도에 미적용 | ||||
| 검토결과 | 2021년 매출액 : 269백만원 (→ 관리종목지정유예) 2022년 매출액 : 358백만원 (→ 관리종목지정유예) 2023년 매출액 : 243백만원 (→ 관리종목지정유예) |
|||
| 해당여부 | 없음 | 없음 | ||
| 법인세비용차감전 계속사업손실 (비지배지분 제외) |
요 건 | 자기자본 50% 초과(&10억원 이상)의 법인세비용차감전계속사업손실이 최근 3년간 2회 이상(& 최근 사업연도 법인세비용차감전계속사업손실 발생) | 관리종목으로 지정된 다음 해에도 자기자본 50% 초과 & 10억원 이상의 법인세비용차감전계속사업손실 발생 | - |
| 기술성장기업(우량기업부 기업 제외) 상장일 속한 사업연도 포함 3개 사업연도 미적용, 이익미실현 기업 상장일 속한 사업연도 포함 5개 사업연도 미적용 | ||||
| 검토결과 | 2021년 법인세비용차감전계속사업손실 : 38억원(손실률 12.17% → 관리종목지정유예) 2022년 법인세비용차감전계속사업손실 : 71억원(손실률 24.34% → 관리종목지정유예) 2023년 법인세비용차감전계속사업손실: 136억원(손실률 87.87% → 1회 해당) |
- | ||
| 해당여부 | 없음 |
없음. | - | |
| 자본잠식(연결) |
요 건 | 최근 사업연도 말 자본잠식률 50% 이상 | 관리종목으로 지정된 다음 해에도 자본잠식률 50% 이상 발생 | 최근 사업연도 전액 자본잠식 |
| 검토결과 | 2023년말 자본금: 90억원 2023년말 자기자본(비지배지분 제외): 155억원 |
- | ||
| 해당여부 | 없음 | 없음 | - | |
| 자기자본 (연결, 비지배지분 제외) |
요 건 | 최근 사업연도 말 자기자본 10억원 미만 | 관리종목으로 지정된 다음 해에도 자기자본 10억원 미만 발생 | - |
| 검토결과 | 2023년말 자기자본(비지배지분 제외): 155억원 |
- | ||
| 해당여부 | 없음. | 없음. | - | |
| 감사의견 | 요 건 | - | - | 최근 사업연도 감사의견 비적정(부적정ㆍ의견거절ㆍ범위제한 한정) |
| 검토결과 | - | - | 2023년 감사의견 : 적정 | |
| 해당여부 | - | - | 없음. | |
| 시가총액 | 요 건 | 시가총액이 40억원 미만인 상태가 연속하여 30일 지속 | - | 관리종목 지정 후 90일 간 “연속 10일 & 누적 30일 이상 시가총액 40억원 이상”의 조건을 미충족 |
| 정기보고서 미제출 | 요 건 | 분기, 반기, 사업보고서를 법정제출기한 내 미제출 | - | 2년간 3회 이상 분기, 반기, 사업보고서를 법정제출기한 내 미제출 |
| 사업보고서 법정제출기한 후 10일 내 미제출 | ||||
| 분기, 반기, 사업보고서 미제출로 관리종목 지정된 상태에서 분기, 반기, 사업보고서를 미제출 | ||||
| 거래량 | 요 건 | 분기 월평균 거래량이 유동주식 수의 1%에 미달 | - | 2분기 연속 |
| 월간 거래량 1만주, 소액주주 300인 이상이 20% 이상 지분 보유 등은 적용 배제3333 | ||||
| 지분분산 | 요 건 | 최근 사업연도 말 기준 소액주주 200인 미만 또는 소액주주의 지분이 20% 미만 | - | 2년 연속 |
| 300인 이상의 소액주주가 유동주식수의 10%이상으로서 100만주 이상 소유하는 경우 제외 | ||||
| 불성실공시 | 요 건 | - | 1년 간 불성실공시 벌점 15점 이상 | - |
| 지배구조 | 요 건 | 사외이사/감사위원회 요건 미충족 | - | 2년 연속 |
| 회생절차/파산신청 | 요 건 | 회생절차 개시 신청 또는 파산신청 | 개시신청 기각, 결정 취소, 회생계획 불인가 등 | - |
| 재무관리 위반 | 요 건 | 변경·추가 상장이 유예된 기간 중에 증권의 발행 및 공시 등에 관한 규정에 따른 재무관리 기준을 위반한 경우 | - | - |
| 기타 상장폐지 사유 | 요 건 | 모든 상장폐지 사유(형식 상장폐지 및 상장적격성 실질심사 대상 결정)가 발생한 경우 관리종목 지정 | - | 최종 부도 또는 은행거래정지 |
| 해산사유(피흡수합병, 파산선고) | ||||
| 정관 등에 주식양도 제한을 두는 경우 | ||||
| 유가증권시장 상장의 경우 | ||||
| 우회상장시 우회상장 관련 규정 위반 시 (심사 종료 전 기업결합 완료 및 의무보유 위반 등) |
||||
| 주1: | 코스닥시장상장규정 제3조(회계처리기준 및 재무제표 적용기준)에 의거하여, 연결재무제표를 기준으로 하는 때에는 당기순손익과 자기자본은 비지배지분을 제외한 금액을 기준으로 함 |
(1) 매출액 미달 여부 검토
코스닥시장 상장규정 제53조 1항 1호에 따라 최근 사업연도의 매출액이 30억 미만일 경우 관리종목으로 지정받게 됩니다. 기술성장기업 특례요건에 의하여 상장일 속한 사업연도 포함 5개 사업연도에 미적용됨에 따라 당사는 2024년까지 동 조건에 의한 지정유예가 되어 있습니다. 당사는 2021년 2.7억원, 2022년 3.6억원, 2023년 2.4억원으로 지속적으로 30억 미만을 기록하였고, ㈜인터내셔널사이언티픽스탠다드의 매출과 합한다고 가정할 경우 2021년 60.5억원, 2022년 46.5억원, 2023년 37.7억원으로 30억원을 초과하게 됩니다. ㈜인터내셔널사이언티픽스탠다드의 매출액이 2024년 반기 8.7억원으로 크게 감소하여 2024년에 매출액이 30억 미만일 기록할 수 있으나 2024년까지 지정유예가 되어 있어 동 조건으로 인하여 관리종목으로 지정되지 않습니다. 2025년에 당사 및 ㈜인터내셔널사이언티픽스탠다드의 매출액 현재 수준이 유지되는 경우 관리종목이 될 가능성이 있습니다.
| [매출액 내역] |
| (단위 : 천원) |
| 구 분 |
2024년 반기 |
2024년 반기 연환산 |
2023년 |
2022년 |
2021년 |
|---|---|---|---|---|---|
| 당 사 | 71 | 142 | 243 | 358 | 269 |
| ㈜인터내셔널사이언티픽스탠다드 | 877 | 1,754 | 3,524 | 4,294 | 5,777 |
| 합 계 | 948 | 1,896 | 3,767 | 4,652 | 6,046 |
| (출처 : 정기보고서) |
(2) 법인세비용차감전순손실 발생 여부 검토
당사는 법인세비용차감전순손실/자기자본이 2021년 12.18%, 2022년 28.41%으로 자기자본의 50%를 넘는 법인세비용차감전순손실이 발생하지 않았으나 2023년은 87,87%로 자기자본의 50%를 넘는 법인세비용차감전순손실이 발생하였습니다. 2024년 반기 법인세비용차감전순손실은 5,589백만원으로 단순 연환산시 법인세비용차감전순손실/자기자본 비율은 113.87%로 50%를 초과하고 관리종목에 지정됩니다.
| [법인세비용차감전순손실 발생 여부 검토] |
| (단위 : 백만원) |
| 구분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 법인세비용차감전순손실 (연결, 비지배지분 제외) |
5,589 | 13,602 | 8,301 | 3,831 |
| 자기자본(연결) |
9,817 | 15,479 | 29,223 | 31,461 |
| 법인세비용차감전순손실/자기자본 | 113.87% | 87.87% | 28.41% | 12.18% |
| 주) 2024년 반기 법인세비용차감전순손실/자기자본의 경우 손실을 연환산하여 계산하였습니다. |
| [2024년 법인세비용차감전순손실 시뮬레이션] |
| (단위 : 백만원) |
| 구 분 | 금 액 | 비고 |
|---|---|---|
| 법인세비용차감전순손실 |
||
| 2024년 반기 법인세비용차감전순손실 |
5,589 | - |
| 2024년 법인세비용차감전순손실(연환산) |
11,178 | - 단순 연환산 |
| ㈜인터내셔널사이언티픽스탠다드 2024년 반기 법인세비용차감전순손실 | 545 | - 일회성 수익인 채무면제이익 등 영업외손익 제거 - 2024년 상반기 손익이 유지된다는 가정 |
| ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상 | 1,813 | - 고객관계가치 851백만원과 영업권 962백만원 전액 손상 가정 (주1) |
| 2024년 예상 법인세비용차감전순손실 | 13,536 | - |
| 자기자본 | ||
| 2024년 반기 자기자본 | 9,817 | - |
| 금번 유상증자 | 24,022 | - 예정발행가액 기준 |
| 자산재평가 | 2,788 | - |
| 당기순이익 | -7,947 | - 2024년 상반기는 기반영 |
| 2024년 예상 자기자본 | 28,680 | - |
| 법인세비용차감전순손실/자기자본 | ||
| 2024년 예상 법인세비용차감전순손실/자기자본 | 47.20% | - |
| 2024년 예상 법인세비용차감전순손실/자기자본 50% 수준인 법인세비용차감전순손실 | 14,340 | - |
| (주1) 무형자산 손상과 관련된 구체적인 사항은 1. 사업위험 - 나. 재무안정성 악화 위험을 참고하시기 바랍니다. (출처 : 당사 제시) |
당사 및 ㈜인터내셔널사이언티픽스탠다드가 상반기 수준의 수익성을 유지하고, ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상된다는 가정에서 금번 유상증자 및 자산재평가로 인하여 예상되는 법인세비용차감전순손실/자기자본은 47.20% 수준으로 관리종목 기준인 50%를 소폭 하회하는 수준입니다. 따라서 당사가 주장하는 매출확대 방안이 미실현되고 연구개발비용과 판매비와 관리비 등 각종 비용이 증가하여 법인세차감전계속사업손실이 확대될 경우 법인세비용차감전순손실/자기자본에 따른 관리종목에 지정 가능성
이 높아질 수 있으니 투자자께서는 이점 유의하시기 바랍니다.
(3) 자본잠식 여부 검토
코스닥시장 상장규정 제53조 1항 4호에 따라 최근 사업연도 말을 기준으로 자본잠식률 50% 이상인 경우 관리종목으로 지정됩니다. 당사는 2024년 반기말 기준으로 자본잠식 상태가 아니므로 자본잠식 요건에 의한 관리종목 지정요건에 해당하지 않습니다. 그러나 최근 3년간 비슷한 수준의 당기순손실이 발생할 경우 자본잠식으로 인한 관리종목 지정 가능성이 있습니다. 다만, 금번 유상증자 조달을 통해 자본을 확충하여, 자본잠식에 의한 관리종목 지정 리스크는 낮출 수 있을 것으로 판단됩니다.
| [자본잠식 여부 검토] | |
| (연결 기준) | (단위 : 백만원) |
| 구분 | 2024년 반기 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|---|
| 자본금 | 8,950 | 8,950 | 4,475 | 4,463 |
| 자기자본 | 9,817 | 15,479 | 29,223 | 31,461 |
| 자본잠식여부 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 |
| 출처: | 당사 제공 |
| [2024년 자본잠식 시뮬레이션] |
| (단위 : 백만원) |
| 구 분 | 금 액 | 비고 |
|---|---|---|
| 당기순이익 |
||
| 2024년 반기 당기순이익 |
-5,589 | - |
| 2024년 반기 당기순이익(연환산) |
-11,178 | - 단순 연환산 |
| ㈜인터내셔널사이언티픽스탠다드 2024년 반기 당기순이익 | -545 | - 일회성 수익인 채무면제이익 등 영업외손익 제거 - 2024년 상반기 손익이 유지된다는 가정 |
| ㈜인터내셔널사이언티픽스탠다드 무형자산 전액 손상 | -1,813 | - 고객관계가치 851백만원과 영업권 962백만원 전액 손상 가정 (주1) |
| 2024년 예상 당기순이익 | -13,536 | - |
| 자본금 | ||
| 2024년 반기 자본금 | 8,950 | - |
| 금번 유상증자 증가 자본금 | 6,150 | - 예정발행가액 기준 |
| 2024년말 예상 자본금 | 15,100 | - |
| 자기자본 | ||
| 2024년 반기 자기자본 | 9,817 | - |
| 금번 유상증자 | 24,022 | - 예정발행가액 기준 |
| 자산재평가 | 2,788 | - |
| 당기순이익 | -7,947 | - 2024년 상반기는 기반영 |
| 2024년 예상 자기자본 | 28,680 | - |
| 자본잠식 | ||
| 2024년 예상 자본잠식율 | - | - 해당사항 없음 |
| 2024년 예상 50% 자본잠식 수준 당기순이익 | -34,666 | - |
| (주1) 무형자산 손상과 관련된 구체적인 사항은 1. 사업위험 - 나. 재무안정성 악화 위험을 참고하시기 바랍니다.
(출처 : 당사 제시) |
(4) 시가총액 미달여부 검토
코스닥시장 상장규정 제53조 1항 5호에 따라 보통주 시가총액 40억원 미만이 30일간 지속되는 경우 관리종목으로 지정됩니다. 당사의 2023년 시가총액은 최고 90,674백만원, 최저 35,743백만원, 평균 570,612백만원으로 시가총액 40억원 미만을 기록한 바가 없어 관리종목 지정요건에 해당하지 않습니다. 금번 유상증자 전 주식수 기준 시가총액 미달에 해당하기 위해서는 주당 235원 이하로 하락해야 됩니다.
| [시가총액 미달여부 검토] |
| (단위: 백만원) |
| 구분 | 시가총액(최고) | 시가총액(최저) | 시가총액(평균) |
|---|---|---|---|
| 2023년 |
90,674 |
35,743 | 64,337 |
| (출처 : 한국거래소 정보데이터시스템) |
(5) 정기보고서 미제출 여부 검토
코스닥시장 상장규정 제53조 1항 6호에 따라 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 관리종목으로 지정됩니다.
당사는 최근 3년 법정 제출기한 내에 제출하여 왔으며, 향후에도 정기보고서를 법정 제출기한 내에 제출할 예정으로, 관리종목 지정요건에 해당하지 않습니다.
(6) 지배구조 미달 여부 검토
코스닥시장 상장규정 제53조 1항 7호에 따라 최근 사업연도 사업보고서상 A)사외이사의 수가 법에서 정하는 수에 미달 B) 법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 관리종목으로 지정됩니다.
당사는 본 공시서류 제출일 전일 현재 등기임원 6명 중 사내이사 2명, 기타비상무이사 1명, 사외이사 2명, 감사 1명으로 구성되어 있으며, 상법 제542조의 8에 따르면 자산총액 1,000억원 미만의 코스닥 상장 벤처기업은 사외이사 선임 의무가 면제됨에도 사외이사를 선임하고 있습니다. 이에 당사는 지배구조 미달 요건에 의한 관리종목 지정요건에 해당하지 않습니다.
(7) 거래량 미달 여부 검토
코스닥시장 상장규정 제53조 1항 8호에 따라 분기월평균거래량이 유동주식수의 1%에 미달하는 경우 관리종목으로 지정됩니다. 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다.
| 가) 신규 신규상장법인의 경우. 다만, 신규상장일이 속하는 분기에 한정함. 나) 분기의 월평균거래량이 1만주 이상인 경우. 이 경우 보통주식 상장법인이 액면주식을 발행한 때에는 액면가액 5,000원을 기준으로 함. 다) 세칙으로 정하는 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. 이 경우 소액주주가 소유한 주식 수와 소액주주의 수는 최근 사업연도 말을 기준으로 하되, 최근 사업연도 말 이후 주주명부를 폐쇄한 경우에는 그 폐쇄시점 현재를 기준으로 거래소에 제출한 주주명부 및 「주식·사채 등의 전자등록에 관한 법률」에 따른 소유자명세를 기준으로 함. |
당사는 2023년말 기준 소액주주 지분율 64.2%, 소액주주 수 12,962명임에 따라 상기 다) 항목에 해당되어 거래량 미달에 따른 관리종목 지정 요건에 해당되지 않습니다.
(8) 주식분산 미달 여부 검토
코스닥시장 상장규정 제53조 1항 9호에 따라 최근 사업연도말 소액주주가 200인 미만이거나 소액주주지분이 20% 미만일 경우 관리종목으로 지정됩니다.
당사는 2023년말 기준 소액주주 지분율 64.2%, 소액주주 수 12,962명임에 따라 주식분산 미달에 따른 관리종목 지정 요건에 해당되지 않습니다.
(9) 기타사항
코스닥시장 상장규정 제53조 1항 10호에서 13호까지에 따라 회생절차개시신청, 파산신청, 상장폐지사유발생, 재무관리기준 위반 요건에 해당하는 경우 관리종목으로 지정됩니다. 당사는 본 공시서류 제출일 전일 현재 동 관리종목지정요건에 해당하지 않습니다.
관리종목으로 지정될 경우 중요 사유 발생시마다 한국거래소는 일정기간 매매거래정지 명령을 발동할 수 있습니다. 이 외에도 주식의 미수나 신용거래가 금지되며, 미수나 신용거래의 증거금이 되는 대용유가증권으로도 사용할 수 없습니다. 또한, 이러한 관리종목 지정사유 확인 당일 코스닥시장에서의 매매거래는 정지됩니다. 이를 기한 내에 해결하지 못한다면 코스닥시장 상장폐지 사유에 해당하여, 당사 주식은 향후 장내에서 거래가 이루어지지 못할 수 있습니다. 증권신고서 제출일 현재 당사는 관리종목 이슈는 없는 상황이나, 향후에도 당사 손익에 따른 관리종목 발생 가능성에 대해서는 지속적으로 모니터링 할 필요가 있습니다. 투자자께서는 이 점 유의하여 투자해 주시기 바랍니다.
또한, 최근 상장 기업에 대한 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 특히, "코스닥시장 상장규정 제28조(관리종목), 코스닥시장 상장규정 제38조(상장의 폐지) 및 코스닥시장 상장규정 제38조의2(실질심사위원회의 심사 등)"에 유의하시기 바랍니다.
자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융감독법규정보시스템(http://law.fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
3. 기타위험
| 가. 인수인의 실권주 인수분 물량 출회에 따른 주가하락 위험 실권주를 인수한 대표주관회사 또는 인수회사가 수익 확정을 위해 인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 각 사에서 인수한 실권주를 일정 기간 보유하더라도, 동 인수물량이 잠재 매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사 및 인수회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 19.0%를 추가수수료로 지급하게 되며, 이를 고려시 대표주관회사 및 인수회사의 실권주 매입단가는 청약자들보다 19.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 금번 유상증자를 주주배정후 실권주 일반공모 방식으로 진행하고 있으며, 구주주 청약 및 일반공모 청약 이후 발생한 최종 실권주는 대표주관회사 (주)BNK투자증권과 인수회사 SK증권(주), (주)상상인증권에서 각자의 인수비율에 따라 자기계산으로 인수하게 됩니다.
| [대표주관회사 및 인수회사의 인수조건] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
| 대표주관회사 | (주)BNK투자증권 | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 X 인수비율(33.4%) |
대표주관수수료 : 5천만원 인수수수료 : 모집총액의 1.5% 中 33.4% 실권수수료 : 잔액인수금액의 19.0% |
| 인수회사 | SK증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 X 인수비율(33.3%) |
인수수수료 : 모집총액의 1.5% 中 33.3% 실권수수료 : 잔액인수금액의 19.0% |
| 인수회사 | (주)상상인증권 | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 X 인수비율(33.3%) |
인수수수료 : 모집총액의 1.5% 中 33.3% 실권수수료 : 잔액인수금액의 19.0% |
만일 구주주 청약 및 일반공모 청약 이후 최종 실권주가 발생할 경우에는 대표주관회사인 (주)BNK투자증권와 인수회사 SK증권(주), (주)상상인증권에서 각자의 인수비율에 따라 자기계산으로 인수하게 되며, 당사는 각 증권사에게 인수의무비율에 따른 잔액인수금액의 19.0%를 실권수수료로 지급하게 됩니다.
따라서 실권주를 인수한 대표주관회사 또는 인수회사가 수익 확정을 위해 인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 각 사에서 인수한 실권주를 일정 기간 보유하더라도, 동 인수물량이 잠재 매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사 및 인수회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 19.0%를 추가수수료로 지급하게 되며, 이를 고려시 대표주관회사 및 인수회사의 실권주 매입단가는 청약자들보다 19.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 나. 유상증자 신주발행에 따른 물량 출회 및 주가 희석화 위험 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 확정발행가액보다 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 존재합니다. 또한 본 유상증자의 발행예정주식수 12,300,000주는 당사 발행주식총수 17,900,252주의 68.7%에 해당하는 규모로, 보호예수되지 않아 일시적 물량 출회로 인한 주가 하락 위험이 존재합니다. 이처럼 주가희석화 및 물량수급의 불균형에 따른 주가하락의 가능성이 존재하므로 투자자의 손실을 초래할 위험이 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 금번 유상증자를 주주배정후 실권주 일반공모 방식으로 진행하고 있습니다. 금번 유상증자에 따른 모집가액은 '증권의 발행 및 공시 등에 관한 규정' 제5-18조에 의거 주주배정 증자 시 가격 산정절차 폐지 및 가격 산정의 자율화에 따라 발행가액을 자유롭게 산정할 수 있으나, '(舊) 유가증권의 발행 및 공시 등에 관한 규정' 제57조를 적용하여 산정합니다.
그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 확정발행가액보다 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 존재합니다. 또한 본 유상증자의 발행예정주식수 12,300,000주는 당사 발행주식총수 17,900,252주의 68.7%에 해당하는 규모로, 보호예수되지 않아 일시적 물량 출회로 인한 주가 하락 위험이 존재합니다. 이처럼 주가희석화 및 물량수급의 불균형에 따른 주가하락의 가능성이 존재하므로 투자자의 손실을 초래할 위험이 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 다. 환금성 제약 및 원금 손실 가능성에 대한 위험 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다. 또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장 전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 코스닥시장 상장법인으로서 이번 유상증자로 발행되는 신주는 코스닥시장에상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다.
그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다. 또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장 전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 라. 주가하락에 따른 발행금액 감소 위험 확정발행가액이 당초 계획 대비 하락할 경우에는 당사가 계획했던 공모자금 조달 규모가 감소하게 되어, 자금운용계획의 변동이 불가피하며, 당사 영업활동에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
금번 유상증자의 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 결정됩니다. 다만 '자본시장과 금융투자업에 관한 법률' 제165조의6 및 '증권의 발행 및 공시 등에 관한 규정' 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 25% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 25% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. (단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
따라서 확정발행가액이 당초 계획 대비 하락할 경우에는 당사가 계획했던 공모자금 조달 규모가 감소하게 되어, 자금운용계획의 변동이 불가피하며, 당사 영업활동에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
마. 전환사채 및 주식매수선택권 행사에 따른 주가 하락 위험 전환사채 및 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
당사는 2022년 10월 06일 제1회 무기명식 무보증 사모 전환사채를 발행하였으며, 증권신고서 제출일 현재 미상환사채의 잔액은 16,500백만원, 전환가액은 4,058원입니다. 증권신고서 제출일 현재 당사의 주가는 전환가액보다 낮은 상황이나, 향후 주가가 상승하여 전환가액보다 높아질 경우 전환에 따른 신주 4,066,042가 추가 발행됨에 따라 주가 희석의 위험이 있습니다.
| [미상환 전환사채 발행 현황] | |||
| (기준일 : | 증권신고서 제출일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| (출처 : 당사 제시) |
또한, 당사는 증권신고서 제출일 기준 추가 주식 발행에 따른 기존 주주의 지분 희석을 야기할 수 있는 미행사 주식매수선택권이 존재합니다. 당사의 미행사 주식매수선택권의 수량은 총 285,000주이며, 이 중 현재 행사 가능한 수량은 70,000주(행사가격 6,375원)입니다. 나머지 100,000주(행사가격 4,686원)는 2025년 02월 28일부터 행사 가능하며, 115,000주(행사가격 3,566원)는 2026년 02월 14일부터 행사 가능합니다. 당사 2024년 반기말 종가는 2,765원으로 주식매수선택권의 행사가격이 외가격(Out of the Money, OTM) 상태이므로, 향후 주식매수선택권이 행사될 가능성이 낮을 것으로 판단되나, 전량 행사 될 경우 기존 주주의 지분 희석을 야기할 수 있으며, 금번 유상증자의 신주배정기준일 전에 주식매수선택권의 일부가 행사될 경우 구주주 배정비율이 변동될 수 있습니다. 당사의 미행사 주식매수선택권 부여 현황은 다음과 같습니다.
| [주식매수선택권 현황] | |||
| (기준일 : | 증권신고서 제출일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
행사기간 | 미행사수량 | 행사가격 |
|---|---|---|---|---|---|---|---|
| 이철환 | 등기임원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
40,000 | 4,686 |
| 이대견 | 미등기임원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 40,000 | 6,375 |
| 이조운이외3인 | 직원 | 2022.03.10 | 신주교부 | 보통주 | 2024.03.10 ~ 2029.03.09 | 30,000 | 6,375 |
| 강주형외3인 | 직원 | 2023.02.28 | 신주교부 | 보통주 | 2025.02.28 ~ 2030.02.27
|
60,000 | 4,686 |
| 이광용 | 미등기임원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
80,000 | 3,566 |
| 김현외2인 | 직원 | 2024.02.14 | 신주교부 | 보통주 | 2026.02.14 ~ 2031.02.13
|
35,000 | 3,566 |
| (출처 : 당사 제시) |
본 유상증자 완료 후 전환사채 및 주식매수선택권은 지분 희석 방지 조항에 따라 행사가액이 하향조정될 예정입니다.
따라서 향후 전환사채 및 주식매수선택권이 행사될 경우 이는 당사 주가의 상승 압박 영향을 미칠 수 있으며, 향후 시장에 출회될 경우 물량 출회에 따른 주가 하락 위험이 존재합니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 바. 금융감독기관의 관리감독기준 강화에 따른 위험 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 투자주의환기종목 지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 투자주의환기종목 지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있습니다. 투자자 여러분들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다.
특히, "코스닥시장 상장규정 제28조(관리종목), 코스닥시장 상장규정 제38조(상장의 폐지) 및 코스닥시장 상장규정 제38조의2(실질심사위원회의 심사 등"에 유의하시기 바랍니다. 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| 사. 유상증자 일정 관련 위험 및 철회 가능성 관련 위험 본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경되거나 관계기관과의 업무 진행과정에서 본 증권신고서상의 예상 일정에 차질을 가져올 수 있습니다. 또한 금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사의 잔액인수 방식으로 진행되며, 인수계약서에 의거하여, 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생할 경우에는 당사 혹은 대표주관회사 등의 판단에 따라 유상증자가 철회될 수 있습니다. 만일 유상증자 진행이 철회될 경우, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있고 이는 보상받지 못할 수 있습니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
「자본시장과 금융투자업에 관한 법률」 제120조 3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 본 공시서류를 참조하시기 바랍니다.
본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경되거나 관계기관과의 업무 진행과정에서 본 증권신고서상의 예상 일정에 차질을 가져올 수 있습니다.
또한 금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사의 잔액인수 방식으로 진행되며, 인수계약서에 의거하여, 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생할 경우에는 당사 혹은 대표주관회사 등의 판단에 따라 유상증자가 철회될 수 있습니다. 만일 유상증자 진행이 철회될 경우, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있고 이는 보상받지 못할 수 있습니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 아. 분석정보의 한계 및 투자판단 관련 위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있습니다. 본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단하시기 바랍니다. |
당사의 주식가치는 금번 유상증자 실시에 따른 전 과정에서 다양한 영향을 받아 하락할 수 있습니다.
본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 본 주식을 청약하고자 하는 투자자께서는 투자결정을 하기 전에 본 공시서류의 상기 투자위험요소 뿐만 아니라 다른 부분 또한 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없습니다. 따라서 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단할 필요가 있습니다.
당사는 상기에 기술된 투자위험요소 외에도 불안정한 경제상황 등에 의하여 직·간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 실제 결과는 현재시점에서의 평가와는 상당히 다를 수 있는 점을 유의하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생할 경우, 당사의 사업환경과 재무상태, 기타 운영결과에 부정적인 영향을 미칠 수 있습니다. 이에 따른 주가 하락으로 투자자께서는 금번 공모 과정에서 취득하게 되는 주식의 투자금액의 일부 또는 전부를 잃을 수 있습니다.
또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 최초에 예측했던 것과 다를 수 있는 점을 유의하시기 바랍니다.
| 자. 집단 소송 제기 위험 공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 차. 차입공매도 유상증자 참여 제한 관련 위험 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률과 시행령」이 개정되어 2021년 4월 6일부터 시행됨에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막 날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자 참여를 제한하되, 예외적인 경우에만 증자 참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 상기 사항을 위반 시 과징금 등의 제재 조치를 받을 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
주권상장법인이 유상증자 계획을 공시한 이후 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우 증자참여를 허용하고 있습니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 이와 관련 유상증자 참여가 제한되는 공매도 시점과 증자참여가 허용되는 예외사유를 시행령에서 정하도록 위임하고 있습니다.
시행령에 따르면, 유상증자 계획이 공시된 다음 날부터, 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지 공매도 한 경우 증자참여가 제한됩니다 (「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제1항)
다만, 다음의 경우 공매도를 통해 발행가격에 부당한 영향을 미쳤다고 보지 않아 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제2항「금융투자업규정」제6-34조)
ⅰ) 마지막 공매도 이후 발행가격 산정 기산일까지 공매도 주문 수량 이상을 증권시장 정규거래시간에 매수(체결일 기준)
ⅱ) 금융위원회가 정하는 기준을 충족한 독립된 거래단위를 운영하는 법인 내에서 공매도를 하지 않은 거래단위가 증자참여
ⅲ) 시장조성 또는 유동성공급을 위한 거래과정에서 공매도
상기 공매도제도 개선 관련 자본시장법 시행령 시행에 따라, 당사의 주식을 해당 기간 동안 공매도하는 투자자께서는 금번 유상증자 참여가 제한될 수 있음을 유의하시기 바랍니다. 해당 법령과 관련된 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| 카. 기타 투자자 유의사항 당사의 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우, 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 공시서류에 기재된 정보에만 의존하여 투자 판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 유의하시어 투자에 임하시기 바랍니다. |
(1) 금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분들께서는 이 점을 유의하여 주시기 바랍니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
(3) 본 공시서류의 공시심사 과정에서 기재사항은 청약일 이전에 변경될 수 있고, 일부 내용은 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 공시서류상의 일정에 차질을 가져올 수 있습니다. 또한 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다.
(4) 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
(5) 당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점을 유의하여 투자에 임하시기 바랍니다.
(6) 만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다.
(7) 본건 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
(8) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있으니 투자의사를 결정하시는 데 참조하시기 바랍니다.
이와 같이, 본 건 유상증자를 통해 취득한 당사의 주식 가치는 하락할 수 있으며, 본본 공시서류에서 제시된 투자위험요소 및 기타 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 다시 한번 유의하여 주시기 바랍니다.
| ※ 상기 제반사항을 고려하시어 투자자 제위의 현명한 판단을 바랍니다. 투자자는 본건 공모주식에의 투자 여부를 결정함에 있어서 필요한 경우 스스로 별도의 독립된 자문을 받아야 하며, 이에 따른 투자의 결과에 대하여는 투자자가 책임을 부담합니다. |
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」제119조, 제125조, 금융감독원의「금융투자회사의 기업실사 모범규준」에 따라 인수인이 본 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 (주)BNK투자증권입니다. 발행회사인 (주)압타머사이언스는 "동사" 또는 "발행회사"로 기재하였습니다. 또한 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 예측정보에 대한 실제 결과는 예상하지 못한 다양한 원인으로 인해 예측내역과 상당한 격차가 발생할 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 회 사 명 | 고 유 번 호 |
|---|---|---|
| 대표주관회사 | (주)BNK투자증권 | 00251400 |
2. 분석의 개요
대표주관회사인 (주)BNK투자증권은 「자본시장과 금융투자업에 관한 법률」제71조 및 동법 시행령 제68조에 의거하여, 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의 의무를 다하기 위해 「금융투자회사의 기업실사(Due Diligence) 모범규준」의 내용을 내부 규정에 반영하여 2012년 2월 1일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하고 있습니다.
다만, 「금융투자회사의 기업실사 모범규준」제3조제2항에 따라 발행회사의 재무 및 영업현황, 사업 환경, 투자위험, 인수 형태, 신용평가등급 등을 감안하여 실사 내용을 강화하거나 완화할 수 있으며, 동조 제5항에 따르면 금융투자회사의 이사회나 리스크관리위원회의 의사결정을 거쳐 '모범규준'의 내용(실사수준)을 생략하거나 강화 또는 완화 적용할 수 있도록 허용하고 있습니다. 따라서, 대표주관회사는 지분증권의 인수 또는 모집·매출의 주선업무를 수행함에 있어 발행회사가 일정한 요건을 충족할 경우 기업실사 수준을 완화하여 적용하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사인 (주)BNK투자증권이 기업실사과정을 통해 발행회사인 (주)압타머사이언스로부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 주주배정후 실권주 일반공모 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
본 지분증권은 대표주관회사인 (주)BNK투자증권의 내부 규정상 기업실사 기준을 적용하여 기업실사 업무를 수행하였습니다.
| 「금융투자회사의 기업실사 모범규준」 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 '리스크관리위원회 등')의 의사결정을 거쳐야 한다. |
|
일자 |
장소 |
기업 실사 내용 |
|---|---|---|
|
2024년 7월 11일 |
대표주관회사 및 |
가) 방식별, 조건별 유상증자 Simulation |
|
2024년 7월 12일 |
대표주관회사 및 |
가) 유상증자 위험요소 검토 |
|
2024년 7월 23일 |
대표주관회사 및 |
가) 유상증자 세부일정협의 |
|
2024년 8월 14일 |
발행회사 본사 |
가) 기업실사 점검항목 세부사항 확인 라) 증권신고서 작성 가이드 및 추가자료 작성 |
| 2024년 9월 10일 ~ 9월 19일 | 발행회사 본사 | 금융감독원의 정정신고서 제출 요구에 따른 가) 기업실사 점검항목 확인 나) 주요 투자위험요소 정리 다) 주요 경영진 면담 라) 증권신고서 작성 가이드 및 추가자료 작성 |
4. 기업실사 참여자
| [대표주관회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| (주)BNK투자증권 | 기업금융부 | 안재성 | 상무 | 기업실사 총괄 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 19년 |
| (주)BNK투자증권 | 기업금융부 | 하준욱 | 이사 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 16년 |
| (주)BNK투자증권 | 기업금융부 | 고승재 | 부장 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 16년 |
| (주)BNK투자증권 | 기업금융부 | 문상호 | 차장 | 기업실사 책임 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 10년 |
| (주)BNK투자증권 | 기업금융부 | 김태훈 | 대리 | 기업실사 및 서류작성 등 | 2024년 07월 11일 ~ 2024년 09월 19일 |
기업금융업무 등 2년 |
| 서율회계법인 | - | 류승영 | 공인회계사 | 합의된 절차에 따른 회계 및 재무실사업무 지원 | 2024년 07월 11일 ~ 2024년 09월 19일 |
공인회계사경력 16년 |
| 서율회계법인 | - | 박주영 | 공인회계사 | 합의된 절차에 따른 회계 및 재무실사업무 지원 | 2024년 07월 11일 ~ 2024년 09월 19일 |
공인회계사경력 16년 |
| [발행회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 |
|---|---|---|---|---|
| (주)압타머사이언스 | 경영지원실 | 이철환 | 상무 | 기업실사 총괄 |
| (주)압타머사이언스 | 전략지원팀 | 정지은 | 팀장 | 기업실사 총괄 및 질의사항 응답 |
| (주)압타머사이언스 | 전략지원팀 | 김혜리 | 과장 | 기업실사 자료 제공 및 질의사항 응답 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 (주)BNK투자증권은 (주)압타머사이언스가 2024년 08월 26일, 2024년 9월 10일, 2024년 9월 19일 이사회에서 결의한 기명식 보통주 12,300,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다
| 긍정적 요인 | ▶ 2023년 두번째 압타머 신약으로 FDA 승인을 획득한 노인성 황반변성 치료제인 아이베릭사의 Izervay의 출시, 글로벌 제약사 아스텔라스의 인수합병(59억 달러 규모) 등으로 인해, 압타머 기반 제품 개발에 대해 시장의관심이 증대되고 있어, 관련 시장의 규모 또한 확대될 가능성이 존재합니다. ▶ 동사는 지속적으로 고도화한 기술을 바탕으로 전임상 또는 임상 초기 단계에서 물질을 조기 기술이전(License-out)하여 수익성은 높이고 리스크는 줄이는 사업전략을 구사하고 있습니다. 동사는 간암치료제(AST-201) 및 혈액암치료제(AST-202) 등의 신약 파이프라인을 개발 중이나, 신고서 제출일 현재 동사가 체결한 기술 수출(License-out) 계약 사항은 없습니다. 향후 기술 수출(License-out) 계약이 이루어질 경우, 계약금 수취 및단계별 기술료 수취 등으로 동사 손익에 긍정적인 영향을 미칠 수도 있습니다. |
| 부정적 요인 | ▶ 동사의 전방산업인 압타머 산업은 원천 특허 공개 직후 아직 압타머 기반 진단 제품과 신약 제품의 본격적인 출시가 이루어지지 않은 초기 형성 단계의 시장으로서 항체 의약품 등 기타 의약품 시장에 비해 아직 시장 규모가 크지 않으며, 향후 추정치에 대한 실제 시장 형성에 대한 불확실성이존재합니다. 또한 향후 관련 기술 개발 및 상용화가 지연될 경우, 미래 시장의 규모가 예상보다 낮을 수 있습니다. 이러한 경우, 동사의 영업 실적에 부정적인 영향을 미칠 수 있습니다. ▶ 신약 개발 사업은 대표적인 고위험, 고부가가치(high risk, high return) 분야이며 임상 성공 가능성은 낮습니다. 동사 또는 파트너사가 임상에 실패할 경우, 기술이전 계약이 중도 해지될 리스크가 존재하며, 이에 따라 향후 동사의 재무 안정성이 부정적 영향을 받을 수 있습니다. 특히 기술이전 완료 이후에는 동사가 아닌 파트너사의 역량과 제반 상황에 따라 임상이 지연되거나 실패할 가능성이 존재합니다. ▶ 동사는 연구개발에 대한 지속적인 투자로 인해 영업손실 및 당기순손실 상태가 지속되고 있습니다. 동사는 후보물질 발굴, 임상 진행 등 향후에도 지속적인 연구개발에 따라 영업비용이 증가할 가능성이 높은 가운데신약 개발 관련 매출 발생은 없습니다. 향후 신약 개발 관련 매출이 발생하더라도, 바이오 사업의 특성상 전문 연구개발인력들의 높은 인건비 및 임상비용을 상회하지 못하는 매출액이 발생하거나, 경쟁제품들의 선제적인 시장 선점, 연구개발실패 등의 리스크, 관련 규제기관의 기준 강화에 따라 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. ▶ 동사는 2024년 하반기 당기순손실 규모 및 이에 따른 자기자본 감소 규모에 따라 자본잠식률 또는 법인세비용차감전계속사업손실률 등의 요건에 해당하여 관리종목으로 지정될 위험이 존재합니다. ▶ 동사가 계획하고 있는 금번 유상증자와 관련하여 발행예정인 주식수는12,300,000주로 이는 기존 발행주식수의 약 68.71%에 해당하는 대규모 물량입니다. 단기간 내 대규모 유통주식수의 증가는 동사 주가에 부정적 영향을 미칠 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 채무상환자금, 시설자금 및 운영자금으로 사용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 동사가 제출한 자료와 당사가 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 용역을 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다 하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2024년 09월 19일 |
| 대표주관회사 주식회사 BNK투자증권 |
| 대표이사 신 명 호 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
| (단위: 원) |
| 구 분 | 금 액 |
|---|---|
| 모집 또는 매출총액(1) | 24,021,900,000 |
| 발행제비용(2) | 478,022,440 |
| 순 수 입 금 [ (1)-(2) ] | 23,543,877,560 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로, 모집가액 확정 시 변경될 수 있습니다. 주2) 상기 모집 또는 매출총액은 우선적으로 아래 자금의 사용 목적에 따라 사용할 예정입니다. 주3) 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. 발행제비용은 보유자금으로 충당할 예정입니다. |
나. 발행제비용의 내역
| (단위: 원) |
| 구분 | 금액 | 지급일자 | 계산근거 |
|---|---|---|---|
| 발행분담금 | 4,323,940 | 신고서제출일 | 총모집금액 * 0.018% (10원 미만 절사) |
| 대표주관수수료 | 50,000,000 | 납입일 3영업일 이내 | 정액 |
| 인수수수료 | 360,328,500 | 납입일 3영업일 이내 | 총모집금액 * 1.5% |
| 상장수수료 | 3,850,000 | 신주상장일 | 250만원+100억원 초과금액의 10억원당 9만원 (「코스닥시장 상장규정」시행세칙 별표 14) |
| 등기비용 | 24,600,000 | 등기일 | 등록세(증자자본금의 0.4%)(지방세법 제28조) |
| 지방교육세 | 4,920,000 | 등기일 | 등록세의 20% (지방세법 제151조) |
| 기타비용 | 30,000,000 | - | 투자설명서 인쇄 및 발송 등 |
| 합계 | 478,022,440 | - | - |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액입니다. |
| 주2) 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가기준으로 산정되며, 유관기관 정책 등에 따라 변동될 수 있습니다. |
| 주3) 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사가 금번 유상증자를 통해 조달 예정인 공모자금은 아래와 같이 사용할 예정입니다. 다만, 하기 투자계획은 현 시점에서 예상되는 계획이며, 향후 집행 시점의 경영환경 등을 고려하여 변경될 가능성이 있으므로 절대적인 계획이 아님을 투자자께서는 인지하시기 바랍니다.
| (기준일 : | 2024년 09월 19일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| 3,450 | - | 12,172 | 8,400 | - | - | 24,022 |
| 주1) 상기 금액은 예정발행가액을 기준으로 산정한 금액으로 모집가액 확정 시 변경될 수 있습니다. 주2) 금번 발행과 관련된 발행제비용은 보유자금으로 충당할 예정입니다. 주3) 사채권자의 상환청구가 연기될 경우 채무상환자금을 축소하고 시설자금 및 운영자금을 증가시킬 수 있습니다. |
나. 자금의 세부 사용내역
| (단위: 백만원) |
| 구분 | 단계 | 사용(예정) 시기 | 합계 | 자금사용 우선순위 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2024년 | 2025년 | 2026년 | |||||||||||
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||||
| R&D비용 | AST-201 (ApDC 고형암 치료제) |
임상1상 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | 3,640 | 2순위 |
| AST-202 (ApDC 혈액암 치료제) |
전임상 준비 | - | - | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 4,520 | ||
| AST-203 (TROP2-ApDC) (ApDC 후속 파이프라인) |
후보물질 | - | - | - | - | 520 | 1,900 | 100 | 400 | - | 2,920 | ||
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 (연세대학교의료원) |
- | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 | ||
| R&D비용 소계 | 310 | 250 | 750 | 570 | 2,940 | 2,470 | 1,240 | 1,350 | 1,600 | 11,480 | |||
| 채무상환자금 | 제1회 전환사채 상환 | 8,400 | - | - | - | - | - | - | - | - | 8,400 | 1순위 | |
| 시설투자비용 | 분석CRO | GLP/GCLP 인증기관 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 3,450 | 3순위 |
| 운영비용 | 급여, 지급수수료 등 판관비 | 20 | 160 | 20 | 240 | - | 162 | 90 | - | - | 692 | ||
| 총 합계 | 8,980 | 810 | 1,170 | 1,210 | 3,340 | 3,032 | 1,730 | 1,750 | 2,000 | 24,022 | - | ||
| (출처: 당사 제시) |
당사는 금번 유상증자 자금 중 약 11,480백만원을 고형암 치료제(코드명: AST-201)의 임상시험, 면역항암제/혈액암 치료제(코드명: AST-202)과 압타머 기반 후보물질 개발 비용, ApRC플랫폼(방사성의약품 개발 플랫폼) 공동연구비용 등으로 활용할 예정이며, 분석 CRO의 시설투자비용 3,450백만원, 기타사업 운영비 및 판관비 등 운영자금 692백만원, 채무상환자금 8,400백만원을 집행할 계획입니다. 사채상환자금 84억원은 제1회 전환사채의 1차 조기상환청구권 행사시 지급기일인 2024년 10월 06일 상환자금으로 본 유상증자 납입일 전 IPO시 조달자금 중 미사용분에 대한 선지급분으로 전용될 예정입니다.
(1) 운영자금 - R&D 연구개발자금
1) AST-201
고형암 치료제 AST-201은 비임상 단계에서 작용기전 및 세포수준에서의 유효성 연구가 완료되었고, 종양 동물모델 평가를 통해 우수한 표적 약물전달 및 종양 억제 효과, 그리고 면역관문억제제와의 병용투어에 의한 시너지 효과를 확인하였습니다. 2024년 3월 12일 국내 식약처에 AST-201 1상 임상시험에 대한 IND 신청을 마쳤으며,2024년 3분기에 승인을 예상하고 있습니다. 임상시험을 위한 연구자 구성(CI: 분당차병원 전홍재 교수), 임상시험 CRO 계약(C&R 리서치)이 완료되었고, 2024년 4분기부터 환자 모집이 본격적으로 시작될 것으로 예상합니다.
또한 AST-201 적응증 확대를 위해 국외 임상을 준비하고 있으며, 2024년 하반기 내IND 승인 획득을 목표로 하고 있습니다. 이에 따라 금번 유상증자 자금 중 3,640백만원을 임상(국내) 1a상, 임상(국외) 1b상 진행을 위한 비용을 집행할 계획입니다. 2025년에는 임상(국내)1a상에 해당하는 40명 등록 및 분석비용으로, 2026년에는 임상(국외)1b상 30명 등록 및 분석비용 및 임상시험 결과보고 및 정산 비용으로 사용할 계획입니다.
[AST-201 임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-201 임상 | 임상비용 | 280 | 200 | 660 | - | 410 | 400 | 640 | - | 840 | 3,640 |
| 임상약 관리 | 10 | - | 10 | - | 20 | 20 | 20 | - | 10 | ||
| 분석비용 | 20 | - | 30 | - | 40 | - | 30 | - | - | ||
| 소계 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | ||
| (출처: 당사 제시) |
2) AST-202
면역항암제/혈액암 치료제 AST-202는 높은 표적 선택성과 특이성을 보유한 CD25 표적 압타머에 세포독성 약물을 접합함으로써 CD25-양성 종양세포들을 제거하고 종양조직 내 면역활성화를 유도하도록 디자인된 압타머 기반 표적약물전달 치료제입니다. 국가신약개발과제로 선정된 이후 표적과의 높은 특이성과 빠른 세포 내재화 속도가 규명되었고, 압타머-약물 비율 등 물질 자체의 최적화가 완료되었습니다. 혈액암의 동물모델에서 진행된 유효성 평가에서 주2회/2주 투약만으로 종양이 완전히 사라지는 용량군을 확인했으며, 투약 중단 이후 회복기간에도 종양 재성장이 관찰되지 않는 우수한효과가 확인되었습니다. 또한, 혈액암 동물모델의 생존률 평가에서도 AST-202 투여용량 전체군에서 80% 이상의 생존률을 확인했습니다. 2024년 하반기에 후보물질을 확정하고 전임상 단계 진입을 계획하고 있으며, 해당 데이터를 바탕으로 국내외 제약사 대상 기술이전 및 공동연구를 목표로 합니다. 이에 따라 금번 유상증자 자금 중 4,520백만원을 전임상 시험비용으로 집행할 계획입니다.
[AST-202 전임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-202 전임상 | CMC | - | - | - | 520 | 1,600 | 100 | 400 | - | 700 | 4,520 |
| GLP 독성 | - | - | - | - | 300 | - | - | 900 | - | ||
| 소계 | - | - | - | 520 | 1,900 | 100 | 400 | 900 | 700 | ||
| (출처: 당사 제시) |
3) AST-203 (TROP2-ApDC)
ApDC 후속 파이프라인으로 연구 중인 Trop2 타겟 ApDC(AST-203) 또한 췌장암 동물모델에서 동일 표적에 대한 기허가 ADC(Trodelvy) 대비 2배 우수한 항종양효과와 6.7배 빠른 표적침투력을 확인했습니다. 앞서 작용기전 연구, 종양모델에서의 생체분포 연구 등이 완료되었고, 약동력학적 특성 연구 및 추가적인 동물모델 평가(비소세포 폐암) 등이 신속하게 진행되고 있어 AST-202에 이어 빠르게 전임상단계로 진입할 예정입니다. Trop2는 췌장암을 비롯해 유방암, 폐암, 방광암 등 다수 고형암에서 과발현되는 표적 막단백질로, 다양한 암종으로 확대 가능성이 높습니다. 특허출원한 기술을 바탕으로 후보물질 단계에서 조기 기술이전 및 공동연구를 추진할 계획이며, 2,920백만원을 추가적인 연구 데이터 확보 목적으로 집행할 계획입니다.
[AST-203 전임상 개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| AST-203 전임상 | 연구용역 | - | - | - | - | 520 | 1,600 | 100 | 400 | - | 2,920 |
| 분석비용 | - | - | - | - | - | 300 | - | - | - | ||
| 소계 | - | - | - | - | 520 | 1,900 | 100 | 400 | - | ||
| (출처: 당사 제시) |
4) ApRC 공동연구
당사는 연세대학교의료원 핵의학과 강원준 교수 연구팀과 '방사성동위원소 표적전달기술'을 공동개발하고 있으며, 이를 바탕으로 치료용 방사성의약품 개발을 계획하고 있습니다. 지난 6월 압타머를 활용한 진단용 방사성동위원소 전달플랫폼에 대한 논문이 국제학술지에 등재된 바 있으며, 동일한 기전과 절차를 바탕으로 갈륨(68Ga)을 활용한 치료용 방사성의약품으로 확대해나갈 것입니다. 해당 프로젝트는 국내 기업과의 공동개발 및 국가연구과제를 통해 일부 자금을 확보할 것으로 예상하여, 타 프로젝트보다 소규모로 약 400백만원을 편성하였습니다.
[ApRC 공동개발비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | 합 계 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||
| ApRC 공동연구 | 연구용역 | - | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 |
| 소계 | - | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | ||
| (출처: 당사 제시) |
ApDC 파이프라인 개발 계획 및 비용 관련 상세 내역은 하기와 같습니다.
[ApDC 파이프라인의 향후 개발 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AST-201 (고형암 치료제) |
임상(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| 임상(국외) | ● | ● | ● | ● | ● | ● | ● | ● | ● | |
| AST-202 (혈액암 치료제) |
전임상(국내) | - | - | - | ● | ● | ● | ● | ● | ● |
| AST-203 (고형암 치료제) |
전임상(국내) | - | - | - | - | ● | ● | ● | ● | ● |
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| (출처: 당사 제시) |
(2) 운영/시설자금 - 체외진단/분석CRO
1) 압토디텍트 렁(AptoDetect™-Lung)
당사는 3등급 체외진단의료기기로 허가받은 압토디텍트 렁(AptoDetect™-Lung)을 폐암 조기진단 검사제품으로 국내 시장에 진출하였습니다. 다기관 임상시험에 참여 중인 10개 상급종합병원을 포함한 다수의 상급병원에서 비급여 처방을 진행하고 있으며, 폐결절이 발견되지 않은 일반 폐암검진 희망자 대상으로 하는 건강검진시장 진출을 앞두고 있습니다. 자체 영업력 외에도 권역별 병원 네트워크를 갖춘 대리점을 통해 대형병원 및 검진전문병원 대상 영업 마케팅을 수행하고 있습니다. 지난 2024년 1분기에는 해외수출을 위한 qPCR 방식의 압토디텍트 렁 PCR 7을 출시했으며, 인도 동남아시아 미국 등 각국 파트너와 협의하여 해외시장 진출을 준비하고 있습니다.
압토디텍트 렁은 의료기기 제조 및 품질관리 기준을 인증받은 GMP 시설 하에서 자체 생산하고 있으며, 국내 시장 공급용은 포항 GMP시설에서 생산, 인도 및 동남아시아 공급용은 인도 GMP시설에서 생산할 계획입니다.
압토디텍트 렁(AptoDetect™-Lung) 임상 및 PMS 비용으로 450백만원, 압토디텍트 렁(AptoDetect™-Lung) PCR 7의 임상 및 개발비용으로 230백만원, 인건비 및 기타 운영비로 450백만원, 생산 및 GMP 시설 유지비로 540백만원을 사용할 계획입니다. 사업개발 및 사업화 비용 관련 상세 내역은 하기와 같습니다.
[진단 사업 확장 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AptoDetect-Lung | 사업화(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| AptoDetect-Lung PCR 7 |
사업화(국외) | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| 품목허가(국내) | ● | ● | ● | ● | ● | ● | ● | ● | ● | |
| (출처: 당사 제시) |
[진단 사업 개발 사업화 비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| AptoDetect-Lung | 임상비용 | - | - | - | - | - | - | 90 | - | - |
| PMS | - | 140 | - | 220 | - | - | - | - | - | |
| 소계 | - | 140 | - | 220 | - | - | 90 | - | - | |
| AptoDetect-Lung PCR 7 |
임상비용 | - | - | - | - | - | 162 | - | - | |
| 개발비 | 20 | 20 | 20 | 20 | - | - | - | - | - | |
| 소계 | 20 | 20 | 20 | 20 | - | 162 | - | - | - | |
| 합계 | 20 | 160 | 20 | 240 | - | 162 | 90 | - | - | |
| (출처: 당사 제시) |
2) 분석CRO
당사는 지난 2024년 5월 GLP인증과 GCLP인증을 보유한 비임상 CRO를 자회사로 인수했으며, 8월 현재 소규모합병을 완료하였습니다. 해당 사업부는 식약처 GLP인증/GCLP 인증을 보유하고 있으며, 분석장비의 유지보수, 노후화장비 교체 등에 3,450백만원을 사용할 계획입니다.
[분석CRO 사업 확장 계획 및 일정]
| 분류 | 세부 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| 비임상CRO | 시설투자 | ● | ● | ● | ● | ● | ● | ● | ● | ● |
| (출처: 당사 제시) |
[분석CRO 사업 개발 사업화 비용]
| (단위: 백만원) |
| 프로젝트 | 항목 | 2024년 | 2025년 | 2026년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
| 비임상CRO | 시설투자 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 |
| 합계 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | |
| (출처: 당사 제시) |
(3) 채무상환
당사는 165억원의 미상환 전환사채를 보유하고 있습니다. 동 전환사채의 전환가액은 4,058원이고, 증권신고서 제출일 현재 외가격(OTM : Out of The Money) 상태입니다. 따라서 조기상환청구일(사채의발행일로부터 2년이 되는날)인 2024년 10월 06일 전환사채 165억원에 대해 조기 상환 청구가 발생할 가능성이 높습니다. 당사는 165억원 중 84억원을 사용하였고, 81억원은 단기금융상품으로 보유하고 있습니다. 전환사채 액면 전액에 대해 조기상환청구가 발생할 경우 단기금융상품 81억원 및 공모자금 중 84억원을 사용할 예정입니다.
사채상환자금 84억원은 제1회 전환사채의 1차 조기상환청구권 행사시 지급기일인 2024년 10월 06일 상환자금으로 본 유상증자 납입일 전 IPO시 조달자금 중 미사용분에 대한 선지급분으로 전용될 예정입니다.
| [채무상환대상] |
| (단위: 백만원) |
| 종목 | 차입처 | 차입금액 | 차입일 | 만기일 | 이자율 |
|---|---|---|---|---|---|
| 전환사채 | 사모 | 16,500 | 2022.10.06 | 2027.10.06 | 0.00% |
| 조기상환청구금액(예정) | 지급기일 | 비고 |
| 13,500 | 2024.10.06 | 1차 조기상환 |
| 3,000 | 2025.01.06 | 2차 조기상환 |
| (출처: 당사 제시) |
다. 유상증자 대금 납입 이후부터 집행 완료 시점까지 관리/집행 통제 방안
당사는 금번 유상증자 납입일부터 예상 집행시기(2024년~2026년)까지 다소 차이가 있고 자금 집행이 장기간에 걸쳐 발생하는 바, 보다 철저한 유상증자 대금 관리 및 집행 통제를 실행할 예정입니다.
CFO는 매일 재무팀 담당자가 전일 실적 및 당일 계획, 잔고증명서(주1회 첨부), 금융상품 운용 현황을 구분하여 작성한 자금일보의 내역이 적정하게 작성되었는지 검토 후 그룹웨어 전자결재를 통해 승인하며, 잔액 차이 발생 시 자금팀 담당자는 차이를 소명하고 CFO는 이를 검토 후 승인합니다. 또한 전결권자는 매월 자금팀 담당자가 월별 입출금 실적, 금융상품 운용 현황을 구분하여 작성한 자금월보의 내역이 적정한지 검토하고, 금융기관으로부터 수령한 잔고증명서와 월보상 잔액이 일치하는 경우 그룹웨어 전자결재를 통해 승인하며, 다만 잔액 차이 발생 시 재무팀 담당자는 차이를 소명하고 전결권자는 이를 검토 후 승인합니다. 법인인감 및 사용인감은 인감사용 및 관리규정에 의거하여, 관리되고 있으며 법인인감은 대표이사가 금고에 보관하고 있고, 각 팀들은 대표이사 보고 후 전략지원팀장을 통하여 날인이 가능합니다. 뿐만 아니라 당사는 별도의 내부통제 관련 부서를 운영하여 위임전결규정 등 내부 규정에 따라 자금관리 및 집행이 이루어지고 있는지 수시로 감사를 진행하고 있습니다. 해당 감사 결과에 대해서는 정기적으로 감사위원회에 보고를 하며 내부통제시스템이 엄격하게 관리될 수 있도록 노력하고 있습니다.
라. 자금 집행의 부족한 자금의 재원마련 등 운용 계획
| [자금사용 우선순위] | |
| (단위: 백만원) | |
| 구분 | 단계 | 사용(예정) 시기 | 합계 | 자금사용 우선순위 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2024년 | 2025년 | 2026년 | |||||||||||
| 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | |||||
| R&D비용 | AST-201 (ApDC 고형암 치료제) |
임상1상 | 310 | 200 | 700 | - | 470 | 420 | 690 | - | 850 | 3,640 | 2순위 |
| AST-202 (ApDC 혈액암 치료제) |
전임상 준비 | - | - | - | 520 | 1,900 | 100 | 400 | 900 | 700 | 4,520 | ||
| AST-203 (TROP2-ApDC) (ApDC 후속 파이프라인) |
후보물질 | - | - | - | - | 520 | 1,900 | 100 | 400 | - | 2,920 | ||
| ApRC 플랫폼 (방사성의약품 개발 플랫폼) |
공동연구 (연세대학교의료원) |
- | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 400 | ||
| R&D비용 소계 | 310 | 250 | 750 | 570 | 2,940 | 2,470 | 1,240 | 1,350 | 1,600 | 11,480 | |||
| 채무상환자금 | 제1회 전환사채 상환 | 8,400 | - | - | - | - | - | - | - | - | 8,400 | 1순위 | |
| 시설투자비용 | 분석CRO | GLP/GCLP 인증기관 | 250 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 400 | 3,450 | 3순위 |
| 운영비용 | 급여, 지급수수료 등 판관비 | 20 | 160 | 20 | 240 | - | 162 | 90 | - | - | 692 | ||
| 총 합계 | 8,980 | 810 | 1,170 | 1,210 | 3,340 | 3,032 | 1,730 | 1,750 | 2,000 | 24,022 | - | ||
| (출처: 당사 제시) |
금번 유상증자로 조달된 자금은 상기와 같이 집행할 계획이며, 실제 모집된 자금이 예상보다 부족할 경우에는, 채무상환자금을 우선으로 하며 운영자금은 자체 보유 현금, 차입 등 다양한 조달 방법으로 조달할 예정이나, 증권신고서 제출일 현재 구체적인 사항은 정해지지 않았습니다.
또한, 공모기간 중 당사의 경영실적의 저하 또는 주식시장의 급격한 변동 등에 따라 모집 예정금액의 일부만 청약이 이루어질 경우 청약이 미달하여 대표주관회사 및 인수회사가 잔여주식을 인수하게 된다면 당사는 대표주관회사 및 인수회사에 총 발행금액의 1.5%를 기본 인수수수료로써 지급하는 것과는 별도로 추가적으로 대표주관회사 및 인수회사가 인수하는 잔여주식 인수금액의 19.0%에 해당하는 금액을 실권수수료로 지급하게 됩니다.
이러한 경우에는 금번 유상증자를 통해서 조달하는 자금의 규모가 대표주관회사 및 인수회사에 지급한 실권수수료 만큼 축소될 수 있습니다. 만일, 금번 유상증자 기간 중 당사의 경영 실적의 저하 또는 주식시장의 급격한 변동 등에 따라 최초 모집 예정금액 대비하여 낮은 규모가 조달될 경우 당사가 계획한 자금 사용 목적이 당사의 계획대로 진행되지 않을 수 있으며, 이러한 경우 당사가 계획한 자금운용이 불가능할 수 있습니다. 또한, 당사는 공모자금 유입 후 실제 투자집행 시기까지의 자금보유 기간에는 국내 제1금융권 및 증권사 등 안정성이 높은 금융기관의 상품에 예치할 계획이며, 자금의 사용시기가 도래하여 단기간 내에 자금의 사용이 예상되는 경우에는 적격금융기관의 수시입출금 예금, 정기예금 등 안정성이 높은 금융상품 또는 AA등급대(A1등급대) 이상의 단기금융상품으로 운용할 예정입니다. 만약 금번 유상증자의 공모금액이 당초 계획한 금액에 미달할 경우 부족분은 당사의 자체자금 등을 이용하여 충당할 예정입니다.
만약 금번 유상증자의 공모금액이 당초 계획한 금액에 미달할 경우 부족분은 당사의 자체자금 등을 이용하여 충당할 예정이며, 이밖에도 K-바이오 펀드 등 투자기관을 대상으로 한 투자 유치 활동 및 오픈 이노베이션 차원의 전략적투자자를 대상으로 한 영구 CB 발행 등 다각적인 신규 투자 유치 활동을 병행할 예정이나 현재로서 구체화된 신규 투자 유치 활동은 없습니다. 궁극적으로 회사는 연구개발에 차질이 생기지 않는 것을 최우선 과제로 삼고 자금 관리에 만전을 기할 방침입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
본 건의 경우 시장조성 또는 안정조작에 관한 사항은 해당사항 없습니다.
제2부 발행인에 관한 사항
| [투자자 주의사항] |
|---|
| ■ 당사는 2021년부터 2023년까지 별도의 연결대상 종속회사를 보유한 바 없으나, 2024년 05월 27일 (주)인터내셔널사이언티픽스탠다드의 지분 100%를 취득함에 따라, 2024년반기에는 (주)인터내셔널사이언티픽스탠다드를 당사의 연결대상 종속회사로 인식하였습니다. ■ 이에, 본 증권신고서는 2021년부터 2023년까지는 개별 재무제표를 기준으로 작성하였으며, 2024년 반기는 연결 재무제표를 기준으로 작성하였습니다. ■ (주)인터내셔널사이언티픽스탠다드 간주취득일은 2024년 6월 30일입니다. 이에, 2024년 반기말 기준 당사 연결재무상태표상에는 (주)인터내셔널사이언티픽스탠다드의 자산및 부채가 연결대상 종속회사로서 포함되어 있으나, 연결손익계산서상에는 2024년 반기에 발생한 (주)인터내셔널사이언티픽스탠다드 별도 매출 및 손익은 간주취득일 이전 손익에 해당되므로 포함되어 있지 않습니다. ■ 한편, 당사는 2024년 6월 14일 (주)인터내셔널사이언티픽스탠다드를 피합병회사로 하여 흡수합병 계약을 체결하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다. 이에 합병 후 당사는 별도의 연결대상 종속회사가 존재하지 않으며, 2024년 3분기부터 합병 후 개별 재무제표를 기준으로 당사의 재무자료가 공시될 예정입니다. ■ 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
I. 회사의 개요
1. 회사의 개요
1. 연결대상 종속회사 개황
가. 연결대상 종속회사 현황(요약)
| (2024년 반기말 현재) | (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | 1 | - | - | 1 | - |
| 합계 | 1 | - | - | 1 | - |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조 |
| (증권신고서 제출일 현재) | (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | 1 | - | 1 | 0 | - |
| 합계 | 1 | - | 1 | 0 | - |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조 |
1-1. 연결대상회사의 변동내용
| (2024년 반기말 현재) |
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
(주)인터내셔널사이언티픽스탠다드 | 지분 취득으로 당반기 중 자회사로 신규연결 |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
| (증권신고서 제출일 현재) |
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
(주)인터내셔널사이언티픽스탠다드 | 2024년 08월 19일 소규모합병 완료로 연결 제외 |
| - | - |
나. 회사의 법적, 상업적 명칭
회사 정관상 회사의 명칭은 다음과 같습니다.
| 구분 | 회사의 명칭 |
| 한글 | 주식회사 압타머사이언스 |
| 영문 | Aptamer Sciences Inc (약호 Aptsci) |
다. 설립일자
회사의 설립일은 2011년 04월 01일입니다.
라. 본사의 주소, 전화번호 및 홈페이지
| 본사의 주소 | 경기도 성남시 분당구 판교로228번길 15 판교세븐벤처밸리 1단지 3동 301호 |
| 전화번호 | (031)786-0317 |
| 홈페이지 주소 | www.aptsci.com |
마. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
바. 회사의 주권상장(또는 등록ㆍ지정) 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)현황 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 유형 |
|---|---|---|
| 코스닥시장 상장 | 2020년 09월 16일 | 기술성장기업의 코스닥시장 상장 |
2. 회사의 연혁
가. 본점 소재지 및 그 변경
| 이전일 | 소재지 | 비 고 |
|---|---|---|
| 2019.03.29 | 경기도 성남시 분당구 돌마로 172, 407호 (정자동, 분당서울대학교병원 헬스케어혁신파크) |
이전 |
| 2021.08.18 | 경기도 성남시 분당구 판교로228번길 15, 3동 301호 (삼평동, 판교세븐벤처밸리1) |
이전 |
나. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2021.03.25 | 정기주총 | 사외이사 김민우 감사 이찬기 |
기타비상무이사 류성호 | 기타비상무이사 장승기 감사 오세현 |
| 2022.03.29 | 정기주총 | 사외이사 송진호 | - | - |
| 2023.03.30 | 정기주총 | 사내이사 이철환 | 사내이사 한동일 | - |
| 2024.03.28 | 정기주총 | - | 기타비상무이사 류성호 사외이사 김민우 감사 이찬기 |
- |
(주1) 최근 3년간의 주요 경영진의 중요한 변동 사항입니다.
다. 최대주주의 변동
당사는 최근 3개년 내에 최대주주가 변동된 사실이 없습니다.
라. 상호의 변동
당사의 설립 이후 보고서 작성기준일 현재까지 상호의 변동은 없습니다.
마. 회사가 화의, 회사정리절차 등
보고서 작성기준일 현재 해당사항이 없습니다.
바. 지분인수 및 합병 등
당사는 2024년 5월 24일 이사회 결의를 통해 (주)인터내셔널사이언티픽스탠다드 주식 1,010,000주(지분율 100%)를 취득하였고 2024년 6월 11일 이사회 결의로 소규모 합병을 결의하였으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.
- 합병 주요일정
① 합병계약일 : 2024년 6월 14일
② 합병반대의사통지기간 : 2024년 6월 28일 ~ 2024년 7월 12일
③ 채권자이의제출기간 : 2024년 7월 16일 ~ 2024년 8월 16일
④ 합병기일 : 2024년 8월 19일
사. 회사의 업종 또는 주된 사업의 변화
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
아. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
| (2024년 반기말 현재) |
| 연월 | 주요 내용 |
|---|---|
| 2021. 06 | 표적항암치료제 공동연구 계약 |
| 2021. 08 | 본점 이전(경기도 성남시 분당구 판교로228번길 15 판교세븐벤처밸리 1단지 3동 301호) |
| 2022. 03 | 파킨슨병 치료제 공동개발계약 |
| 2022. 04 | AST-201 CDMO 계약 |
| 2022. 06 | 압타머사이언스, 폐암진단키트 신의료기술평가 유예 대상 확정 |
| 2022. 10 | 제1회 무기명식 이권부 무보증 사모전환사채 발행 |
| 2022. 11 | 국가신약개발사업 과제 선정 (CD25-ApDC) |
| 2023. 02 | 주식발행초과금 자본전입 (무상증자) |
| 2023. 04 |
폐암진단키트(AptoDetect™-Lung)
다기관 전향적 임상시험 착수
|
| 2023. 05 |
ApDC 업무 협약 체결(하이셀텍 社)
|
| 2023. 06 |
폐암진단키트(AptoDetect™-Lung) 상급병원 비급여 검사 시작
|
| 2023. 08 |
폐암진단키트(AptoDetect™-Lung) 지씨셀 공급 계약
|
| 2024. 03 |
고형암 치료제 AST-201 국내 1상 임상시험 IND 신청 |
| 2024. 03 |
방사성의약품 표적전달기술 공동연구 협약 체결(연세대학교의료원) |
| 2024. 05 | (주)인터내셔널사이언티픽스탠다드 지분인수 |
| 2024. 06 | (주)인터내셔널사이언티픽스탠다드와 소규모 합병계약 체결 |
| (증권신고서 제출일 현재) |
| 연월 | 주요 내용 |
|---|---|
| 2021. 06 | 표적항암치료제 공동연구 계약 |
| 2021. 08 | 본점 이전(경기도 성남시 분당구 판교로228번길 15 판교세븐벤처밸리 1단지 3동 301호) |
| 2022. 03 | 파킨슨병 치료제 공동개발계약 |
| 2022. 04 | AST-201 CDMO 계약 |
| 2022. 06 | 압타머사이언스, 폐암진단키트 신의료기술평가 유예 대상 확정 |
| 2022. 10 | 제1회 무기명식 이권부 무보증 사모전환사채 발행 |
| 2022. 11 | 국가신약개발사업 과제 선정 (CD25-ApDC) |
| 2023. 02 | 주식발행초과금 자본전입 (무상증자) |
| 2023. 04 |
폐암진단키트(AptoDetect™-Lung)
다기관 전향적 임상시험 착수
|
| 2023. 05 |
ApDC 업무 협약 체결(하이셀텍 社)
|
| 2023. 06 |
폐암진단키트(AptoDetect™-Lung) 상급병원 비급여 검사 시작
|
| 2023. 08 |
폐암진단키트(AptoDetect™-Lung) 지씨셀 공급 계약
|
| 2024. 03 |
고형암 치료제 AST-201 국내 1상 임상시험 IND 신청 |
| 2024. 03 |
방사성의약품 표적전달기술 공동연구 협약 체결(연세대학교의료원) |
| 2024. 05 | (주)인터내셔널사이언티픽스탠다드 지분인수 |
| 2024. 06 | (주)인터내셔널사이언티픽스탠다드와 소규모 합병계약 체결 |
| 2024. 08 | (주)인터내셔널사이언티픽스탠다드 합병 |
3. 자본금 변동사항
가. 자본금 변동추이
| (단위 : 원, 주) |
| 종류 | 구분 | 14기 반기 (2024년 6월말) |
13기 (2023년말) |
12기 (2022년말) |
|---|---|---|---|---|
| 보통주 | 발행주식총수 | 16,980,252 | 16,980,252 | 8,490,126 |
| 액면금액 | 500원 | 500원 | 500원 | |
| 자본금 | 8,490,126,000 | 8,490,126,000 | 4,245,063,000 | |
| 우선주 | 발행주식총수 | 920,000 | 920,000 | 460,000 |
| 액면금액 | 500원 | 500원 | 500원 | |
| 자본금 | 460,000,000 | 460,000,000 | 230,000,000 | |
| 합 계 | 자본금 | 8,950,126,000 | 8,950,126,000 | 4,475,063,000 |
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | - | - | 50,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 16,980,252 | 920,000 | 17,900,252 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | - | - | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | - | - | - | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 16,980,252 | 920,000 | 17,900,252 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 16,980,252 | 920,000 | 17,900,252 | - | |
(주) 당사의 정관상 발행할 주식의 총수는 50,000,000주로 이중 12,500,000주(25%) 한도 내에서 종류주식으로의 발행이 가능합니다.
나. 자기주식 취득 및 처분 현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
다. 다양한 종류의 주식
당사는 설립 이후 10회에 걸쳐 제3자배정 유상증자를 통한 종류주식을 발행하였으며, 보고서 작성기준일 현재 아래와 같이 전환우선주 920,000주가 있습니다.
1) 종류주식(명칭) 발행현황
| (단위 : 원) |
| 발행일자 | 2011년 11월 06일 | |||
| 주당 발행가액(액면가액) | 500 | 500 | ||
| 발행총액(발행주식수) | 115,000,000 | 230,000 | ||
| 현재 잔액(현재 주식수) | 460,000,000 | 920,000 | ||
| 주식의 내용 |
존속기간(우선주권리의 유효기간) | - | ||
| 이익배당에 관한 사항 | 배당률 3% (참가적, 누적적) | |||
| 잔여재산분배에 관한 사항 | 없음 | |||
| 상환에 관한 사항 |
상환권자 | 없음 | ||
| 상환조건 | - | |||
| 상환방법 | - | |||
| 상환기간 | - | |||
| 주당 상환가액 | - | |||
| 1년 이내 상환 예정인 경우 |
- | |||
| 전환에 관한 사항 |
전환권자 | 주주 | ||
| 전환조건 (전환비율 변동여부 포함) |
우선주 1주당 보통주 1주 | |||
| 발행이후 전환권 행사내역 |
N | |||
| 전환청구기간 | 발행 1개월 후부터 존속기간 만료일까지 보통주로 전환이 가능 |
|||
| 전환으로 발행할 주식의 종류 |
보통주 | |||
| 전환으로 발행할 주식수 |
920,000 | |||
| 의결권에 관한 사항 | 의결권 없음 | |||
| 기타 투자 판단에 참고할 사항 (주주간 약정 및 재무약정 사항 등) |
- | |||
(주) 2019년 10월 28일 및 2023년 03월 02일의 100% 무상증자를 반영한 잔액 및 주식수입니다.
5. 정관에 관한 사항
가. 정관 이력
본 사업보고서에 첨부된 정관의 최근 개정일은 2023년 3월 30일이며, 안건에는 하기의 정관 변경 안건이 포함되어 있습니다.
나. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2021.03.25 | 제10기 정기주주총회 | 주식 등의 전자등록, 이익배당기준일 정비 및 동등배당 근거 명시, 전자투표 도입시 감사 선임 주총 결의 요건 완화, 주주명부의 폐쇄일 기준일 정비, 소집통지 절차 간소화 등 |
법개정에 따른 적용 등 |
| 2023.03.30 | 제12기 정기주주총회 | 신주의 동등배당, 전환사채의 발행 |
현행 코스닥 준용하여 변경
|
(주) 상기 자료는 최근 3사업연도 정관 변경 사항입니다.
다. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| 1 | 압타머 기술 플랫폼을 기반으로 맞춤형(Custom) 압타머 발굴 및 생산 서비스 제공 | 영위 |
| 2 | 압타머 응용 기술 및 제품 개발 (연구 및 진단용 어세이 기술, 약물전달기술, 치료제 개발 등) |
영위 |
| 3 | 각호에 부대되는 사업 일체 행위 | 영위 |
II. 사업의 내용
1. 사업의 개요
당사는 압타머 기술 플랫폼(Aptamer Technology Platform)을 기반으로 단백질이나 유전자 소재로는 개발이 어려운 혁신적인 치료제 및 진단제품 개발을 통해 국민 삶의 질 향상 나아가 국가 의료비 절약에 기여한다는 비전으로 2011년 4월에 포항공대에서 spin-off 한 바이오기업으로 압타머 분야의 글로벌 선도기업으로 인정받고 있습니다.
당사의 압타머 기술 플랫폼은 변형핵산 기반 고성능 압타머를 효과적으로 발굴하는 기술과 발굴된 압타머를 응용목적에 맞게 최적화하는 기술, 그리고 이에 기반한 혁신적인 치료제 및 진단제품 개발 기술에 이르기까지 광범위하고 또한 완성도가 매우 높습니다.
당사는 독창적인 압타머 기술 플랫폼을 근간으로 일반적으로 5~7년이 소요되는 신약후보물질 발굴 기간을 2~3년으로 단축시킨 획기적인 신약개발 시스템을 구축하였고, 현재 압타머-약물 접합 플랫폼(Aptamer-Drug Conjugate, ApDC®)
을 기반으로 차세대 표적전달 항암제 개발에 박차를 가하고 있습니다. 발굴된 치료제의 임상적 유효성(Proof of Concept)을 확보한 후에 글로벌 제약사에게 라이센싱하거나 regional player와 공동개발을 추진하여 수익을 창출하는 사업모델로, 이를 위하여 Bio USA, Bio Europe, ChinaBio 등의 비즈니스 파트너링 미팅에 참가하여 다수의 파트너사와 기술 이전 및 공동개발 협력 등을 논의해 오고 있습니다.
당사의 ApDC® 플랫폼은 항체 기반의 ADC(Antibody-Drug Conjugate)기술의 의학적 미충족 수요를 해결할 수 있고, 다양한 약물형태(펩타이드, 단백질, 핵산, 방사성동위원 등)들의 접합 및 표적전달이 가능한 차세대 표적 약물전달 기술로써 난치성 암에 대한 항암제 개발을 필두로 치료제 개발 영역을 확대해가고 있습니다. 가장 앞서 개발 중인 AST-201은 간암, 폐암을 포함한 고형암 치료제로, GPC3 표적 압타머에 항암제인 젬시타빈 약물을 내재화한 물질로써 다수의 항암동물모델(간암, 폐암)에서 우수한 종양억제 효능을 입증하고, 면역관문억제제와의 병용요법에서도 우수한 시너지 효과를 확인하였습니다. 2024년 3월 12일 식약처에 1상 임상 IND 신청을 마쳤으며 3분기 중 승인을 예상하고 있습니다. 후속 파이프라인인 AST-202(혈액암), AST-203(고형암)의 개발도 동물모델에서 경쟁약물 대비 우수한 유효성이 입증되었고, 이후 약동력학적 특성 분석, 공정개발 등의 전임상개발이 순조롭게 진행되고 있습니다.
당사의 진단제품 개발은 AptoMIA(Aptamer-based Multivariate Index Assay) platform에 기반하여 암 등 조기진단이 어려운 질병을 대상으로 개발하고 있으며, 폐암을 조기에 진단할 수 있는 압타머 기반 압토디텍트 렁(AptoDetect™-Lung)을 세계 최초로 상용화하였습니다. 혈액에 존재하는 7종의 단백질 바이오마커를 정량적으로 검출하고 알고리즘을 통하여 폐암 위험도에 대한 진단정보를 제공하는 기술입니다.
2022년 7월 평가 유예 신의료기술로 선정 고시(보건복지부 고시 제2022-174호)되어 서울 아산병원 등 상급종합병원에서 비급여로 사용 중에 있으며, 대형병원 및 검진전문병원 건강검진센터에도 추가적으로 검사를 확대하고자 영업 및 마케팅을 진행하고 있습니다. 또한, 중국 및 싱가포르, 인도 등 해외 시장에서도 현지 파트너와 협력하여 현지 임상 및 판매허가 획득을 위한 절차를 진행 중에 있습니다.
그 밖에 사업에 대한 자세한 사항은 'Ⅱ.사업의 내용 _ 7. 기타 참고사항' 항목을 참조하시기 바랍니다.
2. 주요 제품 및 서비스
가. 주요 제품 등의 현황
| (단위 : 천원) |
|
서비스 및 제품명 |
2024년도 매출액 |
2023년도 매출액 |
2022년도 매출액 |
제 품 설 명 |
|
AST-201 |
- | - | - | 항암물질 젬시타빈을 내재화하여 GPC3-양성종양(간세포암, 비소세포폐암 등)에 선택적인 항암 효능을 가진 압타머-약물 복합체 |
| AST-202 (혈액암치료제) |
- | - | - |
1. CD25 발현률이 높은 혈액암(급성골수성백혈병, T 세포 림프종 등)을 직접 타겟하는 압타머-약물 복합체 2. 종양조직에서 조절 T 세포 선택적인 활성조절과 사멸을 유도해서 항종양 면역활성을 높이는 압타머-약물 복합체 |
|
AST-203 (고형암 치료제) |
- | - | - |
1. Trop2 양성 종양에 선택적인 압타머-약물 복합체 2. ADC 개발에 난항을 격고 있는 췌장암 및 폐암을 주요 적응증으로 개발 |
| 압토디텍트 렁 (AptoDetect™-Lung) |
560 (0.8%) |
- | 2,860 (0.8%) |
혈액에서 7종 단백질을 측정하고 알고리즘
분석을 통하여 폐암 위험도 정보 제공 |
|
올리고 합성 서비스 |
63,635 (89.6%) |
215,136 (88.5%) |
319,326 (89.1%) |
압타머 포함 다양한 oligonucleotides 물질에 대한 다양한 형태의 합성 서비스를 제공
|
|
압타머 발굴 서비스 |
6,861 (9.7%) |
28,050 (11.5%) |
36,067 (10.1%) |
변형 핵산 라이브러리를 이용한 차세대 압타머 발굴 기술을 기반으로 높은 특이도와 연구자들에게 제공하는 서비스.
|
(1) AST-201 고형암치료제
| 제품명 | AST-201 (고형암치료제)
|
| 제품 개요 |
종양세포 특이적 세포막 단백질인 글라이피칸3(GPC3)에 선택적으로 결합하고
세포 독성 물질인 젬시타빈(Gemcitabine)을 내재화한 표적형
압타머-약물 복합체
|
| 제품의 특징 |
- 간암을 포함한 GPC3-양성 종양에 선택적으로 약물을 전달하는 기술
- 약물을 내재화한 압타머를 세포 표면단백질(GPC3) 의존적으로 세포 내로
- 압타머의 높은 조직 침투력과 신장을 통한 신속한 배출(renal clearance)로
- 면역항암제와의 병용투여 시너지 효과 |
| 목표시장 |
- 예상 적응증은 GPC3-양성 간세포암(>70%), 비소세포폐암(>50%) 등
- 주요 적응증인 간암의 글로벌 시장 규모는 2019년 기준17.3억불. CAGR 20.2%로
|
(가) 특징
표적 물질인 글라이피칸3(GPC3)는
간암, 폐암 등에서
특이적으로 발현하는 단백질로, 특히 전암성 병변(간경화)를 효과적으로 구분할 수 있는 세포막 단백질이며, GPC3 발현 정도와 생존율 간의 상관관계가 높아 항암치료법 개발을 위한 우수한 표적 분자입니다. 검증된 항암제인 젬시타빈을 GPC3 압타머 서열 내에 도입하여 단일 핵산분자 내에 표적 전달 기능과 항암 기능을 동시에 구현한 이중기능 압타머 치료제입니다.
젬시타빈을 압타머 분자 내에 내재화함으로써 생체 내(특히, 간조직 내) Cytidine deaminase (CDA) 대사 프로세스로 인해 효능이 상실되는 위험을 해소시키며, 젬시타빈의 주요 내성 기전인 Nucleoside transporter의 변형과 상관없이 GPC3 수용체를 통한 종양 세포로의 능동적 약물 전달을 통해 높은 치료 효과를 나타냅니다. 또한, 단일 압타머 분자에 복수의 젬시타빈을 내재화하고 압타머의 강한 결합력으로 효과적인 암세포 전달을 일으킬 수 있도록 디자인되었습니다.
(나) 적응증
AST-201은 GPC3-양성인 종양의 치료를 목표로 합니다. 대표적인 GPC3-양성 종양은 간세포암(HCC),
비소세포폐암(NSCLC) 등
이 있습니다.
특히 GPC3는 특히 간암 조직에서 특이적으로 발현되며 간병변증인 간경화 및 간염 등을 구분할 수 있기 때문에 이를 표적으로 한 진단 및 치료제 개발 연구가 계속되어 왔습니다. 실제로 GPC3는 간세포암(HCC) 환자의 70~80%에서 특이적으로 발현되며, HCC유래 세포주에서 발현율이 매우 높은 것으로 보고되고 있습니다. 또한 보고에 따르면 GPC3 발현이 높을수록 생존률이 낮은 것을 확인할 수 있습니다.
현재 간암에 대한 허가된 1차 치료제는 TKI 계열 표적 저해제(Sorafenib, Lenvatinib),
Atezolizumab+Bevacizumab의 병용요법이 있습니다. TKI 계열 약물들은 충분한 치료효과를 보이지 못하고 있으며, Atezolizumab+Bevacizumab 병용요법의 경우 sorafenib보다 유의한 생존기간 연장을 나타내고 있어 임상에서 많이 사용되고 있습니다만 GPC3 발현이 높은 환자군은 sorafenib 대비 유의한 생존기간 연장을 나타내지 못하고 있어, 이들 환자군은 아직도 의학적 미충족 수요가 높으며, 위장관 출혈 이상반응으로 투여에 제한을 받는 환자군들도 있습니다.
이러한 시장 상황과 미충족수요들을 바탕으로 AST-201의 간암을 주요 적응증으로 한 개발방향/전략은 여전히 유효하며 또한 폐암, 일부 췌장암 등으로 적응증을 확장하고자 합니다.
(다) 개발현황
AST-201은 비임상 측면에서 작용기전 연구 및 세포수준에서의 유효성 연구가 완료되었고, 종양 동물모델 평가를 통해 우수한 표적 약물전달 및 종양 억제 효과, 그리고 면역관문억제제와의 병용투여에 의한 시너지 효과를 확인하였습니다.
2024년 3월 12일 국내 식약처에 AST-201 1상 임상시험에 대한 IND 신청을 마쳤으며 3사분기 승인을 예상하고 있습니다. 임상시험을 위한 연구자 구성(CI: 분당차병원 전홍재 교수), 임상시험 CRO 계약(C&R 리서치)이 완료되었고, 하반기부터 환자모집이 본격적으로 시작될 것으로 예상합니다.
(2) AST-202 (혈액암치료제)
| 제품명 | AST-202 (혈액암치료제) |
| 제품 개요 |
- 혈액암 세포에 과발현된 CD25를 표적으로 한 압타머-약물 접합체로 종양세포의 직접적 사멸 유도 - Treg(조절 T세포) 표면에 과발현된 CD25 수용체에 작용하여 종양조직 내 Treg의 선택적 억제 및 사멸을 유도하여 항종양 면역 활성을 극대화 |
| 제품의 특징 |
- CD25 선택적 압타머-약물 접합체 - CD25-양성 세포 선택적 사멸 유도 - 나노미셀 구조 형성에 의한 개선된 안정성 및 약동력학적 프로파일, 향상된 유효성 - 낮은 혈액학적 부작용(경쟁 ADC 대비 안전) - 선택적 Treg 불활성화와 사멸 유도 및 이를 통한 항종양 면역 활성 증대 - 신속한 종양 표적화와 투과성, 빠른 체내 배출 특성을 활용함으로써 장기적인 Treg - 높은 종양조직 투과성 및 빠른 종양세포 내재화률, 이를 통한 빠른 세포사멸 유도 - 면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대 |
| 목표시장 |
- 글로벌 ADC 시장은 2021년 기준 58억불. 2030년까지 CAGR 16.4%로 성장 예상 (Grand View Research 시장보고서) (Data Intelligence 시장보고서) - 글로벌 급성골수성 백혈병 시장은 2023~2030년 예측기간 중 CAGR 11.3%로 성장 예상 (Data Bridge Market Research 시장보고서) - 혈액암 치료제 ADC인 Adcetris의 연간 매출은 2022년 기준 14.8억불, 2021년 대비 12.8% 성장 예상 (Biopharma PEG article) |
(가) 특징
ADC 개발의 주요 장애물은 용량제한 독성(DLT)으로 인한 좁은 치료용량계수(Therapeutic index)입니다. 이는 항체의 약동력학적 특성과 effector 기능 등 항체 고유의 특성으로 인한 off-target 부작용들에 기인한 것으로 파악되고, 이를 해결할 차세대 약물전달 플랫폼으로 압타머-약물 접합체(ApDCⓡ)가 주목받고 있습니다. AST-202 또한 이러한 기조하에서 개발된 파이프라인으로 T 세포 림프종, 급성골수성 백혈병에서 특징적으로 과발현되고 있는 CD25 단백질을 표적으로 하는 ApDCⓡ입니다. CD25-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술을 적용 압타머에 3개의 약물이 접합되도록 디자인되어 potency가 개선됨과 더불어 나노미셀의 고차구조를 형성함으로써 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
더불어, CD25는 면역 억제 조절 T 세포(Treg)에도 많이 발현되어 항종양 면역반응 증대를 위한 표적으로도 주목받고 있습니다. 그러나, 이를 위한 항체 기반의 Treg depletion 전략은 표적 선택성이 부족하면 CD25-high Treg, CD25-low Teff을 모두 저해하거나 systemic Treg depletion이 유도되어 자가면역 측면의 부작용 우려가 높을 수 있습니다. AST-202는 이러한 측면에서도 표적 선택성이 높은 CD25 압타머에 약물을 접합하여 Treg을 선택적으로 depletion 시킴으로써 종양조직 내 Teff/Treg의 비율을 높여 항종양 면역 활성을 극대화할 수 있음과 동시에 항체 대비 짧은 반감기를 가져 체외배출이 신속하게 이루짐으로 자가면역 부작용 우려를 최소화할 수 있습니다.
(나) 적응증
높은 CD25 발현율을 보이는 급성백혈병(acute myeloid leukemia), T세포 림프종(lymphoma) 등의 혈액암에 대한 ApDC 치료제 개발을 하고자 합니다. 주요 적응증으로는 더불어, 종양미세환경 내 침투된 Treg을 선택적 억제함으로써 항종양 면역 활성 증대와 이를 통한 항암효과를 확인할 수 있는 다양한 고형암을 대상으로도 적응증 확대를 모색하고 있습니다.
(다) 개발현황
AST-202는 높은 표적 선택성과 특이성을 보유한 CD25 표적 압타머에 세포독성 약물을 접합함으로써 CD25-양성 종양세포를 선택적으로 제거하고, 종양조직 내 면역활성화를 유도하도록 디자인된 압타머 기반 표적약물전달 치료제입니다.
국가신약개발과제로 선정된 이후 표적과의 높은 특이성과 빠른 세포 내재화 속도가 규명되었고, 당사 고유의 분지형 링커를 이용하여 압타머-약물 비율 조절하는 등 물질 자체의 최적화가 완료되었습니다. In-vitro에서 우수한 표적 결합, 약물전달 및 CD25-양성인 종양세포 및 조절 T 세포(Treg)의 선택적 depletion의 효과를 확인하였습니다. 또한, 1차적으로 혈액암의 동물모델에서 진행된 유효성 평가에서 주2회/2주 투약만으로 종양이 완전히 사라지는 용량군을 확인했으며, 투약 중단 이후 회복기간에도 종양 재성장이 관찰되지않는 우수한 효과가 확인되었습니다. 추가적인 시험을 통해 종양성장억제 효과의 최소 유효용량, 투여빈도 등을 확인하였습니다. 종양모델에서의 생존률 시험에서도 AST-202 투여군의 생존률이 극적으로 개선되는 효과가 확인되었습니다.
현재는 후보물질을 확정하고 전임상 진입단계에 있습니다. 압타머의 예비독성 평가에서 hERG 시험/복귀돌연변이 시험/염색체이상반응 시험에서 모두 음성의 결과를 얻어 심장 및 유전독성의 가능성이 매우 낮은 물질임을 확인했습니다. 또한, 자체 개발된 ELOHA 시험법의 생체시료분석법이 개발되었고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)가 완료되었습니다. 더불어, 추가적인 혈액암 동물모델 평가를 통해 독성대비 유효용량범위 평가, 비교약물(Adcetris) 대비 효능 평가 등을 위한 시험이 진행 중에 있습니다.
(3) AST-203 (고형암치료제)
| 제품명 | AST-203 (고형암치료제) |
| 제품 개요 |
- 암세포 표면에 과발현된 Trop2를 표적으로 한 압타머-약물 접합체 - 항체 대비 우수한 종양 침투성을 바탕으로 동물모델에서 동일 표적의 ADC 대비 우수한 항종양 효과 확인 |
| 제품의 특징 |
- Trop2 선택적 압타머-약물 접합체 - Trop2-양성 종양세포의 선택적 사멸유도 나노미셀 구조 형성에 의한 개선된 안정성 및 약동력학적 프로파일, 향상된 유효성 - 낮은 혈액학적 부작용(경쟁 ADC 대비 안전) - 신속한 종양 표적화와 빠른 체내 배출 특성을 활용함으로써 종양성장 억제효과는 높이고, 장기적인 약물의 노출을 최소화하여 용량제한독성을 개선하고 넓은 치료용량계수 확보 - 높은 종양조직 투과성 및 빠른 종양세포 내재화률 - 면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대 |
| 목표시장 |
- 글로벌 ADC 시장은 2021년 기준 58억불. 2030년까지 CAGR 16.4%로 성장 예상 (Grand View Research 시장보고서) |
가) 특징
AST-203도 당사의 압타머-약물 접합체(ApDC®) 플랫폼을 기반으로 개발되었습니다. 다양한 암종에서 과발현되어 있고, 특히 최근 가장 주목받고 있는 ADC 표적인 Trop2 단백질을 표적으로 하는 ApDC®입니다. Trop2-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 신속한 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술을 적용 압타머에 3개의 약물이 접합되도록 디자인되어 potency가 개선됨과 더불어 나노미셀의 고차구조를 형성함으로써 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
더불어, 3차원으로 배양된 Trop2-양성 종양 spheroid에서 항체 대비 최대 6.7배 높은 조직침투율을 보였으며, Trop2-양성 종양 동물모델(췌장암)을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 더불어, 동일 표적에 대한 승인된 ADC인 Trodelvy와 동물모델에서의 효능비교 실험에서 상대적으로 우수한 종양성장 억제효과가 관찰되었습니다. 또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다.
(나) 적응증
높은 Trop2 발현율을 보이는 다양한 고형암에 대한 ApDC 치료제 개발을 하고자 합니다. 주요 적응증으로는 Trop2-발현이 높으나 ADC 치료제 개발의 난항을 겪고 있는 췌장암과 비소세포폐암입니다. ApDC가 보이는 우수한 종양침투능, 상대적으로 낮은 부작용 가능성 등은 ADC 개발이 어려운 난치성 암에 대한 미충족 수요를 해결할 수 있는 대안이 될 수 있을 것입니다.
(다) 개발현황
AST-203은 높은 표적 선택성과 특이성을 보유한 Trop2 표적 압타머에 세포독성 약물을 접합함으로써 Trop2-양성 종양세포를 선택적으로 제거하고, 혈액학적 부작용 가능성을 최소화할 수 있도록 설계된 압타머 기반 표적약물전달 치료제입니다.
Trop2 표적과의 높은 특이성과 빠른 세포 내재화 속도가 규명되었고, 당사 고유의 분지형 링커를 이용하여 압타머-약물 비율 조절하는 등 물질 자체의 최적화가 완료되었습니다. In-vitro에서 우수한 표적 결합, 약물전달 및 Trop2-양성인 종양세포의 선택적 사멸의 효과와 bystander effect를 확인하였습니다. 또한, 1차적으로 췌장암의 동물모델에서 진행된 유효성 평가에서 용량의존적이 항종양 효과가 확인되었으며, 비교약물로 사용된 동일 표적의 기 승인 ADC인 Trodelvy와의 효능비교에서도 상대적으로 우수한 항종양 효과를 확인하였습니다.
현재는 후보물질 확정과 적응증 확대 가능성을 판단하기 위한 추가적인 in vivo 평가와 약동력학적 특성을 파악하기 위한 PK 시험을 진행하고 있습니다. 압타머의 PK 시험을 위해 자체적으로 ELOHA 시험법, ApDC 분석을 위해 변형 ELOHA 시험법, 페이로드 PK 분석을 위한 LC-MS법 등의 생체시료분석법이 개발되었고, 이를 바탕으로 설치류에서의 약동력학적 평가(PK)가 진행 중에 있습니다.
(4) RNA전달 압타머
(가) 특징
RNA전달 압타머는 일종의 운반체로서 ASO, siRNA와 같은 유전자치료제를 목표 조직이나 세포로 전달하고 세포막을 통과하여 정확한 곳에 도달할 수 있도록 돕습니다. 플랫폼 기술로서 다양한 약물에의 적용이 용이한 확장성을 보유하고 있습니다.
(나) 적응증
트랜스페린 수용체(TfR) 압타머는 BBB 투과가 필요한 CNS(중추신경계) 질환 치료제와 근육으로의 약물 전달이 필요한 신경근육계 질환 치료제 개발에 활용될 수 있습니다. 아시알로당단백질 수용체(ASGPR) 압타머는 간을 표적으로 하는 다양한 치료제 개발에 활용될 수 있습니다.
(다) 개발 현황
압타머 플랫폼 사업화 확장을 위하여 항체 뿐만 아니라 펩타이드, 단백질 및 ASO와 siRNA를 포함한 핵산치료제 모달리티를 가진 파트너사들과 MTA를 체결하여 플랫폼 적용 평가 추진 등 다양한 협력을 추진하고 있습니다.
(5) 압토디텍트 렁 (AptoDetectTM-Lung)
|
제품명 |
압토디텍트 렁 (AptoDetect™-Lung) | |||
|
제품의 |
- 체외진단 다지표검사 (IVDMIA) 제품
- 모델명 : ALUC-1096 (88 tests/kit), ALUC-1048 (40 tests/kit)
- 임상적 성능 (민감도/특이도): 75%/92%
- 검체: 혈청 (serum)
- 검사방법: 압타머 기반 비드 마이크로어레이법 (측정장비: Luminex 200)
|
|||
|
사용목적 |
폐암 발병 가능성이 높은 그룹을 대상으로 조기진단 정보제공 - 폐결절이 발견된 환자 대상 진단 검사 - 장기흡연자 등 고위험군 대상 선별 검사 |
|||
|
시장 환경 |
- 국내: 폐결절 대상 진단검사 (9백억원 규모 시장)
- 중국: 고위험군 선별검사 (2조원 규모 시장)
- EarlyCDT®-Lung (7종 자가항체 측정), Epi-prolung®
|
|||
|
인증 현황 |
- 특허 국내, 일본, 중국, 싱가포르 등록
- 식약처 3등급 체외진단 의료기기 품목허가 (체외 제허 17-748호, 2017. 09)
|
|||
|
진행 사항 |
- 평가 유예 신의료기술 선정 및 보건복지부 고시 - 10개 상급종합병원(경희대병원 등) 임상시험 및 비급여 코드 등록 진행 중
- 24년 1월, 서울아산병원, 경희의료원 비급여 처방 시행 중
|
|||
|
향후 계획 |
- 병원에서 비급여 검사 확대 및 건강검진센터 진출을 통한 매출 증대 - 다기관 임상시험 완료 후, 신의료기술 인증 및 보험 등재 절차 진행
- 식약처를 통해 PMS (시판 후 조사) 계획서 승인 후 진행
- 해외 전시회 참여를 통한 공동 상업화 파트너사 발굴 |
나. 주요 제품 등의 가격변동추이
|
(단위 : 천원) |
|
사업연도 품 목 |
2024년도 반기 |
2023년도 |
2022년도 |
||
|
AST-201 (고형암치료제) |
내 수 |
- | - |
- |
|
|
수 출 |
- | - |
- |
||
|
AST-202 (면역항암제/혈액암치료제) |
내 수 |
- | - |
- |
|
|
수 출 |
- | - |
- |
||
| RNA전달 압타머 |
내 수 |
- | - |
- |
|
|
수 출 |
- | - |
- |
||
|
압토디텍트 렁 |
내 수 |
1,820~3,080
|
1,820~3,080
|
1,820~3,080
|
|
|
수 출 |
- |
- |
|||
|
압타머 |
압타머 합성 |
내 수 |
500~1,000
|
500~1,000 |
500~1,000 |
|
수 출 |
500~1,000
|
500~1,000 |
500~1,000 |
||
|
압타머 발굴 |
내 수 |
17,800
|
13,860 |
13,200 |
|
|
수 출 |
17,800
|
13,860 |
13,200 |
||
|
(주1) ALUC-1048(48-well), ALUC-1096 (96-well) kit 기준 단가이며, 시장상황에 따라 변동 될수 있습니다. (주2) Stage1~3 기준 단가이며, 시장상황에 따라 변동 될수 있습니다. |
3. 원재료 및 생산설비
가. 주요 원재료 매입 현황
|
(단위 : 천원, $, €) |
|
매입 유형 |
품 목 |
구 분 |
2024년도 반기 (제14기) |
2023년도 |
2022년도 (제12기) |
|
원재료 |
연구 시약 등 (주1) |
국 내 |
179,189 | 272,533 | 618,822 |
|
수 입 |
27,854 | 6,113,633 | 4,024,876 | ||
|
($20,537
) |
($4,585,927) | ($3,209,446) | |||
|
-
|
- | - | |||
|
소 계 |
207,043
|
6,386,166 | 4,643,698 | ||
|
압토디텍트 렁 시약 등 |
국 내 |
195
|
78,933 | 18,008 | |
|
수 입 |
-
|
- | - | ||
|
소 계 |
195
|
78,933 | 18,008 | ||
|
총 합 계 |
국 내 |
179,384 | 351,465 | 636,830 | |
|
수 입 |
27,854 | 6,113,633 | 4,024,876 | ||
| ($20,537) | ($4,585,927) | ($3,209,446) | |||
| - | - | - | |||
|
합 계 |
207,238 | 6,465,098 | 4,661,706 | ||
| (
주1) 압타머 서비스 및 연구개발 활동을 위해 매입한 시약이며, 24년 3월 AST-201 국내 1상 임상시험 IND 승인 신청으로 인해 연구활동을 위한 시약의 매입이 감소 하였습니다.
|
나. 주요 원재료의 가격변동추이
|
(단위 : 천원, $) |
|
사업연도 품 목 |
2024년도 반기 |
2023년도 |
2022년도 |
||
|
압타머 서비스 |
압타머 합성 (주1) |
국 내 |
95 | 95 | 87 |
|
수 입 |
16
|
16 |
13 |
||
|
($12)
|
($12) |
($11) |
|||
|
압타머 발굴 (주2) |
국 내 |
2,628
|
2,630 |
2,630 |
|
|
수 입 |
1,478
|
1,464 |
1,464 |
||
|
($1,137)
|
($1,132) |
($1,132) |
|||
|
압토디텍트 렁(AptoDetect™-Lung) |
원재료 (주3) |
국 내 |
336
|
381 |
303 |
|
수 입 |
- | - |
- |
||
| - | - |
- |
|||
|
(주1) 압타머 합성 원재료에 대해서는 OH-form 100ug의 가격을 기준으로 작성하였습니다. (주2) 압타머 발굴 원재료에 대해서는 1개 표적의 가격을 기준으로 작성하였습니다. (주3) 1kit에 투입되는 양을 기준으로 작성하였습니다. |
다. 주요 매입처에 관한 사항
|
(단위 : 천원, $, €) |
|
폼목 |
구입처 |
2024년도 반기 |
2023년도 |
2022년도 |
|
|
압타머 |
압타머 합성 |
국 내 |
93,837 | 256,222 | 257,193 |
|
수 입 |
11,942 | 10,258 | 38,102 | ||
| ($8,778) | ($7,700) | ($30,349) | |||
|
압타머 발굴 |
국 내 |
7,861 | 12,341 | 10,683 | |
|
수 입 |
- | - | - | ||
| - | - | - | |||
| 압토디텍트 렁 (AptoDetect™ -Lung) |
원재료 |
국 내 |
195
|
78,933 | 18,008 |
라. 생산 및 생산설비에 관한 사항
(1) 생산능력 및 생산실적
(가) 압타머 서비스
1) 압타머 합성
당사가 보유한 카타로그 압타머에 대한 합성 서비스는 설립부터 계속하여 진행하고 있습니다. 많은 고객으로부터 고품질의 합성 노하우를 인정받아 일반 DNA 올리고뉴클레오타이드 합성 서비스 또한 제공하고 있습니다.
당사의 합성 생산능력은 수십 mg까지 자체 합성이 가능한 수준으로써 전임상개발 이전단계(동물효능평가)까지를 대상으로 합니다. 전임상 및 임상을 위한 압타머 합성은 Outsourcing이 가능한 업체를 확보하고 있고 내부합성과 동일한 품질로 생산되도록 관리합니다.
2) 압타머 발굴
당사의 압타머 발굴 서비스는 압타머 플랫폼 기술을 통해 약 8주 정도의 기간이 소요되는 서비스입니다. 1인의 연구원이 한 번의 발굴 진행으로 최대 48개의 표적 분자에 대해 동시에 압타머를 개발할 수 있는 다중 발굴 플랫폼입니다.
(나) 압토디텍트 렁 (AptoDetect™-Lung)
당사의 생산부서는 1일 8시간 근무기준으로 11일에 1로트를 생산할 수 있으며, 1로트는 50~110 키트에 해당되는 양입니다. 연간 250일 근무일 기준으로 연간 생산량은 2,970 키트입니다. 압토디텍트 렁(1 키트당 88 검체 테스트)을 사용했을 때, 연간 260,000건을 테스트할 수 있는 수량입니다.
당사의 압토디텍트 렁은 국내 식약처 3등급 체외진단의료기기로서 의료기기 제조 및 품질관리 기준을 인증받은 GMP 시설 하에서 생산하고 있으며, 국제 표준화 기구 (ISO)의 의료기기 제조 및 품질관리 기준인 ISO 13485:2016 인증을 보유하고 있습니다.
회사는 향후 중국, 싱가포르, 인도 등 아시아 시장 내 매출이 가시화되는 시점에 맞추어, 연간 10만 키트 규모의 GMP 공장을 증설하고 시장 진입을 본격화할 예정입니다.
(2) 생산설비에 관한 사항
(가) 현황
|
(단위: 천원) |
|
구분 |
자산별 |
소재지 |
취득 원가 |
기초가액 (2024. |
당기증감 |
당기 상각 |
기말가액 (2024. |
비고 |
|
|
증가 |
감소 |
||||||||
|
GMP 시설 |
토지 |
포항시 남구 |
- |
- |
- | - | - | - |
- |
|
건물 |
- |
- |
- | - | - | - |
임대 |
||
|
시설장치 |
124,000 | 1 | - | - | - | 1 | - | ||
|
기계장치 |
121,559 | 472 | - | - | 353 | 119 | - | ||
(나) 설비의 신설·매입계획
|
(단위 : 천원) |
|
구 분 |
설비 능력 |
총소요 자금 |
기지 |
지출예정 |
비 고 |
||
|
2024년 |
2025년 |
2026년 |
|||||
|
GMP 시설 증설 |
- |
3,000,000 |
- |
1,200,000 |
1,800,000 |
- |
GMP시설 등 |
|
폐암 IVD 생산 설비 |
연10만Kit |
893,700 |
- |
163,300 |
730,400 |
- |
생산 증설외 |
|
계 |
- |
3,893,700 |
- |
1,363,300 |
2,530,400 |
- |
- |
※상기 계획은 폐암 사업 경과에 따라 변동 될수 있습니다.
4. 매출 및 수주상황
가. 매출실적
|
(단위 : 천원, $) |
|
매출 유형 |
품 목 |
2024년도 반기 |
2023년도 |
2022년도 |
|
|
용역 매출 |
압타머 |
수 출 |
17,611 | 30,791 | 54,458 |
| ($13,147) | ($23,378) | ($42,910) | |||
|
내 수 |
52,885 | 212,395 | 300,935 | ||
|
합 계 |
70,496 | 243,186 | 355,393 | ||
| 제품 매출 |
압토디텍트 렁 (AptoDetect™-Lung) |
수 출 |
-
|
- | - |
|
-
|
- | - | |||
|
내 수 |
560 | - | 2,860 | ||
|
합 계 |
560 | - | 2,860 | ||
|
합 계 |
수 출 |
17,611 | 30,791 | 54,458 | |
| ($13,147) | ($23,378) | ($42,910) | |||
|
내 수 |
53,445 | 212,395 | 303,795 | ||
|
합 계 |
71,056 | 243,186 | 358,253 | ||
나. 주요 매출처 등 현황
|
(단위 : 천원, $) |
|
매출 유형 |
품 목 |
매 출 처 |
2024년도 반기 (제14기) |
2023년도 (제13기) |
2022년도 (제12기) |
|
|
용역 |
압타머 서비스 |
국내 |
주요 매출처1 |
19,238 | 45,054 | 70,782 |
|
주요 매출처2 |
11,416 | 42,397 | 65,864 | |||
|
주요 매출처3 |
11,058 | 39,288 | 45,455 | |||
|
기타 |
11,173 | 85,656 | 118,834 | |||
|
해외 |
주요 매출처4 |
9,658 ($7,117) |
13,414 ($10,273) |
12,886 ($10,130) |
||
|
기타 |
7,953 ($6,030) |
17,377 ($13,105) |
41,572 ($32,780) |
|||
|
소계 |
70,496 | 243,186 | 355,393 | |||
|
제품 매출 |
압토디텍트 렁 (AptoDetect™ -Lung) |
국내 |
주요 매출처5 | 560 | - | 2,860 |
|
합계 |
71,056 | 243,186 | 358,253 | |||
다. 수주현황
당사와 같은 기술이전을 주 수익모델로 하는 신약연구개발 회사의 경우 일반 제조업이나 용역업체와 같은 수주는 발생하지 않습니다.
라. 판매경로 등
(1) 판매 조직
당사가 개발하는 압타머 신약의 사업화는 파트너사와의 공동개발 및 라이센싱을 통해 진행됩니다. 회사 내에 라이센싱을 위한 전담부서가 있으며, 국내외 관련 학회(Bio-USA, Bio-China, Inter-Biz conference, Bio-Korea, KDDF show-case 등)는 물론 다양한 파트너링 회의를 적극적으로 활용하고 있습니다. 또한, 지역별 agency를 활용하여 해외 파트너 발굴을 위해 노력하고 있습니다.
진단 제품의 경우, 국내는 학회(대한폐암학회, 결핵 및 호흡기학회, 진단검사의학회, 표적치료연구회 등), 전시회, 블로그 등을 통해 적극 홍보하고 있습니다. 해외는 중국과 싱가포르 파트너사를 통해 홍보를 진행하고 있으며, CMEF, K-Med Expo 등 해외 전시회 참여도 적극 진행 중입니다.
|
품목 |
담당 부서 |
구분 |
|
혁신 신약 |
연구개발본부 |
국내외 기술이전 |
|
진단 제품 |
ADL사업부 |
국내외 사업총괄 |
|
압타머 서비스 |
임상/BD본부 |
국내외 사업총괄 |
(2) 판매 전략
(가) 혁신 신약
1) 라이센싱을 통한 수익 창출모델
당사의 치료제 개발사업은 ApDC® 플랫폼을 기반으로 AST-201(고형암치료제), AST-202(면역항암제/혈액암치료제), AST-203(고형암치료제) 등 혁신적인 약물을 지속적으로 발굴하여 글로벌 제약사에게 라이센싱하거나 공동개발을 추진하여 수익을 창출하는 모델입니다. 라이센싱을 위해서는 임상적 효과 검증 (Proof of Concept)이 일반적인 선결 조건이지만, 당사가 개발하는 약물들이 first-in-class 인 점을 고려하여 전임상 단계에서부터 공동개발을 통한 조기 라이센싱이 가능토록 추진하고 있습니다. 압타머 기반 약물이 독창적인 약효 data를 보여줌에 따라 선도물질 최적화 단계부터 다수의 글로벌 제약사가 관심을 표명한 점을 고려할 때, 전임상 개발단계에서의 조기 라이센싱 가능성은 매우 크다고 판단됩니다.
2) 임상시험 공동개발 파트너 발굴 병행 추진
전임상 단계에서의 조기 라이센싱을 기본전략으로 하나, 이와 병행하여 regional player와의 공동개발을 진행하여 임상적 유효성(Proof of Concept)을 확보한 후에 글로벌 라이센싱을 진행하는 전략도 함께 추진 중입니다.
(나) 압토디텍트 렁 (AptoDetect™-Lung)
고위험군 선별검사에 사용되는 흉부 CT 또는 저선량 CT(LDCT) 기술의 높은 위양성을 보완할 목적으로 사용되는 병원 외래시장과 2019년 7월부터 국가암검진 사업에 폐암이 추가되면서 빠르게 성장하고 있는 고위험군 선별 검진시장에서 LDCT 기술을 대체할 수 있습니다.
1) 국내 판매 전략
3가지 판매 전략을 통해 국내 시장에 진출하고 있습니다.
① 당사의 폐암 조기진단 키트는 지난 해 7월 11일 한국보건의료연구원(NECA)으로부터 평가 유예 신의료기술 대상으로 보건복지부 고시(제2022-174호)되었으며, 같은 해 9월 1일부터 2년간 비급여로 병원에서 사용 가능합니다.
이에 따라, 영상진단검사(흉부 CT 또는 저선량CT)에서 폐결절이 발견된 환자를 대상으로 검사가 가능하게 되었습니다. 다기관 임상시험에 참여 중인 10개 상급종합병원을 포함한 다수의 상급병원과 비급여 코드 확보를 진행 중에 있고, 현재 4개 병원(서울아산병원, 경희의료원, 영남대학교병원, 충남대학교병원)에 대한 코드를 확보하였습니다. 그 외 상급종합병원들 또한, 비급여 코드 확보를 위해 영업/마케팅에 주력하고 있습니다. 올해 1월부터 서울아산병원과 경희의료원에서 비급여 처방이 시행되고 있습니다. 추후 경희의료원, 영남대학교병원, 충남대학교병원에서도 비급여 처방이 시행될 수 있게 진행하고자 합니다.
② 당사는 자체 영업력 외에도 권역별 병원 네트워크를 갖춘 ㈜지씨셀(GC녹십자의료재단의 검체검사서비스 영업 및 마케팅을 지씨셀에서 담당)과 검사 활성화를 위해 8월 18일 상품매매 계약서를 체결하였습니다. 이를 통해 전국의 병의원 및 건강검진센터 시장에 진입하기 위한 영업망을 구축하였고, 대형병원 및 검진전문병원을 중심으로 건강검진센터에 진입하고자 영업 및 마케팅을 양사 협력하에 진행하고 있습니다.
③ 당사와 ㈜지씨셀간 계약에 따라, GC녹십자의료재단과 신규 수탁의료기관으로서 9월 14일부터 비소세포폐암 위험도 검사(압토디텍트 렁)가 가능하게 되었습니다. 기존 수탁의료기관인 이원의료재단의 경우에는 키트 독점 공급 계약은 만료되었지만, 판매 영업은 계속 수행하면서 재위탁 형식으로 GC녹십자의료재단에서 검사를 시행하는 것으로 변경하였습니다.
2) 해외 판매 전략
현지 시장을 잘 아는 각국 판매대리점을 통하여 현지 인허가를 획득한 후 완제품을 수출하는 방안을 기본전략으로 하고 있습니다. 다만, 현재 논의 중인 인도의 한 기업과는 인도 현지 GMP 시설에서 생산하는 방안으로 논의 중이며, 인도에서 당사 키트를 생산할 경우 국내에서 생산한 것보다 저렴한 가격으로 생산이 가능할 것입니다. 저렴하게 생산된 키트는 동남아시아 지역 진출 시 유리할 것으로 예상합니다.
코로나19 이후 각국의 체외진단 의료기기 인허가에 대한 기준이 점차 강화되고 있습니다. 당사는 현지 시장을 잘 아는 각국 판매대리점을 통하여 LDT(Laboratory Developed Test) 서비스 론칭을 먼저 추진하는 방안을 기본전략으로 하고 있습니다. 이후 LDT 서비스를 통해 축적된 데이터 등을 활용하여 각국 인허가를 획득하는 것으로 추진하고 있으며, 중국 및 동남아시아 국가들로 그 범위를 확대하고자 합니다.
특히, 동남아시아 지역은 Biomed 그룹과 싱가포르 판매계약을 체결하였습니다. Biomed는 단기적으로 Tan Tock Seng Hospital(TTSH)과 같이 LDT 서비스를 위한 임상시험을 준비하고 있으며, 완료 후 LDT 서비스 론칭을 추진할 계획입니다.
인도의 한 기업과는 현재 당사 키트를 인도 내에서 판매하기 위한 절차를 진행하고 있습니다. 먼저 CDSCO(인도중앙의약품 표준 통제국)로부터 Test license를 받는 절차를 진행하고 있으며, 해당 license를 받은 후 소규모 후향적 임상시험을 진행할 계획입니다. 임상시험을 진행하기 위해 인도의 병원 소속 의사를 모집 중이며, 임상시험을 위한 시설을 구축하고 있습니다.
해당 임상시험을 통해 CDSCO로부터 품목허가 인증을 획득한 후 인도 내 판매를 진행할 계획이며, 인도에서 생산된 저렴한 키트를 바탕으로 동남아시아에 판매하고자 합니다.
5. 위험관리 및 파생거래
가. 환위험 및 위험관리
환위험은 환율의 변동으로 인하여 금융상품의 미래현금흐름에 대한 공정가치가 변동할 위험입니다. 당사는 보고서 작성기준일 현재 기능통화 이외의 외화로 표시된 화폐성 자산의 비중이 작아 당사의 손익에 미치는 영향은 중요하지 않습니다.
나. 유동성위험 및 위험관리
유동성 위험이란 당사가 일시적인 자금부족으로 정해진 결제시점에서 결제의무를 이행하지 못함으로써 거래 상대방의 자금조달계획 등에 악영향을 미치게 되는 위험을 의미합니다. 당사는 차입금 규모 대비 현금 및 현금상 보유 금액이 더 많아 재무안정성이 양호합니다. 또한 당사는 적정 유동성의 유지를 위하여 주기적인 자금수지 예측, 조정을 통해 유동성위험을 관리하고 있습니다.
다. 시장위험과 위험관리
시장위험은 미래의 시장 이자율 변동에 따라 예금 또는 차입금 등에서 발생하는 이자수익 및 이자비용이 변동될 위험을 뜻합니다. 당사는 보고서 작성기준일 현재 차입금규모가 적어 당사의 손익에 미치는 영향은 중요하지 않습니다.
라. 기타위험 및 위험관리
상기 언급된 위험들 이외에 대한 자세한 사항은 III. 재무에 관한 사항 - 5. 재무제표 주석 을 참조하시기 바랍니다.
마. 파생상품 거래현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
6. 주요계약 및 연구개발활동
가. 라이센스아웃 (License-out) 계약
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 라이센스인 (License-in) 계약
당사는 보고서 작성기준일 현재 당사가 체결한 라이센스인 (License-in) 계약의 현황은 다음과 같습니다.
|
[라이센스인 계약 총괄표] |
|
(단위 : 백만원) |
|
품목 |
계약상대방 |
대상지역 |
계약체결일 |
계약종료일 |
총계약 |
지급 |
수익배분 |
|
압타머 관련 |
포항공과 |
전세계 |
2010.5.17 |
영구존속 |
600 |
600 |
- |
|
IVD (한국)
|
한국 내 |
2013.7.31 |
2024.7.30 |
- |
- |
순판매액 기준 6% |
|
|
IVD |
중국, 일본,
인도, 대만,
인도네시아,
라오스, 필리핀
|
2016.1.25 |
2024.1.24 |
- |
- |
순판매액 기준 3.5% |
|
|
시약 |
전세계 |
2011.6.07 |
2022.6.06 |
20 |
20 |
순판매액 기준 |
|
|
Aptamer |
미국 |
2014.6.11 |
2022.6.11 |
- |
- |
기술적용제품 |
|
|
폐암진단 |
서울 |
한국 내 |
2016.3.01 |
계약제품의 |
- |
- |
폐암 IVD
|
|
(주1) 계약종료일은 정해져 있지 않으며, 3년마다 자동연장되는 계약입니다. (주3) 2023년 7월 20일자로 포항공과대학교 산학협력단과 당사 간 체결한 IVD - 한국 내, IVD - 아시아 12개국, 시약 관련 기술이전 계약 내용이 변경되어, 제품 판매 시 지급되는 수수료율이 하향 조정되었습니다. |
(1) 품목 : 압타머 관련 기술자산 및 특허
|
① 계약상대방 |
포항공과대학교 산학협력단 |
|
② 계약내용 |
계약대상기술 특허에 대한 우선적으로 사용할 수 있는 권리 |
|
③ 대상지역 |
전세계 |
|
④ 계약기간 |
계약체결일 : 2010.05.17 계약종료일 : 영구존속 (단, 특허는 존속기간 만료일) |
|
⑤ 총 계약금액 |
600백만원 |
|
⑥ 지급금액 |
600백만원 |
|
⑦ 계약조건 |
- |
|
⑧ 회계처리방법 |
- |
|
⑨ 대상기술 |
포스텍이 보유하고 있는 압타머설비, 압타머 라이브러리 등의 기술자산과 |
|
⑩ 기타사항 |
- |
(2) 품목 : IVD - 한국 내
|
① 계약상대방 |
포항공과대학교 산학협력단 |
|
② 계약내용 |
계약대상 기술에 대한 상업화 Sublicense |
|
③ 대상지역 |
한국 내 |
|
④ 계약기간 |
계약체결일 : 2013.7.31 (3년마다 자동연장되는 계약) |
|
⑤ 총 계약금액 |
- |
|
⑥ 지급금액 |
- |
|
⑦ 계약조건 |
IVD 제품 판매시 순판매액의 6% |
|
⑧ 회계처리방법 |
지급할 경상 기술료는 판매관리비로 회계처리 |
|
⑨ 대상기술 |
압타머 기술 기반으로 라이센스된 IVD 분야 |
|
⑩ 기타사항 |
2023년 7월 20일자로 포항공과대학교 산학협력단과 당사 간 체결한 IVD - 한국 내 관련 기술이전 계약 내용이 변경되어, 기존 IVD 제품 판매 시 지급되는 수수료율이 순판매액의 12%에서 6%로 조정되었습니다. |
(3) 품목 : IVD - 아시아 12개국
|
① 계약상대방 |
포항공과대학교 산학협력단 |
|
② 계약내용 |
계약대상 기술에 대한 상업화 Sublicense |
|
③ 대상지역 |
중국, 일본, 싱가포르, 인도, 대만, 인도네시아, 태국, 베트남, 말레이시아, 라오스, 캄보디아, 필리핀 |
|
④ 계약기간 |
계약체결일 : 2016.01.25 (3년마다 자동연장되는 계약) |
|
⑤ 총 계약금액 |
- |
|
⑥ 지급금액 |
- |
|
⑦ 계약조건 |
IVD 제품 판매시 순판매액의 3.5% |
|
⑧ 회계처리방법 |
지급할 경상 기술료는 판매관리비로 회계처리 |
|
⑨ 대상기술 |
압타머 기술 기반으로 라이센스된 IVD 분야 |
|
⑩ 기타사항 |
2023년 7월 20일자로 포항공과대학교 산학협력단과 당사 간 체결한 IVD - 아시아 12개국 관련 기술이전 계약 내용이 변경되어, 기존 IVD 제품 판매시 지급되는 수수료율이 순판매액의 7%에서 3.5%로 조정되었습니다. |
(4) 품목 : 시약
|
① 계약상대방 |
포항공과대학교 산학협력단 |
|
② 계약내용 |
계약대상 기술에 대한 상업화 Sublicense |
|
③ 대상지역 |
전세계 |
|
④ 계약기간 |
계약체결일 : 2011.06.07 (3년마다 자동연장되는 계약) |
|
⑤ 총 계약금액 |
20백만원 |
|
⑥ 지급금액 |
20백만원 |
|
⑦ 계약조건 |
학문연구용 시약 관련 순판매액의 3% |
|
⑧ 회계처리방법 |
지급할 경상 기술료는 판매관리비로 회계처리 |
|
⑨ 대상기술 |
압타머 기술 기반으로 라이센스된 시약 분야 |
|
⑩ 기타사항 |
2023년 7월 20일자로 포항공과대학교 산학협력단과 당사 간 체결한 시약 관련 기술이전 계약 내용이 변경되어, 기존 학문연구용 시약 판매 시 지급되는 수수료율이 순판매액의 6%에서 3%로 조정되었습니다. |
(5) Aptamer Sandwich Assay 기술
|
① 계약상대방 |
포항공과대학교 산학협력단 |
|
② 계약내용 |
대상기술에 대한 전용 실시권 부여 및 이를 활용한 압타머 시약개발 |
|
③ 대상지역 |
미국 |
|
④ 계약기간 |
계약체결일 : 2014.06.11 (3년마다 자동연장되는 계약) |
|
⑤ 총 계약금액 |
- |
|
⑥ 지급금액 |
- |
|
⑦ 계약조건 |
기술적용 제품 총 매출액의 6% |
|
⑧ 회계처리방법 |
지급할 경상 기술료는 판매관리비로 회계처리 |
|
⑨ 대상기술 |
Aptamer Sandwich Assay (압타머를 이용한 Sandwich 형태의 어세이) |
|
⑩ 기타사항 |
- |
(6) 기타 (폐암진단키트 개발 노하우)
|
① 계약상대방 |
포항공과대학교 산학협력단 |
|
② 계약내용 |
대상기술에 대한 전용 실시권 부여 및 이를 활용한 압타머 시약개발 |
|
③ 대상지역 |
미국 |
|
④ 계약기간 |
계약체결일 : 2014.06.11 (3년마다 자동연장되는 계약) |
|
⑤ 총 계약금액 |
- |
|
⑥ 지급금액 |
- |
|
⑦ 계약조건 |
기술적용 제품 총 매출액의 6% |
|
⑧ 회계처리방법 |
지급할 경상 기술료는 판매관리비로 회계처리 |
|
⑨ 대상기술 |
Aptamer Sandwich Assay (압타머를 이용한 Sandwich 형태의 어세이) |
|
⑩ 기타사항 |
- |
다. 판매계약
|
계약상대방 |
계약 체결일 |
계약 종료일 |
내 용 |
계약금액 |
|
이원의료재단 |
2019.08.21 |
2022.12.31 |
압토디텍트 렁(AptoDetect™-Lung)의
상업적 서비스를 위한 독점적 공급 (대상지역: 한국 내)
|
- |
|
중국 BGT사
|
2018.11.07 |
2028.11.07 |
압토디텍트 렁(AptoDetect™-Lung)의
상업적 서비스를 위한 독점적 공급 (대상지역: 중국 전지역 - 홍콩, 마카오 포함)
|
- |
|
Biomed사 |
2019.12.30 |
2024.12.30 |
압토디텍트 렁(AptoDetect™-Lung)의
상업적 서비스를 위한 독점적 공급 (대상지역: 싱가포르)
|
- |
|
㈜지씨셀 (주2)
|
2023.08.18 |
2026.08.17 |
압토디텍트 렁(AptoDetect™-Lung)의 상업적 서비스를 위한 독점적 공급
(대상지역: 대한민국)
|
- |
(주1) 이원의료재단과는 계약이 만료되었지만, 판매 영업은 계속 수행하면서 재위탁 형식으로 GC녹십자 의료재단에서 검사를 시행하는 것으로 변경하였습니다.
(주2) ㈜지씨셀은 수탁의료기관인 GC녹십자의료재단의 검체검사서비스 영업 및 마케팅을 전담하고 있으며, GC녹십자의료재단에 압토디텍트 렁 키트를 독점적으로 공급하고 있습니다.
라. 연구개발 활동
(1) 연구개발활동의 개요
당사는 고성능 압타머를 발굴하고 최적화하는 압타머 Platform 기술을 바탕으로 혁신적인 신약 및 진단제품 개발을 위한 역량 확보에 역점을 두고 기초연구를 수행하는 연구부서와 응용기술 개발을 담당하는 사업부가 유기적으로 협력하여 지속적인 연구개발을 추진해 나가고 있습니다
(2) 연구개발 담당 조직
(가) 연구개발 조직 개요
당사의 연구개발 조직은 보고서 작성기준일 현재 CTO, 기술고문과 24인의 실무 기술인력을 포함한 총 26인이며, 연구개발본부, 임상개발팀, ADL사업부 3개의 조직으로 구성되어 있습니다.
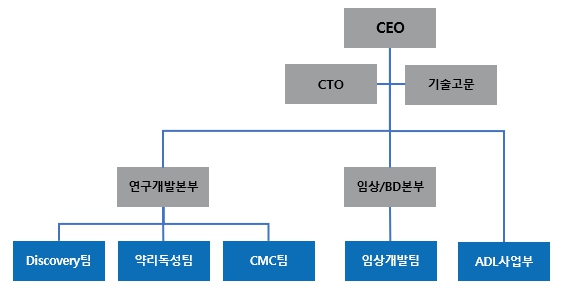 |
|
연구개발 조직 |
보고서 작성기준일 현재 연구개발 본부별 인력 및 주요 업무는 다음과 같습니다.
|
총괄 |
본부 |
본부 인력 |
주요 업무 |
|
CTO/기술고문 (2명) |
연구개발본부 |
19인 |
신약 연구, 신약 전임상, 임상개발 |
| 임상개발팀 |
1인 |
임상 개발 | |
|
ADL사업부 |
4인 |
압토디텍트 렁(AptoDetect™-Lung) 생산 및 임상시험, 판매지원 |
(나) 연구개발 인력 현황
|
구분 |
인원 |
|||
|
박사 |
석사 |
학사 |
합계 |
|
|
연구개발본부 |
5 | 13 | 1 | 19 |
| 임상개발팀 | 1 | - | - | 1 |
|
ADL사업부 |
- | 2 | 2 | 4 |
|
합계 |
6 |
15 |
3 |
24 |
(다) 핵심 연구인력 현황
|
직위 |
성명 |
담당업무 |
주요경력 |
연구실적 |
|
CTO |
류성호 |
신약 기술 |
한국과학기술원 생명과학과 (박사 '85) 국립보건원 박사후 연구원 포스텍 교수 ('88~'22) ㈜압타머사이언스 이사 ('11~현재) |
조합기술을 이용한 펩티드 분자다양성 창출 및 응용 AlloMap 플랫폼 기술 개발 및 구축 논문: 국내 60편, 해외 253편 |
|
기술 |
장승기 |
압타머 관련 |
Univ. of NY of Stony Brook 분자생물학 (박사 '89) 포스텍 교수 ('91~'23) 포스텍 생명공학연구센터 센터장 ㈜압타머사이언스 기술고문 ('11~현재) |
C형 간염 바이러스 효능이 있는 압타머 개발 치료백신 개발을 위한 동물모델 확립 및 백신효능 기전연구 논문: 92편, 특허 22건 |
|
상무 이사 |
이대견 |
연구개발 본부장 |
포스텍 생명과학(박사 '09) ㈜와이디생명과학 팀장('15~'17) ㈜압타머사이언스 연구개발본부 본부장('18~현재) |
신약 개발 업무 총괄 전임상 및 임상 업무 (당뇨 및 간암) 논문 20편(SCI), 특허 5건 |
|
팀장 |
안홍선 |
약리독성팀 |
단국대학교 나노바이오의과학과(박사 '14) 바이오톡스텍 연구원('18~21) 제이투에이치바이오텍 연구원('21-23) |
AST-201, AST-202의 전임상 업무 논문 5편, 특허 10건 |
| 팀장 | 강주형 |
Discovery팀 |
고려대학교 의과학과(박사 '17) |
신규 파이프라인 발굴/개발 연구 (고형암, 면역항암제) |
| 팀장 | 임소령 |
CMC팀 |
부산대학교 바이오소재전공(석사 '13) |
Aptamer-drug conjugate 생산 총괄 |
| 팀장 | 김기중 | 임상개발팀 |
중앙대학교 동물번식육종(박사 '15) 지엔에스바이오 임상총괄팀장 ('16~'19) ㈜대웅제약 임상총괄 ('21~'23) |
19개 연구과제 참여 국내IND 12건, 임상진행 18건 |
(3) 연구개발 비용
당사는 연구개발비용 중 향후 수익 실현 가능성이 높은 개발 단계의 지출에 대해서는한국채택국제회계기준 (K-IFRS)에 따라 자산처리하여 무형자산 중 개발비로 계상하고 있으며, 기준을 충족하지 못하는 지출은 당기 비용으로 회계처리하고 있습니다. 당사의 최근 3년간 연구개발비용 현황은 다음과 같습니다.
|
[연구개발비용 현황] |
|
(단위 : 백만원) |
|
구 분 |
2024년도 반기 |
2023년도 |
2022년도 |
|
|
자산 처리 |
원재료비 |
- | - |
- |
|
인건비 |
- | - |
- |
|
|
감가상각비 |
- | - |
- |
|
|
위탁용역비 |
- | - |
- |
|
|
기타 |
- | - |
- |
|
|
소 계 |
- | - |
- |
|
|
비용 처리 |
제조원가 |
- | - |
- |
|
판관비 |
1,959 | 9,359 | 6,025 | |
|
소 계 |
1,959 | 9,359 | 6,025 | |
|
연구개발비용 합계 |
1,959 | 9,359 | 6,025 | |
|
매출액 |
71 | 243 | 358 | |
|
연구개발비용/매출액 |
2758% | 3848% | 1682% | |
(4) 연구개발 실적
(가) 연구개발 진행 현황 및 향후계획
|
[연구개발 진행 요약표] |
|
구분 |
품목 |
적응증 |
표적 단백질 |
현재 진행단계(주1) |
비고 |
|
치료제 |
신약 |
AST-201 |
고형암 (간암)
|
글라이피칸3
|
- GLP 독성시험 완료 - 임상의약품 생산 완료 |
|
AST-202 |
고형암 혈액암 |
CD25 |
- 동물모델 유효성 평가 - 전임상 단계 |
- 자사개발 (국가신약개발과제 수행 중)
|
|
| AST-203 |
고형암 |
Trop2 |
- 동물모델 유효성 평가 - 선도물질 최적화 단계 |
- 자사개발 |
|
|
표적 방사선 (ApRC) |
항암 |
Undisclosed |
- 동물모델 유효성 평가 |
- 공동연구 (연세대 세브란스 병원 |
|
|
면역조절인자 표적 전달 (ApIS) |
면역항암 |
Undisclosed/ 항종양 면역세포 활성화 |
- 작용기작 및 개념증명 |
- 공동연구 추진 |
(나) 주요 파이프라인
1) AST-201 (고형암치료제)
|
①구 분 |
고형암치료제 |
|
②적응증 |
-
GPC3-양성 종양 - 진행성 간세포암(HCC), 비소세포폐암(NSCLC)
|
|
③작용기전 |
① 수용체(GPC3) 선택적 결합 및 이를 매개로 한 세포 내재화
② Lysosomal degradation을 통한 활성 젬시타빈 방출
③ DNA 손상 및 합성억제, 암세포 성장억제 및 사멸유도
|
|
④제품의특성 |
- 비-TKI 계열 간암 치료제, systemic 항암제의 표적 특이적 약물전달
- 암세포의 젬시타빈 내성 극복 - 종양 특이적 약물전달을 통한 부작용 최소화 및 표적 약리작용 증대 - 약물-압타머 비율(drug-to-aptamer ratio)의 정확한 조절
- 생산 공정의 용이성(약물 내재화를 위한 별도의 공정 필요 없음)
- 폐암, 면역관문억제제 병용요법 등으로의 확장
|
|
⑤진행경과 |
- 원료의약품, 임상용 완제의약품 GMP 생산 완료
- 동물모델에서의 면역관문억제제와의 병용투여 시너지 효과 확인 - GLP 독성시험 완료(시험평가 완료)
- IND 신청완료 |
|
⑥향후계획 |
- 임상1a/b 개시(2024.4Q)
|
|
⑦경쟁제품 |
- 간암의 1차 치료제: Sorafenib, Lenvatinib 등 TKI 계열 약물,
- 간암의 2차 치료제: TKI 계열약물, 일부 면역항암제, 병용치료법
- 기타 암종의 젬시타빈 치료법 |
|
⑧관련논문등 |
“Targeted Therapy of Hepatocellular Carcinoma Using Gemcitabine
-Incorporated GPC3 Aptamer”(2020) Jun Young Park, Ju Ri Chae,
Ye Lim Cho, Youndong Kim, Dasom Lee, Jeong Kyun Lee, Won Jun Kang, Pharmaceutics 2020, 12, 985. |
|
⑨시장규모 |
- 글로벌 간암치료제 시장은 2019년 기준 17.3억불. CAGR 20.2%로 2027년까지
73.8억불 시장으로 성장(Fortune Business Insights 시장보고서)
|
|
⑩기타사항 |
- 글리피칸-3 특이적 압타머 복합체 및 이의 용도 PCT 출원(2020.11, PCT/KR2020 /015536),
|
2) AST-202 (혈액암치료제)
|
①구 분 |
항암제 |
|
②적응증 |
혈액암
|
|
③작용기전 |
- 혈액암에 과발현된 CD25를 표적으로 한 압타머-약물 접합체로 종양세포의 직접적 - Treg(조절 T세포) 표면에 과발현된 CD25 수용체에 작용하여 종양조직 내 Treg의 |
|
④제품의특성 |
- CD25 선택적 압타머-약물 접합체 - CD25-양성 세포 선택적 사멸 유도 - 나노미셀 구조 형성에 의한 개선된 안정성 및 약동력학적 프로파일, 향상된 유효성 - 낮은 혈액학적 부작용(경쟁 ADC 대비 안전) - 선택적 Treg 불활성화와 사멸 유도 및 이를 통한 항종양 면역 활성 증대 - 신속한 종양 표적화와 투과성, 빠른 체내 배출 특성을 활용함으로써 장기적인 Treg소실로 인한 자가면역 등 부작용 및 비특이적 독성 등 부작용 최소화 - 높은 종양조직 투과성 및 종양세포 내재화률, 이를 통한 빠른 세포사멸 유도 - 면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대 |
|
⑤진행경과 |
- 혈액암 동물모델에서의 종양성장 억제 및 완전관해 효과 확인 - 혈액암 동물모델 생존률 평가에서 대조군 대비 AST-202 투여군의 월등히 우수한 생존률 확인 - 고형암 동물모델에서의 유효성 평가 완료 - ELOHA assay 기반 생체시료분석법 개발 완료 - In vitro 대사안정성 및 설치류 렛트 약동력학적(PK) 분석 완료 |
|
⑥향후계획 |
- In vivo 효능평가(추가 혈액암, 경쟁약물 비교 평가, 고형암, 단독투여 및 면역관문억제제 병용투여) - ApDC의 물리화학적 특성, CMC 공정개발(2024, 3Q) - 전임상 GLP 독성 평가(2025) |
|
⑦경쟁제품 |
- CD25 표적 치료제 승인 약물 없음.
- 개발 중인 파이프라인: ADC therapeutics의 ADCT-301(ADC, 임상1, 2상),
|
|
⑧관련논문등 |
- CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용 : 대한민국 특허 출원(2023.06, 10-2023-0149904), |
|
⑨시장규모 |
- 글로벌 ADC 시장은 2021년 기준 58억불. 2030년까지 CAGR 16.4%로
- 글로벌 비호지킨림프종 시장은 2022년 73억불, CAGR 8.2%, 2030년 135억불 예상 (DataM Intelligence 시장보고서)
- 글로벌 급성골수성백혈병 시장은 2023~2030년 예측기간 중 CAGR 11.3%로 성장 |
|
⑩기타사항 |
2022년 제3차 국가신약개발사업 신약기반 확충 연구과제 선정
|
(주1) 보고서 제출일 현재 미국면역항암학회(SITC)에 참가해 'CD25-ApDC 면역항암제’에 대한 최신 연구결과가 발표되었습니다.
(주2) CD25-ApDC에 대한 특허출원이 진행되었습니다(국내출원 및 PCT 출원 동시 진행).
3) AST-203 (고형암 치료제)
|
①구 분 |
항암제 |
|
②적응증 |
고형암 |
|
③작용기전 |
- 다양한 암세포에 과발현하는 세포막 단백질인 Trop2를 표적으로 하는 압타머와 약물 접합체(ApDC®) - 세포 내 리소좀에 존재하는 단백질분해효소 cathepsin B 특이적으로 절단되는 - 방출된 약물은 튜블린다량체화 억제제로 세포분열을 억제하고 세포사멸을 유도함 |
|
④제품의특성 |
- Trop2 선택적 압타머-약물 접합체 - Trop2-양성 종양세포의 선택적 사멸유도 - 나노미셀 구조 형성에 의한 개선된 안정성 및 약동력학적 프로파일, 향상된 - 낮은 혈액학적 부작용(경쟁 ADC 대비 안전) - 신속한 종양 표적화와 빠른 체내 배출 특성을 활용함으로써 종양성장 억제효과는 - 높은 종양조직 투과성 및 빠른 종양세포 내재화률 - 면역관문억제제 병용 투여를 통한 반응률 개선 및 시너지 효과 기대 |
|
⑤진행경과 |
- Trop2 압타머의 표적 선택성, 세포 선택성 확인 - ApDC의 최적화 및 in vitro 활성/기전 평가 완료 - 3차원 종양배양 조건에서 ApDC의 항체대비 우수한 투과성 및 그에 따른 종양 사멸 효과 확인 - microPET 분석을 통한 동물모델에서의 종양 표적화 및 전반적인 조직분포 확인 고형암 동물모델에서의 유효성 평가 진행 중 |
|
⑥향후계획 |
- In vivo 효능평가(비소세포 폐암 모델, 추가적인 췌장암 모델, ICI 병용 평가) - ApDC의 물리화학적 특성, 생체시료분석법 개발, 약동력학적 분석 - 비임상 후보물질 확보(2025. 1Q) |
|
⑦경쟁제품 |
- Trodelvy(Trop2 ADC, approved): 삼중음성 유방암 치료제로 승인받은 - 개발 중인 파이프라인: Daiichi Sankyo의 DS1062(Trop2 ADC, 임상3상), 레고켐의 LCB84(Trop2 ADC, 임상1/2상) |
|
⑧관련논문등 |
해당사항 없음 |
| ⑨시장규모 |
- 글로벌 ADC 시장은 2021년 기준 58억불. 2030년까지 CAGR 16.4%로 성장예상 - Trodelvy 단일 품목의 연 기준 2021년 판매는 3.8억불 |
| ⑩기타사항 | 해당사항 없음 |
4) RNA전달 압타머
|
①구 분 |
약물 전달 플랫폼 |
|
②적응증 |
- 트랜스페린 수용체(TfR) 압타머 : 중추 신경계 질환, 신경 근육계 질환 - 아시알로당단백질 수용체(ASGPR) 압타머 : 간질환 |
|
③작용기전 |
압타머가 표적과 결합하여 Receptor(수용체)를 매개로한 약물의 세포 투과, 또는 |
|
④제품의특성 |
- 결합력이 우수한 특징 보유 (빠른 결합, 산성도에 의한 구조 변화)
- 표적 세포로의 우수한 전달 효율 확인 - 기존 항체 기반 전달체에 비해 동물과 인간에 동시 적용이 가능한 장점을 보유하고 있으며, 압타머로 인한 면역 반응을 유발하지 않아 부작용의 위험이
적음 - 다양한 약물 적용 가능 : mRNA, ASO, siRNA 등 |
|
⑤진행경과 |
- 압타머 발굴 및 최적화 완료 - 최적화된 압타머의 표적 선택성 확인 및 in vitro 작용기전 평가 완료 - RNA delivery 효능 확인 - 다양한 치료제 모달리티 적용에 대해 국내외 기업들과 MTA 체결 후 평가를 진행 |
|
⑥향후계획 |
- 공동 연구 및 자체연구를 통한 data package 보완 - 파트너링을 통한 응용제품 pipeline 확장 |
|
⑦경쟁제품 |
- 트랜스페린 수용체(TfR) 압타머의 경쟁 제품 ·표적세포막 단백질을 표적으로 RMT를 유도하는 항체 기반 플랫폼이 개발되어 ·TfR 표적의 항체 기반 플랫폼은 종간 교차 반응성이 낮아 개발이 어려움 - 아시알로당단백질 수용체(ASGPR) 압타머의 경쟁 제품 ·siRNA가 연결된 3개의 GalNAc(N-acetylgalactosamine) 분자가 ASGPR에 결합해 |
|
⑧관련논문등 |
- 혈액-뇌 장벽 침투 압타머 및 이의 이용 PCT 출원 PCT/KR2021/008212(2021.06.29.), 유럽 출원 21833239.3(2022.12.22.), 일본 출원 2022-580190(2022.12.23.), 미국 출원 18/013,355(2022.12.23.), 중국 출원 202180051261.4(2023.02.20.) |
|
⑨기타사항 |
- 다국적 제약회사 E사와 MTA 체결 및 올리고 핵산 복합체에 대한 물질 평가 진행중 - 일본 제약회사 M사와 MTA 체결 및 올리고 핵산 복합체에 대한 물질 평가 진행중 |
(다) 후속 파이프라인 개발
1) 압타머 기반 항암약물/방사선동위원소 전달 치료제 (ApDC®, ApRC)
|
①구 분 |
압타머 기반 항암약물전달/방사선동위원소 치료제(ApDC®, ApRC)
|
|
②적응증 |
고형암 |
|
③작용기전 |
- ApDC® ·다양한 암세포에 과발현하는 세포막 단백질인 1을 표적으로 하는 압타머와 세포
독성 약물을 결합한 항암제 ·종양 표적화된 ApDC®는 내포작용에 의해 세포 내로 들어가고 방출된 약물에
- ApRC(압타머-치료용 방사선동위원소 접합체)
·표적 특이적 압타머를 활용하여 치료용 방사선핵종의 종양 표적 전달 ·전달된 방사선핵종에 의한 DNA 손상 및 세포사멸 유도
|
|
④제품의특성 |
- 표적 압타머 기술과 링커-약물 기술을 접합한 압타머 기반 항암약물전달 치료제
- 항체기반 약물전달체(ADC)의 용량제한독성(DLT)와 그로 인한 좁은 치료계수
- ApRC의 치료용 방사선핵종의 표적 전달을 위해 압타머-chelator 접합체 도입
- ApRC의 경우, 방사선핵종의 신속한 종양 표적 전달 및 빠른 체외 배출로 치료효과 |
|
⑤진행경과 |
- 신규 ApDC® 개발을 위한 새로운 표적 압타머(≥2 종) 발굴 완료, 세포선택성 및
- ApRC 제조를 위한 압타머-chelator 합성공정 확립
- 진단용 방사선핵종인 68Ga를 활용한 ApRC ≥4 종 제작 및 다양한 종양 동물모델 |
|
⑥향후계획 |
- 신규 ApDC®의 압타머 및 약물접합체 최적화
- 신규 ApDC®의 in vivo 표적화 및 효능 평가(췌장암, 소세포폐암 모델)
- 치료용 방사선핵종이 탑재된 ApRC의 제작 및 안정성 평가
- ApRC의 개념입증(POC)를 바탕으로 플랫폼 기술이전 및 공동개발 추진
|
|
⑦경쟁제품 |
- 췌장암, 소세포폐암 등을 적응증으로 개발하고 있는 ADC 및 PDC 파이프라인
- PLUVICTO(PSMA 표적 방사선치료제, 전립선암), 펩타이드 기반 표적 방사선 치료
기술(Peptidream, RazyeBio, Bicycle therapeutics), 항체 기반 표적 방사선 치료 기
술ㄱ |
|
⑧관련논문등 |
해당사항 없음 |
|
⑨시장규모 |
- 글로벌 ADC 시장은 2021년 기준 58억불. 2030년까지 CAGR 16.4%로
성장예상 - 종양표적 방사선 치료제 PLUVICTO 단일 품목의 연기준 2023년 글로벌 판매는
9.8억불 |
|
⑩기타사항 |
해당사항 없음 |
2) AptoDetect™-HCC (간암 진단키트)
|
①구 분 |
AptoDetect™-HCC (간암 조기진단)
|
|
②적응증 |
간암 조기진단 |
|
③작용기전 |
간암 특이적 바이오마커 5종 이하 단백질을 혈액에서 측정하여 위험도 제공
|
|
④제품의특성 |
- 정상인 및 간암 발병 고위험군 대상 조기진단 정보 제공 1그룹: 정상인 대상 간암 선별 검사
2그룹: B형간염, C형간염, 간경변증 환자 등 고위험군 대상 선별 검사
- 혈액에서 5종이하 단백질 측정, 알고리즘을 통한 점수화 (score 0~10)
- 간암 진단 가이드 및 간암 위험도 정보 제공 - 극미량의 검체시료로 분석 가능 (혈청, 3μl)
|
|
⑤진행경과 |
- 간암 특이적 마커를 포함한 classifier 확정
|
|
⑥향후계획 |
- 확정된 classifier에 대한 추가 탐색적 임상 수행
|
|
⑦경쟁제품 |
- 이그젝트사이언스 간암진단 제품(Oncoguard Liver) 임상시험 진행 중
바이오마커: methlyation DNA 3종 + 단백질 1종(AFP)
- 프로테옴텍 간암진단키트 22년 시판 예정
바이오마커 : 혈중 autoantibody 측정
① 현재 체외진단 옵션: AFP 또는 PIVKA-II 단일마커를 사용한 진단. 낮은 진단
정확도로 미충족 수요 높음 ② 혈액에서 간암 조기진단 및 고위험군 대상 환자 선별 검사를 높은 정확도로 위험도 정보 제공 ③ 상용화된 단일마커 진단법의 높은 위양성률을 극복할 수 있음 |
|
⑧관련논문등 |
해당사항 없음 |
|
⑨시장규모 |
간암 진단 시장 (2017년 기준 82억 5,000만불, 2028년 기준 174억불 예상)
|
|
⑩기타사항 |
해당사항 없음 |
(라) 압타머 아카이브
당사는 기구축된 우수한 압타머 발굴 플랫폼 기술을 사용하여 현재까지 약 250여종의 단백질에 특이적으로 결합력이 확인된 1,500여종의 압타머 서열정보 아카이브를 보유하고 있습니다.
특히 치료제 개발에 중요한 의미를 갖는 세포막 단백질에 특이적으로 결합하는 압타머 발굴에 집중하여 아래 표와 같이 단백질 250여종에 대한 압타머를 확보하고 있으며, 지속적으로 압타머 개발과제 및 연구협력을 통해 아카이브를 확장하고 있어 경쟁사와의 격차는 더욱 벌어질 것으로 예상합니다.
![이미지: [압타머 아카이브 (DB) 구축]](%5B%EC%95%95%ED%83%80%EB%A8%B8%20%EC%95%84%EC%B9%B4%EC%9D%B4%EB%B8%8C%20%28db%29%20%EA%B5%AC%EC%B6%95%5D.jpg) |
|
[압타머 아카이브 (DB) 구축] |
(5) 연구개발 완료 실적
|
[연구개발완료 실적] |
|
구분 |
품목 |
적응증 |
개발완료일 |
현재 현황 |
비고 |
|
진단제품 |
압토디텍트 렁 (AptoDetect™-Lung) |
폐암 |
2017년 9월 |
국내 판매중 | 평가 유예 신의료기술 (보건복지부 고시 제2022-174호)에 따라, 병원내 비급여 검사 가능 |
(6) 연구개발활동 및 판매 중단 현황
해당사항 없음
(7) 기타 연구개발 실적
당사는 보고서 작성기준일 현재 연구개발과 관련이 있는 정부 출연과제 수행 실적은 다음과 같습니다.
|
지원기관 |
사업명 |
과제명 |
과제기간 |
|
중소기업청 |
창업성장 건강진단 연계형 기술개발사업 |
압타머를 이용한 표적 암세포 및 혈관내피세포 분리기술개발 및 kit 제품 개발 |
2013.06 ~ 2014.05 |
|
보건산업진흥원 |
보건의료연구 개발사업 |
압타머 기반 신종인플루엔자 바이러스 실시간 |
2014.03 ~ 2016.10 |
|
범부처 |
범부처전주기 신약개발사업 |
선택적 인슐린 수용체 아고니스트 압타머 개발 |
2016.12 ~ 2018.06 |
|
범부처 신약개발사업단 |
범부처전주기 신약개발사업 |
선택적 인슐린 수용체 아고니스트 개발 |
2019.01 ~ 2019.09 |
|
보건산업진흥원 |
첨단의료기술개발 |
압타머 A48ms를 이용한 인슐린 수용체 표적 당뇨 치료제 비임상 개발 |
2020.04 ~ 2022.12 |
|
보건산업진흥원 |
코로나19 치료제· |
Covid-19 중화압타머 치료제 개발 |
2021.05 ~ 2022.05 |
|
국가신약개발재단 |
국가신약개발사업 |
CD25 표적 압타머-약물 접합체를 이용한 조절 T 세포 선택적 억제/사멸 기전의 면역항암제용 선도물질 도출 |
2022.08 |
(8) 지적재산권 현황
(가) 포항공대 압타머 사업단에서 개발되어 당사가 우선 실시권을 보유한 특허
당사는 2011년 포항공대 보유 압타머 기술자산에 대한 우선 실시권을 확보하였으며, 해당 우선 실시권은 포항공대 특허에 대하여 당사가 배타적 실시권의 행사를 선택할 수 있는 옵션 권리입니다. 당사가 우선 실시권을 보유한 해당 기술자산은 다음과 같습니다.
|
번호 |
특허명 |
특허권자 |
출원번호 |
등록번호 |
국가 |
존속기간 |
|
1 |
생물약제인 것의 지속형 포뮬레이션 |
포항공대 산학협력단 |
12422950 |
US8247493 B2 |
미국 |
2029.05.23 |
|
2 |
압타머를 이용한 Sandwich 형태의 |
포항공대 산학협력단 |
13092209 |
US8785132 B2 |
미국 |
2032.04.13 |
|
3 |
아미노링커 올리고 뉴클레오타이드의 제조방법 (Method of preparing 5'-amino-linker oligonucleotides derivatives) |
포항공대 산학협력단 |
12559666 (2009.09.15) |
US8124756 B2 (2012.02.28) |
미국 |
2029.10.27 |
| 4 |
C형 간염바이러스의 표면 단백질 E2에 |
포항공대 산학협력단 |
1020130048749 (2013.04.30) |
10-1480495 (2015.01.02) |
한국 |
2033.04.30 |
|
5 |
인슐린 수용체 압타머 및 이를 포함하는 약학적 조성물 (Aptamer against insulin receptor containing the same) |
포항공대 산학협력단 |
1020160094621 (2016.07.26) |
10-1881500 (2018.07.18) |
한국 |
2036.07.26 |
(나) 당사가 출원한 지적재산권(특허권, 상표권)
|
번호 |
구분 |
내용 |
권리자 |
출원일 |
등록일 |
적용제품 |
국가 |
|
1 |
특허권 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 |
2015.09.11 |
- |
폐암 조기 |
PCT |
|
2 |
백혈구에 선택적으로 결합하는 압타머 및 이의 용도 |
㈜압타머사이언스 |
2017.04.26 |
2019.06.20 |
- |
한국 |
|
|
3 |
인플루엔자 H3N2 아형에 결합하는 압타머 및 이의 용도 |
㈜압타머사이언스/포항공대 |
2017.08.23 |
11항 대리 특허에 통합됨 |
- |
미국 |
|
|
4 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 |
2018.03.08 |
2023.01.06 |
폐암 조기 |
싱가 |
|
|
5 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 |
2018.03.12 |
2020.02.11 |
폐암 조기 |
한국 |
|
|
6 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 |
2018.03.12 |
2021.12.10 |
폐암 조기 |
중국 |
|
|
7 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 |
2018.03.12 |
2021.03.23 |
폐암 조기 |
일본 |
|
|
8 |
비소세포 폐암 검출을 위한 단백질 바이오마커 패널과 진단 방법의 사용 |
㈜압타머사이언스 |
2018.03.12 |
- |
폐암 조기 |
인도 |
|
|
9 |
인슐린 수용체 압타머 및 이를 포함하는 당뇨병 치료용 약학적 조성물 |
㈜압타머사이언스 |
2018.05.10 |
- |
당뇨 치료제 |
PCT |
|
|
10 |
대리 바이러스를 이용한 압타머 제조 방법 |
㈜압타머사이언스/포항공대 |
2018.08.22 |
2021.07.05 |
- |
한국 |
|
|
11 |
METHOD FOR PREPARING |
㈜압타머사이언스/포항공대 |
2018.08.22 |
- |
- |
PCT |
|
|
12 |
압타머를 이용한 다중(multiplex) |
㈜압타머사이언스 |
2019.02.01 |
2020.11.05 |
- |
한국 |
|
|
13 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 |
2019.11.08 |
2020.09.04 |
간암 |
한국 |
|
|
14 |
압타머를 이용한 다중(multiplex) |
㈜압타머사이언스 |
2019.12.09 |
- |
- |
PCT |
|
|
15 |
인슐린 수용체 압타머 및 이를 포함하는 당뇨병 치료용 약학적 조성물 |
㈜압타머사이언스 |
2020.02.19 |
- |
당뇨 |
미국 |
|
|
16 |
Allosteric enhancer IR-A43 increases insulin binding by stabilizing hotspot of the insulin receptor |
㈜압타머사이언스 |
2020.03.20 |
- |
당뇨 |
미국 |
|
|
17 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 |
2020.11.06 |
- |
간암 |
PCT |
|
|
18 |
Insulin receptor-specific aptamer and use thereof |
㈜압타머사이언스 |
2021.03.26 |
- |
당뇨 |
PCT |
|
|
19 |
신종 코로나바이러스 특이적 |
㈜압타머사이언스 |
2021.04.22 |
- |
항원 |
한국 |
|
|
20 |
혈액-뇌 장벽 침투 압타머 및 이의 이용 |
㈜압타머사이언스 |
2021.06.24 |
- |
BBB |
한국 |
|
|
21 |
혈액-뇌 장벽 침투 압타머 및 이의 이용 |
㈜압타머사이언스 |
2021.06.29 |
- |
BBB |
PCT |
|
|
압타머를 이용한 다중 (multiplex) PCR 방법 |
㈜압타머사이언스 |
2021.07.30 |
- |
- |
미국 |
||
|
인슐린 수용체 특이적 압타머 및 이의 이용 |
㈜압타머사이언스 /포항공과대학교 산학협력단 |
2022.03.03 |
- |
당뇨 치료제 |
한국 |
||
|
EGFRvIII 특이적 압타머 및 이의 용도 |
㈜압타머사이언스 |
2022.03.18 |
- |
GBM |
한국 |
||
|
25 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 |
2022.05.05 |
- |
간암 |
미국 |
|
|
26 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 |
2022.05.06 |
- |
간암 |
일본 |
|
|
27 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 |
2022.05.24 |
- |
간암 |
유럽 |
|
|
28 |
글리피칸-3 특이적 압타머 복합체 및 이의 용도 |
㈜압타머사이언스 |
2022.06.20 |
- |
간암 |
중국 |
|
| 29 |
방사선 내성 암 바이오 마커에 특이적으로 결합하는 압타머 및 이의 용도 |
㈜압타머사이언스 /한국원자력의학원 |
2022.12.16 | - | 진단 | 한국 | |
|
30 |
BLOOD-BRAIN BARRIER PENETRATING APTAMER AND USE THEREOF |
㈜압타머사이언스 |
2022.12.22 |
- |
BBB셔틀 |
유럽 |
|
|
31 |
BLOOD-BRAIN BARRIER PENETRATING APTAMER AND USE THEREOF |
㈜압타머사이언스 |
2022.12.23 |
- |
BBB셔틀 |
일본 |
|
|
32 |
BLOOD-BRAIN BARRIER PENETRATING APTAMER AND USE THEREOF |
㈜압타머사이언스 |
2022.12.23 |
- |
BBB셔틀 |
미국 |
|
|
33 |
혈액-뇌 장벽 침투 압타머 및 이의 이용 |
㈜압타머사이언스 |
2023.02.20 |
- |
BBB셔틀 |
중국 |
|
|
34 |
인슐린 수용체 특이적 |
㈜압타머사이언스 /포항공과대학교 산학협력단 |
2023.03.03 |
- |
당뇨 치료제 |
PCT |
|
|
35 |
티미딘으로부터 개질된 |
㈜압타머사이언스 |
2023.03.09 |
- |
- |
한국 |
|
|
36 |
EGFRvIII 특이적 압타머 및 |
㈜압타머사이언스 |
2023.03.17 |
- |
GBM |
PCT |
|
| 37 |
CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용 |
㈜압타머사이언스 |
2023.06.16 |
- |
혈액암 치료제 |
한국 |
|
| 38 |
CD25를 표적으로 하는 압타머 및 이의 약물 접합체의 이용 |
㈜압타머사이언스 |
2023.11.02 |
- |
혈액암 치료제 |
PCT |
|
| 39 | 티미딘으로부터 개질된 뉴클레오시드의 제조방법 |
㈜압타머사이언스 | 2023.11.02 | - | - | PCT | |
| 40 |
분지형의 효소 절단 가능한 링커-페이로드와 이의 효율적인 제조방법 |
㈜압타머사이언스 |
2023.12.26 |
- |
링커 |
한국 |
|
| 41 |
글리피칸-3 특이적 변형 압타머 및 이의 용도 |
㈜압타머사이언스 | 2024.01.26 | - | 간암 치료제 |
한국 | |
| 42 |
치료용 담체로서 항 Trop2 압타머 |
㈜압타머사이언스 | 2024.07.15 | - | 췌장암 치료제 |
한국 |
(다) 당사가 출원한 상표권
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
적용제품 |
출원국 |
|||
|
1 |
압타머사이언스 |
㈜압타머사이언스 |
2018.10.05 |
2019.06.13 |
전체제품 |
한국 |
|||
|
2 |
Aptamer Sciences |
㈜압타머사이언스 |
2018.10.05 |
2019.06.13 |
한국 |
||||
|
3 |
|
㈜압타머사이언스 |
2019.02.01 |
2019.12.26 |
한국 |
||||
|
4 |
AptoDetect |
㈜압타머사이언스 |
2018.10.15 |
2019.9.05 |
폐암 조기 |
한국 |
|||
|
5 |
AptoDetect |
㈜압타머사이언스 |
2018.10.12 |
2019.6.28 |
중국 |
||||
|
6 |
AptoDetect |
㈜압타머사이언스 |
2018.10.23 |
심사통과 |
인도네시아 |
||||
|
7 |
AptoDetect |
㈜압타머사이언스 |
2018.10.17 |
2019.12.06 |
일본 |
||||
|
8 |
AptoDetect |
㈜압타머사이언스 |
2018.10.19 |
2019.9.05 |
싱가포르 |
||||
|
9 |
|
㈜압타머사이언스 |
2019.09.10 |
2020.03.07 |
전체제품 |
중국 |
|||
|
10 |
ApDC® |
㈜압타머사이언스 |
2024.01.31 |
- |
치료제 |
한국 |
|||
| 11 | ApRC | ㈜압타머사이언스 | 2024.06.12 | - | 치료제 | 한국 |
7. 기타 참고사항
가. 산업 동향
(1) 압타머 산업의 연혁
압타머 기술은 1990년 미국 콜로라도 주립대학의 Larry Gold 교수에 의해 처음 발명된 이후 1999년 Gilead Sciences사로 기술이전 되었다가 2000년대 들어 SomaLogic, Archemix, Eyetech사로 사업영역별로 기술이전 되어 본격적인 상업화 단계에 돌입하게 되었습니다.
2005년 최초의 압타머 치료제인 Macugen이 Eyetech/Pfizer사에 의해 출시되면서 본격적인 시장의 주목을 받게 되었고, 압타머를 이용한 치료제 개발권을 독점하고 있던 Archemix사는 2006년부터 Pfizer, Merck, Johnson & Johnson (J&J)사 등 여러 글로벌 제약사들과 전략적 제휴계약을 체결하면서 당시 최고로 유망한 바이오텍 회사의 하나로 주목받았습니다. 또한, 압타머 진단제 개발권을 독점하고 있던 SomaLogic사 역시 Novartis사 등과 전략적 제휴 계약을 체결하면서 다양한 진단제품 개발을 주도하였습니다.
![이미지: [압타머 특허의 기술이전 흐름도]](%EC%95%95%ED%83%80%EB%A8%B8%20%ED%8A%B9%ED%97%88%EC%9D%98%20%EA%B8%B0%EC%88%A0%EC%9D%B4%EC%A0%84%20%ED%9D%90%EB%A6%84%EB%8F%84%20%282020_08_06%2003_01_21%20utc%29.jpg) |
|
[압타머 특허의 기술이전 흐름도] |
일부 회사만이 독점한 폐쇄적인 특허상황은 연구자들도 매우 제한적인 접근이 가능했고, 이는 기술 개량 지연을 초래하면서 바이오 시장의 주류로 자리 잡지 못하게 된 주된 원인이 되었습니다.
2010년 압타머 발굴 원천기술 특허가 만료되고 연구논문 성과가 급증하는 추세를 보이고, 최근 압타머 2호 신약으로 FDA 승인을 획득한 노인성 황반변성 치료제인 아이베릭사의 Izervay의 출시와 글로벌 제약사 아스텔라스의 인수합병은 본격적인 압타머 기반 제품 개발에 대한 시장의 관심 증대의 계기가 되었고, 새로운 치료제 및 제품 출시의 시발점이 될 것으로 보입니다.
(2) 압타머 시장 전망
글로벌 압타머 시장은 2017년 13억불 규모에서 2025년에는 59억불 규모로 성장하면서 연평균 20.9%의 높은 성장률을 보일 것으로 전망되고 있습니다. 분야별로 보면 연구 분야는 5억불 규모에서 2025년에는 24억불 규모로, 진단 분야는 2017년 4억불 규모에서 2025년 20억불 규모로, 치료 분야는 2017년 1억불 규모에서 2025년 5.3억불 규모로 성장할 것으로 전망됩니다. 아직은 압타머 기반 치료제가 본격적으로 시장에 출시하지 않았기에 치료 분야의 시장이 적은 비율을 차지하지만, 향후 현재 임상 시 진행 중인 치료제들의 출시가 있게 되면 치료 분야에서 급격한 성장이 예상됩니다.
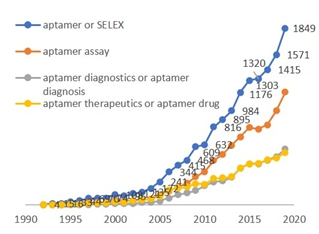 |
|
압타머 분야 연도별 논문 게재수 |
![이미지: [글로벌 압타머 시장 전망, 2017-2025]](emb00001f6825fe.jpg) |
|
[글로벌 압타머 시장 전망, 2017-2025] |
(출처: Global Aptamer Market, Transparency Market Research, 2017-2025)
항체 기술은 30년 이상의 오랜 연구 기간을 통해 기술적 성숙도를 키워왔음에도 불구하고 여전히 항체 자체로는 해결할 수 없는 미충족 수요가 상당히 있고, 압타머 기술은 이를 해결하기 위한 대표적인 대안기술로 주목받고 있습니다. 치료제 소재로서 압타머는 핵산 물질로 항체와 달리 면역원성이 낮고 항체 대비 1/5-1/10의 작은 크기로 높은 조직 투과성을 보이며, 표적과 3차원 공간 인식을 통해 결합함으로써 높은 표적 선택성과 결합력을 가지고 있습니다. 생물학적으로 생산되는 항체 조각 기술, 비항체 단백질 결합체 기술과 달리 화학적으로 합성되기에 제조 공정상 야기되는 잔류 단백질 등의 문제도 없어 제조공정에서의 우위가 있습니다.
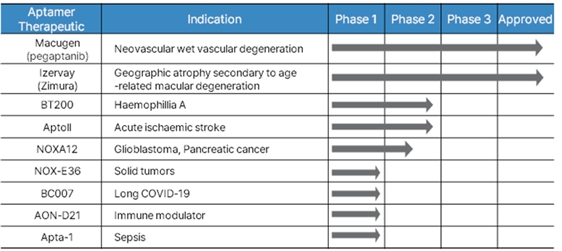 |
|
글로벌 압타머 치료제 임상 진행 현황 |
안과부터 종양학, 감염성 질환에 이르기까지 다양한 적응증에 대한 압타머 치료제가 현재 임상에 사용되고 있습니다. 2023년 마침내 두 번째 압타머 신약으로 아이베릭사의 노인성 황반변성 치료제 ‘Izervay’가 FDA의 승인을 취득하였고, 같은 해 아이베릭사는일본의 글로벌제약회사인 아스텔라스에 59억 달러로 인수되어 종속회사로 편입되었습니다.
(3) 압타머 회사
압타머 발굴 기술이 본격적인 성장기에 접어들면서 압타머 분야에서 활동하는 회사들도 늘어나고 있습니다. 압타머 회사는 압타머 발굴 서비스를 제공하는 회사와 압타머 기반 치료제 및 진단제를 개발하는 회사로 구분할 수 있습니다.
변형핵산 SELEX 기술과 ViroSELEX 기술 등 차별화된 기술력을 보유하고 있는 당사는 BCC 리서치 등 시장조사 전문기관들이 발간하는 보고서에서 아시아권에서는 유일하게 압타머 분야 major player에 포함되고 있습니다; The major players in aptamers market include: AM Bio (US), Aptamer Sciences (South Korea), Aptamer Solutions (UK), Aptus Biotech (Spain), Base Pair Bio (US), NeoVentures (Canada), SomaLogic (US), TriLink (US) and Vivonics (US).
치료제 분야는 Pfizer, Novartis사 등 글로벌 제약회사가 주도해 오고 있으며, 최근 AstraZen eca사가 압타머 기반 약물전달 기술 개발을 시작한다고 발표하였고, 이외에도 Otsuka 제약을 필두로 한 일본 제약회사, 그리고 아이베릭(구 Ophthotech), Noxxon, Ribomics, TAGCyx사 등이 활동하고 있습니다. 아이베릭사는 노인성 황반변성(AMD) 치료제인 Izervay (약물명: avancicaptad pegol)에 대한 FDA 승인을 취득하였고, Ribomics사도 RBM-007 약물을 대상으로 wet AMD 치료제 임상 2b상을 진행하고 있습니다.
2020년 국내에서는 GC녹십자가 일본의 TAGCyx사와 혈전 장애 치료 압타머(TAGX-0004)에 대한 공동 연구개발 계약을 체결하였으며, 아주약품도 일본의 Ribomics사로부터 노인성 황반변성 치료제(RBM-007, 임상 2상 진행 중)에 대한 한국 및 동남아지역 판매계약을 체결하였습니다.
진단제 분야는 압타머 기술의 발명자인 Larry Gold 박사가 설립한 미국의 SomaLogic사가 SOMAscan array 기술을 기반으로 Wellness Chip 개발을 추진하고 있고, SPAC 합병을 통하여 21년 나스닥에 상장하였습니다. 이외 미국의 동반진단제품을 개발하는 Caris Life Sciences사 등이 포함됩니다.
![이미지: [압타머 회사 현황]](%EC%95%95%ED%83%80%EB%A8%B8%20%ED%9A%8C%EC%82%AC%20%ED%98%84%ED%99%A9%20%282020_08_06%2003_01_21%20utc%29.jpg) |
|
[압타머 회사 현황] |
나. 시장 현황
(1) 간암치료제 시장 (AST-201)
(가) 시장의 특성
전 세계 간암 환자는 2012년 약 80만명이 새로 발견되었으며, 이중 62.5%인 50만명이 간세포 암(HCC) 환자로 판명되었습니다. 주요 7개 시장(미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본)의 2014년 간세포 암 진단은 96,300명이며, 2024년에는 118,600명으로 증가할 것으로 예측됩니다. (출처: Global Data 2015)
간암의 발생은 주로 아시아 지역과 사하라 사막 이남 아프리카 지역에서 높고, 북미와 유럽은 상대적으로 낮습니다. 중국의 경우 B형 간염바이러스 감염이 주된 원인이며, 일본의 경우 C형 간염바이러스 감염이 주된 원인이 됩니다.
국내의 간암 환자는 2021년 15,131명이 새로 진단되어 전체 암종 중 7위에 해당하지만, 2022년도 사망률 통계에 따르면 10만 명당 19.9명으로 암 사망원인 2위를 차지했습니다. (출처: 통계청 2022년 사망원인 통계)
간암 치료에 사용되는 1차 치료제는 Sorafenib(상표명 Nexavar)이지만 치료 효과가 낮고 (2-3개월 생존 연장), 환자 대부분이 재발하기 때문에 2차 치료제 개발 및 Sorafenib을 대체할 수 있는 1차 치료제 개발에 대한 수요가 높습니다. 2020년 Atezolizumab+Bevacizumab의 병용요법이 Sorafenib 대비 우수한 치료 효과를 바탕으로 기존치료제인 Sorafenib, Levantinib과 함께 새로운 1차 치료제로 승인되었습니다. 2차 치료제 라인업에는 일부 TKI 계열 약물 및 면역항암제들이 포함되어 있지만, 최근 BMS사가 자사 면역항암제 옵디보(Opdivo)의 간암치료제 가속 승인을 자진 철회할 정도로 충분한 치료목표를 달성하지 못하고 있는 실정입니다.
간 조직의 특성상 화학 치료제에 대한 간 독성이 개발의 큰 허들이고, 면역항암제의 적응증 추가도 어려운 상황에서 효과적으로 간암을 치료할 수 있는 새로운 기전의 치료제 개발의 수요는 더욱 높아지고 있습니다. 또한, 신규 후보 치료제들의 효능 미충족으로 효과적으로 간암을 치료할 수 있는 새로운 기전의 치료제 개발의 수요가 높습니다.
(나) 시장 규모 및 전망
글로벌 간암 치료제 시장은 2019년 기준 17.3억불 규모에 달했으며, 연평균 20.2%의 성장률로 2027년 약 73억불 시장으로 성장할 전망입니다.
현재의 간암 치료제 시장은 1차 치료제인 Sorafenib, Atezolizumab+bevacizumab 병용요법 등 치료옵션이 제한적이며, 향후 시장에 진입할 표적 치료제 파이프라인에 의해 시장 규모가 증가할 전망입니다. (출처: Fortune Business Insight)
2024년까지 7개 주요 시장 중 가장 큰 시장은 2.3억불 규모의 미국이 차지할 전망이지만 낮은 연평균 성장률 (CAGR 1.3%)을 기록할 것으로 예상하며 이는 Sorafenib의 특허 기간 종료 (2020-2022년)에 따른 제네릭 등장과 가격 인하에 기인할 것으로 분석됩니다. 같은 기간 내에 나머지 유럽 5개국(영국, 프랑스, 독일, 이탈리아, 스페인) 및 일본은 상대적으로 높은 연평균 성장률(유럽 4%, 일본 3.7%)을 기록할 것으로 예상됩니다.
향후 시장 성장은 Sorafenib 1차 치료 이후 사용 가능한 고비용의 2차 치료제 개발이 환자의 생존 연장과 치료 기간 연장으로 치료에 포함되는 환자 수를 증가시켜 시장 성장을 견인할 것으로 예측됩니다. 인구 고령화와 C형 간염 바이러스 감염에 따른 간암 환자의 증가(7개 주요 시장 연평균 성장률 1.97%)에 따라 간암 치료제 시장의 성장이 예상됩니다. (출처: Global Data 2015)
(2) 면역항암제 시장 (AST-202)
(가) 면역관문억제 기반 면역항암제 시장의 특성
면역항암제는 인체의 면역체계 자체를 강화시켜 항암작용을 나타내는 방식으로, 효과가 광범위하며 전신면역계의 기억능력을 통해 효과가 장기간 지속되는 치료법입니다. 세부적으로는 면역조절제(Immunomodulator), 항암백신(Cancer vaccine), 입양세포치료제(Adoptive cell therapy), 항체기반 표적치료제(Antibody-based targeted therapy), 항암바이러스(Oncolytic virus)로 구분하여 설명할 수 있습니다. 현재 시장에서 허가받은 치료제는 주로 면역관문억제제입니다.
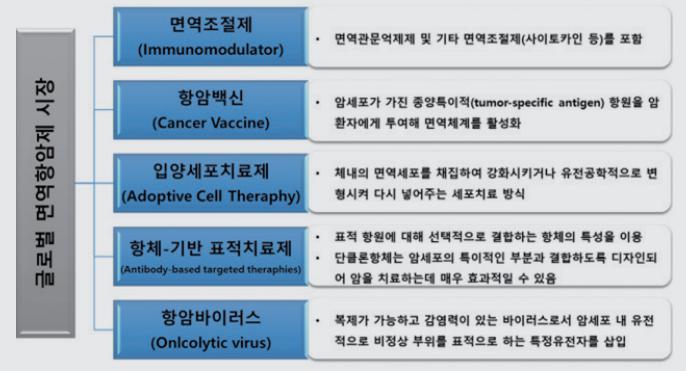 |
|
글로벌 면역항암제 시장 |
[글로벌 면역항암제 시장 세부분류 및 설명(Frost & Sullivan 2020)]
암세포는 그 표면에 PD-L1을 발현하여 T 세포에 의한 면역 공격을 억제하는데, 면역관문억제제의 경우 ①활성이 저하된 T 세포의 면역관문수용체(PD-1, CTLA-4 등)에 결합하여 T 세포의 기능을 활성시키거나, ②암세포 표면의 PD-L1과 결합하여 암세포가 T 세포의 면역 공격을 받을 수 있도록 하는 작용기전으로 암을 사멸시킵니다. 이러한 면역관문억제제는 체내 면역반응을 동적으로 이용함으로써 부작용이 적고 뛰어난 치료효과를 보이며, 펨브롤리주맙(Pembrolizumab, 상표명 키트루다), 니볼루맙(Nivolumab, 상표명 옵디보)등 여러 약물이 FDA승인을 받고 있습니다. 또한, 미충족 의학 수요가 높은 흑색종, 비소세포폐암 등의 암종에서부터 두경부암, 신장암, 대장암 등 FDA 승인 적응증을 확대해나가며 시장을 넓혀가고 있습니다.
그러나, 면역항암제는 일부 암종 및 환자에서 기존 항암제를 뛰어넘는 큰 효과를 보였음에도 불구하고, 대다수의 환자에게서 반응률이 약 20% 내외로 치료 효과가 제한적이라는 한계를 보이고 있습니다. 또한, 현재 사용되고 있는 면역항암제는 PD-1, PD-L1, CTLA-4 등과 같이 특정 타겟 단백질에 집중되어 있으므로 기존 항암제와 마찬가지로 내성 문제가 한계점으로 남아있는 실정입니다.
따라서, 최근에는 면역관문억제제와 기존/신규 약물과 병용하는 치료법 혹은 암세포의 면역 회피를 차단하는 새로운 기전(T 세포 활성 제어 바이오마커)을 이용한 치료법의 개발 수요가 높아지고 있습니다.
면역관문억제제의 반응률에 영향을 미치는 큰 요인 중 하나는 종양미세환경(Tumor- Microenviroment, TME)으로, TME는 다양한 면역세포, 기질세포, 세포외기질 등으로 구성되며 암세포는 TME 매개되는 다양한 기전으로 면역 감시를 회피하고 있습니다. 특히, 조절 T 세포(Regulatory T cell, Treg)는 종양 내로 T 세포 침투를 제한하며, 종양 내에서 낮은 효과 T 세포(Effector T cell, Teff)/Treg 세포 비율은 면역치료요법의 제한 혹은 실패에 상당히 기여하고 있음이 밝혀지고 있습니다. 따라서, 종양 내 Treg을 타겟으로 하여 Treg 활성 조절과 선택적 사멸을 일으켜 Teff/Treg 세포 비율을 높임으로써, Teff 반응을 유도하는 새로운 면역치료제의 개발 수요는 매우 높은 실정입니다.
(나) 면역항암제 시장 규모 및 전망
IQVIA 보고서(2021)에 따르면, 2021년부터 2025년까지 항암제 시장의 연평균 성장률은 9~12% 그리고 시장규모는 약 2,700억달러까지 성장할 것으로 예상되고 있습니다. 항암제 관련 분야에 있어서 지난 5년간 괄목할 만한 성장세는 계속 유지될 것으로 보이며, 특히 면역항암제 분야는 소비규모(시장규모) 측면에서 전체 항암제 분야 중 20%를 차지하면서 항암 치료제 분야를 선도하는 부문이 될 것으로 예상되고 있습니다. 2025년까지 면역항암제는 더욱 향상된 치료를 위한 신규의 선택지로 각광받으며, 시장규모가 조사기관에 따라 다르지만 500억달러를 휠씬 상회할 것으로 전망되고 있습니다.
(3) RNA전달 압타머 시장
(가) 시장의 특성
현재 바이오의약품 및 유전자 치료제 분야에서 RNA치료제 시장이 새로운 주목을 받아 급격한 발전을 겪고 있습니다. RNA치료제는 유전자를 수정하거나 대체하여 다양한 질병을 치료하는데 사용되는데, 특히 암, 유전자 관련 질환, 대사성 질환 등의 질병에 대한 효과적인 치료법을 찾는 데 중점이 맞추어져 있습니다. mRNA 백신은 전염병 대응에서 성공을 거두었으며, siRNA, ASO 치료제는 암 및 유전자 관련 질환의 치료에 대한 새로운 접근법을 제시하고 있습니다.
이러한 RNA치료제의 임상적 성공을 위해서는 효과적인 전달체의 개발이 필수적입니다. 치료제의 안정성을 높이고 표적 조직까지 효과적으로 전달할 수 있는 기술의 개발이 향후 RNA치료제의 성패를 좌우할 핵심 요소로 인식되고 있는 만큼 맞춤형 약물 전달 기술(플랫폼)의 개발은 RNA치료제 시장의 성장과 밀접한 연간이 있으며 이에 대한 수요는 지속적으로 증가할 것으로 예상됩니다.
(나) 시장 규모 및 전망
RNA 치료제 시장 규모는 지난 2022년 5조1000억원에서 2024년 14조5000억원으로 3배 이상 성장할 전망입니다. 향후 등장할 치료제들의 시장성에 따라 수십조원의 시장까지 가능하다는 분석이 주를 이루고 있습니다.(츨처 : 시장조사기관 글로벌데이터)
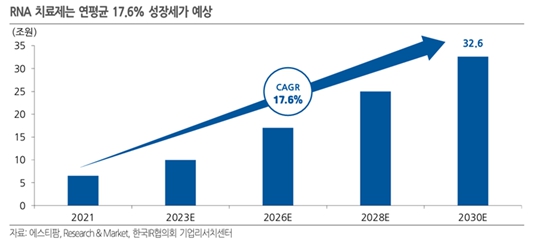 |
|
RNA 치료제는 연평균 17.6% 성장세가 예상 |
![이미지: [RNA 약물 개발의 성장 추이 (출처=미국화학회 2023년 CAS 보고서 ‘RNA 약물’)]](%5Brna%20%EC%95%BD%EB%AC%BC%20%EA%B0%9C%EB%B0%9C%EC%9D%98%20%EC%84%B1%EC%9E%A5%20%EC%B6%94%EC%9D%B4.%20%5B%EC%B6%9C%EC%B2%98%3D%EB%AF%B8%EA%B5%AD%ED%99%94%ED%95%99%ED%9A%8C%202023%EB%85%84%20cas%20%EB%B3%B4%EA%B3%A0%EC%84%9C%20%E2%80%98rna%20%EC%95%BD%EB%AC%BC%E2%80%99%5D.jpg) |
|
[RNA 약물 개발의 성장 추이 (출처=미국화학회 2023년 CAS 보고서 ‘RNA 약물’)] |
mRNA, siRNA, ASO 등 다양한 형태의 RNA 기반 치료제들이 개발/승인되고 있으며, 항암, 퇴행성신경질환, 대사질환, 유전적 근위축증 등 적용 영역 또한 다양하게 확대해가고 있는 등 빠른 속도로 시장이 성장하고 있습니다.
세계의 안티센스 올리고뉴클레오티드(ASO) 치료제 시장 규모는 2033년까지 14.5%의 CAGR로 성장할 것으로 예측되고 있습니다.
(출처: Antisense Oligonucleotide (ASO) Therapeutics Market Report 2023-2033)
이러한 RNA치료제 시장의 성장과 함께 이의 표적전달 기술에 대한 수요도 함께 증대되고 있습니다. 이에 차세대 약물전달 플랫폼으로서 압타머 또한 새로운 기술 및 혁신 수요에 대한 필요성에 발맞춰 효과적인 올리고뉴클레오티드 치료제의 전달 플랫폼으로서 많은 주목을 받고 있습니다. 따라서 약물전달을 위한 압타머 플랫폼은 의료 및 의약품 분야에서 지속적으로 중요한 역할을 할 것으로 기대되며, 기술의 발전과 응용 분야의 확대에 따라 시장 성장이 계속될 것으로 예측됩니다.
(4) 압토디텍트 렁(AptoDetect™-Lung) 시장
(가) 시장의 특성
고령화 사회 진입으로 만성질환과 암을 중심으로 질병 발생이 증가함에 따라 선진국들은 보건 의료비 지출을 줄이기 위하여 기존의 치료 중심 보건의료 정책을 질병의 조기진단, 예방과 관리 중심으로 변화시키고 있습니다.
이에 따라 체외진단 의료기기 시장이 급성장하고 있습니다.
폐암은 2022년 전 세계적으로 약 248만 명이 발병하고, 약 182만 명이 사망하는 사망률 1위 암이며, 2021년 우리나라에서는 약 3.1만 명이 신규로 발생하였습니다.
(출처: GLOBOCAN 2022, 국립암센터 2021년 암등록통계)
최근에는 폐암의 가장 큰 발병 원인으로 알려진 흡연뿐 아니라 비흡연자에게서도 폐암 발병률이 증가하고 있습니다. 특히, 미세먼지는 1군 발암물질로 분류되었으며, 갈수록 악화되는 대기오염은 조기사망에 이를 만큼 심각한 폐질환의 원인으로 대두되고 있습니다. 조리시 발생하는 요리매연 (cooking fume)으로 인한 여성 폐암 발병률 또한 증가하는 추세입니다.
폐암은 자각증세가 없으며 환자의 80%가 진행된 병기에서 발견되고 있어 진단 후 5년 생존율이 30% 미만이지만, 수술이 가능한 조기 단계 발견 시 5년 생존율이 61%까지 상승하기에 조기진단에 대한 수요는 지속해서 증가할 것으로 예상됩니다.
회사가 개발한 제품은 혈액을 사용하여 폐암 고위험군에서 폐암 환자를 조기에 진단하기 위한 제품으로, 인허가 환경을 고려하여 국내는 폐결절이 발견된 환자를 대상으로, 해외는 폐암 고위험군(만 54세-74세, 흡연력 30갑년 이상)으로 조기진단 목표시장을 정의하고 있습니다. 회사의 자체 추정에 따르면 중국, 한국 등 동아시아 시장 규모는 2024년 약 3.4조원에 이를 것입니다.
(나) 기존 진단법의 한계
폐암의 5년 생존율이 낮은 원인은 폐암을 초기에 진단할 수 있는 마땅한 진단기술이 없기 때문입니다. 단일 마커를 사용한 검사법(CEA, Cyfra 21-1 등)은 높은 위양성으로 임상 적용에 한계가 많아 제한된 용도로만 사용됩니다. 기존 진단방법인 이미지 분석 (X-ray, CT 등)은 진단 정확도가 낮고 고비용이며, 방사선 노출, 조영제 부작용의 위험이 존재합니다.
(다) 폐암 진단시장의 요구
폐암 조기진단 시장은 간편하고 정확도가 높은 바이오마커를 이용한 액체생검 기반 비침습적 조기 진단법이 요구되고 있습니다. 폐암 고위험군(만 54세~74세, 흡연력 30갑년 이상)을 대상으로 조기 진단하여 적절한 후속검사를 받도록 하거나 흉부 CT 검사에서 폐결절이 발견된 환자들을 대상으로 폐암 위험도 정보를 제공하여 불필요한 후속검사를 줄이는 검사가 필요합니다.
다만, 폐암 고위험군 대상 검진은 국가암 조기검진 프로그램의 일환으로 진행되고 있으나 해당 검진 대상자로 포함되기 위해서는 직전 건강검진 시 작성하는 문진표에서 흡연력 30갑년 이상임을 작성해야 하며, 만 54세~74세에 포함되어야 합니다.
이로 인해 폐암 고위험군 뿐만 아니라 고위험군에 포함되지 않는 흡연자를 포함하여, 미세먼지, 요리매연 등에 지속적으로 노출된 자에 대한 폐암 진단시장의 요구는 확대되고 있는 추세입니다.
(라) 수요변동 요인
폐암 국가암검진사업의 대상은 만 54~74세 30갑년 이상의 흡연력을 가진 고위험군으로 이들에 한해 2년마다 저선량 흉부 CT 검사를 제공합니다. 국민건강과 복지를 위해 국가암검진사업이 확대되고 있고, 소득수준이 증가함에 따라 자발적인 암 조기진단 시장은 확대될 것으로 전망됩니다.
(마) 제품의 라이프사이클
암 조기진단 제품을 상용화하기 위해서는 원천기술 개발, 바이오마커의 검증, 정부 규제기관 (식약처)의 인허가 과정에 상당한 시간과 비용이 소요됩니다. 이러한 과정을 통해 인허가 승인 시 시장 선점 효과가 크고 진입장벽이 높은 의료기기 시장의 특성상 제품의 수명이 깁니다. 바이오마커 패널과 진단방법에 대한 특허를 출원하여 기술 보호를 받고 있으므로 기술의 완성도와 규제환경을 고려할 때 경쟁제품 (기술)이 시장에 진입하기까지 당사의 제품은 오랜 기간 독보적인 지위를 유지할 것으로 예상합니다.
다. 회사 경쟁력
(1) 압타머 기반 신약 개발 기술 플랫폼
|
기술명 |
압타머 기반 신약 개발 기술 (Aptamer Drug Discovery System)
|
|
기술의 목적 |
- 신약 표적에 대한 선도물질을 발굴하고 축적된 노하우를 기반으로 한 최적화 - 일반 치료제 개발 프로세스 5년에서 7년 소요되는 후보물질 도출 과정을 3년 내에 - ApDC® 항암제와 키메릭 압타머를 포함한 2개의 압타머 복합체(BiFAp) 신약 개발 |
|
기술의 내용 |
-변형핵산 기반 압타머 아카이브의 다양성으로부터 세포막 수용체 단백질에 대하여 |
|
기술의 경쟁력 |
- 발굴 초기 단계에서부터 압타머의 작용기능 선별을 통한 개발 기간 단축 - 압타머 물성의 경쟁력을 바탕으로 강력한 druggability 확보와 약물전달 전략 확보
- 단계별 최적화 과정을 통해 결과물 보호를 위한 강력한 특허 전략 확보 |
|
기술의 연속성 |
- 기확보된 세포막 수용체에 대한 압타머 서열 아카이브 정보와 선도 물질 선별특화 - 압타머 물질 합성 역량 및 기능성 분자 모듈화 도입 전략으로 기술의 연속성 및 |
당사는 기존 압타머 치료제 개발 업체들이 겪었던 문제점을 개발 전략의 차별성 확보와 압타머 물성의 개선을 통해 해결하고자 하였습니다.
당사가 보유한 핵심기술역량을 기반으로 압타머 치료제 개발 시스템을 구축하여 표적에 대한 선도물질 발굴로부터 최적화를 거쳐 개발 후보 물질을 도출하기까지 전 과정을 2~3년 내 완료할 수 있습니다. 일반적인 치료제 개발에서 통상 5~7년 소요되는 과정을 대폭 단축시킨 경쟁력 있는 기술 기반입니다.
당사가 운영중인 치료제 개발 플랫폼은 다음과 같습니다.
(가) ApDC® (압타머-약물 접합체) 플랫폼
ApDCⓡ 플랫폼은 압타머를 운반체로 이용한 약물전달 플랫폼으로 안전성과 치료효과를 동시에 높일 수 있는 차세대 표적 약물전달 기술로 주목받고 있습니다. 당사의 변형핵산 SELEX 기술로 발굴된 압타머는 항체와 유사한 수준의 표적 선택성과 특이성을 가지고 있으며, 반면 크기는 항체의 1/10 수준으로 종양조직으로 빠르게 표적화되고 이어서 종양조직 중심부까지 침투하여 약물을 방출할 수 있습니다. 더불어 항체 대비 상대적으로 짧은 체내 반감기와 빠른 체외 배출의 특성을 보여 안전하면서도 치료용량계수를 넓힐 수 있어 ADC 개발의 주요 이슈로 대두되는 독성 및 부작용 문제를 최소화할 수 있는 차세대 약물전달 플랫폼입니다.
| 플랫폼 기술 | ADC | ApDC® |
| 전달체 | 항체 | 압타머 |
| 페이로드 | MMAE, PBD, DM1, SN38/Dxd | MMAE, Gemcitabine |
| 링커 |
개발 파이프라인별 다양한 유형의 링커 적용 pH 절단형, 효소절단형, 비절단형 등 |
Branched linker (BLinker) 효소절단형 |
| 비고 |
- 표준 표적 약물전달 플랫폼 - 15종 승인, >400 종 개발 중 - 해결과제 -> 용량제한독성(Dose-limiting toxicity)와 이에 - 과제 극복 전략 -> 다양한 페이로드 및 링커 개발 |
- 차세대 표적 약물전달 기술 및 ADC의 미충족 과제에 대한 대안 기술 - 높은 종양 투과성, 빠른 체외배출, 항체와 다른 활성 - BLinker와 나노미셀 구조를 통해 향상된 대사안정성, |
실제 3차원으로 배양된 종양 spheroid에서 항체 대비 최대 8.9배 높은 조직침투율을 보였으며, 종양동물모델을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 또한 ApDCⓡ 플랫폼에는 당사가 자체적으로 개발해 특허출원한 분지형 링커(BLinker)-페이로드가 적용되는데, 이를 통해 압타머에 탑재할 수 있는 약물의 수를 증가시킬 수 있을 뿐만 아니라, 컨주게이트의 양친매성을 극대화해 자가중합을 통한 구형 나노미셀(spherical nanomicelle)을 형성합니다. 실제 BLinker를 적용해 제작된 압타머-약물 컨주게이트는 높은 혈장 안정성을 보여 탑재된 약물의 혈액 내 방출을 최소화할 수 있었으며, 이에 따른 약동력학적 프로파일이 크게 개선되었음이 실험적으로 증명되었습니다. 또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다.
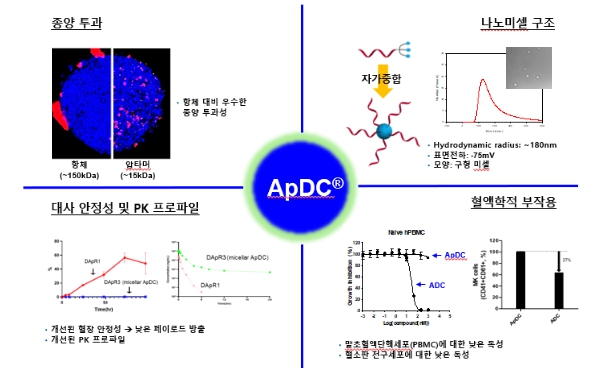 |
|
ApDCⓡ플랫폼의 경쟁력 및 차별점 |
앞서 기술된 ApDC®플랫폼의 특장점 및 차별화 포인트와 당사가 보유한 다양한 세포막 단백질 표적 압타머 라이브러리를 바탕으로 저분자 약물의 표적전달을 통한 ADC의 미충족 과제를 해결할 수 있는 차세대 약물전달 기술의 개발(AST-201, AST-202, AST-203)뿐만 아니라, 면역활성화 분자, siRNA나 ASO 등의 올리고뉴클레오티드, 펩타이드/단백질, 치료용 방사성핵종의 표적전달 등 다양한 유형의 ApDCⓡ개발로 플랫폼의 적용 영역을 확대하고 있습니다.
(2) 압타머 진단개발 기술
|
기술명 |
압타머 진단제품 개발 기술 (Aptamer Diagnostic Development System) |
|||
|
기술의 목적 |
- 높은 특이성을 갖는 압타머를 기반으로 기존 체외진단법의 한계를 극복할 수 있는 - 당사는 다지표 진단기술(AptoMIA)과 현장 진단기술(AptoPOC) 2개의 진단개발
|
|||
|
기술의 내용 |
질환 관련 단백질에 특이적으로 결합하는 후보 압타머군을 선별하고, 당사 고유의
|
|||
|
기술의 경쟁력 |
- 기존 기술로는 진단법 개발이 어려운 질환에 대한 해결방안 제공 - 압타머의 우수한 물성은 높은 민감도와 특이도를 기반으로 진단기술의 정확도 제고 - 후속 파이프라인 확장성이 우수한 플랫폼 기술 기반 - 다수 바이오마커 동시 검출을 통한 결과의 신뢰성 향상, 검사비용/시간 절감
- 다지표 진단 원천기술(특허) 보유
|
|||
|
기술의 연속성 |
- 조기진단에 대한 관심이 증대하면서 다양한 질환으로 확장 가능 - MFDS 인증을 받은 상업적으로 검증된 기술 - 혈액 외에 소변, 뇌척수액 등 다양한 액체생검 시료에 적용 가능
- 유행성 질병(펜더믹)에 신속하게 대응할 수 있는 플랫폼 기술
|
압타머는 높은 특이도, 보관 안정성, 생산 및 타소재와의 결합이 용이한점 등 기본적으로 진단소재로 사용하기에 매우 적합한 소재이며, PCR 증폭을 통해 매우 뛰어난 검출한계가 가능하다는 점까지 더해져 진단법 개발에 매우 특화된 소재입니다.
당사가 운영 중인 진단제품 개발 플랫폼은 다음과 같습니다.
(가) AptoMIA (Aptamer-based Multivariate Index Assay) 플랫폼
다양한 원인에 의해 생기는 암질환은 단일 바이오마커로 진단하는 것은 어려움이 있으므로 다수의 바이오마커를 측정하여 민감도와 특이도를 높이는 다지표 진단법(IVDMIA)으로 진단 패러다임이 변하고 있습니다. 다지표 진단법은 다수의 바이오마커에 대한 측정값을 입력하여 특정 알고리즘에서 계산된 지표(index)로 진단정보를 제공하므로 높은 민감도와 특이도로 위양성률을 줄일 수 있습니다.
AptoMIA 다지표 진단기술은 일련의 과정을 통해, 생체 시료에 존재하는 바이오마커들의 농도가 압타머 농도로 전환되어 이를 분석함으로써 측정할 수 있는 기술입니다.
다수의 바이오마커 특이적인 압타머들을 하나의 웰(well)에서 혈액시료와 반응시키고 (단백질-압타머 결합), 결합된 압타머들 각각의 농도를 측정함으로써 결합 단백질의 농도를 비드 마이크로어레이(bead microarray) 기술과 mPCR(multiplex PCR) 기술을 이용하여 정량 분석하고 (압타머 정량), 특정 알고리즘으로 분석하여 진단정보를 제공하는 단계로 구성됩니다.
![이미지: [당사 다지표 진단 기술 (AptoMIA) 프로세스]](%EB%8B%B9%EC%82%AC%20%EB%8B%A4%EC%A7%80%ED%91%9C%20%EC%A7%84%EB%8B%A8%20%EA%B8%B0%EC%88%A0%20%28aptomia%29%20%ED%94%84%EB%A1%9C%EC%84%B8%EC%8A%A4%20%282020_08_06%2003_01_21%20utc%29.jpg) |
|
[당사 다지표 진단 기술 (AptoMIA) 프로세스] |
(나) AptoPOC (Aptamer-based Point-Of-Care) 플랫폼
AptoPOC 현장진단 플랫폼은 혈액, 인후분비물, 뇨내 바이오마커 특이적인 압타머쌍 기반 측방유동면역분석 기술로 15분 이내에 특정 질환 또는 감염성 바이러스 진단결과를 정성, 정량분석으로 확인할 수 있는 기술입니다.
당사의 압타머쌍 스크리닝 기술(PAIR-SCAN)을 통해 발굴된 높은 특이성의 압타머쌍을 사용하여 타 바이러스와의 변별력이 우수하고 진단 정확도가 높습니다.
![이미지: [당사 현장 진단 기술 모식도]](%EB%8B%B9%EC%82%AC%20%ED%98%84%EC%9E%A5%20%EC%A7%84%EB%8B%A8%20%EA%B8%B0%EC%88%A0%20%28aptopoc%29%20%EB%AA%A8%EC%8B%9D%EB%8F%84%20%282020_08_06%2003_01_21%20utc%29.jpg) |
|
[당사 현장 진단 기술 모식도] |
라. 제품 및 서비스 현황
(1) AST-201 (고형암치료제)
| [경쟁 제품 및 당사 개발 제품 경쟁력 비교] |
|
개발약물 |
회사 |
물질유형 |
작용기전 |
개발단계 |
특징 |
|
Sorafenib Lenvatinb |
Bayer Eisai |
저분자화합물 |
VEGFR2, PDGFR inhibitor 신혈관형성 억제 |
1차 치료제 승인 |
전체생존율 (OS)
2~3개월 개선 |
|
Atezolizumab+ Bevacizumab |
Roche |
단일클론항체 병용 |
Anti-PD-L1 + anti-VEGF |
1차 치료제 승인 |
전체생존율 (OS)
6개월 개선 |
|
AST-201 |
압타머사이언스 |
압타머복합체 |
GPC3 표적 약물 전달 |
1상 임상 IND
|
간 내성 극복 전략으로 |
AST-201은 간암 세포에 특이적인 세포막 단백질인 GPC3에 선택적인 결합을 통해 약물을 전달하므로 다음과 같은 경쟁력이 있습니다.
(가) 작용 기전
GPC3 결합에 의한 효과적인 세포 내재화는 약물 전달 효율을 높이며, ApDC 형태로 내재된 젬시타빈의 효능을 보호하고 간암 세포로의 효과적인 전달 작용이 가능합니다. 기존 젬시타빈 저항성의 형성 기전을 완전히 우회하는 GPC3 경유 세포 내재화는 치료 후 저항성에 의한 치료 효과 저하 가능성을 낮춥니다. 또한, 항체나 비항체 단백질 결합체와는 달리 핵산 기반 물질로 우수한 조직 투과성을 확보하여 효과적인 고형암 치료가 가능합니다.
![이미지: [GPC3 압타머에 젬시타빈이 내재됨으로써 종양 약물저항성 기전 극복]](%5Bgpc3%20%EC%95%95%ED%83%80%EB%A8%B8%EC%97%90%20%EC%A0%AC%EC%8B%9C%ED%83%80%EB%B9%88%EC%9D%B4%20%EB%82%B4%EC%9E%AC%EB%90%A8%EC%9C%BC%EB%A1%9C%EC%8D%A8%20%EC%A2%85%EC%96%91%20%EC%95%BD%EB%AC%BC%EC%A0%80%ED%95%AD%EC%84%B1%20%EA%B8%B0%EC%A0%84%20%EA%B7%B9%EB%B3%B5%5D.jpg) |
|
[GPC3 압타머에 젬시타빈이 내재됨으로써 종양 약물저항성 기전 극복] |
(나) 독성 및 부작용
GPC3는 검증된 종양 특이적 세포막 표지자로서 비 선택적 약물 전달에 의한 부작용을 최소화하고, 표적 선택선 압타머에 약물을 실어 전달함으로써 gemcitabine의 치료용량 대비 휠씬 적은 용량으로 항암 효과를 달성할 수 있어 약물에 의한 부작용 또한 최소화 할 수 있습니다. 더불어, 압타머의 신속한 종양조직 표적화와 체외로의 빠른 배출 특성은 정상 조직에서의 약물 노출, 그에 따른 부작용을 최소화하고, 넓은 범위의 치료계수를 확보할 수 있습니다.
(다) 제조 및 생산
AST-201은 압타머-약물 복합체이지만 단일 공정으로 제조 가능하여 품질 관리 및 대량생산 측면에서의 용이성을 확보하고 있습니다.
(2) AST-202 (혈액암치료제)
DC 개발의 주요 장애물은 용량제한 독성(DLT)으로 인한 좁은 치료용량계수(Therapeutic index)입니다. 이는 항체의 약동력학적 특성과 effector 기능 등 항체 고유의 특성으로 인한 off-target 부작용들에 기인한 것으로 파악되고, 이를 해결할 차세대 약물전달 플랫폼으로 압타머-약물 접합체(ApDCⓡ)가 주목받고 있습니다. AST-202 또한 이러한 기조하에서 개발된 파이프라인으로 T 세포 림프종, 급성골수성 백혈병에서 특징적으로 과발현되고 있는 CD25 단백질을 표적으로 하는 ApDCⓡ입니다. CD25-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술을 적용 압타머에 3개의 약물이 접합되도록 디자인되어 potency가 개선됨과 더불어 나노미셀의 고차구조를 형성함으로써 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
더불어, CD25는 면역 억제 조절 T 세포(Treg)에도 많이 발현되어 항종양 면역반응 증대를 위한 표적으로도 주목받고 있습니다. 그러나, 이를 위한 항체 기반의 Treg depletion 전략은 표적 선택성이 부족하면 CD25-high Treg, CD25-low Teff을 모두 저해하거나 systemic Treg depletion이 유도되어 자가면역 측면의 부작용 우려가 높을 수 있습니다. AST-202는 이러한 측면에서도 표적 선택성이 높은 CD25 압타머에 약물을 접합하여 Treg을 선택적으로 depletion 시킴으로써 종양조직 내 Teff/Treg의 비율을 높여 항종양 면역 활성을 극대화할 수 있음과 동시에 항체 대비 짧은 반감기를 가져 체외배출이 신속하게 이루짐으로 자가면역 부작용 우려를 최소화할 수 있습니다.
 |
|
CD25-ApDCⓡ의 작용개요 |
또한, 압타머는 항체 대비 종양 조직 투과성이 우수하므로 종양 내 침투된 Treg 도달 및 약물활성이 좋을 것으로 예상되고, 더불어 면역관문억제제(PD-1/PD-L1) 병용투여를 통해 기존 면역항암제의 반응률 개선 효과 및 시너지효과가 기대되며, CD25의 종양 발현율이 높은 lymphoma, leukemia 등의 혈액암으로 적응증 확대도 기대할 수 있습니다.
(다) 차별화 포인트 및 경쟁력
압타머를 이용한 약물 전달은 항체에 비해 상대적으로 반감기가 짧고 조직 투과성이 뛰어난 압타머를 활용하기 때문에 종양 내 침투가 용이하며, 그에 따라 효과적이고 신속한 약물전달을 기대할 수 있습니다. 또한, 종양 내 Treg에 약물전달 후 체내에서 빠르게 제거되어 전신 면역계에 영향이 적을 것이라 예상됨으로써 항체를 이용한 Treg depletion 전략의 문제점 및 부작용을 극복할 수 있는 대안이 될 수 있습니다.
(3) AST-203 (고형암치료제)
AST-203도 당사의 압타머-약물 접합체(ApDCⓡ) 플랫폼을 기반으로 개발되었습니다. 다양한 암종에서 과발현되어 있고, 특히 최근 가장 주목받고 있는 ADC 표적인 Trop2 단백질을 표적으로 하는 ApDCⓡ입니다. Trop2-양성 세포에 대한 선택성이 높고, 세포결합 이후 빠르게 내재화되어 신속한 세포사멸을 유도합니다. 당사 고유의 분지형 링커기술을 적용 압타머에 3개의 약물이 접합되도록 디자인되어 potency가 개선됨과 더불어 나노미셀의 고차구조를 형성함으로써 생체안정성 및 약동력학적 특성 개선, 이에 따른 유효성이 대폭 증가되었습니다.
더불어, 3차원으로 배양된 Trop2-양성 종양 spheroid에서 항체 대비 최대 8.9배 높은 조직침투율을 보였으며, Trop2-양성 종양 동물모델(췌장암)을 이용한 생체분포실험에서도 빠른 종양 표적화와 신장을 통한 신속한 체외 배출이 확인된 바 있습니다. 더불어, 동일 표적에 대한 승인된 ADC인 Trodelvy와 동물모델에서의 효능비교 실험에서 상대적으로 우수한 종양성장 억제효과가 관찰되었습니다. 또한, 혈구세포들에 대한 독성 평가에서도 ADC와는 다르게 혈액을 구성하는 단핵구, 혈소판 전구세포 등에 영향을 미치지 않는 안전한 약물전달체로 확인되어 ADC의 주요 부작용인 혈소판 및 호중구 감소에 대한 우려를 최소화할 수 있을 것으로 예상됩니다.
높은 Trop2 발현율을 보이는 다양한 고형암에 대한 표적약물전달 치료제입니다. 주요 적응증으로는 Trop2-발현이 높으나 ADC 치료제 개발의 난항을 겪고 있는 췌장암과 비소세포폐암입니다. ApDC가 보이는 우수한 종양침투능, 상대적으로 낮은 부작용 가능성 등은 ADC 개발이 어려운 난치성 암에 대한 미충족 수요를 해결할 수 있는 대안이 될 수 있을 것입니다.
(가) AST-202/AST-203
의 차별화 포인트 및 경쟁력
압타머를 이용한 약물 전달은 항체에 비해 상대적으로 반감기가 짧고 조직 투과성이 뛰어난 압타머를 활용하기 때문에 종양 내 침투가 용이하며, 그에 따라 효과적이고 신속한 약물전달을 기대할 수 있습니다. 또한, 종양 조직 또는 세포에 약물전달 후 체내에서 빠르게 제거되어 ApDC는 ADC 대비 부작용 측면에서 보다 안전한 약물전달 플랫폼이며 이를 바탕으로 한층 개선된 치료용량계수를 확보할 수 있을 것으로 예상됩니다. 더불어, 당사 고유의 분지형 링커 기술을 접목함으로써 나노미셀의 초분자 구조를 형성함으로 ApDC의 생체안정성 및 약동력학적 특성이 개선되고, 이를 바탕으로 동물모델에서의 약효 또한 한층 증대될 수 있습니다.
(4) RNA전달 압타머
(가) 경쟁상황
트랜스페린 수용체(TfR) 압타머의 경쟁 상황 : 퇴행성 뇌질환의 치료제 개발은 질환의 발병원인이 명확하지 않고 임상에서의 어려움 등으로 높은 투자비용 대비 매우 낮은 성공 확률을 보이고 있습니다. 알츠하이머병과 파킨슨병 치료제의 개발은 항체를 이용한 응집체 제거를 목표로 진행되어 왔지만, 항체의 낮은 BBB 투과율은 이를 극복하기 위한 BBB 셔틀 개발이 시급한 상황입니다. 현재 BBB 셔틀 시장의 주요 플레이어로는 Ossianix, Inc., Insightec, Angiochem Inc., Armagen Technologies, Inc., BrainsGate, BiOasis Technologies, Inc., CarThera, F. Hoffman La-Roche 및 Iproteos사 등이 있으나, 시장을 선도하고 주목받는 플레이어로 Denali therapeutics가 알려져 있습니다.
아시알로당단백질 수용체(ASGPR) 압타머의 경쟁상황 : GalNAc은 간세포에서 풍부하게 발현되는 세포 표면 단백질인 ASGPR을 인식하고 결합할 수 있는 당 분자입니다. siRNA에 GalNAc을 접합시켜 siRNA 전달의 효율성을 높여줄수 있는데 앨라일람의 제품 Givlaari, Oxlumo, Leqvio는 GalNAc 전달기술을 활용하였습니다. 앨라일람은 siRNA 치료제로 FDA 승인을 최초로 받았는데 2018년 8월 온파트로를 처음으로 승인, RNA 치료제로서는 두번째로 승인받았습니다.
(나) 비교우위 상황
RNA전달 압타머는 최근 치료제 분야에서 주목받고 있는 핵산(RNA)치료제를 특정 조직이나 세포를 목표로 정확한 전달을 가능케 합니다. 이는 치료 효과를 최대화하고 부작용을 최소화하는 데 도움이 됩니다. 선택적 약물 전달의 미충족 수요가 높은 ASO, siRNA와 같은 핵산 치료제에 적용할 때 핵산 물질로 구성되어 있는 당사의 압타머는 경쟁사 대비 개발 용이성과 생산 단가 측면에서 우수성을 보여줍니다.
다수 글로벌 제약사들 및 국내 바이오텍, 제약사들이 당사의 RNA전달 압타머 기술에 많은 관심을 보이고 있으며, 공동연구, 기술이전 등 사업화와 관련된 활발한 논의와 MTA가 진행되고 있습니다.
(5) 압토디텍트 렁 (AptoDetect™-Lung)
(가) 경쟁상황
인구 고령화와 건강한 삶 추구로 치료 중심에서 조기 예방 및 관리 중심으로 헬스케어 시장이 가파르게 성장하고 있고, 융합기술의 발달로 새로운 진단법과 신규 바이오마커 기반 액체생검 시장이 빠르게 성장하고 있습니다.
국내에서 식약처의 승인을 받은 폐암 조기진단 제품을 출시한 기업은 현재까지 당사가 유일하며, 글로벌 경쟁기업으로는 영국의 Oncimmune사와 독일의 Epigenomics사가 있으나 당사 제품은 높은 성능지표 (민감도/특이도), 사용 편의성, 검사속도(throughput)에서 경쟁력이 우수합니다.
|
업체명 |
㈜압타머사이언스 |
Oncimmune |
Epigenomics |
|
제품명 |
압토디텍트 렁 (AptoDetect™-Lung) |
EarlyCDT®-Lung |
Epi-prolung® |
|
본사 |
한국 |
영국 |
독일 |
|
목표시장 |
폐암 조기진단 |
폐암 조기진단 |
폐암 조기진단 |
|
바이오마커 |
단백질 7종 |
자가항체 7종 (p53, CAGE, HuD, GBU4-5, MAGE A4, NY-ESO-1, SOX2) |
DNA 메틸레이션 (SHOX2, PTGER) |
|
바이오마커 |
한국, 일본, 중국, |
한국, 중국, 일본, 미국, 유럽, 이스라엘 |
중국 특허 심사 중 (중국파트너인 Biochain사 출원) |
|
핵심기술 |
압타머 기술, 진단 알고리즘 |
자가항체 측정기술, 진단 알고리즘 |
변형 DNA 증폭기술 |
|
검사방법 |
Luminex를 이용한 |
ELISA (효소 면역분석) |
qPCR |
|
성능(민감도 |
75% / 92% (다기관 임상: 69% / 83%) |
41% / 91% |
67% / 90% |
|
검체사용량 |
5 μL (serum) |
20 μL (serum/plasma) |
3.5 mL (plasma) |
|
포장단위 |
88 테스트/키트, 40 테스트/키트 |
10 테스트/키트 |
32 테스트/키트 |
|
인허가 |
국내 식약처 (2017) |
국내 없음, CE (2017) |
국내 없음, CE (2017) |
(나) 비교우위 사항
독창적인 진단소재(압타머)를 기반으로 신규 발굴한 바이오마커와 체외진단 다지표 기술로 제품화된 당사의 제품과 직접 비교할 수 있는 경쟁업체는 매우 제한적인 것으로 판단하고 있습니다. 고감도 압타머와 최적화된 체외진단 다지표 기술을 활용한 당사 기술은 모방이 불가능하여 기술 및 사업적 진입장벽이 매우 높습니다.
당사 제품은 원천기술을 확보한 상태로 모방이 불가능하고 글로벌 경쟁사들에 비해 동등 이상의 임상 성능 보유, 사용 편의성 등 높은 경쟁력을 가지고 있습니다. 당사는 독자적인 압타머 기술을 바탕으로 바이오마커 및 암 조기진단 제품을 개발하는 국내 유일의 선도기업입니다. 액체생검을 이용하여 암의 위험도를 측정하는 암 조기진단 제품을 개발함으로써, 암 진단 및 국민 삶의 질 향상 나아가 국가 의료비 절약을 위해 최선의 노력을 다하고 있습니다.
(다) 신의료기술 평가 유예 대상 선정
당사의 압토디텍트 렁은 22년 6월 20일 평가 유예 신의료기술에 선정되었고, 같은 해 7월 11일 보건복지부에서 고시(제 2022-174호) 되었습니다. 이를 통해 같은 해 9월 1일부터 향후 2년간 병원 등에서 비급여로 사용 중입니다. 향후 건강보험수가 진입 시 사용되는 임상적 근거를 쌓을 수 있게 되었습니다.
마. 신규사업 등의 내용과 전망
당사는 2024년 5월 24일 이사회 결의로 비임상 CRO분석 서비스를 주요 사업으로 하는 ㈜인터내셔널사이언티픽스탠다드(이하 ISS) 지분(100%)를 인수하여 사업영역을 확대하였습니다.
(1) 신규사업 내용 및 진출 목적
당사는 ISS가 쌓아온 바이오의약품 분석역량과 임상시험 수행 경험을 활용하여 압타머 기반 ApDC 플랫폼의 기술역량을 강화하고 글로벌 제약바이오사 대상 MTA·기술이전 가능성을 확대하고자 합니다. ISS는 식약처 GLP·GCLP 인증기관으로써 우수한 연구진과 많은 경험, 제약·바이오·병원 파트너십은 갖추고 있으므로, 당사의 파이프라인 경쟁력 강화에 큰 힘이 될 것입니다.
(2) 신규사업 시장의 특성 및 성장성
CRO(Contract Research Organization)는 임상시험수탁기관으로, 의약품을 개발하는 제약사나 의료기기 제조업체, 건강기능식품 개발사 또는 연구기관으로부터 개발 단계에서 위탁 받아 연구를 수행하고, 객관적 시험 결과를 전달하는 역할을 합니다. CRO는 제약사들의 신약개발 시 들어가는 연구개발 비용 감소와 신약 출시기간 단축이라는 수요에 맞게 발전해 왔습니다. 신약 연구, 개발은 후보물질 탐색부터 임상시험까지 오랜 기간이 걸리는 반면, 성공 확률이 낮은 하이리스크-하이리턴(high-risk, high-return) 사업입니다. 이에 따라 대부분의 제약회사들은 높은 리스크와 많은 비용이 들어가는 단계를 자체적으로 진행하기 보다는 CRO와 같은 수탁기관과 협업하여 신약을 개발하게 됩니다.
CRO 사업분야는 1) 기술 수준이 높고 2) 기술의 변화속도가 빠르며 3) 표준의 중요성이 크고 4) 개발프로세스의 복잡성이 크다는 특징이 있습니다. 따라서 제약바이오 업계의 수요가 매우 큰 반면, 이러한 연구개발서비스를 제공하는 민간부문의 공급 규모는 부족한 상황입니다. 이는 국내 CRO 업체가 2000년대부터 설립되기 시작하였고, 경력을 갖춘 전문인력이 아직 많지 않은 까닭입니다. 정부에서도 2022년 제약산업 육성 · 지원 시행계획을 확정하여 제약산업 전문인력양성에 힘쓰고 있습니다. 결론적으로 CRO 사업분야는 전체 연구개발서비스 자체의 성장가능성이 클 뿐만 아니라, 민간부문을 통한 R&D 서비스산업 활성화의 잠재력 또한 크기 때문에 지속적으로 커질 것으로 예상됩니다.
(3) 신규사업 관련 투자 및 예상 자금소요액
신규사업부문의 의약품 분석장비의 유지보수, 임차료 등을 포함한 운영자금은 해당 사업부문의 자체 매출이 발생함에 따라 별도의 자금투자에 따른 부담은 크지 않을 것으로 예상되며, 보고서 제출일 현재 당사와 소규모합병을 추진하고 있습니다.
III. 재무에 관한 사항
1. 요약재무정보
당사의 재무제표는 한국채택국제회계기준(K-IFRS)에 따라 작성되었습니다.
1) 연결재무제표
주식회사 압타머사이언스와 그 종속회사
| (단위 : 원) |
| 과 목 | 제 14기 반기 (2024년 6월말) |
제 13기 (2023년 12월말) |
제 12기 (2022년 12월말) |
| 유동자산 | 21,060,847,666 | 25,033,614,040 | 37,964,324,879 |
| 현금및현금성자산 | 1,125,630,306 | 1,237,369,971 | 1,222,371,742 |
| 단기금융상품 | 18,500,000,000 | 22,500,000,000 | 34,179,250,000 |
| 파생상품자산 | 61,741,892 | 676,066,548 | 1,281,537,398 |
| 매출채권 | 90,087,018 | 24,866,270 | - |
| 재고자산 | 49,131,709 | 71,473,724 | 43,648,706 |
| 기타유동금융자산 | 308,790,426 | 335,791,643 | 548,569,162 |
| 기타유동자산 | 180,277,369 | 19,325,984 | 633,122,521 |
| 유동계약자산 | 675,824,016 | - | - |
| 당기법인세자산 | 69,364,930 | 168,719,900 | 55,825,350 |
| 비유동자산 | 10,039,113,243 |
7,502,004,939 | 7,681,021,700 |
| 유형자산 | 7,936,054,978 | 7,250,878,352 | 7,440,565,559 |
| 무형자산 | 1,842,851,311 | 38,861,460 | 48,033,586 |
| 당기손익-공정가치 측정 금융자산 | 680,000 | 680,000 | 680,000 |
| 기타비유동금융자산 | 118,648,040 | 89,352,000 | 120,311,000 |
| 기타비유동자산 | 140,878,914 | 122,233,127 | 71,431,555 |
| 자산총계 | 31,099,960,909 | 32,535,618,979 | 45,645,346,579 |
| 유동부채 | 18,101,789,203 | 15,239,181,806 | 2,537,725,210 |
| 비유동부채 | 3,181,350,347 | 1,817,540,266 | 13,884,784,434 |
| 부채총계 | 21,283,139,550 | 17,056,722,072 | 16,422,509,644 |
| 지배기업지분 | 9,816,821,359 | 15,478,896,907 | 29,222,836,935 |
| 자본금 | 8,950,126,000 | 8,950,126,000 | 4,475,063,000 |
| 기타불입자본 | 65,280,986,858 | 65,221,648,856 | 69,560,565,535 |
| 결손금 | (64,414,291,499) | (58,692,877,949) | (44,812,791,600) |
| 비지배지분 | - | - | - |
| 자본총계 | 9,816,821,359 | 15,478,896,907 | 29,222,836,935 |
| 기간 | (2024.01.01~ 2024.06.30) |
(2023.01.01~ 2023.12.31) |
(2022.01.01~ 2022.12.31) |
| 매출액 | 71,055,726 | 243,186,322 | 358,252,888 |
| 영업손실 | (3,628,481,615) | (12,206,656,526) | (8,319,877,014) |
| 법인세비용차감전순이익(손실) | (5,589,196,414) | (13,601,504,427) | (8,301,279,314) |
| 당기순이익(손실) | (5,589,196,414) | (13,601,504,427) | (7,115,574,962) |
| 지배지분순이익 | (5,589,196,414) | (13,601,504,427) | (7,115,574,962) |
| 비지배지분순이익 | - | - | - |
| 당기총포괄이익 | (5,721,413,550) | (13,880,086,349) | (6,975,924,080) |
| 지배기업 소유주 기본주당이익 | (329) | (801) | (419) |
| 연결에 포함된 회사수 | 1 | - | - |
2) 별도재무제표
주식회사 압타머사이언스
| (단위 : 원) |
| 과 목 | 제 14기 반기 (2024년 6월말) |
제 13기 (2023년 12월말) |
제 12기 (2022년 12월말) |
| 유동자산 | 21,380,412,940 | 25,033,614,040 | 37,964,324,879 |
| 현금및현금성자산 | 868,001,287 | 1,237,369,971 | 1,222,371,742 |
| 단기금융상품 | 18,500,000,000 | 22,500,000,000 | 34,179,250,000 |
| 파생상품자산 | 61,741,892 | 676,066,548 | 1,281,537,398 |
| 매출채권 | 8,247,018 | 24,866,270 | - |
| 재고자산 | 49,131,709 | 71,473,724 | 43,648,706 |
| 기타유동금융자산 | 1,814,600,287 | 335,791,643 | 548,569,162 |
| 기타유동자산 | 9,425,667 | 19,325,984 | 633,122,521 |
| 당기법인세자산 | 69,265,080 | 168,719,900 | 55,825,350 |
| 비유동자산 | 7,288,542,684 | 7,502,004,939 | 7,681,021,700 |
| 유형자산 | 7,040,641,482 | 7,250,878,352 | 7,440,565,559 |
| 무형자산 | 29,845,287 | 38,861,460 | 48,033,586 |
| 당기손익-공정가치 측정 금융자산 | 680,000 | 680,000 | 680,000 |
| 종속기업투자주식 | 1 | - | - |
| 기타비유동금융자산 | 76,497,000 | 89,352,000 | 120,311,000 |
| 기타비유동자산 | 140,878,914 | 122,233,127 | 71,431,555 |
| 자산총계 | 28,668,955,624 | 32,535,618,979 | 45,645,346,579 |
| 유동부채 | 16,836,997,206 | 15,239,181,806 | 2,537,725,210 |
| 비유동부채 | 2,015,137,059 | 1,817,540,266 | 13,884,784,434 |
| 부채총계 | 18,852,134,265 | 17,056,722,072 | 16,422,509,644 |
| 자본금 | 8,950,126,000 | 8,950,126,000 | 4,475,063,000 |
| 기타불입자본 | 65,280,986,858 | 65,221,648,856 | 69,560,565,535 |
| 결손금 | (64,414,291,499) | (58,692,877,949) | (44,812,791,600) |
| 자본총계 | 9,816,821,359 | 15,478,896,907 | 29,222,836,935 |
| 기간 | (2024.01.01~ 2024.06.30) |
(2023.01.01~ 2023.12.31) |
(2022.01.01~ 2022.12.31) |
| 매출액 | 71,055,726 | 243,186,322 | 358,252,888 |
| 영업손실 | (3,628,481,615) | (12,206,656,526) | (8,319,877,014) |
| 법인세비용차감전순이익(손실) | (5,589,196,414) | (13,601,504,427) | (8,301,279,314) |
| 당기순이익(손실) | (5,589,196,414) | (13,601,504,427) | (7,115,574,962) |
| 총포괄이익 | (5,721,413,550) | (13,880,086,349) | (6,975,924,080) |
| 기본주당이익(손실) | (329) | (801) | (419) |
2. 연결재무제표
2-1. 연결 재무상태표
| 연결 재무상태표 |
| 제 14 기 반기말 2024.06.30 현재 |
| 제 13 기말 2023.12.31 현재 |
| (단위 : 원) |
| 제 14 기 반기말 | 제 13 기말 | |
|---|---|---|
| 자산 | ||
| I. 유동자산 | 21,060,847,666 | 25,033,614,040 |
| 현금및현금성자산 | 1,125,630,306 | 1,237,369,971 |
| 단기금융상품 | 18,500,000,000 | 22,500,000,000 |
| 파생상품자산 | 61,741,892 | 676,066,548 |
| 매출채권 및 기타유동채권 | 90,087,018 | 24,866,270 |
| 유동재고자산 | 49,131,709 | 71,473,724 |
| 기타유동금융자산 | 308,790,426 | 335,791,643 |
| 기타유동자산 | 180,277,369 | 19,325,984 |
| 유동계약자산 | 675,824,016 | 0 |
| 당기법인세자산 | 69,364,930 | 168,719,900 |
| II. 비유동자산 | 10,039,113,243 | 7,502,004,939 |
| 유형자산 | 7,936,054,978 | 7,250,878,352 |
| 무형자산 | 1,842,851,311 | 38,861,460 |
| 당기손익-공정가치측정금융자산 | 680,000 | 680,000 |
| 기타비유동금융자산 | 118,648,040 | 89,352,000 |
| 기타비유동자산 | 140,878,914 | 122,233,127 |
| 자산총계 | 31,099,960,909 | 32,535,618,979 |
| 부채 | ||
| I. 유동부채 | 18,101,789,203 | 15,239,181,806 |
| 매입채무 및 기타금융부채 | 910,330,048 | 662,701,667 |
| 단기차입금 | 151,101,500 | 0 |
| 유동성전환사채 | 9,019,849,984 | 8,225,950,071 |
| 유동성 파생상품부채 | 7,244,466,650 | 6,304,239,897 |
| 유동성리스부채 | 326,555,756 | 43,482,656 |
| 기타 유동부채 | 62,786,505 | 2,807,515 |
| 계약부채 | 386,698,760 | 0 |
| II. 비유동부채 | 3,181,350,347 | 1,817,540,266 |
| 순확정급여부채 | 2,745,503,144 | 1,805,685,786 |
| 이연법인세부채 | 177,957,114 | 0 |
| 비유동리스부채 | 257,890,089 | 11,854,480 |
| 부채총계 | 21,283,139,550 | 17,056,722,072 |
| 자본 | ||
| 지배기업의 소유주에게 귀속되는 자본 | 9,816,821,359 | 15,478,896,907 |
| 자본금 | 8,950,126,000 | 8,950,126,000 |
| 기타불입자본 | 65,280,986,858 | 65,221,648,856 |
| 이익잉여금(결손금) | (64,414,291,499) | (58,692,877,949) |
| 비지배지분 | 0 | 0 |
| 자본총계 | 9,816,821,359 | 15,478,896,907 |
| 부채및자본총계 | 31,099,960,909 | 32,535,618,979 |
2-2. 연결 포괄손익계산서
| 연결 포괄손익계산서 |
| 제 14 기 반기 2024.01.01 부터 2024.06.30 까지 |
| 제 13 기 반기 2023.01.01 부터 2023.06.30 까지 |
| (단위 : 원) |
| 제 14 기 반기 | 제 13 기 반기 | |||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| I. 매출액 | 19,698,137 | 71,055,726 | 24,576,576 | 103,055,370 |
| II. 매출원가 | 3,095,890 | 11,623,912 | 5,092,126 | 19,855,447 |
| III.매출총이익 | 16,602,247 | 59,431,814 | 19,484,450 | 83,199,923 |
| IV. 판매비와관리비 | 1,432,316,667 | 3,687,913,429 | 4,349,743,290 | 6,920,640,459 |
| 급여, 판관비 | 477,458,779 | 999,713,637 | 491,873,319 | 984,102,559 |
| 감가상각비, 판관비 | 68,648,934 | 137,806,845 | 76,188,878 | 151,282,691 |
| 경상연구개발비 | 585,454,922 | 1,959,375,405 | 3,571,331,502 | 5,360,099,775 |
| 기타 영업비용 | 300,754,032 | 591,017,542 | 210,349,591 | 425,155,434 |
| V. 영업손실 | (1,415,714,420) | (3,628,481,615) | (4,330,258,840) | (6,837,440,536) |
| 기타수익 | 15,992 | 18,874 | 778 | 42,874 |
| 기타손실 | 180 | 180 | 5 | 5 |
| 금융수익 | 194,340,217 | 413,106,349 | 367,938,501 | 677,813,102 |
| 금융원가 | 1,963,761,848 | 2,373,839,842 | 669,356,106 | 1,000,426,054 |
| VI. 법인세비용차감전순이익(손실) | (3,185,120,239) | (5,589,196,414) | (4,631,675,672) | (7,160,010,619) |
| 법인세비용(수익) | 0 | 0 | 0 | 0 |
| 계속영업이익(손실) | (3,185,120,239) | (5,589,196,414) | (4,631,675,672) | (7,160,010,619) |
| 중단영업이익(손실) | 0 | 0 | 0 | 0 |
| 당기순이익(손실) | (3,185,120,239) | (5,589,196,414) | (4,631,675,672) | (7,160,010,619) |
| 기타포괄손익 | 15,713,413 | (132,217,136) | (11,367,922) | (232,904,510) |
| 당기손익으로 재분류되지 않는항목(세후기타포괄손익) | 15,713,413 | (132,217,136) | (11,367,922) | (232,904,510) |
| 확정급여제도의 재측정손익(세후기타포괄손익) | 15,713,413 | (132,217,136) | (11,367,922) | (232,904,510) |
| X. 총포괄손익 | (3,169,406,826) | (5,721,413,550) | (4,643,043,594) | (7,392,915,129) |
| 당기순이익(손실)의 귀속 | ||||
| 지배기업의 소유주에게 귀속되는 당기순이익(손실) | (3,185,120,239) | (5,589,196,414) | (4,631,675,672) | (7,160,010,619) |
| 비지배지분에 귀속되는 당기순이익(손실) | 0 | 0 | 0 | 0 |
| 포괄손익의 귀속 | ||||
| 포괄손익, 지배기업의 소유주에게 귀속되는 지분 | (3,169,406,826) | (5,721,413,550) | (4,643,043,594) | (7,392,915,129) |
| 포괄손익, 비지배지분 | 0 | 0 | 0 | 0 |
| XI. 주당이익 | ||||
| 기본주당이익(손실) (단위 : 원) | (188) | (329) | (273) | (422) |
| 희석주당이익(손실) (단위 : 원) | (188) | (329) | (273) | (422) |
2-3. 연결 자본변동표
| 연결 자본변동표 |
| 제 14 기 반기 2024.01.01 부터 2024.06.30 까지 |
| 제 13 기 반기 2023.01.01 부터 2023.06.30 까지 |
| (단위 : 원) |
| 자본 | |||||||
|---|---|---|---|---|---|---|---|
| 지배기업의 소유주에게 귀속되는 지분 | 비지배지분 | 자본 합계 | |||||
| 자본금 | 자본잉여금 | 자본조정 | 결손금 | 지배기업의 소유주에게 귀속되는 지분 합계 | |||
| 2023.01.01 (기초자본) | 4,475,063,000 | 68,749,921,111 | 810,644,424 | (44,812,791,600) | 29,222,836,935 | 0 | 29,222,836,935 |
| 당기순이익(손실) | (7,160,010,619) | (7,160,010,619) | 0 | (7,160,010,619) | |||
| 주식보상비용 | 121,726,335 | 0 | 121,726,335 | 0 | 121,726,335 | ||
| 확정급여채무의 재측정요소 | (232,904,510) | (232,904,510) | 0 | (232,904,510) | |||
| 무상증자 | 4,475,063,000 | (4,511,353,523) | 0 | 0 | (36,290,523) | 0 | (36,290,523) |
| 2023.06.30 (기말자본) | 8,950,126,000 | 64,238,567,588 | 932,370,759 | (52,205,706,729) | 21,915,357,618 | 0 | 21,915,357,618 |
| 2024.01.01 (기초자본) | 8,950,126,000 | 64,258,500,958 | 963,147,898 | (58,692,877,949) | 15,478,896,907 | 0 | 15,478,896,907 |
| 당기순이익(손실) | (5,589,196,414) | (5,589,196,414) | 0 | (5,589,196,414) | |||
| 주식보상비용 | 59,338,002 | 0 | 59,338,002 | 0 | 59,338,002 | ||
| 확정급여채무의 재측정요소 | (132,217,136) | (132,217,136) | 0 | (132,217,136) | |||
| 무상증자 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2024.06.30 (기말자본) | 8,950,126,000 | 64,258,500,958 | 1,022,485,900 | 64,414,291,499 | 9,816,821,359 | 0 | 9,816,821,359 |
2-4. 연결 현금흐름표
| 연결 현금흐름표 |
| 제 14 기 반기 2024.01.01 부터 2024.06.30 까지 |
| 제 13 기 반기 2023.01.01 부터 2023.06.30 까지 |
| (단위 : 원) |
| 제 14 기 반기 | 제 13 기 반기 | |
|---|---|---|
| Ⅰ. 영업활동현금흐름 | (2,815,920,610) | (7,334,744,396) |
| 영업에서 창출된 현금흐름 | (3,362,567,888) | (7,728,142,396) |
| 이자지급(영업) | 449,784,612 | (3,558,833) |
| 이자수취 | (2,592,154) | 403,225,363 |
| 법인세환급 | 99,454,820 | (6,268,530) |
| Ⅱ. 투자활동현금흐름 | 2,730,021,084 | 7,671,576,076 |
| 단기금융상품의 처분 | 24,500,000,000 | 33,500,000,000 |
| 사업결합으로 인한 증가 | 257,629,018 | 0 |
| 무형자산의 취득 | 0 | (2,613,428) |
| 유형자산의 취득 | (7,130,392) | (295,052,230) |
| 단기대여금및수취채권의 취득 | (1,500,000,000) | 0 |
| 단기금융상품의 취득 | (20,500,000,000) | (25,500,000,000) |
| 선급금의 증가 | (20,477,542) | (30,758,266) |
| Ⅲ. 재무활동현금흐름 | (26,420,321) | (61,193,023) |
| 장기미지급금의 증가 | 0 | 14,191,688 |
| 유동성미지급금의 증가 | 16,306,725 | 3,410,179 |
| 신주발행비 지급 | 0 | (36,290,523) |
| 리스부채의 상환 | (42,727,046) | (42,504,367) |
| 외화표시현금의 환율변동효과 | 580,182 | 104,409 |
| Ⅴ. 현금및현금성자산의 증가(감소) | (111,739,665) | 275,743,066 |
| Ⅴ. 기초현금및현금성자산 | 1,237,369,971 | 1,222,371,742 |
| Ⅵ. 기말현금및현금성자산 | 1,125,630,306 | 1,498,114,808 |
3. 연결재무제표 주석
| 제 14 (당)기 반기 2024년 06월 30일 현재 |
| 제 13 (전)기 2023년 12월 31일 현재 |
| 주식회사 압타머사이언스와 그 종속기업 |
1. 일반사항
(1) 지배기업의 개요
주식회사 압타머사이언스(이하 "지배기업") 는 2011년 4월 1일에 설립되었으며, 본사는 경기도 성남시에 소재하고 있습니다. 지배기업은 2020년 9월 16일 증권거래소에 상장하였으며, 압타머 기술 플랫폼을 기반으로 한 맞춤형 압타머 발굴 및 생산, 서비스 제공, 압타머 응용기술 및 제품 개발(연구 및 진단용 어세이 기술, 약물전달기술, 치료제 개발 등)을 주요사업으로 영위하고 있습니다. 설립시 자본금은 280백만원이었으나, 수차례의 증자와무상증자를 통하여 2024년 06월 30일 현재 보통주 자본금 8,490백만원, 우선주 자본금은 460백만원입니다.
보고기간 종료일 현재 지배기업의 주주현황은 다음과 같습니다.
| 구 분 | 소유주식수(주) | 보통주 지분율 |
||
|---|---|---|---|---|
| 보통주 | 우선주 | 합 계 | ||
| 한동일 | 2,810,000 | - | 2,810,000 | 16.5% |
| 류성호 | 1,020,000 | - | 1,020,000 | 6.0% |
| 장승기 | 1,020,000 | - | 1,020,000 | 6.0% |
| 포항공과대학 산학협력단 | 368,000 | 920,000 | 1,288,000 | 2.2% |
| 기타 | 11,762,252 | - | 11,762,252 | 69.3% |
| 합 계 | 16,980,252 | 920,000 | 17,900,252 | 100% |
(2) 종속기업의 개요
보고기간 종료일 현재 연결대상 종속기업의 현황은 다음과 같습니다.
| 회사명 | 설립연도 | 지배력 취득연도 |
주요업무 | 소재지 | 결산일 | 지분율(%) |
|---|---|---|---|---|---|---|
| 주식회사 인터내셔널사이언티픽스탠다드 (*) | 2008년 | 2024년 | 의약품분석 , 임상검체 분석 | 대한민국 | 12.31 | 100.0 |
(*) 당반기 중 100% 지분 취득으로 지배력을 획득하여 종속기업으로 편입되었습니다.
(주석 35 참조)
(3) 종속기업의 요약 재무정보
보고기간 종료일 현재 연결대상 종속기업의 요약 재무정보는 다음과 같습니다.
| (단위 : 천원) | ||||||
|---|---|---|---|---|---|---|
| 종속기업 | 자산 | 부채 | 자본 | 매출 | 반기순이익 | 총포괄손익 |
| 주식회사 인터내셔널사이언티픽스탠다드 (*) | 2,126,178 | 3,761,223 | (1,635,045) | - | - | - |
(*) 간주취득일은 2024년 6월 30일로, 당반기말 기준 손익정보를 기재하지 않았습니다.
2. 중요한 회계정책
반기연결재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며 연차연결재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 반기연결재무제표는 보고기간말 현재 유효한 한국채택국제회계기준에 따라 작성되었으며, 반기연결재무제표를 작성하기 위하여 채택한 중요한 회계정책은 별도의 언급이 없는 한 전기 연차연결재무제표 작성시 채택한 회계정책과 동일하게 적용되었습니다.
연결실체는 당기 중 종속기업을 취득함에 따라 연결재무제표를 최초 공시하고 있으며, 이에 따라 비교표시된 전기 재무제표는 개별재무제표입니다.
반기연결재무제표 작성을 위하여 채택한 중요한 회계정책은 다음과 같습니다.
(1) 회계정책의 변경과 공시
1) 연결실체가 채택한 제ㆍ개정 기준서 및 해석서
연결실체가 2024년 1월 1일 이후 개시하는 회계기간부터 적용한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
(가) 기업회계기준서 제1001호 '재무제표 표시' (개정) - 부채의 유동/비유동 분류
동 개정사항은 유동부채와 비유동부채의 분류는 보고기간말에 존재하는 기업의 권리에 근거한다는 점을 명확히 하고 기업이 부채의 결제를 연기할 수 있는 권리를 행사할지 여부에대한 기대와는 무관하다는 점을 강조합니다. 그리고 보고기간말에 차입약정을 준수하고 있다면 해당 권리가 존재한다고 설명하고 결제는 현금, 지분상품, 그 밖의 자산 또는 용역을 거래상대방에게 이전하는 것으로 그 정의를 명확히 합니다.
(나) 기업회계기준서 제1116호 '리스' (개정) - 판매후리스에서 생기는 부채
동 개정사항은 판매후리스 거래의 후속측정에 대해 규정합니다. 판매후리스 사용권자산 및 리스부채에도 일반적인 리스 후속측정 방식을 적용하되, 판매자-리스이용자가 보유하는 사용권에 대해서는 관련 손익을 인식하지 않는 방식으로 리스부채를 인식하고 '(수정)리스료'를 산정합니다.
(다) 기업회계기준서 제1001호 '재무제표 표시' (개정) - 가상자산
동 개정사항은 가상자산을 직접 보유하는 경우, 고객 대신 보유하는 경우, 발행하는 경우에 가상자산 보유 발행에 따른 회사의 회계정책, 재무제표에 미치는 영향 등 재무제표 이용자에게 중요한 정보를 공시하도록 규정하고 있습니다.
(라) 기업회계기준서 제1007호 '현금흐름표' 및 제1107호 '금융상품:공시' (개정) - 공급자금융약정
동 개정사항은 재무제표 이용자가 기업의 부채와 현금흐름에 미치는 영향을 평가할 수 있도록 재무활동에서 생기는 부채의 변동에 공급자금융약정 정보를 구분하여 공시하고 공급자금융약정으로 발생하는 유동성 위험을 공시하도록 규정하고 있습니다.개정내용을 최초로 적용하는 회계연도 내 표시하는 중간보고기간에는 경과규정에 따라 해당 내용을 공시할 필요가 없습니다.
동 기준서의 개정 또는 제정이 재무제표에 미치는 유의적인 영향은 없습니다.
2) 공표되었으나 아직 시행되지 않은 제ㆍ개정 기준서 및 해석서
반기말 현재 제정ㆍ공표되었으나 시행일이 도래하지 않아 연결실체가 채택하지 않은 한국채택국제회계기준의 기준서 및 해석서는 다음과 같습니다.
(1) 기업회계기준서 제1021호 '환율변동효과'와 제1101호 '한국채택국제회계기준의 최초채택' (개정) - 교환가능성 결여
동 개정사항은 한 통화를 다른 통화로 교환 가능한지 여부를 평가하고 교환 가능하지 않은경우 사용할 현물환율을 결정할 때 일관된 접근 방식을 적용하고 관련 정보를 공시하도록 요구합니다. 동 개정사항은 2025 년 1 월 1 일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다.
연결실체는 상기에 열거된 제ㆍ개정사항이 재무제표에 미치는 영향이 중요하지 않을 것으로 판단하고 있습니다.
(2) 재무제표 작성기준
1) 측정기준
연결재무제표는 금융상품 등 아래의 회계정책에서 별도로 언급하고 있는 사항을 제외하고는 역사적원가를 기준으로 작성되었습니다.
2) 기능통화와 표시통화
연결재무제표는 회사의 기능통화이면서 표시통화인 "원(KRW)"으로 표시되고 있으며 별도로 언급하고 있는 사항을 제외하고는 "원(KRW)" 단위로 표시되고 있습니다.
(3) 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전이익에 적용하여 계산합니다.
(4) 중요한 회계추정 및 판단
연결재무제표의 작성시 경영진은 회계정책의 적용이나 자산, 부채, 수익, 비용의 장부금액 및 우발부채의 금액에 영향을 미칠 수 있는 판단과 추정 및 가정을 하여야 합니다. 보고기간말 현재 이러한 추정치는 경영진의 최선의 판단 및 추정에 따라 이루어지고 있으며 추정치와 추정에 대한 가정은 지속적으로 검토되고 있으나 향후 경영환경의 변화에 따라 실제 결과와는 중요하게 다를 수도 있습니다.
3. 금융상품의 범주
(1) 금융자산의 범주
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 상각후원가 측정 금융자산 | ||
| 현금및현금성자산 | 1,125,630 | 1,237,370 |
| 단기금융상품 | 18,500,000 | 22,500,000 |
| 매출채권 | 90,087 | 24,866 |
| 기타유동금융자산 | 308,790 | 335,792 |
| 기타비유동금융자산 | 118,648 | 89,352 |
| 당기손익-공정가치 측정 금융자산 | ||
| 파생상품자산 | 61,742 | 676,067 |
| 기타금융자산 | 680 | 680 |
| 합계 | 20,205,578 | 24,864,127 |
(2) 금융부채의 범주
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 상각후원가 측정 금융부채 | ||
| 매입채무 | - | 26,383 |
| 단기차입금 | 151,102 | - |
| 기타유동금융부채 | 910,330 | 636,318 |
| 유동성리스부채 | 326,556 | 43,483 |
| 비유동리스부채 | 257,890 | 11,854 |
| 전환사채 | 9,019,850 | 8,225,950 |
| 당기손익-공정가치 측정 금융부채 | ||
| 유동성파생상품부채 | 7,244,467 | 6,304,240 |
| 합계 | 17,910,195 | 15,248,228 |
(3) 금융상품 범주별 순손익
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상각후원가 측정 금융자산 | ||||
| 이자수익 | 193,927 | 412,114 | 272,190 | 581,230 |
| 외화관련손익 | (1,194) | (21,804) | 64,292 | 54,569 |
| 대손상각비 | - | - | - | 2,421 |
| 당기손익-공정가치 측정 금융자산 |
||||
| 평가손실 |
(614,325) | (614,325) | (157,283) | (157,283) |
| 상각후원가 측정 금융부채 |
||||
| 이자비용 | (407,603) | (796,492) | (339,215) | (659,727) |
| 당기손익-공정가치 측정 금융부채 |
||||
| 평가손실 |
(940,227) | (940,227) | (141,402) | (141,402) |
| 합계 |
(1,769,422) | (1,960,733) | (301,418) | (320,192) |
4. 공정가치
(1) 보고기간말 현재 금융상품의 종류별 장부금액과 공정가치의 비교내용은 다음과 같습니다.
<당반기>
| (단위: 천원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 파생상품자산(유동) | 61,742 | 61,742 |
| 당기손익-공정가치측정 금융자산(비유동) | 680 | 680 |
| 소계 | 62,422 | 62,422 |
| <금융부채> | ||
| 파생상품부채(유동) | 7,244,467 | 7,244,467 |
<전기>
| (단위: 천원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 파생상품자산(유동) | 676,067 | 676,067 |
| 당기손익-공정가치측정 금융자산(비유동) | 680 | 680 |
| 소계 | 676,747 | 676,747 |
| <금융부채> | ||
| 파생상품부채(비유동) | 6,304,240 | 6,304,240 |
(2) 공정가치로 측정되는 자산·부채의 공정가치 측정치
1) 공정가치 서열체계 및 측정방법
공정가치란 측정일에 시장참여자 사이의 정상거래에서 자산을 매도할 때 받거나 부채를 이전할 때 지급하게 될 가격을 의미합니다. 공정가치 측정은 측정일에 현행 시장 상황에서자산을 매도하거나 부채를 이전하는 시장참여자 사이의 정상거래에서의 가격을 추정하는 것으로, 회사는 공정가치 평가시 시장정보를 최대한 사용하고, 관측 가능하지 않은 변수는최소한으로 사용하고 있습니다.
회사는 공정가치로 측정되는 자산·부채를 공정가치 측정에 사용된 투입변수에 따라다음과 같은 공정가치 서열체계로 분류하였습니다.
수준1 : 활성시장에서 공시되는 가격을 공정가치로 측정하는 자산·부채의 경우 동 자산·부채의 공정가치는 수준1로 분류됩니다.
수준2 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 모든 유의적인 투입변수가 시장에서 관측한 정보에 해당하면 자산·부채의 공정가치는 수준2로 분류됩니다.
수준3 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 하나 이상의 유의적인 투입변수가 시장에서 관측불가능한 정보에 해당하면 동 금융상품의 공정가치는 수준3으로 분류됩니다.
자산·부채의 공정가치는 자체적으로 개발한 내부평가모형을 통해 평가한 값을 사용하거나 독립적인 외부평가기관이 평가한 값을 제공받아 사용하고 있습니다.
2) 보고기간말 현재 재무상태표에 공정가치로 측정되는 자산·부채의 공정가치 서열체계별 공정가치 금액은 다음과 같습니다.
<당반기>
| (단위 : 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 당기손익-공정가치측정 금융자산 | 61,742 | - | - | 61,742 | 61,742 |
| <부채> | |||||
| 당기손익-공정가치측정 금융부채 | 7,244,467 | - | - | 7,244,467 | 7,244,467 |
<전기>
| (단위 : 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 당기손익-공정가치측정 금융자산 | 676,747 | - | - | 676,747 | 676,747 |
| <부채> | |||||
| 당기손익-공정가치측정 금융부채 | 6,304,240 | - | - | 6,304,240 | 6,304,240 |
3) 가치평가기법 및 투입변수 설명
보고기간 종료일 현재 재무상태표에서 공정가치로 측정되는 자산·부채 중 공정가치서열체계 수준3으로 분류된 항목의 가치평가기법과 투입변수는 다음과 같습니다.
| (단위 : 천원) | ||||
| 구분 | 장부금액 | 공정가치 | 가치평가기법 | 투입변수 |
| 금융자산 : | ||||
| 파생상품자산 | 61,742 | 61,742 | 이항모형 | 주가변동성, 무위험이자 |
| 금융부채 : | ||||
| 파생상품부채 | 7,244,467 | 7,244,467 | 이항모형 | 주가변동성, 무위험이자 |
5. 현금및현금성자산 및 장단기금융상품
(1) 보고기간말 현재 현금및현금성자산 및 장단기금융상품의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 현금및현금성자산 | ||
| 보통예금 | 1,125,630 | 1,237,370 |
| 단기금융상품 | ||
| 정기예금 | 11,500,000 | 15,000,000 |
| 중소기업금융 채권 | 7,000,000 | 7,500,000 |
| 소계 | 18,500,000 | 22,500,000 |
6. 당기손익-공정가치측정 금융자산
(1) 보고기간말 현재 당기손익-공정가치측정 금융자산 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 유동자산 | ||
| 파생상품자산 |
61,742 |
676,067 |
| 비유동자산 | ||
| 지분상품 | 680 | 680 |
(2) 당반기 및 전반기 중 당기손익으로 인식된 금액은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전반기 |
| 당기손익-공정가치측정 금융자산 | ||
| 평가손익 | (614,325) | (157,283) |
7. 매출채권
(1) 보고기간말 현재 매출채권의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 매출채권 | 234,803 | 24,866 |
| 대손충당금 | (144,716) | - |
| 합계 | 90,087 | 24,866 |
(2) 보고기간말 현재 매출채권의 연령분석은 다음과 같습니다.
<당반기말>
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 1년 이하 | 1년 초과 | 합 계 |
| 매출채권(*) | 90,087 | 144,716 | 234,803 |
(*) 연령분석은 대상 채권의 회수기준일을 기준으로 분석하였습니다.
<전기말>
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 1년 이하 | 1년 초과 | 합 계 |
| 매출채권(*) | 24,866 | - | 24,866 |
(*) 연령분석은 대상 채권의 회수기준일을 기준으로 분석하였습니다.
8. 기타금융자산
보고기간말 현재 기타금융자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 미수금 | 33,309 | - | 29,685 | - |
| 미수수익 | 214,683 | - | 258,164 | - |
| 보증금 | 60,798 | 118,648 | 47,943 | 89,352 |
| 합계 | 308,790 | 118,648 | 335,792 | 89,352 |
9. 재고자산
보고기간말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||||
| 평가전금액 | 평가충당금 | 장부금액 | 평가전금액 | 평가충당금 | 장부금액 | |
| 원재료 | 20,134 | - | 20,134 | 56,027 | - | 56,027 |
| 재공품 | 4,525 | - | 4,525 | 6,753 | (1,723) | 5,030 |
| 제품 | 24,472 | - | 24,472 | 14,882 | (4,465) | 10,417 |
| 합계 | 49,132 | - | 49,132 | 77,662 | (6,188) | 71,474 |
10. 계약자산
보고기간말 현재 계약자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||||
| 총장부금액 | 대손충당금 | 순장부금액 | 총장부금액 | 대손충당금 | 순장부금액 | |
| 계약자산(*) | 675,824 | - | 675,824 | - | - | - |
(*) 당반기말 기준 수익인식에 대한 수행의무는 완료했으나, 미청구된 금액 입니다.
11. 기타자산
보고기간말 현재 기타자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 선급금(*) | 371 | 129,486 | 307 | 109,008 |
| 선급비용 | 179,907 | 11,393 | 19,019 | 13,225 |
| 합계 | 180,277 | 140,879 | 19,326 | 122,233 |
(*) 선급금에는 특허출원비용 당기말 129,486천원 및 전기말 109,008천원이 포함되어 있습니다.
12. 유형자산
(1) 보고기간말 현재 유형자산 장부금액의 구성내역은 다음과 같습니다.
| (단위: 천원) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | |||||||
| 취득원가 | 사업결합 | 상각 누계액 |
정부 보조금 |
장부금액 | 취득원가 | 상각 누계액 |
정부 보조금 |
장부금액 | |
| 토지 | 2,618,919 | - | - | - | 2,618,919 | 2,618,919 | - | - | 2,618,919 |
| 건물 | 3,925,631 | - | (302,601) | - | 3,623,030 | 3,925,631 | (253,531) | - | 3,672,100 |
| 기계장치 | 1,925,292 | 328,961 | (1,355,387) | (1) | 898,866 | 1,922,172 | (1,225,508) | (1) | 696,663 |
| 비품 | 128,020 | 32,210 | (86,699) | - | 73,530 | 124,009 | (78,831) | - | 45,178 |
| 시설장치 | 552,044 | 3,709 | (422,118) | - | 133,634 | 552,044 | (392,192) | - | 159,852 |
| 사용권자산 | 208,503 | 530,534 | (150,961) | - | 588,076 | 210,752 | (152,586) | - | 58,166 |
| 합계 | 9,358,408 | 895,414 | (2,317,765) | (1) | 7,936,055 | 9,353,527 | (2,102,648) | (1) | 7,250,878 |
(2) 당반기와 전기 중 유형자산 장부금액의 변동내역은 다음과 같습니다.
<당반기>
| (단위: 천원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 기초 | 취득 | 사업결합 | 처분 | 상각 | 국고보조금상계액 | 기말 |
| 토지 | 2,618,919 | - | - | - | - | - | 2,618,919 |
| 건물 | 3,672,100 | - | - | - | (49,070) | - | 3,623,030 |
| 기계장치 | 696,663 | 3,120 | 328,961 | - | (129,879) | - | 898,866 |
| 비품 | 45,178 | 4,010 | 32,210 | - | (7,868) | - | 73,530 |
| 시설장치 | 159,852 | - | 3,709 | - | (29,926) | - | 133,634 |
| 사용권자산 | 58,166 | 41,302 | 530,534 | - | (41,926) | - | 588,076 |
| 합계 | 7,250,878 | 48,432 | 895,414 | - | (258,668) | - | 7,936,055 |
<전기>
| (단위: 천원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 기초 | 취득 | 처분 | 상각 | 국고보조금상계액 | 기타 | 기말 |
| 토지 | 2,618,919 | - | - | - | - | - | 2,618,919 |
| 건물 | 3,770,241 | - | - | (98,141) | - | - | 3,672,100 |
| 기계장치 | 602,467 | 284,565 | - | (272,031) | 669 | 80,993 | 696,663 |
| 비품 | 49,019 | 12,577 | - | (16,418) | - | - | 45,178 |
| 건설중인자산 | 80,993 | - | - | - | - | (80,993) | - |
| 시설장치 | 219,705 | - | - | (59,853) | - | - | 159,852 |
| 사용권자산 | 99,222 | 43,552 | - | (84,608) | - | - | 58,166 |
| 합계 | 7,440,566 | 340,695 | - | (531,051) | 669 | - | 7,250,878 |
13. 무형자산
(1) 보고기간말 현재 무형자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||||||
| 취득원가 | 사업결합 (*) |
상각 누계액 | 장부금액 | 취득원가 | 사업결합 | 상각 누계액 | 장부금액 | |
| 고객관계가치 | - | 851,469 | - | 851,469 | - | - | - | - |
| 영업권 | - | 961,533 | - | 961,533 | - | - | - | - |
| 특허권 | 76,366 | - | (47,814) | 28,552 | 76,366 | - | (40,225) | 36,141 |
| 상표권 | 14,103 | - | (13,155) | 948 | 14,103 | - | (11,772) | 2,331 |
| 개발비 | 40,000 | - | (40,000) | - | 40,000 | - | (40,000) | - |
| 소프트웨어 | 4,670 | 4 | (4,325) | 349 | 4,670 | - | (4,281) | 389 |
| 지적재산권 | 620,000 | - | (620,000) | - | 620,000 | - | (620,000) | - |
| 합계 | 755,139 | 1,813,006 | (725,294) | 1,842,851 | 755,139 | - | (716,278) | 38,861 |
(*) 당반기 중 사업결합으로 인한 잠재적으로 식별가능한 무형자산의 공정가치 평가금액 이며,최종 가치평가 결과에 따라 금액이 변동될 수 있습니다.
(2) 무형자산의 변동내용은 다음과 같습니다.
<당반기>
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 사업결합 | 상각 | 기말 |
| 고객관계가치 | - | - | 851,469 | - | 851,469 |
| 영업권 | - | - | 961,533 | - | 961,533 |
| 특허권 | 36,141 | - | - | (7,589) | 28,552 |
| 상표권 | 2,331 | - | - | (1,383) | 948 |
| 소프트웨어 | 389 | - | 4 | (44) | 349 |
| 합계 | 38,861 | - | 1,813,006 | (9,016) | 1,842,851 |
<전기>
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 사업결합(*) | 상각 | 기말 |
| 특허권 | 38,741 | 12,466 | - | (15,066) | 36,141 |
| 상표권 | 5,152 | - | - | (2,821) | 2,331 |
| 개발비 | 4,000 | - | - | (4,000) | - |
| 소프트웨어 | 141 | 440 | - | (192) | 389 |
| 합계 | 48,034 | 12,906 | - | (22,079) | 38,861 |
(3) 비용으로 인식한 연구와 개발 지출의 총액은 다음과 같습니다.
| (단위 : 천원) | |||
|---|---|---|---|
| 구분 | 계정과목 | 당반기 | 전반기 |
| 판매비와관리비 | 경상연구개발비 | 1,959,375 | 5,360,100 |
14. 리스
(1) 보고기간말 현재 기초자산 유형별 사용권자산의 내역은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 부동산 | 129,697 | 7,259 |
| 기계장치 | 408,834 | - |
| 차량운반구 | 49,544 | 50,907 |
| 합계 | 588,076 | 58,166 |
(2) 보고기간 중 리스와 관련해 손익으로 인식된 금액은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
|
사용권자산의 감가상각비 |
||||
|
부동산 |
10,752 | 21,026 | 10,888 | 21,031 |
| 기계장치 | - | - | - | - |
| 차량운반구 | 10,450 | 20,900 | 10,450 | 20,900 |
|
리스부채에 대한 이자비용(금융원가에 포함) |
1,080 | 2,592 | 1,805 | 3,559 |
|
단기리스료(매출원가 및 관리비에 포함) |
- | - | - | - |
|
단기리스가 아닌 소액자산 리스료(관리비에 포함) |
450 | 900 | 360 | 720 |
(3) 보고기간말 현재 리스부채의 내역은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당반기말 | 전기말 | ||
| 최소리스료 | 최소리스료의 현재가치 |
최소리스료 | 최소리스료의 현재가치 |
|
| 1년 이내 | 363,014 | 326,556 | 44,992 | 43,483 |
| 1년 초과 5년 이내 | 278,374 | 257,890 | 13,584 | 11,854 |
| 합계 | 641,388 | 584,446 | 58,576 | 55,337 |
(4) 보고기간말 현재 리스부채의 유동성분류 내역은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 유동 | 326,556 | 43,483 |
| 비유동 | 257,890 | 11,854 |
| 합계 | 584,446 | 55,337 |
15. 매입채무 및 기타유동금융부채
보고기간말 현재 매입채무 및 기타유동금융부채의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 매입채무 | - | 26,383 |
| 미지급금 | 759,682 | 545,729 |
| 미지급비용 | 150,648 | 90,590 |
| 합계 | 910,330 | 662,702 |
16. 퇴직급여부채
(1) 퇴직급여부채의 내용은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 확정급여채무의 현재가치 | 2,745,503 | 1,805,686 |
| 사외적립자산의 공정가치 | - | - |
| 순확정급여부채 금액 | 2,745,503 | 1,805,686 |
(2) 확정급여채무의 변동내용은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전기 |
| 기 초 | 1,805,686 | 1,295,800 |
| 당기근무원가 | 146,602 | 195,455 |
| 신입/전입효과 | 4,457 | 37,874 |
| 이자원가 | 42,477 | 66,511 |
| 재측정요소 : | ||
| - 재무적가정의 변동으로 인한 보험수리적손익 | 14,535 | 140,633 |
| - 인구통계적가정변경효과 | - | (6,611) |
| - 경험적조정으로 인한 보험수리적손익 | 117,682 | 144,560 |
| - 경험조정 효과 (*) | 737,611 | - |
| 급여지급액 | (123,548) | (68,536) |
| 기 말 | 2,745,503 | 1,805,686 |
(*) 사업결합시 발생된 금액 입니다.
(3) 총비용
1) 당기손익으로 인식한 총비용의 내용은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기 | 전반기 |
| 당기근무원가 | 151,059 | 107,247 |
| 순이자손익 | 42,477 | 33,256 |
| 합계 | 193,536 | 140,502 |
2) 당기손익으로 인식한 총비용의 계정과목별 내용은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기 | 전반기 |
| 매출원가 | 1,061 | 993 |
| 판매비와관리비 | 130,346 | 98,780 |
| 연구개발비 | 62,129 | 40,730 |
| 합계 | 193,536 | 140,502 |
17. 계약부채
보고기간말 현재 계약부채의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 계약부채(선수금) | 386,699 | - |
(*) 당반기중 사업결합으로 인하여 386,699천원이 증가하였습니다.
18. 기타부채
보고기간말 현재 기타부채의 내용은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 선수금 | 62,608 | 2,608 |
| 예수금 | 179 | 200 |
| 합계 | 62,787 | 2,808 |
19. 차입금
(1) 당반기말과 전기말 현재 차입금의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 단기차입금 | 151,102 | - |
(2) 당반기말과 전기말 현재 단기차입금의 세부내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 채권자 | 이자율(%) | 금 액 | |
| 당반기말 | 당반기말 | 전기말 | ||
| 운전자금 | 유승필(*) | 4.6 | 151,102 | - |
(*) 외상매출채권을 차입금의 담보로 제공 하였습니다.
20. 전환사채
(1) 보고기간말 현재 전환사채의 내역은 다음과 같습니다.
| (단위: 천원) | ||
| 구 분 | 당기말 | 전기말 |
| 유동부채(*) | ||
| 전환사채 | 16,500,000 | 16,500,000 |
| 전환권 조정 | (7,480,150) | (8,274,050) |
| 파생상품부채(조기상환권) | 7,244,467 | 6,304,240 |
| 부채의 합계 | 16,264,318 | 14,530,190 |
| 파생상품자산(매도청구권) | 61,742 | 676,067 |
| 전환권대가(자본잉여금) | 4,460,507 | 4,460,507 |
(*) 전환사채의 조기상환청구권 행사가능시점이 1년 미만으로 도래함에 따라 유동부채로 분류하였습니다.
(2) 전환사채의 주요 발행조건을 다음과 같습니다.
| 구 분 | 제1회 무기명식 이권부 무보증 사모 전환사채 (*1) |
|---|---|
| 발행일 | 2022년 10월 06일 |
| 만기일 | 2027년 10월 06일 |
| 액면가액 | 16,500,000,000원 |
| 발행가액 | 16,500,000,000원 |
| 이자지급조건 | 표시이자: 0.0%, 만기보장수익률: 0.0% |
| 전환가격 | 1주당 4,058원 (*2) |
| 전환가격조정 | 시가를 하회하는 발행가액으로 주식연계사채 발행, 유상증자 및 무상증자, 주식 배당 및 준비금의 자본전입 등 일정사유 발생시 전환가격 조정 |
| 전환권 청구기간 | 발행후 1년이 경과하는 날부터 만기직전 1개월 |
| 발행할 주식의 종류 | 기명식 보통주 |
| 사채권자의 조기상환권에 관한 사항 | 사채의 발행일로부터 2년이 되는날 및 그 이후 매3개월에 해당되는 날에 본 사채의 전부 또는 일부에 대하여 만기 전 조기상환을 청구할 수 있다. |
| 매도청구권에 관한 사항 | 사채의 발행일로부터 12개월이 되는날로부터 23개월이 되는 날까지매 1개월에 해당하는 날에 사채권자가 보유하고 있는 본 사채의 권면총액의 20% 한도로 발행회사 또는 발행회사가 지정하는 자에게 매도하여 줄 것을 청구할 수 있으며, 사채권자는 이 청구에 따라 보유 하고있는 본 사채를 매수인에게 매도하여야 한다. |
(*1) 전환사채에 포함된 내재 파생상품의 경우 주계약인 사채에서 분리하여 조기상환권은 파생금융부채로, 매도청구권은 파생금융자산으로 인식 및 평가 하였으며, 발행가액에서 부채요소를 차감한 잔여가치는 전환권의 가치에 해당하며, 세효과 차감후 금액을 자본으로 계상하였습니다.
(*2) 무상증자로 인해 조정된 전환가격 입니다.
(3) 당기와 전기 중 전환사채와 관련하여 발생한 손익은 다음과 같습니다.
| (단위: 천원) | ||
| 구 분 | 당반기 | 전반기 |
| 이자비용 | (793,900) | (656,168) |
| 파생상품부채평가손실(*) | (1,554,551) | (298,685) |
| 합계 | (2,348,451) | (954,853) |
(*) 전환사채 발행시 분리된 내재파생상품을 공정가치로 평가한 손익 입니다.
21. 자본금 및 기타불입자본
(1) 당기말과 전기말 현재 자본금의 내역은 다음과 같습니다.
| 구 분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 보통주 | 우선주 | 보통주 | 우선주 | |
| 발행할주식의 총수 | 50,000,000주 | 50,000,000주 | ||
| 1주당 액면금액 | 500원 | 500원 | 500원 | 500원 |
| 발행한 주식수 | 16,980,252주 | 920,000주 | 16,980,252주 | 920,000주 |
| 자본금 | 8,490,126천원 | 460,000천원 | 8,490,126천원 | 460,000천원 |
(2) 당반기 및 전기 중 자본금 및 기타불입자본의 변동내역은 다음과 같습니다.
<당반기>
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 주식수(주) | 자본금 | 주식발행초과금 | 주식선택권 | 전환권대가 | 기타자본잉여금 |
| 기초 | 17,900,252 | 8,950,126 | 59,654,509 | 963,148 | 4,460,507 | 143,485 |
| 주식보상비용 | - | - | - | 59,338 | - | - |
| 기말 | 17,900,252 | 8,950,126 | 59,654,509 | 1,022,486 | 4,460,507 | 143,485 |
<전기>
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 주식수(주) | 자본금 | 주식발행초과금 | 주식선택권 | 전환권대가 | 기타자본잉여금 |
| 기초 | 8,950,126 | 4,475,063 | 64,145,930 | 810,644 | 4,460,507 | 143,485 |
| 주식보상비용 | - | - | - | 152,504 | - | - |
| 무상증자 | 8,950,126 | 4,475,063 | (4,491,421) | - | - | - |
| 기말 | 17,900,252 | 8,950,126 | 59,654,509 | 963,148 | 4,460,507 | 143,485 |
(3) 주식기준보상제도
1) 회사는 임직원 등에게 주식결제형 주식선택권을 부여하였으며, 그 주요 내용은 다음과 같습니다.
| 구 분 | 5차 부여분 | 6차부여분 | 7차부여분 |
| 부여일 | 2022-03-10 | 2023-02-28 | 2024-02-14 |
| 부여주식수(*) | 75,000주 | 60,000주 | 115,000주 |
| 행사가격(*) | 12,750원 | 9,372원 | 3,566원 |
| 가득조건 | 부여일 이후 2년 경과 시점에서 최초부여주식의 40%, 3년 경과 시점에서 30%, 4년 경과 시점에서 30% 행사가능하며 행사일 현재 재직중인 자 |
||
| 행사가능기간 | 2024-03-10 ~ 2029-03-09 | 2025-02-28 ~ 2030-02-27 | 2026-02-14 ~ 2031-02-13 |
| 부여일의 공정가치 | 5,592원 | 5,786원 | 1,856원 |
(*) 부여주식수 및 행사가격은 무상증자가 고려되지 않은 최초 부여주식수 및 행사가격입니다.
2) 당반기와 전기 중 주식선택권 부여주식수의 변동내역은 다음과 같습니다.
| (단위: 주) | ||
|---|---|---|
| 구분 | 당반기 | 전기 |
| 기초 | 105,000 | 75,000 |
| 부여 | 115,000 | 60,000 |
| 행사 | - | - |
| 소멸 | - | (30,000) |
| 기말 | 220,000 | 105,000 |
3) 회사는 이항모형에 의한 공정가치접근법을 적용하여 보상원가를 산정하였으며, 이 때 부여일 주가는 현금흐름할인법에 의해 측정된 공정가치를 이용하였고, 그 밖에 보상원가 산정에 사용된 주요 가정은 다음과 같습니다.
| (금액단위: 원) | |||
|---|---|---|---|
| 구 분 | 5차 부여분 | 6차 부여분 | 7차 부여분 |
| 보통주 공정가치 | 5,592 | 5,786 | 1,856 |
| 무위험이자율 | 2.66% | 3.83% | 3.46% |
| 예상주가변동성 | 43.3% | 72.6% | 70.6% |
당반기와 전반기 중 비용으로 인식한 주식보상비용은 각각 136,988천원과 121,727천원 입니다.
22. 결손금
(1) 당기 및 전기 중 결손금의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전기 |
| 기초 | 58,692,878 | 44,812,792 |
| 당기순손실 | 5,589,196 | 13,601,504 |
| 확정급여제도의 재측정요소 | 132,217 | 278,582 |
| 기말 | 64,414,291 | 58,692,878 |
23. 매출액
회사는 다음의 주요 판매유형별 재화나 용역을 한 시점에 이전함으로써 수익을 창출합니다. 당반기와 전반기 중 매출액을 구성하는 주요 수익의 내역은 다음과 같습니다.
| (단위 : 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 당반기 | 전반기 | |||
| 3개월 | 누적 | 3개월 | 누적 | ||
| 용역매출 |
합성서비스 |
19,558 | 63,635 | 24,577 | 95,255 |
| 발굴서비스 |
- | 6,861 | - | 7,800 | |
| 소계 | 19,558 | 70,496 | 24,577 | 103,055 | |
| 제품매출 | 폐암진단키트 | 140 | 560 | - | - |
| 합계 | 19,698 | 71,056 | 24,577 | 103,055 | |
24. 종업원급여 및 기타영업비용
(1) 당반기 및 전반기 중 판매비와 관리비 종업원급여의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 390,957 | 808,957 | 393,786 | 807,256 |
| 퇴직급여 | 68,625 | 130,346 | 50,180 | 98,780 |
| 주식보상비용 | 17,877 | 60,410 | 47,907 | 78,067 |
| 합계 | 477,459 | 999,714 | 491,873 | 984,103 |
1) 경상연구개발비에 포함된 당반기 및 전반기 중 종업원급여의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 278,655 | 560,514 | 254,254 | 474,088 |
| 퇴직급여 | 32,133 | 62,129 | 21,559 | 40,730 |
| 주식보상비용 | 20,927 | (1,072) | 23,682 | 43,659 |
| 합계 | 331,715 | 621,571 | 299,495 | 558,476 |
2) 매출원가에 포함된 당반기 및 전반기 중 종업원급여의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 832 | 8,793 | 8,176 | 12,675 |
| 퇴직급여 | 122 | 1,061 | 742 | 993 |
| 합계 | 955 | 9,854 | 8,918 | 13,668 |
(2) 당반기 및 전반기 중 기타영업비용의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 복리후생비 | 55,867 | 117,423 | 53,525 | 113,716 |
| 지급수수료 | 149,237 | 259,971 | 59,196 | 126,468 |
| 여비교통비 | 22,189 | 49,806 | 15,162 | 28,707 |
| 세금과공과 | 23,774 | 47,759 | 22,496 | 42,731 |
| 건물관리비 | 20,782 | 42,215 | 21,343 | 42,384 |
| 보험료 | 8,747 | 15,274 | 6,550 | 11,441 |
| 기타 | 20,158 | 58,570 | 32,078 | 59,707 |
| 합계 | 300,754 | 591,018 | 210,350 | 425,155 |
25. 기타수익 및 기타비용
(1) 당반기 및 전반기 중 기타수익 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 잡이익 | 16 | 19 | 1 | 43 |
(2) 당반기 및 전반기 중 기타비용의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 잡손실 | - | - | - | - |
26. 금융수익 및 금융비용
(1) 당반기 및 전반기 중 금융수익의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 금융수익 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | 193,927 | 412,114 | 272,190 | 581,230 |
| 외화환산이익 | 169 | 708 | 23,846 | 23,960 |
| 외환차익 | 244 | 284 | 71,903 | 72,623 |
| 합계 | 194,340 | 413,106 | 367,939 | 677,813 |
(2) 당반기 및 전반기 중 금융비용의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 금융비용 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용 | 407,603 | 796,492 | 339,215 | 659,727 |
| 외화환산손실 | 277 | 11,262 | 445 | 1,469 |
| 외환차손 | 1,330 | 11,534 | 31,011 | 40,545 |
| 파생상품부채평가손실 | 1,554,551 | 1,554,551 | 298,685 | 298,685 |
| 합계 | 1,963,762 | 2,373,840 | 669,356 | 1,000,426 |
27. 법인세비용
(1) 당반기와 전반기의 법인세비용은 없으며, 자본에 직접 부가되거나 차감된 법인세부담액과 이연법인세 또한 없습니다.
(2) 회사는 이연법인세자산에 대한 미래 실현가능성은 일시적차이가 실현되는 기간동안 과세소득을 창출할 수 있는 회사의 능력,전반적인 경제환경과 산업에 대한 전망등 다양한 요소들을 고려하여 평가합니다.
(3) 회사는 주기적으로 이러한 사항들을 검토하고 있으며, 당반기말 현재 일시적 차이순액, 세무상결손금 및 이월세액공제로 인한 이연법인세자산에 대하여 그 실현가능성이 확실하지 아니하므로 이연법인세 자산으로 인식하지 않았습니다.
(4) 당반기 중 사업결합으로 인하여 이연법인세부채 177백만원이 발생하였습니다.
28. 비용의 성격별 분류
당반기와 전반기 중 발생한 비용의 성격별 분류는 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 재고자산의 변동 | 28,210 | 28,530 | (26,612) | (28,470) |
| 원재료 등의 매입 | (28,210) | (28,530) | 13,373 | 15,231 |
| 종업원급여 | 810,129 | 1,631,139 | 800,286 | 1,556,248 |
| 경상연구개발비 | 253,739 | 1,337,805 | 3,271,834 | 4,801,622 |
| 감가상각비와 무형자산상각비 | 68,649 | 138,555 | 76,238 | 151,332 |
| 복리후생비 | 55,867 | 117,577 | 53,614 | 113,805 |
| 지급임차료 | - | 1,706 | 1,366 | 1,366 |
| 지급수수료 | 149,237 | 259,971 | 59,292 | 126,564 |
| 여비교통비 | 22,189 | 49,806 | 15,162 | 28,707 |
| 세금과공과 | 23,774 | 47,759 | 22,496 | 42,731 |
| 건물관리비 | 20,782 | 42,215 | 21,343 | 42,384 |
| 보험료 | 8,747 | 15,274 | 6,550 | 11,441 |
| 기타 | 22,300 | 57,730 | 39,893 | 77,535 |
| 합계(*) | 1,435,413 | 3,699,537 | 4,354,835 | 6,940,496 |
(*)포괄손익계산서상 매출원가 및 판매관리비의 합계액 입니다.
29. 주당이익
(1) 당반기 및 전반기 중 보통주 기본 주당손익 산정내역은 다음과 같습니다.
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 보통주 당기순손실 | (3,185,120) | (5,589,196) | (4,631,676) | (7,160,011) |
| 가중평균유통보통주식수 | 16,980,252주 | 16,980,252주 | 16,980,252주 | 16,980,252주 |
| 보통주 기본주당손익 (원) | (188) | (329) | (273) | (422) |
(2) 당반기 가중평균유통보통주식수 산정내역은 다음과 같습니다.
| 구분 | 당반기 | |||
|---|---|---|---|---|
| 보통주식수(주) | 기산일 | 일수(일) | 적수 | |
| 기초 | 16,980,252 | 2024.01.01 | 182 | 3,090,405,864 |
| 변동 | - | - | - | - |
| 합계 | 16,980,252 | - | - | 3,090,405,864 |
| 일수 | 182 | |||
| 가중평균유통보통주식수 | 16,980,252 | |||
(3) 연결실체의 잠재적보통주는 희석화 효과가 없으므로 기본주당손익과 희석주당손익은 동일합니다.
(4) 반희석효과로 인하여 희석주당이익을 계산할 때 고려하지 않았지만 잠재적으로 미래에 기본주당이익을 희석화할 수 있는 잠재적 보통주의 내용은 다음과 같습니다.
| (단위 : 주) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 전환우선주 | 460,000 | 460,000 |
| 주식선택권 | 220,000 | 105,000 |
| 전환사채 | 2,033,021 | 2,033,021 |
(*)잠재적 보통주는 무상증자가 고려되지 않은 최초의 부여주식수 및 발행 주식수 입니다.
30. 현금흐름표
(1) 현금및현금성자산은 재무상태표와 현금흐름표상의 금액이 일치하게 관리되고 있습니다.
(2) 당반기 및 전반기 중 영업에서 창출된 현금흐름은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전반기 |
| 법인세비용 차감전 순손실 | (5,589,196) | (7,160,011) |
| 조정항목 | ||
| (1) 손익항목의 조정 | 2,470,044 | 893,678 |
| 감가상각비 | 258,669 | 266,191 |
| 무형자산상각비 | 9,016 | 12,987 |
| 퇴직급여 | 193,536 | 140,502 |
| 대손상각비 | - | (2,421) |
| 주식보상비용 | 59,338 | 121,726 |
| 이자비용 | 796,492 | 659,727 |
| 외화환산손실 | 11,262 | 1,469 |
| 이자수익 | (412,114) | (581,230) |
| 외화환산이익 | (708) | (23,960) |
| 파생상품평가손실 | 1,554,551 | 298,685 |
| (2) 영업활동으로 인한 자산부채의 변동 | (243,415) | (1,461,809) |
| 매출채권의 감소(증가) | 16,734 | 2,430 |
| 미수금의 감소(증가) | (3,624) | 187,727 |
| 선급금의 감소(증가) | (46) | 290,731 |
| 장기선급비용의 감소(증가) | 916 | - |
| 재고자산의 감소(증가) | 22,342 | (28,470) |
| 선급비용의 감소(증가) | 10,862 | 8,364 |
| 매입채무의 증가(감소) | (26,383) | 1,221 |
| 미지급금의 증가(감소) | (209,152) | (1,969,471) |
| 예수금의 증가(감소) | (21) | 182 |
| 선수금의 증가(감소) | 60,000 | 2,516 |
| 미지급비용의 증가(감소) | 8,505 | 47,488 |
| 퇴직금의 지급 | (123,548) | (4,527) |
| 영업활동으로 창출된 현금 | (3,362,568) | (7,728,142) |
(3) 당반기 및 전반기 중 현금및현금성자산의 사용을 수반하지 않는 중요한 사항은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전반기 |
| 보험수리적손익으로 인한 확정급여채무의 증가(감소) | 132,217 | 232,905 |
| 사용권자산의 취득으로 인한 리스부채의 증가(감소) | 41,302 | 43,552 |
| 리스부채의 유동성 대체 | 4,609 | 20,801 |
(4) 재무활동에서 발생한 부채의 당반기 및 전반기 중 변동내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 유동성장기미지급금 | 장기미지급금 | 유동리스부채 | 비유동리스부채 |
| 전반기초 | 149,296 | - | 46,025 | 51,605 |
| 현금흐름 | 3,410 | 14,192 | (42,504) | - |
| 비현금흐름 | (5,209) | 5,209 | 64,352 | (20,801) |
| 전반기말 | 147,497 | 19,401 | 67,873 | 30,805 |
| 당반기초 | 188,875 | - | 43,483 | 11,854 |
| 현금흐름 | 16,307 | - | (42,727) | - |
| 비현금흐름 | - | - | 325,800 | 246,036 |
| 당반기말 | 205,182 | - | 326,556 | 257,890 |
31. 특수관계자거래
(1) 보고기간말 현재 연결실체의 특수관계자는 다음과 같습니다.
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타특수관계자 | 임직원, 포항공과대학교 산학협력단 | 임직원, 포항공과대학교 산학협력단 |
(2) 당반기 및 전반기 중 특수관계자와의 주요 거래 내역은 다음과 같습니다.
<당반기>
| (단위: 천원) | |||
|---|---|---|---|
| 특수관계자 | 매출 등 | 매입 등 | |
| 합성 매출 | 지급수수료 | 경상연구개발비 | |
| 포항공과대학교 산학협력단 | 2,336 | 442 | 2,760 |
<전반기>
| (단위: 천원) | |||
|---|---|---|---|
| 특수관계자 | 매출 등 | 매입 등 | |
| 합성 매출 | 지급수수료 | 경상연구개발비 | |
| 포항공과대학교 산학협력단 | 39,455 | 1,322 | 2,323 |
(3) 보고기간말 현재 특수관계자와의 채권채무잔액은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 특수관계자 | 당기말 | 전기말 | ||
| 외상매출금 | 미지급비용 | 외상매출금 | 미지급비용 | |
| 포항공과대학교 산학협력단 | - | 476 | 264 | 1,624 |
(4) 당반기 및 전반기 중 주요 경영진에 대한 보상 내역은 다음과 같습니다.
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급 여 | 118,257 | 236,515 | 104,868 | 185,323 |
| 퇴직급여 | 27,286 | 51,468 | 22,459 | 40,418 |
| 주식기준보상 | 10,807 | 21,614 | 10,807 | 10,807 |
| 합계 | 156,350 | 309,597 | 138,134 | 236,548 |
(5) 연결실체는 포항공과대학교 산학협력단과 라이선스 계약 등을 통해 매출액의 일정 비율을 기술료로 지급하고 있습니다(주석 32 참조).
32. 우발상황과 약정사항
1) 연결실체는 2011년 6월 7일 포항공과대학교 산학협력단과 체결한 압타머를 이용한 학문연구용 시약의 상업적 제공에 대한 라이선스 계약에 의해 관련 매출에 대하여 연순판매액의 3%를 경상기술료로 지급하고 있습니다.
2) 연결실체는 2013년 7월 31일 포항공과대학교 산학협력단과 체결한 IVD 라이선스 계약(한국 내)에 의해 IVD제품의 한국 내 순판매액의 6%를 기술료로 지급해야 합니다.
3) 연결실체는 2014년 6월 11일 포항공과대학교 산학협력단과 체결한 기술이전계약서 (Aptamer sandwich Assay에 대한)에 의해 기술적용 연간 총 매출액의 3%를 기술료로 지급해야 합니다.
4) 연결실체는 2016년 1월 25일 포항공과대학교 산학협력단과 체결한 IVD 라이선스 계약(중국, 일본, 싱가포르, 인도, 대만, 인도네시아, 태국, 베트남, 말레이시아, 라오스,캄보디아, 필리핀)에 의해 기술적용 연간 순 매출액의 3.5%를 기술료로 지급해야 합니다.
5) 연결실체는 2016년 3월 1일 서울아산병원과 체결한 기술이전 계약(폐암진단키트 개발 노하우)에 의해 폐암IVD의 한국내 매출액의 1%를 기술료로 지급해야 합니다.
6) 연결실체는 2022년 08월 01일 과학기술정보통신부의 CD25 표적 압타머-약물접합체를 이용한 면역 항암제 연구개발 과제에 착수 하였으며 규정에 따라 정부출연금의 10%를 기술료로 지급해야 합니다.
7) 연결실체는 당반기말 현재 서울보증보험으로부터 12,000천원의 한도로 지급보증보험을 제공받고 있습니다.
8) 연결실체는 당반기말 현재 차입금 151,102 천원의 담보로 외상매출채권을 제공하였습니다.
33. 영업부문
(1) 연결실체는 기업회계기준서 제1108호(영업부문)에 따른 보고부문을 단일부문으로 식별하였습니다. 회사의 경영진은 부문에 자원을 배분하고 부문의 성과를 평가하기 위하여 회사의 최고영업의사결정자에게 보고되는 정보에 기초하여 영업부문을 결정하고 있습니다. 단일의 보고부문은 동일한 성격의 생산품과 용역을 제공하며 해당 영업단위에서 요구되는 기술과 마케팅 전략이 동일하므로, 통합하여 운영되고 있습니다.
(2) 연결실체의 당반기 수익 중 국내와 해외 비중은 75.2% 대 24.8% 이며,국내외 발생국가는 일본, 네덜란드, 대만, 영국등 다양하게 존재하고 있습니다. 또한 회사의 주요 고객은 대학, 연구소 및 기업 등 다양하게 구성되어 있으며 계절적 영향을 받지 않습니다.
(3) 당반기와 전반기 중 회사 매출액의 10% 이상을 차지하는 고객과 관련된 정보는 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 고객 | 당반기 | 전반기 |
| 고객 A | 19,238 | 39,455 |
| 고객 B | 11,416 | 14,600 |
| 고객 C | 11,058 | 11,896 |
| 고객 D | 9,658 | - |
| 고객 E | 7,398 | - |
| 합계 | 58,768 | 65,951 |
34. 위험관리
(1) 금융위험관리
연결실체는 경영활동과 관련하여 신용위험, 유동성위험 및 시장위험 등 다양한 금융위험에 노출되어 있습니다. 회사는 금융위험이 경영에 미칠 수 있는 불리한 효과를 최소화하기 위해노력하고 있습니다.
1) 신용위험관리
연결실체는 채무불이행으로 인한 재무적 손실을 경감시키기 위하여 신용도가 일정 수준 이상인 거래처와 거래하고, 충분한 담보 또는 지급보증을 수취하고 있습니다. 회사는신용위험노출 및 거래처의 신용등급을 주기적으로 검토하여 거래처의 여신한도 및 담보수준을 재조정하는 등 신용위험을 관리하고 있습니다.
금융상품 종류별 신용위험의 최대 노출금액은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당반기 | 전기 | ||
| 장부금액 |
신용위험 최대노출금액 |
장부금액 |
신용위험 최대노출금액 |
|
| 유동자산 | ||||
| 현금및현금성자산 | 1,125,630 | 1,125,630 | 1,237,370 | 1,237,370 |
| 단기금융상품 | 18,500,000 | 18,500,000 | 22,500,000 | 22,500,000 |
| 매출채권 | 90,087 | 90,087 | 24,866 | 24,866 |
| 기타유동금융자산 | 308,790 | 308,790 | 335,792 | 335,792 |
| 파생상품자산 | 61,742 | 61,742 | 676,067 | 676,067 |
| 소계 | 20,086,250 | 20,086,250 | 24,774,095 | 24,774,095 |
| 비유동자산 | ||||
| 당기손익-공정가치 측정 금융자산 | 680 | 680 | 680 | 680 |
| 기타비유동금융자산 | 118,648 | 118,648 | 89,352 | 89,352 |
| 소계 | 119,328 | 119,328 | 90,032 | 90,032 |
| 합계 | 20,205,578 | 20,205,578 | 24,864,127 | 24,864,127 |
2) 유동성위험관리
연결실체는 미래의 현금흐름을 예측하여 단기 및 중장기 자금조달 계획을 수립하여 유동성위험을 관리하고 있으며, 금융부채의 잔존계약 만기에 따른 만기분석내용은 다음과 같습니다.
<당반기>
| (단위: 천원) | |||||
|---|---|---|---|---|---|
구 분 |
장부금액 | 계약상 현금흐름 | |||
| 1년 미만 | 1년 이상 ~ 3년 미만 |
3년 이상 | 합 계 | ||
| 매입채무 | - | - | - | - | - |
| 단기차입금 | 151,102 | 151,102 | - | - | 151,102 |
| 미지급금 | 554,500 | 554,500 | - | - | 554,500 |
| 유동성장기미지급금 | 205,182 | 205,182 | - | - | 205,182 |
| 유동성리스부채 | 326,556 | 363,014 | - | - | 363,014 |
| 전환사채 | 9,019,850 | 16,500,000 | - | - | 16,500,000 |
| 비유동리스부채 | 257,890 | - | 278,374 | - | 278,374 |
| 미지급비용 | 150,648 | 129,486 | - | - | 129,486 |
| 합계 | 10,665,727 | 17,903,284 | 278,374 | - | 18,181,658 |
(주) 잔존계약에 따른 만기금액은 할인되지 아니한 계약상 현금흐름임
<전기>
| (단위: 천원) | |||||
|---|---|---|---|---|---|
구 분 |
장부금액 | 계약상 현금흐름 | |||
| 1년 미만 | 1년 이상 ~ 3년 미만 |
3년 이상 | 합 계 | ||
| 매입채무 | 26,383 | 26,383 | - | - | 26,383 |
| 미지급금 | 356,853 | 356,853 | - | - | 356,853 |
| 유동성장기미지급금 | 188,875 | 188,875 | - | - | 188,875 |
| 유동성리스부채 | 43,483 | 44,992 | - | - | 44,992 |
| 전환사채 | 8,225,950 | 16,500,000 | - | - | 16,500,000 |
| 비유동리스부채 | 11,854 | - | 13,584 | - | 13,584 |
| 미지급비용 | 90,590 | 90,590 | - | - | 90,590 |
| 합계 | 8,943,988 | 17,207,693 | 13,584 | - | 17,221,277 |
3) 외환위험관리
① 보고기간말 현재 외환위험에 노출되어 있는 회사의 금융자산 및 금융부채의 내역의 원화환산 기준액은 다음과 같습니다.
| (단위: USD,천원) | |||||
|---|---|---|---|---|---|
| 구 분 | 통화 | 당반기말 | 전기말 | ||
| 외화금액 | 원화환산액 | 외화금액 | 원화환산액 | ||
| 금융자산 | |||||
| 외화예금 | USD | 3,965 | 5,508 | 6,714 | 8,657 |
| 매출채권 | 1,227 | 1,705 | - | - | |
| 금융부채 | |||||
| 미지급금 | USD | - | - | 122,760 | 158,287 |
② 연결실체는 외화거래 수행에 따라 다양한 환율변동위험에 노출되어 있습니다. 주요 통화별 환율변동시 민감도 분석내용은 다음과 같습니다.
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | |
| USD | 10%상승 | 721 | (14,963) |
| 10%하락 | (721) | 14,963 | |
③ 이자율위험은 시장이자율의 변동으로 인하여 금융상품에서 발생하는 이자수익 및 이자비용이 변동할 위험을 의미합니다.
당반기 및 전반기 중 이자율이 1% 변동시 이자율 변동이 손익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | |||
| 금액 | 비율(*) | 금액 | 비율(*) | ||
| 차입금 | 151,102 | - | |||
| 이자율 재설정일 | 1-5년 | 151,102 | 100% | - | - |
| 이자비용 | 상승시 | (1,511) | - | ||
| 하락시 | 1,511 | - | |||
(*) 위의 차입금 비율은 전체 차입금 중 변동금리에 노출된 해당 차입금의 비율을 나타냅니다.
(2) 자본위험관리
연결실체의 자본관리 목적은 계속기업으로 영업활동을 유지하고 주주 및 이해관계자의 이익을 극대화하하고 자본비용의 절감을 위하여 최적의 자본구조를 유지하는데 있습니다. 회사는 배당조정, 신주발행 등의 정책을 통하여 자본구조를 경제환경의 변화에따라 적절히 수정변경하고 있습니다. 회사의 자본위험관리정책은 전기와 중요한 변동이 없습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당반기 | 전기 |
| 부채총계 | 21,283,140 | 17,056,722 |
| 차감: 현금및현금성자산 | 1,125,630 | 1,237,370 |
| 순부채 | 20,157,509 | 15,819,352 |
| 자본총계 | 9,816,821 | 15,478,897 |
| 순부채비율 | 205.34% | 102.20% |
35. 사업결합
연결실체는 2024년 5월 27일 ㈜인터내셔널사이언티픽스탠다드의 지분을 100 % 취득하여지배력을 획득 하였습니다 (간주취득일: 2024년 6월 30일).
연결실체가 취득일에 취득 또는 인수한 식별가능한 자산 및 부채의 공정가치, 취득일의 비지배지분 및 영업권은 다음과 같습니다.
| (단위: 천원) | |
|---|---|
| 구 분 | 금액 |
| 자산 : | |
| 현금및현금성자산 | 257,629 |
| 매출채권 | 84,205 |
| 선급금 | 18 |
| 선급비용 | 170,834 |
| 당기법인세자산 | 100 |
| 계약자산 | 675,824 |
| 유형자산 | 895,413 |
| 무형자산 | 851,473 |
| 임차보증금 | 42,151 |
| 2,977,648 | |
| 부채: | |
| 단기차입금 | 1,651,102 |
| 미지급금 | 397,915 |
| 미지급비용 | 57,362 |
| 계약부채 | 386,699 |
| 리스부채 | 530,534 |
| 기타비유동부채 | 737,612 |
| 이연법인세부채 | 177,957 |
| 합 계 | 3,939,180 |
| 식별가능한 순자산 가액 | (961,533) |
| 비지배지분 | - |
| 영업권 | 961,533 |
| 이전대가 | - |
식별가능한 순자산의 공정가치와 영업권은 잠정적으로 결정된 금액으로서 최종 가치평가 결과에 따라 금액이 변동될 수 있습니다.
36. 보고기간 후 사건
(1) 2024년 7월 15일 이사회에서 지배회사의 종속회사인 주식회사 인터내셔널사이언티픽스탠다드와의 합병 승인이 결의되었습니다.
4. 재무제표
4-1. 재무상태표
| 재무상태표 |
| 제 14 기 반기말 2024.06.30 현재 |
| 제 13 기말 2023.12.31 현재 |
| (단위 : 원) |
| 제 14 기 반기말 | 제 13 기말 | |
|---|---|---|
| 자산 | ||
| I. 유동자산 | 21,380,412,940 | 25,033,614,040 |
| 현금및현금성자산 | 868,001,287 | 1,237,369,971 |
| 단기금융상품 | 18,500,000,000 | 22,500,000,000 |
| 파생상품자산 | 61,741,892 | 676,066,548 |
| 매출채권 | 8,247,018 | 24,866,270 |
| 재고자산 | 49,131,709 | 71,473,724 |
| 기타유동금융자산 | 1,814,600,287 | 335,791,643 |
| 기타유동자산 | 9,425,667 | 19,325,984 |
| 당기법인세자산 | 69,265,080 | 168,719,900 |
| II. 비유동자산 | 7,288,542,684 | 7,502,004,939 |
| 유형자산 | 7,040,641,482 | 7,250,878,352 |
| 무형자산 | 29,845,287 | 38,861,460 |
| 당기손익-공정가치 측정 금융자산 | 680,000 | 680,000 |
| 종속기업투자주식 | 1 | 0 |
| 기타비유동금융자산 | 76,497,000 | 89,352,000 |
| 기타비유동자산 | 140,878,914 | 122,233,127 |
| 자산총계 | 28,668,955,624 | 32,535,618,979 |
| 부채 | ||
| I. 유동부채 | 16,836,997,206 | 15,239,181,806 |
| 매입채무 및 기타금융부채 | 463,227,861 | 662,701,667 |
| 기타 유동부채 | 62,786,505 | 2,807,515 |
| 유동성전환사채 | 9,019,849,984 | 8,225,950,071 |
| 유동파생상품부채 | 7,244,466,650 | 6,304,239,897 |
| 유동 리스부채 | 46,666,206 | 43,482,656 |
| II. 비유동부채 | 2,015,137,059 | 1,817,540,266 |
| 순확정급여부채 | 2,007,891,227 | 1,805,685,786 |
| 비유동 리스부채 | 7,245,832 | 11,854,480 |
| 부채총계 | 18,852,134,265 | 17,056,722,072 |
| 자본 | ||
| 자본금 | 8,950,126,000 | 8,950,126,000 |
| 기타불입자본 | 65,280,986,858 | 65,221,648,856 |
| 이익잉여금(결손금) | (64,414,291,499) | (58,692,877,949) |
| 자본총계 | 9,816,821,359 | 15,478,896,907 |
| 부채및자본총계 | 28,668,955,624 | 32,535,618,979 |
4-2. 포괄손익계산서
| 포괄손익계산서 |
| 제 14 기 반기 2024.01.01 부터 2024.06.30 까지 |
| 제 13 기 반기 2023.01.01 부터 2023.06.30 까지 |
| (단위 : 원) |
| 제 14 기 반기 | 제 13 기 반기 | |||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| I. 매출액 | 19,698,137 | 71,055,726 | 24,576,576 | 103,055,370 |
| 용역수익 | 19,558,137 | 70,495,726 | 24,576,576 | 103,055,370 |
| 제품매출액 | 140,000 | 560,000 | 0 | 0 |
| II. 매출원가 | 3,095,890 | 11,623,912 | 5,092,126 | 19,855,447 |
| 용역매출원가 | 3,031,306 | 11,436,192 | 5,092,126 | 19,855,447 |
| 제품매출원가 | 64,584 | 187,720 | 0 | 0 |
| III.매출총이익 | 16,602,247 | 59,431,814 | 19,484,450 | 83,199,923 |
| IV. 판매비와관리비 | 1,432,316,667 | 3,687,913,429 | 4,349,743,290 | 6,920,640,459 |
| 급여 | 477,458,779 | 999,713,637 | 491,873,319 | 984,102,559 |
| 상각비 | 68,648,934 | 137,806,845 | 76,188,878 | 151,282,691 |
| 경상연구개발비 | 585,454,922 | 1,959,375,405 | 3,571,331,502 | 5,360,099,775 |
| 기타영업비용 | 300,754,032 | 591,017,542 | 210,349,591 | 425,155,434 |
| V. 영업손실 | (1,415,714,420) | (3,628,481,615) | (4,330,258,840) | (6,837,440,536) |
| 기타수익 | 15,992 | 18,874 | 778 | 42,874 |
| 기타비용 | 180 | 180 | 5 | 5 |
| 금융수익 | 194,340,217 | 413,106,349 | 367,938,501 | 677,813,102 |
| 금융비용 | 1,963,761,848 | 2,373,839,842 | 669,356,106 | 1,000,426,054 |
| VI. 법인세비용차감전순이익(손실) | (3,185,120,239) | (5,589,196,414) | (4,631,675,672) | (7,160,010,619) |
| VII. 법인세비용(수익) | 0 | 0 | 0 | 0 |
| VIII. 당기순이익(손실) | (3,185,120,239) | (5,589,196,414) | (4,631,675,672) | (7,160,010,619) |
| IX. 기타포괄손익 | 15,713,413 | (132,217,136) | (11,367,922) | (232,904,510) |
| 순확정급여의 재측정요소 | 15,713,413 | (132,217,136) | (11,367,922) | (232,904,510) |
| X. 총포괄손익 | (3,169,406,826) | (5,721,413,550) | (4,643,043,594) | (7,392,915,129) |
| XI. 주당이익 | ||||
| 기본주당이익(손실) (단위 : 원) | (188) | (329) | (273) | (422) |
| 희석주당이익(손실) (단위 : 원) | (188) | (329) | (273) | (422) |
4-3. 자본변동표
| 자본변동표 |
| 제 14 기 반기 2024.01.01 부터 2024.06.30 까지 |
| 제 13 기 반기 2023.01.01 부터 2023.06.30 까지 |
| (단위 : 원) |
| 자본 | |||||
|---|---|---|---|---|---|
| 자본금 | 자본잉여금 | 자본조정 | 결손금 | 자본 합계 | |
| 2023.01.01 (기초자본) | 4,475,063,000 | 68,749,921,111 | 810,644,424 | (44,812,791,600) | 29,222,836,935 |
| 당기순이익(손실) | (7,160,010,619) | (7,160,010,619) | |||
| 주식보상비용 | 121,726,335 | 121,726,335 | |||
| 확정급여채무의 재측정요소 | (232,904,510) | (232,904,510) | |||
| 무상증자 | 4,475,063,000 | (4,511,353,523) | (36,290,523) | ||
| 2023.06.30 (기말자본) | 8,950,126,000 | 64,238,567,588 | 932,370,759 | (52,205,706,729) | 21,915,357,618 |
| 2024.01.01 (기초자본) | 8,950,126,000 | 64,258,500,958 | 963,147,898 | (58,692,877,949) | 15,478,896,907 |
| 당기순이익(손실) | (5,589,196,414) | (5,589,196,414) | |||
| 주식보상비용 | 59,338,002 | 59,338,002 | |||
| 확정급여채무의 재측정요소 | (132,217,136) | (132,217,136) | |||
| 무상증자 | 0 | ||||
| 2024.06.30 (기말자본) | 8,950,126,000 | 64,258,500,958 | 1,022,485,900 | (64,414,291,499) | 9,816,821,359 |
4-4. 현금흐름표
| 현금흐름표 |
| 제 14 기 반기 2024.01.01 부터 2024.06.30 까지 |
| 제 13 기 반기 2023.01.01 부터 2023.06.30 까지 |
| (단위 : 원) |
| 제 14 기 반기 | 제 13 기 반기 | |
|---|---|---|
| Ⅰ. 영업활동현금흐름 | (2,815,920,610) | (7,334,744,396) |
| 영업활동으로 창출된 현금흐름 | (3,362,567,888) | (7,728,142,396) |
| 이자지급 | 449,784,612 | (3,558,833) |
| 이자수취 | (2,592,154) | 403,225,363 |
| 법인세환급 | 99,454,820 | (6,268,530) |
| Ⅱ. 투자활동현금흐름 | 2,472,392,065 | 7,671,576,076 |
| 1. 투자활동으로인한 현금 유입액 | 24,500,000,000 | 33,500,000,000 |
| 단기금융상품의 처분 | 24,500,000,000 | 33,500,000,000 |
| 2. 투자활동으로인한 현금 유출액 | (22,027,607,935) | (25,828,423,924) |
| 유형자산의 취득 | (7,130,392) | (295,052,230) |
| 무형자산의 취득 | 0 | (2,613,428) |
| 종속기업투자주식의 취득 | (1) | 0 |
| 단기금융상품의 취득 | (20,500,000,000) | (25,500,000,000) |
| 단기대여금의 증가 | (1,500,000,000) | 0 |
| 선급금의 증가 | (20,477,542) | (30,758,266) |
| Ⅲ. 재무활동현금흐름 | (26,420,321) | (61,193,023) |
| 1. 재무활동으로인한 현금 유입액 | 16,306,725 | 17,601,867 |
| 장기미지급금의 증가 | 14,191,688 | |
| 유동성미지급금의 증가 | 16,306,725 | 3,410,179 |
| 2. 재무활동으로인한 현금 유출액 | (42,727,046) | (78,794,890) |
| 리스부채의 상환 | (42,727,046) | (42,504,367) |
| 주식발행비용의 발생 | 0 | (36,290,523) |
| IV. 현금및현금성자산에 대한 환율변동효과 | 580,182 | 104,409 |
| Ⅴ. 현금및현금성자산의 증가(감소) | (369,368,684) | 275,743,066 |
| Ⅵ. 기초현금및현금성자산 | 1,237,369,971 | 1,222,371,742 |
| VII. 기말현금및현금성자산 | 868,001,287 | 1,498,114,808 |
5. 재무제표 주석
| 제 14 (당)기 반기 2024년 06월 30일 현재 |
| 제 13 (전)기 2023년 12월 31일 현재 |
| 주식회사 압타머사이언스 |
1. 일반사항
주식회사 압타머사이언스(이하 "회사") 는 2011년 4월 1일에 설립되어, 압타머 기술 플랫폼을 기반으로 한 맞춤형 압타머 발굴 및 생산, 서비스 제공, 압타머 응용 기술 및 제품 개발(연구 및 진단용 어세이 기술, 약물전달기술, 치료제 개발 등)을 주요사업으로 영위하고있으며, 본사는 경기도 성남시에 소재하고 있습니다. 회사의 설립시자본금은 280백만원이었으나, 수차례의 증자를 통하여 2024년 06월 30일 현재의 보통주 자본금 8,490백만원,우선주 자본금은 460백만원입니다.
보고기간 종료일 현재 주주현황은 다음과 같습니다.
| 구 분 | 소유주식수(주) | 보통주 지분율 |
||
|---|---|---|---|---|
| 보통주 | 우선주 | 합 계 | ||
| 한동일 | 2,810,000 | - | 2,810,000 | 16.5% |
| 류성호 | 1,020,000 | - | 1,020,000 | 6.0% |
| 장승기 | 1,020,000 | - | 1,020,000 | 6.0% |
| 포항공과대학 산학협력단 | 368,000 | 920,000 | 1,288,000 | 2.2% |
| 기타 | 11,762,252 | - | 11,762,252 | 69.3% |
| 합 계 | 16,980,252 | 920,000 | 17,900,252 | 100% |
2. 중요한 회계정책
반기재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 반기재무제표는 보고기간말 현재 유효한 한국채택국제회계기준에 따라 작성되었으며, 회사의 반기재무제표는 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표로서 종속기업 투자는 직접적인 지분투자에 근거하여 원가로 측정하고 있습니다.
반기재무제표를 작성하기 위하여 채택한 중요한 회계정책은 별도의 언급이 없는 한 전기 연차재무제표 작성시 채택한 회계정책과 동일하게 적용되었습니다.
반기재무제표 작성을 위하여 채택한 중요한 회계정책은 다음과 같습니다.
(1) 회계정책의 변경과 공시
1) 회사가 채택한 제ㆍ개정 기준서 및 해석서
회사가 2024년 1월 1일 이후 개시하는 회계기간부터 적용한 제ㆍ개정 기준서 및 해석서는다음과 같습니다.
(가) 기업회계기준서 제1001호 '재무제표 표시' (개정) - 부채의 유동/비유동 분류
동 개정사항은 유동부채와 비유동부채의 분류는 보고기간말에 존재하는 기업의 권리에 근거한다는 점을 명확히 하고 기업이 부채의 결제를 연기할 수 있는 권리를 행사할지 여부에대한 기대와는 무관하다는 점을 강조합니다. 그리고 보고기간말에 차입약정을 준수하고 있다면 해당 권리가 존재한다고 설명하고 결제는 현금, 지분상품, 그 밖의 자산 또는 용역을 거래상대방에게 이전하는 것으로 그 정의를 명확히 합니다.
(나) 기업회계기준서 제1116호 '리스' (개정) - 판매후리스에서 생기는 부채
동 개정사항은 판매후리스 거래의 후속측정에 대해 규정합니다. 판매후리스 사용권자산 및 리스부채에도 일반적인 리스 후속측정 방식을 적용하되, 판매자-리스이용자가 보유하는 사용권에 대해서는 관련 손익을 인식하지 않는 방식으로 리스부채를 인식하고 '(수정)리스료'를 산정합니다.
(다) 기업회계기준서 제1001호 '재무제표 표시' (개정) - 가상자산
동 개정사항은 가상자산을 직접 보유하는 경우, 고객 대신 보유하는 경우, 발행하는 경우에 가상자산 보유 발행에 따른 회사의 회계정책, 재무제표에 미치는 영향 등 재무제표 이용자에게 중요한 정보를 공시하도록 규정하고 있습니다.
(라) 기업회계기준서 제1007호 '현금흐름표' 및 제1107호 '금융상품:공시' (개정) - 공급자금융약정
동 개정사항은 재무제표 이용자가 기업의 부채와 현금흐름에 미치는 영향을 평가할 수 있도록 재무활동에서 생기는 부채의 변동에 공급자금융약정 정보를 구분하여 공시하고 공급자금융약정으로 발생하는 유동성 위험을 공시하도록 규정하고 있습니다.개정내용을 최초로 적용하는 회계연도 내 표시하는 중간보고기간에는 경과규정에 따라 해당 내용을 공시할 필요가 없습니다.
동 기준서의 개정 또는 제정이 재무제표에 미치는 유의적인 영향은 없습니다.
2) 공표되었으나 아직 시행되지 않은 제ㆍ개정 기준서 및 해석서
반기말 현재 제정ㆍ공표되었으나 시행일이 도래하지 않아 회사가 채택하지 않은 한국채택국제회계기준의 기준서 및 해석서는 다음과 같습니다.
(가) 기업회계기준서 제1021호 '환율변동효과'와 제1101호 '한국채택국제회계기준의 최초채택' (개정) - 교환가능성 결여
동 개정사항은 한 통화를 다른 통화로 교환 가능한지 여부를 평가하고 교환 가능하지 않은경우 사용할 현물환율을 결정할 때 일관된 접근 방식을 적용하고 관련 정보를 공시하도록 요구합니다. 동 개정사항은 2025 년 1 월 1 일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다.
당사는 상기에 열거된 제ㆍ개정사항이 재무제표에 미치는 영향이 중요하지 않을 것으로 판단하고 있습니다.
(2) 재무제표 작성기준
1) 측정기준
재무제표는 금융상품 등 아래의 회계정책에서 별도로 언급하고 있는 사항을 제외하고는 역사적원가를 기준으로 작성되었습니다.
2) 기능통화와 표시통화
재무제표는 회사의 기능통화이면서 표시통화인 "원(KRW)"으로 표시되고 있으며 별도로 언급하고 있는 사항을 제외하고는 "원(KRW)" 단위로 표시되고 있습니다.
(3) 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전이익에 적용하여 계산합니다.
(4) 중요한 회계추정 및 판단
재무제표의 작성시 경영진은 회계정책의 적용이나 자산, 부채, 수익, 비용의 장부금액 및 우발부채의 금액에 영향을 미칠 수 있는 판단과 추정 및 가정을 하여야 합니다.보고기간말 현재 이러한 추정치는 경영진의 최선의 판단 및 추정에 따라 이루어지고 있으며 추정치와 추정에 대한 가정은 지속적으로 검토되고 있으나 향후 경영환경의 변화에 따라 실제 결과와는 중요하게 다를 수도 있습니다.
3. 금융상품의 범주
(1) 금융자산의 범주
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 상각후원가 측정 금융자산 | ||
| 현금및현금성자산 | 868,001 | 1,237,370 |
| 단기금융상품 | 18,500,000 | 22,500,000 |
| 매출채권 | 8,247 | 24,866 |
| 기타유동금융자산 | 1,814,600 | 335,792 |
| 기타비유동금융자산 | 76,497 | 89,352 |
| 당기손익-공정가치 측정 금융자산 | ||
| 유동파생상품자산 | 61,742 | 676,067 |
| 기타금융자산 | 680 | 680 |
| 합계 | 21,329,767 | 24,864,127 |
(2) 금융부채의 범주
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 상각후원가 측정 금융부채 | ||
| 매입채무 | - | 26,383 |
| 기타유동금융부채 | 463,228 | 636,318 |
| 유동리스부채 | 46,666 | 43,483 |
| 비유동리스부채 | 7,246 | 11,854 |
| 유동성전환사채 | 9,019,850 | 8,225,950 |
| 당기손익-공정가치 측정 금융부채 | ||
| 유동파생상품부채 | 7,244,467 | 6,304,240 |
| 합계 | 16,781,458 | 15,248,228 |
(3) 금융상품 범주별 순손익
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상각후원가 측정 금융자산 | ||||
| 이자수익 | 193,927 | 412,114 | 272,190 | 581,230 |
| 외화관련손익 | (1,194) | (21,804) | 64,292 | 54,569 |
| 대손상각비 | - | - | - | 2,421 |
| 당기손익-공정가치 측정 금융자산 | ||||
| 평가손실 | (614,325) | (614,325) | (157,283) | (157,283) |
| 상각후원가 측정 금융부채 | ||||
| 이자비용 | (407,603) | (796,492) | (339,215) | (659,727) |
| 당기손익-공정가치 측정 금융부채 | ||||
| 평가손실 | (940,227) | (940,227) | (141,402) | (141,402) |
| 합계 | (1,769,422) | (1,960,733) | (301,418) | (320,192) |
4. 공정가치
(1) 보고기간말 현재 금융상품의 종류별 장부금액과 공정가치의 비교내용은 다음과 같습니다.
<당반기>
| (단위: 천원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 파생상품자산(유동) | 61,742 | 61,742 |
| 당기손익-공정가치측정 금융자산(비유동) | 680 | 680 |
| 소계 | 62,422 | 62,422 |
| <금융부채> | ||
| 파생상품부채(비유동) | 7,244,467 | 7,244,467 |
<전기>
| (단위: 천원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 파생상품자산(유동) | 676,067 | 676,067 |
| 당기손익-공정가치측정 금융자산(비유동) | 680 | 680 |
| 소계 | 676,747 | 676,747 |
| <금융부채> | ||
| 파생상품부채(비유동) | 6,304,240 | 6,304,240 |
(2) 공정가치로 측정되는 자산·부채의 공정가치 측정치
1) 공정가치 서열체계 및 측정방법
공정가치란 측정일에 시장참여자 사이의 정상거래에서 자산을 매도할 때 받거나 부채를 이전할 때 지급하게 될 가격을 의미합니다. 공정가치 측정은 측정일에 현행 시장 상황에서자산을 매도하거나 부채를 이전하는 시장참여자 사이의 정상거래에서의 가격을 추정하는 것으로, 회사는 공정가치 평가시 시장정보를 최대한 사용하고, 관측 가능하지 않은 변수는최소한으로 사용하고 있습니다.
회사는 공정가치로 측정되는 자산·부채를 공정가치 측정에 사용된 투입변수에 따라 다음과 같은 공정가치 서열체계로 분류하였습니다.
수준1 : 활성시장에서 공시되는 가격을 공정가치로 측정하는 자산·부채의 경우 동 자산·부채의 공정가치는 수준1로 분류됩니다.
수준2 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 모든 유의적인 투입변수가 시장에서 관측한 정보에 해당하면 자산·부채의 공정가치는 수준2로 분류됩니다.
수준3 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 하나 이상의 유의적인 투입변수가 시장에서 관측불가능한 정보에 해당하면 동 금융상품의 공정가치는 수준3으로 분류됩니다.
자산·부채의 공정가치는 자체적으로 개발한 내부평가모형을 통해 평가한 값을 사용하거나 독립적인 외부평가기관이 평가한 값을 제공받아 사용하고 있습니다.
2) 보고기간말 현재 재무상태표에 공정가치로 측정되는 자산·부채의 공정가치 서열체계별 공정가치 금액은 다음과 같습니다.
<당반기>
| (단위 : 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 당기손익-공정가치측정 금융자산 | 61,742 | - | - | 61,742 | 61,742 |
| <부채> | |||||
| 당기손익-공정가치측정 금융부채 | 7,244,467 | - | - | 7,244,467 | 7,244,467 |
<전기>
| (단위 : 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 당기손익-공정가치측정 금융자산 | 676,747 | - | - | 676,747 | 676,747 |
| <부채> | |||||
| 당기손익-공정가치측정 금융부채 | 6,304,240 | - | - | 6,304,240 | 6,304,240 |
3) 가치평가기법 및 투입변수 설명
보고기간 종료일 현재 재무상태표에서 공정가치로 측정되는 자산·부채 중 공정가치서열체계 수준3으로 분류된 항목의 가치평가기법과 투입변수는 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | 가치평가기법 | 투입변수 |
| 금융자산 : | ||||
| 파생상품자산 | 61,742 | 61,742 | 이항모형 | 주가변동성, 무위험이자 |
| 금융부채 : | ||||
| 파생상품부채 | 7,244,467 | 7,244,467 | 이항모형 | 주가변동성, 무위험이자 |
(3) 회사는 상각후원가로 측정되는 금융자산 및 금융부채의 장부금액은 공정가치와 유사하다고 판단하고 있습니다.
5. 현금및현금성자산 및 단기금융상품
(1) 보고기간말 현재 현금및현금성자산 및 단기금융상품의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 현금및현금성자산 | ||
| 보통예금 | 868,001 | 1,237,370 |
| 단기금융상품 | ||
| 정기예금 | 11,500,000 | 15,000,000 |
| 중소기업금융 채권 | 7,000,000 | 7,500,000 |
| 소계 | 18,500,000 | 22,500,000 |
6. 당기손익-공정가치측정 금융자산
(1) 보고기간말 현재 당기손익-공정가치측정 금융자산 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 유동자산 | ||
| 파생상품자산 | 61,742 | 676,067 |
| 비유동자산 | ||
| 지분상품 | 680 | 680 |
(2) 당반기 및 전반기 중 당기손익으로 인식된 금액은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전반기 |
| 당기손익-공정가치 금융자산 | ||
| 평가손익 | (614,325) | (157,283) |
7. 매출채권
(1) 보고기간말 현재 매출채권의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 매출채권 | 8,247 | 24,866 |
| 대손충당금 | - | - |
| 합계 | 8,247 | 24,866 |
(2) 보고기간말 현재 매출채권의 연령분석은 다음과 같습니다.
<당반기말>
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 1년 이하 | 1년 초과 | 합 계 |
| 매출채권(*) | 8,247 | - | 8,247 |
(*) 연령분석은 대상 채권의 회수기준일을 기준으로 분석하였습니다.
<전기말>
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 1년 이하 | 1년 초과 | 합 계 |
| 매출채권(*) | 24,866 | - | 24,866 |
(*) 연령분석은 대상 채권의 회수기준일을 기준으로 분석하였습니다.
8. 기타금융자산
보고기간말 현재 기타금융자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 미수금 | 33,309 | - | 29,685 | - |
| 미수수익 | 220,493 | - | 258,164 | - |
| 보증금 | 60,798 | 76,497 | 47,943 | 89,352 |
| 대여금 | 1,500,000 | - | - | - |
| 합계 | 1,814,600 | 76,497 | 335,792 | 89,352 |
9. 재고자산
보고기간말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||||
| 평가전금액 | 평가충당금 | 장부금액 | 평가전금액 | 평가충당금 | 장부금액 | |
| 원재료 | 20,134 | - | 20,134 | 56,027 | - | 56,027 |
| 재공품 | 4,525 | - | 4,525 | 6,753 | (1,723) | 5,030 |
| 제품 | 24,472 | - | 24,472 | 14,882 | (4,465) | 10,417 |
| 합계 | 49,132 | - | 49,132 | 77,662 | (6,188) | 71,474 |
10. 기타자산
보고기간말 현재 기타자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||
| 유동 | 비유동 | 유동 | 비유동 | |
| 선급금(*) | 353 | 129,486 | 307 | 109,008 |
| 선급비용 | 9,073 | 11,393 | 19,019 | 13,225 |
| 합계 | 9,426 | 140,879 | 19,326 | 122,233 |
(*) 선급금에는 특허출원비용 당반기말 129,486천원 및 전기말 109,008천원이 포함되어 있습니다.
11. 종속기업투자주식
보고기간말 현재 종속기업투자주식의 내역은 다음과 같습니다.
| (단위: 천원) | |||||
|---|---|---|---|---|---|
| 회사명 | 소재지 | 결산월 | 주요 영업활동 | 당반기말 | |
| 지분율 | 장부금액 | ||||
| (주)인터내셔널사이언티픽스탠다드(*) | 대한민국 | 12월 | 의약품분석, 임상검체 분석 | 100% | - |
(*) 당반기 중 지분을 신규로 취득하였습니다.
12. 유형자산
(1) 보고기간말 현재 유형자산 장부금액의 구성내역은 다음과 같습니다.
| (단위: 천원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||||||
| 취득원가 | 상각 누계액 |
정부 보조금 |
장부금액 | 취득원가 | 상각 누계액 |
정부 보조금 |
장부금액 | |
| 토지 | 2,618,919 | - | - | 2,618,919 | 2,618,919 | - | - | 2,618,919 |
| 건물 | 3,925,631 | (302,601) | - | 3,623,030 | 3,925,631 | (253,531) | - | 3,672,100 |
| 기계장치 | 1,925,292 | (1,355,387) | (1) | 569,904 | 1,922,172 | (1,225,508) | (1) | 696,663 |
| 비품 | 128,020 | (86,699) | - | 41,320 | 124,009 | (78,831) | - | 45,178 |
| 시설장치 | 552,044 | (422,118) | - | 129,926 | 552,044 | (392,192) | - | 159,852 |
| 사용권자산 | 208,503 | (150,961) | - | 57,542 | 210,752 | (152,586) | - | 58,166 |
| 합계 | 9,358,408 | (2,317,765) | (1) | 7,040,641 | 9,353,527 | (2,102,648) | (1) | 7,250,878 |
(2) 당반기와 전기 중 유형자산 장부금액의 변동내역은 다음과 같습니다.
<당반기>
| (단위: 천원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 기초 | 취득 | 처분 | 상각 | 국고보조금상계액 | 기타 | 기말 |
| 토지 | 2,618,919 | - | - | - | - | - | 2,618,919 |
| 건물 | 3,672,100 | - | - | (49,070) | - | - | 3,623,030 |
| 기계장치 | 696,663 | 3,120 | - | (129,879) | - | - | 569,904 |
| 비품 | 45,178 | 4,010 | - | (7,868) | - | - | 41,321 |
| 시설장치 | 159,852 | - | - | (29,926) | - | - | 129,926 |
| 사용권자산 | 58,166 | 41,302 | - | (41,926) | - | - | 57,542 |
| 합계 | 7,250,878 | 48,432 | - | (258,668) | - | - | 7,040,641 |
<전기>
| (단위: 천원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 기초 | 취득 | 처분 | 상각 | 국고보조금상계액 | 기타 | 기말 |
| 토지 | 2,618,919 | - | - | - | - | - | 2,618,919 |
| 건물 | 3,770,241 | - | - | (98,141) | - | - | 3,672,100 |
| 기계장치 | 602,467 | 284,565 | - | (272,031) | 669 | 80,993 | 696,663 |
| 비품 | 49,019 | 12,577 | - | (16,418) | - | - | 45,178 |
| 건설중인자산 | 80,993 | - | - | - | - | (80,993) | - |
| 시설장치 | 219,705 | - | - | (59,853) | - | - | 159,852 |
| 사용권자산 | 99,222 | 43,552 | - | (84,608) | - | - | 58,166 |
| 합계 | 7,440,566 | 340,695 | - | (531,051) | 669 | - | 7,250,878 |
13. 무형자산
(1) 보고기간말 현재 무형자산의 내역은 다음과 같습니다.
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | ||||
| 취득원가 | 상각 누계액 | 장부금액 | 취득원가 | 상각 누계액 | 장부금액 | |
| 특허권 | 76,366 | (47,814) | 28,552 | 76,366 | (40,225) | 36,141 |
| 상표권 | 14,103 | (13,155) | 948 | 14,103 | (11,772) | 2,331 |
| 개발비 | 40,000 | (40,000) | - | 40,000 | (40,000) | - |
| 소프트웨어 | 4,670 | (4,325) | 345 | 4,670 | (4,281) | 389 |
| 지적재산권 | 620,000 | (620,000) | - | 620,000 | (620,000) | - |
| 합계 | 755,139 | (725,294) | 29,845 | 755,139 | (716,278) | 38,861 |
(2) 무형자산의 변동내용은 다음과 같습니다.
<당반기>
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 기말 |
| 특허권 | 36,141 | - | (7,589) | 28,552 |
| 상표권 | 2,331 | - | (1,383) | 948 |
| 소프트웨어 | 389 | - | (44) | 345 |
| 합계 | 38,861 | - | (9,016) | 29,845 |
<전기>
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 기초 | 취득 | 상각 | 기말 |
| 특허권 | 38,741 | 12,466 | (15,066) | 36,141 |
| 상표권 | 5,152 | - | (2,821) | 2,331 |
| 개발비 | 4,000 | - | (4,000) | - |
| 소프트웨어 | 141 | 440 | (192) | 389 |
| 합계 | 48,034 | 12,906 | (22,079) | 38,861 |
(3) 비용으로 인식한 연구와 개발 지출의 총액은 다음과 같습니다.
| (단위 : 천원) | |||
|---|---|---|---|
| 구분 | 계정과목 | 당반기 | 전반기 |
| 판매비와관리비 | 경상연구개발비 | 1,959,375 | 5,360,100 |
14. 리스
(1) 보고기간말 현재 기초자산 유형별 사용권자산의 내역은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 부동산 | 27,535 | 7,259 |
| 차량운반구 | 30,007 | 50,907 |
| 합계 | 57,542 | 58,166 |
(2) 보고기간 중 리스와 관련해 손익으로 인식된 금액은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 사용권자산의 감가상각비 | ||||
| 부동산 | 10,752 | 21,026 | 10,888 | 21,031 |
| 차량운반구 | 10,450 | 20,900 | 10,450 | 20,900 |
| 리스부채에 대한 이자비용(금융원가에 포함) | 1,080 | 2,592 | 1,805 | 3,559 |
| 단기리스료(매출원가 및 관리비에 포함) | - | - | - | - |
| 단기리스가 아닌 소액자산 리스료(관리비에 포함) | 450 | 900 | 360 | 720 |
(3) 보고기간말 현재 리스부채의 내역은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당반기말 | 전기말 | ||
| 최소리스료 | 최소리스료의 현재가치 |
최소리스료 | 최소리스료의 현재가치 |
|
| 1년 이내 | 48,055 | 46,666 | 44,992 | 43,483 |
| 1년 초과 5년 이내 | 8,149 | 7,246 | 13,584 | 11,854 |
| 합계 | 56,205 | 53,912 | 58,576 | 55,337 |
(4) 보고기간말 현재 리스부채의 유동성분류 내역은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 유동 | 46,666 | 43,483 |
| 비유동 | 7,246 | 11,854 |
| 합계 | 53,912 | 55,337 |
(5) 운용리스 제공 내역
보고기간말 현재 회사가 운용리스로 제공한 자산의 장부금액은 없습니다.
15. 매입채무 및 기타유동금융부채
보고기간말 현재 매입채무 및 기타유동금융부채의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당반기말 | 전기말 |
| 매입채무 | - | 26,383 |
| 미지급금 | 364,132 | 545,729 |
| 미지급비용 | 99,095 | 90,590 |
| 합계 | 463,228 | 662,702 |
16. 퇴직급여부채
(1) 퇴직급여부채의 내용은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 확정급여채무의 현재가치 | 2,007,891 | 1,805,686 |
| 사외적립자산의 공정가치 | - | - |
| 순확정급여부채 금액 | 2,007,891 | 1,805,686 |
(2) 확정급여채무의 변동내용은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전기 |
| 기 초 | 1,805,686 | 1,295,800 |
| 당기근무원가 | 146,602 | 195,455 |
| 신입/전입효과 | 4,457 | 37,874 |
| 이자원가 | 42,477 | 66,511 |
| 재측정요소 : | ||
| - 재무적가정의 변동으로 인한 보험수리적손익 | 14,535 | 140,633 |
| - 인구통계적가정변경효과 | - | (6,611) |
| - 경험적조정으로 인한 보험수리적손익 | 117,682 | 144,560 |
| 급여지급액 | (123,548) | (68,536) |
| 기 말 | 2,007,891 | 1,805,686 |
(3) 총비용
1) 당반기와 전반기 중 당기손익으로 인식한 총비용의 내용은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기 | 전반기 |
| 당기근무원가 | 151,059 | 107,247 |
| 순이자손익 | 42,477 | 33,256 |
| 합계 | 193,536 | 140,502 |
2) 당반기와 전반기 중 당반기손익으로 인식한 총비용의 계정과목별 내용은 다음과 같습니다.
| (단위 : 천원) | ||
|---|---|---|
| 구분 | 당반기 | 전반기 |
| 매출원가 | 1,061 | 993 |
| 판매비와관리비 | 130,346 | 98,780 |
| 연구개발비 | 62,129 | 40,730 |
| 합계 | 193,536 | 140,502 |
17. 기타부채
(1) 보고기간말 현재 기타부채의 내용은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 선수금 | 62,608 | 2,608 |
| 예수금 | 179 | 200 |
| 합계 | 62,787 | 2,808 |
18. 전환사채
(1) 보고기간말 현재 전환사채의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 유동부채(*) | ||
| 전환사채 | 16,500,000 | 16,500,000 |
| 전환권 조정 | (7,480,150) | (8,274,050) |
| 파생상품부채(조기상환권) | 7,244,467 | 6,304,240 |
| 부채의 합계 | 16,264,318 | 14,530,190 |
| 파생상품자산(매도청구권) | 61,742 | 676,067 |
| 전환권대가(자본잉여금) | 4,460,507 | 4,460,507 |
(*) 전환사채의 조기상환청구권 행사가능시점이 1년 미만으로 도래함에 따라 유동부채로 분류하였습니다.
(2) 전환사채의 주요 발행조건을 다음과 같습니다.
| 구 분 | 제1회 무기명식 이권부 무보증 사모 전환사채 (*1) |
|---|---|
| 발행일 | 2022년 10월 06일 |
| 만기일 | 2027년 10월 06일 |
| 액면가액 | 16,500,000,000원 |
| 발행가액 | 16,500,000,000원 |
| 이자지급조건 | 표시이자: 0.0%, 만기보장수익률: 0.0% |
| 전환가격 | 1주당 4,058원 (*2) |
| 전환가격조정 | 시가를 하회하는 발행가액으로 주식연계사채 발행, 유상증자 및 무상증자, 주식 배당 및 준비금의 자본전입 등 일정사유 발생시 전환가격 조정 |
| 전환권 청구기간 | 발행후 1년이 경과하는 날부터 만기직전 1개월 |
| 발행할 주식의 종류 | 기명식 보통주 |
| 사채권자의 조기상환권에 관한 사항 | 사채의 발행일로부터 2년이 되는날 및 그 이후 매3개월에 해당되는 날에 본 사채의 전부 또는 일부에 대하여 만기 전 조기상환을 청구할 수 있다. |
| 매도청구권에 관한 사항 | 사채의 발행일로부터 12개월이 되는날로부터 23개월이 되는 날까지매 1개월에 해당하는 날에 사채권자가 보유하고 있는 본 사채의 권면총액의 20% 한도로 발행회사 또는 발행회사가 지정하는 자에게 매도하여 줄 것을 청구할 수 있으며, 사채권자는 이 청구에 따라 보유 하고있는 본 사채를 매수인에게 매도하여야 한다. |
(*1) 전환사채에 포함된 내재 파생상품의 경우 주계약인 사채에서 분리하여 조기상환권은 파생금융부채로, 매도청구권은 파생금융자산으로 인식 및 평가 하였으며, 발행가액에서 부채요소를 차감한 잔여가치는 전환권의 가치에 해당하며, 세효과 차감후 금액을 자본으로 계상하였습니다.
(*2) 무상증자로 인해 조정된 전환가격 입니다.
(3) 당반기와 전반기 중 전환사채와 관련하여 발생한 손익은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전반기 |
| 이자비용 | (793,900) | (656,168) |
| 파생상품평가손실(*) | (1,554,551) | (298,685) |
| 합계 | (2,348,451) | (954,853) |
(*) 전환사채 발행시 분리된 내재파생상품을 공정가치로 평가한 손익입니다.
19. 자본금 및 기타불입자본
(1) 당반기말과 전기말 현재 자본금의 내역은 다음과 같습니다.
| 구 분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 보통주 | 우선주 | 보통주 | 우선주 | |
| 발행할주식의 총수 | 50,000,000주 | 50,000,000주 | ||
| 1주당 액면금액 | 500원 | 500원 | 500원 | 500원 |
| 발행한 주식수 | 16,980,252주 | 920,000주 | 16,980,252주 | 920,000주 |
| 자본금 | 8,490,126천원 | 460,000천원 | 8,490,126천원 | 460,000천원 |
(2) 당반기 및 전기 중 자본금 및 기타불입자본의 변동내역은 다음과 같습니다.
<당반기>
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 주식수(주) | 자본금 | 주식발행초과금 | 주식선택권 | 전환권대가 | 기타자본잉여금 |
| 기초 | 17,900,252 | 8,950,126 | 59,654,509 | 963,148 | 4,460,507 | 143,485 |
| 주식보상비용 | - | - | - | 59,338 | - | - |
| 기말 | 17,900,252 | 8,950,126 | 59,654,509 | 1,022,486 | 4,460,507 | 143,485 |
<전기>
| (단위: 천원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 주식수(주) | 자본금 | 주식발행초과금 | 주식선택권 | 전환권대가 | 기타자본잉여금 |
| 기초 | 8,950,126 | 4,475,063 | 64,145,930 | 810,644 | 4,460,507 | 143,485 |
| 주식보상비용 | - | - | - | 152,504 | - | - |
| 무상증자 | 8,950,126 | 4,475,063 | (4,491,421) | - | - | - |
| 기말 | 17,900,252 | 8,950,126 | 59,654,509 | 963,148 | 4,460,507 | 143,485 |
(3) 주식기준보상제도
1) 회사는 임직원 등에게 주식결제형 주식선택권을 부여하였으며, 그 주요 내용은 다음과 같습니다.
| 구 분 | 5차 부여분 | 6차부여분 | 7차부여분 |
| 부여일 | 2022-03-10 | 2023-02-28 | 2024-02-14 |
| 부여주식수(*) | 75,000주 | 60,000주 | 115,000주 |
| 행사가격(*) | 12,750원 | 9,372원 | 3,566원 |
| 가득조건 | 부여일 이후 2년 경과 시점에서 최초부여주식의 40%, 3년 경과 시점에서 30%, 4년 경과 시점에서 30% 행사가능하며 행사일 현재 재직중인 자 |
||
| 행사가능기간 | 2024-03-10 ~ 2029-03-09 | 2025-02-28 ~ 2030-02-27 | 2026-02-14 ~ 2031-02-13 |
| 부여일의 공정가치 | 5,592원 | 5,786원 | 1,856원 |
(*) 부여주식수 및 행사가격은 무상증자가 고려되지 않은 최초 부여주식수 및 행사가격입니다.
2) 당반기와 전기 중 주식선택권 부여주식수의 변동내역은 다음과 같습니다.
| (단위: 주) | ||
|---|---|---|
| 구분 | 당반기 | 전기 |
| 기초 | 105,000 | 75,000 |
| 부여 | 115,000 | 60,000 |
| 행사 | - | - |
| 소멸 | - | (30,000) |
| 기말 | 220,000 | 105,000 |
3) 회사는 이항모형에 의한 공정가치접근법을 적용하여 보상원가를 산정하였으며, 이 때 부여일 주가는 현금흐름할인법에 의해 측정된 공정가치를 이용하였고, 그 밖에 보상원가 산정에 사용된 주요 가정은 다음과 같습니다.
| (금액단위: 원) | |||
|---|---|---|---|
| 구 분 | 5차 부여분 | 6차 부여분 | 7차 부여분 |
| 보통주 공정가치 | 5,592 | 5,786 | 1,856 |
| 무위험이자율 | 2.66% | 3.83% | 3.46% |
| 예상주가변동성 | 43.3% | 72.6% | 70.6% |
당반기와 전반기 중 비용으로 인식한 주식보상비용은 각각 136,988천원과 121,727천원 입니다.
20. 결손금
보고기간말 결손금의 변동내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전기 |
| 기초 | 58,692,878 | 44,812,792 |
| 당기순손실 | 5,589,196 | 13,601,504 |
| 확정급여제도의 재측정요소 | 132,217 | 278,582 |
| 기말 | 64,414,291 | 58,692,878 |
21. 매출액
회사는 다음의 주요 판매유형별 재화나 용역을 한 시점에 이전함으로써 수익을 창출합니다. 당반기와 전반기 중 매출액을 구성하는 주요 수익의 내역은 다음과 같습니다.
| (단위 : 천원) | |||||
|---|---|---|---|---|---|
| 구분 | 당반기 | 전반기 | |||
| 3개월 | 누적 | 3개월 | 누적 | ||
| 용역매출 |
합성서비스 |
19,558 | 63,635 | 24,577 | 95,255 |
| 발굴서비스 |
- | 6,861 | - | 7,800 | |
| 소계 | 19,558 | 70,496 | 24,577 | 103,055 | |
| 제품매출 | 폐암진단키트 | 140 | 560 | - | - |
| 합계 | 19,698 | 71,056 | 24,577 | 103,055 | |
22. 종업원급여 및 기타영업비용
(1) 당반기 및 전반기 중 판매비와 관리비 종업원급여의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 390,957 | 808,957 | 393,786 | 807,256 |
| 퇴직급여 | 68,625 | 130,346 | 50,180 | 98,780 |
| 주식보상비용 | 17,877 | 60,410 | 47,907 | 78,067 |
| 합계 | 477,459 | 999,714 | 491,873 | 984,103 |
1) 경상연구개발비에 포함된 당반기 및 전반기 중 종업원급여의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 278,655 | 560,514 | 254,254 | 474,088 |
| 퇴직급여 | 32,133 | 62,129 | 21,559 | 40,730 |
| 주식보상비용 | 20,927 | (1,072) | 23,682 | 43,659 |
| 합계 | 331,715 | 621,571 | 299,495 | 558,476 |
2) 매출원가에 포함된 당반기 및 전반기 중 종업원급여의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 832 | 8,793 | 8,176 | 12,675 |
| 퇴직급여 | 122 | 1,061 | 742 | 993 |
| 합계 | 955 | 9,854 | 8,918 | 13,668 |
(2) 당반기 및 전반기 중 기타영업비용의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 복리후생비 | 55,867 | 117,423 | 53,525 | 113,716 |
| 지급수수료 | 149,237 | 259,971 | 59,196 | 126,468 |
| 여비교통비 | 22,189 | 49,806 | 15,162 | 28,707 |
| 세금과공과 | 23,774 | 47,759 | 22,496 | 42,731 |
| 건물관리비 | 20,782 | 42,215 | 21,343 | 42,384 |
| 보험료 | 8,747 | 15,274 | 6,550 | 11,441 |
| 기타 | 20,158 | 58,570 | 32,078 | 59,707 |
| 합계 | 300,754 | 591,018 | 210,350 | 425,155 |
23. 기타수익 및 기타비용
(1) 당반기 및 전반기 중 기타수익 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 잡이익 | 16 | 19 | 1 | 43 |
(2) 당반기 및 전반기 중 기타비용의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 잡손실 | - | - | - | - |
24. 금융수익 및 금융비용
(1) 당반기 및 전반기 중 금융수익의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 금융수익 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | 193,927 | 412,114 | 272,190 | 581,230 |
| 외화환산이익 | 169 | 708 | 23,846 | 23,960 |
| 외환차익 | 244 | 284 | 71,903 | 72,623 |
| 합계 | 194,340 | 413,106 | 367,939 | 677,813 |
(2) 당반기 및 전반기 중 금융비용의 내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 금융비용 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용 | 407,603 | 796,492 | 339,215 | 659,727 |
| 외화환산손실 | 277 | 11,262 | 445 | 1,469 |
| 외환차손 | 1,330 | 11,534 | 31,011 | 40,545 |
| 파생상품부채평가손실 | 1,554,551 | 1,554,551 | 298,685 | 298,685 |
| 합계 | 1,963,762 | 2,373,840 | 669,356 | 1,000,426 |
25. 법인세비용
(1) 당반기와 전반기의 법인세비용은 없으며, 자본에 직접 부가되거나 차감된 법인세부담액과 이연법인세 또한 없습니다.
(2) 회사는 이연법인세자산에 대한 미래 실현가능성은 일시적차이가 실현되는 기간동안 과세소득을 창출할 수 있는 회사의 능력,전반적인 경제환경과 산업에 대한 전망등 다양한 요소들을 고려하여 평가합니다.
(3) 회사는 주기적으로 이러한 사항들을 검토하고 있으며, 당반기말 현재 일시적 차이순액, 세무상결손금 및 이월세액공제로 인한 이연법인세자산에 대하여 그 실현가능성이 확실하지 아니하므로 이연법인세 자산으로 인식하지 않았습니다.
26. 비용의 성격별 분류
당반기와 전반기 중 발생한 비용의 성격별 분류는 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 재고자산의 변동 | 28,210 | 28,530 | (26,612) | (28,470) |
| 원재료 등의 매입 | (28,210) | (28,530) | 13,373 | 15,231 |
| 종업원급여 | 810,129 | 1,631,139 | 800,286 | 1,556,248 |
| 경상연구개발비 | 253,739 | 1,337,805 | 3,271,834 | 4,801,622 |
| 감가상각비와 무형자산상각비 | 68,649 | 138,555 | 76,238 | 151,332 |
| 복리후생비 | 55,867 | 117,577 | 53,614 | 113,805 |
| 지급임차료 | - | 1,706 | 1,366 | 1,366 |
| 지급수수료 | 149,237 | 259,971 | 59,292 | 126,564 |
| 여비교통비 | 22,189 | 49,806 | 15,162 | 28,707 |
| 세금과공과 | 23,774 | 47,759 | 22,496 | 42,731 |
| 건물관리비 | 20,782 | 42,215 | 21,343 | 42,384 |
| 보험료 | 8,747 | 15,274 | 6,550 | 11,441 |
| 기타 | 22,300 | 57,730 | 39,893 | 77,535 |
| 합계(*) | 1,435,413 | 3,699,537 | 4,354,835 | 6,940,496 |
(*)포괄손익계산서상 매출원가 및 판매관리비의 합계액 입니다.
27. 주당이익
(1) 당반기 및 전반기 중 보통주 기본 주당손익 산정내역은 다음과 같습니다.
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 보통주 당기순손실 | (3,185,120) | (5,589,196) | (4,631,676) | (7,160,011) |
| 가중평균유통보통주식수 | 16,980,252주 | 16,980,252주 | 16,980,252주 | 16,980,252주 |
| 보통주 기본주당손익 (원) | (188) | (329) | (273) | (422) |
(2) 당반기 가중평균유통보통주식수 산정내역은 다음과 같습니다.
| 구분 | 당반기 | |||
|---|---|---|---|---|
| 보통주식수(주) | 기산일 | 일수(일) | 적수 | |
| 기초 | 16,980,252 | 2024.01.01 | 182 | 3,090,405,864 |
| 변동 | - | - | - | - |
| 합계 | 16,980,252 | - | - | 3,090,405,864 |
| 일수 | 182 | |||
| 가중평균유통보통주식수 | 16,980,252 | |||
(3) 회사의 잠재적보통주는 희석화 효과가 없으므로 기본주당손익과 희석주당손익은 동일합니다.
(4) 반희석효과로 인하여 희석주당이익을 계산할 때 고려하지 않았지만 잠재적으로 미래에 기본주당이익을 희석화할 수 있는 잠재적 보통주의 내용은 다음과 같습니다.
| (단위 : 주) | ||
|---|---|---|
| 구 분 | 당반기말 | 전기말 |
| 전환우선주 | 460,000 | 460,000 |
| 주식선택권 | 220,000 | 105,000 |
| 전환사채 | 2,033,021 | 2,033,021 |
(*)잠재적 보통주는 무상증자가 고려되지 않은 최초의 부여주식수 및 발행 주식수 입니다.
28. 현금흐름표
(1) 현금및현금성자산은 재무상태표와 현금흐름표상의 금액이 일치하게 관리되고 있습니다.
(2) 당반기 및 전반기 중 영업에서 창출된 현금흐름은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전반기 |
| 법인세비용 차감전 순손실 | (5,589,196) | (7,160,011) |
| 조정항목 | ||
| (1) 손익항목의 조정 | 2,470,044 | 893,678 |
| 감가상각비 | 258,669 | 266,191 |
| 무형자산상각비 | 9,016 | 12,987 |
| 퇴직급여 | 193,536 | 140,502 |
| 대손상각비 | - | (2,421) |
| 주식보상비용 | 59,338 | 121,726 |
| 이자비용 | 796,492 | 659,727 |
| 외화환산손실 | 11,262 | 1,469 |
| 이자수익 | (412,114) | (581,230) |
| 외화환산이익 | (708) | (23,960) |
| 파생상품평가손실 | 1,554,551 | 298,685 |
| (2) 영업활동으로 인한 자산부채의 변동 | (243,415) | (1,461,809) |
| 매출채권의 감소(증가) | 16,734 | 2,430 |
| 미수금의 감소(증가) | (3,624) | 187,727 |
| 선급금의 감소(증가) | (46) | 290,731 |
| 장기선급비용의 감소(증가) | 916 | - |
| 재고자산의 감소(증가) | 22,342 | (28,470) |
| 선급비용의 감소(증가) | 10,862 | 8,364 |
| 매입채무의 증가(감소) | (26,383) | 1,221 |
| 미지급금의 증가(감소) | (209,152) | (1,969,471) |
| 예수금의 증가(감소) | (21) | 182 |
| 선수금의 증가(감소) | 60,000 | 2,516 |
| 미지급비용의 증가(감소) | 8,505 | 47,488 |
| 퇴직금의 지급 | (123,548) | (4,527) |
| 영업활동으로 창출된 현금 | (3,362,568) | (7,728,142) |
(3) 당반기 및 전반기 중 현금및현금성자산의 사용을 수반하지 않는 중요한 사항은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 구 분 | 당반기 | 전반기 |
| 보험수리적손익으로 인한 확정급여채무의 증가(감소) | 132,217 | 232,905 |
| 사용권자산의 취득으로 인한 리스부채의 증가(감소) | 41,302 | 43,552 |
| 리스부채의 유동성 대체 | 4,609 | 20,801 |
(4) 재무활동에서 발생한 부채의 당반기 및 전반기 중 변동내역은 다음과 같습니다.
| (단위: 천원) | ||||
|---|---|---|---|---|
| 구 분 | 유동성장기미지급금 | 장기미지급금 | 유동리스부채 | 비유동리스부채 |
| 전반기초 | 149,296 | - | 46,025 | 51,605 |
| 현금흐름 | 3,410 | 14,192 | (42,504) | - |
| 비현금흐름 | (5,209) | 5,209 | 64,352 | (20,801) |
| 전반기말 | 147,497 | 19,401 | 67,873 | 30,805 |
| 당반기초 | 188,875 | - | 43,483 | 11,854 |
| 현금흐름 | 16,307 | - | (42,727) | - |
| 비현금흐름 | - | - | 45,911 | (4,609) |
| 당반기말 | 205,182 | - | 46,666 | 7,246 |
29. 특수관계자거래
(1) 보고기간말 현재 회사의 특수관계자는 다음과 같습니다.
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 기타특수관계자 | 임직원, 포항공과대학교 산학협력단 | 임직원, 포항공과대학교 산학협력단 |
| 종속기업 | (주)인터내셔널사이언티픽스탠다드(*) | - |
(*) 당반기 중 신규로 종속기업에 편입되었습니다.
(2) 당반기 및 전반기 중 특수관계자와의 주요 거래 내역은 다음과 같습니다.
| (단위: 천원) | |||
|---|---|---|---|
| 특수관계자 | 거래내용(*) | 당반기 | 전반기 |
| 포항공과대학교 산학협력단 | 매출 | 2,336 | 39,455 |
| 기타비용 | 3,202 | 3,645 | |
| (주)인터내셔널사이언티픽스탠다드 | 기타비용 | 65,958 | - |
| 이자수익인식 | 5,810 | - | |
(*) 거래내용 중 기타비용은 경상연구개발비 등 판매비와 관리비로 처리된 비용입니다.
(3) 당반기말과 전기말 현재 특수관계자와의 채권채무잔액은 다음과 같습니다.
<당반기말>
| (단위: 천원) | ||||
|---|---|---|---|---|
| 특수관계자 | 채권 | 채무 | ||
| 대여금(*) | 미수수익 | 미지급금 | 미지급비용 | |
| 포항공과대학교 산학협력단 | - | - | - | 476 |
| (주)인터내셔널사이언티픽스탠다드 | 1,500,000 | 5,810 | 2,365 | - |
| 합계 | 1,500,000 | 5,810 | 2,365 | 476 |
(*) 당반기 중 발생한 금액 입니다.
<전기말>
| (단위: 천원) | ||
|---|---|---|
| 특수관계자 | 채무 | |
| 미지급금 | 미지급비용 | |
| 포항공과대학교 산학협력단 | 264 | 1,624 |
(4) 당반기 및 전반기 중 주요 경영진에 대한 보상 내역은 다음과 같습니다.
| (단위:천원) | ||||
|---|---|---|---|---|
| 구 분 | 당반기 | 전반기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급 여 | 118,257 | 236,515 | 104,868 | 185,323 |
| 퇴직급여 | 27,286 | 51,468 | 22,459 | 40,418 |
| 주식기준보상 | 10,807 | 21,614 | 10,807 | 10,807 |
| 합계 | 156,350 | 309,597 | 138,134 | 236,548 |
(5) 회사는 포항공과대학교 산학협력단과 라이선스 계약 등을 통해 매출액의 일정 비율을 기술료로 지급하고 있습니다(주석 30 참조).
30. 우발상황과 약정사항
1) 회사는 2011년 6월 7일 포항공과대학교 산학협력단과 체결한 압타머를 이용한 학문연구용 시약의 상업적 제공에 대한 라이선스 계약에 의해 관련 매출에 대하여 연순판매액의 3%를 경상기술료로 지급하고 있습니다.
2) 회사는 2013년 7월 31일 포항공과대학교 산학협력단과 체결한 IVD 라이선스 계약(한국 내)에 의해 IVD제품의 한국 내 순판매액의 6%를 기술료로 지급해야 합니다.
3) 회사는 2014년 6월 11일 포항공과대학교 산학협력단과 체결한 기술이전계약서 (Aptamer sandwich Assay에 대한)에 의해 기술적용 연간 총 매출액의 3%를 기술료로 지급해야 합니다.
4) 회사는 2016년 1월 25일 포항공과대학교 산학협력단과 체결한 IVD 라이선스 계약(중국, 일본, 싱가포르, 인도, 대만, 인도네시아, 태국, 베트남, 말레이시아, 라오스,캄보디아, 필리핀)에 의해 기술적용 연간 순 매출액의 3.5%를 기술료로 지급해야 합니다.
5) 회사는 2016년 3월 1일 서울아산병원과 체결한 기술이전 계약(폐암진단키트 개발 노하우)에 의해 폐암IVD의 한국내 매출액의 1%를 기술료로 지급해야 합니다.
6) 회사는 2022년 08월 01일 과학기술정보통신부의 CD25 표적 압타머-약물접합체를 이용한 면역 항암제 연구개발 과제에 착수 하였으며 규정에 따라 정부출연금의 10%를 기술료로 지급해야 합니다.
7) 당반기말 현재 당사가 타인으로부터 제공받은 보증의 내역은 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 제공자 | 제공내역 | 보증금액 |
| 서울보증보험(주) | 지급보증보험 | 12,000 |
31. 영업부문
(1) 회사는 기업회계기준서 제1108호(영업부문)에 따른 보고부문을 단일부문으로 식별하였습니다. 회사의 경영진은 부문에 자원을 배분하고 부문의 성과를 평가하기 위하여 회사의 최고영업의사결정자에게 보고되는 정보에 기초하여 영업부문을 결정하고 있습니다. 단일의 보고부문은 동일한 성격의 생산품과 용역을 제공하며 해당 영업단위에서 요구되는 기술과 마케팅 전략이 동일하므로, 통합하여 운영되고 있습니다.
(2) 회사의 당반기 수익 중 국내와 해외 비중은 75.2% 대 24.8% 이며,국내외 발생국가는 일본, 네덜란드, 대만, 영국 등 다양하게 존재하고 있습니다. 또한 회사의 주요 고객은 대학, 연구소 및 기업 등 다양하게 구성되어 있으며 계절적 영향을 받지 않습니다.
(3) 당반기와 전반기 중 회사 매출액의 10% 이상을 차지하는 고객과 관련된 정보는 다음과 같습니다.
| (단위: 천원) | ||
|---|---|---|
| 고객(*) | 당반기 | 전반기 |
| 고객 A | 19,238 | 39,455 |
| 고객 B | 11,416 | 14,600 |
| 고객 C | 11,058 | 11,896 |
| 고객 D | 9,658 | - |
| 고객 E | 7,398 | - |
| 합계 | 58,768 | 65,951 |
(*) 매출의 10% 이상인 고객에 대해서만 표시하고 비교표시는 하지 아니하였습니다.
32. 위험관리
(1) 금융위험관리
회사는 경영활동과 관련하여 신용위험, 유동성위험 및 시장위험 등 다양한 금융위험에 노출되어 있습니다. 회사는 금융위험이 경영에 미칠 수 있는 불리한 효과를 최소화하기 위해노력하고 있습니다.
1) 신용위험관리
회사는 채무불이행으로 인한 재무적 손실을 경감시키기 위하여 신용도가 일정 수준 이상인 거래처와 거래하고, 충분한 담보 또는 지급보증을 수취하고 있습니다. 회사는신용위험노출 및 거래처의 신용등급을 주기적으로 검토하여 거래처의 여신한도 및 담보수준을 재조정하는 등 신용위험을 관리하고 있습니다.
금융상품 종류별 신용위험의 최대 노출금액은 다음과 같습니다.
| (단위 : 천원) | ||||
|---|---|---|---|---|
| 구분 | 당반기 | 전기 | ||
| 장부금액 |
신용위험 최대노출금액 |
장부금액 |
신용위험 최대노출금액 |
|
| 유동자산 | ||||
| 현금및현금성자산 | 868,001 | 868,001 | 1,237,370 | 1,237,370 |
| 단기금융상품 | 18,500,000 | 18,500,000 | 22,500,000 | 22,500,000 |
| 매출채권 | 8,247 | 8,247 | 24,866 | 24,866 |
| 기타유동금융자산 | 1,814,600 | 1,814,600 | 335,792 | 335,792 |
| 파생상품자산 | 61,742 | 61,742 | 676,067 | 676,067 |
| 소계 | 21,252,590 | 21,252,590 | 24,774,095 | 24,774,095 |
| 비유동자산 | ||||
| 당기손익-공정가치 측정 금융자산 | 680 | 680 | 680 | 680 |
| 기타비유동금융자산 | 76,497 | 76,497 | 89,352 | 89,352 |
| 소계 | 77,177 | 77,177 | 90,032 | 90,032 |
| 합계 | 21,329,767 | 21,329,767 | 24,864,127 | 24,864,127 |
2) 유동성위험관리
회사는 미래의 현금흐름을 예측하여 단기 및 중장기 자금조달 계획을 수립하여 유동성위험을 관리하고 있으며, 금융부채의 잔존계약 만기에 따른 만기분석내용은 다음과 같습니다.
<당반기>
| (단위: 천원) | |||||
|---|---|---|---|---|---|
구 분 |
장부금액 | 계약상 현금흐름 | |||
| 1년 미만 | 1년 이상 ~ 3년 미만 |
3년 이상 | 합 계 | ||
| 매입채무 | - | - | - | - | - |
| 미지급금 | 158,950 | 158,950 | - | - | 158,950 |
| 유동성장기미지급금 | 205,182 | 205,182 | - | - | 205,182 |
| 유동성리스부채 | 46,666 | 48,055 | - | - | 48,055 |
| 전환사채 | 9,019,850 | 16,500,000 | - | - | 16,500,000 |
| 비유동리스부채 | 7,246 | - | 8,149 | - | 8,149 |
| 미지급비용 | 99,095 | 99,095 | - | - | 99,095 |
| 합계 | 9,536,991 | 17,011,283 | 8,149 | - | 17,019,432 |
(주) 잔존계약에 따른 만기금액은 할인되지 아니한 계약상 현금흐름임
<전기>
| (단위: 천원) | |||||
|---|---|---|---|---|---|
구 분 |
장부금액 | 계약상 현금흐름 | |||
| 1년 미만 | 1년 이상 ~ 3년 미만 |
3년 이상 | 합 계 | ||
| 매입채무 | 26,383 | 26,383 | - | - | 26,383 |
| 미지급금 | 356,853 | 356,853 | - | - | 356,853 |
| 유동성장기미지급금 | 188,875 | 188,875 | - | - | 188,875 |
| 유동성리스부채 | 43,483 | 44,992 | - | - | 44,992 |
| 전환사채 | 8,225,950 | 16,500,000 | - | - | 16,500,000 |
| 비유동리스부채 | 11,854 | - | 13,584 | - | 13,584 |
| 미지급비용 | 90,590 | 90,590 | - | - | 90,590 |
| 합계 | 8,943,988 | 17,207,693 | 13,584 | - | 17,221,277 |
3) 외환위험관리
① 보고기간말 현재 외환위험에 노출되어 있는 회사의 금융자산 및 금융부채의 내역의 원화환산 기준액은 다음과 같습니다.
| (단위: USD,천원) | |||||
|---|---|---|---|---|---|
| 구 분 | 통화 | 당반기말 | 전기말 | ||
| 외화금액 | 원화환산액 | 외화금액 | 원화환산액 | ||
| 금융자산 | |||||
| 외화예금 | USD | 3,965 | 5,508 | 6,714 | 8,657 |
| 매출채권 | USD | 1,227 | 1,705 | - | - |
| 금융부채 | |||||
| 미지급금 | USD | - | - | 122,760 | 158,287 |
② 회사는 외화거래 수행에 따라 다양한 환율변동위험에 노출되어 있습니다. 주요 통화별 환율변동시 민감도 분석내용은 다음과 같습니다.
| (단위: 천원) | |||
|---|---|---|---|
| 구 분 | 당반기말 | 전기말 | |
| USD | 10%상승 | 721 | (14,963) |
| 10%하락 | (721) | 14,963 | |
(2) 자본위험관리
회사의 자본관리 목적은 계속기업으로 영업활동을 유지하고 주주 및 이해관계자의 이익을 극대화하하고 자본비용의 절감을 위하여 최적의 자본구조를 유지하는데 있습니다. 회사는 배당조정, 신주발행 등의 정책을 통하여 자본구조를 경제환경의 변화에 따라 적절히 수정변경하고 있습니다. 회사의 자본위험관리정책은 전기와 중요한 변동이 없습니다.
| (단위: 천원) | ||
|---|---|---|
| 구분 | 당반기 | 전기 |
| 부채총계 | 18,852,134 | 17,056,722 |
| 차감: 현금및현금성자산 | 868,001 | 1,237,370 |
| 순부채 | 17,984,133 | 15,819,352 |
| 자본총계 | 9,816,821 | 15,478,897 |
| 순부채비율 | 183.20% | 102.20% |
33. 보고기간 후 사건
(1) 당사는 2024년 7월 15일 이사회에서 당사의 종속회사인 주식회사 인터내셔널사이언티픽스탠다드와의 합병 승인에 대하여 결의하였습니다.
6. 배당에 관한 사항
가. 배당정책
당사는 미래 수익 극대화 및 주주환원을 통하여 주주가치를 제고할 예정이며, 향후 이익 창출시 주식의 시장가치 및 법률에 따른 배당가능이익 등을 고려하여 주주친화적 배당정책을 수행할 수 있도록 노력하겠습니다. 다만, 현재 당사는 당기순손실 및 결손금 누적으로 배당을 실시하지 못하고 있습니다.
나. 배당에 관한 사항
당사의 정관상 배당에 관한 사항은 다음과 같습니다.
|
제 12 조 (신주의 동등배당) 1. 회사가 정한 배당기준일전에 유상증자, 무상증자 및 주식배당에 의하여 발행한 주식에 대하여는 동등배당한다. 2. 제1항의 규정에도 불구하고 배당기준일을 정하는 이사회 결의일로부터 그 배당기준일까지 발행한 신주에 대하여는 배당을 하지 아니한다. 1. 이익준비금 2. 별도적립금 3. 주주배당금 4. 임의적립금 5. 기타의 이익잉여금처분 2. 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. 3. 전항의 배당은 이사회 결의로 정하는 배당기준일 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ※ 제16조제1항에 따라 정한 정기주주총회의 기준일과 다른날로 배당기준일을 정할 수 있음. 4. 이익배당은 주주총회의 결의로 정한다. 다만, 제56조제6항에 따라 재무제표를 이사회가 승인하는 경우 이사회 결의로 이익배당을 정한다. 제 60 조(분기배당) 1. 회사는 사업년도 개시일부터 3월, 6월 및 9월 말일(이하 "분기배당 기준일"이라 한다) 현재의 주주에게 자본시장과 금융투자업에 관한 법률 제165조의12에 의한 분기배당을 할 수 있다. 2. 제1항의 분기배당은 이사회의 결의로 하되, 그 결의는 제1항의 각 기준일 이후 45일 내에 하여야 한다. 3. 분기배당은 직전결산기의 대차대조표상의 순재산액에서 다음 각호의 금액을 공제한 액을 한도로 한다. ① 직전결산기의 자본금의 액 ② 직전결산기까지 적립된 자본준비금과 이익준비금의 합계액 ③ 직전결산기의 정기주주총회에서 이익배당하기로 정한 금액 ④ 직전결산기까지 정관의 규정 또는 주주총회의 결의에 의하여 특정목적을 위해 적립한 임의준비금 ⑤ 상법 시행령 제19조에서 정한 미실현이익 ⑥ 분기배당에 따라 당해 결산기에 적립하여야 할 이익준비금 합계액 ⑦ 당해 영업년도 중에 분기배당이 있었던 경우 그 금액의 합계액 4. 제1항의 분기배당은 분기배당 기준일 전에 발행한 주식에 대하여 동등배당한다. 5. 분기배당을 할 때에는 종류주식에 대하여도 보통주식과 동일한 배당률을 적용한다. 제 61 조 (배당금지급청구권의 소멸시효) 1. 배당금은 배당이 확정된 날로부터 5년이 경과하여도 수령 되지 않은 때에는 당 회사는 지급의무를 면하는 것으로 한다. 2. 전항의 시효의 완성으로 인한 배당금은 당회사에 귀속한다. 3. 이익배당금에 대하여는 이자를 지급하지 않는다. |
다. 주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제14기 반기 | 제13기 | 제12기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | -5,589 | - | - | |
| (별도)당기순이익(백만원) | -5,589 | -13,602 | -7,116 | |
| (연결)주당순이익(원) | -329 | -801 | -419 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
라. 과거 배당 이력
당사는 창립 후 현재까지 배당 이력이 없습니다
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 증자(감자)현황
※ 당반기 중 변동사항은 없으며, 관련 내용은 2024.03.20 에 제출된 2023년도 사업보고서를 참고하시기 바랍니다.
나. 미상환 전환사채 발행현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
1 | 2022.10.06 | 2027.10.06 | 16,500 | 보통주 | 2023.10.06~ 2027.09.06 |
100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| 합 계 | - | - | - | 16,500 | - | - | 100 | 4,058 | 16,500,000,000 | 4,066,042 | - |
| [채무증권의 발행 등과 관련된 사항] |
라. 채무증권 발행실적
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - |
마. 기업어음증권 미상환 잔액
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
바. 단기사채 미상환 잔액
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
사. 회사채 미상환 잔액
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | 16,500 | - | - | - | 16,500 | |
| 합계 | - | - | - | 16,500 | - | - | - | 16,500 | |
아. 신종자본증권 미상환 잔액
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
자. 조건부자본증권 미상환 잔액
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 유상증자 (공모자금) |
- | 2020.09.10 | 시설자금 : 3,893 운영자금 : 960 기타자금 : 27,012 |
31,865 | 시설자금 : - 운영자금 : 84 기타자금 : 20,506 |
20,590 | -연구시설 확장 -압타머 합성 및 생산 기능 본사 통합 |
(주1) 2020년 상장공모 유상증자대금 319억원에 대하여 시설자금 39억원, 운영자금 10억원, 기타자금 270억원으로 계획 및 사용하고 있으며, 보고서 작성기준일 현재 미사용 자금은 예금 보관되어 있습니다.
(주2) 상장주선인의 의무취득분 10억원은 상기 자금 조달금액에서 제외되었습니다.
(주3) 기타자금은 해외임상비용 및 연구개발비용 등으로 사용할 예정입니다.
나. 사모자금의 사용내역
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 전환사채(무기명식 이권부 무보증 사모전환사채) |
1 | 2022.10.06 | 운영자금 (임상비용) |
16,500 | 운영자금 (임상비용) |
8,407 | - |
다. 미사용자금의 운용내역
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 종류 | 운용상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 보통예금 | 868 | - | 수시입출금 |
| 예ㆍ적금 | 정기예금 | 11,500 | 2023.07 ~ 2024.04 | 9개월 |
| 채권 | 중소기업금융채권 (주1) |
7,000 | 2023.10 ~ 2024.04 | 6개월 |
| 계 | 19,368 | - | ||
(주1) 금융상품 가입금액에는 전환사채 발행액 중 미사용 자금이 포함되어 있습니다.
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
(1) 과거회계기간으로부터 한국채택국제회계기준으로의 전환에 따른 조정
당사는 한국채택국제회계기준(이하 K-IFRS) 도입을 위한 준비를 기간을 거쳐, 2017년 1월1일을 전환일로 하고, 2018년 1월 1일을 채택일로 하여 K-IFRS로 전환하였으며, 2018년 사업연도부터 K-IFRS 기준 감사를 받았습니다.
(2) 연결재무제표 작성에 관한 사항
당사는 당반기 중 (주)인터내셔널사이언티픽스탠다드 주식 1,010,000주(지분율 100%)를 취득하여 종속기업으로 편입하여 연결재무제표에 대한 당반기 검토를 받았습니다.
(3) 합병, 분할, 자산양수도, 영업양수도에 관한 사항
당사는 2024년 6월 11일 이사회 결의를 통해 (주)인터내셔널사이언티픽스탠다드와의 소규모 합병을 결의하였으며, 합병 기일은 2024년 8월 19일 입니다.
[소규모 합병 현황]
- 합병방법 : (주)압타머사이언스가 (주)인터내셔널사이언티픽스탠다드를 흡수합병
- 합병목적 : (주)압타머사이언스의 신약 개발 플랫폼 기술력 강화 및 안정적인 매출 확보를 통한 재무구조 개선
- 합병비율 : (주)압타머사이언스 : (주)인터내셔널사이언티픽스탠다드
= 1.0 : 0.0 (무증자 소규모 합병)
- 합병상대회사 현황
① 회사명 : (주)인터내셔널사이언티픽스탠다드
② 주요사업 : 임상/비임상 검체, 바이오 의약품 분석법 개발 및 분석 서비스
③ 회사와의 관계 : 자회사
④ 주요재무현황
(단위 : 원)
| 구분 | 2024년 반기 (2024.01.01~2024.06.30) |
2023년 (2023.01.01~2023.12.31) |
2022년 (2022.01.01~2022.12.31) |
| 자산총계 | 2,126,178,132 | 1,695,635,578 | 2,254,420,634 |
| 부채총계 | 3,761,223,032 | 7,025,395,007 | 6,228,190,378 |
| 자본금 | 5,050,000,000 | 5,050,000,000 | 5,050,000,000 |
| 자본총계 | (1,635,044,900) | (5,329,759,429) | (3,973,769,744) |
| 매출액 | - | 3,960,897,418 | 5,185,296,672 |
| 영업이익 | - | (1,186,455,856) | (620,274,300) |
| 당기순이익 | - | (1,355,989,685) | (696,124,966) |
(*) 2024년 6월 30일 간주취득으로, 당반기말 기준 손익정보를 기재하지 않았습니다.
- 합병주요일정
① 합병계약일 : 2024년 6월 14일
② 합병반대의사통지기간 : 2024년 6월 28일 ~ 2024년 7월 12일
③ 채권자이의제출기간 : 2024년 7월 16일 ~ 2024년 8월 16일
④ 합병기일 : 2024년 8월 19일
(4) 자산유동화와 관련한 자산매각의 회계처리 및 우발채무 등에 관한 사항
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
(5) 기타 재무제표 이용에 유의하여야 할 사항
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 대손충당금 설정현황
(1) 계정과목별 대손충당금 설정내용(연결기준)
| (기준일 : 2024.06.30) | (단위: 천원, %) |
| 구분 | 계정과목 | 채권총액 | 대손충당금 | 대손충당금 설정률 |
| 제14기 반기(*) | 매출채권 | 234,803 | 144,716 | 61.63% |
| 제13기 | 매출채권 | 24,866 | - | 0.00% |
| 제12기 | 매출채권 | - | - | 0.00% |
(2) 대손충당금 변동현황(연결기준)
| (기준일 : 2024.06.30) | (단위: 천원) |
| 구 분 | 제14기 반기 | 제13기 | 제12기 |
| 1. 기초 대손충당금 잔액합계 | - | - | - |
| 2. 순대손처리액(①-②±③) | (144,716) | - | - |
| ① 대손처리액(상각채권액) | - | - | - |
| ② 상각채권회수액 | - | - | - |
| ③ 기타증감액 | (144,716) | - | - |
| 3. 대손상각비 계상(환입)액 | - | - | - |
| 4. 기말 대손충당금 잔액합계 | 144,716 |
- | - |
(3) 대손충당금 설정기준
회사는 재무제표일 현재 매출채권의 회수가능성에 대한 개별분석 및 신용위험특성과연체일을 기준으로 측정한 기대신용손실을 대손충당금으로 인식하고 있습니다.
(4) 경과기간별 매출채권잔액 현황(연결기준)
| (기준일 : 2024.06.30) | (단위: 천원, %) |
| 구 분 | 3월 이하 | 3월 초과 1년 이하 |
1년 초과 | 계 |
| 금액 | 90,087 | - | 144,716 | 234,803 |
| 구성비율(%) | 38.4% | - | 61.6% | 100.0% |
다. 재고자산 현황
(1) 재고자산의 보유현황
| (단위: 천원, %, 회) |
| 사업부문 | 계정과목 | 제14기 반기 | 제13기 | 제12기 |
| 전체 | 제품 | 24,473 | 10,417 | 16,245 |
| 상품 | - | - | - | |
| 원재료 | 20,134 | 56,027 | 21,498 | |
| 재공품 | 4,525 | 5,029 | 5,906 | |
| 소계 | 49,133 | 71,473 | 43,649 | |
| 총자산대비 재고자산 구성비율 (재고자산합계/기말자산총계*100) |
0.17% | 0.22% | 0.10% | |
| 재고자산회전율(회수) [연환산 매출원가÷{(기초재고+기말재고)÷2}] |
0.00회 | 0.00회 | 0.03회 | |
| (주) 2023년 , 2024년 반기는 별도의 매출원가를 계상하지 않거나 소액이므로 재고자산회전율이 산출되지 않았습니다. |
(2) 재고자산의 실사내용
당사는 매 월말 기준으로 자체적으로 재고실사를 수행하고 있습니다. 보고서 작성기준일로 현업담당자, 회계담당자로 실사팀을 구성하여 재고실사를 진행하여 장부상 재고와 실제 재고수량을 확인하였으며, 중요한 차이가 발생되지 않았습니다.
라. 수주 계약 현황
II. 사업의 내용의 수주 계약 현황을 참조하시기 바랍니다.
마. 공정가치 평가 내역
공정가치 평가내역은 III. 재무에 관한 사항 - 4. 재무제표 주석을 참조하시기 바랍니다.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
1) 회계감사인의 명칭 및 감사의견
| 사업연도 | 감사인 | 감사의견 | 강조사항 등 | 핵심감사사항 |
|---|---|---|---|---|
| 제14기(당반기) | 대주회계법인 | - | - | - |
| 제13기(전기) | 삼덕회계법인 | 적정 | 해당사항없음 | 해당사항없음 |
| 제12기(전전기) | 삼덕회계법인 | 적정 | 해당사항없음 | 해당사항없음 |
* 검토의견은 연결ㆍ별도 재무제표에 대한 검토의견이며, 제14기 반기 검토결과 상기 반기연결재무제표가 한국채택국제회계기준 제1034호(중간재무보고)에 따라 중요성의 관점에서 공정하게 표시하지 않은 사항이 발견되지 아니하였습니다.
2) 감사용역 체결현황
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제14기(당반기) | 대주회계법인 | 개별재무제표감사,분ㆍ 반기검토 ,내부회계관리제도 검토, 재고실사(주1) |
60백만원 | 560 | 20백만원 | 193 |
| 제13기(전기) | 삼덕회계법인 | 개별재무제표감사,분ㆍ 반기검토 ,내부회계관리제도 검토, 재고실사 |
60백만원 | 453 | 60백만원 | 453 |
| 제12기(전전기) | 삼덕회계법인 | 개별재무제표감사,분ㆍ 반기검토 ,내부회계관리제도 검토, 재고실사 |
60백만원 | 453 | 60백만원 | 453 |
(주1) 당반기 중 추가된 종속회사에 대한 연결재무제표 분ㆍ 반기검토는 보고서제출일 현재 소규모합병 진행(합병기일 2024.08.19) 중으로 추가적인 감사용역 계약은 없습니다.
3) 회계감사인과의 비감사용역 계약체결 현황
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제14기(당반기) | - | - | - | - | - |
| 제13기(전기) | 2024.02.23 | 법인세 및 지방소득세 세무조정 업무 |
2024.01.01 ~2024.03.31 |
4백만원 | 삼덕회계법인 |
| 제12기(전전기) | 2023.02.02 | 법인세 및 지방소득세 세무조정 업무 |
2023.01.01 ~2023.03.31 |
4백만원 | 삼덕회계법인 |
4) 내부감사기구가 회계감사인과 논의한 결과
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2024년 02월 19일 | 회사측: 감사, 재무담당이사 감사인측: 업무수행이사, 담당회계사 |
서면회의 | 감사결과, 감사에서의 유의적발견사항, 감사인의 독립성,후속사건 등 |
2. 내부통제에 관한 사항
당사는 현재 내부회계관리제도를 운영 중에 있으며, 주기적으로 내부통제 시스템 및 구조에 대한 평가를 수행하고 있습니다. 기말 감사 후 운영실태보고서 결과에 대한 내용을 기재 예정입니다.
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
1) 이사회의 구성현황
당사의 이사회는 이사로 구성되고 법령 또는 정관에 정한 사항, 주주총회로부터 위임받은 사항, 회사 경영의 기본방침 및 업무집행에 관한 주요사항을 의결하며 이사 및 경영진의 직무집행을 감독하고 있습니다.
보고서 작성기준일 현재 당사의 이사회는 사내이사 2인, 기타비상무이사 1인, 사외이사 2인으로서 총 5인의 이사로 구성되어 있으며, 각 이사의 주요 경력 및 업무 분장은 "Ⅶ. 임원 및 직원 등에 관한 사항"을 참조하시기 바랍니다.
2) 이사회의 주요 의결사항
| 개최일자 | 의 안 내 용 | 가결 여부 |
사내이사 | 기타 비상무이사 |
사외이사 | ||
|---|---|---|---|---|---|---|---|
| 한동일 | 이철환 | 류성호 | 김민우 | 송진호 | |||
| 2024-02-14 | 1. 제 13기 재무제표 승인의 건 | 가결 | 참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
| 2024-02-14 | 1. 주식매수선택권 부여의 건 | 가결 | 참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
| 2024-02-14 | 1. 2023년(제13기) 정기주주총회 소집의 건 | 가결 | 참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
| 2024-05-24 | 1. 타법인 지분 취득의 건 | 가결 | 참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
| 2024-06-11 | 1. (주)인터내셔널사이언티픽스탠다드와 의 합병계약체결의 건 | 가결 | 참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
| 2024-07-01 | 1. 주식매수선택권 부여 취소의 건 | 가결 | 참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
| 2024-07-15 | 1. (주)인터내셔널사이언티픽스탠다드와 의 합병 승인의 건 | 가결 | 참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
참석 (찬성) |
3) 이사회 내의 위원회 구성
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
4) 이사의 독립성
(1) 이사회 구성원 및 선임에 관한 사항
이사는 주주총회에서 선임하며, 주주총회에서 선임할 이사 후보자는 이사회에서 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다. 이사의 선임과 관련하여 관련 법규에 의거한 주주제안이 있는 경우, 이사회는 적법한 범위 내에서 이를 주주총회에 의안으로 제출하고 있습니다. 상기와 같은 절차에 따라 선임된 당사의 이사는 최대주주 또는 주요주주와의 관계에 있어서 독립적입니다.
| 직위 | 성명 | 추천인 | 담당업무 | 회사와의 거래관계 |
최대주주 또 주요주주와의 관계 |
| 대표이사 | 한동일 | 이사회 | 경영총괄 | - | 본인 |
| 사내이사 | 이철환 | 이사회 | CFO | - | 임원 |
| 기타 비상무이사 |
류성호 | 이사회 | CTO | - | 임원 |
| 사외이사 | 김민우 | 이사회 | 기술/ 경영일반 |
- | 임원 |
| 사외이사 | 송진호 | 이사회 | 경영일반 | - | 임원 |
(2) 사외이사후보추천위원회
당사는 보고서 작성기준일 현재 사외이사후보추천위원회를 구성하고 있지 않습니다.
5) 사외이사의 전문성
당사는 김민우 사외이사를 2024년 3월 28일 개최된 제13기 정기주주총회에서 재선임되었습니다. 본 사외이사는 미시건대학교 유기화학 박사학위 취득자로서 Zafgen사 등에서 재직하였으며, 압타머 기반 신약에 심도 높은 조언과 방향성 제시 및 회사의 신약 사업의 가치 창출에 기여할 것으로 판단되며 이러한 직무 수행에 있어 전문성을 갖추고 있습니다.
당사는 송진호 사외이사를 2022년 3월 29일 개최된 제11기 정기주주총회에서 선임되었습니다. 본 사외이사는 마그나인베스트먼트 등 투자회사에 재직하면서 벤처 기업 등 성장성 있는 기업에 대한 투자 및 사업화 관련 다양한 경험을 쌓았습니다. 특히 바이오 산업에 대한 폭넓은 지식과 경험을 바탕으로 이사회의 합리적인 의사결정에 기여 할 수 있는 전문성을 갖추고 있습니다.
당사는 이사회 개최 전에 사외이사가 해당 안건 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고 기타 사내 주요 현안에 대해서도 수시로 정보를 제공하고 있습니다.
6) 사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 5 | 2 | - | - | - |
(주) 보고서 제출일 기준 전체이사의 수는 5명이며 이중 사내이사는 2명, 기타비상무이사는 1명, 사외이사는 2명입니다.
7) 사외이사 교육 미실시 내역
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | - 당사의 사외이사께서는 충분한 자격 요건을 갖추고 있다고 판단하였으며, 공시대상기간 중 사외이사를 대상으로 별도의 교육을 실시하거나 위탁교육 등 외부기관이 제공하는 교육을 이수하도록 한 바 없습니다. - 당사는 사외이사가 업무 수행에 있어 전문적인 직무수행이 가능하도록 보조하고 있습니다. 관련 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고 기타 주요 현안에 대해서도 수시로 정보를 제공하고 있습니다. - 향후 직무관련 교육이 필요한 경우 적극적으로 참여할 계획입니다. |
2. 감사제도에 관한 사항
1) 감사위원회(감사) 설치 여부 및 구성방법 등
당사는 보고서 작성기준일 현재 감사위원회를 별도로 설치하고 있지 않으며, 주주총회 결의에 의하여 선임된 비상근 감사 1명이 감사업무를 수행하고 있습니다.
[감사의 인적사항]
| 성 명 | 주요 경력 | 최대주주등과 이해관계 |
결격요건 여부 |
비 고 |
|---|---|---|---|---|
| 이찬기 | - (주)압타머사이언스 감사 ('21~현재) - 삼성회계법인 대표이사 ('19~현재) - 삼정회계법인 ('03~'19) - 한국공인회계사회 지방세심의위원 ('07~'11) - 서울시립대 세무전문대학 (석사) - 고려대 경영학 (학사) |
해당사항 없음 |
해당사항 없음 |
비상근 /등기 |
| (주1) 2024년 3월 28일 개최된 제13기 정기주주총회 결의를 통해 재선임되었습니다. |
2) 감사의 독립성
감사는 이사회에 참석하여 독립적으로 이사의 업무를 감독할 수 있으며, 제반 업무와 관련하여 관련 장부 및 관계 서류의 제출을 해당 부서에 요구할 수 있습니다. 또한, 필요시 당사로부터 영업에 관한 사항을 보고 받을 수 있으며, 적절한 방법으로 경영정보접근을 위하여 당사 정관에 다음과 같은 조항을 두고 있습니다.
| 구 분 | 내 용 |
|---|---|
| 정관 제52조 (감사의 직무) |
1. 감사는 당회사의 회계와 업무를 감사한다. 2. 감사는 이사회에 출석하여 의견을 진술할 수 있다. 3. 감사는 회의의 목적사항과 소집의 이유를 기재한 서면을 이사회에 제출하여 임시총회의 소집을 청구할 수 있다. 4. 감사는 그 직무를 수행하기 위하여 필요한 때에는 자회사에 대하여 영업의 보고를 요구 할 수 있다. 이 경우 자회사가 지체없이 보고를 하지 아니할 때 또는 그 보고의 내용을 확인할 필요가 있는 때에는 자회사의 업무와 재산상태를 조사할 수 있다. 5. 감사는 회사의 비용으로 전문가의 도움을 구할 수 있다. 6. 감사는 필요하면 회의의 목적사항과 소집이유를 적은 서면을 이사(소집권자가 있는 경우에는 소집권자)에게 제출하여 이사회 소집을 청구할 수 있다. 7. 제6항의 청구를 하였는데도 이사가 지체 없이 이사회를 소집하지 아니하면 그 청구한 감사가 이사회를 소집할 수 있다. |
| (주1) 2021년 3월 25일 개최된 제10기 정기주주총회에서 결의된 정관 변경 내용으로 반영하였습니다. |
3) 감사의 주요활동내역
| 개최일자 | 의 안 내 용 | 가결여부 | 참석여부 |
|---|---|---|---|
| 2024-02-14 | 1. 제 13기 재무제표 승인의 건 | 가결 | 참석 |
| 2024-02-14 | 1. 주식매수선택권 부여의 건 | 가결 | 참석 |
| 2024-02-14 | 1. 2023년(제13기) 정기주주총회 소집의 건 | 가결 | 참석 |
| 2024-05-24 | 1. 타법인 지분 취득의 건 | 가결 | 참석 |
| 2024-06-11 | 1. (주)인터내셔널사이언티픽스탠다드와 의 합병계약체결의 건 | 가결 | 참석 |
| 2024-07-01 | 1. 주식매수선택권 부여 취소의 건 | 가결 | 참석 |
| 2024-07-15 | 1. (주)인터내셔널사이언티픽스탠다드와 의 합병 승인의 건 | 가결 | 참석 |
4) 감사위원회 위원의 인적사항 및 사외이사 여부
당사는 보고서 작성기준일 현재 해당사항이 없습니다
5) 감사 교육 미실시 내역
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | 보고서 작성기준일 현재 당사의 감사를 대상으로 교육을 실시하거나 위탁교육 등 외부기관이 제공하는 교육을 이수한 바 없습니다. 당사의 감사가 업무를 수행함에 있어 전문적인 직무수행이 가능하도록 보고하고 있습니다. 관련 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고 기타 주요 현안에 대해서도 수시로 정보를 제공하고 있습니다. |
6) 감사 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 경영지원본부 | 5 | 본부장 및 팀장 외 |
- 회사 경영활동에 대한 감사 업무 지원 - 주주총회, 이사회 등 경영전반에 관한 감사업무 지원 |
7) 준법지원인 등 지원조직 현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
3. 주주총회 등에 관한 사항
1) 투표제도 현황
| (기준일 : | 2024년 06월 30일 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 도입 |
| 실시여부 | - | - | 제11기(2021년) 정기주주총회에서 실시 |
2) 소수주주권의 행사여부
당사는 보고서 작성기준일 현재까지 소수주주권의 행사 사실이 존재하지 않습니다.
3) 경영권 경쟁 여부
당사는 보고서 작성기준일 현재까지 경영권과 관련하여 경쟁이 발생한 사실이 없습니다.
4) 의결권 현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 16,980,252 | - |
| 우선주 | 920,000 | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | 920,000 | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 16,980,252 | - |
| 우선주 | - | - |
5) 주식의 사무
| 구분 | 내용 | ||
|---|---|---|---|
| 정관상 신주인수권의 내용 |
제 9조 (신주인수권) 1. 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다. 2. 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다. ① 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 「자본시장과 금융투자업에 관한 법률」 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 ② 「상법」 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 ③ 발행하는 주식총수의 100분의 20범위 내에서 우리사주조합원에게 주식을 배정하는 경우 ④ 발행주식 총수의 100분의 30을 초과하지 않는 범위 내에서 긴급한 자금 조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 ⑤ 발행주식총수 100분의 30을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산ㆍ판매ㆍ자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 ⑥ 주권을 코스닥 시장에 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 3. 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. 4. 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. 5. 제2항에 따라 주주 외의 자에게 신주를 배정하는 경우 회사는 상법 제416조제1호, 제2호, 제2호의2, 제3호 및 제4호에서 정하는 사항을 그 납입기일의 2주 전까지 주주에게 통지하거나 공고하여야 한다. |
||
| 결산일 | 12월 31일 | 정기주주총회 | 이사회결의로 정한 날 3월 이내 |
| 주주명부폐쇄시기 | 이사회결의로 일정한 기간을 정함 단, 3개월내로 정지 및 2주 전 이를 공고 |
||
| 주권의 종류 | 일주권, 오주권, 일십주권, 오십주권, 일백주권, 오백주권, 일천주권, 일만주권(8종) |
||
| 명의개서대리인 | KB국민은행 증권대행부 | ||
| 주주의 특전 | 해당사항없음 | 공고게재 | 홈페이지(www.aptsci.com) 및 한국경제신문 |
6) 주주총회 의사록 요약
| 구분 | 의안내용 | 결의내용 | 주의 논의내용 |
|---|---|---|---|
| 제11기 정기주주총회 2022-03-29 |
제 1호 의안 : 재무제표 승인의 건 | 원안대로 가결 | 특이사항 없음 |
| 제 2호 의안 : 사외이사 선임의 건 | 원안대로 가결 | ||
| 제 3호 의안 : 이사보수한도 승인의 건 | 원안대로 가결 | ||
| 제 4호 의안 : 감사 보수한도 승인의 건 | 원안대로 가결 | ||
| 제 5호 의안 : 주식매수선택권 부여 승인의 건 | 원안대로 가결 | ||
| 제12기 정기주주총회 2023-03-30 |
제 1호 의안 : 재무제표 승인의 건 | 원안대로 가결 | 특이사항 없음 |
| 제 2호 의안 : 정관변경의 건 | 원안대로 가결 | ||
| 제 3호 의안 : 사내이사 선임의 건 | 원안대로 가결 | ||
| 제 4호 의안 : 이사보수한도 승인의 건 | 원안대로 가결 | ||
| 제 5호 의안 : 감사 보수한도 승인의 건 | 원안대로 가결 | ||
| 제 6호 의안 : 주식매수선택권 부여 승인의 건 | 원안대로 가결 | ||
제13기 정기주주총회 2024-03-28 |
제 1호 의안 : 재무제표 승인의 건 | 원안대로 가결 | 특이사항 없음 |
| 제 2호 의안 : 이사 선임의 건 | 원안대로 가결 | ||
| 제 3호 의안 : 감사 선임의 건 | 원안대로 가결 | ||
| 제 4호 의안 : 이사보수한도 승인의 건 | 원안대로 가결 | ||
| 제 5호 의안 : 감사 보수한도 승인의 건 | 원안대로 가결 | ||
| 제 6호 의안 : 주식매수선택권 부여 승인의 건 | 원안대로 가결 |
VI. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 한동일 | 본인 | 보통주 | 2,800,000 | 16.49 | 2,810,000 | 16.55 | 장내매수 |
| 류성호 | 등기임원 | 보통주 | 1,020,000 | 6.01 | 1,020,000 | 6.01 | - |
| 이철환 | 등기임원 | 보통주 | 6,000 | 0.04 | 14,000 | 0.08 | 장내매수 |
| 장승기 | 미등기임원 | 보통주 | 1,020,000 | 6.01 | 1,020,000 | 6.01 | - |
| 이대견 | 미등기임원 | 보통주 | 22,200 | 0.13 | 22,200 | 0.13 | - |
| 이광용 | 미등기임원 | 보통주 | 0 | 0 | 8,000 | 0.05 | 장내매수 |
| 계 | 보통주 | 4,868,200 | 28.67 | 4,894,200 | 28.82 | - | |
| 우선주 | - | - | - | - | - | ||
2. 최대주주의 주요경력 및 개요
| 성 명 (생년월일) |
직책 | 주요경력 | 비고 |
|---|---|---|---|
| 한동일 ('59.09.11) |
대표이사 | - 한국과학기술원 화학과 (박사'90) - (주) SK 의약연구 팀장 ('00~'03) - 포스텍 생명공학연구센터 사업개발총괄('03~'11) - ㈜압타머사이언스 대표이사 ('11~현재) |
- |
3. 최대주주 변동내역
- 당사는 최근 5년간 최대주주 변동 사항이 없습니다.
4. 주식 소유현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 한동일 | 2,810,000 | 16.55 | - |
| 류성호 | 1,020,000 | 6.01 | - | |
| 장승기 | 1,020,000 | 6.01 | - | |
| 우리사주조합 | - | - | - | |
5. 소액주주현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 12,239 | 12,245 | 99.95 | 11,337,518 | 16,980,252 | 66.77 | - |
(주1) 소유주식은 의결권 있는 주식수(16,980,252주) 기준입니다.
6. 주가 및 주식거래실적
| 구분 | 2024년 01월 | 2024년 02월 | 2024년 03월 | 2024년 04월 | 2024년 05월 | 2024년 06월 | |
| 주가 | 최고 | 3,685 | 3,965 | 3,510 | 3,290 | 2,875 | 2,885 |
| 최저 | 2,975 | 3,015 | 3,085 | 2,600 | 2,660 | 2,595 | |
| 평균 | 3,343 | 3,270 | 3,252 | 2,836 | 2,777 | 2,746 | |
| 월간 거래량 | 최고(일) | 127,450 | 2,677,781 | 1,993,936 | 355,894 | 542,029 | 582,990 |
| 최저(일) | 21,080 | 26,770 | 12,271 | 14,977 | 11,671 | 13,548 | |
| 합계(월) | 1,238,107 | 5,910,614 | 3,943,011 | 1,343,502 | 1,707,026 | 1,368,774 | |
| ※ 최근 6개월간 주가 및 거래량이며, 최고주가, 최저주가 및 평균주가는 종가를 기준으로 가중산술평균값으로 작성하였습니다. |
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
1) 임원 현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 한동일 | 남 | 1959.09 | 대표 이사 |
사내이사 | 상근 | 경영총괄 |
- 한국과학기술원 화학과 (박사) - ㈜압타머사이언스 대표이사 |
2,810,000 | - | 본인 | 12년3개월 | 2026.04.08 |
| 이철환 | 남 | 1973.10 | 상무 이사 |
사내이사 | 상근 | CFO |
- 한국외대 재무회계 (석사) - 한양대 경영학 (박사) - JW생명과학, 대교, 엠케이전자 - ㈜압타머사이언스 경영지원본부장 |
14,000 | - | 타인 | 1년3개월 | 2026.03.30 |
| 류성호 | 남 | 1956.12 | 이사 | 기타비상무이사 | 비상근 | CTO |
- 한국과학기술원 생명과학과(박사) - 국립보건원 박사후 연구원 - 포스텍 교수 |
1,020,000 | - | 타인 | 12년3개월 | 2027.03.28 |
| 김민우 | 남 | 1960.01 | 이사 | 사외이사 | 비상근 | 기술/ 경영일반 |
- Response Therapeutics Inc. Executive Vice President - Zafgen - SK Biopharm - 미시건대학교 유기화학(박사) |
- | - | 타인 | - | 2027.03.28 |
| 송진호 | 남 | 1967.07 | 이사 | 사외이사 | 비상근 | 경영일반 | - 연세대 경영학 (학사/석사) - 국민대 BIT대학원 경영학 (박사) - 케이알투자증권, 퀀트와이즈투자자문 - 마그나인베스트먼트 부사장 |
- | - | 타인 | - | 2025.03.29 |
| 이찬기 | 남 | 1969.09 | 감사 | 감사 | 비상근 | 감사 | - 삼성회계법인 대표이사 - 삼정회계법인 - 한국공인회계사회 지방세심의위원 - 서울시립대 세무전문대학(석사) - 고려대 경영학(학사) |
- | - | 타인 | - | 2027.03.28 |
| 이광용 | 남 | 1967.01 | 전무 이사 |
미등기 | 상근 | 임상/BD 담당임원 |
- KAIST 생물학과 - 세종대학교/Syracuse MBA - 한국얀센, 한국화이자 - 올릭스(주) 전략/임상개발 전무 |
8,000 | - | 타인 | 8개월 | - |
| 이대견 | 남 | 1973.09 | 상무 이사 |
미등기 | 상근 | 연구개발 본부장 |
- 포스텍 박사 - 서울대학교 박사후 연구원 - 서울대학교 연구교수 - 와이디생명과학 이사 |
22,200 | - | 타인 | 5년3개월 | - |
| 장승기 | 남 | 1959.04 | 고문 | 미등기 | 비상근 | 기술 자문 |
- Univ. of NY at Stony Brook. 분자생물학 - 포스텍 교수 - 포스텍 생명공학연구센터 센터장 |
1,020,000 | - | 타인 | - | - |
2) 직원 등 현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 사무 | 남 | 5 | - | - | - | 5 | 3.4 | 185 | 37 | - | - | - | - |
| 사무 | 여 | 6 | - | - | - | 6 | 2.6 | 126 | 21 | - | |||
| 연구 | 남 | 14 | - | - | - | 14 | 3.2 | 381 | 27 | - | |||
| 연구 | 여 | 14 | - | - | - | 14 | 3.8 | 315 | 23 | - | |||
| 합 계 | 39 | - | - | - | 39 | - | 1,009 | 26 | - | ||||
3) 미등기임원 보수 현황
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 2 | 132 | 66 | - |
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
1) 주주총회 승인금액
| (단위 : 백만원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 5 | 1,000 | - |
| 감사 | 1 | 100 | - |
나. 보수지급금액
1) 이사ㆍ감사 전체
| (단위 : 백만원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 6 | 279 | 47 | - |
(주1) 보수총액은 2024년 6월 30일 기준 현재 등기임원에 한하여 2024년 1월부터 6월까지 지급총액 기준이며, 1인당 평균 보수액은 보수총액을 등기임원의 수로 단순평균하여 산출하였습니다.
2) 유형별
| (단위 : 백만원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
3 | 243 | 81 | - |
| 사외이사 (감사위원회 위원 제외) |
2 | 33 | 17 | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 3 | 3 | - |
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
<주식매수선택권의 부여 및 행사현황>
<표1>
| (단위 : 백만원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
1 | 22 | - |
| 사외이사 (감사위원회 위원 제외) |
- | - | - |
| 감사위원회 위원 또는 감사 | - | - | - |
| 업무집행지시자 등 | 1 | 21 | - |
| 계 | 2 | 43 | - |
※ 공정가치 산정방법은 이항모형에 의한 공정가치접근법을 적용하여 보상원가를 산정하였으며, 부여일 주가는 현금흐름할인법에 의해 측정된 공정가치를 이용하였습니다.
<표2>
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 이철환 | 등기임원 | 2023.02.28 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 40,000 | 2025.02.28 ~ 2030.02.27 |
4,686 | X | - |
| 이대견 | 미등기임원 | 2022.03.10 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 40,000 | 2024.03.10 ~ 2029.03.09 |
6,375 | X | - |
| 이조운이외3인 | 직원 | 2022.03.10 | 신주교부 | 보통주 | 25,000 | - | - | - | - | 30,000 | 2024.03.10 ~ 2029.03.09 |
6,375 | X | - |
| 강주형외3인 | 직원 | 2023.02.28 | 신주교부 | 보통주 | 40,000 | - | - | - | - | 60,000 | 2025.02.28 ~ 2030.02.27 |
4,686 | X | - |
| 이광용 | 미등기임원 | 2024.02.14 | 신주교부 | 보통주 | 80,000 | - | - | - | - | 80,000 | 2026.02.14 ~ 2031.02.13 |
3,566 | X | - |
| 김현외2인 | 직원 | 2024.02.14 | 신주교부 | 보통주 | 35,000 | - | - | - | - | 35,000 | 2026.02.14 ~ 2031.02.13 |
3,566 | X | - |
※ 2023년 3월 2일 배정기준일 기준 무상증자 반영함.
※ 공시서류작성기준일(2024년 6월 30일) 현재 종가 : 2,765원
VIII. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| (주)압타머사이언스 | - | 1 | 1 |
| ※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조 |
2. 타법인출자 현황(요약)
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | 1 | 1 | - | 1 | - | 1 |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | - | - | - | - | - | - |
| 계 | - | 1 | 1 | - | 1 | - | 1 |
| ※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조 |
IX. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
3. 대주주와의 영업거래
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
4. 대주주 이외의 이해관계자와의 거래
| (단위: 천원) |
|
성명 (법인명) |
관계 | 구분 | 2024년 반기 | 2023년 | 2022년 | |||
| 금액 | 내용 | 금액 | 내용 | 금액 | 내용 | |||
| 포항공과대학교 산학협력단 | 기타특수 관계자 (주1) |
매출 등 | 2,336 | 합성매출외 | 42,397 | 합성매출외 | 65,864 | 합성매출외 |
| 채권 잔액 | - | - | - | - | - | - | ||
| 매입 등 | 3,202 | 경상연구개발비등 | 7,914 | 경상연구개발비등 | 1,964 | 경상연구개발비등 | ||
| 채무 잔액 | 476 | 미지급비용 | 1,624 | 미지급비용 | 4,092 | 미지급비용 | ||
| ㈜인터내셔널사이언티픽스탠다드 | 종속회사 | 매출 등 | - | - | - | - | - | - |
| 채권 잔액 | 1,505,810 | 대여금 등 |
- | - | - | - | ||
| 매입 등 | 65,958 | 경상연구개발비 | - | - | - | - | ||
| 채무 잔액 | 2,365 | 미지급금 | - | - | - | - | ||
| (주1) 회사가 발행한 1차 우선주의 투자자로 회사에 유의적인 영향력을 행사할 수 있습니다. |
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
가. 소규모 합병 진행
당사는 2024년 6월 11일 이사회 결의를 통해 (주)인터내셔널사이언티픽스탠다드 와의 소규모 합병결의를 하였고, 2024년 7월 15일자 주주총회를 갈음하는 이사회 결의로 아래와 같이 소규모 합병이 승인되었으며, 2024년 8월 19일을 합병기일로 하여 (주)인터내셔널사이언티픽스탠다드를 합병하였습니다.
[합병 주요내용]
- 합병회사(존속회사) : (주)압타머사이언스
- 피합병회사(소멸회사) : (주)인터내셔널사이언티픽스탠다드
- 합병목적 : (주)압타머사이언스의 신약 개발 플랫폼 기술력 강화 및 안정적인 매출 확보를 통한 재무구조 개선
- 합병비율 : (주)압타머사이언스 : (주)인터내셔널사이언티픽스탠다드
= 1.0 : 0.0 (무증자 소규모 합병)
- 합병주요일정
① 합병계약일 : 2024년 6월 14일
② 합병반대의사통지기간 : 2024년 6월 28일 ~ 2024년 7월 12일
(반대의사표시 주주수 및 비율 : 224명(376,451주), 2.22%)
③ 채권자이의제출기간 : 2024년 7월 16일 ~ 2024년 8월 16일
④ 합병기일 : 2024년 8월 19일
2. 우발부채 등에 관한 사항
가. 중요한 소송사건 :
보고서 작성기준일 현재 해당사항이 없습니다.
나. 견질 또는 담보용 어음, 수표 현황
보고서 작성기준일 현재 해당사항이 없습니다.
다. 채무보증현황
보고서 작성기준일 현재 해당사항이 없습니다.
라. 채무인수약정 현황
보고서 작성기준일 현재 해당사항이 없습니다.
마. 그 밖의 우발채무 등
1) 연결실체는 2011년 6월 7일 포항공과대학교 산학협력단과 체결한 압타머를 이용한 학문연구용 시약의 상업적 제공에 대한 라이선스 계약에 의해 관련 매출에 대하여 연순판매액의 3%를 경상기술료로 지급하고 있습니다.
2) 연결실체는 2013년 7월 31일 포항공과대학교 산학협력단과 체결한 IVD 라이선스 계약(한국 내)에 의해 IVD제품의 한국 내 순판매액의 6%를 기술료로 지급해야 합니다.
3) 연결실체는 2014년 6월 11일 포항공과대학교 산학협력단과 체결한 기술이전계약서 (Aptamer sandwich Assay에 대한)에 의해 기술적용 연간 총 매출액의 3%를 기술료로 지급해야 합니다.
4) 연결실체는 2016년 1월 25일 포항공과대학교 산학협력단과 체결한 IVD 라이선스 계약(중국, 일본, 싱가포르, 인도, 대만, 인도네시아, 태국, 베트남, 말레이시아, 라오스,캄보디아, 필리핀)에 의해 기술적용 연간 순 매출액의 3.5%를 기술료로 지급해야 합니다.
5) 연결실체는 2016년 3월 1일 서울아산병원과 체결한 기술이전 계약(폐암진단키트 개발 노하우)에 의해 폐암IVD의 한국내 매출액의 1%를 기술료로 지급해야 합니다.
6) 연결실체는 2022년 08월 01일 과학기술정보통신부의 CD25 표적 압타머-약물접합체를 이용한 면역 항암제 연구개발 과제에 착수 하였으며 규정에 따라 정부출연금의 10%를 기술료로 지급해야 합니다.
7) 연결실체는 당반기말 현재 서울보증보험으로부터 12,000천원의 한도로 지급보증보험을 제공받고 있습니다.
8) 연결실체는 당반기말 현재 차입금 151,102 천원의 담보로 외상매출채권을 제공하였습니다.
바. 자본으로 인정되는 채무증권의 발행
보고서 작성기준일 현재 해당사항이 없습니다.
3. 제재 등과 관련된 사항
보고서 작성기준일 현재 해당사항이 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 제재현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 소규모 합병 진행
당사는 2024년 6월 11일 이사회 결의로 (주)인터내셔널사이언티픽스탠다드와의 소규모 합병을 결의하였으며, 합병 반대의사표시 기간(2024년 6월 28일~2024년 7월 12일) 종료 후 2024년 7월 15일 이사회 결의로 소규모 합병이 승인되었습니다.
소규모 합병에 대한 채권자이의제출 기간(2024. 7. 16 ~ 2024. 8. 16) 종료로 2024년 8월 19일(합병기일)자로 소규모 합병이 완료되었습니다.
다. 중소기업기준 검토표
 |
|
중소기업기준검토표_압타머사이언스 2023_1 |
 |
|
중소기업기준검토표_압타머사이언스 2023_2 |
라. 특례상장기업의 재무사항 비교표
당사는 기술성장기업으로 코스닥시장 상장규정 제7조 제2항에서 정하는 신규상장 심사요건 특례를 적용받아 2020년 9월 16일 코스닥시장에 상장되었습니다.
당사는 특례상장기업으로서 코스닥시장 상장을 위한 증권신고서에 미래 제품별 매출액을 추정하여 기재하였는바, 투자설명서에 기재된 최근 3개 사업연도에 대한 재무사항 예측치와 실적을 비교하면 다음과 같습니다.
| (상장일 : | 2020. 09. 16 | 인수인 : 키움증권) | (단위 :백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 괴리율(%) |
| 2021년 | 매출액 | 9,657 | 269 | 97 |
| 진단제품 |
2,042 |
- |
100 | |
| 신약 | 7,615 |
269 |
96 | |
| 영업이익 | (5,019) | (4,067) | 19 | |
| 당기순이익 | (5,169) | (3,831) | 26 | |
| 2022년 | 매출액 | 35,695 |
358 |
99 |
| 진단제품 | 15,604 |
3 |
100 | |
| 신약 | 20,091 |
355 |
98 | |
| 영업이익 | 10,012 |
(8,320) |
183 | |
| 당기순이익 | 9,862 |
(7,116) |
172 | |
| 2023년 | 매출액 | 78,274 | 243 | 100 |
| 진단제품 | 33,442 | - | 100 | |
| 신약 | 44,832 | 243 | 99 | |
| 영업이익 | 41,427 | (12,207) | 129 | |
| 당기순이익 | 32,196 | (13,602) | 142 |
(주1) '괴리율'은 '(예측치-실적치)/예측치'로 산정하여 백분율로 기재하였으며,
예측치는 투자설명서에 기재된 예측치를 반영하였습니다.
(주2) 괴리율 차이는 다음과 같습니다.
-
매출액
당사는 진단제품의 경우 투자설명서상 2020년 하반기부터는 본격적인 매출이 발생될 것으로 예상하였고, 해외시장 진출의 발판을 마련하기 위해 세계 최대 시장인 중국 진출을 위하여 협력 계약을 체결하고 임상 및 ICL 기반 서비스 사업을 추진한 바 있습니다. 2023년 해외사장 진출의 본격화를 예상하여 투자설명서상 추정 매출 33,442백만원으로 기재하였으나 실적은 0원으로 괴리율은 100%입니다.
괴리 발생 원인으로는 1~2차년도 중국발 코로나19 가 유행함에 따라 중국시장 진출의 어려움을 겪었으며, 국내 시장의 경우 코로나19의 영향과 더불어 신의료기술 평가 유예 제도 시행이 지연됨에 따라 임상 활동 또한 지연되었습니다. 3차년도의 평가유예 시행이후 로는 2022년 기말 기존 수탁기관의 계약 종료에 따른 새로운 새로운 수탁기관과의 계약 과정에서 수탁기관 공백에 따른 병원별 비급여 코드 확보에 어려움을 겪었으며, 수탁기관과의 공동 마케팅 활동 또한 어려움을 겪었습니다. 이로 인해 진단제품의 1~3차 년도 괴리율이 100% 100% 100% 발생되었으나 2023년 하반기 새로운 수탁기관과의 계약으로 현재는 비급여 코드를 활발히 확보 중이며, 건강검진 시장 진입과 공동 마케팅 활동에 전념하고 있습니다.
신약개발사업의 경우 당초 당뇨치료제 AST-102(인슐린 민감제)의 글로벌 라이센싱 계약 을 통하여 기술료 수입을 통한 본격적인 매출 증대를 예상 했으나, 당뇨 신약 시장에서의 인슐린의 통용된 사용에 대한 진입시 높은 장벽으로 시장성을 기대하기 어려웠으며 부득이하게 개발사업을 중지 하였습니다. 현재 동사가 개발중인 고형암치료제 AST-201( 바이오마커인 글라이피칸3(GPC3)에 선택적으로 결합하는 표적형 압타머 신약) 으로 2024년 3월 국내 1상 임상시험 IND 승인 신청을 완료하였습니다.
-
영업이익
1차년도 예측치 -5,019백만원 실적치 -4,067 백만원으로 괴리율 19%이며, 주요 괴리 발생원인으로는 매출 괴리율 발생원인에 기인합니다. 또한 국내 시장의 신의료 기술 평가 유예 제도 시행 지연과
해외시장의 코로나19에 의한 해외 임상 지연,
임상개발비의 지출 또한 지연됨에 따라 괴리율이 상대적으로 소폭 발생되었으나, 2차년도의 경우 예측치 10,012백만원 실적치 -8,320백만원 괴리율 183%, 3년차도의 경우 예측치 41,427백만원 실적치 -12,207백만원 괴리율 129%으로 2차년도의 경우 압타머를 이용한
신약개발이라는 특수성의 사유로 지연되었던 CDMO의 발굴로 인한 임상개발비의 지출의 본격화로 1차년도에 비해 괴리율이 대폭 상승하였으며, 3년차도의 경우 2024년 1분기내
IND filing 및 임상1상시험을
앞두고 전 임상단계 연구개발비의 지출금액이 대부분 발생됨에 따라 괴리율이 129% 발생되었습니다.
- 당기순이익
1차년도 예측치 -5,169만원 실적치-3,831만원으로 괴리율 26%가 발생되었으며
2년차도의 경우 예측치 9,862백만원 실적치 -7,116백만원으로 괴리율 172% 가 발생되었습니다.
주요 괴리 발생 원인으로는 1차년도의 경우 코로나 유행에 따른 임상지연의 사유로 임상개발비 지출의 이연으로 괴리율이 상대적으로 소폭 발생하였으나 2~3차년도의 경우 추정 매출의 괴리와 전환사채발행시 회계 처리 기준에 의한 이자비용과 파생상품 평가손실의 인식으로 괴리율이 대폭 증가하였습니다. 특히 3차년도의 경우 임상 1상 진입전 전임상 단계의 지출의 발생 시점이 도래함에 따라 예측치 32,196백만원 실적치 -13,602백만원으로 142%의 괴리율이 발생되었으며, 전환사채 발행시 회계처리 기준으로 인한 이자비용 14억 파생상품 평가손실 12억이 영업외비용 26억에 포함되어 손실이 증가 되었습니다.
마. 매출액 미달에 대한 관리종목 지정유예 현황
(최근 사업연도 매출액 30억원 미만)
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|
| 사업연도 | 매출금액 | 해당여부 | 사유 | 종료시점 | |
| 2023 | 243 | 해당 | 해당 | 기술성장 특례 적용 기업 | 2024년 12월 31일 |
※ 2024년 반기 매출액은 71백만원임.
바. 계속사업손실에 대한 관리종목 지정유예 현황
(자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속 사업손실 발생)
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원, %) |
| 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | ||||
|---|---|---|---|---|---|---|
| 사업연도 | 법인세 차감전 계속사업손익(A) |
자기자본금액 (B) |
비율(A/B) | 해당 여부 |
종료 시점 |
|
| 2021년 | -3,831 | 31,461 | -12 | 미해당 | 미해당 | 2022.12.31 |
| 2022년 | -8,301 | 29,223 | -28 | |||
| 2023년 | -13,602 | 15,479 | -88 | |||
(주1) 당사는 2020년 9월 16일 코스닥시장에 기술성장기업으로 상장하였습니다.
(주2) 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도(상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 5개 사업연도에 대해서는 해당 요건을 적용 받지 않습니다.
(주3) 거래소에서 규정하고 있는 기술성장기업의 경우에는 영업손실 발생 요건을 적용 받지 않습니다.
(주4) 세전이익 요건의 경우 신규상장일이 속하는 사업연도(상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 3개 사업연도에 대해서는 해당 요건을 적용 받지 않습니다. 지정유예 기간의 종료 후 처음으로 관리종목 지정요건의판단 대상이 되는 3개 사업연도는 2023년부터 2025년까지입니다.
XI. 상세표
1. 연결대상 종속회사 현황(상세)
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| (주)인터내셔널사이언티픽스탠다드 | 2008.06.27 | 강원도 춘천시 | 의약품 분석 및 임상검체분석 | 1,696 | 당사 지분 100% | 미해당 |
※ 상기 최근사업연도말 자산총액은 2023년도 기준입니다.
| (기준일 : 증권신고서 제출일) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - |
| - | - | - | - | - | - | - |
| - | - | - | - | - | - | - |
2. 계열회사 현황(상세)
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | 1 | (주)인터내셔널사이언티픽스탠다드 | 140111-0036390 |
| - | - |
| (기준일 : 증권신고서 제출일) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | - | - | - |
| - | - |
3. 타법인출자 현황(상세)
| (기준일 : | 2024년 06월 30일 | ) | (단위 : 원, 천주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| (주)인터내셔널사이언티픽 스탠다드 |
비상장 | 2024.05.27 | 사업 다각화 |
1 | - | - | - | 1,010 | 1 | - | 1,010 | 100.0 | 1 | 1,695,635,578 | -1,355,989,685 |
| 합 계 | - | - | - | 1,010 | 1 | - | 1,010 | - | 1 | 1,695,635,578 | -1,355,989,685 | ||||
※ 상기 최근사업연도 재무현황은 2023년도말 기준입니다.
| (기준일 : 증권신고서 제출일) | (단위 : 원, 천주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - | - | - | ||||
【 전문가의 확인 】
1. 전문가의 확인
보고서 작성기준일 현재 해당사항이 없습니다.
2. 전문가와의 이해관계
보고서 작성기준일 현재 해당사항이 없습니다.