 |
|
글로벌 tpd 시장 스냅샷 |
정 정 신 고 (보고)
| 2024년 07월 26일 |
1. 정정대상 공시서류 : 증권신고서(합병)
2. 정정대상 공시서류의 최초제출일 : 2024년 07월 01일
[증권신고서 제출 및 정정 연혁]
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2024년 07월 01일 | 증권신고서(합병) | 최초제출 |
| 2024년 07월 08일 | [기재정정]증권신고서(합병) | 자진정정(굵은 빨간색) |
| 2024년 07월 17일 | [기재정정]증권신고서(합병) | 자진정정(굵은 파란색) |
| 2024년 07월 26일 | [기재정정]증권신고서(합병) | 자진정정(굵은 보라색) |
3. 정정사항
| 항 목 | 정정요구ㆍ명령관련 여부 | 정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|---|
|
※ 금번 '[정정]증권신고서'는 일부 내용 정정 및 추가에 따른 것으로, 정정 및 추가 기재된 사항은 굵은 보라색으로 표시하였습니다. 본문의 정정 기재에 따른 요약정보의 정정기재된 사항은 별도로 정오표를 작성하지 않았습니다. |
||||
| VI. 투자위험요소 | ||||
| 가-9. 신약개발 관련 및 목표 시장 경쟁 심화 위험 | 아니오 | 보완 기재 | (주1) 정정 전 | (주1) 정정 후 |
| 나-7. 잦은 자금조달 관련 위험 | 아니오 | 보완 기재 | (주2) 정정 전 | (주2) 정정 후 |
(주1) 정정 전
소멸회사는 단백질 분해 기발 치료제 모델인 PROTAC(PROteolysis Targeting Chimera)의 한계 극복을 위해 차세대 기술인 bioPROTAC 기술을 개발하여 기존 치료제로 해결할 수 없는 의학적 미충족 수요를 충족 가능한 First in class 신약 개발을 목적으로 하고 있습니다.
소멸회사는 고유의 synthetic 라이브러리를 활용하여 신규 Nanobody(전통적 항체보다 작은 항체)를 자체적으로 발굴 가능하며, Yeast display 시스템과 High-throughput screening 시스템을 활용하여 TPD(표적단밸질 분해 기술)가 개선된 고유 engineered protein 확보가 가능합니다. 또한 First in calss 신약의 잠재력이 있는 10여개의 Novel target(기존에 연구되지 않은 새로운 표적)을 확보하고 있으며 bioPROTAC을 제작하기 위한 핵심기술을 내재화하고 있습니다.
해당 기술을 바탕으로 소멸회사는 암, 소뇌실조증, 아토피 피부염을 적응증으로 하는 파이프라인을 보유하고 있습니다. 소멸회사는 총 4개의 파이프라인을 보유하고 있으며 현재 발굴단계로 아직 전임상단계에 도달하지 못하였습니다. 소멸회사는 전임상단계 연구부터 기술이전 또는 공동연구로 개발을 진행 할 계획입니다.
EPD-301의 경우 Precision Nanosystems Inc과의 공동연구계약이 '23년 8월 체결되어 현재 전임상/임상개발을 위해 폐를 타겟으로 하는 LNP 선정이 완료되었으며향후 LNP 유효성 연구 확인 후 '24년 3Q내에 전임상 시료 생산 시작을 목표로 하고 있습니다. 아울러 '25년 말까지 IND 제출 완료를 목표로 하고 있으며 국내 임상 1상 자체 진행과 글로벌 기술이전을 병행할 계획이 있습니다.
EPD-401의 경우 최종 리드 후보 물질 선정을 위한 단백질체학 연구가 진행 중이며 선택성을 확인하여 최종 후보 물질 선정 계획에 있습니다. 선정된 물질로 '24년 4Q 생체 내 실험을 진행 후 '25년 내 전임상 단계 진입을 목표로 하고 있습니다.
EPD-201의 경우 진행이 보류된 상태로 향후 추가적인 연구 여부를 판단할 계획입니다.
EPD-501의 경우 일리미스테라퓨틱스와의 공동연구로 퇴행성 질환 치료제 개발 과제를 런칭하였습니다.
증권신고서 제출일 전일 기준 소멸회사의 파이프라인 현황 및 전임상단계 연구 계획은 다음과 같습니다.
| [소멸회사 파이프라인 현황] |
| 프로그램 | 타겟 | 적응증 | 발굴단계 | 전임상 | 임상 | 시판허가 | 비고 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구축물 합성 | 시험관 효능평가 | 작용 기전 연구 | 시험관 효능평가 | 1상 | 2상 | 3상 | ||||||
| EPD-301 | SOX2 | 암 | ||||||||||
| EPD-201 | ATXN1 | 1형 소뇌실조 | ||||||||||
| EPD-401 | STAT3 | 아토피 피부염 / 암 | ||||||||||
| EPD-501 | 미공개 | 퇴행성 뇌질환 | 공동개발(일리미스테라퓨틱스) | |||||||||
| 출처: 소멸회사 제공 |
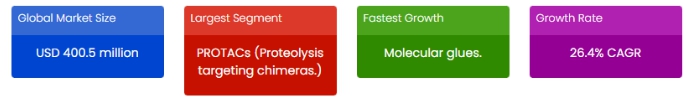
SkyQuest Technology Report에 따르면 글로벌 TPD(표적단백질분해 기술) 시장은 '23~'30년까지 CAGR 26.4%로 성장할 것을 전망하고 있으며, '30년 33억달러 규모의 시장이 될 것으로 기대하고 있습니다.
| [글로벌 TPD 시장 전망 2023-2030] |
|
| 출처: SkyQuest Technology Report : Global Targeted Protein Degradation Market |
| [글로벌 TPD 시장 전망] |
|
| 출처: SkyQuest Technology Report : Global Targeted Protein Degradation Market |
우호적인 TPD관련 시장 전망에 따라 국내외 다수의 업체들이 R&D를 진행하고 있으며 TPD기술은 크게 MG와 PROTAC으로 구분됩니다.
MG와 PROTAC기술의 비교내용과 국내외 TPD 경쟁사 R&D현황은 다음과 같습니다.
| [MG/PROTAC 기술 비교표] |
| 구분 | MG | PROTAC |
| 정의 | 표적 단백질과 E3 ligase의 동시에 결합하는 물질이지만, PROTAC과 달리 단일 화학적 요소로 이루어진 경우가 대부분. E3 ligase에 결합한 분자 접착제가 표적 단백질에 결합하도록 유도 가능. | 표적단백질에 결합하는 리간드(Warhead)와 E3 ligase 리간드(Binder)를 인위적으로 링커(linker)로 결합시킨 ‘이종 이중기능 분자’ (Heterobifunctional molecule). 분자량이 커 기존 약물과 다른 특성 지님. |
| 장점 | - 단백질-단백질 상호작용을 조절할 수 있어서, 다양한 생리적 기능 조절에 활용 가능하다. - 약물 개발에서 다양한 타겟 단백질에 대한 효과적인 표적화 가능성이 있다. - FDA승인된 치료제 사례 존재(레날리도마이드 2007년 사용 허가 다발성골수종) |
- 고도의 선택성으로 원하는 단백질을 표적으로 지정할 수 있다. - 낮은 농도에서도 효과적으로 작용할 수 있어, 약물의 효과를 증대시킬 수 있다. |
| 단점 | - 특정 단백질에 대한 선택성이 필요하며, 부작용이나 비특이적 효과가 발생할 수 있다. - 상업적으로 활용 가능한 MG를 개발하는 것이 기술적으로 어려울 수 있다. |
- 디자인된 PROTAC의 합성 및 최적화가 기술적으로 복잡할 수 있다. - 특정 조건에서는 프로테아소말 분해 기능이 제한될 수 있다 - 아직 임상 시험단계에 있다. |
| 주요 회사 | 누릭스, C4테라퓨틱스, 핀테라퓨틱스 등 | 아비나스, 키메라, 유빅스테라퓨틱스 등 |
| 출처: 소멸회사 제공 |
| [TPD경쟁사 현황] |
| 구분 | 회사명 | MG/PROTAC 여부 | 물질/기술명/플랫폼 | 타겟 | 적응증 | 개발단계 | 주요투자자 |
|---|---|---|---|---|---|---|---|
| 국내 | 오름테라퓨틱스 | DAC | ORM-5029 | GSPT1 (+ HER2 Ab) | 유방암 | 임상 1상 | KG인베스트먼트, 인터베스트, 프리미어파트너스 등 |
| ORM-6151 | GSPT1 (+ CD33 Ab) | 급성 골수성 백혈병 | 임상 1상 | ||||
| 유빅스테라퓨틱스 | PROTAC | UBX-303-1 | BTK | 혈액암 | 임상 1상 | 미래에셋벤처투자, 에이티넘인베스트먼트 등 | |
| UBX-103 | AR | 전립선암 | 전임상 | ||||
| 업테라 | PROTAC | UP1002 | PLK1 | 암 | 전임상 | IMM인베스트먼트, 메리츠증권 등 | |
| 핀테라퓨틱스 | MG & PROTAC | MG | CK1alpha | 암 | 전임상 | KG인베스트먼트, DSC인베스트먼트 등 | |
| 해외 | 아비나스 | PROTAC | ARV-471 | ER | 유방암 | 임상 3상 | Public company |
| ARV-766 | AR | 전립선암 | 임상 2상 | ||||
| 키메라 | PROTAC | KT-474 | IRAK4 | 아토피피부염 | 임상 2상 | ||
| KT-333 | STAT3 | 혈액암 | 임상 1상 | ||||
| 누릭스 | MG & PROTAC | NX-2127 | BTK + IKZF | 혈액암 | 임상 1상 | ||
| NX-5948 | BTK | 혈액암 | 임상 1상 | ||||
| C4테라퓨틱스 | MG & PROTAC | Cemsidomide | IKZF1/3 | 혈액암 | 임상 1상 | ||
| CFT1946 | BRAF V600 | BRAF V600E cancers | 임상 1상 |
| 출처: 소멸회사 제공 |
(후략)
(주1) 정정 후
소멸회사는 단백질 분해 기발 치료제 모델인 PROTAC(PROteolysis Targeting Chimera)의 한계 극복을 위해 차세대 기술인 bioPROTAC 기술을 개발하여 기존 치료제로 해결할 수 없는 의학적 미충족 수요를 충족 가능한 First in class 신약 개발을 목적으로 하고 있습니다.
소멸회사는 고유의 synthetic 라이브러리를 활용하여 신규 Nanobody(전통적 항체보다 작은 항체)를 자체적으로 발굴 가능하며, Yeast display 시스템과 High-throughput screening 시스템을 활용하여 TPD(표적단밸질 분해 기술)가 개선된 고유 engineered protein 확보가 가능합니다. 또한 First in calss 신약의 잠재력이 있는 10여개의 Novel target(기존에 연구되지 않은 새로운 표적)을 확보하고 있으며 bioPROTAC을 제작하기 위한 핵심기술을 내재화하고 있습니다.
해당 기술을 바탕으로 소멸회사는 암, 소뇌실조증, 아토피 피부염을 적응증으로 하는 파이프라인을 보유하고 있습니다. 소멸회사는 총 4개의 파이프라인을 보유하고 있으며 현재 발굴단계로 아직 전임상단계에 도달하지 못하였습니다. 소멸회사는 전임상단계 연구부터 기술이전 또는 공동연구로 개발을 진행 할 계획입니다.
EPD-301의 경우 Precision Nanosystems Inc과의 공동연구계약이 '23년 8월 체결되어 현재 전임상/임상개발을 위해 폐를 타겟으로 하는 LNP 선정이 완료되었으며향후 LNP 유효성 연구 확인 후 '24년 3Q내에 전임상 시료 생산 시작을 목표로 하고 있습니다. 아울러 '25년 말까지 IND 제출 완료를 목표로 하고 있으며 국내 임상 1상 자체 진행과 글로벌 기술이전을 병행할 계획이 있습니다.
EPD-401의 경우 최종 리드 후보 물질 선정을 위한 단백질체학 연구가 진행 중이며 선택성을 확인하여 최종 후보 물질 선정 계획에 있습니다. 선정된 물질로 '24년 4Q 생체 내 실험을 진행 후 '25년 내 전임상 단계 진입을 목표로 하고 있습니다.
EPD-201의 경우 진행이 보류된 상태로 향후 추가적인 연구 여부를 판단할 계획입니다.
EPD-501의 경우 일리미스테라퓨틱스와의 공동연구로 퇴행성 질환 치료제 개발 과제를 런칭하였습니다.
증권신고서 제출일 전일 기준 소멸회사의 파이프라인 현황 및 전임상단계 연구 계획은 다음과 같습니다.
| [소멸회사 파이프라인 현황] |
| 프로그램 | 타겟 | 적응증 | 발굴단계 | 전임상 | 임상 | 시판허가 | 비고 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구축물 합성 | 시험관 효능평가 | 작용 기전 연구 | 시험관 효능평가 | 1상 | 2상 | 3상 | ||||||
| EPD-301 | SOX2 | 암 | ||||||||||
| EPD-201 | ATXN1 | 1형 소뇌실조 | ||||||||||
| EPD-401 | STAT3 | 아토피 피부염 / 암 | ||||||||||
| EPD-501 | 미공개 | 퇴행성 뇌질환 | 공동개발(일리미스테라퓨틱스) | |||||||||
| 출처: 소멸회사 제공 |
SkyQuest Technology Report에 따르면 글로벌 TPD(표적단백질분해 기술) 시장은 '23~'30년까지 CAGR 26.4%로 성장할 것을 전망하고 있으며, '30년 33억달러 규모의 시장이 될 것으로 기대하고 있습니다.
| [글로벌 TPD 시장 전망 2023-2030] |
|
| 출처: SkyQuest Technology Report : Global Targeted Protein Degradation Market |
| [글로벌 TPD 시장 전망] |
|
| 출처: SkyQuest Technology Report : Global Targeted Protein Degradation Market |
우호적인 TPD관련 시장 전망에 따라 국내외 다수의 업체들이 R&D를 진행하고 있으며 TPD기술은 크게 MG와 PROTAC으로 구분됩니다.
MG와 PROTAC기술의 비교내용과 국내외 TPD 경쟁사 R&D현황은 다음과 같습니다.
| [MG/PROTAC 기술 비교표] |
| 구분 | MG | PROTAC |
| 정의 | 표적 단백질과 E3 ligase의 동시에 결합하는 물질이지만, PROTAC과 달리 단일 화학적 요소로 이루어진 경우가 대부분. E3 ligase에 결합한 분자 접착제가 표적 단백질에 결합하도록 유도 가능. | 표적단백질에 결합하는 리간드(Warhead)와 E3 ligase 리간드(Binder)를 인위적으로 링커(linker)로 결합시킨 ‘이종 이중기능 분자’ (Heterobifunctional molecule). 분자량이 커 기존 약물과 다른 특성 지님. |
| 장점 | - 단백질-단백질 상호작용을 조절할 수 있어서, 다양한 생리적 기능 조절에 활용 가능하다. - 약물 개발에서 다양한 타겟 단백질에 대한 효과적인 표적화 가능성이 있다. - FDA승인된 치료제 사례 존재(레날리도마이드 2007년 사용 허가 다발성골수종) |
- 고도의 선택성으로 원하는 단백질을 표적으로 지정할 수 있다. - 낮은 농도에서도 효과적으로 작용할 수 있어, 약물의 효과를 증대시킬 수 있다. |
| 단점 | - 특정 단백질에 대한 선택성이 필요하며, 부작용이나 비특이적 효과가 발생할 수 있다. - 상업적으로 활용 가능한 MG를 개발하는 것이 기술적으로 어려울 수 있다. |
- 디자인된 PROTAC의 합성 및 최적화가 기술적으로 복잡할 수 있다. - 특정 조건에서는 프로테아소말 분해 기능이 제한될 수 있다 - 아직 임상 시험단계에 있다. |
| 주요 회사 | 누릭스, C4테라퓨틱스, 핀테라퓨틱스 등 | 아비나스, 키메라, 유빅스테라퓨틱스 등 |
| 출처: 소멸회사 제공 |
| [TPD경쟁사 현황] |
| 구분 | 회사명 | 설립일 | MG/PROTAC 여부 | 물질/기술명/플랫폼 | 타겟 | 적응증 | 개발단계 | 주요투자자 |
|---|---|---|---|---|---|---|---|---|
| 국내 | 오름테라퓨틱스 | 2016년 | DAC | ORM-5029 | GSPT1 (+ HER2 Ab) | 유방암 | 임상 1상 | KG인베스트먼트, 인터베스트, 프리미어파트너스 등 |
| ORM-6151 | GSPT1 (+ CD33 Ab) | 급성 골수성 백혈병 | 임상 1상 | |||||
| 유빅스테라퓨틱스 | 2018년 | PROTAC | UBX-303-1 | BTK | 혈액암 | 임상 1상 | 미래에셋벤처투자, 에이티넘인베스트먼트 등 | |
| UBX-103 | AR | 전립선암 | 전임상 | |||||
| 업테라 | 2018년 | PROTAC | UP1002 | PLK1 | 암 | 전임상 | IMM인베스트먼트, 메리츠증권 등 | |
| 핀테라퓨틱스 | 2017년 | MG & PROTAC | MG | CK1alpha | 암 | 전임상 | KG인베스트먼트, DSC인베스트먼트 등 | |
| 해외 | 아비나스 | 2013년 | PROTAC | ARV-471 | ER | 유방암 | 임상 3상 | Public company |
| ARV-766 | AR | 전립선암 | 임상 2상 | |||||
| 키메라 | 2017년 | PROTAC | KT-474 | IRAK4 | 아토피피부염 | 임상 2상 | ||
| KT-333 | STAT3 | 혈액암 | 임상 1상 | |||||
| 누릭스 | 2009년 | MG & PROTAC | NX-2127 | BTK + IKZF | 혈액암 | 임상 1상 | ||
| NX-5948 | BTK | 혈액암 | 임상 1상 | |||||
| C4테라퓨틱스 | 2016년 | MG & PROTAC | Cemsidomide | IKZF1/3 | 혈액암 | 임상 1상 | ||
| CFT1946 | BRAF V600 | BRAF V600E cancers | 임상 1상 |
TPD 의약품은 재발성·불응성 암 환자에 대한 강력한 대안이 될 것이라는 점에서 전통적인 저분자화합물 저해제 시장을 대체하며 ADC와 유사하게 성장할 것으로 전망되고 있으나, 아직 상용화된 신약이 없는 까닭에 TPD 의약품의 시장규모를 파악하기는 쉽지 않습니다.
한편, 최근 TPD 기술 관련한 국내 경쟁사의 연구개발, 상용화 움직임은 다음과 같습니다. 지난 7월 16일 오름테라퓨틱스는 미국 제약사인 버텍스 파마슈티컬과 TPD 기술인 이중 정밀 표적 단백질 분해 기술을 수출하는 계약을 체결하였다고 발표하였습니다. 계약은 선급금 1,500만 달러와 최대 3개 타겟에 대해 각각 최대 3억 1,000만 달러의 추가 옵션 및 마일스톤으로 이루어져 있습니다. 해당 계약을 통해 버텍스는 오름테라퓨틱스의 TPD 기술을 활용해, 유전자편집 치료제의 새로운 전처치제(본격적인 치료 전에 체내 환경을 최적화하고 치료 효과를 높이는 약제)를 발굴하기 위한 연구권한을 보유하게 되었습니다. 또한, 유빅스테라퓨틱스는 지난 7월 1일 TPD 전립선암 치료제 후보물질 UBX-103의 글로벌 개발 권리를 계약금 50억원 포함 총 1,500억원에 유한양행에 이전하는 기술이전 계약을 체결하였다고 발표하였습니다. UBX-103은 전임상 단계 진행 중으로, 2025년 상반기까지 임상 1상 임상시험계획(IND) 승인을 목표로 비임상 연구가 진행되고 있습니다.
이처럼, 상기와 같이 TPD 의약품 시장선점을 위한 글로벌 경쟁이 가속화 되고 있는 환경 속에서 TPD 경쟁사들 대비 설립시점이 늦은 후발주자인 소멸회사의 임상연구 계획이 예정대로 진행될지, 그 성과가 실질적인 상용화에 부합할지 여부에 대해서도 현재 시점에 확정되지 않았다는 점을 투자자께서는 유의하시기 바랍니다.
(후략)
(주2) 정정 전
(전략)
| [
존속회사의 상장 이후 조달한 자금 현황]
|
| 발행일
|
종류
|
사용용도
|
금액 (백만원) |
주당 발행 /전환가(원) |
자금사용목적
|
실제 자금사용 용도
|
배정대상자
|
| 2011-10-05 | 유상증자(제3자배정 보통주) |
기타자금 |
5,000 | 12,350 | 일본 기업과의 전략적 제휴 |
연구개발 자금 |
나우일본테크놀로지투자펀드 1호 |
| 2012-10-26 | 유상증자(제3자배정 보통주) |
운영자금 |
16,326 | 14,050 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
| 2012-10-26 | 제3회 사모전환사채 |
시설자금 |
1,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
| 운영자금 |
1,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 타법인증권취득자금 |
4,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 기타자금 |
10,650 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 2014-04-15 | 제4회 사모전환사채 |
운영자금 |
7,000 | 30,750 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
인터베스트글로벌제약펀드 |
| 2014-08-25 | 유상증자(제3자배정 전환우선주) |
운영자금 |
3,031 | 43,050 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
State Good Group Limited |
| 2014-10-30 | 유상증자(제3자배정 전환우선주) |
운영자금 |
50,001 | 45,700 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
파이안제2호 유한회사 등 |
| 2015-12-03 | 유상증자(제3자배정 전환우선주) |
운영자금 |
20,000 | 81,800 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
유한양행 |
| 2016-07-15 | 유상증자(제3자배정 전환우선주) |
운영자금 |
59,999 | 51,500 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
삼성증권 등 |
| 2016-07-08 | 제5회 사모전환사채 |
운영자금 |
19,990 | 58,406 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
Tasly (Hong Kong) pharmaceuticals Ltd. 등
|
| 2018-05-18 | 유상증자(제3자배정 전환우선주) |
운영자금 |
139,999 | 90,100 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
유한양행 등 |
| 타법인증권취득자금 |
60,000 | 90,100 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
유한양행 등 |
||
| 2018-05-18 | 제6회 사모전환사채 |
운영자금 |
50,000 | 102,680 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
키움프라이빗에쿼티 등 |
| 2020-12-17 | 제7회 사모전환사채 |
타법인증권취득자금 |
20,000 | 140,950 | 타법인 증권 취득자금 |
툴젠 지분인수 |
유한양행 |
| 2020-12-21 | 유상증자(제3자배정 보통주) |
타법인증권취득자금 |
58,524 | 136,400 | 타법인 증권 취득자금 |
툴젠 지분인수 |
김진수 등 |
| 2023-01-10 | 유상증자(주주배정후 실권주 일반공모) |
운영자금 |
85,217 | 14,700 | 기술개발 등 |
연구개발 자금 |
주주배정 후 실권주 일반공모 |
| 합계 |
611,737 | ||||||
| 출처: 존속회사 자체 자료 |
소멸회사는 2021년 설립 이후 2021년 08월 27일~2021년 10월 08일 5회에 걸친 유상증자 6억원(제3자배정 전환우선주), 2022년 03월 29일 유상증자 25억원(제3자배정 상환전환우선주), 2022년 06월 27일 유상증자 18억원(제3자배정 상환전환우선주)을 통해 자금을 조달하였습니다. 소멸회사가 설립 이후 조달한 자금 현황은 다음과 같습니다.
소멸회사는 설립 이후, 아래와 같이 자금을 조달하였으며, 투자 시점 별 주요 연구성과는 다음과 같습니다.
| 구분 | 주요 연구성과 |
|---|---|
| 2021.08~ | 회사 설립(창업자 및 연구 개발진 구성)을 통한 연구개발 환경 마련, 주요 경영진 및 연구 개발진의 경력 및 향후 연구 개발 계획 등을 고려한 투자 유치 진행 |
| 2022.06~ |
1. 바이오프로탁 신규 플랫폼에 대한 In Vivo POC 검증
- A549 (폐암), BxPC3 (췌장암) xenograft models에서 SOX2 degrader의 항암 효능 확인
2. 전임상 단계 진입할 후보물질 확보 (EPD-301) / 후속 파이프라인 lead candidates 도출 (EPD-401)
- EPD-301: 1) 총 9종의 암세포주에서 apoptosis 유도에 의한 암세포주 사멸 효과 확인 (GI50: < 1 nM)
2) Ubiquitination & Proteasome dependent SOX2 degradation, SOX2-dependent efficacy 등 기본적인 MoA 확인
3) 2종의 암세포주 xenograft models에서 In Vivo 효능까지 확인
4) 전임상/임상 단계 개발에 사용할 LNP 후보 도출 완료
- EPD-401: 기존 저분자화합물 STAT3 PROTAC보다 더 potent한 bioPROTAC lead candidates 도출
3. 3종의 E3 proteins에 대한 Engineering 완료
- SKP2 mutant 1종 (SKP-E2)이 WT대비 월등히 개선된 STAT3 분해능을 보임을 확인
1) 전임상 단계 개발 또는 2) 신규 과제 런칭 위한 타사와의 Partnership 관계 확립
- Lung targeted delivery 가능한 LNP 확보 협력: Precision Nanosystems Inc.
- 단백질 형태로의 bioPROTAC 개발 협력 (STAT3 program): 제넥신
- 신규 CNS 과제 공동연구: I社
4. 특허 4건 출원
- SOX2 특이적으로 결합하는 단일 도메인 항체, 이를 포함하는 융합단백질 및 이의 용도 (출원번호: 10-2023-0158319)
- STAT3 특이적으로 결합하는 단일 도메인 항체, 이를 포함하는 융합단백질 및 이의 용도 (출원번호: 10-2023-0097975)
- βTrCP 단편 및 이의 변이체, 및 이의 용도 (출원번호: 10-2023-0097974)
- SKP2 단편 및 이의 변이체, 및 이의 용도 (출원번호: 10-2023-0097976)
|
| [
소멸회사의 설립 이후 조달한 자금 현황]
|
| 발행일
|
종류
|
사용 용도 |
금액(백만원)
|
발행가(원)
|
희석 발행가 (무상증자 고려) |
주2)의 ①, ②에 해당하는 |
| 2021-08-27 | 유상증자 (제3자배정 전환우선주) |
미정 |
300 | 659,091 | 6,591 |
X |
| 2021-09-30 | 100 | 659,091 | 6,591 |
X | ||
| 2021-09-30 | 40 | 659,091 | 6,591 |
X | ||
| 2021-09-30 | 60 | 659,091 | 6,591 |
X | ||
| 2021-10-08 | 100 | 659,091 | 6,591 |
X | ||
| 2022-03-29 | 유상증자 (제3자배정 상환전환우선주) |
1,501 | 2,769,300 | 27,693 |
X | |
| 2022-03-29 | 1,002 | 2,769,300 | 27,693 |
X | ||
| 2022-03-29 | 17 | 2,769,300 | 27,693 |
X | ||
| 2022-03-29 | 17 | 2,769,300 | 27,693 |
X | ||
| 2022-06-27 | 346 | 2,769,300 | 27,693 |
X | ||
| 2022-06-27 | 1,501 | 2,769,300 | 27,693 |
X | ||
| 2024-04-30 | 500 | 33,876 | 33,876 | X |
||
| 합계 |
4,984 | |||||
| 출처: 소멸회사 자체 자료 |
| 주1) 2022년 09월 21일 기준, 1 : 10 무상증자를 진행하였고, 2022년 10월 21일 기준 1: 10 주식분할을 진행하였습니다. |
|
주2) 외부기관평가는 크게 3가지로 분류됨. ① 재무제표 표시를 위한 기업가치평가 → 외부감사법 적용 - 금융감독원(상장사)과 한국공인회계사회(비상장사) 감리 등을 통해 관리·감독되고 있음
② 합병, 중요 자산의 양수도 가액 등의 적정성을 검토하기 위해 수행되는 의무적 기업가치 평가 →
자본시장법 적용(- 자본시장법령은 투자자 보호 등을 위해 일부 합병의 경우 기업으로 하여금 외부평가기관으로부터 합병가액 등이 적정한지에 대한 평가를 받고 그 평가결과를 공개하도록 규정하고 있음)
③ 그 外에 회사가 기업 내부 참고 목적으로 임의로 수행하는 기업가치 평가로, 평가결과를 사적 계약에 따라 당사자에게만 제공하는 경우 평가방법론에 대한 규율이 없음 |
소멸회사가 가장 최근에 투자를 유치한 시점은 2024년 4월 30일 이며, 주당 발행가는 33,876원이었습니다. 한편, 본건 합병을 위한 피합병법인의 합병가액은 40,512원으로, 최근 투자 유치 시점 대비 2개월여 지나지 않은 시점에 피합병회사의 1주당 발행가가 약 19.6% 가량 할증되었다고 분석할 수 있습니다. 피합병법인이 영위하는 업종 특성과 초기 개발단계에 있는 파이프라인 특성 상, 투자 시점마다의 연구성과가 명확하게 합리적으로 측정되거나 계산, 판단되는데에는 한계가 존재합니다. 다만, 본건 합병의 경우 피합병회사 기 발행 지분 100%를 합병존속회사가 취득 및 법인격을 합병하는 방식으로 진행될 예정인 점을 고려하였을 때, 가장 최근의 투자유치 가격을 기준으로 약 20% 수준의 경영권 프리미엄을 가산한 가치를 양 합병당사회사간의 합의된 가격으로 설정하였습니다. 한 편, 본 건 합병을 위해 산정된 피합병회사의 합병가액 및 피합병회사의 종전 투자내역을 바탕으로 한 피합병회사의 기업가치는 절대적으로 합리적인 방식으로 계산, 산정되었다고 판단할 수 없을뿐더러, 본 건 합병을 통해 양 당사회사 간에 예상, 계획하고 있는 합병의 효과가 십분 발행될 것이라는 확신 역시 할 수 없습니다. 이 점 투자자께서는 유의하시기 바랍니다.
존속회사와 소멸회사의 경우 바이오의약품 기업 특성 상 합병 후에도 추가적인 자금조달 가능성을 배제할 수 없습니다. 존속회사와 소멸회사의 추가 자금조달 필요성이 지속될 경우 존속회사와 소멸회사의 자금 유동성이 크게 악화될 수 있고 추가적인 자금조달을 진행할 수 있으며, 반복적인 유상증자 및 주식연계채권 발행으로 주주가치가 심각하게 훼손될 수 있으니 투자자께서는 이 점 각별히 유의하시기 바랍니다.
한편, 존속회사와 소멸회사는 조달한 자금을 계획했던 자금의 사용목적과 사업 계획에 따라 적절한 시점에 자금을 집행하기 위해 노력하였으나, 존속회사가 2023년 01월 10일 실시한 주주배정후 실권주 일반공모 유상증자를 통해 유입된 공모자금이 증권신고서상 작성한 자금사용목적과 일부 다르게 사용된 사례가 존재합니다. 유상증자 당시 자금사용목적의 우선순위 1순위로 약 347억원을 GX-188E 자궁경부암 임상비용으로 지출 계획하였으나, 유상증자 이후 MSD社의 키트루다가 자궁경부암 1차 치료제로 허가를 받으면서, 자궁경부암 2차 치료제 시장의 성장성이 낮아짐에 따라 GX-188E 임상에 사용하기로 했던 자금계획을 다른 적응증의 임상에 투자하기로 개발전략을 수정하였습니다. 현재까지 존속회사는 주주배정후 실권주 일반공모 유상증자를 통해 조달한 845억원 중 2024년 1분기 기준 약 293억원을 지출하였으며, 구체적으로는 GX-188E 77억원, GX-E4 44억원, GX-H9 61억원, GX-I7 63억원 등에 자금을 사용하였습니다.
존속회사는 공모자금이 보다 효율적으로 사용되기 위해 자금사용목적과 달리 사용하고자 하는 경우 자금사용목적을 변경하는 이유에 대해 내부품의를 거쳐 승인된 경우에 한해 자금사용목적을 변경하고 있으며, 중대한 사안일 경우에는 이사회결의를 통해 제한함으로써 자금사용목적을 변경할 계획입니다. 이 부분에 대해서는 정기보고서 제출시 마다 공모자금의 사용 내역에 자금사용목적 변경에 대한 전후 상황 및 자금사용 용도에 대해 상세히 기재할 것이며, 보다 철저히 관리해 나갈 예정입니다. 또한 공모를 통해 조달된 자금은 각 용도별로 통장을 마련하여 해당 용도에 대해서만 자금이 집행될 수 있도록 별도의 공모 자금 집행 프로세스를 마련하여 통제할 계획입니다. 이러한 발생상황을 정기보고서 제출시 마다 계속적으로 업데이트할 예정이나, 위와 같이 별도의 통장 및 통제 프로세스에도 불구하고 내부통제 절차가 제대로 작동하지 않을 경우 공모자금이 당초 목적에 부합되지 않게 사용되고 이는 회사가 외부에서 자금을 조달하는데 불리하게 작용될 수 있기에 투자자께서는 이 점 유의하시기 바랍니다. 또한, 과거 자금사용내역처럼 보다 더 효율적으로 투자해야할 상황이 발생한다면 기존의 자금사용목적에서 일부 변경될 소지가 있으니 투자자께서는 이 점 유의하여주시기 바랍니다.
존속회사와 소멸회사는 합병 이후, 파이프라인 연구개발과 임상시험 등에 있어 시너지 효과가 발생할 것으로 기대하고 있으며, 합병 후 자금조달 계획(유상증자 및 채무증권 발행 등)은 증권신고서 제출 시점 기준 계획된 바 없습니다. 향후 관련 자금조달 계획이 구체화되어 결정되는 때, 전자공시 등을 통해 성실히 안내드릴 예정입니다.
한편, 존속회사는 글로벌 R&D 프로젝트 수행 및 마곡 내 첨단 클러스터 간 시너지 창출을 위해 아래와 같이 신규 시설투자를 계획하고 있습니다.
신규 시설투자 등(2023.6.28)
| 1. 투자구분 |
제넥신 컨소시엄 R&D센터 신규시설투자
|
|
| 2. 투자내역 |
투자금액(원)
|
29,420,000,000 |
| 자기자본(원)
|
280,907,962,296 |
|
| 자기자본대비(%)
|
10.47 |
|
| 대규모법인여부 |
미해당 |
|
| 3. 투자목적 |
글로벌 R&D 프로젝트 수행 및 마곡 내 첨단 클러스터간 시너지 창출
|
|
| 4. 투자기간 |
시작일 |
2023-07-12 |
| 종료일 |
2026-02-11 |
|
| 5. 이사회결의일(결정일)
|
2023-06-28 |
|
| -사외이사 참석여부 |
참석(명)
|
2 |
| 불참(명)
|
0 |
|
| 6. 감사(감사위원) 참석여부
|
참석 |
|
| 7. 공시유보 관련내용 |
유보사유 |
- |
| 유보기한 |
- |
|
| 8. 기타 투자판단에 참고할 사항 |
1. 상기 기재된 자기자본은 한국채택국제회계기준(K-IFRS)에 따라 작성된 2022년말 재무제표 금액입니다. 2. 본 건은 마곡 도시개발사업지구단위 계획구역 내 당사 외 2개사가 컨소시엄의 형태로 참여하며 당사의 지분비율은 28%에 해당합니다. 3. 시설 소재지:서울특별시 강서구 마곡동 762-3번지 4. 상기 투자내역의 투자금액은 순수 건물 건설비용으로 설계, 감리, 소방설비, 전산설비 등의 비용은 포함되지 않았습니다. 5. 투자기간의 시작일과 종료일은 공사의 시작일 및 투자계획상 완공 예정일을 기재 하였습니다. 6. 상기 투자금액과 기간은 경영환경 및 건축사정에 따라 변동될 수 있습니다. |
|
상기 시설투자에 필요한 자금은 현재까지 당사 자체 보유 현금으로 지급되었으며, 추가로 필요한 자금 규모 및 투자자금의 전체 조달구조는 아래와 같습니다.
[제넥신 컨소시엄 R&D센터 신규시설투자 개요]
| 총 투자금액 | 총 투자금액(취득액) 산정 근거 | 2024년 6월말 기준 집행 완료 금액 |
향후 집행 예정 금액 |
향후 집행 예정 금액의 조달 재원 |
|---|---|---|---|---|
| 29,420,000,000원 |
투자금액은 순수 건물 건설비용 (설계, 감리, 소방설비, 전산설비 등의 비용은 미포함)
|
7,116,200,000원
|
22,303,800,000원
|
차입(은행 시설대 등) 마곡컨소시엄제일차를 통한 차입 진행 |
(주2) 정정 후
(전략)
| [
존속회사의 상장 이후 조달한 자금 현황]
|
| 발행일
|
종류
|
사용용도
|
금액 (백만원) |
주당 발행 /전환가(원) |
자금사용목적
|
실제 자금사용 용도
|
배정대상자
|
| 2011-10-05 | 유상증자(제3자배정 보통주) |
기타자금 |
5,000 | 12,350 | 일본 기업과의 전략적 제휴 |
연구개발 자금 |
나우일본테크놀로지투자펀드 1호 |
| 2012-10-26 | 유상증자(제3자배정 보통주) |
운영자금 |
16,326 | 14,050 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
| 2012-10-26 | 제3회 사모전환사채 |
시설자금 |
1,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
| 운영자금 |
1,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 타법인증권취득자금 |
4,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 기타자금 |
10,650 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 2014-04-15 | 제4회 사모전환사채 |
운영자금 |
7,000 | 30,750 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
인터베스트글로벌제약펀드 |
| 2014-08-25 | 유상증자(제3자배정 전환우선주) |
운영자금 |
3,031 | 43,050 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
State Good Group Limited |
| 2014-10-30 | 유상증자(제3자배정 전환우선주) |
운영자금 |
50,001 | 45,700 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
파이안제2호 유한회사 등 |
| 2015-12-03 | 유상증자(제3자배정 전환우선주) |
운영자금 |
20,000 | 81,800 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
유한양행 |
| 2016-07-15 | 유상증자(제3자배정 전환우선주) |
운영자금 |
59,999 | 51,500 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
삼성증권 등 |
| 2016-07-08 | 제5회 사모전환사채 |
운영자금 |
19,990 | 58,406 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
Tasly (Hong Kong) pharmaceuticals Ltd. 등
|
| 2018-05-18 | 유상증자(제3자배정 전환우선주) |
운영자금 |
139,999 | 90,100 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
유한양행 등 |
| 타법인증권취득자금 |
60,000 | 90,100 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
유한양행 등 |
||
| 2018-05-18 | 제6회 사모전환사채 |
운영자금 |
50,000 | 102,680 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
키움프라이빗에쿼티 등 |
| 2020-12-17 | 제7회 사모전환사채 |
타법인증권취득자금 |
20,000 | 140,950 | 타법인 증권 취득자금 |
툴젠 지분인수 |
유한양행 |
| 2020-12-21 | 유상증자(제3자배정 보통주) |
타법인증권취득자금 |
58,524 | 136,400 | 타법인 증권 취득자금 |
툴젠 지분인수 |
김진수 등 |
| 2023-01-10 | 유상증자(주주배정후 실권주 일반공모) |
운영자금 |
85,217 | 14,700 | 기술개발 등 |
연구개발 자금 |
주주배정 후 실권주 일반공모 |
| 합계 |
611,737 | ||||||
| 출처: 존속회사 자체 자료 |
소멸회사는 2021년 설립 이후 2021년 08월 27일~2021년 10월 08일 5회에 걸친 유상증자 6억원(제3자배정 전환우선주), 2022년 03월 29일 유상증자 25억원(제3자배정 상환전환우선주), 2022년 06월 27일 유상증자 18억원(제3자배정 상환전환우선주)을 통해 자금을 조달하였습니다. 소멸회사가 설립 이후 조달한 자금 현황은 다음과 같습니다.
소멸회사는 설립 이후, 아래와 같이 자금을 조달하였으며, 투자 시점 별 주요 연구성과는 다음과 같습니다.
| 구분 | 주요 연구성과 |
|---|---|
| 2021.08~ | 회사 설립(창업자 및 연구 개발진 구성)을 통한 연구개발 환경 마련, 주요 경영진 및 연구 개발진의 경력 및 향후 연구 개발 계획 등을 고려한 투자 유치 진행 |
| 2022.06~ |
1. 바이오프로탁 신규 플랫폼에 대한 In Vivo POC 검증
- A549 (폐암), BxPC3 (췌장암) xenograft models에서 SOX2 degrader의 항암 효능 확인
2. 전임상 단계 진입할 후보물질 확보 (EPD-301) / 후속 파이프라인 lead candidates 도출 (EPD-401)
- EPD-301: 1) 총 9종의 암세포주에서 apoptosis 유도에 의한 암세포주 사멸 효과 확인 (GI50: < 1 nM)
2) Ubiquitination & Proteasome dependent SOX2 degradation, SOX2-dependent efficacy 등 기본적인 MoA 확인
3) 2종의 암세포주 xenograft models에서 In Vivo 효능까지 확인
4) 전임상/임상 단계 개발에 사용할 LNP 후보 도출 완료
- EPD-401: 기존 저분자화합물 STAT3 PROTAC보다 더 potent한 bioPROTAC lead candidates 도출
3. 3종의 E3 proteins에 대한 Engineering 완료
- SKP2 mutant 1종 (SKP-E2)이 WT대비 월등히 개선된 STAT3 분해능을 보임을 확인
1) 전임상 단계 개발 또는 2) 신규 과제 런칭 위한 타사와의 Partnership 관계 확립
- Lung targeted delivery 가능한 LNP 확보 협력: Precision Nanosystems Inc.
- 단백질 형태로의 bioPROTAC 개발 협력 (STAT3 program): 제넥신
- 신규 CNS 과제 공동연구: I社
4. 특허 4건 출원
- SOX2 특이적으로 결합하는 단일 도메인 항체, 이를 포함하는 융합단백질 및 이의 용도 (출원번호: 10-2023-0158319)
- STAT3 특이적으로 결합하는 단일 도메인 항체, 이를 포함하는 융합단백질 및 이의 용도 (출원번호: 10-2023-0097975)
- βTrCP 단편 및 이의 변이체, 및 이의 용도 (출원번호: 10-2023-0097974)
- SKP2 단편 및 이의 변이체, 및 이의 용도 (출원번호: 10-2023-0097976)
|
| [
소멸회사의 설립 이후 조달한 자금 현황]
|
| 발행일
|
종류
|
사용 용도 |
금액(백만원)
|
발행가(원)
|
희석 발행가 (무상증자 고려) |
주2)의 ①, ②에 해당하는 |
| 2021-08-27 | 유상증자 (제3자배정 전환우선주) |
미정 |
300 | 659,091 | 6,591 |
X |
| 2021-09-30 | 100 | 659,091 | 6,591 |
X | ||
| 2021-09-30 | 40 | 659,091 | 6,591 |
X | ||
| 2021-09-30 | 60 | 659,091 | 6,591 |
X | ||
| 2021-10-08 | 100 | 659,091 | 6,591 |
X | ||
| 2022-03-29 | 유상증자 (제3자배정 상환전환우선주) |
1,501 | 2,769,300 | 27,693 |
X | |
| 2022-03-29 | 1,002 | 2,769,300 | 27,693 |
X | ||
| 2022-03-29 | 17 | 2,769,300 | 27,693 |
X | ||
| 2022-03-29 | 17 | 2,769,300 | 27,693 |
X | ||
| 2022-06-27 | 346 | 2,769,300 | 27,693 |
X | ||
| 2022-06-27 | 1,501 | 2,769,300 | 27,693 |
X | ||
| 2024-04-30 | 500 | 33,876 | 33,876 | X |
||
| 합계 |
4,984 | |||||
| 출처: 소멸회사 자체 자료 |
| 주1) 2022년 09월 21일 기준, 1 : 10 무상증자를 진행하였고, 2022년 10월 21일 기준 1: 10 주식분할을 진행하였습니다. |
|
주2) 외부기관평가는 크게 3가지로 분류됨. ① 재무제표 표시를 위한 기업가치평가 → 외부감사법 적용 - 금융감독원(상장사)과 한국공인회계사회(비상장사) 감리 등을 통해 관리·감독되고 있음
② 합병, 중요 자산의 양수도 가액 등의 적정성을 검토하기 위해 수행되는 의무적 기업가치 평가 →
자본시장법 적용(- 자본시장법령은 투자자 보호 등을 위해 일부 합병의 경우 기업으로 하여금 외부평가기관으로부터 합병가액 등이 적정한지에 대한 평가를 받고 그 평가결과를 공개하도록 규정하고 있음)
③ 그 外에 회사가 기업 내부 참고 목적으로 임의로 수행하는 기업가치 평가로, 평가결과를 사적 계약에 따라 당사자에게만 제공하는 경우 평가방법론에 대한 규율이 없음 |
소멸회사가 가장 최근에 투자를 유치한 시점은 2024년 4월 30일 이며, 주당 발행가는 33,876원이었습니다. 한편, 본건 합병을 위한 피합병법인의 합병가액은 40,512원으로, 최근 투자 유치 시점 대비 2개월여 지나지 않은 시점에 특별한 연구성과의 도출 등 기업가치 제고에 영향을 미치는 이벤트가 발생하지 않았음에도 피합병회사의 1주당 발행가가 약 19.6% 가량 할증되었다고 분석할 수 있습니다.
피합병법인이 영위하는 업종 특성과 초기 개발단계에 있는 파이프라인 특성 상, 투자 시점마다의 연구성과가 명확하게 합리적으로 측정되거나 계산, 판단되는데에는 한계가 존재합니다. 더욱이 소멸회사의 타겟하고 있는 주요 기술이 상용화된 기술이 아니고, 기술 개발과 상용화에 장기간이 소요될 수 있는 가능성이 높다는 부분에서 합리적이고 계량적인 방법으로의 가치 평가와 판단에 제약사항이 존재하고 있습니다.
다만, 본건 합병의 경우 피합병회사 기 발행 지분 100%를 합병존속회사가 취득 및 법인격을 합병하는 방식으로 진행될 예정인 점을 고려하였을 때, 가장 최근의 투자유치 가격을 기준으로 약 20% 수준의 경영권 프리미엄을 가산한 가치를 양 합병당사회사간의 합의된 가격으로 설정하였습니다. 이는 소멸회사의 설립 이후 자금조달 내역과 마찬가지로, 소멸회사의 타겟 기술이 향후 상용화될 가능성 등을 담보하거나 정교하고 합리적으로 추정되었음을 증빙하는 것이 아님에 유의할 필요가 있습니다.
한 편, 본 건 합병을 위해 산정된 피합병회사의 합병가액 및 피합병회사의 종전 투자내역을 바탕으로 한 피합병회사의 기업가치는 절대적으로 합리적인 방식으로 계산, 산정되었다고 판단할 수 없을뿐더러, 본 건 합병을 통해 양 당사회사 간에 예상, 계획하고 있는 합병의 효과가 십분 발행될 것이라는 확신 역시 할 수 없습니다. 이 점 투자자께서는 유의하시기 바랍니다.
존속회사와 소멸회사의 경우 바이오의약품 기업 특성 상 합병 후에도 추가적인 자금조달 가능성을 배제할 수 없습니다. 존속회사와 소멸회사의 추가 자금조달 필요성이 지속될 경우 존속회사와 소멸회사의 자금 유동성이 크게 악화될 수 있고 추가적인 자금조달을 진행할 수 있으며, 반복적인 유상증자 및 주식연계채권 발행으로 주주가치가 심각하게 훼손될 수 있으니 투자자께서는 이 점 각별히 유의하시기 바랍니다.
한편, 존속회사와 소멸회사는 조달한 자금을 계획했던 자금의 사용목적과 사업 계획에 따라 적절한 시점에 자금을 집행하기 위해 노력하였으나, 존속회사가 2023년 01월 10일 실시한 주주배정후 실권주 일반공모 유상증자를 통해 유입된 공모자금이 증권신고서상 작성한 자금사용목적과 일부 다르게 사용된 사례가 존재합니다. 유상증자 당시 자금사용목적의 우선순위 1순위로 약 347억원을 GX-188E 자궁경부암 임상비용으로 지출 계획하였으나, 유상증자 이후 MSD社의 키트루다가 자궁경부암 1차 치료제로 허가를 받으면서, 자궁경부암 2차 치료제 시장의 성장성이 낮아짐에 따라 GX-188E 임상에 사용하기로 했던 자금계획을 다른 적응증의 임상에 투자하기로 개발전략을 수정하였습니다. 현재까지 존속회사는 주주배정후 실권주 일반공모 유상증자를 통해 조달한 845억원 중 2024년 1분기 기준 약 293억원을 지출하였으며, 구체적으로는 GX-188E 77억원, GX-E4 44억원, GX-H9 61억원, GX-I7 63억원 등에 자금을 사용하였습니다.
존속회사는 공모자금이 보다 효율적으로 사용되기 위해 자금사용목적과 달리 사용하고자 하는 경우 자금사용목적을 변경하는 이유에 대해 내부품의를 거쳐 승인된 경우에 한해 자금사용목적을 변경하고 있으며, 중대한 사안일 경우에는 이사회결의를 통해 제한함으로써 자금사용목적을 변경할 계획입니다. 이 부분에 대해서는 정기보고서 제출시 마다 공모자금의 사용 내역에 자금사용목적 변경에 대한 전후 상황 및 자금사용 용도에 대해 상세히 기재할 것이며, 보다 철저히 관리해 나갈 예정입니다. 또한 공모를 통해 조달된 자금은 각 용도별로 통장을 마련하여 해당 용도에 대해서만 자금이 집행될 수 있도록 별도의 공모 자금 집행 프로세스를 마련하여 통제할 계획입니다. 이러한 발생상황을 정기보고서 제출시 마다 계속적으로 업데이트할 예정이나, 위와 같이 별도의 통장 및 통제 프로세스에도 불구하고 내부통제 절차가 제대로 작동하지 않을 경우 공모자금이 당초 목적에 부합되지 않게 사용되고 이는 회사가 외부에서 자금을 조달하는데 불리하게 작용될 수 있기에 투자자께서는 이 점 유의하시기 바랍니다. 또한, 과거 자금사용내역처럼 보다 더 효율적으로 투자해야할 상황이 발생한다면 기존의 자금사용목적에서 일부 변경될 소지가 있으니 투자자께서는 이 점 유의하여주시기 바랍니다.
존속회사와 소멸회사는 합병 이후, 파이프라인 연구개발과 임상시험 등에 있어 시너지 효과가 발생할 것으로 기대하고 있으며, 합병 후 자금조달 계획(유상증자 및 채무증권 발행 등)은 증권신고서 제출 시점 기준 계획된 바 없습니다. 향후 관련 자금조달 계획이 구체화되어 결정되는 때, 전자공시 등을 통해 성실히 안내드릴 예정입니다.
한편, 존속회사는 글로벌 R&D 프로젝트 수행 및 마곡 내 첨단 클러스터 간 시너지 창출을 위해 아래와 같이 신규 시설투자를 계획하고 있습니다.
신규 시설투자 등(2023.6.28)
| 1. 투자구분 |
제넥신 컨소시엄 R&D센터 신규시설투자
|
|
| 2. 투자내역 |
투자금액(원)
|
29,420,000,000 |
| 자기자본(원)
|
280,907,962,296 |
|
| 자기자본대비(%)
|
10.47 |
|
| 대규모법인여부 |
미해당 |
|
| 3. 투자목적 |
글로벌 R&D 프로젝트 수행 및 마곡 내 첨단 클러스터간 시너지 창출
|
|
| 4. 투자기간 |
시작일 |
2023-07-12 |
| 종료일 |
2026-02-11 |
|
| 5. 이사회결의일(결정일)
|
2023-06-28 |
|
| -사외이사 참석여부 |
참석(명)
|
2 |
| 불참(명)
|
0 |
|
| 6. 감사(감사위원) 참석여부
|
참석 |
|
| 7. 공시유보 관련내용 |
유보사유 |
- |
| 유보기한 |
- |
|
| 8. 기타 투자판단에 참고할 사항 |
1. 상기 기재된 자기자본은 한국채택국제회계기준(K-IFRS)에 따라 작성된 2022년말 재무제표 금액입니다. 2. 본 건은 마곡 도시개발사업지구단위 계획구역 내 당사 외 2개사가 컨소시엄의 형태로 참여하며 당사의 지분비율은 28%에 해당합니다. 3. 시설 소재지:서울특별시 강서구 마곡동 762-3번지 4. 상기 투자내역의 투자금액은 순수 건물 건설비용으로 설계, 감리, 소방설비, 전산설비 등의 비용은 포함되지 않았습니다. 5. 투자기간의 시작일과 종료일은 공사의 시작일 및 투자계획상 완공 예정일을 기재 하였습니다. 6. 상기 투자금액과 기간은 경영환경 및 건축사정에 따라 변동될 수 있습니다. |
|
상기 시설투자에 필요한 자금은 현재까지 당사 자체 보유 현금으로 지급되었으며, 추가로 필요한 자금 규모 및 투자자금의 전체 조달구조는 아래와 같습니다.
[제넥신 컨소시엄 R&D센터 신규시설투자 개요]
| 총 투자금액 | 총 투자금액(취득액) 산정 근거 | 2024년 6월말 기준 집행 완료 금액 |
향후 집행 예정 금액 |
향후 집행 예정 금액의 조달 재원 |
|---|---|---|---|---|
| 29,420,000,000원 |
투자금액은 순수 건물 건설비용 (설계, 감리, 소방설비, 전산설비 등의 비용은 미포함)
|
7,116,200,000원
|
22,303,800,000원
|
차입(은행 시설대 등) 마곡컨소시엄제일차를 통한 차입 진행 |
【 대표이사 등의 확인 】
 |
|
대표이사등의 확인_240726 |
증 권 신 고 서
| ( 합 병 ) | |
| 금융위원회 귀중 | 2024년 07월 26일 |
| 회 사 명 : |
(주)제넥신 |
| 대 표 이 사 : |
홍 성 준 |
| 본 점 소 재 지 : |
서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크 |
| (전 화) 02-6098-2600 | |
| (홈페이지) http://www.genexine.com | |
| 작 성 책 임 자 : | (직 책) CEO (성 명) 홍 성 준 |
| (전 화) 02-6098-2600 | |
| 모집 또는 매출 증권의 종류 및 수 : | (주)제넥신 기명식 보통주 4,131,598주 |
| 모집 또는 매출총액 : |
금 27,020,650,920원 |
| 증권신고서(합병등) 및 투자설명서 열람장소 | |
| 가. 증권신고서(합병등) | |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr | |
| 나. 투자설명서 | |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr | |
| 서면문서 : (주)제넥신 → 서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크 (주)이피디바이오테라퓨틱스 → 서울특별시 구로구 디지털로 306, 대륭포스트타워2차 1207호(구로동) |
|
【 대표이사 등의 확인 】
 |
|
대표이사등의 확인 |
요약정보
I. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 [합병등]의 개요-Ⅵ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 사업위험 |
■ 존속회사 사업위험 가-2. 신약개발 사업 고유 특성에 따른 위험
|
| 회사위험 |
■ 공통(존속회사, 소멸회사) 회사위험 나-6. 정부 연구개발 과제 수행 관련 위험 존속회사와 소멸회사는 정부 차원에서 신약 연구개발의 중요성을 감안하여, 다양한 정부과제를 통해 연구개발비 지원을 지속적으로 확대하고 있으므로, 존속회사와 소멸회사는 이에 적극적으로 참여함으로써 향후 신규 사업의 추진에 있어서 객관적인 평가와 공신력을 획득하고 정부의 연구개발 진도 관리에 따라 과제의 성공가능성을 높일 계획입니다. 하지만 향후 존속회사와 소멸회사의 신약개발 파이프라인에 대한 국책과제 추가 선정의 불확실성, 현재 진행중인 과제의 실패에 따른 과제 참여의 제한, 정부의 정책 변화에 따른 국고보조금의 감소 등은 지속적으로 자금이 투입되어야 하는 존속회사와 소멸회사의 연구개발활동에 부정적인 영향을 미칠 수 있습니다. 특히, 현행 제도 상 정부 출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제 받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제제 조치가 가해질 수 있음을 투자판단에 참고하시기 바랍니다.
|
| 기타 투자위험 | 다-1. 소규모합병 관련 위험 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대하는 의사를 통지하는 때(접수기간 : 2024년 07월 15일~2024년 07월 29일)에는 존속회사는 주주총회의 승인을 얻어 합병을 진행하거나 합병 계약을 해제할 수 있으니 이 점 유의하여주시기 바랍니다. 다-2. 주주의 합병 반대 의사통지에 의하여 합병이 무산될 가능성 관련 위험 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대하는 의사를 통지하는 때에는 존속회사는 본건 합병을 소규모합병 절차에 따라 진행하지 아니하며, 이 경우 존속회사는 합병 계약을 해제할 수 있다는 점 투자자께서는 유의하시기 바랍니다. 다-3. 합병계약서 상의 계약 해제 조건 관련 위험 본건 합병계약은 합병기일 이전에 합병계약서에 기재된 계약의 해제 조건과 같은 사유가 발생 시 해제될 수 있습니다. 다-4. 인력 승계에 따른 위험 합병계약이 정하는 바에 따라 소멸회사인 (주)이피티바이오테라퓨틱스의 모든 직원은 존속회사인 (주)제넥신의 직원이 될 예정입니다. 다만, 소멸회사 이사의 지위는 본건 합병의 효력 발생과 함께 소멸합니다. 합병계약에 따라 합병 이전에 취임한 존속회사의 이사의 임기는 「상법」 제527조의4에도 불구하고, 합병 전의 임기를 적용하기 때문에 본래의 임기 만료일까지 계속됩니다. 또한 이번 합병 이후 소멸회사의 대표이사인 최재현은 존속회사의 사내이사로 선임 될 예정입니다. 다-5. 적격합병요건 충족 관련 위험 2017년 12월 19일 법인세법 개정으로 2018년 1월 1일부터 법인세법상 적격합병 요건에 고용승계 요건이 추가되었습니다. 주요 내용을 살펴보면 합병등기일 1개월 전 피합병회사에 종사하는 근로자 중 합병회사가 승계한 근로자의 비율이 80% 이상이고 합병등기일이 속하는 사업연도의 종료일까지 그 비율 이상을 유지하도록 하고 있습니다. (1) 적격합병요건의 충족 (주)제넥신 및 (주)이피디바이오테라퓨틱스는 「법인세법」 제44조(합병 시 피합병법인에 대한 과세)에서 규정한 요건을 충족하고 있습니다. 해당되는 요건으로는 사업영위기간, 지분의 연속성, 사업의 계속성 및 근로자 고용 승계입니다. (2) 적격합병의 사후관리요건의 충족 존속회사는 「법인세법」 제44조의3(적격합병 시 합병법인에 대한 과세특례)에서 규정한 요건을 충족하여야 예상대로 TAX risk를 제거할 수 있습니다. 해당되는 요건으로는 사업의 계속성, 지배주주 등의 연속성, 고용의 지속유지 등입니다. 존속회사는 상기 요건을 모두 충족하고 있으며 향후 이를 유지할 계획입니다. 만약 사후관리요건을 충족하지 못할 경우 합병회사는 법인세 납부 등 재무적 위험에 노출될 수 있으니 투자자께서는 이 점 유의하여 주시기 바랍니다. 다-6. 본질가치 평가에 따른 평가방법상 추정의 오류로 인한 합병 비율의 중요한 차이 발생 위험 외부평가기관은 소멸회사의 수익가치 산정시 각종 통계 자료와 업계 자료 등을 활용하여 산정하였습니다. 수익가치 산정시 사용한 가정 및 추정이 소멸회사의 미래 수익을 보장하는 것이 아니며, 추정에 사용한 가정이 변동할 경우 소멸회사의 합병가액이 과대평가 될 수 있으며, 추정오류로 인해 투자자에게 손실이 발생할 수 있습니다. 또한 본 합병에서 소멸회사의 합병가액 산정 시 외부평가기관은 관련 법령 및 시행세칙, 평가업무 관련 가이드라인 등 외부평가인이 따라야 할 규정을 준수하였습니다. 다만, 미래기간에 대한 추정은 합병당사회사 경영진에 의한 경영전략이나 영업계획의 수정 등 다양한 제반 요소들의 변동에 따라 중대한 영향을 받을 수도 있습니다. 한편 평가인이 선관주의의무를 다하여 기재하였지만 본 합병에 대한 평가범위가 매우 넓으며 평가에 사용된 수치가 많으므로 평가보고서 상 의도하지 않은 표현의 실수나 단순 오타 등이 발생할 수 있습니다. 또한, 계산상의 실수로 인해 수치상 오류가 발생할 가능성도 있습니다. 이 경우 합병가액의 적정성이 손상될 수 있고, 상대적으로 낮게 평가된 회사의 주주의 경우 신주배정 비율 하락으로 인해 손해를 볼 가능성이 있으며 이 경우 투자자들의 소송이 제기될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. 다-7. 존속회사 주식가치 변동위험 본 합병으로 소멸회사 (주)이피디바이오테라퓨틱스 기명식 보통주식 1주당 존속회사 (주)제넥신 기명식 보통주식 6.1947003주의 비율로 합병신주가 배정되어 교부됩니다. 상기의 합병비율은 합병계약 체결 이후 존속회사 (주)제넥신의 주식가격 변동에 따라 추가 조정되지 않고 고정되며, 이에 따라 소멸회사 주주가 합병에 따라 교부받게 되는 존속회사 주식가치 변동위험이 존재합니다. 다-8. 합병신주의 추가상장 시 주가하락의 위험 존속회사의 합병신주 추가상장예정일은 2024년 10월 17일로 (주) 제넥신 보통주식 4,131,598주가 추가 상장될 예정입니다. 금번 합병으로 인해 소멸회사의 주주이자 등기임원인최재현(1975. 3. 26.) 및 이승현(1979. 9. 20.)은 2년을, "소멸회사"의 나머지 주주들은 각 교부받은 "존속회사"의 주식의 50%에 대해서는 1개월, 나머지 50%에 대해서는 3개월 동안 관계 법령에 따른 전자등록일 또는 예탁일로부터 각각 인출 및 매각이 제한됩니다. 해당 매각제한이 해제될 경우 본 물량출하에 따른 주가하락이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. 다-9. 추가자금 소요에 따른 위험 본건 합병은 존속회사가 소멸회사의 주주에게 발행하는 합병신주가 합병회사 발행주식총수의 10%를 초과하지 아니하고, 소멸회사 주주에게 지급하는 합병교부금(현금 등)이 존속회사 최종대차대조표상 순자산가액의 5%를 초과하지 아니하며, 소멸회사의 총주주 동의 하에 진행되는 합병입니다. 존속회사 (주)제넥신의 경우 소규모합병, 소멸회사 (주)이피디바이오테라퓨틱스의 경우 간이 합병입니다. 이에 따라 양사 주주들에게 주식매수청구권 규정은 적용되지 않거나 주식매수청구권 불이행 확약이 되어있어 합병 진행에 있어 주식매수청구권 관련 추가 자금 소요 위험은 적을 것으로 예상됩니다. 다-10. 주식매수청구권 행사에 따른 과세 관련 사항 본건 합병은 존속회사가 소멸회사의 주주에게 발행하는 합병신주가 합병회사 발행주식총수의 10%를 초과하지 아니하고, 소멸회사 주주에게 지급하는 합병교부금(현금 등)이 존속회사 최종대차대조표상 순자산가액의 5%를 초과하지 아니하며, 소멸회사의 총주주 동의 하에 진행되는 합병입니다. 존속회사 (주)제넥신의 경우 소규모합병, 소멸회사 (주)이피디바이오테라퓨틱스의 경우 간이 합병입니다. 이에 따라 양사 주주들에게 주식매수청구권 규정은 적용되지 않거나 주식매수청구권 불이행 확약이 되어있어 합병 진행에 있어 주식매수청구권 관련 과세 위험은 적을 것으로 예상됩니다. 다-11. 소멸회사 우회상장에 해당될 위험 본 합병의 경우 소규모/간이합병에 해당하며, 「코스닥시장 상장규정」 제33조에 따르면 소규모/간이합병의 경우 우회상장 해당사항이 아님이 명시되어 있습니다. 존속회사는 주요사항보고서 제출일 현재 한국거래소에 본 합병과 관련하여 소멸회사의 우회상장에 해당되지 않음을 거래소로부터 확인받은 바 있습니다. 본 합병에 따라 보통주권 상장법인((주)제넥신)을 존속법인으로 하여 합병하는데 있어 주권비상장법인의 상장의 효과는 있으나, 「코스닥시장 상장규정」 및 동법 시행세칙에서 명시하고 있는 직전사업연도의 재무제표를 기준으로 자산총계ㆍ자본금 및 매출액 중 두 가지 이상이 코스닥시장 상장법인보다 더 크거나, 코스닥시장 상장법인의 최대주주 변경 등이 있는 경우에 해당되지 않음에 따라 우회상장에 해당되지 않으며, 이에 따라 본건 합병이 상장예비심사 대상이 아님을 확인하였습니다. 다-12. 소액주주 소송제기 가능성에 따른 위험 양사의 소액주주들은 절차상 하자나 합병비율이 불공정하다는 이유 등으로 본건 합병과 관련하여 합병 무효의 소를 제기할 가능성이 있습니다. 합병 무효의 소가 제기되어 합병 무효의 판결이 법원에서 확정되는 경우 합병 자체가 무효로 돌아갈 위험이 있습니다. 그러나 본건 합병은 상법 등 관련 법에서 정한 절차를 준수하여 진행되고 있으므로 절차상 하자를 이유로 합병이 무효가 될 위험성은 높지 않으나 그 가능성을 배제하기는 어렵다는 점을 참고하시기 바랍니다. 다-13. 관련 법령상의 규제 또는 특칙 본 합병계약은 체결과 동시에 효력을 발생하는 것으로 하되, 본 합병과 관련하여 필요한 정부기관의 승인ㆍ인가ㆍ신고ㆍ수리 중 본 합병당사회사들의 영업에 중대한 영향을 미치는 승인ㆍ인가ㆍ신고ㆍ수리가 확정적으로 거부된 경우, 또는 합병기일 전일 또는 합병당사회사들이 달리 합의하는 날까지 승인ㆍ인가ㆍ신고ㆍ수리를 받지 못한 때에는 본 합병 계약은 해제될 수 있습니다. 다만, 증권신고서 제출 전일 현재 본건과 관련하여 법령상의 규제 및 특칙에 위배되는 사항은 없습니다. 다-14. 소멸회사 자기주식에 대한 신주 배정 관련 법적 위험 존속회사인 (주)제넥신은 합병기일 현재 소멸법인인 (주)이피티바이오테라퓨틱스의 주식을 보유하고 있지 않습니다. 또한 존속회사에게 소규모 합병이며, 소멸법인의 경우 총주주 동의하에 주식매수청구권 행사가 제한된 간이합병이기 때문에 합병의 과정에서 존속회사가 자기주식에 신주를 배정하게 될 위험은 낮습니다. 다-15. 일정 변경 관련 위험 본 증권신고서는 공시 심사과정에서 일부 내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무 진행과정에서 일정이 변경되거나 신고서 내용이 정정되거나 일정이 변경될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
| 합병등 관련 투자위험 |
1. 합병의 성사를 어렵게 하는 위험요소 제12조(선행조건) 각 당사자가 본 계약에 따라 본건 합병을 이행할 의무는 합병기일까지 다음 각호의 조건이 충족될 것을 조건으로 한다. 가. 각 당사자의 주주총회(이사회로 갈음할 경우 이사회를 의미)에서 본 계약과 본건 합병이 적법하게 승인되었을 것
당사자들은 합병기일 이전에는 다음 각 호의 사유가 있는 경우 본 계약을 해제할 수 있다. 단, 본 조 마호을 제외하고, 각 해제사유의 발생에 책임이 있는 회사는 해제할 수 없다. 가. 당사자들이 본 계약을 해제하기로 서면으로 상호 합의하는 경우 마. 본 계약 체결일 이후 합병기일까지 "존속회사" 또는 "소멸회사"의 재무상태, 경영실적, 자산 및 영업상태 또는 전망에 중대한 부정적 변경이 발생한 경우 나. 합병승인 주주총회에서 합병이 무산될 가능성 소멸회사인 (주)이피디바이오테라퓨틱스는 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다. 다만, 소멸회사인 (주)이피디바이오테라퓨틱스의 사내이사는 2인으로 상법 상 이사회 구성요건을 충족하지 못하므로. 소멸회사인 (주)이피디바이오테라퓨틱스의 합병 승인은 주주총회를 통해 진행되며, 「상법」 제363조 4항에 따라, 소멸회사인 (주)이피디바이오테라퓨틱스는 자본금 10억원 미만의 회사로 총주주 동의에 따라 주주총회 소집절차를 생략 및 서면에 의한 결의로서 주주총회의 결의를 갈음할 예정입니다. 양사의 소액주주들은 절차상 하자나 합병비율이 불공정하다는 이유 등으로 본건 합병과 관련하여 합병 무효의 소를 제기할 가능성이 있습니다. 합병 무효의 소가 제기되어 합병 무효의 판결이 법원에서 확정되는 경우 본 합병 자체가 무효로 돌아갈 위험이 있습니다. 그러나 본건 합병은「상법」등 관련 법에서 정한 절차를 준수하여 진행되고 있으므로 절차상 하자를 이유로 합병이 무효가 될 위험은 높지 않다고 생각됩니다.
|
II. 형태
| 합병등 형태 | 흡수합병 |
| 우회상장 여부 | 해당사항없음 |
III. 주요일정
| 이사회 결의일 | 2024년 06월 26일 | |
| 계약일 | 2024년 07월 01일 | |
| 주주총회를 위한 주주확정일 | 2024년 07월 15일 | |
| 승인을 위한 주주총회일 | 2024년 08월 12일 | |
| 주식매수청구권 행사 기간 및 가격 |
시작일 | - |
| 종료일 | - | |
| (주식매수청구가격-회사제시) | - | |
| 소규모합병 공고일 합병 공고 반대주주 반대의사 통지기간 존속회사의 합병승인을 위한 주총갈음 이사회결의일 소멸회사의 합병승인을 위한 주주총회일 채권자 이의제출 공고일 채권자 이의제출 기간 합병기일 합병종료보고 주주총회 갈음 이사회 결의일 합병등기 예정일(해산등기 예정일) 합병신주 상장예정일 |
2024년 07월 15일 2024년 07월 15일 ~ 2024년 07월 29일 2024년 08월 12일 2024년 08월 12일 2024년 08월 12일 2024년 08월 12일 ~ 2024년 09월 13일 2024년 10월 01일 2024년 10월 01일 2024년 10월 02일 2024년 10월 17일 |
|
| 주1: 본 합병은 「상법」 제527조의3의 소규모합병으로 추진하는 바, (주)제넥신의 주주총회 승인은 2024년 08월 12일 이사회 승인으로 갈음합니다. (주)이피디바이오테라퓨틱스은 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다. 다만, 소멸회사인 (주)이피디바이오테라퓨틱스의 사내이사는 2인으로 상법 상 이사회 구성요건을 충족하지 못하므로. 소멸회사인 (주)이피디바이오테라퓨틱스의 합병 승인은 2024년 08월 12일 주주총회를 통해 진행됩니다. 주2) 존속회사의 경우 소규모합병 절차에 따라 진행되며 주식매수청구권이 인정되지 않습니다. 소멸회사는 본건 합병을 총주주 동의에 따른 간이합병 절차에 따라 진행하므로, 주식매수청구권이 인정되지 않습니다. 주3) 존속회사의 경우 소규모합병에 대한 반대의사 접수(접수기간 : 2024년 07월 15일 ~ 2024년 07월 29일)를 위한 주주확정기준일은 2024년 07월 15일이며, 소멸회사는 총주주 동의를 거쳐 간이합병을 진행하므로, 별도의 합병반대의사 접수절차는 진행하지 않습니다. 주4) 「상법」 제526조의 합병종료보고총회는 2024년 10월 01일 (주)제넥신의 이사회결의 개최와 공고 절차로 갈음할 예정입니다. 주5) 상기 합병일정은 공시 시점 현재의 예상 일정이며, 본건 합병을 위하여 필요한 인허가의 취득, 합병 선행조건의 충족여부, 관계기관과의 협의, 기타 사정에 의하여 변경될 수 있습니다. 주6) 2019년 09월 16일 「주식ㆍ사채 등의 전자등록에 관한 법률」("전자증권법")의도입에 따라 전자증권법 제25조에 의거하여 합병신주는 전자등록계좌부에 전자등록될 예정이며 신주권교부가 이루어지지 않습니다. |
IV. 평가 및 신주배정 등
| (단위 : 원, 주) |
| 비율 또는 가액 | 1: 6.1947003 (주)제넥신 : (주)이피디바이오테라퓨틱스 |
||||
| 외부평가기관 | 태성회계법인 | ||||
| 발행증권 | 종류 | 수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 |
| 기명식보통주 | 4,131,598 | 500 | 6,540 | 27,020,650,920 | |
| 지급 교부금 등 | 합병주식의 교부와 단주 매각 대금 지급 외에는 별도의 합병 교부금 지급은 없습니다. | ||||
주1) 합병가액 및 합병비율 산정과 관련한 자세한 내용은 「제1부 합병의 개요 - Ⅱ.합병 가액 및 그 산출근거」를 참조하시기 바랍니다.
주2) 합병신주의 배정으로 1주 미만의 단주가 발생하는 경우에는 단주가 귀속될 주주에게 합병신주의 추가상장일에 한국거래소에서 거래되는 종가를 기준으로 계산된 금액을 1개월 이내에 현금으로 지급할 예정입니다.
V. 당사회사에 관한 사항 요약
| (단위 : 원, 주) |
| 회사명 | (주)제넥신 | (주)이피디바이오테라퓨틱스 | |
|---|---|---|---|
| 구분 | 존속회사 | 소멸회사 | |
| 발행주식수 | 보통주 | 41,510,594 | 400,000 |
| 우선주 | - | 264,160 | |
| 총자산 | 365,386,798,248 | 1,432,089,777 | |
| 자본금 | 20,755,297,000 | 20,000,000 | |
주1: 발행주식수는 증권신고서 제출 전일 현재 기준 발행주식의 총수입니다.
주2: 총자산 및 자본금은 (주)제넥신은 2024년 1분기말 연결재무제표 기준이며, (주)이피디바이오테라퓨틱스는 2024년 1분기말 별도재무제표 기준입니다.
주3: (주)제넥신의 2024년 1분기말 연결재무제표는 한국채택국제회계기준(K-IFRS)기준으로 작성되었으며, (주)이피디바이오테라퓨틱스의 2024년 1분기말 별도재무제표는 한국채택국제회계기준(K-IFRS)에 따라 전환한 금액입니다.
주4: (주)제넥신의 2024년 1분기말 연결 재무제표 및 (주)이피디바이오테라퓨틱스의 2024년 1분기말 별도재무제표는 검토받지 아니하였습니다.
주5: 합병기일까지 (주)이피디바이오테라퓨틱스가 발행한 종류주식은 보통주식으로 전환할 예정입니다.
VI. 그 외 추가사항
| 【주요사항보고서】 | [정정] 주요사항보고서(회사합병 결정)-2024.07.08 |
| 【기 타】 | - |
제1부 합병의 개요
본건 합병은 소규모합병으로 진행되며, 피합병회사가 주권상장법인이 아닌 경우에 해당하므로 증권의 발행 및 공시 등에 관한 규정(이하 "규정") 제2-9조 제3항 및 기업공시서식작성기준(별지)에 따라 다음과 같이 증권신고서 기재사항 및 첨부서류 일부를 생략합니다.
| 기업공시서식 작성기준 별지서식(2024.5.20 시행) 159pg |
|
IV. 소규모합병의 특례 소규모합병으로서 피합병회사가 주권상장법인이 아닌 경우에 증권신고서(합병등)을 제출하는 경우에는 규정 제2-9조제3항에 따라 다음과 같이 기재사항 및 첨부서류 일부를 생략할 수 있따. 다만, 최근 사업연도말 현재 피합병회사의 부채총계가 자산총계보다 큰 경우 또는 피합병회사의 자산총계가 합병회사 자산총계의 100분의 5이상인 경우에는 그러하지 아니하다.
나. 제2부 당사회사에 관한 사항 (2) 첨부서류의 생략 규정 제 2-9조 제2항 제1호, 제2호, 제4호 ~ 제9호의 첨부서류 |
| 증권의 발행 및 공시 등에 관한 규정 |
|
제2-9조(합병의 증권신고서의 기재사항 및 첨부서류) ① 제2-6조에도 불구하고 합병으로 인하여 증권을 모집 또는 매출하는 경우에는 영
제129조에 따라 증권신고서에 다음 각 호의 사항을 기재하여야 한다. 1. 법
제119조제5항에 따른 대표이사 및 이사의 영
제124조 각 호의 사항에 대한 서명 2. 합병의 개요 가. 합병에 관한 일반사항 나. 합병가액과 상대가치(영
제176조의5제2항에 따라 상대가치를 공시해야 하는 경우에 한한다) 및 각각에 대한 산출근거(외부평가가 의무화된 경우 외부평가기관의 합병비율의 적정성에 대한 평가의견을 포함한다)<개정 2013. 9. 17.> 다. 합병의 요령 라. 모집 또는 매출되는 증권의 주요 권리내용 마. 모집 또는 매출되는 증권의 취득에 따른 투자위험요소 바. 출자ㆍ채무보증 등 당사회사간의 이해관계에 관한 사항 사. 주식매수청구권에 관한 사항 아. 그 밖에 투자자 보호를 위하여 필요한 사항 3. 당사회사에 관한 사항(신설합병의 경우에는 소멸회사를 말한다) 가. 회사의 개요 나. 사업의 내용 다. 재무에 관한 사항 라. 회계감사인의 감사의견 마. 이사회 등 회사의 기관 및 계열회사에 관한 사항 바. 주주에 관한 사항 사. 임원 및 직원 등에 관한 사항 아. 그 밖에 투자자 보호를 위하여 필요한 사항 ② 제1항의 신고서에는 다음 각 호의 서류를 첨부하여야 한다. 1. 합병당사회사 및 신설합병회사의 정관 또는 이에 준하는 것으로서 조직운영 및 투자자의 권리의무를 정한 것 2. 합병당사회사의 합병 주주총회 소집을 위한 이사회의 의사록 사본 또는 그 밖에 이에 준하는 서류 3. 합병당사회사의 법인등기부등본 4. 합병에 관하여 행정관청의 허가ㆍ인가 또는 승인 등을 필요로 하는 경우에는 그 허가ㆍ인가 또는 승인 등이 있었음을 증명하는 서류 5. 합병계약서 및 계획서 사본 6. 합병당사회사의 최근 3사업연도 재무제표에 대한 회계감사인의 감사보고서(합병당사회사가 주권상장법인인 경우로서 최근 사업연도에 대한 회계감사인의 감사가 종료되지 않은 경우에는 그 직전 2사업연도에 대한 회계감사인의 감사보고서를 말한다). 다만, 다음 각 목의 어느 하나에서 정하는 요건에 해당하는 경우에는 같은 목에서 정하는 서류로 제출할 수 있다. 가. 외감법
제2조에 따른 외부감사 대상법인 또는 법
제159조에 따른 사업보고서 제출대상법인(이하 이 장에서 "외부감사의무법인"이라 한다)으로서 설립 후 3사업연도가 경과하지 아니한 경우에는 경과한 사업연도에 대한 감사보고서(기업인수목적회사가 설립된 후 최초 사업연도가 경과하지 아니한 경우에는 회사 설립시점의 감사보고서를 말한다) 나. 외부감사의무법인이 아닌 법인으로서 영
제176조의5제3항제2호의 규정을 적용받는 경우에는 동 규정에 따른 감사의견을 입증할 수 있는 감사보고서 등의 서류 다. 외부감사의무법인이 아닌 법인으로서 영
제176조의5제3항제2호의 규정을 적용받지 아니하는 경우에는 회사 제시 최근 3사업연도 재무제표 7. 합병당사회사의 최근 3사업연도 회계감사인의 연결감사보고서(최근 사업연도에 대한 회계감사인의 감사가 종료되지 않은 경우에는 그 직전 2사업연도, 설립 후 3사업연도가 경과하지 아니한 경우에는 경과한 사업연도에 대한 감사보고서를 말한다) 8. 합병당사회사의 반기재무제표에 대한 회계감사인의 반기감사보고서 또는 반기검토보고서(법
제160조에 따른 반기보고서 제출대상법인에 해당하지 않는 경우에는 회사 제시 반기재무제표로 한다) 9. 합병당사회사의 분기재무제표에 대한 회계감사인의 분기감사보고서 또는 분기검토보고서(법
제160조에 따른 분기보고서 제출대상법인으로서 영
제170조제1항제2호 단서의 규정을 적용받지 않는 경우에는 회사 제시 분기재무제표로 한다) 10. 합병당사회사 중 주권비상장법인의 경우에는 주주명부 11. 제1항제2호나목에 따른 외부평가기관의 평가의견서 12. 예비투자설명서를 사용하려는 경우에는 예비투자설명서 13. 간이투자설명서를 사용하려는 경우에는 간이투자설명서 ③ 「상법」 제527조의3에 따른 소규모합병으로서 피합병회사가 주권상장법인이 아닌 경우와 집합투자기구간 합병하는 경우에 신고서를 제출하는 자는 제1항 및 제2항에도 불구하고 감독원장이 정하는 바에 따라 기재사항 및 첨부서류 등의 일부를 생략한 신고서를 제출할 수 있다. |
I. 합병에 관한 기본사항
회사명 정의
- 존속회사(합병 후 존속회사, 합병법인): 주식회사 제넥신
- 소멸회사(합병 후 소멸회사, 피합병법인): 주식회사 이피디바이오테라퓨틱스
1. 합병의 목적
가. 합병의 상대방과 배경
(1) 합병의 상대방
| 합병후 존속회사 (합병존속회사) |
상 호 | 주식회사 제넥신 |
| 소재지 | 서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크 | |
| 대표이사 | 홍 성 준 | |
| 법인구분 | 코스닥시장 상장법인 |
| 합병후 소멸회사 (합병소멸회사) |
상 호 | 주식회사 이피디바이오테라퓨틱스 |
| 소재지 | 서울특별시 구로구 디지털로 306, 대륭포스트타워2차 1207호(구로동) |
|
| 대표이사 | 최 재 현 | |
| 법인구분 | 비상장법인 |
(2) 회사간 합병 배경
합병당사회사들이 영위하고 있는 제약ㆍ바이오 시장은 개인 삶의 질 향상, 인구의 고령화, 만성질환 증가, 암 유병률 증가 등에 따라 지속적으로 확대되고 있습니다. 글로벌 제약ㆍ바이오 시장은 2023년 기준 1.6조달러 규모에서 향후 연평균 6%~9% 성장하여 2028년 2.2조 달러 규모에 달할 전망입니다.
이 중 합병당사회사들의 주력 분야인 종양학 분야는 환자의 조기 진단 및 신규 항암제의 지속적인 도입, 많은 국가에서의 접근 가능성, 장기 치료에 의한 사용량 증가 등의 영향으로 향후 5년간 104% 증가하여 2028년 총 매출 4,400억 달러로 가장 많은 의약품 지출이 예상되는 분야입니다.
특히 합병 이후 주력 제품이 될 표적단백질분해기술(TPD) 시장은 전 세계적으로 2023~2030년 동안 연평균 성장률(CAGR) 26.4%로 성장할 것으로 예상되며, 시장 규모는 2022년 5억 달러에서 2030년 33억 달러까지 성장할 것으로 기대됩니다. 합병 당사회사들은 이렇게 빠르게 성장하는 시장에 신속하게 대응하고, 존속회사와 소멸회사 각자의 장점을 합쳐 시너지를 내기 위해 하나의 회사로 통합하여 글로벌 선두 바이오 신약개발 회사로 도약하기 위한 발판을 마련하고자 합니다.
본 합병은 존속회사 (주)제넥신이 소멸회사 (주)이피디바이오테라퓨틱스를 합병하는 건입니다. 존속회사 (주)제넥신은 1999년 설립된 바이오 신약개발 회사로서 다수의 플랫폼 연구개발 및 글로벌 임상시험 수행 역량을 보유하고 있으며, 2023년 인도네시아에서 에서 만성신장성 빈혈 대상 치료제를 허가받는 등 글로벌 수준의 신약개발 경험과 역량을 보유하고 있습니다.
소멸회사 (주)이피디바이오테라퓨틱스는 2021년 설립된 표적단백질분해기술(TPD) 플랫폼 개발 회사로서 국내 TIPS 지원을 받고, KDDF 과제로도 선정되었을 뿐만 아니라 해외 대형 제약회사와 공동연구개발을 수행하는 등 시장성과 기술적 차별성을 인정받았습니다. TPD 약물은 특정 단백질을 유비퀴틴-프로테아좀 시스템에 연결하여 분해하는 메커니즘을 통해 작용합니다. 이 시스템은 질병을 유발하는 단백질을 표적으로 하여, 특히 기존의 소분자 치료제가 다루기 어려운 단백질을 효과적으로 제거하는 데 강점을 보입니다. 이와 같은 장점으로 인해 TPD 약물이 임상 개발 단계로 진입하는 사례가 늘어나면서 지속적인 성장을 보이고 있습니다. (주)이피디바이오테라퓨틱스의 EPDeg™ 기술은 기존의 소분자로 이루어진 일반적인 TPD 약물과 달리 나노바디(nanobody)와 변형된 E3 단백질을 융합시킨 구조이며, 이는 mRNA형태로 지질나노입자 (LNP)와 같은 전달체를 이용하여 특정 조직에서 원하는 단백질을 효과적으로 분해할 수 있습니다. 이는 기존의 약물로는 치료가 어려운 질병에 효과적으로 대응할 수 있는 새로운 방법을 제공합니다. TPD 약물 시장의 급성장과 기술의 발전은 미래의 의약품 개발에 큰 변화를 가져올 것입니다.
(주)제넥신이 보유한 특정 항원을 정밀하게 표적화하는 항체 기술과 새롭게 성장하고 있는 TPD 약물의 융합은 기존의 치료제들로는 해결하기 어려운 단백질을 효과적으로 분해 할수 있는 새로운 방법을 제공합니다. 이는 특정 단백질의 기능을 억제하거나 변형 시키는데 그치지 않고, 단백질을 완전히 분해하여 제거함으로써 질병의 근본 원인을 직접적으로 타겟팅할 수 있으며, 새로운 기전을 통해 작용하므로 보다 효과적이고 혁신적인 치료방법을 제공할 수 있습니다.
결론적으로, 합병당사회사들은 기업 구조 단일화를 통해 연구개발 역량과 기술적 차별성을 보유한 신약개발 회사가 됨으로써 향후 글로벌 선두 바이오 신약개발 회사로 성장하고자 합니다.
(3) 우회상장 해당여부
해당사항 없습니다.
나. 회사의 경영, 재무, 영업 등에 미치는 중요 영향 및 효과
(1) 회사의 경영에 미치는 영향 및 효과
본건 합병 완료시 (주)제넥신은 존속회사로 계속 남아있고, (주)이피디바이오테라퓨틱스는 합병 후 소멸할 예정입니다. 존속회사인 (주)제넥신은 본 합병을 함에 있어 합병 비율에 따라 신주를 발행할 계획이며, 본 합병 완료 후 존속회사인 (주)제넥신의 최대주주 변경은 없습니다.
본건 합병 후 존속회사인 (주)제넥신 이사 및 감사로 재직하는 자는 달리 사임 등 임기 종료사유가 발생하지 않는 한, 본건 합병 후에도 상법 제527조의4에도 불구하고 남은 임기동안 존속회사인 (주)제넥신의 이사 및 감사의 지위를 유지합니다. 하지만 합병 후 소멸하는 (주)이피디바이오테라퓨틱스의 이사 및 감사의 임기는 본건 합병의 효력 발생과 동시에 만료되어 기존 지위를 상실합니다.
합병기일(2024년 10월 01일 예정) 이후 주요 경영방침에 대해서는 합병 전 소멸회사인 (주)이피디바이오테라퓨틱스의 운영방침을 고려하여 종합적인 검토가 필요할 것으로 예상되며, 검토 결과를 바탕으로 적법한 절차에 따라 결정할 예정입니다. 이 외에 향후 임원구성에 대한 사항으로, 합병 전 소멸회사인 (주)이피디바이오테라퓨틱스의 대표이사인 최재현 사내이사를 합병 후 존속법인인 (주)제넥신의 사내이사(각자 대표이사)로 선임할 계획을 가지고 있습니다.
| 합병 전/후 존속회사의 최대주주 및 특수관계인 지분 변동 현황 |
| (기준일: 증권신고서 제출일 전일) | (단위: 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
합병 전 | 합병 후 | ||||
| (주)제넥신 | (주)이피디바이오테라퓨틱스 | (주)제넥신 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | 주식수 | 지분율 | |||
| (주)한독 | 최대주주 | 보통주 | 6,048,534 | 14.57 | - | - | 6,048,534 | 13.25 |
| 최대주주 등 합계 | 보통주 | 6,048,534 | 14.57 | 300,000 | 45.17 | 6,048,534 | 13.25 | |
| 발행주식 총수 | 보통주 | 41,510,594 | 100.00 | 664,160 | 100.00 | 45,642,192 | 100.00 | |
| 주1) 상기 지분율은 보통주 기준입니다. |
| 주2) 합병 후 지분율 및 주식수는 증권신고서 제출일 전일을 기준으로 합병신주 발행 예상 주식수를 적용한 수치이며, 해당 내용은 추후 변동될 수 있습니다. |
| 주3) 존속회사는 증권신고서 제출일 전일 기준 소멸회사의 주식을 보유하고 있지 않아, 합병 신주 배정 여부에 따른 법적 위험이 없습니다. 또한 소멸회사는 증권신고서 제출일 전일 기준 자기주식을 보유하고 있지 않아, 소멸회사의 자기주식에 합병 신주 배정 여부에 따른 법적 위험이 없습니다. |
| 주4) 본 합병 이후 (주)제넥신은 존속법인으로 계속 남아있게 되며, (주)이피디바이오테라퓨틱스는 해산할 예정입니다. |
(2) 회사의 재무에 미치는 영향 및 효과
존속회사는 소멸회사를 흡수합병함에 따라, 존속회사가 보유한 대외적 인지도, 사업 네트워크 등을 활용하여 소멸회사가 영위하고 있는 사업의 역량을 강화할 수 있으며, 각사가 영위하는 사업 부문의 일괄체계를 구축해 불필요한 자원낭비를 줄이고, 인적ㆍ물적 자원을 효율적으로 활용해 경영의 효율성을 증대하여 존속회사의 재무에 긍정적인 영향을 기대하고 있습니다.
또한, 바이오 분야 연구개발 산업은 대규모 연구개발비 투자가 필요하며, 기술의 상용화까지 장기간이 소요되는 특징을 가지고 있습니다. 본 합병을 통해 양사 기술력의 융합으로 연구개발 역량 증가, 중복 투자비용 등의 감소와 상용화기간 단축이 기대되며, 인적/물적 자원을 효율적으로 활용해 경영의 효율성을 증대하여 합병회사의 재무에 긍정적인 영향을 기대하고 있습니다.
| 합병 후 재무제표(추정) |
| (단위: 원) |
| 구분 | 합병 전 별도재무상태표(2024년 1분기말 기준) | 합병 후 재무상태표(*1) | |
| (주)제넥신 | (주)이피디바이오 테라퓨틱스 |
||
| 자산 | |||
| 유동자산 | 58,526,342,430 | 726,565,701 | 59,252,908,131 |
| 비유동자산 | 334,069,406,501 | 705,524,076 | 361,794,956,390 |
| 영업권과 식별무형자산 (추정)(*2) | - | - | 27,010,269,743 |
| 기타비유동자산 | 334,069,406,501 | 705,524,076 | 334,784,686,647 |
| 자산총계 | 392,595,748,931 | 1,432,089,777 | 421,047,864,521 |
| 부채 | |||
| 유동부채 | 51,692,057,706 | 7,806,308,094 | 59,498,365,800 |
| 비유동부채 | 25,520,566,398 | 232,340,919 | 25,752,907,317 |
| 부채총계 | 77,212,624,104 | 8,038,649,013 | 85,251,273,117 |
| 자본 | |||
| 자본금(*2) | 20,755,297,000 | 20,000,000 | 22,841,096,500 |
| 자본잉여금(*2) | 355,009,534,509 | 102,847,759 | 380,066,608,581 |
| 기타자본구성요소 | (42,743,027,233) | - | (42,743,027,233) |
| 이익잉여금 | (17,638,679,449) | (6,729,406,995) | (24,368,086,444) |
| 자본총계 | 315,383,124,827 | (6,606,559,236) | 335,796,591,404 |
| 부채와자본총계 | 392,595,748,931 | 1,432,089,777 | 421,047,864,521 |
| 주1: 합병 후 재무상태표는 합병법인 및 피합병법인의 각각 2024년 1분기말 별도재무상태표 기준이며, 합병법인은 한국채택국제회계기준을 따르며, 피합병법인은 일반기업회계기준에 따라 작성한 재무상태표를 한국채택국제회계기준으로 전환한 수치입니다. 주2: 합병 후 재무상태표의 자본금과 자본잉여금은 합병비율을 고려하여 산출되었습니다. 다만, 실제 합병기일 기준으로 작성될 합병재무상태표는 피합병회사 순자산의 매수가격배분을 통해 작성될 것이기 때문에 상기 합병 후 추정 재무수치와 차이가 있을 수 있습니다. |
(주1) 재무정보(재무제표) 이용상의 유의사항
| 구분 | 위치 | 회계처리기준 (재무제표 작성기준) |
해당 재무제표 |
|---|---|---|---|
| 합병가액 및 그 산출근거 | 증권신고서 본문 | 한국채택국제회계기준(K-IFRS) | 2021년~ 2024년 3월 : 피합병법인의 별도재무상태표, 분할존속부문의 분할별도재무상태표 및 분할별도손익계산서 |
| 외부평가기관의평가의견서 | 첨부문서 | 한국채택국제회계기준(K-IFRS) | 상동 |
| 재무에 관한 사항 | 증권신고서 본문 | 일반기업회계기준(K-GAAP) | 2021년~2024년 3월 : 피합병법인의 요약재무정보 |
* 상기 재무정보에 제시한 2021년부터 2024년 3월까지의 피합병법인의 재무정보는 일반기업회계기준(K-GAAP)에 따라 작성하였습니다. 합병가액 산정 시에 사용한 피합병법인(분할존속부문 포함)의 재무정보는 한국채택국제회계기준(K-IFRS)으로 작성하여 적용하였습니다.
(3) 회사의 영업에 미치는 영향 및 효과
존속회사인 (주)제넥신은 면역항암, 유전자백신 분야에서 증명된 독자적인 원천기술을 가지고, 다수 파이프라인의 글로벌 임상시험 및 사업화를 진행하였으며, 소멸회사인 (주)이피디바이오테라퓨틱스는 표적단백질분해를 기반으로 한 치료제 분야에서 차세대 기술을 개발, 보유하고 있습니다. 본 합병으로 (주)제넥신이 보유한 신약 및 바이오베터 개발 기술을 활용해 바이오프로탁 기초 연구 및 기술 개발을 진행하고, 나아가 기술의 상용화 및 EPDeg 바이오프로탁을 기반으로 한 신약 후보물질을 개발하는데 시너지를 기대하고 있습니다. 양사의 기술 융합을 통해 차세대 면역유전자치료제 기술을 개발함으로써 글로벌 바이오시장에서 사업경쟁력을 확보할 수 있을 것으로 예상합니다.
(4) 합병 당사회사 주주가치에 미치는 효과
증권신고서 제출 전일 현재 소멸회사인 (주)이피디바이오테라퓨틱스 주주명부에 등재되어 있는 주주(기 발행 우선주 전량 보통주 전환 가정)들이 보유한 보통주식 1주당 존속회사인 (주)제넥신 보통주식 6.1947003주를 교부할 예정입니다. 존속회사인 (주)제넥신은 소멸회사인 (주)이피디바이오테라퓨틱스 주식을 보유하고 있지 않으며, 소멸회사인 (주)이피디바이오테라퓨틱스는 자기주식을 보유하고 있지 않으므로 포합주식과 소멸회사의 자기주식에 대해서는 합병신주를 배정하지 않습니다. 양사는 본 건 합병 완료 이후, 상기 언급한 경영 및 재무, 영업적 측면의 긍정적 기대효과의 발현을 통해 외형 및 수익성이 성장하며, 기업가치가 상승될 것이라 판단하고 있습니다. 이는 향후 주주 환원 측면에서도 긍정적인 결과를 만들어내어 궁극적으로 주주가치를 제고해 나갈 수 있을 것으로 판단합니다.
다. 향후 회사구조개편에 관한 계획
본 증권신고서 제출 전일 현재 향후 회사구조 개편에 관해 구체적으로 계획하고 있는 사항은 없습니다.기업공시서식 작성기준 제12-1-1조에 따른 작성지침에 맞추어 부연하자면, 본건 합병 등이 완료된 이후 1년 내에 또 다른 합병 등 회사의 구조개편에 관한 계획(상대회사나 추진시기 등)은 없습니다. 1년 내에 추진되지는 않더라도 본건 합병등이 보다 넓은 차원에서의 구조개편 일환으로 추진되는 경우에 대해 기재하자면, 2023년 9월 제넥신과 이피디바이오테라퓨틱스는 차세대 TPD 플랫폼 기술을 활용한 항암신약 개발 기초 연구 및 아토피 피부염 등 난치성 질환 치료제 공동 개발 등에 대한 업무협약을 체결하였고, 그 이후 최근 바이오텍 투자 시장이 어려운 상황에서 지속적인 바이오프로탁 연구개발을 진행할 수 있는 제넥신과 표적단백질분해제 분야의 대표 기술인 프로탁의 한계를 극복하기 위한 바이오프로탁 플랫폼 개발에 나서고 있는 이피디바이오테라퓨틱스의 M&A를 위해 본건 합병을 추진하게 되었습니다. 이번 합병으로 제넥신이 보유한 신약 및 바이오베터 개발 기술을 활용해 바이오프로탁 기초 연구 및 기술 개발을 진행할 예정이며, 나아가 기술의 상용화 및 EPDeg 바이오프로탁을 기반으로 한 신약 후보물질 개발에 있어 시너지를 기대하고 있습니다.
2. 합병 상대방 회사의 개요
가. 회사의 개황
(1) 회사의 법적, 상업적 명칭
합병 상대방 회사의 명칭은 주식회사 이피디바이오테라퓨틱스라고 표기합니다. 또한 영문으로는 EPD Biotherapeutics Inc.(약호 EPD Biotherapeutics)라 표기합니다.
(2) 설립일자
주식회사 이피디바이오테라퓨틱스는 2021년 08월 06일 설립되었습니다.
(3) 주요사업의 내용
소멸회사인 (주)이피디바이오테라퓨틱스는 차세대 표적 단백질 분해 치료제 개발을 주요 사업으로 영위하고 있으며, 회사가 영위하는 목적사업은 다음과 같습니다.
| 목적사업 |
|---|
| 1. 생명공학 관련 제품 연구, 개발, 제조, 가공, 매매업 |
| 2. 위 각호에 관련된 부대사업 일체 |
나. 임직원 현황
(1) 임원 현황
| (기준일: 2024년 06월 30일) | (단위: 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당업무 | 주요경력 | 소유주식수 | 최대주주와 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 최재현 | 남 | 1975.03 | 대표이사 | 사내이사 | 상근 | 경영 총괄 | 서울대학교 미생물학과 학사, 석사 Univ. of Toronto 박사 (00.01~02.02) LG화학 바이오텍 연구소 (07.09~11.03) Transition Therapeutics (11.09~15.12) 삼성전자 종합기술원 (16.02~19.03) Trillium Therapeutics (19.08~21.07) Arvinas (21.08~현재) EPD Biotherapeutics CEO |
300,000 | - | 최대주주 | 21.08~현재 | 2024.09 |
| 이승현 | 남 | 1979.09 | 전무 | 사내이사 | 상근 | 경영 총괄 | 아주대학교 생명분자공학부 학사 아주대학교 분자과학기술학과 석사, 박사 (10.08~17.01) 삼성전자 종합기술원 (17.02~21.07) 유틸렉스 (21.08~현재) EPD Biotherapeutics CFO |
100,000 | - | 등기임원 | 21.08~현재 | 2024.09 |
| 용예령 | 여 | 1981.12 | 이사 | 미등기 | 상근 | 약물평가 | 연세대학교 생화학과 학사, 석사, 박사 (10.09~17.04) 삼성전자 종합기술원 (17.05~18.11) 코오롱 생명과학 (18.12~22.04) ABL Bio (22.05~현재) EPD Biotherapeutics 이사 |
600 | - | 미등기임원 | 22.05~현재 | - |
(2) 직원 등 현황
| [소멸회사의 본부별/직위별 인원] |
| (기준일: 2024년 06월 30일) |
| 구분 | 경영진 | 약물평가팀 | 플랫폼발굴팀 | 연구지원팀 | 비임상개발팀 | 경영지원팀 | 합계 |
| 임원 | 2 | - | - | - | - | - | 2 |
| 팀장 | - | 1 | - | - | 1 | - | 2 |
| 팀원 | - | 6 | 3 | 1 | - | 1 | 11 |
| 합계 | 2 | 7 | 3 | 1 | 1 | 1 | 15 |
다. 주요주주 현황
(1) 최대주주 및 특수관계인의 주식 소유 현황
| (기준일: 2024년 06월 30일) | (단위: 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
주식수 | 지분율 | 비고 |
|---|---|---|---|---|---|
| 최재현 | 본인 | 보통주 | 300,000 | 45.17 | - |
| 계 | 보통주 | 300,000 | - | ||
| 우선주 | - | - | - | ||
(2) 주식의 분포
| (기준일: 2024년 06월 30일) | (단위: 주, %) |
| 구분 | 주주명 | 보통주 | 우선주 | 지분율 | 비고 |
|---|---|---|---|---|---|
| 5% 이상 주주 | 최재현 | 300,000 | - | 45.17 | - |
| 이승현 | 100,000 | - | 15.06 | - | |
| 미래에셋바이오프론티어 투자조합 | - | 54,200 | 8.16 | - | |
| 메디톡스투자조합1호 | - | 54,200 | 8.16 | ||
| (주)퓨쳐플레이 | - | 45,500 | 6.85 | ||
| 하나테크밸류업펀드 | - | 36,200 | 5.45 | ||
| 우리사주조합 | - | - | - | - | |
라. 최근 3년간 요약재무정보 및 외부감사 여부
| (단위: 원) |
| 구분 | 제4기 (2024년 3월말) |
제3기 (2023년 12월말) |
제3기 (2022년 12월말) |
|---|---|---|---|
| 감사인(감사의견) | 검토받지 않은 재무제표 |
한울회계법인 (적정) |
한울회계법인 (적정) |
| 회계처리기준 | 일반기업회계기준 (K-GAAP) |
일반기업회계기준 (K-GAAP) |
일반기업회계기준 (K-GAAP) |
| [유동자산] | 666,641,967 | 968,176,291 | 2,616,679,387 |
| ㆍ당좌자산 | 666,641,967 | 968,176,291 | 2,616,679,387 |
| [비유동자산] | 695,586,092 | 746,654,134 | 923,604,471 |
| ㆍ유형자산 | 630,671,606 | 681,353,401 | 855,812,531 |
| ㆍ무형자산 | 4,914,486 | 5,300,733 | 4,591,940 |
| ㆍ기타비유동자산 | 60,000,000 | 60,000,000 | 63,200,000 |
| 자산총계 | 1,362,228,059 | 1,714,830,425 | 3,540,283,858 |
| [유동부채] | 22,664,295 | 61,830,422 | 16,101,260 |
| [비유동부채] | 200,834,933 | 200,834,933 | 44,914,640 |
| 부채총계 | 223,499,228 | 262,665,355 | 61,015,900 |
| [자본금] | 324,700,000 | 324,700,000 | 324,700,000 |
| [자본잉여금] | 4,671,098,881 | 4,671,098,881 | 4,671,098,881 |
| [결손금] | (3,857,070,050) | (3,543,633,811) | (1,516,530,923) |
| 자본총계 | 1,138,728,831 | 1,452,165,070 | 3,479,267,958 |
| 사업연도 | (2024.01.01~ 2024.03.31) |
(2023.01.01~ 2023.12.31) |
(2022.01.01~ 2022.12.31) |
| 매출액 | - | - | - |
| 영업이익 | (511,825,645) | (2,387,906,583) | (1,641,496,743) |
| 당기순이익 | (313,436,239) | (2,027,102,888) | (1,246,845,813) |
3. 합병의 형태
가. 합병 방법
본 합병은 (주)제넥신이 (주)이피디바이오테라퓨틱스를 흡수합병하는 건이며, 합병존속회사인 (주)제넥신은 존속하고, 합병소멸회사인 (주)이피디바이오테라퓨틱스는 소멸합니다. (주)제넥신은 본건 합병을 함에 있어 합병신주를 발행하며, 합병기일 현재 (주)이피디바이오테라퓨틱스의 주주명부에 등재되어 있는 주주들에게 각 지분 비율에 따라 합병신주를 교부합니다.
나. 간이합병 또는 소규모합병 여부
본건 합병으로 인하여 존속회사가 발행하는 신주의 총수는 보통주 4,131,598주로서 존속회사의 발행주식총수인 41,510,594주의 약 9.95%이므로 이는 「상법」 제527조의 3(소규모합병)의 규정이 정하는 바에 해당됩니다. 또한, 본건 합병은 소멸회사가 총주주의 동의를 받아 합병을 진행하므로 「상법」 제527조의2(간이합병)의 규정이 정하는 바에 해당됩니다.
| [상 법] |
| 제527조의2 (간이합병) ① 합병할 회사의 일방이 합병후 존속하는 경우에 합병으로 인하여소멸하는 회사의 총주주의 동의가 있거나 그 회사의 발행주식총수의 100분의 90 이상을 합병후 존속하는 회사가 소유하고 있는 때에는 합병으로 인하여 소멸하는 회사의 주주총회의 승인은 이를 이사회의 승인으로 갈음할 수 있다. ② 제1항의 경우에 합병으로 인하여 소멸하는 회사는 합병계약서를 작성한 날부터 2주내에주주총회의 승인을 얻지 아니하고 합병을 한다는 뜻을 공고하거나 주주에게 통지하여야 한다. 다만, 총주주의 동의가 있는 때에는 그러하지 아니하다. 제527조의3(소규모합병) ① 합병후 존속하는 회사가 합병으로 인하여 발행하는 신주 및 이전하는 자기주식의 총수가 그 회사의 발행주식총수의 100분의 10을 초과하지 아니하는 경우에는 그 존속하는 회사의 주주총회의 승인은 이를 이사회의 승인으로 갈음할 수 있다. 다만, 합병으로 인하여 소멸하는 회사의 주주에게 제공할 금전이나 그 밖의 재산을 정한 경우에 그 금액 및 그 밖의 재산의 가액이 존속하는 회사의 최종 대차대조표상으로 현존하는 순자산액의 100분의 5를 초과하는 경우에는 그러하지 아니하다. ② 제1항의 경우에 존속하는 회사의 합병계약서에는 주주총회의 승인을 얻지 아니하고 합병을 한다는 뜻을 기재하여야 한다. ③ 제1항의 경우에 존속하는 회사는 합병계약서를 작성한 날부터 2주내에 소멸하는 회사의상호 및 본점의 소재지, 합병을 할 날, 주주총회의 승인을 얻지 아니하고 합병을 한다는 뜻을 공고하거나 주주에게 통지하여야 한다. ④ 합병후 존속하는 회사의 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 제3항의 규정에 의한 공고 또는 통지를 한 날부터 2주내에 회사에 대하여서면으로 제1항의 합병에 반대하는 의사를 통지한 때에는 제1항 본문의 규정에 의한 합병을 할수 없다 ⑤ 제1항 본문의 경우에는 제522조의3의 규정은 이를 적용하지 아니한다. |
다. 합병 후 존속회사의 상장계획
합병 후 존속회사인 (주)제넥신은 본 증권신고서 제출 전일 현재 한국거래소 코스닥시장 주권상장 법인이며, 합병 후에도 코스닥시장 상장법인으로서의 지위를 유지합니다.
라. 합병의 방법상 특기할 만한 사항
존속회사인 (주)제넥신은 본건 합병을 소규모합병으로 추진하는 바, 주주총회의 승인을 이사회의 승인으로 갈음할 수 있습니다. 하지만 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대하는 의사를 통지하는 때(접수기간 : 2024년 07월 15일~2024년 07월 29일)에는 존속회사는 주주총회의 승인을 얻어 합병을 진행하거나 합병 계약을 해제할 수 있습니다.
「상법」 제527조의3에 따른 소규모합병이므로 존속회사의 주주에 대해서는 주식매수청구권이 부여되지 않습니다.
또한 소멸회사인 (주)이피디바이오테라퓨틱스는 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다. 다만, 소멸회사인 (주)이피디바이오테라퓨틱스의 사내이사는 2인으로 상법 상 이사회 구성요건을 충족하지 못하므로. 소멸회사인 (주)이피디바이오테라퓨틱스의 합병 승인은 주주총회를 통해 진행되며, 「상법」 제363조 4항에 따라, 소멸회사인 (주)이피디바이오테라퓨틱스는 자본금 10억원 미만의 회사로 총주주 동의에 따라 주주총회 소집절차를 생략 및 서면에 의한 결의로서 주주총회의 결의를 갈음할 예정입니다.
소멸회사인 (주)이피디바이오테라퓨틱스는 본건 합병을 총주주 동의에 따른 간이합병 절차에 따라 진행하므로, 주식매수청구권이 부여되지 않습니다.
4. 진행경과 및 일정
가. 진행경과
| 일자 | 내용 |
|---|---|
| 2024년 06월 26일 | 합병계약 체결에 관한 이사회 결의 |
| 2024년 07월 01일 | 합병계약 체결 |
| 2024년 07월 01일 | 회사합병결정 제출 |
| 2024년 07월 01일 | 증권신고서(합병) 제출 |
나. 주요일정
| 구 분 | (주)제넥신 (존속회사) |
(주)이피디바이오테라퓨틱스 (소멸회사) |
|
| 합병이사회 결의일 | 2024년 06월 26일 | 2024년 06월 26일 | |
| 주요사항보고서 제출일 | 2024년 06월 26일 | - | |
| 주주확정 기준일 공고 | 2024년 06월 26일 | 2024년 06월 26일 | |
| 합병계약일 | 2024년 07월 01일 | 2024년 07월 01일 | |
| 증권신고서 제출일 | 2024년 07월 01일 | - | |
| 주주확정 기준일 | 2024년 07월 15일 | 2024년 07월 15일 | |
| 합병반대의사 통지 접수기간 | 시작일 | 2024년 07월 15일 | - |
| 종료일 | 2024년 07월 29일 | - | |
| 주주총회 소집 통지 및 공고일 | - | - | |
| 합병승인을 위한 주총갈음 이사회결의일/ 합병승인을 위한 주주총회일 |
2024년 08월 12일 | 2024년 08월 12일 |
|
| 주식매수청구권 행사 기간 | 시작일 | - | - |
| 종료일 | - | - | |
| 채권자 이의제출기간 | 시작일 | 2024년 08월 12일 | 2024년 08월 12일 |
| 종료일 | 2024년 09월 13일 | 2024년 09월 13일 | |
| 합병기일 | 2024년 10월 01일 | ||
| 합병종료보고 주주총회 갈음 이사회 결의일 | 2024년 10월 01일 | - | |
| 합병등기(해산등기) 예정일 | 2024년 10월 02일 | ||
| 합병신주상장 예정일 | 2024년 10월 17일 | - | |
| 주1: 본 합병은 「상법」 제527조의3의 소규모합병으로 추진하는 바, (주)제넥신의 주주총회 승인은 2024년 08월 12일 이사회 승인으로 갈음합니다. (주)이피디바이오테라퓨틱스은 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다. 다만, 소멸회사인 (주)이피디바이오테라퓨틱스의 사내이사는 2인으로 상법 상 이사회 구성요건을 충족하지 못하므로. 소멸회사인 (주)이피디바이오테라퓨틱스의 합병 승인은 2024년 08월 12일 주주총회를 통해 진행됩니다. 주2: 존속회사의 경우 소규모합병 절차에 따라 진행되며 주식매수청구권이 인정되지 않습니다. 소멸회사는 본건 합병을 총주주 동의에 따른 간이합병 절차에 따라 진행하므로, 주식매수청구권이 인정되지 않습니다. 주3: 존속회사의 경우 소규모합병에 대한 반대의사 접수(접수기간 : 2024년 07월 15일 ~ 2024년 07월 29일)를 위한 주주확정기준일은 2024년 07월 15일이며, 소멸회사인 (주)이피디바이오테라퓨틱스는 총주주 동의를 거쳐 간이합병을 진행하므로, 별도의 합병반대의사 접수절차는 진행하지 않습니다. 주4: 상법 제526조의 합병종료보고총회는 2024년 10월 01일 (주)제넥신의 이사회결의 개최와 공고 절차로 갈음할 예정입니다. 주5: 상기 합병일정은 공시 시점 현재의 예상 일정이며, 본건 합병을 위하여 필요한 인허가의 취득, 합병 선행조건의 충족여부, 관계기관과의 협의, 기타 사정에 의하여 변경될 수 있습니다. 주6: 2019년 09월 16일 「주식ㆍ사채 등의 전자등록에 관한 법률」("전자증권법")의도입에 따라 전자증권법 제25조에 의거하여 합병신주는 전자등록계좌부에 전자등록될 예정이며 신주권교부가 이루어지지 않습니다. |
다. 증권신고서 제출 여부
| 구 분 | 내 용 |
|---|---|
| 증권신고서 제출대상 여부 | ○ |
| 제출을 면제받은 경우 그 사유 | - |
5. 합병의 성사 조건
가. 합병계약서 상의 계약 해제 조건
합병계약서에 기재된 계약의 선행조건 및 해제조건은 아래와 같으며, 이와 같은 사유가 발생하는 경우 합병계약이 해제 또는 효력 소멸됨으로써 본 합병이 성사되지 않을 수 있습니다.
| [본 합병계약서 상의 선행조건 및 해제 조건] |
|---|
|
제12조(선행조건) 각 당사자가 본 계약에 따라 본건 합병을 이행할 의무는 합병기일까지 다음 각호의 조건이 충족될 것을 조건으로 한다.
가. 각 당사자의 주주총회(이사회로 갈음할 경우 이사회를 의미)에서 본 계약과 본건 합병이 적법하게 승인되었을 것
당사자들은 합병기일 이전에는 다음 각 호의 사유가 있는 경우 본 계약을 해제할 수 있다. 단, 본 조 마호을 제외하고, 각 해제사유의 발생에 책임이 있는 회사는 해제할 수 없다. 가. 당사자들이 본 계약을 해제하기로 서면으로 상호 합의하는 경우 마. 본 계약 체결일 이후 합병기일까지 "존속회사" 또는 "소멸회사"의 재무상태, 경영실적, 자산 및 영업상태 또는 전망에 중대한 부정적 변경이 발생한 경우 |
나. 합병승인 주주총회에서 합병이 무산될 가능성
소멸회사인 (주)이피디바이오테라퓨틱스는 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다. 다만, 소멸회사인 (주)이피디바이오테라퓨틱스의 사내이사는 2인으로 상법 상 이사회 구성요건을 충족하지 못하므로. 소멸회사인 (주)이피디바이오테라퓨틱스의 합병 승인은 주주총회를 통해 진행되며, 「상법」 제363조 4항에 따라, 소멸회사인 (주)이피디바이오테라퓨틱스는 자본금 10억원 미만의 회사로 총주주 동의에 따라 주주총회 소집절차를 생략 및 서면에 의한 결의로서 주주총회의 결의를 갈음할 예정입니다.
한편, 존속회사인 (주)제넥신은 본건 합병을 소규모합병으로 추진하는 바, 주주총회의 승인을 이사회의 승인으로 갈음할 수 있습니다. 하지만 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대(접수기간 : 2024년 07월 15일~2024년 07월 29일)하는 의사를 통지하는 때에는 존속회사는 주주총회의 승인을 얻어 합병을 진행하거나 합병 계약을 해제할 수 있습니다.
6. 관련 법령 상의 규제 또는 특칙
합병 계약은 체결과 동시에 효력을 발생하는 것으로 하되, 본 합병과 관련하여 필요한 정부기관의 승인ㆍ인가ㆍ신고ㆍ수리 중 합병 당사회사들의 영업에 중대한 영향을미치는 승인ㆍ인가ㆍ신고ㆍ수리가 확정적으로 거부된 경우에는 본 합병계약은 해제될 수 있습니다.
본 합병의 경우 소멸회사의 자산 및 매출액이 300억원 미만이므로 공정거래위원회의 기업결합신고대상에 해당하지 않아 신고 의무가 없습니다.
[기업결합 신고 구분]
| 구 분 | 신고의무자 | 기업결합 유형 | 신고시기 |
| 사전신고 | 대규모회사 | 주식취득 | 계약일 완료 후 이행완료 전 |
| 합병 | |||
| 영업양수 | |||
| 회사신설 참여 | 주총(이사회) 의결일 이후 이행완료 전 | ||
| 사후신고 | 대규모회사 외의 자 | 주식취득 | 주권교부일 등으로부터 30일 |
| 합병 | 합병등기일로부터 30일 | ||
| 영업양수 | 대금지불 완료일부터 30일 | ||
| 회사신설 참여 | 주금납입기일 다음날부터 30일 | ||
| 대규모회사 | 임원겸임 | 겸임되는 회사의 주주총회(사원총회)에서 선임이 의결된 날부터 30일 |
| 주: 대규모회사 = 자산총액 또는 매출액의 규모가 2조원 이상인 회사 출처: 공정거래위원회 홈페이지 |
| 【독점규제 및 공정거래에 관한 법률】 |
|
제12조(기업결합의 신고) 1. 다른 회사의 발행주식총수[「상법」 제370조(의결권 없는 주식)의 규정에 의한 의결권없는 주식을 제외한다. 이하 같다]의 100분의 20(상장법인의 경우에는 100분의 15) 이상을 소유하게 되는 경우 2. 다른 회사의 발행주식을 제1호에 따른 비율 이상으로 소유한 자가 당해 회사의 주식을 추가로 취득하여 최다출자자가 되는 경우 3. 임원겸임의 경우(계열회사의 임원을 겸임하는 경우를 제외한다) 4. 제7조(기업결합의 제한)제1항제3호 또는 제4호에 해당하는 행위를 하는 경우 5. 새로운 회사설립에 참여하여 그 회사의 최다출자자가 되는 경우 ② 제1항에 규정된 기업결합신고대상회사 및 상대회사의 자산총액 또는 매출액의 규모는 각각 기업결합일 전부터 기업결합일 후까지 계속하여 계열회사의 지위를 유지하고 있는 회사의 자산총액 또는 매출액을 합산한 규모를 말한다. 다만, 제7조(기업결합의 제한)제1항제4호의 규정에 의한 영업양수의 경우에 영업을 양도(영업의 임대, 경영의 위임 및 영업용고정자산의 양도를 포함한다)하는 회사의 자산총액 또는 매출액의 규모는 계열회사의 자산총액 또는 매출액을 합산하지 아니한 규모를 말한다. <신설 2004. 12. 31.> ③ 제1항에 불구하고 다음 각 호의 어느 하나에 해당하는 경우에는 신고대상에서 제외한다. <신설 2001. 1. 16., 2002. 1. 26., 2002. 8. 26., 2004. 12. 31., 2007. 8. 3., 2016. 3. 29., 2020. 2. 11.> 1. 「벤처투자 촉진에 관한 법률」 제2조제10호 또는 제11호에 따른 중소기업창업투자회사 또는 벤처투자조합이 「중소기업창업 지원법」 제2조제2호에 따른 창업자(이하 "창업자"라 한다) 또는 벤처기업의 주식을 제1항제1호에 따른 비율 이상으로 소유하게 되거나 창업자 또는 벤처기업의 설립에 다른 회사와 공동으로 참여하여 최다출자자가 되는 경우 2. 「여신전문금융업법」에 따른 신기술사업금융업자 또는 신기술사업투자조합이 「기술보증기금법」 제2조(정의)제1호의 신기술사업자(이하 "신기술사업자"라 한다)의 주식을 제1항제1호에 따른 비율 이상으로 소유하게 되거나 신기술사업자의 설립에 다른 회사와 공동으로 참여하여 최다출자자가 되는 경우 3. 기업결합신고대상회사가 다음 각 목의 어느 하나에 해당하는 회사의 주식을 제1항제1호에 따른 비율 이상으로 소유하게 되거나 다음 각 목의 어느 하나에 해당하는 회사의 설립에 다른 회사와 공동으로 참여하여 최다출자자가 되는 경우 가. 「자본시장과 금융투자업에 관한 법률」에 따른 투자회사 나. 「사회기반시설에 대한 민간투자법」에 따라 사회기반시설 민간투자사업시행자로 지정된 회사 다. 나목에 따른 회사에 대한 투자목적으로 설립된 투자회사(「법인세법」 제51조의2제1항제6호에 해당하는 회사에 한한다) 라. 「부동산투자회사법」에 따른 부동산투자회사 ④ 제1항의 규정은 관계중앙행정기관의 장이 다른 법률의 규정에 의하여 미리 당해기업결합에 관하여 공정거래위원회와 협의한 경우에는 이를 적용하지 아니한다. ⑤ 제1항제1호ㆍ제2호 또는 제5호의 규정에 의한 주식의 소유 또는 인수의 비율을 산정하거나 최다출자자가 되는지 여부를 판단함에 있어서는 당해회사의 특수관계인이 소유하고 있는 주식을 합산한다. <개정 2004. 12. 31., 2007. 8. 3.> ⑥ 제1항의 규정에 의한 기업결합의 신고는 당해 기업결합일부터 30일 이내에 이를 하여야 한다. 다만, 제1항제1호ㆍ제2호ㆍ제4호 또는 제5호의 규정에 의한 기업결합(대통령령으로 정하는 경우는 제외한다)으로서 기업결합의 당사회사 중 1 이상의 회사가 대규모회사인 경우에는 합병계약을 체결한 날 등 대통령령이 정하는 날부터 기업결합일 전까지의 기간 내에 이를 신고하여야 한다. <개정 1999. 2. 5., 2004. 12. 31., 2009. 3. 25.> ⑦ 공정거래위원회는 제6항에 따라 신고를 받으면 신고일부터 30일 안에 제7조에 해당하는지를 심사하고, 그 결과를 해당 신고자에게 통지하여야 한다. 다만, 공정거래위원회가 필요하다고 인정할 경우에는 그 기간의 만료일 다음 날부터 계산하여 90일까지 그 기간을 연장할 수 있다. <신설 2012. 3. 21.> ⑧ 제6항 단서의 규정에 따라 신고를 하여야 하는 자는 제7항에 따른 공정거래위원회의 심사결과를 통지받기 전까지 각각 주식소유, 합병등기, 영업양수계약의 이행행위 또는 주식인수행위를 하여서는 아니된다. <개정 2004. 12. 31., 2012. 3. 21.> ⑨ 제7조(企業結合의 제한)제1항에 규정된 기업결합을 하고자 하는 자는 제6항에 규정된 신고기간이전이라도 당해 행위가 경쟁을 실질적으로 제한하는 행위에 해당하는지 여부에 대하여 공정거래위원회에 심사를 요청할 수 있다. <개정 1999. 2. 5., 2001. 1. 16., 2004. 12. 31., 2012. 3. 21.> ⑩ 공정거래위원회는 제9항에 따라 심사를 요청받은 경우에는 30일이내에 그 심사결과를 요청한 자에게 통지하여야 한다. 다만, 공정거래위원회가 필요하다고 인정할 때에는 그 기간의 만료일 다음날부터 기산하여 90일의 범위안에서 그 기간을 연장할 수 있다. <개정 1999. 2. 5., 2001. 1. 16., 2004. 12. 31., 2012. 3. 21.> ⑪ 제1항의 규정에 의한 신고의무자가 2이상인 경우에는 공동으로 신고하여야 한다. 다만, 공정거래위원회가 대통령령이 정하는 바에 의하여 신고의무자가 소속된 기업집단에 속하는 회사중 하나의 회사를 기업결합신고대리인(이하 이 條에서 "代理人"이라 한다)으로 정하여 그 대리인이 신고한 경우에는 그러하지 아니하다. <개정 2012. 3. 21.> [전문개정 1996. 12. 30.] |
| 【독점규제 및 공정거래에 관한 법률 시행령】 |
|
제18조(기업결합의 신고등) ② 법 제12조제1항 각 호 외의 부분 전단에서 "자산총액 또는 매출액의 규모가 대통령령이 정하는 기준에 해당하는 다른 회사"라 함은 자산총액 또는 매출액이 300억원 이상인 회사를 말한다. <신설 2005. 3. 31., 2007. 11. 2., 2017. 9. 29.> ③ 제1항과 제2항에도 불구하고 법 제12조(기업결합의 신고)제1항에 따른 기업결합신고대상회사와 상대회사가 모두 외국회사(외국에 주된 사무소를 두고 있거나 외국 법률에 따라 설립된 회사를 말한다)이거나 기업결합신고대상회사가 국내회사이고 상대회사가 외국회사인 경우에는 제1항과 제2항의 요건을 충족함과 동시에 그 외국회사 각각의 국내 매출액이 300억원 이상인 경우에 한하여 법 제12조(기업결합의 신고)제1항에 따른 신고의 대상이 된다. 이 경우 국내 매출액의 산정에 필요한 사항은 공정거래위원회가 정하여 고시한다. <신설 2007. 11. 2., 2017. 9. 29.> ④ 법 제12조(기업결합의 신고)제1항의 규정에 의하여 신고를 하고자 하는 자는 공정거래위원회가 정하여 고시하는 바에 따라 신고의무자 및 상대방 회사의 명칭ㆍ매출액ㆍ자산총액ㆍ사업내용과 당해 기업결합의 내용 및 관련시장 현황 등을 기재한 신고서에 신고내용을 입증하는데 필요한 관련서류를 첨부하여 공정거래위원회에 제출하여야 한다. <개정 2001. 3. 27., 2007. 11. 2.> ⑤ 공정거래위원회는 제4항에 따라 제출된 신고서 또는 첨부서류가 미비된 경우에는 기간을 정하여 해당 서류의 보정을 명할 수 있다. 이 경우 보정에 소요되는 기간(보정명령서를 발송하는 날과 보정된 서류가 공정거래위원회에 도달하는 날을 포함한다)은 법 제12조제7항 및 제10항의 기간에 산입하지 아니한다. <개정 2001. 3. 27., 2005. 3. 31., 2007. 11. 2., 2012. 6. 19.> ⑥ 법 제12조(기업결합의 신고)제1항제1호에서 "100분의 20(주권상장법인의 경우에는 100분의 15)이상을 소유하게 되는 경우"라 함은 100분의 20(주권상장법인의 경우에는 100분의 15. 이하 이 항에서 같다)미만의 소유상태에서 100분의 20이상의 소유상태로 되는 경우를 말한다. <개정 2001. 3. 27., 2006. 4. 14., 2007. 11. 2., 2008. 7. 29.> ⑦ 법 제12조제1항제2호에서 "최다출자자가 되는 경우"라 함은 최다출자자가 아닌 상태에서 최다출자자가 되는 경우를 말한다. <신설 2005. 3. 31., 2007. 11. 2.> ⑧ 법 제12조(기업결합의 신고)제2항 본문 및 같은 조 제6항 본문 및 단서에서 "기업결합일"이라 함은 다음 각호의 날을 말한다. <개정 1999. 3. 31., 2001. 3. 27., 2005. 3. 31., 2007. 11. 2., 2009. 5. 13.> 1. 다른 회사의 주식을 소유하게 되거나 주식소유비율이 증가하는 경우에는 다음 각목의 날 가. 주식회사의 주식을 양수하는 경우에는 주권을 교부받은 날. 다만, 주권이 발행되어 있지 아니한 경우에는 주식대금을 지급한 날을 말하며, 주권을 교부받기 전 또는 주식대금의 전부를 지급하기 전에 합의ㆍ계약등에 의하여 의결권 기타 주식에 관한 권리가 실질적으로 이전되는 경우에는 당해권리가 이전되는 날을 말한다. 나. 주식회사의 신주를 유상취득하는 경우에는 주식대금의 납입기일의 다음 날 다. 주식회사외의 회사의 지분을 양수하는 경우에는 지분양수의 효력이 발생하는 날 라. 가목 내지 다목에 해당하지 아니하는 경우로서 감자 또는 주식의 소각 그 밖의사유로 주식소유비율이 증가하는 경우에는 주식소유비율의 증가가 확정되는 날 2. 임원겸임의 경우에는 임원이 겸임되는 회사의 주주총회 또는 사원총회에서 임원의 선임이 의결된 날 3. 영업양수의 경우에는 영업양수대금의 지불을 완료한 날. 다만, 계약체결일부터 90일을 경과하여 영업양수대금의 지불을 완료하는 경우에는 당해 90일이 경과한 날을 말한다. 4. 다른 회사와의 합병의 경우에는 합병등기일 5. 새로운 회사설립에 참여하는 경우에는 배정된 주식의 주식대금의 납입기일의 다음 날 ⑨ 법 제12조(기업결합의 신고)제6항 단서에서 "대통령령으로 정하는 경우"란 다른 회사의 주식을 소유하게 되거나 최다출자자가 되는 경우로서 다음 각 호의 어느 하나에 해당하는 경우를 말한다. <개정 2011. 12. 30.> 1. 「자본시장과 금융투자업에 관한 법률」 제9조(그 밖의 용어의 정의)제13항에 따른 증권시장에서 경쟁매매(매매 당사자 간의 계약이나 합의에 따라 수량, 가격 등을 결정하고, 그 매매의 결제를 증권시장을 통하여 하는 방법으로 주식을 취득하는 경우는 제외한다)를 통하여 주식을 취득하는 경우 2. 유상증자의 결과 실권주(失權株)의 발생으로 주식소유비율이 증가하는 경우 또는 자기의 의사와 무관하게 다른 회사의 이사회 또는 주주총회의 결정을 통하여 행하여지는 주식의 소각 또는 감자에 따라 주식소유비율이 증가하는 경우 등 공정거래위원회가 정하여 고시하는 경우 ⑩ 법 제12조제6항 단서에서 "대통령령이 정하는 날"이라 함은 다음 각호의 날을 말한다. <신설 2005. 3. 31., 2007. 11. 2., 2008. 6. 25., 2008. 7. 29., 2009. 5. 13., 2011. 12. 30., 2012. 6. 19.> 1. 다른 회사의 주식을 소유하게 되거나 최다출자자가 되는 경우에는 주식을 취득ㆍ소유하기로 계약ㆍ합의 등을 하거나 이사회 등을 통하여 결정된 날 2. 합병ㆍ영업양수가 있는 경우에는 합병계약을 체결한 날 또는 영업양수계약을 체결한 날 3. 새로운 회사설립에 참여하는 경우에는 회사설립의 참여에 대한 주주총회 또는 이에 갈음하는 이사회의 의결이 있는 날 ⑪ 법 제12조제6항 단서의 규정에 의한 신고를 한 대규모회사는 신고후 주식의 소유일, 합병의 등기일ㆍ영업의 양수일 또는 회사의 설립일까지 신고사항에 중요한 변경이 있는 경우에는 그 변경사항을 신고하여야 한다. <개정 1999. 3. 31., 2001. 3. 27., 2005. 3. 31., 2007. 11. 2., 2009. 5. 13.> ⑫ 삭제 <2012. 6. 19.> [전문개정 1997. 3. 31.] |
II. 합병 가액 및 그 산출근거
1. 합병의 합병가액 및 비율
합병법인 및 피합병법인의 합병가액과 이에 따른 합병 비율은 다음과 같습니다.
| (단위: 원) |
| 구분 | (주)제넥신 (합병법인) |
(주)이피디바이오테라퓨틱스 (피합병법인) |
|---|---|---|
| 가. 기준시가(주1) | 6,540 | N/A |
| 나. 본질가치[(Ax1+Bx1.5)÷2.5](주2) | N/A | 40,512 |
| A. 자산가치 | 7,865 | 2,824 |
| B. 수익가치 | N/A | 65,638 |
| 다. 상대가치(주3) | N/A | N/A |
| 라. 1주당 합병가액 | 6,540 | 40,512 |
| 마. 합병비율(주4) | ||
| 보통주 합병비율 | 1.0000000 | 6.1947003 |
| 전환우선주 합병비율 | 1.0000000 | 6.1947003 |
| 제1회 상환전환우선주 합병비율 | 1.0000000 | 6.1947003 |
| 제2회 상환전환우선주 합병비율 | 1.0000000 | 7.3688776 |
| 주1: 「자본시장과 금융투자업에 관한 법률 시행령」 176조의5에 의하여, 주권상장법인인 합병법인의 주당 합병가액은 기준시가로 평가하였습니다. 피합병법인의 기준주가는 주권비상장법인이므로 산정하지 아니하였습니다. 주2: 피합병법인의 주당 합병가액은 「증권의 발행 및 공시 등에 관한규정 시행세칙」 제4조를 적용하여 자산가치와 수익가치를 1과 1.5의 비율로 가중산술평균한 가액으로 산정하였습니다. 주3: 「증권의 발행 및 공시 등에 관한 규정 시행세칙」 제7조 제1항 제1호 따른 유사회사 요건을 충족하는 법인이 3사 미만이므로, 비교목적으로 공시되는 피합병법인의 상대가치는 산정하지 아니하였습니다. (주4) 합병비율에 따르면 피합병법인 보통주식 1주에 대하여 합병법인 보통주식 6.1947003주가 교부됩니다. 한편, 분석기준일 현재 피합병법인이 발행한 종류주식 264,160주 전체는 합병계약서에 따라 합병기일전에 피합병법인의 보통주로 전환될 예정이며 합병비율에 따라 제넥신의 보통주식으로 발행 교부될 예정입니다. 분석 및 평가의 목적으로 산정한 분석기준일 현재 피합병법인의 우선주식 합병비율은 피합병법인 전환우선주 1주에 대하여 합병법인 보통주식 6.1947003주, 피합병법인 제1회상환전환우선주 1주에 대하여 합병법인 보통주식 6.1947003주, 피합병법인 제2회 상환전환우선주 1주에 대하여 합병법인 보통주식 7.3688776주로 산정됩니다. 출처: 회사제시자료 및 태성회계법인 Analysis |
2. 산출근거
본 합병의 당사회사인 (주)제넥신과 (주)이피디바이오테라퓨틱스는 주권상장법인과 주권비상장법인 간 합병에 해당하므로 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5의 제1항제2호에 의거 합병비율을 산출하였습니다. 관련 법규는 아래와 같습니다.
| [자본시장과 금융투자업에 관한 법률 시행령] |
|
제176조의5(합병의 요건ㆍ방법 등) 1. 주권상장법인 간 합병의 경우에는 합병을 위한 이사회 결의일과 합병계약을 체결한 날 중 앞서는 날의 전일을 기산일로 한 다음 각 목의 종가(증권시장에서 성립된 최종가격을 말한다. 이하 이 항에서 같다)를 산술평균한 가액(이하 이 조에서 “기준시가”라 한다)을 기준으로 100분의 30(계열회사 간 합병의 경우에는 100분의 10)의 범위에서 할인 또는 할증한 가액. 이 경우 가목 및 나목의 평균종가는 종가를 거래량으로 가중산술평균하여 산정한다. 가. 최근 1개월간 평균종가. 다만, 산정대상기간 중에 배당락 또는 권리락이 있는 경우로서 배당락 또는 권리락이 있은 날부터 기산일까지의 기간이 7일 이상인 경우에는 그 기간의 평균종가로 한다. 나. 최근 1주일간 평균종가 다. 최근일의 종가 2. 주권상장법인(코넥스시장에 주권이 상장된 법인은 제외한다. 이하 이 호 및 제4항에서 같다)과 주권비상장법인 간 합병의 경우에는 다음 각 목의 기준에 따른 가격 가. 주권상장법인의 경우에는 제1호의 가격. 다만, 제1호의 가격이 자산가치에 미달하는 경우에는 자산가치로 할 수 있다. 나. 주권비상장법인의 경우에는 자산가치와 수익가치를 가중산술평균한 가액 ② 제1항제2호나목에 따른 가격으로 산정하는 경우에는 금융위원회가 정하여 고시하는 방법에 따라 산정한 유사한 업종을 영위하는 법인의 가치(이하 이 항에서 “상대가치”라 한다)를 비교하여 공시하여야 하며, 같은 호 각 목에 따른 자산가치ㆍ수익가치 및 그 가중산술평균방법과 상대가치의 공시방법은 금융위원회가 정하여 고시한다. <개정 2013. 8. 27.> |
2.1. (주)제넥신 기명식 보통주 합병가액
2.1. 합병법인의 합병가액 산정
주권상장법인의 합병가액은 원칙적으로 기준시가를 적용하되, 자본시장과 금융투자업에 관한 법률 시행령 176조의5 제1항 제2호 가목에 따라 기준시가가 자산가치보다낮은 경우에는 자산가치로 할 수 있도록 되어 있습니다.
합병법인의 기준시가와 자산가치 및 합병 당사회사의 합병가액 결정방법에 따른 합병법인의 합병가액 평가결과는 다음과 같습니다.
| (단위: 원) |
|
구분 |
금액 |
|---|---|
| 가. 기준시가 | 6,540 |
| 나. 자산가치 | 7,865 |
| 다. 합병가액 | 6,540 |
출처 : 합병법인 제시자료, 한국거래소, 태성회계법인 Analysis
2.1.1. 합병법인의 기준시가 산정
합병법인의 기준시가는 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제1항 제1호에 따라 합병을 위한 이사회 결의일(2024년 6월 26일)과 합병계약 체결예정일(2024년 7월 1일) 중 앞서는 날의 전일(2024년 6월 25일)을 기산일로 한 최근 1개월 간의 거래량 가중산술평균종가, 최근 1주일 간의 거래량 가중산술평균종가, 최근일의 종가를 산술평균한 가액으로 산정하였으며, 기준시가 산정 내역은 다음과 같습니다. 한편, 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제1항 제1호에 따르면 상술한 방법으로 산출된 가액을 기준으로 100분의 30(계열회사 간 주식교환의 경우에는 100분의 10)의 범위에서 할인 또는 할증한 가액을 기준주가로 적용할 수 있도록 규정되어 있으나 본 평가에서는 적용하지 아니하였습니다.
| (단위: 원) |
|
구분 |
기간 | 금액 |
|---|---|---|
| A. 최근 1개월 가중산술평균종가 | 2024-5-26 ~ 2024-6-25 | 6,890 |
| B. 최근 1주일 가중산술평균종가 | 2024-6-19 ~ 2024-6-25 | 6,399 |
| C. 최근일 종가 | 2024-6-25 | 6,330 |
| D. 기준시가[(A+B+C)/3] | 6,540 | |
출처 : 한국거래소, 태성회계법인 Analysis
한편, 상기 기준시가 산정을 위해 2024년 6월 25일을 기산일로하여 소급한 1개월 주가 및 거래량 현황과 1개월 및 1주일의 거래량 가중산술평균종가, 그리고 최근일 종가는 다음과 같습니다.
| (단위: 원, 주) |
| 일자 | 종가(원) | 거래량(주) | 종가 X 거래량 (원) |
|---|---|---|---|
| 2024-06-25 | 6,330 | 56,282 | 356,265,060 |
| 2024-06-24 | 6,240 | 85,681 | 534,649,440 |
| 2024-06-21 | 6,390 | 92,178 | 589,017,420 |
| 2024-06-20 | 6,530 | 48,640 | 317,619,200 |
| 2024-06-19 | 6,490 | 132,761 | 861,618,890 |
| 2024-06-18 | 6,650 | 105,931 | 704,441,150 |
| 2024-06-17 | 6,720 | 88,668 | 595,848,960 |
| 2024-06-14 | 6,670 | 195,795 | 1,305,952,650 |
| 2024-06-13 | 6,890 | 1,116,774 | 7,694,572,860 |
| 2024-06-12 | 6,970 | 178,079 | 1,241,210,630 |
| 2024-06-11 | 7,010 | 96,554 | 676,843,540 |
| 2024-06-10 | 7,010 | 131,447 | 921,443,470 |
| 2024-06-07 | 7,310 | 185,694 | 1,357,423,140 |
| 2024-06-05 | 7,050 | 103,972 | 733,002,600 |
| 2024-06-04 | 7,100 | 82,728 | 587,368,800 |
| 2024-06-03 | 7,170 | 77,598 | 556,377,660 |
| 2024-05-31 | 7,110 | 93,310 | 663,434,100 |
| 2024-05-30 | 7,160 | 84,877 | 607,719,320 |
| 2024-05-29 | 7,060 | 89,786 | 633,889,160 |
| 2024-05-28 | 7,070 | 99,168 | 701,117,760 |
| 2024-05-27 | 7,190 | 121,494 | 873,541,860 |
| A. 최근 1개월 가중산술평균종가 | 6,890 | ||
| B. 최근 1주일 가중산술평균종가 | 6,399 | ||
| C. 최근일 종가 | 6,330 | ||
출처 : 한국거래소, 태성회계법인 Analysis
2.1.2. 합병법인의 자산가치 산정
합병법인의 1주당 자산가치는 「증권의 발행 및 공시 등에 관한 규정 시행세칙」 제5조에 의거하여, 주요사항보고서 제출일이 속하는 사업연도의 직전 사업연도말 현재의 별도재무상태표상의 자본총계에서 일부 조정항목을 가감하여 산정한 순자산가액을 분석기준일 현재의 발행주식총수로 나누어 산정하였습니다.
| (단위: 원, 주) |
|
구분 |
금액 |
|---|---|
| 가. 최근사업연도말 별도재무제표상 자본총계(주1) | 332,399,337,449 |
| 나. 조정항목(A-B) | (5,898,268,152) |
| A. 가산항목 | 26,083,989,783 |
| (1) 최근사업연도말 현재 자기주식(주2) | 938,886,067 |
| (2) 분석기준일까지 유상증자 등에 의하여 증가한 자본금 | - |
|
(3) 분석기준일까지 전환권(또는 신주인수권) 행사 등에 의하여 증가한 자본금 |
- |
| (4) 분석기준일까지 자본잉여금 및 재평가잉여금 증가액 | - |
| (5) 분석기준일까지 이익잉여금의 증감을 수반하지 아니한 중요한 순자산 증가액(주3) | 14,118,480,477 |
| (6) 분석기준일 현재 전환주식등 향후 자본금을 증가시킬 수 있는 증권의 권리 행사 가능성(주4) | - |
| (7) 분석기준일 현재 투자주식 중 취득원가로 측정하는 시장성 없는 투자주식의 순자산가액이 재무상태표에 계상된 금액보다 높은 경우 차이 금액. 단, 손상이 발생한 경우는 제외(주5) | 3,447,221,754 |
| (8) 분석기준일 현재 투자주식 중 시장성 있는 주식의 종가가 재무상태표에 계상된 금액보다 높은 경우 차이 금액(주6) | 7,579,401,485 |
| (9) 분석기준일까지 발생한 오류수정이익 | - |
| B. 차감항목 | 31,982,257,935 |
| (1) 분석기준일 현재 실질가치 없는 무형자산 | - |
| (2) 분석기준일 현재 회수가능성 없는 채권 | - |
| (3) 분석기준일 현재 퇴직급여채무 또는 퇴직급여충당부채 과소설정액 | - |
| (4) 분석기준일까지 손상차손이 발생한 자산의 손상차손(주7) | - |
| (5) 분석기준일까지 유상감자에 의하여 감소한 자본금 | - |
| (6) 분석기준일까지 배당금 지급, 전기오류수정손실 등 | - |
| (7) 분석기준일까지 이익잉여금의 증감을 수반하지 아니한 중요한 순자산 감소액(주3) | 7,723,875,839 |
| (8) 분석기준일 현재 투자주식 중 취득원가로 측정하는 시장성 없는 주식의 순자산가액이 재무상태표에 계상된 금액보다 낮은 경우 차이 금액(주5) | 13,625,721,798 |
| (9) 분석기준일 현재 투자주식 중 시장성 있는 주식의 종가가 재무상태표에 계상된 금액보다 낮은 경우 차이 금액(주6) | 10,632,660,298 |
| 다. 조정된 순자산가액(가 + 나) | 326,501,069,297 |
| 라. 발행주식총수 | 41,510,594 |
| (1) 분석기준일 현재 재무상태표상 발행주식총수 | 41,510,594 |
| (2) 분석기준일까지 전환주식등 향후 자본금을 증가시킬 수 있는 증권의 권리 행사 가능성(주4) | - |
| 마. 1주당 자산가치 (다 / 라)(주8) | 7,865 |
출처: 합병법인 제시자료, 사업보고서 및 태성회계법인 Analysis
(주1) 증권의 발행 및 공시 등에 관한 규정 시행세칙 제5조에 따라 주요사항보고서를 제출하는 날이 속하는 사업연도의 직전 사업연도말인 2023년 12월 31일 현재 한국채택국제회계기준(K-IFRS)에 의하여 작성된 감사받은 별도재무상태표 상 금액을 적용하였으며, 합병법인의 2023년 12월 31일로 종료하는 사업연도의 별도재무상태표는 다음과 같습니다.
| (단위: 원) |
|
구분 |
금액 |
|---|---|
| 자산 |
|
| Ⅰ. 유동자산 | 84,492,937,964 |
| 현금및현금성자산 | 2,700,053,320 |
| 단기금융상품 | 10,000,000,000 |
| 당기손익금융자산 | 44,450,208,913 |
| 매출채권및기타채권 | 12,276,086,931 |
| 파생상품자산 | - |
| 기타유동자산 | 14,744,988,578 |
| 당기법인세자산 | 321,600,222 |
| Ⅱ. 비유동자산 | 328,360,560,478 |
| 장기매출채권및기타채권 | 583,264,370 |
| 당기손익금융자산 | 9,746,094,491 |
| 기타포괄손익금융자산 | 21,329,412,055 |
| 관계기업및공동기업투자 | 165,687,048,162 |
| 종속기업투자 | 10,172,034,502 |
| 투자부동산 | 2,962,585,326 |
| 유형자산 | 113,743,726,142 |
| 무형자산 | 1,997,312,088 |
| 기타장기채권 | 76,675,795 |
| 순확정급여자산 | 1,185,875,059 |
| 기타비유동자산 | 876,532,488 |
| 자산총계 | 412,853,498,442 |
| 부채 | |
| Ⅰ. 유동부채 | 55,310,516,520 |
| 매입채무및기타채무 | 7,356,005,485 |
| 단기차입금 | 44,575,040,000 |
| 전환사채 | - |
| 파생상품부채 | 485,541,673 |
| 리스부채 | 55,461,464 |
| 기타유동부채 | 2,838,467,898 |
| Ⅱ. 비유동부채 | 25,143,644,473 |
| 장기차입금 | 22,681,435,176 |
| 파생상품부채 | - |
| 리스부채 | 39,532,911 |
| 순확정급여부채 | - |
| 기타장기채무 | 2,422,676,386 |
| 기타비유동부채 | - |
| 부채총계 | 80,454,160,993 |
| 자본 | |
| 자본금 | 20,755,297,000 |
| 보통주자본금 | 20,755,297,000 |
| 자본잉여금 | 646,857,262,411 |
| 기타자본구성요소 | (43,365,494,060) |
| 이익잉여금(결손금) | (291,847,727,902) |
| 자본총계 | 332,399,337,449 |
| 부채와자본총계 | 412,853,498,442 |
출처: 합병법인 제시자료, 사업보고서 및 태성회계법인 Analysis
(주2) 최근 사업연도말 현재 자기주식수는 60,816주입니다.
(주3) 최근사업연도말 이후부터 분석기준일까지 이익잉여금의 증감을 수반하지 아니한 중요한 순자산 증감액은 다음과 같습니다.
| (단위: 원) |
|
구분 |
금액 |
|---|---|
| 이익잉여금의 증감을 수반하지 아니한 중요한 순자산 증가액 | |
| 기타자본잉여금 | 3,374,575,854 |
| 기타포괄손익금융자산 평가손익 | 1,049,636 |
| 현금및현금성자산 등 | 10,742,854,987 |
| 합계 | 14,118,480,477 |
| 이익잉여금의 증감을 수반하지 아니한 중요한 순자산 증가액 | |
| 주식선택권 소멸 | (3,374,575,854) |
| 주식선택권 인식 | 621,417,191 |
| 종속기업투자주식 청산 | 10,477,034,502 |
| 합계 | 7,723,875,839 |
(주4) 2021년 4월 1일에 개정되어 2021년 4월 12일부터 시행된 증권의 발행 및 공시등에 관한 규정 시행세칙에 따르면 전환사채 등과 관련하여 향후 자본금을 증가 시킬수 있는 증권의 권리가 행사될 가능성이 확실한 경우에는 권리 행사를 가정하여 이를순자산 및 발행주식의 총수에 반영한다라고 기재되어 있습니다. 합병법인의 최근 사업연도말 재무상태표에는 주식선택권*1)이 존재합니다.
*1) 분석기준일 현재 합병법인이 부여한 주식선택권의 잔존 수량은 594,550주입니다. 주식선택권의 1주당 행사가격 8,340원~67,193원은 분석기준일 현재 합병가액을 고려할 때 합리적인 투자자라면 주식선택권의 행사 가능성이 낮은 상황입니다. 이를 고려하여 피합병법인의 주식선택권 행사가액을 순자산증가액에 반영하지 않았으며, 주식선택권 행사에 따른 행사가능 주식수 594,550주는 모두 발행주식총수 가산에서 제외하였습니다.
(주5) 분석기준일 현재 합병법인이 보유한 투자주식의 내역은 다음과 같으며, 이 중 취득원가로 측정하는 시장성 없는 투자주식의 순자산가액과 취득원가의 차이를 조정하였습니다.
| (단위: 원) |
| 구분 |
장부가액 |
피투자회사 순자산가액(*1) |
지분율(*2) | 순자산가액 X 지분율 |
조정금액 |
|---|---|---|---|---|---|
| (A) | (B) | (C) | (D = B x C) | (D - A) | |
| [기타포괄손익-공정가치측정금융자산] | |||||
| I-Mab | 9,041,991,220 | (*3) | 4.47% | (*3) | (*3) |
| ㈜지아이이노베이션 | 3,651,511,500 | (*3) | 0.69% | (*3) | (*3) |
| ㈜와이바이오로직스 | 2,761,059,600 | (*3) | 1.19% | (*3) | (*3) |
| ㈜프로젠 | 164,450,000 | (*3) | 0.12% | (*3) | (*3) |
| ㈜코스온 | - | (15,286,955,983) | 5.73% | (875,182,511) | - |
| ㈜에스엘백시젠 | 2,026,200,000 | 2,791,000,000 | 8.11% | 226,277,727 | (1,799,922,273) |
| ㈜이노퓨틱스 | 1,000,001,600 | 2,802,665,184 | 5.85% | 163,915,300 | (836,086,300) |
| 진메디신㈜ | 1,000,017,410 | (7,008,204,282) | 0.55% | (38,721,581) | (1,000,017,410) |
| Pharmajet | 523,720,725 | 30,481,416,000 | 0.75% | 228,569,038 | (295,151,687) |
| Egret | 1,160,460,000 | 695,772,902 | 5.56% | 38,654,050 | (1,121,805,950) |
| 소계 | 21,329,412,055 | 14,475,693,821 | (256,487,976) | (5,052,983,620) | |
| [당기손익금융자산] | |||||
| ㈜에스엘백시젠 | 5,148,900,000 | 2,791,000,000 | 5.40% | 150,851,818 | (4,998,048,182) |
| ㈜칼로스메디칼 | 1,000,027,956 | (24,569,142,285) | 1.59% | (389,994,744) | (1,000,027,956) |
| 미래에셋청년창업 투자조합 3호 | 1,597,344,135 | 16,134,789,238 | 9.90% | 1,597,344,135 | - |
| 소계 | 7,746,272,091 | (5,643,353,047) | 1,358,201,209 | (5,998,076,138) | |
| [종속관계기업투자주식] | |||||
| 네오이뮨텍 | 42,395,400,000 | (*3) | 21.18% | (*3) | (*3) |
| Simnogen | 758,409,219 | 1,547,773,916 | 49.00% | 758,409,219 | (0) |
| KGBio | 38,694,175,333 | 197,599,091,668 | 20.32% | 40,142,714,103 | 1,448,538,770 |
| ㈜툴젠 | 78,507,959,400 | (*3) | 14.12% | (*3) | (*3) |
| ㈜큐로젠 | 3,000,180,000 | 6,905,948,087 | 6.16% | 425,517,960 | (2,574,662,040) |
| Rezolute, Inc | 2,330,924,210 | (*3) | 4.61% | (*3) | (*3) |
| CoImmune, Inc | - | (3,809,513,711) | 22.94% | (874,033,444) | - |
| ILKOGEN | - | 2,207,416,204 | 50.00% | 1,103,708,102 | 1,103,708,102 |
| KinGen Biotech, Inc | - | (5,836,767,673) | 50.00% | (2,918,379,091) | - |
| ㈜에스엘포젠 | 10,172,034,502 | 11,408,161,519 | 97.01% | 11,067,009,384 | 894,974,882 |
| 소계 | 175,859,082,664 | 210,022,110,010 | 49,704,946,233 | 872,559,714 | |
| 합계 | 204,934,766,810 | 218,854,450,784 | 50,806,659,466 | (10,178,500,044) | |
| 취득원가로 측정하는 시장성 없는 투자주식 가산항목 | 3,447,221,754 | ||||
| 취득원가로 측정하는 시장성 없는 투자주식 차감항목 | (13,625,721,798) | ||||
(*1) 피투자회사 순자산가액은 각 회사의 감사받은 연결 및 별도재무상태표 및 합병법인 제시자료 상 순자산가액을 기준으로 하였습니다.
(*2) 지분율은 합병법인에서 제공받은 지분율을 사용하였습니다.
(*3) 해당 투자주식은 시장성 있는 투자주식이므로 조정하지 아니하였습니다.
(주6) 분석기준일 현재 합병법인이 보유한 시장성 있는 투자주식의 내역은 다음과 같으며, 이 중 분석기준일의 종가와 최근 사업연도말 재무상태표에 계상된 금액의 차이를 조정하였습니다.
| (단위: 원) |
| 구분 |
장부가액 |
보유주식수(*1) | 분석기준일 종가 | 종가상당액 | 조정금액 |
|---|---|---|---|---|---|
| (A) | (B) | (C) | (D = B x C) | (D - A) | |
| [기타포괄손익-공정가치측정금융자산] | |||||
| I-Mab | 9,041,991,220 | 8,488,885 | 1,064 | 9,034,794,122 | (7,197,098) |
| ㈜지아이이노베이션 | 3,651,511,500 | 151,515 | 10,330 | 1,565,149,950 | (2,086,361,550) |
| ㈜와이바이오로직스 | 2,761,059,600 | 176,991 | 10,450 | 1,849,555,950 | (911,503,650) |
| ㈜프로젠 | 164,450,000 | 23,000 | 5,940 | 136,620,000 | (27,830,000) |
| 소계 | 15,619,012,320 | 8,840,391 | 12,586,120,022 | (3,032,892,298) | |
| [종속관계기업투자주식] | |||||
| 네오이뮨텍 | 42,395,400,000 | 20,936,000 | 1,662 | 34,795,632,000 | (7,599,768,000) |
| ㈜툴젠 | 78,507,959,400 | 1,118,347 | 70,300 | 78,619,794,100 | 111,834,700 |
| Rezolute, Inc | 2,330,924,210 | 1,826,019 | 5,366 | 9,798,490,995 | 7,467,566,785 |
| 소계 | 123,234,283,610 | 23,880,366 | 123,213,917,095 | (20,366,515) | |
| 합계 | 138,853,295,930 | 32,720,757 | 135,800,037,117 | (3,053,258,813) | |
| 시장성 있는 투자주식 가산항목 | 7,579,401,485 | ||||
| 시장성 있는 투자주식 차감항목 | (10,632,660,298) | ||||
(*1) 보유주식수는 합병법인에서 제공받은 보유주식수를 사용하였습니다.
(주7) 최근 사업연도말 이후부터 분석기준일 현재까지 2023년말 별도재무상태표상 종속관계기업투자주식에 대하여 9,816,054,100원의 손상차손을 추가로 계상하였습니다. 다만 이 금액은 모두 (주6)의 시장성 있는 투자주식의 최근 사업연도말 재무상태표에 계상된 금액과 분석기준일의 종가 차이로 이미 반영되어 있습니다.
2.2. 피합병법인의 합병가액 산정
「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 및 「증권의 발행 및 공시 등에 관한 규정」 제5-13조와 동규정 시행세칙 제4조에 의하여 비상장법인의 합병가액은 자산가치와 수익가치를 각각 1과 1.5의 비율로 가중산술평균한 가액(이하 "본질가치")으로 산정하였으며, 상대가치는 비교목적으로 분석하였으나 3개 이상의 유사회사가 존재하지 않아 가치를 산정하지 아니하였습니다.
피합병법인의 본질가치 및 합병당사회사의 합병가액 결정방법에 따른 피합병법인의 주당 합병가액 평가결과는 다음과 같습니다.
| (단위: 원) |
|
구분 |
금액 |
|---|---|
| 가. 본질가치[(Ax1+Bx1.5)/2.5] | 40,512 |
| A. 자산가치 | 2,824 |
| B. 수익가치 | 65,638 |
| 나. 상대가치 | N/A |
| 다. 합병가액(=가) | 40,512 |
출처: 회사제시자료, 태성회계법인 Analysis
피합병법인의 합병가액 산정을 위하여 금융감독원 "외부평가업무 가이드라인"의 문단 30의 내용에 따라 다음과 같이 (주)이피디바이오테라퓨틱스의 최근 주식거래 현황 등을 고려하였습니다. 금융감독원 "외부평가업무 가이드라인"의 문단 30에 의하면 평가자는 대상자산의 최근 3년간 거래가격, 과거평가실적 등이 존재하고 입수가능한 경우 이를 고려하여 최종가치 산출에 반영여부를 검토하여야 하며, 시장에서 충분한 기간 거래된 후 그 대상물건의 내용에 정통한 거래 당사자 간에 성립된다고 인정되는 적정가격과 평가방법으로 구한 가치가 차이가 나는 경우 반드시 가치 조정 여부를 고려하여야하며, 가치조정을 하지 않는 경우 가치조정을 하지 않는 사유를 문서화하고 평가의견서에 기재하여야 합니다.
(1) 최근 3년간의 유상증자 등 현황
| (단위: 원, 주) |
|
구분 |
발행일자 | 증자방식 | 발행주식수 | 주당 발행가액 |
|---|---|---|---|---|
| 설립(*) | 2021-08-06 | 주주배정 |
400,000 |
50 |
| 유상증자(*) | 2021-09-03 | 제3자배정 |
45,500 |
6,591 |
| 유상증자(*) | 2021-10-01 | 제3자배정 |
30,400 |
6,591 |
| 유상증자(*) | 2021-10-09 | 제3자배정 |
15,200 |
6,591 |
| 유상증자(*) | 2022-04-01 | 제3자배정 |
90,400 |
27,693 |
| 유상증자(*) | 2022-04-02 | 제3자배정 |
1,200 |
27,693 |
| 유상증자(*) | 2022-06-28 | 제3자배정 |
66,700 |
27,693 |
| 유상증자(**) |
2024-04-30 | 제3자배정 |
14,760 |
33,876 |
(*) 2022년 실시한 무상증자와 액면분할이 반영된 발행주식수와 주당 발행가액입니다.
출처: 회사제시자료 및 태성회계법인 Analysis
(**) 최근 유상증자 발행가액은 별도 외부평가 없이 특수관계 없는 제3자와 협의를 통해 기존 유상증자의 주당 발행가액(최근 국내 신약개발사 상장 시 공모시총을 기초로 산정)을 고려하여 결정되었습니다.
(2) 최근 3년간 주식양수도 현황
| (단위: 원, 주) |
| 거래일자 | 양수자 | 양도자 | 거래주식수 | 주당 거래가액 |
|---|---|---|---|---|
| 해당사항 없음 | ||||
출처: 회사제시자료
(3) 최근 3년간 장외주식 거래 현황
| (단위: 원) |
| 구분 | 인터넷 주소 | 주당 거래가액 |
|---|---|---|
| 38커뮤니케이션 | http://www.38.co.kr | 해당사항 없음 |
| 프리스닥 | http://presdaqfunding.co.kr | 해당사항 없음 |
| 피스톡 | http://www.pstock.co.kr | 해당사항 없음 |
출처: 상기 인터넷 사이트
상기 장외시장 거래사이트를 확인한 결과, 동 사이트에 게시된 피합병법인의 최근 3년간 시세정보 및 거래내역은 존재하지 않습니다.
(4) 최근 3년간의 평가실적
| (단위: 원) |
| 목적 | 평가기준일 | 주당 평가액 | 평가방법 |
|---|---|---|---|
| 해당사항 없음 | |||
(5) 검토의견
피합병법인은 최근 3년간 7건(설립 제외)의 유상증자를 실시하고 양수도 거래는 발생하지 않았으며, 해당 주식 거래에서 본 평가인은 구체적인 평가방법 및 주요 가정사항에 대한 정보를 입수할 수 없었습니다. 따라서 금융감독원 "외부평가업무 가이드라인"의 문단30의 내용에 따른, "시장에서 충분한 기간 거래된 후 그 대상물건의 내용에 정통한 거래당사자 간에 성립한다고 인정되는 적정가격"이라고 판단할 수 있는 충분하고 합리적인 근거를 확인하지 못하였습니다. 이에 따라 본 평가에서 산정한 피합병법인의 합병가액에 대한 추가적인 가치 조정은 반영하지 아니하였습니다. 또한 최근 유상증자 주당 발행가액이 피합병법인의 합병가액 산정을 위한 자산가치 및수익가치 각각과 차이가 있으나 이를 모두 고려한 본질가치(합병가액)와는 현저한 차이가있다고 볼 수 없어 피합병법인의 합병가액에 대한 추가적인 가치 조정은 반영하지 아니하였습니다.
2.2.1. 피합병법인의 자산가치 산정
피합병법인의 1주당 자산가치는 「증권의 발행 및 공시 등에 관한 규정 시행세칙」 제5조에 의거하여, 주요사항보고서 제출일이 속하는 사업연도의 직전 사업연도말 현재의 재무상태표 상의 자본총계에서 일부 조정항목을 가감하여 산정한 순자산가액을 분석기준일 현재의 발행주식총수로 나누어 산정하였습니다.
| (단위: 원, 주) |
|
구분 |
금액 |
|---|---|
| 가. 최근사업연도말 별도재무제표상 자본총계(주1) | (6,135,019,263) |
| 나. 조정항목(A - B) | 8,018,402,048 |
| A. 가산항목 | 8,018,402,048 |
| (1) 최근사업연도말 현재 자기주식 | - |
| (2) 분석기준일까지 유상증자 등에 의하여 증가한 자본금(주2) | 7,380,000 |
|
(3) 분석기준일까지 전환권(또는 신주인수권) 행사 등에 의하여 증가한 자본금 |
- |
| (4) 분석기준일까지 자본잉여금 및 재평가잉여금 증가액(주2) | 492,629,760 |
| (5) 분석기준일까지 이익잉여금의 증감을 수반하지 아니한 중요한 순자산 증가액 | - |
| (6) 분석기준일 현재 전환주식등 향후 자본금을 증가시킬 수 있는 증권의 권리 행사 가능성(주3) | 7,518,392,288 |
| (7) 분석기준일 현재 투자주식 중 취득원가로 측정하는 시장성 없는 투자주식의 순자산가액이 재무상태표에 계상된 금액보다 높은 경우 차이 금액. 단, 손상이 발생한 경우는 제외 | - |
| (8) 분석기준일 현재 투자주식 중 시장성 있는 주식의 종가가 재무상태표에 계상된 금액보다 높은 경우 차이 금액 | - |
| (9) 분석기준일까지 발생한 오류수정이익 | - |
| B. 차감항목 | - |
| (1) 분석기준일 현재 실질가치 없는 무형자산 | - |
| (2) 분석기준일 현재 회수가능성 없는 채권 | - |
| (3) 분석기준일 현재 퇴직급여채무 또는 퇴직급여충당부채 과소설정액 | - |
| (4) 분석기준일까지 손상차손이 발생한 자산의 손상차손 | - |
| (5) 분석기준일까지 유상감자에 의하여 감소한 자본금 | - |
| (6) 분석기준일까지 배당금 지급, 전기오류수정손실 등 | - |
| (7) 분석기준일까지 이익잉여금의 증감을 수반하지 아니한 중요한 순자산 감소액 | - |
| (8) 분석기준일 현재 투자주식 중 취득원가로 측정하는 시장성 없는 주식의 순자산가액이 재무상태표에 계상된 금액보다 낮은 경우 차이 금액 | - |
| (9) 분석기준일 현재 투자주식 중 시장성 있는 주식의 종가가 재무상태표에 계상된 금액보다 낮은 경우 차이 금액 | - |
| 다. 조정된 순자산가액(가 + 나) | 1,883,382,785 |
| 라. 발행주식총수 | 666,957 |
| (1) 분석기준일 현재 재무상태표상 발행주식총수(주4) | 666,957 |
| (2) 분석기준일까지 전환주식등 향후 자본금을 증가시킬 수 있는 증권의 권리 행사 가능성(주3) | - |
| 마. 1주당 자산가치 (다 ÷ 라) | 2,824 |
출처: 피합병법인 제시자료, 태성회계법인 Analysis
(주1) 증권의 발행 및 공시 등에 관한 규정 시행세칙 제5조에 따라 주요사항보고서를 제출하는 날이 속하는 사업연도의 직전 사업연도말인 2023년 12월 31일 현재 일반기업회계기준(K-GAAP)에 의하여 작성된 재무상태표를 한국채택국제회계기준(K-IFRS)으로 전환한 재무상태표 상 금액을 적용하였으며, 피합병법인의 2023년 12월 31일로 종료하는 사업연도의 재무상태표는 다음과 같습니다.
| (단위: 원) |
|
구분 |
금액 |
|---|---|
| 자산 | |
| Ⅰ. 유동자산 | 968,176,291 |
| 현금및현금성자산 | 880,910,083 |
| 기타유동자산 | 87,266,208 |
| Ⅱ. 비유동자산 | 835,998,523 |
| 유형자산 | 772,272,782 |
| 무형자산 | 5,300,733 |
| 기타비유동자산 | 58,425,008 |
| 자산총계 | 1,804,174,814 |
| 부채 | |
| Ⅰ. 유동부채 | 7,679,000,736 |
| 기타유동부채 | 160,608,448 |
| 전환우선주 | 2,299,719,143 |
| 전환상환우선주 | 1,692,029,371 |
| 파생금융부채 | 3,526,643,774 |
| Ⅱ. 비유동부채 | 260,193,341 |
| 기타비유동부채 | 260,193,341 |
| 부채총계 | 7,939,194,077 |
| 자본 | |
| 자본금 | 200,000,000 |
| 보통주자본금 | 200,000,000 |
| 우선주자본금 | - |
| 자본잉여금 | - |
| 기타자본 | (104,151,412) |
| 이익잉여금(결손금) | (6,230,867,841) |
| 자본총계 | (6,135,019,263) |
| 부채와자본총계 | 1,804,174,814 |
(Source: 피합병법인 제시자료, K-IFRS로 전환된 재무제표)
(주2) 최근 사업연도말부터 분석기준일까지 피합병법인의 유상증자 현황은 다음과 같으며 이로 인하여 자본금과 자본잉여금이 증가하였습니다.
| (단위: 원, 주) |
| 구분 | 내용 |
|---|---|
| 발행형태 | 상환전환우선주식 |
| 증자방식 | 제3자배정증자 |
| 이사회 결의일 | 2024-04-23 |
| 발행주식수 | 14,760 |
| 액면가 | 500 |
| 발행가 | 33,876 |
| 자본금 | 7,380,000 |
| 자본잉여금 | 492,629,760 |
(Source: 피합병법인 제시자료)
(주3) 2021년 4월 1일에 개정되어 2021년 4월 12일부터 시행된 증권의 발행 및 공시 등에 관한 규정 시행세칙에 따르면 전환사채 등과 관련하여 향후 자본금을 증가시킬 수 있는 증권의 권리가 행사될 가능성이 확실한 경우에는 권리 행사를 가정하여 이를 순자산 및 발행주식의 총수에 반영한다라고 기재되어 있습니다. 피합병법인의 최근 사업연도말 재무상태표에는 주식매입선택권*1)이 존재합니다.
*1) 피합병법인은 2022년 10월 31일과 2023년 11월 20일 두 차례에 걸쳐 총 32,860주의 주식선택권을 부여하였으며 행사가격은 모두 22,150원입니다. 분석기준일 현재 1,520주가 소멸되어 31,340주로 변경되었습니다. 주식선택권의 1주당 행사가격 22,150원은 분석기준일 현재 합병가액을 고려할 때 합리적인 투자자라면 주식선택권의 행사가능성이 높은 상황입니다. 다만 피합병법인은 본 건 합병을 위한 이사회 전인 2024년 6월 25일에 주식선택권을 부여받은 임직원과의 합의를 통해 주식선택권의 부여를 취소하였습니다. 이를 고려하여 피합병법인의 주식선택권 행사가액 694,181,000원을 순자산 증가액에 반영하지 않고, 주식선택권 행사에 따른 행사가능 주식수 31,340주도 발행주식 총수에 가산하지 않았습니다.
한편, 금융감독원이 제정한 "외부평가업무 가이드라인(2009.6)" 붙임2의 문단11 "전환가능증권(CB, BW등)이 있는 경우, 해당 증권의 전환 여부를 고려하여 주식수를 산출하고 최종 주당가치를 산출해야 한다"는 규정에 따라, 피합병법인이 발행한 전환우선주와 전환상환우선주 전량이 합병기일 전에 보통주로 전환한다는 내용의 합병계약서에 근거하여 전환우선주, 전환상환우선주 그리고 이와 관련된 항목(상환할증금 및 파생금융부채)의 장부가액을 순자산가액에 가산하였으며, 보통주식으로의 전환시 발행할 주식수를 피합병법인의 발행주식총수에 합산 반영하였습니다. 순자산가액에 가산 반영한 최근 사업연도말 현재 전환우선주와 전환상환우선주의 장부가액 내역은 다음과 같습니다.
| (단위: 원) |
|
구분 |
금액 |
|---|---|
| 전환우선주 | 2,299,719,143 |
| 전환상환우선주(*) | 1,692,029,371 |
| 파생금융부채(**) | 3,526,643,774 |
| 합계 | 7,518,392,288 |
(*) 전환상환우선주의 주계약 가치로 발행일시점의 가치를 유효이자율법을 적용하여 상각한 장부가액입니다.
(**) 전환상환우선주의 전환권과 상환권의 상호의존성을 고려하여 하나의 내재파생상품으로 분리하였으며, 매 결산기말 공정가치로 평가하고 있습니다.
(주4) 분석기준일 현재 재무상태표상 발행주식총수는 아래와 같이 산정하였습니다.
| (단위: 주) |
|
구분 |
주식수 |
|---|---|
| A. 보통주 | 400,000 |
| B. 전환우선주의 보통주 전환 주식(*1) | 91,100 |
| C. 제1회 상환전환우선주의 보통주 전환 주식(*2) | 158,300 |
| D. 제2회 상환전환우선주의 보통주 전환 주식(*3) | 17,557 |
|
E. 발행주식총수( D = A + B + C + D ) |
666,957 |
(*1) 전환우선주의 보통주 전환 주식수는 아래와 같이 산정되었습니다.
| (단위: 원, 주) |
|
구분 |
내용 |
|---|---|
| a. 피합병법인 본질가치[(①x1+②x1.5)÷2.5] | 27,020,025,813 |
| ① 피합병법인의 자산가치 | 1,883,382,785 |
| ② 피합병법인의 수익가치 | 43,777,787,831 |
| b. 전환주식(*) 1주당 보통주 1주 전환시 총 주식수 | 664,160 |
| c. 합병가액(c = a / b) | 40,683 |
| d. 전환우선주 발행가액 | 6,591 |
| e. 조정 후 우선주 1주당 전환하는 보통주의 수(e = 1 x d / (c x 70%)) | 1 |
| f. 전환우선주 주식수 | 91,100 |
| g. 보통주 전환 주식수(g = e x f) | 91,100 |
(*) 피합병법인이 발행한 보통주로 전환 가능한 증권인 전환우선주, 상환전환우선주, 주식선택권을 모두 포함한 수량입니다.
전환우선주의 전환비율 적용시 발행금액 대비 합병대가 금액은 다음과 같습니다.
| (단위: 원, 주) |
| 주주 | 우선주 발행금액 | 보통주 전환 후 합병대가 | 발행금액 대비 비율(B/A) |
||
|---|---|---|---|---|---|
| 주식수 | 금액 | 주식수 | 금액 | ||
| (주)퓨처플레이 |
45,500 | 299,886,405 | 45,500 | 1,843,313,998 | 615% |
| 미래에셋 Innovative Growth 투자조합 |
15,200 | 100,181,832 | 15,200 | 615,788,413 | 615% |
| (주)반반벤처스 | 6,100 | 40,204,551 | 6,100 | 247,125,613 | 615% |
| 고광표 | 4,500 | 29,659,095 | 4,500 | 182,305,780 | 615% |
| 고광민 | 1,600 | 10,545,456 | 1,600 | 64,819,833 | 615% |
| 조유희 | 1,500 | 9,886,365 | 1,500 | 60,768,593 | 615% |
| 황혜진 | 1,500 | 9,886,365 | 1,500 | 60,768,593 | 615% |
| 경기하나버팀목재기지원펀드2호 | 15,200 | 100,181,832 | 15,200 | 615,788,413 | 615% |
| 합계 | 91,100 | 600,431,901 | 91,100 | 3,690,679,236 | 615% |
2021년 8월 24일, 9월 29일, 10월 6일 전환우선주 투자자와 우선주인수계약서를 작성하였습니다. 일반적인 전환비율은 우선주 1주당 보통주 1주로 전환 되지만 우선주인수계약서상 회사가 타사와의 합병시 교환비율 산정을 위한 회사 주식의 평가가액의 70%가 그 당시 본건 우선주식의 전환가격을 하회하는 경우에는 전환비율이 조정됩니다. 우선주인수계약서상의 주요 요약은 다음과 같습니다.
| 제3조(본건 우선주식의 내용) 4. 전환에 관한 사항 다. 최초의 전환가격은 본건 우선주식 인수가격으로 하여 최초의 전환비율은 1로서 본건 우선주식 1주당 전환대상 주식 1주로 전환한다. 마. 회사가 타사와의 합병시 교환비율 산정을 위한 회사 주식의 평가가액의 70%가 그 당시의 본건 우선주식의 전환가격을 하회하는 경우, 본건 우선주식의 전환가격은 평가가액의 70%로 조정한다. |
(Source: 피합병법인 제시자료)
전환우선주 계약의 조건에 따라 피합병법인의 1주당 합병가액은 다음의 방식으로 산출하였습니다.
(a) 피합병법인의 자산가치 및 수익가치를 현재의 (전환가격 및 전환비율 조정 전 기준) 발행주식총수로 나누어 잠정 합병가액 산정
(b) 잠정 합병가액의 70%가 기존 전환가격을 초과하므로, 전환가격을 조정하지 않음
(c) 피합병법인의 자산가치 및 수익가치를 조정된 전환가격을 기준으로 한 잠재주식을 포함한 발행주식 총수로 나누어 최종 합병가액 산정
(*2) 제1회 상환전환우선주의 보통주 전환 주식수는 아래와 같이 산정되었습니다.
| (단위: 원, 주) |
|
구분 |
내용 |
|---|---|
| a. 피합병법인 본질가치[(①x1+②x1.5)÷2.5] | 27,020,025,813 |
| ① 피합병법인의 자산가치 | 1,883,382,785 |
| ② 피합병법인의 수익가치 | 43,777,787,831 |
| b. 전환주식(*) 1주당 보통주 1주 전환시 총 주식수 | 664,160 |
| c. 합병가액(c = a / b) | 40,683 |
| d. 상환전환우선주 발행가액 | 27,693 |
| e. 조정 후 우선주 1주당 전환하는 보통주의 수(e = 1 x d / (c x 70%)) | 1.0000000 |
| f. 상환전환우선주 주식수 | 158,300 |
| g. 보통주 전환 주식수(g = e x f) | 158,300 |
(*) 피합병법인이 발행한 보통주로 전환 가능한 증권인 전환우선주, 상환전환우선주, 주식선택권을 모두 포함한 수량입니다.
제1회 상환전환우선주의 전환비율 적용시 발행금액 대비 합병대가 금액은 다음과 같습니다
| (단위: 원, 주) |
| 주주 | 우선주 발행금액 | 보통주 전환 후 합병대가 | 발행금액 대비 비율(B/A) |
||
|---|---|---|---|---|---|
| 주식수 | 금액 | 주식수 | 금액 | ||
| 미래에셋 바이오 프론티어 투자조합 | 54,200 | 1,500,960,600 | 54,200 | 2,195,771,840 | 146% |
| 하나테크밸류업펀드 | 36,200 | 1,002,486,600 | 36,200 | 1,466,548,720 | 146% |
| 류종우 | 600 | 16,615,800 | 600 | 24,307,437 | 146% |
| 용예령 | 600 | 16,615,800 | 600 | 24,307,437 | 146% |
| 퓨처플레이혁신솔루션펀드 | 12,500 | 346,162,500 | 12,500 | 506,404,945 | 146% |
| 메디톡스투자조합1호 | 54,200 | 1,500,960,600 | 54,200 | 2,195,771,840 | 146% |
| 합계 | 158,300 | 4,383,801,900 | 158,300 | 6,413,112,219 | 146% |
2022년 3월 29일, 6월 24일 상환전환우선주 투자자와 우선주인수계약서를작성하였습니다. 일반적인 전환비율은 우선주 1주당 보통주 1주로 전환 되지만 우선주인수계약서상 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우에는 전환비율이 조정됩니다. 우선주인수계약서상의 주요 요약은 다음과 같습니다.
| 제11조 전환권에 관한 사항 ③ 전환비율은 다음과 같다. 명확하게 하기 위하여 본 항의 각 호는 중복적으로 적용한다. 1. 본건 종류주식의 보통주로의 전환비율은 종류주식 1주당 보통주 1주로 한다. 2. 회사의 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우는 전환비율을 다음과 같이 조정한다. 조정 후 우선주 1주당 전환하는 보통주의 수 = 조정 전 우선주 1주당 전환되는 보통주의 수 x 조정 전 본건 우선주식의 전환가격 / 조정기준단가의 [70]%에 해당하는 금액 |
(Source: 피합병법인 제시자료)
상환전환우선주 계약의 조건에 따라 피합병법인의 1주당 합병가액은 다음의 방식으로 산출하였습니다.
(a) 피합병법인의 자산가치 및 수익가치를 현재의 (전환가격 및 전환비율 조정 전 기준) 발행주식총수로 나누어 잠정 합병가액 산정
(b) 잠정 합병가액의 70%가 기존 전환가격을 초과하므로, 전환가격을 조정하지 않음
(c) 피합병법인의 자산가치 및 수익가치를 조정된 전환가격을 기준으로 한 잠재주식을 포함한 발행주식 총수로 나누어 최종 합병가액 산정
(*3) 제2회 상환전환우선주의 보통주 전환 주식수는 아래와 같이 산정되었습니다.
| (단위: 원, 주) |
|
구분 |
내용 |
|---|---|
| a. 피합병법인 본질가치[(①x1+②x1.5)÷2.5] | 27,020,025,813 |
| ① 피합병법인의 자산가치 | 1,883,382,785 |
| ② 피합병법인의 수익가치 | 43,777,787,831 |
| b. 전환주식(*) 1주당 보통주 1주 전환시 총 주식수 | 664,160 |
| c. 합병가액(c = a / b) | 40,683 |
| d. 상환전환우선주 발행가액 | 33,876 |
| e. 조정 후 우선주 1주당 전환하는 보통주의 수(e = 1 x d / (c x 70%)) | 1.1895455 |
| f. 상환전환우선주 주식수 | 14,760 |
| g. 보통주 전환 주식수(g = e x f) | 17,557 |
(*) 피합병법인이 발행한 보통주로 전환 가능한 증권인 전환우선주, 상환전환우선주, 주식선택권을 모두 포함한 수량입니다.
제2회 상환전환우선주의 전환비율 적용시 발행금액 대비 합병대가 금액은 다음과 같습니다
| (단위: 원, 주) |
| 주주 | 우선주 발행금액 | 보통주 전환 후 합병대가 | 발행금액 대비 비율(B/A) |
||
|---|---|---|---|---|---|
| 주식수 | 금액 | 주식수 | 금액 | ||
| 이노헬스펀드1호 | 8,856 | 300,005,856 | 10,534 | 426,757,575 | 142% |
| ㈜ 이노큐브 | 5,904 | 200,003,904 | 7,023 | 284,518,554 | 142% |
| 합계 | 14,760 | 500,009,760 | 17,557 | 711,276,129 | 142% |
2024년 4월 23일 상환전환우선주 투자자와 우선주인수계약서를 작성하였습니다. 일반적인 전환비율은 우선주 1주당 보통주 1주로 전환 되지만 우선주인수계약서상 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우에는 전환비율이 조정됩니다. 우선주인수계약서상의 주요 요약은 다음과 같습니다.
| 제11조 전환권에 관한 사항 ③ 전환비율은 다음과 같다. 명확하게 하기 위하여 본 항의 각 호는 중복적으로 적용한다. 1. 본건 종류주식의 보통주로의 전환비율은 종류주식 1주당 보통주 1주로 한다. 2. 회사의 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우는 전환비율을 다음과 같이 조정한다. 조정 후 우선주 1주당 전환하는 보통주의 수 = 조정 전 우선주 1주당 전환되는 보통주의 수 x 조정 전 본건 우선주식의 전환가격 / 조정기준단가의 [70]%에 해당하는 금액 |
(Source: 피합병법인 제시자료)
상환전환우선주 계약의 조건에 따라 피합병법인의 1주당 합병가액은 다음의 방식으로 산출하였습니다.
(a) 피합병법인의 자산가치 및 수익가치를 현재의 (전환가격 및 전환비율 조정 전 기준) 발행주식총수로 나누어 잠정 합병가액 산정
(b) 잠정 합병가액의 70%가 기존 전환가격을 미달하므로, 전환가격을 잠정 합병가액의 70%로 하향 조정
(c) 피합병법인의 자산가치 및 수익가치를 조정된 전환가격을 기준으로 한 잠재주식을 포함한 발행주식 총수로 나누어 최종 합병가액 산정
2.2.2. 피합병법인의 수익가치 산정
피합병법인인 이피디바이오의 주당 수익가치는 증권의 발행 및 공시 등에 관한 규정시행세칙 제6조에 따라 미래의 수익가치 산정에 관하여 일반적으로 공정하고 타당한것으로 인정되는 모형 중에서 현금흐름할인모형을 적용하여 산정하였습니다.
상기 평가방법에 의한 이피디바이오의 1주당 수익가치는 다음과 같으며, 상세내역은 "3.3 피합병법인의 수익가치 산정 세부내역"에 기술되어 있습니다.
| (단위: 백만원, 주, 원/주) |
| 내역 | 금액 |
|---|---|
| A. 추정기간동안의 현재가치 | 39,091 |
| B. 영구현금흐름의 현재가치 | 2,688 |
| C. 이월결손금 효과 | 1,999 |
| D. 영업가치(D=A+B+C) | 43,778 |
| E. 비영업용자산부채의 가치 | - |
| F. 기업가치(F=D+E) | 43,778 |
| G. 차입금 | - |
| H. 주주가치(H=F-G) | 43,778 |
| I. 발행주식수(단위: 주)(주1) | 666,957 |
| J. 1주당 수익가치(J=H/I) (원/주) | 65,638 |
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
(주1) 발행주식수는 전환우선주 및 상환전환우선주의 조정된 전환가격을 기준으로 한 잠재주식을 포함한 발행주식 총수를 적용하였습니다.
2.2.3. 피합병법인의 상대가치 산정
자본시장과금융투자업에관한법률 시행령 제176조의5에 의하면 주권상장법인과 주권비상장법인 간의 합병인 경우 비상장법인의 합병가액 산정시 주권상장법인 중 유사회사를 선정하여 유사회사의 주가를 기준으로 한 상대가치를 증권신고서에 비교하여 공시하도록 하고 있습니다. 이에 따른 유사회사의 선정 및 검토결과는 아래와 같습니다.
(1) 유사회사 선정조건
증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조에 의하면, 상대가치를 산출하기위해서는 유사회사를 선정하며, 유사회사는 피합병법인과 한국거래소 업종분류에 따른 소분류 업종이 같은 주권상장법인 중 매출액에서 차지하는 비중이 가장 큰 제품 또는 용역의 종류가 유사한 법인으로서 최근 사업연도말 주당법인세비용차감전계속사업이익과 주당순자산을 비교하여 각각 100분의 30이내의 범위에 있는 법인이면서다음 각 호의 요건을 구비하는 3사 이상의 주권상장법인으로 하여야 합니다.
요건 1. 주당법인세비용차감전계속사업이익이 액면가액의 10% 이상일 것
요건 2. 주당순자산이 액면가액 이상일 것
요건 3. 상장일이 속하는 사업연도의 결산을 종료하였을 것
요건 4. 최근사업연도의 재무제표에 대한 감사인의 감사의견이 "적정" 또는 "한정"일 것
따라서, 본 합병비율의 평가 시 상대가치 산정은 증권의 발행 및 공시 등에 관한 규정시행세칙 제7조의 한국거래소 업종분류에 따른 소분류 업종이 피합병법인과 동일한 주권상장법인 중 매출액에서 차지하는 비중이 가장 큰 제품 또는 용역의 종류가 유사한법인으로서 최근 사업연도말 주당법인세비용차감전계속사업이익과 주당순자산을비교하여 각각 100분의 30 이내의 범위에 있는 법인 중 상기 요건 1부터 요건 4를 충족하는 유사회사의 존재 여부를 검토하였습니다.
(2) 유사회사의 검토결과
피합병법인은 한국거래소 업종분류에 따른 소분류 업종분류상 "자연과학 및 공학 연구개발업"을 영위하고 있습니다. 분석기준일 현재 소분류 업종분류상 "자연과학 및 공학 연구개발업"을 영위하는 주권상장법인(코넥스 제외)은 총 54개사입니다.
1) 제품 또는 용역의 종류가 유사한 주권상장법인 검토
분석기준일 현재 피합병법인과 유사한 소분류 업종분류인 "자연과학 및 공학 연구개발업"을 영위하는 주권상장법인 54개사 중 매출액에서 차지하는 비중이 가장 큰 제품 또는 용역이 피합병법인의 주요 매출부문과 유사한 회사는 14개사입니다.
이하 분석기준일 현재 "자연과학 및 공학 연구개발업"을 영위하는 주권상장법인 54개사의 '주요 제품 또는 용역' 및 '유사기업 해당여부에 대한 검토 결과'는 다음과 같습니다.
| 회사명 | 주요 제품 또는 용역 | 유사기업여부 |
|---|---|---|
| CG인바이츠 | 의약품 연구개발 중 임상시험분석 | 미해당 |
| CJ 바이오사이언스 | 미생물 유전체 생명정보 분석 플랫폼 및 솔루션 | 미해당 |
| EDGC | 진단시약 및 진단키트 판매 | 미해당 |
| HLB바이오스텝 | 실험실 구축, 기자재 납품 | 미해당 |
| HLB제약 | 전문약 제조 및 판매 | 미해당 |
| SK바이오팜 | 신약연구개발(중추신경계 분야, 항암제 ) | 미해당 |
| 고바이오랩 | 신약연구개발(마이크로바이옴 치료제 등) | 미해당 |
| 내츄럴엔도텍 | 고기능성 건강기능식품 소재와 자연주의 화장품 | 미해당 |
| 네오이뮨텍 | 신약연구개발(교모세포종, 폐암 등 고형암, 거대B세포림프종 등) | 해당 |
| 드림씨아이에스 | 임상시험수탁(CRO) | 미해당 |
| 디앤디파마텍 | 신약연구개발(비알콜성지방간염, 섬유화질환 등) | 미해당 |
| 디엔에이링크 | 유전체분석서비스 | 미해당 |
| 디티앤씨알오 | 임상시험수탁(CRO) | 미해당 |
| 랩지노믹스 | 유전체분자진단 | 미해당 |
| 리가켐바이오 | 신약연구개발(ADC와 합성신약 등) | 미해당 |
| 메드팩토 | 신약연구개발(저분자화합물, 항체 등으로 암 치료제) | 해당 |
| 메지온 | 사료판매, 신약연구개발(발기부전, 전립성비대증, 단심실증 치료제 등) | 미해당 |
| 모아라이프플러스 | 전문의약품유통, 신약연구개발(면역조절, 항암제 등) | 미해당 |
| 바이오인프라 | 임상시험수탁(CRO) | 미해당 |
| 바이오톡스텍 | 비임상CRO | 미해당 |
| 바이젠셀 | 신약연구개발(면역항암세포치료제 등) | 해당 |
| 박셀바이오 | 신약연구개발(면역항암세포치료제 등), 반려동물헬스케어 | 미해당 |
| 셀리드 | 신약연구개발(면역항암세포백신 등) | 미해당 |
| 셀리버리 | 신약연구개발(파킨슨병, 췌장암 등) | 해당 |
| 신라젠 | 신약연구개발(항암) | 해당 |
| 싸이토젠 | 바이오/진단 서비스 | 미해당 |
| 아이엠비디엑스 | 암 정밀의료 | 미해당 |
| 아이진 | 신약연구개발(노화 관련 성인질환, 백신 등) | 미해당 |
| 알테오젠 | 바이오의약품 연구개발, 생산 및 판매 | 미해당 |
| 압타머사이언스 | 신약연구개발(항암) | 해당 |
| 압타바이오 | 신약연구개발(항암) | 해당 |
| 에이디엠코리아 | 임상시험수탁(CRO) | 미해당 |
| 에이비온 | 신약연구개발(바이오마커, 비소세포폐암 등) | 해당 |
| 에이프릴바이오 | 신약연구개발(자가면역질환, 염증질환, 암 등) | 해당 |
| 올릭스 | 신약연구개발(비대흉터치료, 탈모, 황반변성 등) | 미해당 |
| 와이바이오로직스 | 신약연구개발(항체치료제) | 해당 |
| 우정바이오 | 시험대행, 감염관리 등 | 미해당 |
| 인벤티지랩 | 장기지속형 주사제 개발 | 해당 |
| 제넥신 | 신약연구개발(암, 빈혈, DNA백신 등) | 해당 |
| 지노믹트리 | 암 조기진단 기술 및 제품 개발 | 미해당 |
| 지니너스 | 암 유전체 진단, 세포 분석 솔루션 | 미해당 |
| 지아이이노베이션 | 신약연구개발(면역항암제, 알레르기 등) | 해당 |
| 진매트릭스 | 의료용 진단 시약 개발, 판매 | 미해당 |
| 차백신연구소 | 신약연구개발(백신) | 미해당 |
| 카이노스메드 | 신약연구개발(뇌질환, 에이즈 등) | 미해당 |
| 큐라클 | 신약연구개발(혈관내피기능장애, 고령화 등) | 미해당 |
| 큐라티스 | 신약연구개발(백신) | 미해당 |
| 큐로셀 | 신약연구개발(CAR-T치료제) | 미해당 |
| 큐리언트 | 의약품 유통, 신약연구개발(항암 등) | 미해당 |
| 툴젠 | 신약연구개발(유전자교정) | 미해당 |
| 티움바이오 | 신약연구개발(희귀/난치성 질환) | 미해당 |
| 파로스아이바이오 | 신약연구개발(희귀/난치성 질환) | 해당 |
| 프레스티지바이오파마 | 바이오시밀러, 항체 신약 개발 | 미해당 |
| 헬릭스미스 | 신약연구개발(유전자치료 등) | 미해당 |
(Source: 한국거래소, 전자공시시스템)
2) 증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조 제5항
주요 매출부문 및 제품 또는 용역의 종류가 피합병법인과 유사기업에 해당하는 주권상장법인 14개사 중 증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조 제5항의 네가지 요건을 모두 충족하는 주권상장법인은 없습니다.
| (단위: 원) |
| 상대가치 요건 1: 증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조 제5항 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 회사명 | 액면 가액 |
요건1 | 요건2 | 요건3 | 요건4 | 유사회사 여부 | ||||
| 주당법인세비용차감전계속사업이익 | 충족여부(주1) | 주당순자산 | 충족여부(주2) | 상장일 | 충족여부(주3) | 감사의견 | 충족여부(주4) | |||
| 네오이뮨텍(*) | 0.0001 | (2.0395) | 미충족 | 3.0640 | 충족 | 2021-03-16 | 충족 | 적정 | 충족 | 미충족 |
| 메드팩토 | 500 | (1,665) | 미충족 | 3,342 | 충족 | 2019-12-19 | 충족 | 적정 | 충족 | 미충족 |
| 바이젠셀 | 500 | (937) | 미충족 | 3,749 | 충족 | 2021-08-25 | 충족 | 적정 | 충족 | 미충족 |
| 셀리버리 | 500 | (652) | 미충족 | (902) | 미충족 | 2018-11-09 | 충족 | 의견거절 | 미충족 | 미충족 |
| 신라젠 | 500 | (168) | 미충족 | 548 | 충족 | 2016-12-06 | 충족 | 적정 | 충족 | 미충족 |
| 압타머사이언스 | 500 | (801) | 미충족 | 912 | 충족 | 2020-09-16 | 충족 | 적정 | 충족 | 미충족 |
| 압타바이오 | 500 | (659) | 미충족 | 2,751 | 충족 | 2019-06-12 | 충족 | 적정 | 충족 | 미충족 |
| 에이비온 | 500 | (1,524) | 미충족 | 521 | 충족 | 2021-09-08 | 충족 | 적정 | 충족 | 미충족 |
| 에이프릴바이오 | 1,000 | (662) | 미충족 | 2,704 | 충족 | 2022-07-28 | 충족 | 적정 | 충족 | 미충족 |
| 와이바이오로직스 | 500 | (1,667) | 미충족 | 1,870 | 충족 | 2023-12-05 | 충족 | 적정 | 충족 | 미충족 |
| 인벤티지랩 | 500 | (3,212) | 미충족 | 525 | 충족 | 2022-11-22 | 충족 | 적정 | 충족 | 미충족 |
| 제넥신 | 500 | (967) | 미충족 | 8,212 | 충족 | 2009-09-15 | 충족 | 적정 | 충족 | 미충족 |
| 지아이이노베이션 | 500 | (1,275) | 미충족 | 1,661 | 충족 | 2023-03-30 | 충족 | 적정 | 충족 | 미충족 |
| 파로스아이바이오 | 500 | (737) | 미충족 | 2,343 | 충족 | 2023-07-27 | 충족 | 적정 | 충족 | 미충족 |
(*) 금액단위가 USD 입니다.
(Source: 한국거래소, 전자공시시스템, 태성회계법인 Analysis)
(주1) 주당법인세차감전계속사업이익이 액면가액의 10% 이상
(주2) 주당순자산이 액면가액 이상
(주3) 상장일이 속하는 사업연도의 결산종료
(주4) 최근 사업연도 재무제표에 대한 외부감사인의 감사의견이 "적정" 또는 "한정"
3) 증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조 제1항 제1호
상기 증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조 제5항에 따른 유사회사가 존재하지 않으므로 증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조 제1항 제1호에 따른 유사회사(유사회사의 최근 사업연도말 주당법인세비용차감전계속사업이익과 주당순자산을 피합병법인과 비교하여 각각 100분의 30 이내의 범위)는 검토하지 않았습니다.
4) 유사회사 검토결과
증권의 발행 및 공시 등에 관한 규정 시행세칙 제7조에 따른 유사회사 요건을 충족하는 법인이 3사 미만이므로, 비교목적으로 공시되는 피합병법인의 상대가치는 산정하지 아니하였습니다.
3. 피합병법인에 대한 이해 및 수익가치 산정 세부내역
3.1. 피합병법인의 주요 사업분야에 대한 이해
(1) 글로벌 신약개발 시장 현황
글로벌 신약개발 시장은 혁신적인 치료법을 제공하며 전 세계 의료 패러다임을 변화시키고 있습니다. 2024년 현재 이 시장은 지속적인 성장을 거듭하며 여러 요인에 의해 주도되고 있습니다. 주요 요인으로는 고령화 사회의 도래, 만성 질환의 증가, 바이오테크놀로지의 발전, 그리고 규제 환경의 변화 등이 있습니다 .
글로벌 신약개발 시장은 2023년 약 1.3조 달러 규모에 달했으며, 2024년부터 2030년까지 연평균 성장률(CAGR)이 7.2%에 이를 것으로 예상됩니다.(*1) 특히 항암제, 면역치료제, 희귀질환 치료제 등의 분야에서 강력한 성장이 기대됩니다.
이 중 항암제 시장은 가장 빠르게 성장하는 분야 중 하나로, 면역치료제와 항체약물접합체(ADC) 및 PROTAC 등 새로운 치료 패러다임이 주요 동력입니다. 2023년 기준 항암제 시장은 약 2,000억 달러에 달했으며, 향후 10년간 연평균 12% 이상의 성장률을 보일 것으로 전망됩니다.(*2)
희귀질환 치료제 시장은 비교적 작은 시장이지만, 높은 가격 상승과 빠른 승인 절차 덕분에 수익성이 높습니다. 글로벌 희귀질환 치료제 시장은 2023년 약 1,500억 달러규모로 평가되었으며 연평균 성장률은 11%로 예상됩니다.(*3)
한편 바이오의약품의 비중이 점차 증가하면서 단백질 기반 약물, 세포 치료제, 유전자 치료제 등이 주목 받고 있습니다. 2024년 바이오의약품 시장은 전체 신약개발 시장의 약 35%를 차지할 것으로 보입니다.(*4)
신약개발 시장은 글로벌 제약사와 바이오테크 기업 간의 협력과 경쟁이 매우 치열한 분야입니다. 주요 기업으로는 화이자(Pfizer), 로슈(Roche), 노바티스(Novartis), 존슨앤드존슨(Johnson & Johnson), 머크(Merck) 등이 있습니다. 이들은 혁신적인 신약 개발 뿐만 아니라, 바이오테크 스타트업과의 협력 및 인수합병(M&A), 라이선스(License) 계약 등을 통해 파이프라인을 강화하고 있습니다.
각국의 규제 당국은 신약의 안전성과 효능을 보장하기 위해 엄격한 승인 절차를 운영하고 있습니다. 미국 FDA, 유럽 EMA, 일본 PMDA 등의 기관이 대표적입니다. 최근몇 년간 혁신 치료제에 대한 신속 승인 프로그램이 도입되면서 신약 출시 속도가 빨라지고 있습니다.
신약개발 시장은 기술 혁신과 규제 환경의 변화에 크게 영향을 받으며, 지속적인 투자가 이루어지고 있습니다. 향후 10년간 신약개발 시장의 성장은 전 세계적인 건강 증진과 치료 가능성 확대에 중요한 역할을 할 것입니다.
(*1) MarketsandMarkets: "Pharmaceutical Drug Delivery Market - Global Forecast to 2028"
Grand View Research: "Drug Discovery Market Size, Share & Trends Analysis Report By Type (Small Molecule Drugs, Biologics), By Service (Drug Metabolism And Pharmacokinetics (DMPK) Studies, Drug Toxicology Testing), By End Use, By Region, And Segment Forecasts, 2023 - 2030"
(*2) GlobalData: "Global Oncology Market Size, Share & Trends Analysis Report By Product (Targeted Therapy, Immunotherapy), By Cancer Type (Lung, Breast, Colorectal), By Region, And Segment Forecasts, 2022 - 2030"
BCC Research: "Global Market for Cancer Therapeutics"
(*3) EvaluatePharma: "World Preview 2023, Outlook to 2028"
Orphan Drug Report: "Orphan Drug Market: Global Industry Trends, Share, Size, Growth, Opportunity and Forecast 2023-2030"
(*4) IQVIA Institute: "Global Medicine Spending and Usage Trends: Outlook to 2027"
BioPlan Associates: "11th Annual Report and Survey of Biopharmaceutical Manufacturing Capacity and Production
3.2. 피합병법인에 대한 이해 및 과거 재무제표
3.2.1. 피합병법인 개요
평가대상회사는 생명공학 관련 제품의 연구, 개발, 제조, 가공 및 매매를 목적으로 2021년 8월 6일 설립되었습니다. 회사의 최대주주는 대표이사이며, 본사는 서울특별시구로구 디지털로 306, 대륭포스트타워 2차 1207호에 소재하고 있습니다.
3.2.2. 주주현황 및 연혁
(1) 주주현황
분석기준일 현재 회사의 주요 주주현황은 다음과 같습니다.
| 주주명 | 주식의 종류 | 보유주식수 | 지분율 |
|---|---|---|---|
|
최재현 대표이사 |
보통주 |
300,000 |
45.2% |
|
이승현 CFO
|
보통주 |
100,000 |
15.1% |
|
㈜퓨처플레이 |
전환우선주 |
45,500 |
6.9% |
|
㈜반반벤처스 |
전환우선주 |
6,100 |
0.9% |
|
고광표 |
전환우선주 |
4,500 |
0.7% |
|
고광민 |
전환우선주 |
1,600 |
0.2% |
|
조유희 |
전환우선주 |
1,500 |
0.2% |
|
황혜진 |
전환우선주 |
1,500 |
0.2% |
|
류종우 |
상환전환우선주 |
600 |
0.1% |
|
용예령 |
상환전환우선주 |
600 |
0.1% |
|
미래에셋바이오프론티어 투자조합 |
상환전환우선주 |
54,200 |
8.2% |
|
메디톡스투자조합1호
|
상환전환우선주 |
54,200 |
8.2% |
|
하나테크밸류업펀드 |
상환전환우선주 |
36,200 |
5.5% |
|
미래에셋InnovativeGrowth 투자조합
|
전환우선주 |
15,200 |
2.3% |
|
경기하나버팀목재기지원펀드2호
|
전환우선주 |
15,200 |
2.3% |
|
퓨처플레이혁신솔루션펀드
|
상환전환우선주 |
12,500 |
1.9% |
|
이노헬스펀드1호
|
상환전환우선주 |
8,856 |
1.3% |
|
㈜이노큐브 |
상환전환우선주 |
5,904 |
0.9% |
|
합계
|
664,160 |
100.0% |
|
(Source: 회사제시자료)
(2) 연혁
회사의 주요 연혁은 다음과 같습니다.
| 연도 | 내용 |
|---|---|
| 2021년 8월 | 법인 설립 |
| 2021년 10월 | 1차 증자(6억원) |
| 2022년 3월 | 본사 이전(서울시 구로구) |
| 2022년 6월 | 2차 증자(44억원) / 기업부설연구소 인증 |
| 2022년 11월 | TIPS 창업사업화 과제 선정 |
| 2023년 6월 | 이노큐브 공모전 수상 |
| 2023년 10월 | TIPS 해외마케팅 과제 선정 |
| 2023년 11월 | KHIDI-Amgen 학회 3위 수상 |
| 2024년 2월 | Takeda-Korea Acceleration Program 대상 기업 선정 |
| 2024년 4월 | 3차 증자(5억원) |
3.2.3 평가대상회사의 주요 사업현황
대상회사의 주요사업은 생명공학 연구 및 치료물질 개발로 구성되어 있습니다. 의견서 제출일 현재 대상회사가 체결한 라이선스, 공동개발 계약 등 경영상의 주요 계약과 연구개발 활동은 다음과 같습니다.
가. 경영상의 주요 계약
(1) 주요 라이선스 아웃(License-Out) 계약
해당 사항 없음
(2) 주요 라이선스 인(License-In) 계약
해당 사항 없음
(3) 제약/바이오 기업과의 공동개발(Co-development) 및 기타 상업화 계약
[공동개발 및 기타 상업화 계약 총괄표]
| # | 계약목적(*1) | 체결일 | 계약 주체 | 진행단계 | 계약규모(*1) | |
|---|---|---|---|---|---|---|
| 파트너사 | 소멸회사 계약주체 |
|||||
| 1 | bioPROTAC 기술 기반 독성 X 단백질 제거 및 치료제 개발 | 2024.05.16 | 일리미스테라퓨틱스 | 이피디바이오테라퓨틱스 | Discovery | N/A(비용수령) |
(*1) 비밀유지계약에 따라 표적 단백질은 X로 표시하고, 계약 규모는 기재하지 않았습니다.
1) 품목: bioPROTAC기술 기반 독성 X 단백질 치료제
| 계약 주체 |
이피디바이오테라퓨틱스 |
| 계약 상대방 |
일리미스테라퓨틱스 |
| 계약 내용 |
bioPROTAC 기술 기반 독성 X 단백질 제거 및 치료제 개발 관련 공동 연구 수행 |
| 대상 지역 |
전세계 |
| 계약 기간 |
계약체결일로부터 32주 동안 단계별 공동연구 수행. 단, 양 당사자의 서면합의로 공동연구기간을 변경할 수 있음 |
| 총 계약금액 |
주) |
| 지급 금액 |
주) |
| 계약 조건 |
- 연구계획서에 기재된 바에 따라 공동연구를 수행하도록 함. - 양사에서 각자 지정된 연구책임자는 매월 1회 이상 회의를 하며, 공동연구 진행 사항, 결과 등을 상호 보고 및 논의함. - 이피디바이오는 연구계획서에 따라 각 단계별 공동연구를 수행을 완료한 후 일리미스테라퓨틱스에게 결과보고서를 제출하고, 일리미스테라퓨틱스는 다음 단계의 공동연구 진행여부에 대해 이피디바이오에 통지함. 공동연구는 연구계획서에 따라 최종후보물질이 도출되었다고 이피디바이오가 일리미스테라퓨틱스에게 서면 통지하는 날 완료. - 일리미스테라퓨틱스는 공동연구 완료 후 3개월 이내에 최종후보물질에 대한 POC 연구 진행여부를 결정하고 이피디바이오에게 통지함. - 일리미스테라퓨틱스가 POC연구를 진행하기로 이피디바이오에게 통지한 경우, 이피디바이오는 최종후보물질의 염기서열을 일리미스테라퓨틱스에게 전달함. - 일리미스테라퓨틱스는 POC연구 착수일로부터 1년동안 POC연구를 수행함. 단, 양 당사자의 서면합의로 POC 연구기간을 연장할 수 있음. |
| 회계처리방법 |
- 양사 합의된 연구단계 및 비용에 따라 일리미스테라퓨틱스가 연구비를 지급 - 연구비 지급에 규정된 경우를 제외하고 공동연구에 소요되는 각 당사자의 인건비, 재료비 등 제반 비용은 각 당사자가 각자 부담함. |
| 대상기술 |
이피디바이오테라퓨틱스에서 보유한 bioPROTAC 기반 유전자치료제 기술 |
| 개발진행경과 |
Discovery 연구단계 |
| 기타사항 |
- |
주) 양사간 비밀유지계약에 따라 기재를 생략하였습니다.
나. 연구개발 활동
(1) 연구개발활동의 개요
대상회사는 난치성 암 치료제, 아토피를 비롯한 면역질환 치료제, 치매 등의 뇌질환 치료제 등 다양한 차세대 표적단백질분해제 파이프라인의 성공적인 개발을 위하여 전문성을 갖춘 연구개발인력을 확보하고 연구개발부문을 구축해왔습니다. 연구개발부문 인원은 총 14명으로 전 임직원수 대비 93.3%를 차지하고 있습니다.
(2) 연구개발 담당조직
대상회사는 의견서 제출일 현재 총 15명의 임직원 중 임원을 포함한 연구개발인력이14명인 연구중심 초기 바이오 벤처기업입니다. 특히 연구인력 14명 중 박사학위 소지자는 9명, 석사학위소지자는 4명으로 석ㆍ박사급 인력의 비중이 92.9%를 차지합니다.
[연구개발 조직 구성]
| 본부 |
팀명 |
주요업무 |
| 연구소 |
플랫폼발굴팀 |
표적단백질분해제 후보물질의 디자인 및 엔지니어링 |
| 약물평가팀 |
표적단백질분해제 후보물질의 in vitro 유효성 평가, 약효평가 및 기전 연구 |
|
| 연구지원팀 |
국가과제 수행 지원, 전자연구노트관리, 실험실 안전관리 |
|
| 약물개발본부 |
비임상개발팀 |
표적단백질분해제 후보물질의 GMP생산, 독성평가, 약동학ㆍ약력학 분석 및 임상시험 허가문서 작성 |
1) 연구개발인력 현황
의견서 제출일 현재 대상회사는 임원을 포함해 박사급 9명, 석사급 4명, 학사급 1명 총 14명의 연구개발인력을 보유하고 있으며, 그 현황은 아래와 같습니다.
[연구개발인력 현황]
(단위: 명)
| 구분 |
인원 |
|||
| 박사 |
석사 |
학사 |
합계 |
|
| 대표이사 및 임원 |
2 | - | - | 2 |
| 플랫폼발굴팀 |
1 | 2 | - | 3 |
| 약물평가팀 |
5 | 2 | - | 7 |
| 연구지원팀 |
- | - | 1 | 1 |
| 비임상개발팀 |
1 | - | - | 1 |
| 합계 | 9 | 4 | 1 | 14 |
[연구개발인력 변동]
(단위: 명)
| 구분 |
2021년말 |
2022년말 |
2023년말 |
의견서 제출일 현재 |
| 박사 |
3 | 5 | 8 | 9 |
| 석사 |
1 | 5 | 4 | 4 |
| 학사 |
- | 1 | 1 | 1 |
| 합계 |
4 | 11 | 13 | 14 |
2) 핵심 연구개발인력
대상회사의 연구개발을 담당하는 임원 및 핵심 연구개발인력의 주요 이력은 아래와 같습니다.
[핵심 연구개발인력 현황]
| # |
성명 |
직급 |
담당업무 |
최종학위 |
근속연수 |
주요경력 |
주요연구개발실적 |
| 1 | 최재현 | 대표이사 |
연구개발총괄 |
박사 |
2년 11개월 |
Univ. of Toronto 의과학 박사 '07~'11 Transition Therapeutics (캐나다) '11~'15 삼성전자 종합기술원 '16~'19 Trillium Therapeutics (캐나다) '19~'21 Arvinas (미국) '21~현재 이피디바이오테라퓨틱스 CEO |
- 총 19년간 신약개발 경력 (해외 기업: 10년) - 논문 출판: 13건 / 특허 출원: 11건 - 총 3개의 임상단계 약물 개발에 기여 (ELND005, SAIT-301, TTI-622) - Arvinas에서 신규 과제 2개 기획 및 런칭 - TIPS R&D 사업 연구책임자 (과제번호: S3201518) |
| 2 | 이승현 |
전무 |
연구총괄 |
박사 |
2년 11개월 |
아주대 분자과학기술학 박사 '10~'16 삼성전자 종합기술원 '17~'21 유틸렉스 R&D센터 '21~현재 이피디바이오테라퓨틱스 CTO |
- 치료용항체 및 치료용 단백질 다수의 원천물질 개발 이중항체, CAR-T 세포치료제, ADC용 항체 다수 개발 - 코로나바이러스 중화단백질 개발 - 미국 최종등록완료 특허 23건 외 출원 다수 및 논문 출판 13건 - 임상단계 약물 개발 3건 (SAIT301, EU103, EU307) - 2024 국가신약개발재단 과제 연구책임자 (과제번호: RS-2024-00337873) |
| 3 | 용예령 | 이사 |
약물평가팀장 |
박사 |
2년 3개월 |
연세대 생화학박사 '09~'10 연세대학교 (박사후과정) |
- 퇴행성 관절염의 새로운 기전 발견을 통한 치료제 개발
- 엑소좀, miRNA, CTC 이용한 암진단기술 개발
- SAIT301 항암항체약물의 임상1상 검체 분석
- 난치암 환자의 암조직 및 암세포주 은행 구축
- 골관절염 세포유전자치료제 Invossa 공정 개발 및 특성 분석
- 면역항암 이중항체 개발
- bioPROTAC 플랫폼의 항암제, 아토피치료제 개발
- 국제특허등록 2건을 포함한 15건 국제특허 출원
- Nature cell biology (2007) 외 3편 논문 발표
|
| 4 | 최기영 |
부장 |
비임상개발팀장 |
박사 |
10개월 |
서울대 이학박사 '14~'21 셀리드 연구개발기획팀장 '22 액트테라퓨틱스 연구소장 및 개발본부장 '22~'23 큐라미스 '23~현재 이피디바이오테라퓨틱스 비임상개발팀장 |
- CMC개발 및 규제대응업무이력 다수 - 비임상개발연구 및 GLP tox 관리이력 다수 - 공정 및 시험법 개발연구 및 DS 관리이력 다수 - bioPROTAC 비임상개발 총괄 - 총 6건의 임상개발물질에 기여 - 논문 5편 발표 |
| 5 | 장자영 |
수석 |
약물평가 |
박사 |
10개월 |
고려대 생명공학 박사 '18~'23 Weill cornell medicine (박사후과정) '23~현재 이피디바이오테라퓨틱스 수석연구원 |
- 2017 Best Research Award, School of Life Science at Korea University - 2021 학문후속세대지원 (박사후 국외연수, 한국연구재단) - SCI 논문 11편 발표 - 특허 2건 국내 출원 및 1건 해외 등록 |
| 6 | 김영훈 |
책임 |
약물평가 |
박사 |
1년
|
연세대 감염 및 면역생물학 박사 '18~'20 연세대학교 의과대학 (미생물학교실, 박사후과정) |
- 미생물을 이용한 MASH 완화 및 원발경화성 담관염 치료제 전임상 및 IND 단계에 기여 - 연세대학교 의과대학 최우수 학술상 및 논문상 (대상, 장려) 수상 - 제 1저자 논문 Nature communications, Autophay 포함 총 6편 (총 IF: 50.217) 발표 |
| 7 | Bai Xuelian | 책임 |
플랫폼발굴 |
박사 |
2년 2개월 |
이화여대 생명과학 박사 '20~'22 프로지니어 '22~현재 이피디바이오테라퓨틱스 책임연구원 |
- 3종의 항체라이브러리 제작경험 보유 - 신규 항체 라이브러리 제작관련 기술이전 2건 - 논문 3편 발표, 특허 5건 출원 |
| 8 | 송성미 |
책임 |
약물평가 |
박사 |
2년 9개월 |
서울대 약학 박사 '20~'21 서울대학교 약학대학 (박사후 과정) '21~현재 이피디바이오테라퓨틱스 책임연구원 |
- mRNA 기반 bioPROTAC 신규 후보물질 발굴 연구 및 In vitro 항암 효능 평가 - ‘Nature’ 자매지 ‘Cell death & Disease’ 항암제 분야 논문 1저자 (BK21 Excellent paper award) - SCI 상위 20 % 항암제 분야 논문 4편 a및 리뷰 논문 1편 발표 |
| 9 | 이수현 |
책임 |
약물평가 |
박사 |
6개월 |
연세대학교 이학박사 '23~'23 연세대학교 (시스템생물학, 박사후과정) '24~ 현재 이피디바이오테라퓨틱스 책임연구원 |
- 파킨슨병 관련 제 1저자로서 총 3편의 논문 발표 - BK21 FOUR Research Symposium 우수 구두 발표상 수상 (2022) - BK21 연세바이오시스템교육연구단-Best Research Awards 우수 논문상 수상 (2022) |
| 10 | 오연지 |
책임 |
플랫폼발굴 |
석사 |
2년 2개월 |
이화여대 약학 석사 '16~'18 SK텔레콤 연구원 '18~'22 유틸렉스 선임연구원 '22~현재 이피디바이오테라퓨틱스 책임연구원 |
- T세포 면역분야관련 SCI급 국제학술지 1건 발표
- 특허 3건 등록 및 3건 출원
|
| 11 | 임새이 |
책임 |
약물평가 |
석사 |
1년 10개월 |
충남대 이학석사 '19~'22 에이비엘바이오 '22~현재 이피디바이오테라퓨틱스 책임연구원 |
- 면역항암이중항체 연구 개발 및 평가 - Bioprotac 기반 항암제 연구개발 및 평가 - 특허 5건 출원 |
| 12 | 전유나 |
선임 |
플랫폼발굴 |
석사 |
1년 10개월 |
울산대 의과학석사 '21~'22 유틸렉스 주임연구원 '22~현재 이피디바이오테라퓨틱스 선임연구원 |
- 퇴행성 뇌질환 및 항체 분야 논문 2편 발표 - bioPROTAC 관련 특허 2건 출원
|
| 13 | 송혜린 |
선임 |
약물평가 |
석사 |
2년 4개월 |
강원대 이학석사 '22~ 현재 이피디바이오테라퓨틱스 선임연구원 |
- bioPROTAC degrader 후보물질의 효능평가 - SCIE급 논문 2편 발표
|
| 14 | 이미란 |
연구원 |
연구지원 |
학사 |
1년 8개월 |
한서대 식품생물공학 학사 '22~현재 이피디바이오테라퓨틱스 연구원 |
- 국가과제관리, 전자연구노트시스템 관리 등 업무 진행중 |
(3) 연구개발비용
대상회사는 의견서 제출일 현재 연구 및 임상개발 등에 소요되는 모든 직접 비용을 아래와 같이 당기비용으로 회계처리하고 있습니다.
[연구개발비용 현황]
(단위: 천원)
| 구분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 | |
|---|---|---|---|---|---|
| 비용의 성격별 분류 | 재료비 | 93,116 | 568,531 | 432,132 | 28,885 |
| 종업원 급여 | 162,973 | 487,903 | 260,652 | - | |
| 외주용역비 | 25,146 | 309,662 | 158,148 | 25,000 | |
| 기타 | 3,020 | 7,943 | 28,032 | 28,131 | |
| 합계 | 284,255 | 1,374,039 | 878,965 | 82,016 | |
| 회계처리 내역 | 판관비 | 284,255 | 1,374,039 | 878,965 | 82,016 |
| 제조경비 | - | - | - | - | |
| 개발비(무형자산) | - | - | - | - | |
| 합계 | 284,255 | 1,374,039 | 878,965 | 82,016 | |
| 연구개발비/매출액 비율 | - | - | - | - | |
(4) 연구개발실적
1) 연구개발 진행 현황 및 향후 계획
의견서 제출일 현재 대상회사의 주요 신약 파이프라인 연구개발 현황은 아래와 같습니다.
[주요 신약 파이프라인 연구개발 진행 총괄표]
| 구분 | 품목 | 적응증 | 현재 진행단계 | 비고 | |
|---|---|---|---|---|---|
| 단계 | 승인일 | ||||
| bioPROTAC 기반 유전자치료제 |
EPD-301 | 폐암 |
비임상개발 |
- | - |
| EPD-401 | 아토피피부염, 고형암 |
후보물질도출 |
- | - | |
| EPD-201 | 제1형 척수소뇌실조증 |
Discovery | - | - | |
| EPD-501 | 중추신경계질환 |
Discovery | - | 일리미스테라퓨틱스 공동연구 |
|
(가) 품목: EPD-301 (bioPROTAC 기반 폐암 유전자치료제)
| 구분 |
bioPROTAC 기반 유전자치료제 신약 |
| 적응증 |
폐암 (폐암 중 기존 치료제에 대한 반응성이 낮은 폐편평세포암, 소세포폐암) |
| 작용기전 |
유비퀴틴화에 의한 SOX2 단백질 특이적 분해 |
| 제품의 특성 |
- siRNA의 경우 약물 투여 이전에 이미 발현되어 존재하는 SOX2 단백질에는 아무 영향을 미칠 수 없으나, 당사의 차세대 TPD는 약물 투여 이전에 이미 존재하는 SOX2 단백질도 투여되자마자 바로 분해시킬 수 있으므로 보다 신속하고 효과적인 치료 효능을 보임. - SOX2와 같은 전사인자 (transcription factor)는 활성부위나 결합포켓이 존재하지 않아 기존의 저분자화합물 기반의 PROTAC으로 접근하기 어려운 타겟이므로 당사의 차세대 TPD와 같은 새로운 플랫폼의 필요성이 큰 분야임. |
| 진행경과 |
- 후보물질 선별 연구완료 - 후보물질 In vitro / In vivo 유효성 및 예비안전성 확인 - 최종 LNP 제형 선정 연구 중 (단백체분석, 예비 분포시험 등) |
| 향후계획 |
- 2024년 4Q 비임상시료 제조 - 2025년 IND enabling study 및 GLP tox study 진행 - 2025년 임상시험용 시료 3배치 제조 - 2025년 4Q 식약처 임상시험 1상 IND 승인신청 |
| 경쟁제품 |
SOX2 siRNA |
| 관련논문 등 |
- 2022년 미국 5th Annual TPD summit
학회 구두발표 - 2023년 KHIDI-Amgen Science Academy Pitching Day 3위 수상 - 2024년 Takeda-Korea Startup/Biopharma Acceleration Program 2023 1위 수상 - 2024년 미국 AACR annual meeting 2024 학회 포스터발표 - 2024년 독일 The European mRNA Conference 2024 학회 구두발표 |
| 시장규모 |
- 전세계 폐암 시장규모 (연평균 9% 성장) : 348억달러(약45.6조원)(2023) a
582억달러(약76.6조원)(2028) (출처: 대신증권 Industry Report, 2024.04) |
| 기타사항 |
- |
(나) 품목: EPD-401 (bioPROTAC 기반 아토피피부염 / 고형암 유전자치료제)
| 구분 |
bioPROTAC 기반 유전자치료제 신약 |
| 적응증 |
아토피피부염, 고형암 |
| 작용기전 |
유비퀴틴화에 의한 STAT3 단백질 분해 |
| 제품의 특성 |
- 현재 개발중인 경쟁약물들은 모두 저분자화합물 (small molecule) 기반 약물로써 STAT3와 상동성이 높은 STAT1, STAT6까지 저해하거나 분해하기 때문에 이로 인한 독성이 야기될 수 있음. 반면에 STAT3 결합을 위해 나노바디 기술 접목한 당사의 STAT3 차세대 표적단백질분해제 치료제는 경쟁 약품 대비 우월한 selectivity 보유 가능함 - 저분자화합물 리간드를 사용하여 제한된 개수의 E3 단백질을 recruit하는 PROTAC 대비 현존하는 모든 E3 단백질을 활용 가능한 당사 차세대 TPD 플랫폼의 차별성으로 인해 기존 STAT3 PROTAC보다 더 강력한 STAT3 분해 약물 도출이 가능함 |
| 진행경과 |
- 후보물질 선별 연구 중 - 후보물질 In vitro / In vivo 유효성 및 예비안전성 확인 중 |
| 향후계획 |
- 2025년 2Q 최종 후보물질 선별 완료 - 2025년 4Q 비임상시료 제조 |
| 경쟁제품 |
저분자화합물 기반 STAT3 저해제, PROTACs |
| 관련논문 등 |
- |
| 시장규모 |
- 전세계 아토피피부염 시장규모: 10조원(2024) (출처: https://www.biotimes.co.kr/news/articleView.html?idxno=11813) |
| 기타사항 |
- |
(다) 품목: EPD-201 (bioPROTAC 기반 제1형 척수소뇌실조증 유전자치료제)
| 구분 |
bioPROTAC 기반 유전자치료제 신약 |
| 적응증 |
제1형 척수소뇌실조증 |
| 작용기전 |
유비퀴틴화에 의한 Ataxin1 단백질 분해 |
| 제품의 특성 |
- Ataxin1과 같은 전사인자 (transcription factor)는 활성부위나 결합포켓이 존재하지 않아 기존의 저분자화합물 기반 PROTAC으로 접근하기 어려운 타겟이므로 당사의 차세대 TPD와 같은 새로운 플랫폼의 필요성이 큰 분야임. - 현재 마땅한 치료제가 없고 문헌상 결과로 판단했을 때 상대적으로 낮은 분해효율만으로도 치료효과가 기대되는 상황이므로, 자사 치료제의 치료 효과를 기대할 수 있음. |
| 진행경과 |
- 후보물질 선별 연구 중 - 후보물질 In vitro / In vivo 유효성 및 예비안전성 확인 중 |
| 향후계획 |
- 2025년 2Q 최종 후보물질 선별 완료 - 2025년 4Q 비임상시료 제조 |
| 경쟁제품 |
Ataxin1 타겟 ASO, 승인받은 치료제 없음 |
| 관련논문 등 |
- |
| 시장규모 |
- 전세계 척수소뇌 실조증 환자: 약 30만명 추산 (2020년) - 국내 척수소뇌 실조증 환자: 약 4000명 추산 (2020년) (출처: http://biospectator.com/view/news_view.php?varAtcId=11531)
- 현재 승인받은 치료제 없음 |
| 기타사항 |
- |
(라) 품목: EPD-501 (bioPROTAC 기반 중추신경계 질환 유전자치료제)
| 구분 |
bioPROTAC 기반 유전자치료제 신약 |
| 적응증 |
중추신경계 질환 (CNS disease) |
| 작용기전 |
주) |
| 제품의 특성 |
주) |
| 진행경과 |
- 타겟에 효율적으로 작용하는 E3 단백질 스크리닝 연구 완료 - 후보물질 도출 연구 중 |
| 향후계획 |
- 2024년 4Q 최종 후보물질 도출 |
| 경쟁제품 |
주) |
| 관련논문 등 |
- |
| 시장규모 |
- 전세계 CNS disease 시장규모 : 860억달러(약111.8조원)(2019) a
1,310억달러(약170.3조원)(2025) (출처: http://www.bosa.co.kr/news/articleView.html?idxno=2133957) |
| 기타사항 |
- |
주) 양사간 비밀유지계약에 따라 기재를 생략하였습니다.
(5) 정부 및 민간과제 수행실적
[정부 및 민간과제 수행 실적]
(단위: 천원)
| # | 연구과제명 | 주관부서 | 연구기간 | 정부출연금 | 관련제품 | 비고 |
|---|---|---|---|---|---|---|
| 1 | biologics 기반 신규 표적단백질 분해제 개발 (TIPS)
|
중소벤처기업부 |
2021.11.01 ~ 2023.10.31 | 500,000 | EPD-301 | 완료 |
| 2 | BioPROTAC 표적단백질 분해제: EPDegTM (창업사업화)
|
중소벤처기업부 |
2022.11.01 ~ 2023.08.31 | 100,000 | EPD-301 | 완료 |
| 3 | 신진 연구인력 채용지원사업 |
중소벤처기업부 |
2023.06.01 ~ 2026.05.31 | 60,000 | EPD-301 | 진행중 |
| 4 | BioPROTAC 표적단백질 분해제: EPDegTM (해외마케팅)
|
중소벤처기업부 |
2023.09.01 ~ 2024.06.30 | 100,000 | EPD-301 | 완료 |
| 5 | 신규타겟 SOX2를 표적하는 신규모달리티 ‘차세대 TPD’ 선도물질 도출 |
국가신약개발재단 |
2024.04.01 ~ 2025.12.31 | 656,250 | EPD-301 | 진행중 |
(6) 대학교와의 연구협력 계약(Sponsored Research Agreement)
대상회사는 과학자문단인 이지민교수 (당시 강원대학교 교수, 현재 한국과학기술원 교수)와 설립 초기 협력을 통해 bioPROTAC의 개념검증 및 신규타겟발굴을 위한 연구를 진행하였으며, 성공적으로 해당 과제를 종료하고 파이프라인 개발에 연구결과를 활용하였습니다.
(7) 유사 신약개발회사의 연구개발 활동
대상회사와 유사한 표적 단백질 분해(Targeted Protein Degradation, TPD) 분야의 국내외 신약개발회사의 연구개발 활동은 아래와 같습니다.
(단위: B USD)
| 회사 | 주요 파이프라인 | 창립년도 | 임직원수 | 시가 | |
| 전임상 단계 | 임상 단계 | ||||
| 오름테라퓨틱 | 5개 | 1개 (1상 1개) | 2016 | - | 비상장 |
| 업테라 | 4개 | - | 2018 | - | 비상장 |
| 핀테라퓨틱스 | 3개 | - | 2017 | - | 비상장 |
| Arvinas | 6개 | 4개 (3상 1개, 2상 1개, 1상 2개) | 2013 | 445 | 1.976 |
| Kymera | 2개 | 3개 (2상 1개, 1상 2개) | 2015 | 186 | 2.595 |
| Nurix | 8개 | 3개 (1상 3개) | 2009 | 284 | 1.534 |
| C4 Therapeutics | 3개 | 2개 (1상 2개) | 2015 | 145 | 0.388 |
3.2.4 재무제표
(1) 재무상태표(주1)
| (단위: 백만원) |
|
구분 |
2021년 | 2022년 | 2023년 | 2024년 3월말 |
|---|---|---|---|---|
| Ⅰ.유동자산 | 356 | 2,620 | 968 | 727 |
| 현금및현금성자산 | 326 | 304 | 431 | 365 |
| 단기금융상품 | - | 2,200 | 450 | 250 |
| 수취채권(유동) | 6 | 32 | 5 | 59 |
| 기타자산(유동) | 24 | 83 | 72 | 41 |
| 당기법인세자산 | 0 | 1 | 10 | 11 |
| Ⅱ.비유동자산 | 3 | 1,092 | 836 | 706 |
| 유형자산 | 3 | 856 | 681 | 631 |
| 사용권자산 | - | 175 | 91 | 70 |
| 무형자산 | - | 5 | 5 | 5 |
| 수취채권(비유동) | - | 57 | 58 | - |
| 자산총계 | 359 | 3,712 | 1,804 | 1,432 |
| Ⅰ.유동부채 | 1,304 | 7,279 | 7,679 | 7,806 |
| 매입채무 및 기타채무 | 5 | 20 | 75 | 46 |
| 전환우선주 | 1,292 | 1,984 | 2,300 | 2,300 |
| 전환상환우선주 | - | 1,421 | 1,692 | 1,763 |
| 파생금융부채 | - | 3,776 | 3,527 | 3,570 |
| 리스부채(유동) | - | 67 | 70 | 63 |
| 복구충당부채(유동) | - | - | - | 48 |
| 기타부채(유동) | 6 | 12 | 16 | 16 |
| Ⅱ.비유동부채 | 24 | 229 | 260 | 232 |
| 리스부채(비유동) | - | 80 | 11 | - |
| 복구충당부채(비유동) | - | 47 | 48 | - |
| 확정급여채무 | 24 | 102 | 202 | 232 |
| 부채총계 | 1,328 | 7,508 | 7,939 | 8,039 |
| 자본금 | 20 | 200 | 200 | 200 |
| 주식발행초과금 | - | - | - | - |
| 기타자본 | - | (167) | (104) | (77) |
| 이익잉여금 | (989) | (3,829) | (6,231) | (6,729) |
| 자본총계 | (969) | (3,796) | (6,135) | (6,607) |
(Source: 피합병법인 제시자료)
(주1) 회사의 재무제표는 일반기업회계기준(K-GAAP)에 의하여 작성된 후 한국채택국제회계기준(K-IFRS)으로 전환되었으며, 2021년, 2022년, 2023년, 2024년 3월말 기준 재무제표는 감사받지 아니한 재무제표입니다. 본 평가인은 회사 제시 재무제표의 신뢰성 확보를 위하여 일반기업회계기준 재무제표에 대한 임의감사보고서와 한국채택국제회계기준 전환 항목 및 효과를 검토하였으며 또한 분석기준일 현재의 자산과 부채에 대한 실재성과 완전성을 질문과 문서검증 등의 방법으로 검토하는 절차를 수행하였습니다.
(2) 손익계산서(주1)
| (단위: 백만원) |
|
구분 |
2021년 | 2022년 | 2023년 | 2024년 3월말 |
|---|---|---|---|---|
| Ⅰ. 매출액 | - | - | - | - |
| Ⅱ. 매출원가 | - | - | - | - |
| III. 매출총이익 | - | - | - | - |
| IV. 판매비와관리비 | 294 | 1,723 | 2,410 | 578 |
| V. 영업이익(손실) | (294) | (1,723) | (2,410) | (578) |
| VI. 영업외수익 | 0 | 397 | 611 | 199 |
| VII. 영업외비용 | 695 | 1,515 | 593 | 116 |
| VIII. 법인세차감전순이익(손실) | (989) | (2,841) | (2,392) | (495) |
| Ⅸ. 법인세비용 | - | - | - | - |
| X. 당기순이익(손실) | (989) | (2,841) | (2,392) | (495) |
(Source: 피합병법인 제시자료)
(주1) 회사의 재무제표는 일반기업회계기준(K-GAAP)에 의하여 작성된 후 한국채택국제회계기준(K-IFRS)으로 전환되었으며, 2021년, 2022년, 2023년, 2024년 3월말 기준 재무제표는 감사받지 아니한 재무제표입니다. 본 평가인은 회사 제시 재무제표의 신뢰성 확보를 위하여 일반기업회계기준 재무제표에 대한 임의감사보고서와 한국채택국제회계기준 전환 항목 및 효과를 검토하였으며 또한 분석기준일 현재의 자산과 부채에 대한 실재성과 완전성을 질문과 문서검증 등의 방법으로 검토하는 절차를 수행하였습니다.
3.3. 피합병법인의 수익가치 산정 세부내역
3.3.1. 평가방법의 개요
피합병법인의 수익가치를 평가하기 위해서 현금흐름할인법을 사용하였습니다. 먼저 피합병법인의 향후 추정기간 동안 영업이익을 추정한 후 법인세 등을 감안한 세후영업이익에서 감가상각비, 운전자본의 증감을 반영하고, 투자현금흐름(CAPEX; Capital Expenditure)을 차감하여 기업잉여현금흐름(FCFF; Free Cash Flow to Firm)을 산출합니다. 이 기업잉여현금흐름에 내재된 위험을 반영한 적절한 가중평균자본비용(WACC; Weighted Average Cost of Capital)으로 할인하여 영업가치를 산정한 후 비영업자산을 가산하고, 이자부부채 및 부채성항목을 차감하여 피합병법인의 수익가치를 평가하였습니다.
이하 본 평가의견서 상 투자현금흐름은 편의상 약칭 "CAPEX", 기업잉여현금흐름은
"FCFF", 가중평균자본비용은 "WACC"로 기재합니다.
3.3.2. 주요 가정
(1) 평가기준일 및 분석기준일
본 평가는 주요사항보고서 제출일이 속하는 사업연도의 최근 결산 분기말인 2024년 3월 31일을 평가기준일로 하여 분석기준일까지 이용가능한 자료를 반영하여 수행하였습니다.
(2) 평가에 이용한 재무제표
본 평가시 피합병법인의 일반기업회계기준(K-GAAP)에 의하여 작성된 2021년~2023년 재무제표를 이용하였습니다. 또한, 분석기준일까지 이용가능한 피합병법인의 최근 결산 실적(2024년 3월)을 반영하여 수행하였습니다.
(3) 현금흐름 분석기간
현금흐름 분석기간은 합리적으로 예측 가능한 미래로서 현금흐름이 정상상태(Steady state)에 도달하리라 예측되는 기간으로 2024년 4월 1일부터 2047년 12월 31일까지 23년 9개월간의 현금흐름을 분석하였습니다. 또한 매기의 현금흐름은 연중에 균등하게 발생한다고 가정하였습니다.
(4) 계속기업 가정과 영구성장률
계속기업 가정 하에 2048년 이후의 영구현금흐름 산정 시 산업의 특성, 피합병법인의 과거 성장률 및 현금흐름 분석기간 동안의 현금흐름 연평균 성장률 등을 고려하여영구성장률은 0.0%를 적용하였습니다.
(5) 거시경제지표 및 법인세율
1) 거시경제지표
2024년부터 2028년까지 대한민국 소비자물가상승률, 명목임금상승률 등의 주요 거시경제지표는 The Economic Intelligence Unit(이하 "EIU")의 예측치를 적용하였습니다.
| 구분 | 2024년 | 2025년 | 2026년 | 2027년 | 2028년 |
|---|---|---|---|---|---|
| 소비자물가상승률 | 2.10% | 1.60% | 2.00% | 1.70% | 1.80% |
| 명목임금상승률 | 3.10% | 2.80% | 4.10% | 3.40% | 3.50% |
(Source: The Economic Intelligence Unit)
2) 법인세율
법인세비용 추정 시 피합병법인의 영업이익은 과세표준과 동일하다고 가정하였으며 하기 표의 국내 법인세법상 과세표준의 구간별 법인세율(지방소득세 포함)을 적용하였습니다.
| 구분 | 법인세율(지방소득세 포함) |
|---|---|
| 과세표준 2억원 이하 | 9.9% |
| 과세표준 2억원 초과 200억원 이하 | 20.9% |
| 과세표준 200억원 초과 3,000억원 이하 | 23.1% |
| 과세표준 3,000억원 초과 | 26.4% |
3.3.3. 피합병법인 수익가치 산정 결과
피합병법인의 과거 3개년 실적 및 향후 24개년의 추정현금흐름 및 수익가치는 다음과같습니다.
| (단위: 백만원) |
| 구분 | 실적 | 추정 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2022년 | 2023년 | 2024년 1~3월 |
2024년 4월~9월 |
2025년 | 2026년 | 2027년 | 2028년 | 2029년 | |
| 매출액 | - | - | - | - | - | - | - | - | - |
| 매출원가 | - | - | - | - | - | - | - | - | - |
| 매출총이익 | - | - | - | - | - | - | - | - | - |
| 판매비와관리비 | 1,641 | 2,388 | 548 | 2,096 | 5,900 | 7,167 | 4,767 | 4,841 | 3,839 |
| 영업이익(EBIT) | (1,641) | (2,388) | (548) | (2,096) | (5,900) | (7,167) | (4,767) | (4,841) | (3,839) |
| 법인세비용 | - | - | - | - | - | - | |||
| 세후영업이익 | (2,096) | (5,900) | (7,167) | (4,767) | (4,841) | (3,839) | |||
| (+)감가상각비 및 무형자산상각비 | 204 | 204 | 204 | 204 | 204 | 204 | |||
| (-)투자액(CAPEX) | 204 | 204 | 204 | 204 | 204 | 204 | |||
| (-)순운전자본의 증감 | - | - | - | - | - | - | |||
| 영업현금흐름(FCFF) | (2,096) | (5,900) | (7,167) | (4,767) | (4,841) | (3,839) | |||
| 현가계수 | 0.9441 | 0.8255 | 0.7080 | 0.6073 | 0.5209 | 0.4468 | |||
| 현재가치 | (1,979) | (4,870) | (5,075) | (2,895) | (2,522) | (1,715) | |||
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 15,280 | 46,140 | 92,498 | 61,948 | 77,731 | 93,582 | 89,243 | 81,656 | 72,960 |
| 매출원가 | 2,789 | 8,422 | 16,884 | 11,308 | 14,189 | 17,082 | 16,290 | 14,905 | 13,318 |
| 매출총이익 | 12,491 | 37,718 | 75,614 | 50,640 | 63,542 | 76,500 | 72,953 | 66,750 | 59,642 |
| 판매비와관리비 | 6,043 | 14,884 | 28,164 | 18,409 | 22,930 | 27,472 | 25,725 | 23,393 | 20,902 |
| 영업이익(EBIT) | 6,448 | 22,834 | 47,449 | 32,231 | 40,612 | 49,028 | 47,227 | 43,358 | 38,740 |
| 법인세비용 | 1,348 | 4,772 | 9,917 | 6,736 | 8,488 | 10,247 | 9,871 | 9,062 | 8,097 |
| 세후영업이익 | 5,100 | 18,062 | 37,532 | 25,495 | 32,124 | 38,781 | 37,357 | 34,296 | 30,644 |
| (+)감가상각비 및 무형자산상각비 | 895 | 2,703 | 5,418 | 3,629 | 4,553 | 5,481 | 5,227 | 4,783 | 4,274 |
| (-)투자액(CAPEX) | 895 | 2,703 | 5,418 | 3,629 | 4,553 | 5,481 | 5,227 | 4,783 | 4,274 |
| (-)순운전자본의 증감 | 5,608 | 11,326 | 17,014 | (11,212) | 5,793 | 5,818 | (1,593) | (2,785) | (3,191) |
| 영업현금흐름(FCFF) | (508) | 6,736 | 20,518 | 36,707 | 26,331 | 32,964 | 38,949 | 37,080 | 33,835 |
| 현가계수 | 0.3833 | 0.3287 | 0.2820 | 0.2419 | 0.2075 | 0.1779 | 0.1526 | 0.1309 | 0.1123 |
| 현재가치 | (195) | 2,214 | 5,786 | 8,878 | 5,463 | 5,866 | 5,945 | 4,855 | 3,800 |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 56,927 | 52,002 | 68,177 | 82,692 | 97,345 | 94,939 | 89,867 | 78,697 | 56,044 |
| 매출원가 | 10,391 | 9,492 | 12,445 | 15,094 | 17,769 | 17,330 | 16,404 | 14,365 | 10,230 |
| 매출총이익 | 46,536 | 42,510 | 55,732 | 67,598 | 79,575 | 77,609 | 73,463 | 64,332 | 45,814 |
| 판매비와관리비 | 16,308 | 14,898 | 19,531 | 23,690 | 27,887 | 27,198 | 25,745 | 22,545 | 16,056 |
| 영업이익(EBIT) | 30,227 | 27,612 | 36,201 | 43,908 | 51,688 | 50,411 | 47,718 | 41,787 | 29,758 |
| 법인세비용 | 6,317 | 5,771 | 7,566 | 9,177 | 10,803 | 10,536 | 9,973 | 8,733 | 6,220 |
| 세후영업이익 | 23,910 | 21,841 | 28,635 | 34,731 | 40,885 | 39,875 | 37,745 | 33,053 | 23,539 |
| (+)감가상각비 및 무형자산상각비 | 3,334 | 3,046 | 3,993 | 4,844 | 5,702 | 5,561 | 5,264 | 4,610 | 3,283 |
| (-)투자액(CAPEX) | 3,334 | 3,046 | 3,993 | 4,844 | 5,702 | 5,561 | 5,264 | 4,610 | 3,283 |
| (-)순운전자본의 증감 | (5,884) | (1,808) | 5,937 | 5,327 | 5,378 | (883) | (1,861) | (4,100) | (8,314) |
| 영업현금흐름(FCFF) | 29,794 | 23,649 | 22,698 | 29,404 | 35,508 | 40,758 | 39,606 | 37,153 | 31,853 |
| 현가계수 | 0.0963 | 0.0826 | 0.0709 | 0.0608 | 0.0521 | 0.0447 | 0.0384 | 0.0329 | 0.0282 |
| 현재가치 | 2,870 | 1,954 | 1,609 | 1,787 | 1,851 | 1,823 | 1,519 | 1,222 | 899 |
| 추정기간동안의 현재가치(A) | 39,091 | ||||||||
| 영구현금흐름의 현재가치(B)(주1) | 2,688 | ||||||||
| 이월결손금 효과(C)(주2) | 1,999 | ||||||||
| 영업가치(D=A+B+C) | 43,778 | ||||||||
| 비영업용자산부채의 가치(E) | - | ||||||||
| 기업가치(F=D+E) | 43,778 | ||||||||
| 차입금(G) | - | ||||||||
| 주주가치(H=F-G) | 43,778 | ||||||||
| 발행주식수(I)(단위: 주)(주3) | 666,957 | ||||||||
| 1주당 수익가치(J=H/I)(단위: 원/주) | 65,638 | ||||||||
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
(주1) 영구현금흐름의 현재가치는 추정기간 이후 최초연도인 2048년의 세후영업이익이 영구히 지속됨을 가정하는 영구성장모형을 적용하여 추정하였으며, 그 세부 산정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 금액 |
|---|---|
| A. 2048년 매출액 | 37,606 |
| B. 2048년 매출원가 | 6,865 |
| C. 2048년 판매비와관리비 | 10,773 |
| D. 2048년 영업이익(D=A-B-C) | 19,968 |
| E. 2048년 법인세비용 | 4,173 |
| F. 2048년 세후영업이익(F=D-E)(*1) | 15,795 |
| G. 가중평균자본비용 | 16.58% |
| H. 영구성장률 | 0.00% |
| I. 2047년말 Terminal Value(I=F/(G-H)) | 95,239 |
| J. 현가할인계수 | 0.0282 |
| K. 영구현금흐름의 현재가치(K=IxJ) | 2,688 |
(*1) 영구현금흐름 추정시 유무형자산상각비와 CAPEX 투자 금액은 동일하며, 순운전자본 변동금액은 0으로 가정하였습니다. 따라서 2048년 FCFF는 세후영업이익과 동일합니다.
(주2) 이월결손금 효과의 세부내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 2024년 | 2025년 | 2026년 | 2027년 | 2028년 | 2029년 | 2030년 | 2031년 | 2032년 |
|---|---|---|---|---|---|---|---|---|---|
| A. 과세소득 | (2,096) | (5,900) | (7,167) | (4,767) | (4,841) | (3,839) | 6,448 | 22,834 | 47,449 |
| B. 이월결손금 공제 | - | - | - | - | - | - | (6,448) | (22,834) | (2,676) |
| 기초 | 3,348 | 5,444 | 11,344 | 18,511 | 23,278 | 28,119 | 31,958 | 38,406 | 61,240 |
| 발생 | 2,096 | 5,900 | 7,167 | 4,767 | 4,841 | 3,839 | - | - | - |
| 공제 | - | - | - | - | - | - | (6,448) | (22,834) | (2,676) |
| 기말 | 5,444 |
11,344 | 18,511 | 23,278 | 28,119 | 31,958 | 38,406 | 61,240 | 63,916 |
| C. 법인세 감소효과(C=Bx20.9%) | - | - | - | - | - | - | 1,348 | 4,772 | 559 |
| D. 현가계수 | 0.8577 | 0.7357 | 0.6311 | 0.5413 | 0.4643 | 0.3983 | 0.3416 | 0.2930 | 0.2513 |
| E. 이월결손금 효과(E=CxD) | 1,999 |
(주3) 발행주식수는 전환우선주와 상환전환우선주의 조정된 전환가격을 기준으로 한잠재주식을 포함하여 산정하였습니다.
3.3.4. 매출액 추정
피합병법인의 매출액은 피합병법인이 개발하고 있는 EPD301 파이프라인이 신약 승인을 받아 상용화 되어 발생하는 매출액입니다.
(1) 추정 대상 파이프라인
평가기준일 현재 피합병법인의 파이프라인 현황은 다음과 같습니다.
| Program | Target | Indication | Discovery Stage |
|---|---|---|---|
| EPD-301 | SOX2 | Cancers | in vivo efficacy evaluation |
| EPD-201 | ATXN1 | Spinocerebella Ataxia Type1 | MoA study |
| EPD-401 | STAT3 | Atopic dermatitis / Cancers | in vitro efficacy evaluation |
(Source: 피합병법인 제시자료)
피합병법인의 파이프라인 중에서 연구개발 단계를 고려하여 EPD301 파이프라인에 대해 향후 상용화 단계에서의 매출액을 추정하였습니다. EPD301은 PROTAC 기술을 이용하여 SOX2 단백질을 타겟하는 파이프라인으로 여러 암의 치료제로 개발할 수 있는 잠재력이 있으며, 이 중 SOX2 단백질 반응률과 시장 규모 그리고 임상 전략 등을 고려하여 우선적으로 LSCC(Lung Squamous Cell Carcinoma, 폐의 편평상피세포암)을 적응증으로 설정하였습니다.
(2) 매출액 추정 방법
피합병법인은 EPD301 파이프라인을 LSCC 하나의 적응증으로 미국, 유럽, 일본 그리고 중국(도시) 지역에 진출할 예정입니다. 피합볍업인의 임상 전략은 우선적으로 미국과 중국에서 임상 승인 절차에 진입하고 미국에서 최종 승인을 받은 이후에 그 결과를 가지고 유럽과 일본에서 임상 승인 절차에 진입하는 것입니다. 또한 LSCC는 현재 치료제가 없는 질병이므로 임상 2상 이후 조건부 승인을 얻어 상용화 개시와 임상3상을 동시에 진행하는 것을 목표로 하고 있습니다.
피합병법인은 2030년에 조건부 승인을 얻어 미국과 중국 시장에서 상용화 개시 후, 2033년에 완전 승인을 얻으면서 일본과 유럽 시장에 승인 절차에 진입하여 2038년부터 상용화 개시하는 것을 목표로 하고 있습니다.
EPD301의 추정 매출액은 지역별로 추정기간의 LSCC 치료제 시장규모에서 SOX2 단백질에 반응하는 환자 비율을 적용하여 시장규모를 추정한 후, 현재 치료제가 없는현실과 피합병법인의 연구 개발 위치 등을 고려한 목표 시장점유율을 적용하여 산정하였습니다. 여기에 신약 개발의 성공가능성을 반영하기 위해 임상성공확률(POS)를적용하여 최종 매출액을 산정하였습니다.
종양 치료제에 대한 임상 단계별 임상성공확률과 전임상 단계에서부터 누적 확률은 다음과 같습니다.
| 단계 | 성공확률 | 누적 단계 | 누적 확률 |
|---|---|---|---|
| Pre | 50.27% | Pre to Ph1 | 50.27% |
| Ph1 | 48.80% | Pre to Ph2 | 24.53%(*1) |
| Ph2 | 24.60% | Pre to Ph3 | 6.03%(*2) |
| Ph3 | 47.70% | Pre to NDA/BLA | 2.88%(*3) |
| NDA/BLAl | 92.00% | Pre to Approval | 2.65%(*4) |
| - | - | Pre to Approval_C | 5.55%(*5) |
(*1) Pre 50.27% x Ph1 48.80%
(*2) Pre to Ph2 24.53% x Ph2 24.60%
(*3) Pre to Ph3 6.03% x Ph3 47.70%
(*4) Pre to NDA/BLA 2.88% x NDA/BLA 92.00%
(*5) Pre to Ph3 6.03% x NDA/BLA 92.00%
(Source: Clinical Development Success Rates and Contributing Factors, 2011~2020, BIO. 태성회계법인 Anlaysis)
(3) 시장규모
매출이 발생하는 2030년부터 2048년까지 지역별 시장규모는 다음과 같습니다.
| (단위: 백만USD) |
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 8MM NSCLC | 41,038 | 43,972 | 47,116 | 50,484 | 54,094 | 57,961 | 62,105 | 66,545 | 71,303 | |
| 8MM SCC | 24.44% | 10,028 | 10,745 | 11,513 | 12,336 | 13,218 | 14,163 | 15,176 | 16,261 | 17,423 |
| 8MM SCC with SOX2 |
39.40% | 3,951 | 4,233 | 4,536 | 4,860 | 5,208 | 5,580 | 5,979 | 6,407 | 6,865 |
| 지역별 시장규모 | ||||||||||
| 미국 | 45% | 1,777 | 1,904 | 2,041 | 2,186 | 2,343 | 2,510 | 2,690 | 2,882 | 3,088 |
| 유럽 | 23% | 925 | 991 | 1,062 | 1,138 | 1,219 | 1,306 | 1,399 | 1,499 | 1,607 |
| 일본 | 9% | 372 | 399 | 427 | 458 | 491 | 526 | 563 | 604 | 647 |
| 중국(도시) | 22% | 877 | 939 | 1,006 | 1,078 | 1,156 | 1,238 | 1,327 | 1,422 | 1,523 |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 | 2048년 |
|---|---|---|---|---|---|---|---|---|---|---|
| 8MM NSCLC | 76,401 | 81,863 | 87,715 | 93,987 | 100,706 | 107,906 | 115,621 | 123,887 | 132,744 | 142,234 |
| 8MM SCC | 18,669 | 20,004 | 21,434 | 22,966 | 24,608 | 26,367 | 28,252 | 30,272 | 32,437 | 34,756 |
| 8MM SCC with SOX2 |
7,356 | 7,881 | 8,445 | 9,049 | 9,696 | 10,389 | 11,131 | 11,927 | 12,780 | 13,694 |
| 지역별 시장규모 | ||||||||||
| 미국 | 3,309 | 3,545 | 3,799 | 4,071 | 4,362 | 4,673 | 5,007 | 5,365 | 5,749 | 6,160 |
| 유럽 | 1,722 | 1,845 | 1,976 | 2,118 | 2,269 | 2,431 | 2,605 | 2,791 | 2,991 | 3,205 |
| 일본 | 693 | 743 | 796 | 853 | 914 | 979 | 1,049 | 1,124 | 1,204 | 1,290 |
| 중국(도시) | 1,632 | 1,749 | 1,874 | 2,008 | 2,151 | 2,305 | 2,470 | 2,646 | 2,836 | 3,038 |
(Source: 피합병법인 제시자료, Global Drug Forecast and Market Analysis to 2029 - Forecast Update, January 2022, GlobalData. Epideiology Forecast to 2032, February 2024, GlobalData. 태성회계법인 Analysis)
(4) 목표 시장점유율
현재 LSCC에 대해서는 치료제가 없으며 피합병법인은 2023년 세계 최초로 암유발 전사인자인 SOX2를 분해할 수 있는 약물에 대한 in vivo efficacy를 확인하여 보고하였습니다. 이는 SOX2가 과다 발현하는 LSCC 환자 치료제 시장에서 아직 경쟁약물이 없으며 피합병법인이 전 세계에서 선도적인 위치에 있음을 의미합니다. 따라서 피합병법인의 예상대로 EPD301이 신약 승인을 받을 경우 대단히 높은 시장점유율이 예상되지만, 후속적으로 경쟁자들이 약물 개발에 성공하여 시장에 진입할 가능성을 고려해서 최대 시장점유율을 70%로 가정하였고, 시장점유율은 상용화 개시연도부터 점차 증가해서 개시 6년차에 정점에 도달한 후 점차 감소하는 신약의 시장점유율 커브에 대한 연구 결과를 적용하였습니다.
신약 출시 이후 시장점유율 커브는 다음과 같습니다.
| 구분 | 1년차 | 2년차 | 3년차 | 4년차 | 5년차 | 6년차 | 7년차 | 8년차 | 9년차 | 10년차 | 11년차 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 시장점유율 | 11.0% | 31.0% | 58.0% | 76.0% | 89.0% | 100.0% | 89.0% | 76.0% | 58.0% | 31.0% | 11.0% |
(Source: Drug launch curve in modern era, Nature Review, 2018)
(5) 매출액 추정 요약
위의 내용을 종합하여 매출이 발생하는 2030년부터 2048년까지 추정 매출액은 다음과 같습니다.
| (외화단위: 백만USD, 원화단위: 백만원) |
| 구분 | 합계 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 |
|---|---|---|---|---|---|---|---|---|---|---|
| 미국 | 14,230 | 137 | 413 | 828 | 1,163 | 1,460 | 1,757 | 1,676 | 1,533 | 1,254 |
| 유럽 | 10,135 | - | - | - | - | - | - | - | - | 124 |
| 일본 | 4,080 | - | - | - | - | - | - | - | - | 50 |
| 중국(도시) | 7,019 | 68 | 204 | 409 | 574 | 720 | 867 | 827 | 756 | 618 |
| 합계(외화) | 35,464 | 204 | 617 | 1,237 | 1,737 | 2,179 | 2,624 | 2,502 | 2,290 | 2,046 |
| 합계(원화) | 47,763,083 | 275,230 | 831,103 | 1,666,138 | 2,339,302 | 2,935,299 | 3,533,883 | 3,370,015 | 3,083,509 | 2,755,137 |
| POS | 5.55% | 5.55% | 5.55% | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% | |
| 매출액(원화) | 1,345,333 | 15,280 | 46,140 | 92,498 | 61,948 | 77,731 | 93,582 | 89,243 | 81,656 | 72,960 |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 | 2048년 |
|---|---|---|---|---|---|---|---|---|---|---|
| 미국 | 718 | 273 | 293 | 313 | 336 | 360 | 386 | 413 | 443 | 474 |
| 유럽 | 374 | 749 | 1,051 | 1,319 | 1,588 | 1,515 | 1,386 | 1,133 | 649 | 247 |
| 일본 | 150 | 302 | 423 | 531 | 639 | 610 | 558 | 456 | 261 | 99 |
| 중국(도시) | 354 | 135 | 144 | 155 | 166 | 177 | 190 | 204 | 218 | 234 |
| 합계(외화) | 1,596 | 1,458 | 1,912 | 2,319 | 2,729 | 2,662 | 2,520 | 2,207 | 1,571 | 1,054 |
| 합계(원화) | 2,149,693 | 1,963,714 | 2,574,537 | 3,122,646 | 3,675,958 | 3,585,109 | 3,393,581 | 2,971,781 | 2,116,360 | 1,420,088 |
| POS | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% | 2.65% |
| 매출액(원화) | 56,927 | 52,002 | 68,177 | 82,692 | 97,345 | 94,939 | 89,867 | 78,697 | 56,044 | 37,606 |
(Source: Drug launch curve in modern era, Nature Review, 2018. Clinical Development Success Rates and Contributing Factors, 2011~2020, BIO)
3.3.5. 매출원가 추정
본 평가에 적용된 가정이 피합병법인이 신약 개발을 완료하여 상용화하는 것이므로 상용화 이후 매출원가는 향후 추정 매출액에 목표 기업의 매출원가율을 적용하여 추정하였습니다.
목표 기업은 2021년 Bloomberg에서 선정한 글로벌 바이오텍 9개사 중에서 2021년 아스트라제네카에 합병된 Alexion과 화이자에 합병된 Seagen을 제외한 7개사를 적용하였습니다.
| (단위: 백만USD) |
| 목표 기업 | 매출 | 매출원가 | 매출원가율 |
|---|---|---|---|
| Amgen | 28,190.0 | 8,451.0 | 30.0% |
| Gilead | 27,116.0 | 6,498.0 | 24.0% |
| Biogen | 9,835.6 | 2,533.4 | 25.8% |
| Regeneron | 13,117.2 | 932.1 | 7.1% |
| Vertex | 9,869.2 | 1,262.2 | 12.8% |
| BioMarin | 2,419.2 | 514.9 | 21.3% |
| Incyte | 3,695.6 | 255.0 | 6.9% |
| 평균 | 18.3% |
(Source: Global Biotech 2021 Outlook, Bloomberg. 2023.4Q, SEC. 태성회계법인 Analysis)
3.3.6. 판매비와 관리비 추정
판매비와 관리비는 일반 판매비와 관리비, 임상개발비용, 로열티로 구분하여 추정하였습니다. 이 중 일반 판매비와 관리비는 상용화 시점을 기준으로 이전과 이후를 구분하였는데, 상용화 이전 시점에는 과거 3년 동안의 판매비와 관리비 발생 내역을 기초로 향후 피합병법인의 인력 계획 등을 고려하여 인건비와 인건비성경비, 고정비, 상각비 등을 추정하였고, 상용화 이후 시점에는 매출원가와 마찬가지로 추정 매출액에 목표 기업의 판매비와 관리비 비율을 적용하여 추정하였습니다.
임상개발비용은 목표 시장인 미국, 유럽, 일본, 중국 지역에서 신약 개발 승인을 얻기위해 소요될 것으로 예상되는 비용이며, 지역별 임상스케쥴과 소요 비용 그리고 임상단계별 성공확률을 적용하여 추정하였습니다.
마지막으로 로열티는 EPD301 약물이 치료제가 되기 위해 필요한 전달물질에 소요될 것으로 예상되는 비용입니다.
(1) 일반 판매비와 관리비
1) 상용화 이전 시점
상용화 이전 시점의 일반 판매비와 관리비는 인건비와 인건비성경비, 고정비, 상각비로 구분하여 추정하였습니다.
피합병법인의 과거 실적 및 상용화 이전인 2029년까지의 일반 판매비와 관리비 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 실적 | 추정 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2022년 | 2023년 | 2024년 1-3월 |
2024년 4-12월 |
2025년 | 2026년 | 2027년 | 2028년 | 2029년 | |
| 인건비 | 680 | 1,039 | 303 | 932 | 1,534 | 1,774 | 1,834 | 1,898 | 2,456 |
| 인건비성경비 | 76 | 121 | 36 | 113 | 186 | 215 | 222 | 230 | 297 |
| 고정비 | 135 | 140 | 37 | 108 | 146 | 149 | 152 | 154 | 157 |
| 상각비 | 133 | 202 | 51 | 153 | 204 | 204 | 204 | 204 | 204 |
| 연구개발비(*) | 618 | 886 | 121 | - | - | - | - | - | - |
| 합계 | 1,641 | 2,388 | 548 | 1,306 |
2,070 | 2,342 | 2,412 | 2,487 | 3,115 |
(*) 연구개발비는 임상개발비용으로 별도로 추정합니다.
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
인건비는 임직원 급여와 퇴직급여로 구성되어 있습니다. 인원수는 피합병법인의 사업계획 등을 고려하여 점차 증가하는 것으로 가정하였고, 인당 연평균 급여는 과거 3년 동안의 평균 급여가 국내 임금 상승률만큼 상승함을 가정하였습니다. 또한 추정기간의 퇴직급여는 연간 급여의 1개월분이 발생한다고 가정하였습니다.
피합병법인의 과거 실적 및 상용화 이전인 2029년까지의 일반 판매비와 관리비 중 인건비 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 실적 | 추정 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2022년 | 2023년 | 2024년 1-3월 |
2024년 4-12월 |
2025년 | 2026년 | 2027년 | 2028년 | 2029년 | |
| 급여 | 635 | 876 | 275 | 861 | 1,416 | 1,637 | 1,693 | 1,752 | 2,267 |
| 평균인원(명) | 8.0 | 13.0 | 14.5 | 15.0 | 18.0 | 20.0 | 20.0 | 20.0 | 25.0 |
| 인당 연평균 급여 | 79 | 67 | 76 | 77 | 79 | 82 | 85 | 88 | 91 |
| 퇴직급여 | 45 | 162 | 28 | 72 | 118 | 136 | 141 | 146 | 189 |
| 인건비 합계 | 680 | 1,039 | 303 | 932 | 1,534 | 1,774 | 1,834 | 1,898 | 2,456 |
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
인건비성경비는 인건비에 연동해서 발생하는 비용으로 복리후생비, 여비교통비, 통신비, 세금과공과, 보험료, 사무용품비로 구성되어 있습니다. 인건비성경비는 과거 3년 동안의 평균 인건비 대비 발생비율이 유지되는 것으로 가정하여 추정하였습니다.
피합병법인의 과거 실적 및 상용화 이전인 2029년까지의 일반 판매비와 관리비 중 인건비성경비 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 실적 | 추정 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 2022년 | 2023년 | 2024년 1-3월 |
발생 비율 | 2024년 4-12월 |
2025년 | 2026년 | 2027년 | 2028년 | 2029년 | |
| 급여 | 635 | 876 | 275 | 861 | 1,416 | 1,637 | 1,693 | 1,752 | 2,267 | |
| 복리후생비 | 31 | 50 | 14 | 5.17% | 45 | 73 | 85 | 88 | 91 | 117 |
| 여비교통비 | 3 | 1 | 0 | 0.22% | 2 | 3 | 4 | 4 | 4 | 5 |
| 통신비 | 1 | 1 | 0 | 0.08% | 1 | 1 | 1 | 1 | 1 | 2 |
| 세금과공과 | 16 | 26 | 9 | 2.95% | 25 | 42 | 48 | 50 | 52 | 67 |
| 보험료 | 24 | 42 | 13 | 4.60% | 40 | 65 | 75 | 78 | 81 | 104 |
| 사무용품비 | 1 | 0 | 0 | 0.09% | 1 | 1 | 1 | 1 | 2 | 2 |
| 인건비성경비 합계 | 76 | 121 | 36 | 113 | 186 | 215 | 222 | 230 | 297 | |
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
고정비는 지급임차료, 지급수수료, 소모품비 등으로 구성되어 있습니다. 고정비는 과거 3년 평균 발생금액이 추정기간 동안 국내 소비자물가상승률만큼 상승함을 가정하였습니다.
피합병법인의 과거 실적 및 상용화 이전인 2029년까지의 일반 판매비와 관리비 중 고정비 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 실적 | 추정 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2022년 | 2023년 | 2024년 1-3월 |
2024년 4-12월 |
2025년 | 2026년 | 2027년 | 2028년 | 2029년 | |
| 접대비 | 3 | 7 | 2 | 5 | 6 | 6 | 6 | 6 | 7 |
| 전력비 | 5 | 10 | 2 | 6 | 9 | 9 | 9 | 9 | 9 |
| 지급임차료 | 65 | 72 | 18 | 53 | 72 | 74 | 75 | 76 | 78 |
| 수선비 | 1 | 1 | - | 0 | 1 | 1 | 1 | 1 | 1 |
| 운반비 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 도서인쇄비 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 소모품비 | 19 | 3 | 1 | 7 | 9 | 10 | 10 | 10 | 10 |
| 지급수수료 | 35 | 37 | 11 | 30 | 40 | 41 | 41 | 42 | 43 |
| 건물관리비 | 7 | 9 | 2 | 6 | 9 | 9 | 9 | 9 | 9 |
| 고정비 합계 | 135 | 140 | 37 | 108 | 146 | 149 | 152 | 154 | 157 |
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
상각비는 감가상각비와 무형자산상각비이며, 상용화 이전 시점까지는 대규모 시설 투자 등 자본적 지출이 예상되지 않으므로 최근 사업연도의 상각비가 유지되는 것으로 가정하였습니다.
2) 상용화 이후 시점
상용화 이후 일반 판매비와 관리비는 향후 추정 매출액에 목표 기업의 판매관리비율을 적용하여 추정하였습니다.
목표 기업은 매출원가 추정과 마찬가지로 2021년 Bloomberg에서 선정한 글로벌 바이오텍 9개사 중에서 2021년 아스트라제네카에 합병된 Alexion과 화이자에 합병된 Seagen을 제외한 7개사를 적용하였으며, 판매관리비율은 목표 기업의 매출액 대비 영업비용 비율에서 매출원가율을 제외하여 산정하였습니다.
| (단위: 백만USD) |
| 목표 기업 | Sales(A) | Income before tax(B) | interest(C) | Etc(D) | R&D(E)(*) | 조정 EBIT (F=B-C-D-E) |
조정 EBIT 비율 (G=F/A) |
|---|---|---|---|---|---|---|---|
| Amgen | 28,190.0 | 7,855.0 | 2,875.0 | - | 4,784.0 | 15,514.0 | 55.0% |
| Gilead | 27,116.0 | 6,859.0 | 944.0 | 1,155.0 | 5,718.0 | 14,676.0 | 54.1% |
| Biogen | 9,835.6 | 1,296.8 | 315.5 | - | 2,462.0 | 4,074.3 | 41.4% |
| Regeneron | 13,117.2 | 4,199.3 | 73.0 | 186.1 | 4,439.0 | 8,897.4 | 67.8% |
| Vertex | 9,869.2 | 4,379.8 | 44.1 | 527.1 | 3,162.9 | 8,113.9 | 82.2% |
| BioMarin | 2,419.2 | 188.6 | 17.3 | - | 746.8 | 952.7 | 39.4% |
| Incyte | 3,695.6 | 834.2 | 2.6 | - | 1,627.6 | 2,464.4 | 66.7% |
| 평균 | 58.1% | ||||||
| 영업비용 비율 | 41.9% | ||||||
| 매출원가율 | 18.3% | ||||||
| 판매관리비율 | 23.6% |
(*) 피합병법인의 연구개발비용은 별도로 추정하므로 목표 기업의 영업비용에 포함된 연구개발비용을 제외하고 EBIT 산정함
(Source: Global Biotech 2021 Outlook, Bloomberg. 2023.4Q, SEC. 태성회계법인 Analysis)
(2) 임상개발비용
피합병법인의 EPD301은 LSCC 1개의 적응증으로 미국, 유럽, 일본, 중국(도시)에 진출할 계획이며, 현재 치료제가 없는 질환이므로 임상 2상 통과 이후 조건부 승인을 얻어 상용화를 시작하면서 동시에 임상 3상을 진행하려는 전략입니다. 여러 지역 중에서 시장 규모와 신뢰도, 파급력 등을 고려하여 미국 시장을 우선적으로 도전하고, 미국에서 최종 승인을 얻은 이후 그 결과를 가지고 일본과 유럽의 신약 승인 절차에 진입할 예정입니다. 즉 임상 2상까지는 미국에서 승인받은 자료를 이용할 수 있으며 임상 3상만 일부 수행을 가정하여 미국 임상비용의 50%를 적용하였습니다. 한편 중국의경우 타국가 승인과 무관하게 대규모 다국가 임상시험으로 신약개발승인이 가능하므로 미국 임상시험에 중국 환자를 포함하여 진행하는것으로 가정하여 미국 임상개발비용의 20%를 적용하였습니다.
마지막으로 매출액 추정과 마찬가지로 임상개발비용에서도 신약개발의 위험을 현금흐름에 반영하기 위해 임상 단계별 성공확률을 적용하였습니다.
피합병법인의 추정기간 동안의 임상개발비용 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 합계 | 2024년 | 2025년 | 2026년 | 2027년 | 2028년 | 2029년 |
|---|---|---|---|---|---|---|---|
| 임상개발단계 | |||||||
| 미국 | Pre | Pre | Ph1 | Ph2 | Ph2 | NDA/BLA | |
| 유럽 | Pre | Pre | Pre | Pre | Pre | Pre | |
| 일본 | Pre | Pre | Pre | Pre | Pre | Pre | |
| 중국(도시) | Pre | Pre | Ph1 | Ph2 | Ph2 | NDA/BLA | |
| 임상개발비용 | |||||||
| 미국 | 109,620 | 790 | 3,830 | 8,000 | 8,000 | 8,000 | 6,000 |
| 유럽 | 40,500 | - | - | - | - | - | - |
| 일본 | 40,500 | - | - | - | - | - | - |
| 중국(도시) | 25,800 | - | - | 1,600 | 1,600 | 1,600 | 6,000 |
| 소계 | 216,420 | 790 | 3,830 | 9,600 | 9,600 | 9,600 | 12,000 |
| POS | 100.00% | 100.00% | 50.27% | 24.53% | 24.53% | 6.03% | |
| 위험조정 임상개발비용 | 22,021 | 790 | 3,830 | 4,826 | 2,355 | 2,355 | 724 |
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 |
|---|---|---|---|---|---|---|---|
| 임상개발단계 | |||||||
| 미국 | Approval_C | Approval_C | Approval_C | Approval | Approval | Approval | Approval |
| 유럽 | Pre | Pre | Pre | Ph3 | Ph3 | Ph3 | NDA/BLA |
| 일본 | Pre | Pre | Pre | Ph3 | Ph3 | Ph3 | NDA/BLA |
| 중국(도시) | Approval_C | Approval_C | Approval_C | Approval | Approval | Approval | Approval |
| 임상개발비용 | |||||||
| 미국 | 25,000 | 25,000 | 25,000 | - | - | - | - |
| 유럽 | - | - | - | 12,500 | 12,500 | 12,500 | 3,000 |
| 일본 | - | - | - | 12,500 | 12,500 | 12,500 | 3,000 |
| 중국(도시) | 5,000 | 5,000 | 5,000 | - | - | - | - |
| 소계 | 30,000 | 30,000 | 30,000 | 25,000 | 25,000 | 25,000 | 6,000 |
| POS | 5.55% | 5.55% | 5.55% | 2.65% | 2.65% | 2.65% | 2.65% |
| 위험조정 임상개발비용 | 1,665 | 1,665 | 1,665 | 662 | 662 | 662 | 159 |
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
위 스케쥴에 따라 미국과 중국에서는 2030년부터 조건부 상용화, 2033년부터 완전 상용화가 개시되고, 유럽과 일본은 2033년부터 승인 절차에 진입하여 2038년에 상용화가 개시된다고 추정(NDA/BLA 기간이 2037년까지)하였습니다.
(3) 로열티
피합병법인의 EPD301이 치료제로 기능하기 위해서는 별도의 전달 물질이 필요합니다. 피합병법인은 임상 1상에 진입하는 시점에 전달 물질 공급자와 공급 계약을 체결할 예정이며, 통상 상용화 이후 매출액의 3~5% 로열티를 수수합니다. 본 평가에서는 추정 매출액의 5%를 로열티 수수료로 가정하여 판매비와 관리비에 가산하였습니다.
(4) 판매비와 관리비 종합 요약
피합병법인의 과거 실적 및 추정기간 동안의 판매비와 관리비 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 실적 | 추정 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2022년 | 2023년 | 2024년 1~3월 |
2024년 4월~9월 |
2025년 | 2026년 | 2027년 | 2028년 | 2029년 | |
| 일반판관비 | 1,641 | 2,388 | 548 | 1,306 | 2,070 | 2,342 | 2,412 | 2,487 | 3,115 |
| 임상개발비용 | 618 | 886 | 121 | 790 | 3,830 | 4,826 | 2,355 | 2,355 | 724 |
| 로열티 | - | - | - | - | - | - | - | - | - |
| 합계 | 2,260 | 3,274 | 669 | 2,096 |
5,900 | 7,167 | 4,767 | 4,841 | 3,839 |
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 |
|---|---|---|---|---|---|---|---|---|---|
| 일반판관비 | 3,613 | 10,911 | 21,874 | 14,650 | 18,382 | 22,130 | 21,104 | 19,310 | 17,254 |
| 임상개발비용 | 1,665 | 1,665 | 1,665 | 662 | 662 | 662 | 159 | - | - |
| 로열티 | 764 | 2,307 | 4,625 | 3,097 | 3,887 | 4,679 | 4,462 | 4,083 | 3,648 |
| 합계 | 6,043 | 14,884 | 28,164 | 18,409 | 22,930 | 27,472 | 25,725 | 23,393 | 20,902 |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 |
|---|---|---|---|---|---|---|---|---|---|
| 일반판관비 | 13,462 | 12,297 | 16,123 | 19,555 | 23,020 | 22,451 | 21,252 | 18,610 | 13,253 |
| 임상개발비용 | - | - | - | - | - | - | - | - | - |
| 로열티 | 2,846 | 2,600 | 3,409 | 4,135 | 4,867 | 4,747 | 4,493 | 3,935 | 2,802 |
| 합계 | 16,308 | 14,898 | 19,531 | 23,690 | 27,887 | 27,198 | 25,745 | 22,545 | 16,056 |
3.3.7. CAPEX 및 유무형자산상각비 추정
피합병법인은 추정기간 동안 대규모 시설투자 등 자본적 지출을 계획하고 있지 않으며, 상용화 이후 치료제의 생산도 외부에 위탁할 예정입니다. 따라서 상용화 이전 시점까지는 최근 사업연도 상각비와 동일한 규모로 자본적 지출이 발생한다고 가정하였습니다. 또한 상용화 이후 시점부터는 판매비와 관리비 추정금액에 상각비가 포함되어 있으므로 목표기업의 매출액 대비 상각비 비율을 적용하여 피합병법인의 상각비를 산정하고 그 금액과 동일하게 자본적 지출이 발생한다고 가정하였습니다.
목표 기업의 매출액 대비 상각비 비율은 다음과 같습니다.
| (단위: 백만USD) |
| 목표 기업 | 매출 | 상각비 | 상각비 비율 |
|---|---|---|---|
| Amgen | 28,190.0 | 4,071.0 | 14.4% |
| Gilead | 27,116.0 | 2,693.0 | 9.9% |
| Biogen | 9,835.6 | 494.8 | 5.0% |
| Regeneron | 13,117.2 | 421.0 | 3.2% |
| Vertex | 9,869.2 | 181.3 | 1.8% |
| BioMarin | 2,419.2 | 104.4 | 4.3% |
| Incyte | 3,695.6 | 82.7 | 2.2% |
| 평균 | 5.9% |
(Source: Global Biotech 2021 Outlook, Bloomberg. 2023.4Q, SEC. 태성회계법인 Analysis)
피합병법인의 과거 실적 및 추정기간 동안의 CAPEX와 상각비 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 실적 | 추정 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2022년 | 2023년 | 2024년 1~3월 |
2024년 4월~9월 |
2025년 | 2026년 | 2027년 | 2028년 | 2029년 | |
| 매출 | - | - | - | - | - | - | - | - | - |
| 상각비 | 133 | 202 | 51 | 204 | 204 | 204 | 204 | 204 | 204 |
| CAPEX | - | - | - | 204 | 204 | 204 | 204 | 204 | 204 |
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출 | 15,280 | 46,140 | 92,498 | 61,948 | 77,731 | 93,582 | 89,243 | 81,656 | 72,960 |
| 상각비 | 895 | 2,703 | 5,418 | 3,629 | 4,553 | 5,481 | 5,227 | 4,783 | 4,274 |
| CAPEX | 895 | 2,703 | 5,418 | 3,629 | 4,553 | 5,481 | 5,227 | 4,783 | 4,274 |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출 | 56,927 | 52,002 | 68,177 | 82,692 | 97,345 | 94,939 | 89,867 | 78,697 | 56,044 |
| 상각비 | 3,334 | 3,046 | 3,993 | 4,844 | 5,702 | 5,561 | 5,264 | 4,610 | 3,283 |
| CAPEX | 3,334 | 3,046 | 3,993 | 4,844 | 5,702 | 5,561 | 5,264 | 4,610 | 3,283 |
(Source: 피합병법인 제시자료, 태성회계법인 Analysis)
3.3.8. 순운전자본 추정
피합병법인의 운전자산은 매출채권과 재고자산, 운전부채는 매입채무로 구분하여 운전자본의 성격에 따라 관련 손익에 연동하여 추정하였습니다.
피합병법인의 상용화 시점 이후 추정기간 동안의 순운전자본 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출채권 | 3,607 | 10,892 | 21,836 | 14,624 | 18,350 | 22,092 | 21,067 | 19,276 | 17,223 |
| 재고자산 | 3,247 | 9,806 | 19,659 | 13,166 | 16,520 | 19,889 | 18,967 | 17,354 | 15,506 |
| 매입채무 | 1,247 | 3,764 | 7,546 | 5,054 | 6,342 | 7,635 | 7,281 | 6,662 | 5,952 |
| 순운전자본 | 5,608 | 16,934 | 33,948 | 22,736 | 28,528 | 34,346 | 32,753 | 29,969 | 26,777 |
| 순운전자본변동 | 5,608 | 11,326 | 17,014 | (11,212) | 5,793 | 5,818 | (1,593) | (2,785) | (3,191) |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출채권 | 13,439 | 12,276 | 16,094 | 19,521 | 22,980 | 22,412 | 21,215 | 18,578 | 13,230 |
| 재고자산 | 12,099 | 11,052 | 14,490 | 17,575 | 20,689 | 20,177 | 19,099 | 16,725 | 11,911 |
| 매입채무 | 4,644 | 4,242 | 5,562 | 6,746 | 7,942 | 7,745 | 7,332 | 6,420 | 4,572 |
| 순운전자본 | 20,893 | 19,085 | 25,022 | 30,349 | 35,727 | 34,844 | 32,982 | 28,883 | 20,569 |
| 순운전자본변동 | (5,884) | (1,808) | 5,937 | 5,327 | 5,378 | (883) | (1,861) | (4,100) | (8,314) |
(1) 운전자본 비율
피합병법인의 운전자본 비율은 영업비용 추정과 마찬가지로 목표 기업의 매출액과 매출원가 대비 운전자본 비율을 적용하였습니다.
| (단위: 백만USD) |
| 목표 기업 | Sales | 매출채권 | 매출채권 비율 | 매출원가 | 재고자산 | 재고자산 비율 | 매입채무 | 매입채무 비율 |
|---|---|---|---|---|---|---|---|---|
| Amgen | 28,190.0 | 7,268.0 | 25.8% | 8,451.0 | 9,518.0 | 112.6% | 1,590.0 | 18.8% |
| Gilead | 27,116.0 | 4,660.0 | 17.2% | 6,498.0 | 1,787.0 | 27.5% | 550.0 | 8.5% |
| Biogen | 9,835.6 | 1,664.1 | 16.9% | 2,533.4 | 2,527.4 | 99.8% | 403.3 | 15.9% |
| Regeneron | 13,117.2 | 5,667.3 | 43.2% | 932.1 | 2,580.5 | 276.8% | 606.6 | 65.1% |
| Vertex | 9,869.2 | 1,563.4 | 15.8% | 1,262.2 | 738.8 | 58.5% | 364.9 | 28.9% |
| BioMarin | 2,419.2 | 633.7 | 26.2% | 514.9 | 1,107.2 | 215.0% | 683.1 | 132.7% |
| Incyte | 3,695.6 | 743.6 | 20.1% | 255.0 | 63.0 | 24.7% | 109.6 | 43.0% |
| 평균 | 23.6% | 116.4% | 44.7% |
(Source: Global Biotech 2021 Outlook, Bloomberg. 2023.4Q, SEC. 태성회계법인 Analysis)
(2) 매출채권
매출채권은 추정 매출액에 목표 기업의 매출액 대비 매출채권 비율을 적용하여 추정하였습니다.
피합병법인의 상용화 시점 이후 추정기간 동안의 매출채권 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출 | 15,280 | 46,140 | 92,498 | 61,948 | 77,731 | 93,582 | 89,243 | 81,656 | 72,960 |
| 매출채권(23.6%) | 3,607 | 10,892 | 21,836 | 14,624 | 18,350 | 22,092 | 21,067 | 19,276 | 17,223 |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출 | 56,927 | 52,002 | 68,177 | 82,692 | 97,345 | 94,939 | 89,867 | 78,697 | 56,044 |
| 매출채권(23.6%) | 13,439 | 12,276 | 16,094 | 19,521 | 22,980 | 22,412 | 21,215 | 18,578 | 13,230 |
(Source: 태성회계법인 Analysis)
(2) 재고자산과 매입채무
재고자산과 매입채무는 추정 매출원가에 목표 기업의 매출원가 대비 재고자산과 매입채무 비율을 적용하여 추정하였습니다.
피합병법인의 상용화 시점 이후 추정기간 동안의 재고자산과 매입채무 추정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | 2030년 | 2031년 | 2032년 | 2033년 | 2034년 | 2035년 | 2036년 | 2037년 | 2038년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출원가 | 2,789 | 8,422 | 16,884 | 11,308 | 14,189 | 17,082 | 16,290 | 14,905 | 13,318 |
| 재고자산(116.4% | 3,247 | 9,806 | 19,659 | 13,166 | 16,520 | 19,889 | 18,967 | 17,354 | 15,506 |
| 매입채무(44.7%) | 1,247 | 3,764 | 7,546 | 5,054 | 6,342 | 7,635 | 7,281 | 6,662 | 5,952 |
| 구분 | 2039년 | 2040년 | 2041년 | 2042년 | 2043년 | 2044년 | 2045년 | 2046년 | 2047년 |
|---|---|---|---|---|---|---|---|---|---|
| 매출원가 | 10,391 | 9,492 | 12,445 | 15,094 | 17,769 | 17,330 | 16,404 | 14,365 | 10,230 |
| 재고자산(116.4% | 12,099 | 11,052 | 14,490 | 17,575 | 20,689 | 20,177 | 19,099 | 16,725 | 11,911 |
| 매입채무(44.7%) | 4,644 | 4,242 | 5,562 | 6,746 | 7,942 | 7,745 | 7,332 | 6,420 | 4,572 |
(Source: 태성회계법인 Analysis)
3.3.9. WACC의 산정
현금흐름할인법(DCF)을 이용하여 기업가치를 산정하기 위해서는 가중평균자본비용(WACC)을 산출하여야 합니다. CAPM(Capital Asset Pricing Model)을 이용하여 자기자본비용을 구하고 외부차입 조달비용을 이용하여 타인자본비용을 산출한 후, 이를 각각 자기자본과 타인자본의 비율에 따라 가중평균하여 WACC를 산출하였습니다. 상기 방식을 적용하여 산출한 할인율은 16.58%이며, 구체적인 산정내역은 다음과 같습니다.
| 구분 | 적용비율 |
|---|---|
| 가. 무위험이자율(Rf)(주1) | 3.40% |
| 나. 국내시장프리미엄(Rm-Rf)(주1) | 8.00% |
| 다. Unlevered Beta(주2) | 1.0565 |
| 라. Levered Beta(주2) | 1.0565 |
| 마. Size Premium(주3) | 4.73% |
| 바. 자기자본비용(가 + 나 X 라 + 마) | 16.58% |
| 사. 타인자본비용(주4) | 16.21% |
| 아. 자기자본비율(주5) | 100.00% |
| 자. 타인자본비율(주5) | 0.00% |
| 차. Tax Rate | 20.90% |
| 카. 가중평균자본비용(바 X 아 + 사 X (1-차) X 자) | 16.58% |
(Source: Bloomberg, 태성회계법인 Analysis)
(주1) 2024년 3월말 기준 Bloomberg상 한국 무위험이자율(Rf)을 산정하였으며, 한국공인회계사회에서 발표한 평가기준일 Market Risk Premium의 중위값을 적용하였습니다.
(주2) 아래 기술한 베타 산정 표에 따른 유사 동종기업의 Unlevered Beta와 목표 자본구조에 따라 산정되었습니다.
(주3) 금융감독원이 제정한 "외부평가업무 가이드라인(2009.6)"은 할인율을 산정함에있어 평가대상의 위험요소 및 성장성 등을 종합적으로 고려하도록 하고 있으며, 이에 따라 추가적인 수익률의 증감 반영에 대하여 검토하였습니다. 자기자본비용을 산정함에 있어 기업규모 또는 상대적 산업특성에 따라 실제 시장에서 투자자로부터 CAPM에 의해 산정된 수익률보다 추가적인 수익률을 요구 받습니다. 이것은 일반적으로 규모가 작은 기업이 규모가 큰 기업에 비하여 높은 자기자본비용 수준을 보이는 것에기인하므로 본 평가에서는 이러한 Size Premium을 추가로 고려하였습니다. Size Premium은 한국공인회계사회가 발표한 '한국의 기업규모위험 프리미엄 연구결과' 5분위 평균치인 4.73%를 적용하였습니다.
(주4) 타인자본비용은 피합병법인의 2024년 3월 31일 현재 신용등급 및 재무상태를 고려하여 Kisnet 채권수익률 기준, B+등급의 장기(5년) 무보증 공모 회사채 수익률을 적용하였습니다.
(주5) 피합병법인은 평가기준일 현재 차입금이 없으며 향후에도 무부채 기업을 목표하고 있으므로 목표자본구조는 자기자본 100%를 적용하였습니다.
본 분석에서는 유사 동종기업의 Levered Beta와 Hamada Model을 통하여 피합병법인의 자기자본비용을 추정하였으며, 유사 동종기업은 다음과 같은 기준으로 선정하였습니다.
평가대상회사는 한국거래소 상장회사 업종코드 소분류 기준으로 "자연과학 및 공학 연구개발업"을 영위하고 있으며, 신약연구개발을 주력사업으로 영위하고 있습니다. 따라서 국내 54개의 "자연과학 및 공학 연구개발업" 주권상장법인 중 평가대상회사와 유사하게 신약연구개발을 주 사업으로 하는 14개사 중 평가일 기준으로 상장 후 2년이 지난 8개사(최근 사업연도 감사의견이 비적정이거나 관리종목인 1개사 제외 후)를 대용기업으로 선정하였습니다.
유사 동종기업 8개사의 영업Beta(Unlevered Beta)의 평균값은 1.1315, 부채비율의 평균값은 9.49%이며, 세부적인 영업Beta의 산정내역은 다음과 같습니다.
| (단위: 백만원) |
| 구분 | Levered Beta (주1) |
Market Cap (주2) |
타인자본 (주3) |
Tax Rate (주4) |
Unlevered Beta (주5) |
부채비율 (주6) |
|---|---|---|---|---|---|---|
| 네오이뮨텍 | 1.492 | 33,200 | 3,662 | 20.90% | 1.372 | 11.03% |
| 메드팩토 | 1.337 | 439,907 | 2,361 | 20.90% | 1.331 | 0.54% |
| 바이젠셀 | 0.894 | 98,129 | 7,446 | 20.90% | 0.843 | 7.59% |
| 신라젠 | 1.091 | 523,212 | 9,924 | 20.90% | 1.075 | 1.90% |
| 압타머사이언스 | 0.615 | 55,865 | 8,700 | 20.90% | 0.548 | 15.57% |
| 압타바이오 | 1.229 | 156,315 | 14,806 | 20.90% | 1.143 | 9.47% |
| 에이비온 | 1.131 | 144,711 | 15,638 | 20.90% | 1.042 | 10.81% |
| 제넥신 | 1.263 | 360,613 | 68,665 | 20.90% | 1.098 | 19.04% |
| 평균 | 1.057 | 9.49% | ||||
(Source: 동종기업의 사업보고서, Bloomberg, 태성회계법인 Analysis)
(주1) 평가기준일인 2024년 3월 31일 기준 Bloomberg 조회한 조정 2년 Weekly Beta입니다.
(주2) 평가기준일인 2024년 3월 31일 기준 KRX 조회한 유사 동종기업의 시가 총액입니다.
(주3) 평가기준일인 2024년 3월 31일 기준 DART 조회한 유사 동종기업의 이자부 부채 금액입니다.
(주4) 법인세 및 지방소득세 세율을 적용하였습니다.
(주5) 유사 동종기업의 Levered Beta와 자본구조에 따라 다음과 같이 산정되었습니다. Unlevered Beta = Levered Beta / [1+(1-Tax Rate) x (타인자본/자기자본)]
(주6) 부채비율은 타인자본/자기자본으로 산정하였습니다.
4. 합병비율의 적정성에 대한 종합평가의견
본 평가인은 합병 당사회사가 제시한 합병비율이 자본시장과 금융투자업에 관한 법률 시행령 제176조의5, 그리고 증권 발행 및 공시 등에 관한 규정 제5-13조 및 동규정 시행세칙 제4조 내지 제8조에서 규정하고 있는 합병가액 산정방법에 따라 산정되었는지에 대하여 검토하였습니다.
본 평가인은 본 검토업무를 수행함에 있어 합병법인의 2023년 12월 31일로 종료하는 회계연도의 감사받은 별도재무상태표 및 주가자료와 피합병법인의 2023년 12월 31일로 종료하는 회계연도의 재무제표와 2024년에서 2047년까지 사업계획을 검토하였습니다.
합병법인과 피합병법인의 보통주 주당 합병가액은 합병법인 6,540원(주당 액면가액 500원), 피합병법인 40,512원(주당 액면가액 500원)으로 산정되었습니다. 합병계약서에 따라 합병기일전에 피합병법인이 발행한 종류주식 전체의 보통주 전환이 요구되므로, 피합병법인이 발행한 종류주식의 리픽싱 조건에 따라 발행주식수를 조정하였습니다. 상술하자면 평가기준일 기준, 피합병법인의 전환가능주식 주당 합병가액은 전환가능성 및 경제적실질을 반영하여 전환우선주와 제1회 상환전환우선주의 주당 합병금액은 보통주와 동일한 금액으로 추정하였고, 제2회 상환전환우선주 주당 합병금액은 48,191원으로 추정하였습니다. 따라서 합병 당사회사 간 합의한 합병법인의 보통주와 피합병법인의 보통주 합병비율 1:6.1947003, 피합병법인의 전환우선주 합병비율 1:6.1947003, 제1회 상환전환우선주 합병비율 1:6.1947003 제2회 상환전환우선주 합병비율 1:7.3688776은 적정한 것으로 판단됩니다.
다만, 분석기준일 현재 피합병법인이 발행한 종류주식 264,160주 전체는 합병계약서에 따라 합병기일전에 피합병법인의 보통주로 전환할 예정이며 보통주 합병비율 1:6.1947003에 따라 제넥신의 보통주식으로 발행 교부될 예정입니다.
본 평가인의 검토 결과 이러한 합병비율은 중요성의 관점에서 자본시장과 금융투자업에 관한 법률 시행령 제176조의5, 증권의 발행 및 공시 등에 관한 규정 제5-13조 및 동규정 시행세칙 제4조 내지 제8조에서 규정하고 있는 합병가액 산정방법에 위배되어 산정되었다는 점이 발견되지 아니하였습니다.
III. 합병의 요령
1. 합병대가의 배정
가. 합병대가의 배정 내용
합병신주 배정기준일(「주식ㆍ사채등의 전자등록에 관한 법률」상 합병기일의 직전 영업일을 의미함) 현재 기준, 소멸회사인 (주)이피디바이오테라퓨틱스 주주명부에 등재되어 있는 보통주 주주들이 보유한 보통주식 1주당 합병회사 (주)제넥신 보통주식 6.1947003주를 발행할 예정입니다.
한편, 존속회사인 (주)제넥신은 소멸회사인 (주)이피디바이오테라퓨틱스 주식을 보유하고 있지 않으며, 소멸회사인 (주)이피디바이오테라퓨틱스는 자기주식을 보유하고 있지 않으므로 포합주식과 소멸회사의 자기주식에 대해서는 합병신주를 배정하지 않습니다.
- 배정 대상: 합병기일 현재 (주)이피디바이오테라퓨틱스 주주명부에 등재되어 있는 주주
- 배정 기준일: 2024년 09월 30일(합병기일의 직전 영업일)
- 상장예정일: 2024년 10월 17일
상기 일정은 증권신고서 제출 전일 현재의 예상 일정이며, 본건 합병을 위하여 필요한 인허가의 취득, 합병 선행조건의 충족여부, 관계기관과의 협의, 기타 사정에 의하여 변경될 수 있습니다.
한편, 「주식ㆍ사채 등의 전자등록에 관한 법률」("전자증권법")이 도입됨에 따라 효력발생과 동시에 전자등록(발행)이 완료되어 전자등록계좌부에 기재될 예정으로 별도로 신주권교부가 이루어지지 않는다는 점 투자자께서는 참고하시기 바랍니다.
나. 합병대가 배정 시 발생하는 단주 처리 방법
합병신주의 배정으로 1주 미만의 단주가 발생하는 경우에는 단주가 귀속될 주주에게합병신주의 주권상장일에 한국거래소에서 거래되는 종가를 기준으로 계산된 금액을 주권상장일로부터 1개월 이내에 현금으로 지급하며, 해당 단주는 「상법」 제341조의2제3호에 따라 (주)제넥신의 자기주식 취득으로 처리합니다.
다. 자기주식 및 포합주식에 대한 신주배정
존속회사인 (주)제넥신은 소멸회사인 (주)이피디바이오테라퓨틱스 주식을 보유하고 있지 않으며, 소멸회사인 (주)이피디바이오테라퓨틱스는 자기주식을 보유하고 있지 않으므로 포합주식과 소멸회사의 자기주식에 대해서는 합병신주를 배정하지 않습니다.
라. 신주의 상장 등에 관한 사항
(주)제넥신은 한국거래소 코스닥시장에 본건 합병에 따라 교부되는 신주에 대한 상장을 신청할 예정입니다. 합병신주의 상장예정일은 2024년 10월 17일이며, 관계기관 등과의 협의 및 승인 과정에서 변경될 수 있습니다.
마. 신주의 이익배당기산일
합병신주가 존속회사의 배당기준일을 정하는 이사회 결의일 이전에 발행된 경우 합병신주에 대해 존속회사의 기존 보통주식과 동등하게 배당을 하고, 그 외의 경우 합병신주에 대하여는 배당을 하지 않습니다.
2. 교부금 등 지금
(주)제넥신이 (주)이피디바이오테라퓨틱스를 흡수합병함에 있어 소멸회사인 (주)이피디바이오테라퓨틱스의 주주에게 합병비율에 따른 합병주식의 발행과 단주 매각 대금 지급 외에는 별도의 합병 교부금 지급은 없습니다.
3. 특정주주에 대한 보상
존속회사인 (주)제넥신이 소멸회사인 (주)이피디바이오테라퓨틱스를 흡수합병함에 있어 존속회사 및 존속회사의 특수관계인이 소멸회사의 특정 주주에게 합병 대가에 따른 신주배정과 단주 매각 대금 지급 외에 지급하는 직간접적인 추가보상은 없습니다.
4. 합병 등 소요비용
합병 관련 법률검토비용 및 자문비용, 회계, 세무에 필요한 비용 등 제반 비용은 증권신고서 제출 전일 현재 확정되지 않았으며, 증권신고서 제출 전일 기준으로 추정되는 제반 소요비용은 아래와 같습니다.
| (단위 : 백만원) |
| 구분 | 금액 | 산출근거 |
|---|---|---|
| 외부평가 & 자문수수료 |
130 | 절차 주관, 법률 및 회계, 재무자문 수수료 등 (금번 합병 및 향후 과정 전반을 포함하여 포괄적으로 산출하였으며, 향후 합병회계처리에 필요한 회계자문수수료 및 각종 평가비용까지 포함된 금액으로 일부 조정 가능) |
| 상장수수료 | 4 | (주)제넥신 보통주 추가상장 수수료 - 추가상장 예상 시가총액 : 약 256억원 (주가 6,210원 가정 / 2024년 06월 28일 종가) - 수수료 : 394만원(추가상장 시가총액 기준 100억원 초과 300억원 이하일 경우 250만원+100억원 초과금액의 10억원당 9만원) |
| 기타비용 | 10 | 등록세, 공고비, 투자설명서 제작발송비, 등기비용 및 제세금, 주주배정통지서발송비 등 |
| 합계 | 144 | - |
| 주) 본 합병 관련 소요비용은 협의과정에서 변동될 수 있습니다. |
5. 자기주식 등 소유 현황 및 처리방법
가. 합병 당사회사의 자기주식 및 포합주식 소유 현황
| (기준일: 증권신고서 제출 전일 현재) | (단위: 주, %) |
| 구분 | 종류 | 주식수 | 비율 | |
|---|---|---|---|---|
| 존속회사 주식회사 제넥신 |
자기주식 | 보통주 | 60,816 | 0.15% |
| 소멸회사발행주식 | 보통주 | - | - | |
| 소멸회사 주식회사 이피디바이오테라퓨틱스 |
자기주식 | 보통주 | - | - |
| 존속회사발행주식 | 보통주 | - | - | |
존속회사인 (주)제넥신은 소멸회사인 (주)이피디바이오테라퓨틱스 주식을 보유하고 있지 않으며, 소멸회사인 (주)이피디바이오테라퓨틱스는 자기주식을 보유하고 있지 않으므로 포합주식과 소멸회사의 자기주식에 대해서는 합병신주를 배정하지 않습니다.
또한, 소멸회사인 (주)이피디바이오테라퓨틱스는 본건 합병을 총주주 동의에 따른 간이합병 절차에 따라 진행하므로, 주식매수청구권이 인정되지 않습니다. 따라서, 소멸회사는 주식매수청구권을 행사한 보통주주들로부터 매수하여 보유하게 될 보통주 자기주식이 없어 합병신주를 배정하지 않습니다.
6. 근로계약 관계의 이전
존속회사인 (주)제넥신은 소멸회사인 (주)이피디바이오테라퓨틱스의 직원을 합병기일 현재 (주)제넥신의 직원으로 승계합니다. 다만, 소멸회사의 이사의 지위는 해산등기와 함께 소멸합니다.
7. 종류주주의 손해 등
증권신고서 제출 전일 현재 소멸회사는 전환우선주 91,100주, 제1회 상환전환우선주 158,300주, 제2회 상환전환우선주 14,760주를 발행하였습니다.
1. 전환우선주
전환우선주의 보통주 전환 주식수는 아래와 같이 산정되었습니다.
| (단위: 원, 주) |
|
구분 |
내용 |
|---|---|
| a. 피합병법인 본질가치[(①x1+②x1.5)÷2.5] | 27,020,025,813 |
| ① 피합병법인의 자산가치 | 1,883,382,785 |
| ② 피합병법인의 수익가치 | 43,777,787,831 |
| b. 전환주식(*) 1주당 보통주 1주 전환시 총 주식수 | 664,160 |
| c. 합병가액(c = a / b) | 40,683 |
| d. 전환우선주 발행가액 | 6,591 |
| e. 조정 후 우선주 1주당 전환하는 보통주의 수(e = 1 x d / (c x 70%)) | 1 |
| f. 전환우선주 주식수 | 91,100 |
| g. 보통주 전환 주식수(g = e x f) | 91,100 |
(*) 피합병법인이 발행한 보통주로 전환 가능한 증권인 전환우선주, 상환전환우선주, 주식선택권을 모두 포함한 수량입니다.
전환우선주의 전환비율 적용시 발행금액 대비 합병대가 금액은 다음과 같습니다.
| (단위: 원, 주) |
| 주주 | 우선주 발행금액 | 보통주 전환 후 합병대가 | 발행금액 대비 비율(B/A) |
||
|---|---|---|---|---|---|
| 주식수 | 금액 | 주식수 | 금액 | ||
| (주)퓨처플레이 |
45,500 | 299,886,405 | 45,500 | 1,843,313,998 | 615% |
| 미래에셋 Innovative Growth 투자조합 |
15,200 | 100,181,832 | 15,200 | 615,788,413 | 615% |
| (주)반반벤처스 | 6,100 | 40,204,551 | 6,100 | 247,125,613 | 615% |
| 고광표 | 4,500 | 29,659,095 | 4,500 | 182,305,780 | 615% |
| 고광민 | 1,600 | 10,545,456 | 1,600 | 64,819,833 | 615% |
| 조유희 | 1,500 | 9,886,365 | 1,500 | 60,768,593 | 615% |
| 황혜진 | 1,500 | 9,886,365 | 1,500 | 60,768,593 | 615% |
| 경기하나버팀목재기지원펀드2호 | 15,200 | 100,181,832 | 15,200 | 615,788,413 | 615% |
| 합계 | 91,100 | 600,431,901 | 91,100 | 3,690,679,236 | 615% |
2021년 8월 24일, 9월 29일, 10월 6일 전환우선주 투자자와 우선주인수계약서를 작성하였습니다. 일반적인 전환비율은 우선주 1주당 보통주 1주로 전환 되지만 우선주인수계약서상 회사가 타사와의 합병시 교환비율 산정을 위한 회사 주식의 평가가액의 70%가 그 당시 본건 우선주식의 전환가격을 하회하는 경우에는 전환비율이 조정됩니다. 우선주인수계약서상의 주요 요약은 다음과 같습니다.
| 제3조(본건 우선주식의 내용) 4. 전환에 관한 사항 다. 최초의 전환가격은 본건 우선주식 인수가격으로 하여 최초의 전환비율은 1로서 본건 우선주식 1주당 전환대상 주식 1주로 전환한다. 마. 회사가 타사와의 합병시 교환비율 산정을 위한 회사 주식의 평가가액의 70%가 그 당시의 본건 우선주식의 전환가격을 하회하는 경우, 본건 우선주식의 전환가격은 평가가액의 70%로 조정한다. |
출처: 피합병법인 제시자료
전환우선주 계약의 조건에 따라 피합병법인의 1주당 합병가액은 다음의 방식으로 산출하였습니다.
(a) 피합병법인의 자산가치 및 수익가치를 현재의 (전환가격 및 전환비율 조정 전 기준) 발행주식총수로 나누어 잠정 합병가액 산정
(b) 잠정 합병가액의 70%가 기존 전환가격을 초과하므로, 전환가격을 조정하지 않음
(c) 피합병법인의 자산가치 및 수익가치를 조정된 전환가격을 기준으로 한 잠재주식을 포함한 발행주식 총수로 나누어 최종 합병가액 산정
2. 제1회 상환전환우선주
제1회 상환전환우선주의 보통주 전환 주식수는 아래와 같이 산정되었습니다.
| (단위: 원, 주) |
|
구분 |
내용 |
|---|---|
| a. 피합병법인 본질가치[(①x1+②x1.5)÷2.5] | 27,020,025,813 |
| ① 피합병법인의 자산가치 | 1,883,382,785 |
| ② 피합병법인의 수익가치 | 43,777,787,831 |
| b. 전환주식(*) 1주당 보통주 1주 전환시 총 주식수 | 664,160 |
| c. 합병가액(c = a / b) | 40,683 |
| d. 상환전환우선주 발행가액 | 27,693 |
| e. 조정 후 우선주 1주당 전환하는 보통주의 수(e = 1 x d / (c x 70%)) | 1.0000000 |
| f. 상환전환우선주 주식수 | 158,300 |
| g. 보통주 전환 주식수(g = e x f) | 158,300 |
(*) 피합병법인이 발행한 보통주로 전환 가능한 증권인 전환우선주, 상환전환우선주, 주식선택권을 모두 포함한 수량입니다.
제1회 상환전환우선주의 전환비율 적용시 발행금액 대비 합병대가 금액은 다음과 같습니다
| (단위: 원, 주) |
| 주주 | 우선주 발행금액 | 보통주 전환 후 합병대가 | 발행금액 대비 비율(B/A) |
||
|---|---|---|---|---|---|
| 주식수 | 금액 | 주식수 | 금액 | ||
| 미래에셋 바이오 프론티어 투자조합 | 54,200 | 1,500,960,600 | 54,200 | 2,195,771,840 | 146% |
| 하나테크밸류업펀드 | 36,200 | 1,002,486,600 | 36,200 | 1,466,548,720 | 146% |
| 류종우 | 600 | 16,615,800 | 600 | 24,307,437 | 146% |
| 용예령 | 600 | 16,615,800 | 600 | 24,307,437 | 146% |
| 퓨처플레이혁신솔루션펀드 | 12,500 | 346,162,500 | 12,500 | 506,404,945 | 146% |
| 메디톡스투자조합1호 | 54,200 | 1,500,960,600 | 54,200 | 2,195,771,840 | 146% |
| 합계 | 158,300 | 4,383,801,900 | 158,300 | 6,413,112,219 | 146% |
2022년 3월 29일, 6월 24일 상환전환우선주 투자자와 우선주 인수계약서를작성하였습니다. 일반적인 전환비율은 우선주 1주당 보통주 1주로 전환 되지만 우선주인수계약서상 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우에는 전환비율이 조정됩니다. 우선주인수계약서상의 주요 요약은 다음과 같습니다.
| 제11조 전환권에 관한 사항 ③ 전환비율은 다음과 같다. 명확하게 하기 위하여 본 항의 각 호는 중복적으로 적용한다. 1. 본건 종류주식의 보통주로의 전환비율은 종류주식 1주당 보통주 1주로 한다. 2. 회사의 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우는 전환비율을 다음과 같이 조정한다. 조정 후 우선주 1주당 전환하는 보통주의 수 = 조정 전 우선주 1주당 전환되는 보통주의 수 x 조정 전 본건 우선주식의 전환가격 / 조정기준단가의 [70]%에 해당하는 금액 |
출처: 피합병법인 제시자료
상환전환우선주 계약의 조건에 따라 피합병법인의 1주당 합병가액은 다음의 방식으로 산출하였습니다.
(a) 피합병법인의 자산가치 및 수익가치를 현재의 (전환가격 및 전환비율 조정 전 기준) 발행주식총수로 나누어 잠정 합병가액 산정
(b) 잠정 합병가액의 70%가 기존 전환가격을 초과하므로, 전환가격을 조정하지 않음
(c) 피합병법인의 자산가치 및 수익가치를 조정된 전환가격을 기준으로 한 잠재주식을 포함한 발행주식 총수로 나누어 최종 합병가액 산정
3. 제2회 상환전환우선주
제2회 상환전환우선주의 보통주 전환 주식수는 아래와 같이 산정되었습니다.
| (단위: 원, 주) |
|
구분 |
내용 |
|---|---|
| a. 피합병법인 본질가치[(①x1+②x1.5)÷2.5] | 27,020,025,813 |
| ① 피합병법인의 자산가치 | 1,883,382,785 |
| ② 피합병법인의 수익가치 | 43,777,787,831 |
| b. 전환주식(*) 1주당 보통주 1주 전환시 총 주식수 | 664,160 |
| c. 합병가액(c = a / b) | 40,683 |
| d. 상환전환우선주 발행가액 | 33,876 |
| e. 조정 후 우선주 1주당 전환하는 보통주의 수(e = 1 x d / (c x 70%)) | 1.1895455 |
| f. 상환전환우선주 주식수 | 14,760 |
| g. 보통주 전환 주식수(g = e x f) | 17,557 |
(*) 피합병법인이 발행한 보통주로 전환 가능한 증권인 전환우선주, 상환전환우선주, 주식선택권을 모두 포함한 수량입니다.
제2회 상환전환우선주의 전환비율 적용시 발행금액 대비 합병대가 금액은 다음과 같습니다
| (단위: 원, 주) |
| 주주 | 우선주 발행금액 | 보통주 전환 후 합병대가 | 발행금액 대비 비율(B/A) |
||
|---|---|---|---|---|---|
| 주식수 | 금액 | 주식수 | 금액 | ||
| 이노헬스펀드1호 | 8,856 | 300,005,856 | 10,534 | 426,757,575 | 142% |
| ㈜ 이노큐브 | 5,904 | 200,003,904 | 7,023 | 284,518,554 | 142% |
| 합계 | 14,760 | 500,009,760 | 17,557 | 711,276,129 | 142% |
2024년 4월 23일 상환전환우선주 투자자와 우선주인수계약서를 작성하였습니다. 일반적인 전환비율은 우선주 1주당 보통주 1주로 전환 되지만 우선주 인수계약서상 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우에는 전환비율이 조정됩니다. 우선주인수계약서상의 주요 요약은 다음과 같습니다.
| 제11조 전환권에 관한 사항 ③ 전환비율은 다음과 같다. 명확하게 하기 위하여 본 항의 각 호는 중복적으로 적용한다. 1. 본건 종류주식의 보통주로의 전환비율은 종류주식 1주당 보통주 1주로 한다. 2. 회사의 다른 회사와의 합병 시 합병비율 산정을 위한 주당 평가금액의 70%에 해당하는 금액이 그 당시 본건 우선주식의 전환가격을 하회하는 경우는 전환비율을 다음과 같이 조정한다. 조정 후 우선주 1주당 전환하는 보통주의 수 = 조정 전 우선주 1주당 전환되는 보통주의 수 x 조정 전 본건 우선주식의 전환가격 / 조정기준단가의 [70]%에 해당하는 금액 |
출처: 피합병법인 제시자료
상환전환우선주 계약의 조건에 따라 피합병법인의 1주당 합병가액은 다음의 방식으로 산출하였습니다.
(a) 피합병법인의 자산가치 및 수익가치를 현재의 (전환가격 및 전환비율 조정 전 기준) 발행주식총수로 나누어 잠정 합병가액 산정
(b) 잠정 합병가액의 70%가 기존 전환가격을 미달하므로, 전환가격을 잠정 합병가액의 70%로 하향 조정
(c) 피합병법인의 자산가치 및 수익가치를 조정된 전환가격을 기준으로 한 잠재주식을 포함한 발행주식 총수로 나누어 최종 합병가액 산정
이와 같은 전환비율의 조정을 고려하여 합병비율을 산정한 관계로 종류주주에게 미치는 손해는 없을 것으로 판단됩니다. 또한, 피합병법인이 발행한 종류주식 264,160주 전체는 합병계약서에 따라 합병기일전에 피합병법인의 보통주로 전환할 예정이며 보통주 합병비율 1:6.1947003에 따라 (주)제넥신의 보통주식으로 발행 교부될 예정입니다.
8. 채권자 보호절차
존속회사 및 소멸회사는 「상법」 제232조 및 제527조의5의 규정에 따라 다음과 같은 채권자 보호절차를 진행할 예정입니다.
| 구분 | 일자 및 장소 | |
|---|---|---|
| 채권자 이의제출 공고 | 2024년 08월 12일 | |
| 채권자 이의제출 기간 | 2024년 08월 12일 ~ 2024년 09월 13일 | |
| 공고매체 | (주)제넥신 | 회사 홈페이지 (http://www.genexine.com) |
| (주)이피디바이오테라퓨틱스 | 회사 홈페이지 (http://www.epdbio.com) |
|
| 채권자 이의제출 장소 | (주)제넥신 | 서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크 |
| (주)이피디바이오테라퓨틱스 | 서울특별시 구로구 디지털로 306, 대륭포스트타워 2차 1207호(구로동) | |
가. 「상법」 제527조의5 제1항에 의거 각 합병 당사자는 주주총회의 승인결의가 있은 날부터 2주내에 채권자에 대하여 합병에 이의가 있으면 1월 이상의 기간 내에 이를 제출할 것을 공고하고 알고 있는 채권자에 대하여는 각각 이를 최고하여야 합니다.
나. 「상법」 제232조 제2항에 의거 채권자가 위 기간 내에 이의를 제출하지 아니한 때에는 합병을 승인한 것으로 간주합니다.
다. 「상법」 제232조 제3항에 의거 이의를 제출한 채권자가 있는 때에는 각 합병당사자는 그 채권자에 대하여 변제 또는 상당한 담보를 제공하거나 이를 목적으로 하여 상당한 재산을 신탁회사에 신탁합니다.
라. 「상법」 제439조 제3항 및 제530조 제2항에 의거 사채권자가 이의를 제기하려면 사채권자집회의 결의가 있어야 하며, 이 경우 법원은 이해관계인의 청구에 의하여 사채권자를 위하여 이의 제기 기간을 연장할 수 있습니다.
마. 소멸회사인 (주)이피디바이오테라퓨틱스가 합병기일 현재 보유하고 있는 부채에 대한 일체의 권리와 의무는 존속회사인 (주)제넥신이 승계합니다.
9. 그 밖의 합병 등 조건
가. 합병계약서상의 계약 해제 조건
합병계약서에 기재된 계약의 선행조건 및 해제조건은 아래와 같습니다.
| [본 합병계약서 상의 선행조건 및 해제 조건] |
|---|
|
제12조(선행조건) 각 당사자가 본 계약에 따라 본건 합병을 이행할 의무는 합병기일까지 다음 각호의 조건이 충족될 것을 조건으로 한다. 가. 각 당사자의 주주총회(이사회로 갈음할 경우 이사회를 의미)에서 본 계약과 본건 합병이 적법하게 승인되었을 것
당사자들은 합병기일 이전에는 다음 각 호의 사유가 있는 경우 본 계약을 해제할 수 있다. 단, 본 조 마호을 제외하고, 각 해제사유의 발생에 책임이 있는 회사는 해제할 수 없다. 가. 당사자들이 본 계약을 해제하기로 서면으로 상호 합의하는 경우 마. 본 계약 체결일 이후 합병기일까지 "존속회사" 또는 "소멸회사"의 재무상태, 경영실적, 자산 및 영업상태 또는 전망에 중대한 부정적 변경이 발생한 경우 |
나. 이사 및 감사의 임기
(주)제넥신 (주)이피디바이오테라퓨틱스을 흡수합병하여 (주)제넥신이 존속하고, (주)이피디바이오테라퓨틱스는 소멸합니다.
본건 합병 후 존속회사인 (주)제넥신 이사 및 감사로 재직하는 자는 달리 사임 등 임기 종료사유가 발생하지 않는 한, 본건 합병 후에도 상법 제527조의4에도 불구하고 남은 임기동안 존속회사인 (주)제넥신의 이사 및 감사의 지위를 유지합니다. 하지만 합병 후 소멸하는 (주)이피디바이오테라퓨틱스의 이사 및 감사의 임기는 본건 합병의 효력 발생과 동시에 만료되어 기존 지위를 상실합니다.
※ 관련 법령
| 【상법】 |
|---|
| 제527조의4(이사ㆍ감사의 임기) ① 합병을 하는 회사의 일방이 합병후 존속하는 경우에 존속하는 회사의 이사 및 감사로서 합병전에 취임한 자는 합병계약서에 다른 정함이 있는 경우를 제외하고는 합병후 최초로 도래하는 결산기의 정기총회가 종료하는 때에 퇴임한다. ② 삭제 <2001.7.24.> [본조신설 1998.12.28.] |
합병기일(2024년 10월 01일 예정) 이후 주요 경영방침에 대해서는 합병 전 소멸회사인 (주)이피디바이오테라퓨틱스의 운영방침을 고려하여 종합적인 검토가 필요할 것으로 예상되며, 검토 결과를 바탕으로 적법한 절차에 따라 결정할 예정입니다. 이 외에 향후 임원구성에 대한 사항으로, 합병 전 소멸회사인 (주)이피디바이오테라퓨틱스의 대표이사인 최재현 사내이사를 합병 후 존속법인인 (주)제넥신의 사내이사(각자 대표이사)로 선임할 계획을 가지고 있습니다.
다. 계약의 효력 발생
본 합병의 합병계약은 합병당사회사인 (주)제넥신 및 (주)이피디바이오테라퓨틱스가 합병계약서에 서명 또는 기명날인함과 동시에 효력을 발생합니다.
라. 존속회사의 정관 변경사항
해당사항 없습니다.
마. 합병기일
본 건 합병의 합병기일은 2024년 10월 01일로 합니다. 다만, 합병 절차의 진행에 따라 필요한 경우에는 법령에 위반하지 않는 한 (주)제넥신과 (주)이피디바이오테라퓨틱스가 협의하여 합병기일을 변경할 수 있습니다.
바. 관할합의
합병계약의 체결, 이행, 해석, 또는 본 계약의 위반과 관련하여 (주)제넥신과 (주)이피디바이오테라퓨틱스 사이에서 발생하는 분쟁은 서울중앙지방법원을 제1심 합의관할법원으로 지정하여 해결하기로 합의하였습니다.
사. 자산 및 권리의무의 이전
소멸회사인 (주)이피디바이오테라퓨틱스는 본건 합병의 결과 그 자산과 부채 및 권리의무의 일체를 존속회사인 (주)제넥신에 인계하고 존속회사는 이를 승계합니다.
아. 합병계약서에 정하지 않은 사항
본건의 합병계약서에 규정된 내용 이외의 합병에 필요한 사항은 계약의 취지에 따라 (주)제넥신과 (주)이피디바이오테라퓨틱스가 협의하여 이를 결정할 예정입니다.
IV. 영업 및 자산의 내용
해당사항 없습니다.
V. 신주의 주요 권리내용에 관한 사항
1. 합병 시 발행되는 신주의 주요 권리내용
가. 합병 신주의 법상 명칭
| 명칭 | 액면금액 | 발행신주 |
|---|---|---|
| 주식회사 제넥신 보통주 | 500원 | 4,131,598주 |
나. 합병신주의 권리내용
(1) 합병신주의 권리
합병신주는 (주)제넥신 기명식 보통주식으로 관계 법령 및 회사의 정관이 정하는 사항 외에 별도로 보통주주의 권리를 침해하는 사항은 없습니다.
합병 후 존속회사에 적용될 정관이 정하는 (주)제넥신 기명식 보통주식의 권리는 다음과 같습니다. 하기 정관의 내용은 본 합병의 효력이 발생하는 날부터 시행될 예정입니다.
| [(주)제넥신 정관] |
| 제 5조(발행예정주식총수) 회사가 발행할 주식의 총수는 300,000,000주로 한다 제 6조(설립 시에 발행하는 주식의 총수) 회사가 설립 시에 발행하는 주식의 총수는 10,000주(1주의 금액 5,000원 기준)로 한다. 제 7조(1주의 금액) 주식 1주의 금액은 500원으로 한다. 제 8조(주식 및 주권의 종류) ① 회사가 발행할 주식의 종류는 기명식 보통주식과 기명식 종류주식으로 한다. ② 회사가 발행하는 종류주식은 이익배당 및 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다. 제 8조의2(주식 등의 전자등록) 회사는 「주식ㆍ사채 등의 전자등록에 관한 법률」 제2조제1호에 따른 주식등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식등을 전자등록하여야 한다. 다만 회사가 법령에 따른 등록의무를 부담하지 않는 주식등의 경우에는 그러하지 아니할 수 있다. 제 12조(신주인수권) ① 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다. ② 회사는 제 1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 이외의 자에게 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 「자본시장과 금융투자업에 관한 법률」 제 165조의 6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 「상법」 542조의 3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4. 「근로복지기본법」 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 발행주식총수의 100분의 50을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 6. 발행주식총수의 100분의 50분을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산ㆍ판매ㆍ자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 주권을 유가증권시장 또는 코스닥시장에 신규 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 ③ 제2항 각호중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다 ④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. 제 13조(주식매수선택권) ① 회사는 주주총회의 특별결의로 발행주식총수의 100분의 15 번위 내에서 주식매수선택권을 부여할 수 있다. 다만 「상법」 제542조의3제3항의 규정에 따라 발행주식총수의 100분의 3 범위 내에서 이사회의 결의로 주식매수선택권을 부여할 수 있다. 이 경우 주식매수선택권은 경영성과 또는 주가지수 등에 연동하는 성과연동형으로 부여할 수 있다. ② 제1항 단서의 규정에 따라 이사회 결의로 주식매수선택권을 부여한 경우에는 그 부여 후 처음으로 소집되는 주주총회의 승인을 얻어야 한다. ③ 제1항의 규정에 의한 주식매수선택권 부여대상자는 회사의 설립ㆍ경영ㆍ해외영업과 기술혁신 등에 기여하거나 기여할 수 있는 회사의 이사ㆍ감사 또는 피용자 및 「상법 시행령」 제 30조 1항이 정하는 관계회사의 이사ㆍ감사 또는 피용자로 한다. 다만, 회사의 이사에 대하여는 이사회의 결의로 주식매수선택권을 부여할 수 없다. ④ 제3항의 규정에도 불구하고 「상법」 제542조의8제2항의 최대주주와 그 특수관계인 및 주요주주와 그 특수관계인에게는 주식매수선택권을 부여할 수 없다. 다만, 회사 또는 제3항의 관계회사의 임원이 됨으로써 특수관계인에 해당하게 된 자(그 임원이 계열회사의 상무에 종사하지 아니하는 이사ㆍ감사인 경우를 포함한다)에게는 주식매수선택권을 부여할 수 있다. ⑤ 임원 또는 직원 1인에 대하여 부여하는 주식매수선택권은 발행주식총수의 100분의 10을 초과할 수 없다. ⑥ 다음 각 호의 어느 하나에 해당하는 경우에는 이사회의 결의로 주식매수선택권의 부여를 취소할 수 있다. 1. 주식매수선택권을 부여 받은 자가 본인의 의사에 따라 사임 또는 사직한 경우 2. 주식매수선택권을 부여 받은 자가 고의 또는 과실로 회사에 중대한 손해를 입힌 경우 3. 회사의 파산 등으로 주식매수선택권의 행사에 응할 수 없는 경우 4. 기타 주식매수선택권 부여계약에서 정한 취소사유가 발생한 경우 ⑦ 회사는 주식매수선택권을 다음 각 호의 1에서 정한 방법으로 부여한다. 1. 주식매수선택권의 행사가격으로 새로이 기명식 보통주식을 발행하여 교부하는 방법 2. 주식매수선택권의 행사가격으로 기명식 보통주식의 자기주식을 교부하는 방법 3. 주식매수선택권으 행사가격과 시가와의 차액을 현금 또는 자기주식으로 교부하는 방법 ⑧ 주식매수선택권을 부여받은 자는 제1항의 결의일로부터 3년 이상 경과한 날로부터 10년 내에 별도 계약에 정하는 바에 따라 행사할 수 있다. ⑨ 주식매수선택권을 부여받은 자는 제1항의 결의일로부터 3년 이상 재임 또는 재직하여야 행사할 수 있다. 다만, 주식매수선택권을 부여받은 자가 제1항의 결의일로부터 3년내에 사망하거나 기타 본인의 귀책사유가 아닌 사유로 사임 또는 퇴직한 경우에는 그 행사기간 동안 주식매수선택권을 행사할 수 있다. ⑩ 주식매수선택권을 행사할 주식의 1주당 행사가격은 다음 각 호의 가격 이상으로 한다. 주식매수선택권을 부여한 후 그 행사가격을 조정하는 경우에도 또한 같다. 1. 새로이 주식을 발행하여 교부하는 경우에는 다음 각 목의 가격 중 높은 금액 가. 주식매수선택권의 부여일을 기준으로 한 주식의 실질가액 나. 당해 주식의 권면액 2. 자기주식을 양도하는 경우에는 주식매수선택권 부여일을 기준으로 한 주식의 실질가액 ⑪ 주식매수선택권의 행사로 인하여 발행한 신주에 대한 이익의 배당에 관하여는 제 14조의 규정을 준용한다. 제 14조(신주의 배당기산일) 회사가 유상증자, 무상증자 및 주식배당에 의하여 발행한 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전 영업연도 말에 발행된 것으로 본다. 제 30조(주주의 의결권) 주주의 의결권은 1주마다 1개로 한다. 제 31조(상호주에 대한 의결권 제한) 회사, 회사와 회사의 자회사 또는 회사의 자회사가 다른 발행주식총수의 10분의 1을 초과하는 주식을 가지고 있는 경우, 그 다른 자회사가 가지고 있는 이 회사의 주식은 의결권이 없다. 제 32조(의결권의 불통일행사) ① 2 이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3일전에 회사에 대하여 서면으로 그 뜻과 이유를 통ㅎ 제 33조(의결권의 대리행사) ① 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있다. ② 제 1항의 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다. 제 58조(이익배당) ① 이익의 배당은 금전, 주식 및 기타의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 수종의 주식을 발행한 때에는 주주총회의 결의에 따라 그와 다른 종류의 주식으로도 할 수 있다. ③ 제 1항의 배당은 매결산기 말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익배당은 주주총회의 결의로 정한다. 다만 제 55조제4항에 따라 이사회가 재무제표를 승인하는 경우 이사회의 결의로 이익배당을 정한다. 제 59조(배당금 지급청구권의 소멸시효) ① 배당금의 지급청구권은 5년간 이를 행사하지 아니하면 소멸시효가 완성된다. ② 제1항의 시효의 완성으로 인한 배당금은 이 회사에 귀속된다. 제 60조(분기배당) ① 회사는 이사회의 결의로 사업연도 개시일로부터 3월ㆍ6월 및 9월의 말일(이하 "분기배당 기준일"이라 한다)의 주주에게 자본시장과 금융투자업에 관한 법률 제165조의 12에 따라 분기배당을 할 수 있다. ② 제 1항의 이사회의 결의는 분기배당 기준일 이후 45일 내에 하여야 한다. ③ 분기배당은 직전결산기의 대차대조표상의 순자산가액에서 다음 각호의 금액을 공제한 액을 한도로 한다. 1. 직전결산기의 자본금의 액 2. 직전결산기까지 적립된 자본준비금과 이익준비금의 합계액 3. 직전결산기의 정기주주총회에서 이익배당하기로 정한 금액 4. 직전결산기까지 정관의 규정 또는 주주총회의 결의에 의하여 특정목적을 위해 적립한 임의준비금 5. 상법 시행령 제19조에서 정한 미실현이익 6. 분기배당에 따라 당해 결산기에 적립하여야 할 이익준비금의 합계액 ④ 사업연도 개시일 이후 분기배당 기준일 이전에 신주를 발행한 경우(준비금의 자본전입, 주식배당, 전환사채의 전환청구, 신주인수권부사채의 신주인수권 행사에 의한 경우를 포함한다)에는 분기배당에 관해서는 당해 신주는 직전사업연도 말에 발행된 것으로 본다. 다만, 분기배당 기준일 후에 발행된 신주에 대하여는 최근 분기배당 기준일 직후에 발행된 것으로 본다. ⑤ 제 9조의 우선주식에 대한 분기배당은 보통주식과 동일한 배당률을 적용한다. |
본 합병 이후 (주)제넥신의 정관 상 보통주의 권리는 변동 없습니다.
(2) 합병신주의 이익배당기산일
합병신주에 대한 이익배당기산일은 2024년 01월 01일로 합니다.
(3) 신주의 상장 등에 관한 사항
(주)제넥신은 한국거래소 코스닥시장에 본 건 합병에 따라 발행되는 합병신주(보통주)에 대한 상장을 2024년 10월 10일 신청할 예정이며, 2024년 10월 17일 상장될 예정입니다. 단, 유관기관과의 업무 협의 및 승인과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.
다. 합병신주의 교부조건
(1) 교부대상
합병기일(2024년 10월 01일) 현재 주주명부에 등재된 (주)이피디바이오테라퓨틱스 보통주 주주
(2) 교부비율
(주)이피디바이오테라퓨틱스의 보통주 1주당 6.1947003주의 비율로 존속회사인 (주)제넥신의 기명식 보통주식을 교부합니다.
(3) 신주배정 시 발행하는 단주 처리 방법
합병신주의 배정으로 1주 미만의 단주가 발생하는 경우에는 단주가 귀속될 주주에게 합병신주의 주권상장일에 한국거래소에서 거래되는 종가를 기준으로 계산된 금액을 현금으로 지급할 예정이며, 해당 단주는 「상법」 제341조의2 제3호에 따라 합병존속회사인 (주)제넥신의 자기주식 취득으로 처리합니다.
※ 관련 법령
| [상 법] |
|---|
|
제341조의2(특정목적에 의한 자기주식의 취득) 1. 회사의 합병 또는 다른 회사의 영업전부의 양수로 인한 경우 2. 회사의 권리를 실행함에 있어 그 목적을 달성하기 위하여 필요한 경우 3. 단주(端株)의 처리를 위하여 필요한 경우 4. 주주가 주식매수청구권을 행사한 경우 |
(4) 교부금 지급
"(3) 신주배정 시 발생하는 단주 처리 방법"에 따라 지급되는 금전 이외에 금번 합병에 참여하는 회사의 주주에게는 어떠한 교부금도 지급하지 않습니다.
VI. 투자위험요소
1. 합병의 성사를 어렵게 하는 위험요소
가. 합병계약서 상의 계약 해제 조건
본 합병계약은 합병기일 이전에 다음과 같은 사유가 발생 시 해제될 수 있습니다. 합병계약서에 기재된 계약의 선행조건 및 해제조건은 아래와 같습니다.
| [본 합병계약서 상의 선행조건 및 해제 조건] |
|---|
|
제12조(선행조건) 각 당사자가 본 계약에 따라 본건 합병을 이행할 의무는 합병기일까지 다음 각호의 조건이 충족될 것을 조건으로 한다. 가. 각 당사자의 주주총회(이사회로 갈음할 경우 이사회를 의미)에서 본 계약과 본건 합병이 적법하게 승인되었을 것
당사자들은 합병기일 이전에는 다음 각 호의 사유가 있는 경우 본 계약을 해제할 수 있다. 단, 본 조 마호을 제외하고, 각 해제사유의 발생에 책임이 있는 회사는 해제할 수 없다. 가. 당사자들이 본 계약을 해제하기로 서면으로 상호 합의하는 경우 마. 본 계약 체결일 이후 합병기일까지 "존속회사" 또는 "소멸회사"의 재무상태, 경영실적, 자산 및 영업상태 또는 전망에 중대한 부정적 변경이 발생한 경우 |
나. 합병승인 주주총회에서 합병이 무산될 가능성
소멸회사인 (주)이피디바이오테라퓨틱스는 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다. 다만, 소멸회사인 (주)이피디바이오테라퓨틱스의 사내이사는 2인으로 상법 상 이사회 구성요건을 충족하지 못하므로. 소멸회사인 (주)이피디바이오테라퓨틱스의 합병 승인은 주주총회를 통해 진행되며, 「상법」 제363조 4항에 따라, 소멸회사인 (주)이피디바이오테라퓨틱스는 자본금 10억원 미만의 회사로 총주주 동의에 따라 주주총회 소집절차를 생략 및 서면에 의한 결의로서 주주총회의 결의를 갈음할 예정입니다.
한편, 존속회사인 (주)제넥신은 본건 합병을 소규모합병으로 추진하는 바, 주주총회의 승인을 이사회의 승인으로 갈음할 수 있습니다. 하지만 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대(접수기간 : 2024년 07월 15일~2024년 07월 29일)하는 의사를 통지하는 때에는 존속회사는 주주총회의 승인을 얻어 합병을 진행하거나 합병 계약을 해제할 수 있습니다.
다. 관련 법령 상의 인허가 또는 승인 등에 따른 합병 계약 취소의 위험
합병 계약은 체결과 동시에 효력을 발생하는 것으로 하되, 본 합병과 관련하여 필요한 정부기관의 승인ㆍ인가ㆍ신고ㆍ수리 중 합병당사회사의 영업에 중대한 영향을 미치는 승인ㆍ인가ㆍ신고ㆍ수리가 확정적으로 거부된 경우에는 본 합병계약은 해제될 수 있습니다.
라. 합병당사회사 소액주주의 소송제기 가능성
양사의 소액주주들은 절차상 하자나 합병비율이 불공정하다는 이유 등으로 본건 합병과 관련하여 합병 무효의 소를 제기할 가능성이 있습니다. 합병 무효의 소가 제기되어 합병 무효의 판결이 법원에서 확정되는 경우 본 합병 자체가 무효로 돌아갈 위험이 있습니다. 그러나 본건 합병은「상법」등 관련 법에서 정한 절차를 준수하여 진행되고 있으므로 절차상 하자를 이유로 합병이 무효가 될 위험은 높지 않다고 생각됩니다.
한편 합병비율의 불공정성을 이유로 본 합병이 무효로 될 위험성과 관련하여서는 대법원의 판례가 "합병당사자 회사의 전부 또는 일부가 주권상장법인인 경우 증권거래법과 그 시행령 등 관련 법령이 정한 요건과 방법 및 절차 등에 기하여 합병가액을 산정하고 그에 따라 합병비율을 정하였다면 그 합병가액 산정이 허위자료에 의한 것이라거나 터무니없는 예상 수치에 근거한 것이라는 등의 특별한 사정이 없는 한, 그 합병비율이 현저하게 불공정하여 합병계약이 무효로 된다고 볼 수 없을 것이다." (대법원 2008. 1. 10. 선고 2007 다 64136 판결)라고 판시하고 있습니다. 따라서「자본시장과 금융투자업에 관한 법률」및 관련 법령에 따라 합병비율이 산정되어 진행되는 본건 합병에서 합병이 무효로 돌아갈 위험성은 높지 않은 것으로 판단됩니다.
본건 합병의 경우 존속회사인 (주)제넥신은 주권상장법인으로 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제1항 제2호 가에 의거 보통주에 대한 기준주가를 합병가액으로 산출하였습니다. 소멸회사인 (주)이피디바이오테라퓨틱스는 주권비상장법인으로서 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제1항 제2호 나에 의거 자산가치와 수익가치를 가중산술평균한 가액을 합병가액으로 산출하였습니다. 자세한 내용은 제1부 Ⅱ. 합병 가액 및 그 산출근거를 참고하시기 바랍니다. 이와 관련된 법규는 아래와 같습니다.
※ 관련 법령
| 【자본시장과 금융투자업에 관한 법률 시행령】 |
|---|
|
제176조의5(합병의 요건ㆍ방법 등) 1. 주권상장법인 간 합병의 경우에는 합병을 위한 이사회 결의일과 합병계약을 체결한 날 중 앞서는 날의 전일을 기산일로 한 다음 각 목의 종가(증권시장에서 성립된 최종가격을 말한다. 이하 이 항에서 같다)를 산술평균한 가액(이하 이 조에서 "기준시가"라 한다)을 기준으로 100분의 30(계열회사 간 합병의 경우에는 100분의 10)의 범위에서 할인 또는 할증한 가액. 이 경우 가목 및 나목의 평균종가는 종가를 거래량으로 가중산술평균하여 산정한다. 가. 최근 1개월간 평균종가. 다만, 산정대상기간 중에 배당락 또는 권리락이 있는 경우로서 배당락 또는 권리락이 있은 날부터 기산일까지의 기간이 7일 이상인 경우에는 그 기간의 평균종가로 한다. 나. 최근 1주일간 평균종가 다. 최근일의 종가 2. 주권상장법인(코넥스시장에 주권이 상장된 법인은 제외한다. 이하 이 호 및 제4항에서 같다)과 주권비상장법인 간 합병의 경우에는 다음 각 목의 기준에 따른 가격 가. 주권상장법인의 경우에는 제1호의 가격. 다만, 제1호의 가격이 자산가치에 미달하는 경우에는 자산가치로 할 수 있다. 나. 주권비상장법인의 경우에는 자산가치와 수익가치를 가중산술평균한 가액 |
본건 합병의 합병비율은 「자본시장과 금융투자업에 관한 법률」 및 관련 법령에 따라 산정되었고, 본건 합병은 상법 등 관련 법에서 정한 절차를 준수하여 진행되고 있어 합병무효로 판정될 가능성은 낮으나, 본건 합병의 합병비율과 관련하여 소송이 제기될 가능성을 배제하기는 어렵다는 점을 참고하시기 바랍니다.
마. 기타 유의사항
본 증권신고서에 기재된 내용은 증권신고서 제출 전일 현재까지 발생되거나 확정된 것으로서 본 증권신고서 제출 전일 현재 증권신고서 상에 기재된 사항 이외에 본 합병에 영향을 미칠 수 있는 자산, 부채, 현금흐름 또는 손익 상황에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다. 그러나 본 증권신고서에 의한 합병의 진행 과정에서 관계법령상의 인허가, 승인 및 관계기관과의 협의 등에 의해 합병의 일정이 변경될 수 있습니다. 또한, 합병계약 승인을 위한 이사회 및 주주총회에 따라서도 본건 합병의 성사 여부가 변경될 수도 있으며 본건 합병에 따른 합병신주의 발행과 그에 따른 주식 매도 등으로 인해 합병 이후 주가의 변동성이 커질 수 있습니다.
주주 및 투자자는 투자의사를 결정함에 있어 본 증권신고서 외에도 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에 있는 본 합병당사회사들의 공시사항 및 보고사항 등을 참고하시어 투자 의사를 결정하시기 바랍니다.
2. 합병에 따라 배정되는 신주의 향후 상장 추진 또는 상장폐지 가능성
가. 합병신주 상장예정일
(주)제넥신는 한국거래소 코스닥시장에 본 합병에 따라 발행되는 합병신주(보통주)에 대한 상장을 신청할 예정이며, 한국거래소 승인 이후 2024년 10월 17일 상장될 예정입니다.
2019년 09월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 및 승인 과정에서 상기일정은 변경될 수 있음을 유의하시기 바랍니다.
나. 상장폐지 가능성
본 합병은 「자본시장과 금융투자업에 관한 법률」제165조의4에 의한 요건ㆍ방법 등의 기준을 따르고 있으며 「코스닥시장 상장규정」제33조에서 정하는 우회상장에 해당되지 않기 때문에, 「코스닥시장 상장규정」제54조 제1항 제12호에서 정하는 상장폐지 요건에 해당되지 않는 바 상장폐지 가능성은 없습니다.
3. 합병이 성사될 경우 관련 증권을 투자함에 있어 고려해야할 위험요소
3-1. 사업위험
| 가-1. 국내외 거시경기 침체 및 불확실성이 미치는 위험 코로나19 이후 세계 각국은 중국의 리오프닝, 주요 선진국의 견조한 고용 등에 힘입어 민간소비가 양호한 성장세를 보였음에도 불구하고, 금융 불안 심화, 지정학적 리스크, 통화긴축의 여파로 인한 투자심리 위축 등의 영향으로 성장세가 둔화되고 있습니다. 2024년부터는 금리인상 사이클이 마무리되고 신용긴축의 영향도 줄어들면서 점차 회복세를 보일 것으로 전망되나, 그 속도는 코로나19 이전의 성장세(2015~2019년 평균 세계경제성장률 3.4%) 수준을 하회할 것으로 예상됩니다. 이처럼 코로나19 이후에도 여전히 통화긴축, 인플레이션 지속, 지정학적 분열 등의 불확실성이 존재하고 있으며, 경기 회복 지연은 향후에도 한동안 지속될 가능성을 배제할 수 없습니다. 이러한 거시경제 불확실성은 국내외 경기 전반에 걸쳐 영향을 미칠 수 있는 요인으로, 존속회사가 영위하는 사업 및 재무실적에 부정적인 요인으로 작용할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
① IMF 세계경제전망
국제통화기금(IMF)이 2024년 04월 발표한 "World Economic Outlook"에 따르면, 2024년 04월 세계 경제성장률 전망치는 2024년 01월의 전망치인 3.1%보다 0.1%p 증가한 3.2%를, 2024년과 2025년의 성장률은 각각 3.2%를 전망하였습니다. 2024년 전망치의 경우 지난 01월 비해 0.1%p 상향 조정되었으며, 2025년 전망치는 기존 전망치를 유지하였습니다. 국제통화기금(IMF)에 따르면, 최근 미국의 예상보다 강한 성장세, 물가 하락 및 견조한 민간소비에 따른 전세계 국가의 양호한 회복세 등을 감안하여 2024년의 성장률을 0.1%p 상향조정하였습니다.2024년 04월 국제통화기금의 세계 경제성장률 전망은 다음과 같습니다.
| [2024년 04월 국제통화기금 세계 경제성장률 전망] |
| (단위: %, %p) |
|
구분 |
2023년 |
2024년(E) |
2025년(E) |
||||
|
24년 01월 |
24년 04월 |
조정폭 |
24년 01월 |
24년 04월 |
조정폭 |
||
|
(A) |
(B) |
(B-A) |
(C) |
(D) |
(D-C) |
||
|
세 계 |
3.2 |
3.1 | 3.2 | 0.1 | 3.2 | 3.2 | 0.0 |
|
선진국 |
1.6 |
1.5 | 1.7 | 0.2 | 1.8 | 1.8 | 0.0 |
|
미국 |
2.5 |
2.1 | 2.7 | 0.6 | 1.7 | 1.9 | 0.2 |
|
유로존 |
0.4 |
0.9 | 0.8 | -0.1 | 1.7 | 1.5 | -0.2 |
|
일본 |
1.9 |
0.9 | 0.9 | 0.0 | 0.8 | 1.0 | 0.2 |
|
한국 |
1.4 |
2.3 | 2.3 | 0.0 | 2.3 | 2.3 | 0.0 |
|
신흥국 |
4.3 |
4.1 | 4.2 | 0.1 | 4.2 | 4.2 | 0.0 |
|
중국 |
5.2 |
4.6 | 4.6 | 0.0 | 4.1 | 4.1 | 0.0 |
|
인도 |
7.8 |
6.5 | 6.8 | 0.3 | 6.5 | 6.5 | 0.0 |
| 출처: 국제통화기금(World Economic Oulook, 2024.04) |
선진국의 경우 견조한 성장세를 보여주고 있는 미국을 제외하고 대부분 2024년 경제성장률을 2024년 1월 전망치 대비 동결 혹은 하향 조정하였습니다. 주요 선진국 중 미국의 2024년 성장률 전망치를 2024년 1월 전망치였던 2.1% 대비 0.6%p 상향조정한 2.7%로 전망하였으나, 유로존은 긴축적 통화정책 등의 영향으로 2024년 경제 성장률을 2024년 1월 전망치 0.9% 대비 0.1%p 하향한 0.8%로 전망하였습니다. 신흥국의 경우, 2024년 성장률 전망치를 2024년 1월 전망치였던 4.1% 대비 0.1%p 상향조정한 4.2%로 전망하였습니다.중국의 2024년 경제 성장률을 2024년 1월 전망치 4.6%로 동결하였으며, 인도의 2024년 경제 성장률을 2024년 1월 전망치 6.5% 대비 0.3%p 상향한 6.8%로 전망하였습니다.
국제통화기금(IMF)은 2024년 향후 성장률에 대해 상ㆍ하방 요인이 균형을 이루고 있는 것으로 평가하였습니다. 전세계적으로 선거의 해(Great Election Year)를 맞아 각 국의 재정부양 확대가 기대되며, 물가 안정에 따른 조기 금리 인하, AI 발전에 따른 생산성 향상, 성공적인 구조개혁 추진 등을 성장률을 높일 상방 요인으로 제시하였습니다. 동시에 지속되고 있는 지정학적 갈등의 확산, 고금리가 지속되는 상황에서 높은 부채의 수준, 중국의 경기둔화 등을 전세계 경제성장률을 제약할 우려가 있는 하방 요인으로 제시하였습니다.
2024년에는 미국ㆍ유럽의 경기연착륙 기대, 인플레이션의 완화, 그리고 기준금리 인하 등으로 경제 상황이 개선될 것으로 예상되기는 하나, 반대로 러시아-우크라이나 및 이스라엘-하마스 전쟁으로 인한 지정학적 리스크, 높은 시장 금리가 지속됨에 따른 금융 불안정성, 경기 침체 우려등 국내외 경제에 큰 영향을 미칠 수 있는 불확실성 역시 상존하고 있습니다.향후 세계 경제성장률과 국가별 경기 회복의 속도는 주요국 인플레이션 통제와 기준금리 조정 시기에 맞물려 결정될 것으로 예상됩니다. 다만, 현재로서 기준금리 조정 시기를 단언하기는 어렵습니다. 2023년 12월 FOMC에서 금리를 동결하면서 향후 2024년 금리 인하 가능성에 대해 시사하였지만, 정확한 금리 인하 시기는 예측할 수 없어 글로벌 경기의 성장 경로는 다소 불확실한 상태입니다.
② 한국은행 국내경제전망
2024년 02월 한국은행이 발표한 경제전망 보고서에 따르면, 2023년 국내 경제 성장률은 1.4%, 2024년 2.1%로 예상됩니다. 이는 11월에 발표한 2024년 예상 수치와 동일한 수치로써, 경기 둔화의 기조가 예상보다 오래 지속될 것임을 의미합니다. 국내 경기는 소비, 건설투자 등 내수 회복모멘텀 약화에도 불구하고 수출이 양호한 증가세를 이어가면서 지난 2023년 11월 전망에 대체로 부합하는 완만한 개선흐름을 이어갈 것으로 예측됩니다.
한국은행은 각 부문에 대해서 다음과 같이 전망하고 있습니다. 민간소비는 모멘텀이 약한 상황이며 향후 가계 실질소득 개선에 힘입어 회복하겠으나 그 속도는 완만할 것으로 보고 있습니다. 이는 임금 상승 및 물가 둔화로 가계 실질소득이 개선됨에 따른 결과로 해석됩니다. 설비투자 및 지식재산생산물투자는 반도체 첨단공정 및 신성장산업 관련 투자를 중심으로 회복세를 보일 전망입니다. 건설투자는 신규착공 위축 등으로 당초 예상보다 부진한 흐름을 이어갈 전망이며, 재화수출은 글로벌 IT 경기가 회복되고 미국의 수입수요도 견조한 흐름을 이어가면서 증가세가 확대될 전망입니다.
| [한국은행 국내 경제전망] |
| (단위: %) |
|
구분 |
2023년 |
2024년(E) |
2025년(E) | ||
|
연간 |
상반기 |
하반기 |
연간 |
연간 | |
|
GDP |
1.4 |
2.2 | 2.0 | 2.1 | 2.3 |
|
민간소비 |
1.8 | 1.1 | 2.0 | 1.6 | 2.3 |
|
설비투자 |
0.5 |
2.6 | 5.7 | 4.2 | 3.7 |
|
지식재산생산물투자 |
1.6 | 1.5 | 2.8 | 2.2 | 3.3 |
|
건설투자 |
1.4 | (-)2.4 | (-)2.9 | (-)2.6 | (-)1.0 |
|
재화수출 |
2.9 | 6.0 | 3.2 | 4.5 | 3.6 |
|
재화수입 |
(-)0.6 |
0.1 | 5.4 | 2.7 | 3.1 |
| 출처: 한국은행 경제전망보고서(2024년 02월) |
다만, 한국은행은 향후 국내외 수요부진 심화, 유가 하락과 중동지역의 지정학적 정세 불안과 그에 따른 유가 급등, 국내외 기상이변, 비용압력의 파급영향 지속 등의 불확실성이 존재함을 언급했습니다.
상기 기재한 바와 같이 코로나19 이후 세계 각국은 중국의 리오프닝, 주요 선진국의 견조한 고용 등에 힘입어 민간소비가 양호한 성장세를 보였음에도 불구하고, 금융 불안 심화, 지정학적 리스크, 통화긴축의 여파로 인한 투자심리 위축 등의 영향으로 성장세가 둔화되고 있습니다. 2024년부터는 금리인상 사이클이 마무리되고 신용긴축의 영향도 줄어들면서 점차 회복세를 보일 것으로 전망되나, 그 속도는 코로나19 이전의 성장세(2015~2019년 평균 세계경제성장률 3.4%) 수준을 하회할 것으로 예상됩니다. 이러한 거시경제 불확실성은 국내외 경기 전반에 걸쳐 영향을 미칠 수 있는 요인으로, 존속회사가 영위하는 사업 및 재무실적에 부정적인 요인으로 작용할 수 있습니다. 투자자 여러분들께서는 이 점을 반드시 유의하여 주시기 바랍니다.
|
가-2. 신약개발 사업 고유 특성에 따른 위험 |
제약 및 바이오 업계의 특성상 개발 중인 모든 신약은 임상 실패의 불확실성을 내포하고 있습니다. 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 또한, 신약허가신청(NDA) 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 관리 규정을 따라야 합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공하기 까지는 상당한 확률적 불확실성을 내포하고 있습니다.
| [신약개발 및 승인 프로세스] |
 |
|
신약개발 프로세스 |
| 출처 : 글로벌 제약시장 임상 파이프라인 분석(한국바이오경제연구센터, 2017) |
| [임상시험 구분] |
| 구분 | 목적 | 내용 |
| Phase 1 (1상) |
ㆍ안전성 검토 ㆍ내약성 평가 ㆍPK/PD 정의/서술 ㆍ치료효과 추정 |
ㆍ용량-내약성 임상시험 ㆍ안전용량 범위와 부작용 확인 ㆍ체내 약물 동태 검토 ㆍ1a: SAD, 1b: MAD |
| Phase 2 (2상) |
ㆍ단기 유효성/안전성 검토 ㆍ목표 적응증에 대한 탐구 ㆍ후속 시험을 위한 용량 추정 ㆍ치료확증 시험을 위한 시험설계, 평가항목, 평가방법에 대한 근거 제공 |
ㆍ용량-반응 탐색 임상시험 ㆍ소수의 환자에서의 비교적 단기간에 걸친 초기 임상시험 ㆍ2a: 약효확인, 유효용량 검토 ㆍ2b: 약효입증, 유효용량 확인, 유효성 및 안전성의 균형 검토 |
| Phase 3 (3상) |
ㆍ안전성, 유효성 재확인 ㆍ임상적용을 위한 Risk/Benefit의 상대평가 근거제공 ㆍ용량과 반응에 대한 관계 확립 ㆍ효과에 대한 검증 |
ㆍ무작위 배정에 의한 용량-반응 임상시험 ㆍ유효성 확립을 위한 적절하고 잘 통제된 임상시험 ㆍ이환율/사망률을 위한 임상시험 ㆍ충분한 환자에서 유효성 및 안전성 확립 ㆍ대조군을 이용한 비교 임상시험 ㆍ대규모 임상시험 |
| Phase 4 (4상, PMS) |
ㆍ시판 후 안전성 조사 및 추가 임상시험 ㆍ일반 또는 특정 대상군/환경에서 Risk/Benefit에 대한 이해 ㆍ흔하지 않은 이상반응 확인 ㆍ추천되는 용량을 확인 ㆍ모든 시험 디자인이 가능 |
ㆍ장기투여시 부작용 검토 ㆍ안전성 재확립 ㆍ새로운 적응증 등 탐색 연구 ㆍ대조군을 이용한 유효성 임상시험 ㆍ이환율/사망률에 대한 임상시험 ㆍ부가적인 평가 항목에 대한 임상시험 ㆍ약물경제학적 측면의 임상시험 |
| 주1: 약물의 농도-반응 관계를 PK/PD라고 합니다. PK(Pharmacokinetics 약동학)는 약물의 흡수, 분포, 생체 내 변화 및 배설을 연구합니다. PD(Pharmacodynamics 약력학)는 생체에 대한 약물의 생리학적 및 생화학적 작용과 그 작용 기전, 즉 약물이 일으키는 생체의 반응을 주로 연구합니다. |
| 주2: SAD(단회용량상승, single ascending dose) : 단회용량을 투여한 후 안전성과 내약성을 확인합니다. |
| 주3: MAD(다중용량 상승, multiple ascending dose) : 반복 투여를 통해 더 높은 용량으로 증량해가면서 최대 내약 용량을 확인합니다. |
IQVIA Institute(2024) 보고서에 따르면, 2010년부터 2023년까지 FDA 임상 파이프라인을 대상으로 조사된 임상의 성공률은 평균 7.6%로 나타났습니다. 또한 신약개발 과정에 소요되는 기간 및 비용 분석에 관하여 분석기관마다 편차는 있으나, 일반적으로 신약후보물질이 초기 연구 및 임상시험을 거쳐 출시되기까지 보통 10~15년 정도가 소요되는 것으로 알려져 있습니다. 또한 Evaluate Pharma World Preview 2023에 따르면 전 세계 제약 R&D 비용은 2014년 1,450억달러에서 꾸준히 상승하여 2021년 2,490억달러, 2028년에는 3,020억달러가 소요될 것으로 예상하였습니다.
| [연도별 임상 단계별 이행성공률 및 임상 성공률 추이(2010~2023, FDA)] |
 |
|
임상단계별 이행 성공율 및 임상성공율 |
| 출처: Global Trends in R&D 2024, IQVIA Institute, 2024.01 |
| [전 세계 제약 R&D 비용 추이] |
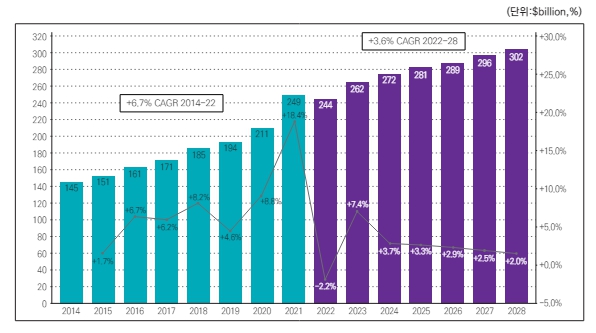 |
|
세계 의약품 시장 연구개발 비용 |
| 출처: 2024 제약바이오산업 Databook |
존속회사는 독자적인 원천기술인 hyFc 융합 단백질 및 DNA 백신 제조기술을 바탕으로차세대 혁신 신약을 연구개발하고 있습니다.
hyFc는 항체의 일부 구조인 Fc를 혼합한 플랫폼 기술입니다. 기존 항체의 Fc 단편을 분리하여 융합시켜 개발한 기술로서 약효 자체는 뛰어나지만 지속성이 짧은 단백질 약물의 효능을 지속시키는 기전입니다. 존속회사는 인체에서 유래한 IgD, IgG4 항체로 플랫폼 구조를 구성하여, 자가면역반응과 같은 부작용을 최소화 하고 기존 효능을 극대화하는 플랫폼을 설계하였습니다.이와 같은 고유의 플랫폼 기술을 활용하여 기존 단백질 치료제를 개선한 바이오베터(biobetter) 뿐만이 아닌, 새로운 단백질을 적용한 신약 또한 개발하고 있습니다.
DNA백신 제조기술은 DNA 벡터기술(유전체 운반 기술)을 기반으로 면역반응을 유도하는 항원을 코딩하는 유전자를 plasmid DNA 내에 삽입하여 전기천공법으로 생체 내 주입하고, 체내에서 DNA 전사 및 번역 과정을 거쳐 단백질 및 펩타이드 형태로 발현된 항원이 면역반응을 유도하도록 만든 것입니다.
존속회사는 해당 플랫폼을 바탕으로 면역항암제 내분기계 질환, 면역계통 질환 등 다양한 적응증에 대응할 수 있는 신약을 개발하고 있으며, 증권신고서 제출일 전일 기준 존속회사 파이프라인 현황은 다음과 같습니다.
| [존속회사의 플랫폼/품목별 파이프라인 현황] |
| 플랫폼 | 품목 | 적응증 | 진행 단계 | 국가 | 승인일 (종료일) |
임상진입일 | 임상 시험 유형 (단독/병용 요법, 약재 명) |
비고 |
|---|---|---|---|---|---|---|---|---|
| hyFc | GX-E4 | 투석환자 만성 신장 질환 관련 빈혈 | Phase3 | 유럽/아시아 9개국가 |
2023-11 | 2024-01 | 단독 | 대한민국 |
| 비투석환자 만성신장질환 빈혈증 | Phase3 | 아시아 7개국가 |
(2023-12) | 2020-08 (타국가) 2021-08 (대한민국) |
단독 | |||
| 투석환자 만성 신장 질환 관련 빈혈 (건강성인) | Phase1 | 대한민국 | 2024-05 | 단독 | ||||
| GX-I7 | 말기 고형암 (대장암, 유방암, 난소암, 자궁경부암, 소장암, 항문암) |
Phase1b | 대한민국 | (2020-03) | 2018-03 | 단독 | ||
| 말기 고형암 (대장암, 유방암, 난소암, 자궁경부암, 소장암, 항문암) |
Phase1b | 대한민국 | (2020-04) | 2018-10 | 병용 (싸이클로포스파마이드) |
|||
| 교모세포종 | Phase1b | 대한민국 | (2020-09) | 2018-06 | 단독 | |||
| 삼중음성유방암 | Phase1b/2 | 대한민국 | (2023-12) | 2019-03 | 병용(Keytruda) | |||
| 교모세포종(재발성) | Phase2 | 대한민국 | 2021-11 | 2021-12 | 병용(Avastin) | |||
| 교모세포종(신환) | Phase2 | 중국 | - | - | 병용(Temodal) | 조기 종료 | ||
| COVID-19 | Phase 1b | 대한민국 | (2022-07) | 2021-02 | 단독 | 조기 종료 | ||
| COVID-19 | Phase 2 | 인도네시아 | (2023-02) | 2021-02 | 단독 | 조기 종료 | ||
| GX-H9 | 성인 성장호르몬 결핍증 | Phase 2a | 유럽/대한민국 | (2017-05) | 2015-01 | 단독 | ||
| 소아 성장호르몬 결핍증 | Phase 3 | 중국 | - | - | 단독 | |||
| GX-G3 | 호중구감소증, 골수억제 항암제를 복용하는 비골수성 기형증 |
Phase2a | 유럽/아시아 5개국가 |
(2018-12) | 2017-02 | 단독 | ||
| GX-P1 | 자가면역질환 | Phase1 | 대한민국 | (2021-07) | 2020-08 | 단독 | ||
| DNA백신 | GX-188E | 진행성/재발성 자궁경부암 | Phase1b/2 | 대한민국 | (2023-12) | 2018-06 | 병용(Keytruda) | |
| 절제 가능한 국소 진행성 두경부암(IIT) | Phase2 | 대한민국 | 2022-03 | 2022-04 | 병용(Keytruda, GX-I7) | |||
| 재발성 및/또는 전이성 두경부암(IIT) | Phase2 | 대한민국 | 2022-03 | 2022-08 | 병용(Opdivo, GX-I7) |
| 출처: 존속회사 제공 |
신약 개발의 경우 안전성과 유효성 문제, 효율성(추가 개발 비용 과다, 다른 파이프라인 확대 또는 집중 등) 또는 시장 수요나 정책의 변화와 같은 다양한 이유로 개발이 중단될 수 있습니다. 존속회사 증권신고서 제출일 전일 기준 또한 연구개발 활동을 중단하거나 보류하고 있는 파이프라인이 존재합니다.
| [존속회사의 플랫폼/품목별 파이프라인 현황] |
| 품목 | 적응증 | 진행 단계 | 국가 | 승인일 (종료일) |
임상진입일 | 임상 시험 유형 (단독/병용 요법, 약재 명) |
중단 연도 |
중단 사유 |
|---|---|---|---|---|---|---|---|---|
| GX-19N | COVID-19 | Phase 1/2a | 대한민국 | 2020-12 | - | 단독 | 2022년 | 세계 백신시장 수급상황에 비추어 사업성이 낮고, 위약군에 대한 윤리적인 문제로 임상연구 중단 |
| GX-19N | COVID-19 | Phase 2/3 | 인도네시아 | 2021-07 | - | 단독 | 2022년 | 세계 백신시장 수급상황에 비추어 사업성이 낮고, 위약군에 대한 윤리적인 문제로 임상연구 중단 |
| GX-G8 | 단장증후군 | Phase 1 | 프랑스 | 2019-03 | - | 단독 | 2023년 | 단장증후군은 정확한 유병률조차 알려지지 않은 매우 희귀한 질병으로, 환자수가 매우 적어 국내 및 해외에서 환자 모집에 어려움이 있음 |
| 출처: 존속회사 제공 |
존속회사는 라이선스 아웃 및 연구용역위탁 서비스를 통해 매출이 발생하고 있으나, 신약의 상품화를 통한 매출은 발생하지 않은 상태입니다.
존속회사의 파이프라인 GX-E4는 에페사®(EFESA)라는 제품명으로 '24년 4월 인도네시아에 출시되었으나, KGbio와의 라이선스아웃 계약 상 아시아 지역에서 발생한 매출은 로열티 수취가 불가능한 구조입니다. 이에 따라 '24년 온기 신약 상용화에 따른 매출액은 발생 가능성이 낮습니다. 존속회사는 해당 파이프라인을 '24년 1월 국내 품목허가 신청하였으며 품목허가 까지 '25년 1Q 내로 품목허가 획득을 예상하고 있습니다(글로벌 제약사가 국내에서 허가 받은 신약에 대한 허가심사기간 평균 300일). 이에 따라 '25년 상용화 판매 매출 발생을 전망하고 있으며, '29년부터 유럽/중동/북아프리카/남아시아의 로열티 매출이 발생할 것으로 예상하고 있습니다.
GX-H9 파이프라인의 경우 라이선스 아웃 당시 1) 계약금 / 2) Sales Milestone / 3) 로열티로 이루어져있는 통상 라이선스 아웃 계약에서 계약금과 Sales Milestone만을 수취하기로 계약하여 향후 상용화에 따른 수익이 일부 제한되어있습니다. 해당 파이프라인은 중국에서 '23년 8월 3상이 완료되었으며, 제품의 유효성 확인 및 배치 안정성 검사를 진행중으로 해당 절차가 종료되면 '24년 4Q에 CSR 완료 및 품목허가 신청서 제출 계획이 있습니다.
그러나 신약개발 업체 특성 상 지속적인 연구개발에 자원이 투입되어야 하며, 계속적인 영업적자를 기록하고 있습니다. 존속회사의 임상단계를 거치고 있는 파이프라인은 추가적인 연구개발이 필요하며 이에 따라, 향후 연구개발활동이 확대될 것으로 예상됩니다. 존속회사는 소멸회사와의 합병을 통해 TPD플랫폼을 활용한 신규 파이프라인을 확장할 예정입니다.
존속회사의 연구개발비용 추이는 다음과 같습니다.
| [존속회사의 연구개발비용] |
| (단위: 천원) |
| 구 분 | 2024년 | 2023년 | 2022년 | 2021년 | |
|---|---|---|---|---|---|
| 비용의 성격별 분류 | 원재료비 | 300,020 | 1,228,258 | 2,978,808 | 6,250,786 |
| 인건비 | 1,036,732 | 6,022,955 | 5,514,035 | 7,628,771 | |
| 감가상각비 | 731,023 | 2,811,957 | 2,460,012 | 1,123,771 | |
| 위탁용역비 | 4,061,970 | 2,963,485 | 9,749,777 | 21,730,433 | |
| 기타경비 | 1,733,974 | 13,314,309 | 6,475,155 | 2,757,531 | |
| 연구개발비용 계 | 7,863,719 | 26,340,964 | 27,177,787 | 39,491,292 | |
| 정부보조금 | (2,584) | (10,468) | (733,142) | (6,373,365) | |
| 보조금 차감 후 금액 | 7,861,135 | 26,330,496 | 26,444,645 | 33,117,928 | |
| 회계처리내역 | 판매비와 관리비 | 7,861,135 | 26,330,496 | 26,444,645 | 33,117,928 |
| 제조경비 | - | - | - | ||
| 개발비 (무형자산) | - | - | - | ||
| 회계처리금액 계 | 7,861,135 | 26,330,496 | 26,444,645 | 33,117,928 | |
| 연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액×100] |
379% | 595% | 164% | 90% | |
| 출처: 존속회사 정기보고서, 연결 기준 |
이와 같이 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 존속회사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실을 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 존속회사는 지속적으로 신약 상용화를 통한 매출 시현을 위해 유망한 파이프라인을 도입하고 있으나, 향후에도 라이선스 아웃 계약 조건이나 허가 지연 및 파이프라인 폐기 등의 이유로 신약 상용화 매출은 발생하지 못할 가능성이 있습니다. 존속회사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있으므로 투자자 여러분께서는 이 점 유의하여 주시기 바랍니다.
| 가-3. 목표 시장 성장성 둔화 및 경쟁 심화에 따른 위험 존속회사는 고유 기반기술(hybrid Fc; hyFc)과 노하우 기술(고수율 세포주 제조 및 공정개발 기술)을 바탕으로 차세대 유전자재조합 단백질 신약과 DNA 벡터기술(유전체 운반 기술)을 기반으로한 유전자치료제 신약을 개발하고 있습니다. 존속회사가 개발을 목표로 하고 있는 치료제들 중 임상3상 또는 라이선스 아웃을 진행한 건들의 적응증은 크게 1) 암(GX-I7, GX-188E), 2) 성장호르몬 결핍증(GX-H9), 3) 빈혈(GX-E4)로 구성이 되어있습니다. 면역항암제 시장은 대형 제약사의 블록버스터 약물을 위시하여, 다양한 병용요법이 연구되고 있으며 약의 형태 역시 세대를 거쳐가며 시장이 지속적으로 성장하고 있습니다. 그러나 암의 유병률이 낮아지거나, 약가가 낮아지는 등의 시장 성장 저해 요소가 발생 시 시장의 성장률은 둔화될 수 있습니다. 또한 다양한 바이오벤처들은 새로운 후보물질을 단독으로 임상하여 제품화하는 것보다 블록버스터 약물과 병용임상을 하여 성공가능성을 높이려는 추세입니다. 이에 따라 바이오벤처들의 면역항암제 시장 진입 경쟁은 심화되고 있으니 주의하시기 바랍니다. 성장호르몬 결핍증 치료제 시장은 2세대 지속형 치료제가 등장하면서 시장이 확대되고 있으며, 이러한 환경은 2세대 지속형 치료제를 개발하는 존속회사에게 기회가 될 수 있습니다. 그러나 2세대 지속형 치료제는 임상승인이 완료되어 제품화된 케이스가 다수 존재하며 존속회사의 제품이 경제적, 편의성, 효능적 측면에서 우월함을 보이지 못할 경우 경쟁이 어려울 가능성이 있으니 주의하시기 바랍니다. 만성신장질환에 의한 빈혈 시장 역시 2세대 지속형 치료제가 등장하면서 시장이 확대되고 있으며, 이러한 환경은 2세대 지속형 치료제를 개발하는 존속회사에게 기회가 될 수 있습니다. 그러나 2세대 지속형 치료제는 빅파마에서 제조한 바가 있으며, 바이오시밀러가 존재하는 상황입니다. 존속회사의 제품의 경우 국가별로 승인 상태가 상이하나, 품목허가를 획득하거나 3상 성공이후 품목허가를 대기하고 있습니다. 여타 파이프라인과 다르게 제품화 단계 이전에 실패로 인한 위험은 상대적으로 낮을 수 있으나, 제품이 경제적, 편의성, 효능적 측면에서 우월함을 보이지 못할 경우 기존 제품들과의 경쟁이 어려울 가능성이 있으니 주의하시기 바랍니다. |
존속회사는 고유 기반기술(hybrid Fc; hyFc)과 노하우 기술(고수율 세포주 제조 및 공정개발 기술)을 바탕으로 차세대 유전자재조합 단백질 신약과 DNA 벡터기술(유전체 운반 기술)을 기반으로한 유전자치료제 신약을 개발하고 있습니다.
존속회사가 개발을 목표로 하고 있는 치료제들 중 임상3상 또는 라이선스 아웃을 진행한 건들의 적응증은 크게 1) 암(GX-I7, GX-188E), 2) 성장호르몬 결핍증(GX-H9), 3) 빈혈(GX-E4)로 구성이 되어있습니다. 각각의 적응증 별 치료제 시장 및 경쟁 현황은 다음과 같습니다.
① 면역항암제
암이란 세포에 발생한 돌연변이에 의해 정상세포가 비정상적으로 세포분열을 일으켜 발생하는 질병입니다. 형태에 따라 고형암과 혈액암으로 구분되며 고형암은 체내 조직이나 장기에 덩어리(종양)를 형성하는 질환이고 혈액암은 특정한 혈액세포가 비정상적으로 증식하면서 미성숙 혈액세포가 증가되는 등 인체의 기능이 비정상적으로 작동하여 손상을 입게 되는 것을 말합니다.
항암치료의 방법으로는 절제수술, 방사선요법 및 화학요법이 대표적입니다. 수술을 통한 병변의 절제는 완치를 기대할 수 있는 가장 근원적인 방법으로 조기에 발견, 진단된 암에서는 적극적으로 수술을 고려할 수 있습니다.
| [세대별 항암제 종류 및 특징] |
|
구분 |
특징 |
|
|
1세대 (1950년대~) |
화학항암제 |
- 약물을 이용하여 암세포를 죽이는 전신치료 방법 |
|
2세대 (2000년대~) |
표적항암제 |
- 암세포나 암조직에만 많이 발현되는 특정 단백질이나 유전자 변화를 표적으로 삼아 암의 성장과 암의 발생에 관여하는 활동을 방해하는 치료방법 - 암세포만을 식별해 공격하는 장점이 있지만, 유전자 변이를 가진 환자에만 사용할 수 있어 다양한 암치료가 불가능 |
|
3세대 (2010년대~) |
면역항암제 |
- 인체 면역세포를 활성화시켜 암세포를 사멸시키는 방법 |
| 출처: 약학정보원 및 업계자료 취합 |
수술과는 별개로 또는 수술 전/후에 방사선요법이나 화학요법(화학항암제)을 실시할 수 있는데 두 방법 모두 암의 증식원리인 세포분열 과정을 억제하거나 차단하여 암의 진전을 막는 치료방법입니다. 방사선요법은 에너지가 높은 방사선을 쬐어 암세포의 사멸을 유도하고, 화학요법은 세포독성항암제와 같은 화합물을 경구투여 또는 정맥으로 주사하여 암세포의 사멸을 유도합니다. 하지만 이러한 고전적 치료방법은 암세포와 정상세포를 구분하여 치료하는 것이 아니기 때문에 정상세포에도 방사선이나 세포독성항암제의 작용이 나타나 심각한 부작용을 일으키며, 이로 인해 암세포만 선택적으로 공격할 수 있는 새로운 치료법에 대한 연구가 계속되었습니다.그 결과 개발된 것이 2000년대의 표적항암제입니다. 표적항암제는 암세포에만 특이적으로 높게 발현되는 단백질이나 신호전달체계에만 작용해 암세포를 억제하는 치료기전을 가지고 있습니다. 따라서, 무차별적인 방사선요법이나 세포독성항암제와는 달리 정상세포는 공격하지 않아서 상대적으로 항암효과는 있으면서 부작용은 매우 약하거나 거의 나타나지 않는 것이 특징입니다. 하지만, 돌연변이가 흔하게 일어나는 암세포/조식에서는 표적항암제를 무력화시키거나 표적단백질 외에 다른 단백질을 통해 생상을 이어가는 방식을 표출하는 등 단기간에 표적항암제에 내성을 획득하는 기전이 보고된 바, 이를 극복하기 위한 더 나은 발전이 필요하였습니다.여기에 면역항암제로 최초의 면역관문억제제인 여보이가 출시되면서 항암치료의 새로운 장이 열렸고, 면역항암제는 우리 몸의 면역체계를 이용하여 암을 치료하는 방법으로 효과 및 안정성 측면에서 큰 주목을 받고 있으며, 모든 항암치료방법은 현재 각각 단독으로 또는 다양한 병용의 방법으로 환자들에게 사용되고 있습니다. 따라서 현재 세계 항암제 시장은 특성이 상이한 방사선 치료를 제외하면 전통적인 화학항암제와 표적항암제, 면역항암제로 구분되어 발전하고 있는 상황이고 특히 면역항암제의 개발 및 성장속도가 매우 높습니다.
| [각 세대별 항암제 원리] |
|
| 출처: 표적치료에 대한 이해(2016.10), 삼성서울병원 |
한편, 면역항암제의 경우 2010년 최초의 면역항암제이면서 최초의 수지상세포백신인 Dendreon의 Provenge가 승인되고 T세포 면역조절항체인 Yervoy가 2011년 승인을 받으면서 면역항암제에 대한 시장의 관심이 높아졌습니다. 이후에는 PD-1, PD-L1 저해제로 대표되는 면역관문저해 항체의약품(여보이, 키트루다, 옵디보, 티센트릭, 임핀지, 바벤시오 등)이 승인되었습니다. 그 외에도 면역항암제의 다른 기전으로서 이중항체와 항암바이러스, 최초의 유전자 조작 면역세포치료제인 CAR-T 2종이 승인되어, 면역세포치료제(예스카타, 킴리아 등)와 항암바이러스치료제(임리직 등) 등이 다수 판매되고 있고 있습니다
| [면역항암제 제품과 발전 단계] |
|
| 출처: 메리츠증권 리서치센터(2018.02.26) |
Evaluate Pharma 'World Preview 2023'에서 발표한 2028년 전 세계 판매 상위 Top 10 의약품 중 면역항암제 Keytruda(키트루다)를 1위로 예측하며, 시장을 지배할 것으로 예상하고 있습니다. Merck사의 면역항암제 Keytruda(키트루다)는 2022년 USD 209억 달러를 판매한 품목으로, 2028년 예상매출은 USD 300억 달러로 Global 매출액 1위를 유지할 것으로 예상됩니다. 또한 BMS사의 면역항암제 Opdivo(옵디보) 는 2022년 매출액 USD 93억달러의 매출을 기록했으며, 2028년 USD 140억달러에 이르는 Global 매출액을 예상하고 있습니다.
| [2028년 매출 상위 10대 의약품 전망] |
| (단위 : 십억 달러) |
|
| 출처: Evaluate Pharma 'World Preview 2023' |
이처럼 글로벌 면역항암제 시장은 키트루다, 옵디보, 티센트릭, 임핀지 등 면역관문억제제들의 적응증 확대, 킴리아, 예스카타 등 CAR-T 치료제의 출시, 병용요업 및 수술 전·후 보조요법으로 적용 방식 확대, 신규 면역항암제의 출시 등으로 인해 지소적으로 고성장할 것으로 전망됩니다. FutureWise Market Research 자료에 따르면 글로벌 면역항암제 시장 규모는 인구 증가와 고령화에 따른 질병 유병률 증가, 기존 치료법의 한계를 개선하는 치료방식, 이에 따른 해당 시장에 대한 관심 및 R&D 활동의 증가로 2020년 747억 달러에서 연 평균 11.8% 성장(2021-2027)하여 2027년에는 1,595억 달러에 이를 것으로 전망됩니다.
| [글로벌 면역항암제 시장 현황 및 전망] |
| (단위: 백만 달러) |
|
| 출처: FutureWise Market Research, 2021 |
이처럼 항암치료제 분야는 면역항암제로 패러다임 전환이 이뤄지고 있습니다. 그 중에서도 현재는 면역관문억제제가 면역항암제 시장을 견인하고 있는 상황이며, 2017년 CAR-T 세포 치료제의 승인 및 본격적인 적용을 시작으로 다양한 세포 치료제에 대한 연구개발 또한 활발히 진행되고 있습니다.
현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황입니다. 나아가, 면역세포치료제 또한 상용화가 가속화되면서 시장이 빠르게 확대되고 있습니다. 재생의료연합에 따르면 2020년 세포기반면역항암제의 임상시험 건수는 총 1,220건으로 확인되었으며,임상 3상 개수는 25개에 이르면서 점차 면역세포치료제 시장 또한 경쟁이 심화될 예정입니다. 미국 FDA에서 허가를 받은 CAR-T 치료제는 Novartis 社의 킴리아(Kymriah), Gilead 社의 예스카타(Yescarta)와 테카투스(Tecartus), BMS 社의 브레얀지(Breyanzi)와 아베크마(Abecma) 등이 이미 존재하고 있습니다.
현재 항암제 신약 개발의 주요 트렌드는 암 종에 무관한 바이오마커(생체지표) 기반의 항암제 개발 및 병용 요법입니다. 과거에도 특정 암에서 효능이 있는 환자군을 세밀하게 나누는 바이오마커를 기반으로 하는 항암제들은 있었으나, 최근에는 암의 종류에 상관없는 바이오마커 기반의 항암제가 승인 및 개발되고 있습니다. 대표적인 예가 PD-1이라는 면역관문 억제기전을 가진 면역항암제인 '키트루다'로, 2017년 현미부수체불안정성(microsatellite instability-high, MSI-H) 또는 DNA복제실수교정결핍(mismatch repair deficient, dMMR)라는 바이오마커를 가진 고형 종양에 대해 허가를 받으면서, 종양 유형에 무관한 바이오마커 기반 최초의 암 치료제로서, 현재 다수의 암종에 1차 치료제로 적용되고 있습니다. 이 같은 암종에 구분 없는 항암제 개발에 따라, 경쟁 관계에 있어서 동일 질환 내 경쟁관계 보다는 동일 작용기전 내 경쟁관계가 중요한 요소가 되었습니다.
또한 과거에는 암 치료를 위해 한가지 항암제만 처방하던 단일요법(Monotherapy)이 주류였으나 현재는 두 가지 또는 그 이상의 항암제를 동시에 혹은 순차적으로 처방하여 암을 치료하는 병용 요법(Combination Therapy)으로 패러다임이 변화하였습니다. 상호 보완적인 작용기전을 가지는 항암제를 동시에 혹은 순차적으로 처방할 경우 시너지 효과가 극대화되어 더욱 우수한 치료 효과를 나타내기 때문입니다. 이에 따라 다수의 바이오 제약사들은 면역항암제와 기존 항암제 혹은 면역항암제들 사이의 최적 조합의 병용요법 개발을 위하여 수많은 연구 및 개발을 진행하고 있습니다.
Nature Reviews Drug Discovery(2020) 논문 분석에 따르면, 2019년 기준 활성화 상태인 면역관문억제제의 임상시험은 2975개로 확인되었습니다. 제품별로는 키트루다(펨브롤리주맙)와 옵디보(니볼루맙)의 임상연구가 전체 임상시험의 56%를 차지했으며, 유형별로는 단일요법 보다는 병용요법 연구가 전체 임상시험의 76%를 차지했습니다. 병용요법 연구로는 서로 다른 기전의 면역관문억제제간 병용연구를 비롯하여, 항암화학요법, 표적항암요법, 방사선요법 등과의 병용연구가 진행되고 있습니다.
| [주요 면역항암제(면역관문억제제) 임상연구 동향] |
|
| 출처: J. Tang et al., Nature Reviews Drug Discovery 2020, 19, 163-164 |
증권신고서 제출일 전일 기준 존속회사의 면역항암제 파이프라인은 총 9건입니다. 이중 단독 2건,병용 7건으로 글로벌 트렌드와 비슷하게 78%가 병용으로 임상이 진행되고 있습니다.
| [존속회사의 면역항암제 파이프라인 현황] |
| 플랫폼 | 품목 | 적응증 | 진행 단계 | 국가 | 승인일 (종료일) |
임상진입일 | 임상 시험 유형 (단독/병용 요법, 약재 명) |
비고 |
|---|---|---|---|---|---|---|---|---|
| hyFc | GX-I7 | 말기 고형암(대장암, 유방암, 난소암, 자궁경부암, 소장암, 항문암) | Phase1b | 대한민국 | (2020-03) | 2018-03 | 단독 | |
| 말기 고형암(대장암, 유방암, 난소암, 자궁경부암, 소장암, 항문암) | Phase1b | 대한민국 | (2020-04) | 2018-10 | 병용(싸이클로포스파마이드) | |||
| 삼중음성유방암 | Phase1b/2 | 대한민국 | (2023-12) | 2019-03 | 병용(Keytruda) | |||
| DNA백신 | GX-188E | 진행성/재발성 자궁경부암 | Phase1b/2 | 대한민국 | (2023-12) | 2018-06 | 병용(Keytruda) | |
| 절제 가능한 국소 진행성 두경부암(IIT) | Phase2 | 대한민국 | 2022-03 | 2022-04 | 병용(Keytruda, GX-I7) | |||
| 재발성 및/또는 전이성 두경부암(IIT) | Phase2 | 대한민국 | 2022-03 | 2022-08 | 병용(Opdivo, GX-I7) |
| 출처: 존속회사 제공 |
존속회사는 GX-I7과 GX-188E 를 통해 면역항암제를 개발하고 있습니다.
GX-I7의 경우 hyFc 플랫폼을 활용하여 자연적 구조로는 매우 불안정한 IL-7을 융합시키고 추가 엔지니어링으로 안정화시켜 생산에 성공함으로써 유일한 T세포 증폭제로의 독자적인 면역치료제 파이프라인 개발을 전략적으로 계획하였습니다. 그리고 존속회사의 파이프라인 역시 단독요법 보다는 기존 화학항암제, 표적항암제와의 병용요법, 다른 타겟의 면역항암제와의 상호 보완적인 기전을 통해 항암효과 및 전체 생존율의 증대 등의 시너지 효과를 기대하고 있습니다.
GX-I7과 유사한 방식으로 암치료 백신을 개발중인 회사는 대표적으로 Revimmune社의 CYT107과 BioNtech社의 BNT-152, Geilead社의 Trodlvy등으로 각각 고형암, 고형암, 삼중음성 유방암을 적응증으로하고 있으며, 각각 임상 2상, 임상1상, 치료제 승인이 되었습니다. GX-I7의 경쟁약물 개발 현황은 다음과 같습니다.
| [GX-I7 경쟁약물 개발현황] |
|
| 출처: 존속회사 제시 |
GX-188E의 경우 DNA 벡터기술과 플랫폼 기술을 통해 HPV(인간유두종바이러스) 16/18 유래 질환 치료 DNA 백신을 사용하고 있습니다. DNA백신은 기존의 약품으로는 예방/치료하기 어려운 질환에 적용할 수 있으며, 바이오 산업분야에서는 차세대 신기술에 속합니다.
GX-188E와 유사하게 DNA 백신 플랫폼을 기반으로 HPV16/18 암치료백신을 개발 중인 회사는 대표적으로 미국 Inovio社의 VGX-3112 및 Nykode社의 VB10.16이 있고, 유사한 환자군을 대상으로 임상 2상을 진행 중입니다. HPV 유래 암을 타겟으로 한 암치료백신의 약물 개발현황은 다음과 같습니다.
| [GX-188E 경쟁약물 개발현황] |
|
| 출처: 존속회사 제시 |
면역항암제 시장은 대형 제약사의 블록버스터 약물을 위시하여, 다양한 병용요법이 연구되고 있으며 약의 형태 역시 세대를 거쳐가며 시장이 지속적으로 성장하고 있습니다. 그러나 암의 유병률이 낮아지거나, 약가가 낮아지는 등의 시장 성장 저해 요소가 발생 시 시장의 성장률은 둔화될 수 있습니다. 또한 다양한 바이오벤처들은 새로운 후보물질을 단독으로 임상하여 제품화하는 것보다 블록버스터 약물과 병용임상을 하여 성공가능성을 높이려는 추세입니다. 이에 따라 바이오벤처들의 면역항암제 시장 진입 경쟁은 심화되고 있으니 주의하시기 바랍니다.
② 성장호르몬 결핍증
성장호르몬 결핍증(Growth Hormone Deficiency, GHD)은 성장호르몬이 충분히 분비되지 않는 상태로, 소아와 성인 모두에게 영향을 미칠 수 있습니다. 출생 시부터 뇌하수체나 시상하부의 발달 이상으로 인해 성장호르몬이 부족하거나 종양, 감염, 방사선 치료, 외상 등으로 인해 뇌하수체가 손상되어 발생이 됩니다. 이에따라 저성장이나 과도한피로, 근육량 감소 등의 증상이 나타날 수 있습니다. 일반적으로 성장호르몬 결핍증은 인공 성장호르몬을 주사하여 보충하는 방식으로 치료하고 있습니다. Grandviewresearch에 따르면 2023년 기준 전세계 GH(Growth Hormone, 성장호르몬) 시장의 규모는 63억달러로 규모입니다.
| [글로벌 성장호르몬 시장 규모] |
|
| 출처: Grandviewresearch |
현재 사용되는 1세대 성장호르몬 결핍증 치료제는 Norditropin®, Genotropin®, Omnitrope®가 있습니 다. Norditropin®의 글로벌 점유율은 44% 글로벌 매출액은 약 22.5억달러, 유럽 매출액은 약 4.3억달러로 추정됩니다. 나아가, Genotropin®의 글로벌 점유율은 11%, 글로벌 매출액은 5.7억달러, 유럽에서의 매출액은 약 1.1억달러로 추산되고 있습니다. Omnitope®의 글로벌 점유율은 9%이며 글로벌 매출액 은 4.6억달러, 유럽에서의 매출액은 0.9억달러로 추산되고 있습니다.위의 1세대 호르몬 치료제는 매일 투여를 해야 하는 등 투여 편의성이 좋지 않아, 최근 한국을 포함한 글로벌 회사들이 다양한 기술을 이용하여 투여 횟수를 줄일 수 있는 지속형 성장호르몬 제품을 개발하고 있습니다.
글로벌 리서치 기관인 Global Data에 따르면 2세대 지속형 치료제는 2030년까지 시장의 약 90% 이상을 점유할 것으로 전망하였습니다. 지금까지 성장호르몬 시장에서 지속형 2세대 제품으로 선두에서 개발하고 있는 회사는 Ascendis社, Opko社, NovoNordisk社 등 제한적인 상황입니다. 현재 성공적으로 출시된 지속형 2세대 제품으로는 주 1회 투여하는 Ascendis社의 소아성장호르몬 결핍 환자를 대상으로 하는 Skytofa 그리고 Novo Nordisk社의 성인성장호르몬 결핍 환자를 대상으로 하는 Sogroya와 OPKO/Pfizer社의 소아성장호르몬 결핍 환자를 대상으로 하는 Ngenla가 있습니다. 또한 각각 Ascendis Pharma는 성인 성장호르몬 결핍 환자를 대상으로 임상 3상을, NovoNordisk는 소아성장호르몬 결핍 환자를 대상으로 임상 3상을 진행하고 있습니다.
존속회사의 GX-H9은 임상2상에서 1세대 성장호르몬 대비 동등 이상의 키성장 속도와 우수한 안전성 프로파일을 보여주었습니다. 따라서, GX-H9은 우수한 효능 및 월 2회 제형 개발가능성으로 상용화된 제품 또는 현재 개발중인 지속형 제형들과의 차별성을 바탕으로, 제품개발을 가속화한다면 글로벌 제약사들과 함께 지속적으로 성장하는 성장호르몬시장을 선도할 수 있을 것으로 예상하고 있습니다. 현재 경쟁약물 개발 현황은 다음과 같습니다.
| [GX-H9 경쟁약물 개발현황] |
|
| 출처: 존속회사 제공 |
성장호르몬 결핍증 치료제 시장은 2세대 지속형 치료제가 등장하면서 시장이 확대되고 있으며, 이러한 환경은 2세대 지속형 치료제를 개발하는 존속회사에게 기회가 될 수 있습니다. 그러나 2세대 지속형 치료제는 임상승인이 완료되어 제품화된 케이스가 다수 존재하며 존속회사의 제품이 경제적, 편의성, 효능적 측면에서 우월함을 보이지 못할 경우 경쟁이 어려울 가능성이 있으니 주의하시기 바랍니다.
③ 만성신장질환 빈혈
건강한 신장은 적혈구 생선을 촉진하는 호르몬인 erythropoietin(EPO)를 생성하는데, 만성신부전증 환자의 경우 EPO 생성이 부족하여 빈혈이 발생하게 됩니다, 이때 ESA(Erythropoiesis stimulating agent) 중 EPO가 주요한 치료제입니다.
1세대 치료제인 속효성(Short-acting) EPO 제품으로는 Amgen社가 출시한 Epogen을 선두로 다양한 바이오시밀러 들이 출시된 상황이며, 2세대 지속형(Long-acting) EPO 제품으로는 Amgen/Kyowa Kirin社가 출시한 Aranesp®/Nesp®, 그리고 Roche社가 출시한 Mircera®가 전 세계적으로 상용화되어 보급되고 있습니다.
글로벌 리서치 기관인 글로벌데이터에 따르면 주요 8개국 시장의 만성신장질환으로 인한 빈혈 환자 수는 2019년 400만명에서 2029년 450만명으로 늘어날 것으로 예측됩니다(출처: GlobalData, Chronic Kidney Disease-Anemia: Epidemiology Forecast to 2029). 또한 Precision business insight에 따르면 만성신장질환으로 인한 빈혈 시장은 2023년 기준 8.7억달러로 예상되며 '24~'30년동안 CAGR 5.8%의 성장을 보일 것으로 예상하고 있습니다(출처 : Precision business insight - Anemia in Chronic Kidney Disease Market)
또한, 글로벌 의약품 조사기관 IQVIA에 따르면 2021년 전세계 EPO 시장의 매출액은 69억달러 수준으로 그 중 2세대 치료제인 지속형 EPO의 점유율은 약 39%입니다. 전세계 EPO 제품의 판매량은 꾸준히 상승하는 추세로 2018년 기준 1.7억 개에서 2021년 기준 2.0억 개로 증가하였습니다. 그 중 지속형 EPO의 판매량은 2018년 기준 3천 1백만개에서 2021년 기준 3천 3백만개로 증가하였습니다.
글로벌 리서치 기관인 Evaluate Pharma에서 제공하는 EPO 제품의 예상 매출액 자료에 따르면 지속형 EPO의 점유율은 지속적으로 증가하여 2028년에는 62.8%까지 상승할 것으로 분석되었습니다
EPO 제품은 사용주기가 짧은 1세대와 2세대로 구분이 되어있으며, 1세대의 경우 Amgen社의 Epogen을 선두로 다양한 바이오시밀러가 출시되어있고, 2세대의 경우 Amgen/Kyowa Kirin이 출시한 Aranesp®/Nesp® (Darbepoetin Alfa) 와 Roche 가 출시한 Mircera®(Methoxy polyethylene glycol-Epoetin Beta) 가 전세계적으로 상용화 되었으며, 현재는 Aranesp®/Nesp®의 biosimilar 들이 출시되고 있습니다.
존속회사의 GX-E4는 생체 내 존재하는 IgG4 와 IgD의 부위 중 세포 독성 기능이 없는 서열을 사용한 기반기술을 바탕으로 개발되어 세포독성이 없으며, 타 제품(Aranesp®)대비 약동학적 프로파일의 변동폭이 낮아 ESA의 장기 투여에 따른 부작용 수준이 낮을 것으로 예상됩니다.
만성신장질환에 의한 빈혈 환자들에게는 10~12g/dL에 이르는 적정 수준의 헤모글로빈 수치 유지가 매우 중요하며, 임상3상에서 GX-E4는 경쟁 약물인 Mircera® 대비 헤모글로빈 반응율(기저치 대비 헤모글로빈 수치를 1.0g/dL 이상 상승하면서 수혈없이 10~12g/dL를 유지하는 환자의 비율)에서 유사한 결과를 보여주고 있습니다.
증권신고서 제출일 전일 기준 존속회사의 GX-E4는 한국 등 아시아 시장을 1차 타겟 시장으로 계획하고 있습니다. 인도네시아에서 2023년 10월 품목허가를 승인받았습니다.(제품명 : EFESA) 그리고 한국에서 2024년 1월 GX-E4의 품목허가 신청을 하였고, 이후 호주, 대만 등 5개국에 품목허가를 추가 신청할 계획입니다. 또한 시장성과 경쟁력을 확인하면서 동시에 파트너사와 함께 유럽을 포함한 다국가 임상을 통해 진출 시장을 확장할 계획에 있습니다.
| [GX-E4 파이프라인 현황] |
| 제품명 | 적응증 | 현재 진행단계 | 제품 출시일 (국가) |
향후 계획 | |
| 임상 단계(국가) | 허가 현황(국가) | ||||
| EFESA | 만성신장질환 환자 중 비투석 환자의 빈혈치료 |
임상3상 완료 (인도네시아, 한국, 말레이시아, 필리핀, 태국, 타이완, 호주) |
- 2023년 10월 품목허가 승인 (인도네시아) - 2024년 1월 품목허가 신청 (한국) |
2024년 4월 (인도네시아) |
- 국내의 품목허가 취득은 2025년 1분기 예상 - 호주 및 아시아 국가에서 품목허가 신청예정 |
| 만성신장질환 환자 중 투석 환자의 빈혈치료 |
2023년 11월 임상 3상 승인완료(한국) 2024년 5월 가교임상 1상 승인완료(한국) |
임상 3상 진행 중(한국, 조지아, 인도네시아, 대만, 터키) | - | - 만성신장질환 환자 중 투석 환자까지 시장 확장 예정 | |
| 출처: 존속회사 제시 |
만성신장질환에 의한 빈혈 시장 역시 2세대 지속형 치료제가 등장하면서 시장이 확대되고 있으며, 이러한 환경은 2세대 지속형 치료제를 개발하는 존속회사에게 기회가 될 수 있습니다. 그러나 2세대 지속형 치료제는 빅파마에서 제조한 바가 있으며, 바이오시밀러가 존재하는 상황입니다. 존속회사의 제품의 경우 국가별로 승인 상태가 상이하나, 품목허가를 획득하거나 3상 성공이후 품목허가를 대기하고 있습니다. 여타 파이프라인과 다르게 제품화 단계 이전에 실패로 인한 위험은 상대적으로 낮을 수 있으나, 제품이 경제적, 편의성, 효능적 측면에서 우월함을 보이지 못할 경우 기존 제품들과의 경쟁이 어려울 가능성이 있으니 주의하시기 바랍니다.
| 가-4. 기술이전 지연 및 실패 위험 존속회사는 신약개발업을 영위하면서 파이프라인별 파트너쉽과 기술이전을 통한 비즈니스 모델을 전개하고 있습니다. 대부분 국내 및 해외 제약사와 공동개발을 통한 임상시험으로 진행되며 해당 제품의 상용화또는 임상단계에서 글로벌 대형 기업으로의 기술이전을 목표하고 있습니다. 단기 수익의 창출은 국내 및 해외 제약사로의 조기 기술이전을 통한 기술료로 발생되며, 중장기적인 수익은 임상2상 이후 해외 글로벌 제약사로의 기술이전을 통한 기술료 및 로열티로 발생되며 또한 상용화에 따른 기술료, 로열티 수취로 수익창출이 이루어집니다. 존속회사는 현재기술이전에 따른 단계별 마일스톤 및 시판 로열티 등은 적정 시점에 적정 기준을 통과 하여야만 수취 가능합니다. 만약 파트너사(Licensee)의 임상 진행이나 허가 취득 과정 등에 차질이 발생하는 경우 기술이전 계약이 중도 해지될 리스크가 존재합니다. 존속회사의 기술이전 내역 중 BSK에 기술이전한 GX-188의 경우를 제외한 다른 기술이전 내역의 경우 계약금 반환 의무는 없습니다. 그러나 GX-188의 경우 제넥신의 귀책사유로 계약이 해지될 경우 계약에 의해 지불된 모든 금액에 대한 반환 의무가 있어 상기한 바와 같은 기술이전 관련 리스크가 존재합니다. 또한, 기술이전 지연이나 실패, 파트너사의 연구개발 및 허가취득 지연이나 실패로 인해 존속회사가 예측하는 수익성 및 재무적인 안정성의 불확실성이 존재한다는 점을 투자자께서는 유의하여 투자하시기 바랍니다. |
신약을 출시하기 위해서는 전임상(=비임상), 임상 1~3상 및 규제 당국의 허가 단계를 모두 통과해야 하기 때문에 오랜 시간이 소요됩니다. 또한, 전임상 개발비용 대비 임상 1상은 3배, 2상은 8배, 3상은 30배의 비용이 소요되는 등 임상 단계별로 비용 리스크가 커집니다.
| [개발단계별 신약 개발비 비교] |
|
| 출처: Paul, S.M. et al. (2010) How to improve R&D productivity: The pharmaceutical industry’s grand challenge. Nature Review Drug Discovery. 9(3), 203-214; Eli Lilly Study (2010) |
존속회사와 같은 바이오벤처 기업은 대규모의 신약 개발 비용과 오랜 개발 기간에 따른 리스크를 최소화 하기 위해 전임상 또는 임상 초기단계에서 국내외 대형 제약사에 기술이전하여 조기에 수익을 실현하고 또 여기서 발생한 수익으로 다음 파이프라인을 발굴 및 개발하는 것을 기본적인 수익모델로 삼고 있습니다. 국내외 대형 제약사 역시 물질 발굴부터 시판까지의 낮은 개발 확률 리스크 및 상대적으로 고비용인 인하우스 고정비용을 최소화하기 위해 더욱 활발한 기술 이전을 추진하는 추세에 있습니다.존속회사는 다국적 제약사와 국내 대기업에서 다양한 사업개발 경험이 있는 전문 인력들을 구성하여 적응증 전략 구축 단계부터 전방 시장에 대한 다국적 제약사의 미충족 수요를 파악하여 시장 가능성을 예측하고 있습니다. 또한 전임상 단계부터 기술이전에 필요한 데이터 패키지를 구축하고 특허 전략을 계획하는 등 체계적으로 기술이전에 필요한 프로세스를 구축 및 시행하고 있습니다.
신약 파이프라인의 기술이전이 성공하면, 일반적으로 기술이전의 대가로 초기 계약금, 임상단계 및 허가단계 성공시마다 마일스톤 수입금, 신약 발매 후 매출액의 일정 비율에 대한 로열티 수입, 특정 금액 이상의 매출 발생시 판매 마일스톤 수입이 발생하게 됩니다. 초기 계약금은 계약 직후 수령하게 되는데, 계약조건에 따라 반환 의무가 있을 수 있고, 마일스톤 수입은 개발 단계별로 성공 시 받게 되며, 로열티는 최종 허가 이후 해당 제품이 시장에서 매출을 발생시킬 경우 받게 되는 수수료입니다
| [라이선스 계약 수익구조] |
| 구분 | 설명 | |
| 총 계약금액 | 계약금(Upfront Payment) | 계약 직후 또는 일정기간에 받는 확정된 금액 |
| 마일스톤(Milestone) | 개발 단계별로 성공할 경우 받는 금액 | |
| 로열티(Royalty) | 신약 출시 후 매출금액에 따라 받는 금액 | |
| 출처: 금융감독원 보도자료 ("제약바이오 기업의 공시실태 및 투자자 보호 방안") |
존속회사는 신약개발업을 영위하면서 파이프라인별 파트너쉽과 기술이전을 통한 비즈니스 모델을 전개하고 있습니다. 대부분 국내 및 해외 제약사와 공동개발을 통한 임상시험으로 진행되며 해당 제품의 상용화또는 임상단계에서 글로벌 대형 기업으로의 기술이전을 목표하고 있습니다. 단기 수익의 창출은 국내 및 해외 제약사로의 조기 기술이전을 통한 기술료로 발생되며, 중장기적인 수익은 임상2상 이후 해외 글로벌 제약사로의 기술이전을 통한 기술료 및 로열티로 발생되며 또한 상용화에 따른 기술료, 로열티 수취로 수익창출이 이루어집니다.
증권신고서 제출일 전일 기준 존속회사의 총 10건의 기술이전 계약을 체결하였으며 총괄표와 품목별 상세 내역은 다음과 같습니다.
| [기술이전 계약 내역] |
| (단위: $ or \ (천원) |
| 품목 | 계약상대방 | 대상지역 | 계약체결일 | 계약종료일 | 총 계약금액 | 수취금액 | 진행단계 |
| GX-188 | BSK | 중국 | 2014.07 | 2030.08 | $5,000,000 | $3,000,000 | 중국 임상준비 |
| GX-I7 | NeoImmuneTech | 유럽/미국 | 2015.06 | 특허만료일 | $12,500,000 | $7,500,000 | 미국 임상 2상 진행 |
| G3, H9, G8, P2 (전용실시권) G6 (중국권리 양도) |
I-Mab(Tasgen) | 중국 | 2015.1 | 특허만료일 | $100,000,000 | $20,000,000 | GX-H9 중국 3상 완료 |
| GX-E4 | CWB* | 중국 | 2016.02 | 별도계약해지시 | $44,500,000 | $3,750,000 | 중국 임상1b/2 진행 |
| GX-E4 | KGbio | 아세안지역 / MENA |
2015.12 | 별도계약해지시 | $3,000,000 | $3,000,000 | 호주, 인도네시아 등 아세안 다국가 임상3상 완료 / 인도네시아 품목허가 획득 |
| GX-I7 | I-Mab | 중국 | 2017.12 | 특허만료 또는 상업판패 이후 15년 | $560,000,000 | $12,000,000 | 중국 임상2상 조기 종료 |
| GX-P1, GX-P10(장기이식 면역거부반응 적응증 치료제) | 제넨바이오 | 전세계 | 2020.01 | 계약체결일 후 20년 | \191,000,000 | \7,000,000 | 한국 임상 1상 종료 (GX-P1) |
| GX-P1 (면역억제 기전을 활용한 뇌졸증, 자궁내막증, 조산증 치료제) | Turret Capital Management |
전세계 | 2020.12 | 계약체결일 후 10년 | Egret 주식 1백만주 + $200,000,000 | Egret 주식 1백만주 |
미국 임상 1b상 IND승인 |
| GX-I7 | KGbio | 아세안지역/ MENA/ 호주, 뉴질랜드/ 기타 아프리카 | 2021.02 | 별도계약해지시 | $1,100,000,000 | $27,000,000 | 인도네시아 임상2상 조기 종료 |
| GX-E4 | KGbio | 아세안지역, MENA, 남아시아, 유럽 및 기타 아프리카 국가 | 2022.03 | 별도계약해지시 | $13,000,000 | $8,000,000 | 유럽 포함 다국가 임상 3상 진행 |
| CWB*: Shanghai ChemoWanbang Biopharma(중국) |
| 1) 품목 : GX-188E | |
| 계약상대방 | Nanjing BioSciKin Co, Ltd.(BSK, 중국) |
| 계약내용 | 치료백신(GX-188) 관련 특허기술을 이용한 중국내 개발권, 사업권등의 이전 |
| 대상지역 | 중국지역(대만, 홍콩, 마카오 포함) |
| 계약기간 | 2015년 - 2030년 |
| 계약총 금액 | 미화 5,000,000 달러 ($5,000,000) |
| 계약조건 | 1)Upfront : $1,000,000 (반환조항 없음) 2)마일스톤: - Completion of document transfer: $2,000,000 - Completion of tech transfer: $1,000,000 - Completion of IND filing in the territory: $1,000,000 3) Royalty: 시판 최소 6개월 전에 재계약 예정 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | HPV 항원 특이적 T 세포 면역반응을 유도하는 치료 DNA 백신 |
| 개발진행경과 | - 계약상대방의 임상 경과 : 중국 허가용 공정개발 및 임상준비 - 회사의 임상 경과 : 자궁경부암 한국 임상 1b/2 종료 |
| 기타사항 | 1. GX-188E 물질 특허 (치료 DNA 백신 기술) (1) 특허번호 : 중국 CN 103180343 B (2) 출원일 : 2010.08.13 (3) 발명의 명칭 : 사람 파필로마바이러스 변형체 및 면역 증강제를 포함하는 자궁경부암 예방 또는 치료용 조성물 2. GX-188E 단독 용법용량 특허 (치료 DNA 백신 기술 -단독 치료 임상) (1) 특허번호 : 중국 CN 107073070 A (2) 출원일 : 2015.08.14 (3) 발명의 명칭 : 자궁경부암의 치료 방법 |
| 2) 품목 : GX-I7 | |
| 계약상대방 | NeoImmuneTech, Inc.(네오이뮨텍, 미국) |
| 계약내용 | 항암면역치료제(GX-I7)의 전용실시권 |
| 대상지역 | 북미, 남미, 중미, 유럽 |
| 계약기간 | 2015년 ~ 특허만료일 |
| 계약총 금액 | 미화 12,500,000 달러( $12,500,000) / Royalty 별도 |
| 계약조건 | 1)Upfront : $4,500,000 (반환조항 없음) 2)마일스톤: - IND approval of 1st clinical trial: $1,000,000 - Completion of 1st clinical trial: $2,000,000 - IND approval of 2nd clinical trial: $2,000,000 - Completion of 2nd clinical trial: $3,000,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 인터루킨-7 |
| 개발진행경과 | - 계약상대방의 임상 경과: 고형암 대상 임상 1b/2a상, 비소세포폐암 (1L) 대상 임상 2상, 거대 B세포 림프종 대상 임상 1b상 시험 및 교모세포종 대상 임상시험 포함 총 9개 임상시험 진행중 - 회사의 임상 경과 :삼중음성유방암 대상 임상1b/2 완료(2017.12~2023.12), 재발성 교모세포종 대상 임상 2상 진행중 (2022~) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 미국 US 7867491 B2 / 미국 US 8586038 B2 / 미국(DIV) US 108441104 B2 / 캐나다 CA 2687377 C / 유럽 EP 2662449 B1/ 브라질 BRPI08116377 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-I7 물질 특허 (1) 특허번호 : 미국 US 10208099 B2 / 미국(CA) US 11041007 B2 / 캐나다 CA 2986388 A1 / 유럽 EP 3307766 A1 / 브라질 BR 1120170266415 (2) 출원일 : 2016.06.10 (3) 발명의 명칭 : 변형된 인터루킨-7 단백질 및 이의 용도 3. GX-I7 HPV 용도 특허 (1) 특허번호 : 미국 US 11708399 B2 (2) 출원일 : 2016.12.02 (3) 발명의 명칭 : 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 사람 파필로마바이러스 유래 질환의 예방 또는 치료용 약학적 조성물 4. GX-I7 Flu 용도 특허 (1) 특허번호 : 미국 US 11357827 B2 (2) 출원일 : 2016.11.30 (3) 발명의 명칭 : 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 인플루엔자 바이러스 감염의 예방 또는 치료용 약학적 조성물 5. GX-I7 제형 특허 (1) 특허번호 : US 11548927 B2 (2) 출원일 : 2016.11.02 (3) 발명의 명칭 : 변형된 인터루킨-7 융합 단백질의 제형 |
| 3) 품목: 5종단백질치료제GX-H9 (human growth hormone), GX-G6 (GLP-1), GX-G3 (G-CSF), GX-G8(GLP-2), GX-P2(PD-L1) | |
| 계약상대방 | I-Mab Biopharma (I-Mab, 중국) |
| 계약내용 | 중국내 GX-G3, GX-H9, GX-G8, GX-P2의 전용실시권 및 GX-G6의 중국 권리 양도 |
| 대상지역 | 중국지역 |
| 계약기간 | 2015년 ~ 2045년 |
| 계약총 금액 | 미화 100,000,000 달러 ($100,000,000) / Royalty 별도 |
| 계약조건 | 1) Upfront: 2) 전용실시권 (G3, H9, G8, P2): $13,000,000 3) 양도 (G6): $7,000,000 GX-G3 마일스톤: - Net Sales Exceeding $50M: $5,000,000 - Net Sales Exceeding $100M: $10,000,000 GX-H9 마일스톤: - Net Sales Exceeding $150M: $15,000,000 - Net Sales Exceeding $250M: $25,000,000 GX-G8 마일스톤: - Initate Ph3 trial: $1,000,000 - Approval of NDA: $1,000,000 GX-P2 (Rheumatoid Arthritis) 마일스톤: - Initate Ph3 trial: $6,000,000 - Approval of NDA: $10,000,000 GX-P2 (Lupus) 마일스톤: - Initate Ph3 trial: $3,000,000 - Approval of NDA: $4,000,000 GX-G6 마일스톤: - Net Sales Exceeding $100M: $10,000,000 - Net Sales Exceeding $150M: $15,000,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 성장호르몬결핍증 치료제, 당뇨병치료제, 호중구 감소증치료제 |
| 개발진행경과 | - 계약상대방의 임상 경과: 소아 성장호르몬 임상 3상 완료 (2023.08. Topline 결과 발표) - I-Mab에서 CSPC에 sub L/O하여 CSPC가 당뇨병치료제 및 비만치료제 GX-G6 임상 2상 완료 - 회사의 임상 경과 : GX-H9 유럽 성인 및 소아 임상 2상 완료 |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-H9 용법용량 특허 (성인) (1) 특허번호 : 중국 CN 109152816 B (2) 출원일 : 2017.02.16 (3) 발명의 명칭 : hGH 융합단백질을 포함하는 성장호르몬 결핍을 치료하기 위한 약학 조성물 3. GX-H9 용법용량 특허 (소아) (1) 특허번호 : 중국 CN 110177567 A (2) 출원일 : 2017.08.30 (3) 발명의 명칭 : hGH 융합단백질을 포함하는 성장호르몬 결핍을 치료하기 위한 약학 조성물 4. GX-G3 물질 특허 (1) 특허번호 : 중국 CN 105131127 B / 홍콩 HK1218127 / 마카오 J/003487 (2) 출원일 : 2012.06.11 (3) 발명의 명칭 : 면역글로불린 융합 단백질 5. GX-G6 물질 특허 (1) 특허번호 : 중국 CN 105801705 B (권리양도 완료) (2) 출원일 : 2014.12.31 (3) 발명의 명칭 : GLP-1 및 면역글로불린 하이브리드 Fc 융합 폴리펩타이드 및 이의 용도 6. GX-G6 용법용량 특허 (1) 특허번호 : 중국 CN 113573739 A (2) 출원일 : 2020.03.09 (3) 발명의 명칭 : GLP-1 융합 단백질 및 그 용도 7. GX-G8 물질 특허 (1) 특허번호 : 중국 CN 107207618 B (2) 출원일 : 2015.12.31 (3) 발명의 명칭 : GLP 및 면역글로불린 하이브리드 Fc 융합 폴리펩타이드 및 이의 용도 8. GX-P1 물질 특허 (1) 특허번호 : 중국 CN 115103685 A (2) 출원일 : 2021.01.06 (3) 발명의명칭: PD-L1 단백질이포함된융합단백질및이의용도 |
| 4) 품목 : GX-E4 | |
| 계약상대방 | SHANGHAI CHEMOWANBANG BIOPHARMA CO., LTD.(CWB, 중국) |
| 계약내용 | 지속형 빈혈치료제 GX-E4의 중국내 개발권 및 사업권 |
| 대상지역 | 중국전역(홍콩, 마카오, 대만 제외) |
| 계약기간 | 2016년 ~ 별도의 계약 해지시 |
| 계약총 금액 | 미화 44,500,000 달러 ($ 44,500,000) / Royalty 별도 |
| 계약조건 | 1) Upfront: $2,000,000 2) 마일스톤: - Completion of tech transfer: $1,000,000 - CKD anemia - CFDA Ph1 approval: $750,000 - CKD anemia - CFDA Ph2 approval: $1,000,000 - CKD anemia - CFDA Ph3 approval: $2,750,000 - CKD anemia - CFDA NDA approval: $6,000,000 - Chemo-induced anemia - CFDA Ph1 approval: $3,000,000 - Chemo-induced anemia - CFDA NDA approval: $5,000,000 - Net sales exceeding $100M: $8,000,000 - Net sales exceeding $150M: $15,000,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 erythropoietin |
| 개발진행경과 | - 계약상대방의 임상 경과: 중국 임상1b상 진행 - 회사의 임상 경과: 비투석 환자 대상 임상3상 완료 및 투석 환자 대상 다국가 임상 3상 진행 |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-E4 물질 특허 (1) 특허번호 : 중국 CN 105175553 B (2) 출원일 : 2012.06.11 (3) 발명의 명칭 : 면역글로불린 융합 단백질 3. GX-E4 용법용량 특허 (1) 특허번호 : 중국 CN 114159552 A (2) 출원일 : 2016.01.08 (3) 발명의 명칭 : 지속형 EPO 제제를 이용한 빈혈 치료 방법 4. GX-E4 제형/제법 특허 (고순도조성물) (1) 특허번호 : 중국 CN 108137665 A (2) 출원일 : 2016.10.06 (3) 발명의 명칭 : 지속형 에리트로포이에틴 함유 조성물 |
| 5) 품목 : GX-E4 | |
| 계약상대방 | PT KALBE-GENEXINE BIOLOGICS (KGbio, 인도네시아) |
| 계약내용 | 지속형 빈혈치료제 GX-E4의 대상지역내 개발권 및 사업권 |
| 대상지역 | 아세안 지역 (인도네시아, 말레이시아, 싱가폴, 필리핀, 태국, 브루나이, 베트남, 미얀마, 캄보디아, 라오스) 및 MENA, 스리랑카, 나이지리아, 타이완, 호주, 뉴질랜드 |
| 계약기간 | 2015년 ~ JVA 종료일 까지 |
| 계약총 금액 | 미화 3,000,000 달러 ($3,000,000) / Royalty 별도 |
| 계약조건 | 1)Upfront: $1,500,000 2)마일스톤: - Completion of tech transfer: $1,500,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 erythropoietin |
| 개발진행경과 | - 계약상대방의 임상 경과: 비투석 환자 대상 임상 3상 (인도네시아, 말레이시아, 필리핀, 태국, 타이완, 호주) 완료. 인도네시아 품목허가 획득. - 회사의 임상 경과: 비투석 환자 대상 임상3상 완료 및 비투석 환자 대상 국내 품목허가 신청. 투석 환자 대상 다국가 임상 3상 진행 |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호: 싱가포르 SG 156826 / 호주 AU 2008257923 B2 (2) 출원일: 2008.05.30 (3) 발명의 명칭: 면역글로불린 융합 단백질 2. GX-E4 용법용량 특허 (1) 특허번호: 인도네시아 IDP000083876 (2) 출원일: 2016.01.08 (3) 발명의 명칭: 지속형 EPO 제제를 이용한 빈혈 치료 방법 3. GX-E4 제형/제법 특허 (고순도조성물) (1) 특허번호: 인도네시아 IDP000063622 / 인도네시아(DIV) IDP0085909 / 호주 AU 2016334954 B2 (2) 출원일: 2016.10.06 (3) 발명의 명칭: 지속형 에리트로포이에틴 함유 조성물 |
| 6) 품목 : GX-I7 | |
| 계약상대방 | I-Mab Biopharma (I-Mab, 중국) |
| 계약내용 | 항암면역치료제(GX-I7)의 전용실시권 |
| 대상지역 | 중국 전역(대만, 홍콩, 마카오 포함) |
| 계약기간 | 2017년 ~ 관련특허 만료일 또는 첫 상업생산 15년 후 까지 |
| 계약총 금액 | 미화 560,000,000 달러 ($560,000,000) / Royalty 별도 |
| 계약조건 | 1) Upfront: $12,000,000 2) 마일스톤: - Completion of first Ph2 clinical trial: $5,000,000 - Completion of first Ph3 clinical trial: $8,000,000 - First NDA or BLA approval: $10,000,000 - Net Sales exceeds $100M USD: $5,000,000 - Net Sales exceeds $200M USD: $20,000,000 - Net Sales exceeds $500M USD: $50,0000,000 - Net Sales exceeds $1,000M USD: $150,000,000 - Net Sales exceeds $2,000M USD: $300,000,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 인터루킨-7 |
| 개발진행경과 | - 계약상대방의 임상 경과: 고형암 중국 임상 2상 진행, 뇌암(교모세포종) 중국 임상2상 조기 종료 - 회사의 임상 경과: 삼중음성유방암 대상 임상1b/2 완료 (2017.12~2023.12), 재발성 교모세포종 대상 임상 2상 진행중 (2022~) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호: 중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B / 홍콩 HK 1141303 / 홍콩(DIV1) HK 1191959 / 홍콩(DIV2) HK 1191347 (2) 출원일: 2008.05.30 (3) 발명의 명칭: 면역글로불린 융합 단백질 2. GX-I7 물질 특허 (1) 특허번호: 중국 CN 114853873 A / 홍콩 HK 1256149 A1 (2) 출원일: 2016.06.10 (3) 발명의 명칭: 변형된 인터루킨-7 단백질 및 이의 용도 3. GX-I7 HPV 용도 특허 (1) 특허번호: 중국 CN 108697765 A / 대만 TW I774651 B / 홍콩 HK 19122600 (2) 출원일: 2016.12.02 (3) 발명의 명칭: 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 사람 파필로마바이러스 유래 질환의 예방 또는 치료용 약학적 조성물 4. GX-I7 Flu 용도 특허 (1) 특허번호: 중국 CN 108697764 A / 대만 TW I775733 B / 홍콩 HK 19122601.8 (2) 출원일: 2016.11.30 (3) 발명의 명칭: 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 인플루엔자 바이러스 감염의 예방 또는 치료용 약학적 조성물 5. GX-I7 제형 특허 (1) 특허번호: 중국 CN 108778337 A / 대만 TW I720051 B / 홍콩 HK 19122944.2 (2) 출원일: 2016.11.02 (3) 발명의 명칭: 변형된 인터루킨-7 융합 단백질의 제형 6. GX-I7+CPI 병용 투여 (1) 특허번호: 중국 CN 113365650 A / 홍콩 HK 40056403 A (2) 출원일: 2019.11.15 (3) 발명의 명칭: IL-7 단백질 및 면역 관문 저해제의 조합으로 종양을 치료하는 방법 7. GX-I7 용법용량 특허 (1) 특허번호: 중국 CN 114746106 A (2) 출원일: 2020.09.04 (3) 발명의 명칭: 종양에서 IL-7 융합 단백질을 이용하여 림프구 수를 증가시키는 방법 |
| 7) 품목 : GX-P1, GX-P10 | |
| 계약상대방 | 주식회사 제넨바이오 |
| 계약내용 | PD-L1 면역글로불린 hyFc 융합단백질 (GX-P1, GX-P10) 전용실시권 (장기이식 면역거부반응 적응증에 한정) |
| 대상지역 | 전세계 |
| 계약기간 | 2020년 ~ 계약일로부터 20년간 |
| 계약총 금액 | 원화 191,000,000,000 / Royalty 별도 |
| 계약조건 | 1) Upfront: \7,000,000,000 2) 마일스톤: - 임상 3상 CSR 최종화: \10,000,000,000 - 누적 순매출액 1,000억원 달성: \4,000,000,000 - 누적 순매출액 2,500억원 달성: \10,000,000,000 - 누적 순매출액 5,000억원 달성: \20,000,000,000 - 누적 순매출액 10,000억원 달성: \40,000,000,000 - 누적 순매출액 20,000억원 달성: \100,000,000,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 수익 인식 포함된 용역대가는 수행의무 완료시점에 수익인식 |
| 대상기술 | PD-L1 면역글로불린 hyFc 융합단백질의 완제의약품 |
| 개발진행경과 | - 회사의 임상 경과 : 한국 임상1상 종료 (GX-P1) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 미국 US 7867491 B2 / 미국 US 8586038 B2 / 미국(DIV) US 108441104 B2 / 캐나다 CA 2687377 C / 유럽 EP 2662449 B1/ 브라질 BRPI0811637-7 / 러시아 RU 2530168 C2/중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B / 홍콩 HK 1141303 / 홍콩(DIV1) HK 1191959 / 홍콩(DIV2) HK 1191347 / 한국 KR 10-0897938 B1 / 한국(DIV1) KR 1380732 B1 / 한국(DIV2) KR 1380729 B1 / 일본 JP 5577243 B2 / 싱가포르 SG 156826 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-P1 물질 특허 (1) 특허번호 : 대만 TW I817075B / 미국 US 17/794832 / 유럽 EP 21744724.2 / 일본 JP 2022-544089 / 중국 CN 115103685 A / 2021210773 A1 / 캐나다 CA 3164910 / 한국 KR 10-2506179 B1 / 호주 AU 2021210773 A1 (2) 출원일 : 2021.01.06 (3) 발명의 명칭 : PD-L1 단백질이 포함된 융합 단백질 및 이의 용도 3. GX-P10 물질 특허 (1) 특허번호 : 한국 KR 2021-0141311 A / PCT WO2021/230460 A1 (2) 출원일 : 2021.01.06 (3) 발명의 명칭 : PD-L1 단백질 및 단량체성 IL-10 변이체가 포함된 융합 단백질 및 이의 용도 |
| 8) 품목 : GX-P1 | |
| 계약상대방 | Turret Capital Management |
| 계약내용 | 면역억제 기전을 활용한 뇌졸중, 자궁내막증, 조산증 치료제의 기술이전계약 |
| 대상지역 | 전세계 |
| 계약기간 | 2020년 ~ 특허만료일 |
| 계약총 금액 | Egret 주식 1백만주 + 미화200,000,000 달러 |
| 계약조건 | 1) Upfront: Egret Therapeutics 주식 1백만주 2) 마일스톤: - 누적 매출액 $250M: $25,000,000 - 누적 매출액 $500M: $25,000,000 - 누적 매출액 $750M: $25,000,000 - 누적 매출액 $1B: $25,000,000 - 누적매출액$2B: $100,000,000 |
| 회계처리방법 | - 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 - Egret주식 1주당 $1.0292로 가치평가 (2020.12.31기준) |
| 대상기술 | GX-P1 면역억제 기전을 활용한 뇌졸중, 자궁내막증, 조산증 치료제) |
| 개발진행경과 | - 계약상대방의 임상경과: 미국 임상1b상 IND 승인 |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 미국 US 7867491 B2 / 미국 US 8586038 B2 / 미국(DIV) US 108441104 B2 / 캐나다 CA 2687377 C / 유럽 EP 2662449 B1/ 브라질 BRPI08116377 / 러시아 RU 2530168 C2 / 중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B / 홍콩 HK 1141303 / 홍콩(DIV1) HK 1191959 / 홍콩(DIV2) HK 1191347 / 한국 KR 10-0897938 B1 / 한국(DIV1) KR 1380732 B1 / 한국(DIV2) KR 1380729 B1 / 일본 JP 5577243 B2 / 싱가포르 SG 156826 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-P1 물질 특허 (1) 특허번호 : 대만 TW 202130359 A / 미국 US 17/794832 / 유럽 EP 21744724.2 / 일본 JP 2022-544089 / 중국 CN 115103685 A / 2021210773 A1 / 캐나다 CA 3164910 / 한국 KR 10-2506179 B1 / 호주 AU 2021210773 A1 (2) 출원일 : 2021.01.06 (3) 발명의 명칭 : PD-L1 단백질이 포함된 융합 단백질 및 이의 용도 |
| 9) 품목 : GX-I7 | |
| 계약상대방 | PT KALBE-GENEXINE BIOLOGICS (KGbio, 인도네시아) |
| 계약내용 | 항암면역치료제(GX-I7)의 전용실시권 |
| 대상지역 | ASEAN 국가, MENA 국가, 호주, 뉴질랜드, 남아시아 (인도 포함) 및 기타 아프리카 |
| 계약기간 | 2021년 ~ 별도계약해지시 |
| 계약총 금액 | 미화 1,100,000,000 달러($1,100,000,000) / Royalty 별도 |
| 계약조건 | 1) Upfront: $27,000,000 2) 마일스톤: - BLA submission: $13,000,000 - BLA approval: $10,000,000 - 누적매출액 $500M: $50,000,000 - 누적매출액 $1B: $100,000,000 - 누적매출액 $2B: $200,000,000 - 누적매출액 $3B: $300,000,000 - 누적매출액 $5B: $400,000,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 인터루킨-7 |
| 개발진행경과 | - 계약상대방의 임상경과: 코로나바이러스 감염증 대상 임상2상 조기종료 - 회사의 임상 경과 : 삼중음성유방암 대상 임상1b/2 완료 (2017.12~2023.12), 재발성 교모세포종 대상 임상 2상 진행중 (2022~) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 싱가포르 SG 156826 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-I7 물질 특허 (1) 특허번호 : 인도 IN 437292 / 인도네시아 ID P000074097 (2) 출원일 : 2016.06.10 (3) 발명의 명칭 : 변형된 인터루킨-7 단백질 및 이의 용도 3. GX-I7+CPI 병용 투여 (1) 특허번호 : 뉴질랜드 NZ 775946 / 인도 IN 202117026652 / 인도네시아 ID P00202104485 / 호주 AU 2019379325 A1 (2) 출원일 : 2019.11.15 (3) 발명의 명칭 : IL-7 단백질 및 면역 관문 저해제의 조합으로 종양을 치료하는 방법 4. GX-I7 용법용량 특허 (1) 특허번호 : 남아프리카 ZA 2022/03778 / 뉴질랜드 NZ 784775 /사우디아라비아 SA 522431834 / 싱가포르 11202201344V / 아랍에미리트 AE P6000377/2022 / 이스라엘 IL 291084 / 인도 IN 202247018416 / 인도네시아 ID P00202203594 / 태국 TH 2201001343 / 호주 AU 2020343018 A1 (2) 출원일 : 2020.09.04 (3) 발명의 명칭 : 종양에서 IL-7 융합 단백질을 이용하여 림프구 수를 증가시키는 방법 |
| 10) 품목 : GX-E4 | |
| 계약상대방 | PT KALBE-GENEXINE BIOLOGICS (KGbio, 인도네시아) |
| 계약내용 | 지속형 빈혈치료제 GX-E4의 대상지역내 개발권 및 사업권 |
| 대상지역 | 아세안지역, MENA, 남아시아, 유럽 및 기타 아프리카 국가 |
| 계약기간 | 2022년 ~ JVA 종료일 까지 |
| 계약총 금액 | 미화 13,000,000 달러 ($13,000,000) / Royalty 별도 |
| 계약조건 | 1) Upfront: $8,000,000 2) 마일스톤: - BLA submission for Dialysis in Europe: $5,000,000 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 erythropoietin |
| 개발진행경과 | - 계약상대방의 임상 경과: 비투석 환자 대상 임상 3상 (인도네시아, 말레이시아, 필리핀, 태국, 타이완, 호주) 완료. 인도네시아 품목허가 획득. - 회사의 임상 경과 : 투석 환자 대상 임상 3상 진행 (한국, 조지아, 터키, 대만 승인 완료) 및 임상 3상 신청 (이탈리아, 폴란드, 체코, 불가리아, 헝가리, 인도네시아), 건강성인 대상 가교 1상 신청(한국) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 싱가포르 SG 156826 / 유럽 EP 2662449 B1 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-E4 물질 특허 (1) 특허번호 : 유럽 EP 3176264 B1 (2) 출원일 : 2012.06.11 (3) 발명의 명칭 : 면역글로불린 융합 단백질 3. GX-E4 용법용량 특허 (1) 특허번호 : 유럽 EP 3243525 A1 (2) 출원일 : 2016.01.08 (3) 발명의 명칭 : 지속형 EPO 제제를 이용한 빈혈 치료 방법 4. GX-E4 제형/제법 특허 (고순도조성물) (1) 특허번호 : 호주 AU 2016334954 B2 (2) 출원일 : 2016.10.06 (3) 발명의 명칭 : 지속형 에리트로포이에틴 함유 조성물 |
존속회사는 기술이전 계약 총 계약금액에서($2,229,000,000) 가장 큰 비중을 차지하고 있는 GX-I7($1,672,500,000)을 1)네오이뮨텍(유럽/미국), 2)I-Mab(중국). 3)KGbio(아세안/MENA/호주,뉴질랜드/기타 아프리카) 총 세개의 회사와 기술이전 계약 체결하였습니다. 존속회사는 상기 기술이전 계약을 체결한 세개의 회사에 각각 21.2%/ 4.5% / 20.3% 출자한 바 있습니다. 지분관계가 존재하는 회사간의 기술이전 계약은 지분관계가 없는 제3 법인간의 기술이전 계약에 비하여 파이프라인에 대한 가치평가 객관성이 다소 열위할 수 있으니 주의하시기 바랍니다.
다음은 GX-I7 기술이전계약 대상의 주요주주 내역입니다.
| [네오이뮨텍 주요주주 정보] |
| 명 칭 | 주요주주 | ||
| 성명 | 지분(%) | 비고 | |
| 네오 이뮨텍 |
제넥신 | 21.2% | |
| 양세환 | 5.8% | ||
| Others | 73.1% | - | |
| 출처 : 네오이뮨텍 정기보고서 |
| [I-Mab 주요주주 정보] |
| 명 칭 | 주요주주 | ||
| 성명 | 지분(%) | 비고 | |
| I-Mab | C-Bridge entities | 15.5 | 아시아 바이오-제약 투자회사 |
| Hillhouse | 8.4 | 글로벌 사모펀드 회사 | |
| Genexine | 4.5 | - | |
| Others | 71.6 | - | |
| 출처 : 존속회사 정기보고서 |
| [KGbio 주요주주 정보] |
| 명 칭 | 주요주주 | ||
| 성명 | 지분(%) | 비고 | |
| KGbio | PT. Kalbe Farma, Tbk | 55.5 | 동남아 최대 제약회사 |
| Genexine | 20.3 | - | |
| General Atlantic | 23.8 | 미국 투자회사 | |
| Others | 0.4 | - | |
| 출처 : 존속회사 정기보고서 |
존속회사는 2021년부터 2024년 1분기까지 각각 307억원, 101억원, 3억원, 1,200백만원의 기술이전 관련 매출이 발생하였으며, 내용은 아래와 같습니다.
| [기술이전 관련 매출 추이] |
| (단위: 백만원) |
| 매출유형 | 품 목 | 파트너 | 2024년 1분기 | 2023년 연간 | 2022년 연간 | 2021년 연간 |
| 기술이전 | GX-H9(지속형 성장호르몬) | I-Mab | - | 274 | - | - |
| GX-E4(빈혈치료제) | KGbio | - | - | 10,060 | - | |
| GX-I7 | KGbio | - | - | - | 29,908 | |
| hyFc 플랫폼 | 유한양행 | - | - | - | 528 | |
| 기타기술이전 | 기타 | - | - | - | 47 | |
| 기술재산권 (로열티) | FSH(난포자극호르몬) | 동아ST | 12 | 70 | 67 | 180 |
| 합계 | 12 | 344 | 10,127 | 30,663 | ||
존속회사는 현재 기술이전에 따른 단계별 마일스톤 및 시판 로열티 등은 적정 시점에 적정 기준을 통과 하여야만 수취 가능합니다. 만약 파트너사(Licensee)의 임상 진행이나 허가 취득 과정 등에 차질이 발생하는 경우 기술이전 계약이 중도 해지될 리스크가 존재합니다. 존속회사의 기술이전 내역 중 BSK에 기술이전한 GX-188의 경우를 제외한 다른 기술이전 내역의 경우 계약금 반환 의무는 없습니다. 그러나 GX-188의 경우 제넥신의 귀책사유로 계약이 해지될 경우 계약에 의해 지불된 모든 금액에 대한 반환 의무가 있어 상기한 바와 같은 기술이전 관련 리스크가 존재합니다.
또한, 기술이전 지연이나 실패, 파트너사의 연구개발 및 허가취득 지연이나 실패로 인해 존속회사가 예측하는 수익성 및 재무적인 안정성의 불확실성이 존재한다는 점을 투자자께서는 유의하여 투자하시기 바랍니다.
| 가-5. 핵심연구 인력 이탈 관련 위험 존속회사는 지식과 경험이 풍부한 전문인력의 확보가 신약 연구개발 사업의 핵심 경쟁력이라는 사실을 인지하고 우수한 전문 인력을 영입하고자 기존 조직원들의 역량을 최대한으로 끌어올리기 위해 다양한 지원을 아끼지 않고 있습니다. 존속회사의 연구개발 인력은 총 46명이며 박사 7명, 석사 26명, 학사 13명 등으로 구성되어있고, 바이오연구소에 37명, 임상개발본부에 9명이 배치되어있습니다. 존속회사의 바이오연구소를 총괄하고 있는 핵심인력은 권광현 연구소장이고, 임상개발본부를 총괄하고 있는 핵심인력은 변미선 본부장(미등기 임원)입니다. 또한 후보물질 발굴 및 신기술 도입 역량 강화를 위해 새롭게 확대 개편한 디스커버리팀을 담당하고 있는 이주형 이사가 핵심 연구인력입니다. 이들 주요 핵심 연구인력은 다년간의 업계 경험을 통해 전문성을 갖춘 인력으로 동사는 해당 인력들을 적극 활용하여 기존 사업을 안정적으로 수행함과 동시에 회사를 성장시키기 위한 노력을 지속하고 있습니다. 소멸회사의 연구개발 인력은 총 14명이며 박사 9명, 석사 4명, 학사 1명으로 구성되어있고, 플랫폼발굴팀에 12명, 비임상개발팀에 1명이 배치되어있습니다. 소멸회사의 연구개발핵심 인력은 총 4인으로 최재현 대표이사, 이승현 CTO, 용예령 약물평가팀장, 최기영 비임상개발팀장입니다. 핵심인력들은 임상단계 약물을 개발한 이력이 있으며(각각 3건, 3건, 2건, 6건) 이들 주요 핵심 연구인력은 다년간의 업계 경험을 통해 전문성을 갖춘 인력으로 인력 확보 및 유출방지를 위하여 존속회사로의 의무복무확약 및 존속회사 주식매수선택권 부여 등의 방안을 제시할 계획입니다. 신약 개발은 세계적으로 중소규모부터 대규모 제약회사들까지 다양하게 연구를 하고 있기에 존속회사와 같은 벤처기업이 전문성이 있는 우수한 인력을 확보하는 것은 어려우며 나아가 핵심인력을 유지하고 유출을 방지하는 것 또한 매우 어려운 일입니다. 이러한 특성으로 인하여 존속회사의 노력에도 불구하고 존속회사의 핵심인력이 해외 및 국내의 경쟁회사로 유출되는 경우, 존속회사의 경쟁적 지위를 약화시킬 수 있습니다. 또한 존속회사의 첨단 신약을 이해하고 기여할만한 대체인력을 찾고 교육/훈련하는 과정에서 많은 비용이 소요되어 존속회사의 수익성과 안정성에 부정적인 영향을 미칠 수 있으니 참고해주시기 바랍니다. |
신약 개발사업은 후보물질 발굴, 비임상시험, 임상시험, 허가, 생산 및 마케팅 등 전 단계에 걸쳐 전문인력을 필요로 합니다. 특히 기존 의약품으로 치료가 어려웠던 난치성 질환에 대하여 의학적 미충족 수요를 충족시킬 수 있는 first-in-class 신약을 개발하거나 글로벌 시장가치가 매우 높은 블록버스터급 신약을 개발하기 위해서는 해당 분야에 지식과 경험을 갖춘 우수한 전문인력을 확보하는 것이 중요하며, 각 분야별 전문인력의 확보 여부는 곧 존속회사와 같은 연구개발 벤처기업의 경쟁력으로 직결됩니다.
존속회사는 지식과 경험이 풍부한 전문인력의 확보가 신약 연구개발 사업의 핵심 경쟁력이라는 사실을 인지하고 우수한 전문 인력을 영입하고자 기존 조직원들의 역량을 최대한으로 끌어올리기 위해 다양한 지원을 아끼지 않고 있습니다.
존속회사의 증권신고서 제출일 현재 연구개발 조직도 및 인력 현황은 다음과 같습니다. 존속회사의 연구개발 인력은 총 46명이며 박사 7명, 석사 26명, 학사 13명 등으로 구성되어있고, 바이오연구소에 37명, 임상개발본부에 9명이 배치되어있습니다.
| [연구개발 조직 개요] |
| 구분 | 팀명 | 인원 | 담당업무 |
| 바이오연구소 | - 비임상팀 - USP팀 - DSP팀 - 분석1팀 - 분석2팀 - 분석3팀 - QA팀 - Discovery팀 - 연구개발운영파트 |
37 | - 단백질치료제 개발, 유전자백신개발, 세포주 제조,배양, 정제,CMC, 분석 및 비임상시험 |
| 임상개발본부 | - 임상과학팀 - 임상운영1팀 - 임상운영2팀 |
9 | - 임상 개발 전략 수립 - 임상 시험 기획 - 임상 시험 결과 해석 |
| 출처: 존속회사 정기보고서 |
| [연구관련 전문인력 현황] |
| 구분 | 2021년말 | 2022년말 | 2023년말 | 증권신고서 제출일 전일 기준 |
|---|---|---|---|---|
| 박사 | 8 | 10 | 9 | 7 |
| 석사 | 42 | 32 | 26 | 26 |
| 학사 | 25 | 28 | 22 | 13 |
| 합계 | 75 | 70 | 57 | 46 |
| 출처: 존속회사 제공 |
소멸회사의 현재 연구개발 조직도 및 인력 현황은 다음과 같습니다. 소멸회사의 연구개발 인력은 총 14명이며 박사 9명, 석사 4명, 학사 1명으로 구성되어있고, 플랫폼발굴팀에 12명, 비임상개발팀에 1명이 배치되어있습니다.
| [연구개발 조직 개요] |
| 구분 | 팀명 | 인원 | 담당업무 |
| 대표이사 | - | 1 | - 연구개발 총괄 |
| 연구소 | - 플랫폼발굴팀 | 12 | - bioPROTAC 형태의 표적단백질분해제 디자인, 표적결합나노바디 발굴, E3 엔지니어링 - bioPROTAC in vitro 유효성 평가, 약효평가 및 작용기전연구 - 연구성과 관리 및 국가과제 수행 지원 |
| 약물개발본부 | - 비임상개발팀 | 1 | - bioPROTAC 후보물질의 GMP생산, 독성평가, 약동학/약력학 분석 및 임상시험 허가문서 작성 - 임상시험 허가 전략 및 일정 관리 |
| 출처: 소멸회사 제공 |
| [연구관련 전문인력 현황] |
| 구분 | 2021년말 | 2022년말 | 2023년말 | 증권신고서 제출일 전일 기준 |
|---|---|---|---|---|
| 박사 | 3 | 5 | 8 | 9 |
| 석사 | 1 | 5 | 4 | 4 |
| 학사 | - | 1 | 1 | 1 |
| 합계 | 4 | 11 | 13 | 14 |
| 출처: 소멸회사 제공 |
존속회사의 바이오연구소를 총괄하고 있는 핵심인력은 권광현 연구소장이고, 임상개발본부를 총괄하고 있는 핵심인력은 변미선 본부장(미등기 임원)입니다. 또한 후보물질 발굴 및 신기술 도입 역량 강화를 위해 새롭게 확대 개편한 디스커버리팀을 담당하고 있는 이주형 이사가 핵심 연구인력입니다. 이들 주요 핵심 연구인력은 다년간의 업계 경험을 통해 전문성을 갖춘 인력으로 동사는 해당 인력들을 적극 활용하여 기존 사업을 안정적으로 수행함과 동시에 회사를 성장시키기 위한 노력을 지속하고 있습니다. 존속회사의 핵심 연구개발 인력 현황은 다음과 같습니다.
| [존속회사의 핵심 연구개발인력 현황] |
| 직책 | 성명 | 부서 | 근속 연수 | 기술이전 / 임상 / FDA 성공 및 승인 이력 | 주요 경력 | 주요 연구실적(논문, 학회발표) |
|---|---|---|---|---|---|---|
| 연구소장 | 권광현 | 바이오연구소 | 9년 7개월 | GX-I7 DS PPQ 1000L scale 생산 (CMC) (2022) GX-I7 임상 2상 (CMC) (2022) GX-I7 DP 생산 (CMC) (2020) GX-I7 DS 1000L scale 생산 (CMC) (2019) GX-E4 기술이전 (CWB, 중국 회사) (2017) GX-E2(빈혈치료제) 과학기술정보통신부 국가연구개발 우수성과 과제 선정 (2017) GX-E4 기술이전 (KGbio, 인도네시아 회사) (2016) 2015년 한국구조생물학회 가을 연례학술대회, 젊은과학자상 수상 |
-前 제넥신 정제팀장 -前 포항공대 박사후 연구원 -포항공대 생명과학과 박사 |
<논문> - Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. (2019년 Nature chemical biology) - Crystal structure of a Fanconi anemia-associated nuclease homolog bound to 5’ flap DNA: Basis of interstrand crosslink repair by FAN1. (2014년 Genes & Dev.) - Crystal structures of the structure-selective nuclease Mus81-Eme1 bound to flap DNA substrates. (2014년 EMBO. Journal) - An Ankyrin Repeat Domain of AKR2 Drives Chloroplast Targeting through Coincident Binding of Two Chloroplast Lipids. (2014년 Dev. Cell) - Crystal structure of the Mre11-Rad50-ATPγS complex: understanding the interplay between Mre11 and Rad50. (2011년 Genes & Dev.) |
| 임상개발 본부장 |
변미선 | 임상개발본부 | 15년 2개월 | GX-E4 임상3상 완료 및 국내 BLA 신청(2023) GX-P1 US Turrent capital(Egret Therapeutics) L/O(2020) GX-P1 MFDS 임상1상 승인/완료(2020-2021) GX-H9 FDA pre-IND meeting(2021) GX-H9 유럽/아시아 ph2 임상완료(2019) GX-G6 호주임상 2상 승인(2019) GX-G6 중국 Imab L/O&CSPC sub-L/O(2018) GX-G6 유럽(EMA) 임상 1상 승인/완료(2017-2019) GX-G6 보건복지부과제 승인/완료(2013-2019) |
-前 (주)제넥신 임상과학 팀장 -前 (주)제넥신 비임상 팀장 -前 인하대의과대학 박사후연구원 -가톨릭의과대학원 박사 |
<논문> - Understanding the Pharmacokinetic Journey of Fc-Fusion protein, rhIL-7-hyFc, Using Complementary Approach of Two Analytical Methods, Accelerator Mass Spectrometry and ELISA.(2023년, ACS) - Preclinical immunogenicity testing using anti-drug antibody analysis of GX-G3, Fc-fused recombinant human granulocyte colony-stimulating factor, in rat and monkey models. (2021년 Sci Rep) - A glycosylated Fc-fused glucagon-like peptide-1 receptor agonist exhibits equivalent glucose lowering to but fewer gastrointestinal side effects than dulaglutide. (2020년 Diabetes Obes Metab.) <학회발표> - GX-G6, a novel long-acting glucagon-like peptide receptor agonist: result of phase I study in healthy volunteers. (2019년 ADA) |
| 이사 | 이주형 | Discovery팀 | 1년 6개월 | - 前 (주)파멥신 항체공학팀 팀장 - 前 UAB Department of Pathology 연구원 - University of Alabama at Birmingham (UAB) 생물리학/생화학 박사 |
<논문> - A conserved aromatic moiety in the ectodomain is a key determinant for structural integrity and protein trafficking of TNFR superfamily. (2020년 FASEB Journal) - Revisiting Immunotherapy: A Focus on Prostate Cancer. (2020년 Cancer Research) - Endostatin inhibits androgen-independent prostate cancer growth by suppressing nuclear receptor-mediated oxidative stress. (2017년 FASEB Journal) - Endostatin: A novel inhibitor of androgen receptor function in prostate cancer. (2015년 PNAS) - Bacteriophage hyaluronidase effectively inhibits growth, migration and invasion by disrupting hyaluronan-mediated Erk1/2 activation and RhoA expression in human breast carcinoma cells.(2010년 Cancer Letters) <학회발표> - A novel anti-Tie2 antibody stabilizes vessel and increases tumor infiltrated lymphocytes (2020년 AACR) - Endostatin inhibits androgen-independent prostate cancer growth by suppressing nuclear receptor-mediated oxidative stress (2017년 AACR) - Endostatin regulates androgen receptor-mediated metabolic and oxido-reductive pathways in prostate cancer cells (2016년 AACR) - Proteome-based combined treatment strategies synergizing antagonism of androgen receptor function in prostate cancer (2015년 AACR) - Endostatin is a novel inhibitor of androgen receptor function in prostate cancer (2014년 AACR) - In vitro studies on anti-cancer effect of Streptococcus pyogenes phage hyaluronidase (HylP) on breast cancer (2008년 AACR) |
| 출처: 존속회사 정기보고서 |
소멸회사의 연구개발핵심 인력은 총 4인으로 최재현 대표이사, 이승현 CTO, 용예령 약물평가팀장, 최기영 비임상개발팀장입니다. 핵심인력들은 임상단계 약물을 개발한 이력이 있으며(각각 3건, 3건, 2건, 6건) 이들 주요 핵심 연구인력은 다년간의 업계 경험을 통해 전문성을 갖춘 인력으로 인력 확보 및 유출방지를 위하여 존속회사로의 의무복무확약 및 존속회사 주식매수선택권 부여 등의 방안을 제시할 계획입니다.
소멸회사의 핵심 연구개발 인력 현황은 다음과 같습니다.
| [소멸회사의 핵심 연구개발인력 현황] |
| 직책 | 성명 | 부서 | 근속 연수 | 기술이전 / 임상성공 / FDA 승인 등 이력 | 주요 경력 | 주요 연구실적(논문, 학회발표) |
| CEO | 최재현 | 대표이사 | 2년 11개월 | 임상단계 약물 개발 3건 기여 (ELND005, SAIT-301, TTI-622) | Univ. of Toronto 의과학 박사 ‘07~’11 Transition Therapeutics (캐나다) ‘11~’15 삼성전자 종합기술원 ‘16~’19 Trillium Therapeutics (캐나다) ‘19~’21 Arvinas (미국) ‘21~현재 이피디바이오테라퓨틱스 CEO |
총 19년간 신약개발 경력 (해외 기업: 10년) 논문 출판: 13건 / 특허 출원: 11건 해외 학회 구두 발표 5건 Arvinas에서 신규 과제 2개 기획 및 런칭 TIPS R&D 사업 연구책임자 (과제번호: S3201518) |
| CTO | 이승현 | 연구소 | 2년 11개월 | 임상단계 약물 개발 3건 기여(SAIT301, EU103, EU307) | 아주대 분자과학기술학 박사 ‘10~’16 삼성전자 종합기술원 ‘17~’21 유틸렉스 R&D센터 ‘21~현재 이피디바이오테라퓨틱스 CTO |
치료용항체 및 치료용 단백질 다수의 원천물질 개발 이중항체, CAR-T 세포치료제, ADC용 항체 다수 개발 코로나바이러스 중화단백질 개발 미국 최종등록완료 특허 23건 외 출원 다수 및 논문 출판 13건 2024 국가신약개발재단 과제 연구책임자 (과제번호: RS-2024-00337873) |
| 팀장 | 용예령 | 약물평가팀 | 2년 3개월 | 임상단계 약물개발 2건 기여 (Invossa, ABL105) |
연세대 생화학 박사 '09~'10 연세대학교 (박사후과정) '10~'17 삼성전자 종합기술원 (바이오연구소, 전문연구원) '17~'18 코오롱 생명과학 (분자생물팀, 차장) '18~'22 에이비엘바이오 (디스커버리팀, 수석) '22~현재 이피디바이오테라퓨틱스 약물평가팀장 / 이사 |
퇴행성 관절염의 새로운 기전 발견을 통한 치료제 개발 엑소좀, miRNA, CTC 이용한 암진단기술 개발 SAIT301 항암항체약물의 임상1상 검체 분석 난치암 환자의 암조직 및 암세포주 은행 구축 골관절염 세포유전자치료제 Invossa 공정 개발 및 특성 분석 면역항암 이중항체 개발 bioPROTAC 플랫폼의 항암제, 아토피치료제 개발 국제특허등록 2건을 포함한 15건 국제특허 출원 |
| 팀장 | 최기영 | 비임상개발팀 | 10개월 | 임상단계 약물개발 6건 기여 (BVAC-C 3건, BVAC-B, BVAC-P, AdCLD-Cov19-1) |
서울대 이학 박사 ‘14~’21 셀리드 연구개발기획팀장 ’22 액트테라퓨틱스 연구소장 및 개발본부장 ‘22~’23 큐라미스 ‘23~현재 이피디바이오테라퓨틱스 비임상개발팀장 / 부장 |
CMC개발 및 규제대응업무이력 다수 비임상개발연구 및 GLP tox 관리이력 다수 공정 및 시험법 개발연구 및 DS 관리이력 다수 bioPROTAC 비임상개발 총괄 논문 5편 발표 |
| 출처: 소멸회사 제공 |
존속회사는 연구인력 및 주요 직원들에 대해 사기진작 및 보상과 함께 장기근속 유도로 이탈을 방지하기 위하여 주식매수선택권을 부여하고 있습니다. 존속회사가 현재까지 부여한 주식매수선택권은 다음과 같습니다.
| [주식매수선택권 부여 현황] |
| (기준일 : | 2024.03.31 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| OOO외 15인 | 직원 | 2014.03.21 | 신주교부 | 보통주 | 611,000 | - | 111,995 | 389,805 | 221,195 | - | 2022.03.21~2024.03.20 | 13,121 | X | X |
| 이성희 | 퇴직자 | 2018.02.06 | 신주교부 | 보통주 | 32,500 | - | 32,500 | - | 32,500 | - | 2021.02.06~2023.02.05 | 51,471 | X | X |
| OOO외 23인 | 직원 | 2018.02.06 | 신주교부 | 보통주 | 141,050 | - | 54,512 | 50,905 | 90,145 | - | 2021.02.06~2023.02.05 | 51,471 | X | X |
| OOO외 13인 | 직원 | 2019.05.22 | 신주교부 | 보통주 | 10,673 | - | - | - | 6,526 | 4,147 | 2022.05.22~2024.05.21 | 47,502 | X | X |
| OOO외 10인 | 직원 | 2019.11.28 | 신주교부 | 보통주 | 11,850 | - | - | - | 6,000 | 5,850 | 2022.11.28~2024.11.27 | 37,250 | X | X |
| OOO외 2인 | 직원 | 2019.12.27 | 신주교부 | 보통주 | 1,755 | - | - | - | 1,300 | 455 | 2022.12.27~2024.12.26 | 37,687 | X | X |
| 박종섭 | 퇴직자 | 2020.03.04 | 신주교부 | 보통주 | 6,500 | - | - | - | - | 6,500 | 2023.03.04~2025.03.03 | 38,875 | X | X |
| 허민규 | 퇴직자 | 2020.07.15 | 신주교부 | 보통주 | 6,500 | - | - | - | - | 6,500 | 2023.07.15~2025.07.14 | 62,442 | X | X |
| OOO외 30인 | 직원 | 2020.07.15 | 신주교부 | 보통주 | 126,750 | - | - | - | 62,400 | 64,350 | 2023.07.15~2025.07.14 | 62,442 | X | X |
| 김기완 | 퇴직자 | 2021.02.18 | 신주교부 | 보통주 | 1,950 | - | - | - | - | 1,950 | 2024.02.18~2026.02.17 | 67,193 | X | X |
| 이장희 | 퇴직자 | 2021.02.18 | 신주교부 | 보통주 | 2,340 | - | - | - | - | 2,340 | 2024.02.18~2026.02.17 | 67,193 | X | X |
| OOO외 28인 | 직원 | 2021.02.18 | 신주교부 | 보통주 | 53,300 | - | - | - | 33,995 | 19,305 | 2024.02.18~2026.02.17 | 67,193 | X | X |
| Neil warma | 퇴직자 | 2021.03.29 | 신주교부 | 보통주 | 3,900 | - | - | - | - | 3,900 | 2024.03.29~2026.03.28 | 64,692 | X | X |
| OOO외 21인 | 직원 | 2021.08.13 | 신주교부 | 보통주 | 52,520 | - | - | - | 24,700 | 27,820 | 2024.08.13~2026.08.12 | 58,441 | X | X |
| 박현진 | 미등기임원 | 2022.03.07 | 신주교부 | 보통주 | 39,000 | - | - | - | - | 39,000 | 2025.03.07~2027.03.06 | 31,874 | X | X |
| 이장희 | 퇴직자 | 2022.03.07 | 신주교부 | 보통주 | 10,400 | - | - | - | - | 10,400 | 2025.03.07~2027.03.06 | 31,874 | X | X |
| 김기용 | 퇴직자 | 2022.03.07 | 신주교부 | 보통주 | 7,800 | - | - | - | - | 7,800 | 2025.03.07~2027.03.06 | 31,874 | X | X |
| 김기완 | 퇴직자 | 2022.03.07 | 신주교부 | 보통주 | 3,120 | - | - | - | - | 3,120 | 2025.03.07~2027.03.06 | 31,874 | X | X |
| 허민규 | 퇴직자 | 2022.03.07 | 신주교부 | 보통주 | 6,240 | - | - | - | - | 6,240 | 2025.03.07~2027.03.06 | 31,874 | X | X |
| 최은호 | 퇴직자 | 2022.03.07 | 신주교부 | 보통주 | 2,600 | - | - | - | - | 2,600 | 2025.03.07~2027.03.06 | 31,874 | X | X |
| OOO외 15인 | 직원 | 2022.03.07 | 신주교부 | 보통주 | 67,470 | - | - | - | 33,540 | 33,930 | 2025.03.07~2027.03.06 | 31,874 | X | X |
| Neil warma | 퇴직자 | 2022.03.29 | 신주교부 | 보통주 | 130,000 | - | - | - | - | 130,000 | 2025.03.29~2027.03.28 | 30,436 | X | X |
| 우정원 | 퇴직자 | 2022.03.29 | 신주교부 | 보통주 | 52,000 | - | - | - | - | 52,000 | 2025.03.29~2027.03.28 | 30,436 | X | X |
| 홍성준 | 등기임원 | 2022.03.29 | 신주교부 | 보통주 | 45,550 | - | - | - | - | 45,550 | 2025.03.29~2027.03.28 | 30,436 | X | X |
| 이혁종 | 등기임원 | 2022.03.29 | 신주교부 | 보통주 | 6,500 | - | - | - | - | 6,500 | 2025.03.29~2027.03.28 | 30,436 | X | X |
| Peter Laivins | 등기임원 | 2022.03.29 | 신주교부 | 보통주 | 6,500 | - | - | - | - | 6,500 | 2025.03.29~2027.03.28 | 30,436 | X | X |
| 배진건 | 등기임원 | 2022.03.29 | 신주교부 | 보통주 | 6,500 | - | - | - | - | 6,500 | 2025.03.29~2027.03.28 | 30,436 | X | X |
| 전현철 | 등기임원 | 2022.03.29 | 신주교부 | 보통주 | 6,500 | - | - | - | - | 6,500 | 2025.03.29~2027.03.28 | 30,436 | X | X |
| OOO외 3인 | 직원 | 2022.12.07 | 신주교부 | 보통주 | 10,790 | - | - | - | - | 10,790 | 2025.12.07~2027.12.06 | 16,769 | X | X |
| OOO외 34인 | 직원 | 2023.03.10 | 신주교부 | 보통주 | 50,700 | - | - | - | 4,400 | 46,300 | 2026.03.10~2028.03.09 | 14,730 | X | X |
| OOO외 10인 | 직원 | 2023.09.14 | 신주교부 | 보통주 | 22,600 | - | - | - | - | 22,600 | 2026.03.10~2028.03.09 | 9,400 | X | X |
| OOO외 12인 | 직원 | 2024.03.13 | 신주교부 | 보통주 | 19,300 | - | - | - | - | 19,300 | 2027.03.13~2029.03.12 | 8,340 | X | X |
| 출처: 존속회사 정기보고서 |
신약 개발은 세계적으로 중소규모부터 대규모 제약회사들까지 다양하게 연구를 하고 있기에 존속회사와 같은 벤처기업이 전문성이 있는 우수한 인력을 확보하는 것은 어려우며 나아가 핵심인력을 유지하고 유출을 방지하는 것 또한 매우 어려운 일입니다. 이러한 특성으로 인하여 존속회사의 노력에도 불구하고 존속회사의 핵심인력이 해외 및 국내의 경쟁회사로 유출되는 경우, 존속회사의 경쟁적 지위를 약화시킬 수 있습니다. 또한 존속회사의 첨단 신약을 이해하고 기여할만한 대체인력을 찾고 교육/훈련하는 과정에서 많은 비용이 소요되어 존속회사의 수익성과 안정성에 부정적인 영향을 미칠 수 있으니 참고해주시기 바랍니다.
| 가-6. 지적재산권 관련 위험 존속회사와 같은 연구개발기업은 특허의 출원 및 등록과 관련제도를 통한 지적재산권의 관리가 중요하며 핵심 기술 및 제품에 대한 권리를 보호할 수 있는 장치를 마련하는 것이 필요합니다. 특허의 출원은 특허법인을 통한 사전 조사를 바탕으로 진행되며, 신규성을확인하고 연구개발을 통해 진보성을 확보 후 출원을 하는 방식으로 진행하여 특허 등록이 거절될 확률을 최소화하고 있습니다. 존속회사는 원천기술인 hybrid Fc 특허를 기반으로 설립된 벤처기업으로서, 강력하고 경쟁력 있는 지적재산권 확보 및 확보된 지적재산권을 통한 글로벌 사업개발의 우위를 선점하는 것이 사업의 핵심 성공요인입니다. 합병회사는 핵심 원천 기술이자 플랫폼 기술인 hybrid Fc 기술과 유전자 치료백신 분야 관련 기술 및 DNA 벡터기술을 기반으로한 DNA백신관련 기술에 대하여 다수의 특허를 보유하고 있습니다. 원천기술인 hybrid Fc에 대한 특허는 주요 국가들에서 권리를 확보한 상태이지만, 기존 경쟁 약물들의 종래의 특허를 회피하면서 기술의 가치를 극대화할 수 있는 특허 에버그리닝 전략 확립과 후발 개발업체의 바이오시밀러 혹은 바이오베터 개발을 예측하여 장기적인 특허전략을 수립하여 지적재산권 보호를 위한 적극적인 노력을 하고 있습니다. 존속회사의 이 같은 노력에도 불구하고 향후 출원 예정인 특허가 최종적으로 등록이 되지 않을 수 있으며, 등록된 특허가 제품 출시 전에 만료, 표기, 소멸될 수 있습니다. 국가별로 현행 특허관련 법률이 개정되어 특허 보호 범위나 기간이 축소될 수도 있습니다. 또한, 경쟁 업체가 존속회사 보유 특허 기술과 유사한 기술을 발견하여 존속회사의 특허권을 침해하거나 존속회사 보유 특허 기술과 유사한 기술을 이미 보유하여 존속회사가 이를 침해했다고 주장하는 경우, 소송 등의 분쟁이 발생할 수 있습니다. 특허 분쟁이 발생할 경우 존속회사의 영업 및 재무 상황에 부정적 영향을 끼칠 수 있기 때문에 투자자께서는 이점 유의하여 투자하시기 바랍니다. |
존속회사와 같은 연구개발기업은 특허의 출원 및 등록과 관련제도를 통한 지적재산권의 관리가 중요하며 핵심 기술 및 제품에 대한 권리를 보호할 수 있는 장치를 마련하는 것이 필요합니다. 특허의 출원은 특허법인을 통한 사전 조사를 바탕으로 진행되며, 신규성을확인하고 연구개발을 통해 진보성을 확보 후 출원을 하는 방식으로 진행하여 특허 등록이 거절될 확률을 최소화하고 있습니다.
존속회사는 원천기술인 hybrid Fc 특허를 기반으로 설립된 벤처기업으로서, 강력하고 경쟁력 있는 지적재산권 확보 및 확보된 지적재산권을 통한 글로벌 사업개발의 우위를 선점하는 것이 사업의 핵심 성공요인입니다. 합병회사는 핵심 원천 기술이자 플랫폼 기술인 hybrid Fc 기술과 유전자 치료백신 분야 관련 기술 및 DNA 벡터기술을 기반으로한 DNA백신관련 기술에 대하여 다수의 특허를 보유하고 있습니다.
원천기술인 hybrid Fc에 대한 특허는 주요 국가들에서 권리를 확보한 상태이지만, 기존 경쟁 약물들의 종래의 특허를 회피하면서 기술의 가치를 극대화할 수 있는 특허 에버그리닝 전략 확립과 후발 개발업체의 바이오시밀러 혹은 바이오베터 개발을 예측하여 장기적인 특허전략을 수립하여 지적재산권 보호를 위한 적극적인 노력을 하고 있습니다.
그리고 이러한 특허 전략을 토대로 장벽특허에 대한 분쟁을 사전에 예방하고, 경쟁 업체에 대한 방어 전략을 수립하여 광범위한 특허포트폴리오 구축을 통한 지속적인 권리범위 확장 및 사업화, 다각화를 진행 중에 있습니다. 존속회사는 '24년 1분기 기준 33종의 특허를 등록하였으며, 특허의 상세내역은 다음과 같습니다.
| 번호 | 내용 | 권리자 | 출원일 | 등록일 | 적용 제품 |
비고 |
| 1 | IL-12 활성을 증가시키는 IL-12p40 소단위체의 유전자 및 이를 DNA백신 면역증강제로 이용하는 용도 | 제넥신 | 01.03.13(한국) 01.03.15 (미국,일본, 유럽, 호주, 캐나다, 중국) 01.09.20(PCT) |
03.09.17(한국) 06.01.05(호주) 06.09.27(유럽) 06.10.25(중국) 07.08.07(미국) 08.09.05(일본) 11.03.02(미국) 12.11.11(캐나다) |
GX-188E GX-110E GX-051 |
IL12M기술 |
| 2 | Immunoglobulin fusion protein |
제넥신 / POSTECH | 08.05.30(한국) 08.05.30(미국외 14개국) 08.05.30(PCT) 09.11.15(이스라엘) 09.11.06(중국) 09.11.06(인도) 10.08.12(홍콩) 18.12.04(마카오) |
09.05.08(한국) 11.01.11(미국) 11.09.15(싱가폴) 12.09.17(이스라엘) 13.02.27(유럽9개국) 13.05.14(캐나다) 13.07.18(호주) 14.07.11(일본) 14.10.10 (러시아) 15.11.25(중국) 16.09.09(홍콩) 19.03.11(마카오) 20.11.24(브라질) 21.01.29(홍콩) |
항체융합 단백질 치료제 |
hyFc기술 |
| 3 | HPV변형체 및 면역증강제를 포함하는 자궁경부암 |
제넥신 | 09.07.02(한국) 10.08.13(PCT) 10.08.13 (미국, 유럽, 중국, 일본) 16.05.03(홍콩) |
12.07.11(한국) 15.04.07(미국) 15.05.01(일본) 16.01.20(중국) 18.02.28(유럽) 21.06.01(중국) 21.10.15(홍콩) |
GX-188E | DNA 치료백신 기술 (GX-188E 물질 특허) |
| 4 | 자궁경부암의 치료방법 | 제넥신 | 15.08.14(PCT) 17.02.01(캐나다) 17.02.13(브라질) 17.02.14(일본) 17.02.14(미국) 17.02.15(맥시코) 17.03.15(한국) 17.03.15(유럽) 17.03.30(중국) 18.01.19(홍콩) |
21.03.11(호주) 21.10.05(미국) 23.01.02(멕시코) 23.04.17(한국) 23.06.26(캐나다) 23.09.25(일본) 24.04.03 (유럽) |
GX-188E | DNA 치료백신 기술 (단독치료 임상) |
| 5 | 변형된 인터루킨-7 단백질 및 이의 용도 | 제넥신 | 16.06.10(한국) 16.06.10(PCT) 16.09.15(미국) 17.11.10(인도) 17.12.11(중국) 17.12.08(일본) 17.11.17(캐나다) 17.12.11(브라질) 18.01.03(유럽) 18.01.08(인도네시아) 18.01.10(러시아) 18.11.28(홍콩) 18.12.13(미국-CA) 22.04.13(중국-DIV1) 22.06.08(일본-DIV2) |
18.06.26(한국) 19.02.19(미국) 19.12.04(러시아) 21.01.14(인도네시아) 22.06.10(일본) 22.06.22(미국-CA) 23.07.05(인도) 24.02.27 (캐나다) |
GX-I7 | 물질특허 |
| 6 | GLP 및 면역글로불린 하이브리드 Fc 융합 폴리펩타이드 및 이의 용도 | 제넥신 | 15.12.30(한국) 15.12.31 (PCT) 15.12.31(대만) 17.07.10(유럽) 17.06.22(미국) 17.06.29(일본) 17.06.29(중국) 18.05.07(홍콩) |
18.01.29(한국) 18.08.03(일본) 19.09.04(유럽) 20.01.21(미국) 20.02.21(대만) 20.10.09(홍콩) 20.10.30(중국) |
GX-G6/G8 | 물질특허 |
| 7-1 | hGH 융합단백질을 포함하는 성장호르몬 결핍을 치료하기 위한 약학 조성물(성인) |
제넥신/한독 | 17.02.16(PCT) 17.02.16(한국) 17.02.16(요르단) 17.02.17(베네수엘라) 17.02.17(대만) 18.08.09(캐나다) 18.08.10(미국) 18.08.16(브라질) 18.08.16(일본) 18.09.11(유럽) 18.09.14(인도네시아) 18.09.14(러시아) 18.09.18(중국) 18.12.13(한국) 19.06.14(홍콩) |
20.09.11(러시아) 21.06.11(일본) 21.10.07(한국) 21.12.11(대만) 22.03.16(요르단) 22.08.16(중국) 22.08.03(유럽 20개국) |
GX-H9 (성인) |
- |
| 7-2 | hGH 융합단백질을 포함하는 성장호르몬 결핍을 치료하기 위한 약학 조성물(소아) | 제넥신/한독 | 17.08.30(PCT) 17.08.30(베네수엘라) 17.08.30(대만) 17.08.30(한국) 18.12.13(한국) 19.02.12(요르단) 19.02.15(캐나다) 19.02.27(일본) 19.02.28(미국) 19.02.28(브라질) 19.03.25(인도) 19.03.26(유럽) 19.03.28(인도네시아) 19.03.29(러시아) 19.04.28(중국) 19.12.18(홍콩) 23.01.27(일본-DIV) |
20.12.29(대만) 21.05.25(러시아) 21.07.01(대만) 21.09.30(한국) 22.07.27(유럽 20개국) 23.08.17(일본) 23.09.10(요르단) 23.10.10(인도네시아) 24.01.12(인도) |
GX-H9 (소아) |
- |
| 8 | 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 사람 파필로마바이러스 유래 질환의 예방 또는 치료용 약학적 조성물 | 제넥신 | 16.12.02(PCT) 16.12.02(한국) 16.12.02(대만) 18.03.14(한국) 18.05.10(미국) 18.06.01(중국) 19.04.18(홍콩) |
20.07.08(한국) 22.08.21(대만) 23.07.05(미국) |
GX-I7 | HPV 용도 |
| 9 | 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 인플루엔자 바이러스 감염의 예방 또는치료용 약학적 조성물 | 제넥신 | 16.11.30(한국) 16.11.30(PCT) 16.12.02(대만) 18.05.18(미국) 18.06.01(중국) 19.04.18(홍콩) |
22.06.14(미국) 22.09.01(대만) 23.11.16 (한국) |
GX-I7 | Flu 용도 |
| 10 | 변형된 인터루킨-7 융합 단백질의 제형 | 제넥신 | 15.11.06(한국) 16.11.02(PCT) 16.11.04(대만) 18.05.03(미국) 18.06.12(중국) 19.04.25(홍콩) |
20.11.18(대만) 21.03.01(대만) 22.04.11(한국) 23.01.10(미국) |
GX-I7 | 제형 |
| 11 | GLP-1-hyFc 용량용법 | 제넥신 | 20.03.09(미국) 20.03.09(PCT) |
- | GX-G6 | 임상 |
| 12 | PD-L1 단백질이 포함된 융합 단백질 및 이의 용도 | 제넥신 | 21.01.06(PCT) 21.01.06(한국) 21.01.07(대만) 22.07.14(캐나다) 22.07.20(일본, 중국) 22.07.22(미국) 22.08.01(호주) 22.08.22(유럽) 23.02.28(한국-DIV) |
23.02.28(한국) 23.10.01 (대만) |
GX-P1 | 물질 |
| 13 | PD-L1 단백질 및 단량체성 IL-10 변이체가 포함된 융합 단백질 및 그의 용도 | 제넥신 | 21.01.06(PCT) 21.01.06(한국) 21.01.07(대만) |
- | GX-P10 | 물질 |
| 14 | 신규 IL-10 변이체 단백질 및 그의 용도 | 제넥신 / 프로젠 | 20.07.07(PCT) 20.07.07(한국) 20.07.08(대만) 22.02.07(유럽) 22.01.07(일본) 22.01.10(미국) 22.03.08(중국) |
- | GX-P10 | |
| 15 | 종양에서 IL-7 융합 단백질을 이용하여 림프구 수를 증가시키는 방법 |
제넥신 / 네오이뮨텍 | 20.09.04(PCT) 22.01.31(뉴질랜드) 22.02.03(캐나다) 22.02.11(싱가포르) 22.02.21(호주) 22.02.22(브라질) 22.02.23(멕시코) 22.02.25(미국) 22.03.02(중국) 22.03.03(일본, 사우디아라비아,아랍에미리트, 태국, 이스라엘, 유럽) 22.03.24(인도네시아) 22.03.28(베트남) 22.03.29(인도) 22.03.30(러시아) 22.03.31(한국) 22.04.01(남아프리카공화국) |
- | GX-I7 | 용법용량 |
| 16 | IL-7 단백질 및 면역체크억제제 조합으로 종양을 치료하는 방법 | 제넥신 / 네오이뮨텍 | 19.11.15(PCT) 21.05.14(미국) 21.03.26(유럽) 21.05.07(캐나다) 21.05.10(호주) 22.05.16(뉴질랜드) 21.06.14(인도네시아, 한국) 21.06.16(일본) 21.06.22(중국) 21.12.17(인도) 21.12.31(홍콩) |
- | GX-I7 | 병용투여 |
| 17 | 변형된 인터루킨-7 단백질 및 이의 용도 | 제넥신 / 네오이뮨텍 | 20.04.16(한국) 21.04.16(미국) |
- | modified GX-I7 | MGM 보완 |
| 18 | 변형된 인터루킨-7 및 TGF 베타 수용체 II를 포함하는 융합단백질 및 이의 용도 | 제넥신 / POSTECH | 20.11.13(PCT) 20.11.13(한국) 22.04.07(호주) |
22.05.23(한국) 24.02.01(호주) |
GX-72 | |
| 19 | 신규 코로나바이러스 예방 및 치료용 백신 조성물 | 제넥신 / 벡시젠 | 20.12.16(한국) 21.12.16(한국) 21.12.16(PCT) |
- | GX-19N | 코로나백신 |
| 20 | 자궁경부암의 치료방법 | 제넥신 | 20.04.24(미국) 21.04.26(PCT) 21.04.26(미국) 22.06.30(한국) 22.10.17(사우디아라비아) 22.10.18(멕시코) 22.10.19(캐나다) 22.10.20(싱가포르, 브라질) 22.10.21(일본, 인도) 22.10.22(태국) 22.10.24(아랍에미리트, 유럽, 중국, 이스라엘, 호주, 남아프리카, 베트남, 뉴질랜드, 러시아, 인도네시아, 콜롬비아, 페루, 필리핀) |
24.01.30(미국) | GX-188E | PD-1 항체 병용 |
| 21 | 항-TAA 항체, 항-PD-L1 항체 및 IL-2를 포함하는 융합단백질 및 이의 용도 | 제넥신 | 20.01.31(한국) 21.01.27(PCT) 22.06.30(호주) |
22.05.18(한국) | tri-specific | 면역항암제 |
| 22 | 지속형 에리트로포이에틴 함유 조성물 | 제넥신 / 녹십자 | 15.10.07(한국) 16.10.06(PCT) 16.10.05(인도네시아) 16.10.06(중국) 16.10.07(대만) 18.05.03(호주) |
18.04.03(한국) 19.10.16(인도네시아) 19.04.01(대만) 20.06.11(호주) 23.02.23(인도네시아-DIV) |
GX-E4 | 고순도조성물 |
| 23 | 지속형 EPO 제제를 이용한 빈혈 치료 방법 | 제넥신 / 녹십자 | 16.01.08(한국) 16.01.08(유럽) 16.01.08(중국) 16.01.08(브라질) 16.01.08(러시아) 16.01.08(일본) 16.01.08(미국) 16.01.08(대만) 17.08.08(인도네시아) 21.12.09(중국) |
18.06.21(대만) 18.11.28(러시아) 19.07.26(일본) 22.11.02(인도네시아) 23.09.13(한국) |
GX-E4 | 치료방법 (용법용량) |
| 24 | COVID-19 mRNA 백신 전달시스템 | 제넥신 / 화이바이오메드/포항공대 | 21.07.09(한국-priority) 21.07.12(한국-priority) 22.07.06(한국) 22.07.07(PCT) |
- | mRNA백신 제형 | HA 제형 |
| 25 | Method of Inducing Stem Cell Mobilization | 네오이뮨텍 / 제넥신 / 포항공대 | 20.10.26(미국) 21.10.25(PCT) 23.04.26(미국) 23.05.24(유럽) 23.05.09(한국) |
- | GX-I7 | 줄기세포 Mobilization |
| 26 | 결핵의 예방 또는 치료용 약학적 조성물 | 제넥신, 질병관리청 | 20.12.04(한국) 21.12.03(PCT) 23.07.04(필리핀, 인도네시아, 인도) |
- | 결핵 | 결핵 DNA 백신 |
| 27 | 코로나바이러스 백신 조성물 및 이의 사용 방법 | 제넥신 / 에스엘벡시젠 | 21.09.24(한국) 21.11.03(한국) |
- | GX-19N | 부스터 용량용법 |
| 28 | PD-L1 및 IL-10의 융합단백질을 유효성분으로 하는 이식거부반응 치료용 약학적 조성물 | 제넥신 / 제넨바이오 | 21.11.08(PCT) | - | GX-P10 | 용도 |
| 29 | 코로나바이러스 감염 질환의 치료 또는 예방을 위한 인터루킨-7 융합 단백질의 투여 요법 | 제넥신 | 21.11.12(한국) 22.11.14(PCT) |
- | GX-I7 | 코로나 치료제 |
| 30 | hGH 융합단백질의 고농도 투여 제형 | 제넥신 / 한독 | 21.11.26(한국) 22.10.19(PCT) |
- | GX-H9 | 제형 |
| 31 | 변형된 인터루킨-7 및 VEGF 길항제를 포함하는 암 치료용 조성물 및 이를 이용한 암 치료방법 | 제넥신 제넥신 / 네오이뮨텍 |
22.01.03(한국) 22.12.30(PCT) |
- |
GX-I7 | 병용투여 |
| 32 | HPV-특이적 DNA 백신, IL-7 단백질 및 면역관문억제제 조합의 종양 치료방법 | 제넥신 / 연세대학교 산학협력단 | 22.03.10(한국) 23.03.07(PCT) |
- | Triple Combo |
병용투여 |
| 33 | Long-acting EPO 융합단백질의 생산 방법 | 제넥신 | 23.03.02(한국) | - | GX-E4 | 제조방법 |
| 출처: 존속회사 정기보고서 |
존속회사의 이 같은 노력에도 불구하고 향후 출원 예정인 특허가 최종적으로 등록이 되지 않을 수 있으며, 등록된 특허가 제품 출시 전에 만료, 표기, 소멸될 수 있습니다. 국가별로 현행 특허관련 법률이 개정되어 특허 보호 범위나 기간이 축소될 수도 있습니다.
또한, 경쟁 업체가 존속회사 보유 특허 기술과 유사한 기술을 발견하여 존속회사의 특허권을 침해하거나 존속회사 보유 특허 기술과 유사한 기술을 이미 보유하여 존속회사가 이를 침해했다고 주장하는 경우, 소송 등의 분쟁이 발생할 수 있습니다. 특허 분쟁이 발생할 경우 존속회사의 영업 및 재무 상황에 부정적 영향을 끼칠 수 있기 때문에 투자자께서는 이점 유의하여 투자하시기 바랍니다.
| 가-7. 정책 및 규제 변화 관련 위험 제약/바이오산업은 대표적인 미래 성장 산업으로 각국 정부가 적극적인 육성 정책을 시행하는 한편 환자 보호 측면에서 인허가 및 약가 결정에 각국 정부가 엄격하게 개입하는 양면적 특성을 가지고 있습니다. 한편, 국내를 비롯한 미국, 유럽 등 글로벌 선진국에서는 제약·바이오 산업을 국민의 건강을 증진하고 일자리와 고부가가치를 창출하는 핵심 기간산업이자 미래 신성장 동력 산업으로 인지하고, 제약ㆍ바이오 산업에 대한 우호적 정책을 펼치고 있는 상황입니다. 이와 같이 세계적으로 자국의 바이오 산업을 국가 주요 산업으로 성장시키려고 하는 추세와 더불어, 경쟁관계에 있는 타 국가의 산업을 견제하는 상황 역시 발생하고 있습니다. 상기 언급된바와 같이 제약 및 신약개발 산업에 대한 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에도 불구하고, 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 또한 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않을 경우, 규제 완화의 범위가 축소될 수 있습니다. 또한 국제 정세에 따라 해외국가에서 비우호적인 정책이 진행되어 각 회사들의 신약 개발 로드맵이 변경될 가능성이 존재합니다. 이러한 우호/비우호적인 정책 및 규제 완화/강화등의 변동 가능성은 존속회사 사업에 부정적인 영향을 미칠 수 있으니 참고하시기 바랍니다. |
제약/바이오산업은 대표적인 미래 성장 산업으로 각국 정부가 적극적인 육성 정책을 시행하는 한편 환자 보호 측면에서 인허가 및 약가 결정에 각국 정부가 엄격하게 개입하는 양면적 특성을 가지고 있습니다. 제약 및 신약개발 사업과 관련된 국내 법률 중 존속회사의 사업과 밀접하게 연관된 법률로는 식품의약품안전처 및 보건복지부 소관의 '약사법'이 대표적이며, 그 외 보건복지부 소관의 '국민건강보험법', '생명윤리 및 안전에 관한 법률', '제약산업 육성 및 지원에 관한 특별법', '희귀질환관리법', '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률'과 식품의약품안전처 소관의 '실험동물에 관한 법률' 등이 있습니다.
특히, '약사법' 하위 시행령/시행규칙 중 의약품 등의 안전에 관한 규칙, 의약품 등의 제조업 및 수입자의 시설기준령 시행규칙, 생물학적 제제 등의 제조ㆍ판매관리 규칙, 동물용 의약품등 취급규칙 등과 이의 하위 규정을 준수해야 합니다. 이에 따라, 신약 후보물질의 발굴에서부터 동물을 대상으로 하는 비임상시험, 인체를 대상으로 하는 임상시험, 품목허가에 이르기 까지 임상 승인에 관한 규정, 의약품의 약리 및 독성, 안정성 시험 기준, 임상시험 실시기관 지정에 관한 규정, 품목허가ㆍ심사 등의 규정 등을 반드시 준수하여 진행해야 합니다. 또한 제조 및 판매 단계에서도 제조소 시설 기준, 제조 및 품질관리 규정, 포장 및 공급에 관한 규정, 표시 등에 관한 규정을 준수해야 하며, 사후에도 정기적으로 규제기관으로부터 제품 생산 공정 및 품질관리 전반에 대한 실사 및 관리, 감독을 받게 됩니다. 이러한 규제 및 검증을 통해 제약산업의 선진화 정책을 시현할 수 있지만, 각종 규제 및 절차, 검증 강화로 인한 부담이 높아지는 경우, 존속회사의 사업에 부정적인 영향을 미칠 수 있습니다.
| [의약품 등의 안전에 관한 규칙] |
|
제2조(의약품등의 제조업 허가ㆍ신고 등) 제9조(안전성ㆍ유효성에 관한 자료) 1. 기원 또는 발견 및 개발 경위에 관한 자료 2. 구조결정, 물리화학적 성질에 관한 자료 3. 안정성에 관한 자료 4. 독성에 관한 자료 5. 약리작용에 관한 자료 6. 임상시험성적에 관한 자료 7. 외국의 사용현황 등에 관한 자료 8. 국내 유사제품과의 비교검토 및 해당 의약품등의 특성에 관한 자료 제10조(기준 및 시험방법에 관한 자료) ② 제1항에 따라 기준 및 시험방법에 관한 자료를 제출하려는 자는 심사대상물품(식품의약품안전처장이 품질검사를 위하여 특별히 필요하다고 인정하는 경우에만 해당한다)을 식품의약품안전처장에게 제출하여야 한다. |
| 출처: 국가법령정보센터 |
한편, 국내를 비롯한 미국, 유럽 등 글로벌 선진국에서는 제약·바이오 산업을 국민의 건강을 증진하고 일자리와 고부가가치를 창출하는 핵심 기간산업이자 미래 신성장 동력 산업으로 인지하고, 제약ㆍ바이오 산업에 대한 우호적 정책을 펼치고 있는 상황입니다.
국내 정부의 경우, 한-미 FTA 발효, 약가제도 개편 등 제약산업의 환경 악화로 2012년 제약산업 육성대책 마련 필요성이 제기되었으며, 제약산업 발전기반 조성 및 국제 경쟁력 강화를 촉진하기 위하여, 2012년 '제약산업 육성 및 지원에 관한 특별법'을 시행하였습니다. 이에 따라 2013년부터 5년 단위의 제약산업육성ㆍ지원 종합계획과 1년 단위의 제약산업육성ㆍ지원 시행계획을 수립ㆍ시행하여 세부 과제를 추진하고 있습니다.
| [제3차 제약바이오산업 육성·지원 5개년 종합계획] |
|
| 출처: 보건복지부 |
미국정부의 경우 국가 생명공학 및 바이오제조 이니셔티브(NBBI), 미국의 국가안보각서 및 바이오방어 전략 등을 통해서 생명 공학 및 제조를 위한 연방 투자확대, 기술혁신을 위한 안정적인 데이터 환경 조성 및 미국 바이오 제조 역량 강화를 위한 규제 간소화와 인재 육성 투자 등을 과제로 삼고 제약·바이오 산업을 체계적인 국가 전략을 바탕으로 육성시키고 있습니다.
| [국가 바이오기술 및 바이오제조 행정명령 주요 내용] |
|
| 출처: 코트라, '미국의 바이오제약 산업 육성 정책과 시사점' |
이와 같이 세계적으로 자국의 바이오 산업을 국가 주요 산업으로 성장시키려고 하는 추세와 더불어, 경쟁관계에 있는 타 국가의 산업을 견제하는 상황 역시 발생하고 있습니다. '24년 1 월 25 일 미 하원에서는 중국 최대 유전체회사인 BGI(Beijing Genomics Insitute) 그룹과 그 관계회사의 미국내 사업 금지를 내용으로 하는 Biosecure Act(생물보안법)가 발의되었습니다. 동 법안이 제정될 경우, BGI 그룹과 그 자회사인 MGI Tech, MGI Tech 의 자회사인 Complete Genomics 를 비롯하여 Wuxi AppTec(우시앱텍) 및 관계사 Wuxi Biologics(우시바이오) 등 중국인민해방군(PLA, People's Liberation Army)과 연결된 기업을 적대적 해외 바이오 기업으로 정의되고, 이들이 제조한 제품 또는 서비스를 사용·이용하는 것이 금지됩니다. 3 월 6 일 미국 상원 국토안보위원회가 생물보안법을 11 대 1 로 통과시키며 법제화에 한발짝 더 다가섰으며, 하원 및 상원 전체회의 통과 후 대통령의 서명을 받으면 최종 법안으로 실효성을 갖게 되는 상황입니다.
| [생물보안법 관련 바이든 행정명령 세부계획 요약] |
| Initiative | 요약 |
|---|---|
| Grow Domestic Biomanufacturing Capacity | 미국내 바이오생산설비 확대로 자국내 공급망 강화 |
| Expand Market Opportunities for Bio-based Products | 바이오기반 물질·제품 확대로 화학제품의 대체재를 마련하고 신규 산업 육성으로 고용 확대 |
| Drive Research and Development (R&D) to Solve Our Greatest Challenges | 연방정부 차원에서 바이오기술의 R&D 우선순위를 확립하여 의약품, 기후변화, 식품·농업분야 혁신의 돌파구 마련 |
| Improve Access to Quality Federal Data | 바이오기술과 컴퓨터공학 및 AI 기술을 접목하여 당면한 과제·문제에 폭넓은 데이터를 활용하여 효율적으로 대응할 수 있도록 함 |
| Train a Diverse Skilled Workforce | 전문대~대학원까지 인력부족을 해소하기 위해 교육기회 확대 |
| Streamline Regulations for Products of Biotechnology | 효율적 규제절차 마련으로 우수 바이오제품의 빠른 상업화 지원 |
| Advance Biosafety and Biosecurity to Reduce Risk | 감염예방·검역분야 인센티브 부여, 생물안정성 연구투자로 리스크 축소 |
| Protect the U.S. Biotechnology Ecosystem | 바이오데이터 분야 보안 강화로 바이오생산 공급망내 외부 위험요소로부터 보호 |
| Build a Thriving, Secure Global Bioeconomy with Partners and Allies | 기후변화 및 보건위기등 긴급한 글로벌 이슈 타개에 있어 바이오기술 및 생산분야를 활용하기 위해 국제적 네트워크 공조체제 마련 |
| 출처: 백악관, 신영증권 |
상기 언급된바와 같이 제약 및 신약개발 산업에 대한 우호적인 정책 기조 및 지원 계획, 규제 완화 노력에도 불구하고, 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 또한 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않을 경우, 규제 완화의 범위가 축소될 수 있습니다. 또한 국제 정세에 따라 해외국가에서 비우호적인 정책이 진행되어 각 회사들의 신약 개발 로드맵이 변경될 가능성이 존재합니다. 이러한 우호/비우호적인 정책 및 규제 완화/강화등의 변동 가능성은 존속회사 사업에 부정적인 영향을 미칠 수 있으니 참고하시기 바랍니다.
| 가-8. 업무 위탁 기관(CMO,CDMO 등) 관련 위험 존속회사는 시판제품의 판매를 위한 생산 설비를 가지고 있지 않습니다. 다만 현재 단계의 연구개발에 필요한 일부 생산 능력을 200L 규모의 Pilot 시설을 포함하여 보유하고있으며, 임상시험 수행과 상용화 준비를 위한 생산 활동을 지속적으로 CDMO를 통하여 수행하고 있습니다. 존속회사는 신약개발 단계에서 초기연구 개발에 필수적인 인프라와 인력 및 기술은 내재화하고, 그 이외 인프라 및 기능을 아웃소싱 하는 전략을 취하고 있습니다. 따라서 존속회사 주요 파이프라인은 국제의약품규제조화위원회(ICH) 가이드라인에 준하여 GLP, cGMP, GCP에 의하여 위탁기관에 의해 생산 또는 임상 진행되고 있으며, 향후에도 같은 방식으로 진행할 예정입니다. 그러나 존속회사가 생산 및 임상시험 업무를 위탁한 CMO 및 CRO 자체의 사정으로 인한 의도하지 않은 결과를 통제하기 어려울 수 있습니다. CMO의 경우 생산 시료의 품질 저하나 생산 일정의 지연 등으로 신약 개발에 부정적인 영향을 줄 수 있으며, CRO의 경우 시험 일정 지연으로 인하여 신약 개발 일정을 지연시키거나 시험 결과 분석 상의 오류로 신약 개발과 관련된 의사 결정을 어렵게 할 수 있습니다. 이와 같이 업무위탁 기관을 활용할 경우 존속회사가 통제할 수 없는 위험요소로 인하여 존속회사의 신약 개발 일정 지연 또는 부정적 결과 도출 등이 발생할 수 있으며 이로 인하여 존속회사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다. |
존속회사는 시판제품의 판매를 위한 생산 설비를 가지고 있지 않습니다. 다만 현재 단계의 연구개발에 필요한 일부 생산 능력을 200L 규모의 Pilot 시설을 포함하여 보유하고있으며, 임상시험 수행과 상용화 준비를 위한 생산 활동을 지속적으로 CDMO를 통하여 수행하고 있습니다.
| [제품 별 생산능력] |
| 분류 | 제품 포트폴리오 | 생산 규모 | 생산 실적 |
| 유전자재조합 단백질 |
항체융합 단백질 바이오베터 |
200 리터 규모 파일럿 시설 |
- 초기 효능 및 독성 시험용: GCSF-hyFc, hGH-hyFc, EPO-hyFc 개발제품의 초기 효능, 독성시험용 등 - 연구용: GLP1-hyFc, PDL1-hyFc, 항체바이오베터 등 다수 |
| 유전자 치료제 |
DNA 백신, 아데노바이러스 기반 백신 |
5 g /월 (DNA 백신) 1 x 10^12 pfu/월 (아데노바이러스) |
- 효능 및 독성시험용: DNA 백신의 시험용 생산 |
존속회사는 신약개발 단계에서 초기연구 개발에 필수적인 인프라와 인력 및 기술은 내재화하고, 그 이외 인프라 및 기능을 아웃소싱 하는 전략을 취하고 있습니다. 따라서 존속회사 주요 파이프라인은 국제의약품규제조화위원회(ICH) 가이드라인에 준하여 GLP, cGMP, GCP에 의하여 위탁기관에 의해 생산 또는 임상 진행되고 있으며, 향후에도 같은 방식으로 진행할 예정입니다.
존속회사의 비임상/임상 관련 주요 업무위탁 기관 이용현황은 다음과 같습니다.
| [존속회사 업무위탁 기관 이용현황] |
| 플랫폼 | 품목 | 적응증 | 업무위탁 관련 | |||
|---|---|---|---|---|---|---|
| 업무위탁 여부 (CRO,CMO,CDMO 등) |
주요 업무 | 업무위탁 여부 (CRO,CMO,CDMO 등) |
주요 업무 | |||
| hyFc | GX-E4 | 투석환자 만성 신장 질환 관련 빈혈 | CMO | 임상 시료 생산 | CRO | 임상시험위탁 |
| 비투석환자 만성신장질환 빈혈증 | CRO | 임상시험위탁 | ||||
| 투석환자 만성 신장 질환 관련 빈혈 (건강성인) | CRO | 임상시험위탁 | ||||
| GX-I7 | 말기 고형암(대장암, 유방암, 난소암, 자궁경부암, 소장암, 항문암) | CMO | 임상 시료 생산 | CRO | 임상시험위탁 | |
| 말기 고형암(대장암, 유방암, 난소암, 자궁경부암, 소장암, 항문암) | CRO | 임상시험위탁 | ||||
| 교모세포종 | CRO | 임상시험위탁 | ||||
| 삼중음성유방암 | CRO | 임상시험위탁 | ||||
| 교모세포종(재발성) | CRO | 임상시험위탁 | ||||
| 교모세포종(신환) | - | - | ||||
| 삼중음성유방암, 췌장암, 비소세포폐암, 소세포암, 대장암 | - | - | ||||
| 비소세포폐암 1L | - | - | ||||
| 재발 교모세포종 | - | - | ||||
| 신규 교모세포종 | - | - | ||||
| 미만성거대B세포림프종 | - | - | ||||
| 두경부 편평세포선암 | - | - | ||||
| 특발성 CD4 T 림프구감소증 | - | - | ||||
| COVID-19 | CRO | 임상시험위탁 | ||||
| COVID-19 | CRO | 임상시험위탁 | ||||
| GX-H9 | 성인 성장호르몬 결핍증 | CMO | 임상 시료 생산 | CRO | 임상시험위탁 | |
| 소아 성장호르몬 결핍증 | - | - | ||||
| GX-G3 | 호중구감소증, 골수억제 항암제를 복용하는 비골수성 기형증 | CMO | 임상 시료 생산 | CRO | 임상시험위탁 | |
| GX-P1 | 자가면역질환 | CMO | 임상 시료 생산 | CRO | 임상시험위탁 | |
| 뇌염증질환 | - | - | ||||
| DNA백신 | GX-188E | 진행성/재발성 자궁경부암 | CMO | 임상 시료 생산 | CRO | 임상시험위탁 |
| 절제 가능한 국소 진행성 두경부암(IIT) | - | - | ||||
| 재발성 및/또는 전이성 두경부암(IIT) | - | - | ||||
| 출처: 존속회사 제공 |
그러나 존속회사가 생산 및 임상시험 업무를 위탁한 CMO 및 CRO 자체의 사정으로 인한 의도하지 않은 결과를 통제하기 어려울 수 있습니다. CMO의 경우 생산 시료의 품질 저하나 생산 일정의 지연 등으로 신약 개발에 부정적인 영향을 줄 수 있으며, CRO의 경우 시험 일정 지연으로 인하여 신약 개발 일정을 지연시키거나 시험 결과 분석 상의 오류로 신약 개발과 관련된 의사 결정을 어렵게 할 수 있습니다. 이와 같이 업무위탁 기관을 활용할 경우 존속회사가 통제할 수 없는 위험요소로 인하여 존속회사의 신약 개발 일정 지연 또는 부정적 결과 도출 등이 발생할 수 있으며 이로 인하여 존속회사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다.
■ 소멸회사 사업위험
| 가-9. 신약개발 관련 및 목표 시장 경쟁 심화 위험 소멸회사는 단백질 분해 기발 치료제 모델인 PROTAC(PROteolysis Targeting Chimera)의 한계 극복을 위해 차세대 기술인 bioPROTAC 기술을 개발하여 기존 치료제로 해결할 수 없는 의학적 미충족 수요를 충족 가능한 First in class 신약 개발을 목적으로 하고 있습니다. 소멸회사는 고유의 synthetic 라이브러리를 활용하여 신규 Nanobody(전통적 항체보다 작은 항체)를 자체적으로 발굴 가능하며, Yeast display 시스템과 High-throughput screening 시스템을 활용하여 TPD(표적단밸질 분해 기술)가 개선된 고유 engineered protein 확보가 가능합니다. 또한 First in calss 신약의 잠재력이 있는 10여개의 Novel target(기존에 연구되지 않은 새로운 표적)을 확보하고 있으며 bioPROTAC을 제작하기 위한 핵심기술을 내재화하고 있습니다. TPD를 기반으로 한 신약개발 시장은 빠른 속도로 성장할 것이 예상되며, 다양한 개발업체에서 조기에 기술이전을 실행하는 등 활발한 연구가 지속되고 있습니다. 존속회사의 경우 bioPROTAC 플랫폼을 통해 기존 제품들의 한계를 극복하고자 합니다. 또한 존속회사는 전임상단계부터 외부와의 협력을 통해 위험을 분산하고 성공 가능성을 높이려는 전략을 시행하고 있습니다. 그럼에도 불구하고 신약 개발업의 초기기술에 집중하고 있는 존속회사 사업의 특성 상 기술개발의 실패 또는 경쟁심화에 따른 개발 중단 등 위험이 발생할 수 있으니 주의하시기 바랍니다. |
소멸회사는 단백질 분해 기발 치료제 모델인 PROTAC(PROteolysis Targeting Chimera)의 한계 극복을 위해 차세대 기술인 bioPROTAC 기술을 개발하여 기존 치료제로 해결할 수 없는 의학적 미충족 수요를 충족 가능한 First in class 신약 개발을 목적으로 하고 있습니다.
소멸회사는 고유의 synthetic 라이브러리를 활용하여 신규 Nanobody(전통적 항체보다 작은 항체)를 자체적으로 발굴 가능하며, Yeast display 시스템과 High-throughput screening 시스템을 활용하여 TPD(표적단밸질 분해 기술)가 개선된 고유 engineered protein 확보가 가능합니다. 또한 First in calss 신약의 잠재력이 있는 10여개의 Novel target(기존에 연구되지 않은 새로운 표적)을 확보하고 있으며 bioPROTAC을 제작하기 위한 핵심기술을 내재화하고 있습니다.
해당 기술을 바탕으로 소멸회사는 암, 소뇌실조증, 아토피 피부염을 적응증으로 하는 파이프라인을 보유하고 있습니다. 소멸회사는 총 4개의 파이프라인을 보유하고 있으며 현재 발굴단계로 아직 전임상단계에 도달하지 못하였습니다. 소멸회사는 전임상단계 연구부터 기술이전 또는 공동연구로 개발을 진행 할 계획입니다.
EPD-301의 경우 Precision Nanosystems Inc과의 공동연구계약이 '23년 8월 체결되어 현재 전임상/임상개발을 위해 폐를 타겟으로 하는 LNP 선정이 완료되었으며향후 LNP 유효성 연구 확인 후 '24년 3Q내에 전임상 시료 생산 시작을 목표로 하고 있습니다. 아울러 '25년 말까지 IND 제출 완료를 목표로 하고 있으며 국내 임상 1상 자체 진행과 글로벌 기술이전을 병행할 계획이 있습니다.
EPD-401의 경우 최종 리드 후보 물질 선정을 위한 단백질체학 연구가 진행 중이며 선택성을 확인하여 최종 후보 물질 선정 계획에 있습니다. 선정된 물질로 '24년 4Q 생체 내 실험을 진행 후 '25년 내 전임상 단계 진입을 목표로 하고 있습니다.
EPD-201의 경우 진행이 보류된 상태로 향후 추가적인 연구 여부를 판단할 계획입니다.
EPD-501의 경우 일리미스테라퓨틱스와의 공동연구로 퇴행성 질환 치료제 개발 과제를 런칭하였습니다.
증권신고서 제출일 전일 기준 소멸회사의 파이프라인 현황 및 전임상단계 연구 계획은 다음과 같습니다.
| [소멸회사 파이프라인 현황] |
| 프로그램 | 타겟 | 적응증 | 발굴단계 | 전임상 | 임상 | 시판허가 | 비고 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구축물 합성 | 시험관 효능평가 | 작용 기전 연구 | 시험관 효능평가 | 1상 | 2상 | 3상 | ||||||
| EPD-301 | SOX2 | 암 | ||||||||||
| EPD-201 | ATXN1 | 1형 소뇌실조 | ||||||||||
| EPD-401 | STAT3 | 아토피 피부염 / 암 | ||||||||||
| EPD-501 | 미공개 | 퇴행성 뇌질환 | 공동개발(일리미스테라퓨틱스) | |||||||||
| 출처: 소멸회사 제공 |
SkyQuest Technology Report에 따르면 글로벌 TPD(표적단백질분해 기술) 시장은 '23~'30년까지 CAGR 26.4%로 성장할 것을 전망하고 있으며, '30년 33억달러 규모의 시장이 될 것으로 기대하고 있습니다.
| [글로벌 TPD 시장 전망 2023-2030] |
|
| 출처: SkyQuest Technology Report : Global Targeted Protein Degradation Market |
| [글로벌 TPD 시장 전망] |
|
| 출처: SkyQuest Technology Report : Global Targeted Protein Degradation Market |
우호적인 TPD관련 시장 전망에 따라 국내외 다수의 업체들이 R&D를 진행하고 있으며 TPD기술은 크게 MG와 PROTAC으로 구분됩니다.
MG와 PROTAC기술의 비교내용과 국내외 TPD 경쟁사 R&D현황은 다음과 같습니다.
| [MG/PROTAC 기술 비교표] |
| 구분 | MG | PROTAC |
| 정의 | 표적 단백질과 E3 ligase의 동시에 결합하는 물질이지만, PROTAC과 달리 단일 화학적 요소로 이루어진 경우가 대부분. E3 ligase에 결합한 분자 접착제가 표적 단백질에 결합하도록 유도 가능. | 표적단백질에 결합하는 리간드(Warhead)와 E3 ligase 리간드(Binder)를 인위적으로 링커(linker)로 결합시킨 ‘이종 이중기능 분자’ (Heterobifunctional molecule). 분자량이 커 기존 약물과 다른 특성 지님. |
| 장점 | - 단백질-단백질 상호작용을 조절할 수 있어서, 다양한 생리적 기능 조절에 활용 가능하다. - 약물 개발에서 다양한 타겟 단백질에 대한 효과적인 표적화 가능성이 있다. - FDA승인된 치료제 사례 존재(레날리도마이드 2007년 사용 허가 다발성골수종) |
- 고도의 선택성으로 원하는 단백질을 표적으로 지정할 수 있다. - 낮은 농도에서도 효과적으로 작용할 수 있어, 약물의 효과를 증대시킬 수 있다. |
| 단점 | - 특정 단백질에 대한 선택성이 필요하며, 부작용이나 비특이적 효과가 발생할 수 있다. - 상업적으로 활용 가능한 MG를 개발하는 것이 기술적으로 어려울 수 있다. |
- 디자인된 PROTAC의 합성 및 최적화가 기술적으로 복잡할 수 있다. - 특정 조건에서는 프로테아소말 분해 기능이 제한될 수 있다 - 아직 임상 시험단계에 있다. |
| 주요 회사 | 누릭스, C4테라퓨틱스, 핀테라퓨틱스 등 | 아비나스, 키메라, 유빅스테라퓨틱스 등 |
| 출처: 소멸회사 제공 |
| [TPD경쟁사 현황] |
| 구분 | 회사명 | 설립일 | MG/PROTAC 여부 | 물질/기술명/플랫폼 | 타겟 | 적응증 | 개발단계 | 주요투자자 |
| 국내 | 오름테라퓨틱스 | 2016년 | DAC | ORM-5029 | GSPT1 (+ HER2 Ab) | 유방암 | 임상 1상 | KG인베스트먼트, 인터베스트, 프리미어파트너스 등 |
| ORM-6151 | GSPT1 (+ CD33 Ab) | 급성 골수성 백혈병 | 임상 1상 | |||||
| 유빅스테라퓨틱스 | 2018년 | PROTAC | UBX-303-1 | BTK | 혈액암 | 임상 1상 | 미래에셋벤처투자, 에이티넘인베스트먼트 등 | |
| UBX-103 | AR | 전립선암 | 전임상 | |||||
| 업테라 | 2018년 | PROTAC | UP1002 | PLK1 | 암 | 전임상 | IMM인베스트먼트, 메리츠증권 등 | |
| 핀테라퓨틱스 | 2017년 | MG & PROTAC | MG | CK1alpha | 암 | 전임상 | KG인베스트먼트, DSC인베스트먼트 등 | |
| 해외 | 아비나스 | 2013년 | PROTAC | ARV-471 | ER | 유방암 | 임상 3상 | Public company |
| ARV-766 | AR | 전립선암 | 임상 2상 | |||||
| 키메라 | 2017년 | PROTAC | KT-474 | IRAK4 | 아토피피부염 | 임상 2상 | ||
| KT-333 | STAT3 | 혈액암 | 임상 1상 | |||||
| 누릭스 | 2009년 | MG & PROTAC | NX-2127 | BTK + IKZF | 혈액암 | 임상 1상 | ||
| NX-5948 | BTK | 혈액암 | 임상 1상 | |||||
| C4테라퓨틱스 | 2016년 | MG & PROTAC | Cemsidomide | IKZF1/3 | 혈액암 | 임상 1상 | ||
| CFT1946 | BRAF V600 | BRAF V600E cancers | 임상 1상 |
| 출처: 소멸회사 제공 |
TPD 의약품은 재발성·불응성 암 환자에 대한 강력한 대안이 될 것이라는 점에서 전통적인 저분자화합물 저해제 시장을 대체하며 ADC와 유사하게 성장할 것으로 전망되고 있으나, 아직 상용화된 신약이 없는 까닭에 TPD 의약품의 시장규모를 파악하기는 쉽지 않습니다.
한편, 최근 TPD 기술 관련한 국내 경쟁사의 연구개발, 상용화 움직임은 다음과 같습니다. 지난 7월 16일 오름테라퓨틱스는 미국 제약사인 버텍스 파마슈티컬과 TPD 기술인 이중 정밀 표적 단백질 분해 기술을 수출하는 계약을 체결하였다고 발표하였습니다. 계약은 선급금 1,500만 달러와 최대 3개 타겟에 대해 각각 최대 3억 1,000만 달러의 추가 옵션 및 마일스톤으로 이루어져 있습니다. 해당 계약을 통해 버텍스는 오름테라퓨틱스의 TPD 기술을 활용해, 유전자편집 치료제의 새로운 전처치제(본격적인 치료 전에 체내 환경을 최적화하고 치료 효과를 높이는 약제)를 발굴하기 위한 연구권한을 보유하게 되었습니다. 또한, 유빅스테라퓨틱스는 지난 7월 1일 TPD 전립선암 치료제 후보물질 UBX-103의 글로벌 개발 권리를 계약금 50억원 포함 총 1,500억원에 유한양행에 이전하는 기술이전 계약을 체결하였다고 발표하였습니다. UBX-103은 전임상 단계 진행 중으로, 2025년 상반기까지 임상 1상 임상시험계획(IND) 승인을 목표로 비임상 연구가 진행되고 있습니다.
이처럼, 상기와 같이 TPD 의약품 시장선점을 위한 글로벌 경쟁이 가속화 되고 있는 환경 속에서 TPD 경쟁사들 대비 설립시점이 늦은 후발주자인 소멸회사의 임상연구 계획이 예정대로 진행될지, 그 성과가 실질적인 상용화에 부합할지 여부에 대해서도 현재 시점에 확정되지 않았다는 점을 투자자께서는 유의하시기 바랍니다.
'22년부터 '24년까지 전세계적으로 TPD기술을 기반으로 한 기술이전 계약은 약 16건이 발생하였습니다. 대대수 암 또는 자가면역 질환을 적응증으로 하고 있으며, 다수의 건들이 개발 초기에 이전되었습니다.또한 소멸회사와 같이 항체나 Nanobody를 활용한 bioPROTAC 컨셉의 신약 개발업체는 증가하고 있으나 정확히 같은 기술을 기반으로 개발하는 업체들은 제한적이며, 소멸회사가 파악한 바로는 경쟁사가 국내 2곳, 해외 3곳이 존재합니다.
'22년 ~ '24년 TPD 기술이전 계약 현황과 bioPROTAC경쟁사 현황은 다음과 같습니다.
| ['22 ~ '24 TPD 기술이전 계약] |
| 일자 | 개발사 | 도입업체 | 물질 또는 기술명 | 타겟 | 적응증 | 개발단계 | 최대 계약 규모(USD, mil) |
|---|---|---|---|---|---|---|---|
| 2023.11 | 오름테라퓨틱스 | BMS | ORM-6151 | αCD33 aAb 기반 GSPT1 | 급성 골수성 백혈병, 공수이형성증후군 | 1상 | 180 |
| 2023.1 | Monte Rosa Tx | Roche | QuEEN Platform | TPD molecular glue | 암, 신경질환 | - | 2,050 |
| 2023.09 | Orionis Biosciences | Genetech | Allo-Glue | TPD molecular glue | 암, 신경질환 | - | 2,047 |
| 2023.07 | PeptiDream | Astellas | PDPS | TPD 펩타이드 물질 및 라이브러리 플랫폼 | 암, 신경질환 | - | 21 |
| 2023.06 | Cullgen | Astellas Pharma | uSMITE 플랫폼 | E3 ligand 표적 단백질 분해 | - | - | 2,020 |
| 2023.06 | Biotheryx | Incyte | PRODEGY 플랫폼 | TPD 플랫폼 | 암, 염증성 질환 | - | 360 |
| 2023.04 | Proxygen GmbH | MSD | - | TPD 플랫폼 | u/d | - | 2,550 |
| 2023.04 | Nurix Therapeutics | Gilead Sciences | GS-6791(NX-0479) | IRAK4 이중결합 | 류마티스 관절염 등 염증성 질환 | - | 455 |
| 2023.03 | SyntheX | BMS | ToRNeDo플랫폼 | TPD플랫폼 | n/d | n/d | 550 |
| 2022.1 | Jrmincare | Reche/Genentech | JMKX002992 | 안드로겐수용체 | 전립선암 | n/d | 650 |
| 2022.08 | Proxygen GmbH | Merck KGaA | 플랫폼 | TPD플랫폼 | n/d | n/d | 554 |
| 2022.06 | Evotec | BMS | EVOpanOmics, EVOpanHunter | TPD 약물개발 파트너십 | n/d | n/d | 5,000 |
| 2022.05 | Amphista | Merck KGaA | Eclipsys | TPD 약물개발 플랫폼 | 암, 면역질환 | n/d | 1,044 |
| 2022.05 | Amphista | BMS | Eclipsys | TPD 약물개발 플랫폼 | n/d | n/d | 1,280 |
| 2022.04 | Plexium | Abbvie | n/d | TPD플랫폼 | n/d | n/d | 565 |
| 2022.02 | Plexium | Amgen | 2개 후보물질 | RNA degrader형태의 TPD 플랫폼 물질 | 종양과 다른 심각한 질환 | n/d | 500 |
| 출처: KDDF website, 소멸회사 제공 |
| [bioPROTAC 경쟁사 현황] |
| 회사 | 플랫폼 | |
|---|---|---|
| 국내 | 뉴클릭스 바이오 | Circular mRNA 기반 bioPROTAC |
| 나이벡 | NIPEP-TPP 활용한 bioPROTAC | |
| 국외 | 76Bio | DELTX |
| UbiquiTx, Inc | Ubiquibody (추정) | |
| CureMed Biopharma Tech | Circular mRNA 기반 bioPROTAC | |
| 출처: 소멸회사 제공 |
TPD를 기반으로 한 신약개발 시장은 빠른 속도로 성장할 것이 예상되며, 다양한 개발업체에서 조기에 기술이전을 실행하는 등 활발한 연구가 지속되고 있습니다. 존속회사의 경우 bioPROTAC 플랫폼을 통해 기존 제품들의 한계를 극복하고자 합니다. 또한 존속회사는 전임상단계부터 외부와의 협력을 통해 위험을 분산하고 성공 가능성을 높이려는 전략을 시행하고 있습니다. 그럼에도 불구하고 신약 개발업의 초기기술에 집중하고 있는 존속회사 사업의 특성 상 기술개발의 실패 또는 경쟁심화에 따른 개발 중단 등 위험이 발생할 수 있으니 주의하시기 바랍니다.
| 가-10. 지적재산권 관리 위험 소멸회사와 같이 기술력과 그를 반영한 지적재산권이 회사의 사업을 영위하는데 있어 큰 비중을 차지하고 있는 신약개발 바이오벤처는 지적재산권 관리가 기업가치 제고의 핵심사안 중 하나입니다. 따라서 소멸회사는 이러한 점을 인지하고 연구개발과 더불어 이를 보호하기 위한 특허를 출원 및 등록하고 있습니다. 이 같은 노력에도 불구하고 향후 출원 예정인 특허가 최종적으로 등록이 되지 않을 수 있으며 심사 청구가 되지 않아 특허가 취하될 가능성도 존재합니다. 또한 등록된 특허가 제품 출시 전에 만료, 표기, 소멸될 수 있습니다. 국가별로 현행 특허관련 법률이 개정되어 특허 보호 범위나 기간이 축소될 수도 있습니다. 또한, 경쟁 업체가 보유 특허 기술과 유사한 기술을 발견하여 특허권을 침해하거나 존속회사가 보유하게 될 특허 기술과 유사한 기술을 이미 보유하여 이를 침해했다고 주장하는 경우, 소송 등의 분쟁이 발생할 수 있습니다. 특허 분쟁이 발생할 경우 영업 및 재무 상황에 부정적 영향을 끼칠 수 있기 때문에 투자자께서는 이점 유의하여 투자하시기 바랍니다. |
소멸회사와 같이 기술력과 그를 반영한 지적재산권이 회사의 사업을 영위하는데 있어 큰 비중을 차지하고 있는 신약개발 바이오벤처는 지적재산권 관리가 기업가치 제고의 핵심사안 중 하나입니다. 따라서 소멸회사는 이러한 점을 인지하고 연구개발과 더불어 이를 보호하기 위한 특허를 출원 및 등록하고 있습니다.
소멸회사는 유전자 조작 기술을 통해 E3플랫폼에 대해서 adpater단백질에 대한 결합력이 개선된 다수의 변이 E3를 확보하였고, βTrCP와 SKP2에 대하여 특허를 출원한 바 있습니다. 소멸회사의 항암제는 암유발 전사인자인 SOX2를 분해하는 약물을 개발하고 있는데, 해당 약물에 대한 특허 역시 출원한 바 있습니다. 또한 아토피피부염을 유발하는 전사인자인 STAT3를 분해하는 약물에 대한 특허를 출원하였습니다.
소멸회사가 출원한 특허 기술들은(bioPROTAC) 기존의 PROTAC 기술에서 필요한 노동집약적 링커 개발과정이 필요 없으며, 더 높은 분해능력과 다양한 타겟을 분해할 수 있습니다.
현재 소멸회사가 보유하고 있는 파이프라인과 관련한 특허의 출원 및 등록 현황은 다음과 같습니다.
| [지적재산권 현황] |
| 구분 | 상태 | 출원번호 | 발명의 명칭 | 출원일 |
|---|---|---|---|---|
| 특허 | 출원 | 2023-0097974 | βTrCP 단편 및 이의 변이체, 및 이의 용도 | 2023.07.27 |
| 특허 | 출원 | 2023-0097975 | STAT3 특이적으로 결합하는 단일 도메 인 항체, 이를포함하는 융합단백질 및 이의 용도 | 2023.07.27 |
| 특허 | 출원 | 2023-0097976 | SKP2 단편 및 이의 변이체, 및 이의 용도 | 2023.07.27 |
| 특허 | 출원 | 2023-0158319 | SOX2 특이적으로 결합하는 단일 도메 인 항체, 이를 포함하는 융합단백질 및 이의 용도 | 2023.11.15 |
| 출처: 소멸회사 제공 |
이 같은 노력에도 불구하고 향후 출원 예정인 특허가 최종적으로 등록이 되지 않을 수 있으며 심사 청구가 되지 않아 특허가 취하될 가능성도 존재합니다. 또한 등록된 특허가 제품 출시 전에 만료, 표기, 소멸될 수 있습니다. 국가별로 현행 특허관련 법률이 개정되어 특허 보호 범위나 기간이 축소될 수도 있습니다.
또한, 경쟁 업체가 보유 특허 기술과 유사한 기술을 발견하여 특허권을 침해하거나 존속회사가 보유하게 될 특허 기술과 유사한 기술을 이미 보유하여 이를 침해했다고 주장하는 경우, 소송 등의 분쟁이 발생할 수 있습니다. 특허 분쟁이 발생할 경우 영업 및 재무 상황에 부정적 영향을 끼칠 수 있기 때문에 투자자께서는 이점 유의하여 투자하시기 바랍니다.
3-2. 회사위험
| [투자자 주의사항] |
| ■ 본 증권신고서는 존속회사의 경우 영업활동 및 재무에 대해 보다 정확하고 실체적인 정보 전달을 위하여 연결재무제표를 기준으로 작성하였으나, 자세한 설명을 위하여 일부 별도 재무제표를 기준으로 작성한 부분은 본문에 별도 기준이라고 기재하였습니다. 소멸회사의 경우 종속기업이 존재하지 않아 별도(개별)재무제표로 작성하였으니 투자자분들께서는 이점 유의하시기 바랍니다. |
■ 공통(존속회사, 소멸회사) 회사위험
| 나-1. 성장성 및 수익성 감소에 따른 위험 존속회사는 독자적인 원천기술을 바탕으로 hyFc 플랫폼(항체융합 단백질 플랫폼) 및 고생산 세포주 제조, 공정개발 기술과 DNA 백신 치료제 기술을 보유한 R&D 중심 바이오텍으로서, 주요 파이프라인인 GX-I7, GX-188E, GX-H9, GX-E4 등에 대해서 오픈이노베이션 전략을 통해 국내외 다양한 파트너사와 임상시험을 진행함으로써 치료제 개발 및 제품의 상업화 달성에 주력하고 있습니다. 존속회사는 기술이전 및 연구용역/서비스 관련 매출이 주를 이루고 있는 매출구조상, 기술이전 계약 여부에 따라 매출액이 크게 변동하는 특성을 갖고 있으며, 관계기업 및 공동기업 투자에 따른 지분법손익 등 영업외손익에 따라 수익성이 결정됩니다. 이에 따라, 향후 파이프라인의 제품화 실패 혹은 라이선스 아웃 등이 어려움을 겪어, 영업손실이 지속되고, 지분법손실 및 파생상품평가 손실 등 영업외손실이 발생할 경우 수익성 악화로 재무구조는 악화될 가능성이 존재하니, 투자자께서는 투자판단시 이 점 유의하시기 바랍니다. |
존속회사는 독자적인 원천기술을 바탕으로 hyFc 플랫폼(항체융합 단백질 플랫폼) 및 고생산 세포주 제조, 공정개발 기술과 DNA 백신 치료제 기술을 보유한 R&D 중심 바이오텍으로서, 주요 파이프라인인 GX-I7, GX-188E, GX-H9, GX-E4 등에 대해서 오픈이노베이션 전략을 통해 국내외 다양한 파트너사와 임상시험을 진행함으로써 치료제 개발 및 제품의 상업화 달성에 주력하고 있습니다.
차세대 단백질 신약의 경우 존속회사의 고유 기반기술(hybrid Fc; hyFc)과 노하우 기술 (고생산 세포주 제조 및 공정개발 기술) 을 바탕으로 기존의 단백질 치료제에 비해 체내의 반감기 및 효능을 현저히 향상시킨 차세대 의약품 개발에 집중하고 있으며, 제품의 목표시장은 전 세계를 대상으로 하고 있습니다.
존속회사가 개발하고 있는 단백질 치료제는 주로 암, 내분기계 질환, 면역계통 질환 등의만성질환을 대상으로 한 치료제입니다. 대표적 파이프라인으로 항암 면역치료제 (GX-I7)를 보유하고 있으며, 차세대 단백질 신약으로 지속형 인간성장호르몬 (GX-H9), 빈혈 치료제 (GX-E4) 등을 개발하고 있습니다.
사업화의 핵심은 파이프라인별 파트너쉽과 기술이전에 있습니다. 항체융합단백질 치료제 파이프라인은 대부분 국내 및 해외 제약사와 공동개발 및 임상시험으로 진행되며 해당 제품의 상용화 또는 임상단계에서 글로벌 대형 기업으로의 기술이전을 목표하고 있습니다. 실제로 존속회사는 미국, 유럽, 중국, 아세안 지역을 대상으로 기술수출계약을 체결함에 따라 2021년 305억원, 2022년 101억원의 차세대 단백질 신약 기술이전 관련 매출을 기록하였습니다.다음은 존속회사의 주요 기술이전 계약 관련 세부 내용입니다.
| [투자판단 관련 주요경영사항(2021.02.18] |
| 1. 제목 | GX-I7 (면역항암제) 기술이전 계약체결 | |
| 2. 주요내용 | *투자유의사항 본 계약을 통한 수익 인식은 개발 및 임상시험과 품목허가 등의 성공 여부에 따라 달라질 수 있습니다. 계약 조건에 따라, 규제기관에 의한 연구-개발의 중단, 품목허가 실패 등 발생시 계약이 해지될 수 있습니다. 1.계약상대방 : KGbio (인도네시아) 2.계약의 주요내용 (단위 : US Dollar) 1) 계약기술 및 적응증 : 면역항암제 GX-I7 적용 모든 적응증(종양 및 감염증) 2) 계약금액 - 계약금 (Upfront) : $ 27,000,000 (원화 29,907,900,000원,19년도말 자기자본 대비 10.07%) - 마일스톤 (Milestone) : $ 1,073,000,000 (원화 1,188,562,100,000원) 임상단계, 허가, 상업화 등 단계별 일정 계획에 따라 수령 예정 => 총 계약금액 : $ 1,100,000,000 (원화 1,218,470,000,000원) - 경상기술료 (Royalty) : 별도수령 (해당 지역 상업화 제품 연간 순매출액의 10%) 3) 계약지역 : ASEAN 국가, MENA 국가, 호주, 뉴질랜드, 남아시아 (인도 포함) 및 기타 아프리카 4) 계약체결일 : 2021년 02월 18일 5) 계약기간 : 계약일로부터 양방 당사자 서면 종료 합의시까지 |
|
| 3. 사실발생(확인)일 | 2021-02-18 | |
| 4. 결정일 | 2021-02-18 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| (1) 상기 사실발생(확인)일은 계약 체결일입니다. (2) 총 계약금액은 사실발생일의 매매기준율 1,107.07/USD를 적용한 금액입니다. (3) 향후 계약내용 변경 및 공시의무 발생시 즉시 공시 할 예정입니다. |
||
| ※ 관련공시 | - | |
| 출처: 존속회사 투자판단 관련 주요경영사항 공시 |
| [투자판단 관련 주요경영사항(2022.05.23] |
| 1. 제목 | GX-E4(지속형 빈혈 치료제)기술이전 계약체결 | |
| 2. 주요내용 | * 투자유의사항 본 계약은 조건부 계약으로, 본 계약을 통한 수익 인식은 임상시험과 품목허가 등의 성공여부에 따라 달라질 수 있습니다. 계약 조건에 따라, 규제기관에 의한 연구ㆍ개발의 중단, 품목허가 실패 등 발생시 계약이 해지될 수 있습니다. 1. 계약상대방 : KGbio - 국적 : 인도네시아 - 설립일자 : 2015년 12월 28일 - 최근 매출액 : 0원 2.계약의 주요내용 (단위 : US Dollar) - 계약기술 및 적응증 : 투석 및 비투석에 대한 만성신장질환으로 인한 빈혈증 3. 계약금액 - 계약금 (Upfront) : $ 8,000,000 (원화 9,771,200,000원) → 2022년 12월 이내 수령 - 마일스톤 (Milestone) : $ 5,000,000 (원화 6,107,000,000원) → 유럽국가의 투석을 위한 BLA 제출시 수령예정 => 총 계약금액 : $13,000,000 (원화 15,878,200,000원) - 경상기술료 (Royalty) : 순매출액에 따라 합의된 비율로 수령 4. 최근 사업연도 매출액 또는 자기자본 대비 총 계약금액 비율 - 최근 사업연도 매출액(18,543,494,616원)대비85.63% - 최근 사업연도 자기자본(536,533,108,490원)대비 2.96% 5. 계약지역 : ASEAN 국가(인도네시아, 말레이시아, 싱가포르, 필리핀, 태국, 브루나이, 베트남, 미얀마, 캄보디아, 라오스), 나이지리아, 대만, 호주, 뉴질랜드, MENA 국가(알제리, 바레인, 이집트, 이라크, 이스라엘), 요르단, 쿠웨이트, 레바논, 예멘, 아랍에미리트, 리비아, 모로코, 오만, 팔레스타인, 카타르, 사우디아라비아, 튀니지), 남아시아(인도, 파키스탄, 방글라데시 및 스리랑카), 유럽(서부 및 동부유럽, CIS국가 포함)및 기타 아프리카 국가 6. 계약기간 : 계약 체결일로부터 합작법인 계약이 종료될 때까지 7. 계약체결일 : 2022년 03월 24일 |
|
| 3. 사실발생(확인)일 | 2022-03-23 | |
| 4. 결정일 | 2022-03-23 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 1) 상기 사실발생(확인)일은 계약서 수령일 입니다. 2) 당사는 PT Kalbe Farma Tbk와 2015.12.29. 합작법인을 설립하였으며 상기계약의 계약상대방인 KGbio는 당사와 PT Kalbe Farma Tbk의 합작법인입니다. 3) 상기 계약은 2015년12월 29일 KGbio와 체결한 기술이전계약의 변경계약서 입니다. 4) 상기 계약의 계약금은 2022년 12월 이내 지급받기로 별도 합의하였습니다. 5) 상기 계약의 마일스톤은 유럽국가의 투석을 위한 BLA(생물의약품허가신청) 제출시 수령하는 금액입니다. 6) 상기 2.주요내용의 4. 최근 사업연도 매출액 및 자기자본은 2020년 말 연결재무제표 기준입니다. 7) 총 계약금액은 사실발생일의 매매기준율 1,221.40/USD를 적용한 금액입니다. 8) 향후 계약내용 변경 및 공시의무 발생시 즉시 공시 할 예정입니다. |
||
| ※ 관련공시 | - | |
| 【계약상 특이사항 등 투자위험요소】 |
| 1) 본 계약은 다음 중 하나에 해당하는 경우 종료될 수 있습니다. - 해지하는 당사자의 서면합의 - 상대방이 본 계약의 중요한 조항을 위반하여 상대방이 해당 위반을 시정하기 위한 통지를 받은 날로부터 30일 이내에 시정되지 않은 경우, 위반하지 않는 당사자가 상대방에게 서면으로 통지한 경우 - 불가항력 사건이 발생하여 30일 이상 중단되지 않고 계속되었을 경우 - 상대방이 파산, 파산, 파산, 청산, 사법관리 또는 기타 유사한 절차에 부쳐지거나 업무를 정지하거나 지불을 할 수 없게 된 경우 2) 본 기술이전 계약의 수익인식은 임상시험, 허가, 상업화 이후 누적 매출액 등의 조건 달성 여부에 따르며, 미실현가능성도 있습니다 |
| 출처: 존속회사 투자판단 관련 주요경영사항 공시 |
존속회사는 기술이전 및 연구용역/서비스 관련 매출이 주를 이루고 있는 매출구조상, 기술이전 계약 여부에 따라 매출액이 크게 변동하는 특성을 갖고 있습니다. 존속회사의 매출액은 2021년과 2022년 GX-I7 GX-E4의 기술이전계약 체결로 각각 368억원, 161억원의 매출을 기록하였으나, 2023년 및 2024년 1분기에는 기술이전 매출이 발생하지 않아 2023년 44억원, 2024년 1분기 21억원이 매출을 기록하였습니다. 존속회사의 최근 3년 및 2024년 1분기 매출 추이는 다음과 같습니다.
| [존속회사의 최근 매출 실적 추이] |
| (단위: 백만원) |
| 사업부문 | 매출유형 | 품 목 | 파트너 | 2024년 1분기 | 2023년 | 2022년 | 2021년 |
| 신약개발 | 기술이전 | GX-H9(지속형 성장호르몬) | I-Mab | - | 274 | - | - |
| GX-E4(빈혈치료제) | KGbio | - | - | 10,060 | - | ||
| GX-I7 | KGbio | - | - | - | 29,908 | ||
| hyFc 플랫폼 | 유한양행 | - | - | - | 528 | ||
| 기타기술이전 | 기타 | - | - | - | 47 | ||
| 소계 | 0 | 274 | 10,060 | 30,483 | |||
| 기술재산권 (로열티) | FSH(난포자극호르몬) | 동아ST | 12 | 70 | 67 | 180 | |
| 소계 | 12 | 70 | 67 | 180 | |||
| 연구용역/서비스 | 세포주구축외 | 프로젠 | 165 | 3,825 | 5,461 | - | |
| 프로젝트개발용역 | NeoImmuneTech, KGbio 외 | 1,896 | - | 11 | 5,939 | ||
| 비임상분석/동물실험 | 프로젠 외 | - | - | - | 37 | ||
| 정부기관 연구용역 | 정부기관 | - | - | - | 109 | ||
| 기타용역 | 기타 | - | 7 | 540 | 80 | ||
| 소계 | 2,061 | 3,832 | 6,012 | 6,165 | |||
| 합계 | 2,073 | 4,427 | 16,139 | 36,828 | |||
| 출처: 존속회사 정기보고서 |
존속회사는 상기 기술한 바와 같이 기술이전, 기술재산권(로열티), 연구용역/서비스 관련 매출이 지속적으로 발생하고 있으나, 신약 개발을 위한 연구개발비 지출로 최근 직전 3개년간 지속적인 영업손실을 기록하는 모습을 보이고 있습니다.
한편, 존속회사는 2009년 상장 이후 최근 사업연도까지 기술이전매출 실적이 부족하여 영업손실이 지속되고 있으며, 관계사 아이맵으로 지속형 성장호르몬 기술이전에 성공했던 2015년을 제외하면 전 사업연도 영업손실이 발생하였습니다. 적자 지속으로 2008년부터 이월결손금이 누적되어 2023년 별도기준 결손금은 2,918억원(연결 기준 3,366억원) 수준입니다. 존속회사는 기술이전매출 이외에 매년 용역매출 및 기타매출 발생을 통해 영업적자를 회복하려 노력하였으나, 매년 발생되는 R&D 비용을 충당하기에는 부족한 상황입니다. 존속회사는 보유한 파이프라인의 상용화를 통해 수익성을 개선하기 위해 노력중이며, 2025년부터는 GX-E4의 상용화를 통한 매출 발생을 기대하고 있습니다. 2007년부터 최근 사업년도인 2023년까지 존속회사의 수익성 현황은 다음과 같습니다.
| [2007년 이후 존속회사의 수익성 현황] |
| (단위: 백만원) |
| 구분 | 2007년 | 2008년 | 2009년 | 2010년 | 2011년 | 2012년 | 2013년 | 2014년 | 2015년 | 2016년 | 2017년 | 2018년 | 2019년 | 2020년 | 2021년 | 2022년 | 2023년 |
| 매출액(수익) | 1,209 | 1,337 | 1,069 | 1,079 | 2,661 | 6,252 | 5,755 | 16,656 | 32,520 | 11,352 | 28,455 | 12,882 | 11,303 | 18,543 | 38,320 | 15,887 | 3,871 |
| 매출원가 | 0 | 113 | 131 | 200 | 291 | 651 | 1,996 | 3,389 | 4,896 | 4,779 | 10,692 | 6,327 | 3,850 | 6,867 | 5,022 | 4,567 | 2,537 |
| 매출총이익 | 1,209 | 1,224 | 938 | 879 | 2,370 | 5,600 | 3,758 | 13,266 | 27,624 | 6,573 | 17,762 | 6,555 | 7,453 | 11,677 | 33,298 | 11,320 | 1,334 |
| 판매비와관리비 | 1,318 | 1,532 | 1,430 | 2,631 | 8,662 | 8,293 | 10,809 | 18,474 | 26,537 | 37,459 | 44,621 | 44,638 | 51,989 | 50,406 | 49,657 | 44,844 | 41,828 |
| 영업이익 | -110 | -307 | -492 | -1,752 | -6,291 | -2,693 | -7,051 | -5,208 | 1,087 | -30,885 | -26,859 | -38,083 | -44,536 | -38,729 | -16,359 | -33,524 | -40,494 |
| 당기순이익 | -187 | -528 | -494 | -2,146 | -6,889 | -2,096 | -8,999 | -7,413 | -1,427 | -30,933 | -19,330 | -34,067 | 979 | 18,242 | -51,142 | -45,059 | -39,142 |
| 자본총계 | 5,715 | 7,104 | 38,500 | 36,886 | 24,361 | 45,825 | 38,303 | 100,932 | 125,766 | 130,125 | 113,909 | 320,507 | 319,345 | 554,289 | 522,751 | 286,427 | 332,399 |
| 이익잉여금(결손금) | 476 | -52 | -890 | -3,036 | -20,685 | -23,363 | -32,483 | -40,004 | -41,702 | -106,528 | -125,724 | -160,141 | -158,362 | -144,796 | -158,446 | -214,623 | -291,848 |
| 주: 존속회사는 상장 이후 연결재무제표 작성 사업연도가 6개 사업연도에 불과하여(2011년, 2012년, 2020년, 2021년, 2022년, 2023년) 적자 추이를 용이하게 파악할 수 있도록 별도재무재표 기준으로 작성하였습니다. 출처: 존속회사 제공 |
존속회사의 최근 3개년 영업손실은 2021년 194억원, 2022년 337억원, 2023년 412억원, 2024년 1분기 126억원을 기록하였으며, 이는 매년 400억원 이상 소요되는 판매비와관리비 때문입니다. 존속회사의 판매비와관리비 중 무형자산 인식요건을 충족하지 못한 경상연구개발비 규모가 가장 큰 비중을 차지하고 있으며, 전체 판매비와관리비에서 경상연구개발비가 차지하는 비중은 2024년 1분기 63.54%, 2023년 63.25%, 2022년 58.71%, 2021년 64.71%입니다. 존속회사의 연구개발비는 원재료비, 연구인건비, 감가상각비, 위탁용역비 등으로 구성되어 있으며, 특히 CRO 업체에 대한 임상 위탁 시 발생하는 비용인 위탁용역비가 경상연구개발비에서 큰 비중을 차지하고 있습니다. 특히 2024년 1분기의 경우 전년 동기 대비 높은 매출을 기록하였음에도 영업손실은 악화되었는데, 이는 2024년 1분기 KB Bio GX-E4 라이선스아웃 매출에 따른 해외원천세가 발생하였기 때문입니다. 이로 인해 2024년 1분기 세금과공과는 1,586백만원으로 전년 44백만원 대비 1,542백만원 높게 발생하였습니다.
이와 같이, 지속적인 신약개발에 따라 판매비와관리비 규모가 유지되는 가운데 향후 기술이전 및 연구용역/서비스 관련 매출 부재로 매출액이 감소할 경우 존속회사 수익성에 부정적으로 작용할 수 있으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다. 존속회사의 최근 3년 및 2024년 1분기의 요약 손익계산서 및 판매비와관리비는 다음과 같습니다.
| [존속회사의 요약 손익계산서 추이] |
| (단위: 백만원) |
| 구분 | 2024년 1분기 | 2023년 1분기 | 2023년 | 2022년 | 2021년 |
| 매출 | 2,073 | 692 | 4,427 | 16,139 | 36,828 |
| 매출원가 | 2,346 | 457 | 4,039 | 4,776 | 5,022 |
| 매출총이익 | (273) | 235 | 387 | 11,363 | 31,806 |
| 판매비와관리비 | 12,371 | 11,623 | 41,628 | 45,042 | 51,180 |
| 영업이익(손실) | (12,644) | (11,389) | (41,241) | (33,679) | (19,373) |
| 기타수익 | 1,442 | 1,314 | 5,998 | 37,178 | 3,635 |
| 기타비용 | 338 | 142 | 12,867 | 5,065 | 7,199 |
| 금융수익 | 328 | 3,350 | 5,000 | 354 | 321 |
| 금융비용 | 661 | 998 | 6,910 | 5,488 | 4,787 |
| 지분법이익 | 11,181 | - | 19,736 | 897 | 28,634 |
| 지분법손실 | 10,873 | 16,053 | 36,576 | 51,028 | 50,107 |
| 법인세비용차감전순이익 (손실) |
(11,566) | (23,918) | (66,860) | (56,831) | (48,876) |
| 법인세비용 | - | - | - | - | - |
| 당기순이익(손실) | (11,566) | (23,918) | (66,860) | (56,831) | (48,876) |
| 출처: 존속회사 정기보고서 |
| [존속회사의 판매비와관리비 추이] |
| (단위: 백만원) |
| 구분 | 2024년 1분기 | 2023년 1분기 | 2023년 | 2022년 | 2021년 |
| 급여 | 827 | 1,271 | 4,882 | 5,065 | 4,396 |
| 퇴직급여 | 58 | 128 | 1,112 | 556 | 473 |
| 복리후생비 | 164 | 241 | 937 | 1,105 | 986 |
| 여비교통비 | 24 | 56 | 181 | 193 | 22 |
| 접대비 | 10 | 21 | 44 | 125 | 192 |
| 세금과공과 | 1,586 | 44 | 317 | 975 | 5,031 |
| 임차료 | 5 | - | - | 2 | 34 |
| 대손상각비(환입) | 14 | 68 | (2,559) | 2,559 | 285 |
| 감가상각비 | 375 | 380 | 1,418 | 1,386 | 1,301 |
| 경상연구개발비 | 7,861 | 7,643 | 26,330 | 26,445 | 33,118 |
| 차량유지비 | 2 | 11 | 47 | 77 | 76 |
| 지급수수료 | 595 | 783 | 5,346 | 2,181 | 1,724 |
| 자문료 | - | - | - | - | 3 |
| 기술료 | - | - | 39 | 38 | 987 |
| 보험료 | 18 | 25 | 87 | 100 | 66 |
| 주식보상비용 | 409 | 507 | 1,739 | 1,988 | 1,267 |
| 무형자산상각비 | 32 | 51 | 158 | 212 | 250 |
| 기타판매비와관리비 | 392 | 394 | 1,550 | 2,036 | 967 |
| 합계 | 12,371 | 11,623 | 41,628 | 45,042 | 51,180 |
| 출처: 존속회사 정기보고서 |
한편, 존속회사는 증권신고서 제출 전일 기준 지분법을 적용하고 있는 관계회사 및 공동회사가 8개사가 있으며, 지분법손익에 따라 존속회사의 당기손이익에 유의미한 영항을 끼치고 있습니다. 존속회사의 관계회사 및 공동회사가 존속회사 수익성에 미치는 영향은 동 보고서 <VI. 투자위험요소 - 나-8. 종속회사 및 계열회사 관련 위험>을 참고하시기 바랍니다.
이밖에, 존속회사의 글로벌 경쟁사 4사(Pfizer, Novo Nordisk, Amegen, Roche)는 존속회사의 파이프라인 GX-H9 및 지속형에리트로포이에틴 제품화에 성공해 시장을 선점하고 있어, 존속회사가 임상 성공 및 제품화에 성공하더라도 시장 침투가 어려울 수 있으며, 시장 내 성공한 기존 제품이 존재함에 따라 라이선스아웃이 어려울 수 있어 수익성 확보가 어려울 수 있습니다. 투자자께서는 이 점 주의하시기 바랍니다.
| [존속회사의 글로벌 경쟁사 현황] |
| 구분 | 지속형 성장호르몬_GX-H9 | 지속형 성장호르몬_GX-H9 | 지속형에리트로포이에틴 | 지속형에리트로포이에틴 |
| 회사명 | Pfizer | Novo Nordisk | Amgen | Roche |
| 제품명 | Ngenla | Sogroya | Aranesp | Mircera |
| 출시일자 | 2023년 | 2024년 | 2009년 | 2008년 |
| 2024년 예상 글로벌 연매출 | 미화 276 백만달러 | 미화 115 백만달러 | 미화 1,435 백만달러 | 미화 1,076 백만달러 |
| 출처: Global data(2024), 존속회사 제공 |
존속회사는 혁신 바이오 신약개발을 목표로 지속적인 R&D 투자와 다양한 항암제개발을 위한 임상시험을 추진해 왔으며 코로나19 백신개발을 위한 투자 등 대규모 프로젝트들의 가동으로 인한 시설 및 연구비 투자와 원부자재 확보를 위한 지출 등으로 인해 장기간의 지속적인 적자가 발생하게 되었습니다. 그럼에도 불구하고 2023년 이전에는 기술이전계약을 체결하여, 2021년 305억, 2022년 100억의 매출성과를 이루었으며 존속회사가 개발한 신약 파이프라인의 기술수출을 통한 매출 확보에 대한 노력은 지속적으로 진행중입니다. 현재도 주요 신약파이프라인인 항암백신, 지속형 성장호르몬제, 지속형 신성빈혈치료제의 글로벌 제약사를 상대로 한 기술수출을 위한 노력은 계속 되고 있습니다.
존속회사는 후보물질발굴부터 시작해 해외에서 임상3상까지 마친 지속형 신성빈혈치료제 '에페사®(EFESA)'는 지난해 인도네시아에서 허가를 받고 올해 4월부터 판매를 시작하였습니다. 국내 식약처에는 지난 1월 품목허가 신청을 완료하였으며 이르면 2025년 1분기 중 품목허가를 받을 것으로 기대하고 있습니다. 국내 신성빈혈 시장은 약 1천억원을 형성하고 있으며, 존속회사는 현재 국내판매와 마케팅을 담당할 파트너사 물색 중에 있습니다. 2025년 1분기 중 품목허가를 받게되면 존속회사에서는 2025년부터 정기적인 판매 매출이 발생할 것으로 예상되며, 2029년부터는 정기적인 로열티 매출 또한 발생할 것으로 기대하고 있습니다.
또한 존속회사는 비용절감, 효율성 및 결과 향상을 목표로 하여 수익성 개선을 위해 노력하고 있습니다. 2023년에는 조직 통폐합, 팀장 감축 및 고연봉임원 퇴사 등이 감행되었으며, R&D비용과 관련해서는 효율성을 극대화 하기 위해 가치를 창출하지 못하는 파이프라인의 개발비용 투자를 과감히 중단하는 등 개발비용에 대한 예산 수정을 감행하여 선택과 집중 전략을 추진하였습니다. 향후에도 동일한 목표로 비용절감을 위해 노력할 예정입니다. 또한 현재 보유중인 부동산 자산을 활용해 수년 후 임대를 통한 수익발생도 가능할 것으로 기대하고 있습니다.
한편, 소멸회사의 설립 이후 요약 손익계산서 추이는 다음과 같습니다.
| [소멸회사의 설립 이후 손익계산서 추이] |
| (단위: 백만원) |
|
구분 |
2021년 | 2022년 | 2023년 | 2024년 3월말 |
|---|---|---|---|---|
| Ⅰ. 매출액 | - | - | - | - |
| Ⅱ. 매출원가 | - | - | - | - |
| III. 매출총이익 | - | - | - | - |
| IV. 판매비와관리비 | 270 | 1,641 | 2,388 | 548 |
| - 인건비 | 148 | 419 | 551 | 140 |
| - 유무형자산상각비 | 0 | 133 | 202 | 51 |
| - 임차료 | 16 | 65 | 72 | 18 |
| - 경상연구개발비 | 82 | 879 | 1,374 | 284 |
| - 기타판매관리비 | 23 | 146 | 189 | 55 |
| V. 영업이익(손실) | (270) | (1,641) | (2,388) | (548) |
| VI. 영업외수익 | 0 | 396 | 361 | 198 |
| - 국고보조금 | - | 361 | 319 | 61 |
| VII. 영업외비용 | 0 | 1 | - | - |
| VIII. 법인세차감전순이익(손실) | (270) | (1,247) | (2,027) | (350) |
| Ⅸ. 법인세비용 | - | - | - | - |
| X. 당기순이익(손실) | (270) | (1,247) | (2,027) | (350) |
| 출처: 소멸회사 제공 |
소멸회사는 전임상 단계 신약개발 사업을 영위하고 있어 설립이후 매출이 발생하지 않고 있으며, 판매비와관리비는 2021년 270백만원, 2022년 1,641백만원, 2023년 2,388백만원 2024년 3월말 548백만원이 발생해 존속회사 손익에 직접적으로 영향을 미치고 있습니다. 소멸회사의 판매비와관리비는 경상연구개발비가 큰 비중을 차지하고 있으며 경상연구개발비 세부 내역은 다음과 같습니다.
| [소멸회사의 설립 이후 경상연구개발비 추이] |
| (단위: 백만원) |
|
구분 |
2021년 | 2022년 | 2023년 | 2024년 3월말 |
|---|---|---|---|---|
| 재료비 | 29 | 432 | 569 | 93 |
| 인건비 | - | 261 | 488 | 163 |
| 외주용역비 | 25 | 158 | 310 | 25 |
| 기타경비 | 28 | 28 | 8 | 3 |
| 경상연구개발비 합계 | 82 | 879 | 1,374 | 284 |
| 출처: 소멸회사 제공 |
소멸회사의 경상연구개발비는 2021년 82백만원, 2022년 879백만원, 2023년 1,374백만원, 2024년 3월말 284백만원이 발생하는 등 매년 증가하는 추세를 보입니다. 소멸회사는 정부과제 참여를 통해 2022년 361백만원, 2023년 319백만원의 국고보조금을 지원받으며 영업손실을 일부 보전하고 있으나, 높은 판매비와관리비로 인해 매년 당기순손실을 기록하고 있습니다.
존속회사는 및 소멸회사는 기술이전 및 연구용역/서비스 관련 매출이 주를 이루고 있는 매출구조상, 기술이전 계약 여부에 따라 매출액이 크게 변동하는 특성을 갖고 있으며, 관계기업 및 공동기업 투자에 따른 지분법손익 등 영업외손익에 따라 수익성이 결정됩니다. 이에 따라, 향후 파이프라인의 제품화 실패 혹은 라이선스 아웃 등이 어려움을 겪어, 영업손실이 지속되고, 지분법손실 및 파생상품평가 손실 등 영업외손실이 발생할 경우 수익성 악화로 재무구조는 악화될 가능성이 존재하니, 투자자께서는 투자판단시 이 점 유의하시기 바랍니다.
| 나-2. 차입금/재무안정성 및 현금흐름 관련 위험 존속회사와 소멸회사는 신약을 연구개발하는 바이오의약품 기업으로서 초기 투자비용부터 전임상 연구, 임상 시험 및 품목 승인 과정까지 모든 단계에서 막대한 연구개발비용이 발생합니다. 존속회사와 소멸회사는 여러 파이프라인의 높은 성장성과 기술력을 인정받아 설립 초기부터 여러 차례 증자나 주식연계채권 발행을 통해 자금을 조달하였으며, 이를 통해 업종 평균 대비 양호한 부채비율을 기록하고, 재무안정성을 확보하고자 노력하였습니다. 단, 향후에 존속회사 사업부문 영업 환경이 지속적으로 악화되거나, 연구개발의 지속적인 투자로 인한 자금 소요 등의 예상치 못한 환경의 변화에 따라 외부자금 조달 수요가 발생할 경우 존속회사의 재무안정성 약화로 이어질 위험이 존재합니다. 소멸회사의 부채비율은 2024년 1분기 23.68%, 2023년 18.11%, 2022년 1.75%, 2021년 3.45%로 낮은 수준이며, 유동비율 또한 해당 기간 전부 1000%를 상회하며 우수한 재무안정성을 보이고 있습니다. 단, 앞서 기술한 바와 같이 존속회사와 소멸회사의 사업이 본 궤도에 진입하기 전까지 영업활동으로 인한 현금흐름이 지속적으로 적자를 기록할 것으로 예상되며, 파트너쉽과 기술이전이 예상보다 지연되거나 연구개발비가 증가하게 될 경우 재무안정성 및 유동성이 악화될 수 있음을 투자자께서는 유의하여 주시기 바랍니다. |
[차입금 및 재무안정성 위험]
존속회사와 소멸회사는 신약을 연구개발하는 바이오의약품 기업으로서 초기 투자비용부터 전임상 연구, 임상 시험 및 품목 승인 과정까지 모든 단계에서 막대한 연구개발비용이 발생합니다. 존속회사와 소멸회사는 여러 파이프라인의 높은 성장성과 기술력을 인정받아 설립 초기부터 여러 차례 증자나 주식연계채권 발행을 통해 자금을 조달하였으며, 이를 통해 업종 평균 대비 양호한 부채비율을 기록하고, 재무안정성을 확보하고자 노력하였습니다. 먼저 존속회사의 재무안정성 지표는 다음과 같습니다.
| [존속회사의 재무안정성 지표] |
| (단위: 백만원, %) |
| 구 분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 |
| 자산총계 | 365,387 | 376,587 | 388,781 | 636,865 |
| 유동자산 | 66,655 | 92,160 | 52,384 | 57,274 |
| 비유동자산 | 298,732 | 284,427 | 336,397 | 579,591 |
| 부채총계 | 77,321 | 79,683 | 111,387 | 117,406 |
| 유동부채 | 51,787 | 54,526 | 78,933 | 59,154 |
| 비유동부채 | 25,534 | 25,157 | 32,453 | 58,252 |
| 자본총계 | 288,066 | 296,904 | 277,394 | 519,459 |
| 자본금 | 20,755 | 20,755 | 12,572 | 12,515 |
| 차입금 | 68,531 | 67,256 | 83,730 | 51,850 |
| 부채비율 | 26.84% | 26.84% | 40.15% | 22.60% |
| 유동비율 | 128.71% | 169.02% | 66.37% | 96.82% |
| 차입금의존도 | 18.76% | 17.86% | 21.54% | 8.14% |
| 이자비용 | 639 | 4,111 | 3,810 | 700 |
| 이자보상배율 | -19.78 | -10.03 | -8.84 | -27.69 |
| EBITDA | (11,382) | (36,272) | (28,870) | (16,075) |
| 차입금/EBTDA | -16.61% | -53.93% | -34.48% | -31.00% |
| 매출액 대비 EBITDA | -609.96% | -931.58% | -208.68% | -52.60% |
| EBITA / 금융비용 | -1721.93% | -524.92% | -526.05% | -335.80% |
| 출처: 존속회사 정기보고서 |
존속회사는 2023년 852억원 규모의 유상증자로 자본을 확충하는 등 재무구조 개선을 위해 노력하였으며, 2024년 1분기 기준 차입금의존도 18.76%, 부채비율 26.84%, 유동비율 128.71%를 기록하며 수치상으로는 양호한 재무 건전성을 보입니다. 단, 존속회사는 영업손실이 지속되고 있으며 단기 이자 지급 능력을 나타내는 이자보상배율과 원금상환능력을 나타내는 영업현금흐름(EBITDA) 대비 차입금이 부(-)의 값을 보이고 있으므로 존속회사의 부채상환능력은 낮은 수준이라고 판단됩니다.
추가적으로, 향후에 존속회사 사업부문 영업 환경이 지속적으로 악화되거나, 연구개발의 지속적인 투자로 인한 자금 소요 등의 예상치 못한 환경의 변화에 따라 외부자금 조달 수요가 발생할 경우 존속회사의 재무안정성 약화로 이어질 위험이 존재하오니 투자자분들께서는 이점 유의하시기 바랍니다.
2024년 1분기 기준 존속회사의 차입금 규모는 685억원이며 기발행 전환사채는 전부 조기상환 청구 및 소각되었습니다. 차입금 규모는 2023년 673억원, 2022년 837억원 2021년 519억원으로, 매년 유사한 수준을 유지하고 있다고 판단됩니다.
| [존속회사의 2024년 1분기 기준 차입금 내역] |
| (단위: 천원, %) |
| 차입처 | 차입일자 | 만기일 | 내 역 | 이자율(%) | 당분기말 | 부대조건 |
| 기업은행 | 2022-08-26 | 2024-08-28 | 시설자금대출 | 5.26 | 10,000,000 | 제넥신 마곡 토지 및 사옥 담보 |
| 2020-10-08 | 2024-10-10 | 시설자금대출 | 4.73 | 20,000,000 | 제넥신 마곡 토지 및 사옥 담보 | |
| 2021-01-28 | 2028-08-26 | 시설자금대출 | 5.39 | 20,000,000 | 제넥신 마곡 토지 및 사옥 담보, 분할 조기상환가능 | |
| 2022-08-23 | 2024-08-23 | 운전자금대출 | 5.74 | 9,000,000 | 제넥신 마곡 토지 및 사옥 담보 | |
| 마곡컨소시엄제일차 | 2023-07-12 | 2026-07-12 | PF 한도대출_TR A | 8.00 | 1,214,772 | 제넥신 마곡 토지 및 사옥 담보, 마곡 신사옥 토지 담보 마곡컨소시엄제일차 차입약정금액의 130% 연대보증 |
| 2023-07-12 | 2026-07-12 | PF 한도대출_TR B | 11.00 | 8,316,000 | 제넥신 마곡 토지 및 사옥 담보, 마곡 신사옥 토지 담보 마곡컨소시엄제일차 차입약정금액의 130% 연대보증 |
|
| 합 계 | - | 68,530,772 | ||||
| 출처: 존속회사 정기보고서 |
한편, 소멸회사는 증권신고서 제출 전일 기준 금융기관 및 금융기관 외에 개인 또는 다른법인으로부터 차입한 부채와 발행한 사채가 없습니다. 소멸회사의 재무안정성 지표는 다음과 같습니다.
| [소멸회사의 재무안정성 지표] |
| (단위: 백만원, %) |
| 구 분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 |
| 자산총계 | 1,363 | 1,715 | 3,540 | 359 |
| 유동자산 | 668 | 968 | 2,617 | 350 |
| 비유동자산 | 696 | 747 | 924 | 9 |
| 부채총계 | 261 | 263 | 61 | 12 |
| 유동부채 | 32 | 62 | 16 | 12 |
| 비유동부채 | 229 | 201 | 45 | - |
| 자본총계 | 1,102 | 1,452 | 3,479 | 348 |
| 자본금 | 325 | 325 | 325 | 25 |
| 차입금 | - | - | - | - |
| 부채비율 | 23.68% | 18.11% | 1.75% | 3.45% |
| 유동비율 | 2087.50% | 1561.29% | 16356.25% | 2916.67% |
| 차입금의존도 | - | - | - | - |
| 출처: 소멸회사 자체자료 |
소멸회사의 부채비율은 2024년 1분기 23.68%, 2023년 18.11%, 2022년 1.75%, 2021년 3.45%로 낮은 수준이며, 유동비율 또한 해당 기간 전부 1000%를 상회하며 우수한 재무안정성을 보이고 있습니다. 단, 앞서 기술한 바와 같이 존속회사와 소멸회사의 사업이 본 궤도에 진입하기 전까지 영업활동으로 인한 현금흐름이 지속적으로 적자를 기록할 것으로 예상되며, 파트너쉽과 기술이전이 예상보다 지연되거나 연구개발비가 증가하게 될 경우 재무안정성 및 유동성이 악화될 수 있음을 투자자께서는 유의하여 주시기 바랍니다.
한편, 재무제표 IFRS 전환 후 소멸회사의 재무안정성 지표는 다음과 같습니다.
| [IFRS 전환 후 소멸회사의 재무안정성 지표] |
| (단위: 백만원, %) |
| 구분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 |
| 자산총계 | 1,432 | 1,804 | 3,712 | 359 |
| 유동자산 | 727 | 968 | 2,620 | 356 |
| 비유동자산 | 706 | 836 | 1,092 | 3 |
| 부채총계 | 8,039 | 7,939 | 7,508 | 1,328 |
| 유동부채 | 7,806 | 7,679 | 7,279 | 1,304 |
| 비유동부채 | 232 | 260 | 229 | 24 |
| 자본총계 | -6,607 | -6,135 | -3,796 | -969 |
| 자본금 | 200 | 200 | 200 | 20 |
| 차입금 | - | - | - | - |
| 부채비율 | -121.67% | -129.41% | -197.79% | -137.05% |
| 유동비율 | 9.31% | 12.61% | 35.99% | 27.30% |
| 차입금의존도 | - | - | - | - |
| 출처: 소멸회사 자체자료 |
2024년 1분기 기준 소멸회사의 부채총계와 자본총계는 8,039백만원 및 -6,607백만원으로 부채총계는 IFRS 전환 이전 대비 7,778백만원 증가하였으며 자본총계는 IFRS 전환 대비 7,709백만원 감소하였습니다. 이는 IFRS 적용으로 소멸회사가 보유하고 있는 전환우선주의 주 계약과 옵션을 분리하여 회계처리해 전환권을 자본에서 부채로 인식하였기 때문입니다. 따라서 IFRS 전환 이후 소멸회사는 완전자본잠식 상태이며, 부채비율은 -121.67%, 유동비율은 9.31%로 재무건정성이 매우 위험한 상태로 투자자께서는 이 점 유의하여주시기 바랍니다. 다만, 합병계약서에 따라 합병기일 전에 소멸회사가 발행한 종류주식 전체가 보통주 전환이 요구되므로, 순자산금액 7,518백만원이 증가하여 자본잠식에서 벗어날 예정입니다.
[현금흐름 위험]
존속회사는 2024년 1분기 및 최근 3년간 지속적으로 부(-)의 영업활동현금흐름을 보이고 있으며, 이러한 부(-)의 영업활동현금흐름은 대체적으로 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 존속회사의 2024년 1분기 및 최근 5개년 현금흐름표 추이는 다음과 같습니다.
| [최근 5개년 현금흐름 추이] |
| (단위: 백만원) |
| 구분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 | 2020년 | 2019년 |
| 영업활동현금흐름 | (5,016) | (38,055) | (39,800) | (12,745) | (22,691) | (41,572) |
| 영업활동으로 창출된 현금흐름 | (4,077) | (36,342) | (38,778) | (12,560) | (23,972) | (42,720) |
| 이자수취 | 142 | 1,023 | 288 | 183 | 1,079 | 1,152 |
| 이자지급 | (973) | (2,428) | (1,301) | (485) | (154) | (250) |
| 법인세환급(납부) | (108) | (307) | (10) | 117 | 356 | 247 |
| 투자활동현금흐름 | (244) | (34,283) | (1,915) | (7,704) | (64,394) | 1,637 |
| 투자활동으로 인한 현금유입액 | 68,002 | 133,847 | 93,090 | 103,176 | 80,131 | 129,998 |
| 배당금수취 | - | 711 | 434 | - | 22,000 | 66,105 |
| 단기금융상품의 처분 | - | 7,000 | - | - | 8 | 9 |
| 당기손익금융자산의 처분 | 67,981 | 103,108 | 59,393 | 20,535 | 41,566 | 60,868 |
| 기타포괄손익금융자산의 처분 | - | 2,499 | 1,769 | 55,072 | 14,263 | - |
| 관계,공동기업투자의 감소 | - | 19,300 | - | - | 1,617 | 2,149 |
| 유형자산 등의 처분 | - | 195 | 31,228 | 27,162 | 66 | 360 |
| 무형자산의 처분 | - | - | 200 | - | - | - |
| 대여금의 감소 | - | 900 | - | 274 | - | - |
| 보증금 등의 변동 | 2 | 135 | 67 | 133 | 610 | 507 |
| 투자활동으로 인한 현금유출액 | 68,246 | 168,130 | 95,006 | 110,880 | (144,525) | (128,361) |
| 단기금융상품의 취득 | - | 17,000 | 4,000 | - | 1,500 | 13,000 |
| 대여금의 증가 | 70 | 1,024 | - | - | - | - |
| 당기손익금융자산의 취득 | 66,612 | 142,509 | 57,200 | 7,104 | 17,000 | 20,102 |
| 기타포괄손익금융자산의 취득 | - | - | 322 | 12,167 | 24,299 | 2,235 |
| 관계/공동기업투자의 증가 | - | - | - | - | 76,996 | 87,416 |
| 유형자산의 취득 | 1,522 | - | 756 | 32,080 | 22,208 | 3,962 |
| 무형자산의 취득 | - | 7,273 | 31,747 | 56,433 | 1,909 | 1,120 |
| 보증금 등의 변동 | 42 | 106 | 32 | 574 | 613 | 526 |
| 선급금 등의 변동 | - | 218 | 949 | 2,523 | - | - |
| 재무활동현금흐름 | 939 | 60,427 | 31,632 | 43,087 | 73,358 | 3,328 |
| 재무활동으로 인한 현금유입액 | 1,274 | 111,624 | 38,376 | 43,348 | 97,959 | 3,497 |
| 주식선택권의 행사 | - | 660 | 1,976 | 7,502 | 3,358 | 3,497 |
| 유상증자 | - | 84,502 | - | 5,946 | 58,501 | - |
| 전환사채의 발행 | - | 13,206 | - | - | 20,900 | - |
| 차입금의 증가 | 1,274 | 13,256 | 36,400 | 23,400 | 15,200 | - |
| 임대보증금의증가 | - | - | - | 6,500 | - | - |
| 재무활동으로 인한 현금유출액 | 335 | 51,197 | 6,744 | 261 | (24,601) | (168) |
| 자기주식의 취득 | - | 939 | - | - | - | - |
| 종속기업투자의 증가 | 305 | 6,486 | - | - | - | - |
| 전환우선주의 전환 | - | - | - | - | - | 0 |
| 전환사채의 전환 | - | - | - | - | 14 | - |
| 전환사채의 상환 | - | 20,952 | 1,500 | - | 14,409 | - |
| 차입금의 상환 | - | 16,000 | 5,000 | - | 10,000 | - |
| 리스부채의 상환 | 30 | 189 | 244 | 232 | 178 | 168 |
| 임대보증금의 상환 | - | 6,631 | - | - | - | - |
| 주식발행비용 | - | - | - | 29 | - | - |
| 현금및현금성자산의 순증가(감소) | (4,321) | (11,911) | (10,083) | 22,637 | (13,727) | (36,607) |
| 기초현금및현금성자산 | 6,032 | 17,942 | 27,796 | 5,212 | 19,092 | 55,680 |
| 현금및현금성자산에 대한 환율변동효과 | 4 | 0 | 229 | (53) | (154) | (21) |
| 기말현금및현금성자산 | 1,715 | 6,032 | 17,942 | 27,796 | 5,212 | 19,052 |
| 출처: 존속회사 정기보고서 |
2019년 존속회사는 16,509백만원의 당기순손실(-) 발생하였으며, 감가상각비 및 관계기업처분이익의 조정, 이자 관련 수취 및 지급 등으로 최종적으로 41,572백만원의 부(-)의 영업활동현금흐름이 발생하였습니다. 투자활동현금흐름의 경우 관계기업 네오이뮨텍, Rezolute, KGbio, Colmmune 지분투자를 진행하여 총 87,416백만원의 관계/공동기업투자가 발생하였고 마곡1/2 신사옥 건축에 따른 건설중인 유형자산 취득가액 증가로 3,962백만원이 발생하였으며 이로인해 투자활동으로 인한 현금 유출은 총 128,361백만원을 기록하였습니다. 단, 배당금 수취 66,105백만원 및 단기금융상품 감소 등으로 인한 투자활동현금유입으로 투자활동현금흐름은 1,637백만원을 기록하였습니다. 재무활동현금흐름의 경우 주식매수선택권 행사 등으로 3,328백만원을 기록하였습니다. 이에 2019년말 현금및현금성자산은 기초 55,680백만원 대비 36,627백만원 감소한(환율변동효과 고려) 19,052백만원을 보유하게 되었습니다.
2020년 존속회사는 지분법이익 발생으로 27,536백만원의 당기순이익(+)이 발생하였으나 기타 조정사항을 거쳐 최종적으로 22,691백만원의 부(-)의 영업활동현금흐름을 기록하였습니다. 27,536백만원 상당의 큰 당기순이익(+)이 발생하였음에도 불구하고, 최종적으로 부(-)의 영업활동현금흐름이 발생한 이유는 관계기업처분이익이 현금의 유입이 없는 수입의 차감항목으로 59,132백만원 상당이 가감조정되었기 때문입니다. 투자활동현금흐름의 경우 관계기업 툴젠 지분투자로 인한 76,996백만원의 관계/공동기업투자, 마곡1/2 신사옥 건축에 따른 건설중인 유형자산 취득가액 증가로 인한 22,208백만원의 유형자산 취득으로 최종적으로 64,394백만원의 부(-)의 투자활동현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 존속회사가 발행한 200억원 규모의 전환사채(7CB)와 585억원 규모의 제3자배정 유상증자에 따라 73,358백만원의 양(+)의 재무활동현금흐름이 발생하였습니다. 이에 2020년말 현금및현금성자산은 기초 19,093백만원 대비 13,881백만원 감소한(환율변동효과 고려) 5,212백만원을 보유하게 되었습니다.
2021년 존속회사는 48,561백만원의 당기순손실(-)이 발생하였으며 최종적으로 12,745백만원의 부(-)의 영업활동현금흐름을 기록하였습니다. 존속회사는 관계기업 KGbio 및 KinGen Biotech의 32,080백만원 규모의 지분투자를 진행하였으며, 마곡1/2 신사옥 건축에 따른 취득가액 56,433백만원 상당의 유형자산 취득이 발생하였으나, 코리아바이오파크 건물매각에 따른 계약금 및 중도금 취득으로 일부 보전해 최종적인 투자활동현금흐름은 -7,704백만원이 발생하였습니다. 재무활동현금흐름은 234억원 규모의 차입금 증대, 75억원 규모의 주식매수선택권 행사 등으로 43,087백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 2021년말 현금및현금성자산은 기초 5,212백만원 대비 22,584백만원 증가한(환율변동효과 고려) 27,796백만원을 보유하게 되었습니다.
2022년 존속회사는 56,831백만원의 당기순손실(-)이 발생하였으며 영업활동현금흐름은 -39,800백만원이 발생하였습니다. 존속회사는 마곡1 신사옥 토지 및 건물 취득을 완료해 31,747백만원의 투자활동현금흐름 유출이 발생하였으나 코리아바이오파크 건물매각 자금 취득으로 31,228백만원의 투자활동현금흐름 유입으로 최종적으로 -1,915백만원의 투자활동현금흐름을 기록하였습니다. 재무활동현금흐름의 경우 추가 차입이 발생해 31,632백만원을 기록하였습니다. 이에 2022년말 현금및현금성자산은 기초 27,796백만원 대비 10,083백만원 감소한(환율변동효과 고려) 17,942백만원을 보유하게 되었습니다.
2023년 존속회사는 66,860백만원의 당기순손실(-)이 발생하였으며 영업활동현금흐름은 -38,055백만원이 발생하였습니다. 존속회사는 마곡2 신사옥 건축에 따른 투자활동현금흐름 유출 등으로 34,283백만원의 부(-)의 투자활동현금흐름을 기록하였으나, 부족한 현금을 마련하기 위해 주주배정후 실권주 일반공모 유상증자를 진행하여 공모자금 85,217백만원 상당의 재무활동현금흐름 유입이 발생하였습니다. 이에 2023년말 현금및현금성자산은 기초 17,942백만원에서 11,911백만원 감소한(환율변동효과 고려) 6,032백만원을 보유하고 있으나, 유상증자를 통한 공모자금 일부를 수익증권 가입을 통해 당기손익금융자산으로 운용하고 있어, 이를 포함한 현금성자산은 적정한 수준으로 판단됩니다.
2024년 1분기 기준 존속회사는 현금및현금성자산 1,715백만원을 보유하고 있으나, 단기금융상품 14,000백만원 및 당기손익금융자산 36,785백만원 형태로 보유 현금을 일부 분산해 보유하고 있습니다.
소멸회사의 설립 이후 현금성자산 추이는 2021년 326백만원, 2022년 2,504백만원, 2023년 881백만원, 2024년 1분기 615백만원이며, 소멸회사는 유상증자로 인한 재무활동현금흐름 유입으로 부(-)의 영업활동현금흐름을 보전하고 있습니다.
존속회사 및 소멸회사는 현금흐름에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 최근 5년간 지속적으로 음(-)의 영업활동현금흐름을 보이고 있으며, 영업 실적이 개선되지 않아 음(-)의 영업활동현금흐름이 계속 발생할 경우 유동성 리스크가 부각될 위험이 있습니다. 때문에 보유 파이프라인의 라이선스 아웃 및 영업활동 전반에 대한 모니터링이 필요하다고 판단되며, 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있습니다. 투자자께서는 회사의 현금흐름 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다.
| 나-3. 연구개발비 회계처리 관련 위험 존속회사와 소멸회사는 '제약ㆍ바이오 산업 주요 회계처리에 대한 감독지침(2018.09.19 및 2022.09.22)'과 한국채택국제회계기준(K-IFRS)에 따라 임상 3상 개시 시점에 도달하기 전 신약 개발에 지출하는 연구개발비의 경우 전액 비용으로 처리하고 있으며, 이에 따라 자체 개발 파이프라인에 대해서는 무형자산을 인식하고 있지 않습니다. 존속회사와 소멸회사의 회계정책으로 현재까지 비용처리하던 연구개발과 동일한 내용에 대하여 가시적인 기간내 회계정책을 변경하여 자산화 가능성은 없습니다. 즉, 향후 존속회사와 소멸회사가 비용처리하고 있는 연구개발비용 이외에 자산화된 연구개발비에 대한 손상 관련 비용 발생 위험은 제한적입니다. 이처럼 존속회사와 소멸회사는 연구개발비의 무형자산 인식과 관련한 회계처리의 불확실성은 없는 상황이나, 바이오의약품 업종 특성 상 지속적인 연구개발 활동이 사업에 필수적인 요소이며, 개발중인 파이프라인이 임상단계에 진입할수록 연구개발비 부담은 증가할 예정입니다. 투자자분들께서는 이 점 유의하여 주시기 바랍니다. |
존속회사와 소멸회사는 '제약ㆍ바이오 산업 주요 회계처리에 대한 감독지침(2018.09.19 및 2022.09.22)'과 한국채택국제회계기준(K-IFRS)에 따라 임상 3상 개시 시점에 도달하기 전 신약 개발에 지출하는 연구개발비의 경우 전액 비용으로 처리하고 있습니다. 2024년 1분기말 현재 자체 파이프라인에서 연구개발비를 자산화 한 내역은 없습니다. 금융위원회가 제시한 제약ㆍ바이오 산업의 연구개발비 자산화 회계처리 방법은 다음과 같습니다.
| [약품유형별 연구개발비의 자산화 가능 단계] |
| 유형 | 자산화 가능 | 설정 근거 |
| 신약 | 임상 3상 개시 승인 | - 장기간 다수 환자를 대상으로 시험약의 안전성ㆍ약효에 대한 검증을 거치지 않은 상태(임상 3상 개시 승인 이전)에는 일반적으로 자산가치의 객관적 입증이 어려울 것으로 판단 - 최근 10년간 임상 3상 개시 승인 이후 정부 최종 승인율이 약 50%(美 제약 바이오 업계 통계 |
| 바이오시밀러 | 임상 1상 개시 승인 | - 정부가 오리지널 약과의 유사성 검증자료를 확인하지 않은 상태(임상 1상 개시 승인 이전)에서는 일반적으로 자산가치의 객관적 입증이 어려울 것으로 판단됨 - 美 연구 결과, 임상 1상 개시 승인 이후 최종 승인율 약 60% |
| 출처: 금융위원회 기업회계팀(제약ㆍ바이오 감독지침(2018.09.19)) |
한국채택국제회계기준(K-IFRS)은 내부적으로 창출한 무형자산(개발비) 인식 요건을 충족하는 경우 해당 비용을 자산화하고 있으며, 그렇지 못한 경우 비용 처리 하도록 규정하고 있습니다. 한국채택국제회계기준(K-IFRS)은 연구단계에서 사용된 연구비는 모두 비용처리를 하도록 하고, 개발단계에서 지출한 비용도 자산인식요건을 충족하지 못할 경우 경상개발비로 당기비용화하도록 하고 있습니다. 무형자산으로 인정되는 개발비는 개발단계에서 지출한 비용이 자산인식요건을 충족해야만 무형자산으로 인정됩니다. 한국채택국제회계기준(K-IFRS) 상 연구개발비의 무형자산 인식 기준은 다음과 같습니다.
| [한국채택국제회계기준(K-IFRS) 상 연구개발비의 무형자산 인식 기준] |
|
① 무형자산을 사용 또는 판매하기 위해 그 자산을 완성시킬 수 있는 기술적 실현가능성을 제시할 수 있다. |
| 출처: 한국채택국제회계기준(K-IFRS) |
존속회사와 소멸회사의 회계정책으로 현재까지 비용처리하던 연구개발과 동일한 내용에 대하여 가시적인 기간내 회계정책을 변경하여 자산화 가능성은 없습니다. 존속회사는 2018년 연구개발비 자산화 관련 회계감리를 수행하였고, 그 결과 2016년까지 인식한 개발비를 전액 비용처리 및 재무제표를 재작성 하였습니다. 해당시점 이후부터 현재까지 연구개발비를 자산화한 내역은 없습니다. 단, 존속회사는 당기 중으로 제약ㆍ바이오 산업 주요 회계처리에 대한 감독지침(2018.09.19 및 2022.09.22)'과 한국채택국제회계기준(K-IFRS)에 따라 연구개발비의 무형자산 인식 기준을 재검토하여 충족하는 경우 연구개발비용을 일부 자산화 할 계획입니다. 이에 따라, 향후 존속회사와 소멸회사가 비용처리하고 있는 연구개발비용 이외에 자산화된 연구개발비에 대한 손상 관련 비용 발생 위험은 제한적입니다. 하지만, 매년 발생하는 연구개발비를 전액 비용으로 처리함에 따라 높은 판관비 발생으로 존속회사와 소멸회사의 수익성은 악화되고 있습니다. 존속회사의 최근 분기 및 3개년의 연구개발비 추이는 다음과 같습니다.
| [존속회사의 연구개발비 추이] |
| (단위: 백만원) |
| 구 분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 | |
| 비용의 성격별 분류 | 원재료비 | 300 | 1,228 | 2,979 | 6,251 |
| 인건비 | 1,037 | 6,023 | 5,514 | 7,629 | |
| 감가상각비 | 731 | 2,812 | 2,460 | 1,124 | |
| 위탁용역비 | 4,062 | 2,963 | 9,750 | 21,730 | |
| 기타경비 | 1,734 | 13,314 | 6,475 | 2,758 | |
| 연구개발비용 계 | 7,864 | 26,341 | 27,178 | 39,491 | |
| 정부보조금 | (3) | (10) | (733) | -6,373 | |
| 보조금 차감 후 금액 | 7,861 | 26,330 | 26,445 | 33,118 | |
| 회계처리내역 | 판매비와 관리비 | 7,861 | 26,330 | 26,445 | 33,118 |
| 제조경비 | - | - | - | - | |
| 개발비 (무형자산) | - | - | - | - | |
| 회계처리금액 계 | 7,861 | 26,330 | 26,445 | 33,118 | |
| 연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액×100] |
379% | 595% | 164% | 90% | |
| 출처: 종속회사 정기보고서 |
존속회사의 연구개발비 규모는 2021년 331억원, 2022년 264억원 2023년 263억원 2024년 1분기 79억원으로 매출액 대비 연구개발비 비율은 100%를 초과하는 등 높은 수준을 유지하고 있습니다. 소멸회사의 최근 분기 및 3개년의 연구개발비 추이는 다음과 같습니다.
| [소멸회사의 연구개발비 추이] |
| (단위: 백만원) |
| 구 분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 | |
| 비용의 성격별 분류 | 재료비 | 93 | 569 | 432 | 29 |
| 인건비 | 163 | 488 | 261 | - | |
| 외주용역비 | 25 | 310 | 158 | 25 | |
| 기타경비 | 3 | 8 | 28 | 28 | |
| 회계처리내역 | 판매비와 관리비 | 284 | 1,374 | 879 | 82 |
| 제조경비 | - | - | - | - | |
| 개발비 (무형자산) | - | - | - | - | |
| 회계처리금액 계 | 284 | 1,374 | 879 | 82 | |
| 연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액×100] |
N/A | N/A | N/A | N/A | |
| 주1: 소멸회사의 매출이 발생하지 않음에 따라 매출액 대비 연구개발비 비율은 기재하지 않음 출처: 소멸회사 자체자료 |
소멸회사의 연구개발비 규모는 2021년 0.82억원, 2022년 9억원 2023년 14억원 2024년 1분기 3억원으로 해당 기간동안 매출이 발생하지 않음에 따라 연구개발비는 소멸회사의 수익성에 직접적으로 부정적인 영향을 끼쳤습니다.
이처럼 존속회사와 소멸회사는 연구개발비의 무형자산 인식과 관련한 회계처리의 불확실성은 없는 상황이나, 바이오의약품 업종 특성 상 지속적인 연구개발 활동이 사업에 필수적인 요소이며, 개발중인 파이프라인이 임상단계에 진입할수록 연구개발비 부담은 증가할 예정입니다. 투자자분들께서는 이 점 유의하여 주시기 바랍니다.
| 나-4. 우발부채 관련 위험 존속회사는 증권신고서 제출일 전일 현재 담보 제공으로 인한 우발채무(소송 건 제외)를 보유하고 있으며, 존속회사가 제공한 담보와 관련하여 우발채무가 현실화되거나 추가적인 대손충당이 발생할 경우 존속회사의 재무안정성에 부정적인 영향을 끼칠 수 있습니다. 소멸회사는 증권신고서 제출 전일 현재 (1) 소멸회사의 지분에 대한 질권 등 담보 설정(제공) 내역, (2) 소멸회사가 금융기관 및 금융기관 외에 개인 또는 다른 법인으로부터 차입한 부채 현황, (3) 소멸회사가 발행한 사채 현황, (4) 소멸회사가 제3자를 위하여 제공하였거나, 역으로 제3자로부터 회사가 제공받은 담보 및 보증현황이 없습니다. |
존속회사는 증권신고서 제출일 전일 현재 담보 제공으로 인한 우발채무(소송 건 제외)를 보유하고 있으며, 존속회사가 제공한 담보와 관련하여 우발채무가 현실화되거나 추가적인 대손충당이 발생할 경우 존속회사의 재무안정성에 부정적인 영향을 끼칠 수 있습니다.
(1) 2024년 1분기말 기준 존속회사가 금융기관과 체결한 금융거래 약정사항은 다음과 같습니다.
| [존속회사가 담보로 제공한 자산 내역] |
| (단위: 천원) |
| 금융기관 | 차입약정내용 | 당분기말 | 전기말 | ||
| 약정한도액 | 실행액 | 약정한도액 | 실행액 | ||
| 기업은행 | 시설자금대출 | 10,000,000 | 10,000,000 | 10,000,000 | 10,000,000 |
| 시설자금대출 | 20,000,000 | 20,000,000 | 20,000,000 | 20,000,000 | |
| 시설자금대출 | 20,000,000 | 20,000,000 | 20,000,000 | 20,000,000 | |
| 운전자금대출 | 10,000,000 | 9,000,000 | 10,000,000 | 9,000,000 | |
| 하나은행 | 운전자금대출 | 7,000,000 | - | 7,000,000 | - |
| 마곡컨소시엄제일차(주1) | 시설자금한도대출 | 41,440,000 | 9,530,772 | 41,440,000 | 8,256,475 |
| 합 계 | 108,440,000 | 68,530,772 | 108,440,000 | 67,256,475 | |
| 주1) 존속회사를 포함한 3개사는 2023년 07월 11일 마곡 신사옥 및 R&D센터 신규시설 투자 목적으로 148,000,000천원(존속회사분 41,440,000천원)의 차입약정을 마곡컨소시엄제일차와 체결하였습니다. |
| 출처: 존속회사 정기보고서 |
(2) 2024년 1분기말 기준 존속회사가 담보로 제공한 자산 내역은 다음과 같습니다.
| [존속회사가 담보로 제공한 자산 내역] |
| (단위: 천원) |
| 담보제공자산(주1) | 장부금액 | 담보설정금액 | 관련 채무 | 채무금액 | 담보권자 |
| 마곡 토지 | 23,150,534 | 72,000,000 | 단기차입금 | 10,000,000 | 기업은행 |
| 마곡 사옥 | 67,017,665 | 장기차입금 | 20,000,000 | 기업은행 | |
| 장기차입금 | 20,000,000 | 기업은행 | |||
| 단기차입금 | 9,000,000 | 기업은행 | |||
| 12,000,000 | 단기차입금 | - | 하나은행 |
| 주1) 존속회사는 마곡컨소시엄제일차 차입약정금의 130%인 53,872,000천원에 대하여 연대보증인으로서 부동산 담보(존속회사 마곡 토지 및 사옥, 마곡 신사옥 토지)를 추가로 제공하였습니다. |
| 출처: 존속회사 정기보고서 |
(3) 2024년 1분기말 기준 존속회사가 타인으로부터 제공받은 지급보증 내역은 다음과 같습니다.
| [존속회사가 타인으로부터 제공받은 지급보증 내역] |
| (단위: 천원) |
| 지급보증제공자 | 보증내용 | 보증한도 | |
| 당분기말 | 전기말 | ||
| 서울보증보험 | 이행보증 | 529,061 | 529,061 |
| 출처: 존속회사 정기보고서 |
(4) 2024년 1분기말 기준 존속회사가 가입한 보험내역은 다음과 같습니다.
| [존속회사가 가입한 보험내역] |
| (단위: 천원) |
| 지급보증제공자 | 보증내용 | 부보금액 | 부보내역 | |
| 당분기말 | 전기말 | |||
| 흥국화재해상보험 | 재산종합보험 | 131,777,530 | 131,777,530 | 마곡사옥 재물위험담보(시설, 기계, 집기비품 등) |
| 출처: 존속회사 정기보고서 |
소멸회사는 증권신고서 제출 전일 현재 (1) 소멸회사의 지분에 대한 질권 등 담보 설정(제공) 내역, (2) 소멸회사가 금융기관 및 금융기관 외에 개인 또는 다른 법인으로부터 차입한 부채 현황, (3) 소멸회사가 발행한 사채 현황, (4) 소멸회사가 제3자를 위하여 제공하였거나, 역으로 제3자로부터 회사가 제공받은 담보 및 보증현황이 없습니다.
또한, 「발명진흥법」제15조1항에 의하면, 종업원 등은 직무발명에 대하여 특허등을 받을 수 있는 권리나 특허권 등을 계약이나 근무규정에 따라 사용자등에게 승계하게 하거나 전용실시권을 설정한 경우에는 정당한 보상을 받을 권리를 가진다고 정하고 있습니다. 단, 소멸회사는 직무발명보상에 대항 규정 내지 보상지급내역이 없는 바, 본 합병으로 소멸회사의 임직원에 대한 직무발명보상금 지급의무가 존속회사로 승계되어 우발채무가 발생할 가능성은 없을 것으로 판단됩니다.
투자자께서는 투자 판단 시, 존속회사의 담보 제공 등과 관련한 우발부채 현황을 면밀히 확인하시고, 이로 인한 우발부채 현실화 또는 사법기관의 제재로 인한 존속회사의 평판 하락 가능성에 유의하시기 바랍니다.
| 나-5. 계류 중인 소송에 관한 위험 존속회사와 소멸회사는 법률위반으로 인한 리스크를 회피하고자 지속적으로 회사의 영업활동에 관련된 법률검토 및 법률자문을 받고 있으며 담당 임직원에 대한 법률적 내부통제에 힘쓰고 있습니다. 다만, 증권신고서 제출 전일 현재 존속회사의 2건의 소송에 대한 결과가 나오지 않은 상황이며, 향후 소송 결과에 따라 존속회사의 평판에 부정적인 영향을 미쳐 경영실적 및 재무안정성에 부정적인 영향을 줄 수 있으므로 투자자 여러분께서는 이 점 유의하시기 바랍니다. |
존속회사는 증권신고서 제출 전일 현재 2건의 소송을 진행중에 있습니다. 소송의 사건 경위 및 진행상황 등 소송요약표는 아래와 같습니다.
| 원고 및 피고 (소송가액) |
계류법원 | 사건 경위 | 양사 주장 | 예상법률비용 | 예상 종결시점 |
진행상황 |
| 원고: ICHOR MEDICAL SYSTEMS, INC. 피고: 당사 소송가액: 116,788백만원 |
국제 상공회의소 (ICC) |
- 2012년 Ichor社와 electroporator (TriGrid)를 임상 시험에 적용하기 위해 License and Option Agreement (2012.09.07)를 체결. - 이후 Cervical Cancer 적응증으로 별개의 임상 시험 진행을 위해 Non-Commercial and Research License Agreement (2016.11.03)를 체결함. - Ichor 社는 상기 계약에 대한 존속회사의 계약 위반을 주장하고 이에 대해 보상해줄 것을 ICC(International Chamber of Commerce)에 중재 신청 |
[Ichor측 주장] - 2016 년 계약 전에 당사와 Ichor社는 추후 commercialization에 대해 deal strucrue를 논의하였고, 2016년 계약은 당사가 Merck社와의 병용투여 임상 계약 체결을 급히 진행하면서 체결되었음. - 2016 년 계약은 Cervical Cancer 환자 대상으로 임상 I/II 상 시험에 한정하여 맺은 계약이었는데, 당사가 계약 상 허용된 범위를 넘어서 GX-188E를 사용함. [ 당사 주장] - 2016 년 논의 되었던 deal structure는 양사 합의되지 않았고 최종 2016년 계약서에는 해당 내용에 대해 언급되지 않음. - 당사는 2016년 계약 상 허용된 범위 내에서 모든 업무를 수행함. |
4.5억원(~2026.05) (매월 담당 수행 변호사 타임차지 발생 비용) |
2026년 5월
|
Ichor측의 Request for Arbitration을 확인 후 소송대응을 위한 법무법인을 선정하였으며 중재인 및 중재지를 확정하고 당사의 답변서를 제출하였음
|
| 원고: 서울경제진흥원 피고: 당사 소송가액: 1,448백만원 |
서울고등법원 | 마곡산업단지 입주기업 50개사가 기부채납의 위법성이 있어 서울경제진흥원과 소송 진행중 | [서울시 주장] 입주기업과의 협의하에 작성된 계약을 근거로 한 행정처분 [당사 주장] 기부채납행위에 법률위반 |
1천만원 이하 +성공보수 | 2024년 10월 | 기부채납액 14억원은 23년 분기에 기 납부하였으며 소송결과에 따라 환급 예정. 현재 1심패소 후 2심 법무법인 선임하여 2심 변론(8/28) 및 판결(10월 예상) 대기 중. |
1. ICC 국제 중재사건
2016년 11월 03일 美 'ICHOR MEDICAL SYSTEMS, INC.'(이하 "ICHOR")와 Cervical caner 임상 관련 비상업적 라이선스 계약을 체결하였으며 ICHOR은 존속회사의 계약 위반을 주장하고 이에 대해 보상해줄 것을 ICC(International Chamber of Commerce)에 중재 신청 하였습니다. 청구금액은 1,168억원이며 소송 관련 공시 내용은 아래와 같습니다.
[소송 등의 제기ㆍ신청(일정금액 이상의 청구)]
| 1. 사건의 명칭 | ICC 국제 중재사건 | 사건번호 | 28624/PDP | |
| 2. 원고ㆍ신청인 | ICHOR MEDICAL SYSTEMS, INC. | |||
| 3. 청구내용 | 신청인은 당사의 계약 위반을 주장하고 이에 대해 보상해줄 것을 중재 신청 | |||
| 4. 청구금액 | 청구금액(원) | 116,788,000,000 | ||
| 자기자본(원) | 296,903,615,688 | |||
| 자기자본대비(%) | 39.34 | |||
| 대기업여부 | 해당 | |||
| 5. 관할법원 | ICC(International Chamber of Commerce) | |||
| 6. 향후대책 | 당사는 본 건과 관련하여 중재대리인을 선임하여 대응할 예정입니다. | |||
| 7. 제기ㆍ신청일자 | 2024-05-06 | |||
| 8. 확인일자 | 2024-05-07 | |||
| 9. 기타 투자판단에 참고할 사항 | - 상기 청구금액은 USD 86,000,000를 5/7일자 기준환율 (1USD = 1,358.00원)을 적용하여 환산한 금액입니다. - 상기 자기자본은 23년말 연결재무제표 기준입니다. - 제기ㆍ신청일자는 현지시간 기준이며, 확인일자는 ICC로부터 통보받은 날을 기재하였습니다. |
|||
| ※관련공시 | - | |||
| 출처: Dart 전자공시시스템 |
존속회사는 국내 대형 로펌을 수임하여 중재인 선정 및 소송에 대한 답변을 준비중이며, 내부적으로는 당시 상황에 대한 사실관계를 파악하고 있습니다.
존속회사가 수임한 로펌 의견에 따르면 ICC 중재 사건은 통상 1.5~2년이 소요되며, 현재 관련 자료를 검토 중에 있는 초기 단계라 승소 전망을 섣불리 예측하기 어려운 상황입니다.
하지만 존속회사 내부 검토 의견으로는 계약 위반 주장에 대한 근거가 미약하고, 사전 약속에 대한 사실 관계도 계약서 밖의 사안으로 추가 확실한 증거가 없다면 손해배상의 근거가 되기에는 미흡할 것으로 보고 있습니다. 현재 계약 및 관련 자료 존재 여부를 확인하고 있으며, 전반적으로 Ichor의 주장에 대한 반박의 근거 확보에 최선을 다하고 있습니다.
더불어 해당 소송에 따른 현재 진행되고 있는 연구개발 중단의 위험은 낮을 것으로 판단되며, 해당 소송에 대해서는 수임한 로펌과 적극적으로 대응을 진행하고 있습니다.
2. 시정명령 취소의 소
존속회사는 마곡산업단지 토지 취득과 관련해 서울경제진흥원으로부터 1,448,173천원의 기부채납 이행 요청을 받았으나 이에 불복하여 '공공지원시설 건립부지 기부채납 의무'에 대한 시정명령 취소 소송 진행하였습니다. 기부채납액 14억원은 2023년 3분기에 기 납부하였으며, 소송 결과에 따라 환급이 진행될 예정입니다. 2023년 9월 23일 1심 판결에 따라, 원고들의 청구가 기각되었으나 종속회사는 2023년 10월 10일 항소장을 제출하였으며, 2심 판결 대기중입니다(7월 예정).
소멸회사는 증권신고서 제출 전일 현재 (1) 소멸회사가 당사자가 되어 현재 계속 중인 소송, (2) 소멸회사의 재산에 대해 강제집행 또는 보전처분, (3) 소멸회사에 소송이 제기되지는 않았지만 소송이 예상되거나 그와 관련된 통지를 받았거나 협상이 진행 중인 각종 분쟁은 없습니다.
법률 분쟁은 통상적으로 장기간에 걸쳐 진행되며, 사안에 따라 매우 큰 규모의 분쟁이 될 경우 큰 규모의 소송비용이 발생할 수 있습니다. 존속회사와 소멸회사는 법률위반으로 인한 리스크를 줄이고자 지속적으로 회사의 영업활동에 관련된 법률검토 및 법률자문을 받고 있으며 담당 임직원에 대한 법률적 내부통제에 힘쓰고 있습니다. 다만, 증권신고서 제출 전일 현재 존속회사의 2건의 소송에 대한 결과가 나오지 않은 상황이며, 향후 소송 결과에 따라 존속회사의 평판에 부정적인 영향을 미쳐 경영실적 및 재무안정성에 부정적인 영향을 줄 수 있으므로 투자자 여러분께서는 이 점 유의하시기 바랍니다.
|
나-6. 정부 연구개발 과제 수행 관련 위험 존속회사와 소멸회사는 정부 차원에서 신약 연구개발의 중요성을 감안하여, 다양한 정부과제를 통해 연구개발비 지원을 지속적으로 확대하고 있으므로, 존속회사와 소멸회사는 이에 적극적으로 참여함으로써 향후 신규 사업의 추진에 있어서 객관적인 평가와 공신력을 획득하고 정부의 연구개발 진도 관리에 따라 과제의 성공가능성을 높일 계획입니다. 하지만 향후 존속회사와 소멸회사의 신약개발 파이프라인에 대한 국책과제 추가 선정의 불확실성, 현재 진행중인 과제의 실패에 따른 과제 참여의 제한, 정부의 정책 변화에 따른 국고보조금의 감소 등은 지속적으로 자금이 투입되어야 하는 존속회사와 소멸회사의 연구개발활동에 부정적인 영향을 미칠 수 있습니다. 특히, 현행 제도 상 정부 출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제 받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제제 조치가 가해질 수 있음을 투자판단에 참고하시기 바랍니다. |
존속회사는 설립 이래 총 72건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하여 총 673억원의 정부보조금을 수령하였으며, 현재 진행중인 정부 과제에 대해서도 특이사항 없이 진행 중에 있습니다. 존속회사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 존속회사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔습니다. 또한, 지속적이고 책임감있는 연구개발을 위해 협약된 사업의 종료 후 정부납부기술료를 납부해 기술실시 권리를 온전히 확보하고 있으며, 기술소유권자로서 해당 기술의 사업화를 위해 적극적으로 노력해왔습니다. 현재 진행중인 정부과제 또한, 협약 종료 후 제품화 및 기술이전 등 관련 매출의 발생 시 일정금액의 정부납부기술료를 제외한 금액이 존속회사의 매출로 연결되는 만큼 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
| [존속회사가 수행중인 정부 연구개발 과제 현황] |
| (단위: 천원) |
| 계약상대방 | 계약일 | 계약명칭 | 계약기간 | 정부보조금 | 성과 |
| 보건복지부 | 2023.06.01 | 차세대 신규 다항원성 결핵 치료용 DNA 백신 (GX-170)의 임상1상 연구 | 2023.06.01-2024.12.31 | 319,903 | 참여기업 |
| 주1: 존속회사가 주관 또는 참여기업으로서 진행된 정부과제는 정부보조금 수령시 계약기관에서 지정한 정부납부기술료를 지급함으로써 그 기술소유권자를 존속회사로 귀속시키게 되어있어, 매출발생시 존속회사 매출로 인식됩니다. |
| 출처: 존속회사 자체자료 |
한편 소멸회사는 설립 이후 4건의 정부 연구개발 과제를 수행하였으며, 그 중 2건은 현재 연구개발 진행 중입니다. 소멸회사가 설립 이후 수행한 연구개발 과제 현황은 아래와 같습니다.
| [소멸회사의 설립 이후 수행한 정부 연구개발 과제 현황] |
| 과제번호 | 과제명 | 부처 | 기간 | 현황 |
| S3201518 | Biologics 기반 신규 표적 단백질 분해제 개발(TIPS) |
중소벤처기업부 | 2021.11.01 ~ 2023.10.31 | 종료 |
| 20106138 | BioPROTAC 표적단백질 분해제 EPDegTM(창업사업화) |
중소벤처기업부 | 2022.11.01 ~ 2023.08.31 | 종료 |
| S3352813 | 신진 연구인력 채용지원사업 | 중소벤처기업부 | 2023.06.01 ~ 2026.05.31 | 진행중 |
| 20190934 | BioPROTAC 표적단백질 분해제 EPDegTM(해외마케팅) |
중소벤처기업부 | 2023.09.01 ~ 2024.06.30 | 진행중 |
| 출처: 소멸회사 자체자료 |
소멸회사의 정부과제별 총 사업비 수령 현황은 다음과 같습니다.
| [소멸회사의 정부과제별 사업비 수령 현황] |
| 과제번호 | 총사업비(현물 제외) | 정부보조금 수령액 | 정부보조금 미수령액 |
||||||
| 정부보조금 | 민간부담금 | 합계 | 2021 | 2022 | 2023 | 2024.03 | 합계 | ||
| S3201518 | 500 | 6 | 506 | - | 347 | 189 | - | 536 | - |
| 20106138 | 100 | 15 | 115 | - | 18 | 97 | - | 115 | - |
| S3352813 | 60 | - | 60 | - | - | 18 | - | 18 | 42 |
| 20190934 | 100 | 14 | 114 | - | - | 34 | 61 | 95 | 19 |
| 합계 | 760 | 35 | 795 | - | 366 | 337 | 61 | 764 | 61 |
| 출처: 소멸회사 자체자료 |
단, 소멸회사가 진행중인 정부 과제 중 '신진 연구인력 채용지원사업'의 경우 한국산업기술진흥협회의 채용지원사업 관리지침(2023.08)에 의하면, 지원기업이 채용지원사업 자격요건을 갖춘 제3의 기업으로 포괄 합병하는 경우에는 현재 진행 중인 협약을 유지할 수 있되, 합병되는 기업에 채용지원 사업으로 지원받는 인력이 있는 경우, 사업공고에 따른 기업당 지원규모 제한에도 불구하고 현재 진행 중인 협약을 유지할 수 있다고 정하고 있고, 합병 시 협약변경을 위한 제출 서류들을 정하고 있습니다(지침 8. 나.항). 따라서, 존속회사가 한국산업기술진흥협회의 채용지원사업 자격요건에 해당하지 않으면 합병에 따라 협약이 해지될 수 있으므로 투자자께서는 이 점 주의하여 주시기 바랍니다.
존속회사와 소멸회사는 정부 차원에서 신약 연구개발의 중요성을 감안하여, 다양한 정부과제를 통해 연구개발비 지원을 지속적으로 확대하고 있으므로, 존속회사와 소멸회사는 이에 적극적으로 참여함으로써 향후 신규 사업의 추진에 있어서 객관적인 평가와 공신력을 획득하고 정부의 연구개발 진도 관리에 따라 과제의 성공가능성을 높일 계획입니다.
하지만 향후 존속회사와 소멸회사의 신약개발 파이프라인에 대한 국책과제 추가 선정의 불확실성, 현재 진행중인 과제의 실패에 따른 과제 참여의 제한, 정부의 정책 변화에 따른 국고보조금의 감소 등은 지속적으로 자금이 투입되어야 하는 존속회사와 소멸회사의 연구개발활동에 부정적인 영향을 미칠 수 있습니다. 특히, 현행 제도 상 정부 출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제 받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제제 조치가 가해질 수 있음을 투자판단에 참고하시기 바랍니다.
| 나-7. 잦은 자금조달 관련 위험 존속회사와 소멸회사는 신주 상장으로 주주가치가 훼손될 수 있는 자금조달방법인 유상증자나 주식연계채권을 통해 자금을 조달한 이력이 있습니다. 존속회사와 소멸회사의 경우 바이오의약품 기업 특성 상 합병 후에도 추가적인 자금조달 가능성을 배제할 수 없습니다. 존속회사와 소멸회사의 추가 자금조달 필요성이 지속될 경우 존속회사와 소멸회사의 자금 유동성이 크게 악화될 수 있고 추가적인 자금조달을 진행할 수 있으며, 반복적인 유상증자 및 주식연계채권 발행으로 주주가치가 심각하게 훼손될 수 있으니 투자자께서는 이 점 각별히 유의하시기 바랍니다. |
존속회사와 소멸회사는 신주 상장으로 주주가치가 훼손될 수 있는 자금조달방법인 유상증자나 주식연계채권을 통해 자금을 조달한 이력이 있습니다. 존속회사는 2009년 상장 이후 2011년 10월 05일 유상증자 50억원(제3자배정 보통주, 기타자금), 2012년 10월 26일 유상증자 163억원(제3자배정 보통주, 운영자금), 제3회 사모 전환사채(CB) 167억원(시설자금 10억원, 운영자금 10억원, 타법인증권취득자금 40억원, 기타자금 107억원), 2014년 04월 15일 제4회 사모전환사채(CB) 70억원(운영자금), 2014년 08월 25일 유상증자 30억원(제3자배정 전환우선주, 운영자금), 2014년 10월 30일 유상증자 500억원(제3자배정 전환우선주, 운영자금), 2015년 12월 03일 유상증자 200억원(제3자배정 전환우선주, 운영자금), 2016년 07월 15일 유상증자 600억원(제3자배정 전환우선주, 운영자금), 2016년 07월 08일 제5회 사모전환사채(CB) 200억원(운영자금), 2018년 05월 18일 유상증자 2,000억원(제3자배정 전환우선주, 운영자금 1,400억원, 타법인증권취득자금 600억원), 제6회 사모전환사채(CB) 500억원(운영자금), 2020년 12월 17일 제7회 사모전환사채(CB) 200억원(타법인증권취득자금), 2020년 12월 21일 유상증자 585억원(제3자배정 보통주, 타법인증권취득자금), 2023년 01월 10일 유상증자 852억원(주주배정후 실권주 일반공모, 운영자금)을 통해 자금을 조달하였습니다. 존속회사가 상장 이후 조달한 자금 현황은 다음과 같습니다.
| [
존속회사의 상장 이후 조달한 자금 현황]
|
| 발행일
|
종류
|
사용용도
|
금액 (백만원) |
주당 발행 /전환가(원) |
자금사용목적
|
실제 자금사용 용도
|
배정대상자
|
| 2011-10-05 | 유상증자(제3자배정 보통주) |
기타자금 |
5,000 | 12,350 | 일본 기업과의 전략적 제휴 |
연구개발 자금 |
나우일본테크놀로지투자펀드 1호 |
| 2012-10-26 | 유상증자(제3자배정 보통주) |
운영자금 |
16,326 | 14,050 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
| 2012-10-26 | 제3회 사모전환사채 |
시설자금 |
1,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
| 운영자금 |
1,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 타법인증권취득자금 |
4,000 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 기타자금 |
10,650 | 16,650 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
한독약품 |
||
| 2014-04-15 | 제4회 사모전환사채 |
운영자금 |
7,000 | 30,750 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
인터베스트글로벌제약펀드 |
| 2014-08-25 | 유상증자(제3자배정 전환우선주) |
운영자금 |
3,031 | 43,050 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
State Good Group Limited |
| 2014-10-30 | 유상증자(제3자배정 전환우선주) |
운영자금 |
50,001 | 45,700 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
파이안제2호 유한회사 등 |
| 2015-12-03 | 유상증자(제3자배정 전환우선주) |
운영자금 |
20,000 | 81,800 | 공동 연구개발 및 전략적 동반자관계 형성 |
연구개발 자금 |
유한양행 |
| 2016-07-15 | 유상증자(제3자배정 전환우선주) |
운영자금 |
59,999 | 51,500 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
삼성증권 등 |
| 2016-07-08 | 제5회 사모전환사채 |
운영자금 |
19,990 | 58,406 | 기술개발과 해외시장 개척자금 |
연구개발 자금 |
Tasly (Hong Kong) pharmaceuticals Ltd. 등
|
| 2018-05-18 | 유상증자(제3자배정 전환우선주) |
운영자금 |
139,999 | 90,100 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
유한양행 등 |
| 타법인증권취득자금 |
60,000 | 90,100 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
유한양행 등 |
||
| 2018-05-18 | 제6회 사모전환사채 |
운영자금 |
50,000 | 102,680 | 기술개발과 JV 설립 자본금 투자 등 |
연구개발 자금 |
키움프라이빗에쿼티 등 |
| 2020-12-17 | 제7회 사모전환사채 |
타법인증권취득자금 |
20,000 | 140,950 | 타법인 증권 취득자금 |
툴젠 지분인수 |
유한양행 |
| 2020-12-21 | 유상증자(제3자배정 보통주) |
타법인증권취득자금 |
58,524 | 136,400 | 타법인 증권 취득자금 |
툴젠 지분인수 |
김진수 등 |
| 2023-01-10 | 유상증자(주주배정후 실권주 일반공모) |
운영자금 |
85,217 | 14,700 | 기술개발 등 |
연구개발 자금 |
주주배정 후 실권주 일반공모 |
| 합계 |
611,737 | ||||||
| 출처: 존속회사 자체 자료 |
소멸회사는 2021년 설립 이후 2021년 08월 27일~2021년 10월 08일 5회에 걸친 유상증자 6억원(제3자배정 전환우선주), 2022년 03월 29일 유상증자 25억원(제3자배정 상환전환우선주), 2022년 06월 27일 유상증자 18억원(제3자배정 상환전환우선주)을 통해 자금을 조달하였습니다. 소멸회사가 설립 이후 조달한 자금 현황은 다음과 같습니다.
소멸회사는 설립 이후, 아래와 같이 자금을 조달하였으며, 투자 시점 별 주요 연구성과는 다음과 같습니다.
| 구분 | 주요 연구성과 |
|---|---|
| 2021.08~ | 회사 설립(창업자 및 연구 개발진 구성)을 통한 연구개발 환경 마련, 주요 경영진 및 연구 개발진의 경력 및 향후 연구 개발 계획 등을 고려한 투자 유치 진행 |
| 2022.06~ |
1. 바이오프로탁 신규 플랫폼에 대한 In Vivo POC 검증
- A549 (폐암), BxPC3 (췌장암) xenograft models에서 SOX2 degrader의 항암 효능 확인
2. 전임상 단계 진입할 후보물질 확보 (EPD-301) / 후속 파이프라인 lead candidates 도출 (EPD-401)
- EPD-301: 1) 총 9종의 암세포주에서 apoptosis 유도에 의한 암세포주 사멸 효과 확인 (GI50: < 1 nM)
2) Ubiquitination & Proteasome dependent SOX2 degradation, SOX2-dependent efficacy 등 기본적인 MoA 확인
3) 2종의 암세포주 xenograft models에서 In Vivo 효능까지 확인
4) 전임상/임상 단계 개발에 사용할 LNP 후보 도출 완료
- EPD-401: 기존 저분자화합물 STAT3 PROTAC보다 더 potent한 bioPROTAC lead candidates 도출
3. 3종의 E3 proteins에 대한 Engineering 완료
- SKP2 mutant 1종 (SKP-E2)이 WT대비 월등히 개선된 STAT3 분해능을 보임을 확인
1) 전임상 단계 개발 또는 2) 신규 과제 런칭 위한 타사와의 Partnership 관계 확립
- Lung targeted delivery 가능한 LNP 확보 협력: Precision Nanosystems Inc.
- 단백질 형태로의 bioPROTAC 개발 협력 (STAT3 program): 제넥신
- 신규 CNS 과제 공동연구: I社
4. 특허 4건 출원
- SOX2 특이적으로 결합하는 단일 도메인 항체, 이를 포함하는 융합단백질 및 이의 용도 (출원번호: 10-2023-0158319)
- STAT3 특이적으로 결합하는 단일 도메인 항체, 이를 포함하는 융합단백질 및 이의 용도 (출원번호: 10-2023-0097975)
- βTrCP 단편 및 이의 변이체, 및 이의 용도 (출원번호: 10-2023-0097974)
- SKP2 단편 및 이의 변이체, 및 이의 용도 (출원번호: 10-2023-0097976)
|
| [
소멸회사의 설립 이후 조달한 자금 현황]
|
| 발행일
|
종류
|
사용 용도 |
금액(백만원)
|
발행가(원)
|
희석 발행가 (무상증자 고려) |
주2)의 ①, ②에 해당하는 |
| 2021-08-27 | 유상증자 (제3자배정 전환우선주) |
미정 |
300 | 659,091 | 6,591 |
X |
| 2021-09-30 | 100 | 659,091 | 6,591 |
X | ||
| 2021-09-30 | 40 | 659,091 | 6,591 |
X | ||
| 2021-09-30 | 60 | 659,091 | 6,591 |
X | ||
| 2021-10-08 | 100 | 659,091 | 6,591 |
X | ||
| 2022-03-29 | 유상증자 (제3자배정 상환전환우선주) |
1,501 | 2,769,300 | 27,693 |
X | |
| 2022-03-29 | 1,002 | 2,769,300 | 27,693 |
X | ||
| 2022-03-29 | 17 | 2,769,300 | 27,693 |
X | ||
| 2022-03-29 | 17 | 2,769,300 | 27,693 |
X | ||
| 2022-06-27 | 346 | 2,769,300 | 27,693 |
X | ||
| 2022-06-27 | 1,501 | 2,769,300 | 27,693 |
X | ||
| 2024-04-30 | 500 | 33,876 | 33,876 | X |
||
| 합계 |
4,984 | |||||
| 출처: 소멸회사 자체 자료 |
| 주1) 2022년 09월 21일 기준, 1 : 10 무상증자를 진행하였고, 2022년 10월 21일 기준 1: 10 주식분할을 진행하였습니다. |
|
주2) 외부기관평가는 크게 3가지로 분류됨. ① 재무제표 표시를 위한 기업가치평가 → 외부감사법 적용 - 금융감독원(상장사)과 한국공인회계사회(비상장사) 감리 등을 통해 관리·감독되고 있음
② 합병, 중요 자산의 양수도 가액 등의 적정성을 검토하기 위해 수행되는 의무적 기업가치 평가 →
자본시장법 적용(- 자본시장법령은 투자자 보호 등을 위해 일부 합병의 경우 기업으로 하여금 외부평가기관으로부터 합병가액 등이 적정한지에 대한 평가를 받고 그 평가결과를 공개하도록 규정하고 있음)
③ 그 外에 회사가 기업 내부 참고 목적으로 임의로 수행하는 기업가치 평가로, 평가결과를 사적 계약에 따라 당사자에게만 제공하는 경우 평가방법론에 대한 규율이 없음 |
소멸회사가 가장 최근에 투자를 유치한 시점은 2024년 4월 30일 이며, 주당 발행가는 33,876원이었습니다. 한편, 본건 합병을 위한 피합병법인의 합병가액은 40,512원으로, 최근 투자 유치 시점 대비 2개월여 지나지 않은 시점에 특별한 연구성과의 도출 등 기업가치 제고에 영향을 미치는 이벤트가 발생하지 않았음에도 피합병회사의 1주당 발행가가 약 19.6% 가량 할증되었다고 분석할 수 있습니다.
피합병법인이 영위하는 업종 특성과 초기 개발단계에 있는 파이프라인 특성 상, 투자 시점마다의 연구성과가 명확하게 합리적으로 측정되거나 계산, 판단되는데에는 한계가 존재합니다. 더욱이 소멸회사의 타겟하고 있는 주요 기술이 사용화된 기술이 아니고, 기술 개발과 상용화에 장기간이 소요될 수 있는 가능성이 높다는 부분에서 합리적이고 계량적인 방법으로의 가치 평가와 판단에 제약사항이 존재하고 있습니다.
다만, 본건 합병의 경우 피합병회사 기 발행 지분 100%를 합병존속회사가 취득 및 법인격을 합병하는 방식으로 진행될 예정인 점을 고려하였을 때, 가장 최근의 투자유치 가격을 기준으로 약 20% 수준의 경영권 프리미엄을 가산한 가치를 양 합병당사회사간의 합의된 가격으로 설정하였습니다. 이는 소멸회사의 설립 이후 자금조달 내역 마찬가지로, 소멸회사의 타겟 기술이 향후 상용화될 가능성을 담보하거나 정교하고 합리적으로 추정되었음을 증빙하는 것이 아님에 유의할 필요가 있습니다.
한 편, 본 건 합병을 위해 산정된 피합병회사의 합병가액 및 피합병회사의 종전 투자내역을 바탕으로 한 피합병회사의 기업가치는 절대적으로 합리적인 방식으로 계산, 산정되었다고 판단할 수 없을뿐더러, 본 건 합병을 통해 양 당사회사 간에 예상, 계획하고 있는 합병의 효과가 십분 발행될 것이라는 확신 역시 할 수 없습니다. 이 점 투자자께서는 유의하시기 바랍니다.
존속회사와 소멸회사의 경우 바이오의약품 기업 특성 상 합병 후에도 추가적인 자금조달 가능성을 배제할 수 없습니다. 존속회사와 소멸회사의 추가 자금조달 필요성이 지속될 경우 존속회사와 소멸회사의 자금 유동성이 크게 악화될 수 있고 추가적인 자금조달을 진행할 수 있으며, 반복적인 유상증자 및 주식연계채권 발행으로 주주가치가 심각하게 훼손될 수 있으니 투자자께서는 이 점 각별히 유의하시기 바랍니다.
한편, 존속회사와 소멸회사는 조달한 자금을 계획했던 자금의 사용목적과 사업 계획에 따라 적절한 시점에 자금을 집행하기 위해 노력하였으나, 존속회사가 2023년 01월 10일 실시한 주주배정후 실권주 일반공모 유상증자를 통해 유입된 공모자금이 증권신고서상 작성한 자금사용목적과 일부 다르게 사용된 사례가 존재합니다. 유상증자 당시 자금사용목적의 우선순위 1순위로 약 347억원을 GX-188E 자궁경부암 임상비용으로 지출 계획하였으나, 유상증자 이후 MSD社의 키트루다가 자궁경부암 1차 치료제로 허가를 받으면서, 자궁경부암 2차 치료제 시장의 성장성이 낮아짐에 따라 GX-188E 임상에 사용하기로 했던 자금계획을 다른 적응증의 임상에 투자하기로 개발전략을 수정하였습니다. 현재까지 존속회사는 주주배정후 실권주 일반공모 유상증자를 통해 조달한 845억원 중 2024년 1분기 기준 약 293억원을 지출하였으며, 구체적으로는 GX-188E 77억원, GX-E4 44억원, GX-H9 61억원, GX-I7 63억원 등에 자금을 사용하였습니다.
존속회사는 공모자금이 보다 효율적으로 사용되기 위해 자금사용목적과 달리 사용하고자 하는 경우 자금사용목적을 변경하는 이유에 대해 내부품의를 거쳐 승인된 경우에 한해 자금사용목적을 변경하고 있으며, 중대한 사안일 경우에는 이사회결의를 통해 제한함으로써 자금사용목적을 변경할 계획입니다. 이 부분에 대해서는 정기보고서 제출시 마다 공모자금의 사용 내역에 자금사용목적 변경에 대한 전후 상황 및 자금사용 용도에 대해 상세히 기재할 것이며, 보다 철저히 관리해 나갈 예정입니다. 또한 공모를 통해 조달된 자금은 각 용도별로 통장을 마련하여 해당 용도에 대해서만 자금이 집행될 수 있도록 별도의 공모 자금 집행 프로세스를 마련하여 통제할 계획입니다. 이러한 발생상황을 정기보고서 제출시 마다 계속적으로 업데이트할 예정이나, 위와 같이 별도의 통장 및 통제 프로세스에도 불구하고 내부통제 절차가 제대로 작동하지 않을 경우 공모자금이 당초 목적에 부합되지 않게 사용되고 이는 회사가 외부에서 자금을 조달하는데 불리하게 작용될 수 있기에 투자자께서는 이 점 유의하시기 바랍니다. 또한, 과거 자금사용내역처럼 보다 더 효율적으로 투자해야할 상황이 발생한다면 기존의 자금사용목적에서 일부 변경될 소지가 있으니 투자자께서는 이 점 유의하여주시기 바랍니다.
존속회사와 소멸회사는 합병 이후, 파이프라인 연구개발과 임상시험 등에 있어 시너지 효과가 발생할 것으로 기대하고 있으며, 합병 후 자금조달 계획(유상증자 및 채무증권 발행 등)은 증권신고서 제출 시점 기준 계획된 바 없습니다. 향후 관련 자금조달 계획이 구체화되어 결정되는 때, 전자공시 등을 통해 성실히 안내드릴 예정입니다.
한편, 존속회사는 글로벌 R&D 프로젝트 수행 및 마곡 내 첨단 클러스터 간 시너지 창출을 위해 아래와 같이 신규 시설투자를 계획하고 있습니다.
신규 시설투자 등(2023.6.28)
| 1. 투자구분 |
제넥신 컨소시엄 R&D센터 신규시설투자
|
|
| 2. 투자내역 |
투자금액(원)
|
29,420,000,000 |
| 자기자본(원)
|
280,907,962,296 |
|
| 자기자본대비(%)
|
10.47 |
|
| 대규모법인여부 |
미해당 |
|
| 3. 투자목적 |
글로벌 R&D 프로젝트 수행 및 마곡 내 첨단 클러스터간 시너지 창출
|
|
| 4. 투자기간 |
시작일 |
2023-07-12 |
| 종료일 |
2026-02-11 |
|
| 5. 이사회결의일(결정일)
|
2023-06-28 |
|
| -사외이사 참석여부 |
참석(명)
|
2 |
| 불참(명)
|
0 |
|
| 6. 감사(감사위원) 참석여부
|
참석 |
|
| 7. 공시유보 관련내용 |
유보사유 |
- |
| 유보기한 |
- |
|
| 8. 기타 투자판단에 참고할 사항 |
1. 상기 기재된 자기자본은 한국채택국제회계기준(K-IFRS)에 따라 작성된 2022년말 재무제표 금액입니다. 2. 본 건은 마곡 도시개발사업지구단위 계획구역 내 당사 외 2개사가 컨소시엄의 형태로 참여하며 당사의 지분비율은 28%에 해당합니다. 3. 시설 소재지:서울특별시 강서구 마곡동 762-3번지 4. 상기 투자내역의 투자금액은 순수 건물 건설비용으로 설계, 감리, 소방설비, 전산설비 등의 비용은 포함되지 않았습니다. 5. 투자기간의 시작일과 종료일은 공사의 시작일 및 투자계획상 완공 예정일을 기재 하였습니다. 6. 상기 투자금액과 기간은 경영환경 및 건축사정에 따라 변동될 수 있습니다. |
|
상기 시설투자에 필요한 자금은 현재까지 당사 자체 보유 현금으로 지급되었으며, 추가로 필요한 자금 규모 및 투자자금의 전체 조달구조는 아래와 같습니다.
[제넥신 컨소시엄 R&D센터 신규시설투자 개요]
| 총 투자금액 | 총 투자금액(취득액) 산정 근거 | 2024년 6월말 기준 집행 완료 금액 |
향후 집행 예정 금액 |
향후 집행 예정 금액의 조달 재원 |
|---|---|---|---|---|
| 29,420,000,000원 |
투자금액은 순수 건물 건설비용 (설계, 감리, 소방설비, 전산설비 등의 비용은 미포함)
|
7,116,200,000원
|
22,303,800,000원
|
차입(은행 시설대 등) 마곡컨소시엄제일차를 통한 차입 진행 |
■ 존속회사 회사위험
| 나-8. 종속회사 및 계열회사 관련 위험 증권신고서 제출 전일 기준 존속회사가 지분법을 적용하고 있는 관계기업 및 공동기업은 8개사가 있습니다. 관계기업 및 공동기업 투자주식의 경우 지분법 회계처리를 적용받으며, 지분법이 적용되는 투자자산의 경우 해당 관계기업의 손익 및 자본변동은 당사가 보유한 지분에 비례하는 만큼 법인세비용차감전이익 및 기타포괄손익에 반영됩니다. 뿐만 아니라 투자회사의 사업악화 등에 따라 지분증권의 공정가치가 크게 하락할 경우 손상 및 감액손실이 발생할 수도 있습니다. 존속회사는 관계기업 및 공동기업의 R&D 지속 등으로 2024년 1분기 109억원의 지분법 손실을 기록하였으며, 2023년에는 366억원의 지분법 손실을 기록하였습니다. 특히 존속회사의 관계회사들이 주로 영위하는 바이오의약품 개발 관련 산업은 불확실성이 높은 산업으로 바이오 시장 및 산업의 상황이 불리하게 변화하거나, 개발중인 파이프라인이 계획대로 진행되지 않을 경우 존속회사 지분법 손익에 반영되어 존속회사 재무 안정성에 부정적인 영향을 미칠 가능성이 있습니다. |
2024년 1분기 기준, 존속회사의 단순 투자목적을 제외한 종속기업 및 관계/공동기업은 다음과 같습니다.
| [2024
년 1분기 기준 존속회사의 종속회사 및 관계기업/공동기업 개요]
|
| 구분
|
회사명
|
상세내용
|
| 종속기업 |
㈜에스엘포젠 |
2016년 12월 포스텍과 합작 설립한 회사이며, DNA 백신 생산에 대한 CDMO를 주요사업으로 하여 다품좀 소량생산을 통한 환자의 맞춤형 DNA 백신 생산을 위하여 설립되었으며, 23년 매출 90억원이 발생했습니다. 현재 당사가 지분 100%를 보유하여 종속기업으로 분류되어 있습니다.
|
| 관계기업 |
네오이뮨텍 (NeoImmuneTech, Inc.) |
2014년 4월 미국내 면역학을 이용한 바이오의약품 연구/개발 및 판매를 위해 10.5억원(지분율 50.0%)의 투자를 시작으로 현재까지 누적 453억원(지분율 21.2%, 최대주주)의 투자를 진행하고 있습니다. GX-I7 의 임상연구 개발을 위한 다수의 투자자 유치를 통해 적극적인 임상연구개발 활동을 진행중임에 따라, 2022년 604억원, 2023년 552억원의 당기순손실 증가 추세를 보이고 있습니다. 향후 운영자금 현황에 따라 추가적인 투자가 발생할 수 있습니다.
|
| 관계기업 |
Simnogen (Simnogen Biotech Co. Ltd) |
2017년 5월 중국내 바이오의약품 개발 및 사업화를 위하여 총 11.0억원(지분율 49.0%)를 투자하여, Nanjing Bioscikin(51.0%)와 합작하여 설립한 회사입니다. 양사간의 시너지를 위한 다각도 논의가 진행되고 있으며, 회사는 2022년 0.3억원의 당기순이익, 2023년 0.5억원의 당기순손실을 기록하였습니다.
|
| 관계기업 |
KGbio (PT Kalbe-Genexine Biologics) |
2016년 3월 지속형 빈혈치료제 GX-E4의 개발 및 조기 상업화를 위해 인도네시아 제약기업 Kalbe Farma와 공동으로 바이오의약품 합작법인을 설립하고 지분 40.0%(13,200주)를 12.2억원에 취득하였습니다. 지속적인 연구개발 사업활동을 위해 추가적인 투자가 이루어졌으며 현재 총 투자금액은 386.9억원(지분 20.3%) 입니다. 2022년 127억원, 2023년 87억원의 당기순손실이 발생하였으며, 향후 자금 현황에 따라 추가적인 투자가 발생할 수 있습니다.
|
| 관계기업 |
(주)툴젠
|
툴젠은 1999년 설립하여 리서치용 유전자교정 제품 및 서비스를 주된 사업으로 영위하였고 지속적인 연구개발을 통해 ZFN 유전자가위, TALEN 유전자가위 개발에 이어 2012년 CRISPR 유전자가위 개발에 성공하면서 현재의 사업기반을 마련하였습니다. 현재 툴젠은 CRISPR 유전자교정 원천특허를 기반으로 특허수익화 사업 및 유전자교정 기술을 적용한 치료제, 종자 및 동물 관련 제품에 대한 연구개발을 진행하고 있습니다. 제넥신은 현재까지 현물출자와 현금납입을 통해 누적 795억원을 투자하여 14.1% 지분을 보유한 최대주주입니다. |
| 관계기업 |
(주)큐로젠
|
큐로젠은 자가면역질환, B세포 림프종, 비알코올성 지방간염, 기능성 치료 세포주 치료제 소재 및 치료 기술 개발회사로 설립되었습니다.제넥신은 현재까지 누적 30억원을 투자하여 6.2%의 지분율을 보유하였으며, 제넥신 임원이 이사회 인원으로 기재되어 활동하고 있는 관계기업입니다. |
| 관계기업 |
Rezolute, Inc | 2019년 1월 글로벌 신약개발 전략지역 미국의 교두보 확보를 위해, 미국 장외주식시장(OQCOB) 상장사인 Rezolute, Inc의 지분 27.0%(제넥신 27.0%, 한독 27.0% 공동투자)를 139.9억원에 취득하였습니다. 피투자 회사가 가진 기술력에 대한 시너지 효과와 우수한 인적자원 확보를 통해 GX-H9 등 다양한 임상연구개발에 가속화를 기대하고 있습니다. 제넥신은 현재까지 258억원을 투자하여 4.6% 지분율을 보유하고 있습니다. 주요제품 임상 진행에 따라 2022년 556억, 2023년 190억의 당기순손실을 보이고 있습니다.
|
| 공동기업 |
CoImmune, Inc. | 2019년 2월, 미국내 cGMP 시설을 확보하여 MCB/WCB Banking 및 R&D Pipeline 개발을 목적으로 SCM생명과학과 합작회사를 설립하였습니다. 합작회사에서 운영할 cGMP 시설의 투자를 위해 2018년 11월 파산신청을 진행한 Argos Therapeutics Inc. (Durham, NC 소재, Dendritic Cell Vaccine 연구개발 회사(462명): Dendritic Cell Vaccine 임상 3상 실패)의 설비자산을 미국 델라웨어 법원 경매를 통해 cGMP 시설 및 관련 IP를 USD 11,324,330에 취득하였으며 운영자금 USD 1,500,000 을 지분 SCM생명과학 51.0%, 제넥신 49.0%에 따라 배분 투자하였습니다. 제넥신의 현재까지 누적투자금액은 170.0억원이며 22.9% 지분율을 보유하고 있습니다.
|
| 공동기업 |
ILKOGEN | 2013년 12월 호중구감소증치료제 임상개발 및 사업화를 위해 터키 ILKOGEN(ILKOGEN Ilac Sanayi ve Ticaret A.S.)의 지분 50.0%를 2.6억원에 취득하였습니다. 현재까지 총 95.0억원(지분 50.0%)를 투자하고 있습니다. 2022년 0.2억원, 2023년 0.2억원의 당기순손실이 발생하고 있습니다.
|
| 출처: 존속회사 제공 |
2024년 1분기 기준 존속회사는 1개의 종속회사(주식회사 에스엘포젠)를 보유하고 있었으나 증권신고서 제출 전일 기준 청산이 완료된 상태입니다. 에스엘포젠은 DNA 백신 CDO 회사로, 2016년 12월 15일 존속회사와 포스텍(포항공과대학교)이 합작해 설립되었습니다. 에스엘포젠을 설립하게 된 배경으로는 존속회사와 동남아시아 대형 제약사인 칼베 파르마(인도네시아 소재)가 공동 투자해 존속회사가 개발 중인 DNA 백신 생산시설 확보를 위해 추진 되었으며, 이를 위해 존속회사는 내부
생산기술연구소의 연구인력 및 일부를 에스엘포젠으로 이전하였으며 플라스미 DNA 기반 CDMO 사업을 영위하였습니다. 단, 직원들의 퇴사가 이어졌고 최초 목표했던 사업영역을 충실히 이행할 수 없다는 판단 아래, 이에 따라 청산을 진행하였습니다. 2024년 06월 07일자로 청산 종결을 위한 임시주주총회를 개최하였고, 이후 청산종결등기가 완료되었으며, 잔여 재산 100%는 존속회사로 배분되었습니다.
한편, 존속회사는 상기한 연결대상 종속회사 외에도 경영참여를 목적으로 지분을 취득하여 지분법을 적용하고 있는 기업이 존재합니다. 존속회사가 지분법을 적용하고 있는 관계기업 및 공동기업은 8개사로, 2024년 1분기 기준 세부 내용은 다음과 같습니다.
| [2024
년 1분기 기준 존속회사의 관계기업 및 공동기업 현황]
|
| 구분 | 회사명 | 소재지 | 주요 영업활동 |
|---|---|---|---|
| 관계기업 |
네오이뮨텍 (NeoImmuneTech, Inc.)(주3)
|
미국 |
면역학을 이용한 바이오의약품 연구/개발 및 판매 |
| 관계기업 |
Simnogen (Simnogen Biotech Co. Ltd) | 중국 |
중국, 글로벌 임상개발 및 사업화 |
| 관계기업 |
KGbio (PT Kalbe-Genexine Biologics) | 인도네시아 |
아세안, 글로벌 임상개발 및 사업화 |
| 관계기업 |
㈜툴젠(주1,주3) |
대한민국 |
유전자교정 연구개발 및 유전자교정 기술 기반 치료 개발 및 품종개량 |
| 관계기업 |
㈜큐로젠(주2) |
대한민국 |
유전자 및 단백질을 이용한 치료제 개발 |
| 관계기업 |
Rezolute, Inc(주1)
|
미국 |
글로벌 임상개발 및 사업화 |
| 공동기업 |
CoImmune, Inc. | 미국 |
글로벌 임상개발 및 사업화 |
| 공동기업 |
ILKOGEN | 터키 |
글로벌 임상개발 및 사업화 |
|
주1: 지분율 20% 미만이나, 주주간약정에 따라 유의적인 영향력이 있는 것으로 판단하여 관계기업으로 분류하였습니다.
주2: 당사 임원이 피투자회사의 사외이사를 겸직하고 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업으로 분류하였습니다.
주3: 당분기말 현재 ㈜툴젠 985,721주와 NeoImmuneTech, Inc. 20,936,000주는 보호예수로 인해 매각이 제한되어 있습니다.
주4: KinGen Biotech, Inc는 보유주식주 전량 매도하였습니다. |
2024년 1분기말 기준, 존속회사의 관계기업 등 투자내역은 취득금액이 2,282억인데 반해, 장부금액은 1,321억으로 투자금에 비해 2024년 1분기말 기준 가치가 961억원 가량 하락하였습니다. 특히, 공동기업인 CoImmune(Colmmune, Inc), ILKOGEN(ILKOGEN)의 장부가치는 0원으로 표기되었으며 해당 기업에 투자한 자금을 회수할 가능성이 지극히 적은 것으로 판단했기 때문입니다. 존속회사가 관계, 공동기업 투자에 나선 것은 해당 기업들의 성장 가능성을 높게 판단했기 때문이나, 코로나19 엔데믹 전환으로 바이오 시장 전체가 어려움을 겪으며, 투자 기업들의 가치도 하락하고 이익 창출력도 제한되었습니다. 존속회사 역시, 2023년 6월 합작사 아지노모도제넥신 지분을 일본 파트너사인 아지노모도에 전량 매각하여 193억원을 확보하는 등, 손실이 크거나, 저평가된 관계, 공동기업 추가 매각을 내부적으로 적극 검토할 예정입니다.
| [2024
년 1분기 기준 존속회사의 종속회사 및 관계기업/공동기업 개요]
|
| (단위: 천원)
|
| 구 분 |
회 사 명 |
지분율(%) |
취득금액 |
장부금액 |
장부금액 - 취득금액 |
향후 추가 예상 손실 및 대책
|
최대주주 (최대주주와의 관계) |
| 관계 기업 |
네오이뮨텍(NeoImmuneTech,Inc.) | 21.18% | 45,246,777 | 23,628,837 | -21,617,940 | 네오이뮨텍은 항암제 개발에서 희귀질환 치료제로 신약 개발의 중심축을 옮기는 등, 상업화를 위한 FDA 허가에 집중하고 있습니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다. |
현 최대주주 : 제넥신 |
| 관계 기업 |
Simnogen (Simnogen Biotech Co. Ltd) | 49.00% | 1,102,598 | 772,218 | -330,380 | Simnogen은 중국 심시어그룹과 함께 설립한 조인트벤처로, 중국 내 자궁경부암 치료백신 개발을 진행하기 위한 목적으로 설립되었습니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다. |
현 최대주주 : 심시어그룹(중국, 51%), 제넥신(49%) |
| 관계 기업 |
KGbio (PT Kalbe-Genexine Biologics) | 20.32% | 38,694,175 | 37,679,062 | -1,015,113 | KGbio는 인도네시아 칼베 파르마사와 제넥신이 합작 설립한 조인트벤처로, 신성빈혈 치료제 개발을 진행하고 있습니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다. |
현 최대주주 : 칼베 파르마(인도네시아, 64%) |
| 관계 기업 |
㈜툴젠
|
14.10% | 79,480,998 | 61,321,945 | -18,159,053 | 툴젠은 유전자 가위 기술 분야에서 1세대 ZFN 부터 2세대 TALEN에 이어 가장 최신의 3세대 CRISPR-Cas9까지 개발한 회사입니다. 다만, 치료제 개발 등의 사업화가 지연되며 최근 5년간의 연도별 매출이 20억원 미만을 기록하는 등 수익화에 어려움을 겪고 있습니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다. |
현 최대주주 : 제넥신 |
| 관계 기업 |
㈜큐로젠
|
6.16% | 3,000,180 | 2,408,254 | -591,926 | 2019년 설립된 ㈜큐로젠은 난치성질환 혁신신약 개발 전문 바이오 벤처기업으로, 자가면역질환, 비알코올성 지방간염, B세포 림프종 등 대표 난치성질환의 고효율 분자표적들에 대한 치료 원천기술을 바탕으로 비알콜성지방간염(NASH) 및 자가면역질환 혁신신약 후보물질의 비임상 및 임상을 진행하고 있습니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다. |
제넥신은 2020년 11월 전략적 투자 계약을 체결하여 큐로젠 지분을 인수하였습니다. |
| 관계 기업 |
Rezolute, Inc
|
4.55% | 25,827,875 | 6,271,170 | -19,556,705 | Rezolute는 희귀, 대사 질환에 대한 표적 치료제를 개발하고 있는
미국의 바이오벤처입니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다.
|
현 최대주주 : Federated Global Investment Management Corp(19.76%). |
| 공동 기업 |
CoImmune, Inc | 22.94% | 25,374,549 | - | -25,374,549 | CoImmune은 급성 림프구성 백혈병, 전이성 신장암 치료제 등을 개발하는 회사로, SCM생명과학과 제넥신이 공동 투자한 미국의 바이오벤처입니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생하거나 추가적인 자금지원이 필요할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다. |
현 최대주주 : SCM생명과학(23.8%) |
| 공동 기업 |
ILKOGEN | 50.00% | 9,500,093 | - | -9,500,093 | ILKOGEN은 2013년 튀르키예 제약사 일코와 함께 설립한 조인트벤처로, 다국가 임상 3상 등을 주도할 계획을 가지고 있습니다. 향후 기업가치에 대해서는 예상할 수 없으나, 기업가치의 훼손이 발생하거나 추가적인 자금지원이 필요할 경우, 존속회사의 재무건전성에 부정적 영향을 미칠 수 있습니다. | 제넥신, 일코 공동기업(각 50%) |
| 합 계 |
|
- | 228,227,245 | 132,081,486 | -96,145,759 |
- |
- |
2019년 11월 존속회사가 CDMO 사업 목적으로 설립했던 'KinGen Biotech, Inc'는 Covid-19 시국을 맞이하여 지속적인 경영 악화 및 임직원 대부분의 퇴사로 존속회사가 보유했던 전체 지분을 최대주주인 'KinGen Holdings'에 2024년 01월 23일 전량 양도하였습니다. 2024년 1분기 기준 관계기업 및 공동기업의 요약 재무정보는 다음과 같습니다.
| [2024년 1분기 기준 존속회사 관계기업 및 공동기업의 요약 재무정보] |
| (단위: 천원) |
| 구 분 | 회 사 명 | 자 산 | 부 채 | 매 출 | 당분기순손익 | 총포괄손익 | ||
|---|---|---|---|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |||||
| 관계기업 | 네오이뮨텍 (NeoImmuneTech, Inc.) | 65,138,771 | 15,454,056 | 11,084,545 | 2,398,453 | - | (12,233,508) | (11,525,438) |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 1,397,684 | 186,937 | 8,665 | - | - | (13,749) | (13,749) |
| 관계기업 | KGbio (PT Kalbe-Genexine Biologics) | 87,941,743 | 183,598,496 | 16,375,661 | 51,993,278 | 6,991,284 | 2,706,403 | 2,706,403 |
| 관계기업 | ㈜툴젠 | 64,821,126 | 25,371,503 | 2,259,607 | 61,993,557 | 121,121 | (4,674,046) | (4,610,123) |
| 관계기업 | ㈜큐로젠 | 4,499,659 | 1,441,240 | 72,080 | 254,195 | 1,164 | (1,306,356) | (1,306,356) |
| 관계기업 | Rezolute, Inc | 129,406,110 | 8,168,342 | 10,785,174 | 3,251,175 | - | (18,468,648) | (18,155,283) |
| 공동기업 | CoImmune, Inc | 2,292,961 | 4,867,338 | 1,874,227 | 1,068,851 | - | (28,424,478) | (28,424,478) |
| 공동기업 | ILKOGEN | 352,967 | 2,731,882 | 986,703 | - | - | (2,224) | (2,224) |
| 출처: 존속회사 정기보고서 |
존속회사의 2024년 1분기 중 관계기업투자 변동내역은 다음과 같습니다.
| [2024년 1분기 기준 관계기업투자 변동내역] |
| (단위: 천원) |
| 구분 | 회사명 | 기초 | 취득 | 처분및배당 | 지분법손익 | 지분법 자본변동등 |
기말 | ||
|---|---|---|---|---|---|---|---|---|---|
| 지분법손익 | 손상차손 | 처분손익 (주1) |
|||||||
| 관계기업 | 네오이뮨텍(NeoImmuneTech,Inc.) | 24,597,420 | - | - | (2,224,107) | - | - | 1,255,524 | 23,628,837 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 758,409 | - | - | (6,737) | - | - | 20,546 | 772,218 |
| 관계기업 | KGbio (PT Kalbe-Genexine Biologics) | 36,715,556 | - | - | 287,381 | - | - | 676,125 | 37,679,062 |
| 관계기업 | ㈜툴젠 | 62,473,148 | - | - | (1,129,565) | - | (32,109) | 10,471 | 61,321,945 |
| 관계기업 | ㈜큐로젠 | 2,487,821 | - | - | (79,566) | - | - | - | 2,408,255 |
| 관계기업 | Rezolute, Inc | 2,330,924 | - | - | (840,316) | 4,375,816 | (48,134) | 452,879 | 6,271,169 |
| 공동기업 | CoImmune, Inc | - | - | - | - | - | - | - | - |
| 공동기업 | ILKOGEN | - | - | - | - | - | - | - | - |
| 합 계 | 129,363,278 | - | - | (3,992,910) | 4,375,816 | (80,243) | 2,415,545 | 132,081,486 | |
| 주1: 주식매수선택권 행사 등으로 인한 지분율 감소 시 처분손익으로 인식한 금액입니다. 주2: 지분법손실 및 손상차손으로 반영한 누적금액은 미실현이익 대비 손실금액입니다. 출처: 존속회사 정기보고서 |
관계기업 및 공동기업 투자주식의 경우 지분법 회계처리를 적용받으며, 지분법이 적용되는 투자자산의 경우 해당 관계기업의 손익 및 자본변동은 존속회사가 보유한 지분에 비례하는 만큼 법인세비용차감전이익 및 기타포괄손익에 반영됩니다. 뿐만 아니라 투자회사의 사업악화 등에 따라 지분증권의 공정가치가 크게 하락할 경우 손상 및 감액손실이 발생할 수도 있습니다.
2020년 이후, 존속회사가 신규로 취득한 타법인 투자 금액은 약 1,212억 이었으며, 관련해 지분법손실 및 손상차손으로 반영한 누적 금액은 약 1,367억원으로 존속회사의 수익성에 부정적인 영향을 미치고 있습니다. 이처럼, 신약 파이프라인 확보 등 사업권과 네트워크 강화 등의 목적으로 존속회사가 취득한, 또는 취득할 타법인 투자 건과 관련하여, 투자 지분의 가치 변동에 따라 존속회사 수익성 및 재무건전성에 부정적인 영향을 미칠 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다.
| [
연도별 타법인 투자 현황]
|
| (단위: 천원)
|
| 구분 | 2020 년 | 2021 년 | 2022 년 | 2023 년 | 2024 년 1분기 |
|---|---|---|---|---|---|
| 기초 금액 |
96,825,690 | 193,990,634 | 206,567,467 | 162,639,605 | 129,363,278 |
| 취득 금액 |
96,353,565 | 24,123,333 | 756,000 | - | - |
| 처분 및 배당 |
- | - | (433,751) | (10,061,851) | - |
| 지분법손익 |
(14,752,744) | (33,912,994) | (34,294,710) | (31,372,182) | -3,992,910 |
| 손상차손 |
- | (12,048,852) | (15,776,665) | 5,115,959 | 4,375,816 |
| 처분손익 |
21,072,473 | 24,488,158 | (59,997) | (510,625) | -80,243 |
| 지분법 자본변동 등 |
(5,508,351) | 9,927,188 | 5,881,261 | 3,552,371 | 2,415,545 |
| 기말 |
193,990,634 | 206,567,467 | 162,639,605 | 129,363,277 | 132,081,486 |
| 출처: 존속회사 정기보고서
|
존속회사는 관계기업 및 공동기업의 R&D 지속 등으로 2024년 1분기 109억원의 지분법 손실을 기록하였으며, 2023년에는 366억원의 지분법 손실을 기록하였습니다. 특히 존속회사의 관계회사들이 주로 영위하는 바이오의약품 개발 관련 산업은 불확실성이 높은 산업으로 바이오 시장 및 산업의 상황이 불리하게 변화하거나, 개발중인 파이프라인이 계획대로 진행되지 않을 경우 존속회사 지분법 손익에 반영되어 존속회사 재무 안정성에 부정적인 영향을 미칠 가능성이 있습니다.
상기한 바와 같이, 존속회사는 사업 다각화를 통해 성장을 도모하고자 존속회사 본원 사업과는 다른 사업을 영위하고 있는 다양한 기업의 지분 취득 또는 신규 설립 등의 방법으로 투자하고 있습니다. 그러나 존속회사의 종속기업 및 관계기업/공동기업이 존속회사의 연결기준 안정성 및 수익성을 더욱 악화시키고 있으며, 향후 종속기업 및 관계기업/공동기업의 사업환경이 악화되어 경영실적이 더욱 부진해질 경우 존속회사의 경영실적에도 부정적인 영향을 끼칠 수 있습니다. 또한, 종속기업 및 관계기업의 경영 환경이 지속적으로 악화될 경우 존속회사는 해당 기업에 자금을 대여하거나 신용공여, 담보 제공 및 연대 보증 등의 방법으로 지원할 수 있으며, 해당 기업들의 안정성 및 유동성 위험이 존속회사에도 전이될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 나-9. 특수관계자 거래 위험 존속회사는 최근 3개년 및 2024년 1분기 기준 관계기업, 공동기업, 기타특수관계자와 매출, 매입, 채권채무 거래 내역이 존재하며, 특수관계자와의 매출 거래 금액은 2024년 1분기 1,999백만원, 2023년 2,284백만원, 2022년 11,430백만원, 2021년 31,398백만원으로 매출액 대비 특수관계자 매출은 순서대로 96.41%, 51.59%, 70.82%, 85.30%로 높은 수준입니다. 이 중 대부분은 기술이전, 연구용역 제공 수입 및 시료생산 판매 등으로 존속회사의 관계기업인 네오이뮨텍(NeoImmuneTech, Inc.), KGbio에서 발생하였습니다. 존속회사의 글로벌 파트너쉽 확보 및 임상/사업개발 역량 향상에 따라 존속회사의 관계기업 등에 대한 매출의존도는 추후 감소할 것으로 예상합니다. 하지만, 관계기업 등에 대한 매출은 존속회사가 보유한 지분율에 따라 지분법손익으로 차감되기 때문에 기술이전 기술료의 수익성이 낮아지게 되므로 투자자께서는 이점 유의하시기 바랍니다. |
존속회사는 최근 3개년 및 2024년 1분기 기준 관계기업, 공동기업, 기타특수관계자와 매출, 매입, 채권채무 거래 내역이 존재하며, 특수관계자와의 매출 거래 금액은 2024년 1분기 1,999백만원, 2023년 2,284백만원, 2022년 11,430백만원, 2021년 31,398백만원으로 매출액 대비 특수관계자 매출은 순서대로 96.41%, 51.59%, 70.82%, 85.30%로 높은 수준입니다. 이 중 대부분은 기술이전, 연구용역 제공 수입 및 시료생산 판매 등으로 존속회사의 관계기업인 네오이뮨텍(NeoImmuneTech, Inc.), KGbio에서 발생하였습니다. 특수관계자 매출 내역은 다음과 같습니다.
| [존속회사의 특수관계자 매출 내역] |
| (단위: 백만원) |
| 연도 | 특수관계자 구분 | 특수관계자명 | 특수관계자 매출 | 연결기준 매출액 | 매출액 대비 | 매출 내용 |
| 2024년 1분기 | 관계기업 | 네오이뮨텍 | 1,531 | 2,073 | 96.41% | 시료생산 판매, 위탁개발 |
| 관계기업 | KGbio | 467 | GX-E4 임상용역 매출 | |||
| 소계 | 1,999 | |||||
| 2023년 | 관계기업 | 네오이뮨텍 | 2,280 | 4,427 | 51.59% | 시료생산 판매, 위탁개발 |
| 관계기업 | KGbio | 4 | 시료생산 판매 | |||
| 소계 | 2,284 | |||||
| 2022년 | 관계기업 | 네오이뮨텍 | 1,371 | 16,139 | 70.82% | 시료생산 판매, 위탁개발 |
| 관계기업 | KGbio | 10,060 | GX-E4 기술이전 매출 | |||
| 소계 | 11,430 | |||||
| 2021년 | 관계기업 | 네오이뮨텍 | 1,487 | 36,828 | 85.30% | 시료생산 판매, 위탁개발 |
| 관계기업 | KGbio | 29,911 | GX-I7 기술이전 매출 | |||
| 소계 | 31,398 | |||||
| 출처: 존속회사 제공 |
존속회사의 특수관계자 매출거래 비중이 높은 이유는 현지 바이오의약품 개발 및 상용화와 관련된 사업전략에 기인합니다. 각 지역별, 국가별로 바이오의약품 개발 및 출시규제가 상이하기 때문에, 현지 제약/바이오 회사와 제휴하여 해외 합작회사를 설립 후, 해당 회사에 기술 수출하는 전략으로 초기 해외사업화를 추진하였습니다.
한편, 존속회사는 상법 상 금지되는 주요주주 등 이해관계자와의 거래내역이 없으며, 존속회사의 특수관계자 대상으로 추가적인 자금 지원이 계획된 바도 없습니다. 추후 관련 내용이 현실화 될 경우 공시 등을 통해 성실히 안내할 예정입니다.
상장회사는 상법 제542조의 9에 따라, 주요 주주 등 이해관계자와의 거래에 있어서 금지되는 사항이 있으며, 존속회사는 해당 상법 상 제약사항을 성실히 검토하여 수행하고 있습니다.
| 상법 제542조의 9(주요주주 등 이해관계자와의 거래) |
|
① 상장회사는 다음 각 호의 어느 하나에 해당하는 자를 상대방으로 하거나 그를 위하여 신용공여(금전 등 경제적 가치가 있는 재산의 대여, 채무이행의 보증, 자금 지원적 성격의 증권 매입, 그 밖에 거래상의 신용위험이 따르는 직접적ㆍ간접적 거래로서 대통령령으로 정하는 거래를 말한다. 이하 이 조에서 같다)를 하여서는 아니 된다. <개정 2011. 4. 14.>
1. 주요주주 및 그의 특수관계인
2. 이사(제401조의2제1항 각 호의 어느 하나에 해당하는 자를 포함한다. 이하 이 조에서 같다) 및 집행임원
3. 감사
② 제1항에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우에는 신용공여를 할 수 있다. <개정 2011. 4. 14.> 1. 복리후생을 위한 이사ㆍ집행임원 또는 감사에 대한 금전대여 등으로서 대통령령으로 정하는 신용공여
2. 다른 법령에서 허용하는 신용공여
3. 그 밖에 상장회사의 경영건전성을 해칠 우려가 없는 금전대여 등으로서 대통령령으로 정하는 신용공여
③ 자산 규모 등을 고려하여 대통령령으로 정하는 상장회사는 최대주주, 그의 특수관계인 및 그 상장회사의 특수관계인으로서 대통령령으로 정하는 자를 상대방으로 하거나 그를 위하여 다음 각 호의 어느 하나에 해당하는 거래(제1항에 따라 금지되는 거래는 제외한다)를 하려는 경우에는 이사회의 승인을 받아야 한다. 1. 단일 거래규모가 대통령령으로 정하는 규모 이상인 거래
2. 해당 사업연도 중에 특정인과의 해당 거래를 포함한 거래총액이 대통령령으로 정하는 규모 이상이 되는 경우의 해당 거래
④ 제3항의 경우 상장회사는 이사회의 승인 결의 후 처음으로 소집되는 정기주주총회에 해당 거래의 목적, 상대방, 그 밖에 대통령령으로 정하는 사항을 보고하여야 한다. ⑤ 제3항에도 불구하고 상장회사가 경영하는 업종에 따른 일상적인 거래로서 다음 각 호의 어느 하나에 해당하는 거래는 이사회의 승인을 받지 아니하고 할 수 있으며, 제2호에 해당하는 거래에 대하여는 그 거래내용을 주주총회에 보고하지 아니할 수 있다. 1. 약관에 따라 정형화된 거래로서 대통령령으로 정하는 거래
2. 이사회에서 승인한 거래총액의 범위 안에서 이행하는 거래 [본조신설 2009. 1. 30.]
|
존속회사의 글로벌 파트너쉽 확보 및 임상/사업개발 역량 향상에 따라 존속회사의 관계기업 등에 대한 매출의존도는 추후 감소할 것으로 예상합니다. 하지만, 관계기업 등에 대한 매출은 존속회사가 보유한 지분율에 따라 지분법손익으로 차감되기 때문에 기술이전 기술료의 수익성이 낮아지게 되므로 투자자께서는 이점 유의하시기 바랍니다.
| 나-10. 최대주주 변동 가능성에 따른 위험 존속회사는 합병 및 주식매수선택권 행사로 인해 희석이 발생하여 최대주주의 지분율이 하락할 수 있습니다. 이로 인해 적대적 M&A 등의 경영권 분쟁이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
존속회사의 최대주주는 증권신고서 제출일 기준 14.57%를 보유한 (주)한독이며, 5% 이상 주주로는 성영철 前대표이사가 5.87%를 보유하고 있습니다. 본 합병 완료 시 존속회사의 최대주주 지분은 14.57%에서 13.25%로 변동될 예정이며, 최대주주의 변경은 없습니다.
또한 존속회사는 최근 5년간 최대주
주가 변동된 이력이 없으나, 향후 규제당국의 인허가 등 합병절차의 원활한 진행여부, 합병의 중장기적 시너지 창출 정도에 따라 본 합병이 합병 후 존속회사에 부정적인 영향을 미칠 가능성이 있기 때문에 투자자께서는 이점 유의하시기 바랍니다.
| [합병 전ㆍ후 최대주주 및 특수관계인의 지분 변동 현황] |
| (기준일: 증권신고서 제출일 전일) | (단위: 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
합병 전 | 합병 후 | ||||
| (주)제넥신 | (주)이피디바이오테라퓨틱스 | (주)제넥신 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | 주식수 | 지분율 | |||
| (주)한독 | 최대주주 | 보통주 | 6,048,534 | 14.57 | - | - | 6,048,534 | 13.25 |
| 최대주주 등 합계 | 보통주 | 6,048,534 | 14.57 | 300,000 | 45.17 | 6,048,534 | 13.25 | |
| 발행주식 총수 | 보통주 | 41,510,594 | 100.00 | 664,160 | 100.00 | 45,642,192 | 100.00 | |
| 주1) 상기 지분율은 보통주 기준입니다. |
| 주2) 합병 후 지분율 및 주식수는 증권신고서 제출일 전일을 기준으로 합병신주 발행 예상 주식수를 적용한 수치이며, 해당 내용은 추후 변동될 수 있습니다. |
| 주3) 존속회사는 증권신고서 제출일 전일 기준 소멸회사의 주식을 보유하고 있지 않아, 합병 신주 배정 여부에 따른 법적 위험이 없습니다. 또한 소멸회사는 증권신고서 제출일 전일 기준 자기주식을 보유하고 있지 않아, 소멸회사의 자기주식에 합병 신주 배정 여부에 따른 법적 위험이 없습니다. |
| 주4) 본 합병 이후 (주)제넥신은 존속법인으로 계속 남아있게 되며, (주)이피디바이오테라퓨틱스는 해산할 예정입니다. |
한편, 존속회사가 임직원에게 부여한 주식매수선택권 중 미행사수량은 증권신고서 제출 전일 현재 594,550주이며 해당 미행사 주식매수선택권은 발행주식총수의 1.43%에 해당하는 수준입니다.
또한, 소멸회사는 설립 이후 임직원에게 31,340주(소멸 제외)의 주식매수선택권을 부여하였습니다. 다만 소멸회사는 본 건 합병을 위한 이사회 전인 2024년 6월 25일에 주식선택권을 부여받은 임직원과의 합의를 통해 주식선택권의 부여를 취소하였습니다. 따라서 소멸회사는 잔존 주식매수선택권이 존재하지 않아 합병 후 존속회사에게 승계되는 주식매수선택권은 없습니다.
향후 존속회사의 주식매수선택권 행사에 따라 발행주식 총수가 증가해 최대주주 (주)한독의 지분율이 일부 하락할 수 있으니 투자자께서는 투자 판단 시 이점 유의하시기 바랍니다. 존속회사와 소멸회사의 임직원에게 부여한 주식매수선택권을 전량 행사했을 때 최대주주 (주)한독의 지분율 시뮬레이션은 다음과 같습니다.
| [합병 전ㆍ후 최대주주 및 특수관계인의 지분 변동 현황] |
| (기준일: 증권신고서 제출일 전일) | (단위: 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
합병 후 | 합병 후 존속회사 주식매수선택권 전량 행사 가정 |
||
| 주식수 | 지분율 | 주식수 | 지분율 | |||
| (주)한독 | 최대주주 | 보통주 | 6,048,534 | 13.25 | 6,048,534 | 13.08 |
| 최대주주 등 합계 | 보통주 | 6,048,534 | 13.25 | 6,048,534 | 13.08 | |
| 발행주식 총수 | 보통주 | 45,642,192 |
100.00 | 46,236,742 |
100.00 | |
상기와 같이 존속회사는 합병 및 주식매수선택권 행사로 인해 희석이 발생하여 최대주주의 지분율이 하락할 수 있습니다. 이로 인해 적대적 M&A 등의 경영권 분쟁이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 나-11. 매출채권 회수지연 및 미회수에 따른 위험 존속회사는 기술이전을 주된 영업으로 하는 회사입니다. 기술이전 매출은 매월 경상적인 형태로 발생하지 않으며, 기술도입 파트너사와의 계약을 통해 특정시점에 대규모로 발생하는 특징을 가지고 있습니다. 따라서 매출채권 회수시간 산정 기준시점에 대규모 기술이전이 발생할 경우, 매출채권회전율 산정계산법 상 매출채권회전율이 지나치게 높아지는 경우가 있습니다. 투자자께서는 이점 참고하시기 바랍니다. 존속회사는 고객의 지급불능 상태에서 발생하는 추정 손실의 회계처리를 위해 대손충당금 계정을 사용하고 있습니다. 대손충당금의 적정성을 평가 시에는 매출채권 잔액의 연령분석, 과거 손상발생 경험, 고객의 신용도 및 결제조건의 변경 등에 근거합니다. 고객의 재무상태가 악화될 경우, 실제 상각금액은 예상금액보다 늘어날 수 있습니다 존속회사는 매출채권 부실 방지를 위해 지속적인 추심 절차를 지속하고 있으며, 현재 주요 매출채권에 대해 특별한 부실 징후가 없는 상황이나, 향후 존속회사 매출채권 관련 충당금 정책에 따라 보유 중인 주요 매출채권의 연령이 1년을 초과할 경우 대손충당금 적립으로 인해 존속회사 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 이점 유의하시기 바랍니다. |
존속회사는 기술이전을 주된 영업으로 하는 회사입니다. 기술이전 매출은 매월 경상적인 형태로 발생하지 않으며, 기술도입 파트너사와의 계약을 통해 특정시점에 대규모로 발생하는 특징을 가지고 있습니다. 따라서 매출채권 회수시간 산정 기준시점에 대규모 기술이전이 발생할 경우, 매출채권회전율 산정계산법 상 매출채권회전율이 지나치게 높아지는 경우가 있습니다. 투자자께서는 이점 참고하시기 바랍니다.
존속회사의 매출채권 회전율과 그에 따른 평균 회수일은 2024년 1분기 0.35회(1,054일), 2023년 0.39회(940일), 2022년 2.33회(157일), 2021년 13.05회(28일)로, 회수에 비교적 오랜 시간이 소요되고 있습니다. 매출채권회전율이 낮다는 것은 매출채권의 회수 기간이 길어져 대손 발생 위험이 증가함을 의미하며, 이로 인한 대손 발생 위험의 확대로 존속회사의 수익성에 부정적인 영향을 미칠 수 있습니다.
| [존속회사의 매출채권 회전율 및 회수기간 현황] |
| 단위: 천원, %, 일 |
|
구분 |
2024년 1분기 |
2023년 |
2022년 |
2021년 |
|
매출액 |
2,073,219 | 4,426,627 | 16,139,032 | 36,828,455 |
|
기초 매출채권 |
11,053,358 | 11,735,947 | 2,111,908 | 3,533,811 |
|
기말 매출채권 |
923,666 | 11,053,358 | 11,735,947 | 2,111,908 |
|
매출채권 평균 |
5,988,512 | 11,394,653 | 6,923,928 | 2,822,860 |
|
매출채권회전율 |
0.35 | 0.39 | 2.33 | 13.05 |
| 매출채권회수기간 | 1,054 | 940 | 157 | 28 |
| 주1: 매출채권회전율 = 매출액 ÷ [(기초 매출채권 + 기말 매출채권) ÷ 2] |
| 주2: 매출채권회수기간 = 365 ÷ 매출채권회전율 |
| 출처: 존속회사 정기보고서 |
존속회사의 2024년 1분기 기준 매출채권 약 9.2억원의 대손충당금 설정률은 37.04%로 높은 수준이며, 2023년에는 2.97%, 2022년 20.11%, 2021년 51.13%를 기록하였습니다. 존속회사는 고객의 지급불능 상태에서 발생하는 추정 손실의 회계처리를 위해 대손충당금 계정을 사용하고 있으며, 대손충당금의 적정성은 매출채권 잔액의 연령분석, 과거 손상 발생 경험, 고객의 신용도 및 결제조건의 변경 등에 근거하여 평가합니다. 존속회사는 매출채권 부실 방지를 위해 지속적인 추심 절차를 지속하고 있으며, 현재 주요 매출채권에 대해 특별한 부실 징후가 없는 상황이나, 향후 존속회사 매출채권 관련 충당금 정책에 따라 보유 중인 주요 매출채권의 연령이 1년을 초과할 경우 대손충당금 적립으로 인해 존속회사 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 이점 유의하시기 바랍니다.
(1) 최근 3개년 및 2024년 1분기 기준 존속회사의 매출채권 및 대손충당금 설정 현황은 다음과 같습니다.
| [존속회사의 매출채권 및 대손충당금 설정 현황] |
| 단위: 천원 |
|
구분 |
2024년 1분기 |
2023년 |
2022년 |
2021년 |
|
매출채권 |
923,666 | 11,053,358 | 11,735,947 | 2,111,908 |
|
차감:대손충당금 |
(342,133) | (327,783) | (2,360,653) | (1,079,800) |
|
대손충당금 설정률 |
37.04% | 2.97% | 20.11% | 51.13% |
|
매출채권순액 |
581,533 | 10,725,575 | 9,375,294 | 1,032,108 |
| 출처: 존속회사 정기보고서 |
당사는 고객의 지급불능 상태에서 발생하는 추정 손실의 회계처리를 위해 대손충당금 계정을 사용하고 있습니다. 대손충당금의 적정성을 평가 시에는 매출채권 잔액의 연령분석, 과거 손상발생 경험, 고객의 신용도 및 결제조건의 변경 등에 근거합니다. 고객의 재무상태가 악화될 경우, 실제 상각금액은 예상금액보다 늘어날 수 있습니다
아래 내역은 대손충당금이 설정된 존속회사의 주요 매출채권이며, 당해 매출채권의 평가에 따라 추가적인 대손충당금이 설정될 위험 역시 상존하고 있음을 투자자께서는 유의하시기 바랍니다. 경상적인 형태의 매출이 발생하지 않는 존속회사의 업종 특성을 감안하더라도, 매출채권회전율 등 존속회사의 활동성 지표가 지속적으로 악화되고 있는 것도 사실입니다. 지속적인 R&D 등 투자를 위한 소요자금이 지속적으로 발생하는 업종 특성 상, 활동성 지표 저하에 따른 수익성 악화는 존속회사 적자폭 지속 및 확대 등 수익성 및 재무건전성에 부정적인 영향을 줄 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 2024년 1분기말 기준, [
대손충당금이 설정된 주요 매출채권 현황]
|
| (단위: 백만원) |
| 채무자명
|
회사와의 관계 |
채권 금액 |
대손충당금 설정금액 |
대손충당금 설정 비율 |
대손충당금 설정 사유 |
채권 회수를 위한 조치 내역
|
향후 추가적인 대손발생 가능성
|
| KinGen Biotech | 전 관계회사 | 337 | (337) | 100% | 관계회사 재무구조 악화에 따른 회수불가 | 매분기별 채권회수절차 진행 | 추가 거래관계 없음 (100% 대손설정 중) |
| 출처: 존속회사 제시 |
(2) 최근 3개년 및 2024년 1분기 기준 매출채권의 연령 및 각 연령별로 손상된 채권 금액은 다음과 같습니다.
| [매출채권의 연령 및 연령별 손상된 채권 금액] |
| 단위: 천원 |
| 구분 | 2024년 1분기 | 2023년 | 2022년 | 2021년 | ||||||||
| 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | |
| 정상채권 | 579,136 | - | 579,136 | 10,723,178 | - | 10,723,178 | 1,264,574 | - | 1,264,574 | 1,032,108 | - | 1,032,108 |
| 3개월 이하 | - | - | - | - | - | - | - | - | - | - | - | - |
| 3개월 초과 6개월 이하 | - | - | - | - | - | - | - | - | - | - | - | |
| 6개월 초과 1년 이하 | - | - | - | - | - | - | 10,138,400 | (2,027,680) | 8,110,720 | - | - | - |
| 1년 초과 | 344,530 | (342,133) | 2,397 | 330,180 | (327,783) | 2,397 | 332,973 | (332,973) | - | 1,079,800 | (1,079,800) | - |
| 합 계 | 923,666 | (342,133) | 581,533 | 11,053,358 | (327,783) | 10,725,575 | 11,735,947 | (2,360,653) | 9,375,294 | 2,111,908 | (1,079,800) | 1,032,108 |
| 주1: 매출채권의 기간 구분은 연체일을 기준으로 구분하였습니다. |
| 주2: 매출채권 10,138,400천원이 2024년 1월 말 회수되었습니다. |
| 출처: 존속회사 정기보고서 |
| 나-12. 관리종목 지정에 따른 위험 존속회사는 향후 매출액 및 법인세비용차감전계속사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있고, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니다. |
존속회사는 2008년 12월 기술보증기금과 생명공학연구원으로부터 기술평가를 받아 2009년 09월 코스닥시장에 상장하였습니다. 존속회사는 국내외 주요 파트너로의 기술이전과 연구용역을 통하여 매출을 시현하고 있으나, 글로벌 임상시험 인원확충에 따른 인건비 증가, 연구개발비용 발생 등으로 설립 이후 현재까지 지속적으로 영업손실을 기록하고 있습니다.
존속회사는 2011년 매출액 26.6억원을 기록하여 코스닥시장상장규정에 따른 매출액 30억원 이상 요건을 충족시키지 못해 2012년 03월 21일 관리종목에 지정된 바 있습니다. 다만 2012년 기술이전 및 용역수입 증가로 매출액 63.4억원을 기록하여 2013년 03월 08일 관리종목 지정이 다시 해제되었습니다. 존속회사는 해당년도 이후 연간 매출이 지속적으로 30억원을 상회하였으며, 증권신고서 제출 전일까지 매출액 요건 이외에 다른 사유로 인해 관리종목이 지정된 사례는 없습니다.
다만, 존속회사는 향후 매출액 및 법인세비용차감전계속사업손실 요건, 자본잠식 요건 등을 충족하지 못할 경우 관리종목으로 지정될 가능성이 있으며, 관리종목으로 지정된 다음 해에도 같은 요건을 충족하지 못할 경우 다시 상장적격성 실질심사 대상이 될 수 있고, 심사 여부에 의거하여 상장폐지가 될 가능성이 있습니
다. 존속회사 대상
코스닥시장 관리종목 지정 사유 및 퇴출 요건에 대한 검토결과는 다음과 같습니다.
| 구분 | 관리종목 | 상장적격성 실질심사 | 형식적 상장폐지 | |
| 매출액(별도) | 요 건 | - 최근 사업연도 30억원 미만(지주회사는 연결 기준) - 기술성장기업(우량기업부 기업 제외) 및 이익미실현기업은 상장일 속한 사업연도 포함 5개 사업연도에 미적용 |
관리종목으로 지정된 다음 해에도 매출액 30억원 미달 사유 발생 | - |
| 검토결과 | 2021년 매출액 : 383억원 (→ 해당사항 없음) 2022년 매출액 : 159억원 (→ 해당사항 없음) 2023년 매출액 : 39억원 (→ 해당사항 없음) |
|||
| 해당여부 | 없음 | 없음 | ||
| 법인세비용차감전 계속사업손실 (비지배지분 제외) |
요 건 | -자기자본 50% 초과(&10억원 이상)의 법인세비용차감전계속사업손실이 최근 3년간 2회 이상(& 최근 사업연도 법인세비용차감전계속사업손실 발생) - 기술성장기업(우량기업부 기업 제외) 상장일 속한 사업연도 포함 3개 사업연도 미적용, 이익미실현 기업 상장일 속한 사업연도 포함 5개 사업연도 미적용 |
관리종목으로 지정된 다음 해에도 자기자본 50% 초과 & 10억원 이상의 법인세비용차감전계속사업손실 발생 | - |
| 검토결과 | 2021년 법인세비용차감전계속사업손실 : 480억원(손실률 9.25% → 해당사항 없음) 2022년 법인세비용차감전계속사업손실 : 560억원(손실률 20.18% → 해당사항 없음) 2023년 법인세비용차감전계속사업손실: 669억원(손실률 22.52% → 해당사항 없음) |
|||
| 해당여부 | 없음 | 없음 | ||
| 자본잠식(연결) | 요 건 | 최근 사업연도 말 자본잠식률 50% 이상 | 관리종목으로 지정된 다음 해에도 자본잠식률 50% 이상 발생 | 최근 사업연도 전액 자본잠식 |
| 검토결과 | 2023년말 자본금: 208억원 2023년말 자기자본(비지배지분 제외): 2,966억원 |
|||
| 해당여부 | 없음 | 없음 | ||
| 자기자본 미달 (연결, 비지배지분 제외) |
요 건 | 최근 사업연도 말 자기자본 10억원 미만 | 관리종목으로 지정된 다음 해에도 자기자본 10억원 미만 발생 | |
| 검토결과 | 2023년말 자기자본(비지배지분 제외): 2,966억원 | |||
| 해당여부 | 없음. | 없음. | ||
| 감사의견 | 요 건 | - | - | 최근 사업연도 감사의견 비적정(부적정ㆍ의견거절ㆍ범위제한 한정) |
| 검토결과 | - | - | 2023년 감사의견 : 적정 | |
| 해당여부 | - | - | 없음. | |
| 시가총액 | 요 건 | 시가총액이 40억원 미만인 상태가 연속하여 30일 지속 | 관리종목 지정 후 90일 간 "연속 10일 & 누적 30일 이상 시가총액 40억원 이상"의 조건을 미충족 | |
| 정기보고서 미제출 | 요 건 | 분기, 반기, 사업보고서를 법정제출기한 내 미제출 | 2년간 3회 이상 분기, 반기, 사업보고서를 법정제출기한 내 미제출 | |
| 사업보고서 법정제출기한 후 10일 내 미제출 | ||||
| 분기, 반기, 사업보고서 미제출로 관리종목 지정된 상태에서 분기, 반기, 사업보고서를 미제출 | ||||
| 거래량 | 요 건 | 분기 월평균 거래량이 유동주식 수의 1%에 미달 | 2분기 연속 | |
| 월간 거래량 1만주, 소액주주 300인 이상이 20% 이상 지분 보유 등은 적용 배제 | ||||
| 지분분산 | 요 건 | 최근 사업연도 말 기준 소액주주 200인 미만 또는 소액주주의 지분이 20% 미만 | 2년 연속 | |
| 300인 이상의 소액주주가 유동주식수의 10%이상으로서 100만주 이상 소유하는 경우 제외 | ||||
| 불성실공시 | 요 건 | - | 1년 간 불성실공시 벌점 15점 이상 | |
| 지배구조 | 요 건 | 사외이사/감사위원회 요건 미충족 | 2년 연속 | |
| 회생절차/파산신청 | 요 건 | 회생절차 개시 신청 또는 파산신청 | 개시신청 기각, 결정 취소, 회생계획 불인가 등 | |
| 재무관리 위반 | 요 건 | 변경/추가 상장이 유예된 기간 중에 증권의 발행 및 공시 등에 관한 규정에 따른 재무관리 기준을 위반한 경우 | ||
| 기타 상장폐지 사유 | 요 건 | 모든 상장폐지 사유(형식 상장폐지 및 상장적격성 실질심사 대상 결정)가 발생한 경우 관리종목 지정 | 최종 부도 또는 은행거래정지 | |
| 해산사유(피흡수합병, 파산선고) | ||||
| 정관 등에 주식양도 제한을 두는 경우 | ||||
| 유가증권시장 상장의 경우 | ||||
| 우회상장시 우회상장 관련 규정 위반 시 (심사 종료 전 기업결합 완료 및 의무보유 위반 등) |
||||
| 주) 코스닥시장상장규정 제3조(회계처리기준 및 재무제표 적용기준)에 의거하여, 연결재무제표를 기준으로 하는 때에는 법인세비용차감전계속사업손실과 자기자본은 비지배지분을 제외한 금액을 기준으로 기재 |
(1) 매출액 미달 여부 검토
| [매출액 미달 여부 검토] | |
| (K-IFRS, 별도) | (단위 : 백만원) |
| 구분 | 2023년 | 2022년 | 2021년 |
| 매출액 | 3,871 | 15,887 | 38,320 |
| 출처: 존속회사 정기보고서 |
「코스닥시장 상장규정」 제53조1항1호에 따라 최근 사업연도의 매출액이 30억원 미만일 경우 관리종목으로 지정되게 됩니다. 존속회사는 2009년 상장 이후 2011년까지 매출액 요건 30억원에 미달하였으나, 이후 기술이전 등으로 매출이 상승해 2012년부터 최근 사업연도까지 지속적으로 매출액이 30억원을 상회하고 있습니다. 존속회사의 최근 3개년 매출액은 2021년 383억원, 2022년 159억원, 2023년 39억원입니다.
또한 존속회사는 「제약산업 육성 및 지원에 관한 특별법」 제2조제3호에 따른 혁신형 제약기업에 선정되어 「코스닥시장 상장규정」 제53조1항1호나목에 따라 유효기간이 만료되는 2026년 11월 27일까지 최근사업연도의 매출액 미달 요건으로 인한 관리종목 지정이 유예되며, 재인증 심사가 승인될 경우 이 기간은 연장될 수 있습니다. 단, 라이선스 아웃 실패 등의 사유로 존속회사의 매출 감소 또는 혁신형제약기업 재인증 실패의 경우 향후 관리종목 지정 가능성이 있음을 투자자께서는 유의하여 주시기 바랍니다.
(2) 법인세비용차감전계속사업손실 발생 여부 검토
| [법인세비용차감전계속사업손실 발생 여부 검토] | |
| (K-IFRS, 연결) | (단위 : 백만원) |
| 구분 | 2023년 | 2022년 | 2021년 |
| 법인세비용차감전계속사업손실 | (66,874) | (55,974) | (48,042) |
| 자기자본 | 296,904 | 277,394 | 519,459 |
| 법인세비용차감전순이익/자기자본 | -22.52% | -20.18% | -9.25% |
| 주) 법인세비용차감전계속사업손실은 비지배지분을 제외한 금액 출처: 존속회사 정기보고서 |
「코스닥시장 상장규정」 제53조1항2호에 따라 최근 3사업연도 중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근 사업연도에 법인세비용차감전계속사업손실이 있는 경우 관리종목으로 지정되게 됩니다.
존속회사는 최근 3사업연도(2021년~2023년) 중 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 발생한 적 없어 해당사항 없습니다.(2021년 -9.25%, 2022년 -20.18%, 2023년 -22.52%)
(3) 자본잠식 여부 검토
| [자본잠식 여부 검토] | |
| (K-IFRS, 연결) | (단위 : 백만원) |
| 구분 | 2023년 | 2022년 | 2021년 |
| 자기자본 | 296,904 | 277,394 | 519,459 |
| 자본금 | 20,755 | 12,572 | 12,515 |
| 자본잠식여부 | 미해당 | 미해당 | 미해당 |
| 감사의견 | 적정 | 적정 | 적정 |
| 출처: 존속회사 정기보고서 |
「코스닥시장 상장규정」 제53조1항4호에 따라 최근 사업연도 말을 기준으로 자본잠식률 50% 이상인 경우 관리종목으로 지정됩니다. 존속회사는 최 근 사업연도 말 기준 자본잠식 상태가 아니므로 자본잠식 요건에 의한 관리종목 지정요건에 해당하지 않습니다. 그러나 향후에도 지속적으로 최근 3년간 비슷한 수준의 당기순손실이 지속될 경우 자본잠식으로 인한 관리종목 지정 가능성이 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(4) 시가총액 미달여부 검토
「코스닥시장 상장규정」 제53조1항5호에 따라 보통주 시가총액 40억원 미만이 30일간 지속되는 경우 관리종목으로 지정됩니다. 존속회사의 2023년 시가총액은 최고 653,652백만원, 최저 310,914백만원, 평균 447,871백만원으로 시가총액 40억원 미만을 기록한 바가 없어 관리종목 지정요건에 해당하지 않습니다.
| [시가총액 미달여부 검토] |
| (단위: 백만원) |
| 구분 | 시가총액(최고) | 시가총액(최저) | 시가총액(평균) |
| 2023년 | 653,652 | 310,914 | 447,871 |
| 출처: 한국거래소 정보데이터시스템 |
(5) 정기보고서 미제출 여부 검토
「코스닥시장 상장규정」 제53조1항6호에 따라 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 관리종목으로 지정됩니다.
존속회사는 최근 3년 법정 제출기한 내에 제출하여 왔으며, 향후에도 정기보고서를 법정 제출기한 내에 제출할 예정으로, 관리종목 지정요건에 해당하지 않습니다.
(6) 지배구조 미달 여부 검토
「코스닥시장 상장규정」 제53조1항7호에 따라 최근 사업연도 사업보고서상 A) 사외이사의 수가 법에서 정하는 수에 미달 B) 법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 관리종목으로 지정됩니다.
존속회사는 증권신고서 제출일 전일 현재 사내이사 1명, 사외이사 2명, 감사 1명으로 구성되어 있습니다. 이에 존속회사는 지배구조 미달 요건에 의한 관리종목 지정요건에 해당하지 않습니다.
(7) 거래량 미달 여부 검토
「코스닥시장 상장규정」 제53조1항8호에 따라 분기월평균거래량이 유동주식수의 1%에 미달하는 경우 관리종목으로 지정됩니다. 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다.
| 가) 신규 신규상장법인의 경우. 다만, 신규상장일이 속하는 분기에 한정함. 나) 분기의 월평균거래량이 1만주 이상인 경우. 이 경우 보통주식 상장법인이 액면주식을 발행한 때에는 액면가액 5,000원을 기준으로 함. 다) 세칙으로 정하는 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. 이 경우 소액주주가 소유한 주식 수와 소액주주의 수는 최근 사업연도 말을 기준으로 하되, 최근 사업연도 말 이후 주주명부를 폐쇄한 경우에는 그 폐쇄시점 현재를 기준으로 거래소에 제출한 주주명부 및 「주식·사채 등의 전자등록에 관한 법률」에 따른 소유자명세를 기준으로 함. |
존속회사는 2023년말 기준 소액주주 지분율 78.19%, 소액주주 수 92,133명임에 따라 상기 다) 항목에 해당되어 거래량 미달에 따른 관리종목 지정 요건에 해당되지 않습니다.
(8) 주식분산 미달 여부 검토
「코스닥시장 상장규정」 제53조1항9호에 따라 최근 사업연도말 소액주주가 200인 미만이거나 소액주주지분이 20% 미만일 경우 관리종목으로 지정됩니다.
존속회사는 2023년말 기준 소액주주 지분율 78.19%, 소액주주 수 92,133명임에 따라 주식분산 미달에 따른 관리종목 지정 요건에 해당하지 않습니다.
(9) 기타사항
「코스닥시장 상장규정」 제53조1항10호에서 13호까지에 따라 회생절차개시신청, 파산신청, 상장폐지사유발생, 재무관리기준 위반 요건에 해당하는 경우 관리종목으로 지정됩니다. 존속회사는 증권신고서 제출 전일 현재 동 관리종목지정요건에 해당하지 않습니다.
관리종목으로 지정될 경우 중요 사유 발생시마다 한국거래소는 일정기간 매매거래정지 명령을 발동할 수 있습니다. 이 외에도 주식의 미수나 신용거래가 금지되며, 미수나 신용거래의 증거금이 되는 대용유가증권으로도 사용할 수 없습니다. 또한, 이러한 관리종목 지정사유 확인 당일 코스닥시장에서의 매매거래는 정지됩니다. 이를 기한 내에 해결하지 못한다면 코스닥시장 상장폐지 사유에 해당하여, 존속회사 주식은 향후 장내에서 거래가 이루어지지 못할 수 있습니다. 존속회사는 과거 전 임원진의 횡령, 배임 혐의로 인하여 상장 적격성 실질심사를 받은 바 있으며, 최대주주의 변경, 재무구조 개선, 내부통제 개선 등을 통해 이러한 이슈가 재발하지 않도록 유의하고 있습니다. 증권신고서 제출 전일 현재 존속회사는 관리종목 이슈는 없는 상황이나, 향후에도 존속회사 손익에 따른 관리종목 발생 가능성에 대해서는 지속적으로 모니터링 할 필요가 있습니다. 투자자께서는 이 점 유의하여 투자해 주시기 바랍니다.
|
나-13. 임상결과에 따른 기업가치 급등락 위험 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준에 불과합니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 존속회사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. 특히 임상의 진행 중 경과가 존속회사 기업가치와 주가에 중요한 영향을 끼치고 있기에 투자자께서는 이점 유의하시기 바랍니다. |
업종 특성상 존속회사의 기업가치는 통상적으로 개발중인 파이프라인의 사업가치에 따라 결정됩니다. 이에 따라 바이오의야품 기업의 주가 또한 파이프라인의 임상실험 진행 및 결과 발표에 따라 영향을 받고 있습니다. 존속회사의 연구개발 활동 중단 현황은 다음과 같습니다.
| [존속회사의 연구개발활동/판매 중단 현황] |
| 구 분 | 품 목 | 적응증 | 연구 | 최종 진행단계 | 연구 중단일 |
중단 사유 | ||
| 시작일 | 단계(국가) | 승인일 | ||||||
| 바이오 | 신약 | GX-19N | COVID-19 | 2020년 | 임상1/2a상(한국) | 2020년 | 2022.03 | 세계 백신시장 수급상황에 비추어 사업성이 낮고 위약군에 대한 윤리적인 문제로 임상연구 중단 |
| 2021년 | 임상2/3상(인도네시아) | 2021년 | ||||||
| 바이오 | 신약 | GX-G8 | 단장증후군 | 2017년 | 임상 1상(프랑스) | 2019년 | 2023.09 | 단장증후증은 정확한 유병률 조차 알려지지 않은 매우 희귀한 질병으로, 환자수가 매우 적어 국내 및 해외에서 환자 모집에 어려움이 있음. |
| 출처: 존속회사 정기보고서 |
먼저 존속회사는 2022년 03월 11일 존속회사의 COVID-19 예방 DNA 백신 GX-19N 임상시험 중 1. 엔데믹 시대로 전환됨에 따라 새로운 백신개발에 대한 긴급성이 떨어진 점 2. 새로운 백신 개발에 대한 시장의 니즈가 낮아졌다는 점 3. 방어효능을 보기 위한 임상 3상 진행 시 위약을 접종 받아야 하는 임상 참여군에 대한 윤리성 문제가 있다는 점을 들어 GX-19N의 사업성이 낮다고 판단하였습니다. 따라서, 2021년 승인받은 인도네시아 2/3상 시험철회를 신청하였으며, 아르헨티나 허가 당국에 신청한 부스터 백신 임상시험 또한 신청을 철회하기로 결정하였습니다. 해당 품목의 임상 철회 공시 상세 내역은 아래와 같습니다.
|
[투자판단 관련 주요경영사항(2022.03.11)] |
| 1. 제목 | COVID-19 예방 DNA 백신 GX-19N의 2/3상 임상시험 자진 철회 결정 | |
| 2. 주요내용 | ※ 투자유의사항 - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험, 품목허가 과정에서 기대에 상응하지 못하는 결과가 발생할 수 있으며, 상업화 계획을 변경하거나 포기할 수 있는 가능성이 상존합니다. - 투자자는 위 사항과 사업보고서를 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. 1. 임상시험 제목 - 건강한 성인을 대상으로 COVID-19 예방 DNA 백신 GX-19N의 유효성, 안정성 및 면역원성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약대조, 제2/3상 임상시험 2. 임상시험 단계 - 제 2/3상 3. 대상질환(정응증) - 코로나바이러스감염증-19(COVID-19)의 예방 4. 임상 철회 결정 사유 - 인도네시아의 1차백신 및 부스터 접종이 전 국민 대상으로 빠르게 확산됨에 따라 임상시험의 환경이 변화됨. 즉 부스터샷까지 정부지원으로 신속히 맞을 수 있도록 수급상황이 호전됨. - 이에 위약군을 포함하는 임상시험 대상자 모집과 운영이 어렵고 윤리적 이슈가 제기될 수 있어 기 승인받은 미 접종자 대상 임상계획 승인 및 기접종자 대상 부스터 임상계획 변경신청 모두 자진 철회. |
|
| 3. 사실발생(확인)일 | 2022-03-11 | |
| 4. 결정일 | 2022-03-11 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 상기 '3. 사실발생(확인)일은 인도네시아 공동개발사(PT Kalbe Farma)에 제넥신의 철회계획을 통지한 날입니다. | ||
| ※ 관련공시 | 2021-07-07 투자판단 관련 주요경영사항(COVID-19 예방 DNA 백신 GX-19N 의 2/3상 임상시험 계획 인도네시아 식약처 승인) 2021-08-30 투자판단 관련 주요경영사항(COVID-19 예방 DNA 백신 GX-19N 의 2/3상 임상시험 계획 변경 신청) |
|
| 출처: 존속회사 투자판단 관련 주요경영사항 공시 |
해당 공시 다음날 주가는 전일 종가 대비 11.52% 하락하는 등 주가는 2022년 03월 11일을 고점으로 이전 수준의 값을 회복하지 못하고 있습니다. GX-19N 중단 공시 이후 3개월간 존속회사의 주가 추이는 다음과 같습니다.
| [GX-19N 중단 공시 이후 3개월간 존속회사 주가 추이] |
 |
|
존속회사 주가 추이(3개월) |
| 출처: KRX 정보데이터시스템 |
또한 존속회사는 2023년 09월 04일 단장증후근 치료제인 GX-G8의 임상 1상을 자진 중단하였습니다. GX-G8은 프랑스식약처(ANSM)으로부터 2019년 03월 임상 1상 허가를 받았으나, 단장증후근은 정확한 유병률이 알려지지 않은 희귀한 질병으로 환자수가 매우 적어 국내외 환자 모집이 어려웠기 때문에 임상 1상을 중단하였습니다. 해당 품목의 임상 철회 공시 상세 내역은 아래와 같습니다.
|
[투자판단 관련 주요경영사항(2023.09.04)] |
| 투자 유의사항 | - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. - 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. - 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
|
| 1. 제목 | GX-G8(단장증후군 치료제) 임상 1상 시험 자진 중단 | |
| 2. 주요내용 | 1) 임상시험명칭 | A randomized, double-blind, placebo-controlled, single ascending dose study, to investigate the safety, tolerability, pharmacokinetic and pharmacodynamic profiles of GX-G8 in healthy volunteers 건강한 자원자를 대상으로 한 GX-G8의 안전성, 내약성, 약동학 및 약력학적 프로파일을 조사하기 위한 무작위, 이중맹검, 위약 대조, 단계적용량증량 임상시험 |
| 2) 임상시험단계 | 임상 1상 | |
| 3) 임상시험승인기관 | ANSM(프랑스 식약처) | |
| 4) 임상시험실시국가 | 프랑스 | |
| 5) 임상시험실시기관 | EUROFINS OPTIMED | |
| 6) 대상질환 | 단장증후군 | |
| 7) 신청일 | 2019-01-10 | |
| 8) 승인일(결정일) | 2019-03-06 | |
| 9) 등록번호 | GX-G8-001 / OP105518.GEX | |
| 10) 임상시험목적 | 건강한 남성 피험자에서 GX-G8 단일 용량의 안정성, 내약성 및 PK/PD 평가 | |
| 11) 임상시험방법 | - 건강한 남성 자원자 40명을 대상으로 이중 맹검, 무작위, 위약대조, 단계적용량증량 임상시험임. - 스크리닝을 거쳐 본 임상시험에 참여하는 것이 적절하다고 판단된 대상자는 시험약 투여 전날(Day -1) 실시 기간에 입원하여 Day 1에 임상시험용의약품을 피하 투여 받고, 기타 임상계획서에 기술된 임상시험 절차를 마친 뒤 Day 5에 퇴원함. 이 후 각 투여군 마다 방문 Day 28까지 예정된 검사가 진행됨. 용량 증량은 시험책임자와 의뢰자 대표와의 회의에서 시험약 투여 후 14일까지의 안전성 관련 자료 및 PK 결과를 평가하고 임상시험의 지속 및 다음 단계로의 용량 증량 유무를 상호 동의 하에 최종 결정함. |
|
| 12) 1차 지표 | 안전성 평가로 12주동안 아래 검사를 수행함. - 부작용(AE), 신체검사, 활력징후, 심전도(ECG), 실험실 측정, 면역원성, 주입 부위 반응 |
|
| 13) 1차 지표 통계분석방법 | 안전성 분석 - 이상반응(AE): 수집된 이상반응은 Medical Dictonary (MedDRA)를 이용하여 SOC(System Organ Class) 및 PT (Preferred Term)별로 표준화 됨. 임상시험에서 발생한 이상반응, 중증도, 중대함, 임상시험용의약품과의 관련성 그리고 SOC 및 PT로 요약된 이상반응 등에 대하여 투약군과 용량군 별로 대상자 수, 발생 건수 및 발생률 등으로 제시됨. - 신체검사, 심전도 및 활력징후: 연구기간동안 기록된 신체 검사, ECG(QTCF 포함) 및 활력 징후는 개별적으로 기술되고 정량적 매개변수는 기술 통계(대상자 수, 평균, 표준편차, 중앙값, 최소값, 최대값)를 사용하여 요약됨. - 실험실적 검사: 연구 기간 동안 기록된 모든 실험실 검사치는 개별적으로 기술되며, 기준 범위를 벗어난 값 및 임상적 관련성(시험 책임자 평가)에 대하여 표시됨. 정량적 매개변수는 기술 통계에 의해 요약됨. - 면역원성: 측정 파라미터는 ADA 스크리닝, 확인 시험(confirmatory test), ADA 역가(titier), 중화항체 확인, 억제율(inhibition %)이며, 스크리닝, 기저 치, 투여 기간 및 임상 종료시점 등에서 측정됨. 기저 치와 각 평가 시점 간의 측정값 변화는 기술 통계를 사용하여 기술됨 |
|
| 14) 임상시험기간 | 30주 | |
| 15) 목표 시험대상자 수 | 40명 | |
| 3. 자진취하 등 사유 | - 단장증후증은 정확한 유병률 조차 알려지지 않은 매우 희귀한 질병으로, 환자수가 매우 적어 국내 및 해외에서 환자 모집에 어려움이 있음. - 전략적 경영의사결정 |
|
| 4. 사실발생(확인)일 | 2023-09-04 | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 '4.사실발생(확인)일'은 당사가 내부검토를 통해 자진중단 의사결정을 완료한 일자입니다. - 본 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정임. |
||
| ※ 관련 공시 | - | |
| 출처: 존속회사 투자판단 관련 주요경영사항 공시 |
GX-G8은 GX-19N과 달리 임상 중단 이후 주가가 급격히 하락하지는 않았으나, 등락을 반복하며 현재는 약보합세를 나타내고 있습니다. GX-G8 임상 1상 자진 중단 이후 3개월간 존속회사의 주가 및 거래량 추이는 다음과 같습니다.
| [GX-G8 중단 공시 이후 3개월간 존속회사 주가 추이] |
 |
|
존속회사 주가 추이(3개월) |
| 출처: KRX 정보데이터시스템 |
이와같이, 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준에 불과합니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 존속회사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다.
특히 임상의 진행 중 경과가 존속회사 기업가치와 주가에 중요한 영향을 끼치고 있기에 투자자께서는 이점 유의하시기 바랍니다.
| 나-14. 환율 변동에 따른 위험 존속회사는 지속적으로 환율변동을 모니터링하고 있으며, 환리스크를 최소화하기 위하여 외화거래 및 외화자산과 부채의 관리에 만전을 기하고 있습니다. 그러나 만약 예기치 못한 외환시장의 변동으로 인하여 환율이 급격히 하락할 경우 존속회사의 손익 및 재무구조에 악영향을 미칠 수 있으니 이 점 유의하시기 바랍니다. |
존속회사는 바이오의약품 치료제의 글로벌 사업화 및 임상개발 과정에서 외화거래를 하고 있습니다. 해외 바이오/제약사로의 기술이전, 용역수행으로 외화매출거래가 발생하며, 해외 CRO(Contract Research Organization)에게 해외 독성시험, 임상시험 위탁, CMO(Contract Manufacturing Organization)에게 Cell Banking, 임상시료생산을 위탁함으로써 외화매입거래가 발생합니다.
2024년 1분기말 기준 존속회사가 보유한 외화자산은 약 1,380,464천원으로 현금및현금성자산 877,753천원과 매출채권 119,863천원, 미수금 382,848 천원으로 구성되어 있으며, 외화부채는 약 299,327천원으로 전액 미지급금으로 구성되어 있습니다. 존속회사는 외화거래에 있어 별도의 환헷지를 실행하고 있지 않아 환율의 변동이 존속회사의 손익에 영향을 미치는 환위험에 노출되어 있습니다. 존속회사는 수출에 의한 외화유입액이 원부재료의 수입 등에 의한 외화유출액보다 많으며, 외화포지션상 외화자산이 외화부채보다 많아 환율의 하락에 따른 평가손이 발생할수 있습니다. 2024년 1분기 기준 존속회사의 외화로 표시된 자산 및 부채 금액은 다음과 같습니다.
| [2024년 1분기 기준 존속회사의 외화로 표시된 자산/부채 장부금액] |
| (단위: 외화 1단위, 천원) |
| 구 분 | 외화 | 원화환산액 |
| 현금및현금성자산 | ||
| USD | 651,731.90 | 877,753 |
| 매출채권 | ||
| USD | 88,998.44 | 119,863 |
| 미수금 | ||
| USD | 284,264.68 | 382,848 |
| 외화자산합계 | 1,380,464 | |
| 미지급금 | ||
| USD | 2,402.40 | 3,236 |
| EUR | 203,789.21 | 296,091 |
| GBP | - | - |
| 비지배지분투자금융부채 | ||
| USD | - | - |
| 외화부채합계 | 299,327 | |
| 출처: 존속회사 정기보고서 |
존속회사의 환포지션을 고려할 때 환율 변동이 존속회사의 손익에 미치는 영향은 아래와 같습니다.
| [2024년 1분기 기준 존속회사의 외화로 표시된 자산/부채 장부금액] |
| (단위: 천원) |
| 구 분 | 당분기말 | |
| 10% 상승시 | 10% 하락시 | |
| 현금및현금성자산 | 87,775 | (87,775) |
| 매출채권 | 11,986 | (11,986) |
| 미수금 | 38,285 | (38,285) |
| 미지급금 | (29,933) | 29,933 |
| 합 계 | 108,113 | (108,113) |
| 출처: 존속회사 정기보고서 |
최근 6개월간 원달러 환율 추이는 다음과 같습니다.
| 최근 6개월 원달러 추이(2023년 12월 14일 ~ 2024년 06월 14일) |
 |
|
원달러 환율 추이(6개월) |
| 출처: 서울외국환중개 |
존속회사는 지속적으로 환율변동을 모니터링하고 있으며, 환리스크를 최소화하기 위하여 외화거래 및 외화자산과 부채의 관리에 만전을 기하고 있습니다. 그러나 만약 예기치 못한 외환시장의 변동으로 인하여 환율이 급격히 하락할 경우 존속회사의 손익 및 재무구조에 악영향을 미칠 수 있으니 이 점 유의하시기 바랍니다.
| 나-15. 내부회계관리제도 및 내부통제 관련 위험 존속회사는 코스닥 상장법인으로「주식회사 등의 외부감사에 관한 법률」(이하 '외감법')에 따라 신뢰할 수 있는 회계정보의 작성과 공시를 위해 내부회계관리규정 및 내부회계관리제도를 갖추고 있어야 합니다. 또한, 외부감사인은 존속회사의 내부회계관리제도 운영실태를 검토 및 감사를 진행하여야 하며, 해당 결과는 감사보고서에 표명하도록 되어 있습니다. |
존속회사는 코스닥 상장법인으로「주식회사 등의 외부감사에 관한 법률」(이하 '외감법')에 따라 신뢰할 수 있는 회계정보의 작성과 공시를 위해 내부회계관리규정 및 내부회계관리제도를 갖추고 있어야 합니다. 또한, 외부감사인은 존속회사의 내부회계관리제도 운영실태를 검토 및 감사를 진행하여야 하며, 해당 결과는 감사보고서에 표명하도록 되어 있습니다. 최근 사업연도 기준 존속회사 외부감사인의 내부회계관리제도 검토 의견은 아래와 같습니다.
| 내부회계관리제도 검토의견 |
| 사업연도 | 감사인 | 감사의견 및 검토 의견 | 지적사항 |
| 제25기 | 삼정회계법인 | [감사의견] 회사의 내부회계관리제도는 2023년 12월 31일 현재 「내부회계관리제도 설계 및 운영 개념체계」에 따라 중요성의 관점에서 효과적으로 설계 및 운영되고 있습니다. | 해당사항 없음 |
| 제24기 | 대성삼경회계법인 | [감사의견] 회사의 내부회계관리제도는 2022년 12월 31일 현재 「내부회계관리제도 설계 및 운영 개념체계」에 따라 중요성의 관점에서 효과적으로 설계 및 운영되고 있습니다. | 해당사항 없음 |
| 제23기 | 대성삼경회계법인 | [감사의견] 회사의 내부회계관리제도는 2021년 12월 31일 현재 「내부회계관리제도 설계 및 운영 개념체계」에 따라 중요성의 관점에서 효과적으로 설계 및 운영되고 있습니다. | 해당사항 없음 |
| 출처: 존속회사 정기보고서 |
존속회사는 내부회계관리 제도 구축을 완료해 2021년 02월 18일 이사회 보고를 완료하였으며, 감사위원회 지원조직 내 내부회계관리 파트장 1인이 재무활동 건전성 및 타당성 검토 지원과 내부회계관리제도 운영실태 검토지원을 진행중입니다. 존속회사는 현 내부회계관리제도를 철저히 운영하여 외부 감사인의 내부회계관리제도에 대한 검토의견을 받을 계획입니다.
다만, 내부회계관리를 철저히 운영함에도 불구하고 회계처리 위반, 혹은 관련 임직원의 배임 및 횡령 등 발생으로 내부회계관리가 적절하게 운영되지 않을 경우 과태료 등의 법적 제재가 부과될 수 있습니다. 과태료 부과 시 법정최고금액에 과태료 예정금액 산정표에 따른 비율을 적용하여 예정금액을 산정하고, 가증, 감경하여 최종 과태료부과금액을 결정하고 있습니다.
| [과태료 부과기준(외감규정 별표9 참조)] |
 |
|
과태료 부과기준 |
| 출처: 금융감독원 보도자료 |
특히, 이사 등 내부회계관리제도 운영 관련자가 회계정보를 내부회계관리제도에 의하지 아니하고 위조, 변조, 훼손 또는 파기한 사실이 확인되는 경우, 5년 이하의 징역 또는 5천만원 이하의 벌금이 부과될 수 있습니다. 또한, 코스닥시장 상장규정에 따라 내부회계관리제도 비적정 시 투자주의환기종목에 지정될 수 있습니다.(「코스닥시장 상장규정」제52조)
종합적으로 존속회사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 감사한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분께서는 공시된 존속회사의 내부회계관리 운영실태를 충분히 확인하시고 투자에 임해주시기 바랍니다.
■ 소멸회사 회사위험
| 나-16. 낮은 회사 인지도에 따른 위험 기술 경쟁력과 사업 역량에도 불구하고 소멸회사는 글로벌 주요 경쟁업체들과 비교하여 규모 및 인지도 측면에서 다소 열위한 부분이 존재합니다. 이는 향후 글로벌 파트너사와의 공동개발 및 판권 계약 진행 시 약점으로 작용할 수 있으며 수익 창출에 부정적인 영향을 줄 수 있습니다. 하지만, 소멸회사가 보유한 원천 기술을 바탕으로 국내외 주요 협력사들과 체결한 공동연구계약 등을 고려했을 때, 소멸회사의 인지도에 따른 위험은 제한적일 것을 판단됩니다. |
소멸회사는 표적단백질 분해를 기반으로 한 치료제 분야에서 차세대 기술을 개발, 보유하고 있습니다. 본 합병으로 소멸회사는 존속회사가 보유한 신약 및 바이오베터 개발 기술을 활용해 바이오프로탁(bioPROTAC) 기초 연구 및 기술 개발을 진행하고, 나아가 기술의 상용화 및 EPDeg 바이오프로탁을 기반으로 한 신약 후보물질을 개발하는데 시너지를 기대하고 있습니다. 양사의 기술 융합을 통해 차세대 면역유전자치료제 기술을 개발함으로써 글로벌 바이오시장에서 사업경쟁력을 확보할 수 있을 것으로 예상합니다. 소멸회사의 핵심 역량은 아래와 같습니다.
| [소멸회사의 핵심 역량] |
| 1.경영진 그룹 전문성 확보 | 2. 회사 고유 플랫폼 기술 보유 | 3. Novel Targets 보유 |
| - PROTAC biology: Arvinas社 노하우 접목한 PROTAC 타겟 선정 업무 경력 - 항암약물 개발 경력(Small molecules, therapeutic antibodies, PROTACS) / Immuno-Oncology 전문성 보유 - 항체 발굴 및 단백질 개량 전문성 보유: 약 20종 이상의 물질 발굴 및 개량 경험(항암면역항체, 면역단백질, 세포수용체 등 다양) - 국내외 다수 바이오텍사 재직 경험(S사, L사, K사, A사, T사 등) |
- 신규 Target binder (nanobody) 확보 기술: EPD 고유 synthetic 라이브러리 활용하여 신규 nanobody 자체적 발굴 가능 - E3 protein engineering 기술: Yeasy display system / High-throughput screening system 활용하여 표적단백질 분해능이 개선된 EPD 고유 engineering E3 proteins 확보 가능 - 각 타겟별 효율적인 분해 가능한 E3 proteins 예측 assay system 보유 - 신규 binder의 세포 내에서의 target binding 검증 assay system 보유 |
- 10여개 novel targets 기확보; 모두 First-in-class drug potential 보유한 targets - 네 종류의 main theme으로 구성된 undruggable proteins을 타겟으로 하는 파이프라인 확충 예정 > Transcription factors > RNA modulating proteins > Scaffolding proteins > Disease causing specific mutant proteins |
| 출처: 소멸회사 자체자료 |
이러한 기술 경쟁력과 사업 역량에도 불구하고 소멸회사는 글로벌 주요 경쟁업체들과 비교하여 규모 및 인지도 측면에서 다소 열위한 부분이 존재합니다. 이는 향후 글로벌 파트너사와의 공동개발 및 판권 계약 진행 시 약점으로 작용할 수 있으며 수익 창출에 부정적인 영향을 줄 수 있습니다. 하지만, 소멸회사가 보유한 원천 기술을 바탕으로 국내외 주요 협력사들과 체결한 공동연구계약 등을 고려했을 때, 소멸회사의 인지도에 따른 위험은 제한적일 것을 판단됩니다.
| 나-17. 연구계약 지위 승계 여부에 따른 위험 합병 후 존속한 회사는 합병으로 인하여 소멸된 회사의 권리의무를 승계하기 때문에, 원칙적으로 본 합병의 개별적인 권리의무 이전절차 없이 존속회사가 소멸회사의 계약 상 권리 의무를 포괄승계합니다. 단, 소멸회사와 다케다가 체결한 'Research Collaboration Agreement' 계약은 준거법을 일본법으로 정하고 있어 본 합병에 따른 계약상의 지위 승계 여부 등에 관한 구체적인 사항은 결정된 바 없으니 투자자께서는 이점 주의하시기 바랍니다. |
소멸회사는 증권신고서 제출 전일 기준 2건의 기술지도 자문계약과 3건의 공동연구계약을 체결하였습니다.
[1. 자문계약]
소멸회사는 University of Connecticut 교수 및 KAIST 의과대학원 조교수 각 1인과 2022년 기술지도(자문) 계약을 체결하였습니다. 자문 내용은 바이오프로탁 제작 및 효능 평가 관련된 기술 자문이며 계약기간은 4년으로, 각 계약서는 양도금지조항을 두고 있습니다.
단, 「상법」 제235조 및 제530조1항에 의거하여 합병 후 존속한 회사는 합병으로 인하여 소멸된 회사의 권리의무를 승계하기 때문에, 원칙적으로 본 합병의 개별적인 권리의무 이전절차 없이 존속회사가 소멸회사의 계약 상 권리 의무를 포괄승계합니다. 따라서 해당 자문계약의 경우에도 지위 이전 절차 없이 본 합병에 따라 자문계약의 권리의무는 존속회사로 승계될 것으로 판단됩니다.
[2. 공동연구계약]
소멸회사가 체결한 공동연구계약은 다음과 같습니다.
| [소멸회사가 체결한 공동연구계약] |
| 업체 | 계약의 종류 | 계약 체결일 | 계약 유지 기간 | 주요 내용 |
| (주)제넥신 | MOU (Memorandum of Understanding |
2023.09.18 | 3년 | bioPROTAC 공동연구 |
| (주)제넥신 | MTA (Material Transfer Agreement) |
2023.09.18 | 미정 | epd4105에 대한 feasibility test |
| Takeda Pharmaceutical Company Limited (이하 "다케다") |
Research Collaboration | 2024.03.12 | 1년 | SOX2 bioPROTAC의 폐암 동물모델에서의 효능평가를 다케다가 지원후 연구결과에 대한 우선검토권 보유 |
| 출처: 소멸회사 자체자료 |
소멸회사와 다케다가 체결한 'Research Collaboration Agreement'에 의하면, 소멸회사는 2024년 03월 13일 일본법에 설립된 다케다에게 SOX2 bioPROTAC의 폐암 동물모델에서의 효능평가에 관한 연구결과를 검토하고 사용할 수 있는 비독점적인 권한을 부여고 다케다에게 연구비로 USD 100,000달러를 제공받았습니다. 상기 계약서상 본 합병을 사전통지사항 내지 해제사항으로 정하고 있는 명시적인 규정은 없는 것으로 판단됩니다. 단, 상기 계약은 준거법을 일본법으로 정하고 있어 본 합병에 따른 계약상의 지위 승계 여부 등에 관한 구체적인 사항은 결정된 바 없으니 투자자께서는 이점 주의하시기 바랍니다.
3-3. 기타위험
| 다-1. 소규모합병 관련 위험 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대하는 의사를 통지하는 때(접수기간 : 2024년 07월 15일~2024년 07월 29일)에는 존속회사는 주주총회의 승인을 얻어 합병을 진행하거나 합병 계약을 해제할 수 있으니 이 점 유의하여주시기 바랍니다. |
존속회사인 (주)제넥신은 소멸회사인 (주)이피디바이오테라퓨틱스를 흡수합병하여, 존속회사는 존속하고 소멸회사는 해산합니다. 존속회사는 본건 합병을 함에 있어 합병신주를 발행하여, 합병기일 현재 소멸회사의 주주명부에 등재되어 있는 주주들에게 각 지분비율에 따라 교부합니다.
본건 합병으로 인하여 존속회사가 발행하는 신주의 총수는 보통주 4,131,598주로서 존속회사의 발행주식총수인 41,510,594주의 약 9.95%이므로 이는 「상법」 제527조의 3(소규모합병)의 규정이 정하는 바에 해당됩니다. 따라서, 존속회사의 경우 존속회사 주주의 주식매수청구권 규정은 적용되지 않습니다.
하지만 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20 이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대하는 의사를 통지하는 때(접수기간 : 2024년 07월 15일~2024년 07월 29일)에는 존속회사는 주주총회의 승인을 얻어 합병을 진행하거나 합병 계약을 해제할 수 있으니 이 점 유의하여주시기 바랍니다.
| 【 상법 】 |
|---|
|
제522조의3(합병반대주주의 주식매수청구권) ②제527조의2제2항의 공고 또는 통지를 한 날부터 2주내에 회사에 대하여 서면으로 합병에 반대하는 의사를 통지한 주주는 그 기간이 경과한 날부터 20일 이내에 주식의 종류와 수를 기재한 서면으로 회사에 대하여 자기가 소유하고 있는 주식의 매수를 청구할 수 있다. <신설 1998.12.28.> [본조신설 1995.12.29.] [제목개정 2015.12.1.] [제목개정 2015.12.1.] |
| 다-2. 주주의 합병 반대 의사통지에 의하여 합병이 무산될 가능성 관련 위험 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대하는 의사를 통지하는 때에는 존속회사는 본건 합병을 소규모합병 절차에 따라 진행하지 아니하며, 이 경우 존속회사는 합병 계약을 해제할 수 있다는 점 투자자께서는 유의하시기 바랍니다. |
소멸회사인 (주)이피디바이오테라퓨틱스는 총주주의 동의를 얻어 간이합병 방식으로 합병절차를 진행하므로 주주총회 승인을 이사회 승인으로 갈음할 수 있습니다. 다만, 소멸회사인 (주)이피디바이오테라퓨틱스의 사내이사는 2인으로 상법 상 이사회 구성요건을 충족하지 못하므로. 소멸회사인 (주)이피디바이오테라퓨틱스의 합병 승인은 주주총회를 통해 진행되며, 「상법」 제363조 4항에 따라, 소멸회사인 (주)이피디바이오테라퓨틱스는 자본금 10억원 미만의 회사로 총주주 동의에 따라 주주총회 소집절차를 생략 및 서면에 의한 결의로서 주주총회의 결의를 갈음할 예정입니다.
한편, 존속회사인 (주)제넥신은 본건 합병을 소규모합병으로 추진하는 바, 주주총회의 승인을 이사회의 승인으로 갈음할 수 있습니다. 하지만 「상법」 제527조의3 제4항에 의해 존속회사 발행주식총수의 100분의 20이상에 해당하는 주식을 소유한 주주가 소규모합병 공고일로부터 2주 내에 서면으로 합병계약에 대한 주주총회의 승인을 이사회의 승인으로 갈음하는 것에 반대(접수기간 : 2024년 07월 15일~2024년 07월 29일)하는 의사를 통지하는 때에는 존속회사는 본건 합병을 소규모합병 절차에 따라 진행하지 아니하며, 이 경우 존속회사는 합병 계약을 해제할 수 있습니다
| 다-3. 합병계약서 상의 계약 해제 조건 관련 위험 본건 합병계약은 합병기일 이전에 합병계약서에 기재된 계약의 해제 조건과 같은 사유가 발생 시 해제될 수 있습니다. |
본 합병계약은 합병기일 이전에 다음과 같은 사유가 발생 시 해제될 수 있습니다. 합병계약서에 기재된 계약의 선행조건 및 해제 조건은 아래와 같습니다.
| [본 합병계약서 상의 선행조건 및 해제 조건] |
|---|
|
제12조(선행조건) 각 당사자가 본 계약에 따라 본건 합병을 이행할 의무는 합병기일까지 다음 각호의 조건이 충족될 것을 조건으로 한다. 가. 각 당사자의 주주총회(이사회로 갈음할 경우 이사회를 의미)에서 본 계약과 본건 합병이 적법하게 승인되었을 것 다. 본 계약의 상대방 당사자가 제14조의 확약사항을 포함하여 본 계약상 확약 및 의무사항을 모두 이행하고 준수하였을 것
당사자들은 합병기일 이전에는 다음 각 호의 사유가 있는 경우 본 계약을 해제할 수 있다. 단, 본 조 마호을 제외하고, 각 해제사유의 발생에 책임이 있는 회사는 해제할 수 없다. 가. 당사자들이 본 계약을 해제하기로 서면으로 상호 합의하는 경우 마. 본 계약 체결일 이후 합병기일까지 "존속회사" 또는 "소멸회사"의 재무상태, 경영실적, 자산 및 영업상태 또는 전망에 중대한 부정적 변경이 발생한 경우 |
| 다-4. 인력 승계에 따른 위험 합병계약이 정하는 바에 따라 소멸회사인 (주)이피티바이오테라퓨틱스의 모든 직원은 존속회사인 (주)제넥신의 직원이 될 예정입니다. 다만, 소멸회사 이사의 지위는 본건 합병의 효력 발생과 함께 소멸합니다. 합병계약에 따라 합병 이전에 취임한 존속회사의 이사의 임기는 「상법」 제527조의4에도 불구하고, 합병 전의 임기를 적용하기 때문에 본래의 임기 만료일까지 계속됩니다. 또한 이번 합병 이후 소멸회사의 대표이사인 최재현은 존속회사의 사내이사로 선임 될 예정입니다. |
합병계약이 정하는 바에 따라 소멸회사인 (주)이피티바이오테라퓨틱스의 모든 직원은 존속회사인 (주)제넥신의 직원이 될 예정입니다.
다만, 소멸회사 이사의 지위는 본건 합병의 효력 발생과 함께 소멸합니다. 합병계약에 따라 합병 이전에 취임한 존속회사의 이사의 임기는 「상법」 제527조의4에도 불구하고, 합병 전의 임기를 적용하기 때문에 본래의 임기 만료일까지 계속됩니다. 또한 이번 합병 이후 소멸회사의 대표이사인 최재현은 존속회사의 사내이사로 선임 될 예정입니다.
| 【 합병계약서 】 | ||||||
|---|---|---|---|---|---|---|
|
제10
조 (
종업원의
인수
등) "존속회사"는 "소멸회사"의 종업원을 합병기일에 있어서 "존속회사"의 종업원으로 인수하는 것을 원칙으로 하며, 이를 위해 "존속회사"는 본건 합병기일에 "소멸회사"의 종업원들과 새로운 근로계약을 체결하기로한다. 다만, 종업원 승계와 관련된 자세한 사항은 합병기일을 그 기한으로하여 "존속회사"와 "소멸회사"가 협의하여 정하기로하되, 새로운 근로계약 상 조건은 기존 "소멸회사"와 종업원 사이에 보상과 복리후생등에 대하여 기체결한근로계약서의 내용보다 불리하지않은 내용으로 체결하기로하며, 기타 인사 관련사항은 "존속회사"와 "소멸회사"의 인사제도를 고려하여 형평성있게 협의한다. 제11
조(
이사
및
감사)
(1) 합병기일 전에 취임한 "존속회사"의 이사 및 감사는 달리 임기종료 사유가 발생하지않는 한 상법 제527조의4 제1항의규정에도 불구하고 선임시 정해진 임기까지 그 지위를 유지한다. (2) "소멸회사"의 이사의 지위는 합병등기와 더불어 소멸한다. (3) 본건 합병 이후 "존속회사"의 사내이사로의 취임을 예정하는 자는 아래와 같다. "존속회사"는 본건 합병기일 이후 차기주주총회에서 아래 사람이 사내이사로 선임될 수 있도록 협조하고 이사회에서 대표이사(각자대표)로 선임하기로한다.
|
| 【 상법 】 |
|---|
| 제527조의4(이사ㆍ감사의 임기) ① 합병을 하는 회사의 일방이 합병후 존속하는 경우에 존속하는 회사의 이사 및 감사로서 합병전에 취임한 자는 합병계약서에 다른 정함이 있는 경우를 제외하고는 합병후 최초로 도래하는 결산기의 정기총회가 종료하는 때에 퇴임한다. |
| 다-5. 적격합병요건 충족 관련 위험 2017년 12월 19일 법인세법 개정으로 2018년 1월 1일부터 법인세법상 적격합병 요건에 고용승계 요건이 추가되었습니다. 주요 내용을 살펴보면 합병등기일 1개월 전 피합병회사에 종사하는 근로자 중 합병회사가 승계한 근로자의 비율이 80% 이상이고 합병등기일이 속하는 사업연도의 종료일까지 그 비율 이상을 유지하도록 하고 있습니다. (1) 적격합병요건의 충족 (주)제넥신 및 (주)이피디바이오테라퓨틱스는 「법인세법」 제44조(합병 시 피합병법인에 대한 과세)에서 규정한 요건을 충족하고 있습니다. 해당되는 요건으로는 사업영위기간, 지분의 연속성, 사업의 계속성 및 근로자 고용 승계입니다. (2) 적격합병의 사후관리요건의 충족 존속회사는 「법인세법」 제44조의3(적격합병 시 합병법인에 대한 과세특례)에서 규정한 요건을 충족하여야 예상대로 TAX risk를 제거할 수 있습니다. 해당되는 요건으로는 사업의 계속성, 지배주주 등의 연속성, 고용의 지속유지 등입니다. 존속회사는 상기 요건을 모두 충족하고 있으며 향후 이를 유지할 계획입니다. 만약 사후관리요건을 충족하지 못할 경우 합병회사는 법인세 납부 등 재무적 위험에 노출될 수 있으니 투자자께서는 이 점 유의하여 주시기 바랍니다. |
본건 합병은 「법인세법」 제44조의 제2항에서 요구하는 적격합병요건을 모두 충족하여 적격합병에 해당할 것으로 예상됩니다. 「법인세법」상 적격합병요건 충족여부는 다음과같습니다.
| [적격합병 해당요건] |
| 적격요건 | 충족여부 | 비고 |
|---|---|---|
| 1. 합병등기일 현재 1년 이상 사업을 계속하던 내국법인간의 합병일 것 | 충족예상 | - |
| 2. 피합병회사의 주주 등이 받은 합병대가의 총합계액 중 주식 등의 가액이 80% 이상일 것 | 충족예상 | - |
| 3. 피합병회사의 주주 등에 합병으로 받은 주식 등 배정 시 주요 지배주주 등에게 각각 피합병회사에 대한 지분비율 이상의 주식 등을 배정할 것 | 충족예상 | - |
| 4. 피합병회사의 주요 지배주주 등이 합병등기일이 속하는 사업연도 종료일까지 그 주식 등을 보유할 것 | 충족예상 | - |
| 5. 합병회사의 합병등기일이 속하는 사업연도 종료일까지 피합병회사로부터 승계받은 사업을 계속할 것 | 충족예상 | - |
| 6. 피합병회사의 근로자 중 80% 이상 승계하고, 합병기일이 속하는 사업연도말까지 그 비율을 유지할 것 | 충족예상 | - |
한편 적격합병 요건을 유지하기 위해서는 합병등기일이 속하는 사업연도말로부터 일정 기간 동안 존속회사는 다음의 3가지 사후관리 요건을 충족해야합니다.
① 존속회사는 사후관리 기간(합병등기일이 속하는 사업연도의 다음 사업연도의 개시일부터 2년) 동안 소멸회사로부터 승계받은 사업을 폐지하지 않을 것
② 소멸회사의 주요 지배주주등이 사후관리 기간(합병등기일이 속하는 사업연도의 다음 사업연도의 개시일부터 2년) 동안 존속회사등으로부터 받은 주식을 50% 이상 처분하지 않을 것
③ 사후관리 기간(합병등기일이 속하는 사업연도의 다음 사업연도의 개시일부터 3년) 동안 각 사업연도 종료일 현재 존속회사에 종사하는 근로자 수가 합병등기일 1개월 전 당시 소멸회사와 존속회사에 각각 종사하는 근로자 수의 합의 100분의 80 미만으로 하락하지 않을 것
증권신고서 제출 전일 현재 존속회사는 소멸회사로부터 승계받은 사업을 폐지할 계획이 없으며, 소멸회사의 주요 지배주주 등이 존속회사로부터 받은 주식 전체의 50% 이상을 처분할 가능성은 낮은 것으로 판단됩니다. 또한, 존속회사는 합병기일 현재 소멸회사의 근로자를 존속회사의 근로자로 승계ㆍ고용할 예정이고, 존속회사에 종사하는 근로자의 수는 합병등기일 1개월 전 당시 소멸회사와 존속회사에 각각 종사하는 근로자 수의 합의 100분의 80미만으로 하락할 가능성은 낮을 것으로 판단됩니다.
상기와 같이 본건 합병은 적격합병요건을 모두 충족할 것으로 예상되나 추후에 사후 관리요건이 미충족되는 사건이 발생하거나 세무당국으로부터 적격합병요건 미충족이 결정되는 경우 주주나 회사가 세금을 부담할 가능성이 있습니다.
※ 관련 법령
| 【법인세법】 |
|---|
|
제44조【합병 시 피합병법인에 대한 과세】 ① 피합병법인이 합병으로 해산하는 경우에는 그 법인의 자산을 합병법인에 양도한 것으로 본다. 이 경우 그 양도에 따라 발생하는 양도손익(제1호의 가액에서 제2호의 가액을 뺀 금액을 말한다. 이하 이 조 및 제44조의 3에서 같다)은 피합병법인이 합병등기일이 속하는 사업연도의 소득금액을 계산할 때 익금 또는 손금에 산입한다. (2010. 12. 30. 개정) 1. 피합병법인이 합병법인으로부터 받은 양도가액 (2010. 12. 30. 개정) 2. 피합병법인의 합병등기일 현재의 자산의 장부가액 총액에서 부채의 장부가액 총액을 뺀 가액(이하 이 관에서 "순자산 장부가액"이라 한다) (2010. 12. 30. 개정) ② 제1항을 적용할 때 다음 각 호의 요건을 모두 갖춘 합병(이하 "적격합병"이라 한다)의 경우에는 제1항 제1호의 가액을 피합병법인의 합병등기일 현재의 순자산 장부가액으로 보아 양도손익이 없는 것으로 할 수 있다. 다만, 대통령령으로 정하는 부득이한 사유가 있는 경우에는 제2호ㆍ제3호 또는 제4호의 요건을 갖추지 못한 경우에도 적격합병으로 보아 대통령령으로 정하는 바에 따라 양도손익이 없는 것으로 할 수 있다. (2018. 12. 24. 개정) 1. 합병등기일 현재 1년 이상 사업을 계속하던 내국법인 간의 합병일 것. 다만, 다른 법인과 합병하는 것을 유일한 목적으로 하는 법인으로서 대통령령으로 정하는 법인의 경우는 제외한다. (2010. 12. 30. 개정) 2. 피합병법인의 주주등이 합병으로 인하여 받은 합병대가의 총합계액 중 합병법인의 주식등의 가액이 100분의 80 이상이거나 합병법인의 모회사(합병등기일 현재 합병법인의 발행주식총수 또는 출자총액을 소유하고 있는 내국법인을 말한다)의 주식등의 가액이 100분의 80 이상인 경우로서 그 주식등이 대통령령으로 정하는 바에 따라 배정되고, 대통령령으로 정하는 피합병법인의 주주등이 합병등기일이 속하는 사업연도의 종료일까지 그 주식등을 보유할 것 (2018. 12. 24. 개정) 3. 합병법인이 합병등기일이 속하는 사업연도의 종료일까지 피합병법인으로부터 승계받은 사업을 계속할 것 (2010. 12. 30. 개정) 4. 합병등기일 1개월 전 당시 피합병법인에 종사하는 대통령령으로 정하는 근로자 중 합병법인이 승계한 근로자의 비율이 100분의 80 이상이고, 합병등기일이 속하는 사업연도의 종료일까지 그 비율을 유지할 것 (2017. 12. 19. 신설) ③ 다음 각 호의 어느 하나에 해당하는 경우에는 제2항에도 불구하고 적격합병으로 보아 양도손익이 없는 것으로 할 수 있다. (2018. 12. 24. 개정) 1. 내국법인이 발행주식총수 또는 출자총액을 소유하고 있는 다른 법인을 합병하거나 그 다른 법인에 합병되는 경우 (2016. 12. 20. 신설) 2. 동일한 내국법인이 발행주식총수 또는 출자총액을 소유하고 있는 서로 다른 법인 간에 합병하는 경우 (2016. 12. 20. 신설) ④ 제1항부터 제3항까지의 규정에 따른 양도가액 및 순자산 장부가액의 계산, 합병대가의 총합계액의 계산, 승계받은 사업의 계속 여부에 관한 판정기준 등에 관하여 필요한 사항은 대통령령으로 정한다. (2010. 12. 30. 개정) |
| 다-6. 본질가치 평가에 따른 평가방법상 추정의 오류로 인한 합병 비율의 중요한 차이 발생 위험 외부평가기관은 소멸회사의 수익가치 산정시 각종 통계 자료와 업계 자료 등을 활용하여 산정하였습니다. 수익가치 산정시 사용한 가정 및 추정이 소멸회사의 미래 수익을 보장하는 것이 아니며, 추정에 사용한 가정이 변동할 경우 소멸회사의 합병가액이 과대평가 될 수 있으며, 추정오류로 인해 투자자에게 손실이 발생할 수 있습니다. 또한 본 합병에서 소멸회사의 합병가액 산정 시 외부평가기관은 관련 법령 및 시행세칙, 평가업무 관련 가이드라인 등 외부평가인이 따라야 할 규정을 준수하였습니다. 다만, 미래기간에 대한 추정은 합병당사회사 경영진에 의한 경영전략이나 영업계획의 수정 등 다양한 제반 요소들의 변동에 따라 중대한 영향을 받을 수도 있습니다. 한편 평가인이 선관주의의무를 다하여 기재하였지만 본 합병에 대한 평가범위가 매우 넓으며 평가에 사용된 수치가 많으므로 평가보고서 상 의도하지 않은 표현의 실수나 단순 오타 등이 발생할 수 있습니다. 또한, 계산상의 실수로 인해 수치상 오류가 발생할 가능성도 있습니다. 이 경우 합병가액의 적정성이 손상될 수 있고, 상대적으로 낮게 평가된 회사의 주주의 경우 신주배정 비율 하락으로 인해 손해를 볼 가능성이 있으며 이 경우 투자자들의 소송이 제기될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
본 합병 소멸회사의 합병가액은 「증권의 발행 및 공시 등에 관한 규정 시행세칙」 제4조를 적용하여 자산가치와 수익가치를 1과 1.5의 비율로 가중산술평균한 가액으로 산정하였습니다.
외부평가기관은 관련 규정에 따라 소멸회사의 자산가치와 수익가치를 산정하였으며, 수익가치 분석방법으로는 현금흐름할인법을 사용하였습니다. 외부평가기관은 수익가치를 산정하는 과정에서 다수의 추정 자료를 사용하였습니다.
수익가치 분석방법은 미래의 현금흐름에 대한 기준 또는 할인의 대상에 따라 현금흐름할인모형, 배당할인모형 등 다양한 평가방법이 있으며, 증권의 발행 및 공시 등에 관한 규정 시행세칙 제6조에 따르면 수익가치는 현금흐름할인모형, 배당할인모형 등미래의 수익가치 산정에 관하여 일반적으로 공정하고 타당한 것으로 인정되는 방법을 적용하여 합리적으로 산정하도록 되어 있습니다.
외부평가기관은 소멸회사의 수익가치를 현금흐름할인법으로 산정하였습니다. 현금은 기업의 모든 활동을 경제적으로 환산시켜 주는 지표이며, 기업이 창출하는 현금흐름은 기업의 모든 기대수익과 위험을 반영한 결과물입니다. 따라서 현금흐름할인법은 일반적으로 회사의 기업가치를 가장 합리적으로 반영한다고 인정되므로, 본 평가시에 수익가치 산정방법으로 채택하였습니다.
현금흐름할인법은 평가대상회사로부터 기대되는 미래 현금유입액을 측정한 후 할인율을 적용하여 현재가치를 산정하는 방법입니다. 현금흐름은 다양하게 정의될 수 있으며, 일반적으로 주주에게 귀속되는 잉여현금흐름, 기업 전체에 귀속되는 잉여현금흐름 등을 사용합니다. 기업잉여현금흐름할인법은 일정기간 동안 기업의 현금흐름을 추정하여 추정기간의 기업잉여현금흐름과 추정기간 이후의 기업잉여현금흐름을 가중평균자본비용(WACC; Weighted Average Cost of Capital)으로 할인한 현재가치의 합으로 영업가치를 산정한 후 비영업용 자산을 가산하여 기업가치를 산출합니다. 그리고 산출된 기업가치에서 이자부부채만큼 차감함으로써 최종적으로 자기자본가치를 산정합니다.
본 합병에서 소멸회사의 합병가액 산정 시 외부평가기관은 금융감독원이 제정한 "외부평가업무 가이드라인(2009.6)"과 한국공인회계사회가 제정한 "가치평가서비스 수행기준(2008.8)"을 준수하였습니다. 또한 평가법인은 합병당사회사가 제시한 합병비율이「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5, 그리고 「증권의 발행 및 공시 등에 관한 규정」 제5-13조 및 동규정 시행세칙 제4조 내지 제8조에서 규정하고 있는 합병가액 산정방법에 따라 산정되었는지에 대하여 검토하였습니다. 평가보고서 상 미래기간에 대한 추정은 합병당사회사 경영진에 의한 경영전략이나 영업계획의 수정 등 다양한 제반 요소들의 변동에 따라 중대한 영향을 받을 수도 있습니다. 한편 평가인이 선관주의의무를 다하여 기재하였지만 본 합병에 대한 평가범위가 매우 넓으며 평가에 사용된 수치가 많으므로 평가보고서 상 의도하지 않은 표현의 실수나 단순 오타 등이 발생할 수 있습니다. 또한 계산상의 실수로 인해 수치상 오류가 발생할 가능성도 있습니다. 이 경우 합병가액이 적정성이 손상될 수 있고, 상대적으로 낮게 평가된 회사의 주주의 경우 신주배정 비율 하락으로 인해 손해를 볼 가능성이 있으며 이 경우 투자자들의 소송이 제기될 수 있습니다. 투자자께서는 이점 유의하시기 바랍니다.
| 다-7. 존속회사 주식가치 변동위험 본 합병으로 소멸회사 (주)이피디바이오테라퓨틱스 기명식 보통주식 1주당 존속회사 (주)제넥신 기명식 보통주식 6.1947003주의 비율로 합병신주가 배정되어 교부됩니다. 상기의 합병비율은 합병계약 체결 이후 존속회사 (주)제넥신의 주식가격 변동에 따라 추가 조정되지 않고 고정되며, 이에 따라 소멸회사 주주가 합병에 따라 교부받게 되는 존속회사 주식가치 변동위험이 존재합니다. |
본 합병으로 소멸회사 (주)이피디바이오테라퓨틱스 기명식 보통주식 1주당 존속회사 (주)제넥신 기명식 보통주식 6.1947003주의 비율로 합병신주가 배정되어 교부됩니다. 상기의 합병비율은 합병계약 체결 이후 존속회사 (주)제넥신의 주식가격 변동에 따라 추가 조정되지 않고 고정되며, 이에 따라 소멸회사 주주가 합병에 따라 교부받게 되는 존속회사 주식가치 변동위험이 존재합니다.
존속회사인 (주)제넥신은 코스닥시장 상장법인이고, 소멸회사인 (주)이피디바이오테라퓨틱스는 주권 비상장법인이므로 「증권발행 및 공시등에 관한규정 시행세칙」 제4조 내지 제8조에 따라 산정된 본질가치(자산가치와 수익가치를 각각 1과 1.5로 하여 가중산술평균한 가액)를 합병가액으로 평가하였습니다.
존속회사 및 소멸회사의 합병가액과 이에 따른 합병비율은 다음과 같습니다.
| (단위: 원) |
| 구분 | (주)제넥신 (합병법인) |
(주)이피디바이오테라퓨틱스 (피합병법인) |
|---|---|---|
| 가. 기준시가(주1) | 6,540 | 해당사항없음 |
| 나. 본질가치[(Ax1+Bx1.5)÷2.5](주2) | 해당사항없음 | 40,512 |
| A. 자산가치 | 7,865 | 2,824 |
| B. 수익가치 | 해당사항없음 | 65,638 |
| 다. 상대가치(주3) | 해당사항없음 | 해당사항없음 |
| 라. 1주당 합병가액 | 6,540 | 40,512 |
| 마. 합병비율 | 1 | 6.1947003 |
| 출처: 합병당사법인 제시자료, 태성회계법인 Analysis) | |
| (주1) | 주권상장법인의 합병가액은 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제1항 제2호 가목에 따라, 원칙적으로 기준시가를 적용하되 기준시가가 자산가치보다 낮은 경우에는 자산가치로 할 수 있도록 되어 있습니다. 존속법인인 제넥신의 경우 자산가치가 기준시가보다 높으나, 금번 합병의 경우 기준시가를 적용하였습니다. |
| (주2) | 소멸법인인 이피디바이오테라퓨틱스의 합병가액은 「증권의 발행 및 공시 등에 관한 규정시행세칙」 제4조를 적용하여 자산가치와 수익가치를 1과 1.5의 비율로 가중산술평균한 가액으로 산정하였습니다. |
| (주3) | 「증권의 발행 및 공시 등에 관한 규정 시행세칙」 제7조 제1항 제1호 따른 유사회사 요건을 충족하는 법인이 3사 미만이므로, 비교목적으로 공시되는 소멸회사의 상대가치는 산정하지 아니하였습니다. |
주권상장법인의 합병가액은「자본시장과 금융투자업에 관한 법률 시행령」176조의5 제1항 제2호 가목에 따라, 원칙적으로 기준시가를 적용하되 기준시가가 자산가치보다 낮은 경우에는 자산가치로 할 수 있습니다. 주권상장법인인 존속회사는 자산가치가 기준시가보다 높으나, 다수의 시장참여자들에 의해 주식시장에서 거래되어 형성된 시가를 기초로 산정된 기준시가가 기업의 실질가치를 적절하게 반영하고 있다고 판단하여 본 평가에서는 기준시가를 합병가액으로 산정하였습니다.
상기 합병비율은 향후 존속회사의 주식 가격 변동에 따라 추가 조정되지 않고 고정됩니다. 이에 따라 소멸회사의 주주가 합병에 따라 교부받게 되는 존속회사의 주식가치 변동 위험이 존재합니다.
| [ 자본시장과 금융투자업에 관한 법률 시행령 ] |
|---|
|
제176조의5(합병의 요건ㆍ방법 등) 1. 주권상장법인 간 합병의 경우에는 합병을 위한 이사회 결의일과 합병계약을 체결한 날 중 앞서는 날의 전일을 기산일로 한 다음 각 목의 종가(증권시장에서 성립된 최종가격을 말한다. 이하 이 항에서 같다)를 산술평균한 가액(이하 이 조에서 "기준시가"라 한다)을 기준으로 100분의 30(계열회사 간 합병의 경우에는 100분의 10)의 범위에서 할인 또는 할증한 가액. 이 경우 가목 및 나목의 평균종가는 종가를 거래량으로 가중산술평균하여 산정한다. 나. 최근 1주일간 평균종가 다. 최근일의 종가 가. 주권상장법인의 경우에는 제1호의 가격. 다만, 제1호의 가격이 자산가치에 미달하는 경우에는 자산가치로 할 수 있다. 나. 주권비상장법인의 경우에는 자산가치와 수익가치를 가중산술평균한 가액 |
| 다-8. 합병신주의 추가상장 시 주가하락의 위험 존속회사의 합병신주 추가상장예정일은 2024년 10월 17일로 (주) 제넥신 보통주식 4,131,598주가 추가 상장될 예정입니다. 금번 합병으로 인해 소멸회사의 주주이자 등기임원인최재현(1975. 3. 26.) 및 이승현(1979. 9. 20.)은 2년을, "소멸회사"의 나머지 주주들은 각 교부받은 "존속회사"의 주식의 50%에 대해서는 1개월, 나머지 50%에 대해서는 3개월 동안 관계법령에 따른 전자등록일 또는 예탁일로부터 각각 인출 및 매각이 제한됩니다. 해당 매각제한이 해제될 경우 본 물량출하에 따른 주가하락이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
존속회사의 합병신주 추가상장예정일은 2024년 10월 17일로 (주) 제넥신 보통주식 4,131,598주가 추가 상장될 예정입니다. 금번 합병으로 인해 소멸회사의 주주이자 등기임원인 최재현(1975. 3. 26.) 및 이승현(1979. 9. 20.)은 2년을,
"소멸회사"의 나머지 주주들은 각 교부받은 "존속회사"의 주식의 50%에 대해서는 1개월, 나머지 50%에 대해서는 3개월 동안 관계법령에 따른 전자등록일 또는 예탁일로부터 각각 인출 및
매각이 제한됩니다. 해당 매각제한이 해제될 경우 본 물량출하에 따른 주가하락이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 다-9. 추가자금 소요에 따른 위험 본건 합병은 존속회사가 소멸회사의 주주에게 발행하는 합병신주가 합병회사 발행주식총수의 10%를 초과하지 아니하고, 소멸회사 주주에게 지급하는 합병교부금(현금 등)이 존속회사 최종대차대조표상 순자산가액의 5%를 초과하지 아니하며, 소멸회사의 총주주 동의 하에 진행되는 합병입니다. 존속회사 (주)제넥신의 경우 소규모합병, 소멸회사 (주)이피디바이오테라퓨틱스의 경우 간이 합병입니다. 이에 따라 양사 주주들에게 주식매수청구권 규정은 적용되지 않거나 주식매수청구권 불이행 확약이 되어있어 합병 진행에 있어 주식매수청구권 관련 추가 자금 소요 위험은 적을 것으로 예상됩니다. |
본건 합병은 존속회사가 소멸회사의 주주에게 발행하는 합병신주가 합병회사 발행주식총수의 10%를 초과하지 아니하고, 소멸
회사 주주에게 지급하는 합병교부금(현금 등)이 존속회사 최종대차대조표상 순자산가액의 5%를 초과하지 아니하며, 소멸회사의 총주주 동의 하에 진행되는 합병입니다.
존속회사 (주)제넥신의 경우 소규모합병, 소멸회사 (주)이피디바이오테라퓨틱스의 경우 간이 합병입니다. 이에 따라 양사 주주들에게 주식매수청구권 규정은 적용되지 않거나 주식매수청구권 불이행 확약이 되어있어 합병 진행에 있어 주식매수청구권 관련 추가 자금 소요 위험은 적을 것으로 예상됩니다.
| 다-10. 주식매수청구권 행사에 따른 과세 관련 사항 본건 합병은 존속회사가 소멸회사의 주주에게 발행하는 합병신주가 합병회사 발행주식총수의 10%를 초과하지 아니하고, 소멸회사 주주에게 지급하는 합병교부금(현금 등)이 존속회사 최종대차대조표상 순자산가액의 5%를 초과하지 아니하며, 소멸회사의 총주주 동의 하에 진행되는 합병입니다. 존속회사 (주)제넥신의 경우 소규모합병, 소멸회사 (주)이피디바이오테라퓨틱스의 경우 간이 합병입니다. 이에 따라 양사 주주들에게 주식매수청구권 규정은 적용되지 않거나 주식매수청구권 불이행 확약이 되어있어 합병 진행에 있어 주식매수청구권 관련 과세 위험은 적을 것으로 예상됩니다. |
본건 합병은 존속회사가 소멸회사의 주주에게 발행하는 합병신주가 합병회사 발행주식총수의 10%를 초과하지 아니하고, 소멸회사 주주에게 지급하는 합병교부금(현금 등)이 존속회사 최종대차대조표상 순자산가액의 5%를 초과하지 아니하며, 소멸회사의 총주주 동의 하에 진행되는 합병입니다.
존속회사 (주)제넥신의 경우 소규모합병, 소멸회사 (주)이피디바이오테라퓨틱스의 경우 간이 합병입니다. 이에 따라 양사 주주들에게 주식매수청구권 규정은 적용되지 않거나 주식매수청구권 불이행 확약이 되어있어 합병 진행에 있어 주식매수청구권 관련 과세 위험은 적을 것으로 예상됩니다.
| 다-11. 소멸회사 우회상장에 해당될 위험 본 합병의 경우 소규모/간이합병에 해당하며, 「코스닥시장 상장규정」 제33조에 따르면 소규모/간이합병의 경우 우회상장 해당사항이 아님이 명시되어 있습니다. 존속회사는 주요사항보고서 제출일 현재 한국거래소에 본 합병과 관련하여 소멸회사의 우회상장에 해당되지 않음을 거래소로부터 확인받은 바 있습니다. 본 합병에 따라 보통주권 상장법인((주)제넥신)을 존속법인으로 하여 합병하는데 있어 주권비상장법인의 상장의 효과는 있으나, 「코스닥시장 상장규정」 및 동법 시행세칙에서 명시하고 있는 직전사업연도의 재무제표를 기준으로 자산총계ㆍ자본금 및 매출액 중 두 가지 이상이 코스닥시장 상장법인보다 더 크거나, 코스닥시장 상장법인의 최대주주 변경 등이 있는 경우에 해당되지 않음에 따라 우회상장에 해당되지 않으며, 이에 따라 본건 합병이 상장예비심사 대상이 아님을 확인하였습니다. |
「코스닥시장 상장규정」 및 시행세칙에서 명시하고 있는 직전사업연도의 재무제표를 기준으로 자산총계ㆍ자본금 및 매출액 중 두 가지 이상이 코스닥시장 상장법인보다 더 크거나, 코스닥시장 상장법인의 최대주주 변경 등이 있는 경우 우회상장에 해당된다고 정의하고 있습니다.
본 합병의 경우 소규모/간이합병에 해당하며, 「코스닥시장 상장규정」 제33조에 따르면 소규모/간이합병의 경우 우회상장 해당사항이 아님이 명시되어 있습니다. 존속회사는 주요사항보고서 제출일 현재 한국거래소에 본 합병과 관련하여 소멸회사의 우회상장에 해당되지 않음을 거래소로부터 확인받은 바 있습니다. 본 합병에 따라 보통주권 상장법인((주)제넥신)을 존속법인으로 하여 합병하는데 있어 주권비상장법인의 상장의 효과는 있으나, 「코스닥시장 상장규정」 및 동법 시행세칙에서 명시하고 있는 직전사업연도의 재무제표를 기준으로 자산총계ㆍ자본금 및 매출액 중 두 가지 이상이 코스닥시장 상장법인보다 더 크거나, 코스닥시장 상장법인의 최대주주 변경 등이 있는 경우에 해당되지 않음에 따라 우회상장에 해당되지 않으며, 이에 따라 본건 합병이 상장예비심사 대상이 아님을 확인하였습니다.
| [우회상장 해당 여부 검토] |
| (단위 : 원) |
| 구 분 | 내 용 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. 주권비상장법인의 명칭 | (주)이피디바이오테라퓨틱스 | ||||||||||||
| 2-1. 합병의 주요사항보고서 제출일 이전 1년 이내에 주권비상장법인의 최대주주등 또는 5%이상 주주가 당사의 최대주주가 되었는지 여부 | 해당사항 없음 | ||||||||||||
| 2-2. 합병으로 인하여 주권비상장법인의 최대주주등 또는 5%이상 주주가 당사의 최대주주가 되는지의 여부(합병의 주요사항보고서상 합병비율에 따라 최대주주가 되는 경우를 말함) | 해당사항 없음 | ||||||||||||
| 3. 주권비상장법인의 규모가 당사보다 더 큰지 여부 |
2023년말 별도기준 : 해당사항없음
|
본건 합병은 우회상장에 해당되지 않으며, 이에 따라 「코스닥시장 상장규정」 제54조에서 정하는 상장폐지 요건에 해당되지 않는 바, 존속회사의 보통주식의 상장폐지가능성은 없는 것으로 확인됩니다. 다만, 향후 「코스닥시장 상장규정」에서 규정하는 경영권 변동 여부 관련 사항이 발생될 경우 우회상장 여부에 대해 재확인 요청이 발생할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다
|
[코스닥시장 상장규정] 제33조(우회상장) 가. 「상법」 제522조에 따른 합병. 다만, 「상법」 제527조의2에 따른 간이합병 또는 「상법」 제527조의3에 따른 소규모합병은 제외한다.
제34조(우회상장 심사서류 제출 등) ③우회상장 심사와 결과의 통지 등에 관하여는 상장예비심사신청 후 신고사항에 관한 제5조, 상장예비심사 등에 관한 제6조(제2항 및 제6항은 제외한다), 상장예비심사 결과의 효력불인정에 관한 제8조 및 상장예비심사 결과에 대한 이의신청에 관한 제10조를 준용한다. 이 경우 “상장예비심사”는 “우회상장심사”로, “상장예비심사신청서”는 “우회상장 심사서류”로 본다. ⑥ 제1항부터 제5항까지의 규정 외에 우회상장 해당 여부 판단을 위한 세부 적용 방법과 제출 서류 등은 세칙으로 정한다.
제30조(경영권 변동의 기준) 제32조(우회상장 심사서류 제출 등) 1. 보통주식 상장법인이 주권비상장법인(주식이 아닌 지분증권을 발행하는 법인을 포함한다. 이하 이 항에서 같다) 또는 코넥스시장 상장법인과 「상법」 제522조에 따른 합병을 하는 경우: 합병의 주요사항보고서 제출일 |
| 다-12. 소액주주 소송제기 가능성에 따른 위험 양사의 소액주주들은 절차상 하자나 합병비율이 불공정하다는 이유 등으로 본건 합병과 관련하여 합병 무효의 소를 제기할 가능성이 있습니다. 합병 무효의 소가 제기되어 합병 무효의 판결이 법원에서 확정되는 경우 합병 자체가 무효로 돌아갈 위험이 있습니다. 그러나 본건 합병은 상법 등 관련 법에서 정한 절차를 준수하여 진행되고 있으므로 절차상 하자를 이유로 합병이 무효가 될 위험성은 높지 않으나 그 가능성을 배제하기는 어렵다는 점을 참고하시기 바랍니다. |
양사의 소액주주들은 절차상 하자나 합병비율이 불공정하다는 이유 등으로 본건 합병과 관련하여 합병 무효의 소를 제기할 가능성이 있습니다. 합병 무효의 소가 제기되어 합병 무효의 판결이 법원에서 확정되는 경우 본 합병 자체가 무효로 돌아갈 위험이 있습니다. 그러나 본건 합병은「상법」등 관련 법에서 정한 절차를 준수하여 진행되고 있으므로 절차상 하자를 이유로 합병이 무효가 될 위험은 높지 않다고 생각됩니다.
한편 합병비율의 불공정성을 이유로 본 합병이 무효로 될 위험성과 관련하여서는 대법원의 판례가 "합병당사자 회사의 전부 또는 일부가 주권상장법인인 경우 증권거래법과 그 시행령 등 관련 법령이 정한 요건과 방법 및 절차 등에 기하여 합병가액을 산정하고 그에 따라 합병비율을 정하였다면 그 합병가액 산정이 허위자료에 의한 것이라거나 터무니없는 예상 수치에 근거한 것이라는 등의 특별한 사정이 없는 한, 그 합병비율이 현저하게 불공정하여 합병계약이 무효로 된다고 볼 수 없을 것이다." (대법원 2008. 1. 10. 선고 2007 다 64136 판결)라고 판시하고 있습니다. 따라서「자본시장과 금융투자업에 관한 법률」및 관련 법령에 따라 합병비율이 산정되어 진행되는 본건 합병에서 합병이 무효로 돌아갈 위험성은 높지 않은 것으로 판단됩니다.
본건 합병의 경우 존속회사인 (주)제넥신은 주권상장법인으로 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제1항 제2호 가에 의거 보통주에 대한 기준주가를 합병가액으로 산출하였습니다. 소멸회사인 (주)이피디바이오테라퓨틱스는 주권비상장법인으로서 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의5 제1항 제2호 나에 의거 자산가치와 수익가치를 가중산술평균한 가액을 합병가액으로 산출하였습니다. 자세한 내용은 제1부 Ⅱ. 합병 가액 및 그 산출근거를 참고하시기 바랍니다. 이와 관련된 법규는 아래와 같습니다.
※ 관련 법령
| 【자본시장과 금융투자업에 관한 법률 시행령】 |
|---|
|
제176조의5(합병의 요건ㆍ방법 등) 1. 주권상장법인 간 합병의 경우에는 합병을 위한 이사회 결의일과 합병계약을 체결한 날 중 앞서는 날의 전일을 기산일로 한 다음 각 목의 종가(증권시장에서 성립된 최종가격을 말한다. 이하 이 항에서 같다)를 산술평균한 가액(이하 이 조에서 "기준시가"라 한다)을 기준으로 100분의 30(계열회사 간 합병의 경우에는 100분의 10)의 범위에서 할인 또는 할증한 가액. 이 경우 가목 및 나목의 평균종가는 종가를 거래량으로 가중산술평균하여 산정한다. 가. 최근 1개월간 평균종가. 다만, 산정대상기간 중에 배당락 또는 권리락이 있는 경우로서 배당락 또는 권리락이 있은 날부터 기산일까지의 기간이 7일 이상인 경우에는 그 기간의 평균종가로 한다. 나. 최근 1주일간 평균종가 다. 최근일의 종가 2. 주권상장법인(코넥스시장에 주권이 상장된 법인은 제외한다. 이하 이 호 및 제4항에서 같다)과 주권비상장법인 간 합병의 경우에는 다음 각 목의 기준에 따른 가격 가. 주권상장법인의 경우에는 제1호의 가격. 다만, 제1호의 가격이 자산가치에 미달하는 경우에는 자산가치로 할 수 있다. 나. 주권비상장법인의 경우에는 자산가치와 수익가치를 가중산술평균한 가액 |
본건 합병의 합병비율은 「자본시장과 금융투자업에 관한 법률」 및 관련 법령에 따라 산정되었고, 본건 합병은 상법 등 관련 법에서 정한 절차를 준수하여 진행되고 있어 합병무효로 판정될 가능성은 낮으나, 본건 합병의 합병비율과 관련하여 소송이 제기될 가능성을 배제하기는 어렵다는 점을 참고하시기 바랍니다.
| 다-13. 관련 법령상의 규제 또는 특칙 본 합병계약은 체결과 동시에 효력을 발생하는 것으로 하되, 본 합병과 관련하여 필요한 정부기관의 승인ㆍ인가ㆍ신고ㆍ수리 중 본 합병당사회사들의 영업에 중대한 영향을 미치는 승인ㆍ인가ㆍ신고ㆍ수리가 확정적으로 거부된 경우, 또는 합병기일 전일 또는 합병당사회사들이 달리 합의하는 날까지 승인ㆍ인가ㆍ신고ㆍ수리를 받지 못한 때에는 본 합병 계약은 해제될 수 있습니다. 다만, 증권신고서 제출 전일 현재 본건과 관련하여 법령상의 규제 및 특칙에 위배되는 사항은 없습니다. |
| 다-14. 소멸회사 자기주식에 대한 신주 배정 관련 법적 위험 존속회사인 (주)제넥신은 합병기일 현재 소멸법인인 (주)이피티바이오테라퓨틱스의 주식을 보유하고 있지 않습니다. 또한 존속회사에게 소규모 합병이며, 소멸법인의 경우 총주주 동의하에 주식매수청구권 행사가 제한된 간이합병이기 때문에 합병의 과정에서 존속회사가 자기주식에 신주를 배정하게 될 위험은 낮습니다. |
존속회사인 (주)제넥신은 합병기일 현재 소멸법인인 (주)이피티바이오테라퓨틱스의 주식을 보유하고 있지 않습니다. 또한 존속회사에게 소규모 합병이며, 소멸법인의 경우 총주주 동의하에 주식매수청구권 행사가 제한될 예정이기 때문에 합병의 과정에서 존속회사가 자기주식에 신주를 배정하게 될 위험은 낮습니다.
| 다-15. 일정 변경 관련 위험 본 증권신고서는 공시 심사과정에서 일부 내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무 진행과정에서 일정이 변경되거나 신고서 내용이 정정되거나 일정이 변경될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
본 증권신고서는 공시 심사과정에서 일부 내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무 진행과정에서 일정이 변경되거나 신고서 내용이 정정되거나 일정이 변경될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
「자본시장과 금융투자업에 관한 법률」제120조 3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
본 증권신고서에 기재된 내용은 신고서 제출일 현재까지 발생된 것으로 본 신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익 상황에 중대한 변동을 가져 오거나 중요한 영향을 미치는 사항은 없는 것으로 파악됩니다. 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 합병당사회사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있고, 향후 진행경과 또한 동 전자공시 홈페이지에 공시될 예정이므로 투자의사를 결정하시는 데 참조하시기 바랍니다.
4. 합병등과 관련된 거래상대방 또는 제3자와 풋옵션(Put Option), 콜옵션(Call Option), 풋백옵션(Put Back Option)등 계약을 체결한 경우
해당사항 없습니다.
VII. 주식매수청구권에 관한 사항
본 합병은 증권의 발행 및 공시 등에 관한 규정 제2-9조 제3항의 요건을 충족하고 있으므로, <VII. 주식매수청구권에 관한 사항>의 작성을 생략합니다.
VIII. 당사회사간의 이해관계 등
1. 당사회사간의 관계
가. 계열회사 또는 자회사 등의 관계
해당사항 없습니다.
나. 임원의 상호겸직
해당사항 없습니다.
다. 일방 당사회사의 대주주 및 특수관계인이 상대방 당사회사의 특수관계인인 경우
해당사항 없습니다.
라. 그 밖에 영업의 경쟁 또는 보완관계 여부 등 상호관련사항
본 합병은 존속회사 (주)제넥신이 소멸회사 (주)이피디바이오테라퓨틱스를 합병하는 건입니다. 존속회사 (주)제넥신은 1999년 설립된 바이오 신약개발 회사로서 다수의 플랫폼 연구개발 및 글로벌 임상시험 수행 역량을 보유하고 있으며, 2023년 인도네시아에서 에서 만성신장성 빈혈 대상 치료제를 허가받는 등 글로벌 수준의 신약개발 경험과 역량을 보유하고 있습니다.
소멸회사 (주)이피디바이오테라퓨틱스는 2021년 설립된 표적단백질분해기술(TPD) 플랫폼 개발 회사로서 국내 TIPS 지원을 받고, KDDF 과제로도 선정되었을 뿐만 아니라 해외 대형 제약회사와 공동연구개발을 수행하는 등 시장성과 기술적 차별성을 인정받았습니다. TPD 약물은 특정 단백질을 유비퀴틴-프로테아좀 시스템에 연결하여 분해하는 메커니즘을 통해 작용합니다. 이 시스템은 질병을 유발하는 단백질을 표적으로 하여, 특히 기존의 소분자 치료제가 다루기 어려운 단백질을 효과적으로 제거하는 데 강점을 보입니다. 이와 같은 장점으로 인해 TPD 약물이 임상 개발 단계로 진입하는 사례가 늘어나면서 지속적인 성장을 보이고 있습니다. (주)이피디바이오테라퓨틱스의 EPDegTM 기술은 기존의 소분자로 이루어진 일반적인 TPD 약물과 달리 나노바디(nanobody)와 변형된 E3 단백질을 융합시킨 구조이며, 이는 mRNA형태로 지질나노입자 (LNP)와 같은 전달체를 이용하여 특정 조직에서 원하는 단백질을 효과적으로 분해할 수 있습니다. 이는 기존의 약물로는 치료가 어려운 질병에 효과적으로 대응할 수 있는 새로운 방법을 제공합니다. TPD 약물 시장의 급성장과 기술의 발전은 미래의 의약품 개발에 큰 변화를 가져올 것입니다.
(주)제넥신이 보유한 특정 항원을 정밀하게 표적화하는 항체 기술과 새롭게 성장하고 있는 TPD 약물의 융합은 기존의 치료제들로는 해결하기 어려운 단백질을 효과적으로 분해 할수 있는 새로운 방법을 제공합니다. 이는 특정 단백질의 기능을 억제하거나 변형 시키는데 그치지 않고, 단백질을 완전히 분해하여 제거함으로써 질병의 근본 원인을 직접적으로 타겟팅할 수 있으며, 새로운 기전을 통해 작용하므로 보다 효과적이고 혁신적인 치료방법을 제공할 수 있습니다.
결론적으로, 합병당사회사들은 기업 구조 단일화를 통해 연구개발 역량과 기술적 차별성을 보유한 신약개발 회사가 됨으로써 향후 글로벌 선두 바이오 신약개발 회사로 성장하고자 합니다.
2. 당사회사간의 관계
가. 당사회사간의 출자내역
해당사항 없습니다.
나. 당사회사간의 채무보증 및 담보제공
해당사항 없습니다.
다. 당사회사간의 매입ㆍ매출거래, 채권ㆍ채무 등 (2024년 1분기 기준)
존속회사: (주)제넥신
- 해당사항 없습니다.
소멸회사: (주)이피디바이오테라퓨틱스
- 해당사항 없습니다.
3. 당사회사 대주주와의 거래내용
본 합병 당사회사의 최대주주는 아래와 같으며, 이에 대한 거래내용은 다음과 같습니다.
| 회사 | 최대주주 |
|---|---|
| (주)제넥신 | (주)한독 |
| (주)이피디바이오테라퓨틱스 | 최재현 |
가. 대주주 등에 대한 신용공여 등
해당사항 없습니다.
나. 대주주와의 자산양수도 등
해당사항 없습니다.
다. 대주주와의 영업거래
해당사항 없습니다.
IX. 기타 투자자보호에 필요한 사항
1. 과거 합병 및 분할 등의 내용
가. (주)제넥신의 과거 합병 등의 내용
(주)제넥신은 면역항암, 유전자백신, 유전자교정 분야에서 시너지를 창출하고, 핵심원천기술간 유기적인 융합개발로 차세대 기술을 확보함으로써 글로벌 시장에서의 사업경쟁력을 향상시키고자 2019년 6월 19일 이사회 결의를 통하여 (주)툴젠과 합병계약을 체결하고 절차를 진행 하였습니다.
단, (주)제넥신과 (주)툴젠은 2019년 7월 30일 임시주주총회에서 각각 합병계약 승인 후 관계법령에 따라 주주총회일 이후 2019년 7월 31일 부터 2019년 8월 19일 까지 주식매수청구권 행사를 진행하였으며, 주식매수청구권행사 접수 결과 (주)제넥신과 (주)툴젠이 지급하여야 하는 매수대금이 각각 금 1,300억원과 500억원을 초과함을 확인하였습니다.
2019년 6월 19일에 (주)제넥신과 (주)툴젠이 체결한 합병계약서 3.6조에 의거 합병에 반대하는 주주들의 주식매수청구권 행사로 인하여 (주)제넥신이 지급해야 하는 매수대금이 금 1,300억원을 초과하거나 (주)툴젠이 지급하여야 하는 매수대금이 금 500억원을 초과하는 경우, 양사는 사전 상호 협의 후 이사회를 거쳐 상대방 당사자에게 서면통지로 합병계약을 해제 할 수 있었으며, 양사는 상호협의 후 의사회결의를 거쳐 합병 계약을 해제한 바 있습니다. (주)툴젠과의 합병 철회 이외에, 증권신고서 제출 전일 현재 (주)제넥신의 과거 합병 등에 관련한 내용은 없습니다.
나. (주)이피디바이오테라퓨틱스의 과거 합병 등의 내용
해당사항 없습니다.
2. 대주주의 지분현황 등
가. 합병 전ㆍ후 최대주주 및 특수관계인 지분 변동 현황
| [합병 전ㆍ후 최대주주 및 특수관계인의 지분 변동 현황] |
| (기준일: 증권신고서 제출일 전일) | (단위: 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
합병 전 | 합병 후 | ||||
| (주)제넥신 | (주)이피디바이오테라퓨틱스 | (주)제넥신 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | 주식수 | 지분율 | |||
| (주)한독 | 최대주주 | 보통주 | 6,048,534 | 14.57 | - | - | 6,048,534 | 13.25 |
| 최대주주 등 합계 | 보통주 | 6,048,534 | 14.57 | 300,000 | 45.17 | 6,048,534 | 13.25 | |
| 발행주식 총수 | 보통주 | 41,510,594 | 100.00 | 664,160 | 100.00 | 45,642,192 |
100.00 | |
| 주1) 상기 지분율은 보통주 기준입니다. |
| 주2) 합병 후 지분율 및 주식수는 증권신고서 제출일 전일을 기준으로 합병신주 발행 예상 주식수를 적용한 수치이며, 해당 내용은 추후 변동될 수 있습니다. |
| 주3) 존속회사는 증권신고서 제출일 전일 기준 소멸회사의 주식을 보유하고 있지 않아, 합병 신주 배정 여부에 따른 법적 위험이 없습니다. 또한 소멸회사는 증권신고서 제출일 전일 기준 자기주식을 보유하고 있지 않아, 소멸회사의 자기주식에 합병 신주 배정 여부에 따른 법적 위험이 없습니다. |
| 주4) 본 합병 이후 (주)제넥신은 존속법인으로 계속 남아있게 되며, (주)이피디바이오테라퓨틱스는 해산할 예정입니다. |
나. 합병 후 존속회사 대주주의 향후 지분 양수도에 관하여 합병 전ㆍ후 대주주간 사전합의가 있는 경우
해당사항 없습니다.
다. 합병 후 대주주의 지분 매각 제한 및 근거
존속회사의 합병신주 추가상장예정일은 2024년 10월 17일로 (주) 제넥신 보통주식 4,131,598주가 추가 상장될 예정입니다. 금번 합병으로 인해 소멸회사의 주주이자 등기임원인 최재현(1975. 3. 26.) 및 이승현(1979. 9. 20.)은 2년을, "소멸회사"의 나머지 주주들은 각 교부받은 "존속회사"의 주식의 50%에 대해서는 1개월, 나머지 50%에 대해서는 3개월 동안 관계법령에 따른 전자등록일 또는 예탁일로부터 각각 인출 및 매각이 제한됩니다. 합병계약서 상의 지분 매각 제한 근거는 다음과 같습니다.
| [본 합병계약서 상의 지분 매각 제한 근거] |
| 제15조(합병 기일 후 확약사항) (중략) 본건 합병으로 인하여 소멸회사의 주주들에게 교부되는 " 존속회사"의 주식(합병신주를 포함함, 이하동일)에 관하여 "소멸회사"의 주주이자 등기임원인 최재현(1975. 3. 26.생) 및 이승현(1979. 9. 20.생)은 2 년을, " 소멸회사"의 나머지 주주들은 각 교부받은 " 존속회사"의 주식의 50% 에 대해서는 1 개월, 나머지 50% 에 대해서는 3 개월 동안 관계법령에 따른 전자등록일 또는 예탁일로부터 각각 인출하거나 매각할 수 없다. 단, "소멸회사"의 주주들은 한국거래소규정 등 관계규정 및 관계법령상 본건 합병 관련하여 요구되는 의무보유 관련 사항 및 금융감독원, 금융위원회 및 한국거래소 등 관련기관과의 협의 내지 관련기관으로부터의 지시, 권고 등에 따른 조치를 성실히 이행하기로 한다. |
3. 합병 등 이후 회사의 자본변동
합병 이후 합병회사의 자본변동 내역은 다음과 같습니다.
| (단위 : 주, 원) |
| 구분 | 종류 | 합병 전(주1) | 합병 후(주2) | |
|---|---|---|---|---|
| (주)제넥신 (합병존속회사) |
(주)이피디바이오테라퓨틱스 (합병소멸회사) |
|||
| 수권주식수 | 합 계 | 300,000,000 | 1,000,000 | 300,000,000 |
| 발행주식수 | 보통주 | 41,510,594 | 400,000 | 45,642,192 |
| 우선주 | - | 264,160 | - | |
| 합 계 | 41,510,594 | 664,160 | 45,642,192 | |
| 자본금 | 20,755,297,000 | 324,700,000 | 22,821,096,000 | |
| 주1: 합병 전 수권주식수, 발행주식수는 증권신고서 제출 전일 현재, 자본금은 2024년 1분기말 기준입니다. 주2: 합병 후 자본금에 대하여는 합병 후 예상되는 발행주식의 총수(45,642,192주)에 액면금액(500원)을 곱하여 추정하였습니다. 주3: 합병 후 자본현황은 실제 합병기일 기준으로 작성될 재무제표와 차이가 발생할 수 있습니다. 주4: 피합병법인이 발행한 우선주 264,160주 전체는 합병계약서에 따라 합병기일전에 피합병법인의 보통주로 전환될 예정입니다. |
4. 경영방침 및 임원구성
존속회사인 (주)제넥신은 소멸회사인 (주)이피디바이오테라퓨틱스의 직원을 합병기일 현재 (주)제넥신의 직원으로 승계합니다. 다만, 소멸회사의 이사의 지위는 해산등기와 함께 소멸합니다. 이밖에 존속회사인 (주)제넥신의 향후 주요 경영방침에 대하여 사전에 합의되거나 계획ㆍ양해된 바는 없습니다.
5. 사업계획 등
합병존속회사인 (주)제넥신은 합병 완료 후 합병소멸회사인 (주)이피디바이오테라퓨틱스의 주된 사업을 계속 영위할 예정입니다. 증권신고서 제출 전일 현재 추가 사업 진출과 사업 목적 변경 및 폐지 등을 계획하거나 확정된 사항은 없습니다.
6. 합병등 이후 재무상태표
| 합병 후 재무제표(추정) |
| (단위: 원) |
| 구분 | 합병 전 별도재무상태표(2024년 1분기말 기준) | 합병 후 재무상태표(*1) | |
| (주)제넥신 | (주)이피디바이오 테라퓨틱스 |
||
| 자산 | |||
| 유동자산 | 58,526,342,430 | 726,565,701 | 59,252,908,131 |
| 비유동자산 | 334,069,406,501 | 705,524,076 | 361,794,956,390 |
| 영업권과 식별무형자산 (추정)(*2) | - | - | 27,010,269,743 |
| 기타비유동자산 | 334,069,406,501 | 705,524,076 | 334,784,686,647 |
| 자산총계 | 392,595,748,931 | 1,432,089,777 | 421,047,864,521 |
| 부채 | |||
| 유동부채 | 51,692,057,706 | 7,806,308,094 | 59,498,365,800 |
| 비유동부채 | 25,520,566,398 | 232,340,919 | 25,752,907,317 |
| 부채총계 | 77,212,624,104 | 8,038,649,013 | 85,251,273,117 |
| 자본 | |||
| 자본금(*2) | 20,755,297,000 | 20,000,000 | 22,841,096,500 |
| 자본잉여금(*2) | 355,009,534,509 | 102,847,759 | 380,066,608,581 |
| 기타자본구성요소 | (42,743,027,233) | - | (42,743,027,233) |
| 이익잉여금 | (17,638,679,449) | (6,729,406,995) | (24,368,086,444) |
| 자본총계 | 315,383,124,827 | (6,606,559,236) | 335,796,591,404 |
| 부채와자본총계 | 392,595,748,931 | 1,432,089,777 | 421,047,864,521 |
| 주1: 합병 후 재무상태표는 합병법인 및 피합병법인의 각각 2024년 1분기말 별도재무상태표 기준이며, 합병법인은 한국채택국제회계기준을 따르며, 피합병법인은 일반기업회계기준에 따라 작성한 재무상태표를 한국채택국제회계기준으로 전환한 수치입니다. 주2: 합병 후 재무상태표의 자본금과 자본잉여금은 합병비율을 고려하여 산출되었습니다. 다만, 실제 합병기일 기준으로 작성될 합병재무상태표는 피합병회사 순자산의 매수가격배분을 통해 작성될 것이기 때문에 상기 합병 후 추정 재무수치와 차이가 있을 수 있습니다. |
| 합병 후 재무제표(추정) |
| (단위: 원) |
| 구분 | 합병 전 손익계산서(2024년 1분기말 기준) | 합병 후 손익계산서(*1) | |
| (주)제넥신 | (주)이피디바이오테라퓨틱스 | ||
| 매출액 | 2,073,219,312 | - | 2,073,219,312 |
| 매출원가 | 2,346,149,291 | - | 2,346,149,291 |
| 매출총이익 | (272,929,979) | - | - 272,929,979 |
| 판매비와관리비 | 12,196,044,285 | 578,119,089 | 12,774,163,374 |
| 영업이익 | (12,468,974,264) | (578,119,089) | (13,047,093,353) |
| 영업외수익 | 5,644,884,771 | 198,797,787 | 5,843,682,558 |
| 영업외비용 | 10,814,589,956 | 115,918,243 | 10,930,508,199 |
| 당기순이익 | (17,638,679,449) | (495,239,545) | (18,133,918,994) |
| 주1: | 합병 후 재무상태표는 합병법인 및 피합병법인의 각각 2024년 1분기말 별도손익계산서 기준이며, 합병법인과 피합병법인은 한국채택국제회계기준을 따라 작성하였습니다. |
| 합병 후 재무제표(추정) |
| (단위: 원) |
| 구분 | 합병 전 별도재무상태표(2023년 말 기준) | 합병 후 재무상태표(*1) | |
| (주)제넥신 | (주)이피디바이오 테라퓨틱스 |
||
| 자산 | |||
| 유동자산 | 84,492,937,964 | 968,176,291 | 85,461,114,255 |
| 비유동자산 | 328,360,560,478 | 835,998,523 | 356,216,584,814 |
| 영업권과 식별무형자산 (추정)(*2) | 0 | 0 | 27,010,269,743 |
| 기타비유동자산 | 328,360,560,478 | 835,998,523 | 329,206,315,071 |
| 자산총계 | 412,853,498,442 | 1,804,174,814 | 441,677,699,069 |
| 부채 | |||
| 유동부채 | 55,310,516,520 | 7,679,000,736 | 62,989,517,256 |
| 비유동부채 | 25,143,644,473 | 260,193,341 | 25,403,837,814 |
| 부채총계 | 80,454,160,993 | 7,939,194,077 | 88,393,355,070 |
| 자본 | |||
| 자본금(*2) | 20,755,297,000 | 20,000,000 | 22,841,096,500 |
| 자본잉여금(*2) | 646,857,262,411 | 75,848,588 | 671,887,337,312 |
| 기타자본구성요소 | (43,365,494,060) | (43,365,494,060) | |
| 이익잉여금 | (291,847,727,902) | (6,230,867,851) | (298,078,595,753) |
| 자본총계 | 332,399,337,449 | (6,135,019,263) | 353,284,343,999 |
| 부채와자본총계 | 412,853,498,442 | 1,804,174,814 | 441,677,699,069 |
| 주1: 합병 후 재무상태표는 합병법인 및 피합병법인의 각각 2023년말 별도재무상태표 기준이며, 합병법인과 피합병법인은 한국채택국제회계기준을 따라 작성하였습니다. 주2: 합병 후 재무상태표의 자본금과 자본잉여금은 합병비율을 고려하여 산출되었습니다. 다만, 실제 합병기일 기준으로 작성될 합병재무상태표는 피합병회사 순자산의 매수가격배분을 통해 작성될 것이기 때문에 상기 합병 후 추정 재무수치와 차이가 있을 수 있습니다. |
| 합병 후 재무제표(추정) |
| (단위: 원) |
| 구분 | 합병 전 손익계산서(2023년말 기준) | 합병 후 손익계산서(*1) | |
| (주)제넥신 | (주)이피디바이오테라퓨틱스 | ||
| 매출액 | 3,871,428,531 | - | 3,871,428,531 |
| 매출원가 | 2,537,335,594 | - | 2,537,335,594 |
| 매출총이익 | 1,334,092,937 | - | 1,334,092,937 |
| 판매비와관리비 | 41,827,676,955 | 2,410,164,114 | 44,237,841,069 |
| 영업이익 | (40,493,584,018) | (2,410,164,114) | (42,903,748,132) |
| 영업외수익 | 37,244,258,093 | 611,052,116 | 37,855,310,209 |
| 영업외비용 | 35,892,790,206 | 593,169,948 | 36,485,960,154 |
| 당기순이익 | (39,142,116,131) | (2,392,281,946) | (41,534,398,077) |
| 주1: | 합병 후 재무상태표는 합병법인 및 피합병법인의 각각 2023년말 별도손익계산서 기준이며, 합병법인과 피합병법인은 한국채택국제회계기준을 따라 작성하였습니다. |
| 합병 전후 주요 재무지표(추정) |
| (단위: 원) |
| 구분 | 합병 전 (2024년 1분기말 기준) | 합병 후 | ||
|---|---|---|---|---|
| (주)제넥신 | (주)이피디바이오 테라퓨틱스 |
|||
| 성장성비율 | 매출액 증가율 | 114% | N/A | 114% |
| 영업이익 증가율 | N/A | N/A | N/A | |
| 당기순이익 증가율 | N/A | N/A | N/A | |
| 총자산 증가율 | -4.9% | -20.6% | -4.7% | |
| 활동성비율 | 총자산 회전율 | 0.5% | 0.0% | 0.5% |
| 재고자산 회전율 | N/A | N/A | N/A | |
| 매출채권 회전율 | 0.35 | N/A | 0.35 | |
| 수익성비율 | 매출액 영업이익율 | N/A | N/A | N/A |
| 매출액 순이익률 | N/A | N/A | N/A | |
| 총자산 순이익률 | -4.4% | -30.6% | -4.2% | |
| 자기자본 순이익률 | -4.8% | N/A | -4.7% | |
| 안정성비율 | 유동비율 | 128.7% | 9.3% | 113.1% |
| 부채비율 | 24.5% | N/A | 25.4% | |
| 차입금의존도 | 0.17 | N/A | 0.17 | |
| 주1: | 증가율 산정 시 기초 : 2023년말, 기말 : 2024년 1분기말 |
7. 그밖에 투자의사결정에 필요한 사항
가. 합병계약서 등의 공시
「상법」 제522조의2 제1항에 의거, 합병 승인 주주총회일의 2주전부터 합병을 한 날 이후 6개월이 경과하는 날까지 다음 각호의 서류를 본점에 비치할 예정입니다.
| ① 합병계약서 ② 합병으로 인하여 소멸하는 회사의 주주에게 발행하는 주식의 배정에 관하여 그 이유를 기재한 서면 ③ 각 회사의 최종 대차대조표와 손익계산서 |
주주 및 회사채권자는 영업시간 내에는 언제든지 상기 서류의 열람을 청구하거나, 회사가 정한 비용을 지급하고 그 등본 또는 초본의 교부를 청구할 수 있습니다.
나. 투자설명서의 공시 및 교부
(1) 투자설명서의 공시
(주)제넥신은 「자본시장과 금융투자업에 관한 법률」 제123조에 의거, 증권신고서가 금융위원회에 의해 그 효력이 발생하는 날에 투자설명서를 금융감독원 전자공시시스템 홈페이지(http://dart.fss.or.kr)에 공시하는 방법으로 금융위원회에 제출할 예정입니다. (주)제넥신은 투자설명서를 존속회사와 소멸회사의 본점, 금융위원회 및 한국거래소에 비치하여 존속회사와 소멸회사의 주주가 열람할 수 있도록 조치할 예정입니다.
(2) 투자설명서의 교부
본 합병으로 인한 합병대가로 (주)제넥신 보통주식을 교부받는 소멸회사의 주주(「자본시장과 금융투자업에 관한 법률」 제9조 제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 따라 투자설명서의 교부가 면제되는 자 제외)는 합병계약 승인을 위한 임시주주총회 전에 투자설명서를 교부받아야 합니다.
① 투자설명서 교부 대상 및 방법
- 교부 대상 : 합병계약 승인 주주총회를 위한 주주확정기준일(2024년 07월 15일) 현재 주주명부상 등재된 (주)이피디바이오테라퓨틱스의 주주
- 교부 방법 : 주주명부상 등재된 주소로 투자설명서를 우편으로 발송
② 기타 사항
본 합병으로 인한 합병대가로 (주)제넥신 보통주식을 교부 받는 소멸회사의 주주 중 우편으로 발송되는 투자설명서를 사정 상 수령하지 못할 경우, 「자본시장과 금융투자업에 관한 법률」 제124조 및 제436조에 의거한 전자문서의 방법으로 투자설명서를 교부 받으시거나 투자설명서 수령거부 의사를 서면으로 표시해 주시기 바랍니다.
존속회사 및 소멸회사의 본점에도 투자설명서를 비치할 예정이니, 투자설명서를 수령하지 못한 투자자께서는 이 점 참고하시기 바랍니다.
③ 투자설명서 수령에 관한 세부사항은 존속회사 및 소멸회사에 문의하시기 바랍니다.
※ 관련 법령
| [상 법] |
|---|
|
제522조의2(합병계약서 등의 공시) 1. 합병계약서 2. 합병을 위하여 신주를 발행하거나 자기주식을 이전하는 경우에는 합병으로 인하여 소멸하는 회사의 주주에 대한 신주의 배정 또는 자기주식의 이전에 관하여 그 이유를 기재한 서면 3.각 회사의 최종의 대차대조표와 손익계산서 ②주주 및 회사채권자는 영업시간내에는 언제든지 제1항 각호의 서류의 열람을 청구하거나, 회사가 정한 비용을 지급하고 그 등본 또는 초본의 교부를 청구할 수 있다. <개정 1998. 12. 28.> [본조신설 1984. 4. 10.][제목개정 2015. 12. 1.] |
| [자본시장과 금융투자업에 관한 법률] |
|---|
|
제9조(그 밖의 용어의 정의)
⑤ 이 법에서 “전문투자자”란 금융투자상품에 관한 전문성 구비 여부, 소유자산규모 등에 비추어 투자에 따른 위험감수능력이 있는 투자자로서 다음 각 호의 어느 하나에 해당하는 자를 말한다. 다만, 전문투자자 중 대통령령으로 정하는 자가 일반투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우 금융투자업자는 정당한 사유가 있는 경우를 제외하고는 이에 동의하여야 하며, 금융투자업자가 동의한 경우에는 해당 투자자는 일반투자자로 본다. <개정 2009. 2. 3.> 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자 제123조(투자설명서의 작성ㆍ공시) ② 투자설명서에는 증권신고서(제119조제2항의 일괄신고추가서류를 포함한다. 이하 이 장에서 같다)에 기재된 내용과 다른 내용을 표시하거나 그 기재사항을 누락하여서는 아니 된다. 다만, 기업경영 등 비밀유지와 투자자 보호와의 형평 등을 고려하여 기재를 생략할 필요가 있는 사항으로서 대통령령으로 정하는 사항에 대하여는 그 기재를 생략할 수 있다. ③ 대통령령으로 정하는 집합투자증권 및 파생결합증권의 발행인은 제1항 외에 다음 각 호의 구분에 따라 투자설명서 및 간이투자설명서를 금융위원회에 추가로 제출하여야 하며, 이를 총리령으로 정하는 장소에 비치하고 일반인이 열람할 수 있도록 하여야 한다. 다만, 그 집합투자증권 및 파생결합증권의 모집 또는 매출을 중지한 경우에는 제출ㆍ비치 및 공시를 하지 아니할 수 있다. <개정 2008. 2. 29., 2013. 5. 28.> 1. 제1항에 따라 투자설명서 및 간이투자설명서를 제출한 후 총리령으로 정하는 기간마다 1회 이상 다시 고친 투자설명서 및 간이투자설명서를 제출할 것 2. 제182조제8항에 따라 변경등록을 한 경우 변경등록의 통지를 받은 날부터 5일 이내에 그 내용을 반영한 투자설명서 및 간이투자설명서를 제출할 것 제124조(정당한 투자설명서의 사용) 1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 “전자문서수신자”라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 제436조(전자문서에 의한 신고 등) ② 제1항의 전자문서에 의한 신고 등의 방법 및 절차, 그 밖에 필요한 사항은 대통령령으로 정한다. |
| [자본시장과 금융투자업에 관한 법률 시행령] |
|---|
|
제132조(투자설명서의 교부가 면제되는 자) 1. 제11조제1항제1호다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화ㆍ전신ㆍ팩스, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. 제385조(전자문서에 의한 신고 등) ② 전자문서의 방법에 의하여 신고서등을 제출할 때 필요한 표준서식ㆍ방법ㆍ절차 등은 금융위원회가 정하여 고시한다. 이 경우 금융위원회는 해당 신고서등이 거래소, 협회 또는 예탁결제원에 함께 제출되는 것일 때에는 그 표준서식ㆍ방법ㆍ절차 등을 정하거나 변경함에 있어서 미리 해당 기관의 의견을 들을 수 있다. ③ 거래소, 협회 또는 예탁결제원의 업무 관련 규정에 따라 제출하는 신고서등의 경우에는 제2항 전단에도 불구하고 해당 기관이 이를 정할 수 있다. ④ 신고서등을 제출하는 자가 전자문서의 방법에 의하는 경우에 그 전자문서의 효력과 도달시기 등 전자문서에 관한 사항은 「정보통신망 이용촉진 및 정보보호 등에 관한 법률」에서 정하는 바에 따른다. |
【 전문가의 확인 】
1. 전문가의 확인
해당사항 없습니다.
2. 전문가와의 이해관계
해당사항 없습니다.