 |
|
보수위원회 설치(이사회의사록) |
정 정 신 고 (보고)
| 2023년 12월 18일 |
1. 정정대상 공시서류 : 증권신고서
2. 정정대상 공시서류의 최초제출일 : 2023년 05월 16일
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2023년 05월 16일 | 증권신고서(지분증권) | 최초제출 |
| 2023년 06월 08일 | [기재정정]증권신고서(지분증권) | 정정제출 요구 및 일정변경에 따른 정정(파란색) |
| 2023년 08월 17일 | [기재정정]증권신고서(지분증권) | 정정제출 요구 및 일정변경에 따른 정정(초록색) |
| 2023년 11월 20일 | [기재정정]증권신고서(지분증권) | 정정제출 요구 및 일정변경에 따른 정정(빨간색) |
| 2023년 12월 04일 | [기재정정]증권신고서(지분증권) | 일정변경에 따른 정정(보라색) |
| 2023년 12월 18일 | [기재정정]증권신고서(지분증권) | 기재정정(갈색) |
| [정정사항] |
| 항 목 | 정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|
| - 단순 오타 및 표현 수정 등은 별도의 색깔표시 없이 정정하였습니다. - 요약정보에는 본문의 정정사항을 반영하였으며, 정오표를 별도로 기재하지 않았습니다. - 금번 정정사항은 기재정정으로, 정정사항 확인의 편의를 위해 정정사항은 '굵은 갈색 글씨체'를 사용하여 기재하였습니다. |
|||
| 1부 모집 또는 매출에 관한 사항 - Ⅱ. 투자위험요소 | |||
| 2. 회사위험 | 기재정정 | ||
| 가. 지속적인 영업적자로 인한 재무구조 악화 위험 | (주1) 정정 전 | (주1) 정정 후 | |
| 가-2. 임원 급여 및 상여 지급에 따른 재무구조 악화 위험 | (주2) 정정 전 | (주2) 정정 후 | |
| 가-3. 대표이사 등에 대한 보수지급과 관련한 배임 이슈에 따른 위험 | (주3) 정정 전 | (주3) 정정 후 | |
| 나. 재무 안정성 악화 위험 | (주4) 정정 전 | (주4) 정정 후 |
|
| 다. 잦은 자금조달로 인한 주주가치 희석화 | (주5) 정정 전 | (주5) 정정 후 |
|
| 라. 청약 참여율에 따른 최대주주 변경 위험 | (주6) 정정 전 | (주6) 정정 후 | |
| 바. 종속회사 관련 위험 | (주7) 정정 전 | (주7) 정정 후 |
|
| 바-1. 종속회사 VGXI 계속기업불확실성에 따른 위험 | (주8) 정정 전 | (주8) 정정 후 | |
| 더. 과거 공시의무 미이행에 따른 위험 | (주9) 정정 전 | (주9) 정정 후 |
|
| Ⅴ. 자금의 사용목적 | (주10) 정정 전 | (주10) 정정 후 | |
| 2부 발행인에 관한 사항 - Ⅲ. 재무에 관한 사항 | |||
| 3. 재무제표 주석 | (주11) 정정 전 | (주11) 정정 후 | |
(주1) 정정 전
당사의 최근 3개년 및 2023년 3분기까지 판매비와관리비 내역은 다음과 같습니다.
| [판매비와 관리비 내역] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 |
| 급여 | 11,917 | 14,711 | 20,415 | 15,383 | 14,761 |
| 퇴직급여 | 681 | 555 | 706 | 527 | 535 |
| 복리후생비 | 1,379 | 1,223 | 1,636 | 1,312 | 1,038 |
| 여비교통비 | 306 | 283 | 408 | 181 | 160 |
| 접대비 | 92 | 101 | 127 | 93 | 93 |
| 통신비 | 129 | 87 | 125 | 91 | 54 |
| 수도광열비 | 536 | 478 | 131 | 112 | 100 |
| 교육훈련비 | 4 | 4 | 5 | 2 | 2 |
| 세금과공과 | 224 | 163 | 295 | 223 | 160 |
| 감가상각비 | 3,500 | 1,687 | 2,362 | 1,100 | 846 |
| 지급임차료 | 520 | 488 | 663 | 562 | 184 |
| 수선비 | 22 | 22 | 31 | 15 | 29 |
| 보험료 | 164 | 81 | 108 | 70 | 65 |
| 차량유지비 | 78 | 97 | 128 | 100 | 92 |
| 경상연구개발비 | 5,219 | 8,813 | 12,147 | 11,441 | 8,396 |
| 운반비 | 107 | 104 | 145 | 135 | 114 |
| 도서인쇄비 | 21 | 6 | 10 | 8 | 8 |
| 회의비 | 13 | 12 | 17 | 20 | 11 |
| 사무용품비 | 181 | 156 | 244 | 150 | 81 |
| 소모품비 | 41 | 29 | 41 | 47 | 30 |
| 지급수수료 | 3,838 | 3,031 | 5,397 | 2,477 | 2,155 |
| 무형자산상각비 | 224 | 147 | 183 | 156 | 117 |
| 사용권자산상각비 | 1,741 | 1,582 | 2,110 | 1,547 | 753 |
| 견본비 | 12 | 14 | 16 | 12 | 15 |
| 물류비 | 14 | 14 | 20 | 12 | 7 |
| 광고선전비 | 369 | 253 | 342 | 194 | 168 |
| 대손상각비 | -1,060 | 902 | 1,297 | 111 | -174 |
| 수출제비용 | 55 | 88 | 117 | 98 | 66 |
| 잡비 | 0 | 7 | 194 | 12 | 3 |
| 합계 | 30,337 | 35,139 | 49,420 | 36,191 | 29,871 |
출처) 당사 정기보고서 및 당사 제시
이처럼 지속적인 영업적자로 인해 당사의 재무구조는 악화되어 왔으며, 추후에도 당사 파이프라인의 제품화 성공 혹은 라이센스 아웃 또는 플라스미드 CDMO 사업의 매출 성장 등으로 영업흑자로 전환되지 못한다면 재무구조는 계속해서 악화될 것으로 예상됩니다.
(중략)
VGXI는 현재 우드랜드 공장 및 콘로에 위치한 신규공장에서 CDMO 관련 생산을 진행하고 있으며, 우드랜드는 연간 700리터, 신규공장은 3,000리터 생산가능 능력을 보유하고 있습니다. 2020년 이후 우드랜드 공장은 70%~80% 가동률을 보였지만, 신규공장의 경우 2023년 5월 신규오더에 대한 첫 가동이 시작되어 본 공시서류 제출 전일 현재까지 가동율 약 5% 수준입니다.
| CDMO 생산 가동율 |
| (단위 : 리터, %) |
| 구분 | 2020년 1분기 |
2020년 2분기 |
2020년 3분기 |
2020년 4분기 |
2021년 1분기 |
2021년 2분기 |
2021년 3분기 |
2021년 4분기 |
2022년 1분기 |
2022년 2분기 |
2022년 3분기 |
2022년 4분기 |
2023년 1분기 | 2023년 2분기 | 2023년 3분기 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 우드랜드 공장 |
생산가능 용량 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 |
| 가동율 | 71% | 75% | 88% | 85% | 67% | 88% | 63% | 88% | 88% | 75% | 81% | 54% | 27% | 35% | 33% | |
| 콘로 공장 | 생산가능 용량 | - | - | - | - | - | - | - | - | - | - | - | - | 3,000 | 3,000 | 3,000 |
| 가동율 | - | - | - | - | - | - | - | - | - | - | - | - | 2% | 5% | 24% | |
| 출처) 당사 제시 |
(주1) 정정 후
당사의 최근 3개년 및 2023년 3분기까지 판매비와관리비 내역은 다음과 같습니다.
| [판매비와 관리비 내역] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 |
| 급여 | 11,917 | 14,711 | 20,415 | 15,383 | 14,761 |
| 퇴직급여 | 681 | 555 | 706 | 527 | 535 |
| 복리후생비 | 1,379 | 1,223 | 1,636 | 1,312 | 1,038 |
| 여비교통비 | 306 | 283 | 408 | 181 | 160 |
| 접대비 | 92 | 101 | 127 | 93 | 93 |
| 통신비 | 129 | 87 | 125 | 91 | 54 |
| 수도광열비 | 536 | 478 | 131 | 112 | 100 |
| 교육훈련비 | 4 | 4 | 5 | 2 | 2 |
| 세금과공과 | 224 | 163 | 295 | 223 | 160 |
| 감가상각비 | 3,500 | 1,687 | 2,362 | 1,100 | 846 |
| 지급임차료 | 520 | 488 | 663 | 562 | 184 |
| 수선비 | 22 | 22 | 31 | 15 | 29 |
| 보험료 | 164 | 81 | 108 | 70 | 65 |
| 차량유지비 | 78 | 97 | 128 | 100 | 92 |
| 경상연구개발비 | 5,219 | 8,813 | 12,147 | 11,441 | 8,396 |
| 운반비 | 107 | 104 | 145 | 135 | 114 |
| 도서인쇄비 | 21 | 6 | 10 | 8 | 8 |
| 회의비 | 13 | 12 | 17 | 20 | 11 |
| 사무용품비 | 181 | 156 | 244 | 150 | 81 |
| 소모품비 | 41 | 29 | 41 | 47 | 30 |
| 지급수수료 | 3,838 | 3,031 | 5,397 | 2,477 | 2,155 |
| 무형자산상각비 | 224 | 147 | 183 | 156 | 117 |
| 사용권자산상각비 | 1,741 | 1,582 | 2,110 | 1,547 | 753 |
| 견본비 | 12 | 14 | 16 | 12 | 15 |
| 물류비 | 14 | 14 | 20 | 12 | 7 |
| 광고선전비 | 369 | 253 | 342 | 194 | 168 |
| 대손상각비 | -1,060 | 902 | 1,297 | 111 | -174 |
| 수출제비용 | 55 | 88 | 117 | 98 | 66 |
| 잡비 | 0 | 7 | 194 | 12 | 3 |
| 합계 | 30,337 | 35,139 | 49,420 | 36,191 | 29,871 |
출처) 당사 정기보고서 및 당사 제시
DIV(자회사-베트남) 매출채권 회수지연으로 상각비 설정 3,026백만원 설정하였으며, 매출채권의 회수가능성에 대하여 총연체전이율을 사용하여 대손충당금을 설정하였으나 CDMO 거래처로부터 미회수 금액 $3M이 입금되어 대손상각되었던 금액 (1,244백만원)이 감소되어 별도 재무제표의 대손상각 금액은 1,782백만원으로 설정되었습니다. 대손상각에서 직접 제거하지 않고 내부거래에서 제거한 이유는 관리를 위하여 별도로 구분하기 위함입니다.
[단위: 백만원]
| 설정된 대손상각 | 내부거래 | 잔액 | |
|---|---|---|---|
| 진원 | 3,026 | (1,244) | 1,782 |
별도에서 설정되었던 자회사 DIV의 매출채권은 내부거래로 제거 되었으며, 별도와 마찬가지로 CDMO 외부 거래처로부터 장기 매출채권을 수취함에 따라 1,060백만원을 환입처리 하였습니다.
[단위: 백만원]
| 설정된 대손상각 | 내부거래 | 잔액 | |
|---|---|---|---|
| 진원 | 3,026 | (1,244) | 1,782 |
| VGXI Inc | 4 | (164) | (160) |
| DIV | 0 | (2,682) | (2,682) |
| 계 | 3,030 | (4,090) | (1,060) |
(중략)
VGXI는 현재 우드랜드 공장 및 콘로에 위치한 신규공장에서 CDMO 관련 생산을 진행하고 있으며, 우드랜드는 연간 700리터, 신규공장은 3,000리터 생산가능 능력을 보유하고 있습니다. 2020년 이후 우드랜드 공장은 70%~80% 가동률을 보였지만, 신규공장의 경우 2023년 5월 신규오더에 대한 첫 가동이 시작되어 본 공시서류 제출 전일 현재까지 가동율 약 24% 수준입니다.
| CDMO 생산 가동율 |
| (단위 : 리터, %) |
| 구분 | 2020년 1분기 |
2020년 2분기 |
2020년 3분기 |
2020년 4분기 |
2021년 1분기 |
2021년 2분기 |
2021년 3분기 |
2021년 4분기 |
2022년 1분기 |
2022년 2분기 |
2022년 3분기 |
2022년 4분기 |
2023년 1분기 | 2023년 2분기 | 2023년 3분기 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 우드랜드 공장 |
생산가능 용량 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 |
| 가동율 | 71% | 75% | 88% | 85% | 67% | 88% | 63% | 88% | 88% | 75% | 81% | 54% | 27% | 35% | 33% | |
| 콘로 공장 | 생산가능 용량 | - | - | - | - | - | - | - | - | - | - | - | - | 3,000 | 3,000 | 3,000 |
| 가동율 | - | - | - | - | - | - | - | - | - | - | - | - | 2% | 5% | 24% | |
| 출처) 당사 제시 |
당사는 VGXI의 신규공장 관련해 언론매체와 인터뷰 등을 통해 당시 회사가 예측하고 있는 영업실적을 여러 차례 언급한 바 있습니다. 그러나 예상되는 수주량과 실제 결과는 많은 괴리를 보이고 있습니다. 실제 수주 현황은 아래와 같습니다.
| 수주금액 |
| (단위:1,000 USD) |
|
|
1분기 |
1-2분기 |
1-3분기 |
1-4분기 |
|---|---|---|---|---|
|
2022년 |
10,986 |
16,885 |
18,980 |
22,077 |
|
2023년 |
8,609 |
12,182 |
15,105 |
|
|
증감 |
(2,377) |
(4,703) |
(3,875) |
|
다음은 당사의 당3분기 보고기간 중 원가기준 투입법을 적용하여 기간에 걸쳐 수익을 인식한 계약으로서 계약금액이 전기 매출액의 5% 이상인 주요 계약의 내역은 아래와 같습니다.
| (단위: USD) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 회사명 | 품목 (*1) | 발주처 (*1) | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
| 총액 | 손실충당금 | 총액 | 손실충당금 | |||||||
| 진원생명과학(주) | 임상용 Plasmid DNA | A 회사 | 2023-01-31 | 2024-01-30 | 5,311,200 | 16.2% | - | - | 663,288 | 3,250 |
| 진원생명과학(주) | 임상용 Plasmid DNA | B 회사 | 2022-02-01 | 2022-12-31 | 2,441,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | C 회사 | 2022-02-23 | 2023-04-30 | 2,416,700 | 100.00% | 68,750 | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | D 회사 | 2022-05-26 | 2023-04-30 | 2,211,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | E 회사 | 2022-02-02 | 2022-09-30 | 1,966,600 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | F 회사 | 2019-09-20 | 2022-12-31 | 2,831,061 | 100.00% | - | - | - | - |
| 합계 | 17,178,061 | 68,750 | - | 663,288 | 3,250 | |||||
(*1) 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았습니다.
미수금 충당을 잡은 이유는 별도 재무상태표에서 자회사의 대여금에 대한 미수수익(10,011백만원)에 대하여 충당금을 설정하기 때문입니다. 이는 특수관계인이지만 대여금의 이자에 대하여 회수가 지연되어 보수적인 관점에서 과거 일정기간동안 3개월별 전이율을 분석하고 이를 이용하여 대손율을 산정하는 총연체전이율을 사용하여 충당금을 설정한 것입니다.
진행률이 낮은 이유는 기존의 생산설비와 새로운 공장 생산설비를 함께 진행함에 있어서 예정과 같이 원활하게 진행되지 못하였고, 새로운 생산인력 증원에 따른 트레이닝으로 인해 생산 업무의 진행도 이전만큼 원활하지 못하여 진행율이 과거보다는 낮아졌습니다.
(후략)
(주2) 정정 전
정관 제31조 이사의 보수 1항에 따라 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여금과 영업활동비, 학자금등으로 하며 년간 보수 한도는 500억원으로 합니다. 2017월 03월 개최된 제41기 정기주주총회에서 정관 변경을 통해 제31조 이사의 보수 1항 이사의 년간 보수 한도를 500억으로 증액 하였으며,이는 회사 규모가 커지는 상황을 대비하여 의결정족수 부족에 따른 스톡옵션 지급 등이 제한적이기에 우수한 인재 영입을 준비하기 위해 한도 증액시 최대 금액으로 변경한 것이며, 최대주주의 지분율이 낮은 상황에서 정관 변경을 위한 의결 정족수 충족하는 것이 쉐도우 보팅 제도의 폐지가 예정됨에 따라 선제적으로 대응하였습니다. 보수 결정에 대한 의사결정은 이사회 의장인 대표이사의 판단이 보수를 결정하는데 매우 큰 영향을 행사하는 상황이나 급여의 경우 통상적으로 전년 대비 일정한 임금 상승률을 적용하는 경우가 많으며 상여는 계량지표 성과와 비계량지표 성과를 반영하여 산출하고 있으나 향후 평가제도를 개선하여 명확한 계량적 평가를 진행하도록 변경할 계획입니다.이처럼 임원 보수 한도를 정관에 정하고 집행에 대해서는 이사회 의장에게 일임함에 따라 임원 보수 책정에 있어 이사회 의장이 막강한 권한을 갖고 있어 객관성이 결여될 소지가 있으며 회사의 영업성과에 반해 지급될 가능성도 있습니다. 한편, 당사는 매년 이사회 안건으로 상정하여 임원보수를 결정하고 있으며, 지급금액에 대해서는 지급시 인사팀의 검토 후 대표이사 승인을 득하는 절차로 진행하고 있습니다. 또한, 승인된 자료는 회계팀으로 전달되며, 회계팀에서 지급할 금액과 정관상의 금액을 검토한 후 회계에 반영 합니다. 당사는 임원의 보수와 관련해 이사회 의장의 독단적 결정을 견제할 수 있는 보상위원회와 같은 기구의 마련 등을 포함해 다각도로 합리적 임원 보수 산정 및 지급을 위한 제도적 장치를 마련하기로 하고 검토 중에 있습니다. 이와 관련 2023년 12월말에 개최되는 임시주주총회에서 정관 변경을 계획하고 있으며 변경안에서 황금낙하산 조항 삭제와 보수위원회 설치를 추진하고 있습니다.
당사는 현재 정관 변경을 위해서는 주주총회에서 특별결의하여야 합니다. 그러나 최대주주의 지분율이 낮아 의결 정족수를 채우지 못할 가능성이 높습니다. 실제 2023년 3월 개최된 주주총회에서도 상정된 특별결의 안건 등이 의결 정족수 부족으로 처리되지 못한 바 있어 정관 변경에 대해 어려움이 있어 상당기간 현재 정관이 유지될 가능성이 높기에 투자자께서는 유의하시기 바랍니다.
정관 제31조 이사의 퇴직금 3항에 따르면
① 이사의 임기 중 적대적 인수, 합병으로 인해 그 의사에 반해 해임되는 경우
② 이사의 임기 중 비자발적으로 사임하는 경우
③ 그 사유를 불문하고 이사의 임기중 주주총회 결의에 의하여 해임되는 경우
상기 ①~③에 해당하는 경우 퇴직금외에 보상액으로 해임 및 사임 후 7일 이내에 60억원을 지급하고 대표이사의 경우에는 100억원을 지급합니다.
당사의 정관 제31조 이사의 퇴직금 3항과 같이 조항을 변경한 사유는 다음과 같습니다.
① 최대주주의 지분율이 낮음에 따라 적대적 M&A에 노출되어 있어 경영권 안정이 필요한 사항이기에 이를 방지하고자 일반적으로 사용되는 황금낙하산 조항을 정관에 반영하였으나, 주주의 의견을 반영하여 다음 개최되는 주주총회에서 해당 조항을 삭제하는 정관 변경 의안을 상정할 계획입니다. 또한 해당 정관 변경 사항 중에는 임원보수 한도를 현실화하는 내용도 검토하여 반영할 계획입니다.
② 현재 진행중인 연구개발의 지속성 등으로 인해 경영권 안정이 필요하기에 이를 반영하였습니다.
③ 상기 ①~②와 마찬가지로 황금낙하산 조항으로 경영권 유지를 위해 변경하였습니다.
상기 ①~③에 해당하는 경우 지급하는 퇴직위로금액을 추가한 사유는 첫째, 해당 금액을 지급해야 함으로써 적대적 M&A에 대한 매력을 떨어지게 하기 위해서 개략적으로 규모를 크게 설정하였으며, 둘째, 향후 CDMO 사업이 크게 확장되는 상황을 감안하여 선제적으로 반영한 것이고, 쉐도우 보팅 제도 폐지에 따라 해당 제도가 부활되지 않으면 향후 수십년간 특별결의 사항인 정관 변경이 매우 어려울 것이라 판단하여 보수한도 등의 규모를 매우 크게 설정하였습니다.
또한 당사는 소액주주 비율이 높아 정족수 미달의 위험이 있을 가능성이 커 의안을 상정해도 부결될 위험이 있습니다. 이러한 경우에 대비하여 ① 전자투표제도 등과 같은 다양한 의결권 행사 방법 도입 ② 주주총회 집중 예상일이 아닌 일자에 주주총회 개최와 같은 대응하는 방법으로 대비할 계획입니다.
당사는 바이오 기업으로 대개의 여타 바이오 기업과 마찬가지로 경영실적이 저조하나 연구개발을 진행하고 있는 품목이 기술이전 혹은 상품화가 되면 수년에서 수십년에 걸쳐 투입된 연구개발자금을 회수하고도 매년 높은 이윤이 발생할 가능성이 높습니다. 이러한 산업의 특성상 증권신고서에 기재한 바와 같이 지속적인 연구개발의 투자와 일관성 있는 사업의 추진을 위해서는 경영권의 안정이 필요하며 이러한 연구개발의 지속성 등을 위한 경영권의 안정화가 회사 가치 증대에 도움이 된다고 판단하여 퇴직위로금 조항을 2014년 정관에 신설하였습니다. 높은 금액의 퇴직위로금을 통해 적대적 M&A를 방지하기 위한 목적으로 황금 낙하산 조항을 마련했으나 퇴직위로금 지급이 실제 발생하면 회사의 손실을 초래하기 때문에 현재 당사 등기임원은 퇴직위로금을 지급받지 않기로 하였으며 해당 내용에 대한 확약서 제출과 미이행시 법적 제재를 받겠다는 각서를 제출하기로 했습니다.
(주2) 정정 후
정관 제31조 이사의 보수 1항에 따라 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여금과 영업활동비, 학자금등으로 하며 년간 보수 한도는 500억원으로 합니다. 2017월 03월 개최된 제41기 정기주주총회에서 정관 변경을 통해 제31조 이사의 보수 1항 이사의 년간 보수 한도를 500억으로 증액 하였으며,이는 회사 규모가 커지는 상황을 대비하여 의결정족수 부족에 따른 스톡옵션 지급 등이 제한적이기에 우수한 인재 영입을 준비하기 위해 한도 증액시 최대 금액으로 변경한 것이며, 최대주주의 지분율이 낮은 상황에서 정관 변경을 위한 의결 정족수 충족하는 것이 쉐도우 보팅 제도의 폐지가 예정됨에 따라 선제적으로 대응하였습니다. 보수 결정에 대한 의사결정은 이사회 의장인 대표이사의 판단이 보수를 결정하는데 매우 큰 영향을 행사하는 상황이나 급여의 경우 통상적으로 전년 대비 일정한 임금 상승률을 적용하는 경우가 많으며 상여는 계량지표 성과와 비계량지표 성과를 반영하여 산출하고 있으나 향후 평가제도를 개선하여 명확한 계량적 평가를 진행하도록 변경할 계획입니다.이처럼 임원 보수 한도를 정관에 정하고 집행에 대해서는 이사회 의장에게 일임함에 따라 임원 보수 책정에 있어 이사회 의장이 막강한 권한을 갖고 있어 객관성이 결여될 소지가 있으며 회사의 영업성과에 반해 지급될 가능성도 있습니다. 한편, 당사는 매년 이사회 안건으로 상정하여 임원보수를 결정하고 있으며, 지급금액에 대해서는 지급시 인사팀의 검토 후 대표이사 승인을 득하는 절차로 진행하고 있습니다. 또한, 승인된 자료는 회계팀으로 전달되며, 회계팀에서 지급할 금액과 정관상의 금액을 검토한 후 회계에 반영 합니다. 당사는 임원의 보수와 관련해 이사회 의장의 독단적 결정을 견제할 수 있는 보상위원회와 같은 기구의 마련 등을 포함해 다각도로 합리적 임원 보수 산정 및 지급을 위한 제도적 장치를 마련하기로 하고 검토 중에 있습니다. 이와 관련 2023년 12월 4일자 정관 제31조 제1항에 의거하여 임원보수집행은 이사회 의장에게 위임되어 있으나, 의장이 권한을 행사하지 아니하고 사외이사 및 외부전문가로 구성된 별도의 독립적인 보수위원회에 모든 결정권한을 위임하여 집행하기로 이사회에서 결의하였습니다.
 |
|
보수위원회 설치(이사회의사록) |
또한, 당사는 바이오 기업으로 대개의 여타 바이오 기업과 마찬가지로 경영실적이 저조하나 연구개발을 진행하고 있는 품목이 기술이전 혹은 상품화가 되면 수년에서 수십년에 걸쳐 투입된 연구개발자금을 회수하고도 매년 높은 이윤이 발생할 가능성이 높습니다. 이러한 산업의 특성상 증권신고서에 기재한 바와 같이 지속적인 연구개발의 투자와 일관성 있는 사업의 추진을 위해서는 경영권의 안정이 필요하며 이러한 연구개발의 지속성 등을 위한 경영권의 안정화가 회사 가치 증대에 도움이 된다고 판단하여 퇴직위로금 조항을 2014년 정관에 신설하였습니다. 높은 금액의 퇴직위로금을 통해 적대적 M&A를 방지하기 위한 목적으로 황금 낙하산 조항을 마련했으나 퇴직위로금 지급이 실제 발생하면 회사의 손실을 초래하기 때문에 현재 당사 등기임원은 퇴직위로금을 지급받지 않기로 하였으며 해당 내용에 대한 확약서 제출과 미이행시 법적 제재를 받겠다는 각서를 제출하였습니다.
 |
|
확약서 |
 |
|
확약서_조병문 |
(주3) 정정 전
| 가-3. 배임 이슈에 따른 위험 당사는 2021년 27,434백만원, 2022년 40,084백만원, 2023년 3분기 37,092백만원의 영업손실이 발생하고 있습니다. 이처럼 지속적인 대규모 적자에도 불구하고 박영근 대표이사에게 최근 2020년부터 신고서제출일 현재까지 약 186억원, 조병문 전무이사에게 약 36억원을 지급하였습니다. 특정 임원들에게 지급되었던 급여 및 상여금 등은 회사의 재무상태 및 손익에 큰 영향을 끼치고 있습니다. 현재 국내 상장사의 횡령·배임이 증가하고 있으며, 이에 따라 주식 매매 거래 정지 및 상장폐지 등으로 이어질 수 있습니다. 거래소의 유가증권시장 공시규정에 따르면 거래소는 임직원 등의 횡령 및 배임 혐의 이슈가 발생할 경우 해당 상장사에 조회공시를 요구하며, 조회공시를 요구받은 코스피 상장사는 늦어도 다음날까지 조회공시에 응해야 합니다. 만약 거래소의 조회공시 요구 시점이 오전인 경우 당일 오후까지 해당 내용에 대해 공시해야 하며 요구 시점이 오후일 경우에는 그 이튿날까지 공시해야 합니다. 공시를 통해 횡령 및 배임이 확인되면 거래소의 판단에 따라 매매 거래가 정지될 수 있으며 거래를 정지하고 상장적격성 실질심사 대상에 해당하는지 여부를 판단합니다. 이 과정에서 횡령·배임 규모가 자기자본의 5%, 대기업의 경우 2.5% 이상일 경우 상장적격성 실질심사 대상에 포함됩니다. 심의 대상으로 결정되면 해당 종목에 대한 기업심사위원회의 심의 절차가 진행되며 대상으로 결정되지 않는다면 매매거래 정지가 해제돼 주식 거래가 재개됩니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2021년 27,434백만원, 2022년 40,084백만원, 2023년 3분기 37,092백만원의 영업손실이 발생하고 있습니다. 이처럼 지속적인 대규모 적자에도 불구하고 박영근 대표이사에게 최근 2020년부터 신고서제출일 현재까지 약 209억원, 조병문 전무이사에게 약 45억원을 지급하였습니다. 당사는 급여 및 상여금 산정에 대한 명시적 기준을 사전에 마련하지 않고, 사실상 박영근과 조병문의 의사만으로 결의가 가능한 이사회를 통해 본인들의 급여 및 상여금 결정 권한을 대표이사 박영근에게 일임한 후, 박영근이 본인과 조병문의 성과를 평가하여 높은 수준의 급여와 성과급을 결정, 해당 자금을 지급받아 사용하였습니다.특정 임원들에게 지급되었던 급여 및 상여금 등은 회사의 재무상태 및 손익에 큰 영향을 끼치고 있습니다.
현재 국내 상장사의 횡령·배임이 증가하고 있으며, 이에 따라 주식 매매 거래 정지 및 상장폐지 등으로 이어질 수 있습니다. 거래소의 유가증권시장 공시규정에 따르면 거래소는 임직원 등의 횡령 및 배임 혐의 이슈가 발생할 경우 해당 상장사에 조회공시를 요구하며, 조회공시를 요구받은 코스피 상장사는 늦어도 다음날까지 조회공시에 응해야 합니다.
공시를 통해 횡령 및 배임이 확인되면 거래소의 판단에 따라 매매 거래가 정지될 수 있으며 거래를 정지하고 상장적격성 실질심사 대상에 해당하는지 여부를 판단합니다. 이 과정에서 횡령·배임 규모가 자기자본의 5%, 대기업의 경우 2.5% 이상일 경우 상장적격성 실질심사 대상에 포함됩니다. 심의 대상으로 결정되면 해당 종목에 대한 기업심사위원회의 심의 절차가 진행되며 대상으로 결정되지 않는다면 매매거래 정지가 해제돼 주식 거래가 재개됩니다.
주주 등에 의해 배임 소송이 제기되고 재판에 의해 배임이 확정된다면 형법 조항 제355조(횡령, 배임)에 따라 10년 이하의 징역 또는 3천만원 이하의 벌금에 처해질 수 있으며 이에 따라 최악의 경우 상장폐지까지 이를 수 있습니다.
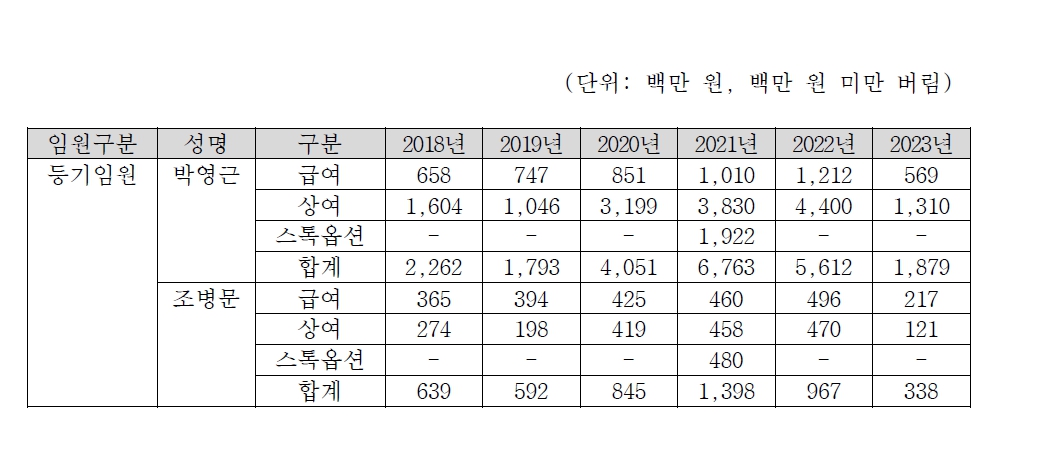
| [최근 5년간 임원(등기&종속회사 임원) 급여 및 상여 내역 |
| (단위: 천원) |
| 임원구분 | 성명 | 구분 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | 총계 | 2022년말 자기자본 대비 비율 |
|---|---|---|---|---|---|---|---|---|---|---|
| 등기임원 | 박영근 | 급여 | 658,011 | 747,114 | 851,810 | 1,010,491 | 1,212,584 | 1,075,513 | 5,555,523 | 2.93% |
| 상여 | 1,604,200 | 1,046,200 | 3,199,300 | 3,830,300 | 4,400,300 | 1,310,000 | 15,390,300 | 8.10% | ||
| 합계 | 2,262,211 | 1,793,314 | 4,051,110 | 4,840,791 | 5,612,884 | 2,385,514 | 20,945,824 | 11.03% | ||
| 등기임원 | 조병문 | 급여 | 365,191 | 394,406 | 425,959 | 460,036 | 496,839 | 399,908 | 2,542,339 | 1.34% |
| 상여 | 274,800 | 198,200 | 419,920 | 458,300 | 470,300 | 121,000 | 1,942,520 | 1.02% | ||
| 합계 | 639,991 | 592,606 | 845,879 | 918,336 | 967,139 | 520,908 | 4,484,859 | 2.36% |
| 출처) 당사 제시 주1) 2023년의 경우 9월까지 내역임. |
당사는 박영근 대표이사와 조병문 전무이사의 보수 수령 행위는 업무상 횡령 및 배임에 해당하지 않는다고 판단하고 있습니다. 이와 관련하여, 판단의 객관성을 담보하기 위하여, 법무법인 및 서울 소재 법학전문대학원에 재직하고 있는 법학교수에게 각각 본건에 대한 검토를 의뢰하였고, 그 결과 우선 횡령죄의 구성 요건에 해당하지 않는다는 결론을 얻었습니다. 나아가 배임죄와 관련해서도, 정관에서 보수 한도액만을 정하고 구체적인 사항을 이사회 또는 대표이사에게 위임하는 방식은 허용된다는 것이 학자 및 대법원 판례의 일관된 입장인 점, 대표이사 박영근과 전무이사 조병문이 업무상 배임 행위에 해당하려면 과다한 보수 결정 절차에 계획적·적극적으로 관여하였을 것이 요구되는데, 대표이사 박영근과 전무이사 조병문의 지분율을 고려할 때 주주총회에서 부당한 영향력을 행사하였다고 보기 어려운 주주총회 특별결의를 통해 마련된 정관의 보수규정은 적법하며, 따라서 정관에서 규정한 방식에 따른 보수 또한 적법한 점, 정관상 보수한도액이 다소 과다한 것으로 비춰질 수 있으나 정관 기재만으로 바로 보수청구권이 발생하는 것은 아니고 실지급액은 그 한도에 미치지 못하는 점, 임원의 보수 결정 기준에 있어 매출·영업이익 등의 객관적 지표 못지 않게 리더십·기여도·전문성 등 주관적 지표가 중요하고 그 판단에 있어서 정성적 평가가 불가피한 점 등을 고려할 때, 해당 보수의 결정자나 수취자에게 배임죄의 책임을 묻기는 어려운 것으로 판단된다는 결론을 얻었습니다. 투자자께서는 이 점 유의하시기 바랍니다.
(주3) 정정 후
| 가-3. 대표이사 등에 대한 보수지급과 관련한 배임 이슈에 따른 위험 당사는 2021년 27,434백만원, 2022년 40,084백만원, 2023년 3분기 37,092백만원의 영업손실이 발생하고 있습니다. 이처럼 지속적인 대규모 적자에도 불구하고 박영근 대표이사에게 최근 2020년부터 신고서제출일 현재까지 약 186억원, 조병문 전무이사에게 약 36억원을 지급하였습니다. 특정 임원들에게 지급되었던 급여 및 상여금 등은 회사의 재무상태 및 손익에 큰 영향을 끼치고 있습니다. 당사는 금번 공모 과정에서, 과거 박영근 대표이사 및 조병문 전무에게 지급된 급여 및 상여금과 관련하여 횡령 또는 배임 가능성에 대한 외부 법률검토를 진행하였습니다. 당사는 법무법인 린과 성균관대학교 법학전문대학원 고동원 교수에게 '1) 정관을 통해 보수한도액을 정하고 이사회의 의장인 대표이사 박영근이 박영근과 조병문의 급여 및 상여금을 결정하는 보수 지급방식 2) 과거 박영근과 조병문에게 지급된 보수액의 적정성'의 측면에서 당사에 대한 횡령죄 또는 배임죄에 해당하는지 여부를 검토 의뢰하였습니다. 법률의견서에 따르면 회사의 업무를 총괄하거나 자금을 관리하는 등의 직무를 수행하는 사람이 보수의 지급 근거 없이 보수 명목으로 임의로 회사 자금을 수취하였다는 등의 사정이 존재하지 아니하는 한, 횡령죄의 구성요건에 해당할 여지는 없는 것으로 판단하였으며, 이사회 의장인 대표이사가 각 개별 이사의 보수 지급액을 정한 것은 정관에서 정한 보수 총액 범위 내에서 정관의 규정에 따라 각 개별 이사의 보수금액을 정한 것이어서 합법적인 절차이고, 개별 이사의 보수 금액 결정에 있어서도 계량지표 성과와 비계량지표 성과를 반영하여 산출하는 등 객관적 기준을 가지고 산정하고 있다는 점에서 보면 배임행위에 해당하지 않는다는 의견을 제시하였습니다. 당사는 상기 법률의견서 등을 토대로 박영근 대표이사의 보수 지급 관련 행위가 배임죄 등 법률위반에 해당한다고 규정하기 어렵다고 판단하고 있으나, 기존주주들 혹은 투자자들이 사법 기관에 박영근 대표 등을 고소 고발할 가능성은 상존하며, 동일 사건에 대한 판결을 아직 찾아볼 수 없어 관계 법률상 제재 처분을 받을 가능성을 완전히 배제할 수는 없을 것으로 사료됩니다. 배임이슈가 현실화 될 경우 당사의 대표이사 및 임원이 법률상 제재 처분을 받아 직무수행이 불가능한 상황이 발생할 수 있으며,「유가증권시장 상장규정」에 따라 상장 적격성 실질심사 대상에 해당되어 매매거래 정지 및 상장폐지가 이루어지는 등 투자자들의 피해가 발생할 수 있으니 이 점 참고하시기 바랍니다. 상기 서술한 배임이슈는 본 건 유상증자 이후에라도 언제든지 현실화 될 가능성을 배제할 수 없으며, 추후 매매거래 정지 및 상장폐지 등의 결과를 초래할 경우 본 건 투자자께서는 일부 원금회수만 가능하거나 최악의 경우 원금회수가 불가능한 상황이 발생할 수 있으니 이 점 반드시 유의하시어 투자에 임해주시길 바랍니다. |
당사는 2021년 27,434백만원, 2022년 40,084백만원, 2023년 3분기 37,092백만원의 영업손실이 발생하고 있습니다. 이처럼 지속적인 대규모 적자에도 불구하고 박영근 대표이사에게 최근 2020년부터 신고서제출일 현재까지 약 209억원, 조병문 전무이사에게 약 45억원을 지급하였습니다. 당사는 급여 및 상여금 산정에 대한 명시적 기준을 사전에 마련하지 않고, 사실상 박영근과 조병문의 의사만으로 결의가 가능한 이사회를 통해 본인들의 급여 및 상여금 결정 권한을 대표이사 박영근에게 일임한 후, 박영근이 본인과 조병문의 성과를 평가하여 높은 수준의 급여와 성과급을 결정, 해당 자금을 지급받아 사용하였습니다.특정 임원들에게 지급되었던 급여 및 상여금 등은 회사의 재무상태 및 손익에 큰 영향을 끼치고 있습니다.
현재 국내 상장사의 횡령·배임이 증가하고 있으며, 이에 따라 주식 매매 거래 정지 및 상장폐지 등으로 이어질 수 있습니다. 거래소의 유가증권시장 공시규정에 따르면 거래소는 임직원 등의 횡령 및 배임 혐의 이슈가 발생할 경우 해당 상장사에 조회공시를 요구하며, 조회공시를 요구받은 코스피 상장사는 늦어도 다음날까지 조회공시에 응해야 합니다.
공시를 통해 횡령 및 배임이 확인되면 거래소의 판단에 따라 매매 거래가 정지될 수 있으며 거래를 정지하고 상장적격성 실질심사 대상에 해당하는지 여부를 판단합니다. 이 과정에서 횡령·배임 규모가 자기자본의 5%, 대기업의 경우 2.5% 이상일 경우 상장적격성 실질심사 대상에 포함됩니다. 심의 대상으로 결정되면 해당 종목에 대한 기업심사위원회의 심의 절차가 진행되며 대상으로 결정되지 않는다면 매매거래 정지가 해제돼 주식 거래가 재개됩니다.
주주 등에 의해 배임 소송이 제기되고 재판에 의해 배임이 확정된다면 형법 조항 제355조(횡령, 배임)에 따라 10년 이하의 징역 또는 3천만원 이하의 벌금에 처해질 수 있으며 이에 따라 최악의 경우 상장폐지까지 이를 수 있습니다.
| [최근 5년간 임원(등기&종속회사 임원) 급여 및 상여 내역 |
| (단위: 천원) |
| 임원구분 | 성명 | 구분 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | 총계 | 2022년말 자기자본 대비 비율 |
|---|---|---|---|---|---|---|---|---|---|---|
| 등기임원 | 박영근 | 급여 | 658,011 | 747,114 | 851,810 | 1,010,491 | 1,212,584 | 1,075,513 | 5,555,523 | 2.93% |
| 상여 | 1,604,200 | 1,046,200 | 3,199,300 | 3,830,300 | 4,400,300 | 1,310,000 | 15,390,300 | 8.10% | ||
| 퇴직금 | 454,354 | 878,280 | 778,147 | 1,190,662 | 1,507,876 | 1,760,832 | 6,570,151 | 3.46% | ||
| 합계 | 2,716,565 | 2,671,594 | 4,829,257 | 6,031,453 | 7,120,760 | 4,146,345 | 27,515,974 | 14.49% | ||
| 등기임원 | 조병문 | 급여 | 365,191 | 394,406 | 425,959 | 460,036 | 496,839 | 399,908 | 2,542,339 | 1.34% |
| 상여 | 274,800 | 198,200 | 419,920 | 458,300 | 470,300 | 121,000 | 1,942,520 | 1.02% | ||
| 퇴직금 | 181,509 | 346,028 | 251,983 | 281,921 | 315,411 | 312,264 | 1,689,116 | 0.89% | ||
| 합계 | 821,500 | 938,634 | 1,097,862 | 1,200,257 | 1,282,550 | 833,172 | 6,173,975 | 3.25% |
| 출처) 당사 제시 주1) 2023년의 경우 9월까지 내역임. |
당사는 금번 공모 과정에서, 과거 박영근 대표이사 및 조병문 전무에게 지급된 급여 및 상여금과 관련하여 횡령 또는 배임 가능성에 대한 외부 법률검토를 진행하였습니다. 당사는 법무법인 린과 성균관대학교 법학전문대학원 고동원 교수에게 각각 아래와 같이 본 건에 대한 검토를 의뢰하였습니다.
1) 정관을 통해 보수한도액을 정하고 이사회의 의장인 대표이사 박영근이 급여 및 상여금을 결정하는 보수 지급방식이 횡령 또는 배임죄에 해당하는지 여부
2) 과거 박영근과 조병문에게 지급된 보수액의 적정성에 비추어 횡령 또는 배임죄 해당 여부
■ 법무법인 린
(1) 사안의 개요
귀사는 아래와 같은 연혁을 거쳐 정관 제31조를 변경하고, 이에 근거하여 정관에 정한 보수한도의 범위에서 대표이사 박영근이 구체적인 사항을 결정하는 방식으로 대표이사 본인을 비롯한 임원에 대한 보수를 지급하고 있습니다.
|
(1) 2014. 3. 27. 주주총회에서 변경되기 전의 정관 제31조(임원의 보수) 1. 이사 및 감사의 보수는 주주총회의 결의로서 이를 정한다. 단, 감사의 보수결정을 위한 의안과는 구분하여 의결하여야 한다. 2. 이사 및 감사의 퇴직금은 주주총회의 결의로써 정한 임원퇴직금 지급규정에 의한다. (2) 2014. 3. 27. 주주총회에서 변경한 정관 제31조(이사의 보수) 1. 이사의 보수는 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여와 영업활동비, 학자금 등으로 하며 연간 보수한도는 30억원으로 한다. 이에 대한 집행은 이사회 의장에게 일임한다. 2. 이사의 퇴직금 지급은 주주총회 결의를 거친 임원퇴직금 지급규정에 의한다.
(3) 2017. 3. 31. 주주총회에서 변경한 정관 제31조(이사의 보수와 퇴직금) 1. 이사의 보수는 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여와 영업활동비, 학자금 등으로 하며 연간 보수한도는 500억원으로 한다. 이에 대한 집행은 이사회 의장에게 일임한다. 2. 이사의 퇴직금 지급은 주주총회 결의를 거친 임원퇴직금 지급규정에 의한다. (3항 생략) |
한편, 귀사는 주주배정후실권주일반공모방식 유상증자를 위하여 2023. 5. 16. 금융감독원에 증권신고서를 제출하였으나, 2023. 5. 30. 금융감독원으로부터 ‘중요사항의 기재나 표시내용이 불분명하여 투자자의 합리적인 투자판단을 저해하거나 투자자에게 중대한 오해를 일으킬 수 있는 사실이 발견되었다’는 이유로 ‘자본시장과 금융투자업에 관한 법률 제122조 제1항 및 제131조에 따라 증권신고서에 대한 정정신고서의 제출’을 요구받았습니다.
이에 귀사는 2023. 6. 8. 과 2023. 8. 17. 금융감독원에 각 증권신고서 (정정신고서)를 제출하였으나, 금융감독원으로부터 재차 증권신고서(정정신고서) 제출 및 자료보완을 요구받았습니다.
그리고 귀사에 대한 2023. 8. 17. 자 금융감독원의 증권신고서(정정신고서) 제출 및 자료보완 요구사항 중에는 『(박영근 및 조병문에 대한) 급여 및 상여금 지급과 관련하여 ‘횡령ㆍ배임이슈에 따른 위험’여부에 대한 의견을 제시할 것』을 요구하는 사항이 포함되어 있습니다.
(2) 질의사항
대표이사 박영근과 전무이사 조병문에 대한 보수 지급이 아래 각 사항의 측면에서 귀사에 대한 횡령죄 또는 배임죄에 해당하는지 여부.
1) 정관을 통해 보수 한도액을 정하고 이사회의 의장인 대표이사 박영근이 박영근과 조병문의 급여 및 상여금을 결정하는 보수 지급방식의 적정성
2) 2018년부터 2023년 6월까지의 기간 동안 박영근과 조병문에게 지급된 보수액의 적정성
(3) 전제사항
본 검토의견은 귀사가 질의한, 2018년부터 2023년 6월까지의 박영근과 조병문에게 지급된 보수의 결정에 이르는 일부의 과정(보수 결정 방식, 보수액의 적정성)에 대한 횡령ㆍ배임 성립 가능성에 대한 법률검토에 국한되고, 본 의견서에서 달리 명시적으로 다루지 아니하는 사항은 실체적ㆍ절차적으로 적법한 것임을 전제합니다. 또한 본 의견서에서 달리 명시적으로 다루지 않는 한 해당 사항 이외의 발생가능한 문제는 본 검토의견의 범위에서 제외됩니다.
본 검토의견의 기초가 된 사실관계는 본 의견서 작성일까지 귀사로부터 온/오프라인으로 전달받은 정보만을 토대로 한 것이며, 위 정보에 대한 독자적인 조사나 검증 등은 수행하지 아니하였습니다.
이하는 법무법인 린의 답변사항(법률의견)입니다.
(4) 횡령죄의 성립여부
귀사의 질의사항은, 정관에 따른 보수지급 방식과 실 지급 보수액의 적정성 측면에서 2018년부터 2023년 6월까지 기간 동안의 대표이사 박영근과 전무이사 조병문에 대한 보수 지급행위가 횡령 또는 배임죄에 해당하는지 여부입니다.
먼저, 횡령죄는 타인의 재물을 보관하는 자가 그 재물을 횡령하거나 그 반환을 거부할 때 성립하는 바, 귀사의 경우 회사의 업무를 총괄하거나 자금을 관리하는 등의 직무를 수행하는 사람이 보수의 지급 근거 없이 보수 명목으로 임의로 회사 자금을 수취하였다는 등의 사정이 존재하지 아니하는 한, 횡령죄의 구성요건에 해당할 여지는 없는 것으로 판단됩니다.
(5) 배임죄의 성립 가능성
가. 정관상 임원 보수 결정 방식과 배임죄의 성부
1) 우선적 고려사항 -주주총회 결의 대상
귀사는 2014. 3. 27. 및 2017. 3. 31.자 정관 변경을 통해 ‘이사의 보수는 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여와 영업활동비, 학자금 등’으로 정의하고, 이에 대한 연간 보수한도는 500억 원, 이에 대한 집행은 이사회 의장에게 일임하였습니다 우선적으로, 정관의 변경은 회사의 특정 임원이 아닌 주주총회의 결의에 의하여야 합니다. 따라서 이사가 이사의 직무내용, 회사의 재무상황이나 영업실적 등에 비추어 지나치게 과다하여 합리적 수준을 현저히 벗어나는 보수 지급 기준을 마련하고 그 지위를 이용하여 주주총회에 영향력을 행사하여 이에 관한 주주총회 결의가 성립되도록 함으로써 회사를 위하여 직무를 충실하게 수행하여야 하는 상법 제382조의3에서 정한 의무를 위반하여 회사 재산의 부당한 유출을 야기함으로써 회사와 주주의 이익을 침해하는 것으로서 회사에 대한 배임행위로 평가할 수 있을 정도에 이르는 등의 특별한 사정이 존재하지 아니하는 한, 적법하게 개최된 주주총회의 결의에 따라 임원 보수 결정에 관한 정관 내용을 변경한 행위를 두고 특정인의 배임행위라고 평가하기는 어려운 것으로 판단됩니다.
일반적으로 상법 또는 정관에 다른 정함이 있는 경우를 제외하고는 주주총회의 결의는 출석한 주주의 의결권의 과반수와 발행주식총수의 4분의 1 이상의 수로써 하여야 합니다. 심지어 귀사의 이사 보수 연간한도액을 정하는 정관 변경의 경우, 주주총회의 결의에 의하여야 할 뿐 아니라 출석한 주주의 의결권의 3분의 2 이상의 수와 발행주식총수의 3분의 1 이상의 수를 필요로 하는 특별결의 대상입니다.
그런데, 연간 보수한도를 정하면서 그 구체적인 보수액을 결정하는 집행을 대표이사에게 맡기는 내용의 귀사 정관 변경은 2014. 3. 27. 최초로 확인됩니다. 그러나 해당 정관 변경에 대한 주주총회 결의가 존재할 당시, 귀사로부터 제공받은 자료에 의하면 대표이사 박영근과 전무이사 조병문의 경우 회사 주식을 전혀 보유하고 있지 아니하였습니다. 또한 귀사로부터 제공받은 자료에 의하면, 연간 보수한도를 500억 원으로 증액하는 내용의 정관 변경이 이루어진 2017. 3. 31. 시점의 경우, 대표이사 박영근은 회사 주식 474,246주(2.97%), 전무이사 조병문은 93,153주(0.58%)를 보유하고 있었습니다.
이와 같은 지분 보유현황에 비추어 볼 때, 대표이사 박영근 또는 조병문 전무이사가 합리적 수준을 현저히 벗어나는 보수 지급 기준을 자의적으로 마련하기 위해 주주총회에 영향력을 행사할 수 있는 정도로 귀사의 주식을 보유하고 있었다고 보기는 어려울 것으로 판단됩니다. 따라서 특별한 사정이 없는 한, 귀사의 이사 연간보수 한도액 및 그 집행에 관한 정관 변경의 주주총회 결의 과정에서 대표이사 박영근과 전무이사 조병문이 주주총회에 지배적인 영향력을 행사하였을 가능성은 희박한 것으로 사료됩니다. 결국 적법하게 개최된 주주총회의 결의에 따라 임원 보수 결정에 관한 정관 내용을 변경한 행위를 두고 특정인의 배임행위라고 평가하기는 어려운 것으로 판단됩니다.
2) 정관에서 이사 보수의 한도액을 정한 뒤 구체적인 사항을 이사회에 위임한 것 관련
상법 제361조는 “주주총회는 본법 또는 정관에 정하는 사항에 한하여 결의할 수 있다.”라고 규정하고 있는데, 이러한 주주총회 결의사항은 반드시 주주총회가 정해야 하고 정관이나 주주총회의 결의에 의하더라도 이를 다른 기관이나 제3자에게 위임하지 못하지만, 정관 또는 주주총회에서 임원의 보수 총액 내지 한도액만을 정하고 개별 이사에 대한 지급액 등 구체적인 사항을 이사회에 위임하는 것은 가능하다는 것이 확고한 판례의 입장입니다. 따라서 귀사의 정관에서 임원의 보수 한도액을 정하고 구체적인 사항을 이사회의 의장에 위임하는 방식 자체만으로는 이것이 회사에 대한 관계에서 배임행위라고 볼 수 없습니다.
3) 정관에서 정한 이사 보수 한도액의 적정성 관련
이사의 직무와 그 지급받는 보수 사이에는 합리적 비례관계가 유지되어야 하므로, 회사의 채무 상황이나 영업실적에 비추어 합리적인 수준을 벗어나 현저히 균형성을 잃을 정도로 과다하여서는 아니 됩니다. 이사의 보수 한도가 증액되면 해당 이사들은 그 증액된 보수총액의 한도 내에서 보수를 받을 수 있게 되는 위치에 서게 되고, 만일 이사회의 의장인 대표이사가 자신의 보수를 정할 수 있다면 합리적인 수준을 벗어나서 현저히 균형성을 잃을 정도로 과다한 수준의 보수도 얼마든지 정할 수도 있게 되는 점 등을 함께 고려하면, 제반사정에 비추어 귀사의 이사 연간보수 한도액인 500억 원은 일견 외관상으로는 다소 과다한 것으로 비춰질 여지가 있습니다.
그러나, ‘이사 보수한도 승인’ 결의는 미등기이사를 포함하여 전년도 내지 해당년도 평균 내지 예상 인원 전체에 대한 총 한도액을 정한 것에 불과하다고 보는 것이 타당합니다. 귀사의 정관과 같이 임원보수의 총액 내지 한도액만을 정하고 개별 이사에 대한 지급액 등 구체적인 사항은 이사회에 위임할 수 있음은 앞서 살펴본 바와 같은데, 이러한 경우 정관상 보수한도가 규정되어 있는 것만으로는 이사의 보수청구권이 바로 발생한다고 볼 수 없고, 이사회가 업무집행으로서 각 이사의 보수액을 결정한 경우에 비로소 정관의 이사 보수총액 규정이 구체화되어 이사에게 회사에 대한 보수청구권이 생긴다고 보아야 합니다.
또한 ‘정관상 이사의 연간보수 한도액을 다소 높게 책정한 뒤 구체적인 집행은 이사회의 의장에게 일임’하는 판단이 배임에 해당하는지 여부는, 그러한 판단에 이르게 된 경위와 동기, 판단대상인 사업의 내용, 기업이 처한 경제적 상황, 손실발생의 개연성과 이익획득의 개연성 등 제반 사정을 살펴, 자기 또는 제3자가 재산상 이익을 취득한다는 인식과 본인에게 손해를 가한다는 인식하의 의도적 행위임이 인정되는 경우에 한하여, 배임의 고의를 인정하여야 합니다.
귀사로부터 제공받은 2018년부터 2023년 6월까지의 박영근과 조병문의 보수 지급 내역을 살펴보면 다음과 같습니다.
 |
|
등기이사 보수 총액 |
귀사의 이사에게 지급된 보수 총액을 살펴볼 때, 설정된 한도액에 비해 실제 집행된 보수액은 그에 미치지 못하는 수준인 사실이 확인되는바, 후술하는 바와 같이 보수 집행절차나 그 액수의 적정성에 대한 제반사정들을 함께 고려하면, 정관상 이사 보수의 연간한도액을 다소 높게 책정한 뒤 구체적인 사항은 이사회의 의장인 대표이사에게 맡기는 형식의 보수지급방식은 특별한 사정이 없는 한 해당 내용 자체만으로는 대표이사 박영근 또는 전무이사 조병문에게 배임의 책임을 묻기 어려운 것으로 판단됩니다.
나. 정관에 따른 임원 보수 실 지급액과 배임죄의 성부
1) 평가 기준 관련
귀사는 2018년부터 2023년 6월까지의 기간 동안 박영근과 조병문에 대한 보수를 결정하는 과정에서 급여에 대하여는 ‘이사회 결의에 따라 임원급여 Table을 기초로 리더십, 전문성, 회사기여도 등을 종합적으로 반영’하고, 상여금의 경우에는 ‘정관의 이사의 보수 규정에 따라 재무 부분에 기여한 계량지표와 리더십, 전문성, 기타 기여도로 구성된 비계량지표를 종합적으로 평가하여 연봉의 0%~300% 범위 내’에서 ① 재무 부분 기여도의 일정 범위에서 산출한 금액과 ② 비계량지표와 관련하여 연구, 개발, 업무 등의 성과에 따른 기여도를 반영한 뒤 이를 평가하여 보수를 결정한 것으로 파악됩니다.
위와 같은 보수결정이 적법한지 여부에 관하여서는 리더십, 전문성, 회사기여도, 기타 비계량적인 연구, 개발, 업무 등의 성과는 그 특성상 이를 일률적ㆍ계량적으로 평가하기 어려워 정성적 판단이 불가피한바, 귀사의 위와 같은 보수결정방식이 곧바로 자의적이거나 임의적인 판단이라고 단정할 수는 없고, 회사의 경영진인 임원의 보수를 결정함에 있어 그러한 추상적ㆍ비계량적인 요소를 고려하는 것이 회사에 손해를 끼치는 행위에 해당한다고 보기 어려울 뿐 아니라, 오히려 해당 임원의 성과를 평가하는 과정의 핵심은 영업이익의 원천인 기업가 정신과 같은 추상적ㆍ비계량적 요소에 있다고 보는 것이 타당합니다.
그렇다면, 대표이사 박영근과 전무이사 조병문이 회사의 경영진으로서 리더십과 전문성을 갖추고 있을 뿐 아니라, 회사기여도, 기타 비계량적인 연구, 개발, 업무 등의 성과에서 차지하는 비중이 절대적인 인력인 경우 특별한 사정이 없는 한, 해당 지급기준을 통하여 자체적인 정성 평가를 반영하여 보수를 결정한 것 자체를 두고 고의에 의한 배임행위라고 평가하기는 어려운 것으로 판단됩니다.
덧붙여, 귀사의 매출 중 상당 비중은 ‘의약품이나 그 원료의 제조 및 판매’에서 발생하는 것으로 확인되는데, 해당 분야의 특성상 연구개발 비용이 회사 지출에서 큰 비중을 차지할 것으로 보이고, 위 비용 중 상당 부분은 연구개발 인력 대한 보수가 차지할 것임이 분명합니다. 또한 의약품의 특성상 연구개발은 장기간에 걸쳐 제품 개발, 사업화, 이익실현의 과정을 거쳐야 하기 때문에, 연구 성과가 즉각적으로 매출에 반영되기는 어려운 구조이고, 따라서 연구개발 참여 인력에 대한 보수는 장래의 기대이익 토대로 회사의 경영상 판단에 따라 결정할 수밖에 없습니다. 이러한 사정을 고려하더라도 대표이사 박영근 기타 임원들에 대한 보수액 판단이 귀사의 합리적 경영 판단에 근거한 것이라면 특별한 사정이 없는 한, 보수액의 절대적인 수치만을 보고 배임행위로 판단할 수는 없다고 판단됩니다.
2) 실 지급 보수액 관련
상법이 정관 또는 주주총회의 결의로 이사의 보수를 정하도록 한 것은, 이사 자신이 자신의 보수를 결정하게 될 경우 사적인 이익의 추구를 앞세워 보수를 과다 책정함으로써 회사의 자본충실을 해할 염려가 있기 때문에 이사들의 고용계약과 관련하여 사익 도모의 폐해를 방지함으로써 회사와 주주 및 회사채권자의 이익을 보호하기 위한 것이므로, 비록 보수와 직무의 상관관계가 상법에 명시되어 있지 않더라도 이사가 회사에 대하여 제공하는 직무와 그 지급받는 보수 사이에는 합리적 비례관계가 유지되어야 하며, 회사의 채무 상황이나 영업실적에 비추어 합리적인 수준을 벗어나서 현저히 균형성을 잃을 정도로 과다하여서는 아니된다는 것이 판례의 입장입니다.
한편, 이사 보수의 적정성 여부를 판단할 때 회사의 재무 상황이나 영업 실적 등도 고려 요소가 될 수 있겠지만, 또 하나의 중요한 판단 요소는 ‘이사의 보수가 그 직무 수행에 비추어 적정한지’의 여부입니다. 이사의 보수는 직무 수행의 대가로서 지급되는 것이므로, 이사 보수의 적정성을 판단하기 위하여는 기본적으로 직무 수행의 난이도, 직무 수행에 필요한 전문성의 정도 등의 여러 요소를 반드시 함께 고려하여야만 합니다. 특히 판례(대법원 2016. 1. 28. 선고 2014다11888 판결 등)는 보수의 과다 여부를 판단함에 있어, 절대적인 수치상 액수가 아니라 합리적인 수준을 벗어나 “현저히” 균형성을 잃은 과다 보수라는 판단 기준을 제시하고 있는데, 보수가 ‘합리적인 수준을 벗어나 현저히 균형성을 잃은 정도’에 해당한다고 평가하기 위하여는 이사의 직무 수행 정도 등을 모두 고려하더라도 그 액수가 납득할 수 없을 정도의 과다한 수치에 해당하여야만 하고, 그러한 사정을 고려하지 않은 채 단순히 실제 지급되는 보수액의 수치가 높다는 사정만으로는 ‘현저히 균형성을 잃은 과다 보수’라고 평가하기 어렵습니다.
아울러 해당 판례는 대표이사가 주주들의 반대에도 불구하고 자신의 이익을 위해 주주총회에 영향력을 행사하는 등 계획적이고 적극적이며 지배적인 영향력 행사가 있을 때에 비로소 배임행위에 해당한다는 의미로 해석하는 것이 바람직하고, 단순히 보수가 사회통념에 비추어 과다하면 배임행위에 해당한다는 취지를 설시한 것으로는 볼 수 없습니다. 이와 같이, 보수액의 적정성을 판단함에 있어서는 이사가 회사에 대하여 제공하는 직무와 그 지급받는 보수 사이의 합리적 비례관계를 고려해야 하는데, 직무와 보수 사이의 합리적 비례관계는 회사가 종사하는 업종의 특성에 대한 판단이 선행되어야 하므로, 귀사의 현황만을 단독으로 평가하여 합리적 비례관계 여부를 재단할 수는 없고, 유사 업종에 종사하는 업체의 보수 지급 현황을 기준으로 비교하는 것이 바람직하다고 사료됩니다. 귀사의 등기부상 설립 목적은 다음과 같습니다.
 |
|
등기부상 설립 목적 |
따라서 귀사의 등기상 목적에 부합하고 실제 매출 중 상당부분을 차지하는 ‘의료용 물질 또는 의약품 제조업’부분을 기준으로 유사 업종에 종사하는 업체들을 기준으로 임원의 보수 현황을 비교하여 검토할 필요가 있습니다.
우선, 이사ㆍ감사 등의 임원들에게 지급된 보수의 합계는 해당 임원들의 회사의 경영에 대해 차지하는 전체적인 비중과 그에 대한 보수의 합리적 비례관계에 대한 판단근거로 사용될 수 있습니다. 이 때 귀사의 이사ㆍ감사 보수 지급금액 합계 비중은 아래와 같이 유사 업종의 업체들에 비하여 특별히 과다하다고 보기는 어려운 것으로 판단됩니다.
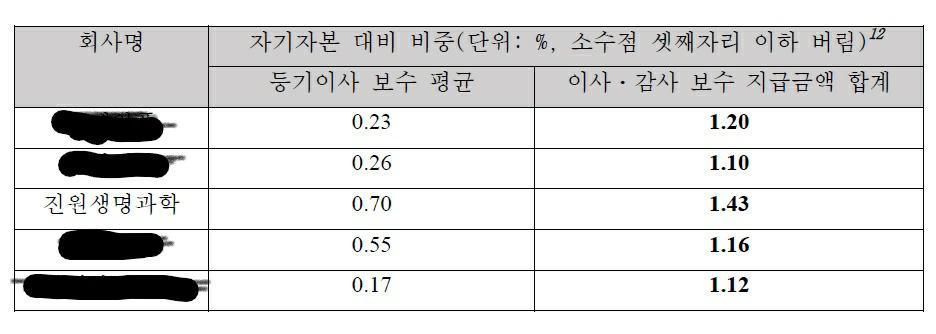 |
|
등기이사의 보수 평균(1) |
다만, 귀사의 등기이사의 보수 평균은 유사한 업체에 비해 높은 측면이 있으나, 이는 ‘타 업체에 비해 등기이사의 회사에 대한 기여도 비중이 절대적’이라는 취지의 귀사의 견해에 부합하는 수치로 볼 수 있는 수준입니다.
또한, 등기이사 보수 평균, 이사ㆍ감사 보수 지급금액 합계 등의 수치의 경우, 해당 업체의 개별 임원이 담당하는 업무의 중요도, 임원의 수 및 그 구성에 따라 그 보수액이 달라질 수 있으므로, 만약 대표이사 단독의 기여도가 절대적인 비중을 차지하는 회사의 경우 대표이사의 보수 비중만을 별도로 비교하여 확인할 필요가 있습니다.
이에 관하여 아래와 같이 유사 업종의 타 업체의 경우에도 귀사와 유사한 수치의 대표이사 보수 비중이 확인되는 점에 비추어, 귀사의 경영 전반에 대한 대표이사 박영근의 기여도가 절대적으로 높은 수준에 해당한다는 귀사의 견해대로라면 귀사의 자기자본 대비 대표이사의 보수 비중이 특별히 과다하여 그러한 보수액을 집행한 것이 배임에 해당한다고 보기는 어려운 것으로 판단됩니다.
 |
|
자기자본 대비 대표이사 보수 비중(1) |
■ 서울 성균관대학교 법학전문대학원 고동원 교수
질의사항 (1) 정관 제31조가 이사에 대한 연간 보수 한도 금액을 정하고 구체적인 집행은 이사회 의장에게 위임하고 있는데, 이 경우 이사 보수액 산정에 대한 명시적인 기준을 별도로 마련하지 않으면 법에 저촉되는지 여부
질의사항 (1)에 대한 답변(법률의견)
이사의 연간 보수 한도를 정관이나 주주총회에서 정하고 각 이사들에게 지급할 구체적인 보수 금액을 이사회나 이사회 의장(대표이사)에게 위임하는 것이 정관이나 주주총회에서 이사의 보수 금액을 정하도록 하고 있는 상법 제388조에 위배되는 것이 아닌지에 대한 의문이 제기될 수 있습니다.
이에 대해 학설과 판례는 상법에 위배되지 않는다는 입장을 취하고 있습니다. 즉, 대법원은 “주주총회에서는 임원 보수의 총액 또는 한도액만을 정하고 개별 이사에 대한 지급액 등 구체적인 사항은 이사회에 위임할 수 있다”라고 하고 있으며(대법원 2012. 3. 29. 선고 2012다1993 판결), 학설도 이사회나 대표이사에게 위임할 수 있다고 보는 것이 통설이고, 실무도 그러합니다(송옥렬, 「상법강의(제13판)」, 박영사, 2023, 1005면).
따라서, 귀사는 정관 규정에 의하여 정관에서 정한 이사 보수 금액 총액 한도 이내에서 구체적인 개별 이사 보수 금액 결정 권한을 이사회 의장인 대표이사에게 위임한 것이므로, 이는 법률이 허용하는 방식이고 개별 이사 보수 금액 산정에 대한 별도의 기준을 사전에 마련하지 않았다고 하여 위법한 것은 아닙니다.
판례와 학설의 입장에 비추어볼 때, 귀사가 정관에 이사의 연간 보수 한도 금액을 정하고 개별 이사에 대한 보수 금액 결정과 지급 등 구체적인 사항을 이사회 의장인 대표이사에게 위임한 것은 상법 제388조에 위반되지 않아 적법하다고 할 수 있습니다. 따라서, 귀사의 이사회 의장인 대표이사가 정관에서 정한 총 보수액 한도 내에서 각 개별 이사의 직무 수행 정도 등을 고려하여 보수 금액을 정하게 되므로 이사 보수 산정에 대한 명시적 기준을 사전에 마련하지 않았다고 하여 위법한 행위는 아닙니다.
질의사항 (2) 대표이사나 전무이사에게 지급한 보수 금액이 ‘과다 보수’에 해당하는지 여부
질의사항 (2)에 대한 답변(법률의견)
상법은 이사 보수액 결정 절차에 관한 사항은 규정하고 있지만, 이사 보수액의 적정성에 관한 내용은 규정하고 있지 않습니다. 그럼에도 불구하고 판례는 “이사가 회사에 대하여 제공하는 직무와 지급받는 보수 사이에는 합리적 비례관계가 유지되어야 하며, 합리적인 수준을 벗어나서 현저히 균형성을 잃을 정도로 과다하여서는 아니 된다.”라고 하여(대법원2016. 1. 28. 선고 2014다11888 판결) 이사 보수는 적정해야 한다는 입장을 취하고 있습니다. 이는 과다 보수 지급은 회사 재산의 부당한 유출을 야기하여 회사 주주 및 채권자 등 이해관계자의 이익을 훼손할 수 있기 때문인 것으로 이해됩니다.
이러한 이사 보수의 적정성 여부를 판단할 때, 회사의 재무 상황이나 영업 실적 등도 고려 요소가 될 수 있겠지만, 무엇보다도 중요한 판단 요소는 이사의 보수가 그 직무 수행에 비추어 적정한 지라고 할 수 있습니다. 즉, 이사의 보수가 직무 수행의 대가로서 지급되는 것이라는 점에서 이사 직무 수행의 난이도와 직무 수행에 필요한 전문성 정도 등의 여러 요소를 고려할 필요가 있는 것입니다. 위에서 본 것처럼, 판례가 이사의 직무와 지급받는 보수 사이에 “합리적 비례관계”가 유지되어야 한다는 것도 바로 이러한 입장에 있다고 할 수 있습니다.
특히, 판례는 ‘단순한’ 과다 보수가 아니라 합리적인 수준을 벗어난 “현저히” 균형성을 잃은 과다 보수라는 판단 기준을 제시하고 있어서, 과다보수를 인정하기 위해서는 이사의 직무 수행 정도 등에 비해서 그 보수액이 상당히 큰 금액이어야 한다는 것인데, 그만큼 과다 보수를 인정하기 위한 요건이 까다롭다는 점을 알 수 있습니다.
더욱이 귀사의 매출액이나 총자산 규모에 비하면 이사에 대한 보수 금액이 과다한 액수라고 보기도 어렵습니다. 귀사의 별도재무제표 기준으로 보면, 귀사의 매출액은 2021년 342억 원, 2022년 456억 원이고, 영업손실액은 2021년 262억 원, 2022년 312억 원이며, 총자산은 2021년 말 기준 2,323억 원, 2022년 말 기준 2,232억 원인데, 대표이사 및 전무이사에게 지급한 보수 총액은 2021년 59억 원(주식매수선택권 23억 8천만 원 제외), 2022년 64억 9천만 원입니다. 즉, 총자산 규모가 2,000억 원이 넘고 매출액도 400억 원이 넘는 회사에서 임원에 대한 보수 금액이 60억 내외라는 점은 비록 적자 상황이지만 과도한 금액이라고 보기가 어려울 것입니다.
영업 적자의 주요 요인이 귀사의 주요 업무인 DNA백신 및 핵산 기반 치료제와 플라스미드 DNA 의약품 관련 연구 개발비 투자라는 점에서 이는 불가피한 상황이라고 할 수 있고, 회사가 적자 상황이라고 할지라도 이사의 직무 수행이 이루어지는 한 이에 대한 적정한 보수 지급은 해야 할 것이라는 점(김건식 외 2인, 회사법 제7판, 박영사, 2023, 474면 참조)도 고려되어야 할 것입니다. 특히, 판례가 적시하는 것처럼, ‘현저히’ 과다한 보수이어야 한다는 점을 고려할 때 이러한 지급 금액이 과다한 보수라고 보기는 더욱 어려운 것입니다.
질의사항 (3) 과다 보수에 해당한다면 이를 지급받은 대표이사나 전무이사가 횡령이나 배임행위를 한 것에 해당하는지 여부
질의사항 (3)에 대한 답변(법률의견)
귀사의 정관에 따라 이사회 의장인 대표이사가 개별 이사의 보수 지급액을 결정하고 이에 따라 이사가 보수를 지급받는 것은 보관 중인 재물을 영득(領得)한 것이 아니므로 횡령죄의 요건에 해당하지 않아 더 나아가 살펴볼 필요 없이 업무상 횡령 행위에 해당하지 않습니다.
다음으로 업무상 배임죄에 해당하는지 여부를 살피건대, 업무상 배임 행위에 해당하려면 첫째, ‘과다한 보수’에 해당할 것, 둘째, 과다한 보수 결정 절차에 계획적·적극적으로 관여하였을 것이라는 두 가지 요건을 모두 충족하여야 하는바, “과다한 보수”에 해당하는지 여부는 앞서 (2번)에서 살펴보았고, 대표이사나 전무이사가 보수액 결정 행위에 영향력을 행사했는지 여부에 대해서 살펴보면, 판례는 과다 보수 지급을 받은 이사가 배임 행위에 해당하려면, 해당 이사가 과다 보수 지급 결정에 영향력을 행사하는 등의 계획적·적극적 관여 행위가 있어야 된다고 보고 있습니다. 즉, 주주총회에서 이사 보수액을 정한 사안에서 “회사에 대한 경영권 상실 등으로 퇴직을 앞둔 이사가 회사에서 최대한 많은 보수를 받기 위하여 그에 동조하는 다른 이사와 함께 과다 보수 지급 기준을 마련하고 지위를 이용하여 주주총회에 영향력을 행사함으로써 소수주주의 반대에 불구하고 이에 관한 주주총회 결의가 성립되도록 하였다면, 이는 회사를 위하여 직무를 충실하게 수행하여야 하는 상법 제382조의3에서 정한 의무를 위반하여 회사재산의 부당한 유출을 야기함으로써 회사와 주주의 이익을 침해하는 것으로서 회사에 대한 배임행위에 해당[한다.]”라고 하고 있습니다(대법원 2016. 1. 28. 선고 2014다11888 판결). 즉, 과다 보수를 받았다고 하여 바로 배임행위가 되는 것이 아니라 과다 보수를 지급받은 이사가 이러한 과다 보수 지급 결정에 영향력을 행사한 경우에 한하여 배임 행위를 인정하고 있는 것입니다.
이러한 판례의 입장에 비추어 볼 때, 귀사의 이사 연간 보수 지급 총액은 정관에 규정되어 있고, 정관 개정에 귀사의 대표이사나 전무이사가 계획적으로 관여할 여지가 없습니다. 즉, 귀사의 대표이사나 전무이사가 정관 개정을 위한 주주총회 결의 시에 주주들에게 영향력을 행사하여 정관 개정에 찬성하도록 했다는 정황은 전혀 보이지 않습니다. 또한, 귀사의 이사회 의장인 대표이사가 각 개별 이사의 보수 지급액을 정한 것은 정관에서 정한 보수 총액 범위 내에서 정관의 규정에 따라 각 개별 이사의 보수금액을 정한 것이어서 합법적인 절차이고, 더욱이 개별 이사의 보수 금액 결정에 있어서도 급여는 통상적으로 전년 대비 일정한 임금 상승률을 적용하는 경우가 많고 상여금은 계량지표 성과와 비계량지표 성과를 반영하여 산출하는 등 나름대로 객관적 기준을 갖고 산정하고 있다는 점에서 보면 배임행위에 해당하지 않는다고 판단됩니다.
■ 당사의 판단 및 투자자 유의사항
법무법인 린 및 고동원 교수의 위와 같은 법률의견에도 불구하고, 위 법률의견에는 다음과 같은 한계 내지 유의할 점이 있습니다.
첫째, 법률의견의 기초가 된 사실관계는 당사가 법무법인 린 및 고동원 교수에게 전달한 정보를 토대로 한 것이며, 법무법인 린 및 고동원 교수는 위 정보들에 대한 독자적인 조사나 검증 등은 수행한 바가 없습니다. 그러므로 만의 하나 위 정보가 부분적으로라도 실체적 진실과 다르거나 부정확한 것으로 밝혀진 경우에는 법률검토의 견의 결과가 달라질 수 있습니다.
둘째, 법무법인 린 및 고동원 교수의 법률검토의견은 2018년부터 2023년 6월까지 박영근 대표이사와 조병문 전무이사에게 지급된 보수와 관련하여, 보수 결정 방식(정관)의 유효성 및 보수액의 적정성 측면에서 본 형사상 횡령·배임죄의 성립 가능성에 대한 법률검토에 국한되고, 나머지 사항들은 실체적·절차적으로 모두 적법한 것임을 전제한 것입니다. 따라서, 만약 대표이사와 전무이사가 주주총회에 영향력을 행사하여 정관을 고의로 유리하게 작성한 사실 등이 있다면 법률의견의 결론은 달라질 수 있습니다.
셋째, 법무법인 린 및 고동원 교수의 법률검토의견은 의견서 작성일 현재의 유효한 대한민국 법령, 판례 및 일반 법 해석 이론에 근거한 법률검토 의견이고, 형사책임의 성립 여부 등에 관하여 규제당국 또는 사법당국과 별도로 협의하거나 확인하는 과정은 거치지 아니하였습니다. 그러므로 관점에 따라서는 본 검토의견과 견해를 달리하는 부분이 있을 수 있습니다.
마지막으로, 법무법인 린 및 고동원 교수의 위와 같은 법률의견에도 불구하고, 당사의 과다보수와 동일한 사건에 대한 판결 등은 아직 찾아볼 수 없는 바, 그렇다면 선례가 없는 당사의 케이스에 대하여 사법기관이 어떻게 판단할지는 아직은 확언할 수 없다 할 것입니다.
당사는 상기 법률의견서 등을 토대로 박영근 대표이사의 보수 지급 관련 행위가 배임죄 등 법률위반에 해당한다고 규정하기 어렵다고 판단하고 있으나, 기존주주들 혹은 투자자들이 사법 기관에 박영근 대표 등을 고소 고발할 가능성은 상존하며, 동일 사건에 대한 판결을 아직 찾아볼 수 없어 관계 법률상 제재 처분을 받을 가능성을 완전히 배제할 수는 없을 것으로 사료됩니다. 배임이슈가 현실화 될 경우 당사의 대표이사 및 임원이 법률상 제재 처분을 받아 직무수행이 불가능한 상황이 발생할 수 있으며,「유가증권시장 상장규정」에 따라 상장 적격성 실질심사 대상에 해당되어 매매거래 정지 및 상장폐지가 이루어지는 등 투자자들의 피해가 발생할 수 있으니 이 점 참고하시기 바랍니다.
(주4) 정정 전
한편, 당사는 2023년 3분기 기준으로 장부금액 기준 관련 리스부채 포함 9,225백만원 수준의 차입금을 보유하고 있으며, 이 중 제4회 전환사채 잔액 1억원이 미상환 상태로 남아 있습니다. 2023년 4월초 5회차 전환사채 인수계약에 의거 사채권자가 조기상환을 요청하여 사채권에 대한 매매계약을 통해 회사가 사채권을 전량 취득하여 소각하였습니다.
(주4) 정정 후
한편, 당사는 2023년 3분기 기준으로 장부금액 기준 관련 리스부채 포함 9,225백만원 수준의 차입금을 보유하고 있으며, 이 중 제4회 전환사채 잔액 1억원이 미상환 상태로 남아 있었으나 제4회 전환사채 잔액 1억원은 2023년 11월 25일 만기가 도래하여 상환되었습니다. 2023년 4월초 5회차 전환사채 인수계약에 의거 사채권자가 조기상환을 요청하여 사채권에 대한 매매계약을 통해 회사가 사채권을 전량 취득하여 소각하였습니다.
(주5) 정정 전
당사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였으며, 내역은 아래와 같습니다.
| [2020년~신고서제출일 현재 자본시장을 통한 자금조달 내역] |
| (단위 : 백만원) |
| 구분 | 최초 주요사항보고서 공시일 | 납입일 | 규모 | 발행방식 | 자금사용목적 |
| 유상증자 | 2019년 11월 08일 | 2020년 01월 28일 | 19,800 | 주주배정 후 실권주 일반공모 | 운영자금 등 |
| 유상증자 | 2020년 04월 29일 | 2020년 07월 03일 | 76,475 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제4회 전환사채 | 2020년 11월 23일 | 2020년 11월 25일 | 24,000 | 사모 전환사채 | 시설자금 및 운영자금 등 |
| 유상증자 | 2021년 09월 01일 | 2021년 12월 02일 | 113,760 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제5회 전환사채 | 2022년 04월 13일 | 2022년 04월 15일 | 11,700 | 사모 전환사채 | 운영자금 |
| 유상증자 | 2023년 09월 06일 | 2023년 09월 15일 | 2,470 | 제3자배정 유상증자 | 운영자금 |
| 유상증자 | 2023년 05월 16일 | 2024년 01월 23일 | 66,660 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 합계 | 314,865 | - | - | ||
| 주) 금번 유상증자의 납입일인 2024년 01월 23일은 예정일이므로, 관계기관과의 협의에 의하여 달라질 수 있으며, 발행규모는 예정발행가액 기준으로 확정발행가액 산정 시 변경될 수 있습니다. 출처) 당사 제시 |
(중략)
| [최근 3개년 및 2023년 3분기 자금조달 내역 및 사용 현황] | |
| (기준일: 본 공시서류 제출 전일 현재) | (단위 : 백만원) |
| 구 분 | 납입일 | 납입금액 | 자금사용 계획 | 실제 자금사용 현황 | 차이발생 사유 등 |
| 주주배정후실권주 일반공모 유상증자 |
2020.01.28 | 19,800 |
(1) 채무상환 : 10,000백만원 소요 예정 (3) 원부재료 구매 : 2,500백만원 소요 예정 (4) GLS -1200 축농증 치료제 연구개발비 : 2,800백만원 소요 예정 |
(1) 채무상환 : 9,589백만원 (7) GLS -5700 지카 백신 연구개발비 : 111백만원 (10) GLS-7000 sc4D5-VT dRP 연구개발비 : 13백만원 |
1. 신고서상 자금사용 용도변경 추가항목: |
| 주주배정후실권주 일반공모 유상증자 |
2020.07.03 | 76,475 |
(1) 발행제비용 : 2,663백만원 소요 예정 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 8,864백만원 소요 예정 |
(1) 발행제비용 : 2,663백만원 |
1. 신고서상 자금사용 용도변경 추가항목: 2) VGX-6150 C형간염치료 연구개발비 3) GLS-6100,6150 C형간염예방 연구개발비 4) GLS-5300 MERS 예방 DNA 백신 연구개발비 5) Microneedle and device 개발비 등 6) B형간염 항체치료제 연구개발비 7) GLS -1027 당뇨병성 신장병증 치료제 연구개발비 8) GLS -1200 축농증 치료제 연구개발비 9) RNA백신 기반 연구개발비 10) CCHF 콩고출혈열 연구개발비 11) MERS-Abs 연구개발비 12) 일반운영비 |
| 제4회 사모 전환사채 | 2020.11.25 | 24,000 | 운영자금 19,000 시설자금 5,000 |
운영자금 19,000백만원 시설자금 5,000백만원 |
- |
| 주주배정후실권주 일반공모 유상증자 (주1) |
2021.12.02 | 113,760 | (1) 발행제비용 : 2,700백만원 소요 예정 (2) CDMO설비 신규 증설자금(VGXI 신규시설자금) : 90,823백만원 소요 예정 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 20,237백만원 소요 예정 |
(1) 발행제비용 : 2,700백만원 (2) CDMO설비 신규 증설자금(VGXI 신규시설자금) : 59,354백만원 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 9,387백만원 (4) GLS -5700 지카 백신 연구개발비 : 120백만원 (5) Microneedle and device 개발비 등 : 1,080백만원 (6) GLS -1200 축농증 치료제 연구개발비 : 82백만원 (7) RNA백신 기반 연구개발비 : 334백만원 (8) GLS -1200 코로나19 연구개발비 : 762백만원 (9) Pan.코로나 연구개발비 : 116백만원 (10) GLS -1027 자가면역질환 연구개발비 : 140백만원 (11) GLS -1027 기타 연구개발비 : 52백만원 (12) HnMc 연구개발비 : 5백만원 (13) 일반운영비 :33,027만원 (14) GLS -5140 STFSV예방 DNA 백신 연구개발비 :2,151백만원 (15) GLS -5300(MERS) : 22백만원 (16) CCHF-콩고출혈열 : 11백만원 (17) GLS -6100, 6150 C 형간염[예방] : 5백만원 (18) PlasMab : 4백만원 (19) CCR8 : 9백만원 (20) CCAR-M : 16백만원 (21) RAS : 1백만원이 지출되었습니다. (22) BaAB : 3백만원이 지출되었습니다. |
1. 신고서상 자금사용 용도변경 추가항목: 1) GLS -5700 지카 백신 연구개발비 2) Microneedle and device 개발비 등 3) GLS -1200 축농증 치료제 연구개발비 4) RNA백신 기반 연구개발비 5) GLS-1200 코로나19 연구개발비 6) Pan.코로나 연구개발비 7) GLS-1027 자가면역질환 연구개발비 8) GLS-1027 기타 연구개발비 9) HnMc 연구개발비 10) 일반운영비 11) GLS-5140 STFSV예방 DNA 백신 12) GLS-5300(MERS) 연구개발비 13) CCHF-콩고출혈열 연구개발비 14) GLS-6100, 6150 C 형간염[예방] 연구개발비 |
| 제5회 사모 전환사채 | 2022.04.15 | 11,700 | 운영자금 11,700 | 운영자금 11,700백만원 | - |
| 제3자 배정 유상증자 | 2023.09.15 | 2,470 | 운영자금 2,470 | 운영자금 2,470 | - |
| 출처) 당사 정기보고서 및 당사 제시 주1) 2021년 12월 02일 납입 완료된 유상증자 자금은 2023년 3분기말 현재 총 109,381백만원을 사용하여 유증자금이 4,379백만원 남아있습니다.(미사용 유증자금은 우리은행, 신한은행, 국민은행에 각각 보관하고 있습니다.) |
이처럼 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 핵산 백신 및 핵산 기반 연구개발이 제품화에 실패하거나 플라스미드 CDMO 사업 관련 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원활하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다.
(주5) 정정 후
당사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였으며, 내역은 아래와 같습니다.
| [2020년~신고서제출일 현재 자본시장을 통한 자금조달 내역] |
| (단위 : 백만원) |
| 구분 | 최초 주요사항보고서 공시일 | 납입일 | 규모 | 발행방식 | 자금사용목적 |
| 유상증자 | 2019년 11월 08일 | 2020년 01월 28일 | 19,800 | 주주배정 후 실권주 일반공모 | 운영자금 등 |
| 유상증자 | 2020년 04월 29일 | 2020년 07월 03일 | 76,475 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제4회 전환사채 | 2020년 11월 23일 | 2020년 11월 25일 | 24,000 | 사모 전환사채 | 시설자금 및 운영자금 등 |
| 유상증자 | 2021년 09월 01일 | 2021년 12월 02일 | 113,760 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제5회 전환사채 | 2022년 04월 13일 | 2022년 04월 15일 | 11,700 | 사모 전환사채 | 운영자금 |
| 유상증자 | 2023년 09월 06일 | 2023년 09월 15일 | 2,470 | 제3자배정 유상증자 | 운영자금 |
| 유상증자 | 2023년 05월 16일 | 2024년 02월 22일 | 66,660 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 합계 | 314,865 | - | - | ||
| 주) 금번 유상증자의 납입일인 2024년 02월 22일은 예정일이므로, 관계기관과의 협의에 의하여 달라질 수 있으며, 발행규모는 예정발행가액 기준으로 확정발행가액 산정 시 변경될 수 있습니다. 출처) 당사 제시 |
(중략)
| [최근 3개년 및 2023년 3분기 자금조달 내역 및 사용 현황] | |
| (기준일: 본 공시서류 제출 전일 현재) | (단위 : 백만원) |
| 구 분 | 납입일 | 납입금액 | 자금사용 계획 | 실제 자금사용 현황 | 차이발생 사유 등 |
| 주주배정후실권주 일반공모 유상증자 |
2020.01.28 | 19,800 |
(1) 채무상환 : 10,000백만원 소요 예정 (3) 원부재료 구매 : 2,500백만원 소요 예정 (4) GLS -1200 축농증 치료제 연구개발비 : 2,800백만원 소요 예정 |
(1) 채무상환 : 9,589백만원 (7) GLS -5700 지카 백신 연구개발비 : 111백만원 (10) GLS-7000 sc4D5-VT dRP 연구개발비 : 13백만원 |
1. 신고서상 자금사용 용도변경 추가항목: |
| 주주배정후실권주 일반공모 유상증자 |
2020.07.03 | 76,475 |
(1) 발행제비용 : 2,663백만원 소요 예정 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 8,864백만원 소요 예정 |
(1) 발행제비용 : 2,663백만원 |
1. 신고서상 자금사용 용도변경 추가항목: 2) VGX-6150 C형간염치료 연구개발비 3) GLS-6100,6150 C형간염예방 연구개발비 4) GLS-5300 MERS 예방 DNA 백신 연구개발비 5) Microneedle and device 개발비 등 6) B형간염 항체치료제 연구개발비 7) GLS -1027 당뇨병성 신장병증 치료제 연구개발비 8) GLS -1200 축농증 치료제 연구개발비 9) RNA백신 기반 연구개발비 10) CCHF 콩고출혈열 연구개발비 11) MERS-Abs 연구개발비 12) 일반운영비 |
| 제4회 사모 전환사채 | 2020.11.25 | 24,000 | 운영자금 19,000 시설자금 5,000 |
운영자금 19,000백만원 시설자금 5,000백만원 |
- |
| 주주배정후실권주 일반공모 유상증자 (주1) |
2021.12.02 | 113,760 | (1) 발행제비용 : 2,700백만원 소요 예정 (2) CDMO설비 신규 증설자금(VGXI 신규시설자금) : 90,823백만원 소요 예정 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 20,237백만원 소요 예정 |
(1) 발행제비용 : 2,700백만원 (2) CDMO설비 신규 증설자금(VGXI 신규시설자금) : 59,354백만원 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 9,387백만원 (4) GLS -5700 지카 백신 연구개발비 : 120백만원 (5) Microneedle and device 개발비 등 : 1,080백만원 (6) GLS -1200 축농증 치료제 연구개발비 : 82백만원 (7) RNA백신 기반 연구개발비 : 334백만원 (8) GLS -1200 코로나19 연구개발비 : 762백만원 (9) Pan.코로나 연구개발비 : 116백만원 (10) GLS -1027 자가면역질환 연구개발비 : 140백만원 (11) GLS -1027 기타 연구개발비 : 52백만원 (12) HnMc 연구개발비 : 5백만원 (13) 일반운영비 :33,027만원 (14) GLS -5140 STFSV예방 DNA 백신 연구개발비 :2,151백만원 (15) GLS -5300(MERS) : 22백만원 (16) CCHF-콩고출혈열 : 11백만원 (17) GLS -6100, 6150 C 형간염[예방] : 5백만원 (18) PlasMab : 4백만원 (19) CCR8 : 9백만원 (20) CCAR-M : 16백만원 (21) RAS : 1백만원이 지출되었습니다. (22) BaAB : 3백만원이 지출되었습니다. |
1. 신고서상 자금사용 용도변경 추가항목: 1) GLS -5700 지카 백신 연구개발비 2) Microneedle and device 개발비 등 3) GLS -1200 축농증 치료제 연구개발비 4) RNA백신 기반 연구개발비 5) GLS-1200 코로나19 연구개발비 6) Pan.코로나 연구개발비 7) GLS-1027 자가면역질환 연구개발비 8) GLS-1027 기타 연구개발비 9) HnMc 연구개발비 10) 일반운영비 11) GLS-5140 STFSV예방 DNA 백신 12) GLS-5300(MERS) 연구개발비 13) CCHF-콩고출혈열 연구개발비 14) GLS-6100, 6150 C 형간염[예방] 연구개발비 |
| 제5회 사모 전환사채 | 2022.04.15 | 11,700 | 운영자금 11,700 | 운영자금 11,700백만원 | - |
| 제3자 배정 유상증자 | 2023.09.15 | 2,470 | 운영자금 2,470 | 운영자금 2,470 | - |
| 출처) 당사 정기보고서 및 당사 제시 주1) 2021년 12월 02일 납입 완료된 유상증자 자금은 2023년 3분기말 현재 총 109,381백만원을 사용하여 유증자금이 4,379백만원 남아있습니다.(미사용 유증자금은 우리은행, 신한은행, 국민은행에 각각 보관하고 있습니다.) |
당사는 코로나19 백신 및 치료제와 관련하여 시장으로부터 자금을 조달하였습니다. 특히 지난 2021년 12월 주주배정 유상증자를 통해 연구개발비용으로 아래 표와 같이 약 200억원을 조달한 바 있습니다. 그러나, 코로나19 백신(GLS-5130)으로 계획된 13,237백만원 가운데 5,620백만원만 지출하였고, 코로나19 치료제(GLS-1027)으로 계획된 7,000백만원 가운데 4,836백만원만 지출하였습니다. 해당 잔여 합계금액 9,781백만원은 현재 회사의 일반운영비로 사용한 상태입니다.
[단위: 백만원]
| 우선순위 | 적응증 | 제품명 | 구분 | 2021년 | 2022년 | 합계 |
|---|---|---|---|---|---|---|
| 1 | 코로나19 | DNA백신(GLS-5310) | 3상임상기관비용 | 6,700 | 6,537 | 13,237 |
| 2 | 코로나19 | 임상악화 방지 경구용치료제(GLS-1027) | 2상임상연구 | 7,000 | - | 7,000 |
| 합계 | 13,700 | 6,537 | 20,237 |
이처럼 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 핵산 백신 및 핵산 기반 연구개발이 제품화에 실패하거나 플라스미드 CDMO 사업 관련 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원활하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다.
(주6) 정정 전
당사는 본 공시서류 제출 전일 현재 제4회 전환사채 미발행 주식수가 총 8,129주가 존재하며, 주식매수선택권의 경우 행사기간 만료되어 전환가능 주식수가 없습니다.
| [전환사채 발행 현황] | |
| (기준일 : 본 공시 서류 제출 전일 현재) | (단위: 백만원, 주) |
| 종류/구분 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율(%) | 전환가액 | 권면(전자등록)총액 | 전환가능주식수 | |||||||
| 제4회사모 전환사채 |
2020년 11월 25일 | 2023년 11월 25일 | 24,000 | 기명식 보통주식 |
2021년 11월 25일~ 2023년 10월 25일 |
100 | 12,301 | 100 | 8,129 | 전환가액 조정 |
| 제5회사모 전환사채 |
2022년 04월 15일 | 2025년 04월 15일 | 11,700 | 기명식 보통주식 |
2023년 04월 15일~ 2025년 03월 15일 |
100 | 10,265 | - | - | 전환가액 조정 |
| 합 계 | - | - | 35,700 | 기명식 보통주식 |
- | 100 | - | 100 | 8,129 |
- |
| 주1) 2020년 11월에 발행한 4CB는 2023년 05월 10일 미상환사채 11억원 중 10억원에 대해 풋옵션 행사되어 잔액 1억원입니다. 주2) 2022년 04월에 발행한 5CB는 2023년 04월12일 기준 현재 잔액 0억원으로 상환 완료하였습니다. 출처) 당사 정기보고서 |
제4회 전환사채의 전환가능기간은 2021년 11월 25일부터 2023년 10월 25일까지입니다. 상기 기발행된 전환사채가 당사 보통주로 전환될 경우, 최대주주를 포함한 기존 주주의 지분율이 희석될 위험이 있습니다. 기발행 전환사채가 보통주로 전환될 경우 총발행주식수 78,473,817주의 약 0.01%(금번 유상증자 22,000,000주 포함 0.01%)에 해당합니다.
(주6) 정정 후
당사는 본 공시서류 제출 전일 현재 발행된 전환사채는 없으며, 주식매수선택권의 경우 행사기간 만료되어 전환가능 주식수가 없습니다.
| [전환사채 발행 현황] | |
| (기준일 : 본 공시 서류 제출 전일 현재) | (단위: 백만원, 주) |
| 종류/구분 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율(%) | 전환가액 | 권면(전자등록)총액 | 전환가능주식수 | |||||||
| 제4회사모 전환사채 |
2020년 11월 25일 | 2023년 11월 25일 | 24,000 | 기명식 보통주식 |
2021년 11월 25일~ 2023년 10월 25일 |
100 | 12,301 | - | - | 전환가액 조정 |
| 제5회사모 전환사채 |
2022년 04월 15일 | 2025년 04월 15일 | 11,700 | 기명식 보통주식 |
2023년 04월 15일~ 2025년 03월 15일 |
100 | 10,265 | - | - | 전환가액 조정 |
| 합 계 | - | - | 35,700 | 기명식 보통주식 |
- | 100 | - | - | - | - |
| 주1) 2020년 11월에 발행한 4CB는 2023년 05월 10일 미상환사채 11억원 중 10억원에 대해 풋옵션 행사되어 잔액 1억원입니다. 잔액 1억원에 대해 2023년 11월 25일 만기가 도래함에 따라 전액 상환되었습니다. 주2) 2022년 04월에 발행한 5CB는 2023년 04월12일 기준 현재 잔액 0억원으로 상환 완료하였습니다. 출처) 당사 정기보고서 |
제4회 전환사채의 전환가능기간은 2021년 11월 25일부터 2023년 10월 25일까지였으나 전액 상환되었습니다.
(주7) 정정 전
한편, 2023년 3분기까지 당사가 자회사 VGXI에 대여한 원금은 총 135,825백만원(환율 1,344.80원 기준)으로 2023년 3분기 기준 자산총액 191,399백만원 대비 70.96%에 해당합니다.
당사가 VGXI에 대여형태로 거래하는 이유는 VGXI에서 영업이익이 발생하면 대여금 회수를 통해 더 이상 시장에서 자금을 조달하는 것이 아니라 회수된 자금을 연구개발에 사용할 계획이었습니다. 올해 8월과 9월 VGXI에 대여가 이뤄지지 않았습니다. 해당 내용은 당사가 금번 유증을 통해 자금을 조달하면 8월과 9월 대여를 통해 VGXI의 시설자금과 운영자금으로 사용할 계획이 표기된 부분입니다.
향후 VGXI의 신규 공장의 운영이 어렵게 되어 판매 증진을 통한 실적 개선 기회를 잃게 될 경우 VGXI로부터 대여금 회수가 어려워져 심각한 자금 경색으로 본사 및 계열사 전체가 지속적인 경영의 어려움과 최악의 경우 부도 상황에도 처할 수 있으므로 투자자 여러분들께서는 이 점 유의하여 주시기 바랍니다.
자회사 VGXI Inc 의 주요 비용 내역
| 구분(단위 : 백만원) | 2023년 3분기 |
2022년 | 2021년 | 2020년 | ||||
| 제조비 | 판관비 | 제조비 | 판관비 | 제조비 | 판관비 | 제조비 | 판관비 | |
| 급여 | 8,839 | 2,815 | 8,987 | 6,250 | 5,381 | 5,056 | 5,427 | 5,917 |
| 복리후생비 | 2,885 | 758 | 2,863 | 871 | 2,114 | 668 | 1,854 | 656 |
| 감가상각비 | 3,186 | 1,995 | 800 | 424 | 653 | 591 | 603 | 588 |
| 경상연구개발비 | - | - | - | - | - | 600 | - | 472 |
| 지급수수료 | 2,801 | 2,975 | 300 | 4,494 | 207 | 1,702 | 253 | 1,430 |
| 무형자산상각비 | - | 217 | - | 167 | 1,179 | 138 | 1,170 | 106 |
| 사용권자산상각비 | - | 725 | - | 1,038 | - | 747 | 464 | 252 |
| 원재료비 | 2,534 | - | 7,155 | - | 4,728 | - | 5,357 | - |
| 외주가공비 | 649 | - | 309 | - | 120 | - | 135 | - |
| 잡급(계약직) | 2,814 | 879 | 2,936 | 426 | 1,521 | 123 | 1,513 | 13 |
| 여비교통비 | 11 | 142 | 21 | 212 | 14 | 149 | 5 | 103 |
| 통신비 | 13 | 98 | 14 | 86 | 7 | 49 | 9 | 21 |
| 수도광열비 | 294 | 510 | 296 | 100 | 227 | 78 | 193 | 71 |
| 세금과공과 | 46 | 108 | 366 | 142 | 157 | 82 | 209 | 60 |
| 지급임차료 | - | 61 | - | 66 | - | 29 | - | 17 |
| 수선비 | 452 | - | 300 | - | 188 | 1 | 162 | - |
| 보험료 | 206 | 152 | 116 | 90 | 49 | 59 | 62 | 55 |
| 차량유지비 | - | 16 | - | 32 | - | 28 | - | 26 |
| 운반비 | 233 | 3 | 455 | 6 | 355 | 8 | 325 | 6 |
| 교육훈련비 | 5 | 3 | 4 | 1 | - | 1 | - | 2 |
| 도서인쇄비 | - | 17 | 1 | 2 | 4 | 1 | 1 | - |
| 사무용품비 | 4 | 164 | 12 | 198 | 11 | 81 | 8 | 56 |
| 소모품비 | 14 | 18 | 54 | 9 | 26 | 2 | 26 | - |
| 대손상각비 | - | 4 | - |
- |
- |
- |
- |
- |
| 잡비 | - | 1 | 128 | 182 | - | - | - | 176 |
| 소계 | 24,986 | 11,661 | 25,117 | 14,796 | 16,941 | 10,193 | 17,776 | 10,027 |
| 합계 | 36,647 | 39,913 | 27,134 | 27,803 | ||||
출처) 당사 제시
또한 연도별 지급수수료 상세 내역은 아래와 같습니다.
| 구분(단위 : 백만원) | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| HR수수료 | 74 | 1 | - | - |
| 장비유지비 | 2,013 | 2 | 2 | 2 |
| 소프트웨어유지비 | 55 | 32 | 22 | 18 |
| 서버유지비 | 57 | 32 | 22 | 17 |
| 인터넷서비스 | - | 39 | 29 | 28 |
| 외부서비스 | 914 | 378 | 118 | 336 |
| 법무수수료 | 2,332 | 3,897 | 1,417 | 940 |
| 감사수수료 | 288 | 102 | 82 | 79 |
| 은행수수료 | 29 | 11 | 10 | 10 |
| 폐기물수수료 | 14 | - |
- |
- |
| 계 | 5,776 | 4,494 | 1,702 | 1,430 |
| 출처) 당사 제시 주1) 평균 환율은 2023년 3분기 1,300.32원, 2022년 1,291.95원, 2021년 1,144.42원, 2020년 1,180.05원 적용 |
(주7) 정정 후
2023년 3분기말 기준으로 선급금 4,845백만원중에서 자회사 VGXI에 생산의뢰를 위하여 선급으로 지급한 금액은 4,617백만원에 이르며, 진원생명과학이 100% 자회사인 VGXI에 대여한 금액은 135,825백만원(USD 101백만달러)이며, VGXI는 자본잠식 상태이어서 진원생명과학의 투자자산에서 전액 9,672백만원을 손상차손으로 회계처리 하였습니다.
위와 같이 VGXI에 선급금으로 지급되고 대여한 금액이 진원생명과학의 자산의 73.4% (4,617+135,825/191,405백만원)에 해당되는 상황에서 VGXI가 현재와 같이 영업실적이 저조한 상황이 개선되지 않으면 계속성에 불확실성을 갖게 되어 진원생명과학의 선급금 및 대여금의 회수에도 부정적인 영향을 미쳐 진원생명과학 또한 계속기업으로서 불확실성이 있으며 관리종목으로 지정될 가능성도 있습니다.
(중략)
또한 연도별 지급수수료 상세 내역은 아래와 같습니다.
| 구분(단위 : 백만원) | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| HR수수료 | 74 | 1 | - | - |
| 장비유지비 | 2,013 | 2 | 2 | 2 |
| 소프트웨어유지비 | 55 | 32 | 22 | 18 |
| 서버유지비 | 57 | 32 | 22 | 17 |
| 인터넷서비스 | - | 39 | 29 | 28 |
| 외부서비스 | 914 | 378 | 118 | 336 |
| 법무수수료 | 2,332 | 3,897 | 1,417 | 940 |
| 감사수수료 | 288 | 102 | 82 | 79 |
| 은행수수료 | 29 | 11 | 10 | 10 |
| 폐기물수수료 | 14 | - |
- |
- |
| 계 | 5,776 | 4,494 | 1,702 | 1,430 |
| 출처) 당사 제시 주1) 평균 환율은 2023년 3분기 1,300.32원, 2022년 1,291.95원, 2021년 1,144.42원, 2020년 1,180.05원 적용 |
지급수수료 중 장비유지비의 세부 내역은 아래와 같습니다.
[단위: 백만원]
| 구분 | 금액 |
|---|---|
| 유지보수비 | 354 |
| 측정비 | 100 |
| 프로젝트 손실 | 1,559 |
| 합계 | 2,013 |
프로젝트손실분의 금액(1,559백만원)은 프로젝트 진행중에서 미숙련 및 제조의 미숙 등으로 원가를 초과하여 발생된 비용이며, 프로젝트 손실로 기재된 지급수수료 금액은 외부에 지급되는 비용은 아니며 재무상태표에 부채성 충당금으로 반영되었습니다. 숙련도가 완료되기 전까지는 해당 지급수수료에 반영된 프로젝트손실분의 금액은 매분기마다 발생될 수 있습니다.
(주8) 정정 전
(주8) 정정 후
|
바-1. 종속회사 VGXI 계속기업불확실성에 따른 위험 종속회사 VGXI Inc.는 2023년 3분기까지 완전 자본잠식이 되었으며, 3분기 보고일까지 완전 자본 잠식된 금액을 회복할 정도의 수주 및 이익을 기대하기 어려워 별도 재무제표에 자회사 VGXI Inc. 투자금액 9,672백만원 전액을 손상차손으로 인식하였습니다. 또한 별도 재무제표의 자회사 투자자산에 대하여 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표로서 지배기업, 관계기업의 투자자 또는 공동기업의 참여자가 투자자산을 피투자자의 보고된 성과와 순자산에 근거하지 않고 직접적인 지분투자에 근거하여 원가법으로 표시한 재무제표 원가법을 적용하였으나, 연결 재무제표에서는 자회사의 손실이 재무제표에 반영되었기에 해당금액의 차이가 발생하는 바 이에 대하여 손상으로 인식하였으며, 자회사 VGXI Inc.는 2023년 3분기 현재 완전 잠식상태이기에 별도재무상태표의 자회사 VGXI, Inc.의 투자금액 전액을 손상으로 인식하여 제거하였으며, 별도 손익계산서에서는 기타비용인 손상차손으로 전액 인식하였습니다. 2023년 3분기말 기준으로 선급금 4,845백만원중에서 자회사 VGXI에 생산의뢰를 위하여 선급으로 지급한 금액은 4,617백만원에 이르며, 진원생명과학이 100% 자회사인 VGXI에 대여한 금액은 135,825백만원(USD 101백만달러)이며, VGXI는 자본잠식 상태이어서 진원생명과학의 투자자산에서 전액 9,672백만원을 손상차손으로 회계처리 하였습니다. 위와 같이 VGXI에 선급금으로 지급되고 대여한 금액이 진원생명과학의 자산의 73.4% (4,617+135,825/191,405백만원)에 해당되는 상황에서 VGXI가 현재와 같이 영업실적이 저조한 상황이 개선되지 않으면 계속성에 불확실성을 갖게 되어 진원생명과학의 선급금 및 대여금의 회수에도 부정적인 영향을 미쳐 진원생명과학 또한 계속기업으로서 불확실성이 있으며 관리종목으로 지정될 가능성도 있습니다. |
종속회사 VGXI Inc.는 2023년 3분기까지 완전 자본잠식이 되었으며, 3분기 보고일까지 완전 자본 잠식된 금액을 회복할 정도의 수주 및 이익을 기대하기 어려워 별도 재무제표에 자회사 VGXI Inc. 투자금액 9,672백만원 전액을 손상차손으로 인식하였습니다. 또한 별도 재무제표의 자회사 투자자산에 대하여 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표로서 지배기업, 관계기업의 투자자 또는 공동기업의 참여자가 투자자산을 피투자자의 보고된 성과와 순자산에 근거하지 않고 직접적인 지분투자에 근거하여 원가법으로 표시한 재무제표 원가법을 적용하였으나, 연결 재무제표에서는 자회사의 손실이 재무제표에 반영되었기에 해당금액의 차이가 발생하는 바 이에 대하여 손상으로 인식하였으며, 자회사 VGXI Inc.는 2023년 3분기 현재 완전 잠식상태이기에 별도재무상태표의 자회사 VGXI, Inc.의 투자금액 전액을 손상으로 인식하여 제거하였으며, 별도 손익계산서에서는 기타비용인 손상차손으로 전액 인식하였습니다.
2023년 3분기말 기준으로 선급금 4,845백만원중에서 자회사 VGXI에 생산의뢰를 위하여 선급으로 지급한 금액은 4,617백만원에 이르며, 진원생명과학이 100% 자회사인 VGXI에 대여한 금액은 135,825백만원(USD 101백만달러)이며, VGXI는 자본잠식 상태이어서 진원생명과학의 투자자산에서 전액 9,672백만원을 손상차손으로 회계처리 하였습니다.
위와 같이 VGXI에 선급금으로 지급되고 대여한 금액이 진원생명과학의 자산의 73.4% (4,617+135,825/191,405백만원)에 해당되는 상황에서 VGXI가 현재와 같이 영업실적이 저조한 상황이 개선되지 않으면 계속성에 불확실성을 갖게 되어 진원생명과학의 선급금 및 대여금의 회수에도 부정적인 영향을 미쳐 진원생명과학 또한 계속기업으로서 불확실성이 있으며 관리종목으로 지정될 가능성도 있습니다.
나아가, 대내외적인 거시경제가 악화되어 재무적으로 자금 조달이 원활해지지 않는다면 계속기업으로의 불확실성이 더욱 확대될 수 있습니다. 투자자분들은 향후 당사의 사업이 수익성 개선을 달성하지 못 한다면 계속 기업으로의 존속에 대한 불확실성이 존재할 수 있다는 점 유념하여 주시고, 「 제1부 모집 또는 매출에 관한 사항 - III. 투자위험요소 - 2.회사위험 - 가. 지속적인 영업적자로 인한 재무구조 악화 위험 」를 면밀히 검토하시어 투자에 임해주시길 바라겠습니다.
(주9) 정정 전
(주9) 정정 후
|
더. 과거 공시의무 미이행에 따른 위험 당사는 금번 공모 과정에서 과거 2020년 08월 3일 및 21년 12월 8일 금전대여 후 다수의 정정공시가 누락된 점을 지적 받아 2023년 12월 4일 공시서류에 대해 일괄 검토하였습니다. 검토결과 21건의 지연공시 대상이었기 때문에 당사는 2023년12월 4일 해당 공시사항들에 대해 일괄적으로 정정공시하였습니다. |
기업공시제도란 기업이 주주 또는 투자자에게 기업의 중요경영사항에 관한 중요한 정보를 정기 또는 수시로 공개토록 하여 투자자가 스스로 자유로운 판단과 책임하에 투자의사 결정을 하도록 유도하고 증권시장에서의 정보형평성을 제고하기 위한 제도입니다. 기업 공시는 정보 형평을 통해 증권시장의 효율성을 실현하는 중요한 제도로 내부자 거래 등 불공정거래행위를 방지하고 기업 활동에 대한 사회적 감시기능을 합니다. 금융위원회는 자본시장법을 통해 기업공시제도의 법적 근거를 마련하고 있으며 제391조(공시규정)를 통해 거래소가 개설 운영하는 둘 이상의 증권시장에 대하여 별도의 공시규정으로 정하도록 하고 있습니다. 따라서, 유가증권시장 상장법인은 『자본시장과 금융투자업에 관한 법률』과 한국거래소에서 운영하는 『유가증권시장규정』에 의거하여 공시의무가 발생되게 됩니다. 당사는 1987년 11월 26일 유가증권시장에 상장되었으며 현재까지 유가증권시장 상장사의 지위로 다음의 공시의무를 지고 있습니다.
| [ 공시체계 분류표 ] |
| 대 분 류 | 공 시 분 류 |
|---|---|
| 발행시장 공시 | 발행공시 |
| 유통시장공시 | 정기공시 |
| 주요사항보고서 | |
| 기타공시 | |
| 지분공시 | |
| 수시공시 | |
| 공정공시 |
당사는 금번 공모 과정에서 과거 2020년 08월 3일 및 21년 12월 8일 금전대여 후 다수의 정정공시가 누락된 점을 지적 받아 2023년 12월 4일 공시서류에 대해 일괄 검토하였습니다. 검토결과 21건의 지연공시 대상이었기 때문에 당사는 2023년 12월 4일 해당 공시사항들에 대해 일괄적으로 정정공시하였습니다. 정정공시된 내역은 다음과 같습니다.
| [ 정정공시 이행 내역] |
| 날짜 | 보고서명 | 사유 | 비고 |
|---|---|---|---|
| 2023-12-04 | 금전대여결정 | 주계약 후 분할계약 체결 누락공시 10건 | 공시 누락 |
| 2023-12-04 | 주계약 후 분할계약 체결 누락공시 11건 | 공시 누락 |
주1) 1차 주계약은 2023.08.03 이사회 결의로 금전대여계약을 체결하였고, 분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다.
주2) 2차 주계약은 2021.12.08 이사회 결의로 금전대여계약을 체결하였고,분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다.
| [ 금전대여 결정] |
| 1. 대여 상대 | 브이지엑스아이(주) | 영문 | VGXI, Inc. | ||
| - 회사와의 관계 | 계열회사 | ||||
| 2. 금전대여 내역 | 거래일자 | 2020-08-04 | |||
| 대여금액(원) | 62,772,797,092 | ||||
| 자기자본(원) | 24,060,166,535 | ||||
| 자기자본대비(%) | 260.90 | ||||
| 대규모법인여부 | 미해당 | ||||
| 이율(%) | 4.6 | ||||
| 대여기간 | 시작일 | 2020-08-04 | |||
| 종료일 | 2029-11-10 | ||||
| 3. 금전대여 목적 | 시설자금(공장증축) 대여 | ||||
| 4. 금전대여 총잔액(원) | 62,772,797,092 | ||||
| 5. 이사회결의일(결정일) | 2023-11-10 | ||||
| - 사외이사 참석여부 | 참석(명) | 1 | |||
| 불참(명) | 0 | ||||
| - 감사(사외이사가 아닌 감사위원) 참석여부 | 참석 | ||||
| 6. 기타 투자판단과 관련한 중요사항 | |||||
| - 상기 대여금액은 대여원금 USD52,790,175에 대해 이사회 당일 매매기준율(1,189.10원/1USD)을 적용하여 산출한 금액입니다. - 상기 자기자본은 2019년말 연결기준 자본총계입니다. - 상기 대여금은 일시에 대여하는 것이 아니라 시설의 공정단계에 따라 VGXI의 요청에 의거하여 소요금액만큼 순차적으로 대여할 예정입니다. - 대여기간 만료 후 미상환잔액이 있을 경우 대여기간 연장이 가능합니다, 상기 대여금액은 대여원금 USD52,790,175에 대해 이사회 당일 매매기준율(1,189.10원/1USD)을 적용하여 산출한 금액입니다. - 상기 자기자본은 2019년말 연결기준 자본총계입니다. - 상기 대여금은 일시에 대여하는 것이 아니라 시설의 공정단계에 따라 VGXI의 요청에 의거하여 소요금액만큼 순차적으로 대여할 예정입니다. - 대여기간 만료 후 미상환잔액이 있을 경우 대여기간 연장이 가능합니다, - 상기 대여금은 총 9차례 걸쳐 대여가 이루어 졌으며, 상세 내역은 아래와 같습니다. <계약명(계약체결일)>/대여금액/대여기간 1차 주계약(2020.08.03)/USD52,790,175/2020.08.04~2023.08.03 <분할계약> 1-1차(2020.08.04)/USD 3,200,000/2020.08.04.~2023.08.03. 1-2차(2020.10.13)/USD 3,600,000/2020.10.13.~2023.10.12. 1-3차(2020.11.13)/USD11,400,000/2020.11.13.~2023.11.12. 1-4차(2021.01.14)/USD 3,700,000/2021.01.14.~2024.01.13. 1-5차(2021.04.26)/USD13,000,000/2021.04.26.~2024.04.25. 1-6차(2021.08.17)/USD 5,000,000/2021.08.17.~2024.08.16. 1-7차(2021.09.13)/USD 5,000,000/2021.09.13.~2024.09.12. 1-8차(2021.10.12)/USD 5,000,000/2021.10.12.~2024.10.11. 1-9차(2021.11.11)/USD 2,890,175/2021.11.11.~2024.11.10. 분할계약 합계 USD52,790,175 - - * 1차 주계약은 2023.08.03 이사회 결의로 금전대여계약을 체결하였고,분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다. - 만기 대여연장계약의 상세내용은 아래와 같습니다. <계약명(연장결정일)>/대여금액/대여기간 1차 주계약(2023.11.10)/USD52,790,175/2020.08.04.~2029.11.10. <분할계약> 1-1차(2023.07.19)/USD 3,200,000/2023.08.04.~2028.08.03. 1-2차(2023.10.06)/USD 3,600,000/2023.10.13.~2028.10.12. 1-3차(2023.11.10)/USD11,400,000/2023.11.13.~2028.11.12. * 만기 1차 주계약은 2023.11.10 이사회 결의로 금전대여연장계약을 체결하고. 1-1차 분할계약 만기연장계약은 2023.07.19 이사회 결의, 1-2차 분할계약 만기연장계약은 2023.10.06 이사회 결의, 1-3차 분할계약 만기연장계약은 2023.11.10 이사회 결의를 통해 각각의 금전대여만기연장계약을 체결하여 집행하였습니다. |
|||||
| ※ 관련공시 | 2020-08-03 금전대여 결정 | ||||
| [ 금전대여 결정] |
| 1. 대여 상대 | 브이지엑스아이(주) | 영문 | VGXI,Inc. | ||
| - 회사와의 관계 | 계열회사 | ||||
| 2. 금전대여 내역 | 거래일자 | 2021-12-13 | |||
| 대여금액(원) | 92,133,600,000 | ||||
| 자기자본(원) | 98,508,792,118 | ||||
| 자기자본대비(%) | 93.53 | ||||
| 대규모법인여부 | 미해당 | ||||
| 이율(%) | 4.6 | ||||
| 대여기간 | 시작일 | 2021-12-13 | |||
| 종료일 | 2026-07-05 | ||||
| 3. 금전대여 목적 | 시설자금(공장증축) 대여 | ||||
| 4. 금전대여 총잔액(원) | 154,906,397,092 | ||||
| 5. 이사회결의일(결정일) | 2021-12-08 | ||||
| - 사외이사 참석여부 | 참석(명) | 1 | |||
| 불참(명) | 0 | ||||
| - 감사(사외이사가 아닌 감사위원) 참석여부 | 참석 | ||||
| 6. 기타 투자판단과 관련한 중요사항 | |||||
| - 상기 대여금액은 대여원금 USD78,000,000에 대해 이사회 당일 매매기준율(1,181.20원/1USD)를 적용하여 산출한 금액입니다. - 상기 자기자본은 2020년말 연결기준 자본총계입니다. - 상기 대여금은 일시에 대여하는 것이 아니라 시설의 공정단계에 따라 VGXI의 요청에 의거하여 소요금액만큼 순차적으로 대여할 예정입니다. - 대여기간 만료 후 미상환잔액이 있을 경우 대여기간 연장이 가능합니다. - 상기 대여금은 총 11차례 걸쳐 대여가 이루어 졌으며, 상세 내역은 아래와 같습니다. <계약명(계약체결일)>/대여금액/대여기간 2차 주계약(2021.12.13)/USD78,000,000/2021.12.13.~2024.12.12 <분할계약> 2-1차(2021.12.16)/USD12,000,000/2021.12.16.~2024.12.15. 2-2차(2022.01.26)/USD10,000,000/2022.01.26.~2025.01.25. 2-3차(2022.02.23)/USD13,209,825/2022.02.23.~2025.02.22. 2-4차(2022.07.08)/USD 2,000,000/2022.07.08.~2025.07.07. 2-5차(2022.10.07)/USD 2,000,000/2022.10.07.~2025.10.06. 2-6차(2022.10.14)/USD 2,000,000/2022.10.14.~2025.10.13. 2-7차(2022.12.05)/USD 3,000,000/2022.12.05.~2025.12.04. 2-8차(2023.02.17)/USD 1,000,000/2023.02.17.~2026.02.16. 2-9차(2023.05.30)/USD 1,000,000/2023.05.30.~2026.05.29. 2-10차(2023.06.20)/USD 1,000,000/2023.06.20.~2026.06.19. 2-11차(2023.07.06)/USD 1,000,000/2023.07.06.~2026.07.05. 분할계약 합계 USD48,209,825 - - * 2차 주계약은 2021.12.08 이사회 결의로 금전대여계약을 체결하였고,분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다. |
|||||
| ※ 관련공시 | 2021-12-08 금전대여 결정 | ||||
자본시장법 제151조(조사 및 정정요구 등) 2항 및 자본시장법 시행령 제159조(금융위원회의 조치)에 따르면 보고의무 위반시 금융위원회가 거래 정지, 금지, 임원 해임권고, 고발 및 수사기관 통보, 경고 및 주의 등의 조치를 취할 수 있습니다. 또한, 자본시장법 제429조(공시위반에 대한 과징금), 제444조(벌칙), 제445(벌칙)에 따라 미보고, 중요사항에 관한 허위기재 또는 누락은 형사처벌 및 과징금 부과 대상에 해당됩니다. 따라서, 금번 증권신고서 제출 전 누락된 공시가 정정 공시 되었음에도, 이행 내역과 별도로 향후 자본시장법상의 공시 위반으로 행정처분과 형사처벌 및 과징금의 제재가 존재할 수 있습니다.
| [ 불성실공시법인 지정예고] |
| 1. 회사명 | 진원생명과학(주) | |
| 2. 불성실공시 유형 | 공시불이행 | |
| 3. 불성실공시 내용 | - 금전대여 결정('20.08.03) 이후 정정사실 발생('20.10.13, '20.11.13, '21.01.14, '21.04.26, '21.08.17, '21.09.13, '21.10.12, '21.11.11, '23.07.19, '23.10.06) 10건의 지연공시('23.12.04) - 금전대여 결정('21.12.08) 이후 정정사실 발생('21.12.16, '22.01.26, '22.02.23, '22.07.08, '22.10.07, '22.10.14, '22.12.05, '23.02.17, '23.05.30, '23.06.20, '23.07.06) 11건의 지연공시('23.12.04) |
|
| 4. 예고일자 | 2023-12-04 | |
| 5. 최근 1년간 부과누계벌점 | 0 | |
| 6. 근거 | 유가증권시장 공시규정 제33조 | |
| 7. 공시위반관리종목 여부 | 미해당 | |
| 8. 기타 투자판단과 관련한 중요사항 | - 유가증권시장공시규정 제34조의 규정에 의거 당해 법인은 상기 예고 내용에 대하여 이의를 신청('23.12.13限)할 수 있고, - 유가증권시장상장공시위원회 심의를 거쳐 불성실공시법인지정 여부, 부과벌점 및 공시위반제재금의 부과 여부가 결정됨 (다만, ①이의신청이 없고, ②위반의 동기가 고의·중과실이 아니고, ③위반의 중요성이 중대한 위반이 아니며, ④과거 1년간 공시의무 위반사실이 없는 경우에는 상장공시위원회 심의를 생략할 수 있음) - 추후 불성실공시법인 지정 여부 등 그 구체적인 결과가 확정되는 대로 재공시하겠음 * 부과벌점이 10점 이상이 되는 경우에는 지정일 당일 1일간 매매거래정지됨 |
|
| ※관련공시 | 2023-12-04 금전대여 결정 2023-12-04 금전대여 결정 |
|
이에 따라 한국거래소는 2023년 12월 4일 불성실공시법인지정예고 공시를 하였으며, 한국거래소가 불성실공시법인지정여부를 결정하여 최종 불성실공시법인으로 지정되는 경우로서 당해 부과벌점이 10점 이상인 경우 매매거래가 1일간 정지될 수 있습니다. 또한 동 건에 따른 부과벌점을 포함하여 최근 1년간 누계벌점이 15점 이상이 되는 경우 유가증권시장상장규정 제47조제1항제12호가목에 따라 상장 적격성 실질심사 대상이 될 수 있습니다. 당사의 최근 1년간 불성실공시법인 부과벌점은 0점이나, 향후 1년간 벌점이 누적될 가능성을 배제할 수 없습니다. 투자자들께서는 이 점에 특히 유의하시기 바랍니다.
(주10) 정정 전
다. 자금 집행 방식 및 회수 계획
당사는 직전 유상증자 납입 이후 본 공시서류 제출 전일 현재 공사 비용 집행을 위해 VGXI에 대여금 101,000,000달러를 대여하였습니다. 그 내역은 다음과 같습니다.
| [VGXI 대여금 상세 내역] | |
| (기준일 : 본 공시서류 제출일 전일 현재) | (단위: USD) |
|
구분 |
관계 |
대여시기 |
대여금액 |
금리 |
만기 |
비고 |
|---|---|---|---|---|---|---|
| VGXI, Inc. | 자회사 | 2020-08-04 | 3,200,000 | 4.60% | 2028-08-03 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2020-10-13 | 3,600,000 | 4.60% | 2028-10-12 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2020-11-13 | 11,400,000 | 4.60% | 2028-11-12 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2021-01-14 | 3,700,000 | 4.60% | 2024-01-13 |
- |
| VGXI, Inc. | 자회사 | 2021-04-26 | 13,000,000 | 4.60% | 2024-04-25 |
- |
| VGXI, Inc. | 자회사 | 2021-08-17 | 5,000,000 | 4.60% | 2024-08-16 | - |
| VGXI, Inc. | 자회사 | 2021-09-13 | 5,000,000 | 4.60% | 2024-09-12 | - |
| VGXI, Inc. | 자회사 | 2021-10-12 | 5,000,000 | 4.60% | 2024-10-11 | - |
| VGXI, Inc. | 자회사 | 2021-11-11 | 2,890,175 | 4.60% | 2024-11-10 | - |
| VGXI, Inc. | 자회사 | 2021-12-16 | 12,000,000 | 4.60% | 2024-12-15 | - |
| VGXI, Inc. | 자회사 | 2022-01-26 | 10,000,000 | 4.60% | 2025-01-25 |
- |
| VGXI, Inc. | 자회사 | 2022-02-23 | 13,209,825 | 4.60% | 2025-02-22 |
- |
| VGXI, Inc. | 자회사 | 2022-07-08 | 2,000,000 | 4.60% | 2025-07-07 | - |
| VGXI, Inc. | 자회사 | 2022-10-07 | 2,000,000 | 4.60% | 2025-10-06 | - |
| VGXI, Inc. | 자회사 | 2022-10-14 | 2,000,000 | 4.60% | 2025-10-13 |
- |
| VGXI, Inc. | 자회사 | 2022-12-05 | 3,000,000 | 4.60% | 2025-12-04 | - |
| VGXI, Inc. | 자회사 | 2023-02-17 | 1,000,000 | 4.60% | 2026-02-16 | - |
| VGXI, Inc. | 자회사 | 2023-05-30 | 1,000,000 | 4.60% | 2026-05-29 | - |
| VGXI, Inc. | 자회사 | 2023-06-20 | 1,000,000 | 4.60% | 2026-06-19 | - |
| 합계 | 101,000,000 | - | - | - | ||
|
주1) 대여금에 대한 이자는 대여일로부터 1년 단위로 이자를 상환하도록 계약을 체결하였습니다. |
(중략)
1) 필요 추가 조달 자금 규모
당사 및 자회사의 2023년 수주상황에 따른 예상 수입과 그에 따른 필요 추가 조달 자금 규모는 아래 표와 같습니다. VGXI의 경우 예상 차입금은 전액 모회사인 진원생명과학으로부터의 대여금을 통해 차입 예정이며, 2023년 05월부터 신규공장 가동에 따라 매출 변동이 커질것으로 예상하지만, 보수적으로 평년 평균정도로 인식하였습니다. 또한 미래의 매출을 기대하여 많은 인원 및 비용이 투입되어 예상 지출 금액을 높게 설정하였습니다.
| [진원생명과학] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 |
|---|---|---|---|---|---|---|
| 기초 (1일) | 1,527 | 71,757 | 50,247 | 48,837 | 23,827 | 22,117 |
| 자금조달 | - | - | 66,660 | - | - | - |
| 수입 | 1,000 | 1,100 | 1,200 | 1,100 | 900 | 900 |
| 지출 | 2,610 | 2,610 | 2,610 | 2,610 | 2,610 | 2,610 |
| 대여 | 10,000 | 20,000 | - | 23,500 | - | - |
| 기말(말일) | 71,757 | 50,247 | 48,837 | 23,827 | 22,117 | 20,407 |
출처) 당사 제시
아래 표에서 2023년 8월과 9월 VGXI에 대여가 이뤄지지 않았습니다. 해당 내용은 당사가 금번 유증을 통해 자금을 조달하면 8월과 9월 대여를 통해 VGXI의 시설자금과 운영자금으로 사용할 계획이 표기된 부분입니다. 마찬가지로 11월에 표기된 23,500백만원도 금번 유증을 통해 자금을 조달하면 대여할 금액을 표기한 것입니다.
| [VGXI] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 |
|---|---|---|---|---|---|---|
| 기초 (1일) | 1,142 | 9,723 | 13,304 | 11,885 | 18,966 | 17,547 |
| 차입 (진원) | 10,000 | 20,000 | - | 23,500 | - | - |
| 수입 | 2,000 | 2,000 | 2,000 | 2,000 | 2,000 | 2,000 |
| 지출 | 3,419 | 18,419 | 3,419 | 18,419 | 3,419 | 3,419 |
| 기말(말일) | 9,723 | 13,304 | 11,885 | 18,966 | 17,547 | 16,128 |
출처) 당사 제시
| [DIV] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 |
|---|---|---|---|---|---|---|
| 기초 (1일) | 175 | 176 | 167 | 178 | 169 | 160 |
| 차입 (진원) | - | - | - | - | - | - |
| 수입 | 3,420 | 3,410 | 3,430 | 3,410 | 3,410 | 3,410 |
| 지출 | 3,419 | 3,419 | 3,419 | 3,419 | 3,419 | 3,419 |
| 기말(말일) | 176 | 167 | 178 | 169 | 160 | 151 |
출처) 당사 제시
(주10) 정정 후
다. 자금 집행 방식 및 회수 계획
당사는 직전 유상증자 납입 이후 본 공시서류 제출 전일 현재 공사 비용 집행을 위해 VGXI에 대여금 101,000,000달러를 대여하였습니다. 그 내역은 다음과 같습니다.
| [VGXI 대여금 상세 내역] | |
| (기준일 : 본 공시서류 제출일 전일 현재) | (단위: USD) |
|
구분 |
관계 |
대여시기 |
대여금액 |
금리 |
만기 |
비고 |
|---|---|---|---|---|---|---|
| VGXI, Inc. | 자회사 | 2020-08-04 | 3,200,000 | 4.60% | 2028-08-03 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2020-10-13 | 3,600,000 | 4.60% | 2028-10-12 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2020-11-13 | 11,400,000 | 4.60% | 2028-11-12 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2021-01-14 | 3,700,000 | 4.60% | 2024-01-13 |
- |
| VGXI, Inc. | 자회사 | 2021-04-26 | 13,000,000 | 4.60% | 2024-04-25 |
- |
| VGXI, Inc. | 자회사 | 2021-08-17 | 5,000,000 | 4.60% | 2024-08-16 | - |
| VGXI, Inc. | 자회사 | 2021-09-13 | 5,000,000 | 4.60% | 2024-09-12 | - |
| VGXI, Inc. | 자회사 | 2021-10-12 | 5,000,000 | 4.60% | 2024-10-11 | - |
| VGXI, Inc. | 자회사 | 2021-11-11 | 2,890,175 | 4.60% | 2024-11-10 | - |
| VGXI, Inc. | 자회사 | 2021-12-16 | 12,000,000 | 4.60% | 2024-12-15 | - |
| VGXI, Inc. | 자회사 | 2022-01-26 | 10,000,000 | 4.60% | 2025-01-25 |
- |
| VGXI, Inc. | 자회사 | 2022-02-23 | 13,209,825 | 4.60% | 2025-02-22 |
- |
| VGXI, Inc. | 자회사 | 2022-07-08 | 2,000,000 | 4.60% | 2025-07-07 | - |
| VGXI, Inc. | 자회사 | 2022-10-07 | 2,000,000 | 4.60% | 2025-10-06 | - |
| VGXI, Inc. | 자회사 | 2022-10-14 | 2,000,000 | 4.60% | 2025-10-13 |
- |
| VGXI, Inc. | 자회사 | 2022-12-05 | 3,000,000 | 4.60% | 2025-12-04 | - |
| VGXI, Inc. | 자회사 | 2023-02-17 | 1,000,000 | 4.60% | 2026-02-16 | - |
| VGXI, Inc. | 자회사 | 2023-05-30 | 1,000,000 | 4.60% | 2026-05-29 | - |
| VGXI, Inc. | 자회사 | 2023-06-20 | 1,000,000 | 4.60% | 2026-06-19 | - |
| VGXI, Inc. | 자회사 | 2023-07-06 | 1,000,000 | 4.60% | 2026-07-05 | - |
| 합계 | 101,000,000 | - | - | - | ||
|
주1) 대여금에 대한 이자는 대여일로부터 1년 단위로 이자를 상환하도록 계약을 체결하였습니다. |
(중략)
라. 필요 추가 조달 자금 규모 및 필수 운영비 지출 계획
1) 필요 추가 조달 자금 규모
당사 및 자회사의 2023년 수주상황에 따른 예상 수입과 그에 따른 필요 추가 조달 자금 규모는 아래 표와 같습니다. VGXI의 경우 예상 차입금은 전액 모회사인 진원생명과학으로부터의 대여금을 통해 차입 예정이며, 2023년 05월부터 신규공장 가동에 따라 매출 변동이 커질것으로 예상하지만, 보수적으로 평년 평균정도로 인식하였습니다. 또한 미래의 매출을 기대하여 많은 인원 및 비용이 투입되어 예상 지출 금액을 높게 설정하였습니다.
당사는 금번 유증이 지연됨에 따라 필요자금 조달을 위해 2023년 9월 제3자배정 유상증자 24.7억원을 진행하였으며, 동월에 국내 신한은행으로부터 옥천공장의 토지 및 건물을 담보로 3개월(9월6일-12월6일) 단기로 21억원 대출을 진행하였습니다. 12월에 신한은행의 담보대출 만기로 인하여 해당 대출금의 일부 15억원은 전북은행에게 옥천공장의 토지와 건물을 담보로 1년 장기대출로 대환했으며, 차액 6억원은 회사 보유금액으로 상환하였습니다.
2024년 2월에 자금조달 금액으로 표기된 66,660백만원은 금번 유증을 통해 조달 예정인 금액입니다. 해당 금액은 본 유증 과정에서 변경되어 실제 유입되는 금액은 달라질 수 있습니다.
| [진원생명과학] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 | 2024-02-01 |
|---|---|---|---|---|---|---|---|
| 기초 (1일) | 4,470 | 3,659 | 6,849 | 5,731 | 4,519 | 2,880 | 1,380 |
| 자금조달 | - | 4,570 | - | - | 1,500 | - | 66,660 |
| 수입 | 1,164 | 777 | 1,124 | 983 | 1,000 | 1,000 | 1,000 |
| 지출 | 1,975 | 2,157 | 2,242 | 2,195 | 4,139 | 2,500 | 3,500 |
| 대여 | - | - | - | - | - | - | 23,500 |
| 기말(말일) | 3,659 | 6,849 | 5,731 | 4,519 | 2,880 | 1,380 | 42,040 |
출처) 당사 제시
아래 표에서 2023년 8월과 9월 VGXI에 대여가 이뤄지지 않았습니다. 해당 내용은 당사가 금번 유증을 통해 자금을 조달하면 8월과 9월 대여를 통해 VGXI의 시설자금과 운영자금으로 사용할 계획이 표기된 부분입니다. 마찬가지로 2024년 2월에 표기된 23,500백만원도 금번 유증을 통해 자금을 조달하면 대여할 금액을 표기한 것입니다.
2023년 11월 8,232백만원은 당사가 채무보증을 하고 VGXI가 Amerisource로부터 차입한 USD7.5M에 대해 선이자 및 관련 수수료 일체를 제외하고 실제 유입된 금액을 적용환율로 환산한 원화금액입니다.
| [VGXI] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 | 2024-02-01 |
|---|---|---|---|---|---|---|---|
| 기초 (1일) | 1,107 | 1,169 | 556 | 4,585 | 12,415 | 9,567 | 7,007 |
| 차입 (금융기관) | - | - | - | 8,232 | - | - | - |
| 차입 (진원) | - | - | - | - | - | - | 23,500 |
| 수입 | 3,380 | 3,698 | 8,996 | 2,067 | 1,920 | 1,920 | 1,920 |
| 지출 | 3,318 | 4,311 | 4,967 | 2,469 | 4,768 | 4,480 | 4,480 |
| 기말(말일) | 1,169 | 556 | 4,585 | 12,415 | 9,567 | 7,007 | 27,947 |
출처) 당사 제시
적용환율) 2023년 8월부터 11월까지의 각 환율은 서울외국환중개소에서 제공한 각 월별 평균환율을 적용하였으며, 12월부터는 신한투자증권에서 제시한 2024년 예측환율 1,280원을 적용하였습니다.
(주11) 정정 전
27. 기타자본
(1) 기타자본의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 신주인수권대가 | 2,063,517,465 | 2,063,517,465 |
| 전환권대가 | 11,681,833 | 485,964,253 |
| 자기주식 | (2,955,448,445) | (2,955,448,445) |
| 기타자본조정 | 2,025,020,495 | 2,025,020,495 |
| 주식선택권 | 18,680,494,631 | 18,680,494,631 |
| 합계 | 19,825,265,979 | 20,299,548,399 |
(주11) 정정 후
27. 기타자본
(1) 기타자본의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 신주인수권대가 | 2,063,517,465 | 2,063,517,465 |
| 전환권대가 | 11,681,833 | 485,964,253 |
| 자기주식 | (2,955,448,445) | (2,955,448,445) |
| 기타자본조정 | 2,025,020,495 | 2,025,020,495 |
| 주식선택권 | 18,680,494,631 | 18,680,494,631 |
| 합계 | 19,825,265,979 | 20,299,548,399 |
당3분기말 현재 신주인수권대가는 종료되었으며, 신주인수권의 내역은 다음과 같습니다.
[단위: 원]
| 구 분 | 발행일 | 만기일 | 조기상환일 | 권면총액 | 신주인수권 대가 | 잔액 | |
|---|---|---|---|---|---|---|---|
| 신주인수권부사채(1차) | 2009-08-28 | 2012-08-28 | 2010-08-28 | 조기상환 | 100억원 | 2,052,314,267 | 2,052,314,267 |
| 신주인수권부사채(2차) | 2012-03-21 | 2015-03-21 | 2013-03-21/ 2013-06-21 |
조기상환 | 90억원 | 11,203,198 | 2,063,517,465 |
종료된 신주인수권대가로 신주인수권 권한은 없습니다.
【 대표이사 등의 확인 】
 |
|
대표이사확인서_20231218 |
증 권 신 고 서
| ( 지 분 증 권 ) |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2023년 05월 16일 | 증권신고서(지분증권) | 최초제출 |
| 2023년 06월 08일 | [기재정정]증권신고서(지분증권) | 정정제출 요구 및 일정변경에 따른 정정(파란색) |
| 2023년 08월 17일 | [기재정정]증권신고서(지분증권) | 정정제출 요구 및 일정변경에 따른 정정(초록색) |
| 2023년 11월 20일 | [기재정정]증권신고서(지분증권) | 정정제출 요구 및 일정변경에 따른 정정(빨간색) |
| 2023년 12월 04일 | [기재정정]증권신고서(지분증권) | 일정변경에 따른 정정(보라색) |
| 2023년 12월 18일 | [기재정정]증권신고서(지분증권) | 기재정정(갈색) |
| 금융위원회 귀중 | 2023년 12월 18일 |
| 회 사 명 : |
진원생명과학(주) |
| 대 표 이 사 : |
박영근 |
| 본 점 소 재 지 : |
서울시 영등포구 여의대로108 |
| (전 화)02-3458-4030 | |
| (홈페이지) http://www.genels.com | |
| 작 성 책 임 자 : | (직 책) 부장 (성 명)박한모 |
| (전 화) 02-3458-4030 | |
| 모집 또는 매출 증권의 종류 및 수 : | 기명식 보통주 22,000,000주 | |
| 모집 또는 매출총액 : | 66,660,000,000 | 원 |
| 증권신고서 및 투자설명서 열람장소 |
| 가. 증권신고서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 투자설명서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : 진원생명과학(주) →서울시 영등포구 여의대로108 한국투자증권(주) →서울시 영등포구 의사당대로88 한양증권(주) →서울시 영등포구 국제금융로6길7 |
【 대표이사 등의 확인 】
 |
|
대표이사확인서_증권신고서 |
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 | 가. 코로나19유행, 러시아-우크라이나 전쟁 및 대내외 불확실성이 미치는 위험 코로나19가 엔데믹(풍토병화)으로 전환되는 상황으로 3년 넘게 이어진 코로나19로 인해 겪었던 일상의 불편함이 해소될 것이라는 기대가 크게 높아졌습니다. 그러나 전문가들 사이에서는 매일 1만명 넘는 확진자가 꾸준히 나오는 만큼 코로나19는 여전히 종식되지 않았으며 사실상 '각자도생'이 될 공산이 있다는 우려가 나오며 , 코로나19에 걸릴 경우 중증 또는 사망으로 이어질 가능성이 높은 고위험군에 대한 보호책 역시 해결해야 할 과제입니다. 2023년 04월 11일 국제통화기금(IMF)이 발표한 '세계경제전망(World Economic Outlook)'에 따르면, 2022년 세계 경제성장률은 3.4%를 기록했으며, 2023년에는 2.8%, 2024년에는 3.0%의 성장률을 기록할 것으로 전망됩니다. 2023년의 전망치는 작년 10월 대비 0.1%p 상향되었는데 이는 중국의 리오프닝에 따른 경기 회복 기대와 미ㆍ유로 등 주요국의 예상외 견조한 소비ㆍ투자 등에 따른 영향입니다. 그러나 러시아-우크라이나 전쟁과 중국의 경기회복에 따른 에너지가격 상승, 노동시장의 경직성 등으로 인플레이션이 지속될 가능성이 존재하며, 중국의 낮은 백신 접종률 및 부족한 의료시설에 따른 경기회복 제약 등으로 인해 경기하방 위험은 여전하다고 언급했습니다. 국내 경기 또한 글로벌 코로나19 팬데믹의 추후 재발 가능성과 더불어 소비 및 금융 시장 심리 악화, 러시아-우크라이나 전쟁의 장기화, 원자재 가격의 급격한 상승, 높은 인플레이션으로 인한 고강도 통화정책 실시 등 부정적인 요인들은 향후에도 경기 회복세가 둔화될 수 있는 가능성이 존재합니다. 나아가, 코로나19 이외에도 2022년 02월 24일 러시아가 우크라이나를 침공함으로써 러시아-우크라이나 전쟁이 발발하였습니다. 본 공시서류 제출일 현재 러시아-우크라이나 전쟁이 당사에 직접적으로 영향을 미칠지 여부는 미지수입니다. 따라서 투자자께서는 러시아-우크라이나 전쟁이 당사 및 당사가 영위하는 사업에 미칠 영향에 대해 면밀히 검토하시기 바랍니다. 나. 글로벌 제약사의 자체 생산비중 증가 관련 위험 제약 산업에서 바이오의약품이 신성장 동력으로 부상함에 따라 주요 제약사들의 바이오의약품 생산에 대한 수요는 빠르게 증가하고 있으며, 이와 같은 수요를 충당하기 위해 제약사는 자체 생산능력을 확보하거나 CDMO업체를 활용하고 있습니다. 과거에는 기술 유출 등의 문제로 제약사들이 자체 생산능력 확보를 통한 생산을 선호하였으나, 최근에는 바이오의약품에 대한 수요 증가 및 자본 집약적인 사업 특성과 복잡한 제조적 특징으로 인해 많은 제약사들은 임상 및 상업단계 제조를 위해 CDMO를 활용하고 있는 추세입니다. 다만, 글로벌 바이오 시장은 급격한 변화를 겪어 왔으며, 특히 바이오 산업에 대한 규제 변화, 특허 및 지적재산권 보호에 관한 우려 증가, 환자 보호법 강화, 바이오 의약품 약가 규제 및 배상 강화 등의 요인으로 글로벌 제약사들의 아웃소싱 전략에도 급격한 변화가 발생할 가능성을 배제할 수 없습니다. 만약 향후 글로벌 제약사들이 자체 생산 비중을 확대하는 전략 변경이 현실화될 경우, 당사와 같은 CDMO사업자의 수익성 및 매출 실적에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하시기 바랍니다. 다. 신약개발 특성에 따른 위험 당사가 주요사업으로 영위하는 바이오신약개발 산업의 특성상 현재 연구개발하고 있는 신약이 상업화되기까지는 막대한 비용과 시간이 필요합니다. 현재 연구개발 중인 DNA백신은 대부분 임상 또는 비임상 단계에 있어 가시적인 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. 2021년 8월 21일 인도 제약사 자이더스 캐딜라(Zydus Cadila)의 자이코브-디(ZyCov-D)가 세계 첫 DNA 기반 코로나19 백신으로 긴급사용 승인받은 바 있지만 당사가 개발 중인 DNA백신 및 핵산 기반 바이오의약품 역시 임상 시험을 계획대로 진행하여 신약으로서 허가를 받아 제품화 된다고 하더라도 시장 경쟁력 결여 등의 이유로 수익 창출에 실패할 가능성도 있습니다. 또한, 시판 과정에서 예상치 못한 부작용의 발견, 경쟁 제품 대비 약효 저하 등으로 인해 시판 후에라도 당사가 고려하고 있는 정도의 수익 창출에 실패할 가능성도 상존하고 있으며 당사의 성장성 및 재무안정성에 부정적인 영향을 미칠 수 있습니다. 또한, 바이오산업의 특성 상 전임상에 대한 성공 후 진행될 임상시험에서 임상실패로 인하여 예상 임상시험비용을 초과하여 비용이 지출되거나, 소요된 연구개발비용의 회수 가능성이 현저히 낮아지는 경우 당사의 수익성 및 재무안정성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이와 같이 당사가 지니고 있는 바이오의약품 연구개발의 파이프라인별 임상성공 확률과 임상실패 위험 및 임상시험 비용 등을 면밀히 검토하여 투자에 임하시길 바랍니다. 라. 핵심연구인력 유출 위험 당사가 영위하고 있는 바이오 관련 산업은 기술 수준이 높고 변화의 정도가 빠르게 진행되고 있기 때문에 핵심연구 인력을 확보하는 것이 중요합니다. 당사는 연구개발부문 산하에 우수 연구인력을 채용하여 연구개발을 진행하고 있으며, 풍부한 경험과 연구개발 능력을 갖추는 것이 핵심 경쟁력임을 충분히 인지하고 있습니다. 이에 해당 핵심 연구인력 및 조직을 유지하기 위해 보상책을 제공하고 있으나, 그럼에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히 경쟁심화에 따른 당사 우수 인력 스카우트 등은 핵심기술 노하우 유출 등으로 이어질 수 있으며 이는 당사의 경쟁력을 약화시키며 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자분들께서는 이 점 참고하시기 바랍니다. 마. 지적재산권 침해에 따른 위험 당사가 영위하고 있는 제약 및 바이오 사업은 개발회사가 보유한 특화된 기술 및 제품화 능력에 의하여 성패가 결정되는 기술지향형 산업이며, 이를 영위하기 위해서는 기술보호가 필수적입니다. 당사 역시 신약 연구개발 기업으로서 기술 노하우 및 지적재산권의 보호를 사업을 영위하는데 있어 큰 비중을 차지하고 있는 핵심 사안으로 고려하고 있습니다. 이에 당사는 당사 핵심 기술 및 제품에 대한 권리를 보호할 수 있도록 국내뿐만 아니라 해외 에서도 특허 출원 및 등록을 진행하여 지식재산의 권리화에 힘쓰고 있습니다. 본 공시서류 제출일 현재 당사가 권리자인 특허에 대한 침해, 무효 주장에 관한 소송은 존재하지 아니하나 향후 제 3 자에 의하여 당사가 보유하고 있는 특허에 대한 침해, 무효 소송 또는 기타 분쟁이 발생할 가능성을 배제할 수 없고 당사가 해당 지식재산권을 효과적으로 관리하지 못하여 당사 특허가 무효 또는 소멸될 수 있으며, 이 경우 당사의 기술 및 사업경쟁력은 약화되어 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다. 바. 연구개발 실패 위험 한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데 통상적으로 각 단계별로 전임상 시험 3년, 임상1상 1.5년, 임상2상 2년, 임상3상 3년, 발매허가(NDA) 6개월로 약 10년의 시간이 소요된다고 알려져 있습니다. 당사가 연구개발 하는 가장 앞선 단계의 DNA백신은 임상2a상을 진행하고 있는 코로나19 DNA백신(GLS-5310)으로 국내 코로나19 팬데믹 상황을 고려하여 신속한 제품개발을 추진하고 있어 제품화까지 1~2년 이상의 기간이 소요될 것으로 예상됩니다. 하지만 이는 긴급사용승인을 예상한 일정으로, 국내외 타사 코로나19 백신들이 보급되면서 국내 백신 접종률이 증가한다면 백신 미접종 상태의 임상시험 대상자 모집이 어려워지고 신규 백신에 대한 필요성이 낮아져 계획 중인 임상 연구 및 제품화가 지연될 수 있습니다. 이 외에도 당사가 예상치 못한 이유로 인해 백신 개발 일정이 지연된다면 제품화까지 당사 예상 대비 장기간이 소요될 수 있으며, 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발 비용은 따로 회수할 수 없어 당사의 수익성 및 성장성에 악영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. 사. 정부 정책 및 규제 변화에 따른 위험 당사는 바이오 의약품 연구개발을 수행함에 따라, 각 산업에 대한 안전성 관련 규제에 영향을 받을 수 있습니다. 특히 당사의 유전자 백신 연구개발의 경우, 임상 시험에서 의도하지 않은 유전자의 삽입이 발생할 수 있으며, 이러한 비특이적 유전자의 삽입에 의한 돌연변이로 인해 오랜 시간이 지난 뒤 부작용이 발생할 수 있는 사항에 따라, 정부로부터 안정성에 대한 규제와 유전자치료제의 품질, 비임상, 임상시험의 규정 및 가이드라인의 규제를 받게 됩니다. 또한, 바이오 의약품 연구개발에 대한 정부의 정책 변화로 정부 지원이 축소 또는 변경되거나 임상 단계에서 적용되는 규정 등의 변화가 일어나는 경우, 합병회사 사업에 부정적인 영향을 미칠 수 있습니다. 아. 패브릭사업부문의 저성장 및 사업부문 축소 가능성 당사가 영위하고 있는 섬유사업은 한때 제조업 중에서 가능 높은 고용효과로 우리나라 경제 성장의 견인차 역할을 해온 산업이긴 하나, 타산업의 발전 및 중국과 동남아 여러나라의 생산기반 확대로 증가세가 둔화되고 있습니다. 현재 섬유산업은 중국, 중동지역의 경기에 따라 민감하게 반응하며, 러시아와 우크라이나 전쟁이 장기화 되면서 세계경기의 침체와 주요시장의 위축으로 성장세가 둔화되고 있고 후발국들의 진출로 경쟁이 더욱 치열해지고 있습니다. 당사의 패브릭 사업 부문은 지속적으로 영업손실을 기록하고 있습니다. 섬유산업 전반의 저성장 기조로 인하여 매출성장성이 낮고, 대내외 경제 악재로 인해 영업이익 상승 가능성도 저조합니다. 또한, 예상치 못한 수입국의 경기 상황과 환율변동 및 저임금의 노동력을 바탕으로 한 개발도상국의 저가 물량 공세로 인해 가격변동 등으로 인한 가격인하 경쟁이 발생 할 위험이 존재합니다. 섬유산업의 저성장 기조는 지속될 것으로 예상되며 당사의 패브릭사업부문의 매출비중 감소 및 저성장 기조를 지속할 경우 재무구조 악화는 물론 사업구조 축소의 위험이 있습니다.투자자 여러분께서는 이점 유의하셔서 투자에 임하여주시기 바랍니다. |
| 회사위험 |
가. 지속적인 영업적자로 인한 재무구조 악화 위험 바-2. 종속회사 VGXI 계속기업불확실성에 따른 위험 종속회사 VGXI Inc.는 2023년 3분기까지 완전 자본잠식이 되었으며, 3분기 보고일까지 완전 자본 잠식된 금액을 회복할 정도의 수주 및 이익을 기대하기 어려워 별도 재무제표에 자회사 VGXI Inc. 투자금액 9,672백만원 전액을 손상차손으로 인식하였습니다. 또한 별도 재무제표의 자회사 투자자산에 대하여 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표로서 지배기업, 관계기업의 투자자 또는 공동기업의 참여자가 투자자산을 피투자자의 보고된 성과와 순자산에 근거하지 않고 직접적인 지분투자에 근거하여 원가법으로 표시한 재무제표 원가법을 적용하였으나, 연결 재무제표에서는 자회사의 손실이 재무제표에 반영되었기에 해당금액의 차이가 발생하는 바 이에 대하여 손상으로 인식하였으며, 자회사 VGXI Inc.는 2023년 3분기 현재 완전 잠식상태이기에 별도재무상태표의 자회사 VGXI, Inc.의 투자금액 전액을 손상으로 인식하여 제거하였으며, 별도 손익계산서에서는 기타비용인 손상차손으로 전액 인식하였습니다. 2023년 3분기말 기준으로 선급금 4,845백만원중에서 자회사 VGXI에 생산의뢰를 위하여 선급으로 지급한 금액은 4,617백만원에 이르며, 진원생명과학이 100% 자회사인 VGXI에 대여한 금액은 135,825백만원(USD 101백만달러)이며, VGXI는 자본잠식 상태이어서 진원생명과학의 투자자산에서 전액 9,672백만원을 손상차손으로 회계처리 하였습니다. 위와 같이 VGXI에 선급금으로 지급되고 대여한 금액이 진원생명과학의 자산의 73.4% (4,617+135,825/191,405백만원)에 해당되는 상황에서 VGXI가 현재와 같이 영업실적이 저조한 상황이 개선되지 않으면 계속성에 불확실성을 갖게 되어 진원생명과학의 선급금 및 대여금의 회수에도 부정적인 영향을 미쳐 진원생명과학 또한 계속기업으로서 불확실성이 있으며 관리종목으로 지정될 가능성도 있습니다.
더. 과거 공시의무 미이행에 따른 위험 당사는 금번 공모 과정에서 과거 2020년 08월 3일 및 21년 12월 8일 금전대여 후 다수의 정정공시가 누락된 점을 지적 받아 2023년 12월 4일 공시서류에 대해 일괄 검토하였습니다. 검토결과 21건의 지연공시 대상이었기 때문에 당사는 2023년12월 4일 해당 공시사항들에 대해 일괄적으로 정정공시하였습니다. |
| 기타 투자위험 | 가. 유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. 나. 공시서류 정정에 따른 일정 변경 위험 본 공시서류는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다. 다. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 크게 하락할 경우 당사가 계획했던 자금조달 계획 등에 차질이 발생할 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있으니 이 점 유의하시기 바랍니다. 라. 신주의 환금성 제약 및 주가 변동에 따른 손실위험 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. 마. 집단 소송 제기 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있으니 이 점 유의하시기 바랍니다. 바. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다. 사. 개인종합자산관리계좌(ISA) 납입한도에 따른 청약제한 위험 개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다. 아. 잦은 자금조달로 인한 주주가치 희석화 당사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였습니다. 당사는 금번 유상증자 자금을 이용하여 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다. 당사는 정부보조금을 제외하고 경상연구개발비로 2021년 연결기준 6,561백만원, 2022년 연결기준 11,413백만원을 사용하였으며, 이는 매출액 대비 각각 16.95%, 23.43% 수준이며, 최근 3개년 평균 매출액 대비 연구개발비의 비중은 19.1%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다. 이처럼 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 핵산 백신 및 핵산 기반 바이오의약품의 연구개발이 제품화에 실패하거나 플라스미드 CDMO 사업 관련 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원할하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다. 자. 최종 실권주 인수 시 매각에 따른 일시적 물량 출회에 따른 투자위험 금번 유상증자는 주주배정 후 실권주 일반 공모로 진행되며, 금번 유상증자로 인해 발행되는 주식의 물량 출회 및 주가 희석화 등으로 주가가 하락할 가능성이 존재합니다. 한편금번 증자로 인해 발행되는 신주 22,000,000주로 증권신고서 제출일 현재 당사 발행주식총수 78,473,817주의 28.03%에 해당합니다. 금번 유상증자로 인해 추가 발행 및 상장되는 신주는 전량 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 존재합니다. 또한 구주주 청약결과 실권주 및 단수주가 발생하는 경우 동 수량은 일반에게 공모할 예정이며, 일반공모에서도 청약이 미달될 경우 미달된 수량(최종 실권주)은 대표주관사 한국투자증권(주) 및 한양증권(주) 최종 실권주를 인수할 수 있습니다. 그렇게되면 당사는 최종 실권주를 인수한 금액의 15.0%를 실권수수료로 지급하게 됩니다. 수수료를 고려한 대표주관회사 및 인수회사의 실질 매입단가는 일반청약자들 보다 15.0% 낮으며, 대표주관회사 및 인수회사는 당사 주식을 인수한 후 신주교부일 전영업일부터 즉시 매각이 가능합니다. 대표주관회사 및 인수회사가 조기에 장내에서 최종 실권주를 매각할 경우, 주가가 단기적으로 하락할 수 있으니, 투자자께서는 이점 유의하시기 바랍니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 22,000,000 | 1,000 | 3,030 | 66,660,000,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 한국투자증권 | 보통주 | 11,000,000 | 33,330,000,000 | 대표주관수수료: 모집총액의 0.1% 인수수수료 : 모집총액의 2.1%*50% 실권수수료 : 잔액인수금액의 15% |
잔액인수 |
| 인수 | 한양증권 | 보통주 | 11,000,000 | 33,330,000,000 | 인수수수료 : 모집총액의 2.1%*50% 실권수수료 : 잔액인수금액의 15% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2024년 02월 14일 ~ 2024년 02월 15일 | 2024년 02월 22일 | 2024년 02월 16일 | 2024년 02월 22일 | 2024년 01월 08일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2023년 05월 17일 | 2024년 02월 07일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 시설자금 | 2,679,800,000 |
| 운영자금 | 62,280,200,000 |
| 발행제비용 | 1,700,000,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | [정정] 주요사항보고서(유무상증자결정)-2023.12.04 |
| 【기 타】 | 1) 진원생명과학(주) 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 한국투자증권, 인수회사는 한양증권(주)입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것으로 대표주관회사및 인수회사는 주주배정후 실권주 일반공모 후 최종실권주를 잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 I. 5 인수등에 관한 사항'을 참고하여 주시기 바랍니다. 대표주관회사인 한국투자증권(주) 및 인수회사 한양증권㈜은 투자중개업자로서 타인의 계산으로 증권의 발행ㆍ인수에대한 청약의 권유, 청약, 청약의 승낙 및 자본시장법상의 증권의 인수업무를 수행합니다. 3) 상기 모집가액, 모집총액 및 발행제비용은 예정모집가액 기준으로 산정된 것으로 향후 변경될 수 있습니다. 확정모집가액은 구주주 청약초일 전 제3거래일에 결정될 예정입니다. 4) 상기 청약기일은 구주주의 청약기일이며, 일반공모의 청약기일은 2024년 02월 19일 ~ 2024년 02월 20일(2영업일간)입니다. 5) 금융감독원에서 본 증권신고서를 심사하는 과정에서 정정요구 조치를 취할 수 있으며, 정정요구 등에 따라 본 신고서에 기재된 일정이 변경될 수 있습니다. 6) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. 7) 「자본시장과 금융투자업에 관한 법률」제180조의4 및 동법 시행령 제208조의4에 의거, 2023년 05월 17일부터 2024년 02월 07일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. 8) 「증권 인수업무 등에 관한 규정」 제9조제2항에 의해 고위험고수익투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 25,000주(액면가 1,000원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니하고 자기 계산으로 인수할 수 있습니다. |
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」 제165조의6제2항제1호에 의거 당사와 대표주관회사인 한국투자증권㈜ 및 인수회사인 한양증권(주) 간에 주주배정 후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하였습니다.
당사는 기명식 보통주 22,000,000주를 주주배정 후 실권주 일반공모 방식으로 발행하기로 결정하였으며 동 증권의 개요는 다음과 같습니다.
| (단위 : 주, 원) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집가액 | 모집총액 | 모집방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 22,000,000 | 1,000 | 3,030 | 66,660,000,000 | 주주배정후 실권주 일반공모 |
| 주1) | 이사회 결의일: 2023년 05월 16일, 2023년 05월 31일, 2023년 06월 22일, 2023년 07월 13일, 2023년 08월 17일, 2023년 11월 20일, 2023년 12월 04일 |
| 주2) | 1주의 모집가액 및 모집총액은 예정 발행가액 기준으로 산출한 예정금액입니다. |
「증권의 발행 및 공시 등에 관한 규정」 제5-18조에서 주주배정 증자시 가격산정 절차폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시등에 관한 규정」제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
■모집예정가액의 산출 근거
2023년 08월 17일 이사회결의일 직전 거래일을 기산일로 하여 유가증권시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와, 1주일 가중산술평균주가 및 최근일 종가를 산술평균하여 산정한 가액과 기산일 최근일 종가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다. (단, 호가단위 미만은 호가단위로 절상하기로하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
| 기준주가 ×【 1 - 할인율(25%)】 | ||
| ▶ 모집예정가액 | = | ------------------------------------- |
| 1 + 【증자비율 × 할인율(25%)】 |
| [ 예정 발행가액 산정표] | |
| 기산일 : 2023년 08월 16일 |
(단위 : 원, 주) |
| 일자 | 가중평균주가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2023/08/16 | 4,327원 | 393,012 | 1,700,414,175 |
| 2023/08/14 | 4,434원 | 492,061 | 2,181,554,175 |
| 2023/08/11 | 4,550원 | 648,092 | 2,948,863,685 |
| 2023/08/10 | 4,686원 | 625,563 | 2,931,500,440 |
| 2023/08/09 | 4,786원 | 1,005,239 | 4,811,027,565 |
| 2023/08/08 | 4,693원 | 942,609 | 4,423,679,970 |
| 2023/08/07 | 4,944원 | 2,341,088 | 11,574,368,195 |
| 2023/08/04 | 4,800원 | 3,412,348 | 16,379,349,055 |
| 2023/08/03 | 4,612원 | 5,036,477 | 23,229,754,020 |
| 2023/08/02 | 4,302원 | 676,523 | 2,910,477,525 |
| 2023/08/01 | 4,427원 | 1,526,042 | 6,755,937,715 |
| 2023/07/31 | 4,261원 | 1,476,707 | 6,292,243,880 |
| 2023/07/28 | 4,028원 | 830,953 | 3,346,926,845 |
| 2023/07/27 | 4,033원 | 2,175,092 | 8,772,482,975 |
| 2023/07/26 | 3,645원 | 1,273,789 | 4,642,598,375 |
| 2023/07/25 | 3,943원 | 909,210 | 3,585,192,420 |
| 2023/07/24 | 4,155원 | 2,640,856 | 10,972,813,545 |
| 2023/07/21 | 4,162원 | 6,291,397 | 26,184,960,490 |
| 2023/07/20 | 3,750원 | 852,825 | 3,198,375,940 |
| 2023/07/19 | 3,612원 | 449,822 | 1,624,606,905 |
| 2023/07/18 | 3,668원 | 484,635 | 1,777,423,540 |
| 2023/07/17 | 3,730원 | 438,097 | 1,634,300,130 |
| 1개월 가중산술평균주가 (A) | 4,349원 | - | |
| 1주일 가중산술평균주가 (B) | 4,522원 | - | |
| 최근일 종가 (C) | 4,320원 | - | |
| A,B,C의 산술평균 (D) | 4,397원 | (A+B+C)/3 | |
| 기준주가 (E) | 4,320원 | (C와 D중 낮은가액) | |
| 할인율 (F) | 25% | - | |
| 증자비율 (G) | 28.30% | - | |
| 예정 발행가액 | 3,030원 | 기준주가 × (1-할인율) / 1 + (유상증자비율 × 할인율 ) (단, 호가단위 미만은 호가단위로 절상하기로하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.) |
|
■ 공모일정 등에 관한 사항
| [주요일정] |
| 날 짜 | 내 용 | 비 고 |
|---|---|---|
| 2023년 12월 04일 | 이사회결의 | 주요사항보고서 제출 |
| 2023년 12월 18일 | 증권신고서(예비투자설명서) 제출 | - |
| 2023년 12월 19일 | 신주발행공고 및 기준일 공고 | 당사 인터넷 홈페이지 (www.genels.com) |
| 2024년 01월 03일 | 1차 발행가액 확정 | 신주배정기준일 전 제3거래일 |
| 2024년 01월 05일 | 권리락 | 신주배정기준일 전 제1거래일 |
| 2024년 01월 08일 | 유상증자 신주배정기준일(주주확정) | - |
| 2024년 01월 18일 | 신주배정 통지 | - |
| 2024년 01월 25일 ~ 2024년 01월 31일 |
신주인수권증서 상장 및 거래 기간 | 5거래일 이상 동안 거래 |
| 2024년 02월 01일 | 신주인수권증서 상장폐지 | 신주인수권증서 상장폐지일과 구주주청약 초일 사이 5거래일 확보 |
| 2024년 02월 07일 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2024년 02월 08일 | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (www.genels.com) |
| 2024년 02월 14일 ~ 2024년 02월 15일 |
구주주 청약 | - |
| 2024년 02월 16일 | 일반공모청약 공고 | 당사 인터넷 홈페이지 (www.genels.com) 한국투자증권 홈페이지 (http://www.truefriend.com) 한양증권 홈페이지 (http://www.hygood.co.kr) |
| 2024년 02월 19일 ~ 2024년 02월 20일 |
일반공모청약 | - |
| 2024년 02월 22일 | 주금납입/환불/배정공고 | - |
| 2024년 02월 26일 | 무상증자 신주배정기준일(주주확정) | - |
| 2024년 03월 08일 | 유상증자 신주상장 예정일 | - |
| 2024년 03월 15일 | 무상증자 신주상장 예정일 | - |
| 주) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
※ 무상증자에 관한 사항
당사는 2023년 05월 16일 및 2023년 05월 31일 및 2023년 06월 22일 및 2023년 07월 13일 및 2023년 08월 17일 및 2023년 11월 20일 및 2023년 12월 04일에 개최된 이사회에서 무상증자를 결의하였으며, 유상증자 납입일(2024년 02월 22일)의 2영업일 후인 2024년 02월 26일을 무상증자 신주배정기준일로 하여, 유상증자 후 주주명부에 기재된 주주(자기주식 제외)에 대하여 소유주식 1주당 0.2주의 비율로 신주를 무상으로 배정하는 증자를 시행할 예정입니다. 금번유상증자로 인해 발행되는 신주의 경우에도 자동적으로 무상증자에 참여하여 신주를 받을 수 있는 권리가 발생하게 됩니다.
1) 신주의 재원 : 주식발행초과금
2) 단주 처리방법 : 신주의 상장 초일 종가를 기준으로 현금 지급합니다.
3) 무상증자에 관한 기타사항은 이사회를 통해 대표이사에게 위임되었으며, 상기 일정은 유관 기관과의 협의를 통해 변경될 수 있음.(본 무상증자는 유상증자 청약자도 무상증자를 받을 수 있도록 진행되고 있습니다. 만약, 유상증자 일정이 변경되면, 본 무상증자의 일정 또한 변경될 수 있습니다.)
[무상증자 개요]
| 구분 | 내용 |
|---|---|
| 무상증자 신주배정 기준일 | 2024년 02월 26일 |
| 무상증자 신주의 주당 발행가액 | 1,000원 |
| 무상증자 신주의 종류와 수 | 보통주 20,052,871주 |
| 1주당 신주배정 수 | 0.2주 |
| 무상증자 신주의 재원 | 주식발행초과금 |
| 무상증자 신주권 유통 예정일 | 2024년 03월 15일 |
| 무상증자 신주상장일 | 2024년 03월 15일 |
| 주) | 무상증자 신주 수는 주식관련사채의 행사, 자기주식수 변동, 단수주 등에 의하여 변동될 수 있습니다. |
2. 공모방법
|
[공모방법 : 주주배정후 실권주 일반공모] |
| 모 집 대 상 | 주 수(%) | 비 고 |
|---|---|---|
| 구주주 청약 (신주인수권증서 보유자 청약) |
22,000,000주 (100%) |
▶ 구주 1주당 신주 배정비율 : 1주당 0.2810985992주 ▶ 신주배정 기준일 : 2024년 01월 08일 ▶ 구주주 청약일 : 2024년 02월 14일~2024년 02월 15일 (2일간) ▶ 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권 증서가 배정됨) |
| 초과 청약 | - | ▶ 「자본시장과 금융투자업에 관한 법률」제165조의6의제2조제2항에 의거 초과청약 ▶ 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 ▶ 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 |
| 일반모집 청약 (고위험고수익투자신탁청약 포함) |
- | ▶ 구주주 및 초과청약 후 발생하는 단수주 및 실권주에 대해 배정됨 ▶ 일반모집 청약일 : 2024년 02월 19일 ~2024년 02월 20일(2일간) |
| 합 계 | 22,000,000주 (100%) |
- |
| 주1) | 본 건 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행되며, 구주주의 청약결과 발생하는 실권주 및 단수주에 대해서는 이를 일반에게 공모합니다. |
| 주2) | 「자본시장과 금융투자업에 관한 법률」제165조의7(우리사주조합원에 대한 주식의 배정 등에 관한 특례) 에 의해 당사의 우리사주조합은 공모주식의 20.0%를 배정받을 권리가 존재합니다. 그러나 「자본시장과 금융투자업에 관한 법률 시행령」제176조의9(우리사주조합원에 대한 주식의 배정 등에 관한 특례의 예외 등)에 의거하여, 당사 우리사주조합원에 대한 배정은 우리사주조합 급여 총액이 우리사주조합 배정금액보다 미달하는 관계로 우선배정하지 아니합니다. |
| 주3) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.2810985992의 비율로 배정하되, 1주 미만의 단수주는 절사합니다. 다만, 신주배정기준일 현재 신주의 배정비율은 신주배정기준일 전 주식관련사채의 권리 행사, 주식매수선택권의 행사, 자기주식의 변동 등으로 인하여 변동될 수 있습니다. |
| 주3) | 신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20.0%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. ① 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수 ② 신주인수권증서 청약 한도주식수 = 보유한 신주인수권 증서의 수량 ③ 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율(20.0%) |
| 주4) | 구주주 청약 결과 발생한 미청약주식은 다음 각항과 같이 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」제9조제2항제3호에 따라 고위험고수익투자신탁에 공모주식의 5%를 배정하고, 나머지 95%에 해당하는 주식은 개인투자자 및 기관투자자에게 구분 없이 배정합니다. 고위험고수익투자신탁에 대한 공모주식 5%와 개인투자자 및 기관투자자에 대한 공모주식 95%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 어느 한 그룹에서 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. ① 1단계: 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. ② 2단계: 이후 최종 잔여주식은 최고청약자부터 순차적으로 우선 배정하되, 동순위 최대청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다. |
| 주5) | 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수에 미달하는 경우에는 청약주식수대로 배정하되 잔여주식은 대표주관회사와 인수회사가 각각 자기의 계산으로 인수합니다. |
| 주6) | 단, 「증권 인수업무 등에 관한 규정」제9조제2항에 의거 일반청약자에 대하여 배정하여야할 주식이 25,000주 이하(액면가 1,000원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 일반에게 공모하지 않고, 대표주관회사 및 인수회사가 인수할 수 있습니다. |
▶ 구주주 1주당 배정비율 산출근거
| 구분 | 상세내역 |
|---|---|
| A. 보통주식 | 78,473,817주 |
| B. 우선주식 | - |
| C. 발행주식총수 (A + B) | 78,473,817주 |
| D. 자기주식 + 자기주식신탁 | 209,464주 |
| E. 자기주식을 제외한 발행주식총수 (C - D) | 78,264,353주 |
| F. 유상증자 주식수 | 22,000,000주 |
| G. 증자비율 (F / C) | 28.03% |
| H. 우리사주조합 배정 | - |
| I. 구주주 배정 (F - H) | 22,000,000주 |
| J. 구주주 1주당 배정비율 (I / E) | 0.2810985992 |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」제5-18조에 의거 주주배정 증자시 가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
가. 1차 발행가액: 신주배정기준일 전 제3거래일을 기산일로 하여 유가증권시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 최근일 종가를 산술평균하여 산정한 가액과 최근일 종가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다..(단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
▶ 1차 발행가액 = 기준주가 × (1-할인율) / [1 + (증자비율 × 할인율)]
나. 2차 발행가액: 구주주 청약 초일 전 제3거래일을 기산일로 하여 유가증권시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 최근일 종가를 산술평균하여 산정한 가액과 최근일 종가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다(단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.).
▶ 2차 발행가액 = 기준주가 × (1-할인율)
다. 확정 발행가액: 1차 발행가액과 2차 발행가액 중 낮은 가액을 확정 발행가액으로 합니다. 다만,「자본시장과 금융투자업에 관한 법률」제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2규정에 의거하여 1차 발행가액과 2차 발행가액 중 낮은 가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일로부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가격을 확정발행가액으로 합니다.(단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
▶ 확정 발행가액 = MAX【MIN(1차 발행가액, 2차 발행가액), 청약일전 과거 제3거래일로부터 제5거래일까지의 가중산술평균주가의 60%】
라. 최종 발행가액은 구주주청약일 초일 전 제3거래일에 결정되어 금융감독원 전자공시시스템에 공시될 예정이며, 회사의 인터넷 홈페이지(www.genels.com)에 공고하여 개별통지에 갈음할 예정입니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 22,000,000 | |||||||||||||||||||||||||||||||
| 주당 모집가액 또는 매출가액 | 예정가액 | 3,030 | ||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||
| 모집총액 또는 매출총액 | 예정가액 | 66,660,000,000 | ||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||
| 청 약 단 위 |
1) 구주주
|
|||||||||||||||||||||||||||||||
| 청약기일 | 구주주 (신주인수권증서 보유자) |
개시일 | 2024년 02월 14일 |
| 종료일 | 2024년 02월 15일 | ||
| 일반모집 또는 매출 | 개시일 | 2024년 02월 19일 | |
| 종료일 | 2024년 02월 20일 | ||
| 청약 증거금 |
구주주(신주인수권증서 보유자) | 청약금액의 100% | |
| 초 과 청 약 | 청약금액의 100% | ||
| 일반모집 또는 매출 | 청약금액의 100% | ||
| 납입기일 | 2024년 02월 22일 | ||
| 배당기산일(결산일) | 2024년 01월 01일 | ||
| 주1) 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. 주2) 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
(1) 공고의 일자 및 방법
| 구 분 | 일 자 | 공고방법 |
|---|---|---|
| 신주발행(신주배정기준일)의 공고 | 2024년 01월 08일 | 당사 인터넷 홈페이지 (www.genels.com) |
| 모집 또는 매출가액 확정의 공고 | 2024년 02월 07일 | 당사 인터넷 홈페이지 (www.genels.com) |
| 실권주 일반공모 청약공고 | 2024년 02월 16일 | 당사 인터넷 홈페이지 (www.genels.com) 한국투자증권(주) 홈페이지 (http://www.truefriend.com) 한양증권(주) 홈페이지 (http://www.hygood.co.kr) |
| 실권주 일반공모 배정 및 환불 공고 | 2024년 02월 22일 | 한국투자증권(주) 홈페이지 (http://www.truefriend.com) 한양증권(주) 홈페이지 (http://www.hygood.co.kr) |
주) 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 및 인수회사의 홈페이지에 게시함으로써 개별통지에 갈음합니다.
(2) 청약방법
1) 우리사주조합 청약: 「자본시장과 금융투자업에 관한 법률」제165조의7(우리사주조합원에 대한 주식의 배정 등에 관한 특례) 에 의해 우리사주조합은 공모주식의 20.0%를 배정받을 권리가 존재합니다. 그러나 「자본시장과 금융투자업에 관한 법률 시행령」 제176조의9(우리사주조합원에 대한 주식의 배정 등에 관한 특례의 예외 등)에 의거하여, 당사 우리사주조합원에 대한 배정은 우리사주조합 급여 총액이 우리사주조합 배정금액보다 미달하는 관계로 우선배정하지 아니합니다.
2) 구주주 청약: 구주주 중 주권을 증권회사에 예탁한 실질주주는 주권을 예탁한 증권회사의 본ㆍ지점 및 한국투자증권㈜의 본ㆍ지점에서 청약할 수 있습니다. 다만, 구주주 중 주식을 증권회사 계좌에 보유하지 않은 특별계좌부 등재 주주(기존 명부주주)의 경우는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 한국투자증권㈜의 본ㆍ지점에서 청약할 수 있습니다. 청약시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출해야 합니다.
| 2019년 9월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한국투자증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
|
「주식ㆍ사채 등의 전자등록에 관한 법률」 |
3) 신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도 주식수의 20%를 추가로 청약할 수 있습니다. 이때, 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
a. 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수
b. 신주인수권증서청약 한도주식수 = 보유한 신주인수권 증서의 수량
c. 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 * 초과청약 비율(20%)
4) 일반공모 청약 : 일반청약자는 「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약하여야 합니다. 일반청약자의 청약 시, 각 청약처별로 다중청약은 가능하나, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구를 제외한 청약자의 한 개 청약처에 대한 복수청약은 불가능합니다. 또한 고위험고수익투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」제2조제18호에 따른 요건을 충족하고, 제9조제4항에 해당하지 않음을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
5) 1인당 청약한도를 초과하는 청약은 초과되는 부분에 한하여 무효로 하며, 청약사무 취급처는 그 차액을 납입일까지 당해 청약자에게 이를 반환하되, 받은 날부터의 이자는 지급하지 아니합니다.
6) 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」 제9조 제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 따라 투자설명서의 교부가 면제되는자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다.
7) 청약한도
a. 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.2810985992주를 곱하여 산정된 신주인수권증서(단, 1주 미만은 절사)와 초과청약가능 주식수(보유하고 있는 신주인수권증서 1주당 0.2주를 곱하여 산정된 수, 단 1주 미만은 절사)를 합한 주식수로 하되, 신주배정기준일 전 주식관련사채 및 종류주식의 권리행사, 주식매수선택권의 행사 등으로 구주주의 1주당 배정비율은 변경될 수 있습니다.
b. 일반공모 청약자의 청약한도는 일반공모 총 공모주식 100% 범위 내로 하며, 청약한도를 초과하는 부분에 대해서는 청약이 없는 것으로 간주합니다.
8) 기타
a. 일반공모 배정을 함에 있어 이중청약이 있는 경우에는 그 청약자의 청약 전부를 청약하지 아니한 것으로 봅니다. 단, 구주주가 신주배정비율에 따라 배정받은 주식을 청약한 후 일반공모에 참여하는 경우에는 금지되는 이중청약이 있는 경우로 보지 않습니다. 단, 동일한 집합투자기구라도 운용주체(집합투자업자)가 다른 경우는 예외로 합니다.
b. 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 합니다.
c. 청약자는 '금융실명거래 및 비밀보장에 관한 법률'에 의거 실지 명의에 의해 청약해야 합니다.
d. 「자본시장과 금융투자업에 관한 법률」 제180조의4 및 같은 법 시행령 제208조의4 제1항에 따라 2023년 05월 17일부터 2024년 02월 07일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위(*)가 모집(매출)에 따른 주식을 취득하는 경우 (*) 「금융투자업규정」 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
(3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
한국투자증권(주) 본ㆍ지점 | 2024년 02월 14일 ~ 2024년 02월 15일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 주식을 예탁하고 있는 해당 증권회사 본ㆍ지점 2) 한국투자증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁 청약 포함) |
한국투자증권(주) 및 한양증권(주) 본ㆍ지점 | 2024년 02월 19일 ~ 2024년 02월 20일 |
|
(4) 청약결과 배정방법
1) 구주주 청약: 신주배정일기준 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 1주당 0.2810985992주를 곱하여 산정된 배정주식수(단,1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 다만, 신주배정기준일 현재 신주의 배정비율은 신주배정기준일 전 주식관련사채의 권리 행사, 주식매수선택권의 행사, 자기주식의 변동 등으로 인하여 변동될 수 있습니다.
2) 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주가 있는 경우, 실권주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율 : 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다.(단, 초과청약 주식수가 실권주에 미달한 경우 100% 배정)
(i) 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수
(ii) 신주인수권증서청약 한도주식수 = 보유한 신주인수권 증서의 수량
(iii) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 x 초과청약 비율(20%)
3) 일반공모 청약 : 상기 구주주청약 및 초과청약 결과 발생한 미청약주식 및 단수주는 다음과 같이 대표주관회사 및 인수회사가 일반에게 공모하되,「증권 인수업무 등에 관한 규정」제9조 제2항 제3호에 따라 고위험고수익투자신탁에 공모주식의 5%를 배정하며, 나머지 95%에 해당하는 주식은 개인청약자 및 기관투자자에게 구분 없이 배정합니다. 고위험고수익투자신탁에 대한 공모주식 5%와 개인투자자 및 기관투자자에 대한 공모주식 95%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 「증권 인수업무 등에 관한 규정」 제9조 제3항에 따라 어느 한 그룹만 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
(i) 일반공모에 관한 배정수량 계산시에는 대표주관회사와 인수회사의 청약물량에 대해서는 대표주관회사와 인수회사의 총청약물량을 일반공모 배정분 주식수로 나눈 통합청약경쟁률에 따라 대표주관회사와 인수회사의 각 청약자에 배정하는 방식으로 한다.
(ii) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 5사 6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 다만, 고위험고수익투자신탁에 대한 공모주식 5%와 개인투자자 및 기관투자자(집합투자업자포함)에 대한 공모주식 95%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 한 그룹만 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. 이후 최종 잔여주식은 최고청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는대표주관회사 및 인수회사가 합리적으로 판단하여 배정합니다.
(iii) 일반공모 청약결과 "대표주관회사"와 "인수회사"의 총 청약물량이 일반공모 배정분 주식수에 미달하는 경우, 배정 결과 발생하는 잔여주식은 대표주관회사와 인수회사가 각각 자기의 계산으로 인수한다.
(iv) 단, "대표주관회사" 및 "인수회사"는 「증권 인수업무 등에 관한 규정」제9조 제2항 제7호에 따라 고위험고수익투자신탁, 일반청약자에 배정하여야 할 주식이 25,000주 이하(액면가 1,000원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 자기 계산으로 인수할 수 있습니다.
(5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 진원생명과학(주), 대표주관회사 및 인수회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- 금번 유상증자에 청약하고자 하는 투자자께서는 (「자본시장과 금융투자업에 관한법률」제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」제132조에 따라 투자설명서의 교부가 면제되는 자 제외) 청약하시기 전 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
- 투자설명서 수령거부 의사표시는 서면, 전화, 전신, 모사전송, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 가능합니다.
1) 투자설명서 교부 방법 및 일시
|
구분 |
교부방법 |
교부일시 |
|
구주주 청약자 |
1),2),3)을 병행 |
- |
| 1) 우편 송부 | 구주주(신주인수권증서) 청약초일 전까지 | |
|
2) 한국투자증권㈜의 본,지점에서 교부 |
구주주(신주인수권증서) 청약종료일까지 | |
|
3) 한국투자증권㈜의 홈페이지나 HTS에서 교부 |
||
|
일반 청약자 |
1),2)를 병행 |
- |
|
1) 한국투자증권㈜ 및 한양증권(주)의 본, 지점에서 교부 |
일반공모 청약종료일까지 | |
|
2) 한국투자증권㈜ 및 한양증권(주)의 홈페이지나 HTS, MTS에서 교부 |
| ※ 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다. |
2) 확인절차
① 우편을 통한 투자설명서 수령시
- 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
- HTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
- 주주배정 유상증자의 경우 유선청약이 가능합니다. 유선상으로 신분확인을 하신 후, 투자설명서 교부 확인을 해주시고 청약을 진행하여 주시기 바랍니다.
② 지점 방문을 통한 투자설명서 수령시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
③ 홈페이지 또는 HTS, MTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
3) 기타
① 금번 유상증자의 경우, 본 증권신고서의 효력발생 이후 주주명부상 주주에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는, 한국투자증권㈜ 및 한양증권(주)의 본ㆍ지점 방문을 통해 인쇄물을 받으실 수 있으며, 또한 동일한 내용의 투자설명서를 전자문서의 형태로 한국투자증권(주) 및 한양증권(주)의 홈페이지에서 다운로드 받으실 수 있습니다. 한편, 일반공모 청약시 투자자께서는 대표주관회사 및 인수회사에 방문하여 투자설명서 인쇄물을 수령하시거나 대표주관회사 및 인수회사에 방문하여 홈페이지에서 동일한 내용의 투자설명서를 전자문서의 형태로 다운로드 받으시는 2가지 방법으로 투자설명서를 교부받으실 수 있습니다. 다만, 전자문서의 형태로 교부 받으실 경우, 「자본시장과 금융투자업에 관한 법률」 제124조 제1항 각호의 요건을 모두 충족해야만 청약이 가능합니다.
② 구주주 청약시 한국투자증권㈜ 이외의 증권회사를 이용한 청약 방법
해당 증권회사의 청약방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
| ※ 관련법규 「자본시장과 금융투자업에 관한 법률」 제9조 (그 밖의 용어의 정의) ⑤ 이 법에서 "전문투자자"란 금융투자상품에 관한 전문성 구비 여부, 소유자산규모 등에 비추어 투자에 따른 위험감수능력이 있는 투자자로서 다음 각 호의 어느 하나에 해당하는 자를 말한다. 다만, 전문투자자 중 대통령령으로 정하는 자가 일반투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우 금융투자업자는 정당한 사유가 있는 경우를 제외하고는 이에 동의하여야 하며, 금융투자업자가 동의한 경우에는 해당 투자자는 일반투자자로 본다. <개정 2009.2.3> 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자 제124조 (정당한 투자설명서의 사용) ① 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외한다)에게 제123조에 적합한 투자설명서(집합투자증권의 경우 투자자가 제123조에 따른 투자설명서의 교부를 별도로 요청하지 아니하는 경우에는 제2항제3호에 따른 간이투자설명서를 말한다. 이하 이 항 및 제132조에서 같다)를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 아니 된다. 이 경우 투자설명서가 제436조에 따른 전자문서의 방법에 따르는 때에는 다음 각 호의 요건을 모두 충족하는 때에 이를 교부한 것으로 본다.<개정 2013.5.28> 1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 "전자문서수신자"라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 「자본시장과 금융투자업에 관한 법률 시행령」 제11조 (증권의 모집·매출) ① 법 제9조제7항 및 제9항에 따라 50인을 산출하는 경우에는 청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다. 다만, 다음 각 호의 어느 하나에 해당하는 자는 합산 대상자에서 제외한다. <개정 2009.10.1, 2010.12.7, 2013.6.21, 2013.8.27> 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 제10조제1항제1호부터 제4호까지의 자 나. 제10조제3항제12호·제13호에 해당하는 자 중 금융위원회가 정하여 고시하는 자 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사·감정인·변호사·변리사·세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주(법 제9조제1항제1호에 따른 최대주주를 말한다. 이하 같다)와 발행주식총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는 그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자 제132조 (투자설명서의 교부가 면제되는 자) 법 제124조제1항 각 호 외의 부분 전단에서 "대통령령으로 정하는 자"란 다음 각 호의 어느 하나에 해당하는 자를 말한다. <개정 2009.7.1, 2013.6.21> 1. 제11조 제1항 제1호 다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화·전신·모사전송, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. |
(6) 주권 유통에 관한 사항
주권유통개시일: 2024년 03월 08일(유상증자 신주) (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
(7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2024년 02월 22일부터 해당 청약사무 취급처에서 환불합니다.
(8) 주금납입장소 : 우리은행 코엑스지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2024년 01월 08일 | 한국투자증권(주) | 00160144 |
| 2024년 01월 08일 |
한양증권(주) | 00162416 |
(1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」제165의6조3항 및「증권의 발행 및 공시 등에 관한 규정」제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
(2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 9월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
(3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 한국투자증권(주)과 인수회사인 한양증권(주)로 합니다.
(4) 신주인수권증서 매매 등
1) 금번 유상증자시 신주인수권증서는 전자증권제도 시행 이후에 발행되고 상장될 예정으로 실물은 발행 되지 않고 전자증권으로 등록발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
2) 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(5) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 한국투자증권(주)의 본ㆍ지점을 통해 해당 신주인수권증서에 기재되어 있는 수량만큼 청약할 수 있으며 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(6) 신주인수권증서의 상장
당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2024년 01월 25일부터 2024년 01월 31일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2024년 02월 01일에 상장폐지될 예정입니다. (「유가증권시장 상장규정」 제150조 "신규상장"에 따라 5거래일 이상 상장되어야 하며, 동 규정 제152조 "신주인수권증서의 상장폐지기준"에 따라 주주청약 개시일 5거래일전에 상장폐지되어야 함)
(7) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래관련 사항은 다음과 같습니다.
1) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
2) 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2024년 01월 25일부터 2024년 01월 31일까지(5거래일간) 거래 | 2024년 01월 18일(예정)부터 2024년 02월 02일까지 거래 |
① 상장거래 : 2024년 01월 25일부터 2024년 01월 31일까지(5영업일간) 거래 가능합니다.
② 계좌대체거래 : 2024년 01월 18일(예정)부터 2024년 02월 02일까지 거래 가능 합니다.
* 신주인수권증서 상장거래의 결제일인 2024년 02월 02일까지 계좌대체(장외거래) 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다.
* 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다.
3) 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
① '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다.
② '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한국투자증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
(1) 본 증권신고서는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자시 이러한 점을 감안하시기 바랍니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조제3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
(3) 본 증권신고서에 기재된 내용은 신고서 제출일 현재까지 발생된 것으로 본 신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익상황에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다. 따라서, 주주 및 투자자가 투자의사를 결정함에 있어 유의하여야 할 사항이 본 증권신고서상에 누락되어 있지 않습니다.
(4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
(5) 본 증권신고서의 예정 모집가액은 확정되어 있는 것은 아니며, 청약일 3거래일 전에 확정발행가액을 산정함으로써 확정될 예정입니다. 또한, 본 증권신고서의 발행예정금액은 추후 주당 발행가액이 확정되는 내용에 따라 변경될 수 있음을 유의하여 주시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
|---|---|---|---|
| 대표 | 한국투자증권㈜ | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 |
대표주관수수료: 모집총액의 0.1% 인수수수료 : 모집총액의 2.1%*50% 실권수수료 : 잔액인수금액의 15% |
| 인수 | 한양증권㈜ | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 |
인수수수료 : 모집총액의 2.1%*50% 실권수수료 : 잔액인수금액의 15% |
| 주1) | 최종 실권주 : 구주주청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 |
| 주2) | 모집총액 : 최종 발행가액 X 총 발행주식수 |
II. 증권의 주요 권리내용
당사가 금번 주주배정후 실권주 일반공모 유상증자를 통하여 발행할 증권은 기명식 보통주이며, 동 증권의 주요 권리내용은 다음과 같습니다.
1. 액면금액
제5조의2 【1주의 금액】
본 회사가 발행하는 주식1주의 금액은 1,000원으로 한다
2. 주식의 발행 및 배정에 관한 사항
제5조 【발행예정주식의 총수】
본 회사가 발행할 주식의 총수는 300,000,000주로 한다.
제6조 【주식의 종류, 수와 내용】
1. 회사는 보통주식과 종류주식을 발행할 수 있다. 회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식과 이들의 전부 또는 일부를 혼합한 주식으로 한다.
2. 종류주식의 발행한도는 제5조 발행예정주식총수의 4분의1 범위 내로 한다.
3. 종류주식에 대한 최저 배당률은 연 액면금액의 1% 이상으로 발행 시 이사회가 우선배당률을 정하며, 회사가 청산될 경우 잔여재산 분배에 있어 우선주식 발행 시 이사회에서 정한 금액을 한도로 보통주를 보유한 주주에 우선하여 잔여 재산의 분배를 받을 권리를 가진다.
4. 종류주식에 대하여 제3항에 따른 배당을 하지 못한 사업연도가 있는 경우 그 배당분에 대하여 발행시 이사회 결의에 의하여 누적적 또는 비누적인 것으로 할 수 있다.
5. 종류주식은 의결권이 없다.
6. 종류주식의 전환된 주식에 대한 이익의 배당에 관하여는 제10조의 규정을 준용한다.
7. 회사가 유상증자 또는 무상증자를 실시하는 경우 종류주식에 대한 신주의 배당은 유상증자의 경우에는 회사가 발행하기로 한 주식으로, 무상증자의 경우에는 그와 같은 종류주식으로 한다.
8. 회사는 이사회의 결의에 의하여 아래의 조건에 따라 회사의 이익으로 상환되는 종류주식 이나 보통주식으로 전환되는 종류주식 및 이를 전부 또는 일부를 혼합하여 발행할 수 있다.
1) 회사는 종류주식의 발행총수 범위 내에서 회사 또는 종류주식 주주의 청구에 따라 상환되는 종류주식을 발행할 수 있다.
가. 종류주식의 상환가액은 발행가 및 이에 대하여 발행일로부터 상환일까지 연 1%이상으로 발행시 이사회에서 정한 비율에 따라 산정한 금액으로 하되, 회사의 직전연도 당기순이익 등을 고려하여 이사회가 정하는 바에 따라 가감할 수 있는 것으로 한다. 다만 상환시 종류주식에 대하여 이미 지급된 배당금은 상환가액에서 공제하기로 한다.
나. 종류주식의 상환기간 및 상환청구기간은 종류주식 발행 후 1개월이 경과한 날로부터 10년이 되는 날의 범위내에서 발행시 이사회 결의로 정한다. 다만, 상환기간이 만료되었음에도 불구하고 상환기간내에 상환하지 못한 경우와 발행시 누적적 배당으로 결의되었을 때 우선적 배당이 완료되지 아니한 경우에는 상환기간은 상환 및 배당이 완료될 때까지 연장되는 것으로 한다.
다. 회사는 종류주식을 일시에 또는 분할하여 상환할 수 있다. 이 경우 상환대상인 주식의 취득일 2주일 전에 그 사실을 그 주식의 주주 및 주주명부에 기재된 권리자에게 통지 또는 공고하여야 한다.
라. 주주는 종류주식 전부를 일시에 또는 분할하여 상환해 줄 것을 회사에 청구할 수 있다. 이 경우 상환청구 주주는 2주일 이상의 기간을 정하여 상환 뜻과 상환대상주식을 회사에 통지 하여야 한다.
마. 회사는 주식 취득의 대가로 현금 외의 유가증권(다른 종류의 주식은 제외한다)이나 그 밖에 자산을 교부할 수 있다.
2) 회사는 종류주식의 발행총수 범위 내에서 주주의 청구에 따라 보통주로 전환되는 종류주식을 발행할 수 있다.
가. 종류주식의 전환조건은 종류주식 1주를 보통주식 1주로 전환하는 것으로 한다.
나. 전환청구를 할 수 있는 기간은 종류주식 발행 후 1개월이 경과한 날로부터 10년이 되는 날의 범위내에서 발행시 이사회 결의로 정하고 그 기간 만료와 동시에 보통주식으로 전환된다. 다만, 발행시 누적적 배당으로 결의되었을 경우에는 위 기간 중 소정의 배당을 하지 못하였을 때, 소정의 배당을 완료할 때까지 그 기간을 연장한다.
3) 회사는 위 1호 및 2호의 성격을 동시에 지닌 종류주식을 발행할 수 있다.
제7조 【주식 및 신주인수권증서에 표시되어야 할 권리의 전자등록】
본 회사는 주권 및 신주인수권증서를 발행하는 대신 전자등록기관의 전자등록 계좌부에 주식 및 신주인수권증서에 표시되어야 할 권리를 전자등록한다.
제8조 【주식의 발행 및 배정】
1. 본 회사가 이사회의 결의로 신주(제3호의 경우에는 이미 발행한 주식을 포함한다)를 발행하는 경우 다음 각 호의 방식에 의한다.
1) 주주에게 그가 가진 주식 수에 따라서 신주를 배정하기 위하여 신주인수의 청약을 할 기회를 부여하는 방식
2) 발행주식총수의 100분의 50을 초과하지 않는 범위내에서 신기술의 도입, 재무구조의 개선등 회사의 경영상 목적을 달성하기 위하여 필요한 경우 제1호 외의 방법으로 특정한 자(본 회사 주주를 포함한다)에게 신주를 배정하기 위하여 신주인수의 청약을 할 기회를 부여하는 방식
3) 발행주식총수의 100분의 50을 초과하지 않는 범위내에서 제1호 외의 방법으로 불특정 다수인(본 회사 주주를 포함한다)에게 신주인수의 청약을 할 기회를 부여하고 이에 따라 청약을 한 자에 대하여 신주를 배정하는 방식
2. 제1항제3호의 방식으로 신주를 배정하는 경우에는 이사회의 결의로 다음 각 호의 어느 하나에 해당하는 방식으로 신주를 배정하여야 한다.
1) 신주인수의 청약을 할 기회를 부여하는 자의 유형을 분류하지 아니하고 불특정 다수의 청약자에게 신주를 배정하는 방식
2) 관계 법령에 따라 우리사주조합원에 대하여 신주를 배정하고 청약되지 아니한 주식까지 포함하여 불특정 다수인에게 신주인수의 청약을 할 기회를 부여하는 방식
3) 주주에 대하여 우선적으로 신주인수의 청약을 할 수 있는 기회를 부여하고 청약되지 아니한 주식이 있는 경우 이를 불특정 다수인에게 신주를 배정받을 기회를 부여하는 방식
4) 투자매매업자 또는 투자중개업자가 인수인 또는 주선인으로서 마련한 수요예측 등 관계 법규에서 정하는 합리적인 기준에 따라 특정한 유형의 자에게 신주인수의 청약을 할 수 있는 기회를 부여하는 방식
3. 제1항 제2호 및 제3호에 따라 신주를 배정하는 경우 상법에서 정하는 사항을 그 납입기일의 2주 전까지 주주에게 통지하거나 공고하여야 한다. 다만, 관계 법령에 따라 주요사항보고서를 금융위원회 및 거래소에 공시함으로써 그 통지 및 공고를 갈음할 수 있다.
4. 제1항 각 호의 어느 하나의 방식에 의해 신주를 발행할 경우에는 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다.
5. 회사는 신주를 배정하는 경우 그 기일까지 신주인수의 청약을 하지 아니하거나 그 가액을 납입하지 아니한 주식이 발생하는 경우에 그 처리방법은 발행가액의 적정성등 관련 법령에서 정하는 바에 따라 이사회 결의로 정한다.
6. 회사는 신주를 배정하면서 발생하는 단주에 대한 처리방법은 이사회의 결의로 정한다.
7. 회사는 제1항 제1호에 따라 신주를 배정하는 경우에는 주주에게 신주인수권증서를 발행하여야 한다.
제9조 【주식매수선택권】
1. 본 회사는 임,직원(상법시행령에서 정하는 관계회사의 임,직원을 포함한다. 이하 이조에서 같다.)에게 발행주식 총수의 100분의 15의 범위 내에서 주식매수선택권을 주주총회의 특별결의에 의하여 부여할 수 있다. 다만 발행주식 총수의 100분의 3의 범위 내에서는 이사회 결의로 회사의 이사를 제외한 자에 대하여 주식매수선택권을 부여할 수 있다. 이사회의 결의로 주식매수선택권을 부여한 경우 회사는 부여 후 처음으로 소집되는 주주총회의 승인을 받아야 한다. 주주총회 또는 이사회 결의에 의해 부여하는 주식매수선택권은 경영성과목표 또는 시장지수등에 연동하는 성과연동형으로 할 수 있다.
2. 주식매수선택권을 부여 받을 자는 회사의 설립, 경영, 해외영업 또는 기술혁신 등에 기여하거나 기여할 수 있는 자로 한다.
3. 주식매수선택권의 행사로 교부할 주식은 기명식 보통주식으로 한다.
4. 주식매수선택권의 부여대상이 되는 임,직원의 수는 재직하는 임,직원의 100분의 90을 초과할 수 없고, 임원 또는 직원 1인에 대하여 부여하는 주식매수선택권은 발행주식 총수의 100분의 10을 초과할 수 없다.
5. 주식매수선택권을 행사할 주식의 1주당 행사가격은 다음 각 호의 가액 이상으로 한다. 주식매수선택권을 부여한 후 그 행사가격을 조정하는 경우에도 또한 같다.
1) 새로이 주식을 발행하여 교부하는 경우에는 다음 각목의 가격 중 높은 금액
가. 주식매수선택권의 부여일을 기준으로 한 주식의 실질가액
나. 당해 주식의 권면금액
2) 자기 주식을 양도하는 경우에는 주식매수선택권 부여일을 기준으로 한 주식의 실질가액
6. 주식매수선택권은 이를 부여하는 제1항의 결의일로부터 2년이 경과한 날로부터 5년 내에 행사할 수 있다.
7. 주식매수선택권을 부여 받은 자는 제1항의 결의일로부터 2년 이상 재임 또는 재직하여야 행사할 수 있다. 다만, 주식매수선택권을 부여 받은 자가 제1항의 결의일로부터 2년 내에 사망하거나 기타 본인의 귀책사유가 아닌 사유로 퇴임 또는 퇴직한 경우에는 그 행사기간 동안 주식매수선택권을 행사할 수 있다.
8. 다음 각 호의 1에 해당하는 경우에는 이사회의 결의로 주식매수선택권의 부여를 취소할 수 있다.
1) 주식매수선택권을 부여 받은 임,직원이 본인의 의사에 따라 퇴임하거나 퇴직한 경우
2) 주식매수선택권을 부여 받은 임,직원이 고의 또는 과실로 회사에 중대한 손해를 끼친 경우
3) 회사의 파산 또는 해산 등으로 주식매수선택권의 행사에 응할 수 없는 경우
4) 기타 주식매수선택권 부여 계약에서 정한 취소사유가 발생한 경우
9. 주식매수선택권의 행사로 인하여 발행한 신주에 대한 이익의 배당에 관하여는 제10조의 규정을 준용한다.
3. 배당에 관한 사항
제10조 【신주의 배당기산일】
본 회사가 유상증자, 무상증자 및 주식배당에 의하여 신주를 발행하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전 영업연도 말에 발행된 것으로 본다.
제41조 【이익금의 처분】
본 회사는 매사업연도의 처분전이익잉여금을 다음과 같이 처분한다.
1. 이익준비금
2. 기타 법정적립금
3. 배당금
4. 임의적립금
5. 기타의 이익잉여금 처분액
제42조 【이익배당】
1. 이익의 배당은 금전과 주식 및 기타의 재산으로 할 수 있다.
2. 제1항의 배당금은 매결산기 말 현재의 주주명부에 등록된 주주 또는 질권자에게 이를 지급 한다.
3. 이익의 배당을 주식으로 하는 경우, 회사가 수종의 주식을 발행한 때에는 주주총회의 결의 로 그와 다른 종류의 주식으로도 할 수 있다.
제43조 【배당금지급청구권의 소멸시효】
1. 배당금의 지급청구권은 지급통지일로부터 5년간 이를 행사하지 아니하면 소멸시효가 완성 한다.
2. 제1항의 시효의 완성으로 인한 배당금은 본 회사에 귀속한다.
4. 의결권에 관한 사항
제16조 【주주의 의결권】
각 주주의 의결권은 1주마다 1개로 한다.
제16조의2 【의결권의 불통일행사】
1. 2이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3일전에 회사에 대하여 서면으로 그 뜻과 이유를 통지하여야 한다.
2. 본 회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 다만, 주주가 신탁을 인수하였 거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니하다.
제16조의3 【의결권의 대리행사】
1. 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있다.
2. 제1항의 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다.
III. 투자위험요소
| 【투자자 유의사항】 |
|---|
| ■ 금번 유상증자를 청약하고자 하는 투자자들은 투자결정을 하기전에 증권신고서의 다른 기재 부분 뿐만 아니라 특히 아래 기재된 투자위험요소를 주의깊게 검토한 후 이를 고려하여 최종적인 투자판단을 하시기 바랍니다. ■ 당사는 본 증권신고서를 통하여 청약 전에 투자자께서 숙지하셔야 하는 부분에 대하여 성실히 기재하고자 노력하고 있습니다. 다만, 당사가 현재 알고 있지 못하거나 중요 하지 않다고 판단하여 아래 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수 없으므로, 투자자는 아래 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 자신의 독자적이고도 세밀한 판단에 의해야 합니다. 따라서 증권신고서에 기재된 사항은 투자 판단 시 참고 자료로 활용하실 것을 권고드리며, 투자자의 투자 판단에 대한 결과는 투자자 본인에게 귀속됨을 다시 한번 알려드립니다. ■ 만일, 아래 기재한 투자위험요소가 실제로 발생하는 경우, 당사의 사업, 재무상태, 기타 영업활동에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있음을 유의하시기 바랍니다. ■ 2009년 2월 4일 부로 시행된 『자본시장과 금융투자업에 관한 법률』제124조에 의거 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자 (전문투자자, 그밖에 대통령령으로 정하는 자를 제외함) 에게 적합한 투자설명서를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 안됩니다. 다만, 『자본시장과 금융투자업에 관한 법률 시행령』제132조에 의거하여 투자설명서를 받기를 거부한다는 의사를 서면으로 표시한 자는 투자설명서의 교부없이 청약이 가능합니다. ■ 본 공시서류의 기재사항은 투자 결정 위한 참고사항일 뿐이며, 투자에 대한 모든 손익 및 투자책임은 투자자 본인에게 귀속됨을 다시 한 번 말씀드립니다. |
1. 사업위험
[주요 용어]
| 출처) 당사 정기보고서 및 당사 제시 |
| 용어 | 설명 |
|---|---|
| DNA 백신 | 현재 사용하고 있는 백신과는 달리 병원균이나 바이러스 등의 특정 항원에 해당하는 유전자를 인공적으로 복제하여 합성한 후 인체의 근육이나 피부에 주사하면, 각 조직 내 세포에서 생성된 항원이 면역반응을 유도하여 항체를 형성하고, 활성화된 살상T세포를 통해 치료와 예방이 가능한 백신입니다. |
| DNA기반 유전자의약품 | DNA 기반 유전자의약품은 플라스미드에 삽입된 암호화된 유전자 서열의 종류에 따라, DNA 기반 단백질의약품과 DNA기반 단클론 항체의약품으로 구분할 수 있습니다. 기존 단백질 의약품과 단클론 항체의약품은 바이오의약품 생산공정을 통해 단백질과 단클론항체로 제품을 생산한 후 환자에 투여하여 질병을 치료를 하게 됩니다, 하지만, DNA 기반 유전자의약품은 해당 치료용 단백질과 치료용 단클론항체를 암호화하는 유전자서열을 플라스미드에 삽입한 후, 이 플라스미드를 환자의 체내에 투여하면, 체내에서 단백질과 단클론항체가 직접 생성되어 질병을 치료하게 됩니다. |
| 핵산 | 핵산(Nucleic acids)은 뉴클레오티드(nucleotides)라는 단위체로 구성된 중합체입니다. 핵산에는 DNA와 RNA라는 두 가지 유형이 있으며, 유전정보의 저장과 전달, 그리고 발현을 돕는 기능을 담당한다. 단백질의 형태를 결정하는 데 중요한 폴리펩티드(polypeptides)의 일차 구조인 아미노산 서열은 유전자에 의해 설계되어 있습니다. 이런 유전자는 바로 DNA라는 핵산에 의해 구성됩니다. |
| 플라스미드 | 유전자 치료는 치료에 필요한 유전자를 원하는 체내 세포로 전달하여 유전적 결함을 치료하거나 새로운 기능을 추가하는 치료기법입니다. 이를 위해서 대상 세포로 치료 유전자를 전달하는 방법이 가장 중요한데, 여기서 쓰이는 치료 유전자 전달체 역할을 하는 것이 플라스미드입니다. 플라스미드 기반의 DNA백신은 바이러스를 직접 죽이거나 약화시켜 만든 기존 백신과는 달리 바이러스의 유전정보를 바탕으로 치료에 적합한 DNA만을 추출하여 플라스미드에 주입하게 됩니다. 이 플라스미드를 사람 몸에 접종하면 세포속에 들어가 바이러스의 세포 표면에 있는 것과 흡사한 단백질(항원)이 만들어지는데, 이 단백질(항원)이 면역반응을 유도하여 바이러스에 대한 면역력을 형성하게 됩니다. |
| cGMP | cGMP (Current Good Manufacturing Practice)는 인체에 투여할 의약품을 생산 및 품질평가를 하는 기준으로, 미국FDA (Food and Drug Adminstration)가 인정하는 기준으로 국내에서는 선진GMP라고도 부릅니다. 미국 등 선진국 의약품 규제기관들은cGMP 규정을 엄격히 적용하고 있고 의약품의 허가 및 수입허가시 본 규정에 따른 생산 및 관리를 필수 적으로 요구하고 있습니다. |
| CDMO | CDMO (Contract Development and Manufacturing Organization)는 신약 개발회사가 생산시설 건설에 엄청난 비용과 시간을 투자하지 않고 제품을 확보할 수 있도록 의약품을 전문적으로 위탁 생산개발해 주는 사업을 의미합니다. |
| RNA | RNA(Ribonucleic acid)는 리보핵산이라고 하는데, 지방, 단백질, 탄수화물과 더불어 생명체를 이루는 주된 물질입니다. RNA의 염기는 아데닌, 구아닌, 유라실, 시토신으로 이루어져 있고, RNA 분자들은 유전자의 조절, 세포 시그널의 인식 등 다양한 생명현상에 작용할 뿐 아니라 유전자 정보를 매개, 유전자의 발현 등에 관여합니다. |
| mRNA | mRNA(messenger RNA)은 메신저 리보핵산이라 하는데, 번역의 주형으로 이용되는 RNA의 일종으로, 유전정보가 담겨 있습니다. 단백질을 합성하기 위한 정보를 DNA로부터 리보솜에 전달하는 역할을 하기 때문에 '전령RNA'라고도 합니다. |
| C형간염 | C형 간염은 C형 간염 바이러스(hepatitis C virus, HCV)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환을 의미합니다. |
| 코로나19 | 코로나19는 COVID-19이라 명명되었고, 2019년 12월 중국 후베이성 우한시에서 SARS-CoV2 바이러스의 감염에 의해 최초로 발병하여 전세계로 급속도로 전파되고 있는 전염병으로, 높은 감염율과 치명율을 보이고 있는 세 번째 코로나바이러스 관련 신종 감염병입니다. |
| 중증열성 혈소판 감소 증후군 | 중증열성혈소판감소증후군(Severe Fever with Thrombocytopenia Syndrome, SFTS)은 STFS 바이러스에 감염된 진드기에 물려 바이러스에 감염되면 7~14일의 잠복기간을 거쳐 1주일 이상 고열, 두통, 어지럼증, 관절통, 구토, 설사 등의 증상을 겪고 콩팥, 심장을 포함한 여러 장기의 복합적 기능부전과 함께 심하면 사망에 이르는 신종바이러스 감염질환입니다. |
| 융합단백질 | 융합단백질(Fusion protein)은 2개 이상의 이종(異種)단백질의 일부 또는 전부가 결합된 단백질입니다. 대부분의 경우 유전자의 코드배열을 다른 유전자의 코드배열과 유합한 잡종유전자를 발현시켜서 얻고. 단백질의 기능이나 국재 등을 해석할 때 이미 알고 있어서 검출하기가 용이한 단백질(β-갈락토시드가수분해효소나 클로람페니콜아세틸전달효소 등)을 목적으로 하는 단백질과 융합시킨 융합단백질을 사용하는 경우가 많습니다. |
| 혈우병 | 혈우병(hemophilia)은 X 염색체에 있는 유전자의 선천성, 유전성 돌연변이로 인해 혈액 내의 응고인자(피를 굳게 하는 물질)가 부족하게 되어 발생하는 출혈성 질환을 말합니다. |
| 면역글로블린 | 면역 글로불린(Immunoglobulin)은 항원의 자극에 의하여 면역반응으로 만들어지는 당단백질 분자로써 주로 혈액 내에서 특정한 항원과 특이적으로 결합하여 항원-항체 반응을 일으킵니다. 다른 말로는 항체(antibody)라고도 하며 B 림프구로부터 생산되어 박테리아와 바이러스 등의 병원성 미생물을 침전이나 응집반응으로 항원을 제거하는 기능을 수행합니다. |
| 종양괴사인자(TNF) | 종양괴사인자는 TNF. 카켁틴(cachectin)이라고도 합니다. 인간을 포함해 동물 체내에서 만들어지는 제암효과를 가진, 이른바 생물학적 응답조절물질(BRM)의 일종으로 1975년 미국 슬론케터링 암연구소에서 처음 발견했습니다. 대식세포가 내독소(endotoxin)로 알려진 세균이 갖고 있는 독성물질과 반응하여 만들어집니다. |
| 소두증 | 소두증(Microephaly)은 두부 및 뇌가 정상보다도 이상하게 작은 선천성 기형의 하나로 대개의 경우 앞이마의 발달이 나쁘고 상하로 두부가 작게 보입니다. 반면 안면의 발달은 정상이지만, 천문(泉門) 및 봉합선은 빨리 폐쇄합니다. 뇌 그 자체에도 선천성 기형, 이를테면 축소뇌나 수두증을 수반하는 경우가 많으며 정박(精薄)을 나타내는 것 외에 여러가지 신경증상을 나타낼 수 있습니다. |
| 단클론항체 | 단클론 항체(monoclonal antibody, mAb)는 단 하나의 B 세포가 항원의 자극을 받아 증식, 클론을 형성하여 생산해 내는 특성이 동일한 항체를 의미합니다. mAb는 하나의 항원결정기에만 결합하는 단일 친화력을 가진 항체이며, 이와 비교되는 개념으로 다클론 항체(polyclonal antibody)가 있습니다. |
| T세포 | T세포(T-Cell)는 골수의 조혈줄기세포에서 유래하고 가슴샘 내에서 분화하여 성숙T세포가 되어 말초림프조직으로 이행하는 세포입니다. 가슴샘 내에 있는 동안은 미성숙 상태로 보통 T세포가 아닌 가슴샘세포 또는 가슴샘림프구라고 하며 비장, 림프절의 가슴샘의존역에 분포합니다. |
| 제 1상 임상 | 제1상 임상시험은 의약품 후보 물질의 전임상 동물실험에 의해 얻은 독성, 흡수, 대사, 배설 및 약리작용 데이터를 토대로 비교적 한정된(통상 20~80명, 때로 20명 이하) 인원의 건강한 성인에게 신약을 투여하고 그 약물의 체내동태(pharmacokinetics), 인체에서의 약리작용, 부작용 및 안전하게 투여할 수 있는 투여량(내약량)의 등을 결정하는 것을 목적으로 하는 임상시험입니다. |
| 제 2a상 임상 | 제2a상 임상시험은 신약의 안전성과 예비 효능을 증명하기 위한 단계로, 약리효과의 확인, 적정용량 또는 용법을 결정하기 위한 시험입니다. 통상 면밀히 평가될 수 있는 환자에 대해 한정된 인원수의 범위에서 행해지며 대상환자수는 100~200명 내외이나, 향균제와 같이 다양한 적응증을 갖는 약물의 경우에는 훨씬 많은 환자 수에서 진행되기도 합니다. |
| 제 2b상 임상 | 제2a상 임상시험의 결과에 따라 설계된 용량을 가지고 다시 환자에 투여, 어느 만큼의 용량이 가장 효과가 있을지 적정 투여 용량의 범위를 정하는 과정입니다. |
| 제 3상 임상 | 제3상 임상시험은 신약의 유효성이 어느 정도까지는 확립한 후에 행해지며, 시판허가를 얻기 위한 마지막 단계의 임상시험으로서 비교대조군과 시험처치군을 동시에 설정하여 용량, 효과, 효능과 안전성을 비교 평가하기 위한 시험입니다. 대상환자 수는 약물의 특성에 따라 달라지고 일반적으로 1/1000의 확률로 나타나는 부작용을 확일할 수 있는 경우가 바람직합니다. |
진원생명과학 주식회사는 1976년 01월에 의류용 심지 전문제조 및 판매를 주된 목적으로 설립되었으며 1987년 11월 유가증권시장에 상장되었습니다. 현재는 기존 의류용 심지 전문제조 및 판매업과 더불어 코로나19 DNA 백신, 코로나19 경구용 치료제, 코로나19 코 스프레이 치료제, SFTS(중증열성 혈소판 감소 증후군) DNA백신 등의 임상개발을 수행하고 있으며, 핵산기반 백신 및 핵산기반 유전자의약품(유전자 치료제)의 연구개발과 마케팅을 통한 플라스미드 임상용 의약품을 전문생산하는 바이오 CDMO 사업을 추가하여 영위하고 있습니다. 각 사업부문의 성격과 위험요소가 상이하여 사업위험을 각 사업부문별로 기재하였으니 투자자 여러분께서는 이 점을 참고하시기 바랍니다.
| [사업부문별 매출 현황] |
| (단위 : 백만원) |
|
구 분 |
2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 | 2019년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 매출비중 | 매출액 | 비율 | 매출액 | 매출비중 | 매출액 | 매출비중 | 매출액 | 매출비중 | 매출액 | 매출비중 | |
| CDMO 매출액 | 17,373 | 63.29% | 25,739 | 66.21% | 31,506 | 64.70% | 22,360 | 57.8% | 26,409 | 63.63% | 23,588 | 57.20% |
| 의류용 심지 | 5,382 | 19.61% | 7,255 | 18.66% | 9,356 | 19.20% | 8,897 | 23.0% | 9,404 | 22.66% | 12,130 | 29.41% |
| 심지 및 기타상품 | 3,818 | 13.91% | 4,832 | 12.43% | 6,522 | 13.40% | 5,447 | 14.1% | 4,136 | 9.97% | 4,549 | 11.03% |
| 컨설팅 등 | 876 | 3.19% | 1,047 | 2.69% | 1,334 | 2.70% | 1,996 | 5.1% | 1,554 | 3.74% | 974 | 2.36% |
| 합계 | 27,448 | 100.00% | 38,873 | 100.00% | 48,718 | 100% | 38,700 | 100% | 41,503 | 100% | 41,241 | 100% |
출처) 당사 정기보고서
| 가. 코로나19유행, 러시아-우크라이나 전쟁 및 대내외 불확실성이 미치는 위험 코로나19가 엔데믹(풍토병화)으로 전환되는 상황으로 3년 넘게 이어진 코로나19로 인해 겪었던 일상의 불편함이 해소될 것이라는 기대가 크게 높아졌습니다. 그러나 전문가들 사이에서는 매일 1만명 넘는 확진자가 꾸준히 나오는 만큼 코로나19는 여전히 종식되지 않았으며 사실상 '각자도생'이 될 공산이 있다는 우려가 나오며 , 코로나19에 걸릴 경우 중증 또는 사망으로 이어질 가능성이 높은 고위험군에 대한 보호책 역시 해결해야 할 과제입니다. 2023년 04월 11일 국제통화기금(IMF)이 발표한 '세계경제전망(World Economic Outlook)'에 따르면, 2022년 세계 경제성장률은 3.4%를 기록했으며, 2023년에는 2.8%, 2024년에는 3.0%의 성장률을 기록할 것으로 전망됩니다. 2023년의 전망치는 작년 10월 대비 0.1%p 상향되었는데 이는 중국의 리오프닝에 따른 경기 회복 기대와 미ㆍ유로 등 주요국의 예상외 견조한 소비ㆍ투자 등에 따른 영향입니다. 그러나 러시아-우크라이나 전쟁과 중국의 경기회복에 따른 에너지가격 상승, 노동시장의 경직성 등으로 인플레이션이 지속될 가능성이 존재하며, 중국의 낮은 백신 접종률 및 부족한 의료시설에 따른 경기회복 제약 등으로 인해 경기하방 위험은 여전하다고 언급했습니다. 국내 경기 또한 글로벌 코로나19 팬데믹의 추후 재발 가능성과 더불어 소비 및 금융 시장 심리 악화, 러시아-우크라이나 전쟁의 장기화, 원자재 가격의 급격한 상승, 높은 인플레이션으로 인한 고강도 통화정책 실시 등 부정적인 요인들은 향후에도 경기 회복세가 둔화될 수 있는 가능성이 존재합니다. 나아가, 코로나19 이외에도 2022년 02월 24일 러시아가 우크라이나를 침공함으로써 러시아-우크라이나 전쟁이 발발하였습니다. 본 공시서류 제출일 현재 러시아-우크라이나 전쟁이 당사에 직접적으로 영향을 미칠지 여부는 미지수입니다. 따라서 투자자께서는 러시아-우크라이나 전쟁이 당사 및 당사가 영위하는 사업에 미칠 영향에 대해 면밀히 검토하시기 바랍니다. |
신종 코로나 바이러스 감염증(이하 '코로나-19')은 중국 후베이성 우한시에서 2019년 12월 01일 처음 발생 후 확산 중인 급성 호흡기 질환입니다. 감염 확산세가 전세계로 이어지면서 2020년 03월 11일, 세계보건기구(WHO)는 감염병 경보를 기존 5단계에서 최고 단계인 6단계로 상향 조정하여 '세계적 대유행(Pandemic)'으로 선포하였습니다.
세계 각국은 백신 개발과 코로나-19 확산 방지에 총력을 다하고 있습니다. 2021년 백신 접종을 시작으로, 세계 각국은 일정 수준 이상의 백신 접종률 달성을 위해 총력을 기울이고 있습니다. 2020년 10월 인도에서 처음 발견된 코로나-19 변이 바이러스인 델타 변이 바이러스는 기존 코로나-19 백신으로 방어가 가능한 것으로 알려져 있지만, 다른 변이 바이러스보다 전파 속도가 빠른 데다 더 심각한 증상을 유발하는 것으로 알려져 있습니다.
또한, 오미크론 변이는 남아공 과학자들이 스파이크 단백질에 32가지 유전자 변이를 일으킨 새로운 변이, 'B.1.1.529'가 발견됐다고 보고하면서 알려졌습니다. 처음 발견된 것은 아프리카 보츠와나이고 남아공에서 확산되었으며, 세계보건기구(WHO)는 이날 전문가 회의를 열어 이 변이종에 오미크론이라는 이름을 붙이고 '우려 변이종'으로 분류했습니다. 그리고 이는 델타 변이와 같은 가장 높은 수준의 분류 단계입니다. 2021년 하반기 들어 백신 접종과 방역 체계가 강화되면서 위드 코로나 정책이 유지될 것으로 예상되었지만, 변이 바이러스인 오미크론의 등장과 확진자 수 급증으로 국내 방역조치는 재차 강화되었습니다.
코로나19가 엔데믹(풍토병화)으로 전환되는 상황으로 3년 넘게 이어진 코로나19로 인해 겪었던 일상의 불편함이 해소될 것이라는 기대가 크게 높아졌습니다. 그러나 전문가들 사이에서는 매일 1만명 넘는 확진자가 꾸준히 나오는 만큼 코로나19는 여전히 종식되지 않았으며 사실상 '각자도생'이 될 공산이 있다는 우려가 나오며 , 코로나19에 걸릴 경우 중증 또는 사망으로 이어질 가능성이 높은 고위험군에 대한 보호책 역시 해결해야 할 과제입니다.
또한 향후 새로운 강력한 변이 바이러스의 출현으로 인한 팬데믹 재확산의 가능성은 언제나 존재합니다. 이 경우 경기 회복세가 다시 꺾여 경기 둔화가 가속화될 수 있으며 실물 경기 전체에 악영향을 미쳤던 2020년과 같은 사태가 되풀이될 가능성을 배제할 수 없습니다.
2023년 4월 IMF(국제통화기금)가 발표한 세계경제전망에 따르면 2021년에는 6.1%2022년에는 3.4%를 기록하였으며, 2023년에는 2.8%, 2024년에는 3.0%의 성장률을 기록할 것으로 전망됩니다. 2023년의 전망치는 작년 10월 대비 0.1%p 상향되었는데 이는 중국의 리오프닝에 따른 경기 회복 기대와 미ㆍ유로 등 주요국의 예상외 견조한 소비ㆍ투자 등에 따른 영향입니다. 그러나 러시아-우크라이나 전쟁과 중국의 경기회복에 따른 에너지가격 상승, 노동시장의 경직성 등으로 인플레이션이 지속될 가능성이 존재하며, 중국의 낮은 백신 접종률 및 부족한 의료시설에 따른 경기회복 제약 등으로 인해 경기하방 위험은 여전하다고 언급했습니다.
이와 더불어, IMF는 1) 상반된 지표에 따른 과잉ㆍ과소 통화정책 위험, 2) 상이한 정책 여건으로 인한 강달러 지속과 국가간 긴장 증가, 3) 식품ㆍ에너지 추가 충격 등으로 인한 인플레 장기화, 4) 신흥국 부채 취약성, 5) 러시아산 가스 유럽공급 중단, 6) 코로나 변이, 원숭이두창 등 전염병 재확산, 7) 중국 부동산 문제 악화, 8) 세계경제 분절화 및 국제협력 약화 등을 위험 요인으로 언급하였습니다.
| [IMF 주요국의 경제성장률 전망치] |
| (단위: %, %p) |
| 경제성장률 | 2020년 | 2021년 | 2022년 | 2023년 | ||||
|---|---|---|---|---|---|---|---|---|
| 전망 ('22.10월 기준) |
전망 ('23.4월 기준) |
조정폭 ('22.10월 대비) |
전망 ('22.10월 기준) |
전망 ('23.4월 기준) |
조정폭 ('22.10월 대비) |
|||
| 세계 | -3.1 | 6.1 | 3.2 | 3.4 | 0.2 | 2.7 | 2.8 | 0.1 |
| 선진국 | -4.5 | 5.2 | 2.4 | 2.7 | -0.3 | 1.1 | 1.3 | 0.2 |
| 미국 | -3.4 | 5.7 | 1.6 | 2.1 | 0.5 | 1 | 1.6 | 0.6 |
| 유로존 | -6.3 | 5.4 | 3.1 | 3.5 | 0.4 | 0.5 | 0.8 | 0.3 |
| 일본 | -4.5 | 1.7 | 1.7 | 1.1 | -0.6 | 1.6 | 1.3 | -0.3 |
| 신흥개도국 | -2.0 | 6.8 | 3.7 | 4.0 | 0.3 | 3.7 | 3.9 | 0.2 |
| 중국 | 2.2 | 8.1 | 3.2 | 3.0 | -0.2 | 4.4 | 5.2 | 0.8 |
| 인도 | -6.6 | 8.7 | 6.8 | 6.8 | 0 | 6.1 | 5.9 | -0.2 |
| 한국 | -0.7 | 4.1 | 2.6 | 2.6 | 0 | 2 | 1.5 | -0.5 |
| 출처) IMF World Economic Outlook (2023.04) |
한편, 국내 경기의 경우 2023년 2월 한국은행이 발표한 경제전망보고서에 따르면 최근 국내외 여건변화 등을 감안할때 경제성장률은 2022년 2.6%, 2023년 1.5% 수준을 나타낼 것이라고 전망하였습니다. 한국은행은 향후 국내경제가 주요국 경기 동반 부진 등으로 잠재수준을 하회하는 성장 흐름을 이어갈 것으로 전망하였으나, 내년 하반기 이후에는 대외 불확실성이 줄어들면서 부진이 점차 완화될 것으로 예상하였습니다. 그러나, 향후 코로나19 바이러스의 변이에 의한 재확산, 실업률 증가, 금융 여건 악화 등 팬데믹 관련 위험뿐만 아니라 우크라이나 사태, 주요국의 통화정책 긴축 움직임 등이 세계 경제에 부정적인 영향을 끼칠 수 있으며 특히 코로나19 확산세가 지속될 경우 경기 회복세가 더뎌질 수 있습니다.
| [ 국내 주요 거시경제지표 전망 ] |
| (단위: 전년동기 대비 %) |
| 경제성장률 | 2021 | 2022 | 2023(E) | 2024년(E) | ||||
|---|---|---|---|---|---|---|---|---|
| 연간 | 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | 연간 | |
| GDP | 4.1 | 3.0 | 2.2 | 2.6 | 1.1 | 2.0 | 1.6 | 2.4 |
| 민간소비 | 3.7 | 4.1 | 4.6 | 4.4 | 3.3 | 1.3 | 2.3 | 2.4 |
| 설비투자 | 9.0 | -6.4 | 5.4 | -0.7 | 3.2 | -8.9 | -3.1 | 3.6 |
| 지식재산생산물 투자 | 4.4 | 4.6 | 5.0 | 4.8 | 3.6 | 3.5 | 3.5 | 3.5 |
| 건설투자 | -1.6 | -4.5 | -2.6 | -3.5 | 0.1 | -1.5 | -0.7 | 0.4 |
| 상품수출 | 10.5 | 6.0 | 0.3 | 3.1 | -4.0 | 5.0 | 0.5 | 3.4 |
| 상품수입 | 12.8 | 5.3 | 3.9 | 4.6 | -0.4 | -0.1 | -0.2 | 3.1 |
| 출처) 한국은행 경제전망보고서(2023.02) |
향후 코로나19의 재확산, 러시아-우크라이나 지정학적 리스크 및 글로벌 인플레이션 지속 등으로 인해 글로벌 경제가 악화되는 경우 당사의 사업 및 수익성에 부정적인 영향을 끼칠 수 있습니다. 투자자께서는 이점 유의하시기 바랍니다.
|
나. 글로벌 제약사의 자체 생산비중 증가 관련 위험 |
당사가 영위하는 바이오 CDMO(Contract Development & Manufacturing Organization)사업은 자체 생산역량이 부족하거나, 의약품 R&D 및 마케팅에 사업역량을 집중하기 위해 생산을전략적으로 아웃소싱하는 글로벌 제약사들을 고객으로 하는 바이오의약품 위탁개발ㆍ생산 사업입니다. 당사가 주력하는 분야인 바이오의약품 CDMO 사업은 신약개발에서 제품 판매에 이르기까지 오랜 시간과 대규모의 투자를 필요로 하기에 전체 프로세스를 일원화할 수 있는 기업은 몇몇 소수의 대규모 다국적제약회사를 제외하고는 많지 않습니다. 특히 바이오의약품 CDMO산업은 첨단 생명 공학 기술이 요구되고, 첨단설비를 갖추는데 막대한 설비투자비 및 품질관리 기술을 필요로 하고 있음에 따라 최적의 비용과 고효율로 제품의 생산을 전담할 수 있는 위탁생산 전문기업(CDMO)의 출현이 요구되고 있고 관련 시장도 급격히 성장하고 있습니다.
바이오의약품이 제약 산업의 신성장 동력으로 부상하면서 주요 제약사들의 바이오의약품 생산에 대한 수요는 빠르게 증가하고 있습니다. 이러한 생산 수요를 충당하기 위해서 제약사들은 1) 신규 설비를 증설하거나 바이오의약품을 생산하기 위한 자체 생산능력(In-house)을 확보하거나, 2) 위탁생산업체(CDMO)에 아웃소싱을 맡김으로써 외부에서 생산능력을 조달하는 전략을 종합적으로 사용하고 있습니다.
과거에는 기술 유출 등의 문제로 제약사들이 자체 생산능력 확보를 통한 생산을 선호하였으나, 최근에는 다양한 요인에 의해 자체 생산능력을 확보하는 전략보다는 위탁생산업체(CDMO)의 생산능력을 이용하는 이점이 커짐에 따라 위탁생산업체에 생산을아웃소싱 하는 사례가 빠르게 증가하고 있습니다.
바이오의약품 CDMO 시장의 성장요인은 다음과 같습니다.
1) 블록버스터 바이오의약품 지속 개발
2000년 전후에 출시된 블록버스터 바이오의약품(자가면역질환 치료제, 항암제,
당뇨 치료제 등)이 여전히 높은 매출 성장을 지속하고 있으며, 최근에는 면역
항암제, 고지혈증, 아토피 등 새로운 분야에서 유망 치료제 신약이 지속적으로
출시되고 있습니다.
2) 글로벌 제약사 및 중소형 바이오텍의 생산분야 아웃소싱 확대 추세
제약사들은 의약품 시판허가 및 판매수요 예측의 불확실성을 최소화하기 위해
대규모 자본투자가 소요되는 생산분야에서 전문CDMO를 활용하는 추세를 확대하고
있습니다. 이러한 시장의 변화는 CDMO산업에 새로운 기회로 작용합니다.
3) 공급 안정성 확보를 위한 복수 생산설비(Dual Sourcing) 수요
최근 각국의 의약품규제기관은 제약사들에게 의약품 공급 안정성 강화를 권고하고
있습니다. 미국 FDA는 단일 Site에서만 생산되는 의약품에 대해서는 별도의
"Contingency Plan" 수립을 요구하고 있습니다. 이러한 규제강화 흐름에 따라
CDMO를 활용해 복수 생산설비를 운영하는 사례가 확대되고 있습니다.
상기 기재한 요인들에 의해 의약품 생산시장 내 CDMO 생산비중은 향후에도 확대될 것으로 예상되고 있습니다.
4) 특허만료에 따른 바이오시밀러 출시
Humira, Herceptin, Remicade, Lantus 등 기존 블록버스터바이오의약품의 특허가향후 5~6년 내에는 대부분 만료될 예정으로 바이오시밀러 시장은 큰 폭의 성장을지속할 것으로 예측되며, 이와 같은 바이오시밀러 시장 확대가 전체 바이오의약품의 생산수요 증가를 더욱 가속화 할 것으로 전망됩니다.
상기 기재한 요인들에 의해 의약품 생산시장 내 CDMO 생산비중은 향후에도 확대될 것으로 예상되고 있습니다. Frost&Sullivan에 의하면, 바이오의약품을 위탁생산하는CMO 사업 및 세포주개발, 공정, 제형, 분석법 등 세포주 개발~초기 임상까지 개발서비스를 제공하는 CDO사업을 모두 포괄하는 Bio CDMO 시장의 규모는 2021년 기준 128억불에서 향후 5년간 연평균 10.1% 성장해 2026년 203억불 규모로 성장할 것으로 전망됩니다.
| [CDMO 시장 규모 추이 및 전망] |
 |
|
CDMO 시장규모 전망 |
| 출처 : Frost & Sullivan(2021.07) |
상기와 같이 글로벌 제약사의 바이오의약품에 대한 전략적인 아웃소싱 규모 증가에 따라 향후 글로벌 CDMO 시장 규모는 지속적으로 성장할 것으로 예상되고 있습니다. 다만, 글로벌 바이오 시장은 급격한 변화를 겪어 왔으며, 특히 바이오 산업에 대한 규제 변화, 특허 및 지적재산권 보호에 관한 우려 증가, 환자 보호법 강화, 바이오 의약품 약가 규제 및 배상 강화 등의 요인으로 글로벌 제약사들의 아웃소싱 전략에도 급격한 변화가 발생할 가능성을 배제할 수 없습니다. 만약 향후 글로벌 제약사들이 자체 생산 비중을 확대하는 전략 변경이 현실화될 경우, 당사와 같은 CDMO 사업자의 수익성 및 매출 실적에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하시기 바랍니다.
|
다. 신약개발 특성에 따른 위험 |
신약개발 사업은 사업화에 성공 시 통상적으로 특허권에 의해 일정기간 동안 독점권으로 보호받게 되며, 시판 승인 후 일정기간 동안 독점 판매기간을 인정받을 수도 있습니다. 대부분의 국가에서 특허 존속기간은 출원 후 20년이며, 특허의 존속기간과 관계없이 신약의 경우, 미국은 시판 승인 후 5년 이상의 시장독점권, EU는 10년의 시장독점권, 국내은 6년의 시장독점권을 보장받을 수 있습니다. 이처럼 특허권 및 독점판매권(시장독점권)을 통해 일정기간 배타적 수익을 보장받을 수 있기 때문에 글로벌 블록버스터급 신약 개발에 성공 시 막대한 수익을 창출할 수 있는 고부가가치 사업입니다.
그러나, 신약 개발 과정은 후보물질의 유효성과 안전성을 평가하고 이에 대한 근거를 마련하기 위한 중요한 과정으로 관련 규정과 절차를 반드시 준수해야합니다. 먼저, 타겟 질환에 대해 약리적인 효과가 있을 것으로 예상되는 후보물질 탐색 및 발굴을 시작으로, 세포와 동물을 가지고 하는 전임상 연구(preclinical study)와 사람을 대상으로 하는 임상 연구(clinical study)를 통해 후보물질의 안전성과 유효성에 대한 검증을 분석하여, 최종적으로 규제 당국으로부터 의약품 품목 허가를 받아야 합니다.
특히, 건강한 성인 또는 환자를 대상으로 하는 임상시험을 진행하고자 할 때에는 효능과 안전성에 대한 각 국가의 정부규제가 엄격하여, 임상시험 이전 단계부터 엄격한 규제에 의해 축적된 다양한 데이터를 각 국가의 규제 당국에 제출하여야 합니다. 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험), 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험 계획 승인(IND)을 통과하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 또한, 임상시험을 성공적으로 마치고 신약허가신청(NDA) 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 규정을 따라야 하며, 약물을 시판한 이후에도 부작용을 추적하여 검토하는 제4상 임상 연구를 진행해야 합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 제품으로의 성공확률이 매우 낮은, 대표적인 High Risk, High Return, Long Term Investment 사업입니다.
| [신약 개발 과정] |
|
| 출처: 한국임상시험포털 |
[신약 개발 과정]
| 단계 | 내용 | Time/ scope |
|---|---|---|
| 신약 후보 물질 도출을 위한 탐색(Discovery) | 의약학적 개발 목표(목적 효능, 작용기전 등)를 설정하여 개발 대상 물질 선정 | 2~5년 |
| 전임상시험 (Pre-Clinical Trial) |
도출된 후보 물질의 유효성과 독성을 검증하기 위해 동물 모델 대상 생화학적 실험 | 2~3년 |
| 임상시험계획승인신청 (IND Application) |
전임상 시험을 통해 후보물질의 안전성과 유효성이 검증되면 사람을 대상으로 연구를 수행하기 위해 FDA/식약처에 임상시험계획에 대한 승인을 신청 | 0.5년 |
| 임상 1상 | 건강한 지원자 또는 대상 시험 질병의 위험도가 높은 환자를 대상으로 내약성, 부작용 및 약물의 체내 동태 등 안전성 확인 | 0.5~1년 10~100명 건강한 지원자 |
| IND 신청 | 0.5년 | |
| 임상 2상 | 소수의 환자를 대상으로 안전성과 예비효능을 평가하여 신약 가능성과 최적 용량 용법을 결정하고 치료 효과를 탐색 | 1~2년 100명 이상의 환자 |
| IND 신청 | 0.5년 | |
| 임상 3상 | 가장 규모가 큰 임상시험 단계로 다수의 환자를 대상으로 안전성과 유효성에 대한 추가 정보 및 확증적 자료를 확보 | 2~4년 1000명 이상의 환자 |
| 신약 승인(NDA) | FDA/식약처가 제약 업체에서 제출한 모든 전임상 및 임상 시험 자료를 검토하여 최종 시판 허가 여부를 결정 | 0.5~2년 검토 |
| 임상 4상 or PMS(시판 후 조사) | 추후 연구 및 모니터링 |
출처) 당사 제시
신약개발 과정에 소요되는 기간 및 비용 분석에 관하여 분석기관마다 편차는 있으나, 일반적으로 신약후보물질이 초기 연구 및 임상시험을 거쳐 출시되기까지 보통 10~15년 정도가 소요되는 것으로 알려져 있습니다. 이러한 시간적, 재정적 막대한 투자에도 불구하고, 신약개발의 최종 성공률은 다소 낮은 수준입니다.
| [단계별 임상 성공률 추이] |
|
| 출처: Estimation of clinical trial success rates and related parameters. Biostatistics. Wong et al(2018) |
본 공시서류 제출일 현재, 당사 파이프라인의 연구개발 정도는 아래와 같습니다.
| [당사 파이프라인 적응증 및 진행단계] |
|
구분 |
품목 |
적응증 |
연구시작일 |
현재 진행단계 |
비고 |
||
|---|---|---|---|---|---|---|---|
|
단계(국가) |
승인일 |
||||||
|
핵산 기반 바이오 신약 |
DNA 백신 |
GLS-5300 |
메르스 예방 |
2015년 |
임상1/2a상 완료(한국) |
2017년 |
공동개발 |
|
GLS-5700 |
지카바이러스예방 |
2016년 |
임상1상 완료(푸에르토리코) |
2016년 |
공동개발 |
||
|
GLS-5310 |
코로나19 예방 |
2020년 |
임상1/2a상(한국) |
2020년 |
정부보조금 |
||
|
GLS-6150/GLS-6100 |
C형 간염예방 |
2017년 |
임상1상 완료(한국) 후 중단 |
2018년/2021년 |
정부보조금 |
||
|
VGX-6150 |
만성C형 간염치료 |
2011년 |
임상1상 완료(한국) 후 중단 |
2013년 |
공동개발 |
||
| GLS-5140 |
중등열성혈소판감소 증후군예방 |
2015년 |
전임상 |
- |
정부보조금 |
||
|
핵산기반 단백질 및 단클론항체의약품 |
GLS-7100, 혈액응고 8인자 dRP |
A형 혈우병 치료 |
2014년 |
신약후보물질 |
- |
- |
|
|
GLS-8000, B형간염면역글로블린 Plas-mAb |
HBV 감염예방 |
2017년 |
신약후보물질 |
- |
특허양수 |
||
|
항염증 치료 신약 |
천연물 유래성분 |
GLS-1200, |
항염증제(만성 축농증치료) |
2018년 |
임상2상(미국) |
2020년 |
라이선스인 |
|
코로나19 감염 예방약물 |
2020년 |
임상 2상 (미국) |
2020년 |
라이선스인 | |||
|
저분자량 화학합성 성분 |
GLS-1027 |
당뇨병성 신장질환치료 |
2019년 |
임상2상 준비(미국) |
- |
- |
|
|
코로나19 중증방지 약물 |
2020년 |
임상2상(미국), 임상2상(북마케도니아, 불가리아, 한국) |
2020년, 2021년 |
- | |||
| 출처) 당사 제시 주) 현재 중단된 연구개발은 중단된 파이프라인에도 포함되어 있으며, 향후보고서에는 중단파이프라인에만 포함할 예정임 |
주요 파이프라인 연구개발 세부 현황은 다음과 같습니다.
(가) 품목 : GLS-5300
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
메르스(중동호흡기증후군) 예방 |
|
3. 작용기전 |
GLS-5300 접종으로 체내 메르스 바이러스 특이적 T세포 면역반응 및 항체 면역반응이 유도되어, 메르스 바이러스의 감염을 억제하여 예방에 성공할 수 있음 |
|
4. 제품의 특성 |
기존백신대비 백신에 의한 메르스 감염우려 전무하고, 대장균 발효 및 정제에 의한 백신의 생산으로 생산기간이 단축되고 가격 경쟁력이 우수하며, 주성분인 플라스미드 DNA특성한 장기보관이 가능하여 응급백신으로 개발 용이 |
|
5. 진행경과 |
[임상 1상]-글로벌 임상 임상시험승인일 : 미국 FDA(2015.11.19), 임상시작일 : 2016.1.28, 진행국가 : 미국, 1상임상 예비결과 발표 (2018.06.27), 1상임상결과 논문게재 (Lancet Infectious Disease, 2019.7.25) [임상 1/2a상]-국내 임상 임상시험승인일: 국내 식품의약품안전처(2017.09.17), 임상시작일: 2018.9.5, 1/2a상 임상중간결과 발표(2020.5), 1/2a상 임상시험 종료(2020.4.24) |
|
6. 향후 계획 |
당사와의 계약에 따라 당사에서는 국내 1/2a상 임상시험을, 이노비오사는 임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사가 수행하기로 함. 당사의 1/2a 임상시험은 완료됨(2020.04.24). 이후, 이노비오사에서는 CEPI의 연구비를 지원받아 수행한 임상2상의 초기 데이터 분석 결과에 의하여 중단함(2022.11.17). |
|
7. 경쟁제품 |
개발에 성공한 제품은 없으며 전임상과 임상단계에서 개발 중 |
|
8. 관련논문등 |
A synthetic consensus anti-spike protein DNA vaccine induces protective immunity against Middle East respiratory syndrome coronavirus in nonhuman primates (Sci Transl Med. 2015) Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1,open-label, single-arm, dose-escalation trial (Lancet Infect Dis. 2019) |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
미국 이노비오사와 메르스백신의 공동연구계약을 체결하고 공동개발 (2015.05.27) |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
- 전염병대비혁신연합(CEPI)은 이노비오사와 계약을 체결하여 전세계 응급 비축용 백신개발 지원 (2018.04.12) : 당사는 자회사인 VGXI를 통해 전세계 메르스 응급백신의 생산과 공급을 담당 - 국내에서 메르스 DNA백신의 개발 및 국가기관에 응급백신을 공급하기 위해, 2016년 12월7일 |
출처) 당사 제시
(나) 품목 : GLS-5700
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
지카(Zika) 바이러스 감염 예방 |
|
3. 작용기전 |
GLS-5700 접종으로 체내 지카 바이러스 특이적 T세포 면역반응 및 항체 면역반응이 유도되어, |
|
4. 제품의 특성 |
기존백신대비 백신에 의한 지카 바이러스 감염우려 전무하고, 대장균 발효 및 정제에 의한 백신의생산으로 생산기간이 단축되고 가격 경쟁력이 우수하며, 주성분인 플라스미드 DNA 특성한 장기 |
|
5. 진행경과 |
[임상 1상]-미국,캐나다 임상시험승인일 : 미국 FDA(2016.6.20), 임상시작일 : 2016.7.27, 진행국가 : 미국, 캐나다, 1상 [임상 1b상]-푸에르토리코(미국령) 임상시험승인일 : 미국 FDA(2016.8.30), 임상시험대상자 모집등록 완료: 2017.6.16, 임상시험 종료: 2018.6 |
|
6. 향후 계획 |
임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사가 수행하기로 계약하였으므로 당사는 임상 1상과 1b상 완료 후 추가 임상은 중단함. |
|
7. 경쟁제품 |
NIH/VRC 705 임상 2상 완료됨. NIAID(미국국립알레르기·감염병연구소)/ZPIV, NIAID(미국국립알레르기·감염병연구소)/rZIKV, Moderna TX/mRNA-1893 등 임상 1상 대상자 모집중이거나 완료됨. |
|
8. 관련논문등 |
Safety and Immunogenicity of an Anti-Zika Virus DNA Vaccine -- Preliminary Report (2017, The |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
미국 이노비오사와 지카 DNA백신의 공동연구계약을 체결하고 공동개발 (2016.1.22) |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
해당사항 없음 |
출처) 당사 제시
(다) 품목 : GLS-5310
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
코로나19 감염증 예방 |
|
3. 작용기전 |
정상인에게 GLS-5310 접종으로 체내 SARS-CoV-2 바이러스 특이적 T세포 면역반응과 항체면역반응이 유도되어, SARS-CoV-2 바이러스의 감염을 억제함으로서 코로나19 감염증을 예방 |
|
4. 제품의 특성 |
약독화 생백신 대비 DNA백신은 감염의 우려가 없음, 바이러스에 대한 항체 면역반응과 더불어 강력한 세포성 면역반응 유도할 수 있음 |
|
5. 진행경과 |
[신약후보물질 연구] 2021년1월21일 고용량군의 등록을 시작하여, 2021년3월4일 임상1상 연구 대상자45명의 등록을 완료하고, 2021년5월 모든 대상자의 접종이 완료되었고 2021년7월8일, 임상1상 중간분석1차결과를 확인하고 자료모니터링위원회 심의를 통과하여 임상2a상에 진입, 피내접종과 비강내접종을 병용하는 임상시험을 미국에서 수행하기위해, 2020년 1월 19일 미국 FDA에 임상시험계획 승인 신청을 하여 2021년 7월27일 임상 승인을 받음. 2021년9월6일, 국가임상시험지원재단과 코로나19백신 임상2a상 대상자 모집지원 협약을 체결. 2023년 3월 자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)을 이용한 코로나19 DNA 백신(GLS-5310)의 안전성 및 면역원성에 대한 임상 1상 결과를 국제감염병학회 (International Society for Infectious Diseases, ISID) 학술지인 국제감염질환저널(International Journal of Infectious Diseases)에 게재. 2023년 5월 SARS-CoV-2를 포함한 전염병 대비를 위한 DNA 백신 관련 내용의 리뷰논문을 Vaccines 학술지에 게재. 2023년 6월 임상 1상 분석결과 중에서 GLS-5310 DNA 기초접종 후 mRNA 백신을 추가접종한 대상자들에 대한 면역원성 결과를 Vaccine (Elsevier) 학술지에 게재. [1상] 임상시험 기간 동안 중대한 이상반응이나 중대한 약물이상반응 또는 시험약 투약 중단을 유도한 TEAE는 단 한 건도 발생하지 않음. [2a상] 임상시험 기간 동안 Grade 4에 해당하는 TEAE 발현은 없었고, 중대한 이상반응 또는 특별 관심 이상반응은 단 한 건도 발생하지 않음. |
|
6. 향후 계획 |
기초백신 접종을 위한 대상자 모집이 현 상황에서는 불가함. 추가접종(부스터 샷)의 1상 임상시험을 미국에서 진행 중이며, 부스터 접종 여부에 대한 임상결과를 분석, 평가하고자 함. |
|
7. 경쟁제품 |
DNA 백신(없음), mRNA 백신(큐라티스/QTP104, 아이진/EG-COVID, 에스티팜/STP2104), 합성항원 백신(SK바이오사이언스/GBP510, 유바이오로직스/EuCorVac-19) 등 (국내 2023년 5월 기준) |
|
8. 관련논문등 |
- Immune response enhancement with GLS-5310 DNA primary vaccine against SARS-C oV-2 followed by administration of an mRNA vaccine heterologous boost. (Vaccine-Elsevier, 2023, 06) - DNA Vaccines for Epidemic Preparedness: SARS-CoV-2 and Beyond. Vaccines. (Vaccines, 2023, 05) - Safety and immunogenicity of the bi-cistronic GLS-5310 COVID-19 DNA vaccine delivered with the GeneDerm suction device. (Int J Infect Dis., 2023, 03) - Molecular distribution in intradermal injection for transfer and delivery of therapeutics. (Front. Drug Deliv., 2023, 01) |
|
9. 시장 규모 |
비록 긴급사용허가를 받아 시판중인 제품이 존재하지만, 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
질병관리본부 국립보건연구원 용역연구개발 (2020.4) |
|
11. 정부보조금 |
- 2020년 3월27일 ‘2020년도 질병 관리본부 긴급 현안 지정 학술연구개발 용역과제’인 ‘핵산백신 플랫폼을 활용한 코로나19 백신후보물질 개발 사업’에 우선 순위 협상대상자로 선정 (2020년 4월부터 2020년 12월까지 145백만원을 지원 받음) - 2021년2월4일, 코로나19백신인 GLS-5310의1/2a상 임상개발비용인98억원중73억원의 연구비를 정부로부터 지원을 받는 협약을‘코로나19 치료제 백신 신약개발사업단”과 체결 |
|
12. 기타 사항 |
해당사항없음 |
출처) 당사 제시
(라) 품목 : GLS-6150/GLS-6100
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
C형간염 예방 |
|
3. 작용기전 |
정상인(또는 만성 C형간염 완치자)에게 GLS-6150/GLS-6100 접종으로 체내 HCV 바이러스 특이적 T세포 면역반응 이 유도되어, HCV바이러스의 감염 및 재감염을 억제하여 예방에 성공할 수 있음 |
|
4. 제품의 특성 |
기존치료제로 완치된 만성C형간염 환자나 고위험 정상인을 대상으로 HCV 감염 및 재감염을 예방 |
|
5. 진행경과 |
[임상 1상]- GLS-6150 (C형 간염 완치자 대상) 임상시험승인일 : 국내 식품의약품안전처(2018.2.5), 임상시작일 : 2018.9.4, [임상 1상]- GLS-6100 (정상인) 임상시험 승인일: 국내 식품의약품안전처(2021.5.20) |
|
6. 향후 계획 |
보건복지부의 후속과제 지원 계획에 따라 GLS-6100(고위험 정상인 대상) 임상시험 추진 계획이었으나, 이후 과제에 대한 후속 지원이 없어 개발 종료함 |
|
7. 경쟁제품 |
NIAID, ReiThera (임상 2상) |
|
8. 관련논문등 |
Preclinical evaluation of multi-antigenic HCV DNA vaccine for the prevention of Hepatitis C virus |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 |
|
10.공동개발 |
미국 이노비오사와 연구계약을 체결하여 아시아 지역독점개발권리 확보 (2011.10.7) |
|
11. 정부보조금 |
보건복지부의 기술개발사업 면역백신개발과제로 선정(2017년 6월부터 2020년 12월까지 |
|
12. 기타 사항 |
해당사항 없음 |
출처) 당사 제시
(마) 품목 : VGX-6150
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
만성 C형 간염 환자의 면역치료 |
|
3. 작용기전 |
만성C형간염 환자에 VGX-6150 접종으로 체내 HCV 바이러스 특이적 T세포 면역반응 이 유도되어, HCV바이러스에 감염된 세포를 제거하거나 HCV 바이러스 의 방출을 억제하여 만성C형간염을 |
|
4. 제품의 특성 |
기존 만성C형간염 면역치료제 대비 부작용이 없고, DAA 등의 항바이러스 의약품 대비 면역기억작용으로 지속적인 만성C형간염 억제 효과를 보임, 바이러스 항원의 변이에 대비하기 위해, 공통 |
|
5. 진행경과 |
[임상 1상]-한국 임상시험승인일: 국내 식품의약품안전처(2013.10.8), 진행국가: 한국, 임상결과 발표: 2020.2.20 - VGX-6150을 만성 C형 간염 환자를 대상으로 단계적으로 증량하였을 때 내약성이 양호하였고, 모든 용량군에서 안전성에 위배되는 특이사항은 관찰되지 않음. - VGX-6150을 만성C형 간염 환자 및 표준치료에 실패한 환자를 대상으로 단계적 증량 이후 최고 용량인 6mg을 추가 투여하였을 때, 내약성이 우수하고 안전성 측면에서 양호한 임상시험용의약품으로 평가됨. |
|
6. 향후 계획 |
2상임상단계의 진입을 보류 |
|
7. 경쟁제품 |
Chron Tech Pharma (임상 2상)-임상실패, NIAID/AdCh3NSmut1, MVA-NSmut(임상 1/2상) |
|
8. 관련논문등 |
- Preclinical evaluation of multi-antigenic HCV DNA vaccine for the prevention of Hepatitis C virus |
|
9. 시장 규모 |
초기 임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 |
|
10. 공동개발 |
미국 이노비오사와 연구계약을 체결하여 아시아 지역독점개발권리 확보 (2011.10.7) |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
해당사항 없음 |
출처) 당사 제시
(바) 품목 : GLS-5140
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
중증열성혈소판감소증후군 예방 |
|
3. 작용기전 |
정상인에게 SFTS DNA백신 접종으로 체내 SFTS 바이러스 특이적 T세포 면역반응과 항체면역반응이 유도되어, |
|
4. 제품의 특성 |
약독화 생백신 대비 DNA백신은 감염의 우려가 없음, 바이러스에 대한 항체 면역반응과 더불어 강력한 세포성 면역반응 유도할 수 있음 |
|
5. 진행경과 |
[신약후보물질 연구] 후보물질 도출연구 착수: 2015.12, 후보물질 효능평가 완료 후 결과 논문게재(Nature Communications 2019), 전임상연구 완료 : 2020.10 실험동물에서 백신 후보물질 선정 및 용량 용법 최적화 연구, 임상시험1상 계획 하에 식품의약품안전처 사전상담과와 3차례 사전상담 진행: 2022.08.31(1차), 2022.12.05(2차) , 2023.06.07(3차) |
|
6. 향후 계획 |
국내1상 임상시험 IND filing 중임 |
|
7. 경쟁제품 |
DNA 백신 경쟁제품 없음, 국내외 최초 백신개발. 물질발굴 단계이거나 비임상연구 단계(Moderna TX/국립감염병연구소, 에스티팜 mRNA 백신, 바이로큐어(주) 재조합 백신, mRNA백신)에서 개발 중임. |
|
8. 관련논문등 |
Severe fever and thrombocytopenia syndrome virus infection: Considerations for vaccine evaluation of a rare |
|
9. 시장 규모 |
초기 개발단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
한국과학기술원과 복지부 국책연구개발과제에 참여하여 공동개발 (2015.12) |
|
11. 정부보조금 |
보건복지부의 기술개발사업 면역백신개발 과제로 선정(2015년12월부터2019년11월까지180백만원을 지원받았음), 보건복지부 백신실용화기술개발사업의 미래대응 미해결 감염병 신규백신 개발 분야의 지원과제로 선정되어 임상시험승인까지의 연구개발비용을 지원받게 되었음(2020년 10월부터 2022년 12월까지). 협약연장함(2023년 12월 31일까지) |
|
12. 기타 사항 |
중증열성 혈소판 감소 증후군 예방 DNA백신에 대한 특허 출원 (대한민국 특허청) 출원번호/일자: 10-2018-0074418/2018.6.28 2020년2월4일 대한민국 특허 등록 |
출처) 당사 제시
(사) 품목 : GLS-7100
|
1. 구분 |
핵산기반 바이오신약 - 혈액응고 8인자 dRP |
|
2. 적응증 |
A형혈우병(8인자 결핍증) 치료 |
|
3. 작용기전 |
혈액응고 8인자의 돌연변이로 인한 A형 혈우병 환자에게핵산기반 혈액응고 8인자 dRP을 투여하면, 투여부위와 간에서 발현 분비된 단백질 치환 목적의 치료물질이 다른 응고인자들과 상호작용하여 혈액응고 기작이 원활하게 회복되도록 함으로써 A형 혈우병을 치료 |
|
4. 제품의 특성 |
기존 혈액응고 8인자 단백질의약품의 경우 반감기가 짧은 이유로 2-3일에 한번씩 주사해야 하는 단점이 있지만, 핵산기반 혈액응고 8인자는 1회 투여로 체내 지속발현 효과를 기대할 수 있어 투여회수를 줄일 수 있음. 기존 혈액응고 8인자 단백질 약제 투여시 항체 생성으로 인한 저항성이 부작용 증가 및 약효 감소로 나타나는 문제가 있지만, 핵산기반 치료제의 경우는 체내에서 혈액응고 8인자를 생성하므로 이러한 저항성 문제가 나타날 가능성이 낮고 전달체를 이용하여 간에서 생성되도록 유도할 수 있으므로 보다 효율적인 효능을 기대할 수 있음.현재 임상개발중인 타사 바이러스 운반체 이용 치료제의 경우 바이러스 벡터에 대한 면역반응으로 인하여 반복적인 투여가 어려운 반면, 핵산기반 혈액응고 8인자 의약품의 경우 바이러스 벡터에 대한 면역반응이 없어 반복적인 투여가 가능. 또한, 유전자 치환 목적으로 사용하는 혈액응고 8인자 바이러스 벡터의 경우에 매우 비싼 약가가 책정되어 치료제로 사용하기에 경제적인 부담이 매우 높지만, 핵산기반 혈액응고 8인자는 상대적으로 저렴한 가격에 치료받을 수 있음. |
|
5. 진행경과 |
[신약 후보 물질 연구] 후보물질 도출연구 착수: 2014.10, 후보물질 제작 완료/ 혈액 응고8인자의 체내 생성량과 활성을 높이기 위한 후보물질 개선연구 진행 중. 코로나19 연구개발에 집중하기 위해 추가적인 후보물질 개선연구를 2022년 하반기까지 잠정 연기. |
|
6. 향후 계획 |
혈우병 동물모델에서 개선된 후보물질의 효능평가 완료(2024년 상반기). |
|
7. 경쟁제품 |
Altuviiio/BIVV001, efanesoctocog alfa (Sanofi) - hFVIII replacement therapy IV/QW, FDA approved 시판중 (2023. 2), SB-525/PF-07055480 (Sangano Therapeutics, Pfizer) - recombinant AAV2/6 hFVIII gene therapy, 임상 3상 진행중 (2020), BMN270 (BioMarin Pharmaceutical) - AAV5-hFVIII, 임상 3상 진행중 (2018), Afstyla, NBP-601 (SK Chemical, CSL Behring) - hFVIII recombinant single chain IV/DIW, FDA approved 시판중 (2016. 5). |
|
8. 관련논문등 |
Ultrasound-mediated gene delivery of factor VIII plasmids for hemophilia A gene therapy in mice (Molecular Therapy Neucleic Acids, 2022) Treatment of Hemophilia A Using Factor VIII Messenger RNA Lipid Nanoparticles (Molecular Therapy Neucleic Acids, 2020) |
|
9. 시장 규모 |
2021년 128억 달러에서 연평균 7.5%씩 성장하여, 2031년에는 269억 달러에 이를 것이라고 전망됨 (제약산업 분석기업; Allied Market Research) |
|
10.공동개발 |
해당사항 없음 |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
해당사항 없음 |
출처) 당사 제시
(아) 품목 : GLS-8000
|
1. 구분 |
핵산기반 바이오신약 - B형간염 면역글로블린 Plas-mAb |
|
2. 적응증 |
B형간염 바이러스(HBV) 감염 치료 및 예방 |
|
3. 작용기전 |
간이식 예정자 또는 모계 감염 우려자에 B형간염 면역글로블린 Plas-mAb을 투여하면, 투여부위에서 발현 분비된 치료물질이 혈중에서 HBV S 항원을 포함하고 있는 바이러스 감염성 입자를 제거하고, HBV preS1을 통한 바이러스가 숙주 세포로의 침입을 방해함으로서 HBV 감염을 예방 |
|
4. 제품의 특성 |
기존 B형간염 바이러스 면역글로불린이 HBV S 면역글로불린에 한정되어 있는 것에 반해 S 면역글로불린과 preS1 면역글로불린을 동시에 투여함으로써 HBV 감염을 치료하고 예방할 수 있음. HBV 면역글로블린이나 치료용 백신을 투여하는 치료방법에 비하여, 핵산기반 HBV 면역글로블린 Plas-mAb 치료제는 체외에서 생산한 단백질 제재를 체내에 투여함으로써 발생할 수 있는 부작용을 최소화할 수 있으며, 체내에서 지속적으로 mAb를 생성할 수 있으므로 일정기간 동안 지속적인 약효를 기대할 수 있음.면역글로불린치료제 생산의 어려움으로 고가인 기존 HBV 면역글로불린 대비, 핵산기반 항체치료제의 특성 상, 상대적으로 낮은 가격의 면역글로불린을 제공함으로써 기존 시장 침투가 용이하고 신규 시장 확보가 가능함. |
|
5. 진행경과 |
[신약후보물질 연구] 후보물질 도출연구 착수 : 2017.4, 3종의 후보물질 플라스미드 제작 및 연구용 시료 생산 완료/ 동물세포에서 발현/항체생성과 항원 결합능력 확인. 실험동물에서4종의 후보물질로부터 항체 생성 및 체내 분포 경향 분석 연구 진행 중이고, 항preS1 면역글로블린과 항S 면역글로불린을 동시에 처리하면 우수한 B형간염 바이러스 억제효과를 확인. |
|
6. 향후 계획 |
높은 국내 분포를 보이는 B형 간염 바이러스 유전자C형에 대한 억제 효과를 평가하는 동물실험 (2024년 상반기) |
|
7. 경쟁제품 |
기존 시장에서 B형 간염 면역 글로불린이 허가되어 사용되고 있음 (예 : Cangene Corporation 사 HepaGamB, Grifols 사 HyperHEPB, Biotest Pharmaceuticals Corporation 사 Nabi-HB 등), GC녹십자사의 GC1102 (재조합 HBV 면역글로불린) : HBV 관련 간이식 환자 대상으로 임상 2/3상 시험 진행 중 (2018), 차백신연구소의 CVI-HBV-002 - 신규 항원(L-HBsAg)과 면역증강제 병용요법으로 HBV 치료용 백신 임상 2상 진행중 (2023), 현재 개발되고 있는 preS1 면역글로불린 제품은 없음. |
|
8. 관련논문등 |
Generation and Characterization of a Neutralizing Human Monoclonal Antibody to Hepatitis B Virus PreS1 from a Phage-Displayed Human Synthetic Fab Library (J. Microbiol. Biotechnol., 2018) Construction and Characterization of an Anti-Hepatitis B Virus preS1 Humanized Antibody that Binds to the Essential Receptor Binding Site (J. Microbiol. Biotechnol., 2017) |
|
9. 시장 규모 |
세계 B형 간염 치료제 시장 규모는 2022-2026년 4억 7,149만 달러의 증가가 전망되나(Global Hepatitis B Therapeutics Market 2022-2026),핵산기반 면역글로블린 연구개발은 초기 개발단계이고 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움. |
|
10.공동개발 |
해당사항 없음 |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
강원대학교 산학협력단이 보유한 B형간염 바이러스의 preS1에 특이적으로 결합하는 항체 2종에 대한 특허와 기술을양수함으로서 독점적 개발권리를 확보함 (계약체결일 : 2017.4.5) 1종 후보물질 국내 특허 등록 완료 (등록번호 : KR 101864693 B1 / 등록일자: 2018.5.30) |
출처) 당사 제시
(자) 품목 : GLS-1200
|
1. 구분 |
항염증치료신약-천연물유래성분, 쓴맛수용체신호전달물질 |
|
2. 적응증 |
만성 축농증 치료, 코로나19 감염 방지 |
|
3. 작용기전 |
키나(Cinchona)나무의 나무껍질에서 추출한 성분인 Quinine은 호흡기관인 부비동의 쓴맛 수용체를 자극하여 체내 항염증물질의 분비를 유도함으로서, 염증의 원인인 세균을 제거하여 만성 축농증을 치료. 코로나19 및 독감을 포함한 다른 바이러스에 의한 감염을 예방 |
|
4. 제품의 특성 |
Quinine은 지난 150년간 말라리아치료제등의 성분으로 이용되었고 우수한 안전성이 확인됨, 비염 및 축농증 치료시 Quinine과 반응성이 있는 쓴맛수용체를 지닌 환자를 진단법에 의해 선별한다면 치료 효율을 극대화 할 수 있음, Quinine을 코 스프레이로 투약하면 코 상피세포내에서 산화질소(NO) 가스를 생성하여 세포 밖으로 분비하게 됨. 코로나19 바이러스가 코를 통해 인체에 진입하면 상기도(upper respiratory tract)에 존재하는 코 상피세포(nasal epithelial cell)에 감염되어 세포 안으로 바이러스 유전자가 삽입되고 바이러스 복제가 일어남. 이때, 코로나19 바이러스가 감염된 세포 안으로 Quinine투약으로 생성된 산화질소(NO) 가스가 이동하여 바이러스의 복제를 저해함으로써 감염을 방지하게 됨 |
|
5. 진행경과 |
[임상 1/2상] 임상시험승인 및 시작일: 미국 FDA(2015.10), 진행국가 : 미국, 임상 완료일 : 2017년 5월 [임상2상] 축농증 치료 임상시험승인, 미국FDA(2020.4) [임상2상] 코로나19 감염 방지 임상시험승인, 미국FDA(2020.4), 임상시험대상자의 50%이상의 등록이 완료(2020.9), 미국 내 코로나19 감염병 유행의 진원지이며 다수의 감염사례가 발생하고 있는 루이지에나주 바톤루지시에 2차 임상시험실시기관을 추가(2020,9). 임상대상자를 일반인으로 확대해서 진행할 수 있도록 IRB승인 득함(2021.4). 대상자 모집에 대해 지속적인 노력으로 184명 등록(2022.12). 하지만 코로나 19 감염 대상자를 모집하는데 고충이 큼. |
|
6. 향후 계획 |
만성 축농증 치료제 : 코로나19 감염병 사태에 따라 2상 임상시험 착수. 축농증 환자를 대상으로 하며, 내시경 부비강 수술을 받은 환자에게 GLS-1200 혹은 위약을 치료받게 한 이후에 질환에 감염되는 비율을 평가하는 것으로 임상시험이 설계되었으나, COVID-19 관련 임상시험으로 인해 중단함. 코로나19 감염방지 코스프레이 치료제 : 임상2상연구 종료 (2022년) : 2023년에 임상2상 연구를 종료하여, 임상결과 분석 및 임상시험결과보고서 작성을 수행할 계획임. |
|
7. 경쟁제품 |
유사한 작용기전의 경쟁제품 없음 |
|
8. 관련논문등 |
Bitter Tastes Bodyguards (2106, Scientific American), Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 |
|
10. 공동개발 |
해당사항없음 |
|
11. 정부보조금 |
해당사항없음 |
|
12. 기타 사항 |
미국 University of Pennsylvania가 보유한 호흡기 감염의 치료제 개발을 위한 쓴맛 수용체 신호 |
출처) 당사 제시
(차) 품목 : GLS-1027
|
1. 구분 |
항염증치료신약-저분자량 화학합성성분 |
|
2. 적응증 |
당뇨병성 신장질환등 자가면역의 치료, 코로나19 감염병 중증방지 치료 |
|
3. 작용기전 |
당뇨병성 신장질환의 원인인 , Th 17 세포를 직접억제함으로 IL-17생성을 감소시킴으로서 치료함 |
|
4. 제품의 특성 |
GLS-1027은 염증질환의 치료에 이용되는 경구용 의약품으로, RA, 1형당뇨병, Colitis, Uveitis에서 효능을 확인하였고, 1상임상연구를 통해 약물의 안전성을 확인함 |
|
5. 진행경과 |
[임상 1상] 임상시험승인 및 시작일: 미국 FDA(2008.2), 진행국가 : 미국, 임상 완료일 : 2008년 9월 [임상2상]-임상승인 및 시작일 : 미국 FDA(2020.11), 북마케도니아(2021.7.2.), 국내 식약처(2021.9.8). 국내 임상시험 개시방문 완료(2022.4.8)하고 대상자 모집 및 등록 착수, 코로나19 감염된 중등증 입원환자 수의 급격한 감소로 인해 환자 모집의 어려워 국내 임상시험 조기종료(2022.08), 미국과 북마케도니아 포함한 3개국에서 132명 대상자 등록 완료(2022.6.22) 및 임상시험 완료(2022.12), 현재 결과 분석 중임. |
|
6. 향후 계획 |
코로나19감염후 심각한 폐질환 방지 2상임상연구 종료 (2022년) |
|
7. 경쟁제품 |
MTX(methotrexate) : 경구용 anti-folate치료제, 핵산대사효소억제, 일시적 염증억제, 35% 치료율 |
|
8. 관련논문등 |
Clin Immunol. 2007, JPET 2006, EJP 2008, BJ Pharmacol 2008 |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10. 공동개발 |
해당사항없음 |
|
11. 정부보조금 |
해당사항없음 |
|
12. 기타 사항 |
해당사항없음 |
출처) 당사 제시
이와 같이 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실을 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있으므로 투자자 여러분께서는 이 점 유의하여 주시기 바랍니다.
|
라. 핵심연구인력 유출 위험 |
당사가 영위하고 있는 바이오 관련 산업은 기술 수준이 높고 변화의 정도가 빠르게 진행 되고 있기 때문에 핵심 연구인력을 확보하는 것이 중요합니다. 따라서 핵심 연구 인력의 이탈이 발생하는 경우 매출 및 영업에 부정적인 영향을 미칠 위험이 있습니다.
바이오 기술 개발에는 연구 인력의 능력이 매우 중요하게 작용하며, 지속적으로 우수한 인재를 유치하는 것이 회사의 성과를 결정하는 주요한 요인입니다. 특히 당사와 같은 중소/벤처기업은 인력의 규모가 작기 때문에 개인이 회사의 연구 성과에 미치는 비중이 크다고 할 수 있습니다.
당사의 연구개발 전문인력은 2023년 3분기 기준 박사급 17명, 석사급 21명 등, 총 44명의 연구인력을 보유하고 있으며, 주요 핵심 연구인력이 관련 업계에서 장기간의 경력과 전문지식을 확보하고 있습니다. 당사의 연구개발 조직도와 연구 인력 현황은 다음과 같습니다.
<연구개발 조직 구성>
|
구 분 |
팀 |
주요업무 |
|---|---|---|
|
기업부설 R&D 연구소 |
핵산기반 백신 및 |
- 핵산 기반 바이오 의약품의 타겟 발굴 및 전임상 연구 - 오픈 이노베이션을 통한 바이오 의약품 혁신 기술 개발 - 신약개발 파이프라인 개발 및 국내외 현황과 특허 조사 |
|
신약개발본부 |
임상개발팀, |
- 핵산 기반 백신 및 항염증 치료 의약품의 국내 IND승인 및 임상시험 일정 및 진도 관리 - 임상 효능 평가를 위한 임상검체 면역반응 분석 - IND package의 Non-GLP 비임상시험 수행 및 분석 |
|
글로벌임상개발 본부 |
임상면역학 실험실 |
- 핵산 기반 바이오 신약과 항염증 치료 신약의 국내외 임상면역원성 평가시험 개발, 수행 및 관리 |
|
Clinical Project Management 팀 |
- 핵산 기반 바이오신약과 항염증 치료신약의 글로벌 임상시험 관리 |
출처) 당사 제시
<조직도>
 |
|
연구소 조직도 |
<연구개발 인력 현황>
| 기준 : 2023년 09월 30일 | (단위 : 명) |
|
구분 |
인원 |
||||
|---|---|---|---|---|---|
|
박사 |
석사 |
기타 |
합계 |
||
|
기업부설 |
신약연구개발팀 전략기획팀 |
7 |
12 | 2 | 21 |
|
신약개발본부 |
임상면역반응 분석팀 임상개발팀 |
3 |
4 |
1 |
8 |
|
글로벌임상 개발본부 |
임상면역학 실험실 |
5 | 5 |
1 | 11 |
|
Clinical Project Management팀 |
2 | 0 | 2 | 4 | |
|
계 |
17 | 21 | 6 | 44 | |
출처) 당사 제시
당사의 핵심 연구인력은 최고의학책임자인 죠엘 메슬로(Joel N. Maslow), 최고과학개발책임자인 카 무투마니(Kar Muthumani), 기업부설 R&D 연구소장 이사 김원일, 신약개발본부 이사 권이주, 임상 중개연구 책임자 크리스틴 로버츠(Christine C. Roberts) 이며, 그 현황은 다음과 같습니다.
<핵심 연구인력 현황>
|
직위 |
성명 |
담당업무 |
주요경력 |
주요 연구실적 |
|---|---|---|---|---|
|
최고의학책임자 |
죠엘 메슬로 (Joel N. Maslow) |
임상개발 총괄 |
* Univ. of Virginia, Ph.D. Physics (’83) * Jefferson Medical College, M.D. (’84) * Drexel University, M.B.A. (’08) * Morristown Medical Center, Chief, Division of Infectious Diseases (‘12~’16) * St. Georges School of Medicine, Professor of Medicine (‘12~’16) * Univ. of Pennsylvania School of Medicine, Associate Dean for Research (‘02~’11) * Philadelphia VA Medical Center, Associate Chief of Staff for Research (‘02~’11) * University of Pennsylvania School of Medicine, Associate Professor of Medicine in Infectious Diseases (‘02~’11) * Philadelphia VA Medical Center, Interim Chief of Medicine (‘08~’10) * Philadelphia VA Medical Center, Section Chief for Infectious Diseases(‘99~’05) * Philadelphia VA Medical Center, Director for HIV/AIDS research (‘99~’06) * Tuft's University School of Veterinary Medicine, Adjunct Associate Professor in Comparative Medicine(‘96~’99) * Boston University School of Medicine, Associate Professor of Medicine (‘90~’99) * Inovio Pharmaceuticals, Chief Medical Officer (‘06) * New Jersey AIDS Society, Board Member (‘14~’15) * Rapid Pathogen Screening, Scientific Advisory Board (‘14~) * Examworks (formerly Network Medical Review), Third party reviewer (‘99~’15) * NMR, Third party reviewer (‘11~’12) * Aries, founding member(‘11~’13) |
[논문] * Severe fever and thrombocytopenia syndrome virus infection: Considerations for vaccine evaluation of a rare disease. (’19, HUMAN VACCINES & IMMUNOTHERAPEUTICS) * Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial (’19, Lancet Infect Dis) * Zika-Induced Male Infertility in Mice Is Potentially Reversible and Preventable by Deoxyribonucleic Acid Immunization. (’18, J Infect Dis.) * Safety and Immunogenicity of an Anti-Zika Virus DNA Vaccine - Preliminary Report. (‘17 N Engl J Med) * Vaccines for emerging infectious diseases: Lessons from MERS coronavirus and Zika virus. (‘17 Hum Vaccin Immulother.) * Preclinical evaluation of multi antigenic HCV DNA vaccine for the prevention of Hepatitis C virus infection. (’17, Sci Rep.) * Vaccine development for emerging virulent infectious diseases. (’17, Vaccine) * Persistent colonization of potable water as a source of Mycobacterium avium infection in AIDS. (’94, Lancet) * Adult pneumococcal cellulitis: case report and review of the literature. (99’, Clin Inf Dis) *Latent infection with Mycobacterium avium as a source for disseminated disease in rhesus macaques. (03’, J Infect Dis) 외 다수의 국제 학술지 논문 발표 [학회발표] * DNA vaccine (GLS-5300) against the MERS-CoV: Results of a Phase I study (’18, WHO-IVI Joint Symposium for MERS-CoV Vaccine Development) * Developments in Emerging Infectious Diseases. (’16, International Society for Vaccines) 외 다수의 학회 및 초청강연 발표 [저서] * Epidemiologic Typing Systems. Society for Healthcare Epidemiology of America (SHEA): A Practical Handbook for Hospital Epidemiologists. (’10) 외 다수의 저서 |
|
최고과학개발책임자 |
카 무투마니 (Kar Muthumani) |
전임상시험 지원 |
*Madurai Kamaraj University, India. 학사,석사,박사(’96) *Dept. of Life Sciences, Ben-Gurion University of the Negev, Israel.방문연구원 (’97) *Dept. of Biology, Texas A&M University, Texas, USA, Postdoctoral Research Fellow(’97-98) *Dept. of Pathology and Lab. Medicine University of Pennsylvania School of Medicine PA-USA, Postdoctoral Research Fellow(’98-’00) *Dept. of Pathology and Lab. Medicine, Perelman School of Medicine at the University of Pennsylvania, PA-USA, Research Associate(’00-’04) *Pathology and Lab. Medicine, Perelman School of Medicine at the University of Pennsylvania, PA-USA, Senior Research Investigator (’04-’07) *Perelman School of Medicine at the University of Pennsylvania, PA, USA. Research Assistant Professor (’08-’15) *The Wistar Institute, Philadelphia, PA, USA, Assistant Professor (’16-’19) *Director for the laboratory of Emerging Infectious Diseases, The Wistar Institute (’16-’20) *Associate Professor, The Wistar Institute, Philadelphia, PA, USA.(’20) |
[논문] *Somasundaram R, Connelly T, Choi R, Choi H, Samarkina A, Li L, Gregorio E, Chen Y,Thakur R, Abdel-Mohsen M, Beqiri M, Kiernan M, Perego M, Wang F, Xiao M, Brafford P, Yang X, Xu X, Secreto A, Danet-Desnoyers G, Traum D, Kaestner KH, Huang AC,Hristova D, Wang J, Fukunaga-Kalabis M, Krepler C, Ping-Chen F, Zhou X, Gutierrez A, Rebecca VW, Vonteddu P, Dotiwala F, Bala S, Majumdar S, Dweep H,Wickramasinghe J, Kossenkov AV, Reyes-Arbujas J, Santiago K, Nguyen T, Griss J,Keeney F, Hayden J, Gavin BJ, Weiner D, Montaner LJ, Liu Q, Peiffer L, Becker J, Burton EM, Davies MA, Tetzlaff MT, Muthumani K, Wargo JA, Gabrilovich D, Herlyn M. Tumor-infiltrating mast cells are associated with resistance to anti-PD-1 therapy. Nat Commun. 2021 Jan 12;12(1):346. PMID: 33436641 *Singh KS, Sharma R, Reddy PAN, Vonteddu P, Good M, Sundarrajan A, Choi H, Muthumani K, Kossenkov A, Goldman AR, Tang HY, Totrov M, Cassel J, Murphy ME, Somasundaram R, Herlyn M, Salvino JM, Dotiwala F. IspH inhibitors kill Gram-negative bacteria and mobilize immune clearance. Nature. 2021 Jan;589(7843):597-602. PMID: 33361818. *Choi H, Kudchodkar SB, Ho M, Reuschel EL, Reynolds E, Xu Z, Bordoloi D, Ugen KE, Tebas P, Kim J, Abdel-Mohsen M, Thangamani S, Weiner DB, Muthumani K. A novel synthetic DNA vaccine elicits protective immune responses against Powassan virus. PLoS Negl Trop Dis. 2020 Oct 29;14(10):e0008788. PMID: 33119599 *Khoshnejad M, Dia Y, Patel A, Xu Z, Zhu X, Yun K, Wojtak K, Qureshi R, Humeau L,Muthumani K, Weiner DB. DNA-Encoded Glutamine Synthetase Enzyme as Ammonia-Lowering Therapeutic for yperammonemia. Nucleic Acid Ther. 2020 Dec;30(6):379-391. PMID: 32907467. *Schultheis K, Pugh HM, Oh J, Nguyen J, Yung B, Reed C, Cooch N, Chen J, Yan J, Muthumani K, Humeau LM, Weiner DB, Broderick KE, Smith TRF. Active immunoprophylaxis with a synthetic DNA-encoded monoclonal anti-respiratory syncytial virus scFv-Fc fusion protein confers protection against infection and durable activity. Hum Vaccin Immunother. 2020 Sep 1;16(9):2165-2175. PMID: 32544376 [저서] *Chung C, Ugen KE, Sardesai NY, Weiner DB, Muthumani K: Protocols for Developing Novel Chikungunya Virus DNA Vaccines. Methods Mol. Biol. 2016; 1426:311-32: PMID: 27233283. [강연] *October 2019: “In vivo expression of plasmid encoded IgG for immune check point targets by synthetic enhanced DNA as a new tool for cancer immunotherapy”.International Society for Vaccines, October 2019, Ghent, Belgium. *September 2019: “Synthetic nucleic acid antibody prophylaxis (DMAb) + DNA vaccine confers rapid and durable protective immunity against Zika virus challenge”. Elsevier Conference: 13th Vaccine Congress 2019, Bangkok, Thailand. *Oct 2018: “Rapid response to Zika vaccine development- Lessons learned, Keystone meeting on Framing the Response to Emerging Virus Infections, Hong Kong. *June 2018: “Synthetic nucleic acid antibody prophylaxis (DMAb) + DNA vaccine confers rapid and durable protective immunity against Zika virus challenge” 2nd International Conference on Zika Virus and Aedes related Infections, Tallinn, Estonia. |
|
기업부설 R&D 연구소 연구소장 (이사) |
김원일 |
전임상 연구개발 총괄 |
* 미국 미네소타 주립대학 분자세포생물학 이학박사 (Ph.D.)(’08) * 미국 보스턴어린이병원/하버드의대 혈액종양과 박사후 연구원 * 미국 프레데릭국립암연구소 혈액줄기세포섹션 박사후 연구원 * 미국 세인트주드 어린이연구병원 종양과책임연구원(‘16~‘20) * ㈜사이러스테라퓨틱스 상무/연구위원(’20~‘21) |
[논문] * Stephanie Nance, Jennifer Kamens, Cary Koss, Beisi Xu, Sharnise Mitchell, Anitria Cotton, Michele Connelly, Jing Ma, Duane Currier, William Wright, Kanisha Kavdia, Vishwajeeth Pagala, Wonil Kim, Ji-Hoon Cho, Yiping Fan, Aman Seth, NathanielTwarog, John Choi, Monika L Metzger, Hiroto Inaba, Sima Jeha, Jeffrey Rubnitz, Junmin Peng, Taosheng Chen, Anang Shelat, R. Kiplin Guy, and Tanja Gruber (2020) Proteasome Inhibition Targets the KMT2A Transcriptional Complex. (Submitted to Cancer Discovery) * Wonil Kim, Kimberly D. Klarmann, Jonathan R. Keller (2016) Id2 is Required for Hematopoietic and Erythroid Progenitor Development to Maintain Red Blood Cell Production under Stress. (In preparation) * Matthew C. Stubbs, Wonil Kim, Megan Bariteau, Tina Davis, Sridhar Vempati, Janna Minehart, Matthew Witkin, Jun Qi, Andrei V. Krivtsov, James E. Bradner, Andrew L. Kung, and Scott A. Armstrong (2015) Selective inhibition of HDAC1 and HDAC2 as a potential therapeutic option for B-ALL. Clin Cancer Res 21(10):2348-58 * Wonil Kim, Kimberly D. Klarmann, Jonathan R. Keller (2014) Gfi-1 regulates the erythroid transcription factor network through Id2 repression in murine hematopoietic progenitor cells. Blood 124(10):1586-96 * Won-Il Kim, Ilze Matise, Miechaleen D. Diers and David A. Largaespada (2009) RAS oncogene suppression induces apoptosis followed by more differentiated and less myelosuppressive disease upon relapse of acute myeloid leukemia. Blood 113(5):1086-96 * Won-Il Kim (2008) Oncogenic Roles of RAS in Acute Myeloid Leukemia Cooperated with MLL-AF9. Dissertation for Ph.D. degree accomplished in University of Minnesota * Won-Il Kim, Stephen M. Wiesner, and David A. Largaespada (2007) Vav promoter-tTA conditional transgene expression system for hematopoietic cells drives high level expression in developing B and T cells. Experimental Hematology 35(8):1231-9 * Tae Yon Kim, Won-Il Kim, Ronald E. Smith and EunDuck P. Kay (2001) Role of p27 (Kip1) in cAMP- and TGF-beta2-mediated antiproliferation in rabbit corneal endothelial cells. Investigative Ophthalmology and Visual Science 42(13):3142-9 * Tae Yon Kim, Won-Il Kim, Ronald E. Smith, EunDuck P. Kay (2001). Differential activity of TGF-beta2 on the expression of p27Kip1 and Cdk4 in actively cycling and contact inhibited rabbit corneal endothelial cells. Molecular Vision 7:261-70 * Won-Il Kim, Woo-Bok Lee, Kiwon Song, Jinmi Kim (2000). Identification of a putative DEAD-box RNA helicase and a zinc-finger protein in Candida albicans by functional complementation of the S. cerevisiae rok1 mutation. Yeast 16(5):401-9 [학회발표] * 2019 Poster presentation and abstract published with the study title of “KMT2A-rearranged Infant Acute Lymphoblastic Leukemia Cells Undergo ER-Stress-Induced Apoptosis Fol-lowing Exposure to Proteasome Inhibitors” at 61th America Society of Hematology (ASH) Annual Meeting. * 2013 Oral presentation with the study of “Gfi-1 regulates the erythroid transcription factor net-work through Id2 repression in murine hematopoietic progenitor cells” at 55th American Society of Hematology (ASH) Annual Meeting. * 2008 Poster presentation and abstract published with the study title of “A Murine AML Model for the Development of Resistance to NRAS(G12V) Oncogene Repression and/or Ara-C Treatment in Vivo” at 50th American Society of Hematology (ASH) Annual Meeting. * 2007 Poster presentation and abstract published with the study title of “RAS oncogene sup-pression induces apoptosis followed by more differentiated and less myelosuppressive disease upon relapse of acute myeloid leukemia” at 49th America Society of Hematol-ogy (ASH) Annual Meeting. * 2006 Poster Presentation with the study title of “Vav promoter-tTA conditional transgene ex-pression system for hematopoietic cells drives high level expression in developing B and T cells” at Mouse Models of Cancer in American Association of Cancer Research (AACR). * 2003 Poster presentation with the study title of “The Effect of p27 Expression on the Growth of Rabbit Corneal Endothelial Cells” at 42nd American Society for Cell Biology Annual Meeting. [저서] * Kimberly D. Klarmann, Ming Ji, Huajie Li, Ande Satyanarayana, Wonil Kim, Emily Bowers, Bjorg Gudmundsdottir and Jonathan R. Keller (2011) Novel Targets in Myelogenous Leukemia: The Id Family of Proteins. Myeloid Leukemia - Basic Mechanisms of Leukemogenesis, ISBN: 978-953-307-789-5, InTech |
|
신약개발본부 (이사) |
권이주 |
임상개발 총괄 |
* 아주대학교 대학원 신경과학 박사(’06) * 아주대학교 의료원/아주대학교 의과대학 연구강사('06~'08) * 삼성생명과학 연구소/성균관대학교 의과대학, 박사후 연구원 * 미국 Emory University, School of Medicine, Post-doctoral Fellow * 미국 University of Rochester, Aab Cardiovascular Research * 서울아산병원/울산대학교 의과대학 연구부교수('14~'15) * ㈜안트로젠, R&D 중앙연구소 책임연구원/부장('15~'16) * ㈜지디에프아이브레인셀연구소 CRO, MW & Statistics Divisions * ㈜드림씨아이에스 CRO, Medical Affair Division 이사('19) * 올리패스㈜, 임상개발실 이사('19~'22) * 진원생명과학㈜, 신약개발본부 이사('22~ ) |
[논문] * B23/Nucleophosmin promotes reconstitution of synaptic path in hippocampus * Akt1-Inhibitor of DNA binding2 is essential for growth cone formation and axon * Leptin elongates hypothalamic neuronal cilia via transcriptional regulation and * Cleavage of tau by asparagine endopeptidase mediates the neurofibrillary * HDAC5 interacts with KLF2 and inhibits its transcription in vascular endothelial * SRPK2 phosphorylates tau and mediates the cognitive defects in Alzheimer's * p48 Ebp1 acts as a downstream mediator of Trk signaling in neurons, contributing neuronal differentiation. ('11, Neurochemistry international) * PI(3,4,5)P3 regulates the interaction between Akt and B23 in the nucleus. * Ribosomal protein S3, a new substrate of Akt, serves as a signal mediator * Inhibition of neuronal differentiation by Akt-dependent Id2 phosphorylation. * Neuronal Polarity:Fate determination of neurite into axon or dendrite. * Expression of Disabled 1 suppresses astroglial differentiation in neural stem cells. ('09, Molecular and cellular neurosciences) * Overexpression of BETA2/NeuroD induces neurite outgrowth in F11 * Differential regulation of tyrosine hydroxylase expression by sonic hedgehog. * Activation of the tyrosine hydroxylase promoter by NeuroD in neural stem cell('05, Experimental Neurobiology) * The amino acid compositions of formula for children with inherited metabolic [학술 활동] 초빙 강연 * Hwasun International Vaccine Forum 2022 (’22, Korea) * Korea Academy of Aesthetic Surgery ('16, Korea)
* Biomedical Research Center, Asan Institute for Life Sciences('15,Asan Medical 국제학회 발표 * Presentation of Annual Meeting of ATVB ('13, Orlando, USA) * Presentation in 40th Annual Meeting of SFN ('10, San Diego, USA) * Presentation in 39th Annual Meeting of SFN ('09, Chicago, USA) * Presentation in Biennial Meeting of the International SFN ('09, Korea) * Presentation in 35th, Annual Meeting of SFN ('05, Washington DC, USA) * Presentation in 34th, Annual Meeting of SFN ('04, San Diego, USA) * Presentation in 16th, International Congress of the IFAA ('04, Kyoto, Japan) 외 다수의 학회 발표 |
|
임상실험실분석팀장 |
크리스틴 로버츠 (Christine Roberts) |
임상면역평가 |
* Lehigh University, Ph.D. Molecular Biology (’94) * Lehigh University, Research Assistant (‘94~’01) * Merck & Company, Vaccines Basic Research, Merck Co-Op Program, Staff Biochemist (‘01~’03) * Merck & Company, Vaccines Basic Research, Research Biochemist (‘03~’05) * Merck & Company, Vaccines Basic Research, Senior Research Biochemist (‘05~’08) * Merck & Company, Vaccines Basic Research, Research Fellow (‘08~’10) * Merck & Company Director, Vaccine Clinical Assays (‘10~’15) |
[논문] * Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial ('19, Lancet Infect Dis) * Assay Challenges for Emerging Infectious Diseases: The Zika Experience. ('18, Vaccines) * Zika-Induced Male Infertility in Mice Is Potentially Reversible and Preventable by Deoxyribonucleic Acid Immunization. ('18, J Infect Dis.) * Safety and Immunogenicity of an Anti-Zika Virus DNA Vaccine - Preliminary Report. ('17, N Engl J Med.) 외 다수의 국제 학술지 논문발표 [학회발표] * The prevalence of HPV 16/18 among young sexually active Norwegian women. ('00, 40th ICAAC Meeting) * Detection of HPV in three different types of specimens of the female genital tract. ('05, 22nd International Papillomavirus Conference) * HPV detection using a novel real-time HPV Multiplex PCR Assay: Comparison with the Linear Array HPV Genotyping PCR Assay. ('06, 23rd International Papillomavirus Conference)외 다수의 학회 발표 |
출처) 당사 제시
연구개발 인력은 모두 모회사인 진원생명과학에 소속되어 있으며, 정규직으로 여의도 본사 및 미국 펜실베니아주 포트 워싱턴의 연구소에서 근무하고 있습니다. 종속회사인 VGXI의 인력은 모두 연구개발이 아닌 생산인력으로 일부 계약직 형태의 직원을 제외하고 모두 정규직이며 미국 텍사스주 우드랜드(The Woodland) 소재 기존 공장과 콘로(Conroe) 소재 신규 공장에서 근무하고 있습니다. 전체 약 140명 가운데 60여명은 기존 공장에서 근무하나 필요에 따라 신규 공장에서 근무하기도 합니다. 당사의 연구개발 인력현황과 총 지급액은 다음과 같으며, 당사는 인력의 유지와 안정적인 연구개발지원을 위하여 다양한 복리후생정책 및 체계적인 보상을 통해 전문 인력을 유지하고 있습니다.
VGXI USA 인력 겸직 현황
| 직위 | 성명 | 겸직 현황 |
|---|---|---|
|
최고의학책임자(CMO) |
조엘 매슬로우(Joel Maslow) |
1. 모리스 타운 메디컬센터 의과대학 교수 |
|
최고과학개발책임자(CSO) |
카 무투마니(Kar Muthumani) |
1. 인도 Sri Ramachandra 의과대학 국제초빙교수 |
| 주) 현재 미국 글로벌임상본부에 근무하는 인원 모두는 풀타임 근무자이며, 상기2명이 외부 기관에 명예직으로 활동하고 있음 출처) 당사 제시 |
| [국내 연구개발 인력현황] |
| (단위 : 원) |
| 년도 | 재직형태 | 근무지 | 인원 | 급여총액 |
|---|---|---|---|---|
| 2020 | 정규직 | 국내 | 12명 | 638,855,279 |
| 2021 | 28명 | 992,009,108 | ||
| 2022 | 45명 | 2,083,293,420 | ||
| 2023 | 35명 | 1,432,349,439 |
주1) 2023년도의 경우 9월까지의 급여임.
주2) 2020년(1월~4월) 스톡옵션 행사 차익 54,036,000원 포함
주3) 2020년(5월~11월) 스톡옵션 행사 차익 111,503,600원 포함
주4) 2021년(1월~11월) 2021년 스톡옵션 행사 차익 286,655,000원 포함
출처) 당사 제시
| [국외 연구개발 인력현황] |
| (단위 : 원) |
| 년도 | 재직형태 | 근무지 | 인원 | 급여총액 |
|---|---|---|---|---|
| 2020 | 정규직 | 국외 | 11명 | 1,758,260,835 |
| 2021 | 10명 | 1,915,355,844 | ||
| 2022 | 13명 | 2,162,269,081 | ||
| 2023 | 15명 | 1,580,052,718 |
주) 2023년도의 경우 9월까지의 급여임.
출처) 당사 제시
하지만 연구업계 특성상 연구직원들이 학계나 국가 연구원 등에서의 근무를 선호하고 있으며, 개인적인 학업 증진을 위한 해외 유학 등의 사유로 핵심 연구인력의 이탈이 발생할 수 있습니다. 또한 대형 바이오업체에 비하여 상대적으로 임금 수준 등에서 열위에 있기 때문에 경쟁 기업의 우수 인력 스카우트 등의 이유로 핵심 기술 인력의 이탈 가능성이 있으며 이는 당사의 제품개발에 부정적인 영향을 미칠 수 있습니다. 투자자분들께서는 이점 유의하여주시기 바랍니다.
| 마. 지적재산권 침해에 따른 위험 당사가 영위하고 있는 제약 및 바이오 사업은 개발회사가 보유한 특화된 기술 및 제품화 능력에 의하여 성패가 결정되는 기술지향형 산업이며, 이를 영위하기 위해서는 기술보호가 필수적입니다. 당사 역시 신약 연구개발 기업으로서 기술 노하우 및 지적재산권의 보호를 사업을 영위하는데 있어 큰 비중을 차지하고 있는 핵심 사안으로 고려하고 있습니다. 이에 당사는 당사 핵심 기술 및 제품에 대한 권리를 보호할 수 있도록 국내뿐만 아니라 해외 에서도 특허 출원 및 등록을 진행하여 지식재산의 권리화에 힘쓰고 있습니다. 본 공시서류 제출일 현재 당사가 권리자인 특허에 대한 침해, 무효 주장에 관한 소송은 존재하지 아니하나 향후 제 3 자에 의하여 당사가 보유하고 있는 특허에 대한 침해, 무효 소송 또는 기타 분쟁이 발생할 가능성을 배제할 수 없고 당사가 해당 지식재산권을 효과적으로 관리하지 못하여 당사 특허가 무효 또는 소멸될 수 있으며, 이 경우 당사의 기술 및 사업경쟁력은 약화되어 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다. |
당사와 같은 연구개발 기업은 특허의 출원 및 등록과 관련제도를 통한 지적재산권의 관리가 중요하며 핵심 기술 및 제품에 대한 권리를 보호할 수 있는 장치를 마련하는 것이 필요합니다. 특허는 산업상 유용한 발명을 한 자가 자신이 이룬 발명의 내용을 공개하는 대가로 일정한 기간 동안 독점적, 배타적 권리를 부여받는 공적 계약의 일종입니다. 제약산업 분야는 지식재산권 중 특허권의 비중이 타 산업에 비해 높은 편입니다. 이에 따라 제품화 성공 시 높은 경제적 효익의 확보가 가능하나 개발 성공까지 막대한 비용과 많은 시간이 소요되고 성공률이 낮다는 신약개발산업 특징에 기인한 부분입니다. 한편 신약개발에 성공하더라도 개발된 신약이 매우 우수하여 높은 상업적 성공가능성을 보이면 잠재 경쟁업체들이 이에 대한 제네릭 의약품(Generic, 복제의약품)을 개발하여 그 경쟁력을 위협할 수 있는데, 견고한 특허장벽은 이러한 제네릭 의약품의 시장진입에 대한 효과적인 대비책이 될 수 있습니다.
본 공시서류 제출일 현재 당사는 국내외 총 6건의 특허를 보유하고 있으며, 당사가 보유한 특허권의 세부 내역은 아래와 같습니다.
[당사의 지적재산권 현황]
|
종류 |
취득일 |
취득국가 |
제목 |
내용 |
근거법령 |
독점적 사용기간 |
취득소요인력/기간 |
상용화 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|
|
특허 |
2013.10.25 |
KR, CN, EP, JP, US, AU, HK |
면역 조절제 활성을 갖는 화합물 |
The present invention provides a compound, wherein the compound is 3-phenyl-4,5-dihydro-5-isoxazoleacetic acid
|
특허법 |
~2026.03.14 |
4명/7년 |
상용화 준비 |
||
|
특허 |
2013.04.17 |
EP, ES |
COMPOUNDS HAVING IMMUNOMODULATOR ACTIVITY |
The present invention provides a compound, wherein the compound is 3-phenyl-4,5-dihydro-5-isoxazoleacetic acid
|
EPC |
~2033.04.18 |
3명/2년 |
상용화 준비 |
||
|
특허 |
2014.05.13 |
KR, US |
암세포 증식 억제와 혈관신생 억제를 위한 융합 단백질 및 이를 포함한 항암 조성물 |
본 발명은 암 특이적 항체와 혈관신생 억제제가 결합된 융합 단백질 및 이를 포함하는 암 치료 조성물에 관한 것으로, 구체적으로, 본 발명에 따른 바람직한 암 특이적 항체는 트라스투주맵 또는 이의 단편이며, 혈관신생 억제제는 VEGF-트랩이다. |
특허법 |
~2032.06.07 |
3명/2년 |
상용화 미정 |
||
|
특허 |
2017.03.30 |
KR, US |
대상포진 예방 및 치료용 DNA 백신 조성물 및 이를 이용한 VZV 항원에 대한 T세포 활성화 방법 |
본 발명은 대상포진 바이러스(VZV) 단백질을 부호화하는 VZV 유래 유전자의 삽입 부위를 포함하는 적어도 일종의 플라스미드, 및약제학적으로 허용 가능한 기타의 성분을 포함하는 대상포진 예방 및 치료용 DNA 백신 조성물을제공한다. |
특허법 |
~2034.10.21 |
7명/3년 |
상용화 미정 |
||
|
특허 |
2018.05.30 |
KR, US |
B형 간염 바이러스의 preS1에 특이적으로 결합하는 항체 및 이의 용도 |
본 발명은 HBV(hepatitis B virus)의 표면항원 프리-S1(preS1)에 특이적으로 결합하는, 항체, 상기 항체를 코딩하는 폴리뉴클레오티드, 상기 폴리뉴클레오티드를 포함하는 발현 벡터, 및 상기 발현 벡터를 포함하는 형질전환체, 상기 항체의 HBV 감염의 예방 또는 치료 용도 및 상기 항체의 HBV 검출용도를 제공하는 것이다. |
특허법 |
~2034.11.27 |
3명/4년 |
상용화 미정 |
||
|
특허 |
2020.02.04 |
KR |
중증 열성 혈소판 감소 증후군(SFTS) 바이러스 감염 질환 예방 또는 치료용 백신 조성물 |
본 발명은 중증 열성 혈소판 감소 증후군(Severe Fever with Thrombocytopenia Syndrome; SFTS) 바이러스 질환에 의한 감염병을 예방 또는 치료하기 위한 백신 조성물에 관한 것이다. |
특허법 |
~2038.06.28 |
11명/2년 |
상용화 미정 |
||
| 특허 | 2023.06.29 | KR | 이물질 및 분비물에의한 오염을 방지하는 흡인기 플랫 모듈 | 본 발명은 DNA백신 접종 시 세포내로 백신이 잘 유입되게 하여 면역원성 효율을 증가하기 위한 목적으로 개발된 의료기기 관한 것으로 외부 구조물에 의해 이물질 및 분비물이 내부로의 유입을 차단하여 오염을 방지할 수 있는 구조물 용도 관련 내용이다. | 특허법 | ~2041.08.26 | 8명/2년 | 상용화 미정 |
출처) 당사 제시
또한 본 공시서류 제출일 현재 당사가 체결 중인 라이선스 인 계약의 현황은 다음과 같습니다.
<라이선스인 계약 총괄표>
|
품목 |
계약상대방 |
대상지역 |
계약체결일 |
계약종료일 |
총 계약금액 |
수취금액 |
진행단계 |
|---|---|---|---|---|---|---|---|
|
쓴맛 수용체 신호전달 |
The Trustees of the University |
전세계 |
2018년 6월 20일 |
1) 마지막 특허의 만료 또는 포기일 2) 첫 번째 상업적 판매 후 10년중 늦은 날 |
라이선스 발행 수수료 1만불 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
- |
임상2상 |
|
약물 전달법 |
RUTGERS, THE STATE UNIVERSITY OF NEW JERSEY |
전세계 |
2018년 10월 22일 |
1) 마지막 특허의 만료 또는 포기일 2) 첫 번째 상업적 판매 후 10년 중 늦은 날 |
라이선스 발행 수수료 5천불 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
- |
비임상 |
|
니파(Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 핵산 기반 백신 후보물질의 기술 |
THE WISTAR INSTITUTE OF ANATOMY AND BIOLOGY |
전세계 |
2021년 12월 7일 |
1) 마지막 특허의 만료 또는 포기일 2) 첫 번째 상업적 판매 후 12년 후 |
첫번째 라이선스 발행 수수료 2만5천불과 두 번째 라이선스 발행 수수료 5만불 외 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
- |
비임상 |
출처) 당사 제시
① 품 목 : 쓴맛 수용체 신호전달 물질 및 기술
|
1. 계약 상대방 |
미국, The Trustees of the University of Pennsylvania |
|||
|
2. 계약 내용 |
계약상대방이 보유한 호흡기 감염의 치료제 개발을 위한 쓴맛 수용체 신호전달 물질 및 쓴맛 수용체 진단법 개발 기술에 대해 당사가 독점적인 라이선스를 갖게 됨 | |||
|
3. 대상 지역 |
전세계 |
|||
|
4. 계약 기간 |
계약 체결일 : 2018년 6월 20일 |
|||
|
5. 총 계약금액 |
라이선스 발행수수료 약 12백만원(US$10,000) 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
|||
|
6. 계약 조건 |
계약금 : 약 12백만원(US$10,000), 지급 조건: 계약 체결시 매년 라이선스 유지수수료 약 12백만원(US$10,000) 지급 마일스톤 :
로열티 : 순매출액의 2%, 지급 조건 : 매출 발생 시 분기별 지급, 최소 연례로열티 50만불 서브-라이선스 수입에 대해서는 25% 지급, 임상3상 첫 번째 피험자 투여 후에는 15% 지급하기로 함 기존 특허비용 $39,691.15를 지급하고, $25,000 한도 내에서 특허 관련 비용을 보전해 주기로 함 |
|||
|
7. 회계처리방법 |
계약금, 라이선스 유지수수료 - 일시에 비용 인식 마일스톤: 임상2상까지 전액 비용 처리, 임상3상 승인 이후의 마일스톤은 무형자산으로 계상 |
|||
|
8. 대상 기술 |
호흡기 감염의 치료제 개발을 위한 쓴맛 수용체 신호전달 물질 및 쓴맛 수용체 진단법 | |||
|
9. 개발 진행경과 |
<거래 상대방> 코분무기(Nasal spray)를 이용한 비염, 축농증 치료제의 안전성과 유효성 확인을 위한 1/2상 임상연구 종료 (지역 : 미국, 임상단계 : 1/2상, 임상시작일 : 2015년 10월, 임상 완료일 : 2017년 5월) 코로나19 감염방지를 위한 코 스프레이 치료제의 미국 FDA 2상임상 승인 (2020년 4월29일) 미국 특허청으로부터 코 스프레이 치료제 및 축농증 치료제의 원천 기술에 대한 특허 등록 (2021년 1월) 미국 내 2차 임상시험 실시기관 추가 및 임상시험대상자를 일반인으로 확대 진행하고자 미국 IRB 승인 득함 (2021년 4월) 임상시험대상자 225명 등록 계획 중184명 등록 완료(2022년 12월) 코로나19에 감염된 대상자 모집의 고충으로 대상자 모집 조기 종료(2022년12월) |
|||
|
10. 기타 사항 |
없음 |
② 품 목 : 약물 전달법
|
1. 계약 상대방 |
미국, RUTGERS, THE STATE UNIVERSITY OF NEW JERSEY |
|||||||
|
2. 계약 내용 |
계약상대방의 약물 전달법에 대해 당사가 독점적인 라이선스를 갖게 됨 |
|||||||
|
3. 대상 지역 |
전세계 |
|||||||
|
4. 계약 기간 |
계약 체결일 : 2018년 10월 22일 |
|||||||
|
5. 총 계약금액 |
라이선스 발행수수료 약 6백만원(US$5,000) 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
|||||||
|
6. 계약 조건 |
계약금 : 약 6백만원(US$5,000), 지급 조건: 계약 체결 후 30일 이내 라이선스 유지수수료: 1-2년차 매년 2천불, 3년차 4천불, 4년차 이후 매년 5천불->상업적 판매 개시 후 지급하지 않음 마일스톤 :
로열티 : 순매출액의 2.5%, 지급 조건 : 매출 발생 시 분기별 지급, 단, 아래 표와 같이 최소 연례로열티를 지급하기로함
|
|||||||
|
7. 회계처리방법 |
계약금, 라이선스 유지수수료 - 일시에 비용 인식 마일스톤: 임상2상까지 전액 비용 처리, 임상3상 승인 이후의 마일스톤은 무형자산으로 계상 |
|||||||
|
8. 대상 기술 |
약물 전달법 |
|||||||
|
9. 개발 진행경과 |
<거래 상대방> 해당 약물 전달법 이용 기능적인 견본품 제작 및 실험실내 효능평가를 동물에서 수행완료 <회사> |
|||||||
|
10. 기타 사항 |
없음 |
③ 품 목 : 니파(Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 핵산 기반
백신 후보물질의 기술
|
1. 계약 상대방 |
미국, THE WISTAR INSTITUTE OF ANATOMY AND BIOLOGY |
||||||
|
2. 계약 내용 |
계약상대방이 보유한 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기술에 대해 당사가 독점적인 라이선스를 갖게 됨 |
||||||
|
3. 대상 지역 |
전세계 |
||||||
|
4. 계약 기간 |
계약 체결일 : 2021년 12월 7일 |
||||||
|
5. 총 계약금액 |
총 라이선스 발행수수료 약 93백만원(US$75,000) 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
||||||
|
6. 계약 조건 |
계약금 : 약93백만원(US$75,000), 지급 조건: 계약 체결시와 1년뒤 또는 제품 개발 자금 조달시 라이선스 유지수수료 : 2023년 1월 1일까지 약12백만원(US$10,000) 지급, 2024~2028 년간 약18백만원 (US$15,000) 지급, 2029~계약종료일 년간 약31백만원(US$25,000) 지급 마일스톤 :
로열티 : 총 순매출액 약1,200억원(US$100,000,000) 미만 시 4%, 지급 조건 : 매출 발생 시 분기별 마지막날로부터 30일 이내 지급
서브-라이선스 수입에 대해서는 첫 IND 제출일까지 20% 지급, 첫 IND 제출일 이후 임상 2상 첫 번째 피험자 투여일까지는 15% 지급, 임상 2상 첫 번째 피험자 투약일 이후 본 계약서 종료일까지는 10% 지급하기로 함. |
||||||
|
7. 회계처리방법 |
계약금, 라이선스 유지수수료 - 일시에 비용 인식 마일스톤: 임상2상까지 전액 비용 처리, 임상3상 승인 이후의 마일스톤은 무형자산으로 계상 |
||||||
|
8. 대상 기술 |
니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기술 |
||||||
|
9. 개발 진행경과 |
<거래 상대방> 포와산 (Powassan) 바이러스를 예방하는 DNA 백신의 효능평가를 동물에서 수행 완료 및 해당 연구결과를 퍼블릭 라이브러리 오브 사이언스 (PLOS Neglected Infectious Diseases)에 게재함 (2020년 10월 29일) 니파 (Nipah) 바이러스를 예방하는 DNA 백신이 쥐 동물실험에서 바이러스 항체생성을 확인함 (2019년 7월 16일 The Wistar Institute blog) <회사> |
||||||
|
10. 기타 사항 |
없음 |
현재 당사는 기술보호를 위해 국내뿐만 아니라 해외에서도 특허 등록을 진행하고 있습니다. 또한, 전문 컨설팅 기관으로부터 특허의 침해 여부 및 전략에 관하여 정기적으로 컨설팅을 받고 있습니다. 그럼에도 불구하고 향후 당사가 보유한 지적재산권을 적절히 보호하지 못하거나 당사가 사용하는 기술과 관련한 지적재산권 관련 분쟁이 발생하는 경우 당사의 경쟁력은 약화될 수 있으며 이는 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다. 이점 유의하여 투자해 주시기 바랍니다.
| 바. 연구개발 실패 위험 한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데 통상적으로 각 단계별로 전임상 시험 3년, 임상1상 1.5년, 임상2상 2년, 임상3상 3년, 발매허가(NDA) 6개월로 약 10년의 시간이 소요된다고 알려져 있습니다. 당사가 연구개발 하는 가장 앞선 단계의 DNA백신은 임상2a상을 진행하고 있는 코로나19 DNA백신(GLS-5310)으로 국내 코로나19 팬데믹 상황을 고려하여 신속한 제품개발을 추진하고 있어 제품화까지 1~2년 이상의 기간이 소요될 것으로 예상됩니다. 하지만 이는 긴급사용승인을 예상한 일정으로, 국내외 타사 코로나19 백신들이 보급되면서 국내 백신 접종률이 증가한다면 백신 미접종 상태의 임상시험 대상자 모집이 어려워지고 신규 백신에 대한 필요성이 낮아져 계획 중인 임상 연구 및 제품화가 지연될 수 있습니다. 이 외에도 당사가 예상치 못한 이유로 인해 백신 개발 일정이 지연된다면 제품화까지 당사 예상 대비 장기간이 소요될 수 있으며, 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발 비용은 따로 회수할 수 없어 당사의 수익성 및 성장성에 악영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사가 주요사업으로 영위하는 바이오신약개발 산업의 특성상 현재 연구개발하고 있는 신약이 상업화되기까지는 막대한 비용과 시간이 필요합니다. 특히, 임상시험에 진입하여도 최소 8-9년이 소요되며 그에 필요한 비용이 요구됩니다. 또한, 임상시험을 진행한다고 하더라도 시험결과 효능이 부족하거나 안전성 평가에 적합하지 못한 결과가 나올 경우 해당 신약의 연구개발은 중단될 수 밖에 없습니다. 이러할 경우 당사의 비용 및 시간 투자에도 불구하고 엄청난 손실을 야기할 수 밖에 없습니다. 이에 따라 당사는 핵산 기반 백신 및 의약품(단클론항체 치료제, 단백질 의약품) 범위에서 국내 기업부설연구소 소속 연구원들의 내부 논의를 통해 1차적으로 연구개발과제를 선정한 후 국내 신약개발본부 및 미국 글로벌임상개발본부와 2차 합의 후 최고의사결정권자인 대표이사의 승인을 통해 연구개발과제를 선정하고 있습니다.
한 개의 신약이 나오기 위해서는 여러 단계를 거치게 되는데, 먼저 신약 후보물질을 도출하기 위한 탐색 과정을 거칩니다. 이 과정에서는 신약의 효능이나 작용기전을 기반으로 신약개발 대상물질을 선정합니다. 유효물질(hit compound), 선도물질(lead compound)을 거쳐 신약 후보물질이 선정되면 후보물질의 안전성과 효과를 확인하기 위해 동물 모델을 대상으로 전임상시험(pre-clinical study)을 진행합니다. 전임상시험을 통해 후보물질의 효과와 안전성을 검증하면 규제기관에 임상시험계획승인 신청(IND : Investigational New Drug Application)을 하고, 사람을 대상으로 약물의 효과와 부작용 등의 안전성을 확인하는 임상시험(clinical trial)을 수행합니다. 3상까지의 임상시험을 마친 후에는 식약처에 의약품 시판허가를 취득하기 위해 신약에 대한 전임상시험 결과와 임상시험 결과를 최종 취합하여 제출하게 되는데, 이를 신약 허가신청(NDA : New Drug Application) 이라고 합니다. 신약 허가신청에서 승인을 받게 되면, 제4상 임상시험으로 분류되는 시판 후 조사(PMS : Post-Market Surveillance)를 통해 임상시험에서 발견하기 어려웠던 부작용에 대해서 추적 조사를 수행합니다.
| [신약 개발 및 승인 프로세스] |
|
| 출처: 글로벌 제약시장 임상 파이프라인 분석(한국바이오경제연구센터) |
임상1상은 주로 건강한 성인을 대상으로 약물의 독성 여부를 평가합니다. 약물의 효과보다는 안전성에 주로 초점을 맞추기 때문에 대부분 성공률이 높습니다. 임상2상은 환자를 대상으로 부작용 뿐만 아니라 효능과 효력을 평가하기 때문에 성공률이 제일 낮을 수밖에 없습니다. 임상3상은 임상2상과 같이 환자를 대상으로 약효와 부작용을 보는 단계이지만, 환자 수가 훨씬 크고 약의 dose(복용량)를 결정하는 단계입니다. 임상3상은 임상2상에서 적은 수의 환자를 대상으로 이미 약효와 부작용을 테스트했기 때문에 비교적 성공 확률이 높은 69%입니다. 임상3상은 규모가 가장 크고 비용이 제일 많이 드는 데다 임상 기간이 평균 3년으로 가장 깁니다. 임상에서 가장 성공률이 높은 단계는 신약의 제품허가 승인 단계인 NDA 입니다. NDA 단계는 임상1상에서 3상까지 해당 적응증에 대한 모든 임상 테스트를 통과한 상태에서 다시 한번 최종 검토하는 과정이기 때문에 통상적으로 통과할 확률이 높습니다.
당사는 연구개발을 위해서 지속적으로 시장을 통해 자금을 조달하고 있으며, 최근 3년 동안 3차례의 공모 유상증자(210,035백만원)와 두 차례의 사모 주식관련사채 발행(35,700백만원)을 통해 자금을 조달하였습니다.
| [유상증자 내역] |
| (단위: 백만원, 주) |
| 증자방식 | 청약일(구주주) | 납입일 | 최종발행금액 | 증자비율 | 모집주식 수 |
|---|---|---|---|---|---|
| 주주배정후 실권주 일반공모 | 2020년 01월 16일~ 2020년 01월 17일 |
2020년 01월 28일 | 19,800 | 50.16% | 11,000,000 |
| 주주배정후 실권주 일반공모 | 2020년 06월 25일~ 2020년 06월 26일 |
2020년 07월 03일 | 76,475 | 34.72% | 11,500,000 |
| 주주배정후 실권주 일반공모 | 2021년 11월 24일~ 2021년 11월 25일 |
2021년 12월 02일 | 113,760 | 12.74% | 5,760,000 |
| 합 계 | - | - | 210,035 | 28,260,000 |
출처) 당사 제시
| [전환사채 발행 현황] |
| (단위: 백만원, 주) |
| 종류/구분 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율(%) | 전환가액 | 권면(전자등록)총액 | 전환가능주식수 | |||||||
| 제4회사모 전환사채 |
2020년 11월 25일 | 2023년 11월 25일 | 24,000 | 기명식 보통주식 |
2021년 11월 25일~ 2023년 10월 25일 |
100 | 12,301 |
- | - | 전환가액 조정 |
| 제5회사모 전환사채 |
2022년 04월 15일 | 2025년 04월 15일 | 11,700 | 기명식 보통주식 |
2023년 04월 15일~ 2025년 03월 15일 |
100 | 10,265 | - | - | 전환가액 조정 |
| 합 계 | - | - | 35,700 | 기명식 보통주식 |
- | 100 | - | - | - | - |
| 주1) 2020년 11월에 발행한 4CB는 2023년 05월 10일 미상환사채 11억원 중 10억원에 대해 풋옵션 행사되어 잔액 1억원입니다. 잔액 1억원에 대해 2023년 11월 25일 만기가 도래함에 따라 전액 상환되었습니다. 주2) 2022년 04월에 발행한 5CB는 2023년 04월12일 기준 현재 잔액 0억원으로 상환 완료하였습니다. 출처) 당사 제시 |
2021년 12월 기준과 2022년 12월 및 본 공시서류 제출일 현재 기준으로 당사 파이프라인의 연구개발 정도 및 연구개발비용은 아래와 같으며, 현재 당사의 연구개발 항목 우선순위는 1순위가 코로나19 백신(GLS-5310, 부스터샷 포함) 및 치료제(GLS-1027)입니다. 해당 연구개발 자금은 지난 증자를 통해 회사에 유보된 자금을 사용할 계획입니다. 2순위는 SFTS백신(GLS-5140)과 해당 연구에 사용되는 의료기기(GeneDerm)의 개량입니다. 3순위는 코로나19 감염을 방지하는 목적을 미국에서 임상2상을 진행하다 임상시험대상자 모집이 어려워 임상시험대상자 모집을 조기 종료한 GLS-1200으로 자체 자금으로 적응증을 변경하여 개발을 이어나가고자 합니다. 4순위는 만성B형 간염치료 및 예방용 항체인 GLS-8000 등으로 현재 연구소에서 기초 연구를 진행 중인 프로젝트입니다.
| [연구개발 진행정도] |
| (단위 : 백만원) |
| 우선순위 |
프로젝트명 |
2021년 12월 |
2022년 12월 |
본 공시서류 제출 전일 현재 |
연구 성과물 |
시계열적 연구개발비 사용 내역 | 연구개발 비용 |
|---|---|---|---|---|---|---|---|
| 연구 중단 |
통합독감 DNA백신 |
이노비오 주도 개발 중 |
이노비오 주도 개발 중 |
이노비오 연구개발 중단 |
임상 1상, 조류독감 백신(VGX-3400)에의해 유도된 T 면역세포 반응의 분석 보고서 확보함. |
[2009년] - CRO 용역비(14.3) - 프로토콜 개발비(120.6) - 병원 연구비(34.8) - 기타(148.7) [2010년] - CRO 용역비(28.2) - 프로토콜 개발비(3.7) - 병원 연구비(118.1) - 데이터 분석비(33.9) - 플라스미드 생산(117.4) - 운영비 및 기타(85.2) - UFDV Upfront(3498.0) [2011년] - 병원 연구비(99.0) - 데이터 분석비(169.4) - 운영비 및 기타(47.5) - UFDV Upfront(29.5) - UFDV 자문료(25.7) [2012년] - 병원 연구비(49.4) - 데이터 분석비(32.2) - 운영비 및 기타(85.7) - UFDV Upfront(28.8) - UFDV 자문료(43.5) [2013년] - 기타(28.5) - UFDV Upfront(28.5) [2014년] - 운영비 및 기타(31.9) - UFDV Upfront(76.6) [2015년] - UFDV 연간 유지비(55.4) [2016년] - UFDV 연간 유지비(119.1) - 문서 보관기간 연장비(0.5) [2017년] - 외부 평가 용역료(123.8) [2020년] - 라이센스 계약비(237.8) |
5,515.7 |
| 연구 중단 |
VGX-6150 만성C형 간염 치료백신 |
한국 1상 임상 종료 |
한국 1상 임상 종료 |
개발 중단 |
1상임상 종료 식약처 보고, 국제학술대회 구두 및 포스터 발표 (2018년 Liver Week 2018, 2019년 HCV2019), 비임상결과 국제학술지 논문게재 (2017년 Scientific Report), 임상결과 국제학술지 게재 (2020년 Journal of Hepatology) |
[2011년] - 안전성 실험(5.0) - 플라스미드 생산(575.6) [2012년] - 안전성 실험(213.4) - 플라스미드 생산(2576.5) [2013년] - 안전성 실험(326.1) - 임상 1상(127.5) [2014년] - 안전성 실험(85.4) - 임상 1상(240.9) [2015년] - 안전성 실험(20.0) - 플라스미드 생산(41.7) - 임상 1상(247.6) - 임상시험 종료 비용(76.3) [2016년] - 임상시험 종료 비용(246.0) [2017년] - 임상시험 종료 비용(127.0) - 기술 자문료 등(19.8) [2018년] - 기술 자문료 등(4.5) [2020년] - 기술 자문료 등(15.9) [2021년] - 기술 자문료 등(5.8) |
4,955 |
| 연구 중단 |
GLS-6150 만성C형 간염 치료백신 |
한국 1상 임상 종료 |
한국 1상 임상 종료 |
한국 1상 임상 종료 후 중단 |
복지부 지원 연구개발 과제 선정, 식약처 임상승인서, 임상시험대상자 모집 완료, 임상시험결과보고서(CSR) 최종본 수령(2022년 12월 8일) 향후 중단 파이프라인으로 변경예정 |
[2020년] - 임상 관련 비용 등(77.0) [2021년] - 임상 관련 비용 등(88.3) [2022년] - 임상시험 용역비, 통계분석비 등(4.7) |
170 |
| 연구 중단 |
GLS-6100 C형 간염 예방백신 |
식약처 1상임상 승인 |
한국 1상 임상 종료 |
후속과제 지원없어 개발 중단 |
복지부 지원 연구개발 과제 선정, 식약처 임상시험계획승인서(2021년 5월), 보건복지부의 후속과제 지원 계획에 따라 GLS-6100(고위험 정상인 대상) 임상시험 추진 계획이었으나, 이후 과제에 대한 후속 지원이 없어 개발 종료함. 향후 중단 파이프라인으로 변경예정 |
||
| 연구 중단 |
GLS-5300 메르스 백신 |
한국 1/2a상 임상시험 종료, (중동내 2상임상부터) |
한국 1/2a상 임상시험 종료, 이노비오 주도개발 (중동내 2상임상부터) |
한국 1/2a상 임상시험 종료, (중동내 2상임상부터) |
- 미국 FDA 1상 임상승인, 1상임상연구 종료, 임상연구결과 국제학술지 논문제개 (Lancet Infectious Disease) - 한국 식약처 1/2a상 임상승인, 서울대병원/분당서울대병원에서 임상연구 진행중 - 국제백신연구소(IVI) 지원 과제 선정 비임상결과 국제학술지 논문 게재 (Science Translational Medicine) |
[2015년] - 플라스미드 생산, 자문료 등(716.0) [2016년] - 임상시험 연구비, 업무 위탁 비용 등(452.6) [2017년] - 임상시험 연구비, 업무 위탁비용 등(96.8) - CRO 비용, 플라스미드 생산비 등(387.6) [2018년] - CRO 비용, 플라스미드 생산비 등(49.1) [2020년] - 임상 관련 비용, 통계 분석비 등(29.1) [2021년] - 임상 관련 비용, 통계 분석비 등(9.4) [2022년] - 임상시험 용역비 등(21.6) [2023년] - 임상시험 용역비 등(0.3) |
1,762.5 |
| 연구 중단 |
GLS-5700 지카 DNA 백신 |
이노비오 주도 개발 (2상임상부터) |
이노비오 주도 개발 (2상임상부터) |
미국 1상 임상시험종료 (2상임상부터) |
- 임상연구 중간결과를 국제 저명 의학전문 학술잡지인 New England Journal of Medicine에 발표(2021년 9월) |
[2016년] - 플라스미드 생산 등(1747.0) - Zika-001 임상 업무 위탁비 등(672.9) - Zika-002 임상 업무 위탁비 등(457.6) [2017년] - CRO 비용 등(487.8) - 공동 연구 개발비 등(148.5) - 플라스미드 생산(20.6) - Zika-001 CRO 비용 등(1152.1) - Zika-002 CRO 비용 등(2248.5) [2018년] - 플라스미드 생산(36.5) - Zika-001 CRO 비용 등(188.9) - Zika-002 CRO 비용 등(1111.7) [2020년] - 임상 관련 비용(54.0) - Zika-002 임상시험 종료 비용 등(60.3) [2021년] - 임상 관련 비용(24.4) - Zika-002 운영비 등(12.7) [2022년] - Zika-002 운영비 등(153.1) [2023년] - Zika-002 운영비 등(33.1) |
8,609.7 |
| 3 |
GLS-1200 축농증 치료제 |
미국 2상 임상 잠정 중단 |
미국 2상 임상 잠정 중단 |
미국 2상 임상 잠정 중단 |
- 축농증 치료 2상임상연구에 대한 미국 FDA 임상승인신청완료, 미국 FDA 2상임상 승인 |
[2020년] - 임상기관 연구비 등(215.0) [2021년] - 운영비 등(50.9) [2022년] - 운영비 등(48.0) [2023년] - 운영비 등(33.9) |
347.8 |
| 3 |
GLS-1200 코로나19 감염방지 |
미국 2상 임상 진행중 |
미국 2상 임상 진행중 |
- 대상자 184명 등록 완료 |
미국 FDA 2상 임상승인 |
[2020년] - 컨설팅비, 통계 분석비 등(1717.5) [2021년] - CRO 비용 등(352.4) [2022년] - 컨설팅 비용 등(403.7) [2023년] - 컨설팅 비용 등(358) |
2,831.6 |
| 1 |
GLS-1027 당뇨병성 신장병증 치료제 |
개발 잠정 중단 |
개발 잠정 중단 |
동물에서 약물의 효능평가 연구계획 |
당뇨병성 신장질환치료제 안전성 평가에 대한1상임상연구 종료 |
[2016년] - 기술가치평가 의뢰 비용(16.6) [2017년] - 자산 구매 계약비(1071.4) [2018년] - 특허 연차료 등(8.1) [2020년] - 특허 연차료 등(341.3) [2021년] - 임상시험 용역비 등(106.5) |
1,543.9 |
| 1 |
GLS-1027 코로나19 증상악화 방지 경구용 치료제 |
미국, 북마케도니아, 한국 식약처, 유럽의 약품청(EMA), 불가리아 식약청 2상 임상 승인 현재 임상 피험자 등록 진행 중 |
미국, 북마케도니아 2상 임상승인, 2상 임상승인신청 |
- 미국, 북마케도니아, 한국 식약처, 유럽의약품청(EMA), 불가리아 식약청 2상 임상 승인 |
- 코로나19 증상악화 방지 경구용 치료제로 2상임상 신청 및 승인 |
[2020년] - 컨설팅 비용, 통계 분석비 등(941.0) [2021년] - 통계 분석비, 모니터링비 등(460.1) [2022년] - 임상시험 연구비 등(3826.3) - 전임상 시험비(18.6) [2023년] - CRO 용역비 등(500.3) - 과제 종료비, 안정성 시험 등(317.9) - 전임상 시험비 등(7.8) |
6,029 |
| 1 |
GLS-5310 코로나19 백신 |
한국 임상 1상의 1차 중간분석 결과 확인 임상 1상의 2차 중간분석 진행 중 임상 2a상 연구를 위해 5개 기관과 임상 연구 계약 체결 국가임상시험지원재단가 2상 연구의 대상자 모집을 위한 [백신 임상시험참여의향자모집 및 연계 공공플랫폼]이용 협약서 체결 |
한국 1/2a상 임상시험 진행중 |
- 한국 임상 1상 결과 확인 - 임상 2a상 연구를 위해 5개 기관과 임상 연구 계약 체결 - 임상 2a상 중간결과 분석 중 - 국가임상시험지원재단가 2상 연구의 대상자 모집을 위한 [백신 임상시험참여의향자 모집 및 연계 공공플랫폼] 이용 협약서 체결 |
- '2020년도 질병관리본부 긴급 현안 지정 학술연구개발 용역과제’인 ‘핵산백신 플랫폼을 활용한 코로나19 백신후보물질 개발 사업’에 우선 순위 협상대상자로 선정됨 |
[2020년] - 임상시험 기기 등(301.7) - 동물구입 및 동물 실험비 등(224.2) - 임상시험 용역비 등(472) - 시약및 기기 구입 등(502.4) [2021년] - 임상시험 기기 등(153.7) - 동물구입 및 동물 실험비 등(4) - 임상시험 용역비 등(491.7) - 시약및 기기 구입 등(2,176) [2022년] - 임상시험 비용 등(1,917) [2023년] - 임상시험 비용 등(276.5) - 임상시험 용역비, 임상시험기관 연구비 등(283.3) |
9,068.5 |
| 1 |
GLS-5310 코로나19 백신(부스터샷) |
- | - | - 기존 피내 접종과 비강내 접종을 병용하는 임상 1상 시험계획을 미국 FDA로부터 승인 - 대상자 69명 모집 완료 -중간결과 분석 중 - 임상결과 분석 중 |
-코로나19 추가접종 백신으로 임상 1상 시험계획서의 미국 FDA 승인(2022년 1월) -임상시험실시기관에서의 임상시험 종료(2023년 6월) |
[2022년] - 임상CRO, 임상시험기관 연구비 포함한 임상시험 비용 등(1,677) [2023년] - 임상CRO, 임상시험기관 연구비 포함한 임상시험 비용 등(589) |
|
| 2 |
GLS-5140 SFTS 백신 |
비임상연구 |
비임상연구 |
-비임상연구 |
-대한민국 특허등록 (2020년 2월), 해외특허PCT출원 |
[2020년] - 효능평가 연구비, 시약 구매 등(84.0) [2022년] - 유효성 평가, 계약 체결비 등(659.1) [2023년] - 플라스미드 생산 및 시약 구입 등(1480.9) - 동물 실험비, 특허비 등(10.9) |
2,234.9 |
| 4 |
GLS-7100 혈우병 치료제 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
mRNA 신약개발 플랫폼을 이용한 제품후보물질 개선 연구 진행중 (코로나19 백신 연구개발로 지연됨) | [2014년] - 연구비(21.0) [2015년] - 연구비(37.8) - 시약 구입(2.3) [2016년] - 동물, 분석 시약 구입 등(18.8) [2020년] - 위탁시험 계약금, 시약 구입 등(25.3) |
105.2 |
| 4 |
GLS-8000 만성B형간염치료 및 예방용 항체 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
- 대한민국 특허 등록, 미국 특허 등록 |
[2017년] - 플라스미드 합성 등(9.8) [2018년] - 시약 재료비(2.2) [2020년] - 용역 연구비, 항원 제작 등(53.3) [2021년] - 시약 재료비 등(9.2) [2022년] - 5년차 연차등록료(0.2) |
74.7 |
| 연구 중단 |
GLS-3000 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
상업화 타당성 문제로 연구개발 중단 | 제형화기술인 LNP 기술을 보유한 기관들로부터 해당 기술 평가 중 개발중단 | [2020년] - 후보물질 비임상 유효성 평가 (24) |
24 |
| 4 |
지카 mRNA백신 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
|
- 복지부 백신실용화과제 mRNA 신속백신제작 플랫폼 과제 수행 완료 (2022년 12월) |
[2022년] - 전임상 연구 시약 재료비 (152) - 복지부과제 기업부담금 (120) |
272 |
| 4 | CAR-M |
- | - |
타당성검증 효능평가연구 |
- GPC3 CAR 백터 제작 및 생산 - 단핵세포의 M1 거대세포 분화 유도 - CAR 형질전환 거대세포의 식세포 증가 확인 |
[2023년] - 전임상 연구 시약 재료비 (5.5) - PBMC 기반 CAR-M 연구 (11) |
16.5 |
| 4 | Microneedle and device 개발비 등 |
효과적인 경피용 약물전달 기술개발 | 효과적인 경피용 약물전달 기술개발 | 효과적인 경피용 약물전달 기술개발 | - 시제품 개발 및 성능시험, 안전성 시험, 안정성 시험, 멸균 시험 등 단계별 진행 - 차세대 경피약물 전달 시스템 스프레이-코팅 마이크로니들 기술에 대한 중국특허 등록 (2023년 4월) |
[2017년] - 기술 개발비 (78) [2020년] - 기술 개발비 (444) - 법률 자문료 (38) [2021년] - 기술 개발비 (179) - 특허 비용 (30) [2022년] - 기술 개발비 (790) [2023년] - 기술 개발비 (285) |
1,844 |
| 4 | PlasMab |
- |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
- CTLA4 PlasMab 유전자 합성 - 세포주에서의 PlasMab 발현 확인 |
[2022년] - 전임상 연구 시약 재료비 (2) [2023년] - 전임상 연구 시약 재료비 (4) |
6 |
| 4 | RNA백신 기반 연구개발비 |
RNA 백신 개발을 위한 기초 연구 | RNA 백신 개발을 위한 플랫폼 확립 연구 | RNA 백신 개발을 위한 플랫폼 확립 및 품질관리 연구 | - FDA, EMA, 식약처의 가이드라인에 부합하는 mRNA 백신 R&D 플랫폼을 수립. - 다양한 5' cap과 LNP를 적용하여 mRNA 백신 연구개발에 가장 적합한 조합을 플랫폼 확립. - 동물실험에서 mRNA 백신의 우수한 발현양상을 확인. |
[2020년] - 전임상 연구 시약 재료비 (166) - 독성평가 용역 연구비 (25) [2021년] - mRNA 배송비 (3) - 특허 비용 (25) [2022년] - 전임상 연구 시약 재료비 (12) [2023년] - 전임상 연구 시약 재료비 (6.5) - 한국연구재단과제 기업부담금 (7.5) - mRNA 품질 관리 및 공정 확립 (20.1) - 세포내 타겟 mRNA 발현 연구 (0.6) - mRNA 기반 BsAb 발현 연구 (2.8) - 면역 항암제 후보물질 제작 (0.7) |
269.2 |
| 4 | CCR8 |
- |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
- CCR8 유전자 합성 - 단클론 항체 서열 확보 |
[2023년] - 전임상 연구 시약 재료비 (2) - 단클론 항체 서열 분석 (5.6) |
7.6 |
| 4 | 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 핵산 기반 백신 개발 | 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기술에 대해 독점적인 라이선스인 | 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기초연구 | 니파 (Nipah) DNA 백신의 동물실험 수행 | - 니파 (Nipah) DNA 백신의 면역효능 확인 | [2022년] - 니파(Nipah) 및 포와산(Powassan) 바이러스를 예방하는 핵산 기반 백신 특허료 지불 (65) [2023년] - 니파(Nipah) DNA 백신의 동물 실험(37) - 니파(Nipah) DNA 백신 후보물질 제작 (1.6) |
103.6 |
| 4 | Pan-Corona | - | 타당성검증 효능평가연구 | 타당성검증 효능평가연구 | - Pan-Corona 백신 항원 후보물질 개발 - Pan-Coronal 단클론 항체 Hybridoma 구축 |
[2022년] - 전임상 연구 시약 재료비 (24.2) - Hybridoma 세포 배양 및 단클론 항체 분석 (5.3) - Pan-Corona 백신 유효성 평가 동물 실험 (75.5) [2023년] - Pan-Corona 백신 및 hybridoma 효능 평가 (3.1) - Pan-Corona 백신 유효성 평가 동물 실험 (7.9) |
116 |
| 합계 | 45,950.4 |
||||||
| 출처) 당사 제시 |
| 주) 연구개발비용은 2006년부터 2023년 9월까지 지출 합계 |
현재 당사는 공동개발을 진행하는 부분은 없으며, 미국 나스닥 상장사인 이노비오와 지카, 메르스 DNA백신에 대해 공동개발을 진행했으나, 모두 당사가 담당하기로 한 임상1상을 종료했고, 2상부터는 이노비오가 담당합니다. 당사가 담당하기로 한 임상1상을 마무리함에 따라 당사는 계약에 의거 해당 제품에 대해 35%의 지분을 확보하고 있습니다. 현재 메르스 DNA 백신에 대한 임상2상은 공동개발사인 이노비오가 개발을 중단한 상태입니다.
종속회사인 VGXI는 연구개발하는 회사가 아니라 당사가 개발하는 DNA백신의 생산을 담당하는 회사로 당사와 계약에 의거 DNA백신을 생산하여 공급하고 있습니다. 계약금액은 품목 및 생산수량에 따라 차이가 있으나 다른 업체와 비교하여 통상적인 수준의 금액을 책정하고 있습니다.
가장 최근 VGXI 생산한 제품은 당사가 임상을 준비하고 있는 SFTS(중증열성혈소판감소증후군)예방 DNA백신이며, 해당 물량으로 임상1상과 임상2상에 사용이 가능할 것으로 예상됩니다.
| [최근 3년 및 2023년 3분기 세부 연구개발 비용] |
| (단위 : 백만원) |
|
과 목 |
2023년 3분기 | 2022년 | 2021년 | 2020년 | 2019년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | ||
|
회계처리 |
판매비와 관리비 |
5,219 | 6,871 |
12,147 |
12,977 |
11,441 |
14,358 |
8,396 |
8,867 |
5,874 | 5,711 |
|
개발비(무형자산) |
- | - |
- |
- |
- |
- |
- |
- | - | - | |
|
연구개발비용 계(주1) |
5,219 | 6,871 |
12,147 |
12,977 |
11,441 |
14,358 |
8,396 |
8,867 |
5,874 | 5,711 | |
|
(정부보조금) |
(6) | (6) |
(734) |
(734) |
(4,880) |
(4,880) |
(960) |
(960) |
(669) | (669) | |
|
정부보조금 차감 후 연구개발비용 계 |
5,213 | 6,865 |
11,413 |
12,243 |
6,561 |
9,478 |
7,436 |
7,907 |
5,205 | 5,042 | |
|
연구개발비 / 매출액 비율(주2) |
18.99% | 26.56% |
23.4% |
26.8% |
17.0% |
27.7% |
17.9% |
22.1% |
12.6% | 14.6% | |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 연구개발비용은 전액 판관비로 계상되어 있으며, 정부보조금을 차감하기 전의 연구개발비용 지출총액입니다. |
| 주2) 매출액 대비 정부보조금 차감 후 연구개발비용이 차지하는 비율로 산출하였습니다. |
상기 표에서 연결기준 연구개발비용이 별도기준 연구개발비용보다 낮은 이유는 당사에서 VGXI로 지급되었던 연구개발비용은 연결기준 재무제표에서 내부거래로 제거 되었기 때문입니다. VGXI는 당사가 연구개발을 진행 중인 핵산 기반 백신에 필요한 플라스미드 DNA를 공급하고 있으며, 당사가 VGXI에 지급한 연구개발비용은 2020년 943백만원, 2021년 3,251백만원, 2022년 829백만원, 2023년 1~9월 1,652백만원이며, 이는 당사의 GLS-5310 코로나19, GLS-5140 SFTS 예방 등의 연구개발에 필요한 임상시료에 대한 생산비용을 지급한 내역으로 상세내역은 아래와 같습니다.
| [VGXI 생산비용] |
| (단위 : 백만원) |
| 구분 | 세부내역 | 2023년 1~9월 | 2022년 | 2021년 | 2020년 |
|---|---|---|---|---|---|
| GLS-5310 코로나19 | 임상시료 생산 | - | 198 | 3,170 | 31 |
| GLS-5140 SFTS 예방 | 임상시료 생산 | 1,652 | 631 | - | - |
| C형간염 예방 | 임상시료 생산 | - | - | 78 | 790 |
| RNA백신 | 임상시료 생산 | - |
- | 3 | 122 |
| 합계 | 1,652 | 829 | 3,251 | 943 | |
K-IFRS 회계기준에 따르면 연구개발비에 대해 기술적 실현가능성등 특정 요건을 충족하는 경우 자산으로 처리하고, 충족하지 못하는 경우 비용으로 인식하도록 규정하고 있습니다. 당사는 K-IFRS 회계기준에 따라, 당사가 연구개발하고 있는 프로젝트가 전임상부터 임상2상단계까지 진행되고 있어 지출 비용에 대해 연구개발비(판관비)로 당기 비용처리하고 있습니다. 향후 해당 프로젝트가 자산화 요건을 충족하는 연구개발 단계에 이를 경우 관련 개발비에 대해 자산으로 인식하여 회계처리할 예정입니다.
당사가 연구개발하는 과정에서 시험결과 효능이 미약하게 나와 중간에 중단하게 되거나, 효율적 자금 사용을 위해 보류 중인 파이프라인 또는 연구개발 계획에 변동이 존재합니다. 당사는 지난 2020년 12월 한국 식약처로부터 1/2a 임상승인을 받아 코로나19를 예방하는 DNA백신인 GLS-5310을 개발하고 있습니다. 올해 5월 10일 2a상의 마지막 임상시험대상자의 마지막 임상기관 방문으로 현재 임상2a상은 종료됐으며 최종분석을 진행 중입니다. 해당 결과는 빠르면 올해 하반기에 확인할 수 있을 것으로 예상하고 있습니다. 코로나19로 인한 팬데믹 상황이 엔데믹으로 변했고 그에 따라 정부의 코로나 대응 정책도 변화하고 있습니다. 그러나 당사는 GLS-5310의 임상2a상의 최종결과를 확인하기 전까지 해당 연구개발 계획에 대한 변동은 없습니다. 또한, 당사는 2020년 1월 19일 GLS-5310의 글로벌 개발과 함께 기존 피내 접종과 비강내 접종을 병용하는 임상시험을 미국에서 수행하고자 미국 FDA에 1상 임상시험계획(IND) 승인을 신청하였으며 2021년 7월 27일 승인을 받았습니다. 그러나 코로나19 팬데믹 상황이 변화함에 미국에서 mRNA백신과 아데노바이러스 전달체 백신을 접종한 대상자에게 자체 개발 흡인작용 접종기인 진덤(GeneDerm)을 이용한 피내 접종군과 피내 접종 및 코 스프레이를 이용한 비강내 접종을 병용한 접종군을 비교하고자 2022년 1월 3일 미국 FDA로부터 코로나19 백신 접종자들을 대상으로 하여 GLS-5310을 부스터샷으로 접종하는 임상시험계획(IND)에 대해 승인을 받았습니다. 해당 임상시험계획의 승인은 지난 2021년 7월27일 승인받은 임상시험계획(IND)에 대해 임상시험계획을 변경하여 승인받은 것입니다. 2022년 8월 미국에서 진행하고 있는 코로나19 DNA 백신 GLS-5310의 부스터샷(추가접종) 1상 임상시험 대상자 전체 69명의 등록이 완료됐습니다. 현재 중간분석을 진행하고 있으며 1년 추적관찰 후 최종분석이 진행될 예정입니다. 이처럼 과거 자금 사용 계획과 실제 자금 사용 내역에 차이가 발생하며 세부적인 사항은 아래와 같습니다.
| [코로나19 백신 연구개발 자금사용 내역] |
| (단위 : 백만원) |
| 구 분 | 코로나19 백신 자금사용 계획 | 실제 자금사용 현황 | 사용 예정 금액 |
|---|---|---|---|
| 2020년 01월 주주배정후실권주 일반공모 유상증자 |
0 백만원 | - 임상용시료 구입(57) - 임상시험 연구비(4) - 임상용시료 운송비외(1) 합계: 62백만원 |
잔액 없음 |
| 2020년 07월 주주배정후실권주 일반공모 유상증자 |
8,864 백만원 | - 임상용시료 구입(450) - 임상시험 CRO 및 연구비(5,194) - 임상접종기기 인허가 및 컨설팅비(177) - 임상시험 실험실 인증 기술조사비(33) - 임상시험 실험기기 구입(85) - 임상용시료 운송비 및 기타비용(70) 합계: 6,009백만원 |
잔액 없음 |
| 2021년 12월 주주배정후실권주 일반공모 유상증자 |
13,237 백만원 | - 임상용시료 구입(27) - 임상시험 CRO 및 연구비(8,016) : 고려대학교 부속병원(264) : 한림대학교 산학협력단(111) : 인하대학교 부속병원(55) : 길의료재단(1) - 임상접종기기 인허가 및 컨설팅비(8) - 임상시험 실험기기 구입(11) - 임상용시료 운송비 및 기타비용(163) 합계: 8,225백만원 |
GLS-5310 코로나19 백신 사용 예정 금액 세부내역 - 2a상 임상결과 통계분석비, 결과보고서 개발비 : 200 - 3상 임상기관비용(1차년도) : 6,700 |
| 출처) 당사 제시 |
자금사용계획에 배정되지 않았으나, 신규 감염병(코로나19)이 발생함에 따라 관련 연구를 시작했고, 연구개발이 진행되는 과정에서 당초 계획대로 진행되지 않고 지연됨에 따라 자금사용계획 대비 실제 자금사용 금액이 낮습니다. 20년 07월 잔액이 없는 부분은 일반운영비로 사용한 부분이며, 21년 12월 잔여금액은 2a상 임상결과 분석비와 당초 계획대로 코로나19 DNA 백신(GLS-5310)의 임상3상에 진입하게 되면 사용할 예정입니다.
이 외에도 당사가 예상치 못한 이유로 인해 백신 개발 일정이 지연된다면 제품화까지 당사 예상 대비 장기간이 소요될 수 있으며, 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발 비용은 따로 회수할 수 없어 당사의 수익성 및 성장성에 악영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| [연구개발 중단 파이프라인] |
| (단위 : 백만원) |
|
프로젝트명 |
제품설명 |
개발단계 |
중단 사유 | 연구개발비 |
|---|---|---|---|---|
| GLS-5100 | 대상포진 백신 | 전임상연구 | 타사 백신이 우수한 효능으로 전세계 시장을 독점하고 있어 개발 중단 | 780 |
| GLS-7000 | 유방암 치료제 | 전임상연구 | 동물실험결과 기존 치료방법 대비 효과가 미약하여 개발 중단 | 86 |
| GLS-8100 | 류마티스 관절염 치료제 | 전임상연구 | 동물실험을 통해 효능을 확인하였지만, 해당 관절염 동물 모델을 구축하는데 시간과 연구비용이 많이 소모되어, 국책과제 선정될 때까지 개발 중단 | 713 |
| GLS-3700 | H7N9 신종플루 예방백신 |
전임상연구 | 국책 지원과제 모색 중 |
1,580 |
| GLS-7300 | 비만대사 유전자치료제 | 전임상연구 | 동물실험결과 비만치료효과가 미약하여 개발 중단 | 132 |
| GLS-5300 | 메르스 예방 | 임상 1/2a상 시험 (한국) |
계약에 따라 임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사에서 수행 예정. 이후, 이노비오사는 CEPI의 연구비를 지원받아 진행하기로 했던 임상연구를 중단한다고 발표함(2022.11.17). |
1,762.5 |
| GLS-5700 | 지카바이러스 예방 | 임상 1상 시험 (푸에르토리코) |
계약에 따라 임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사에서 수행 예정. | 8,609.7 |
| GLS-6150/GLS-6100 | C형 간염 예방 | 임상 1상 시험 (한국) |
보건복지부의 후속과제 지원 계획에 따라 GLS-6100(고위험 정상인 대상) 임상시험 추진 계획이었으나, 이후 과제에 대한 후속 지원이 없어 개발 종료함 | 170 |
| GLS-5200 | 에볼라 바이러스 DNA 백신 | 임상 1상 시험 (미국, 캐나다) |
당사는 GLS-5200 임상시험용 DNA 백신을 대량생산하여 공급하여 이노비오에 전달함에 따라 해당 제품에 대한 지분을 확보하였고, 공동개발기관인 이노비오는 임상 1상 연구를 완료함. 당사는 해당 임상을 진행하지 않음. | 3,194 |
| VGX-6150 | 만성 C형 간염 치료 | 임상 1상 시험 (한국) |
2상 임상시험 진입을 보류- COVID-19에 대한 백신과 치료제 개발에 대한 임상시험 진행으로 인해 후순위로 결정되어 보류 상태임 | 4,955 |
| VGX-3400 | 통합독감DNA백신 | 임상 1상 시험 (한국) |
미국 이노비오사에서 임상 2상시험 부터 개발 진행으로 중단 | 5,515.7 |
| VGX-7100 | 허혈질환 유전자치료제 | 전임상연구 | 동물실험결과 새로운 혈관생성 효과가 미약하여 개발 중단 | 115 |
| VGX-7200 | DNA 기반 알츠하이머 항체치료제 | 전임상연구 | 알츠하이머 치료제 전세계 개발 동향 반영 후속 개발 중단 | 42 |
| GLS-3000 | 코로나19 mRNA백신 | 전임상연구 | LNP 제형화기술을 보유한 기관들로부터 해당 기술 평가 중 상업화 타당성 문제로 개발 중단 | 24 |
| 미정 | CCHF 콩고출혈열 |
전임상연구 | SFTS 과제 우선 수행으로 인한 후속 연구 중단 | 28 |
| 미정 | HnMc 항암치료제 | 전임상연구 | 미토콘드리아 타겟팅에 의한 일반세포내 독성 문제로 개발 중단 | 5 |
| 미정 | Adiponetin 항암치료제 | 전임상연구 | 동물실험결과 항암치료효과가 미약하여 개발 중단 | 95 |
| 합계 | 27,806.9 |
|||
| 출처) 당사 제시 |
| 사. 정부 정책 및 규제 변화에 따른 위험 당사는 바이오 의약품 연구개발을 수행함에 따라, 각 산업에 대한 안전성 관련 규제에 영향을 받을 수 있습니다. 특히 당사의 유전자 백신 연구개발의 경우, 임상 시험에서 의도하지 않은 유전자의 삽입이 발생할 수 있으며, 이러한 비특이적 유전자의 삽입에 의한 돌연변이로 인해 오랜 시간이 지난 뒤 부작용이 발생할 수 있는 사항에 따라, 정부로부터 안전성에 대한 규제와 유전자치료제의 품질, 비임상, 임상시험의 규정 및 가이드라인의 규제를 받게 됩니다. 또한, 바이오 의약품 연구개발에 대한 정부의 정책 변화로 정부 지원이 축소 또는 변경되거나 임상 단계에서 적용되는 규정 등의 변화가 일어나는 경우, 합병회사 사업에 부정적인 영향을 미칠 수 있습니다. |
제약 산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업으로, 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 제약 및 신약개발 사업과 관련된 국내 법률 중 당사의 사업과 밀접하게 연관된 법률로는 식품의약품안전처 및 보건복지부 소관의 '약사법'이 대표적이며, 그 외 보건복지부 소관의 '국민건강보험법', '생명윤리 및 안전에 관한 법률', '제약산업 육성 및 지원에 관한 특별법', '희귀질환관리법', '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률'과 식품의약품안전처 소관의 '실험동물에 관한 법률' 등이 있습니다.
특히, 당사는 DNA 치료제 백신 연구 개발을 수행함에 따라, 유전자치료제 안전성 관련 규제에 영향을 받을 수 있습니다. 이러한 비특이적 유전자의 삽입에 의한 돌연변이로 인해 오랜 시간이 지난 뒤 부작용이 발생할 수 있는 사항에 따라, 정부로부터 안전성에 대한 규제 및 유전자치료제의 품질, 비임상, 임상시험의 규정 및 가이드라인의 규제를 받게 됩니다.
DNA백신 분야는 현재 미국 이노비오사의 HPV 관련 자궁경부전암 및 암 치료 백신인 VGX-3100이 글로벌 3상임상연구를 진행하고 있습니다. 또한, 당사의 메르스 DNA백신인 GLS-5300은 한국내 2상임상단계(1/2a상임상)연구 결과를 분석하고 있어, 향후 수 년이내에 사람을 대상으로 하는 DNA백신의 시판 허가 및 상업화가능성이 높아지고 있습니다. 이에따라, 성공적인 제품화 단계로의 준비를 위해 안전성 검증을 위한 품질 평가 기술 개발 및 안전관리 체제의 확립이 필수적으로 요구되며, 이는 DNA치료제백신 분야에 있어 선제적인 안전 관리 및 효율적인 제품화 진행을 위한 기반을 확립 하는데 매우 중요하게 적용되는 만큼, 과학적인 측면의 연구가 지속적으로 뒷받침되어야 합니다. 관련 하여 유전자치료제의 품질 관리, 안전성 및 유효성에 대한 정부 정책과 규제 변화에 따른 위험이 발생할 수 있습니다.
| [유전자 치료 연구 관련 법률] |
| 생명윤리 및 안전에 관한 법률 |
|---|
| 제47조 (유전자치료) ① 인체 내에서 유전적 변이를 일으키는 일련의 행위에 해당하는 유전자 치료에 관한 연구는 다음 각호의 모두에 해당하는 경우에만 할 수 있다. 1. 유전질환, 암, 후천성면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러일으키는 질병의 치료를 위한 연구 2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료를 위한 연구 ② 유전물질 또는 유전물질이 도입된 세포를 인체로 전달하는 일련의 행위에 해당하는 유전자치료에 관한 연구는제1항제1호 또는 제2호 중 어느 하나에 해당하는 경우에만 할 수 있다. ③ 유전자치료는 배아, 난자, 정자 및 태아에 대하여 시행하여서는 아니 된다. |
당사는 내부에 담당 인력과 외부 전문가들을 통하여 국내 및 해외 제약 산업 정책 및 규제 환경을 지속적으로 모니터링하고 있으며, 각국의 규제 당국과의 소통을 통해 정책 및 규제 환경의 변화에 효과적으로 대비하기 위해 최선의 노력을 다하고 있습니다. 그럼에도 불구하고 국내를 포함한 주요 국가에서의 제약 산업 관련 정책이 비우호적 분위기로 전환되거나 규제가 강화되는 경우, 당사의 사업에 부정적인 영향을 미칠 수 있습니다.
| 아. 패브릭사업부문의 저성장 및 사업부문 축소 가능성 당사가 영위하고 있는 섬유사업은 한때 제조업 중에서 가능 높은 고용효과로 우리나라 경제 성장의 견인차 역할을 해온 산업이긴 하나, 타산업의 발전 및 중국과 동남아 여러나라의 생산기반 확대로 증가세가 둔화되고 있습니다. 현재 섬유산업은 중국, 중동지역의 경기에 따라 민감하게 반응하며, 러시아와 우크라이나 전쟁이 장기화 되면서 세계경기의 침체와 주요시장의 위축으로 성장세가 둔화되고 있고 후발국들의 진출로 경쟁이 더욱 치열해지고 있습니다. 당사의 패브릭 사업 부문은 지속적으로 영업손실을 기록하고 있습니다. 섬유산업 전반의 저성장 기조로 인하여 매출성장성이 낮고, 대내외 경제 악재로 인해 영업이익 상승 가능성도 저조합니다. 또한, 예상치 못한 수입국의 경기 상황과 환율변동 및 저임금의 노동력으을 바탕으로 한 개발도상국의 저가 물량 공세로 인해 가격변동 등으로 인한 가격인하 경쟁이 발생 할 위험이 존재합니다. 섬유산업의 저성장 기조는 지속될 것으로 예상되며 당사의 패브릭사업부문의 매출비중 감소 및 저성장 기조를 지속할 경우 재무구조 악화는 물론 사업구조 축소의 위험이 있습니다.투자자 여러분께서는 이점 유의하셔서 투자에 임하여주시기 바랍니다. |
당사는 1976년 (주)동염으로 창립되어 의류용 심지 제직, 가공, 판매 등 패브릭을 주력으로 사업을 영위하였으나, 2008년 이후 주력으로 바이오의약품 및 바이오CDMO 사업을 진행중입니다. 하지만, 바이오의약품 및 바이오CDMO사업에 영업손실이 지속중이며, 기존 패브릭 사업부문도 사업 축소에 따라 매출액이 크게 성장하지 못하는 부진한 영업실적을 보이고 있습니다. 당사의 사업부문별 매출액 및 영업익, 당기순익의 추이는 다음과 같습니다.
| [사업부문별 매출실적] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 | 2019년 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 제약 | 패브릭 | 계 | 제약 | 패브릭 | 계 | 제약 | 패브릭 | 계 | 제약 | 패브릭 | 계 | 제약 | 패브릭 | 계 | 제약 | 패브릭 | 계 | |
| 총매출액 | 18,248 | 9,200 | 27,448 | 26,786 | 12,087 | 38,873 | 32,840 | 15,878 | 48,718 | 24,356 | 14,344 | 38,700 | 27,963 | 13,5400 | 41,503 | 24,562 | 16,679 | 41,241 |
| 영업이익(손실) | (32,572) | (4,520) | (37,092) | (21,648) | (1,748) | (23,396) | (37,061) | (3,023) | (40,084) | (23,769) | (3,665) | (27,434) | (16,036) | (2,423) | (18,459) | (6,306) | (1,903) | (8,209) |
| 당기순이익(손실) | (35,354) | (2,612) | (37,967) | (22,995) | (505) | (23,500) | (36,762) | (1,388) | (38,150) | (15,259) | (629) | (15,888) | (15,737) | (2,911) | (18,648) | (4,984) | (2,635) | (7,619) |
출처) 당사 정기보고서
당사는 면, P/C 및 CVC 등을 소재로 한 의류용 접착, 비접착 심지를 주 ITEM으로 하여 VIETNAM 해외공장에서 제조한 심지 (Dress Shirts, Caps등의 부자재로 쓰임)를 판매하고 있습니다. 당사의 주력 매출제품인 심지(부직포)는 양복 및 모자등의 소재에 사용되는 제품이지만 현재 섬유업계의 추세가 과거의 정장스타일 양복보다는 캐주얼한 옷이 주류가 되어 매출이 크게 증가하지 못했으며 모자의 경우도 저렴한 단가를 내세운 중국 및 저개발국가들의 시장장악력 상승 및 저가공세로 인해 매출이 감소하고 있는 추세입니다. 당사의 패브릭사업부문 또한 영업손실이 2019년 19억원, 2020년 24억원, 2021년 36억원이며, 2022년 30억원, 2023년 3분기 45억원을 기록하며 영업손실이 지속되고 있습니다.
당사는 향후 매출부진과 영업손실 누적을 개선하기 위해 기존 섬유시장에서 사용되는 심지소재의 개선과 섬유제품으로 대체하여 사용할 수 있는 신시장을 개척을 위해 노력 중입니다. 하지만 아직 그에 대한 매출이 기대만큼 이루어지지 않고 있으며 이익 또한 성과를 보이고 있지 않습니다. 패브릭 사업부문의 매출증대와 이익개선 뿐 아니라 고부가가치제품개발과 다양한 소재개발을 시도하고 있으나 아직 매출증가 및 이익개선으로 이어지고 있지 않으며 사업부문 축소의 우려가 있습니다. 개선 노력에도 불구하고, 매출증가 및 이익증가등 실적이 확연히 증가되지 않을 경우 재무구조의 악화는 물론 계속기업의 존속성에 심각한 위협이 될 수 있으므로 투자자 여러분께서는 이 점 유의하시기 바랍니다.
2. 회사위험
| [투자자 주의사항] | |||||||||||||||||||
|
■ 본 증권신고서는 당사의 영업활동 및 재무에 대해 보다 정확하고 실체적인 정보 전달을 위하여 연결재무제표를 기준으로 작성하였으나, 자세한 설명을 위하여 일부 별도 재무제표를 기준으로 작성한 부분은 본문에 별도 기준이라고 기재하였습니다. 투자자분들께서는 이점 유의하시기 바랍니다.
|
| [연결 기준 주요 재무상황 총괄표] |
| (단위: 백만원, 배, %) |
| 구분 | 2023년 3분기 | 2022년 | 2021년 | 2020년 | 비 고 |
| (제48기) | (제47기) | (제46기) | (제45기) | ||
| 외부감사인 | 삼일회계법인 | 삼덕회계법인 | 삼덕회계법인 | 삼덕회계법인 | - |
| 감사의견 | - | 적정 | 적정 | 적정 | - |
| 자산총계 | 191,399 | 222,867 | 250,857 | 136,571 | - |
| 유동자산 | 36,203 | 73,063 | 134,633 | 108,760 | - |
| 비유동자산 | 155,196 | 149,804 | 116,223 | 27,810 | - |
| 부채총계 | 33,052 | 41,395 | 44,350 | 38,062 | - |
| 유동부채 | 25,802 | 33,836 | 34,759 | 36,705 | - |
| 비유동부채 | 7,250 | 7,560 | 9,591 | 1,357 | - |
| 자본총계 | 158,347 | 181,471 | 206,507 | 98,509 | - |
| 자본금 | 78,474 | 77,752 | 77,479 | 44,771 | - |
| 매출 | 27,448 | 48,718 | 38,700 | 41,503 | |
| 매출원가 | 34,204 | 39,382 | 29,943 | 30,091 | - |
| 영업이익 | -37,092 | -40,084 | -27,434 | -18,459 | - |
| EBITDA | -31,627 | -34,660 | -22,784 | -14,438 | - |
| 당기순이익 | -37,967 | -38,150 | -15,888 | -18,648 | - |
| 영업현금흐름 | -17,586 | -24,113 | -4,849 | -15,916 | - |
| 투자현금흐름 | 21,438 | 8,055 | -146,398 | -44,305 | - |
| 재무현금흐름 | -13,345 | 7,013 | 111,023 | 106,235 | - |
| 기초현금 | 13,261 | 22,310 | 62,432 | 16,922 | - |
| 기말현금 | 6,805 | 13,261 | 22,310 | 62,432 | - |
| 영업이익률 | -135.14% | -82.28% | -70.89% | -44.48% | 영업이익 ÷ 매출액 |
| EBITDA이익률 | -115.23% | -71.14% | -58.87% | -34.79% | EBITDA ÷ 매출액 |
| 당기순이익률 | -138.32% | -78.31% | -41.05% | -44.93% | 당기순이익 ÷ 매출액 |
| ROA | -79.35% | -17.12% | -6.33% | -13.65% | 당기순이익 ÷ 자산총계 |
| ROE | -95.91% | -21.02% | -7.69% | -18.93% | 당기순이익 ÷ 자본총계 |
| 매출액 성장률 | 125.36% | 25.89% | -6.75% | 0.63% | - |
| 영업이익 성장률 | n/a | n/a | n/a | n/a | - |
| 당기순이익 성장률 | n/a | n/a | n/a | n/a | - |
| 자산총계 성장률 | -14.12% | -11.16% | 83.68% | 166.99% | - |
| 이자보상비율 | -40.49 | -5.5 | -6.2 | -20.3 | 영업이익 ÷ 이자비용 |
| EBITDA 이자보상비율 | -34.53 | -4.7 | -5.1 | -15.9 | EBITDA ÷ 이자비용 |
| 부채비율 | 20.87% | 22.81% | 21.48% | 38.64% | 부채총계 ÷ 자본총계 |
| 유동비율 | 140.31% | 215.94% | 387.34% | 296.31% | 유동자산 ÷ 유동부채 |
| 총차입금 | 9,225 | 19,666 | 18,400 | 17,766 | - |
| 총차입금 의존도 | 4.82% | 8.82% | 7.33% | 13.01% | 총차입금 ÷ 자산총계 |
| 주1) 2023년 3분기 ROA, ROE는 단순 연환산수치를 사용하였으며, 2023년 3분기 매출액 성장률은 2023년 3분기 매출액을 단순 연환산 하여 비교하였고, 2023년 3분기 자산총계성장률은 2022년과 비교하였습니다. 출처) 당사 정기보고서 |
| 가. 지속적인 영업적자로 인한 재무구조 악화 위험 당사는 DNA백신 및 핵산 기반 치료제, 플라스미드 DNA 의약품 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 지속적인 당기순손실이 발생하고 있습니다. 당사의 영업손실은 2020년 18,459백만원(영업이익률 : -44.48%), 2021년 27,434백만원(영업이익률 : -70.89%), 2022년 40,084백만원(영업이익률 : -82.28%), 2023년 3분기 37,092백만원(영업이익률 : -135.14%)로, 평균 -83.20%의 수준의 이익률을 보이고 있으며, 이로 인하여 당기순손실이 지속되고 있는 상황입니다. 당사는 지속적인 영업적자로 과부족한 운영자금(급여, 연구개발비 등)을 자본시장을 통해 자금조달하여 대체해 왔으며, 조달한 자금 중 일부가 이사 및 감사의 보수 및 급여 등의 운영비로 사용되고 있는 상황입니다. 이처럼 지속적인 영업적자로 인해 당사의 재무구조는 악화되어 왔으며, 추후에도 당사 파이프라인의 제품화 성공 혹은 라이센스 아웃 또는 플라스미드 CDMO 사업의 매출 성장 등으로 영업흑자로 전환되지 못한다면 재무구조는 계속해서 악화될 것으로 예상됩니다. 당사의 플라스미드 DNA 수주는 2020년 19,301천달러, 2021년 13,724천달러, 2022년 22,077천달러, 2023년 1월부터 9월까지 15,105천달러 수주계약을 보이고 있습니다. 당사는 금번 주주배정 후 실권주 일반공모로 유입되는 자금 중 자회사 VGXI에 대여금을 통해 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다.단, 국제규격(cGMP) 플라스미드 DNA 생산시설이 한정된 상황에서 가능성이 낮지만 기존고객(계약상대방)이 생산시설을 VGXI에서 다른 플라스미드 DNA 생산시설로 변경하거나 기존고객(계약상대방)의 판단에 따라 VGXI와 신규 플라스미드 DNA생산시설 1곳을 추가하여 2곳의 생산시설에 발주할 경우 기존고객(계약상대방)과의 계약금액이 줄어들거나 신규발주물량이 없을 가능성도 있어 수주잔고가 하락할 위험이 있습니다. 또한, 신규고객에 대한 영업활동을 진행하여도 해당 고객이 VGXI가 아닌 다른 생산시설에 발주할 경우 신규고객에 대한 유치가 어려울 수도 있습니다.또한, 당사 파이프라인의 경우 빠른 시일 내에 제품화가 어려울 것으로 보이며, 매출로 이어지지 않고 비용만 지속적으로 투입될 경우 수익성이 악화될 위험도 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 DNA백신 및 핵산 기반 치료제, 플라스미드 DNA 의약품 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 지속적인 당기순손실이 발생하고 있습니다.
당사의 영업손실은 2020년 18,459백만원(영업이익률 : -44.48%), 2021년 27,434백만원(영업이익률 : -70.89%), 2022년 40,084백만원(영업이익률 : -82.28%), 2023년 3분기 37,092백만원(영업이익률 : -135.14%)로, 평균 -83.20%의 수준의 이익률을 보이고 있으며, 이로 인하여 당기순손실이 지속되고 있는 상황입니다. 당사의 손익계산서상 주요 계정 및 수익성 추이는 다음과 같습니다.
| [손익계산서 주요계정 및 수익성 추이] |
| (단위 : 백만원) |
| 구 분 | 2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 |
| 매출액 | 27,448 | 38,873 | 48,718 | 38,700 | 41,503 |
| 매출원가 | 34,204 | 27,129 | 39,382 | 29,943 | 30,091 |
| 매출총이익 | -6,755 | 11,744 | 9,336 | 8,757 | 11,412 |
| 판매비와관리비 | 30,337 | 35,139 | 49,420 | 36,191 | 29,871 |
| 영업손익 | -37,092 | -23,396 | -40,084 | -27,434 | -18,459 |
| 기타이익 | 1,300 | 2,406 | 2,907 | 10,753 | 2,274 |
| 기타손실 | 1,993 | 847 | 1,147 | 675 | 2,920 |
| 금융수익 | 747 | 5,402 | 8,675 | 8,615 | 2,308 |
| 금융원가 | 916 | 7,036 | 8,406 | 6,793 | 1,429 |
| 법인세비용차감전계속사업손익 | -37,954 | -23,471 | -38,054 | -15,534 | -18,226 |
| 법인세 | 13 | 29 | 96 | 354 | 422 |
| 당기순손익 | -37,967 | -23,500 | -38,150 | -15,888 | -18,648 |
| 매출총이익률 | -24.61% | 30.21% | 19.16% | 22.63% | 27.50% |
| 판매비와관리비율 | 110.53% | 90.39% | 101.44% | 93.52% | 71.97% |
| 영업이익률 | -135.14% | -60.19% | -82.28% | -70.89% | -44.48% |
| 당기순이익률 | -138.32% | -60.45% | -78.31% | -41.05% | -44.93% |
| 출처) 당사 정기보고서 및 당사 제시 |
[성장성]
당사의 연결기준 매출액은 글로벌 제약회사들을 중심으로 유전자 치료제의 원료인 플라스미드 DNA에 대한 수요가 증가하면서 당사의 CDMO사업부문 매출이 증가하여 매출액에서 높은 비중을 차지하고 있습니다.
2020년 매출액이 41,503백만원으로 전년대비 0.63% 증가하였고, 2021년 코로나19 확산으로 인하여 CDMO 부문과 패브릭 부문 매출 감소로 인해 매출액 38,700백만원으로 전년대비 6.75% 감소하였습니다. 2022년에는 코로나19 회복으로 인하여 CDMO사업부문 및 패브릭 부문인 의류용 심지의 매출이 전년 대비 각 40.9%, 5.2% 증가한 31,506백만원, 9,356백만원을 시현하여 2022년 매출액은 48,718백만원으로 전년 대비 25.89% 증가하였습니다. 2023년 3분기 매출은 27,448백만원으로 전년 동기 대비 -29.39% 감소하였는데, 이는 CDMO 사업부분에서는 2022년말부터 경기침체를 우려한 제약사들의 위탁주문생산 문의가 감소하였기 때문입니다. 다만 현재 신규공장에서 상업용 단위의 위탁생산 주문된 생산이 완료되면 생산 주문은 경기침체와는 관계없이 위탁 생산 의뢰가 발생될 것으로 예상하고 있습니다. 그리고 패브릭사업부문의 경우 역시 전세계의 경기침체를 우려한 소비력이 감소됨에 따라 섬유제품의 판매가 감소되었기 때문입니다.
| [사업부문별 매출 현황] |
| (단위 : 백만원) |
| 품목 | 2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 | |||||
| 매출액 | 비율 | 매출액 | 비율 | 매출액 | 비율 | 매출액 | 비율 | 매출액 | 비율 | |
| CDMO 매출 | 17,373 | 63.29% | 25,739 | 66.21% | 31,506 | 64.67% | 22,360 | 57.78% | 26,409 | 63.63% |
| 의류용 심지 | 5,382 | 19.61% | 7,255 | 18.66% | 9,356 | 19.20% | 8,897 | 22.99% | 9,404 | 22.66% |
| 자수사 및 기타상품 | 3,818 | 13.91% | 4,832 | 12.43% | 6,522 | 13.39% | 5,447 | 14.07% | 4,136 | 9.97% |
| 컨설팅 등 | 876 | 3.19% | 1,047 | 2.69% | 1,334 | 2.74% | 1,996 | 5.16% | 1,554 | 3.74% |
| 합 계 | 27,449 | 100.00% | 38,873 | 100.00% | 48,718 | 100% | 38,700 | 100% | 41,503 | 100% |
| 매출성장률 | -29.39% | 36.40% | 25.89% | -6.75% | 0.63% | |||||
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 2023년 3분기 매출성장률은 전년 동기 대비 매출성장률입니다. |
[수익성]
당사의 최근 3년 매출은 성장하는 추세에 있으나, 2023년 3분기의 매출이 전년 동기 대비 감소한 이유는 2022년말부터 경기침체를 예상하여 고객사들이 생산의뢰를 소극적으로 하고 있으나, 현재 기존과 다른 규모의 생산의뢰를 받아 이를 완료할 경우에 업계에서 신규공장에서의 양산 생산체계에 문제가 없음을 알리게 되어 향후에는 대규모의 주문생산의뢰 체계로 변경될 것으로 기대하고 있습니다. 당사는 아직까지 매출원가와 판매비와관리비를 커버하지 못하고 있어 영업손실 및 당기순손실이 지속되고 있는 상황입니다. 2023년 3분기의 연결기준 매출총이익률은 -24.61%를 보였으며, 판매비와관리비율은 110.53%, 영업이익률은 -135.14%, 당기순이익률은 -138.32%를 보였습니다.
2020년에는 매출 증가로 11,412백만원의 매출총이익이 발생하였으나, 급여 14,761백만원과 연구개발비 8,396백만원 등의 판매비와 관리비로 18,459백만원의 영업손실이 발생하였으며, 이로 인하여 18,648백만원의 당기순손실이 발생하였습니다.
2021년에는 매출 감소로 8,757백만원의 매출총이익이 발생하였으며, 15,383백만원의 급여와 11,441백만원의 연구개발비 등의 판매비와 관리비에 의하여 27,434백만원의 영업손실이 발생하였으며, 이로 인하여 15,888백만원의 당기순손실이 발생하였습니다.
2022년은 매출이 48,718백만원으로 증가하였으나 원가율 상승으로 매출총이익이 감소하여 9,336백만원 발생하였으며, 급여 20,415백만원, 연구개발비 12,147백만원 등의 판매비와관리비로 40,084백만원의 영업손실 및 38,150백만원의 당기순손실이 발생하였습니다.
2023년 3분기에는 신규공장의 본격적인 생산에 앞서 숙달된 생산경험이 필요하기에 사전에 많은 인원들을 고용하여 훈련을 하고 있으며 이에 관련되는 비용 및 신축공장의 제조부서에서 사용된 비용이 증가되어, 매출액보다 많게 되었습니다. 해당 부문의 경우는 제조부서의 인원 및 사용된 비용들을 판관비로 전환하지 않고 매출원가로 기재합니다. 연결 재무제표 작성시 해당금액이 매출원가로 반영되어 매출액을 초과하여 매출손실이 발생하게 되었고, 이에 따라 매출액 대비 매출원가가 증가하여 6,755백만원의 매출총손실이 발생하였으며, 급여 11,917백만원, 연구개발비 5,219백만원 등의 판매비와관리비로 37,092백만원의 영업손실이 발생하고 있으며, 37,967백만원의 당기순손실이 발생하고 있는 상황입니다.
위에서 언급한 바와 같이 당사 연결손익계산서의 매출총손실의 발생은 자회사 VGXI Inc 의 매출액에 대응하는 매출원가가 증가되어 발생되었습니다. 자회사 VGXI Inc 의 신규공장 투자에 따른 제조부문에 배분되는 고정자산의 감가상각 및 제조 투입인원의 인건비 등의 증가로 인해 발생된 원가가 매출액을 상회하여 발생되었습니다. 자회사 VGXI Inc 에서 신규공장의 투자를 추가적으로 진행하고 미래의 발생될 수 있는 대규모 수주에 대응하기 위하여 선제적으로 추가로 신규인원을 투입함에도 불구하고 현재와 같이 전세계의 경기가 계속적으로 침체되거나 경기가 회복이 되었음에도 회사가 기대하는 수주의 양보다 수주가 적을 경우에는 투입되는 매출원가보다 매출액이 적어 계속적으로 매출총손실이 발생될 수 있으며, 이에 따라 당기순손실이 예상보다 오랜기간동안 지속될 수 있습니다. 투자자분들께서는 이점 유의하시길 바라겠습니다.
당사의 최근 3개년 및 2023년 3분기까지 판매비와관리비 내역은 다음과 같습니다.
| [판매비와 관리비 내역] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 |
| 급여 | 11,917 | 14,711 | 20,415 | 15,383 | 14,761 |
| 퇴직급여 | 681 | 555 | 706 | 527 | 535 |
| 복리후생비 | 1,379 | 1,223 | 1,636 | 1,312 | 1,038 |
| 여비교통비 | 306 | 283 | 408 | 181 | 160 |
| 접대비 | 92 | 101 | 127 | 93 | 93 |
| 통신비 | 129 | 87 | 125 | 91 | 54 |
| 수도광열비 | 536 | 478 | 131 | 112 | 100 |
| 교육훈련비 | 4 | 4 | 5 | 2 | 2 |
| 세금과공과 | 224 | 163 | 295 | 223 | 160 |
| 감가상각비 | 3,500 | 1,687 | 2,362 | 1,100 | 846 |
| 지급임차료 | 520 | 488 | 663 | 562 | 184 |
| 수선비 | 22 | 22 | 31 | 15 | 29 |
| 보험료 | 164 | 81 | 108 | 70 | 65 |
| 차량유지비 | 78 | 97 | 128 | 100 | 92 |
| 경상연구개발비 | 5,219 | 8,813 | 12,147 | 11,441 | 8,396 |
| 운반비 | 107 | 104 | 145 | 135 | 114 |
| 도서인쇄비 | 21 | 6 | 10 | 8 | 8 |
| 회의비 | 13 | 12 | 17 | 20 | 11 |
| 사무용품비 | 181 | 156 | 244 | 150 | 81 |
| 소모품비 | 41 | 29 | 41 | 47 | 30 |
| 지급수수료 | 3,838 | 3,031 | 5,397 | 2,477 | 2,155 |
| 무형자산상각비 | 224 | 147 | 183 | 156 | 117 |
| 사용권자산상각비 | 1,741 | 1,582 | 2,110 | 1,547 | 753 |
| 견본비 | 12 | 14 | 16 | 12 | 15 |
| 물류비 | 14 | 14 | 20 | 12 | 7 |
| 광고선전비 | 369 | 253 | 342 | 194 | 168 |
| 대손상각비 | -1,060 | 902 | 1,297 | 111 | -174 |
| 수출제비용 | 55 | 88 | 117 | 98 | 66 |
| 잡비 | 0 | 7 | 194 | 12 | 3 |
| 합계 | 30,337 | 35,139 | 49,420 | 36,191 | 29,871 |
출처) 당사 정기보고서 및 당사 제시
대손충당금은 매출채권의 회수가능성에 대하여 총연체전이율을 사용하여 설정하였으며, 진원생명과학의 매출채권중에서 주요금액인 DIV(자회사-베트남) 매출채권 회수지연으로 대손상각 전체금액은 3,026백만원으로 설정되었습니다. 당3분기에 CDMO 거래처로부터 미회수 금액 미화 3백만달러가 입금되어 대손상각으로 처리하였던 금액 (1,244백만원)이 감소되어 별도 재무제표의 대손상각 금액은 1,782백만원으로 설정되었습니다. 대손상각에서 직접 제거하지 않고 내부거래에서 제거한 이유는 관리를 위하여 별도로 구분하였습니다.
[단위: 백만원]
| 설정된 대손상각 | 내부거래 | 잔액 | |
|---|---|---|---|
| 진원생명과학 | 3,026 | (1,244) | 1,782 |
별도재무제표에서 설정되었던 자회사 DIV의 매출채권은 연결 재무제표에서는 내부거래로 제거 되었으며, 별도재무제표와 마찬가지로 CDMO 외부 거래처로부터 장기 매출채권이 수취됨에 따라 1,060백만원을 환입처리 하였습니다.
[단위: 백만원]
| 설정된 대손상각 | 내부거래 | 잔액 | |
|---|---|---|---|
| 진원생명과학 | 3,026 | (1,244) | 1,782 |
| VGXI Inc | 4 | (164) | (160) |
| DIV | 0 | (2,682) | (2,682) |
| 계 | 3,030 | (4,090) | (1,060) |
지속적인 영업적자로 인해 당사의 재무구조는 악화되어 왔으며, 추후에도 당사 파이프라인의 제품화 성공 혹은 라이센스 아웃 또는 플라스미드 CDMO 사업의 매출 성장 등으로 영업흑자로 전환되지 못한다면 재무구조는 계속해서 악화될 것으로 예상됩니다.
당사의 플라스미드 DNA 수주는 2020년 19,301천달러, 2021년 13,724천달러, 2022년 22,077천달러, 2023년 1월부터 9월까지 15,105천달러 수주계약을 보이고 있습니다. 당사의 해외 판매지점인 VGXI USA(VGXI를 포함하여)는 신규 고객과 공급계약 전반에 대한 계약조건이 담긴 마스터 세일즈 계약(Master Sales Agreement: MSA)를 체결하고 개별적으로 PO를 통해 발주를 진행합니다. 통상 전체 발주금액의 50%를 선수금으로 받고 있으며, 50% 이하일 경우에는 생산이 시작되기 전에 선수금 총액이 계약의 최소 50%에 해당하는 금액이 될 수 있도록 진행하고 있습니다. 만약 CEO가 MSA에서 요구하는 것 보다 더 낮은 선수금을 특별하게 승인할 경우에는 해당 내용이 구매약정서에 상세히 기재하고 있습니다.
당사는 VGXI의 신규공장 관련해 언론매체와 인터뷰 등을 통해 당시 회사가 예측하고 있는 영업실적을 여러 차례 언급한 바 있습니다. 그러나 예상되는 수주량과 실제 결과는 많은 괴리를 보이고 있습니다. 실제 수주 현황은 아래와 같습니다.
| 수주금액 |
| (단위:1,000 USD) |
|
|
1분기 |
1-2분기 |
1-3분기 |
1-4분기 |
|---|---|---|---|---|
|
2022년 |
10,986 |
16,885 |
18,980 |
22,077 |
|
2023년 |
8,609 |
12,182 |
15,105 |
|
| 증감 |
(2,377) |
(4,703) |
(3,875) |
|
다음은 당사의 당3분기 보고기간 중 원가기준 투입법을 적용하여 기간에 걸쳐 수익을 인식한 계약으로서 계약금액이 전기 매출액의 5% 이상인 주요 계약의 내역은 아래와 같습니다.
| (단위: USD) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 회사명 | 품목 (*1) | 발주처 (*1) | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
| 총액 | 손실충당금 | 총액 | 손실충당금 | |||||||
| 진원생명과학(주) | 임상용 Plasmid DNA | A 회사 | 2023-01-31 | 2024-01-30 | 5,311,200 | 16.2% | - | - | 663,288 | 3,250 |
| 진원생명과학(주) | 임상용 Plasmid DNA | B 회사 | 2022-02-01 | 2022-12-31 | 2,441,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | C 회사 | 2022-02-23 | 2023-04-30 | 2,416,700 | 100.00% | 68,750 | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | D 회사 | 2022-05-26 | 2023-04-30 | 2,211,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | E 회사 | 2022-02-02 | 2022-09-30 | 1,966,600 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | F 회사 | 2019-09-20 | 2022-12-31 | 2,831,061 | 100.00% | - | - | - | - |
| 합계 | 17,178,061 | 68,750 | - | 663,288 | 3,250 | |||||
(*1) 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았습니다.
미수금 충당을 잡은 이유는 별도 재무상태표에서 자회사의 대여금에 대한 미수수익(10,011백만원)에 대하여 충당금을 설정하기 때문입니다. 이는 특수관계인이지만 대여금의 이자에 대하여 회수가 지연되어 보수적인 관점에서 과거 일정기간동안 3개월별 전이율을 분석하고 이를 이용하여 대손율을 산정하는 총연체전이율을 사용하여 충당금을 설정한 것입니다.
진행률이 낮은 이유는 기존의 생산설비와 새로운 공장 생산설비를 함께 진행함에 있어서 예정과 같이 원활하게 진행되지 못하였고, 새로운 생산인력 증원에 따른 트레이닝으로 인해 생산 업무의 진행도 이전만큼 원활하지 못하여 진행율이 과거보다는 낮아졌습니다.
당사 플라스미드 DNA CDMO 공장은 미국 FDA와 같은 규제기관의 생산시설에 대한 실사를 통한 별도의 인증을 받지 않았습니다. 당사 CDMO 생산시설에 플라스미드 DNA 생산을 의뢰한 고객사에게 생산품과 함께 생산에 관련된 모든 자료를 전달하며 해당 자료가 포함된 IND(임상시험계획)가 고객사에 의해 규제기관에 제출되고 규제기관으로부터 IND(임상시험계획)가 승인을 받으면 당사 플라스미드 DNA CDMO 생산시설은 cGMP급 생산을 하는 시설로 인정받는 것입니다.
| CDMO 공장 수주계약 내용 | |
| 기준일 : 본 공시서류 제출 전일 현재 | (단위 : 천달러) |
| 구분 | 2023년 1월-9월 | 2022년 | 2021년 | 2020년 | |
|---|---|---|---|---|---|
| 거래상대방 국적 | 미국 | 13,806 | 21,737 | 11,034 | 17,312 |
| 아시아 | 1,237 | 410 | 6 | 2,307 | |
| 기타 국가 | 62 | -70 | 2,684 | -318 | |
| 합계 | 15,105 | 22,077 | 13,724 | 19,301 | |
| 계약건수 | 61 | 92 | 116 | 96 | |
| 평균 수주 금액 | 248 | 240 | 118 | 201 | |
| 출처) 당사 제시 주)계약건수는 추가 계약건 포함 |
매출은 공정 진행 단계에 따라 인식하고 있습니다. 거래처에서 요청한 생산이 진행이 되면서 발생되는 프로젝트의 원가를 계약시 설정된 예정원가의 비율만큼 진행되었다고 보아 동일한 비율로 고객과 계약된 금액에 적용한 금액을 인식합니다. 인식하는 금액이 최초 선수금으로 받았던 금액을 초과하면 수익으로 인식되는 금액만큼 고객에게 발행일로부터 30일 기한의 인보이스를 청구합니다. 단, 당사는 최종 잔금을 모두 수령하기 전까지 고객에게 제품을 전달하지 않습니다.
VGXI는 현재 우드랜드 공장 및 콘로에 위치한 신규공장에서 CDMO 관련 생산을 진행하고 있으며, 우드랜드는 연간 700리터, 신규공장은 3,000리터 생산가능 능력을 보유하고 있습니다. 2020년 이후 우드랜드 공장은 70%~80% 가동률을 보였지만, 신규공장의 경우 2023년 5월 신규오더에 대한 첫 가동이 시작되어 본 공시서류 제출 전일 현재까지 가동율 약 24% 수준입니다.
| CDMO 생산 가동율 |
| (단위 : 리터, %) |
| 구분 | 2020년 1분기 |
2020년 2분기 |
2020년 3분기 |
2020년 4분기 |
2021년 1분기 |
2021년 2분기 |
2021년 3분기 |
2021년 4분기 |
2022년 1분기 |
2022년 2분기 |
2022년 3분기 |
2022년 4분기 |
2023년 1분기 | 2023년 2분기 | 2023년 3분기 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 우드랜드 공장 |
생산가능 용량 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 | 700 |
| 가동율 | 71% | 75% | 88% | 85% | 67% | 88% | 63% | 88% | 88% | 75% | 81% | 54% | 27% | 35% | 33% | |
| 콘로 공장 | 생산가능 용량 | - | - | - | - | - | - | - | - | - | - | - | - | 3,000 | 3,000 | 3,000 |
| 가동율 | - | - | - | - | - | - | - | - | - | - | - | - | 2% | 5% | 24% | |
| 출처) 당사 제시 |
대표적인 플라스미드 DNA 위탁생산기업으로는 미국의 VGXI, 벨기에의 Eurogentec, 미국의 Aldevron, 영국의 Cobra 등이 있습니다. 총 생산용량의 경우 비공개된 경우가 많으며, 업계에서 통상적으로 생산능력에 대해 최저용량에서 최대용량까지 공개하고 있습니다.
| [VGXI의 생산용량] |
|
업체명 |
생산용량 |
|---|---|
|
VGXI, US |
10L to 1500L scale available |
| 출처) 당사 제시 |
| [VGXI CDMO 생산용량경쟁업체 비교] |
|
업체명 |
생산용량 |
|---|---|
|
Danaher (formerly Aldevron), US |
10L to 1000L scale available |
|
Eurogentec, Belgium |
80L to 2200L scale available |
|
Charles River (formerly Cobra Bio), US |
1L to 100L scale available |
| 출처) 당사 제시 |
현재 전세계적으로 플라스미드 DNA 생산시설을 확인할 수 있지만, 플라스미드 DNA 수요에 따라 자체적으로 생산하는 기업 및 기관이 많이 포함되어 있습니다. 플라스미드 DNA는 연구소에서 연구를 목적으로 소량 생산은 쉽게 가능하나 이는 농도와 순도가 낮은 저품질의 플라스미드 DNA입니다. 임상에 사용되는 플라스미드 DNA는 우수 의약품 제조 및 품질관리 기준(cGMP)에 맞추어 생산할 것을 미국 FDA에서 권고하고 있기 때문에 VGXI와 같이 해당 규격에 맞추어 플라스미드 DNA 위탁생산사업을 하는 기업은 한정적인 상황입니다.
| 2020년 플라스미드 DNA 생산시설 |
 |
|
플라스미드DNA 생산시설 |
또한, 플라스미드 DNA는 의약품의 원재료 또는 DNA백신 완제품으로 사용되는 것으로 미국 FDA 등 규제기관의 임상시험계획승인(IND) 과정에서 어떤 생산시설에서 생산되었는지와 관련 생산자료(CMC)가 제출되며 해당 생산시설을 변경하기 위해서는 기존 생산시설과 신규 생산시설에서의 생산품질이 동일하거나 우수하다는 동등성평가 결과를 제출하여 하기 때문에 임상연구개발 과정에서 생산시설 변경은 어려운 측면이 있습니다. 그렇기에 기존 고객으로부터 수주계약 실패의 빈도는 매우 낮으며, 신규고객 유치 또한 오랜시간이 필요합니다. 또한 당사는 각종 학회 등의 전문가 집단과의 교류 등을 통한 오프라인 형태의 영업방식을 사용하여 최근까지 마케팅 전문가 1인의 소규모 영업조직이 운영됐으나, 신규고객 유치를 위해 최근 해당 분야 전문가를 최고영업책임자(CCO)로 영입하여 4-5명 규모의 영업조직을 갖추는 등의 방법으로 노력하고 있습니다.
| CDMO 마케팅팀 비용 |
| (단위 : 백만원) |
| VGXI USA | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
|---|---|---|---|---|
| 급여 | 457 | 239 | 179 | 189 |
| 복리후생비 | 104 | 61 | 53 | 55 |
| 광고선전비 | 282 | 245 | 125 | 97 |
| 여비교통비 | 69 | 83 | 7 | 3 |
| 통신비 | 1 | 1 | 1 | 3 |
| 세금과공과 | 10 | 16 | 10 | 9 |
| 운반비 | - | - | 1 | - |
| 사무용품 | 5 | - | 1 | 3 |
| 지급수수료 | 81 | 62 | 40 | 80 |
| 계 | 1,009 | 707 | 417 | 439 |
| 출처) 당사 제시 |
당사는 금번 주주배정 후 실권주 일반공모로 유입되는 자금 중 자회사 VGXI에 대여금을 통해 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다. 단, 국제규격(cGMP) 플라스미드 DNA 생산시설이 한정된 상황에서 가능성이 낮지만 기존고객(계약상대방)이 생산시설을 VGXI에서 다른 플라스미드 DNA 생산시설로 변경하거나 기존고객(계약상대방)의 판단에 따라 VGXI와 신규 플라스미드 DNA생산시설 1곳을 추가하여 2곳의 생산시설에 발주할 경우 기존고객(계약상대방)과의 계약금액이 줄어들거나 신규발주물량이 없을 가능성도 있어 수주잔고가 하락할 위험이 있습니다. 또한, 신규고객에 대한 영업활동을 진행하여도 해당 고객이 VGXI가 아닌 다른 생산시설에 발주할 경우 신규고객에 대한 유치가 어려울 수도 있습니다. 또한, 당사 파이프라인의 경우 빠른 시일 내에 제품화가 어려울 것으로 보이며, 매출로 이어지지 않고 비용만 지속적으로 투입될 경우 수익성이 악화될 위험도 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 가-2. 임원 급여 및 상여 지급에 따른 재무구조 악화 위험 당사는 지속된 적자에도 불구하고 당사의 판매비와 관리비 중에서 급여가 가장 많은 비용으로 발생하고 있으며, 2022년 이사 및 감사의 보수총액은 6,680백만원으로 1인당 평균보수액은 1,665백만원이며, 2023년 3분기 이사 및 감사의 보수총액은 2,971백만원으로 1인당 평균보수액은 743백만원이며, 스톡옵션의 경우 행사기한이 만료되어 부여수량이 없습니다. 당사는 지속적인 영업적자로 과부족한 운영자금(급여, 연구개발비 등)을 자본시장을 통해 자금조달하여 대체해 왔으며, 조달한 자금 중 일부가 이사 및 감사의 보수 및 급여 등의 운영비로 사용되고 있는 상황입니다. 이처럼 지속적인 영업적자로 인해 당사의 재무구조는 악화되어 왔으며, 지속된 적자에도 불구하고 임원 급여 및 상여 지급으로 영업손실이 증가되어 수익성이 악화될 위험도 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 지속된 적자에도 불구하고 당사의 판매비와 관리비 중에서 급여가 가장 많은 비용으로 발생하고 있으며, 2022년 이사 및 감사의 보수총액은 6,680백만원으로 1인당 평균보수액은 1,665백만원이며, 2023년 3분기 이사 및 감사의 보수총액은 2,971백만원으로 1인당 평균보수액은 743백만원이며, 스톡옵션의 경우 행사기한이 만료되어 부여수량이 없습니다.
2023년 3분기말 기준, 당사의 이사 및 감사 보수 한도는 이사의 경우 500억원이며, 감사의 경우 5억원입니다.
당사는 지속적인 영업적자로 과부족한 운영자금(급여, 연구개발비 등)을 자본시장을 통해 자금조달하여 대체해 왔으며, 조달한 자금 중 일부가 이사 및 감사의 보수 및 급여 등의 운영비로 사용되고 있는 상황입니다.
| [이사ㆍ감사 전체의 보수 한도] |
| (단위 : 백만원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|
등기이사 |
3 |
50,000 |
정관에 보수한도 금액 기재 |
|
감사 |
1 |
500 |
정관에 보수한도 금액 기재 |
출처) 당사 정기보고서 및 당사 제시
| [보수지급금액] |
| (단위 : 백만원) |
| 구 분 | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| 인원수 | 4 | 4 | 4 | 4 |
| 보수총액 | 2,971 | 6,680 | 8,385 | 4,944 |
| 1인당 평균보수액 | 743 | 1,665 | 2,096 | 1,236 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 대표이사에 대한 급여를 기본연봉(전년도 급여)에 대해 장기 재임시 기본연봉 인상 폭이 증가하도록 아래 '급여 인상률 산출식'을 적용하여 매년 급여를 산출하여 지급하고 있습니다.
| 기본연봉 인상률 상한선(%)= 10 + 2 × [(대표이사 총 재임년수) - 5] |
즉, 재임 6년차 이후 인상률은 10%와 계산식으로부터 도출된 값 사이의 범위에서 급여를 결정하고 있습니다. 그러나, 인상률 상한선은 최대 20%를 한도로 합니다.
이러한 기준에 따라 산출된 대표이사의 급여 인상률은 아래와 같습니다.
| 구분 | 2017-2018년(7~8년차) | 2019-2020년(9~10년차) | 2021-2023년(11~13년차) |
| 급여 인상률 | 12%, | 14%, | 20% |
대표이사 외 등기임원은 정관에서 정한 절차에 따라 이사 보수한도 내에서 매년 5%~15% 범위 내에서 임금 경쟁력과 경영성과 및 기여도 그리고 경영 여건 등을 고려하여 결정하며, 비등기임원은 비등기임원보수한도(2022년 3월 기존 7억원에서 15억원으로 이사회에서 상향했음) 내에서 개인별 직무 전문성 및 학위/경력 등을 고려하여 결정합니다.
한편, 당사는 이사회 결의에 따라 임원급여 Table을 기초로 리더십, 전문성, 회사기여도 등을 종합적으로 반영하여 급여를 산정하고 있으며, 정관의 "이사의 보수 규정"에 따라 재무 부분에 기여한 계량지표와 리더십, 전문성, 기타 기여도로 구성된 비계량지표를 종합적으로 평가하여 연봉의 0%~500% 범위 내에서 상여를 지급하고 있습니다. 이에 따라 산출된 금액이 연간 5억원을 초과할 경우 「자본시장과 금융투자업에 관한 규정」제159조제2항에 따라 정기보고서에 공시하고 있습니다.
| [최근 5년간 임원(등기&종속회사 임원) 급여 및 법인카드 사용액 내역 |
| (단위: 천원) |
| 임원구분 | 성명 | 구분 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 |
|---|---|---|---|---|---|---|---|---|
| 등기임원 | 박영근 | 급여 | 658,011 | 747,114 | 851,810 | 1,010,491 | 1,212,584 | 1,075,514 |
| 상여 | 1,604,200 | 1,046,200 | 3,199,300 | 3,830,300 | 4,400,300 | 1,310,000 | ||
| 스톡옵션 | - | - | - | 1,922,400 | - | - | ||
| 법인카드 사용액 | 95,186 | 62,883 | 28,770 | 33,968 | 38,349 | 37,699 | ||
| 합계 | 2,357,397 | 1,856,197 | 4,079,880 | 6,797,159 | 5,651,233 | 2,423,213 | ||
| 등기임원 | 조병문 | 급여 | 365,191 | 394,406 | 425,959 | 460,036 | 496,839 | 399,908 |
| 상여 | 274,800 | 198,200 | 419,920 | 458,300 | 470,300 | 121,000 | ||
| 스톡옵션 | - | - | - | 480,600 | - | - | ||
| 법인카드 사용액 | 13,644 | 20,700 | 8,605 | 11,242 | 6,542 | 1,945 | ||
| 합계 | 653,635 | 613,306 | 854,484 | 1,401,178 | 973,681 | 522,853 | ||
| 종속회사(DIV) 등기임원 |
박희곤 | 급여 | 39,628 | 44,193 | 47,245 | 50,536 | 52,426 | 41,037 |
| 상여 | 5,000 | 12,000 | 12,500 | 7,000 | 8,000 | 6,000 | ||
| 스톡옵션 | - | - | - | 176,220 | - | - | ||
| 합계 | 44,628 | 56,193 | 59,745 | 233,756 | 60,426 | 47,037 |
| 출처) 당사 제시 주1) 2023년의 경우 9월까지 내역임. 주2) 상기 표는 급여 및 법인카드 사용액을 모두 포함하고 있기 때문에, 실제 임원에게 지급된 합계 금액보다 과대계산 될 수 있음. |
| [최근 5년간 임원(등기임원) 법인카드 사용액 내역 |
| (단위: 천원) |
| 임원구분 | 성명 | 구분 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 |
|---|---|---|---|---|---|---|---|---|
| 등기임원 (대표이사) |
박영근 | 해외출장 항공 및 교통 | 6,932 | 4,915 | 2,932 | 3,352 | 5,340 | 7,212 |
| 해외출장 숙박 | 48,736 | 21,703 | 7,458 | 6,953 | 12,660 | 10,716 | ||
| 접대비 | 28,467 | 27,018 | 3,967 | 2,978 | 5,983 | 11,259 | ||
| 회사비품 | 11,051 | 9,248 | 14,414 | 20,685 | 14,366 | 8,512 | ||
| 합계 | 95,186 | 62,883 | 28,770 | 33,968 | 38,349 | 37,699 | ||
| 등기임원 (전무이사) |
조병문 | 건강검진(대표이사, 전무이사) | 1,955 | 2,037 | 25 | 3,076 | 2,547 | 576 |
| 해외출장 항공 및 교통 |
629 | 8,706 | 78 | 242 | 97 | 71 | ||
| 해외출장 숙박 |
915 | 2,815 | - | - | - | - | ||
| 접대비 | 10,145 | 7,141 | 8,501 | 7,925 | 3,898 | 1,298 | ||
| 합계 | 13,644 | 20,700 | 8,605 | 11,242 | 6,542 | 1,945 |
| 출처) 당사 제시 주) 2023년의 경우 9월까지 내역임. |
| [최근 5년간 임원(등기&종속회사 임원) 자회사 급여 내역] |
| (단위: 천달러, 천원) |
| 임원구분 | 성명 | 구분 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023/ 3Q | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| USD | KRW | USD | KRW | USD | KRW | USD | KRW | USD | KRW | USD | KRW | |||
| 종속회사(VGXI) 등기임원 |
박영근 | 급여 | 400 | 440,120 | 460 | 536,199 | 500 | 590,025 | 600 | 686,652 | 640 | 826,848 | 467 | 610,369 |
| 상여 | 1,000 | 1,100,300 | 1,900 | 2,214,735 | 2,948 | 3,478,787 | 2,200 | 2,517,724 | 2,300 | 2,971,485 | - | - | ||
| 합계 | 1,400 | 1,540,420 | 2,360 | 2,750,934 | 3,448 | 4,068,812 | 2,800 | 3,204,376 | 2,940 | 3,798,333 | 467 | 610,369 | ||
| 종속회사(VGXI) 등기임원 |
조병문 | 급여 | 140 | 154,042 | 150 | 174,848 | 155 | 182,908 | 160 | 183,107 | 165 | 213,172 | 120 | 156,840 |
| 상여 | 120 | 132,036 | 133 | 155,031 | 160 | 188,808 | 90 | 102,998 | 113 | 145,990 | - | - | ||
| 합계 | 260 | 286,078 | 283 | 329,879 | 315 | 371,716 | 250 | 286,105 | 278 | 359,162 | 120 | 156,840 | ||
| 종속회사(DIV) 등기임원 |
박희곤 | 급여 | 78 | 85,953 | 74 | 86,295 | 75 | 88,103 | 80 | 91,034 | 76 | 98,365 | 58 | 75,817 |
| 상여 | - | - | - | - | - | - | - | - | - | - | ||||
| 합계 | 78 | 85,953 | 74 | 86,295 | 75 | 88,103 | 80 | 91,034 | 76 | 98,365 | 58 | 75,817 | ||
| 출처) 당사 제시 |
| [최근 5년간 등기 임원의 자회사(VGXI) 법인카드 사용액 내역 |
| (단위: 달러, 천원) |
| 구분 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| USD | KRW | USD | KRW | USD | KRW | USD | KRW | USD | KRW | USD | KRW | |
| Auto Maintenance (차량유지비) |
$2,974.87 | 3,867 | $4,467.45 | 5,808 | $6,894.61 | 8,963 | $5,613.30 | 7,297 | $4,053.99 | 5,270 | $3,942.87 | 5,126 |
| Business Marketing Expense (마케팅비용) |
$14,540.00 | 18,902 | $478.50 | 622 | $0.00 | 0 | $0.00 | 0 | $515.46 | 670 | $0.00 | 0 |
| Business Meals - Admin (식대) |
$450.05 | 585 | $1,770.09 | 2,301 | $302.15 | 393 | $712.68 | 926 | $1,910.34 | 2,483 | $2,999.42 | 3,899 |
| Business Meals - Corporate (식대) |
$9,024.77 | 11,732 | $5,938.96 | 7,721 | $1,333.05 | 1,733 | $2,070.23 | 2,691 | $1,388.92 | 1,806 | $1,060.56 | 1,378 |
| Charitable Donations (기부금) |
$0.00 | 0 | $21,500.00 | 27,950 | $11,500.00 | 14,950 | $11,500.00 | 14,950 | $12,625.00 | 16,413 | $0.00 | 0 |
| Computer Software - Exp- Corp (소프트웨어사용) |
$108.24 | 141 | $108.24 | 141 | $228.24 | 297 | $372.27 | 484 | $241.44 | 314 | $272.60 | 354 |
| Corporate - Travel (출장비) |
$123,506.36 | 160,558 | $145,111.55 | 188,645 | $74,737.93 | 97,159 | $107,803.61 | 140,145 | $136,438.75 | 177,370 | $73,298.16 | 95,288 |
| Courier Expense - Corp (운송비) |
$2,383.70 | 3,099 | $382.31 | 497 | $4,569.09 | 5,940 | $6,396.20 | 8,315 | $3,243.52 | 4,217 | $1,623.29 | 2,110 |
| Employee Parking (주차비) |
$2,820.00 | 3,666 | $4,440.00 | 5,772 | $4,440.00 | 5,772 | $4,440.00 | 5,772 | $4,440.00 | 5,772 | $3,330.00 | 4,329 |
| Furniture & Office Expense (사무용품비) |
$0.00 | 0 | $0.00 | 0 | $19,974.66 | 25,967 | $32,790.41 | 42,628 | $42,338.23 | 55,040 | $0.00 | 0 |
| Membership Dues (협회비) |
$3,569.85 | 4,641 | $4,616.51 | 6,001 | $3,529.57 | 4,588 | $3,450.57 | 4,486 | $4,196.44 | 5,455 | $2,359.57 | 3,067 |
| Office Supplies - Corporate (사무기기용품) |
$1,033.85 | 1,344 | $1,616.92 | 2,102 | $4,192.78 | 5,451 | $7,071.83 | 9,193 | $2,594.40 | 3,373 | $1,727.46 | 2,245 |
| Organizational Expense (조직운영비) |
$0.00 | 0 | $0.00 | 0 | $100.00 | 130 | $2,163.00 | 2,812 | $0.00 | 0 | $129.60 | 168 |
| Outside Services-Corp (통신 및 보안 서비스비) |
$10,352.77 | 13,459 | $8,988.91 | 11,686 | $9,018.92 | 11,725 | $13,608.65 | 17,691 | $2,188.92 | 2,846 | $8,989.18 | 11,686 |
| Subscriptions - Corp (구독비) |
$0.00 | 0 | $0.00 | 0 | $0.00 | 0 | $193.77 | 252 | $692.69 | 900 | $1,741.43 | 2,264 |
| 합계 | $ 170,764.46 | 221,994 | $199,419.44 | 259,246 | $140,821.00 | 183,068 | $198,186.52 | 257,642 | $216,868.10 | 281,929 | $101,474.14 | 131,916 |
| 출처) 당사 제시 주1) 2023년의 경우 9월까지 내역임. 주2) 환율 1,300원 가정 주3) VGXI의 법인카드는 대표이사 및 공용카드로 공용카드를 사용하지 못하는 상황에서 대표이사 법인카드로 출장비 및 소모품 등을 결제하는 상황이며 VGXI CFO인 조병문 전무이사에게는 별도의 법인카드가 지급되지 않았음. |
VGXI는 당사가 100% 지분을 보유한 미국 법인입니다. 등기임원은 당사 박영근 대표이사와 조병문 전무이사 2인입니다. 해당 등기임원의 보수는 당사와 별도로 VGXI에서도 지급되고 있습니다. VGXI는 임원 보수에 대해 당사 기준을 준용하여 적용했습니다. 급여의 경우 당사에서 지급되는 부분을 감안하여 일부 하향조정했으며 상여의 경우에는 VGXI의 상여 산출 프로그램에 의해 지급했습니다. VGXI의 상여는 근속기간, 회사가 매년 설정한 매출액 목표에서 달성 수준을 계량화하여 평가하며 정성적인 평가항목으로 조직 내 직책에 맞춰 설정된 역할의 수행과 그에 따른 업무성과를 평가합니다. 그리고 최종적으로 회사 전체 상여에서 비례적으로 배분하여 조정합니다.
당사는 매년 3월 전년도 계량지표와 비계량지표에 대한 각 성과를 평가하여 산출된 점수에 비례하여 해당년도 귀속 상여금을 결정하고 있습니다. 또한 특별한 성과가 있는 경우 스팟 보너스를 지급하기도 합니다. 이러한 운영방식은 자회사 VGXI도 동일합니다.
당사의 임원 성과평가 지표는 매년 경영환경 및 사업계획에 따라 조금씩 변경되지만 크게 사업, 전략, 리더십 및 기타 기여 등 3개 영역에서 총 7~10개의 목표항목을 설정하고 회계연도 결산 후 각 항목의 달성도를 내부적으로 평가하고 있습니다. 사업 영역에서는 주로 매출액, 신규고객 발굴 등 사업성과를 직접적으로 보여주는 계량지표를 활용하여 성과를 측정합니다. 전략 영역에서는 사업환경 변화에 따른 기술전략 수립 및 추진, 연구성과 확보, 생산능력 확보, 핵심연구인력 확보와 같은 비계량적이지만 사업핵심역량 강화 관점에서 필수적인 활동의 성과를 주로 판단하고 있습니다. 이외에 임원이 담당하는 역할에 따라 자금조달 및 유동성 관리와 같은 재무적 목표가 포함되기도 합니다. 리더십 및 기타 기여 영역을 통해서는 조직관리, 기업 이미지 제고 및 대외홍보활동, 원가절감과 같은 경영개선 활동 등의 목표 대비 달성도를 평가합니다. 대규모 선행투자를 수반하는 장기 연구개발 과제 중심의 바이오/CDMO 사업 특성상 단기 성과 측정에는 비계량지표가 50% 내외의 상당한 비중으로 반영되고 있으나, 향후 제도를 개선하여 명확한 계량지표를 중심으로 성과평가를 진행할 계획입니다.
상여 금액은 연봉을 기초로 인센티브지급률을 곱하여 산출됩니다. 인센티브지급률=Target지급률*성과평가점수/100으로 계산됩니다. Target지급률은 평가결과 100점(Target)을 기준으로 대표이사는 200%, 전무이사는 70%입니다. 즉, 대표이사가 특정 년도 성과평가 점수 122점을 받으면 인센티브지급률은 244%입니다. 전무이사가 특정 년도 성과평가 점수 103점을 받으면 인센티브지급률은 72%입니다.
VGXI의 경우 인센티브지급률은 Target지급률*달성기준지급률로 계산됩니다. 진원생명과학과 비교할 때 대표이사의 Target 지급률이 250%인 점과 인센티브지급률을 구간으로 적용했다는 점이 다릅니다. 달성기준지급률은 2018년 이전에는 대표이사와 전무이사가 동일하였으나 2019년부터 대표이사의 경우 목표 초과 달성시 지급률은 상향조정하여 성과에 대한 보상을 강화했습니다. 대표이사가 특정 년도 115점을 받으면 인센티브지급률은 250%*150%으로 계산하여 375%가 됩니다.
|
최종 성과평가 점수 |
달성기준지급률 (전무이사) |
달성기준지급률 (대표이사) |
|---|---|---|
|
120점 이상 |
150% |
200% |
|
100점 이상 120점 미만 |
125% |
150% |
|
90점 이상 100점 미만 |
100% |
100% |
|
70점 이상 90점 미만 |
80% |
80% |
|
70점 미만 |
50% |
50% |
| [최근 6년간 박영근 대표이사의 임원 인센티브 및 특별보너스 현황] |
|
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
|
|---|---|---|---|---|---|---|---|
|
성과평가 |
사업 |
27.0 / 30 |
30.0 / 20 |
55.0 / 30 |
17.5 / 20 |
20.0 / 20 |
40.0 / 20 |
|
전략 |
90.5 / 70 |
92.0/ 80 |
77.5 / 70 |
105.0 / 70 |
91.5 / 70 |
74.0 / 70 |
|
|
리더십 |
10.0 / 10 |
15.0 / 10 |
10.0 / 10 |
||||
|
성과평가 점수 |
117.5 / 100 |
122.0 / 100 |
132.5 / 100 |
132.5 / 100 |
126.5 /100 |
124.0 / 100 |
|
|
인센티브 (귀속년도 기준) |
인센티브 지급률* |
235% |
244% |
265% |
265% |
253% |
248% |
|
인센티브 지급액 |
1,585백만원 |
1,880백만원 |
2,333백만원 |
2,800백만원 |
3,200백만원 |
||
|
특별 보너스 (지급시점 기준) |
특별 보너스 지급액 |
- |
- |
- |
- |
1,000백만원 |
1,200백만원 |
|
특별 보너스 지급 사유 |
- |
- |
- |
- |
코로나19 DNA 백신(GLS-5310) 임상2a상 진입 |
코로나19 경구용 치료제 임상2상 IND 유럽의약품청과 불가리아 승인 |
|
| 주1)* 성과평가 목표(100점) 달성 시 기본연봉 대비 200%(Target 지급률), 최종 성과평가 점수에 비례하여 지급률 결정 (인센티브 지급률 = Target 지급률 × 성과평가 점수 ÷ 100) 주2) 인센티브 귀속년도의 익년도 지급 |
| [최근 6년간 조병문 전무이사의 임원 인센티브 및 특별보너스 현황] |
|
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
|
|---|---|---|---|---|---|---|---|
|
성과평가 |
사업 |
27.0 / 30 |
39.0 / 30 |
40.0 / 30 |
0.0 / 20 |
0.0 / 20 |
20.0 / 20 |
|
전략 |
76.0 / 70 |
65.0 / 70 |
64.0 / 70 |
94.0 / 70 |
90.0 / 70 |
48.0 / 70 |
|
|
리더십 |
10.0 / 10 |
12.0 / 10 |
10.0 / 10 |
||||
|
성과평가 점수 |
103.0 / 100 |
104.0 / 100 |
104.0 / 100 |
104.0 / 100 |
102.0 /100 |
78.0 / 100 |
|
|
인센티브 (귀속년도 기준) |
인센티브 지급률** |
72% |
73% |
73% |
73% |
71% |
55% |
|
인센티브 지급액 |
269백만원 |
292백만원 |
314백만원 |
340백만원 |
360백만원 |
||
|
특별 보너스 (지급시점 기준) |
특별 보너스 지급액 |
- |
- |
- |
- |
100백만원 |
110백만원 |
|
특별 보너스 지급 사유 |
- |
- |
- |
- |
코로나19 DNA 백신(GLS-5310) 임상2a상 진입 |
코로나19 경구용 치료제 임상2상 IND 유럽의약품청과 불가리아 승인 |
|
| 주1)* 성과평가 목표(100점) 달성 시 기본연봉 대비 200%(Target 지급률), 최종 성과평가 점수에 비례하여 지급률 결정 (인센티브 지급률 = Target 지급률 × 성과평가 점수 ÷ 100) 주2) 인센티브 귀속년도의 익년도 지급 |
모회사 및 자회사 각각 임원 급여와 계량, 비계량 평가를 기초로 산정된 임원 상여금 산정 내역은 아래와 같습니다. 상여금은 매년 이사회에서 산출된 계량지표와 비계량지표에 대해 협의 후 이사회 의장에게 일임하였습니다.
당사는 이사회에서 상여금 관련 산출된 계량지표와 비계량지표에 대해 협의를 진행한 바 있으나 정관 제31조 1항에 의거 임원급여 및 상여 금액을 이사회에서 결정하지 않고 이사회 의장에게 금액 결정을 일임하고 있습니다. 이사회 이후 이사회 의장인 대표이사는 총무팀 인사부서에서 내부 평가에 따라 산출된 금액에 대한 품의서를 승인함에 따라 임원의 급여 및 상여 금액을 결정하고 있습니다.
| [최근 5년간 등기 임원 상여금 산정 내역] |
| 년도 | 기간 | 등기 임원의 수행 내용 |
|---|---|---|
| 2018년 | 반기 | - 계량지표; GLS-1027 APA계약; 이노비오로부터 $1,000,000에 양수, 2017/12/26, 산출된 가치 $9,273,000 - 비계량지표; B형간염면역글로블린 특허 등록, 지카 DNA백신 전미임상연구포럼에서 10대 우수연구사 수상, 자회사 위탁생산시설 확장, C형간염예방 DNA백신 국내 임상1상승인 |
| 사업 | - 계량지표; GLS-1027 APA계약; 이노비오로부터 $1,000,000에 양수, 2017/12/26, 산출된 가치 $9,273,000 - 비계량지표; B형간염면역글로블린 등록, 지카 DNA백신 전미임상연구포럼에서 10대 우수연구사 수상, 자회사 위탁생산시설 확장, C형간염예방 DNA백신 국내 임상1상승인, 쓴맛수용체이용 염증치료기술 라이선스인, 메르스백신 1상임상연구중간결과 WHO/IVI 공동심포지엄에서 발표, SFTS DNA백신 특허 출원, mRNA백신 생산 및 연구관련 기술 라이선스인, 자회사 위탁생산시설에 RNA생산시설 구축 |
|
| 2019년 |
반기 | - 계량지표; CMO 대량 수주(5건 총 약 12백만불) - 비계량지표; 메르스 DNA백신의 임상1상 결과 국제학술지 게재, 자회사 위탁생산시설에 개인맞춤형 암백신 신속생산시스템 구축 |
| 사업 | - 계량지표; CMO 대량 수주(5건 총 약 12백만불) - 비계량지표; 메르스 DNA백신의 임상1상 결과 국제학술지 게재, 자회사 위탁생산시설에 개인맞춤형 암백신 신속생산시스템 구축, 쓴맛수용체이용 염증치료기술이용 만성 축농증 치료제 미국 FDA 임상2상 승인, 자회사 생산시설에 임상시험의약품용 파일럿 mRNA생산공정 구축, 자회사 신규 대량생산시설 구축 결정 및 시행사 선정 |
|
| 2020년 |
반기 | - 계량지표; CMO 대량 수주 (360만불+230만불), 코로나19 백신 전임상 개발지원 국책과제(약1.5억원) 계약 체결 - 비계량지표; 휴스턴 매소디스트 병원과 코로나19 RNA 백신 개발 협력, GLS-1200의 코로나19 감염방지치료제 특허 출원, 코로나19 김염방지 코스프레이 치료제인 GLS-1200의 미국 FDA 임상2상 승인, 메르스 DNA백신 1/2a상 임상연구 중간결과를 국제 학술대회에서 발표, 메르스 DNA백신 국내 임상 2a상 연구 종료, 자회사 생산시설에 개인 맞춤형 암백신 신속생산시스템 구축 완료 |
| 사업 | - 계량지표; 코로나19 백신 전임상 개발지원 국책과제(약1.5억원) 계약 체결, SFTS DNA백신 복지부 백신실용화기술개발 사업선정 (3년간 17억원), CMO 대량 수주 (360만불+230만불) - 비계량지표; 자회사 생산시설이 2020년 세계백신대회에서 Best CMO상 수상, 휴스턴 매소디스트 병원과 코로나19 RNA 백신 개발 협력, GLS-1200의 코로나19 감염방지치료제 특허 출원, 코로나19 김염방지 코스프레이 치료제인 GLS-1200의 미국 FDA 임상2상 승인, 메르스 DNA백신 1/2a상 임상연구 중간결과를 국제 학술대회에서 발표, 메르스 DNA백신 국내 임상 2a상 연구 종료, 자회사 생산시설에 개인 맞춤형 암백신 신속생산시스템 구축 완료, 최고과학개발책임자 Kar Muthimani박사 영입, 경구용 코로나19 중증억제 치료제 GLS-1027의 미국 FDA 임상2상 승인, 자회사 위탁생산시설 대량생산시설 착공, 코로나19 백신 GLS-5310 국내 임상1/2a상 승인 |
|
| 2021년 |
반기 | - 계량지표; 정부지원과제(코로나19 백신 임상 연구비 약 73억원, mRNA 기반 신속 백신제작 플랫폼 정부지원 약 8억원) 선정 - 비계량지표; mRNA 대규모 생산기반 및 글로벌 네트워크 구축 협력계약 체결(한미사이언스) 및 코로나19 백신, GLS-1027, GLS-1200 임상연구 수행, C형간염 예방백신 1상 임상연구 IND 승인, 신변종감염병 대응 플랫폼 핵심기술 개발 국책과제 참여 등 |
| 사업 | - 계량지표; 정부지원과제(코로나19 백신 임상 연구비 약 73억원, mRNA 기반 신속 백신제작 플랫폼 정부지원 약 8억원) 선정 - 비계량지표; 코로나19 제품 3종(백신, 감염방지 코 스프레이 치료제, 경구용 치료제)의 임상2상 연구 수행 및 Gene Delivery Device의 개발 등 |
|
| 2022년 | 반기 | - 계량지표; 니파 및 포와산 바이러스 예방 핵산기반 백신 후보물질의 기술이전 - 비계량지표; 코로나19 부스터 전용 백신 미국 1상 수행, mRNA 플랫폼 구축 및 암이나 자가면역질환 등에 적용가능한 혁신적인 치료방법에 대한 기초 연구 성과 |
| 사업 | - 계량지표; 니파 및 포와산 바이러스 예방 핵산기반 백신 후보물질의 기술이전 - 비계량지표; 자회사의 신규공장 준공 및 SFTS 1상임상을 위한 IND 준비, 지카 mRNA 백신 선도물질의 유효성 및 안정성 평가 완료 |
|
| 2023년 |
반기 |
- 계량지표; 신규공장 첫 계약 수주(약 7,111백만원) - 비계량지표; 임상1상결과의SCI 논문2편출판, DNA 백신개발기술과면역원성평가방법의SCI 논문1편출판, Suction device(진덤)의국내특허등록2건, 국내출원1건, Suction device(진덤) 해외8개국PCT 출원 |
| 출처) 당사 제시 |
VGXI의 상여 관련 평가 항목은 1) 품질 2) 비교할 수 없는 헌신 3) 업무의 책임성 4) 리더쉽 5) 혁신 성과 6) 조직내 역할 수행이며 임원의 상여 산출은 아래 성과를 바탕으로 회사의 성과 측정 및 평가 시스템에 의해 산출되었습니다.
| [최근 5년간 등기 임원의 자회사(VGXI) 상여금 산정 내역] |
| 년도 | 등기 임원의 수행 내용 |
|---|---|
2018년 |
차트기록을 대체하는 온도추적시스템 시행, 새로운 크림프기계 사용 시작, 생산공장 문 업그레이드, 케이 밸리데이터의 대체시스템 검토, Highly Documented 플라스미드 스몰스케일의 공정시간 단축(수천억원의 미래가치 창출 및 맞춤형 항암치료제에 필요), IQ/QQ 관련 요건에 맞게 5밀리리터 바이럴 용량 추가, 재고관리용 소프트웨어 시행, 새로운 cGMP생산시설 확충, 공정개발에 필요한 플라스미드 정제절차 완료, Highly Documented 플라스미드 스몰스케일 생산공정을 위한 플라스미드 정제절차 검토, 플라스미드 스몰스케일 생산공정을 위한 일회용 퍼멘터 사용 검토, mRNA 생산기술력을 갖추기 위하여 휴스턴메소디스트 병원 연구센터와 mRNA생산기술이전 라이센스를 취득함과 동시에 전략적 파트너십 구축(mRNA생산기술력은 연 수백억에서 수천억원 미래가지가 있음), 기존의 우드랜즈 생산시설에서 다양한 규모의 유효성 cGMP DNA 플라스미드 생산시설과 cGMP mRNA 생산공장 확충, 2019년에 FDA승인받은 Zolgensma® 임상3상용에 필요한 DNA Plasmid을 생산함. 일회용 치료제 가격은 25억원에 달하고, 유전자치료제에 꼭 필요한 핵심원료의 기술력 개발을 확보했음. 유전자치료제는 미래의 의약품으로 그 핵심원료를 개발하는점은 천문학적 가치를 가짐, 세계백신총회로부터 최우수CMO 부문(VIE대상) 최종후보에 선정됨. |
| 2019년 |
기존 생산시설을 모든면에서 업그레이드함. 바닥과 벽을 업그레이드하고 멸균처리기를 새것으로 교체함 cGMP생산시설의 문들을 업그레이드함, 교육시설, 보관실, 냉동공간을 리노베잇함, 케이 밸리데이터의 대체시스템을 완성함, 업스트림 장비 전환세정시스템 인증 완료함, 2018년이후의 수정 예방조치들을 완료함, 제조소 총람을 완료함, 플라스미드 원액의 멸균한도를 측정 개발함, 냉장시설의 차트기록을 대체하는 온도추적시스템을 시행함, mRNA스몰스케일의 생산을 위한 기술이전을 완료하고, mRNA 스몰스케일 생산시설을 구축함, 맞춤형 면역항암제 개발을 위한 계약서를 GT사와 체결함, FDA승인받은 상업용 AAV유전자치료제의 플라스미드DNA 공급기관으로 VGXI가 자격요건을 인정받음, 대형제약사 고객을 위한 다년공급계약을 체결함, 급속 생산완료시간을 세계최단기간인 12일로 단축함. 맞춤형 암치료제 개발의 핵심은 시간단축이며 천문학적 가치를 가짐, 긴급환자를 위한 cGMP제품을 생산함, 세계백신총회로부터 최우수CMO 부문(VIE대상) 준우승에 선정됨, Lysis coil apparatus for purification of polynucleotides - PCT WO2019232324 published 2019. 특허출원. |
| 2020년 |
품질관리시스템 소프트웨를 업그레이드함, 원료물질의 적정 보관환경을 확보함, 제조소 총람을 완료함, 2019년이후의 수정 예방조치들을 완료함, 차트기록을 대체하는 온도추적시스템을 시행함, 디지털 UV데이터 캡쳐 자동화 작업을 수행함, 라이시스 스키드에 플로우센서와 펌프콘트롤을 확보함. DNA플라스미드 생산에 중요한 시스템, 완충액 유효기한을 확보함, 12일로 단축된 급속 생산완료공정을 체계화시킴, 발효공정을 위한 공기순환장치를 업그레이드함, 1g이상의 mRNA대량생산을 위한 공정시스템 개발시작함. 현재까지 1g이상의 대량mRNA생산이 가능한 회사는 몇 안됨. Covid19와 같은 팬데믹상황에서는 mRNA대량생산 시스템이 필수, 응급상황중의 긴급코로나백신 개발을 위해 CEPI로부터 공동선정됨. DNA플라즈미드 긴급생산의 기술력을 인정받음, 12일로 단축된 급속 생산완료공정을 통해 맞춤형GMP플라스미드를 성공적으로 생산함, Covid19백신을 두달만에 생산해서 출고함, 새공장의 디자인과 설계를 완료하고 시공사를 선정함. 시공사 선정과정에서 수입억에서 수백억의 공사비를 절감함, 12만스퀘어피트 신규생산시설의 기공식을 개최함, 맞춤형 cGMP플라스미드DNA백신을 생산콘로시로부터 저가에 부지를 구입하고, 세제혜택과 경제적혜택을 받음. i)$400,000의 직접적 현금보조금을 제공받고, ii)7년간 $1,215,306의 세금혜택을 받으며, iii)인프라 구축에 $175,000 규모의 지원을 받음.함, 플라스미드 정제절차에서 1회용 자외선흐름 세포들을 실행함, 세계백신총회로부터 최우수CMO 부문(VIE대상) 최우수상을 수상함. 세계적 CMO들과 경쟁에서 얻은 수상으로 엄청난 경제적 광고효과를 누림. |
| 2021년 |
2019년부터의 수정 및 예방조치들을 완료함, 2020년부터의 수정 및 예방조치들을 완료함, 완충액 유효기간 개발보고서를 완성함, 1g이상 mRNA대량생산 공정과정을 완성함. 미래의 엄청난 경제적 가치를 가짐. 1g이상 대량생산 공정이 가능한 회사는 몇 안됨, 판매세 면세절차 실행함, 과거 설비구입비용에 대한 세금환급 받음. $1.3 Million, 새 생산설비 타임라인 완료함, 새 생산설비 인력보충 및 확보계획 완료함.새 생산설비 설치 및 인증작업 계획을 완료함, 팬데믹 인력난과 원자재 공급채널 난항에도 불구하고 콘로 새 생산시설 건설이 빠른속도로 추진됨, 초희귀 유전질환에 대한 새로운 유전자 치료제 개발에 기여 및 지원하였으며, 초희귀 유전질환의 치료제 개발에 선정됨, 고객별 맞춤형 기자재 사용 가능성을 연구함, 품질관리 설비를 새로 설치 혹은 업데이트함, 플라스미드 샘플의 품질테스트를 위한 Capillary Gel Electrophoresis 방식을 개발함, 낮은 수율의 플라스미드 생산을 위한 강력한 절차를 개발, 확정 완료함. |
| 2022년 | GMP, GDP, and QCBD에 대한 직원교육프로그램을 향상시킴, FDA의 데이터 가이드라인에 부합하는 회사 data SOP 구축함, 2021년이후의 수정 예방조치들을 완료함, 잔여 Kanamycin을 측정할수 있는 테스트를 구축함, Mycoplasma를 측정할수 있는 테스트를 구축함, 새 생산시설에 입주 및 인증, 가동시작, mRNA GMP 상품생산을 실행함, mRNA테스팅을 개발 및 실행함, 고객별 특화된 포텐시 에세이를 실행함, VGXI웹사이트의 검색엔진 최적화작업을 수행함, 변형 최적화된 COVID백신을 위한 대규모 GMP제조 및 제품 배송완료를 통해 초기고객 접촉에서 가장 빠른 타임라인을 달성함. 이를 통해 고객은 기록적인 시간내에 1상시험이 가능함, 새로운 12만스퀘어피트 생산시설의 공사완공과 개업축하연을 개최함. 동일한 시설을 2023년기준으로 환산하면, 약 추가 870억원 이상의 비용증가와 6개월이상의 건축기간 초과됨 (부지확보, 디자인, 설계 등의 기간을 감안할 경우임), Oligo dT monolith 사용과 유기휘발성 용매 제거방법을 향상함으로써 1g mRNA생산 시스템을 구축함. 이는 VGXI의 비밀공정과정으로서 미래의 천문학적 금전가치를 가짐, A사고객이 기록적인 시간내에 Covid임상시험을 시작할수 있도록 성공적인 약물시험을 촉진함. 회사시작부터 인간투여까지 단 196일 소요됨, 현재 제조시설을 콘로의 새 시설로 기술이전 계획을 수립하고 시행함, High volume and continuous flow process plasmid DNA manufacturing (AVSI-0050). 특허등록. |
| 2023년 |
현재까지 진행된 GT사의 임상1상 총 36명 환자를 위한 맞춤형 면역치료제를 성공적으로 생산 지원함, 콘로에서 대규모생산을 위한 플라즈미드 정제절차를 활용하여 업스트림 연속 처리를 위한 데이슨 테크놀로지 파크에서 5일이내 최대 1500리터 퍼멘테이션 및 정제할수 있는 기술을 구축함, 데이슨 테크롤로지 파크의 환경모니터링에 필요한 곰팡이 및 박테리아 계수를 위한 2가지 새로운 방법을 구현함, 일회용 기자재를 이용하여 완전자동화 구축을 실행중. |
| 출처) 당사 제시 |
| [최근 6년간 CEO(박영근 대표이사)의 임원 인센티브 및 특별보너스 현황] |
|
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
|
|---|---|---|---|---|---|---|---|
|
성과평가 |
결과형 목표 |
30.0 / 50 |
60.0 / 50 |
50.0 / 50 |
50.0 / 50 |
37.5 / 50 |
50.0 / 50 |
|
과정형 목표 |
62.5 / 50 |
58.8 / 50 |
58.0 / 50 |
56.5 / 50 |
77.0 / 50 |
50.0 / 50 |
|
|
성과평가 점수 |
92.5 / 100 |
118.8 / 100 |
108.0 / 100 |
106.5 / 100 |
114.5 / 100 |
100.0/ 100 |
|
|
인센티브 (귀속년도 기준) |
인센티브 지급률* |
250% |
313% |
375% |
375% |
375% |
375% |
|
인센티브 지급액 |
$ 1,000,000 |
$ 1,440,000 |
$ 1,948,500 |
$ 2,200,000 |
$2,300,000 |
||
|
특별 성과급 (지급시점 기준) |
특별 성과급 지급액 |
- |
- |
$ 460,000 (’19.10) |
$ 1,100,000 (’20.07) |
- |
- |
|
특별 성과급 지급 사유 |
- |
- |
(19.06) long-term master supply agreement of personalized cancer therapies with Geneos Therapeutics |
(20.05) Completion of accelerated cGMP manufacturing of the first clinical batch of a personalized neoantigen vaccine for Geneos Therapeutics |
- |
- |
|
| 주1)성과평가 Target(100점) 달성 시 기본연봉 대비 250%(Target 지급률), 최종 성과평가 점수의 구간별로 정해진 성과급 지급률에 따라 최종 결정 주2) 인센티브 귀속년도의 익년도 지급 |
| [최근 6년간 CFO(조병문 전무이사)의 임원 인센티브 및 특별보너스 현황] |
|
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
|
|---|---|---|---|---|---|---|---|
|
성과평가 |
결과형 목표 |
25.0 / 50 |
70.0/ 50 |
67.5 / 60 |
52.5 / 60 |
42.5 / 60 |
52.5 / 60 |
|
과정형 목표 |
75.0 / 50 |
45.0 / 50 |
52.5 / 40 |
26.3 / 40 |
50.0 / 40 |
42.5 / 40 |
|
|
성과평가 점수 |
100.0 / 100 |
115.0 / 100 |
120.0 / 100 |
78.8 / 100 |
92.5 / 100 |
95.0 / 100 |
|
|
인센티브 (귀속년도 기준) |
인센티브 지급률** |
88% |
88% |
105% |
56% |
70% |
70% |
|
인센티브 지급액 |
$ 120,000 |
$ 133,000 |
$ 160,000 |
$90,000 |
$113,000 |
||
|
특별 성과급 (지급시점 기준) |
특별 성과급 지급액 |
- |
- |
- |
- |
- |
- |
|
특별 성과급 지급 사유 |
- |
- |
- |
- |
- |
- |
|
| 주1)성과평가 Target(100점) 달성 시 기본연봉 대비 250%(Target 지급률), 최종 성과평가 점수의 구간별로 정해진 성과급 지급률에 따라 최종 결정 주2) 인센티브 귀속년도의 익년도 지급 |
현재 상여 지급을 위한 평가 과정을 보다 엄격하게 계량화된 평가를 위한 제도를 개선하고자 하며 명확한 성과 측정 시스템을 마련하여 체계적인 운영을 통해 향후 영업이익이 발생하기 전까지는 박영근 대표이사 및 조병문 전무이사가 진원생명과학 및 VGXI에서 상여를 받지 않을 계획입니다.
당사의 경우 정관에 보수한도를 규정하고 이사회 의장이 매년 기본급과 상여금을 정하여 집행하고 있습니다.
| 정관 제31조 【이사의 보수와 퇴직금】 |
|
1. 이사의 보수는 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여금과 영업활동비, 학자 금등으로 하며 년간 보수 한도는 500억원으로 한다. 이에 대한 집행은 이사회 의장에게 일임한다. 2. 이사의 퇴직금은 주주총회의 결의로써 정한 임원퇴직금 지급규정에 의한다. ② 이사의 임기 중 비자발적으로 사임하는 경우 ③ 그 사유를 불문하고 이사의 임기중 주주총회 결의에 의하여 해임되는 경우 상기 ①~③에 해당하는 경우 퇴직금외에 보상액으로 해임 및 사임 후 7일 이내에 60억원을 지급하고 대표이사의 경우에는 100억원을 지급한다. |
임원퇴직금규정의 제5조(퇴직금)에 따라 임원이 퇴직하였을 때에는 직위별로 정한 임원의 퇴직금 지급률에 의해 산출한 금액을 퇴직금으로 지급하고 있습니다.
박영근 대표이사의 경우 대학생 자녀 1인에 대해 회사 학자금 규정에 따라 반기 3백만원(년간 6백만원)의 학자금을 2020년까지 수령한 바 있습니다.
정관 제31조 이사의 보수 1항에 따라 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여금과 영업활동비, 학자금등으로 하며 년간 보수 한도는 500억원으로 합니다. 2017월 03월 개최된 제41기 정기주주총회에서 정관 변경을 통해 제31조 이사의 보수 1항 이사의 년간 보수 한도를 500억으로 증액 하였으며,이는 회사 규모가 커지는 상황을 대비하여 의결정족수 부족에 따른 스톡옵션 지급 등이 제한적이기에 우수한 인재 영입을 준비하기 위해 한도 증액시 최대 금액으로 변경한 것이며, 최대주주의 지분율이 낮은 상황에서 정관 변경을 위한 의결 정족수 충족하는 것이 쉐도우 보팅 제도의 폐지가 예정됨에 따라 선제적으로 대응하였습니다. 보수 결정에 대한 의사결정은 이사회 의장인 대표이사의 판단이 보수를 결정하는데 매우 큰 영향을 행사하는 상황이나 급여의 경우 통상적으로 전년 대비 일정한 임금 상승률을 적용하는 경우가 많으며 상여는 계량지표 성과와 비계량지표 성과를 반영하여 산출하고 있으나 향후 평가제도를 개선하여 명확한 계량적 평가를 진행하도록 변경할 계획입니다.이처럼 임원 보수 한도를 정관에 정하고 집행에 대해서는 이사회 의장에게 일임함에 따라 임원 보수 책정에 있어 이사회 의장이 막강한 권한을 갖고 있어 객관성이 결여될 소지가 있으며 회사의 영업성과에 반해 지급될 가능성도 있습니다. 한편, 당사는 매년 이사회 안건으로 상정하여 임원보수를 결정하고 있으며, 지급금액에 대해서는 지급시 인사팀의 검토 후 대표이사 승인을 득하는 절차로 진행하고 있습니다. 또한, 승인된 자료는 회계팀으로 전달되며, 회계팀에서 지급할 금액과 정관상의 금액을 검토한 후 회계에 반영 합니다. 당사는 임원의 보수와 관련해 이사회 의장의 독단적 결정을 견제할 수 있는 보상위원회와 같은 기구의 마련 등을 포함해 다각도로 합리적 임원 보수 산정 및 지급을 위한 제도적 장치를 마련하기로 하고 검토 중에 있습니다. 이와 관련 정관 제31조 제1항에 의거하여 임원보수집행은 이사회 의장에게 위임되어 있으나, 의장이 권한을 행사하지 아니하고 사외이사 및 외부전문가로 구성된 별도의 독립적인 보수위원회에 모든 결정권한을 위임하여 집행하기로 2023년 12월 4일자 이사회에서 결의하였습니다.
 |
|
보수위원회 설치(이사회의사록) |
또한, 당사는 바이오 기업으로 대개의 여타 바이오 기업과 마찬가지로 경영실적이 저조하나 연구개발을 진행하고 있는 품목이 기술이전 혹은 상품화가 되면 수년에서 수십년에 걸쳐 투입된 연구개발자금을 회수하고도 매년 높은 이윤이 발생할 가능성이 높습니다. 이러한 산업의 특성상 증권신고서에 기재한 바와 같이 지속적인 연구개발의 투자와 일관성 있는 사업의 추진을 위해서는 경영권의 안정이 필요하며 이러한 연구개발의 지속성 등을 위한 경영권의 안정화가 회사 가치 증대에 도움이 된다고 판단하여 퇴직위로금 조항을 2014년 정관에 신설하였습니다. 높은 금액의 퇴직위로금을 통해 적대적 M&A를 방지하기 위한 목적으로 황금 낙하산 조항을 마련했으나 퇴직위로금 지급이 실제 발생하면 회사의 손실을 초래하기 때문에 현재 당사 등기임원은 퇴직위로금을 지급받지 않기로 하였으며 해당 내용에 대한 확약과 함께 미이행시 법적 책임을 지겠다는 내용도 아래와 같이 확약하였습니다.
 |
|
확약서_박영근 |
 |
|
확약서_조병문 |
박영근 대표이사 및 조병문 전무이사는 정관에 명시된 퇴직위로금 명목의 보상액 각각 100억원과 60억원에 대해 지급받지 않기로 했으며, 해당 조항은 12월 개최되는 임시주총에서 정관변경을 통해 해당 조항을 삭제하는 안건을 상정할 예정입니다.
임원 퇴직금 규정 제5조에 의하면
① 임원이 퇴직하였을 때에는 다음 각호에서 정한 임원의 퇴직금 지급률에 의하여 산출한 금액을 퇴직금으로 지급한다.
1. 대표이사: 재임 매 1년에 대하여 월-급여액의 4.5개월분 이내
2. 부사장 : 재임 매 1년에 대하여 월-급여액의 4.0개월분 이내
3. 전무이사: 재임 매 1년에 대하여 월급여액의 3.5개월분 이내
4. 상무이사: 재임 매 1년에 대하여 월급여액의 3.0개월분 이내
5. 이사, 감사: 재임 매 1년에 대하여 월급여액의 2.5개월분 이내
② 임원이 연임되었을 경우에는 퇴직으로 보지 아니하고 연임기간을 합산하여 현실적으로 퇴직하였을 때에 퇴직금을 계산 지급한다.
이에 따라 산출된 대표이사 및 전무이사 퇴직금은 다음과 같습니다.
| 2023.09.30 기준 퇴직금 |
| (단위: 백만원) |
| 임원구분 | 성명 | 퇴직금( 2023.09.30 기준) |
|---|---|---|
| 등기임원 (대표이사) |
박영근 | 8,436 |
| 등기임원 (전무이사) |
조병문 | 2,725 |
주) 2023년 4월 책정된 연봉의 1/12 평균임금 x 재직일수/365(계속근속연수) x 임원퇴직금 규정 배수 적용
당사는 상기 임원 퇴직금에 대해 매년 비용처리 하고 있습니다. 다음 주주총회 결의에 따라 대표이사가 퇴직할 경우 8,436백만원, 전무이사가 퇴직할 경우 2,725백만원을 지급해야 하며, 2023년 09월 30일 기준 퇴직금에 대한 산정 내역은 다음과 같습니다.
| 퇴직금 상세내역 |
| (단위: 원) |
| 임원구분 | 성명 | 2017 이전 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023/9월 | 합계 |
|---|---|---|---|---|---|---|---|---|---|
| 등기임원 (대표이사) |
박영근 | 1,865,481,446 | 454,353,774 | 878,280,150 | 778,146,813 | 1,190,661,817 | 1,507,876,145 | 1,760,832,227 | 8,435,632,372 |
| 등기임원 (전무이사) |
조병문 | 1,035,633,690 | 181,508,703 | 346,028,475 | 251,982,604 | 281,921,037 | 315,411,389 | 312,264,037 | 2,724,749,935 |
출처) 당사 제시
당사의 퇴직금 규정은 1980년에 제정되었고 2008년에 1차례 개정되어 현재까지 유지되고 있습니다. 제정 당시 당사는 섬유그룹의 계열사로 해당 그룹사는 모두 동일한 내용으로 퇴직금 규정을 제정했습니다. 2005년 그룹사에서 분리되었고 현재 대표이사 취임 전인 2008년에 부사장을 임명함에 따라 해당 직위를 신설하는 개정을 하여 현재까지 적용하고 있습니다. 해당 퇴직금 규정이 근래 여러 기업의 퇴직금 지급률 수준을 초과하는 부분에 대해 실제적으로 비교한 바는 없습니다. 박영근 대표이사와 조병문 전무이사는 각각 2006년과 2005년부터 현재까지 임원으로 약 18년간 재직함에 따라 장기근속에 기인하여 퇴직금 규모가 다른 기업에 비해 큰 편입니다. 당사는 삼성생명과 한국산업은행의 퇴직연금에 가입되어 있고 매년 비용 처리하여 왔습니다. 2022년도말 기준 적립률은 100%이며 만약 현재 퇴직금을 지급해야 할 상황이 발생하게 되면 올해 미적립된 부분에 대해 약 20억원의 현금 유출이 있으나, 퇴직금 지급 발생시 퇴직충당금과 퇴직연금자산에서 처리되므로 재무제표에 큰 영향이 없습니다.
박영근 대표이사와 조병문 전무이사는 VGXI에서 퇴직금 및 퇴직위로금을 지급받지 않습니다. VGXI는 별도의 퇴직금 및 퇴직위로금 지급 규정이 없으며 개인별 체결한 고용계약에 의해 일부 직원은 일정 개월의 월 급여를 퇴직위로금 지급하는 계약을 체결했으나, 박영근 대표이사와 조병문 전무이사는 별도의 고용계약이 없어 퇴직금 및 퇴직위로금 지급 대상이 아닙니다.
| 가-3. 대표이사 등에 대한 보수지급과 관련한 배임 이슈에 따른 위험 당사는 2021년 27,434백만원, 2022년 40,084백만원, 2023년 3분기 37,092백만원의 영업손실이 발생하고 있습니다. 이처럼 지속적인 대규모 적자에도 불구하고 박영근 대표이사에게 최근 2020년부터 신고서제출일 현재까지 약 186억원, 조병문 전무이사에게 약 36억원을 지급하였습니다. 특정 임원들에게 지급되었던 급여 및 상여금 등은 회사의 재무상태 및 손익에 큰 영향을 끼치고 있습니다. 당사는 금번 공모 과정에서, 과거 박영근 대표이사 및 조병문 전무에게 지급된 급여 및 상여금과 관련하여 횡령 또는 배임 가능성에 대한 외부 법률검토를 진행하였습니다. 당사는 법무법인 린과 성균관대학교 법학전문대학원 고동원 교수에게 '1) 정관을 통해 보수한도액을 정하고 이사회의 의장인 대표이사 박영근이 박영근과 조병문의 급여 및 상여금을 결정하는 보수 지급방식 2) 과거 박영근과 조병문에게 지급된 보수액의 적정성'의 측면에서 당사에 대한 횡령죄 또는 배임죄에 해당하는지 여부를 검토 의뢰하였습니다. 법률의견서에 따르면 회사의 업무를 총괄하거나 자금을 관리하는 등의 직무를 수행하는 사람이 보수의 지급 근거 없이 보수 명목으로 임의로 회사 자금을 수취하였다는 등의 사정이 존재하지 아니하는 한, 횡령죄의 구성요건에 해당할 여지는 없는 것으로 판단하였으며, 이사회 의장인 대표이사가 각 개별 이사의 보수 지급액을 정한 것은 정관에서 정한 보수 총액 범위 내에서 정관의 규정에 따라 각 개별 이사의 보수금액을 정한 것이어서 합법적인 절차이고, 개별 이사의 보수 금액 결정에 있어서도 계량지표 성과와 비계량지표 성과를 반영하여 산출하는 등 객관적 기준을 가지고 산정하고 있다는 점에서 보면 배임행위에 해당하지 않는다는 의견을 제시하였습니다. 당사는 상기 법률의견서 등을 토대로 박영근 대표이사의 보수 지급 관련 행위가 배임죄 등 법률위반에 해당한다고 규정하기 어렵다고 판단하고 있으나, 기존주주들 혹은 투자자들이 사법 기관에 박영근 대표 등을 고소 고발할 가능성은 상존하며, 동일 사건에 대한 판결을 아직 찾아볼 수 없어 관계 법률상 제재 처분을 받을 가능성을 완전히 배제할 수는 없을 것으로 사료됩니다. 배임이슈가 현실화 될 경우 당사의 대표이사 및 임원이 법률상 제재 처분을 받아 직무수행이 불가능한 상황이 발생할 수 있으며,「유가증권시장 상장규정」에 따라 상장 적격성 실질심사 대상에 해당되어 매매거래 정지 및 상장폐지가 이루어지는 등 투자자들의 피해가 발생할 수 있으니 이 점 참고하시기 바랍니다. 상기 서술한 배임이슈는 본 건 유상증자 이후에라도 언제든지 현실화 될 가능성을 배제할 수 없으며, 추후 매매거래 정지 및 상장폐지 등의 결과를 초래할 경우 본 건 투자자께서는 일부 원금회수만 가능하거나 최악의 경우 원금회수가 불가능한 상황이 발생할 수 있으니 이 점 반드시 유의하시어 투자에 임해주시길 바랍니다. |
당사는 2021년 27,434백만원, 2022년 40,084백만원, 2023년 3분기 37,092백만원의 영업손실이 발생하고 있습니다. 이처럼 지속적인 대규모 적자에도 불구하고 박영근 대표이사에게 최근 2020년부터 신고서제출일 현재까지 약 209억원, 조병문 전무이사에게 약 45억원을 지급하였습니다. 당사는 급여 및 상여금 산정에 대한 명시적 기준을 사전에 마련하지 않고, 사실상 박영근과 조병문의 의사만으로 결의가 가능한 이사회를 통해 본인들의 급여 및 상여금 결정 권한을 대표이사 박영근에게 일임한 후, 박영근이 본인과 조병문의 성과를 평가하여 높은 수준의 급여와 성과급을 결정, 해당 자금을 지급받아 사용하였습니다.특정 임원들에게 지급되었던 급여 및 상여금 등은 회사의 재무상태 및 손익에 큰 영향을 끼치고 있습니다.
현재 국내 상장사의 횡령·배임이 증가하고 있으며, 이에 따라 주식 매매 거래 정지 및 상장폐지 등으로 이어질 수 있습니다. 거래소의 유가증권시장 공시규정에 따르면 거래소는 임직원 등의 횡령 및 배임 혐의 이슈가 발생할 경우 해당 상장사에 조회공시를 요구하며, 조회공시를 요구받은 코스피 상장사는 늦어도 다음날까지 조회공시에 응해야 합니다.
공시를 통해 횡령 및 배임이 확인되면 거래소의 판단에 따라 매매 거래가 정지될 수 있으며 거래를 정지하고 상장적격성 실질심사 대상에 해당하는지 여부를 판단합니다. 이 과정에서 횡령·배임 규모가 자기자본의 5%, 대기업의 경우 2.5% 이상일 경우 상장적격성 실질심사 대상에 포함됩니다. 심의 대상으로 결정되면 해당 종목에 대한 기업심사위원회의 심의 절차가 진행되며 대상으로 결정되지 않는다면 매매거래 정지가 해제돼 주식 거래가 재개됩니다.
주주 등에 의해 배임 소송이 제기되고 재판에 의해 배임이 확정된다면 형법 조항 제355조(횡령, 배임)에 따라 10년 이하의 징역 또는 3천만원 이하의 벌금에 처해질 수 있으며 이에 따라 최악의 경우 상장폐지까지 이를 수 있습니다.
| [최근 5년간 임원(등기&종속회사 임원) 급여 및 상여 내역 |
| (단위: 천원) |
| 임원구분 | 성명 | 구분 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | 총계 | 2022년말 자기자본 대비 비율 |
|---|---|---|---|---|---|---|---|---|---|---|
| 등기임원 | 박영근 | 급여 | 658,011 | 747,114 | 851,810 | 1,010,491 | 1,212,584 | 1,075,513 | 5,555,523 | 2.93% |
| 상여 | 1,604,200 | 1,046,200 | 3,199,300 | 3,830,300 | 4,400,300 | 1,310,000 | 15,390,300 | 8.10% | ||
| 퇴직금 | 454,354 | 878,280 | 778,147 | 1,190,662 | 1,507,876 | 1,760,832 | 6,570,151 | 3.46% | ||
| 합계 | 2,716,565 | 2,671,594 | 4,829,257 | 6,031,453 | 7,120,760 | 4,146,345 | 27,515,974 | 14.49% | ||
| 등기임원 | 조병문 | 급여 | 365,191 | 394,406 | 425,959 | 460,036 | 496,839 | 399,908 | 2,542,339 | 1.34% |
| 상여 | 274,800 | 198,200 | 419,920 | 458,300 | 470,300 | 121,000 | 1,942,520 | 1.02% | ||
| 퇴직금 | 181,509 | 346,028 | 251,983 | 281,921 | 315,411 | 312,264 | 1,689,116 | 0.89% | ||
| 합계 | 821,500 | 938,634 | 1,097,862 | 1,200,257 | 1,282,550 | 833,172 | 6,173,975 | 3.25% |
| 출처) 당사 제시 주1) 2023년의 경우 9월까지 내역임. |
당사는 금번 공모 과정에서, 과거 박영근 대표이사 및 조병문 전무에게 지급된 급여 및 상여금과 관련하여 횡령 또는 배임 가능성에 대한 외부 법률검토를 진행하였습니다. 당사는 법무법인 린과 성균관대학교 법학전문대학원 고동원 교수에게 각각 아래와 같이 본 건에 대한 검토를 의뢰하였습니다.
1) 정관을 통해 보수한도액을 정하고 이사회의 의장인 대표이사 박영근이 급여 및 상여금을 결정하는 보수 지급방식이 횡령 또는 배임죄에 해당하는지 여부
2) 과거 박영근과 조병문에게 지급된 보수액의 적정성에 비추어 횡령 또는 배임죄 해당 여부
■ 법무법인 린
(1) 사안의 개요
귀사는 아래와 같은 연혁을 거쳐 정관 제31조를 변경하고, 이에 근거하여 정관에 정한 보수한도의 범위에서 대표이사 박영근이 구체적인 사항을 결정하는 방식으로 대표이사 본인을 비롯한 임원에 대한 보수를 지급하고 있습니다.
|
(1) 2014. 3. 27. 주주총회에서 변경되기 전의 정관 제31조(임원의 보수) 1. 이사 및 감사의 보수는 주주총회의 결의로서 이를 정한다. 단, 감사의 보수결정을 위한 의안과는 구분하여 의결하여야 한다. 2. 이사 및 감사의 퇴직금은 주주총회의 결의로써 정한 임원퇴직금 지급규정에 의한다. (2) 2014. 3. 27. 주주총회에서 변경한 정관 제31조(이사의 보수) 1. 이사의 보수는 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여와 영업활동비, 학자금 등으로 하며 연간 보수한도는 30억원으로 한다. 이에 대한 집행은 이사회 의장에게 일임한다. 2. 이사의 퇴직금 지급은 주주총회 결의를 거친 임원퇴직금 지급규정에 의한다.
(3) 2017. 3. 31. 주주총회에서 변경한 정관 제31조(이사의 보수와 퇴직금) 1. 이사의 보수는 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여와 영업활동비, 학자금 등으로 하며 연간 보수한도는 500억원으로 한다. 이에 대한 집행은 이사회 의장에게 일임한다. 2. 이사의 퇴직금 지급은 주주총회 결의를 거친 임원퇴직금 지급규정에 의한다. (3항 생략) |
한편, 귀사는 주주배정후실권주일반공모방식 유상증자를 위하여 2023. 5. 16. 금융감독원에 증권신고서를 제출하였으나, 2023. 5. 30. 금융감독원으로부터 ‘중요사항의 기재나 표시내용이 불분명하여 투자자의 합리적인 투자판단을 저해하거나 투자자에게 중대한 오해를 일으킬 수 있는 사실이 발견되었다’는 이유로 ‘자본시장과 금융투자업에 관한 법률 제122조 제1항 및 제131조에 따라 증권신고서에 대한 정정신고서의 제출’을 요구받았습니다.
이에 귀사는 2023. 6. 8. 과 2023. 8. 17. 금융감독원에 각 증권신고서 (정정신고서)를 제출하였으나, 금융감독원으로부터 재차 증권신고서(정정신고서) 제출 및 자료보완을 요구받았습니다.
그리고 귀사에 대한 2023. 8. 17. 자 금융감독원의 증권신고서(정정신고서) 제출 및 자료보완 요구사항 중에는 『(박영근 및 조병문에 대한) 급여 및 상여금 지급과 관련하여 ‘횡령ㆍ배임이슈에 따른 위험’여부에 대한 의견을 제시할 것』을 요구하는 사항이 포함되어 있습니다.
(2) 질의사항
대표이사 박영근과 전무이사 조병문에 대한 보수 지급이 아래 각 사항의 측면에서 귀사에 대한 횡령죄 또는 배임죄에 해당하는지 여부.
1) 정관을 통해 보수 한도액을 정하고 이사회의 의장인 대표이사 박영근이 박영근과 조병문의 급여 및 상여금을 결정하는 보수 지급방식의 적정성
2) 2018년부터 2023년 6월까지의 기간 동안 박영근과 조병문에게 지급된 보수액의 적정성
(3) 전제사항
본 검토의견은 귀사가 질의한, 2018년부터 2023년 6월까지의 박영근과 조병문에게 지급된 보수의 결정에 이르는 일부의 과정(보수 결정 방식, 보수액의 적정성)에 대한 횡령ㆍ배임 성립 가능성에 대한 법률검토에 국한되고, 본 의견서에서 달리 명시적으로 다루지 아니하는 사항은 실체적ㆍ절차적으로 적법한 것임을 전제합니다. 또한 본 의견서에서 달리 명시적으로 다루지 않는 한 해당 사항 이외의 발생가능한 문제는 본 검토의견의 범위에서 제외됩니다.
본 검토의견의 기초가 된 사실관계는 본 의견서 작성일까지 귀사로부터 온/오프라인으로 전달받은 정보만을 토대로 한 것이며, 위 정보에 대한 독자적인 조사나 검증 등은 수행하지 아니하였습니다.
이하는 법무법인 린의 답변사항(법률의견)입니다.
(4) 횡령죄의 성립여부
귀사의 질의사항은, 정관에 따른 보수지급 방식과 실 지급 보수액의 적정성 측면에서 2018년부터 2023년 6월까지 기간 동안의 대표이사 박영근과 전무이사 조병문에 대한 보수 지급행위가 횡령 또는 배임죄에 해당하는지 여부입니다.
먼저, 횡령죄는 타인의 재물을 보관하는 자가 그 재물을 횡령하거나 그 반환을 거부할 때 성립하는 바, 귀사의 경우 회사의 업무를 총괄하거나 자금을 관리하는 등의 직무를 수행하는 사람이 보수의 지급 근거 없이 보수 명목으로 임의로 회사 자금을 수취하였다는 등의 사정이 존재하지 아니하는 한, 횡령죄의 구성요건에 해당할 여지는 없는 것으로 판단됩니다.
(5) 배임죄의 성립 가능성
가. 정관상 임원 보수 결정 방식과 배임죄의 성부
1) 우선적 고려사항 -주주총회 결의 대상
귀사는 2014. 3. 27. 및 2017. 3. 31.자 정관 변경을 통해 ‘이사의 보수는 퇴직금 및 주식매수선택권을 제외한 기본금 및 상여와 영업활동비, 학자금 등’으로 정의하고, 이에 대한 연간 보수한도는 500억 원, 이에 대한 집행은 이사회 의장에게 일임하였습니다 우선적으로, 정관의 변경은 회사의 특정 임원이 아닌 주주총회의 결의에 의하여야 합니다. 따라서 이사가 이사의 직무내용, 회사의 재무상황이나 영업실적 등에 비추어 지나치게 과다하여 합리적 수준을 현저히 벗어나는 보수 지급 기준을 마련하고 그 지위를 이용하여 주주총회에 영향력을 행사하여 이에 관한 주주총회 결의가 성립되도록 함으로써 회사를 위하여 직무를 충실하게 수행하여야 하는 상법 제382조의3에서 정한 의무를 위반하여 회사 재산의 부당한 유출을 야기함으로써 회사와 주주의 이익을 침해하는 것으로서 회사에 대한 배임행위로 평가할 수 있을 정도에 이르는 등의 특별한 사정이 존재하지 아니하는 한, 적법하게 개최된 주주총회의 결의에 따라 임원 보수 결정에 관한 정관 내용을 변경한 행위를 두고 특정인의 배임행위라고 평가하기는 어려운 것으로 판단됩니다.
일반적으로 상법 또는 정관에 다른 정함이 있는 경우를 제외하고는 주주총회의 결의는 출석한 주주의 의결권의 과반수와 발행주식총수의 4분의 1 이상의 수로써 하여야 합니다. 심지어 귀사의 이사 보수 연간한도액을 정하는 정관 변경의 경우, 주주총회의 결의에 의하여야 할 뿐 아니라 출석한 주주의 의결권의 3분의 2 이상의 수와 발행주식총수의 3분의 1 이상의 수를 필요로 하는 특별결의 대상입니다.
그런데, 연간 보수한도를 정하면서 그 구체적인 보수액을 결정하는 집행을 대표이사에게 맡기는 내용의 귀사 정관 변경은 2014. 3. 27. 최초로 확인됩니다. 그러나 해당 정관 변경에 대한 주주총회 결의가 존재할 당시, 귀사로부터 제공받은 자료에 의하면 대표이사 박영근과 전무이사 조병문의 경우 회사 주식을 전혀 보유하고 있지 아니하였습니다. 또한 귀사로부터 제공받은 자료에 의하면, 연간 보수한도를 500억 원으로 증액하는 내용의 정관 변경이 이루어진 2017. 3. 31. 시점의 경우, 대표이사 박영근은 회사 주식 474,246주(2.97%), 전무이사 조병문은 93,153주(0.58%)를 보유하고 있었습니다.
이와 같은 지분 보유현황에 비추어 볼 때, 대표이사 박영근 또는 조병문 전무이사가 합리적 수준을 현저히 벗어나는 보수 지급 기준을 자의적으로 마련하기 위해 주주총회에 영향력을 행사할 수 있는 정도로 귀사의 주식을 보유하고 있었다고 보기는 어려울 것으로 판단됩니다. 따라서 특별한 사정이 없는 한, 귀사의 이사 연간보수 한도액 및 그 집행에 관한 정관 변경의 주주총회 결의 과정에서 대표이사 박영근과 전무이사 조병문이 주주총회에 지배적인 영향력을 행사하였을 가능성은 희박한 것으로 사료됩니다. 결국 적법하게 개최된 주주총회의 결의에 따라 임원 보수 결정에 관한 정관 내용을 변경한 행위를 두고 특정인의 배임행위라고 평가하기는 어려운 것으로 판단됩니다.
2) 정관에서 이사 보수의 한도액을 정한 뒤 구체적인 사항을 이사회에 위임한 것 관련
상법 제361조는 “주주총회는 본법 또는 정관에 정하는 사항에 한하여 결의할 수 있다.”라고 규정하고 있는데, 이러한 주주총회 결의사항은 반드시 주주총회가 정해야 하고 정관이나 주주총회의 결의에 의하더라도 이를 다른 기관이나 제3자에게 위임하지 못하지만, 정관 또는 주주총회에서 임원의 보수 총액 내지 한도액만을 정하고 개별 이사에 대한 지급액 등 구체적인 사항을 이사회에 위임하는 것은 가능하다는 것이 확고한 판례의 입장입니다. 따라서 귀사의 정관에서 임원의 보수 한도액을 정하고 구체적인 사항을 이사회의 의장에 위임하는 방식 자체만으로는 이것이 회사에 대한 관계에서 배임행위라고 볼 수 없습니다.
3) 정관에서 정한 이사 보수 한도액의 적정성 관련
이사의 직무와 그 지급받는 보수 사이에는 합리적 비례관계가 유지되어야 하므로, 회사의 채무 상황이나 영업실적에 비추어 합리적인 수준을 벗어나 현저히 균형성을 잃을 정도로 과다하여서는 아니 됩니다. 이사의 보수 한도가 증액되면 해당 이사들은 그 증액된 보수총액의 한도 내에서 보수를 받을 수 있게 되는 위치에 서게 되고, 만일 이사회의 의장인 대표이사가 자신의 보수를 정할 수 있다면 합리적인 수준을 벗어나서 현저히 균형성을 잃을 정도로 과다한 수준의 보수도 얼마든지 정할 수도 있게 되는 점 등을 함께 고려하면, 제반사정에 비추어 귀사의 이사 연간보수 한도액인 500억 원은 일견 외관상으로는 다소 과다한 것으로 비춰질 여지가 있습니다.
그러나, ‘이사 보수한도 승인’ 결의는 미등기이사를 포함하여 전년도 내지 해당년도 평균 내지 예상 인원 전체에 대한 총 한도액을 정한 것에 불과하다고 보는 것이 타당합니다. 귀사의 정관과 같이 임원보수의 총액 내지 한도액만을 정하고 개별 이사에 대한 지급액 등 구체적인 사항은 이사회에 위임할 수 있음은 앞서 살펴본 바와 같은데, 이러한 경우 정관상 보수한도가 규정되어 있는 것만으로는 이사의 보수청구권이 바로 발생한다고 볼 수 없고, 이사회가 업무집행으로서 각 이사의 보수액을 결정한 경우에 비로소 정관의 이사 보수총액 규정이 구체화되어 이사에게 회사에 대한 보수청구권이 생긴다고 보아야 합니다.
또한 ‘정관상 이사의 연간보수 한도액을 다소 높게 책정한 뒤 구체적인 집행은 이사회의 의장에게 일임’하는 판단이 배임에 해당하는지 여부는, 그러한 판단에 이르게 된 경위와 동기, 판단대상인 사업의 내용, 기업이 처한 경제적 상황, 손실발생의 개연성과 이익획득의 개연성 등 제반 사정을 살펴, 자기 또는 제3자가 재산상 이익을 취득한다는 인식과 본인에게 손해를 가한다는 인식하의 의도적 행위임이 인정되는 경우에 한하여, 배임의 고의를 인정하여야 합니다.
귀사로부터 제공받은 2018년부터 2023년 6월까지의 박영근과 조병문의 보수 지급 내역을 살펴보면 다음과 같습니다.
 |
|
등기이사 보수 총액 |
귀사의 이사에게 지급된 보수 총액을 살펴볼 때, 설정된 한도액에 비해 실제 집행된 보수액은 그에 미치지 못하는 수준인 사실이 확인되는바, 후술하는 바와 같이 보수 집행절차나 그 액수의 적정성에 대한 제반사정들을 함께 고려하면, 정관상 이사 보수의 연간한도액을 다소 높게 책정한 뒤 구체적인 사항은 이사회의 의장인 대표이사에게 맡기는 형식의 보수지급방식은 특별한 사정이 없는 한 해당 내용 자체만으로는 대표이사 박영근 또는 전무이사 조병문에게 배임의 책임을 묻기 어려운 것으로 판단됩니다.
나. 정관에 따른 임원 보수 실 지급액과 배임죄의 성부
1) 평가 기준 관련
귀사는 2018년부터 2023년 6월까지의 기간 동안 박영근과 조병문에 대한 보수를 결정하는 과정에서 급여에 대하여는 ‘이사회 결의에 따라 임원급여 Table을 기초로 리더십, 전문성, 회사기여도 등을 종합적으로 반영’하고, 상여금의 경우에는 ‘정관의 이사의 보수 규정에 따라 재무 부분에 기여한 계량지표와 리더십, 전문성, 기타 기여도로 구성된 비계량지표를 종합적으로 평가하여 연봉의 0%~300% 범위 내’에서 ① 재무 부분 기여도의 일정 범위에서 산출한 금액과 ② 비계량지표와 관련하여 연구, 개발, 업무 등의 성과에 따른 기여도를 반영한 뒤 이를 평가하여 보수를 결정한 것으로 파악됩니다.
위와 같은 보수결정이 적법한지 여부에 관하여서는 리더십, 전문성, 회사기여도, 기타 비계량적인 연구, 개발, 업무 등의 성과는 그 특성상 이를 일률적ㆍ계량적으로 평가하기 어려워 정성적 판단이 불가피한바, 귀사의 위와 같은 보수결정방식이 곧바로 자의적이거나 임의적인 판단이라고 단정할 수는 없고, 회사의 경영진인 임원의 보수를 결정함에 있어 그러한 추상적ㆍ비계량적인 요소를 고려하는 것이 회사에 손해를 끼치는 행위에 해당한다고 보기 어려울 뿐 아니라, 오히려 해당 임원의 성과를 평가하는 과정의 핵심은 영업이익의 원천인 기업가 정신과 같은 추상적ㆍ비계량적 요소에 있다고 보는 것이 타당합니다.
그렇다면, 대표이사 박영근과 전무이사 조병문이 회사의 경영진으로서 리더십과 전문성을 갖추고 있을 뿐 아니라, 회사기여도, 기타 비계량적인 연구, 개발, 업무 등의 성과에서 차지하는 비중이 절대적인 인력인 경우 특별한 사정이 없는 한, 해당 지급기준을 통하여 자체적인 정성 평가를 반영하여 보수를 결정한 것 자체를 두고 고의에 의한 배임행위라고 평가하기는 어려운 것으로 판단됩니다.
덧붙여, 귀사의 매출 중 상당 비중은 ‘의약품이나 그 원료의 제조 및 판매’에서 발생하는 것으로 확인되는데, 해당 분야의 특성상 연구개발 비용이 회사 지출에서 큰 비중을 차지할 것으로 보이고, 위 비용 중 상당 부분은 연구개발 인력 대한 보수가 차지할 것임이 분명합니다. 또한 의약품의 특성상 연구개발은 장기간에 걸쳐 제품 개발, 사업화, 이익실현의 과정을 거쳐야 하기 때문에, 연구 성과가 즉각적으로 매출에 반영되기는 어려운 구조이고, 따라서 연구개발 참여 인력에 대한 보수는 장래의 기대이익 토대로 회사의 경영상 판단에 따라 결정할 수밖에 없습니다. 이러한 사정을 고려하더라도 대표이사 박영근 기타 임원들에 대한 보수액 판단이 귀사의 합리적 경영 판단에 근거한 것이라면 특별한 사정이 없는 한, 보수액의 절대적인 수치만을 보고 배임행위로 판단할 수는 없다고 판단됩니다.
2) 실 지급 보수액 관련
상법이 정관 또는 주주총회의 결의로 이사의 보수를 정하도록 한 것은, 이사 자신이 자신의 보수를 결정하게 될 경우 사적인 이익의 추구를 앞세워 보수를 과다 책정함으로써 회사의 자본충실을 해할 염려가 있기 때문에 이사들의 고용계약과 관련하여 사익 도모의 폐해를 방지함으로써 회사와 주주 및 회사채권자의 이익을 보호하기 위한 것이므로, 비록 보수와 직무의 상관관계가 상법에 명시되어 있지 않더라도 이사가 회사에 대하여 제공하는 직무와 그 지급받는 보수 사이에는 합리적 비례관계가 유지되어야 하며, 회사의 채무 상황이나 영업실적에 비추어 합리적인 수준을 벗어나서 현저히 균형성을 잃을 정도로 과다하여서는 아니된다는 것이 판례의 입장입니다.
한편, 이사 보수의 적정성 여부를 판단할 때 회사의 재무 상황이나 영업 실적 등도 고려 요소가 될 수 있겠지만, 또 하나의 중요한 판단 요소는 ‘이사의 보수가 그 직무 수행에 비추어 적정한지’의 여부입니다. 이사의 보수는 직무 수행의 대가로서 지급되는 것이므로, 이사 보수의 적정성을 판단하기 위하여는 기본적으로 직무 수행의 난이도, 직무 수행에 필요한 전문성의 정도 등의 여러 요소를 반드시 함께 고려하여야만 합니다. 특히 판례(대법원 2016. 1. 28. 선고 2014다11888 판결 등)는 보수의 과다 여부를 판단함에 있어, 절대적인 수치상 액수가 아니라 합리적인 수준을 벗어나 “현저히” 균형성을 잃은 과다 보수라는 판단 기준을 제시하고 있는데, 보수가 ‘합리적인 수준을 벗어나 현저히 균형성을 잃은 정도’에 해당한다고 평가하기 위하여는 이사의 직무 수행 정도 등을 모두 고려하더라도 그 액수가 납득할 수 없을 정도의 과다한 수치에 해당하여야만 하고, 그러한 사정을 고려하지 않은 채 단순히 실제 지급되는 보수액의 수치가 높다는 사정만으로는 ‘현저히 균형성을 잃은 과다 보수’라고 평가하기 어렵습니다.
아울러 해당 판례는 대표이사가 주주들의 반대에도 불구하고 자신의 이익을 위해 주주총회에 영향력을 행사하는 등 계획적이고 적극적이며 지배적인 영향력 행사가 있을 때에 비로소 배임행위에 해당한다는 의미로 해석하는 것이 바람직하고, 단순히 보수가 사회통념에 비추어 과다하면 배임행위에 해당한다는 취지를 설시한 것으로는 볼 수 없습니다. 이와 같이, 보수액의 적정성을 판단함에 있어서는 이사가 회사에 대하여 제공하는 직무와 그 지급받는 보수 사이의 합리적 비례관계를 고려해야 하는데, 직무와 보수 사이의 합리적 비례관계는 회사가 종사하는 업종의 특성에 대한 판단이 선행되어야 하므로, 귀사의 현황만을 단독으로 평가하여 합리적 비례관계 여부를 재단할 수는 없고, 유사 업종에 종사하는 업체의 보수 지급 현황을 기준으로 비교하는 것이 바람직하다고 사료됩니다. 귀사의 등기부상 설립 목적은 다음과 같습니다.
 |
|
등기부상 설립 목적 |
따라서 귀사의 등기상 목적에 부합하고 실제 매출 중 상당부분을 차지하는 ‘의료용 물질 또는 의약품 제조업’부분을 기준으로 유사 업종에 종사하는 업체들을 기준으로 임원의 보수 현황을 비교하여 검토할 필요가 있습니다.
우선, 이사ㆍ감사 등의 임원들에게 지급된 보수의 합계는 해당 임원들의 회사의 경영에 대해 차지하는 전체적인 비중과 그에 대한 보수의 합리적 비례관계에 대한 판단근거로 사용될 수 있습니다. 이 때 귀사의 이사ㆍ감사 보수 지급금액 합계 비중은 아래와 같이 유사 업종의 업체들에 비하여 특별히 과다하다고 보기는 어려운 것으로 판단됩니다.
 |
|
등기이사의 보수 평균(1) |
다만, 귀사의 등기이사의 보수 평균은 유사한 업체에 비해 높은 측면이 있으나, 이는 ‘타 업체에 비해 등기이사의 회사에 대한 기여도 비중이 절대적’이라는 취지의 귀사의 견해에 부합하는 수치로 볼 수 있는 수준입니다.
또한, 등기이사 보수 평균, 이사ㆍ감사 보수 지급금액 합계 등의 수치의 경우, 해당 업체의 개별 임원이 담당하는 업무의 중요도, 임원의 수 및 그 구성에 따라 그 보수액이 달라질 수 있으므로, 만약 대표이사 단독의 기여도가 절대적인 비중을 차지하는 회사의 경우 대표이사의 보수 비중만을 별도로 비교하여 확인할 필요가 있습니다.
이에 관하여 아래와 같이 유사 업종의 타 업체의 경우에도 귀사와 유사한 수치의 대표이사 보수 비중이 확인되는 점에 비추어, 귀사의 경영 전반에 대한 대표이사 박영근의 기여도가 절대적으로 높은 수준에 해당한다는 귀사의 견해대로라면 귀사의 자기자본 대비 대표이사의 보수 비중이 특별히 과다하여 그러한 보수액을 집행한 것이 배임에 해당한다고 보기는 어려운 것으로 판단됩니다.
 |
|
자기자본 대비 대표이사 보수 비중(1) |
■ 서울 성균관대학교 법학전문대학원 고동원 교수
질의사항 (1) 정관 제31조가 이사에 대한 연간 보수 한도 금액을 정하고 구체적인 집행은 이사회 의장에게 위임하고 있는데, 이 경우 이사 보수액 산정에 대한 명시적인 기준을 별도로 마련하지 않으면 법에 저촉되는지 여부
질의사항 (1)에 대한 답변(법률의견)
이사의 연간 보수 한도를 정관이나 주주총회에서 정하고 각 이사들에게 지급할 구체적인 보수 금액을 이사회나 이사회 의장(대표이사)에게 위임하는 것이 정관이나 주주총회에서 이사의 보수 금액을 정하도록 하고 있는 상법 제388조에 위배되는 것이 아닌지에 대한 의문이 제기될 수 있습니다.
이에 대해 학설과 판례는 상법에 위배되지 않는다는 입장을 취하고 있습니다. 즉, 대법원은 “주주총회에서는 임원 보수의 총액 또는 한도액만을 정하고 개별 이사에 대한 지급액 등 구체적인 사항은 이사회에 위임할 수 있다”라고 하고 있으며(대법원 2012. 3. 29. 선고 2012다1993 판결), 학설도 이사회나 대표이사에게 위임할 수 있다고 보는 것이 통설이고, 실무도 그러합니다(송옥렬, 「상법강의(제13판)」, 박영사, 2023, 1005면).
따라서, 귀사는 정관 규정에 의하여 정관에서 정한 이사 보수 금액 총액 한도 이내에서 구체적인 개별 이사 보수 금액 결정 권한을 이사회 의장인 대표이사에게 위임한 것이므로, 이는 법률이 허용하는 방식이고 개별 이사 보수 금액 산정에 대한 별도의 기준을 사전에 마련하지 않았다고 하여 위법한 것은 아닙니다.
판례와 학설의 입장에 비추어볼 때, 귀사가 정관에 이사의 연간 보수 한도 금액을 정하고 개별 이사에 대한 보수 금액 결정과 지급 등 구체적인 사항을 이사회 의장인 대표이사에게 위임한 것은 상법 제388조에 위반되지 않아 적법하다고 할 수 있습니다. 따라서, 귀사의 이사회 의장인 대표이사가 정관에서 정한 총 보수액 한도 내에서 각 개별 이사의 직무 수행 정도 등을 고려하여 보수 금액을 정하게 되므로 이사 보수 산정에 대한 명시적 기준을 사전에 마련하지 않았다고 하여 위법한 행위는 아닙니다.
질의사항 (2) 대표이사나 전무이사에게 지급한 보수 금액이 ‘과다 보수’에 해당하는지 여부
질의사항 (2)에 대한 답변(법률의견)
상법은 이사 보수액 결정 절차에 관한 사항은 규정하고 있지만, 이사 보수액의 적정성에 관한 내용은 규정하고 있지 않습니다. 그럼에도 불구하고 판례는 “이사가 회사에 대하여 제공하는 직무와 지급받는 보수 사이에는 합리적 비례관계가 유지되어야 하며, 합리적인 수준을 벗어나서 현저히 균형성을 잃을 정도로 과다하여서는 아니 된다.”라고 하여(대법원2016. 1. 28. 선고 2014다11888 판결) 이사 보수는 적정해야 한다는 입장을 취하고 있습니다. 이는 과다 보수 지급은 회사 재산의 부당한 유출을 야기하여 회사 주주 및 채권자 등 이해관계자의 이익을 훼손할 수 있기 때문인 것으로 이해됩니다.
이러한 이사 보수의 적정성 여부를 판단할 때, 회사의 재무 상황이나 영업 실적 등도 고려 요소가 될 수 있겠지만, 무엇보다도 중요한 판단 요소는 이사의 보수가 그 직무 수행에 비추어 적정한 지라고 할 수 있습니다. 즉, 이사의 보수가 직무 수행의 대가로서 지급되는 것이라는 점에서 이사 직무 수행의 난이도와 직무 수행에 필요한 전문성 정도 등의 여러 요소를 고려할 필요가 있는 것입니다. 위에서 본 것처럼, 판례가 이사의 직무와 지급받는 보수 사이에 “합리적 비례관계”가 유지되어야 한다는 것도 바로 이러한 입장에 있다고 할 수 있습니다.
특히, 판례는 ‘단순한’ 과다 보수가 아니라 합리적인 수준을 벗어난 “현저히” 균형성을 잃은 과다 보수라는 판단 기준을 제시하고 있어서, 과다보수를 인정하기 위해서는 이사의 직무 수행 정도 등에 비해서 그 보수액이 상당히 큰 금액이어야 한다는 것인데, 그만큼 과다 보수를 인정하기 위한 요건이 까다롭다는 점을 알 수 있습니다.
더욱이 귀사의 매출액이나 총자산 규모에 비하면 이사에 대한 보수 금액이 과다한 액수라고 보기도 어렵습니다. 귀사의 별도재무제표 기준으로 보면, 귀사의 매출액은 2021년 342억 원, 2022년 456억 원이고, 영업손실액은 2021년 262억 원, 2022년 312억 원이며, 총자산은 2021년 말 기준 2,323억 원, 2022년 말 기준 2,232억 원인데, 대표이사 및 전무이사에게 지급한 보수 총액은 2021년 59억 원(주식매수선택권 23억 8천만 원 제외), 2022년 64억 9천만 원입니다. 즉, 총자산 규모가 2,000억 원이 넘고 매출액도 400억 원이 넘는 회사에서 임원에 대한 보수 금액이 60억 내외라는 점은 비록 적자 상황이지만 과도한 금액이라고 보기가 어려울 것입니다.
영업 적자의 주요 요인이 귀사의 주요 업무인 DNA백신 및 핵산 기반 치료제와 플라스미드 DNA 의약품 관련 연구 개발비 투자라는 점에서 이는 불가피한 상황이라고 할 수 있고, 회사가 적자 상황이라고 할지라도 이사의 직무 수행이 이루어지는 한 이에 대한 적정한 보수 지급은 해야 할 것이라는 점(김건식 외 2인, 회사법 제7판, 박영사, 2023, 474면 참조)도 고려되어야 할 것입니다. 특히, 판례가 적시하는 것처럼, ‘현저히’ 과다한 보수이어야 한다는 점을 고려할 때 이러한 지급 금액이 과다한 보수라고 보기는 더욱 어려운 것입니다.
질의사항 (3) 과다 보수에 해당한다면 이를 지급받은 대표이사나 전무이사가 횡령이나 배임행위를 한 것에 해당하는지 여부
질의사항 (3)에 대한 답변(법률의견)
귀사의 정관에 따라 이사회 의장인 대표이사가 개별 이사의 보수 지급액을 결정하고 이에 따라 이사가 보수를 지급받는 것은 보관 중인 재물을 영득(領得)한 것이 아니므로 횡령죄의 요건에 해당하지 않아 더 나아가 살펴볼 필요 없이 업무상 횡령 행위에 해당하지 않습니다.
다음으로 업무상 배임죄에 해당하는지 여부를 살피건대, 업무상 배임 행위에 해당하려면 첫째, ‘과다한 보수’에 해당할 것, 둘째, 과다한 보수 결정 절차에 계획적·적극적으로 관여하였을 것이라는 두 가지 요건을 모두 충족하여야 하는바, “과다한 보수”에 해당하는지 여부는 앞서 (2번)에서 살펴보았고, 대표이사나 전무이사가 보수액 결정 행위에 영향력을 행사했는지 여부에 대해서 살펴보면, 판례는 과다 보수 지급을 받은 이사가 배임 행위에 해당하려면, 해당 이사가 과다 보수 지급 결정에 영향력을 행사하는 등의 계획적·적극적 관여 행위가 있어야 된다고 보고 있습니다. 즉, 주주총회에서 이사 보수액을 정한 사안에서 “회사에 대한 경영권 상실 등으로 퇴직을 앞둔 이사가 회사에서 최대한 많은 보수를 받기 위하여 그에 동조하는 다른 이사와 함께 과다 보수 지급 기준을 마련하고 지위를 이용하여 주주총회에 영향력을 행사함으로써 소수주주의 반대에 불구하고 이에 관한 주주총회 결의가 성립되도록 하였다면, 이는 회사를 위하여 직무를 충실하게 수행하여야 하는 상법 제382조의3에서 정한 의무를 위반하여 회사재산의 부당한 유출을 야기함으로써 회사와 주주의 이익을 침해하는 것으로서 회사에 대한 배임행위에 해당[한다.]”라고 하고 있습니다(대법원 2016. 1. 28. 선고 2014다11888 판결). 즉, 과다 보수를 받았다고 하여 바로 배임행위가 되는 것이 아니라 과다 보수를 지급받은 이사가 이러한 과다 보수 지급 결정에 영향력을 행사한 경우에 한하여 배임 행위를 인정하고 있는 것입니다.
이러한 판례의 입장에 비추어 볼 때, 귀사의 이사 연간 보수 지급 총액은 정관에 규정되어 있고, 정관 개정에 귀사의 대표이사나 전무이사가 계획적으로 관여할 여지가 없습니다. 즉, 귀사의 대표이사나 전무이사가 정관 개정을 위한 주주총회 결의 시에 주주들에게 영향력을 행사하여 정관 개정에 찬성하도록 했다는 정황은 전혀 보이지 않습니다. 또한, 귀사의 이사회 의장인 대표이사가 각 개별 이사의 보수 지급액을 정한 것은 정관에서 정한 보수 총액 범위 내에서 정관의 규정에 따라 각 개별 이사의 보수금액을 정한 것이어서 합법적인 절차이고, 더욱이 개별 이사의 보수 금액 결정에 있어서도 급여는 통상적으로 전년 대비 일정한 임금 상승률을 적용하는 경우가 많고 상여금은 계량지표 성과와 비계량지표 성과를 반영하여 산출하는 등 나름대로 객관적 기준을 갖고 산정하고 있다는 점에서 보면 배임행위에 해당하지 않는다고 판단됩니다.
■ 당사의 판단 및 투자자 유의사항
법무법인 린 및 고동원 교수의 위와 같은 법률의견에도 불구하고, 위 법률의견에는 다음과 같은 한계 내지 유의할 점이 있습니다.
첫째, 법률의견의 기초가 된 사실관계는 당사가 법무법인 린 및 고동원 교수에게 전달한 정보를 토대로 한 것이며, 법무법인 린 및 고동원 교수는 위 정보들에 대한 독자적인 조사나 검증 등은 수행한 바가 없습니다. 그러므로 만의 하나 위 정보가 부분적으로라도 실체적 진실과 다르거나 부정확한 것으로 밝혀진 경우에는 법률검토의견의 결과가 달라질 수 있습니다.
둘째, 법무법인 린 및 고동원 교수의 법률검토의견은 2018년부터 2023년 6월까지 박영근 대표이사와 조병문 전무이사에게 지급된 보수와 관련하여, 보수 결정 방식(정관)의 유효성 및 보수액의 적정성 측면에서 본 형사상 횡령·배임죄의 성립 가능성에 대한 법률검토에 국한되고, 나머지 사항들은 실체적·절차적으로 모두 적법한 것임을 전제한 것입니다. 따라서, 만약 대표이사와 전무이사가 주주총회에 영향력을 행사하여 정관을 고의로 유리하게 작성한 사실 등이 있다면 법률의견의 결론은 달라질 수 있습니다.
셋째, 법무법인 린 및 고동원 교수의 법률검토의견은 의견서 작성일 현재의 유효한 대한민국 법령, 판례 및 일반 법 해석 이론에 근거한 법률검토 의견이고, 형사책임의 성립 여부 등에 관하여 규제당국 또는 사법당국과 별도로 협의하거나 확인하는 과정은 거치지 아니하였습니다. 그러므로 관점에 따라서는 본 검토의견과 견해를 달리하는 부분이 있을 수 있습니다.
마지막으로, 법무법인 린 및 고동원 교수의 위와 같은 법률의견에도 불구하고, 당사의 과다보수와 동일한 사건에 대한 판결 등은 아직 찾아볼 수 없는 바, 그렇다면 선례가 없는 당사의 케이스에 대하여 사법기관이 어떻게 판단할지는 아직은 확언할 수 없다 할 것입니다.
당사는 상기 법률의견서 등을 토대로 박영근 대표이사의 보수 지급 관련 행위가 배임죄 등 법률위반에 해당한다고 규정하기 어렵다고 판단하고 있으나, 기존주주들 혹은 투자자들이 사법 기관에 박영근 대표 등을 고소 고발할 가능성은 상존하며, 동일 사건에 대한 판결을 아직 찾아볼 수 없어 관계 법률상 제재 처분을 받을 가능성을 완전히 배제할 수는 없을 것으로 사료됩니다. 배임이슈가 현실화 될 경우 당사의 대표이사 및 임원이 법률상 제재 처분을 받아 직무수행이 불가능한 상황이 발생할 수 있으며,「유가증권시장 상장규정」에 따라 상장 적격성 실질심사 대상에 해당되어 매매거래 정지 및 상장폐지가 이루어지는 등 투자자들의 피해가 발생할 수 있으니 이 점 참고하시기 바랍니다.
| 나. 재무 안정성 악화 위험 당사는 2023년 3분기 연결기준 33,052백만원의 부채가 있으며, 부채비율은 20.87%, 차입금의존도는 4.82%입니다. 당사는 2020년 이후 자본시장을 통해 공모 형태로 총 4회(금번 유상증자 포함)에 걸친 자금 조달로 인해 최근 3년 동안 연결기준으로 부채비율이 2020년말 38.64%에서 2023년 3분기 20.87%로 완화되었습니다. 2020년 01월 주주배정 후 실권주 일반공모의 진행 및 공모자금을 활용하여 전환사채 상환하였으며, 2020년 07월, 2021년 12월 두 차례의 공모 유상증자를 진행하여 차입금의존도가 2020년말 13.01%에서 2023년 3분기말 4.82%로 재무지표가 개선되었습니다. 그러나 당사는 과거에도 비교적 안정적인 안정성 비율을 보였으나, 지속적인 당기순손실로 인하여 재무지표가 악화된 바 있으며, 이를 유상증자 또는 주식관련사채의 발행 및 행사를 통하여 개선시켜왔습니다. 현재의 수익상황 및 당기순손실이 지속된다면 다시 재무안정성 지표가 악화될 위험이 있습니다. 투자자 여러분께서는 이 점 유의하시어 투자해 주시기 바랍니다. |
당사는 2023년 3분기 연결기준 33,052백만원의 부채가 있으며, 부채비율은 20.87%, 차입금의존도는 4.82%입니다. 당사는 2020년 이후 자본시장을 통해 공모 형태로 총 4회(금번 유상증자 포함)에 걸친 자금 조달로 인해 최근 3년 동안 연결기준으로 부채비율이 2020년말 38.64%에서 2023년 3분기 20.87%로 완화되었습니다. 2020년 01월 주주배정 후 실권주 일반공모의 진행 및 공모자금을 활용하여 전환사채 상환하였으며, 2020년 07월, 2021년 12월 두 차례의 공모 유상증자를 진행하여 차입금의존도가 2020년말 13.01%에서 2023년 3분기 4.82%로 재무지표가 개선되었습니다. 당사의 최근 3년 및 2023년 3분기의 재무안정성 지표 추이는 다음과 같습니다.
| [연결기준 재무안정성 지표 추이] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 |
2022년 | 2021년 | 2020년 |
| 자산총계(A) | 191,399 | 222,867 | 250,857 | 136,571 |
| 유동자산 | 36,203 | 73,063 | 134,633 | 108,760 |
| 비유동자산 | 155,196 | 149,804 | 116,223 | 27,810 |
| 부채총계(B) | 33,052 | 41,395 | 44,350 | 38,062 |
| 유동부채 | 25,802 | 33,836 | 34,759 | 36,705 |
| 비유동부채 | 7,250 | 7,560 | 9,591 | 1,357 |
| - 총차입금(C) | 9,225 | 19,666 | 18,400 | 17,766 |
| - 단기차입금 | 3,002 | 701 | - | 151 |
| - 전환사채 | 106 | 11,545 | 9,754 | 15,484 |
| - 리스부채 | 6,117 | 7,420 | 8,645 | 2,132 |
| 자본총계(D) | 158,347 | 181,471 | 206,507 | 98,509 |
| 부채비율(B/D) | 20.87% | 22.81% | 21.48% | 38.64% |
| 총차입금 의존도(C/A) | 4.82% | 8.82% | 7.33% | 13.01% |
| 이자보상배율(E/F) | -40.49 | -5.48 | -6.16 | -20.31 |
| - 영업이익(E) | -37,092 | -40,084 | -27,434 | -18,459 |
| - 이자비용(F) | 916 | 7,309 | 4,455 | 909 |
출처) 당사 정기보고서 및 당사 제시
부채 중 이자발생부채의 증가로 인해서 당사 영업에 따른 이익을 통하여 회사의 이자
용을 얼마나 충당할 수 있는지를 보여주는 이자보상배율의 경우 영업손실로 인하여 지속적으로 음(-)의 수치를 보이고 있습니다.
당사의 최근 3개년 및 2023년 3분기까지의 연결기준 이자보상배율 추이를 살펴보면, 2020년 -20.31, 2021년 -6.16, 2020년 -5.48, 2023년 3분기 -40.49를 나타내고 있습니다.
한편, 당사는 2023년 3분기 기준으로 장부금액 기준 관련 리스부채 포함 9,225백만원 수준의 차입금을 보유하고 있으며, 이 중 제4회 전환사채 잔액 1억원이 미상환 상태로 남아 있었으나 제4회 전환사채 잔액 1억원은 2023년 11월 25일 만기가 도래하여 상환되었습니다. 2023년 4월초 5회차 전환사채 인수계약에 의거 사채권자가 조기상환을 요청하여 사채권에 대한 매매계약을 통해 회사가 사채권을 전량 취득하여 소각하였습니다.
[상환 후]
| [재무안정성 비율] | |
| (기준일: 2023년 09월 30일) |
(단위 : 백만원) |
| 구분 | 별도 | 연결 |
| 자산총계 | 191,405 | 191,399 |
| 부채총계 | 19,906 | 33,052 |
| 총차입금 | 5,608 | 9,225 |
| 자본총계 | 171,499 | 158,347 |
| 부채비율 | 11.61% | 20.87% |
| 총차입금 의존도 | 2.93% | 4.82% |
| 출처) 당사 정기보고서 및 당사 제시 |
단기차입금 902백만원은 자회사 Dong-Il Interlining,LTD 에서 베트남 신한비나은행에서 기계장치등을 담보로 운영 목적을 위하여 차입하였습니다. 또한 당사는 3분기 중에 단기차입금 2,100백만원을 신한은행에서 일반대출로 운영자금 목적으로 차입하였습니다.
| [연결기준 단기차입금 현황] | |
| (기준일: 2023년 09월 30일) | (단위 : 백만원) |
| 구분 | 차입처 | 금리 | 금액 |
| 외화단기차입금 | Shinhan Bank VN | Libor 3M+2.5%P.A | 902 |
| 일반대출 | 신한은행 | 6.24% | 2,100 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사의 2023년 3분기 연결기준 부채비율은 20.87%이며, 차입금의존도는 4.82%로 재무안정성지표는 비교적 안정적이라고 할 수 있습니다. 그러나 당사는 과거에도 비교적 안정적인 안정성 비율을 보였으나, 지속적인 당기순손실로 인하여 재무지표가 악화된 바 있으며, 이를 유상증자 또는 주식관련사채의 발행 및 행사를 통하여 개선시켜왔습니다. 현재의 수익상황 및 당기순손실이 지속된다면 다시 재무안정성 지표가 악화될 위험이 있습니다. 투자자 여러분께서는 이 점 유의하시어 투자해 주시기 바랍니다.
| 다. 잦은 자금조달로 인한 주주가치 희석화 당사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였습니다. 당사는 금번 유상증자로 유입되는 자금 중 자회사 VGXI에 대여금을 통해 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다. 당사는 정부보조금을 제외하고 경상연구개발비로 2022년 연결기준 11,413백만원, 2023년 3분기 연결기준 5,219백만원을 사용하였으며, 이는 매출액 대비 각각 23.43%, 18.99%수준이며, 최근 3개년 및 2023년 3분기 연결기준 평균 매출액 대비 연구개발비의 비중은 19.33%%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다. 이처럼 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 핵산 백신 및 핵산 기반 바이오의약품의 연구개발이 제품화에 실패하거나 플라스미드 CDMO 사업 관련 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원할하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였으며, 내역은 아래와 같습니다.
| [2020년~신고서제출일 현재 자본시장을 통한 자금조달 내역] |
| (단위 : 백만원) |
| 구분 | 최초 주요사항보고서 공시일 | 납입일 | 규모 | 발행방식 | 자금사용목적 |
| 유상증자 | 2019년 11월 08일 | 2020년 01월 28일 | 19,800 | 주주배정 후 실권주 일반공모 | 운영자금 등 |
| 유상증자 | 2020년 04월 29일 | 2020년 07월 03일 | 76,475 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제4회 전환사채 | 2020년 11월 23일 | 2020년 11월 25일 | 24,000 | 사모 전환사채 | 시설자금 및 운영자금 등 |
| 유상증자 | 2021년 09월 01일 | 2021년 12월 02일 | 113,760 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제5회 전환사채 | 2022년 04월 13일 | 2022년 04월 15일 | 11,700 | 사모 전환사채 | 운영자금 |
| 유상증자 | 2023년 09월 06일 | 2023년 09월 15일 | 2,470 | 제3자배정 유상증자 | 운영자금 |
| 유상증자 | 2023년 05월 16일 | 2024년 02월 22일 | 66,660 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 합계 | 314,865 | - | - | ||
| 주) 금번 유상증자의 납입일인 2024년 02월 22일은 예정일이므로, 관계기관과의 협의에 의하여 달라질 수 있으며, 발행규모는 예정발행가액 기준으로 확정발행가액 산정 시 변경될 수 있습니다. 출처) 당사 제시 |
당사의 주요사업은 지속적인 연구개발과 임상시험을 통해 DNA백신 및 핵산 기반 치료제의 신약바이오의약품과 항염증 치료 신약을 개발하고 제품화하는 사업과, 미국 자회사 VGXI를 통하여 유전자 치료제의 원료가 되는 플라스미드 DNA CDMO 사업이 있습니다. 이를 위하여 생산 시설 확충 및 연구개발을 위한 투자 또한 필연적인 사항입니다. 당사는 기존 파이프라인 외에도 새로운 파이프라인을 추가하며 미래성장동력 확보를 위하여 연구개발 및 임상시험을 지속적으로 해왔으며 향후에도 계속 진행할 예정입니다.
또한 과거에는 기술 유출 등의 문제로 제약사들이 자체 생산능력 확보를 통한 생산을 선호하였으나, 최근에는 mRNA 코로나19 백신 개발 등의 유전자 치료제 시장 규모 확대 및 자본 집약적인 사업 특성과 복잡한 제조적 특징으로 인해 CDMO업체를 활용 하는 추세이며, 이에 따라 임상 및 상업단계 제조를 위해 제약사들의 mRNA 백신 핵심 원료 및 플라스미드 DNA에 대한 수요도 증가하는 추세입니다. 이를 충족시키기 위해 금번 유상증자 자금 중 자회사 VGXI에 대여금을 통해 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다. 세부 자금사용 계획에 대해서는 제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
| [최근 3년 및 2023년 3분기 연결기준 경상연구개발비] |
| (단위 : 백만원) |
|
구 분 |
2023년 3분기 |
2022년 | 2021년 | 2020년 |
|
경상연구개발비 |
5,219 | 12,147 | 11,441 | 8,396 |
| 출처) 당사 정기보고서 및 당사 제시 |
| [최근 3년 및 2023년 3분기 세부 연구개발 비용] |
| (단위 : 백만원) |
|
과 목 |
2023년 3분기 | 2022년 | 2021년 | 2020년 | 2019년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | ||
|
회계처리 |
판매비와 관리비 |
5,219 | 6,871 |
12,147 |
12,977 |
11,441 |
14,358 |
8,396 |
8,867 |
5,874 | 5,711 |
|
개발비(무형자산) |
- | - |
- |
- |
- |
- |
- |
- | - | - | |
|
연구개발비용 계(주1) |
5,219 | 6,871 |
12,147 |
12,977 |
11,441 |
14,358 |
8,396 |
8,867 |
5,874 | 5,711 | |
|
(정부보조금) |
(6) | (6) |
(734) |
(734) |
(4,880) |
(4,880) |
(960) |
(960) |
(669) | (669) | |
|
정부보조금 차감 후 연구개발비용 계 |
5,213 | 6,865 |
11,413 |
12,243 |
6,561 |
9,478 |
7,436 |
7,907 |
5,205 | 5,042 | |
|
연구개발비 / 매출액 비율(주2) |
18.99% | 26.56% |
23.4% |
26.8% |
17.0% |
27.7% |
17.9% |
22.1% |
12.6% | 14.6% | |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 연구개발비용은 전액 판관비로 계상되어 있으며, 정부보조금을 차감하기 전의 연구개발비용 지출총액입니다. |
| 주2) 매출액 대비 정부보조금 차감 후 연구개발비용이 차지하는 비율로 산출하였습니다. |
상기 표에서 연결기준 연구개발비용이 별도기준 연구개발비용보다 낮은 이유는 당사에서 VGXI로 지급되었던 연구개발비용은 연결기준 재무제표에서 내부거래로 제거 되었기 때문입니다. VGXI는 당사가 연구개발을 진행 중인 핵산 기반 백신에 필요한 플라스미드 DNA를 공급하고 있으며, 현재까지 당사가 VGXI에 지급한 연구개발비용은 2020년 943백만원, 2021년 3,251백만원, 2022년 829백만원, 2023년 1~9월 1,652백만원입니다.
한편, K-IFRS 회계기준에 따르면 연구개발비에 대해 기술적 실현가능성 등 특정 요건을 충족하는 경우 자산으로 처리하고, 충족하지 못하는 경우 비용으로 인식하도록 규정하고 있습니다. 당사는 K-IFRS 회계기준에 따라, 당사가 연구개발하고 있는 프로젝트가 전임상부터 임상2상단계까지 진행되고 있어 지출 비용에 대해 연구개발비(판관비)로 당기 비용처리하고 있습니다. 향후 해당 프로젝트가 자산화 요건을 충족하는 연구개발 단계에 이를 경우 관련 개발비에 대해 자산으로 인식하여 회계처리할 예정입니다.
당사는 정부보조금을 제외하고 경상연구개발비로 2022년 연결기준 11,413백만원, 2023년 3분기 연결기준 5,219 백만원을 사용하였으며, 이는 매출액 대비 각각 23.43%, 18.99% 수준이며, 최근 3개년 및 2023년 3분기 연결기준 평균 매출액 대비 연구개발비의 비중은 19.33%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다.
| [최근 3개년 및 2023년 3분기 자금조달 내역 및 사용 현황] | |
| (기준일: 본 공시서류 제출 전일 현재) | (단위 : 백만원) |
| 구 분 | 납입일 | 납입금액 | 자금사용 계획 | 실제 자금사용 현황 | 차이발생 사유 등 |
| 주주배정후실권주 일반공모 유상증자 |
2020.01.28 | 19,800 |
(1) 채무상환 : 10,000백만원 소요 예정 (3) 원부재료 구매 : 2,500백만원 소요 예정 (4) GLS -1200 축농증 치료제 연구개발비 : 2,800백만원 소요 예정 |
(1) 채무상환 : 9,589백만원 (7) GLS -5700 지카 백신 연구개발비 : 111백만원 (10) GLS-7000 sc4D5-VT dRP 연구개발비 : 13백만원 |
1. 신고서상 자금사용 용도변경 추가항목: |
| 주주배정후실권주 일반공모 유상증자 |
2020.07.03 | 76,475 |
(1) 발행제비용 : 2,663백만원 소요 예정 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 8,864백만원 소요 예정 |
(1) 발행제비용 : 2,663백만원 |
1. 신고서상 자금사용 용도변경 추가항목: 2) VGX-6150 C형간염치료 연구개발비 3) GLS-6100,6150 C형간염예방 연구개발비 4) GLS-5300 MERS 예방 DNA 백신 연구개발비 5) Microneedle and device 개발비 등 6) B형간염 항체치료제 연구개발비 7) GLS -1027 당뇨병성 신장병증 치료제 연구개발비 8) GLS -1200 축농증 치료제 연구개발비 9) RNA백신 기반 연구개발비 10) CCHF 콩고출혈열 연구개발비 11) MERS-Abs 연구개발비 12) 일반운영비 |
| 제4회 사모 전환사채 | 2020.11.25 | 24,000 | 운영자금 19,000 시설자금 5,000 |
운영자금 19,000백만원 시설자금 5,000백만원 |
- |
| 주주배정후실권주 일반공모 유상증자 (주1) |
2021.12.02 | 113,760 | (1) 발행제비용 : 2,700백만원 소요 예정 (2) CDMO설비 신규 증설자금(VGXI 신규시설자금) : 90,823백만원 소요 예정 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 20,237백만원 소요 예정 |
(1) 발행제비용 : 2,700백만원 (2) CDMO설비 신규 증설자금(VGXI 신규시설자금) : 59,354백만원 (3) 코로나 19 DNA 백신 개발 등 연구개발비 : 9,387백만원 (4) GLS -5700 지카 백신 연구개발비 : 120백만원 (5) Microneedle and device 개발비 등 : 1,080백만원 (6) GLS -1200 축농증 치료제 연구개발비 : 82백만원 (7) RNA백신 기반 연구개발비 : 334백만원 (8) GLS -1200 코로나19 연구개발비 : 762백만원 (9) Pan.코로나 연구개발비 : 116백만원 (10) GLS -1027 자가면역질환 연구개발비 : 140백만원 (11) GLS -1027 기타 연구개발비 : 52백만원 (12) HnMc 연구개발비 : 5백만원 (13) 일반운영비 :33,027만원 (14) GLS -5140 STFSV예방 DNA 백신 연구개발비 :2,151백만원 (15) GLS -5300(MERS) : 22백만원 (16) CCHF-콩고출혈열 : 11백만원 (17) GLS -6100, 6150 C 형간염[예방] : 5백만원 (18) PlasMab : 4백만원 (19) CCR8 : 9백만원 (20) CCAR-M : 16백만원 (21) RAS : 1백만원이 지출되었습니다. (22) BaAB : 3백만원이 지출되었습니다. |
1. 신고서상 자금사용 용도변경 추가항목: 1) GLS -5700 지카 백신 연구개발비 2) Microneedle and device 개발비 등 3) GLS -1200 축농증 치료제 연구개발비 4) RNA백신 기반 연구개발비 5) GLS-1200 코로나19 연구개발비 6) Pan.코로나 연구개발비 7) GLS-1027 자가면역질환 연구개발비 8) GLS-1027 기타 연구개발비 9) HnMc 연구개발비 10) 일반운영비 11) GLS-5140 STFSV예방 DNA 백신 12) GLS-5300(MERS) 연구개발비 13) CCHF-콩고출혈열 연구개발비 14) GLS-6100, 6150 C 형간염[예방] 연구개발비 |
| 제5회 사모 전환사채 | 2022.04.15 | 11,700 | 운영자금 11,700 | 운영자금 11,700백만원 | - |
| 제3자 배정 유상증자 | 2023.09.15 | 2,470 | 운영자금 2,470 | 운영자금 2,470 | - |
| 출처) 당사 정기보고서 및 당사 제시 주1) 2021년 12월 02일 납입 완료된 유상증자 자금은 2023년 3분기말 현재 총 109,381백만원을 사용하여 유증자금이 4,379백만원 남아있습니다.(미사용 유증자금은 우리은행, 신한은행, 국민은행에 각각 보관하고 있습니다.) |
당사는 코로나19 백신 및 치료제와 관련하여 시장으로부터 자금을 조달하였습니다. 특히 지난 2021년 12월 주주배정 유상증자를 통해 연구개발비용으로 아래 표와 같이 약 200억원을 조달한 바 있습니다. 그러나, 코로나19 백신(GLS-5130)으로 계획된 13,237백만원 가운데 5,620백만원만 지출하였고, 코로나19 치료제(GLS-1027)으로 계획된 7,000백만원 가운데 4,836백만원만 지출하였습니다. 해당 잔여 합계금액 9,781백만원은 현재 회사의 일반운영비로 사용한 상태입니다.
(단위 : 백만원)
| 우선순위 | 적응증 | 제품명 | 구분 | 2021년 | 2022년 | 합계 |
|---|---|---|---|---|---|---|
| 1 | 코로나19 | DNA백신(GLS-5310) | 3상임상기관비용 | 6,700 | 6,537 | 13,237 |
| 2 | 코로나19 | 임상악화 방지 경구용치료제(GLS-1027) | 2상임상연구 | 7,000 | - | 7,000 |
| 합계 | 13,700 | 6,537 | 20,237 |
이처럼 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 핵산 백신 및 핵산 기반 연구개발이 제품화에 실패하거나 플라스미드 CDMO 사업 관련 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원활하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다.
|
라. 청약 참여율에 따른 최대주주 변경 위험 |
당사의 본 공시서류 제출 전일 기준 최대주주는 당사 대표이사 박영근으로 5,396,525주(지분율 6.88%) 보유하고 있으며, 특수관계인을 포함할 시 6,860,748주(지분율 8.75%)를 보유 중에 있습니다. 박영근 대표이사는 2020년 01월 당사의 주주배정 유상증자에 참여하여 당사의 최대주주가 되었습니다.
당사는 본 공시서류 제출 전일 현재 발행된 전환사채는 없으며, 주식매수선택권의 경우 행사기간 만료되어 전환가능 주식수가 없습니다.
| [전환사채 발행 현황] | |
| (기준일 : 본 공시 서류 제출 전일 현재) | (단위: 백만원, 주) |
| 종류/구분 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율(%) | 전환가액 | 권면(전자등록)총액 | 전환가능주식수 | |||||||
| 제4회사모 전환사채 |
2020년 11월 25일 | 2023년 11월 25일 | 24,000 | 기명식 보통주식 |
2021년 11월 25일~ 2023년 10월 25일 |
100 | 12,301 | - | - | 전환가액 조정 |
| 제5회사모 전환사채 |
2022년 04월 15일 | 2025년 04월 15일 | 11,700 | 기명식 보통주식 |
2023년 04월 15일~ 2025년 03월 15일 |
100 | 10,265 | - | - | 전환가액 조정 |
| 합 계 | - | - | 35,700 | 기명식 보통주식 |
- | 100 | - | - | - | - |
| 주1) 2020년 11월에 발행한 4CB는 2023년 05월 10일 미상환사채 11억원 중 10억원에 대해 풋옵션 행사되어 잔액 1억원입니다. 잔액 1억원에 대해 2023년 11월 25일 만기가 도래함에 따라 전액 상환되었습니다. 주2) 2022년 04월에 발행한 5CB는 2023년 04월12일 기준 현재 잔액 0억원으로 상환 완료하였습니다. 출처) 당사 정기보고서 |
제4회 전환사채의 전환가능기간은 2021년 11월 25일부터 2023년 10월 25일까지였으나 전액 상환되었습니다.
금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.2810985992의 배정비율로 신주인수권증서를 교부받게 됩니다.(신주배정기준일 전 주식매수선택권의 행사, 자기주식 수의 변동 등에 의하여 변동 가능성이 있습니다.) 이에 따라 최대주주인 박영근 대표이사는 1,516,956주, 특수관계인들은 총 411,591주를 배정받게 됩니다. 금번 유상증자에서 최대주주는 자금 여력에 따라 최대한 참여할 예정으로, 현재는 최대주주인 박영근 대표는 배정분의 약 30% 정도 참여를 계획 중이며, 특수관계인들에 대한 청약 참여 여부는 미정입니다. 만약 최대주주 및 특수관계인이 전액 미참여할 경우 지분율은 현재 8.75%에서 6.83%까지 감소할 수 있으며, 최대주주가 배정분의 30% 참여하고, 특수관계인이 전액 미참여할 경우 최대주주 및 특수관계인의 지분율은 현재 7.95%에서 7.28%까지 감소할 수 있습니다.
| [최대주주 및 특수관계인 청약율에 따른 지분변동 가정] |
| 성명 | 현재 | 증자 후 (최대주주 및 특수관계인 미참여) |
증자 후 (박영근 대표 30% 참여, 특수관계인 미참여) |
||||
| 주식수(주) | 지분율(%) | 배정주식수(주) | 주식수(주) | 지분율(%) | 주식수(주) | 지분율(%) | |
| 박영근 | 5,396,525 | 6.88 | 1,516,956 | 5,396,525 | 5.37 | 5,851,611 | 5.82 |
| 조병문 | 757,491 | 0.97 | 212,930 | 757,491 | 0.75 | 757,491 | 0.75 |
| 최성호 | 64,675 | 0.08 | 18,180 | 64,675 | 0.06 | 64,675 | 0.06 |
| 박희곤 | 64,500 | 0.08 | 18,131 | 64,500 | 0.06 | 64,500 | 0.06 |
| 채재경 | 75,817 | 0.10 | 21,312 | 75,817 | 0.08 | 75,817 | 0.08 |
| EDWARD JAE HO CHUNG | 490,363 | 0.62 | 137,840 | 490,363 | 0.49 | 490,363 | 0.49 |
| 이혜영 | 11,377 | 0.01 | 3,198 | 11,377 | 0.01 | 11,377 | 0.01 |
| 합 계 | 6,860,748 | 8.75 | 1,928,547 | 6,860,748 | 6.83 | 7,315,834 | 7.28 |
| 주1) 상기 박영근 대표의 30% 참여에 따른 청약 참여주식수는 예정발행가액 기준 409,550주입니다. 주2) 증자 전 발행주식 총수 : 78,473,817주 → 증자 후 발행주식 총수 : 100,473,817주 출처) 당사 제시 |
최대주주 및 특수관계인은 증자 과정에서 신주인수권을 주간사를 통해 매각한 바 있으며, 해당 자금과 급여를 통해 증자에 참여하였습니다.
당사는 2019년 제3자배정 유상증자를 통해 735,661주를 박영근 대표이사 등 특수관계인에게 배정하여, 최대주주 및 특수관계인의 지분율이 12.45%에서 15.39%로 증가하였습니다. 기존 소액주주 지분율의 경우 기존 소액주주는 일반청약에 참여하지 않았다고 가정 시 희석효과로 인해 86.73%에서 83.82%로 2.91% 감소하였습니다. 또한 2018년 대표이사의 급여 3,897백만원 중 2,500백만원 및 전무이사의 급여 940백만원 중 300백만원, 감사의 급여 28백만원 중 50백만원청약에 참여하였습니다.
| [2019년 임원 증자 등 참여현황] |
| 직위 | 성명 | 2019년 | ||||||||
| 제3자배정유상증자 | ||||||||||
| 배정 주식수 | 청약주식수 | 참여비율 | 급여 | 총 청약대금 | 급여 대비 청약대금 비율 |
증자후 주식수 | 증자전 지분율 | 증자후 지분율 | ||
| 대표이사(최대주주) | 박영근 | 623,441 | 623,441 | 100% | 3,897 | 2,500 | 64.15% | 1,422,596 | 3.77% | 6.49% |
| 전무이사 | 조병문 | 74,813 | 74,813 | 100% | 940 | 300 | 31.91% | 239,529 | 0.78% | 1.09% |
| 감사 | 최성호 | 12,469 | 12,469 | 100% | 28 | 50 | 178.57% | 20,431 | 0.04% | 0.09% |
| 출처) 당사 제시 주1) 24,938주를 배정받은 이전오는 본 공시서류 제출 전일 현재 특수관계인이 아닙니다. 주2) 급여는 2018년 기준. 주3) 급여 및 청약대금의 단위는 백만원임 주4) 급여는 세전 금액으로 약 40% 내외의 소득세를 공제 후 실제 수령한 금액과는 차이가 있음 |
| 구분 | 2019년 11월 제3자배정유상증자 | ||||
|---|---|---|---|---|---|
| 증자전 | 증자후 | ||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||
| 최대주주 및 특수관계인 | 최대주주 | 799,155 | 3.77% | 1,422,596 | 6.49% |
| 특수관계인 | 1,839,374 | 8.68% | 1,951,594 | 8.90% | |
| 소계 | 2,638,529 | 12.45% | 3,374,190 | 15.39% | |
| 기존 소액주주 | 18,377,788 | 86.73% | 18,377,788 | 83.82% | |
| 자사주 | 174,179 | 0.82% | 174,179 | 0.79% | |
| 신규주주(일반청약) | - | 0.00% | - | 0.00% | |
| 총발행주식수 | 21,190,496 | 100.00% | 21,926,157 | 100.00% | |
| 출처) 당사 제시 |
당사는 2020년 1월 주주배정 유상증자를 통해 11,000,000주 추가 발행하였으며, 박영근 대표이사 참여비율 120%로 초과청약하여 최대주주 지위 확보하였습니다. 해당 유상증자를 통해 최대주주 및 특수관계인 지분율은 7.80%에서 8.51%로 상승하였으며, 기존 소액주주 지분율의 경우 기존 소액주주는 일반청약에 참여하지 않았다고 가정 시 희석효과로 인해 91.41%에서 90.08%로 1.33% 감소하였습니다. 또한 2019년 대표이사의 급여 4,607백만원 중 3,976백만원 및 전무이사의 급여 943백만원 중 247백만원, 감사의 급여 29백만원 중 105백만원청약에 참여하였습니다.
당사는 2020년 7월 주주배정 유상증자를 통해 11,500,000주 추가 발행하였으며, 최대주주 및 특수관계인 일부 참여에 따라 지분율 9.18%에서 8.27% 감소하였습니다. 기존 소액주주 지분율의 경우 기존 소액주주는 일반청약에 참여하지 않았다고 가정 시 자기주식수 174,179주 보유에 따라 기존 소액주주 지분율 희석 발생하지 않았으며, 지분율 90.29%에서 91.31%로 1.02% 증가하였습니다. 또한 2019년 대표이사의 급여 4,607백만원 중 1,554백만원 및 전무이사의 급여 943백만원 중 218백만원, 감사의 급여 29백만원 중 19백만원청약에 참여하였습니다.
| [2020년 임원 증자 등 참여현황] |
| 직위 | 성명 | 2020년 01월 주주배정 유상증자 | 2020년 07월 주주배정 유상증자 | |||||||||||||||||
| 배정 주식수 |
청약 주식수 |
참여 비율 |
급여 | 총 청약대금 |
급여 대비 청약대금 비율 |
증자후 주식수 |
증자전 지분율 |
증자후 지분율 |
배정 주식수 |
청약 주식수 |
참여 비율 |
신주인수권 매각 |
급여 | 총 청약대금 |
급여 대비 청약대금 비율 |
증자후 주식수 |
증자전 지분율 |
증자후 지분율 |
||
| 대표이사(최대주주) | 박영근 | 719,408 | 863,289 | 120% | 4,607 | 3,976 | 86.30% | 2,285,885 | 6.49 | 6.94 | 797,935 | 597,935 | 75% | 200,000 | 4,607 | 1,554 | 33.73% | 2,883,820 | 6.90 | 6.46 |
| 전무이사 | 조병문 | 121,130 | 121,130 | 100% | 943 | 247 | 26.19% | 360,659 | 1.09 | 1.10 | 125,895 | 37,200 | 30% | 88,695 | 943 | 218 | 23.11% | 397,859 | 1.09 | 0.89 |
| 감사 | 최성호 | 10,331 | 10,331 | 100% | 29 | 105 | 362.07% | 30,762 | 0.09 | 0.09 | 11,459 | 15,816 | 138% | - 4,357 | 29 | 19 | 65.52% | 46,578 | 0.10 | 0.10 |
| 이사 | 박희곤 | 20,000 | 20,000 | 100% | 142 | - | 0.00% | 20,000 | 0% | 0.06 | 6,981 | - | 0% | 6,981 | 142 | 36 | 25.35% | 20,000 | 0.06 | 0.04 |
| 이사 | 채재경 | 10,000 | 10,000 | 100% | - | - | - | 15,687 | 0.03 | 0.05 | 5,475 | - | 0% | 5,475 | - | 18 | - | 15,687 | 0.05 | 0.04 |
| 출처) 당사 제시 주1) 급여는 2019년 기준. 주2) 급여 및 청약대금의 단위는 백만원임 주3) 채재경 이사 급여는 미공개로 기재하지 않음 주4) 급여는 세전 금액으로 약 40% 내외의 소득세를 공제 후 실제 수령한 금액과는 차이가 있음 |
| 구분 | 2020년 01월 주주배정 유상증자 | 미참여시 희석률 |
신주인수권증서 가중산술평균주가 |
||||
|---|---|---|---|---|---|---|---|
| 증자전 | 증자후 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 최대주주 및 특수관계인 | 최대주주 | 1,422,596 | 6.49% | 2,285,885 | 6.94% | -33.41% | 480.22원 |
| 특수관계인 | 287,439 | 1.31% | 515,034 | 1.56% | |||
| 소계 | 1,710,035 | 7.80% | 2,800,919 | 8.51% | |||
| 기존 소액주주 | 20,041,943 | 91.41% | 29,659,322 | 90.08% | |||
| 자사주 | 174,179 | 0.79% | 174,179 | 0.53% | |||
| 신규주주(일반청약) | - | 0.00% | 291,737 | 0.89% | |||
| 총발행주식수 | 21,926,157 | 100.00% | 32,926,157 | 100.00% | |||
| 출처) 당사 제시 주1) 미참여시 희석율 = (미참여시 증자 후 지분율 - 기존 소액주주 증자 전 지분율) / 기존소액주주 증자 전 지분율 주2) 미참여시 증자후 지분율 = 증자 전 기존 소액주주 주식수 / 증자 후 총발행주식수 주3) 2019년 12월 30일부터 2020년 01월 07일까지 유가증권시장에서 성립된 거래대금을 거래량으로 가중산술평균한 5일 가중산술평균주가 |
| 구분 | 2020년 07월 주주배정 유상증자 | 미참여시 희석률 |
신주인수권증서 가중산술평균주가 |
||||
|---|---|---|---|---|---|---|---|
| 증자전 | 증자후 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 최대주주 및 특수관계인 | 최대주주 | 2,285,885 | 6.90% | 2,883,820 | 6.46% | -25.78% | 2,252.88원 |
| 특수관계인 | 754,619 | 2.28% | 807,922 | 1.81% | |||
| 소계 | 3,040,504 | 9.18% | 3,691,742 | 8.27% | |||
| 기존 소액주주 | 29,904,125 | 90.29% | 40,741,136 | 91.31% | |||
| 자사주 | 174,179 | 0.53% | 174,179 | 0.39% | |||
| 신규주주(일반청약) | - | 0.00% | 11,751 | 0.03% | |||
| 총발행주식수 | 33,118,808 | 100.00% | 44,618,808 | 100.00% | |||
| 출처) 당사 제시 주1) 미참여시 희석율 = (미참여시 증자 후 지분율 - 기존 소액주주 증자 전 지분율) / 기존소액주주 증자 전 지분율 주2) 미참여시 증자후 지분율 = 증자 전 기존 소액주주 주식수 / 증자 후 총발행주식수 주3) 2020년 06월 08일부터 2020년 06월 12일까지 유가증권시장에서 성립된 거래대금을 거래량으로 가중산술평균한 5일 가중산술평균주가 |
당사는 2021년 12월 주주배정 유상증자를 통해 5,760,000주 추가 발행하였으며, 최대주주 및 특수관계인 일부 참여에 따라 지분율 8.88%에서 8.10% 감소하였습니다. 기존 소액주주 지분율의 경우 기존 소액주주는 일반청약에 참여하지 않았다고 가정 시 자기주식수 209,464주 보유에 따라 기존 소액주주 지분율 희석 발생하지 않았으며, 지분율 90.66%에서 91.05%로 0.40% 증가하였습니다. 또한 2020년 대표이사의 급여 8,149백만원 중 1,659백만원 및 전무이사의 급여 1,226백만원 중 166백만원, 감사의 급여 31백만원 중 28백만원청약에 참여하였습니다.
| [2021년 임원 증자 등 참여현황] |
| 직위 | 성명 | 2021년 주식매수선택권 행사 | 2021년 12월 주주배정 유상증자 |
2021년 12월 주주배정 무상증자 |
||||||||||||||
| 행사 주식수 |
행사후 주식수 |
총 행사대금 |
행사전 지분율 |
행사후 지분율 |
배정 주식수 |
청약 주식수 |
참여 비율 |
신주인수권 매각 |
증자후 주식수 |
급여 | 총 청약대금 |
급여 대비 청약대금 비율 |
증자전 지분율 |
증자후 지분율 |
배정 주식수 |
증자후 주식수 |
||
| 대표이사(최대주주) | 박영근 | 240,000 | 3,123,820 | 934 | 6.46 | 6.91 | 399,517 | 84,000 | 21% | 315,517 | 3,207,820 | 8,149 | 1,659 | 20.36% | 6.89 | 6.28 | 1,603,910 | 4,811,730 |
| 전무이사 | 조병문 | 60,000 | 457,608 | 233 | 0.89 | 1.01 | 58,525 | 8,400 | 14% | 50,125 | 466,008 | 1,226 | 166 | 13.54% | 1.01 | 0.91 | 233,004 | 699,012 |
| 감사 | 최성호 | 20,000 | 55,000 | 78 | 0.08 | 0.12 | 7,034 | 1,440 | 20% | 5,594 | 56,440 | 31 | 28 | 90.32% | 0.11 | 0.11 | 28,220 | 84,660 |
| 이사 | 박희곤 | 22,000 | 42,000 | 86 | 0.04 | 0.09 | 5,371 | 1,000 | 19% | 4,371 | 43,000 | 148 | 20 | 13.51% | 0.09 | 0.08 | 21,500 | 64,500 |
| 이사 | 채재경 | 20,000 | 35,687 | 78 | 0.04 | 0.08 | 4,564 | 1,213 | 27% | 3,351 | 36,900 | - | 24 | - | 0.08 | 0.07 | 18,450 | 55,350 |
| 출처) 당사 제시 주1) 급여는 2020년 기준. 주2) 총행사대금, 급여 및 청약대금의 단위는 백만원임 주3) 채재경 이사 급여는 비공개 주4) 급여는 세전 금액으로 약 40% 내외의 소득세를 공제 후 실제 수령한 금액과는 차이가 있음 |
| 구분 | 2021년 12월 주주배정 유상증자 | 미참여시 희석율 |
신주인수권증서 가중산술평균주가 |
||||
|---|---|---|---|---|---|---|---|
| 증자전 | 증자후 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 최대주주 및 특수관계인 | 최대주주 | 3,123,820 | 6.89% | 3,207,820 | 6.28% | -11.27% |
4,179.70원 |
| 특수관계인 | 903,121 | 1.99% | 929,257 | 1.82% | |||
| 소계 | 4,026,941 | 8.88% | 4,137,077 | 8.10% | |||
| 기존 소액주주 | 41,101,411 | 90.66% | 46,526,176 | 91.05% | |||
| 자사주 | 209,464 | 0.46% | 209,464 | 0.41% | |||
| 신규주주(일반청약) | - | 0.00% | 225,099 | 0.44% | |||
| 총발행주식수 | 45,337,816 | 100.00% | 51,097,816 | 100.00% | |||
|
출처) 당사 제시 주3) 2021년 10월 28일부터 2021년 11월 03일까지 유가증권시장에서 성립된 거래대금을 거래량으로 가중산술평균한 5일 가중산술평균주가 |
| [2020년 이후 유상증자 급여 대비 청약 참여율] |
| (단위 : 백만원) |
| 직위 | 성명 | 2020년 01월 주주배정 유상증자 | 2020년 07월 주주배정 유상증자 | 2021년 12월 주주배정 유상증자 | 2023년 9월 제3자배정유상증자 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 급여 | 총 청약대금 |
급여 대비 청약대금 비율 |
급여 | 총 청약대금 |
급여 대비 청약대금 비율 |
급여 | 총 청약대금 |
급여 대비 청약대금 비율 |
급여 | 총 청약대금 |
급여 대비 청약대금 비율 |
||
| 대표이사(최대주주) | 박영근 | 4,607 | 3,976 | 86.30% | 4,607 | 1,554 | 33.73% | 8,149 | 1,659 | 20.36% | 9,450 | 2,000 | 21.16% |
| 전무이사 | 조병문 | 943 | 247 | 26.19% | 943 | 218 | 23.12% | 1,226 | 166 | 13.54% | 1,333 | 200 | 15.00% |
| 감사 | 최성호 | 29 | 105 | 362.07% | 29 | 19 | 65.52% | 31 | 28 | 90.32% | 35 | 50 | 142.86% |
| 이사 | 박희곤 | 142 | - | 0.00% | 142 | 36 | 25.35% | 148 | 20 | 13.51% | 159 | - | - |
| 이사 | 채재경 | - | - | - | - | 18 | - | - | 24 | - | - | 70 | - |
| 출처) 당사 제시 주1) 급여는 각 유상증자 납입일 직전년도 기준 주2) 급여는 세전 금액으로 약 40% 내외의 소득세를 공제 후 실제 수령한 금액과는 차이가 있음 |
최대주주는 현재까지 급여수준으로 보았을때 자금여건에 비해 배정주식수보다 적게 증자에 참여하였으며, 이에 따른 최대주주 및 특수관계인의 낮은 지분율은 적대적 M&A등의 위험성을 내포할 수 있으며, 이러한 점은 경영진 변동의 위험성으로 이어져 안정적인 경영활동이 어려울 수 있습니다. 투자자분들은 투자 시, 이 점 유의해주시기 바랍니다.
| 마. 지속적인 연구개발 비용에 따른 손익 악화 위험 당사는 주요사업으로 핵산 백신 및 핵산 기반 치료제를 연구개발하고 있기 때문에 지속적으로 연구개발 비용이 발생하고 있습니다. 당사는 2023년 3분기말까지 통합독감 DNA백신(유니버셜 인플루엔자 DNA 백신) 3,968백만원, VGX-6150(만성C형간염 치료백신) 4,608백만원, GLS-5310(코로나19 백신, 부스터샷 포함) 7,967백만원, GLS-1200(코로나19 감염방지 코스프레이 치료제) 3,180백만원을 포함한 주요 파이프라인 연구개발을 위해 55,401백만원을 지출하였습니다. 당사는 파이프라인의 지속적인 개발 뿐만 아니라 금번 유상증자 대금을 활용하여 SFTS 임상시험 및 의료기기 개발 등에 사용할 예정입니다. 이처럼 당사는 제품화되기까지 계속적으로 연구개발비를 사용할 예정이며 이는 판관비에 해당되어 당사의 손익계산서에 부정적인 악영향을 끼칠 것으로 예상됩니다. 또한, 당사는 영업적자가 지속되고 있기 때문에 부족한 연구개발비를 외부에서 차입, 조달하여야 하며 적기에 자금을 조달하지 못할 경우 연구개발 진행에 원할하지 않을 가능성이 존재하오니 투자자께서는 이 점 유의하시기 바랍니다. 당사가 연구개발하는 과정에서 시험결과 효능이 미약하게 나와 중간에 중단하게 되거나, 효율적 자금 사용을 위해 보류 중인 파이프라인이 존재합니다. 코로나19 DNA 백신(GLS-5310) 및 치료제(GLS-1027, GLS-1200) 등 당사가 보유한 파이프라인에 대하여 장기간 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발 비용은 따로 회수할 수 없어 당사의 손익에 악영향을 미칠 수 있으며 이로 인해 회사 가치가 훼손될 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 주요사업으로 핵산 백신 및 핵산 기반 치료제를 연구개발하고 있기 때문에 지속적으로 연구개발 비용이 발생하고 있습니다. 당사는 2023년 3분기말까지 통합독감 DNA백신(유니버셜 인플루엔자 DNA 백신) 3,968백만원, VGX-6150(만성C형간염 치료백신) 4,608백만원, GLS-5310(코로나19 백신, 부스터샷 포함) 7,967백만원, GLS-1200(코로나19 감염방지 코스프레이 치료제) 3,180백만원을 포함한 주요 파이프라인 연구개발을 위해
55,401백만원을 지출하였습니다. 당사는 연구개발에 사용되는 금액을 모두 당기의 비용으로 인식하여 경상 연구개발비로 회계처리 합니다. 다만 만약 3상 임상승인을 받는다면 "제약,바이오 기업의 연구개발비 회계처리 관련감독지침"에 따라 해당 프로젝트는 3상 승인 받은 이후의 금액은 개발비 자산으로 회계처리할 예정입니다.
| [연구개발 진행정도] |
| (단위 : 백만원) |
| 우선순위 |
프로젝트명 |
2021년 12월 |
2022년 12월 |
본 공시서류 제출 전일 현재 |
연구 성과물 |
시계열적 연구개발비 사용 내역 | 연구개발 비용 |
|---|---|---|---|---|---|---|---|
| 연구 중단 |
통합독감 DNA백신 |
이노비오 주도 개발 중 |
이노비오 주도 개발 중 |
이노비오 연구개발 중단 |
임상 1상, 조류독감 백신(VGX-3400)에의해 유도된 T 면역세포 반응의 분석 보고서 확보함. |
[2009년] - CRO 용역비(14.3) - 프로토콜 개발비(120.6) - 병원 연구비(34.8) - 기타(148.7) [2010년] - CRO 용역비(28.2) - 프로토콜 개발비(3.7) - 병원 연구비(118.1) - 데이터 분석비(33.9) - 플라스미드 생산(117.4) - 운영비 및 기타(85.2) - UFDV Upfront(3498.0) [2011년] - 병원 연구비(99.0) - 데이터 분석비(169.4) - 운영비 및 기타(47.5) - UFDV Upfront(29.5) - UFDV 자문료(25.7) [2012년] - 병원 연구비(49.4) - 데이터 분석비(32.2) - 운영비 및 기타(85.7) - UFDV Upfront(28.8) - UFDV 자문료(43.5) [2013년] - 기타(28.5) - UFDV Upfront(28.5) [2014년] - 운영비 및 기타(31.9) - UFDV Upfront(76.6) [2015년] - UFDV 연간 유지비(55.4) [2016년] - UFDV 연간 유지비(119.1) - 문서 보관기간 연장비(0.5) [2017년] - 외부 평가 용역료(123.8) [2020년] - 라이센스 계약비(237.8) |
5,515.7 |
| 연구 중단 |
VGX-6150 만성C형 간염 치료백신 |
한국 1상 임상 종료 |
한국 1상 임상 종료 |
개발 중단 |
1상임상 종료 식약처 보고, 국제학술대회 구두 및 포스터 발표 (2018년 Liver Week 2018, 2019년 HCV2019), 비임상결과 국제학술지 논문게재 (2017년 Scientific Report), 임상결과 국제학술지 게재 (2020년 Journal of Hepatology) |
[2011년] - 안전성 실험(5.0) - 플라스미드 생산(575.6) [2012년] - 안전성 실험(213.4) - 플라스미드 생산(2576.5) [2013년] - 안전성 실험(326.1) - 임상 1상(127.5) [2014년] - 안전성 실험(85.4) - 임상 1상(240.9) [2015년] - 안전성 실험(20.0) - 플라스미드 생산(41.7) - 임상 1상(247.6) - 임상시험 종료 비용(76.3) [2016년] - 임상시험 종료 비용(246.0) [2017년] - 임상시험 종료 비용(127.0) - 기술 자문료 등(19.8) [2018년] - 기술 자문료 등(4.5) [2020년] - 기술 자문료 등(15.9) [2021년] - 기술 자문료 등(5.8) |
4,955 |
| 연구 중단 |
GLS-6150 만성C형 간염 치료백신 |
한국 1상 임상 종료 |
한국 1상 임상 종료 |
한국 1상 임상 종료 후 중단 |
복지부 지원 연구개발 과제 선정, 식약처 임상승인서, 임상시험대상자 모집 완료, 임상시험결과보고서(CSR) 최종본 수령(2022년 12월 8일) 향후 중단 파이프라인으로 변경예정 |
[2020년] - 임상 관련 비용 등(77.0) [2021년] - 임상 관련 비용 등(88.3) [2022년] - 임상시험 용역비, 통계분석비 등(4.7) |
170 |
| 연구 중단 |
GLS-6100 C형 간염 예방백신 |
식약처 1상임상 승인 |
한국 1상 임상 종료 |
후속과제 지원없어 개발 중단 |
복지부 지원 연구개발 과제 선정, 식약처 임상시험계획승인서(2021년 5월), 보건복지부의 후속과제 지원 계획에 따라 GLS-6100(고위험 정상인 대상) 임상시험 추진 계획이었으나, 이후 과제에 대한 후속 지원이 없어 개발 종료함. 향후 중단 파이프라인으로 변경예정 |
||
| 연구 중단 |
GLS-5300 메르스 백신 |
한국 1/2a상 임상시험 종료, (중동내 2상임상부터) |
한국 1/2a상 임상시험 종료, 이노비오 주도개발 (중동내 2상임상부터) |
한국 1/2a상 임상시험 종료, (중동내 2상임상부터) |
- 미국 FDA 1상 임상승인, 1상임상연구 종료, 임상연구결과 국제학술지 논문제개 (Lancet Infectious Disease) - 한국 식약처 1/2a상 임상승인, 서울대병원/분당서울대병원에서 임상연구 진행중 - 국제백신연구소(IVI) 지원 과제 선정 비임상결과 국제학술지 논문 게재 (Science Translational Medicine) |
[2015년] - 플라스미드 생산, 자문료 등(716.0) [2016년] - 임상시험 연구비, 업무 위탁 비용 등(452.6) [2017년] - 임상시험 연구비, 업무 위탁비용 등(96.8) - CRO 비용, 플라스미드 생산비 등(387.6) [2018년] - CRO 비용, 플라스미드 생산비 등(49.1) [2020년] - 임상 관련 비용, 통계 분석비 등(29.1) [2021년] - 임상 관련 비용, 통계 분석비 등(9.4) [2022년] - 임상시험 용역비 등(21.6) [2023년] - 임상시험 용역비 등(0.3) |
1,762.5 |
| 연구 중단 |
GLS-5700 지카 DNA 백신 |
이노비오 주도 개발 (2상임상부터) |
이노비오 주도 개발 (2상임상부터) |
미국 1상 임상시험종료 (2상임상부터) |
- 임상연구 중간결과를 국제 저명 의학전문 학술잡지인 New England Journal of Medicine에 발표(2021년 9월) |
[2016년] - 플라스미드 생산 등(1747.0) - Zika-001 임상 업무 위탁비 등(672.9) - Zika-002 임상 업무 위탁비 등(457.6) [2017년] - CRO 비용 등(487.8) - 공동 연구 개발비 등(148.5) - 플라스미드 생산(20.6) - Zika-001 CRO 비용 등(1152.1) - Zika-002 CRO 비용 등(2248.5) [2018년] - 플라스미드 생산(36.5) - Zika-001 CRO 비용 등(188.9) - Zika-002 CRO 비용 등(1111.7) [2020년] - 임상 관련 비용(54.0) - Zika-002 임상시험 종료 비용 등(60.3) [2021년] - 임상 관련 비용(24.4) - Zika-002 운영비 등(12.7) [2022년] - Zika-002 운영비 등(153.1) [2023년] - Zika-002 운영비 등(33.1) |
8,609.7 |
| 3 |
GLS-1200 축농증 치료제 |
미국 2상 임상 잠정 중단 |
미국 2상 임상 잠정 중단 |
미국 2상 임상 잠정 중단 |
- 축농증 치료 2상임상연구에 대한 미국 FDA 임상승인신청완료, 미국 FDA 2상임상 승인 |
[2020년] - 임상기관 연구비 등(215.0) [2021년] - 운영비 등(50.9) [2022년] - 운영비 등(48.0) [2023년] - 운영비 등(33.9) |
347.8 |
| 3 |
GLS-1200 코로나19 감염방지 |
미국 2상 임상 진행중 |
미국 2상 임상 진행중 |
- 대상자 184명 등록 완료 |
미국 FDA 2상 임상승인 |
[2020년] - 컨설팅비, 통계 분석비 등(1717.5) [2021년] - CRO 비용 등(352.4) [2022년] - 컨설팅 비용 등(403.7) [2023년] - 컨설팅 비용 등(358) |
2,831.6 |
| 1 |
GLS-1027 당뇨병성 신장병증 치료제 |
개발 잠정 중단 |
개발 잠정 중단 |
동물에서 약물의 효능평가 연구계획 |
당뇨병성 신장질환치료제 안전성 평가에 대한1상임상연구 종료 |
[2016년] - 기술가치평가 의뢰 비용(16.6) [2017년] - 자산 구매 계약비(1071.4) [2018년] - 특허 연차료 등(8.1) [2020년] - 특허 연차료 등(341.3) [2021년] - 임상시험 용역비 등(106.5) |
1,543.9 |
| 1 |
GLS-1027 코로나19 증상악화 방지 경구용 치료제 |
미국, 북마케도니아, 한국 식약처, 유럽의 약품청(EMA), 불가리아 식약청 2상 임상 승인 현재 임상 피험자 등록 진행 중 |
미국, 북마케도니아 2상 임상승인, 2상 임상승인신청 |
- 미국, 북마케도니아, 한국 식약처, 유럽의약품청(EMA), 불가리아 식약청 2상 임상 승인 |
- 코로나19 증상악화 방지 경구용 치료제로 2상임상 신청 및 승인 |
[2020년] - 컨설팅 비용, 통계 분석비 등(941.0) [2021년] - 통계 분석비, 모니터링비 등(460.1) [2022년] - 임상시험 연구비 등(3826.3) - 전임상 시험비(18.6) [2023년] - CRO 용역비 등(500.3) - 과제 종료비, 안정성 시험 등(317.9) - 전임상 시험비 등(7.8) |
6,029 |
| 1 |
GLS-5310 코로나19 백신 |
한국 임상 1상의 1차 중간분석 결과 확인 임상 1상의 2차 중간분석 진행 중 임상 2a상 연구를 위해 5개 기관과 임상 연구 계약 체결 국가임상시험지원재단가 2상 연구의 대상자 모집을 위한 [백신 임상시험참여의향자모집 및 연계 공공플랫폼]이용 협약서 체결 |
한국 1/2a상 임상시험 진행중 |
- 한국 임상 1상 결과 확인 - 임상 2a상 연구를 위해 5개 기관과 임상 연구 계약 체결 - 임상 2a상 중간결과 분석 중 - 국가임상시험지원재단가 2상 연구의 대상자 모집을 위한 [백신 임상시험참여의향자 모집 및 연계 공공플랫폼] 이용 협약서 체결 |
- '2020년도 질병관리본부 긴급 현안 지정 학술연구개발 용역과제’인 ‘핵산백신 플랫폼을 활용한 코로나19 백신후보물질 개발 사업’에 우선 순위 협상대상자로 선정됨 |
[2020년] - 임상시험 기기 등(301.7) - 동물구입 및 동물 실험비 등(224.2) - 임상시험 용역비 등(472) - 시약및 기기 구입 등(502.4) [2021년] - 임상시험 기기 등(153.7) - 동물구입 및 동물 실험비 등(4) - 임상시험 용역비 등(491.7) - 시약및 기기 구입 등(2,176) [2022년] - 임상시험 비용 등(1,917) [2023년] - 임상시험 비용 등(276.5) - 임상시험 용역비, 임상시험기관 연구비 등(283.3) |
9,068.5 |
| 1 |
GLS-5310 코로나19 백신(부스터샷) |
- | - | - 기존 피내 접종과 비강내 접종을 병용하는 임상 1상 시험계획을 미국 FDA로부터 승인 - 대상자 69명 모집 완료 -중간결과 분석 중 - 임상결과 분석 중 |
-코로나19 추가접종 백신으로 임상 1상 시험계획서의 미국 FDA 승인(2022년 1월) -임상시험실시기관에서의 임상시험 종료(2023년 6월) |
[2022년] - 임상CRO, 임상시험기관 연구비 포함한 임상시험 비용 등(1,677) [2023년] - 임상CRO, 임상시험기관 연구비 포함한 임상시험 비용 등(589) |
|
| 2 |
GLS-5140 SFTS 백신 |
비임상연구 |
비임상연구 |
-비임상연구 |
-대한민국 특허등록 (2020년 2월), 해외특허PCT출원 |
[2020년] - 효능평가 연구비, 시약 구매 등(84.0) [2022년] - 유효성 평가, 계약 체결비 등(659.1) [2023년] - 플라스미드 생산 및 시약 구입 등(1480.9) - 동물 실험비, 특허비 등(10.9) |
2,234.9 |
| 4 |
GLS-7100 혈우병 치료제 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
mRNA 신약개발 플랫폼을 이용한 제품후보물질 개선 연구 진행중 (코로나19 백신 연구개발로 지연됨) | [2014년] - 연구비(21.0) [2015년] - 연구비(37.8) - 시약 구입(2.3) [2016년] - 동물, 분석 시약 구입 등(18.8) [2020년] - 위탁시험 계약금, 시약 구입 등(25.3) |
105.2 |
| 4 |
GLS-8000 만성B형간염치료 및 예방용 항체 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
- 대한민국 특허 등록, 미국 특허 등록 |
[2017년] - 플라스미드 합성 등(9.8) [2018년] - 시약 재료비(2.2) [2020년] - 용역 연구비, 항원 제작 등(53.3) [2021년] - 시약 재료비 등(9.2) [2022년] - 5년차 연차등록료(0.2) |
74.7 |
| 연구 중단 |
GLS-3000 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
상업화 타당성 문제로 연구개발 중단 | 제형화기술인 LNP 기술을 보유한 기관들로부터 해당 기술 평가 중 개발중단 | [2020년] - 후보물질 비임상 유효성 평가 (24) |
24 |
| 4 |
지카 mRNA백신 |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
|
- 복지부 백신실용화과제 mRNA 신속백신제작 플랫폼 과제 수행 완료 (2022년 12월) |
[2022년] - 전임상 연구 시약 재료비 (152) - 복지부과제 기업부담금 (120) |
272 |
| 4 | CAR-M |
- | - |
타당성검증 효능평가연구 |
- GPC3 CAR 백터 제작 및 생산 - 단핵세포의 M1 거대세포 분화 유도 - CAR 형질전환 거대세포의 식세포 증가 확인 |
[2023년] - 전임상 연구 시약 재료비 (5.5) - PBMC 기반 CAR-M 연구 (11) |
16.5 |
| 4 | Microneedle and device 개발비 등 |
효과적인 경피용 약물전달 기술개발 | 효과적인 경피용 약물전달 기술개발 | 효과적인 경피용 약물전달 기술개발 | - 시제품 개발 및 성능시험, 안전성 시험, 안정성 시험, 멸균 시험 등 단계별 진행 - 차세대 경피약물 전달 시스템 스프레이-코팅 마이크로니들 기술에 대한 중국특허 등록 (2023년 4월) |
[2017년] - 기술 개발비 (78) [2020년] - 기술 개발비 (444) - 법률 자문료 (38) [2021년] - 기술 개발비 (179) - 특허 비용 (30) [2022년] - 기술 개발비 (790) [2023년] - 기술 개발비 (285) |
1,844 |
| 4 | PlasMab |
- |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
- CTLA4 PlasMab 유전자 합성 - 세포주에서의 PlasMab 발현 확인 |
[2022년] - 전임상 연구 시약 재료비 (2) [2023년] - 전임상 연구 시약 재료비 (4) |
6 |
| 4 | RNA백신 기반 연구개발비 |
RNA 백신 개발을 위한 기초 연구 | RNA 백신 개발을 위한 플랫폼 확립 연구 | RNA 백신 개발을 위한 플랫폼 확립 및 품질관리 연구 | - FDA, EMA, 식약처의 가이드라인에 부합하는 mRNA 백신 R&D 플랫폼을 수립. - 다양한 5' cap과 LNP를 적용하여 mRNA 백신 연구개발에 가장 적합한 조합을 플랫폼 확립. - 동물실험에서 mRNA 백신의 우수한 발현양상을 확인. |
[2020년] - 전임상 연구 시약 재료비 (166) - 독성평가 용역 연구비 (25) [2021년] - mRNA 배송비 (3) - 특허 비용 (25) [2022년] - 전임상 연구 시약 재료비 (12) [2023년] - 전임상 연구 시약 재료비 (6.5) - 한국연구재단과제 기업부담금 (7.5) - mRNA 품질 관리 및 공정 확립 (20.1) - 세포내 타겟 mRNA 발현 연구 (0.6) - mRNA 기반 BsAb 발현 연구 (2.8) - 면역 항암제 후보물질 제작 (0.7) |
269.2 |
| 4 | CCR8 |
- |
타당성검증 효능평가연구 |
타당성검증 효능평가연구 |
- CCR8 유전자 합성 - 단클론 항체 서열 확보 |
[2023년] - 전임상 연구 시약 재료비 (2) - 단클론 항체 서열 분석 (5.6) |
7.6 |
| 4 | 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 핵산 기반 백신 개발 | 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기술에 대해 독점적인 라이선스인 | 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기초연구 | 니파 (Nipah) DNA 백신의 동물실험 수행 | - 니파 (Nipah) DNA 백신의 면역효능 확인 | [2022년] - 니파(Nipah) 및 포와산(Powassan) 바이러스를 예방하는 핵산 기반 백신 특허료 지불 (65) [2023년] - 니파(Nipah) DNA 백신의 동물 실험(37) - 니파(Nipah) DNA 백신 후보물질 제작 (1.6) |
103.6 |
| 4 | Pan-Corona | - | 타당성검증 효능평가연구 | 타당성검증 효능평가연구 | - Pan-Corona 백신 항원 후보물질 개발 - Pan-Coronal 단클론 항체 Hybridoma 구축 |
[2022년] - 전임상 연구 시약 재료비 (24.2) - Hybridoma 세포 배양 및 단클론 항체 분석 (5.3) - Pan-Corona 백신 유효성 평가 동물 실험 (75.5) [2023년] - Pan-Corona 백신 및 hybridoma 효능 평가 (3.1) - Pan-Corona 백신 유효성 평가 동물 실험 (7.9) |
116 |
| 합계 | 45,950.4 |
||||||
| 출처) 당사 제시 |
| 주) 연구개발비용은 2006년부터 2023년 9월까지 지출 합계 |
당사는 상기 파이프라인의 지속적인 개발 뿐만 아니라 자금조달을 통해 중증열성혈소판감소증후군(SFTS) 임상시험 및 의료기기 개발등에 사용할 예정입니다. 이처럼 당사는 제품화되기까지 계속적으로 연구개발비를 사용할 예정이며 이는 판관비에 해당되어 당사의 손익계산서에 부정적인 악영향을 끼칠 것으로 예상됩니다.
또한, 당사는 영업적자가 지속되고 있기 때문에 부족한 연구개발비를 외부에서 차입, 조달하여야 하며 적기에 자금을 조달하지 못할 경우 연구개발 진행에 원할하지 않을 가능성이 존재하오니 투자자께서는 이 점 유의하시기 바랍니다.
| [연구개발 과제 및 세부내역] |
| (단위 : 백만원) |
| 과제 | 연구개발 내용 | 연구비 세부내역 | 금액 |
| GLS-1200 (Rhinovirus 감염방지 치료제) | - 비임상시험 수행(2023년~2024년) - 임상시험 수행(2023년~2024년) |
- 비임상시험- 단회 투여, 반복 투여의 독성평가 : 192.5 - 약물 효능평가 및 효력평가 : 100 - 임상 2상 수행비 : 1,982.5 |
2,275 |
| GLS-1027 (당뇨병성 신장병증 치료제) | - 비임상연구 수행(2023년~2024년) | - 포도막염 질환 동물에서의 효능, 효력 평가 : 234 - Prodrug 개발, 합성, 품질 검사비 : 130 |
364 |
| GLS-5140 (SFTS 백신) | - 비임상 연구 추가 진행(2023년) - 임상1상 IND 신청 완료(2023년) |
- 비임상 효능평가, 독성평가 연구비 : 2,000 - 비임상, 임상용 백신 생산비 및 품질평가 비 : 2,000 - 임상 1상 수행비 및 대상자 검체 분석비 : 7,400 |
11,400 |
| GLS-7100 (혈우병 치료제) | - mRNA 신약개발 연구 플랫폼에서의 효능평가 수행 (2023년~2024년) | - 비임상 효능 평가 연구비 : 50 - 실험동물에서 효능 및 독성 평가 연구비 : 300 |
350 |
| GLS-8000 (만성B형간염치료 및 예방용 항체) |
- mRNA 신약개발 연구 플랫폼에서의 효능평가 수행 (2023년~2024년) | - 비임상 효능 평가 연구비 : 50 - 실험동물에서 효능 및 독성 평가 연구비 : 500 |
550 |
| pDNA 플랫폼 기반 백신과 저분자 치료제 연구 | - 바이러스 감염 예방 백신 및 저분자 약물 치료제 개발 연구 (2023년~2024년) | -유효물질 발굴 및 비임상 효능 평가 연구비 : 540 -실험동물에서 효능 및 독성 평가 연구비 : 856.2 |
1,396.2 |
| mRNA 플랫폼 기반의 백신 및 항체치료제 연구 | - 연구개발용 mRNA 생산공정 및 품질관리 확립으로 mRNA 신약개발 연구 플랫폼 구축 완료 (2021년~2022년) - 바이러스 감염 예방 백신 및 항암 백신과 항체치료제 연구개발 수행 (2023년~2024년) |
-유효물질 발굴 및 비임상 효능 평가 연구비 : 870 -백신 및 항체치료제용 mRNA 생산 및 전달체 개선 연구비 : 500 -후보물질 도출 및 실험동물에서 효능 및 독성 평가 연구비 : 3,040 |
4,410 |
| GLS-5310 (코로나19 DNA백신 개발) | - 한국 임상 2a상 결과분석 수행(2023년) - 한국 임상 1/2a상 최종 결과분석 수행(2023년~2024년) |
- 임상시험실시기관의 임상 수행비 : 750 - CRO의 임상시험 수행 및 과제 관리비 : 600 - 임상결과 통계분석비, 결과보고서 개발비 : 200 |
1,550 |
| GLS-5310 (코로나19 DNA백신 부스터샷) | - 미국 FDA로 부터 기존 피내 접종과 비강내 접종을 병용하는 임상 1상 시험계획을승인(2022년) - 미국 임상 1상 시험의 대상자 69명 모집 완료하고, 중간결과 분석 중(2022년~2023년) - 1상 임상시험 최종결과 분석 계획(2024년) |
"- 임상시험실시기관 3곳 비용 : 1,044 - 임상시험 검체 중화항체가 분석비 및 분석 시료 구입비 : 166.4 - 임상시험 중간결과 분석(통계, CSR, QC) : 19 - 임상시험 최종결과 분석 (통계, CSR, QC) : 20" |
1,249.4 |
| GLS-1027 (코로나19 임상악화방지 경구용 치료제 개발) | - 임상 2상 대상자 132명에 대한 임상결과 분석 중(2023년) | - 비임상 연구의 독성평가, 효능평가 수행비 : 1,000 - 임상 2상 검체 분석비 : 1,173.9 - 임상 2상 수행비 : 312 |
2,485.9 |
| 합계 | 26,030.5 | ||
| 출처) 당사 제시 |
| 주) 연구비 세부내역은 이전 유사 연구수행 경험을 토대로 통상적 범위에서 소요될 것으로 예상되는 금액을 산출하였습니다 |
| [최근 3년 및 2023년 3분기 세부 연구개발 비용] |
| (단위 : 백만원) |
|
과 목 |
2023년 3분기 | 2022년 | 2021년 | 2020년 | 2019년 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | ||
|
회계처리 |
판매비와 관리비 |
5,219 | 6,871 |
12,147 |
12,977 |
11,441 |
14,358 |
8,396 |
8,867 |
5,874 | 5,711 |
|
개발비(무형자산) |
- | - |
- |
- |
- |
- |
- |
- | - | - | |
|
연구개발비용 계(주1) |
5,219 | 6,871 |
12,147 |
12,977 |
11,441 |
14,358 |
8,396 |
8,867 |
5,874 | 5,711 | |
|
(정부보조금) |
(6) | (6) |
(734) |
(734) |
(4,880) |
(4,880) |
(960) |
(960) |
(669) | (669) | |
|
정부보조금 차감 후 연구개발비용 계 |
5,213 | 6,865 |
11,413 |
12,243 |
6,561 |
9,478 |
7,436 |
7,907 |
5,205 | 5,042 | |
|
연구개발비 / 매출액 비율(주2) |
18.99% | 26.56% |
23.4% |
26.8% |
17.0% |
27.7% |
17.9% |
22.1% |
12.6% | 14.6% | |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 연구개발비용은 전액 판관비로 계상되어 있으며, 정부보조금을 차감하기 전의 연구개발비용 지출총액입니다. |
| 주2) 매출액 대비 정부보조금 차감 후 연구개발비용이 차지하는 비율로 산출하였습니다. |
당사는 2023년 3분기 연결기준 매출액의 18.99%를, 2022년 연결기준 매출액의 23.43%를 연구개발 비용으로 사용하여 왔으며, 2020년부터 SFTS 예방 DNA 백신, 코로나19 경구용 치료제, 감염방지 코 스프레이 치료제 개발 등으로 증가하는 추세입니다. 당사는 금번 자금조달된 자금과 자체자금을 통해 향후에도 연구개발비용에 많은 투자를 할 예정이오니 투자자께서는 이 점 유의하시기 바랍니다.
한편, 당사가 주요사업으로 영위하는 바이오 신약 개발 산업의 특성상 현재 연구개발하고 있는 신약이 상업화되기까지는 막대한 비용과 시간이 필요합니다. 특히, 임상시험에 진입하여도 최소 8-9년이 소요되며 그에 필요한 비용이 요구됩니다. 또한, 임상시험을 진행한다고 하더라도 시험결과 효능이 부족하거나 안전성 평가에 적합하지 못한 결과가 나올 경우 해당 신약의 연구개발은 중단될 수 밖에 없습니다. 이러할 경우 당사의 비용 및 시간 투자에도 불구하고 엄청난 손실을 야기할 수 밖에 없습니다.
당사는 과거 10년 동안 63,280백만원(정부보조금 차감 전, 연결)의 연구개발비용을 지출하였습니다. 그러나 당사가 보유한 파이프라인 중 성공한 사례는 존재하지 않으며, 현재 당사는 신약 개발을 위해 지속적으로 연구개발비를 지출하고 있으나 파이프라인에 대한 성공 가능성을 알 수 없습니다.
| [10년간 지출 경상연구개발비 내역(연결)] |
| (단위 : 백만원) |
| 구분 | 경상연구개발비 |
| 2023년 3분기 | 5,219 |
| 2022년 | 12,147 |
| 2021년 | 11,441 |
| 2020년 | 8,396 |
| 2019년 | 5,874 |
| 2018년 | 5,661 |
| 2017년 | 8,398 |
| 2016년 | 3,931 |
| 2015년 | 831 |
| 2014년 | 759 |
| 2013년 | 623 |
| 합계 | 63,280 |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주) 연구개발비용은 전액 판관비로 계상되어 있으며, 정부보조금을 차감하기 전의 연구개발비용 지출총액입니다. |
당사는 연구소에서 내부 협의를 통해 연구개발 과제를 1차 선정하고 신약개발본부 및 글로벌임상본부의 검토를 통해 대표이사가 최종 승인하여 연구개발 과제를 선정하고 있으며, 동일한 적응증에 대한 제품이 승인되거나 임상과정에서의 결과가 당사보다 우수할 경우, 시장성 측면에 대한 검토 후 수익성이 없다고 판단되는 경우 및 임상1상 결과 안전성에 문제가 있는 경우 등 연구결과가 연구개발을 지속하는 것이 부적절한 경우 관련 부서의 장과 경영진이 내부검토후 합의를 통해 연구개발을 중단하게 되거나, 효율적 자금 사용을 위해 보류 중인 파이프라인이 존재합니다. 코로나19 DNA 백신(부스터샷)(GLS-5310) 및 치료제(GLS-1027, GLS-1200) 등 당사가 보유한 파이프라인에 대하여 장기간 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발 비용은 따로 회수할 수 없어 당사의 손익에 악영향을 미칠 수 있으며 이로 인해 회사 가치가 훼손될 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| [연구개발 중단 파이프라인] |
| (단위 : 백만원) |
|
프로젝트명 |
제품설명 |
개발단계 |
중단 사유 | 연구개발비 |
|---|---|---|---|---|
| GLS-5100 | 대상포진 백신 | 전임상연구 | 타사 백신이 우수한 효능으로 전세계 시장을 독점하고 있어 개발 중단 | 780 |
| GLS-7000 | 유방암 치료제 | 전임상연구 | 동물실험결과 기존 치료방법 대비 효과가 미약하여 개발 중단 | 86 |
| GLS-8100 | 류마티스 관절염 치료제 | 전임상연구 | 동물실험을 통해 효능을 확인하였지만, 해당 관절염 동물 모델을 구축하는데 시간과 연구비용이 많이 소모되어, 국책과제 선정될 때까지 개발 중단 | 713 |
| GLS-3700 | H7N9 신종플루 예방백신 |
전임상연구 | 국책 지원과제 모색 중 |
1,580 |
| GLS-7300 | 비만대사 유전자치료제 | 전임상연구 | 동물실험결과 비만치료효과가 미약하여 개발 중단 | 132 |
| GLS-5300 | 메르스 예방 | 임상 1/2a상 시험 (한국) |
계약에 따라 임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사에서 수행 예정. 이후, 이노비오사는 CEPI의 연구비를 지원받아 진행하기로 했던 임상연구를 중단한다고 발표함(2022.11.17). |
1,762.5 |
| GLS-5700 | 지카바이러스 예방 | 임상 1상 시험 (푸에르토리코) |
계약에 따라 임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사에서 수행 예정. | 8,609.7 |
| GLS-6150/GLS-6100 | C형 간염 예방 | 임상 1상 시험 (한국) |
보건복지부의 후속과제 지원 계획에 따라 GLS-6100(고위험 정상인 대상) 임상시험 추진 계획이었으나, 이후 과제에 대한 후속 지원이 없어 개발 종료함 | 170 |
| GLS-5200 | 에볼라 바이러스 DNA 백신 | 임상 1상 시험 (미국, 캐나다) |
당사는 GLS-5200 임상시험용 DNA 백신을 대량생산하여 공급하여 이노비오에 전달함에 따라 해당 제품에 대한 지분을 확보하였고, 공동개발기관인 이노비오는 임상 1상 연구를 완료함. 당사는 해당 임상을 진행하지 않음. | 3,194 |
| VGX-6150 | 만성 C형 간염 치료 | 임상 1상 시험 (한국) |
2상 임상시험 진입을 보류- COVID-19에 대한 백신과 치료제 개발에 대한 임상시험 진행으로 인해 후순위로 결정되어 보류 상태임 | 4,955 |
| VGX-3400 | 통합독감DNA백신 | 임상 1상 시험 (한국) |
미국 이노비오사에서 임상 2상시험 부터 개발 진행으로 중단 | 5,515.7 |
| VGX-7100 | 허혈질환 유전자치료제 | 전임상연구 | 동물실험결과 새로운 혈관생성 효과가 미약하여 개발 중단 | 115 |
| VGX-7200 | DNA 기반 알츠하이머 항체치료제 | 전임상연구 | 알츠하이머 치료제 전세계 개발 동향 반영 후속 개발 중단 | 42 |
| GLS-3000 | 코로나19 mRNA백신 | 전임상연구 | LNP 제형화기술을 보유한 기관들로부터 해당 기술 평가 중 상업화 타당성 문제로 개발 중단 | 24 |
| 미정 | CCHF 콩고출혈열 |
전임상연구 | SFTS 과제 우선 수행으로 인한 후속 연구 중단 | 28 |
| 미정 | HnMc 항암치료제 | 전임상연구 | 미토콘드리아 타겟팅에 의한 일반세포내 독성 문제로 개발 중단 | 5 |
| 미정 | Adiponetin 항암치료제 | 전임상연구 | 동물실험결과 항암치료효과가 미약하여 개발 중단 | 95 |
| 합계 | 27,806.9 |
|||
| 출처) 당사 제시 |
당사는 전 최대주주의 모회사인 미국 나스닥 상장사 이노비오와 통합독감 DNA백신, 에볼라 DNA백신, 메르스 DNA백신, 지카 DNA백신, 만성C형 간염 DNA백신 등의 공동연구개발을 진행한 바 있습니다. 이노비오가 초기 연구를 하고 당사가 특정 제품을 라이선스-인하여 임상1상을 담당하고 후기 임상은 이노비오가 담당하는 구조로 당사가 임상1상을 담당함에 따라 아시아 지역 등 특정 지역의 판권의 확보 또는 해당 제품에 대해 일정 지분(최소 10%-최대 35%) 얻는 구조입니다. 그러나 현재 이노비오와 공동개발한 제품은 당사가 임상1상을 담당하여 판권 또는 지분을 확보함에도 불구하고 이노비오가 개발 타당성 부족 또는 개발자금 확보 실패 등의 사유로 개발을 중단함에 따라 상업화 또는 기술이전에 따른 혜택을 기대하기 어려운 상황입니다. 이처럼 당사가 인적 물적 자원을 투입하여 임상1상을 수행해도 후기 임상을 담당하는 이노비오가 개발을 중단한다면 수익을 기대하기 어렵고 비용만 발생합니다. 이는 DNA백신의 상용화에도 부정적으로 작용함에 따라 투자자들께서는 이점 유의하시기 바랍니다.
| 바. 종속회사 관련 위험 당사는 신고서 제출일 현재 2개의 종속기업이 있으며 동 종속기업들에 대해서 당사는 지분율 100%를 보유하고 있으며, 이들의 경영실적은 당사의 연결재무제표에 반영하고 있습니다. VGXI는 플라스미드 DNA의 cGMP 생산설비를 갖추고 관련되는 의약품 생산 의뢰에 대해 주문자 방식으로 생산을 하는 업체입니다. 현재 당사 및 바이오텍 기업 등에 납품한 실적을 가지고 있으나 다년간의 계약을 통해 생산이 진행됨에 따라 수주잔량에 따라 매출액 변동의 위험을 안고 있습니다. VGXI는 2018년 생산시설의 확장을 완료하였으며, 2021년 12월 주주배정 후 실권주 일반공모를 통한 유입자금 중 일부를 당사로부터 차입하여 약 4,000평 규모의 가변형 플라스미드 DNA와 mRNA 생산 시설을 완공하여 2023년 1분기70억원 규모의 초도물량 수주를 받았으며, 금번 주주배정 후 실권주 일반공모를 통한 유입자금 중 일부를 당사로부터 차입하여 장비 구입, 공장 부지 추가 매입, 원재료 발주 등을 진행할 계획입니다. 종속기업인 DIV는 옷의 안감과 겉감 사이에 옷감을 생산, 판매를 주로 하며, 자수(패턴)실을 판매하는 사업을 영위하고 있습니다. 저가의 노동력을 이용하기 위하여 2003년에 베트남에 진출하였습니다. 그러나 저가 노동력의 품질에 대한 인식 저하로 인해 어려움을 겪었으며 이에 대한 해결을 통해 경쟁력을 확보하고자 노력하였으나 완전히 해소되었다 판단하기는 어렵습니다. 지속적인 품질 개선을 위한 노력을 바탕으로 중국 업체와 경쟁 중에 있습니다. 코로나19 사태로 인하여 셧다운 및 소비 심리 악화 등의 영향으로 2020년말 기준 10,521백만원의 매출액 및 31백만원의 당기순이익이 2021년말 기준 10,381백만원의 매출액 및 192백만원의 당기순손실, 2022년말 기준 11,309백만원의 매출액 및 583백만원의 당기순손실, 2023년 3분기말 기준 5,803백만원의 매출액, 551백만원의 당기순손실이 발생하였습니다. 당사는 종속회사들을 원가법으로 평가하고 있고, 종속기업들은 최근 매출액이 증가하는 추세였으나 2023년 3분기 CDMO 사업부분에서는 2022년말부터 경기침체를 우려한 제약사들의 위탁주문생산 문의 감소로 인해 전년 동기 대비 매출이 감소하였으며, 패브릭사업부문의 경우에도 전세계의 경기침체를 우려한 소비력이 감소됨에 따라 섬유제품의 판매가 감소되었기 때문에 전년 동기 대비 매출이 감소하였지만, 2023년 3분기까지 손상처리를 하지 않았으며, 종속기업들에 대한 채권에 대하여 대손충당금을 설정하고 있지 않는 상황입니다. 종속회사가 영위하는 사업이 실패하거나 파산할 경우 당사의 연결 및 개별 재무제표에 직접적인 영향이 발생할 수 있으며, 이는 당사의 재무상태에 부정적인 영향을 미칠 수 있으므로 투자자 여러분들께서는 이 점 유의하여 주시기 바랍니다. |
당사는 신고서 제출일 현재 2개의 종속기업이 있으며 동 종속기업들에 대해서 당사는 지분율 100%를 보유하고 있으며, 이들의 경영실적은 당사의 연결재무제표에 반영하고 있습니다. 당사의 종속회사에 대한 지분투자 금액은 K-IFRS 회계처리 기준에 따라 해당 개별 종속회사의 영업실적에 의한 재무제표 작성 후, 연결 재무제표로 합산 작성되어 공시되고 있어 종속회사의 실적에 따라 당사의 연결재무제표 손익에 직접적인 영향을 미치고 있습니다. 이 외에 1개의 특수관계자가 존재합니다.
추가적으로 당사는 베트남에 패브릭사업에 관련한 자회사 1개가 있으며, 미국에 제약사업과 관련된 자회사 1개가 있습니다. 해외에 자회사가 존재하기에 국내법이 적용되지 않고 각 국가의 법이 적용되어 급격하게 정치적, 경기적 및 환경적으로 변경될 경우 이에 대한 빠른 대응이 어려워 해외 자회사가 정상적으로 운영되지 않을 수도 있으니 이점 투자자분들께서는 유의하시길 바라겠습니다. 더불어 현재 전세계적인 경기침체로 인하여 베트남 및 미국의 자회사의 매출이 예상과는 다르게 하향되어 재무안정성이 더욱 악화될 수 있으니 이점 또한 투자자분들께서는 유의하시길 바랍니다.
한편, 당사 및 자회사(VGXI USA, VGXI Inc)의 매출인식 프로세스는 다음과 같습니다.
| [매출인식 프로세스](모회사: 진원생명과학- VGXI USA) |
| 1. 고객사와 계약서(MSA) 작성 | 고객사가 진원생명과학(VGXI USA 지점)과 처음 거래일 경우에는 진원생명과학(VGXI USA 지점)과 고객사의 의약품위탁생산을 위한 계약서(Master product Sale Agreement)를 작성합니다. |
| 2. 고객사와 구매약정서(PO) 작성 | 고객사가 위탁생산을 의뢰할 때마다 고객사와 계약된 MSA에 의거하여, 세부적인 생산조건이 포함된 구매약정서(Purchase Order)를 건별로 계약을 진행합니다. |
| 3. 고객사에게 계약금 수령 | PO 계약서 작성과 동시에 PO 계약서에 기재된 총금액의 25~60% 를 고객사에 청구하며 고객사의 지급이 완료되면, 위탁생산을 위하여 자회사 (VGXI Inc)에게 생산을 의뢰합니다. |
| 4. 자회사에게 위탁생산 계약금 지급 | 자회사(VGXI Inc) 에 생산을 의뢰하고 모회사(진원생명과학- VGXI USA)가 산정한 위탁생산 총금액의 25-60%를 자회사 (VGXI Inc) 에게 외주가공비로 지급을 합니다. |
| 5. 수익 인식 | 자회사(VGXI Inc) 에게 의뢰한 제품의 생산공정이 진행됨에 따라 계약된 PO 의 총금액에 생산이 진행된 비율만큼 (생산진행률)을 곱하여 수익으로 인식합니다. |
| 6. 고객사에게 중도금 청구 | 생산이 진행되는 단계에 따라, 계약에 기재된 바에 따라 조건이 충족될 때마다 고객사에게 금액을 청구합니다. |
| 7. 자회사 생산의뢰 중도금 지급 | 진원생명과학(VGXI USA 지점)은 고객사에게 대금의 수취여부와 관계없이, 생산이 진행되는 단계에 따라 자회사 (VGXI Inc)가 청구한 외주가공비를 지급합니다. |
| 8. 고객사에게 잔금 청구 | 자회사 (VGXI Inc)의 위탁생산이 완료를 통보 받으면, 최종 위탁생산 의약품의 인도 전에 고객사에게 잔금을 청구합니다. |
| 9. 자회사 위탁생산 잔금 지급 | 진원생명과학(VGXI USA 지점)은 고객사에게 잔금의 수취여부와 관계없이, 최종 위탁생산이 완료되면 자회사 (VGXI Inc) 가 청구한 외주가공비를 지급합니다. |
| 10. 고객사에게 의약품 인도 | 고객사로부터 잔금 입금이 확인되면 생산이 완료된 의약품을 고객사에 전달될 수 있도록 합니다. |
| 출처) 당사 제시 |
| [매출인식 프로세스](자회사: VGXI Inc) |
| 1.진원생명과학(VGXI USA 지점)과 자회사(VGXI Inc) 위탁생산 계약 | 진원생명과학(VGXI USA 지점)과 자회사(VGXI Inc)는 위탁생산을 위하여 상호간의 합의된 MSA 계약을 하였습니다. MSA 계약서에 의거하여 자회사 (VGXI Inc) 는 진원생명과학(VGXI USA 지점)이 생산의뢰를 할 때마다 위탁생산을 진행합니다. |
| 2. 모회사로부터 위탁생산 계약금 수령 | 위탁 생산의뢰와 동시에 진원생명과학(VGXI USA 지점)이 산정한 위탁생산 총금액의 25~60%를 자회사 (VGXI Inc)에 지급을 하고, 지급완료가 확인되면 자회사 (VGXI Inc)는 위탁생산을 진행합니다. |
| 3. 수익 인식 | 위탁생산 의뢰된 제품의 생산공정이 진행됨에 따라 위탁생산의 총금액에 생산이 진행된 비율만큼(생산진행률)을 곱하여 수익으로 인식합니다. |
| 4. 모회사에게 중도금 청구 | 생산이 진행되는 단계에 따라 산출된 금액을 위탁생산 의뢰자인 모회사 진원생명과학(VGXI USA 지점)에게 금액을 청구합니다. |
| 5. 모회사에게 잔금 청구 | 위탁생산이 완료된 후, 최종 위탁생산 의약품의 인도 전에 위탁생산 의뢰자인 모회사 진원생명과학(VGXI USA 지점)에게 잔금을 청구합니다. |
| 6. 의약품 인도 | 잔금 입금이 확인되면 위탁 생산된 의약품을 지정된 배송 장소로 전달합니다. |
| 출처) 당사 제시 |
[종속회사 내역 및 상세]
(1) VGXI 개요
당사는 DNA 플라스미드의 고순도 농축에 있어서 기술력을 지니고 있어, 당사의 차기 주요 사업 목적인 DNA 플라스미드 의약품을 생산하기 위해 취득하였습니다.
VGXI는 플라스미드 DNA의 cGMP 생산설비를 갖추고 관련되는 의약품 생산 의뢰에 대해 주문자 방식으로 생산을 하는 업체입니다. 현재 당사 및 바이오텍 기업 등에 납품한 실적을 가지고 있으나 다년간의 계약을 통해 생산이 진행됨에 따라 수주잔량에 따라 매출액 변동의 위험을 안고 있습니다. VGXI는 2018년 생산시설의 확장을 완료하였으나, 2021년부터 적자전환하여 2023년 3분기까지 당기순손실이 발생하였고, 2023년 3분기 기준 22,197백만원의 당기순손실이 발생하고 있습니다.
VGXI는 2019년 12월 플라스미드 DNA와 mRNA에 대한 생산시설 건설에 대한 BE&K Building Group을 시행사로 선정하였으며, 2021년 12월 주주배정 후 실권주 일반공모를 통한 유입자금 중 일부를 당사로부터 차입하여 약 4,000평 규모의 가변형 플라스미드 DNA와 mRNA 생산 시설을 완공하여 2023년 1분기 70억원 규모의 초도물량 수주를 받았으며, 금번 주주배정 후 실권주 일반공모를 통한 유입자금 중 일부를 당사로부터 차입하여 장비 구입, 공장 부지 추가 매입, 원재료 발주 등을 진행할 계획입니다.
2020년 11월 VGXI가 미국 텍사스주 콘로시에 마련한 생산시설 부지에서 유전자 치료제 및 코로나19 백신과 mRNA 백신 등에 사용되는 플라스미드의 폭발적인 수요에 대응하기 위한 1차 신규 생산시설 건설에 착수함에 따라 기공식을 개최했습니다. 데이슨(Deison) Technology Park에 건설된 생산시설은 본사로 이용되고 있으며, 해당 시설은 품질평가 실험실, 정제 및 충전, 포장 설비와 원부자재 창고 그리고 공정 지원에 필요한 공간은 물론 사무실과 편의시설 등을 갖춘 2층 규모이며, 2022년 2분기 완공 예정이었습니다.
2021년 3월 VGXI가 진행성 간세포암종(HCC)에 대한 치료제를 개발하고 있는 미국 지니어스 테라퓨틱스(Geneos Therapeutics)와 협력을 강화하기로 하고, 1b/2a 임상시험을 위한 추가 공급 계약을 체결했습니다.
2021년 4월 VGXI가 미국 텍사스주 콘로시에 건설 중인 신규 생산시설에 대한 마지막 강철빔이 세워져 골조 공사가 마무리됨에 따라 시공사인 BE&K Building Group 주최로 상량식을 진행하였습니다.
2021년 8월 VGXI가 ‘Rare Trait Hope Fund(레어 트레이트 호프 펀드)’가 지원하는 아스파르틸글루코사민뇨(Aspartylglucosaminuria) 유전자 치료제 개발 프로젝트에 파트너로 참여하여 지원하기로 하였습니다.
2021년 9월 VGXI가 플라스미드 DNA 및 mRNA 생산 능력을 최대한 높이기 위해 신규 2공장 건설에 투입되고, 신규 3공장 건설도 추진하기 위해, 지분을 통한 자금을 조달하기 위해 JP모건을 주간사로 선정했습니다.
2021년 10월 VGXI는 미국 텍사스주 콘로시 데이슨 테크놀로지 파크(Deison Technology Park)에 건설 중인 신규1공장의 외관 공사를 마무리하였습니다.
2022년 1월 VGXI가 제40회 JP모건 헬스케어 컨퍼런스(J.P. Morgan Healthcare Conference)에 공식 초청을 받아 참가하였습니다.
2022년10월에는 미국 텍사스주 콘로시 데이슨 테크놀로지 파크(Deison TechnologyPark)에 자회사 VGXI의 신규1공장을 증설하였습니다.
2023년1월VGXI가 제41회JP모건 헬스케어 컨퍼런스(J.P. Morgan Healthcare Conference)에 공식 초청을 받아 참가하였습니다.
종속회사인 VGXI의 경우 2021년과 2023년초 미국 내 취득한 부지를 담보로 은행권으로부터 차입을 검토했으나, 신규공장에서 매출이 발생하고 있지 않아 은행권으로부터 차입이 어렵다는 답변을 받은 바 있습니다. 은행에 대한 차입 검토 상세 내역은 다음과 같습니다.
| 금융기관명 | 상담시기 | 내용 |
|---|---|---|
| T사 | 2021.08 | 주거래 은행으로, 대출 상담을 진행했으나 현재 신규공장을 건설 중으로 해당 부지에 대한 담보 대출이 어려우며, 영업이익이 적어 현금창출능력이 부족해 대출 불가 결정. |
| C사 | 2021.08 | 상업용 부동산 관련 서비스를 제공하는 회사로, VGXI 신규 공장 부지에 대한 담보 대출을 협의했으나, 담보 능력 부족 판단되어 대출 불가 판정. |
| U사 | 2021.08 | 미국 대규모 은행으로, 대출 상담을 진행했고, 3천만불에 대해 60개월 만기 3.25%-3.75% 이율로 검토됐으나 영업이익이 적어 현금창출능력이 부족해 최종 대출 불가 판정. |
| J사 | 2021.09 | 투자 유치를 위한 주간사로 선정하고 진행했으나 VGXI의 가치에 대한 이견으로 인해 실제 투자 유치가 이뤄지지 않음. |
| T사 | 2023.01 | VGXI의 신규 공장 완공 후 부지는 물론 해당 시설에 대한 담보로 대출을 협의했으나, 현재 모회사로부터 대여금이 매우 많은 상태로 대출 불가 판정. |
| J사 | 2023.01 | VGXI의 신규 공장에 투입할 수 있는 2천5만불에 대한 브릿론(bridge loan)에 대한 협의를 진행했으나 현재 보류 상태임. |
상기표와 같이 종속회사인 VGXI는 2021년과 2023년초 금융기관으로부터 부지 및 완공된 시설을 통한 담보 대출을 추진했으나, 모회사인 진원생명과학으로부터 대여금이 매우 많고 현재 신규 오더를 수주하지 못해 계약잔고가 매우 부족하여 현금창출능력이 부족하여 자체적으로 자금 조달이 어려운 상황입니다.
또한, 지난 2021년 9월 JP모건을 주간사로 선정하여 VGXI가 신규2공장 건설자금에 대한 조달을 시도했으나 회사가치에 대한 이견이 좁혀지지 않아 현재는 VGXI의 IPO를 우선으로 검토하고 있으며 미국 내 스팩 합병 및 IPO를 위한 조건이 충족될 것으로 예상되는 3~5년 후 구체화할 수 있을 것으로 예상하고 있습니다.
이러한 투자조달 실패에도 불구하고, 종속회사에 대한 투자지속이 회사의 이익에 부합하다고 판단한 이유는 VGXI는 진원생명과학이 100% 지분을 보유한 회사이며, 플라스미드 DNA 위탁개발생산을 통해 매출을 달성하고 있기 때문입니다.
플라스미드 DNA는 현재까지는 DNA백신의 벌크 형태로 주요 고객사가 DNA백신 개발사로 DNA백신은 상업화가 진행되지 않아 임상용으로 수요가 전부였습니다. 또한, 연구소에서 소량의 플라스미드 DNA를 생산할 수 있어 위탁개발생산이 전세계적으로 제한적이었습니다. 그러나 유전자치료제 및 세포치료제의 상업화가 이뤄짐에 따라 해당 치료제의 원재료로 사용되는 플라스미드 DNA 수요가 3-4년전부터 급속도로 증가하였으며, 그에 따라 VGXI를 비롯한 플라스미드 DNA 위탁생산회사가 생산규모를 확장하고 있는 실정이나 현재까지 확장된 생산시설에서 매출이 시작되는 상황으로 본격적인 매출이 발생하고 있지는 않습니다. 그러므로 해당 생산시설 법인이 자체적으로 자금을 조달하기 어려운 실정이며 사업의 성공 가능성을 높게 평가하는 진원생명과학과 같은 모회사에서 자금을 수혈하는 상황이며 추후에 이러한 종속회사에 대한 투자지속이 회사에 이익에 부합한다고 판단하였습니다.
VGXI의 신규1공장 1단계(3,000L규모) 플라스미드 DNA 생산 시설은 마무리된 상태로 올해초 수주한 약 75억원 규모의 발주에 대해 현재 생산을 시작했기에 추가적인 수주가 가능하다고 판단되며 이에 따라 해당 시설의 운영에 필요한 필터류 등의 소모품과 생산인력의 급여 등의 운영비를 금번 증자를 통해 조달하여 성공적으로 신규공장을 가동하게 되면 해당 실적을 바탕으로 당사로부터 받은 대여금의 상환이 이뤄질 수 있다고 판단합니다.
추가적으로 전세계적인 경기침체로 인하여 글로벌 제약사 및 신생 연구업체들의 연구지원이 줄어듦에 따라 연구개발활동이 감소하게 될 수 있으며, 연구개발이 감소함에 따라 자회사 VGXI Inc의 수주금액도 비례적으로 감소하고 있으며, 이에 따라 매출도 하향되어 재무안정성이 더욱 악화될 수 있습니다.
그에 따라 당기순손실은 증가되고 자본의 감소로 이어져 회사의 전체 자본금이 감소될 수 있습니다. 이에 회사는 자본을 보전하고자 외부에서 자본을 유입할 수 있습니다. 자본 유입의 정도에 따라 현재의 최대주주의 지분이 약화되어 최대주주가 변경될 수 있는 위험이 있습니다.
| 회사명 | VGXI, Inc. | |||
| 대표이사 | 박영근 | |||
| 주소 | 2700 Research Forest Drive, Suite 180 The Woodlands, Texas 77381 U.S.A | |||
| 설립일 | 2008년 5월 15일 | |||
| 사업내용 | CDMO매출 | |||
| 종업원수 | 144명 - 2023년 9월 30일 기준 |
|||
| 외부감사인 | Fitts Roberts (미국 현지 감사인) | |||
| 내부통제 방안 | 현지 미국 외부감사인으로부터 감사를 받고 있으며, 자회사이기에 내부회계관리제도 수준의 내부통제가 구축되지는 않았습니다. 하지만 2008년 설립때부터 2023년 현재까지 자체 내부 규정에 따라 단 한건의 자금 및 기타 문제가 발생하지 않았습니다. 향후 자회사 내부회계관리제도가 적용되기 이전에 삼정(KPMG)와 같이 대형 회계법인과 내부회계관리제도에서 요청하는 수준 높은 내부통제를 구축할 예정입니다. |
|||
| 연혁 | 2008년 | VGX International, Inc.이 100% 출자하여 설립 05월 김병진 대표이사 취임 |
||
| 2008년 | VGX Pharmaceuticals, Inc.로 부터 생산시설/인력/영업 양수 | |||
| 2010년 | GMP 시설 확충 | |||
| 2011년 | 05월 김병진 대표이사 사임, 박영근 대표이사 취임 | |||
| 2012년 | cGMP 제품의 HD 플라즈미드 생산 | |||
| 2013년 | 2013년 세계백신회의에서 CMO 부문 최우수상 수상 | |||
| 2014년 | 2014년 세계백신회의에서 CMO 부문 최우수상 수상 | |||
| 2017년 | 2017년 세계백신회의에서 백신생산/공정개발 부문 최우수상 수상 | |||
| 2018년 | - RNA 생산시설을 포함하여 전체 생산시설의 확장 - 미국 휴스턴 매소디스트병원 연구소(Houston Methodist Research Institute)로부터 mRNA 백신 및 RNA 치료제 생산의 핵심 기술과 mRNA 백신 설계 및 연구 기술을 이전받음. |
|||
| 2019년 | 플라즈미드 DNA와 mRNA에 대한 생산시설 건설에 대한 BE&K Building Group을 시행사로 선정 | |||
| 2020년 | 세계백신회의에서 CMO 부문 최우수상 수상 | |||
| 2022년 | 10월 신규1공장 준공식 개최 | |||
| 구분(단위 : 백만원) | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| 자산총계 | 152,483 | 151,836 | 117,274 | 41,852 |
| 부채총계 | 169,858 | 146,926 | 104,648 | 30,343 |
| 자본총계 | (17,375) | 4,910 | 12,626 | 11,509 |
| 매출액 | 17,482 | 31,129 | 25,416 | 28,199 |
| 당기순이익 | (22,197) | (8,821) | (870) | 284 |
| 출처) 당사 정기보고서 및 당사 제시 주1) 2020년, 2021년, 2022년 재무정보는 현지 감사인의 감사보고서를 이용하였습니다. 주2) VGXI의 대표이사는 당사 김병진 前 대표이사가 겸직하였으며, 2011년 05월 당사 대표이사 및 VGXI의 대표이사가 박영근 대표이사로 변경되었습니다. 박영근 대표이사는 2006년 12월부터 당사의 등기임원으로 재직 중 일신 상의 사유로 김병진 前 대표이사가 사임하면서 당사 및 VGXI의 대표이사로 취임하였습니다. |
VGXI 매출내역에 대한 상세내역은 아래와 같습니다.
| 구분(단위 : 백만원) | 2023년 3분기 |
2022년 | 2021년 | 2020년 |
| CMO매출 | 16,752 | 29,776 | 23,410 | 26,694 |
| Shipping매출 | 506 | 549 | 739 | 709 |
| Royalty매출 | 224 | 804 | 1,267 | 796 |
| 합계 | 17,482 | 31,129 | 25,416 | 28,199 |
주1) Royalty 매출 - 플라스미드 DNA 제조기술 라이선스 사용료
종속회사인 VGXI는 2018년 9월 미국 휴스턴 매소디스트 병원연구소와 mRNA 백신 및 RNA 치료제 생산의 핵심기술과 mRNA 백신 설계 및 연구 기술을 이전받는 독점적 라이선스-인 계약을 체결하였습니다. 계약상대방의 존쿡 교수 연구팀이 보유한 mRNA 백신 및 RNA 치료제 생산의 핵심기술은 당시 소규모 생산만이 가능한 상황이기에 VGXI는 5만불의 라이선스 수수료를 지급하고 VGXI가 자신들의 비용으로 대규모 생산이 가능하도록 공정을 개발하기로 했습니다. 현재 수년간의 노력 끝에 대규모 생산 체제가 마련되었고, 금번 자금조달의 mRNA 생산 장비 구입비 2백만불을 통해 위탁생산사업을 추진할 예정입니다. 해당 위탁생산에 대한 로열티는 1백만불까지의 판매 수익에 대해서는 5%, 그후 판매 수익에 대해서는 1%를 지급하여야 하며, 계약상대방이 고객사를 소개하여 판매 수익이 발생하면 순매출액의 10%를 수수료 지급하기로 하나 상한선은 20만불입니다.
당사가 VGXI에 대여형태로 거래하는 이유는 VGXI에서 영업이익이 발생하면 대여금 회수를 통해 더 이상 시장에서 자금을 조달하는 것이 아니라 회수된 자금을 연구개발에 사용할 계획이었습니다. 올해 8월과 9월 VGXI에 대여가 이뤄지지 않았습니다. 해당 내용은 당사가 금번 유증을 통해 자금을 조달하면 8월과 9월 대여를 통해 VGXI의 시설자금과 운영자금으로 사용할 계획이 표기된 부분입니다.
향후 VGXI의 신규 공장의 운영이 어렵게 되어 판매 증진을 통한 실적 개선 기회를 잃게 될 경우 VGXI로부터 대여금 회수가 어려워져 심각한 자금 경색으로 본사 및 계열사 전체가 지속적인 경영의 어려움과 최악의 경우 부도 상황에도 처할 수 있으므로 투자자 여러분들께서는 이 점 유의하여 주시기 바랍니다.
자회사 VGXI Inc 의 주요 비용 내역
| 구분(단위 : 백만원) | 2023년 3분기 |
2022년 | 2021년 | 2020년 | ||||
| 제조비 | 판관비 | 제조비 | 판관비 | 제조비 | 판관비 | 제조비 | 판관비 | |
| 급여 | 8,839 | 2,815 | 8,987 | 6,250 | 5,381 | 5,056 | 5,427 | 5,917 |
| 복리후생비 | 2,885 | 758 | 2,863 | 871 | 2,114 | 668 | 1,854 | 656 |
| 감가상각비 | 3,186 | 1,995 | 800 | 424 | 653 | 591 | 603 | 588 |
| 경상연구개발비 | - | - | - | - | - | 600 | - | 472 |
| 지급수수료 | 2,801 | 2,975 | 300 | 4,494 | 207 | 1,702 | 253 | 1,430 |
| 무형자산상각비 | - | 217 | - | 167 | 1,179 | 138 | 1,170 | 106 |
| 사용권자산상각비 | - | 725 | - | 1,038 | - | 747 | 464 | 252 |
| 원재료비 | 2,534 | - | 7,155 | - | 4,728 | - | 5,357 | - |
| 외주가공비 | 649 | - | 309 | - | 120 | - | 135 | - |
| 잡급(계약직) | 2,814 | 879 | 2,936 | 426 | 1,521 | 123 | 1,513 | 13 |
| 여비교통비 | 11 | 142 | 21 | 212 | 14 | 149 | 5 | 103 |
| 통신비 | 13 | 98 | 14 | 86 | 7 | 49 | 9 | 21 |
| 수도광열비 | 294 | 510 | 296 | 100 | 227 | 78 | 193 | 71 |
| 세금과공과 | 46 | 108 | 366 | 142 | 157 | 82 | 209 | 60 |
| 지급임차료 | - | 61 | - | 66 | - | 29 | - | 17 |
| 수선비 | 452 | - | 300 | - | 188 | 1 | 162 | - |
| 보험료 | 206 | 152 | 116 | 90 | 49 | 59 | 62 | 55 |
| 차량유지비 | - | 16 | - | 32 | - | 28 | - | 26 |
| 운반비 | 233 | 3 | 455 | 6 | 355 | 8 | 325 | 6 |
| 교육훈련비 | 5 | 3 | 4 | 1 | - | 1 | - | 2 |
| 도서인쇄비 | - | 17 | 1 | 2 | 4 | 1 | 1 | - |
| 사무용품비 | 4 | 164 | 12 | 198 | 11 | 81 | 8 | 56 |
| 소모품비 | 14 | 18 | 54 | 9 | 26 | 2 | 26 | - |
| 대손상각비 | - | 4 | - |
- |
- |
- |
- |
- |
| 잡비 | - | 1 | 128 | 182 | - | - | - | 176 |
| 소계 | 24,986 | 11,661 | 25,117 | 14,796 | 16,941 | 10,193 | 17,776 | 10,027 |
| 합계 | 36,647 | 39,913 | 27,134 | 27,803 | ||||
출처) 당사 제시
또한 연도별 지급수수료 상세 내역은 아래와 같습니다.
| 구분(단위 : 백만원) | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| HR수수료 | 74 | 1 | - | - |
| 장비유지비 | 2,013 | 2 | 2 | 2 |
| 소프트웨어유지비 | 55 | 32 | 22 | 18 |
| 서버유지비 | 57 | 32 | 22 | 17 |
| 인터넷서비스 | - | 39 | 29 | 28 |
| 외부서비스 | 914 | 378 | 118 | 336 |
| 법무수수료 | 2,332 | 3,897 | 1,417 | 940 |
| 감사수수료 | 288 | 102 | 82 | 79 |
| 은행수수료 | 29 | 11 | 10 | 10 |
| 폐기물수수료 | 14 | - |
- |
- |
| 계 | 5,776 | 4,494 | 1,702 | 1,430 |
| 출처) 당사 제시 주1) 평균 환율은 2023년 3분기 1,300.32원, 2022년 1,291.95원, 2021년 1,144.42원, 2020년 1,180.05원 적용 |
지급수수료 중 장비유지비의 세부 내역은 아래와 같습니다.
[단위: 백만원]
| 구분 | 금액 |
|---|---|
| 유지보수비 | 354 |
| 측정비 | 100 |
| 프로젝트 손실 | 1,559 |
| 합계 | 2,013 |
프로젝트손실분의 금액(1,559백만원)은 프로젝트 진행중에서 미숙련 및 제조의 미숙 등으로 원가를 초과하여 발생된 비용이며, 프로젝트 손실로 기재된 지급수수료 금액은 외부에 지급되는 비용은 아니며 재무상태표에 부채성 충당금으로 반영되었습니다. 숙련도가 완료되기 전까지는 해당 지급수수료에 반영된 프로젝트손실분의 금액은 매분기마다 발생될 수 있습니다.
| 회사명 | VGXI, USA (해외지점) | |||
| 대표이사 | 박영근 | |||
| 주소 | 2700 Research Forest Drive, Suite 180 The Woodlands, Texas 77381 U.S.A | |||
| 설립일 | 2008년 7월 2일 | |||
| 사업내용 | CDMO매출 | |||
| 종업원수 | 16명 - 2023년 9월 30일 기준 |
|||
| 외부감사인 | Fitts Roberts (미국 현지 감사인) | |||
| 내부통제 방안 | 미국에서 별도로 외부감사인으로부터 감사를 받으며, 해외 지점이므로 내부회계관리제도의 범위에 포함되어 있습니다. |
|||
| 연혁 | 2008년 | 해외지점 설치 | ||
| 구분(단위 : 백만원) | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| 자산총계 | 16,823 | 19,587 | 117,273 | 9,014 |
| 부채총계 | 10,736 | 12,351 | 104,648 | 7,668 |
| 자본총계 | 6,087 | 7,236 | 12,625 | 1,346 |
| 매출액 | 21,149 | 37,104 | 25,711 | 29,207 |
| 당기순이익 | (615) | 1,261 | 1,110 | 1,534 |
| 출처) 당사 정기보고서 및 당사 제시 |
VGXI USA 인력 겸직 현황
| 직위 | 성명 | 겸직 현황 |
|---|---|---|
|
최고의학책임자(CMO) |
조엘 매슬로우(Joel Maslow) |
1. 모리스 타운 메디컬센터 의과대학 교수 |
|
최고과학개발책임자(CSO) |
카 무투마니(Kar Muthumani) |
1. 인도 Sri Ramachandra 의과대학 국제초빙교수 |
| 주) 현재 미국 글로벌임상본부에 근무하는 인원 모두는 풀타임 근무자이며, 상기2명이 외부 기관에 명예직으로 활동하고 있음 출처) 당사 제시 |
진원생명과학 해외지점 VGXI USA 의 주요 비용 내역
| 구분(단위 : 백만원) | 2023년 3분기 |
2022년 | 2021년 | 2020년 |
| 급여 | 2,245 | 2,078 | 1,915 | 1,758 |
| 감가상각비 | 995 | 1,291 | 175 | 56 |
| 경상연구개발비 | 1,178 | 2,145 | 678 | 520 |
| 지급수수료 | 82 | 61 | 41 | 80 |
| 사용권자산상각비 | 246 | 306 | 254 | 233 |
| 광고선전비 | 282 | 243 | 113 | 90 |
| 대손상각비 | 9 | - | - | -332 |
| 외주가공비 | 16,538 | 29,549 | 20,997 | 24,751 |
| 복리후생비 | 104 | 62 | 54 | 55 |
| 여비교통비 | 69 | 84 | 7 | 3 |
| 통신비 | 1 | 1 | 1 | 3 |
| 세금과공과 | 10 | 16 | 10 | 10 |
| 운반비 | - | 1 | - | |
| 사무용품비 | - | - | 1 | 4 |
| 소모품비 | 11 | - | - | - |
| 합계 | 21,770 | 35,837 | 24,246 | 27,231 |
출처) 당사 제시
(2) DONG-IL Interlining, LTD.
종속기업인 DIV는 옷의 안감과 겉감 사이에 옷감을 생산, 판매를 주로 하며, 자수(패턴)실을 판매하는 사업을 영위하고 있습니다. 저가의 노동력을 이용하기 위하여 2003년에 베트남에 진출하였습니다. 그러나 저가 노동력의 품질에 대한 인식 저하로 인해 어려움을 겪었으며 이에 대한 해결을 통해 경쟁력을 확보하고자 노력하였으나 완전히 해소되었다 판단하기는 어렵습니다. 지속적인 품질 개선을 위한 노력을 바탕으로 중국 업체와 경쟁 중에 있습니다. 코로나19 사태로 인하여 셧다운 및 소비 심리 악화 등의 영향으로 2020년말 기준 10,521백만원의 매출액 및 31백만원의 당기순이익이 2021년말 기준 10,381백만원의 매출액 및 192백만원의 당기순손실, 2022년말 기준 11,309백만원의 매출액 및 583백만원의 당기순손실, 2023년 3분기말기준 5,803백만원의 매출액, 551백만원의 당기순손실이 발생하였습니다.
추가적으로 현재 전세계적인 경기침체로 소비재의 매출이 급감하고 있으며, 코로나로 인한 경기회복이 아직 코로나 이전의 경기수준으로 회복되지 않아 베트남 자회사의 주요 매출인 모자의 원재료로 사용되는 심지의 매출이 감소하고 있습니다. 이러한 매출의 감소가 지속될 경우 재무안정화는 악화될 수 있으며 재무 안정화가 악화되어 재무제표의 자산 감소 및 당기순손실이 예상보다 더 증가될 수 있습니다. 자회사의 재무안정성의 악화로 인하여 모회사인 진원생명과학에서 베트남 자회사에 추가적인 대출을 진행할 수 있으며, 그로 인하여 진원생명과학의 재무 안정화에도 영향을 미칠 수 있습니다.
| 회사명 | DONG-IL Interlining, LTD. (약식 DIV) | |||
| 대표이사 | 박희곤 | |||
| 주소 | Lot E10, LOTECO Industrial Zone, Bien Hoa City, Dong Nai Province. VIETNAM | |||
| 설립일 | 2003년 4월 1일 | |||
| 사업내용 | 섬유심지 | |||
| 종업원수 | 89명 (한국인 4명 포함) - 2023년 9월 30일 기준 |
|||
| 외부감사인 | MOORE AISC (베트남 현지 감사인) | |||
| 내부통제 방안 | 현지 베트남 외부감사인으로부터 감사를 받고 있으며, 자회사이기에 내부회계관리제도 수준의 내부통제가 구축되지는 않았습니다. 하지만 2003년 설립때부터 2023년 현재까지 자체 내부 규정에 따라 단 한건의 자금 및 기타 문제가 발생하지 않았습니다. 향후 자회사 내부회계관리제도가 적용되기 이전에 삼정(KPMG)와 같이 대형 회계법인과 내부회계관리제도에서 요청하는 수준 높은 내부통제를 구축할 예정입니다. |
|||
| 연혁 | 2003년 3월 | 베트남 법인 창립 (베트남 정부로부터 투자허가서 취득) | ||
| 2004년 1월 | 심지 상업생산 및 판매 개시 | |||
| 2007년 9월 | 자수사 상업판매 개시 | |||
| 2008년 1월 | 수출성과를 인정받아 Golden Dragon Award 수상 (주관 : Vietnam Economic Times지와 베트남 정부 계획투자국) | |||
| 2010년 1월 | 수출입성과를 인정받아 The Leading External Trade Marks of Vietnam Award 수상 (주관 : 베트남 정부의 국제경제협력위원회) | |||
| 구분(단위 : 백만원) | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| 자산총계 | 10,670 | 9,187 | 8,217 | 6,842 |
| 부채총계 | 9,334 | 7,390 | 6,002 | 4,625 |
| 자본총계 | 1,336 | 1,797 | 2,216 | 2,217 |
| 매출액 | 5,803 | 11,309 | 10,381 | 10,521 |
| 당기순이익 | (551) | (583) | (192) | 31 |
| 출처) 당사 정기보고서 및 당사 제시 주1) 2020년, 2021년, 2022년 재무정보는 현지 감사인의 감사보고서를 이용하였습니다. |
자회사 DIV 의 주요 비용 내역
| 구분(단위 : 백만원) | 2023년 3분기 | 2022년 | 2021년 | 2020년 | ||||
| 제조비 | 판관비 | 제조비 | 판관비 | 제조비 | 판관비 | 제조비 | 판관비 | |
| 급여 | 496 | 405 | 684 | 536 | 574 | 445 | 573 | 453 |
| 복리후생비 | 99 | 103 | 129 | 124 | 100 | 94 | 108 | 106 |
| 수도광열비 | 444 | 12 | 793 | 19 | 752 | 21 | 608 | 17 |
| 감가상각비 | 46 | 18 | 64 | 19 | 54 | 15 | 53 | 13 |
| 소모품비 | 48 | - | 79 | - | 90 | - | 75 | - |
| 수선비 | 105 | 11 | 118 | 18 | 39 | 11 | 34 | 14 |
| 지급수수료 | - | 49 | - | 59 | - | 51 | - | 56 |
| 원재료비 | 4,461 | - | 6,400 | - | 7,293 | - | 6,241 | - |
| 외주가공비 | 215 | - | 243 | - | 329 | - | 195 | - |
| 수출제비용 | 52 | 24 | 68 | 59 | 79 | 46 | 62 | 43 |
| 여비교통비 | - | 10 | - | 30 | - | 19 | - | 47 |
| 통신비 | - | 7 | - | 8 | - | 18 | - | 9 |
| 접대비 | - | 9 | - | 19 | - | 13 | - | 16 |
| 세금과공과 | 31 | 25 | 66 | 28 | 47 | 24 | 46 | 21 |
| 보험료 | 10 | - | 13 | - | 11 | - | 12 | - |
| 차량유지비 | - | 21 | - | 35 | - | 20 | - | 24 |
| 운반비 | 32 | 59 | 50 | 72 | 51 | 64 | 48 | 51 |
| 도서인쇄비 | - | 3 | - | 5 | - | 4 | - | 4 |
| 사무용품비 | - | 10 | - | 20 | - | 13 | - | 12 |
| 광고선전비 | - | 12 | - | 35 | - | 25 | - | 31 |
| 대손상각비 | - | - | - | 74 | - | 3 | - | 5 |
| 무형자산상각비 | 22 | - | 28 | - | 24 | - | 25 | - |
| 잡비 | - | 9 | 1 | 12 | 2 | 12 | 1 | 2 |
| 소계 | 6,061 | 787 | 8,736 | 1,172 | 9,445 | 898 | 8,081 | 924 |
| 합계 | 6,848 | 9,908 | 10,343 | 9,005 | ||||
출처) 당사 제시
당사는 매년 상기 종속기업들과 매출, 매입 등의 거래 내역이 있습니다. Dong-il Interlining Ltd.의 경우 영업망이 베트남에 있기 때문에, 당사에서 Dong-il Interlining Ltd.로부터 매입하여 판매할 경우도 있으며, 당사에서 Dong-il Interlining Ltd.에 매출하여 고객들에게 판매되는 경우도 있어 매출, 매입의 거래가 지속적으로 발생하고 있습니다. VGXI, Inc.의 경우 당사에서 VGXI, Inc.로부터 Plasmid DNA를 매입하여 일부 고객사들에게 판매를 하고 있기 때문에 매입의 거래가 있습니다. 당사는 주요 종속회사와 거래에 의하여 2023년 3분기말 기준 Dong-il Interlining Ltd.로부터 매출채권 7,148백만원, 대여금 968만원 등 채권 8,119백만원이 있으며, 매입채무 177백만원이 있습니다. 또한 VGXI, Inc.로부터는 플라스미드 CDMO 생산시설 증설 등 시설자금을 위한 대여금 136,161백만원, 선급금 등 5,730백만원과 매입채무 등 1,912백만원이 있습니다. 당사의 주요 종속회사와의 거래 내역과 채권 및 채무 내역은 다음과 같습니다.
| [주요 종속회사와의 거래 내역] |
| (단위 : 백만원) |
| 회사명 | 특수관계자성격 | 거래내역 | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| Dong-il Interlining Ltd. | 종속회사 | 매출 | 3,561 | 6,005 | 4,874 | 3,714 |
| 자금대여 | - | - | 835 | - | ||
| 이자수익 | 32 | 43 | 35 | 39 | ||
| 매입 | 1,403 | 3,371 | 2,812 | 2,408 | ||
| VGXI, Inc. | 종속회사 | 자금대여 | 6,504 | 39,929 | 53,903 | 20,644 |
| 이자수익 | 4,453 | 5,200 | 1,900 | 185 | ||
| 매입 등 | 17,893 | 30,775 | 25,047 | 25,958 |
| 출처) 당사 정기보고서 및 당사 제시 |
| [주요 종속회사와의 채권 및 채무 내역] |
| (단위 : 백만원) |
| 회사명 | 특수관계자성격 | 거래종류 | 2023년 3분기 |
2022년 | 2021년 | 2020년 |
| Dong-il Interlining Ltd. | 종속회사 | 매출채권 | 7,148 | 5,408 | 4,650 | 3,145 |
| 대여금 | 968 | 912 | 854 | 779 | ||
| 미수수익 | 3 | 14 | 13 | 15 | ||
| 매입채무 | 177 | 273 | 321 | 274 | ||
| 소 계 | 채권 | 8,119 | 6,334 | 5,517 | 3,939 | |
| 채무 | 177 | 273 | 321 | 274 | ||
| VGXI, Inc. | 종속회사 | 대여금 | 136,161 | 122,928 | 76,809 | 19,802 |
| 선급금 | 5,730 | 4,506 | 2,817 | 792 | ||
| 미수수익 | 9,992 | 5,100 | 1,968 | 181 | ||
| 매입채무 | 1,912 | 3,983 | 2,382 | 1,911 | ||
| 소 계 | 채권 | 151,883 | 132,534 | 81,594 | 20,775 | |
| 채무 | 1,912 | 3,983 | 2,382 | 1,911 |
| 출처) 당사 정기보고서 및 당사 제시 |
한편, 2022년 기준 당사 별도기준 매출액은 45,606백만원, 영업손실 31,268백만원, 당기순손실은 20,113백만원이며, 종속기업 실적이 포함된 연결기준 매출액은 48,718백만원, 영업손실 40,084백만원, 당기순손실 38,054백만원으로, 종속기업을 포함함으로써 영업적자 폭이 확대되었습니다. 이는 우수인력 확충 등으로 상여 및 급여가 증가하였으며, VGXI와 Aldeveron 및 이노비오와 진행하는 소송의 진행비용으로 지급수수료 증가와 지속적으로 연구개발비가 증가하였기 때문입니다.
2023년 3분기 기준 당사 별도기준 매출액은 25,852백만원, 영업손실 21,059백만원, 당기순손실은 20,874백만원이며, 종속기업의 실적이 포함된 연결기준 매출액은 27,448백만원, 영업손실 37,092백만원, 당기순손실 37,967백만원으로 종속기업을 포함함으로써 영업적자 폭이 증가하였습니다.
| [당사의 별도 및 연결 손익 비교] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 | 2022년3분기 | 2022년 | 2021년 | 2020년 | |||||
| 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | 별도 | 연결 | |
| 매출액 | 25,852 | 27,448 | 36,228 | 38,873 | 45,606 | 48,718 | 34,221 | 38,700 | 35,774 | 41,503 |
| 영업손익 | -21,059 | -37,092 | -21,519 | -23,396 | -31,268 | -40,084 | -26,287 | -27,434 | -17,777 | -18,459 |
| 당기순손익 | -20,874 | -37,967 | 5,744 | -23,500 | -20,113 | -38,054 | -13,665 | -15,534 | -17,723 | -18,648 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 경영상의 목적으로 각 종속회사들의 지분을 취득하여 현재 연결대상회사로 편입하고 있습니다. 당사는 종속회사들을 원가법으로 평가하고 있고, 종속기업들은 최근 매출액이 증가하는 추세였으나 2023년 3분기 CDMO 사업부분에서는 2022년말부터 경기침체를 우려한 제약사들의 위탁주문생산 문의 감소로 인해 전년 동기 대비 매출이 감소하였으며, 패브릭사업부문의 경우에도 전세계의 경기침체를 우려한 소비력이 감소됨에 따라 섬유제품의 판매가 감소되었기 때문에 전년 동기 대비 매출이 감소하였지만, 2023년 3분기까지 손상처리를 하지 않았으며, 종속기업들에 대한 채권에 대하여 대손충당금을 설정하고 있지 않는 상황입니다. 당사의 종속회사가 영위하는 사업이 실패하거나 파산할 경우 당사의 연결 및 개별 재무제표에 직접적인 영향이 발생할 수 있으며, 이는 당사의 재무상태에 부정적인 영향을 미칠 수 있으므로 투자자 여러분들께서는 이 점 유의하여 주시기 바랍니다.
[그외 특수관계자 내역 및 상세]
(1) 특수관계자 현황
| 회사명 | 소재지 | 당사와의 관계 |
| 535 Penn Investments, LLC. | 미국 Montgomery | 박영근 대표이사의 배우자 100% 보유 |
출처) 당사 정기보고서
주요 종속기업을 제외하고 당사는 1개의 특수관계자가 있습니다. 535 Penn Investment, LLC의 지분구조는 당사 박영근 대표이사의 배우자가 100% 지분을 보유하고 있어 당사와 특수관계가 존재합니다.
해당 특수관계자는 미국 펜실베니아주 Fort Washington 소재의 건물을 소유하고 있습니다. 2018년부터 당사의 글로벌 임상개발 본부가 해당 건물의 일부분을 임차하여 사무실 및 연구실로 사용하고 있으며, 이에 대해 임차비용을 지급하고 있습니다.
당사는 미국 글로벌임상본부의 근무자들의 주거지역에 따른 출퇴근 접근성을 고려하여 사무실을 필라델피아 시내에서 약 30분 거리에 위치한 포트 워싱턴(Fort Washington) 지역으로 이전하기로 결정했으며 마침 특수관계자가 소유한 건물이 포트 워싱턴 지역 내 고속도로 출입구에서 2-3분 거리에 위치하고 있어 특수관계자 소유 건물을 임차하게 되면 계약의 안전성 및 입주시 각종 부대시설 및 연구공간의 특수장비 설치공사 등의 편리성이 높다고 판단하여 해당 건물의 일정 공간을 임차하기로 결정했습니다. 하기 표에서 보는 바와 같이, 해당 건물의 임차기업 4곳에 대해 2017년 1square feet당 월 임대료 단가는 최대 USD1.92에서 최저 USD1.71이며 중간값은 USD1.75입니다. 이를 바탕으로 당사는 9,243sq/ft에 대해 2019년 년간 USD198,724.50로 계약했으며 이를 월 임대료로 환산하면 USD16,560.38이며 단가(1sqft 당 임대료)는 USD1.79로 평균범위에 위치하게 됩니다.
[최초 계약시 임대수준]
|
계약상대방 |
월 임대료 |
면적(sq/ft) |
단가(1sqft/month) |
|---|---|---|---|
|
Center for Interventional Pain Spine, LLC |
9,490.25 |
5,423 |
1.75 |
|
Delaware Steel company of Pennsylvania |
6,125.00 |
3,500 |
1.75 |
|
Reit Management & Research, LLC |
5,326.42 |
2,779 |
1.92 |
|
SINGLETARY GROUP, INC |
5,876.67 |
3,440 |
1.71 |
출처) 당사 제시
주) 월 임대료 및 단가의 단위는 미화(USD)
계약시점 기준에 임대시세에는 평균범위에 위치하여 다른 요소들을 고려하였을 때 이점이 있다고 판단하였으며, 해당 부동산 임대 계약서는 일반적으로 사용되는 임대차 계약으로 임차인 입장에서 독소 조항은 없는 것으로 판단하였습니다. 해당 임대차 계약은 2018년 09월 15일부터 2023년 12월까지 63.5개월로 올해 계약이 만료될 예정이며, 통상적인 임대차 계약 기간으로 판단하였습니다. LoopNet(www.loopnet.com)을 통해 해당 지역에 유사한 건물의 임대료 현재 시세를 조회하면 1sq/ft의 연간(1YR) 임대료는 455 Pennsylvania Ave는 $22.5, 520 Pennsylvania Ave는 $20-$23으로 2023년 미국 글로벌임상본부가 계약에 의해 지급하는 1sq/ft의 연간(1YR) 임대료 $23.5과 크게 차이를 보이는 것은 아닌 것으로 판단됩니다.
[현재 계약시 임대시세]
| 건물 위치 | 단가 (1sqft/년) | 단가(1sqft/월) |
|---|---|---|
| 455 Pennsylvania Ave | 22.50 | 1.88 |
| 520 Pennsylvania Ave | 20.00-23.00 | 1.67-1.92 |
| 535 Penn Investments, LLC | 21.48 | 1.79 |
출처) 당사 제시
주1) 2023년 7월 13일 기준
주2) 단가의 단위는 미화(USD)
해당 임대차 계약에 임대료 조정에 관한 조항이 포함되어 있지 않으며, 계약 만료까지 1년 미만의 기간이 남아 있기 때문에 임대료를 낮출 수 없는 상황입니다. 아직까지 당사는 특수관계자 부동산 임대에 대한 재계약 계획을 가지고 있지 않지만, 이전비용, 기존 시설의 원상 복구비, 신규 시설의 인테리어 비용 등을 고려할 때 재계약 가능성이 있는 것도 사실입니다. 만약 재계약을 진행하게 된다면 해당 지역 부동산 시세를 반영하여 적정 임대료 수준에서 계약을 진행할 계획입니다.
해당 임대 관련하여 이사회는 2018년 09월 05일에 적법한 절차에 따라 해외지점(VGXI USA) 임상연구소 설치 운영의 건을 승인하는 결의를 하였으며, 해당 의안은 임대인이 상법 제398조(이사등과 회사간의 거래) 4호에 해당하는 법인이므로 의장인 박영근 대표이사는 의결권이 없음을 설명하고, 이사 상호간에 충분한 토의를 가진 후 의결권이 있는 출석이사 전원의 찬성으로 가결되었습니다. 2018년 09월 05일 개최된 이사회 의사록에 박영근 대표이사는 특수관계자로 의결권 제한이 명시되어 있으며, 투표권을 행사하지 못하였습니다. 2018년 사업보고서에 박영근 대표가 찬성하였다고 기재되어 있는 부분은 해당 이사회에 제1호 의안인 독점 라이선스 계약 체결에 대한 찬성이며, 해당 임차 관련한 의안은 아니며 사업보고서 상 주요 이사회 개최 내역에 기재시 각 의안별로 찬성과 반대, 투표권 없음을 구분하여 기재하지 않음에 따라 오해의 소지가 발생할 수 있습니다. 그럼에도 불구하고 이사회의장인 박영근 대표는 대표이사로서 영향력을 가지고 있으며 실질적으로 의안이 가결되는것에 대해 영향을 줄 수 있음에 대해 투자자들께서는 유의하시길 바랍니다.
| [2018년 09월 05일 개최된 이사회 의사록] |
 |
|
이사회의사록 |
| 출처 : 당사 제시 |
해당 특수관계자와의 거래에서 발생한 매출ㆍ매입 거래 내역은 아래와 같습니다.
| [특수관계자와의 거래 내역] |
| (단위 : 백만원) |
| 회사명 | 특수관계자 성격 | 거래내역 | 2023년 3분기 | 2022년 | 2021년 | 2020년 |
| 535 Penn Investments, LLC | 기타 | 기타채권 | 45 | 42 | 39 | 36 |
| 기타채무 | 398 | 430 | 320 | 272 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 상기 특수관계자와의 거래내역 등을 감사보고서에 기재하고 있으며 해당 지역의 평균 임대료와 비교하여 임대가격을 산정하였고, 특수관계자 소유 부동산의 경우 이용편의성 측면에서 이점이 있다고 판단하였습니다.
당사의 연결 기준 자산총계는 2023년 3분기 기준 191,399백만원으로, 「상법」제542조의9제3항 및 「상법 시행령」 제35조제4항에서 정하고 있는 자산총계 2조원 이상의 상장회사에 해당되지 않기 때문에 특수관계자와의 거래는 이사회 승인 및 주주총회 보고사항이 아니라고 판단됩니다.
당사는 이해상충 방지를 위해 특수관계자와의 거래시 내부 위임전결규정에 따라 거래가 이루어지며, 자산규모대비 주요사항일 경우 이사회 결의를 통해서 거래가 이루어지고 있습니다. 또한 의사결정시 법률 검토를 통하여 법률리스크를 관리하고 있습니다.
그럼에도 불구하고 특수관계자와의 거래에 대해 내부통제규정이 제대로 준수되지 않을 경우, 상호간의 이해상충으로 인해 당사간의 부적절한 거래나 당사에 불리한 경영방침이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
|
바-2. 종속회사 VGXI 계속기업불확실성에 따른 위험 종속회사 VGXI Inc.는 2023년 3분기까지 완전 자본잠식이 되었으며, 3분기 보고일까지 완전 자본 잠식된 금액을 회복할 정도의 수주 및 이익을 기대하기 어려워 별도 재무제표에 자회사 VGXI Inc. 투자금액 9,672백만원 전액을 손상차손으로 인식하였습니다. 또한 별도 재무제표의 자회사 투자자산에 대하여 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표로서 지배기업, 관계기업의 투자자 또는 공동기업의 참여자가 투자자산을 피투자자의 보고된 성과와 순자산에 근거하지 않고 직접적인 지분투자에 근거하여 원가법으로 표시한 재무제표 원가법을 적용하였으나, 연결 재무제표에서는 자회사의 손실이 재무제표에 반영되었기에 해당금액의 차이가 발생하는 바 이에 대하여 손상으로 인식하였으며, 자회사 VGXI Inc.는 2023년 3분기 현재 완전 잠식상태이기에 별도재무상태표의 자회사 VGXI, Inc.의 투자금액 전액을 손상으로 인식하여 제거하였으며, 별도 손익계산서에서는 기타비용인 손상차손으로 전액 인식하였습니다. 2023년 3분기말 기준으로 선급금 4,845백만원중에서 자회사 VGXI에 생산의뢰를 위하여 선급으로 지급한 금액은 4,617백만원에 이르며, 진원생명과학이 100% 자회사인 VGXI에 대여한 금액은 135,825백만원(USD 101백만달러)이며, VGXI는 자본잠식 상태이어서 진원생명과학의 투자자산에서 전액 9,672백만원을 손상차손으로 회계처리 하였습니다. 위와 같이 VGXI에 선급금으로 지급되고 대여한 금액이 진원생명과학의 자산의 73.4% (4,617+135,825/191,405백만원)에 해당되는 상황에서 VGXI가 현재와 같이 영업실적이 저조한 상황이 개선되지 않으면 계속성에 불확실성을 갖게 되어 진원생명과학의 선급금 및 대여금의 회수에도 부정적인 영향을 미쳐 진원생명과학 또한 계속기업으로서 불확실성이 있으며 관리종목으로 지정될 가능성도 있습니다. |
종속회사 VGXI Inc.는 2023년 3분기까지 완전 자본잠식이 되었으며, 3분기 보고일까지 완전 자본 잠식된 금액을 회복할 정도의 수주 및 이익을 기대하기 어려워 별도 재무제표에 자회사 VGXI Inc. 투자금액 9,672백만원 전액을 손상차손으로 인식하였습니다. 또한 별도 재무제표의 자회사 투자자산에 대하여 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표로서 지배기업, 관계기업의 투자자 또는 공동기업의 참여자가 투자자산을 피투자자의 보고된 성과와 순자산에 근거하지 않고 직접적인 지분투자에 근거하여 원가법으로 표시한 재무제표 원가법을 적용하였으나, 연결 재무제표에서는 자회사의 손실이 재무제표에 반영되었기에 해당금액의 차이가 발생하는 바 이에 대하여 손상으로 인식하였으며, 자회사 VGXI Inc.는 2023년 3분기 현재 완전 잠식상태이기에 별도재무상태표의 자회사 VGXI, Inc.의 투자금액 전액을 손상으로 인식하여 제거하였으며, 별도 손익계산서에서는 기타비용인 손상차손으로 전액 인식하였습니다.
2023년 3분기말 기준으로 선급금 4,845백만원중에서 자회사 VGXI에 생산의뢰를 위하여 선급으로 지급한 금액은 4,617백만원에 이르며, 진원생명과학이 100% 자회사인 VGXI에 대여한 금액은 135,825백만원(USD 101백만달러)이며, VGXI는 자본잠식 상태이어서 진원생명과학의 투자자산에서 전액 9,672백만원을 손상차손으로 회계처리 하였습니다.
위와 같이 VGXI에 선급금으로 지급되고 대여한 금액이 진원생명과학의 자산의 73.4% (4,617+135,825/191,405백만원)에 해당되는 상황에서 VGXI가 현재와 같이 영업실적이 저조한 상황이 개선되지 않으면 계속성에 불확실성을 갖게 되어 진원생명과학의 선급금 및 대여금의 회수에도 부정적인 영향을 미쳐 진원생명과학 또한 계속기업으로서 불확실성이 있으며 관리종목으로 지정될 가능성도 있습니다.
나아가, 대내외적인 거시경제가 악화되어 재무적으로 자금 조달이 원활해지지 않는다면 계속기업으로의 불확실성이 더욱 확대될 수 있습니다. 투자자분들은 향후 당사의 사업이 수익성 개선을 달성하지 못 한다면 계속 기업으로의 존속에 대한 불확실성이 존재할 수 있다는 점 유념하여 주시고, 「 제1부 모집 또는 매출에 관한 사항 - III. 투자위험요소 - 2.회사위험 - 가. 지속적인 영업적자로 인한 재무구조 악화 위험 」를 면밀히 검토하시어 투자에 임해주시길 바라겠습니다.
| 사. 소송으로 발생 가능한 우발채무에 따른 위험 증권신고서 제출 전일 현재, 당사는 소송으로 인한 발생 가능한 우발채무에 따른 위험이 존재합니다. 현재 진행 중인 소송 등의 패소로 인해 손실이 발생할 수 있으며 이러한 시기는 합리적 예측이 불가능합니다. 당사의 우발채무가 현실화될 경우 당사의 재무 안정성과 경영성과 및 현금흐름에 부정적인 영향을 미칠 수 있으므로 투자시 유의할 필요가 있습니다. 현재 진행 중인 소송 등에 대하여 소송가액은 미정인 상태로, 이에 대하여 당사 재무제표상 부채로 계상되어 있지 않습니다. 그러나 소송 결과에 따라 소송가액이 확정되고 당사가 패소하여 소송가액 및 소송비용을 지불하게 될 경우 우발채무가 현실화되어 당사의 재무 건정성에 악영향을 줄 수 있습니다. 또한 당사가 최종적으로 패소할 경우 시장에서 당사의 평판이 악화되어 신규 계약 수주에 차질이 생길 수 있습니다. 투자자께서는 이 점 유의하셔서 투자에 임하시기 바랍니다. |
본 공시서류 제출 전일 현재, 당사는 소송으로 인한 발생 가능한 우발채무에 따른 위험이 존재합니다. 현재 진행 중인 소송 등의 패소로 인해 손실이 발생할 수 있으며 이러한 시기는 합리적 예측이 불가능합니다. 당사의 우발채무가 현실화될 경우 당사의 재무 안정성과 경영성과 및 현금흐름에 부정적인 영향을 미칠 수 있으므로 투자시 유의할 필요가 있습니다.
당사가 원고 또는 피고로 계류 중인 소송사건이 6건 존재하며 내용은 다음과 같습니다.
| [계류 중인 소송 상세 내역] |
| 구분 | 계류법원 | 원고 | 피고 | 사건내용 | 소송가액 | 소송비용 | 진행현황 | |
|---|---|---|---|---|---|---|---|---|
| 당기 | 전기 | |||||||
| 1 | 미국 펜실베니아 몽고메리 카운티 법원 |
Inovio Pharmaceuticals Inc. (미국) | 진원생명과학 및 자회사 VGXI Inc | VGXI를 상대로 코로나19 백신 생산에 필요한 정보를 달라고 소송제기 | - |
미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. |
미국 자회사 VGXI Inc.에서 약 50만달러를 지급하였음. |
가처분 기각(피고승소), 소송 진행 중 |
| 2 | 미국 펜실베니아 몽고메리 카운티 법원 |
진원생명과학 | Inovio Pharmaceuticals Inc. (미국) |
Cellectra 사용권 분쟁 | - |
미국 자회사 VGXI Inc.에서 약 16만달러를 지급하였음. |
미국 지점 VGXI USA 에서 8만달러를 지급하였음. |
소송 진행 중 |
| 3 | 미국 텍사스남부 휴스턴 지방법원 |
VGXI Inc. | Aldevron LLC (미국) |
VGXI Inc 의 영업 비밀 남용, 특허 침해 및 계약 위반 | - | 미국 자회사 VGXI Inc.에서 약 58만달러를 지급하였음. | 미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. | 2023년 10월 양측이 중재에 합의함에 따라 소송이 종결 |
| 4 | 서울중앙지방법원(*) | 진원생명과학 | A 제약회사외 2 (*) | 영업비밀침해 금지 | 400백만원 |
- |
- |
합의하여 소취하로 종결 |
| 5 | 서울중앙지방법원(*) | 진원생명과학 | A 제약회사외 2 (*) | 영업비밀침해 금지 가처분 | 100백만원 | - |
당사에서 45백만원 지급하였음. |
화해 권고 결정으로 종결 |
| 6 | 서울행정법원 | 진원생명과학 | 1. 한국보건산업진흥원 2. 코로나19 치료제/백신 신약개발사업단 |
정산금회수처분 취소 청구 | - | - | - | 소송 진행 중 |
(*)소송상대방과의 합의에 따라 회사명 비공개하기로 하였습니다.
상기 내역 중 1번 소송은 2020년 06월 03일 이노비오가 당사 자회사 VGXI가 보유하고 있는 코로나19 백신 관련 생산 공정 기술의 이전을 요구하며 소송을 제기하였습니다. 이노비오는 개발하고 있는 코로나19 DNA 백신(INO-4800)의 생산량 확대를 위해 VGXI가 부당하게 생산 공정 기술을 공유하지 않았다고 주장하였습니다.
2020년 06월 25일 이노비오가 제기한 VGXI의 생산 기술 이전 가처분 신청을 법원이 기각하였으며, 현재 본안 소송이 진행 중입니다. 2020년 07월 07일 진원생명과학과 VGXI는 이노비오가 VGXI의 생산 기술을 타사에 허락 없이 제공하였다는 취지로반소를 제기하여 진행 중입니다. 본안 소송에서 당사 및 자회사 VGXI가 패소할 경우 극단적으로 이노비오의 코로나19 DNA백신(INO-4800)에 대해 VGXI의 생산 기술을 제공하여야 하나 현재 이노비오가 해당 제품의 개발을 중단한 상황이기에 패소에 따른 영향을 극히 제한적으로 판단됩니다.
2번 소송은 2020년 12월 07일 이노비오가 당사와 체결한 Cellectra 라이센스 계약의 해지를 통보했고, 그에 따라 당사가 이노비오를 상대로 펜실베니아 몽고메리 카운티 법원에 제기한 소송입니다.
2021년 07월 29일 이노비오는 당사와 체결한 계약에 대하여 2020년 01월 당사의 최대주주 변경을 경영권 변동이라 판단하여 이를 근거로 2020년 08월 09일 해제 의사표시를 하였기 때문에 이미 계약은 해지되었다고 주장하였습니다.
이에 대해 당사는 2020년 01월 단순히 최대주주가 변경되었으며, 기존 경영진은 교체하지 않고 계속 유지되고 있으므로 이노비오의 해제 주장은 설득력이 없으며 이에 따라 당사와 이노비오간 체결한 Cellectra 계약이 계속 유효하다고 주장하였습니다.
그에 따라 이노비오가 한국에서 Cellectra 기기 관련 활동을 할 수 없고, 제3자와
Cellectra 관련 계약을 체결할 수 없고, 이노비오의 위법행위로 인한 손해에 대해 배상할 것을 청구했습니다. 본 소송의 소송가액은 5만불 이상으로 현재 디스커버리(증거 수집 절차)를 진행하고 있으며 이 과정에서 원고인 당사의 손해액이 산정되어 재판부 및 배심원에게 제출되는 것으로 현재 산출된 손해배상액 규모는 없습니다. 미국 텍사스 지역의 경우 5만불 이하가 국내와 비교할때 소액소송으로 분류되는 것이고 5만불 이상의 소송은 소송을 제기할 때 원고가 피해보상액 및 위자료 등 손해액을 산정하여 소송가액을 제출하는 국내와 달리 디스커버리(증거 수집 절차)에서 오랜 기간 소송 당사자들의 증거 제출 과정을 통해 손해액이 산정되며 이 또한 재판과정에서 지속적으로 변경되는 부분입니다.
3번 소송의 경우 2019년 06월 12일 VGXI가 Aldevron을 피고로 하여 기술이전 기간이 만료되었음에도 불구하고, 지속적으로 VGXI의 기술을 사용하여 제품을 생산하였기에 VGXI의 생산 관련 특허를 침해했다고 주장하며 소송을 제기했고 2023년10월 양측이 중재에 합의함에 따라 소송이 종결되었습니다.
4번 소송은 영업비밀침해 금지에 대한 소를 제기한 바 있으나 양측이 합의하여 소취하로 종결되었습니다.
5번 소송은 영업비밀침해 금지에 대한 가처분 신청으로 재판부의 화해권고 결정으로 종결되었으며, 해당 권고 결정은 유효하게 유지됩니다.
6번 소송의 경우 당사는 재단법인 범부처신약개발사업단과 코로나19 DNA백신(GLS-5310)의 1/2상 임상개발에 대한 연구개발과제협약서를 2020년 12월 29일 체결하여 당사가 현물 416백만원과 현금 2,042백만원을 출연하고 정부가 7,376백만원을 지원하였습니다. 해당 연구기간은 21년 12월 28일까지였습니다. 연구개발사업이 종료됨에 따라, ‘국가연구개발사업 연구개발비 사용 기준’에 따른 정산이 진행되었고, 23년 1월 5일자로 위탁정산기관인 도원회계법인으로부터 정산보고서를 통보받았습니다. 정산보고서에는 당사가 자회사 VGXI에 코로나19 DNA백신 생산비용 등으로 지급한 3,216백만원에 대해 사업비 불인정하여 정부지분액 2,518백만원에 대한 회수를 요청했습니다. 사업비 불인정 사유는 계열사 등으로 법인이 분리되어 있으나 인적, 물적 구분이 명확하지 아니한 기관간 거래라는 것입니다. 당사는 VGXI에 지급한 비용은 인적, 물적 구분이 명확한 별도 법인에게 적법한 절차를 통해 정당하고 합리적으로 지급한 연구개발비로 판단하여 해당 회수 요청이 부당하다고 판단하여 23년 4월 4일 서울행정법원에 정산금회수처분 취소 소송을 제기했습니다.
아래는 사업비 불인정액에 대한 세부내역이며, 현재 소송이 제기됨에 따라 당사는 회수 요청에 응하지 않고 있으며 이에 따른 별도의 조치는 없는 상황입니다. 본 소송의 결과에 따라 당사가 패소할 경우 당사는 해당 회수 요청에 따라 정산금을 반환하여야 하며 반환금에는 연구개발비 잔액 2,205백만원을 포함하여 총 4,733백만원입니다.
| [VGXI 코로나 지급 내역] |
| (단위 : 백만원) |
| 지급일 | 사용목적 | 2021년 |
| 2021-04-30 | 임상시료 생산비용 | 5 |
| 2021-04-15 | 임상시료 생산비용 | 1,256 |
| 2021-04-09 | 임상시료 생산비용 | 108 |
| 2021-04-09 | 임상시료 생산비용 | 6 |
| 2021-04-09 | 임상시료 생산비용 | 1,036 |
| 2021-06-30 | 임상시료 생산비용 | 49 |
| 2021-06-30 | 임상시료 생산비용 | 7 |
| 2021-08-30 | 임상시료 생산비용 | 452 |
| 2021-08-30 | 임상시료 생산비용 | 92 |
| 2021-10-20 | 임상시료 배송비 | 5 |
| 2021-11-19 | 임상시료 생산비용 | 37 |
| 2021-11-25 | 임상시료 생산비용 | 31 |
| 2021-11-25 | 임상시료 생산비용 | 133 |
| 합계 | 3,216 | |
또한, SFTS예방 DNA백신 생산비용으로 아래의 금액을 자회사 VGXI에게 지급하였습니다.
| [SFTS예방 DNA백신 지급 내역] |
| (단위 : 백만원) |
| 구분 | 2023년 1~9월 | 2022년 | 2021년 | 2020년 | 계 |
|---|---|---|---|---|---|
| 임상시료 생산비용 | 1,473 | 631 | - | - | 2,104 |
| 임상시료 배송비 | 13 | 28 | - | 84 | 125 |
| 계 | 1,486 | 659 | - | 84 | 2,229 |
당사가 패소할 경우 향후 정부과제 수행에 따른 지원금을 받는데 있어 불리한 측면이 있을 수 있으나 현재 관련된 명확한 규정이 존재하는 것이 아니기 때문에 단언하기는 어려운 실정입니다.투자자께서는 이 점 유의하셔서 투자에 임하시기 바랍니다.
| 아. 공모로 조달된 자금의 사용목적 변경 당사는 2020년부터 현재까지 공모로 조달한 자금은 210,035백만원입니다. 차입금 상환 및 연구개발비, 원부재료의 구매를 위하여 2020년 01월 28일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 19,800백만원의 자금 조달을 진행하였으며, VGXI의 CDMO 설비 신규 증설자금 및 코로나19 DNA 백신 등의 연구개발비를 조달하기 위해 2020년 07월 03일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 76,475백만원의 자금을 조달하였습니다. 또한 자회사 VGXI의 생산시설 설비자금 및 당사의 코로나 백신 및 치료제의 연구개발비를 조달하기 위해 2021년 12월 02일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 113,760백만원의 자금 조달을 진행하였습니다. 그러나, 상기 유상증자에 의하여 유입된 납입대금이 증권신고서상 작성한 자금사용계획과 실제 자금사용 현황과 일부 다르게 사용하였습니다. 금번 자금사용목적은 2,680백만원의 시설투자금, 62,280백만원의 운영자금(급여 등 일반 운영비) 및 1,700백만원의 발행제비용 등으로 사용될 예정입니다. 하지만, 과거 자금사용내역처럼 보다 더 효율적으로 투자해야할 상황이 발생한다면 사용목적에서 일부 변경될 소지가 있사오니 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2020년부터 현재까지 공모로 조달한 자금은 210,035백만원입니다. 차입금 상환 및 연구개발비, 원부재료의 구매를 위하여 2020년 01월 28일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 19,800백만원의 자금 조달을 진행하였으며, VGXI의 CDMO 설비 신규 증설자금 및 코로나19 DNA 백신 등의 연구개발비를 조달하기 위해 2020년 07월 03일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 76,475백만원의 자금을 조달하였으며, CDMO설비 신규 증설자금 및 코로나19 DNA백신 등의 연구개발비를 조달하기 위하여 2021년 12월 02일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 113,760백만원의 자금 조달을 진행하였습니다. 그러나, 상기 유상증자에 의하여 유입된 납입대금이 증권신고서상 작성한 자금사용계획과 실제 자금사용 현황과 일부 다르게 사용하였으며, 해당 내용은 다음과 같습니다.
1) 주주배정 후 실권주 일반공모(2020년 01월)
자금조달 당시 신고서상 자금사용계획은 채무상환, 발행제비용, 원부재료 구매, GLS-1200 축농증 치료제 연구개발비, GLS-1027 당뇨병성 신장병증 치료제 연구개발비, mRNA백신 기반 연구개발비 등으로 구성되어 있었으나 현재 실제 사용현황과는 일부 차이가 발생하였습니다. 2023년 3분기말 기준 19,800백만원 전액 사용하였습니다.
| [자금사용계획과 실제 자금사용현황] | |
| (기준일 : 2023년 09월 30일) | (단위 : 백만원) |
| 유상증자 당시 자금사용계획 | 실제 자금사용 현황 | 차이 발생 사유 | ||
|---|---|---|---|---|
| 항목 | 금액 | 항목 | 금액 | |
| 채무상환 | 10,000 | 채무상환 | 9,589 | - |
| 발행제비용 | 764 | 발행제비용 | 787 | - |
| 원부재료 구매 | 2,500 | 원부재료 구매 | 2,500 | - |
| GLS-1200 축농증 치료제 연구개발비 | 2,800 | GLS -1200 축농증 치료제 연구개발비 | 201 |
주성분 Quinine이 호흡기관인 부비동의 쓴맛 수용체를 자극하여 체내 항염증물질의 분비를 유도함으로서, 염증의 원인인 세균을 제거하여 만성 축농증을 치료할 것으로 예상함. 자금 사용 내역은 임상시험 착수에 따른 임상시험용의약품 생산 및 IND승인 관련 비용임- 치료제 및 위약의 적정성, 멸균, 안정성 등의 확인 시험 수행 비용, 치료제 물질 점성을 포함한 특성 관련한 시험 수행 비용, 시험법 개발 및 리포트 작성 비용. 실험 재료 등 연구 관련 비용, 치료제 개발에 대한 물질특성 기관 상담, 인허가(RA) 전문기관 상담 및 개발 관련 법률 자문료, 라이선스 유지 비용. 업체 및 유관 기관과의 미팅 비용, 개발 치료제의 물성을 파악하고, 치료제 개발 진행에 법률적 문제나 FDA 등의 인허가 유관 기관으로의 승인을 순조롭게 진행하고자 지출된 비용임. |
| GLS-1027 당뇨병성 신장병증 치료제 연구개발비 | 2,800 | GLS -1027 당뇨병성 신장병증 치료제 연구개발비 | 324 | 염증질환의 치료에 이용되는 경구용 의약품으로 개발되었고, RA, 1형당뇨병, Colitis, Uveitis에서 효능을 확인하였음, 해당 비용은 GLS-1027 치료제의 약리 및 약효능을 평가하고자 수행한 비임상시험(세포실험, 동물실험) 및 관련 실험에 지출되었음. |
| mRNA백신 기반 연구개발비 | 936 | mRNA백신 기반 연구개발비 | 191 | VGXI에서 휴스턴 메스디스트 병원으로부터 기술이전한 mRNA IVT용 플라스미드를 전달받음. 이 IVT용 플라스미드를 이용하여 IVT를 진행하여 생산 효율을 평가하고, luciferase나 HA1 유전자를 삽입한 mRNA를 제작, 생산, 정제함으로써 마우스에서의 기초적인 간독성 평가를 진행함. mRNA 제작과 생산에 필요한 5' cap이나 시약 등 실험재료 구입 및 실험 비용 지불. mRNA 생산과 정제 플랫폼 확립 및 LNP 제형 등의 기술적인 한계가 있어서 R&D 연구 범위가 축소됨. |
| - | - | GLS -5700 지카 백신 연구개발비 | 111 | 백신 운반비, 임상시험실시기관의 임상시험 개시 비용, 임상시험대상자 보험가입비, 임상시험 업무 위탁비용 등의 임상1상 수행 비용으로 지출되었음. |
| - | - | VGX-6150 C형간염치료 연구개발비 | 16 | 만성 C형 간염 환자에 핵산기반의 치료용 백신을 접종하여 체내 C형 간염 바이러스(HCV) 특이적 T세포 면역반응을 유도함으로써 HCV바이러스에 감염된 세포를 제거하거나 HCV 바이러스 방출을 억제하여 만성 C형 간염을 치료할 목적으로 연구개발하여 임상1상 완료. 강원대학교 신정임 교수의 기술 자문료와 임상 데이터 보관관리 비용 지불. |
| - | - | GLS-6100,6150 C형간염예방 연구개발비 | 74 | 정상인 또는 만성 C형 간염 완치자에게 핵산기반의 C형 간염 바이러스(HCV) 백신을 접종하여 체내에서 HCV 바이러스 특이적 T세포 면역반응을 유도함으로써 HCV 감염 및 치료 후 재감염을 억제하는 예방 백신 개발연구. C형 간염 완치자를 대상으로 한 GLS-6150과 정상인을 대상으로 한 GLS-6100 접종으로 한 임상 1상 승인 및 CRO 비용 지불. |
| - | - | GLS-7000 sc4D5-VT dRP 연구개발비 | 13 | Her2 양성 암환자에 핵산기반 이중기능 항암융합단백질 dRP을 투여하여 발현물질이 HER2 양성 종양 부위에 집적되고 VEGF 신호를 차단함으로써 신생혈관형성을 억제하여 종양 성장 및 전이를 억제하는 기전으로 암을 치료할 것으로 예상. sc4D5-VEGF-Trap의 적응증 타당성 확인을 위한 TNBC 세포주 시험, 세포주내 발현 및 PK 실험 등 연구비용 지출. |
| - | - | GLS-5300 MERS 예방 DNA 백신 연구개발비 | 28 | 임상시험 진행 시 방문별 수집되는 임상검체는 DNA백신의 안전성과 면역효능을 평가하는 분석 물질임. 검체를 분석하려면, 분석법이 개발되고 이에 대한 전문가의 검증이 필요로 함. 해당 비용은 백신 개발에 대한전문가 자문료와 백신의 임상평가법(SOP) 개발 및 임상시험자의 심의료 등에 소요되었음. |
| - | - | 단클론 항체치료제 연구개발비 | 55 | 류마티스 관절염의 원인인 TNF알파와 결합하는 단클론항체를 생성하여 관절염을 치료하는 목적으로 핵산기반의 항 TNF 알파 PlasMab을 연구. 핵산기반 단클론항체 치료제는 생산기간이 단축되고 가격경쟁력이 우수하고, 1회 투여로 체내 지속발현 효과를 기대할 수 있으며, DNA는 면역원성이 없어 안전하고 반복 투여가 가능함. PlasMab의 치료제 적용 타당성을 검토하기 위해 Humira-PlasMab을 제작, 세포주에서의 발현과 동물 모델에서의 효능평가 연구비용 지출. |
| - | - | 혈액응고 8인자 연구개발비 | 25 | A형 혈우병 환자에 혈액응고 8인자 dRP를 투여하여 발현 분비된 치료물질이 다른 응고인자들과 반응하여 응고작용이 회복되도록 도움으로써 A형 혈우병을 치료하는 기작으로 연구. 핵산기반의 혈액응고 8인자 dRP는 1회 투여로 체내 지속발현 효과를 기대할 수 있고 벡터에 대한 면역반응이 없어 반복적인 투여가 가능. 플라스미드 DNA 기반의 혈액응고 8인자를 제작하여 FVIII-dRP 대조물질과 함께 A형 혈우병 마우스 모델에서 효능 비교 실험비용 지출. |
| - | - | VGX-3400 UniFlu 연구개발비 | 238 | 매우 다양한 변이로 인하여 백신의 개발이 어려운 influenza 바이러스의 백신으로써 통합 독감백신을 개발할 목적으로 협력파트너인 INOVIO사와 공동연구 및 기술사용을 위한 협약의 비용 지불. INOVIO사의 임상2상 단계에 참여 |
| - | - | Cellectra | 59 | 조직내 DNA백신을 효율적으로 전달하고자 현재 개발 중인 GeneDerm과의 성능 비교를 위한 연구개발비용 |
| - | - | Microneedle and device 개발비 등 | 482 | 미국 뉴저지주립대 럿거스 대학과 공동으로 개발하고 있는 마이크론 크기의 의료기기임. 이 기기는 경피용 약물을 보다 효과적으로 체내에 전달하고자 개발을 진행하고 있으며, 당사에서 개발되었거나 향후 개발될 약물 즉, GLS-1027(면역조절제), C형 간염백신, DNA 및 mRNA 기반 약물과 백신의 효율적이고 표적화된 약물을 전달하는데 적용될 수 있을 것으로 기대함. 발생비용은 기술개발 비용에 해당함. |
| - | - | B형간염 항체치료제 연구개발비 | 53 | B형 간염 바이러스(HBV)의 핵산기반 항체치료제 개발을 위하여 강원대학교에서 기술이전한 HBV preS1 단클론항체(PlasMab)를 제작, 생산하여 만성 B형 간염 마우스 모델에서 그 효능을 평가함. HBV preS1 단클론항체의 제작, B형 간염 항원 제작, 효능 평가용 시약 구입 및 동물 실험을 위한 수탁 연구비 등의 지출. |
| - | - | SFTSV 예방 DNA 백신 연구개발비 | 84 | 비임상시험(동물실험)에서 DNA 백신의 효능 평가를 위한 연구 비용 |
| - | - | GLS-5100 대상포진 백신 연구개발비 | 33 | 일반운영비 항목으로 분류되지 않았음 - 대상포진 DNA 백신 전임상 시료생산 관련 시약 및 재료 구입으로 지출 (주식회사 씨앤티 20-04-29). 고령자 또는 면역이 약화된 환자에게 핵산기반 대상포진 바이러스(VZV) 백신을 접종함으로써 특이적 T세포 면역반응과 항체면역반응이 유도되어 수두-대상포진 바이러스의 복제 및 활성을 억제하는 연구비용 지출. |
| - | - | GLS-5310 코로나19 백신 연구개발비 | 62 | 보관온도 조건에 따른 DNA백신의 안정성 평가 목적의 동물 구입비용 및 외부 실험실 대여, 면역원성 분석의 실험재료 |
| - | - | 면역억제제 Anti-CD3 Plas-F(ab') 연구개발비 | 24 | T 세포에 의한 자가면역질환 치료 및 장기이식 거부반응을 억제할 수 있는 면역억제제인 OKT3 anti-CD3 단클론항체를 플라스미드 DNA 기반의 Plas-F(ab')로 제작하고, 효능평가를 진행하기 위해 필요한 시약 구입비용 지출. |
| - | - | GLS-1027 코로나19 연구개발비 | 334 | 염증질환의 치료에 이용되는 경구용 의약품으로 개발되었고, 당뇨병성 신장병증 치료제에 이어 코로나19로 적응증을 확대. 적응증 확대에 대한 법률 자문 비용, 특허 연차료, 치료제의 물성 확인의 시험법 개발, 치료제의 cGMP 제조비용, 치료제 배송료 등 임상시험 개시 전단계 지출 비용, 과제 보관 및 유지비용 등이 포함되었음. |
| - | - | GLS-1200 코로나19 연구개발비 | 309 | 염증질환의 치료에 이용되는 경구용 의약품으로 만성축농증에 이어 코로나19로 적응증을 확대하면서 개발에 사용된 비용임. 치료제의 코로나19 적응증 확대 관련 법률 자문 비용, IND filing 및 승인 관련 하여 IND 제출을 위한 비임상시험 자료 개발비, 임상관계 당국과의 사전 미팅 진행 비용, 임상통계 자문료, 임상2상 착수 비용 등이 포함됨. |
| - | - | MERS-Abs 연구개발비 | 80 | GLS-5300 MERS 예방DNA 백신 개발 단계에 발생한 지출 비용으로 DNA 플라스미드 정제 키트, 단백질 발현 확인 목적의 웨스턴블럿 실험의 시약 구입비, 동물 및 사람 검체에서의 항체 발현 확인용 ELISA 키트 구입비, 혈청 내 단백질 발현 확인용도의 단일항체 시료 생산 관련 비용 등이 포함됨. |
| - | - | 일반운영비 | - | |
| - | - | - 신약관련 지급비용 (자문료-Rutgers Univ.) | 317 | Microneedle and device의 개발을 위해 선행되어야 할 럿거스 대학과의 자문료 |
| - | - | - 신약관련 지급비용 (자문료-Wistar.) | 120 | 혁신적인 DNA 백신 개발등을 위하여 국제적 DNA 리딩 연구소인 위스타와의 자문 계약 |
| - | - | - 신약관련 지급비용 (특허권) | 10 | 신약개발된 제품에 대한 특허권 등록 |
| - | - | - 신약관련 지급비용 (수수료 및 공용물품등) | 2,804 | 신약 개발과 관련된 법률적 검토 및 관련 수수료 지급 및 신약개발팀 및 R&D 팀에서 부서 전체가 개발하는 신약개발 프로젝트들의 연구를 위해 발생된 비용 |
| - | - | - 신약관련 지급비용 (글로벌임상팀-급여상여 및 공용물품등) | 877 | 신약 개발중에서 글로벌 임상을 목적으로 하는 신약프로젝트를 담당하는 글로벌 임상팀의 임금 및 부서 공통적인 연구를 위해 발생된 비용 |
| 합계 | 19,800 | 합계 | 19,800 | - |
|
출처) 당사 정기보고서 및 당사 제시 |
유상증자 당시 예정했던 자금사용목적은 6가지 항목에 19,800백만원이었으나 실제 사용된 항목은 24가지로 기존 자금사용계획과 상이하였습니다. 상이한 이유는 연구개발 진행정도가 당초 계획과 달리 진행되거나 중단됨에 따라 해당 자금을 일반운영비 및 신규 연구개발에 사용한 것입니다.
| [기존 사용목적과 차이발생 항목] |
| 항목 | 차이발생 항목 |
|---|---|
| 신규연구개발비 추가 | 1) GLS -5700 지카 백신 연구개발비 |
| 2) VGX-6150 C형간염치료 연구개발비 | |
| 3) GLS-6100,6150 C형간염예방 연구개발비 | |
| 4) GLS-7000 sc4D5-VT dRP 연구개발비 | |
| 5) GLS-5300 MERS 예방 DNA 백신 연구개발비 | |
| 6) 단클론 항체치료제 연구개발비 | |
| 7) 혈액응고 8인자 연구개발비 | |
| 8) UniFlu 연구개발비 | |
| 9) Cellectra | |
| 10) Microneedle and device 개발비 등 | |
| 11) B형간염 항체치료제 연구개발비 | |
| 12) SFTSV 예방 DNA 백신 연구개발비 | |
| 13) 일반운영비 | |
| 14) GLS-5100 대상포진 백신 연구개발비 | |
| 15) GLS-5310 코로나19 백신 연구개발비 | |
| 16) 면역억제제 Anti-CD3 Plas-F(ab') 연구개발비 | |
| 17) GLS-1027 코로나19 연구개발비 | |
| 18) GLS-1200 코로나19 연구개발비 | |
| 19) MERS-Abs 연구개발비 |
출처) 당사 제시
2) 주주배정 후 실권주 일반공모(2020년 07월)
| [자금사용계획과 실제 자금사용현황] | |
| (기준일 : 2023년 09월 30일) | (단위 : 백만원) |
| 유상증자 당시 자금사용계획 | 실제 자금사용 현황 | 차이 발생 사유 | ||
| 항목 | 금액 | 항목 | 금액 | |
| 발행제비용 | 2,663 | 발행제비용 | 2,663 | - |
| CDMO설비 신규 증설자금(VGXI 신규시설자금) | 64,948 | CDMO설비 신규 증설자금(VGXI 신규시설자금) | 60,313 | - |
| 코로나 19 DNA 백신 개발 등 연구개발비 | 8,864 | 코로나 19 DNA 백신 개발 등 연구개발비 | 6,009 | GLS-5310은 코로나19을 예방하는 기초접종 목적으로 개발된 DNA백신이며, 식약처로부터 임상시험 1상/2a상 계획서에 대해 IND 승인을 득하였음. 본 임상시험에는 코로나 19 감염 이력이 전무하면서, 코로나 19 백신을 접종받지 않은 대상자만이 등록할 수 있었음(기초백신 투약 조건임). 코로나19 발병 초기에 국내에서는 당사를 포함한 10개 이상의 개발사들이 코로나19 백신 개발에 참여하게 되면서 대상자 모집에 난항을 겪었음. 당사의 임상 2a에서는 대상자 300명 등록을 계획하고 착수했으나, 상기와 같은 이유 때문에 대상자수를 126명으로 조정해서 임상을 진행하는 것으로 임상시험계획을 변경하였음. 사용내역은 1상/2a상 IND 준비 및 진행 비용, 임상시험실시기관의 임상시험 수행 관련 세팅 비용(기관 수: 임상 1상 1곳, 임상 2a상 5곳) 및 1상 기관의 임상시험 운영비, CRO계약 및 착수 비용, 1상 임상시험 대상자 선별시 검사비용, 임상시험대상자의 기관 방문별 검사료, 검체 운반비, 검체분석 비용 일체, 분석 관련 소모품 구입 일체, 임상통계전문가의 자문료, 1상의 중간결과와 최종결과 분석, 2a상 중간분석 비용 등이 포함되었음. |
| - | - | GLS -5700 지카 백신 연구개발비 | 40 | 임상1상 관리와 CRO 서비스 등 과제 유지비용으로 과제 완료될 때까지 지속적으로 발생하는 비용임. |
| - | - | VGX-6150 C형간염치료 연구개발비 | 6 | 만성 C형 간염 환자에 핵산기반의 치료용 백신을 접종하여 체내 C형 간염 바이러스(HCV) 특이적 T세포 면역반응을 유도함으로써 HCV바이러스에 감염된 세포를 제거하거나 HCV 바이러스 방출을 억제하여 만성 C형 간염을 치료할 목적으로 연구개발하여 임상1상 완료. 강원대학교 신정임 교수의 기술 자문료와 임상 데이터 보관관리 비용 지불. |
| - | - | GLS-6100,6150 C형간염예방 연구개발비 | 91 | 정상인 또는 만성 C형 간염 완치자에게 핵산기반의 C형 간염 바이러스(HCV) 백신을 접종하여 체내에서 HCV 바이러스 특이적 T세포 면역반응을 유도함으로써 HCV 감염 및 치료 후 재감염을 억제하는 예방 백신 개발연구. C형 간염 완치자를 대상으로 한 GLS-6150과 정상인을 대상으로 한 GLS-6100 접종으로 한 임상 1상 CRO 비용과 drug product 생산 및 안정성 검사비 지불 |
| - | - | GLS-5300 MERS 예방 DNA 백신 연구개발비 | 11 | 임상시험 진행 시 방문별 수집되는 임상검체는 DNA백신의 안전성과 면역효능을 평가하는 분석 물질임. 검체분석을 위해 필요한 임상검체 분석용 및 연구용 기자재 구입과 임상 1상 면역분석 업무 위탁으로 발생한 비용임. |
| - | - | Microneedle and device 개발비 등 | 209 | 미국 뉴저지주립대 럿거스 대학과 공동으로 개발하고 있는 마이크론 크기의 의료기기임. 이 기기는 경피용 약물을 보다 효과적으로 체내에 전달하고자 개발을 진행하고 있으며, 당사에서 개발되었거나 향후 개발될 약물 즉, GLS-1027(면역조절제), C형 간염백신, DNA 및 mRNA 기반 약물과 백신의 효율적이고 표적화된 약물을 전달하는데 적용될 수 있을 것으로 기대함. 발생비용은 기술개발 비용에 해당함. |
| - | - | B형간염 항체치료제 연구개발비 | 9 | B형 간염 바이러스(HBV)를 타겟하는 단클론항체를 개발하여 만성 B형 간염의 치료를 위한 핵산기반 HBV 치료제를 개발. 단클론항체의 효능을 시험하기 위한 HBV 발현 연구 모델을 구축하는 시약재료비 지출. |
| - | - | GLS -1027 당뇨병성 신장병증 치료제 연구개발비 | 125 | 염증질환의 치료에 이용되는 경구용 의약품으로 개발되었고, RA, 1형당뇨병, Colitis, Uveitis에서 효능을 확인하였음, 해당 비용은GLS-1027 치료제의 약리 및 약효능을 평가하고자 수행한 비임상시험(세포실험, 동물실험) 및 관련 실험에 지출되었음- 치료제의 독성연구를 위한 동물구입비 및 시약 등 실험재료 구입비, 임상 1상의 검체 분석비용 등 |
| - | - | GLS -1200 축농증 치료제 연구개발비 | 65 | 주성분Quinine이 호흡기관인 부비동의 쓴맛 수용체를 자극하여 체내 항염증물질의 분비를 유도함으로서, 염증의 원인인 세균을 제거하여 만성 축농증을 치료할 것으로 예상함. 자금 사용 내역은 임상시험 과제 유지비용임. |
| - | - | RNA백신 기반 연구개발비 | 27 | mRNA와 circRNA 기반의 RNA 백신 개발을 위한 기초 연구 수행. VGXI에서 mRNA 백터를 받은 후 IVT 수행하여 mRNA 생산하고 mRNA 플랫폼 확립을 위한 기초 연구결과 확보함. 새로운 구조의 CircRNA를 연구하여 CircRNA 기술 특허 및 침해 분석 후 선행특허 출원. |
| - | - | CCHF 콩고출혈열 연구개발비 | 16 | CCHF 콩고출혈열 특허 비용 지불 |
| - | - | MERS-Abs 연구개발비 | 10 | MERS 항체 발현 확인용 ELISA 키트 구입비와MERS 클로닝 및 타당성평가 연구를 위한 시약 구입비용임. |
| - | - | 일반운영비 | - |
|
| - | - | - 신약관련 지급비용 (글로벌임상팀-급여상여 및 공용물품등) | 2,007 | 신약 개발중에서 글로벌 임상을 목적으로 하는 신약프로젝트를 담당하는 글로벌 임상팀의 임금 및 부서 공통적인 연구를 위해 발생된 비용 |
| - | - | - 신약관련 지급비용 (수수료 및 공용물품등) | 4,874 | 신약 개발과 관련된 법률적 검토 및 관련 수수료 지급 및 신약개발팀 및 R&D 팀에서 부서 전체가 개발하는 신약개발 프로젝트들의 연구를 위해 발생된 비용 |
| 합계 | 76,475 | 합계 | 76,475 | - |
|
출처) 당사 정기보고서 및 당사 제시 |
유상증자 당시 예정했던 자금사용목적은 3가지 항목에 76,475백만원이었으나 실제 사용된 항목은 15가지로 기존 자금사용계획과 상이하였습니다.
자금조달 당시 신고서상 자금사용계획 시설자금으로는 CDMO 설비 신규 증설자금 64,948백만원으로 구성되어 있었으나 환율변동에 따라 실제 사용현황과는 일부 차이가 발생하였습니다. 2023년 3분기말 기준 CDMO설비 신규 증설자금으로 60,313백만원 사용하였습니다.
상이한 이유는 연구개발 진행정도가 당초 계획과 달리 지연되거나 중단됨에 따라 해당 자금을 일반운영비 및 신규 연구개발에 사용한 것입니다.
| [기존 사용목적과 차이발생 항목] |
| 항목 | 차이발생 항목 |
| 신규연구개발비 추가 | 1) GLS -5700 지카 백신 연구개발비 |
| 2) VGX-6150 C형간염치료 연구개발비 | |
| 3) GLS-6100,6150 C형간염예방 연구개발비 | |
| 4) GLS-5300 MERS 예방 DNA 백신 연구개발비 | |
| 5) Microneedle and device 개발비 등 | |
| 6) B형간염 항체치료제 연구개발비 | |
| 7) GLS -1027 당뇨병성 신장병증 치료제 연구개발비 | |
| 8) GLS -1200 축농증 치료제 연구개발비 | |
| 9) RNA백신 기반 연구개발비 | |
| 10) CCHF 콩고출혈열 연구개발비 | |
| 11) MERS-Abs 연구개발비 | |
| 12) 일반운영비 |
출처) 당사 제시
3) 주주배정 후 실권주 일반공모(2021년 12월)
| [자금사용계획과 실제 자금사용현황] | |
| (기준일 : 2023년 09월 30일) | (단위 : 백만원) |
| 유상증자 당시 자금사용계획 | 실제 자금사용 현황 | 차이 발생 사유 | ||
| 항목 | 금액 | 항목 | 금액 | |
| 발행제비용 | 2,700 | 발행제비용 | 2,700 | - |
| CDMO설비 신규 증설자금(VGXI 신규시설자금) 외형 및 3,000L | 34,932 | CDMO설비 신규 증설자금(VGXI 신규시설자금) | 59,354 |
- |
| CDMO설비 신규 증설자금(VGXI 신규시설자금) 4,500L | 55,891 | 코로나 19 DNA 백신 개발 등 연구개발비 (GLS-5310) | 5,620 | 기존 계획보다 적게 사용한 경우에는 기존 개발 단계 계획과 해당 금원으로 진행한 개발단계 비교 기재하고, 기존 계획만큼 개발하지 못하게 된 사유 작성 |
| 운영자금 | 20,237 | GLS -5700 지카 백신 연구개발비 (Zika-002) | 120 | 임상1상 DB Medical 용어(MedDRA) 구입비, WHO DDE 연간사용료, CRO 서비스 비용, 임상시험대상자의 기관 방문별 비용 등. 해당 품목 구입비는 임상시험 결과에서 안전성 평가 항목 중에서 이상반응(질환명)을 기관(organ system)별로 분류할 때 사용하는 의학명용 프로그램이며, 구입 이후 해마다 사용료를 납부해야 지속적으로 사용할 수 있음. |
| - | - | GLS -1200 축농증 치료제 연구개발비 | 82 |
주성분Quinine이 호흡기관인 부비동의 쓴맛 수용체를 자극하여 체내 항염증물질의 분비를 유도함으로서, 염증의 원인인 세균을 제거하여 만성 축농증을 치료할 것으로 예상함. 자금 사용 내역은 임상시험 과제 유지비, 검체수송비용, 임상통계 자문비용임. |
| - | - | GLS-6100,6150 C형간염예방 연구개발비 | 5 | 정상인 또는 만성 C형 간염 완치자에게 핵산기반의 C형 간염 바이러스(HCV) 백신을 접종하여 체내에서 HCV 바이러스 특이적 T세포 면역반응을 유도함으로써 HCV 감염 및 치료 후 재감염을 억제하는 예방 백신 개발연구. C형 간염 완치자를 대상으로 한 GLS-6150과 정상인을 대상으로 한 GLS-6100 접종으로 한 임상 1상 CRO 비용과 데이터 분석비용 지불 |
| - | - | GLS-5300 MERS 예방 DNA 백신 연구개발비 | 22 | 임상 1상 결과 분석을 위해 기관에서의 임상검체 배송비, 임상시험수탁기관(CRO)의 임상시험 진행 비용 |
| - | - | Microneedle and device 개발비 등 | 1,080 | DNA백신을 조직내로 효과적으로 전달해서 면역원성을 증가하고자 기능이 향상된 새로운 모델의 suction device를 개발 중임. GLS-5140 임상시험 1상부터 적용할 계획이며, 추후 비임상과 임상시험에서 DNA백신 접종 시에 사용하고자 함. 해당 비용은 새로운 기종의 개발 비용, 의료기기 개발 전문업체의 컨설팅 비용, 기기 모델 제작비용, 시제품 개발비, FDA/ EU의 의료기기 가이드라인에 따른 각종 시험(시제품의 성능시험, 안전성 시험, 안정성 시험, 멸균 시험 등 단계별 진행), 의료기기 RA 컨설턴트 비용 등이 포함되었음. |
| - | - | GLS-5140 SFSV 예방 DNA백신 | 2,151 |
SFTS 바이러스 예방 치료용 백신 조성물 특허지분 전용 기술실시 계약체결 지급금, GMP등급 및 임상시험용 플라스미드 생산, 비임상 시험 비용(외부기관 동물실험실 대여비, 동물실험 IRB 심사료, 동물구입비, 유효성 평가 동물실험 비용 및 시약구입비 등 일체) |
| - | - | RNA백신 기반 연구개발비 | 334 |
mRNA와 circRNA 기반의 RNA 백신 개발을 위한 플랫폼 확립 연구 수행. mRNA 약품의 제작, 생산, 정제, 품질관리 등 FDA, EMA, 식약처의 가이드라인에 부합하는 mRNA 백신 R&D 플랫폼을 수립. 다양한 5' cap과 LNP를 적용하여 mRNA 백신 연구개발에 가장 적합한 조합을 플랫폼화함으로써 동물실험을 통하여 mRNA 백신의 우수한 발현양상을 확인함. |
| - | - | CCHF 콩고출혈열 연구개발비 | 11 | CCHF 콩고출혈열 백신의 유럽과 캐나다 특허 출원 신청 금액 지불. |
| - | - | HnMc | 5 | 암세포내 mitochondria를 타겟하여 항암효과를 나타낼 수 있는 펩타이드 구조물질인 HnMc를 핵산기반 플랫폼에 적용하여 연구 수행. HnMc 특허를 보유한 대학연구기관과 공동연구 계약을 맺고, 핵산기반 HnMc 항암물질의 기초적인 세포사멸 효능 및 독성 연구를 공동으로 진행함. |
| - | - | PlasMab | 4 | 일반운영비 항목으로 분류되었으나, plasmid DNA 기반의 단클론항체(PlasMab)의 제작과 연구에 사용되는 세포주 구입을 위한 지출 내역임. 바이러스 전염병과 항암 면역치료제 개발 목적으로 PlasMab 플랫폼 확립을 위한 기초연구 수행. |
| - | - | CCR8 | 9 | 새로운 항암 면역치료의 타겟으로 CCR8을 선정하여 이에 필요한 단클론항체를 제작하기 위한 기초연구 수행. |
| - | - | CAR-M | 16 | 고형암 치료에 있어서 암미세환경에서의 CAR-T의 단점을 극복할 수 있는 CAR-macrophage(CAR-M)에 대한 연구에 착수하여 플라스미드 DNA 기반의 CAR 백터를 제작하고 단핵세포주에서 CAR 구성 물질들의 발현양상과 CAR-M 세포 형성을 확인함. |
| - | - | GLS-1027 자가면역질환 | 140 | 포도막염 동물 모델(dog)에서의 약물 효능 평가를 위한 전임상 시험 비용(미국 코넬대에서 진행하고 있는 동물실험 비용, 동물질환 진단 비용, 약물 운송비, 특허비용 등) |
| - | - | GLS-1027 기타 | 52 | 당뇨병성 관련 과제 유지비 |
| - | - | GLS-1027 염증성 | 4,644 | 코로나 19 감염에 의한 중증 폐렴 방지에 대한 치료제의 다기관 임상 2상의 지출비용(국내외 4개국, 10개 임상시험 실시기관에서 임상2상을 진행하였음. 국내외IND 준비 및 심사 진행비, 임상시험실시기관별의 초기 세팅 비용, 시험대상들의 보험료, 국내외 CRO와의 임상시험 위탁 계약비 및 착수 비용 등) |
| - | - | 일반운영비 | - | |
| - | - | - 신약관련 지급비용 (자문료-Wistar.) | 844 | 혁신적인 DNA 백신 개발등을 위하여 국제적 DNA 리딩 연구소인 위스타와의 자문 계약 |
| - | - | - 신약관련 지급비용 (글로벌임상팀-급여상여 및 공용물품등) | 9,178 | 신약 개발중에서 글로벌 임상을 목적으로 하는 신약프로젝트를 담당하는 글로벌 임상팀의 임금 및 부서 공통적인 연구를 위해 발생된 비용 |
| - | - | - 신약관련 지급비용 (수수료 및 공용물품등) | 1,758 | 신약 개발과 관련된 법률적 검토 및 관련 수수료 지급 및 신약개발팀 및 R&D 팀에서 부서 전체가 개발하는 신약개발 프로젝트들의 연구를 위해 발생된 비용 |
| - | - | - 신약관련 기기구입 | 1,103 | 신약 개발등을 위하여 필요한 기기 구입 |
| - | - | - 인건비 (신약 및 R&D 인원 포함) | 18,732 | 신약개발팀 및 R&D 인원을 포함한 인건비 |
| - | - | - 일반경비 | 1,417 | 신약 개발 이외의 일반 경비 지급 |
| 합계 | 113,760 | 합계 | 109,381 |
- |
|
출처) 당사 정기보고서 및 당사 제시 (미사용 유증자금은 우리은행, 신한은행, 국민은행에 각각 보관하고 있습니다.) |
유상증자 당시 예정했던 자금사용목적은 3가지 항목에 113,760백만원이었으나 실제 사용된 항목은 17가지로 기존 자금사용계획과 상이하였습니다.
자금조달 당시 신고서상 자금사용계획 시설자금으로는 3,000L CDMO 설비 신규 증설자금 34,932백만원 및 4,500L 규모 생산시설자금 55,891백만원으로 구성되어 있었으나 현재 실제 사용현황과는 일부 차이가 발생하였습니다. 58,053백만원은 당초 계획된 CDMO설비 신규 증설자금(VGXI 신규시설자금) 외형 및 3,000L로 집행하기로 한 34,932백만원을 모두 집행 후, 잔액 23,121백만원은 예상치 못했던 우크라이나와 러시아의 전쟁으로 인한 관련 비용 증가 및 환율의 상승 등으로 인해 3,000L CDMO 설비 추가 신규증설자금과 코로나19 및 공장이 위치한 텍사스 지역의 대규모 폭우로 인한 공사지연으로 인해 생산 가동이 늦어져 기대하였던 수주물량의 지연과 원부자재 가격상승에 따른 비용부담 증가가 수익성 악화로 이어져 운영 자금 부족으로 VGXI의 운영비로 사용되었습니다.
2023년 3분기말 기준 CDMO설비 신규 증설자금으로125,251백만원(건물 82,226백만원 및 장비 43,025백만원) 사용하였으며, 3,000L CDMO 시설에 필요시 언제든 최소의 비용으로 4,500L의 CDMO 설비가 증축될 수 있도록 공간등이 확보된 설계 및 시공을 하여 건물이 완성되어 있습니다. 향후 4,500L의 생산설비가 필요시 증측되더라도 이미 이를 고려하였기에 생산 설비 증축 시간의 감소 및 4,500L 에 맞는 추가 관련 장비 구입등의 부담을 최소화 할 수 있도록 설계 및 시공되어 4,500L의 생산설비의 미래에 발생될 일부 비용이 선반영된 상태이기에 비용은 더욱 증가되었습니다. 생산시설에 투입된 주요 비용은 아래의 표를 참고 하시길 바라겠습니다.
현재 4,500L 2단계 시설에 대해서는 1단계 시설이 본격 가동되면 2단계 설비를 설치할 예정으로 4,500L 2단계 시설 구축이 연기된 상태입니다. 하지만 당사의 기대에도 불구하고 전세계적인 경기침체등의 이유로 글로벌 제약사들이 연구개발의 투자가 감소된다면 4,500L 생산설비는 추가적으로 증축이 될 가능성이 현저히 낮아 당사가 고려한 비용 절감의 효과가 없어 질 수 있으며, 현재 전세계적인 인플레이션 영향으로 미래의 4,500L 증축시에는 예상보다 많은 비용이 소요될 것으로 추정되어 4,500L 의 추가 증축에 대하여 미래에 이를 회의적으로 보아 추가증축이 이루어지지 않을 수도 있으니 이점 투자자분들께서는 유의 하시길 바라겠습니다.
(단위: 천미화, 백만원)
| 구분 | 3,000L 생산시설 주요 투입금액 | |
|---|---|---|
| USD | KRW | |
| 건물 | 63,251 | 82,226 |
| 장비 | 33,096 | 43,025 |
| 토지 | 3,220 | 4,186 |
| cGMP 관련 | 1,774 | 2,306 |
| 합계 | 101,341 | 131,743 |
주) 환율은 1달러=1,300원
출처) 당사 제시
유상증자 당시 예정했던 자금사용목적과 상이한 이유는 연구개발 진행정도가 당초 계획과 달리 지연되거나 중단됨에 따라 해당 자금을 일반운영비 및 신규 연구개발에 사용한 것입니다.
| [기존 사용목적과 차이발생 항목] |
| 항목 | 차이발생 항목 |
| 신규연구개발비 추가 | 1) GLS -5700 지카 백신 연구개발비 |
| 2) Microneedle and device 개발비 등 | |
| 3) GLS -1200 축농증 치료제 연구개발비 | |
| 4) RNA백신 기반 연구개발비 | |
| 5) GLS-1200 코로나19 연구개발비 | |
| 6) Pan.코로나 연구개발비 | |
| 7) GLS-1027 자가면역질환 연구개발비 | |
| 8) GLS-1027 기타 연구개발비 | |
| 9) HnMc 연구개발비 | |
| 10) 일반운영비 | |
| 11) GLS-5140 STFSV예방 DNA 백신 | |
| 12) GLS-5300(MERS) 연구개발비 | |
| 13) CCHF-콩고출혈열 연구개발비 | |
| 14) GLS-6100, 6150 C 형간염[예방] 연구개발비 |
출처) 당사 제시
당사는 당시 회사 상황에 맞춰 효율적으로 판단되는 부분에 자금을 사용하였으며, 자회사의 시설자금 등으로 조달한 자금은 증권신고서상 기입된 내역에 맞춰 자회사에 대여금으로 사용했으나, VGXI에서 집행하는 과정에서 납기지연, 원자재 가격 인상 등으로 인해 4,500L 시설자금 일부가 3,000L 설비 구축에 일부 사용되어 차이가 발생하며, 공모자금 가운데 연구개발 비용은 연구개발 진전도와 여러 변수에 따라 발생한 내용에 맞춰 사용함에 따라 잦은 번복이 있었습니다. 해당 변수에는 당초 예정되었던 개발 과정이 중간에 진행된 연구 결과 지속적인 개발이 어려워 연구개발을 중단한 경우도 있으며, 예정된 향후 일정이 식약처 등 규제기관의 추가적인 실험 요구 등으로 인해 해당 실험에 관련 비용을 집행하는 부분, 운송 과정 및 통관 절차 등의 행정비용이 당초 예측했던 부분과의 차이 발생 등 사유가 있습니다. 특히 당사는 신변종 감염병에 대한 핵산 기반 백신 및 치료제를 개발하는 회사로 다른 회사와 비교할 때 신변종 감염병 상황에 따라 연구개발 지속 여부가 자주 바뀌는 상황입니다. 또한 당사가 개발하고 있는 DNA백신은 현재 상업화된 제품이 거의 없는 상황으로, 코로나19 팬데믹 상황에서 인도 자이더스사의 자이코브-디라는 코로나19 DNA백신이 인도정부에 의해 신약판매허가를 받은 바 있으나 일반적인 백신과 달리 연구개발 환경이 자주 변화되는 특이점이 있습니다. 이에 따라 실제 자금사용현황은 신고서에 기재한 자금사용목적과 차이가 발생하였습니다.
코로나19로 인한 팬데믹 상황이 엔데믹으로 변했고 그에 따라 정부의 코로나 대응 정책도 변화하고 있습니다. 그러나 당사는 GLS-5310의 임상2a상의 최종결과를 확인하기 전까지 해당 연구개발 계획에 대한 변동은 없습니다.또한, 당사는 2020년 1월 19일 GLS-5310의 글로벌 개발과 함께 기존 피내 접종과 비강내 접종을 병용하는 임상시험을 미국에서 수행하고자 미국 FDA에 1상 임상시험계획(IND) 승인을 신청하였으며 2021년 7월 27일 승인을 받았습니다. 그러나 코로나19 팬데믹 상황이 변화함에 미국에서 mRNA백신과 아데노바이러스 전달체 백신을 접종한 대상자에게 자체 개발 흡인작용 접종기인 진덤(GeneDerm)을 이용한 피내 접종군과 피내 접종 및 코 스프레이를 이용한 비강내 접종을 병용한 접종군을 비교하고자 2022년 1월 3일 미국 FDA로부터 코로나19 백신 접종자들을 대상으로 하여 GLS-5310을 부스터샷으로 접종하는 임상시험계획(IND)에 대해 승인을 받았습니다. 해당 임상시험계획의 승인은 지난 2021년 7월27일 승인받은 임상시험계획(IND)에 대해 임상시험계획을 변경하여 승인받은 것입니다. 2022년 8월 미국에서 진행하고 있는 코로나19 DNA 백신 GLS-5310의 부스터샷(추가접종) 1상 임상시험 대상자 전체 69명의 등록이 완료됐습니다. 현재 중간분석을 진행하고 있으며 1년 추적관찰 후 최종분석이 진행될 예정입니다.
당사는 공모자금이 보다 효율적으로 사용되기 위해 자금사용목적과 달리 사용하고자 하는 경우 자금사용목적을 변경하는 합리적 이유에 대해 내부품의를 거쳐 승인된 경우에 한해 자금사용목적을 변경하고 있으며, 이 부분에 대해 향후 당초 예상한 내용과 다른 사유 및 향후 진행계획 등 현재 시점에서 과거와 미래에 대한 자금사용목적 변경에 대한 시계열적 관리를 강화하여 보다 철저히 관리해 나갈 예정입니다. 또한 공모를 통해 조달된 자금은 각 용도별로 통장을 마련하여 해당 용도에 대해서만 자금이 집행될 수 있도록 별도의 공모 자금 집행 프로세스를 마련하여 통제할 계획입니다.이러한 발생상황을 정기보고서 제출시 마다 계속적으로 업데이트하고 있으나, 실제 자금사용목적과 변경된 상황이 발생한 사실이 있으며 위와 같이 별도의 통장 및 통제 프로세스에도 불구하고 내부통제 절차가 제대로 작동하지 않을 경우 공모자금이 당초 목적에 부합되지 않게 사용되고 이는 회사가 외부에서 자금을 조달하는데 불리하게 작용될 수 있기에 투자자께서는 이 점 유의하시기 바랍니다.
금번 자금사용목적은 2,680백만원의 시설투자금, 62,280백만원의 운영자금(급여 등 일반 운영비) 및 1,700백만원의 발행제비용 등으로 사용될 예정입니다. 하지만, 과거 자금사용내역처럼 보다 더 효율적으로 투자해야할 상황이 발생한다면 사용목적에서 일부 변경될 소지가 있사오니 투자자께서는 이 점 유의하시기 바랍니다.
| 자. 회사의 유동성 관련 위험 당사는 연결기준 최근 3년 및 2023년 3분기까지 지속적으로 음(-)의 영업활동현금흐름을 보이고 있으며, 투자활동현금흐름의 경우 2022년을 제외하고 지속적으로 음(-)의 현금흐름을 보이고 있는 상황입니다. 이러한 음(-)의 영업활동현금흐름과 투자활동현금흐름을 재무활동현금흐름을 통하여 충당하고 있는 상황이며, 2023년 3분기말 연결기준 당사는 6,805백만원의 현금 및 현금성자산을 보유하고 있습니다. 2020년 연결기준으로 15,916백만원의 음(-)의 영업활동현금흐름, 44,305백만원의 음(-)의 투자활동현금흐름, 106,235백만원의 양(+)의 재무활동현금흐름이 발생하면서 2020년말 연결기준 62,432백만원의 현금 및 현금성자산을 보유하게 되었습니다. 2021년 연결기준으로 4,849백만원의 음(-)의 영업활동현금흐름, 146,398백만원의 음(-)의 투자활동현금흐름, 111,023백만원의 양(+)의 재무활동현금흐름이 발생하면서 2020년말 연결기준 22,310백만원의 현금 및 현금성자산을 보유하게 되었습니다. 2022년 연결기준으로 24,113백만원의 음(-)의 영업활동현금흐름, 8,055백만원의 양(+)의 투자활동현금흐름, 7,013백만원의 양(+)의 재무활동현금흐름이 발생하면서 2020년말 연결기준 13,261백만원의 현금 및 현금성자산을 보유하게 되었습니다. 2023년 3분기연결기준으로 -17,586백만원의 음(-)의 영업활동현금흐름, 24,467백만원의 양(+)의 투자활동현금흐름, -13,345백만원의 음(-)의 재무활동현금흐름이 발생하면서 2023년 3분기말 연결기준 6,805백만원의 현금 및 현금성자산을 보유하게 되었습니다. 투자자들께서는 대내외적 환경이 급격하게 침체되거나 당사의 영업 성과에 부정적인 영향으로 음(-)의 현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있음을 면밀히 검토하시고 투자에 임해주시기 바랍니다. |
당사는 연결기준 최근 3년 및 2023년 3분기까지 지속적으로 음(-)의 영업활동현금흐름을 보이고 있으며, 투자활동현금흐름의 경우 2022년을 제외하고 지속적으로 음(-)의 현금흐름을 보이고 있는 상황입니다. 이러한 음(-)의 영업활동현금흐름과 투자활동현금흐름을 재무활동현금흐름을 통하여 충당하고 있는 상황이며, 2023년 3분기말 연결기준 당사는 6,805백만원의 현금 및 현금성자산을 보유하고 있습니다. 당사의 최근 3년간 및 2023년 3분기까지의 요약 연결 현금흐름 추이는 다음과 같습니다.
| [당사 연결기준 현금흐름 추이] |
| (단위: 백만원) |
| 구 분 | 2023년 3분기 |
2022년 3분기 | 2022년 | 2021년 | 2020년 |
| 영업활동현금흐름 | -17,586 | -15,437 | -24,113 | -4,849 | -15,916 |
| - 당기순이익 | -37,967 | -23,500 | -38,150 | -15,888 | -18,648 |
| - 현금의 유출이 없는 비용등의 가감 | 9,396 | 6,443 | 7,593 | 2,550 | 4,870 |
| - 영업활동으로인한자산ㆍ부채의변동 | 10,605 | -1,141 | 3,743 | 8,255 | -2,333 |
| - 이자수취 | 435 | 2,790 | 3,086 | 424 | 245 |
| - 이자지급 | -55 | -29 | -59 | 0 | -49 |
| 투자활동현금흐름 | 24,467 | 4,164 | 8,055 | -146,398 | -44,305 |
| - 단기금융상품의 증가 | -71,846 | -184,629 | -271,629 | -133,000 | -151,413 |
| - 단기금융상품의 감소 | 99,000 | 224,629 | 324,629 | 76,000 | 123,877 |
| - 유형자산의 취득 | -2,656 | -36,161 | -45,306 | -82,442 | -16,153 |
| 재무활동현금흐름 | -13,345 | 7,370 | 7,013 | 111,023 | 106,235 |
| 현금및현금성자산의환율변동효과 | 7 | 60 | -3 | 101 | -503 |
| 기초현금및현금성자산 | 13,261 | 22,310 | 22,310 | 62,432 | 16,922 |
| 기말현금및현금성자산 | 6,805 | 18,467 | 13,261 | 22,310 | 62,432 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 2020년에는 연결기준으로 18,648백만원의 당기순손실이 발생하였으며, 감가상각비 2.640백만원 등 현금유출이 없는 손익가감 4,870백만원 등이 발생하면서 총 15,916백만원의 음(-)의 영업활동현금흐름이 발생하였고, 투자활동현금흐름의 경우 단기금융상품이 27,536백만원이 증가하면서 44,305백만원의 음(-)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 2020년 01월, 2020년 07월 두 차례의 주주배정 후 실권주 일반공모의 납입이 완료되면서 92,724백만원이 유입되었고, 제4회 전환사채 를 발행하여 23,520백만원이 유입되었습니다. 이를 통하여 3회차 전환사채를 일부 상환하면서 9,541백만원의 현금 유출이 있어 총 106,235백만원의 양(+)의 재무활동현금흐름이 있었습니다. 이에 따라 2020년 연결기준 62,432백만원의 현금 및 현금성자산을 보유하고 있습니다.
2021년 연결기준으로 15,888백만원의 당기순손실이 발생하였으며, 매출이 증가함에 따라 매입채무 증가 10,610백만원 및 기타유동비금융자산 증가 4,471백만원 등으로 자산부채증감에서 8,254백만원이 유입되었고, 감가상각비 2,937백만원 및 사용권자산상각비 1,547백만원 등으로 현금유출입이 없는 손익 가감이 2,550백만원이 있었음에도 4,849백만원의 음(-)의 영업활동현금흐름이 발생하게 되었습니다. 투자활동현금흐름의 경우 단기금융상품 57,000백만원 증가 및 유형자산의 82,442백만원 취득 등으로 146,398백만원의 음(-)의 현금흐름이 발생하였으며, 2021년 12월 주주배정 후 실권주 일반공모 방식의 유상증자를 통한 113,760백만원 등으로 111,023백만원의 양(+)의 재무활동현금흐름이 발생하면서 2021년말 연결기준 22,310백만원의 현금 및 현금성자산을 보유하게 되었습니다.
2022년에는 연결기준으로 38,150백만원의 당기순손실이 발생하였으며, 감가상각비 3,122백만원 등 현금유출이 없는 손익가감 7,593백만원 등이 발생하면서 총 24,113백만원의 음(-)의 영업활동현금흐름이 발생하였습니다. 또한 건설중인자산 등의 취득으로 45,306백만원의 유형자산 취득이 있었으나, 단기금융상품에서 53,000백만원이 감소하면서 총 8,055백만원의 양(+)의 투자활동현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 제5회 사모 전환사채 11,700백만원 등으로 7,013백만원의 현금이 유입되었으며, 이로 인하여 2022년말 연결기준 13,261백만원의 현금 및 현금성자산을 보유하게 되었습니다.
2023년 3분기에는 연결기준으로 37,967백만원의 당기순손실이 발생하였으며, 감가상각비 6,675백만원, 사용권자산상각비 1,741백만원 등 현금유출이 없는 손익가감 9,396백만원 등이 발생하면서 총 17,586백만원의 음(-)의 영업활동현금흐름이 발생하였고, 투자활동현금흐름의 경우 단기금융상품의 증감이 -71,846백만원이 발생하였고, 총 24,467백만원의 양(+)의 현금흐름이 발생하였습니다. 재무활동현금흐름의 경우 사채의 상환으로 인해 16,280백만원이 감소하여 총 13,345백만원의 음(-)의 재무활동현금흐름이 있었습니다. 이에 따라 2023년 3분기말 연결기준 6,805백만원의 현금 및 현금성자산을 보유하고 있습니다.
한편, 당사는 2020년 01월, 2020년 07월, 2021년 12월 세 차례의 주주배정 후 실권주 일반공모를 통하여 유상증자 대금이 유입되고 전환사채를 상환하면서 연결 기준으로 유동비율이 2020년말 296.31%에서 2021년말 387.34% 개선되는 추세를 보였습니다. 그러나 당기순손실이 심화되면서 2022년말 유동비율 215.94%, 2023년 3분기 유동비율 140.31%로 악화되었습니다.
| [최근 3년 및 2023년 3분기 연결기준 당사 유동성 관련 비율] |
| 구 분 | 2023년 3분기 |
2022년 | 2021년 | 2020년 | 비 고 |
| 유동비율 | 140.31% | 215.94% | 387.34% | 296.31% | 유동자산 / 유동부채 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으며, 2023년 3분기말 기준 연결기준으로 유동비율 140.31% 입니다.
투자자들께서는 대내외적 환경이 급격하게 침체되거나 당사의 영업 성과에 부정적인 영향으로 음(-)의 현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있음을 면밀히 검토하시고 투자에 임해주시기 바랍니다.
| 차. 매출채권 회수 지연 가능성에 따른 위험 당사 매출채권의 연령분석을 해보았을 때, 대부분의 매출채권은 6개월 이하이며, 이에 따라 대손충당금설정률은 2020년말 연결기준 5.67%, 2021년말 4.40%, 2022년말 14.80%, 2023년 3분기말 8.60%를 보이고 있습니다. 또한 2022년말 및 2023년 3분기말 기준 매출채권 총액 대비 1년이 초과한 매출채권의 비율은 각 3.83%, 11.46% 수준으로, 당사의 재무구조에 유의적인 부정적인 영향을 미칠 가능성은 낮은 것으로 판단되고 있습니다. 그러나, 매출채권 부실 방지에 대한 적극적인 노력이 미진할 경우 당사의 자금수지 및 재무상태에 악영향을 줄 수 있으며, 충당금 설정률이 높아질 경우 손익에 부정적인 영향을 미칠 수 있습니다. 한편, 제약 사업 부문의 경우 선수금 50%를 수령 후에 시료 생산에 들어가고 있으나, 패브릭 사업부문의 경우 고객사의 외형에 따라 현금까지의 결제일자의 차이가 많이 발생할 수 있어 매출채권 회수에 어려움이 발생할 수 있습니다. 이처럼 매출채권 회수 시간의 지연은 자금수지 불균형으로 이어질 가능성이 있으며, 매출을 위한 투자자금(원자재 구입비, 운영자금 등)의 부족으로 매출 부진을 초래하거나, 매출이 증대 함에도 불구하고 현금 회수 지연에 따른 유동자금 감소로 인한 유동성 위기를 겪을 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 보고기간 종료일 현재 매출채권, 대여금, 미수금 등 받을 채권 잔액의 회수가능성에 대한 개별분석 및 과거의 5년간의 대손경험율을 토대로 하여 매출채권 연령(Aging)을 기초로 하여 예상되는 대손추정액을 대손충당금으로 설정하고 있습니다.
또한 당사는 회사정리절차개시, 화의절차개시 등으로 인하여 채권의 원금, 기간, 이자율 등이 재조정된 채권에 대해 현재가치로 평가하고 있는 바, 장부가액과 현재가치와의 차이를 대손상각비로 처리하고 있습니다. 또한 대손경험율을 산정함에 있어서 대손금의 해당여부를 판단하는 대손처리기준은 세법과 거래처별 개별분석으로 처리하고 있습니다. 한편 폐업 또는 기타의 사유일 경우에는 회수가능성을 별도로 판단하여, 기 설정된 대손율의 적용과는 별도로 개별 건에 대해서 해당 건별로 대손충당금으로 추가 설정하고 있습니다. 매출채권잔액기준으로 연령(aging)분석 결과를 토대로 최대 100%까지 대손상각률을 적용, 대손예상액을 산정하여 반영하고 있습니다.
| [당사 연결기준 매출채권 연령분석 및 추이] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 |
2022년 3분기 | 2022년 | 2021년 | 2020년 |
| 매출채권 총액 | 6,420 | 12,794 | 10,541 | 7,780 | 7,853 |
| 6개월이하 | 3,663 | 12,738 | 9,415 | 10,077 | 8,920 |
| 6개월초과-1년이하 | 139 | 1,800 | 2,736 | 89 | 106 |
| 1년초과-3년이하 | 448 | 318 | 320 | 304 | 343 |
| 3년초과 | 288 | 24 | 83 | - | 192 |
| 적용대상 제외 (주3) | 1,883 | -2,086 | -2,014 | -2,692 | -1,707 |
| 대손충당금 | -552 | -1,423 | -1,560 | -342 | -445 |
| 매출채권 장부가액 | 5,868 | 11,371 | 8,980 | 7,438 | 7,408 |
| 대손충당금 설정률 | 8.60% | 11.12% | 14.80% | 4.40% | 5.67% |
| 자산총계 | 191,399 | 222,867 | 222,867 | 250,857 | 136,571 |
| 자산총계 대비 매출채권(장부금액) 비중 | 3.07% | 5.10% | 4.03% | 2.96% | 5.42% |
| 매출액 | 27,448 | 48,718 | 48,718 | 38,700 | 41,503 |
| 평균 매출채권회전율(회) | 4.32 | 5.18 | 5.93 | 5.21 | 5.02 |
| 출처) 당사 정기보고서 및 당사 제시 주1) 매출채권회전율 = 연환산 매출액÷{(전기매출채권+당기매출채권)÷2}] 주2) 2023년 3분기 평균 매출채권회전율(회)는 매출액을 단순 연환산하여 산정하였습니다. 주3) 적용대상 제외의 경우 특수관계인, 미청구분, 받을어음 및 전자어음은 연체율을 적용하지 않았으며, 내부거래제거분도 포함되어 있습니다. |
당사의 최근 3년간 매출채권 내역을 살펴보면, 매출액이 증가하면서 매출채권 또한 증가하여 왔습니다. 2021년 코로나19 심화로 인해 CDMO 및 패브릭 부문 매출이 감소함에도 불구하고 2020년말 기준 원/달러 환율이 1,088.0원에서 2021년말 기준 1,185.5원으로 증가하여 대손충당금을 제외한 매출채권 장부가액은 2020년 7,408백만원에서 2021년 7,438백만원으로 증가하였습니다. 2022년 코로나19 회복에 따른 매출 상승과 연말 기준 원/달러 환율이 1,267.3원까지 증가함에 따라 대손충당금을 제외한 매출채권 장부가액이 8,980백만원까지 증가하였습니다. 2023년 3분기말 기준 원/달러 평균 환율이 1344.8원으로 전년말 평균 환율 1,267.3원 대비 증가함에 따라 매출채권 잔액은 전년 동기대비 49.82% 감소한 6,420백만원입니다.
최근 3년 매출채권이 증가함에 따라 평균 매출채권회전율의 경우 2020년 5.02회 이후 2021년 5.21회, 2022년 5.93회로 증가하였으나, 2023년 3분기에 매출채권이 감소함에 따라 매출액을 단순 연환산한 값이 2022년대비 57.74% 감소하여 매출채권회전율이 4.32회를 기록하였습니다.
매출채권의 연령분석을 해보았을 때, 대부분의 매출채권은 6개월 이하이며, 이에 따라 대손충당금설정률은 2020년말 연결기준 5.67%, 2021년말 4.40%, 2022년말 14.80%, 2023년 3분기말 8.60% 추세를 보이고 있습니다. 또한 2022년말 및 2023년 3분기말 기준 매출채권 총액 대비 1년이 초과한 매출채권의 비율은 각 3.83%, 11.46% 수준으로, 당사의 재무구조에 유의적인 부정적인 영향을 미칠 가능성은 낮은 것으로 판단되고 있습니다. 그러나, 매출채권 부실 방지에 대한 적극적인 노력이 미진할 경우 당사의 자금수지 및 재무상태에 악영향을 줄 수 있으며, 충당금 설정률이 높아질 경우 손익에 부정적인 영향을 미칠 수 있습니다.
한편, 제약 사업 부문의 경우 선수금 50%를 수령 후에 시료 생산에 들어가고 있으나, 패브릭 사업부문의 경우 고객사의 외형에 따라 현금까지의 결제일자의 차이가 많이 발생할 수 있어 매출채권 회수에 어려움이 발생할 수 있습니다. 이처럼 매출채권 회수 시간의 지연은 자금수지 불균형으로 이어질 가능성이 있으며, 매출을 위한 투자자금(원자재 구입비, 운영자금 등)의 부족으로 매출 부진을 초래하거나, 매출이 증대 함에도 불구하고 현금 회수 지연에 따른 유동자금 감소로 인한 유동성 위기를 겪을 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 카. 재고자산 진부화 위험 당사는 최근 3년 재고자산 증가하였으며, 2020년말 연결기준 8,299백만원에서 2023년 3분기말 연결기준 15,540백만원이 되었습니다. 총자산 대비 재고자산 구성비율은 2021년 설비투자 목적의 주주배정 후 실권주 일반공모 방식의 유상증자 자금 조달로 인해 자산의 급격한 증가로 2020년 6.08%에서 2021년 4.26%로 감소하였지만, 2023년 3분기에 재고자산 증가하여 8.12%로 증가하였습니다. 총자산대비 재고자산 구성비율은 2020년 이후 10% 이내 수준을 보이고 있습니다. 당사는 향후 보다 정확한 수요예측 및 생산량조절을 통해 적정수준의 재고자산 보유를 위해 노력하고, 진부화된 재고자산에 대한 적시 평가를 통한 관리를 지속할 예정입니다. 다만, 향후 매출 증가 및 품목 다변화에 의한 재고자산 증가 및 산업환경 변화에 대한 적응 미숙으로 인한 재고자산의 진부화 가능성은 여전히 존재하며, 이에 따라 재고자산의 평가손실 및 폐기가 지속된다면 당사의 수익성에 악영향을 미칠 수 있습니다. 투자자께서는 이점 유의하시기 바랍니다. |
당사는 재고자산을 총평균법에 의해 산정된 취득원가로 평가하고 있으며, 연중 계속기록법에 의하여 수량 및 금액을 계산하고 매 회계연도의 결산기에 실지 재고조사를 실시하여 그 기록을 조정하고 있습니다. 다만, 재고자산의 순실현가능금액이 취득원가보다 하락한 경우에는 시가를 재무상태표가액으로 하고 있습니다. 한편, 감액된 재고자산의 시가가 장부금액보다 상승한 경우에는 최초의 장부금액을 초과하지 않는 범위내에서 평가손실을 환입하고 있습니다.
| [재고자산 현황] |
| (단위 : 백만원) |
| 구 분 | 2023년 3분기 |
2022년 | 2021년 | 2020년 |
| 제품(총액) | 4,856 | 3,764 | 3,324 | 2,283 |
| (제품 평가충당금) | -173 | -107 | -53 | -26 |
| 제품(장부가액) | 4,684 | 3,657 | 3,272 | 2,256 |
| 상품(총액) | 2,295 | 3,143 | 2,005 | 1,892 |
| (상품 평가충당금) | -184 | -94 | -29 | -24 |
| 상품(장부가액) | 2,111 | 3,049 | 1,977 | 1,868 |
| 재공품 | 1,151 | 785 | 671 | 490 |
| 원재료(총액) | 7,521 | 6,828 | 4,133 | 3,518 |
| (원재료 평가충당금) | -76 | -70 | -109 | -114 |
| 원재료(장부가액) | 7,445 | 6,758 | 4,025 | 3,404 |
| 미착품 | 149 | 615 | 744 | 281 |
| 합 계 | 15,540 | 14,864 | 10,688 | 8,299 |
| 총자산대비 재고자산 구성비율(%) | 8.12% | 6.67% | 4.26% | 6.08% |
| 출처) 당사 정기보고서 및 당사 제시 주1) 총자산대비 재고자산 구성비율(%) = [재고자산÷기말자산총계×100] |
당사는 최근 3년 재고자산 증가하였으며, 2020년말 연결기준 8,299백만원에서 2023년 3분기말 연결기준 15,540백만원이 되었습니다. 총자산 대비 재고자산 구성비율은 2021년 설비투자 목적의 주주배정 후 실권주 일반공모 방식의 유상증자 자금 조달로 인해 자산의 급격한 증가로 2020년 6.08%에서 2021년 4.26%로 감소하였지만, 2023년 3분기에 재고자산 증가하여 8.12%로 증가하였습니다. 총자산대비 재고자산 구성비율은 2020년 이후 10% 이내 수준을 보이고 있습니다.
당사의 재고자산은 대부분 패브릭사업에 속하며 더불어 원활한 패브릭사업을 위하여 일정량의 재고를 보유하여야 합니다. 하지만, 패브릭 사업부문의 매출액이 증가하지 않고 최근 현재와 같은 수준 또는 하회하는 매출이 지속되고 있어 재고자산이 적절하게 소진되지 못하고 있습니다. 매출이 발생하지 못해 재고자산이 증가할 경우 창고에 보관된 기간이 길어지는 것을 의미하므로 회사 입장에서는 재고 보관비용의 증가, 재고자산의 노후화 위험을 동시에 부담할 가능성을 시사합니다.
당사는 향후 보다 정확한 수요예측 및 생산량조절을 통해 적정수준의 재고자산 보유를 위해 노력하고, 진부화된 재고자산에 대한 적시 평가를 통한 관리를 지속할 예정입니다. 다만, 향후 매출 증가 및 품목 다변화에 의한 재고자산 증가 및 산업환경 변화에 대한 적응 미숙으로 인한 재고자산의 진부화 가능성은 여전히 존재하며, 이에 따라 재고자산의 평가손실 및 폐기가 지속된다면 당사의 수익성에 악영향을 미칠 수 있습니다. 투자자께서는 이점 유의하시기 바랍니다.
| 타. 환율변동에 따른 위험 당사의 최근 3개년 및 2023년 3분기까지 매출액의 해외매출 비중은 88.95% 수준으로, 2020년 연결기준 매출액 41,503백만원 중 93.28%에 해당하는 38,712백만원, 2021년 연결기준 매출액 38,700백만원 중 91.50%에 해당하는 35,412백만원, 2022년 연결기준 매출액 44,180백만원 중 90.69%에 해당하는 44,180백만원, 2023년 3분기 기준 27,448백만원 중 88.95%에 해당하는 24,416백만원의 매출이 해외에서 발생하고 있어 관련 통화 환율변동에 따른 위험이 증가하고 있습니다. 당사에서는 향후 예측할수 없는 환율의 급변동 상황 또는 기존 매출처의 경영(제품지급 결제구조) 및 영업악화등의 경우가 발생될 경우 당사의 생산 및 매출, 수익성에 부정적인 영향을 미칠수 있으니 투자자분들께서는 주의하시기 바랍니다. |
당사의 최근 3개년 및 2023년 3분기까지 매출액의 해외매출 비중은 88.95% 수준으로, 2020년 연결기준 매출액 41,503백만원 중 93.28%에 해당하는 38,712백만원, 2021년 연결기준 매출액 38,700백만원 중 91.50%에 해당하는 35,412백만원, 2022년 연결기준 매출액 44,180백만원 중 90.69%에 해당하는 44,180백만원, 2023년 3분기 기준 27,448백만원 중 88.95%에 해당하는 24,416백만원의 매출이 해외에서 발생하고 있어 관련 통화 환율변동에 따른 위험이 증가하고 있습니다. 특히, 당사는 대부분의 거래처가 해외에 존재하고 매출이 해외에 집중되어 있는 만큼 환율 변동에 큰 영향을 받고 있습니다. 특히 미국 달러화와 관련된 환율 변동 위험에 노출되어 있으며, 당사의 손익이 환율에 민감하게 반응하여 변동가능성을 내포하고 있는 상황입니다.
| [판매경로별 매출구성] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 |
2022년 3분기 | 2022년 | 2021년 | 2020년 | |||||
| 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | |
| 수 출 | 24,416 | 88.95% | 35,666 | 91.75% | 44,180 | 90.69% | 35,412 | 91.50% | 38,712 | 93.28% |
| 내 수 | 3,032 | 11.05% | 3,207 | 8.25% | 4,538 | 9.31% | 3,288 | 8.50% | 2,791 | 6.72% |
| 합 계 | 27,448 | 100% | 38,873 | 100% | 48,718 | 100% | 38,700 | 100% | 41,503 | 100% |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 외화거래 수행에 따라 다양한 환율변동위험에 노출되어 있습니다. 주요 통화별 환율변동시 민감도 분석내용은 다음과 같습니다.
| [통화별 환율변동시 민감도 분석] |
| (단위 : 백만원) |
| 구분 | 2023년 3분기 |
2022년 | 2021년 | 2020년 | |||||
| 10%상승 | 10%하락 | 10%상승 | 10%하락 | 10%상승 | 10%하락 | 10%상승 | 10%하락 | ||
| 본점 | USD | 14,943 | -14,943 | 13,140 | -13,140 | 8,815 | -8,815 | 3,549 | -3,549 |
| EUR | 2 | -2 | 2 | -2 | 2 | -2 | 2 | -2 | |
| 해외지점 | USD | 521 | -521 | 673 | -673 | 115 | -115 | 141 | -141 |
| 합계 | USD | 15,463 | -15,463 | 13,814 | -13,814 | 8,930 | -8,930 | 3,690 | -3,690 |
| EUR | 2 | -2 | 2 | -2 | 2 | -2 | 2 | -2 | |
| 출처) 당사 정기보고서 및 당사 제시 |
외환자산 및 부채는 환율 변동에 따라 외화관련 손익으로 반영되며, 2020년 연결기준 외화관련이익 356백만원, 외화관련 손실 2,781백만원, 2021년 연결기준 외화관련 이익 4,707백만원과 외화관련 손실 345백만원, 2022년 연결기준 외화관련 이익 1,259백만원, 외화관련 손실 981백만원, 2023년 3분기 외화관련이익 1,032백만원, 외화관련 손실 384백만원이 발생하였습니다.
| [최근 3년 및 2023년 3분기 외화관련 손익] |
| (단위 : 백만원) |
| 구 분 | 2023년 3분기 |
2022년 | 2021년 | 2020년 |
| 외환차익 | 261 | 1,147 | 1,225 | 266 |
| 외화환산이익 | 1,356 | 112 | 3,482 | 90 |
| 외화관련 이익 소계 | 1,032 | 1,259 | 4,707 | 356 |
| 외환차손 | 204 | 688 | 304 | 1,146 |
| 외화환산손실 | 180 | 293 | 41 | 1,635 |
| 외화관련 손실 소계 | 384 | 981 | 345 | 2,781 |
| 출처) 당사 정기보고서 및 당사 제시 |
상기와 같이 당사가 보유한 외화자산, 매출채권 등의 규모나 외화의 유출입 흐름 등을 감안할 때, 환율 변동에 따른 위험이 있습니다. 다만 당사에서는 해외 매출에 따른 외화 유입 시 이를 외화채무로 결제하여 외화 관련 위험을 상계하고 있어 환율 변동에 따른 리스크가 전체 경영에 미치는 영향이 다소 크지 않다고 판단하고 있습니다. 또한 거래처로부터 매출에 대한 외화가 입금이 되면 경영진은 내부적으로 환율 변동에 대한 환위험을 수시로 측정하고 관리하여 환율변동에 따른 위험을 축소하고 있습니다. 그러나 당사에서는 향후 예측할수 없는 환율의 급변동 상황 또는 기존 매출처의 경영(제품지급 결제구조) 및 영업악화등의 경우가 발생될 경우 당사의 생산 및 매출, 수익성에 부정적인 영향을 미칠수 있으니 투자자분들께서는 주의하시기 바랍니다.
| 파. 우리사주조합 미배정에 관한 사항 「자본시장과 금융투자업에 관한 법률」제165조의7(우리사주조합원에 대한 주식의 배정 등에 관한 특례)에 따르면 유가증권시장에 상장된 법인이 주식의 모집하거나 매출하는 경우 우리사주조합에 발행예정주식수의 20%를 배정하여야 합니다. 그러나「자본시장과 금융투자업에 관한 법률 시행령」제176조의9제3항제1호에 의거 당사 우리사주조합에 대한 배정을 실시하지 않습니다. 당사 우리사주조합은 1987년 10월 01일 설립되었으며, 본 공시서류 제출 전일 현재 43명으로 구성되어 있습니다. 우리사주조합원이 직전 12개월간 지급받은 급여총액 2,304백만원으로, 금번 유상증자 모집예정금액 66,660백만원의 20%인 13,332백만원에 미달하는 관계로 당사 우리사주조합원에 대한 우선배정을 실시하지 않을 계획입니다. 우리사주조합은 회사의 내부 관계자로서 조합원의 유상증자 참여 여부가 투자자에게 중요한 투자판단 근거로써 활용될 수 있습니다. 다만, 금번 유상증자의 경우 우리사주조합에 우선배정을 진행하지 않을 예정으로, 투자자께서는 이 점 유의하시기 바랍니다. |
「자본시장과 금융투자업에 관한 법률」제165조의7(우리사주조합원에 대한 주식의 배정 등에 관한 특례)에 따르면 유가증권시장에 상장된 법인이 주식의 모집하거나 매출하는 경우 우리사주조합에 발행예정주식수의 20%를 배정하여야 합니다. 그러나「자본시장과 금융투자업에 관한 법률 시행령」제176조의9제3항제1호에 의거 당사 우리사주조합에 대한 배정을 실시하지 않습니다.
당사 우리사주조합은 1987년 10월 01일 설립되었으며, 본 공시서류 제출 전일 현재43명으로 구성되어 있습니다. 우리사주조합원이 직전 12개월간 지급받은 급여총액 2,304백만원으로, 금번 유상증자 모집예정금액 66,660백만원의 20%인 13,332백만원에 미달하는 관계로 당사 우리사주조합원에 대한 우선배정을 실시하지 않을 계획입니다.
이에 따라 당사는 관련 법률을 근거, 금번 진행하는 유상증자의 경우 우리사주조합에 우선배정하지 않고 기존 주주에게 공모 주식 100%를 배정할 예정입니다. 금번 유상증자의 배정 방법은 다음과 같습니다.
|
[공모방법 : 주주배정후 실권주 일반공모] |
| 모 집 대 상 | 주 수(%) | 비 고 |
| 구주주 청약 (신주인수권증서 보유자 청약) |
22,000,000주 (100%) |
▶ 구주 1주당 신주 배정비율 : 1주당 0.2810985992주 ▶ 신주배정 기준일 : 2024년 01월 08일 ▶ 구주주 청약일 : 2024년 02월 14일~2024년 02월 15일 (2일간) ▶ 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권 증서가 배정됨) |
| 초과 청약 | - | ▶ 「자본시장과 금융투자업에 관한 법률」제165조의6의제2조제2항에 의거 초과청약 ▶ 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 ▶ 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 |
| 일반모집 청약 (고위험고수익투자신탁청약 포함) |
- | ▶ 구주주 및 초과청약 후 발생하는 단수주 및 실권주에 대해 배정됨 ▶ 일반모집 청약일 : 2024년 02월 19일 ~2024년 02월 20일(2일간) |
| 합 계 | 22,000,000주 (100%) |
- |
| 주1) | 본 건 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행되며, 구주주의 청약결과 발생하는 실권주 및 단수주에 대해서는 이를 일반에게 공모합니다. |
| 주2) | 「자본시장과 금융투자업에 관한 법률」제165조의7(우리사주조합원에 대한 주식의 배정 등에 관한 특례) 에 의해 당사의 우리사주조합은 공모주식의 20.0%를 배정받을 권리가 존재합니다. 그러나 「자본시장과 금융투자업에 관한 법률 시행령」제176조의9(우리사주조합원에 대한 주식의 배정 등에 관한 특례의 예외 등)에 의거하여, 당사 우리사주조합원에 대한 배정은 우리사주조합 급여 총액이 우리사주조합 배정금액보다 미달하는 관계로 우선배정하지 아니합니다. |
| 주3) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.2810985992의 비율로 배정하되, 1주 미만의 단수주는 절사합니다. 다만, 신주배정기준일 현재 신주의 배정비율은 신주배정기준일 전 주식관련사채의 권리 행사, 주식매수선택권의 행사, 자기주식의 변동 등으로 인하여 변동될 수 있습니다. |
| 주3) | 신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20.0%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. ① 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수 ② 신주인수권증서 청약 한도주식수 = 보유한 신주인수권 증서의 수량 ③ 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율(20.0%) |
| 주4) | 구주주 청약 결과 발생한 미청약주식은 다음 각항과 같이 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」제9조제2항제3호에 따라 고위험고수익투자신탁에 공모주식의 5%를 배정하고, 나머지 95%에 해당하는 주식은 개인투자자 및 기관투자자에게 구분 없이 배정합니다. 고위험고수익투자신탁에 대한 공모주식 5%와 개인투자자 및 기관투자자에 대한 공모주식 95%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 어느 한 그룹에서 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. ① 1단계: 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. ② 2단계: 이후 최종 잔여주식은 최고청약자부터 순차적으로 우선 배정하되, 동순위 최대청약자가 최종 잔여 주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다. |
| 주5) | 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수에 미달하는 경우에는 청약주식수대로 배정하되 잔여주식은 대표주관회사가 자기의 계산으로 인수합니다. |
| 주6) | 단, 「증권 인수업무 등에 관한 규정」제9조제2항에 의거 일반청약자에 대하여 배정하여야할 주식이 25,000주 이하(액면가 1,000원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 일반에게 공모하지 않고, 대표주관회사가 인수할 수 있습니다. |
우리사주조합은 회사의 내부 관계자로서 조합원의 유상증자 참여 여부가 투자자에게 중요한 투자판단 근거로써 활용될 수 있습니다. 다만, 금번 유상증자의 경우 우리사주조합에 우선배정을 진행하지 않을 예정으로, 투자자께서는 이 점 유의하시기 바랍니다.
| 「자본시장과 금융투자업에 관한 법률」 |
|
제165조의7(우리사주조합원에 대한 주식의 배정 등에 관한 특례) 1. 「외국인투자 촉진법」에 따른 외국인투자기업 중 대통령령으로 정하는 법인이 주식을 발행하는 경우 2. 그 밖에 해당 법인이 우리사주조합원에 대하여 우선배정을 하기 어려운 경우로서 대통령령으로 정하는 경우 ② 우리사주조합원이 소유하는 주식수가 신규로 발행되는 주식과 이미 발행된 주식의 총수의 100분의 20을 초과하는 경우에는 제1항을 적용하지 아니한다. ③ 제165조의6제1항제1호의 방식으로 신주를 발행하는 경우 제1항에 따른 우리사주조합원에 대한 배정분에 대하여는 「상법」 제419조제1항부터 제3항까지의 규정을 적용하지 아니한다. ④ 금융위원회는 제1항에 따른 우리사주조합원에 대한 주식의 배정과 그 주식의 처분 등에 필요한 기준을 정하여 고시할 수 있다. |
| 「자본시장과 금융투자업에 관한 법률 시행령」 |
|
제176조의9(우리사주조합원에 대한 주식의 배정 등에 관한 특례의 예외 등) ② 법 제165조의7제1항 각 호 외의 부분 본문에서 "대통령령으로 정하는 증권시장"이란 유가증권시장을 말한다. ③ 법 제165조의7제1항제2호에서 "대통령령으로 정하는 경우"란 다음 각 호의 어느 하나에 해당하는 경우를 말한다. 1. 주권상장법인(유가증권시장에 주권이 상장된 법인을 말한다)이 주식을 모집 또는 매출하는 경우 우리사주조합원(「근로복지기본법」에 따른 우리사주조합의 조합원을 말한다. 이하 이 조에서 같다)의 청약액과 법 제165조의7제1항 각 호 외의 부분 본문에 따라 청약 직전 12개월간 취득한 해당 법인 주식의 취득가액(취득가액이 액면액에 미달하는 경우에는 액면액을 말한다. 이하 이 조에서 같다)을 합산한 금액이 그 법인으로부터 청약 직전 12개월간 지급받은 급여총액(소득세과세대상이 되는 급여액을 말한다)을 초과하는 경우 ④ 법 제165조의7제2항에 따른 우리사주조합원의 소유주식수는 법 제119조제1항에 따라 증권의 모집 또는 매출에 관한 신고서를 금융위원회에 제출한 날(법 제119조제2항 전단에 따른 일괄신고서를 제출하여 증권의 모집 또는 매출에 관한 신고서를 제출하지 아니하는 경우에는 주주총회 또는 이사회의 결의가 있은 날)의 직전일의 주주명부상 우리사주조합의 대표자 명의로 명의개서된 주식에 따라 산정한다. 다만, 「근로복지기본법」 제43조제1항에 따른 수탁기관(이하 이 항에서 "수탁기관"이라 한다)을 통해서 전자등록(「주식ㆍ사채 등의 전자등록에 관한 법률」 제2조제2호에 따른 전자등록을 말한다. 이하 같다)된 주식의 경우에는 같은 법 제22조제2항에 따른 고객계좌부에 따라 산정하고, 수탁기관이 예탁결제원에 예탁한 주식의 경우에는 법 제310조제1항에 따른 투자자계좌부에 따라 산정한다. |
| 「증권 인수업무 등에 관한 규정」 |
|
제9조(주식의 배정) |
| 「근로복지기본법」 |
|
제38조(우리사주조합원에 대한 우선배정의 범위) ② 제1항의 법인 외의 법인이 「자본시장과 금융투자업에 관한 법률」에 따라 모집 또는 매출하거나 유상증자를 하는 경우 그 모집 등을 하는 주식 총수의 100분의 20의 범위에서 「상법」 제418조에도 불구하고 우리사주조합원에게 해당 주식을 우선적으로 배정할 수 있다. |
| 「근로복지기본법 시행령」 |
|
제19조의2(우리사주조합원에 대한 우선배정의 범위) ② 법 제38조제1항에서 "대통령령으로 정하는 증권시장"이란 유가증권시장을 말한다. |
| 출처) 국가법령정보센터 |
| 하. 내부통제 미작동 위험 당사는 감사인으로부터 2022년도 내부회계관리제도에 대한 감사를 받았으며, 아래와 같이 내부회계관리제도의 미비점 및 중요한 취약점에 대한 지적사항과 부적정의견을 받았습니다. 이에 당사는 2023년 상반기에 내부회계관리제도에 대한 지적사항을 개선하고 내부통제활동에 대한 재구축을 위해 외부용역 계약을 체결하였고, 미비점을 보완할 계획입니다. 임원 급여 지급 및 유상증자 자금 사용과 관련하여 감사인으로부터 내부통제에 대해 지적받은 사항은 없지만, 내부통제 절차 미비로 인해 중요취약점으로 지적받을 시 감사의견에 부정적인 영향을 미칠 수 있습니다. |
당사는 감사인으로부터 2022년도 내부회계관리제도에 대한 감사를 받았으며, 아래와 같이 내부회계관리제도의 미비점 및 중요한 취약점에 대한 지적사항과 부적정의견을 받았습니다. 이에 당사는 2023년 상반기에 내부회계관리제도에 대한 지적사항을 개선하고 내부통제활동에 대한 재구축을 위해 외부용역 계약을 체결하였고, 미비점을 보완할 계획입니다. 임원 급여 지급 및 유상증자 자금 사용과 관련하여 감사인으로부터 내부통제에 대해 지적받은 사항은 없지만, 내부통제 절차 미비로 인해 중요취약점으로 지적받을 시 감사의견에 부정적인 영향을 미칠 수 있습니다.
| 사업연도 | 감사인 | 구분 | 의견 내용 (비적정) | 상세내용 | 개선계획 | 관련투자 위험 |
|---|---|---|---|---|---|---|
| 2022년 | 삼덕회계법인 | 「주식회사 등의 외부감사에 관한 법률」 제8조 제6항의 종합의견 |
우리는 대한민국의 회계감사기준에 따라 감사를 수행하였습니다. 이 기준에 따른 우리의 책임은 이 감사보고서의 내부회계관리제도감사에 대한 감사인의 책임 단락에 기술되어 있습니다. 우리는 내부회계관리제도감사와 관련된 대한민국의 윤리적 요구사항에 따라 회사로부터 독립적이며, 그러한 요구사항에 따른 기타 윤리적 책임들을 이행하였습니다. 우리가 입수한 감사증거가 부적정의견을 위한 근거로서 충분하고 적합하다고 우리는 믿습니다. 중요한 취약점은 내부회계관리제도 미비점 혹은 미비점들의 결합으로, 회사의 재무제표의 중요한 왜곡표시가 적시에 예방되거나 발견ㆍ수정되지 못할 가능성이 낮지 않은 경우에 존재합니다. 다음의 중요한 취약점이 식별되었으나, 첨부된 내부회계관리제도 운영실태보고서에는 포함되지 않았습니다. |
- | 당사는 2023년 KPMG(삼정) 회계법인과 함께 내부회계관리제도의 개선을 통하여 보다 강화된 통제활동을 구축하고 개선중입니다. | - |
| (1) 회사는 내부회계관리제도에서 요구하는 통제환경, 위험평가 ,통제활동, 정보 및 의사소통 및 모니터링 수준이 운영되고 있지 않습니다. | 회사의 내부회계관리 통제의 설계내용중 외부서비스제공자에게 윤리강령에 대한 서약서를 받게 되어 있으나, 서약서를 전달 및 수령하지 못하였습니다. 감사의 내부회계관리제도 감독 사항과 관련된 내용이 이사회에 보고한 내용이 없습니다. 내부회계 통제담당자들의 내부회계관련 통제활동에 대한 평가가 인사고과에 반영되지 않았습니다. |
회사 공식 홈페이지에 윤리강령을 게시하여 외부서비스제공자도 이를 인지할 수 있도록 공유하여 개선하였습니다. 내부회계관리제도의 감독이 효과적으로 진행될 수 있도록 이사회 의사록에 기재되어 이사들 및 감사가 공유할 수 있도록 개선하였습니다. 통제담당자들의 내부회계운영의 성과 달성에 대한 평가를 인사고과에서 반영하여 개선할 예정입니다. |
회사의 윤리경영 및 실천지침에 대한 내용이 외부서비스제공자에게 전달되지 않아 진원생명과학 경영진의 윤리경영에 대한 실천지침이 준수되지 않을 위험이 있습니다. 감사의 내부회계관리제도 감독이 효과적으로 이행되지 않아서 내부회계관리제도의 목적이 달성되지 못할 위험이 있습니다. 성과평가를 통한 윤리규범/내부통제 준수 촉진 부족 및 미준수 징계를 통한 경각심 고취 부족으로 임직원의 도덕적 해이 및 내부통제 불이행이 만연해질 위험이 있습니다. |
|||
| 회사는 윤리강령이 외부서비스제공자(벤더 및 협력사)에게 공유되고 있지 않으며, 회사는 "감사의 내부회계관리제도 감독 사항" 관련 내용을 이사회에 보고한 사실이 없습니다. 또한 통제담당자등에 대한 적격성평가, 성과평가, 보상 또는 징계조치가 적시에 이루어지고 있지 않습니다. | ||||||
| 회사는 회계기준변경 검토보고서를 작성하지 않고 있으며, 위험 식별 및 분석을 위한 부서별 Risk Survey를 적시에 수행하고 있지 않습니다. | 회계기준 변경에 대하여 검토하고 승인한 증거를 찾을 수 없었습니다. 부서별로 위험 식별 및 분석을 위한 Risk servey 를 적시에 수행하고 이를 검토 및 승인한 문서가 없었습니다. |
회계기준변경 사항에 대하여 회사의 재무제표에 미칠 영향을 검토하고 승인하는 절차를 추가로 개선할 예정입니다. 해당 사항에 대하여 별도의 통제활동으로 개선중입니다. |
회사에 중요한 영향을 미치는 회계기준변경내역이 충분히 검토/분석되지 않아서 변경된 회계기준변경내역이 회사의 회계처리에 적시에 반영되지 못할 위험이 있습니다. 주요 변화사항들이 적시에 식별되지 않아 이에 따른 위험요인과 이에 대응하기 위한 통제활동이 적시에 업데이트되지 못할 위험이 있습니다. |
|||
| 회사는 프로세스별 업무분장(Segregation Of Duty)의 주기적 관리가 이루어지지 않고 있습니다. | 회사의 업무분장에 관하여는 사규로 규정되어 있으나, 주기적으로 검토한 증거가 없었습니다. | 부서별 업무분장에 대하여 문서로 개선중입니다. | 프로세스별 주요 업무에 대한 업무분장이 이루어지지 않아 통제가 우회되고 부정이 발생될 위험이 있습니다. | |||
| 회사는 내부회계관리제도 연간운영계획에 따른 중간 및 기말평가 내역에 대해 경영진과 이사회 간의 의사소통을 하고 있지 않으며, 내부회계관리제도의 미비점에 대하여 개선활동을 수행할 책임이 있는 담당자, 책임자 및 이사회와 적절하게 의사소통되고 있지 않습니다. 이러한 미비점은 회사의 재무제표의 중요한 왜곡표시가 기업의 내부회계관리제도에 의해 발견.수정되지 못할 수 있는 중요한 취약점을 의미합니다. |
회사의 이사회에 감사가 내부회계관리보고를 기중에 보고한 내용은 없으며, 기말에 보고한 내용만으로는 충분한 의사소통이 있었다고 보기 어렵다고 지적을 받았습니다. 내부회계관리제도의 미비점에 대한 책임있는 담당자와, 책임자 및 이사회와 충분한 의사소통을 한 내역을 찾을 수 없었습니다. |
내부회계관리제도의 중요 내용이 이사회 의사록에 기재되어 이사회간의 의사소통이 원활히 진행되어 개선되고 있습니다. 미비점의 발생되지 않도록 책임있는 담당자와 책임자 및 이사회와 사전에 충분한 의사소통을 진행하여 개선중입니다. |
경영진과 이사회(감사) 간의 의사소통이 적시에 충분하게 이루어지지 않아서 내부통제 감독(내부회계관리제도 포함)이 효과적으로 이행되지 않을 위험이 있습니다. 미비점 분류가 부정확하여 중요한 취약점이 적시에 경영진 및 감사(위원회)에 보고되지 않을 위험이 있습니다. |
|||
| (2) 회사는 대여금의 기대신용손실 평가와 관련하여 이를 적시에 검토하기 위한 충분하고 적합한 통제활동을 설계하지 않았습니다. 이러한 미비점은 대여금 등의 재무상태표 계정과 기타의대손상각비 등의 포괄손익계산서 계정이 적절히 기록되지 않을 수 있는 중요한 취약점을 의미합니다. | 별도 재무제표상의 자회사 대여금은 금액적 중요성에 해당됨에도 불구하고 이를 적시에 검토하기 위한 충분하고 적합한 통제활동을 설계하지 않았습니다. | 별도 재무제표상 자회사 대여금 충당금에 대하여 통제활동을 추가적으로 설계 구축하여 개선하였습니다. | 별도 재무제표의 자회사 대여금의 관리가 제대로 이루어지지 않아 부실채권이 발생하거나 회수가 지연될 수 있습니다. 기대신용손실률의 측정이 부정확하여 대여금의 대손충당금이 왜곡표시될 위험이 있습니다. | |||
| (3) 회사는 원가기준 투입법을 적용하여 기간에 걸쳐 수익을 인식하는 계약과 관련하여 진행률 산정의 근거가 되는 Materials & Supplies cost및 Labor hour(시간)및 프로젝트 코드가 실제 발생한 대로 기표 되지 않거나 프로젝트 별로 적절하게 집계 되지 않을 리스크를 적시에 예방하기 위한 충분하고 적합한 통제활동을 설계하지 않았습니다. 이러한 미비점은 계약자산 및 계약부채 등의 재무상태표 계정과 매출액 등의포괄손익계산서 계정이 적절히 기록되지 않을 수 있는 중요한 취약점을 의미합니다. | 회사는 수익을 인식하는 진행율과 관련하여 산정의 근거가 되는 원재료비, 노무비에 대하여 원재료비 및 노무비의 각각의 시스템에서 프로젝트별로 구분되어 있는 자료를 엑셀로 다운 받아 이를 각각의 프로젝트별로 매칭한 후 투입된 원가를 각각의 프로젝트의 원가로 산정하여 이를 예정원가와 비교하여 생산진행율로 인식하고 있습니다. 이에시스템에서 산출되는 원가 및 매칭된 금액에 대하여는 통제활동이 설계되어 있고, 실제로 시스템에 투입시 각각의 검토자와 승인권자의 승인을 받은 원재료와 노무비가 각각의 시스템으로 투입되어 기입되어 집니다. 하지만 회사는 실질적으로 그러한 활동을 진행하더라도 해당 과정에 대한 상세한 설계통제가 미비되어 프로젝트별로 적절하게 집계되지 않을 가능성이 있는 리스크를 예방하는 통제활동을 설계하지 않았습니다. | 해당 통제활동에 대하여 원재료비 및 노무비등에 대하여 프로젝트별로 적절하게 집계될 리스크를 예방하여 계약자산 및 계약부채가 재무제표에 적합하게 기록될 수 있는 통제활동으로 설계구축하여 개선하였습니다. | 계약자산 및 계약부채 등의 재무상태표 계정과 매출액 등의 포괄손익계산서 계정이 적절히 기록되지 않을 수 있는 위험이 있습니다. |
출처) 당사 제시
당사는 전년도 내부회계관리를 구축하고 운영하였으나 내부회계 감사기준에 완전히 부합하는 내부회계관리를 구축하고 운영하지 못하여 외부감사인에게 내부회계관리에 대하여 부적정 의견을 받았습니다. 이에 당사는 2023년부터는 국내 굴지의 회계법인인 삼정(KPMG)회계법인에게 내부회계관리제도의 구축 및 운영테스트를 위한 컨설팅 용역을 의뢰하여, 2023년도 내부회계의 감사기준에 적정의견을 받을 수 있도록 고강도의 내부회계 통제프로세스로 개선 중입니다. 하지만, 2023년에새로이 지정된 외부 감사인인 삼일(PwC) 회계법인의 내부회계 감사기준에 부합하지 못한다면 전년도와 같이 내부회계 감사에세 부적정의 의견을 받을 수 있습니다. 내부회계 부적정 의견을 받을 경우 은행등으로부터의 차입 및 여러가지로 재정 안정성이 악화되는 상황이 발생될 수 있습니다. 그러나 상기와 같이 감사인이 제시한 부적정 사유는 내부 통제절차 마련을 통해 충분히 개선 가능한 사항들로 판단되나 투자자께서는 이 점 유의하시기 바랍니다.
| 거. 감사인 지정 경위와 지정감사인으로 변경됨에 따른 위험 당사는 외부감사인 지정 관련 법령에 따라 재무기준 지정사유 (3년 영업손실, 3년 부의영업현금흐름, 3년 이자보상배율 1미만)로 금융감독원으로부터 외부감사인을 직권 지정 받았습니다. 이에 당사는 지정감사인으로부터 3년 동안 외부감사를 받게 되고, 3년 경과 후에도 감사인 지정사유에 해당된다면 계속하여 금융감독원으로부터 외부감사인을 직권 지정 받을 수 있습니다. 외부감사인을 직권 지정 받은 경우는 새롭게 지정 받은 감사인과 충분한 논의 및 보다 많은 자료를 제공하여야 하며 이러한 과정에서 외부감사인과 충분히 소통하지 못하여 감사의견에 부정적인 영향을 미칠 수 있습니다. |
당사는 외감법 제11조 및 동법 시행령 제14조에 따라 감사인 지정사유 (3년 영업손실, 3년 부의영업현금흐름, 3년 이자보상배율 1미만)에 해당하여 금융감독원으로부터 외부감사인을 직권 지정 받았습니다. 이에 당사는 지정감사인으로부터 3년 동안 외부감사를 받게 되고, 3년 경과 후에도 감사인 지정사유에 해당된다면 계속하여 금융감독원으로부터 외부감사인을 직권 지정 받을 수 있습니다. 외부감사인을 직권 지정 받은 경우는 새롭게 지정 받은 감사인과 충분한 논의 및 보다 많은 자료를 제공하여야 하며 이러한 과정에서 외부감사인과 충분히 소통하지 못하여 감사의견에 부정적인 영향을 미칠 수 있습니다.
| 너. 셀렉트라 이용권 소송에 따라 따른 위험 이노비오가 개발한 셀렉트라(Cellectra)는 DNA백신을 근육 내 또는 피내 세포들에 전달하는 DNA 백신의 체내 전달에 필요한 기기입니다. 앞서 이노비오는 셀렉트라(Cellectra)의 한국내 독점권을 진원생명과학에 부여하는 계약을 체결했으나 2020년 10월 통제권의 변경(Change of Control)이라는 이유로 셀렉트라(Cellectra) 라이센스 계약의 해지를 통보했습니다. 그러나 당사는 최대주주 변경이 통제권의 변경(Change of Control)에 해당되지 않는다 판단하여 이노비오가 한국에서 셀렉트라(Cellectra)에 대한 권한이 없고 이노비오의 라이선스 계약 해지로 인한 손해에 대해 배상할 것을 청구하는 소송을 제기했습니다. 이 같은 분쟁으로 당사는 셀렉트라(Cellectra) 사용에 제한적임에 따라 DNA 백신 개발에 차질이 발생할 수 있습니다. 그러나 자체 개발한 흡인작용 피내 접종기 진덤(GeneDerm)을 사용하여 코로나19 DNA백신 개발에 적용했으며 향후 개발하고자 파이프라인들에도 적용할 예정입니다. 그러나 셀렉트라를 이용하여 연구개발을 하여야 하는 상황이 생긴다면 문제가 발생할 수 있으니 투자자께서는 이 점 유의하시길 바랍니다. |
이노비오가 개발한 셀렉트라(Cellectra)는 DNA백신을 근육 내 또는 피내 세포들에 전달하는 DNA 백신의 체내 전달에 필요한 기기입니다. 앞서 이노비오는 셀렉트라(Cellectra)의 한국내 독점권을 진원생명과학에 부여하는 계약을 체결했으나 2020년 10월 통제권의 변경(Change of Control)이라는 이유로 셀렉트라(Cellectra) 라이센스 계약의 해지를 통보했습니다. 그러나 당사는 최대주주 변경이 통제권의 변경(Change of Control)에 해당되지 않는다 판단하여 이노비오가 한국에서 셀렉트라(Cellectra)에 대한 권한이 없고 이노비오의 라이선스 계약 해지로 인한 손해에 대해 배상할 것을 청구하는 소송을 제기했습니다. 이 같은 분쟁으로 당사는 셀렉트라(Cellectra) 사용에 제한적임에 따라 DNA 백신 개발에 차질이 발생할 수 있습니다. 그러나 자체 개발한 흡인작용 피내 접종기 진덤(GeneDerm)을 사용하여 코로나19 DNA백신 개발에 적용했으며 향후 개발하고자 파이프라인들에도 적용할 예정입니다. 그러나 셀렉트라를 이용하여 연구개발을 하여야 하는 상황이 생긴다면 문제가 발생할 수 있으니 투자자께서는 이 점 유의하시길 바랍니다.
자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)은 기존 DNA 백신 접종에 이용되는 셀렉트라(Cellectra)와 같이 전기 자극을 이용하는 전기천공기기와는 달리 피내 주사 부위에 대한 흡인압력을 이용함에 따라 전기천공기기 대비 투여 편의성이 높습니다. 그리고기기에 대한 가격 경쟁력도 갖추었으며 DNA백신 체내 전달의 효과 측면에서도 코로나19 DNA백신 개발 과정에서 접종 시 투여 부위에 손상을 주지 않고 DNA 백신의 세포내 전달과 항원 발현을 우수하게 유도할 뿐만 아니라 코로나19 DNA백신인 당사의 GLS-5310의 면역반응을 높은 수준으로 유도했다는 연구결과를 얻었고 이를 2021년 11월 사이언스의 자매지 Science Advances(사이언스 어드밴시스)에 게재한 바 있습니다. 진덤(GeneDerm) 대규모 접종의 투여 편의성을 획기적으로 개선한 피내 접종 약물 및 백신 전달 플랫폼으로서 코로나19 DNA 백신뿐만 아니라 피부암을 포함한 적응증 확대를 통해 세포유전자 치료제 전달 분야로의 확장성을 넓힐 수 있으나 셀렉트라(Cellectra) 기기를 사용한 연구개발이 필요한 경우에는 문제가 발생할 수 있으니 투자자께서는 이 점 유의하시길 바랍니다.
Cellectra는 주사 접종부위에 전기 충격을 가해 세포막에 일시적인 틈을 형성하고 투과성을 증가시켜 DNA 백신이 세포내 핵으로 이동하는 것을 용이하게 해줍니다. Cellectra를 적용할 수 있는 주사 접종법은 근육 내 접종 또는 피내 접종이 알려져 있으며, 적은 양의 백신으로도 면역반응을 효과적으로 유도할 수 있습니다. 하지만 전기적 자극에 의해 주사 부위의 통증 또는 출혈과 같은 이상반응이 동반되며 세포 및 조직의 손상을 유발할 가능성이 높습니다. 이외에도 기기의 사용 절차가 복잡하고 사용 비용이 상대적으로 높아 대량 백신 접종에는 적합하지 않습니다.
반면 진덤(GeneDerm)은 부항의 원리를 활용한 것으로 진덤(GeneDerm) 기기를 이용하여 주사 접종부위에 압력(음압)을 가하게 됩니다. 이 때 접종부위에 존재하는 피부세포의 세포막을 통과하지 못하는 물질을 세포내로 받아들이는 작용이 증가하며, 해당 작용을 통해 DNA 백신이 세포내 핵으로 이동하게 됩니다. 진덤(GeneDerm)을 적용할 수 있는 주사 접종법은 망투(Mantoux) 피내 접종이 있으며, 압력(음압) 적용을 통한 흡인작용 시 접종부위의 홍반, 열감, 또는 붓기가 생길 수 있지만 통증을 유발하지는 않습니다. 또한 알려진 부작용도 없으며, 기기 작동이 간편하고 사용 비용이 저렴하여 대량 백신 접종에 유리합니다.
|
더. 과거 공시의무 미이행에 따른 위험 당사는 금번 공모 과정에서 과거 2020년 08월 3일 및 21년 12월 8일 금전대여 후 다수의 정정공시가 누락된 점을 지적 받아 2023년 12월 4일 공시서류에 대해 일괄 검토하였습니다. 검토결과 21건의 지연공시 대상이었기 때문에 당사는 2023년12월 4일 해당 공시사항들에 대해 일괄적으로 정정공시하였습니다. |
기업공시제도란 기업이 주주 또는 투자자에게 기업의 중요경영사항에 관한 중요한 정보를 정기 또는 수시로 공개토록 하여 투자자가 스스로 자유로운 판단과 책임하에 투자의사 결정을 하도록 유도하고 증권시장에서의 정보형평성을 제고하기 위한 제도입니다. 기업 공시는 정보 형평을 통해 증권시장의 효율성을 실현하는 중요한 제도로 내부자 거래 등 불공정거래행위를 방지하고 기업 활동에 대한 사회적 감시기능을 합니다. 금융위원회는 자본시장법을 통해 기업공시제도의 법적 근거를 마련하고 있으며 제391조(공시규정)를 통해 거래소가 개설 운영하는 둘 이상의 증권시장에 대하여 별도의 공시규정으로 정하도록 하고 있습니다. 따라서, 유가증권시장 상장법인은 『자본시장과 금융투자업에 관한 법률』과 한국거래소에서 운영하는 『유가증권시장규정』에 의거하여 공시의무가 발생되게 됩니다. 당사는 1987년 11월 26일 유가증권시장에 상장되었으며 현재까지 유가증권시장 상장사의 지위로 다음의 공시의무를 지고 있습니다.
| [ 공시체계 분류표 ] |
| 대 분 류 | 공 시 분 류 |
|---|---|
| 발행시장 공시 | 발행공시 |
| 유통시장공시 | 정기공시 |
| 주요사항보고서 | |
| 기타공시 | |
| 지분공시 | |
| 수시공시 | |
| 공정공시 |
당사는 금번 공모 과정에서 과거 2020년 08월 3일 및 21년 12월 8일 금전대여 후 다수의 정정공시가 누락된 점을 지적 받아 2023년 12월 4일 공시서류에 대해 일괄 검토하였습니다. 검토결과 21건의 지연공시 대상이었기 때문에 당사는 2023년 12월 4일 해당 공시사항들에 대해 일괄적으로 정정공시하였습니다. 정정공시된 내역은 다음과 같습니다.
| [ 정정공시 이행 내역] |
| 날짜 | 보고서명 | 사유 | 비고 |
|---|---|---|---|
| 2023-12-04 | 금전대여결정 | 주계약 후 분할계약 체결 누락공시 10건 | 공시 누락 |
| 2023-12-04 | 주계약 후 분할계약 체결 누락공시 11건 | 공시 누락 |
주1) 1차 주계약은 2023.08.03 이사회 결의로 금전대여계약을 체결하였고, 분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다.
주2) 2차 주계약은 2021.12.08 이사회 결의로 금전대여계약을 체결하였고,분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다.
| [ 금전대여 결정] |
| 1. 대여 상대 | 브이지엑스아이(주) | 영문 | VGXI, Inc. | ||
| - 회사와의 관계 | 계열회사 | ||||
| 2. 금전대여 내역 | 거래일자 | 2020-08-04 | |||
| 대여금액(원) | 62,772,797,092 | ||||
| 자기자본(원) | 24,060,166,535 | ||||
| 자기자본대비(%) | 260.90 | ||||
| 대규모법인여부 | 미해당 | ||||
| 이율(%) | 4.6 | ||||
| 대여기간 | 시작일 | 2020-08-04 | |||
| 종료일 | 2029-11-10 | ||||
| 3. 금전대여 목적 | 시설자금(공장증축) 대여 | ||||
| 4. 금전대여 총잔액(원) | 62,772,797,092 | ||||
| 5. 이사회결의일(결정일) | 2023-11-10 | ||||
| - 사외이사 참석여부 | 참석(명) | 1 | |||
| 불참(명) | 0 | ||||
| - 감사(사외이사가 아닌 감사위원) 참석여부 | 참석 | ||||
| 6. 기타 투자판단과 관련한 중요사항 | |||||
| - 상기 대여금액은 대여원금 USD52,790,175에 대해 이사회 당일 매매기준율(1,189.10원/1USD)을 적용하여 산출한 금액입니다. - 상기 자기자본은 2019년말 연결기준 자본총계입니다. - 상기 대여금은 일시에 대여하는 것이 아니라 시설의 공정단계에 따라 VGXI의 요청에 의거하여 소요금액만큼 순차적으로 대여할 예정입니다. - 대여기간 만료 후 미상환잔액이 있을 경우 대여기간 연장이 가능합니다, 상기 대여금액은 대여원금 USD52,790,175에 대해 이사회 당일 매매기준율(1,189.10원/1USD)을 적용하여 산출한 금액입니다. - 상기 자기자본은 2019년말 연결기준 자본총계입니다. - 상기 대여금은 일시에 대여하는 것이 아니라 시설의 공정단계에 따라 VGXI의 요청에 의거하여 소요금액만큼 순차적으로 대여할 예정입니다. - 대여기간 만료 후 미상환잔액이 있을 경우 대여기간 연장이 가능합니다, - 상기 대여금은 총 9차례 걸쳐 대여가 이루어 졌으며, 상세 내역은 아래와 같습니다. <계약명(계약체결일)>/대여금액/대여기간 1차 주계약(2020.08.03)/USD52,790,175/2020.08.04~2023.08.03 <분할계약> 1-1차(2020.08.04)/USD 3,200,000/2020.08.04.~2023.08.03. 1-2차(2020.10.13)/USD 3,600,000/2020.10.13.~2023.10.12. 1-3차(2020.11.13)/USD11,400,000/2020.11.13.~2023.11.12. 1-4차(2021.01.14)/USD 3,700,000/2021.01.14.~2024.01.13. 1-5차(2021.04.26)/USD13,000,000/2021.04.26.~2024.04.25. 1-6차(2021.08.17)/USD 5,000,000/2021.08.17.~2024.08.16. 1-7차(2021.09.13)/USD 5,000,000/2021.09.13.~2024.09.12. 1-8차(2021.10.12)/USD 5,000,000/2021.10.12.~2024.10.11. 1-9차(2021.11.11)/USD 2,890,175/2021.11.11.~2024.11.10. 분할계약 합계 USD52,790,175 - - * 1차 주계약은 2020.08.03 이사회 결의로 금전대여계약을 체결하였고,분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다. - 만기 대여연장계약의 상세내용은 아래와 같습니다. <계약명(연장결정일)>/대여금액/대여기간 1차 주계약(2023.11.10)/USD52,790,175/2020.08.04.~2029.11.10. <분할계약> 1-1차(2023.07.19)/USD 3,200,000/2023.08.04.~2028.08.03. 1-2차(2023.10.06)/USD 3,600,000/2023.10.13.~2028.10.12. 1-3차(2023.11.10)/USD11,400,000/2023.11.13.~2028.11.12. * 만기 1차 주계약은 2023.11.10 이사회 결의로 금전대여연장계약을 체결하고. 1-1차 분할계약 만기연장계약은 2023.07.19 이사회 결의, 1-2차 분할계약 만기연장계약은 2023.10.06 이사회 결의, 1-3차 분할계약 만기연장계약은 2023.11.10 이사회 결의를 통해 각각의 금전대여만기연장계약을 체결하여 집행하였습니다. |
|||||
| ※ 관련공시 | 2020-08-03 금전대여 결정 | ||||
| [ 금전대여 결정] |
| 1. 대여 상대 | 브이지엑스아이(주) | 영문 | VGXI,Inc. | ||
| - 회사와의 관계 | 계열회사 | ||||
| 2. 금전대여 내역 | 거래일자 | 2021-12-13 | |||
| 대여금액(원) | 92,133,600,000 | ||||
| 자기자본(원) | 98,508,792,118 | ||||
| 자기자본대비(%) | 93.53 | ||||
| 대규모법인여부 | 미해당 | ||||
| 이율(%) | 4.6 | ||||
| 대여기간 | 시작일 | 2021-12-13 | |||
| 종료일 | 2026-07-05 | ||||
| 3. 금전대여 목적 | 시설자금(공장증축) 대여 | ||||
| 4. 금전대여 총잔액(원) | 154,906,397,092 | ||||
| 5. 이사회결의일(결정일) | 2021-12-08 | ||||
| - 사외이사 참석여부 | 참석(명) | 1 | |||
| 불참(명) | 0 | ||||
| - 감사(사외이사가 아닌 감사위원) 참석여부 | 참석 | ||||
| 6. 기타 투자판단과 관련한 중요사항 | |||||
| - 상기 대여금액은 대여원금 USD78,000,000에 대해 이사회 당일 매매기준율(1,181.20원/1USD)를 적용하여 산출한 금액입니다. - 상기 자기자본은 2020년말 연결기준 자본총계입니다. - 상기 대여금은 일시에 대여하는 것이 아니라 시설의 공정단계에 따라 VGXI의 요청에 의거하여 소요금액만큼 순차적으로 대여할 예정입니다. - 대여기간 만료 후 미상환잔액이 있을 경우 대여기간 연장이 가능합니다. - 상기 대여금은 총 11차례 걸쳐 대여가 이루어 졌으며, 상세 내역은 아래와 같습니다. <계약명(계약체결일)>/대여금액/대여기간 2차 주계약(2021.12.13)/USD78,000,000/2021.12.13.~2024.12.12 <분할계약> 2-1차(2021.12.16)/USD12,000,000/2021.12.16.~2024.12.15. 2-2차(2022.01.26)/USD10,000,000/2022.01.26.~2025.01.25. 2-3차(2022.02.23)/USD13,209,825/2022.02.23.~2025.02.22. 2-4차(2022.07.08)/USD 2,000,000/2022.07.08.~2025.07.07. 2-5차(2022.10.07)/USD 2,000,000/2022.10.07.~2025.10.06. 2-6차(2022.10.14)/USD 2,000,000/2022.10.14.~2025.10.13. 2-7차(2022.12.05)/USD 3,000,000/2022.12.05.~2025.12.04. 2-8차(2023.02.17)/USD 1,000,000/2023.02.17.~2026.02.16. 2-9차(2023.05.30)/USD 1,000,000/2023.05.30.~2026.05.29. 2-10차(2023.06.20)/USD 1,000,000/2023.06.20.~2026.06.19. 2-11차(2023.07.06)/USD 1,000,000/2023.07.06.~2026.07.05. 분할계약 합계 USD48,209,825 - - * 2차 주계약은 2021.12.08 이사회 결의로 금전대여계약을 체결하였고,분할계약은 별도 이사회 결의없이 각각의 금전대여계약만을 체결하여 집행하였습니다. |
|||||
| ※ 관련공시 | 2021-12-08 금전대여 결정 | ||||
자본시장법 제151조(조사 및 정정요구 등) 2항 및 자본시장법 시행령 제159조(금융위원회의 조치)에 따르면 보고의무 위반시 금융위원회가 거래 정지, 금지, 임원 해임권고, 고발 및 수사기관 통보, 경고 및 주의 등의 조치를 취할 수 있습니다. 또한, 자본시장법 제429조(공시위반에 대한 과징금), 제444조(벌칙), 제445(벌칙)에 따라 미보고, 중요사항에 관한 허위기재 또는 누락은 형사처벌 및 과징금 부과 대상에 해당됩니다. 따라서, 금번 증권신고서 제출 전 누락된 공시가 정정 공시 되었음에도, 이행 내역과 별도로 향후 자본시장법상의 공시 위반으로 행정처분과 형사처벌 및 과징금의 제재가 존재할 수 있습니다.
| [ 불성실공시법인 지정예고] |
| 1. 회사명 | 진원생명과학(주) | |
| 2. 불성실공시 유형 | 공시불이행 | |
| 3. 불성실공시 내용 | - 금전대여 결정('20.08.03) 이후 정정사실 발생('20.10.13, '20.11.13, '21.01.14, '21.04.26, '21.08.17, '21.09.13, '21.10.12, '21.11.11, '23.07.19, '23.10.06) 10건의 지연공시('23.12.04) - 금전대여 결정('21.12.08) 이후 정정사실 발생('21.12.16, '22.01.26, '22.02.23, '22.07.08, '22.10.07, '22.10.14, '22.12.05, '23.02.17, '23.05.30, '23.06.20, '23.07.06) 11건의 지연공시('23.12.04) |
|
| 4. 예고일자 | 2023-12-04 | |
| 5. 최근 1년간 부과누계벌점 | 0 | |
| 6. 근거 | 유가증권시장 공시규정 제33조 | |
| 7. 공시위반관리종목 여부 | 미해당 | |
| 8. 기타 투자판단과 관련한 중요사항 | - 유가증권시장공시규정 제34조의 규정에 의거 당해 법인은 상기 예고 내용에 대하여 이의를 신청('23.12.13限)할 수 있고, - 유가증권시장상장공시위원회 심의를 거쳐 불성실공시법인지정 여부, 부과벌점 및 공시위반제재금의 부과 여부가 결정됨 (다만, ①이의신청이 없고, ②위반의 동기가 고의·중과실이 아니고, ③위반의 중요성이 중대한 위반이 아니며, ④과거 1년간 공시의무 위반사실이 없는 경우에는 상장공시위원회 심의를 생략할 수 있음) - 추후 불성실공시법인 지정 여부 등 그 구체적인 결과가 확정되는 대로 재공시하겠음 * 부과벌점이 10점 이상이 되는 경우에는 지정일 당일 1일간 매매거래정지됨 |
|
| ※관련공시 | 2023-12-04 금전대여 결정 2023-12-04 금전대여 결정 |
|
이에 따라 한국거래소는 2023년 12월 4일 불성실공시법인지정예고 공시를 하였으며, 한국거래소가 불성실공시법인지정여부를 결정하여 최종 불성실공시법인으로 지정되는 경우로서 당해 부과벌점이 10점 이상인 경우 매매거래가 1일간 정지될 수 있습니다. 또한 동 건에 따른 부과벌점을 포함하여 최근 1년간 누계벌점이 15점 이상이 되는 경우 유가증권시장상장규정 제47조제1항제12호가목에 따라 상장 적격성 실질심사 대상이 될 수 있습니다. 당사의 최근 1년간 불성실공시법인 부과벌점은 0점이나, 향후 1년간 벌점이 누적될 가능성을 배제할 수 없습니다. 투자자들께서는 이 점에 특히 유의하시기 바랍니다.
3. 기타위험
| 가. 유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. |
금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분께서는 이 점 유의하시기 바랍니다.
이 증권신고서의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있으며, 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점 유의하여 투자에 임하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
| 나. 공시서류 정정에 따른 일정 변경 위험 본 공시서류는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다. |
"자본시장과 금융투자업에 관한 법률" 제120조 3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 참조하시기 바랍니다.
본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행과정에서 일정이 변경될 수도 있으므로 투자자들께서는 투자시 이러한 점을 감안하시기 바랍니다.
| 다. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 크게 하락할 경우 당사가 계획했던 자금조달 계획 등에 차질이 발생할 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있으니 이 점 유의하시기 바랍니다. |
금번 유상증자의 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 결정됩니다. 다만 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. (단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
일반공모 후 미청약분에 대해서는 그 전부를 대표주관회사 및 인수회사가 인수하므로 청약 미달에 따른 위험은 없으나, 주가 하락으로 발행가액이 낮아져 당사가 목표로 하는 규모의 자금을 조달하지 못할 수도 있습니다. 이 경우, 당사의 재무안정성이 부정적인 영향을 받을 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 라. 신주의 환금성 제약 및 주가 변동에 따른 손실위험 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 존재하오니, 투자자께서는 이 점 유의하시기 바랍니다.
당사는 코스피 상장법인으로서 이번 유상증자로 발행되는 신주는 코스피시장에 상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다. 그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다.
본 유상증자의 자세한 일정은 본 신고서의 "제1부 모집 또는 매출에 관한 사항 - I. 모집 또는 매출에 관한 일반사항" 중 '1. 공모의 개요'를 참고하시기 바랍니다.
또한 유가증권시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다.
| 마. 집단 소송 제기 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있으니 이 점 유의하시기 바랍니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있음을 유의하시기 바랍니다.
| 바. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다. |
금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사 및 인수회사의 잔액인수 방식으로 진행됩니다. 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다.
유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다.
또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다.
| 사. 개인종합자산관리계좌(ISA) 납입한도에 따른 청약제한 위험 개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다. |
개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다.
| 아. 잦은 자금조달로 인한 주주가치 희석화 당사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였습니다. 당사는 금번 유상증자 자금을 이용하여 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다. 당사는 정부보조금을 제외하고 경상연구개발비로 2021년 연결기준 6,561백만원, 2022년 연결기준 11,413백만원을 사용하였으며, 이는 매출액 대비 각각 16.95%, 23.43% 수준이며, 최근 3개년 평균 매출액 대비 연구개발비의 비중은 19.1%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다. 이처럼 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 핵산 백신 및 핵산 기반 바이오의약품의 연구개발이 제품화에 실패하거나 플라스미드 CDMO 사업 관련 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원할하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였으며, 내역은 아래와 같습니다.
| [2020년~신고서제출일 현재 자본시장을 통한 자금조달 내역] |
| (단위 : 백만원) |
| 구분 | 최초 주요사항보고서 공시일 | 납입일 | 규모 | 발행방식 | 자금사용목적 |
| 유상증자 | 2019년 11월 08일 | 2020년 01월 28일 | 19,800 | 주주배정 후 실권주 일반공모 | 운영자금 등 |
| 유상증자 | 2020년 04월 29일 | 2020년 07월 03일 | 76,475 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제4회 전환사채 | 2020년 11월 23일 | 2020년 11월 25일 | 24,000 | 사모 전환사채 | 시설자금 및 운영자금 등 |
| 유상증자 | 2021년 09월 01일 | 2021년 12월 02일 | 113,760 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 제5회 전환사채 | 2022년 04월 13일 | 2022년 04월 15일 | 11,700 | 사모 전환사채 | 운영자금 |
| 유상증자 | 2023년 09월 06일 | 2023년 09월 15일 | 2,470 | 제3자배정 유상증자 | 운영자금 |
| 유상증자 | 2023년 05월 16일 | 2024년 02월 22일 | 66,660 | 주주배정 후 실권주 일반공모 | 시설자금 및 운영자금 등 |
| 합계 | 314,865 | - | - | ||
| 주) 금번 유상증자의 납입일인 2024년 02월 22일은 예정일이므로, 관계기관과의 협의에 의하여 달라질 수 있으며, 발행규모는 예정발행가액 기준으로 확정발행가액 산정 시 변경될 수 있습니다. 출처) 당사 제시 |
당사의 주요사업은 지속적인 연구개발과 임상시험을 통해 DNA백신 및 핵산 기반 치료제의 신약바이오의약품과 항염증 치료 신약을 개발하고 제품화하는 사업과, 미국 자회사 VGXI를 통하여 유전자 치료제의 원료가 되는 플라스미드 DNA CDMO 사업이 있습니다. 이를 위하여 생산 시설 확충 및 연구개발을 위한 투자 또한 필연적인 사항입니다. 당사는 기존 파이프라인 외에도 새로운 파이프라인을 추가하며 미래성장동력 확보를 위하여 연구개발 및 임상시험을 지속적으로 해왔으며 향후에도 계속 진행할 예정입니다.
또한 화이자, 모더나 mRNA 코로나19 백신 개발 등 유전자 치료제 시장의 규모 확대로 인해 mRNA 백신 핵심 원료 및 플라스미드 DNA에 대한 수요도 증가하는 추세입니다. 이를 충족시키기 위해 금번 유상증자 자금을 이용하여 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다. 세부 자금사용 계획에 대해서는 제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
| 자. 최종 실권주 인수 시 매각에 따른 일시적 물량 출회에 따른 투자위험 금번 유상증자는 주주배정 후 실권주 일반 공모로 진행되며, 금번 유상증자로 인해 발행되는 주식의 물량 출회 및 주가 희석화 등으로 주가가 하락할 가능성이 존재합니다. 한편금번 증자로 인해 발행되는 신주 22,000,000주로 증권신고서 제출일 현재 당사 발행주식총수 78,473,817주의 28.03%에 해당합니다. 금번 유상증자로 인해 추가 발행 및 상장되는 신주는 전량 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 존재합니다. 또한 구주주 청약결과 실권주 및 단수주가 발생하는 경우 동 수량은 일반에게 공모할 예정이며, 일반공모에서도 청약이 미달될 경우 미달된 수량(최종 실권주)은 대표주관사 한국투자증권(주) 및 한양증권(주) 최종 실권주를 인수할 수 있습니다. 그렇게되면 당사는 최종 실권주를 인수한 금액의 15.0%를 실권수수료로 지급하게 됩니다. 수수료를 고려한 대표주관회사 및 인수회사의 실질 매입단가는 일반청약자들 보다 15.0% 낮으며, 대표주관회사 및 인수회사는 당사 주식을 인수한 후 신주교부일 전영업일부터 즉시 매각이 가능합니다. 대표주관회사 및 인수회사가 조기에 장내에서 최종 실권주를 매각할 경우, 주가가 단기적으로 하락할 수 있으니, 투자자께서는 이점 유의하시기 바랍니다. |
| [유상증자 모집예정 내역] |
| 구 분 | 내 용 |
|---|---|
| 모집예정 주식 종류 | 기명식보통주 |
| 모집예정주식수 | 22,000,000주 |
| 현재 발행주식총수 | 78,473,817주 |
| 증자비율 | 28.03% |
| 할인율 | 25% |
금번 증자로 인해 발행되는 신주 22,000,000주로 증권신고서 제출일 현재 당사 발행주식총수 78,473,817주의 28.03%에 해당합니다. 이로 인해 주가희석화 및 물량수급의 불균형에 따른 주가하락의 가능성이 존재하므로 투자자의 손실을 초래할 위험이 있습니다.
금번 유상증자에 따른 모집가액은 '증권의 발행 및 공시 등에 관한 규정' 제5-18조에 의거 주주배정 증자 시 가격 산정절차 폐지 및 가격 산정의 자율화에 따라 발행가액을 자유롭게 산정할 수 있으나, '(舊) 유가증권의 발행 및 공시 등에 관한 규정' 제57조에 의해 산출됩니다. 그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 증자에 따른 모집가격 산정 시 결정된 1주당 모집가액보다 향후 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 있습니다.
또한 금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 주권의 상장일은 2024년 03월 08일로 예정되어 있습니다. 금번 유상증자에 따라 향후 유가증권시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다. 「자본시장과 금융투자업에 관한 법률」 제165조의6의 ②조 2항에 의거 초과청약을 실시하며 초과청약비율은 배정신주 1주당 0.2주로서 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약이 가능합니다.
구주주 초과청약을 실시한 후 그 결과로 나온 미청약주식 및 단수주는 본 유상증자의 대표주관회사인 한국투자증권(주) 및 인수회사인 한양증권(주)에서 일반에게 공모하되, 개인투자자 및 기관투자자(집합투자업자 포함)에게 구분없이 배정합니다. 최종적으로 일반공모 청약을 완료한 주식 수의 합계가 모집하여야 할 주식수에 미달하는 경우 미달된 잔여주식은 대표주관회사 및 인수회사가 자기계산으로 실권주식 전량을 인수할 수 있습니다.
따라서 실권주를 인수한 대표주관회사 및 인수회사가 잔액인수한 물량을 조기에 장내에서 대량 매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 인수한 실권주를 일정 기간 보유하더라도 동 인수물량이 잠재매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 15.0%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관회사의 실권주 매입단가는 일반청약자들보다 15.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 소지가 높을 것으로 예상되기 때문입니다.
금번 유상증자로 추가 발행되는 주식은 일시적인 물량출회에 따른 주가 하락의 가능성과 유통주식수 증가에 따른 희석화 위험이 존재합니다. 금번 유상증자에 따른 모집예정주식 22,000,000주는 보호예수되지 않아 일시적인 물량 출회가 가능하오니 투자자 여러분께서는 이 점 유의하여 주시기 바랍니다.
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」제119조 및 제125조, 금융감독원의 「금융투자회사의 기업실사 모범규준」에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 한국투자증권(주)입니다. 발행회사인 진원생명과학(주)는 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 회 사 명 | 고 유 번 호 |
| 대표주관회사 | 한국투자증권(주) | 00160144 |
2. 분석의 개요
대표주관회사인 한국투자증권(주)(이하 "대표주관회사"라 합니다.)는『자본시장과금융투자업에관한법률』제71조 및 동법시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 2012년 02월 01일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
다만, '모범규준' 제3조 제②항에 따라 발행회사의 재무 및 영업현황, 사업 환경, 투자위험, 인수 형태, 신용평가등급 등을 감안하여 강화하거나, 완화할 수 있으며, 동조 제⑤항에 따르면 금융투자회사의 이사회나 리스크관리위원회의 의사결정을 거쳐 '모범규준'의 내용(실사수준)을 생략하거나 강화 또는 완화 적용할 수 있도록 허용하였는 바, 주관회사는 지분증권의 인수 또는 모집·매출의 주선업무를 수행함에 있어서 지분증권의 특성 및 발행회사의 일정요건 충족여부 등에 따라 기업실사 수준을 완화하여 적용할 수 있도록 규정하고 있습니다.
본 지분증권은 대표주관회사인 한국투자증권(주)의 내부 규정상 기업실사 기준을 적용하여 기업실사 업무를 수행하였습니다.
| 「금융투자회사의 기업실사 모범규준」 제3조(적용범위 등) ①이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ②이 규준은 주간회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 ‘리스크관리위원회 등’)의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요 내용
| 일자 | 실사내용 |
| 2023-04-25 ~ 2023-04-26 |
* 발행회사 초도 방문 - 발행회사의 유상증자 의사 확인 - 자금조달 희망금액 등 발행회사 의견 청취 * 발행회사의 유상증자 방식결정 협의 * 유상증자 일정 협의 및 확정 * 유상증자를 위한 사전 준비사항 및 진행절차 설명 - 발행가 산정 및 세부일정 설명 * 세부 증자관련 논의 - 유상증자 방식 결정 및 대주주 증자 참여 논의 * 유상증자 진행에 대한 질의/응답 * 실사 사전요청자료 송부 |
| 2023-04-27 ~ 2023-04-30 |
미국 현지 실사 - 생산 시설 방문 - 완공된 생산시설 내 설비 확인 - 생산시설 확충 관련 자금 지출 내역 확인 |
| 2023-05-02 ~ 2023-05-04 |
* 증자리스크 검토 - 발행시장 상황, 자금조달규모 적정성, 공모가액 희망 할인율 * 발행사와의 협의 - 발행가액 산정방식, 발행일정, 발행규모, 인수수수료 협의 * 기업실사 진행 및 추가자료 요청 - 기업실사 관련 자료요청 및 절차에 대한 설명 - 기업실사 관련 Q&A * 이사회 등 상법 절차 및 정관 등 검토 * 투자위험요소 실사 1) 사업위험관련 실사 - 기존사업 및 신규사업에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 3) 기타위험관련 실사 - 주가 희석화관련 위험 등 체크 * 담당자 인터뷰 - 회사개요, 사업의 내용, 주요 재무적 이슈 확인 - 자금사용 계획 파악 - 향후 사업추진계획 및 발행회사의 비전 검토 |
| 2023-05-08 ~ 2023-05-16 |
* 증권신고서 작성 및 조언 * 이사회의사록 등 검토 * 인수계약서 작성 및 체결 * 증권신고서 인수인의 의견 완료 * 첨부서류 등 검토 * 증권신고서 업데이트 |
| 2023.06.01 ~ 2023.12.18 |
(정정) 금융감독원의 정정요구제출에 따른 증권신고서 작성 가이드 및 추가자료 작성 |
4. 기업실사 참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
| 한국투자증권(주) | IB2본부 | 이현규 | 본부장 | 기업실사 총괄 | 2023년 04월 25일 ~ 2023년 12월 18일 |
기업금융업무 등 31년 |
| 한국투자증권(주) | 커버리지1담당 | 김성열 | 상무 | 기업실사 총괄 | 2023년 04월 25일 ~ 2023년 12월 18일 |
기업금융업무 등 27년 |
| 한국투자증권(주) | ECM1부 | 채승용 | 이사 | 기업실사 책임 | 2023년 04월 25일 ~ 2023년 12월 18일 |
기업금융업무 등 21년 |
| 한국투자증권(주) | ECM1부 | 박상욱 | 팀장 | 기업실사 실무 | 2023년 04월 25일 ~ 2023년 12월 18일 |
기업금융업무 등 13년 |
| 한국투자증권(주) | ECM1부 | 정인묵 | 과장 | 기업실사 실무 | 2023년 04월 25일 ~ 2023년 12월 18일 |
기업금융업무 등 6년 |
| 한국투자증권(주) | ECM1부 | 고선영 | 대리 | 기업실사 실무 | 2023년 04월 25일 ~ 2023년 12월 18일 |
기업금융업무 등 5년 |
| 한국투자증권(주) | ECM1부 | 함현중 | 대리 | 기업실사 실무 | 2023년 04월 25일 ~ 2023년 12월 18일 |
기업금융업무 등 3년 |
[발행회사]
| 소속 | 부서 | 성명 | 직급 | 담당업무 |
| 진원생명과학 | - | 박영근 | 대표이사 | CEO |
| 진원생명과학 | 임원 | 조병문 | 전무이사 | CFO |
| 진원생명과학 | 신약개발본부 | 권이주 | 이사 | 신약개발 |
| 진원생명과학 | 재경본부 | 채재경 | 이사 | 재무/회계 |
| 진원생명과학 | 총무본부 | 박한모 | 부장 | 공시 |
| 진원생명과학 | 경영지원팀 | 김정인 | 부장 | 경영/기획 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합의견
가. 대표주관회사인 한국투자증권(주)는 진원생명과학(주)가 2023년 05월 16일 및 2023년 05월 31일, 2023년 06월 22일, 2023년 07월 13일, 2023년 08월 17일 , 2023년 11월 20일, 2023년 12월 04일 이사회에서 결의한 보통주식 22,000,000주에 대한 주주배정 후 실권주 일반공모 증자를 잔액인수함에 있어 진원생명과학(주)에 대하여 다음과 같이 평가합니다.
| 긍정적요인 | ▶동사의 매출은 CDMO 매출이 주를 이루고 있습니다. 동사는 임상 및 비임상 시험에 필요한 유전자치료제 및 DNA 백신의 원료인 국제규격(cGMP) 플라스미드(Plasmid) DNA 제품을 2008년 6월 미국에설립한 현지법인인 VGXI, Inc.에서 생산하여 해외 판매지점인 VGXI USA를 통해 판매하고 있습니다. 또한, 2018년 9월 미국 휴스턴 매소디스트 병원 연구소(HoustonMethodist Research Institute, HMRI)와 독점적 라이선스 계약을 통해, 임상 등급의mRNA 생산 기술을 확보하여 생산공정 스케일업을 진행하고 있으며, 이에 따라 mRNA 백신 및 mRNA 치료제의 위탁생산 서비스 제공을 위한 준비가 계획대로 추진되고 있으며, 동사는 이에 맞추어 지속적인 연구개발을 수행하고 있어 산업 내 경쟁우위가 있다고 판단됩니다. ▶ 과거에는 이노비오와의 공동연구 등으로 인하여 독자적인 DNA백신 연구개발 등이 어려웠으나, 현재는 동사에서 독자적인 연구개발을 진행중에 있습니다. ▶ 동사는 mRNA 원액 생산 기술을 보유하고 있으며, 2018년 美 휴스턴의 메소디스트 병원 연구소로부터 mRNA 원액 생산 공적을 독점 License-In하여 생산공정 최적화 및 스케일업을 진행하였습니다. 금번 신축 공장에는 mRNA원액(DS) 생산 라인도 추가되었으며 건설 중인 新공장의 70%는 Plasmid DNA 생산시설, 30%는 mRNA 원액생산 시설입니다. 동사는 mRNA 백신의 원료와 원액을 둘다 위탁생산하게 가능하게 되어, 동사의 매출처를 다변화하고 고객사를 확대하여 높은 매출 성장을 이끌 것으로 판단됩니다. |
| 부정적요인 | ▶ 동사의 코로나19 DNA 백신(GLS-5310)은 2020년 02월 우리나라에 코로나19 확진 사례가 발생한 직후 백신 후보물질의 디자인 및 제작을 추진하다가 2020년 03월 27일 '2020년도 질병관리본부 긴급 현안 지정 학술연구개발 용역과제'인 '핵산백신 플랫폼을 활용한 코로나19 백신후보물질 개발 사업'에 우선 순위 협상대상자로 선정된 후 정부지원을 받아 임상개발을 진행 중입니다. 그러나 현재로서는 현재 연구 개발이 진행 중인 DNA백신 또는 코로나19 경구용 치료제 및 코 스프레이 치료제의 임상 성공 가능성에 대해서는 상당히 불확실한 상황이며, 임상 개발이 실패할 경우 동사에서 사용한 연구개발비는 자산이 되지 못하고 비용으로만 처리될 가능성이 있습니다. 또한, 연구개발이 완료되어 시판되는 시점에서 코로나 바이러스의 유행성이 멈출 경우 해당 백신 및 치료제에 대한 수익성이 없을 수도 있으며, 타 경쟁사들이 우선적으로 백신 및 치료제 개발에 성공할 경우에도 동사의 수익성에 부정적인 영향을 미칠 가능성이 있습니다. ▶ 동사가 연구개발 하는 가장 앞선 단계의 DNA백신은 임상2a상을 진행하고 있는 코로나19 DNA백신(GLS-5310)으로 국내 코로나19 팬데믹 상황을 고려하여 신속한 제품개발을 추진하고 있어 제품화까지 1~2년 이상의 기간이 소요될 것으로 예상됩니다. 하지만 이는 긴급사용승인을 예상한 일정으로, 국내외 타사 코로나19 백신들이 보급되면서 국내 백신 접종률이 증가한다면 백신 미접종 상태의 임상시험 대상자 모집이 어려워지고 신규 백신에 대한 필요성이 낮아져 계획 중인 임상 연구 및 제품화가 지연될 수 있습니다. 이 외에도 동사가 예상치 못한 이유로 인해 백신 개발 일정이 지연된다면 제품화까지 동사 예상 대비 장기간이 소요될 수 있으며, 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발 비용은 따로 회수할 수 없어 동사의 수익성 및 성장성에 악영향을 미칠 수 있습니다. ▶ 동사 및 동사의 관계법인이 개발한 제품이 해외 주요국 허가기관 승인을 득하지 못하거나 지연될 경우 동사 매출에 부정적 영향을 줄 수 있으며, 제약시장 환경 변화와 의약품 관련 지원 및 규제정책 변화 등으로 전방산업 전망이 악화될 경우 동사의 사업성도 악화될 수 있습니다. 또한, 동사의 미국 자회사인 VGXI가 건설 중인 생산 시설의 설립 및 cGMP 적용이 예상보다 지연되거나, 보완이 필요할 경우에도 동사의 생산 및 영업활동에 부정적인 영향을 미칠 수 있습니다. ▶ 동사는 핵산 백신 및 핵산 기반 바이오의약품 연구개발을 위해 개발할 의약품을 직접 선정 및 연구개발 프로세스를 디자인하고, 전임상시험 혹은 임상시험 등 각 단계에 대한 위탁업자 선정 및 연구개발 과정의 세부항목을 조율하는 역할을 하고 있습니다. 또한 효율적인 연구개발 수행을 위해 파트너와 함께 공동연구를 진행하고 있기 때문에, 연구개발파트너와의 계약이 만료되거나 연구개발이 중단될 시 연구개발에 심각한 위험을 초래할 수 있습니다. 또한, 동사가 임상시험 업무를 위탁한 CRO 자체의 사정으로 인한 의도하지 않은 결과를 통제하기 어려울 수 있습니다. ▶ 동사는 DNA백신 및 핵산 기반 치료제, 플라스미드 DNA 의약품 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 지속적인 당기순손실이 발생하고 있습니다. 당사의 영업손실은 2020년 18,459백만원(영업이익률 : -44.48%), 2021년 27,434백만원(영업이익률 : -70.89%), 2022년 40,084백만원(영업이익률 : -82.28%), 2023년 3분기 -37,092백만원(영업이익률 : -135.14%)로, 평균 83.19%의 수준의 이익률을 보이고 있으며, 이로 인하여 당기순손실이 지속되고 있는 상황입니다. 당사의 손익계산서상 주요 계정 및 수익성 추이는 다음과 같습니다. ▶ 동사는 2023년 3분기 연결기준 33,052백만원의 부채가 있으며, 부채비율은 20.87%, 차입금의존도는 4.82%입니다. 동사는 2020년 이후 자본시장을 통해 공모 형태로 총 4회(금번 유상증자 포함)에 걸친 자금 조달로 인해 최근 3년 동안 연결기준으로 부채비율이 2020년말 38.64%에서 2023년 3분기 20.87%로 완화되었습니다. 2020년 01월 주주배정 후 실권주 일반공모의 진행 및 공모자금을 활용하여 전환사채 상환하였으며, 2020년 07월, 2021년 12월 두 차례의 공모 유상증자를 진행하여 차입금의존도가 2020년말 13.01%에서 2023년 3분기말 4.82%로 재무지표가 개선되었습니다. 그러나 동사는 과거에도 비교적 안정적인 안정성 비율을 보였으나, 지속적인 당기순손실로 인하여 재무지표가 악화된 바 있으며, 이를 유상증자 또는 주식관련사채의 발행 및 행사를 통하여 개선시켜왔습니다. 현재의 수익상황 및 당기순손실이 지속된다면 다시 재무안정성 지표가 악화될 위험이 있습니다. ▶ 동사는 2020년 이후 자본시장을 통해 사모 및 공모 형태로 총 6회(금번 유상증자 포함)에 걸쳐 자금을 조달하였습니다. 금번 유상증자 자금 중 자회사 VGXI에 대여금을 통해 CDMO 사업 부문의 공정 장비 구입을 위해 2,680백만원, 급여를 위해 20,821백만원을 지급하여 운영할 예정이며, 당사 급여 등 운영비로 41,459백만원을 사용할 예정입니다. 동사는 정부보조금을 제외하고 경상연구개발비로 2022년 연결기준 11,413백만원, 2023년 3분기 연결기준 5,219백만원을 사용하였으며, 이는 매출액 대비 각각 23.43%, 18.99% 수준이며, 최근 3개년 및 2023년 3분기 연결기준 평균 매출액 대비 연구개발비의 비중은 19.33%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 동사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다. ▶ 금번 유상증자에서 최대주주는 자금 여력에 따라 최대한 참여할 예정으로, 현재는 최대주주인 박영근 대표는 배정분의 약 30% 정도 참여를 계획 중이며, 특수관계인들에 대한 청약 참여 여부는 미정입니다. 만약 최대주주 및 특수관계인이 전액 미참여할 경우 지분율은 현재 8.75%에서 6.83%까지 감소할 수 있으며, 최대주주가 배정분의 30% 참여하고, 특수관계인이 전액 미참여할 경우 최대주주 및 특수관계인의 지분율은 현재 7.95%에서 7.28%까지 감소할 수 있습니다. ▶ 동사는 주요사업으로 핵산 백신 및 핵산 기반 치료제를 연구개발하고 있기 때문에 지속적으로 연구개발 비용이 발생하고 있습니다. 동사는 2023년 3분기말까지 통합독감 DNA백신(유니버셜 인플루엔자 DNA 백신) 3,968백만원, VGX-6150(만성C형간염 치료백신) 4,608백만원, GLS-5310(코로나19 백신, 부스터샷 포함) 7,967백만원, GLS-1200(코로나19 감염방지 코스프레이 치료제) 3,180백만원을 포함한 주요 파이프라인 연구개발을 위해 55,401백만원을 지출하였습니다. ▶ 동사는 상기 파이프라인의 지속적인 개발 뿐만 아니라 자금조달을 통해 중증열성혈소판감소증후군(SFTS) 임상시험 및 의료기기 개발 등에 사용할 예정입니다. 이처럼 동사는 제품화되기까지 계속적으로 연구개발비를 사용할 예정이며 이는 판관비에 해당되어 동사의 손익계산서에 부정적인 악영향을 끼칠 것으로 예상됩니다. 또한, 동사는 영업적자가 지속되고 있기 때문에 부족한 연구개발비를 외부에서 차입, 조달하여야 하며 적기에 자금을 조달하지 못할 경우 연구개발 진행에 원할하지 않을 가능성이 존재합니다. ▶ 동사가 연구개발하는 과정에서 시험결과 효능이 미약하게 나와 중간에 중단하게 되거나, 효율적 자금 사용을 위해 보류 중인 파이프라인이 존재합니다. 코로나19 DNA 백신(GLS-5310) 및 치료제(GLS-1027, GLS-1200) 등 동사가 보유한 파이프라인에 대하여 장기간 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발 비용은 따로 회수할 수 없어 동사의 손익에 악영향을 미칠 수 있으며 이로 인해 회사 가치가 훼손될 수 있습니다. ▶ 동사는 소송으로 인한 발생 가능한 우발채무에 따른 위험이 존재합니다. 현재 진행 중인 소송 등의 패소로 인해 손실이 발생할 수 있으며 이러한 시기는 합리적 예측이 불가능합니다. 동사의 우발채무가 현실화될 경우 동사의 재무 안정성과 경영성과 및 현금흐름에 부정적인 영향을 미칠 수 있습니다. ▶ 동사는 2020년부터 현재까지 공모로 조달한 자금은 210,035백만원입니다. 차입금 상환 및 연구개발비, 원부재료의 구매를 위하여 2020년 01월 28일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 19,800백만원의 자금 조달을 진행하였으며, VGXI의 CDMO 설비 신규 증설자금 및 코로나19 DNA 백신 등의 연구개발비를 조달하기 위해 2020년 07월 03일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 76,475백만원의 자금을 조달하였으며, CDMO설비 신규 증설자금 및 코로나19 DNA백신 등의 연구개발비를 조달하기 위하여 2021년 12월 02일 주주배정 후 실권주 일반공모 방식의 유상증자를 통해 113,760백만원의 자금 조달을 진행하였습니다. 그러나, 상기 유상증자에 의하여 유입된 납입대금이 증권신고서상 작성한 자금사용계획과 실제 자금사용 현황과 일부 다르게 사용하였습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 시설자금 및 운영자금으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 진원생명과학(주)가 제출한 자료와 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 실사를 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수 변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 대표주관회사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2023년 12월 18일 |
| 대표주관회사 : 한국투자증권 주식회사 |
| 대표이사 정 일 문 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
|
(단위: 원) |
|
구 분 |
금 액 |
|---|---|
|
모집 또는 매출총액(1) |
66,660,000,000 |
|
발행제비용(2) |
1,700,000,000 |
|
순 수 입 금 [ (1)-(2) ] |
64,960,000,000 |
| 주1) | 상기 금액은 예정 모집가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) | 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) | 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. |
나. 발행제비용의 내역
|
(단위: 원) |
|
구 분 |
금 액 |
지급일자 |
계산근거 |
|---|---|---|---|
|
발행분담금 |
11,998,800 |
신고서제출일 |
모집총액의 0.018%(10원 미만 절사) |
| 대표주관수수료 | 66,660,000 | 납입일익일 | 납입금액의 0.1% |
|
인수수수료 |
1,399,860,000 |
납입일익일 |
납입금액의 2.1% |
|
상장수수료 |
12,870,000 |
신주상장일 |
1,047만원+500억원 초과금액의 10억원당 15만원 (유가증권시장상장규정 시행세칙 별표 10) |
|
등록세 |
88,000,000 |
등기일 |
증자 자본금의 0.4% |
|
교육세 |
17,600,000 |
등기일 |
등록세의 20% |
|
기타비용 |
103,011,200 |
- |
구주주청약서, 투자설명서 인쇄 및 발송비 등 |
|
합 계 |
1,700,000,000 |
- |
- |
주1) 상기 금액은 예정 모집가액을 기준으로 산정한 금액입니다.
주2) 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가, 유관기관 정책 등에 따라 변동될 수 있습니다.
주3) 기타비용은 예상금액으로 변동될 수 있습니다.
주4) 발행제비용은 공모금액에서 지급될 예정입니다.
2. 자금의 사용목적
가. 공모자금 사용계획
| (기준일 : | 2023년 12월 04일 | ) | (단위 : 원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| 2,679,800,000 | - | 62,280,200,000 | - | - | 1,700,000,000 | 66,660,000,000 |
| 주1) 상기 금액은 예정 모집가액을 기준으로 산정한 금액으로 모집가액 확정시 변경 될 수 있습니다. 주2) 기타자금은 발행제비용입니다. |
나. 공모자금 세부 사용목적
당사는 금번 유상증자로 조달된 자금을 당사의 자회사 RNA원액(DS)생산 시설자금, 자회사 급여 지급을 위한 일반운영비 및 당사 급여 등 일반운영비로 사용할 예정입니다. 금번 유상증자를 통한 공모자금의 사용 우선순위의 경우 회사의 실적과 직결되는 VGXI의 CDMO 사업에 초점을 맞추어 시설자금을 1순위로 선정하였으며, 당사 급여 등 일반운영비를 2순위로 선정하였습니다. 자회사 급여는 3순위입니다. 금번 유상증자 자금이 계획보다 적게 유입되는 경우 부족분은 당사의 자체자금으로 충당할 계획입니다.
VGXI(차입회사)는 Amerisource Funding, Inc(대여회사)와 750만불 규모의 리볼링 대여를 합의했고, 대여회사에서 당사(보증회사)의 채무보증을 요구하여 당사는 11월 16일 이사회를 개최하여 채무보증을 결의하고 공시하였습니다. 대여계약의 체결 등은 11월내 모두 완료될 예정입니다. 해당 차입의 이율은 월스트릿저널 발표기준 우대금리+연이자 3%(단, 최소 보장이자는 6%)이며차입기간은 2년이나 만기 전 연장이 가능합니다.
하지만, 유상증자가 취소될 경우, 당사는 수차례 걸쳐 시장에서 조달한 자금을 투입한 VGXI의 신규 공장의 운영이 어렵게 되어 판매 증진을 통한 실적 개선 기회를 잃게 되고 VGXI로부터 대여금 회수가 어려워져 심각한 자금 경색으로 본사 및 계열사 전체가 지속적인 경영의 어려움과 최악의 경우 부도 상황에도 처할 수 있습니다.
| [ 유상증자 자금사용의 우선순위 ] |
| (단위 : 백만원) |
| 우선순위 | 자금용도 | 세부 내용 | 금 액 |
|---|---|---|---|
| 1 | 시설자금 | 자회사 RNA 생산 시설자금 | 2,680 |
| 2 | 운영자금 | 당사 급여 등 일반운영비 | 41,459 |
| 3 | 운영자금 | 자회사 일반운영비(급여) | 20,821 |
| - | 운영자금 | 발행제비용 | 1,700 |
| 합계 | 66,660 | ||
출처) 당사 제시
1) VGXI 생산 시설자금
당사의 CDMO 사업부문은 2009년 7월에 미국 국립보건원(NIH)에서 지원하는 HIV DNA백신 연구/개발(HVDDT)프로젝트에 필요한 DNA백신을 공급하기 위하여 생산시설을 확충하였습니다. 본 확충작업을 통하여 VGXI는 DNA백신 제조시장을 선점할 수 있는 발판을 마련하였습니다.
콘로에 위치한 신규공장은 당초 3,000L 1단계와 4,500L 2단계로 증설을 계획했으며, 2단계 4,500L 48백만달러(지난 21년도 유증에서 조달한 자금)은 전액 설비에 대한 비용입니다. 신규공장의 건설비는 88백만달러이며 해당 비용은 지난 2020년도 7월과 2021년도 유증에서 자금을 조달한 바 있습니다. 88백만달러에는 약2천만달러의 설비 비용이 책정되어 있습니다. 그러나 해당 설비 비용이 코로나19 및 텍사스 지역의 대규모 폭우, 우크라이나와 러시아의 전쟁으로 인한 원자재 가격 급등, 유통비용을 증가, 환율의 상승 등으로 인해 폭등했습니다. 그리고 완공된 3,000L 1단계 시설에 발주 수주가 제약. 바이오 고객사의 미국 긴축정책의 영향에 따른 연구개발비 축소로 지연되어 당사는 4,500L 2단계 설비의 구입 및 설치를 연기하고 해당 비용으로 책정된 48백만달러를 부족한 1단계 설비의 구입 및 설치 비용으로 충당했습니다.
또한 VGXI는 시행사 BE&K와 계약을 통해 전체 공사를 발주하였으며, 해당 계약 총액 약 9천만달러를 공사시간에 맞추어 지급한 바 있습니다. VGXI가 금번 유상증자 자금을 통해 매입 예정이었던 공장 부지는 신규1공장의 부지 구입 계약 당시 VGXI가 옵션으로 구입 권한을 갖게 된 부지입니다. 해당 부지는 당사가 보유한 부지(원 형태의 부지에서 반원)의 반대편으로 향후 신규2공장 및 신규3공장 증설에 사용할 계획이며, 해당 지역의 부동산 가격을 고려할 때도 구입에 따른 손실은 제한적이라 판단하였습니다. VGXI는 공장 부지 매매계약을 통해 취득한 부지 구입 옵션이 만료되는 상황에서 금번 유상증자 대금 중 대여금을 통해 해당 옵션을 행사하여 토지를 구입하고자 하였습니다. 그러나 해당 부지는 향후 2-3년 뒤에 사용하고자 하기 때문에 미국 텍사스 콘로시와 협의를 통해 부지 구입 옵션의 행사기한을 당초 2023년 8월 6일에서 90일 연장하기로 합의하였습니다. VGXI가 자체적으로 자금 조달을 꾸준히 노력하여 해당 자금으로 부지 구입을 진행할 계획입니다. 현재 부지 구입 옵션의 행사기한에 대해 추가적인 연장을 협의하지 않아 해당 옵션의 행사기한은 만료가 되었습니다.
한편, 2023년 3분기 CDMO 매출은 17,373백만원으로 전년 동기 대비 32.50% 감소하였는데, 이는 CDMO 사업부분에서는 2022년말부터 경기침체를 우려한 제약사들의 위탁주문생산 문의 감소하였기 때문입니다. 다만 현재 신규공장에서 상업용 단위의 위탁생산 주문이 완료되면 생산 주문은 경기침체와는 관계없이 위탁 생산 의뢰가 발생될 것으로 예상하고 있습니다.
| [CDMO 매출 현황] |
| (단위 : 백만원) |
|
품목 |
2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 |
2020년 |
|||||
|---|---|---|---|---|---|---|---|---|---|---|
|
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
|
|
CDMO 매출 |
17,373 | 63.29% | 25,739 | 66.21% | 31,506 | 64.7% | 22,360 | 57.78% | 26,409 | 63.6% |
| 매출성장률 | -32.50% | 49.54% | 40.9% | -15.3% | 12.0% | |||||
| 주1) 2022년 3분기, 2023년 3분기 매출성장률은 전년 동기 대비 매출성장률입니다. 출처) 당사 정기보고서 |
최근 전세계 유전자치료제 시장의 빠른 성장에 힘입어, 플라스미드 DNA의 의약품 위탁수주가 증가하는 추세이며, 수주잔고는 2018년 5,921천USD, 2019년 16,697천USD, 2020년 15,293천USD, 2021년 9,181천USD, 2022년 9,283천USD를 보이고 있습니다.
| [매출액 및 수주잔고 현황] |
| (단위: 백만원, 천USD) |
| 구분 | 2023년 3분기 | 2022년 3분기 | 2022년 | 2021년 | 2020년 |
|---|---|---|---|---|---|
| 수익(매출액) | 27,448 | 38,873 | 48,718 | 38,700 | 41,503 |
| 매출액 증가율 | -29.39% | 36.40% | 25.89% | -6.75% | 0.63% |
| 수주잔고 현황(천USD) | 8,446 | 10,373 |
9,283 | 9,181 | 15,293 |
| 주1) 2022년 3분기, 2023년 3분기 매출성장률은 전년 동기 대비 매출성장률입니다. |
| 주2) 상기 수주잔고는 당사가 기 공시한 5% 이상 단일공급계약체결 공시사항만을 집계한 것이며, 5% 미만 계약의수주잔고는 제외하였습니다. 출처) 당사 정기보고서 |
| [2023년 3분기말 기준 수주 현황] |
| (단위 :USD) |
| 품목(*1) | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
|---|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
| 임상용 Plasmid DNA |
2023-01-31 |
2024-01-30 |
- |
5,311,200 |
- |
861,820 |
- |
4,449,380 |
| 합 계 | - |
5,311,200 |
- |
861,820 |
- |
4,449,380 | ||
| 주1) 상기 수주잔고는 당사가 기 공시한 5% 이상 단일공급계약체결 공시사항만을 집계한 것이며, 5% 미만 계약의 수주잔고는 제외하였습니다. 출처) 당사 정기보고서 |
또한 2018년 9월17일 자회사 VGXI가 임상용 의약품 mRNA를 생산하기 위해 미국 휴스턴 매소디스트 병원 연구소(Houston Methodist Research Institute)와 독점적 라이선스-인 계약을 체결함에 따라, mRNA 백신 및 mRNA 치료제 생산의 핵심 기술과 mRNA 백신 설계 및 연구 기술을 이전 받아 mRNA 백신 및 mRNA 치료제 연구개발 사업에 진출하게 되었습니다. 자회사인 VGXI는 mRNA 기반 의약품의 상업적 생산을 위한 파일럿 생산공정을 성공적으로 구축한 후 대규모 cGMP 생산공정을 구축하기 위한 공정 스케일업 및 최적화 단계를 진행하고 있습니다. 이에 당사는 2019년 12월 VGXI가 기존 생산시설과는 별도로 약 10배 이상 규모로 유전자치료제 원료물질인 플라스미드 DNA와 mRNA에 대한 대한 새로운 생산시설 건설을 결정하고, BE&K Building Group을 시행사로 선정했습니다. 유전자치료제 제품들이 미국시장에 성공적으로 진입함에 따라 형성된 플라스미드 DNA 및 mRNA의 폭발적 생산 수요에 적극적으로 대응하기 위해 추가 확장을 추진 하였습니다. 금번 신축 공장에는 mRNA 원액(DS) 생산 라인도 추가되었습니다. 신공장의 70%는 Plasmid DNA 생산시설이며, 30%는 mRNA 원액생산 시설입니다. 이에 따라 당사는 mRNA 백신의 원료와 원액을 둘다 위탁생산 하게 되었습니다. 이 생산시설의 CAPA는 3,000L 규모이며,2023년 01월 계약한 70억원 규모의 생산을 위해 가동 중입니다.
|
[RNA 장비등 시설자금사용계획] |
|
(단위 : USD, 원) |
| 구분 | 2023년 3분기 | 2023년 4분기 | 2024년 1분기 | 비용 | |
|---|---|---|---|---|---|
| 달러 | 원화 | ||||
| RNA Equipment (RNA 장비) |
$1,275,200.00 | $369,600.00 | $355,200.00 | $2,000,000.00 | 2,679,800,000.00 |
| 합계 | $2,000,000.00 |
2,679,800,000 | |||
| 주) 투자자분들의 이해를 돕기 위해 환율은 1339.9원을 적용하여 환산하였습니다. 실제 자금 집행시 환율에 따라 금액이 변경될 수 있습니다. 출처) 당사 제시 |
| [미국 휴스턴 소재 VGXI 생산 시설 ] |
 |
|
VGXI 생산 장비1 |
 |
|
VGXI 생산 장비2 |
 |
|
VGXI 생산 장비3 |
| 출처: 당사 제시 |
2) VGXI 원재료 구입등 운영자금
바이오의약품 CMO사업은 임상 및 비임상 시험에 필요한 유전자치료제 및 DNA 백신의 원료인 국제규격(cGMP) 플라스미드(Plasmid) DNA 제품을 2008년 6월 미국에 설립한 현지법인인 VGXI, Inc.에서 생산하여 해외 판매지점인 VGXI USA를 통해 판매하고 있습니다. 또한, 2018년 9월 미국 휴스턴 매소디스트 병원 연구소 (Houston Methodist Research Institute, HMRI)와 독점적 라이선스 계약을 통해, 임상 등급의 mRNA 생산 기술을 확보하여 생산공정 스케일업을 진행했으며, 이에 따라 mRNA 백신 및 mRNA 치료제의 위탁생산 서비스 제공을 위한 준비를 마무리하고 있습니다.
플라스미드 DNA는 최근 미국 및 전세계에 시판된 바이러스 운반체 기반 유전자치료제들의 원료물질로 이용되고 있고, 플라스미드 DNA 유전자치료제에서는 주성분으로 이용되고 있어, 전세계 유전자치료제 의약품 생산의 근간을 이루는 중요한 역할을하고 있습니다. 즉, AAV 운반체 기반 유전자치료제 또는 렌티바이러스 운반체 기반 유전자치료제를 생산하기 위해서는 반드시 플라스미드 DNA의 의약품 생산이 전제되어야 합니다. 따라서, 최근 전세계 유전자치료제 시장의 급속적인 성장에 힘입어, 플라스미드 DNA의 의약품 위탁생산 산업의 성장이 가속화 되고 있습니다.
'Viral Vector & Plasmid DNA Manufacturing Market (2019년5월, Acumen Research and Consulting사 발행)’보고서에 의하면, 2026년까지 18억불의 시장 규모와 2019년부터 2022년까지의 연평균성장률(CAGR) 21.4%를 전망하였습니다.
비록 유전자치료제 시장의 급속한 성장으로 이들의 원료물질인 플라스미드 DNA의 전세계 의약품 생산 수요는 증가하고 있지만, 원료물질이라는 점과 고순도, 고농도의플라스미드 GMP 생산기술이 필요 하다는 점들로 인해, 전문적인 위탁 생산기업이 전세계적으로 많지 않고, 기업들간 기술력의 차이가 있습니다.
대표적인 플라스미드 DNA 위탁생산기업으로는 미국의 VGXI사 (진원생명과학 자회사), 벨기에의 Eurogentec사, 미국의 Aldevron사, 영국의 Cobra사등이 있습니다. 최근 플라스미드 DNA의 전세계 위탁생산 수요가 증가함에 따라, 몇몇 기업들의 생산시설 확장 보도가 이어지고 있습니다. 미국의 VGXI사와 Adveron사는 2020년대초까지 연 매출 10억불의 생산시설의 확장을 완료하거나 진행하고 있습니다.
당사가 현재 수행 중인 플라스미드 DNA 및 RNA 원액 생산 CDMO 사업을 위해 필요한 원재료 구입비등 총 예산은 4,276만달러 수준으로 예상하고 있습니다.
다만, VGXI의 신규 공장 1단계 3,000L를 가동하기 위해 필요한 필터류 등의 원재료를 선제적으로 구입하여 신규 공장의 오더를 수주하는데 있어 우위를 점하고자 했던 기존 계획을 철회하고, 현재 오더를 수주하지 못하고 있는 상황에서 해당 자금을 금번 유증을 통해 조달하여 사용하는 것보다는 신규 오더를 받으면 계약금액의 50%를 받기 때문에 오더를 수주한 이후 해당 선수금을 통해 계약분에 필요한 원재료를 구입할 계획입니다.
| 출처) 당사 제시 |
| 용어 | 설명 |
|---|---|
| Fermentation (배양 공정) | 플라스미드 DNA를 대량 생산하기 위한 첫 공정으로써, 생산하고자 하는 플라스미드 DNA를 갖고 있는 미생물(대장균)을 배양기에서 대량 배양하기 위한 방법이며, 미생물의 성장에 필요한 영양분을 함유한 배지에서 최적화된 온도와 pH, 산소 농도 등을 유지하여 높은 수율의 플라스미드 생산이 가능하도록 합니다. 이런 미생물 배양기는 미생물의 성장에 필요한 요소들을 매우 정밀하고 정확하게 조절할 수 있어야 하고, 성장한 미생물을 오염없이 용이하게 다음 공정으로 전달할 수 있어야 하므로, 배양기에 필요한 라인(Line)과 튜브(Tubing), 코넥터(Connector) 등 모든 부품의 품질은 미생물의 대량 배양 공정상 품질관리에 있어서 매우 중요한 요소입니다. |
| Harvest (수득 공정) | 배양한 미생물(대장균)을 대량으로 수득하는 과정은 플라스미드 DNA 생산수율을 높이는데 매우 중요한 공정입니다. 대량 배양 과정에서 미생물을 고정하여 배양에서 수득까지 높은 농도와 생산성을 지속적으로 안정하게 유지하기 위하여 실관 막(Hollow Fiber Membrane) 배양기를 사용합니다. |
| Lysis (용해 공정) | 배양한 미생물(대장균)을 용해하여 플라스미드 DNA가 용출될 수 있도록 하는 과정입니다. 적당한 조성의 용해 버퍼를 사용하여 미생물 내 세포 물질의 오염과 미생물 슬러지를 최소화하면서 플라스미드 DNA를 수득하는 것이 중요하므로, 이를 위하여 용해 공정상 유속을 조절하는 Lysis Flow Kit를 사용합니다. |
| Depth Filtration (심층 여과 공정) | 미생물(대장균) 배양 후 분리단계로 용해 공정이후 배양액내 미생물 파쇄물을 제거하여 배양액을 분리하는 장치입니다. 효과적인 여과를 위하여 다양한 막과 여과방법을 통하여 총 처리량을 많도록 하는 주요 공정임으로 여과 중 온도, 전도도 등과 함께 유량을 모니터링하기 위해 Depth Filtration Flow Kit가 중요한 소모품으로 사용됩니다. |
| Anion Exchange XT5000 (음이온 교환 XT5000) | 미생물(대장균) 용해물질이 여과된 용액에서 플라스미드 DNA를 분리정제하기 위해 음이온 교환 크로마토그래피를 사용하는 과정입니다. 대량의 플라스미드 DNA를 분리정제할 수 있도록 분당 50리터까지 처리 가능한 Mustang Q XT5000 크로마토그래피를 사용합니다.. |
| Anion Exchange Monolith (음이온 교환수지 단일체) | 음이온 교환수지 단일체를 의미하고, 음이온 교환 크로마토그래피를 수행할 때 사용하는 컬럼입니다. 다양한 유속에서 높은 효율의 정제와 높은 생산성을 얻을 수 있는, 플라스미드 DNA 분리정제에 중요한 컬럼 소모품으로 40리터의 음이온 교환수지 단일체를 사용합니다. |
| RNA Filtration (RNA 여과 공정) | 플라스미드 DNA를 정제하기 위해 용액내에 포함된 RNA를 제거하는 과정으로 배양된 미생물에서 얻어진 뉴클레오타이드 혼합물에서 플라스미드 DNA만을 수득하는 중요한 과정입니다. |
| HIC (Hydrophobic Interaction Chromatography, 소수성 상호작용 크로마토그래피) | 친수성인 플라스미드 DNA를 정제하기 위해 사용하는 소수성 상호작용 크로마토그래피로써 플라스미드 DNA 용액내에 소수성 친화도가 높은 단백질과 같은 오염물을 제거하기 위한 과정으로 고염도의 버퍼 조성에서 사용합니다. 대량의 플라스미드 DNA 정제를 위하여 100 nm 입자 기공과 65 μm 레진을 사용하고 높은 소수친화도를 갖는 Toyopearl Butyl 650M Resin 제품으로 소수성 상호작용 크로마토그래피를 수행합니다. |
| UF/DF (Ultrafiltration/Diafiltration, 버퍼 교환) | 플라스미드 DNA 생산의 다운스트림 공정으로 정제 단계를 거치면서 희석된 플라스미드 DNA를 농축하기 위한 한외여과(UF)와 최종 제품 버퍼로 교환하기 위한 희석여과(DF) 과정으로 버퍼 교환으로 총칭합니다. 희석여과는 한외여과에서 투과수량만큼 교환하고자 하는 정용여과 완충용액(Diafiltration buffer)을 주입하여 플라스미드 DNA의 안정성을 확보할 수 있습니다. |
| Aseptic (무균 공정) | 전체적인 공정상 생물학적인 오염을 막기 위해 고효율의 무균 필터를 사용합니다. |
| 기타 소모품 | 미생물 배양 배지와 각종 버퍼의 조성, 필터 등 필요한 소모품입니다. |
|
[VGXI 대여금 자금사용계획] |
|
(단위 : USD, 원) |
| 구분 | Description | 2023년 3분기 | 2023년 4분기 | 2024년 1분기 | 비용 | 비고 | |
|---|---|---|---|---|---|---|---|
| 달러 | 원화 | ||||||
| Payroll (급여) |
ADMIN / SALES | $1,209,910.00 | $1,209,910.00 | $1,209,910.00 | $3,629,730.00 | 4,863,475,227.00 | 관리/영업 부문 급여 |
| MFG / PD / Materials | $2,423,428.00 | $2,423,428.00 | $2,423,428.00 | $7,270,284.00 | 9,741,453,531.60 | 생산 부문 급여 | |
| Quality Control / Quality Assurance |
$1,068,870.00 | $1,068,870.00 | $1,068,870.00 | $3,206,610.00 | 4,296,536,739.00 | 품질관리 부문 급여 | |
| Facilities | $477,650.00 | $477,650.00 | $477,650.00 | $1,432,950.00 | 1,920,009,705.00 | 시설관리 부문 급여 | |
| 합계 | $5,179,858.00 | $5,179,858.00 | $5,179,858.00 | $15,539,574.00 | 20,821,475,202.60 | - | |
| 주) 투자자분들의 이해를 돕기 위해 환율은 1339.9원을 적용하여 환산하였습니다. 실제 자금 집행시 환율에 따라 금액이 변경될 수 있습니다. 출처) 당사 제시 |
당사는 상기 표와 같이 금번 유상증자를 통해 1,554만달러(20,821백만원)를 조달하여 자회사 VGXI의 급여를 지급할 예정입니다.
3) 연구개발비용(SFTS 임상시험 및 의료기기 개발등)
당사는 금번 유상증자를 통하여 모집되는 자금 중 21,340백만원을 사용하여 SFTS 임상시험 및 의료기기 개발등에 사용할 계획이었으며. 개발에 사용되는 자금은 회계상 연구개발비로 처리될 예정이었습니다. 하지만, 주가 하락으로 인해 예정모집 총액이 줄어듦에 따라 금번 유상증자 대금 중 연구개발 관련 자금사용계획은 철회하였습니다.
다. 자금 집행 방식 및 회수 계획
당사는 직전 유상증자 납입 이후 본 공시서류 제출 전일 현재 공사 비용 집행을 위해 VGXI에 대여금 101,000,000달러를 대여하였습니다. 그 내역은 다음과 같습니다.
| [VGXI 대여금 상세 내역] | |
| (기준일 : 본 공시서류 제출일 전일 현재) | (단위: USD) |
|
구분 |
관계 |
대여시기 |
대여금액 |
금리 |
만기 |
비고 |
|---|---|---|---|---|---|---|
| VGXI, Inc. | 자회사 | 2020-08-04 | 3,200,000 | 4.60% | 2028-08-03 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2020-10-13 | 3,600,000 | 4.60% | 2028-10-12 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2020-11-13 | 11,400,000 | 4.60% | 2028-11-12 | 만기 연장 |
| VGXI, Inc. | 자회사 | 2021-01-14 | 3,700,000 | 4.60% | 2024-01-13 |
- |
| VGXI, Inc. | 자회사 | 2021-04-26 | 13,000,000 | 4.60% | 2024-04-25 |
- |
| VGXI, Inc. | 자회사 | 2021-08-17 | 5,000,000 | 4.60% | 2024-08-16 | - |
| VGXI, Inc. | 자회사 | 2021-09-13 | 5,000,000 | 4.60% | 2024-09-12 | - |
| VGXI, Inc. | 자회사 | 2021-10-12 | 5,000,000 | 4.60% | 2024-10-11 | - |
| VGXI, Inc. | 자회사 | 2021-11-11 | 2,890,175 | 4.60% | 2024-11-10 | - |
| VGXI, Inc. | 자회사 | 2021-12-16 | 12,000,000 | 4.60% | 2024-12-15 | - |
| VGXI, Inc. | 자회사 | 2022-01-26 | 10,000,000 | 4.60% | 2025-01-25 |
- |
| VGXI, Inc. | 자회사 | 2022-02-23 | 13,209,825 | 4.60% | 2025-02-22 |
- |
| VGXI, Inc. | 자회사 | 2022-07-08 | 2,000,000 | 4.60% | 2025-07-07 | - |
| VGXI, Inc. | 자회사 | 2022-10-07 | 2,000,000 | 4.60% | 2025-10-06 | - |
| VGXI, Inc. | 자회사 | 2022-10-14 | 2,000,000 | 4.60% | 2025-10-13 |
- |
| VGXI, Inc. | 자회사 | 2022-12-05 | 3,000,000 | 4.60% | 2025-12-04 | - |
| VGXI, Inc. | 자회사 | 2023-02-17 | 1,000,000 | 4.60% | 2026-02-16 | - |
| VGXI, Inc. | 자회사 | 2023-05-30 | 1,000,000 | 4.60% | 2026-05-29 | - |
| VGXI, Inc. | 자회사 | 2023-06-20 | 1,000,000 | 4.60% | 2026-06-19 | - |
| VGXI, Inc. | 자회사 | 2023-07-06 | 1,000,000 | 4.60% | 2026-07-05 | - |
| 합계 | 101,000,000 | - | - | - | ||
|
주1) 대여금에 대한 이자는 대여일로부터 1년 단위로 이자를 상환하도록 계약을 체결하였습니다. |
당사는 금번 유상증자를 통하여 자금조달이 완료되면 증권신고서에 기재된 VGXI 시설자금 및 운영비를 시점에 맞춰 적법한 이사회결의를 통하여 VGXI에 추가로 대여형태로 집행할 계획입니다. VGXI에 대한 대여금의 만기는 5년으로 하고, 대여금에 대한 이자는 국세청 고시 이율을 적용하여, 1년 단위로 수취할 계획입니다.
본 공시서류 제출일 전일 현재의 자회사 VGXI Inc의 대여금은 미화 101백만달러입니다. 이에 대한 기대신용손실은 향후 외부평가를 하여 손상징후가 발견된다면 전년도 22년과 동일하게 이를 재무제표에 반영할 예정입니다. 2022년에는 회사가 평가한 기대신용손실은 동종업종의 기대신용손실모형을 적용하였으며, 자회사 VGXI Inc에게 대여한 미화 101백만달러에 대하여 17억원을 대손으로 설정하여 별도 재무상태표의 자산이 해당금액만큼 감소하고, 별도 손익계산서의 당기순손실이 해당금액만큼 증가하였습니다. 또한 자회사 VGXI Inc 는 2023년 3분기 기준으로 자본잠식이 되었기에 VGXI Inc 의 투자자산 전액을 자회사 손상으로 보아 별도 재무제표에 반영하여 자산을 감소시키고 영업외 비용인 손상차손을 증가시켰으며 당기손실이 증가되어 자본이 감소 되었습니다.
2023년 3분기 자회사 대여금에 대하여 손상평가는 전년도말에 인식하였던 기대신용손실모형 (Expected Credit Loss)을 적용하였으며 기대신용손실모형은 당사가 미래에 발생할 채무불이행률 (Probability of Default: PD)과 미래의 부도시점 대출금액 즉, 신용위험노출금액(Exposure at Default: EAD)을 구하고, 대출금액이 부도가 나게 되면 그 시점에서의 신용위험노출금액(EDA) 중에서 몇 %의 금액이 손실로 발생할 것인가에 대한 채무불이행시의 손실률(Loss Given Default: LGD)을 구하여 신용위험(Credit Risk)을 대여금의 손상가능성 금액으로 인식하였습니다. 참고로 각각의 채무불이행율, 신용위험노출금액 그리고 채무불이행시의 손실율은 2022년 3월에 세계 3대 신용평가기관 중 피치그룹과 스탠더드 앤드 푸어스의 모회사인 S&P 글로벌에서 발표한 자료를 각각 참고하여 적용하였습니다. 자회사 대여금에 대하여 손상으로 인식한 이유는 당사의 수주계약 상황만으로 판단해 보았을 때 대여금이 회수될 여지가 불분명하고 회수될 기한이 구분되지 않기에 대여금에 대하여 손상을 인식하였습니다. 또한 금번 유상증자 금액 중 자회사의 운영자금을 위하여 대여될 대여금 역시 자회사 VGXI Inc.가 현재와 같이 수주계약이 계획과 다르게 과거 년도 정도의 매출액만 발생된다면, 추가적으로 지급되는 대여금들 또한 손상으로 인식되어 당기손순실 금액이 더욱 가중될 수 있으니 이 점 투자자 및 주주분들께서는 충분히 검토하시길 바라겠습니다.
자회사 VGXI Inc 의 대여금에 대하여는 자회사이므로 자금에 대한 통제가 가능하며, 이에 대한 회수 계획은 자회사 VGXI Inc가 신규 오더 등의 수주를 통해 매분기 적정 수익이 발생하면, 진원생명과학이 분할하여 대여한 대여금에 대하여는 대여된 순서대로 회수할 계획입니다.
2023년 8월 3일, 2023년 10월 12일, 2023년 11월 12일 각각 만기가 도래하는 $3.2M, $3.6M, $11.4M 대여금은 이사회(2023년 7월 19일)에서 자회사의 회수가 현재로는 불가능하여 만기를 2028 년 8월 3일, 2028년 10월 12일, 2028년 11월 12일까지 5년으로 기한을 연장하고 이율은 동일한 4.6%를 적용하는 것을 결의하였습니다. 당사가 자회사와의 대여금 및 발생이자에 대하여는 계약조건으로 기재된 바와 같이 상호 합의 후 언제든 전부 또는 일부가 상환될 수 있기에 자회사가 자금의 여력이 발생할 경우 발생된 이자 및 대여금 원금에 대하여 상환을 진행할 예정입니다. 그러나 회사는 보고서를 제출하는 현재까지 자회사가 충분히 운영될 수 있는 계약들을 수주 받지 못하였기에 대여금 등의 회수 가능성은 현재로서는 불투명합니다.
또한, 자회사 VGXI Inc의 매출등이 기대와는 다르게 하향된다면 운영자금이 부족하게 될 수 있지만, 당사는 금번 자회사에 운영비 약 23,501백만원에 대한 대여금 지급 후 추가적인 대여를 계획하고 있지 않으며 앞으로는 VGXI가 자체적인 자금조달을 통해 운영비를 마련하도록 할 예정입니다. 자체 자금 조달이 어려울 경우 당사는 금번과 같은 주주를 대상으로 공모가 아닌 당사가 보유한 VGXI의 지분 가운데 일정 부분을 매각 또는 신주 발행 등의 방법으로 운영비를 조달할 계획입니다.
당사는 이러한 상황이 되지 않도록 사전에 다각도로 자회사 VGXI Inc를 통하여 자회사 운영에 이상이 없도록 자금을 융통할 계획입니다. 그럼에도 불구하고 외부에서 자금을 지원 받을 경우 현재 최대주주의 지분율이 하락하여 최대주주가 변경될 수 있으니 투자자께서는 이점 유의하시길 바라겠습니다. 더불어 자회사 VGXI Inc 대여금에 대하여 기대신용손실 모형을 외부에서 평가시에는 과거 회사가 적용한 기대신용손실 모형으로 산출된 대손충당금의 설정 금액과 다르게 대손금액이 증가될 수 있기에 별도 재무상태표의 자산이 예상보다 감소하고, 손익계산서의 당기순손실의 금액이 예상보다 증가될 수 있습니다. 투자자분들께서는 이점 유의하시길 바라겠습니다.
| [ 대여금 관련 주요 금융조건 ] |
| 구분 | 내용 |
|---|---|
| 대주 | 진원생명과학(주) |
| 차주 | VGXI |
| 총 대여금액 | $17,540,000 (실제 집행 시기의 필요 금액과 환율에 의하여 일부 변동될 수 있습니다) |
| 대여일자 | 금번 유상증자 납입일 이후 필요시기에 맞게 순차적으로 대여 예정 |
| 만기 | 5년 |
| 대여금리 | 대여 당시 국세청 고시 이율 적용 |
| 자금사용 목적 | 시설/운영자금 |
| 기타사항 | - |
출처) 당사 제시
대여금의 원금에 대해서는 발생하는 수익을 통해 점진적인 회수를 계획하고 있으며, 이와 별도로 미국 현지에서 추가 증설과 기존 설비를 위한 자금조달이 이루어질 경우 대여금을 회수할 수 있을 것으로 예상하고 있습니다. 자회사 DIV는 현재 지속적인 신제품 개발 및 수주활동을 증가하고 있으며, 5-7년 이내로 대여금을 상환하려는 목표로 노력하고 있습니다. 또한, 당사는 VGXI로부터 지속적인 재무 및 유동성 현황에 대한 자료를 받아 원금 및 이자에 대한 회수 가능성에 대하여 모니터링할 계획입니다.
현재까지는 대여금 회수 계획에서 언급한 바와 같이 매출 증가를 목표로 노력하고 있으나, 회사가 기대하는 바와 같이 진행되지 않고 경기침체 및 회사에 악영향을 미치는 상황이 계속될 경우 종속회사의 운영을 목적으로 추가적인 자금 대여가 필요할 수 있으며, 당사는 종속회사의 자금부족 문제를 해소하기 위해 대여를 해야 하는 상황이 발생하기 때문에 투자자께서는 이점 주의하시길 바랍니다.
또한, 종속회사 DIV의 신용상태는 변동되지 않았고, 대여금의 만기 상환 기간이 남아 있으며, 대여금의 이자에 대하여 지연된 바가 없어서 기대손실 모형을 적용하지 않았습니다. 그러나 적자가 지속되고 있어 이자상환 등이 어려울 경우 이에 대한 기대손실모형을 적용하여 대손상각을 추가로 적용하게 되어 별도 손익 계산서에 악영향을 미칠 수 있습니다.
라. 필요 추가 조달 자금 규모 및 필수 운영비 지출 계획
1) 필요 추가 조달 자금 규모
당사 및 자회사의 2023년 수주상황에 따른 예상 수입과 그에 따른 필요 추가 조달 자금 규모는 아래 표와 같습니다. VGXI의 경우 예상 차입금은 전액 모회사인 진원생명과학으로부터의 대여금을 통해 차입 예정이며, 2023년 05월부터 신규공장 가동에 따라 매출 변동이 커질것으로 예상하지만, 보수적으로 평년 평균정도로 인식하였습니다. 또한 미래의 매출을 기대하여 많은 인원 및 비용이 투입되어 예상 지출 금액을 높게 설정하였습니다.
당사는 금번 유증이 지연됨에 따라 필요자금 조달을 위해 2023년 9월 제3자배정 유상증자 24.7억원을 진행하였으며, 동월에 국내 신한은행으로부터 옥천공장의 토지 및 건물을 담보로 3개월(9월6일-12월6일) 단기로 21억원 대출을 진행하였습니다. 12월에 신한은행의 담보대출 만기로 인하여 해당 대출금의 일부 15억원은 전북은행에게 옥천공장의 토지와 건물을 담보로 1년 장기대출로 대환했으며, 차액 6억원은 회사 보유금액으로 상환하였습니다.
2024년 2월에 자금조달 금액으로 표기된 66,660백만원은 금번 유증을 통해 조달 예정인 금액입니다. 해당 금액은 본 유증 과정에서 변경되어 실제 유입되는 금액은 달라질 수 있습니다.
| [진원생명과학] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 | 2024-02-01 |
|---|---|---|---|---|---|---|---|
| 기초 (1일) | 4,470 | 3,659 | 6,849 | 5,731 | 4,519 | 2,880 | 1,380 |
| 자금조달 | - | 4,570 | - | - | 1,500 | - | 66,660 |
| 수입 | 1,164 | 777 | 1,124 | 983 | 1,000 | 1,000 | 1,000 |
| 지출 | 1,975 | 2,157 | 2,242 | 2,195 | 4,139 | 2,500 | 3,500 |
| 대여 | - | - | - | - | - | - | 23,500 |
| 기말(말일) | 3,659 | 6,849 | 5,731 | 4,519 | 2,880 | 1,380 | 42,040 |
출처) 당사 제시
아래 표에서 2023년 8월과 9월 VGXI에 대여가 이뤄지지 않았습니다. 해당 내용은 당사가 금번 유증을 통해 자금을 조달하면 8월과 9월 대여를 통해 VGXI의 시설자금과 운영자금으로 사용할 계획이 표기된 부분입니다. 마찬가지로 2024년 2월에 표기된 23,500백만원도 금번 유증을 통해 자금을 조달하면 대여할 금액을 표기한 것입니다.
2023년 11월 8,232백만원은 당사가 채무보증을 하고 VGXI가 Amerisource로부터 차입한 USD7.5M에 대해 선이자 및 관련 수수료 일체를 제외하고 실제 유입된 금액을 적용환율로 환산한 원화금액입니다.
| [VGXI] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 | 2024-02-01 |
|---|---|---|---|---|---|---|---|
| 기초 (1일) | 1,107 | 1,169 | 556 | 4,585 | 12,415 | 9,567 | 7,007 |
| 차입 (금융기관) | - | - | - | 8,232 | - | - | - |
| 차입 (진원) | - | - | - | - | - | - | 23,500 |
| 수입 | 3,380 | 3,698 | 8,996 | 2,067 | 1,920 | 1,920 | 1,920 |
| 지출 | 3,318 | 4,311 | 4,967 | 2,469 | 4,768 | 4,480 | 4,480 |
| 기말(말일) | 1,169 | 556 | 4,585 | 12,415 | 9,567 | 7,007 | 27,947 |
출처) 당사 제시
적용환율) 2023년 8월부터 11월까지의 각 환율은 서울외국환중개소에서 제공한 각 월별 평균환율을 적용하였으며, 12월부터는 신한투자증권에서 제시한 2024년 예측환율 1,280원을 적용하였습니다.
| [DIV] | |
| (기준일 : 본 공시서류 제출 전일 현재) | (단위: 백만원) |
| 구분 | 2023-08-01 | 2023-09-01 | 2023-10-01 | 2023-11-01 | 2023-12-01 | 2024-01-01 |
|---|---|---|---|---|---|---|
| 기초 (1일) | 175 | 176 | 167 | 178 | 169 | 160 |
| 차입 (진원) | - | - | - | - | - | - |
| 수입 | 3,420 | 3,410 | 3,430 | 3,410 | 3,410 | 3,410 |
| 지출 | 3,419 | 3,419 | 3,419 | 3,419 | 3,419 | 3,419 |
| 기말(말일) | 176 | 167 | 178 | 169 | 160 | 151 |
출처) 당사 제시
2) 월별 필수 운영비
당사의 예상 월별 필수 운영비는 2,610,931천원 중 급여 1,121,340천원과 경상연구개발비 1,073,002천원이 예상됩니다. 자회사 VGXI와 DIV의 월별 필수 운영비의 경우 각각 3,419,625천원, 873,434천원 예상되며, 세부내역은 하기 표와 같습니다.
| [진원생명과학] | |
| (단위: 천원) | |
| 구분 | 진원생명과학 | VGXI USA(지점) | 계 |
|---|---|---|---|
| 급여 | 896,078 | 225,262 | 1,121,340 |
| 퇴직급여 | 49,116 | - | 49,116 |
| 복리후생비 | 43,716 | 5,495 | 49,211 |
| 여비교통비 | 3,354 | 2,597 | 5,951 |
| 세금과공과 | 10,688 | 1,482 | 12,170 |
| 지급임차료 | 50,407 | - | 50,407 |
| 차량유지비 | 4,637 | - | 4,637 |
| 경상연구개발비 | 912,767 | 160,235 | 1,073,002 |
| 소모품비 | 1,654 | - | 1,654 |
| 지급수수료 | 94,440 | 10,422 | 104,862 |
| 사용권자산 | 66,592 | 26,837 | 93,429 |
| 광고선전비 | 5,834 | 24,196 | 30,030 |
| 운반비 | 5,063 | - | 5,063 |
| 통신비 | 2,442 | - | 2,442 |
| 견본비 | 843 | - | 843 |
| 물류비 | 1,552 | - | 1,552 |
| 수출제비용 | 5,222 | - | 5,222 |
| 계 | 2,154,405 | 456,526 | 2,610,931 |
출처) 당사 제시
| [VGXI] | |
| (단위: 천원) | |
| 구분 | 제조비 | 판관비 | 계 |
|---|---|---|---|
| 급여 | 826,392 | 295,958 | 1,122,350 |
| 복리후생비 | 312,549 | 79,447 | 391,996 |
| 여비교통비 | 1,727 | 17,854 | 19,581 |
| 통신비 | 1,351 | 10,186 | 11,537 |
| 수도광열비 | 36,398 | 76,879 | 113,277 |
| 세금과공과 | 6,077 | 18,536 | 24,613 |
| 지급임차료 | - | 86,791 | 86,791 |
| 수선비 | 45,134 | - | 45,134 |
| 보험료 | 22,441 | 17,106 | 39,547 |
| 외주가공비 | 71,045 | - | 71,045 |
| 운반비 | 28,005 | - | 28,005 |
| 지급수수료 | 38,759 | 314,478 | 353,237 |
| 원재료 | 478,889 | - | 478,889 |
| 외부연구수수료 | 594,716 | - | 594,716 |
| 소모공기구 | 2,692 | - | 2,692 |
| 시험비 | 7,305 | - | 7,305 |
| 차량유지비 | - | 2,640 | 2,640 |
| 사무용품비 | - | 25,385 | 25,385 |
| 소모품비 | - | 887 | 887 |
| 계 | 2,473,479 | 946,147 | 3,419,626 |
출처) 당사 제시
| [DIV] | |
| (단위: 천원) | |
| 구분 | 제조비 | 판관비 | 계 |
|---|---|---|---|
| 급여 | 59,837 | 45,033 | 104,870 |
| 복리후생비 | 10,560 | 12,448 | 23,008 |
| 수도광열비 | 52,999 | 1,408 | 54,407 |
| 세금과공과 | 4,328 | 3,222 | 7,550 |
| 수선비 | 8,975 | - | 8,975 |
| 차량유지비 | - | 2,416 | 2,416 |
| 운반비 | - | 5,727 | 5,727 |
| 소모품비 | 7,105 | - | 7,105 |
| 지급수수료 | - | 5,417 | 5,417 |
| 물류비 | 3,721 | - | 3,721 |
| 수출제비용 | 7,003 | 2,699 | 9,702 |
| 외주가공비 | 15,209 | - | 15,209 |
| 원재료 | 622,161 | - | 622,161 |
| 여비교통비 | - | 1,569 | 1,569 |
| 광고선전비 | - | 1,596 | 1,596 |
| 계 | 791,898 | 81,535 | 873,433 |
출처) 당사 제시
VI. 그 밖에 투자자보호를 위해 필요한 사항
해당사항 없습니다.
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
1-1. 연결대상 종속회사 개황
(1) 연결대상 종속회사 현황(요약)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | 2 | 0 | 0 | 2 | 2 |
| 합계 | 2 | 0 | 0 | 2 | 2 |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조 |
(2) 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
1-2. 회사의 법적·상업적 명칭
당사의 명칭은 진원생명과학 주식회사라고 표기합니다.
또한 영문으로는 GeneOne Life Science, Inc., 라 표기합니다.
약식으로 표기할 경우에는 진원생명과학(주)라고 표기합니다.
1-3. 설립일자 및 존속기간
초기에는 의류용 심지 전문제조/판매를 목적으로 1976년1월27일에 설립되었습니다. 1987년11월16일에 유가증권시장에 상장되어 매매가 개시되었습니다.
1-4. 본사의 주소, 전화번호, 홈페이지 주소
① 주 소 : 서울시 영등포구 여의대로108, 20층(여의도동, 파크원NH금융타워)
② 전화번호 : 02-3458-4030
③ 홈페이지 : http://www.genels.com
1-5. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
1-6. 주요사업의 내용 및 향후 추진 신규사업
(1) 회사의 주요 목적사업
| 주요 목적 사업 | 사업영위 여부 | 정관 |
|---|---|---|
| 1. 생명공학을 이용한 의약품 개발 | 영위 |
제2조(목적) |
| 2. 의약품, 원료의약품 제조 및 판매 | 미영위 | |
| 3. 의약품, 원료의약품 위탁 제조 및 판매 | 영위 | |
| 4. 제약산업 전반에 대한 컨설팅, 건설 및 건설관리 | 미영위 | |
| 5.의약품의 NRDO(No Research Development Only) 컨설팅 및 서비스 | 영위 | |
| 6. 비임상 및 임상 병리학 시험분석 및 대행서비스 | 미영위 | |
| 7. 의약품의 연구학술용역 | 영위 | |
| 8. 유전체 의학을 이용한 개인별 유전체 분석, 진단 및 의약품 개발 | 영위 | |
| 9. 각종 심지의 제조 및 판매 | 영위 | |
| 10. 각종 직물의 제직, 가공 및 판매 | 영위 | |
| 11. 섬유봉제 및 섬유제조 관련 상품과 각종 부직포 판매 | 영위 | |
| 12. 수출입업, 도매, 소매업, 통신판매업 | 영위 | |
| 13. 부동산의 매매 및 임대업 | 미영위 | |
| 14. 생명공학, 제약산업 또는 이와 관련된 업체에 대한 투자 | 미영위 | |
| 15. 생명공학, 제약산업 또는 이와 관련된 의약품 및 장비 수입,수출,판매 | 미영위 | |
| 16. 생명공학, 제약산업 또는 이와 관련된 연구장비 및 의료기기의 개발, 제조, 판매, 대여 | 영위 | |
| 17. 각호의 사업에 관련된 사업 | 영위 | |
| 18. 각호의 사업 또는 이에 관련된 사업에 대한 투자 | 영위 |
(2) 향후 추진하고자 하는 신규사업
신약개발사업은 핵산 기반 바이오 신약과 항염증 치료 신약으로 나눌 수 있습니다. 핵산기반 바이오 신약은 DNA 기반 의약품과 mRNA 기반 의약품으로 나눌 수 있으며, 치료 목적에 따라 핵산 기반 백신, 핵산 기반 유전자의약품으로 구성되어 있습니다. DNA기반 의약품 중 DNA백신은 다수의 제품이 전임상시험 및 국내외 임상시험 수행 중에 있으며, DNA 기반 단백질의약품 및 단클론항체 의약품은 타당성 검증연구를 통해 전임상 후보물질을 도출하고 있습니다. mRNA기반 의약품은 연구개발 기반 플랫폼 구축을 완료하고, mRNA 백신 후보물질을 이용한 효능 및 안전성 평가 연구를 진행하고 있습니다. DNA백신은 신변종 바이러스로부터 초래하는 질병을 사전에 예방하기 위한 신변종 감염병 DNA백신과 만성화된 감염질병에 대비하기 위한 만성 감염병 DNA백신으로 구분됩니다.
당사는 신변종 감염병 DNA백신으로 코로나19 DNA백신, SFTS DNA백신, 니파 DNA 백신, 포와산 DNA 백신을 개발하고 있습니다.
SFTS DNA백신(GLS-5140)은 중증열성 혈소판 감소 증후군 바이러스(SFTS)에 감염된 살인진드기에 물리게 되면 감염되는 SFTS 감염병의 예방 DNA백신입니다.
2015년12월 KAIST 산학협력단과 보건복지부기술개발사업에 참여하여 살인진드기바이러스 항원 후보물질 4종을 도출하였고, 마우스와 페렛을 이용한 동물실험에서 예방능력이 있음을 확인하였습니다. 그 결과를 2019년8월23일 국제 저명학술지인 Nature Communications에 발표하였습니다. 또한, 2018년6월29일 KAIST와 공동으로 "중증열성 혈소판 감소증후군(SFTS) 예방 DNA백신"에 대한 특허를 한국 특허청에 출원하였고, 2020년2월4일 특허등록을 받았습니다. 2019년6월26일 해외특허 출원을 위해 특허협력 조약(PCT)을 출원했습니다. 2020년10월 보건복지부 백신실용화기술개발사업단의 미래대응 미해결 감염병 신규백신 개발 분야의 지원과제로 선정되어 임상시험 1상의 임상시험계획 승인까지의 연구개발비용을 지원받게 되었습니다. 실험동물을 이용한 전임상시험을 통해 백신의 최종 후보물질을 선정하였고, 임상시험에 적용하기 위한 적절한 용량 및 용법을 결정하기 위한 동물실험을 완료하였습니다. 해당 실험결과는 2022년11월10일과 11월11일 양일간 진행된 화순국제백신포럼에 연자로 초청되어 발표한 바 있습니다. 현재 임상시험 1상을 계획하고 있으며, 2022년8월31일, 12월5일, 2023년6월7일에 식품의약품안전처 사전상담과와 3차례사전상담회의를 열어 임상 1상에 대한 임상시험계획 신청에 필요한 제출 자료에 대해 논의하였습니다. 임상시험 1상 IND 승인을 득하고자 현재 IND filing을 준비하고 있습니다.
코로나19 DNA백신(GLS-5310)은 2020년2월 우리나라에 코로나19 확진 사례가 발생한 직후 백신 후보물질의 디자인 및 제작을 추진하다가 2020년3월27일 <2020년도질병관리본부 긴급 현안 지정 학술연구개발 용역과제>인 "핵산백신 플랫폼을 활용한코로나19 백신후보물질 개발 사업"에 우선 순위 협상대상자로 선정되었습니다.
2020년4월 후보물질을 제작한 후 생체 외에서 후보물질로부터 코로나19 바이러스 항원이 생성되는 것을 확인하였습니다. 2020년5월 VGXI사에서 후보물질의 cGMP생산공정 개발연구를 완료하였고, 2020년7월 후보물질을 마우스에 접종한 후 우수한 항원 특이적 T세포면역반응과 항원 특이적 결합항체 반응, 그리고 중화항체의 생성을 확인하였습니다. 2020년9월 임상시험용 백신의 cGMP생산을 완료하여 1154 바이알을 보관하고 있습니다. 임상에서의 투여 경로를 실험동물에 적용하여 후보물질의 용량증량에 따른 면역원성 평가를 완료하였고, 2020년12월4일 국내 식품의약품안전처로부터 1/2a상 임상시험계획 승인을 받았습니다. 임상시험 1상 착수를 위해2020년12월18일 고대구로병원과 임상시험 계약을 체결하였고, 12월31일 첫 대상자의 접종을 완료, 2021년1월21일 고용량군의 등록 시작, 2021년3월4일 임상1상 임상시험대상자 45명의 등록을 완료하고, 2021년5월 모든 대상자의 접종이 완료되었습니다. 2021년7월8일 임상 1상중간분석 1차결과를 확인하고 자료모니터링위원회 (DSMB) 심의를 통과하여 임상 2a상 시험에 진입하였습니다. 임상 2a상은 총 5개 기관에서 실시하며, 위약대조군이 있고 이중눈가림 임상시험으로 120명을 계획하고 착수하였습니다. 총 126명이 등록되었고, 2023년1월6일 마지막 대상자의 최종방문이완료되었으며, 2023년5월10일 위약을 접종한 대상자 중에서 본인 동의 하에 GLS- 5310을 재접종한 마지막 대상자가 최종방문을 마쳤습니다. 현재 임상결과를 분석하고 있습니다. 2021년2월4일 코로나 19백신인 GLS-5310의 1/2a상 임상개발비용인 98억원중 73억원의 연구비를 정부로부터 지원을 받았고 2020년12월4일 "코로나19치료제 백신 신약개발사업단"과 협약을 체결하였습니다. GLS-5310의 글로벌 개발과 함께, 기존 피내 접종과 비강내접종을 병용하는 임상시험을 미국에서 수행하고자 2020년1월19일 미국 FDA에 임상시험계획 승인을 신청하였으며, 2021년7월27일 승인을 받았습니다. 또한, 2021년9월6일 국가임상시험지원재단과 코로나19백신 임상2a상 대상자 모집지원 협약을 체결하였습니다. 2021년7월22일 코로나19 DNA백신인 GLS-5310의 백신 조성물 특허에 대한 국내 및 PCT 출원을 완료하였습니다.
2023년1월, 자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)을 이용한 코로나19 DNA 백신(GLS-5310)의 안전성 및 면역원성에 대한 임상 1상 결과를 국제감염병학회 (International Society for Infectious Diseases, ISID) 학술지인 국제감염질환저널(International Journal of Infectious Diseases; 2021년 인용지수: 12.074)에 발표했습니다. 2023년5월 SARS-CoV-2를 포함한 전염병 대비를 위한 DNA 백신 관련 내용의 리뷰논문을 Vaccines 학술지에 발표하였고, 2023년6월 임상 1상 분석결과 중에서 GLS-5310 DNA 기초접종 후 mRNA 백신을 추가접종한 대상자들에 대한면역원성 결과를 Vaccine (Elsevier) 학술지에 게재하였습니다.
당사는 2021년12월7일 미국위스타연구소(Wistar Institute of Anatomy and Biology)가 보유한 니파(Nipah) 및 포와산(Powassan) 바이러스를 예방하는 핵산 백신 후보물질의 기술이전 계약을 체결했습니다. 국제보건기구의 10대 우선 대응 감염병중 하나인 니파 바이러스와 심각한 뇌염을 유발하는 포와산 바이러스는 아직 승인된 백신과 치료제가 없습니다. 본 라이선스 인 계약을 통하여 미국 위스타 연구소에서 보유하고있는 니파와 포와산 바이러스의 DNA 백신을 확보함으로써 당사가 보유한 핵산 백신플랫폼과 체내전달 기술을 적용하여 해당 백신들을 개발할 계획이며, 현재 이를 위한기초 연구가 진행되고 있습니다.
당사는 2023년5월 위스타 연구소와 니파 바이러스(Nipah virus) 예방 및 치료를 위한저분자 화합물 신약을 개발하기 위한 공동 연구 계약을 맺었습니다. 현재 연구개발 중인 니파 바이러스 백신에 추가하여, 니파 바이러스를 표적으로 하는 제품 포트폴리오 다각화의 일환으로 저분자 화합물 기반 항바이러스 치료제 연구를 시작했습니다. 본 연구는 위스타 연구소의 인체면역결핍바이러스(HIV, Human Immunodeficiency Virus) 연구 프로그램, 백신 및 면역 치료 센터 책임자인 루이스 몬타네르 박사(Dr. Luis J. Montaner)의 주관으로 진행되며, 해당 연구의 약물 스크리닝 및 저분자 화합물 디자인은 HIV 및 코로나19를 포함한 전염병에 대한 저분자 치료제 개발에 광범위한 경험을 갖고 있는 위스타 연구소 분자 스크리닝 및 단백질 발현 센터 (Molecular Screening & Protein Expression Facility) 책임자인 조셉 살비노 박사(Dr. Joseph Salvino)가 수행하고 있습니다.
DNA백신을 피내에 타겟팅하고 발현 효율성을 높이기 위해 흡인작용 피내 접종기 GeneDerm을 적용하고 있습니다. GeneDerm의 흡인기 모듈에 대해 2021년8월27일개량특허를 국내에 출원, 2023년6월29일 특허 등록하였으며, 2022년11월10일과 11월11일 PCT출원을 완료하였습니다. 또한, 물리적/화학적/생물학적 시험과 성능 및 전기/전자파 성능시험 등 각종 시험검사 완료, 제조 및 품질관리기준(GMP) 인정서 및 ISO-13485 취득 완료, 그리고 기술문서 심사에 통과하여 2022년4월29일 식품의약품안전처로 부터 의료기기(품목명: 전동식 의료용 흡인기, 2등급)로 승인을 득하였습니다. 해당 흡인기를 2021년10월 햄스터 공격감염 모델을 이용한 동물실험에 적용하여 GLS-5310이 야생형 및 베타 변이 코로나 19 바이러스에 대한 감염을 완벽하게예방함을 확인하였습니다. 2021년11월5일 DNA 백신의 흡인작용 피내 접종기인 GeneDerm의 플랫폼 개발과 이를 이용해서 확인된 연구결과를 사이언스의 자매지 Science Advances (사이언스 어드밴시스)에 게재하였습니다. 또한, 미국 뉴저지주립대학인 럿거스(Rutgers) 대학 연구진과 공동연구로 진행된 자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)의 약물전달 메커니즘 연구결과를 2023년1월 국제학술지 약물전달 프론티어스(Frontiers in Drug Delivery)에 게재했습니다.
2022년1월3일 미국 FDA로부터 코로나19백신접종자들을 대상으로 하여 GLS-5310을 부스터샷으로 접종하는 임상시험계획을 승인받았습니다. 해당 임상시험은 지난 2021년7월27일 승인받은 임상시험계획서에 대해 계획을 변경하여 승인받은 것으로미국에서 mRNA백신과 아데노바이러스전달체백신을 접종한 대상자에게 GeneDerm흡인압력을 이용한 피내 접종군과 피내 접종 및 코 스프레이를 이용한 비강내 접종을병용한 접종군을 비교하고자 합니다. 2022년9월 말 기준, 69명 중 69명이 등록되었고, 현재 결과를 분석하고 있습니다.
DNA기반 단백질의약품 및 단클론항체 의약품은 기존 단백질의약품 및 단클론항체 의약품 대비 우수한 가격 경쟁력, 체내 안전성 및 약효 지속성을 장점으로 하여 당사 R&D 기술력으로 직접 개발하고 있습니다. 당사가 개발/보유하고 있는 DNA 백신 플랫폼은 감염성 질환에 대한 예방백신 개발에 적용할 수 있는 기술입니다. 이 기술로 개발된 백신을 동물에 접종 시 면역원성이 잘 유도됨을 확인하여 DNA백신 개발에 대한 기술적 방법 및 결과가 2021년12월17일 Methods Mol Biol 온라인판으로 출판되었습니다.
당사는 DNA 기반 단백질의약품으로 DNA기반으로 한 혈우병 치료제의 개발 타당성에 대한 검증연구를 진행하고 있습니다.
DNA기반 혈우병치료제는 2014년10월 강원대 의생명과학대학과 플라스미드 기반으로 한 혈우병 치료제의 의약품개발 타당성 검증 연구를 착수하였습니다. 현재, 당사 자체적으로 혈액응고 8인자의 체내 생성량과 활성을 높이기 위한 제품후보물질에대한 개선 연구를 진행하고 있습니다.
당사는 DNA 기반 단클론항체 의약품으로 DNA기반 B형간염 면역글로블린의 개발 타당성 검증연구를 진행하고 있습니다.
DNA기반 B형간염 면역글로블린은 2017년4월 강원대학교 산학협력단이 보유하고 있는 B형간염 바이러스의 preS1에 특이적으로 결합하는 항체 2종에 대한 특허와 기술을 양수하여 타당성 검증 연구를 착수하였습니다. 이중 1종에 대한 특허는 2018년6월11일 한국 특허청으로부터 특허등록을 받았고, 2019년2월5일 미국 특허등록을 받았습니다. 나머지 1종은 2019년1월25일 한국 특허청에 특허 출원을 완료하였습니다. DNA기반 B형간염 항preS1 면역글로블린 2종의 후보물질 플라스미드와 항S면역글로불린 2종의 후보물질 플라스미드를 제작하여 연구용 시료를 생산하였고, 동물세포에서 항체생성과 항원 결합능력을 확인하였습니다. 현재, 실험동물에서 4종의 후보물질로부터 항체 생성 및 체내 분포 경향 분석 연구를 진행하고 있고, 2019년9월 B형간염바이러스 연구분야의 세계적 권위자인 건국대 의학전문대학원 김균환 교수 연구팀과 함께 실험동물을 이용한 효능평가 연구를 수행한 결과 항preS1 면역글로블린과 항S면역글로불린을 동시에 처리한 조건에서 우수한 바이러스 억제효과를 확인하였습니다. 현재, 당사 자체적으로 높은 국내 분포를 보이는 B형간염바이러스 유전자 C형에 대한 억제효과를 평가하는 세포 수준의 실험과 동물실험을 진행하고 있습니다.
또한, 류마티스 관절염 치료 목적으로 DNA 기반의 항 TNF 알파 단클론항체 후보 물질을 제작하여, 동물세포에서의 항체 생성과 TNF 알파 결합능력 및 아밀로이드 베타와의 결합력을 확인하고, 동물세포에서 TNF 알파의 세포살상반응 억제능을 확인하였으나, 상업화 적합성 문제로 연구개발을 중단하였습니다.
당사는 mRNA기반 의약품의 연구개발을 수행하기 위해 기반 플랫폼 구축을 완료하고, mRNA 백신 후보물질을 이용한 효능 및 안전성 평가 연구를 진행하고 있습니다.
2018년9월17일 자회사 VGXI가 임상용 의약품 mRNA를 생산하기 위해 미국 휴스턴매소디스트 병원 연구소(Houston Methodist Research Institute)와 독점적 라이선스-인 계약을 체결함에 따라, mRNA백신 및 mRNA 치료제 생산의 핵심 기술과 mRNA백신 설계 및 연구 기술을 이전 받아 mRNA 백신 및 mRNA 치료제 연구개발사업에 진출하게 되었습니다. 자회사인 VGXI는 mRNA 기반 의약품의 상업적 생산을 위한 파일럿 생산공정을 성공적으로 구축한 후 대규모 cGMP 생산공정을 구축하기 위한 공정 스케일업 및 최적화 단계를 진행하고 있습니다.
당사는 국내 mRNA백신 기반 신속 백신 개발 플랫폼 구축과 함께 mRNA 기반의 항암 백신과 단클론 항체 플랫폼 개발을 위한 연구를 진행하고 있습니다.
2021년5월31일 한미사이언스와 mRNA 백신 대규모 생산기반 및 글로벌 네트워크 구축을 위한 상호협력개발을 체결하였습니다. 이번 계약에 따라 당사와 한미사이언스는 양사가 보유한 핵심 기술을 상호 협력으로 더욱 최적화함으써 수율과 에너지 자원 활용을 극대화하는 방법 등 mRNA 백신의 글로벌 대규모 생산을 위한 차세대 생산기술을 함께 연구하고, 코로나19 및 신종 감염병mRNA백신의 공동 연구 및 사업화를 포함한 포괄적인 글로벌 핵산 사업 네트워크 구축을 위한 파트너로서 기술확보 및 시장개척 등을 위한 논의를 시작하였습니다.
당사는 2021년6월17일 mRNA 기반 신속백신제작 플랫폼을 구축하고 백신 선도물질발굴 및 유효성을 평가하는 연구가 보건복지부 백신실용화기술개발사업단의 미래대응, 미해결 신변종 감염병백신 플랫폼 개발 분야의 지원 과제로 선정되었습니다. 질병청으로부터 기술이전을 받은 지카 백신 항원을 본 과제에 적용하여 지카 mRNA백신 선도물질 발굴 및 유효성 평가를 수행함으로써, 생산 효율성과 안정성이 증진된 mRNA백신 원액생산공정 및 품질평가법을 개발하고, 원부자재의 국산화 가능여부를 확인하며, 초기 임상시험용 mRNA백신을 생산할 수 있는 LNP 제형공정 스케일 업을 목표로 하고 있습니다. mRNA 기반 신속백신제작 플랫폼의 구축을 완료한 상태이며, 지카 mRNA 백신 선도물질의 유효성 및 안전성 평가를 2022년12월31일부로완료하였습니다. 현재 확보된 지카 mRNA 백신 선도물질의 효능과 안정성을 추가적인 동물 모델에서 재확인하는 연구를 진행하고 있습니다.
당사는 2021년6월25일 원형(circular) mRNA백신 기술을 활용한 새로운 mRNA백신용 플랫폼 개발 연구가 과학기술정보통신부 신변종감염병 대응 플랫폼 기술개발 사업의 세부연구로 선정이 되어 공동연구개발기관으로 참여하게 되었습니다. 총 43개월 동안 원형(circular) mRNA 플랫폼의 구축, 생산 및 유효성 평가를 수행하고, mRNA 대량생산 공정 최적화 및 cGMP 수준의 임상용 백신의 생산을 담당하게 됩니다. 2021년9월에 원형(circular) mRNA 플랫폼의 특허 가출원을 완료한 후, 원형 (circular) mRNA 플랫폼 기술의 문제점을 보완하여 2022년9월에 특허의 국내정식출원과 국제출원(PCT)을 하였습니다. 현재, 원형(circular) mRNA의 공정 최적화를 위한 지속적인 연구개발과 함께, 신변종 감염병 선정을 위한 대상감염병(Disease X) 3종을 결정하여 백신으로 사용할 원형(circular) mRNA의 제작을 진행중에 있습니다.
당사는 R&D 역량 강화를 위한 전략적인 오픈 이노베이션(Open Innovation)을 지속적으로 추진중에 있으며, 그 결과 모 대학 연구진과 함께 mRNA 전달체를 특정 세포나 조직에 이동할 수 있도록 조절하는 타겟팅 기능을 연구하고 있습니다. 당사가 확보하고 있는 mRNA 플랫폼에 적용하여 미충족 수요(Unmet Need)가 많은 암치료 분야에 mRNA 기반의 항암 백신과 단클론 항체를 적용함에 있어서 치료용 mRNA의 단점을 극복하고 장점을 극대화하고자 하는 목적으로 공동연구를 진행하고 있습니다. 그 외에도 여러 방면으로 오픈 이노베이션을 진행하여 다양한 난치성 전염병의 백신 연구개발을 비롯하여 암이나 자가면역 질환, 퇴행성만성질환 등에 적용가능한 혁신적인 치료방법과 당사의 mRNA 플랫폼에 적용할 수 있는 새로운 치료방법을 연구기관들과 논의 중에 있습니다.
당사는 2022년12월8일, 자사 VGXI의 고객사인 애스톤 사이언스와 전략적 업무제휴양해각서(MOU)를 체결함으로써 신약개발에 대한 파트너로서 새로운 타깃 물질에 대한 차세대 핵산 기반 백신의 공동 연구 및 개발을 위해 역량을 공유하는 오픈 이노베이션을 통해 협력하기로 하였습니다. 본 MOU의 후속 조치로써 치료 목적의 백신 신약 연구와 개발을 위하여 인공지능(AI) 스크리닝 방법을 통한 새로운 항원 결정기에 대한 정보를 공유하고, 플라스미드 DNA 백신을 mRNA 기반 백신으로 전환하기 위한 연구 등을 우선 수행하기 위한 후속 논의를 진행하고 있습니다. 현재 mRNA 항암 백신 신약개발 공동 프로젝트를 구성하여 새로운 항원 결정기를 찾고 효능 및 안정성을 검토하는 연구에 착수하였습니다.
항염증 치료 신약은 천연물 유래 성분 의약품과 저분자량 화학합성의약품으로 나눌 수 있습니다. 천연물 유래 성분 의약품으로 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물이 있으며, 저분자량 화학합성의약품으로 항염증 면역제어 경구 약물이 있습니다.
항염증 면역제어 경구약물(GLS-1027)은 당사가 보유한 1상 임상시험이 종료된 GLS-1027(구VGX-1027)을 이용하여 자가면역성 신장질환 등의 치료를 위한 임상개발을 준비하고 있습니다. 공정개발 연구를 통해 불순물이 제거된 GLS-1027을 생산하였고, 기존 물질과의 항염증 반응을 평가하기 위해 이탈리아 카타리나 대학 니콜라티교수 연구팀과 협력하여 동물실험을 진행하여, GLS-1027이 코로나19 감염 후 생성되는 다수의 염증유발물질(싸이토카인)들의 억제 능력을 보여주었기 때문에, 2020년10월28일 코로나19 감염 후 과대 면역에 의한 심각한 폐질환을 방지하는 치료제로서GLS-1027의 2상 임상시험계획 승인 신청서를 미국 FDA에 제출했고, 11월30일 미국 FDA로부터 승인을 받았습니다. GLS-1027(국제 일반명 zenozulac)은 경구용 캡슐 약제로 빠른 체내 소실과 우수한 안전성을 임상1상 연구를 통해 이미 확인하였고, 선천성 면역세포에만 작용하여 싸이토카인 분비를 억제함으로서 과대 면역을 제어하여 정상수치로 면역이 회복될 수 있게 바이러스로 인한 감염을 치료하게 됩니다.본 약제에 대한 2상 임상시험은 코로나19 확진자를 대상으로 132명을 계획하고 코로나19 바이러스 감염 시부터 GLS-1027을 선제적으로 투약하여 코로나19에 의한 심각한 폐렴 발병을 예방할 수 있는지를 평가하고자 하였습니다. 우리나라를 포함한 총 4개국(우리나라, 미국, 북 마케도니아, 불가리아)에서 수행하는 다지역 임상시험(MRCT)으로 설계되었습니다. 2021년3월1일 바톤루지 임상시험센터의 IRB 승인을 받았고, 2021년7월2일 북 마케도니아 식약처로부터 승인을 받아 임상시험을 착수하였습니다. 2021년11월1일 유럽의약품청(EMA)과 불가리아 허가당국으로부터 GLS-1027의 임상 2상 시험계획을 승인받았습니다. 2022년3월25일 기준으로 현재 3개국(미국, 북마케도니아, 불가리아)에서 임상시험대상자 118명의 등록을 완료하였습니다. 국내에서는 2021년1월29일 임상시험대상자 15명에 대한 GLS-1027의 2상 임상시험계획 승인 신청서를 식약처에 제출하였고, 2021년9월8일 승인받았습니다. 임상시험대상자의 빠른 등록을 위해 국내 5개 임상시험실시기관에서 진행되었으며, 2022년4월8일 마지막 임상시험 개시방문(SIV)을 완료하여 임상시험대상자 모집과 등록을 진행하였습니다만, 국내에서는 코로나 19에 감염된 중등증 입원환자 수의 급격한 감소로 인해 환자 모집의 어려움이 있었습니다. 이후, 한국을 제외한 3개국에서계획한 환자 모집을 완료하여 국내에서의 환자 모집은 조기 종료되었습니다.
2022년6월22일 임상 2상 임상시험에 계획된 132명 대상자 모두 등록이 완료되었고,2022년12월 기준 대상자 모두 임상시험을 완료했습니다. 현재 결과를 분석하고 있습니다.
2021년6월30일 코로나19 중증 폐렴을 유발하는 햄스터 공격감염 연구결과를 발표하였습니다. GLS-1027(국제 일반명 zenozulac)이 용량 의존적으로 폐렴증상 마커들의 발현 감소를 유도했고, 폐 부위 조직에서 바이러스 유발 세포융합체(syncytia)와 세포이형성(atypia)이 탁월하게 감소함을 확인하였습니다. 또한, 코로나19 바이러스 남아공 변이주인 B.1.351 β variant 에서도 동일한 결과를 확인할 수 있었습니다.
당사는 신약개발사업을 당사 기술력으로 직접 수행하기 위해, 2010년2월 과학기술정보통신부로부터 기업부설연구소 인가를 받아 운영하고 있고, 2013년9월 중소기업청으로부터 당사의 우수한 연구개발 능력을 평가받아 기술혁신형 중소기업(INNO- BIZ) 인증을 받았고, 2019년3월 기술보증기금으로부터 벤처기업확인서를 받았습니다. 또한 코로나19백신, 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물, 항염증 면역제어 경구약물의 글로벌 임상개발을 효율적으로 수행하기 위해 미국 펜실베니아주 Fort Washington시에 글로벌 임상개발 본부를 설립하였고 최고의학책임자를 임명하였습니다. 또한, 신종 감염병에 대한 핵산 기반 백신 개발과 면역학 및 종양학 분야의 기존 개발 역량을 크게 확장하고자 최고과학개발책임자를 임명하였습니다.
당사는 핵산기반 바이오 신약의 개발을 위하여 국내외 기업 및 전문연구기관과 적극적이고 지속적인 협력연구를 진행하고 있습니다. SFTS DNA 백신 개발을 위해 한국과학기술원 (KAIST)과 협력하고, 코로나19 DNA백신 개발을 위해 질병관리청 공공백신개발지원센터, 고대구로병원, 고대안산병원, 한림대강남성심병원, 가천대길병원, 인하대병원, 국가임상시험지원재단과 협력하고 있습니다. mRNA기반 의약품의 개발을 위해 미국 휴스턴 매소디스트 병원연구소(Houston Methodist Research Institute), 가톨릭대학교, 한국과학기술연구원(KIST)과 협력하고 있습니다. 또한, 항염증 치료 신약 개발을 위하여 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이약물의 개발을 미국펜실베니아 대학과 협력하고 있습니다. 성공적인 제품개발을 위해 세계적 감염병 치료 및 예방분야 전문가인 고려대학교 구로병원 김우주 교수 및강원대학교 의과대학 신정임 교수의 과학자문과 자회사인 VGXI와 협력하여 연구개발을 진행하고 있습니다.
1-7. 계열회사에 관한 사항
계열회사는 해외2개입니다. 미국 휴스턴 소재의 VGXI, Inc.,는 당사 지분율 100%로
DNA백신을 생산/판매하는 회사로 2008년5월에 설립된 비상장법인입니다. 베트남소재의 Dong-IL Interlining, Ltd.,는 당사 지분율 100%로 의류용 심지를 제조/판매
하고 있는 회사로 2003년 4월에 설립된 비상장법인입니다.
1-8. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)여부 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 등 여부 |
특례상장 등 적용법규 |
|---|---|---|---|
| 상장 | 1987년 11월 26일 | - | - |
2. 회사의 연혁
2-1. 회사의 연혁
(1) 2019년4월에는 제3회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권을 행사하여 자본금이 211억9천만원입니다.
(2) 2019년7월에는 제3자 배정 유상증자를 하여 자본금이 219억여원이 되었습니다
(3) 2020년1월에는 "주주배정후 실권주일반공모증자방식"으로 유상증자를 하여 자본금이 329억원입니다.
(4) 2020년1월에는 최대주주가 브이지엑스파마수티컬스(유)에서 박영근으로 변경 되었습니다.
(5) 2020년1월에는 제3회 무기명식 이권부 무보증 사모 전환사채 90억원을 조기 상 환하여 5억5천만원이 미상환잔액으로 남았습니다.
(6) 2020년2월에는 제2회 무기명식 이권부 무보증 사모 전환사채의 미상환잔액 2억 원을 조기 상환하였습니다.
(7) 2020년3월에는 제3회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권을 행사하였으며 자본금은 329억원입니다.
(8) 2020년4월에는 주식매수선택권 행사로 자본금이 329억6천8백만원입니다.
(9) 2020년4월에는 제3회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권을 행사하였으며 자본금은 330억8천만원입니다.
(10) 2020년4월에는 주식매수선택권 행사로 자본금이 331억1천9백만원입니다.
(11) 2020년7월에는 "주주배정후 실권주일반공모증자방식"으로 유상증자를 하여 자본금이 446억원입니다.
(12) 2020년9월에는 주식매수선택권 행사로 자본금이 446억8천7백만원입니다.
(13) 2020년10월에는 주식매수선택권 행사로 자본금이 447억3천9백만원입니다.
(14) 2020년11월에는 주식매수선택권 행사로 자본금이 447억6천2백만원입니다.
(15) 2020년12월에는 주식매수선택권 행사로 자본금이 447억7천1백만원입니다.
(16) 2021년3월에는 주식매수선택권 행사로 자본금이 451억8천9백만원입니다.
(17) 2021년4월에는 본점을 이전하였습니다.(서울시 영등포구 여의대로108 (20층
여의도동, 파크원NH금융타워)
(18) 2021년7월에는 주식매수선택권 행사로 자본금이 452억1천1백만원입니다.
(19) 2021년11월에는 제4회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권 을 행사하였으며 자본금은 453억3천8백만원입니다.
(20) 2021년12월에는 "주주배정후 실권주일반공모증자방식"으로 유상증자를 하여 자본금이 511억원입니다.
(21) 2021년12월에는 제4회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권 을 행사하였으며 자본금은 518억원입니다.
(22) 2021년12월에는 주주배정 무상증자를 하여 자본금이 773억원입니다.
(23) 2021년12월에는 제4회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권 을 행사하였으며 자본금은 774억8천만원입니다.
(24) 2022년1월에는 제4회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권 을 행사하였으며 자본금은 775억4천만원입니다.
(25) 2022년1월에는 제4회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권 을 행사하였으며 자본금은 775억6천만원입니다.
(26) 2022년 1월에는 주식매수선택권 행사로 자본금이 776억1천만원입니다.
(27) 2022년3월에는 제4회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권 을 행사하였으며 자본금은 776억8천만원입니다.
(28) 2022년7월에는 제4회 무기명식 이권부 무보증 사모 전환사채에 대해 전환권 을 행사하였으며 자본금은 777억5천만원입니다.
(29) 2022년10월에는 미국 텍사스주 콘로시 데이슨 테크놀로지 파크(Deison Technology Park)에 자회사 VGXI의 신규공장을 증설하였습니다.
2-2. 경영활동과 관련된 중요한 사항의 발생내용
(1) 2019년2월5일 미국 특허청으로부터 B형간염 바이러스의 preS1에 특이적으로
결합하는 항체 물질 1종에 대한 특허 등록을 받았습니다.
(2) 2020년2월4일 대한민국 특허청으로부터 중증 열성 혈소판 감소 증후군(SFTS)
바이러스 감염 질환 예방 또는 치료용 백신 조성물에 대한 특허 등록을 받았습니다.
(3) 2020년4월13일 미국 FDA로부터 만성 축농증 치료를 위한 천연 성분 물질인
만성 축농증 치료제(GLS-1200)의 임상2상 연구 승인을 받았습니다.
(4) 2020년4월29일 미국 FDA로부터 코로나19 감염 방지 코 스프레이 치료제인
GLS-1200의 2상 임상시험의 승인을 받았습니다.
(5) 2020년11월30일 미국 FDA로부터 코로나19 감염 후 심각한 폐질환을 억제하는
경구용 치료제인 GLS-1027의 2상 임상시험의 승인을 받았습니다.
(6) 2020년12월4일 MFDS(식품의약품안전처)로부터 코로나19 감염을 예방하는
DNA백신인 GLS-5310의 1/2a상 임상연구의 승인을 받았습니다.
(7) 2021년1월6일 미국 특허청으로부터 코 스프레이 치료제 및 축농증 치료제인
GLS-1200의 원천 기술에 대한 특허 등록을 받았습니다.
(8) 2021년2월4일 코로나19 치료제 백신 신약개발사업단으로 코로나19 DNA백신
GLS-5310의 1/2a상 임상개발 지원에 대한 협약을 체결하였습니다.
(9) 2021년5월21일 MFDS(식품의약품안전처)로부터 C형간염 고위험군을 대상으
로 하는 C형간염을 예방하는 DNA백신인 GLS-6100의 임상1상 연구의 승인을 받
았습니다
(10) 2021년7월2일 북마케도니아 식약처로부터 경구용 코로나19 치료제인 GLS-
1027의 2상 임상승인을 받았습니다.
(11) 2021년7월27일 미국 FDA로부터 코로나19 백신(GLS-5310)의 피내접종과
비강내 접종 병용 임상연구의 1상 임상승인을 받았습니다.
(12) 2021년9월6일 국가임상시험지원재단과 코로나19백신(GLS-5310)의 2상임상
시험 대상자 모집지원 협약을 체결하였습니다.
(13) 2021년9월8일 MFDS(식품의약품안전처)로부터 경구용 코로나19 치료제인
GLS-1027의 2상 임상승인을 받았습니다.
(14) 2021년11월1일 유럽의약품청(EMA)과 불가리아 허가당국으로부터 경구용
코로나19 치료제인 GLS-1027의 2상 임상승인을 받았습니다.
(15) 2021년12월 7일 미국 위스타 연구소(Wistar Institute of Anatomy and Biology
)로부터 니파(Nipah) 및 포와산(Powassan) 바이러스를 예방하는 핵산 백신 후보물
질의 기술이전 계약을 체결하였습니다.
(16) 2022년1월3일 미국 FDA로부터 코로나19 백신 접종자들을 대상으로 GLS- 5310을 부스터샷으로 접종하는 임상시험계획을 승인받았습니다. 해당 임상시험 은 지난 2021년7월27일 승인받은 임상시험계획서에 대해 계획을 변경하여 승인 받은 것입니다.
(17) 2022년4월29일 식품의약품안전처로 부터 흡인작용 피내 접종기 GeneDerm을 의료기기(품목명: 전동식 의료용 흡인기, 2등급)로 승인을 득하였습니다.
2-3. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2020년 03월 31일 | 정기주총 | 사외이사 김상돈 | 대표이사 박영근 사내이사 조병문 감 사 최성호 |
사외이사 이전오 |
| 2023년 03월 30일 | 정기주총 | - | - | 대표이사 박영근 사내이사 조병문 사외이사 김상돈 감 사 최성호 |
* 제47기(2023.03.30) 정기주주총회에서 의결정족수 부족으로 이사 및 감사 선임을 결의하지 못함.
3. 자본금 변동사항
3-1. 자본금 변동추이
| (단위 : 원, 주) |
| 종류 | 구분 | 제48기 3분기 (2023년) |
47기 (2022년말) |
46기 (2021년말) |
|---|---|---|---|---|
| 보통주 | 발행주식총수 | 78,473,817 | 77,479,055 | 44,771,008 |
| 액면금액 | 1,000 | 1,000 | 1,000 | |
| 자본금 | 78,473,817,000 | 77,479,055,000 | 44,771,008,000 | |
| 우선주 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 기타 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 합계 | 자본금 | 78,473,817,000 |
77,479,055,000 | 44,771,008,000 |
4. 주식의 총수 등
4-1. 주식의 총수 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 종류주식 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 300,000,000 | - | 300,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 78,473,817 |
- | 78,473,817 |
- | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | - | - | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | - | - | - | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 78,473,817 |
- | 78,473,817 |
- | |
| Ⅴ. 자기주식수 | 209,464 | - | 209,464 | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 78,264,353 | - | 78,264,353 |
- | |
4-2. 자기주식 취득 및 처분 현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 주) |
| 취득방법 | 주식의 종류 | 기초수량 | 변동 수량 | 기말수량 | 비고 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 취득(+) | 처분(-) | 소각(-) | |||||||
| 배당 가능 이익 범위 이내 취득 |
직접 취득 |
장내 직접 취득 |
- | - | - | - | - | - | - |
| - | - | - | - | - | - | - | |||
| 장외 직접 취득 |
- | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 공개매수 | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 소계(a) | - | - | - | - | - | - | - | ||
| - | - | - | - | - | - | - | |||
| 신탁 계약에 의한 취득 |
수탁자 보유물량 | - | - | - | - | - | - | - | |
| - | - | - | - | - | - | - | |||
| 현물보유물량 | 기명식보통주 | 174,179 | - | - | - | 174,179 | - | ||
| - | - | - | - | - | - | - | |||
| 소계(b) | 기명식보통주 | 174,179 | - | - | - | 174,179 | - | ||
| - | - | - | - | - | - | - | |||
| 기타 취득(c) | 기명식보통주 | 35,285 | - | - | - | 35,285 | - | ||
| - | - | - | - | - | - | - | |||
| 총 계(a+b+c) | 기명식보통주 | 209,464 | - | - | - | 209,464 | - | ||
| - | - | - | - | - | - | - | |||
* 상기 기타 취득(c)은 무상증자 단주처리를 위한 취득임.
5. 정관에 관한 사항
5-1. 정관 이력 : 최근 개정일 2020년 3월 31일
5-2. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2020년 03월 31일 | 제44기 정기주주총회 | 주권등의 전자등록 | 상법개정 |
5-3. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| 1 | 생명공학을 이용한 의약품 개발 | 영위 |
| 2 | 의약품, 원료의약품 제조 및 판매 | 미영위 |
| 3 | 의약품, 원료의약품 위탁 제조 및 판매 | 영위 |
| 4 | 제약산업 전반에 대한 컨설팅, 건설 및 건설관리 | 미영위 |
| 5 | 의약품의 NRDO(No Research Development Only) 컨설팅 및 서비스 | 영위 |
| 6 | 비임상 및 임상 병리학 시험분석 및 대행서비스 | 미영위 |
| 7 | 의약품의 연구학술용역 | 영위 |
| 8 | 유전체 의학을 이용한 개인별 유전체 분석, 진단 및 의약품 개발 | 영위 |
| 9 | 각종 심지의 제조 및 판매 | 영위 |
| 10 | 각종 직물의 제직, 가공 및 판매 | 영위 |
| 11 | 섬유봉제 및 섬유제조 관련 상품과 각종 부직포 판매 | 영위 |
| 12 | 수출입업, 도매, 소매업, 통신판매업 | 영위 |
| 13 | 부동산의 매매 및 임대업 | 미영위 |
| 14 | 생명공학, 제약산업 또는 이와 관련된 업체에 대한 투자 | 미영위 |
| 15 | 생명공학, 제약산업 또는 이와 관련된 의약품 및 장비 수입,수출,판매 | 미영위 |
| 16 | 생명공학, 제약산업 또는 이와 관련된 연구장비 및 의료기기의 개발, 제조, 판매, 대여 | 영위 |
| 17 | 각호의 사업에 관련된 사업 | 영위 |
| 18 | 각호의 사업 또는 이에 관련된 사업에 대한 투자 | 영위 |
II. 사업의 내용
1. 사업의 개요
1-1. 회사의 현황
(1) 영업개황
① 바이오의약품 사업
당사의 바이오의약품 사업은 바이오의약품 CDMO사업과 차세대 바이오신약 개발사업으로 구분합니다.
바이오의약품 CDMO사업은 임상 및 비임상 시험에 필요한 유전자치료제 및 DNA 백신의 원료인 국제규격(cGMP) 플라스미드(Plasmid) DNA 제품을 2008년6월 미국에 설립한 현지법인인 VGXI, Inc.에서 생산하여 해외 판매지점인 VGXI USA를 통해 판매하고 있습니다. 또한, 2018년9월 미국 휴스턴 매소디스트 병원 연구소 (Houston Methodist Research Institute, HMRI)와 독점적 라이선스 계약을 통해, 임상 등급의mRNA 생산 기술을 확보하여 생산공정 스케일업을 진행하여 mRNA 백신 및 mRNA치료제의 위탁생산 서비스 제공을 위한 준비가 계획대로 추진되고 있습니다
신약개발사업은 핵산 기반 바이오 신약과 항염증 치료 신약으로 나눌 수 있습니다. 핵산기반 바이오 신약은 DNA 기반 의약품과 RNA 기반 의약품으로 나눌 수 있으며, 치료 목적에 따라 핵산 기반 백신, 핵산기반 유전자의약품으로 구성되어 있습니다. DNA백신은 신변종 바이러스로부터 초래하는 질병을 사전에 예방하는 신변종 감염병 DNA백신과 만성화된 감염질병에 대비하는 만성 감염병 DNA백신으로 구분됩니다.
메르스 DNA 백신(GLS-5300)은 중동호흡기증후군 코로나바이러스의 예방백신입니다. 메르스는 중증 급성 호흡기 질환으로 치사율이 40% 이상으로 높으며, 중동지역을 포함한 해외 방문으로 국내에서는 2022년7월에 메르스 의심신고가 116건 접수되고 있어 우리나라 정부는 지속적으로 메르스 감염에 대한 조기발견 및 지역사회 전파차단에 심혈을 기울이고 있습니다. 당사는 2015년5월27일 이노비오와 메르스 DNA백신의 공동연구계약을 체결하였고, 전임상 연구와 임상분야에서는 IND신청 및 승인, 임상시험 관리, 그리고 임상시료의 대량생산을 담당하여 해외 1상 및 국내 1/2a상 임상연구를 주도적으로 진행해왔습니다.
2015년11월19일 미국 FDA로부터 1상 임상시험계획 승인을 받았습니다. 1상 임상시험은 2015년11월11일 미국 국방부 산하 월터리드 미육군 연구소(Walter Reed Army Institute of Research)가 임상시험 관련 비용을 부담하는 조건으로 공동연구개발 계약을 체결하여 착수하였습니다. 2017년2월24일 임상시험 중간결과를 발표하였고, 2018년6월27일 WHO와 IVI 공동주최 메르스 백신 국제심포지엄에서 1상 임상시험 예비결과를 발표하였습니다. 임상시험을 완료한 후 그 결과를 2019년7월25일 국제 저명 의학전문학술지인 Lancet Infectious Disease에 발표하였습니다.
우수한 안전성과 높은 백신 면역반응을 확인하였고, 2015년 국내 메르스 사태에서 확보한 메르스 감염환자의 혈액과 비교 평가한 결과, 백신 접종 60주 후 메르스 완치 환자와 유사한 면역반응이 지속적으로 유지됨을 확인하였습니다.
또한, 당사는 국내에서 메르스 DNA백신의 개발 및 국가기관에 응급백신을 공급하기위한 목적으로 2016년12월7일 국제백신연구소(IVI)로부터 개발비 전액을 지원을 받는 계약을 체결하였습니다. 2017년6월30일 국내에서 1/2a상 임상시험을 수행하기 위해, 국내 식품의약품안전처에 임상시험계획 승인을 받고자 신청하였고, 2017년9월14일 임상시험계획 승인을 받았습니다. 2018년6월 1/2a상 임상시험을 위한 임상시험기관의 임상시험심사위원회(IRB)의 허가를 받았고, 2018년9월5일 첫번째 임상시험대상자의 첫 접종이 이뤄진 후, 1/2a상 임상시험을 서울대병원과 분당서울대병원에서 진행하여, 2019년5월30일 모든 임상시험대상자를 대상으로 백신 접종을 완료하였으며 2020년4월에 임상시험이 종료되었습니다. 임상시험 기간동안 GLS- 5300을 투여한 모든 접종군에서 백신과 관련 있는 중대한 이상반응은 발현되지 않았으며,백신을 투여한 그룹에서 접종 용량과 접종 횟수에 상관없이 그룹 간 내약성의 차이는없었으며, 백신의 효과가 잘 유지되는 것을 확인하였습니다. 이노비오와의 계약에 의해 후속 개발은 이노비오에서 담당하고 당사는 일정 지분을 갖습니다.
지카 DNA백신(GLS-5700)은 소두증을 유발하는 것으로 알려진 지카(Zika) 바이러스감염을 예방하거나 치료를 목적으로 개발한 백신입니다. 2016년1월22일 이노비오와DNA백신 개발의 공동연구 계약을 체결하였으며, 당사에서는 전임상 연구, 임상시료의 대량생산, 임상 1상시험 개발을 담당하여 수행했습니다. 2016년6월20일 미국 FDA로부터 임상시험계획 승인을 받았고, 2017년10월10일 우수한 임상시험 중간결과를 국제 저명 의학전문 학술잡지인 New England Journal of Medicine에 발표하였습니다. 또한, 푸에르토리코에서 160명의 피험자를 대상으로 하는 추가 1상 (1b상) 임상시험도 미국 FDA로부터 2016년8월30일에 승인을 받아 착수하였고, 2017년6월16일 임상시험대상자 160명의 등록이 완료된 후 모든 임상시험대상자를 대상으로 백신 접종을 완료하였으며, 2028년6월 임상시험이 종료되었습니다. GLS-5700 백신을 단회 혹은 다회 투여한 두 그룹 모두에서 접종부위에 이상반응이 일시적으로 발현했지만 경미했고, 두 그룹에서 용량에 따른 발현의 차이는 없었습니다. 또한, GLS- 5700과 관련 있는 중대한 이상반응은 관찰되지 않았고, 두 그룹간 내약성의 차이는 없었으며 백신의 효과가 잘 유지되는 것을 확인했습니다. 이노비오와의 계약에 의해 후속 개발은 이노비오에서 담당하고 당사는 일정 지분을 갖습니다.
SFTS DNA백신(GLS-5140)은 중증열성 혈소판 감소 증후군 바이러스(SFTS)에 감염된 살인진드기에 물리게 되면 감염되는 SFTS 감염병의 예방 DNA백신입니다.
2015년12월 KAIST 산학협력단과 보건복지부기술개발사업에 참여하여 살인진드기바이러스 항원 후보물질 4종을 도출하였고, 마우스와 페렛을 이용한 동물실험에서 예방능력이 있음을 확인하였습니다. 그 결과를 2019년8월23일 국제 저명학술지인 Nature Communications에 발표하였습니다. 또한, 2018년6월29일 KAIST와 공동으로 "중증열성 혈소판 감소증후군(SFTS) 예방 DNA백신"에 대한 특허를 한국 특허청에 출원하였고, 2020년2월4일 특허등록을 받았습니다. 2019년6월26일 해외 특허 출원을 위해 특허협력 조약(PCT)를 출원했습니다. 2020년10월 보건복지부 백신실용화기술개발사업단의 미래대응 미해결 감염병 신규백신 개발 분야의 지원과제로 선정되어 임상시험 1상의 임상시험계획 승인까지의 연구개발비용을 지원받게 되었습니다. 실험동물을 이용한 전임상시험을 통해 백신의 최종 후보물질을 선정하였고, 임상시험에 적용하기 위한 적절한 용량 및 용법을 결정하기 위한 동물실험을 완료하였습니다. 해당 실험결과는 2022년11월10일과 11월11일 양일간 진행된 화순국제백신포럼에 연자로 초청되어 발표한 바 있습니다. 현재 임상시험 1상을 계획하고 있으며, 2022년8월31일과 12월5일, 2023년6월7일에 식품의약품안전처 사전상담과와 3차례사전상담회의를 열어 임상 1상에 대한 임상시험계획 신청에 필요한 제출 자료에 대해 논의하였습니다. 임상시험 1상 IND 승인을 득하고자 현재 IND filing을 준비하고 있습니다.
코로나19 DNA백신(GLS-5310)은 2020년2월 우리나라에 코로나19 확진 사례가 발생한 직후 백신 후보물질의 디자인 및 제작을 추진하다가 2020년3월27일 <2020년도질병관리본부 긴급 현안 지정 학술연구개발 용역과제>인 "핵산백신 플랫폼을 활용한코로나19 백신후보물질 개발 사업"에 우선 순위 협상대상자로 선정되었습니다.
2020년4월 후보물질을 제작한 후 생체 외에서 후보물질로부터 코로나19 바이러스 항원이 생성되는 것을 확인하였습니다. 2020년5월 VGXI사에서 후보물질의 cGMP생산공정 개발연구를 완료하였고, 2020년7월 후보물질을 마우스에 접종한 후 우수한 항원 특이적 T세포면역반응과 항원 특이적 결합항체 반응, 그리고 중화항체의 생성을 확인하였습니다. 2020년9월 임상시험용 백신의 cGMP생산을 완료하여 1154바이알을 보관하고 있습니다. 임상에서의 투여 경로를 실험동물에 적용하여 후보물질의 용량증량에 따른 면역원성 평가를 완료하였고, 2020년12월4일 국내 식품의약품안전처로부터 1/2a상 임상시험계획 승인을 받았습니다. 임상시험 1상 착수를 위해2020년12월18일 고대구로병원과 임상시험 계약을 체결하였고, 12월31일 첫 대상자의 접종을 완료, 2021년1월21일 고용량군의 등록 시작, 2021년3월4일 임상1상 임상시험대상자 45명의 등록을 완료하고, 2021년5월 모든 대상자의 접종이 완료되었습니다. 2021년7월8일 임상 1상중간분석 1차결과를 확인하고 자료모니터링위원회 (DSMB) 심의를 통과하여 임상 2a상 시험에 진입하였습니다. 임상 2a상은 총 5개 기관에서 실시하며, 위약대조군이 있고 이중눈가림 임상시험으로 120명을 계획하고 착수하였습니다. 총 126명이 등록되었고, 2023년1월6일 마지막 대상자의 최종방문이 완료되었으며, 2023년5월10일 위약을 접종한 대상자 중에서 본인 동의 하에 GLS-5310을 재접종한 마지막 대상자가 최종방문을 마쳤습니다. 현재 임상결과를 분석하고 있습니다. 2021년2월4일 코로나19백신인 GLS-5310의 1/2a상 임상개발비용인98억원중 73억원의 연구비를 정부로부터 지원을 받았고 2020년12월4일 "코로나19 치료제 백신 신약개발사업단"과 협약을 체결하였습니다. GLS-5310의 글로벌 개발과 함께, 기존 피내 접종과 비강내접종을 병용하는 임상시험을 미국에서 수행하고자 2020년1월19일 미국 FDA에 임상시험계획 승인을 신청하였으며, 2021년 7월27일 승인을 받았습니다. 또한, 2021년9월6일 국가임상시험지원재단과 코로나 19백신 임상2a상 대상자 모집지원 협약을 체결하였습니다. 2021년7월22일 코로나 19 DNA백신인 GLS-5310의 백신 조성물 특허에 대한 국내 및 PCT 출원을 완료하였습니다. 2023년1월, 자체개발 흡인작용 피내접종기 진덤(GeneDerm)을 이용한 코로나19 DNA 백신(GLS-5310)의 안전성및 면역원성에 대한 임상1상 결과를 국제감염병학회(International Society for Infectious Diseases, ISID) 학술지인국제감염질환저널(International Journal of Infectious Diseases; 2021년인용지수: 12.074)에 발표했습니다. 2023년5월 SARS-CoV-2를 포함한 전염병 대비를 위한 DNA 백신 관련 내용의 리뷰논문을 Vaccines 학술지에 발표하였고, 2023년6월 임상 1상 분석결과 중에서 GLS-5310 DNA 기초접종 후 mRNA 백신을 추가접종한 대상자들에 대한면역원성 결과를 Vaccine (Elsevier) 학술지에 게재하였습니다.
당사는 2021년12월7일 미국위스타연구소(Wistar Institute of Anatomy and Biology)가 보유한 니파(Nipah) 및 포와산(Powassan) 바이러스를 예방하는 핵산 백신 후보물질의 기술이전 계약을 체결했습니다. 국제보건기구의 10대 우선 대응 감염병중 하나인 니파 바이러스와 심각한 뇌염을 유발하는 포와산 바이러스는 아직 승인된 백신과 치료제가 없습니다. 본 라이선스 인 계약을 통하여 미국 위스타 연구소에서 보유하고있는 니파와 포와산 바이러스의 DNA 백신을 확보함으로써 당사가 보유한 핵산 백신플랫폼과 체내전달 기술을 적용하여 해당 백신들을 개발할 계획이며, 현재 이를 위한기초 연구가 진행되고 있습니다.
당사는 2023년5월 위스타 연구소와 니파 바이러스(Nipah virus) 예방 및 치료를 위한저분자 화합물 신약을 개발하기 위한 공동 연구 계약을 맺었습니다. 현재 연구개발 중인 니파 바이러스 백신에 추가하여, 니파 바이러스를 표적으로 하는 제품 포트폴리오 다각화의 일환으로 저분자 화합물 기반 항바이러스 치료제 연구를 시작했습니다. 본 연구는 위스타 연구소의 인체면역결핍바이러스(HIV, Human Immunodeficiency Virus) 연구 프로그램, 백신 및 면역 치료 센터 책임자인 루이스 몬타네르 박사(Dr. Luis J. Montaner)의 주관으로 진행되며, 해당 연구의 약물 스크리닝 및 저분자 화합물 디자인은 HIV 및 코로나19를 포함한 전염병에 대한 저분자 치료제 개발에 광범위한 경험을 갖고 있는 위스타 연구소 분자 스크리닝 및 단백질 발현 센터(Molecular Screening & Protein Expression Facility) 책임자인 조셉 살비노 박사(Dr. Joseph Salvino)가 수행하고 있습니다.
DNA백신을 피내에 타겟팅하고 발현 효율성을 높이기 위해 흡인작용 피내 접종기 GeneDerm을 적용하고 있습니다. GeneDerm의 흡인기 모듈에 대해 2021년8월27일개량특허를 국내에 출원, 2023년6월29일 특허 등록하였으며, 2022년11월10일과 11월11일 PCT출원을 완료하였습니다. 또한, 물리적/화학적/생물학적 시험과 성능 및 전기/전자파 성능시험 등 각종 시험검사 완료, 제조 및 품질관리기준(GMP) 인정서 및 ISO-13485 취득 완료, 그리고 기술문서 심사에 통과하여 2022년4월29일 식품의약품안전처로 부터 의료기기(품목명: 전동식 의료용 흡인기, 2등급)로 승인을 득하였습니다. 해당 흡인기를 2021년10월 햄스터 공격감염 모델을 이용한 동물실험에적용하여 GLS-5310이 야생형 및 베타 변이 코로나 19 바이러스에 대한 감염을 완벽하게 예방함을 확인하였습니다. 2021년11월5일 DNA 백신의 흡인작용 피내 접종기인 GeneDerm의 플랫폼 개발과 이를 이용해서 확인된 연구결과를 사이언스의 자매지 Science Advances (사이언스 어드밴시스)에 게재하였습니다. 또한, 미국 뉴저지주립대학인 럿거스(Rutgers) 대학 연구진과 공동연구로 진행된 자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)의 약물전달 메커니즘 연구결과를 2023년1월 국제학술지 약물전달 프론티어스(Frontiers in Drug Delivery)에 게재했습니다.
2022년1월3일 미국 FDA로부터 코로나19백신접종자들을 대상으로 하여 GLS-5310을 부스터샷으로 접종하는 임상시험계획을 승인받았습니다. 해당 임상시험은 지난 2021년7월27일 승인받은 임상시험계획서에 대해 계획을 변경하여 승인받은 것으로미국에서 mRNA백신과 아데노바이러스 전달체 백신을 접종한 대상자에게 Gene Derm 흡인압력을 이용한 피내 접종군과 피내 접종 및 코 스프레이를 이용한 비강내 접종을 병용한 접종군을 비교하고자 합니다. 2022년9월 말 기준, 69명 중 69명이 등록되었고, 현재 결과를 분석하고 있습니다.
당사는 만성 감염병 DNA백신으로 C형 간염 DNA백신을 개발하고자 2011년10월7일 이노비오사와 계약을 체결하여 일본을 제외한 아시아 지역의 개발 및 판권을 확보하였습니다.
만성C형 간염 환자의 치료를 위한 백신인 VGX-6150은 2013년10월18일 국내 식품의약품안전처로부터 임상시험계획을 승인받아 연세대 세브란스병원과 부산대병원에서 18명의 만성 C형 간염 임상시험대상자 대상으로 1상 임상시험을 진행하였습니다. 또한, 추가접종 후 면역기억에 의한 장기간 치료 효과를 확인하기 위해 2014년9월26일 국내 식품의약품안전처로부터 상기 1상 임상시험이 종료된 임상시험대상자 중 희망자에 한해 후속 임상시험계획을 승인받아 추가 임상시험을 완료하였습니다. 2017년9월26일 HCV 2017 국제심포지엄에서 VGX-6150 안전성과 면역원성에대한결과를 발표하였고, 심각한 부작용 없이 매우 안전하면서도 C형 간염 바이러스에 대한 T세포 면역반응을 높인다는 1상 임상시험시험 결과를 간 연구분야의 국제적전문 학술지인 "저널 오브 헤파톨로지(Journal of Hepatology)"의 2020년2월20일자 온라인판에 게재하였습니다.
C형 간염 예방을 위한 DNA백신인 GLS-6150과 GLS-6100은 VGX-6150의 임상 연구 중간 결과를 이용하여 신청한 보건복지부 기술개발사업단 주관 과제로 2017년 6월9일 선정되어 개발을 착수하였습니다. GLS-6100은 국내에서 1상 임상시험을 수행하기 위한 임상시험계획 승인 신청서를 2021년1월4일 식약처에 제출하였고, 2021년5월20일 승인받았습니다. 이후 과제에 대한 후속 지원이 없어 개발을 종료했습니다. GLS-6150은 기존 치료제로 완치된 만성C형 간염 환자를 대상으로 재감염을 예방하는 제품이고, GLS-6100은 C형 간염 감염 고위험군을 대상으로 하는 만성C형 간염 예방하는 제품입니다. GLS-6150은 2017년10월31일 국내에서 1상 임상시험을위해, 국내 식품의약품안전처에 임상시험계획 승인을 신청하였고, 2018년2월2일 승인을 득하였습니다. 2018년7월 1상 임상시험을 위한 임상시험기관의 임상시험심사위원회(IRB)의 허가를 받았고, 2018년9월4일 첫번째 임상시험대상자의 첫 접종이 이뤄진 후, 1상 임상시험을 연세의료원 세브란스병원과 부산대병원에서 진행하였습니다. 2018년9월4일 첫번째 임상시험대상자의 첫 접종이 있었고 2020년5월11일 임상시험을 종료하여 식약처에 종료 보고를 완료하였습니다. 1상 임상시험전반에 대한안전성 결과와 면역원성 결과에 대한 통계분석이 완료되었으며, 2022년12월8일 임상결과보고서(CSR) 최종본을 수령하였습니다.
DNA기반 단백질의약품 및 단클론항체 의약품은 기존 단백질의약품 및 단클론항체 의약품 대비 우수한 가격 경쟁력, 체내 안전성 및 약효 지속성을 장점으로 하여 당사 R&D 기술력으로 직접 개발하고 있습니다. 당사가 개발/보유하고 있는 DNA 백신 플랫폼은 감염성 질환에 대한 예방백신 개발에 적용할 수 있는 기술입니다. 이 기술로 개발된 백신을 동물에 접종 시 면역원성이 잘 유도됨을 확인하여 DNA백신 개발에 대한 기술적 방법 및 결과가 2021년12월17일 Methods Mol Biol 온라인판으로 출판되었습니다.
DNA기반 혈우병치료제는 2014년10월 강원대 의생명과학대학과 플라스미드 기반 혈우병 치료제의 의약품개발 타당성 검증 연구를 착수하였습니다. 현재, 당사 자체적으로 혈액응고 8인자의 체내 생성량과 활성을 높이기 위한 제품후보물질의 개선 연구를 진행하고 있습니다.
DNA기반 B형 간염 면역글로블린은 2017년4월 강원대학교 산학협력단이 보유하고 있는 "B형 간염 바이러스의 preS1에 특이적으로 결합하는 항체" 2종에 대한 특허와 기술을 양수하여 타당성 검증 연구를 착수하였습니다. 이중 1종에 대한 특허는 2018년6월11일 한국 특허청으로부터 특허등록을 받았고, 2019년2월5일 미국 특허등록을 받았습니다. 나머지 1종은 2019년1월25일 한국 특허청에 특허 출원을 완료하였습니다. DNA기반 B형 간염 항preS1 면역글로블린 2종의 후보물질 플라스미드와 항S면역글로불린 2종의 후보물질 플라스미드를 제작하여 연구용 시료를 생산하였고, 동물세포에서 항체생성과 항원 결합능력을 확인하였습니다. 현재, 실험동물에서 4종의 후보물질로부터 항체 생성 및 체내 분포 경향 분석 연구를 진행하고 있고, 2019년9월 B형 간염바이러스 연구분야의 세계적 권위자인 건국대 의학전문대학원 김균환교수 연구팀과 함께 실험동물을 이용한 효능평가 연구를 수행한 결과, 항preS1 면역글로블린과 항S면역글로불린을 동시에 처리한 조건에서 우수한 바이러스 억제효과를 보이는 것으로 확인하였습니다. 현재, 당사 자체적으로 국내에서 높은분포를 보이는 B형 간염바이러스 유전자C형에 대한 억제효과를 평가하는 세포수준의 실험과 동물실험을 진행하고 있습니다.
또한, 류마티스 관절염 치료 목적으로 DNA 기반의 항 TNF 알파 단클론항체 후보 물질을 제작하여, 동물세포에서의 항체 생성과 TNF 알파 결합능력 및 아밀로이드 베타와의 결합력을 확인하고, 동물세포에서 TNF 알파의 세포살상반응 억제능을 확인하였으나, 상업화 적합성 문제로 연구개발을 중단하였습니다.
당사는 mRNA기반 의약품의 연구개발을 수행하기 위해 기반 플랫폼 구축을 완료하고, mRNA 백신 후보물질을 이용하여 효능 및 안전성평가를 수행하고 있습니다.
2018년9월17일 자회사 VGXI가 임상용의약품 mRNA를 생산하기 위해 미국휴스턴 매소디스트 병원 연구소(Houston Methodist Research Institute)와 독점적 라이선스-인 계약을 체결함에 따라, mRNA 백신 및 mRNA 치료제 생산의 핵심기술과 mRNA백신 설계 및 연구 기술을 이전 받아 mRNA 백신 및 mRNA 치료제 연구개발사업에 진출하게 되었습니다. 자회사인 VGXI는 mRNA 기반 의약품의 상업적 생산을 위한 파일럿 생산공정을 성공적으로 구축한 후 대규모 cGMP 생산공정을 구축하기 위한 공정 스케일업 및 최적화 단계를 진행하고 있습니다.
코로나19 mRNA 백신은 2020년2월 우리나라에 코로나19 확진 사례가 발생한 직후휴스턴 매소디스트 병원 연구소의 John Cooke 연구팀으로부터 mRNA 백신 설계 및연구 기술을 이전 받아 mRNA 백신 후보물질의 디자인 및 제작을 진행하였습니다. 2020년3월27일 <2020년도 질병관리본부 긴급 현안 지정 학술연구개발 용역 과제>인 "핵산백신 플랫폼을 활용한 코로나19 백신후보물질 개발 사업"에 우선 순위 협상대상자로 선정되었습니다. 2020년5월 후보물질 2종을 제작한 후, 2020년9월 생체 외에서 후보물질로부터 코로나19 바이러스 항원이 생성되는 것을 확인하였고, 2020년11월 실험동물에서 후보물질 접종 후 항체면역반응과 T세포면역반응이 유도됨을 확인하였고, LNP 기술을 보유한 기관들로부터 해당 mRNA 백신 평가를 진행하였으나, 상업적 타당성 문제로 개발을 종료하였습니다.
당사는 2021년5월31일 한미사이언스와 mRNA 백신 대규모 생산기반 및 글로벌 네트워크 구축을 위한 상호협력개발을 체결하였습니다. 이번 계약에 따라 당사와 한미사이언스는 양사가 보유한 핵심 기술을 상호 협력함으로써 더욱 최적화하고 수율과 에너지 자원 활용을 극대화하는 방법 등 mRNA 백신의 글로벌 대규모 생산을 위한 차세대 생산기술을 함께 연구하고, 코로나19 및 신종 감염병 mRNA백신의 공동 연구 및 사업화를 포함한 포괄적인 글로벌 핵산 사업 네트워크 구축을 위한 파트너로서기술확보 및 시장개척 등을 위한 논의를 시작하였습니다.
당사는 2021년6월17일 mRNA 기반 신속백신제작 플랫폼을 구축하고 백신 선도물질발굴 및 유효성을 평가하는 연구가 보건복지부 백신실용화기술개발사업단의 미래대응, 미해결 신변종 감염병 백신 플랫폼 개발 분야의 지원 과제로 선정되었습니다.
질병청으로부터 기술이전을 받은 지카 백신 항원을 본 과제에 적용하여 지카 mRNA백신 선도물질 발굴 및 유효성 평가를 수행함으로써, 생산 효율성과 안정성이 증진된mRNA백신 원액생산공정 및 품질평가법을 개발하고, 원부자재의 국산화 가능여부를 확인하며, 초기 임상시험용 mRNA백신을 생산할 수 있는 LNP 제형공정 스케일 업을 목표로 하고 있습니다. mRNA 기반 신속백신제작 플랫폼의 구축을 완료한 상태이며, 지카 mRNA 백신 선도물질의 유효성 및 안전성 평가를 2022년12월31일부로완료하였습니다. 현재 확보된 지카 mRNA 백신 선도물질의 효능과 안정성을 추가적인 동물 모델에서 재확인하는 연구를 진행하고 있습니다.
당사는 2021년6월25일 원형(circular) mRNA백신 기술을 활용한 새로운 mRNA백신용 플랫폼 개발 연구가 과학기술정보통신부 신변종 감염병 대응 플랫폼 기술개발사업의 세부연구로 선정이 되어 공동연구개발기관으로 참여하게 되었습니다. 총 43개월 동안 원형(circular) mRNA 플랫폼의 구축, 생산 및 유효성 평가를 수행하고, mRNA 대량생산 공정 최적화 및 cGMP 수준의 임상용 백신의 생산을 담당하게 됩니다. 2021년9월에 원형(circular) mRNA 플랫폼의 특허 가출원을 완료한 후, 원형 (circular) mRNA 플랫폼 기술의 문제점을 보완하여 2022년9월에 특허의 국내정식출원과 국제출원(PCT)을 하였습니다. 현재, 원형(circular) mRNA 공정 최적화를 위한 지속적인 연구개발과 함께, 신변종 감염병 선정을 위한 대상감염병(Disease X) 3종을 결정하여 백신으로 사용할 원형(circular) mRNA의 제작을 진행중에 있습니다.
당사는 R&D 역량 강화를 위한 전략적인 오픈 이노베이션(Open Innovation)을 지속적으로 추진중에 있으며, 그 결과 모 대학 연구진과 함께 mRNA 전달체를 특정 세포나 조직에 이동할 수 있도록 조절하는 타겟팅 기능을 연구하고 있습니다. 당사가 확보하고 있는 mRNA 플랫폼에 적용하여 미충족 수요(Unmet Need)가 많은 암치료 분야에 mRNA 기반의 항암 백신과 단클론 항체를 적용함에 있어서 치료용 mRNA의 단점을 극복하고 장점을 극대화하고자 하는 목적으로 공동연구를 진행하고 있습니다. 그 외에도 여러 방면으로 오픈 이노베이션을 진행하여 다양한 난치성 전염병의 백신 연구개발을 비롯하여 암이나 자가면역질환, 퇴행성만성질환 등에 적용가능한 혁신적인 치료방법과 당사의 mRNA 플랫폼에 적용할 수 있는 새로운 치료방법을 연구기관들과 논의 중에 있습니다.
당사는 2022년12월8일, 자사 VGXI의 고객사인 애스톤 사이언스와 전략적 업무제휴양해각서(MOU)를 체결함으로써 신약개발에 대한 파트너로서 새로운 타깃 물질에 대한 차세대 핵산 기반 백신의 공동 연구 및 개발을 위해 역량을 공유하는 오픈 이노베이션을 통해 협력하기로 하였습니다. 본 MOU의 후속 조치로써 치료 목적의 백신 신약 연구와 개발을 위하여 인공지능(AI) 스크리닝 방법을 통한 새로운 항원 결정기에 대한 정보를 공유하고, 플라스미드 DNA 백신을 mRNA 기반 백신으로 전환하기 위한 연구 등을 우선 수행하기 위한 후속 논의를 진행하고 있습니다. 현재 mRNA 항암 백신 신약개발 공동 프로젝트를 구성하여 새로운 항원 결정기를 찾고 효능 및 안정성을 검토하는 연구에 착수하였습니다.
항염증 치료 신약은 천연물 유래 성분 의약품과 저분자량 화학합성의약품으로 나눌 수 있습니다. 천연물 유래 성분 의약품으로 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물이 있으며, 저분자량 화학합성의약품으로 항염증 면역제어 경구 약물이 있습니다.
쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물(GLS-1200)은 2018년 6월26일 미국 펜실베니아 대학교로부터 호흡기 감염에 대한 혁신 치료제 및 진단법 개발을 위한 쓴맛 수용체 신호전달 물질 및 관련 기술을 기술이전 받았습니다. 만성 축농증 치료를 위해 임상용 의약품의 생산을 완료하고, 2019년8월5일 미국 FDA에 2상 임상시험 진행을 위한 임상시험계획 승인을 신청하였습니다. 본 임상은 미국 펜실베니아 대학교 임상시험센터에서 실시되며 만성 축농증 환자의 부비동 수술 이후 7주에 거쳐 만성 축농증 치료제(GLS-1200)인 코 스프레이를 비강을 통해 투여한 후 4개월 동안 급성 축농증의 재발 여부를 확인하는 목적으로 위약대조군과 함께 99명의 환자를 대상으로 진행할 것을 계획하고 있습니다. 2020년4월13일 미국 FDA로부터 2상임상시험계획 승인을 받았지만 코로나19 감염병 사태로 인해 임상시험이 잠정중단되었지만, COVID-19 관련 임상시험의 결과분석과 CSR이 마무리되는 대로 임상시험 착수를 계획하고 있습니다. 2020년4월22일, GLS-1200에 대해 펜실베니아 대학교와 공동으로 코로나19 및 독감을 포함한 다른 바이러스에 의한 감염을 예방하는 용도에 대한 특허를 미국 특허청에 출원하였고, 2021년1월6일 미국 특허청에등록을 받았습니다. 비강에 분무된 GLS-1200은 비강 부위 세포의 쓴맛 수용체와 결합하여, 산화질소를 생성 분비하게 하여 코로나19 바이러스를 사멸하는 MOA를 예상하고 있습니다. 2020년4월29일, 코로나19 감염 예방 코 스프레이 약물로 2상 임상시험계획 승인을 미국 FDA로부터 받아, 2020년6월11일 펜실베니아 대학교 임상시험센터에서 의료계 종사자들을 대상으로 한 첫 임상시험대상자 투약이 진행되었고, 2020년9월, 계획된 225명 임상시험대상자에서 50% 이상 대상자 등록이 완료되었습니다. 2021년1월18일 GLS-1200은 코 부위에 분포하고 있는 코로나19 바이러스 농도를 감소시켰고, 족제비 감염 동물 모델을 통해 비강 세포 내 감염을 억제하는 것으로 확인되었습니다. 미국 루이지에나주 바톤루지시에 2차 임상시험실시기관을 추가하였고, 2021년4월 임상대상자를 일반인으로 확대해서 진행할 수 있도록 하는 IRB 승인을 받았습니다. 대상자 모집에 지속적으로 노력하여 2022년12월 기준 184명이 등록되었으나, 코로나19에 감염된 대상자를 모집하는데 어려움이 있어 임상시험대상자 모집을 조기 종료하였습니다. 2023년에 임상2상 연구를 종료하여, 임상결과 분석 및 임상시험결과보고서 작성을 수행할 계획입니다.
항염증 면역제어 경구약물(GLS-1027)은 당사가 보유한 1상 임상시험이 종료된 GLS-1027(구VGX-1027)을 이용하여 자가면역성 신장질환 등의 치료를 위한 임상개발을 준비하고 있습니다. 공정개발 연구를 통해 불순물이 제거된 GLS-1027을 생산하였고, 기존 물질과의 항염증 반응을 평가하기 위해 이탈리아 카타리나 대학 니콜라티교수 연구팀과 협력하여 동물실험을 진행하여, GLS-1027이 코로나19 감염 후 생성되는 다수의 염증유발물질(싸이토카인)들의 억제 능력을 보여주었기 때문에, 2020년10월28일 코로나19 감염 후 과대 면역에 의한 심각한 폐질환을 방지하는 치료제로서GLS-1027의 2상 임상시험계획 승인 신청서를 미국 FDA에 제출했고, 11월30일 미국 FDA로부터 승인을 받았습니다. GLS-1027(국제 일반명 zenozulac)은 경구용 캡슐 약제로 빠른 체내 소실과 우수한 안전성을 임상1상 연구를 통해 이미 확인하였고, 선천성 면역세포에만 작용하여 싸이토카인 분비를 억제함으로서 과대 면역을 제어하여 정상수치로 면역이 회복될 수 있게 바이러스로 인한 감염을 치료하게 됩니다.본 약제에 대한 2상 임상시험은 코로나19 확진자를 대상으로 132명을 계획하고 코로나19 바이러스 감염 시부터 GLS-1027을 선제적으로 투약하여 코로나19에 의한 심각한 폐렴 발병을 예방할 수 있는지를 평가하고자 하였습니다. 우리나라를 포함한 총4개국(우리나라, 미국, 북 마케도니아, 불가리아)에서 수행하는 다지역 임상시험 (MRCT)으로 설계되었습니다. 2021년3월1일 바톤루지 임상시험센터의 IRB 승인을 받았고, 2021년7월2일 북 마케도니아 식약처로부터 승인을 받아 임상시험을 착수하였습니다. 2021년11월1일 유럽의약품청(EMA)과 불가리아 허가당국으로부터 GLS-1027의 임상 2상 시험계획을 승인받았습니다. 2022년3월25일 기준으로 현재 3개국(미국, 북마케도니아, 불가리아)에서 임상시험대상자 118명의 등록을 완료하였습니다. 국내에서는 2021년1월29일 임상시험대상자 15명에 대한 GLS-1027의 2상 임상시험계획 승인 신청서를 식약처에 제출하였고, 2021년9월8일 승인받았습니다. 임상시험대상자의 빠른 등록을 위해 국내 5개 임상시험실시기관에서 진행되었으며, 2022년4월8일 마지막 임상시험 개시방문(SIV)을 완료하여 임상시험대상자 모집과등록을 진행하였습니다만, 국내에서는 코로나 19에 감염된 중등증 입원환자 수의 급격한 감소로 인해 환자 모집의 어려움이 있었습니다. 이후, 한국을 제외한 3개국에서계획한 환자 모집을 완료하여 국내에서의 환자 모집은 조기 종료되었습니다. 2022년6월22일 임상 2상 임상시험에 계획된 132명 대상자 모두 등록이 완료되었고, 2022년12월 기준 대상자 모두 임상시험을 완료했습니다. 현재 결과를 분석하고 있습니다.
2021년6월30일 코로나19 중증 폐렴을 유발하는 햄스터 공격감염 연구결과를 발표하였습니다. GLS-1027(국제 일반명 zenozulac)이 용량 의존적으로 폐렴증상 마커들의 발현 감소를 유도했고, 폐 부위 조직에서 바이러스 유발 세포융합체(syncytia)와 세포이형성(atypia)이 탁월하게 감소함을 확인하였습니다. 또한, 코로나19 바이러스 남아공 변이주인 B.1.351 β variant 에서도 동일한 결과를 확인할 수 있었습니다.
당사는 신약개발사업을 당사 기술력으로 직접 수행하기 위해, 2010년2월 과학기술정보통신부로부터 기업부설연구소 인가를 받아 운영하고 있고, 2013년9월 중소기업청으로부터 당사의 우수한 연구개발 능력을 평가받아 기술혁신형 중소기업(INNO- BIZ) 인증을 받았고, 2019년 3월 기술보증기금으로부터 벤처기업확인서를 받았습니다. 또한 메르스 DNA백신, 지카 DNA백신, 코로나19백신, 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물, 항염증 면역제어 경구약물의 글로벌 임상개발을 효율적으로 수행하기 위해 미국 펜실베니아주 Fort Washington시에 글로벌 임상개발 본부를 설립하였고 최고의학책임자를 임명하였습니다. 또한, 신종 감염병에 대한 핵산 기반 백신 개발과 면역학 및 종양학 분야의 기존 개발 역량을 크게 확장하고자 최고과학개발책임자를 임명하였습니다.
당사는 핵산기반 바이오 신약의 개발을 위하여 국내외 기업 및 전문연구기관과 적극적이고 지속적인 협력연구를 진행하고 있습니다. 지카 DNA백신의 개발을 위해 이노비오(Inovio), 미국 위스타(Wistar) 백신연구소, 캐나다 라발(Laval) 대학교와 협력하고, 메르스 DNA 백신의 개발을 위해 이노비오(Inovio), 미국 국방부 월터리드 미육군연구소(WRAIR), 국제백신연구소(IVI), 서울대병원, 분당서울대병원과 협력하고, C형 간염 예방 및 치료 DNA 백신 개발을 위해 연세의료원 세브란스병원, 부산대병원,한국 과학기술원(KAIST)과 협력하고 있으며, SFTS DNA 백신 개발을 위해 한국과학기술원 (KAIST)과 협력하고, 코로나19 DNA백신 개발을 위해 질병관리청 공공백신개발지원센터, 고대구로병원, 고대안산병원, 한림대강남성심병원, 가천대길병원, 인하대병원, 국가임상시험지원재단과 협력하고 있습니다. mRNA기반 의약품의 개발을 위해 미국 휴스턴 매소디스트 병원연구소(Houston Methodist Research Institute), 가톨릭대학교, 한국과학기술연구원(KIST)과 협력하고 있습니다. 또한, 항염증 치료 신약 개발을 위하여 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이약물의 개발을 미국펜실베니아 대학과 협력하고 있습니다. 성공적인 제품개발을 위해 세계적 감염병 치료 및 예방분야 전문가인 고려대학교 구로병원 김우주 교수 및 강원대학교 의과대학 신정임 교수의 과학자문과 자회사인 VGXI와 협력하여 연구개발을 진행하고 있습니다
② 섬유사업
섬유산업부문은 경기불황, 환율변동 등의 영향으로 해외수출 및 내수가 부진하고 여기에 후발국의 섬유 저가공세는 계속 이어져 가격하락 및 시장잠식요인으로 작용하였습니다.
③ 회사 매출액과 영업손익 및 손익
당3분기말 연결재무제표기준으로 회사의 매출액은 274여억원이었으며, 영업손실 371 여억원, 당기순손실 380여억원을 기록하였습니다.
(2) 시장점유율 등
① 바이오의약품 사업
플라스미드 DNA 기반의 바이오의약품 연구/개발 사업과 플라스미드 DNA 생산/공급(CDMO) 사업은 아직까지 전세계적으로 완제의약품으로 승인을 받은 의약품이 없는 관계로 시장점유율을 예측하기 곤란합니다.
② 섬유사업
심지사업은 국내시장 수요의 50~60%선 점유율을 차지하고 있습니다.
(3) 시장의 특성
① DNA백신 및 핵산기반 치료제 분야
DNA백신 시장은 "2019 Global industry Trends, Growth, Share, Size, and 2025 Forecast Research Report (2019년 5월, Industry Research사 발행)"에 의하면, DNA백신이 기존 백신들 대비 효과적이고 부작용이 적은 특성으로 말미암아, 2017년 기준 잠재 수익의 시장점유율이 미국에서 58%, 유럽에서 28%로 평가하고 있고, 2025년말까지 62억불 규모의 시장과 2019년부터 2025년까지 연평균성장률(CAGR)7.7%를 전망하였습니다. 또 다른 시장분석기관인 ResearchAndMarkets.com은 2019년부터 2027년까지의 연평균성장률(CAGR) 42.03%를 전망하기도 하였습니다.
핵산기반 치료제 시장은 주로 유전질환과 유전적 장애를 대상으로 하는 치료제로 개발이 되고 있습니다. 기존 치료제들이 치료효능이 거의 없거나 크지 않다 보니까, 혁신의약품으로 평가를 받고 있습니다. "Nucleic Acid-based Therapeutics Market 2018 Professional Analysis by Technology Type till 2020 (2019년10월, Market Research Future사 발행)"보고서에 의하면, 2022년말까지 전세계 핵산기반 치료제의 시장은 7억 4198만불 규모의 시장과 2019년부터 2022년까지의 연평균성장률 (CAGR) 6.8%를 전망하였습니다.
DNA백신 분야는 현재 미국 이노비오사의 HPV 관련 자궁경부전암 및 암 치료 백신인 VGX-3100이 글로벌 3상임상연구를 진행하고 있습니다. 향후 수 년이내에 사람을 대상으로 하는 DNA백신의 시판 허가 및 상업화가능성이 높아지고 있습니다.
DNA 백신개발사들의 차별적인 제품 개발 전략으로 인해, 동일질환을 대상으로 하는중복적인 제품 개발 사례는 비교적 적은 편입니다.
핵산기반치료제 중 mRNA 치료제 분야는 다국적 제약사들의 자금 및 협력을 지원받은 바이오텍 기업들이 신종감염병 치료제 및 항암치료제를 대상으로 임상 개발을 진행 중에 있습니다. 대표적인 바이오텍기업들로는 Moderna, CureVac, BioNTech사등이 있습니다. 핵산기반치료제 중 플라스미드 DNA 치료제 분야는 현재 한국의 헬릭스미스사가 당뇨병성 신경병증 및 당뇨병성 족부궤양을 대상으로 한 엔젠시스 (Engensis, VM202)라는 제품의 글로벌 3상임상연구를 진행하고 있습니다.
② 플라스미드 DNA CDMO산업
플라스미드 DNA는 최근 미국 및 전세계에 시판된 바이러스 운반체 기반 유전자치료제들의 원료물질로 이용되고 있고, 플라스미드 DNA 유전자치료제에서는 주성분으로 이용되고 있어, 전세계 유전자치료제 의약품 생산의 근간을 이루는 중요한 역할을하고 있습니다. 즉, AAV 운반체 기반 유전자치료제 또는 렌티바이러스 운반체 기반 유전자치료제를 생산하기 위해서는 반드시 플라스미드 DNA의 의약품 생산이 전제되어야 합니다. 따라서, 최근 전세계 유전자치료제 시장의 급속적인 성장에 힘입어, 플라스미드 DNA의 의약품 위탁생산 산업의 성장이 가속화 되고 있습니다
"Viral Vector & Plasmid DNA Manufacturing Market (2019년5월, Acumen Research and Consulting사 발행)" 보고서에 의하면, 2026년까지 18억불의 시장 규모와 2019년부터 2022년까지의 연평균성장률(CAGR) 21.4%를 전망하였습니다.
비록 유전자치료제 시장의 급속한 성장으로 이들의 원료물질인 플라스미드 DNA의 전세계 의약품 생산 수요는 증가하고 있지만, 원료물질이라는 점과 고순도, 고농도의플라스미드 GMP 생산기술이 필요 하다는 점들로 인해, 전문적인 위탁 생산기업이 전세계적으로 많지 않고, 기업들간 기술력의 차이가 있습니다.
대표적인 플라스미드 DNA 위탁생산기업으로는 미국의 VGXI사 (진원생명과학 자회사), 벨기에의 Eurogentec사, 미국의 Aldevron사, 영국의 Cobra사등이 있습니다. 최근 플라스미드 DNA의 전세계 위탁생산 수요가 증가함에 따라, 몇몇 기업들의 생산시설 확장 보도가 이어지고 있습니다. 미국의 VGXI사와 Adveron사는 2020년대초까지 연 매출 10억불의 생산시설의 확장을 완료하거나 진행하고 있습니다.
③ 섬유사업
당사는 상기 바이오의약품사업과 별도로 면, P/C 및 CVC 등을 소재로 한 의류용 접착, 비접착 심지를 주 ITEM으로 하여 VIETNAM 해외공장에서 제조한 심지(Dress Shirts, Caps등의 부자재로 쓰임)를 판매하고 있습니다. 동남아 저개발국에서 저가심지제품이 일부 생산되고 있음을 감안할 때 제품차별화를 통한 비교우위와 다품종 소Lot화로 다양한 수요자의 욕구에 신속히 대응하는 판매전략이 요구됨에 따라 고부가가치제품개발과 다양한 소재개발로 해외수출 확대에 노력하고 있습니다.주거래처는 국내외의류업체(수출 및 내수용 봉제업체) 및 해외 Buyer로서 다양한 Sales Network를 가지고 있습니다. 비록 심지시장이 직물제품시장에 비해 협소한 편이나 품질우위 및 가격 경쟁력을 유지하며 판매확대에 힘쓰고 있습니다.
(4) 신규사업 등의 내용 및 전망
① 신약개발사업 부문
신약개발사업은 핵산 기반 바이오 신약과 항염증 치료 신약으로 나눌 수 있습니다. 핵산기반 바이오 신약은 DNA 기반 의약품과 mRNA 기반 의약품으로 나눌 수 있으며, 치료 목적에 따라 핵산 기반 백신, 핵산 기반 유전자의약품으로 구성되어 있습니다. DNA기반 의약품 중 DNA백신은 다수의 제품이 전임상시험 및 국내외 임상시험 수행 중에 있으며, mRNA기반 의약품은 연구개발 기반 플랫폼 구축을 완료하고, mRNA 백신 후보물질을 이용한 효능 및 안전성 연구를 진행하고 있습니다. DNA백신은 신변종 바이러스로부터 초래하는 질병을 사전에 예방하기 위한 신변종 감염병 DNA백신과 만성화된 감염질병에 대비하기 위한 만성 감염병 DNA백신으로 구분됩니다.
당사는 신변종 감염병 DNA백신으로 코로나19 DNA백신, 메르스 DNA백신, 지카 DNA백신, SFTS DNA백신, 니파 DNA 백신, 포와산 DNA 백신 을 개발하고 있습니다
메르스 DNA 백신(GLS-5300)은 중동호흡기증후군 코로나바이러스의 예방백신입니다. 메르스는 중증 급성 호흡기 질환으로 치사율이 40% 이상으로 높으며, 중동지역을 포함한 해외 방문으로 국내에서는 2022년7월에 메르스 의심신고가 116건 접수되고 있어 우리나라 정부는 지속적으로 메르스 감염에 대한 조기발견 및 지역사회 전파차단에 심혈을 기울이고 있습니다. 당사는 2015년5월27일 이노비오와 메르스 DNA백신의 공동연구계약을 체결하였고, 전임상 연구와 임상분야에서는 IND신청 및 승인, 임상시험 관리, 그리고 임상시료의 대량생산을 담당하여 해외 1상 및 국내 1/2a상 임상연구를 주도적으로 진행해왔습니다.
2015년11월19일 미국 FDA로부터 1상 임상시험계획 승인을 받았습니다. 1상 임상시험은 2015년11월11일 미국 국방부 산하 월터리드 미육군 연구소(Walter Reed Army Institute of Research)가 임상시험 관련 비용을 부담하는 조건으로 공동연구개발 계약을 체결하여 착수하였습니다. 2017년2월24일 임상시험 중간결과를 발표하였고, 2018년6월27일 WHO와 IVI 공동주최 메르스 백신 국제심포지엄에서 1상 임상시험 예비결과를 발표하였습니다. 임상시험을 완료한 후 그 결과를 2019년7월25일 국제 저명 의학전문학술지인 Lancet Infectious Disease에 발표하였습니다.
우수한 안전성과 높은 백신 면역반응을 확인하였고, 2015년 국내 메르스 사태에서 확보한 메르스 감염환자의 혈액과 비교 평가한 결과, 백신 접종 60주 후 메르스 완치 환자와 유사한 면역반응이 지속적으로 유지됨을 확인하였습니다.
또한, 당사는 국내에서 메르스 DNA백신의 개발 및 국가기관에 응급백신을 공급하기위한 목적으로 2016년12월7일 국제백신연구소(IVI)로부터 개발비 전액을 지원을 받는 계약을 체결하였습니다. 2017년 6월30일 국내에서 1/2a상 임상시험을 수행하기 위해, 국내 식품의약품안전처에 임상시험계획 승인을 받고자 신청하였고, 2017년 9월14일 임상시험계획 승인을 받았습니다. 2018년6월 1/2a상 임상시험을 위한 임상시험기관의 임상시험심사위원회(IRB)의 허가를 받았고, 2018년9월5일 첫번째 임상시험대상자의 첫 접종이 이뤄진 후, 1/2a상 임상시험을 서울대병원과 분당서울대병원에서 진행하여, 2019년5월30일 모든 임상시험대상자를 대상으로 백신 접종을 완료하였으며 2020년4월에 임상시험이 종료되었습니다. 임상시험 기간동안 GLS- 5300을 투여한 모든 접종군에서 백신과 관련 있는 중대한 이상반응은 발현되지 않았으며, 백신을 투여한 그룹에서 접종 용량과 접종 횟수에 상관없이 그룹 간 내약성의 차이는 없었으며, 백신의 효과가 잘 유지되는 것을 확인하였습니다. 이노비오와의 계약에 의해 후속 개발은 이노비오에서 담당하고 당사는 일정 지분을 갖습니다.
지카 DNA백신(GLS-5700)은 소두증을 유발하는 것으로 알려진 지카(Zika) 바이러스감염을 예방하거나 치료를 목적으로 개발한 백신입니다. 2016년1월22일 이노비오와DNA백신 개발의 공동연구 계약을 체결하였으며, 당사에서는 전임상 연구, 임상시료의 대량생산, 임상 1상시험 개발을 담당하여 수행했습니다. 2016년6월20일 미국 FDA로부터 임상시험계획 승인을 받았고, 2017년10월10일 우수한 임상시험 중간결과를 국제 저명 의학전문 학술잡지인 New England Journal of Medicine에 발표하였습니다. 또한, 푸에르토리코에서 160명의 피험자를 대상으로 하는 추가 1상(1b상) 임상시험도 미국 FDA로부터 2016년8월30일에 승인을 받아 착수하였고, 2017년6월16일 임상시험대상자 160명의 등록이 완료된 후 모든 임상시험대상자를 대상으로 백신접종을 완료하였으며, 2028년6월 임상시험이 종료되었습니다. GLS-5700 백신을 단회 혹은 다회 투여한 두 그룹 모두에서 접종부위에 이상반응이 일시적으로 발현했지만 경미했고, 두 그룹에서 용량에 따른 발현의 차이는 없었습니다. 또한, GLS-5700과 관련 있는 중대한이상반응은 관찰되지 않았고, 두 그룹간 내약성의 차이는 없었으며 백신의 효과가 잘 유지되는 것을 확인했습니다. 이노비오와의 계약에 의해 후속 개발은 이노비오에서 담당하고 당사는 일정 지분을 갖습니다.
SFTS DNA백신(GLS-5140)은 중증열성 혈소판 감소 증후군 바이러스(SFTS)에 감염된 살인진드기에 물리게 되면 감염되는 SFTS 감염병의 예방 DNA백신입니다.
2015년12월 KAIST 산학협력단과 보건복지부기술개발사업에 참여하여 살인진드기바이러스 항원 후보물질 4종을 도출하였고, 마우스와 페렛을 이용한 동물실험에서 예방능력이 있음을 확인하였습니다. 그 결과를 2019년8월23일 국제 저명학술지인 Nature Communications에 발표하였습니다. 또한, 2018년6월29일 KAIST와 공동으로 "중증열성 혈소판 감소증후군(SFTS) 예방 DNA백신"에 대한 특허를 한국 특허청에 출원하였고, 2020년2월4일 특허등록을 받았습니다. 2019년 6월26일 해외특허 출원을 위해 특허협력 조약(PCT)를 출원했습니다. 2020년10월 보건복지부 백신실용화기술개발사업단의 미래대응 미해결 감염병 신규백신 개발 분야의 지원과제로 선정되어 임상시험 1상의 임상시험계획 승인까지의 연구개발비용을 지원받게 되었습니다. 실험동물을 이용한 전임상시험을 통해 백신의 최종 후보물질을 선정하였고, 임상시험에 적용하기 위한 적절한 용량 및 용법을 결정하기 위한 동물실험을 완료하였습니다. 해당 실험결과는 2022년11월10일과 11월11일 양일간 진행된 화순국제백신포럼에 연자로 초청되어 발표한 바 있습니다. 현재 임상시험 1상을 계획하고 있으며, 2022년8월31일과 12월5일, 2023년6월7일에 식품의약품안전처 사전상담과와 3차례사전상담회의를 열어 임상 1상에 대한 임상시험계획 신청에 필요한 제출 자료에 대해 논의하였습니다. 임상시험 1상 IND 승인을 득하고자 현재 IND filing을 준비하고 있습니다.
코로나19 DNA백신(GLS-5310)은 2020년2월 우리나라에 코로나19 확진 사례가 발생한 직후 백신 후보물질의 디자인 및 제작을 추진하다가 2020년3월27일 <2020년도질병관리본부 긴급 현안 지정 학술연구개발 용역과제>인 "핵산백신 플랫폼을 활용한코로나19 백신후보물질 개발 사업"에 우선 순위 협상대상자로 선정되었습니다.
2020년4월 후보물질을 제작한 후 생체 외에서 후보물질로부터 코로나19 바이러스 항원이 생성되는 것을 확인하였습니다. 2020년5월 VGXI사에서 후보물질의 cGMP생산공정 개발연구를 완료하였고, 2020년7월 후보물질을 마우스에 접종한 후 우수한 항원 특이적 T세포면역반응과 항원 특이적 결합항체 반응, 그리고 중화항체의 생성을 확인하였습니다. 2020년9월 임상시험용 백신의 cGMP생산을 완료하여 1154바이알을 보관하고 있습니다. 임상에서의 투여 경로를 실험동물에 적용하여 후보물질의 용량증량에 따른 면역원성 평가를 완료하였고, 2020년12월4일 국내 식품의약품안전처로부터 1/2a상 임상시험계획 승인을 받았습니다. 임상시험 1상 착수를 위해 2020년12월18일 고대구로병원과 임상시험 계약을 체결하였고, 12월31일 첫 대상자의 접종을 완료, 2021년1월21일 고용량군의 등록 시작, 2021년3월4일 임상1상 임상시험대상자 45명의 등록을 완료하고, 2021년5월 모든 대상자의 접종이 완료되었습니다. 2021년7월8일 임상 1상중간분석 1차결과를 확인하고 자료모니터링위원회 (DSMB) 심의를 통과하여 임상 2a상 시험에 진입하였습니다. 임상 2a상은 총 5개 기관에서 실시하며, 위약대조군이 있고 이중눈가림 임상시험으로 120명을 계획하고 착수하였습니다. 총 126명이 등록되었고, 2023년1월6일 마지막 대상자의 최종방문이 완료되었으며, 2023년5월10일 위약을 접종한 대상자 중에서 본인 동의 하에 GLS- 5310을 재접종한 마지막 대상자가 최종방문을 마쳤습니다. 현재 임상결과를 분석하고 있습니다. 2021년2월4일 코로나 19백신인 GLS-5310의 1/2a상 임상개발비용인 98억원중 73억원의 연구비를 정부로부터 지원을 받았고 2020년12월4일 "코로나19치료제 백신 신약개발사업단"과 협약을 체결하였습니다. GLS-5310의 글로벌 개발과 함께, 기존 피내 접종과 비강내접종을 병용하는 임상시험을 미국에서 수행하고자 2020년1월19일 미국 FDA에 임상시험계획 승인을 신청하였으며, 2021년7월27일 승인을 받았습니다. 또한, 2021년9월6일 국가임상시험지원재단과 코로나19백신 임상2a상 대상자 모집지원 협약을 체결하였습니다. 2021년7월 22일 코로나19 DNA백신인 GLS-5310의 백신 조성물 특허에 대한 국내 및 PCT 출원을 완료하였습니다.
2023년1월, 자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)을 이용한 코로나19 DNA 백신(GLS-5310)의 안전성 및 면역원성에 대한 임상 1상 결과를 국제감염병학회 (International Society for Infectious Diseases, ISID) 학술지인 국제감염질환저널(International Journal of Infectious Diseases; 2021년 인용지수: 12.074)에 발표했습니다. 2023년5월 SARS-CoV-2를 포함한 전염병 대비를 위한 DNA 백신 관련 내용의 리뷰논문을 Vaccines 학술지에 발표하였고, 2023년6월 임상 1상 분석결과 중에서 GLS-5310 DNA 기초접종 후 mRNA 백신을 추가접종한 대상자들에 대한면역원성 결과를 Vaccine (Elsevier) 학술지에 게재하였습니다.
당사는 2021년12월7일 미국 위스타 연구소(Wistar Institute of Anatomy and Biology)가 보유한 니파(Nipah) 및 포와산(Powassan) 바이러스를 예방하는 핵산 백신 후보물질의 기술이전 계약을 체결했습니다. 국제보건기구의 10대 우선 대응 감염병중 하나인 니파 바이러스와 심각한 뇌염을 유발하는 포와산 바이러스는 아직 승인된 백신과 치료제가 없습니다. 본 라이선스 인 계약을 통하여 미국 위스타 연구소에서 보유하고 있는 니파와 포와산 바이러스의 DNA 백신을 확보함으로써 당사가 보유한 핵산 백신 플랫폼과 체내전달 기술을 적용하여 해당 백신들을 개발할 계획이며, 현재이를 위한 기초 연구가 진행되고 있습니다.
당사는 2023년5월 위스타 연구소와 니파 바이러스(Nipah virus) 예방 및 치료를 위한저분자 화합물 신약을 개발하기 위한 공동 연구 계약을 맺었습니다. 현재 연구개발 중인 니파 바이러스 백신에 추가하여, 니파 바이러스를 표적으로 하는 제품 포트폴리오 다각화의 일환으로 저분자 화합물 기반 항바이러스 치료제 연구를 시작했습니다. 본 연구는 위스타 연구소의 인체면역결핍바이러스(HIV, Human Immunodeficiency Virus) 연구 프로그램, 백신 및 면역 치료 센터 책임자인 루이스 몬타네르 박사(Dr. Luis J. Montaner)의 주관으로 진행되며, 해당 연구의 약물 스크리닝 및 저분자 화합물 디자인은 HIV 및 코로나19를 포함한 전염병에 대한 저분자 치료제 개발에 광범위한 경험을 갖고 있는 위스타 연구소 분자 스크리닝 및 단백질 발현 센터(Molecular Screening & Protein Expression Facility) 책임자인 조셉 살비노 박사 (Dr. Joseph Salvino)가 수행하고 있습니다.
DNA백신을 피내에 타겟팅하고 발현 효율성을 높이기 위해 흡인작용 피내 접종기 GeneDerm을 적용하고 있습니다. GeneDerm의 흡인기 모듈에 대해 2021년8월27일개량특허를 국내에 출원, 2023년 6월 29일 특허 등록하였으며, 2022년11월10일과 11월11일 PCT출원을 완료하였습니다. 또한, 물리적/화학적/생물학적 시험과 성능 및 전기/전자파 성능시험 등 각종 시험검사 완료, 제조 및 품질관리기준(GMP) 인정서 및 ISO-13485 취득 완료, 그리고 기술문서 심사에 통과하여 2022년4월29일 식품의약품안전처로 부터 의료기기(품목명: 전동식 의료용 흡인기, 2등급)로 승인을 득하였습니다. 해당 흡인기를 2021년10월 햄스터 공격감염 모델을 이용한 동물실험에 적용하여 GLS-5310이 야생형 및 베타 변이 코로나 19 바이러스에 대한 감염을 완벽하게 예방함을 확인하였습니다. 2021년11월5일 DNA 백신의 흡인작용 피내 접종기인 GeneDerm의 플랫폼 개발과 이를 이용해서 확인된 연구결과를 사이언스의 자매지 Science Advances (사이언스 어드밴시스)에 게재하였습니다. 또한, 미국 뉴저지주립대학인 럿거스(Rutgers) 대학 연구진과 공동연구로 진행된 자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)의 약물전달 메커니즘 연구결과를 2023년1월국제학술지 약물전달 프론티어스(Frontiers in Drug Delivery)에 게재했습니다.
2022년1월3일 미국 FDA로부터 코로나19백신접종자들을 대상으로 하여 GLS-5310을 부스터샷으로 접종하는 임상시험계획을 승인받았습니다. 해당 임상시험은 지난 2021년7월27일 승인받은 임상시험계획서에 대해 계획을 변경하여 승인받은 것으로미국에서 mRNA백신과 아데노바이러스 전달체 백신을 접종한 대상자에게 Gene Derm 흡인압력을 이용한 피내 접종군과 피내 접종 및 코 스프레이를 이용한 비강내 접종을 병용한 접종군을 비교하고자 합니다. 2022년9월 말 기준, 69명 중 69명이 등록되었고, 현재 결과를 분석하고 있습니다.
당사는 만성 감염병 DNA백신으로 C형 간염 DNA백신을 개발하고자 2011년10월7일 이노비오사와 계약을 체결하여 일본을 제외한 아시아 지역의 개발 및 판권을 확보하였습니다.
만성C형 간염 환자의 치료를 위한 백신인 VGX-6150은 2013년10월18일 국내 식품의약품안전처로부터 임상시험계획을 승인받아 연세대 세브란스병원과 부산대병원에서 18명의 만성 C형 간염 임상시험대상자 대상으로 1상 임상시험을 진행하였습니다. 또한, 추가접종 후 면역기억에 의한 장기간 치료 효과를 확인하기 위해 2014년9월26일 국내 식품의약품안전처로부터 상기 1상 임상시험이 종료된 임상시험대상자 중 희망자에 한해 후속 임상시험계획을 승인받아 추가 임상시험을 완료하였습니다. 2017년9월26일 HCV 2017 국제심포지엄에서 VGX-6150 안전성과 면역원성에 대한 결과를 발표하였고, 심각한 부작용 없이 매우 안전하면서도 C형 간염 바이러스에 대한 T세포 면역반응을 높인다는 1상 임상시험시험 결과를 간 연구분야의 국제적 전문 학술지인 "저널 오브 헤파톨로지(Journal of Hepatology)"의 2020년2월20일자 온라인판에 게재하였습니다.
C형 간염 예방을 위한 DNA백신인 GLS-6150과 GLS-6100은 VGX-6150의 임상 연구 중간 결과를 이용하여 신청한 보건복지부 기술개발사업단 주관 과제로 2017년 6월9일 선정되어 개발을 착수하였습니다. GLS-6100은 국내에서 1상 임상시험을 수행하기 위한 임상시험계획 승인 신청서를 2021년1월4일 식약처에 제출하였고, 2021년5월20일 승인받았습니다. 이후 과제에 대한 후속 지원이 없어 개발을 종료했습니다. GLS-6150은 기존 치료제로 완치된 만성C형 간염 환자를 대상으로 재감염을 예방하는 제품이고, GLS-6100은 C형 간염 감염 고위험군을 대상으로 하는 만성C형 간염 예방하는 제품입니다. GLS-6150은 2017년10월31일 국내에서 1상 임상시험을위해, 국내 식품의약품안전처에 임상시험계획 승인을 신청하였고, 2018년2월2일 승인을 득하였습니다. 2018년7월 1상 임상시험을 위한 임상시험기관의 임상시험심사위원회(IRB)의 허가를 받았고, 2018년9월4일 첫번째 임상시험대상자의 첫 접종이 이뤄진 후, 1상 임상시험을 연세의료원 세브란스병원과 부산대병원에서 진행하였습니다. 2018년9월4일 첫번째 임상시험대상자의 첫 접종이 있었고 2020년5월11일 임상시험을 종료하여 식약처에 종료 보고를 완료하였습니다. 1상 임상시험전반에 대한안전성 결과와 면역원성 결과에 대한 통계분석이 완료되었으며, 2022년12월 8일 임상결과보고서(CSR) 최종본을 수령하였습니다.
DNA기반 단백질의약품 및 단클론항체 의약품은 기존 단백질의약품 및 단클론항체 의약품 대비 우수한 가격 경쟁력, 체내 안전성 및 약효 지속성을 장점으로 하여 당사 R&D 기술력으로 직접 개발하고 있습니다. 당사가 개발/보유하고 있는 DNA 백신 플랫폼은 감염성 질환에 대한 예방백신 개발에 적용할 수 있는 기술입니다. 이 기술로 개발된 백신을 동물에 접종 시 면역원성이 잘 유도됨을 확인하여 DNA백신 개발에 대한 기술적 방법 및 결과가 2021년12월17일 Methods Mol Biol 온라인판으로 출판되었습니다.
당사는 DNA 기반 단백질의약품으로 DNA기반으로 한 혈우병 치료제의 개발 타당성에 대한 검증연구를 진행하고 있습니다.
DNA기반 혈우병치료제는 2014년10월 강원대 의생명과학대학과 플라스미드 기반으로 한 혈우병 치료제의 의약품개발 타당성 검증 연구를 착수하였습니다. 현재, 당사 자체적으로 혈액응고 8인자의 체내 생성량과 활성을 높이기 위한 제품후보물질에대한 개선 연구를 진행하고 있습니다.
당사는 DNA 기반 단클론항체 의약품으로 DNA기반 B형간염 면역글로블린의 개발 타당성 검증연구를 진행하고 있습니다.
DNA기반 B형간염 면역글로블린은 2017년4월 강원대학교 산학협력단이 보유하고 있는 "B형간염 바이러스의 preS1에 특이적으로 결합하는 항체" 2종에 대한 특허와 기술을 양수하여 타당성 검증 연구를 착수하였습니다. 이중 1종에 대한 특허는 2018년6월11일 한국 특허청으로부터 특허등록을 받았고, 2019년2월5일 미국 특허등록을 받았습니다. 나머지 1종은 2019년1월25일 한국 특허청에 특허 출원을 완료하였습니다. DNA기반 B형간염 항preS1 면역글로블린 2종의 후보물질 플라스미드와 항S면역글로불린 2종의 후보물질 플라스미드를 제작하여 연구용 시료를 생산하였고, 동물세포에서 항체생성과 항원 결합능력을 확인하였습니다. 현재, 실험동물에서 4종의 후보물질로부터 항체 생성 및 체내 분포 경향 분석 연구를 진행하고 있고, 2019년9월 B형간염바이러스 연구분야의 세계적 권위자인 건국대 의학전문대학원 김균환 교수 연구팀과 함께 실험동물을 이용한 효능평가 연구를 수행한 결과 항preS1 면역글로블린과 항S면역글로불린을 동시에 처리한 조건에서 우수한 바이러스 억제효과를 확인하였습니다. 현재, 당사 자체적으로 높은 국내 분포를 보이는 B형간염바이러스 유전자 C형에 대한 억제효과를 평가하는 세포 수준의 실험과 동물실험을 진행하고 있습니다.
또한, 류마티스 관절염 치료 목적으로 DNA 기반의 항 TNF 알파 단클론항체 후보 물질을 제작하여, 동물세포에서의 항체 생성과 TNF 알파 결합능력 및 아밀로이드 베타와의 결합력을 확인하고, 동물세포에서 TNF 알파의 세포살상반응 억제능을 확인하였으나, 상업화 적합성 문제로 연구개발을 중단하였습니다.
당사는 mRNA기반 의약품의 연구개발을 수행하기 위해 기반 플랫폼 구축을 완료하고, mRNA 백신 후보물질을 이용하여 효능 및 안전성 연구를 진행하고 있습니다.
2018년9월17일 자회사 VGXI가 임상용 의약품 mRNA를 생산하기 위해 미국 휴스턴매소디스트 병원 연구소(Houston Methodist Research Institute)와 독점적 라이선스-인 계약을 체결함에 따라, mRNA백신 및 mRNA 치료제 생산의 핵심 기술과 mRNA백신 설계 및 연구 기술을 이전 받아 mRNA 백신 및 mRNA 치료제 연구개발사업에 진출하게 되었습니다. 자회사인 VGXI는 mRNA 기반 의약품의 상업적 생산을 위한 파일럿 생산공정을 성공적으로 구축한 후 대규모 cGMP 생산공정을 구축하기 위한 공정 스케일업 및 최적화 단계를 진행하고 있습니다.
코로나19 mRNA백신은 2020년2월 우리나라에 코로나19 확진 사례가 발생한 직후 휴스턴 매소디스트 병원 연구소의 John Cooke 연구팀으로부터 mRNA 백신 설계 및연구 기술을 이전 받아 mRNA 백신 후보물질의 디자인 및 제작을 진행하였습니다.
2020년3월27일 <2020년도 질병관리본부 긴급 현안 지정 학술연구개발 용역과제>인 "핵산백신 플랫폼을 활용한 코로나19 백신후보물질 개발 사업"에 우선 순위 협상대상자로 선정되었습니다. 2020년5월 후보물질을 2종을 제작한 후, 2020년9월 생체외에서 후보물질로부터 코로나19 바이러스 항원이 생성되는 것을 확인하였고, 2020년11월 실험동물에서 후보물질 접종 후 항체면역반응과 T세포면역반응이 유도됨을 확인하였고, LNP 기술을 보유한 기관들로부터 해당 mRNA 백신의 평가를 진행하였으나, 상업적 타당성 문제로 개발을 종료하였습니다.
당사는 국내 mRNA백신 기반 신속 백신 개발 플랫폼 구축과 함께 mRNA 기반의 항암 백신과 단클론 항체 플랫폼 개발을 위한 연구를 진행하고 있습니다.
2021년5월31일 한미사이언스와 mRNA 백신 대규모 생산기반 및 글로벌 네트워크 구축을 위한 상호협력개발을 체결하였습니다. 이번 계약에 따라 당사와 한미사이언스는 양사가 보유한 핵심 기술을 상호 협력으로 더욱 최적화함으써 수율과 에너지 자원 활용을 극대화하는 방법 등 mRNA 백신의 글로벌 대규모 생산을 위한 차세대 생산기술을 함께 연구하고, 코로나19 및 신종 감염병mRNA백신의 공동 연구 및 사업화를 포함한 포괄적인 글로벌 핵산 사업 네트워크 구축을 위한 파트너로서 기술확보 및 시장개척 등을 위한 논의를 시작하였습니다.
당사는 2021년6월17일 mRNA 기반 신속백신제작 플랫폼을 구축하고 백신 선도물질발굴 및 유효성을 평가하는 연구가 보건복지부 백신실용화기술개발사업단의 미래대응, 미해결 신변종 감염병백신 플랫폼 개발 분야의 지원 과제로 선정되었습니다.
질병청으로부터 기술이전을 받은 지카 백신 항원을 본 과제에 적용하여 지카 mRNA백신 선도물질 발굴 및 유효성 평가를 수행함으로써, 생산 효율성과 안정성이 증진된mRNA백신 원액생산공정 및 품질평가법을 개발하고, 원부자재의 국산화 가능여부를 확인하며, 초기 임상시험용 mRNA백신을 생산할 수 있는 LNP 제형공정 스케일 업을 목표로 하고 있습니다. mRNA 기반 신속백신제작 플랫폼의 구축을 완료한 상태이며, 지카 mRNA 백신 선도물질의 유효성 및 안전성 평가를 2022년12월31일부로완료하였습니다. 현재 확보된 지카 mRNA 백신 선도물질의 효능과 안정성을 추가적인 동물 모델에서 재확인하는 연구를 진행하고 있습니다.
당사는 2021년6월25일 원형(circular) mRNA백신 기술을 활용한 새로운 mRNA백신용 플랫폼 개발 연구가 과학기술정보통신부 신변종감염병 대응 플랫폼 기술개발 사업의 세부연구로 선정이 되어 공동연구개발기관으로 참여하게 되었습니다. 총 43개월동안 원형(circular)mRNA 플랫폼의 구축, 생산 및 유효성 평가를 수행하고 mRNA대량생산 공정 최적화 및 cGMP 수준의 임상용 백신의 생산을 담당하게 됩니다.
2021년9월에 원형(circular) mRNA 플랫폼의 특허 가출원을 완료한 후, 원형(circular) mRNA 플랫폼 기술의 문제점을 보완하여 2022년9월에 특허의 국내정식출원과 국제출원(PCT)을 하였습니다. 현재, 원형(circular) mRNA 공정 최적화를 위한 지속적인 연구개발과 함께, 신변종 감염병 선정을 위한 대상감염병(Disease X) 3종을 결정하여 백신으로 사용할 원형(circular) mRNA의 제작을 진행중에 있습니다.
당사는 R&D 역량 강화를 위한 전략적인 오픈 이노베이션(Open Innovation)을 지속적으로 추진중에 있으며, 그 결과 모 대학 연구진과 함께 mRNA 전달체를 특정 세포나 조직에 이동할 수 있도록 조절하는 타겟팅 기능을 연구하고 있습니다. 당사가 확보하고 있는 mRNA 플랫폼에 적용하여 미충족 수요(Unmet Need)가 많은 암치료 분야에 mRNA 기반의 항암 백신과 단클론 항체를 적용함에 있어서 치료용 mRNA의 단점을 극복하고 장점을 극대화하고자 하는 목적으로 공동연구를 진행하고 있습니다. 그 외에도 여러 방면으로 오픈 이노베이션을 진행하여 다양한 난치성 전염병의 백신 연구개발을 비롯하여 암이나 자가면역 질환, 퇴행성만성질환 등에 적용가능한 혁신적인 치료방법과 당사의 mRNA 플랫폼에 적용할 수 있는 새로운 치료방법을 연구기관들과 논의 중에 있습니다.
당사는 2022년12월8일, 자사 VGXI의 고객사인 애스톤 사이언스와 전략적 업무제휴양해각서(MOU)를 체결함으로써 신약개발에 대한 파트너로서 새로운 타깃 물질에 대한 차세대 핵산 기반 백신의 공동 연구 및 개발을 위해 역량을 공유하는 오픈 이노베이션을 통해 협력하기로 하였습니다. 본 MOU의 후속 조치로써 치료 목적의 백신 신약 연구와 개발을 위하여 인공지능(AI) 스크리닝 방법을 통한 새로운 항원 결정기에 대한 정보를 공유하고, 플라스미드 DNA 백신을 mRNA 기반 백신으로 전환하기 위한 연구 등을 우선 수행하기 위한 후속 논의를 진행하고 있습니다. 현재 mRNA 항암 백신 신약개발 공동 프로젝트를 구성하여 새로운 항원 결정기를 찾고 효능 및 안정성을 검토하는 연구에 착수하였습니다.
항염증 치료 신약은 천연물 유래 성분 의약품과 저분자량 화학합성의약품으로 나눌 수 있습니다. 천연물 유래 성분 의약품으로 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물이 있으며, 저분자량 화학합성의약품으로 항염증 면역제어 경구 약물이 있습니다.
쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물(GLS-1200)은 2018년6월26일 미국 펜실베니아 대학교로부터 호흡기 감염에 대한 혁신 치료제 및 진단법 개발을 위한 쓴맛 수용체 신호전달 물질 및 관련 기술을 기술이전 받았습니다. 만성 축농증 치료를 위해 임상용 의약품의 생산을 완료하고, 2019년8월5일 미국 FDA에 2상 임상시험 진행을 위한 임상시험계획 승인을 신청하였습니다. 본 임상은 미국 펜실베니아 대학교 임상시험센터에서 실시되며 만성 축농증 환자의 부비동 수술 이후 7주에 거쳐 만성 축농증 치료제(GLS-1200)인 코 스프레이를 비강을 통해 투여한 후 4개월 동안 급성 축농증의 재발 여부를 확인하는 목적으로 위약대조군과 함께 99명의 환자를 대상으로 진행할 것을 계획하고 있습니다. 2020년4월13일 미국 FDA로부터 2상임상시험계획 승인을 받았지만 코로나19 감염병 사태로 인해 임상시험이 잠정중단 되었지만, COVID-19 관련 임상시험의 결과분석과 CSR이 마무리되는 대로 임상시험 착수를 계획하고 있습니다. 2020년4월22일, GLS-1200에 대해 펜실베니아 대학교와 공동으로 코로나19 및 독감을 포함한 다른 바이러스에 의한 감염을 예방하는 용도에 대한 특허를 미국 특허청에 출원하였고, 2021년1월6일 미국 특허청에등록을 받았습니다.비강에 분무된 GLS-1200은 비강 부위 세포의 쓴맛 수용체와 결합하여, 산화질소를 생성 분비하게 하여 코로나19 바이러스를 사멸하는 MOA를 예상하고 있습니다. 2020년4월29일, 코로나19 감염 예방 코 스프레이 약물로 2상 임상시험계획 승인을 미국 FDA로부터 받아, 2020년6월11일 펜실베니아 대학교 임상시험센터에서 의료계 종사자들을 대상으로 한 첫 임상시험대상자 투약이 진행되었고, 2020년9월, 계획된 225명 임상시험대상자에서 50% 이상 대상자 등록이 완료되었습니다. 2021년1월18일 GLS-1200은 코 부위에 분포하고 있는 코로나19 바이러스 농도를 감소시켰고, 족제비 감염 동물 모델을 통해 비강 세포 내 감염을 억제하는 것으로 확인되었습니다. 미국 루이지에나주 바톤루지시에 2차 임상시험실시기관을 추가하였고, 2021년4월 임상대상자를 일반인으로 확대해서 진행할 수 있도록 하는 IRB 승인을 받았습니다. 대상자 모집에 지속적으로 노력하여 2022년12월 기준 184명이 등록되었으나, 코로나19에 감염된 대상자를 모집하는데 어려움이 있어 임상시험대상자 모집을 조기 종료하였습니다. 2023년에 임상2상 연구를 종료하여, 임상결과 분석 및 임상시험결과보고서 작성을 수행할 계획입니다.
항염증 면역제어 경구약물(GLS-1027)은 당사가 보유한 1상 임상시험이 종료된 GLS-1027(구VGX-1027)을 이용하여 자가면역성 신장질환 등의 치료를 위한 임상개발을 준비하고 있습니다. 공정개발 연구를 통해 불순물이 제거된 GLS-1027을 생산하였고, 기존 물질과의 항염증 반응을 평가하기 위해 이탈리아 카타리나 대학 니콜라티 교수 연구팀과 협력하여 동물실험을 진행하여, GLS-1027이 코로나19 감염 후 생성되는 다수의 염증유발물질(싸이토카인)들의 억제 능력을 보여주었기 때문에, 2020년10월28일 코로나19 감염 후 과대 면역에 의한 심각한 폐질환을 방지하는 치료제로서GLS-1027의 2상 임상시험계획 승인 신청서를 미국 FDA에 제출했고, 11월30일 미국 FDA로부터 승인을 받았습니다. GLS-1027(국제 일반명 zenozulac)은 경구용 캡슐 약제로 빠른 체내 소실과 우수한 안전성을 임상1상 연구를 통해 이미 확인하였고, 선천성 면역세포에만 작용하여 싸이토카인 분비를 억제함으로서 과대 면역을 제어하여 정상수치로 면역이 회복될 수 있게 바이러스로 인한 감염을 치료하게 됩니다.본 약제에 대한 2상 임상시험은 코로나19 확진자를 대상으로 132명을 계획하고 코로나19 바이러스 감염 시부터 GLS-1027을 선제적으로 투약하여 코로나19에 의한 심각한 폐렴 발병을 예방할 수 있는지를 평가하고자 하였습니다. 우리나라를 포함한 총 4개국(우리나라, 미국, 북 마케도니아, 불가리아)에서 수행하는 다지역 임상시험(MRCT)으로 설계되었습니다. 2021년3월1일 바톤루지 임상시험센터의 IRB 승인을 받았고, 2021년7월2일 북 마케도니아 식약처로부터 승인을 받아 임상시험을 착수하였습니다. 2021년11월1일 유럽의약품청(EMA)과 불가리아 허가당국으로부터 GLS-1027의 임상 2상 시험계획을 승인받았습니다. 2022년3월 25일 기준으로 현재3개국(미국, 북마케도니아, 불가리아)에서 임상시험대상자 118명의 등록을 완료하였습니다. 국내에서는 2021년1월29일 임상시험대상자 15명에 대한 GLS-1027의 2상 임상시험계획 승인 신청서를 식약처에 제출하였고, 2021년9월8일 승인받았습니다. 임상시험대상자의 빠른 등록을 위해 국내 5개 임상시험실시기관에서 진행되었으며, 2022년4월8일 마지막 임상시험 개시방문(SIV)을 완료하여 임상시험대상자 모집과 등록을 진행하였습니다만, 국내에서는 코로나 19에 감염된 중등증 입원환자 수의 급격한 감소로 인해 환자 모집의 어려움이 있었습니다. 이후, 한국을 제외한 3개국에서계획한 환자 모집을 완료하여 국내에서의 환자 모집은 조기 종료되었습니다. 2022년6월22일 임상 2상 임상시험에 계획된 132명 대상자 모두 등록이 완료되었고, 2022년12월 기준 대상자 모두 임상시험을 완료했습니다. 현재 결과를 분석하고 있습니다.
2021년6월30일 코로나19 중증 폐렴을 유발하는 햄스터 공격감염 연구결과를 발표하였습니다. GLS-1027(국제 일반명 zenozulac)이 용량 의존적으로 폐렴증상 마커들의 발현 감소를 유도했고, 폐 부위 조직에서 바이러스 유발 세포융합체(syncytia)와 세포이형성(atypia)이 탁월하게 감소함을 확인하였습니다. 또한, 코로나19 바이러스 남아공 변이주인 B.1.351 β variant 에서도 동일한 결과를 확인할 수 있었습니다.
당사는 신약개발사업을 당사 기술력으로 직접 수행하기 위해, 2010년2월 과학기술정보통신부로부터 기업부설연구소 인가를 받아 운영하고 있고, 2013년9월 중소기업청으로부터 당사의 우수한 연구개발 능력을 평가받아 기술혁신형 중소기업(INNO- BIZ) 인증을 받았고, 2019년3월 기술보증기금으로부터 벤처기업확인서를 받았습니다. 또한 메르스 DNA백신, 지카 DNA백신, 코로나19백신, 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물, 항염증 면역제어 경구약물의 글로벌 임상개발을 효율적으로 수행하기 위해 미국 펜실베니아주 Fort Washington시에 글로벌 임상개발 본부를 설립하였고 최고의학책임자를 임명하였습니다. 또한, 신종 감염병에 대한 핵산 기반 백신 개발과 면역학 및 종양학 분야의 기존 개발 역량을 크게 확장하고자 최고과학개발책임자를 임명하였습니다.
당사는 핵산기반 바이오 신약의 개발을 위하여 국내외 기업 및 전문연구기관과 적극적이고 지속적인 협력연구를 진행하고 있습니다. 지카 DNA백신의 개발을 위해 이노비오(Inovio), 미국 위스타(Wistar) 백신연구소, 캐나다 라발(Laval) 대학교와 협력하고, 메르스 DNA 백신의 개발을 위해 이노비오(Inovio), 미국 국방부 월터리드 미육군연구소(WRAIR), 국제백신연구소(IVI), 서울대병원, 분당서울대병원과 협력하고, C형 간염 예방 및 치료 DNA 백신 개발을 위해 연세의료원 세브란스병원, 부산대병원,한국 과학기술원(KAIST)과 협력하고 있으며, SFTS DNA 백신 개발을 위해 한국과학기술원 (KAIST)과 협력하고, 코로나19 DNA백신 개발을 위해 질병관리청 공공백신개발지원센터, 고대구로병원, 고대안산병원, 한림대강남성심병원, 가천대길병원, 인하대병원, 국가임상시험지원재단과 협력하고 있습니다. mRNA기반 의약품의 개발을 위해 미국 휴스턴 매소디스트 병원연구소(Houston Methodist Research Institute), 가톨릭대학교, 한국과학기술연구원(KIST)과 협력하고 있습니다. 또한, 항염증 치료 신약 개발을 위하여 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이약물의 개발을 미국펜실베니아 대학과 협력하고 있습니다. 성공적인 제품개발을 위해 세계적 감염병 치료 및 예방분야 전문가인 고려대학교 구로병원 김우주 교수 및강원대학교 의과대학 신정임 교수의 과학자문과 자회사인 VGXI와 협력하여 연구개발을 진행하고 있습니다
② 바이오의약품 CDMO사업부문
2016넌3월 VGXI의 생산시설을 추가로 확충하여 10리터에서 40리터까지의 발효 공정 시설을 확보하여 고객수요에 맞춰 소규모 임상용 플라스미드 DNA 생산이 가능해졌고, 기존 500리터 규모 생산시설에 새로운 정제 시설이 추가됨으로써 전체 생산용량이 증가하고 동시에 여러 제품의 생산이 가능하게 되었습니다.
2018년11월, 유전자 치료제 시장이 급속히 성장함에 따라 유전자 치료제의 원료 또는 제품으로 이용되는 고품질 플라스미드 DNA의 전세계적인 수요 증가에 대응하고자 자회사 VGXI의 생산면적의 확장을 통해 기존 전체 면적 대비 17%, 우수의약품제조 및 품질관리 기준(cGMP) 생산시설 면적은 70% 이상 확충하게 되었습니다.
2018년9월 미국 휴스턴 매소디스트 병원연구소(Houston Methodist Research Institute, HMRI)와 독점적 라이선스 계약을 통해 임상 등급의 mRNA 생산을 위한 기술 이전을 진행 중이며, mRNA 백신 및 RNA 치료제의 위탁생산 서비스 제공을 위한준비가 계획대로 추진되고 있습니다.
2019년12월 임상시험용 파일럿규모의 mRNA생산공정의 구축을 완료하였고, 공정 스케일업 및 최적화 단계를 착수하였습니다.
2019년7월 개인 맞춤형 신생항원(neoantigen) 암 백신 개발 기업인 지니어스 테라퓨틱스(Geneos Therapeutics)와 장기 공급계약을 체결하고 개인 맞춤형 신생항원 암백신의 우수의약품제조 및 품질관리 기준(cGMP) 생산 시스템 구축에 착수하였습니다.각광받고 있는 개인 맞춤형 신생항원 암 백신은 빠른 기간에 고순도의 암 백신을 생산하는 것이 성공의 관건인데, VGXI는 회사가 보유한 플라스미드의 고순도 고수율 생산공정을 최적화함으로써 생산기간을 기존의 1/10 수준으로 단축할 수 있습니다.
2019년12월 VGXI가 기존 생산시설과는 별도로 유전자치료제원료물질인 플라스미드 DNA와 mRNA에 대한 새로운 생산시설 건설을 결정하고, BE&K Building Group을 시행사로 선정했습니다. 유전자치료제 제품들이 미국시장에 성공적으로 진입함에 따라 형성된 플라스미드 DNA 및 mRNA의 폭발적 생산 수요에 적극적으로 대응하기 위해 금번 확장뿐만 아니라 추가 확장도 추진할 계획입니다. 첫번째 단계로가변형 플라스미드 DNA와 mRNA 생산 시설을 구축하기로 하고 2-3년 후 완공을 목표로 하고 있습니다.
2020년1월 VGXI가 미국 나스닥 상장기업인 이노비오가 추진하는 신종 코로나 바이러스(2019-nCoV) 감염병 예방 DNA백신의 연구개발에 참여하여 임상용 백신 생산을 수행하게 되었습니다. 전염병대비혁신연합(CEPI)은 중국 우한에서 발원한 변종 코로나바이러스(2019-nCoV) 감염병 예방 백신을 개발하도록 이노비오에 9백만 달러까지 지원하였습니다. VGXI는 에볼라, 지카 및 메르스 등의 신종 감염병에 대해 긴급한 백신 개발 일정에 맞춰 지연없이 지원함으로써 신변종 감염병 예방백신의 생산능력 및 생산시설로서의 역할을 입증한 바 있습니다.
2020년5월 VGXI가 DNA기반 개인 맞춤형 신생항원(neoantigen) 암 백신 제품을 5일만에 cGMP생산을 마치고 2주 이내에 품질평가를 거쳐 출시한 후 환자의 첫 접종을 수행함으로써 신속 생산 시스템의 구축을 성공적으로 완료했습니다. 해당 제품은 미국 지니어스 테라퓨틱스(Geneos Therapeutics)가 암환자의 종양 유전자 정보를 이용하여 개인 맞춤형 신생 항원을 설계한 후 DNA 백신 형태로 암을 치료하는 백신으로, 환자의 암조직 채취부터 cGMP생산 및 환자 접종까지 6~8주를 목표로 하고 있습니다. 해당제품의 성공적인 개발을 위해서는 평균 6~8개월이 소요되는 DNA백신의 cGMP생산 및 출시 기간을 수주 이내로 축소하는 것이 핵심이며, VGXI의 탁월한 고순도 생산 기술력이 있었기에 가능했습니다.
2020년11월 VGXI가 미국 텍사스주 콘로시에 마련한 생산시설 부지에서 유전자 치료제 및 코로나19 백신과 RNA 백신 등에 사용되는 플라스미드의 폭발적인 수요에 대응하기 위한 1차 신규 생산시설 건설에 착수함에 따라 기공식을 개최했습니다.
데이슨(Deison) Technology Park에 건설되는 신규 생산시설은 본사로 이용될 예정이며, 해당 시설은 품질평가 실험실, 정제 및 충전, 포장 설비와 원부자재 창고 그리고 공정 지원에 필요한 공간은 물론 사무실과 편의시설 등을 갖춘 2층 규모입니다.
2021년3월 VGXI가 진행성 간세포암종(HCC)에 대한 치료제를 개발하고 있는 미국 지니어스 테라퓨틱스(Geneos Therapeutics)와 협력을 강화하기로 하고, 1b/2a 임상시험을 위한 추가 공급 계약을 체결했습니다.
2021년4월 VGXI가 미국 텍사스주 콘로시에 건설 중인 신규 생산시설에 대한 마지막 강철빔이 세워져 골조 공사가 마무리됨에 따라 시공사인 BE&K Building Group 주최로 상량식을 진행하였습니다.
2021년8월 VGXI가 "Rare Trait Hope Fund(레어 트레이트 호프 펀드)"가 지원하는 아스파르틸글루코사민뇨(Aspartylglucosaminuria) 유전자 치료제 개발 프로젝트에 파트너로 참여하여 지원하기로 하였습니다.
2021년9월 VGXI가 플라스미드 DNA 및 mRNA 생산 능력을 최대한 높이기 위해 신규 2공장 건설에 투입되고, 신규 3공장 건설도 추진하기 위해, 지분을 통한 자금을 조달하기 위해 JP모건을 주간사로 선정했습니다.
2021년10월 VGXI는 미국 텍사스주 콘로시 데이슨 테크놀로지 파크(Deison Technology Park)에 건설 중인 신규1공장의 외관 공사를 마무리하였습니다.
2022년1월 VGXI가 제40회 JP모건 헬스케어 컨퍼런스(J.P. Morgan Healthcare Conference)에 공식 초청을 받아 참가하였습니다.
2022년10월 미국 텍사스주 콘로시 데이슨 테크놀로지 파크(Deison TechnologyPark)에 자회사 VGXI의 신규1공장을 증설하였습니다.
2023년1월 VGXI가 제41회JP모건 헬스케어 컨퍼런스(J.P. Morgan Healthcare Conference)에 공식 초청을 받아 참가하였습니다.
(5) 조직도
 |
|
조직도(2023) |
2. 주요 제품 및 서비스
2-1. 주요 제품의 현황
① Plasmid DNA CMO : 임상시험용 DNA백신 및 유전자치료제의 원료로 사용되며 당(3분)기말까지의 매출액과 총매출액에 대한 비중은 각각 17,373백만원, 63.3% 입니다.
② 의류용 심지(제품) : Dress Shirt, Caps, 양복 및 의류전제품(심지사용 제품에 한 함)의 부자재로 사용되며, 주요 상표는 "INTERON"이고 당(3분)기말까지의 매출 액과 총매출액에 대한 비중은 각각 5,382백만원, 19.6%입니다.
③ 심지상품 및 기타 : 당(3분)기말까지의 매출액과 총매출액에 대한 비중은 각각 3,818백만원, 13.9%입니다.
④ 컨설팅등: 당(3분)기말까지의 매출액과 총매출액에 대한 비중은 각각 876백만 원, 3.2%입니다.
* (연결 기준 총매출액 : 27,448백만원)
2-2. 주요 제품 등의 가격변동추이
의류용 심지(DIV 외주제품)의 경우, 2018년 평균 1Yd당 1,033원, 2019년 평균 1Yd당 1,054원, 2020년 평균 1,109원, 2021년 1Yd당 평균 1,214원, 2022년 1Yd당 평균 1,423원, 2023년3분기말 1Yd당 평균 1,499원입니다.
* 평균단가산출은 총수출매출액을 총수량으로 나눈 단순평균단가이며, 평균단가 변동요인은 환율변동 및 원자재가격변동에 따른 제품단가변동 등에 의한 영향때문입니다.
3. 원재료 및 생산설비
3-1. 주요 원재료
(1) 주요 원재료등의 현황
심지제조용 원단을 중국 등에서 수입하고 있으며 당3분기말까지의 매입액은 821백만원입니다.
(2) 주요 원재료등의 평균단가 가격변동추이
심지제품 구성단가 중 원부자재인 원단에 대해 평균단가 가격변동추이를 살펴보면, 2019년 1Yd당 평균 816원, 2020년 1Yd당 평균842원, 2021년 1Yd당 평균912원, 2022년 1Yd당 평균905원, 2023년 당3분기말 기준 1Yd당 평균929원으로, 원자재 매입평균단가는 환율변동동 및 원자재가격과 구성비에 따라 변동됩니다.
* 평균단가산출기준 : 당3분기말 평균단가로 산출함.
3-2. 생산 및 설비에 관한 사항
(1) 생산능력
당사는 2005년 4월부터 옥천공장의 완전조업중단으로 생산이 없습니다.
(2005년 1월31일 공시 참조)
(2) 생산실적 및 가동률
① 생산실적
당사는 자가생산시설은 없으며, 당사의 해외현지법인으로부터 임가공생산 혹은 완제품(상품) 구입으로 대체하고 있습니다.
② 당해 사업연도의 가동율
2005년 4월부터 완전조업 중단하였습니다.
(3) 생산설비의 현황등
당사는 충북 옥천에 24,815㎡규모의 공장을 소유하고 있으며, 당(3분)기말 현재
① 공장 부지 장부가액은 1,769백만원입니다.
② 공장내 건물은 16,400㎡규모이며, 건물 장부가액은 765백만원입니다.
③ 구축물의 규모는 2,580㎡로 장부가액은 0백만원입니다.
4. 매출 및 수주상황
4-1. 매출실적(연결 기준)
(단위:백만원)
|
사업부문 |
매출유형 |
품목 |
제48기 |
제47기 |
제46기 |
|
|---|---|---|---|---|---|---|
|
의약품, 원료 |
CDMO매출 |
Plasmid |
수출 |
17,373 |
31,506 |
22,360 |
|
내수 |
- |
- |
- |
|||
|
합계 |
17,373 |
31,506 |
22,360 |
|||
|
각종 심지의 |
제품 |
심지 |
수출 |
5,157 |
9,121 |
8,695 |
|
내수 |
225 |
235 |
202 |
|||
|
합계 |
5,382 |
9,356 |
8,897 |
|||
|
각 사업에 |
상품 |
상품, |
수출 |
1,011 |
2,219 |
2,364 |
|
내수 |
2,807 |
4,303 |
3,083 |
|||
|
합계 |
3,818 |
6,522 |
5,447 |
|||
|
의약품, 원료 |
기타 |
컨설팅 등 |
수출 |
876 |
1,334 |
1,993 |
|
내수 |
- |
- |
3 |
|||
|
합계 |
876 |
1,334 |
1,996 |
|||
|
합 계 |
수출 |
24,416 |
44,180 |
35,412 |
||
|
내수 |
3,032 |
4,538 |
3,288 |
|||
|
합계 |
27,448 |
48,718 |
38,700 |
|||
4-2. 판매경로 및 판매방법등
(1) 판매조직
 |
|
판매조직도(2023) |
(2) 판매경로
심지사업의 경우 직수출은 해외영업활동을 통해 생산지에서 해외구매자에게 직접 판매하고 있으며, LOCAL수출은 국내영업활동을 통해 생산지에서 국내 구매자에게 판매되며 수출비중은 62%이고, 내수비중은 38%입니다. 또한 CDMO사업은 전액 해외판매입니다.
(3) 판매방법 및 조건
심지 사업의 경우 실 수요자에게 직접 판매를 하거나 국내외 Agent를 통해 판매를 하고 있습니다.
판매조건은 수출의 경우 L/C 및 T/T Base로 대금결제가 이루어지며, 내수의 경우에는 현금 및 어음, 선수금 등을 통한 판매로 이루어집니다.
(4) 판매전략
심지사업의 경우 고부가가치 신제품 판촉강화 및 다품종 소Lot 생산체제 강화입니다
4-3. 수주상황
| (단위 :USD) |
| 품목 | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
|---|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
|
임상용 Plasmid DNA |
2023-01-31 |
2024-01-30 |
0 |
5,311,200 |
0 |
0 |
0 |
5,311,200 |
(*1) 당사는 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았습니다.
5. 위험관리 및 파생거래
5-1. 금융위험관리
연결실체는 경영활동과 관련하여 신용위험, 유동성위험 및 시장위험 등 다양한 금융위험에 노출되어 있습니다. 연결실체의 전반적인 위험관리는 연결실체의 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화 하는데 중점을 두고 있습니다.
1) 신용위험관리
연결실체의 전반적인 위험관리는 연결실체의 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화 하는데 중점을 두고 있습니다. 연결실체는 신용위험노출 및 거래처의 신용등급을 주기적으로 검토하여 거래처의 여신한도 및 담보수준을 재조정하는 등 신용위험을 관리하고 있습니다.
금융상품 종류별 신용위험의 최대 노출금액은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전기 | ||
| 장부금액 |
신용위험 최대노출금액 |
장부금액 |
신용위험 최대노출금액 |
|
| 현금성자산(현금 제외) | 6,774,558,301 | 6,774,558,301 | 13,249,416,691 | 13,249,416,691 |
| 매출채권 및 기타채권 | 6,830,633,967 | 6,830,633,967 | 10,578,609,151 | 10,578,609,151 |
| 기타금융자산(유동) | 5,302,608,818 | 5,302,608,818 | 32,617,996,392 | 32,617,996,392 |
| 기타금융자산(비유동) (*) | 1,450,369,942 | 1,450,369,942 | 1,503,973,595 | 1,503,973,595 |
| 합계 | 20,358,171,028 | 20,358,171,028 | 57,949,995,829 | 57,949,995,829 |
(*) 기타포괄손익-공정가치측정금융자산 제외
2) 유동성위험관리
연결실체는 미래의 현금흐름을 예측하여 단기 및 중장기 자금조달 계획을 수립하여 유동성위험을 관리하고 있으며, 금융부채의 잔존계약 만기에 따른 만기분석내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 장부금액 | 1년이내 | 1년초과~2년이내 | 2년초과~5년이내 | 5년초과 | 합계 |
| 매입채무및기타채무 | 11,993,994,154 | 11,993,994,154 | - | - | - | 11,993,994,154 |
| 단기차입금 | 3,001,731,232 | 3,034,042,465 | - | - | - | 3,034,042,465 |
| 전환사채 | 106,419,187 | 106,419,187 | - | - | - | 106,419,187 |
| 파생상품부채 | 2,943,222 | 2,943,222 | - | - | - | 2,943,222 |
| 기타금융부채 | 6,329,347,923 | 2,403,091,993 | 3,189,170,401 | 1,888,470,734 | 1,200,000 | 7,481,933,128 |
| 합계 | 21,434,435,718 | 17,540,491,021 | 3,189,170,401 | 1,888,470,734 | 1,200,000 | 22,619,332,156 |
<전기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 장부금액 | 1년이내 | 1년초과~2년이내 | 2년초과~5년이내 | 5년초과 | 합계 |
| 매입채무및기타채무 | 7,528,579,884 | 7,528,579,884 | - | - | - | 7,528,579,884 |
| 단기차입금 | 701,146,398 | 701,146,398 | - | - | - | 701,146,398 |
| 전환사채 | 11,544,744,489 | 11,544,744,489 | - | - | - | 11,544,744,489 |
| 파생상품부채 | 2,732,912,980 | 2,732,912,980 | - | - | - | 2,732,912,980 |
| 기타금융부채 | 9,748,130,802 | 4,238,409,193 | 3,626,808,659 | 1,881,712,950 | 1,200,000 | 9,748,130,802 |
| 합계 | 32,255,514,553 | 26,745,792,944 | 3,626,808,659 | 1,881,712,950 | 1,200,000 | 32,255,514,553 |
3) 시장위험
연결실체는 환율과 이자율의 변동으로 인한 시장위험에 노출되어 있습니다.
(가) 외환위험관리
연결실체는 외화거래 수행에 따라 다양한 환율변동위험에 노출되어 있습니다. 주요 통화별 환율변동시 민감도 분석내용은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 당3분기 | 전기 | |||
| 10% 상승 | 10% 하락 | 10% 상승 | 10% 하락 | ||
| 본점 | USD | 14,942,620,619 | (14,942,620,619) | 13,140,435,561 | (13,140,435,561) |
| EUR | 1,906,384 | (1,906,384) | 1,811,824 | (1,811,824) | |
| 해외지점 | USD | 520,804,515 | (520,804,515) | 673,162,253 | (673,162,253) |
| 합계 | USD | 15,463,425,134 | (15,463,425,134) | 13,813,597,814 | (13,813,597,814) |
| EUR | 1,906,384 | (1,906,384) | 1,811,824 | (1,811,824) | |
(나) 이자율위험관리
연결실체는 고정이자율과 변동이자율로 자금을 차입하고 있으며, 이로 인하여 이자율위험에 노출되어 있습니다. 연결실체는 고정금리차입금과 변동금리차입금의 적절한 균형유지 정책을 수행하는 등 이자율위험을 관리하고 있으며, 이자율위험에 노출된 차입금 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기 |
| 단기차입금 | 3,001,731,232 | 701,146,398 |
이자율 1% 변동시 민감도 분석내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전기 | ||
| 1% 상승 | 1% 하락 | 1% 상승 | 1% 하락 | |
| 이자비용 | 40,023,083 | (40,023,083) | 7,011,464 | (7,011,464) |
(다) 기타가격위험요소
연결실체는 지분상품에서 발생하는 가격변동위험에 노출되어 있습니다. 지분상품은 매매목적이 아닌 전략적 목적으로 보유하고 있습니다. 보고기간말 현재 공정가치로 평가하는 기타포괄손익-공정가치측정금융자산은 다른변수가 일정하고 지분상품의 가격이 10% 변동할 경우 가격변동이 자본에 미치는 영향은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전기 | ||
| 10% 상승 | 10% 하락 | 10% 상승 | 10% 하락 | |
| 기타포괄손익-공정가치측정금융자산 | 3,849,692 | (3,849,692) | 14,548,655 | (14,548,655) |
5-2. 자본위험관리
연결실체의 자본관리 목적은 계속기업으로 영업활동을 유지하고 주주 및 이해관계자의 이익을 극대화하하고 자본비용의 절감을 위하여 최적의 자본구조를 유지하는데 있습니다. 연결실체는 배당조정, 신주발행 등의 정책을 통하여 자본구조를 경제환경의 변화에 따라 적절히 수정변경하고 있습니다. 연결실체의 자본위험관리정책은 전기와 중요한 변동이 없습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기 |
| 부채총계 | 33,052,232,201 | 41,395,394,097 |
| 차감: 현금및현금성자산과 단기금융상품 | (11,650,430,052) | (45,260,897,357) |
| 순부채 (*) | 21,401,802,149 | - |
| 자본총계 | 158,346,611,660 | 181,471,292,500 |
| 부채비율 | 20.87% | 22.8% |
| 순부채비율 | 13.52% | 0% |
(*) 부채총계가 현금 및 현금성자산과 단기금융상품보다 적을 경우에는 순부채의 금액을 "-"으로 기재하였습니다.
5-3. 파생상품
파생상품은 최초 인식시 계약일의 공정가치로 측정하고 이후 공정가치로 재측정하고있습니다.
(가) 내재파생상품
① 금융자산이 주계약인 복합계약
내재파생상품을 포함하는 금융자산은 복합계약 전체를 고려하여 분류를 결정하고 내재파생상품을 분리하여 인식하지 않습니다. 계약상 현금흐름이 원금과 이자로만 구성되어 있는지를 판단할 때에도 해당 복합계약 전체를 고려합니다.
② 그 밖의 복합계약(복합계약이 금융자산이 아닌 주계약을 포함하는 경우)
내재파생상품의 경제적 특성 및 위험이 주계약의 경제적 특성 및 위험과 밀접하게 관련되어 있지 않고, 내재파생상품과 동일한 조건을 가진 별도의 금융상품 등이 파생상품의 정의를 충족하며 복합계약의 공정가치 변동이 당기손익으로 인식되지 아니하는경우 주계약과 분리하여 별도의 파생상품으로 회계처리하고 있습니다.
(나) 위험회피회계
연결실체는 특정위험으로 인해 인식된 자산이나 부채 또는 미인식된 확정계약의 전체 또는 일부의 공정가치 변동에 대한 위험회피의 경우 공정가치위험회피회계를 적용하며특정위험으로 인해 인식된 자산이나 부채 또는 발생가능성이 매우 높은 예상거래의 현금흐름 변동에 대한 위험회피의 경우 현금흐름위험회피회계를 적용하고 있습니다.
위험회피회계를 적용하기 위하여 연결실체는 위험회피관계, 위험관리목적, 위험회피전략,회피대상위험 및 위험회피효과 평가방법 등을 문서화하고 있습니다. 위험회피효과는 회피대상위험으로 인한 파생상품의 공정가치나 현금흐름의 변동이 위험회피대상항목의 공정가치나 현금흐름의 변동위험을 상쇄하는 효과를 의미합니다.
(다) 공정가치위험회피
위험회피수단으로 지정되고, 공정가치위험회피회계의 적용요건을 충족한 파생금융상품의 공정가치 변동은 당기손익으로 인식하고 있으며, 회피대상위험으로 인한 위험회피대상항목의 공정가치 변동도 당기손익으로 인식하고 있습니다. 단, 위험회피대상항목이 지분상품이며, 공정가치의 변동을 기타포괄손익으로 표시하기로 선택한 경우에는 위험회피수단의 손익 및 회피대상위험으로 인한 위험회피대상항목의 손익을 기타포괄손익으로 인식하고 있습니다. 공정가치위험회피회계는 위험회피수단이 소멸, 매각, 행사 또는 종료되거나 공정가치위험회피회계의 적용조건을 더 이상 충족하지 않을 경우 중단됩니다. 회피대상위험으로 인한 위험회피대상항목의 장부금액 조정액은 위험회피회계가 중단된 날부터 상각하여 당기손익으로 인식하고 있습니다.
(라) 현금흐름위험회피
위험회피수단으로 지정되고 현금흐름위험회피회계의 적용요건을 충족한 파생상품의 공정가치 변동분 중 위험회피에 효과적인 부분은 기타포괄손익으로 처리하며, 위험회피에 비효과적인 부분은 당기손익으로 인식하고 있습니다. 현금흐름위험회피회계는 위험회피수단이 소멸, 매각, 행사 또는 종료되거나, 현금흐름위험회피회계의 적용요건을 더 이상 충족하지 않을 경우 중단됩니다. 현금흐름위험회피회계를 중단하는 경우에 위험회피대상의 미래 현금흐름이 여전히 발생할 것으로 예상되는 경우에 현금흐름위험회피적립금 누계액은 미래 현금흐름이 생길 때까지 또는 현금흐름위험회피적립금이 차손이며 그 차손의 전부나 일부가 미래기간에 회복되지 않을 것으로 예상될 때까지 현금흐름위험회피적립금에 남겨두고 있습니다. 다만, 위험회피대상의 미래현금흐름이 더 이상 발생할 것으로 예상되지 않는 경우에는 현금흐름위험회피적립금 누계액은 즉시 당기손익으로 인식합니다.
(마) 해외사업장순투자의 위험회피
해외사업장에 대한 순투자 위험회피의 경우, 위험회피에 효과적인 부분은 기타포괄손익으로 인식하며, 위험회피에 비효과적인 부분은 당기손익으로 인식하고 있습니다. 위험회피에 효과적이어서 기타포괄손익으로 인식한 부분은 향후 그 해외사업장을 처분하거나 그 해외사업장의 일부를 처분하는 시점에 기업회계기준서 제1021호 '환율변동효과'에 따라 재분류조정으로 기타포괄손익에서 당기손익으로 재분류합니다.
6. 주요계약 및 연구개발활동
6-1. 경영상의 주요계약등
(가) 라이선스 아웃 계약
해당사항 없음
(나) 라이선스 인 계약
공시서류 작성기준일 현재 당사가 체결 중인 라이선스 인 계약의 현황은 다음과 같습니다.
<라이선스인 계약 총괄표>
|
품목 |
계약상대방 |
대상지역 |
계약체결일 |
계약종료일 |
총 계약금액 |
수취금액 |
진행단계 |
|---|---|---|---|---|---|---|---|
|
쓴맛 수용체 신호전달 |
The Trustees of the University |
전세계 |
2018년 6월 20일 |
1) 마지막 특허의 만료 또는 포기일 2) 첫 번째 상업적 판매 후 10년중 늦은 날 |
라이선스 발행 수수료 1만불 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
- |
임상2상 |
|
약물 전달법 |
RUTGERS, THE STATE UNIVERSITY OF NEW JERSEY |
전세계 |
2018년 10월 22일 |
1) 마지막 특허의 만료 또는 포기일 2) 첫 번째 상업적 판매 후 10년 중 늦은 날 |
라이선스 발행 수수료 5천불 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
- |
비임상 |
|
니파(Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 핵산 기반 백신 후보물질의 기술 |
THE WISTAR INSTITUTE OF ANATOMY AND BIOLOGY |
전세계 |
2021년 12월 7일 |
1) 마지막 특허의 만료 또는 포기일 2) 첫 번째 상업적 판매 후 12년 후 |
첫번째 라이선스 발행 수수료 2만5천불과 두 번째 라이선스 발행 수수료 5만불 외 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
- |
비임상 |
출처) 당사 제시
① 품 목 : 쓴맛 수용체 신호전달 물질 및 기술
|
1. 계약 상대방 |
미국, The Trustees of the University of Pennsylvania |
|||
|
2. 계약 내용 |
계약상대방이 보유한 호흡기 감염의 치료제 개발을 위한 쓴맛 수용체 신호전달 물질 및 쓴맛 수용체 진단법 개발 기술에 대해 당사가 독점적인 라이선스를 갖게 됨 | |||
|
3. 대상 지역 |
전세계 |
|||
|
4. 계약 기간 |
계약 체결일 : 2018년 6월 20일 |
|||
|
5. 총 계약금액 |
라이선스 발행수수료 약 12백만원(US$10,000) 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
|||
|
6. 계약 조건 |
계약금 : 약 12백만원(US$10,000), 지급 조건: 계약 체결시 매년 라이선스 유지수수료 약 12백만원(US$10,000) 지급 마일스톤 :
로열티 : 순매출액의 2%, 지급 조건 : 매출 발생 시 분기별 지급, 최소 연례로열티 50만불 서브-라이선스 수입에 대해서는 25% 지급, 임상3상 첫 번째 피험자 투여 후에는 15% 지급하기로 함 기존 특허비용 $39,691.15를 지급하고, $25,000 한도 내에서 특허 관련 비용을 보전해 주기로 함 |
|||
|
7. 회계처리방법 |
계약금, 라이선스 유지수수료 - 일시에 비용 인식 마일스톤: 임상2상까지 전액 비용 처리, 임상3상 승인 이후의 마일스톤은 무형자산으로 계상 |
|||
|
8. 대상 기술 |
호흡기 감염의 치료제 개발을 위한 쓴맛 수용체 신호전달 물질 및 쓴맛 수용체 진단법 | |||
|
9. 개발 진행경과 |
<거래 상대방> 코분무기(Nasal spray)를 이용한 비염, 축농증 치료제의 안전성과 유효성 확인을 위한 1/2상 임상연구 종료 (지역 : 미국, 임상단계 : 1/2상, 임상시작일 : 2015년 10월, 임상 완료일 : 2017년 5월) 코로나19 감염방지를 위한 코 스프레이 치료제의 미국 FDA 2상임상 승인 (2020년 4월29일) 미국 특허청으로부터 코 스프레이 치료제 및 축농증 치료제의 원천 기술에 대한 특허 등록 (2021년 1월) 미국 내 2차 임상시험 실시기관 추가 및 임상시험대상자를 일반인으로 확대 진행하고자 미국 IRB 승인 득함 (2021년 4월) 임상시험대상자 225명 등록 계획 중184명 등록 완료(2022년 12월) 코로나19에 감염된 대상자 모집의 고충으로 대상자 모집 조기 종료(2022년12월) |
|||
|
10. 기타 사항 |
없음 |
② 품 목 : 약물 전달법
|
1. 계약 상대방 |
미국, RUTGERS, THE STATE UNIVERSITY OF NEW JERSEY |
|||||||
|
2. 계약 내용 |
계약상대방의 약물 전달법에 대해 당사가 독점적인 라이선스를 갖게 됨 |
|||||||
|
3. 대상 지역 |
전세계 |
|||||||
|
4. 계약 기간 |
계약 체결일 : 2018년 10월 22일 |
|||||||
|
5. 총 계약금액 |
라이선스 발행수수료 약 6백만원(US$5,000) 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
|||||||
|
6. 계약 조건 |
계약금 : 약 6백만원(US$5,000), 지급 조건: 계약 체결 후 30일 이내 라이선스 유지수수료: 1-2년차 매년 2천불, 3년차 4천불, 4년차 이후 매년 5천불->상업적 판매 개시 후 지급하지 않음 마일스톤 :
로열티 : 순매출액의 2.5%, 지급 조건 : 매출 발생 시 분기별 지급, 단, 아래 표와 같이 최소 연례로열티를 지급하기로함
|
|||||||
|
7. 회계처리방법 |
계약금, 라이선스 유지수수료 - 일시에 비용 인식 마일스톤: 임상2상까지 전액 비용 처리, 임상3상 승인 이후의 마일스톤은 무형자산으로 계상 |
|||||||
|
8. 대상 기술 |
약물 전달법 |
|||||||
|
9. 개발 진행경과 |
<거래 상대방> 해당 약물 전달법 이용 기능적인 견본품 제작 및 실험실내 효능평가를 동물에서 수행완료 <회사> |
|||||||
|
10. 기타 사항 |
없음 |
③ 품 목 : 니파(Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 핵산 기반
백신 후보물질의 기술
|
1. 계약 상대방 |
미국, THE WISTAR INSTITUTE OF ANATOMY AND BIOLOGY |
||||||
|
2. 계약 내용 |
계약상대방이 보유한 니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기술에 대해 당사가 독점적인 라이선스를 갖게 됨 |
||||||
|
3. 대상 지역 |
전세계 |
||||||
|
4. 계약 기간 |
계약 체결일 : 2021년 12월 7일 |
||||||
|
5. 총 계약금액 |
총 라이선스 발행수수료 약 93백만원(US$75,000) 외 년간 라이선스 유지수수료, 마일스톤, 로열티 등 별도 |
||||||
|
6. 계약 조건 |
계약금 : 약93백만원(US$75,000), 지급 조건: 계약 체결시와 1년뒤 또는 제품 개발 자금 조달시 라이선스 유지수수료 : 2023년 1월 1일까지 약12백만원(US$10,000) 지급, 2024~2028 년간 약18백만원 (US$15,000) 지급, 2029~계약종료일 년간 약31백만원(US$25,000) 지급 마일스톤 :
로열티 : 총 순매출액 약1,200억원(US$100,000,000) 미만 시 4%, 지급 조건 : 매출 발생 시 분기별 마지막날로부터 30일 이내 지급
서브-라이선스 수입에 대해서는 첫 IND 제출일까지 20% 지급, 첫 IND 제출일 이후 임상 2상 첫 번째 피험자 투여일까지는 15% 지급, 임상 2상 첫 번째 피험자 투약일 이후 본 계약서 종료일까지는 10% 지급하기로 함. |
||||||
|
7. 회계처리방법 |
계약금, 라이선스 유지수수료 - 일시에 비용 인식 마일스톤: 임상2상까지 전액 비용 처리, 임상3상 승인 이후의 마일스톤은 무형자산으로 계상 |
||||||
|
8. 대상 기술 |
니파 (Nipah) 및 포와산 (Powassan) 바이러스를 예방하는 DNA 백신 후보물질의 기술 |
||||||
|
9. 개발 진행경과 |
<거래 상대방> 포와산 (Powassan) 바이러스를 예방하는 DNA 백신의 효능평가를 동물에서 수행 완료 및 해당 연구결과를 퍼블릭 라이브러리 오브 사이언스 (PLOS Neglected Infectious Diseases)에 게재함 (2020년 10월 29일) 니파 (Nipah) 바이러스를 예방하는 DNA 백신이 쥐 동물실험에서 바이러스 항체생성을 확인함 (2019년 7월 16일 The Wistar Institute blog) <회사> |
||||||
|
10. 기타 사항 |
없음 |
6-2. 연구개발 활동
(1) 연구개발활동의 개요
당사는 핵산기반 바이오 신약과 항염증 치료 신약을 연구개발하고 있습니다. 핵산 기반 바이오 신약은 DNA 기반 의약품과 mRNA 기반 의약품으로 나눌 수 있으며, 치료목적에 따라 핵산 기반 백신, 핵산기반 유전자 의약품으로 구성되어 있습니다. 항염증 치료 신약은 천연물유래 성분 의약품과 화학합성의약품으로 나룰 수 있습니다.
DNA 기반 의약품 중 DNA백신은 다수의 제품이 국내외 임상연구을 수행중에 있으며, DNA기반 단백질의약품 및 단클론항체 의약품은 타당성 검증연구를 통해 전임상개발 후보물질을 도출하고 있으며, mRNA기반 의약품은 연구개발 기반 구축 및 전임상 개발 후보물질의 도출을 준비하고 있습니다.
항염증 치료신약인 천연물 유래 성분 의약품과 저분자량 화학합성 의약품은 글로벌 2상임상시험 단계에 있습니다.
(2) 연구개발 담당조직
① 연구개발 조직 개요
당사의 연구개발 조직은 기업부설 R&D 연구소와 신약개발본부(서울시 영등포구 소재), 글로벌임상개발본부(미국 소재)로 구성되었으며, 기업부설 R&D 연구소는 산하 연구개발팀과 전략기획팀을 두고 있습니다. 당사 연구개발조직 현황은 다음과 같습니다.
<연구개발 조직 구성>
|
구 분 |
팀 |
주요업무 |
|---|---|---|
|
기업부설 R&D 연구소 |
핵산기반 백신 및 |
- 핵산 기반 바이오 의약품의 타겟 발굴 및 전임상 연구 - 오픈 이노베이션을 통한 바이오 의약품 혁신 기술 개발 - 신약개발 파이프라인 개발 및 국내외 현황과 특허 조사 |
|
신약개발본부 |
임상개발팀, 임상면역반응 분석팀 |
- 핵산 기반 백신 및 항염증 치료 의약품의 국내 IND승인 및 임상시험 일정 및 진도 관리 - 임상 효능 평가를 위한 임상검체 면역반응 분석 - IND package의 Non-GLP 비임상시험 수행 및 분석 |
|
글로벌임상개발 본부 |
임상면역학 실험실 |
- 핵산 기반 바이오 신약과 항염증 치료 신약의 국내외 임상면역원성 평가시험 개발, 수행 및 관리 |
|
Clinical Project Management 팀 |
- 핵산 기반 바이오신약과 항염증 치료신약의 글로벌 임상시험 관리 |
<조직도>
 |
|
연구소 조직도 |
② 연구개발 인력 현황
공시서류 작성기준일 현재 당사는 박사급 14명, 석사급 20명 등, 총 43명의 연구인력을 보유하고 있으며, 그 현황은 다음과 같습니다.
<연구개발 인력 현황>
| 기준 : 2023년 09월 30일 |
(단위 : 명) |
|
구분 |
인원 |
||||
|---|---|---|---|---|---|
|
박사 |
석사 |
기타 |
합계 |
||
|
기업부설 |
신약연구개발팀 전략기획팀 |
7 |
12 | 2 | 21 |
|
신약개발본부 |
임상면역반응 분석팀 임상개발팀 |
3 |
4 |
1 |
8 |
|
글로벌임상 개발본부 |
임상면역학 실험실 |
5 | 5 |
1 | 11 |
|
Clinical Project Management팀 |
2 | 0 | 2 | 4 | |
|
계 |
17 | 21 | 6 | 44 | |
③ 핵심 연구인력
당사의 핵심 연구인력은 최고의학책임자인 죠엘 메슬로(Joel N. Maslow), 최고과학개발책임자인 카 무투마니(Kar Muthumani), 기업부설 R&D 연구소장 이사 김원일, 신약개발본부 이사 권이주, 임상 중개연구 책임자 크리스틴 로버츠(Christine C. Roberts) 이며, 그 현황은 다음과 같습니다.
<핵심 연구인력 현황>
|
직위 |
성명 |
담당업무 |
주요경력 |
주요 연구실적 |
|---|---|---|---|---|
|
최고의학책임자 |
죠엘 메슬로 (Joel N. Maslow) |
임상개발 총괄 |
* Univ. of Virginia, Ph.D. Physics (’83) * Jefferson Medical College, M.D. (’84) * Drexel University, M.B.A. (’08) * Morristown Medical Center, Chief, Division of Infectious Diseases (‘12~’16) * St. Georges School of Medicine, Professor of Medicine (‘12~’16) * Univ. of Pennsylvania School of Medicine, Associate Dean for Research (‘02~’11) * Philadelphia VA Medical Center, Associate Chief of Staff for Research (‘02~’11) * University of Pennsylvania School of Medicine, Associate Professor of Medicine in Infectious Diseases (‘02~’11) * Philadelphia VA Medical Center, Interim Chief of Medicine (‘08~’10) * Philadelphia VA Medical Center, Section Chief for Infectious Diseases(‘99~’05) * Philadelphia VA Medical Center, Director for HIV/AIDS research (‘99~’06) * Tuft's University School of Veterinary Medicine, Adjunct Associate Professor in Comparative Medicine(‘96~’99) * Boston University School of Medicine, Associate Professor of Medicine (‘90~’99) * Inovio Pharmaceuticals, Chief Medical Officer (‘06) * New Jersey AIDS Society, Board Member (‘14~’15) * Rapid Pathogen Screening, Scientific Advisory Board (‘14~) * Examworks (formerly Network Medical Review), Third party reviewer (‘99~’15) * NMR, Third party reviewer (‘11~’12) * Aries, founding member(‘11~’13) |
[논문] * Severe fever and thrombocytopenia syndrome virus infection: Considerations for vaccine evaluation of a rare disease. (’19, HUMAN VACCINES & IMMUNOTHERAPEUTICS) * Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial (’19, Lancet Infect Dis) * Zika-Induced Male Infertility in Mice Is Potentially Reversible and Preventable by Deoxyribonucleic Acid Immunization. (’18, J Infect Dis.) * Safety and Immunogenicity of an Anti-Zika Virus DNA Vaccine - Preliminary Report. (‘17 N Engl J Med) * Vaccines for emerging infectious diseases: Lessons from MERS coronavirus and Zika virus. (‘17 Hum Vaccin Immulother.) * Preclinical evaluation of multi antigenic HCV DNA vaccine for the prevention of Hepatitis C virus infection. (’17, Sci Rep.) * Vaccine development for emerging virulent infectious diseases. (’17, Vaccine) * Persistent colonization of potable water as a source of Mycobacterium avium infection in AIDS. (’94, Lancet) * Adult pneumococcal cellulitis: case report and review of the literature. (99’, Clin Inf Dis) *Latent infection with Mycobacterium avium as a source for disseminated disease in rhesus macaques. (03’, J Infect Dis) 외 다수의 국제 학술지 논문 발표 [학회발표] * DNA vaccine (GLS-5300) against the MERS-CoV: Results of a Phase I study (’18, WHO-IVI Joint Symposium for MERS-CoV Vaccine Development) * Developments in Emerging Infectious Diseases. (’16, International Society for Vaccines) 외 다수의 학회 및 초청강연 발표 [저서] * Epidemiologic Typing Systems. Society for Healthcare Epidemiology of America (SHEA): A Practical Handbook for Hospital Epidemiologists. (’10) 외 다수의 저서 |
|
최고과학개발책임자 |
카 무투마니 (Kar Muthumani) |
전임상시험 지원 |
*Madurai Kamaraj University, India. 학사,석사,박사(’96) *Dept. of Life Sciences, Ben-Gurion University of the Negev, Israel.방문연구원 (’97) *Dept. of Biology, Texas A&M University, Texas, USA, Postdoctoral Research Fellow(’97-98) *Dept. of Pathology and Lab. Medicine University of Pennsylvania School of Medicine PA-USA, Postdoctoral Research Fellow(’98-’00) *Dept. of Pathology and Lab. Medicine, Perelman School of Medicine at the University of Pennsylvania, PA-USA, Research Associate(’00-’04) *Pathology and Lab. Medicine, Perelman School of Medicine at the University of Pennsylvania, PA-USA, Senior Research Investigator (’04-’07) *Perelman School of Medicine at the University of Pennsylvania, PA, USA. Research Assistant Professor (’08-’15) *The Wistar Institute, Philadelphia, PA, USA, Assistant Professor (’16-’19) *Director for the laboratory of Emerging Infectious Diseases, The Wistar Institute (’16-’20) *Associate Professor, The Wistar Institute, Philadelphia, PA, USA.(’20) |
[논문] *Somasundaram R, Connelly T, Choi R, Choi H, Samarkina A, Li L, Gregorio E, Chen Y,Thakur R, Abdel-Mohsen M, Beqiri M, Kiernan M, Perego M, Wang F, Xiao M, Brafford P, Yang X, Xu X, Secreto A, Danet-Desnoyers G, Traum D, Kaestner KH, Huang AC,Hristova D, Wang J, Fukunaga-Kalabis M, Krepler C, Ping-Chen F, Zhou X, Gutierrez A, Rebecca VW, Vonteddu P, Dotiwala F, Bala S, Majumdar S, Dweep H,Wickramasinghe J, Kossenkov AV, Reyes-Arbujas J, Santiago K, Nguyen T, Griss J,Keeney F, Hayden J, Gavin BJ, Weiner D, Montaner LJ, Liu Q, Peiffer L, Becker J, Burton EM, Davies MA, Tetzlaff MT, Muthumani K, Wargo JA, Gabrilovich D, Herlyn M. Tumor-infiltrating mast cells are associated with resistance to anti-PD-1 therapy. Nat Commun. 2021 Jan 12;12(1):346. PMID: 33436641 *Singh KS, Sharma R, Reddy PAN, Vonteddu P, Good M, Sundarrajan A, Choi H, Muthumani K, Kossenkov A, Goldman AR, Tang HY, Totrov M, Cassel J, Murphy ME, Somasundaram R, Herlyn M, Salvino JM, Dotiwala F. IspH inhibitors kill Gram-negative bacteria and mobilize immune clearance. Nature. 2021 Jan;589(7843):597-602. PMID: 33361818. *Choi H, Kudchodkar SB, Ho M, Reuschel EL, Reynolds E, Xu Z, Bordoloi D, Ugen KE, Tebas P, Kim J, Abdel-Mohsen M, Thangamani S, Weiner DB, Muthumani K. A novel synthetic DNA vaccine elicits protective immune responses against Powassan virus. PLoS Negl Trop Dis. 2020 Oct 29;14(10):e0008788. PMID: 33119599 *Khoshnejad M, Dia Y, Patel A, Xu Z, Zhu X, Yun K, Wojtak K, Qureshi R, Humeau L,Muthumani K, Weiner DB. DNA-Encoded Glutamine Synthetase Enzyme as Ammonia-Lowering Therapeutic for yperammonemia. Nucleic Acid Ther. 2020 Dec;30(6):379-391. PMID: 32907467. *Schultheis K, Pugh HM, Oh J, Nguyen J, Yung B, Reed C, Cooch N, Chen J, Yan J, Muthumani K, Humeau LM, Weiner DB, Broderick KE, Smith TRF. Active immunoprophylaxis with a synthetic DNA-encoded monoclonal anti-respiratory syncytial virus scFv-Fc fusion protein confers protection against infection and durable activity. Hum Vaccin Immunother. 2020 Sep 1;16(9):2165-2175. PMID: 32544376 [저서] *Chung C, Ugen KE, Sardesai NY, Weiner DB, Muthumani K: Protocols for Developing Novel Chikungunya Virus DNA Vaccines. Methods Mol. Biol. 2016; 1426:311-32: PMID: 27233283. [강연] *October 2019: “In vivo expression of plasmid encoded IgG for immune check point targets by synthetic enhanced DNA as a new tool for cancer immunotherapy”.International Society for Vaccines, October 2019, Ghent, Belgium. *September 2019: “Synthetic nucleic acid antibody prophylaxis (DMAb) + DNA vaccine confers rapid and durable protective immunity against Zika virus challenge”. Elsevier Conference: 13th Vaccine Congress 2019, Bangkok, Thailand. *Oct 2018: “Rapid response to Zika vaccine development- Lessons learned, Keystone meeting on Framing the Response to Emerging Virus Infections, Hong Kong. *June 2018: “Synthetic nucleic acid antibody prophylaxis (DMAb) + DNA vaccine confers rapid and durable protective immunity against Zika virus challenge” 2nd International Conference on Zika Virus and Aedes related Infections, Tallinn, Estonia. |
|
기업부설 R&D 연구소 연구소장 (이사) |
김원일 |
전임상 연구개발 총괄 |
* 미국 미네소타 주립대학 분자세포생물학 이학박사 (Ph.D.)(’08) * 미국 보스턴어린이병원/하버드의대 혈액종양과 박사후 연구원 * 미국 프레데릭국립암연구소 혈액줄기세포섹션 박사후 연구원 * 미국 세인트주드 어린이연구병원 종양과책임연구원(‘16~‘20) * ㈜사이러스테라퓨틱스 상무/연구위원(’20~‘21) |
[논문] * Stephanie Nance, Jennifer Kamens, Cary Koss, Beisi Xu, Sharnise Mitchell, Anitria Cotton, Michele Connelly, Jing Ma, Duane Currier, William Wright, Kanisha Kavdia, Vishwajeeth Pagala, Wonil Kim, Ji-Hoon Cho, Yiping Fan, Aman Seth, NathanielTwarog, John Choi, Monika L Metzger, Hiroto Inaba, Sima Jeha, Jeffrey Rubnitz, Junmin Peng, Taosheng Chen, Anang Shelat, R. Kiplin Guy, and Tanja Gruber (2020) Proteasome Inhibition Targets the KMT2A Transcriptional Complex. (Submitted to Cancer Discovery) * Wonil Kim, Kimberly D. Klarmann, Jonathan R. Keller (2016) Id2 is Required for Hematopoietic and Erythroid Progenitor Development to Maintain Red Blood Cell Production under Stress. (In preparation) * Matthew C. Stubbs, Wonil Kim, Megan Bariteau, Tina Davis, Sridhar Vempati, Janna Minehart, Matthew Witkin, Jun Qi, Andrei V. Krivtsov, James E. Bradner, Andrew L. Kung, and Scott A. Armstrong (2015) Selective inhibition of HDAC1 and HDAC2 as a potential therapeutic option for B-ALL. Clin Cancer Res 21(10):2348-58 * Wonil Kim, Kimberly D. Klarmann, Jonathan R. Keller (2014) Gfi-1 regulates the erythroid transcription factor network through Id2 repression in murine hematopoietic progenitor cells. Blood 124(10):1586-96 * Won-Il Kim, Ilze Matise, Miechaleen D. Diers and David A. Largaespada (2009) RAS oncogene suppression induces apoptosis followed by more differentiated and less myelosuppressive disease upon relapse of acute myeloid leukemia. Blood 113(5):1086-96 * Won-Il Kim (2008) Oncogenic Roles of RAS in Acute Myeloid Leukemia Cooperated with MLL-AF9. Dissertation for Ph.D. degree accomplished in University of Minnesota * Won-Il Kim, Stephen M. Wiesner, and David A. Largaespada (2007) Vav promoter-tTA conditional transgene expression system for hematopoietic cells drives high level expression in developing B and T cells. Experimental Hematology 35(8):1231-9 * Tae Yon Kim, Won-Il Kim, Ronald E. Smith and EunDuck P. Kay (2001) Role of p27 (Kip1) in cAMP- and TGF-beta2-mediated antiproliferation in rabbit corneal endothelial cells. Investigative Ophthalmology and Visual Science 42(13):3142-9 * Tae Yon Kim, Won-Il Kim, Ronald E. Smith, EunDuck P. Kay (2001). Differential activity of TGF-beta2 on the expression of p27Kip1 and Cdk4 in actively cycling and contact inhibited rabbit corneal endothelial cells. Molecular Vision 7:261-70 * Won-Il Kim, Woo-Bok Lee, Kiwon Song, Jinmi Kim (2000). Identification of a putative DEAD-box RNA helicase and a zinc-finger protein in Candida albicans by functional complementation of the S. cerevisiae rok1 mutation. Yeast 16(5):401-9 [학회발표] * 2019 Poster presentation and abstract published with the study title of “KMT2A-rearranged Infant Acute Lymphoblastic Leukemia Cells Undergo ER-Stress-Induced Apoptosis Fol-lowing Exposure to Proteasome Inhibitors” at 61th America Society of Hematology (ASH) Annual Meeting. * 2013 Oral presentation with the study of “Gfi-1 regulates the erythroid transcription factor net-work through Id2 repression in murine hematopoietic progenitor cells” at 55th American Society of Hematology (ASH) Annual Meeting. * 2008 Poster presentation and abstract published with the study title of “A Murine AML Model for the Development of Resistance to NRAS(G12V) Oncogene Repression and/or Ara-C Treatment in Vivo” at 50th American Society of Hematology (ASH) Annual Meeting. * 2007 Poster presentation and abstract published with the study title of “RAS oncogene sup-pression induces apoptosis followed by more differentiated and less myelosuppressive disease upon relapse of acute myeloid leukemia” at 49th America Society of Hematol-ogy (ASH) Annual Meeting. * 2006 Poster Presentation with the study title of “Vav promoter-tTA conditional transgene ex-pression system for hematopoietic cells drives high level expression in developing B and T cells” at Mouse Models of Cancer in American Association of Cancer Research (AACR). * 2003 Poster presentation with the study title of “The Effect of p27 Expression on the Growth of Rabbit Corneal Endothelial Cells” at 42nd American Society for Cell Biology Annual Meeting. [저서] * Kimberly D. Klarmann, Ming Ji, Huajie Li, Ande Satyanarayana, Wonil Kim, Emily Bowers, Bjorg Gudmundsdottir and Jonathan R. Keller (2011) Novel Targets in Myelogenous Leukemia: The Id Family of Proteins. Myeloid Leukemia - Basic Mechanisms of Leukemogenesis, ISBN: 978-953-307-789-5, InTech |
|
신약개발본부 (이사) |
권이주 |
임상개발 총괄 |
* 아주대학교 대학원 신경과학 박사(’06) * 아주대학교 의료원/아주대학교 의과대학 연구강사('06~'08) * 삼성생명과학 연구소/성균관대학교 의과대학, 박사후 연구원 * 미국 Emory University, School of Medicine, Post-doctoral Fellow * 미국 University of Rochester, Aab Cardiovascular Research * 서울아산병원/울산대학교 의과대학 연구부교수('14~'15) * ㈜안트로젠, R&D 중앙연구소 책임연구원/부장('15~'16) * ㈜지디에프아이브레인셀연구소 CRO, MW & Statistics Divisions * ㈜드림씨아이에스 CRO, Medical Affair Division 이사('19) * 올리패스㈜, 임상개발실 이사('19~'22) * 진원생명과학㈜, 신약개발본부 이사('22~ ) |
[논문] * B23/Nucleophosmin promotes reconstitution of synaptic path in hippocampus * Akt1-Inhibitor of DNA binding2 is essential for growth cone formation and axon * Leptin elongates hypothalamic neuronal cilia via transcriptional regulation and * Cleavage of tau by asparagine endopeptidase mediates the neurofibrillary * HDAC5 interacts with KLF2 and inhibits its transcription in vascular endothelial * SRPK2 phosphorylates tau and mediates the cognitive defects in Alzheimer's * p48 Ebp1 acts as a downstream mediator of Trk signaling in neurons, contributing neuronal differentiation. ('11, Neurochemistry international) * PI(3,4,5)P3 regulates the interaction between Akt and B23 in the nucleus. * Ribosomal protein S3, a new substrate of Akt, serves as a signal mediator * Inhibition of neuronal differentiation by Akt-dependent Id2 phosphorylation. * Neuronal Polarity:Fate determination of neurite into axon or dendrite. * Expression of Disabled 1 suppresses astroglial differentiation in neural stem cells. ('09, Molecular and cellular neurosciences) * Overexpression of BETA2/NeuroD induces neurite outgrowth in F11 * Differential regulation of tyrosine hydroxylase expression by sonic hedgehog. * Activation of the tyrosine hydroxylase promoter by NeuroD in neural stem cell('05, Experimental Neurobiology) * The amino acid compositions of formula for children with inherited metabolic [학술 활동] 초빙 강연 * Hwasun International Vaccine Forum 2022 (’22, Korea) * Korea Academy of Aesthetic Surgery ('16, Korea)
* Biomedical Research Center, Asan Institute for Life Sciences('15,Asan Medical 국제학회 발표 * Presentation of Annual Meeting of ATVB ('13, Orlando, USA) * Presentation in 40th Annual Meeting of SFN ('10, San Diego, USA) * Presentation in 39th Annual Meeting of SFN ('09, Chicago, USA) * Presentation in Biennial Meeting of the International SFN ('09, Korea) * Presentation in 35th, Annual Meeting of SFN ('05, Washington DC, USA) * Presentation in 34th, Annual Meeting of SFN ('04, San Diego, USA) * Presentation in 16th, International Congress of the IFAA ('04, Kyoto, Japan) 외 다수의 학회 발표 |
|
임상실험실분석팀장 |
크리스틴 로버츠 (Christine Roberts) |
임상면역평가 |
* Lehigh University, Ph.D. Molecular Biology (’94) * Lehigh University, Research Assistant (‘94~’01) * Merck & Company, Vaccines Basic Research, Merck Co-Op Program, Staff Biochemist (‘01~’03) * Merck & Company, Vaccines Basic Research, Research Biochemist (‘03~’05) * Merck & Company, Vaccines Basic Research, Senior Research Biochemist (‘05~’08) * Merck & Company, Vaccines Basic Research, Research Fellow (‘08~’10) * Merck & Company Director, Vaccine Clinical Assays (‘10~’15) |
[논문] * Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial ('19, Lancet Infect Dis) * Assay Challenges for Emerging Infectious Diseases: The Zika Experience. ('18, Vaccines) * Zika-Induced Male Infertility in Mice Is Potentially Reversible and Preventable by Deoxyribonucleic Acid Immunization. ('18, J Infect Dis.) * Safety and Immunogenicity of an Anti-Zika Virus DNA Vaccine - Preliminary Report. ('17, N Engl J Med.) 외 다수의 국제 학술지 논문발표 [학회발표] * The prevalence of HPV 16/18 among young sexually active Norwegian women. ('00, 40th ICAAC Meeting) * Detection of HPV in three different types of specimens of the female genital tract. ('05, 22nd International Papillomavirus Conference) * HPV detection using a novel real-time HPV Multiplex PCR Assay: Comparison with the Linear Array HPV Genotyping PCR Assay. ('06, 23rd International Papillomavirus Conference)외 다수의 학회 발표 |
(3) 연구개발 비용
당3분기말까지 지급된 코로나19 백신 및 만성C형 간염 치료용 DNA백신 등의 연구/개발, 자문료, 임상시료 구입비 등은 아래 표와 같습니다.
<연결 기준>
(기준일 : 2023년 9월 30일) (단위 : 백만원)
|
과 목 |
제48기 |
제47기 |
제46기 |
비고 |
|
|---|---|---|---|---|---|
|
회계처리 |
판매비와 관리비 |
5,219 |
12,147 |
11,441 |
- |
|
개발비(무형자산) |
- |
- |
- |
- |
|
|
연구개발비용 계(*1) |
5,219 |
12,147 |
11,441 |
|
|
|
(정부보조금) |
(6) |
-734 |
-4,880 |
- |
|
|
정부보조금 차감 후 연구개발비용 계 |
5,213 |
11,413 |
6,561 |
|
|
|
연구개발비 / 매출액 비율(*2) |
18.99% |
23.40% |
17.00% |
- |
|
(*1) 연구개발비용은 전액 판관비로 계상되어 있으며, 정부보조금을 차감하기 전의 연구개발비용 지출총액입니다.
(*2) 매출액 대비 정부보조금 차감 후 연구개발비용이 차지하는 비율로 산출하였습다.
<별도 기준>
(기준일 : 2023년 9월 30일) (단위 : 백만원)
|
과 목 |
제48기 |
제47기 |
제46기 |
비고 |
|
|---|---|---|---|---|---|
|
회계처리 |
판매비와 관리비 |
6,871 |
12,977 |
14,358 |
- |
|
개발비(무형자산) |
- |
- |
- |
- |
|
|
연구개발비용 계(*1) |
6,871 |
12,977 |
14,358 |
- |
|
|
(정부보조금) |
(6) |
-734 |
-4,880 |
- |
|
|
정부보조금 차감 후 연구개발비용 계 |
6,865 |
12,243 |
9,478 |
- |
|
|
연구개발비 / 매출액 비율(*2) |
26.56% |
26.80% |
27.70% |
- |
|
(*1) 연구개발비용은 전액 판관비로 계상되어 있으며, 정부보조금을 차감하기 전의 연구개발비용 지출총액입니다.
(*2) 매출액 대비 정부보조금 차감 후 연구개발비용이 차지하는 비율로 산출하였습니다.
(4) 연구개발 실적
① 연구개발 진행 현황 및 향후 계획
공시서류 작성기준일 현재 당사가 연구개발 진행 중인 신약의 현황은 다음과 같습니다.
<연구개발 진행 총괄표>
| [당사 파이프라인 적응증 및 진행단계] |
|
구분 |
품목 |
적응증 |
연구시작일 |
현재 진행단계 |
비고 |
||
|---|---|---|---|---|---|---|---|
|
단계(국가) |
승인일 |
||||||
|
핵산 기반 바이오 신약 |
DNA 백신 |
GLS-5300 |
메르스 예방 |
2015년 |
임상1/2a상 완료(한국) |
2017년 |
공동개발 |
|
GLS-5700 |
지카바이러스예방 |
2016년 |
임상1상 완료(푸에르토리코) |
2016년 |
공동개발 |
||
|
GLS-5310 |
코로나19 예방 |
2020년 |
임상1/2a상(한국) |
2020년 |
정부보조금 |
||
|
GLS-6150/GLS-6100 |
C형 간염예방 |
2017년 |
임상1상 완료(한국) 후 중단 |
2018년/2021년 |
정부보조금 |
||
|
VGX-6150 |
만성C형 간염치료 |
2011년 |
임상1상 완료(한국) 후 중단 |
2013년 |
공동개발 |
||
| GLS-5140 |
중등열성혈소판감소 증후군예방 |
2015년 |
전임상 |
- |
정부보조금 |
||
|
핵산기반 단백질 및 단클론항체의약품 |
GLS-7100, 혈액응고 8인자 dRP |
A형 혈우병 치료 |
2014년 |
신약후보물질 |
- |
- |
|
|
GLS-8000, B형간염면역글로블린 Plas-mAb |
HBV 감염예방 |
2017년 |
신약후보물질 |
- |
특허양수 |
||
|
항염증 치료 신약 |
천연물 유래성분 |
GLS-1200, |
항염증제(만성 축농증치료) |
2018년 |
임상2상(미국) |
2020년 |
라이선스인 |
|
코로나19 감염 예방약물 |
2020년 |
임상 2상 (미국) |
2020년 |
라이선스인 | |||
|
저분자량 화학합성 성분 |
GLS-1027 |
당뇨병성 신장질환치료 |
2019년 |
임상2상 준비(미국) |
- |
- |
|
|
코로나19 중증방지 약물 |
2020년 |
임상2상(미국), 임상2상(북마케도니아, 불가리아, 한국) |
2020년, 2021년 |
- | |||
(가) 품목 : GLS-5300
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
메르스(중동호흡기증후군) 예방 |
|
3. 작용기전 |
GLS-5300 접종으로 체내 메르스 바이러스 특이적 T세포 면역반응 및 항체 면역반응이 유도되어, 메르스 바이러스의 감염을 억제하여 예방에 성공할 수 있음 |
|
4. 제품의 특성 |
기존백신대비 백신에 의한 메르스 감염우려 전무하고, 대장균 발효 및 정제에 의한 백신의 생산으로 생산기간이 단축되고 가격 경쟁력이 우수하며, 주성분인 플라스미드 DNA특성한 장기보관이 가능하여 응급백신으로 개발 용이 |
|
5. 진행경과 |
[임상 1상]-글로벌 임상 임상시험승인일 : 미국 FDA(2015.11.19), 임상시작일 : 2016.1.28, 진행국가 : 미국, 1상임상 예비결과 발표 (2018.06.27), 1상임상결과 논문게재 (Lancet Infectious Disease, 2019.7.25) [임상 1/2a상]-국내 임상 임상시험승인일: 국내 식품의약품안전처(2017.09.17), 임상시작일: 2018.9.5, 1/2a상 임상중간결과 발표(2020.5), 1/2a상 임상시험 종료(2020.4.24) |
|
6. 향후 계획 |
당사와의 계약에 따라 당사에서는 국내 1/2a상 임상시험을, 이노비오사는 임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사가 수행하기로 함. 당사의 1/2a 임상시험은 완료됨(2020.04.24). 이후, 이노비오사에서는 CEPI의 연구비를 지원받아 수행한 임상2상의 초기 데이터 분석 결과에 의하여 중단함(2022.11.17). |
|
7. 경쟁제품 |
개발에 성공한 제품은 없으며 전임상과 임상단계에서 개발 중 |
|
8. 관련논문등 |
A synthetic consensus anti-spike protein DNA vaccine induces protective immunity against Middle East respiratory syndrome coronavirus in nonhuman primates (Sci Transl Med. 2015) Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1,open-label, single-arm, dose-escalation trial (Lancet Infect Dis. 2019) |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
미국 이노비오사와 메르스백신의 공동연구계약을 체결하고 공동개발 (2015.05.27) |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
- 전염병대비혁신연합(CEPI)은 이노비오사와 계약을 체결하여 전세계 응급 비축용 백신개발 지원 (2018.04.12) : 당사는 자회사인 VGXI를 통해 전세계 메르스 응급백신의 생산과 공급을 담당 - 국내에서 메르스 DNA백신의 개발 및 국가기관에 응급백신을 공급하기 위해, 2016년 12월7일 |
(나) 품목 : GLS-5700
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
지카(Zika) 바이러스 감염 예방 |
|
3. 작용기전 |
GLS-5700 접종으로 체내 지카 바이러스 특이적 T세포 면역반응 및 항체 면역반응이 유도되어, |
|
4. 제품의 특성 |
기존백신대비 백신에 의한 지카 바이러스 감염우려 전무하고, 대장균 발효 및 정제에 의한 백신의생산으로 생산기간이 단축되고 가격 경쟁력이 우수하며, 주성분인 플라스미드 DNA 특성한 장기 |
|
5. 진행경과 |
[임상 1상]-미국,캐나다 임상시험승인일 : 미국 FDA(2016.6.20), 임상시작일 : 2016.7.27, 진행국가 : 미국, 캐나다, 1상 [임상 1b상]-푸에르토리코(미국령) 임상시험승인일 : 미국 FDA(2016.8.30), 임상시험대상자 모집등록 완료: 2017.6.16, 임상시험 종료: 2018.6 |
|
6. 향후 계획 |
임상 2상부터 시판허가까지는 공동개발사인 미국 이노비오사가 수행하기로 계약하였으므로 당사는 임상 1상과 1b상 완료 후 추가 임상은 중단함. |
|
7. 경쟁제품 |
NIH/VRC 705 임상 2상 완료됨. NIAID(미국국립알레르기·감염병연구소)/ZPIV, NIAID(미국국립알레르기·감염병연구소)/rZIKV, Moderna TX/mRNA-1893 등 임상 1상 대상자 모집중이거나 완료됨. |
|
8. 관련논문등 |
Safety and Immunogenicity of an Anti-Zika Virus DNA Vaccine -- Preliminary Report (2017, The |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
미국 이노비오사와 지카 DNA백신의 공동연구계약을 체결하고 공동개발 (2016.1.22) |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
해당사항 없음 |
(다) 품목 : GLS-5310
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
코로나19 감염증 예방 |
|
3. 작용기전 |
정상인에게 GLS-5310 접종으로 체내 SARS-CoV-2 바이러스 특이적 T세포 면역반응과 항체면역반응이 유도되어, SARS-CoV-2 바이러스의 감염을 억제함으로서 코로나19 감염증을 예방 |
|
4. 제품의 특성 |
약독화 생백신 대비 DNA백신은 감염의 우려가 없음, 바이러스에 대한 항체 면역반응과 더불어 강력한 세포성 면역반응 유도할 수 있음 |
|
5. 진행경과 |
[신약후보물질 연구] 2021년1월21일 고용량군의 등록을 시작하여, 2021년3월4일 임상1상 연구 대상자45명의 등록을 완료하고, 2021년5월 모든 대상자의 접종이 완료되었고 2021년7월8일, 임상1상 중간분석1차결과를 확인하고 자료모니터링위원회 심의를 통과하여 임상2a상에 진입, 피내접종과 비강내접종을 병용하는 임상시험을 미국에서 수행하기위해, 2020년 1월 19일 미국 FDA에 임상시험계획 승인 신청을 하여 2021년 7월27일 임상 승인을 받음. 2021년9월6일, 국가임상시험지원재단과 코로나19백신 임상2a상 대상자 모집지원 협약을 체결. 2023년 3월 자체 개발 흡인작용 피내 접종기 진덤(GeneDerm)을 이용한 코로나19 DNA 백신(GLS-5310)의 안전성 및 면역원성에 대한 임상 1상 결과를 국제감염병학회 (International Society for Infectious Diseases, ISID) 학술지인 국제감염질환저널(International Journal of Infectious Diseases)에 게재. 2023년 5월 SARS-CoV-2를 포함한 전염병 대비를 위한 DNA 백신 관련 내용의 리뷰논문을 Vaccines 학술지에 게재. 2023년 6월 임상 1상 분석결과 중에서 GLS-5310 DNA 기초접종 후 mRNA 백신을 추가접종한 대상자들에 대한 면역원성 결과를 Vaccine (Elsevier) 학술지에 게재. [1상] 임상시험 기간 동안 중대한 이상반응이나 중대한 약물이상반응 또는 시험약 투약 중단을 유도한 TEAE는 단 한 건도 발생하지 않음. [2a상] 임상시험 기간 동안 Grade 4에 해당하는 TEAE 발현은 없었고, 중대한 이상반응 또는 특별 관심 이상반응은 단 한 건도 발생하지 않음. |
|
6. 향후 계획 |
기초백신 접종을 위한 대상자 모집이 현 상황에서는 불가함. 추가접종(부스터 샷)의 1상 임상시험을 미국에서 진행 중이며, 부스터 접종 여부에 대한 임상결과를 분석, 평가하고자 함. |
|
7. 경쟁제품 |
DNA 백신(없음), mRNA 백신(큐라티스/QTP104, 아이진/EG-COVID, 에스티팜/STP2104), 합성항원 백신(SK바이오사이언스/GBP510, 유바이오로직스/EuCorVac-19) 등 (국내 2023년 5월 기준) |
|
8. 관련논문등 |
- Immune response enhancement with GLS-5310 DNA primary vaccine against SARS-C oV-2 followed by administration of an mRNA vaccine heterologous boost. (Vaccine-Elsevier, 2023, 06) - DNA Vaccines for Epidemic Preparedness: SARS-CoV-2 and Beyond. Vaccines. (Vaccines, 2023, 05) - Safety and immunogenicity of the bi-cistronic GLS-5310 COVID-19 DNA vaccine delivered with the GeneDerm suction device. (Int J Infect Dis., 2023, 03) - Molecular distribution in intradermal injection for transfer and delivery of therapeutics. (Front. Drug Deliv., 2023, 01) |
|
9. 시장 규모 |
비록 긴급사용허가를 받아 시판중인 제품이 존재하지만, 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
질병관리본부 국립보건연구원 용역연구개발 (2020.4) |
|
11. 정부보조금 |
- 2020년 3월27일 ‘2020년도 질병 관리본부 긴급 현안 지정 학술연구개발 용역과제’인 ‘핵산백신 플랫폼을 활용한 코로나19 백신후보물질 개발 사업’에 우선 순위 협상대상자로 선정 (2020년 4월부터 2020년 12월까지 145백만원을 지원 받음) - 2021년2월4일, 코로나19백신인 GLS-5310의1/2a상 임상개발비용인98억원중73억원의 연구비를 정부로부터 지원을 받는 협약을‘코로나19 치료제 백신 신약개발사업단”과 체결 |
|
12. 기타 사항 |
해당사항없음 |
(라) 품목 : GLS-6150/GLS-6100
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
C형간염 예방 |
|
3. 작용기전 |
정상인(또는 만성 C형간염 완치자)에게 GLS-6150/GLS-6100 접종으로 체내 HCV 바이러스 특이적 T세포 면역반응 이 유도되어, HCV바이러스의 감염 및 재감염을 억제하여 예방에 성공할 수 있음 |
|
4. 제품의 특성 |
기존치료제로 완치된 만성C형간염 환자나 고위험 정상인을 대상으로 HCV 감염 및 재감염을 예방 |
|
5. 진행경과 |
[임상 1상]- GLS-6150 (C형 간염 완치자 대상) 임상시험승인일 : 국내 식품의약품안전처(2018.2.5), 임상시작일 : 2018.9.4, [임상 1상]- GLS-6100 (정상인) 임상시험 승인일: 국내 식품의약품안전처(2021.5.20) |
|
6. 향후 계획 |
보건복지부의 후속과제 지원 계획에 따라 GLS-6100(고위험 정상인 대상) 임상시험 추진 계획이었으나, 이후 과제에 대한 후속 지원이 없어 개발 종료함 |
|
7. 경쟁제품 |
NIAID, ReiThera (임상 2상) |
|
8. 관련논문등 |
Preclinical evaluation of multi-antigenic HCV DNA vaccine for the prevention of Hepatitis C virus |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 |
|
10.공동개발 |
미국 이노비오사와 연구계약을 체결하여 아시아 지역독점개발권리 확보 (2011.10.7) |
|
11. 정부보조금 |
보건복지부의 기술개발사업 면역백신개발과제로 선정(2017년 6월부터 2020년 12월까지 |
|
12. 기타 사항 |
해당사항 없음 |
(마) 품목 : VGX-6150
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
만성 C형 간염 환자의 면역치료 |
|
3. 작용기전 |
만성C형간염 환자에 VGX-6150 접종으로 체내 HCV 바이러스 특이적 T세포 면역반응 이 유도되어, HCV바이러스에 감염된 세포를 제거하거나 HCV 바이러스 의 방출을 억제하여 만성C형간염을 |
|
4. 제품의 특성 |
기존 만성C형간염 면역치료제 대비 부작용이 없고, DAA 등의 항바이러스 의약품 대비 면역기억작용으로 지속적인 만성C형간염 억제 효과를 보임, 바이러스 항원의 변이에 대비하기 위해, 공통 |
|
5. 진행경과 |
[임상 1상]-한국 임상시험승인일: 국내 식품의약품안전처(2013.10.8), 진행국가: 한국, 임상결과 발표: 2020.2.20 - VGX-6150을 만성 C형 간염 환자를 대상으로 단계적으로 증량하였을 때 내약성이 양호하였고, 모든 용량군에서 안전성에 위배되는 특이사항은 관찰되지 않음. - VGX-6150을 만성C형 간염 환자 및 표준치료에 실패한 환자를 대상으로 단계적 증량 이후 최고 용량인 6mg을 추가 투여하였을 때, 내약성이 우수하고 안전성 측면에서 양호한 임상시험용의약품으로 평가됨. |
|
6. 향후 계획 |
2상임상단계의 진입을 보류 |
|
7. 경쟁제품 |
Chron Tech Pharma (임상 2상)-임상실패, NIAID/AdCh3NSmut1, MVA-NSmut(임상 1/2상) |
|
8. 관련논문등 |
- Preclinical evaluation of multi-antigenic HCV DNA vaccine for the prevention of Hepatitis C virus |
|
9. 시장 규모 |
초기 임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 |
|
10. 공동개발 |
미국 이노비오사와 연구계약을 체결하여 아시아 지역독점개발권리 확보 (2011.10.7) |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
해당사항 없음 |
(바) 품목 : GLS-5140
|
1. 구분 |
핵산기반 바이오신약 - DNA백신 |
|
2. 적응증 |
중증열성혈소판감소증후군 예방 |
|
3. 작용기전 |
정상인에게 SFTS DNA백신 접종으로 체내 SFTS 바이러스 특이적 T세포 면역반응과 항체면역반응이 유도되어, |
|
4. 제품의 특성 |
약독화 생백신 대비 DNA백신은 감염의 우려가 없음, 바이러스에 대한 항체 면역반응과 더불어 강력한 세포성 면역반응 유도할 수 있음 |
|
5. 진행경과 |
[신약후보물질 연구] 후보물질 도출연구 착수: 2015.12, 후보물질 효능평가 완료 후 결과 논문게재(Nature Communications 2019), 전임상연구 완료 : 2020.10 실험동물에서 백신 후보물질 선정 및 용량 용법 최적화 연구, 임상시험1상 계획 하에 식품의약품안전처 사전상담과와 3차례 사전상담 진행: 2022.08.31(1차), 2022.12.05(2차) , 2023.06.07(3차) |
|
6. 향후 계획 |
국내1상 임상시험 IND filing 중임 |
|
7. 경쟁제품 |
DNA 백신 경쟁제품 없음, 국내외 최초 백신개발. 물질발굴 단계이거나 비임상연구 단계(Moderna TX/국립감염병연구소, 에스티팜 mRNA 백신, 바이로큐어(주) 재조합 백신, mRNA백신)에서 개발 중임. |
|
8. 관련논문등 |
Severe fever and thrombocytopenia syndrome virus infection: Considerations for vaccine evaluation of a rare |
|
9. 시장 규모 |
초기 개발단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10.공동개발 |
한국과학기술원과 복지부 국책연구개발과제에 참여하여 공동개발 (2015.12) |
|
11. 정부보조금 |
보건복지부의 기술개발사업 면역백신개발 과제로 선정(2015년12월부터2019년11월까지180백만원을 지원받았음), 보건복지부 백신실용화기술개발사업의 미래대응 미해결 감염병 신규백신 개발 분야의 지원과제로 선정되어 임상시험승인까지의 연구개발비용을 지원받게 되었음(2020년 10월부터 2022년 12월까지). 협약연장함(2023년 12월 31일까지) |
|
12. 기타 사항 |
중증열성 혈소판 감소 증후군 예방 DNA백신에 대한 특허 출원 (대한민국 특허청) 출원번호/일자: 10-2018-0074418/2018.6.28 2020년2월4일 대한민국 특허 등록 |
(사) 품목 : GLS-7100
|
1. 구분 |
핵산기반 바이오신약 - 혈액응고 8인자 dRP |
|
2. 적응증 |
A형혈우병(8인자 결핍증) 치료 |
|
3. 작용기전 |
혈액응고 8인자의 돌연변이로 인한 A형 혈우병 환자에게핵산기반 혈액응고 8인자 dRP을 투여하면, 투여부위와 간에서 발현 분비된 단백질 치환 목적의 치료물질이 다른 응고인자들과 상호작용하여 혈액응고 기작이 원활하게 회복되도록 함으로써 A형 혈우병을 치료 |
|
4. 제품의 특성 |
기존 혈액응고 8인자 단백질의약품의 경우 반감기가 짧은 이유로 2-3일에 한번씩 주사해야 하는 단점이 있지만, 핵산기반 혈액응고 8인자는 1회 투여로 체내 지속발현 효과를 기대할 수 있어 투여회수를 줄일 수 있음. 기존 혈액응고 8인자 단백질 약제 투여시 항체 생성으로 인한 저항성이 부작용 증가 및 약효 감소로 나타나는 문제가 있지만, 핵산기반 치료제의 경우는 체내에서 혈액응고 8인자를 생성하므로 이러한 저항성 문제가 나타날 가능성이 낮고 전달체를 이용하여 간에서 생성되도록 유도할 수 있으므로 보다 효율적인 효능을 기대할 수 있음.현재 임상개발중인 타사 바이러스 운반체 이용 치료제의 경우 바이러스 벡터에 대한 면역반응으로 인하여 반복적인 투여가 어려운 반면, 핵산기반 혈액응고 8인자 의약품의 경우 바이러스 벡터에 대한 면역반응이 없어 반복적인 투여가 가능. 또한, 유전자 치환 목적으로 사용하는 혈액응고 8인자 바이러스 벡터의 경우에 매우 비싼 약가가 책정되어 치료제로 사용하기에 경제적인 부담이 매우 높지만, 핵산기반 혈액응고 8인자는 상대적으로 저렴한 가격에 치료받을 수 있음. |
|
5. 진행경과 |
[신약 후보 물질 연구] 후보물질 도출연구 착수: 2014.10, 후보물질 제작 완료/ 혈액 응고8인자의 체내 생성량과 활성을 높이기 위한 후보물질 개선연구 진행 중. 코로나19 연구개발에 집중하기 위해 추가적인 후보물질 개선연구를 2022년 하반기까지 잠정 연기. |
|
6. 향후 계획 |
혈우병 동물모델에서 개선된 후보물질의 효능평가 완료(2024년 상반기). |
|
7. 경쟁제품 |
Altuviiio/BIVV001, efanesoctocog alfa (Sanofi) - hFVIII replacement therapy IV/QW, FDA approved 시판중 (2023. 2), SB-525/PF-07055480 (Sangano Therapeutics, Pfizer) - recombinant AAV2/6 hFVIII gene therapy, 임상 3상 진행중 (2020), BMN270 (BioMarin Pharmaceutical) - AAV5-hFVIII, 임상 3상 진행중 (2018), Afstyla, NBP-601 (SK Chemical, CSL Behring) - hFVIII recombinant single chain IV/DIW, FDA approved 시판중 (2016. 5). |
|
8. 관련논문등 |
Ultrasound-mediated gene delivery of factor VIII plasmids for hemophilia A gene therapy in mice (Molecular Therapy Neucleic Acids, 2022) Treatment of Hemophilia A Using Factor VIII Messenger RNA Lipid Nanoparticles (Molecular Therapy Neucleic Acids, 2020) |
|
9. 시장 규모 |
2021년 128억 달러에서 연평균 7.5%씩 성장하여, 2031년에는 269억 달러에 이를 것이라고 전망됨 (제약산업 분석기업; Allied Market Research) |
|
10.공동개발 |
해당사항 없음 |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
해당사항 없음 |
(아) 품목 : GLS-8000
|
1. 구분 |
핵산기반 바이오신약 - B형간염 면역글로블린 Plas-mAb |
|
2. 적응증 |
B형간염 바이러스(HBV) 감염 치료 및 예방 |
|
3. 작용기전 |
간이식 예정자 또는 모계 감염 우려자에 B형간염 면역글로블린 Plas-mAb을 투여하면, 투여부위에서 발현 분비된 치료물질이 혈중에서 HBV S 항원을 포함하고 있는 바이러스 감염성 입자를 제거하고, HBV preS1을 통한 바이러스가 숙주 세포로의 침입을 방해함으로서 HBV 감염을 예방 |
|
4. 제품의 특성 |
기존 B형간염 바이러스 면역글로불린이 HBV S 면역글로불린에 한정되어 있는 것에 반해 S 면역글로불린과 preS1 면역글로불린을 동시에 투여함으로써 HBV 감염을 치료하고 예방할 수 있음. HBV 면역글로블린이나 치료용 백신을 투여하는 치료방법에 비하여, 핵산기반 HBV 면역글로블린 Plas-mAb 치료제는 체외에서 생산한 단백질 제재를 체내에 투여함으로써 발생할 수 있는 부작용을 최소화할 수 있으며, 체내에서 지속적으로 mAb를 생성할 수 있으므로 일정기간 동안 지속적인 약효를 기대할 수 있음.면역글로불린치료제 생산의 어려움으로 고가인 기존 HBV 면역글로불린 대비, 핵산기반 항체치료제의 특성 상, 상대적으로 낮은 가격의 면역글로불린을 제공함으로써 기존 시장 침투가 용이하고 신규 시장 확보가 가능함. |
|
5. 진행경과 |
[신약후보물질 연구] 후보물질 도출연구 착수 : 2017.4, 3종의 후보물질 플라스미드 제작 및 연구용 시료 생산 완료/ 동물세포에서 발현/항체생성과 항원 결합능력 확인. 실험동물에서4종의 후보물질로부터 항체 생성 및 체내 분포 경향 분석 연구 진행 중이고, 항preS1 면역글로블린과 항S 면역글로불린을 동시에 처리하면 우수한 B형간염 바이러스 억제효과를 확인. |
|
6. 향후 계획 |
높은 국내 분포를 보이는 B형 간염 바이러스 유전자C형에 대한 억제 효과를 평가하는 동물실험 (2024년 상반기) |
|
7. 경쟁제품 |
기존 시장에서 B형 간염 면역 글로불린이 허가되어 사용되고 있음 (예 : Cangene Corporation 사 HepaGamB, Grifols 사 HyperHEPB, Biotest Pharmaceuticals Corporation 사 Nabi-HB 등), GC녹십자사의 GC1102 (재조합 HBV 면역글로불린) : HBV 관련 간이식 환자 대상으로 임상 2/3상 시험 진행 중 (2018), 차백신연구소의 CVI-HBV-002 - 신규 항원(L-HBsAg)과 면역증강제 병용요법으로 HBV 치료용 백신 임상 2상 진행중 (2023), 현재 개발되고 있는 preS1 면역글로불린 제품은 없음. |
|
8. 관련논문등 |
Generation and Characterization of a Neutralizing Human Monoclonal Antibody to Hepatitis B Virus PreS1 from a Phage-Displayed Human Synthetic Fab Library (J. Microbiol. Biotechnol., 2018) Construction and Characterization of an Anti-Hepatitis B Virus preS1 Humanized Antibody that Binds to the Essential Receptor Binding Site (J. Microbiol. Biotechnol., 2017) |
|
9. 시장 규모 |
세계 B형 간염 치료제 시장 규모는 2022-2026년 4억 7,149만 달러의 증가가 전망되나(Global Hepatitis B Therapeutics Market 2022-2026),핵산기반 면역글로블린 연구개발은 초기 개발단계이고 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움. |
|
10.공동개발 |
해당사항 없음 |
|
11. 정부보조금 |
해당사항 없음 |
|
12. 기타 사항 |
강원대학교 산학협력단이 보유한 B형간염 바이러스의 preS1에 특이적으로 결합하는 항체 2종에 대한 특허와 기술을양수함으로서 독점적 개발권리를 확보함 (계약체결일 : 2017.4.5) 1종 후보물질 국내 특허 등록 완료 (등록번호 : KR 101864693 B1 / 등록일자: 2018.5.30) |
(자) 품목 : GLS-1200
|
1. 구분 |
항염증치료신약-천연물유래성분, 쓴맛수용체신호전달물질 |
|
2. 적응증 |
만성 축농증 치료, 코로나19 감염 방지 |
|
3. 작용기전 |
키나(Cinchona)나무의 나무껍질에서 추출한 성분인 Quinine은 호흡기관인 부비동의 쓴맛 수용체를 자극하여 체내 항염증물질의 분비를 유도함으로서, 염증의 원인인 세균을 제거하여 만성 축농증을 치료. 코로나19 및 독감을 포함한 다른 바이러스에 의한 감염을 예방 |
|
4. 제품의 특성 |
Quinine은 지난 150년간 말라리아치료제등의 성분으로 이용되었고 우수한 안전성이 확인됨, 비염 및 축농증 치료시 Quinine과 반응성이 있는 쓴맛수용체를 지닌 환자를 진단법에 의해 선별한다면 치료 효율을 극대화 할 수 있음, Quinine을 코 스프레이로 투약하면 코 상피세포내에서 산화질소(NO) 가스를 생성하여 세포 밖으로 분비하게 됨. 코로나19 바이러스가 코를 통해 인체에 진입하면 상기도(upper respiratory tract)에 존재하는 코 상피세포(nasal epithelial cell)에 감염되어 세포 안으로 바이러스 유전자가 삽입되고 바이러스 복제가 일어남. 이때, 코로나19 바이러스가 감염된 세포 안으로 Quinine투약으로 생성된 산화질소(NO) 가스가 이동하여 바이러스의 복제를 저해함으로써 감염을 방지하게 됨 |
|
5. 진행경과 |
[임상 1/2상] 임상시험승인 및 시작일: 미국 FDA(2015.10), 진행국가 : 미국, 임상 완료일 : 2017년 5월 [임상2상] 축농증 치료 임상시험승인, 미국FDA(2020.4) [임상2상] 코로나19 감염 방지 임상시험승인, 미국FDA(2020.4), 임상시험대상자의 50%이상의 등록이 완료(2020.9), 미국 내 코로나19 감염병 유행의 진원지이며 다수의 감염사례가 발생하고 있는 루이지에나주 바톤루지시에 2차 임상시험실시기관을 추가(2020,9). 임상대상자를 일반인으로 확대해서 진행할 수 있도록 IRB승인 득함(2021.4). 대상자 모집에 대해 지속적인 노력으로 184명 등록(2022.12). 하지만 코로나 19 감염 대상자를 모집하는데 고충이 큼. |
|
6. 향후 계획 |
만성 축농증 치료제 : 코로나19 감염병 사태에 따라 2상 임상시험 착수. 축농증 환자를 대상으로 하며, 내시경 부비강 수술을 받은 환자에게 GLS-1200 혹은 위약을 치료받게 한 이후에 질환에 감염되는 비율을 평가하는 것으로 임상시험이 설계되었으나, COVID-19 관련 임상시험으로 인해 중단함. 코로나19 감염방지 코스프레이 치료제 : 임상2상연구 종료 (2022년) : 2023년에 임상2상 연구를 종료하여, 임상결과 분석 및 임상시험결과보고서 작성을 수행할 계획임. |
|
7. 경쟁제품 |
유사한 작용기전의 경쟁제품 없음 |
|
8. 관련논문등 |
Bitter Tastes Bodyguards (2106, Scientific American), Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 |
|
10. 공동개발 |
해당사항없음 |
|
11. 정부보조금 |
해당사항없음 |
|
12. 기타 사항 |
미국 University of Pennsylvania가 보유한 호흡기 감염의 치료제 개발을 위한 쓴맛 수용체 신호 |
(차) 품목 : GLS-1027
|
1. 구분 |
항염증치료신약-저분자량 화학합성성분 |
|
2. 적응증 |
당뇨병성 신장질환등 자가면역의 치료, 코로나19 감염병 중증방지 치료 |
|
3. 작용기전 |
당뇨병성 신장질환의 원인인 , Th 17 세포를 직접억제함으로 IL-17생성을 감소시킴으로서 치료함 |
|
4. 제품의 특성 |
GLS-1027은 염증질환의 치료에 이용되는 경구용 의약품으로, RA, 1형당뇨병, Colitis, Uveitis에서 효능을 확인하였고, 1상임상연구를 통해 약물의 안전성을 확인함 |
|
5. 진행경과 |
[임상 1상] 임상시험승인 및 시작일: 미국 FDA(2008.2), 진행국가 : 미국, 임상 완료일 : 2008년 9월 [임상2상]-임상승인 및 시작일 : 미국 FDA(2020.11), 북마케도니아(2021.7.2.), 국내 식약처(2021.9.8). 국내 임상시험 개시방문 완료(2022.4.8)하고 대상자 모집 및 등록 착수, 코로나19 감염된 중등증 입원환자 수의 급격한 감소로 인해 환자 모집의 어려워 국내 임상시험 조기종료(2022.08), 미국과 북마케도니아 포함한 3개국에서 132명 대상자 등록 완료(2022.6.22) 및 임상시험 완료(2022.12), 현재 결과 분석 중임. |
|
6. 향후 계획 |
코로나19감염후 심각한 폐질환 방지 2상임상연구 종료 (2022년) |
|
7. 경쟁제품 |
MTX(methotrexate) : 경구용 anti-folate치료제, 핵산대사효소억제, 일시적 염증억제, 35% 치료율 |
|
8. 관련논문등 |
Clin Immunol. 2007, JPET 2006, EJP 2008, BJ Pharmacol 2008 |
|
9. 시장 규모 |
초기임상 단계이고, 해당 의약품 시장이 아직 형성되지 않아 목표시장의 예상 규모를 추정하기 어려움 |
|
10. 공동개발 |
해당사항없음 |
|
11. 정부보조금 |
해당사항없음 |
|
12. 기타 사항 |
해당사항없음 |
② 연구개발 완료 실적
공시서류 작성기준일 현재 개발이 완료된 신약은 없습니다.
③ 기타 연구개발 실적
추가로 기재하고자 하는 연구개발 관련 내용 없습니다.
7. 기타 참고사항
7-1. 지적재산권 보유 현황
|
종류 |
취득일 |
취득국가 |
제목 |
내용 |
근거법령 |
독점적 사용기간 |
취득소요인력/기간 |
상용화 여부 |
||
|---|---|---|---|---|---|---|---|---|---|---|
|
특허 |
2013.10.25 |
KR, CN, EP, JP, US, AU, HK |
면역 조절제 활성을 갖는 화합물 |
The present invention provides a compound, wherein the compound is 3-phenyl-4,5-dihydro-5-isoxazoleacetic acid
|
특허법 |
~2026.03.14 |
4명/7년 |
상용화 준비 |
||
|
특허 |
2013.04.17 |
EP, ES |
COMPOUNDS HAVING IMMUNOMODULATOR ACTIVITY |
The present invention provides a compound, wherein the compound is 3-phenyl-4,5-dihydro-5-isoxazoleacetic acid
|
EPC |
~2033.04.18 |
3명/2년 |
상용화 준비 |
||
|
특허 |
2014.05.13 |
KR, US |
암세포 증식 억제와 혈관신생 억제를 위한 융합 단백질 및 이를 포함한 항암 조성물 |
본 발명은 암 특이적 항체와 혈관신생 억제제가 결합된 융합 단백질 및 이를 포함하는 암 치료 조성물에 관한 것으로, 구체적으로, 본 발명에 따른 바람직한 암 특이적 항체는 트라스투주맵 또는 이의 단편이며, 혈관신생 억제제는 VEGF-트랩이다. |
특허법 |
~2032.06.07 |
3명/2년 |
상용화 미정 |
||
|
특허 |
2017.03.30 |
KR, US |
대상포진 예방 및 치료용 DNA 백신 조성물 및 이를 이용한 VZV 항원에 대한 T세포 활성화 방법 |
본 발명은 대상포진 바이러스(VZV) 단백질을 부호화하는 VZV 유래 유전자의 삽입 부위를 포함하는 적어도 일종의 플라스미드, 및약제학적으로 허용 가능한 기타의 성분을 포함하는 대상포진 예방 및 치료용 DNA 백신 조성물을제공한다. |
특허법 |
~2034.10.21 |
7명/3년 |
상용화 미정 |
||
|
특허 |
2018.05.30 |
KR, US |
B형 간염 바이러스의 preS1에 특이적으로 결합하는 항체 및 이의 용도 |
본 발명은 HBV(hepatitis B virus)의 표면항원 프리-S1(preS1)에 특이적으로 결합하는, 항체, 상기 항체를 코딩하는 폴리뉴클레오티드, 상기 폴리뉴클레오티드를 포함하는 발현 벡터, 및 상기 발현 벡터를 포함하는 형질전환체, 상기 항체의 HBV 감염의 예방 또는 치료 용도 및 상기 항체의 HBV 검출용도를 제공하는 것이다. |
특허법 |
~2034.11.27 |
3명/4년 |
상용화 미정 |
||
|
특허 |
2020.02.04 |
KR |
중증 열성 혈소판 감소 증후군(SFTS) 바이러스 감염 질환 예방 또는 치료용 백신 조성물 |
본 발명은 중증 열성 혈소판 감소 증후군(Severe Fever with Thrombocytopenia Syndrome; SFTS) 바이러스 질환에 의한 감염병을 예방 또는 치료하기 위한 백신 조성물에 관한 것이다. |
특허법 |
~2038.06.28 |
11명/2년 |
상용화 미정 |
||
| 특허 | 2023.06.29 | KR | 이물질 및 분비물에의한 오염을 방지하는 흡인기 플랫 모듈 | 본 발명은 DNA백신 접종 시 세포내로 백신이 잘 유입되게 하여 면역원성 효율을 증가하기 위한 목적으로 개발된 의료기기 관한 것으로 외부 구조물에 의해 이물질 및 분비물이 내부로의 유입을 차단하여 오염을 방지할 수 있는 구조물 용도 관련 내용이다. | 특허법 | ~2041.08.26 | 8명/2년 |
7-2. 업계의 현황
(1) 산업의특성
① 바이오의약품 산업
21세기 들어 바이오텍 회사들의 성장과 함께 바이오산업이 빠르게 약진하고 있으며 단일클론항체, 단백질 치료제, 그리고 백신 관련 분야의 약진이 돋보이고 있습니다. 특히 백신개발 다국적 제약사들은 차세대 백신의 연구개발에 집중하여 보다 효과적이고 안전한 백신들이 개발되고 있습니다. 백신사업 분야는 암, HIV, 자가면역질환등으로 적응증이 확대되고 있으며, 특히 예방백신분야에서 치료백신분야로 넓혀지고 있는 추세입니다. 일반적으로 바이오의약품의 개발은 장기간 대규모 자금이 소요되면서도 성공확률이 높지 않은 특성으로 인하여 리스크가 큰 사업입니다.
하지만, 리스크가 큰 만큼 성공할 경우 반대 급부 또한 큰 특성을 가지고 있습니다.
② 바이오의약품 CDMO 산업
바이오의약품은 신약개발에서 제품 판매에 이르기까지 오랜 시간과 대규모의 투자를필요로 하기에 전체 프로세스를 일원화할 수 있는 기업은 몇몇 소수의 대규모 다국적제약회사를 제외하고는 많지 않습니다. 특히 바이오의약품 CDMO산업은 첨단 생명공학 기술이 요구되고, 첨단설비를 갖추는데 막대한 설비투자비 및 품질관리 기술을 필요로 하고 있음에 따라 최적의 비용과 고효율로 제품의 생산을 전담할 수 있는 위탁개발생산 전문기업(CDMO)의 출현이 요구되고 있고 관련 시장도 급격히 성장하고있습니다.
③ 섬유산업
섬유산업은 원자재의 1/3을 해외에서 수입, 가공하여 완제품을 만들어 그 완제품의 2/3을 해외로 수출하는 해외의존형, 수출주도형 산업구조이며, 생산구조는 원료, 사,직물, 염색, 의류, 제조, 유통으로 이어지는 다단계로 형성되어 있고 고용창출효과와 고부가가치를 실현할 수 있는 가공산업입니다.
(2) 산업의 성장성
① DNA백신 및 핵산기반 치료제 분야
DNA백신 시장은 ‘2019 Global industry Trends, Growth, Share, Size, and 2025 Forecast Research Report (2019년5월, Industry Research사 발행)’에 의하면, DNA백신이 기존 백신들 대비 효과적이고 부작용이 적은 특성으로 말미암아, 2017년기준 잠재 수익의 시장점유율이 미국에서 58%, 유럽에서 28%로 평가하고 있고 2025년말까지 62억불 규모의 시장과 2019년부터 2025년까지 연평균성장률(CAGR)
7.7%를 전망하였습니다. 또 다른 시장분석기관인 ResearchAndMarkets.com은 2019년부터 2027년까지의 연평균성장률(CAGR) 42.03%를 전망하기도 하였습니다
핵산기반 치료제 시장은 주로 유전질환과 유전적 장애를 대상으로 하는 치료제로 개발이 되고 있습니다. 기존 치료제들이 치료효능이 거의 없거나 크지 않다 보니까, 혁신의약품으로 평가를 받고 있습니다. "Nucleic Acid-based Therapeutics Market 2018 Professional Analysis by Technology Type till 2020 (2019년10월, Market Research Future사 발행)" 보고서에 의하면, 2022년말까지 전세계 핵산기반 치료제
의 시장은 7억4,198만불 규모의 시장과 2019년부터 2022년까지의 연평균성장률 (CAGR) 6.8%를 전망하였습니다.
② 플라스미드 DNA CDMO 산업
플라스미드 DNA는 최근 미국 및 전세계에 시판된 바이러스 운반체 기반 유전자 치료제들의 원료물질로 이용되고 있고, 플라스미드 DNA 유전자치료제에서는 주성분으로 이용되고 있어, 전세계 유전자치료제 의약품 생산의 근간을 이루는 중요한 역할을 하고 있습니다. 즉, AAV 운반체 기반 유전자치료제 또는 렌티바이러스 운반체 기반 유전자치료제를 생산하기 위해서는 반드시 플라스미드 DNA의 의약품 생산이 전제되어야 합니다. 따라서, 최근 전세계 유전자치료제 시장의 급속적인 성장에 힘입어, 플라스미드 DNA의 의약품 위탁생산 산업의 성장이 가속화 되고 있습니다.
“Viral Vector & Plasmid DNA Manufacturing Market (2019년5월, Acumen Research and Consulting사 발행)’ 보고서에 의하면, 2026년까지 18억불의 시장규모와 2019년부터 2022년까지의 연평균성장률(CAGR) 21.4%를 전망하였습니다.
③ 섬유산업
섬유산업은 국가경제 발전에 견인차 역할을 하는 핵심 기간산업으로 세계 9위의 섬유 수출국이며 섬유 기술력 세계 4위로 생산기술도 고르게 발달되어 있습니다.
국내 섬유·패션산업은 제조업체가 48,375개(1인이상), 섬유패션 도소매업 및 서비스업 포함시 관련 업체가 304,543개사에 달하는 등 국민 경제·생활에 기여효과가 매우 큰 산업입니다.
우리나라 섬유패션산업은 원사, 직물, 염색가공, 패션의류 등 Up Stream에서 Down Stream까지 균형된 생산기반을 보유하고 있으며 생산기술도 고르게 발달되어 있고 의류용의 경우 중·저가 범용품보다 고부가가치 기능성 섬유, 친환경섬유에 치중하는 한편 산업용섬유 등 신섬유 개발 및 생산 확대를 위한 기술력과 제품화 수준을 고도화하고 있습니다.
(한국섬유산연합회 "섬유산업 역사" 발췌)
(3) 경기변동의 특성
① 바이오의약품산업
최근 국내를 포함한 글로벌 제약산업 및 바이오의약품 시장도 세계 경기침체의 영향을 받고 있어 지적재산권의 보호, R&D 생산성, 그리고 효과성이 중시되고 있습니다.하지만, 사람의 건강과 직결되는 산업의 특징상 타 산업에 비해 경기변동의 영향을 상대적으로 적게 받는다고 할 수 있습니다. 특히 평균연령의 증가, 다양한 질병 및 새로운 감염성질환들의 등장 등으로 인하여 바이오의약품에 대한 요구와 수요가 증가하여 경기변동과 무관하게 지속적인 성장을 보이고 있습니다.
② 바이오의약품 CDMO 산업
바이오의약품 CDMO산업의 고객이 주로 정부의 지원을 통해 의약품을 개발하는 바이오 벤처사 또는 전문연구기관인 특성을 가지고 있고 임상시험에 소요되는 바이오 의약품을 생산해주는 산업이니만큼 임상시험이 진행되는 1~3년 단위의 생산계약이 이루어져 여타의 산업에 비하여 경기변동에 상대적으로 덜 민감하다고 할 수 있습니다. 하지만 경기가 극도로 악화되는 경우에는 제약산업의 시장규모 축소로 CDMO산업도 영향을 받을 수 있습니다.
③ 섬유산업
섬유산업은 계절적인 경기변동은 미미하나 환율변동 및 유가상승 등 외적인 영향으로 인한 경기변동이 심한 편입니다.
(4) 경쟁요소 및 향후 전망
① DNA백신 및 핵산기반 치료제 분야
DNA백신 분야는 현재 미국 이노비오사의 HPV 관련 자궁경부전암 및 암 치료 백신인 VGX-3100이 글로벌 3상임상연구를 진행하고 있습니다. 향후 수 년이내에 사람을 대상으로 하는 DNA백신의 시판 허가 및 상업화가능성이 높아지고 있습니다.
DNA 백신개발사들의 차별적인 제품 개발 전략으로 인해, 동일질환을 대상으로 하는중복적인 제품 개발 사례는 비교적 적은 편입니다.
핵산기반치료제 중 mRNA 치료제 분야는 다국적 제약사들의 자금 및 협력을 지원받은 바이오텍 기업들이 신종감염병 백신, 치료제 및 항암치료제를 대상으로 임상 개발진행 중에 있습니다. 대표적인 바이오텍기업들로는 Moderna, CureVac, BioNTech사등이 있습니다. 특히, 코로나19 백신의 2개 제품은 현재 긴급사용승인을받아 대량공급 및 접종을 진행하고 있습니다.
핵산기반치료제 중 플라스미드 DNA 치료제 분야는 현재 한국의 헬릭스미스사가 당뇨병성 신경병증을 대상으로한 엔젠시스(Engensis, VM202)라는 제품의 글로벌 3상임상연구를 진행하고 있습니다..
② 플라스미드 DNA CDMO 산업
비록 유전자치료제 시장의 급속한 성장으로 이들의 원료물질인 플라스미드 DNA의 전세계 의약품 생산 수요는 증가하고 있지만, 원료물질이라는 점과 고순도, 고농도의플라스미드 GMP 생산기술이 필요 하다는 점들로 인해, 전문적인 위탁 생산기업이 전세계적으로 많지 않고, 기업들간 기술력의 차이가 있습니다.
대표적인 플라스미드 DNA 위탁생산기업으로는 미국의 VGXI사 (진원생명과학 자회사), 벨기에의 Eurogentec사, 미국의 Aldevron사, 영국의 Cobra사등이 있습니다. 최근 플라스미드 DNA의 전세계 위탁생산 수요가 증가함에 따라, 몇몇 기업들의 생산시설 확장 보도가 이어지고 있습니다. 미국의 VGXI사와 Adveron사는 2020년대초까지 연 매출 10억불의 생산시설의 확장을 완료하거나 진행하고 있습니다.
(5) 옥천공장 현황
① 일반사항
- 공장 주소 : 충북 옥천군 이원면 건진리 226번지
- 공장 면적 : 24,815㎡
- 공장 부지 장부가액은 1,769백만원입니다.
- 공장내 건물은 16,400㎡규모이며, 건물 장부가액은 779백만원입니다.
- 구축물의 규모는 2,580㎡로 장부가액은 0원입니다.
② 옥천공장 상시 근무자
- 공장관리 실무책임자 : 여인용 차장
- 공장관리 실무관리자 : 이래오 과장
③ 옥천공장 관리 협력업체
- 공장 보안관리 : ㈜ 에스원 옥천 (월정료 : 22만원)
- 공장 전기안전관리 : ㈜국제전기안전관리 (월정료 : 15만원)
- 공장 소방관리 : ㈜청명소방 (월정료 : 19만원)
④ 옥천공장 가동 현황
현재 옥천공장은 가동하지 않고, 본 공장 2층을 창고로 사용하고 있으며, 베트남 공장에서 생산되는 의류용 심지제품을 보관하고 있습니다. 보관된 심지제품은 국내영업활동을 통해 국내 구매자에게 판매되고 있습니다.
⑤ 옥천공장 관리운영보고
공장관리 실무책임자는 수시로 공장 현황에 대해 본사 총무본부에 보고하고 있으며, 관리운영상 비용이 발생할 경우에는 품의서를 작성하여 진행하고 있습니다.
III. 재무에 관한 사항
1. 요약재무정보
※ 연결 및 별도 재무정보는 한국채택국제회계기준(K-IFRS)에 따라 작성되었습니다.
1-1. 요약 연결재무제표
(단위:원)
| 구 분 | 제48기(2023) 3분기 | 제47기(2022) | 제46기(2021) |
|---|---|---|---|
| [유동자산] | 36,202,783,490 | 73,063,156,234 | 134,633,081,215 |
| 당좌자산 | 20,662,754,695 | 58,199,406,875 | 123,945,393,373 |
| 재고자산 | 15,540,028,795 | 14,863,749,359 | 10,687,687,842 |
| [비유동자산] | 155,196,060,371 | 149,803,530,363 | 116,223,480,020 |
| 투자부동산 | 2,640,698,347 | 2,668,058,581 | 2,722,092,443 |
| 유형자산 | 150,234,742,799 | 144,369,110,509 | 110,381,999,863 |
| 무형자산 | 445,991,698 | 563,914,992 | 643,095,121 |
| 기타비유동자산 | 1,874,627,527 | 2,202,446,281 | 2,476,292,593 |
| 자산총계 | 191,398,843,861 | 222,866,686,597 | 250,856,561,235 |
| [유동부채] | 25,802,231,493 | 33,835,688,340 | 34,758,541,470 |
| [비유동부채] | 7,250,000,708 | 7,559,705,757 | 9,591,250,632 |
| 부채총계 | 33,052,232,201 | 41,395,394,097 | 44,349,792,102 |
| [지배회사의 소유주에게 귀속되는 자본] | 158,346,611,660 | 181,471,292,500 | 206,506,769,133 |
| 자본금 | 78,473,817,000 | 77,751,599,000 | 77,479,055,000 |
| 주식발행초과금 | 213,491,409,734 | 211,749,282,814 | 206,606,623,975 |
| 기타자본구성요소 | 19,825,265,979 | 20,299,548,399 | 21,521,211,394 |
| 기타포괄손익누계액 | 21,678,098,073 | 8,825,966,584 | (859,484,326) |
| 이익잉여금(결손금) | (175,121,979,126) | (137,155,104,297) | (98,240,636,910) |
| [비지배지분] | 0 | 0 | 0 |
| 자본총계 | 158,346,611,660 | 181,471,292,500 | 206,506,769,133 |
| 매출액 | 27,448,343,110 | 48,718,300,179 | 38,700,355,313 |
| 영업이익(손실) | (37,092,272,383) | (40,083,888,917) | (27,434,047,838) |
| 당기순이익(손실) | (37,966,874,829) | (38,150,069,804) | (15,887,887,553) |
| [지배회사지분순이익(손실)] | (37,966,874,829) | (38,150,069,804) | (15,887,887,553) |
| [비지배지분순이익(손실)] | 0 | 0 | 0 |
| 기타포괄이익(손실) | 12,852,131,489 | 8,921,053,327 | (388,231,621) |
| 총포괄이익(손실) | (25,114,743,340) | (29,229,016,477) | (16,276,119,174) |
| 주당순이익(손실) | (489) | (492) | (214) |
| 연결에 포함된 회사수 | 2개 | 2개 | 2개 |
1-2. 요약 별도재무제표
(단위:원)
| 구 분 | 제48기(2023)3분기 | 제47기(2022) | 제46기(2021) |
|---|---|---|---|
| [유동자산] | 104,719,224,417 | 106,718,983,795 | 132,919,543,058 |
| 당좌자산 | 100,096,137,003 | 102,117,905,979 | 129,583,538,624 |
| 재고자산 | 4,623,087,414 | 4,601,077,816 | 3,336,004,434 |
| [비유동자산] | 86,686,137,376 | 116,513,964,403 | 99,410,910,784 |
| 종속기업에 대한 투자자산 | 1,336,433,905 | 12,340,414,384 | 12,340,414,384 |
| 투자부동산 | 2,640,698,347 | 2,668,058,581 | 2,722,092,443 |
| 유형자산 | 9,887,469,548 | 11,931,475,729 | 13,067,363,790 |
| 무형자산 | 29,500,171 | 36,850,333 | 52,054,921 |
| 기타비유동자산 | 72,792,035,405 | 89,537,165,376 | 71,228,985,246 |
| 자산총계 | 191,405,361,793 | 223,232,948,198 | 232,330,453,842 |
| [유동부채] | 14,870,253,926 | 28,557,077,443 | 19,990,757,160 |
| [비유동부채] | 5,035,717,578 | 4,767,890,392 | 6,103,589,298 |
| 부채총계 | 19,905,971,504 | 33,324,967,835 | 26,094,346,458 |
| 자본금 | 78,473,817,000 | 77,751,599,000 | 77,479,055,000 |
| 주식발행초과금 | 213,491,409,734 | 211,749,282,814 | 206,606,623,975 |
| 기타자본구성요소 | 19,825,265,979 | 20,299,548,399 | 21,521,211,394 |
| 기타포괄손익누계액 | 211,692,340 | (263,863,040) | (619,873,189) |
| 이익잉여금(결손금) | (140,502,794,764) | (119,628,586,810) | (98,750,909,796) |
| 자본총계 | 171,499,390,289 | 189,907,980,363 | 206,236,107,384 |
| 종속ㆍ관계ㆍ공동기업 투자주식의 평가 방법 | 원가법 | 원가법 | 원가법 |
| 2023년 1월 1일~ 2023년 9월 30일 |
2022년 1월 1일~ 2022년 12월 31일 |
2021년 1월 1일~ 2021년 12월 31일 |
|
| 매출액 | 25,852,459,867 | 45,606,006,334 | 34,220,586,881 |
| 영업이익(손실) | (21,059,467,024) | (31,268,061,355) | (26,286,719,455) |
| 당기순이익(손실) | (20,874,207,954) | (20,113,279,431) | (13,665,327,495) |
| 기타포괄이익(손실) | 475,555,380 | (408,387,434) | (1,551,555,534) |
| 총포괄이익(손실) | (20,398,652,574) | (20,521,666,865) | (15,216,883,029) |
| 주당순이익(손실) | (269) | (260) | (184) |
| 희석주당순이익(손실) | (269) | (260) | (184) |
2. 연결재무제표
|
연결 재무상태표 |
|
제 48 기 3분기말 2023.09.30 현재 |
|
제 47 기말 2022.12.31 현재 |
|
(단위 : 원) |
|
제 48 기 3분기말 |
제 47 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
36,202,783,490 |
73,063,156,234 |
|
현금및현금성자산 |
6,804,551,677 |
13,260,897,357 |
|
매출채권 및 기타유동채권 |
5,867,796,083 |
8,980,464,094 |
|
단기기타채권 |
962,837,884 |
1,598,145,057 |
|
단기기타금융자산 |
5,302,608,818 |
32,617,996,392 |
|
재고자산 |
15,540,028,795 |
14,863,749,359 |
|
기타유동자산 |
1,724,960,233 |
1,741,903,975 |
|
비유동자산 |
155,196,060,371 |
149,803,530,363 |
|
장기기타금융자산 |
1,488,866,859 |
1,649,460,141 |
|
투자부동산 |
2,640,698,347 |
2,668,058,581 |
|
유형자산 |
150,234,742,799 |
144,369,110,509 |
|
무형자산 |
445,991,698 |
563,914,992 |
|
이연법인세자산 |
38,650,749 |
36,423,330 |
|
기타비유동자산 |
347,109,919 |
516,562,810 |
|
자산총계 |
191,398,843,861 |
222,866,686,597 |
|
부채 |
||
|
유동부채 |
25,802,231,493 |
33,835,688,340 |
|
매입채무 및 기타유동채무 |
11,896,972,492 |
7,493,171,591 |
|
단기기타채무 |
97,021,662 |
35,408,293 |
|
단기차입금 |
3,001,731,232 |
701,146,398 |
|
전환사채 |
106,419,187 |
11,544,744,489 |
|
파생상품금융부채 |
2,943,222 |
2,732,912,980 |
|
단기기타금융부채 |
1,950,634,118 |
4,238,409,193 |
|
기타유동부채 |
8,746,509,580 |
7,089,895,396 |
|
비유동부채 |
7,250,000,708 |
7,559,705,757 |
|
장기기타금융부채 |
4,378,713,805 |
5,509,721,609 |
|
퇴직급여부채 |
557,643,487 |
0 |
|
충당부채 |
190,969,811 |
171,350,978 |
|
이연법인세부채 |
485,300,114 |
457,332,566 |
|
기타비유동부채 |
1,637,373,491 |
1,421,300,604 |
|
부채총계 |
33,052,232,201 |
41,395,394,097 |
|
자본 |
||
|
지배기업의 소유주에게 귀속되는 자본 |
158,346,611,660 |
181,471,292,500 |
|
자본금 |
78,473,817,000 |
77,751,599,000 |
|
자본잉여금 |
213,491,409,734 |
211,749,282,814 |
|
주식발행초과금 |
213,491,409,734 |
211,749,282,814 |
|
기타자본구성요소 |
19,825,265,979 |
20,299,548,399 |
|
기타포괄손익누계액 |
21,678,098,073 |
8,825,966,584 |
|
이익잉여금(결손금) |
(175,121,979,126) |
(137,155,104,297) |
|
비지배지분 |
0 |
0 |
|
자본총계 |
158,346,611,660 |
181,471,292,500 |
|
자본과부채총계 |
191,398,843,861 |
222,866,686,597 |
|
연결 포괄손익계산서 |
|
제 48 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 47 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
제 48 기 3분기 |
제 47 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
수익(매출액) |
11,725,972,657 |
27,448,343,110 |
12,547,976,533 |
38,872,887,761 |
|
매출원가 |
13,000,487,836 |
34,203,585,215 |
10,542,503,623 |
27,129,128,908 |
|
매출총이익 |
(1,274,515,179) |
(6,755,242,105) |
2,005,472,910 |
11,743,758,853 |
|
판매비와관리비 |
10,552,615,032 |
30,337,030,278 |
9,228,816,761 |
35,139,349,279 |
|
영업이익(손실) |
(11,827,130,211) |
(37,092,272,383) |
(7,223,343,851) |
(23,395,590,426) |
|
기타수익 |
437,875,270 |
1,299,642,793 |
1,289,467,398 |
2,406,163,483 |
|
기타비용 |
146,993,277 |
1,992,654,795 |
256,072,522 |
847,356,196 |
|
금융수익 |
52,235,189 |
747,221,524 |
1,684,979,011 |
5,402,271,083 |
|
금융비용 |
73,436,286 |
915,762,724 |
3,398,492,468 |
7,036,194,083 |
|
법인세비용차감전순이익(손실) |
(11,557,449,315) |
(37,953,825,585) |
(7,903,462,432) |
(23,470,706,139) |
|
법인세비용(수익) |
53,689 |
13,049,244 |
820,053 |
28,936,732 |
|
계속영업이익(손실) |
(11,557,503,004) |
(37,966,874,829) |
(7,904,282,485) |
(23,499,642,871) |
|
당기순이익(손실) |
(11,557,503,004) |
(37,966,874,829) |
(7,904,282,485) |
(23,499,642,871) |
|
당기순이익(손실)의 귀속 |
||||
|
지배기업의 소유주에게 귀속되는 당기순이익(손실) |
(11,557,503,004) |
(37,966,874,829) |
(7,904,282,485) |
(23,499,642,871) |
|
비지배지분에 귀속되는 당기순이익(손실) |
0 |
0 |
0 |
0 |
|
기타포괄손익 |
3,309,177,927 |
12,852,131,489 |
16,167,230,644 |
29,416,729,534 |
|
후속적으로 당기손익으로 재분류될수있는 항목 |
3,313,816,861 |
12,959,121,118 |
16,149,693,119 |
29,669,924,321 |
|
해외사업장환산외환차이(세후기타포괄손익) |
3,313,816,861 |
12,959,121,118 |
16,149,693,119 |
29,669,924,321 |
|
후속적으로 당기손익으로 재분류되지 않는항목 |
(4,638,934) |
(106,989,629) |
17,537,525 |
(253,194,787) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
(4,638,934) |
(106,989,629) |
17,537,525 |
(253,194,787) |
|
총포괄손익 |
(8,248,325,077) |
(25,114,743,340) |
8,262,948,159 |
5,917,086,663 |
|
포괄손익의 귀속 |
||||
|
포괄손익, 지배기업의 소유주에게 귀속되는 지분 |
(8,248,325,077) |
(25,114,743,340) |
8,262,948,159 |
5,917,086,663 |
|
포괄손익, 비지배지분 |
0 |
0 |
0 |
0 |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(148) |
(489) |
(102) |
(303) |
|
희석주당이익(손실) (단위 : 원) |
(148) |
(489) |
(102) |
(303) |
|
연결 자본변동표 |
|
제 48 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 47 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
자본 |
||||||||
|---|---|---|---|---|---|---|---|---|
|
지배기업의 소유주에게 귀속되는 지분 |
비지배지분 |
자본 합계 |
||||||
|
자본금 |
주식발행초과금 |
이익잉여금(결손금) |
기타자본구성요소 |
기타포괄손익누계액 |
지배기업의 소유주에게 귀속되는 지분 합계 |
|||
|
2022.01.01 (기초자본) |
77,479,055,000 |
206,606,623,975 |
(99,322,788,686) |
21,521,211,394 |
(829,698,775) |
205,454,402,908 |
0 |
205,454,402,908 |
|
당기순이익(손실) |
0 |
0 |
(23,499,642,871) |
0 |
0 |
(23,499,642,871) |
0 |
(23,499,642,871) |
|
기타포괄손익 |
0 |
0 |
0 |
0 |
29,386,943,983 |
29,386,943,983 |
0 |
29,416,729,534 |
|
기타포괄손익-공정가치 측정 금융자산 평가손익 적립금 |
0 |
0 |
0 |
0 |
(253,194,787) |
(253,194,787) |
0 |
(253,194,787) |
|
해외사업환산손익 |
0 |
0 |
0 |
0 |
29,640,138,770 |
29,640,138,770 |
0 |
29,640,138,770 |
|
유상증자 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
전환사채행사 |
222,544,000 |
4,116,133,031 |
0 |
(673,808,252) |
0 |
3,664,868,779 |
0 |
3,664,868,779 |
|
주식매수선택권 행사 |
50,000,000 |
862,044,000 |
0 |
(529,600,000) |
0 |
382,444,000 |
0 |
382,444,000 |
|
2022.09.30 (기말자본) |
77,751,599,000 |
211,584,801,006 |
(122,822,431,557) |
20,317,803,142 |
28,557,245,208 |
215,389,016,799 |
0 |
215,389,016,799 |
|
2023.01.01 (기초자본) |
77,751,599,000 |
211,749,282,814 |
(137,155,104,297) |
20,299,548,399 |
8,825,966,584 |
181,471,292,500 |
0 |
181,471,292,500 |
|
당기순이익(손실) |
0 |
0 |
(37,966,874,829) |
0 |
0 |
(37,966,874,829) |
0 |
(37,966,874,829) |
|
기타포괄손익 |
0 |
0 |
0 |
0 |
12,852,131,489 |
12,852,131,489 |
0 |
12,852,131,489 |
|
기타포괄손익-공정가치 측정 금융자산 평가손익 적립금 |
0 |
0 |
0 |
0 |
(106,989,629) |
(106,989,629) |
0 |
(106,989,629) |
|
해외사업환산손익 |
0 |
0 |
0 |
0 |
12,959,121,118 |
12,959,121,118 |
0 |
12,959,121,118 |
|
유상증자 |
722,218,000 |
1,742,126,920 |
0 |
0 |
0 |
2,464,344,920 |
0 |
2,464,344,920 |
|
전환사채행사 |
0 |
0 |
0 |
(474,282,420) |
0 |
(474,282,420) |
0 |
(474,282,420) |
|
주식매수선택권 행사 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2023.09.30 (기말자본) |
78,473,817,000 |
213,491,409,734 |
(175,121,979,126) |
19,825,265,979 |
21,678,098,073 |
158,346,611,660 |
0 |
158,346,611,660 |
|
연결 현금흐름표 |
|
제 48 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 47 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
제 48 기 3분기 |
제 47 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(17,585,721,355) |
(15,437,126,086) |
|
당기순이익(손실) |
(37,966,874,829) |
(23,499,642,871) |
|
당기순이익조정을 위한 가감 |
9,396,378,352 |
6,442,636,181 |
|
영업활동으로 인한 자산 부채의 변동 |
10,604,662,381 |
(1,140,732,109) |
|
이자수취 |
434,979,408 |
2,789,862,713 |
|
이자지급(영업) |
(54,866,667) |
(29,250,000) |
|
투자활동현금흐름 |
24,467,436,464 |
4,164,313,930 |
|
단기금융상품의 처분 |
99,000,000,000 |
224,629,000,000 |
|
단기대여금및수취채권의 처분 |
0 |
311,058,632 |
|
장기대여금및수취채권의 처분 |
0 |
12,000,000 |
|
유형자산의 처분 |
15,700,000 |
0 |
|
임차보증금의 감소 |
0 |
70,000,000 |
|
단기금융상품의 취득 |
(71,845,878,375) |
(184,629,000,000) |
|
유형자산의 취득 |
(2,656,112,543) |
(36,160,541,742) |
|
무형자산의 취득 |
(32,231,333) |
(68,202,960) |
|
임차보증금의 증가 |
(14,041,285) |
0 |
|
재무활동현금흐름 |
(13,345,034,178) |
7,370,330,384 |
|
단기차입금의 증가 |
2,257,707,184 |
403,284,530 |
|
사채의 발행 |
0 |
11,469,400,000 |
|
유상증자 |
2,469,985,560 |
0 |
|
주식매수선택권의 행사 |
0 |
382,444,000 |
|
사채의 상환 |
(16,279,647,453) |
(3,327,691,920) |
|
전환권 행사 |
0 |
(2,926,760) |
|
신주발행비용 |
(5,640,640) |
0 |
|
리스부채의 지급 |
(1,787,438,829) |
(1,554,179,466) |
|
외화표시현금및현금성자산에 대한 환율변동효과 |
6,973,389 |
59,795,962 |
|
현금및현금성자산의순증가(감소) |
(6,456,345,680) |
(3,842,685,810) |
|
기초현금및현금성자산 |
13,260,897,357 |
22,309,654,214 |
|
기말현금및현금성자산 |
6,804,551,677 |
18,466,968,404 |
3. 연결재무제표 주석
| 제 48 (당)기 3분기 2023년 09월 30일 현재 |
| 제 47 (전)기 2022년 12월 31일 현재 |
| 회사명 : 진원생명과학 주식회사와 그 종속기업 |
1. 일반사항
(1) 지배기업의 개요
진원생명과학주식회사와 그 종속기업(이하 "연결실체")의 지배기업인 진원생명과학주식회사(이하 "지배기업")는 1976년 1월에 설립되어 제약사업 및 패브릭사업 등을 주요 사업으로 영위하고 있습니다. 본사는 서을특별시에 위치하고 있으며, 미국 텍사스주 우드랜드에는 CDMO 생산제조시설이, 베트남 비엔호아에는 패브릭 제조시설이 있습니다. 지배기업은 1987년 11월 유가증권시장에 주식을 상장하였으며 주요주주 현황은 다음과 같습니다.
당3분기말 현재 주요 주주현황은 다음과 같습니다.
| (단위:주) | ||||
|---|---|---|---|---|
| 주 주 명 | 당3분기말 | 전기말 | ||
| 주식수 | 지분율 | 주식수 | 지분율 | |
| 박영근 | 5,396,525 | 6.88% | 4,811,730 | 6.19% |
| 조병문 외 5명 | 1,464,223 | 1.87% | 1,370,658 | 1.76% |
| 기 타 | 71,613,069 | 91.26% | 71,569,211 | 92.05% |
| 합계 | 78,473,817 | 100.00% | 77,751,599 | 100.00% |
(2) 종속기업의 개요
1) 현황
종속기업의 현황은 다음과 같습니다.
<당3분기>
| 회사명 | 지분율 | 소재지 | 보고기간 종료일 | 주요 영업활동 |
|---|---|---|---|---|
| VGXI, Inc. | 100% | 미국 | 2023-09-30 | CDMO 제조 및 생산 |
| Dong-Il Interlining, Ltd | 100% | 베트남 | 2023-09-30 | 심지 제조 및 생산 |
<전기말>
| 회사명 | 지분율 | 소재지 | 보고기간 종료일 | 주요 영업활동 |
|---|---|---|---|---|
| VGXI, Inc. | 100% | 미국 | 2022-12-31 | CDMO 제조 및 생산 |
| Dong-Il Interlining, Ltd | 100% | 베트남 | 2022-12-31 | 심지 제조 및 생산 |
2) 요약재무정보
종속기업의 요약재무정보는 다음과 같습니다.
<당3분기>
| (단위 : 원) | ||||||
|---|---|---|---|---|---|---|
| 회사명 | 당3분기말 | 당3분기 | ||||
| 자산 | 부채 | 자본 | 매출 | 당기순손익 | 총포괄손익 | |
| VGXI, Inc. | 152,482,600,633 | 169,858,059,906 | (17,375,459,273) | 17,482,230,896 | (22,196,957,363) | (21,203,867,508) |
| Dong-il Interlining Ltd. | 10,670,013,720 | 9,333,579,815 | 1,336,433,905 | 5,803,433,967 | (551,413,490) | (460,393,169) |
<전기>
| (단위 : 원) | ||||||
|---|---|---|---|---|---|---|
| 회사명 | 전기말 | 전반기 | ||||
| 자산 | 부채 | 자본 | 매출 | 당기순손익 | 총포괄손익 | |
| VGXI, Inc. | 151,835,567,743 | 146,925,613,798 | 4,909,953,945 | 16,992,742,637 | (1,956,198,028) | (1,002,847,078) |
| Dong-il Interlining Ltd. | 9,186,899,426 | 7,390,072,352 | 1,796,827,074 | 5,804,049,132 | (127,371,224) | 67,165,295 |
2. 재무제표 작성기준 및 중요한 회계정책
2.1 재무제표 작성기준
연결실체의 2023년 9월 30일로 종료하는 9개월 보고기간에 대한 요약3분기연결재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었습니다. 이 중간재무제표는 연차재무제표에 기재되는 사항이 모두 포함되지 않았으므로 전기말 연차재무제표와 함께 이해해야 합니다.
2.1.1 연결실체가 채택한 제ㆍ개정 기준서 및 해석서
연결실체는 2023년 1월 1일로 개시하는 회계기간부터 다음의 제ㆍ개정 기준서 및 해석서를 신규로 적용하였습니다.
(1) 연결실체가 채택한 제ㆍ개정 기준서
(가) 기업회계기준서 제1001호 '재무제표 표시' - '회계정책'의 공시
중요한 회계정책 정보를 정의하고 이를 공시하도록 하였습니다. 해당 기준서의 개정이 연결재무제표에 미치는 중요한 영향은 없습니다.
(나) 기업회계기준서 제1001호 ' 재무제표 표시 ' - 행사가격 조정 조건이 있는 금융부채 평가손익 공시
발행자의 주가 변동에 따라 행사가격이 조정되는 조건이 있는 금융상품의 전부나 일부가 금융부채로 분류되는 경우 그 금융부채의 장부금액과 관련 손익을 공시하도록 하였습니다. 해당 기준서의 개정이 연결재무제표에 미치는 중요한 영향은 없습니다.
(다) 기업회계기준서 제1008호 '회계정책, 회계추정의 변경 및 오류' - '회계추정'의 정의
회계추정을 정의하고, 회계정책의 변경과 구별하는 방법을 명확히 하였습니다.
해당 기준서의 개정이 연결재무제표에 미치는 중요한 영향은 없습니다.
(라) 기업회계기준서 제1012호 '법인세' - 단일거래에서 생기는 자산과 부채에 대한 이연법인세
자산 또는 부채가 최초로 인식되는 거래의 최초 인식 예외 요건에 거래시점 동일한 가산할 일시적차이와 차감할 일시적차이를 발생시키지 않는 거래라는 요건을 추가하였습니다. 해당 기준서의 개정이 연결재무제표에 미치는 중요한 영향은 없습니다.
(마) 기업회계기준서 제1117호 '보험계약' 제정
기업회계기준서 제1117호 '보험계약'은 기업회계기준서 제1104호 '보험계약’을 대체합니다. 보험계약에 따른 모든 현금흐름을 추정하고 보고시점의 가정과 위험을 반영한 할인율을 사용하여 보험부채를 측정하고, 매 회계연도별로 계약자에게 제공한 서비스(보험보장)를 반영하여 수익을 발생주의로 인식하도록 합니다. 또한, 보험사건과 관계없이 보험계약자에게 지급하는 투자요소(해약/만기환급금)는 보험수익에서 제외하며, 보험손익과 투자손익을 구분 표시하여 정보이용자가 손익의 원천을 확인할 수 있도록 하였습니다. 해당 기준서의 제정이 연결재무제표에 미치는 중요한 영향은 없습니다.
(2) 제정 또는 공표되었으나 아직 시행되지 않은 제ㆍ개정 기준서 및 해석서
제정ㆍ공표되었으나 시행일이 도래하지 아니하였고, 연결실체가 조기 적용하지 아니한 제ㆍ개정 기업회계기준서 및 해석서는 다음과 같습니다.
(가) 기업회계기준서 제1001호 '재무제표 표시' 개정 - 부채의 유동/비유동 분류, 약정사항이 있는 비유동부채
보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습 니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기 지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된 경우는 제외됩니다. 또한, 기업이 보고기간말 후에 준수해야하는 약정은 보고기간말에 해당 부채의 분류에 영향을 미치지 않으며, 보고기간 이후 12개월 이내 약정사항을 준수해야하는 부채가 보고기간말 현재 비유동부채로 분류된 경우 보고기간 이후 12개월 이내 부채가 상환될 수 있는 위험에 관한 정보를 공시해야 합니다.동 개정사항은 2024년 1월 1일 이후 시작하는 회계연도부터 적용되며, 조기적용이 허용됩니다. 연결실체는 동 개정으로 인한 연결재무제표의 영향을 검토 중에 있습니다.
2.2 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전이익에 적용하여 계산합니다.
2.3 중요한 회계추정 및 가정
연결실체는 미래에 대하여 추정 및 가정을 하고 있습니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에서 합리적으로 예측가능한 미래의 사건과 같은 다른 요소들을 고려하여 이루어집니다. 이러한 회계추정은 실제 결과와 다를 수도있습니다.
연결실체의 요약반기연결재무제표 작성시 사용된 중요한 회계추정 및 가정은 COVID-19에 따른 불확실성의 변동에 따라 조정될 수 있으며, 당3분기말 현재 COVID-19로 인하여 회사의 사업, 재무상태 및 경영성과 등에 미칠 궁극적인 영향은 합리적으로 예측할 수 없습니다.
요약반기연결재무제표 작성시 사용된 중요한 회계추정 및 가정은 법인세비용을 결정하는데 사용된 추정의 방법을 제외하고는 전기 연결재무제표 작성에 적용된 회계추정 및 가정과 동일합니다.
3. 금융상품의 범주 및 상계
(1) 금융자산의 범주
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융자산 | 상각후원가 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합계 |
| 현금및현금성자산 | - | 6,804,551,677 | - | 6,804,551,677 |
| 매출채권 | - | 5,867,796,083 | - | 5,867,796,083 |
| 단기기타채권 | - | 962,837,884 | - | 962,837,884 |
| 단기기타금융자산 | 4,845,878,375 | 456,730,443 | - | 5,302,608,818 |
| 장기기타금융자산 | - | 1,450,369,942 | 38,496,917 | 1,488,866,859 |
| 합계 | 4,845,878,375 | 15,542,286,029 | 38,496,917 | 20,426,661,321 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융자산 | 상각후원가 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합계 |
| 현금및현금성자산 | - | 13,260,897,357 | - | 13,260,897,357 |
| 매출채권 | - | 8,980,464,094 | - | 8,980,464,094 |
| 단기기타채권 | - | 1,598,145,057 | - | 1,598,145,057 |
| 단기기타금융자산 | - | 32,590,133,505 | - | 32,590,133,505 |
| 파생상품자산 | 27,862,887 | - | - | 27,862,887 |
| 장기기타금융자산 | - | 1,503,973,595 | 145,486,546 | 1,649,460,141 |
| 합계 | 27,862,887 | 57,933,613,608 | 145,486,546 | 58,106,963,041 |
(2) 금융부채의 범주
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융부채 | 상각후원가측정 금융부채 |
합계 |
| 매입채무 | - | 11,896,972,492 | 11,896,972,492 |
| 단기기타채무 | - | 97,021,662 | 97,021,662 |
| 단기차입금 | - | 3,001,731,232 | 3,001,731,232 |
| 전환사채 | - | 106,419,187 | 106,419,187 |
| 파생상품자산 | 2,943,222 | - | 2,943,222 |
| 단기기타금융부채 | - | 1,950,634,118 | 1,950,634,118 |
| 장기기타금융부채 | - | 4,378,713,805 | 4,378,713,805 |
| 합계 | 2,943,222 | 21,431,492,496 | 21,434,435,718 |
<전기말>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융부채 | 상각후원가측정 금융부채 |
합계 |
| 매입채무 | - | 7,493,171,591 | 7,493,171,591 |
| 단기기타채무 | - | 35,408,293 | 35,408,293 |
| 단기차입금 | - | 701,146,398 | 701,146,398 |
| 전환사채 | - | 11,544,744,489 | 11,544,744,489 |
| 파생상품부채 | 2,732,912,980 | - | 2,732,912,980 |
| 단기기타금융부채 | - | 4,238,409,193 | 4,238,409,193 |
| 장기기타금융부채 | - | 5,509,721,609 | 5,509,721,609 |
| 합계 | 2,732,912,980 | 29,522,601,573 | 32,255,514,553 |
(3) 금융상품 범주별 순손익
<당3분기>
| (단위:원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 이자 | 평가손익 | 외화환산손익 | 외환차손익 | 파생상품평가손익 | 합 계 |
| <금융자산> | ||||||
| 현금및현금성자산 | 16,285,585 | - | 7,176,752 | 125,059,943 | - | 148,522,280 |
| 매출채권 및 기타채권 | - | - | 763,885,847 | 135,681,635 | - | 899,567,482 |
| 기타금융자산(유동) | 299,676,746 | - | - | - | - | 299,676,746 |
| 기타금융자산(비유동) | 55,742,623 | - | - | - | - | 55,742,623 |
| 파생상품자산 | - | - | - | - | 284,736,732 | 284,736,732 |
| 기타포괄손익-공정가치측정금융자산 | - | (106,989,629) | - | - | - | (106,989,629) |
| 당기손익-공정가치측정금융자산 | 90,779,838 | - | - | - | 90,779,838 | |
| 합계 | 462,484,792 | (106,989,629) | 771,062,599 | 260,741,578 | 284,736,732 | 1,672,036,072 |
| <금융부채> | ||||||
| 차입금 | (67,445,037) | - | - | - | - | (67,445,037) |
| 전환사채 | (602,590,598) | - | - | - | - | (602,590,598) |
| 매입채무 및 기타채무 | - | - | (180,132,619) | (138,283,122) | - | (318,415,741) |
| 기타금융부채 | (245,727,089) | - | - | (65,234,715) | - | (310,961,804) |
| 합계 | (915,762,724) | - | (180,132,619) | (203,517,837) | - | (1,299,413,180) |
| 총합계 | (453,277,932) | (106,989,629) | 590,929,980 | 57,223,741 | 284,736,732 | 372,622,892 |
<전3분기>
| (단위:원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 이자 | 평가손익 | 외화환산손익 | 외환차손익 | 파생상품평가손익 | 합 계 |
| <금융자산> | ||||||
| 현금및현금성자산 | 94,910,351 | - | 59,795,962 | 406,086,656 | - | 560,792,969 |
| 매출채권 및 기타채권 | - | - | 1,296,372,489 | 437,208,763 | - | 1,733,581,252 |
| 기타금융자산(유동) | 802,319,009 | - | - | 8,550,000 | - | 810,869,009 |
| 기타금융자산(비유동) | 3,460,963,879 | - | - | - | - | 3,460,963,879 |
| 파생상품자산 | - | - | - | - | (178,226,711) | (178,226,711) |
| 기타포괄손익-공정가치측정금융자산 | - | (253,194,787) | - | - | - | (253,194,787) |
| 합계 | 4,358,193,239 | (253,194,787) | 1,356,168,451 | 851,845,419 | (178,226,711) | 6,134,785,611 |
| <금융부채> | ||||||
| 차입금 | (1,409,897,796) | - | - | - | - | (1,409,897,796) |
| 전환사채 | (1,503,970,621) | - | - | - | - | (1,503,970,621) |
| 파생상품부채 | - | - | - | - | 788,922,375 | 788,922,375 |
| 매입채무 및 기타채무 | - | - | (156,435,527) | (333,284,702) | - | (489,720,229) |
| 기타금융부채 | (3,688,943,486) | - | - | - | - | (3,688,943,486) |
| 합계 | (6,602,811,903) | - | (156,435,527) | (333,284,702) | 788,922,375 | (6,303,609,757) |
| 총합계 | (2,244,618,664) | (253,194,787) | 1,199,732,924 | 518,560,717 | 610,695,664 | (168,824,146) |
4. 공정가치
(1) 보고기간말 현재 금융상품의 종류별 장부금액과 공정가치의 비교내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 현금및현금성자산 | 6,804,551,677 | (*1) |
| 매출채권 | 5,867,796,083 | (*1) |
| 단기기타채권 | 962,837,884 | (*1) |
| 단기기타금융자산 | 456,730,443 | (*1) |
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | 4,845,878,375 |
| 기타비유동금융자산 | 1,450,369,942 | (*1) |
| 기타포괄손익-공정가치측정금융자산 | 38,496,917 | 38,496,917 |
| 합계 | 20,426,661,321 | |
| <금융부채> | ||
| 매입채무 | 11,896,972,492 | (*1) |
| 단기기타채무 | 97,021,662 | (*1) |
| 단기차입금 | 3,001,731,232 | (*1) |
| 전환사채 | 106,419,187 | (*1) |
| 파생상품부채 | 2,943,222 | 2,943,222 |
| 단기기타금융부채 | 1,950,634,118 | (*1) (*2) |
| 장기기타금융부채 | 4,378,713,805 | (*1) (*2) |
| 합계 | 21,434,435,718 | |
(*1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 공시대상에서 제외하였습니다.
(*2) 리스부채는 기업회계기준서 제1107호 '금융상품: 공시'에 따라 공정가치 공시대상에서 제외하였습니다.
<전기말>
| (단위: 원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 현금및현금성자산 | 13,260,897,357 | (*1) |
| 매출채권 | 8,980,464,094 | (*1) |
| 단기기타채권 | 1,598,145,057 | (*1) |
| 단기기타금융자산 | 32,590,133,505 | (*1) |
| 파생상품자산 | 27,862,887 | 27,862,887 |
| 장기기타금융자산 | 1,503,973,595 | (*1) |
| 기타포괄손익-공정가치측정금융자산 | 145,486,546 | 145,486,546 |
| 합계 | 58,106,963,041 | |
| <금융부채> | ||
| 매입채무 | 7,493,171,591 | (*1) |
| 단기기타채무 | 35,408,293 | (*1) |
| 단기차입금 | 701,146,398 | (*1) |
| 전환사채 | 11,544,744,489 | (*1) |
| 파생상품부채 | 2,732,912,980 | 2,732,912,980 |
| 단기기타금융부채 | 4,238,409,193 | (*1) (*2) |
| 장기기타금융부채 | 5,509,721,609 | (*1) (*2) |
| 합계 | 32,255,514,553 | |
(*1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 공시대상에서 제외하였습니다.
(*2) 리스부채는 기업회계기준서 제1107호 '금융상품: 공시'에 따라 공정가치 공시대상에서 제외하였습니다.
(2) 공정가치로 측정되는 자산·부채의 공정가치 측정치
1) 공정가치 서열체계 및 측정방법
공정가치란 측정일에 시장참여자 사이의 정상거래에서 자산을 매도할 때 받거나 부채를 이전할 때 지급하게 될 가격을 의미합니다. 공정가치 측정은 측정일에 현행 시장 상황에서 자산을 매도하거나 부채를 이전하는 시장참여자 사이의 정상거래에서의 가격을 추정하는 것으로, 연결실체는 공정가치 평가시 시장정보를 최대한 사용하고, 관측 가능하지 않은 변수는 최소한으로 사용하고 있습니다.
연결실체는 공정가치로 측정되는 자산·부채를 공정가치 측정에 사용된 투입변수에 따라 다음과 같은 공정가치 서열체계로 분류하였습니다.
수준1 : 활성시장에서 공시되는 가격을 공정가치로 측정하는 자산·부채의 경우 동 자산·부채의 공정가치는 수준1로 분류됩니다. 공정가치가 수준1로 분류되는 자산·부채는 한국거래소 및 미국 나스닥에서 거래되는 종가를 기준으로 합니다.
수준2 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 모든 유의적인 투입변수가 시장에서 관측한 정보에 해당하면 자산·부채의 공정가치는 수준2로 분류됩니다.
수준3 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 하나 이상의 유의적인 투입변수가 시장에서 관측불가능한 정보에 해당하면 동 금융상품의 공정가치는 수준3으로 분류됩니다.
자산·부채의 공정가치는 자체적으로 개발한 내부평가모형을 통해 평가한 값을 사용하거나 독립적인 외부평가기관이 평가한 값을 제공받아 사용하고 있습니다.
2) 보고기간말 현재 재무상태표에 공정가치로 측정되는 자산·부채의 공정가치 서열체계별 공정가치 금액은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | - | 4,845,878,375 | - | 4,845,878,375 |
| 기타포괄손익-공정가치측정금융자산 : | - | ||||
| Inovio Pharmaceuticals Inc. (*1) | 38,496,917 | 38,496,917 | - | - | 38,496,917 |
| 합계 | 4,884,375,292 | 38,496,917 | 4,845,878,375 | - | 4,884,375,292 |
| <부채> | |||||
| 금융부채 : | |||||
| 파생상품부채(4CB) | 2,943,222 | - | - | 2,943,222 | 2,943,222 |
(*1) 당3분기말 현재 미국 나스닥(NASDAQ) 시장에서 형성된 주가를 반영하여 공정가치로 평가하였습니다.
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 기타포괄손익-공정가치측정금융자산 : | |||||
| Inovio Pharmaceuticals Inc. | 145,486,546 | 145,486,546 | - | - | 145,486,546 |
| 금융자산 : | |||||
| 파생상품자산(5CB) | 27,862,887 | - | - | 27,862,887 | 27,862,887 |
| 합계 | 173,349,433 | 145,486,546 | - | 27,862,887 | 173,349,433 |
| <부채> | |||||
| 금융부채 : | |||||
| 파생상품부채(4CB) | 332,290,672 | - | - | 332,290,672 | 332,290,672 |
| 파생상품부채(5CB) | 2,400,622,308 | - | - | 2,400,622,308 | 2,400,622,308 |
| 합계 | 2,732,912,980 | - | - | 2,732,912,980 | 2,732,912,980 |
(3) 공정가치 서열체계 수준3 관련 공시
1) 공정가치로 측정되는 자산·부채 중 공정가치 서열체계 수준3으로 분류된 자산·부채의 당기 변동내역은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 파생상품자산 | 파생상품부채 | 합계 |
| 기초잔액 | 27,862,887 | (2,732,912,980) | (2,705,050,093) |
| 당해 기간의 총손익 | |||
| 당기손익에 포함된 손익(*1) | (7,375,067) | 292,111,799 | 284,736,732 |
| 기타변동 | |||
| 상환으로 인한 정산 | (20,487,820) | 2,437,857,959 | 2,417,370,139 |
| 기말잔액 | - | (2,943,222) | (2,943,222) |
(*1) 공정가치 서열체계 수준3 변동내용 중 당기손익으로 인식된 금액과 보고기간말 현재 보유하고 있는 자산·부채의 미실현 손익 변동액으로서 당기손익에 포함된 금액은 포괄손익계산서상 다음과 같은 개별항목으로 표시되고 있습니다.
| (단위: 원) | |
|---|---|
| 구분 | 영업외손익(금융손익) |
| 당기손익 인식금액 | 284,736,732 |
| 보고기간말 현재 보유하고 있는 자산·부채의 미실현손익의 변동액으로서 당기손익에 포함된 금액 | 284,736,732 |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 파생상품자산 | 파생상품부채 | 합계 |
| 기초잔액 | 175,385,091 | - | 175,385,091 |
| 당해 기간의 총손익 | |||
| 당기손익에 포함된 손익(*1) | (178,226,711) | 788,922,375 | 610,695,664 |
| 기타변동 | |||
| 발행 | 11,723,139 | 4,844,175,785 | 4,855,898,924 |
| 기타증감 | |||
| 기말잔액 | 8,881,519 | 4,055,253,410 | 4,064,134,929 |
(*1) 공정가치 서열체계 수준3 변동내용 중 당기손익으로 인식된 금액과 보고기간말 현재 보유하고 있는 자산·부채의 미실현 손익 변동액으로서 당기손익에 포함된 금액은 포괄손익계산서상 다음과 같은 개별항목으로 표시되고 있습니다.
| (단위: 원) | |
|---|---|
| 구분 | 영업외손익(금융손익) |
| 당기손익 인식금액 | 610,695,664 |
| 보고기간말 현재 보유하고 있는 자산·부채의 미실현손익의 변동액으로서 당기손익에 포함된 금액 | 610,695,664 |
2) 보고기간말 현재 재무상태표에서 공정가치로 측정된 자산·부채 중 공정가치 서열체계 수준3으로 분류된 항목의 가치평가기법, 투입변수 및 유의적이지만 관측가능하지 않은 투입변수에 대한 범위 등은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 투입변수 | 유의적이지만 관측 가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수의 범위 | ||
| 평가일 주가 | 무위험할인율 | 주가변동성 | |||||
| 금융부채 : | |||||||
| 파생상품부채(4CB) | 2,943,222 | 옵션평가모형 | 3,900 원 | 3.53%~3.49% | 41.99% | 위험할인율 | 9.25%~10.15% |
<전기말>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 투입변수 | 유의적이지만 관측 가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수의 범위 | ||
| 평가일 주가 | 무위험할인율 | 주가변동성 | |||||
| 금융자산 : | |||||||
| 파생상품자산(4CB) | - | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 파생상품자산(5CB) | 27,862,887 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 합계 | 27,862,887 | ||||||
| 금융부채 : | |||||||
| 파생상품부채(4CB) | 332,290,672 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 파생상품부채(5CB) | 2,400,622,308 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 합계 | 2,732,912,980 | ||||||
3) 관측가능하지 않은 투입변수의 변동에 의한 공정가치 측정치의 민감도
(가) 관측가능하지 않은 투입변수의 변동이 공정가치 측정치에 미치는 영향은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 관측 가능하지 않은 투입변수 | 관측가능하지 않은 투입변수가 공정가치 측정에 미치는 영향 |
| 금융부채 : | ||||
| 파생상품부채(4CB) | 2,943,222 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 관측 가능하지 않은 투입변수 | 관측가능하지 않은 투입변수가 공정가치 측정에 미치는 영향 |
| 금융자산 : | ||||
| 파생상품자산(4CB) | - | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 파생상품자산(5CB) | 27,862,887 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 합계 | 27,862,887 | |||
| 금융부채 : | ||||
| 파생상품부채(4CB) | 332,290,672 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 파생상품부채(5CB) | 2,400,622,308 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 합계 | 2,732,912,980 | |||
(나) 관측가능하지 않은 투입변수의 변동이 금융자산과 금융부채의 공정가치 측정치에 미치는 효과는 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 변동효과의 계산방법 | 공정가치 변동 효과 | |
| 당기손익 | ||||
| 유리한 변동 | 불리한 변동 | |||
| 금융부채 : | ||||
| 파생상품부채(4CB) | - | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | - | - |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 변동효과의 계산방법 | 공정가치 변동 효과 | |
| 당기손익 | ||||
| 유리한 변동 | 불리한 변동 | |||
| 금융자산 : | ||||
| 파생상품자산(4CB) | - | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | - | - |
| 파생상품자산(5CB) | 27,862,887 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 27,922,236 | 27,804,815 |
| 합계 | 27,862,887 | 27,922,236 | 27,804,815 | |
| 금융부채 : | ||||
| 파생상품부채(4CB) | 332,290,672 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 295,995,707 | 368,174,406 |
| 파생상품부채(5CB) | 2,400,622,308 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 2,264,996,376 | 2,531,877,952 |
| 합계 | 2,732,912,980 | 2,560,992,083 | 2,900,052,358 | |
5. 현금및현금성자산
현금및현금성자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 현금 | 29,993,376 | 11,480,666 |
| 보통예금 | 6,774,558,301 | 7,949,720,209 |
| 기타금융자산 | - | 5,299,696,482 |
| 합계 | 6,804,551,677 | 13,260,897,357 |
6. 매출채권 및 기타채권
(1) 매출채권 및 기타채권의 내용은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | ||||
| 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | |
| 매출채권 | 13,826,041,558 | (443,414,102) | 13,382,627,456 | 10,540,716,961 | (1,560,252,867) | 8,980,464,094 |
| 단기기타채권 : | ||||||
| 미수금 | 938,662,446 | - | 938,662,446 | 1,489,098,607 | - | 1,489,098,607 |
| 미수수익 | 21,796,423 | (2,663,412) | 19,133,011 | 111,709,862 | (2,663,412) | 109,046,450 |
| 합계 | 14,786,500,427 | (446,077,514) | 14,340,422,913 | 12,141,525,430 | (1,562,916,279) | 10,578,609,151 |
(2) 보고기간말 현재 매출채권에 대해 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용하고 있으며, 매출채권의 신용위험정보의 세부내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 연체된 일수 | |||||
| 6개월 이하 | 6개월 초과 -> 1년 이하 | 1년 초과 -> 3년 이하 | 3년 초과 | 적용대상 제외 (*) | 계 | |
| 총장부금액 | 3,663,080,527 | 138,924,268 | 447,547,545 | 287,644,231 | 1,882,613,886 | 6,419,810,457 |
| 기대손실율 | 1.07% | 30.56% | 40.86% | 100.00% | - | 8.60% |
| 전체기간기대손실 | (39,050,853) | (42,460,370) | (182,858,920) | (287,644,231) | - | (552,014,374) |
| 순장부금액 | 3,624,029,674 | 96,463,898 | 264,688,625 | - | 1,882,613,886 | 5,867,796,083 |
(*) 개별평가 대상 채권의 경우 연체율을 적용하지 않고 개별평가를 수행하여 손실충당금을 인식하였습니다.
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 연체된 일수 | |||||
| 6개월 이하 | 6개월 초과 -> 1년 이하 | 1년 초과 -> 3년 이하 | 3년 초과 | 적용대상 제외 (*) | 계 | |
| 총장부금액 | 9,415,320,684 | 2,735,783,258 | 320,225,351 | 83,362,672 | (2,013,975,004) | 10,540,716,961 |
| 기대손실율 | 3.2% | 40.9% | 18.3% | 100.0% | - | 14.8% |
| 전체기간기대손실 | (299,508,643) | (1,118,849,578) | (58,531,974) | (83,362,672) | - | (1,560,252,867) |
| 순장부금액 | 9,115,812,041 | 1,616,933,680 | 261,693,377 | - | (2,013,975,004) | 8,980,464,094 |
(*) 특수관계인, 미청구분, 받을어음 및 전자어음은 연체율을 적용하지 않았으며 내부거래제거분도 포함되어 있습니다.
(3) 보고기간말 현재 매출채권 및 기타채권의 손실충당금(대손충당금)의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 매출채권 | 1,560,252,867 | 348,275,835 | (1,000,000) | (1,408,099,052) | 52,584,724 | 552,014,374 |
| 단기기타채권 : | ||||||
| 미수수익 | 2,663,412 | - | - | - | - | 2,663,412 |
| 합계 | 1,562,916,279 | 348,275,835 | (1,000,000) | (1,408,099,052) | 52,584,724 | 554,677,786 |
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 매출채권 | 342,071,302 | 927,045,105 | - | (24,932,416) | 178,812,083 | 1,422,996,074 |
| 단기기타채권 : | ||||||
| 미수수익 | 49,534,498 | 1,935,366 | (51,469,864) | - | - | - |
| 합계 | 391,605,800 | 928,980,471 | (51,469,864) | (24,932,416) | 178,812,083 | 1,422,996,074 |
7. 기타금융자산
(1) 기타금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 단기기타금융자산 : | ||
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | - |
| 상각후원가측정기타금융자산 | 571,587,011 | 32,704,990,073 |
| 차감 : 대손충당금 | (114,856,568) | (114,856,568) |
| 파생상품자산 | - | 27,862,887 |
| 소계 | 5,302,608,818 | 32,617,996,392 |
| 장기기타금융자산 : | ||
| 상각후원가측정기타금융자산 | 1,450,369,942 | 1,503,973,595 |
| 차감 : 대손충당금 | - | - |
| 기타포괄손익-공정가치측정금융자산 | 38,496,917 | 145,486,546 |
| 소계 | 1,488,866,859 | 1,649,460,141 |
| 합계 | 6,791,475,677 | 34,267,456,533 |
(2) 보고기간말 현재 기타금융자산의 손실충당금(대손충당금)의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 단기기타금융자산 : | ||||||
| 상각후원가측정기타금융자산 | 415,852,991 | 10,806,705 | - | - | 286,105,068 | 712,764,764 |
| 장기기타금융자산 : | ||||||
| 상각후원가측정기타금융자산 | 1,303,215,282 | 98,185,590 | - | - | (286,105,068) | 1,115,295,804 |
| 합계 | 1,719,068,273 | 108,992,295 | - | - | - | 1,828,060,568 |
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 단기기타금융자산 : | ||||||
| 상각후원가측정기타금융자산 | 170,630,000 | - | (166,663,458) | (3,966,542) | - | - |
(3) 보고기간말 현재 상각후원가측정기타금융자산의 내용은 다음과 같습니다.
(3) 보고기간말 현재 상각후원가측정기타금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 유동항목 : | ||
| 단기금융상품 | - | 32,000,000,000 |
| 대여금 | 194,856,568 | 194,856,568 |
| 선급부가세 | - | 168,345,902 |
| 보증금 | 376,730,443 | 341,787,603 |
| 차감 : 대손충당금 | (114,856,568) | (114,856,568) |
| 소계 | 456,730,443 | 32,590,133,505 |
| 비유동항목 : | ||
| 장기금융상품 | 2,000,000 | 2,000,000 |
| 보증금 | 1,448,369,942 | 1,392,801,442 |
| 차감 : 대손충당금 | - | - |
| 퇴직연금운용자산 | - | 109,172,153 |
| 소계 | 1,450,369,942 | 1,503,973,595 |
| 합계 | 1,907,100,385 | 34,094,107,100 |
(4) 기타포괄손익-공정가치측정금융자산
1) 보고기간말 현재 기타포괄손익-공정가치측정금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 장기기타포괄손익-공정가치측정금융자산 : | ||
| 시장성있는지분증권 | 38,496,917 | 145,486,546 |
2) 보고기간말 현재 장기기타포괄손익-공정가치측정금융자산의 내용은 다음과 같습니다.
<당3분기>
| (단위: 주,원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 주식수 | 지분율 | 취득원가 | 공정가치 | 장부금액 | 미실현보유손익 |
| Inovio Pharmaceuticals Inc.(*) | 73,590 | 0.03% | 1,414,226,499 | 38,496,917 | 38,496,917 | (1,375,729,582) |
(*)당3분기말 현재 미국 나스닥(NASDAQ) 시장에서 형성된 주가를 반영하여 공정가치로 평가하였습니다.
<전기말>
| (단위: 주,원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 주식수 | 지분율 | 취득원가 | 공정가치 | 장부금액 | 미실현보유손익 |
| Inovio Pharmaceuticals Inc. | 73,590 | 0.03% | 1,414,226,499 | 145,486,546 | 145,486,546 | (1,268,739,953) |
(5) 기타금융자산에 포함된 파생상품자산의 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 전환사채 옵션(*) | - | 27,862,887 |
(*) 당3분기말 중 5CB 전환사채가 전액 상환되어 당3분기말 현재 파생상품자산으로 인식될 금액은 없습니다.
(6) 보고기간말 현재 당기손익-공정가치측정금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 당기손익-공정가치측정금융자산: | ||
| 단기매매증권(MMF) | 4,845,878,375 | - |
8. 파생상품 및 위험회피회계
당3분기말과 전기말 현재 매매목적과 위험회피목적의 파생상품의 거래는 없습니다.
9. 재고자산
(1) 당3분기말과 전기말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 당3분기말 | 전기말 | ||||
| 취득원가 | 평가손실충당금 | 장부금액 | 취득원가 | 평가손실충당금 | 장부금액 | |
| 상품 | 2,295,396,832 | (184,290,007) | 2,111,106,825 | 3,142,662,411 | (93,628,044) | 3,049,034,367 |
| 제품 | 4,856,563,867 | (172,751,692) | 4,683,812,175 | 3,764,306,511 | (107,127,555) | 3,657,178,956 |
| 재공품 | 1,151,257,177 | - | 1,151,257,177 | 784,780,772 | - | 784,780,772 |
| 원재료 | 7,521,681,473 | (76,435,998) | 7,445,245,475 | 6,827,700,540 | (70,102,182) | 6,757,598,358 |
| 미착품 | 148,607,143 | - | 148,607,143 | 615,156,906 | - | 615,156,906 |
| 합계 | 15,973,506,492 | (433,477,697) | 15,540,028,795 | 15,134,607,140 | (270,857,781) | 14,863,749,359 |
(2) 당3분기와 전3분기 중 재고자산과 관련하여 인식한 평가손실 및 평가손실환입은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당3분기 | 전3분기 |
| 매출원가 : | ||
| 재고자산평가손실 | (162,619,916) | (69,045,009) |
| 재고자산평가손실환입 | - | 37,447,915 |
| 합계 | (162,619,916) | (31,597,094) |
10. 기타자산
보고기간말 현재 기타자산의 내용은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당3분기 | 전기말 | ||||
| 유동 | 비유동 | 계 | 유동 | 비유동 | 계 | |
| 선급금 | 250,593,127 | 347,109,919 | 597,703,046 | 194,373,227 | 516,562,810 | 710,936,037 |
| 선급비용 | 721,653,006 | - | 721,653,006 | 976,685,620 | - | 976,685,620 |
| 선급법인세 | 425,995,007 | - | 425,995,007 | 522,978,421 | - | 522,978,421 |
| 선급부가세 | 275,128,934 | - | 275,128,934 | - | - | - |
| 기타 | 51,590,159 | - | 51,590,159 | 47,866,707 | - | 47,866,707 |
| 합계 | 1,724,960,233 | 347,109,919 | 2,072,070,152 | 1,741,903,975 | 516,562,810 | 2,258,466,785 |
11. 관계기업 및 공동기업투자
당3분기말 및 전기말에 관계기업 및 공동기업투자는 없습니다.
12. 투자부동산
(1) 투자부동산의 내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 장부금액 | 공정가치(*) |
| 토 지 | 1,875,411,925 | - | - | 1,875,411,925 | 2,368,312,900 |
| 건 물 | 2,183,392,690 | (1,431,271,433) | - | 752,121,257 | 752,121,257 |
| 구축물 | 413,944,918 | (400,779,753) | - | 13,165,165 | 13,165,165 |
| 합계 | 4,472,749,533 | (1,832,051,186) | - | 2,640,698,347 | 3,133,599,322 |
(*) 토지는 공시지가로 기재하였으며, 건물은 취득원가에서 감가상각누계액을 차감한 장부가액으로 기재하였습니다.
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 장부금액 | 공정가치 |
| 토 지 | 1,875,411,925 | - | - | 1,875,411,925 | 2,560,402,600 |
| 건 물 | 2,183,392,690 | (1,390,746,034) | - | 792,646,656 | 792,646,656 |
| 합 계 | 4,058,804,615 | (1,390,746,034) | - | 2,668,058,581 | 3,353,049,256 |
(2) 투자부동산의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 토지 | 건물 | 구축물 | 합계 |
| 기초 | 1,875,411,925 | 792,646,656 | - | 2,668,058,581 |
| 취득 | - | - | - | - |
| 대체 (*) | - | 15,818,517 | 15,818,517 | |
| 처분 | - | - | - | - |
| 감가상각 | - | (40,525,399) | (2,653,352) | (43,178,751) |
| 기말 | 1,875,411,925 | 752,121,257 | 13,165,165 | 2,640,698,347 |
(*) 당3분기말 중 유형자산에서 대체되었습니다.
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 토지 | 건물 | 합계 |
| 기초 | 1,875,411,925 | 846,680,518 | 2,722,092,443 |
| 취득 | - | - | - |
| 처분 | - | - | - |
| 감가상각 | - | (40,525,399) | (40,525,399) |
| 기말 | 1,875,411,925 | 806,155,119 | 2,681,567,044 |
(3) 투자부동산은 신한은행과 체결한 일반대출, 무역금융 한도와 관련하여 담보로 제공되고 있습니다.
13. 유형자산
(1) 유형자산의 내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액(*) | 정부보조금 | 장부금액 |
| 토지 | 4,080,550,908 | - | - | 249,540,515 | - | 4,330,091,423 |
| 건물 | 82,301,984,019 | (2,072,148,427) | - | 4,047,389,614 | - | 84,277,225,206 |
| 구축물 | - | - | - | - | - | - |
| 기계장치 | 53,439,439,736 | (10,205,246,892) | - | (12,219,742) | - | 43,221,973,102 |
| 차량운반구 | 512,044,297 | (389,779,493) | - | 4,557,258 | - | 126,822,062 |
| 공구와기구 | 2,559,091 | (2,559,091) | - | - | - | - |
| 비품 | 7,864,696,032 | (3,463,595,989) | - | 58,017,224 | - | 4,459,117,267 |
| 리스개량자산 | 14,029,922,855 | (9,091,487,168) | - | 18,953,377 | - | 4,957,389,064 |
| 사용권자산-건물 | 12,290,301,105 | (7,129,647,400) | - | 142,699,691 | - | 5,303,353,396 |
| 사용권자산-차량 | 357,725,436 | (312,031,479) | - | 1,457,241 | - | 47,151,198 |
| 기타유형자산 | 2,470,696,394 | - | - | 1,040,923,687 | - | 3,511,620,081 |
| 건설중인자산 | - | - | - | - | - | - |
| 합계 | 177,349,919,873 | (32,666,495,939) | - | 5,551,318,865 | - | 150,234,742,799 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액(*) | 정부보조금 | 장부금액 |
| 토지 | 3,817,164,919 | - | - | 263,385,989 | - | 4,080,550,908 |
| 건물 | 961,302,235 | (596,659,807) | - | 28,202,716 | - | 392,845,144 |
| 구축물 | 413,944,918 | (398,126,401) | - | - | - | 15,818,517 |
| 기계장치 | 8,415,894,183 | (6,600,572,465) | - | 126,054,797 | - | 1,941,376,515 |
| 차량운반구 | 499,267,327 | (345,881,978) | - | 3,689,777 | - | 157,075,126 |
| 공구와기구 | 2,559,091 | (2,559,091) | - | - | - | - |
| 비품 | 6,125,606,248 | (2,384,863,843) | - | 26,404,815 | - | 3,767,147,220 |
| 리스개량자산 | 13,083,968,956 | (7,699,129,029) | - | 54,581,783 | - | 5,439,421,710 |
| 사용권자산-건물 | 11,981,700,487 | (5,337,351,381) | - | 172,658,138 | - | 6,817,007,244 |
| 사용권자산-차량 | 302,621,139 | (239,300,223) | - | 12,174,480 | - | 75,495,396 |
| 기타유형자산 | 16,420,463,208 | - | - | 600,989,559 | - | 17,021,452,767 |
| 건설중인자산 | 118,585,517,012 | - | - | (13,924,597,050) | - | 104,660,919,962 |
| 합계 | 180,610,009,723 | (23,604,444,218) | - | (12,636,454,996) | - | 144,369,110,509 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
(2) 유형자산의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구분 | 토지 | 건물 | 구축물(*2) | 기계장치 | 차량운반구 | 비품 | 리스개량자산 | 사용권자산 | 기타유형자산 | 건설중인자산 | 합계 | |
| 건물 | 기타 | |||||||||||
| 기초 | 4,080,550,908 | 392,845,144 | 15,818,517 | 1,941,376,515 | 157,075,126 | 3,767,147,220 | 5,439,421,710 | 6,817,007,244 | 75,495,396 | 17,021,452,767 | 104,660,919,962 | 144,369,110,509 |
| 취득 | - | 928,808,054 | - | 367,733,556 | - | 1,251,324,956 | 108,245,977 | - | 35,927,045 | - | - | 2,692,039,588 |
| 대체 |
- | 80,345,543,470 | (15,818,517) | 44,136,827,524 | - | 417,289,745 | - | 8,044,092 | - | (14,550,756,373) | (104,660,919,962) | 5,680,209,979 |
| 처분 | - | - | - | - | - | (12,298,327) | - | - | - | - | - | (12,298,327) |
| 감가상각 | - | (1,437,361,076) | - | (3,232,125,519) | (34,810,322) | (1,034,908,102) | (892,392,972) | (1,675,693,838) | (65,728,484) | - | - | (8,373,020,313) |
| 기타증감 (*1) | 249,540,515 | 4,047,389,614 | - | 8,161,026 | 4,557,258 | 70,561,775 | 302,114,349 | 153,995,898 | 1,457,241 | 1,040,923,687 | - | 5,878,701,363 |
| 기말금액 | 4,330,091,423 | 84,277,225,206 | - | 43,221,973,102 | 126,822,062 | 4,459,117,267 | 4,957,389,064 | 5,303,353,396 | 47,151,198 | 3,511,620,081 | - | 150,234,742,799 |
(*1) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
(*2) 당기 중 구축물을 투자부동산으로 대체하였습니다.
<전3분기>
| (단위: 원) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구분 | 토지 | 건물 | 구축물 | 기계장치 | 차량운반구 | 비품 | 리스개량자산 | 사용권자산 | 기타유형자산 | 건설중인자산 | 합계 | |
| 건물 | 기타 | |||||||||||
| 기초 | 3,817,164,919 | 399,181,833 | 19,356,317 | 10,112,467,839 | 149,285,006 | 2,753,014,577 | 6,170,417,046 | 8,599,178,483 | 188,769,441 | - | 78,282,725,630 | 110,491,561,091 |
| 취득 | - | - | - | 37,637,058,687 | 52,120,086 | 2,179,405,315 | 131,354,964 | - | - | - | (11,033,138,387) | 28,966,800,665 |
| 처분 | - | - | - | - | - | - | - | - | (14,963,183) | - | - | (14,963,183) |
| 감가상각 | - | (25,442,384) | (2,653,352) | (637,106,734) | (29,799,539) | (630,962,289) | (999,104,858) | (1,575,383,095) | (81,002,631) | - | - | (3,981,454,882) |
| 기타증감 (*) | 802,715,490 | 80,617,935 | - | 2,043,468,591 | 8,992,947 | 238,284,920 | 1,166,957,144 | 776,900,494 | 21,429,867 | - | 18,844,475,217 | 23,983,842,605 |
| 기말금액 | 4,619,880,409 | 454,357,384 | 16,702,965 | 49,155,888,383 | 180,598,500 | 4,539,742,523 | 6,469,624,296 | 7,800,695,882 | 114,233,494 | - | 86,094,062,460 | 159,445,786,296 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
(3) 유형자산의 감가상각비는 원가와 판매비와관리비로 분류되었습니다.
(4) 유형자산 중 일부는 일반대출과 관련하여 담보로 제공되고 있습니다. (주석 41 참조)
14. 무형자산
(1) 무형자산의 내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액(*) | 정부보조금 | 장부금액 |
| 영업권 | 183,185,000 | (183,185,000) | - | - | - | - |
| 특허권 | 91,046,524 | (69,879,686) | - | - | - | 21,166,838 |
| 기타의무형자산 | 12,766,925,010 | (12,547,576,557) | - | 13,101,072 | - | 232,449,525 |
| 산업재산권 | 1,045,666,418 | (921,707,559) | - | 68,416,476 | - | 192,375,335 |
| 합계 | 14,086,822,952 | (13,722,348,802) | - | 81,517,548 | - | 445,991,698 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액(*) | 정부보조금 | 장부금액 |
| 영업권 | 183,185,000 | (183,185,000) | - | - | - | - |
| 특허권 | 91,046,524 | (65,529,525) | - | - | - | 25,516,999 |
| 기타의무형자산 | 10,486,857,243 | (10,272,096,519) | - | 14,888,455 | - | 229,649,179 |
| 산업재산권 | 965,966,630 | (653,576,125) | - | (3,641,691) | - | 308,748,814 |
| 합계 | 11,727,055,397 | (11,174,387,169) | - | 11,246,764 | - | 563,914,992 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
(2) 무형자산의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 특허권 | 기타의무형자산 | 산업재산권 | 합계 |
| 기초 | 25,516,999 | 229,649,179 | 308,748,814 | 563,914,992 |
| 취득 | - | - | 32,231,333 | 32,231,333 |
| 처분 | - | - | - | - |
| 감가상각 | (4,350,161) | (10,300,726) | (217,021,288) | (231,672,175) |
| 기타증감(*) | - | 13,101,072 | 68,416,476 | 81,517,548 |
| 기말 | 21,166,838 | 232,449,525 | 192,375,335 | 445,991,698 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
<전3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 특허권 | 기타의무형자산 | 산업재산권 | 합계 |
| 기초 | 36,241,587 | 228,912,365 | 377,941,169 | 643,095,121 |
| 취득 | - | - | 68,202,960 | 68,202,960 |
| 처분 | - | - | - | - |
| 감가상각 | (9,274,544) | (10,604,316) | (134,670,400) | (154,549,260) |
| 기타증감 | - | 43,881,356 | 61,870,400 | 105,751,756 |
| 기말 | 26,967,043 | 262,189,405 | 373,344,129 | 662,500,577 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
(3) 무형자산상각비의 포괄손익계산서의 계정과목별 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전반기 |
| 판매비와관리비 | 224,371,450 | 94,719,832 |
| 매출원가 | 7,300,725 | 4,614,944 |
| 합계 | 231,672,175 | 99,334,776 |
(4) 비용으로 인식한 연구와 개발 지출의 총액은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 계정과목 | 당3분기 | 전반기 |
| 손익계산서 | 경상연구개발비 | 5,219,333,898 | 6,935,667,396 |
(5) 무형자산 중 권리가 제한되어 있는 자산은 없습니다.
15. 차입원가
자본화를 위한 차입금은 없습니다.
16. 정부보조금
연결실체는 신약개발과 관련하여 정부과제수행에 따른 정부보조금을 수령하였습니다. 정부보조금 사용금액과 관련하여 당3분기 중 수익으로 인식한 금액은 6,111,873원입니다. 정부과제로 수령한 보조금과 관련하여 정부지원에 부수되는 조건이 미이행된 금액은 선수금으로 계상하고 있으며,당3분기말 현재 잔액은 없습니다.
17. 리스
(1) 보고기간말 현재 기초자산 유형별 사용권자산의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
|
부동산 |
5,303,353,396 | 6,817,007,244 |
| 차량리스 | 12,860,237 | 17,489,922 |
| 기타 | 34,290,961 | 58,005,474 |
| 합계 | 5,350,504,594 | 6,892,502,640 |
당3분기 중 증가된 사용권자산은 없습니다.
(2) 보고기간 중 리스와 관련해 손익으로 인식된 금액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
|
사용권자산의 감가상각비 |
||
|
부동산 |
1,678,522,580 | 1,575,383,095 |
| 차량리스 | 4,629,685 | 6,624,776 |
| 기타 | 58,270,057 | 74,377,855 |
|
합계 |
1,741,422,322 | 1,656,385,726 |
|
리스부채에 대한 이자비용 |
226,108,256 | 280,409,708 |
|
단기리스가 아닌 소액자산 리스료 |
4,730,029 | 4,494,792 |
리스의 총 현금유출은 1,792,168,858원입니다.
(3) 보고기간말 현재 리스부채의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기말 | 전기말 | ||
| 최소리스료 | 최소리스료의 현재가치 |
최소리스료 | 최소리스료의 현재가치 |
|
| 1년 이내 | 1,916,280,179 | 1,739,959,403 | 2,312,114,374 | 1,911,460,908 |
| 1년 초과 5년 이내 | 5,353,778,235 | 4,377,513,818 | 6,461,246,944 | 5,508,521,609 |
| 합계 | 7,270,058,414 | 6,117,473,221 | 8,773,361,318 | 7,419,982,517 |
(4) 보고기간말 현재 리스부채의 유동성분류 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 유동 | 1,739,959,404 | 1,911,460,908 |
| 비유동 | 4,377,513,805 | 5,508,521,609 |
| 합계 | 6,117,473,209 | 7,419,982,517 |
18. 매각예정자산
보고기간말 현재 매각예정 비유동자산은 없습니다.
19. 매입채무 및 기타채무
매입채무 및 기타채무의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 매입채무 | 11,896,972,492 | 7,493,171,591 |
| 단기기타채무 | 97,021,662 | 35,408,293 |
| 합계 | 11,993,994,154 | 7,528,579,884 |
20. 차입금 및 전환사채
(1) 차입금 및 전환사채의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 차입처 | 연이자율 | 당3분기 | 전기 |
| 유동 : | ||||
| 외화단기차입금 | Shinhan Bank VN | Libor 3M+2.5%P | 901,731,232 | 701,146,398 |
| 일반대출 | 신한은행 | 6.24% | 2,100,000,000 | - |
| 제4회 전환사채 | - | 0.00% | 106,419,187 | 3,862,188,755 |
| 제5회 전환사채 | - | 1.00% | - | 7,682,555,734 |
| 합계 | 3,108,150,419 | 12,245,890,887 | ||
(2) 전환사채의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | ||
| 제 4회(*1) | 제 5회(*2) | 제 4회 | 제 5회 | |
| 전환사채 | 100,000,000 | - | 4,160,000,000 | 11,700,000,000 |
| 사채상환할증금 | 9,380,600 | - | 390,232,960 | 731,682,900 |
| 전환권조정 | (2,832,711) | - | (658,142,058) | (4,560,136,881) |
| 사채할인발행차금 | (128,702) | - | (29,902,147) | (188,990,285) |
| 합계 | 106,419,187 | - | 3,862,188,755 | 7,682,555,734 |
(*1) 현재 4회차 사채총액 240억원은 2023년 11월 25일 만기가 도래함에 따라 전액 상환되었습니다.
(*2) 당3분기말 현재 5회차 전환사채는 계약조건에 따라 전액(117억원) 조기상환 하였습니다.
(3) 전환사채의 발행내역은 다음과 같습니다.
| 구분 | 제4회 전환사채 (무기명식 무보증) | 제5회 전환사채 (무기명식 무보증) |
|---|---|---|
| 권면총액(원) | 24,000,000,000 | 11,700,000,000 |
| 표면이자율 | 0% | 1% |
| 만기이자율 | 3% | 3% |
| 발행일 | 2020년 11월 25일 | 2022년 04월 15일 |
| 만기일 | 2023년 11월 25일 | 2025년 04월 15일 |
| 상환방법 | 만기상환 | 만기상환 |
| 조기상환청구권 가능시기 | 2022년 05월 25일 | 2023년 10월 15일 |
| 전환청구기간 | 2021년 11월 25일~2023년 10월 25일 | 2023년 04월 15일~2025년 03월 15일 |
| 전환가격(발행시) | 27,143 원 | 13,935 원 |
| 조정후전환가격(당3분기말 현재) | 12,301 원 | - |
(4) 당3분기 중 주가변동으로 인하여 전환사채의 전환권 및 옵션의 평가손익이 발생하였습니다. 해당 파생상품평가손익은 포괄손익계산서에 금융손익으로 계상하였습니다.
21. 기타금융부채
(1) 기타금융부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 단기기타금융부채 : | ||
| 상각후원가측정금융부채 | 1,950,634,118 | 4,238,409,193 |
| 파생상품부채 | 2,943,222 | 2,732,912,980 |
| 소계 | 1,953,577,340 | 6,971,322,173 |
| 장기기타금융부채 : | ||
| 상각후원가측정금융부채 | 4,378,713,805 | 5,509,721,609 |
| 소계 | 4,378,713,805 | 5,509,721,609 |
| 합계 | 6,332,291,145 | 12,481,043,782 |
(2) 상각후원가로 측정되는 금융부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| <단기> | ||
| 미지급비용 | 210,674,714 | 2,326,948,285 |
| 리스부채 | 1,739,959,404 | 1,911,460,908 |
| 소계 | 1,950,634,118 | 4,238,409,193 |
| <장기> | ||
| 리스부채 | 4,377,513,805 | 5,508,521,609 |
| 수입보증금 | 1,200,000 | 1,200,000 |
| 소계 | 4,378,713,805 | 5,509,721,609 |
| 합계 | 6,329,347,923 | 9,748,130,802 |
(3) 기타금융부채에 포함된 파생상품부채의 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 전환사채 옵션(*) | 2,943,222 | 2,732,912,980 |
(*) 전환사채의 옵션가치는 변동성을 고려하여 평가하였습니다.
22. 퇴직급여부채
연결실체는 종업원을 위하여 확정급여제도를 운영하고 있으며, 이 제도는 종업원의 퇴직시 근속 1년당 최종 3개월 평균급여에 지급률을 곱한 금액을 지급하도록 되어 있습니다. 확정급여채무의 보험수리적 평가는 적격성이 있는 독립적인 보험계리인에 의해서 예측단위적립방식을 사용하여 수행되었으며, 임원 및 정년초과자는 비계속기준에 의해서 산출되었습니다.
(1) 퇴직급여부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 확정급여채무의 현재가치 | 11,574,051,222 | 10,685,769,121 |
| 사외적립자산의 공정가치 | (11,016,407,735) | (10,794,941,274) |
| 재무상태표에 인식하는 부채(합계) | 557,643,487 | - |
| 재무상태표에 인식하는 자산(합계) | - | 109,172,153 |
(2) 확정급여채무
확정급여채무의 변동내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 기초 | 10,685,769,121 | 9,273,539,562 |
| 근무원가 | 677,812,185 | 514,239,534 |
| 이자원가 | 373,925,016 | 159,368,643 |
| 재측정요소 | - | - |
| 지급액 | (163,455,100) | (198,764,767) |
| 기말 | 11,574,051,222 | 9,748,382,972 |
(3) 사외적립자산
1) 사외적립자산의 공정가치 변동내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 기초 | 10,794,941,274 | 8,453,185,158 |
| 이자수익 | 370,750,261 | 118,334,065 |
| 재측정요소 | - | - |
| 사용자의 기여금 | - | 800,000,000 |
| 급여지급액 | (149,283,800) | (182,348,100) |
| 기말 | 11,016,407,735 | 9,189,171,123 |
2) 사외적립자산의 구성내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 현금 | 13,839 | 94,395 |
| 정기예금 | 11,016,393,896 | 10,794,846,879 |
| 합계 | 11,016,407,735 | 10,794,941,274 |
3) 사외적립자산의 실제수익은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 사외적립자산 | 253,713,228 | 75,711,725 |
(4) 총비용
1) 당기손익으로 인식한 총비용의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 당기근무원가 | 677,812,185 | 514,239,534 |
| 이자원가 | 373,925,016 | 159,368,643 |
| 이자수익 | (370,750,261) | (118,334,065) |
| 합계 | 680,986,940 | 555,274,112 |
2) 당기손익으로 인식한 총비용의 계정과목별 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 판매비와관리비 | 680,986,940 | 555,274,112 |
(5) 보험수리적가정
보험수리적가정의 주요 내용은 다음과 같습니다.
| (단위: %) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 할인율 | 5.13 | 5.13 |
| 임금상승률 | 4.86 | 4.86 |
| 예상퇴직률 | 10.56 | 10.56 |
23. 충당부채
복구충당부채의 변동내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 충당부채변동내용 : | ||
| 기초 | 171,350,978 | 133,776,590 |
| 설정 | - | 31,310,356 |
| 사용 | ||
| 환입 | ||
| 현재가치기간경과 | 19,618,833 | 15,790,866 |
| 기말 : | ||
| 유동성 | - | |
| 비유동성 | 190,969,811 | 180,877,812 |
| 기타사항 : | ||
| 충당부채의 성격 | 임차건물 원상복구 | 임차건물 원상복구 |
| 경제적효익유출예상시기 | 2026-05-31 | 2026-05-31 |
24. 기타부채
보고기간말 현재 기타부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 기타유동부채 : | ||
| 선수금 | 5,313,233,749 | 7,064,936,536 |
| 제세예수금 | 58,900,884 | 24,958,860 |
| 종업원미지급비용 | 1,612,244,505 | - |
| 기타충당부채 | 1,762,130,442 | - |
| 소계 | 8,746,509,580 | 7,089,895,396 |
| 기타유동부채 : | ||
| 장기선수금 | 1,637,373,491 | 1,421,300,604 |
| 소계 | 1,637,373,491 | 1,421,300,604 |
| 합계 | 10,383,883,071 | 8,511,196,000 |
25. 계약자산과 계약부채
보고기간말 현재 계약자산과 계약부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 용역 계약자산 - 미청구공사(*1) | 1,461,710,067 | 2,744,975,488 |
| 용역 계약자산 - 선급계약 (*2) | 347,109,919 | 4,425,933,195 |
| 차감: 손실충당금 | - | |
| 계약자산 합계 | 1,808,819,986 | 7,170,908,683 |
| 용역 계약부채 - 공사선수금(*3) | 2,725,779,544 | 1,976,470,954 |
| 용역 계약부채 - 초과청구공사(*3) | 4,695,012,841 | 5,813,164,232 |
| 계약부채 합계 | 7,420,792,385 | 7,789,635,186 |
(*1) 해당 자산은 연결재무상태표 상 매출채권으로 분류되었습니다.
(*2) 해당 자산은 연결재무상태표 상 기타비유동자산(장기선급금)으로 분류되었습니다.
(*3) 해당 부채는 연결재무상태표 상 기타유동부채(선수금) 및 기타비유동부채(장기선수금)로 분류되었습니다.
26. 자본금과 주식발행초과금
(1) 자본금
1) 자본금의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 발행할주식의 총수 | 300,000,000 | 300,000,000 |
| 1주당 액면금액 | 1,000 | 1,000 |
| 발행한 주식수 | 보통주 78,473,817 주 | 보통주 77,751,599 주 |
| 보통주자본금 | 78,473,817,000 | 77,751,599,000 |
2) 자본금 및 주식발행초과금의 변동내용은 다음과 같습니다.
| (단위:원) | |||||
|---|---|---|---|---|---|
| 구분 | 일자 | 주식수 | 주당발행금액 | 자본금 | 주식발행초과금 |
| <당3분기> | |||||
| 당기초 | 77,751,599 | 1,000 | 77,751,599,000 | 211,749,282,814 | |
| 유상증자 | 2023-09-18 | 722,218 | 1,000 | 722,218,000 | 1,742,126,920 |
| 당(3분)기말 | 78,473,817 | 1,000 | 78,473,817,000 | 213,491,409,734 | |
| <전기> | |||||
| 전기초 | 77,479,055 | 1,000 | 77,479,055,000 | 206,606,623,975 | |
| 전환사채 주식전환 | 2022-01-03 | 64,977 | 1,000 | 64,977,000 | 1,214,828,587 |
| 전환사채 주식전환 | 2022-01-05 | 19,493 | 1,000 | 19,493,000 | 362,599,518 |
| 주식선택권 행사 | 2022-01-06 | 50,000 | 1,000 | 50,000,000 | 1,384,895,968 |
| 전환사채 주식전환 | 2022-03-28 | 64,977 | 1,000 | 64,977,000 | 1,213,748,708 |
| 전환사채 주식전환 | 2022-07-15 | 16,244 | 1,000 | 16,244,000 | 177,910,925 |
| 전환사채 주식전환 | 2022-07-19 | 24,366 | 1,000 | 24,366,000 | 267,371,854 |
| 전환사채 주식전환 | 2022-07-21 | 32,487 | 1,000 | 32,487,000 | 356,821,471 |
| 전3분기말 | 77,751,599 | 1,000 | 77,751,599,000 | 211,584,801,006 | |
(2) 주식발행초과금
1) 주식발행초과금의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 주식발행초과금 | 213,491,409,734 | 211,749,282,814 |
2) 주식발행초과금의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 주식발행초과금 | 211,749,282,814 | 1,742,126,920 | - | 213,491,409,734 |
<전3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 주식발행초과금 | 206,606,623,975 | 4,978,177,031 | - | 211,584,801,006 |
27. 기타자본
(1) 기타자본의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 신주인수권대가 | 2,063,517,465 | 2,063,517,465 |
| 전환권대가 | 11,681,833 | 485,964,253 |
| 자기주식 | (2,955,448,445) | (2,955,448,445) |
| 기타자본조정 | 2,025,020,495 | 2,025,020,495 |
| 주식선택권 | 18,680,494,631 | 18,680,494,631 |
| 합계 | 19,825,265,979 | 20,299,548,399 |
(2) 기타자본의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 신주인수권대가 | 2,063,517,465 | - | - | 2,063,517,465 |
| 전환권대가(*) | 485,964,253 | - | (474,282,420) | 11,681,833 |
| 자기주식 | (2,955,448,445) | - | - | (2,955,448,445) |
| 기타자본조정 | 2,025,020,495 | - | - | 2,025,020,495 |
| 주식선택권 | 18,680,494,631 | - | - | 18,680,494,631 |
| 합계 | 20,299,548,399 | - | (474,282,420) | 19,825,265,979 |
(*) 전환사채의 전환권행사로 감소하였습니다.
<전3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 신주인수권대가 | 2,063,517,465 | - | - | 2,063,517,465 |
| 전환권대가 | 1,200,892,432 | - | (691,564,513) | 509,327,919 |
| 자기주식 | (2,955,448,445) | - | - | (2,955,448,445) |
| 기타자본조정 | 2,002,155,311 | 17,756,261 | - | 2,019,911,572 |
| 주식선택권 | 19,210,094,631 | - | (529,600,000) | 18,680,494,631 |
| 합계 | 21,521,211,394 | 17,756,261 | (1,221,164,513) | 20,317,803,142 |
(3) 자기주식
자사주식의 가격안정과 주식배당 및 무상증자시 발행한 단주의 처리를 위하여 기명식 보통주식을 시가로 취득하고 있으며, 향후 시장상황에 따라 처분할 예정입니다. 당3분기말 중 자기주식의 변동사항은 없습니다.
| (단위: 주,원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전반기 | ||
| 주식수 | 금액 | 주식수 | 금액 | |
| 기초 | 209,464 | (2,955,448,445) | 209,464 | (2,955,448,445) |
| 기말 | 209,464 | (2,955,448,445) | 209,464 | (2,955,448,445) |
(4) 주식기준보상제도
1) 주식선택권 미행사 주식은 당기 중에 전부 만기 소멸되었습니다.
2) 주식선택권 부여주식수의 변동내용은 다음과 같습니다.
| (단위: 주) | ||
|---|---|---|
| 구분 | 당3분기 | 전반기 |
| 4차 | 4차 | |
| 기초 | 1,438,300 | 1,488,300 |
| 행사 | - | (50,000) |
| 만기소멸 | (1,438,300) | - |
| 기말 | - | 1,438,300 |
| 기말행사가능 | 0 | 1,438,300 |
3) 당3분기말와 전기 중 주식선택권 관련 보상원가의 내역은 없습니다.
28. 기타포괄손익누계액
(1) 기타포괄손익누계액의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 | (1,375,729,582) | (1,268,739,953) |
| 해외사업환산손익 (*) | 23,053,827,655 | 10,094,706,537 |
| 합계 | 21,678,098,073 | 8,825,966,584 |
(*) 내부거래에서 발생된 외화환산손익을 반영하였습니다.
(2) 기타포괄손익누계액의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 |
기초 |
증가 | 재분류조정 | 기타감소 | 법인세효과 | 기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 | (1,268,739,953) | (106,989,629) | - | - | - | (1,375,729,582) |
| 해외사업환산손익 | 10,094,706,537 | 12,959,121,118 | - | - | - | 23,053,827,655 |
| 합계 | 8,825,966,584 | 12,852,131,489 | - | - | - | 21,678,098,073 |
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 |
기초 |
증가 | 재분류조정 | 기타감소 | 법인세효과 | 기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 | (978,894,183) | (253,194,787) | - | - | - | (1,232,088,970) |
| 해외사업환산손익 | 149,195,408 | 29,640,138,770 | - | - | - | 29,789,334,178 |
| 합계 | (829,698,775) | 29,386,943,983 | - | - | - | 28,557,245,208 |
29. 이월결손금
(1) 이월결손금의 변동내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 과 목 | 당3분기말 | 전3분기말 |
| 기초금액 | (137,155,104,297) | (99,322,788,686) |
| 반기순이익(손실) | (37,966,874,829) | (23,499,642,871) |
| 재측정요소 | - | - |
| 기말금액 | (175,121,979,126) | (122,822,431,557) |
(2) 당3분기말 중 배당금 지급내용은 없습니다.
30. 매출액 및 매출원가
(1) 매출액의 내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상품매출 | 1,317,164,667 | 3,818,203,963 | 1,453,898,837 | 4,832,545,596 |
| 제품매출 | 1,685,515,678 | 5,381,788,781 | 2,343,887,355 | 7,254,656,926 |
| CDMO매출 | 8,388,666,123 | 17,372,509,115 | 8,003,092,914 | 25,738,830,051 |
| 기타 | 334,626,189 | 875,841,251 | 747,097,427 | 1,046,855,188 |
| 합계 | 11,725,972,657 | 27,448,343,110 | 12,547,976,533 | 38,872,887,761 |
(2) 매출원가의 내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| <제품매출원가> | ||||
| 기초제품 | 5,662,522,642 | 3,764,306,511 | 3,166,425,050 | 3,324,252,599 |
| 당기제품제조원가 | 726,685,954 | 6,347,407,890 | 2,151,799,770 | 6,466,928,387 |
| 기말제품 | (4,856,563,867) | (4,856,563,867) | (3,140,665,139) | (3,140,665,139) |
| 제품매출원가 | 1,532,644,729 | 5,255,150,534 | 2,177,559,681 | 6,650,515,847 |
| <상품매출원가> | ||||
| 기초상품 | 2,435,915,707 | 3,142,662,411 | 2,750,638,498 | 2,005,411,207 |
| 당기상품매입원가 | 2,344,674,403 | 3,977,123,856 | 1,734,023,319 | 5,461,274,776 |
| 기말상품 | (2,295,396,832) | (2,295,396,832) | (3,186,586,566) | (3,186,586,566) |
| 상품매출원가 | 2,485,193,278 | 4,824,389,435 | 1,298,075,251 | 4,280,099,417 |
| <CDMO매출원가> | 8,982,649,829 | 24,124,045,246 | 7,066,868,691 | 16,198,513,644 |
| 합계 | 13,000,487,836 | 34,203,585,215 | 10,542,503,623 | 27,129,128,908 |
31. 용역계약
(1) 용역계약잔액의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: USD) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 변동(*) | 공사수익인식 | 기말 |
| CDMO매출 | 9,283,470 | 12,423,058 | 13,360,180 | 8,346,348 |
(*) 신규수주 및 계약변경증액은 USD 12,840,869이며, 계약변경감소액은 USD 417,811입니다.
<전3분기>
| (단위: USD) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 변동 | 공사수익인식 | 기말 |
| CDMO매출 | 9,181,388 | 21,476,193 | (20,284,364) | 10,373,217 |
(2) 미청구공사 및 초과청구공사의 내용은 다음과 같습니다.
| (단위: USD) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 당3분기 | 전기 | ||||
| 선수금 | 미청구공사 | 초과청구공사 | 선수금 | 미청구공사 | 초과청구공사 | |
| CDMO매출 | 2,026,903 | 1,086,935 | 3,491,235 | 1,559,592 | 2,166,002 | 4,587,046 |
(3) 보고기간 중 원가기준 투입법을 적용하여 기간에 걸쳐 수익을 인식한 계약으로서 계약금액이 전기 매출액의 5% 이상인 주요 계약의 내역은 다음과 같습니다.
<당3분기>
| (단위: USD) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 회사명 | 품목 (*1) | 발주처 (*1) | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
| 총액 | 손실충당금 | 총액 | 손실충당금 | |||||||
| 진원생명과학(주) | 임상용 Plasmid DNA | A 회사 | 2023-01-31 | 2024-01-30 | 5,311,200 | 16.2% | - | - | 663,288 | 3,250 |
| 진원생명과학(주) | 임상용 Plasmid DNA | B 회사 | 2022-02-01 | 2022-12-31 | 2,441,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | C 회사 | 2022-02-23 | 2023-04-30 | 2,416,700 | 100.00% | 68,750 | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | D 회사 | 2022-05-26 | 2023-04-30 | 2,211,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | E 회사 | 2022-02-02 | 2022-09-30 | 1,966,600 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | F 회사 | 2019-09-20 | 2022-12-31 | 2,831,061 | 100.00% | - | - | - | - |
| 합계 | 17,178,061 | 68,750 | - | 663,288 | 3,250 | |||||
(*1) 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았습니다.
<전기>
| (단위: USD) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 회사명 | 품목 (*1) | 발주처 (*1) | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
| 총액 | 손실충당금 | 총액 | 손실충당금 | |||||||
| 진원생명과학(주) | 임상용 Plasmid DNA | 가 회사 | 2019-09-04 | 2021-04-30 | 3,468,245 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | 나 회사 | 2020-12-18 | 2022-01-31 | 2,388,700 | 100.0% | 192,025 | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | 다 회사 | 2021-01-08 | 2022-03-31 | 2,769,820 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | 라 회사 | 2022-01-29 | 2022-12-31 | 2,441,250 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | 마 회사 | 2022-02-12 | 2022-09-30 | 2,966,600 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | 바 회사 | 2022-02-23 | 2023-04-30 | 2,416,700 | 98.0% | 933,441 | - | 45,000 | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | 사 회사 | 2022-03-24 | 2023-08-31 | 1,650,000 | 100.0% | - | - | 275,000 | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | 아 회사 | 2022-05-26 | 2023-04-30 | 1,936,250 | 100.0% | 550,000 | - | 206,250 | - |
| 합계 | 20,037,565 | 1,675,466 | - | 526,250 | - | |||||
(*1) 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았으며, 전기의 발주처명을 영어 알파벳에서 당기의 발주처 영어 알파벳과 혼동을 주지 않기 위하여 한글명으로 변경 하였습니다.
32. 판매비와 관리비
판매비와관리비의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 3,802,657,165 | 11,917,386,062 | 2,782,137,457 | 14,711,269,639 |
| 퇴직급여 | 233,542,034 | 680,986,940 | 181,913,719 | 555,274,112 |
| 복리후생비 | 467,647,140 | 1,378,873,030 | 367,230,216 | 1,222,653,574 |
| 여비교통비 | 85,944,694 | 306,073,511 | 109,279,516 | 283,064,080 |
| 접대비 | 17,274,090 | 92,394,036 | 49,576,637 | 101,401,844 |
| 통신비 | 43,031,970 | 129,072,582 | 31,227,654 | 87,115,429 |
| 수도광열비 | 269,009,339 | 535,664,409 | 326,668,852 | 477,647,986 |
| 교육훈련비 | 1,600,821 | 3,825,169 | 530,261 | 4,355,732 |
| 세금과공과 | 88,225,934 | 223,819,726 | 50,913,805 | 163,451,549 |
| 감가상각비 | 1,472,893,195 | 3,499,744,269 | 577,444,001 | 1,686,821,396 |
| 지급임차료 | 173,492,285 | 520,133,311 | 166,609,450 | 488,338,188 |
| 수선비 | 8,509,270 | 21,624,953 | 8,291,128 | 21,736,347 |
| 보험료 | 53,676,117 | 163,766,932 | 38,036,689 | 80,500,678 |
| 차량유지비 | 21,076,040 | 78,165,303 | 32,479,395 | 97,333,606 |
| 경상연구개발비 | 1,687,986,552 | 5,219,333,898 | 1,877,073,355 | 8,812,740,751 |
| 운반비 | 36,431,044 | 106,767,404 | 32,575,366 | 103,504,074 |
| 도서인쇄비 | 11,820,390 | 21,375,623 | 1,074,525 | 6,035,633 |
| 회의비 | 3,654,693 | 12,678,499 | 3,578,833 | 12,112,882 |
| 사무용품비 | 43,904,533 | 180,607,757 | 75,297,506 | 156,399,397 |
| 소모품비 | (37,563,022) | 41,277,919 | 6,928,001 | 29,129,720 |
| 지급수수료 | 1,250,276,466 | 3,837,841,621 | 1,395,855,938 | 3,030,722,432 |
| 무형자산상각비 | 87,253,133 | 224,371,450 | 52,705,113 | 147,424,945 |
| 사용권자산상각비 | 512,793,735 | 1,741,422,322 | 540,873,684 | 1,582,007,871 |
| 견본비 | 2,426,360 | 11,955,421 | 4,459,371 | 13,822,759 |
| 물류비 | 5,043,182 | 13,804,455 | 5,991,820 | 13,866,822 |
| 광고선전비 | 90,763,747 | 369,052,162 | 48,612,677 | 253,415,997 |
| 대손상각비 | 105,011,613 | (1,059,823,217) | 433,539,085 | 902,112,689 |
| 수출제비용 | 13,723,226 | 54,797,483 | 26,033,716 | 87,713,882 |
| 잡비 | 509,286 | 10,037,248 | 1,878,991 | 7,375,265 |
| 합계 | 10,552,615,032 | 30,337,030,278 | 9,228,816,761 | 35,139,349,279 |
33. 기타수익 및 기타비용
(1) 기타수익의 내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차익 | 52,906,959 | 260,741,578 | 259,892,558 | 851,845,419 |
| 대손충당금환입 | - | - | - | 3,966,542 |
| 외화환산이익 (*1) | 375,801,833 | 771,062,599 | 890,366,890 | 1,356,168,451 |
| 유형자산처분이익 | - | 3,401,673 | - | 1,309,443 |
| 기타수익 (*2) | - | 6,111,873 | 87,202,263 | 120,849,024 |
| 사채상환이익 | - | 216,200,351 | - | - |
| 잡이익 | 9,166,478 | 42,124,719 | 52,005,687 | 72,024,604 |
| 합계 | 437,875,270 | 1,299,642,793 | 1,289,467,398 | 2,406,163,483 |
(*1) 내부거래에서 발생된 외환환산이익을 기타포괄손익으로 반영하였습니다.
(*2) 연결실체가 연구개발하고 있는 의약품들에 대한 정부과제 수행 연구보조금입니다.
(2) 기타비용의 내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차손 | 47,001,948 | 203,517,837 | 139,593,068 | 333,284,702 |
| 외화환산손실 | 93,119,571 | 180,132,619 | 77,362,866 | 156,435,527 |
| 기타의대손상각비 | - | - | - | 1,935,366 |
| 기부금 | - | - | 12,783,395 | 16,019,863 |
| 사채상환손실 | - | 1,593,665,034 | 19,336,490 | 317,336,556 |
| 잡손실 | 6,871,758 | 15,339,305 | 6,996,703 | 22,344,182 |
| 합계 | 146,993,277 | 1,992,654,795 | 256,072,522 | 847,356,196 |
34. 금융수익 및 금융비용
(1) 금융수익의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상각후원가금융자산 이자수익 | 1,710,652,986 | 462,484,792 | 1,684,979,011 | 4,358,193,239 |
| 파생상품평가이익 | - | 284,736,732 | - | 1,044,077,844 |
| 합계 | 1,710,652,986 | 747,221,524 | 1,684,979,011 | 5,402,271,083 |
(2) 금융비용의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상각후원가금융부채 이자비용 | 1,692,405,634 | 816,106,251 | 3,398,492,468 | 6,602,811,903 |
| 차입금 이자비용 | 39,448,449 | 99,656,473 | - | - |
| 파생상품평가손실 | - | - | - | 433,382,180 |
| 합계 | 1,731,854,083 | 915,762,724 | 3,398,492,468 | 7,036,194,083 |
35. 법인세비용
1) 법인세비용은 법인세부담액에서 전기 법인세와 관련하여 당3분기에 인식한 조정사항, 일시적 차이의 발생 및 소멸로 인한 이연법인세변동액 및 당기손익 이외로 인식되는 항목과 관련된 법인세비용 등을 조정하여 산출하였습니다.
36. 비용의 성격별 분류
비용의 성격별 분류는 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상품의 매출원가 | 2,485,193,278 | 4,824,389,435 | 1,298,075,251 | 4,280,099,417 |
| 원재료 사용액 | 1,286,775,900 | 6,614,471,650 | 4,330,275,223 | 10,665,198,866 |
| 관세환급금 | (1,225,734) | (1,225,734) | - | - |
| 타계정으로 대체액 | (260,040) | 64,869,158 | (900,978) | 35,459,362 |
| 제품의 변동 | (33,907,764) | (58,365,785) | (46,941,345) | (94,989,957) |
| 외주가공비 | 242,702,255 | 894,039,804 | 155,985,601 | 470,318,593 |
| 급여 | 7,239,188,160 | 23,571,256,208 | 6,162,828,503 | 24,096,286,866 |
| 퇴직급여 | 233,542,034 | 680,986,940 | 181,913,719 | 555,274,112 |
| 지급수수료 | 3,110,114,878 | 6,705,027,937 | 1,504,968,741 | 3,340,374,676 |
| 여비교통비 | 89,035,224 | 317,424,785 | 117,166,874 | 297,232,489 |
| 복리후생비 | 1,474,309,776 | 4,264,117,358 | 1,024,585,980 | 3,159,861,632 |
| 지급임차료 | 173,492,285 | 520,133,311 | 166,609,450 | 488,338,188 |
| 접대비 | 17,274,090 | 92,394,036 | 49,577,824 | 101,443,718 |
| 감가상각비 | 3,776,448,895 | 6,674,776,742 | 820,720,767 | 2,439,972,410 |
| 경상연구개발비 | 1,687,986,552 | 5,219,333,898 | 1,877,073,355 | 8,812,740,751 |
| 교육훈련비 | 1,622,355 | 9,058,957 | 632,568 | 7,965,753 |
| 세금과공과 | 102,403,452 | 269,317,129 | 32,322,906 | (1,434,567,460) |
| 무형자산상각비 | 89,706,733 | 231,672,175 | 55,214,484 | 154,549,260 |
| 사용권자산상각비 | 512,793,735 | 1,741,422,322 | 540,873,684 | 1,582,007,871 |
| 운반비 | 116,644,807 | 340,116,407 | 168,943,868 | 444,087,302 |
| 기타 | 949,261,997 | 1,565,398,760 | 1,331,393,909 | 2,866,824,338 |
| 합계 | 23,553,102,868 | 64,540,615,493 | 19,771,320,384 | 62,268,478,187 |
(*) 포괄손익계산서상 매출원가 및 판매비와관리비의 합계액입니다.
38. 주당이익
(1) 기본주당순이익
1) 기본주당순이익
| (단위: 원,주) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 기본주당순이익 : | ||||
| 보통주당기순이익(손실) | (11,557,503,004) | (37,966,874,829) | (7,904,282,485) | (23,499,642,871) |
| 가중평균유통보통주식수 | 77,644,188 | 77,576,526 | 77,527,833 | 77,466,706 |
| 기본주당순이익(손실) | (149) | (489) | (102) | (303) |
| 기본주당계속영업이익 : | ||||
| 보통주계속영업이익(손실) | (11,557,503,004) | (37,966,874,829) | (7,904,282,485) | (23,499,642,871) |
| 가중평균유통보통주식수 | 77,644,188 | 77,576,526 | 77,527,833 | 77,466,706 |
| 기본주당계속영업이익(손실) | (149) | (489) | (102) | (303) |
2) 보통주 당기순이익(손실)
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 보통주 당기순이익(손실) : | ||||
| 당기순이익(손실) | (11,557,503,004) | (37,966,874,829) | (7,904,282,485) | (23,499,642,871) |
| 차감 : 우선주배당금 | - | - | ||
| 보통주당기순이익(손실) | (11,557,503,004) | (37,966,874,829) | (7,904,282,485) | (23,499,642,871) |
| 보통주계속영업이익 : | ||||
| 계속영업이익(손실) | (11,557,503,004) | (37,966,874,829) | (7,904,282,485) | (23,499,642,871) |
| 차감 : 우선주배당금 | - | - | ||
| 보통주계속영업이익(손실) | (11,557,503,004) | (37,966,874,829) | (7,904,282,485) | (23,499,642,871) |
3) 가중평균유통보통주식수
| (단위: 주) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 발행주식수 : | 77,853,652 | 77,785,990 | 77,737,297 | 77,676,170 |
| 차감 : 가중평균자기주식수 | (209,464) | (209,464) | (209,464) | (209,464) |
| 가중평균유통보통주식수(*) | 77,644,188 | 77,576,526 | 77,527,833 | 77,466,706 |
(*) 가중평균 유통 보통주식수의 산정 내역
<당3분기>
| (단위: 주) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구분 | 3개월 | 누적 | ||||||||
| 발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
|
| 기초보통주식수 | 77,751,599 | (209,464) | 77,542,135 | 6,125,828,665 | 77,542,135 | 77,751,599 | (209,464) | 77,542,135 | 20,160,955,100 | 77,542,135 |
| 유상증자 | 722,218 | 78,264,353 | 1,017,436,589 | 78,264,353 | 722,218 | - | 78,264,353 | 1,017,436,589 | 78,264,353 | |
| 기말보통주식수 | 78,473,817 | (209,464) | 78,264,353 | 7,143,265,254 | 77,644,188 | 78,473,817 | (209,464) | 78,264,353 | 21,178,391,689 | 77,576,526 |
<전3분기>
| (단위: 주) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구분 | 3개월 | 누적 | ||||||||
| 발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
|
| 기초보통주식수 | 77,678,502 | (209,464) | 77,469,038 | 1,084,566,532 | 77,469,038 | 77,479,055 | (209,464) | 77,269,591 | 154,539,182 | 77,269,591 |
| 전환사채 주식전환 | - | - | 77,469,038 | - | - | 64,977 | 77,334,568 | 154,669,136 | 77,334,568 | |
| 전환사채 주식전환 | - | - | 77,469,038 | - | - | 19,493 | 77,354,061 | 77,354,061 | 77,354,061 | |
| 주식선택권 행사 | - | - | 77,469,038 | - | - | 50,000 | 77,404,061 | 6,269,728,941 | 77,404,061 | |
| 전환사채 주식전환 | - | - | 77,469,038 | - | - | 64,977 | 77,469,038 | 8,444,125,142 | 77,469,038 | |
| 전환사채 주식전환 | 16,244 | - | 77,485,282 | 309,941,128 | 77,485,282 | 16,244 | 77,485,282 | 309,941,128 | 77,485,282 | |
| 전환사채 주식전환 | 24,366 | - | 77,509,648 | 155,019,296 | 77,509,648 | 24,366 | 77,509,648 | 155,019,296 | 77,509,648 | |
| 전환사채 주식전환 | 32,487 | - | 77,542,135 | 5,583,033,720 | 77,542,135 | 32,487 | 77,542,135 | 5,583,033,720 | 77,542,135 | |
| 기말보통주식수 | 77,751,599 | (209,464) | 77,542,135 | 7,132,560,676 | 77,527,833 | 77,751,599 | (209,464) | 77,542,135 | 21,148,410,606 | 77,466,706 |
(2) 희석주당순손익
1) 당3분기말과 전3분기 중 잠재적 보통주를 포함하는 희석주당이익(손실)은 반희석화 효과로 인하여 계산하지 아니하였습니다.
2) 당3분기말 현재 반희석효과로 희석주당순이익을 계산할 때 고려하지 않았지만 향후 희석효과가 발생할 가능성이 있는 잠재적보통주의 내역은 다음과 같습니다.
| 구 분 | 행사금액(*1) | 청구 및 전환 기간 | 부여주식수 | 행사주식 | 기타 (*2) | 행사가능 주식수(*3) |
|---|---|---|---|---|---|---|
| 전환사채 | 12,301 원 | 2021/11/25~2023/10/25 | 884,205 주 | 1,268,273 주 | 392,197 주 | 8,129 주 |
(*1) 행사금액은 유상증자, 무상증자 등을 반영하여 조정하였습니다.
(*2) 주가하락 및 유상증자 등에 따른 행사가액 조정분을 반영하였습니다.
(*3) 행사가능 주식수는 2023년 11월 25일 만기가 도래함에 따라 상환되어 없습니다.
39. 현금흐름표
(1) 현금및현금성자산은 재무상태표와 현금흐름표상의 금액이 일치하게 관리되고 있습니다.
(2) 당기순이익(손실)에 대한 조정 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 퇴직급여 | 680,986,940 | 555,274,112 |
| 재고자산평가손실 | 162,619,916 | 31,597,094 |
| 감가상각비 | 6,674,776,742 | 2,439,972,410 |
| 무형자산상각비 | 231,672,175 | 154,549,260 |
| 사용권자산상각비 | 1,741,422,322 | 1,582,007,871 |
| 사채상환이익 | (216,200,351) | - |
| 사채상환손실 | 1,593,665,034 | 317,336,556 |
| 대손상각비 | (1,059,823,217) | 902,112,689 |
| 기타의대손상각비 | - | 1,935,366 |
| 이자수익 | (462,484,792) | (4,358,193,239) |
| 이자비용 | 915,762,724 | 6,602,811,903 |
| 유형자산처분손실(이익) | (3,401,673) | (1,309,443) |
| 외화환산손실 | 180,132,619 | 156,435,527 |
| 외화환산이익 | (771,062,599) | (1,356,168,451) |
| 대손충당금환입 | - | (3,966,542) |
| 파생상품평가손실 | - | 433,382,180 |
| 파생상품평가이익 | (284,736,732) | (1,044,077,844) |
| 법인세비용 | 13,049,244 | 28,936,732 |
| 합계 | 9,396,378,352 | 6,442,636,181 |
(3) 영업활동 자산·부채의 증감 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 채권의 감소(증가) | 4,444,715,508 | (4,170,589,411) |
| 미수금의 감소(증가) | 539,950,154 | 49,662,659 |
| 미수수익의 감소(증가) | 561,182,660 | 2,008,520,819 |
| 선급금의 감소(증가) | (56,219,900) | 4,514,831,457 |
| 장기선급금의 감소(증가) | 169,452,891 | 599,085,312 |
| 선급비용의 감소(증가) | 199,464,114 | (4,921,072,412) |
| 선급법인세자산의 감소(증가) | 96,983,414 | (127,205,333) |
| 선급부가세의 감소(증가) | (106,783,032) | (44,512,978) |
| 기타유동비금융자산의 감소(증가) | (3,723,452) | (22,956,936) |
| 재고자산의 감소(증가) | (838,899,352) | (5,637,971,511) |
| 이연법인세자산의 감소(증가) | (2,227,419) | - |
| 매입채무의 증가(감소) | 4,311,038,844 | (1,718,658,792) |
| 미지급금의 증가(감소) | (24,797,244) | 23,795,332 |
| 미지급비용의 증가(감소) | (477,896,282) | (1,057,929,151) |
| 미지급세금의 증가(감소) | (21,611,622) | - |
| 선수금의 증가(감소) | (1,751,702,787) | 2,571,653,568 |
| 장기선수금의 증가(감소) | 303,958,437 | 880,472,347 |
| 예수금의 증가(감소) | (964,685) | (18,423,424) |
| 예수제세의 증가(감소) | 2,635,050 | 57,205,100 |
| 비유동채무의 증가(감소) | 1,612,244,505 | - |
| 이연법인세부채증가(감소) | 11,547,891 | - |
| 퇴직금의 지급 | - | (16,416,667) |
| 사외적립자산의 감소(증가) | - | (800,000,000) |
| 환율변동에 의한 자산부채증감 | 1,636,314,688 | 6,689,777,912 |
| 합계 | 10,604,662,381 | (1,140,732,109) |
(4) 현금및현금성자산의 사용을 수반하지 않는 중요한 거래내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 전환사채의 주식전환 | - | 2,740,000,000 |
| 건설중인자산의 대체 |
104,660,919,962 | - |
(5) 재무활동에서 생기는 부채의 변동 내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 현금흐름 | 비현금 변동 | 기말 | ||
| 발생 및 소멸 | 상각등 | 기타(*) | ||||
| 전환사채 | 11,544,744,489 | (16,279,647,453) | 4,243,500,575 | 597,821,576 | - | 106,419,187 |
| 파생상품부채 | 2,732,912,980 | - | (2,437,857,959) | - | (292,111,799) | 2,943,222 |
| 단기차입금 | 701,146,398 | 2,257,707,184 | - | - | 42,877,650 | 3,001,731,232 |
| 리스부채 | 7,419,982,517 | (1,787,438,829) | 32,277,822 | - | 452,651,699 | 6,117,473,209 |
| 합계 | 22,398,786,384 | (15,809,379,098) | 1,837,920,438 | 597,821,576 | 203,417,550 | 9,228,566,850 |
(*) 전환권평가 및 리스 이자, 외화환산 등으로 인한 변동금액입니다.
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 현금흐름 | 비현금 변동 | 기말 | ||
| 발생 및 소멸 | 상각등 | 기타 | ||||
| 전환사채 | 9,754,365,408 | 8,141,708,080 | (8,182,949,901) | 1,450,239,643 | - | 11,163,363,230 |
| 파생상품부채 | - | - | - | - | 4,055,253,410 | 4,055,253,410 |
| 단기차입금 | - | 403,284,530 | - | - | - | 403,284,530 |
| 리스부채 | 8,645,445,637 | (1,554,179,466) | (16,272,626) | - | 1,233,236,627 | 8,308,230,172 |
| 합계 | 18,399,811,045 | 6,990,813,144 | (8,199,222,527) | 1,450,239,643 | 5,288,490,037 | 23,930,131,342 |
40. 특수관계자거래
(1) 특수관계자 현황
| 회사명 | 당사와의 관계 | 비고 | |
|---|---|---|---|
| 당3분기 | 전3분기 | ||
| 535 Penn Investments, LLC. | 기 타 | 기 타 | |
| 기타 | 임 직 원 | 임 직 원 | |
(2) 특수관계자와의 매출·매입 등 중요한 거래내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||
|---|---|---|
| 회사명 | 매출거래 | 매입거래 |
| 이자수익 | 기타 | |
| 535 Penn Investments, LLC. | - | 267,539,157 |
| 기타(임직원) | 1,836,465 | - |
<전3분기>
| (단위: 원) | ||
|---|---|---|
| 회사명 | 매출거래 | 매입거래 |
| 이자수익 | 기타 | |
| 535 Penn Investments, LLC. | - | 276,421,338 |
| 기타(임직원) | 19,022,774 | - |
(3) 특수관계자와의 중요한 자금거래내용은 다음과 같습니다.
<당3분기>
당기 중 특수관계자와 자금거래내역은 없습니다.
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 특수관계자 | 관계 | 자금대여거래 | |
| 대여 | 회수 | ||
| 기타 | 임 직 원 | - | 319,092,090 |
(4) 특수관계자와의 중요한 채권 및 채무의 내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 회사명 | 대여 | 기타 | 채권 계 |
| 535 Penn Investments, LLC. | - | 44,540,785 | 44,540,785 |
| 기타(임직원) | 80,000,000 | - | 80,000,000 |
| 합계 | 80,000,000 | 44,540,785 | 124,540,785 |
<전기말>
| (단위: 원) | |||
|---|---|---|---|
| 회사명 | 대여 | 기타 | 채권 계 |
| 535 Penn Investments, LLC. | - | 41,973,926 | 41,973,926 |
| 기타(임직원) | 80,000,000 | - | 80,000,000 |
| 합계 | 80,000,000 | 41,973,926 | 121,973,926 |
(5) 당기 중 특수관계자와의 담보 및 지급보증 내용은 없습니다.
(6) 주요경영진에 대한 보상
연결실체의 주요 경영진에 대한 보상내역은 다음과 같으며, 주요 경영진에는 연결실체의 기업활동의 계획, 운영, 통제에 대한 중요한 권한과 책임을 가지고 있는 등기이사 및 비등기 이사를 포함하였습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 급여 | 4,432,821,458 | 8,918,209,921 |
| 퇴직급여 | 560,364,538 | 478,028,960 |
| 합계 | 4,993,185,996 | 9,396,238,881 |
41. 우발상황과 약정사항
(1) 사용제한 금융자산
사용제한 금융자산의 내용은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 계정과목 | 종류 | 금융기관 | 당3분기 | 전기말 | 사용제한내용 |
| 장기금융상품 | 당좌예금 | 신한은행 | 2,000,000 | 2,000,000 | 당좌개설보증금 |
(2) 담보제공 및 사용제한 자산 내용은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 계정과목 | 종류 | 장부금액 | 설정금액 | 설정권자 | 내용 |
| 투자부동산 | 토지 및 건물 | 2,521,679,812 | 2,747,000,000 | 신한은행 | 일반대출, 무역금융 담보 |
| 유형자산 | 토지, 건물, 기계장치 | 493,722,449 | 1,058,357,600 | Shinhan Bank Bien Hoa | 일반대출 |
| 합계 | 3,015,402,261 | 3,805,357,600 | |||
(3) 제공받은 담보 및 지급보증내용은 없습니다.
(4) 타인을 위한 담보 및 지급보증제공내용은 없습니다.
(5) 보험가입내용
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 보험의 종류 | 부보자산 | 보험사 | 부보금액 | |
| 당3분기 | 전기 | ||||
| 본사 | 화재보험 | 건물,기계장치 및 재고자산 | DB손해보험 | 3,905,000,000 | 3,905,000,000 |
| 화재보험 | 사무실, 연구소 | 흥국화재해상보험 | 11,200,000,000 | 11,200,000,000 | |
| 임원배상책임 | 임원 업무배상 | DB손해보험 | 5,000,000,000 | 5,000,000,000 | |
| 임상보상보험 | 임상시험대상자 피해보상 | 에이스아메리칸화재해상보험 | 1,000,000,000 | 1,000,000,000 | |
| VGXI,Inc,해외지점 | 재산종합보험 | 제조물책임보상 등 (텍사스 우드랜드 공장) |
CAN | 8,068,800,000 | - |
| 해외지점 | 재산종합보험 | 제조물책임보상 등 (펜실베니아 연구소) |
CAN | 6,724,000,000 | 6,336,500,000 |
| Dong-Il Interlining, Ltd | 재산종합보험 | 건물,기계장치 및 재고자산 | PTI Insurance | 8,207,426,018 | 8,003,408,838 |
상기 보험 외에 차량보험이 DB손해보험에 가입되어 있습니다.
(6) 금융기관 여신한도약정
| 구분 | 금융기관 | 한도약정액 | 미사용액 | 사용제한내용 |
|---|---|---|---|---|
| 무역금융 | 신한은행 | $100,000 | $100,000 | - |
| 내국신용장(*) | 신한은행 | $100,000 | - | - |
| 합계 | $200,000 | $100,000 |
(*) 내국신용장 개설 약정을 맺고 있으며, 한도약정액은 모두 실행 중입니다.
(7) 계류중인 소송사건
| 계류법원 | 원고 | 피고 | 사건내용 | 소송가액 | 소송비용 | 진행현황 | |
|---|---|---|---|---|---|---|---|
| 당3분기 | 전기 | ||||||
| 미국 펜실베니아 몽고메리 카운티 법원 |
Inovio Pharmaceuticals Inc. (미국) | 진원생명과학 및 자회사 VGXI Inc. | VGXI를 상대로 코로나19 백신 생산에 필요한 정보 제공요청 소송제기 | - | 미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. | 미국 자회사 VGXI Inc.에서 약 50만달러를 지급하였음. | 가처분 기각(피고 승소), 소송 진행 중 |
| 미국 텍사스 남부 휴스턴 지방법원 |
VGXI Inc. | Aldevron LLC (미국) | VGXI Inc 의 영업 비밀 남용, 특허 침해 및 계약 위반 | - | 미국 자회사 VGXI Inc.에서 약 58만달러를 지급하였음. | 미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. | 2023년 10월 양측이 중재에 합의함에 따라 소송이 종결 |
| 미국 펜실베니아 몽고메리 카운티 법원 |
진원생명과학 | Inovio Pharmaceuticals Inc. (미국) | Cellectra 사용권 분쟁 | - | 미국 자회사 VGXI Inc.에서 약 16만달러를 지급하였음. | 미국 지점 VGXI USA 에서 8만달러를 지급하였음. | 소송 진행 |
| 서울중앙지방법원 | 진원생명과학 | A 제약회사외 2 | 영업비밀침해 금지 | 400백만원 | - | - | 합의하여 소취하로 종결 |
| 서울중앙지방법원 | 진원생명과학 | A 제약회사외 2 | 영업비밀침해 금지 가처분 | 100백만원 | - | 당사에서 45백만원 지급하였음. | 화해 권고 결정으로 종결 |
| 서울행정법원 | 진원생명과학 | 1. 한국보건산업진흥원 2. 코로나19 치료제/백신 신약개발사업단 |
정산금회수처분 취소 청구 | - | - | - | 소송 진행 중 |
42. 영업부문
(1) 회사의 영업부문은 2개로 구성되어 있으며 그 내용은 다음과 같습니다.
| 구 분 | 제품 및 용역의 유형 |
|---|---|
| 제약사업 | Contract Development Manufacturing Organization (CDMO) 생산, 판매 |
| 패브릭사업 | 의류용 심지제품 제조, 판매 |
(2) 영업부문별 정보는 다음과 같습니다.
1) 영업부문의 당기손익정보는 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 계 |
| 총매출액 | 18,248,350,366 | 9,199,992,744 | 27,448,343,110 |
| 내부거래 | - | - | - |
| 외부거래 | 18,248,350,366 | 9,199,992,744 | 27,448,343,110 |
| 영업이익(손실) | (32,572,226,924) | (4,520,045,459) | (37,092,272,383) |
| 당3분기순이익(손실) | (35,354,379,508) | (2,612,495,321) | (37,966,874,829) |
| 감가상각비와상각비 | 5,022,272,624 | 443,265,417 | 5,465,538,041 |
| 이자수익 | 305,237,524 | 157,247,268 | 462,484,792 |
| 이자비용 | (503,282,469) | (412,480,255) | (915,762,724) |
| 법인세비용 | - | 13,049,244 | 13,049,244 |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 계 |
| 총매출액 | 26,785,685,239 | 12,087,202,522 | 38,872,887,761 |
| 내부거래 | - | - | - |
| 외부거래 | 26,785,685,239 | 12,087,202,522 | 38,872,887,761 |
| 영업이익(손실) | (21,647,843,627) | (1,747,746,799) | (23,395,590,426) |
| 전3분기순이익(손실) | (22,994,711,266) | (504,931,605) | (23,499,642,871) |
| 감가상각비와상각비 | 3,069,177,923 | 347,076,289 | 3,416,254,212 |
| 이자수익 | 3,004,570,714 | 1,353,622,525 | 4,358,193,239 |
| 이자비용 | (5,712,793,963) | (890,017,940) | (6,602,811,903) |
| 법인세비용 | (12,435,220) | (16,501,512) | (28,936,732) |
2) 영업부문의 자산 및 부채정보는 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 총자산 | 174,646,110,085 | 16,752,733,776 | 191,398,843,861 |
| 총부채 | 26,808,233,542 | 6,243,998,659 | 33,052,232,201 |
<전기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 총자산 | 207,206,296,109 | 15,660,390,488 | 222,866,686,597 |
| 총부채 | 40,069,477,570 | 1,325,916,527 | 41,395,394,097 |
3) 주요 고객에 대한 매출 정보는 다음과 같습니다.
<당3분기>
| (단위: 원) | ||
|---|---|---|
| 구분 (*) | 금액 | 영업부문 |
| A 회사 | 3,894,362,176 | 제약사업 |
(*) 회사명은 기밀유지 계약조건 등으로 기재하지 않았습니다.
<전3분기>
| (단위: 원) | ||
|---|---|---|
| 구분 (*) | 금액 | 영업부문 |
| 가 회사 | 3,649,900,758 | 제약사업 |
| 나 회사 | 3,770,663,240 | 제약사업 |
| 다 회사 | 438,405,840 | 패브릭사업 |
| 라 회사 | 1,950,725,079 | 패브릭사업 |
| 합계 | 9,809,694,917 | - |
(*) 회사명은 기밀유지 계약조건 등으로 기재하지 않았으며, 전기의 발주처명을 영어 알파벳에서 당기의 발주처 영어 알파벳과 혼동을 주지 않기 위하여 한글명으로 변경하였습니다.
4) 영업부문의 수익 내역은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 주요 제품/상품/용역 계열 | |||
| 상품매출 | - | 3,818,203,963 | 3,818,203,963 |
| 제품매출 | - | 5,381,788,781 | 5,381,788,781 |
| CDMO매출 | 17,372,509,115 | - | 17,372,509,115 |
| 기타 | 875,841,251 | - | 875,841,251 |
| 합계 | 18,248,350,366 | 9,199,992,744 | 27,448,343,110 |
| 수익 인식시기 | |||
| 한 시점에 인식 | 651,772,852 | 9,199,992,744 | 9,851,765,596 |
| 기간에 걸쳐 인식 | 17,596,577,514 | - | 17,596,577,514 |
| 합계 | 18,248,350,366 | 9,199,992,744 | 27,448,343,110 |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 주요 제품/상품/용역 계열 | |||
| 상품매출 | - | 4,832,545,596 | 4,832,545,596 |
| 제품매출 | - | 7,254,656,926 | 7,254,656,926 |
| CDMO매출 | 25,738,830,051 | - | 25,738,830,051 |
| 기타 | 1,046,855,188 | - | 1,046,855,188 |
| 합계 | 26,785,685,239 | 12,087,202,522 | 38,872,887,761 |
| 수익 인식시기 | |||
| 한 시점에 인식 | 488,769,836 | 12,087,202,522 | 12,575,972,358 |
| 기간에 걸쳐 인식 | 26,296,915,403 | - | 26,296,915,403 |
| 합계 | 26,785,685,239 | 12,087,202,522 | 38,872,887,761 |
(3) 지역별 부문정보는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기/당3분기말 | 전3분기/전기말 | ||
| 매출 | 비유동자산 | 매출 | 비유동자산 | |
| 국내 | 3,031,971,186 | 8,741,989,654 | 3,206,719,068 | 10,238,263,509 |
| 해외 | 24,416,371,924 | 146,454,070,717 | 35,666,168,693 | 139,565,266,854 |
| 합계 | 27,448,343,110 | 155,196,060,371 | 38,872,887,761 | 149,803,530,363 |
42. 위험관리
(1) 금융위험관리
연결실체는 경영활동과 관련하여 신용위험, 유동성위험 및 시장위험 등 다양한 금융위험에 노출되어 있습니다. 연결실체의 전반적인 위험관리는 연결실체의 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화 하는데 중점을 두고 있습니다.
1) 신용위험관리
연결실체의 전반적인 위험관리는 연결실체의 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화 하는데 중점을 두고 있습니다. 연결실체는 신용위험노출 및 거래처의 신용등급을 주기적으로 검토하여 거래처의 여신한도 및 담보수준을 재조정하는 등 신용위험을 관리하고 있습니다.
금융상품 종류별 신용위험의 최대 노출금액은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기말 | 전기말 | ||
| 장부금액 |
신용위험 최대노출금액 |
장부금액 |
신용위험 최대노출금액 |
|
| 현금성자산(현금 제외) | 6,774,558,301 | 6,774,558,301 | 13,249,416,691 | 13,249,416,691 |
| 매출채권 및 기타채권 | 6,830,633,967 | 6,830,633,967 | 10,578,609,151 | 10,578,609,151 |
| 기타금융자산(유동) | 5,302,608,818 | 5,302,608,818 | 32,617,996,392 | 32,617,996,392 |
| 기타금융자산(비유동) (*) | 1,450,369,942 | 1,450,369,942 | 1,503,973,595 | 1,503,973,595 |
| 합계 | 20,358,171,028 | 20,358,171,028 | 57,949,995,829 | 57,949,995,829 |
(*) 기타포괄손익-공정가치측정금융자산 제외
2) 유동성위험관리
연결실체는 미래의 현금흐름을 예측하여 단기 및 중장기 자금조달 계획을 수립하여 유동성위험을 관리하고 있으며, 금융부채의 잔존계약 만기에 따른 만기분석내용은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 장부금액 | 1년이내 | 1년초과~2년이내 | 2년초과~5년이내 | 5년초과 | 합계 |
| 매입채무및기타채무 | 11,993,994,154 | 11,993,994,154 | - | - | - | 11,993,994,154 |
| 단기차입금 | 3,001,731,232 | 3,034,042,465 | - | - | - | 3,034,042,465 |
| 전환사채 | 106,419,187 | 106,419,187 | - | - | - | 106,419,187 |
| 파생상품부채 | 2,943,222 | 2,943,222 | - | - | - | 2,943,222 |
| 기타금융부채 | 6,329,347,923 | 2,403,091,993 | 3,189,170,401 | 1,888,470,734 | 1,200,000 | 7,481,933,128 |
| 합계 | 21,434,435,718 | 17,540,491,021 | 3,189,170,401 | 1,888,470,734 | 1,200,000 | 22,619,332,156 |
계약상 현금흐름으로 이자 등을 포함하고 있어 장부금액과 차이가 있습니다.
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 장부금액 | 1년이내 | 1년초과~2년이내 | 2년초과~5년이내 | 5년초과 | 합계 |
| 매입채무및기타채무 | 7,528,579,884 | 7,528,579,884 | - | - | - | 7,528,579,884 |
| 단기차입금 | 701,146,398 | 701,146,398 | - | - | - | 701,146,398 |
| 전환사채 | 11,544,744,489 | 11,544,744,489 | - | - | - | 11,544,744,489 |
| 파생상품부채 | 2,732,912,980 | 2,732,912,980 | - | - | - | 2,732,912,980 |
| 기타금융부채 | 9,748,130,802 | 4,238,409,193 | 3,626,808,659 | 1,881,712,950 | 1,200,000 | 9,748,130,802 |
| 합계 | 32,255,514,553 | 26,745,792,944 | 3,626,808,659 | 1,881,712,950 | 1,200,000 | 32,255,514,553 |
3) 시장위험
연결실체는 환율과 이자율의 변동으로 인한 시장위험에 노출되어 있습니다.
(가) 외환위험관리
연결실체는 외화거래 수행에 따라 다양한 환율변동위험에 노출되어 있습니다. 주요 통화별 환율변동시 민감도 분석내용은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | |||
| 10% 상승 | 10% 하락 | 10% 상승 | 10% 하락 | ||
| 본점 | USD | 14,942,620,619 | (14,942,620,619) | 13,140,435,561 | (13,140,435,561) |
| EUR | 1,906,384 | (1,906,384) | 1,811,824 | (1,811,824) | |
| 해외지점 | USD | 520,804,515 | (520,804,515) | 673,162,253 | (673,162,253) |
| 합계 | USD | 15,463,425,134 | (15,463,425,134) | 13,813,597,814 | (13,813,597,814) |
| EUR | 1,906,384 | (1,906,384) | 1,811,824 | (1,811,824) | |
(나) 이자율위험관리
연결실체는 고정이자율과 변동이자율로 자금을 차입하고 있으며, 이로 인하여 이자율위험에 노출되어 있습니다. 연결실체는 고정금리차입금과 변동금리차입금의 적절한 균형유지 정책을 수행하는 등 이자율위험을 관리하고 있으며, 이자율위험에 노출된 차입금 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당(3분)기 | 전기 |
| 단기차입금 | 3,001,731,232 | 701,146,398 |
이자율 1% 변동시 민감도 분석내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구분 | 당(3분)기 | 전기 | ||
| 1%상승 | 1%하락 | 1%상승 | 1%하락 | |
| 이자비용 | 40,023,083 | (40,023,083) | 7,011,464 | (7,011,464) |
(다) 기타가격위험요소
연결실체는 지분상품에서 발생하는 가격변동위험에 노출되어 있습니다. 지분상품은 매매목적이 아닌 전략적 목적으로 보유하고 있습니다. 보고기간말 현재 공정가치로 평가하는 기타포괄손익-공정가치측정금융자산은 다른변수가 일정하고 지분상품의 가격이 10% 변동할 경우 가격변동이 자본에 미치는 영향은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | ||
| 10% 상승 | 10% 하락 | 10% 상승 | 10% 하락 | |
| 기타포괄손익-공정가치측정금융자산 | 3,849,692 | (3,849,692) | 14,548,655 | (14,548,655) |
(2) 자본위험관리
연결실체의 자본관리 목적은 계속기업으로 영업활동을 유지하고 주주 및 이해관계자의 이익을 극대화하하고 자본비용의 절감을 위하여 최적의 자본구조를 유지하는데 있습니다. 연결실체는 배당조정, 신주발행 등의 정책을 통하여 자본구조를 경제환경의 변화에 따라 적절히 수정변경하고 있습니다. 연결실체의 자본위험관리정책은 전기와 중요한 변동이 없습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 부채총계 | 33,052,232,201 | 41,395,394,097 |
| 차감: 현금및현금성자산과 단기금융상품 | (11,650,430,052) | (45,260,897,357) |
| 순부채 (*) | 21,401,802,149 | - |
| 자본총계 | 158,346,611,660 | 181,471,292,500 |
| 부채비율 | 20.87% | 22.8% |
| 순부채비율 | 13.52% | 0% |
(*) 부채총계가 현금 및 현금성자산과 단기금융상품보다는 적을 경우에는 순부채의 금액을 "-"으로 기재하였습니다.
4. 재무제표
|
재무상태표 |
| 제 48 기 3분기말 2023.09.30 현재 |
|
제 47 기말 2022.12.31 현재 |
|
(단위 : 원) |
|
제 48 기 3분기말 |
제 47 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
104,719,224,417 |
106,718,983,795 |
|
현금및현금성자산 |
6,026,272,628 |
10,451,735,772 |
|
매출채권 및 기타유동채권 |
9,040,782,524 |
13,969,372,235 |
|
단기기타채권 |
9,853,001,490 |
5,844,719,768 |
|
단기기타금융자산 |
59,383,800,256 |
54,638,330,573 |
|
유동재고자산 |
4,623,087,414 |
4,601,077,816 |
|
기타유동자산 |
15,792,280,105 |
17,213,747,631 |
|
비유동자산 |
86,686,137,376 |
116,513,964,403 |
|
기타비유동금융자산 |
71,724,307,642 |
89,230,965,558 |
|
종속기업 대한 투자자산 |
1,336,433,905 |
12,340,414,384 |
|
투자부동산 |
2,640,698,347 |
2,668,058,581 |
|
유형자산 |
9,887,469,548 |
11,931,475,729 |
|
무형자산 |
29,500,171 |
36,850,333 |
|
기타비유동자산 |
1,067,727,763 |
306,199,818 |
|
자산총계 |
191,405,361,793 |
223,232,948,198 |
|
부채 |
||
|
유동부채 |
14,870,253,926 |
28,557,077,443 |
|
매입채무 |
4,933,551,684 |
6,016,443,739 |
|
기타채무 |
104,938,015 |
35,314,297 |
|
단기차입금 |
2,100,000,000 |
0 |
|
전환사채 |
106,419,187 |
11,544,744,489 |
|
파생상품금융부채 |
2,943,222 |
2,732,912,980 |
|
단기기타금융부채 |
770,310,231 |
1,231,790,774 |
|
기타 유동부채 |
6,852,091,587 |
6,995,871,164 |
|
비유동부채 |
5,035,717,578 |
4,767,890,392 |
|
장기기타금융부채 |
2,695,454,272 |
3,224,826,244 |
|
퇴직급여부채 |
557,643,487 |
0 |
|
충당부채 |
190,969,811 |
171,350,978 |
|
이연법인세부채 |
485,300,114 |
457,332,566 |
|
기타 비유동 부채 |
1,106,349,894 |
914,380,604 |
|
부채총계 |
19,905,971,504 |
33,324,967,835 |
|
자본 |
||
|
자본금 |
78,473,817,000 |
77,751,599,000 |
|
자본잉여금 |
213,491,409,734 |
211,749,282,814 |
|
주식발행초과금 |
213,491,409,734 |
211,749,282,814 |
|
기타자본구성요소 |
19,825,265,979 |
20,299,548,399 |
|
기타포괄손익누계액 |
211,692,340 |
(263,863,040) |
|
이익잉여금(결손금) |
(140,502,794,764) |
(119,628,586,810) |
|
자본총계 |
171,499,390,289 |
189,907,980,363 |
|
자본과부채총계 |
191,405,361,793 |
223,232,948,198 |
|
포괄손익계산서 |
|
제 48 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 47 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
제 48 기 3분기 |
제 47 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
수익(매출액) |
10,938,148,351 |
25,852,459,867 |
10,883,502,791 |
36,227,846,929 |
|
매출원가 |
10,302,472,012 |
24,525,426,608 |
10,181,621,653 |
33,771,540,331 |
|
매출총이익 |
635,676,339 |
1,327,033,259 |
701,881,138 |
2,456,306,598 |
|
판매비와관리비 |
6,554,598,773 |
22,386,500,283 |
6,379,100,806 |
23,975,635,749 |
|
영업이익(손실) |
(5,918,922,434) |
(21,059,467,024) |
(5,677,219,668) |
(21,519,329,151) |
|
기타수익 |
3,695,546,102 |
9,026,460,617 |
14,101,886,755 |
24,497,550,968 |
|
기타비용 |
252,440,396 |
13,282,671,509 |
212,147,927 |
775,126,195 |
|
금융수익 |
3,260,736,756 |
9,922,777,270 |
3,073,134,162 |
9,150,100,556 |
|
금융비용 |
1,690,392,517 |
5,481,307,308 |
1,988,975,245 |
5,609,138,843 |
|
법인세비용차감전순이익(손실) |
(905,472,489) |
(20,874,207,954) |
9,296,678,077 |
5,744,057,335 |
|
법인세비용(수익) |
0 |
0 |
0 |
0 |
|
계속영업이익(손실) |
(905,472,489) |
(20,874,207,954) |
9,296,678,077 |
5,744,057,335 |
|
당기순이익(손실) |
(905,472,489) |
(20,874,207,954) |
9,296,678,077 |
5,744,057,335 |
|
기타포괄손익 |
256,245,355 |
475,555,380 |
1,183,544,741 |
1,784,079,446 |
|
후속적으로 당기손익으로 재분류될수있는 항목 |
260,884,289 |
582,545,009 |
1,166,007,216 |
2,037,274,233 |
|
해외사업장환산외환차이(세후기타포괄손익) |
260,884,289 |
582,545,009 |
1,166,007,216 |
2,037,274,233 |
|
후속적으로 당기손익으로 재분류되지 않는항목 |
(4,638,934) |
(106,989,629) |
17,537,525 |
(253,194,787) |
|
기타포괄손익-공정가치측정금융자산평가손익 |
(4,638,934) |
(106,989,629) |
17,537,525 |
(253,194,787) |
|
총포괄손익 |
(649,227,134) |
(20,398,652,574) |
10,480,222,818 |
7,528,136,781 |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(12) |
(269) |
120 |
74 |
|
희석주당이익(손실) (단위 : 원) |
(12) |
(269) |
120 |
74 |
|
자본변동표 |
|
제 48 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 47 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
주식발행초과금 |
이익잉여금(결손금) |
기타자본구성요소 |
기타포괄손익누계액 |
자본 합계 |
|
|
2022.01.01 (기초자본) |
77,479,055,000 |
206,606,623,975 |
(98,750,909,796) |
21,521,211,394 |
(619,873,189) |
206,236,107,384 |
|
당기순이익(손실) |
0 |
0 |
5,744,057,335 |
0 |
0 |
5,744,057,335 |
|
기타포괄손익 |
0 |
0 |
0 |
0 |
1,784,079,446 |
1,784,079,446 |
|
기타포괄손익-공정가치 측정 금융자산 평가손익 적립금 |
0 |
0 |
0 |
0 |
(253,194,787) |
(253,194,787) |
|
해외사업환산손익 |
0 |
0 |
0 |
0 |
2,037,274,233 |
2,037,274,233 |
|
유상증자 |
0 |
0 |
0 |
0 |
0 |
0 |
|
전환사채행사, 상환 |
222,544,000 |
4,116,133,031 |
0 |
(673,808,252) |
0 |
3,664,868,779 |
|
주식매수선택권 |
50,000,000 |
862,044,000 |
0 |
(529,600,000) |
0 |
382,444,000 |
|
2022.09.30 (기말자본) |
77,751,599,000 |
211,584,801,006 |
(93,006,852,461) |
20,317,803,142 |
1,164,206,257 |
217,811,556,944 |
|
2023.01.01 (기초자본) |
77,751,599,000 |
211,749,282,814 |
(119,628,586,810) |
20,299,548,399 |
(263,863,040) |
189,907,980,363 |
|
당기순이익(손실) |
0 |
0 |
(20,874,207,954) |
0 |
0 |
(20,874,207,954) |
|
기타포괄손익 |
0 |
0 |
0 |
0 |
475,555,380 |
475,555,380 |
|
기타포괄손익-공정가치 측정 금융자산 평가손익 적립금 |
0 |
0 |
0 |
0 |
(106,989,629) |
(106,989,629) |
|
해외사업환산손익 |
0 |
0 |
0 |
0 |
582,545,009 |
582,545,009 |
|
유상증자 |
722,218,000 |
1,742,126,920 |
0 |
0 |
0 |
2,464,344,920 |
|
전환사채행사, 상환 |
0 |
0 |
0 |
(474,282,420) |
0 |
(474,282,420) |
|
주식매수선택권 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2023.09.30 (기말자본) |
78,473,817,000 |
213,491,409,734 |
(140,502,794,764) |
19,825,265,979 |
220,853,095 |
171,499,390,289 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 48 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 47 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
제 48 기 3분기 |
제 47 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(13,276,856,696) |
(18,399,260,443) |
|
당기순이익(손실) |
(20,874,207,954) |
5,744,057,335 |
|
당기순이익조정을 위한 가감 |
5,023,921,473 |
(22,744,412,469) |
|
영업활동으로 인한 자산 부채의 변동 |
2,193,317,044 |
(4,159,518,022) |
|
이자수취 |
434,979,408 |
2,789,862,713 |
|
이자지급(영업) |
(54,866,667) |
(29,250,000) |
|
투자활동현금흐름 |
21,438,313,854 |
8,739,112,833 |
|
단기금융상품의 처분 |
99,000,000,000 |
224,629,000,000 |
|
단기대여금및수취채권의 처분 |
1,008,600,000 |
311,058,632 |
|
장기대여금및수취채권의 처분 |
0 |
12,000,000 |
|
투자부동산의 처분 |
0 |
0 |
|
유형자산의 처분 |
15,700,000 |
0 |
|
임차보증금의 감소 |
0 |
70,000,000 |
|
단기금융상품의 취득 |
(71,845,878,375) |
(184,629,000,000) |
|
단기대여금및수취채권의 취득 |
(1,344,800,000) |
0 |
|
장기대여금및수취채권의 취득 |
(5,190,800,000) |
(30,365,177,927) |
|
유형자산의 취득 |
(204,507,771) |
(1,288,767,872) |
|
재무활동현금흐름 |
(12,593,893,691) |
7,737,310,458 |
|
단기차입금의 증가 |
2,100,000,000 |
0 |
|
사채의 발행 |
0 |
11,469,400,000 |
|
유상증자 |
2,469,985,560 |
0 |
|
주식매수선택권의 행사 |
0 |
382,444,000 |
|
사채의 상환 |
(16,279,647,453) |
(3,327,691,920) |
|
전환권의 행사 |
0 |
(2,926,760) |
|
신주발행비용 |
(5,640,640) |
0 |
|
리스부채의 지급 |
(878,591,158) |
(783,914,862) |
|
외화표시현금및현금성자산에 대한 환율변동효과 |
6,973,389 |
59,795,962 |
|
현금및현금성자산의순증가(감소) |
(4,425,463,144) |
(1,863,041,190) |
|
기초현금및현금성자산 |
10,451,735,772 |
18,352,575,091 |
|
기말현금및현금성자산 |
6,026,272,628 |
16,489,533,901 |
5. 재무제표 주석
| 제 48 (당)기 3분기 2023년 09월 30일 현재 |
| 제 47 (전)기 2022년 12월 31일 현재 |
| 회사명 : 진원생명과학 주식회사 |
1. 일반사항
진원생명과학주식회사(이하 "당사")는 1976년에 설립되어 1987년 11월에 한국거래소에 주식을 상장한 회사로서 제약사업과 패브릭사업을 영위하고 있습니다.
제약사업부분은 바이오의약품 CDMO사업과 신약 개발사업으로 구분합니다. 바이오의약품 CDMO사업은 임상시험에 필요한 유전자치료제 및 DNA 백신의 원료인 국제규격(cGMP) 플라스미드(Plasmid) DNA 제품을 2008년 6월, 미국에 설립한 현지법인인 VGXI, Inc.,에서 생산하여 판매하고 있습니다.
신약 개발사업은 핵산 기반 바이오 신약과 항염증 치료 신약으로 나눌 수 있습니다. 핵산기반 바이오 신약은 DNA 기반 의약품과 mRNA 기반 의약품으로 나눌 수 있으며, 치료 목적에 따라 핵산 백신, 핵산기반 단백질의약품, 핵산기반 단클론항체 의약품으로 구성되어 있습니다. 항염증 치료 신약은 천연물유래 성분 의약품과 화학합성의약품으로 나눌 수 있습니다.
당사는 핵산기반 바이오 신약의 개발을 위하여 국내외 기업 및 전문연구기관과 적극적이고 지속적인 협력연구를 진행하고 있습니다. SFTS DNA 백신 개발을 위해 한국과학기술원(KAIST)과 협력하고, 코로나19 DNA백신 개발을 위해 질병관리청 공공백신개발지원센터, 고대구로병원, 고대안산병원, 한림대강남성심병원, 가천대길병원, 인하대병원, 국가임상시험지원재단과 협력하고 있습니다. mRNA 기반 의약품의 개발을 위해 미국 휴스턴 매소디스트 병원연구소(Houston Methodist Research Institute), 가톨릭대학교, 한국과학기술연구원(KIST)과 협력하고 있습니다. 또한, 항염증 치료 신약 개발을 위하여 쓴맛 수용체를 이용한 항바이러스 및 항균 코스프레이 약물의 개발을 미국 펜실베니아 대학과 협력하고 있습니다. 성공적인 제품개발을 위해 세계적 감염병 치료 및 예방분야 전문가인 고려대학교 구로병원 김우주 교수 및 강원대학교 의과대학 신정임 교수의 과학자문과 자회사인 VGXI와 협력하여 연구개발을 진행하고 있습니다.
패브릭사업부문은 의류용 심지제품을 2003년 3월 베트남에 설립한 현지법인인 Dong-Il Interlining, Ltd.에서 제조하여 판매하고 있습니다.
당3분기말 현재 주요 주주현황은 다음과 같습니다.
| (단위:주) | ||||
|---|---|---|---|---|
| 주주명 | 당3분기말 | 전기말 | ||
| 주식수 | 지분율 | 주식수 | 지분율 | |
| 박영근 | 5,396,525 | 6.88% | 4,811,730 | 6.19% |
| 조병문 외 5명 | 1,464,223 | 1.87% | 1,370,658 | 1.76% |
| 기 타 | 71,613,069 | 91.25% | 71,569,211 | 92.05% |
| 합계 | 78,473,817 | 100.00% | 77,751,599 | 100.00% |
2. 재무제표 작성기준 및 중요한 회계정책
2.1 재무제표 작성기준
당사의 2023년 9월 30일로 종료하는 9개월 보고기간에 대한 요약분기재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었습니다. 이 중간재무제표는 연차재무제표에 기재되는 사항이 모두 포함되지 않았으므로 전기말 연차재무제표와 함께 이해해야 합니다.
2.1.1 당사가 채택한 제ㆍ개정 기준서 및 해석서
당사는 2023년 1월 1일로 개시하는 회계기간부터 다음의 제ㆍ개정 기준서 및 해석서를 신규로 적용하였습니다.
(1) 당사가 채택한 제ㆍ개정 기준서
(가) 기업회계기준서 제1001호 '재무제표 표시' - '회계정책'의 공시
중요한 회계정책 정보를 정의하고 이를 공시하도록 하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(나) 기업회계기준서 제1001호 ' 재무제표 표시 ' - 행사가격 조정 조건이 있는 금융부채 평가손익 공시
발행자의 주가 변동에 따라 행사가격이 조정되는 조건이 있는 금융상품의 전부나 일부가 금융부채로 분류되는 경우 그 금융부채의 장부금액과 관련 손익을 공시하도록 하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(다) 기업회계기준서 제1008호 '회계정책, 회계추정의 변경 및 오류' - '회계추정'의 정의
회계추정을 정의하고, 회계정책의 변경과 구별하는 방법을 명확히 하였습니다.
해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(라) 기업회계기준서 제1012호 '법인세' - 단일거래에서 생기는 자산과 부채에 대한 이연법인세
자산 또는 부채가 최초로 인식되는 거래의 최초 인식 예외 요건에 거래시점 동일한 가산할 일시적차이와 차감할 일시적차이를 발생시키지 않는 거래라는 요건을 추가하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(마) 기업회계기준서 제1117호 '보험계약' 제정
기업회계기준서 제1117호 '보험계약'은 기업회계기준서 제1104호 '보험계약’을 대체합니다. 보험계약에 따른 모든 현금흐름을 추정하고 보고시점의 가정과 위험을 반영한 할인율을 사용하여 보험부채를 측정하고, 매 회계연도별로 계약자에게 제공한 서비스(보험보장)를 반영하여 수익을 발생주의로 인식하도록 합니다. 또한, 보험사건과 관계없이 보험계약자에게 지급하는 투자요소(해약/만기환급금)는 보험수익에서 제외하며, 보험손익과 투자손익을 구분 표시하여 정보이용자가 손익의 원천을 확인할 수 있도록 하였습니다. 해당 기준서의 제정이 재무제표에 미치는 중요한 영향은 없습니다.
(2) 당사가 적용하지 않은 제ㆍ개정 기준서 및 해석서
제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
(가) 기업회계기준서 제1001호 '재무제표 표시' 개정 - 부채의 유동/비유동 분류, 약정사항이 있는 비유동부채
보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습 니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기 지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된 경우는 제외됩니다. 또한, 기업이 보고기간말 후에 준수해야하는 약정은 보고기간말에 해당 부채의 분류에 영향을 미치지 않으며, 보고기간 이후 12개월 이내 약정사항을 준수해야하는 부채가 보고기간말 현재 비유동부채로 분류된 경우 보고기간 이후 12개월 이내 부채가 상환될 수 있는 위험에 관한 정보를 공시해야 합니다. 동 개정사항은 2024년 1월 1일 이후 시작하는 회계연도부터 적용되며, 조기적용이 허용됩니다. 회사는 동 개정으로 인한 재무제표의 영향을 검토 중에 있습니다.
2.2 법인세비용
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전이익에 적용하여 계산합니다.
2.3 중요한 회계추정 및 가정
당사는 미래에 대하여 추정 및 가정을 하고 있습니다. 추정 및 가정은 지속적으로 평가되며, 과거 경험과 현재의 상황에서 합리적으로 예측가능한 미래의 사건과 같은 다른 요소들을 고려하여 이루어집니다. 이러한 회계추정은 실제 결과와 다를 수도있습니다.
당사의 요약3분기재무제표 작성시 사용된 중요한 회계추정 및 가정은 COVID-19에 따른 불확실성의 변동에 따라 조정될 수 있으며, 당3분기말 현재 COVID-19로 인하여 회사의 사업, 재무상태 및 경영성과 등에 미칠 궁극적인 영향은 합리적으로 예측할 수 없습니다.
요약3분기재무제표 작성시 사용된 중요한 회계추정 및 가정은 법인세비용을 결정하는데 사용된 추정의 방법을 제외하고는 전기 재무제표 작성에 적용된 회계추정 및 가정과 동일합니다.
(1) 금융자산의 범주
<당3분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융자산 | 상각후원가 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합계 |
| 현금및현금성자산 | - | 6,026,272,628 | - | 6,026,272,628 |
| 매출채권 | - | 9,040,782,524 | - | 9,040,782,524 |
| 단기기타채권 | - | 9,853,001,490 | - | 9,853,001,490 |
| 단기기타금융자산 | 4,845,878,375 | 54,537,921,881 | - | 59,383,800,256 |
| 장기기타금융자산 | - | 71,685,810,725 | 38,496,917 | 71,724,307,642 |
| 합계 | 4,845,878,375 | 151,143,789,248 | 38,496,917 | 156,028,164,540 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융자산 | 상각후원가 측정금융자산 |
기타포괄손익-공정가치측정금융자산 | 합계 |
| 현금및현금성자산 | - | 10,451,735,772 | - | 10,451,735,772 |
| 매출채권 | - | 13,969,372,235 | - | 13,969,372,235 |
| 단기기타채권 | - | 5,844,719,768 | - | 5,844,719,768 |
| 단기기타금융자산 | - | 54,610,467,686 | - | 54,610,467,686 |
| 파생상품자산 | 27,862,887 | - | - | 27,862,887 |
| 장기기타금융자산 | - | 89,085,479,012 | 145,486,546 | 89,230,965,558 |
| 합계 | 27,862,887 | 173,961,774,473 | 145,486,546 | 174,135,123,906 |
(2) 금융부채의 범주
<당3분기말>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융부채 | 상각후원가측정 금융부채 |
합계 |
| 매입채무 | - | 4,933,551,684 | 4,933,551,684 |
| 단기기타채무 | - | 104,938,015 | 104,938,015 |
| 단기차입금 | - | 2,100,000,000 | 2,100,000,000 |
| 전환사채 | - | 106,419,187 | 106,419,187 |
| 파생상품부채 | 2,943,222 | - | 2,943,222 |
| 단기기타금융부채 | - | 770,310,231 | 770,310,231 |
| 장기기타금융부채 | - | 2,695,454,272 | 2,695,454,272 |
| 합계 | 2,943,222 | 10,710,673,389 | 10,713,616,611 |
<전기말>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 당기손익-공정가치측정금융부채 | 상각후원가측정 금융부채 |
합계 |
| 매입채무 | - | 6,016,443,739 | 6,016,443,739 |
| 단기기타채무 | - | 35,314,297 | 35,314,297 |
| 전환사채 | - | 11,544,744,489 | 11,544,744,489 |
| 파생상품부채 | 2,732,912,980 | - | 2,732,912,980 |
| 단기기타금융부채 | - | 1,231,790,774 | 1,231,790,774 |
| 장기기타금융부채 | - | 3,224,826,244 | 3,224,826,244 |
| 합계 | 2,732,912,980 | 22,053,119,543 | 24,786,032,523 |
(3) 금융상품 범주별 순손익
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 이자 | 평가손익 | 외화환산손익 | 외환차손익 | 파생상품평가손익 | 합계 |
| <금융자산> | ||||||
| 현금및현금성자산 | 16,164,395 | - | 7,176,752 | 125,059,943 | - | 148,401,090 |
| 매출채권 및 기타채권 | - | - | 763,885,847 | 134,188,582 | - | 898,074,429 |
| 기타금융자산(유동) | 299,676,746 | - | 3,825,777,158 | - | - | 4,125,453,904 |
| 기타금융자산(비유동) | 9,231,419,559 | - | 3,935,922,842 | - | - | 13,167,342,401 |
| 파생상품자산 | - | - | - | - | 284,736,732 | 284,736,732 |
| 기타포괄손익-공정가치측정금융자산 | - | (106,989,629) | - | - | - | (106,989,629) |
| 당기손익-공정가치측정금융자산 | 90,779,838 | - | - | - | - | 90,779,838 |
| 합계 | 9,638,040,538 | (106,989,629) | 8,532,762,599 | 259,248,525 | 284,736,732 | 18,607,798,765 |
| <금융부채> | ||||||
| 차입금 | (8,975,342) | - | - | - | - | (8,975,342) |
| 전환사채 | (602,590,598) | - | - | - | - | (602,590,598) |
| 매입채무 및 기타채무 | - | - | (180,132,619) | (120,958,178) | - | (301,090,797) |
| 기타금융부채 | (4,869,741,368) | - | - | (65,234,715) | - | (4,934,976,083) |
| 합계 | (5,481,307,308) | - | (180,132,619) | (186,192,893) | - | (5,847,632,820) |
| 총합계 | 4,156,733,230 | (106,989,629) | 8,352,629,980 | 73,055,632 | 284,736,732 | 12,760,165,945 |
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 이자 | 평가손익 | 외화환산손익 | 외환차손익 | 파생상품평가손익 | 합계 |
| <금융자산> | ||||||
| 현금및현금성자산 | 94,234,599 | - | 59,795,962 | 406,086,656 | - | 560,117,217 |
| 매출채권 및 기타채권 | - | - | 1,296,372,489 | 434,757,515 | - | 1,731,130,004 |
| 기타금융자산(유동) | 833,752,136 | - | 3,084,921,216 | 8,550,000 | - | 3,927,223,352 |
| 기타금융자산(비유동) | 7,178,035,977 | - | 19,052,644,395 | - | - | 26,230,680,372 |
| 파생상품자산 | - | - | - | - | (178,226,711) | (178,226,711) |
| 기타포괄손익-공정가치측정금융자산 | - | (253,194,787) | - | - | - | (253,194,787) |
| 합계 | 8,106,022,712 | (253,194,787) | 23,493,734,062 | 849,394,171 | (178,226,711) | 32,017,729,447 |
| <금융부채> | ||||||
| 전환사채 | (1,503,970,621) | - | - | - | - | (1,503,970,621) |
| 파생상품부채 | - | - | - | - | 788,922,375 | 788,922,375 |
| 매입채무 및 기타채무 | - | - | (151,613,707) | (291,836,528) | - | (443,450,235) |
| 기타금융부채 | (3,671,786,042) | - | - | - | - | (3,671,786,042) |
| 합계 | (5,175,756,663) | - | (151,613,707) | (291,836,528) | 788,922,375 | (4,830,284,523) |
| 총합계 | 2,930,266,049 | (253,194,787) | 23,342,120,355 | 557,557,643 | 610,695,664 | 27,187,444,924 |
4. 공정가치
(1) 보고기간말 현재 금융상품의 종류별 장부금액과 공정가치의 비교내용은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||
|---|---|---|
| 종류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 현금및현금성자산 | 6,026,272,628 | (*1) |
| 매출채권 | 9,040,782,524 | (*1) |
| 단기기타채권 | 9,853,001,490 | (*1) |
| 단기기타금융자산 | 54,537,921,881 | (*1) |
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | 4,845,878,375 |
| 장기기타금융자산 | 71,685,810,725 | (*1) |
| 기타포괄손익-공정가치측정금융자산 | 38,496,917 | 38,496,917 |
| 합계 | 156,028,164,540 | |
| <금융부채> | ||
| 매입채무 | 4,933,551,684 | (*1) |
| 단기기타채무 | 104,938,015 | (*1) |
| 단기차입금 | 2,100,000,000 | (*1) |
| 전환사채 | 106,419,187 | (*1) |
| 파생상품부채 | 2,943,222 | 2,943,222 |
| 단기기타금융부채 | 770,310,231 | (*1) (*2) |
| 장기기타금융부채 | 2,695,454,272 | (*1) (*2) |
| 합계 | 10,713,616,611 | |
(*1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 공시대상에서 제외하였습니다.
(*2) 리스부채는 기업회계기준서 제1107호 '금융상품: 공시'에 따라 공정가치 공시대상에서 제외하였습니다.
<전기말>
| (단위: 원) | ||
|---|---|---|
| 종류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 현금및현금성자산 | 10,451,735,772 | (*1) |
| 매출채권 | 13,969,372,235 | (*1) |
| 단기기타채권 | 5,844,719,768 | (*1) |
| 단기기타금융자산 | 54,610,467,686 | (*1) |
| 파생상품자산 | 27,862,887 | 27,862,887 |
| 장기기타금융자산 | 89,085,479,012 | (*1) |
| 기타포괄손익-공정가치측정금융자산 | 145,486,546 | 145,486,546 |
| 합계 | 174,135,123,906 | |
| <금융부채> | ||
| 매입채무 | 6,016,443,739 | (*1) |
| 단기기타채무 | 35,314,297 | (*1) |
| 전환사채 | 11,544,744,489 | (*1) |
| 파생상품부채 | 2,732,912,980 | 2,732,912,980 |
| 단기기타금융부채 | 1,231,790,774 | (*1) (*2) |
| 장기기타금융부채 | 3,224,826,244 | (*1) (*2) |
| 합계 | 24,786,032,523 | |
(*1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 공시대상에서 제외하였습니다.
(*2) 리스부채는 기업회계기준서 제1107호 '금융상품: 공시'에 따라 공정가치 공시대상에서 제외하였습니다.
(2) 공정가치로 측정되는 자산·부채의 공정가치 측정치
1) 공정가치 서열체계 및 측정방법
공정가치란 측정일에 시장참여자 사이의 정상거래에서 자산을 매도할 때 받거나 부채를 이전할 때 지급하게 될 가격을 의미합니다. 공정가치 측정은 측정일에 현행 시장 상황에서 자산을 매도하거나 부채를 이전하는 시장참여자 사이의 정상거래에서의 가격을 추정하는 것으로, 회사는 공정가치 평가시 시장정보를 최대한 사용하고, 관측 가능하지 않은 변수는 최소한으로 사용하고 있습니다.
당사는 공정가치로 측정되는 자산·부채를 공정가치 측정에 사용된 투입변수에 따라다음과 같은 공정가치 서열체계로 분류하였습니다.
수준1 : 활성시장에서 공시되는 가격을 공정가치로 측정하는 자산·부채의 경우 동 자산·부채의 공정가치는 수준1로 분류됩니다. 공정가치가 수준1로 분류되는 자산·부채는 한국거래소 및 미국 나스닥에서 거래되는 종가를 기준으로 합니다.
수준2 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 모든 유의적인 투입변수가 시장에서 관측한 정보에 해당하면 자산·부채의 공정가치는 수준2로 분류됩니다.
수준3 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 하나 이상의 유의적인 투입변수가 시장에서 관측불가능한 정보에 해당하면 동 금융상품의 공정가치는 수준3으로 분류됩니다.
자산·부채의 공정가치는 자체적으로 개발한 내부평가모형을 통해 평가한 값을 사용하거나 독립적인 외부평가기관이 평가한 값을 제공받아 사용하고 있습니다.
2) 보고기간말 현재 재무상태표에 공정가치로 측정되는 자산·부채의 공정가치 서열체계별 공정가치 금액은 다음과 같습니다.
<당3분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | - | 4,845,878,375 | - | 4,845,878,375 |
| 기타포괄손익-공정가치측정금융자산 : | |||||
| Inovio Pharmaceuticals Inc.(*1) | 38,496,917 | 38,496,917 | - | - | 38,496,917 |
| 합계 | 4,884,375,292 | 38,496,917 | 4,845,878,375 | - | 4,884,375,292 |
| <부채> | |||||
| 금융부채 : | |||||
| 파생상품부채(4CB) | 2,943,222 | - | - | 2,943,222 | 2,943,222 |
(*1) 당3분기말 현재 미국 나스닥(NASDAQ) 시장에서 형성된 주가를 반영하여 공정가치로 평가하였습니다.
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 기타포괄손익-공정가치측정금융자산 : | |||||
| Inovio Pharmaceuticals Inc. | 145,486,546 | 145,486,546 | - | - | 145,486,546 |
| 금융자산 : | |||||
| 파생상품자산(5CB) | 27,862,887 | - | - | 27,862,887 | 27,862,887 |
| 합계 | 173,349,433 | 145,486,546 | - | 27,862,887 | 173,349,433 |
| 금융부채 : | |||||
| 파생상품부채(4CB) | 332,290,672 | - | - | 332,290,672 | 332,290,672 |
| 파생상품부채(5CB) | 2,400,622,308 | - | - | 2,400,622,308 | 2,400,622,308 |
| 합계 | 2,732,912,980 | - | - | 2,732,912,980 | 2,732,912,980 |
(3) 공정가치 서열체계 수준3 관련 공시
1) 공정가치로 측정되는 자산·부채 중 공정가치 서열체계 수준3으로 분류된 자산·부채의 당기 변동내역은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 파생상품자산 | 파생상품부채 | 합계 |
| 기초잔액 | 27,862,887 | (2,732,912,980) | (2,705,050,093) |
| 당해 기간의 총손익 | |||
| 당기손익에 포함된 손익 (*1) | (7,375,067) | 292,111,799 | 284,736,732 |
| 기타변동 | |||
| 상환으로 인한 정산 | (20,487,820) | 2,437,857,959 | 2,417,370,139 |
| 기말잔액 | - | (2,943,222) | (2,943,222) |
(*1) 공정가치 서열체계 수준3 변동내용 중 당기손익으로 인식된 금액과 보고기간말 현재 보유하고 있는 자산·부채의 미실현 손익 변동액으로서 당기손익에 포함된 금액은 포괄손익계산서상 다음과 같은 개별항목으로 표시되고 있습니다.
| (단위: 원) | |
|---|---|
| 구분 | 영업외손익(금융손익) |
| 당기손익 인식금액 | 284,736,732 |
| 보고기간말 현재 보유하고 있는 자산·부채의 미실현손익의 변동액으로서 당기손익에 포함된 금액 | 284,736,732 |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 파생상품자산 | 파생상품부채 | 합계 |
| 기초잔액 | 175,385,091 | - | 175,385,091 |
| 당해 기간의 총손익 | |||
| 당기손익에 포함된 손익 (*1) | (178,226,711) | 788,922,375 | 610,695,664 |
| 매입, 발행, 매도 및 결제 | |||
| 발행 | 11,723,139 | 4,844,175,785 | 4,855,898,924 |
| 기타증감 | - | - | - |
| 기말잔액 | 8,881,519 | 4,055,253,410 | 4,064,134,929 |
(*1) 공정가치 서열체계 수준3 변동내용 중 당기손익으로 인식된 금액과 보고기간말 현재 보유하고 있는 자산·부채의 미실현 손익 변동액으로서 당기손익에 포함된 금액은 포괄손익계산서상 다음과 같은 항목으로 표시되고 있습니다.
| (단위: 원) | |
|---|---|
| 구분 | 영업외손익(금융손익) |
| 당기손익 인식금액 | 610,695,664 |
| 보고기간말 현재 보유하고 있는 자산·부채의 미실현손익의 변동액으로서 당기손익에 포함된 금액 | 610,695,664 |
2) 보고기간말 현재 재무상태표에서 공정가치로 측정된 자산·부채 중 공정가치 서열체계 수준3으로 분류된 항목의 가치평가기법, 투입변수 및 유의적이지만 관측가능하지 않은 투입변수에 대한 범위 등은 다음과 같습니다.
<당3분기말>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 투입변수 | 유의적이지만 관측 가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수의 범위 | ||
| 평가일 주가 | 무위험할인율 | 주가변동성 | |||||
| 금융부채 : | |||||||
| 파생상품부채(4CB) | 2,943,222 | 옵션평가모형 | 3,900 원 | 3.53%~3.49% | 41.99% | 위험할인율 | 9.25%~10.15% |
<전기말>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 투입변수 | 유의적이지만 관측 가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수의 범위 | ||
| 평가일 주가 | 무위험할인율 | 주가변동성 | |||||
| 금융자산 : | |||||||
| 파생상품자산(4CB) | - | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 파생상품자산(5CB) | 27,862,887 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 합계 | 27,862,887 | ||||||
| 금융부채 : | |||||||
| 파생상품부채(4CB) | 332,290,672 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 파생상품부채(5CB) | 2,400,622,308 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 합계 | 2,732,912,980 | ||||||
3) 관측가능하지 않은 투입변수의 변동에 의한 공정가치 측정치의 민감도
(가) 관측가능하지 않은 투입변수의 변동이 공정가치 측정치에 미치는 영향은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 관측 가능하지 않은 투입변수 | 관측가능하지 않은 투입변수가 공정가치 측정에 미치는 영향 |
| 금융부채 : | ||||
| 파생상품부채(4CB) | 2,943,222 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 관측 가능하지 않은 투입변수 | 관측가능하지 않은 투입변수가 공정가치 측정에 미치는 영향 |
| 금융자산 : | ||||
| 파생상품자산(4CB) | - | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 파생상품자산(5CB) | 27,862,887 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 합계 | 27,862,887 | |||
| 금융부채 : | ||||
| 파생상품부채(4CB) | 332,290,672 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 파생상품부채(5CB) | 2,400,622,308 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 합계 | 2,732,912,980 | |||
(나) 관측가능하지 않은 투입변수의 변동이 금융자산과 금융부채의 공정가치 측정치에 미치는 효과는 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 변동효과의 계산방법 | 공정가치 변동 효과 | |
| 당기손익 | ||||
| 유리한 변동 | 불리한 변동 | |||
| 금융부채 : | ||||
| 파생상품부채(4CB) | 2,943,222 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | - | - |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 변동효과의 계산방법 | 공정가치 변동 효과 | |
| 당기손익 | ||||
| 유리한 변동 | 불리한 변동 | |||
| 금융자산 : | ||||
| 파생상품자산(4CB) | - | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | - | - |
| 파생상품자산(5CB) | 27,862,887 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 27,922,236 | 27,804,815 |
| 합계 | 27,862,887 | 27,922,236 | 27,804,815 | |
| 금융부채 : | ||||
| 파생상품부채(4CB) | 332,290,672 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 295,995,707 | 368,174,406 |
| 파생상품부채(5CB) | 2,400,622,308 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 2,264,996,376 | 2,531,877,952 |
| 합계 | 2,732,912,980 | 2,560,992,083 | 2,900,052,358 | |
5. 현금및현금성자산
현금및현금성자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 현금 | 15,176,894 | - |
| 보통예금 | 6,011,095,734 | 5,152,039,290 |
| 기타금융자산 | - | 5,299,696,482 |
| 합계 | 6,026,272,628 | 10,451,735,772 |
6. 매출채권 및 기타채권
(1) 매출채권 및 기타채권의 내용은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 당3분기말 | 전기말 | ||||
| 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | |
| 매출채권 | 12,127,211,036 | (3,086,428,512) | 9,040,782,524 | 15,241,820,564 | (1,272,448,329) | 13,969,372,235 |
| 단기기타채권 : | ||||||
| 미수금 | 172,499,436 | - | 172,499,436 | 749,194,563 | - | 749,194,563 |
| 미수수익 | 10,011,708,979 | (331,206,925) | 9,680,502,054 | 5,225,494,059 | (129,968,854) | 5,095,525,205 |
| 합계 | 22,311,419,451 | (3,417,635,437) | 18,893,784,014 | 21,216,509,186 | (1,402,417,183) | 19,814,092,003 |
(2) 보고기간말 현재 매출채권에 대해 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용하고 있으며, 매출채권의 신용위험정보의 세부내용은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 연체된 일수 | |||||
| 6개월 이하 | 6개월 초과 -> 1년 이하 | 1년 초과 -> 3년 이하 | 3년 초과 | 적용대상 제외 (*) | 계 | |
| 총장부금액 | 2,950,878,535 | 43,646,493 | 275,475,288 | 99,246,418 | 8,757,964,302 | 12,127,211,036 |
| 기대손실율 | 0.4% | 13.1% | 24.8% | 100.0% | - | 25.45% |
| 전체기간기대손실 | (12,241,072) | (5,736,952) | (68,230,956) | (99,246,418) | (2,900,973,114) | (3,086,428,512) |
| 순장부금액 | 2,938,637,463 | 37,909,541 | 207,244,332 | - | 5,856,991,188 | 9,040,782,524 |
(*) 개별평가 대상 채권의 경우 연체율을 적용하지 않고 개별평가를 수행하여 손실충당금을 인식하였습니다.
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 연체된 일수 | |||||
| 6개월 이하 | 6개월 초과 -> 1년 이하 | 1년 초과 -> 3년 이하 | 3년 초과 | 적용대상 제외 (*) | 계 | |
| 총장부금액 | 4,571,472,352 | 2,655,488,879 | 90,699,806 | 11,002,807 | 7,913,156,720 | 15,241,820,564 |
| 기대손실율 | 3.1% | 41.6% | 13.9% | 100.0% | - | 8.3% |
| 전체기간기대손실 | (143,258,419) | (1,105,579,200) | (12,607,903) | (11,002,807) | - | (1,272,448,329) |
| 순장부금액 | 4,428,213,933 | 1,549,909,679 | 78,091,903 | - | 7,913,156,720 | 13,969,372,235 |
(*) 특수관계인, 미청구분, 받을어음 및 전자어음은 연체율을 적용하지 않았으며 내부거래제거분도 포함되어 있습니다.
(3) 보고기간말 현재 매출채권 및 기타채권의 손실충당금(대손충당금)의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 매출채권 | 1,272,448,329 | 1,782,364,913 | (1,000,000) | - | 32,615,270 | 3,086,428,512 |
| 단기기타채권 : | ||||||
| 미수수익 | 129,968,854 | 201,238,071 | - | - | - | 331,206,925 |
| 합계 | 1,402,417,183 | 1,983,602,984 | (1,000,000) | - | 32,615,270 | 3,417,635,437 |
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 매출채권 | 135,052,951 | 975,992,123 | - | (24,932,416) | 141,677,456 | 1,227,790,114 |
| 단기기타채권 : | ||||||
| 미수수익 | 49,534,498 | 1,935,366 | (51,469,864) | - | - | - |
| 합계 | 184,587,449 | 977,927,489 | (51,469,864) | (24,932,416) | 141,677,456 | 1,227,790,114 |
7. 기타금융자산
(1) 기타금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 단기기타금융자산 : | ||
| 상각후원가측정기타금융자산 | 55,250,686,645 | 55,026,320,677 |
| 차감 : 대손충당금 | (712,764,764) | (415,852,991) |
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | - |
| 파생상품자산 | - | 27,862,887 |
| 소계 | 59,383,800,256 | 54,638,330,573 |
| 장기기타금융자산 : | ||
| 상각후원가측정기타금융자산 | 72,801,106,529 | 90,388,694,294 |
| 차감 : 대손충당금 | (1,115,295,804) | (1,303,215,282) |
| 기타포괄손익-공정가치측정금융자산 | 38,496,917 | 145,486,546 |
| 소계 | 71,724,307,642 | 89,230,965,558 |
| 합계 | 131,108,107,898 | 143,869,296,131 |
(2) 보고기간말 현재 기타금융자산의 손실충당금(대손충당금)의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 단기기타금융자산 : | ||||||
| 상각후원가측정기타금융자산 | 415,852,991 | 10,806,705 | - | - | 286,105,068 | 712,764,764 |
| 장기기타금융자산 : | ||||||
| 상각후원가측정기타금융자산 | 1,303,215,282 | 98,185,590 | - | - | (286,105,068) | 1,115,295,804 |
| 합계 | 1,719,068,273 | 108,992,295 | - | - | - | 1,828,060,568 |
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 설정 | 제각 | 환입 | 기타 | 기말 |
| 단기기타금융자산 : | ||||||
| 상각후원가측정기타금융자산 | 170,630,000 | - | (166,663,458) | (3,966,542) | - | - |
(3) 보고기간말 현재 상각후원가측정기타금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 유동항목 : | ||
| 단기금융상품 | - | 32,000,000,000 |
| 대여금 | 55,206,145,860 | 22,984,346,751 |
| 보증금 | 44,540,785 | 41,973,926 |
| 차감 : 대손충당금 | (712,764,764) | (415,852,991) |
| 소계 | 54,537,921,881 | 54,610,467,686 |
| 비유동항목 : | ||
| 장기금융상품 | 2,000,000 | 2,000,000 |
| 대여금 | 71,350,736,587 | 88,884,720,699 |
| 보증금 | 1,448,369,942 | 1,392,801,442 |
| 차감 : 대손충당금 | (1,115,295,804) | (1,303,215,282) |
| 퇴직연금운용자산 | - | 109,172,153 |
| 소계 | 71,685,810,725 | 89,085,479,012 |
| 합계 | 126,223,732,606 | 143,695,946,698 |
(4) 기타포괄손익-공정가치측정금융자산
1) 보고기간말 현재 기타포괄손익-공정가치측정금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 기타포괄손익-공정가치측정금융자산 : | ||
| 시장성있는지분증권 | 38,496,917 | 145,486,546 |
2) 보고기간말 현재 기타포괄손익-공정가치측정금융자산의 내용은 다음과 같습니다.
<당3분기말>
| (단위: 주,원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 주식수 | 지분율 | 취득원가 | 공정가치 | 장부금액 | 미실현보유손익 |
| Inovio Pharmaceuticals Inc.(*) | 73,590 | 0.03% | 1,414,226,499 | 38,496,917 | 38,496,917 | (1,375,729,582) |
(*) 당3분기말 현재 미국 나스닥(NASDAQ) 시장에서 형성된 주가를 반영하여 공정가치로 평가하였습니다.
<전기말>
| (단위: 주,원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 주식수 | 지분율 | 취득원가 | 공정가치 | 장부금액 | 미실현보유손익 |
| Inovio Pharmaceuticals Inc. | 73,590 | 0.03% | 1,414,226,499 | 145,486,546 | 145,486,546 | (1,268,739,953) |
(5) 기타금융자산에 포함된 파생상품자산의 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 전환사채 옵션(*) | - | 27,862,887 |
(*) 당기 중 5CB 전환사채가 전액 상환되어 당3분기말 현재 파생상품자산으로 인식될 금액은 없습니다.
(6) 당기손익-공정가치측정금융자산
1) 보고기간말 현재 당기손익-공정가치측정금융자산의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 당기손익-공정가치측정금융자산 : | ||
| 단기매매증권(MMF) | 4,845,878,375 | - |
8. 파생상품 및 위험회피회계
당3분기말과 전기말 현재 매매목적과 위험회피목적의 파생상품의 거래는 없습니다.
9. 재고자산
(1) 당3분기말과 전기말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 당3분기말 | 전기말 | ||||
| 취득원가 | 평가손실충당금 | 장부금액 | 취득원가 | 평가손실충당금 | 장부금액 | |
| 상품 | 3,615,505,280 | (184,290,007) | 3,431,215,273 | 3,142,662,411 | (93,628,044) | 3,049,034,367 |
| 제품 | 509,706,429 | (172,751,692) | 336,954,737 | 451,340,644 | (107,127,555) | 344,213,089 |
| 원재료 | 716,955,429 | - | 716,955,429 | 633,883,515 | - | 633,883,515 |
| 미착품 | 137,961,975 | - | 137,961,975 | 573,946,845 | - | 573,946,845 |
| 합계 | 4,980,129,113 | (357,041,699) | 4,623,087,414 | 4,801,833,415 | (200,755,599) | 4,601,077,816 |
(2) 당3분기와 전3분기 중 재고자산과 관련하여 인식한 평가손실 및 평가손실환입은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 매출원가 : | ||
| 재고자산평가손실 | (156,286,100) | (69,045,009) |
10. 기타자산
기타자산의 내용은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당3분기말 | 전기말 | ||||
| 유동 | 비유동 | 계 | 유동 | 비유동 | 계 | |
| 선급금 | 4,845,249,502 | 1,067,727,763 | 5,912,977,265 | 4,685,355,486 | 306,199,818 | 4,991,555,304 |
| 선급비용 | 10,869,999,026 | - | 10,869,999,026 | 12,334,266,605 | - | 12,334,266,605 |
| 선급법인세 | 77,031,577 | - | 77,031,577 | 194,125,540 | - | 194,125,540 |
| 합계 | 15,792,280,105 | 1,067,727,763 | 16,860,007,868 | 17,213,747,631 | 306,199,818 | 17,519,947,449 |
11. 종속기업투자
(1) 현황
종속기업의 현황은 다음과 같습니다.
<당3분기>
| 회사명 | 지분율 | 주된사업장 | 보고기간종료일 | 관계의성격 | 측정방법 |
|---|---|---|---|---|---|
| Dong-il Interlining Ltd. | 100% | 베트남 | 2023-09-30 | 생산 및 판매 | 원가법 |
| VGXI, Inc. | 100% | 미국 | 2023-09-30 | 생산 및 판매 | 원가법 |
<전기>
| 회사명 | 지분율 | 주된사업장 | 보고기간종료일 | 관계의성격 | 측정방법 |
|---|---|---|---|---|---|
| Dong-il Interlining Ltd. | 100% | 베트남 | 2022-12-31 | 생산 및 판매 | 원가법 |
| VGXI, Inc. | 100% | 미국 | 2022-12-31 | 생산 및 판매 | 원가법 |
(2) 투자내용
| (단위: 원) | ||||
|---|---|---|---|---|
| 회사명 | 당3분기 | 전기말 | ||
| 취득원가 | 장부금액 | 취득원가 | 장부금액 | |
| Dong-il Interlining Ltd. | 2,668,443,357 | 1,336,433,905 | 2,668,443,357 | 2,668,443,357 |
| VGXI, Inc. | 9,671,971,027 | - | 9,671,971,027 | 9,671,971,027 |
| 합계 | 12,340,414,384 | 1,336,433,905 | 12,340,414,384 | 12,340,414,384 |
(3) 변동내용
종속기업 투자의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 기업명 | 기초 | 취득 | 처분 | 손상차손 | 기말 |
| <종속기업> | |||||
| Dong-il Interlining Ltd. | 2,668,443,357 | - | - | (1,332,009,452) | 1,336,433,905 |
| VGXI, Inc. | 9,671,971,027 | - | - | (9,671,971,027) | - |
| 합계 | 12,340,414,384 | - | - | (11,003,980,479) | 1,336,433,905 |
<전3분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 기업명 | 기초 | 취득 | 처분 | 손상차손 | 기말 |
| <종속기업> | |||||
| Dong-il Interlining Ltd. | 2,668,443,357 | - | - | - | 2,668,443,357 |
| VGXI, Inc. | 9,671,971,027 | - | - | - | 9,671,971,027 |
| 합계 | 12,340,414,384 | - | - | - | 12,340,414,384 |
(4) 요약재무정보
종속기업의 요약재무정보는 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 회사명 | 당3분기말 | 당3분기 | ||||
| 자산 | 부채 | 자본 | 매출 | 당기순손익 | 총포괄손익 | |
| Dong-il Interlining Ltd. | 10,670,013,720 | 9,333,579,815 | 1,336,433,905 | 5,803,433,967 | (551,413,490) | (460,393,169) |
| VGXI, Inc. | 152,482,600,633 | 169,858,059,906 | (17,375,459,273) | 17,482,230,896 | (22,196,957,363) | (21,203,867,508) |
<전기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 회사명 | 전기말 | 전3분기 | ||||
| 자산 | 부채 | 자본 | 매출 | 당기순손익 | 총포괄손익 | |
| Dong-il Interlining Ltd. | 9,186,899,426 | 7,390,072,352 | 1,796,827,074 | 8,691,893,066 | (270,854,661) | 159,675,112 |
| VGXI, Inc. | 151,835,567,743 | 146,925,613,798 | 4,909,953,945 | 25,366,043,167 | (5,210,394,603) | (3,457,846,010) |
12. 투자부동산
(1) 투자부동산의 내용은 다음과 같습니다.
<당3분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 장부금액 | 공정가치(*) |
| 토 지 | 1,875,411,925 | - | - | 1,875,411,925 | 2,368,312,900 |
| 건 물 | 2,183,392,690 | (1,431,271,433) | - | 752,121,257 | 752,121,257 |
| 구축물 | 413,944,918 | (400,779,753) | - | 13,165,165 | 13,165,165 |
| 합계 | 4,472,749,533 | (1,832,051,186) | - | 2,640,698,347 | 3,133,599,322 |
(*) 토지는 공시지가로 기재하였으며, 건물,구축물은 취득원가에서 감가상각누계액을 차감한 장부가액으로 기재하였습니다.
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 장부금액 | 공정가치 |
| 토 지 | 1,875,411,925 | - | - | 1,875,411,925 | 2,560,402,600 |
| 건 물 | 2,183,392,690 | (1,390,746,034) | - | 792,646,656 | 792,646,656 |
| 합계 | 4,058,804,615 | (1,390,746,034) | - | 2,668,058,581 | 3,353,049,256 |
(2) 투자부동산의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 토지 | 건물 | 구축물 | 합계 |
| 기초 | 1,875,411,925 | 792,646,656 | - | 2,668,058,581 |
| 대체 (*) | - | - | 15,818,517 | 15,818,517 |
| 감가상각 | - | (40,525,399) | (2,653,352) | (43,178,751) |
| 기말 | 1,875,411,925 | 752,121,257 | 13,165,165 | 2,640,698,347 |
(*) 당기 중 유형자산에서 대체되었습니다.
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 토지 | 건물 | 합계 |
| 기초 | 1,875,411,925 | 846,680,518 | 2,722,092,443 |
| 감가상각 | - | (40,525,399) | (40,525,399) |
| 기말 | 1,875,411,925 | 806,155,119 | 2,681,567,044 |
(3) 투자부동산은 신한은행과 체결한 일반대출, 무역금융 한도와 관련하여 담보로 제공되고 있습니다.
13. 유형자산
(1) 유형자산의 내용은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액 | 정부보조금 | 장부금액 |
| 기계장치 | 873,674,005 | (469,570,709) | - | - | - | 404,103,296 |
| 차량운반구 | 268,059,455 | (213,614,005) | - | - | - | 54,445,450 |
| 공구와기구 | 2,559,091 | (2,559,091) | - | - | - | - |
| 비품 | 3,432,832,754 | (1,477,587,836) | - | - | - | 1,955,244,918 |
| 리스개량자산 | 6,846,192,899 | (2,217,415,169) | - | - | - | 4,628,777,730 |
| 사용권자산-건물 | 6,102,718,893 | (3,270,680,976) | - | - | - | 2,832,037,917 |
| 사용권자산-차량 | 24,691,654 | (11,831,417) | - | - | - | 12,860,237 |
| 합계 | 17,550,728,751 | (7,663,259,203) | - | - | - | 9,887,469,548 |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액 | 정부보조금 | 장부금액 |
| 구축물 | 413,944,918 | (398,126,401) | - | - | - | 15,818,517 |
| 기계장치 | 758,835,128 | (381,247,389) | - | - | - | 377,587,739 |
| 차량운반구 | 268,059,455 | (194,013,643) | - | - | - | 74,045,812 |
| 공구와기구 | 2,559,091 | (2,559,091) | - | - | - | - |
| 비품 | 3,520,264,688 | (990,828,458) | - | - | - | 2,529,436,230 |
| 리스개량자산 | 6,376,822,635 | (1,284,289,855) | - | - | - | 5,092,532,780 |
| 사용권자산-건물 | 6,079,429,800 | (2,254,865,071) | - | - | - | 3,824,564,729 |
| 사용권자산-차량 | 24,691,654 | (7,201,732) | - | - | - | 17,489,922 |
| 합계 | 17,444,607,369 | (5,513,131,640) | - | - | - | 11,931,475,729 |
(2) 유형자산의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구분 | 구축물 | 기계장치 | 차량운반구 | 비품 | 리스개량자산 | 사용권자산 | 합 계 | |
| 건물 | 기타 | |||||||
| 기초 | 15,818,517 | 377,587,739 | 74,045,812 | 2,529,436,232 | 5,092,532,780 | 3,824,564,729 | 17,489,922 | 11,931,475,731 |
| 취득 | - | 85,361,180 | - | 39,742,203 | 79,404,388 | - | - | 204,507,771 |
| 대체 | (15,818,517) | - | - | (80,334,277) | - | 27,762,550 | - | (68,390,244) |
| 처분 | - | - | - | (12,298,327) | - | - | - | (12,298,327) |
| 감가상각 | - | (79,226,391) | (19,600,362) | (518,250,097) | (826,320,410) | (1,011,867,111) | (4,629,685) | (2,459,894,056) |
| 기타증감 (*) | - | 20,380,768 | - | (3,050,816) | 283,160,972 | (8,422,251) | - | 292,068,673 |
| 기말 | - | 404,103,296 | 54,445,450 | 1,955,244,918 | 4,628,777,730 | 2,832,037,917 | 12,860,237 | 9,887,469,548 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
당기 중 구축물을 투자부동산으로 대체하였습니다.
<전3분기>
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구분 | 구축물 | 기계장치 | 차량운반구 | 비품 | 리스개량자산 | 사용권자산 | 합 계 | |
| 건물 | 기타 | |||||||
| 기초 | 19,356,317 | 443,398,446 | 100,179,628 | 1,899,756,582 | 5,704,260,854 | 4,859,790,854 | 40,621,110 | 13,067,363,791 |
| 취득 | - | - | - | 1,292,352,741 | 60,331,245 | - | - | 1,352,683,986 |
| 처분 | - | - | - | - | - | - | (14,963,183) | (14,963,183) |
| 감가상각 | (2,653,352) | (72,395,326) | (19,600,362) | (480,475,736) | (794,241,765) | (820,023,573) | (6,624,776) | (2,196,014,890) |
| 기타증감(*) | - | 83,777,516 | - | 45,921,761 | 1,095,713,133 | 89,298,960 | - | 1,314,711,370 |
| 기말금액 | 16,702,965 | 454,780,636 | 80,579,266 | 2,757,555,348 | 6,066,063,467 | 4,129,066,241 | 19,033,151 | 13,523,781,074 |
(*) 기타증감액은 장부가액의 환율변동 등으로 인한 증감액입니다.
(3) 유형자산의 감가상각비는 판매비와관리비로 분류되었습니다.
(4) 유형자산 중 소유권이 제한되어 있는 자산은 없습니다.
14. 무형자산
(1) 무형자산의 내용은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액 | 정부보조금 | 장부금액 |
| 영업권 | 183,185,000 | (183,185,000) | - | - | - | - |
| 특허권 | 91,046,524 | (69,879,686) | - | - | - | 21,166,838 |
| 기타의무형자산 | 47,200,000 | (38,866,667) | - | - | - | 8,333,333 |
| 합계 | 321,431,524 | (291,931,353) | - | - | - | 29,500,171 |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 취득원가 | 감가상각누계액 | 손상차손누계액 | 기타증감액 | 정부보조금 | 장부금액 |
| 영업권 | 183,185,000 | (183,185,000) | - | - | - | - |
| 특허권 | 91,046,524 | (65,529,525) | - | - | - | 25,516,999 |
| 기타의무형자산 | 47,200,000 | (35,866,666) | - | - | - | 11,333,334 |
| 합계 | 321,431,524 | (284,581,191) | - | - | - | 36,850,333 |
(2) 무형자산의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 특허권 | 기타의무형자산 | 합계 |
| 기초 | 25,516,999 | 11,333,334 | 36,850,333 |
| 감가상각 | (4,350,161) | (3,000,001) | (7,350,162) |
| 기말 | 21,166,838 | 8,333,333 | 29,500,171 |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 특허권 | 기타의무형자산 | 합계 |
| 기초 | 36,241,587 | 15,813,334 | 52,054,921 |
| 감가상각 | (9,274,544) | (3,480,001) | (12,754,545) |
| 기말 | 26,967,043 | 12,333,333 | 39,300,376 |
(3) 무형자산상각비의 포괄손익계산서의 계정과목별 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 판매비와관리비 | 7,350,162 | 12,754,545 |
(4) 비용으로 인식한 연구와 개발 지출의 총액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 경상연구개발비 | 6,871,240,712 | 9,011,228,891 |
(5) 무형자산 중 권리가 제한되어 있는 자산은 없습니다.
15. 차입원가
자본화를 위한 차입금은 없습니다.
16. 정부보조금
당사는 신약개발과 관련하여 정부과제수행에 따른 정부보조금을 수령하였습니다. 정부보조금 사용금액과 관련하여 당3분기 중 수익으로 인식한 금액은 6,111,873원입니다. 정부과제로 수령한 보조금과 관련하여 정부지원에 부수되는 조건이 미이행된 금액은 선수금으로 계상하고 있으며, 당3분기말 현재 잔액은 없습니다.
17. 리스
(1) 보고기간말 현재 기초자산 유형별 사용권자산의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
|
부동산 |
2,832,037,917 | 3,824,564,729 |
|
차량리스 |
12,860,237 | 17,489,922 |
| 합계 | 2,844,898,154 | 3,842,054,651 |
당3분기 중 증가된 사용권자산은 없습니다.
(2) 보고기간 중 리스와 관련해 손익으로 인식된 금액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
|
사용권자산의 감가상각비 |
||
|
부동산 |
1,011,867,111 | 820,023,573 |
|
차량리스 |
4,629,685 | 6,624,776 |
|
합계 |
1,016,496,796 | 826,648,349 |
|
리스부채에 대한 이자비용 |
159,812,234 | 263,252,264 |
|
단기리스가 아닌 소액자산 리스료 |
4,730,029 | 4,494,792 |
리스의 총 현금유출은 883,321,187원입니다.
(3) 보고기간말 현재 리스부채의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기말 | 전기말 | ||
| 최소리스료 | 최소리스료의 현재가치 |
최소리스료 | 최소리스료의 현재가치 |
|
| 1년 이내 | 729,744,742 | 707,974,191 | 1,165,517,096 | 876,148,271 |
| 1년 초과 5년 이내 | 3,276,471,834 | 2,694,254,272 | 3,707,715,534 | 3,223,626,244 |
| 합계 | 4,006,216,576 | 3,402,228,463 | 4,873,232,630 | 4,099,774,515 |
(4) 보고기간말 현재 리스부채의 유동성분류 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 유동 | 707,974,192 | 876,148,271 |
| 비유동 | 2,694,254,272 | 3,223,626,244 |
| 합계 | 3,402,228,464 | 4,099,774,515 |
18. 매각예정자산
보고기간말 매각예정 비유동자산은 없습니다.
19. 매입채무 및 기타채무
매입채무 및 기타채무의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 매입채무 | 4,933,551,684 | 6,016,443,739 |
| 단기기타채무 | 104,938,015 | 35,314,297 |
| 합계 | 5,038,489,699 | 6,051,758,036 |
20. 차입금 및 전환사채
(1) 차입금 및 전환사채의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 차입처 | 연이자율 | 당3분기말 | 전기말 |
| 유동 : | ||||
| 일반대출 | 신한은행 | 6.24% | 2,100,000,000 | - |
| 제4회 전환사채 | - | 0.00% | 106,419,187 | 3,862,188,755 |
| 제5회 전환사채 | - | 1.00% | - | 7,682,555,734 |
| 합계 | 2,206,419,187 | 11,544,744,489 | ||
(2) 전환사채의 변동내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | ||
| 제 4회(*1) | 제 5회(*2) | 제 4회 | 제 5회 | |
| 전환사채 | 100,000,000 | - | 4,160,000,000 | 11,700,000,000 |
| 사채상환할증금 | 9,380,600 | - | 390,232,960 | 731,682,900 |
| 전환권조정 | (2,832,711) | - | (658,142,058) | (4,560,136,881) |
| 사채할인발행차금 | (128,702) | - | (29,902,147) | (188,990,285) |
| 합계 | 106,419,187 | - | 3,862,188,755 | 7,682,555,734 |
| 유동성대체액 | - | - | - | - |
| 비유동성잔액 | - | - | - | - |
(*1) 당3분기말 현재 4회차 사채총액 240억원은 2023년 11월 25일 만기가 도래함에 따라 전액 상환되었습니다.
(*2) 당3분기말 현재 5회차 전환사채는 계약조건에 따라 전액(117억원) 조기상환 하였습니다.
(3) 전환사채의 발행내역은 다음과 같습니다.
| 구분 | 전환사채 4회차 (무기명식 무보증) | 전환사채 5회차 (무기명식 무보증) |
|---|---|---|
| 권면총액(원) | 24,000,000,000 | 11,700,000,000 |
| 표면이자율 | 0% | 1% |
| 만기이자율 | 3% | 3% |
| 발행일 | 2020년 11월 25일 | 2022년 04월 15일 |
| 만기일 | 2023년 11월 25일 | 2025년 04월 15일 |
| 상환방법 | 만기상환 | 만기상환 |
| 조기상환청구권 가능시기 | 2022년 05월 25일 | 2023년 10월 15일 |
| 전환청구기간 | 2021년 11월 25일~2023년 10월 25일 | 2023년 04월 15일~2025년 03월 15일 |
| 전환가격(발행시) | 27,143 원 | 13,935 원 |
| 조정후전환가격(당3분기말 현재) | 12,312 원 | - |
(4) 당기 중 주가변동으로 인하여 전환사채의 전환권 및 옵션의 평가손익이 발생하였습니다. 해당 파생상품평가손익은 포괄손익계산서에 금융손익으로 계상하였습니다.
21. 기타금융부채
(1) 기타금융부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 단기기타금융부채 : | ||
| 상각후원가측정금융부채 | 770,310,231 | 1,231,790,774 |
| 파생상품부채 | 2,943,222 | 2,732,912,980 |
| 소계 | 773,253,453 | 3,964,703,754 |
| 장기기타금융부채 : | ||
| 상각후원가측정금융부채 | 2,695,454,272 | 3,224,826,244 |
| 합계 | 3,468,707,725 | 7,189,529,998 |
(2) 상각후원가로 측정되는 금융부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| <단기> | ||
| 미지급비용 | 62,336,039 | 306,440,362 |
| 미지급세금 | - | 21,611,622 |
| 리스부채 | 707,974,192 | 876,148,271 |
| 예수금 | - | 27,590,519 |
| 소계 | 770,310,231 | 1,231,790,774 |
| <장기> | - | |
| 리스부채 | 2,694,254,272 | 3,223,626,244 |
| 수입보증금 | 1,200,000 | 1,200,000 |
| 소계 | 2,695,454,272 | 3,224,826,244 |
| 합계 | 3,465,764,503 | 4,456,617,018 |
(3) 기타금융부채에 포함된 파생상품부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 전환사채 옵션 | 2,943,222 | 2,732,912,980 |
22. 퇴직급여부채
당사는 종업원을 위하여 확정급여제도를 운영하고 있으며, 이 제도는 종업원의 퇴직시 근속 1년당 최종 3개월 평균급여에 지급률을 곱한 금액을 지급하도록 되어 있습니다. 확정급여채무의 보험수리적 평가는 적격성이 있는 독립적인 보험계리인에 의해서 예측단위적립방식을 사용하여 수행되었으며, 임원 및 정년초과자는 비계속기준에 의해서 산출되었습니다.
(1) 퇴직급여부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 확정급여채무의 현재가치 | 11,574,051,222 | 10,685,769,121 |
| 사외적립자산의 공정가치 | (11,016,407,735) | (10,794,941,274) |
| 재무상태표에 인식하는 부채(합계) | 557,643,487 | - |
| 재무상태표에 인식하는 자산(합계) | - | 109,172,153 |
(2) 확정급여채무
확정급여채무의 변동내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 기초 | 10,685,769,121 | 9,273,539,562 |
| 근무원가 | 677,812,185 | 514,239,534 |
| 이자원가 | 373,925,016 | 159,368,643 |
| 재측정요소 | - | - |
| 급여지급액 | (163,455,100) | (198,764,767) |
| 기말 | 11,574,051,222 | 9,748,382,972 |
(3) 사외적립자산
1) 사외적립자산의 공정가치 변동내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 기초 | 10,794,941,274 | 8,453,185,158 |
| 이자수익 | 370,750,261 | 118,334,065 |
| 재측정요소 | - | - |
| 사용자의 기여금 | - | 800,000,000 |
| 급여지급액 | (149,283,800) | (182,348,100) |
| 기말 | 11,016,407,735 | 9,189,171,123 |
2) 사외적립자산의 구성내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 현금 | 13,839 | 94,395 |
| 정기예금 | 11,016,393,896 | 10,794,846,879 |
| 합계 | 11,016,407,735 | 10,794,941,274 |
3) 사외적립자산의 실제수익은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 사외적립자산 | 253,713,228 | 75,711,725 |
(4) 총비용
1) 당기손익으로 인식한 총비용의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 당기근무원가 | 677,812,185 | 514,239,534 |
| 이자원가 | 373,925,016 | 159,368,643 |
| 이자수익 | (370,750,261) | (118,334,065) |
| 합계 | 680,986,940 | 555,274,112 |
2) 당기손익으로 인식한 총비용의 계정과목별 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 판매비와관리비 | 680,986,940 | 555,274,112 |
(5) 보험수리적가정
보험수리적가정의 주요 내용은 다음과 같습니다.
| (단위: %) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 할인율 | 5.13 | 5.13 |
| 임금상승률 | 4.86 | 4.86 |
| 예상퇴직률 | 10.56 | 10.56 |
23. 충당부채
복구충당부채의 변동내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 충당부채변동내용 : | ||
| 기초 | 171,350,978 | 133,776,590 |
| 설정 | - | 31,310,356 |
| 현재가치기간경과 | 19,618,833 | 15,790,866 |
| 기말 : | ||
| 유동성 | - | - |
| 비유동성 | 190,969,811 | 180,877,812 |
| 기타사항 : | ||
| 충당부채의 성격 | 임차건물 원상복구 | 임차건물 원상복구 |
| 경제적효익유출예상시기 | 2026-05-31 | 2026-05-31 |
24. 기타부채
기타부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기 |
| 기타유동부채 : | ||
| 선수금 | 6,316,271,582 | 6,970,912,304 |
| 제세예수금 | 53,558,020 | 24,958,860 |
| 종업원미지급비용 | 482,261,985 | - |
| 소계 | 6,852,091,587 | 6,995,871,164 |
| 기타비유동부채 : | ||
| 장기선수금 | 1,106,349,894 | 914,380,604 |
| 소계 | 1,106,349,894 | 914,380,604 |
| 합계 | 7,958,441,481 | 7,910,251,768 |
25. 계약자산과 계약부채
보고기간말 현재 계약자산과 계약부채의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전기 |
| 용역 계약자산 - 미청구공사(*1) | 1,461,710,067 | 2,744,975,487 |
| 용역 계약자산 - 선급계약 (*2) | 5,662,384,138 | 4,425,933,195 |
| 차감: 손실충당금 | - | - |
| 계약자산 합계 | 7,124,094,205 | 7,170,908,682 |
| 용역 계약부채 - 공사선수금(*3) | 2,725,779,544 | 1,976,470,955 |
| 용역 계약부채 - 초과청구공사(*3) | 4,695,012,841 | 5,813,164,232 |
| 계약부채 합계 | 7,420,792,385 | 7,789,635,187 |
(*1) 해당 자산은 재무상태표 상 매출채권으로 분류되었습니다.
(*2) 해당 자산은 재무상태표 상 기타유동자산(선급금) 및 기타비유동자산(장기선급금)으로 분류되었습니다.
(*3) 해당 부채는 재무상태표 상 기타유동부채(선수금) 및 기타비유동부채(장기선수금)로 분류되었습니다.
26. 자본금과 주식발행초과금
(1) 자본금
1) 자본금의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 발행할주식의 총수 | 300,000,000 | 300,000,000 |
| 1주당 액면금액 | 1,000 | 1,000 |
| 발행한 주식수 | 보통주 78,473,817 주 | 보통주 77,751,599 주 |
| 보통주자본금 | 78,473,817,000 | 77,751,599,000 |
2) 자본금 및 주식발행초과금의 변동내용은 다음과 같습니다.
| (단위:주,원) | |||||
|---|---|---|---|---|---|
| 구분 | 일자 | 주식수 | 주당발행금액 | 자본금 | 주식발행초과금 |
| <당3분기> | |||||
| 당기초 | - | 77,751,599 | 1,000 | 77,751,599,000 | 211,749,282,814 |
| 제3자배정유상증자 | 2023-09-18 | 722,218 | 1,000 | 722,218,000 | 1,742,126,920 |
| 당3분기말 | 78,473,817 | 1,000 | 78,473,817,000 | 213,491,409,734 | |
| <전기> | |||||
| 전기초 | 77,479,055 | 1,000 | 77,479,055,000 | 206,606,623,975 | |
| 전환사채 주식전환 | 2022-01-03 | 64,977 | 1,000 | 64,977,000 | 1,192,333,638 |
| 전환사채 주식전환 | 2022-01-05 | 19,493 | 1,000 | 19,493,000 | 355,851,068 |
| 주식선택권 행사 | 2022-01-06 | 50,000 | 1,000 | 50,000,000 | 862,044,000 |
| 전환사채 주식전환 | 2022-03-28 | 64,977 | 1,000 | 64,977,000 | 1,191,253,758 |
| 전환사채 주식전환 | 2022-07-15 | 16,244 | 1,000 | 16,244,000 | 342,151,422 |
| 전환사채 주식전환 | 2022-07-19 | 24,366 | 1,000 | 24,366,000 | 513,732,599 |
| 전환사채 주식전환 | 2022-07-21 | 32,487 | 1,000 | 32,487,000 | 685,292,354 |
| 전3분기말 | 77,751,599 | 1,000 | 77,751,599,000 | 211,749,282,814 | |
(2) 주식발행초과금
1) 주식발행초과금의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 주식발행초과금 | 213,491,409,734 | 211,749,282,814 |
2) 주식발행초과금의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 주식발행초과금 | 211,749,282,814 | 1,742,126,920 | - | 213,491,409,734 |
<전3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 주식발행초과금 | 206,606,623,975 | 4,978,177,031 | - | 211,584,801,006 |
27. 기타자본
(1) 기타자본의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 신주인수권대가 | 2,063,517,465 | 2,063,517,465 |
| 전환권대가 | 11,681,833 | 485,964,253 |
| 자기주식 | (2,955,448,445) | (2,955,448,445) |
| 기타자본조정 | 2,025,020,495 | 2,025,020,495 |
| 주식선택권 | 18,680,494,631 | 18,680,494,631 |
| 합계 | 19,825,265,979 | 20,299,548,399 |
당3분기말 현재 신주인수권대가는 종료되었으며, 신주인수권의 내역은 다음과 같습니다.
[단위: 원]
| 구 분 | 발행일 | 만기일 | 조기상환일 | 권면총액 | 신주인수권 대가 | 잔액 | |
|---|---|---|---|---|---|---|---|
| 신주인수권부사채(1차) | 2009-08-28 | 2012-08-28 | 2010-08-28 | 조기상환 | 100억원 | 2,052,314,267 | 2,052,314,267 |
| 신주인수권부사채(2차) | 2012-03-21 | 2015-03-21 | 2013-03-21/ 2013-06-21 |
조기상환 | 90억원 | 11,203,198 | 2,063,517,465 |
종료된 신주인수권대가로 신주인수권 권한은 없습니다.
(2) 기타자본의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 신주인수권대가 | 2,063,517,465 | - | - | 2,063,517,465 |
| 전환권대가(*1) | 485,964,253 | - | (474,282,420) | 11,681,833 |
| 자기주식 | (2,955,448,445) | - | - | (2,955,448,445) |
| 기타자본조정 | 2,025,020,495 | - | - | 2,025,020,495 |
| 주식선택권 | 18,680,494,631 | - | - | 18,680,494,631 |
| 합계 | 20,299,548,399 | - | (474,282,420) | 19,825,265,979 |
(*1) 당기 중 전환사채의 상환으로 인해 감소하였습니다.
<전3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 증가 | 감소 | 기말 |
| 신주인수권대가 | 2,063,517,465 | - | - | 2,063,517,465 |
| 전환권대가 | 1,200,892,432 | - | (691,564,513) | 509,327,919 |
| 자기주식 | (2,955,448,445) | - | - | (2,955,448,445) |
| 기타자본조정 | 2,002,155,311 | 17,756,261 | - | 2,019,911,572 |
| 주식선택권 | 19,210,094,631 | - | (529,600,000) | 18,680,494,631 |
| 합계 | 21,521,211,394 | 17,756,261 | (1,221,164,513) | 20,317,803,142 |
(3) 자기주식
자사주식의 가격안정과 주식배당 및 무상증자시 발행한 단주의 처리를 위하여 보통주식을 시가로 취득하고 있으며, 향후 시장상황에 따라 처분할 예정입니다. 당3분기 중 자기주식의 변동사항은 없습니다.
| (단위: 주,원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 주식수 | 금액 | 주식수 | 금액 | |
| 기초 | 209,464 | (2,955,448,445) | 209,464 | (2,955,448,445) |
| 기말 | 209,464 | (2,955,448,445) | 209,464 | (2,955,448,445) |
(4) 주식기준보상제도
1) 주식선택권 미행사 주식은 당기 중에 전부 만기 소멸되었습니다.
2) 주식선택권 부여주식수의 변동내용은 다음과 같습니다.
| (단위: 주) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 4차 | 4차 | |
| 기초 | 1,438,300 | 1,488,300 |
| 행사 | - | (50,000) |
| 만기소멸 | (1,438,300) | - |
| 기말 | - | 1,438,300 |
| 기말행사가능 | - | 1,438,300 |
3) 당3분기와 전3분기 중 주식선택권 관련 보상원가의 내역은 없습니다.
28. 기타포괄손익누계액
(1) 기타포괄손익누계액의 내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 | (1,375,729,582) | (1,268,739,953) |
| 해외사업환산손익 | 1,587,421,922 | 1,004,876,913 |
| 합계 | 211,692,340 | (263,863,040) |
(2) 기타포괄손익누계액의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 |
기초 |
증가 | 재분류조정 | 기타감소 | 법인세효과 | 기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 | (1,268,739,953) | (106,989,629) | - | - | - | (1,375,729,582) |
| 해외사업환산손익 | 1,004,876,913 | 582,545,009 | - | - | - | 1,587,421,922 |
| 합계 | (263,863,040) | 475,555,380 | - | - | - | 211,692,340 |
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 |
기초 |
증가 | 재분류조정 | 기타감소 | 법인세효과 | 기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 | (978,894,183) | (253,194,787) | - | - | - | (1,232,088,970) |
| 해외사업환산손익 | 359,020,994 | 2,037,274,233 | - | - | - | 2,396,295,227 |
| 합계 | (619,873,189) | 1,784,079,446 | - | - | - | 1,164,206,257 |
29. 이월결손금
(1) 이월결손금의 내역은 다음과 같습니다.
| 구 분 | 당3분기 | 전3분기 |
|---|---|---|
| 기초금액 | (119,628,586,810) | (98,750,909,796) |
| 당기순이익(손실) | (20,874,207,954) | 5,744,057,335 |
| 재측정요소 | - | - |
| 기말금액 | (140,502,794,764) | (93,006,852,461) |
(2) 당3분기 중 배당금 지급내용은 없습니다.
30. 매출액 및 매출원가
(1) 매출액의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상품매출 | 2,265,597,041 | 7,379,316,567 | 2,542,294,448 | 9,202,027,195 |
| 제품매출 | 227,061,814 | 969,534,596 | 270,447,127 | 1,135,815,132 |
| CDMO매출 | 8,388,666,123 | 17,372,509,115 | 8,003,092,914 | 25,738,830,051 |
| 기타 | 56,823,373 | 131,099,589 | 67,668,302 | 151,174,551 |
| 합계 | 10,938,148,351 | 25,852,459,867 | 10,883,502,791 | 36,227,846,929 |
(2) 매출원가의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| <제품매출원가> | ||||
| 기초제품 | 475,798,665 | 451,340,644 | 376,125,077 | 328,076,465 |
| 당기제품제조원가 | 232,111,217 | 980,395,950 | 291,360,957 | 1,161,017,476 |
| 기말제품 | (509,706,429) | (509,706,429) | (423,066,422) | (423,066,422) |
| 제품매출원가 | 198,203,453 | 922,030,165 | 244,419,612 | 1,066,027,519 |
| <상품매출원가> | ||||
| 기초상품 | 3,685,889,451 | 3,142,662,411 | 2,750,638,498 | 2,005,411,207 |
| 당기상품매입원가 | 2,043,133,033 | 7,538,236,460 | 2,822,418,930 | 9,830,756,375 |
| 기말상품 | (3,615,505,280) | (3,615,505,280) | (3,186,586,566) | (3,186,586,566) |
| 상품매출원가 | 2,113,517,204 | 7,065,393,591 | 2,386,470,862 | 8,649,581,016 |
| <CDMO매출원가> | 7,935,878,462 | 16,408,853,743 | 7,483,062,877 | 23,904,757,245 |
| <기타매출원가> | 54,872,893 | 129,149,109 | 67,668,302 | 151,174,551 |
| 합계 | 10,302,472,012 | 24,525,426,608 | 10,181,621,653 | 33,771,540,331 |
31. 용역계약
(1) 용역계약잔액의 변동내용은 다음과 같습니다.
<당3분기>
| (단위: USD) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 변동(*) | 공사수익인식 | 기말 |
| CDMO매출 | 9,283,470 | 12,423,058 | 13,360,180 | 8,346,348 |
(*) 신규수주 및 계약변경증액은 USD 12,840,869이며, 계약변경감소액은 USD 417,811입니다.
<전3분기>
| (단위: USD) | ||||
|---|---|---|---|---|
| 구분 | 기초 | 변동 | 공사수익인식 | 기말 |
| CDMO매출 | 9,181,388 | 21,476,193 | 20,284,364 | 10,373,217 |
(*) 신규수주 및 계약변경증액은 USD 21,500,343이며, 계약변경감소액은 24,150입니다.
(2) 미청구공사 및 초과청구공사의 내용은 다음과 같습니다.
| (단위: USD) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | ||||
| 선수금 | 미청구공사 | 초과청구공사 | 선수금 | 미청구공사 | 초과청구공사 | |
| CDMO매출 | 2,026,903 | 1,086,935 | 3,491,235 | 1,559,592 | 2,166,002 | 4,587,046 |
(3) 보고기간 중 원가기준 투입법을 적용하여 기간에 걸쳐 수익을 인식한 계약으로서 계약금액이 전기 매출액의 5% 이상인 주요 계약의 내역은 다음과 같습니다.
<당3분기>
| (단위: USD) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 회사명 | 품목 (*1) | 발주처 (*1) | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
| 총액 | 손실충당금 | 총액 | 손실충당금 | |||||||
| 진원생명과학(주) | 임상용 Plasmid DNA | A 회사 | 2023-01-31 | 2024-01-30 | 5,311,200 | 16.20% | - | - | 663,288 | 3,250 |
| 진원생명과학(주) | 임상용 Plasmid DNA | B 회사 | 2022-02-01 | 2022-12-31 | 2,441,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | C 회사 | 2022-02-23 | 2023-04-30 | 2,416,700 | 100.00% | 68,750 | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | D 회사 | 2022-05-26 | 2023-04-30 | 2,211,250 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | E 회사 | 2022-02-02 | 2022-09-30 | 1,966,600 | 100.00% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | F 회사 | 2019-09-20 | 2022-12-31 | 2,831,061 | 100.00% | - | - | - | - |
| 합계 | 17,178,061 | 68,750 | - | 663,288 | 3,250 | |||||
(*1) 당사는 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았습니다.
<전기>
| (단위: USD) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 회사명 | 품목 (*1) | 발주처 (*1) | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
| 총액 | 손실충당금 | 총액 | 손실충당금 | |||||||
| 진원생명과학(주) | 임상용 Plasmid DNA | A 회사 | 2019-09-04 | 2021-04-30 | 3,468,245 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | B 회사 | 2020-12-18 | 2022-01-31 | 2,388,700 | 100.0% | 192,025 | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | C 회사 | 2021-01-08 | 2022-03-31 | 2,769,820 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | D 회사 | 2022-01-29 | 2022-12-31 | 2,441,250 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | E 회사 | 2022-02-12 | 2022-09-30 | 2,966,600 | 100.0% | - | - | - | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | F 회사 | 2022-02-23 | 2023-04-30 | 2,416,700 | 98.0% | 933,441 | - | 45,000 | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | G 회사 | 2022-03-24 | 2023-08-31 | 1,650,000 | 100.0% | - | - | 275,000 | - |
| 진원생명과학(주) | 임상용 Plasmid DNA | H 회사 | 2022-05-26 | 2023-04-30 | 1,936,250 | 100.0% | 550,000 | - | 206,250 | - |
| 합 계 | 20,037,565 | 1,675,466 | - | 526,250 | - | |||||
(*1) 당사는 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았으며, 전기의 발주처명을 영어 알파벳에서 당기의 발주처 영어 알파벳과 혼동을 주지 않기 위하여 한글명으로 변경 하였습니다.
32. 판매비와 관리비
판매비와관리비의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 2,289,527,569 | 7,818,033,237 | 1,818,390,112 | 8,843,039,440 |
| 퇴직급여 | 233,542,034 | 680,986,940 | 181,913,719 | 555,274,112 |
| 복리후생비 | 175,525,970 | 517,921,914 | 147,769,439 | 506,457,546 |
| 여비교통비 | 52,380,006 | 154,581,680 | 38,263,717 | 92,321,129 |
| 접대비 | 15,747,491 | 83,770,574 | 44,418,757 | 91,189,255 |
| 통신비 | 7,908,886 | 23,907,446 | 7,639,133 | 22,946,241 |
| 수도광열비 | 3,896,303 | 13,488,808 | 2,628,302 | 8,746,776 |
| 교육훈련비 | 591,136 | 772,954 | 504,800 | 3,457,300 |
| 세금과공과 | 31,444,438 | 90,777,563 | 33,909,684 | 91,551,564 |
| 감가상각비 | 500,397,430 | 1,486,576,011 | 500,323,853 | 1,409,891,940 |
| 지급임차료 | 155,905,610 | 459,142,764 | 151,232,452 | 446,060,572 |
| 수선비 | 3,364,000 | 10,566,837 | 4,530,000 | 7,114,546 |
| 보험료 | 3,659,900 | 11,800,900 | 7,890,100 | 15,001,100 |
| 차량유지비 | 14,039,643 | 40,566,980 | 15,126,421 | 48,268,897 |
| 경상연구개발비 | 1,723,430,011 | 6,871,240,712 | 1,989,685,790 | 9,011,228,891 |
| 운반비 | 15,909,600 | 44,586,218 | 13,953,601 | 45,040,852 |
| 도서인쇄비 | 337,173 | 2,001,973 | 310,000 | 2,361,000 |
| 회의비 | 3,654,693 | 12,678,499 | 3,578,833 | 12,112,882 |
| 사무용품비 | 993,518 | 6,559,171 | 1,852,932 | 20,447,255 |
| 소모품비 | (46,090,241) | 23,010,816 | 4,121,001 | 25,104,477 |
| 지급수수료 | 376,657,694 | 813,752,946 | 176,048,282 | 628,780,064 |
| 무형자산상각비 | 2,450,043 | 7,350,162 | 3,681,137 | 12,754,545 |
| 사용권자산상각비 | 273,330,448 | 1,016,496,796 | 279,141,455 | 826,648,349 |
| 견본비 | 2,426,091 | 11,889,937 | 4,452,780 | 13,590,182 |
| 물류비 | 5,043,182 | 13,804,455 | 5,991,820 | 13,866,822 |
| 광고선전비 | 86,415,039 | 357,002,876 | 38,105,536 | 227,052,557 |
| 대손상각비 | 614,602,400 | 1,782,051,551 | 891,454,964 | 951,059,707 |
| 수출제비용 | 7,508,706 | 31,179,563 | 12,182,186 | 44,267,748 |
| 합계 | 6,554,598,773 | 22,386,500,283 | 6,379,100,806 | 23,975,635,749 |
33. 기타수익 및 기타비용
(1) 기타수익의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차익 | 52,489,366 | 259,248,525 | 258,615,562 | 849,394,171 |
| 대손충당금환입 | - | - | - | 3,966,542 |
| 외화환산이익 | 3,642,841,833 | 8,532,762,599 | 13,743,934,890 | 23,493,734,062 |
| 유형자산처분이익 | - | 3,401,673 | - | 1,309,443 |
| 기타수익(*1) | - | 6,111,873 | 87,202,263 | 120,849,024 |
| 사채상환이익 | - | 216,200,351 | - | - |
| 잡이익 | 214,903 | 8,735,596 | 12,134,040 | 28,297,726 |
| 합계 | 3,695,546,102 | 9,026,460,617 | 14,101,886,755 | 24,497,550,968 |
(*1) 당사가 연구개발하고 있는 의약품들에 대한 정부과제 수행 연구보조금입니다.
(2) 기타비용의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차손 | 41,604,532 | 186,192,893 | 120,270,385 | 291,836,528 |
| 외화환산손실 | 93,119,571 | 180,132,619 | 72,541,046 | 151,613,707 |
| 손상차손 | 113,194,238 | 11,003,980,479 | - | - |
| 기타의대손상각비 | - | 310,230,366 | - | 1,935,366 |
| 사채상환손실 | - | 1,593,665,034 | 19,336,490 | 317,336,556 |
| 잡손실 | 4,522,055 | 8,470,118 | 6 | 12,404,038 |
| 합계 | 252,440,396 | 13,282,671,509 | 212,147,927 | 775,126,195 |
34. 금융수익 및 금융비용
(1) 금융수익의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상각후원가금융자산 이자수익 | 3,260,736,756 | 9,638,040,538 | 3,073,134,162 | 8,106,022,712 |
| 파생상품평가이익 | - | 284,736,732 | - | 1,044,077,844 |
| 합계 | 3,260,736,756 | 9,922,777,270 | 3,073,134,162 | 9,150,100,556 |
(2) 금융비용의 내용은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상각후원가금융부채 이자비용 | 1,681,417,175 | 5,472,331,966 | 1,988,975,245 | 5,175,756,663 |
| 차입금 이자비용 | 8,975,342 | 8,975,342 | - | - |
| 파생상품평가손실 | - | - | - | 433,382,180 |
| 합계 | 1,690,392,517 | 5,481,307,308 | 1,988,975,245 | 5,609,138,843 |
35. 법인세비용
1) 법인세비용은 법인세부담액에서 전기 법인세와 관련하여 당3분기에 인식한 조정사항, 일시적 차이의 발생 및 소멸로 인한 이연법인세변동액 및 당기손익 이외로 인식되는 항목과 관련된 법인세비용 등을 조정하여 산출하였습니다.
36. 비용의 성격별 분류
비용의 성격별 분류는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 상품의 매출원가 | 10,104,268,559 | 23,603,396,443 | 9,937,202,041 | 32,705,512,812 |
| 원재료 사용액 | 165,584,221 | 605,317,757 | 199,315,205 | 784,284,723 |
| 관세환급금 | (1,225,734) | (1,225,734) | - | - |
| 타계정으로 대체액 | (260,040) | 64,869,158 | (900,978) | 35,459,362 |
| 제품의 변동 | (33,907,764) | (58,365,785) | (46,941,345) | (94,989,957) |
| 외주가공비 | 68,012,770 | 311,434,769 | 92,946,730 | 341,273,391 |
| 급여 | 2,289,527,569 | 7,818,033,237 | 1,818,390,112 | 8,843,039,440 |
| 퇴직급여 | 233,542,034 | 680,986,940 | 181,913,719 | 555,274,112 |
| 지급수수료 | 376,657,694 | 813,752,946 | 176,048,282 | 628,780,064 |
| 여비교통비 | 52,380,006 | 154,581,680 | 38,263,717 | 92,321,129 |
| 복리후생비 | 175,525,970 | 517,921,914 | 147,769,439 | 506,457,546 |
| 지급임차료 | 155,905,610 | 459,142,764 | 151,232,452 | 446,060,572 |
| 접대비 | 15,747,491 | 83,770,574 | 44,418,757 | 91,189,255 |
| 감가상각비 | 500,397,430 | 1,486,576,011 | 500,323,853 | 1,409,891,940 |
| 경상연구개발비 | 1,723,430,011 | 6,871,240,712 | 1,989,685,790 | 9,011,228,891 |
| 교육훈련비 | 591,136 | 772,954 | 504,800 | 3,457,300 |
| 세금과공과 | 31,444,438 | 90,777,563 | 33,909,684 | 91,551,564 |
| 무형자산상각비 | 2,450,043 | 7,350,162 | 3,681,137 | 12,754,545 |
| 사용권자산상각비 | 273,330,448 | 1,016,496,796 | 279,141,455 | 826,648,349 |
| 운반비 | 15,909,600 | 44,586,218 | 13,953,601 | 45,040,852 |
| 기타 | 707,759,293 | 2,340,509,812 | 999,864,008 | 1,411,940,190 |
| 합계 (*) | 16,857,070,785 | 46,911,926,891 | 16,560,722,459 | 57,747,176,080 |
(*) 포괄손익계산서상 매출원가 및 판매비와관리비의 합계액입니다.
37. 주당이익
(1) 기본주당순이익
1) 기본주당순이익
| (단위: 원,주) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 기본주당순이익 : | ||||
| 보통주당기순이익(손실) | (905,472,489) | (20,874,207,954) | 9,296,678,077 | 5,744,057,335 |
| 가중평균유통보통주식수 | 77,644,188 | 77,576,526 | 77,527,833 | 77,466,706 |
| 기본주당순이익(손실) | (12) | (269) | 120 | 74 |
| 기본주당계속영업이익 : | ||||
| 보통주계속영업이익(손실) | (905,472,489) | (20,874,207,954) | 9,296,678,077 | 5,744,057,335 |
| 가중평균유통보통주식수 | 77,644,188 | 77,576,526 | 77,527,833 | 77,466,706 |
| 기본주당계속영업이익(손실) | (12) | (269) | 120 | 74 |
2) 보통주 당기순이익(손실)
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 보통주 당기순이익 : | ||||
| 당기순이익(손실) | (905,472,489) | (20,874,207,954) | 9,296,678,077 | 5,744,057,335 |
| 차감 : 우선주배당금 | - | - | ||
| 보통주 당기순이익(손실) | (905,472,489) | (20,874,207,954) | 9,296,678,077 | 5,744,057,335 |
| 보통주계속영업이익 : | - | - | ||
| 계속영업이익(손실) | (905,472,489) | (20,874,207,954) | 9,296,678,077 | 5,744,057,335 |
| 차감 : 우선주배당금 | - | - | ||
| 보통주계속영업이익(손실) | (905,472,489) | (20,874,207,954) | 9,296,678,077 | 5,744,057,335 |
3) 가중평균유통보통주식수
| (단위: 주) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전3분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 발행주식수 : | 77,853,652 | 77,785,990 | 77,737,297 | 77,676,170 |
| 차감 : 가중평균자기주식수 | (209,464) | (209,464) | (209,464) | (209,464) |
| 가중평균유통보통주식수(*) | 77,644,188 | 77,576,526 | 77,527,833 | 77,466,706 |
(*) 가중평균 유통 보통주식수의 산정 내역
<당3분기>
| (단위: 주) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구분 | 3개월 | 누적 | ||||||||
| 발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
|
| 기초보통주식수 | 77,751,599 | (209,464) | 77,542,135 | 6,125,828,665 | 77,542,135 | 77,751,599 | (209,464) | 77,542,135 | 20,160,955,100 | 77,542,135 |
| 유상증자 | 722,218 | - | 78,264,353 | 1,017,436,589 | 78,264,353 | 722,218 | - | 78,264,353 | 1,017,436,589 | 78,264,353 |
| 기말보통주식수 | 78,473,817 | (209,464) | 78,264,353 | 7,143,265,254 | 77,644,188 | 78,473,817 | (209,464) | 78,264,353 | 21,178,391,689 | 77,576,526 |
<전3분기>
| (단위: 주) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구분 | 3개월 | 누적 | ||||||||
| 발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
발행주식수 | 자기주식수 | 유통주식수 | 적수 | 가중평균 유통주식수 |
|
| 기초보통주식수 | 77,678,502 | (209,464) | 77,469,038 | 1,084,566,532 | 77,469,038 | 77,479,055 | (209,464) | 77,269,591 | 154,539,182 | 77,269,591 |
| 전환사채 주식전환 | - | 77,469,038 | - | - | 64,977 | - | 77,334,568 | 154,669,136 | 77,334,568 | |
| 전환사채 주식전환 | - | 77,469,038 | - | - | 19,493 | - | 77,354,061 | 77,354,061 | 77,354,061 | |
| 주식선택권 행사 | - | 77,469,038 | - | - | 50,000 | - | 77,404,061 | 6,269,728,941 | 77,404,061 | |
| 전환사채 주식전환 | - | 77,469,038 | - | - | 64,977 | - | 77,469,038 | 8,444,125,142 | 77,469,038 | |
| 전환사채 주식전환 | 16,244 | - | 77,485,282 | 309,941,128 | 77,485,282 | 16,244 | - | 77,485,282 | 309,941,128 | 77,485,282 |
| 전환사채 주식전환 | 24,366 | - | 77,509,648 | 155,019,296 | 77,509,648 | 24,366 | - | 77,509,648 | 155,019,296 | 77,509,648 |
| 전환사채 주식전환 | 32,487 | - | 77,542,135 | 5,583,033,720 | 77,542,135 | 32,487 | - | 77,542,135 | 5,583,033,720 | 77,542,135 |
| 기말보통주식수 | 77,751,599 | (209,464) | 77,542,135 | 7,132,560,676 | 77,527,833 | 77,751,599 | (209,464) | 77,542,135 | 21,148,410,606 | 77,466,706 |
(2) 희석주당순손익
1) 당3분기와 전3분기 중 잠재적 보통주를 포함하는 희석주당이익(손실)은 반희석화 효과로 인하여 계산하지 아니하였습니다.
2) 당3분기말 현재 반희석효과로 희석주당순이익을 계산할 때 고려하지 않았지만 향후 희석효과가 발생할 가능성이 있는 잠재적보통주의 내역은 다음과 같습니다.
| 구 분 | 행사금액(*1) | 청구 및 전환 기간 | 부여주식수 | 행사주식 | 기타 (*2) | 행사가능 주식수 |
|---|---|---|---|---|---|---|
| 전환사채(4회) | 12,301 원 | 2021/11/25~2023/10/25 | 884,205 주 | 1,268,273 주 | 392,197 주 | 8,129 주 |
(*1) 행사금액은 유상증자, 무상증자 등을 반영하여 조정하였습니다.
(*2) 주가하락 및 유상증자 등에 따른 행사가액 조정분을 반영하였습니다.
38. 현금흐름표
(1) 현금및현금성자산은 재무상태표와 현금흐름표상의 금액이 일치하게 관리되고 있습니다.
(2) 당기순이익(손실)에 대한 조정 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 퇴직급여 | 680,986,940 | 555,274,112 |
| 재고자산평가손실 | 156,286,100 | 69,045,009 |
| 감가상각비 | 1,486,576,011 | 1,409,891,940 |
| 무형자산상각비 | 7,350,162 | 12,754,545 |
| 사용권자산상각비 | 1,016,496,796 | 826,648,349 |
| 이자수익 | (9,638,040,538) | (8,106,022,712) |
| 이자비용 | 5,481,307,308 | 5,175,756,663 |
| 사채상환이익 | (216,200,351) | - |
| 사채상환손실 | 1,593,665,034 | 317,336,556 |
| 대손상각비 | 1,782,051,551 | 951,059,707 |
| 기타의대손상각비 | 310,230,366 | 1,935,366 |
| 손상차손 | 11,003,980,479 | - |
| 외화환산손실 | 180,132,619 | 151,613,707 |
| 외화환산이익 | (8,532,762,599) | (23,493,734,062) |
| 대손충당금환입 | - | (3,966,542) |
| 유형자산처분손익 | (3,401,673) | (1,309,443) |
| 파생상품평가손실 | - | 433,382,180 |
| 파생상품평가이익 | (284,736,732) | (1,044,077,844) |
| 합계 | 5,023,921,473 | (22,744,412,469) |
(3) 영업활동 자산·부채의 증감 내용은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 매출채권의 감소(증가) | 3,438,418,532 | (5,797,385,050) |
| 미수금의 감소(증가) | 576,695,127 | 89,009,993 |
| 미수수익의 감소(증가) | 4,855,166,467 | 3,530,946,784 |
| 선급금의 감소(증가) | (159,894,016) | (672,220,190) |
| 장기선급금의 감소(증가) | (761,527,945) | (730,087,811) |
| 선급비용의 감소(증가) | (4,680,726,219) | (3,423,308,653) |
| 선급법인세자산의 감소(증가) | 117,093,963 | (117,224,922) |
| 재고자산의 감소(증가) | (178,295,698) | (1,190,723,898) |
| 매입채무의 증가(감소) | (1,175,654,112) | 470,657,534 |
| 미지급금의 증가(감소) | (16,786,895) | 24,432,924 |
| 미지급비용의 증가(감소) | 253,663,298 | 29,180,614 |
| 미지급세금의 증가(감소) | (21,611,622) | - |
| 선수금의 증가(감소) | (654,640,722) | 2,637,001,998 |
| 장기선수금의 증가(감소) | 279,854,840 | 780,752,347 |
| 예수금의 증가(감소) | (1,626,409) | (19,111,816) |
| 예수제세의 증가(감소) | 2,635,050 | 57,205,100 |
| 퇴직금의 지급 | - | (16,416,667) |
| 퇴직급여채무의 증가(감소) | (14,171,300) | - |
| 사외적립자산의 감소(증가) | - | (800,000,000) |
| 환율변동에 의한 자산부채증감 | (247,820,304) | (1,049,500,542) |
| 비현금항목에 관한 기타조정 | 582,545,009 | 2,037,274,233 |
| 합계 | 2,193,317,044 | (4,159,518,022) |
(4) 현금및현금성자산의 사용을 수반하지 않는 중요한 거래내용은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 전환사채의 주식전환 | - | 2,740,000,000 |
(5) 재무활동에서 생기는 부채의 변동 내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 현금흐름 | 비현금 변동 | 기말 | ||
| 발생 및 소멸 | 상각등 | 기타(*) | ||||
| 전환사채 | 11,544,744,489 | (16,279,647,453) | 4,243,500,575 | 597,821,576 | - | 106,419,187 |
| 파생상품부채 | 2,732,912,980 | - | (2,437,857,959) | - | (292,111,799) | 2,943,222 |
| 리스부채 | 4,099,774,515 | (878,591,158) | - | - | 181,045,107 | 3,402,228,464 |
| 합계 | 18,377,431,984 | (17,158,238,611) | 1,805,642,616 | 597,821,576 | (111,066,692) | 3,511,590,873 |
(*) 전환권평가 및 리스 이자, 외화환산 등으로 인한 변동금액입니다.
<전3분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 기초 | 현금흐름 | 비현금 변동 | 기말 | ||
| 발생 및 소멸 | 상각등 | 기타 | ||||
| 전환사채 | 9,754,365,408 | 8,141,708,080 | (8,182,949,901) | 1,450,239,643 | - | 11,163,363,230 |
| 파생상품부채 | - | - | - | - | 4,055,253,410 | 4,055,253,410 |
| 리스부채 | 4,762,553,908 | (783,914,862) | (16,272,626) | - | 397,298,714 | 4,359,665,134 |
| 합계 | 14,516,919,316 | 7,357,793,218 | (8,199,222,527) | 1,450,239,643 | 4,452,552,124 | 19,578,281,774 |
39. 특수관계자거래
(1) 특수관계자 현황
| 회사명 | 당사와의 관계 | 비고 | |
|---|---|---|---|
| 당3분기 | 전3분기 | ||
| Dong-il Interlining Ltd. | 종속회사 | 종속회사 | |
| VGXI, Inc. | 종속회사 | 종속회사 | |
| 535 Penn Investments, LLC. | 기 타 | 기 타 | |
| 기타 | 임 직 원 | 임 직 원 | |
(2) 특수관계자와의 매출·매입 등 중요한 거래내용은 다음과 같습니다.
<당3분기>
| (단위:원) | ||||||
|---|---|---|---|---|---|---|
| 회사명 | 매출 | 이자수익 | 계 | 매입 | 기타 | 계 |
| Dong-il Interlining Ltd. | 3,561,112,604 | 32,211,436 | 3,593,324,040 | 1,402,538,325 | - | 1,402,538,325 |
| VGXI, Inc. | - | 4,453,155,199 | 4,453,155,199 | 17,893,313,744 | 697,668,833 | 18,590,982,577 |
| 535 Penn Investments, LLC | - | - | - | - | 398,045,779 | 398,045,779 |
| 기타(임직원) | - | 2,762,514 | 2,762,514 | - | - | - |
| 합계 | 3,561,112,604 | 4,488,129,149 | 8,049,241,753 | 19,295,852,069 | 1,095,714,612 | 20,391,566,681 |
<전3분기>
| (단위:원) | ||||||
|---|---|---|---|---|---|---|
| 회사명 | 매출 | 이자수익 | 계 | 매입 | 기타 | 계 |
| Dong-il Interlining Ltd. | 4,369,481,599 | 31,433,127 | 4,400,914,726 | 2,573,051,272 | - | 2,573,051,272 |
| VGXI, Inc. | - | 3,717,072,098 | 3,717,072,098 | 24,084,405,757 | 546,527,821 | 24,630,933,578 |
| 535 Penn Investments, LLC | - | - | - | - | 276,421,338 | 276,421,338 |
| 기타(임직원) | - | 19,022,774 | 19,022,774 | - | - | - |
| 합계 | 4,369,481,599 | 3,767,527,999 | 8,137,009,598 | 26,657,457,029 | 822,949,159 | 27,480,406,188 |
(3) 특수관계자와의 중요한 자금거래내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 특수관계자 | 관계 | 자금대여거래 | |
| 대여 | 회수 | ||
| VGXI, Inc. (*1) | 종속회사 | 6,503,600,000 | - |
(*1) 상기 회사의 공장증축을 위한 시설자금을 대여하였으며, 회사와 상기 특수관계 회사간의 대여 및 차입 거래에 대하여는 인정이자 계산시 사용하는 국세청고시 이자율을 적용하고 있습니다.
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 특수관계자 | 관계 | 자금대여거래 | |
| 대여 | 회수 | ||
| VGXI, Inc. | 종속회사 | 30,365,177,927 | - |
| 기타 | 임 직 원 | - | 319,092,090 |
| 합계 | 30,365,177,927 | 319,092,090 | |
(4) 특수관계자와의 중요한 채권 및 채무의 내용은 다음과 같습니다.
<당3분기>
| (단위:원) | |||||||
|---|---|---|---|---|---|---|---|
| 회사명 | 매출채권 | 대여금 | 선급금 | 미수수익 | 기타채권 | 매입채무 | 기타채무 |
| Dong-il Interlining Ltd. | 7,147,717,029 | 968,256,000 | - | 3,416,693 | - | 176,703,398 | - |
| VGXI, Inc. | - | 136,161,000,000 | 5,729,591,607 | 9,991,939,443 | - | 1,912,051,917 | 102,318,194 |
| 535 Penn Investments, LLC | - | - | - | - | 44,540,785 | - | - |
| 기타(임직원) | - | 80,000,000 | - | - | - | - | - |
| 합계 | 7,147,717,029 | 137,209,256,000 | 5,729,591,607 | 9,995,356,136 | 44,540,785 | 2,088,755,315 | 102,318,194 |
(*) 당사는 일반적으로 매출 및 매입 거래일의 1개월에서 3개월이내에 대금을 회수 및 지급하고 있으나, 관계기업 Dong-il Interlining Ltd.에 대한 매출 거래는 거래일부터 통상적으로 10개월이 경과한 달의 말일에 대금을 회수하며 회수기간 동안 이자는 없습니다.
<전기말>
| (단위:원) | |||||||
|---|---|---|---|---|---|---|---|
| 회사명 | 매출채권 | 대여금 | 선급금 | 미수수익 | 기타채권 | 매입채무 | 기타채무 |
| Dong-il Interlining Ltd. | 5,407,640,031 | 912,456,000 | - | 13,799,300 | - | 272,905,945 | - |
| VGXI, Inc. | - | 122,928,100,000 | 4,506,382,527 | 5,100,463,987 | - | 3,888,571,445 | 94,291,999 |
| 535 Penn Investments, LLC | - | - | - | - | 41,973,926 | - | - |
| 기타(임직원) | - | 80,000,000 | - | - | - | - | - |
| 합계 | 5,407,640,031 | 123,920,556,000 | 4,506,382,527 | 5,114,263,287 | 41,973,926 | 4,161,477,390 | 94,291,999 |
(5) 당기 중 특수관계자와의 담보 및 지급보증 내용은 없습니다.
(6) 주요 경영진에 대한 보상
당사의 주요 경영진에 대한 보상내역은 다음과 같으며, 주요 경영진에는 당사의 기업활동의 계획, 운영, 통제에 대한 중요한 권한과 책임을 가지고 있는 등기이사 및 비등기 이사를 포함하였습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기 | 전3분기 |
| 급여 | 3,558,313,302 | 5,125,272,728 |
| 퇴직급여 | 560,364,538 | 478,028,960 |
| 합계 | 4,118,677,840 | 5,603,301,688 |
40. 우발상황과 약정사항
(1) 사용제한 금융자산의 내용은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 계정과목 | 종류 | 금융기관 | 당3분기 | 전기 | 사용제한내용 |
| 장기금융상품 | 당좌예금 | 신한은행 | 2,000,000 | 2,000,000 | 당좌개설보증금 |
(2) 담보제공 및 사용제한 자산 내용은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 계정과목 | 종류 | 장부금액 | 설정금액 | 설정권자 | 내용 |
| 투자부동산 | 토지 및 건물 | 2,521,679,812 | 2,747,000,000 | 신한은행 | 일반대출, 무역금융 담보 |
(3) 제공받은 담보 및 지급보증내용은 없습니다.
(4) 타인을 위한 담보 및 지급보증제공내용은 없습니다.
(5) 보험가입내용
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 보험의 종류 | 부보자산 | 보험사 | 부보금액 | |
| 당3분기 | 전기말 | ||||
| 본사 | 화재보험 | 건물,기계장치 및 재고자산 | DB손해보험 | 3,905,000,000 | 3,905,000,000 |
| 화재보험 | 사무실, 연구소 | 흥국화재해상보험 | 11,200,000,000 | 11,200,000,000 | |
| 임원배상책임 | 임원 업무배상 | DB손해보험 | 5,000,000,000 | 5,000,000,000 | |
| 임상보상보험 | 임상시험대상자 피해보상 | 에이스아메리칸화재해상보험 | 1,000,000,000 | 1,000,000,000 | |
| 해외지점 | 재산종합보험 | 제조물책임보상 등 (텍사스 우드랜드 지점) |
CAN | 6,724,000,000 | 6,336,500,000 |
| 재산종합보험 | 제조물책임보상 등 (펜실베니아 연구소) |
CAN | 8,068,800,000 | - | |
상기 보험 외에 차량보험이 DB손해보험에 가입되어 있습니다.
(6) 금융기관 여신한도약정
| 구분 | 금융기관 | 한도약정액 | 미사용액 | 사용제한내용 |
|---|---|---|---|---|
| 무역금융 | 신한은행 | $100,000 | $100,000 | |
| 내국신용장(*) | 신한은행 | $100,000 | - | |
| 합계 | $200,000 | $100,000 |
(*) 내국신용장 개설 약정을 맺고 있으며, 한도약정액은 모두 실행 중입니다.
(7) 계류중인 소송사건
| 계류법원 | 원고 | 피고 | 사건내용 | 소송가액 | 소송비용 | 진행현황 | |
|---|---|---|---|---|---|---|---|
| 당3분기 | 전기 | ||||||
| 미국 펜실베니아 몽고메리 카운티 법원 |
Inovio Pharmaceuticals Inc. (미국) | 진원생명과학 및 자회사 VGXI Inc. | VGXI를 상대로 코로나19 백신 생산에 필요한 정보 제공요청 소송제기 | - | 미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. | 미국 자회사 VGXI Inc.에서 약 50만달러를 지급하였음. | 가처분 기각(피고 승소), 소송 진행 중 |
| 미국 텍사스 남부 휴스턴 지방법원 |
VGXI Inc. | Aldevron LLC (미국) | VGXI Inc 의 영업 비밀 남용, 특허 침해 및 계약 위반 | - | 미국 자회사 VGXI Inc.에서 약 58만달러를 지급하였음. | 미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. | 2023년 10월 양측이 중재에 합의함에 따라 소송이 종결 |
| 미국 펜실베니아 몽고메리 카운티 법원 |
진원생명과학 | Inovio Pharmaceuticals Inc. (미국) | Cellectra 사용권 분쟁 | - | 미국 자회사 VGXI Inc.에서 약 16만달러를 지급하였음. | 미국 지점 VGXI USA 에서 8만달러를 지급하였음. | 소송 진행 |
| 서울중앙지방법원 | 진원생명과학 | A 제약회사외 2 | 영업비밀침해 금지 | 400백만원 | - | - | 합의하여 소취하로 종결 |
| 서울중앙지방법원 | 진원생명과학 | A 제약회사외 2 | 영업비밀침해 금지 가처분 | 100백만원 | - | 당사에서 45백만원 지급하였음. | 화해 권고 결정으로 종결 |
| 서울행정법원 | 진원생명과학 | 1. 한국보건산업진흥원 2. 코로나19 치료제/백신 신약개발사업단 |
정산금회수처분 취소 청구 | - | - | - | 소송 진행 중 |
41. 영업부문
(1) 회사의 영업부문은 2개로 구성되어 있으며 그 내용은 다음과 같습니다.
| 구 분 | 제품 및 용역의 유형 |
|---|---|
| 제약사업 | Contract Development Manufacturing Organization (CDMO) 생산, 판매 |
| 패브릭사업 | 의류용 심지제품 제조, 판매 |
(2) 영업부문별 정보는 다음과 같습니다.
1) 영업부문의 당기손익정보는 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 계 |
| 총매출액 | 17,503,608,704 | 8,348,851,163 | 25,852,459,867 |
| 내부거래 | - | - | - |
| 외부거래 | 17,503,608,704 | 8,348,851,163 | 25,852,459,867 |
| 영업이익(손실) | (15,886,015,265) | (5,173,451,759) | (21,059,467,024) |
| 당기순이익(손실) | (16,083,409,080) | (4,790,798,874) | (20,874,207,954) |
| 감가상각비와상각비 | 2,177,113,941 | 333,309,028 | 2,510,422,969 |
| 이자수익 | 9,409,559,559 | 228,480,979 | 9,638,040,538 |
| 이자비용 | (5,181,673,117) | (299,634,191) | (5,481,307,308) |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 계 |
| 총매출액 | 25,890,004,602 | 10,337,842,327 | 36,227,846,929 |
| 내부거래 | - | - | - |
| 외부거래 | 25,890,004,602 | 10,337,842,327 | 36,227,846,929 |
| 영업이익(손실) | (20,104,804,264) | (1,414,524,887) | (21,519,329,151) |
| 전기순이익(손실) | (1,469,752,759) | 7,213,810,094 | 5,744,057,335 |
| 감가상각비와상각비 | 1,967,763,659 | 281,531,175 | 2,249,294,834 |
| 이자수익 | 5,794,031,734 | 2,311,990,978 | 8,106,022,712 |
| 이자비용 | (4,346,309,153) | (829,447,510) | (5,175,756,663) |
2) 영업부문의 자산 및 부채정보는 다음과 같습니다.
<당3분기말>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 총자산 | 176,705,902,253 | 14,699,459,540 | 191,405,361,793 |
| 총부채 | 19,346,878,618 | 559,092,886 | 19,905,971,504 |
<전기말>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 총자산 | 205,668,790,242 | 17,564,157,956 | 223,232,948,198 |
| 총부채 | 32,782,322,384 | 542,645,451 | 33,324,967,835 |
3) 주요 고객에 대한 매출 정보는 다음과 같습니다.
<당3분기>
| (단위: 원) | ||
|---|---|---|
| 구분 (*) | 금액 | 영업부문 |
| A 회사 | 3,894,362,176 | 제약사업 |
| B 회사 | 2,371,012,590 | 제약사업 |
| 합계 | 6,265,374,766 | |
(*) 회사명은 기밀유지 계약조건 등으로 기재하지 않았습니다.
<전3분기>
| (단위: 원) | ||
|---|---|---|
| 구분 (*) | 금액 | 영업부문 |
| 가 회사 | 3,649,900,758 | 제약사업 |
| 나 회사 | 3,770,663,240 | 제약사업 |
| 다 회사 | 438,405,840 | 패브릭사업 |
| 라 회사 | 241,263,740 | 패브릭사업 |
| 합계 | 8,100,233,578 | |
(*) 회사명은 기밀유지 계약조건 등으로 기재하지 않았으며, 전기의 발주처명을 영어 알파벳에서 당기의 발주처 영어 알파벳과 혼동을 주지 않기 위하여 한글명으로 변경하였습니다.
4) 영업부문의 수익 내역은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 주요 제품/상품/용역 계열 | |||
| 상품매출 | - | 7,379,316,567 | 7,379,316,567 |
| 제품매출 | - | 969,534,596 | 969,534,596 |
| CDMO매출 | 17,372,509,115 | - | 17,372,509,115 |
| 기타 | 131,099,589 | - | 131,099,589 |
| 합계 | 17,503,608,704 | 8,348,851,163 | 25,852,459,867 |
| 수익 인식시기 | |||
| 한 시점에 인식 | 131,099,589 | 8,348,851,163 | 8,479,950,752 |
| 기간에 걸쳐 인식 | 17,372,509,115 | - | 17,372,509,115 |
| 합계 | 17,503,608,704 | 8,348,851,163 | 25,852,459,867 |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 제약사업 | 패브릭사업 | 합계 |
| 주요 제품/상품/용역 계열 | |||
| 상품매출 | - | 9,202,027,195 | 9,202,027,195 |
| 제품매출 | - | 1,135,815,132 | 1,135,815,132 |
| CDMO매출 | 25,738,830,051 | - | 25,738,830,051 |
| 기타 | 151,174,551 | - | 151,174,551 |
| 합계 | 25,890,004,602 | 10,337,842,327 | 36,227,846,929 |
| 수익 인식시기 | |||
| 한 시점에 인식 | 151,174,551 | 10,337,842,327 | 10,489,016,878 |
| 기간에 걸쳐 인식 | 25,738,830,051 | - | 25,738,830,051 |
| 합계 | 25,890,004,602 | 10,337,842,327 | 36,227,846,929 |
(3) 지역별 부문정보는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기/당3분기말 | 전3분기/전기말 | ||
| 매출 | 비유동자산 | 매출 | 비유동자산 | |
| 국내 | 3,031,971,186 | 80,313,864,342 | 3,206,719,068 | 110,160,183,310 |
| 해외 | 22,820,488,681 | 6,372,273,034 | 33,021,127,861 | 6,353,781,093 |
| 합계 | 25,852,459,867 | 86,686,137,376 | 36,227,846,929 | 116,513,964,403 |
42. 위험관리
(1) 금융위험관리
당사는 경영활동과 관련하여 신용위험, 유동성위험 및 시장위험 등 다양한 금융위험에 노출되어 있습니다. 당사는 금융위험이 경영에 미칠 수 있는 불리한 효과를 최소화하기 위해 노력하고 있습니다. 당사의 전반적인 위험관리는 당사의 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화 하는데 중점을 두고 있습니다.
1) 신용위험관리
당사의 전반적인 위험관리는 당사의 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화 하는데 중점을 두고 있습니다.
당사는 신용위험노출 및 거래처의 신용등급을 주기적으로 검토하여 거래처의 여신한도 및 담보수준을 재조정하는 등 신용위험을 관리하고 있습니다.
금융상품 종류별 신용위험의 최대 노출금액은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기말 | 전기말 | ||
| 장부금액 |
신용위험 최대노출금액 |
장부금액 |
신용위험 최대노출금액 |
|
| 현금성자산(현금 제외) | 6,011,095,734 | 6,011,095,734 | 10,451,735,772 | 10,451,735,772 |
| 매출채권 및 기타채권 | 18,893,784,014 | 18,893,784,014 | 19,814,092,003 | 19,814,092,003 |
| 기타금융자산(유동) | 59,383,800,256 | 59,383,800,256 | 54,638,330,573 | 54,638,330,573 |
| 기타금융자산(비유동) (*) | 71,685,810,725 | 71,685,810,725 | 89,085,479,012 | 89,085,479,012 |
| 합계 | 155,974,490,729 | 155,974,490,729 | 173,989,637,360 | 173,989,637,360 |
(*) 기타포괄손익-공정가치측정금융자산 제외
2) 유동성위험관리
당사는 미래의 현금흐름을 예측하여 단기 및 중장기 자금조달 계획을 수립하여 유동성위험을 관리하고 있으며, 금융부채의 잔존계약 만기에 따른 만기분석내용은 다음과 같습니다.
<당3분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 장부금액 | 1년이내 | 1년초과~2년이내 | 2년초과~5년이내 | 5년초과 | 합계 |
| 매입채무및기타채무 | 5,038,489,699 | 5,038,489,699 | - | - | - | 5,038,489,699 |
| 단기차입금 | 2,100,000,000 | 2,132,311,233 | - | - | - | 2,132,311,233 |
| 전환사채 | 106,419,187 | 106,419,187 | - | - | - | 106,419,187 |
| 파생상품부채 | 2,943,222 | 2,943,222 | - | - | - | 2,943,222 |
| 기타금융부채 | 3,465,764,503 | 1,005,881,842 | 1,111,864,000 | 1,888,470,734 | 1,200,000 | 4,007,416,576 |
| 합계 | 10,713,616,611 | 8,286,045,183 | 1,111,864,000 | 1,888,470,734 | 1,200,000 | 11,287,579,917 |
계약상 현금흐름으로 이자 등을 포함하고 있어 장부금액과 차이가 있습니다.
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구분 | 장부금액 | 1년이내 | 1년초과~2년이내 | 2년초과~5년이내 | 5년초과 | 합계 |
| 매입채무및기타채무 | 6,051,758,036 | 6,051,758,036 | - | - | - | 6,051,758,036 |
| 전환사채 | 11,544,744,489 | 11,544,744,489 | - | - | - | 11,544,744,489 |
| 파생상품부채 | 2,732,912,980 | 2,732,912,980 | - | - | - | 2,732,912,980 |
| 기타금융부채 | 4,456,617,018 | 1,231,790,774 | 1,707,439,518 | 1,516,186,726 | 1,200,000 | 4,456,617,018 |
| 합계 | 24,786,032,523 | 21,561,206,279 | 1,707,439,518 | 1,516,186,726 | 1,200,000 | 24,786,032,523 |
3) 시장위험
당사는 환율과 이자율의 변동으로 인한 시장위험에 노출되어 있습니다.
(가) 외환위험관리
당사는 외화거래 수행에 따라 다양한 환율변동위험에 노출되어 있습니다. 주요 통화별 환율변동시 민감도 분석내용은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | |||
| 10% 상승 | 10% 하락 | 10% 상승 | 10% 하락 | ||
| 본점 | USD | 14,942,620,619 | (14,942,620,619) | 13,140,435,561 | (13,140,435,561) |
| EUR | 1,906,384 | (1,906,384) | 1,811,824 | (1,811,824) | |
| 해외지점 | USD | 520,804,515 | (520,804,515) | 673,162,253 | (673,162,253) |
| 합계 | USD | 15,463,425,134 | (15,463,425,134) | 13,813,597,814 | (13,813,597,814) |
| EUR | 1,906,384 | (1,906,384) | 1,811,824 | (1,811,824) | |
(나) 이자율위험관리
당사는 고정이자율과 변동이자율로 자금을 차입하고 있으며, 이로 인하여 이자율위험에 노출되어 있습니다. 당사는 고정금리차입금과 변동금리차입금의 적절한 균형유지 정책을 수행하는 등 이자율위험을 관리하고 있으며, 이자율위험에 노출된 차입금은 다음과 같습니다.
| (단위:원) | ||
|---|---|---|
| 구분 | 당(3분)기 | 전기 |
| 단기차입금 | 2,100,000,000 | - |
이자율 1% 변동시 민감도 분석내용은 다음과 같습니다.
| (단위:원) | ||||
|---|---|---|---|---|
| 구분 | 당(3분)기 | 전기 | ||
| 1%상승 | 1%하락 | 1%상승 | 1%하락 | |
| 이자비용 | (15,750,000) | 15,750,000 | - | - |
(다) 기타가격위험요소
당사는 지분상품에서 발생하는 가격변동위험에 노출되어 있습니다. 지분상품은 매매목적이 아닌 전략적 목적으로 보유하고 있습니다. 보고기간말 현재 공정가치로 평가하는 기타포괄손익-공정가치측정금융자산은 다른 변수가 일정하고 지분상품의 가격이 10% 변동할 경우 가격변동이 자본에 미치는 영향은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당3분기 | 전기말 | ||
| 10% 상승 | 10% 하락 | 10% 상승 | 10% 하락 | |
| 기타포괄손익-공정가치측정금융자산 | 3,849,692 | (3,849,692) | 14,548,655 | (14,548,655) |
(2) 자본위험관리
당사의 자본관리 목적은 계속기업으로 영업활동을 유지하고 주주 및 이해관계자의 이익을 극대화하하고 자본비용의 절감을 위하여 최적의 자본구조를 유지하는데 있습니다. 당사는 배당조정, 신주발행 등의 정책을 통하여 자본구조를 경제환경의 변화에따라 적절히 수정변경하고 있습니다. 당사의 자본위험관리정책은 전기와 중요한 변동이 없습니다.
| (단위: 원) | ||
|---|---|---|
| 구분 | 당3분기말 | 전기말 |
| 부채총계: | 19,905,971,504 | 33,324,967,835 |
| 차감: 현금 및 현금성자산과 단기금융상품 | (10,872,151,003) | (42,451,735,772) |
| 순부채 (*) | 9,033,820,501 | - |
| 자본총계 | 171,499,390,289 | 189,907,980,363 |
| 부채비율 | 11.61% | 17.50% |
| 순부채비율 | 5.27% | 0% |
(*) 부채총계가 현금 및 현금성자산과 단기금융상품보다는 적을 경우에는 순부채의 금액을 "-"으로 기재하였습니다.
6. 배당에 관한 사항
(1) 배당에 관한 사항
① 이익의 배당은 금전과 주식으로 할 수 있다.
② 제1항의 배당금은 매결산기말 현재의 주주명부에 등록된 주주 또는 질권자에게 이를 지급한다.
③ 이익의 배당을 주식으로 하는 경우, 회사가 수종의 주식을 발행한 때에는 주주 총회의 결의로 그와 다른 종류의 주식으로도 할 수 있다.
④ 배당금의 지급청구권은 지급통지일로부터 5년간 이를 행사하지 아니하면 소멸 시효가 완성된다.
⑤ 제4항의 시효의 완성으로 인한 배당금은 본 회사에 귀속한다.
(2) 주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제48기 (3분기) |
제47기 | 제46기 | ||
| 주당액면가액(원) | 1,000 | 1,000 | 1,000 | |
| (연결)당기순이익(백만원) | -37,967 | -38,150 | -15,888 | |
| (별도)당기순이익(백만원) | -20,874 | -20,113 | -13,655 | |
| (연결)주당순이익(원) | -489 | -492 | -214 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
(3) 과거 배당 이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
(1) 증자(감자)현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2019년 04월 12일 | 전환권행사 | 기명식보통주 | 16,433 | 1,000 | 4,868 | 제3회사모전환사채 |
| 2019년 07월 09일 | 유상증자(제3자배정) | 기명식보통주 | 735,661 | 1,000 | 4,010 | 제3자배정 |
| 2020년 01월 29일 | 유상증자(주주배정) | 기명식보통주 | 11,000,000 | 1,000 | 1,800 | 주주배정후일반공모 |
| 2020년 03월 12일 | 전환권행사 | 기명식보통주 | 11,241 | 1,000 | 4,448 | 제3회사모전환사채 |
| 2020년 04월 02일 | 주식매수선택권행사 | 기명식보통주 | 31,000 | 1,000 | 4,296 | - |
| 2020년 04월 06일 | 전환권행사 | 기명식보통주 | 112,410 | 1,000 | 4,448 | 제3회사모전환사채 |
| 2020년 04월 13일 | 주식매수선택권행사 | 기명식보통주 | 38,000 | 1,000 | 4,296 | - |
| 2020년 07월 03일 | 유상증자(주주배정) | 기명식보통주 | 11,500,000 | 1,000 | 6,650 | 주주배정후일반공모 |
| 2020년 07월 23일 | 주식매수선택권행사 | 기명식보통주 | 12,000 | 1,000 | 3,890 | - |
| 2020년 09월 01일 | 주식매수선택권행사 | 기명식보통주 | 18,000 | 1,000 | 3,890 | - |
| 2020년 09월 01일 | 주식매수선택권행사 | 기명식보통주 | 38,700 | 1,000 | 12,107 | - |
| 2020년 10월 06일 | 주식매수선택권행사 | 기명식보통주 | 25,000 | 1,000 | 3,890 | - |
| 2020년 10월 06일 | 주식매수선택권행사 | 기명식보통주 | 27,500 | 1,000 | 12,107 | - |
| 2020년 11월 03일 | 주식매수선택권행사 | 기명식보통주 | 23,000 | 1,000 | 12,107 | - |
| 2020년 12월 04일 | 주식매수선택권행사 | 기명식보통주 | 8,000 | 1,000 | 12,107 | - |
| 2021년 03월 25일 | 주식매수선택권행사 | 기명식보통주 | 418,000 | 1,000 | 3,890 | - |
| 2021년 07월 15일 | 주식매수선택권행사 | 기명식보통주 | 22,500 | 1,000 | 12,034 | - |
| 2021년 11월 25일 | 전환권행사 | 기명식보통주 | 42,103 | 1,000 | 19,001 | 제4회사모전환사채 |
| 2021년 11월 29일 | 전환권행사 | 기명식보통주 | 84,205 | 1,000 | 19,001 | 제4회사모전환사채 |
| 2021년 12월 03일 | 유상증자(주주배정) | 기명식보통주 | 5,760,000 | 1,000 | 19,750 | 주주배정후일반공모 |
| 2021년 12월 07일 | 전환권행사 | 기명식보통주 | 692,002 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2021년 12월 08일 | 전환권행사 | 기명식보통주 | 32,488 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2021년 12월 14일 | 무상증자 | 기명식보통주 | 25,461,818 | 1,000 | 0 | - |
| 2021년 12월 16일 | 전환권행사 | 기명식보통주 | 194,931 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2022년 01월 03일 | 전환권행사 | 기명식보통주 | 64,977 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2022년 01월 05일 | 전환권행사 | 기명식보통주 | 19,493 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2022년 01월 06일 | 주식매수선택권행사 | 기명식보통주 | 50,000 | 1,000 | 7,667 | - |
| 2022년 03월 28일 | 전환권행사 | 기명식보통주 | 64,977 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2022년 07월 15일 | 전환권행사 | 기명식보통주 | 16,244 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2022년 07월 19일 | 전환권행사 | 기명식보통주 | 24,366 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2022년 07월 21일 | 전환권행사 | 기명식보통주 | 32,487 | 1,000 | 12,312 | 제4회사모전환사채 |
| 2023년 09월 16일 | 유상증자(제3자배정) | 기명식보통주 | 722,218 | 1,000 | 3,420 | 제3자배정 |
(2) 미상환 전환사채 발행현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모전환사채 |
4 | 2020년 11월 25일 | 2023년 11월 25일 | 24,000,000,000 | 기명식 보통주 |
2021.11.25- 2023.10.25 |
100 | 12,301 | 100,000,000 | 8,129 | - |
| 합 계 | - | - | - | - | - | - | 100 | 12,301 | 100,000,000 | 8,129 | - |
| [채무증권의 발행 등과 관련된 사항] |
(3) 채무증권 발행실적
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
|
진원생명과학(주) |
회사채 | 사모 | 2020년 11월 25일 |
24,000 |
0.0 |
- |
2023년 11월 25일 |
주1) |
- |
|
진원생명과학(주) |
회사채 | 사모 | 2022년 04월 15일 |
11,700 |
1.0 |
- |
2025년 04월 15일 | 주2) |
- |
| 합 계 | - | - | - |
35,700 |
0.0 |
- |
- |
- |
- |
주1) 2020년 11월에 발행한 4CB는 2023년 05월 10일 미상환사채 11억원 중 10억원에 대해 풋옵션 행사되어 잔액 1억원입니다.
주2) 2022년 04월에 발행한 5CB는 2023년 04월12일 기준 현재 잔액 0억원으로 상환 완료하였습니다.
(4) 기업어음증권 미상환 잔액
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
(5) 단기사채 미상환 잔액
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
(6) 회사채 미상환 잔액
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
(7) 신종자본증권 미상환 잔액
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
(8) 조건부자본증권 미상환 잔액
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
(1) 공모자금의 사용내역
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
|
주주배정 유상증자 |
36 |
2020년 01월 28일 |
하기 주1) 참조 |
19,800 |
하기 주2) 참조 |
19,800 |
하기 주3) 참조 |
|
주주배정 유상증자 |
39 |
2020년 07월 03일 |
하기 주4) 참조 |
76,475 |
하기 주5) 참조 |
76,475 |
하기 주6) 참조 |
|
주주배정 유상증자 |
50 |
2021년 12월 02일 |
하기 주7) 참조 |
113,760 |
하기 주8) 참조 |
109,381 | 하기 주9) 참조 |
주1) <신고서상 자금사용계획>
(1) 채무상환 : 10,000백만원 소요 예정
(2) 발행제비용 : 764백만원 소요 예정
(3) 원부재료 구매 : 2,500백만원 소요 예정
(4) GLS -1200 축농증 치료제 연구개발비 : 2,800백만원 소요 예정
(5) GLS -1027 당뇨병성 신장병증 치료제 연구개발비 : 2,800백만원 소요 예정
(6) mRNA백신 기반 연구개발비 : 936백만원 소요 예정
주2) <실제 자금사용 현황>
(1) 채무상환 : 9,589백만원이 지출되었습니다.
(2) 발행제비용 : 787백만원이 지출되었습니다.
(3) 원부재료 구매 : 2,500백만원이 지출되었습니다.
(4) GLS -1200 축농증 치료제 연구개발비 : 201백만원이 지출되었습니다.
(5) GLS -1027 당뇨병성 신장병증 치료제 연구개발비 : 324백만원이 지출되었습 니다.
(6) mRNA백신 기반 연구개발비 : 191백만원이 지출되었습니다.
(7) GLS -5700 지카 백신 연구개발비 : 111백만원이 지출되었습니다.
(8) VGX-6150 C형간염치료 연구개발비 : 16백만원이 지출되었습니다.
(9) GLS-6100,6150 C형간염예방 연구개발비 : 74백만원이 지출되었습니다.
(10) GLS-7000 sc4D5-VT dRP 연구개발비 : 13백만원이 지출되었습니다.
(11) GLS-5300 MERS 예방 DNA 백신 연구개발비: 28백만원이 지출되었습니다.
(12) 단클론 항체치료제 연구개발비 : 55백만원이 지출되었습니다.
(13) 혈액응고 8인자 연구개발비 : 25백만원이 지출되었습니다.
(14) UniFlu 연구개발비 : 238백만원이 지출되었습니다.
(15) Cellectra : 59백만원이 지출되었습니다.
(16) Microneedle and device 개발비 등 : 482백만원이 지출되었습니다.
(17) B형간염 항체치료제 연구개발비 : 53백만원이 지출되었습니다.
(18) SFTSV 예방 DNA 백신 연구개발비 : 84백만원이 지출되었습니다.
(19) 일반운영비 : 4,128백만원이 지출되었습니다.
(20) GLS -5100 대상포진 백신 연구개발비 : 33백만원이 지출되었습니다.
(21) GLS-5310 COVID19코로나 백신 연구개발비 : 62백만원이 지출되었습니다.
(22) 면역억제제 Anti-CD3 Plas-F(ab') 연구개발비 : 24백만원이 지출되었습니다.
(23) GLS-1027 COVID19 연구개발비 : 334백만원이 지출되었습니다.
(24) GLS-1200 COVID19 연구개발비 : 309백만원이 지출되었습니다.
(25) MERS-Abs 연구개발비 : 80백만원이 지출되었습니다.
주3) 차이 발생 사유등
1. 신고서상 자금사용 용도변경 추가항목:
1) GLS -5700 지카 백신 연구개발비
2) VGX-6150 C형간염치료 연구개발비
3) GLS-6100,6150 C형간염예방 연구개발비
4) GLS-7000 sc4D5-VT dRP 연구개발비
5) GLS-5300 MERS 예방 DNA 백신 연구개발비
6) 단클론 항체치료제 연구개발비
7) 혈액응고 8인자 연구개발비
8) UniFlu 연구개발비
9) Cellectra
10) Microneedle and device 개발비 등
11) B형간염 항체치료제 연구개발비
12) SFTSV 예방 DNA 백신 연구개발비
13) 일반운영비
14) GLS -5100 대상포진 백신 연구개발비
15) GLS-5310 COVID19코로나 백신 연구개발비
16) 면역억제제 Anti-CD3 Plas-F(ab') 연구개발비
17) GLS-1027 COVID19 연구개발비
18) GLS-1200 COVID19 연구개발비
19) MERS-Abs 연구개발비
당기말 현재 총 19,800백만원을 사용하여 유증자금이 없습니다.
주4) <신고서상 자금사용계획>
(1) 발행제비용 : 2,663백만원 소요 예정
(2) CMO설비 신규 증설자금(VGXI 신규시설자금) : 64,948백만원 소요 예정
(3) 코로나 19 DNA 백신 개발 등 연구개발비 : 8,864백만원 소요 예정
주5) <실제 자금사용 현황>
(1) 발행제비용 : 2,663백만원이 지출되었습니다.
(2) CMO설비 신규 증설자금(VGXI 신규시설자금) : 60,313백만원이 지출되었습 니다.
(3) 코로나 19 DNA 백신 개발 등 연구개발비 : 6,009백만원이 지출되었습니다.
(4) GLS -5700 지카 백신 연구개발비 : 40백만원이 지출되었습니다.
(5) VGX-6150 C형간염치료 연구개발비 : 6백만원이 지출되었습니다.
(6) GLS-6100,6150 C형간염예방 연구개발비 : 91백만원이 지출되었습니다.
(7) GLS-5300 MERS 예방 DNA 백신 연구개발비: 11백만원이 지출되었습니다.
(8) Microneedle and device 개발비 등 : 209백만원이 지출되었습니다.
(9) B형간염 항체치료제 연구개발비 : 9백만원이 지출되었습니다.
(10) GLS -1027 당뇨병성 신장병증 치료제 연구개발비 : 125백만원이 지출되었습 니다.
(11) GLS -1200 축농증 치료제 연구개발비 : 65백만원이 지출되었습니다.
(12) RNA백신 기반 연구개발비 : 27백만원이 지출되었습니다.
(13) CCHF 콩고출혈열 연구개발비 : 16백만원이 지출되었습니다.
(14) MERS-Abs 연구개발비 : 10백만원이 지출되었습니다.
(15) 일반운영비 : 6,881백만원이 지출되었습니다.
주6) 차이 발생 사유등
1. 신고서상 자금사용 용도변경 추가항목:
1) GLS -5700 지카 백신 연구개발비
2) VGX-6150 C형간염치료 연구개발비
3) GLS-6100,6150 C형간염예방 연구개발비
4) GLS-5300 MERS 예방 DNA 백신 연구개발비
5) Microneedle and device 개발비 등
6) B형간염 항체치료제 연구개발비
7) GLS -1027 당뇨병성 신장병증 치료제 연구개발비
8) GLS -1200 축농증 치료제 연구개발비
9) RNA백신 기반 연구개발비
10) CCHF 콩고출혈열 연구개발비
11) MERS-Abs 연구개발비
12) 일반운영비
당기말 현재 총 76,475백만원을 사용하여 유증자금이 없습니다.
주7) <신고서상 자금사용계획>
(1) 발행제비용 : 2,700백만원 소요 예정
(2) CMO설비 신규 증설자금(VGXI 신규시설자금) : 90,823백만원 소요 예정
(3) 코로나 19 DNA 백신 개발 등 연구개발비 : 20,237백만원 소요 예정
주8) <실제 자금사용 현황>
(1) 발행제비용 : 2,700백만원이 지출되었습니다.
(2) CDMO설비 신규 증설자금(VGXI 신규시설자금) : 59,354백만원이 지출되었 습니다.
(3) 코로나 19 DNA 백신 개발 등 연구개발비 : 9,387백만원이 지출되었습니다.
(4) GLS -5700 지카 백신 연구개발비 : 120백만원이 지출되었습니다.
(5) Microneedle and device 개발비 등 : 1,080백만원이 지출되었습니다.
(6) GLS -1200 축농증 치료제 연구개발비 : 82백만원이 지출되었습니다.
(7) RNA백신 기반 연구개발비 : 334백만원이 지출되었습니다.
(8) GLS -1200 COVID19 연구개발비 : 762백만원이 지출되었습니다.
(9) Pan.코로나 연구개발비 : 116백만원이 지출되었습니다.
(10) GLS -1027 자가면역질환 연구개발비 :140백만원이 지출되었습니다.
(11) GLS -1027 기타 연구개발비 : 52백만원이 지출되었습니다.
(12) HnMc 연구개발비 : 5백만원이 지출되었습니다.
(13) 일반운영비 : 33,027백만원이 지출되었습니다.
(14) GLS-5140 STFSV예방 DNA 백신 : 2,151백만원이 지출되었습니다.
(15) GLS-5300(MERS) : 22백만원이 지출되었습니다.
(16) CCHF-콩고출혈열 : 11백만원이 지출되었습니다.
(17) GLS-6100,6150 C 형간염[예방] : 5백만원이 지출되었습니다.
(18) PlasMab : 4백만원이 지출되었습니다.
(19) CCR8 : : 9백만원이 지출되었습니다.
(20) CAR-M : : 16백만원이 지출되었습니다.
(21) RAS : 1백만원이 지출되었습니다.
(22) BaAB : 3백만원이 지출되었습니다.
주9) 차이 발생 사유등
1. 신고서상 자금사용 용도변경 추가항목:
1) GLS -5700 지카 백신 연구개발비
2) Microneedle and device 개발비 등
3) GLS -1200 축농증 치료제 연구개발비
4) RNA백신 기반 연구개발비
5) Microneedle and device 개발비 등
6) GLS -1200 COVID19 연구개발비
7) Pan.코로나 연구개발비
8) GLS -1027 자가면역질환 연구개발비
9) GLS -1027 기타 연구개발비
10) HnMc 연구개발비
11) 일반운영비
12) GLS-5140 STFSV예방 DNA 백신
13) GLS-5300(MERS) 연구개발비
14) CCHF-콩고출혈열 연구개발비
15) GLS-6100,6150 C 형간염[예방] 연구개발비
16) PlasMab 연구개발비
17) CCR8 연구개발비
18) CAR-M 연구개발비
19) RAS 연구개발비
20) Circular RNA 연구개발비
21) BsAB 연구개발비
당3분기말 현재 총 109,381백만원을 사용하여 유증자금이 4,379백만원이 남아 있습니다.
(미사용 유증자금은 우리은행, 신한은행에 각각 보관하고 있습니다.)
(2) 사모자금의 사용내역
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
|
제3자 배정 유상증자 |
35 |
2019년 07월 08일 |
운영자금 |
2,950 |
운영자금 |
2,950 |
주1) 참조 |
|
전환사채 |
4 |
2020년 11월 25일 |
시설자금 |
5,000 |
운영자금 |
5,000 |
주2) 참조 |
|
전환사채 |
4 |
2020년 11월 25일 | 운영자금 | 19,000 |
운영자금 |
19,000 |
주2) 참조 |
|
전환사채 |
5 |
2022년 04월 15일 |
운영자금 |
11,700 |
운영자금 |
11,700 |
주3)참조 |
| 제3자 배정 유상증자 | 53 | 2023년 09월 15일 | 운영자금 | 2,470 | 운영자금 | 0 | 주4)참조 |
주1) 2019년말 제3자 배정 유상증자 자금 전액이 운영자금으로 소진되었습니다.
주2) 당기말 현재 전환사채 전액이 운영자금으로 사용되었습니다.
(시설자금을 운영자금으로 사용하였습니다.)
주3) 당기말 현재 전환사채 전액이 운영자금으로 사용되었습니다.
주4) 당3분기말 제3자 배정 유상증자 자금 전액이 남아있습니다.
(3) 미사용자금의 운용내역
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 종류 | 금융상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 |
MMF예금 |
4,845 |
- |
- |
| 예ㆍ적금 |
외화예금 외 |
2,004 |
- |
- |
| 계 |
6,849 |
- |
8. 기타 재무에 관한 사항
8-1. 대손충당금의 설정현황(연결기준)
(1) 계정과목별 대손충당금 설정내역
(단위:원)
| 구분 | 계정과목 | 채권총액 | 대손충당금 | 대손충당금 설정률 |
|---|---|---|---|---|
| 제 48 당(3분)기말 | 매출채권 | 6,419,810,457 | 552,014,374 | 8.6% |
| 대여금 | 194,856,568 | 114,856,568 | 58.9% | |
| 미수금 | 949,148,453 | - | 0.0% | |
| 미수수익 | 16,352,843 | 2,663,412 | 16.3% | |
| 합계 | 7,580,168,321 | 669,534,354 | 8.8% | |
| 제 47 (전)기말 | 매출채권 | 10,540,716,961 | 1,560,252,867 | 14.8% |
| 대여금 | 194,856,568 | 114,856,568 | 58.9% | |
| 미수금 | 1,489,098,607 | - | 0.0% | |
| 미수수익 | 111,709,862 | 2,663,412 | 2.4% | |
| 합계 | 12,336,381,998 | 1,677,772,847 | 13.6% | |
| 제 46 기말 | 매출채권 | 7,779,595,079 | 342,071,302 | 4.4% |
| 대여금 | 861,130,000 | 170,630,000 | 19.8% | |
| 미수금 | 398,056,781 | - | 0.0% | |
| 미수수익 | 155,922,671 | 49,534,498 | 31.8% | |
| 합계 | 9,194,704,531 | 562,235,800 | 6.1% |
(2) 대손충당금 변동현황
(단위:원)
| 구분 | 제 48 당(3분)기말 | 제 47 (전)기말 | 제 46 기말 |
|---|---|---|---|
| 기초금액 | 1,677,772,847 | 562,235,800 | 572,307,229 |
| 손상차손 | 348,709,293 | 1,367,201,147 | 330,865,751 |
| 기타증감 | 52,151,266 | (4,904,576) | 12,031,710 |
| 제각 | (1,000,000) | (218,133,322) | (226,437,999) |
| 대손충당금환입 | (1,408,099,052) | (28,626,202) | (126,530,891) |
| 기말금액 | 669,534,354 | 1,677,772,847 | 562,235,800 |
(3) 매출채권관련 대손충당금 설정방침
회사는 보고기간 종료일 현재 매출채권등 채권 잔액의 회수가능성에 대해 "Gross Roll Rate 경험율법 (총연체전이율)"을 적용하고 있으며, 이는 동질적인 채권에 대해 적용하며, 과거 일정기간동안 3개월별 전이율을 분석하고 이를 이용하여 대손율을 산정하는 방법을 사용하였음. 분석대상기간은 경험율의 신뢰성을 확보하기에 충분하다고 판단되는 기간인 3년을 기본으로 하며 연체월수는 무연체부터 3년까지로 하였음.매출채권이 3년 이상인 경우는 총연체전이율을 적용하지 않고 추가로 설정하여 인식하였음. 다만, 특수관계자 채권과 관련하여서는 통제 가능한 범위에 있다는 판단하에 "Gross Roll Rate 경험율법" 계산시에 반영하지 않았으며. 별도로 대손충당금이나 대손상각을 설정하지 않았음. 그리고 사업부문별로 매출채권 인식 또는 회수기준등이 상이할 경우에는 각 사업부문별로 각각 구분하여 총연체전이율을 적용하였음.
한편 폐업 또는 파산절차등 기타 중요한 사유가 발생할 경우에는 회수가능성을 별도로 판단하여, 기 설정된 대손율의 적용과는 별도로 개별 건에 대해서 대손충당금으로 추가 설정하고 있습니다.
(4) 당해 사업년도 당(3분)기말 현재 경과기간별 매출채권잔액 현황
(단위:원)
| 구분 | 6월 이하 | 6월 초과 | 1년 초과 | 3년 초과 | 계 | |
|---|---|---|---|---|---|---|
| 1년 이하 | 3년 이하 | |||||
| 금액 | 일반 | 5,516,685,160 | 180,038,597 | 723,086,700 | - | 6,419,810,457 |
| 구성비율 | 85.9% | 2.8% | 11.3% | 0.0% | 100.0% | |
(5) 재고자산의 보유현황
(단위:원)
| 사업부문 | 계정과목 | 제 48 당(3분)기말 | 제 47 (전)기말 | 제 46 기말 | 비고 |
|---|---|---|---|---|---|
| 각종 심지등의 제조 및 판매, CMO 사업 |
제 품 | 4,683,812,175 | 3,657,178,956 | 3,271,521,390 | - |
| 상 품 | 2,111,106,825 | 3,049,034,367 | 1,976,554,116 | - | |
| 재공품 | 1,151,257,177 | 784,780,772 | 670,895,706 | - | |
| 원재료 | 7,445,245,475 | 6,757,598,358 | 4,024,643,159 | - | |
| 미착품 | 148,607,143 | 615,156,906 | 744,073,471 | - | |
| 계 | 15,540,028,795 | 14,863,749,359 | 10,687,687,842 | - | |
| 총자산대비 재고자산 구성비율(%) [재고자산합계÷기말자산총계×100] |
7.8% | 6.7% | 4.3% | - | |
| 재고자산회전율(회수) [연환산 매출액÷{(기초재고+기말재고)÷2}] | 2.3 회 | 3.7 회 | 3.9 회 | - | |
(6) 재고자산의 실사내용
① 실사 일자 : 2023년 9월 30일
② 실사 감사인 : 자체 실사를 통해 확인
8-2. 수주계약현황
수주계약현황은 기준은 각 계약금액이 직전사업년도 매출액(연결 기준)의 5% 이상이며, 원가기준으로 진행률을 측정하는 용역계약입니다.
| (단위 : 백만원) |
| 회사명 | 품목 | 발주처 | 계약일 | 공사기한 | 수주총액 | 진행률 | 미청구공사 | 공사미수금 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 총액 | 손상차손 누계액 |
총액 | 대손 충당금 |
|||||||
| 진원생명과학(주) | 임상용 Plasmid DNA | A 회사 | 2023년 01월 31일 | 2024년01월30일 | 6,490 | 16.20 | 0 | 0 | 803 | 4 |
| 합 계 | 16.20 | 0 | 0 | 803 | 4 | |||||
(*) 당사는 계약서상의 비밀조약에 의하여 품목 및 발주처에 대한 상세기재를 하지 않았습니다.
(*) 수주총액은 계약일 환율 매매기준율에 의해 산출되었습니다.
(*) 미청구공사 및 공시미수금은 해당 분기의 적용환율에 의해 산출되었습니다.
8-3 공정가치평가 내역
(1) 보고기간말 현재 금융상품의 종류별 장부금액과 공정가치의 비교내용은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 현금및현금성자산 | 6,804,551,677 | (*1) |
| 매출채권 | 5,867,796,083 | (*1) |
| 단기기타채권 | 962,837,884 | (*1) |
| 단기기타금융자산 | 456,730,443 | (*1) |
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | 4,845,878,375 |
| 기타비유동금융자산 | 1,450,369,942 | (*1) |
| 기타포괄손익-공정가치측정금융자산 | 38,496,917 | 38,496,917 |
| 합계 | 20,426,661,321 | |
| <금융부채> | ||
| 매입채무 | 11,896,972,492 | (*1) |
| 단기기타채무 | 97,021,662 | (*1) |
| 단기차입금 | 3,001,731,232 | (*1) |
| 전환사채 | 106,419,187 | (*1) |
| 파생상품부채 | 2,943,222 | 2,943,222 |
| 단기기타금융부채 | 1,950,634,118 | (*1) (*2) |
| 장기기타금융부채 | 4,378,713,805 | (*1) (*2) |
| 합계 | 21,434,435,718 | |
(*1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 공시대상에서 제외하였습니다.
(*2) 리스부채는 기업회계기준서 제1107호 '금융상품: 공시'에 따라 공정가치 공시대상에서 제외하였습니다.
<전기>
| (단위: 원) | ||
|---|---|---|
| 종 류 | 장부금액 | 공정가치 |
| <금융자산> | ||
| 현금및현금성자산 | 13,260,897,357 | (*1) |
| 매출채권 | 8,980,464,094 | (*1) |
| 단기기타채권 | 1,598,145,057 | (*1) |
| 단기기타금융자산 | 32,590,133,505 | (*1) |
| 파생상품자산 | 27,862,887 | 27,862,887 |
| 기타비유동금융자산 | 1,503,973,595 | (*1) |
| 기타포괄손익-공정가치측정금융자산 | 145,486,546 | 145,486,546 |
| 합계 | 58,106,963,041 | |
| <금융부채> | ||
| 매입채무 | 7,493,171,591 | (*1) |
| 단기기타채무 | 35,408,293 | (*1) |
| 단기차입금 | 701,146,398 | (*1) |
| 전환사채 | 11,544,744,489 | (*1) |
| 파생상품부채 | 2,732,912,980 | 2,732,912,980 |
| 단기기타금융부채 | 4,238,409,193 | (*1) (*2) |
| 장기기타금융부채 | 5,509,721,609 | - |
| 합계 | 32,255,514,553 | |
(*1) 장부금액이 공정가치의 합리적인 근사치이므로 공정가치 공시대상에서 제외하였습니다.
(*2) 리스부채는 기업회계기준서 제1107호 '금융상품: 공시'에 따라 공정가치 공시대상에서 제외하였습니다.
(2) 공정가치로 측정되는 자산·부채의 공정가치 측정치
1) 공정가치 서열체계 및 측정방법
공정가치란 측정일에 시장참여자 사이의 정상거래에서 자산을 매도할 때 받거나 부채를 이전할 때 지급하게 될 가격을 의미합니다. 공정가치 측정은 측정일에 현행 시장 상황에서 자산을 매도하거나 부채를 이전하는 시장참여자 사이의 정상거래에서의 가격을 추정하는 것으로, 연결실체는 공정가치 평가시 시장정보를 최대한 사용하고, 관측 가능하지 않은 변수는 최소한으로 사용하고 있습니다.
연결실체는 공정가치로 측정되는 자산·부채를 공정가치 측정에 사용된 투입변수에 따라 다음과 같은 공정가치 서열체계로 분류하였습니다.
수준1 : 활성시장에서 공시되는 가격을 공정가치로 측정하는 자산·부채의 경우 동 자산·부채의 공정가치는 수준1로 분류됩니다. 공정가치가 수준1로 분류되는 자산·부채는 한국거래소 및 미국 나스닥에서 거래되는 종가를 기준으로 합니다.
수준2 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 모든 유의적인 투입변수가 시장에서 관측한 정보에 해당하면 자산·부채의 공정가치는 수준2로 분류됩니다.
수준3 : 가치평가기법을 사용하여 자산·부채의 공정가치를 측정하는 경우, 하나 이상의 유의적인 투입변수가 시장에서 관측불가능한 정보에 해당하면 동 금융상품의 공정가치는 수준3으로 분류됩니다.
자산·부채의 공정가치는 자체적으로 개발한 내부평가모형을 통해 평가한 값을 사용하거나 독립적인 외부평가기관이 평가한 값을 제공받아 사용하고 있습니다.
2) 보고기간말 현재 재무상태표에 공정가치로 측정되는 자산·부채의 공정가치 서열체계별 공정가치 금액은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 당기손익-공정가치측정금융자산 | 4,845,878,375 | - | 4,845,878,375 | - | 4,845,878,375 |
| 기타포괄손익-공정가치측정금융자산 : | - | ||||
| Inovio Pharmaceuticals Inc. (*1) | 38,496,917 | 38,496,917 | - | - | 38,496,917 |
| 합계 | 4,884,375,292 | 38,496,917 | 4,845,878,375 | - | 4,884,375,292 |
| <부채> | |||||
| 금융부채 : | |||||
| 파생상품부채(4CB) | 2,943,222 | - | - | 2,943,222 | 2,943,222 |
(*1) 당3분기말 현재 미국 나스닥(NASDAQ) 시장에서 형성된 주가를 반영하여 공정가치로 평가하였습니다.
<전기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 장부금액 | 공정가치 | |||
| 수준1 | 수준2 | 수준3 | 합계 | ||
| <자산> | |||||
| 기타포괄손익-공정가치측정금융자산 : | |||||
| Inovio Pharmaceuticals Inc. | 145,486,546 | 145,486,546 | - | - | 145,486,546 |
| 금융자산 : | |||||
| 파생상품자산(5CB) | 27,862,887 | - | - | 27,862,887 | 27,862,887 |
| 합계 | 173,349,433 | 145,486,546 | - | 27,862,887 | 173,349,433 |
| <부채> | |||||
| 금융부채 : | |||||
| 파생상품부채(4CB) | 332,290,672 | - | - | 332,290,672 | 332,290,672 |
| 파생상품부채(5CB) | 2,400,622,308 | - | - | 2,400,622,308 | 2,400,622,308 |
| 합계 | 2,732,912,980 | - | - | 2,732,912,980 | 2,732,912,980 |
(3) 공정가치 서열체계 수준3 관련 공시
1) 공정가치로 측정되는 자산·부채 중 공정가치 서열체계 수준3으로 분류된 자산·부채의 당기 변동내역은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 파생상품자산 | 파생상품부채 | 합계 |
| 기초잔액 | 27,862,887 | (2,732,912,980) | (2,705,050,093) |
| 당해 기간의 총손익 | |||
| 당기손익에 포함된 손익(*1) | (7,375,067) | 292,111,799 | 284,736,732 |
| 기타변동 | |||
| 상환으로 인한 정산 | (20,487,820) | 2,437,857,959 | 2,417,370,139 |
| 기말잔액 | - | (2,943,222) | (2,943,222) |
(*1) 공정가치 서열체계 수준3 변동내용 중 당기손익으로 인식된 금액과 보고기간말 현재 보유하고 있는 자산·부채의 미실현 손익 변동액으로서 당기손익에 포함된 금액은 포괄손익계산서상 다음과 같은 개별항목으로 표시되고 있습니다.
| (단위: 원) | |
|---|---|
| 구분 | 영업외손익(금융손익) |
| 당기손익 인식금액 | 284,736,732 |
| 보고기간말 현재 보유하고 있는 자산·부채의 미실현손익의 변동액으로서 당기손익에 포함된 금액 | 284,736,732 |
<전3분기>
| (단위: 원) | |||
|---|---|---|---|
| 구분 | 파생상품자산 | 파생상품부채 | 합계 |
| 기초잔액 | 175,385,091 | - | 175,385,091 |
| 당해 기간의 총손익 | |||
| 당기손익에 포함된 손익(*1) | (178,226,711) | 788,922,375 | 610,695,664 |
| 기타변동 | |||
| 발행 | 11,723,139 | 4,844,175,785 | 4,855,898,924 |
| 기타증감 | |||
| 기말잔액 | 8,881,519 | 4,055,253,410 | 4,064,134,929 |
(*1) 공정가치 서열체계 수준3 변동내용 중 당기손익으로 인식된 금액과 보고기간말 현재 보유하고 있는 자산·부채의 미실현 손익 변동액으로서 당기손익에 포함된 금액은 포괄손익계산서상 다음과 같은 개별항목으로 표시되고 있습니다.
| (단위: 원) | |
|---|---|
| 구분 | 영업외손익(금융손익) |
| 당기손익 인식금액 | 610,695,664 |
| 보고기간말 현재 보유하고 있는 자산·부채의 미실현손익의 변동액으로서 당기손익에 포함된 금액 | 610,695,664 |
2) 보고기간말 현재 재무상태표에서 공정가치로 측정된 자산·부채 중 공정가치 서열체계 수준3으로 분류된 항목의 가치평가기법, 투입변수 및 유의적이지만 관측가능하지 않은 투입변수에 대한 범위 등은 다음과 같습니다.
<당3분기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 투입변수 | 유의적이지만 관측 가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수의 범위 | ||
| 평가일 주가 | 무위험할인율 | 주가변동성 | |||||
| 금융부채 : | |||||||
| 파생상품부채(4CB) | 2,943,222 | 옵션평가모형 | 3,900 원 | 3.53%~3.49% | 41.99% | 위험할인율 | 9.25%~10.15% |
<전기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 투입변수 | 유의적이지만 관측 가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수의 범위 | ||
| 평가일 주가 | 무위험할인율 | 주가변동성 | |||||
| 금융자산 : | |||||||
| 파생상품자산(4CB) | - | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 파생상품자산(5CB) | 27,862,887 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 합계 | 27,862,887 | ||||||
| 금융부채 : | |||||||
| 파생상품부채(4CB) | 332,290,672 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 파생상품부채(5CB) | 2,400,622,308 | 옵션평가모형 | 7,140 원 | 3.68%~3.73% | 52.33% | 위험할인율 | 9.67%~14.57% |
| 합계 | 2,732,912,980 | ||||||
3) 관측가능하지 않은 투입변수의 변동에 의한 공정가치 측정치의 민감도
(가) 관측가능하지 않은 투입변수의 변동이 공정가치 측정치에 미치는 영향은 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 관측 가능하지 않은 투입변수 | 관측가능하지 않은 투입변수가 공정가치 측정에 미치는 영향 |
| 금융부채 : | ||||
| 파생상품부채(4CB) | 2,943,222 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
<전기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 가치평가기법 | 관측 가능하지 않은 투입변수 | 관측가능하지 않은 투입변수가 공정가치 측정에 미치는 영향 |
| 금융자산 : | ||||
| 파생상품자산(4CB) | - | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 파생상품자산(5CB) | 27,862,887 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 합계 | 27,862,887 | |||
| 금융부채 : | ||||
| 파생상품부채(4CB) | 332,290,672 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 파생상품부채(5CB) | 2,400,622,308 | 옵션평가모형 | 위험할인율 | 복합금융상품 전체 및 주계약 공정가치에 영향 |
| 합계 | 2,732,912,980 | |||
(나) 관측가능하지 않은 투입변수의 변동이 금융자산과 금융부채의 공정가치 측정치에 미치는 효과는 다음과 같습니다.
<당3분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 변동효과의 계산방법 | 공정가치 변동 효과 | |
| 당기손익 | ||||
| 유리한 변동 | 불리한 변동 | |||
| 금융부채 : | ||||
| 파생상품부채(4CB) | - | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | - | - |
<전기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 변동효과의 계산방법 | 공정가치 변동 효과 | |
| 당기손익 | ||||
| 유리한 변동 | 불리한 변동 | |||
| 금융자산 : | ||||
| 파생상품자산(4CB) | - | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | - | - |
| 파생상품자산(5CB) | 27,862,887 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 27,922,236 | 27,804,815 |
| 합계 | 27,862,887 | 27,922,236 | 27,804,815 | |
| 금융부채 : | ||||
| 파생상품부채(4CB) | 332,290,672 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 295,995,707 | 368,174,406 |
| 파생상품부채(5CB) | 2,400,622,308 | 위험할인율을 1% 증가 또는 감소시킴으로써 공정가치 변동을 산출 | 2,264,996,376 | 2,531,877,952 |
| 합계 | 2,732,912,980 | 2,560,992,083 | 2,900,052,358 | |
IV. 이사의 경영진단 및 분석의견
증권의 발행 및 공시등에 관한 규정 제4-3조 2항에 의거, 분,반기보고서에는 별도 기재를 하지 않습니다.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
1-1. 회계감사인의 명칭 및 감사의견
| 사업연도 | 감사인 | 감사의견 | 강조사항 등 | 핵심감사사항 |
|---|---|---|---|---|
| 제48기(당3분기) | 삼일회계법인 | - | - | - |
|
제47기(전기) |
삼덕회계법인 |
적정 |
(연결)비교표시 전년도 재무제표 재작성 |
- 전환사채 관련 파생상품자산 및 부채 평가 |
|
제46기(전전기) |
삼덕회계법인 |
적정 |
해당사항 없음 |
- 전환사채 관련 파생상품자산 및 부채 평가 - CDMO 수익인식의 적정성 |
1-2. 감사용역 체결현황,
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제48기(당3분기) | 삼일회계법인 | 분·반기 재무제표 검토 별도 및 연결 재무제표에 대한 감사 내부회계관리제도 감사 |
290백만원 |
2,150 |
- |
680 |
|
제47기(전기) |
삼덕회계법인 |
반기검토, 기말감사, 연결감사 |
200백만원 | 1,214 | 200백만원 | 2,028 |
|
제46기(전전기) |
삼덕회계법인 |
반기검토, 기말감사, 연결감사 |
200백만원 | 1,214 | 200백만원 | 1,214 |
1-3. 회계감사인과의 비감사용역 계약체결 현황
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제48기(당3분기) |
- |
- |
- |
- |
- |
|
제47기(전기) |
- |
- |
- |
- |
- |
|
제46기(전전기) |
- |
- |
- |
- |
- |
1-4. 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 내부감사기구가 회계감사인과 논의한 결과
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2023년 01월 27일 | 회사 측 4명 감사인측 5명 |
서면 | 내부회계관리제도 관련사항 |
| 2 | 2023년 02월 22일 | 회사 측 4명 감사인측 5명 |
서면 | 내부회계관리제도 관련사항 |
| 3 | 2023년 03월 14일 | 회사 측 4명 감사인측 5명 |
서면 | 기말회계감사 및 내부회계관리제도 감사 수행 결과 |
| 4 | 2023년 07월 24일 | 회사측: 감사1 외2명 감사인측: 업무수행이사 외1명 |
대면회의 |
재무제표에 대한 감사계획, 예비핵심감사사항, 회사와 지배기구의 책임, 감사인의 독립성, 내부회계 관리제도 운영 및 평가 계획 등 |
| 5 | 2023년 08월 04일 | 회사측: 감사1 외2명 감사인측: 업무수행이사 외1명 |
대면회의 |
반기검토 진행현황 및 주요사항 보고, 내부회계관리제도 설계 및 운영평가 일정 협의, 재무제표 감사와 관련한 회사와 지배기구의 책임 등 |
1-5. 회계감사인의 변경
당사는 주식회사의 외부감사에 관한 법률 및 동법 시행령에 따라 증권선물위원회로부터 감사인 지정을 통보받아 삼일회계법인으로 회계감사인이 변경되었습니다.
2. 내부통제에 관한 사항
2023년 3분기 기준 해당사항 없음
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
1-1. 사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 3 | 1 | - | - | - |
* 상기 이사는 임기만료되었으나, 상법 제386조 및 제415조에 의거하여 권리의무를 유지하고 있습니다.
1-2. 주요 이사회 개최 내역
| 회차 | 개최일자 | 의안내용 | 사외이사 등의 성명 | |||
|---|---|---|---|---|---|---|
| 박영근 (출석률:100%) |
조병문 (출석률:100%) |
김상돈 (출석률:57%) |
최성호 (출석률:100%) |
|||
| 찬 반 여 부 | ||||||
| 제47-6차 | 2023.02.15 | 감사전 재무제표 승인의 건 | 찬성 | 찬성 | 찬성 | 찬성 |
| 제47-7차 | 2023.03.14 | 의안제1호 : 제47기 정기주주총회 소집의 건 의안제2호 : 정관 일부 변경(안) 결정의 건 의안제3호 : 이사 및 감사후보자 추천의 건 의안제4호 : 주식매수선택권부여(안) 결정의 건 의안제5호 : 전자투표 및 전자위임장권유제도 이용의 건 |
찬성 | 찬성 | 찬성 | 찬성 |
| 제48-1차 | 2023.03.30 |
의안제1호 : 임원보수 결정의 건 의안제2호 : 비등기임원 선임 및 담당업무 위촉의 건 의안제3호 : 비등기임원의 보수한도액, 임기 결정의 건 |
찬성 | 찬성 | 찬성 | 찬성 |
| 제48-2차 | 2023.05.16 | -보고사항 : 제48기(2023년) 1분기 실적보고 의안제1호 : 유상 신주발행의 건 의안제2호 : 무상증자 승인의 건 |
찬성 | 찬성 | 불참 | 찬성 |
| 제48-3차 | 2023.05.31 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
찬성 | 찬성 | 불참 | 찬성 |
| 제48-4차 | 2023.06.22 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
찬성 | 찬성 | 불참 | 찬성 |
| 제48-5차 | 2023.07.13 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
찬성 | 찬성 | 불참 | 찬성 |
| 제48-6차 | 2023.07.19 | 의안 제1호 : 금전대여 갱신계약 체결의 건 | 찬성 | 찬성 | 찬성 | 찬성 |
| 제48-7차 | 2023.08.17 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
찬성 | 찬성 | 불참 | 찬성 |
| 제48-8차 | 2023.08.31 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
찬성 | 찬성 | 불참 | 찬성 |
| 제48-9차 | 2023.08.31 | 보고사항 : 제48기(2023년) 반기 실적보고 내부회계 설계구축 완료에 대한 보고 |
찬성 | 찬성 | 찬성 | 찬성 |
| 제48-10차 | 2023.09.05 | 의안 제1호 : 자금 차입의 건 | 찬성 | 찬성 | 찬성 | 찬성 |
| 제48-11차 | 2023.09.06 | 의안 제1호 : 유상증자의 건 (제3자 배정) | 찬성 | 찬성 | 불참 | 찬성 |
| 제48-12차 | 2023.09.06 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
찬성 | 찬성 | 불참 | 찬성 |
1-3. 이사의 독립성
당사의 이사는 주주총회에서 선임하며, 이사 후보는 특정주주가 추천하지 않고 이사회에서 추천합니다. 이사는 상기 이사회에 참석하여 주요 안건을 결의합니다. 또한 각 이사와 회사간의 거래는 없습니다.
1-4. 사외이사 교육 미실시 내역
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | 해외 거주로 교육 참가가 어려움 |
1-5.사외이사 지원조직
해당사항 없음
2. 감사제도에 관한 사항
2-1. 감사의 인적사항
당사의 감사는 비상근 감사로서 최성호 감사 1명이 있는 바, 주요약력은 서울 시립대경영대학원 졸업 후 세동회계법인 공인회계사를 거쳐 비즈스태프 주식회사 이사, 인포맨 소프트 주식회사 이사로 재임하였으며, 현재는 더블인베스트먼트(주) 대표이사를 맡고 있습니다.
2-2. 감사의 독립성
당사의 감사는 독립적인 관점에서 이사회 및 회사 감사의 기능을 하고 있으며 중요 거래의 집행등에 대한 승인절차 하자여부를 검토, 거래의 승인 및 기록, 관련자산의 보호등에 대한 업무분장상태를 점검하고 있습니다. 또한 거래 증빙서류나 장부의 문서화 여부를 확인하는 등, 독립적이고 주기적인 대조, 비교, 조정등의 내부검증 절차를 시행하고 있습니다.
2-3. 감사의 주요 활동 내용
| 회차 | 개최일자 | 의안내용 |
|---|---|---|
| 제47-6차 | 2023.02.15 | 감사전 재무제표 승인의 건 |
| 제47-7차 | 2023.03.14 | 의안제1호 : 제47기 정기주주총회 소집의 건 의안제2호 : 정관 일부 변경(안) 결정의 건 의안제3호 : 이사 및 감사후보자 추천의 건 의안제4호 : 주식매수선택권부여(안) 결정의 건 의안제5호 : 전자투표 및 전자위임장권유제도 이용의 건 |
| 제48-1차 | 2023.03.30 |
의안제1호 : 임원보수 결정의 건 의안제2호 : 비등기임원 선임 및 담당업무 위촉의 건 의안제3호 : 비등기임원의 보수한도액, 임기 결정의 건 |
| 제48-2차 | 2023.05.16 | -보고사항 : 제48기(2023년) 1분기 실적보고 의안제1호 : 유상 신주발행의 건 의안제2호 : 무상증자 승인의 건 |
| 제48-3차 | 2023.05.31 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
| 제48-4차 | 2023.06.22 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
| 제48-5차 | 2023.07.13 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
| 제48-6차 | 2023.07.19 | 의안 제1호 : 금전대여 갱신계약 체결의 건 |
| 제48-7차 | 2023.08.17 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
| 제48-8차 | 2023.08.31 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
| 제48-9차 | 2023.08.31 | 보고사항 : 제48기(2023년) 반기 실적보고 내부회계 설계구축 완료에 대한 보고 |
| 제48-10차 | 2023.09.05 | 의안 제1호 : 자금 차입의 건 |
| 제48-11차 | 2023.09.06 | 의안 제1호 : 유상증자의 건 (제3자 배정) |
| 제48-12차 | 2023.09.06 | 의안제1호 : 유상 신주발행의 건(일정변경) 의안제2호 : 무상증자 승인의 건(일정변경) |
2-4. 감사 교육 미실시 내역
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | - |
2-5. 감사 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 재경본부 | 4 | 이사(14년 1개월) 부장(11년 1개월) 대리(1년 4개월) 주임(1년 1개월) |
내부회계관리제도 운영, 재무회계 업무처리, 자금 관리 |
* 당사는 자산총액이 5,000억원 이하이므로 준법지원인을 두지 않고 있기에 별도의 지원조직은 없습니다.
3. 주주총회 등에 관한 사항
3-1. 투표제도 현황
| (기준일 : | 2023년 09월 30일 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 도입 | 도입 |
| 실시여부 | - | 미실시 | 실시 |
3-2. 의결권 현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 기명식보통주 | 78,473,817 | - |
| 기명식 종류주식 | - | - | |
| 의결권없는 주식수(B) | 기명식보통주 | 209,464 | 자기주식 |
| 기명식 종류주식 | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 기명식보통주 | - | - |
| 기명식 종류주식 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
기명식보통주 | - | - |
| 기명식 종류주식 | - | - | |
| 의결권이 부활된 주식수(E) | 기명식보통주 | - | - |
| 기명식 종류주식 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
기명식보통주 | 78,264,353 | - |
| 기명식 종류주식 | - | - |
3-3. 주식사무
1) 정관상 주식의 발행 및 배정에 관한 내용
제8조 【주식의 발행 및 배정】
1. 본 회사가 이사회의 결의로 신주(제3호의 경우에는 이미 발행한 주식을 포함한다)를 발행하는 경우 다음 각호의 방식에 의한다.
1) 주주에게 그가 가진 주식 수에 따라서 신주를 배정하기 위하여 신주인수의 청약을 할 기회를 부여하는 방식
2) 발행주식총수의 100분의50을 초과하지 않는 범위내에서 신기술의 도입, 재무구조의 개선 등 회사의 경영상 목적을 달성하기 위하여 필요한 경우 제1호 외의 방법으로특정한 자(이 회사 주주를 포함한다)에게 신주를 배정하기 위하여 신주인수의 청약을 할 기회를 부여하는 방식
3) 발행주식총수의 100분의50을 초과하지 않는 범위내에서 제1호의 외의 방법으로 불특정 다수인(이 회사 주주를 포함한다)에게 신주인수의 청약을 할 기회를 부여하고 이에 따라 청약을 한 자에 대하여 신주를 배정하는 방식
2. 제1항 제3호의 방식으로 신주를 배정하는 경우에는 이사회의 결의로 다음 각 호의 어느 하나에 해당하는 방식으로 신주를 배정하여야 한다.
1) 신주인수의 청약을 할 기회를 부여하는 자의 유형을 분류하지 아니하고 불특정 다수의 청약자에게 신주를 배정하는 방식
2) 관계법령에 따라 우리사주조합원에 대하여 신주를 배정하고 청약되지 아니한 주식까지 포함하여 불특정 다수인에게 신주인수의 청약을 할 기회를 부여하는 방식
3) 주주에 대하여 우선적으로 신주인수의 청약을 할 수 있는 기회를 부여하고 청약되지 아니한 주식이 있는 경우 이를 불특정 다수인에게 신주를 배정받을 기회를 부여하는 방식
4) 투자매매업자 또는 투자중개업자가 인수인 또는 주선인으로서 마련한 수요예측등관계 법규에서 정하는 합리적인 기준에 따라 특정한 유형의 자에게 신주인수의 청약을 할 수 있는 기회를 부여하는 방식
3. 제1항제2호 및 3호에 따라 신주를 배정하는 경우 상법에서 정하는 사항을 그 납입기일의 2주전까지 주주에게 통지하거나 공고하여야 한다. 다만, 관계법령에 따라 주요사항보고서를 금융위원회 및 거래소에 공시함으로써 그 통지 및 공고를 갈음할 수 있다.
4. 제1항 각 호의 어느 하나의 방식에 의해 신주를 발행할 경우에는 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다.
5. 회사는 신주를 배정하는 경우 그 기일까지 신주인수의 청약을 하지 아니하거나 그 가액을 납입하지 아니한 주식이 발생하는 경우에 그 처리방법은 발행가액의 적정성 등 관련 법령에서 정하는 바에 따라 이사회 결의로 정한다.
6. 회사는 신주를 배정하면서 발생하는 단주에 대한 처리방법은 이사회의 결의로 정한다.
7. 회사는 제1항 제1호에 따라 신주를 배정하는 경우에는 주주에게 신주인수권증서를 발행하여야 한다.
제10조 【신주의 배당기산일】
본 회사가 유상증자, 무상증자 및 주식배당에 의하여 신주를 발행하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전 영업연도말에 발행한 것으로 본다.
2) 기타 주식사무
① 결산일은 매년 12월31일이며, 정기주주총회는 2~3월중에 개최합니다. 이에 따른주주명부 폐쇄시기는 매년 1월1일부터 1월31일이며, 이 시기에는 권리에 관한 주주명부의 기재변경을 정지합니다.
② 발행할 주권의 종류는 일주권, 오주권, 일십주권, 오십주권, 일백주권, 오백주권, 일천주권,일만주권의 8종입니다.
③ 명의개서업무에 관한 대리인을 두고 있으며, 명의개서 대리인은 주식회사 하나은행으로서 주소는 서울 영등포구 국제금융로72이고 전화번호는 02-368-5860입니다.
④ 주주에 대한 특전부여는 없습니다. 결산공고 등 회사공고는 정관 제4조에 의거, 회사 인터넷 홈페이지(http://www.genels.com)에 게재하고 있으며, 전산장애 등 부득이한 경우에는 서울 특별시에서 발행되는 일간 한국경제신문에 게재합니다.
3-4. 주주총회 의사록 요약
① 제47기 정기주주총회(2023년 3월30일)
- 보고 사항 : 감사보고 및 영업보고와 내부회계관리제도 운영실태보고, 외부감사인 선임보고, 제47기 별도 및 연결 재무제표 이사회 승인 보고
- 결의 사항
제1호 의안 : 정관일부변경(안)의 건은 의결정족수 부족으로 결의하지 못하였습니다.
제2호 의안 : 이사 선임의 건은 의결정족수 부족으로 결의하지 못하였습니다.
제3호 의안 : 상근감사 선임의 건은 의결정족수 부족으로 결의하지 못하였습니다.
제4호 의안 : 주식매수선택권 부여 승인의 건은 의결정족수 부복으로 결의하지 못하 였습니다.
②제46기 정기주주총회(2022년 3월30일)
- 보고 사항 : 감사보고 및 영업보고와 내부회계관리제도 운영실태보고, 제46기 별 도 및 연결 재무제표 이사회 승인 보고
- 결의 사항
제1호 의안 : 비상근감사의 상근감사로 전환의 건은 의결정족수 부족으로 결의하지 못하였습니다.
② 제45기 정기주주총회(2021년 3월31일)
- 보고 사항 : 감사보고 및 영업보고와 내부회계관리제도 운영실태보고, 제45기 별도 및 연결 재무제표 이사회 승인 보고
- 결의 사항
제1호 의안 : 비상근감사의 상근감사로 전환의 건은 의결정족수 부족으로 결의하지 못하였습니다.
VI. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 박영근 | 최대주주 | 기명식보통주 | 4,811,730 | 6.21 | 5,396,525 | 6.88 | - |
| 조병문 | 발행회사임원 | 기명식보통주 | 699,012 | 0.90 | 757,491 | 0.97 | - |
| 최성호 | 발행회사임원 | 기명식보통주 | 50,056 | 0.06 | 64,675 | 0.08 | - |
| 박희곤 | 발행회사임원 | 기명식보통주 | 64,500 | 0.08 | 64,500 | 0.08 | - |
| 채재경 | 발행회사임원 | 기명식보통주 | 55,350 | 0.07 | 75,817 | 0.10 | - |
| EDWARDJAEHOCHUNG | 친인척 | 기명식보통주 | 490,363 | 0.63 | 490,363 | 0.62 | - |
| 이혜영 | 친인척 | 기명식보통주 | 11,377 | 0.01 | 11,377 | 0.01 | - |
| 계 | 기명식보통주 | 6,182,388 | 7.95 | 6,860,748 | 8.75 | - | |
| - | - | - | - | - | - | ||
2. 최대주주의 주요경력 및 개요
(단위:주)
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | |
|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
||||||||
|
박영근 |
남 | 1964년 03월 |
대표이사 |
등기임원 | 상근 | 총괄 | - Dickinson College 경제학 학사 - MIT Sloan School of Management 석사(MBA) - University of Pennsylvania 법대 법학박사 학위 취득 - 미국 변호사 라이센스 취득 - 전) 박영근 법률사무소 대표 - 미국내 계열회사인 VGXI, Inc., 대표이사 겸임 |
5,396,525 |
0 |
3. 최대주주의 최대주주(법인 또는 단체)의 개요
해당사항 없음
4. 최대주주 변동내역
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| 2019년 04월 12일 | VGX Pharmaceuticals,LLC. | 2,638,529 | 12.45 | 전환권 행사 | - |
| 2019년 07월 09일 | VGX Pharmaceuticals,LLC. | 3,374,190 | 15.39 | 제3자배정 유상증자 | - |
| 2020년 01월 29일 | 박영근 | 3,040,504 | 9.18 | 주주배정 유상증자 | 특별관계자 6명(754,619주)포함 |
| 2020년 07월 06일 | 박영근 | 3,679,897 | 8.22 | 주주배정 유상증자 | 특별관계자 6명(793,077주)포함 |
| 2021년 03월 25일 | 박영근 | 4,065,897 | 9.00 | 스톡옵션행사 | 특별관계자 7명(942,077주)포함 |
| 2021년 06월 24일 | 박영근 | 4,057,941 | 8.98 | 특별관계자 장내매도 | 특별관계자 6명(934,121주)포함 |
| 2021년 09월 16일 | 박영근 | 4,033,941 | 8.92 | 특별관계자 장내매도 | 특별관계자 5명(910,121주)포함 |
| 2021년 12월 03일 | 박영근 | 4,033,941 | 8.92 | 특별관계자 장내매도 | 특별관계자 5명(910,121주)포함 |
| 2021년 12월 06일 | 박영근 | 6,182,388 | 7.95 | 유무상증자 | 특별관계자 6명(1,370,658주)포함 |
| 2023년 09월 16일 | 박영근 | 6,860,748 | 8.75 | 제3자배정 유상증자 | 특별관계자 6명(1,464,223주)포함 |
5. 주식 소유현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 박영근 | 6,860,748 | 8.75 | 특별관계자 6명(1,464,223주)포함 |
| - | - | - | - | |
| 우리사주조합 | - | - | - | |
6. 소액주주현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 151,553 | 151,561 | 99.99 | 71,613,069 | 78,473,817 | 91.25 | - |
* 소액주주수는 2022년말 기준입니다.
7. 주가 및 주식거래 실적
<2023.09.30>
(단위:원, 주)
| 월 | 최고주가 | 최저주가 | 가중산술평균 | 최고 일거래량 | 최저 일거래량 | 월 총거래량 |
|---|---|---|---|---|---|---|
| 1 | 8,690 | 7,010 | 7,948 | 3,119,410 | 243,136 | 14,955,516 |
| 2 | 9,050 | 7,100 | 8,175 | 1,149,133 | 200,301 | 8,679,463 |
| 3 | 7,520 | 6,280 | 6,734 | 884,085 | 163,904 | 8,305,581 |
| 4 | 7,100 | 5,880 | 6,523 | 1,217,922 | 309,502 | 10,800,932 |
| 5 | 6,160 | 4,105 | 5,152 | 1,336,444 | 202,850 | 12,223,491 |
| 6 | 5,150 | 3,810 | 4,499 | 696,113 | 219,548 | 7,678,865 |
| 7 | 4,685 | 3,515 | 3,965 | 6,412,490 | 256,561 | 27,687,844 |
| 8 | 5,190 | 3,820 | 4,499 | 5,036,477 | 274,273 | 25,094,166 |
| 9 | 4,125 | 3,430 | 3,756 | 767,158 | 136,593 | 6,262,256 |
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
1-1. 임원 현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
|
박영근 |
남 | 1964년 03월 |
대표이사 |
사내이사 | 상근 | 총괄 | - Dickinson College 경제학 학사 - MIT Sloan School of Management 석사(MBA) - University of Pennsylvania 법대 법학박사 학위 취득 - 미국 변호사 라이센스 취득 - 전) 박영근 법률사무소 대표 - 미국내 계열회사인 VGXI, Inc., 대표이사 겸임 |
5,395,525 | 0 | 본인 | 16년6개월 | 2023년 03월 31일 |
|
조병문 |
남 | 1960년 04월 |
전무이사 |
사내이사 | 상근 | 국내 총괄 |
- 서울대학교 경영전문대학원 석사 - 중앙대학교 산업경제학과 졸업 - 패브릭사업본부 영업이사, 경영관리본부이사 역임 - 미국내 계열회사인 VGXI, Inc., CFO 겸임. |
757,491 | 0 | 발행회사 임원 | 18년1개월 | 2023년 03월 31일 |
|
김상돈 |
남 | 1965년 12월 |
사외이사 |
사외이사 | 비상근 | - |
- Executive MBA degree from St Joseph's University. - BS in Pharmacy degree from University of Sciences. - CEO and board of director for Kimmer corporation, a - Pulmonary, neurology, psychiatry specialist pharmcist |
0 | 0 | 발행회사 임원 | 3년6개월 | 2023년 03월 31일 |
|
최성호 |
남 | 1962년 11월 |
감사 |
감사 | 비상근 | 감사 업무 |
- 서울 시립대학교 세무관리학 석사 - 세동회계법인 공인회계사 - 비즈스태프 주식회사 이사 - 인포맨 소프트 주식회사 이사 - 현) 더블인베스트먼트(주) 대표이사 |
64,675 | 0 | 발행회사 임원 | 17년1개월 | 2023년 03월 31일 |
| 김원일 | 남 | 1972년 11월 | 이사 | 미등기 | 상근 | R&D 연구소 연구소장 |
- 미국 미네소타 주립대학 분자세포생물학 이학박사 (Ph.D.) - 미국 보스턴어린이병원/하버드의대 혈액종양과 박사후 연구원 - 미국 프레데릭국립암연구소 혈액줄기세포섹션 박사후 연구원 - 미국 세인트주드 어린이연구병원 종양과 책임연구원 - ㈜사이러스테라퓨틱스 상무/연구위원 |
0 | 0 | 발행회사 임원 | 1년11개월 | 2024년 03월 31일 |
|
권이주 |
여 | 1973년 03월 |
이사 |
미등기 | 상근 | 신약개발 이사 |
- 아주대학교 대학원 신경과학 이학박사 (Ph.D.) - 미국 Emory University School of Medicine 박사후 연구원 - 미국 University of Rochester, Aab Cardiovascular Research Institute 박사후 연구원 - 서울아산병원/울산대학교 의과대학 연구부교수 - 올리패스㈜ 임상개발실 이사 |
0 | 0 | 발행회사 임원 | 1년10개월 | 2024년 03월 31일 |
| 권진아 | 여 | 1975년 05월 | 이사 | 미등기 | 상근 | 사업개발 이사 |
- 서울대학교 분자유전학/바이러스 유전학 이학박사 (Ph.D.) - 미국 Massachusetts Institute of Technology (MIT), 박사후연구원 - 미국 MIT, Dept. of Biology, 연구교수/책임연구원 - 미국 하워드 휴스 의학연구소(HHMI), 전문연구원 II - ㈜에이치엘비생명과학, 바이오사업부, 본부장/이사 - ㈜에이치엘비, 바이오사업총괄, 사업개발 부문장/이사 |
0 | 0 | 발행회사 임원 | 1년8개월 | 2024년 03월 31일 |
|
박희곤 |
남 | 1966년 09월 |
이사 |
미등기 | 상근 | 베트남법인 법인장 겸 패브릭업무 |
- 충남대학교 섬유공학과 졸업 - 전) (주)동일패브릭 - 전) (주)덕영 차장 - 전) (주)금강실리테크 차장 - 전) (주)코셀 부장 |
64,500 | 0 | 발행회사 임원 | 11년1개월 | 2024년 03월 31일 |
|
채재경 |
남 | 1969년 02월 |
이사 |
미등기 | 상근 | 재경 업무 |
- 수원대학교 회계학과 졸업 - 전) ㈜ 아남인스트루먼트 - 전)세미시스㈜ - 전)㈜그라비티 팀장 - 전)리얼네트웍스아시아퍼시픽 ㈜ 부장 |
75,817 | 0 | 발행회사 임원 | 9년6개월 | 2024년 03월 31일 |
* 상기 등기임원 및 감사는 임기만료되었으나, 상법 제386조 및 제415조에 의거하여 권리의무를 유지하게 됩니다.
1-2. 직원 등 현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
|
바이오의약품 |
남 |
15 |
- |
- |
- |
15 |
2.4 |
1,470 |
98 |
- |
- |
- |
- |
|
바이오의약품 |
여 |
33 |
- |
- |
- |
33 |
2.6 |
1,542 |
47 |
- |
|||
|
섬유산업 |
남 |
9 |
- |
- |
- |
9 |
14 |
479 |
53 |
- |
|||
|
공통 |
남 |
9 |
- |
- |
- |
9 |
8.9 |
663 |
74 |
- |
|||
|
공통 |
여 |
9 |
- |
- |
- |
9 |
5.1 |
501 |
56 |
- |
|||
| 합 계 |
75 |
- |
- |
- |
75 |
5 |
4,655 |
62 |
- |
||||
* 상기 급여에는 미등기임원 보수 및 퇴직 직원 급여 포함.
1-3. 미등기임원 보수 현황
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 |
5 |
663 | 133 | - |
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
2-1. 주주총회 승인금액
| (단위 : 백만원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
|
등기이사 |
3 |
50,000 |
정관에 보수한도 금액 기재 |
|
감사 |
1 |
500 |
정관에 보수한도 금액 기재 |
2-2. 보수지급금액
(1) 이사ㆍ감사 전체
| (단위 : 백만원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 4 |
2,432 |
608 |
- |
2-2. 유형별
| (단위 : 백만원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
2 |
2,906 | 1,453 | - |
| 사외이사 (감사위원회 위원 제외) |
1 |
37 |
37 | - |
| 감사위원회 위원 |
- |
- |
- |
- |
| 감사 |
1 |
28 | 28 | - |
VIII. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| - | - | 2 | 2 |
| ※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조 |
2. 타법인출자 현황(요약)
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 |
- |
2 |
2 |
12,340 |
- |
- |
12,340 |
| 일반투자 |
1 |
- |
1 |
145 |
- |
-107 | 38 |
| 단순투자 | - | - | - |
- |
- |
- |
- |
| 계 | 1 | 2 | 3 |
12,485 |
- |
-107 |
12,378 |
| ※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조 |
IX. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여
해당사항 없음
2. 대주주와의 자산양수도 등
해당사항 없음
3. 대주주와의 영업거래
3-1. 최대주주와의 거래내역 및 채권채무 내역
(가) 거래내역
해당사항 없음
(나) 채권채무 내역
해당사항 없음
3-2. 최대주주외 특수관계자와의 거래 내역 및 채권채무 내역
(가) 거래내역
|
(단위: 백만원) |
||||
|---|---|---|---|---|
|
회사명 |
특수관계자성격 |
거래내역 |
당(3분)기 |
전(3분)기 |
|
Dong-il Interlining Ltd. |
종속회사 |
매출 |
3,561 | 4,369 |
|
자금대여 |
- | - | ||
|
이자수익 |
32 | 31 | ||
|
매입 |
1,403 | 2,573 | ||
|
VGXI, Inc. |
종속회사 |
자금대여 |
6,504 | 30,365 |
|
이자수익 |
4,453 | 3,717 | ||
|
매입 등 |
18,591 | 24,631 | ||
|
535 Penn Investments, LLC |
기타 |
기타채무 |
398 | 276 |
(나) 채권채무내역
|
(단위: 백만원) |
||||
|---|---|---|---|---|
|
회사명 |
특수관계자성격 |
거래종류 |
당(3분)기말 |
전기말 |
|
Dong-il Interlining Ltd. |
종속회사 |
매출채권 |
7,148 |
5,408 |
|
대여금 |
968 |
912 |
||
| 미수수익 | 3 |
14 |
||
|
매입채무 |
177 |
273 |
||
|
소 계 |
채권 |
8,119 |
6,334 |
|
|
채무 |
177 |
273 |
||
|
VGXI, Inc. |
종속회사 |
대여금 |
136,161 |
122,928 |
|
선급금 |
5,730 |
4,506 |
||
|
미수수익 |
9,992 |
5,100 |
||
|
매입채무등 |
2,014 |
3,983 |
||
|
소 계 |
채권 |
151,883 |
132,535 |
|
|
채무 |
2,014 |
3,983 |
||
|
535 Penn Investments, LLC |
기타 |
기타채권 |
44 |
42 |
4. 대주주 이외의 이해관계자와의 거래
4-1. 대여금
<특수관계자와의 대여금 상세 내역>
2023.09.30 (단위: 1USD)
|
구분 |
관계 |
대여시기 |
대여금액 |
금리 |
만기 |
비고 |
|---|---|---|---|---|---|---|
| VGXI, Inc. | 자회사 | 2023-02-17 | 1,000,000 | 4.60% | 2026-02-16 | - |
| VGXI, Inc. | 자회사 | 2023-05-30 | 1,000,000 | 4.60% | 2026-05-29 | - |
| VGXI, Inc. | 자회사 | 2023-06-20 | 1,000,000 | 4.60% | 2026-06-19 | - |
| VGXI, Inc. | 자회사 | 2023-07-06 | 1,000,000 | 4.60% | 2026-07-05 | - |
| VGXI, Inc. | 자회사 | 2023-08-04 | 3,200,000 | 4.60% | 2028-08-03 | 재연장 |
* 대여금에 대한 이자는 대여일로부터 1년 단위로 이자를 상환하도록 계약을 체결하였습니다.
< 임직원 대여>
당사는 임직원에게 자금대여를 하고 있으며, 당3분기말 현재 관련 대여금 잔액은 80백만원입니다.
4-2. 담보제공내역 :
해당사항 없음.
4-3. 채무보증내역 :
해당사항 없음.
5. 기타 특수관계자 현황
| 회사명 | 소재지 | 당사와의 관계 |
|---|---|---|
| 535 Penn Investments, LLC. | 미국 Montgomery | 박영근 대표이사의 배우자 100% 보유 |
주요 종속기업을 제외하고 당사는 1개의 특수관계자가 있습니다.
535 Penn Investment, LLC의 지분구조는 당사 박영근 대표이사의 배우자가 100% 지분을 보유하고 있어 당사와 특수관계가 존재합니다.
해당 특수관계자는 미국 펜실베니아주 Fort Washington 소재의 건물을 소유하고 있습니다. 2018년부터 당사의 글로벌 임상개발 본부가 해당 건물의 일부분을 임차하여사무실 및 연구실로 사용하고 있으며, 이에 대해 임차비용을 지급하고 있습니다.
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
| 신고일자 | 제 목 | 신고내용 | 신고사항의 진행사항 |
|---|---|---|---|
|
2020.11.25 |
제4회 무기명식 무보증 |
1. 권면 총액 : 24,000,000,000원 |
당3분기말 현재 시가하락으로 전환가액이 12,301원으로조정되었으며, 239억원이 전환 및 상환되어 1억원이 미상환잔액으로 남아 있습니다 |
|
2022.04.15 |
제5회 무기명식 무보증 |
1. 권면 총액 : 11,700,000,000원 |
당3분기말 현재 전액 상환하였습니다., |
| 2023.01.31 | 단일판매/공급계약 체결 | 1. 체결 계약명 : Plasmid DNA 공급계약 2. 계약금액 :7,111,592,730원(US$5,787,900) 3. 계약 상대 : 아시아 바이오업체 4. 판매/공급지역 : 아시아 5. 계약기간 : 2023.01.31-2024.01.30 6. 계약일자 : 2023.01.31 |
당3분기말 현재 16.2% 공급이 진행되었습니다. |
2. 우발부채 등에 관한 사항
2-1. 계류중인 소송사건
당사가 원고 또는 피고로 계류 중인 소송사건이 5건 존재하며 내용은 다음과 같습니다.
| [계류 중인 소송 상세 내역] |
| 구분 | 계류법원 | 원고 | 피고 | 사건내용 | 소송가액 | 소송비용 | 진행현황 | |
|---|---|---|---|---|---|---|---|---|
| 당기 | 전기 | |||||||
| 1 | 미국 펜실베니아 몽고메리 카운티 법원 |
Inovio Pharmaceuticals Inc. (미국) | 진원생명과학 및 자회사 VGXI Inc | VGXI를 상대로 코로나19 백신 생산에 필요한 정보를 달라고 소송제기 | - |
미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. |
미국 자회사 VGXI Inc.에서 약 50만달러를 지급하였음. |
가처분 기각(피고승소), 소송 진행 중 |
| 2 | 미국 펜실베니아 몽고메리 카운티 법원 |
진원생명과학 | Inovio Pharmaceuticals Inc. (미국) |
Cellectra 사용권 분쟁 | - |
미국 자회사 VGXI Inc.에서 약 16만달러를 지급하였음. |
미국 지점 VGXI USA 에서 8만달러를 지급하였음. |
소송 진행 중 |
| 3 | 미국 텍사스남부 휴스턴 지방법원 |
VGXI Inc. | Aldevron LLC (미국) |
VGXI Inc 의 영업 비밀 남용, 특허 침해 및 계약 위반 | - | 미국 자회사 VGXI Inc.에서 약 58만달러를 지급하였음. | 미국 자회사 VGXI Inc.에서 약 112만달러를 지급하였음. | 2023년 10월 양측이 중재에 합의함에 따라 소송이 종결 |
| 4 | 서울중앙지방법원(*) | 진원생명과학 | A 제약회사외 2 (*) | 영업비밀침해 금지 | 400백만원 |
- |
- |
합의하여 소취하로 종결 |
| 5 | 서울중앙지방법원(*) | 진원생명과학 | A 제약회사외 2 (*) | 영업비밀침해 금지 가처분 | 100백만원 | - |
당사에서 45백만원 지급하였음. |
화해 권고 결정으로 종결 |
| 6 | 서울행정법원 | 진원생명과학 | 1. 한국보건산업진흥원 2. 코로나19 치료제/백신 신약개발사업단 |
정산금회수처분 취소 청구 | - | - | - | 소송 진행 중 |
(*)소송상대방과의 합의에 따라 회사명 비공개하기로 하였습니다.
상기 내역 중 1번 소송은 2020년 06월 03일 이노비오가 당사 자회사 VGXI가 보유하고 있는 코로나19 백신 관련 생산 공정 기술의 이전을 요구하며 소송을 제기하였습니다. 이노비오는 개발하고 있는 코로나19 DNA 백신(INO-4800)의 생산량 확대를 위해 VGXI가 부당하게 생산 공정 기술을 공유하지 않았다고 주장하였습니다.
2020년 06월 25일 이노비오가 제기한 VGXI의 생산 기술 이전 가처분 신청을 법원이 기각하였으며, 현재 본안 소송이 진행 중입니다. 2020년 07월 07일 진원생명과학과 VGXI는 이노비오가 VGXI의 생산 기술을 타사에 허락 없이 제공하였다는 취지로반소를 제기하여 진행 중입니다.
2번 소송의 경우 알데브론 소송 관련; 2019년06월12일VGXI가Aldevron을 피고로 하여 기술이전 기간이 만료되었음에도 불구하고, 지속적으로VGXI의 기술을 사용하여 제품을 생산하였기에VGXI의 생산 관련 특허를 침해했다고 주장하며 소송을 제기했고 2023년10월 양측이 중재에 합의함에 따라 소송이 종결되었습니다.
3번 소송은 2020년 12월 07일 이노비오가 당사와 체결한 Cellectra 라이센스 계약의해지를 통보했고, 그에 따라 당사가 이노비오를 상대로 펜실베니아 몽고메리 카운티 법원에 제기한 소송입니다.
2021년 07월 29일 이노비오는 당사와 체결한 계약에 대하여 2020년 01월 당사의 최대주주 변경을 경영권 변동이라 판단하여 이를 근거로 2020년 08월 09일 해제 의사표시를 하였기 때문에 이미 계약은 해지되었다고 주장하였습니다.
이에 대해 당사는 2020년 01월 단순히 최대주주가 변경되었으며, 기존 경영진은 교체하지 않고 계속 유지되고 있으므로 이노비오의 해제 주장은 설득력이 없으며 이에 따라 당사와 이노비오간 체결한 Cellectra 계약이 계속 유효하다고 주장하였습니다.
그에 따라 이노비오가 한국에서 Cellectra 기기 관련 활동을 할 수 없고, 제3자와
Cellectra 관련 계약을 체결할 수 없고, 이노비오의 위법행위로 인한 손해에 대해 배상할 것을 청구했습니다.
4번 소송은 영업비밀침해 금지에 대한 소를 제기한 바 있으나 양측이 합의하여 소취하로 종결되었습니다.
5번 소송은 영업비밀침해 금지에 대한 가처분 신청으로 재판부의 화해권고 결정으로 종결되었으며, 해당 권고 결정은 유효하게 유지됩니다.
6번 소송의 경우 당사는 재단법인 범부처신약개발사업단과 코로나19 DNA백신(GLS-5310)의 1/2상 임상개발에 대한 연구개발과제협약서를 2020년 12월 29일 체결하여 당사가 현물 416백만원과 현금 2,042백만원을 출연하고 정부가 7,376백만원을 지원하였습니다. 해당 연구기간은 21년 12월 28일까지였습니다. 연구개발사업이 종료됨에 따라, ‘국가연구개발사업 연구개발비 사용 기준’에 따른 정산이 진행되었고, 23년 1월 5일자로 위탁정산기관인 도원회계법인으로부터 정산보고서를 통보받았습니다. 정산보고서에는 당사가 자회사 VGXI에 코로나19 DNA백신 생산비용 등으로 지급한 3,216백만원에 대해 사업비 불인정하여 정부지분액 2,518백만원에 대한 회수를 요청했습니다. 사업비 불인정 사유는 계열사 등으로 법인이 분리되어 있으나 인적, 물적 구분이 명확하지 아니한 기관간 거래라는 것입니다. 당사는 VGXI에 지급한 비용은 인적, 물적 구분이 명확한 별도 법인에게 적법한 절차를 통해 정당하고 합리적으로 지급한 연구개발비로 판단하여 해당 회수 요청이 부당하다고 판단하여 23년 4월 4일 서울행정법원에 정산금회수처분 취소 소송을 제기했습니다.
2-2. 견질 또는 담보용 어음ㆍ수표 현황
| (기준일 :2023.09.30 ) | (단위 : 매, 백만원) |
| 제 출 처 | 매 수 | 금 액 | 비 고 |
|---|---|---|---|
| 은 행 | - | - | - |
| 금융기관(은행제외) | - | - | - |
| 법 인 | - | - | - |
| 기타(개인) | - | - | - |
3. 제재 등과 관련된 사항
해당사항 없음
4. 작성기준일 이후 발생한 주요사항 등 기타사항
4-1. 중소기업기준검토표
|
[별지 제51호 서식] <2019. 3. 20. 개정> ( 앞 쪽) |
||||||||||
|
사 업 |
2022-01-01 |
중소기업 등 기준검토표 |
법인명 |
진원생명과학㈜ |
||||||
|
사업자 |
120-81-14898 |
|||||||||
|
구분 |
① 요 건 |
② 검 토 내 용 |
③적합여부 |
④적정 |
||||||
|
중 |
(101) |
ㅇ조세특례제한법 시행령 제29조제3항에 따른 소비성 서비스업에 해당하지 않는 사업 |
구분 |
기준경비율코드 |
사업수입금액 |
(17) 적합 |
|
|||
|
(01) |
(04) |
(07) |
||||||||
|
(02) |
(05) |
(08) |
||||||||
|
(03) |
(06) |
(09) |
||||||||
|
계 |
- |
45,606,006,334 | ||||||||
|
(102) |
ㅇ아래 요건 ①, ②를 동시에 충족할 것
|
가. 매 출 액 - 당 회사(10) ( 456억원) - 「중소기업기본법 시행령」 별표 1의 규모기준(11) ( 억원) 이하 나. 자산총액(12) ( 2,232억원) |
(18) |
|||||||
|
(103) |
ㅇ「조세특례제한법 시행령」 제2조제1항제3호에 적합한 기업일 것 |
ㆍ「독점규제 및 공정거래에 관한 법률」 제14조제1항에 따른 상호출자제한기업집단등에 속하는 회사 또는 같은 법 제14조의3에 따라 상호출자제한기업집단등의 소속회사로 편입?통지된 것으로 보는 회사에 해당하지 아니할 것 ㆍ 자산총액 5천억원 이상인 법인이 주식 등의 30%이상 직.간접적으로 소유한 경우로서 최다출자자인 기업이 아닐 것 ㆍ「중소기업기본법 시행령」 제2조제3호에 따른 관계기업에 속하는 기업으로서 같은 영 제7조의4에 따라 산정한 매출액이 「조세특례제한법 시행령」 제2조제1항제1호에 따른 중소기업기준(의① 기준) 이내일 것 |
(19) |
|||||||
|
(104) |
① 중소기업이 규모의 확대 등으로 의 기준을 초과하는 경우 최초 그 사유가 발생한 사업연도와 그 다음 3개 사업연도까지 중소기업으로 보고 그 후에는 매년마다 판단 |
○사유발생 연도(13) ( 년) |
(20) |
|||||||
|
소 |
(105) 사업요건 및 독립성요건을 충족할 것 |
중소기업 업종(101)을 주된사업으로 영위하고, 독립성요건 (103)을 충족하는지 여부 |
(21) (Y), (N) |
|||||||
|
(106) 자산총액이 5천억원 미만으로서, 매출액이 업종별로 「중소기업기본법 시행령」 별표 3의 규모기준("평균매출액등"은 "매출액"으로 봄) 이내일 것 |
가. 매 출 액(14) - 당 회사(15) ( 456억원) - 「중소기업기본법 시행령」 별표 3의 규모기준(15) ( 억원) 이하 |
(22) (Y), (N) |
||||||||
|
중 |
(107) [조세특례제한법]상 중소기업 업종을 주된 사업으로 영위할 것 |
중소기업이 아니고, |
(23) |
(28) |
||||||
|
(108)소유와 경영의 실질적인 독립성이 「중견기업 성장촉진 및 경쟁력 강화에 관한 특별법 시행령」 제2조제2항제1호에 적합할 것 |
ㆍ「독점규제 및 공정거래에 관한 법률」 제14조제1항에 따른 상호출자제한기업집단등에 속하는 회사에 해당하지 아니할 것 ㆍ「독점규제 및 공정거래에 관한 법률 시행령」제17조제1항에 따른 상호출자제한기업진단 지정기준인 자산총액 이상인 법인이 주식등의 30%이상을 직ㆍ간접적으로 소유한 경우로서 최다출자자인 기업이 아닐 것(「중견기업 성장촉진 및 경쟁력 강화에 관한 특별법 시행령」 제2조제3항에 해당하는 기업은 제외) |
(24) |
||||||||
|
(109) 직전 3년 평균 매출액이 다음의 중견기업 대상 세액공제 요건을 충족할 것 ① 중소기업 등 투자세액공제(「조세특례제한법」 제5조제1항) : 1천5백억원 미만(신규상장 중견기업에 한함) ② 연구ㆍ인력개발비에 대한 세액공제(「조세특례제한법」 제10조제1항제3호나목3)) : 5천억원 미만 ③ 기타 중견기업 대상 세액공제 : 3천원억 미만 |
직전 3년 과세연도 매출액의 평균금액 |
(25) |
||||||||
|
직전 3년 |
직전 2년 |
직전 1년 |
평균 |
|||||||
|
( 억원) |
( 억원) |
( 억원) |
( 억원) |
|||||||
4-2. 외국지주회사의 자회사 현황
해당사항 없음
4-3. 보고기간 후 사건
해당사항 없음
XI. 상세표
1. 연결대상 종속회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| VGXI, Inc. | 2008.05.15 | 2700 Research Forest Drive, The Woodlands TX77381. U.S.A |
플라스미드 (DNA백신)제조 |
151,835 | 기업회계기준서 제1110호 "연결재무제표" |
직전연도 자산총액이 지배회사 자산총액의 10% 이상인종속회사 |
| Dong-il Interlining, Ltd. | 2003.04.01 |
Route 15A, Long Binh Ward, Bien Hoa City, |
의류용 심지제조 |
9,187 | 기업회계기준서 제1110호 "연결재무제표" |
직전연도 자산총액이 지배회사 자산총액의 10% 이상인종속회사 |
2. 계열회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | 2 | VGXI, Inc. | - |
| Dong-il Interlining, Ltd. | - |
3. 타법인출자 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2023년 09월 30일 |
) | (단위 : 백만원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
|
INOVIO Pharmaceuticals, Inc. |
상장 | 2007년 03월 30일 | 일반투자 |
1,414 |
73,590 |
0.03 |
145 |
- | - |
-102 |
73,590 |
0.03 |
38 | 441,696 | -361,511 |
|
VGXI, Inc. |
비상장 | 2008년 05월 21일 |
지배 |
525 |
250 |
100 |
9,672 |
- | - |
- |
250 |
100 |
9,672 | 151,835 | -8,821 |
|
Dong-IL Interlining, Ltd. |
비상장 | 2003년 02월 17일 |
지배 |
982 |
- |
100 |
2,668 |
- | - |
- |
- |
100 |
2,668 | 9,187 | -583 |
| 합 계 | - | - |
12,485 |
- |
- |
-102 |
- |
- |
12,378 | 602,718 | -370,915 | ||||
【 전문가의 확인 】
1. 전문가의 확인
해당사항 없음
2. 전문가와의 이해관계
해당사항 없음