 |
|
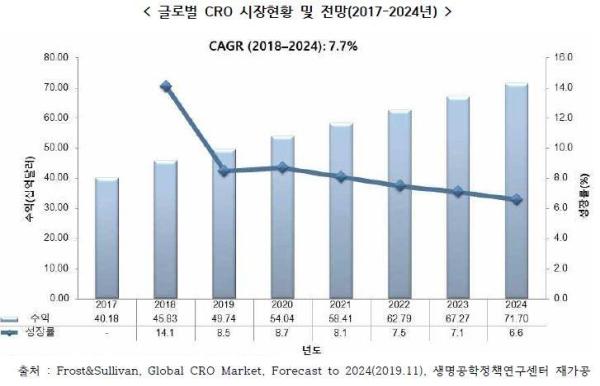
글로벌cro시장전망(2018-2024) |
주주총회소집공고
| 2023 년 12 월 06 일 | ||
| 회 사 명 : | 인바이츠바이오코아 주식회사 | |
| 대 표 이 사 : | 오수연, 양성우 | |
| 본 점 소 재 지 : | 서울시 금천구 디지털로 9길 33 (가산동, IT미래타워 8층) | |
| (전 화)02-2027-6200 | ||
| (홈페이지)https://www.bio-core.com | ||
| 작 성 책 임 자 : | (직 책) 부사장 | (성 명) 홍문기 |
| (전 화) 02-2027-6200 | ||
주주총회 소집공고
| (제23기 임시) |
제23기 임시주주총회 소집 통지(공고)
주주님의 건승과 댁내의 평안을 기원합니다. 우리 회사는 상법 제363조와 정관 제22조에 의하여 제23기 임시주주총회를 아래와 같이 소집하오니 참석하여 주시기 바랍니다.
(의결권있는 발행주식 총수의 100분의 1이하의 주식을 소유한 소액주주에 대한 소집통지는 상법 제542조의4 제1항 및 당사 정관 제24조에 근거하여 본 전자공시시스템에 공고로 갈음합니다.)
- 아 래 -
1. 일 시 : 2023년 12월 21일 (목) 오전 09:00
2. 장 소 : 서울시 금천구 디지털로9길 33, IT미래타워8층 본사 대회의실
3. 회의목적사항
가. 부의안건
제1호 의안 : 자본잉여금의 이익잉여금 전환 승인의 건
4. 경영참고사항 비치
상법 제542조의4에 의거 경영참고사항을 우리 회사의 본점, 금융위원회, 한국거래소 및 한국예탁결제원, 증권대행부에 비치하오니 참고하시기 바랍니다.
5. 전자증권제도 시행에 따른 실물증권 보유자의 권리 보호에 관한 사항
2019년 09월 16일부터 전자증권제도가 시행되어 실물증권은 효력이 상실되었으며, 한국예탁결제원의 특별(명부)계좌주주로 전자등록되어 권리행사 등이 제한됩니다. 따라서 보유중인 실물증권을 한국예탁결제원에 방문하여 전자등록주식으로 전환하시기 바랍니다.
6. 실질주주의 의결권 행사에 관한 사항
「자본시장과 금융투자업에 관한 법률」개정에 따라 한국예탁결제원의 의결권 행사 제도(Shadow Voting)는 폐지되었습니다. 따라서 주주님께서는 한국예탁결제원에 의결권행사에 관한 의사표시를 하실 필요가 없으며, 종전과 같이 주주총회에 참석하여 의결권을 직접행사하거나 또는 위임장에 의거 의결권을 간접행사할 수 있습니다.
가. 본인 또는 대리인의 주주총회 참석에 의한 행사
1) 직접 행사 : 신분증
2) 대리 행사 : 위임장(주주와 대리인의 인적사항 기재, 인감날인), 위임인 인감증명서, 대리인 신분증
2023년 12월 06일
인바이츠바이오코아 주식회사
공동대표이사 오수연, 양성우 (직인생략)
I. 사외이사 등의 활동내역과 보수에 관한 사항
1. 사외이사 등의 활동내역
가. 이사회 출석률 및 이사회 의안에 대한 찬반여부
| 회차 | 개최일자 | 의안내용 | 사외이사 등의 성명 | |||
|---|---|---|---|---|---|---|
| A (출석률: %) |
B (출석률: %) |
C (출석률: %) |
D (출석률: %) |
|||
| 찬 반 여 부 | ||||||
| - | - | - | - | - | - | - |
나. 이사회내 위원회에서의 사외이사 등의 활동내역
| 위원회명 | 구성원 | 활 동 내 역 | ||
|---|---|---|---|---|
| 개최일자 | 의안내용 | 가결여부 | ||
| - | - | - | - | - |
2. 사외이사 등의 보수현황
| (단위 : 원) |
| 구 분 | 인원수 | 주총승인금액 | 지급총액 | 1인당 평균 지급액 |
비 고 |
|---|---|---|---|---|---|
| - | - | - | - | - | - |
II. 최대주주등과의 거래내역에 관한 사항
1. 단일 거래규모가 일정규모이상인 거래
| (단위 : 억원) |
| 거래종류 | 거래상대방 (회사와의 관계) |
거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| 장비매입 | 헬스커넥트 (최대주주의 관계회사) |
2023.02.03 | 4.2 | 1.65 |
| 지분양도 | 인바이츠헬스케어 (최대주주) |
2023.05.17 | 100 | 39.37 |
| 유상증자 (자회사 출자) |
인바이츠투자 (자회사) |
2023.05.19 | 404 | 159.06 |
| 단기대여금 | 뉴레이크인바이츠투자 (손자회사) |
2023.05.31~ | 9.9 | 3.90 |
| 단기차입금(*1) | 뉴레이크얼라이언스 매니지먼트 |
2023.07.28~ 2023.11.30 |
10 | 3.94 |
※ 상기 거래금액 및 비율은 직전년도(2022년) 매출액(254억원) 대비 당기중 단일거래 건 당 1%이상 입니다.
※ 거래금액은 공급가액 기준입니다.
(*1) 거래금액은 거래기간 동안의 이자비용 포함하였으며, 원천징수 후 금액입니다.
2. 해당 사업연도중에 특정인과 해당 거래를 포함한 거래총액이 일정규모이상인 거래
| (단위 : 억원) |
| 거래상대방 (회사와의 관계) |
거래종류 | 거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| 인바이츠헬스케어 (최대주주) |
지분양도 | 2023.05.17 | 100 | 39.37 |
| 인바이츠투자 (자회사) |
유상증자 (자회사 출자) |
2023.05.19 | 404 | 159.06 |
※ 상기 거래금액 및 비율은 직전년도(2022년) 매출액(254억원) 대비 당기중 거래종류별 금액을 모두 합산한 총액 5%이상 건입니다.
※ 거래금액은 공급가액 기준입니다.
III. 경영참고사항
1. 사업의 개요
가. 업계의 현황
(1) 산업의 특성 및 성장성
■ 신약개발 사업부문
신약개발 사업부문에서 영위하는 시험수탁 기관(CRO, Contract Research Organization) 대행사업은 제약회사가 신약개발 기간을 단축하고 비용을 절감하기 위하여 아웃소싱하는 기관으로 신약개발 단계에서 제약사의 의뢰를 받아 의약품품질관리시험, 비임상시험 및 임상시험 진행의 설계, 컨설팅수행, 모니터링, 데이터링, 허가대행 등의 업무를 대행하고 있습니다.
의약품 허가 및 규제의 강화, 신약출시 지연에 따른 규모의 불경제 등 제약시장의 변화는 제약 연구개발(R&D) 생산성 감소, 수익창출력 감소로 이어지고 있습니다. 그에 따라 제약기업들은 연구개발 비용 절감을 위해 점차 임상시험 아웃소싱을 확대하는 추세로, 제약 CRO로의 임상시험 아웃소싱은 특히 선진국을 중심으로 급격히 확산되며 그 중요성이 부각되고 있습니다.
CRO 사업분야는 기술수준이 높고, 기술의 변화속도가 빠르며, 표준의 중요성이 크고, 개발프로세스의 복잡성 또한 크기 때문에 현재 해당 업종 내에 필요한 연구개발서비스를 제공할 수 있는 민간부문의 공급규모는 부족한 반면, 이들을 필요로 하는 업계의 수요는 크다고 평가되고 있습니다. 따라서 CRO 사업분야는 전체 연구개발서비스자체의 성장가능성이 클 뿐만 아니라, 민간부문을 통한 R&D 서비스산업 활성화의 잠재력이 가장 큰 업종으로 볼 수 있습니다.
■ 생명공학 사업부문
1) 유전체분석사업유전체는 유전자 (gene)와 염색체 (chromosome)를 합쳐 만든 용어로, 한 생물이 가지는 모든 유전 정보라고 정의합니다. 유전체 정보는 우리 몸이 어떻게 구성되는 설명해주는 ‘Genetic Blueprint’로 해석할 수 있으며, 인간의 유전체 정보 전체를 분석하는 전장 유전체 분석 (Whole Genome Sequencing, WGS)을 하면, 우리 몸을 만들고 있는 모든 유전적 정보를 알 수 있습니다. 개인별 유전적 특성은 물론, 어떤 질병에 취약한지, 어떤 치료나 약물을 사용했을 때 가장 좋은 효과를 볼 수 있는지 확인 가능하며, 발병된 질병의 예후까지도 예측할 수 있습니다.
의료 빅데이터 분석은 개인의 유전체 정보, 전자의료기록 (EMR), IoT 건강정보 등을 데이터를 수집·가공해 활용하는 산업분야 입니다. 특히, 유전체 분석이 미래 유망 산업으로 각광받으면서 국내 시장도 갈수록 성장하고 있습니다. 앞으로 모든 의료·헬스케어 서비스는 의료 빅데이터를 인공지능(AI)이 종합 분석하여 개개인에게 맞춤 예방과 치료를 제공하는 방향으로 진화할 것으로 예상됩니다. 예방(Preventive), 예측(Predictive), 개인맞춤(Personalized), 참여(Participatory) 등 4P로 요약되는 미래 의료 실현에 있어 의료 빅데이터 분석은 필수이며, 이를 위해서는 선제적으로 많은 데이터가 축적되어야 하며, 해당 데이터를 효율적으로 분석할 수 있으면 폭넓고 정확한 서비스를 제공할 수 있을 것으로 예상됩니다.
유전체 분석은 스마트 헬스케어와 정밀의료의 근간을 이루고 있으며, 치료에서 예방으로 의료 패러다임의 변화를 유도하고 있습니다. 유전체 분석 기술은 염색체의 이상 현상을 현미경으로 확인하던 수준에서 염기서열이 중복되거나 결실되는 현상과 같이 유전자의 구조적 이상을 검사하는 단계로 발달하였으며, 현재는 개인 유전체 해석이 가능할 뿐 만 아니라 소프트웨어와 클라우드, 빅데이터 등의 IT영역과 접목되어 융합산업으로 그 영역이 확장되고 있습니다. 또한 진단, 예측에서부터 표적치료제 개발에 이르기까지 보건산업 내의 다양한 적용이 가능하기 때문에 이를 위한 자동화, 고속화를 포함한 다양한 기술 등이 함께 적용되고 있습니다.
2) 수탁검사사업
당사가 영위하는 수탁검사사업은 ‘체외진단'이 프로세스를 단순화 및 신속화하며 관련 시장의 패러다임 전환이 예상됩니다. 세계적인 고령화 추세와 감염성 질환 증가 등으로 인해 체외진단 시장은 발전 및 시장 확대 속도가 더욱 빨라 질 것으로 예상 됩니다. 경제적이고 효과적인 치료와 예방을 위한 개인 맞춤형 의료 (Personalized Medicine)의 필요성이 증대되고 있습니다. 인구 고령화와 감염성 질환 등으로 인해 조기진단 중요성 역시 점차 커지고 있습니다. 체외진단 (In Vitro Diagnositic, IVD)은 조직, 혈액, 침, 소변, 세포세척액 등 인체에서 유래한 물질을 이용해 몸 밖에서 신속하게 질병을 진단, 예측, 모니터링하는 기술로 정의할 수 있습니다. 코로나19와 같은 감염성 질환 외에도 각종 암, 심혈관질환, 알츠하이머와 같은 중증질환뿐만 아니라 보편적인 질환에서의 조기진단 및 동반진단을 포함한 맞춤 진단과 예후예측 진단에서도 유용하게 활용됩니다. 소량의 검체를 이용해 많은 종류의 검사의 일괄적 처리가 가능하고, 고감도의 질환 정보와 치료 효율을 극대화할 수 있는 정보를 정확하게 제공할 수 있습니다. 국내 체외진단 분야는 보다 정확도를 높인 디지털화 및 대량 진단, 적용 분야가 다양화된 플랫폼 기반의 기술들로 범위를 확장하고 있습니다.
3) 콜드체인사업
콜드체인은 온도에 민감한 생산품을 생산지에서 소비자에게 저온상태로 배송하는 방식을 말하며, 당사가 영위하는 부분은 바이오에 관한 물류 시스템을 영위합니다. 코로나19의 위기를 극복하면서 코로나19 백신과 함께 의약품 물류를 포함한 바이오 물류에 대한 전반적인 관심과 중요도는 국내에서 빠르게 커지고 있습니다. 국내 바이오 물류 시장의 규모는 약 3,500억 원 규모입니다. 특히 지난 2015년 이후 국내 바이오 물류 시장은 매년 약 30%의 빠른 증가세를 보이고 있는 것으로 조사됩니다. 전 세계의 바이오 물류 시장의 규모는 약 880억 달러(약 102조 원)에 이르는 것으로 조사됩니다. 글로벌 바이오 물류 시장 역시 국내 시장과 마찬가지로 지속적인 성장세를 보이고 있는데, 2019년 기준 시장 규모는 전년인 2018년과 비교해 약 4.5% 증가한 것으로 나타났습니다.
(2) 경기변동의 특성, 계절성
가) 경기변동의 특성
■ 신약개발 사업부문
신약개발 사업부문의 CRO 용역 사업은 대부분 제약사가 주요 매출처로서 연구개발이 지속적으로 이루어져야 하는 산업의 성격상 전반적으로 경기변동에 의해 크게 영향을 받지 않는 산업으로 인식되고 있습니다.
■ 생명공학 사업부문
1) 유전체분석사업
개인유전체 정보는 제약회사와 신약 공동개발에 활용 가능하고 정밀의학 시대에 개인맞춤 치료까지 이어질 수 있습니다. 단순 일회성 테스트로 구성되는 시장이 아니라 다양한 형태의 사업모델로 확장이 가능하여, 경기 변동의 영향을 크게 받지 않습니다.
환자가 아닌 건강한 일반인이 건강검진 등을 통해 진단을 하는 경우에는 경제상황에 따라 구매욕구가 변화할 수 있는 요인이 되기 때문에 경기 변동에 따른 영향성 확인이 필요합니다. 다만, 질병을 발견하면 추가 진료가 필요할 경우, 연관검사 및 사후 관리의 유용성 여부에 따라 의료기관의 선택 및 검사항목이 좌우되기 때문에 경기 변동에 대한 영향을 지속적으로 확인해야 합니다.
2) 수탁검사사업
의료산업은 특성상 경기흐름과 관계없이 지속적으로 발생하는 환자 수, 그리고 그에 따른 의료품 및 의료기기의 수요에 의해 경기변동의 영향을 크게 받지 않는 업종입니다. 유전자검사 분야도 이러한 특성을 가지고 있어 가계지출 및 국민총생산의 변화, 경기변동의 영향은 크지 않다고 할 수 있습니다.
기초 진단검사 및 고급 진단검사의 경우, 의료기관의 의뢰를 통해 이루어지므로 치명적인 전염병 출현 시 일시적으로 시장 급증하는 영향이 생길 수 있어 지속적인 관찰을 통한 대비가 필요합니다.
3) 콜드체인사업
콜드체인사업부문의 메디컬 유통 및 콜드체인 유통사업의 경우 경기변동에 따른 수요변화는 크지 않습니다.
나) 계절적 요인
■ 신약개발 사업부문
신약개발 사업부문의 CRO 용역서비스 사업은 계절적인 요인에 따른 수요변화는 크지 않습니다.
■ 생명공학 사업부문
1) 유전체분석사업
신종 감염병 발생 수 증가와 이로 인한 질병에 대한 신속한 예방 및 진단의 필요성이 대두되고 있습니다. 메르스, 사스 또는 COVID-19와 같은 치명적인 전염병 출현 시 일시적으로 시장 급증하며, 계절별로 발생하는 질병의 양상에 주목하여 경기 변동에 대처해야 합니다.
2) 수탁검사사업
제공 받은 시료에서 DNA를 추출하여 질환과의 연관성을 파악하는 분자생물학적 유전자검사 입니다. 계절에 따라 의뢰되는 주요 검사 항목의 변화는 생기지만 일부 호흡기 질환에 대한 진단검사를 제외하고는 계절적인 요인에 크게 영향을 받지 않습니다.
3) 콜드체인사업
콜드 체인 유통 항목은 별도의 계절적 요인에 영향을 받지 않습니다.
(3) 제품의 라이프사이클
■ 신약개발 사업부문
신약개발사업부문의 CRO 용역서비스 사업은 기술수준이 높고, 기술의 변화속도가 빠르며, 표준의 중요성이 크고, 개발프로세스가 복잡하므로 현재 해당 업종내에 필요한 연구개발서비스를 제공할 수 있는 민간부문의 공급규모가 부족한 상황입니다. 또한 CRO용역서비스를 수행한 경험이 많아야 하며, 분석 전문성과 노하우도 확보하여야 합니다. 회사는 독성동태를 위한 분석부분에서 한국 최초의 GLP(Good Laboratory Practice) 인증 분석기관으로 글로벌 기준에 적합한 Regulated Bioanalysis 분야에 있어 최고의 경험과 전문성, 노하우 보유하고 있습니다. 또한, 의약품품질관리사업은 식약처로부터 2023년 5월 인증을 받아 서비스의 영역을 확장하였습니다. 회사가 영위하고 있는 CRO 용역서비스 사업은 전문성과 노하우가 확보되어 있어 상대적으로 오랜 기간동안 시장에서 영향력을 행사할 수 있습니다.
|
* GLP : 비임상시험 관리기준. 의약품 안전성 시험의 신뢰성 보증을 위해 연구인력, 시험시설 및 장비, 시험방법 등을 조직적, 체계적으로 정해 놓은 기준으로서 GLP인증은 시설, 인력, 운영 등의 종합적인 판단에 의거하여 식약처등의 기관으로부터 주어지고 있습니다. |
■ 생명공학 사업부문
생명공학사업부문의 사업영역은 기술에 대한 수명주기 (Life Cycle)의 경우, 지적재산권 등에 의해 보호받고, 여러 분야로 파생이 됨에 따라 기술 수명 주기가 장기화되고 있는 추세입니다. 하지만 기술에 따른 컨텐츠의 경우, 다양한 검사 방법의 개발 및 진단 기법의 발전으로 인한 다양한 질병군의 발견으로 인하여 빠른 기술 수명 주기를 가지고 다양화 및 세분화 되는 경향을 가지고 있습니다.
1) 유전체분석사업
생명공학사업부문에서 생산, 판매하는 진단 키트의 경우, 인간의 질병 진단, 치료에 활용되는 특성상 IT 분야나 기타 제조업과 달리 개발된 신제품이 시장에 바로 판매될 수 없으며, 보수성이 강한 의료산업과 밀접한 관련이 있어 허가 및 신고에 상당한 시간이 소요됩니다. 이러한 특성에 따라 진입하기까지 오랜 시간이 소요되지만, 진입 시 지속되는 시간은 장기간이 될 수 있습니다. 하지만 최근 기술의 발전 속도가 매우 빠르기 때문에 새로운 기술에 대한 기술 수명 주기가 짧아지고 있는 추세입니다.
생명공학사업부문에서 수행하는 개인유전체 분석의 경우, 실제로 병원이나 검진센터에서 사용되기 때문에 안정성 및 신뢰도 확보에 상당한 시간이 소요됩니다. 진입하고 난 후에 기술 수명 주기는 안정적이지만 해당 기술의 컨텐츠는 빠른 변화를 요구 하고 있습니다. 또한 감염성 세균이나 바이러스를 진단하는 제품의 경우 각종 항생제나 항바이러스에 대한 돌연변이종의 출현으로 지속적인 제품의 개선이 필요합니다. 다양한 진단기술과 신기술이 개발되어 조금 더 간편하고 빠르게 진단할 수 있는 방법들이 개발되고 있어 이런 신기술이 도입을 요구 하는 시장의 요구에도 충실하게 반응해야 하며, 지속적인 제품의 개발과 개선이 요구되는 개인유전체 분석 의 경우 라이프 사이클은 점점 더 짧아진다고 할 수 있습니다.
2) 수탁검사사업
당사의 수탁검사사업 영역인 분자생물학적 유전자검사의 경우, 정확한 실험 방법 및 신뢰도 높은 결과 도출, 이를 통해 축적되는 안정적인 결과의 확보가 가장 중요합니다. 진단 검사의 경우, 신제품 개발 후 임상 적용까지 식약처의 인허가 및 한국보건의료연구원의 신의료기술 행위 신청 등을 통해 인정된 검사 방법만이 선정되며, 이를 이용한 신뢰도 높은 검사 결과의 축적에 상당한 기간이 소요됩니다. 검사 목적의 특성 상 유용성의 입증 없이 방법의 변경이 어려우며, 한 가지 유용한 방법이 여러 분야로 파생이 되는 특성을 고려할 때 기술 수명 주기 (Life Cycle)는 장기적으로 안정적인 특징을 보입니다.
3) 콜드체인사업
국내 콜드체인 패키징 분야에 대한 라이프 사이클은 도입기 단계입니다. 상품에 대한 경쟁은 높지 않으나 주 사용자층이 정해져 있다고 할 수 있습니다. 하지만 국내 바이오 의약품 산업 육성 정책과 더불어 성장할 수 있는 잠재력을 가지고 있습니다. 콜드 체인 패키징은 이러한 바이오의약품의 운송에 필수적으로 사용되고 있으며 그 적용은 바이오의약품의 성장과 함께 증가할 것으로 예상됩니다.
(4) 대체시장의 존재여부 및 산업의 향후 전망
■ 신약개발 사업부문
신약개발 사업부문의 CRO 사업분야에 있어서 이를 대체하는 시장은 존재하지 않습니다. 신약(또는 제네릭)개발에 대한 사용 허가를 받기 위해서는 반드시 거쳐야 하는 시험절차에 속하는 사업분야이기 때문에 이를 대체하여 다른 방식으로 신약 등에 대한 허가를 득할 수는 없습니다.
■ 생명공학 사업부문
1) 유전체분석사업
바이오산업 중 질병 예방 및 진단에서 가장 핵심적인 위치를 차지하고 있으며, 기술적으로도 발전 가능성이 높기 때문에 대체시장의 형성이 어렵다고 판단됩니다. 동일 기술의 대체 시장 형성은 가능하지만 현재 빠르게 발전하고 있는 기술의 속도를 따라잡기는 힘들기 때문입니다. 하지만 검사 결과의 대체 시장 형성은 가능할 것으로 판단되며, 현재 널리 이용되고 있는 화학적 검사법을 이용한 진단이나 산전 유전자 검사 등을 통한 태아의 유전질환 판별 등으로 요약될 수 있습니다.
2) 수탁검사사업
질병 진단의 분야뿐 만 아니라 질환 발병을 예측할 수 있는 지표 개발을 통해 특정 질병의 사전 예방 및 맞춤치료 또는 이를 구현할 수 있는 진단용 체외 진단 기기의 개발 및 생산까지 바이오산업 전반에 걸친 모든 작업을 수행하고 있기 때문에 정확한 의미의 대체 시장은 아직 없다고 판단됩니다.
3) 콜드체인 사업
넓은 의미의 콜드체인 시장을 대체할 수 있는 대안은 없으며 콜드 체인에 대한 솔루션 등은 지속적으로 발전해 나갈 것으로 예상합니다.
(5) 관련법규 또는 정부의 규제 등
■ 신약개발 사업부문
신약개발 사업부문의 의약품품질관리사업 및 임상시험검체분석기관으로써의 CRO 사업은 생물학적 동등성시험 및 임상시험실시기관 운용의 실효성을 높이기 위해 약사법의 적용을 받아 임상시험검체분석기관으로 지정을 받아야 수탁업무를 수행할 수 있습니다. 기관 지정을 위해서는 인력·장비 ·기자재·시설 현황, 표준작업지침서 등을 식약처에 제출해야 하며 실태조사를 받아야 합니다.
임상CRO 사업의 경우에는 국내 임상시험 수준 향상을 위해 임상시험수탁기관(CRO)이 자율적으로 등록할 수 있는 민간주도 '자율등록제'를 실시하고 있습니다.
■ 생명공학 사업부문
1) 관련법규
생물다양성협약 (Convention on Biological Diversity, CBD)은 유전자원 관련 최초의 협약이고, 나고야의정서는 ABS원칙 (Access and Benefit-Sharing, CBD 및 나고야의정서에서 규정하고 있는 것으로, 생물유전자원에 대한 접근 및 이익공유에 관한 원칙을 의미, 즉 생물유전자원을 이용하는 자는 유전자원 제공국에 미리 통보해 승인 (PIC)을 받아야 하며, 해당 유전자원을 이용해서 얻은 이익은 상호 합의된 계약조건 (MAT)에 따라 배분해야 한다는 것을 명문화 함)에 따라 유전자원의 접근 및 이익공유에 대해 규정한 국제조약입니다. CBD와 나고야의정서에서는 유전자원뿐 만 아니라 최근에는 유전정보가 그 범위 및 대상인지 여부에 대해 논의하기 시작하였습니다.
CBD 뿐만 아니라 ITPGRFA (International Treaty on Plant Genetic Resources for Food and Agriculture), WHO (World Health Organization), BBNJ (Biological Diversity of Areas Beyond National Jurisdiction) 등의 국제논의에서 유전자원 및 유전정보의 접근 및 이익공유에 대해 논의되기 시작했습니다. 유전정보 관련해서는 UNESCO에서 국제선언으로서 최초로 언급했으며, OECD에서는 유전정보의 국가간 이동, 바이오뱅크 관련 가이드라인 제정 등이 논의되고 있습니다.
유전체분석은 관련 법령 및 정부의 규제가 미치지 못하는 분야였으나 최근 생명공학산업에 대한 관심이 고조되면서 '생명윤리 및 안전에 관한 법률'이 시행되고 있고 병원을 통하지 않은 유전자 검사는 불가하며, '유전자검사기관'과 최근 법개정을 통해 시행중인 '인체유래물연구기관'의 등록을 통해 관리 받고 있습니다.
2) 정밀의료관련 제도적 이슈
|
분야 |
이슈 |
이슈 원인 |
관련 법 |
|---|---|---|---|
|
정보 |
남용가능성 |
개인의 유전체 정보 활용 |
생명윤리법, 개인정보 보호법 |
|
차별가능성 |
개인 유전체 정보의 악용 |
생명윤리법 |
|
|
환자동의서 |
개인의 유전체 정보 수집 및 활용 |
||
|
과대광고 방지 |
유전체/유전자 검사의 상업화 |
||
|
바이오뱅크 구축 |
인체유래물, 유전체 정보 수집 |
||
|
허가 |
느린 인허가 |
유전체 분석 관련 제품/서비스 등장 |
의료기기법 |
|
비의료기관 규제 |
비의료기관의 역할 확대 |
생명윤리법, 의료법 |
|
|
질병예방 유전자검사 규제 |
질병관련 유전자검사 허용 범위 |
생명윤리법, 국민건강보험법 |
|
|
특허 |
유전자 특허정책 |
유전자 특허의 허용 범위 |
특허법 |
|
(출처: 정기철 외,2014) |
|||
3) 허가관련 이슈
가) 의료기기 인허가 시스템
새로운 의료행위의 안전성과 유효성 평가를 위한 신의료기술 평가제도 관련해서는 평가기간에 대한 문제가 제기되고 있습니다. 이에 따라 정부는 바이오헬스산업 시장 활성화를 위해 신의료기술평가 간소화 및 신속화 등의 정책을 추진하고 있습니다.
나) 비의료기관의 역할 확대
맞춤 의료로 인해 건강관리 등 예방 분야에서 비의료기관의 역할이 증대할 것으로 예상됩니다. 다만 비의료기관에 적용되는 규제 및 인력에 요구되는 기준이 높지 않아, 비의료기관에서 제공하는 서비스에 대한 안전성이나 유효성 등에 대한 문제가 제기될 수 있습니다.(전문성 기준이 의료기관에 비해 낮은 상황)
다) 치료에서 예방시스템으로의 전환
생명윤리법에는 질병과의 연관성이 높지 않은 19개 유전자 검사들에 대해 금지하거나 제한하고 있으며, 예방차원에서 이루어지는 유전자 검사에 대한 보험이 괴지 않고 있습니다. 기술발전을 고려해 유전자 검사에 대한 규정을 재검토할 필요가 있고, 예방차원의 유전자 검사를 보험체계에 포함하는 방안을 검토할 필요가 있습니다.
4) 특허관련 이슈
미국의 경우, 최근 유전자 특허 취득을 어렵게 만들고 있는 상황으로 특허를 통한 기술의 지적재산권 보호 문제가 이슈가 되고 있습니다.
유전자 특허 이슈는 미국의 특허정책이 변화면서 유럽 등 주요국뿐만 아니라 국내 정책에도 영향이 있을 것으로 예상됩니다.
5) 콜드체인사업
세계보건기구(WHO)에서는 감염성 물질에 대한 운송 규정을 마련하여 준수하고 있습니다. 감염성 물질에 대한 운송 규정에는 패키징에 대한 조건이 설명되어 있으며 반드시WHO에서 규정하는 감염성 물질이 규정되어 있습니다. 이것은 감염성 물질의 운송 중 발생할 수 있는 위험성을 제거하기 위한 조치로UN 인증을 획득한 포장재에 한해 항공 운송이 가능합니다. 국내의 경우는 질병관리본부에서 지난2013년에 공지한 감염성물질 안전수송 지침이 있으며 그 역시UN인증을 획득한 포장재로 감염성 물질 운송을 요구하고 있습니다. 온도조절이 요구되는 포장재의 경우는 공식적으로 사용되어 지고 있는 ISTA(International Safe Transit Association) 에 등록된 기업의 내부 테스트를 거친 제품에 대하여 그 성능을 인정해 주는 상황입니다.
(6) 자원조달상황
당사의 원재료는 CRO 용역 및 진단키트 등에 사용되는 각종 시약 등을 의미합니다. 현재까지 원재료는 국내 생산 또는 국내 대리점을 통해 직접적으로 구매하여 사용을 하고 있으며, 고정 거래처가 대부분입니다. 당사가 시험하는 시험의 유형 및 종류, 성격에 따라 회사가 지정하는 시험재료에 따라 가격의 차이는 있으나, 시험재료 및 원재료의 가격변동은 거의 없습니다.
당사에서 인건비가 차지하는 원가 비중은 타 산업에 비해 다소 높습니다. 이것은 연구개발 서비스산업적인 특성에 의해 연구직의 비중이 높기 때문입니다. 석·박사 중심의 연구직 구성으로 인해 인건비의 원가 비중이 높은 특성이 있습니다. 또한 CRO 시장의 업체수가 작아 기본적인 수급 기반이 취약하여 유경험 인력 수급이 원활치 않은 문제점이 있으나, 최근에는 분야별 전문 인력의 수급이 서서히 개선되는 등 노동력 수급 상황도 대체로 안정적인 궤도에 올랐다는 평가를 받고 있어 인력, 자금 등과 관련된 자원조달 상에 어려움은 크지 않을 것으로 예상됩니다.
나. 회사의 현황
(1) 영업개황 및 사업부문의 구분
당사는 의약품품질관리시험, 생물학적 동등성시험, 비임상 및 임상에서의 약물 체내동태 연구, 생체시료 중 약물분석법 개발, 독성 동태 시험, 의약품 내 미량분석법 개발, 0상~3상 및 PMS를 포함하는 임상시험 컨설팅을 주 사업으로 영위하고 있으며, 바이오 칩 산업 중 DNA chip, Protein chip 및 PCR 키트를 연구개발 후 제품화하는 사업 등 생명공학 사업부문 및 바이오 물류상품을 취급하는 유통사업부문 등의 사업을 영위하고 있습니다.
신약개발사업부문은 2013년말에 업계 최초로 API6500장비를 확보한 이후, 2015년 API5500 QT 장비 확보에 이어 최근 TQ6500+ 및 TQ5500+ 등의 분석장비를 확보하는 등 최신 분석시설 및 연구인력에 지속적으로 투자하고 있으며, 2021년에는 세계적으로 high-end 급 장비인 TQ7500장비를 도입하였으며, 이를 통해 동종업계 최고의 장비와 고급 연구인력을 보유하고 있습니다. 2023년 5월에는 의약품품질관리사업을 개시하여 비교용출시험, 불순물시험, 안정성시험, 미생물시험 등 원료 및 완제 의약품에 대한 전반적인 품질관리 서비스를 제공하고 있습니다.
생명공학사업부문은 2019년 8월에 NITS(Non Invasive Prenatal Screening) CE 인증 획득, 2020년 3월 COVID-19 진단키트 유럽 CE인증 획득, 2020년 4월 COVID-19 진단키트 수출허가 획득(식품의약품안전처), 2020년 5월 COVID-19 진단키트 국내 긴급사용승인(질병관리본부)과 COVID-19 진단키트 미국 FDA EUA 획득, 2022년 6월에 미국병리학회(CAP)인증을 획득하여 유전체분석, 수탁검사 및 진단제품 사업을 영위하고 있습니다.
당사는 의약품 개발을 위한 Hub 역할을 하고 있는 신약개발사업부문과 유전자 검사제품 공급능력 및 신규 유전자 검사제품 개발능력과 신뢰성 있는 유전자 검사서비스 제공능력을 보유 하고 있는 생명공학사업부문을 기반으로 바이오 물류 및 유통 마켓을 활성화함으로써 국내 시장에서 바이오 선도기업으로서의 위치를 공고히 하고 해외시장으로 진출함으로써 명실공히 글로벌 바이오 선도기업으로 거듭나기 위해 최선을 노력을 다할 것입니다.
(2) 회사의 성장과정
■ 신약개발 사업부문
당사는 신약개발 과정 중 주요 단계인 생체시료 중의 약물분석(Bioanalysis)과 초기임상 시험 (Early-phase clinical trial)을 지원하는 CRO로, 주요 고객층은 신약 및 제네릭 약물 등을 개발하는 제약회사입니다. 세계적으로 제약계의 R&D 생산성이 저하되며, 아웃소싱의 중요성 및 기존의약품보다 월등한 신물질 탐색이 어렵다고 해도 과거와 달리 훨씬 강화된 절차 및 신뢰성 확보로 인하여 임상시험조건을 통과하기가 어려워 졌으며, 최근 강화된 의약품 허가 후 품질 심사의 제도로 전문적 CRO의 역할에 대한 필요성 더욱더 부각되고 있습니다.
당사는 주력 기술 분야가 Bio-analytical labs과 Early development of Phase I clinical trial이며, 이미 다국적 비임상 및 임상 CRO들과 분석 업무의 파트너쉽을 가지고 있으며, 글로벌 수행 프로젝트 경험을 가지고 있어 현재 국내 제약사에서 필요로 하는 서비스를 제공할 수 있는 CRO 업체입니다. 또한 국내 1호 Bio-analytical CRO GLP 인증기관으로서의 전문성과 많은 경험을 가지고 있어 국내 주요 제약회사를 포함한 90개 이상 회사를 클라이언트로 두고 있으며, 화이자, IQVIA, 인텔시어스 등 다국적 기업과 파트너쉽이 체결되어 있습니다.
신약개발사업부문의 CRO 서비스 개시 후부터 현재까지의 성장과정을 살펴보면 아래와 같습니다.
|
구 분 |
시장 여건 |
생산 및 판매활동 개요 |
영업상 주요전략 |
|---|---|---|---|
|
설립시 (2000~2005) |
-.국내 제네릭시장 형성 |
-.주요서비스 . 생동CRO/분석CRO(합성의약품) |
-. GLP기관 인증 획득 -. 비교용출시험 서비스 개시 -. GLP분석서비스 개시 |
|
성장기 (2005~2014) |
-. 특허만료품목 증가 : 제네릭 건수 증가 -. 한미FTA 및 정책변화 에 따른 제약사 신약개발 R&D비용 증가 |
-. 주요서비스 . 생동CRO/분석CRO(합성의약품) . 임상CRO (Phase I, PMS) |
-. 기업부설연구소 인증 -. 분석장비 및 연구인력 업계 최다보유 -. 생동CRO 업계1위 유지 (최다건수 수행) -. 임상1상 사업 개시 |
|
진행중 (2015~현재) |
-. 기존 개량신약 위주의 국내 신약개발시장에서 2상~3상 시장 확대 -. 생동성시험의 GCP기준 적용으로 인한 국내 생동성시험 시장 규모 확대 |
-. 주요서비스 . 분석CRO (합성의약품, 바이오의약품, 방사선표지의약품) . 생동CRO/임상CRO(Phase I~III, PMS) - Project Management - Monitoring - Data Management - Quality Assurance - Consulting . 의약품품질관리 |
-. 임상1상사업 안정적 정착 -. 임상2상~3상 사업개시 ⇒ 매출증대 -. 바이오의약품/AMS를 이용한 방사선표지의약품 분석서비스 개시 ⇒ 경쟁력강화 -. DM 서비스 개시 ⇒ 생동성 및 임상시험의 규정 변화에 대한 신속히 대처하여 경쟁력 강화 - 의약품품질관리시험사업 확대 ⇒ 강화된 규제에 부응하여 전문적인 서비스영역 확장, 매출 확대 |
■ 생명공학 사업부문
1) 유전체분석사업
당사는 2014년 12월 주식회사 지노첵을 흡수합병하여 생명공학사업부문을 신설, 운영하고 있습니다. 동 사업부문의 질환예측 유전체 분석의 경우 국내 4개 검진센터중의 하나인 하나로의료재단과 연계하여 서비스를 시작하여, 경쟁사와는 다르게 순조롭게 시장에 진입을 하였으며, 전략적인 마케팅으로 경쟁사와의 우위를 점할 수 있었습니다. 당사의 경우 경쟁사와의 검사법과 비교할 때 독자적인 기술개발의 장점이 있으며, 또한 경쟁사의 경우 질환예측 유전체 분석에 초점을 두고 시장경쟁을 하고 있으나, 당사의 경우 생애주기별 유전체분석을 위한 모든 분석기반을 구축하여 경쟁사보다 넓은 소비자층을 대상으로 하고 있다는 장점을 보유하고 있습니다.
생명공학 사업부문의 회사설립이후 현재까지의 성장과정을 살펴보면 아래와 같습니다.
|
구 분 |
시장 여건 |
생산 및 판매활동 개요 |
영업상 주요전략 |
|---|---|---|---|
|
설립시 (2000~ 2005) |
○ 인간 유전체(Genome, 게놈) 완전해독 ○ 다국적 기업의 디엔에이칩의 대량생산시스템의 활성화 시기 |
○ 주요서비스: 디엔에이 칩을 이용한 연구분석 서비스 ○주요매출처: 대학교 및 제약사, 국가과제, 기업 |
○ 기술이전을 목적으로 국내외 연구진과협약 및 국가과제 수주 ○ 연구개발 및 분석서비스를 위한 행정시스팀구축(유전자 검사기관, 기업) |
|
성장기 (2005~ 2014) |
○ 유전체분석기술과 IT기술의 결합을 통한 다양한 장비의 개발 ○ 차세대 염기서열결정기술(Next Generation Sequencing, NGS)의 급성장 |
○주요서비스: 디엔에이 칩, Real time PCR을 이용한 연구분석 서비스, 국가과제를 통한 진단제품 및 다양한 제품 개발(남성불임칩, HLA칩,독성칩, 다수의 수산물의 종판별칩 등) ○주요매출처: 기업, 병원, 제약사, 대학 |
○ 마케팅 조직 구축 및 기존 고객들과의 연계를 통한 연구협력 및 영업의 다각화 ○ 기관별 요구에 맞는 상품의 디자인을 통한 꾸준한 마케팅수행 |
|
도약기 (2015~현재) |
○ 차세대 염기서열결정기술(Next Generation Sequencing, NGS)의 성숙기를 통한 시장과열 예시
○ 맞춤형 건강관리 시스템에 관련 시장의 확대 |
○ 주요서비스 - 디엔에이 칩, Real time PCR, NGS, Digital PCR을 이용한 연구분석 서비스 - 생애주기별 예방, 진단, 먹거리 등에 다양한 제품의 상품화 ○ 주요매출처: 일반소비자, 기업, 건강검진 재단, 병원, 한방병원, 식품연구소, 원료수입상 등 |
○ 기관별 맞춤형 제품을 포함한 플랫폼비즈니스 런칭 ○ 제품의 인허가 작업을 통한 판매 확대 및 해외수출 시스템 확보 ○ 국내 의료기관과의 연계를 통한 개인별 맞춤형건강관리 프로세스 제공 |
당사는 한국 식품의약품안전처의 허가를 받은 50여개의 분자 진단 키트를 중심으로, 인간의 전 생애에 걸친 "생애 주기별 맞춤형 유전체 검사 서비스인 모아진(MoA Gene) 프로그램"을 설계하였습니다. 고객은 모아진 프로그램을 통해 생애 주기별 유전체 검사 서비스를 받을 수 있으며, 이를 통해 건강한 삶을 영위할 수 있습니다. 이는 현재 고령화 사회를 맞이하는 입장에서 매우 매력적인 아이템이며, 이는 향후 지속적인 시장 지배력 강화에 큰 영향을 끼칠 것으로 예상하고 있습니다.
또한, 최신 분자 진단 기술인 Digital PCR을 이용하여 태아의 다운 증후군 질환 발생 여부를 조기 스크리닝하는 NITS (Non-Invasive Trisomy Screening: 비 침습적 삼 염색체 검사)를 새로 개발하였습니다. 당사에서 개발한 NITS는 NGS 기반의 스크리닝 기법보다 그 가격이 매우 저렴하며, 분석 시간이 짧고, 한 번에 다수의 샘플을 스크리닝 할 수 있다는 장점을 가지고 있습니다. 이러한 기술적 우위를 통해 당사는 지속적인 시장 지배력 강화를 꾀하고 있습니다.
2) 수탁검사사업
중앙검사센터는 2015년 9월 30일 (재)서울의과학연구소로부터 해당부문의 영업양수를 통하여 운영되고 있으며, 휴먼지놈 검사와 세포유전 검사를 진행하고 있습니다.
당사는 국내 검사센터로는 최초로 유전자 기법을 임상 진단분야에 응용하여 적용하고 있으며, 새로운 검사방법의 개발로 진단의학의 가치를 높이고 있습니다. 또한 당사는 유전자 분석법을 이용한 친자감별검사의 국제 인증서를 획득한 이래, 암관련 유전자의 진단검사를 국내 최초로 실시하였으며, 각종 장기이식이나 골수이식에 필수적인 HLA DNA typing 방법을 실용화하여 지속적인 성장을 하고 있습니다. 또한 국내 최초로 CAP inspection 인증을 받고, 국내 정도관리 진단유전학 분과의 우수한 질 관리를 인정받아 referee기관(국내 4개 기관)으로 선정된 당사의 세포유전 검사는 chromosome, FISH를 활용하여 산전진단 및 선천성 염색체결함, 백혈병 관련검사를 시행하고 있습니다.
3) 콜드체인사업
콜드체인 유통부분은 2016년 글로벌 쿠리어 업체등과의 공급 계약으로 국내 재고의 안정적 운영을 위해 경기도 광명에 보관 창고를 마련하여 국내 공급 물량이 증가하고 있는 추세를 보이고 있습니다.
국내 바이오의약품 산업은 과거 어느 때보다도 더 큰 잠재적 가능성을 보여주고 있으며 이제 도입기를 지나고 있습니다. 바이오의약품 산업 성장과 더불어 콜드체인 패키징 산업도 동반 성장해 나가고 있습니다.
(3) 국내외 시장여건
가) 국내외 시장규모 추이
■ 신약개발사업부문
 |
|
글로벌cro시장전망(2018-2024) |
글로벌 CRO 시장은 2018년 452억 8,300만달러(약 48조 9천억원) 규모를 형성하였고, 연평균 7.7%의 성장율로 2024년 717억 달러 규모로 성장할 것으로 전망됩니다.
정부지원 증가 및 최신 인프라 및 임상인구 용의성 등으로 국내 CRO 시장은 꾸준히 증가할 것으로 기대되며 이는 높은 임상시험 품질, 탄탄한 인프라구조 및 명확한 규제 등 국내 CRO시장의 장점으로 국내 CRO에 위탁하는 제약업체들이 증가하는 추세입니다.
주력 기술 분야가 Bio-analytical labs과 Early development of Phase I clinical trial이며, 이미 다국적 비임상 및 임상CRO들과 분석 업무의 파트너쉽을 가지고 있으며, 글로벌 수행 프로젝트 경험을 가지고 있어 현재 국내 제약사에서 필요로 하는 서비스를 제공할 수 있는 CRO로서 국내 제약사의 제약개발 연구의 글로벌 파트너로서 발전할 수 있는 전망을 가지고 있습니다.
■ 생명공학 사업부문 (유전체사업)
2020년~2025년 글로벌 유전체 분석 시장의 연평균 성장률은 22.8%로 전망되며, 2025년에는 227억 달러(약 30조원) 규모로 성장할 전망입니다. 국내 유전체분석 서비스 산업은 국가건강보험체계가 치료가 아닌 예방으로 전환하면서 성장세를 보일 것으로 전망됩니다. 현재 우리나라에서는 국가가 운영하는 건강보험이 의료비용의 상당 부분을 충당하고 있습니다. 건강보험공단에 따르면 건강보험의 의료비 부담은 2020년 98조원, 2030년 246조원에 달할 것으로 예상되고 있습니다. 기획재정부 역시 중기재정추계를 통해 건보재정 적자폭이 매년 커져 2023년에는 적자로 돌아서고 2025년에는 적자폭이 2.9조원에 달할 것으로 추정했습니다.
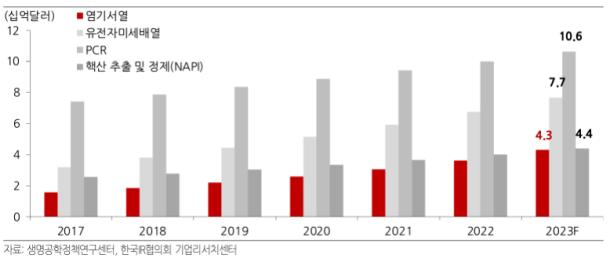 |
|
글로벌 유전체 분석 시장 규모 |
■ 생명공학 사업부문 (콜드체인사업)
백신 등 바이오의약품은 온도 유지 실패시 안정성(stability)이 깨지고 변질의 위험이 있어 안전성(safety)과 유효성(efficacy)이 매우 중요한 요소 입니다. 2020년에는 상온에 노출된 독감백신을 전량 폐기한 사례가 발생했으며, 코로나19 백신 또한 저온 유통이 강조됨에 따라 콜드체인 확보가 매우 중요한 요소입니다. 화이자의 코로나19 백신은 mRNA 유전물질이 매우 불안정하고 효소에 의해 쉽게 파괴되는 특성이 있어 영하 70°C 이하 환경에서 변질을 방지하는 것이 필요합니다.
백신 유통뿐만 아니라 코로나19 백신 진단 키트를 수출하게 되면서 바이오·의약품 콜드체인이 더욱 중요해졌습니다. 바이오·의약품 관련 기업들은 콜드체인 시설을 강화하고 운송 도중 온도이탈이 발생하지 않도록 관련 제품 연구·개발에 노력하고 있습니다.
전세계 콜드체인 물류 시장은 2020년 167억달러 규모로 성장하였습니다. 매년 8%이상의 빠른 성장세를 기록하고 있습니다.
국내에서도 의약품 개정법을 시행하면서 콜드체인 의약품 물류 서비스의 필요성이 커지고 있습니다. 콜드체인 인프라를 갖추기 어려운 중소 유통업체로부터 콜드체인 플랫폼 서비스 수요가 늘어날 것으로 전망되고 있는 가운데 정부 백신 조달 또는 백신 콜드체인 수요 증대가 이어질 것으로 기대되고 있습니다.
나) 경쟁현황
1) 경쟁현황
■ 신약개발 사업부문
신약개발 사업부문은 신약개발 과정 중 주요 단계인 생체시료 중의 약물분석(Bioanalysis, 비임상 및 임상검체분석, 생동)과 초기임상 시험(Early-phase clinical trial, 임상)을 지원하는 CRO로서 보유하고 있습니다.
또한, 국내외 제약사들이 계속 생산하는 제품들의 품질관리서비스를 제공하여 위탁 제약회사의 영역을 넓히고자 하며 경쟁력을 높이고자 합니다. 현재 국내 CRO 시장규모는 2,500억원대로 추산되고 있으며, 25개 가량의 CRO가 국내에서 운영되는 것으로 알려지고 있습니다. 재단법인 한국임상시험산업본부 또한 국내 임상산업은 인프라의 우수성과 연구진의 풍부한 글로벌 임상시험 수행 경험으로 매력적인 지역으로 평가되고 있으며, 그에 따라 임상시험 수행의 증가, 국내 CRO 시장 확대로 이어지고 있습니다.
■ 생명공학 사업부문(유전체 사업)
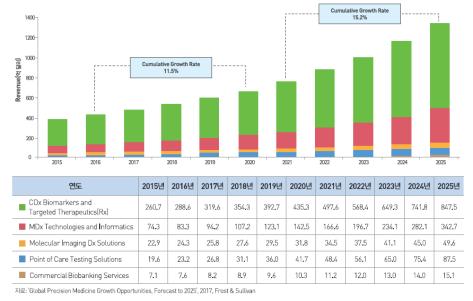
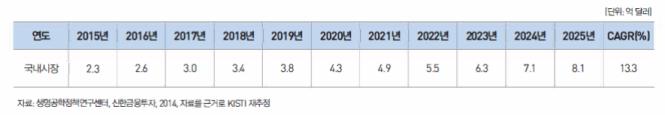
국가 단위의 유전체 분석 프로젝트가 다수 등장할 것으로 기대되며, 국내외 유전체 분석 기업의 영업이익이 늘어날 것으로 전망됩니다. 유전체 데이터 활용 플랫폼 사업이 본격화될 것으로 예상됩니다. 정밀의료 서비스는 유전체 정보, 진료 및 임상정보, 생활습관 정보등을 통합분석하여 환자 개인의 특성에 맞는 맞춤화된 의료서비스를 제공하는 것으로, 진료의 정확도를 높이고 치료 효과를 동시에 높여줄 수 있는 새로운 의료 패러다임입니다. 이러한 정밀의료 서비스의 실현을 위해서는 유전체 정보와 오믹스 기술 및 빅데이터 분석 기술 등이 필요합니다. 세계 정밀의료 서비스 시장은 2015년 384.5억 달러에서 연평균 13.3%로 성장해 2025년 1,322.4억 달러로 전망되며, 국내 정밀의료 서비스 시장은 2015년 2.3억 달러에서 2025년 8.1억 달러로 성장할 전망입니다.
 |
|
세계 정밀의료 서비스 시장 및 전망 |
 |
|
세계 주요 정밀의료 서비스 시장 규모 및 전망 |
 |
|
국내 정밀의료 서비스 시장 및 전망 |
■ 생명공학사업부문(콜드체인사업)
콜드체인 패키징은 바이오 분야에서 사용하고 있는 만큼 글로벌 Reference가 매우 중요한 요소 중에 하나입니다. 글로벌 임상 시험에서 사용되어 지고 있는지 혹은 매우 민감한 의약품 등의 운송에 얼마나 적용되어 사용되었는지 혹은 혹독한 외부 환경에서 안전하게 목표 온도를 유지하였는지에 대한 경험과 데이터 축적이 매우 중요한 진입장벽입니다. 하여 단시간에 시장을 확대하기는 어렵고 시장 선점 효과를 누릴 수 있는 시장입니다. 현재 당사의 콜드체인 패키징 사용에 대한 Reference는 글로벌 물류사인 FedEx, DHL. TNT, World Courier 등을 통하여 다년간 축적되어 왔으며, 신뢰할 수 있는 Qualification data를 고객에게 제공하여 신뢰성을 더욱 확보하고 있습니다.
2) 경쟁업체 현황
■ 신약개발 사업부문
국내 생동CRO 업체중 주요 경쟁업체로는 바이오인프라, PPC코리아(구 바이오썬텍) 및 한국의약연구소 등이 있으며, 2022년 12월 31일 기준 바이오코아와 바이오인프라, PPC코리아(구 바이오썬텍) 등 상위 5개사가 전체 시장의 89.3%를 점유하고 있습니다.
2022년 12월 31일 기준 생동시험계획 승인현황은 다음과 같습니다
|
회사명 |
2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
2021년 |
2022년 |
|
인바이츠바이오코아 |
48 |
40 |
28 |
42 |
60(13) |
72(20) |
49 |
|
바이오인프라 |
33 |
41 |
44 |
37 |
55(17) |
96(24) |
43 |
|
PPC코리아 |
42 |
35 |
38 |
32 |
44(15) |
82(12) |
27 |
|
한국의약연구소 |
10 |
27 |
15 |
41 |
30(5) |
71(12) |
25 |
|
DT&CRO |
- |
- |
2 |
42 |
26(7) |
46(19) |
21 |
|
엠바이오 |
- |
- |
- |
- |
- |
- |
30 |
|
프로메디스 |
6 |
10 |
17 |
17 |
20(3) |
21(1) |
17 |
|
그외 ( 기타 ) |
56 |
38 |
34 |
18 |
26 |
28(4) |
21 |
|
정보없음 |
- |
- |
- |
30 |
62 |
92 |
47 |
|
총계 |
195 |
191 |
178 |
259 |
323 |
508 |
280 |
■ 생명공학 사업부문(유전체사업)
정밀의료 서비스 관련 시장은 연구 방법에 따라 크게 3가지로 구분 할 수 있습니다. 핵심 정밀의료 서비스 시장 [Core Precision Med1c1ne Market)과 임상 및 원격 돌봄 요인[Clinical & Remote Care Factors) 시장, 생활 방식 및 외인성 요인 [Lifestyle and Exogenous Factors) 시장으로 나눠질 수 있으며 여기서는 핵심 정밀의료 서비스 시장을 대상으로 본 시장의 규모를 예측하고 전망했습니다. 핵심 정밀의료 서비스 시장은 동반진단 (CDx) 바이오마커와 표적치료 분야, 분자진단 (MDx) 기술과 NGS 분야, 현장진단 (POCT) 분야 액체 생검 (Liquid Biopsy) 및 기타 최신 기술 분야, 분자 영상 진단 분야, 임상 검체 및 바이오뱅킹 분야[Human Specimen and Imaging Biobanks Service and Tools) 등을 포함합니다. Frost & Sullivan의 정밀의료 서비스 시장 전망 보고서 (2017)에 따르면, 세계 정밀의료 서비스 시장은 2015년 384.5억 달러 규모로 추정되었으며, 이후 연평균 13.3%로 성장하여 2025년 1,322.4억 달러 규모로 성장할 것으로 전망됩니다.
주요 분류별 시장 규모를 살펴보면, 2015년 기준으로 CDx 바이오마커와 표적치료제 분야 (CDx Biomarkers and Targeted Therapeutics) 시장이 260.7억 달러 규모로 가장 큰 비중을 차지하고 있었으며, MDx 및 시퀀싱 분야 (MDx Technologies and Informatics) 시장이 74.3억 달러, 분자 영상진단 분야(Molecular Imaging Ox Solutions) 시장 22.9억 달려, POCT 분야 (Point of Care Testing Solutions) 시장 19.6억 달러, 바이오뱅킹 서비스 (Comme「cial Biobanking Services) 시장 7.1 억 달러 규모로 확인되었습니다.
2025년에는 Dx 바이오마커와 표적치료제 분야가 847.5억 달러로 가장 큰 비중을 차지할 것으로 예상되었으며, MDx 및 시퀀싱 분야 342.7억 달러, POCT 분야가 87.5억 달러, 분자영상진단 분야 49.6 억 달러 등의 순으로 확인되었다 국내시장의 경우, 정밀의료 서비스 시장의 규모를 직접적으로 보여 주는 자료가 미비하여 세계 유전체 분석 시장 대비 한국 시장의 비중을 확인하여 추정하였습니다.
생명공학정책연구센터 (글로벌 유전체 시장 자료)와 신한투자증권 (유전자관련 분석 서비스 시장) 자료를 근거로 2013년 기준 세계 시장 대비 국내 유전체 분석 시장이 약 0.6% 수준임을 확인하였으며, 이를 이용해 2015년 국내 정밀 의료 서비스 시장 규모를 추정하면 2.3억 달러 규모였습니다. 또한 세계 시장과 동일한 성장률[13.3%]을 적용하면 2025년 8.1 억 달러 규모로 성장할 것으로 예상됩니다.
■ 생명공학 사업부문(콜드체인사업)
콜드 체인 패키징에 대한 경쟁업체는 아래와 같습니다.
|
경쟁사 |
패키징 기술수준 |
국내 진출 유무 |
기타 |
|---|---|---|---|
|
Vaqtech |
상 |
국내 진출 |
가장 우수한 제품 성능 제공 |
|
PelicanBiothermal |
상 |
국내 진출 |
제품 편리성 강점으로 시장 점유 |
|
Inmark |
중 |
국내 진출 |
미국 중심으로 시장 점유 |
|
FMS 코리아 |
하 |
국내 업체 |
식품분야 강점 보유 |
|
TAPS인터내셔널 |
하 |
국내 업체 |
백신 포장재 강점 보유 |
3) 비교우위 사항
■ 신약개발 사업부문
① LC/MS/MS를 이용한 생체시료 중 약물의 극미량 분석방법 개발 기술을 보유하고 있으며 그 내용은 다음과 같습니다.
㉠ 수 pg/mL 농도까지 분석 가능한 고감도의 분석방법 개발
㉡ 전혈, 혈장, 뇨, 조직 등 다양한 생체시료 중에서 약물의 분석방법 개발기술
㉢ Chiral compound의 분리 기술
㉣ 생체시료 중에서 약물의 안정화를 개선하기 위한 분석방법 개발
㉤ 내인성 물질의 약물동태평가를 위한 분석방법 개발
㉥ 약물과 대사체의 동시정량 분석방법 개발
㉦ 400여 개의 제네릭 약물에 대해 개발 및 검증을 완료한 분석방법 보유
㉧ 국내 독보적인 NCE (New Chemical Entity)분석법 개발 기술
② 한국 최초의 GLP 인증 분석기관. 글로벌 기준에 적합한 Regulated Bioanalysis 분야에 있어 최고의 경험과 전문성, 노하우 보유하고 있으며, cGLP, OECD 및 ICH 규정 등 글로벌 기준에 적합한 시험진행과 관리, 문서 작성, 관련 SOP 개발 등의 노하우와 전문성 보유하고 있습니다. 지난 15년간 1,300여건 이상의 Regulated Bioanalytical studies를 수행하였고 국내 최대/최고 사양의 질량 분석기 시스템을 보유하고 있습니다.
③ 신약개발 과정 중 다양한 형태의 전임상, 임상시험을 지원하기 위한 분석시험의 경험 및 기술력을 보유하고 있으며 그 내용은 다음과 같습니다.
㉠ Clinical Pharmacokinetic studies
- Human Bioequivalence/Bioavailability Study
- Pharmacokinetic Drug-Drug interaction study
- Clinical Protein binding study
㉡ First in Human Clinical Trials
- Single Ascending Dose Trial (SAD) / Multiple Ascending Dose Trial (MAD)
- Microdosing study
㉢ New Product/Formulation Development Studies
㉣ New Fixed Dose Combination Studies
㉤ Healthy volunteers and patient populations
㉥ Preclinical PK, TK study
④ 대사체규명 및 AMS Study등의 국내 독보적인 기술 확보하고 있으며 그 내용은 다음과 같습니다.
㉠ Metabolite Identification
- Metabolic stability, Reactive/Toxic Metabolite screening
- Metabolite profiling 및 identification
- Pathway elucidation, Metabolic correlations
- Semi-quantification (Cold materials)
㉡ Plasma Protein Binding study
㉢ Total Service Package of AMS study
- Low 14C Human Mass Balance
- Absolute Bioavailability
- Phase 0 Human microdosing
- Metabolite Profiling
- Global Registration Packages
㉣ 국내 유일의 임상 시료 내 방사성 동위원소 분석 CRO
⑤ 특화된 임상 서비스 제공하고 있으며 그 내용은 다음과 같습니다.
㉠ Protocol Development (Korean, English)
- 초기임상 분야에 특화된 프로토콜 개발 기술 보유
- Study design development
㉡ 300 개 이상의 임상시험 프로토콜 보유
- BE, DDI, Food effect, SAD, MAD, 내약성 시험, Micro-dosing study 등
㉢ 1250 여건 이상의 임상시험 수행경험을 통해 project management, monitoring, clinical site
management 노하우 보유
㉣ 글로벌 임상시험 Project management 경험 보유
㉤ Innovative 임상시험 디자인과 수행 경험을 국내 최초로 보유
- C14-labelled compound, AMS분석기기를 이용한 Micro-dosing, Micro-tracer study
㉥ 국내 주요 제약회사를 포함한 90개 이상 회사를 클라이언트로 두고 있으며, 화이자. IQVIA, 인텔시어스 등 다국적 기업과 파트너십이 체결되어 있습니다.
㉦ 일부 국내 대형 제약사의 경우 글로벌 신약개발과 미국 FDA 승인을 위해서는 경험이 풍부한 해외
임상 CRO 및 FDA입증된 분석기관을 우선적으로 선정하여 진행하는 추세입니다. 하지만 대부분 국내 제약사의 경우, 해외 임상 CRO를 사용할 경우 비용의 과다 지출 및 원활한 Communication, 일정협의 등 불편이 발생하여, 국내 CRO에서 대행해 주기를 희망하는 추세이며 이와 같은 상황에서 당사는 국내 CRO 기능을 충실하게 수행하며 동시에 미국 내 임상 CRO와 MOU 체결을 목표로, 국내 제 약업체의 미국 내 진출을 원활하게 하는 역할로 업무범위를 확대하고 있습니다.
㉧ 해외로 진출하는 분석의 경우에도 한국 식약처의 실사를 통과하여 승인된 국내 1 위의 분석기관인 동
사의 신뢰를 바탕으로, 해외 신약을 위한 국내 제약사와의 파트너로서 미국 FDA 승인을 위한 분석
실사 서비스 제공이 가능합니다.
⑥ 다음의 영역에 대해 의약품품질관리서비스를 제공하고 있습니다.
㉠ 비교용출시험
㉡ ICP-MS, GC-MS, LC-MSfmf 이용한 의약품 불순물시험
㉢ 다양한 조건에서의 의약품 안정성시험
㉣ 미생물 시험
㉤ 그 외 의약품 품질관리 전반
■ 생명공학 사업부문
① 유전체분석사업
기술의 완성도
당사는 '생애주기별 맞춤형 유전체 검사 서비스'를 위한 '분자진단 효율성 증대 기술'을 보유하고 있습니다. 해당 기술을 구현하기 위한 세부 기술로 다기능성 프로브 설계 및 유전자 검출 기술, 표적유전자 검출신호의 선택적 증강 및 배경신호 감소 기술, 극소량 세포 유리 DNA(cell-free DNA; cfDNA)의 집적 기술, 디지털 PCR 활용 산전진단 기술, 단일형광 PCR 다중신호 측정기술을 보유하고 있고, 가장 최신의 '분자진단 효율성 증대 기술'이 집적된 NITS 분자진단 키트 관련 특허를 출원 중에 있으며, 해당 특허 외 다수의 관련 특허 확보를 통해 기술장벽을 구축 중에 있습니다. 또한 유전자 증폭을 위한 프라이머 및 프로브 디자인(설계)부터 이를 활용한 제품의 효율 향상, 키트 제조까지 전반적 기술 구현 가능해 높은 수준의 기술완성도를 갖추고 있습니다.
기술의 경쟁우위도
당사는 획득한 유전자 증폭에 사용되는 프라이머(유전자 증폭의 개시점)를 프로브(목표 유전자의 존재를 확인하기 위한 탐침) 역할도 수행 가능한 다기능성으로 설계하였으며, 임산부의 혈장 내 극미량 존재하는 태아 세포 유리 DNA를 size selection(크기 선별 방법)으로 집적하였습니다. 또한 단일 형광 채널에서 대조구로 사용되는 2가지 유전자 신호를 동시 측정가능하도록 PCR(중합효소연쇄반응: 유전자 증폭 반응)에 사용되는 oligonucleotide set를 설계 하여 효율과 정확도를 향상시켰으며, NITS 제품의 분석 장비로 활용하는 디지털 PCR은 일반 PCR 대비 다수의 분석이 가능하다는 장점에도 불구하고, 고가의 분석비용으로 상용화가 미미한 것으로 파악되지만 상기 언급된 바와 같은 진단 제품 설계로 디지털 PCR의 효율향상을 꾀하여, 디지털 PCR의 시장 상용화 가능성을 제시할 수 있습니다.
기술제품의 경쟁력
당사의 핵심기술을 기반으로 한 분자진단 키트는 기술개발과 상용화를 통해 다수의 KFDA(한국 식품의약품안전처) 허가 제품을 보유하고 있고, 유전자 증폭을 위한 프라이머 및 프로브 디자인(설계)부터 이를 활용한 제품의 효율 향상, 키트 제조까지 전반적 기술 구현 가능해 일정 수준 이상의 기술력을 보유하고 있으므로, 따라서 현재 개발 중인 NITS와 같은 신제품 상용화를 통해 유전체분석 시장에서의 점유율을 상승시킬 수 있으며, 당사의 기술은 분석 효율 향상이 가능할 뿐 아니라, 기술 변화에 유연성 있게 대처가 가능합니다.
② 수탁검사사업
중앙검사센터는 국내세포유전 교육기관으로써, 해당 세포 유전 검사실은 국내 최초로 CAP inspection 인증을 받은 바 있습니다, 국내 정도 관리, 진단유전학, 분과의 우수한 질 관리를 인정받아 referee 기관(국내 4개 기관)으로 선정되었으며, 2008년부터 국내 세포유전 정도관리표준화를 위하여 전국 세포유전 실무자를 대상으로 연 2회 워크샵을 주최하여 많은 정보 공유와 교육의 기회를 제공하고 있습니다. 당사 중앙검사센터에서는 이러한 인증 및 교육 등을 직접 목격하고 겪은 숙련자를 다수 보유하고 있다는 것이 또 다른 장점입니다. 두터운 숙련자는 업무 수행에 있어 기존의 골드 스탠다드로 사용하는 검사방법을 매우 정확하게 파악하고 있는 것은 물론, 최신 관련 기술들까지도 파악하고 있습니다. 또한 상황에 따라 알맞은 기술 및 노하우 적용을 적시적소에 함에 따라 불필요한 시간 및 자원 낭비를 할 가능성이 매우 낮습니다. 이에 상황에 맞는 업무 수행을 할 수 있으며, 이는 원가 절감 효과 및 최신 연구용검사 신규검사 셋업을 용이하게 하는 효과를 일으키고 있습니다.
③ 콜드체인사업
콜드체인유통의 주요 상품을 공급하고 있는 인텔시어스 제품에 대한 비교우위는 먼저 ISTA(International Safety Transit Association) 국제안전수송협회 글로벌 인증기업으로 대외 신뢰도를 갖춘 제품을 공급하고 있습니다. UN인증을 획득한 특수 제품의 경우는 인간이나 동물에게 전염될 수 있는 감염성 물질을 국제 운송 규정에 적합하게 운송할 수 있는 장점을 가지고 있습니다. 또한 전 제품에 대한 Qualification report를 제공하여 사용자에게 상품에 대한 사전 서류적 평가를 제공할 수 있는 특징이 있습니다. 또한 콜드 체인 패키징의 온도 유지 성능은 2~8도 조건으로 최대 168시간까지 온도유지가 가능하여 차별적 우위를 선점하고 있습니다. 시장에서 요구하는 콜드 체인 패키징 조건은 먼저 여러 온도 범위에 적용이 가능한지와 다양한 사이즈의 물품을 적재할 수 있는지의 여부가 중요한 요소입니다. 청구회사에서 공급하고 있는 콜들 체인 패키징은 2~8도, 15~25도, 20~24도, -76도 총 4개 온도 범위에 대한 상품을 공급하고 있으며 1ml vial부터 최대 pallet 단위까지의 다양한 규격의 샘플, 혈액, 시약, 약품 등을 안전하게 운송할 수 있는 포장재를 공급하고 있습니다.
다) 자원조달상황
회사의 원재료는 CRO 용역 및 진단키트 등에 사용되는 각종 시약 등을 의미합니다. 현재까지 원재료는 국내 생산 또는 국내 대리점을 통해 직접적으로 구매하여 사용을 하고 있으며, 고정 거래처가 대부분입니다. 회사가 시험하는 시험의 유형 및 종류, 성격에 따라 회사가 지정하는 시험재료에 따라 가격의 차이는 있으나, 시험재료 및 원재료의 가격변동은 거의 없습니다.
회사에서 인건비가 차지하는 원가 비중은 타 산업에 비해 다소 높습니다. 이것은 연구개발 서비스산업적인 특성에 의해 연구직의 비중이 높기 때문입니다. 석·박사 중심의 연구직 구성으로 인해 인건비의 원가 비중이 높은 특성이 있습니다. 또한 CRO 시장의 업체수가 작아 기본적인 수급 기반이 취약하여 유경험 인력 수급이 원활치 않은 문제점이 있으나, 최근에는 분야별 전문 인력의 수급이 서서히 개선되는 등 노동력 수급 상황도 대체로 안정적인 궤도에 올랐다는 평가를 받고 있어 인력, 자금 등과 관련된 자원조달 상에 어려움은 크지 않을 것으로 예상됩니다.
라) 시장점유율
CRO 용역 및 유전체진단 시장은 아직까지 공신력 있는 외부기관에서 발행되는 업계통계자료가 존재하지 않습니다. 다만, 국내 생동CRO 업체 중 주요 경쟁업체로는 바이오인프라, PPC코리아, 및 한국의약연구소 등이 있으며 바이오코아와 바이오인프라, PPC코리아 등 상위 5개사가 국내 생동성 시험시장의 89.3%(총 생동시험계획서 승인 건수 508건중 454건)이상을 점유하고 있습니다.
유전체분석을 영위하는 회사는 당사를 포함하여 씨젠, 마크로젠, 테라젠이텍스, 디엔에이링크 등이 있습니다. 신뢰할 수 있는 시장점유율 통계는 보고된 바 없어 자료가 존재하지 않습니다.
마) 주요 제품 등 관련 각종 산업표준
■ 신약개발사업부문
신약개발 사업부문의 의약품품질관리사업 및 임상시험검체분석기관으로써의 CRO 사업은 생물학적 동등성시험 및 임상시험실시기관 운용의 실효성을 높이기 위해 약사법의 적용을 받아 임상시험검체분석기관으로 지정을 받아야 수탁업무를 수행할 수 있습니다. 기관 지정을 위해서는 인력·장비·기자재·시설 현황, 표준작업지침서 등을 식약처에 제출해야 하며 실태조사를 받아야 합니다.
식품의약품안전처는 최근 생동성시험이 임상시험의 한 부분임을 명확하게 정의하고, 인체대상 시험임에도 별도 체계로 관리돼 온 생동성시험계획 승인, 생동성시험기관 지정 등을 임상시험관리기준에 흡수 통합한다는 취지로 약사법 개정을 완료하였습니다.
'의약품 등의 안전에 관한 규칙'과 '의약품동등성시험기준'이 개정되고 2017년 4월 29일부터는 본격적으로 모든 제네릭의약품의 생동성시험이 신약의 임상시험과 동일한GCP 기준에 따라 실시해야 하며 모든 문서의 양식도 국제공통기술문서(CTD, Common Technical Documentation) 양식으로 작성하여 제출해야 하는 것이 의무화 되었습니다.
■ 생명공학 사업부문
회사는 현재 진단키트 생산 및 제조관련 ISO13485 인증과 유전자검사를 위한 유전자검사기관을 보유하고 있습니다. 현재까지는 제품의 판매보다는 병원 및 국가기관의 연구과제 위주로 매출이 발생됨에 따라 추가적인 인증은 선택사항이었습니다.
회사가 현재 진입하려고 하는 헬스케어 분야는 보건복지부의 유전자검사기관, 유전자연구기관 신고필증을 교부받아야 하며, 사단법인 유전자검사평가원이 시행하는 연 2회 정도의 관리를 별도로 수검하여 등급을 받도록 되어 있습니다.
분자진단제품은 기본적으로 체외진단 시약 또는 의료기기로 분류되며 식약청에서는 품목별 등급을 1~4등급(유전자키트는 3등급)으로 분류하고 있습니다. 이에 따라 인허가 심사에 대한 요건 및 절차가 결정되며 허가심사 가이드라인에 따라 안전성과 유효성 심사 및 임상시험 자료 제출 등을 통해 최종 인허가를 받도록 되어 있습니다. 국내에서는 진단제품의 식약처 인허가 이후에도 진단용으로 사용하기 위해서는 심평원의 신의료기술 행위 신청 및 허가 과정이 추가로 필요합니다.
(4) 신규사업 등의 내용 및 전망
"해당사항 없음'
(5) 조직도
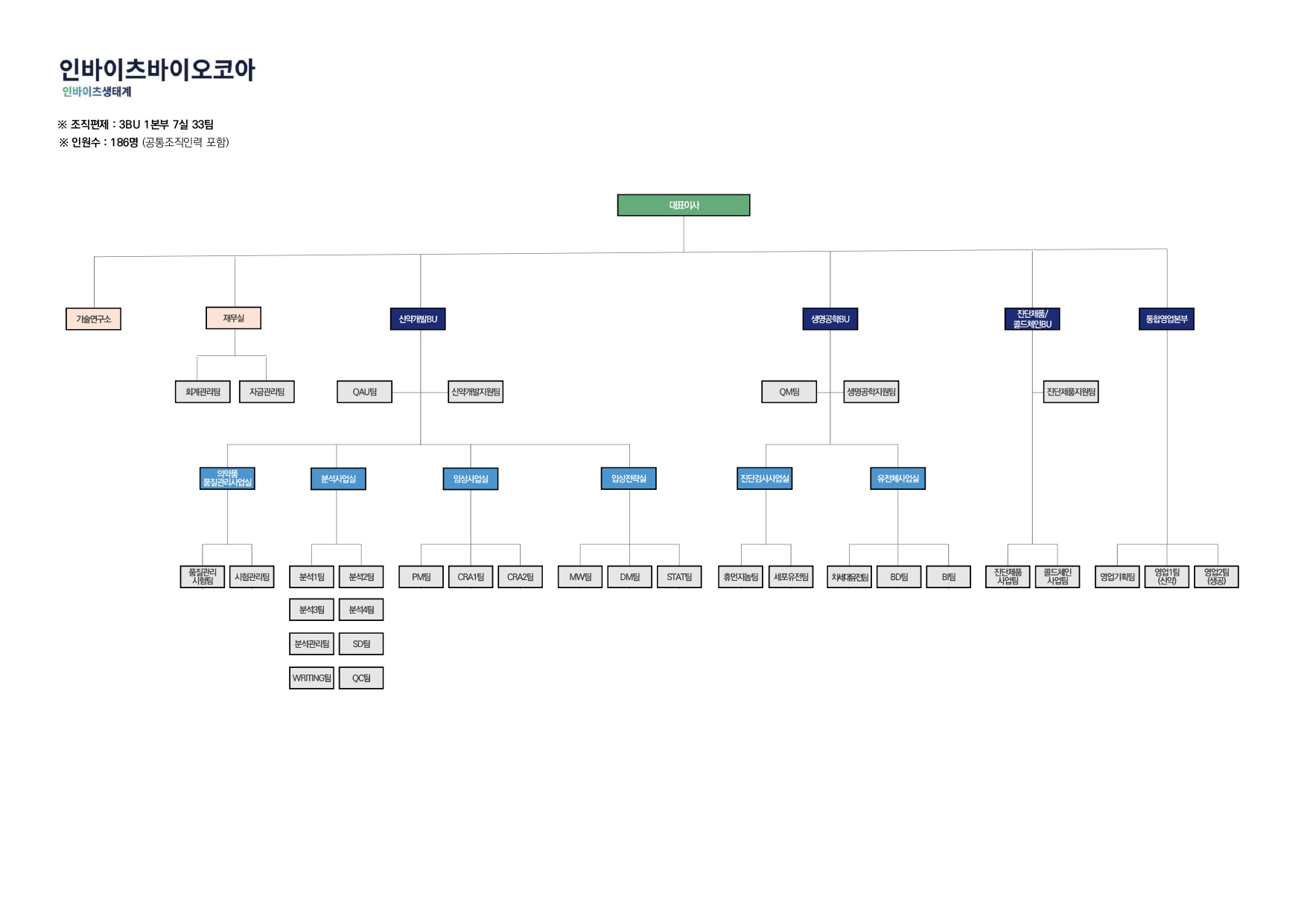 |
|
조직도(23.12.05)_page-0001 |
2. 주주총회 목적사항별 기재사항
□ 기타 주주총회의 목적사항
가. 의안 제목
자본잉여금의 이익잉여금 전환 승인의 건
나. 의안의 요지
인바이츠바이오코아 주식회사에 적립된 자본준비금 및 이익준비금의 총액이 자본금의 1.5배인 5,783,486,250원(2022년 기말 기준)을 초과하므로, 초과한 금액 범위 내에서 회사의 자본준비금인 주식발행초과금 중 일부를 이익잉여금으로 전환하고, 주주가치 제고를 위한 배당가능이익 등의 재원으로 활용하고자 하는 내용입니다.
다. 전환금액 : 금 12,000,000,000원
| 자본준비금 | 전환금액 |
|---|---|
| 18,116,459,592원 | 12,000,000,000원 |
라. 법적근거
상법 제461조의2(준비금의 감소)
IV. 사업보고서 및 감사보고서 첨부
가. 제출 개요
| 제출(예정)일 | 사업보고서 등 통지 등 방식 |
|---|---|
| - | - |
나. 사업보고서 및 감사보고서 첨부
- 당사는 12월 결산 법인으로 제22기 사업보고서 및 감사보고서가 전자공시시스템(http://dart.fss.or.kr)에 공시되어 있습니다.
※ 참고사항
|
▶ 전자투표에 관한 사항 |