 |
|
대표이사 등의 확인서 |
분 기 보 고 서
(제 27 기 3분기)
| 사업연도 | 2023년 01월 01일 | 부터 |
| 2023년 09월 30일 | 까지 |
| 금융위원회 | |
| 한국거래소 귀중 | 2023 년 11 월 14 일 |
| 제출대상법인 유형 : | 주권상장법인 |
| 면제사유발생 : | 해당사항 없음 |
| 회 사 명 : | 선바이오 주식회사 |
| 대 표 이 사 : | 노 광 |
| 본 점 소 재 지 : | 경기도 군포시 산본로 95 |
| (전 화) 031-423-5467 | |
| (홈페이지) http://www.sunbio.com | |
| 작 성 책 임 자 : | (직 책) 이사 (성 명) 안응호 |
| (전 화) 031-423-5467 | |
【 대표이사 등의 확인 】
 |
|
대표이사 등의 확인서 |
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 개황
1. 연결대상 종속회사 현황(요약)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | - | - | - | - | - |
| 합계 | - | - | - | - | - |
| ※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조 |
1-1. 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
나. 회사의 법적, 상업적 명칭
당사의 명칭은 선바이오 주식회사라 칭하고, 영문명으로는 SunBio,Inc.라 표기합니다. 단, 약식으로 표기할 경우에는 선바이오(주)라고 표기합니다.
다. 설립일자 및 존속기간
당사는 1997년 7월 설립되어 현재까지 사업을 영위하고 있습니다.
라. 본사의 주소, 전화번호, 홈페이지 주소
| 구분 | 내용 |
|---|---|
| 본사주소 | 경기도 군포시 산본로 95 |
| 전화번호 | 031-423-5467 |
| 홈페이지 | http://www.sunbio.com |
마. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
바. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)여부 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 등 여부 |
특례상장 등 적용법규 |
|---|---|---|---|
| 코스닥시장 상장 | 2022년 10월 05일 | 기술성장기업의 코스닥시장 상장 |
코스닥시장 상장규정 제2조제31항제2호에 따른 기술성장기업 |
사. 주요 사업의 내용
당사의 사업영역은 바이오신약, 의료기기 및 PEG 유도체의 연구개발 및 생산판매 입니다. 기반 기술은 특화된 PEGylation 기술이며, 이를 활용하여 다수의 바이오신약, 바이오시밀러 의약품, 의료기기 등을 제품화 하고 있습니다. 당사의 기술은 다수의 특허등록에 기반하고, 다수의 해외 업체에게 기술이전 된 바 있으며, 다수의 바이오시밀러, 바이오신약, 의료기기 후보물질들이 현재 개발 또는임상을 진행 중이거나 판매 중 입니다. 당사가 개발하고 Intas Pharma사에 기술이전 한 Pegfilgrastim 바이오시밀러는암 환자용 호중구감소증 치료제이며 세계적으로 5조원의 시장을 형성하고 있습니다. 당사의 Pegfilgrastim 바이오시밀러는 Pelgraz라는 상품명으로 2018년부터 EU 시장에서, 또한 Lapelga라는 상품명으로 2019년부터 Canada에서, NeuPEG라는 상품명으로 2008년부터 인도에서 판매 중입니다.
당사가 개발한 구강건조증치료제 MucoPEG은 2019년 11월 미국 FDA의 미국 판매허가를 득 하였습니다. 당사가 개발 중인 바이오의약품은 인공혈액, 뇌졸중응급처치제, 신부전증 빈혈치료제 등이 있습니다. 당사는 또한 PEGylation 기술의 주요한 원자재인 PEG 유도체의 생산 및 판매를 사업화 하였으며, EU EMA가 인증한 GMP 생산 시설을 갖추었습니다. 주요 사업과 관련한 자세한 사항은 『Ⅱ. 사업의 내용』 부분을 참고해주시기 바랍니다.
당사의 정관에 기재된 목적사업은 다음과 같습니다.
|
목 적 사 업 |
비 고 |
|---|---|
|
1. 의약품 및 의료기기의 연구개발 생산 및 판매 2. 의약품, 건강보조식품, 진단용시약 등의 수출입 및 판매 3. 유기화합물, 의약품중간체, 의약품원료물질 합성생산, 판매 4. 전 각호에 부대되는 사업 |
회사가 |
|
1. 의약품 및 의료기기 개발관련 임상시험 컨설팅 및 위탁 사업 2. 의료정보 수집 및 제공, 병원 및 치료방법 의뢰사업 3. 의료정보통신망 개발 및 관련 소프트웨어개발, 판매사업 4. 의료정보, 의약품개발정보, 의약품 수입수출판매 등에 관한 컨설팅 5. 부동산임대업 6. 화장품 제조 및 판매 8. 2차전지 및 연료전지의 전고체 전해질 소재의 제조 및 판매 사업 |
회사가 영위하지 않는 사업 |
아. 계열회사 총수, 주요 계열회사의 명칭 및 상장여부
당사는 보고서 제출일 현재 해당사항이 없습니다.
자. 신용평가에 관한 사항
당사는 보고서 제출일 현재 해당사항이 없습니다.
2. 회사의 연혁
가. 회사의 연혁
| 구 분 | 내 역 | |
|---|---|---|
| 1996년 | 8월 | 한국 및 미국 특허출원 8건 (뇌졸중치료제, 항암활성제, 인공혈액, 패혈증치료제) |
| 1997년 | 6월 | 선바이오(주) 설립 (총자본금 7억 5천만원, 국민창투 1/3) |
| 1998년 | 6월 | PEG유도체 자체개발 성공 |
| 1998년 | 8월 | 선바이오(주) 연구소 설립 |
| 1998년 | 12월 | 한국 및 미국 특허출원 10건 (PEG유도체 수건, LIPOSOME, PEG-LIPOSOME) |
| 1999년 | 1월 | PEG-SHOP 개설 |
| 1999년 | 2월 | 특허등록 (항암활성제) |
| 1999년 | 5월 | 벤처기업으로 등록 |
| 1999년 | 12월 | 뇌졸중치료제, 항암활성제의 전임상 독성시험 (급독성시험, 약리시험, 항원성시험)완료 |
| 2000년 | 2월 | 자본금 증자 (총자본금 14억, 이수화학(주) 지분참여) |
| 2000년 | 9월 | 자본금 증자 (총자본금 15억) |
| 사옥구입 이전 및 연구소 확장 | ||
| 10월 | 뇌졸중 치료제/인공혈액 영국에서 전임상시험 시작 | |
| 11월 | 한국특허등록 (뇌졸중치료제) | |
| 12월 | 자본금 증자 (총자본금 15억 5천만원) | |
| 2001년 | 3월 | 자본금 증자 (총자본금 15억 6천만원) |
| 5월 | sunbio.com의 인터넷주소 매입 | |
| 5억원 규모의 선바이오 전환사채를 금창창투가 인수 및 주식전환 | ||
| 6월 | 6억원 규모의 선바이오 전환사채를 기업은행이 인수함 | |
| 자본금 증자 (총자본금 16억) | ||
| 11월 | Biogen사와 신약개발 공동추진 | |
| 2002년 | 1월 | BioVectra사와 생체고분자 북미지역 마케팅 계약체결 |
| Amgen사와 신약개발 공동추진 | ||
| 자본금 증자 (총자본금 18억 6천만원) | ||
| 2003년 | 11월 | 미국특허 (#6,828,401 PEG-maleimide 제조방법)등록 |
| 인도의 INTAS PHARMA사와 PEG-GCSF, PEG-IFN 공동개발 (당사의 기술수출) | ||
| 2004년 | 6월 | 한국특허 (hexa-arm PEG 제조방법) 등록 |
| 한국특허 (PEG-EPO 제조방법) 등록 | ||
| 한국특허 (PEG-interferon GCSF 제조방법) 등록 | ||
| 한국특허 (PEG-interferon beta 제조방법) 등록 | ||
| 한국특허 (PEG-interferon alpha 제조방법) 등록 | ||
| 인도의 Serum Institute of India와 PEG-GCSF, PEG-IFN, PEG-EPO 공동개발. (당사의 기술수출) | ||
| 2005년 | 4월 | 한국특허 (PEG-propionaldehyde 제조방법) 등록 |
| 5월 | 미국특허 (#6,858,736 hexa-arm PEG 제조방법) 등록 | |
| 10월 | 미국특허 (#6,956,135, PEG-aldehyde 제조방법) 등록 | |
| 미국특허 (#6,916,962, PEG-aldehyde 제조방법) 등록 | ||
| 미국의 BioSite 사와 공급 및 기술계약 | ||
| 11월 | 미국의 CytImmun Sciences사와 공급 및 기술계약 | |
| 2006년 | 4월 | 미국의 Cartilix사와 공급 및 기술계약 |
| 미국특허 (#7,257,845, PEG-aldehyde 제조방법) 등록 | ||
| 미국특허 (#7,041,855, PEG-aldehyde 제조방법) 등록 | ||
| 2007년 | 9월 | NEUPEG (선바이오 신약1호)이 인도 및 세계시장에서 출시 |
| 한국특허(모발페길레이션기술) 등록 | ||
| 2012년 | 12월 | 한국특허 (구강건조 치료제 기술) 출원 |
| 2014년 | 4월 | NEUPEG (PEG-GCSF) EU에서의 임상완료 |
| 6월 | NEUPEG (PEG-GCSF) 미국에서의 임상완료 | |
| 7월 | PEG-인터페론 (C형 간염체료제) 인도에서의 제품승인 | |
| 12월 | NEUPEG의 미국 FDA filing 완료 | |
| 2015년 | 3월 | 대우스팩2호와 스팩합병 IPO심사 청구 (5월 철회) |
| 6월 | 한국특허 (구강건조증 치료제 기술) 등록 | |
| 6월 | SL인베스트먼트로 부터 전환상환 우선주 5만주(주당4만원)발행 -12월 보통주로 전환 | |
| 8월 | 한국투자파트너스로 부터 전환상환 우선주 5만주(주당4만원) 발행-12월 보통주로 전환 | |
| 10월 | 코스닥 IPO청구 (11월 보호예수동의 문제로철회) | |
| 12월 | 자본금 100% 무상증자 (총자본금 38억) | |
| 12월 | 코넥스 상장 신청서 (보고서) 제출 - 2016년 1월 22일 코넥스 상장 | |
| 2016년 | 1월 | 코넥스 상장 |
| 3월 | 주식매수선택권 부여 (보통주식 100,000주) | |
| 7월 | 한국특허 (폴리에틸렌글리콜 수화젤 주사제) 등록 | |
| 8월 | 주식매수선택권 부여 (보통주식 25,000천주) | |
| 10월 | 본점 소재지 이전 (경기도 군포시 산본로 95) | |
| 11월 | 코스닥 IPO청구 (미승인 결정) | |
| 2017년 | 2월 | 지정자문인 및 유동성 공급계약 변경 (하나금융투자) |
| 3월 | 주식매수선택권 부여 (보통주식 68,500주) | |
| 4월 | 자기주식처분 (400주, 소재불명 원소유주에게 반환) | |
| 10월 | Intas사 pegfilgrastim 바이오시밀러를 EMA에 MAA 파일링 | |
| 2018년 | 3월 | 주식매수선택권 부여 (보통주식 10,000주) |
| 4월 | Apotex사의 Lapelga, Health Canada의 승인 취득 | |
| 9월 | PELGRAZ (Pegfilgrastim)의 EU 승인 승인 취득 | |
| 2019년 | 1월 | 선바이오-팬젠 바이오베터 의약품 공동개발 협약 |
| 2월 | Apobiologix가 LapelgaTM를 캐나다에서 launching | |
| 3월 | 주식매수선택권 부여 (보통주식 35,000주) | |
| 4월 | 주식매수선택권 19,600주 행사 (총자본금 38억) | |
| 6월 | 2019 필라델피아 BIO USA 박람회참가 | |
| 8월 | Apotex사의 Lapelga, 호주 TGA의 승인 취득 | |
| 11월 | 구강건조증치료제 MucoPEG 미국 FDA 판매허가 획득 | |
| 12월 | MucoPEG - 아일랜드 더블린 소재 Meroven사와 MOU체결 | |
| 2020년 | 1월 | MucoPEG - MENA 지역 판매 |
| 6월 | 인공혈액 미국특허 출원 (Novel Modified Hemoglobin as Blood Substitute / 출원번호: 63/044,579) | |
| 10월 | 차세대 페길레이션 기술 미국 특허 취득 (3차 알콕시 폴리에틸렌 글리콜 및 이의 유도체 (TERTIARY ALKOXY POLYETHYLENE GLYCOL AND DERIVATIVESTHEREOF)) | |
| 12월 | 구강건조증치료제 MucoPEG의 Post-approval 미국 임상시험 시작 | |
| 12월 | MucoPEG 기술이전 계약 체결 (중국) | |
| 12월 | BioSciences사와 MOU 체결 (Pegfilgrastim개발) | |
| 2021년 | 1월 | 1주당 0.5주의 비율로 무상증자 |
| 4월 | 주식매수선택권 45,870주 행사 | |
| 6월 | 전환사채 135,135주 전환권 행사 (총자본금 58억) | |
| 10월 | 제2공장 신축을 위한 토지매입 계약체결 (인천광역시 남동구 소재) | |
| 10월 | 코스닥시장 이전상장을 위한 상장예비심사청구서 제출 | |
| 2022년 | 6월 | 코스닥시장 이전상장을 위한 상장예비심사 승인 |
| 9월 | 코스닥시장 이전상장 일반공모 (총자본금 61억) | |
| 10월 | 코스닥시장 이전상장 | |
| 2023년 | 5월 | 이차전지 |
| 주1) | 2017년 4월 원소유주에게 반환한 자기주식 400주는 2002년 한국예탁결제원과 명의개서대리인 계약 체결 후 업무를 진행하는 과정에서 서류를 제출하지 않은 1인 주주의 주권에 대하여 한국예탁결제원에서 회사 명의의 계좌에 주권 입고 후 향후 확인되는 경우 주식을 교부하도록 처리를 요구하여 발생하였습니다. 해당 주식을 자기주식으로 보유하던 중 2017년 4월 소유주가 당사로 연락을 하였기에 적절한 절차를 거쳐 해당 주식을 소유주에게 반환하였습니다. |
나. 회사의 본점소재지 및 그 변경
당사의 설립 후 본점소재지의 변경내역은 다음과 같습니다.
|
일 자 |
내 용 |
|---|---|
|
1997.06 |
설립 (서울시 강남구 개포동 13-3) |
|
2000.10 |
본점 이전 (경기도 안양시 동안구 벌말로 42) |
|
2016.10 |
본점 이전 (경기도 군포시 산본로 95 (당정동)) |
다. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2021년 03월 29일 | 정기주총 | 사내이사 안응호 사내이사 이성훈 |
감사 정유근 | 2024.03.29 임기만료 |
| 2021년 06월 15일 | 임시주총 | - | 대표이사, 사내이사 노광 |
2024.07.15 임기만료 |
| 2022년 03월 28일 | 정기주총 | - | 사외이사 주우식 | 2025.03.28 임기만료 |
3. 자본금 변동사항
가. 자본금 변동추이
| (단위 : 원, 주) |
| 종류 | 구분 | 제27기 (2023년 3분기말) |
제26기 (2022년말) |
제25기 (2021년말) |
|---|---|---|---|---|
| 보통주 | 발행주식총수 | 12,313,555 | 12,313,555 | 11,682,816 |
| 액면금액 | 500 | 500 | 500 | |
| 자본금 | 6,156,777,500 | 6,156,777,500 | 5,841,408,000 | |
| 우선주 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 기타 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 합계 | 자본금 | 6,156,777,500 | 6,156,777,500 | 5,841,408,000 |
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 50,000,000 | - | 50,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 12,313,555 | - | 12,313,555 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | - | - | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | - | - | - | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 12,313,555 | - | 12,313,555 | - | |
| Ⅴ. 자기주식수 | 8,222 | - | 8,222 | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 12,305,333 | - | 12,305,333 | - | |
나. 자기주식 취득 및 처분 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주) |
| 취득방법 | 주식의 종류 | 기초수량 | 변동 수량 | 기말수량 | 비고 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 취득(+) | 처분(-) | 소각(-) | |||||||
| 배당 가능 이익 범위 이내 취득 |
직접 취득 |
장내 직접 취득 |
보통주 | - | - | - | - | - | - |
| 우선주 | - | - | - | - | - | - | |||
| 장외 직접 취득 |
보통주 | - | - | - | - | - | - | ||
| 우선주 | - | - | - | - | - | - | |||
| 공개매수 | 보통주 | - | - | - | - | - | - | ||
| 우선주 | - | - | - | - | - | - | |||
| 소계(a) | 보통주 | - | - | - | - | - | - | ||
| 우선주 | - | - | - | - | - | - | |||
| 신탁 계약에 의한 취득 |
수탁자 보유물량 | 보통주 | - | - | - | - | - | - | |
| 우선주 | - | - | - | - | - | - | |||
| 현물보유물량 | 보통주 | 7,997 | - | - | - | 7,997 | - | ||
| 우선주 | - | - | - | - | - | - | |||
| 소계(b) | 보통주 | - | - | - | - | - | - | ||
| 우선주 | - | - | - | - | - | - | |||
| 기타 취득(c) | 보통주 | 225 | - | - | - | 225 | - | ||
| 우선주 | - | - | - | - | - | - | |||
| 총 계(a+b+c) | 보통주 | 8,222 | - | - | - | 8,222 | - | ||
| 우선주 | - | - | - | - | - | - | |||
| 주1) | 당사는 2016년 1월 한국거래소 코넥스시장 상장 이후 주가 안정을 위하여 당시 주관사였던 미래에셋증권(주)(구: 대우증권(주))와 2016년 3월 자기주식취득신탁계약을 체결하였습니다. 해당 계약 및 상법 등 관련 법령에 따라 아래 표와 같이 코넥스시장에서 자기주식 7,997주를 취득하였습니다. |
| 주2) | 기타취득의 225주는 2021년 01월 08일 무상증자로 인한 단수주 취득분 입니다. |
5. 정관에 관한 사항
가. 정관 변경 이력
당사의 최근 정관 개정일은 2023년 05월 26일 입니다.
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2023년 05월 26일 | 제27기 임시주주총회 | 제2조(목적) | 사업목적의 다각화 |
나. 사업목적 현황
| 구 분 | 사업목적 | 사업영위 여부 |
|---|---|---|
| 1 | 의약품 및 의료기기의 연구개발 생산 및 판매 | 영위 |
| 2 | 의약품 및 의료기기 개발관련 임상시험 컨설팅 및 위탁 사업 | 미영위 |
| 3 | 의료정보 수집 및 제공, 병원 및 치료방법 의뢰사업 | 미영위 |
| 4 | 의료정보통신망 개발 및 관련 소프트웨어개발, 판매사업 | 미영위 |
| 5 | 의료정보, 의약품개발정보, 의약품 수입수출판매 등에 관한 컨설팅 | 미영위 |
| 6 | 의약품, 건강보조식품, 진단용시약 등의 수출입 및 판매 | 영위 |
| 7 | 유기화합물, 의약품중간체, 의약품원료물질 합성생산, 판매 | 영위 |
| 8 | 부동산임대업 | 미영위 |
| 9 | 화장품 제조 및 판매 | 미영위 |
| 10 | 2차전지 및 연료전지의 전고체 전해질 소재의 기술개발 및 기술이전 사업 | 영위 |
| 11 | 2차전지 및 연료전지의 전고체 전해질 소재의 제조 및 판매 사업 | 미영위 |
| 12 | 전 각호에 부대되는 사업 | 영위 |
다. 사업목적 변경 내용
| 구분 | 변경일 | 사업목적 | |
|---|---|---|---|
| 변경 전 | 변경 후 | ||
| 추가 | 2023.05.26 | - | 10. 2차전지 및 연료전지의 전고체 전해질 소재의 기술개발 및 기술이전 사업 |
| 추가 | 2023.05.26 | - | 11. 2차전지 및 연료전지의 전고체 전해질 소재의 제조 및 판매 사업 |
| 수정 | 2023.05.26 | 10. 전 각호에 부대되는 사업 | 12. 전 각호에 부대되는 사업 |
라. 변경 사유
(1) 변경 취지 및 목적 및 필요성
1) 변경 취지 및 목적
당사는 2023년 5월 임시주주총회를 개최하여 사업목적을 추가하였습니다. 추가된 사업목적은 이차전지 고체전해질의 연구개발 및 관련 PEG 소재의 생산판매입니다.
2) 필요성
당사는 매출의 60% 이상이 PEG (폴리에틸렌글리콜 고분자) 소재의 판매에서 발생하고 있습니다. 당사의 기반기술인 PEGylation 기술은 PEG를 의약품과 결합시켜 향상된 약리작용을 얻는 것이며, 이 기술을 이용한 PEG-의약품은 20여개 품목이 세계시장에 출시되어 있으며, 당사도 자체개발한 PEG-filgrastim (호중구감소증 치료제), PEG-interferon alpha (C형간염 치료제, MucoPEG (구강건조증 치료제) 등 3 품목을 승인받은 바 있습니다.
당사의 실적은 PEG 소재 판매실적과 긴밀히 연결되어 있으며, 따라서 당사는 항상 PEG 신소재의 개발에 투자 및 연구를 지속하고 있습니다. 이러한 배경 하에 당사는 새로운 수익창출 기회로서 폴리머, 특히 PEG를 이용한 전고체 전해질의 개발가능성을 확인하였고, 이에 사업목적 변경을 추진하게 되었습니다.
(2) 사업목적 변경 제안 주체
해당 사업은 당사의 기반기술인 PEGylation 기술과 밀접해 있으며, 해당 분야의 전문성을 기반으로 기술 노하우를 보유하고 있는 최대주주(노광 대표이사)의 제안으로 이사회 결의 후 임시주주총회에서 승인 되었습니다.
(3) 해당 사업목적 변경이 회사의 주된 사업에 미치는 영향
이차전지 및 연료전지의 전고체 전해질 소재 개발은, 일단 기존 당사가 보유하고 있는 PEG 소재 라이브러리를 활용하여 진행될 예정으로, 기존 PEG 소재 생산 관련 사업과 시너지를 이루어 매출향상에 기여할 것으로 판단하며, 또한 이차전지용 PEG소재의 생산도 기존의 생산시설을 이용함으로 추가적인 시설비용은 필요치 않습니다.
마. 정관상 사업목적 추가 현황표
| 구 분 | 사업목적 | 추가일자 |
|---|---|---|
|
1 |
2차전지 및 연료전지의 전고체 전해질 소재의 기술개발 및 기술이전 사업 |
2023.05.26 |
|
2 |
2차전지 및 연료전지의 전고체 전해질 소재의 제조 및 판매 사업 |
2023.05.26 |
(1) 사업 분야(업종, 제품 및 서비스의 내용 등) 및 진출 목적
해당 사업의 업종은 제조업이며, 이차전지 및 연료전지의 전고제 전해질 소재의 제품을 생산하여 당사 기존 PEG라이브러리를 활용한 이차전지 및 연료전지의 전고체 전해질 소재 개발과 향후 기술이전을 통한 새로운 수익창출 기회 모색.
(2) 시장의 주요 특성ㆍ규모 및 성장성
이차전지 분야는 전기자동차, 에너지저장장치, 드론, 로봇 등에 적용되어 급성장중인 산업입니다. 현재 사용되는 이차전지 대부분은 액체전해질을 함유하고 있으며, 이는 과충전, 과열, 또는 사고시에 폭발위험성을 내재하고 있습니다. 따라서 관련 산업계는 폭발위험성이 없는 고체전해질을 연구개발 중이며, 고체전해질 소재는, 황화물계열이나 폴리머계열이 연구되고 있습니다. 당사가 연구개발하고자 하는 분야는 PEG소재를 활용한 폴리머계열 고체전해질입니다.
(3) 신규사업과 관련된 투자
2023~2025년의 2개년간은 3억원의 연구자금을 투입하여, 2건 이상의 특허출원을 목표로 합니다. 2025년 하반기부터는 개발된 기술의 기술이전을 통하여 기술료 및 로열티의 수익창출을 목표로 합니다.
총 소요자금은 3억원이며, 자금의 조달은 사내 영업이익을 활용하며, 예상투자회수기간은 2028년까지를 목표로 합니다.
(4) 사업 추진현황
1) 조직 및 인력구성 현황
연구진의 인력구성은 사내 기존 연구진에서 자원한 3~4명으로 구성하며, 이들은 유기화학 전공자로서 10~20년의 경험을 보유하여, 전기화학분야에도 충분히 적응해 나갈 능력이 있습니다.
2) 연구개발활동 내역
당사는 2023년 7월 서울시립대학교 산학협력단 및 화학공학과 정철수교수와 연구계약을 맺고, 향후 당사가 개발하는 PEG 소재를 서울시립대 화학공학과 연구실에서 테스트하게 됩니다. 정철수교수는 시립대에 부임하기 전 삼성SDI에 8년간 근무하며, 폴리머 이차전지를 상용화한 경험이 있습니다. 당사는 또한 2023년 8월 서울시립대학교 소유의 한국 특허 두 건을 인수하였으며, 이들은 이차전지 제조시 양극의 안정화 및 고분자 전해질의 성능유지에 도움을 주는 기술입니다.
|
특허등록번호 |
등록일자 |
특허권자 |
발명자 |
발명의 명칭 |
|---|---|---|---|---|
|
10-2001985 |
2019. 7. 15 |
서울시립대학교 산학협력단 |
정철수 |
겔 고분자 전해질을 포함하는 전기화학소자 및 그의 제조방법 |
|
10-2335794 |
2021. 12. 1 |
서울시립대학교 산학협력단 |
정철수 |
겔 고분자 전해질 및 이를 포함하는 전지화학 소자 |
3) 제품 및 서비스 개발 진척도 및 상용화 여부
당사는 최근 정관개정을 통하여 신사업 수행이 가능하게 된 바, 구체적인 개발 성과는 아직 없으며, 관련 분야의 전문가를 양성하기 위한 직원들의 교육 및 신규 직원 채용을 통한 전공자/전문가 영입에 노력하고 있습니다. 따라서 아직 상용화 여부 등을 언급하기에는 너무 이르다는 평가입니다.
4) 매출 발생 여부
이제 전문가 및 관련 필수 특허 확보 등 거의 본격적 사업 개시를 위한 준비단계라 할 수 있으며, 관련 매출발생은 아직 없습니다.
(5) 기존 사업과의 연관성
현재 전고체 전해질 개발을 위한 후보 물질로는 기존 당사가 보유하고 있는 PEG라이브러리를 활용할 예정이며, 생산도 기존의 생산시설을 사용하게 됨으로서 추가적인 시설투자가 필요치 않고 시간적인 지연도 없습니다. 이와 같이 고체전해질용 PEG소재는 당사가 연구개발 및 생산하지만, 그 PEG소재를 활용한 전지의 제조는 당사의 시설이 전무한 바, 전지의 제조 및 테스트는 서울시립대학교 화학공학과의 연구실과 협업하여 진행하게 됩니다.
(6) 주요 위험
현재까지 파악한 바로는 신규 사업 추진에 따른 기존 영위 사업에의 영향은 없는 것으로 판단합니다. 다만, 본 전고체 전해질 개발사업이 실패하는 경우, 이는 재무적 손실로 반영될 것입니다.
(7) 향후 추진계획
서울시립대학교와의 연구계약에 따라 2023년 7월부터 2025년 6월까지 아래와 같이 연구개발을 목표로 하고 있습니다.
1) 연구개발 목표 : 리튬이차전지용 전해질 개발 기술 전수 및 미래기술 개발
2) 연도별 연구 개발 목표
| 1차년도 | |
| 연구목표 | 전기화학 실험 기술 전수 및 리튬이차전지용 전해질 실험 조건 확립 |
| 정량목표 | 전기화학 및 고분자 전해질과 관련된 교육 자료, 실험결과 보고서 |
| 2차년도 | |
| 연구목표 | 선바이오 타입 고분자 전해질 개발 방향 수립 |
| 정량목표 | 실험 항목별 매뉴얼 작성, 고분자 전해질 개선 보고서 |
3) 연구진행 방법 : 화상회의 및 당사 연구원 1~2명이 학교를 방문하는 방식으로 전기화학의 실험에 참여하는 등 이론 및 실무과정을 수행중에 있습니다.
(8) 미추진 사유
사업목적 추가 승인 이후, 연구계약 등의 추진사항이 존재하므로 해당사항 없습니다.
II. 사업의 내용
1. 사업의 개요
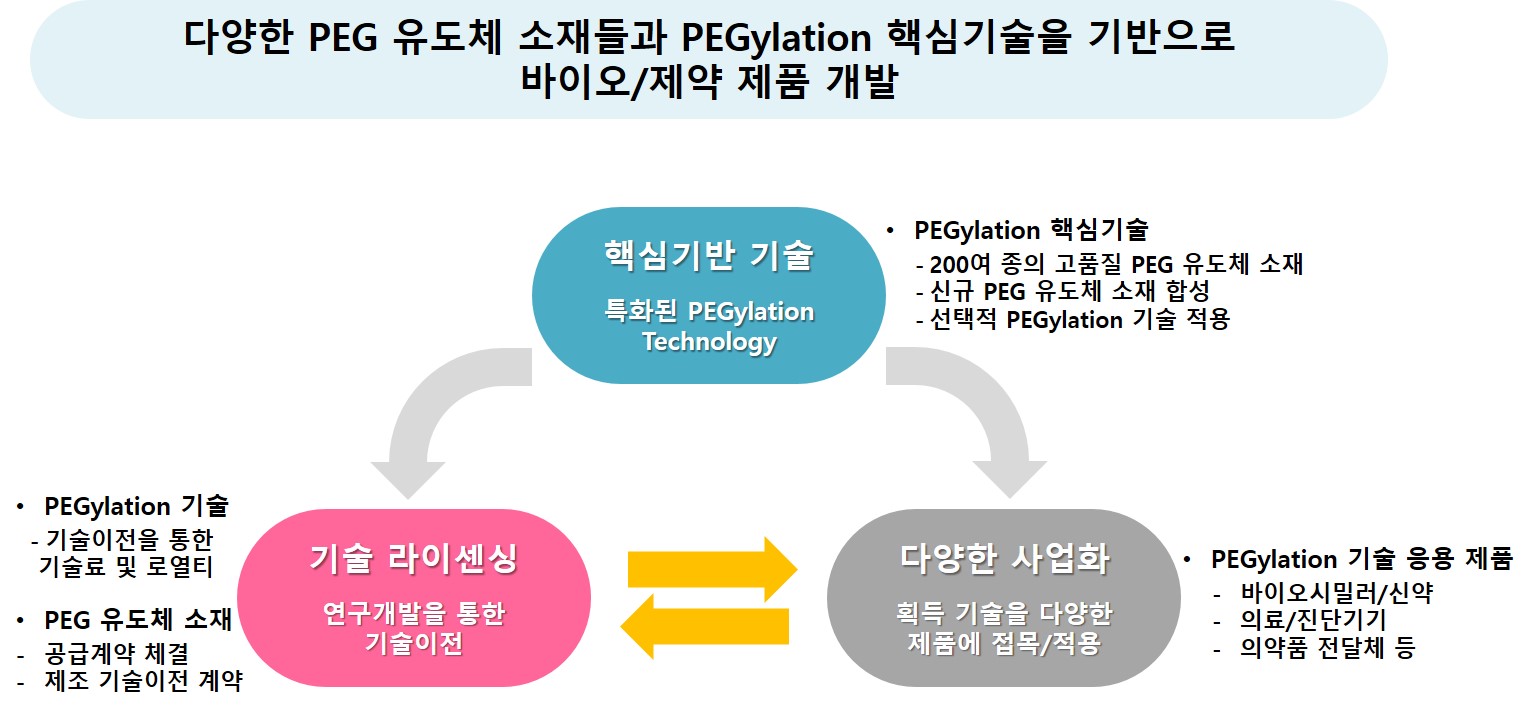
당사는 1997년 설립이후 20여년간 PEG(Polyethylene glycol)라는 생체적합 고분자를 주 성분으로 하는 파생 물질인 “PEG 유도체(PEG derivatives) 소재"를 다양한 형태로 디자인하여 합성, 생산 및 판매하고 있습니다. 그리고, 특정 "PEG 유도체 소재"를 약리활성물질 또는 기타 목표 물질의 표면에 화학적 공유결합으로 부착시키는 기술 즉, "PEGylation" 기술을 활용하여 다양한 바이오시밀러 및 신약 등 의약품 및 의료 소재 등을 개발하고 있으며, 이를 바탕으로 기술이전(라이센싱 아웃) 사업을 진행하고 있습니다.
[당사의 사업분야 및 현황]
|
사 업 분 야 |
내 용 |
현 황 |
수 익 구 조 |
|
|
PEG 유도체 소재 사업 |
- 200여종 PEG 유도체 소재 라이브러리 보유 - 신규 PEG 유도체 소재연구개발 |
자체 생산 판매중 : 국내외(50여개 업체) |
제품 매출 |
|
|
PEGylation 기술 응용 제품 개발 사업 |
호중구 감소증 치료제 |
- Pegfilgrastim 바이오시밀러 제조를 위한 PEG 유도체 및 PEGylation 기술 개발 및 기술이전 |
기술도입사 제품출시 후 판매중(Neupeg™/Pelgraz®/Lapelga™) : 유럽(독일, 영국, 스페인, 노르웨이, 프랑스, 네덜란드, 스웨덴, 브라질, 덴마크), |
기술 이전 수익 및 제품 (PEG유도체 원료) 매출 |
|
구강 |
- MucoPEG™ 제품화 완료, 미국 FDA 의료기기 510(k) 판매승인 |
미국-마케팅용 비교임상 완료 중국-기술이전 완료 |
기술 이전 수익 및 제품 매출 |
|
|
신약/ |
- 인공혈액 - 연골 활액 충진제 |
초기연구 및 비임상 중 |
기술 이전 (계획) |
|
PEGylation 기술이란 약리활성물질 또는 단백질 등의 표면에 PEG(폴리에틸렌글리콜) 유도체라는 생체고분자 소재를 부착(화학적 공유결합)시키는 기술을 말합니다. 이러한 PEGylation 과정은 약리활성물질의 분자량을 높여 체내 잔존시간을 증가시키고, 약리활성물질의 수용성 향상으로 용해도를 증가시키며, 약리활성물질을 감싸주는 마스킹 효과로 항원성을 낮추어 면역반응과 같은 부작용을 완화시켜주는 작용을 합니다. 더욱이 약리효과의 향상으로 투여 기간을 늘려 투여 횟수를 감소시킴으로써 환자 삶의 질을 향상시킬수 있습니다.
![이미지: [PEGylation 기술 사례]](pegylation%20%EA%B8%B0%EC%88%A0%20%EC%82%AC%EB%A1%80.jpg) |
|
[PEGylation 기술 사례] |
당사는 PEGylation 전문업체로서, 20여 년 간 해당 분야의 연구개발을 통하여 의약품, 의료용 소재 등 다양한 분야에 이용되는 원료 소재인 다수의 PEG 유도체 소재를 디자인, 생산 판매하고 있으며, 자체적으로도 특정 PEG 유도체 소재를 이용한 PEGylation 기술을 바탕으로 바이오/제약 응용 제품을 개발하여 사업화하고 있습니다.
 |
|
기술개요 |
PEG 유도체 소재는 신약 및 바이오시밀러와 같은 의약품 분야에서부터 의료용 봉합제 및 성형 필러와 같은 의료용 제품, 바이오칩 및 ELISA와 같은 진단기기의 분자 소재를 비롯하여 화장품, 각종 상업용 제품의 첨가제에 이르기까지 매우 광범위하고 다양한 분야에 활용되고 있습니다. 이렇게 다양한 활용분야를 가진 PEG 유도체 소재사업을 위해, 당사는 신규 PEG 유도체 소재 개발 및 생산에 관한 특허를 보유하여 진입장벽을 구축하고 있으며, 이에 따른 생산 및 품질 측면의 기술 우위를 확보하고 있습니다.
또한, 응용제품 개발 사업과 관련하여, 주로 신규한 PEG 유도체 소재 및 관련 PEGylation 기술개발, 전임상 데이터 확보, 제형 개발, 특허 확보 등에 주력하고, 기술 이전을 통해 임상, 허가 등 제품화 개발은 기술도입 업체가 수행하는 전략으로 비용의 효율화와 전문성의 극대화를 추구하고자 합니다.
2. 주요 제품 및 서비스
가. 주요 제품의 현황
당사의 주요 제품은 PEG 유도체 소재와 PEG 유도체를 기반으로 한 PEGylation 기술 응용제품인 호중구감소증 치료제 바이오시밀러 Pegfilgrastim과 구강건조증 치료제 MucoPEG입니다.
(1) 로열티 매출
| (단위:천원, %) |
|
품 목 |
매출액(비율) |
제 품 설 명 |
||
|---|---|---|---|---|
|
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
||
|
바이오시밀러 (Pegfilgrastim) |
2,751,973 (27.62) |
1,936,603 (26.10) |
3,321,075 (34.84) |
Intas사의 Pegfilgrastim 매출에 대한 런닝로열티 |
(2) 기술료 매출
| (단위:천원, %) |
|
품 목 |
매출액(비율) |
제 품 설 명 |
||
|---|---|---|---|---|
|
2021년 |
2022년 (제26기) |
2023년 (제27기 2분기) |
||
| MucoPEG™ | 190,068 (1.91) |
- | - | MucoPEG™ 구강건조증치료제의 제조기술의 이전 |
(3) PEG유도체 제품 매출
| (단위:천원, %) |
|
품목 |
매출액(비율) |
제품 설명 |
||
|---|---|---|---|---|
|
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
||
|
P1PAL-20 |
4,509,251 (45.25) |
4,154,809 (55.99) |
5,509,788 (57.79) |
Pegfilgrastim 제품 원료로 사용 |
| P1AA-2 | 1,713,192 (17.19) |
- | - | 화이자 코로나 백신용 원료로 사용 |
|
P1MAL-5 |
184,759 (1.85) |
60,475 (0.81) |
53,195 (0.56) |
진단기기 제조에 사용 |
|
P1AM-5 |
121,327 (1.22) |
119,607 (1.61) |
141,993 (1.49) |
진단기기 제조에 사용 |
| P2SP-3 | - | 306,092 (4.13) |
- | 약물전달 시스템에 사용 |
|
기타 |
494,424 (4.96) |
842,810 (11.36) |
507,488 (5.32) |
- 신약개발 및 진단기기 제조에 사용 - 나노기술 및 외과수술용 접착제 등에 사용 |
|
합계 |
7,022,953 (70.48) |
5,483,792 (73.90) |
6,212,464 (65.16) |
- |
나. 주요 제품의 내용
(1) PEG 유도체 소재
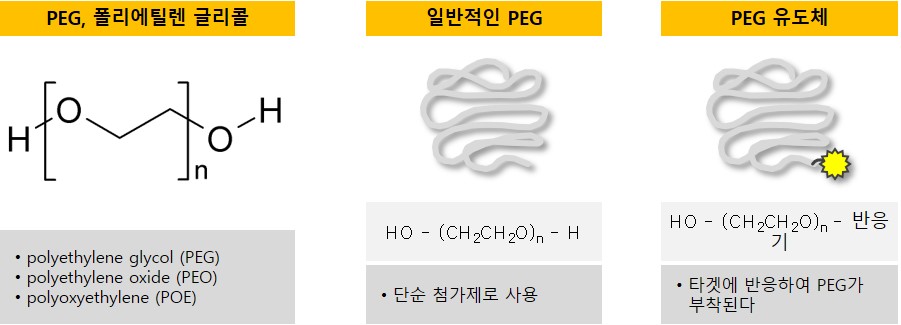
(가) 제품 개요
PEG 유도체 소재는 약리활성이 없는 생체 고분자 소재로서 친수성과 소수성 특징(양친매성)을 동시에 가지기 때문에 물과의 친화력이 낮은 의약품과 단백질의 수용성 향상에 도움을 주며, 의약품의 체내 반감기 증가 및 면역원성 조절에 효과적입니다.
(A) (B) (C)
 |
|
. |
위 그림의 PEG 유도체 소재(그림 C)는 일반적인 PEG(그림 B) 고분자의 말단부분에 의약품이나 단백질 등과 같은 목표물과 화학적 결합을 할 수 있도록 반응기를 합성하여 붙인 형태를 말합니다. 당사는 이러한 일반적인 PEG에 여러 종류의 반응기(amine, maleimide 등)를 붙여 다양한 종류, 다양한 분자량의 PEG 유도체 소재를 생산하여 판매하고 있습니다.
즉, PEG 유도체 소재의 높은 반응 활성도 및 순도가 PEG 유도체 소재 제조 기술에서 가장 중요한 기술력이며, 이러한 기술력은 당사의 PEG 유도체 소재 제조관련 핵심 인력들의 오랜 노하우가 직접적으로 반영된 성과입니다.
특히, Intas사 pegfilgrastim 바이오시밀러의 PEG 유도체 원료인 P1PAL-20 소재는 대량 생산을 위해 당사 건물 1층의 미국GMP(cGMP) 시설에서 생산하고 있습니다. 이 PEG 유도체 소재 생산 시설은 2018년 2월 EMA QP(Quality Person)의 실사(audit)를 받아 제조승인을 받았으며, 연간 40~80 kg의 P1PAL-20을 생산/판매하고 있습니다.
이와 같이 당사의 PEG 유도체 소재 생산 기술력은 200여 가지 PEG 유도체 소재를 1g 규모의 연구용 소량에서 국제 GMP 수준급의 수십 kg 규모까지 세계에서 인정받는 품질로 제조 가능한 우월성을 가지고 있습니다.
(나) 제품의 기능
|
소재 |
종 류 |
분자량 |
구 조 식 |
기능 및 용도 |
||
|---|---|---|---|---|---|---|
|
mPEG 유도체 |
mPEG-amine |
2k 5k 10k 12k 20k 30k |
|
의약품 바이오시밀러 진단기기 |
||
|
mPEG-maleimide |
||||||
|
mPEG-propionaldehyde |
||||||
|
mPEG-succinimidylsuccinate |
||||||
|
mPEG-nitrophenylcarbonate |
||||||
|
등 50여 가지 |
||||||
|
di-PEG 유도체 |
PEG-diamine |
2k 5k 10k 12k 20k 30k |
|
성형 dermal filler Drug delivery (DDS;약물전달 시스템) |
||
|
PEG-dimaleimide |
||||||
|
PEG-dipropionaldehyde |
||||||
|
PEG-succinimidylsuccinate |
||||||
|
PEG-dinitrophenylcarbonate |
||||||
|
등 50여 가지 |
||||||
|
4-arm PEG 유도체 |
4-arm-PEG-amine |
10k 13k 17k 20k |
|
의료기기 sealant nanotechnology (나노기술) |
||
|
4-arm-PEG-succinimidylsuccinate |
||||||
|
4-arm-PEG-succinimidylglutarate |
||||||
|
등 30여 가지 |
||||||
|
6-arm PEG 유도체 |
6-arm-PEG-amine |
10k 13k 15k 17k 20k |
|
Hydrogel Nanotechnology (나노기술) |
||
|
6-arm-PEG-succinimidylsuccinate |
||||||
|
6-arm-PEG-succinimidylglutarate |
||||||
|
등 30여 가지 |
(다) 제품의 필요성
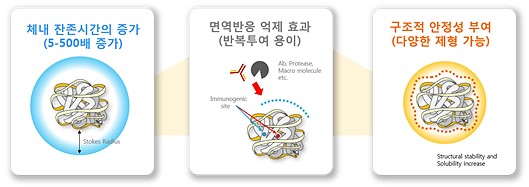
PEG 유도체 소재를 이용한 PEGylation 기술의 효과입니다.
 |
|
PEGylation 기술효과 |
① PEGylation 된 의약품이나 치료용 단백질의 전체 분자량의 증가로 인해 신장 제거율이 낮아져 약물의 체내 잔존시간 즉, 혈중 반감기 증가
② PEG의 ‘마스킹 효과’에 의해 인체 면역 시스템, 즉 항체가 인식하는 epitope*을 가림으로써 약물의 면역원성과 항원성을 낮춰줌
③ PEG의 steric hindrance**에 의해 체내 단백질 분해효소(proteolytic enzyme)의 접근이 막아짐으로써 단백질 분해효소에 대한 안정성 증가
④ PEGylation은 PEG 유도체 소재의 양친매성(분자에 친수기와 소수성을 모두 갖는 화합물) 특징으로 인해 물과의 친화력이 낮은 소수성 의약품과 단백질의 수용성을 향상
⑤ 독성 등의 부작용 완화
* 항체, B세포, T세포등의 면역계가 항원을 식별하게 해주는 항원의 특정한 부분
** 원자단의 부피가 커서 반응을 저해하는 효과
위와 같이 PEGylation 효과를 바탕으로 다양한 PEG 유도체 소재를 이용한 PEGylation 제품들이 꾸준히 연구개발되고 있습니다.
(2) 호중구 감소증 치료제 pegfilgrastim 바이오시밀러(Pelgraz®, Lapelga™, Neupeg™)
(가) 제품 개요
호중구 감소증(Neutropenia)은 혈액 내 세균이나 박테리아가 몸에 침범했을 경우 세균을 파괴하고 방어하는 역할을 하는 호중구(백혈구 내 50~70%)가 감소된 경우를 말합니다. 호중구의 감소는 골수에 이상이 생기거나 암, 약물, 방사선 노출 등의 원인으로 유발되며, 특히 항암 치료시 발생되는 호중구 감소증은 주로 화학요법 치료 후 5~7일 후에 발생하여, 호중구 감소정도에 따라 의학적 응급상황으로 다루는 질환입니다. 즉, 호중구 수치가 저하되어 있는 환자에게 감염은 심각한 위험이기 때문에 즉각적인 조치를 필요로 하며, 과립구 생산을 자극하고 호중구기능을 증진시키는 filgrastim(재조합 단백질: G-CSF(Granulocyte colony-stimulating factor) 제품이 주로 사용되었습니다.
그러나 filgrastim은 치료제로 주사하였을 경우 항원성이 높고, 체내 잔류시간이 짧아 지속적인 약리효과를 위해 주기적으로 반복투여 해야 하는 단점이 있으며, 이러한 단점을 극복하기 위해 filgrastim에 PEGylation 기술을 적용한 pegfilgrastim 제품이 Amgen사의 Neulasta이며, 세계 판매시장이 최고 5조원이며, 2015년 10월 미국특허가 만료되었습니다.
바이오시밀러 제품은 오리지널 신약의 복제품으로 오리지널과 비교하여 생물적 효능의 동등성 및 안전성을 임상시험을 통하여 입증하여서 미국 FDA 등 관련 기관의 품목허가 승인을 획득하여야 시장에 출시할 수 있습니다. 일반 화학적 합성 복제의약품(Generic)은 원료와 제조방법에 상관없이 오리지널 합성의약품과 같은 효능을 가지므로 임상시험이 필요 없어 저렴한 비용에 개발이 가능하지만, 바이오시밀러는 살아있는 세포를 이용하여 단백질을 추출, 의약품을 생산하기 때문에 사용하는 세포, 배양조건, 정제방법 등에 따라 효능이 달라질 가능성이 높습니다. 따라서 임상시험을 통해 오리지널 바이오의약품과의 동등성(similarity)을 증명하는 것이 가장 중요합니다.
당사 pegfilgrastim 바이오시밀러의 2007년 인도승인은 세계최초의 pegfilgrastim 바이오시밀러 승인이였으며, 미국과 유럽의 추가 임상을 통해 2018년 4월 5일 Apobiologix (Apotex 자회사)의 제품명 Lapelga™로 캐나다 최초의 pegfilgrastim 바이오시밀러 품목 승인, 2018년 9월 27일 유럽의약품청(EMA)의 Pelgraz®(Intas: Acord Healthcare)의 품목허가, 그리고 기타 호주, 독일, 영국, 멕시코 등 여러 나라에서 승인을 획득하였습니다.
(나) 제품의 기능
당사의 바이오시밀러 제품은 Amgen사의 Neulasta 의 바이오시밀러 제품입니다. Filgrastim 단백질이 PEG 유도체 소재의 공유 결합에 의해 분자량이 증가하면서 신장을 통해 쉽게 체외로 배출되지 않고, PEGylation에 의해 항원성이 낮아지면서 반감기와 작용 지속시간이 증가하여 화학요법 주기당 1회 투여로 기존의 filgrastim과 다른 편의성과 약효가 증대된 pegfilgrastim (Neulasta) 제품의 바이오시밀러로서 당사의 Pegfilgrastim 바이오시밀러 Pelgraz(Neupeg, Lapelga)는 오리지널 의약품과 동일한 효과와 기능을 나타냅니다.
![이미지: [당사의 바이오시밀러 Pelgraz]](pelgraz-2.jpg) |
|
[당사의 바이오시밀러 Pelgraz] |
(다) 제품의 필요성
여러 형태의 암 발생률이 증가하기 때문에 화학요법으로 유발되는 호중구 감소증 치료제 시장은 상당한 성장을 보일 것으로 예측하며, 호중구감소증 치료제 중 filgrastim을 기반으로 한 제품이 가장 큰 시장을 형성하며, 또한 전체 위험도가 높은 화학요법 환자들을 대상으로 filgrastim의 예방 치료법이 권고되어, filgrastim의 시장은 더욱 성장 할 것으로 예측합니다.
바이오시밀러는 일반적으로는 세포 배양 혹은 유전자 재조합을 통해 생산되는 단백질이나 호르몬 등의 형태입니다. 그리고, 바이오신약에 비해 상대적으로 개발비용 및 개발기간을 절감할 수 있고, 제품 가격이 바이오신약의 약 70% 수준이며, 이미 검증된 제품을 생산하기 때문에 단기간에 성장이 가능하다는 장점이 있습니다. 또한 세계 각국이 의료비 재정부담을 축소하고, 의약품에 대한 환자 접근성 개선 등을 위해
아태 시장을 중심으로 신약 의약품 대비 저렴한 복제약 사용을 장려할 것으로 보여 바이오시밀러 시장이 급격히 확대될 전망입니다.
의료비 지출 비중 및 바이오 의약품 소비액이 가장 높은 미국도 의료 재정 절감을 위해 바이오시밀러의 사용을 권장하는 추세입니다.
(3) 구강건조증 치료제 MucoPEG™
(가) 제품 개요
고령화 및 항암치료를 포함한 방사선 치료 등으로 인해 구강건조 환자가 증가하고 있으며, 따라서 암환자 및 인구 고령화는 구강건조 환자 수의 비례적 증가의 원인이 되고 있습니다.
구강건조증(xerostomia)은 노화 또는 항암 치료시 수반하는 부작용, 기타 질병 등과 같은 여러 가지 원인에 의하여 타액의 분비량이 감소되어 구강 점막이 건조화 되는 질환입니다. 타액은 구강의 주요기능을 원활하게 유지하고, 구강 점막을 보호하는 중요한 역할을 하는데, 타액 분비량이 감소되어 구강 건조증이 생기면 저작기능과 언어기능의 이상을 호소하게 되고, 심한 구취와 충치가 발생되며 정도에 따라 구강 점막의 작열감 또는 구강 점막의 궤양 등으로 심한 고통을 겪게 됩니다.
당사는 일반적인 PEG 소재의 보습기능과 PEG 유도체의 반응기에 의한 PEGylation 공유결합 기술을 응용하여 구강 건조증 치료제 MucoPEG을 개발하였습니다.
(나) 제품의 기능
기존의 구강건조 제품들은 점성을 증가시켜 수분 증발을 막는 CMC(Carboxymethyl cellulose: 카르복시메틸셀룰로오스) 성분, 보습성분의 글리신(glycine) 그리고, 단맛의 솔비톨(sorbitol) 과 같은 성분을 포함한 인공타액 목적의 제품이 상용화 되고 있습니다. 해당 제품들의 제형은 가글제, 스프레이, 치약 같은 젤 타입 등 다양한 형태로 판매되고 있으나 일시적인 보습효과로 구강건조 증상을 완화하여, 효과의 지속성이 짧아 환자들의 만족도가 낮습니다.
그래서 당사는 MucoPEG™ 구강건조증 치료제에 당사의 PEG 유도체 소재와 이를 이용한 구강점막의 PEGylation 기술을 적용하여 건조한 구강점막의 보습 지속성을 증가시키는 제품을 개발하였습니다.
[ 구강 건조증 치료제 MucoPEG ]
|
MucoPEG Product |
Packet Insert |
||||
|
|
구강건조증(xerostomia) 치료제인 MucoPEG™의 작용 기전은 4 개의 가지 구조의 4arm-PEG 유도체(P4SG-10; 4-arm Polyethylene Glycol-Succinimidyl Glutarate 10,000)를 노화 또는 두경부암 방사선 치료, 쇼그렌증후군 등의 질병으로 인해 건조해진 구강 점막 및 점막하 조직에 처리 시, 구강 점막 세포 표면의 아민(amine) 작용기와 PEG 유도체의 N-하이드록시숙신이미드(N-hydroxysuccinimide) 작용기 간의 PEGylation 반응이 일어나게 함으로써, 점막 세포 표면에 PEG로 구성된 보습층이 화학적으로 공유결합 되어 지속적인 보습력이 유지되도록 하는 제품입니다.
![이미지: [MucoPEG 구강점막 적용모식도]](mucopeg%20%EC%A0%81%EC%9A%A9%EB%AA%A8%EC%8B%9D%EB%8F%84.jpg) |
|
[MucoPEG 구강점막 적용모식도] |
(다) 제품의 필요성
인구 고령화, 암 진단기술 발달, 생활습관의 변화 등 여러 원인으로 암 발생률이 증가하여 암 환자들의 항암 및 방사선 치료에 의한 합병증으로 구강건조증이 증가하고, 이외에도 고혈압, 당뇨 등 노인성 질환에 치료제로 사용되는 약 1,800개 약물의 부작용이 구강 건조증을 유발한다는 보고가 있습니다.
따라서 증가하는 구강 건조증 치료를 위해, 기존의 잦은 물 섭취, 사탕이나 껌을 이용한 일시적인 관리법이나 타액 분비를 촉진하여 눈물, 콧물 등의 기타 타액까지 증가되는 부작용의 처방 의약품이 아닌, 건조로 인해 손상된 점막에 자극 없이 오랫동안 보습을 유지하고, 구강 내 세균 증식을 억제하여 구내염 및 구취 등을 개선하는 구강 건조증 치료제의 개발이 필요합니다.
3. 원재료 및 생산설비
가. 매입 현황
(1) 원재료 매입현황
| (단위: 천원) |
|
품목 |
구분 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|---|---|---|---|---|
| P1OH-5 | 국내 | - | - | 65,975 |
| P1OH-10 | 국내 | 2,000 | 76,373 | - |
|
P1OH-20 |
국내 |
1,098,359 | 347,362 | 1,058,232 |
|
P1OH-30 |
국내 |
72,449 | - | - |
|
P1OH-2 |
국내 |
216,800 | - | - |
| P2OH-3 | 국내 | - | 2,300 | - |
| P2OH-5 |
국내 |
- | 500 | - |
| P4OH-10 | 국내 | - | 15,000 | - |
| P4OH-20 |
국내 |
300 | - | - |
| P6OH-20 | 국내 | - | - | 3,000 |
| P6OH-40 | 국내 | - | 1,500 | - |
|
합계 |
국내 | 1,389,908 | 443,035 | 1,127,207 |
| (참고: 원재료 품목으로 기재된 PEG는 유도체 소재가 아닌 PEG 유도체를 합성하기 위한 기본 원료입니다. 예를 들어, P1OH-20은 분자량이 20 kDa(20,000 Da)인 PEG 유도체 소재를 합성하기 위해 사용하는 원재료이며, 당사의 PEG 유도체 소재 주요품목 중 하나인 P1BTC-20과 P1PAL-20 등을 합성할 때 P1OH-20을 사용합니다.) |
(2) 부재료 매입현황
| (단위: 천원) |
|
품목 |
구분 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|---|---|---|---|---|
|
염화메틸렌 |
국내 |
57,437 | 42,663 | 41.449 |
|
에틸에테르 |
국내 |
64,028 | 63,078 | 53.190 |
|
다이옥산 |
국내 |
21,155 | 20,803 | 6.190 |
|
기타 |
국내 |
327,972 | 259,856 | 162.704 |
|
합계 |
국내 |
470,592 | 386,401 | 263,533 |
나. 원재료의 제품별 비중
|
사업연도 |
주요 제품명 |
원재료명 |
원재료 비중(%) |
|---|---|---|---|
| 2021년 (제25기) |
P1PAL-20 | mPEG-OH 20,000 | 81.61 |
| 1,4-Dioxane | 7.56 | ||
| 기타 | 10.83 | ||
| P1MAL-5 | mPEG-OH 5,000 | 3.67 | |
| PFP-TFA | 47.91 | ||
| 기타 | 48.42 | ||
| P1AM-5 | mPEG-OH 5,000 | 58.25 | |
| 기타 | 41.75 | ||
| P1AA-2 | mPEG-OH 2,000 | 48.72 | |
| MgSO4 | 19.72 | ||
| 기타 | 31.56 | ||
| 2022년 (제26기) |
P1PAL-20 | mPEG-OH 20,000 | 77.82 |
| 1,4-Dioxane | 6.37 | ||
| 기타 | 15.82 | ||
| P1MAL-5 | mPEG-OH 5,000 | 4.93 | |
| PFP-TFA | 35.99 | ||
| 기타 | 59.07 | ||
| P1AM-5 | mPEG-OH 5,000 | 50.7 | |
| 기타 | 49.3 | ||
| P2SP-3 | PEG-OH 3,400 | 16.98 | |
| DCC | 4.31 | ||
| 기타 | 78.71 | ||
| 2023년 (제27기 3분기) |
P1PAL-20 | mPEG-OH 20,000 | 78.04 |
| 1,4-Dioxane | 6.39 | ||
| 기타 | 15.57 | ||
| P1MAL-5 | mPEG-OH 5,000 | 4.93 | |
| PFP-TFA | 35.99 | ||
| 기타 | 59.07 | ||
| P1AM-5 | mPEG-OH 5,000 | 44.65 | |
| 기타 | 55.35 | ||
| P1SS-5 | mPEG-OH 5,000 | 42.83 | |
| Succinic anhydride | 8.21 | ||
| 기타 | 48.96 |
다. 원재료 가격변동추이
| (단위: 원, 달러) |
|
품목 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|
|---|---|---|---|---|
| P1OH-5 | 국내 | - | - | 3,238,163 ($2,500) |
| P1OH-10(주1) | 국내 | 2,000,000 | 6,716,690 ($5,300) |
- |
|
P1OH-20 |
국내 |
4,290,464 ($3,800) |
4,815,740 ($3,800) |
4,922,007 ($3,800) |
|
P1OH-30 |
국내 |
7,244,900 ($6,500) |
- | - |
|
P1OH-2 |
국내 |
800,000 | - | - |
| P2OH-3 | 국내 | - | 200,000 | - |
| P2OH-5 |
국내 |
- | 500,000 | - |
| P4OH-10 | 국내 | - | 500,000 | - |
| P4OH-20 |
국내 |
3,000,000 | - | - |
| P6OH-20 | 국내 | - | - | 1,000,000 |
| P6OH-40 | 국내 | - | 1,500,000 | - |
|
염화메틸렌(A) |
국내 |
28,000 | 47,500 | 47,500 |
|
에틸에테르(B) |
국내 |
64,000 | 114,000 | 114,000 |
|
다이옥산(C) |
국내 |
95,000 | 140,000 | 140,000 |
|
참고1. 원료의 가격산출기준은 단가(원/kg)로 기입하였습니다. 참고2. (A)의 가격산출기준은 단가(원/24kg)로 기입하였습니다. 참고3. (B)의 가격산출기준은 단가(원/18L)로 기입하였습니다. 참고4. (C)의 가격산출기준은 단가(원/2L)로 기입하였습니다. |
라. 주요 매입처에 관한 사항
| (단위: 천원) |
|
품목 |
구 입 처 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|
|---|---|---|---|---|---|
| P1OH-5 | 국내 | 파미셀(주) 케미컬사업부문 |
- | - | 65,975 |
|
P1OH-10 |
국내 |
대창화학 |
2,000 | - | - |
|
파미셀(주) 케미컬사업부문 |
- | 76,373 | - | ||
|
P1OH-20 |
국내 |
파미셀(주) 케미컬사업부문 |
1,098,359 | 347,362 | 1,058,232 |
|
P1OH-30 |
국내 |
파미셀(주) 케미컬사업부문 |
72,449 | - | - |
|
P1OH-2 |
국내 |
파미셀(주) 케미컬사업부문 |
216,800 | - | - |
| P2OH-3 | 국내 | 대창화학 | - | 2,300 | - |
|
P2OH-5 |
국내 |
대창화학 |
- | 500 | - |
|
P4OH-10 |
국내 |
대창화학 |
- | 15,000 | - |
| P4OH-20 |
국내 |
대창화학 |
300 | - | - |
|
P6OH-20 |
국내 |
대창화학 |
- | - | 3,000 |
|
P6OH-40 |
국내 |
대창화학 |
- | 1,500 | - |
|
합계 |
1,389,908 | 443,035 | 1,127,207 | ||
마. 생산능력 및 생산실적
(1) PEG 유도체 소재
당사의 다양한 PEG 유도체 소재는 1998년 가장 빠른 제품화로 국내외 많은 거래처에 판매하며 그 품질을 인정받고 있습니다. 그러나 더욱더 다양한 PEG 유도체 소재의 개발 및 대량생산을 위해 생산 설비 및 인력, 분석 장비 등을 확대/구축하고 있으며, 2016년 7월 현재의 군포 신사옥을 임차하여 생산시설 증대 및 GMP 수준급 시설을 완료하였습니다. 해당 시설로 연간 100kg 이상의 PEG 유도체 소재생산 능력을 갖추었으며, 2018년 2월 EU EMA 실사를 완료하였습니다.
|
품 질 |
GMP급 기준 (2018.12 ~ ) |
ISO 9001 기준 (2002 ~ ) |
|
작업모드 |
Semi-automated |
Manual |
|
생산규모 |
20 kg per batch |
10 kg per batch |
|
생산기간(Batch Run Time) |
2 ~ 3 weeks per batch |
2 ~ 4 weeks per batch |
|
연간 생산규모 |
200 kg per year |
100 kg per year |
| (단위: Kg, 백만원) |
|
제품 품목명 |
구 분 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|||
|---|---|---|---|---|---|---|---|
|
수량 |
금액 |
수량 |
금액 |
수량 |
금액 |
||
|
PEG 유도체 |
생산능력 |
250Kg |
- |
250Kg | - | 250Kg | - |
|
생산실적 |
259.80Kg |
- |
192.40Kg | - | 117.72Kg | - | |
|
가동율 |
103.9% |
- |
76.96% | - | 47.09% | - | |
(2) 호중구 감소증 치료제 pegfilgrastim 바이오시밀러
당사의 로열티 및 기술이전 제품인 pegfilgrastim 바이오시밀러 제품은 관련 기술의 연구개발을 완료하여 제휴업체에 기술이전을 통하여 생산 및 분석기술을 이전한 후 제휴업체에서 생산하는 방식입니다. 따라서 기술이전 및 로열티 사업의 생산 및 설비에 관한 내용은 해당사항이 없습니다.즉, 바이오시밀러 의약품인 pegfilgrastim Lapelga™(Pelgraz®, Neupeg™)은 인도 Intas 사에서 생산이 이루어지고 있습니다.
(3) 구강건조증 치료제 MucoPEG™
MucoPEG™의 FDA 510(k) 판매허가를 위해, GMP 수준급 생산 설비 및 장비, 원료 및 중간제품, 완제품 분석장비 등 모든 장비를 GMP 기준에 따라 구입, 관리하며 MucoPEG™을 자체 생산하고 있습니다. 현재 MucoPEG™ 생산 규모가 batch당 1kg(980~ packet)으로 크지 않으나, 최근 중국 업체로의 기술이전 및 판매, 중국내 MucoPEG™ 허가를 위한 자료준비, 중국내 예비 임상 등 MucoPEG™ 수요가 증가하여, 생산규모를 증대하기 위한 생산 설비 및 인력을 충원하고 있습니다.
|
구분 |
현황 |
|
작업 모드(Work mode) |
Semi-automated |
|
생산규모(Batch size) |
1 kg/batch, 5kg/batch* |
|
생산기간(Batch Run Time) |
2주/batch |
|
연간 생산규모 |
120 kg |
| (단위: Kg(g), 백만원) |
|
제품 |
구 분 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|||
|---|---|---|---|---|---|---|---|
|
수량 |
금액 |
수량 |
금액 |
수량 |
금액 |
||
|
MucoPEG |
생산능력 |
40 kg |
- |
60 kg |
- |
60 kg | - |
|
생산량 |
30.5kg |
- |
- |
- |
- | - | |
|
가동율 |
76.3% | - | - |
- |
- | - | |
|
- 생산실적은 해당연도 생산량 중 매출실적이 발생한 양으로 기입. - 가동율은 해당연도 생산량/생산능력 x 100(%)로 계산, - 기말재고는 정확한 기록을 위해 g으로 기재하였음. 'g’은 MucoPEG 1g/packet으로 표기함. 또한, batch당 분석 및 안정성 시험으로 약 100g씩 사용됨으로 재고량에 감소로 반영됨. |
바. 생산설비에 관한 사항
| (단위: 천원) |
|
자산별 |
소재지 |
기초 가액 |
당기증감 |
대체 |
당기 상각 |
분기말 가액 |
|
|---|---|---|---|---|---|---|---|
|
증가 |
감소 |
||||||
| 토지 | 본사 | 22,520,157 | - | - | 22,520,157 | ||
| 기계장치 |
본사 |
221,532 | - | - | - | (44,375) | 177,157 |
| 차량운반구 |
본사 |
- | - | - | - | - | - |
| 공구와기구 |
본사 |
6,109 | - | - | - | (3,180) | 2,929 |
| 비품 |
본사 |
190,812 | 20,481 | - | - | (56,970) | 154,323 |
| 시설장치 |
본사 |
82,668 | - | - | - | (37,431) | 45,236 |
| 구축설비자산 |
본사 |
1,332,268 | - | - | - | (206,839) | 1,125,429 |
| 건설중인자산 | 본사 | 1,074,114 | 5,468,523 | - | - | - | 6,542,637 |
| 사용권자산 | 본사 | 1,106,586 | - | - | (323,183) | (236,249) | 547,155 |
|
합계 |
- |
26,534,246 | 5,489,004 | - | (323,183) | (585,044) | 31,115,023 |
| 주1) | 해당 토지는 당사의 단기차입금과 관련하여 담보로 제공(채권최고액 204억)되어 있습니다. |
| 주2) | 상기 건설중인자산 취득원가에는 자본화이자비용 352,685천원이 포함(자본화이자율 4.02%)되어 있습니다. |
4. 매출 및 수주상황
가. 매출현황
(1) 로열티 및 기술이전
| (단위: 천원, 달러) |
|
매출 유형 |
품 목 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|
|---|---|---|---|---|---|
|
기술료 로열티 |
PHARMASOLUTION LIMITED |
기술료 (MucoPEG)™ |
190,068 ($175,000) |
- | - |
|
Intas Pharma. |
로열티 (Neupeg™) |
2,751,973 ($2,416,034) |
1,936,603 ($1,500,325) |
3,321,075 ($2,549,514) |
|
|
합계 |
기술료 및 로열티 합계 |
2,942,041 ($2,591,034) |
1,936,603 ($1,500,325) |
3,321,075 ($2,549,514) |
|
(2) 제품
| (단위: 천원, 달러) |
|
매출 유형 |
품 목 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|
|---|---|---|---|---|---|
|
제품 |
P1PAL-20 |
수출 |
4,509,251 ($3,870,000) |
4,154,809 ($3,190,000) |
5,509,788 ($4,238,000) |
|
내수 |
- | - | - | ||
|
소계 |
4,509,251 ($3,870,000) |
4,154,809 ($3,190,000) |
5,509,788 ($4,238,000) |
||
| P1AA-2 | 수출 | 1,713,192 ($1,520,000) |
- | - | |
| 내수 | - | - | - | ||
| 소계 | 1,713,192 ($1,520,000) |
- | - | ||
|
P1MAL-5 |
수출 |
183,773 ($160,300) |
60,475 ($47,000) |
53,195 ($40,650) |
|
|
내수 |
986 | - | - | ||
|
소계 |
184,759 ($160,300) |
60,475 ($47,000) |
53,195 ($40,650) |
||
|
P1AM-5 |
수출 |
111,462 ($99,000) |
109,871 ($85,800) |
136,800 ($105,600) |
|
|
내수 |
9,865 | 9,736 | 5,193 | ||
|
소계 |
121,327 ($99,000) |
119,607 ($85,800) |
141,993 ($105,600) |
||
| P2SP-3 |
수출 |
- | 306,092 ($214,500) |
- | |
|
내수 |
- | - | - | ||
|
소계 |
- | 306,092 ($214,500) |
- | ||
|
기타유도체 |
수출 |
422,732 ($369,515) |
812,526 ($635,175) |
467,836 ($355,225) |
|
|
내수 |
32,283 | 30,284 | 39,652 | ||
|
소계 |
455,015 | 842,810 | 507,488 | ||
| MucoPEG | 수출 | 39,409 ($28,600) |
- | - | |
| 내수 | - | - | - | ||
| 소계 | 39,409 ($28,600) |
- | - | ||
|
합계 |
수출 |
6,979,819 ($6,047,415) |
5,443,771 ($4,172,475) |
6,167,619 ($4,739,475) |
|
|
내수 |
43,134 | 40,020 | 44,845 | ||
|
합계 |
7,022,953 | 5,483,792 | 6,212,464 | ||
나. 수주현황
| (단위 :천원,달러) |
| 품목 | 수주 일자 |
납기 | 수주총액 | 기납품액 | 수주잔고 | |||
|---|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | |||
| P1PAL-20 | 2023년 상반기 |
2023년 하반기, 2024년 상반기 |
- | 1,646,035 ($1,224,000) |
- | 617,263 ($459,000) |
- | 1,028,772 ($765,000) |
| 2023년 상.하반기 |
2024년 상반기 |
- | 3,360,655 ($2,499,000) |
- | - | - | 3,360,655 ($2,499,000) |
|
| 합 계 | - | 5,006,690 ($3,723,000) |
- | 617,263 ($459,000) |
- | 4,389,427 ($3,264,000) |
||
| (*) 수주총액 및 잔고는 2023.9.30 환율($1,344.8)을 적용하였고, 기납품액은 실제 매출액을 기재하였습니다. (*) 수주잔고는 제출일 현재 기준으로 작성하였습니다. (*) 영업비밀로 인해 수량은 기재하지 않았습니다. |
다. 판매조직
| 구분 |
판 매 제 품 |
사업모델 |
|
PEG 유도체 소재 |
200여종의 PEG 유도체 소재 |
주문생산, 직접 판매/유통업체(중국) |
|
제조 기술이전 PEG 유도체 |
공급계약 판매 |
|
|
PEGylation 기술 응용 제품 |
pegfilgrastim 바이오시밀러 |
기술이전 및 로열티 |
|
MucoPEG™ 구강건조증 치료제 |
기술이전 및 직접 판매 |
|
|
파이프라인 연구개발 제품 |
기술이전 |
(1) PEG 유도체 소재
회사의 모든 제품에 대해서 당사 홈페이지(www.sunbio.com)에 관련 정보를 게시하고, 국내외 영업은 당사 생체고분자 사업부에서 담당하고 있습니다. 해외영업은 주로 고객사 방문, 해외 학술회의 참석, 인적네트워크를 통한 이메일, 유선을 통해 당상 홈페이지를 홍보하고 제품을 판매를 하고 있습니다.
국내영업은 당사 홈페이지(www.sunbio.com) “ORDER & INQUIRIES” 및 유선을 통해 주문을 받고 있으며 별도의 영업부서는 없으며 생체고분자 사업부 내에 마케팅 업무 담당자가 주문 수주 및 제품발송을 담당하고 있습니다. 그 외 국내 학술회의 참석 및 고객사 방문을 통하여 제품을 홍보하고 있습니다.
(2) 호중구 감소증 치료제 pegfilgrastim 바이오시밀러
당사의 pegfilgrastim 바이오시밀러 제품은 기술이전 업체인 Intas사 및 Intas 자회사 Accord Healthcare, 그리고, 캐나다 Apotex 사의 자회사인 Apobiologix 사가 판매하고 있습니다.
(3) 구강건조증 치료제 MucoPEG™
중국 내 판매를 위해 Guangzhou Bairui 사의 자회사인 PharmaSolution사에 MucoPEG을 기술이전 하였으며, 중국 내 구강건조증 환자를 대상으로 한 임상시험 및 제품 승인을 준비하고 있습니다. 중국내 허가 획득 후, Guangzhou Bairui(PharmaSolution사)가 홍콩과 마카오를 포함한 중국내 판매를 담당할 예정입니다.
미국내 판매를 위해 미국 내 구강 건조증 환자들을 대상으로 GSK사의 Biotene 가글 제품과 당사의 MucoPEG 비교 임상 결과를 바탕으로 기술이전을 통한 판매를 진행할 예정입니다.
라. 판매경로
(1) PEG 유도체 소재
당사의 PEG 유도체 소재 제품은 2010년부터 중국과 동남아 시장은 주로 Guangzhou Bairui 사(유통업체)를 통해 판매하였으며, 2018년 이후 중국 매출의 대부분을 차지하고 있습니다. 그 외, 국내 및 해외 판매는 중간 도매상이나 유통업체를 통하지 않고 직접 최종 고객에게 판매하고 있습니다. 중국 유통업체를 통한 판매경로 및 직접판매에 따른 매출액 비중은 아래와 같습니다.
| (단위: 천원) |
|
년도 |
매출유형 |
품목 |
구분 |
판매경로 |
판매경로별 매출액 |
|---|---|---|---|---|---|
|
2021년도 |
제품 |
PEG 유도체 |
수출 |
직접판매 |
6,757,584 ($5,863,975) (96.76%) |
|
유통업체(중국) |
182,826 ($163,340) (2.62%) |
||||
|
국내 |
직접판매 |
43,134 (0.62%) |
|||
| 2022년도 (제26기) |
제품 |
PEG 유도체 |
수출 |
직접판매 |
4,891,074 ($3,738,975) (89.19%) |
|
유통업체(중국) |
552,697 ($433,500) (10.08) |
||||
|
국내 |
직접판매 |
40,020 (0.73%) |
|||
| 2023년도 (제27기 3분기) |
제품 |
PEG 유도체 |
수출 |
직접판매 |
5,943,020 ($4,571,175) (95.66%) |
|
유통업체(중국) |
224,599 ($168,000) (3.62) |
||||
|
국내 |
직접판매 |
44,845 (0.72%) |
(2) 구강건조증 치료제 MucoPEG™
MucoPEG 제품은 중국 및 미국의 기술이전 업체를 통한 판매를 진행할 예정입니다.
마. 판매전략
(1) PEG 유도체 소재
당사는 홈페이지(www.sunbio.com)의 PEG-PRODUCTS 카테고리에 PEG 유도체 소재 및 PEGylation 기술을 통한 신약개발, 전략적 제휴, 제품 홍보를 통해 영업을 하고 있습니다. PEG 유도체 소재는 당사 홈페이지를 통한 주문 및 직접 주문에 따라 고객의 요구에 맞추어 소량(g) 다품종 및 대량생산(kg), 그리고 GMP 수준급의 대량 생산을 통해 고품질의 제품을 판매를 하고 있습니다. 200여 종의 PEG 유도체 소재는 합성 방법과 분리정제 공정 등에 따라 판매가는 상이합니다.
바이오/제약 등, 바이오의약품의 확대에 따른 PEG 유도체 소재의 사용이 증가할 것으로 예상하며, 특히 2019년 코로나-19 펜데믹 상황의 백신을 위한 mRNA 전달체 원료로 당사의 PEG 유도체 소재가 판매되며 당사의 PEG 유도체 소재 생산 및 품질 수준이 한 번 더 검증되었으며, 이에 맞추어 PEG 유도체 소재 영업을 활발히 하고 있습니다.
(가) 미국 및 유럽지역 영업전략
해외 학술회의 및 박람회 등을 통하여 PEG 유도체 소재 및 당사의 PEGylation 기술 제품(Pegfilgrastim 바이오시밀러, MucoPEG), 그리고 당사를 홍보하고있습니다. 앞으로도 박람회 및 전시회의 참여로 당사의 생체고분자 PEG 유도체 소재들에 대한 홍보 및 PEGylation 기술 관련 업계의 최신동향을 파악하여 경쟁력 있는 새로운 PEG 유도체의 합성 및 PEGylation 기술 응용 신제품 개발로 영업을 확대할 계획입니다.
(나) 중국 및 동남아 제 3세계 시장 영업전략
중국 내 의약품 관련 영업망을 구축하고 있는 광저우 바이루이와 중국내 당사 PEG 제품의 영업을 진행하고 있으며, 이 회사를 통하여 동남아 및 제 3세계 시장 진출도 병행하여 진행하면서 적극적으로 영업망을 확대하고 있습니다. 광저우 바이루이사를 통한 중국내 매출이 연간 4억원 정도이며, 현재는 중국의 End user들이 임상을 진행하고 있어서 판매량이 많지 않으나, 점차 End user들의 임상이 성공하여 시장에 최종의약품이나 의료기기가 출시되면 판매량이 기하급수적으로 증가할 것을 예상합니다.
(다) 국내시장 영업 전략
국내 제약회사 및 대학 기관과 공동 연구 및 기술제휴를 통하여 새로운 매출을 창출할 수 있도록 추진하며, 국내 학술회의 및 박람회 참석으로 현재 시장동향 및 기술동향을 파악하여 이에 부응할 수 있는 새로운 제품 설계 및 개발을 진행할 것입니다.
(라) 새로운 PEG 유도체 소재 및 PEGylation 기술 적용 제품 개발
당사는 (ISO 9001의 규정에 따라) 매년 1건 이상의 제품 품질 개선 및 새로운 PEG 유도체 소재의 신제품 개발을 시행하고, 관련 제품을 특허화 하고 있습니다. 이는 국내외 저널 및 관련 뉴스들을 통하여 최신 기술 동향을 파악하고 신제품을 개발함으로써 매출을 향상시켜 나갈 것입니다.
(2) 호중구감소증치료제 pegfilgrastim 바이오시밀러
캐나다 시장에서 pegfilgrastim 바이오시밀러로 가장 먼저 허가/판매되고 있는 당사 제품 Lapelga™는 캐나다의 넘버원 제네릭 제약사 Apotex사의 자회사인 Apobiologix사가 담당하고 있으며, 모회사 Apotex의 탄탄한 마케팅력을 기반으로 고객 확보를 진행 중입니다.
유럽 시장에서 당사의 제품 Pelgraz®는 Accord Healthcare (Intas 사의 유럽 판매전문 자회사)가 판매하고 있으며, Accord는 전 세계 70개국 65개에 이르는 EMENA(Europe, Middle East & North Africa) 시장에서 영업 활동을 하고 있으며, 이미 유럽시장에서 10여 개의 바이오의약품 등을 판매하며 마케팅 및 기업이미지가 좋은 회사로서 알려져 있어, 영국, 유럽연합, 중동 및 북아프리카 등의 판매에 유리합니다.
(3) 구강건조증 치료제 MucoPEG™
당사의 MucoPEG은 미국 및 중국의 판매를 위해 기술이전 로열티 수익 및 주성분 PEG 유도체 소재 판매 수익을 바탕으로 제품과 주성분 원료를 판매할 계획입니다.
먼저 미국의 판매를 위해 MucoPEG의 기술이전 파트너사들과 기술이전을 논의하는 과정에서 MucoPEG의 임상자료 요청이 있었습니다. FDA는 MucoPEG의 510(k) 획득 과정에서 임상자료를 요구하지 않았으나, 당사는 MucoPEG의 기술이전과 마케팅 효과를 극대화하기 위해 미국 내 구강 건조증 환자들을 대상으로 GSK사의 Biotene 가글 제품과 당사 MucoPEG의 비교 임상을 계획하였습니다. 당사는 비교 임상 결과를 바탕으로 MucoPEG의 효과가 미국시장 점유율 1위의 Biotene 제품과 비교하여 효과 동등성 및 우수성이 검증된다면, 파트너사와의 기술이전시 MucoPEG의 기술 우위를 입증하여 기술의 가치평가를 높이고자 합니다. 그리고 기술이전 사업화 지원 및 협상 전략 지원을 위해 전문 컨설팅 업체인 미리어드생명과학과 계약을 체결(2021.10.22)하여, 라이센싱 파트너사 발굴부터 최종 협상까지 전문 자문을 통해 기술이전 계약을 체결할 계획입니다.
또한, 중국 내 판매를 위해 2020년 12월 중국 PharmaSolutions사(Guangzhou Bairui사 자회사)과 MucoPEG의 제조기술이전 및 중국시장 판권을 부여하는 계약체결 후, MucoPEG 중국내 의료기기 등록을 위해 광둥성 NMPA(National Medical Products Administration: 전CFDA)에 제출할 심사서류 및 품질검사를 위한 MucoPEG(blank label) 300 packets 발송(2021.08.18) 한 후, 심사결과를 기다리고 있습니다. 그리고, PharmaSolutions사는 MucoPEG의 적용증 확대의 차원에서 건조한 점막의 보습효과 즉, 인체 외부로부터 접근 가능한 점막부위인 구강, 비강, 질 점막의 보습효를 추가적으로 계획하고 있습니다.
5. 위험관리 및 파생거래
본 사항은 동 공시서류의 III. 재무에 관한 사항 > 5. 재무제표 주석 > 주석 3. 위험관리를 참조하시기 바랍니다.
6. 주요계약 및 연구개발활동
가. 주요 기술이전 내역
공시서류 작성기준일 현재 당사가 체결한 라이센스아웃(License-out) 계약 중 수익발생하는 계약 현황은 다음과 같습니다.
<라이센스아웃 계약 총괄표>
|
품 목 |
계약상대방 |
대상지역 |
계약체결일 |
계약종료일 |
총계약금액 |
지급금액 |
진행단계 |
| P1MAL-5 | Quidel (미국, 구 BioSite, Inc.) |
- | 2005.10.25 | 2010.10.24 | $140,000 | $140,000 | 제품 판매 |
| 호중구 감소증 치료제 |
Intas Pahrmaceuticals Ltd. (인도) |
전세계 | 2013.07.15 | 종료기간 없음 ;마케팅 종료시 |
$900,000 | $650,000 | (주1) |
| MucoPEG | Pharmasolution Limited (중국) |
중국 | 2020.12.25 | 종료기간 없음 ;마케팅 종료시 |
$350,000 | $175,000 | (주2) |
|
합 계 |
$1,390,000 |
$965,000 |
- |
||||
| 주1) | 현재 인도, 캐나다, 유럽 등 지역에서 판매 중이며, 미국 내 판매를 위한 품목허가 심사 중에 있습니다. 미국 품목 허가시 마일스톤 $250,000 수취할 예정입니다. |
| 주2) | 중국 내 판매를 위한 준비 중이며, 중국 판매 허가시 마일스톤 $175,000 수취할 예정입니다. |
(1) PEG 유도체 소재; P1MAL-5 관련 Quidel사 기술이전
당사는 2005년 11월 3일 Quidel(BioSite, Inc.)과 P1MAL-5 PEG 유도체의 제조기술이전 및 공급계약을 체결하였습니다. 해당 PEG 유도체 제품은 2003년 당사가 미국특허로 등록(US 6828401 B2 Preparation method of peg-maleimide derivatives)한 특허품목이며, 당사가 제조하여 Quidel(Biosite)에 공급하는 것이며, 이 제품의 제조공정 및 분석방법에 관한 기술을 공유하고, 공급계약을 체결 한 것입니다. 이 제품은 Biosite의 다양한 진단 기기의 제조에 사용되었으며, 인수 합병과정을 거치면서도 관련 제품은 인수합병의 주된 품목으로 작용하여 현재까지 꾸준히 당사의 P1MAL-5 유도체 소재가 사용되고 있습니다.
[P1MAL-5 관련 Quidel사 기술이전(수출) 계약 주요 내용]
|
구분 |
내용 |
|---|---|
|
① 계약상대방 |
Biosite Incorporated (미국) |
|
② 계약내용 |
PEG 제품 (methoxy PEG-maleimide, 5,000 Da)에 대한 공급 계약 및 기술 이전 |
|
③ 대상지역 |
- |
|
④ 계약기간 |
계약체결일: 2005. 10. 25. 계약종료일: 2010. 10. 24 |
|
⑤ 총계약금액 |
1. 계약금: 미화 $140,000 2. 추가금: 미화 $100,000 (DMF Filing Fee) 별도 |
|
⑥ 수취금액 |
<반환의무 없는 금액> |
|
⑦ 계약조건 |
1. 계약금: 미화 $140,000 (수취조건: 계약체결 후 5 영업일 이내 수취) 3. 명시된 PEG 제품에 대한 공식 구매 주문시 배송 보장. *계약체결일로부터 90일 경과전까지 기술이전 완료. |
| ⑧ 회계처리방법 |
1. 계약금 일시 수익 인식 |
| ⑨ 대상기술 | methoxy PEG-maleimide, 5,000 Da PEG 제품의 고순도 높은 반응기 활성의 합성방법, 분석 및 분석방법 개발, 분석방법 벨리데이션 기술 |
| ⑩ 개발진행 경과 | <Biosite사> Biosite의 다양한 진단 기기의 제조에 당사의 PEG 유도체 제품이 사용되었으며, Quidel사로 인수 합병 된 후에도 PEG 유도체 제품 공급을 유지하고 있음 <선바이오> PEG 제품의 제조방법에 대한 기술이전 완료 후 현재까지 PEG 유도체 제품 공급 중 |
| ⑪ 기타사항 | 해당 계약 관련하여 2003년부터 현재까지 PEG 유도체 제품 매출이 발생하고 있음 |
(2) 호중구 감소증 치료제 pegfilgrastim 바이오시밀러
바이오시밀러 전문 개발제조사인 Intas는 PEGylaion 기반 바이오시밀러 제품 개발을 위하여, C형 간염치료제(PEG-interferon), 호중구감소증치료제(Pegfilgrastim) 등 바이오시밀러 제조에 필요한 PEG유도체 원료 및 이의 PEGylaion 기술에 대해 기술 실사(due diligence)를 수행하였고, 2003년 11월 기술이전 및 공급 계약을 체결하였습니다. 그 후 Intas사의 담당 Dr. Patankar과 시험결과를 공유하며 기술개발을 진행, 2004년 8월 ~ 9월 2개월간 Intas의 연구진 2명이 동사 체류하며 해당 Pegfilgrastim 제조공정 기술을 습득하였습니다. 그 다음해 2005년 2월, 동사 노광 대표와 당시 바이오팀장이 Intas 사를 직접 방문하여 Pegfilgrastim의 기술이전 후 습득 상황을 확인, 향후 PEG 유도체 원료 공급에 대한 일정 및 추후 개발 일정을 논의하였습니다. 2006년 인도 내 허가를 위해 원료 PEG 유도체 관련 허가자료(제조, 분석 등)를 전달하였으며, 2007년 7월 인도 승인(제품명: Neupeg™) 후 인도와 제3시장의 판매가 이루어 졌습니다. 세계 최초의 Pegfilgrastim 바이오 제네릭(바이오시밀러)의 승인이였으며, 2008년 5월부터 해당 제품 매출에 대한 로열티 5%를 수령하기 시작하였습니다.
2013년 11월 기존의 2003년 계약의 범위였던 “인도 및 아시아(한국, 일본 제외), 아프리카, 오세아니아 내 국가”에서 계약의 범위를 전세계로 확대하는 개정 계약을 체결하였습니다. 해당 변경계약을 통해 추가 기술료를 지급받았으며, 마일스톤 및 로열티율에 대해 별도 합의하였으며, 이에 관한 상세한 내용은 다음과 같습니다.
[Pegfilgrastim 관련 Intas사 기술이전(수출) 계약 주요 내용]
|
구분 |
내용 |
|---|---|
|
① 계약상대방 |
Intas Pahrmaceuticals Ltd.. (인도) |
|
② 계약내용 |
PEG-GCSF(Pegfilgrastim) 개발 프로젝트를 함께 수행하고, PEG-GCSF의 개발에 적용되는 PEGylation 기술의 이전, PEG-GCSF 생산에 필요한 PEG 제품 공급에 대한 계약 체결(2013 개정안) |
|
③ 대상지역 |
개발 및 기술이전한 PEG-GCSF의 판매 대상지역 ; PEG-GCSF의 개발 및 기술을 비독점적으로 사용, 세계적인 권리로 확대. (당사자 쌍방에게 비독점적) |
|
④ 계약기간 |
계약체결일: 2003.11.11. (개정계약 변경일:2013. 07. 15) 계약종료일: 양사간의 사전 서면 승인 없이 계약 종료 불가. |
|
⑤ 총계약금액 |
미화 $900,000, (개정계약 포함, 로열티는 별도) |
|
⑥ 수취금액 |
<반환의무 없는 금액> 개정계약금(Amending Agreement Fee): 미화 $300,000(원화 318백만원)을 2013년 11월 수취함 |
|
⑦ 계약조건 |
계약금(Upfront Fee): 미화 $150,000 개정계약금(Amending Agreement Fee): 미화 $300,000 - 수취조건: EU 마케팅 권한 부여 후($200,000), US 제품승인($250,000) * 양사가 합의한 책임과 일정에 따라 합작 개발 프로젝트를 수행. 2013 계약 변경시 * PEG-GCSF에 대한 용어 개정 (SunBio PEG 제품이 연결된 Intas가 제조한 GCSF를 의미) * PEG-GCSF 라이센싱을 Intas가 3자에게 2차 라이센스 가능. 단 3자는 SunBio로부터 PEG 제품을 직접 구매. *공급조건, 생산현장 변경, 검사, 인증에 대한 내용 추가. *로열티 지급조건 변경 *계약기간의 변경 및 종료내용 삭제 (Intas가 SunBio의 PEG 제품을 이용한 PEG-GCSF를 시장거래 하는 동안 계속 효력 지속 및 갱신 항목 삭제) |
| ⑧ 회계처리방법 |
계약금 및 마일스톤 : 기술료수입으로 일시 수익 인식 |
| ⑨ 대상기술 | 당사가 생산한 PEG 유도체소재인 P1PAL-20(미국특허 등록)을 이용한 N-term PEGylation기술을 GCSF(filgrastim)에 적용하여 고순도의 Pegfilgrastim을 제조, 분리 정제 하는 기술 |
| ⑩ 개발진행 경과 | <Intas 사> 당사의 기술이전 후, 2007년 7월 인도 판매승인(제품명:Neupeg), 2009년~2014년 유럽 및 미국 임상완료, 2018년 4월 캐나다 판매승인(제품명:Lapelga), 2018년 9월 유럽 EMA 판매승인(제품명 Pelgraz), 2019년 8월 호주 판매승인(제품명 Pelgraz), 2021년 11월 멕시코 판매승인(제품명 Pelgraz) 2019년 7월 미국 심사서류 제출 후 판매허가 심사중. <선바이오> Intas사에 기술이전 후 PEG 유도체 소재 P1PAL-20의 대량 생산 및 GMP 수준의 품질을 위해 생산시설 확대 구축 후 2018년 2월 EMA QP(Quality Person)의 실사(audit) 완료. P1PAL-20 PEG 유도체 제품을 Intas사에 공급 중. |
| ⑪ 기타사항 | 해당 계약 관련하여 2003년부터 현재까지 PEG 유도체 제품 매출이 발생하고 있음 |
(3) 구강건조증 치료제 MucoPEG™
당사는 2020년 12월 25일 PharmaSolution 사(Guangzhou Bairui 자회사)와 MucoPEG™ 구강건조증 치료제의 제조기술 이전 및 동 제품의 중국시장(홍콩 및 마카오 포함)에 대한 판권 부여 계약을 체결하였습니다. 본 계약의 주요 내용은 아래와 같습니다.
[MucoPEG 관련 PharmaSolution사 기술이전(수출) 계약 주요 내용]
|
구분 |
내용 |
|---|---|
|
① 계약상대방 |
Pharmasolution Limited (중국) |
|
② 계약내용 |
MucoPEG 제품에 대한 제조방법, 분석 및 분석 밸리데이션 방법, GMP 기준 준수 및 문서화 그리고 특허와 상표 사용에 대한 기술이전 계약 |
|
③ 대상지역 |
마케팅 지역은 홍콩, 마카오를 포함한 중국 시장 전체 |
|
④ 계약기간 |
계약체결일: 2020. 12. 25. 계약종료일: Pharmasolution 사가 MucoPEG에 대한 중국 내 마케팅 종료시까지. |
|
⑤ 총계약금액 |
Licensing Fee: 미화 $350,000 달러 로열티: 제품 생산 및 API 제공에 따른 로열티 지급 ($1/packet) |
|
⑥ 수취금액 |
<반환의무 없는 금액> 계약금(Licensing Fee): 미화 $175,000(190백만원)을 2021년 1월 수취함 |
|
⑦ 계약조건 |
계약금(Licensing Fee): 미화 $175,000 - 수취조건: 계약체결일로부터 2주 이내에 지급.
로열티: Pharmasolution이 중국 내 직접 생산시 API에 대한 로열티 지급 ($1/packet), API(PEG 유도체) 직접 생산시에도 로열티 지급 ($1/packet), 로열티 리포트 제공(다음 해 2월 1일 제공).
- MucoPEG의 중국 시장(홍콩 및 마카오 포함)에 대한 독점 판매권 제공. - 중국 내 임상진행 시 인허가에 필요한 자료 및 임상시험용 MucoPEG은 무상으로 당사가 제공. - 2021년 MucoPEG 50,000 packet 선주문 생산($2.65/packet) - Pharmasolution 사가 MucoPEG에 대한 중국 내 마케팅 종료시 계약 종료 |
| ⑧ 회계처리방법 | 계약금: 기술료수입으로 일시 수익 인식 제품판매 매출: 제품매출로 수익 인식 |
| ⑨ 대상기술 | 당사가 생산하는 PEG 유도체소재인 PEG-SG를 주원료로 구강건조증을 완화하는 제품, 보습제인 PEG-SG와 구강내 점막의 공유결합으로 구강내 보습 지속 효과가 증가된 기술 |
| ⑩ 개발진행 경과 | <Pharmasolution> 2020년 12월 중국 광저우내 구강건조증 환자를 대상으로 소규모 예비임상 진행, 중국 식약처 품목 심사 준비 중. <선바이오> 2018년 MucoPEG™ 허가를 위한 GMP 기준의 생산시설을 갖추고, 2019년 1월 생산 개시, 2019년 11월 5일 US FDA 510(k) 판매허가 (Market Clearance Letter)획득. 2021년12월 마케팅을 위해 경쟁사 GSK Biotene 제품과 미국내 비교임상 시험 진행 (임상시험결과보고서 23년 4~5월 예정) |
| ⑪ 기타사항 | 해당 계약 관련하여 2021년에 제품 매출이 발생하였음 |
(4) 기타 기술이전 내역
당사의 과거 기술이전 실적 중 현재는 종료되어 유효하지 않은 실적 및 그 사유들에 대해 간단히 요약한 내용은 다음과 같습니다.
|
품목 및 관련제품 |
계약상대방 |
계약 내용 |
계약 |
계약 종료일 |
계약금액 |
수수(지급)방법 |
진행 경과 |
|
PEG-IFNα2b |
Intas Pharmaceuticals Ltd.(인도) |
PEG-IFNα2b 개발에 적용되는 PEGylation 기술이전 및 PEG 유도체 공급 |
'03.11.05 |
'08.11.04 |
계약금 |
계약금 전액 수령하여 기술료수입으로 회계처리 (2003.11) |
타사의 C형 간염 완치제의 출시로 인하여 Launching 포기 |
|
PEG-GCSF, PEG-IFN, PEG-EPO |
Serum Institute of India, Ltd. (인도) |
PEG-GCSF, PEG-INF, PEG-EPO의 개발을 위한 기술이전 및 PEG 유도체 공급 계약 |
'04.06.21 |
'09.06.17 |
계약금 |
계약금 전액 수령하여 기술료 수입으로 회계처리 (2004.06) |
SII 내부 결정으로 관련 기술이전 제품 연구중단 |
|
Adamantane- |
Calando Pharmaceuticals Inc. (미국) |
Adamantane-PEG-Lactose의 개발을 위한 공동개발 및 PEG 유도체 공급 계약. |
'05. 08.15 |
'10.08.14 |
계약금 |
계약금 전액 수령하여 기술료 수입으로 회계처리 (2005.08, 2005.11) |
2008.02, Arrowhead research Corp. |
|
P1SH-2 |
BioSite, Inc. (미국) |
P1SH-2의 제조기술이전 및 공급계약 |
'05. 10.25 |
'10.10.24 |
계약금 추가금(DMF Filing) |
계약금 USD 140,000 수령하여 기술료 수입으로 회계처리 (2005.11), 추가금은 DMF Filing을 진행하지 않아 수령금액 없음 |
2007.05, Alere,Inc 인수합병, 연구중단 |
|
Transferrin-PEG-Adamantane |
Calando Pharmaceuticals Inc. (미국) |
Transferrin-PEG-Adamantane의 개발을 위한 공동개발 및 PEG유도체 공급 계약. |
'05. 12.07 |
'10.12.06 |
계약금 |
계약금 중 USD100,000수령하여 기술료 수입으로 회계처리 (2005.12) USD75,000은 목표를 달성하지 못해 수령금액 없음 |
2008.02, Arrowhead research Corp. |
|
P2AC-3 |
Cartilix, Inc. (미국) |
P2AC-3의 제조기술이전 및 공급계약. |
'06. 04.10 |
'13.04.09 |
계약금 추가금(DMF Filing) |
계약금 및 추가금 수령하여 기술료 수입으로 회계처리 (2005.11, 2006.04) |
2009.11, BioMet 인수합병, 연구중단 |
나. 연구개발 활동
(1) 연구개발조직
 |
|
연구개발 조직도 |
당사는 PEGylation 기술을 이용하여 다양한 응용제품을 연구개발하는 연구개발본부(바이오신약사업부 및 임상연구팀) 조직을 중심으로 공인 기업부설연구소를 설립 신고하였으며, 현재까지 20년 이상 공인 기업부설연구소를 운영해오고 있습니다.
|
구분 |
팀명 |
업무내용 |
|
연 구 개 발 본 부 |
연구소장 |
- 연구개발 계획수립 및 R&D 운영 총괄 - 제품개발 계획 및 단계별 설계 검토 - 사업화 기획업무 지원 - 공동 연구개발 관련 대외 업무 총괄 |
|
바이오개발관리부 |
- PEGylation 연구 및 기술개발 - 신약/신제품 개발 및 단계별 진행 - 인허가 전략 수립 및 일정관리 - 신규 정부 R&D 프로젝트 검토 및 연구기획 - PEGylation 기술관련 특허 관리 - 개발 제품 임상시험 계획 및 설계 - 임상시험 관리 |
|
| 바이오연구부 |
- PEGylation 연구 및 기술개발 - 신약/신제품 개발 및 단계별 진행 - 개발 제품 비임상 독성 및 효력 시험 - 신규 PEG 유도체 소재 안전성 시험 |
|
| 사업개발본부 | 생체고분자사업부 | - PEGylation 신기술 개발 - 신규 PEG 유도체 연구 개발 - 신규 PEG 유도체 소재 안정성 시험 - 생체고분자 생산기술 개발 |
(가) 연구개발 인력 현황
당사의 기업부설 연구소 연구소장인 노광 대표의 연구개발 총괄 책임을 바탕으로 PEGylation 기술관련 연구개발 및 기술이전의 다양한 성과를 이루었으며, 바이오신약사업부와 임상연구팀으로 구성되어 있습니다. 현재의 연구개발 핵심인력인 해당 기술 분야의 근무 년 수 10년 이상의 연구원들과 노광대표의 PEG 유도체 및 PEGylation 기술의 사업화 기획력을 바탕으로, 당사는 다양한 PEGylation 기술 응용 제품을 개발 및 계획하고 있습니다. 또한, 관련 분야의 기술 경향들을 모니터하고 업데이트, 공유하며 새로운 원천적인 기술 또는 제품 아이디어를 제안한 발명자에게 격려금 지급의 인센티브 구조를 운영하며 연구력을 향상시키고 있습니다. 당사 기업부설연구소 인원 현황은 다음과 같습니다.
| [기업부설연구소 인력 현황] |
|
구분 |
박사 |
석사 |
학사 |
계 |
|
|
연구소장 노광 대표 |
바이오개발관리부 | 1 | 1 | 0 | 2 |
| 바이오연구부 | 0 | 4 | 0 | 4 | |
| 생체고분자 사업부 | 0 | 2 | 0 | 2 | |
| 합계 | 1 | 7 | 0 | 8 | |
| 주1) | 대표이사 포함 부서 겸직 임원의 경우 포함하여 기재하였습니다. |
| 주2) | 생체고분자사업부 인력 중 연구개발 주요 인력을 기재하였습니다. |
(나) 핵심 연구인력
당사의 핵심 연구인력은 연구소장인 노광 박사와 연구경력 10년 이상의 수석연구원들, 그리고 당사에 장기 근속중인 석사이상 연구인력들이 연구개발에 참여하고 있습니다.
연구소장인 노광 박사는 미국 Rutgers 대학에서 생명공학 박사학위를 취득하였으며, 당시 지도교수인 Dr. Frank F. Davis 와 Dr. Abraham Abuchowski 교수는 1977년 최초로 PEGylation 기술을 연구개발하여 현재 "PEGylation의 아버지"로 평가되고 있습니다. 박사학위 취득 후 노광박사는 지도교수 Davis 교수가 창업한 Enzon 사에서 R&D Project Leader로서 근무(1988-1996)하며 Schering-Plough 사와 함께 C형 간염 치료제인 PEG-interferon alpha (PegIntron®)를 공동 개발하였고, PEG-hemoglobin 등과 같은 다양한 프로젝트를 수행하여 다수의 특허, 논문 그리고 관련서적을 발표하는 등 많은 연구개발 성과를 이루었습니다. 그리고, 현재까지 약 30여년간 PEGylation 원천기술을 바탕으로 다양한 의약품 개발 및 응용연구를 하고 있습니다.
[핵심 연구인력 현황]
| 직위 | 성명 | 담당업무 | 주요경력 | 주요 연구실적 |
| 연구 소장 (대표 이사) |
노광 | 연구총괄 |
[학력] |
[재직 전 연구실적] |
| 부장 (수석 연구원) |
현창민 | 생체고분자 사업부-연구부 | [학력] '97~'99 숭실대 화학과 석사 [주요경력] '99-현재 선바이오㈜부장(수석 연구원) |
[재직전 연구실적] - 사이클로트리베라트릴렌을 기반으로 하는 새로운 컨테이너 호스트의 합성 및 특성화 [재직 후 연구실적] -다중암 폴리에틸렌글리콜(Multi-arm Polyethylene glycol(PEG)및 유도체 개발 -PEG 다양한 유도체 소재 합성연구 -고분자 약물 및 약물전달 시스템 연구 -신규 PEG 유도체 개발 및 합성법 연구 -PEG-lipid 합성 법 연구 -국가과제 3건, 특허 출원및 등록22건 |
| 부장 (수석 연구원) |
이정훈 | 생체고분자사업부 -마케팅팀 |
[학력] '97~'99 경희대 화학과 석사 [주요경력] '99-현재 선바이오㈜부장(수석 연구원) |
[재직전 연구실적] - cis-Fused 된 β-alkoxy cyclic ether의 합성 [재직 후 연구실적] -다중암 폴리에틸렌글리콜(Multi-arm Polyethylene glycol(PEG)및 유도체 개발 -PEG 다양한 유도체 소재 합성연구 -고분자 약물 및 약물전달 시스템 연구 -신규 PEG 유도체 개발 및 합성법 연구 -PEG-lipid 합성 법 연구 -국가과제 3건, 특허 출원및 등록22건 |
| 부장 (수석 연구원) |
안민정 | 개발관리 |
[학력] |
[재직 전 연구실적] -PEG-IFN, PEG-EPO, PEG-GCSF의 PEGylation 연구 및 단백질 분리정제 방법 개발 - 히알루론산을 함유하는 PEG 하이드로젤 시스템으로 구성된 연골 활액 충진제 연구 개발 -PEG-Hb 의 PEGylation 연구 및 분리정제 개발 -국가과제 2건, 특허 출원 및 등록 17건 |
| 실장 (책임 연구원) |
손병희 | 연구 | [학력] '00~'05 순천향대학교 유전공학 학사 '05-'07 순천향대학교 생명공학 석사 [주요경력] '07-'10 삼성생명과학연구소 임상의학연구센터 연구원 '10-현재 선바이오㈜실장(책임 연구원) |
[재직 전 연구실적] - 혈전용해효소를 생산하는 미생물의 분리/동정 및 생리학적 특성에 관한 연구 -TNT 극민감성 미생물인 Pseudomonas sp.의 분리/동정과 TNT 분해능을 가진 미생물의 프로테옴 분석에 관한 연구 - Bacillus licheniformis의 혈전용해 효능 및 프로테옴 분석에 관한 연구 - HFD로 유도된 인슐린 저항성 및 2형당뇨 동물모델에서의 TZDs 계열 약물의 효능 검증에 관한 연구 - PPAR 계열 약물의 Glocose 자극에 의한 인슐린 분비 경로에 관한 연구 - 2형당뇨 동물에서의 Metabolism 분석을 위한 수술적 시술 개발 및 외과적 처치방법 개발 -연구과제 12건, 연구논문 14건 [재직 후 연구실적] - PEG를 유효성분으로 하는 구강건조증 예방 치료 또는 개선을 위한 구강 청정 의약 조성물 개발 - 히알루론산을 함유하는 PEG 하이드로젤 시스템으로 구성된 연골 활액 충진제 개발 - 검증된 생체친화적 졸-겔 하이드로젤 조성물을 이용한 골관절염 질환 개선 치료제 개발 - 생산품의 품질관리 연구 - 기반기술을 활용한 의약품 개발 및 기존 의약품의 약리동력 향상 연구. - 신약개발 품목 및 기술의 응용가능분야 연구 -국책과제 1건, 특허 출원 및 등록 12건 |
| 과장 (책임 연구원) |
황선구 | 연구 |
[학력] |
[재직 전 연구실적] - PEG를 유효성분으로 하는 구강건조증 예방 치료 또는 개선을 위한 구강 청정 의약 조성물 연구개발 - 히알루론산을 함유하는 PEG 하이드로젤 시스템으로 구성된 연골 활액 충진제 연구 개발 -PEG-Hb 의 PEGylation 연구 및 분리정제 개발 |
(2) 연구개발비용
(가) 연구개발비용
| (단위: 천원, %) |
|
구 분 |
2021년 |
2022년 |
2023년 (제27기 3분기) |
|
|
비용의 성격별 분류 |
원재료비 |
114,401 |
90,753 | 137,786 |
|
인건비 |
347,131 |
331,273 | 239,635 | |
|
감가상각비 |
162,457 |
148,719 | 112,109 | |
|
위탁용역비 |
- |
- | - | |
|
기타 |
587,559 |
694,592 | 285,213 | |
|
연구개발비용 합계 |
1,211,548 |
1,265,336 | 774,744 | |
|
회계처리 내역 |
판매비와 관리비 |
1,211,548 |
1,265,336 | 1,824,673 |
|
제조경비 |
- |
- | - | |
|
개발비(무형자산) |
- |
- | - | |
|
회계처리금액 계 |
1,211,548 |
1,265,336 | 1,824,673 | |
|
정부보조금 |
- |
(157,875) | (166,690) | |
| 정부보조금 차감후 연구개발비용 |
1,211,548 |
1,107,461 | 1,657,983 | |
| 매출액 | 9,964,994 | 7,420,394 | 9,533,540 | |
|
연구개발비 / 매출액 비율 [연구개발비용합계÷당기매출액×100] |
12.16 |
14.92 | 17.39 | |
(나) 연구개발 투자규모 및 비중
| (단위: 천원) |
|
년도 |
2021년 |
2022년 (제26기) |
2023년 (제27기 3분기) |
|---|---|---|---|
|
매출액 |
9,964,994 | 7,420,394 | 9,533,540 |
|
경상연구비 |
1,211,548 | 1,265,336 | 1,824,673 |
|
연구비율(%) |
12.16% | 17.05% | 19.14% |
당사의 바이오 신약관련 파이프라인 개발을 위해 2018년 분석 및 제조시설(MucoPEG 공정실) 투자를 단행하였으며, 효능 및 독성시험을 위해 외부 CRO 업체(비임상연구소 2개 업체) 및 한양대 약대, 중앙대 약대 연구팀 등 다양한 연구교류 및 개발을 진행하고 있습니다.
향후 연구개발 관련 pipeline들의 전임상 및 각 파이프라인의 scale up 생산을 계획하고 있습니다. 각 파이프라인들은 1년여에 걸친 전임상 및 효력시험으로 안전성을 확인하고, scale-up 생산의 수율 및 순도를 확인하는 생산 공정 set-up이 이루어질 예정입니다. 생산공정에 따라 분리정제 시스템, 분석 장비, 생산장비 등을 추가하여 여러 pipeline 제품의 생산효율을 증가시킬 계획입니다.
또한 더욱 활발한 연구를 위해 석박사급 연구원의 추가 채용을 진행하며 연구인력 및 시설 확충을 위해 적극적으로 투자를 진행하고 있습니다.
(3) 연구개발실적
(가) 연구개발 진행 현황 및 향후 계획
공시 서류 작성 기준일 현재 당사가 연구개발 완료 또는 진행 중인 신약[개량 신약, 복제약(시밀러) 등]의 현황은 다음과 같습니다.
[연구개발 완료 실적]
|
구분 |
품목 |
적응증 |
개발 |
현재현황 |
비고 |
|
|---|---|---|---|---|---|---|
|
바이오 |
바이오 |
Pelgraz® |
호중구 |
2004년 |
2007(인도), 2019(호주) |
Intas(인도)에 |
|
PEG-IFN |
C형 간염치료제 |
2004년 |
2014 인도승인 |
Intas(인도)에 |
||
|
의료 |
MucoPEG™ |
구강건조증 완화 |
- |
2019년 11월 5일 |
라이센스 아웃 |
|
[연구개발 진행 총괄표]
|
구분 |
품목 |
적응증 |
연구 |
현재진행단계 |
연구 |
||
|
단계 |
승인일 |
||||||
|
바이오 |
의료 |
SynoGel |
연골활액충진제 |
2014년 |
전임상 |
- |
- |
|
신약 |
SBX |
인공혈액, 허혈성 질환치료제, 뇌졸중응급처치제 |
2015년 |
전임상 |
- |
- |
|
|
화학 |
PEG |
PEG-lipid |
백신의 전달체 원료 |
2021년 |
연구개발 |
- |
- |
당사의 여러 제품들은 치료분야 및 의약품 품목 분류에 따라 연구단계와 허가 및 제품화 기간이 상이합니다. 이에 따라 개발 완료 및 제품화가 빠른 품목 및 적용방법, 적응증 분류를 통하여 장/단기 제품화를 계획하고 있습니다.
당사의 다양한 PEG 유도체 소재 및 PEGylation 기술을 이용하여 개발 완료한 제품은 바이오시밀러 제품 2건(Pegfilgrastim, PEG-IFN; B형간염 치료제)과 바이오 의료기기 MucoPEG™ 1건이 있습니다. 이후 시장 확대를 위한 추가적인 기술이전 및 비교 임상시험 등을 계획하며, 제품의 가치와 매출 향상을 위해 꾸준히 노력하고 있습니다.
핵심 기술인 PEGylation 기술을 바탕으로 신약, 바이오시밀러, 의료기기 등 다양한 분야에서 신규 PEG 유도체 소재 및 이를 이용한 제품관련 특허를 국내외에 출원/등록하고 있습니다.
1) 품목 : MucoPEG™
| 구분 | 바이오 의료기기(미국 기준)/ 일반의약품(국내 기준) | ||||||
| 적응증 | 구강건조 증상(통증, 구취,염증,건조감)완화와 불쾌감을 덜어주고, 상쾌하게 보습하고, 구강 건조를 윤활시키는 구강 보습제. | ||||||
| 작용기전 | MucoPEG™은 PEG(polyethylene gycol) 유도체와 구강점막 상피 세포의 결합을 적용한 구강조성물로서 친수성과 보습성이 높은 PEG가 구강세표 표면에 오랜 시간 잔류하면서 구강건조증을 완화 시키는 것을 목표로 합니다. 노화 또는 질병으로 인한 구강 건조증이 있는 사람들을 위한 구강 보습효과와 보습 지속력을 증가시켜 구강건조증을 완화하는 위생 증진 조성물로 개발됨. | ||||||
| 제품의 특성 | 당사의 MucoPEG은 기존 화학합성 의약품의 타액선 자극을 통한 무분별한 타액증가의 부작용이 없으며, 일반 보습제를 이용한 일시적인 구강건조 완화효과와 비교하여 구강점막에 공유결합하여 보습지속성이 크게 증가된 제품임. | ||||||
| 진행경과 |
- 2019년 12월 미국 FDA 기준 의료기기/인공타액 제품으로 510(k) 판매허가 획득
- 2023년 3월 Bio Europe Spring 미팅 참석(미리어드 생명과학), 10여개 업체와 파트너 미팅/논의 |
||||||
| 향후계획 | - 향후 미국의 비교 임상결과에 따라 기술이전 및 주원료 PEG 유도체, MucoPEG 제품 판매 및 로열티 수익을 계획하고 있음. - 기술 및 제품의 인지도 확대를 위해 미국 구강건조증 환자를 대상으로 한 비교임상 후, 임상시험을 진행한 의료기관의 의료진을 통하여 논문으로 연구결과를 발표할 예정임. |
||||||
| 경쟁제품 | GSK, Colgate-Palmolive 사 등 oral care Mouthwashes, 인공타액 제품 등. | ||||||
| 관련논문 등 | 국내 특허 등록 및 미국특허 출원 외 해당제품 관련 논문게재 및 학회발표 사례는 없음. - 2015년 06월 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강 건조증 예방, 치료 또는 개선을 위한 구강 청정제 조성물 및 의약조성물 국내특허 등록 (제10-1526258호) - 2013년 10월 Method of Relieving, Improving, Preventing or Treating Xerostomia 미국특허 출원 (US2014/0155457 A1) - 2021년 3월 FUNCTIONALIZED POLYMERS FOR DRY MUCOSA(US17/208,075) 출원 - 2022년 5월 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강건조증 완화용 구강린스 조성물 PCT, 미국, 일본, 중국 출원 완료, 유럽, 호주, 캐나다 출원 완료 |
||||||
| 시장규모 |
전 세계 구강 건조증 치료제 시장규모는 2018년에 6억 2,530만($625.3 million) 달러로 추정되었으며, 2019년부터 2026년까지 연평균 3.6% 성장할 것으로 예상함. |
||||||
| 기타사항 | 총계약금 미화 $350,000 중 계약금(Licensing Fee) 미화 $175,000(190백만원)을 2021년 1월 수취하였으며, 중국 내 허가 완료 후 잔여계약금 미화 $175,000를 수취예정 선주문 제품판매 매출: 미화 $28,600(39백만원)을 2021년 수취함 |
2) 품목 : SynoGel
| 구분 | 바이오 의료기기(미국 기준)/ 의약품(국내 기준) |
| 적응증 | 골관절염의 통증완화를 위한 연골활액 충진제 |
| 작용기전 | 두 종류의 PEG 유도체를 이용한 하이드로젤(Hydrogel)기술로 4 개 또는 6개의 반응기를 가진 4 arm, 6 arm PEG 유도체 두 종류를 액체상태에서 혼합하여 연골강내 주사기를 이용 주입 후, 연골강내에서 각각의 반응기가 서서히 반응하여 Hydrogel을 형성하는 연골활액 충진제용 주사제로써 연골강내 국소적으로 주사하는 제품. |
| 제품의 특성 | - 기존 제품의 높은 점도로 인하여 관절(연골강) 내 투입 시 높은 돌출압에 의해 통증이 유발되는 단점을 감소시키고, 가교화 시간을 조절하여 주사 시 낮은 점도로 주입을 용이하게 함. 또한, 주입 후 연골강내에서 두 종류의 PEG 유도체가 반응하여 서서히 펩티드 결합을 형성하면서 점탄성이 우수한 수화젤을 형성하게 함으로써, 관절 내 1회 투여로 관절염 질환에 의해 유발된 통증 억제, 연골 보호 효과 및 활막 염증 억제 효과가 우수한 주사제로 개발되고 있음. - 기존제품은 다회 (3~5회) 투여로 인하여 환자의 치료 순응도가 낮아 효과 지속시간을 연장하기 위한 다양한 연구개발 시도가 진행되고 있으나, 당사의 Synogel 1회 투여로 기존 3~5회 투여 시의 효과 및 그 이상의 지속효과를 나타낸다면 환자의 순응도가 높아질 것이며, 그에 따라 과거 관절 치료를 적용할 수 없었던 환자에게도 적용이 가능해지고, 전체적으로 관절강 내 주사제 치료를 받는 환자 수가 증가하는 등의 효과를 보일 것으로 예상됨. |
| 진행경과 | - 제품개발에 적합한 물질의 탐색을 위해 당사에서 생산하는 PEG 유도체 소재 선별시험을 수행 - 선별시험을 통해 선택한 PEG 유도체의 물리적 특성 (점탄성) 측정시험 실시 (Koptri; ㈜한국고분자시험연구원) - 기존 제품의 단점을 보완한 기술의 차별적 특성 확인 - 통증완화 비교시험(비임상효력시험)을 관절염 동물모델을 이용하여 수행(Chemon; ㈜켐온) - Pilot SynoGel™의 제품화를 위한 중소기업 기술개발사업 협약체결 ; 기술혁신개발사업 - ADME Study를 위한 14C-AM 합성 제조 (Curachem; 큐라켐) - SynoGel™의 장기잔존확인 및 ADME 분석을 위한 시험 ; MPI Research - ~2019년, Wuxi Apptec.(US)에서 미국 의료기기 등록을 위한 비임상 시험 (생체적합성 시험) 완료 후 특정 시험항목의 부적합 판정 - 조성 관련 추가 연구 및 부적합 판정의 생체적합성 시험 적합성 확인, 안정성 시험 중. |
| 향후계획 | 제품의 조성관련 추가연구 및 안정성을 확인하고, 변경된 조성으로 전임상 시험(생체적합성 시험 외)을 계획함. 완료 후 미국 임상 진행 예정. |
| 경쟁제품 | Genzyme, Aimmer Biomet, Sanofi 사의 Synvisc-One®, Hyalgan®, Supartz®등 연골활액 충진제품. |
| 관련논문 등 | 국내 특허 등록 및 PCT 출원, 미국, 유럽 특허 출원 외 해당제품 관련 논문게재 및 학회발표 사례는 없음. - 2004년 SynoGel™의 전신이 되는 하이드로젤 제조방법에 대한 국내특허 등록 (제 10-0444944호) - 2016년 7월 SynoGel™ (폴리에틸렌글리콜 수화젤 주사제) 국내특허 등록 (제 10-1637883호) - 2016년 SynoGel™ (Polyethylene Glycol Hydrogel Injection) 국제 PCT 출원 (PCT/KR2016/006434) - 2017년 6월 미국특허 출원 (US 2017/0340774 A1) - 2017년 12월 유럽특허 출원 (16851972.6) - 2021년 9월 국내특허 출원 (6arm PEG 수화겔의 시간 경과에 따른 졸-겔 전환,10-2021-0120387) 2022년 9월 PCT 출원(PCT/KR2022/013531) 23년 1월 미국특허 출원(18/016,672) |
| 시장규모 | - 2022년 전 세계 점성보충제 매출 규모는 $19억 8,000만에 이를 것으로 예상됩니다. CAGR 4.8% 로 2030년까지 미화 28억 9,000만 달러의 시장 가치를 예상함.(출처:Future Market Insights Global and Consulting Pvt. 2022.04) |
| 기타사항 | 정부과제 중소기업청 과제 완료(2015.10~2018.01) |
3) 품목 : SBX 인공혈액 project
| 구분 | 바이오 신약 |
| 적응증 | - 허혈성 질환치료제, 뇌졸중 응급처치지, 당뇨병성 망막증 치료제, 당뇨병성족부궤양치료제 등 허혈부위의 용이한 산소공급 - 응급 수혈을 위한 인공혈액 |
| 작용기전 | 산소운반 단백질인 헤모글로빈(Hb)에 PEGylation 기술을 도입, PEGylated Hb을 제조하여, 적혈구가 통과할 수 없는 미세혈관 및 질환상태의 혈관을 용이하게 통과하여 산소를 공급함. |
| 제품의 특성 | 헤모글로빈의 표면에 PEG를 화학적으로 안정한 형태로 결합한 PEG-단백질 형태로서 이종단백질의 인체투여로 인한 면역거부 반응을 최소화하며, 건강한 세포보다는 신속한 산소공급이 필요로 하는 저산소상태의 세포(Hypoxia)에 선택적으로 산소를 전달하는 특징이 있음. 산소운반체의 가능성은 크나, 인공혈액이라는 대규모의 임상시험 투자에 앞서서, 일단 비교적 소규모이지만 임상의 실시와 결과가 보다 명확히 규정되는 뇌졸중응급처치 개발에 초점을 두고 있음. 혈전이나 출혈 등 원인에 관계없이, 사고 직후 투여하여, 사고 후 처치까지의 서너시간 동안 피가 안 통하는 혈전부위 뇌세포에 산소를 전달하는 것이 시험 프로토콜이며, 혈전뇌졸중의 경우에 혈전부위 뇌세포를 정상적으로 유지하는 것이 시험을 통해 확인되었음. |
| 진행경과 | PEGylated Hb 신규후보 물질을 위한 신규 PEG 유도체 및 PEG-Hb 기술 특허를 출원하였으며, Rat 동물에서의 생존율에 의한 기본 독성, 반감기, 기타 산소전달 관련 효력시험들을 진행(인천 루다큐어 주식회사)하고 있음. 비글 동물모델을 이용한 PK 및 과다출혈 모델에서의 안정성 확인. 한양대 약대 교수팀과 뇌졸중 모델에서 효능시험 등 다기관 동물시험 진행 중. 새로운 제형 및 기술의 신규 후보물질에 대한 허혈부위의 산소전달 및 출혈 시 인공혈액 대체제를 목적으로 다양한 연구개발 및 효능시험이 진행 중이며, 안전하고, 안정한 제형 개발을 위한 연구 및 생산 제조과정 개선 비임상시험 기관인 Charles River Laboratories와 독성시험 진행 중. ; 23년 10월, 독성시험을 위한 시료 발송 |
| 향후계획 | 비임상시험 기관인 Charles River Laboratories와 독성시험 진행. ; ~24년 6월, 독성시험 보고서 완료 예정 |
| 경쟁제품 | Sangart, Biopure,Prolong Pharma사 등 여러 개발 업체들 가운데 사람을 대상으로한 임상이 완료되거나 상용화 업체는 아직 없음. |
| 관련논문 등 | Attenuated Cerebral Ischemic Injury by Polyethylene Glycol-Conjugated Hemoglobin. Biomolecules & Therapeutics, 17(3), 270-275 (2009) 특허 HEMOGLOBIN DERIVATIVE CO-CONJUGATED WITH FATTY ACID-LINKED PEG AND ALKOXY PEG AS A BLOOD SUBSTITUTE (21년 3월 PCT/KR2021/003530, 21년 6월 미국출원 17/357,374) |
| 시장규모 | -세계 보건기구 (World Health Organization)에 따르면, 뇌졸중으로 인한 사망자가 매년 620만 명에 달하며, 2016년 기준 약 1400만 건의 뇌졸중이 발생하였음. 뇌졸중은 전체 사망원인 중 약 10%를 차지하고 있으며, 암에 이어 가장 높은 비중을 차지하고 있고, 인구 고령화에 따른 추세를 고려하였을 때, 2030년에는 현재보다 뇌졸중 발생이 약 3배 증가할 것으로 예측되고 있음. [출처: Paper-Investigation of Stroke Evaluation Methodology and Related Factors Through the Literature Review J Ergon Soc Korea 2017; 36(6): 693-704, http://dx.doi.org/10.5143/JESK.2017.36.6.693, https://www.worldstrokecampaign.org/learn/facts-and-figures.html - 글로벌 잠재적인 인공 혈액 대체품 시장은 2022년까지 약 52억 달러($5,204 million)로 예상되며, 2027년까지 약177억 달러($17,775 million)의 가치를 가정하여 27.8 % 성장할 것으로 예상하기도 함. 특히, 외상성 부상 부문은 2022 년 인공 혈액 대체물 시장에 약19억 달러($1,993 million)로 가장 큰 기여를 할 것으로 예상함(출처: 4) Artificial Blood Substitutes Global Market and Patent Landscape Report till 2025, AheadIntel). |
| 기타사항 | 한양대학교 약대 배옥남교수팀에서 뇌졸중 관련 효능시험 진행 중. 인천 루다큐어 주식회사에서 동물 독성 및 효력시험 진행. |
(나) 기타 연구개발 실적
당사는 PEG 유도체 소재 디자인 및 합성 기술, 그리고 해당 PEG 유도체 소재를 이용한 선택적인 PEGylation 기술을 개발해오면서, 해당 기술 경쟁력 향상을 도모하기 위하여 정부 부처의 R&D 지원 사업에 대해서도 많은 관심을 가지고 지원해왔으며, 하기와 같이 다수의 정부 국책과제를 수행해왔습니다. 해당 과제들은 대부분 동사 단독으로 선정되어 수행하였으며, 과제 수행 중에 중단 또는 실패 없이 성공적으로 정부수행 과제를 완료하였습니다. 그리고, 최근 종근당바이오(주관), 동국대학교 산학협력단과 공동연구 과제로 mRNA 백신용 소재의 국산화를 위한 산자부 과제를 수행하고 있습니다.
[정부 국책과제 수행 실적 요약]
|
연구과제명 |
주관부서 |
연구기간 |
정부 출연금 |
과제 상태 및 연구결과물 |
|
뇌졸중 개발 |
산업자원부 |
'98. 05. ~'99. 10. |
1억 5천만원 |
<과제 성공> 비임상 독성시험 완료 |
|
항암 |
보건복지부 |
'98. 05. ~'00. 04. |
2억 |
<과제 성공> 저산소 상태의 악성 암세포를 고산소 상태의 양성 암세포로 변형시켜 항암제 활성의 증가를 확인하는 효력시험 완료 |
|
생체고분자를 |
중소기업청 |
'05. 04. ~'07. 03. |
1억 78백만원 |
<과제 성공> 모발에 직접적인 PEGylation을 통해 모발 굵기, 헤어볼륨감, 윤기, 컬의 유지력 등의 효과 지속 확인 상표 및 특허 출원등록 박람회 출품 및 전시 |
|
다중암 폴리 에틸렌글리콜 및 유도체 개발 |
전남 테크노파크 |
'10. 05. ~ '10. 12. |
5천만원 |
<과제 성공> 다중암 PEG 유도체 (8-arm PEG-OH)를 신규 합성방법으로 개발 |
|
검증된 생체 친화적 졸-겔 하이드로젤 조성물을 이용한 골관절염 질환 |
중소기업청 |
'15. 10. ~ '17. 09. |
4억 |
<과제 성공> PEG 유도체를 이용한 PEG-하이드로젤 기술을 |
| (5세부)mRNA 백신용 국산 지질나노입자의 핵심 소재 제조 및 GMP급 생산기술 개발 | 산업통상 자원부 |
'22.04. ~'25.12. |
33억 | 2차년도 진행중 |
7. 기타 참고사항
가. 지적재산권 현황
|
No (주1) |
특 허 |
권리자 (출원인) |
등록번호 (출원번호) |
등록일 (출원일) |
적용 제품 (주2) |
국가 |
상태 |
|
- |
헤모글로빈 변성체 그의 제조방법 및 그를 함유하는 항암 활성제 |
노광 |
10-0195609 (10-1996-0020739) |
1999.02.12. (1996.06.11.) |
1세대 산소운반체 |
국내 |
소멸 |
|
- |
폴리에틸렌글리콜-석시니미딜프로피오네이트 |
선바이오㈜ |
10-0291828 (10-1998-0033952) |
2001.03.16. (1998.08.21) |
1세대 산소운반체 |
국내 |
소멸 |
|
- |
헤모글로빈의 누출위험이 없는 헤모글로빈-리포좀 시스템 |
선바이오㈜ |
10-0299413 (10-1998-0049400) |
2001.06.08. (1998.11.18.) |
1세대 산소운반체 |
국내 |
소멸 |
|
- |
폴리에틸렌글리콜-헤모글로빈 결합체 |
선바이오㈜ |
10-0316154 (10-1999-0010469) |
2001.11.17. (1999.03.26.) |
1세대 산소운반체 |
국내 |
소멸 |
|
- |
변형된 인터페론 α 2a 및 2b, 그리고 이들과 PEG 유도체와의 배합체 |
선바이오㈜ |
10-0459105 (10-2001-0007476) |
2004.11.19. (2001.02.15) |
바이오신약 (B형, C 형 |
국내 |
소멸 |
|
- |
생체접착제용 폴리에틸렌글리콜 수화젤 |
선바이오㈜ |
10-0444944 (10-2001-0028654) |
2004.08.09. (2001.05.24.) |
바이오신약 (외과지혈봉합용 젤) |
국내 |
소멸 |
|
1 |
변형된 인터페론-베타, 및 이의 화학적으로 변형된 배합체 |
선바이오㈜ |
10-0511749 (10-2001-0068852) |
2005.08.25. (2001.11.06.) |
바이오신약 (다발성경화증 치료제) |
국내 |
등록 |
|
2 |
G-CSF와 폴리에틸렌 글리콜 유도체의 배합체 |
선바이오㈜ |
10-0480432 (10-2001-0076131) |
2005.03.23. (2001.12.04.) |
바이오시밀러 (호중구 감소증 치료제) |
국내 |
등록 |
|
3 |
인터페론-알파와 폴리에틸렌 글리콜 유도체의 배합체 |
선바이오㈜ |
10-0480429 (10-2001-0076129) |
2005.03.23. (2001.12.04.) |
바이오시밀러 (B형, C 형 간염치료제) |
국내 |
등록 |
|
4 |
인터페론-베타와 폴리에틸렌 글리콜 유도체의 배합체 |
선바이오㈜ |
10-0480430 (10-2001-0076130) |
2005.03.23. (2001.12.04.) |
바이오신약 (다발성경화증 치료제) |
국내 |
등록 |
|
5 |
에리트로포이에틴과 폴리에틸렌 글리콜 유도체의 배합체 |
선바이오㈜ |
10-0480423 (10-2001-0076132) |
2005.03.23. (2001.12.04.) |
바이오시밀러 (신장성 빈혈치료제) |
국내 |
등록 |
|
6 |
신규한 폴리에틸렌 글리콜-프로피온알데히드 유도체 |
선바이오㈜ |
10-0488351 (10-2001-0078244) |
2005.04.29. (2001.12.11) |
PEG 유도체 (Pegfilgrastim 원료*) |
국내 |
등록 |
|
7 |
단백질 의약품 정제방법에서의 바이러스 제거방법 |
선바이오㈜ |
10-0451308 (10-2001-0087154) |
2004.09.22. (2001.12.28.) |
1세대 산소운반체 |
국내 |
등록 |
|
8 |
Hexa-arm polyethylene glycol and its derivatives and the methods of preparation thereof |
선바이오㈜ |
06858736 (10326408) |
2005.02.22. (2002.12.23.) |
PEG 유도체 (연골활액 충진제 원료*) |
미국 |
등록 |
|
9 |
신규한 폴리에틸렌 글리콜-말레이미드 유도체의 합성방법 |
선바이오㈜ |
10-0512483 (10-2003-0028807) |
2005.08.29. (2003.05.07.) |
PEG 유도체 |
국내 |
등록 |
|
10 |
Monofunctional polyethylene glycol aldehydes |
선바이오㈜ |
06916962 (10431294) |
2005.07.12. (2003.05.07.) |
PEG 유도체 (Pegfilgrastim 원료*) |
미국 |
등록 |
|
11 |
신규한 와이-폴리에틸렌 글리콜 유도체 및 그의 제조방법 |
선바이오㈜ |
10-0551096 (10-2003-0055102) |
2006.02.03. (2003.08.08.) |
PEG 유도체 |
국내 |
등록 |
|
12 |
Monofunctional polyethylene glycol aldehydes |
선바이오㈜ |
06956135 (10661268) |
2005.10.18. (2003.09.12.) |
PEG 유도체 (Pegfilgrastim 원료*) |
미국 |
등록 |
|
13 |
Preparation method of peg-maleimide derivates |
선바이오㈜ |
06828401 (10697409) |
2004.12.07. (2003.10.29.) |
PEG 유도체 |
미국 |
등록 |
|
14 |
Monofunctional polyethylene glycol aldehydes |
선바이오㈜ |
07041855 (10715607) |
2006.05.09. (2003.11.18.) |
PEG 유도체 (Pegfilgrastim 원료*) |
미국 |
등록 |
|
15 |
Bifunctional polyethylene glycol derivatives |
선바이오㈜ |
07217845 (10721013) |
2007.05.15. (2003.11.21.) |
PEG 유도체 |
미국 |
등록 |
|
16 |
신규한 와이-폴리에틸렌 글리콜 유도체 및 그의 합성 방법 |
선바이오㈜ |
10-0631855 (10-2004-0022722) |
2006.09.27. (2004.04.01.) |
PEG 유도체 |
국내 |
등록 |
|
17 |
폴리에틸렌글리콜 유도체를 유효성분으로 함유하는 모발 코팅용 조성물 |
선바이오㈜ |
10-0671935 (10-2004-0084796) |
2007.01.15. (2004.10.22.) |
모발코팅제 |
국내 |
등록 |
|
18 |
모발 처리용 조성물, 모발 처리제 및 이를 이용한 모발처리방법 |
선바이오㈜ |
10-0862651 (10-2007-0045253) |
2008.10.02. (2007.05.09.) |
모발코팅제 |
국내 |
등록 |
|
19 |
폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강 건조증 예방, 치료 또는 개선을 위한 구강 청정제 조성물 및 의약 조성물 |
선바이오㈜ |
10-1526258 (10-2013-0054877) |
2015.06.01. (2013.05.15.) |
구강건조증 치료제* |
국내 |
등록 |
|
20 |
폴리에틸렌글리콜 수화젤 주사제 |
선바이오㈜ |
10-1637883 (10-2015-0138210) |
2016.07.04. (2015.09.30.) |
연골활액충진제* |
국내 |
등록 |
|
21 |
Polyethylene glycol hydrogel injection |
선바이오㈜ |
PCT/KR2016/006434 |
2016.06.17. |
연골활액충진제* |
국제 |
출원 |
|
22 |
Tertiary alkoxy polyethylene glycol and derivatives thereof |
선바이오㈜ |
10882954 (16381499) |
2021.01.05. (2019.04.01) |
PEG 유도체* |
미국 |
등록 |
|
23 |
Hemoglobin derivate co-conjugated with fatty acid-linked PEG and alkoxy PEG as a blood substitute |
선바이오㈜ |
PCT/KR2021 /003530 |
2021.03.22 |
2세대 산소운반체 PEG-Hb* |
국제 |
출원 |
|
24 |
Siloxy Polyethylene Glycol and Derivatives thereof |
선바이오㈜ |
- (17208057) |
- (2021.03.22.) |
PEG 유도체* |
미국 |
출원 |
|
25 |
Functionalized Polymers for Mucosa |
선바이오㈜ |
- (17208075) |
- (2021.03.22.) |
건조 점막 치료제* |
미국 |
출원 |
|
26 |
Uricase Derivative Co-conjugated With Fatty acid-linked PEG and optionally, Alkoxy PEG |
선바이오㈜ |
- (17696,374) |
- (2022.03.16.) |
통풍 치료제* |
미국 |
출원 |
|
27 |
Hemoglobin derivate co-conjugated with fatty acid-linked PEG and alkoxy PEG as a blood substitute |
선바이오㈜ |
- (17357374) |
- (2021.06.24.) |
2세대 산소운반체 |
미국 |
출원 |
|
28 |
6arm PEG 수화겔의 시간 경과에 따른 졸-겔 전환 |
선바이오㈜ |
- (10-2021-0120387) |
- (2021.09.09. |
연골활액 충진제* |
국내 |
출원 |
| 29 | 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강건조증 완화용 구강린스 조성물 | 선바이오㈜ | PCT/KR2022/003921 | - (2022.03.21) |
구강건조증 치료제* | 국제 | 출원 |
| 30 | ORAL RINSE COMPOSITIONS FOR ALLEVIATING XEROSTOMIA COMPRISING POLYETHYLENE GLYCOL DERIVATIVES | 선바이오㈜ | - (17/775,913) |
- (2022.05.11) |
구강건조증 치료제* | 미국 | 출원 |
| 31 | 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강건조증 완화용 구강린스 조성물 | 선바이오㈜ | - (2022-527814) |
- (2022.05.11) |
구강건조증 치료제* | 일본 | 출원 |
| 32 | 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강건조증 완화용 구강린스 조성물 | 선바이오㈜ | - (202280001566.9) |
- (2022.06.01) |
구강건조증 치료제* | 중국 | 출원 |
| 33 | ORAL RINSE COMPOSITIONS FOR ALLEVIATING XEROSTOMIA COMPRISING POLYETHYLENE GLYCOL DERIVATIVES | 선바이오㈜ | - (3169206) |
- (2022.07.29) |
구강건조증 치료제* | 캐나다 | 출원 |
| 34 | 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강건조증 완화용 구강린스 조성물 | 선바이오㈜ | - (2022211852.0 ) |
- (2022.08.03) |
구강건조증 치료제* | 호주 | 출원 |
| 35 | 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강건조증 완화용 구강린스 조성물 | 선바이오㈜ | - (22744368.6) |
- (2022.08.04) |
구강건조증 치료제* | 유럽 | 출원 |
| 36 | 6arm PEG 수화겔의 시간 경과에 따른 졸-겔 전환 | 선바이오㈜ | PCT/KR2022/013531 | - (2022.09.08) |
연골활액 충진제* | PCT | 출원 |
| 37 | Sol-Gel conversion over time of 6-arm PEG Hydrogel | 선바이오㈜ | 18/016,672 | - (2023.01.17) |
연골활액 충진제* | 미국 | 출원 |
| 38 | 폴리에틸렌 글리콜 유도체를 유효성분으로 포함하는 구강건조증 완화용 구강린스 조성물 | 선바이오㈜ | - (10-2023-7026980) |
- (2023.08.08) |
연골활액 충진제* | 한국 | 출원 |
|
주1) |
동사 설립 초기 출원하여 20년간 등록 유지하였으나, 존속기간 만료로 소멸됨. 순번에서는 제외함. |
| * 표기는 현재 연구개발 및 상용화 파이프라인임 | |
나. 관련 법령 및 규제환경
(1) PEG 유도체 소재
PEG 유도체 소재는 약리 활성을 나타내는 물질이 아니기 때문에 원료의약품에 해당되지 않으며, 법적 규제 품목이 아닙니다.
(2) 호중구감소증치료제 pegfilgrastim 바이오시밀러
당사의 pegfilgrastim 바이오시밀러는 미생물을 이용한 재조합 단백질을 원료로 한 바이오의약품이며, 오리지널 바이오의약품에 대한 복제 바이오의약품(바이오시밀러)으로 판매를 위해 해당 국가의 의약품 승인을 받아야 합니다. 즉, 정부의 규제 및 관계 법령에 의한 규제 기준에 따라 품목허가를 받아야 합니다.
(3) 구강건조증 치료제 MucoPEG™
MucoPEG과 같이 구강건조증의 대증치료를 위한 치료제는 해당 국가의 제품 허가 기준이 다양합니다. 제품의 형태와 원료(약리/비약리)의 구분기준에 따라 의료기기 혹은 의약품으로 구분되며, 규제기준에 따라 품목허가를 받아야 합니다.
다. 시장의 현황
(1) PEG 유도체 소재
(가) 시장 개요
1) PEG 유도체 소재 시장
당사에서 생산 판매하는 다양한 구조 및 반응기를 가지는 PEG 유도체 소재는 제약, 의료기기 등 다양한 분야에서 사용되고 있습니다. 현재 전 세계 PEG 유도체 소재 시장은 당사를 포함한 Nektar Therapeutics, NOF Corp., Tianjin Jenkem Technology Co. ltd., Laysan Bio, Merck, Creative Pegworks에서 선도하고 있습니다.
PEG 유도체 소재 시장은 1990년대부터 2000년대 초까지는 미국의 Shearwater Polymers사가 주도하였으나, 2001년 Nektar 사에 인수합병된 이후 당사가 주도하는 형국입니다. PEG 유도체 소재의 품질도 당사가 가장 우수하며, 많은 회사들이 당사의 제품을 스탠다드로 사용하고 있기도 합니다. 2010년대 들어서는 중국의 업체들이 등장하여 당사에 위협을 가하고 있지만, 아직 품질 면에서 당사의 수준을 따라오지 못하고 있으며, 이는 중국의 거래처들이 증언하고 있습니다.
PEG 유도체 소재의 활용분야는 매우 넓으며 다양합니다. 신약 및 바이오시밀러와 같은 의약품 분야에서부터 의료용 봉합제 및 성형 필러와 같은 의료용 제품 그리고 PEG 유도체의 결합기술을 이용한 바이오칩 및 ELISA와 같은 진단기기 등에도 사용됩니다.
당사는 PEG 유도체 소재 개발 및 생산에 관한 특허를 보유하고 있으며 이에 따른 기술 우위를 확보하고 있으며 부가가치가 매우 높습니다. 당사의 PEG 유도체 소재 사업은 신약개발(의약품개발) 및 바이오시밀러 의약품 개발과 긴밀하게 연결되어 있는 특징을 가지고 있으며 타 산업에 비해 연구 개발 비중이 높은 차별성을 보유하고 있습니다.
2) PEGylation 기술 시장
당사는 우수한 품질의 다양한 PEG 유도체 소재를 생산 판매하며, 이를 이용하여 다양한 타겟 물질에PEGylation 기술을 적용하여 PEGylated 물질(단백질, 항체 등)을 연구개발합니다. PEGylation은 의약품이나 치료용 단백질의 반감기를 증가시키고, 항원성 및 독성의 감소 등 장점을 제공하며 상당한 시장 성장을 나타냅니다.
PEG 유도체의 효소에 의한 보호 및 반감기 증가 등 이점으로 인해 단백질 의약품의 PEGylation은 필수화되고 있습니다. 또한 제약 및 생명공학 기업들의 연구개발 지출 비용 증가 및 생물학 분야의 급속한 성장, 생활 습관에 따른 유병률의 증가, 비단백질 기반 약물에 대한 단백질 기반 약물로의 채택 증가 등 PEGylation 기술 도입에 따른 단백질 안정성 및 반감기 증가가 시장의 PEGylation 기술 시장의 원동력이 됩니다. 보고서(PEGylated Protein Therapeutics Market)에서 PEGylation 기술 시장은 2018년부터 2025년까지의 연평균 성장률이 6.9%로써 2025년에는 20조 1,465억원(US$ 17,813 million)으로 예상하였습니다.
특히, PEGyated 단백질 중 가장 큰 시장인 GCSF(Colony stimulating factor: filgrastim)는 암 환자의 항암치료 과정에서 발생되는 호중구 감소증으로 인한 감염의 위험을 감소시키기 위한 치료제로 pegfilgrastim의 시장 및 바이오시밀러 시장이 크게 증가될 것으로 예상하였습니다.
![이미지: [세계 PEGylation 기술 적용된 단백질 치료제 시장]](pegylated%20%EC%8B%9C%EC%9E%A5.jpg) |
|
[세계 PEGylation 기술 적용된 단백질 치료제 시장] |
(출처: PEGylated Protein Therapeutics Market-Global Opportunity Analysis and Industry Forecast, 2018-2025)
또한, 만성질환의 증가와 매년 시장이 성장하는 파이프라인 약품들로 인해 PEGylation 기술의 수요가 증가 되면서 PEG 유도체 소재 시장도 지속적인 성장세를 보일 것으로 예상됩니다.
(나) 산업의 연혁
![이미지: [PEG 유도체 소재 연혁]](pegylation%20%EC%82%B0%EC%97%85%EC%9D%98%20%EC%97%B0%ED%98%81.jpg) |
|
[PEG 유도체 소재 연혁] |
PEG(Polyethylene glycol)는 Carbowax라는 브랜드 이름으로 200-2000Da 분자량이 상업적으로 처음 생산되었고, 1950 년대에는 더 큰 수백만 달톤 분자량의 PEG이 생산 가능해졌습니다. 1962년 PEG의 생분해가 최초로 보고되고, 그 후 독성이 낮고 피부 자극이 적으며 안정성이 높은 PEG가 농업, 건설, 화장품, 의료, 제약 등 다양한 산업 용도에 적용되었습니다. 생분해성 고분자에 대한 관심이 지속적으로 증가하면서 물리화학적 특성을 개선하기 위해 다른 생분해성 플라스틱과 혼합되기도 하고, 우수한 물리화학적 특성으로 다양한 분야에서 활용되었습니다.1)
1970년부터 생물학적 치료분야에서 polymer conjugation(PEG 유도체 사용) 연구가 시작되었고 1990년 처음으로 ENZON사에서 PEGylated enzyme인 ADAGEN이 출시된 이후, 현재까지 20여개가 넘는 제품이 출시되었습니다. PEGylation 의약품들의 성공적인 시장 진입과 안정적인 판매량, 그리고 다양한 약물과 단백질에 대한 연구개발이 계속되면서 PEGylation의 의학적 가치가 현재 확고히 확립되어 있습니다. 이렇게 꾸준히 개발되고 있는 PEG-의약품(단백질, 항체, 펩타이드 등)들은 그 자체로서 PEGylation 기술이 약물전달을 위한 효과적이고 안전한 기술임을 입증하는 것입니다.
1) : https://onlinelibrary.wiley.com/doi/full/10.1002/3527600035.bpol9012
|
허가 (년도) |
Disease |
PEG conjugate |
PEGylation technology |
Company / Trade name |
|
1990 |
SCID 중증복합형 면역부전증 |
PEG-adenosine deaminase |
Lysine residues |
Enzon/ |
|
1994 |
ALL 급성림프구성 백혈병 |
PEG-asparaginase |
Lysine residues |
Enzon/ Oncaspar® |
|
2000 |
Hepatitis C C형 간염 |
PEG-interferon alpha 2b |
His34, lysine and N-term(12k) |
Shering-Plough/ PEG-Intron® |
|
2001 |
Hepatitis C C형 간염 |
PEG-interferon alpha 2a |
Lysine residues, branched PEG(40k) |
Roche/ Pegasys® |
|
2002 |
Neutropenia 호중구감소증 |
PEG-G-CSF |
N-terminal (20k) |
Amgen/ Neulasta® |
|
2002 |
Acromegaly 말단비대증 |
PEG-growth hormone receptor antagonist, pegvisomant |
Lysine residues |
Pfizer/ Somavert® |
|
2004 |
ARMD 노화시력감퇴 |
Branched PEG-anti-VEGF aptamer, Pegaptanib |
Oligonucleotide branched PEG(40k) |
Pfizer/ Macugen® |
|
2005 |
Ovarian cancer: 난소암, Karposi’s sarcoma: 카포시육종, AIDS related cancer |
Pegylated liposome- encapsuled doxorubicin |
PEG-liposome |
Janssen/ Doxil®, |
|
2007 |
Anemia associated with chronic kidney disease: 만성신장질환 |
Methoxy PEG-epoetin beta |
Lysine and N-term |
Roche/ Micera® |
|
2008 |
Crohn’s disease 크론병 |
PEGylated fab fragment of humanized anti-TNF (monoclonal antibody), certolizumab pegol |
Branched maleimide (40k) |
UCB/ Cimzia® |
|
2010 |
Gout 통풍 |
Pegloticase |
Lysine residues |
Savient/ Krystexxa® |
|
2012 |
Anemia associated with chronic kidney disease: 만성신장질환 |
PEGinesatide |
Lysine-branched bis-mPEG |
Takeda/ Omontys® |
|
2013 |
Neutropenia 호중구 감소증 |
GlycoPEGylated filgrastim |
mPEG-sialic acid |
Teva/ Lonquex® |
|
2014 |
Opioid-induced constipation |
Naloxegol |
mPEG7(339 Da) |
AstraZeneca/ Movantik |
|
2014 |
Multiple sclerosis (MS) 다발성경화증 |
Peginterferon beta-1a |
mPEG-O-2-methylpropionaldehyde |
Biogen, Inc./ PLEGRIDY |
|
2015 |
Hemophilia A 혈우병 |
PEGylated antihemophilic Factor VIII |
Lysine residues |
Baxalta/ Adynovate |
|
2017 |
Hemophilia B 혈우병 B |
PEG-recombinant coagulation factor lX |
40K-PEG Sialic aicd-CMP :N-linked glycan |
Novo Nordisk /Rebinyn |
|
2017 |
Hemophilia A 혈우병 A |
PEG-recombinant antihemophilic factor |
single, dual branched PEG60K-maleimide linker |
Bayer Healthcare/Jivi |
|
2018 |
Leukemia |
PEG-L-asparaginase |
PEG (n) = 31-39 mPEG-succinimidyl carbonate-5k |
Servier Pharma /Asparlas |
|
2018 |
ADA-SCID |
PEG-recombinant adenosine deaminase |
mPEG-succinimidyl carbonate-80k |
Leadiant Bioscience/ Revcovi |
|
2018 |
Phenylketonuria 페닐 케톤뇨증 |
PEG-recombinant phenylalanine ammonia lyase |
mPEG-NHS-20K |
BioMarin Pharmaceutical /Palynziq |
|
2019 |
Hemophilia A 혈우병 A |
PEG-recombinant antihemophilic factor |
40K-PEG SA-CMP, O-linked glycan |
Novo Nordisk /Esperoct |
| [ PEG-의약품 목록] |
이렇게 PEG 유도체 소재 및 PEGylation 기술은 현재까지도 여러 글로벌 업체에서 꾸준히 새로운 PEG 소재 및 PEGylation 기술로 개발되고 있습니다.
(다) 수요 변동요인
PEG 유도체 소재가 사용되는 의료 및 제약 분야에서는 전세계의 고령화와 새로운 다양한 암이나 질병이증가하면서 의약품 개발이 활발해지고, 소득증가 및 삶의 질 향상으로 의료 지출을 늘리고 있는 추세입니다. 여러 PEG-의약품(단백질, 항체, 펩타이드 등)들의 PEGylation 기술을 이용한 약물전달의 효과와 안전성이 입증되고, 최근 코로나 벡신의 mRNA 전달을 위한 PEG 유도체 소재의 사용으로 여러 다양한 벡신이나 치료제에 더욱 응용된다는 전망에 따라 PEG 유도체 소재의 사용 증가가 더욱 PEG 유도체 소재 시장 성장을 촉진시킬 것입니다.
(라) 시장 규모 및 전망
당사에서 생산 판매하는 다양한 구조 및 반응기를 가지는 PEG 유도체 소재는 제약, 의료기기 등 다양한 분야에서 사용되고 있습니다. 현재 전 세계 PEG 유도체 소재시장은 당사를 포함하여 Nektar Therapeutics, NOF Corp., Tianjin Jenkem Technology Co. ltd., Laysan Bio, Merck, Creative Pegworks에서 판매하고 있습니다.
PEG 소재는 의료 및 제약, 화학, 플라스틱 등 여러 산업에 사용되는 소재입니다. Global market Insights의 보고서에 따르면 PEG소재 시장규모는 2020년 $41억($4.15billion)으로 2021년에서 2027년까지 연평균 9.6% 성장률을 예상하고 있으며, 이러한 성장률은 의료 및 제약 산업의 수요증가에 따른 것이라고 설명하였습니다. PEG 소재 중 PEG 유도체 소재만의 정확한 시장은 파악하기 어려우나, PEG 소재 시장의 약 40%가 의료 및 제약관련 시장으로 추정됩니다. 그러나 제약관련 시장에는 PEG 유도체 소재가 아닌 단순 첨가 및 부형제로써 사용되는 PEG 소재도 포함하기 때문에 정확하게 PEG 유도체 소재 시장규모를 파악할 수 없습니다.
![이미지: [PEG 시장규모 및 전망]](peg%20%EC%8B%9C%EC%9E%A5%EA%B7%9C%EB%AA%A8%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D.jpg) |
|
[PEG 시장규모 및 전망] |
(출처: Polyethylene Glycol Market Size by Application (Medical & Pharmaceutical, Automotive, Building & Construction, Plastics, Aerospace), Industry Analysis Report, Regional Outlook, Price Trends, Competitive Market Share &Forecast, 2020 - 2026)
(2) 호중구 감소증 치료제 pegfilgrastim 바이오시밀러 시장
(가) 시장개요
호중구감소증(CIN)은 항암치료 과정에서 골수기능이 저하되어 호중구가 감소하는 현상으로, 호중구 수치(Absolute Neutrophil Count, ANC)가 정상 범위인 2,000~8,000/mm3 대비 낮은 수치일 때를 의미합니다.
호중구감소증은 항암화학요법의 가장 빈번하고 심각한 합병증 중 하나이며, 화학요법의 강도에 비례하여 중증도가 높아지는 경향을 보입니다. 호중구는 골수에서 생성되어 미생물의 조직 침입에 대항하는 1차적인 방어 역할을 하는데, 호중구 수치가 낮아질수록 면역력이 저하되고 중증으로 발전 시 열을 동반한 발열성 호중구감소증으로 진행될 가능성이 높습니다.
발열성 호중구감소증은 면역력 저하를 동반하여 3~40%의 높은 사망률을 보이는 것으로 알려져 있으며, 환자의 상태를 주시하여 호중구 수치가 정상으로 회복할 때까지 항암제 투여를 중단하거나 투여 용량을 감량하게 됩니다. 이처럼 호중구감소증의 발병은 항암치료에 중대한 영향을 미치므로 발병 즉시 적절한 치료 시행이 권장됩니다. 호중구감소증의 주요 치료제로는 재조합 콜로니 자극인자(CSF: filgrastim, pegfilgrastim 등) 및 항생제가 있습니다.
당사의 pegfilgrastim 바이오시밀러 제품은 다양한 암환자의 증가와 그로인한 항암치료로 증가한 호중구 감소증 환자를 위해, 오리지널 바이오의약품과 비교하여 동일한 효과 및 저렴한 가격의 바이오시밀러 제품을 인도, 유럽, 캐나다, 호주에 판매하고 있습니다. 현재, 세계시장 5조원 규모의 오리지널 의약품 시장과 높은 가격으로 낮았던 환자의 수용도를 높이며 더욱 수요가 증가할 것으로 전망됩니다.
(나) 산업의 연혁
호중구 감소증(Neutropenia)은 혈액 내 세균이나 박테리아가 몸에 침범했을 경우 세균을 파괴하고 방어하는 역할을 하는 호중구(백혈구 내 50~70%)가 감소된 경우를 말합니다.
호중구 수치가 저하되어 있는 환자에게 감염은 심각한 위험이기 때문에 즉각적인 조치를 필요로 하며, 과립구 생산을 자극하고 호중구기능을 증진시키는 filgrastim(재조합 단백질: G-CSF(Granulocyte colony-stimulating factor: 1세대 치료제) 제품이 사용되고 있습니다.
![이미지: [1세대 의약품과 2세대(지속형) 의약품의 차이]](1%EC%84%B8%EB%8C%80%20%EC%9D%98%EC%95%BD%ED%92%88%EA%B3%BC%202%EC%84%B8%EB%8C%80%20%EC%9D%98%EC%95%BD%ED%92%88%EC%9D%98%20%EC%B0%A8%EC%9D%B4.jpg) |
|
[1세대 의약품과 2세대(지속형) 의약품의 차이] |
그러나 filgrastim은 치료제로 주사하였을 경우 항원성이 높고, 체내 잔류시간이 짧아 지속적인 약리효과를 위해 주기적으로 반복투여 해야 하는 단점이 있었으며, 이러한 단점을 극복하기 위해 filgrastim에 PEGylation 기술을 적용한 2세대 제품인 Pegfilgtrastim이 2002년 Amgen사 Neulasta 제품으로 허가 판매되고 있습니다.
Pegfilgrastim은 기존 1세대 filgrastim에 PEG 유도체를 공유결합시켜 filgrastim 대비 항원성이 낮아지고 반감기가 증가되어 효과의 지속력이 높아져, 반복투여의 단점을 개선한 제품으로 현재 시장점유는 1세대 제품이 10-20%, 2세대 제품이 80-90%를 차지하고 있습니다.
현재에도 적용 부위(구강)에 따라, GCSF의 반감기 및 효능을 증가시키기 위해, 신약 또는 바이오 베터로 개발이 이루어지고 있으며 한미약품에서 독자 플랫폼 기술인 ‘랩스커버리(Lapscovery™)’ 기술을 적용하여, 동일한 효능대비 반감기를 증가시켜 국내 및 미국 FDA 승인을 받았습니다.
(다) 수요 변동요인
1) 암환자 수 증가
암은 세계 모든 국가에서 사망의 주요 원인이자 기대 수명 연장의 중요한 장벽으로 자리잡고 있으며, 전 세계적으로 암 발병률과 사망률의 부담이 빠르게 증가하고 있습니다. 2020년 전 세계적으로 약 1,930만 건의 새로운 암 사례와 약 1,000만 명의 암환자 사망이 발생했습니다.
![이미지: [세계 암 사례 전망]](large_unmukkg18w7f0bgwaglr7t1epa5zzfporvweb-zpobg.jpg) |
|
[세계 암 사례 전망] |
(출처: WHO GlobalCAN, World Econmoic Forum)
당사의 pegfilgrastim 바이오시밀러 제품은 항암치료 화학요법에 의한 호중구 감소증의 치료제로써 세계적으로 증가하는 암 발병률에 따라 제품시장도 증가될 것입니다, 추후 새로운 신약의 개발 및 출시는 신약의 효과 및 가격에 따라 수요 변동 요인이 될수 있으나, 화학치료 요법의 치료주기에 적합한 반감기를 가진 pegfilgrastim은 추후 반감기가 증가된 신약과 비교하여 효과 및 안전성 면에서 제품 경쟁력이 높다고 할 수 있습니다.
2) 의료비 부담 증가
기존 오리지널 의약품 시장은 가격적인 측면에서 복잡한 공정과정으로 인한 높은 제조단가와 소수의 경쟁제품으로 인한 시장 지배력 강화로 비교적 높은 약가를 형성하고 있습니다. 이로 인해 단백질의약품의 의료수가는 높은 편으로 현재 서구 사회 전체 의료비 지출의 상당 부분을 차지하고 있습니다. OECD 국가의 평균 1 인당 의료비 지출이 지속적으로 증가하여 각국의 의료비 재정 부담이 가중될 전망이며, 특히 미국의 경우 연간 환자 1인당 의료비는 평균 2만 달러 정도를 지출하고 있는 것으로 보고되고 있습니다.
![이미지: [바이오시밀러 약가 절감 전망]](%EB%B0%94%EC%9D%B4%EC%98%A4%EC%8B%9C%EB%B0%80%EB%9F%AC%20%EC%95%BD%EA%B0%80%20%EC%A0%88%EA%B0%90%20%EC%A0%84%EB%A7%9D.jpg) |
|
[바이오시밀러 약가 절감 전망] |
(출처: IQVIA, Biosimilars in the United States 2020-2024 Competition, Savings, and Sustainability, Sep 2020)
이와 같은 의료비의 부담 문제는 바이오시밀러의 수요에 큰 변동요인으로 꼽고 있습니다. IQVIA에 따르면, 미국은 이를 극복하기 위해, BPCIA 바이오시밀러법 통과 이래 바이오시밀러 지출 170억달러를 통해 총 370억달러의 절감을 꾀한 가운데, 2020년 기준 향후 5년 동안은 새로운 바이오시밀러 출시 및 기존 바이오시밀러의 가격 인하로 이용이 확대되며 지난 5년 동안의 절감 효과에 5배에 달하는 총 1,000억달러의 약가를 아낄 수 있을 것이라고 전망하고 있습니다.
![이미지: [의약품 규정 1일 사용량(DDD) 중 바이오시밀러 비율]](%EC%9D%98%EC%95%BD%ED%92%88%20%EA%B7%9C%EC%A0%95%201%EC%9D%BC%20%EC%82%AC%EC%9A%A9%EB%9F%89%28ddd%29%20%EC%A4%91%20%EB%B0%94%EC%9D%B4%EC%98%A4%EC%8B%9C%EB%B0%80%EB%9F%AC%20%EB%B9%84%EC%9C%A8.jpg) |
|
[의약품 규정 1일 사용량(DDD) 중 바이오시밀러 비율] |
(출처: IQVIA MIDAS, June 2020; IQVIA National Saels Weekly, AUG 2020)
바이오시밀러 산업은 연평균 10%가 넘는 높은 성장률에 더해, 세계 각 정부가 신종 코로나바이러스 감염증(COVID-19) 여파로 막대한 의료비를 지출하면서 그에 따른 재정절감 필요성이 대두되면서 바이오시밀러 산업의 성장은 더욱 가속화될 것이라는 분석도 나오고 있습니다. 즉, 상대적으로 저렴한 제네릭 의약품 사용을 권장하게 될 것이며, 바이오시밀러의 비중도 더욱 높아지게 될 것이고, 바이오시밀러 시장에 보수적이었던 미국도 이에 대한 규제를 완화할 것으로 전망하였습니다.
당사의 pegfilgrastim 바이오시밀러 역시 오리지널 대비 저렴한 약가로 1인당 의료비 및 정부 의료비 부담을 낮추는 목적으로 수요가 증가될 것입니다. 추후 새로운 신약의 개발 및 출시는 신약의 효과 및 가격에 따라 수요 변동 요인이 될수 있으나, 신약에 비해 pegfilgrastim 바이오시밀러의 가격 경쟁력이 높다고 할 수 있습니다.
(라) 시장 규모 및 전망
1) 바이오시밀러 시장 현황 및 전망
바이오의약품은 케미칼의약품 대비 여러 장점을 보유하고 있으나 높은 가격으로 의료비 측면에서 부담이 높습니다. 일일 기준 환자 약가 부담금은 바이오의약품이 케미컬의약품 대비 20배 이상 높으며, 바이오의약품 확대로 여러 국가들의 의료비 지출 역시 증가하고, 고가의 바이오의약품 확대는 개인뿐만 아니라 정부 지출 측면에서 재정 부담이 크게 작용하고 있습니다.
![이미지: [미국의약품 시장 바이오/케미컬 의약품 제제별 지출 증가율]](%EB%AF%B8%EA%B5%AD%20%EB%B0%94%EC%9D%B4%EC%98%A4%EC%9D%98%EC%95%BD%ED%92%88%20%EC%8B%9C%EC%9E%A5.jpg) |
|
[미국의약품 시장 바이오/케미컬 의약품 제제별 지출 증가율] |
(출처: Source : IQVIA MIDAS, IQVIA Institue, Jun 2020)
IQVIA 발표 자료에 따르면, 2015~2019년 지난 5년간 미국 내 전체 의약품 시장의 연평균 성장률은 6.1%, 저분자 의약품은 1.6% 였습니다. 이와 대조적으로 바이오의약품의 연평균 성장률은 14.6%로 고성장 하였으며, 이러한 현상을 감안하면 바이오 의약품 시장 확대에 따른 의약품 지출액 급증은 필연적이며, 인구 노령화로 인한 의료보험 재정 부담 등, 각국 정부의 재정부담 증가를 해결할 수 있는 방안은 바이오시밀러입니다. 즉, 오리지널 바이오의약품과 효능은 동일하면서 상대적으로 낮은 가격의 바이오시밀러 제품의 필요성이 더욱 부각되고 있는 상황입니다.
![이미지: [바이오시밀러 매출 규모 및 향후 전망]](%EB%B0%94%EC%9D%B4%EC%98%A4%EC%8B%9C%EB%B0%80%EB%9F%AC%20%EB%A7%A4%EC%B6%9C%20%EA%B7%9C%EB%AA%A8%20%EB%B0%8F%20%ED%96%A5%ED%9B%84%20%EC%A0%84%EB%A7%9D.jpg) |
|
[바이오시밀러 매출 규모 및 향후 전망] |
(출처: IQVIA 분석 보고서(Biosimilars in the United States 2020-2024))
IQVIA 분석 보고서(Biosimilars in the United States 2020-2024)에 따르면 바이오시밀러의 시장 규모가 2024년까지 800억 달러($80 billion) 수준까지 성장할 것이라 전망합니다. 약가 인하(pricing discounts) 및 소비 규모(volume uptake) 등에 따라 최소 530억 달러($53 billion) 에서 최대 1050억 달러($105 billion)까지 변동될 수 있다고 전망하였습니다.
바이오시밀러 산업은 연평균 10%가 넘는 높은 성장률에 더해, 세계 각 정부가 신종 코로나바이러스 감염증(COVID-19: 코로나-19) 여파로 막대한 의료비를 지출하면서 그에 따른 재정절감 필요성이 대두 되면서 바이오시밀러 산업의 성장은 더욱 가속화 될 것이라는 분석도 나오고 있습니다. 또한, IQVIA 관계자는 COVID-19 여파로 영국, 프랑스, 스페인, 독일, 이탈리아 등 5개 나라가 2020년 한 해 동안 예상치 못하게 지출한 예산이 약 650억 파운드(한화 97조원)에 달하여 각국 정부는 COVID-19로 커진 보험 재정 부담을 낮추기 위해, 상대적으로 저렴한 제네릭 의약품 사용을 권장하게 될 것이며, 바이오시밀러의 비중도 더욱 높아지게 될 것이고, 바이오시밀러 시장에 보수적이었던 미국도 이에 대한 규제를 완화 할 것으로 전망하였습니다.
2) 호중구 감소증 치료제 pegfilgrastim 바이오시밀러 시장 규모 및 전망
전세계 호중구 감소증 치료제는 주로 병원약국, 도매 약국, 그리고 일부 온라인 판매로 이루어지며, 호중 구감소증 치료시장 규모는 2020년 약 129억 달러($12.97 billion)에서 2026년 187억달러($18.9 billion)까지 연평균 6.5%의 시장성장을 예상하였습니다.
![이미지: [세계 호중구 감소증 치료 시장 규모]](%ED%98%B8%EC%A4%91%EA%B5%AC%EA%B0%90%EC%86%8C%EC%A6%9D%20%EC%B9%98%EB%A3%8C.jpg) |
|
[세계 호중구 감소증 치료 시장 규모] |
(출처: Global Neutropenia Treatment Market By Distribution channel, By Treatment, By Region, Industry Analysis and Forecast, 2020 ? 2026)
여러 형태의 암 발생률이 증가하기 때문에 화학요법으로 유발되는 호중구 감소증 치료제 시장은 상당한 성장을 보일 것으로 예측하며, 현재 호중구감소증 치료제 중 filgrastim(Colony-stimulating factor)를 기반으로 한 제품(filgrastim, pegfilgrastim)이 가장 큰 시장을 형성하고 있습니다. 그리고, 전체 위험도가 높은 화학요법 환자들을 대상으로 filgrastim의 예방 치료법이 권고되고 있어, filgrastim의 시장은 더욱 성장할 것으로 예측합니다.
![이미지: [호중구 감소증 치료 시장 점유율]](%ED%98%B8%EC%A4%91%EA%B5%AC%20%EA%B0%90%EC%86%8C%EC%A6%9D%20%EC%B9%98%EB%A3%8C%20%EC%8B%9C%EC%9E%A5%20%EC%A0%90%EC%9C%A0%EC%9C%A8.jpg) |
|
[호중구 감소증 치료 시장 점유율] |
(출처: Global Neutropenia Treatment Market By Distribution channel, kbvresearch)
 |
|
세계 Pegfilgrastim 바이오시밀러 시장규모 |
(출처: Pegfilgrastim Biosimilars Market Top Opportunities By Segments, Strategies By Market Trend And Player, The Business Research Company, October 2021)
세계 pegfilgrastim 바이오시밀러의 시장규모는 2020년 약 8억 달러($ 0.8 billion)에서 2021년 약 8억8천만 달러($0.88 billion)로 연간 10 %로 증가하였습니다. 이러한 성장은 코로나-19이후 회사가 운영을 재개하고 코로나-19 영향에서 회복하면서 적응했기 때문입니다. pegfilgrastim 바이오시밀러 시장 전망은 암 유병률 증가와 바이오시밀러 채택 증가로 회복되어 2023년에 11억5천만 달러($1,158.72), 2025년에는 14억 2천만 달러에 이를 것으로 예상합니다.
북미는 2019년 전 세계 pegfilgrastim 바이오시밀러 시장의 51.1%를 차지하며, 그 다음으로 서유럽(영국, 독일, 프랑스)과 아시아 태평양 및 기타지역이 뒤를 이었으며, 앞으로 pegfilgrastim 바이오시밀러 시장에서 가장 빠르게 성장하는 지역으로 다양한 바이오시밀러 출시로 인한 가격 인하와 함께 암 유병률이 증가함에 따라 중동과 아시아 태평양의 연평균 성장률을 각각 34.7%, 30.3%으로 전망합니다. 전 세계 정부는 비용 효율적인 바이오시밀러 제품에 주력하고 있으며, 각 정부의 바이오시밀러 이니셔티브(Initiative)로 치료 옵션 확장 및 보조금을 통해 처방 및 사용을 장려하며 바이오시밀러 교육 및 활동을 증가하고 있습니다(Global Pegfilgrastim Biosimilars Market Forecast To 2030 by the business research company).
(3) 구강건조증 치료제 MucoPEG™
구강건조증은 타액분비저하로 인한 구강 점막의 건조증이 유발되는 질환입니다. 노화나 약물의 부작용 또는 여러 질병으로 인해 유발되는 경우가 많으며, 구강건조증에 대한 진단 및 치료방법이 다양하고, 원인이 국소적 요인과 전신적 조건이 모두 관여하는 다인성 질환이기 때문에 쉽게 치료하기 어렵습니다. 또한 최근에는 코로나 19의 임상 증상 중 하나로 알려지면서 구강건조증에 대한 관심이 커지고 있습니다.
구강 건조증의 주요 원인으로는 쇼그렌 증후군, 빈혈, 당뇨, 영양소 결핍, 노화 등이 있으며 특히 항암 치료와 동반되는 침샘 근처의 방사선 치료는 구강건조증을 흔히 일으키는 원인으로 꼽힙니다. 구강건조증으로 고통받는 환자들은 일상 생활의 많은 부분에서 제한을 받게 되는데, 건조감이 심하면 말을 하기 어려워질 뿐만 아니라, 음식을 씹어 삼키기 어려워지고 소화 장애를 유발하기도 합니다.
입마름을 완화하기 위해서 인공 타액 제품, 타액 촉진제 등을 사용할 수 있으며 구강 내 염증 방지를 위해 불소나 소독약이 포함된 가글린 액을 사용할 수 있습니다. 이외에도 구강의 전기 자극 또는 침을 통해 타액을 분비하려는 연구가 시도되고 있으며, 줄기세포나 성장인자, 천연 항산화 인자 등을 통한 치료방법 연구가 다방면으로 시도되고 있습니다.
(가) 시장개요
다양한 질병의 치료목적으로 처방되는 약물의 사용 증가와 항암 치료에서 화학요법 및 방사선 요법의 채택 증가는 구강건조증 치료제 시장을 활성화하는 주요 요인 중 일부입니다.
세계 고령화로 급성장하는 노인 인구, 구강 건조증을 유발하는 약물 소비의 급증, 의약품의 쉬운 가용성 및 비용 효율성, 쇼그렌 증후군, HIV, 당뇨병 및 알츠하이머 병과 같은 질병의 유병률이 증가하는 것도 구강건조증 시장 성장의 주요한 요인입니다. 또한 증가하는 암환자의 화학 요법과 방사선 치료는 침샘을 손상시키고 구강 건조를 유발합니다. 화학 요법은 종양 전문의와 의료 종사자가 제공하는 암 환자에 대한 가장 일반적인 치료 형태이며, 질병 통제 예방 센터(CDC)에 따르면 매년 약 650,000명의 암 환자가 외래 종양 클리닉에서 화학 요법을 받게 됩니다.
이처럼, 당사의 구강건조증 MucoPEG 치료제는 항암치료 환자 및 세계 고령화 인구와 신흥국의 생활수준 향상을 기반으로 구매력 상승, 건강 의식 상승, 삶의 질 개선을 위해 노력하는 구강 건조증 환자들의 치료를 목표로 하고 있습니다
(나) 산업의 연혁
구강건조증 치료제는 크게 약리 활성을 가진 전문의약품인 타액 자극제와 구강 건조 증상을 완화시키는 대증 치료제로 나뉩니다.
타액 자극제 중 대표적인 필로카르핀(Pilocarpine)과 세비멜린(Cevimeline)은 구강건조증 치료를 위해 미국 식품의약국(FDA)에서 승인한 타액분비 촉진제(sialogogues) 2종입니다. 환자의 타액분비를 증가시키고 구강건조 증상을 감소시킬 수 있습니다.
Pilocarpine은 콜린성 부교감신경 흥분제이며, 일반적인 경구 투여량은 1일 3회 5-10mg이며, 섭취 30분 후 작용이 개시되고, 작용 지속시간은 약 2-3시간입니다. 일반적인 부작용으로는 위장 장애, 발한, 빈맥, 서맥, 폐 분비물 증가, 평활근 긴장도 증가, 시야 흐림 등이 있습니다.
세비멜린은 M3 muscarinic 수용체에 더 강한 친화력을 가진 타액선 자극제입니다. 필로카르핀에 비해 부작용이 적고, 작용이 오래 지속됩니다. 권장 용량은 30mg 1일 3회이며, 가장 흔한 관련 부작용은 소화불량입니다. 그리고, 티그민(distigmine), 요힘빈(yohimbine), 니코틴산(nicotinic), 말산(malic acid) 등 다양한 약물이 있으며 구강건조증 치료에 긍정적인 영향을 미쳤다고 보고되고 있습니다.
대증 치료(Symptomatic treatment)는 타액 대체제(Saliva substrates)로써 구강 점막에 더 높은 점도와 보호 기능을 제공함으로써 건조증상을 완화시킬 수 있습니다.
타액 대체제는 진해정(lozenge), 스프레이, 구강 세정제(gargle), 젤, 오일, 츄잉껌 또는 치약과 같은 다양한 제형으로 판매되고 있으며, 시중에서 구할 수 있는 대부분의 타액 대체물은 일반적으로 카르복시메틸셀룰로오스(CMC), 뮤신, 잔탄 검(Xanthan Gum), 하이드록시에틸셀룰로오스, 아마인유(Linseed oil) 또는 폴리에틸렌 옥사이드를 포함하고 있습니다. 주로 일시적인 보습력을 제공하기 때문에 짧은 지속시간과 하루에 건조감을 느낄 때 수시로 사용하는 것을 권고합니다. 이러한 제품들의 특별한 부작용은 없습니다.
최근, 이렇게 타액분비 자극효과는 있지만 부작용을 감수해야하는 약리활성물질을 사용하는 것보다 증상을 완화시켜줄 수 있는 대증치료제를 사용하는 것이 구강건조증 환자의 삶의 질 향상에 더 도움을 줄 수 있다는 임상시험 및 보고(Journal of Oral Pathology & Medicine. 2017:46:154-160)가 있습니다.
따라서, 보습 지속력이 우수하고 구강점막에 직접 작용하는 폴리머를 이용한 수분유지에 효과적인 제품, 구강 건조증 환자의 삶의 질을 높이는 제품 개발이 더욱 활발히 이루어지고 있습니다.
(다) 수요 변동요인
1) 세계 고령화 및 생활수준 향상
구강건조 증상은 60세 이상의 개인(12-40%)에서 더 높은 발병률을 보이며 젊은 성인보다 최대 3배 더 높습니다.
급성장하는 노인 인구, 구강 건조증을 유발하는 약물 소비의 급증, 방사선 요법과 화학 요법이 필요한 암의 증가는 구강 건조증 치료제 세계 시장의 주요 성장 요인입니다. 또한, 처방 의약품의 사용 증가, 의약품의 쉬운 가용성 및 비용 효율성, 쇼그렌 증후군, HIV, 당뇨병 및 알츠하이머 병과 같은 질병의 유병률이 증가하는 것도 시장 성장의 주요한 요인입니다.
![이미지: [UN,2019년 세계 인구 고령화 및 노령 부양 비율 OECD 세계 중산층 인구]](un%2C2019%EB%85%84%20%EC%84%B8%EA%B3%84%20%EC%9D%B8%EA%B5%AC%20%EA%B3%A0%EB%A0%B9%ED%99%94%20%EB%B0%8F%20%EB%85%B8%EB%A0%B9%20%EB%B6%80%EC%96%91%20%EB%B9%84%EC%9C%A8%20oecd%20%EC%84%B8%EA%B3%84%20%EC%A4%91%EC%82%B0%EC%B8%B5%20%EC%9D%B8%EA%B5%AC.jpg) |
|
[UN,2019년 세계 인구 고령화 및 노령 부양 비율 OECD 세계 중산층 인구] |
(출처: Source: United Nations, World Population Ageing 2019)
세계 지역별 구강 건조증 치료 시장을 살펴보면, 노인 환자의 지속적 확대로 향후 몇 년간 미국시장이 주도할 가능성이 높으며 2019년 7월 미국 치과협회 자료에 따르면 구강 건조 유병률이 0.9%에서 64.8%로 크게 증가하였다고 합니다. 유럽시장은 구강 건조증과 쇼그렌 증후군 등 관련 질환의 증가를 고려할 때 두 번째로 높은 상승세를 보일 것으로 예상되고, 아시아 태평양 지역은 노인 환자들과 증가하는 의료비 지출 및 정부의 이니셔티브의 급증과 결합하여 가까운 장래에 가장 빠른 성장률을 얻을 것으로 기대됩니다. 중동 및 아프리카 시장은 의료 산업의 첨단 기술 채택률이 높아지고 지역의 의료 시설 수를 강화하는 등의 정부 노력이 증가함에 따라 꾸준한 성장 추세를 보이고 있습니다(출처: Global Dry Mouth Relief Market: Forecast till 2026,April 2020, XEROSTOMIA (DRY MOUTH DISEASE) THERAPEUTICS MARKET - GROWTH, TRENDS, COVID-19 IMPACT, AND FORECASTS (2021 - 2026)).
2) 항우울제 사용 증가에 따른 구강건조 환자 증가
20세 인구의 약 20~30%가 구강건조증을 앓고 있는 것으로 추정되며 이는 우울증 및 불안과 관련된 항우울제의 사용 증가로 인한 것으로 파악되고 있습니다. 항우울제 및 기타 약물, 알코올 음료 및 담배의 높은 소비는 구강건조 증상을 가진 잠재적 환자의 증가를 의미할 수 있습니다. (Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 2008:106:833-839)
(라) 시장 규모 및 전망
전 세계 구강 건조증 치료제 시장규모는 2018년에 6억 2,530만($625.3 million) 달러로 추정되었으며, 2019년부터 2026년까지 연평균 3.6% 성장할 것으로 예상됩니다.
(출처: Xerostomia (Dry Mouth) Therapeutics Market Size, Share, Trends, & Industry Analysis Report, By Product (Artificial Saliva, Dentifrices, Salivary Stimulants, Saliva Substitutes, Drugs, and Salivary Pen): By Distribution Channel: By Regions: Segment Forecast, 2019 - 2026).
암 치료에서 화학 요법 및 방사선 요법의 채택 증가와 처방약 사용 증가가 구강 건조증 치료제 시장을 촉진 할 것으로 예상합니다. 암 환자에게 가장 일반적인 치료법인 화학요법과 방사선 치료는 침샘을 손상시키고, 그로 인해 구강건조증이 유발되기 때문입니다. 질병 통제 예방센터 (CDC: Center for Disease Control & Prevention)에 따르면 매년 약 65만 명의 암 환자가 화학요법치료를 받고 있다고 합니다.
미국의 전문 시장조사 기관인 Grand view research의 정보에 따르면, 미국 구강 건조증 치료제 시장은 2014년 1,283억원($113.5 million), 2015년에 1,300억 원($115.0 million)으로 증가함을 보였고, 2025년까지 점진적인 성장을 할 것으로 예측하였습니다(출처: Xerostomia Therapeutics Market Size, Share & Trends Analysis Report By Type (OTC, Prescription), By Product (Salivary Stimulants, Salivary Substitutes, Dentifrices), By Region, And Segment Forecasts, 2018 - 2025, Grand View Research, 2017.09).
또한, 2016년 기준 전 세계 구강 건조증 치료제 시장규모를 6,802억 원으로 2025년까지 연평균 성장률 3.2%로 지속적인 성장을 할 것으로 전망하였습니다.
![이미지: [미국 구강건조증 치료제 시장 현황 및 전망(백만달러)]](%EB%AF%B8%EA%B5%AD%20%EA%B5%AC%EA%B0%95%EA%B1%B4%EC%A1%B0%EC%A6%9D%20%EC%B9%98%EB%A3%8C%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%20%ED%98%84%ED%99%A9%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D%28%EB%B0%B1%EB%A7%8C%EB%8B%AC%EB%9F%AC%29.jpg) |
|
[미국 구강건조증 치료제 시장 현황 및 전망(백만달러)] |
(출처: Xerostomia Therapeutics Market Size, Share & Trends Analysis Report By Type (OTC, Prescription), By Product (Salivary Stimulants, Salivary Substitutes, Dentifrices), By Region, And Segment Forecasts, 2018 ? 2025)
1) 쇼그렌 증후군 유래 구강 건조증 발병 환자 규모 및 전망
쇼그렌 증후군으로 인한 구강건조증 발병 환자규모는 쇼그렌 증후군 진단 후 약물치료를 받는 환자규모로 정의하였습니다. 쇼그렌 증후군 진단 환자규모는 2021년 기준 미국 27만 명, 중국 54만 명이며, 진단 후 약물치료 시행 환자규모는 미국 16만 명으로 조사됩니다. 미국 기준 진단 환자 수 대비 약물치료 시행 환자의 비중은 59%로 산출되며, 중국의 경우 별도의 약물치료 환자규모 자료가 없는 관계로 미국과 동일한 비중을 대입하였습니다. 해당 수치 대입 시 중국의 쇼그렌 증후군 약물치료 환자 규모는 32만 명으로 계산됩니다.
쇼그렌 증후군의 진단 후 약물치료 환자는 모두 구강건조증을 동반한다고 알려져 있습니다. 쇼그렌 증후군으로 인한 구강건조증 발병 환자규모는 2021년 기준 48만 명으로 추산되며, 2026년 52만 명 규모로 꾸준한 성장세를 보일 것으로 전망됩니다.
![이미지: [쇼그렌 증후군 유래 구강건조증 발병 환자규모 및 전망]](%EC%87%BC%EA%B7%B8%EB%A0%8C%20%EC%A6%9D%ED%9B%84%EA%B5%B0%20%EC%9C%A0%EB%9E%98%20%EA%B5%AC%EA%B0%95%EA%B1%B4%EC%A1%B0%EC%A6%9D%20%EB%B0%9C%EB%B3%91%20%ED%99%98%EC%9E%90%EA%B7%9C%EB%AA%A8%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D.jpg) |
|
[쇼그렌 증후군 유래 구강건조증 발병 환자규모 및 전망] |
2) 두경부암 유래 구강 건조증 발병 환자 규모 및 전망
두경부암으로 인한 구강건조증 발병 환자규모는 두경부암 진단 후 방사선 치료(Radiotherapy)를 받는 모든 환자로 정의하였습니다. 두경부암의 치료 시장은 환자의 병기와 Line of therapy에 따라 세부 치료시장이 구분되며, 방사선 치료 또는 방사선 치료를 동반한 화학항암요법은 초기 단계(Early stage) 및 국소진행성 단계(Locally advanced stage)에서 주로 시행됩니다. 재발 또는 전이 단계에서는 화학항암요법이 일부 사용되나, 표적항암제 및 면역항암제가 주로 권고되고 있습니다. 두경부암 진단 후 방사선 치료를 받는 환자규모는 2021년 기준 미국과 중국 합산 약 18.8만 명으로 추산되며, 2026년에는 21.3만 명으로 소폭 증가할 것으로 예상됩니다.
![이미지: [두경부암 유래 구강건조증 발병 환자규모 및 전망]](%EB%91%90%EA%B2%BD%EB%B6%80%EC%95%94%20%EC%9C%A0%EB%9E%98%20%EA%B5%AC%EA%B0%95%EA%B1%B4%EC%A1%B0%EC%A6%9D%20%EB%B0%9C%EB%B3%91%20%ED%99%98%EC%9E%90%EA%B7%9C%EB%AA%A8%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D.jpg) |
|
[두경부암 유래 구강건조증 발병 환자규모 및 전망] |
이에 따라, 기존 구강 건조증 치료제의 일시적인 효과의 단점을 보완한 당사의 구강건조증 치료제 MucoPEG™ 제품이 출시될 경우 큰 파급력을 보일 것으로 예상합니다.
라. 경쟁 현황
(1) 경쟁 상황
(가) PEG 유도체 소재
당사는 PEG 유도체 소재 생산 및 개발 기술을 보유하고 있으며, 자체 생산 개발하고 있는 PEG 유도체 소재를 통해 PEGylation 기술을 이용한 바이오신약 및 바이오시밀러(신약후보물질) 연구 중심 회사로 기술적 경쟁력을 보유하고 있습니다.
미국, 독일, 일본 그리고 중국의 다수 회사가 진입장벽이 낮은 일반적인 제네릭 PEG 유도체 소재 사업에 참여하고 있어 이로 인해 몇몇 제네릭 PEG 유도체 소재 업체 간 경쟁이 심하여 가격이 낮아질 수 있습니다. 그러나 당사의 의약품 수준의 PEG 유도체 소재의 합성, 생산 공정은 당사의 오랜 노하우를 바탕으로 한 품질보증, 특허 등 지식재산권 구축, 다양한 해외 업체들과의 공동개발, 기술이전 등으로 그 기술의 우수성이 입증되었다고 할 수 있습니다. 즉, 고품질 PEG 유도체 소재에 대한 합성, 생산기술은 모방의 난이도가 높아 진입장벽이 높다고 할수 있습니다.
국외에서는 기존의 타사(Nektar, NOF 등)와 비교하여 품질면에서 경쟁력을 갖추고 있으며, GMP 수준급(품질)의 생산도 가능하여 국외 50여개 업체에 PEG 유도체 소재를 공급하고 있으며, 국내 연구소 및 대학교, 제약회사에 판매하고 있습니다.
(나) 호중구 감소증 치료제 pegfilgrastim 바이오시밀러
Pegfilgrastim은 Amgen Inc.에 의해 2002년 Neulasta로 처음 출시되었고, 현재 아래와 같이 Intas 사를 포함하여 9개의 경쟁사 pegfilgrastim 바이오시밀러가 각각 EU, US, 캐나다 등 시장에 출시되었습니다. 아래 표에 기재된 내용을 바탕으로 당사와 Intas사의 pegfilgrastim 바이오시밀러인 Neupeg™/Lapelga™/Pelgraz®는 인도시장 최초 승인이였으며, 캐나다 시장 최초 승인, 또한 EU에서 최초로 승인받아 선진시장에서는 당사의 바이오시밀러가 1호였습니다. 그러나 그후 아래와 같이 여러 업체가 미국 및 EU 시장에 승인 및 출시하여 pegfilgrastim 바이오시밀러 시장을 점유하고 있습니다.
[해외 경쟁사 업체별 허가 및 경쟁 현황]
| No. |
제품 |
회사명 |
분류 |
시장 |
허가 |
|
1 |
Neulasta |
Amgen Europe |
Original |
Global |
2002 |
|
2 |
Pelgraz®/ |
Intas Pharmaceuticals Ltd/ Accord Healthcare |
Biosimilar |
India Canada /EU /Australia |
2007.08 2018.05 2018.09 2019.08 |
|
3 |
Udenyca |
Coherus BioSciences |
EU(취소) /US |
2018.09 /2018.11 |
|
|
4 |
Fulphila |
Mylan/Biocon |
US /EU /Canada, Australia |
2018.06 /2019.01 /2020.04 |
|
|
5 |
Ziextenzo |
Sandoz |
EU /US /Australia /Canada |
2018.11 /2019.11 /2019.06 /2020.06 |
|
|
6 |
Pelmeg/Cegfila (Pegfilgrastim Mundipharma) |
Cinfa Biotech S.L. Mundipharma Biologics S.L. |
EU |
2018.11 /2019.10 |
|
|
7 |
Grasustek1 |
Juta Pharma (USV) GmbH |
EU |
2019.06 |
|
|
8 |
Nyvepria |
Pfizer USA |
US /EU |
2020.06 /2020.11 |
|
| 9 | Stimufend | Fresenius Kabi Deutschland GmbH | EU /US |
2022.03 /2022.09 |
|
|
10 |
Fylnetra | Amneal Pharmaceuticals and Kashiv Biosciences | US | 2022.05 |
(출처: Biosimilars of Pegfilgrastim, gabionline)
당사의 파트너사인 Intas사는 현재, 미국을 제외한 유럽, 캐나다, 호주 등에 출시한 상태이며 다른 경쟁사들과 달리 Pre-filled Syringe 제형 외에 Pre-filled Injector 제형을 출시하며 환자의 편의성을 개선하였으며, 특히 COVID-19 상황에 병원에 내원하지 않고 환자가 자택에서 투여 가능한 형태의 제형으로 타 경쟁사 제품 대비 경쟁우위에 있습니다.
또한, Pelgraz®는 EU에서 가장 빠른 pegfilgrastim 바이오시밀러로 판매 허가를 받았으며, 1호 승인 제품으로의 인지도와 EU 마케팅을 책임지는 Accord Healthcare가 EU 시장에서 최고의 경쟁력으로 시장을 확대할 것이라 예상합니다.
Intas Pharmaceuticals Ltd. 의 글로벌 자회사인 Accord Healthcare는 전 세계 70개국 65개에 이르는 EMENA(Europe, Middle East & North Africa) 시장에서 영업 활동을 하고 있으며, 제네릭의약품 개발 및 생산 프로세스의 모든 단계를 수행함으로써, 경쟁업체보다 더 빠르고 경제적으로 우수한 품질의 의약품을 환자에게 제공하고 있습니다.
Accord Healthcare는 다양한 파트너들과의 In-licensing, Out-licensing, Co-Marketing 통한 저렴하고 고품질의 의약품을 제공하고 있으며, 유럽 지역 전체에서는 9,300건이 넘는 마케팅 권한을 받아 마케팅 하고 있습니다. 또한, 영국과 아일랜드에서 가장 큰 제네릭 회사와 합병, 공장 인수, 그리고, 2018년 6월 유럽시장의 사업 확장을 위해 스위스 바젤에 새로운 지사를 설립하고, 오스트리아에 사업을 확장하였습니다. 뿐만 아니라 미국 제품 포트폴리오로 260개 이상의 제품이 FDA에 승인된 상태이고, 승인을 기다리고 있거나 개발 중인 제품 등이 200여개 이상으로 미국시장에서 선도적인 제네릭 공급처가 되기 위한 입지를 굳히고 있습니다.
(다) 구강 건조증 치료제 MucoPEG™
현재 판매되고 있는 구강건조 치료 제품들은 물보다 증가된 점성의 특징으로 수분 증발을 막는 CMC(Carboxymethyl cellulose: 카르복시메틸 셀룰로오스), 보습성분의 글리신(glycine)을 주성분으로 합니다. 이로인해 제품의 적용감은 있으나, 보습효과 및 구강건조 증상 완화 효과가 일시적이기 때문에 잦은 사용으로 인한 불편으로 환자의 만족도가 낮다고 합니다. 더 높은 효과 지속력을 위해 젤 타입의 제품으로 치약처럼 입안에 도포하는 제품도 있으나 이는 사용 불편감 및 제품 적용 후 구강 내 이물감으로 느껴져 이러한 불편으로 환자의 만족도가 낮다고 합니다.
구강건조증 및 구강 건강을 위한 시장은 Colgate-Palmolive Company, Procter & Gamble, GlaxoSmithKline plc, Johnson and Johnson Services, Inc. 등이 주요 구강 시장을 운영하며, 관련 제품은 구강세정제, 스프레이, 젤 등 다양한 제품으로 분류됩니다. 사용자 사이에서 인지도를 높이는 다양한 기반과 함께 많은 주요 제약회사는 제품 포트폴리오를 늘리고, 신흥 기업과의 인수 및 합작 투자를 위해 노력하고 있습니다.
![이미지: [MucoPEG 및 국내외 구강건조증 치료제품]](mucopeg%20%EB%B0%8F%20%EA%B5%AD%EB%82%B4%EC%99%B8%20%EA%B5%AC%EA%B0%95%EA%B1%B4%EC%A1%B0%EC%A6%9D%20%EC%B9%98%EB%A3%8C%EC%A0%9C%ED%92%88.jpg) |
|
[MucoPEG 및 국내외 구강건조증 치료제품] |
그러나 당사의 MucoPEG™은 건조한 구강점막에 PEGylation 기술을 적용하여, 보습성분인 PEG 유도체 소재를 간편한 가글링 방법으로 적용하고, 자극적이지 않은 민트향을 추가하여 구강 내 이물감 없이 건조한 구강점막의 표면에 수분층을 형성합니다. 보호막의 코팅 효과는 PEG 유도체의 공유결합으로 지속성을 나타내며, 그 효과의 지속성으로 잦은 사용의 불편감도 감소된 제품으로 경쟁사 제품과 비교하여 경쟁력이 높습니다.
(2) 시장 경쟁력-비교우위
(가) PEG 유도체 소재
PEG 유도체 소재 사업부분에서 경쟁사인 Shearwater Polymers 사는 1992년 PEG 유도체 소재 생산 및 판매, PEGylation 기술을 이용한 신약개발을 수행하는 부분에서 선두에 있었던 회사였습니다. 그러나 2001년 Nektar Therapeutics 사에 합병이 되면서 기존의 공급업체에만 공급을 진행 중이며 현재는 추가적인 PEG 유도체 소재사업은 하지 않고 있습니다. 당사가 PEG 유도체 소재 사업에 있어서는 후발 주자이나 1998년 이후에 꾸준히 PEG 유도체 소재를 생산 판매하고 있으며 이를 이용한 PEGylation 기술로 pegfilgrastim, PEG-Interferon 등의 신약개발을 수행하고 있습니다.
NOF 사와 PEG 유도체 소재 사업에 대한 경쟁우위성에 대해서 당사는 PEG 유도체 소재 사업이 주력 사업부분인데 반해 NOF의 PEG 유도체 사업부분은 전체 NOF 사업부분에서 주력사업부분이 아니며 매출 비중도 크지 않습니다. 또한 NOF의 PEG 유도체 사업은 대량생산 위주로 진행 중이며 소량 다품종 생산을 하고 있지 않습니다. 이로 인해 NOF사를 통한 소량 구매 및 다양한 유도체 구매가 어려운 상황입니다. 당사는 이에 비해 소량 다품종 생산 및 대량 생산을 동시에 진행하고 있으며 국외 및 국내의 거래업체의 요구사항을 충족할 수 있는 제품 생산 및 판매가 가능합니다. 또한 가격 면에 대해서도 당사가 NOF에 비해 우위에 있으며 이에 따른 고객만족도가 우수합니다.
![이미지: [PEG 유도체소재 품질비교]](peg%20%EC%9C%A0%EB%8F%84%EC%B2%B4%EC%86%8C%EC%9E%AC%20%ED%92%88%EC%A7%88%EB%B9%84%EA%B5%90.jpg) |
|
[PEG 유도체소재 품질비교] |
PEG 유도체 소재 (mPEG-PAL-20k) 순도를 NOF 제품과 비교하였습니다. PAGE(Polyacrylamide gel electrophoresis)분석과, GPC(gel permeation chromate-graphy)분석에서 NOF의 제품이 분자량 20k외의 다른 고분자(large molecule)를 포함하는 것을 확인하였으며, 당사의 mPEG-PAL 순도가 우수한 것을 확인하였습니다.
NOF 사의 경우 PEG 유도체를 이용한 DDS(Drug Delivery System, 약물전달기술)개발을 하고 있으나 뚜렷한 출시 제품이 없습니다. 이에 비해 당사는 PEG 유도체 소재 및 이를 이용한 신약제품이 출시되어있습니다(Intas사의 Neupeg™).
![이미지: [Nektar 2020 연간보고서]](nektar%202020%20%EC%97%B0%EA%B0%84%EB%B3%B4%EA%B3%A0%EC%84%9C.jpg) |
|
[Nektar 2020 연간보고서] |
Amgen사에 PEG 유도체 소재를 공급하는 Nektar 사는 자사 연간보고서의 과학과 기술 경쟁(Science and Technology Competition) 부분에 진보된 폴리머를 이용한 컨쥬게이션 기술을 가진 업체들로 Biogen Idec, Horizon Pharma, Dr. Reddy’s 그리고 당사 SunBio를 경쟁자로 언급하였습니다. 그리고 언급한 경쟁자들 중 일부는 지적 재산권 또는 PEGylation materials를 다른 회사에 라이선스하거나 기술을 적용하여 자체 약물 후보를 만든다고 언급하였으며, 당사가 해당된다고 할 수 있습니다. 이처럼 당사는 진보된 polymer인 PEG 유도체 소재를 이용한 PEGylation 기술 분야에서 여러 글로벌기업들과 함께 언급되는 만큼 관련 기술분야에서 높은 인지도를 갖고 있다고 할수 있습니다.
(나) 호중구 감소증 치료제 Pegfilgrastim 바이오시밀러
당사 pegfilgrastim 바이오시밀러의 비교 우위성을 아래와 같이 구분하였습니다.
1) 경쟁제품 대비 편의성
현재 바이오시밀러 경쟁사 제품 대부분 주사제품 방식의 제품을 판매하고 있으나, 당사가 기술이전하여 제품을 제조/판매하고 있는 Intas 사는 Amgen사 Neulasta 주사제품의 편의성을 높인 Onpro(On body Injector) 제품과 유사한 형태의 pre-filled Injector 방식의 제품을 출시 판매하고 있습니다. 오리지널 Amgen사 Onpro와 당사의 Pelgraz® pre-filled Injector 방식의 제품이 경쟁제품 대비 편의성이 증대되었다고 할 수 있습니다.
![이미지: [Amgen사 Pegfilgrastim Onpro(On body injector) & 주사 제품]](amgen.jpg) |
|
[Amgen사 Pegfilgrastim Onpro(On body injector) & 주사 제품] |
![이미지: [Pegfilgrastim 바이오시밀러 Pelgraz Injector & 주사 제품]](pelgraz-2.jpg) |
|
[Pegfilgrastim 바이오시밀러 Pelgraz Injector & 주사 제품] |
2) 동일한 효능
바이오시밀러 제품의 특성상 오리지널 제품 보다 효능이 우수하거나 낮을 수 없습니다. 효능은 모두 동일합니다.
3) 생산수율/품질 우수성 및 원가 경쟁력
Intas에서는 Key Intermediate 물질인 당사의 mPEG-PAL-20k를 사용하여 Pegfilgrastim을 생산하고 있습니다. 당사는 Intas에 공급하는 제품에 대해 대량 생산 체제를 구축하여 직접 생산하고 있으며, 이에 따라 추가적인 외주비용이 들지 않아 가격 경쟁력이 높습니다. Intas는 당사로부터 상대적으로 저렴한 가격으로 원재료를 조달할 수 있기 때문에, 당사의 PEG 유도체를 사용하는 것이 생산 비용 측면에서 효율적입니다.
또한, 당사의 mPEG-PAL-20k는 반응기 활성도(NMR 분석) 93%와 순도(GPC Main Peak Fraction) 99.8%의 품질 우수성을 지니고 있습니다. 경쟁사의 70% 정도의 반응기 활성도와 비교하여 높은 품질의 PEG 유도체 제품으로 pegfilgrastim 제조의 높은 수율 및 효율로 연결되어 원가 경쟁에 유리하게 작용합니다.
그리고, 당사는 EU EMA의 허가를 위한 GMP 급 생산시설 QP Audit에서도 적합판정을 받았으며, 품질관리 면에서 불량품의 발생이나 리콜 등이 없으므로 가격경쟁력 확보에 유리하게 작용하고 있으며, pegfilgrastim의 EMA 품목허가를 통해 SunBio의 인지도가 더 높아진 관계로 새로운 고객사들이 구매에 대한 요청 및 판매를 하고 있습니다.
(다) 구강건조증 치료제 MucoPEG™
1) 경쟁제품 대비 편의성
경쟁제품의 가글액(oral rinse) 400ml~1L 용량, 스프레이 제품의 45ml 용기 등과 비교하여, 당사 MucoPEG은 1회용 packet 포장으로 사용성 및 휴대, 보관 등이 용이합니다.
2) 효능 우수성
기존 제품의 일시적인 구강건조 완화 효과와 비교하여 공유결합에 의한 보습층의 점막 코팅으로 구강건조 완화효과의 지속성이 매우 우수하다고 할 수 있습니다. 이러한 효과는 구강점막세포에 대한 PEG유도체 결합시험 및 건조한 환경에서의 PEG 보습층의 코팅에 의한 세포 생존율 증가로 확인하였습니다.
즉, MucoPEG과 경쟁사인 Colgate사의 Hydris 제품, 그리고 대조군으로 PBS(Phosphate Buffered Saline)를 구강점막 세포에 적용 한 후, 세포를 수차례 PBS로 헹구며 각 제품을 제거하고, 세포들을 25℃/30% 온습도에 노출시켜(건조한 환경) 세포 생존율을 확인한 시험입니다. 시험결과를 아래 기재하였습니다.
<Colgate's Hydris, PBS(Control), MucoPEG 건조한 환경에서의 세포 생존율 비교시험 결과>
|
PBS (Control) |
Hydris (Colgate) |
MucoPEG (SunBio) |
|
|
N |
8 |
8 |
8 |
|
세포 생존율 평균값 |
100% |
12.0% |
71.9% |
상기 자료는 미국 510(k) 심사시 제출된 자료 중 일부를 발췌한 내용이며, 경쟁사 Colgate사의 Hydris 제품의 세포 생존율(Cell Viability) 평균/중간 값은 12.0/11.5%, 당사 MucoPEG의 세포 생존율 평균/중간 값은 71.9/81.5%로 경쟁 제품 대비 우수한 세포생존율을 나타냈습니다. 즉 씻어 내는 과정 후에도 점막 세포에 윤활 및 보습제 성분이 남아 있었던 MucoPEG 제품의 세포들은 PEG 유도체의 공유결합이라는 차별적인 기술을 적용한 PEG 유도체의 보습효과로 세포들의 70~80%가 생존하는 결과를 보였으며, 경쟁사 제품 및 대조군의 세포들은 약 10% 내외가 생존하는 결과를 나타냈습니다. 공유결합에 의한 보습층의 지속성 및 보습효과를 확인하여 MucoPEG 효능의 우수성을 확인한 In-vitro 시험결과입니다.
3) 생산수율 우수성 및 원가 경쟁력
MucoPEG의 주성분 PEG 유도체 소재인 P4SG-10k는 당사에서 제조하며, 반응기 활성도(NMR분석) 96.4% 이상과 순도(GPC Main Peak Fraction) 100% 로 높은 수준의 품질로 MucoPEG의 효능을 높이고 있습니다. 주성분인 P4SG-10k와 첨가제를 포함한 생산과정의 자연 Loss를 감안한 98% 이상의 생산수율 및 주성분 P4SG-10k의 원료에 대한 당사의 독자적인 제조기술은 원료 및 최종 제품의 품질 우수성으로 이어지고 있으며, 향후 기술이전을 통해 당사의 우위성을 입증할 것입니다.
III. 재무에 관한 사항
1. 요약재무정보
| (단위 : 원) |
| 과 목 | 제27기 3분기 (2023년 9월말) |
제26기 (2022년12월말) |
제25기 (2021년12월말) |
|---|---|---|---|
| 회계처리 기준 | K-IFRS | K-IFRS | K-IFRS |
| [유동자산] | 14,980,752,459 | 16,112,462,669 | 11,416,288,699 |
| ㆍ당좌자산 | 13,798,050,139 | 14,913,014,891 | 10,041,176,179 |
| ㆍ재고자산 | 1,182,702,320 | 1,199,447,778 | 1,375,112,520 |
| [비유동자산] | 31,370,046,824 | 26,786,332,118 | 8,303,436,016 |
| ㆍ투자자산 | - | - | - |
| ㆍ유형자산 | 31,115,023,550 | 26,534,246,705 | 8,054,656,206 |
| ㆍ무형자산 | - | - | - |
| ㆍ기타비유동자산 | 255,023,274 | 252,085,413 | 248,779,810 |
| 자산총계 | 46,350,799,283 | 42,898,794,787 | 19,719,724,715 |
| [유동부채] | 17,213,831,047 | 18,034,554,018 | 2,717,435,417 |
| [비유동부채] | 893,986,734 | 1,024,949,577 | 1,605,772,765 |
| 부채총계 | 18,107,817,781 | 19,059,503,595 | 4,323,208,182 |
| [자본금] | 6,156,777,500 | 6,156,777,500 | 5,841,408,000 |
| [자본잉여금] | 12,856,629,533 | 12,856,629,533 | 6,724,545,404 |
| [자본조정] | 2,455,152,196 | 2,325,134,196 | 2,206,203,815 |
| [이익잉여금] | 6,774,422,273 | 2,500,749,963 | 624,359,314 |
| 자본총계 | 28,242,981,502 | 23,839,291,192 | 15,396,516,533 |
| 과 목 | 제27기 3분기 (2023년 9월말) |
제26기 (2022년12월말) |
제25기 (2021년12월말) |
| 매출액 | 9,533,539,569 | 7,420,394,142 | 9,964,993,948 |
| 영업이익(손실) | 4,933,136,553 | 190,910,321 | 3,377,483,888 |
| 법인세비용차감전순이익 | 5,663,966,227 | 937,433,919 | 1,132,611,803 |
| 당(반)기순이익 | 4,744,268,460 | 869,325,809 | 284,736,643 |
| 주당손익 | |||
| - 기본주당이익 | 386 | 74 | 25 |
| - 희석주당이익 | 386 | 73 | 24 |
2. 연결재무제표
당사는 보고서 제출일 현재 해당사항이 없습니다.
3. 연결재무제표 주석
당사는 보고서 제출일 현재 해당사항이 없습니다.
4. 재무제표
4-1. 재무상태표
|
재무상태표 |
|
제 27 기 3분기말 2023.09.30 현재 |
|
제 26 기말 2022.12.31 현재 |
|
(단위 : 원) |
|
제 27 기 3분기말 |
제 26 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
14,980,752,459 |
16,112,462,669 |
|
현금및현금성자산 |
2,051,191,543 |
1,102,325,316 |
|
단기금융상품 |
1,979,079,453 |
9,965,480,962 |
|
매출채권 및 기타유동채권 |
9,767,779,143 |
3,845,208,613 |
|
유동재고자산 |
1,182,702,320 |
1,199,447,778 |
|
비유동자산 |
31,370,046,824 |
26,786,332,118 |
|
유형자산 |
31,115,023,550 |
26,534,246,705 |
|
기타비유동자산 |
255,023,274 |
252,085,413 |
|
자산총계 |
46,350,799,283 |
42,898,794,787 |
|
부채 |
||
|
유동부채 |
17,213,831,047 |
18,034,554,018 |
|
매입채무 및 기타유동채무 |
16,702,043,594 |
17,681,631,140 |
|
단기매입채무 |
0 |
27,211,800 |
|
단기미지급금 |
164,030,370 |
144,756,420 |
|
단기예수금 |
28,522,370 |
28,851,220 |
|
유동 차입금 |
16,000,000,000 |
17,000,000,000 |
|
단기미지급비용 |
185,836,398 |
153,323,847 |
|
유동 리스부채 |
323,654,456 |
327,487,853 |
|
당기법인세부채 |
511,787,453 |
352,922,878 |
|
비유동부채 |
893,986,734 |
1,024,949,577 |
|
장기매입채무 및 기타비유동채무 |
280,636,045 |
802,295,317 |
|
이연법인세부채 |
495,573,986 |
106,234,342 |
|
기타비유동충당부채 |
117,776,703 |
116,419,918 |
|
부채총계 |
18,107,817,781 |
19,059,503,595 |
|
자본 |
||
|
자본금 |
6,156,777,500 |
6,156,777,500 |
|
자본잉여금 |
12,856,629,533 |
12,856,629,533 |
|
기타자본구성요소 |
2,455,152,196 |
2,325,134,196 |
|
이익잉여금(결손금) |
6,774,422,273 |
2,500,749,963 |
|
자본총계 |
28,242,981,502 |
23,839,291,192 |
|
자본과부채총계 |
46,350,799,283 |
42,898,794,787 |
4-2. 포괄손익계산서
|
포괄손익계산서 |
|
제 27 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 26 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
제 27 기 3분기 |
제 26 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
수익(매출액) |
3,957,386,205 |
9,533,539,569 |
2,168,453,702 |
5,377,035,482 |
|
제품매출액 |
2,945,298,720 |
6,212,464,406 |
1,520,352,988 |
3,764,150,298 |
|
로열티수익(매출액) |
1,012,087,485 |
3,321,075,163 |
648,100,714 |
1,612,885,184 |
|
매출원가 |
986,813,210 |
2,775,729,553 |
671,251,899 |
1,829,279,411 |
|
매출총이익 |
2,970,572,995 |
6,757,810,016 |
1,497,201,803 |
3,547,756,071 |
|
판매비와관리비 |
703,298,213 |
1,824,673,463 |
879,292,979 |
2,966,632,906 |
|
영업이익(손실) |
2,267,274,782 |
4,933,136,553 |
617,908,824 |
581,123,165 |
|
금융수익 |
310,200,643 |
829,503,546 |
862,466,456 |
1,472,255,960 |
|
금융원가 |
1,905,323 |
100,413,858 |
22,763,432 |
70,002,372 |
|
기타이익 |
1,765 |
1,740,002 |
1,543 |
10,880,620 |
|
기타손실 |
1 |
16 |
3 |
7,006 |
|
법인세비용차감전순이익(손실) |
2,575,571,866 |
5,663,966,227 |
1,457,613,388 |
1,994,250,367 |
|
법인세비용(수익) |
393,336,925 |
919,697,767 |
330,862,602 |
297,629,674 |
|
당기순이익(손실) |
2,182,234,941 |
4,744,268,460 |
1,126,750,786 |
1,696,620,693 |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
177 |
386 |
96 |
145 |
|
희석주당이익(손실) (단위 : 원) |
177 |
386 |
96 |
145 |
4-3. 자본변동표
|
자본변동표 |
|
제 27 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 26 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
자본 |
|||||
|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본구성요소 |
이익잉여금 |
자본 합계 |
|
|
2022.01.01 (기초자본) |
5,841,408,000 |
6,724,545,404 |
2,206,203,815 |
624,359,314 |
15,396,516,533 |
|
당기순이익(손실) |
1,696,620,693 |
1,696,620,693 |
|||
|
기타포괄손익 |
|||||
|
지분의 발행 |
315,369,500 |
6,203,010,750 |
6,518,380,250 |
||
|
현금배당 |
|||||
|
주식기준보상거래에 따른 증가(감소), 지분 |
867,750,900 |
867,750,900 |
|||
|
미행사주식선택권 |
|||||
|
2022.09.30 (분기말) |
6,156,777,500 |
12,927,556,154 |
3,073,954,715 |
2,320,980,007 |
24,479,268,376 |
|
2023.01.01 (기초자본) |
6,156,777,500 |
12,856,629,533 |
2,325,134,196 |
2,500,749,963 |
23,839,291,192 |
|
당기순이익(손실) |
4,744,268,460 |
4,744,268,460 |
|||
|
기타포괄손익 |
|||||
|
지분의 발행 |
|||||
|
현금배당 |
(615,266,650) |
(615,266,650) |
|||
|
주식기준보상거래에 따른 증가(감소), 지분 |
274,688,500 |
274,688,500 |
|||
|
미행사주식선택권 |
(144,670,500) |
144,670,500 |
0 |
||
|
2023.09.30 (분기말) |
6,156,777,500 |
12,856,629,533 |
2,455,152,196 |
6,774,422,273 |
28,242,981,502 |
4-4. 현금흐름표
|
현금흐름표 |
|
제 27 기 3분기 2023.01.01 부터 2023.09.30 까지 |
|
제 26 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
(단위 : 원) |
|
제 27 기 3분기 |
제 26 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(494,682,893) |
(530,156,988) |
|
영업에서 창출된 현금 |
100,151,019 |
276,423,434 |
|
당기순이익(손실) |
4,744,268,460 |
1,696,620,693 |
|
조정사항 |
(4,644,117,441) |
(1,420,197,259) |
|
이자수취 |
287,852,418 |
1,712,224 |
|
이자지급(영업) |
(511,192,782) |
(414,653,057) |
|
법인세 환급, 영업활동 |
(371,493,548) |
(393,639,589) |
|
투자활동현금흐름 |
2,985,578,049 |
(18,773,184,714) |
|
단기금융삼품의 감소 |
15,926,576,853 |
(19,491,000) |
|
단기금융상품의 증가 |
(7,940,175,344) |
0 |
|
유형자산의 취득 |
(5,000,823,460) |
(18,763,693,714) |
|
유형자산의 처분 |
0 |
10,000,000 |
|
재무활동현금흐름 |
(1,597,526,601) |
23,537,201,238 |
|
주식의 발행 |
0 |
6,938,129,000 |
|
단기차입금의 증가 |
0 |
17,000,000,000 |
|
정부보조금의 수령 |
244,500,000 |
240,000,000 |
|
배당금지급 |
(615,266,650) |
0 |
|
리스료의 지급 |
(226,759,951) |
(221,179,012) |
|
신주발행비의 지급 |
0 |
(419,748,750) |
|
단기차입금의 상환 |
(1,000,000,000) |
0 |
|
현금및현금성자산에 대한 환율변동효과 |
55,497,672 |
609,908,044 |
|
현금및현금성자산의순증가(감소) |
948,866,227 |
4,843,767,580 |
|
기초현금및현금성자산 |
1,102,325,316 |
6,548,518,600 |
|
기말현금및현금성자산 |
2,051,191,543 |
11,392,286,180 |
5. 재무제표 주석
1. 회사의 개요
선바이오 주식회사(이하, "당사")는 1997년 7월 10일에 의약품의 연구개발과 생산 및판매를 사업목적으로 설립되었습니다. 당사는 2016년 1월 22일자로 당사의 주식을 한국거래소 코넥스시장에 상장하였고, 2022년 10월 5일에 한국거래소 코스닥시장으로 이전 상장하였습니다.
당사의 설립시 납입자본금은 750,000천원이었으나, 이후 수차의 증자를 거쳐 보고기간종료일 현재 납입자본금은 6,156,778천원입니다.
당분기말 현재 당사의 주주현황은 다음과 같습니다.
| (단위: 주) |
| 주주명 | 소유주식수 | 지분율 |
|---|---|---|
| 노광 외 특수관계자 | 4,076,196 | 33.10% |
| 자기주식 | 8,222 | 0.07% |
| 기타주주 | 8,229,137 | 66.83% |
| 합 계 | 12,313,555 | 100.00% |
2. 중요한 회계정책
2.1 분기재무제표 작성기준
당사의 재무제표는 연차재무제표가 속하는 기간의 일부에 대하여 한국채택국제회계기준 제1034호 중간재무보고를 적용하여 작성하는 요약 중간재무제표입니다.
이 분기재무제표는 2023년 9월 30일 현재 유효한 한국채택국제회계기준에 따라 작성되었으며, 동 요약 중간재무제표에 대한 이해를 위해서는 한국채택국제회계기준에따라 작성된 2022년 12월 31일자로 종료하는 회계연도에 대한 연차재무제표를 함께이용하여야 합니다.
가. 당사가 채택한 제ㆍ개정 기준서
당사는 2023년 1월 1일로 개시하는 회계기간부터 다음의 주요 제ㆍ개정 기준서를 신규로 적용하였습니다.
- 기업회계기준서 제1001호 '재무제표 표시' 및 국제회계기준 실무서 2 '회계정책 공시' 개정
중요한 회계정책을 정의하고 공시하도록 하며, 중요성 개념을 적용하는 방법에 대한 지침을 제공하기 위하여 국제회계기준 실무서 2 '회계정책 공시'를 개정하였습니다.
- 기업회계기준서 제1001호 '재무제표 표시' 개정
동 개정사항은 발행자의 주가 변동에 따라 행사가격이 조정되는 조건이 있는 금융상품의 전부나 일부가 기업회계기준서 제1032호 ‘금융상품: 표시’ 문단 11의 금융부채 정의 중 (2)에 따라 금융부채로 분류되는 경우에는 그 전환권이나 신주인수권(또는 이를 포함하는 금융부채)에 대하여 보고기간에 발생한 평가손익(당기손익에 포함된 경우로 한정함) 등을 공시하도록 합니다.
- 기업회계기준서 제1008호 '회계정책, 회계추정의 변경 및 오류' 개정
동 개정사항은 회계추정의 변경에 대한 정의를 회계추정치의 정의로 대체합니다. 새로운 정의에 따르면 회계추정치는 “측정불확실성의 영향을 받는 재무제표상 화폐금액”입니다.
- 기업회계기준서 제1012호 '법인세' 개정
자산 또는 부채가 최초로 인식되는 거래의 최초 인식 예외 요건에 거래당시 동일한 가산할 일시적차이와 차감할 일시적차이를 발생시키지 않는 거래라는 요건을 추가하였습니다.
당사는 상기에 열거된 기준서의 개정으로 인하여 당사의 재무제표에 미치는 영향이 중요하지 않을 것으로 판단하고 있습니다.
나. 당사가 적용하지 않은 제ㆍ개정 기준서
제정ㆍ공표되었으나, 아직 시행일이 도래하지 아니하였으며 당사가 조기 적용하지 아니한 주요 제ㆍ개정 기준서는 다음과 같습니다.
- 기업회계기준서 제1001호 '재무제표 표시' 개정
보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된경우는 제외됩니다. 동 개정사항은 2024년 1월 1일 이후 시작하는 회계연도부터 적용될 예정이며, 조기적용이 허용됩니다. 당사는 동 개정으로 인한 재무제표의 영향을 검토 중에 있습니다.
2.2 회계정책
당사의 재무제표는 주석에서 별도로 기술하는 경우를 제외하고는 역사적 원가모형에의하여 작성되었습니다.
중간재무제표의 작성에 적용된 중요한 회계정책은 주석 2.1에서 설명하는 제ㆍ개정기준서의 적용으로 인한 변경을 제외하고는 2022년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성 시 채택한 회계정책과 동일합니다.
2.3 중요한 회계추정 및 가정
중간재무제표를 작성함에 있어, 경영진은 회계정책 적용과 자산과 부채의 장부금액 및 수익과 비용에 영향을 미치는 판단, 추정 및 가정을 하여야 합니다. 추정과 관련 가정은 역사적 경험과 관련성이 있다고 간주되는 기타 요인들에 바탕을 두고 있으며,실제 결과는 이러한 추정치들과 다를 수도 있습니다.
중간재무제표 작성을 위해 회계정책의 적용과 추정 불확실성의 주요 원천에 대해 경영진이 내린 중요한 판단은 2022년 12월 31일로 종료하는 회계연도에 대한 연차재무제표와 동일합니다.
3. 위험관리
당사는 금융상품과 관련하여 신용위험, 유동성위험 및 시장위험에 노출되어 있습니다. 본 주석은 당사가 노출되어 있는 위의 위험에 대한 정보와 당사의 위험관리 목표,정책, 위험 평가 및 관리 절차, 그리고 자본관리에 대해 공시하고 있습니다. 추가적인계량적 정보에 대해서는 본 분기재무제표 전반에 걸쳐서 공시되어 있습니다.
(1) 금융위험관리
1) 위험관리 정책
당사의 위험관리 체계를 구축하고 감독할 책임은 이사회에 있으며 당사의 위험관리 정책은 당사가 직면한 위험을 식별 및 분석하고, 적절한 위험 한계치 및 통제를 설정하고, 위험이 한계치를 넘지 않도록 하기 위해 수립되었습니다. 위험관리정책과 시스템은 시장 상황과 당사의 활동변경을 반영하기 위해 정기적으로 검토되고 있습니다. 당사는 훈련 및 관리기준, 절차를 통해 모든 종업원들이 자신의 역할과 의무를 이해할 수 있는 엄격하고 구조적인 통제환경을 구축하는 것을 목표로 하고 있습니다.
당사의 내부감사는 경영진이 당사의 위험관리 정책 및 절차의 준수여부를 어떻게 관리하는지 감독하고, 당사의 위험관리체계가 적절한지 검토하여 위험관리 통제 및 절차에 대한 정기 및 특별 검토를 수행하고 결과는 이사회에 보고하고 있습니다.
2) 신용위험
신용위험이란 당사의 고객이나 거래상대방이 금융상품에 대한 계약상의 의무를 이행하지 않아 당사가 재무손실을 입을 위험을 의미합니다. 주로 거래처에 대한 매출채권과 기타채권에서 발생합니다.
당사는 계약상대방의 재무상태, 과거 경험 및 기타 요소들을 평가하여 신용도가 일정수준 이상인 계약상대방과 거래하는 정책을 운영하고 있습니다. 당사의 신용위험에 대한 노출은 주로 거래처별 특성의 영향을 받습니다. 고객이 영업하고 있는 산업 및 고객이 위치한 국가의 파산위험 등은 신용위험에 큰 영향을 주지 않습니다. 또한, 당사는 모든 신규 고객에 대해 개별적으로 신용도를 검토하는 정책을 수립하고 있습니다.
한편, 당사는 매출채권 및 기타채권에서 발생할 것으로 예상되는 손실에 대해 충당금을 설정하고 있습니다. 이 충당금은 개별적으로 유의적인 항목에 대한 구체적인 손상차손과 유사한 특성을 가진 금융자산 집합이 발생하였으나 아직 식별되지 않은 손상으로 구성됩니다. 금융자산 집합의 충당금은 유사한 금융자산의 회수에 대한 과거 자료에 근거하여 결정되고 있습니다. 채무증권의 경우 개별분석을 통하여 발생할 것으로 예상되는 손실은 채무증권에서 직접 차감하고 있습니다.
신용위험은 금융기관과의 거래에서도 발생할 수 있으며, 해당 거래는 현금및현금성자산, 각종 예금 그리고 파생금융상품 등의 금융상품 거래를 포함합니다. 이러한 위험을 줄이기 위해, 당사는 신용등급이 높은 은행들에 대해서만 거래를 하는 것을 원칙으로 하고 있으며, 기존의 거래가 없는 금융기관과의 신규거래는 자금팀의 승인, 관리, 감독하에 이루어지고 있습니다.
당사는 금융보증계약 체결 시에는 이사회의 승인 등과 같은 내부 의사결정 프로세스에 따라 계약의 필요성을 평가하고 승인하여 신용위험 등 관련 리스크를 최소화하고 있습니다.
3) 유동성위험
유동성위험이란 당사가 금융부채에 관련된 의무를 충족하는 데 어려움을 겪게 될 위험을 의미합니다. 당사의 유동성 관리방법은 재무적으로 어려운 상황에서도 받아들일 수 없는 손실이 발생하거나, 당사의 평판에 손상을 입힐 위험 없이 만기일에 부채를 상환할 수 있는 충분한 유동성을 유지하도록 하는 것입니다.
일반적으로 당사는 금융부채 상환을 포함하여 상당한 기간에 대한 예상 운영비용을 충당할 수 있는 충분한 자금여력을 보유하고 있다고 판단하고 있습니다. 여기에는 합리적으로 예상할 수 없는 극단적인 상황으로 인한 잠재적인 효과는 포함되지 않았습니다.
4) 시장위험
시장위험이란 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험을 의미합니다. 시장가격 관리의 목적은 수익은 최적화하는 반면 수용가능한 한계 이내로 시장위험 노출을 관리 및 통제하는 것입니다.
① 환위험
당사의 기능통화인 원화 외의 통화로 표시되는 판매, 구매 및 차입에 대해 환위험에 노출되어 있습니다. 이러한 거래들이 표시되는 주된 통화는 USD입니다. 당사는 외화부채 규모의 최소화 및 조기결제 등 환위험 노출을 최소화하기 위한 정책을 수립, 운용하고 있습니다.
② 이자율위험
당사는 변동금리부 금융부채 규모의 증가에 따라 부수되는 이자율 부담을 최소화하기 위한 일환으로 연간 자금수지 계획을 수립하고 시행하고 있으며 장기금융부채를 최소화하고 자금유입의 스케줄에 따라 금융부채의 조달금액 및 차입기간을 최소화하고 있습니다.
(2) 자본관리
당사의 자본관리 정책은 투자자와 채권자, 시장의 신뢰 및 향후 발전을 위해 자본을 유지하는 것입니다. 이사회는 부채비율 및 차입금비율 관리를 통해 자본과 관련된 위험을 분기별로 평가하고 있으며, 해당 비율 분석의 결과를 바탕으로 하여 적정자본을유지하기 위한 정책을 수립, 시행하고 있습니다.
보고기간종료일 현재 부채비율은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 부채총계 | 18,107,818 | 19,059,504 |
| 자본총계 | 28,242,982 | 23,839,291 |
| 부채비율 | 64.11% | 79.95% |
4. 현금및현금성자산 및 단기금융상품
(1) 보고기간종료일 현재 현금및현금성자산의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 보유현금 | - | - |
| 요구불예금 | 2,051,192 | 1,102,325 |
| 합 계 | 2,051,192 | 1,102,325 |
(2) 보고기간종료일 현재 단기금융자산의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| ELB(정기예금) | - | 5,000,000 |
| 전단채 | 1,979,079 | 4,965,481 |
| 합 계 | 1,979,079 | 9,965,481 |
5. 매출채권 및 기타수취채권
(1) 보고기간종료일 현재 매출채권 및 기타수취채권의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 총장부금액 | 대손충당금 | 현재가치 할인차금 |
정부보조금 | 순장부금액 | 총장부금액 | 대손충당금 | 현재가치 할인차금 |
정부보조금 | 순장부금액 | |
| 매출채권 | 9,070,095 | (97,463) | - | - | 8,972,631 | 3,987,804 | (305,632) | - | - | 3,682,172 |
| 미수금 | 552,214 | - | - | (166,690) | 385,524 | 254,594 | - | - | (157,875) | 96,719 |
| 보증금 | 264,000 | - | (8,977) | 0 | 255,023 | 264,000 | - | (11,915) | - | 252,085 |
| 미수수익 | 14,367 | - | - | - | 14,367 | 62,176 | - | - | - | 62,176 |
| 합계 | 9,900,675 | (97,463) | (8,977) | (166,690) | 9,627,545 | 4,568,574 | (305,632) | (11,915) | (157,875) | 4,093,152 |
(2) 당분기와 전기 중 매출채권의 대손충당금 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기초금액 | (305,632) | (932) |
| 환입(전입) | 208,168 | (304,700) |
| 제각 | - | - |
| 기말금액 | (97,464) | (305,632) |
6. 재고자산
(1) 보고기간종료일 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 평가손실충당금 | 장부금액 | 취득원가 | 평가손실충당금 | 장부금액 | |
| 원재료 | 557,733 | (121,853) | 435,880 | 187,725 | (54,313) | 133,412 |
| 재공품 | 7,135 | (6,977) | 158 | 219,673 | (6,110) | 213,563 |
| 제품 | 1,258,449 | (511,785) | 746,664 | 1,329,745 | (477,273) | 852,472 |
| 합 계 | 1,823,317 | (640,615) | 1,182,702 | 1,737,143 | (537,696) | 1,199,447 |
(2) 당분기와 전기 중 재고자산의 평가손실충당금 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기초 | (537,696) | (175,305) |
| 폐기 | 230,038 | 126,739 |
| 환입(설정) | (332,957) | (489,130) |
| 기말금액 | (640,615) | (537,696) |
7. 유형자산
(1) 보고기간종료일 현재 당사의 유형자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 취득원가 | 37,496,188 | 32,330,367 |
| 감가상각누계액 | (6,381,164) | (5,796,121) |
| 장부금액 | 31,115,024 | 26,534,246 |
(2) 당분기와 전기 중 유형자산 장부금액의 변동내역은 다음과 같습니다.
| 1) 당분기말 | (단위: 천원) |
| 구 분 | 기초 | 취득 | 처분 | 상각 | 대체 | 기말 |
|---|---|---|---|---|---|---|
| 토지(*1) | 22,520,157 | - | - | - | - | 22,520,157 |
| 기계장치 | 221,532 | - | - | (44,375) | - | 177,157 |
| 차량운반구 | - | - | - | - | - | - |
| 공구와기구 | 6,109 | - | - | (3,180) | - | 2,929 |
| 비품 | 190,812 | 20,481 | - | (56,970) | - | 154,323 |
| 시설장치 | 82,668 | - | - | (37,431) | - | 45,236 |
| 구축설비자산 | 1,332,268 | - | - | (206,839) | - | 1,125,429 |
| 건설중인자산(*) | 1,074,114 | 5,468,523 | - | - | - | 6,542,637 |
| 사용권자산 | 1,106,586 | - | - | (236,249) | (323,183) | 547,155 |
| 합계 | 26,534,246 | 5,489,004 | - | (585,044) | (323,183) | 31,115,023 |
(*) 상기 건설중인자산 취득원가에는 자본화이자비용 352,685천원이 포함(자본화이자율 4.02%)되어 있습니다.
(*1) 해당 토지는 당사의 단기차입금과 관련하여 담보로 제공(채권최고액 204억)되어 있습니다.
| 2) 전기 | (단위: 천원) |
| 구 분 | 기초 | 취득 | 처분 | 상각 | 대체 | 기말 |
|---|---|---|---|---|---|---|
| 토지(*1) | - | 18,179,807 | - | - | 4,340,350 | 22,520,157 |
| 기계장치 | 285,699 | - | (2) | (64,165) | - | 221,532 |
| 차량운반구 | 1 | - | (1) | - | - | - |
| 공구와기구 | 10,354 | - | (5) | (4,240) | - | 6,109 |
| 비품 | 192,141 | 75,869 | - | (77,198) | - | 190,812 |
| 시설장치 | 148,504 | - | - | (65,836) | - | 82,668 |
| 구축설비자산 | 1,608,053 | - | - | (275,785) | - | 1,332,268 |
| 건설중인자산(*2) | 4,387,150 | 1,027,314 | - | - | (4,340,350) | 1,074,114 |
| 사용권자산 | 1,422,754 | - | - | (316,168) | - | 1,106,586 |
| 합 계 | 8,054,656 | 19,282,990 | (8) | (803,392) | - | 26,534,246 |
(*1) 당사는 전기중 인천시 남동구 소재 부동산 매매계약(매매대금 217억원)을 체결하였으며, 당기중 해당 토지의 소유권 이전이 완료되었습니다. 한편, 해당 토지는 당사의 단기차입금과 관련하여 담보로 제공(채권최고액 204억)되어 있습니다.
(*2) 상기 건설중인자산 취득원가에는 자본화이자비용 497,147천원이 포함(자본화이자율 3.48%)되어 있습니다.
8. 차입금
보고기간종료일 현재 당사의 단기차입금의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 차입처 | 종류 | 당분기말 이자율(%) |
금 액 | |
|---|---|---|---|---|
| 당분기말 | 전기말 | |||
| KEB하나은행 | 시설자금대출 | 4.621 | 12,000,000 | 12,000,000 |
| 시설자금대출 | 4.951 | 4,000,000 | 5,000,000 | |
| 합계 | 16,000,000 | 17,000,000 | ||
당사는 단기차입금과 관련하여 토지(채권최고액 204억)를 담보로 제공하고 있으며, 대표이사로부터 지급보증(61억원)을 제공받고 있습니다.
9. 리스
(1) 당분기와 전기 중 사용권자산의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기초 | 1,106,587 | 1,422,754 |
| 조정(*) | (323,183) | |
| 상각 | (236,249) | (316,167) |
| 기말 | 547,155 | 1,106,587 |
(*) 리스재평가에 따른 조정금액입니다.
(2) 당분기와 전기 중 리스부채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기초 | 1,105,783 | 1,401,665 |
| 조정(*) | (323,183) | |
| 이자비용 | 22,720 | 36,758 |
| 리스료 지급 | (249,480) | (332,640) |
| 기말 | 555,841 | 1,105,783 |
(*) 리스재평가에 따른 조정금액입니다.
(3) 당사가 당분기 및 전기에 리스부채를 측정하기 위하여 적용한 증분차입이자율은 5.09% 및 2.90%이며, 당분기와 전분기 중 리스부채 인식 면제 규정을 적용함에 따라 리스부채로 인식하지 아니한 단기리스료 및 소액 기초자산의 리스료는 각각 2,610천원입니다.
(4) 당분기말 현재 리스부채의 잔존만기별 계약상 현금흐름은 다음과 같습니다.
| (단위 : 천원) |
| 1년 | 2년 | 합계 |
|---|---|---|
| 332,640 | 249,480 | 582,120 |
10. 종업원급여
(1) 당분기와 전분기 중 비용으로 인식된 종업원급여의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전분기 |
|---|---|---|
| 급여 | 1,222,096 | 1,137,741 |
| 확정기여제도에 대한 비용(*) | 89,808 | 88,470 |
| 주식결제형 주식기준보상 | 274,689 | 867,751 |
| 합 계 | 1,586,593 | 2,093,962 |
(*) 당사는 확정기여형퇴직연금제도를 도입하여 당사 부담금을 납부함에 따라 당사가 납부하여야 할 부담금을 퇴직급여로 계상하고 있습니다.
(2) 보고기간종료일 현재 종업원급여 관련 부채금액은 미사용연차에 대한 것으로서 미지급비용으로 계상하고 있습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 미지급비용 | 165,678 | 123,259 |
11. 복구충당부채
당사는 임차계약 종료시 건물부지에 대한 원상복구의무를 부담하고 있으므로 동 복구의무 이행시 지출이 예상되는 비용의 현재가치를 당사의 분기재무상태표에 복구충당부채로 인식하고 있습니다.
당분기와 전기 중 복구충당부채의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기초 | 116,420 | 114,893 |
| 전입액 | 1,356 | 1,527 |
| 기말 | 117,777 | 116,420 |
12. 자본금과 자본잉여금
(1) 보고기간종료일 현재 당사의 자본금 내역은 다음과 같습니다.
| (단위: 원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 수권주식수 | 50,000,000주 | 50,000,000주 |
| 주당금액 | 500 | 500 |
| 발행주식수 | 12,313,555 주 | 12,313,555 주 |
| 보통주자본금 | 6,156,777,500 | 6,156,777,500 |
(2) 자본잉여금
보고기간종료일 현재 자본잉여금은 전액 주식발행초과금입니다.
(3) 당분기중 자본금 및 자본잉여금의 변동내역은 없으며, 전기중 자본금 및 자본잉여금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 자본금 | 자본잉여금 |
|---|---|---|
| 전기초 | 5,841,408 | 6,724,545 |
| - 유상증자(*1) | 315,370 | 6,132,084 |
| 당분기말 | 6,156,778 | 12,856,629 |
(*1) 전기중 코스닥시장으로 이전 상장하였으며 이와 관련하여 신주 630,739주가 발행되었습니다.
13. 자본조정
보고기간종료일 현재 자본조정의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 자기주식 | (229,047) | (229,047) |
| 주식매수선택권 | 2,613,273 | 2,483,255 |
| 신주인수권 | 70,926 | 70,926 |
| 합 계 | 2,455,152 | 2,325,134 |
14. 이익잉여금
보고기간종료일 현재 이익잉여금의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 법정적립금(*1) | 117,406 | 55,879 |
| 주식매수선택권(*2) | 1,151,735 | 1,007,065 |
| 미처분이익잉여금 | 5,505,281 | 1,437,806 |
| 합 계 | 6,774,422 | 2,500,750 |
(*1) 상법상 당사는 자본금의 50%에 달할 때까지 매결산기에 금전에 의한 이익배당액의 10% 이상을 이익준비금으로 적립하도록 규정되어 있으며, 동 이익준비금은 현금으로 배당할 수 없으며, 주주총회의 결의에 의하여 이월결손금의 보전과 자본전입에만 사용될 수 있습니다.
(*2) 행사기간이 종료된 주식매수선택권을 이익잉여금으로 계상하고 있습니다.
15. 법인세비용(수익)
(1) 당분기와 전분기 중 법인세비용(수익)의 구성요소는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 법인세부담액(법인세추납액 ·환급액 포함) | 530,358 | 335,453 |
| 일시적차이로 인한 이연법인세 변동액 | 389,340 | (37,824) |
| 자본에 직접 반영된 법인세비용 | - | - |
| 법인세비용(수익) | 919,698 | 297,629 |
(2) 당분기와 전분기의 법인세비용차감전순손익과 법인세비용(수익)간의 관계는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 법인세비용차감전순이익 | 5,663,966 | 1,994,250 |
| 적용세율에 따른 세부담액(*1) | 1,183,769 | 438,735 |
| 조정사항: | ||
| - 비공제비용 | 59,709 | 191,471 |
| - 기타(법인세환급액,세액공제/감면 외) | (323,780) | (332,576) |
| 법인세비용(수익) | 919,698 | 297,630 |
(*1) 법인세비용차감전순손익에 대하여 법정세율을 적용하여 계산한 금액입니다.
(3) 당분기와 전기 중 일시적차이 및 이연법인세자산(부채)의 변동내역은 다음과 같습니다.
| 1) 당분기 | (단위: 천원) |
| 구분 | 차감할(가산할)일시적차이 | 이연법인세자산(부채) | ||||
|---|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | 기초 | 기말 | |
| 로열티수익 | (1,450,909) | (3,321,075) | 2,630,051 | (2,141,934) | (304,691) | (447,664) |
| 건설중인자산 | (497,147) | (488,181) | - | (985,327) | (104,401) | (205,933) |
| 정부보조금 | 157,875 | 220,050 | (211,236) | 166,690 | 33,154 | 34,838 |
| 미수수익 | (62,176) | (14,367) | 62,176 | (14,367) | (13,057) | (3,003) |
| 미지급비용 | 123,259 | 165,678 | (123,259) | 165,678 | 25,884 | 34,627 |
| 대손충당금 | 265,754 | 6,762 | (265,754) | 6,762 | 55,808 | 1,413 |
| 복구충당부채 | 116,420 | 117,777 | (116,420) | 117,777 | 24,448 | 24,615 |
| 외화환산손실 | 306,571 | - | (306,571) | - | 64,380 | - |
| 외화환산이익 | (26,417) | (384,196) | 26,417 | (384,196) | (5,548) | (80,297) |
| 재고자산평가손실 | 537,696 | 640,615 | (537,696) | 640,615 | 112,916 | 133,888 |
| 리스부채 | 1,105,783 | 555,841 | (1,105,783) | 555,841 | 232,214 | 116,171 |
| 사용권자산 | (1,106,587) | (547,155) | 1,106,587 | (547,155) | (232,383) | (114,355) |
| 장기미지급금 | 24,000 | 24,450 | - | 48,450 | 5,040 | 10,126 |
| 소계 | (505,878) | (3,023,802) | 1,158,512 | (2,371,167) | (106,234) | (495,574) |
| 이연법인세자산(부채) | (106,234) | (495,574) | ||||
| 2) 전기 | (단위: 천원) |
| 구분 | 차감할(가산할)일시적차이 | 이연법인세자산(부채) | ||||
|---|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | 기초 | 기말 | |
| 로열티수익 | (1,966,712) | (1,936,602) | 2,452,405 | (1,450,909) | (432,676) | (304,691) |
| 건설중인자산 | - | (497,146) | - | (497,146) | - | (104,400) |
| 정부보조금 | - | 216,000 | (58,125) | 157,875 | - | 33,154 |
| 장기미지급금 | - | 24,000 | - | 24,000 | - | 5,040 |
| 대손충당금 | - | 265,754 | - | 265,754 | - | 55,808 |
| 미수수익 | - | (62,176) | - | (62,176) | - | (13,057) |
| 미지급비용 | 85,208 | 123,259 | (85,208) | 123,259 | 18,746 | 25,884 |
| 복구충당부채 | 114,893 | 116,420 | (114,893) | 116,420 | 25,276 | 24,448 |
| 외화환산손실 | 976 | 306,571 | (976) | 306,571 | 215 | 64,380 |
| 외화환산이익 | (282,682) | (26,417) | 282,682 | (26,417) | (62,190) | (5,547) |
| 재고자산평가손실 | 175,304 | 537,696 | (175,304) | 537,696 | 38,567 | 112,916 |
| 리스부채 | 1,401,665 | 1,105,783 | (1,401,665) | 1,105,783 | 308,366 | 232,214 |
| 사용권자산 | (1,422,754) | (1,106,587) | 1,422,754 | (1,106,587) | (313,006) | (232,383) |
| 소 계 | (1,894,102) | (933,445) | 2,321,670 | (505,877) | (416,702) | (106,234) |
| 이연법인세자산(부채) | (416,702) | (106,234) | ||||
(4) 상계전 총액기준에 의한 이연법인세자산과 부채 등
| (단위 : 천원) |
| 구 분 | 유동 | 비유동 | 합계 |
|---|---|---|---|
| 이연법인세자산 | 203,353 | 152,325 | 355,679 |
| 이연법인세부채 | (530,964) | (320,289) | (851,253) |
| 순액 | (327,611) | (167,963) | (495,574) |
| 당기법인세부채 | (634,918) | ||
| 당기법인세자산 | 123,131 | ||
| 순액 | (511,787) | ||
16. 주당손익
(1) 기본주당손익
당분기와 전분기의 기본주당손익 계산내역은 다음과 같습니다.
| (단위: 주, 원) |
| 내 역 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 분기순이익 | 2,182,234,941 | 4,744,268,460 | 1,126,750,786 | 1,696,620,693 |
| 가중평균유통보통주식수(*1) | 12,305,333 | 12,305,333 | 11,695,162 | 11,681,525 |
| 기본주당손익 | 177 | 386 | 96 | 145 |
(*1) 가중평균유통보통주식수
| [당분기 : 3개월] | (단위: 주) |
| 구분 | 주식수 | 가중치 | 가중평균주식수 |
|---|---|---|---|
| 기초 | 12,313,555 | 92 | 1,132,847,060 |
| 자기주식 | (8,222) | 92 | (756,424) |
| 합 계 | 1,132,090,636 | ||
| ÷ 92 | |||
| 가중평균유통보통주식수 | 12,305,333 | ||
| [당분기 : 누적] | (단위: 주) |
| 구분 | 주식수 | 가중치 | 가중평균주식수 |
|---|---|---|---|
| 기초 | 12,313,555 | 273 | 3,361,600,515 |
| 자기주식 | (8,222) | 273 | (2,244,606) |
| 합 계 | 3,359,355,909 | ||
| ÷ 273 | |||
| 가중평균유통보통주식수 | 12,305,333 | ||
| [전분기 : 3개월] | (단위: 주) |
| 구분 | 주식수 | 가중치 | 가중평균주식수 |
|---|---|---|---|
| 기초 | 11,682,816 | 92 | 1,074,819,072 |
| 자기주식 | (8,222) | 92 | (756,424) |
| 유상증자 | 630,739 | 3 | 1,892,217 |
| 합 계 | 1,075,954,865 | ||
| ÷ 92 | |||
| 가중평균유통보통주식수 | 11,695,162 | ||
| [전분기 : 누적] | (단위: 주) |
| 구분 | 주식수 | 가중치 | 가중평균주식수 |
|---|---|---|---|
| 기초 | 11,682,816 | 273 | 3,189,408,768 |
| 자기주식 | (8,222) | 273 | (2,244,606) |
| 유상증자 | 630,739 | 3 | 1,892,217 |
| 합 계 | 3,189,056,379 | ||
| ÷ 273 | |||
| 가중평균유통보통주식수 | 11,681,525 | ||
(2) 당분기와 전분기의 희석주당손익 계산내역은 다음과 같습니다.
| (단위: 주, 원) |
| 내 역 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 희석당분기순이익(A) | 2,182,234,941 | 4,744,268,460 | 1,126,750,786 | 1,696,620,693 |
| 가중평균유통보통주식수(B) | 12,305,333 | 12,305,333 | 11,695,162 | 11,681,525 |
| 주식선택권 행사가정(C) | - | - | 30,951 | 16,040 |
| 신주인수권 행사가정(D) | - | - | - | 14,911 |
| 희석주식수(E=B+C+D) | 12,305,333 | 12,305,333 | 11,726,113 | 11,712,476 |
| 희석주당손익(A/E) | 177 | 386 | 96 | 145 |
(3) 당분기와 전분기에 반희석 효과로 인해 희석주당이익을 계산할 때 고려하지 않았지만 잠재적으로 미래에 기본주당이익을 희석할 수 있는 잠재적 보통주의 내역은 다음과 같습니다.
| (단위: 주) |
| 내 역 | 당분기 | 전분기 |
|---|---|---|
| 주식매수선택권 | 201,000 | 231,600 |
| 신주인수권 | 30,000 | 30,000 |
| 합 계 | 231,000 | 261,600 |
17. 주식기준보상
(1) 당분기말 현재 당사는 임직원에게 주식결제형 주식기준보상을 부여하고 있으며 내역은 다음과 같습니다.
| 약정유형 | 5차 | 6차 |
|---|---|---|
| 부여일 | 2019.03.25 | 2021.03.29 |
| 부여수량(주)(*1) | 35,000 | 190,000 |
| 행사개시일 | 2021.03.25 | 2023.03.29 |
| 행사만기일 | 2026.03.24 | 2028.03.28 |
| 행사가격(원)(*2) | 19,270 | 20,150 |
| 가득조건 | 용역제공조건 : 2년 | |
(*1) 최초 부여수량입니다.
(*2) 유상증자 및 무상증자 등을 반영한 조정후 행사가격입니다.
(2) 주식선택권 제도에서 당분기말 현재 행사되지 않은 선택권의 수량과 행사가격은 다음과 같습니다.
| (단위: 주) |
| 부여회차 | 최초부여 | 부여취소 | 행사 | 소멸 | 기말 | 행사가격 |
|---|---|---|---|---|---|---|
| 5차 | 35,000 | - | - | - | 35,000 | 19,270원 |
| 6차 | 190,000 | (16,000) | - | (8,000) | 166,000 | 20,150원 |
| 합 계 | 225,000 | (16,000) | - | (8,000) | 201,000 | - |
(3) 당사는 블랙숄즈모형을 통한 공정가치접근법을 적용해 보상원가를 산정하였으며당분기말 현재 부여하고 있는 주식선택권의 공정가치 산정에 적용된 가정은 다음과 같습니다.
| 구분 | 부여회차 | |
|---|---|---|
| 5차 | 6차 | |
| 부여일 공정가치(원) | 11,880 | 13,238 |
| 부여일 주식가격(원) | 30,000 | 21,900 |
| 행사가격(원) | 19,270 | 20,150 |
| 예상주가변동성 | 0.449173 | 0.757655 |
| 기대행사기간 | 4.5년 | 4.5년 |
| 기대배당금(원) | - | - |
| 무위험이자율 | 1.82% | 1.47% |
(4) 상기 주식선택권과 관련하여 당분기 이후 인식할 보상원가는 없습니다.
18. 매출
(1) 당사는 단일의 영업부문으로 구성되어 있으며, 당분기와 전분기의 매출의 구성내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 제품매출: | ||||
| 인도 | 2,601,627 | 5,690,169 | 1,236,494 | 3,166,108 |
| 미국 | 60,253 | 191,352 | 72,132 | 145,704 |
| 기타해외 | 256,773 | 286,099 | 194,918 | 422,919 |
| 국내 | 26,646 | 44,845 | 16,808 | 29,419 |
| 소계 | 2,945,299 | 6,212,464 | 1,520,353 | 3,764,150 |
| 로열티수익: | ||||
| 인도 | 1,012,087 | 3,321,075 | 648,101 | 1,612,885 |
| 소계 | 1,012,087 | 3,321,075 | 648,101 | 1,612,885 |
| 합계 | 3,957,386 | 9,533,540 | 2,168,454 | 5,377,035 |
(2) 주요 고객에 대한 의존도
당분기와 전분기의 당사의 수익금액 중 전체 수익의 10%이상을 차지하는 주요 고객 및 비중은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| A사 | 7,955,292 | 4,350,397 |
19. 성격별 비용
당분기와 전분기 중 발생한 비용의 성격별 분류에 대한 정보는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 재고자산의 변동 | (50,918) | 16,745 | 39,473 | (261,935) |
| 원재료의 사용액 | 500,574 | 1,127,207 | 78,673 | 418,297 |
| 종업원급여 | 432,958 | 1,586,593 | 695,452 | 2,093,962 |
| 감가상각비 | 194,580 | 585,045 | 166,462 | 576,669 |
| 기타비용 | 612,917 | 1,284,813 | 570,485 | 1,968,918 |
| 합계 | 1,690,111 | 4,600,403 | 1,550,545 | 4,795,912 |
20. 판매비와관리비
당분기와 전분기 중 발생한 판매비와관리비의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 124,502 | 372,767 | 104,759 | 315,363 |
| 퇴직급여 | 9,437 | 28,311 | 8,148 | 27,916 |
| 복리후생비 | 11,214 | 31,418 | 11,652 | 28,354 |
| 여비교통비 | 97 | 681 | 4,812 | 4,860 |
| 접대비 | 1,857 | 3,867 | 546 | 2,983 |
| 통신비 | 598 | 1,846 | 561 | 1,672 |
| 수도광열비 | 26,722 | 64,897 | 20,396 | 49,325 |
| 세금과공과금 | 22,848 | 32,897 | 23,443 | 24,531 |
| 감가상각비 | 33,816 | 107,633 | 36,069 | 107,885 |
| 보험료 | (6,682) | 9,893 | 3,032 | 28,493 |
| 수선비 | 9,710 | 182 | 3,416 | 3,416 |
| 차량유지비 | - | - | 1 | 1 |
| 경상연구개발비 | 214,048 | 774,744 | 346,665 | 1,076,851 |
| 운반비 | 60,084 | 112,055 | 17,694 | 71,153 |
| 교육훈련비 | - | 497 | - | - |
| 도서인쇄비 | 24 | 902 | 102 | 102 |
| 사무용품비 | 58 | 464 | 32 | 205 |
| 소모품비 | 1,066 | 3,275 | 1,294 | 5,074 |
| 지급수수료 | 112,686 | 318,552 | 168,402 | 885,665 |
| 광고선전비 | 19,435 | 65,542 | 17,483 | 17,483 |
| 대손상각비 | 61,142 | (208,168) | 10,310 | 10,872 |
| 협회비 | 636 | 7,000 | - | 3,000 |
| 주식보상비용 | - | 95,418 | 100,476 | 301,429 |
| 합 계 | 703,298 | 1,824,673 | 879,293 | 2,966,633 |
21. 금융수익
당분기와 전분기의 금융수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | 40,673 | 242,981 | 1,569 | 4,289 |
| 외환차익 | 15,403 | 202,326 | 38,526 | 116,382 |
| 외화환산이익 | 254,125 | 384,196 | 822,371 | 1,351,585 |
| 합계 | 310,201 | 829,504 | 862,466 | 1,472,256 |
22. 금융비용
당분기와 전분기의 금융비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용 | 8,300 | 24,077 | 23,067 | 69,963 |
| 외환차손 | 21,843 | 76,337 | - | 39 |
| 외화환산손실 | (28,238) | - | (303) | - |
| 합계 | 1,905 | 100,414 | 22,763 | 70,002 |
23. 기타수익
당분기와 전분기의 기타영업외수익의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 유형자산처분이익 | - | - | - | 9,999 |
| 잡이익 | 2 | 1,740 | 2 | 882 |
| 합계 | 2 | 1,740 | 2 | 10,881 |
24. 기타비용
당분기와 전분기의 기타영업외비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 유형자산처분손실 | - | 7 |
| 잡손실 | - | - |
| 합 계 | - | 7 |
25. 약정사항
(1) 로열티계약
당사는 주요 제품매출처인 Intas Pharmaceuticals Ltd. 와 로열티계약을 체결하고 있습니다. 동 계약에 의할 경우 당사가 공급한 제품을 사용하여 Intas Pharmaceuticals Ltd. 가 판매한 제품의 매출액에서 제반비용을 차감한 금액을 대상으로 3%-5%의 로열티를 수령하도록 되어 있으며, 이러한 계약에 따라 당분기 및 전분기에 인식한 로열티 수익은 각각 3,321,075천원 및 1,612,885천원입니다.
또한, 당사는 Pharmasolution Ltd.와 로열티계약을 체결하고 있습니다. 동 계약에 의할 경우 Pharmasolution Ltd.이 중국에서 판매한 제품수량에 따라 로열티를 수령하도록 되어 있으며, 이러한 계약에 따라 당분기 및 전분기에 인식한 로열티수익은 없습니다.
(2) 기술료계약
당사는 2013년 7월 15일자로 Intas Pharmaceuticals Ltd.와 기술료계약을 체결하였습니다. 동 계약에 의할 경우 당사는 Intas Pharmaceuticals Ltd.으로부터 각 단계별로 총 USD 750,000의 기술료를 수령하기로 약정(누적 수익인식액 USD 500,000)되어 있으며, 이러한 계약에 따라 당분기 및 전분기에 인식한 기술료 수익은 없습니다.
당사는 2020년 12월 25일자로 Pharmasolution Ltd.과 기술료계약을 체결하였습니다. 동 계약에 의할 경우 당사는 Pharmasolution Ltd.으로부터 각 단계별로 총 USD 350,000의 기술료를 수령하기로 약정(누적 수익인식액 USD 175,000)되어 있으며, 이러한 계약에 따라 당분기 및 전분기에 인식한 기술료 수익은 없습니다.
(3) 금융기관과의 약정사항
당분기말 현재 당사는 하나은행과 시설자금대출약정 16,000백만원을 체결하고 있습니다.
(4) 제공하거나 제공받은 지급보증
당사는 당분기말 현재 당사의 차입금 등과 관련하여 대표이사로부터 6,068백만원의 지급보증을 제공받고 있으며, 서울보증보험으로부터 213백만원의 건축공사 안전관리예치금 보증을 제공받고 있습니다.
(5) 계류 중인 소송사건
보고기간종료일 현재 당사가 계류중인 소송사건은 없습니다.
26. 특수관계자
(1) 지배기업
당사의 최상위 지배자는 개인대주주입니다.
(2) 주요 경영진과의 거래
당분기와 전분기 중 주요 경영진에 대한 보상내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 89,428 | 271,050 | 77,161 | 230,042 |
| 퇴직급여 | 7,391 | 22,188 | 6,354 | 22,326 |
| 합계 | 96,819 | 293,238 | 83,516 | 252,368 |
한편, 상기의 주요경영진에는 당사 활동의 계획, 운영, 통제에 대한 중요한 권한 및 책임을 가진 이사 및 집행임원 등이 포함되어 있습니다.
27. 현금흐름표
(1) 당분기와 전분기의 영업활동 현금흐름의 조정내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 재고자산평가손실 | 332,957 | 248,210 |
| 법인세비용(수익) | 919,698 | 297,630 |
| 감가상각비 | 585,045 | 576,669 |
| 대손상각비(환입) | (208,168) | 10,872 |
| 이자비용 | 24,077 | 69,963 |
| 주식보상비용 | 274,689 | 867,751 |
| 이자수익 | (242,981) | (4,289) |
| 외화환산손실 | - | - |
| 외화환산이익 | (384,196) | (1,351,585) |
| 유형자산처분이익 | - | (9,999) |
| 유형자산처분손실 | - | 7 |
| 매출채권의 감소(증가) | (4,753,593) | (1,561,225) |
| 미수금의 감소(증가) | (297,619) | (239,173) |
| 선급금의 감소(증가) | (390,765) | (1,082) |
| 선급비용의 감소(증가) | (351) | 10,371 |
| 재고자산의 감소(증가) | (316,212) | (510,145) |
| 매입채무의 증가(감소) | (27,212) | - |
| 미지급금의 증가(감소) | 19,274 | 159,980 |
| 예수금의 증가(감소) | (329) | 4,532 |
| 선수금의 증가(감소) | - | 4,993 |
| 미지급비용의 증가(감소) | 32,805 | 47,056 |
| 정부보조금의비용상계 | (211,236) | (40,734) |
| 합 계 | (4,644,117) | (1,420,198) |
(2) 당분기와 전분기 중 현금의 유입과 유출이 없는 중요한 거래는 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 건설중인자산의 토지 대체 | - | 4,340,350 |
| 사용권자산과 리스부채의 상계 | 323,183 | - |
| 리스부채의 유동성대체 | (144,671) | - |
| 주식매수선택권의 이익잉여금 대체 | 249,480 | 249,460 |
(3) 당분기와 전분기중 재무활동에서 생기는 부채의 현금흐름 조정 내역은 다음과 같습니다.
| 가. 당분기 | (단위 : 천원) |
| 계정과목 | 기초 | 현금흐름 | 비현금 변동 | 기말 | |
|---|---|---|---|---|---|
| 환율변동 | 기타 | ||||
| 단기차입금 | 17,000,000 | (1,000,000) | - | - | 16,000,000 |
| 미지급금 | - | (615,267) | - | 615,267 | - |
| 리스부채(유동) | 327,488 | (226,760) | - | 222,926 | 323,654 |
| 리스부채(비유동) | 778,295 | - | - | (546,109) | 232,186 |
| 장기미지급금 | 24,000 | - | - | 24,450 | 48,450 |
| 합 계 | 18,129,783 | (1,842,027) | - | 316,534 | 16,604,290 |
| 나. 전분기 | (단위 : 천원) |
| 계정과목 | 기초 | 현금흐름 | 비현금 변동 | 기말 | |
|---|---|---|---|---|---|
| 환율변동 | 기타 | ||||
| 단기차입금 | 1,750,000 | 17,000,000 | - | - | 18,750,000 |
| 리스부채(유동) | 327,488 | (221,179) | - | 221,159 | 327,468 |
| 리스부채(비유동) | 1,074,177 | - | - | (221,159) | 853,018 |
| 장기미지급금 | - | - | - | 24,000 | 24,000 |
| 합 계 | 3,151,665 | 16,778,821 | - | 24,000 | 19,954,486 |
28. 금융상품
(1) 보고기간종료일 현재 범주별 금융상품의 내역은 다음과 같습니다.
① 금융자산
| (단위: 천원) |
| 구 분 | 내 역 | 당분기말 | 전기말 |
|---|---|---|---|
| 상각후원가측정 금융자산 | 현금및현금성자산 | 2,051,192 | 1,102,325 |
| 단기금융상품 | 1,979,079 | 9,965,481 | |
| 매출채권 | 8,972,631 | 3,682,172 | |
| 미수금 | 385,524 | 96,719 | |
| 미수수익 | 14,367 | 62,176 | |
| 보증금 | 255,023 | 252,085 | |
| 합 계 | 13,657,816 | 15,160,958 | |
② 금융부채
| (단위: 천원) |
| 구 분 | 내 역 | 당분기말 | 전기말 |
|---|---|---|---|
| 상각후원가측정 금융부채 | 매입채무 | - | 27,212 |
| 미지급금 | 164,030 | 144,756 | |
| 미지급비용 | 185,836 | 153,324 | |
| 단기차입금 | 16,000,000 | 17,000,000 | |
| 장기미지급금 | 48,450 | 24,000 | |
| 유동성리스부채 | 323,654 | 327,488 | |
| 리스부채 | 232,186 | 778,295 | |
| 합 계 | 16,954,157 | 18,455,075 | |
(2) 금융수익과 금융비용
당분기와 전분기 중 당사의 금융상품 범주별 금융손익은 다음과 같습니다.
① 당분기
| (단위: 천원) |
| 구 분 | 이자수익(비용) | 외환차손익 | 외화환산손익 | 합 계 |
|---|---|---|---|---|
| 상각후원가측정 금융자산 | 242,981 | 125,989 | 384,196 | 753,167 |
| 상각후원가측정 금융부채 | (22,720) | - | - | (22,720) |
| 기타 | (1,357) | - | - | (1,357) |
| 합 계 | 218,905 | 125,989 | 384,196 | 729,090 |
② 전분기
| (단위: 천원) |
| 구 분 | 이자수익(비용) | 외환차손익 | 외화환산손익 | 합 계 |
|---|---|---|---|---|
| 상각후원가측정 금융자산 | 4,289 | 116,343 | 1,351,705 | 1,472,337 |
| 상각후원가측정 금융부채 | (68,823) | - | (120) | (68,943) |
| 기타 | (1,140) | - | - | (1,140) |
| 합 계 | (65,676) | 116,343 | 1,351,585 | 1,402,253 |
(3) 신용위험
① 신용위험에 대한 노출
금융자산의 장부금액은 신용위험에 대한 최대 노출정도를 나타냅니다. 당사는 현금및현금성자산을 신용등급이 우수한 금융기관에 예치하고 있어, 금융기관으로부터의 신용위험은 제한적입니다. 보고기간종료일 현재 당사의 신용위험에 대한 최대 노출정도는 해당 금융자산의 장부금액이며, 대여금및수취채권의 각 지역별 신용위험에 대한 최대 노출정도는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | |
|---|---|---|---|
| 해 외 | 인도 | 8,592,102 | 3,297,326 |
| 미국 | 266,699 | 384,846 | |
| 기타 | 112,675 | - | |
| 국 내 | 401,036 | 410,980 | |
| 합 계 | 6,310,110 | 4,093,152 | |
② 손상차손
보고기간종료일 현재 매출채권의 연령 및 각 연령별로 손상된 채권금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 채권잔액 | 설정률(*) | 손상된 금액 | 채권잔액 | 설정률(*) | 손상된 금액 | |
| 미연체 | 7,821,448 | 0.09% | (6,722) | 2,706,375 | 0.16% | (4,421) |
| 6개월 이내 | 960,187 | 0.69% | (6,607) | 921,581 | 1.50% | (13,800) |
| 9개월 이내 | - | 0.00% | - | 16,728 | 6.75% | (1,129) |
| 12개월 이내 | 288,460 | 29.17% | (84,134) | 75,785 | 25.00% | (18,946) |
| 1년초과 | - | 100.00% | - | 267,335 | 100.00% | (267,335) |
| 합계 | 9,070,095 | 1.07% | (97,463) | 3,987,804 | 7.66% | (305,632) |
(*) 집합평가 매출채권에 대해 기대신용손실률(실무적 간편법)을 적용하여 전체기간 기대신용손실금액을 산정하였습니다.
(4) 유동성위험
보고기간종료일 현재 당사의 금융부채의 계약상 만기는 다음과 같으며 계약상 현금흐름이 유의적으로 더 이른 기간에 발생하거나 유의적으로 상이한 금액일 것으로 기대하지 않습니다.
① 당분기말
| (단위: 천원) |
| 구 분 | 장부금액 | 계약상현금흐름 | ||||
|---|---|---|---|---|---|---|
| 합 계 | 3개월 이내 | 3~6개월 이내 | 6~12개월 이내 | 1년 이상 | ||
| 상각후원가측정 금융부채 | 16,954,157 | 17,411,355 | 620,651 | 16,326,453 | 166,320 | 297,930 |
② 전기말
| (단위: 천원) |
| 구 분 | 장부금액 | 계약상현금흐름 | ||||
|---|---|---|---|---|---|---|
| 합 계 | 3개월 이내 | 3~6개월 이내 | 6~12개월 이내 | 1년 이상 | ||
| 상각후원가측정 금융부채 | 18,455,075 | 18,605,799 | 17,500,719 | 83,160 | 166,320 | 855,600 |
(5) 외환위험
① 환위험에 대한 노출
당사는 USD로 표시된 거래를 하고 있기 때문에 환율변동위험에 노출되어 있으며, 보고기간종료일 현재 당사의 환위험에 대한 노출정도는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 현금및현금성자산 | 1,808,562 | 780,751 |
| 매출채권 | 9,068,936 | 3,987,804 |
| 합 계 | 10,877,498 | 4,768,555 |
② 민감도 분석
보고기간종료일 현재 당사의 금융자산을 구성하는 외화(USD)에 대하여 원화가 변동을 보인다면 당사의 자본과 손익은 증가 또는 감소하였을 것입니다. 이와 같은 분석은 당사가 각 보고기간말에 합리적으로 가능하다고 판단하는 정도의 변동을 가정한 것으로서 분석 시에는 이자율과 같은 다른 변수는 변동하지 않는다고 가정하였습니다. 이러한 가정을 기초로 기능통화의 환율 10% 변동시 환율변동이 손익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 10% 상승 | 10% 하락 | 10% 상승 | 10% 하락 | |
| 손익 증가(감소) | 1,087,750 | (1,087,750) | 476,856 | (476,856) |
(6) 이자율위험
보고기간종료일 현재 당사가 보유하고 있는 변동이자부 금융상품의 장부금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 금융부채 | 16,000,000 | - |
보고기간종료일 현재 다른 변수가 일정하고 변동금리 조건 금융상품에 대한 이자율이 1% P 상승 또는 하락할 경우, 증가 또는 감소한 당분기와 전기의 손익변동금액은다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 1% 상승 | 1% 하락 | 1% 상승 | 1% 하락 | |
| 손익 증가(감소) | (160,000) | 160,000 | - | - |
(7) 공정가치
당사는 공정가치로 측정되는 금융상품에 대하여 공정가치 측정에 사용된 투입변수에따라 다음과 같은 공정가치 서열체계로 분류하고 있습니다.
- '수준 1'은 동일한 자산이나 부채에 대한 활성시장의 (조정되지 않은) 공시가격을 사용하여 도출되는 공정가치입니다.
- '수준 2'는 직접적 또는 간접적으로 관측가능한, 자산이나 부채에 대한 투입변수를 사용하여 도출되는 공정가치입니다.
- '수준 3'은 자산이나 부채에 대하여 관측가능한 시장정보에 근거하지 않은 투입변 수(관측불가능한 변수)를 사용하는 평가기법으로부터 도출되는 공정가치입니다.
6. 배당에 관한 사항
가. 주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제27기 3분기 (2023년 9월말) |
제26기 (2022년12월말) |
제25기 (2021년12월말) |
||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | - | - | - | |
| (별도)당기순이익(백만원) | 4,744 | 869 | 285 | |
| (연결)주당순이익(원) | - | - | - | |
| 현금배당금총액(백만원) | - | 615 | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | 보통주 | - | 0.45 | - |
| 우선주 | - | - | - | |
| 주식배당수익률(%) | 보통주 | - | - | - |
| 우선주 | - | - | - | |
| 주당 현금배당금(원) | 보통주 | - | 50 | - |
| 우선주 | - | - | - | |
| 주당 주식배당(주) | 보통주 | - | - | - |
| 우선주 | - | - | - | |
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 증자(감자)현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2019년 04월 22일 | 주식매수선택권행사 | 보통주 | 19,600 | 500 | 16,130 | - |
| 2021년 01월 08일 | 무상증자 | 보통주 | 3,831,271 | 500 | 500 | - |
| 2021년 03월 26일 | 주식매수선택권행사 | 보통주 | 16,070 | 500 | 19,080 | - |
| 2021년 03월 26일 | 주식매수선택권행사 | 보통주 | 26,300 | 500 | 10,750 | - |
| 2021년 03월 26일 | 주식매수선택권행사 | 보통주 | 3,500 | 500 | 12,540 | - |
| 2021년 06월 02일 | 전환권행사 | 보통주 | 135,135 | 500 | 14,800 | 전환사채 행사 |
| 2022년 09월 28일 | 유상증자(일반공모) | 보통주 | 630,739 | 500 | 11,000 | 코스닥 상장공모 |
미상환 신주인수권부사채 등 발행현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 행사대상 주식의 종류 |
신주인수권 행사가능기간 | 행사조건 | 미상환 사채 |
미행사 신주 인수권 |
비고 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사비율 (%) |
행사가액 | 권면(전자등록)총액 | 행사가능주식수 | ||||||||
| 신주인수권 | - | 2022년 08월 19일 | 2024년 07월 05일 | 330,000,000 | 보통주 | 2023.01.05~ 2024.07.05 |
100 | 11,000 | - | 30,000 | - |
| 합 계 | - | - | - | 330,000,000 | 보통주 | - | 100 | 11,000 | - | 30,000 | - |
| 주1) | 당사의 코스닥시장 상장 주관사인 하나증권에 부여한 신주인수권입니다. |
| [채무증권의 발행 등과 관련된 사항] |
채무증권 발행실적
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| 선바이오(주) | 회사채 | 사모 | 2019.05.13 | 2,000,000 | 표면 0% 만기 4% |
광교회계법인 | 2022.05.13 | 전액 상환 |
- |
| 합 계 | - | - | - | 2,000,000 | - | - | - | - | - |
| 주1) | 해당 전환사채의 전환권은 2021년 6월 2일 모두 행사되었으며, 이와 관련하여 보통주 135,135주가 발행되었습니다. |
기업어음증권 미상환 잔액
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
단기사채 미상환 잔액
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
회사채 미상환 잔액
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
신종자본증권 미상환 잔액
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
조건부자본증권 미상환 잔액
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 유상증자(일반공모) | 1 | 2022.09.27 | 연구개발, 시설자금, 운영자금 | 6,938,129 | 연구 및 시설자금 | 4,996,695 | 향후 사용예정 |
| 주1) | 상기 조달금액은 발행제비용이 제외된 금액입니다. |
나. 사모자금의 사용내역
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 전환사채 | 3회차 | 2019.05.13 | 토지매입,운영자금,연구개발 | 2,000,000 | 토지매입,운영자금,연구개발 | 2,000,000 | - |
| 주1) | 해당 전환사채의 전환권은 2021년 6월 2일 모두 행사되었으며, 이와 관련하여 보통주 135,135주가 발행되었습니다. |
다. 미사용자금의 운용내역
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 종류 | 금융상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 채권 | 전자단기사채 | 1,979,079 | 2023.08 ~ 2023.11 | 3개월 |
| 계 | 1,979,079 | - | ||
| 주1) | 제출일 현재 운용중인 내역을 작성하였습니다. |
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
(1) 재무제표 재작성 유의사항
당사는 보고서 제출일 현재 해당사항이 없습니다.
(2) 합병, 분할, 자산양수도, 영업양수도
당사는 보고서 작성 기준일 최근 3사업연도 현재 해당사항 없습니다.
(3) 자산유동화와 관련한 자산매각의 회계처리 및 우발채무 등에 관한 사항
당사는 보고서 제출일 현재 해당사항이 없습니다.
(4) 기타 재무제표 이용에 유의하여야 할 사항
당사는 보고서 제출일 현재 해당사항이 없습니다.
나. 대손충당금 설정현황 등
(1) 대손충당금 설정내역
| (단위: 천원) |
| 구 분 | 계정과목 | 총장부금액 | 대손충당금 | 대손충당금설정율 |
|---|---|---|---|---|
| 2023년 (제27기 3분기) | 매출채권 | 9,070,095 | 97,463 | 1.07% |
| 2022년 (제26기) | 매출채권 | 3,987,804 | 305,632 | 7.66% |
| 2021년 (제25기) | 매출채권 | 3,428,626 | 932 | 0.03% |
(2) 대손충당금 변동내역
| (단위: 천원) |
| 구 분 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|
| (제27기 3분기) | (제26기) | (제25기) | |
| 기초금액 | (305,632) | (932) | (12,333) |
| 회계정책변경효과 | - | - | - |
| 당기설정액(환입액) | 208,168 | (304,700) | (458) |
| 상각채권의 회수 | - | - | - |
| 제각 | - | - | 11,859 |
| 기말금액 | (97,464) | (305,632) | (932) |
(3) 매출채권 관련 대손충당금 설정 방침
당사는 KIFRS1109 금융상품기준서를 적용함에따라 기대손실모형을 적용하여 집합적 손상검토를 통한 대손경험율을 산정하여 대손충당금을 설정하고 있습니다.
다. 재고자산 현황 등
(1) 재고자산 보유현황
| (단위: 천원) |
| 구 분 | 2023년 | 2022년 | 2021년 |
|---|---|---|---|
| (제27기 3분기) | (제26기) | (제25기) | |
| 원재료 | 435,880 | 133,412 | 595,643 |
| 재공품 | 158 | 213,563 | 23,286 |
| 제품 | 746,664 | 852,472 | 756,184 |
| 합 계 | 1,182,702 | 1,199,447 | 1,375,113 |
| 총자산대비 재고자산 구성비율 | 2.6% | 2.80% | 6.97% |
(2) 재고자산의 실사내역
당사는 연 1회 회계년도말에 외부감사인의 입회에 의한 재고자산 실사를 하고 있어 제27기 3분기에는 재고자산 실사를 하지 않았습니다.
(3) 재고자산 보유내역 및 평가내역
1) 재고자산의 내역은 다음과 같습니다.
| (기준일 : 2023년 09월 30일) (단위: 천원) |
| 구 분 | 2023년 3분기말 | 2022년 기말 | ||||
|---|---|---|---|---|---|---|
| 취득원가 | 평가손실충당금 | 장부금액 | 취득원가 | 평가손실충당금 | 장부금액 | |
| 원재료 | 557,733 | (121,853) | 435,880 | 187,725 | (54,313) | 133,412 |
| 재공품 | 7,135 | (6,977) | 158 | 219,673 | (6,110) | 213,563 |
| 제품 | 1,258,449 | (511,785) | 746,664 | 1,329,745 | (477,273) | 852,472 |
| 합 계 | 1,823,317 | (640,615) | 1,182,702 | 1,737,143 | (537,696) | 1,199,447 |
2) 당분기와 전기 중 재고자산의 평가손실충당금 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 2023년 3분기말 | 2022년 기말 |
|---|---|---|
| 기초금액 | (537,696) | (175,305) |
| 폐기 | 230,038 | 126,739 |
| 환입(설정) | (332,957) | (489,130) |
| 기말금액 | (640,615) | (537,696) |
라. 공정가치평가 내역
보고서 제출일 현재 해당사항이 없습니다.
IV. 이사의 경영진단 및 분석의견
기업공시서식 작성기준에 따라 분ㆍ반기 보고서의 경우에는 이 항목을 기재하지 않습니다.
V. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
당 분기에 변동사항 없으며 관련내용은 2023년 8월 14일에 제출된 2023년 반기보고서를 참고하시기 바랍니다.
2. 내부통제에 관한 사항
당 분기에 변동사항 없으며 관련내용은 2023년 8월 14일에 제출된 2023년 반기보고서를 참고하시기 바랍니다.
VI. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
당 분기에 변동사항 없으며 관련내용은 2023년 8월 14일에 제출된 2023년 반기보고서를 참고하시기 바랍니다.
2. 감사제도에 관한 사항
당 분기에 변동사항 없으며 관련내용은 2023년 8월 14일에 제출된 2023년 반기보고서를 참고하시기 바랍니다.
3. 주주총회 등에 관한 사항
당 분기에 변동사항 없으며 관련내용은 2023년 8월 14일에 제출된 2023년 반기보고서를 참고하시기 바랍니다.
VII. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 노광 | 최대주주 및 대표이사 |
보통주 | 3,160,420 | 27.05 | 3,162,820 | 25.69 | 장내매수 |
| 선바이오(주) | 자사주 | 보통주 | 8,222 | 0.07 | 8,222 | 0.07 | - |
| 안응호 | 사내이사 | 보통주 | 8,982 | 0.08 | 8,982 | 0.07 | - |
| 정춘자 | 모 | 보통주 | 4,757 | 0.04 | 4,757 | 0.04 | - |
| 노찬 | 형 | 보통주 | 60,500 | 0.52 | 65,546 | 0.53 | 장내매수 및 신주청약 |
| 이난숙 | 형수 | 보통주 | 2,000 | 0.02 | 2,000 | 0.02 | - |
| 노완 | 제 | 보통주 | 161,200 | 1.38 | 161,200 | 1.31 | - |
| 이티에스소프트(주) | 노완의 회사 | 보통주 | 42,000 | 0.36 | 42,000 | 0.34 | - |
| 황은숙 | 제수 | 보통주 | 58,500 | 0.50 | 58,500 | 0.48 | - |
| 노성두 | 제 | 보통주 | 45,000 | 0.39 | 45,000 | 0.37 | - |
| 신명희 | 제의 처 | 보통주 | 13,300 | 0.11 | 13,300 | 0.11 | - |
| 노흥덕 | 사촌 | 보통주 | 112,250 | 0.96 | 112,250 | 0.91 | - |
| 박재옥 | 사촌의 처 | 보통주 | 2,364 | 0.02 | 2,364 | 0.02 | - |
| 노태현 | 사촌의 자녀 | 보통주 | 9,300 | 0.08 | 9,300 | 0.08 | - |
| 조학수 | 사촌 | 보통주 | 85,000 | 0.73 | 85,000 | 0.69 | - |
| 노순남 | 누이 | 보통주 | 10,000 | 0.09 | 10,000 | 0.08 | - |
| 조동환 | 매형 | 보통주 | 9,000 | 0.08 | 9,000 | 0.07 | - |
| 노수덕 | 사촌 | 보통주 | 6,500 | 0.06 | 6,500 | 0.05 | - |
| 김선기 | 사촌의 처 | 보통주 | 12,005 | 0.10 | 12,005 | 0.10 | - |
| 노문정 | 사촌의 자녀 | 보통주 | 2,050 | 0.02 | 2,050 | 0.02 | - |
| 이재영 | 조카 손주 | 보통주 | 117 | 0.00 | 117 | 0.00 | - |
| 이윤영 | 조카 손주 | 보통주 | 130 | 0.00 | 130 | 0.00 | - |
| 노선애 | 사촌 | 보통주 | 17,947 | 0.15 | 17,947 | 0.15 | - |
| 김준 | 사촌의 남편 | 보통주 | 20,256 | 0.17 | 20,256 | 0.16 | - |
| 노경애 | 사촌누이 | 보통주 | 25,500 | 0.22 | 25,500 | 0.21 | - |
| 백기황 | 사촌누이 남편 | 보통주 | 30,000 | 0.26 | 30,000 | 0.24 | - |
| 백성현 | 사촌의 자녀 | 보통주 | 10,445 | 0.09 | 10,445 | 0.08 | - |
| 백준현 | 사촌의 자녀 | 보통주 | 10,400 | 0.09 | 10,400 | 0.08 | - |
| 백선우 | 조카 손주 | 보통주 | 400 | 0.00 | 400 | 0.00 | - |
| 박효경 | 고종사촌 | 보통주 | 36,603 | 0.31 | 36,603 | 0.30 | - |
| 김경숙 | 처의 누이 | 보통주 | 20,173 | 0.17 | 20,173 | 0.16 | - |
| 박상갑 | 처 누이남편 | 보통주 | 11,000 | 0.09 | 11,000 | 0.09 | - |
| 김영옥 | 처의 올케 | 보통주 | 30,000 | 0.26 | 30,000 | 0.24 | - |
| 김태형 | 처 조카 | 보통주 | 1,320 | 0.01 | 1,320 | 0.01 | - |
| 김태오 | 처 조카 | 보통주 | 1,320 | 0.01 | 1,320 | 0.01 | - |
| 전상룡 | 동서 | 보통주 | 17,674 | 0.15 | 17,674 | 0.14 | - |
| 김능율 | 동서 | 보통주 | 17,002 | 0.15 | 17,002 | 0.14 | - |
| 박재순 | 관계회사 임원 | 보통주 | 13,335 | 0.11 | 13,335 | 0.11 | - |
| 계 | 보통주 | 4,076,972 | 34.90 | 4,084,418 | 33.17 | - | |
| 우선주 | - | - | - | - | - | ||
2. 최대주주의 주요경력 및 개요
| 성명 | 직책 | 주요경력 |
|---|---|---|
| 노광 | 대표이사 (등기/상근) |
81.02 서울대학교 화학생물공학부 졸업 88.05 Rutgers Univ. 생명공학 박사 88.08~95.05 Enzon Pharma., Inc. 근무, 연구부장 97.06~현재 선바이오(주) 대표이사 |
3. 최대주주 변동내역
당사는 설립일부터 보고서 기준일 현재까지 변동사항이 없습니다.
4. 주식 소유현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 노광 | 3,162,820 | 25.69 | 최대주주 |
| - | - | - | - | |
| 우리사주조합 | - | - | - | |
소액주주현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 5,839 | 5,884 | 99.24 | 6,481,616 | 12,313,555 | 52.64 | - |
| 주1) | 상기 주주현황은 2023년 09월 30일 기준으로 작성하였습니다. |
| 주2) | 소액주주는 발행주식총수의 100분 1에 미달하는 주식을 소유한 주주로 최대 주주 등을 포함한 1% 이상 주식수를 제외한 주식 수이며, 총발행주식수는 의결권 있는 보통주의 총수입니다. |
5. 주가 및 주식거래실적 (최근 6개월)
| (단위:원, 주) |
| 구분 | 2023년 04월 |
2023년 05월 |
2023년 06월 |
2023년 07월 |
2023년 08월 |
2023년 09월 |
|
|---|---|---|---|---|---|---|---|
| 주가 (원) |
최고 | 17,090 | 13,370 | 12,620 | 10,350 | 11,500 | 11,580 |
| 최저 | 8,850 | 11,210 | 10,700 | 8,470 | 9,250 | 9,200 | |
| 평균 | 11,522 | 11,993 | 11,943 | 9,766 | 10,224 | 10,669 | |
| 거래량 (주) |
최고 | 3,103,906 | 457,527 | 640,003 | 60,769 | 1,320,498 | 954,502 |
| 최저 | 9,443 | 19,892 | 14,470 | 7,280 | 6,950 | 3,728 | |
| 월별합계 | 8,111,923 | 1,787,966 | 1,596,622 | 526,275 | 2,173,263 | 1,307,390 | |
| 주1) | 최고가 및 최저가, 평균가는 종가를 기준으로 작성하였습니다. |
VIII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 노광 | 남 | 1957.10 | 대표이사 | 사내이사 | 상근 | 경영총괄 |
- 1981.02 서울대학교 화학생물공학부 졸업 - 1982~1988.02 미국 뉴저지 주 Rutgers University 생명공학 대학원 졸업 - 1988~1995 미국 Enzon Pharmaceuticals, Inc. 근무 - 1997~현재 선바이오㈜ 대표이사(1997~현재) |
3,162,820 | - | 본인 | 26년2개월 | 2024.07.15 |
| 안응호 | 남 | 1955.10 | 이사 | 사내이사 | 상근 | 재무총괄 (CFO) |
- 1978.02 서울대학교 사회과학대학 경제학과 졸업 (경제학사) - 1988.10 Rutgers-the State University of New Jersey 대학원졸업 (경제학박사) - 1989.01~2011.01 한국수출입은행 - 2009.03~2011.12 한국외국어대학교 (겸임교수) - 2012.03~2021.03 경인여자대학교 (교수) - 2021.03~현재 선바이오(주) CFO |
8,982 | - | 타인 | 2년7개월 | 2024.03.29 |
| 이성훈 | 남 | 1957.04 | 이사 | 사내이사 | 상근 | QA총괄 | - 1981.02 한양대학교 공과대학 공업경영학과 졸업 - 1984.01∼1994.07 대우전자 MIS실 제조Process analyst, 해외공장MIS실 담당 - 1994.07∼1999.11 대우정보시스템즈 컨설팅/ERP사업부, 사업부장 - 1999.12∼2000.07 삼일회계법인 MCS본부이사 - 2000.07∼2016.04 한국IBM 컨설팅 Principal, SO executive, QA-RM 담당 - 2016.07∼ 현재 선바이오(주) QA담당 |
- | - | 타인 | 7년2개월 | 2024.03.29 |
| 주우식 | 남 | 1959.06 | 이사 | 사외이사 | 비상근 | 사외이사 | - 1981.02 서울대 법과대학 법학과 졸업 - 1983.02 Cornell대학 경제학 박사 - 1980.05~1999.03 재정경제부 경제정책국 과장 - 1999.03~2012.04 삼성전자, 삼성증권 부사장 - 2012.04~2013.06 KDB 금융그룹 지주 수석 부사장 - 2013.03~2015.02 전주페이퍼 대표이사 사장 - 2015.03~2017.07 삼정KPMG 부회장 - 2018.04~현재 옐로씨매니지먼트(사모펀드) 회장 - 2019.01~현재 현재 선바이오(주) 사외이사 |
- | - | 타인 | 4년8개월 | 2025.03.28 |
| 정유근 | 남 | 1957.09 | 감사 | 감사 | 비상근 | 감사 | - 1981.02 서울대학교 경영대학 졸업 - 1990.12 삼성물산 근무 - 1998.08 삼성전자 근무 - 2001.06 대원세무법인 - 2001.07~현재 신영세무법인 세무사, 한국세무사회 상담위원 - 2018.03~현재 선바이오(주) 감사 |
- | - | 타인 | 5년6개월 | 2024.03.29 |
나. 임원 겸직 현황
| 겸직임원 | 겸직근무지 | ||||||
|---|---|---|---|---|---|---|---|
| 성명 | 직책명 | 회사명 | 직책명 | 담당업무 | 재직기간 | 겸직회사와 당사와의 관계 | 비고 |
| 주우식 | 사외이사 | 옐로씨매니지먼트(사모펀드) | 회장 | 업무총괄 | 2018.04~현재 | 해당사항 없음 | - |
| 정유근 | 감사 | 신영세무법인 | 세무사 | 업무총괄 | 2001.07~현재 | 해당사항 없음 | - |
다. 직원 등 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 선바이오 | 남 | 13 | - | - | - | 13 | 10년5개월 | 533,092 | 41,007 | - | - | - | - |
| 선바이오 | 여 | 10 | - | - | - | 10 | 10년10개월 | 377,765 | 37,777 | - | |||
| 합 계 | 23 | - | - | - | 23 | 10년7개월 | 910,857 | 39,602 | - | ||||
| 주1) | 상기급여총액은 2023년 1월부터 9월까지의 지급총액이며, 해당기간 중도퇴사자는 제외된 금액입니다. |
| 주2) | 당사는 미등기임원은 없으며, 등기임원을 제외하고 작성하였습니다. |
라. 미등기임원 보수 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 천원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | - | - | - | - |
| 주1) | 당사는 보고서 제출일 현재 미등기임원은 없습니다. |
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
가. 이사ㆍ감사 전체의 보수현황
(1) 주주총회 승인금액
| (단위 : 천원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 4 | 500,000 | - |
| 감사 | 1 | 50,000 | - |
(2) 보수지급금액
2-1. 이사ㆍ감사 전체
| (단위 : 천원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 5 | 284,772 | 56,954 | - |
2-2. 유형별
| (단위 : 천원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
3 | 281,572 | 93,857 | - |
| 사외이사 (감사위원회 위원 제외) |
1 | 2,000 | 2,000 | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 1,200 | 1,200 | - |
(3) 이사ㆍ감사의 보수지급기준
당사는 이사 및 감사의 보수한도를 주주총회 결의로 정하고 있으며, 주주총회에서 승인된 보수한도 범위 내에서 각 담당 업무 등을 감안하여 내부 규정에 따라 지급하고 있습니다.
나. 주식매수선택권의 부여 및 행사현황
(1) 이사ㆍ감사의 주식매수선택권의 공정가치
| (단위 : 천원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
1 | 79,515 | - |
| 사외이사 (감사위원회 위원 제외) |
1 | - | - |
| 감사위원회 위원 또는 감사 | - | - | - |
| 업무집행지시자 등 | - | - | - |
| 계 | 2 | 79,515 | - |
<표2>
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 주우식 | 등기임원 | 2019.03.25 | 신주교부 | 보통주 | 30,000 | - | - | - | - | 30,000 | 2021.03.25~2026.03.24 | 12,460 | X | - |
| 5명 | 직원 | 2019.03.25 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2021.03.25~2026.03.24 | 12,460 | X | - |
| 안응호 | 등기임원 | 2021.03.29 | 신주교부 | 보통주 | 40,000 | - | - | - | - | 40,000 | 2023.03.29~2028.03.28 | 20,150 | X | - |
| 이성훈 | 등기임원 | 2021.03.29 | 신주교부 | 보통주 | 15,000 | - | - | - | - | 15,000 | 2023.03.29~2028.03.28 | 20,150 | X | - |
| 25명 | 직원 | 2021.03.29 | 신주교부 | 보통주 | 135,000 | - | - | - | 24,000 | 111,000 | 2023.03.29~2028.03.28 | 20,150 | X | - |
| ※ 공시서류작성기준일(2023년 9월 30일) 현재 종가 : 9,200원 | |
| 주1) | 전환사채 및 무상, 유상증자 등으로 인해 행사가격이 조정되었습니다. |
| 주2) | 행사기간이 종료된 1차~4차는 기재하지 않았습니다. |
IX. 계열회사 등에 관한 사항
가. 계열회사 현황(요약)
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| - | - | - | - |
| ※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조 |
나. 타법인출자 현황(요약)
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | - | - | - | - | - | - |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | - | - | - | - | - | - |
| 계 | - | - | - | - | - | - | - |
| ※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조 |
X. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여등
당사는 보고서 제출일 현재 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
당사는 보고서 제출일 현재 해당사항이 없습니다.
3. 대주주와의 영업거래
당사는 보고서 제출일 현재 해당사항이 없습니다.
4. 대주주 이외의 이해관계자와의 거래
당사는 보고서 제출일 현재 해당사항이 없습니다.
XI. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
| 신고일자 | 제목 | 신고내용 | 신고사항의 진행사황 |
|---|---|---|---|
| 2023.02.17 | 신규시설투자등 | 1. 투자구분 : 신규시설투자(공장신축 등) 2. 투자내역 (1) 투자금액 : 22,151,000천원 (2) 자기자본 : 23,876,645천원 (3) 자기자본대비 : 92.77% (4) 대규모법인여부 : 미해당 3. 투자목적 : 생산시설 증대로 안정적인 생산량 확보 및 주문량 소화 4. 투자기간 : 시작일 2023.04.01 ~ 종료일 2024.04.30 5. 이사회결의일(결정일) : 2023.02.17 6. 기타 투자판단에 참고할 사항 (1) 상기 자기자본은 K-IFRS에 따라 작성된 제25기 개별재무제표 기말 기준에서 2022년 12월까지 자본금 및 자본잉여금 증가분을 포함한 금액입니다. (2) 상기 투자금액은 공장 건축, 생산설비 및 장비구매, 감리등을 포함한 금액이며, 부가세 제외된 금액입니다. (3) 상기 투자기간 시작일과 종료일은 착공일과 준공예정일을 기재하였습니다. (4) 상기 투자에 소요되는 자금은 자기자금 및 금융기관 차입을 통해 진행 할 예정입니다. (5) 투자소재지 : 인천광역시 남동구 논현동 439-3 (6) 상기 투자금액 및 투자기간은 공사진행 과정 및 기타 경영환경 변화등에 따라 변동될 수 있습니다. |
신고일 이후 2023년 04월 기공식을 진행하였으며, 현재 본관동 및 생산동 건축이 진행되고 있습니다. |
2. 우발부채 등에 관한 사항
가. 중요한 소송사건
당사는 보고서 제출일 현재 해당사항이 없습니다.
나. 견질 또는 담보용 어음ㆍ수표 현황
| (기준일 : 2023년 09월 30일) | (단위 : 매, 백만원) |
| 제 출 처 | 매 수 | 금 액 | 비 고 |
|---|---|---|---|
| 은 행 | - | - | - |
| 금융기관(은행제외) | - | - | - |
| 법 인 | - | - | - |
| 기타(개인) | - | - | - |
다. 채무보증 현황
당사는 보고서 제출일 현재 해당사항이 없습니다.
라. 채무인수약정 현황
당사는 보고서 제출일 현재 해당사항이 없습니다.
마. 그 밖의 우발채무 등
당사는 보고서 제출일 현재 해당사항이 없습니다.
바. 자본으로 인정되는 채무증권의 발행
당사는 보고서 제출일 현재 해당사항이 없습니다.
3. 제재 등과 관련된 사항
가. 제재 현황
당사는 2019년 전환사채 발행과 관련하여 증권신고서 제출 또는 전매제한 조치의 공시의무를 위반하여 2021년 금융감독원에 자진신고를 하였으며, 2022년 12월 경고조치로 해당 조사는 종결되었습니다.
| 의무발생일 | 초지기관 | 처벌 또는 조치대상자 |
처벌 또는 조치내용 |
사유 및 근거법령 | 처벌 또는 조치에 대한 회사의 이행 현황 |
재발방지를 위한 회사의 대책 |
|---|---|---|---|---|---|---|
| 2019년 05월 12일 | 금융감독원 | 선바이오(주) | 경고 | - 공시의무 위반 - 자본시장과 금융투자업에 관한 법률 제9조 제7항, 제119조 제1항, 제132조 제1호, 동법 시행령 제11조 제3항, 제120조 제1항 제1호, 제138조 제5호 |
- | 공시교육 강화 및 공시업무 프로세스 개선 |
나. 한국거래소 등으로부터 받은 제재
당사는 보고서 제출일 현재 해당사항이 없습니다.
다. 단기매매차익 발생 및 환수 등의 현황
당사는 보고서 제출일 현재까지 단기매매차익 발생사실을 증권선물위원회(금융감독원장)로부터 통보받은 바 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
나. 중소기업기준 검토표
 |
|
선바이오(주) 중소기업기준검토표_회계법인날인본_1 |
 |
|
선바이오(주) 중소기업기준검토표_회계법인날인본_2 |
다. 외국지주회사의 자회사 현황
당사는 보고서 제출일 현재 해당사항이 없습니다.
라. 법적위험 변동사항
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
마. 금융회사의 예금자 보호 등에 관한 사항
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
바. 기업인수목적회사의 요건 충족 여부
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
사. 기업인수목적회사의 금융투자업자의 역할 및 의무
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
아. 합병등의 사후정보
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
자. 녹색경영
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
차. 정부의 인증 및 그 취소에 관한 사항
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
카. 조건부자본증권의 전환ㆍ채무재조정 사유등의 변동현황
당사는 보고서 작성 기준일 현재 해당사항이 없습니다.
타. 보호예수 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 |
|---|---|---|---|---|---|---|
| 보통주 | 3,160,420 | 2021.11.10 | 2025.10.05 | 상장일로부터 36개월 | 최대주주의 한국거래소 상장규정 및 기타 보호예수기간 연장 |
12,313,555 |
파. 상장기업의 재무사항 비교표
| (기준 재무제표 : | 개별 | ) | (상장일 : | 2022.10.05 | , 인수인 : | 하나증권 | ) | (단위 : 백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 괴리율 |
|---|---|---|---|---|
| 2022년 | 매출액 | 10,354 | 7,420 | 28 |
| 영업이익 | 2,067 | 191 | 91 | |
| 당기순이익 | 1,812 | 869 | 52 | |
| 2023년 | 매출액 | 28,135 | - | - |
| 영업이익 | 16,492 | - | - | |
| 당기순이익 | 13,169 | - | - | |
| 2024년 | 매출액 | 21,702 | - | - |
| 영업이익 | 10,722 | - | - | |
| 당기순이익 | 8,197 | - | - |
| 주1) | '괴리율'은 '(예측치-실적치)/예측치'로 산정하여 백분율로 기재하였습니다 |
| 주2) | 2021년에 발생한 COVID-19 백신의 제조원료 매출이 해당 거래처의 생산시설 관련 업데이트로 인해 2022년에 매출이 발생하지 않은 사유입니다. |
| 주3) | 2022년도 영업이익 및 당기순이익 괴리율은 하기 사항에 따른 괴리입니다. |
| - 매출액 감소, 제조원가 상승, MucoPEG 비교임상 관련비용 대폭증가 |
하. 특례상장기업 관리종목 지정유예 현황
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 백만원, %) |
| 관리종목 지정요건 | 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|---|
| 항목 | 사업연도 | 금액/비율 | 해당 여부 |
종료 시점 |
||
| 최근 사업연도말 매출액 30억원 미만 |
최근 사업연도말 매출액(별도) | 2022년 | 7,420 | 미해당 | 해당 | 2027.12.31 |
| 최근 4사업연도 연속 영업손실 발생 | 최근 4사업연도 각 영업손익 (별도) |
2022년 | 191 | 미해당 | 해당 | - |
| 2021년 | 3,377 | |||||
| 2020년 | 1,639 | |||||
| 2019년 | 1,679 | |||||
| 자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생 | 최근 3사업연도 각 자기자본 대비 법인세차감전 계속사업손익 비율(연결) |
2022년 | 3.9 | 미해당 | 해당 | 2025.12.31 |
| 2021년 | 7.4 | |||||
| 2020년 | 13.6 | |||||
| 주1) | 당사는 2022년 10월 05일에 기술성장기업으로 코넥스시장에서 코스닥시장으로 이전상장하였습니다. |
| 주2) | 매출액 요건(최근 사업연도말 매출액 30억미만)의 경우, 기술성장기업은 신규상장일이 속하는 사업연도를 포함하는 연속하는 5개 사업연도(상장일로부터 상장일이 속한 사업연도의 말일까지 기간이 3월미만인 경우에는 그 다음 사업연도)까지 지정 유예되며, 2028년 부터 대상이 됩니다. |
| 주3) | 기술성장기업의 경우 해당 요건(최근 4사업연도 연속 영업손실 발생)을 적용받지 않습니다. |
| 주4) | 기술성장기업의 경우 신규상장일이 속하는 사업연도를 포함하는 연속하는 3개 사업연도에 대해 해당 요건(자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생)을 적용 받지 않습니다. 다만, 상장일부터 상장일이 속한 사업연도의 말일까지의 기간이 3개월 미만인 경우에는 상장일이 속하는 사업연도와 그 이후 3개 사업연도로 합니다. |
XII. 상세표
1. 연결대상 종속회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (단위 : 천원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - |
| - | - | - | - | - | - | - |
| - | - | - | - | - | - | - |
2. 계열회사 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | - | - | - |
| - | - |
3. 타법인출자 현황(상세)
| ☞ 본문 위치로 이동 |
| (기준일 : | 2023년 09월 30일 | ) | (단위 : 원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - | - | - | ||||
【 전문가의 확인 】
1. 전문가의 확인
당사는 보고서 제출일 현재 해당사항이 없습니다.
2. 전문가와의 이해관계
당사는 보고서 제출일 현재 해당사항이 없습니다.