 |
|
대표이사 등의 확인서_230710 |
투 자 설 명 서
2023년 07월 10일 |
|
| ( 발 행 회 사 명 ) 에스씨엠생명과학 주식회사 |
|
| ( 증권의 종목과 발행증권수 ) 기명식 보통주 4,800,000주 |
|
| ( 모 집 또는 매 출 총 액 ) 21,120,000,000(예정) |
|
| 1. 증권신고의 효력발생일 : |
2023년 07월 08일 |
| 2. 모집가액 : |
4,400원(예정) |
| 3. 청약기간 : |
구주주 청약일 : 2023년 09월 05일 ~ 09월 06일 일반공모 청약일 : 2023년 09월 11일 ~ 09월 12일 |
| 4. 납입기일 : |
2023년 09월 14일 |
| 5. 증권신고서 및 투자설명서의 열람장소 |
|
| 가. 증권신고서 : |
전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 일괄신고 추가서류 : |
해당사항 없음 |
| 다. 투자설명서 : | 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : 에스씨엠생명과학 주식회사 → 인천광역시 연수구 갯벌로 145번길 7-7 (송도동) 한양증권 주식회사 → 서울특별시 영등포구 국제금융로6길 7 |
|
| 6. 안정조작 또는 시장조성에 관한 사항 | |
| 해당사항 없음 |
|
| 이 투자설명서에 대한 증권신고의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 증권의 가치를 보증 또는 승인한 것이 아니며, 이 투자설명서의 기재사항은 청약일 전에 정정될 수 있음을 유의하시기 바랍니다. |
| ( 대 표 주 관 회 사 명 ) 한양증권 주식회사 |
【 대표이사 등의 확인 】
 |
|
대표이사 등의 확인서_230710 |
【 본 문 】
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 |
가. 국내외 거시경기 침체 및 불확실성이 미치는 위험 사. 기술 이전 파트너사의 임상 및 약물 상업화 실패에 따른 수익 감소의 위험 당사의 현재 매출 또한 2019년 05월 (주)한독과 체결한 중등증-중증 아토피 피부염 줄기세포치료제(SCM-AGH)의 기술이전 계약을 통해 발생하고 있으며, 당사는 보유한 파이프라인의 추가적인 라이선스 아웃을 위한 국내외 제약회사를 대상으로 학회, 전시회 및 비즈니스 파트너링 행사 등 기술 교류의 장을 통한 지속적 신약 임상 정보 제공 및 교류활동을 하고 있습니다. 이러한 당사의 향후 계획에도 불구하고 당사의 기술이전 파이프라인 및 향후 개발 진행 예정인 파이프라인의 임상 등에서의 예상치 못한 독성이 관찰되거나 효능이 기대에 미치지 못하여 상업화 과정에 어려움이 있을 수 있습니다. 또한 기술이전한 파트너사의 임상수행 능력 미달, 파트너사의 내부적인 이유로 임상진행이 중단될 가능성도 존재합니다. |
| 회사위험 | 가. 관리종목 지정 및 상장폐지 위험 당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도 (상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 5개 사업연도인 2024년말까지, 법인세전이익 요건의 경우 신규상장일이 속하는 사업연도(상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 3개 사업연도인 2022년말까지 해당 요건을 적용 받지 않습니다(영업이익 요건은 유예기간 없이 적용 면제). 하지만 당사의 노력에도 불구하고 사업환경이 급격히 악화되어 해당 요건별 유예기간이 경과한 시점에도 당사의 매출이 저조하여 재무성과를 나타내지 못할 경우 관리종목으로 지정 또는 상장폐지 요건에 해당할 수 있으니 투자자들께서는 이점 유의하시기 바랍니다. 나. 신규상장 추정 경영실적과 현재 실적의 높은 괴리율 위험 당사는 신규상장 당시 2020년의 예상 매출액을 1,823백만 원으로 추정하였으나, 실제 매출액은 320백만 원으로 추정 매출액과 82.5%의 높은 괴리율이 발생하였습니다. 2021년의 경우 당사는 예상 매출액을 12,879백만 원을 추정하였으나, 실제 매출액은 439백만 원으로 추정 매출액과 96.6%의 높은 괴리율이 발생하였습니다. 2022년의 경우 당사는 예상 매출액을 21,285백만 원을 추정하였으나, 실제 매출액은 396백만 원으로 추정 매출액과 98.1%의 높은 괴리율이 발생하였습니다. 2023년의 경우 당사는 예상 매출액을 37,782백만 원을 추정하였으나,실제 매출액은 연환산하여 산정하면 456백만 원으로 추정 매출액과 98.8%의 높은 괴리율이 발생하였습니다. 상기 기재한 것처럼 2020년부터 2023년 1분기까지의 실제 경영성과와 상장시 추정한 경영성과와는 큰 괴리를 보이고 있으며, 이는 당사가 상장시 계획한 영업활동이 정상적으로 실행되고 있지 않음을 의미합니다. 투자자께서는 당사의 2023년 및 향후 매출액 및 이익 또한 추정치와 높은 괴리를 보일 수 있음을 유의하시고 투자에 임하시기 바랍니다. 다. 매출 발생이 지연될 위험 GlobalData에 따르면, 글로벌 아토피 피부염 시장 규모가 2019년 6.1조원에서 연평균 6.8% 증가하여 2024년에 8.5조원까지 확대될 것으로 예상되고 있습니다. 이는 당사의 중등증-중증 아토피 피부염 치료제 기술 수수료 매출 향상에 긍정적으로 작용할 것으로 판단됩니다. 특히, 아토피 피부염 환자 중 만성 질환자의 약 70%가 유ㆍ소아이기 때문에 특정 시장을 제한하기 보다 성인과 유ㆍ소아 두 시장을 모두 타겟으로 삼아 치료제를 개발할 계획입니다. 한편, 당사가 영위하는 코스메슈티컬 제품인 탈모 완화 기능성 화장품 제품군을 리뉴얼하고 2023년 05월 중등증-중증 아토피 피부염 임상 2상 결과에 따라 스킨케어 제품군을 신규로 출시할 예정입니다. 또한, 할랄 인증서를 확보하여 'Duopharma Biotech Berhad'와의 해외 수출 계약을 맺어 말레이시아를 비롯한 다양한 국가에 유통이 예정됨에 따라 2023년 2분기부터는 해외 매출액이 발생할 것으로 예상됩니다. 2023년 05월에 발주된 1,2차 선적물량에 대한 매출채권 145,500달러는 2분기에 매출로 인식될 예정입니다. 다만, 4분기에 예정된 3차 발주 및 추가 발주의 지연 및 중단 시 매출 성장에 부정적인 영향을 미칠 수 있으니 이 점 유의하시기 바랍니다. 이러한 노력에도 불구하고 당사가 계획하고 있는 연구개발 지연 및 실패하는 경우, 품목허가 및 출시 지연에 따른 제품 생산ㆍ판매 지연, 각 국가별 정책 변화에 따른 수출 지연 등으로 인해 당사의 매출 계획이 지연될 가능성이 존재합니다. 이에 따라 당사의 영업활동 및 수익성은 부정적인 영향을 받을 수 있으니 투자자께서는 이 점 유의하사기 바랍니다. 라. 재무안정성 관련 위험 당사 재무제표를 살펴보면 2023년 1분기말 총자산 26,459백만 원 및 유동자산 5,306백만 원, 총 차입금 5,630백만 원, 차입금 의존도 21.28%, 부채비율 36.04%, 유동비율 164.20%를 나타내고 있습니다. 또한, 2023년 1분기 기준 감가상각비 등을 제외한 월평균 고정비는 1,091백만원으로 보유 현금및현금성자산 4,169백만원 고려했을 시 약 4개월 정도 고정비를 충당할 수 있습니다. 또한, 총 차입금 5,630백만원까지 고려했을 시 금번 유상증자가 실패하거나 주가 하락 등으로 인해 유상증자 자금 규모가 대폭 감소할 경우 유동성 리스크에 직면할 수 있습니다. 이로 인해 기타 운영자금 부족 및 차입금 미상환으로 인한 담보제공자산(토지, 건물)의 담보권 실행을 초래할 수 있습니다. 특히 경상연구개발비 조달이 원활히 되지 않아 진행 예정 중인 임상 및 연구개발이 중단될 수 있으니 이 점 유의하시기 바랍니다. 2020년 320백만 원, 2021년 439백만 원, 2022년 396백만 원, 2023년 1분기 98백만 원의 매출액이 발생하였습니다. 영업손실의 경우 2020년 16,089백만 원, 2021년 12,155백만 원, 2022년 12,579백만 원, 2023년 1분기 3,374백만 원이 발생하였으며, 이자비용의 경우 2020년 508백만 원, 2021년 198백만 원, 2022년 239백만 원, 2023년 1분기 118백만 원이 발생하였고, 당사의 이자보상배율은 지속적으로 1배 미만을 기록하여 영업을 통해 손실이 지속적으로 발생하고 있어 이자비용을 충당하지 못하는 상황입니다. 이는 당사의 채무상환능력이 취약하다는 것을 나타내며, 미미한 매출 수준으로 인해 영업 적자가 심화되고 있음에 기인합니다. 당사의 파이프라인별 임상 진행 단계에 따라 라이선스 아웃 계약 및 로열티 수취 시기가 지연되어 지속적으로 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 이자보상배율이 1배를 하회할 수 있습니다. 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. 향후 유의미한 수준의 매출 발생으로 인한 수익 구조 개선 시기가 지연된다면 손실이 지속적으로 발생하거나, 현재 당사가 진행 중인 파이프라인의 임상 시험이 지연 또는 실패하여 소요된 연구개발비용 등을 회수하지 못할 경우 유동성 악화로 인해 당사의 재무안정성이 악화될 수 있습니다. 이러한 점을 투자자께서 유의하시어 투자에 임하시기를 바랍니다. 마. 관계기업의 경영 실적 부진에 따른 손익 악화 위험 당사는 증권신고서 제출 전일 현재, 지분투자를 수행한 관계회사 1개가 있으며 이에 대한 경영실적은 지분법 회계처리로 재무제표에 반영하고 있습니다. 당사의 관계기업에 대한 지분투자 금액은 최초 투자금액을 원가로 인식하고, 해당 관계기업의 영업실적 중 당사의 몫에 해당하는 금액을 장부금액에 가감하고 있어 관계회사의 실적에 따라 당사의 재무제표 손익에 직접적인 영향을 미치고 있습니다. 코이뮨은 국내 및 이탈리아 기관투자자로부터 시리즈 A단계로 총 45백만 달러(한화 약 510억 원) 규모의 자금조달 유치하였습니다. 당사는 2020년도에 7,555백만 원을 추가 납입하여 총 누적 투자액은 17,597백만 원입니다. 현재 코이뮨은 나스닥 상장을 위한 시리즈 B단계투자 유치를 위해 본격적으로 미국 투자자들과의 협상을 진행할 예정입니다. 다만, 투자 자금 모집 지연 및 실패 등의 이유로 시리즈 B단계 투자 유치가 되지 않는다면 코이뮨의 나스닥 상장 계획에 차질이 생겨 시기가 불투명해질 수 있으니 이 점 유의하시기 바랍니다. 관계기업의 손익은 당사의 지분율(23.88%)에 한하여 재무손익로 반영되고 있음에 따라 코이뮨이 진행하는 임상파이프라인이 대내외적인 변수로 인하여 진행이 지연되거나 자금조달 및 기술이전 성과가 계획과 다르게 진행될 경우, 지속적인 당기순손실이 발생하여 당사의 재무손익에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. 바. 현금흐름 및 유동성 관련 위험 당사는 미미한 수준의 매출 발생 및 지속적인 연구개발 활동으로 인해 음(-)의 영업활동현금흐름을 보이고 있으며, 투자활동현금흐름의 경우, 2020년에는 단기금융상품의 취득, 공동기업투자주식의 취득 등으로 인해 음(-)의 현금흐름을 보였으며, 2021년부터 현재까지 단기금융상품의 감소로 양(+)의 현금흐름을 보였습니다. 임상시험을 진행하면서 2020년 8,846백만 원, 2021년 10,015백만 원, 2022년 9,311백만 원, 2023년 1분기 2,452백만 원의 정부보조금을 제외한 경상연구개발비용이 지출되었습니다. 향후 파이프라인별 임상 단계 진전 및 신규 파이프라인 개발에 따라 더 많은 연구개발비가 투입될 예정이며 이에 따라 영업비용 또한 확대될 것으로 예상됩니다. 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있습니다. 투자자께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다. 사. 재고자산 및 매출채권 관련 위험 당사는 기술이전 계약에 따른 계약금 및 라이선스 수수료 외에 코스메슈티컬 브랜드 '이로로 디어스칼프' 를 개발 및 판매한 이후 관리할 재고자산도 증가하는 추세에 있습니다. 향후 실제 판매량이 예상 판매량을 하회한다면 재고자산회전율이 감소하게 되며, 이를 적절하게 관리하지 못할 시 평가손실 발생 등 당사 손익 및 영업활동에 부정적인 영향을 줄 수 있습니다. 매출채권 회수율을 측정하는 주요지표인 매출채권 회전율은 2023년 1분기 기준 10.9회로, 업종 평균인 5.0회 대비 상회하고 있습니다. 향후 매출 성장 또는 매출처와의 계약에 따라 회전율은 변동할 수 있으며, 추후 매출채권 회수가 지연되어 매출채권회전율이 감소할 경우 당사 유동성 및 손익에 악영향을 미칠 수 있습니다. 해외시장의 경제적 여건 악화, 거래상대방의 채무불이행 등 예상치 못한 사유로 인하여 매출채권의 회수가 지연되거나 최종적으로 손상되어 상각 처리된다면 당사의 수익성에 부정적 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자해주시기 바랍니다. 아. 최대주주 및 특수관계인 지분희석 및 경영권 관련 위험 증권신고서 제출 전일 기준 당사의 최대주주는 송기령으로 2,771,000주(지분율 22.61%) 보유하고 있으며, 특수관계인을 포함할 시 2,872,113주(지분율 23.43%)를 보유 중에 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.39164363의 배정비율로 신주인수권증서를 교부받게 됩니다. 증권신고서 제출일 현재, 최대주주는 국세청과 상속세 연부연납 특례 적용 및 납부기한등 연장신청에 대한 관련 서류를 함께 제출하였으며, 연부연납 승인시 분할납부에 따른 이자 포함 약 141억원의 상속세를 2023년부터 2032년까지 10년 동안 매년 9월 말에 분할 납부할 예정입니다. 납세담보로 보유 주식 중 1,456,887주(11.88%)를 공탁하였습니다. 이와 동시에 납부기한 연장 승인 시 2023년 예정된 납부세액을 2024년에 납부할 수 있게 됩니다. 최대주주는 상속세 납부 자금 및 청약 참여 자금을 마련하기 위해 기존 보유주식을 금번 공모 유상증자 기간 및 유상증자 종료 이후에도 상속세 납부 시기 및 청약 일정에 맞추어 블록딜(장외대량매매)로 매각할 예정입니다. 금번 유상증자에서 최대주주 송기령은 증서 매각 대금을 포함한 청약률은 최소 약 15% 내외를 예상하고 있으며 최대주주를 제외한 특수관계인의 청약률은 현재 미정입니다. 최대주주의 증서 청약률은 매각 당시 주가 흐름과 시장 상황에 따라 변동될 수 있습니다. 만약 시장 상황 악화로 인하여 당사의 주가가 하락한다면 증서 매각대금 또한 감소하여 청약률이 낮아질 수 있습니다. 이 경우 청약률 하락으로 인해 지분 희석이 심화될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
| 기타 투자위험 | 가. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다. 당사가 진행하는 금번 유상증자가 예기치 못한 사유로 인해 철회될 경우 당사는 자본 확충을 위하여 무상감자 등 주주에게 손실을 끼치는 방안 등을 진행할 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있습니다. 2023년 1분기 기준 감가상각비 등을 제외한 당사의 월평균 고정비는 1,091백만원으로 보유 현금및현금성자산 4,169백만원 고려했을 시 약 4개월 정도 고정비를 충당할 수 있습니다. 또한, 총 차입금 5,630백만원까지 고려했을 시 금번 유상증자가 실패하거나 주가 하락 등으로 인해 유상증자 자금 규모가 대폭 감소할 경우 유동성 리스크에 직면할 수 있습니다. 이로 인해 기타 운영자금 부족 및 차입금 미상환으로 인한 담보제공자산(토지, 건물)의 담보권 실행을 초래할 수 있습니다. 특히 경상연구개발비 조달이 원활히 되지 않아 진행 예정 중인 임상 및 연구개발이 중단될 수 있으니 이 점 유의하시기 바랍니다. 나. 주가희석화 및 인수인의 실권주 인수분 물량 출회에 따른 주가하락 위험 신주 상장예정일은 유관기관과의 협의에 따라 변경될 수 있으며, 금번 유상증자에 따른 4,800,000주의 유상신주가 코스닥시장에 추가 상장됩니다. 또한, 구주주 청약주식 및 실권주 일반공모 청약시 기관 및 일반 투자자들의 청약으로 추가 발행되는 주식은 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 또한, 대표주관회사가 잔액인수한 물량은 수익을 확정하기 위해 신주상장일 2영업일 전부터 장내에서 대량 매도할 수 있습니다. 이 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 인수한 실권주를 일정 기간 보유하더라도 동 인수물량이 잠재매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사가 최종 실권주를 인수하게 되면 실권주 인수금액의 15%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관회사의 실권주 매입단가는 일반청약자들보다 15% 낮은 것과 같은 결과가 초래되어 대표주관회사의 실권주 매도단가가 신주의 발행가액보다 낮게 될 가능성이 존재합니다. 투자자께서는 이 점을 반드시 유의하여 주시기 바랍니다. 다. 경영환경변화 등에 따른 위험 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 증권신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분이 독자적으로 결정해야 함을 유의하시기 바랍니다. 라. 청약 후 추가상장일까지 환금성 제약 및 주가의 급격한 변동에 따른 손실위험 당사의 금번 유상증자로 인한 발행신주는 주금 납입일 이후 코스닥시장에 추가 상장일까지 유동성이 제한될 수 있으며, 추가상장 시점에서 신주발행가액보다 시장의 수준이 낮은 경우 환금성 위험 및 원금 손실의 위험이 있습니다. 본 유상증자 기간동안 주가의 변동이 있을 수 있다는 점, 투자자께서는 유의하여 주시기 바랍니다. 마. 유상증자 일정 변경 가능성에 따른 위험 본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 바. 당사의 잘못된 정보 제공 등으로 손해 끼칠 가능성 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있음을 유의하시기 바랍니다. 사. 유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. 아. 관리감독기준 위반에 따른 위험 최근 상장 기업에 대한 관리감독기준이 강화되는 추세이며, 향후 당사가 상장기업 관리감독기준을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 자. 차입공매도 유상증자 참여 제한 관련 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률 시행령」일부개정에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우에만 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 투자자께서는 이 점 유의하시기 바랍니다. 차. 재무제표 작성 기준일 이후 재무상황 변동에 따른 위험 본 공시서류 상 재무제표에 관한 사항은 2023년 1분기 재무제표 (K-IFRS 기준) 작성기준일 이후의 변동을 반영하지 않았습니다. 당사는 금번 유상증자를 진행하는 과정에서 투자 의사결정에 중대한 영향을 미칠 것으로 판단되는 변동사항을 향후에도 상세하게 반영하여 공시할 예정입니다. 그럼에도 불구하고, 당사가 중요하지 않다고 판단하여 기재 및 서술을 생략한 사항 중 당사의 기업가치에 영향을 미칠 만한 사건이 없다고 단정할 수는 없어 주기적이고 면밀한 검토가 필요합니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 4,800,000 | 500 | 4,400 | 21,120,000,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 한양증권 | 보통주 | 4,800,000 | 21,120,000,000 | 인수수수료 : 모집총액의 1.8% 실권수수료 : 잔액인수금액의 15.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2023년 09월 05일 ~ 2023년 09월 06일 | 2023년 09월 14일 | 2023년 09월 07일 | 2023년 09월 14일 | 2023년 07월 12일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2023년 06월 10일 | 2023년 08월 31일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 채무상환자금 | 5,630,000,000 |
| 운영자금 | 15,040,000,000 |
| 발행제비용 | 450,000,000 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | [정정] 주요사항보고서(유무상증자결정)-2023.06.22 |
| 【기 타】 | 1) 에스씨엠생명과학(주) 주주배정 후 실권주 일반공모 유상증자의 대표주관회사는 한양증권(주)입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것으로 대표주관회사는 주주배정 후 실권주 일반공모 후 최종실권주를 잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 I. 5 인수 등에 관한 사항'을 참고하여 주시기 바랍니다. 대표주관회사인 한양증권(주)는 투자중개업자로서 타인의 계산으로 증권의 발행ㆍ인수에대한 청약의 권유, 청약, 청약의 승낙 및 자본시장법상의 증권의 인수업무를 수행합니다. 3) 상기 모집가액, 모집총액 및 발행제비용은 예정모집가액 기준으로 산정된 것으로 향후 변경될 수 있습니다. 확정모집가액은 구주주 청약초일 전 제3거래일에 결정될 예정입니다. 4) 상기 청약기일은 구주주의 청약기일이며, 일반공모의 청약기일은 2023년 09월 11일 ~ 2023년 09월 12일(2영업일간)입니다. 5) 「자본시장과 금융투자업에 관한 법률」제180조의4 및 동법 시행령 제208조의4에 의거, 2023년 06월 10일부터 2023년 08월 31일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. 6) 「증권 인수업무 등에 관한 규정」 제9조제2항에 의해 고위험고수익투자신탁 및 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니하고 자기 계산으로 인수할 수 있습니다. 7) 금융감독원에서 본 증권신고서를 심사하는 과정에서 정정요구 조치를 취할 수 있으며, 정정요구 등에 따라 본 신고서에 기재된 일정이 변경될 수 있습니다. 8) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」 제165조의6제2항제1호에 의거 당사와 대표주관회사인 한양증권(주) 간에 주주배정 후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여, 당사 기명식 보통주 4,800,000주를 주주배정 후 실권주 일반공모 방식으로 발행하기로 결정하였으며 동 증권의 개요는 다음과 같습니다.
| (단위 : 주, 원) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집가액 | 모집총액 | 모집방법 |
| 기명식 보통주 | 4,800,000 | 500 | 4,400 | 21,120,000,000 | 주주배정후 실권주 일반공모 |
| 주1) | 이사회 결의일: 2023년 06월 09일, 2023년 06월 22일 |
| 주2) | 1주의 모집가액 및 모집총액은 예정 발행가액 기준으로 산출한 예정금액입니다. |
「증권의 발행 및 공시 등에 관한 규정」 제5-18조에서 주주배정 증자시 가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
■ 1차 발행가액의 산출근거
신주배정기준일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와, 1주일 가중산술평균주가 및 최근일 가중산술평균주가를 산술평균하여 산정한 가액과 최근일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다. (단, 호가 단위 미만은 호가 단위로 절상하기로 하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
| ▶ 모집예정가액 | = | 기준주가 × [ 1 - 할인율(25%) ] |
| ------------------------------------------------ | ||
| 1 + [ 증자비율 × 할인율(25%) ] |
| [ 1차 발행가액 산정표] | |
| 기산일 : 2023년 07월 07일 | (단위 : 원, 주) |
| 일자 | 가중산술평균주가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2023-07-07 | 6,436 | 35,110 | 224,935,900 |
| 2023-07-06 | 6,525 | 56,386 | 367,896,110 |
| 2023-07-05 | 6,523 | 89,758 | 585,467,150 |
| 2023-07-04 | 6,423 | 58,457 | 375,463,860 |
| 2023-07-03 | 6,559 | 51,153 | 335,514,640 |
| 2023-06-30 | 6,589 | 246,309 | 1,623,045,520 |
| 2023-06-29 | 6,246 | 40,889 | 255,382,580 |
| 2023-06-28 | 6,368 | 22,207 | 141,420,230 |
| 2023-06-27 | 6,351 | 34,143 | 216,834,240 |
| 2023-06-26 | 6,473 | 73,161 | 473,548,240 |
| 2023-06-23 | 6,596 | 79,365 | 523,480,530 |
| 2023-06-22 | 6,431 | 105,706 | 679,814,150 |
| 2023-06-21 | 6,271 | 77,096 | 483,452,080 |
| 2023-06-20 | 6,395 | 76,019 | 486,154,470 |
| 2023-06-19 | 6,485 | 155,005 | 1,005,201,400 |
| 2023-06-16 | 6,674 | 129,433 | 863,818,380 |
| 2023-06-15 | 6,665 | 213,323 | 1,421,764,010 |
| 2023-06-14 | 7,043 | 391,591 | 2,757,869,060 |
| 2023-06-13 | 7,399 | 404,358 | 2,992,032,270 |
| 2023-06-12 | 7,544 | 968,280 | 7,304,796,940 |
| 2023-06-09 | 9,445 | 165,483 | 1,563,048,330 |
| 2023-06-08 | 9,625 | 210,544 | 2,026,403,810 |
| 1개월 가중산술평균주가 (A) | 7,250 | 3,683,611 | 26,707,343,900 |
| 1주일 가중산술평균주가 (B) | 6,499 | 290,699 | 1,889,277,660 |
| 최근일 가중산술평균주가 (C) | 6,437 | 34,945 | 224,935,900 |
| A,B,C의 산술평균 (D) | 6,729 | (A+B+C)/3 | |
| 기준주가 (E) | 6,437 | (C와 D중 낮은가액) | |
| 할인율 (F) | 25% | - | |
| 증자비율 (G) | 39.16% | - | |
| 1차 발행가액 | 4,400 | 기준주가 × (1-할인율) / 1 + (유상증자비율 × 할인율 ) (단, 호가 단위 미만은 호가 단위로 절상하기로 하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.) |
|
■ 공모일정 등에 관한 사항
| [주요일정] |
| 날 짜 | 내 용 | 비 고 |
|---|---|---|
| 2023년 06월 09일 | 이사회결의 | - |
| 2023년 06월 09일 | 신주발행 및 기준일 공고 | 회사 인터넷 홈페이지 (www.scmlifescience.com) |
| 2023년 06월 09일 | 증권신고서 제출 | - |
| 2023년 06월 22일 | (정정)이사회결의 | - |
| 2023년 06월 22일 | (정정)신주발행 및 기준일 공고 | 회사 인터넷 홈페이지 (www.scmlifescience.com) |
| 2023년 06월 23일 | (정정)증권신고서 제출 | - |
| 2023년 07월 07일 | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2023년 07월 11일 | 권리락 | - |
| 2023년 07월 12일 | 신주배정기준일 | - |
| 2023년 07월 24일 | 신주배정통지 | - |
| 2023년 07월 31일~ 2023년 08월 04일 |
신주인수권증서 상장 및 거래기간 | 5영업일 간 거래 |
| 2023년 08월 05일 | 신주인수권증서 상장폐지 | 구주주 청약초일 5거래일 이전에 폐지 |
| 2023년 08월 31일 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 산정 |
| 2023년 09월 01일 | 확정 발행가액 공고 | 회사 인터넷 홈페이지 (www.scmlifescience.com) |
| 2023년 09월 05일~ 2023년 09월 06일 |
구주주 청약 및 초과청약 | - |
| 2023년 09월 07일 | 일반공모 청약 공고 | 회사 인터넷 홈페이지 (www.scmlifescience.com) 한양증권(주) 홈페이지 (www.hygood.co.kr) |
| 2023년 09월 11일~ 2023년 09월 12일 |
일반공모 청약 | - |
| 2023년 09월 14일 | 환불 및 배정 공고 | 한양증권(주) 홈페이지 (www.hygood.co.kr) |
| 2023년 09월 14일 | 주금 납입 / 환불 | - |
| 2023년 09월 27일 | 신주상장 예정일 | - |
※ 무상증자에 관한 사항
당사는 2023년 06월 09일, 2023년 06월 22일 개최된 이사회에서 무상증자를 결의하였으며, 유상증자 납입일(2023년 09월 14일)의 2영업일 후인 2022년 09월 18일을 무상증자 신주배정기준일로 하여, 유상증자 후 주주명부에 기재된 주주(자기주식 제외)에 대하여 소유주식 1주당 0.2주의 비율로 신주를 무상으로 배정하는 증자를 시행할 예정입니다. 금번 유상증자로 인해 발행되는 신주의 경우에도 자동적으로 무상증자에 참여하여 신주를 받을 수 있는 권리가 발생하게 됩니다.
1) 신주의 재원 : 주식발행초과금
2) 단주 처리방법 : 주주별로 발생하는 단주에 대해서 신주의 상장 초일 종가를 기준으로 현금 지급하며, 단주는 자기주식으로 취득 예정임.
3) 무상증자에 관한 기타사항은 이사회를 통해 대표이사에게 위임되었으며, 상기 일정은 유관 기관과의 협의를 통해 변경될 수 있음.(본 무상증자는 유상증자 청약자도 무상증자를 받을 수 있도록 진행되고 있습니다. 만약, 유상증자 일정이 변경되면, 본 무상증자의 일정 또한 변경될 수 있습니다.)
[무상증자 개요]
| 구분 | 내용 |
|---|---|
| 무상증자 신주배정 기준일 | 2023년 09월 18일 |
| 무상증자 신주의 주당 발행가액 | 500원 |
| 무상증자 신주의 종류와 수 | 보통주 3,411,208주 |
| 1주당 신주배정 수 | 0.2주 |
| 무상증자 신주의 재원 | 주식발행초과금 |
| 무상증자 신주권 유통 예정일 | 2023년 10월 12일 |
| 무상증자 신주상장일 | 2023년 10월 12일 |
| 주) | 무상증자 신주 수는 주식관련사채의 행사, 자기주식수 변동, 단수주 등에 의하여 변동될 수 있습니다. |
2. 공모방법
| [공모방법 : 주주배정후 실권주 일반공모] |
| 모집 대상 | 주 수(%) | 비 고 |
| 구주주 청약 (신주인수권증서 보유자 청약) |
4,800,000주(100%) | ▶ 구주주 청약일 : 2023년 09월 05일 ~ 09월 06일 ▶ 구주 1주당 신주 배정비율 : 1주당 0.39164363주 ▶ 신주배정기준일 : 2023년 07월 12일 ▶ 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권증서가 배정됨) |
| 초과 청약 | - | ▶ 「자본시장과 금융투자업에 관한 법률」 제165조의6의제2항제2호에 의거 초과청약 ▶ 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 (단, 1주 미만은 절사함) ▶ 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 ▶ 구주주청약일에 초과청약 접수 |
| 일반모집 청약 (고위험고수익투자신탁, 벤처기업투자신탁 청약 포함) |
- | ▶ 구주주 청약 후 발생하는 단수주 및 실권주 배정 ▶ 일반모집 청약일 : 2023년 09월 11일 ~ 09월 12일 |
| 합계 | 4,800,000주(100%) |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.39164363를 곱하여 산정된 배정주식수로 하되, 1주 미만은 절사합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 주식매수선택권의 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동으로 인하여 1주당 배정주식수가 변동될 수 있습니다. |
| 주3) |
신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20%)을 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. (ii) 신주인수권증서청약 한도주식수 = 보유한 신주인수권증서의 수량 (iii) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율(20%) (1주 미만 절사) |
| 주4) | 「증권 인수업무 등에 관한 규정」제2조(용어의 정의) 제18항, 제19항, 제20항에 의거 ① "고위험고수익투자신탁" 이란 「조세특례제한법」제91조의15제1항에 따른 투자신탁 등을 말합니다. 다만, 해당 투자신탁 등의 최초 설정일·설립일로부터 배정일까지의 기간이 6개월 미만인 경우에는 같은 법 시행령 제93조제3항제1호 및 같은 조 제7항에도 불구하고 배정일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다. ② "벤처기업투자신탁" 이란 「조세특례제한법」제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 조세특례제한법 시행령 일부 개정령 시행 이후 설정된 벤처기업투자신탁에 한함)을 말합니다. 다만, 해당 벤처기업투자신탁의 최초 설정일로부터 배정일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 배정일 직전 영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35 이상이어야 합니다. |
| 주5) | 구주주에 대한 청약 및 초과청약 결과 발생한 실권주 및 단수주에 대하여는 대표주관회사가 다음 각 호와 같이 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」 제9조제2항제6호가목에 따라 고위험고수익투자신탁에 공모주식의 5%를 배정하고, 「증권 인수업무 등에 관한 규정」 제9조제2항제6호나목에 따라 벤처기업투자신탁에 공모주식의 30%를 배정한다. 나머지 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자 포함)에게 구분 없이 배정한다. 고위험고수익투자신탁에 대한 공모주식의 5%와 벤처기업투자신탁에 대한 공모주식의 30%와 개인투자자 및 기관투자자에 대한 공모주식의 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정한다. 다만, 어떤 그룹에 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정한다. |
| 주6) | 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 대표주관회사가 합리적으로 판단하여 배정합니다. |
| 주7) | 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수에 미달하는 경우에는 청약주식수대로 배정하되 잔여주식은 대표주관회사가 자기 계산으로 인수합니다. 단, 「증권 인수업무 등에 관한 규정」제9조제2항제7호에 의거 일반청약자에대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준)이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니하고 대표주관회사가 자기 계산으로 인수할 수 있습니다. |
| ▶ 주의사항 |
|
「자본시장과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 따라 2023년 06월 10일부터 2023년 08월 31일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장 업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
| ▶ 구주주 1주당 배정비율 산출근거 |
| 구분 | 내용 |
| A. 보통주식 | 12,256,040주 |
| B. 우선주식 | - |
| C. 발행주식총수 (A + B) | 12,256,040주 |
| D. 자기주식 + 자기주식신탁 | - |
| E. 자기주식을 제외한 발행주식총수 (C - D) | 12,256,040주 |
| F. 유상증자 주식수 | 4,800,000주 |
| G. 증자비율 (F / C) | 39.16% |
| H. 우리사주조합 배정 | - |
| I. 구주주 배정 (F - H) | 4,800,000주 |
| J. 구주주 1주당 배정비율 (I / E) | 0.39164363 |
| 주) | J.구주주 1주당 배정비율 = I. 구주주 배정 (F - H) / E. 자기주식을 제외한 발행주식총수 (C - D) |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」 제5-18조에서 주주배정 증자시 가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
(1) 1차 발행가액 : 신주배정기준일 전 제3거래일을 기산일로 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와, 1주일 가중산술평균주가 및 최근일 가중산술평균주가를 산술평균하여 산정한 가액과 최근일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다. (단, 호가 단위 미만은 호가 단위로 절상하기로 하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
| 기준주가 ×【 1 - 할인율(25%)】 | ||
| ▶ 1차 발행가액 | = | ------------------------------------- |
| 1 + 【증자비율 × 할인율(25%)】 |
(2) 2차 발행가액 : 구주주 청약일 전 제3거래일을 기산일로 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 최근일 가중산술평균주가를 산술평균하여 산정한 가액과 최근일 가중산술평균주가 중 낮은 금액을기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 25%를 적용합니다. (단, 호가 단위 미만은 호가 단위로 절상하기로 하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
| ▶ 2차 발행가액 = 기준주가 ×【1 - 할인율(25%)】 |
(3) 확정 발행가액 : 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 합니다. 다만, 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액중 낮은 가액이 청약일 전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가액보다 낮은 경우에는 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가액을 확정발행가액으로 합니다. (단, 호가 단위 미만은 호가 단위로 절상하기로 하며, 그 가액이 액면가액 미만인 경우 액면가액으로 합니다.)
| ▶ 확정 발행가액 = MAX【MIN(1차 발행가액, 2차 발행가액), 청약일 전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가의 60%】 |
(4) 최종 발행가액은 구주주청약일 초일 전 제3거래일에 결정되어 금융감독원 전자공시시스템에 공시될 예정이며, 회사의 인터넷 홈페이지(www.scmlifescience.com)에 공고하여 개별통지에 갈음할 예정입니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | ||||||||||||||||||||||||||||||||
| 모집 또는 매출주식의 수 | 4,800,000 | ||||||||||||||||||||||||||||||||
| 주당 모집가액 | 예정가액 | 4,400 | |||||||||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||||||||
| 모집총액 | 예정가액 | 21,120,000,000 | |||||||||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||||||||
| 청 약 단 위 |
1) 구주주
|
||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 및 초과청약 |
개시일 | 2023년 09월 05일 | ||||||||||||||||||||||||||||||
| 종료일 | 2023년 09월 06일 | ||||||||||||||||||||||||||||||||
| 실권주 일반공모 | 개시일 | 2023년 09월 11일 | |||||||||||||||||||||||||||||||
| 종료일 | 2023년 09월 12일 | ||||||||||||||||||||||||||||||||
| 청약 증거금 | 구주주 | 청약금액의 100% | |||||||||||||||||||||||||||||||
| 초과청약 | 청약금액의 100% | ||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | ||||||||||||||||||||||||||||||||
| 납입기일 | 2023년 09월 14일 | ||||||||||||||||||||||||||||||||
| 배당기산일(결산일) | 2023년 01월 01일 | ||||||||||||||||||||||||||||||||
| 주1) | 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
| 주2) | 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
(1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
| 신주발행(신주배정기준일)의 공고 | 2023년 06월 22일 | 회사 인터넷 홈페이지 (www.scmlifescience.com) |
| 모집 또는 매출가액 확정의 공고 | 2023년 09월 01일 | 회사 인터넷 홈페이지 (www.scmlifescience.com) |
| 실권주 일반공모 청약공고 | 2023년 09월 07일 | 회사 인터넷 홈페이지 (www.scmlifescience.com) 한양증권(주) 홈페이지 (www.hygood.co.kr) |
| 실권주 일반공모 배정 및 환불 공고 | 2023년 09월 14일 | 한양증권(주) 홈페이지 (www.hygood.co.kr) |
(2) 청약방법
1) 구주주 중 주권을 증권회사에 예탁한 실질주주는 주권을 예탁한 증권회사의 본ㆍ지점 및 대표주관회사인 한양증권(주)의 본ㆍ지점에서 청약할 수 있습니다. 다만, 구주주 중 주식을 증권회사 계좌에 보유하지 않은 특별계좌부 등재 주주(기존 명부주주)의 경우는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 한양증권(주)의 본ㆍ지점에서 청약할 수 있습니다. 청약시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출해야 합니다.
| 2019년 09월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한양증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
|
「주식ㆍ사채 등의 전자등록에 관한 법률」 |
|---|
| 제29조(특별계좌의 개설 및 관리) ① 발행인이 제25조부터 제27조까지의 규정에 따라 이미 주권등이 발행된 주식등을 전자등록하는 경우 제25조제1항에 따른 신규 전자등록의 신청을 하기 전에 제27조제1항제2호에 따른 통지를 하지 아니하거나 주권등을 제출하지 아니한 주식등의 소유자 또는 질권자를 위하여 명의개서대행회사, 그 밖에 대통령령으로 정하는 기관(이하 이 조에서 "명의개서대행회사등"이라 한다)에 기준일의 직전 영업일을 기준으로 주주명부등에 기재된 주식등의 소유자 또는 질권자를 명의자로 하는 전자등록계좌(이하 "특별계좌"라 한다)를 개설하여야 한다. ② 제1항에 따라 특별계좌가 개설되는 때에 제22조제2항 또는 제23조제2항에 따라 작성되는 전자등록계좌부(이하 이 조에서 "특별계좌부"라 한다)에 전자등록된 주식등에 대해서는 제30조부터 제32조까지의 규정에 따른 전자등록을 할 수 없다. 다만, 다음 각 호의 어느 하나에 해당하는 경우에는 그러하지 아니하다. 1. 해당 특별계좌의 명의자가 아닌 자가 주식등이 특별계좌부에 전자등록되기 전에 이미 주식등의 소유자 또는 질권자가 된 경우에 그 자가 발행인에게 그 주식등에 관한 권리가 표시된 주권등을 제출(주권등을 제출할 수 없는 경우에는 해당 주권등에 대한 제권판결의 정본·등본을 제출하는 것을 말한다. 이하 제2호 및 제3호에서 같다)하고 그 주식등을 제30조에따라 자기 명의의 전자등록계좌로 계좌간 대체의 전자등록을 하려는 경우(해당 주식등에 질권이 설정된 경우에는 다음 각 목의 어느 하나에 해당하는 경우로 한정한다) 가. 해당 주식등에 설정된 질권이 말소된 경우 나. 해당 주식등의 질권자가 그 주식등을 특별계좌 외의 소유자 명의의 다른 전자등록계좌로 이전하는 것에 동의한 경우 2. 해당 특별계좌의 명의자인 소유자가 발행인에게 전자등록된 주식등에 관한 권리가 표시된 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 다른 전자등록계좌로 이전하려는 경우(해당 주식등에 질권이 설정된 경우에는 제1호 각 목의 어느 하나에 해당하는 경우로 한정한다) 3. 해당 특별계좌의 명의자인 질권자가 발행인에게 주권등을 제출하고 그 주식등을 제30조에 따라 특별계좌 외의 자기 명의의 전자등록계좌로 이전하려는 경우 4. 그 밖에 특별계좌에 전자등록된 주식등의 권리자의 이익을 해칠 우려가 없는 경우로서 대통령령으로 정하는 경우 ③ 누구든지 주식등을 특별계좌로 이전하기 위하여 제30조에 따른 계좌간 대체의 전자등록을 신청할 수 없다. 다만, 제1항에 따라 특별계좌를 개설한 발행인이 대통령령으로 정하는 사유에 따라 신청을 한 경우에는 그러하지 아니하다. ④ 명의개서대행회사등이 발행인을 대행하여 제1항에 따라 특별계좌를 개설하는 경우에는 「금융실명거래 및 비밀보장에 관한 법률」 제3조에도 불구하고 특별계좌부에 소유자 또는질권자로 전자등록될 자의 실지명의를 확인하지 아니할 수 있다. |
2) 신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도주식수의 20%를 추가로 청약할 수 있습니다. 이때 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
3) 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자는 「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약합니다. 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자의 청약 시, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구를 제외한 청약자의 한개 청약처에 대한 복수청약이 불가능합니다. 또한 고위험고수익투자신탁 및 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제18호 내지 제20호 중 해당 요건을 충족하고, 제9조제4항에 해당하지 않음을(벤처기업투자신탁이 사모의 방법으로 설정된 경우, 설정일로부터 1년 6개월 이상의 기간동안 환매를 금지하고 있음을 포함하여) 확약하는 서류 및 자산총액이 기재되어 있는서류를 함께 제출하여야 합니다.
4) 1인당 청약한도를 초과하는 청약은 초과되는 부분에 대하여는 무효로 하며, 청약사무 취급처는 그 차액을 납입일까지 당해 청약자에게 반환하며, 받은 날부터의 이자는 지급하지 않습니다.
5) 기타
① 일반공모 배정을 함에 있어 이중청약이 있는 경우에는 그 청약자의 청약 전부를 청약하지 아니한 것으로 봅니다. 단, 신주인수권증서 보유자가 보유한 신주인수권증서 수량에 따라 청약을 한 후 일반공모에 참여하는 경우에는 금지되는 이중청약이 있는 경우로 보지 않습니다.
② 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 합니다.
③ 청약자는 「금융실명거래 및 비밀보장에 관한 법률」에 의거 실지 명의에 의해 청약해야 합니다.
④ 「자본시장과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 따라 2023년 06월 10일부터 2023년 07월 31일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장 업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
(3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
한양증권(주) 본ㆍ지점 | 2023년 09월 05일~ 2023년 09월 06일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 주식을 예탁하고 있는 해당 증권회사 본ㆍ지점 2) 한양증권(주) 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁, 벤처기업투자신탁 청약 포함) |
한양증권(주) 본ㆍ지점 | 2023년 09월 11일~ 2023년 09월 12일 |
|
(4) 청약결과 배정방법
1) 구주주 청약 : 신주배정기준일 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 본 주식을 1주당 0.39164363주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 주식매수선택권의 행사, 자기주식의 변동 등으로 1주당 배정비율이 변동될 수 있습니다.
2) 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주가 있는 경우,실권주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율 : 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다.(단, 초과청약 주식수가 실권주에 미달한 경우 100% 배정)
3) 일반공모 청약
① 상기 구주주 청약 및 초과청약 결과 발생한 실권주 및 단수주는 대표주관회사가 다음 각호와 같이 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」제9조제2항제6호가목에 따라 고위험고수익투자신탁에 공모주식의 5%를 배정하고,「증권 인수업무 등에 관한 규정」제9조제2항제6호나목에 따라 벤처기업투자신탁에 공모주식의 30%를 배정합니다. 나머지 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자)에게 구분 없이 배정합니다. 고위험고수익투자신탁에 대한 공모주식의 5%와 벤처기업투자신탁에 대한 공모주식의 30%와 개인투자자 및 기관투자자에 대한 공모주식의 65%에 대한 청약경쟁률과 배정에 있어서는 별도로 산출 및 배정합니다. 다만, 어느 한 그룹에서 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
② 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 안분 배정하여 잔여주식이 최소화되도록 합니다. 이후 최종 잔여주식은 대표주관회사가 합리적으로 판단하여 배정합니다.
③ 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수에 미달하는 경우에는 청약주식수대로 배정하되 잔여주식은 대표주관회사가 자기 계산으로 인수합니다. 단, 「증권 인수업무 등에 관한 규정」 제9조제2항제7호에 의거 일반청약자에대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 청약자에게 배정하지 아니하고 대표주관회사가 자기 계산으로 인수할 수 있습니다.
(5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」 제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 에스씨엠생명과학(주), 대표주관회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- 금번 유상증자에 청약하고자 하는 투자자께서는 (「자본시장과 금융투자업에 관한법률」 제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 따라 투자설명서의 교부가 면제되는 자 제외) 청약하시기 전 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
- 투자설명서 수령거부 의사 표시는 서면, 전화·전신·모사전송, 전자우편 및 이와비슷한 전자통신으로만 하여야 합니다.
1) 투자설명서 교부 방법 및 일시
|
구분 |
교부방법 |
교부일시 |
|
구주주 청약자 |
1),2),3)을 병행 |
- |
| 1) 우편 송부 | 구주주(신주인수권증서) 청약초일 전까지 | |
| 2) 한양증권(주)의 본ㆍ지점에서 교부 | 구주주(신주인수권증서) 청약종료일까지 | |
| 3) 한양증권(주))의 HTS에서 교부 | ||
|
일반 청약자 |
1),2)를 병행 |
- |
| 1) 한양증권(주)의 본ㆍ지점에서 교부 | 일반공모 청약종료일까지 | |
| 2) 한양증권(주)의 홈페이지나 HTS, MTS에서 교부 |
| 주) | 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다. |
2) 확인절차
① 우편을 통한 투자설명서 수령시(구주주 청약의 경우)
- 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
- HTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
- 주주배정 유상증자 경우 유선청약이 가능합니다. 유선상으로 신분확인을 하신 후, 투자설명서 교부 확인을 해주시고 청약을 진행하여 주시기 바랍니다.
② 지점 방문을 통한 투자설명서 수령시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
③ 홈페이지 또는 HTS, MTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
3) 기타
① 금번 유상증자의 경우, 본 증권신고서의 효력발생 이후 주주명부상 주주분들에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는, 지점방문을 통해 인쇄물을 받으실 수 있습니다. 다만, 전자문서의 형태로 교부받으실 경우, 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각호의 요건을 모두 충족해야만 청약이 가능합니다.
② 구주주 청약시 한양증권(주) 이외의 증권회사를 이용할 경우, 해당 증권회사의 청약방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
|
「자본시장과 금융투자업에 관한 법률」 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 전문투자자 나. 삭제 <2016. 6. 28.> 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사ㆍ감정인ㆍ변호사ㆍ변리사ㆍ세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주[「금융회사의 지배구조에 관한 법률」 제2조제6호가목에 따른 최대주주를 말한다. 이 경우 "금융회사"는 "법인"으로 보고, "발행주식(출자지분을 포함한다.이하 같다)"은 "발행주식"으로 본다. 이하 같다]와 발행주식 총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자
|
(6) 주권교부에 관한 사항
1) 주권유통개시일: 2023년 08월 25일 (2019년 09월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
(7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다.
(8) 주금납입장소 : 중소기업은행 인천항지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
| 회사명 | 회사고유번호 | |
| 2023년 07월 12일 | 한양증권(주) | 00162416 |
(1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」 제165조의6제3항 및 「증권의 발행 및 공시 등에 관한 규정」제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
(2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 09월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
(3) 신주인수권증서 매매의 중개를 할 증권회사는 한양증권(주)로 합니다.
(4) 신주인수권증서 매매 등
1) 금번 유상증자시 신주인수권증서는 전자증권제도 시행 이후에 발행되고 상장될 예정으로 실물은 발행 되지 않고 전자증권으로 등록발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
2) 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량(초과청약이 있는 경우 초과청약 가능수량이 합산된 수량)만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(5) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 한양증권(주)의 본점 및 지점을 통해 해당 신주인수권증서에 기재되어 있는 수량(초과청약이 있는 경우 초과청약 가능수량이 합산된 수량)만큼 청약할 수 있으며 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(6) 신주인수권증서의 상장
당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2023년 07월 31일부터 2023년 08월 04일까지 5거래일간으로 예정하고 있으며, 동 기간중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2023년 08월 08일에 상장폐지될 예정입니다.(「코스닥시장 상장규정」 제16조의3에 근거하여 5거래일 이상 상장되어야 하며, 동 규정 제44조의3에 따라 신주청약개시일 5거래일 전에 상장폐지되어야 함)
(7) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래관련 사항은 다음과 같습니다.
1) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
2) 실질주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 기존 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의계좌대체를 청구합니다. 위탁자계좌를 통하여신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2023년 07월 31일부터 2023년 08월 04일까지(5거래일간) 거래 | 2023년 07월 24일(예정)부터 2023년 08월 08일까지 거래 |
| 주1) | 상장거래 : 2023년 07월 31일부터 2023년 08월 04일(5거래일간) 거래 가능합니다. 2023년 07월 31일부터 2023년 08월 04일까지(5거래일간) 거래 가능합니다. |
| 주2) | 계좌대체거래 : 2023년 07월 24일(예정)부터 2023년 08월 08일까지 거래 가능 합니다. * 신주인수권증서 상장거래의 결제일인 2023년 08월 08일까지 계좌대체(장외거래) 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다. |
| 주3) | 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다. |
3) 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
① '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다.
② '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한양증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 주권교부일 이전의 주식양도의 효력에 관한 사항
주식교부일 이전의 주식의 양도는 발행회사에 대하여 효력이 없습니다. 다만, 「자본시장과 금융투자업에 관한 법률」 제311조제4항에 의거 주권발행 전에 증권시장에서의 매매거래를 투자자계좌부 또는 예탁자계좌부상 계좌 간 대체의 방법으로 결제하는 경우에는 「상법」 제335조제3항에 불구하고 발행인에 대하여 그 효력이 있습니다.
|
※ 「자본시장과 금융투자업에 관한 법률」 제311조 (계좌부기재의 효력) ① 투자자계좌부와 예탁자계좌부에 기재된 자는 각각 그 증권등을 점유하는 것으로 본다. ② 투자자계좌부 또는 예탁자계좌부에 증권등의 양도를 목적으로 계좌 간 대체의 기재를 하거나 질권설정을 목적으로 질물(質物)인 뜻과 질권자를 기재한 경우에는 증권등의 교부가 있었던 것으로 본다. ③ 예탁증권등의 신탁은 예탁자계좌부 또는 투자자계좌부에 신탁재산인 뜻을 기재함으로써 제삼자에게 대항할 수 있다. <개정 2011. 7. 25.> ④ 삭제 <2016. 3. 22.> |
마. 기타 모집 또는 매출에 관한 사항
(1) 청약자가 「금융실명거래 및 비밀보장에 관한 법률」에 의거 실명에 의하여 청약하지 아니한 경우에는 이를 무효처리합니다.
(2) 본 증권신고서는 공시 심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자시 이러한 점을 감안하시기 바랍니다.
(3) 「자본시장과 금융투자업에 관한 법률」 제120조제3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부에서 그 증권의 가치를 보증 또는 승인하는 효력을 가지는 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
(4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
| 대표 | 한양증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 |
인수수수료 : 모집총액의 1.8% 실권수수료 : 잔액인수금액의 15.0% |
| 주1) | 최종 실권주 : 구주주청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 |
| 주2) | 모집총액 : 최종 발행가액 X 총 발행주식수 |
II. 증권의 주요 권리내용
당사가 금번 주주배정후 실권주 일반공모 유상증자를 통하여 발행할 증권은 기명식 보통주이며, 동 증권의 주요 권리내용은 다음과 같습니다.
1. 주식의 발행 및 배정에 관한 사항
제5조(발행예정주식총수) 회사가 발행할 주식의 총수는 100,000,000주로 한다.
제7조(1주의 금액) 주식 1주의 금액은 500원으로 한다.
제8조(주권의 발행과 종류) ① 회사가 발행하는 주권은 기명식으로 한다. ② 회사의 주권은 1주권, 5주권, 10주권, 50주권, 100주권, 500주권, 1,000주권 및 10,000주권의 8종류로 한다. 다만, 「주식·사채 등의 전자등록에 관한 법률 시행령」에 따라 전자등록계좌부에 주식 등을 전자등록하는 경우에는 동 조항은 삭제한다.
제8조의2(주식 등의 전자등록) 회사는「주식·사채 등의 전자등록에 관한 법률」제2조 제1호에 따른 주식 등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식 등을 전자등록하여야 한다. 다만, 회사가 법령에 따른 등록의무를 부담하지 않는 주식 등의 경우에는 그러하지 아니할 수 있다.
제10조(신주인수권) ① 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다.
② 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다.
1. 발행주식총수의 100분의 50을 초과하지 않는 범위 내에서「자본시장과 금융투자업에 관한 법률」제165조의 6에 따라 일반공모증자 방식으로 신주를 발행하는 경우
2.「상법」제542조의 3에 따른 주식매수선택권의 행사에 인하여 신주를 발행하는 경우
3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우
4.「근로복지기본법」제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우
5. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우
6. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산·판매·자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우
7. 자본시장과 금융투자업에 관한 법률 제9조에서 정한 "유가증권시장 또는 코스닥시장 (코넥스시장 포함)"에 주권을 신규상장하기 위하여 신주를 모집하거나 인수인에게 인수하는 경우
③ 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다.
④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다.
2. 배당에 관한 사항
제9조(주식의 종류, 수 및 내용) ① 회사는 보통주식과 종류주식 발행할 수 있고, 회사가 발행하는 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제 또는 제한에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다.
② 제5조의 발행예정주식총수 중 종류주식의 발행주식총수는 30,000,000주로 한다.
③ 종류주식에 대한 우선배당률은 액면금액을 기준으로 하여 연 0% 이상으로 하되 100%를 넘지 못하며 발행 시에 이사회가 정하도록 한다.
④ 종류주식은 제 3 항의 규정에 의한 배당을 받지 못한 사업년도가 있는 경우에는
미배당분을 누적하여 다음 사업년도의 배당시에 우선하여 배당받는다.
⑤ 종류주식의 주주는 보통주식의 주주와 동일한 의결권을 가진다.
⑥ 종류주식의 존속기간은 발행일로부터 10년 이내에서 발행 시에 이사회가 정하도록 하고 이 기간 만료와 동시에 보통주식으로 전환한다. 다만, 존속기간 중 소정의
배당을 하지 못한 경우에는 소정의 배당이 완료될 때까지 존속기간은 연장된다.
⑦ 종류주식의 전환된 주식에 대한 이익의 배당에 관하여는 제 13조(신주의 배당기산일) 규정을 준용한다.
⑧ 보통주식의 배당률이 종류주식의 배당률을 초과할 경우에는 그 초과부분에 대하여 보통주식과 동일한 비율로 참가시켜 배당한다.
⑨ 회사가 유상증자 또는 무상증자를 실시하는 경우 종류주식에 대한 신주의 배정은
무상증자의 경우에는 같은 종류주식으로, 유상증자의 경우에는 회사가 발행하기로
한 종류의 주식으로 한다.
⑩ 회사는 이사회의 결의에 의하여 아래의 조건에 따라 보통주식으로 전환되거나 회사의 이익으로 상환되는 종류주식을 발행할 수 있다.
1. 회사는 종류주식으로 발행할 주식의 총수 범위 내에서 주주의 청구에 따라 상환되는 상환주식을 발행할 수 있다.
가. 상환주식의 상환가액은 발행금액과 미지급된 배당금을 합한 금액으로 한다.
나. 상환주식의 상환청구권 행사기간은 발행일로부터 1년 경과 후부터 상환주식이
주식으로 전환되는 시점 1개월 전까지로 하되, 이사회가 정하는 별도의 발행조건이 있는 경우 이를 적용한다.
다. 상환주식의 주주는 상환일 1개월 전에 서면으로 회사에 상환청구를 통지하며,
회사는 주주로부터 주권을 제출받고 상환가액을 주주에게 지급한다.
라. 상환주식의 상환은 회사에 배당가능한 이익이 있을 때에만 가능하며, 상환청구가 있었음에도 상환되지 아니하거나 우선배당을 받지 못한 경우에는 상환기간은 상환 및 배당이 완료될 때까지 연장되는 것으로 한다.
2. 회사는 종류주식으로 발행할 주식의 총수 범위 내에서 주주의 청구에 따라 보통주식으로 전환되는 전환주식을 발행할 수 있다.
가. 전환주식의 전환조건은 우선주식 1주당 보통주식 1주로 전환되는 것으로 하되,이사회가 정하는 별도의 발행조건이 있는 경우 이를 적용한다.
나. 전환청구기간은 최초 발행일 이후부터 존속기간 만료일의 전일까지로 하고 전환 청구기간내 전환주식 주주의 전환청구시 보통주로 전환될 수 있다.
다. 전환청구에 의하여 전환된 보통주식의 이익의 배당에 관하여는 제 13조(신주의
동등배당) 규정을 준용한다.
3. 회사는 위 제1호 및 제2호의 성격을 동시에 지닌 주식을 발행할 수 있다. 또한 위
제1호 및 제2호의 주식에 대하여는 본 제⑩항에 배치되지 않는 한, 본 제 9조의 다른 규정이 동일하게 적용된다.
4. 종류주식 주주와 회사와의 여타의 권리 및 의무관계에 대해 이 정관에서 특별히 정한 바가 없을 경우에는 해당 주식의 발행 시 작성한 별도의 계약서에 따르기로 한다.
제13조(신주의 동등배당)
회사가 정한 배당기준일 전에 유상증자, 무상증자 및 주식배당에 의하여 발행한 주식에 대하여는 동등배당한다.
제54조(이익배당) ① 이익의 배당은 금전 또는 금전 외의 재산으로 할 수 있다.
② 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다.
③ 제1항의 배당은 이사회 결의로 정하는 배당기준일 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다.
3. 의결권에 관한 사항
제27조(주주의 의결권) 주주의 의결권은 1주마다 1개로 한다.
제28조(상호주에 대한 의결권 제한) 회사, 회사와 회사의 자회사 또는 회사의 자회사가 다른 회사의 발행주식총수의 10분의 1을 초과하는 주식을 가지고 있는 경우, 그 다른 회사가 가지고 있는 이 회사의 주식은 의결권이 없다.
제29조(의결권의 불통일행사) ① 2 이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3일전에 회사에 대하여 서면으로 그 뜻과 이유를 통지하여야 한다.
② 회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 그러나 주주가 주식의 신탁을 인수하였거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니하다.
제30조(의결권의 대리행사) ① 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있다
② 1항의 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다.
제31조(주주총회의 결의방법) 주주총회의 결의는 법령과 정관에 다른 정함이 있는 경우를 제외하고는 출석한 주주의 의결권의 과반수와 발행주식총수의 4분의 1이상의 수로써 한다.
III. 투자위험요소
| 【투자자 유의사항】 |
| ■ 본 건 공모주식을 청약하고자 하는 투자자께서는 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라, 특히 아래에 기재된 「투자위험요소」를 주의깊게 검토한후 이를 고려하여 최종적인 투자판단을 해야합니다. ■ 당사는 본 공시서류를 통하여 청약 전에 투자자께서 숙지하셔야 하는 부분에 대하여 성실히 기재하고자 노력하고 있습니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 아래 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수 없습니다. 투자자께서는 아래 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 자신의 독자적이고도 세밀한 판단에 의해야 합니다. 따라서 본 공시서류에 기재된 사항은 투자 판단 시 참고 자료로 활용하실 것을 권고 드리며, 투자자의 투자 판단에 대한 결과는 투자자 본인에게 귀속됩니다. ■ 만일, 아래 기재한 투자위험요소가 실제로 발생하는 경우, 당사의 사업, 재무상태, 기타 영업활동에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있음을 유의하시기 바랍니다. ■ 2009년 2월 4일 부로 시행된 「자본시장과 금융투자업에 관한 법률」 제124조에 의거 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자 (전문투자자, 그밖에 대통령령으로 정하는 자를 제외함) 에게 적합한 투자설명서를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 안됩니다. 다만, 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 의거하여 투자설명서를 받기를 거부한다는 의사를 서면으로 표시한 자는 투자설명서의 교부없이 청약이 가능합니다. ■ 당사 재무정보는 한국채택국제회계기준 작성기준에 따라 작성되었으며, 당사의 제9기(2022년), 제8기(2021년), 제7기(2020년)의 재무제표는 외부감사인의 감사를 받은 재무제표입니다. ■ 본 공시서류의 기재사항은 투자 결정을 위한 참고사항일 뿐이며, 투자에 대한 모든 손익 및 투자책임은 투자자 본인에게 귀속됨을 다시 한 번 유의하시기 바랍니다. |
| [주요 용어의 정의] |
|
용어 |
내용 |
|---|---|
|
(개발단계)희귀의약품 지정 |
국내에서 임상시험 단계에 있는 의약품일 경우, (개발단계) 희귀의약품 지정을 위한 다음의 지정기준을 만족해야 함 |
|
조건부 품목허가 |
생명을 위협하거나 중대한 질병 치료제로서, 기존 치료법이 없거나 기존 치료에 비해 의미 있는 장점이 있는 의약품을 대상으로 하며, 식약처는 의약품 중 항암제와 희귀의약품 및 세포치료제를 대상으로 조건부 허가 제도를 운영하고 있음 |
|
조혈모줄기세포 |
(Hematopoietic stem cell) 조혈모줄기세포는 정상인의 혈액 중 약 1%정도에 해당되며 모든 혈액세포를 만들어내는 능력을 가진 원조가 되는 줄기세포를 말함 |
|
콜로니 |
(Colony) 단일 세포에서 분열을 통해 성장한 세포들이 이룬 군체를 말하며, 당사에서 확립하는 줄기세포주는 모두 단일 콜로니로부터 분리하여 배양함 |
|
Amylase |
아밀라아제 녹말(당)을 분해하는 소화효소로 침샘과 췌장에서 생산되어 소화작용을 도와주지만, 췌장 괴사가 동반되는 췌장염 발생 시 혈중으로 유리되는 양이 증가하여 췌장염 임상증상 지표물질로 사용함 |
|
CFU-F |
(Colony Forming Unit-Fibroblast) 줄기세포능을 측정하는 방법으로, 하나의 중간엽줄기세포로부터 증식된 세포들이 콜로니를 이룰 수 있는 능력을 평가하는 시험법. CFU-F 형성능이 높은 세포는 자기복제능이 우수한 중간엽줄기세포 특성을 지니는 세포라는 것을 의미함 |
|
CXCL1 |
(Chemokine (C-X-C motif) ligand 1) 호중성 과립구의 케모카인으로 작용하며 다양한 면역반응을 유도하지만, 당사에서 최초로 발모효능을 입증한 발모단백질 |
|
DMN |
(Dimethylnitrosamine) 대사되어 아세트알데하이드를 형성하고, 핵산 및 단백질을 methylation시키는 물질을 형성하여 간세포 (hepatocyte)의 괴사를 유발하여 간섬유화 및 간경변을 유도함 |
| EASI-75 | (Eczema Area and Severity Index)습진 중증도 평가지수가 75% 이상 감소한 것으로 정의됨 |
| EASI-90 | (Eczema Area and Severity Index)습진 중증도 평가지수가 90% 이상 감소한 것으로 정의됨 |
|
ELISA |
(Enzyme-linked immunosorbent assay) 항체나 항원에 효소를 표지하여 효소의 활성을 측정하여 항원-항체 반응의 강도와 그 양을 정량적으로 측정하는 방법 |
|
FBS-CM |
(FBS-conditioned medium) 동물유래 성분인 Fetal Bovine Serum (FBS)를 포함한 배지로 중간엽줄기세포를 배양한 배지 |
|
GCM |
(Density Gradient Centrifugation Method) 농도구배원심분리법으로 중간엽줄기세포를 분리하는 대표적인 분리 기술 |
|
hPL |
(Human platelet lysate) 효과적인 FBS 대체제로 인체 유래 혈소판 용해물 |
|
hPL-CM |
Xeno-free hPL을 포함한 배지로 중간엽줄기세포를 배양한 배지 |
|
ICID |
(International Cosmetic Ingredient Dictionary) 미국화장품협회에서 발행하는 화장품원료사전으로 명명법에 의한 원료명, 상품명, 기능 등이 등재되어 있음 |
|
ICOSL |
(Inducible T Cell Costimulator Ligand) 면역관문 조절 물질로 ICOS와 결합하여 T-세포의 활성과 사이토카인의 분비를 유도 |
|
ICOS |
(Inducible T Cell Costimulator) 면역관문 조절 물질로 ICOSL와 결합하여 T세포의 활성과 사이토카인의 분비를 유도 |
|
IDO |
(Indoleamine 2,3-dioxygenase) T-세포의 기능과 면역활성을 조절하는 효소 |
|
IFN-γ |
(Interferon-γ) 면역세포에서 생산하는 외부 침입자들에 대응하는 단백질로 자연살해세포와 대식세포 등의 선천면역 세포들을 활성화시키는 역할을 담당 |
|
IgE |
(Immunoglobulin E) 면역글로불린 E는 알레르기 질환의 발생에 관여하는 면역글로불린의 한 종류로, 알레르기 질환을 진단하는 가장 우선적인 방법의 하나로 혈청 내 총 IgE를 측정함 |
|
IL-4 |
(Interleukin-4) 보조 Th2 T-세포로의 분화를 유도하는 인터루킨. IL-4에 의해 활성화된 Th2 세포들은 추가적인 IL-4를 생산함 |
|
IL-6 |
(Interleukin-6) 염증성 사이토카인 및 항 염증성 미오카인 두가지 양성적 기능을 갖는 인터루킨 |
|
IL-1β |
(Interleukin-1β) 염증이 발생한 환경에서 면역세포로부터 많이 분비되는 사이토카인 |
|
IL-10 |
(Interleukin-10) 사이토카인 합성 억제 인자로 항염증성 기능을 갖는 인터루킨 |
|
IL-17 |
(Interleukin-17A) 전 염증성 (pro-inflammatory) 사이토카인으로 IL-23의 자극에 반응하여 보조 Th17 T-세포에서 생성되고 염증과 자가면역 병인에 직접적인 역할을 함 |
|
IND |
(Investigational New Drug Application) 임상시험계획승인신청은 인체를 대상으로 한 안전성·유효성자료 수집을 목적으로 해당 의약품을 사용하여 임상시험을 실시하고자 하는 자가 식품의약품안전처장의 승인을 신청하는 과정을 말합니다. |
|
In vitro |
생명체 내부가 아니라 시험관이나 페트리 디쉬와 같이 제어가 가능한 환경에서 수행되는 실험 과정을 의미함 |
|
In vivo |
살아 있는 세포 안에서 직접 생화학, 생물학 실험 등을 하는 것을 의미함 |
| IRB | (Institutional Review Board) 기관생명윤리위원회, 인간을 대상으로 하는 제반 의학실험, 생명과학실험, 행동연구를 비롯한 사회과학연구 등에서 피실험자의 권리와 복지를 보호하기 위해 공식적으로 구성되는 위원회를 말함. 「생명윤리 및 안전에 관한 법률」에 따라 인간을 대상으로 하는 연구는 반드시 IRB의 승인을 받아야 함. |
|
Lipase |
리파아제는 췌장에서 생산되어 지방을 분해하는 효소 중 하나로 췌장염과 같이 췌장이 손상되거나 췌장관이 막히는 경우 췌장관으로 리파아제가 배출되지 못해 증가된 리파아제가 혈액 내로 유입되어 혈중농도를 증가시킴. 췌장염 임상증상 지표물질로 사용함 |
|
LPS |
(Lipopolysaccharide) 그람 음성 박테리아의 외막 구성 성분인 당지질로 면역활성을 유도하는 물질 |
|
MLR |
(Mixed Lymphocyte Reaction) 서로 다른 두 공여자의 말초혈액 단핵세포의 혼합 림프구 반응을 말하며 면역활성을 유도하는 시험법 |
|
MPO |
(Myeloperoxidase) 선천면역의 대표 세포인 호중성 과립구 (neutrophil granulocyte)와 같은 백혈구에 많이 발현되어 있는 항균작용 (antimicrobial activity)을 하는 효소 |
|
MSC |
(Mesenchymal Stem Cell) 중간엽줄기세포로 골수, 지방, 탯줄 조직 등으로부터 추출하기 쉬운 성체줄기세포로, 연골, 뼈, 관절을 재생하는 특징이 있고, 손상을 입거나 염증이 생긴 조직으로 이동하여 면역조절기능을 통한 재생과 질환 치료 효능이 규명된 세포 |
|
NGS |
(Next-generation sequencing) DNA 또는 RNA 시료에서 염기쌍의 신속한 서열분석(sequencing)을 가능하게 하는 차세대 염기서열 분석방법으로 유전체를 무수히 많은 조각으로 나눠서 읽은 후, 얻어진 염기서열 조각을 조립하여 전체 유전체의 서열을 분석함 |
|
Ovalbumin/Alum |
아토피 피부염 유도를 위해 사용하는 달걀 흰자 유래 알부민(Ovalbumin) 및 알루미늄 하이드록사이드 (Alum, aluminum hydroxide)로 함께 혼화하여 복강주사를 통해 감작시킴 |
|
PBMC |
(Peripheral Blood Mononuclear Cell) 말초혈액 단핵세포를 말하며 전혈로부터 피콜(Ficoll)과 원심분리를 이용해 분리함 |
|
Pre-IND 미팅 |
(Pre-Investigational New Drug, Pre-IND) IND 사전상담 미팅은 IND 신청서를 제출하기 전 의뢰자가 FDA 심의 담당관과 IND에 대해 사전상담할 수 있는 절차임. Pre-IND 미팅은 동물연구 결과에 대한 합의 시 결정적인 역할을 수행하며, 이 과정이 끝나야 사람을 대상으로 하는 임상시험을 개시할 수 있음. 또한 이 미팅을 통해 진행할 임상시험의 레이아웃도 제공할 수 있음. |
|
qPCR |
(Quantitative real time polymerase chain reaction) 각 유전자의 정확한 정량을 위해 형광으로 분석하는 시험법 |
|
SCM |
(Subfractionation Culturing Method) 층분리배양법으로 불리는 당사가 자체 개발한 고순도 중간엽줄기세포 분리 및 배양 기술 |
|
Splenocyte |
비장세포로 비장에 위치하거나 비장 조직으로부터 분리되는 다양한 면역 기능을 갖는 T 및 B-림프구, 수지상 세포 및 대식세포와 같은 면역세포 집단 |
|
TCA |
(Taurocholic acid, sodium taurocholate) 콜린산과 타우린의 접합체로 지방의 유화에 관여하는 담즙산으로, 3% TCA (1 mL/kg)를 주입하여 급성 췌장염 질환동물모델을 유도시킬 수 있는 물질 |
|
TGF-β1 |
(Transforming growth factor β1) 세포 성장, 세포 증식, 세포 분화 및 세포 사멸을 포함하여 많은 세포 기능을 수행하는 분비 단백질로 염증반응을 제어하는 면역억제 기능을 담당하기도 함 |
|
TNF-α |
(Tumor necrosis factor-α) 활성화된 대식세포, 보조 T-세포, 자연살해세포 등의 다양한 세포에서 분비되는 대표적인 염증성 사이토카인 |
|
TNFR-1 |
(Tumor necrosis factor receptor 1) 강력한 염증매개 단백질 (종양괴사인자) TNF-α 의 수용체로 중간엽줄기세포에서 발현되는 sTNFR-1(soluble TNFR-1)는 TNF-α 와 결합하여 TNF-α 의 기능을 무력화시키는 방식으로 면역억제 효과를 유도함 |
|
Toluidine blue |
톨루이딘 블루는 산성 조직 성분에 대한 친 화성이 높은 염기성 염료로 비만세포 (mast cell) 특이적 염색 시약으로 사용함 |
|
TYMP |
(Thymidine Phosphorylase) 내피세포의 성장으로 혈관을 신생하는 기능을 포함한 다양한 기능을 보유한 성장인자 |
|
Xeno-free |
동물유래 성분이 전혀 포함되지 않는 세포 배양이나 제조 방법을 총칭할 때 쓰는 용어 |
에스씨엠생명과학 주식회사(이하 당사)는 2005년 인하대병원 성체줄기세포 사업단에서 시작하였으며, 기존 의약품의 한계가 발생한 영역에 대해서 인하대병원 전체 진료과가 성체줄기세포를 중심으로 연구를 진행하고 있습니다.
2020년 코스닥 IPO 성공이후, 2022년 10월 인하대병원ㆍ인하대학교 기술사업화 공동업무협약을 체결하였고 이는 2005년 성체줄기세포사업단의 성과창출 노하우를 그대로 당사가 전수받고 사업화를 추진하고 있습니다.
 |
|
에스씨엠생명과학(주) 연혁 |
| 출처) 당사 제시 |
당사는 성체줄기세포 분리ㆍ배양에 대한 글로벌 원천기술을 보유하고 있어서, 최종 치료제로 규제당국의 승인받을 수 있는 줄기세포를 분리ㆍ배양할 수 있으며, 2037년까지 글로벌 차원으로 권리화가 완료되었고 지속적으로 권리화 보호에 투자할 예정입니다. 당사의 임상파이프라인은 중등증-중증 아토피 피부염과 만성이식편대숙주질환 2개가 임상 2상이 완료되었고 중등증-중증 급성 췌장염은 임상 1/2a가 완료되었습니다. 임상 2상이 완료된 파이프라인은 글로벌 기술이전을 위해 노력할 예정입니다. 당사가 최대주주인 관계회사 미국 CoImmune(코이뮨) 사가 보유한 cGMP시설을 활용할 수 있으며, 자체 GMP시설 구축은 향후 보유 중인 파이프라인의 임상 진행 단계에 맞춰 대량 생산이 필요한 시기에 GMP 시설을 구축할 계획입니다.
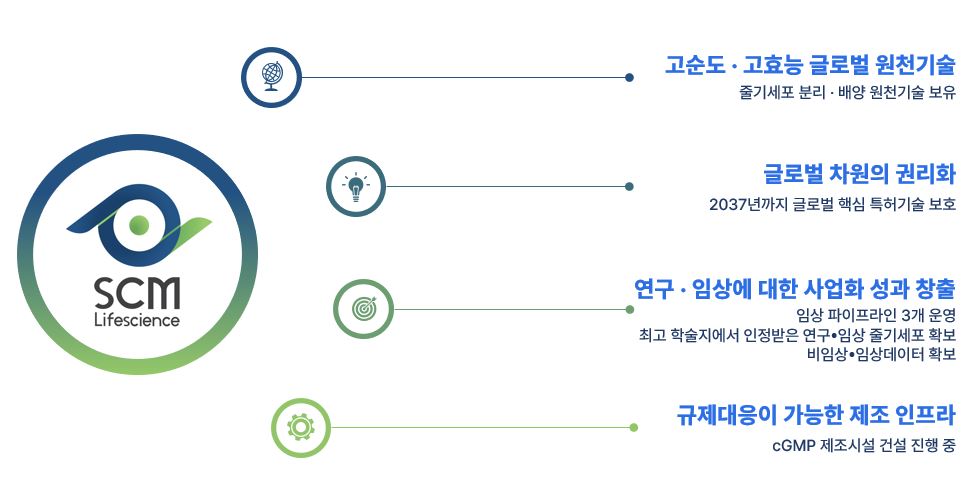 |
|
에스씨엠생명과학(주) 핵심역량 |
| 출처) 당사 제시 |
당사는 층분리배양법을 통하여 하나의 골수에서 다양한 특성을 가진 줄기세포주를 개별 특성에 맞게 분리ㆍ배양하고 있으며, 비임상시험부터 임상시험까지 모두 세포 특성에 맞는 세분화된 데이터를 보유하고 있습니다. 당사는 세분화된 데이터를 토대로 특정 질환에서 치료효과가 극대화 될 수 있는 줄기세포주를 선별하여 임상시험을 진행하고 있습니다. 또한, 신선형 뿐만 아니라 동결형까지 기술력을 확보하여 치료제 부족의 이슈를 선제적으로 해결관리하고 있습니다.
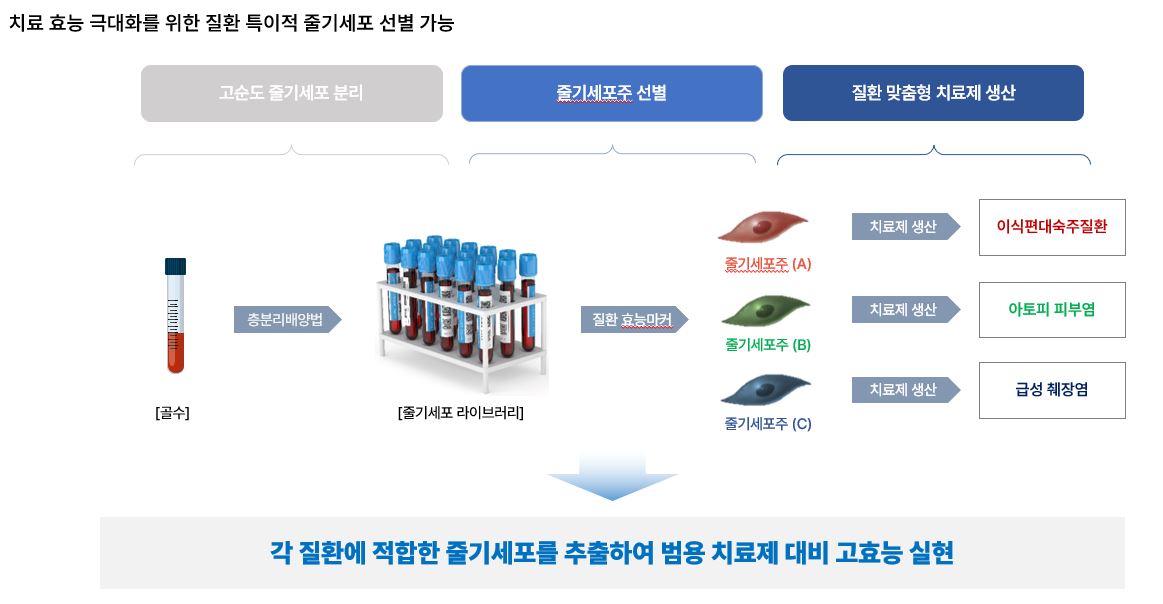 |
|
에스씨엠생명과학(주) 질환특이적 선별 프로세스 |
| 출처) 당사 제시 |
당사는 2022년 8월말에 중등증-중증 급성 췌장염에 대한 임상 1/2a상 결과 발표 및 국제 소화기 분야 학술지 Gastroenterology에 등재되었습니다.
당사는 임상 파이프라인 현황은 다음과 같습니다.
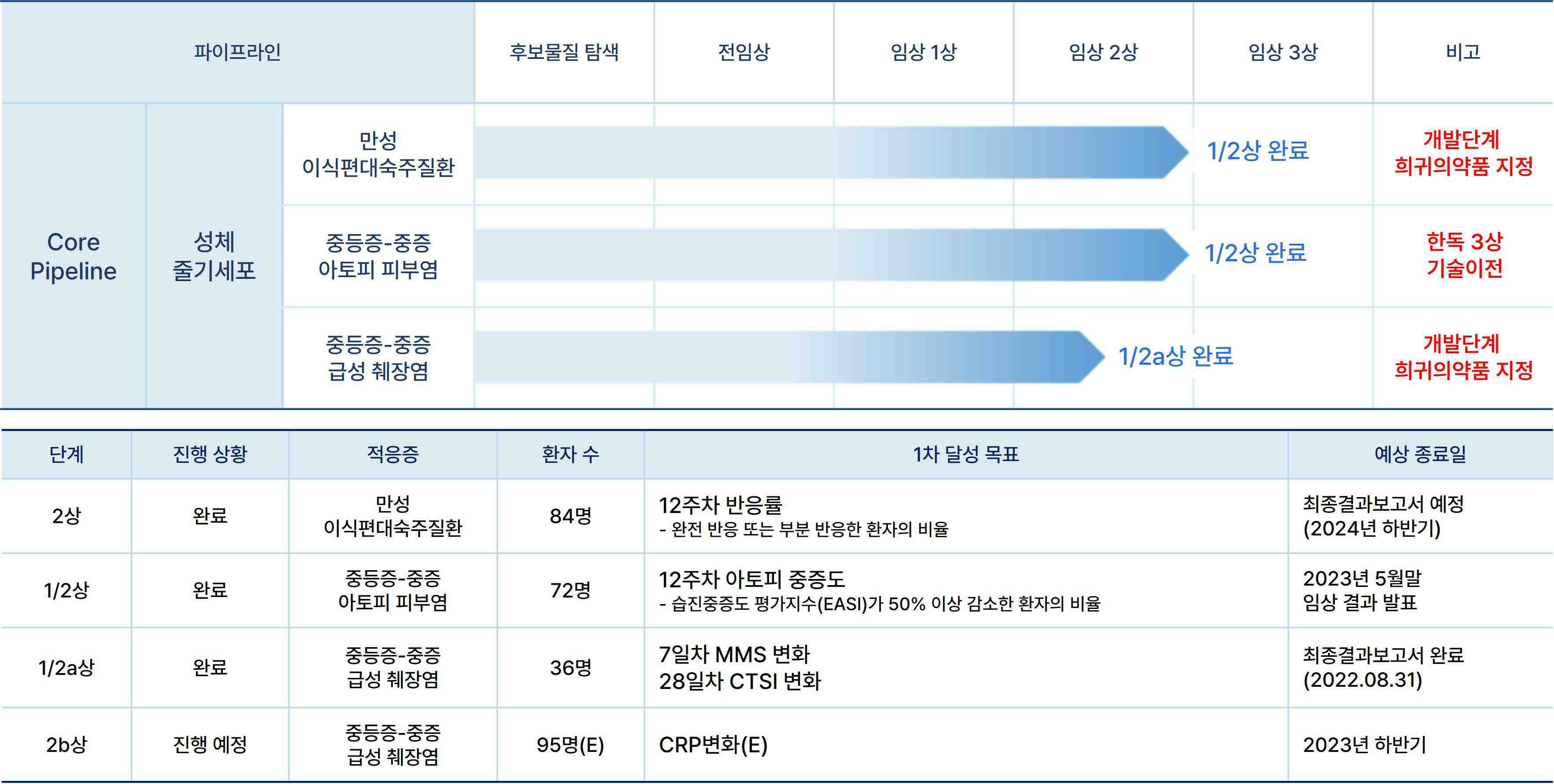 |
|
주요 임상 파이프라인 |
| 출처) 당사 제시 |
줄기세포 사업은 현재 진행 중인 임상 파이프라인 3개에 대해서, 치료제 승인 전까지 기술이전을 통한 라이선스 수익창출과 치료제 승인 이후 치료제 판매를 통하여 수익창출을 목표로 하고 있습니다. 코스메슈티컬 및 더마코스메틱 사업은 줄기세포 배양액 및 식물줄기세포 배양액과의 결합을 통한 다양한 제품군을 구축하고 디지털 마케팅을 통한 고객의 소구점을 다방면으로 충족시켜나갈 계획입니다. 국내 뿐만 아니라 해외 매출 확대에도 중점을 두고 있으며, 할랄인증을 획득하여 중동지역 및 말레이시아 등 본격적으로 진출할 예정입니다.
1. 사업위험
|
가. 국내외 거시경기 침체 및 불확실성이 미치는 위험 |
당사는 자체개발한 원천기술인 층분리배양법을 기반으로 줄기세포치료제와 조직공학 치료제를 연구개발하는 바이오벤처 기업으로, 주요 사업으로는 1)줄기세포치료제와 당사가 개발한 발모 효능 단백질을 활용한 탈모완화 기능성 제품을 판매하는 2)코스메슈티컬로 구성되어 있습니다. 따라서, 각 사업 부문은 국내 정부 정책 추진 방향 및 글로벌 경기에 민감한 영향을 받고 있기 때문에, 세계 각국의 경기 동향을 면밀히 주시하는 등 투자자의 주의가 필요합니다.
① IMF 세계경제전망
2023년 04월 국제통화기금(IMF)이 발표한 '세계경제전망(World Economic Outlook)'에 따르면, 2023년 세계경제성장률 전망치는 2.8%로 직전 전망치(2023년 1월) 2.9% 대비 0.1%p 하향되었습니다. 이는 최근의 금융시장 불안이 실물시장으로 파급될 가능성을 우려한 결과입니다. 이는 인플레이션 대응을 위한 금리 인상, 러시아ㆍ우크라이나 전쟁 지속 등 부정적인 요인에도 불구하고 중국의 리오프닝에 따른 경기 회복 기대와 주요국(미국, 유럽 등)에서의 예상외 견조한 소비 및 투자 등의 영향입니다.
| [세계 경제 성장률 전망치] |
| (단위: %, %p) |
| 구 분 | 2022년 | 2023년(E) | 2024년(E) | ||||
| 23년 01월 | 23년 04월 | 조정폭 | 23년 1월 | 23년 04월 | 조정폭 | ||
| (A) | (B) | (B-A) | (A) | (B) | (B-A) | ||
| 세계 | 3.4 | 2.9 | 2.8 | -0.1 | 3.1 | 3 | -0.1 |
| 선진국 | 2.7 | 1.2 | 1.3 | +0.1 | 1.4 | 1.4 | - |
| 미국 | 2.1 | 1.4 | 1.6 | +0.2 | 1.0 | 1.1 | +0.1 |
| 유로존 | 3.5 | 0.7 | 0.8 | +0.1 | 1.6 | 1.4 | -0.2 |
| 일본 | 1.1 | 1.8 | 1.3 | -0.5 | 0.9 | 1 | +0.1 |
| 영국 | 4.0 | -0.6 | -0.3 | +0.3 | 0.9 | 1 | +0.1 |
| 캐나다 | 3.4 | 1.5 | 1.5 | - | 1.5 | 1.5 | - |
| 신흥국 | 4.0 | 4.0 | 3.9 | -0.1 | 4.2 | 4.2 | - |
| 중국 | 3.0 | 5.2 | 5.2 | - | 4.5 | 4.5 | - |
| 인도 | 6.8 | 6.1 | 5.9 | -0.2 | 6.8 | 6.3 | -0.5 |
| 한국 | 2.6 | 1.7 | 1.5 | -0.2 | 2.6 | 2.4 | -0.2 |
| 출처) IMF, World Economic Outlook(2023.04) |
세부적으로 살펴보면, 선진국의 경우 미국은 견조한 내수의 영향으로 2023년 경제 성장률을 직전 전망치(2023년 1월) 1.2% 대비 0.1%p 상향한 1.3%로 전망하였으며, 유로존은 에너지 도매가격 하락의 영향으로 2023년 경제 성장률을 직전 전망치(2023년 1월) 0.7% 대비 0.1%p 상향한 0.8%로 전망하였습니다. 또한, 일본은 2023년 경제 성장률을 직전 전망치(2023년 1월) 1.8% 대비 0.5%p 하향한 1.3%로 전망하였으며, 영국은 2023년 경제 성장률을 직전 전망치(2023년 1월) -0.6% 대비 0.3%p 상향한 -0.3%로 전망하였고, 한국은 2023년 경제 성장률을 직전 전망치(2023년 1월) 1.7% 대비 0.2%p 하향한 1.5%로 전망하였습니다.
신흥국의 경우, 중국은 2023년 경제 성장률을 직전 전망치(2023년 1월) 5.2%에서 동결하였으며, 인도는 직전 전망치(2023년 1월) 6.1% 대비0.2%p 하향한 5.9%로 전망하였습니다.
이와 더불어, 국제통화기금(IMF)은 1) 중국의 낮은 백신 접종률, 부족한 의료시설 등에 따른 경제 회복 제약 및 부동산업의 위기 심화 가능성, 2) 러시아ㆍ우크라이나 전쟁 및 중국의 경기회복에 따른 에너지 가격 상승과 노동시장의 경직성 등의 영향을 받은 인플레이션의 지속 가능성, 3) 2022년 10월 이후 달러 평가절하, 글로벌 금융여건 완화로 국채 스프레드가 일부 축소되었음에도 불구하고, 여전히 높은 부채 수준, 저성장과 높은 차입비용 등의 신흥국 경제 위험 요인, 4) 러시아ㆍ우크라이나 전쟁 및 미ㆍ중 무역분쟁 등에 따른 블록화와 지정학적 긴장 심화로 인한 경제 분절화 등을 경기 하방 위험 요소로 언급하였습니다.
② 한국은행 국내경제전망
한편 한국은행이 2023년 02월 발간한 '경제전망보고서'에 따르면 2023년 국내 경제성장률은 1.6%, 2024년 국내 경제성장률은 2.4% 수준을 나타낼 것으로 전망됩니다. 한국은행은 향후 국내 경제가 글로벌 경기둔화, 금리상승 등의 영향으로 부진한 성장 흐름이 이어질 전망이며, 하반기 이후에는 중국 및 IT 경기 회복 등으로 점차 나아질 것으로 예상하지만 전망의 불확실성은 높은 상황이라고 밝혔습니다.
| [한국은행 국내 경제성장 전망] |
| (단위: %) |
| 구 분 | 2022년 | 2023년(E) | 2024년(E) | ||||
| 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | 연간 | |
| GDP | 3.0 | 2.2 | 2.6 | 1.1 | 2.0 | 1.6 | 2.4 |
| 민간소비 | 4.1 | 4.6 | 4.4 | 3.3 | 1.3 | 2.3 | 2.4 |
| 설비투자 | -6.4 | 5.4 | -0.7 | 3.2 | -8.9 | -3.1 | 3.6 |
| 지식재산생산물투자 | 4.6 | 5.0 | 4.8 | 3.6 | 3.5 | 3.5 | 3.5 |
| 건설투자 | -4.5 | -2.6 | -3.5 | 0.1 | -1.5 | -0.7 | 0.4 |
| 상품수출 | 6.0 | 0.3 | 3.1 | -4.0 | 5.0 | 0.5 | 3.4 |
| 상품수입 | 5.3 | 3.9 | 4.6 | -0.4 | -0.1 | -0.2 | 3.1 |
| 출처) 한국은행, 경제전망보고서(2023.02) |
국내경제는 주요국 경기 동반 부진 등으로 잠재수준을 하회하였으며, 2023년 하반기 이후에는 대외 불확실성이 줄어들면서 부진이 점차 완화될 것으로 예상하였습니다. 민간소비는 소득여건 개선과 일상회복 지속 등으로 완만한 회복세를 이어갈 전망이지만 회복 속도는 점차 둔화될 전망입니다. 설비투자는 향후 글로벌 수요둔화와 자본조달비용 상승으로 위축될 것으로 예상되며, 건설투자는 주택수요 둔화와 정부SOC예산 감소로 부진한 흐름을 이어갈 전망입니다. 상품수출은 중국과 IT품목을 중심으로 글로벌 수입수요가 약화되면서 부진할 것으로 예측하였습니다.
③ 미국 연방준비제도(Fed)의 기준금리 인상에 따른 경제 성장 둔화 위험
세계 각국은 코로나-19의 초기 확산 당시, 감염병의 유행에 따른 경기 침체를 막기 위해 초저금리 정책을 약 2년간 지속하였습니다. 이 외에도 각국 정부는 경제 활성화를 위해 추가 예산의 투입, 각국 은행의 자산매입 확대, 인프라 투자의 추진 등의 확대 통화 및 재정 정책을 펼쳤습니다. 하지만 과도한 통화 정책과 재정 정책의 영향으로 시장에 유동성이 과잉 공급되고 글로벌 공급망에 병목현상이 발생함에 따라 인플레이션 상승 압력은 점차 커지게 되었습니다.
과도한 인플레이션 상승 압력에 대응하기 위해 주요국은 기준금리를 인상하고 기존의 확장 경제 정책을 중단하였습니다. 하지만 물가 상승률은 쉽게 정상화되지 않았으며 미국 연방준비제도(Fed)는 2022년 5월 미국연방공개시장위원회(FOMC) 정례회의에서 기준금리를 50bp 인상한 데 이어 6월 정례회의에서는 기준금리를 75bp 인상하였고, 7월, 9월, 11월 정례회의에서도 기준금리를 75bp 추가 인상하며 4차례 연속 자이언트 스텝을 단행하였습니다. 또한, 12월 정례회의에서 50bp 인상, 2023년 2월 정례회의에서 25bp 인상을 결정하였습니다. 2023년 3월 FOMC는 물가안정과 SVB 등 은행 파산에 대응하는 금융안정 사이에서 또 다시 베이비스텝을 유지하며 25bp 추가 인상을 결정하였습니다.
이에 따라 증권신고서 제출 전일 기준 미국의 기준금리는 4.75~5.00%이며, 높은 기준금리 인상에도 불구하고 여전히 최종 금리 수준은 확인되지 않고 있으며, 급격한 금리 인상에 따라 미국의 주요 투자은행은 경기 침체 및 긴축 장기화를 우려하고 있습니다. 2023년 4월 미국의 CPI 지수는 전년대비 5.0% 상승한 것으로 발표되는 등 세계는 높은 수준의 인플레이션을 겪고 있습니다. 이처럼 현재 세계의 정세는 불안정한 상황이며, 인플레이션이 정상 수준으로 하락하지 않으면 긴축이 장기화되고 경기 침체로 인해 세계의 수요가 감소하게 될 것으로 전망하고 있습니다.
④ 코로나-19 재확산에 따른 경제 활동 둔화 위험
신종 코로나 바이러스 감염증(코로나-19)은 중국 우한시에서 2019년 12월 1일 처음 발생한 후 현재까지 확산 중인 급성 호흡기 질환입니다. 해당 질환은 매우 빠른 확산세를 보이며 전 세계적으로 확진자가 증가하였고, 2020년 3월 11일 세계보건기구(WHO)는 감염병 경보를 기존 5단계에서 최고 위험 단계인 6단계로 상향 조정하며 '세계적 대유행(Pandemic)'으로 선포하였습니다.
세계 각국은 백신 개발과 사회 정책을 통해 코로나-19의 확산 방지에 총력을 다했습니다. 2021년 주요국의 백신 접종을 시작으로, 세계 각국은 목표 백신 접종률을 달성하기 위해 노력했으나 2020년 10월 인도에서 기존 바이러스 대비 전파 속도가 빠르고 후유증이 심각한 델타 변이 바이러스가 등장함에 따라 코로나-19 사태는 장기화되었습니다. 이후 세계 각국의 노력에도 불구하고 코로나-19는 여전히 종식되지 않은 상태이며 델타 변이 바이러스에 이은 오미크론 변이 바이러스로 인한 확진자 수 급증으로 국내의 경우 방역조치가 재차 강화되었던 바 있습니다.
2023년 1월 30일 국내에서는 실내 마스크 착용에 대한 법적 의무가 일부 시설 외 실내 마스크 착용 권고로 전환되는 등 방역조치가 완화되었으며, 2023년 3월 20일 대중교통, 대형시설 내 개방형 약국에서의 착용의무도 해제되었습니다. 그러나, 코로나-19의 재확산 및 강력한 변이종의 등장 가능성은 여전히 존재하며, 이로 인해 정책의 향방은 예상하기 매우 어려워 실물 경기가 급속히 위축되는 사태가 되풀이될 위험이 있습니다.
이와 같이 여전히 종식되지 않은 코로나-19, 러시아-우크라이나 전쟁, 미ㆍ중 패권 갈등 고조, 인플레이션으로 인한 고물가 지속, 금리인상, 코로나-19의 재확산 및 새로운 변이 바이러스의 등장 가능성 등 부정적인 영향을 미치는 요소가 존재하고 있는 상황입니다. 주요 경제 기관들은 경기 침체의 가능성에 대해 언급하고 있으며 경기 침체가 현실화 되었을 시에 당사가 속한 산업 및 전방산업에 부정적인 영향을 미칠 수 있습니다. 이러한 대내외적 위험이 원할하게 수습되지 못해 장기화되고 경기 침체가 발생할 시에는 당사의 사업, 재무상태 및 영업실적에도 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
|
나. 기술이전 지연 및 실패에 따른 위험 당사는 2019년 (주)한독과 중등증-중증 아토피 피부염 줄기세포치료제 국내 기술이전 계약 체결로 계약금 1,000백만 원을 수령하였으며, 당시 계약 조건에 따라서 1/2상 임상시험 수행으로 2023년 1분기 59백만 원 수익을 발생시켰습니다. |
일반적으로 바이오업종에서 양질의 기술을 보유했으나 자금력과 경험부족 등으로 높은 임상비용을 감당하기 어려운 회사나, 최종 임상 성공여부의 리스크 부담을 경감하고자 하는 회사에서는 기술이전을 통해 각종 기술료를 받음으로써 회사 재무구조 개선에 활용하고 있습니다. 기술이전은 Upfront fee(초기계약금), Milestone(개발단계별 기술료), Running Royalty(매출의 일정 비중을 로열티로 지급) 등으로 구성되어 있으며, 단계별로 수익이 발생하고 있습니다. 이와 같이 당사는 파트너사를 대상으로 기술이전을 통해 선급 계약금, 단계별 기술료 및 로열티 수수료 형태로 매출을 확보하는 사업모델을 구축하고 있습니다.
당사는 2019년 (주)한독과 중등증-중증 아토피 피부염 줄기세포치료제 국내 기술이전 계약 체결로 계약금 1,000백만 원을 수령하였으며, 당시 계약 조건에 따라서 1/2상 임상시험 수행으로 2023년 1분기 59백만 원 수익을 발생시켰습니다. 줄기세포 사업부문 기술이전 매출 추이는 아래와 같습니다.
| [줄기세포 기술이전 매출 추이] |
| (단위 : 백만원) |
| 사업부문 | 매출유형 |
2023년 1분기 |
2022년 1분기 |
2022년 |
2021년 |
2020년 |
|---|---|---|---|---|---|---|
| 줄기세포 | 기술이전수익 | 59 | 59 | 241 | 241 | 215 |
| 출처) 당사 정기보고서 제시 |
당사는 증권신고서 제출 전일까지 2건의 기술이전 계약을 체결한 바 있으며 그 내역은 아래와 같습니다.
| [기술이전 계약 총괄표] |
| 계약 상대방 | 품목 | 대상 지역 | 계약 체결일 | 계약 조건 (요약) | 개발 단계 |
|---|---|---|---|---|---|
| Duopharma Biotech Berhad |
줄기세포치료제 | 동남아시아 4개국 (말레이시아, 싱가포르, 브루나이, 필리핀) |
2018.10.25 | - 지분 투자 : 55억 원 - Milestone Payment (1) 말레이시아에서 인정하는 국가에서 선택한 파이프라인에 대한 IRB(Institutional Review Board, 기관생명윤리위원회) 승인을 받을 시 50만 달러 (2) 첫번째 임상시험 환자 등록 시 50만 달러 (3) Milestone Payment 지급은 선택 파이프라인별로 적용 - Royalty : 제품 판매이익의 50% |
3개 임상 파이프라인 개발 진행 중 |
| ㈜한독 | 중등증-중증 아토피 피부염 치료제 |
대한민국 | 2019.05.24 | - 지분 투자 : 40억 원 - Upfront Payment : 10억 원 - Milestone Payment : 품목허가 취득 시 10억 원 - Royalty : 제품 순매출액의 10% |
국내 임상 1/2상 완료 |
| 출처) 당사 제시 | |
| 주1) | 계약 세부내용의 경우, 영업기밀에 해당하므로 기재하지 않았습니다. |
| 주2) | 당사는 2019년 5월 주식회사 한독과 중등증-중증 아토피 피부염 치료제 기술이전 계약을 체결하여 반환 의무가 없는 Upfront Payment 10억 원을 수령하였으며, 이는 당사의 1/2상 임상시험 수행의무에 대한 대가로서 1/2상 임상시험의 예상 수행기간에 걸쳐 안분하여 매출로 인식합니다. (임상 1상이 개시된 2020년부터 임상 2상 종료 시까지 안분 인식) |
| 주3) | 2023년 05월에 임상 2상이 종료되었으나 외부감사인과 협의를 통해 2023년 2분기(60백만원), 3분기(61백만원), 4분기(61백만원), 2024년 1분기(60백만원) 총 4개 분기에 걸쳐 총 242백만원이 매출로 인식될 예정입니다. |
당사는 이미 기술이전을 완료한 파이프라인 이외에도 파이프라인을 확보하고 있으며, 향후에도 지속적인 기술이전 계약 체결을 위해 노력하고 있습니다. 파트너사와의 관계는 당사가 사업을 영위하는 데 있어 매우 중요한 요소로, 라이선스 추진을 위해 아래와 같이 매년 다양한 학회 및 컨퍼런스에서 회사 소개(IR) 및 임상 결과 발표 등을 통해 미국ㆍ유럽 바이오 및 제약 회사와의 파트너링에 적극적으로 참여하고 있습니다.
다만, 기술이전 계약 파트너사의 제품 개발에 대한 정책 변경이나 제반여건 변동 등 예상치 못한 상황으로 인해 기술이전 계약이 파기될 경우, 기 수령한 선급 계약금(한독으로부터 수령한 10억 원)에 대한 반환 의무는 없으나 계획된 단계별 기술료 및 로열티 수수료 매출이 감소하여 당사의 영업활동 및 수익성에 부정적인 영향을 미칠 수 있습니다. 또한, 향후 체결하게 될 기술이전 계약 조건에 따라 당사가 수행하는 치료제 임상시험이 실패할 경우 선급 계약금 반환, 단계별 기술료 및 로열티 수수료를 수취하지 못하게 되는 상황이 발생하여 당사의 수익성은 부정적인 영향을 받을 수 있습니다.
더불어 당사는 국내 바이오 벤처기업으로서 여전히 글로벌 제약시장에서 인지도는 낮은 상황입니다. 당사의 주요 사업전략이 국내외 제약사 및 바이오 기업 대상 기술이전임을 감안하였을 때, 낮은 인지도는 당사가 보유한 기술 및 사업 역량에도 불구하고 영업 및 계약 체결에 있어 약점으로 작용할 수 있습니다. 또한 현재 국내외 기업들과 기술이전 계약을 체결한 파이프라인의 임상시험 실패 또는 향후 신규 파이프라인의 기술이전 부진 등이 발생할 경우, 당사의 대외 인지도 제고에 부정적 요인으로 작용할 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
| 다. 임상시험의 지연 및 실패 위험 당사의 중등증-중증 아토피 피부염은 현재 체결된 라이선스 계약에 따라 국내 임상 3상은 (주)한독이 진행하고 Duopharma Biotech Berhad와 동남아시아 4개국에 대해서 기술이전 계약협상을 진행할 예정이며, 만성 이식편대숙주질환은 2024년 하반기에 임상 1/2상 결과 발표 후, 임상 1/2상 결과를 토대로 국내외 기술이전 계약협상을 추진하는 것을 우선적으로 진행할 예정입니다. 중등증-중증 급성 췌장염은 2023년 하반기에 임상 2b상 IND를 신청하고 승인받으면 환자모집을 진행할 예정입니다. 그러나, 당사의 임상계획과 달리, 중등증-중증 아토피 피부염 국내 임상 3상을 계약한 한독은 라이선스 계약을 해지할 수 있으며, 한독이 본 라이선스 계약을 해지할 경우, 당사는 국내 임상 3상을 진행할 파트너를 다시 찾는 등의 이유로 임상 시기가 지연될 수 있습니다. 또한 중등증-중증 아토피 피부염 국내 3상을 계약한 한독이 임상 3상을 진행하더라도 환자모집이 장기화되어 임상 3상 일정이 지연될 위험도 충분히 존재합니다. 임상 지연 및 실패 과정에서 발생한 비용은 회수가 불가능하므로 당사의 수익성 및 재무안정성에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 각 임상파이프라인 별로 다음과 같은 임상계획을 가지고 있습니다.
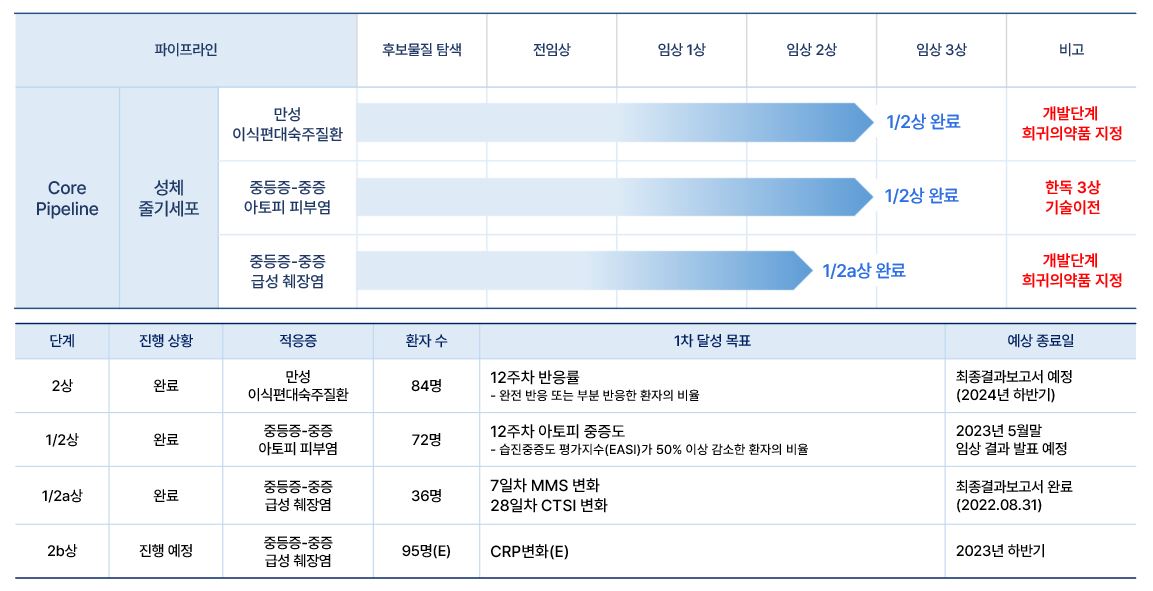 |
|
에스씨엠생명과학(주) 임상파이프라인 현황 및 계획 |
| 출처) 보도자료 및 당사 제시 |
중등증-중증 아토피 피부염은 현재 체결된 라이선스 계약에 따라 국내 임상 3상은 (주)한독이 진행하고 Duopharma Biotech Berhad와 동남아시아 4개국(말레이시아, 싱가포르, 브루나이, 필리핀)에 대해서 기술이전 계약협상을 진행할 예정이며, 임상 1/2상 결과로 토대로, 아토피 피부염에 대해서 글로벌 시장지배력을 확보한 글로벌 제약회사와 기술이전 계약협상을 우선적으로 진행할 예정입니다.
다만, 당사의 중등증-중증 아토피 피부염 치료제와 타사 경쟁 제품을 비교하였을 때, 당사의 중등증-중증 아토피 피부염 임상 2상은 대규모 임상 3상이 아닌 72명을 대상으로 진행한 임상 2상 결과이기 때문에 해당 결과만으로는 약효를 단정짓기는 어려우나, 약효를 확인할 수 있는 지표인 16주차 EASI-75 달성률은 린버크(60.1%~79.7%)와 듀피젠트(44~51%)에 비해 26.5%로 낮은 수치이며, 16주차 EASI-90 달성률도 린버크(42.4%~53.1%)와 듀피젠트(30~36%)에 비해 11.8%로 낮은 수치입니다.
2023년 05월 30일 중등증-중증 아토피 피부염 줄기세포 치료제 임상 1/2상 시험 결과 발표 이후 계약 당사자인 한독과 당사 간 라이선스 계약에 따라 국내 임상 3상의 실행계획을 구체화시킬 예정입니다.
만성 이식편대숙주질환은 2024년 하반기에 계획하고 있는 임상 1/2상 결과 발표 후, 임상 1/2상 결과를 토대로 국내외 기술이전 계약협상을 추진하는 것을 우선적으로 진행할 예정입니다. 현재, 체결된 라이선스 계약에 따라 Duopharma Biotech Berhad와 동남아시아 4개국(말레이시아, 싱가포르, 브루나이, 필리핀)에 대해서 기술이전 계약협상을 진행할 예정입니다. 기술이전 계약 파트너를 찾지 못할 경우, 국내에서 3상은 자체적으로 진행할 예정이지만 해외 임상은 기술이전 계약 파트너를 지속적으로 발굴할 예정입니다. 개발단계희귀의약품으로 지정을 받아 임상 2상 후에 판매가 가능하여 임상 3상 진행 시 많은 도움이 될 것으로 예상됩니다.
중등증-중증 급성 췌장염은 2023년 하반기에 임상 2b상 IND를 신청하고 승인받으면 환자모집을 진행할 예정입니다. 환자 수와 세부 일정 등에 대해서 식약처와 현재 논의 중에 있습니다. 임상 2b가 완료되면, 현재 체결된 라이선스 계약에 따라, Duopharma Biotech Berhad와 동남아시아 4개국(말레이시아, 싱가포르, 브루나이, 필리핀)에 대해서 기술이전 계약협상을 진행할 예정입니다. 기술이전 계약 파트너를 찾지 못할 경우, 국내에서 3상은 자체적으로 진행할 예정이지만 해외 임상은 기술이전 계약 파트너를 지속적으로 발굴할 예정입니다. 개발단계 희귀의약품으로 지정을 받아 임상 2상 후에 판매가 가능하여 임상 3상 진행 시 많은 도움을 줄 것으로 판단됩니다.
그러나, 당사의 임상계획과 달리, 중등증-중증 아토피 피부염 국내 임상 3상을 계약한 한독은 2023년 3분기까지 임상 3상 진행 여부를 결정할 예정입니다. 다만, 한독은 당사와 체결한 기술이전 계약서 중 제17조(계약의 해제 및 해지) 제1항에 따라 계약 당사자 중 일방이 내부 사정으로 인해 본 계약을 이행하지 아니할 의사를 명백히 하거나 이행하지 못하게 될 것이 객관적으로 명백한 경우 기술이전 계약 해제 및 해지가 가능합니다.
한독이 계약을 해지할 경우, 새로운 국내 임상 3상을 진행할 파트너를 찾는 과정에서 임상 시기가 지연될 수 있습니다. 또한, 중등증-중증 아토피 피부염 줄기세포 치료제의 국내 3상을 계약한 한독이 임상 3상을 진행하더라도 환자모집이 장기화되어 임상 3상 일정이 지연될 위험도 충분히 존재합니다.
또한, 중등증-중증 급성 췌장염 줄기세포 치료제의 임상 2b 및 중등증-중증 아토피 피부염 줄기세포 치료제의 임상 3상 IND 승인을 받지 못하거나, 당사가 임상 시험을 진행 중인 줄기세포 치료제 파이프라인이 임상 관련 목표한 임상 피험자 수를 확보하지 못하거나, 임상 결과 유효성 지표 달성에 실패하여 최종적으로 임상이 실패할 위험이 있으며, 이로 인해 당사의 기업 가치가 크게 훼손될 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
임상 지연 및 실패는 아래 표에 기술된 기존 발생한 비용에 대한 회수가 불가능하므로 당사의 수익성 및 재무안정성에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| [파이프라인 임상시험별 지급 금액 추이] |
| (단위: 백만원) |
| 구분 | 임상단계 | 2020년 | 2021년 | 2022년 | 2023년(E) | 2024년 이후(E) | 합계 |
|---|---|---|---|---|---|---|---|
| 중등증-중증 아토피 피부염 | 1/2상 완료 | 766 | 976 | 837 | 311 | 1,080 | 3,970 |
| 만성 이식편대숙주질환 | 1/2상 완료 | 333 | 240 | 319 | 17 | 9,847 | 10,757 |
| 중등증-중증 급성 췌장염 | 1/2a상 완료 | 994 | 697 | 478 | 366 | 7,980 | 10,514 |
| 합계 | - | 2,093 | 1,913 | 1,634 | 693 | 18,907 | 25,241 |
| 출처) 당사 제시 |
| 주1) 위 표에 기재된 임상파이프라인 별 합계액은 2020년 상장 이후부터 지급이 확정 및 예상 금액을 기재하였습니다. |
|
라. 연구개발의 지연 및 실패 위험 당사가 주요사업으로 영위하는 바이오신약개발 산업의 특성상 현재 연구개발하고 있는 신약이 상업화되기까지 막대한 비용과 시간이 필요합니다. 특히, 임상시험에 진입 시 최소 8-9년이 소요되며 그에 필요한 비용이 요구됩니다. 또한, 임상시험을 진행한다고 하더라도 시험결과 효능이 부족하거나 안전성 평가에 적합하지 못한 결과가 나올 경우 해당 신약의 연구개발은 중단될 수 있으며, 이러할 경우 당사의 비용 및 시간 투자에도 불구하고 엄청난 손실을 야기할 수밖에 없습니다. |
당사가 주요사업으로 영위하는 바이오신약개발 산업의 특성상 현재 연구개발하고 있는 신약이 상업화되기까지 막대한 비용과 시간이 필요합니다. 특히, 임상시험에 진입 시 최소 8-9년이 소요되며 그에 필요한 비용이 요구됩니다. 또한, 임상시험을 진행한다고 하더라도 시험결과 효능이 부족하거나 안전성 평가에 적합하지 못한 결과가 나올 경우 해당 신약의 연구개발은 중단될 수 있으며, 이러할 경우 당사의 비용 및 시간 투자에도 불구하고 엄청난 손실을 야기할 수밖에 없습니다.
당사는 줄기세포 분리 및 배양 방법을 사용하여 줄기세포치료제를 개발하고 있습니다. 세포를 분리하는 플랫폼 기술인 층분리배양법을 개발하여 글로벌 특허를 확보하였으며, 최근에는 개선된 층분리배양법을 개발하여 2037년까지 특허권을 확보하였습니다. 당사는 세포치료제 사업의 글로벌 시장 확보를 위하여 가장 중요한 대량생산 최적화 작업들을 지속적으로 전개하여 고밀도 세포배양을 이용하는 1세대 대량생산 제조공정에 이어 저밀도 세포배양과 항산화제를 이용한 2세대 대량생산 제조공정을 확립하였으며, 현재 상업화를 고려하여 3D 바이오리액터를 활용한 3세대 대량생산 제조공정 작업을 수행하고 있습니다. 또한, 당사는 질환 특이적 줄기세포치료제를 개발하기 위해 3단계의 질환 특이적 줄기세포 선별 과정을 수립하여 연구개발을 하고 있습니다.
당사가 보유하고 있는 파이프라인별 연구개발 진행 단계는 아래와 같습니다.
| [연구개발 진행 단계] | |
| (기준일: 2023년 1분기 보고서 기준) | |
| 구분 | 품목 | 적응증 | 연구시작일 | 현재 진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 계획 승인일 | 시험 대상자 수 | |||||
| 줄기세포치료제 | SCM-CGH | 만성 이식편대숙주질환 | 2008년 | 임상 2상 (한국) |
2016년 | 84명 | - |
| SCM-AGH | 중등증-중증 급성 췌장염 | 2010년 | 임상 2a상 (한국) |
2018년 | 2a상 : 36명 | - | |
| SCM-AGH | 중등증-중증 아토피 피부염 | 2013년 | 임상 2상 (한국) |
2020년 | 2상 : 72명 | - | |
| 출처) 당사 정기보고서 제시 |
① 만성 이식편대숙주질환 줄기세포치료제 (SCM-CGH)
|
구분 |
줄기세포치료제(바이오 신약) |
|
적응증 |
만성 이식편대숙주질환 |
|
작용기전 |
면역활성 환경에서 고순도 중간엽줄기세포는 T-세포의 증식 억제와 면역세포 표면에 존재하는 아세틸콜린 수용체를 통하여 면역세포의 활성과 증식을 억제 |
|
제품의 특성 |
신선형 제형의 줄기세포치료제는 층분리배양법으로 분리 및 배양된 줄기세포로 마스터 세포은행과 제조용 세포은행을 구축한 다음, 환자의 투여 일정이 확정되면 제조용 세포은행의 줄기세포를 해동하여 10~12일 간의 배양 과정을 통해 완제품을 제조하여 주사기에 충전된 형태로 공급하는 제형임 |
|
진행경과 |
[세포 확보 및 공정 확립] - 제조공정과 표준작업지침서 완성 (2006) - 치료목적사용 임상시험 2건 실시 (2007.01~2008.12) - 논문 게재 (SCI 1편, 2010) - 세포치료제 제조소 구축 (2009) [비임상시험] - 동물모델 유효성 시험 (2008~2010) → 논문 게재 (SCI 1편, 2010) - 비임상 독성시험 수행 (2008~2010) [임상시험] - 한국 1상 임상시험 실시 (2010~2011) - 한국 2상 임상시험 계획 승인 (2016.04) 및 임상시험 실시 (2018~ 진행 중) - 식약처 개발단계 희귀의약품 지정 (2019.04) - SCM-CGH에 대한 식약처 이식편대숙주질환 줄기세포치료제 치료 목적 사용 허가 (2022.09) - 2상 임상시험대상자 등록 및 투약 완료 (2023.03) |
|
향후계획 |
[국내] 2025년 조건부 품목허가 후 2025년 제품 판매 예정 [글로벌] 국내 임상시험 종료 후 글로벌 임상 추진 예정 |
|
경쟁제품 |
▲ 현재까지는 국내에서 만성 이식편대숙주질환을 근본적으로 치료할 수 있는 치료제는 출시되지 않았으며, 표준 치료법으로 corticosteroid, calcineurininhibitors(cyclosporine, tacrolimus), thalidomide, 체이 광화학요법(extracorporeal photochemotherapy, ECT) 또는 mycophenolatemofetil(MMF), methotrexate 같은 면역억제제가 있음. ▲ Janssen의 BTK 저해제인 임브루비카(Imbruvica)가 2017년 만성 이식편대숙주질환에 대한 적응증 추가로 미국 FDA 허가를 받음. 한국 등 글로벌 시장에서는 3상 임상시험을 진행중이며, 일부 환자에서 증상의 개선이 확인되었고, 개선된 증상이 5개월 이상 지속됨. 그러나 동반된 부작용으로는 피로, 타박상, 설사, 혈소판 감소, 근육 경련, 메스꺼움, 폐렴 등이 발생함. ▲ Novartis의 JAK 신호체계를 선택적으로 억제하는 경구용 소분자 표적 치료제인 자카비(Jakavi)가 한국 등 글로벌 만성 이식편대숙주질환 환자를 대상으로 3상 임상시험을 완료하고 2021년 09월 22일 만성 이식편대숙주질환에 대한 적응증 추가로 미국 FDA 허가를 받았음. 자카비와 기존 치료(BAT, Best available therapy)를 비교한 3상 임상시허에서 연구 1차 평가변수인 24주차 전체 반응률(ORR)은 자카비 치료군이 49.7%, BAT군이 25.6%로 나타남. 그러나 자카비 투여 후 가장 일반적인 혈액학적 이상 반응은 감염, 바이러스 감염이 있음. |
|
관련논문 |
Yi TG et al. (IJSC 2019 Vol. 12(2) 315) |
|
시장 규모 |
2018년 기준 4,600억원 규모에서 연 평균 6.22% 성장하여, 2023년에는 6,260억원 규모에 이를 것으로 전망 (출처 : GlobalData, GVHD Epidemiology and Market Size Database (2019)) |
|
기타사항 |
- |
② 중등증-중증 급성 췌장염 줄기세포치료제 (SCM-AGH)
|
구분 |
줄기세포치료제(바이오 신약) |
|
적응증 |
중등증-중증 급성 췌장염 |
|
작용기전 |
고순도 중간엽줄기세포는 면역관문 조절 물질 ICOSL-ICOS와 상호작용을 통해 조절 T-세포의 활성과 항염증성 사이토카인 IL-10의 생성을 유도하고, 이는 조직 괴사가 동반되는 염증성 환경에서 면역반응을 직접적으로 억제 |
|
제품의 특성 |
▲ 제형 : 동결형 제형의 줄기세포치료제는 제조공정이 완료된 최종 완제품에서의 무균성을 확인한 후 질소 탱크에 저장하여 보관하고 있다가 급성 환자들처럼 빠른 시간 안에 투여가 필요할 경우 완제품을 바로 해동하여 투여할 수 있는 형태의 제형임. ▲ 중증등-중증 급성 췌장염에 대한 줄기세포치료제 SCM-AGH는 2022년 08월 31일 제 1/2a상 임상시험에 대한 결과 보고를 완료하였음. ▲ 2020년 10월 개발단계 희귀의약품 지정을 받았으며, 이를 통해 2b상 임상시험 이후 조건부 품목허가를 받아 빠르게 시장에 진출할 것으로 예상되어 급성 췌장염 치료에 대한 미충족 의료 수요 해소 및 시장을 선도할 수 있을 것으로 판단함. |
|
진행경과 |
[비임상시험] - 동물모델 유효성 시험 (2010~2011) → 논문 게재 (SCI 1편, 2011) - 비임상 독성시험 수행 (2014~2016) [임상시험] - 한국 1/2a상 임상시험 계획 승인 (2018) - 한국 1/2a상 임상시험 모집 완료 (2019~2021) - 한국 1/2a상 임상시험 및 결과발표 완료 (2022) - KDDW2022 임상결과 발표, 최우수 초록 수상(2022) |
|
향후계획 |
[국내] 2026년 조건부 품목허가 후 제품 판매 예정 |
|
경쟁제품 |
▲ 현재 시장에서 출시되어 췌장염 치료에 사용되고 있는 약물인 Futhan과 Miraclid는 단백질 분해효소를 타겟으로 염증 반응을 억제하는 기전을 나타내는 치료제임. 다만, 상기 두 치료제들은 급성 췌장염을 적응증으로 하는 치료제가 아닌 증상 개선을 위한 대중요법으로 허가 받음. ▲ 가장 유력한 경쟁약물은 융합 단백질인 TAK-671(SB-26 또는 울리나시타틴Fc)으로 Takeda Pharmaceutical 및 상성바이오에피스가 협력 개발 중인 약물로서 미국에서 1상 임상시험을 완료하였음. ▲ 다른 경쟁 약물로는 CRAC 채널 억제제인 Auxora(CM4620)으로 CalciMedica, Inc.에서 개발 중인 약물로서 미국에서 SIRS(전신염증반응증후군)을 동반한 급성 췌장염 환자 대상으로 2상 임상시험을 진행 중이나, 당사의 임상시험의 대상자(중등증 이상의 급성 췌장염) 모집 기준의 차이점이 있음. |
|
관련논문 |
Jung et al. (Gastroenterology. 2011, 140(3):998) |
|
시장 규모 |
글로벌 시장 규모는 2025년 73억 7,201만 달러(USD)로 추정하고 있으며, 당사가 목표로 하는 급성 췌장염 환자 비율은 전체 췌장염 환자 중 약 20%의 시장 규모로 약 2조원에 육박함. (출처 : Market Research Future, Global Acute Pancreatitis Market research Report (2019)) |
|
기타사항 |
- |
③ 중등증-중증 아토피 피부염 줄기세포치료제 (SCM-AGH)
|
구분 |
줄기세포치료제(바이오 신약) |
|
적응증 |
중등증-중증 아토피 피부염 |
|
작용기전 |
IL-4 및 IL-17 신호전달체계 역제와 IgE 생성 저해를 통핸 면역 시스템조절 |
|
제품의 특성 |
▲ 제형 : 동결형 제형의 줄기세포치료제는 제조공정이 완료된 최종 완제품에서의 무균성을 확인한 후 질소 탱크에 저장하여 보관하고 있다가 급성 환자들처럼 빠른 시간 안에 투여가 필요할 경우 완제품을 바로 해동하여 투여할 수 있는 형태의 제형임. ▲ Ovalbumin/Alum-유도 아토피 피부염 동물모델에서 동결형 줄기세포치료제 SCM-AGH를 정맥 투여하여 피부 병변의 임상적 증상을 개선하고 혈중 IgE를 낮추는 치료 효능을 확임함. |
|
진행경과 |
[비임상시험] - 동물모델 유효성 시험 (2013~2014) → 논문 게재 (SCI 1편, 2014) [임상시험] - 치료목적사용 임상시험 5명 (2017.06~진행 중) - 한국 1/2상 임상시험 IND 신청 (2019.11) - 한국 1/2상 임상시험 계획 승인 (2020.02) - 한국 1/2상 임상시험 결과보고 완료 |
|
향후계획 |
[국내] 2025년 3상 임상시험 완료 후 2026년 제품 판매 예정 [글로벌] 2025년 Accelerated Approval [가속허가] 제도를 통한 조건부 허가 및 2026년 제품 출시 예정 |
|
경쟁제품 |
지난 10여년 동안 시장을 독점하고 있는 치료제들로 FDA 승인을 받은 엘리델과 프로토픽이 존재하였으며, 첫 바이오의약품으로 인터루킨-4/인터루킨-13 수용체 억제제(anti IL-4/IL-13 receptor)인 듀피젠트가 2017년 3월 미국 FDA로부터 중등증-중증 단계의 성인 아토피 피부염 환자에 대한 사용 승인을 받고, 2019년 3월 소아 아토피 피부염에 대하여 추가 승인을 받음. 2022년에는 경구약이며 JAK1 inhibitor인 린버크와 시빈코가 각각 MFDS에 승인되어 추후 간접적인 경쟁 상품이 될 수 있음. |
|
관련논문 |
Na et al. (Cell Death & Disease. 2014, e1345) |
|
시장 규모 |
글로벌 시장 규모는 2019년 6.1조원 규모에서 2024년 8.5조원 수준으로 증가할 것으로 전망되며, 이 중 중등증-중증 비율은 약 40%로 약 3.4조원 시장이 될 것으로 예상됨. (출처 : 보건산업진흥원, 보건의료 기술가치평가 보고서(2018, GlobalData 자료 재가공)) |
|
기타사항 |
- |
다만, 당사가 예상치 못한 이유로 인해 연구개발 일정이 지연된다면 제품화까지 당사 예상 대비 장기간이 소요될 수 있으며, 연구개발을 진행하는 동안에도 성과가 나오지 않을 경우 연구를 중단하게 되고 사용된 연구개발비용은 따로 회수할 수 없어 당사의 수익성 및 성장성에 악영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 마. 코스메슈티컬 및 더마코스메틱 산업의 불확실성에 대한 위험 당사는 코스메슈티컬 산업과 더마코스메틱 산업 모두 관련되어 있습니다. 현재 CXCL1을 활용한 코스메슈티컬 브랜드 '이로로 디어스칼프'를 출시하여 판매하고 있습니다. 또한 이번 중등증-중증 아토피 피부염 임상 1/2 상 결과 발표로 당사의 줄기세포치료제에 대한 관심이 커지고 있으며, 당사는 이에 스킨케어 제품을 출시하여 더마코스메틱 산업에도 진입하게 되었습니다. 그러나, 당사의 계획과 달리, 코스메슈티컬 및 더마코스메틱 산업의 경쟁이 심화되어 당사가 개발하려고 하는 독자적인 성분 개발이 실패하거나, 시장에서 경쟁력을 확보할 수 없는 위험이 있습니다. 아무리 독자적인 성분을 개발했더라도 고객의 니즈에 부합되지 않으면 매출이 저조할 위험도 충분히 있습니다. 해외 매출이 발생하더라도 고객의 요구사항에 적극적으로 대응할 수 없다면 매출규모가 급격하게 하락할 위험이 존재합니다. 따라서 당사의 수익성 및 재무안정성에 부정적인 영향을 미칠 수 있음을 투자자께서는 유의하시기 바랍니다. |
당사는 단일 세포유래 중간엽줄기세포주를 이용하여 줄기세포가 분비하는 단백질 중발모효능을 나타내는 유효 단백질 물질 2가지 단백질(CXCL1, TYMP)을 발굴하였습니다. 해당 단백질들은 CXCL1(Chemokine (C-X-C motif) ligand 1, 7.9 kDa) 케모카인, TYMP(thymidine phosphorylase, endothelial cell growth factor 1(platelet-derived), hPD-ECGF1, 55kDa)이며 두가지 단백질 중 CXCL1이 분자량이 더 작고, 유효성이 높아 관련 제품 개발에 더 유리하다고 판단되어 핵심 성분으로 설정하였습니다.
![이미지: [발모효능 단백질의 발굴]](27p_%EB%B0%9C%EB%AA%A8%ED%9A%A8%EB%8A%A5%20%EB%8B%A8%EB%B0%B1%EC%A7%88%EC%9D%98%20%EB%B0%9C%EA%B5%B4.jpg) |
|
[발모효능 단백질의 발굴] |
GCM-MSC와 비교하여 cMSC에서 많은 양으로 생산되는 단백질 중 CXCL1, TYMP는 발모에 효능이 있는 유효 물질임을 확인하였습니다. 이를 화장품에 활용하기 위해 CXCL1을 ICID(국제 화장품 원료 사전집)에 등재하였고, 현재 CXCL1을 활용한 코스메슈티컬 브랜드 '이로로 디어스칼프'를 개발하여 판매하고 있습니다.
| [이로로 디어스칼프 제품 라인업] |
|
|
|
|
① 샴푸 (남성용/여성용)
| 구 분 | 내 용 | ||||||
|---|---|---|---|---|---|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 샴푸 - 용량 : 300mL - Type : Wash-off - 탈모완화 기능성 화장품 |
||||||
| 제품 특징 |
- 無실리콘, 無파라벤, 無합성색소
|
② 트리트먼트
| 구 분 | 내 용 |
|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 트리트먼트 - 용량 : 200mL - Type : Wash-off - 탈모완화 기능성 화장품 |
| 제품 특징 |
- 無실리콘, 無파라벤, 無합성색소, 약산성 - 1차 자극 테스트 완료 - 주성분 : 징크피리치온, 살리실산, 덱스판테놀 - 16가지 자연 성분 함유 |
③ 세럼
| 구 분 | 내 용 |
|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 세럼 - 용량 : 100mL - Type : Leave-on - 탈모완화 기능성 화장품 |
| 제품 특징 |
- 無실리콘, 無파라벤, 無합성색소, 약산성 - 1차 자극 테스트 완료 - 주성분 : L-멘톨, 살리실산, 덱스판테놀 - 13가지 자연 성분 함유 |
④ 토닉
| 구 분 | 내 용 |
|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 토닉 - 용량 : 120mL - Type : Leave-on - 탈모완화 기능성 화장품 |
| 제품 특징 |
- 1차 자극 테스트 완료 - 주성분 : L-멘톨, 살리실산, 덱스판테놀 - 9가지 자연 성분 함유 |
당사는 인하대병원과 줄기세포가 분비하는 단백질 중 발모 효능을 보이고 있는 CXCL1의 추가 효능 연구와 줄기세포 배양액 연구를 추진하고 있습니다. 이를 통해 기존 탈모 화장품 제품군을 리뉴얼하고 2023년 05월 중등증-중증 아토피 피부염 임상 2상 결과에 맞추어 스킨케어 제품군을 신규로 출시할 예정입니다. 또한, 할랄 인증서를 확보하여 'DuoPharma Biotech Berhad'와의 해외 수출 계약을 맺어 말레이시아를 비롯한 계약된 다양한 국가에 유통 예정입니다. 2023년 05월에 발주된 1,2차 선적물량에 대한 매출채권 145,500달러는 2분기에 매출로 인식될 예정입니다. 다만, 4분기에 예정된 3차 발주 및 추가 발주의 지연 및 중단 시 매출 성장에 부정적인 영향을 미칠 수 있으니 이 점 유의하시기 바랍니다.
최근 3개년 코스메슈티컬 제품 부문은 꾸준히 매출이 발생하고 있으며 전체 매출 30% 이상의 비중을 차지하고 있습니다. 또한, 비대면 채널을 통한 매출이 증가함에 따라 관리해야 할 재고자산도 증가할 것으로 예상됩니다. 다만, 이를 적절하게 관리하지 못할 시 평가손실 발생 등 당사 손익 및 영업활동에 부정적인 영향을 줄 수 있습니다. 코스메슈티컬 사업부문 매출 추이는 아래와 같습니다.
| [코스메슈티컬 사업부문 매출 및 재고자산 추이] |
| (단위 : 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 1분기 |
|---|---|---|---|---|
|
매출액 |
105 | 198 | 150 | 38 |
| 매출원가 | 43 | 91 | 220 | 26 |
| 매출총이익 | 62 | 107 | -70 | 12 |
| 매출총이익률 | 59% | 54% | -47% | 32% |
| 코스메슈티컬 부문 재고자산 | 33 | 82 | 52 | 36 |
| 출처) 당사 정기 보고서 및 제시 |
이번 중등증-중증 아토피 피부염 임상 1/2 상 결과 발표로 당사의 줄기세포치료제에 대한 관심이 커지고 있으며, 당사는 이에 스킨케어 제품을 출시하여 더마코스메틱 산업에도 진입하게 되었습니다.
 |
|
더마코스메틱 시장 트렌드 |
| 출처) 삼정 KPMG 경제연구원 |
3개 임상파이프라인 중 2개에 대해서 당사의 임상결과가 성공하면서 고순도ㆍ고효능 줄기세포에 대한 관심이 점차 증대되고 있습니다. 줄기세포 배양액을 통하여 케미컬 재료가 가질 수 없는 성분을 통하여 과학적인 데이터 기반의 신뢰성을 기초로 더마코스메틱 산업에서 경쟁력을 확보해 나가고 있습니다. 기존 탈모분야에서 이번에는 스킨케어로 영역을 확장하였습니다. 인하대병원 피부과와 줄기세포 배양액에 대한 체계적인 연구를 수행하여 독자적인 성분 개발해 나가갈 예정입니다.
 |
|
독자적인 성분개발로 경쟁력 확보 |
| 출처) 삼정 KPMG 경제연구원 |
당사는 판매 중인 코스메슈티컬 제품(이로로 디어스칼프 4종)은 직접 또는 대리점을 주된 판매 경로로 하고 있었으나, 디지털 마케팅 전략을 수립하여 비대면 채널을 통한 효율적이면서 효과적인 판매 전략을 추진하고 있습니다. 또한 Duopharma Biotech Berhad을 통한 해외 판매 전략으로 할랄인증 확보 등 미국, 유럽 수출을 위한 인증확보를 위해서 업무를 진행하고 있습니다.
 |
|
해외판매채널 확보 |
| 출처) 삼정 KPMG 경제연구원 |
그러나, 당사의 계획과 달리, 코스메슈티컬 및 더마코스메틱 산업의 경쟁이 심화되어 당사가 개발하려고 하는 독자적인 성분 개발이 실패하거나, 시장에서 경쟁력을 확보할 수 없는 위험이 있습니다. 독자적인 성분을 개발했더라도 고객의 니즈에 부합되지 않으면 매출이 저조할 위험이 충분하며, 해외 매출이 발생하더라도 고객의 요구사항에 적극적으로 대응할 수 없다면 매출규모가 급격하게 하락할 위험이 존재합니다. 따라서 당사의 수익성 및 재무안정성에 부정적인 영향을 미칠 수 있음을 투자자께서는 유의하시기 바랍니다.
|
사. 기술 이전 파트너사의 임상 및 약물 상업화 실패에 따른 수익 감소의 위험 당사의 현재 매출 또한 2019년 05월 (주)한독과 체결한 중등증-중증 아토피 피부염 줄기세포치료제(SCM-AGH)의 기술이전 계약을 통해 발생하고 있으며, 당사는 보유한 파이프라인의 추가적인 라이선스 아웃을 위한 국내외 제약회사를 대상으로 학회, 전시회 및 비즈니스 파트너링 행사 등 기술 교류의 장을 통한 지속적 신약 임상 정보 제공 및 교류활동을 하고 있습니다. 기술이전을 받은 기업이 추가개발에 실패하거나 상업화가 원활히 진행 되지 않는 경우, 반환의무가 있는 계약금이나 마일스톤 등은 기술이전을 완료했더라도 지급의무가 발생할 수 있으며, 총 금액은 임상시험 결과에 따라 중도에 해지되거나 금액이 감소 될 수 있습니다. |
대규모 비용과 높은 임상 실패율, 장시간 소요되는 신약개발 사업의 특성상 많은 바이오 벤처 기업들은 보유한 파이프라인의 기술이전을 사업모델로 하고 있습니다.
당사의 현재 매출 또한 2019년 05월 (주)한독과 체결한 중등증-중증 아토피 피부염 줄기세포치료제(SCM-AGH)의 기술이전 계약을 통해 발생하고 있으며, 당사는 보유한 파이프라인의 추가적인 라이선스 아웃을 위한 국내외 제약회사를 대상으로 학회, 전시회 및 비즈니스 파트너링 행사 등 기술 교류의 장을 통한 지속적 신약 임상 정보 제공 및 교류활동을 하고 있습니다.
당사는 보유 약물에 대한 기술이전 시 아래와 같은 과정을 거치게 됩니다. 당사 신약개발 물질에 대한 데이터 및 경쟁 제품 대비 경쟁력을 분석, 상업화 전략을 수립하며, Non-Confidential, Confidential 자료를 제작하여 잠재고객의 관심도에 따라 지속적으로 업데이트를 합니다. 잠재 고객군 확보 후 당사의 물질에 대한 관심이 높으면, Confidential 자료를 제공하게 되는데, 이에 앞서 양사간 비밀유지협약을 체결하게 됩니다. 이 단계에서는 Confidential 자료 제공과 함께 자료검증에 관한 실사도 진행됩니다. 기술에 대한 실사가 완료되어 기술이전이 더 진전될 경우, 양사는 기술이전에 대한 주요 계약사항을 협의하게 됩니다. 이후 세부 계약사항을 조율하고 확정하여 계약체결을 완료하게 됩니다.
| [기술이전 프로세스] |
|
| 출처) 당사 제시 |
일반적으로 기술이전이 이루어지게 되면, 추가 임상시험 및 판매 허가 획득은 라이선스 인을 한 파트너사에서 진행하지만 계약에 따라 당사에서 추가개발을 진행할 수도 있습니다. 라이선스 인한 파트너사에서 임상시험 결과 및 판매 허가 획득 여부에 따라 마일스톤 및 로열티를 지급하게 되는데 이러한 수익구조는 다음과 같이 정리할 수 있습니다.
| [라이선스 계약 수익구조] |
| 구분 | 내용 | |
|---|---|---|
| 총계약금액 | 계약금 | 계약 체결 직후 또는 일정기간 내에 받게 되는 금액 |
| 마일스톤 | 전임상, 임상, 허가신청, 허가완료 등 개발 단계별로 성공시 받게 되는 금액 | |
| 로열티 | 기술 이전으로 생산된 제품의 매출에 따라 받게 되는 금액 (통상 매출액 대비 비율로 책정) |
|
| 출처) 당사 제시 |
계약금은 계약 직후 수령하게 되는데, 계약조건에 따라 반환의무가 있을 수 있습니다. 마일스톤의 경우 추가개발 진행상황에 따라 수취하게 되는 금액이며, 로열티는 최종 허가 이후 해당 제품이 매출을 발생시킬 경우 받게 되는 수수료입니다.
기술이전을 받은 기업이 추가개발에 실패하거나 상업화가 원활히 진행 되지 않는 경우, 반환의무가 있는 계약금이나 마일스톤 등은 기술이전을 완료했더라도 지급의무가 발생할 수 있습니다. 또한 총 금액은 임상시험 결과에 따라 중도에 해지되거나 금액이 감소 될 수 있습니다.
당사는 증권신고서 제출 전일 현재 2건의 라이선스아웃 계약을 체결하였으며, 그 현황과 상세 내역은 아래와 같습니다.
| [라이선스아웃 계약 총괄표] | |
| (단위 : 백만원) | |
| 구분 | 품목 | 계약 상대방 | 대상 지역 | 계약 체결일 | 계약 종료일 | 총 계약 금액 | 수취 금액 | 진행 단계 |
|---|---|---|---|---|---|---|---|---|
| 1 | 줄기세포치료제 | Duopharma Biotech Berhad |
아세안 4개국 (말레이시아, 싱가포르, 필리핀, 브루나이) |
2018.10.25 | - | 1,200 | - | - |
| 2 | 중등증-중증 아토피 피부염 줄기세포치료제 |
㈜한독 | 한국 | 2019.05.24 | 제품발매일로부터 20년 |
2,000 | 1,000 | 임상 2상 완료 |
| 출처) 당사 정기보고서 및 당사 제시 |
(1) 품목 : 줄기세포치료제
| ① 계약 상대방 | Duopharma Biotech Berhad (말레이시아) |
| ② 계약 내용 | 당사가 개발 완료/개발 중인 줄기세포치료제의 대상 지역에서 독점 개발 및 판매권 |
| ③ 대상 지역 | 아세안 4개국 : 말레이시아, 싱가포르, 필리핀, 브루나이 - 상기 아시아 4개국을 제외한 아세안 국가에 대해서는 The first right of refusal 옵션 부여 |
| ④ 계약 기간 | 적용 특허권 만료 기간까지 |
| ⑤ 총 계약 금액 | 선택 파이프라인별로 약 12억 원(USD 1,000,000), 로열티 별도 - 지분 투자 : 55억 원 |
| ⑥ 수취 금액 | 지분 투자 55억 원 (2018.11.23 납입) |
| ⑦ 계약 조건 | ▲ 지분 투자 : 55억 원 (2018.11.23 납입) ▲ 마일스톤(Milestone) - 1차 마일스톤 : USD 500,000 (말레이시아에서 인정하는 국가에서 선택한 파이프라인에 대한 IRB 승인을 받을 때) - 2차 마일스톤 : USD 500,000 (첫 번째 임상시험 환자 등록 시) ▲ 로열티(Royalty) : 치료제 판매이익의 50% |
| ⑧ 회계 처리 방법 | - |
| ⑨ 대상 기술 | 층분리배양법을 적용한 줄기세포치료제 |
| ⑩ 개발 진행 경과 | 거래 상대방이 아직 치료제 품목을 선택하지 않았으며, 당사는 만성 이식편대숙주질환 2상 임상 임상시험 환자 등록 및 투여를 완료했으며, 2023년 05월 중등증-중증 아토피 피부염 1/2상 임상시험 결과 보고 완료 및 중등증-중증 급성 췌장염 1/2a상 임상시험 결과 보고 완료 |
| ⑪ 기타 사항 | - |
(2) 품목 : 중등증-중증 아토피 피부염 줄기세포치료제
| ① 계약 상대방 | 주식회사 한독 (대한민국) |
| ② 계약 내용 | - 중등중-중증 아토피 피부염 치료를 위한 줄기세포치료제의 국 내 개발 및 판매권 - 임상 3상 및 품목허가는 한독이 담당 |
| ③ 대상 지역 | 대한민국 |
| ④ 계약 기간 | 2019년 5월 24일 ~ 제품 발매일로부터 20년 |
| ⑤ 총 계약 금액 | 20억 원 |
| ⑥ 수취 금액 | 지분 투자 40억 원 (2019.06.05 납입) |
| ⑦ 계약 조건 | ▲ 지분 투자 : 40억 원 (2019.06.05 납입) ▲ 계약금(Upfront) : 10억 원 - 수취조건 : 계약 체결 시 ▲ 마일스톤(Milestone) - 수취조건 : 제품 품목허가 취득 시 ▲ 로열티(Royalty) : 순매출액의 10% - 수취조건 : 매년 1회 정산 ▲ 제품 판매 : 제조원가에 10% 이익 가산 - 수취조건 : 제품 공급 시 |
| ⑧ 회계 처리 방법 | 수령한 계약금은 당사의 임상 1/2상 의무에 대해 지급한 것으로 임상 1/2상 실질적 예상 수행기간에 따라 안분하여 수익인식 |
| ⑨ 대상 기술 | 층분리배양법 기술을 이용하여 개발하고 있는 중등증-중증 아토피 피부염 치료를 위한 줄기세포치료제 |
| ⑩ 개발 진행 경과 | 2020년 2월 식약처로부터 1/2상 임상시험 계획 승인 후 2023년 05월 1/2상 임상시험 결과보고 완료 |
| ⑪ 기타 사항 | - |
이러한 당사의 향후 계획에도 불구하고 당사의 기술이전 파이프라인 및 향후 개발 진행 예정인 파이프라인의 임상 등에서의 예상치 못한 독성이 관찰되거나 효능이 기대에 미치지 못하여 상업화 과정에 어려움이 있을 수 있습니다.
한편, 당사가 보유한 파이프라인과 동일한 적응증을 타겟으로 하는 약품이 현재 시판되고 있거나 임상 시험이 진행되고 있습니다. 파이프라인별 글로벌 제약사들의 현황은 아래와 같습니다.
1)만성 이식편대숙주질환 대상 약품을 보유한 글로벌 제약사는 Novatis, Janssen이 있습니다. Novatis의 자카비는 혈액암 치료 목적 의약품으로 2021년 09월 FDA에 만성 이식편대숙주질환에 대한 적응증 확대를 추가 승인을 받았으며, Janssen의 임부르비카는 골수섬유화증 치료제로 2020년 03월 국내 식약처로부터 만성 이식편대숙주질환 적응증 확대를 추가 승인받았습니다.
2)급성 췌장염 증상 개선용 약품을 보유한 Futhan은 증상 개선용으로 국내 식약처로부터 승인을 받아 시판 중이나, 현재 미국 FDA로부터는 치료 방법에 대해 허가를 받지 못한 상태입니다. JCR Pharmaceutical의 단백질 분해효소 억제제인 Miraclid은 증상 개선용으로 일본, 중국, 인도 등으로 시판 중입니다.
급성 췌장염 전문 치료제의 임상은 Auxora의 CRAC채널 억제제 Auxora(CM4620)가 현재 미국 임상 2상을 진행 중이며, Takeda Pharmaceutical/삼성바이오에피스의 TAK-671이 미국 임상 2상을 준비 중입니다.
3)중등증-중증 아토피 피부염 치료제의 경우 글로벌 제약사 린버크 및 듀피젠트에서 높은 유효성을 보이는 치료제가 시판되고 있기 때문에 당사의 아토피 피부염 줄기세포 치료제가 최종적으로 품목허가를 득한다 하더라도, 시장 점유 확대가 어려울 뿐만 아니라 매출 발생이 예상보다 미미할 수 있습니다.
상기 기재한 글로벌 제약사들은 당사와는 달리 임상 시험 진행 역량이 우수하여 임상 속도가 빠르고 유효성이 더 높은 약품을 보유하여 시장 선점에 우위를 가질 수 있습니다. 이에 따라 회사의 파이프라인이 창출할 수 있는 수익이 예상보다 부진할 수 있고, 상업화에 실패할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
또한, 임상 개발 또는 약물의 상업화에 실패할 경우 수취 예정인 마일스톤 및 로열티가 감소하여 수익성과 재무안정성에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
|
아. 정부 규제 변화에 따른 위험 |
제약바이오 산업은 핵심 미래 성장 산업으로 각국 정부에서 적극적인 육성 정책을 시행하지만 환자 보호 측면에서 인허가 및 약가 결정에 각국 정부는 엄격하게 개입하는 양면적인 특성을 가지고 있습니다.
바이오의약품은 식품의약품안전고시 '생물학적제제 등의 품목허가ㆍ심사 규정'에 따라 생물학적제제, 유전자재조합 의약품, 세포배양 의약품, 세포치료제, 유전자 치료제 등의 제제를 포함하고 있으며, 세포치료제는 해당 규정에 따라 임상 진행 및 품목 허가 등을 진행합니다. 또한, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」(이하 첨단재생바이오법, '19.08월 제정, '20.08월 시행)'의 규제도 적용됩니다. 첨단재생의료법은 첨단재생의료의 안전성 확보 체계 및 기술 혁신ㆍ실용화 방안을 마련하고, 약사법, 생명윤리법 등에 산재한 바이오의약품 관련 규제를 일원화하며, 신속허가제도 도입 및 안전관리체계를 구축하는 것이 핵심입니다. 본 법을 통해 재생의료 임상연구가 가능해져 의료기술의 기술경쟁력을 제고하여 희귀ㆍ난치 질환자에게 새로운 치료 기회를 제공할 수 있을 뿐만 아니라, 품목허가 검증 체계를 첨단바이오의약품 특성에 맞게 재편하여 맞춤형 심사, 우선 심사, 조건부 허가 등의 혜택이 가능할 것으로 기대됩니다.
당사는 세포치료제의 안전성 제고를 위한 원료 및 GMP 관리 시설, 중증ㆍ난치 질환에 대한 치료제 맞춤형 우선 (조건부)심사, 첨단바이오의약품의 임상투여 및 시판 후 장기추적조사 등의 규제를 준수하여 줄기세포치료제 연구를 진행하고 있습니다.
신약 개발사업은 긴 투자기간과 높은 위험을 수반하지만 신약 개발에 성공할 경우 막대한 가치 창출이 가능하며, 국민들에게 양질의 의약품을 공급함으로써 생명연장과 삶의 질 향상이라는 공공적 가치 달성도 가능하기 때문에 우리나라를 비롯한 각국 정부는 국가 경쟁력 강화에 기여할 수 있는 미래 유망 신기술로 제약바이오 연구개발 분야에 대한 투자를 활발히 진행하고 있습니다.
국내 정부는 관계부처 합동으로 2023년 03월에 발표한 '바이오헬스 글로벌 중심국가 도약을 위한 제3차 제약바이오 산업 육성ㆍ지원 종합계획(2023~2027년)'을 통해 글로벌 블록버스터급 신약 창출, 글로벌 수준의 제약바이오 기업 육성, 의약품 수출 2배 달성, 제약바이오 산업 양질 일자리 창출, 임상시험 글로벌 3위 달성을 목표로 설정하였으며, 신약 창출을 위한 R&D 투자 확대, 글로벌 수준의 규제 혁신 및 공급망 인프라 확대 등의 10대 중점 과제를 추진하겠다고 공표하였습니다.
 |
|
바이오헬스 글로벌 중심국가 도약을 위한 제3차 제약바이오 산업 육성 지원 종합계획(2023~2027년) |
| 출처) 보건복지부 |
이처럼 제약바이오 산업에 대한 관심도가 증가함에 따라 정부의 우호적인 시장 정책이 다수 도입되고 있지만, 지원 정책이 이루어지지 않거나 향후 정책 기조의 변화에 따라 정부지원이 축소 또는 규제 강화 등의 대외적 변수가 발생될 수 있습니다. 이에 당사는 정책 및 규제 변화에 신속한 대응을 위한 지속적인 모니터링을 항시적으로 진행하고 있지만, 그럼에도 불구하고 국내외 정책 등의 변동 위험이 존재할 가능성이 존재함으로 당사의 줄기세포치료제 연구 개발 사업 전망에도 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 자. 핵심연구인력유출 위험 당사가 영위하는 사업은 제약바이오 산업은 높은 기술 수준과 빠른 변화로 인해 핵심연구 인력을 확보하는 것이 중요하며, 원활한 임상시험과 줄기세포치료제 생산을 위한 구체적인 노하우를 터득한 전문인력 등 인적 자원에 대한 의존도가 높은 사업입니다. 당사는 연구개발부문 산하에 우수 연구인력을 채용하여 연구개발을 진행하고 있으며, 우수 연구개발인력 확보 및 기존 인력 이탈 최소화를 위해 합리적 보상체계를 마련하고 있습니다. 그럼에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히, 경쟁 심화에 따른 당사 우수 인력 스카우트 등은 핵심기술 노하우 유출 등으로 이어질 수 있으며 이는 당사의 경쟁력을 약화시키며 지속적인 성장에 부정적인 영향을 끼칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 영위하고 있는 제약바이오 산업은 높은 기술 수준과 빠른 변화로 인하여 핵심연구 인력을 확보하는 것이 중요하며, 희귀ㆍ난치성 질환의 줄기세포치료제를 연구개발하는 바이오 벤처기업으로서 원활한 임상시험과 생산을 위한 구체적인 노하우를 터득한 전문인력 등 인적 자원에 대한 의존도가 높습니다.
2023년 1분기 기준, 당사는 박사 5명, 석사 16명 등 총 48명의 연구인력을 보유하고 있으며, 주요 핵심 연구인력이 관련 업계에서 장기간의 경력과 전문지식을 확보하고 있습니다. 당사의 연구개발 조직 구성과 연구 인력 현황은 다음과 같습니다.
| [연구개발 조직 구성] |
① 연구개발부
| 조 직 | 역 할 |
|---|---|
| 연구소장 | 연구개발 관련 업무 총괄 |
| 비임상약리팀 | 줄기세포치료제 효력/약리, 기전, 독성평가 |
| 세포공정팀 | 대량배양 시스템 개발 |
| 효능검증팀 | 질환특이적 치료제 발굴 및 라이브러리 구축, 치료기전 규명, 질환특이적 치료제 특성 규명 |
② 세포치료제 제조소
| 조 직 | 역 할 |
|---|---|
| 제조소장 | 세포치료제 제조 관련 업무 총괄 |
| 제조관리팀 | 세포은행구축, 임상시험용 세포치료제 제조, 위수탁사업, 배양액 생산 |
| 품질관리팀 | 치료제 품질 관리 및 신규 시험법 개발 |
| 품질보증팀 | GMP 문서 시스템 관리, 교정, 적격성 평가, 출하 승인 |
③ 임상개발부
| 조 직 | 역 할 |
|---|---|
| 첨단바이오의약품 본부장 | 임상시험 관련 업무 총괄 |
| 임상시험 관리자1 | 만성 이식편대숙주질환 임상시험 관리 |
| 임상시험 관리자2 | 중등증-중증 급성 췌장염 임상시험 관리 |
| 임상시험 관리자3 | 중등증-중증 아토피 피부염 임상시험 관리 |
| [연구개발 인력 현황] |
| 구 분 | 박사 | 석사 | 학사 | 전문학사 | 합 계 |
|---|---|---|---|---|---|
| 인원수(명) | 5 | 16 | 27 | - | 48 |
| [핵심 연구개발인력 현황] |
| 직 위 (직급) |
성 명 | 주요 경력 | 주요 연구 실적 | 논문/특허 실적 |
재직기간 |
|---|---|---|---|---|---|
| CEO (대표이사) |
손병관 | 인하대병원 소아과 교수(과장) 인하대병원 임상의학연구소장 인하중앙의료원 기획조정실장 인하대병원 진료부원장 환경부지정 환경보건센터장(인하대병원) 및 연합회 회장 인하대학교 의과대학장, 의학전문대학원 원장 대한소아과학회 이사 대한 소아알레르기 호흡기학회 회장 및 이사장 청주의료원 원장 현, 에스씨엠생명과학㈜ 대표이사 |
- Antiallergic effect of anti-Siglec-F through reduction of eosinophilic inflammation in murine allergic rhinitis - 한국 소아의 알레르기비염 역학 - Anti-IL-33 antibody has therapeutic effect in a murine model of allergic rhinitis - Variations of Clonal Marrow Stem Cell Lines Established from Human Bone Marrow in Surface |
논문 160편 | 10개월 |
| CTO (상무) |
전명신 | Heinrich-Heine University Dusseldorf 박사 La Jolla Institute for Immunology 박사후 연구원 서울성모병원 연구교수 현, 인하대학교 의과대학 교수 현, 에스씨엠생명과학㈜ 전무이사 |
- Glucose metabolism에 의한 IL-2 receptor 발현 및 IL-2 signaling 연구 - 다이옥신 receptor (Aryl hydrocarbon receptor-AhR)가 T 세포 신호전달체계에 미치는 영향 연구 - 중간엽줄기세포(Mesenchymal Stem Cell)의 기본 특성 연구 - 중간엽줄기세포의 Immune Modulation Property 기능 연구 (특히, T, B 세포 활성 및 분화에 미치는 분자기전 연구) - AhR 결핍 마우스에서 분리한 MSC의 Immune Modulation 기능 연구 - 아토피피부염, 천식, 다발성경화증, 류마티스 관절염, 뇌졸중, 이식편대숙주질환 등의 질환 동물모델에서의 중간엽줄기세포 치료제 효능 연구 - 각 질환에서의 중간엽줄기세포 치료제의 치료기전 연구 - 뇌졸중 후 전신 면역시스템에서 면역세포 분석 - 뇌세포(neuron cell, astrocytes, glia cells)와 면역세포 공배양을 통해 뇌세포가 면역세포에 미치는 영향 또는 면역세포가 뇌세포에 미치는 영향 등 상호관계 연구 |
논문 35편 특허 1건 |
5개월 |
| 제조소장 (상무) |
함동식 |
가톨릭대 세포생물학 박사 가톨릭대 의과대학 연구교수 현, 에스씨엠생명과학㈜ 제조소장 |
- Human Bone Marow-derived Clonal Mesenchymal Stem Cells Decrease the initial C-Reactive Protein Level in Patients with Moderately Severe to Severe Acute Pancreatitis - Nonclinical and quality assessment of cell therapy products: Report on the 4th Asia Partnership Conference of Regenerative Medicine - Nonclinical assessment of cell therapy products: the perspective from five Asian countries/regions based on regulatory guidelines and the underpinning rationales - A Novel Immunomodulatory Mechanism Dependent on Acetylcholine Secreted by Human Bone Marrow-derived Mesenchymal Stem Cells - Specific PERK inhibitors enhanced glucose-stimulated insulin secretion in a mouse model of type 2 diabetes - Recent progress of national banking project on homozygous HLA-typed induced pluripotent stem cells in South Korea - Autophagy deficiency in beta cells blunts incretin-induced suppression of glucagon release from alpha cells - Long-term Efficacy and Biocompatibility of Encapsulated Islet Transplantation With Chitosan-Coated Alginate Capsules in Mice and Canine Models of Diabetes - Successful xenotransplantation with re-aggregated and encapsulated neonatal pig liver cells for treatment of mice with acute liver failure - Reversal of Hypoglycemia Unawareness with a Single-donor - Transplantation in Korea: A Case Report - The Paradoxical Effects of AMPK on Insulin Gene Expression and Glucose-Induced Insulin Secretion - Antifibrotic effect of rapamycin containing polyethylene glycol-coated alginate microcapsule in islet xenotransplantation. - Metformin alleviates hepatosteatosis by restoring SIRT1-mediated autophagy induction via an AMP-activated protein kinase-independent pathway |
논문 14편 특허 1건 |
6년 10개월 |
| 연구소장 (부장) |
조윤경 |
가톨릭대학교 대학원 신경생물학 석사 인하대병원 임상연구센터 호미오세라피 부설연구소 현, 에스씨엠생명과학㈜ 연구소장 |
- Rapid and effective preparation of clonal bone marrow-derived mesenchymal stem/stromal cell sheets to reduce renal fibrosis - Clinically Relevant Mesenchymal Stem/Stromal Cell Sheet Transplantation Method for Kidney Disease - Interferon-Gamma Primed Human Clonal Mesenchymal Stromal Cell Sheets Exhibit Enhanced Immunosuppressive Function - Long-term efficacy and safety of intravenous injection of clonal mesenchymal stem cells derived from bone marrow in five adults with moderate to severe atopic dermatitis - A Novel Immunomodulatory Mechanism Dependent on Acetylcholine Secreted by Human Bone Marrow-derived Mesenchymal Stem Cell - Comparative study on metabolite level in tissue-specific human mesenchymal stem cells by an ultra-performance liquid chromatography quadrupole time of flight mass spectrometry - Biomimetic chimeric peptide-tethered hydrogels for human mesenchymal stem cell delivery - Manufacture of Clinical-Grade Human Clonal Mesenchymal Stem Cell Products from Single Colony Forming Unit-Derived Colonies Based on the Subfractionation Culturing Method - Pharmacokinetics and in vivo fate of intra-articularly transplanted human bone marrow-derived clonal mesenchymal stem cells - Non-invasive characterization of the adipogenic differentiation of human bone marrow-derived mesenchymal stromal cells by HS-SPME/GC-MS - Isolation of adipose-derived stem cells by using a subfractionation culturing method - Senescing human bone marrow derived clonal mesenchymal stem cells have altered lysophospholipid composition and functionality - Molecular Characterization of Neurally Differenticated Human Bone Marrow-derived Clonal Mesenchymal Stem Cells - Mesenchymal Stem Cell Lines Isolated by Different Isolation Methods Show Variations in the Regulation of Graft-versus-host Disease - Variations of Clonal Marrow Stem Cell Lines Established from Human Bone Marrow in Surface Epitopes, Differentiation Potential, Gene Expression, and Cytokine Secretion - Analysis of neuron-like differentiation of human bone marrow mesenchymal stem cells - Posteromedial compartment cement extrusion after unicompartmental knee arthroplasty treated by arthroscopy: a case report - The Expression of Hypoxia Inducible Factor-1a and Apoptosis in Herniated Discs |
논문 17편 특허 3건 |
8년 11개월 |
| 출처) 당사 분기보고서 및 당사 제시 |
당사는 지식과 경험이 풍부한 인력이 신약 연구개발 사업의 핵심 경쟁력이라는 사실을 인지하고 우수한 인력을 지속적으로 확보하고자 노력하고 있으며, 현재 보유하고 있는 핵심 인력을 유지하기 위하여 능력에 따른 연봉제, 스톡옵션 제도, 회사 비전 공유, 각종 복리후생제도 강화 등 합리적인 보상구조 및 애사심 고취에 힘쓰고 있으며 향후에도 이와 같은 정책을 확대할 계획입니다. 그럼에도 불구하고 불가피하게 연구개발인력의 유출이 발생할 경우 당사의 사업 수행 및 연구개발 활동에 차질이 발생하여 영업활동 및 지속적인 성장에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 차. 지적재산권 관련 위험 당사가 영위하고 있는 제약바이오 사업은 핵심기술에 대한 지적재산권의 확보가 핵심 경쟁력입니다. 따라서 당사는 플랫폼 원천기술 기반의 신약개발 기업으로 기술 노하우 및 지적재산권에 대한 중요성을 인지하고 있음에 따라 지적재산권을 통하여 당사 핵심기술 및 제품에 대한 권리를 보호할 수 있는 방안을 마련하고자 심혈을 기울이고 있습니다. 본 공시서류 제출 전일 현재, 당사가 권리자인 특허에 대한 침해, 무효 주장에 관한 소송은 존재하지 않으나 향후 제 3 자에 의하여 당사가 보유하고 있는 특허에 대한 침해, 무효 소송 또는 기타 분쟁이 발생할 가능성을 배제할 수 없습니다. 또한, 핵심기술과 관련한 지적재산권 관련 분쟁이 발생하는 경우 당사의 영업활동에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
제약바이오 산업은 특허의 츨원 및 등록과 관련된 제도를 통한 지적재산권의 관리가 기업 가치 제고의 핵심사안 중 하나입니다. 특허는 산업상 유용한 발명을 한 자가 자신이 이룬 발명의 내용을 공개하는 대가로 일정한 기간 동안 독점적, 배타적 권리를 부여받는 공적 계약의 일종입니다. 제약산업 분야는 지식재산권 중 특허권의 비중이 타 산업에 비해 높은 편입니다. 특허를 등록 또는 출원한 제품에 대하여는 제반 권리 및 판매에 관한 유효성을 특허로 보호 받기 때문에 특허존속기간 동안 배타적인 권리를 통해 진입장벽을 형성할 수 있습니다. 따라서 당사는 이러한 점을 인지하고 치료제의 연구개발과 더불어 이를 보호하기 위한 특허를 출원 및 등록하고 있습니다.
당사는 증권신고서 제출 전일 기준 국내외 총 92건(등록 47건, 출원 42건, PCT 3건)의 특허 및 20건의 상표권(등록 13건, 출원 7건) 등 지식재산권을 주요 국가 및 전략적 파트너 관할 국가에서 보유하고 있으며, 당사가 보유하고 있는 특허의 출원 및 등록 현황은 아래와 같습니다.
| [지적재산권 출원 ㆍ등록 현황] |
| 구분 | 종류 | 내용 | 소유자 | 출원국 | 출원일 | 등록일 | 적용제품 |
|---|---|---|---|---|---|---|---|
| 1 | 특허 | 층분리배양법을 이용한 골수에서의 중간엽줄기세포 분리방법 | 에스씨엠생명과학 주식회사 | 한국 | 06.08.10 | 08.01.31 | SCM-CGH |
| 2 | 미국 | 06.06.19 | 10.08.24 | ||||
| 3 | 유럽 | 06.06.19 | 14.07.30 | ||||
| 4 | 중국 | 06.06.19 | 13.01.09 | ||||
| 5 | 일본 | 06.06.19 | 12.12.14 | ||||
| 6 | 특허 | 층분리배양법을 이용한 지방-유래 줄기세포의 분리 및 이의 이용 | 에스씨엠생명과학 주식회사 | 한국 | 15.07.29 | 17.08.11 | SCM-AGH |
| 7 | 특허 | 새로운 동결 줄기세포의 제조방법 (Manufacturing process for fresh and frozen stem cells) |
에스씨엠생명과학 주식회사 | 미국 | 11.12.30 | 14.08.05 | SCM-AGH |
| 8 | 특허 | 줄기세포의 층분리 배양 및 증식 방법 (Method for isolation of stem cells from bone marrow using subfractionation culturing method and proliferation thereof) |
에스씨엠생명과학 주식회사 | 한국 | 17.11.06 | 19.05.24 | SCM-AGH |
| 9 | 한국 | 19.05.24 | 20.01.08 | ||||
| 10 | 미국 | 18.07.03 | 22.02.15 | ||||
| 11 | 유럽 | 18.06.22 | - | ||||
| 12 | 일본 | 18.06.21 | 20.10.30 | ||||
| 13 | 중국 | 18.10.10 | 23.04.07 | ||||
| 14 | 호주 | 18.06.19 | 21.01.21 | ||||
| 15 | 러시아 | 18.07.04 | 19.12.12 | ||||
| 16 | 인도네시아 | 18.07.04 | - | ||||
| 17 | 말레이시아 | 18.07.17 | 22.08.18 | ||||
| 18 | 싱가포르 | 18.06.18 | 22.10.06 | ||||
| 19 | 베트남 | 18.07.10 | 22.09.12 | ||||
| 20 | 특허 | 이식편대숙주병의 치료 (Treatment of graft-versus-host disease) |
에스씨엠생명과학 주식회사 | 미국 | 08.05.27 | 16.09.13 | SCM-CGH |
| 21 | 유럽 | 08.05.27 | 17.03.15 | ||||
| 22 | 일본 | 08.05.27 | 15.01.23 | ||||
| 23 | 특허 | 클로날 줄기세포를 포함하는 이식편대숙주질환 치료용 약학적 조성물 | 에스씨엠생명과학 주식회사 | 한국 | 19.12.04 | 21.05.26 | SCM-CGH |
| 24 | 미국 | 21.06.16 | - | ||||
| 25 | 유럽 | 21.06.25 | - | ||||
| 26 | 중국 | 21.06.17 | - | ||||
| 27 | 일본 | 21.06.16 | - | ||||
| 28 | 홍콩 | 22.03.07 | - | ||||
| 29 | 특허 | 중간엽 줄기세포를 이용한 췌장염 치료 방법 (Method for treating pancreatitis with mesenchymal stem cells) |
에스씨엠생명과학 주식회사 | 한국 | 19.12.04 | 21.04.27 | SCM-AGH |
| 30 | 대만 | 19.12.13 | 23.03.21 | ||||
| 31 | 미국 | 21.06.14 | - | ||||
| 32 | 유럽 | 21.06.17 | - | ||||
| 33 | 중국 | 21.06.11 | - | ||||
| 34 | 일본 | 21.06.14 | - | ||||
| 35 | 홍콩 | 22.03.07 | - | ||||
| 36 | 특허 | 클로날 중간엽 줄기세포를 포함하는, 아토피성 피부염 예방 또는 치료용 약학적 조성물(Method for treating atopic dermatitis with clonal mesenchymal stem cells) | 에스씨엠생명과학 주식회사 | 한국 | 14.12.01 | 16.09.02 | SCM-AGH |
| 37 | 미국 | 20.08.13 | 22.08.16 | ||||
| 38 | 대만 | 20.01.14 | - | ||||
| 39 | 한국 | 21.06.11 | - | ||||
| 40 | 유럽 | 21.06.22 | - | ||||
| 41 | 중국 | 21.06.25 | - | ||||
| 42 | 일본 | 21.07.09 | - | ||||
| 43 | 홍콩 | 22.03.07 | - | ||||
| 44 | 특허 | 단일 클로날 줄기세포를 이용한 아토피 피부염 치료용 조성물 및 이를 이용한 방법 | 에스씨엠생명과학 주식회사 | 한국 | 20.03.18 | 21.12.15 | SCM-AGH |
| 45 | 미국 | 21.09.17 | - | ||||
| 46 | 중국 | 21.09.18 | - | ||||
| 47 | 일본 | 21.09.17 | - | ||||
| 48 | 유럽 | 21.10.06 | - | ||||
| 49 | 특허 | 조절 T세포 매개성 질환의 예방 또는 치료용 약학적 조성물(Composition for preventing or treating diseases mediated to regulatory T cell) | 에스씨엠생명과학 주식회사 | 한국 | 17.02.24 | 19.09.19 | SCM-AGH |
| 50 | 미국 | 18.07.11 | 21.08.24 | ||||
| 51 | 유럽 | 18.07.09 | - | ||||
| 52 | 중국 | 18.08.02 | 19.12.10 | ||||
| 53 | 일본 | 18.07.04 | 19.09.06 | ||||
| 54 | 호주 | 18.07.05 | 21.01.21 | ||||
| 55 | 러시아 | 18.07.05 | 20.07.24 | ||||
| 56 | 인도네시아 | 18.07.09 | 21.05.20 | ||||
| 57 | 말레이시아 | 18.07.16 | - | ||||
| 58 | 싱가포르 | 19.12.12 | - | ||||
| 59 | 베트남 | 18.07.24 | - | ||||
| 60 | 특허 | 염증 자극된 중간엽 줄기세포를 포함하는 면역질환 또는 염증 질환의 예방 또는 치료용 약학적 조성물(Pharmaceutical composition for prevention or treatment of immune diseases and inflammatory diseases comprising immunogenic stimulated mesenchymal stem cells) | 에스씨엠생명과학 주식회사 | 한국 | 16.09.07 | 18.01.02 | SCM-CGH |
| 61 | 미국 | 19.03.07 | - | ||||
| 62 | 일본 | 19.03.07 | 23.01.17 | ||||
| 63 | 유럽 | 19.04.04 | - | ||||
| 64 | 특허 | 줄기세포 프라이밍 조성물 및 프라이밍된 줄기세포 | 에스씨엠생명과학 주식회사 | 한국 | 20.12.23 | 23.01.25 | 줄기세포 기능강화 |
| 65 | PCT | 21.12.21 | - | ||||
| 66 | 특허 | hPL 함유 배지에서 배양된 중간엽 줄기세포의 배양액을 포함하는 화장료 조성물 | 에스씨엠생명과학 주식회사 | 한국 | 19.05.02 | 21.11.02 | 줄기세포 배양액 |
| 67 | 유럽 | 21.10.15 | - | ||||
| 68 | 중국 | 21.10.25 | - | ||||
| 69 | 미국 | 21.10.29 | - | ||||
| 70 | 일본 | 21.11.01 | - | ||||
| 71 | 특허 | CXCL1(chemokine (CXC motif) ligand 1) 단백질을 유효성분으로 포함하는 탈모 예방 또는 치료용 약학적 조성물 (Pharmaceutical composition for preventing or treating hair loss comprising CXCL1 protein) | 에스씨엠생명과학 주식회사 | 한국 | 16.08.08 | 16.09.07 | IRORO 모발 제품 (샴푸, 트리트먼트, 세럼) |
| 72 | 러시아 | 18.05.17 | 20.01.16 | ||||
| 73 | 특허 | CXCL1단백질 및 미녹시딜을 유효성분으로 포함하는 탈모 예방 또는 치료용 약학적 조성물(Pharmaceutical composition for preventing or treating hair loss comprising CXCL1 protein) | 에스씨엠생명과학 주식회사 | 한국 | 17.08.08 | 19.07.09 | IRORO 모발 제품 (샴푸, 트리트먼트, 세럼) |
| 74 | 일본 | 17.08.08 | 18.05.25 | ||||
| 75 | 미국 | 18.06.21 | 19.12.24 | ||||
| 76 | 중국 | 17.08.08 | 21.05.28 | ||||
| 77 | 유럽 | 17.08.08 | 19.07.24 | ||||
| 78 | 러시아 | 18.07.04 | 19.12.17 | ||||
| 79 | 특허 | TYMP(thymidine phosphorylase) 단백질을 유효성분으로 포함하는 탈모 예방 또는 치료용 약학적 조성물(Pharmaceutical composition comprising thymidine phosphorylase(TYMP) protein as effective ingredient for prevention or treatment of hiar loss) | 에스씨엠생명과학 주식회사 | 한국 | 16.08.08 | 16.10.26 | IRORO 모발 제품 (샴푸, 트리트먼트, 세럼) |
| 80 | 특허 | 줄기세포의 기능강화용 조성물 | 에스씨엠생명과학 주식회사 | 한국 | 20.01.06 | 21.06.17 | 줄기세포 기능강화 |
| 81 | 미국 | 22.07.06 | - | ||||
| 82 | 일본 | 22.07.06 | - | ||||
| 83 | 유럽 | 22.08.05 | - | ||||
| 84 | 호주 | 22.08.05 | - | ||||
| 85 | 중국 | 22.09.02 | - | ||||
| 86 | 홍콩 | 23.04.19 | - | ||||
| 87 | 말레이시아 | 23.05.03 | - | ||||
| 88 | 특허 | 기능강화 줄기세포를 포함하는 아토피 피부염 예방 또는 치료용 조성물 | 에스씨엠생명과학 주식회사 | 한국 | 21.05.18 | - | 줄기세포 기능강화 |
| 89 | PCT | 22.05.18 | - | ||||
| 90 | 특허 | 기능강화 줄기세포 및 조절 T세포를 포함하는 아토피 피부염 예방 또는 치료용 병용투여 조성물 | 에스씨엠생명과학 주식회사 |
한국 | 21.06.01 | - | 줄기세포 기능강화 |
| 91 | PCT | 22.05.30 | - | ||||
| 92 | 특허 | 기능강화 줄기세포를 포함하는 관절염 예방 또는 치료용 조성물 | 에스씨엠생명과학 주식회사 | 한국 | 22.06.15 | - | 줄기세포 기능강화 |
| 93 | 상표 | SCM | 에스씨엠생명과학 주식회사 | 한국 | 18.07.13 | 19.10.29 | - |
| 94 | SCM Subfractionation Culturing Method |
한국 | 18.07.13 | 19.10.29 | - | ||
| 95 | SCM Stem Cell Medicine |
한국 | 18.07.13 | 19.10.29 | - | ||
| 96 | SCM Specialized Cell Medicine |
한국 | 21.01.05 | 22.08.10 | - | ||
| 97 | 이로로 문양 | 한국 | 18.06.27 | 19.04.01 | - | ||
| 98 | 이로로 문양 | 일본 | 21.08.31 | 22.02.28 | - | ||
| 99 | 이로로 문자 | 한국 | 18.07.04 | 19.04.25 | - | ||
| 100 | 이로로 문자 | 말레이시아 | 22.04.13 | - | |||
| 101 | Iroro Nutreatment | 한국 | 21.09.17 | - | - | ||
| 102 | Iroro Nutreatment | 말레이시아 | 21.09.30 | 22.08.03 | - | ||
| 103 | 엔세리아 문자 | 한국 | 18.05.08 | 18.12.11 | - | ||
| 104 | 베라셀 문자 | 한국 | 18.05.08 | 18.12.11 | - | ||
| 105 | 베라움 문자 | 한국 | 18.05.08 | 18.12.11 | - | ||
| 106 | Nutreatment 문자 | 일본 | 21.12.03 | 22.05.20 | - | ||
| 107 | Nutreatment 문자 | 중국 | 21.11.26 | 22.06.07 | - | ||
| 108 | Nutreatment 문자 | 말레이시아 | 21.11.09 | - | - | ||
| 109 | Nutreatment 문자 | 한국 | 21.11.15 | - | - | ||
| 110 | iroro Nuvon 문자 | 한국 | 22.11.11 | - | - | ||
| 111 | iroro Nuvon 문자 | 말레이시아 | 22.11.16 | - | - | ||
| 112 | iroro Nuvon 문자 | 일본 | 22.11.18 | - | - |
| 출처) 당사 제시 |
현재 당사는 기술보호를 위해 국내뿐만 아니라 해외에서도 특허 등록을 진행하고 있습니다. 현재 당사의 원천기술 및 활용기술과 관련된 소송이나 분쟁은 발생한 내역이 없으며, 전문 컨설팅 기관으로부터 특허의 침해 여부 및 전략에 관하여 정기적으로 컨설팅을 받고 있습니다. 그럼에도 불구하고 당사가 보유하고 있는 지적재산권이 적절히 보호받지 못하는 상황이 발생한다면 사업 경쟁력이 약화될 수 있으며, 향후 제3자에 의하여 당사가 보유하고 있는 특허에 대한 소송 또는 기타 분쟁이 발생할 가능성을 배제할 수 없습니다. 이는 당사의 영업활동에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
2. 회사위험
| 【투자자 유의사항】 |
|
○ 회사위험에는 당사의 주요 재무적 위험요소들이 기재되어 있습니다. 투자자 여러분들의 이해 편의를 위하여, 당사의 최근 3개년간 주요 재무사항 총괄표를 아래와 같이 요약 기재하였으니, 투자 판단에 참고하시기 바랍니다. |
| [주요재무사항 총괄표] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구 분 | 2023년 1분기 | 2022년 1분기 | 2022년 | 2021년 | 2020년 | 비 고 | |
| 외부감사인 | 삼일회계법인 | 삼일회계법인 | 삼일회계법인 | 삼일회계법인 | 삼일회계법인 | - | |
| 감사의견 | - | - | 적정 | 적정 | 적정 | - | |
| (계속기업 불확실성 관련 의견표명) | - | - | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 | - | |
| 1. 자산총계 | 26,459 | 48,850 | 33,020 | 54,045 | 76,292 | - | |
| 유동자산 | 5,306 | 16,877 | 10,040 | 20,312 | 36,086 | - | |
| 비유동자산 | 21,154 | 31,974 | 22,980 | 33,733 | 40,206 | - | |
| 2. 부채총계 | 7,009 | 9,447 | 8,509 | 9,432 | 13,213 | - | |
| 유동부채 | 3,231 | 8,864 | 4,562 | 8,709 | 3,259 | - | |
| 비유동부채 | 3,778 | 583 | 3,947 | 723 | 9,953 | - | |
| 3. 자본총계 | 19,450 | 39,403 | 24,511 | 44,613 | 63,079 | - | |
| 자본금 | 6,069 | 6,011 | 6,060 | 6,011 | 5,937 | - | |
| 자본잉여금 | 163,249 | 161,958 | 163,098 | 161,784 | 160,144 | - | |
| 결손금 | (152,626) | (129,798) | (147,026) | (124,096) | (101,577) | - | |
| 4. 부채비율(%) | 36.04% | 23.98% | 34.72% | 21.14% | 20.95% | 부채총계 ÷ 자본총계 | |
| 5. 유동비율(%) | 164.20% | 190.40% | 220.06% | 233.22% | 1,107.20% | 유동자산 ÷ 유동부채 | |
| 6. 총차입금 | 5,630 | 5,790 | 5,630 | 5,820 | 5,940 | 유동성 차입금 + 비유동성 차입금 | |
| 유동성 차입금 | 2,000 | 5,790 | 2,000 | 5,820 | 120 | - | |
| 비유동성 차입금 | 3,630 | 0 | 3,630 | 0 | 5,820 | - | |
| - 총차입금 의존도(%) | 21.28% | 11.85% | 17.05% | 10.77% | 7.79% | 총차입금 ÷ 자산총계 | |
| - 유동성 차입금 비중(%) | 35.52% | 100.00% | 35.52% | 100.00% | 2.02% | 유동성 차입금 ÷ 총차입금 | |
| - 차입금 평균 이자율 | 1.37% | 1.16% | 5.42% | 4.53% | 15.73% | ||
| 7. 영업활동 현금흐름 | (3,340) | (3,046) | (11,172) | (13,404) | (10,890) | - | |
| - 영업활동현금흐름 총부채 비율(%) | -47.65% | -32.24% | -131.30% | -142.10% | -82.42% | 영업활동현금흐름 ÷ 부채총계 | |
| 8. 투자활동 현금흐름 | 486 | 6,837 | 14,986 | 15,791 | (23,657) | - | |
| 9. 재무활동 현금흐름 | 107 | (118) | 212 | 425 | 30,189 | - | |
| 10. 현금 및 현금성자산 | 4,169 | 16,309 | 8,970 | 19,644 | 35,297 | 현금 및 현금성자산 + 단기금융상품 | |
| 11. 순차입금 | 1,461 | (10,519) | (3,340) | (13,824) | (29,357) | 총차입금 - 현금 및 현금성자산 | |
| - 순차입금 의존도(%) | 5.52% | -21.53% | -10.11% | -25.58% | -38.48% | 순차입금 ÷ 자산총계 | |
| 12. 매출액 | 98 | 114 | 396 | 439 | 320 | - | |
| 13. 매출원가 | 26 | 30 | 220 | 91 | 43 | - | |
| - 매출원가율(%) | 26.67% | 26.78% | 55.62% | 20.80% | 13.40% | 매출원가 ÷ 매출액 | |
| 14. 매출총이익 | 72 | 83 | 176 | 348 | 277 | ||
| 15. 판매비와관리비 | 3,445 | 3,841 | 12,755 | 12,503 | 16,366 | - | |
| - 판매비와관리비율(%) | 3,533.10% | 3,379.86% | 3,221.02% | 2,846.38% | 5,114.32% | 판매비와관리비 ÷ 매출액 | |
| 16. 영업이익(손실) | (3,374) | (3,757) | (12,579) | (12,155) | (16,089) | - | |
| - 영업이익율(%) | -3,459.78% | -3,306.64% | -3,176.64% | -2,767.18% | -5,027.71% | 영업비용 ÷ 영업수익 | |
| 17. 기타수익 | 41 | 60 | 1,575 | 214 | 9,244 | - | |
| 18. 기타비용 | 118 | 60 | 267 | 572 | 11,930 | - | |
| 19. 금융수익 | 8 | 5 | 7 | 27 | 43 | - | |
| 20. 금융원가 | 5 | 3 | 16 | 35 | 86 | ||
| 이자비용 | 77 | 67 | 305 | 264 | 935 | - | |
| - 이자보상배수(배) | (43.74) | (56.06) | (41.25) | (46.09) | (17.21) | 영업이익 ÷ 이자비용 | |
| 21. 법인세비용차감전계속사업이익(손실) | (5,601) | (5,702) | (22,930) | (22,519) | (9,633) | - | |
| 22. 당기순이익(손실) | (5,601) | (5,702) | (22,930) | (22,519) | (9,633) | - | |
| - 당기순이익률(%) | -5,743.59% | -5,018.27% | -5,790.66% | -5,126.47% | -3,010.19% | 당기순이익 ÷ 매출액 | |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 현금 및 현금성자산은 현금 및 현금성 자산, 유동 당기손익-공정가치측정금융자산, 단기금융상품의 합계를 기재하였습니다. |
|
가. 관리종목 지정 및 상장폐지 위험 |
「코스닥시장 상장규정」제53조(관리종목)은 매출액, 법인세비용차감전계속사업손실, 자본잠식 등 코스닥시장 상장법인으로서의 경영성과 및 재무상태에 미달하는 경우 관리종목을 지정하도록 명시되어 있습니다.
| [코스닥시장 관리종목 지정요건 및 상장폐지요건] |
| 구 분 | 관리종목 지정(「코스닥시장 상장규정」 제53조) | 상장폐지(「코스닥시장 상장규정」 제54조, 제56조) |
|---|---|---|
| 1) 매출액 미달(별도) |
최근 사업연도 30억 원 미만 (지주회사는 연결기준) |
2년 연속 매출액 30억 원 미만 [실질심사] 이익미실현기업 관련 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 2) 법인세비용차감전 계속사업손실(연결) | 최근 3사업연도중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 - 기술성장기업은 상장후 3년간 미적용 |
관리종목 지정후 자기자본50% 이상(&10억 원 이상)의 법인세비용차감전계속사업손실 발생 [실질심사] 이익미실현기업 관련, 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 3) 자본잠식 등 | 다음의 어느 하나에 해당하는 경우 A) 최근 사업연도말을 기준으로 자본잠식률 50%이상 B) 최근 사업연도말을 기준으로 자기자본 10억 원 미만 |
가)최근 사업연도말 현재 완전자본잠식의 경우 나)(A) 관리종목 지정후 도래하는 사업연도말 자본잠식률이 50%이상인 경우 다)(B) 관리종목 지정후 도래하는 사업연도말 자기자본이 10억 원 미만인 경우 [실질심사] 사업보고서 또는 반기보고서의 법정제출 기한까지 당해 상장폐지 기준 해당사실을 해소하였음을 입증하는 재무제표 및 이에 대한 감사인(정기재무제표에 대한 감사인과 동일한 감사인에 한함)의 감사보고서를 제출하는 경우 가~다목까지의 규정을 적용하지 않음. |
| 5) 시가총액 미달 | 보통주 시가총액 40억 원 미만 30일간 지속 -천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
관리종목 지정후 90일 기간 경과하는 동안 i) 시가총액 40억 이상으로 10일 이상 계속 ii) 시가총액 40억 이상인 일수가 30일 이상 둘중 하나라도 충족하지 못하면 상장폐지 |
| 6) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않거나, 정기주총에서 재무제표 미승인 or 정기주총 미개최할 경우 | 관리종목 지정법인이 다음 회차에 다음 어느 하나에 해당하는 경우 가)분기, 반기, 사업보고서를 법정제출기한내에 미제출 나)사업보고서의 법정제출기한까지 정기주주총회를 미개최하거나 정기주주총회에서 재무제표 미승인 다)최근 2년간 3회 이상 분기, 반기, 사업보고서 법정제출기한까지 제출하지 아니한 경우 라)법정제출기한까지 사업보고서를 제출하지 아니한 후 법정제출기한의 다음날부터 10일 이내 사업보고서 미제출 |
| 출처) 「코스닥시장 상장규정」 |
| 주1) 상기 관리종목 지정기준은 경영성과 및 재무상태와 관련된 지정기준만 표기한 것입니다. |
| 주2) 자본잠식률 = (자본금 - 자기자본) / 자본금 × 100 |
| 주3) 관리종목 지정 요건 중 장기영업손실에 대한 규정은 2022년 12월 부로 개정되었습니다. |
관리종목 지정 요건별 당사의 실적 현황은 다음과 같습니다.
| [관리종목 요건별 회사 실적 현황] |
| (단위: 백만원) |
| 관리종목 지정요건 | 요건별 회사 현황 | 관리종목 지정유예 여부 |
항목별 지정유예 종료시점 |
||||
|---|---|---|---|---|---|---|---|
| 항목 | 사업연도 | 금액 | 관리종목 지정요건 해당여부 | 해당 | 미해당 | ||
| 최근 사업연도말 매출액 30억 미만 |
최근 사업연도말 매출액(별도) | 2022년 | 396 | 2022년 매출액 396백만원으로, 관리종목 지정요건에 해당 | ● | - | 2024.12.31 |
| 자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생 | 최근 3사업연도 각 법인세차감전 계속사업손익 (연결) |
2022년 | (22,930) | 2021년 50.4%, 2022년 93.5%의 법차손률을 기록하며 자기자본 50% 이상의 법인세차감손실 관리종목 지정요건에 해당 | ● | - | 2022.12.31 |
| 2021년 | (22,519) | ||||||
| 2020년 | (9,633) | ||||||
| 최근 사업연도말 자본잠식률 50% 이상 |
최근 사업연도말 자본잠식률 (별도) |
2022년 | 해당 없음 | 2022년말 기준 자본잠식이 발생하지 않음 | - | ● | - |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 기술성장특례 적용 기업으로서 매출액 요건의 경우 신규상장일이 속하는 사업연도 (상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 5개 사업연도인 2024년말까지, 법인세전이익 요건의 경우 신규상장일이 속하는 사업연도(상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 3개 사업연도인 2022년말까지 해당 요건을 적용 받지 않습니다(영업이익 요건은 유예기간 없이 적용 면제).
하지만 당사의 노력에도 불구하고 사업환경이 급격히 악화되어 해당 요건별 유예기간이 경과한 시점에도 당사의 제품/서비스 매출이 저조하여 재무성과를 나타내지 못할 경우 관리종목으로 지정 또는 상장폐지 요건에 해당할 수 있으니 투자자들께서는 이점 유의하시기 바랍니다.
|
나. 신규상장 추정 경영실적과 현재 실적의 높은 괴리율 위험 |
당사는 2020년 06월 17일에 기술성장기업으로 코스닥시장에 신규상장 하였으며, 상장공모를 위한 증권신고서 상에 아래 근거를 바탕으로 향후 4개년(2020년 ~ 2023년) 경영실적을 추정하였습니다.
당사의 매출액은 줄기세포치료제 및 화장품 매출, 기술이전에 따른 기술료 수익, 용역(위탁연구개발) 등으로 구성되어있습니다. 당사가 신규상장 당시 제시했던 매출 구성별 추정치 및 매출 발생 시기는 아래와 같습니다.
| [상장공모 증권신고서 상 사업부문별 매출 추정치] |
| (단위: 백만원) |
|
구 분 |
2020년(E) (제7기) |
2021년(E) (제8기) |
2022년(E) (제9기) |
2023년(E) (제10기) |
|---|---|---|---|---|
| 화장품 제품 | 1,823 | 4,039 | 5,575 | 6,665 |
| 줄기세포치료제 제품 | - | - | - | 9,767 |
|
기술료 수익 |
- | 8,840 | 15,710 | 21,350 |
|
합 계 |
1,823 | 12,879 | 21,285 | 37,782 |
| 출처) 당사 증권신고서(2020.07) 제시 |
| [상장공모 증권신고서 상 매출액 세부 구성] |
| 구 분 | 내 용 (판매시기) | |
|---|---|---|
| 제품 매출 (생산ㆍ판매) |
줄기세포치료제 |
만성 이식편대숙주질환 치료제 (2023~) 급성 췌장염 치료제 (2024~) 중등증-중증 아토피 피부염 치료제 (2026~) 척수소뇌성 실조증 치료제 (2023~) |
| 수지상세포 백신치료제 | 전이성 신장암 치료제 (2024~) | |
|
탈모완화 기능성 화장품 |
남/여 샴푸, 트리트먼트, 세럼 (2019~) |
|
|
줄기세포 유래 배양액 |
Xeno-free 배양액 (2020~) |
|
| 기술료 수익 |
기술이전에 따라 수령하는 Upfront, Milestone Payment |
한국, 중국, 글로벌(미국, 유럽 등)에 당사가 개발 중인 줄기세포치료제 기술이전 |
| 출처) 당사 증권신고서(2020.07) 제시 |
1) 줄기세포치료제 및 수지상세포 백신치료제 (국내 제품 매출)
당사가 개발 중인 만성 이식편대숙주질환 줄기세포치료제는 국내 2상 임상시험 종료 후 2022년경 조건부 품목허가를 받아 2023년부터 판매할 계획이었습니다. 또한 대만 Steminent 社로부터 척수소뇌성 실조증 줄기세포치료제(동종 지방유래 중간엽줄기세포치료제)를 도입하여 국내 임상시험 종료 후 조건부 품목허가를 받아 2023년도부터 해당 치료제를 판매하여 매출이 발생할 것으로 예상하였습니다. 각 치료제의 국내 목표 시장점유율은 국내 경쟁제품 존재 여부, 직접생산 여부 및 타 치료제 병용투여 여부 등을 고려하여 50%, 25%로 각각 설정하였고, 모두 2023년도에 최초 출시되는 제품으로 초기 시장 점유율을 목표 시장점유율의 25~35% 수준으로 보수적으로 적용하여 산정하였습니다.
2) 화장품 및 줄기세포배양액 (제품 매출)
당사는 2018년도에 모발 재생능력이 확인된 줄기세포 유래 분비 단백질 CXCL1이 함유된 헤어 제품 4종(이로로 디어스칼프 남/여 샴푸, 트리트먼트, 두피세럼)을 개발 완료하여 2019년도부터 제품을 판매해왔으며, 상장 이후 홈쇼핑 및 중국, 러시아 등 해외시장으로 적극적인 마케팅을 통해 제품 판매를 확대하였습니다. 화장품 원료로 사용할 수 있는 고순도 줄기세포배양액도 연구개발하여 2020년 중 제품 개발을 완료하여 대량생산을 통해 국내ㆍ외 화장품 회사에 판매할 계획입니다. 줄기세포배양액의 국내 판매단가는 1L당 2,500,000원, 해외 판매단가는 대량생산 등으로 국내 판매단가 대비 10% 낮은 1L당 2,250,000원으로 산정하였습니다. 화장품 원료로 사용할 수 있는 고순도 줄기세포배양액의 경우 현재 국내ㆍ외 유통 인프라를 구축하고 있는 원료사 B사의 영업 네트워크를 활용하여 시장 진입 초기에 일정 수준 이상의 매출을 확보할 수 있을 것으로 판단하여 산정하였습니다.
3) 기술료 수수료
당사는 세포치료제 중에서도 줄기세포치료제의 연구개발을 주력 사업으로 영위하고 있으며, 전 세계적으로 품목허가를 받은 줄기세포치료제는 7개에 불과할 정도로 성장 가능성이 높은 치료제 분야입니다. 다만, 다른 바이오의약품에 비해 비교적 초기시장으로서 공개된 임상시험 Data가 풍부하지 않고, Reference Deal(비교 가능한 기술이전 계약)이 거의 존재하지 않습니다.
또한, 당사는 만성 이식편대숙주질환, 급성 췌장염, 간경변과 같이 환자수가 많지 않고, 근원적인 치료를 가능케 하는 치료제가 존재하지 않는 희귀ㆍ난치성 적응증을 대상으로 신약을 개발하고 있기 때문에, 줄기세포치료제의 임상시험 성공률, 기술이전 계약 체결 가능성 등의 사항을 고려하지 않았습니다.
당사의 경우 가장 앞선 파이프라인인 만성 이식편대숙주질환이 임상 2상을 진행하고 있고, 개발단계 희귀의약품으로 지정되어 임상 2상 종료 후 조건부 품목허가를 득할 예정입니다. 하지만 간경변 파이프라인은 아직 임상시험 단계에 진입하지 않은 점, 상기 파이프라인의 글로벌 기술이전을 위한 글로벌(미국 등) 임상시험을 진행하고 있지 않은 점 등을 고려하여 배수를 추정하였습니다. 또한 상기 희귀질환 및 만성질환의 임상시험 평균 성공률 9.6%를 준용하여 기술이전 계약의 Upfront 및 Milestone 비율을 전체 계약 규모의 9~10%로 산정하였고, 각각의 단계별 비율은 아래와 같습니다.
| [파이프라인 개발 단계별 추정 Upfront 및 Milestone] |
| (단위: 백만원) |
|
구 분 |
Upfront (1%) |
플랫폼 기술 |
2상 종료 (2%) |
조건부 품목허가 (2%) |
3상 종료 (2%) |
품목허가 (2%) |
|---|---|---|---|---|---|---|
|
만성 이식편대숙주질환 |
980 (2022년) |
2,940 (2023년) |
1,960 (2025년) |
1,960 |
1,950 |
N/A |
|
중등증-중증 |
2,010 (2021년) |
6,030 (2022년) |
4,020 (2024년) |
4,020 (2025년) |
4,020 (2028년) |
N/A |
|
중등증-중증 |
6,830 |
27,340 |
N/A |
N/A |
13,660 |
13,670 |
| 급성 호흡곤란 증후군 | 2,010 (2022년) |
6,030 (2023년) |
4,020 (2025년) |
4,020 (2026년) |
4,020 (2028년) |
N/A |
|
간경변 |
5,630 |
16,800 |
11,300 |
11,300 |
11,270 |
N/A |
| 주) | 층분리배양법 플랫폼 기술 Transfer에 따른 Milestone Payment는 임상 2상이 종료되기 전 3년간(중등증-중증 아토피피부염은 2년간) 안분인식 할 것으로 추정하였습니다. |
당사가 추정하는 Upfront Payment 및 임상시험 단계 종료 시 수령하는 Milestone Payment는 수령하는 시점에 수익 인식이 가능하나, 기술이전 의무를 임상기간에 안분하여 수익 인식을 하고자 합니다.
당사가 신규 상장 당시 시점과 증권신고서 제출 전일 현재 파이프라인별 개발 단계는 다음과 같습니다.
| [당사 줄기세포치료제의 파이프라인별 개발 단계] |
| 파이프라인 | IPO 당시 | 증권신고서 제출 전일 |
|---|---|---|
| SCM-CGH, 만성 이식편대숙주질환 치료제 | 2상 임상시험 진행 중 | 1/2상 임상시험 완료 |
| SCM-AGH, 급성 췌장염 치료제 | 2a상 임상시험 진행 중 | 1/2a상 임상시험 완료 |
| SCM-AGH, 중등증-중증 아토피피부염 치료제 | 1/2상 임상시험 진행 중 | 1/2상 임상시험 완료 |
| SCM-AGH, 급성 호흡곤란 증후군 | 2a상 임상시험 준비 중 | 자진 취하 |
| SCM-AGH, 간경변 치료제 | 비임상시험 진행 중 | 현재 진행 사항 없음(실패) |
| 출처) 당사 증권신고서 및 당사 제시 |
당사는 2024년 조건부 품목허가가 목표인 만성 이식편대숙주질환을 비롯해 중등증-중증 급성 췌장염, 중등증-중증 아토피 피부염 총 3개의 줄기세포치료제를 주력으로 개발하고 있습니다. 또한, 만성 이식편대숙주질환, 중등증-중증 급성 췌장염과 같은 희귀질환을 대상으로 줄기세포치료제의 조건부 허가를 득하여 시장에 진입하고, 중등증-중증의 아토피 피부염 같이 기존 치료제로는 장기적인 효능을 볼 수 없거나 근원적인 치료가 힘들었던 질환을 대상으로 시장을 확대할 계획을 가지고 있으며, 면역관련 질환을 대상으로 제품개발을 진행하고 있으며 유사한 기전에 따라 적응증 확대를 통하여 적용제품의 시장을 확대할 예정입니다.
상기 표에 기재된 파이프라인 외에 신규상장 당시 개발 중이던 후속 파이프라인 '동종 지방유래 중간엽줄기세포 치료제 (척수소뇌성 실조증)'는 2021년 09월 안정성 및 유효성을 평가하기 위한 제2상 임상시험계획(IND)의 자진취하를 공시하였습니다. 식품의약품안전처의 보완 자료로 비임상시험 등의 요청이 있었고, 보완에 대한 연장은 통상적으로 허용되는 기간인 60일 내에 진행되어야하지만, 당사는 비임상시험 자료 등을 60일 이내 제출이 어렵다는 판단 하에 자진취하 하였습니다.
다만, 자진취하 신청 당일 해당 내용에 대한 공시를 수행하지 못한 것에 대하여 2021년 11월 불성실공시법인 지정 및 공시위반제재금 8백만원을 부과받은 이력이 있습니다.
상장공모를 위한 증권신고서 상의 4개년(2020년 ~ 2023년) 추정 경영실적 세부내역은 다음과 같습니다.
| [상장공모시 공시한 추정 손익계산서] | |
| (K-IFRS, 별도) | (단위: 백만원) |
|
구 분 |
2020년(E) |
2021년(E) |
2022년(E) |
2023년(E) |
|---|---|---|---|---|
|
매출액 |
1,823 | 12,879 | 21,285 | 37,782 |
|
매출원가 |
407 | 1,047 | 1,480 | 5,816 |
|
매출총이익 |
1,416 | 11,832 | 19,805 | 31,966 |
|
판매비와관리비 |
15,405 | 15,247 | 15,699 | 16,372 |
|
영업이익(손실) |
(13,986) | (3,415) | 4,106 | 15,593 |
|
영업외수익 |
262 | 218 | 1,338 | 3,640 |
|
영업외비용 |
3,781 | 3,319 | 379 | 199 |
| 법인세비용차감전순이익(손실) | (17,505) | (6,516) | 5,065 | 19,035 |
|
법인세비용 |
- | - | - | - |
|
당기순이익(손실) |
(17,505) | (6,516) | 5,065 | 19,035 |
| 출처) 당사 제시 |
| 주) 법인세비용은 당기순이익에 반영하지 않았습니다. |
하지만, 상기 추정손익과 달리 2020년, 2021년, 2022년 매출 등의 실적은 아래와 같이 높은 괴리가 발생하고 있습니다.
| [추정손익과 현재 손익 비교] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2020년 | 2021년 | 2022년 | 2023년 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 예측 | 실적 | 괴리율 | 예측 | 실적 | 괴리율 | 예측 | 실적 | 괴리율 | 예측(E) | 실적(E) | 괴리율 | |
| 매출액 | 1,823 | 320 | 82.5% | 12,879 | 439 | 96.6% | 21,285 | 396 | 98.1% | 37,782 | 456 | 98.8% |
| 영업이익(손실) | -13,986 | -16,089 | -15.0% | -3,415 | -12,155 | -255.9% | 4,106 | -12,579 | -406.4% | 15,593 | -15,028 | -196.4% |
| 당기순이익(손실) | -17,505 | -9,633 | -45.0% | -6,516 | -22,519 | -245.6% | 5,065 | -22,930 | -552.7% | 19,035 | -22,808 | -219.8% |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 괴리율 = (예측치 - 실적치) / 예측치 * 100 |
| 주2) 본 추정경영실적은 개별재무제표에 관한 것입니다. |
| 주3) 2023년 실적의 경우 연환산하였습니다. |
당사는 신규상장 당시 2020년의 예상 매출액을 전부화장품 제품 매출로 구성하여 1,823백만원으로 추정하였으나, 실제 매출액은 시장 점유 확대 지연 및 수요 부족으로 화장품 제품 판매가 이뤄지지않으며 320백만원을 기록했습니다. 따라서, 실제 매출액은 추정 매출액과 82.5%의 높은 괴리율이 발생하였습니다. 영업손실 13,986백만원과 당기순손실 17,505백만원을 예상 손익으로 추정하였으나, 진행 중이던 만성 이식편대숙주질환(임상 1/2상), 중등증-중증 급성췌장염(임상 1/2a상) 및 중등증-중증 아토피 피부염(임상 1/2상)의 임상시험이 빠르게 진행됨에 따라 시약재료비 및 임상연구비 등에 대한 비용이 증가하였으며 부여했던 주식매수선택권과 관련하여 주식보상 비용이 증가함에 따라 영업손실 16,089백만 원이 발생하였습니다. 다만, 미국 조인트벤처 코이뮨에 추가 투자하는 등 공동기업투자주식에 대한 평가이익이 발생함에 따라 당기순손실은 9,633백만 원이 발생하였습니다.
2021년의 경우 당사는 예상 매출액을 12,879백만 원을 추정하였으나, 실제 매출액은 439백만 원으로 추정 매출액과 96.6%의 높은 괴리율이 발생하였습니다. 4,039백만원의 화장품 제품 매출을 예상하였지만 2020년과 마찬가지로 수요가 뒷받쳐주지 못하여 화장품 제품 매출이 발생하지 않았으며, 계획되어있던 중등증-중증 급성 췌장염 줄기세포 치료제 및 중등증-중증 아토피 피부염 줄기세포 치료제의 기술이전 계약이 체결되지 않아 Upfront Payment에 따른 매출이 발생하지 않았기 때문에 높은 괴리율이 발생하였습니다. 또한 영업손실 3,415백만원과 당기순손실 6,516백만원을 예상 손익으로 추정하였으나, 실제로는 매출이 예상 대비 많이 부진하였으며 경상연구개발비, 급여 등으로 영업손실 12,155백만원이 발생하였습니다. 당기순손실은 전기 대비 공동기업투자주식에 대한 평가손익 등 약 16,800백만원이 감소하며 당기순손실 22,519백만 원이 발생하였습니다.
특히, 2021년 2월, 중등도 이상의 급성 호흡곤란증후군 환자에서 SCM-AGH 치료제 개발을 위한 제2a상 임상시험계획(IND)을 자진 취하하였습니다. 또한 2021년 9월 PolyQ 척수소뇌 실조증 치료에 대한 Stemchymal (동종 지방유래 중간엽줄기세포) 투여의 안전성 및 유효성을 평가하기 위한 공개, 다기관, 단일군, 제2상 임상시험계획(IND)을 자진 취하하였습니다.
2022년의 경우 당사는 예상 매출액을 21,285백만원을 추정하였으나, 실제 매출액은 396백만원으로 추정 매출액과 98.1%의 높은 괴리율이 발생하였습니다. 급성 호흡곤란 증후군 치료제의 Upfront Payment 2,010백만원에 따른 매출을 예상하였으나 해당 파이프라인의 임상 진행을 자진 취하하여 매출이 발생하지 않았으며, 예상과는 달리 임상 지연 및 기술이전 계약 부진으로 인해 중등증-중증 급성 췌장염 줄기세포 치료제 및 중등증-중증 아토피 피부염 줄기세포 치료제의 층분리배양법 플랫폼 기술 Transfer에 따른 매출이 발생하지 않았기 때문에 높은 괴리율이 발생하였습니다. 또한 영업손실 4,106백만원과 당기순손실 5,065백만원을 예상 손익으로 추정하였으나, 실제로는 영업손실 12,579만 원이 발생하였습니다. 당기순손실은 단기투자자산평가이익으로 1,300백만원의 금융수익이 발생하였지만 지분법투자관련손실이 확대됨에 따라 당기순손실 22,930백만원이 발생하였습니다.
2023년의 경우에도 당사는 예상 매출액을 37,782백만원으로 추정하였으나, 실제 매출액은 연환산하여 산정하면 456백만원으로 추정 매출액과 98.8%의 높은 괴리율이 발생하였습니다. 간경변 치료제의 Upfront Payment 5,630백만원에 따른 매출을 예상하였으나 임상 중단으로 인해 매출이 발생하지 않았고, 급성 호흡곤란 증후군 치료제의 기술이전 계약에 따른 플랫폼 기술 Transfer에 따른 매출을 6,030백만원을 예상하였으나 자진 취하로 인해 매출이 발생하지 않으며 높은 괴리율이 발생하였습니다. 또한 영업손실 15,593백만원과 당기순손실 19,035백만원을 예상 손익으로 추정하였습니다. 실제로는 경상연구개발비, 급여 등으로 인해 영업손실 15,028백만원(2023년 1분기 실적의 연환산 기준), 당기순손실이 22,808백만원(2023년 1분기 실적의 연환산 기준)이 발생하였습니다.
이처럼 큰 괴리율이 발생하거나 적자가 발생하고 있는 사유로는 상장 당시 계획했던 임상 시험들이 지연됨에 따라 기술이전 및 제품 판매 등 본격적인 매출 발생이 지연되었습니다.
현재 주요 파이프라인 중 1) 만성 이식편대숙주질환은 임상 1/2상 완료 후 2024년 하반기 최종결과보고 예정이며, 2) 중등증-중증 아토피 피부염은 2023년 5월 임상 1/2상 결과를 발표하였으며, 국내에서 (주)한독이 임상 3상을 담당하고 해외에서는 글로벌 제약회사와 공동 개발이나 기술이전을 추진할 계획입니다. 3) 중등증-중증 급성 췌장염의 경우 임상 1/2a상 완료 이후 현재 임상 2b상을 준비하고 있으며 2023년 하반기 내로 임상시험계획(IND)을 제출할 계획입니다. 다만, 당사가 계획 중인 임상 시험이 지연될 수 있으며, 당사의 노력에도 불구하고 실패할 수 있습니다.
한편, 당사는 2019년 송도 신사옥을 취득하였으며, 2020년 07월 기업공개 당시 2021년까지 연면적 800평 이상의 GMP 제조시설을 신축할 계획이었습니다. 당사는 송도 사옥 리모델링 및 증축공사비, 신규 시설장치 구입 및 GMP 시설 신축 공사대금 사용을 목적으로 1,118백만원을 조달하였으나, 임상 지연 으로 인해 현재 GMP 시설 구축은 진행하지 않고 있습니다. 향후 당사는 보유 중인 파이프라인의 임상 진행 단계에 맞춰 대량 생산이 필요한 시기에 GMP 시설을 구축할 계획입니다.
상기 기재한 것처럼 2020년부터 2023년 1분기까지의 실제 경영성과와 상장시 추정한 경영성과는 큰 괴리를 보이고 있으며, 이는 당사가 상장시 계획한 영업활동이 정상적으로 실행되고 있지 않음을 의미합니다. 투자자께서는 당사의 2023년 및 향후 매출액 및 이익 또한 추정치와 높은 괴리를 보일 수 있음을 유의하시고 투자에 임하시기 바랍니다.
|
다. 매출 발생이 지연될 위험 |
당사는 원천기술인 층분리배양법을 기반으로 생산된 중간엽줄기세포 치료제를 각각의 질환별로 개발하여 제품을 생산 및 판매하는 제약회사의 사업구조와 당사가 보유하고 있는 플랫폼 원천기술을 이용하여 개발한 제품을 질환별, 국가별로 기술이전하는 바이오텍의 사업구조를 가지고 있습니다. 이 외에도, 당사가 개발한 발모 효능 단백질을 활용한 탈모 완화 기능성 코스메슈티컬 제품을 판매하고 있습니다.
임상시험 단계에 있는 파이프라인들은 신약개발의 일환으로 당사가 후보물질 발굴, 비임상시험 등을 모두 자체적으로 진행하여 보유한 자산으로 제3자에게 국내외 국가에서의 전용실시권 부여 및 사용권리를 부여할 수 있습니다. 해당 임상 비용에 대해서는 제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
당사는 설립 이후 2015년 약 70억 원, 2016년 약 100억 원의 투자를 받으면서 본격적으로 만성 이식편대숙주질환 2상과 중등증-중증 급성 췌장염 1/2a상 임상시험을 추진하였으며, 2019년 (주)한독과의 중등증-중증 아토피 피부염 줄기세포치료제 국내 기술이전 계약 체결로 1,000백만 원을 수령하였으며, 당시 계약에 따라 1상 임상시험 수행으로 240백만 원 수익을 발생시켰으며, 2023년 1분기에는 59백만 원의 수익을 발생시켰습니다. 다만, 당사 설립 이후 지속적으로 적자를 기록하고 있습니다.
| [설립 이후 연도별 영업실적] |
| (단위: 백만원) |
| 구분 | 2023년 1분기 | 2022년 | 2021년 | 2020년 | 2019년 | 2018년 | 2017년 | 2016년 | 2015년 | 2014년 |
|---|---|---|---|---|---|---|---|---|---|---|
| 매출 | 98 | 396 | 439 | 320 | 168 | 29 | 30 | 12 | 14 | - |
| 영업이익 | (3,374) | (12,579) | (12,155) | (16,089) | (12,202) | (8,569) | (5,320) | (3,997) | (2,015) | (350) |
| 당기순이익 | (5,601) | (22,930) | (22,519) | (9,633) | (42,554) | (40,095) | (1,744) | (3,955) | (3,247) | (350) |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주) 개별재무제표 기준 |
중등증-중증 아토피 피부염 치료제에 경우 2019년 5월 한독과 기술이전 계약을 체결하였고, 현재 10여개의 국내외 기관 및 바이오 벤처들과 미래 신제품 개발을 위하여 협력연구를 진행하고 있습니다. 향후 국내 시장 공략을 위한 줄기세포치료제는 당사 GMP 제조시설에서 생산 예정이며, 국내 유통 및 영업은 한독이 담당할 예정입니다. 해외 시장의 경우 향후 계약을 체결할 파트너사의 판로를 일차적으로 활용할 계획이며, 추가적으로 컨퍼런스 및 비즈니스 미팅 등에서의 발표를 통해 신규 파트너를 확보하여 개발단계에서 기술이전하는 모델을 추진하고 있습니다.
GlobalData에 따르면, 글로벌 아토피 피부염 시장 규모가 2019년 6.1조원에서 연평균 6.8% 증가하여 2024년에 8.5조원까지 확대될 것으로 예상되고 있습니다. 이는 당사의 중등증-중증 아토피 피부염 치료제 기술 수수료 매출 향상에 긍정적으로 작용할 것으로 판단됩니다. 특히, 아토피 피부염 환자 중 만성 질환자의 약 70%가 유ㆍ소아이기 때문에 특정 시장을 제한하기 보다 성인과 유ㆍ소아 두 시장을 모두 타겟으로 삼아 치료제를 개발할 계획입니다.
한편, 당사가 영위하는 코스메슈티컬 제품인 탈모 완화 기능성 화장품 제품군을 리뉴얼하고 2023년 05월 중등증-중증 아토피 피부염 임상 2상 결과에 따라 스킨케어 제품군을 신규로 출시할 예정입니다. 또한, 할랄 인증서를 확보하여 'Duopharma Biotech Berhad'와의 해외 수출 계약을 맺어 말레이시아를 비롯한 다양한 국가에 유통이 예정됨에 따라 2023년 2분기부터는 해외 매출액이 발생할 것으로 예상됩니다. 2023년 05월에 발주된 1,2차 선적물량에 대한 매출채권 145,500달러는 2분기에 매출로 인식될 예정입니다. 다만, 4분기에 예정된 3차 발주 및 추가 발주의 지연 및 중단 시 매출 성장에 부정적인 영향을 미칠 수 있으니 이 점 유의하시기 바랍니다.
이러한 노력에도 불구하고 당사가 계획하고 있는 연구개발 지연 및 실패하는 경우, 품목허가 및 출시 지연에 따른 제품 생산ㆍ판매 지연, 각 국가별 정책 변화에 따른 수출 지연 등으로 인해 당사의 매출 계획이 지연될 가능성이 존재합니다. 이에 따라 당사의 영업활동 및 수익성은 부정적인 영향을 받을 수 있으니 투자자께서는 이 점 유의하사기 바랍니다.
|
라. 재무안정성 관련 위험 |
당사 재무제표를 살펴보면 2023년 1분기말 총자산 26,459백만 원 및 유동자산 5,306백만 원, 총 차입금 5,630백만 원, 차입금 의존도 21.28%, 부채비율 36.04%, 유동비율 164.20%를 나타내고 있습니다. 당사가 속한 업종인 한국은행 2021년 기업경영분석 상 C21(의료용 물질 및 의약품 중 중소기업) 기준 업종평균 수치를 살펴보면, 부채비율 70.40%, 유동비율 180.56%, 차입금의존도 22.28%입니다. 해당 업종평균 수치를 당사 2023년 1분기 재무 수치와 비교시 유동비율을 제외하고 모두 상회하고 있습니다.
| [요약 재무 현황] | |
| (K-IFRS, 별도) | (단위: 백만원, %) |
| 구 분 | 2023년 1분기 | 2022년 | 2021년 | 2020년 | 업종평균(주1) |
|---|---|---|---|---|---|
| 자산총계 | 26,459 | 33,020 | 54,045 | 76,292 | - |
| 유동자산 | 5,306 | 10,040 | 20,312 | 36,086 | - |
| 비유동자산 | 21,154 | 22,980 | 33,733 | 40,206 | - |
| 부채총계 | 7,009 | 8,509 | 9,432 | 13,213 | - |
| 유동부채 | 3,231 | 4,562 | 8,709 | 3,259 | - |
| 비유동부채 | 3,778 | 3,947 | 723 | 9,953 | - |
| 자본총계 | 19,450 | 24,511 | 44,613 | 63,079 | - |
| 자본금 | 194 | 130 | 185 | 243 | - |
| 부채비율 | 36.04% | 34.72% | 21.14% | 20.95% | 70.40% |
| 유동비율 | 164.20% | 220.06% | 233.22% | 1,107.20% | 180.56% |
| 총차입금 | 5,630 | 5,630 | 5,820 | 5,940 | - |
| 단기 차입금 | 2,000 | 2,000 | 5,820 | 0 | - |
| 장기 차입금 | 3,630 | 3,630 | 0 | 5,820 | - |
| 현금및현금성자산 | 4,169 | 6,916 | 2,890 | 77 | - |
| 단기금융상품 | 0 | 9,745 | 2,053 | 16,754 | - |
| 차입금의존도 | 21.28% | 17.05% | 10.77% | 7.79% | 22.28% |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 업종평균은 한국은행 2021년 기업경영분석 C21(의료용 물질 및 의약품 중 중소기업) 기준 |
이외 은행차입금으로 인해 2020년 5,940백만 원, 2021년 5,820백만 원, 2022년 5,630백만 원, 2023년 1분기 5,630백만 원이 존재합니다. 해당 차입금의 주된 사용처는 보유 중인 파이프라인별 임상 비용과 연구개발비용 등입니다.
2023년 1분기말 현재 장단기차입금 내역은 다음과 같습니다.
| [차입금 상세 내역] | |
| (K-IFRS, 별도) | (단위 : 백만원) |
| 구분 | 차입처 | 내역 | 차입일 | 만기일 | 연이자율(%) | 2023년 1분기 | 2022년 | 2021년 | 2020년 |
|---|---|---|---|---|---|---|---|---|---|
| 단기차입금 | 기업은행 | 중소기업자금대출 | 2022.11.14 | 2023.11.14 | 6.36% | 1,000 | 1,000 | - | |
| 중소기업자금대출 | 2022.11.23 | 2023.11.23 | 6.60% | 1,000 | 1,000 | - | |||
| 유동성장기차입금 | 우리은행 | 기업시설분할상환대출 | 2019.08.19 | 2022.08.19 | 3개월 KORIBOR + 2.64% |
- | - | 5,820 | 120 |
| 단기차입금 소계 | 2,000 | 2,000 | 5,820 | 120 | |||||
| 장기차입금 | 우리은행 | 기업시설분할상환대출 | 2019.08.19 | 2022.08.19 | 3개월 KORIBOR + 2.64% |
- | - | - | 5,820 |
| 장기차입금 | 기업은행 | 중소기업시설자금대출 | 2022.11.14 | 2025.11.14 | 5.90% | 3,630 | 3,630 | - | - |
| 장기차입금 소계 | 3,630 | 3,630 | - | 5,820 | |||||
| 차입금 합계 | 5,630 | 5,630 | 5,820 | 5,940 | |||||
| 출처) 당사 정기보고서 및 당사 제시 |
또한, 2023년 1분기 기준 감가상각비 등을 제외한 월평균 고정비는 1,091백만원으로 보유 현금및현금성자산 4,169백만원 고려했을 시 약 4개월 정도 고정비를 충당할 수 있습니다. 또한, 총 차입금 5,630백만원까지 고려했을 시 금번 유상증자가 실패하거나 주가 하락 등으로 인해 유상증자 자금 규모가 대폭 감소할 경우 유동성 리스크에 직면할 수 있습니다.
이로 인해 기타 운영자금 부족 및 차입금 미상환으로 인한 담보제공자산(토지, 건물)의 담보권 실행을 초래할 수 있습니다. 특히 경상연구개발비 조달이 원활히 되지 않아 진행 예정 중인 임상 및 연구개발이 중단될 수 있으니 이 점 유의하시기 바랍니다.
2023년 1분기 기준 월평균 고정비 지출 상세 내역은 다음과 같습니다.
| [월평균 고정비 지출 상세 내역] | |
| (단위 : 백만원) | |
| 구분 | 월평균 금액 |
|---|---|
| 급여(급여+퇴직급여+복리후생비) | 133 |
| 경상연구개발비 | 817 |
| 지급수수료 | 85 |
| 기타 비용 | 56 |
| 합계 | 1,091 |
| 출처) 당사 제시 |
당사는 신규 상장 당시 후속 파이프라인 확보를 위해 척수소뇌성 실조증 줄기세포치료제, 제1형 및 제3형 당뇨병 치료제의 License-in 계약을 추진하였습니다.
대만 Steminent 社와 체결한 척수소뇌성 실조증 줄기세포치료제 License-in 계약은 신규 상장 당시 2020년 3분기 국내 임상 2상을 목표로 하였지만, 임상시험 계획(IND)를 자진취하 결정 이후 연구가 중단 됨에 따라 추가로 지급되는 비용은 없습니다.
미국 Allele 社와 체결한 당뇨병 치료제 License-in 계약은 현재 국내 비임상 체내 분포, 독성, 종양원성 시험을 위해 검토를 진행 중이며, 2021년 계약금과 2022년 마일스톤 중 개발비 분담금은 지급하였으며, 임상시험계획서(IND) 승인 시 50만 달러를 지급할 예정입니다.
License-in 계약 관련 상세 내역은 다음과 같습니다.
| [License-in 계약 상세 내역] | |
| (단위 : 백만원) | |
| 품목 | 계약 상대방 | 대상지역 | 계약 체결일 | 계약 종료일 | 총 계약 금액 | 지급 금액 | 진행 단계 | ||
|---|---|---|---|---|---|---|---|---|---|
| 2020년 | 2021년 | 2022년 | |||||||
| 척수소뇌성실조증 줄기세포치료제 (Stemchymal) |
Steminent Biotherapeutics, Inc. (대만) |
한국 | 2020년 10월 13일 | 2030년 10월 12일 | 4,510 | 507 | - | - | 자진철회 추가 검토중 |
| 제1형 및 제3형 당뇨병 치료제 |
Allele Biotechnology and Pharmaceuticals Inc. |
한국 | 2021년 06월 30일 | - | 3,389 | - | 858 | 903 | 비임상 |
| 합계 | 7,899 | 507 | 858 | 903 | - | ||||
| 출처) 당사 정기보고서 |
한편, 이자보상배율의 경우 영업활동을 통해 벌어들인 이익으로 차입금에 대한 이자비용을 감내할 수 있는지를 확인할 수 있는 지표로서 활용됩니다.
| [이자보상배율 현황] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2023년 1분기 | 2022년 | 2021년 | 2020년 | 비고 |
|---|---|---|---|---|---|
| 매출액 | 98 | 396 | 439 | 320 | - |
| 영업이익(손실) | (3,374) | (12,579) | (12,155) | (16,089) | - |
| 영업이익률(손실률) | -3,459.78% | -3,176.64% | -2,767.18% | -5,027.71% | 영업이익(손실) ÷ 매출액 |
| 자산총계 | 26,459 | 33,020 | 54,045 | 76,292 | - |
| 총자산 회전율(회) | 0.003 | 0.009 | 0.007 | 0.005 | 매출액 ÷ 평균총자산 |
| 이자비용 | 118 | 239 | 198 | 508 | - |
| 이자보상배율(배) | -28.57 | -52.68 | -61.51 | -31.70 | 영업이익(손실) ÷ 이자비용 |
| 이자비용 부담률 | 121.08% | 60.30% | 44.99% | 158.60% | 이자비용 ÷ 매출액 |
| 차입금 총계 | 5,630 | 5,630 | 5,820 | 5,940 | - |
| 차입금 평균이자율 | 2.10% | 4.24% | 3.40% | 8.54% | 이자비용 ÷ 차입금 총계 |
| 차입금 의존도 | 21.28% | 17.05% | 10.77% | 7.79% | 차입금 총계 ÷ 자산총계 |
| 출처) 당사 정기보고서 및 당사 제시 |
2020년 320백만 원, 2021년 439백만 원, 2022년 396백만 원, 2023년 1분기 98백만 원의 매출액이 발생하였습니다. 영업손실의 경우 2020년 16,089백만 원, 2021년 12,155백만 원, 2022년 12,579백만 원, 2023년 1분기 3,374백만 원이 발생하였으며, 이자비용의 경우 2020년 508백만 원, 2021년 198백만 원, 2022년 239백만 원, 2023년 1분기 118백만 원이 발생하였고, 당사의 이자보상배율은 지속적으로 1배 미만을 기록하여 영업을 통해 손실이 지속적으로 발생하고 있어 이자비용을 충당하지 못하는 상황입니다. 이는 당사의 채무상환능력이 취약하다는 것을 나타내며, 미미한 매출 수준으로 인해 영업 적자가 심화되고 있음에 기인합니다.
당사의 파이프라인별 임상 진행 단계에 따라 라이선스 아웃 계약 및 로열티 수취 시기가 지연되어 지속적으로 매출 실적이 부진할 경우 영업실적 개선이 이루어지지 않아 향후에도 이자보상배율이 1배를 하회할 수 있습니다. 매출 성장 및 수익성 개선이 이루어지지 않는다면, 이자비용으로 인한 재무적 부담으로 인해 당사의 재무 안정성이 훼손될 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다.
향후 유의미한 수준의 매출 발생으로 인한 수익 구조 개선 시기가 지연된다면 손실이 지속적으로 발생하거나, 현재 당사가 진행 중인 파이프라인의 임상 시험이 지연 또는 실패하여 소요된 연구개발비용 등을 회수하지 못할 경우 유동성 악화로 인해 당사의 재무안정성이 악화될 수 있습니다. 이러한 점을 투자자께서 유의하시어 투자에 임하시기를 바랍니다.
한편, 임상시험 단계에 있는 파이프라인들은 당사가 후보물질 발굴, 비임상시험 등을 모두 자체적으로 개발하여 보유한 자산으로서 제3자에게 국내외 권리국가에서의 전용실시권 부여 및 사용권리를 부여할 수 있습니다. 설립 이후 현재까지 총 2건의 라이선스 아웃 계약을 체결하였으며, 총 계약금은 3,200백만 원, 수취 금액은 1,000백만 원입니다. 라이선스 아웃 계약에 따른 로열티 지급 세부 조건은 다음과 같습니다.
당사는 증권신고서 제출 전일 현재까지 2건의 라이선스아웃을 체결한 바 있으며 그 내역은 아래와 같습니다.
| [라이선스아웃 계약 총괄표] |
| 계약 상대방 | 품목 | 대상 지역 | 계약 체결일 | 계약 조건 (요약) | 개발 단계 |
|---|---|---|---|---|---|
| Duopharma Biotech Berhad |
줄기세포치료제 | 동남아시아 4개국 (말레이시아, 싱가포르, 브루나이, 필리핀) |
2018.10.25 | - 지분 투자 : 55억 원 - Milestone Payment (1) 말레이시아에서 인정하는 국가 에서 선택한 파이프라인에 대한 IRB 승인을 받을 시 50만 달러 (2) 첫번째 임상시험 환자 등록 시 50만 달러 (3) Milestone Payment 지급은 선 택 파이프라인별로 적용 - Royalty : 제품 판매이익의 50% |
3개 임상 파이프라인 개발 진행 중 |
| ㈜한독 | 중등증-중증 아토피피부염 치료제 |
대한민국 | 2019.05.24 | - 지분 투자 : 40억 원 - Upfront Payment : 10억 원 - Milestone Payment : 품목허가 취득 시 10억 원 - Royalty : 제품 순매출액의 10% |
국내 임상 1/2상 완료 |
| 주1) | 계약 세부내용의 경우, 영업기밀에 해당하므로 기재하지 않았습니다. |
| 주2) | 당사는 2019년 5월 주식회사 한독과 중등증-중증 아토피 피부염 치료제 기술이전 계약을 체결하여 반환 의무가 없는 Upfront Payment 10억 원을 수령하였으며, 이는 당사의 1/2상 임상시험 수행의무에 대한 대가로서 1/2상 임상시험의 예상 수행기간에 걸쳐 안분하여 매출로 인식합니다(임상 1상이 개시된 2020년부터 임상 2상 종료 시까지 안분 인식). |
| 출처) 당사 제시 |
(1) 품목 : 줄기세포치료제
| ① 계약 상대방 | Duopharma Biotech Berhad (말레이시아) |
| ② 계약 내용 | 당사가 개발 완료/개발 중인 줄기세포치료제의 대상 지역에서 독점 개발 및 판매권 |
| ③ 대상 지역 | 아세안 4개국 : 말레이시아, 싱가포르, 필리핀, 브루나이 - 상기 아시아 4개국을 제외한 아세안 국가에 대해서는 The first right of refusal 옵션 부여 |
| ④ 계약 기간 | 적용 특허권 만료 기간까지 |
| ⑤ 총 계약 금액 | 선택 파이프라인별로 약 12억 원(USD 1,000,000), 로열티 별도 - 지분 투자 : 55억 원 |
| ⑥ 수취 금액 | 지분 투자 55억 원 (2018.11.23 납입) |
| ⑦ 계약 조건 | ▲ 지분 투자 : 55억 원 (2018.11.23 납입) ▲ 마일스톤(Milestone) - 1차 마일스톤 : USD 500,000 (말레이시아에서 인정하는 국가에서 선택한 파이프라인에 대한 IRB 승인을 받을 때) - 2차 마일스톤 : USD 500,000 (첫 번째 임상시험 환자 등록 시) ▲ 로열티(Royalty) : 치료제 판매이익의 50% |
| ⑧ 회계 처리 방법 | - |
| ⑨ 대상 기술 | 층분리배양법을 적용한 줄기세포치료제 |
| ⑩ 개발 진행 경과 | 거래 상대방이 아직 치료제 품목을 선택하지 않았으며, 당사는 만성 이식편대숙주질환 2상 임상 임상시험 환자 등록 및 투여를 완료했으며, 2023년 05월 중등증-중증 아토피 피부염 1/2상 임상시험 결과 보고 완료 및 중등증-중증 급성 췌장염 1/2a상 임상시험 결과 보고 완료 |
| ⑪ 기타 사항 | - |
(2) 품목 : 중등증-중증 아토피 피부염 줄기세포치료제
| ① 계약 상대방 | 주식회사 한독 (대한민국) |
| ② 계약 내용 | - 중등중-중증 아토피 피부염 치료를 위한 줄기세포치료제의 국 내 개발 및 판매권 - 임상 3상 및 품목허가는 한독이 담당 |
| ③ 대상 지역 | 대한민국 |
| ④ 계약 기간 | 2019년 5월 24일 ~ 제품 발매일로부터 20년 |
| ⑤ 총 계약 금액 | 20억 원 |
| ⑥ 수취 금액 | 지분 투자 40억 원 (2019.06.05 납입) |
| ⑦ 계약 조건 | ▲ 지분 투자 : 40억 원 (2019.06.05 납입) ▲ 계약금(Upfront) : 10억 원 - 수취조건 : 계약 체결 시 ▲ 마일스톤(Milestone) - 수취조건 : 제품 품목허가 취득 시 ▲ 로열티(Royalty) : 순매출액의 10% - 수취조건 : 매년 1회 정산 ▲ 제품 판매 : 제조원가에 10% 이익 가산 - 수취조건 : 제품 공급 시 |
| ⑧ 회계 처리 방법 | 수령한 계약금은 당사의 임상 1/2상 의무에 대해 지급한 것으로 임상 1/2상 실질적 예상 수행기간에 따라 안분하여 수익인식 |
| ⑨ 대상 기술 | 층분리배양법 기술을 이용하여 개발하고 있는 중등증-중증 아토피 피부염 치료를 위한 줄기세포치료제 |
| ⑩ 개발 진행 경과 | 2020년 2월 식약처로부터 1/2상 임상시험 계획 승인 후 2023년 05월 1/2상 임상시험 결과보고 완료 |
| ⑪ 기타 사항 | - |
상기 라이선스 아웃 계약을 체결한 치료제가 임상, 품목 허가, 상업화에 실패할 경우 당사가 수취하는 마일스톤 및 로열티의 규모가 예상치보다 감소할 수 있으며 이는 당사의 수익성 및 재무구조에 악영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
|
마. 관계기업의 경영 실적 부진에 따른 손익 악화 위험 |
당사는 증권신고서 제출 전일 현재, 지분투자를 수행한 관계회사 1개가 있으며 이에 대한 경영실적은 지분법 회계처리로 재무제표에 반영하고 있습니다. 당사의 관계기업에 대한 지분투자 금액은 최초 투자금액을 원가로 인식하고, 해당 관계기업의 영업실적 중 당사의 몫에 해당하는 금액을 장부금액에 가감하고 있어 관계회사의 실적에 따라 당사의 재무제표 손익에 직접적인 영향을 미치고 있습니다.
증권신고서 제출 전일 현재, 당사의 관계기업 현황은 다음과 같습니다.
| [관계기업 현황] |
| (기준일 : 증권신고서 제출 전일 현재) |
| 구분 | 회사명 | 설립일 | 지분율 | 설립목적 |
|---|---|---|---|---|
| 1 |
CoImmune, Inc.(비상장) |
2019.02.07 | 23.88% | 차세대 동종 CAR-T 기반 백혈병 치료제 및 수지상 세포 항암 백신 개발 |
| 출처) 당사 정기보고서 및 당사 제시 |
[관계기업 내역 및 상세]
1) CoImmune, Inc.
| 회사명 | CoImmune, Inc. | |||
|---|---|---|---|---|
| 대표이사 | Charles Nicolette | |||
| 주소 | 4233 Technology Drive, Durham, North Carolina, United States 27704 | |||
| 설립일 | 2019년 02월 07일 | |||
| 사업내용 | 차세대 동종 CAR-T 기반 백혈병 세포 치료제, 수지상 세포 항암 백신 개발 | |||
| 종업원수 | 49명 (2023년 1분기 기준) | |||
| 연혁 | 2019.02 | 에스씨엠생명과학(주) 51%투자, (주)제넥신 49% 투자 | ||
| 2020.04 | Formula Pharmaceuticals 합병으로 CAR-CIK platform technology 확보 | |||
| 2020.10 | Series A financing 45M$ 확보 | |||
| 2021.10 | MSK와 CAR-CIK in solid tumors 기술 확보 | |||
| 구분 (단위 : 백만원) |
2023년 1분기 | 2022년 | 2021년 | 2020년 |
| 자산총계 | 25,814 | 32,801 | 60,798 | 78,316 |
| 부채총계 | 3,200 | 2,892 | 4,754 | 3,416 |
| 자본총계 | 22,614 | 29,909 | 56,044 | 74,900 |
| 매출액 | - | 328 | 361 | 2,950 |
| 영업이익(손실) | (8,847) | (33,504) | (37,632) | (16,317) |
| 당기순이익 (손실) |
(8,719) | (33,233) | (37,723) | (16,414) |
| 기초장부금액 | 10,321 | 20,506 | 28,167 | 4,439 |
| 취득 | - | - | - | 16,298 |
| 지분율감소차익 | - | - | 527 | 15,229 |
| 손상차손 | - | (3,443) | - | - |
| 지분법손실 | (2,153) | (8,207) | (10,526) | (6,043) |
| 지분법자본변동 | 380 | 1,465 | 2,338 | (1,756) |
| 기말장부금액 | 8,549 | 10,321 | 20,506 | 28,167 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사는 2019년 02월 미국 Argos Therapeutics의 기술력과 세포치료제 제조시설(cGMP) 및 품질관리 시스템을 확보하기 위하여 ㈜제넥신과 공동으로 인력, 특허, cGMP 제조시설 등 일체를 125억 원에 인수하여, 미국 합작법인 CoImmune, Inc.(이하 "코이뮨")을 설립하여, 설립 당시 당사가 51%, ㈜제넥신이 49% 지분을 보유하였습니다.
코이뮨의 100% 자회사인 CoImmune CAR-CIK Inc.가 2020년 4월 30일 차세대 CAR-T 치료제 개발사인 이탈리아 Formula Phamaceuticals Inc.와 합병을 완료하면서 코이뮨은 이탈리아 Formula의 기존 주주에게 CoImmune 주식 8,961,039주를 합병대가로 지급하였습니다.
코이뮨은 국내 및 이탈리아 기관투자자로부터 시리즈 A단계로 총 45백만 달러(한화 약 510억 원) 규모의 자금조달 유치하였습니다. 당사는 2020년도에 7,555백만 원을 추가 납입하여 총 누적 투자액은 17,597백만 원입니다. 현재 코이뮨은 나스닥 상장을 위한 시리즈 B단계투자 유치를 위해 본격적으로 미국 투자자들과의 협상을 진행할 예정입니다. 다만, 투자 자금 모집 지연 및 실패 등의 이유로 시리즈 B단계 투자 유치가 되지 않는다면 코이뮨의 나스닥 상장 계획에 차질이 생겨 시기가 불투명해질 수 있으니 이 점 유의하시기 바랍니다.
코이뮨은 2021년 10월, 미국 관계회사 코이뮨은 미국의 3대 암 센터인 메모리얼 슬로안 케터링(MemorialSloan Kettering, MSK) 암센터와 코이뮨의 동종CAR-CIK(사이토카인 유도살해 세포) 기술을 이용한 고형암 치료제 개발에 관한 협약을 체결하여 동종 CAR-CIK 치료제를 활용해 나머지 95%에 해당하는 고형암에 CAR-CIK 기술을 적용하는 치료제를 개발하고자 합니다.
세포치료제 분야는 국내외 전문 인력과 체계적인 생산시스템이 절대적으로 부족한 상황입니다. 진입장벽이 높은 cGMP 생산, 콜드체인 시스템 및 품질관리, 컴퓨터 Validation 및 문서화 작업 등 많은 경험을 이용한 컨설팅 사업 및 cGMP 시스템을 활용한 CDMO(Contract Development & Manufacturing Organization, 의약품 위탁개발생산)을 신규사업으로 추진하고 있습니다.
코이뮨의 임상 파이프라인을 살펴보면 다음과 같습니다.
 |
|
CoImmune 임상파이프라인 |
첫번째, CMN-008 프로그램은 급성림프구성 백혈병을 대상질환으로 하며, 비임상시험이 완료되었습니다. 2023년 중반 IND 제출을 위한 자료준비를 완료하는 것을 목표로 하고 있습니다.
두번째, CMN-005프로그램은 급성림프구성 백혈병, 비호지킨림프종, 만성림프구성 백혈병을 대상질환으로 합니다. 이중 급성림프구성 백혈병 환자를 대상으로 용량 비교시험 데이터를 2023년 전기에 확보하였으며, 반복용량 시험에 대한 데이터를 2023년 2분기에 확보 완료하였습니다. 비호지킨림프종 및 만성림프구성 백혈병 환자를 대상으로 한 용량비교시험을 2023년 1분기에 개시하였습니다.
세번째, CMN-006프로그램은 급성골수성 백혈병을 대상질환으로 하며, 2023년 후반기 IND 자료확보 가능한 수준의 연구를 완료할 예정입니다.
네번째, 고형암을 타겟으로 하는 CAR-CIK는 2023년 1분기 개념증명 연구데이터를 확보하였습니다. 암 질환 단백질 CD47과 대식세포 SIRPα 간의 체크포인트 차단제를 분비하는 OrexiCAR 기술로 기존 CAR-T의 면역세포에 의한 항종양 활성을 개선하는 연구 결과를 혈액학 분야에서 가장 많이 인용되는 간행물인 Blood(impact factor: 25.48) 저널에 2023년 2월에 게재하였습니다.
다섯번째, CMN-001 프로그램은 전이성신장암을 대상질환으로 현재 2b 임상시험이 진행중이며, 2024년 전반기내 중간결과를 확보할 예정입니다.
당사는 관계기업과 채권 및 채무 내역 및 거래내역은 존재하지 않고, 자금 거래 내역은 다음과 같습니다.
| [관계기업과의 자금 거래 내역] |
| (단위 : 백만원) |
|
회사명 |
특수관계자성격 |
거래내역 |
2023년 1분기 | 2022년 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|---|---|---|
| CoImmune, Inc. | 지분법적용 투자기업 |
대여 | - | - | - | - | - |
| 회수 | - | - | - | - | - | ||
| 출자 | - | - | - | 7,555 | 10,042 |
| 출처) 당사 정기보고서 및 당사 제시 |
관계기업의 손익은 당사의 지분율(23.88%)에 한하여 재무손익로 반영되고 있음에 따라 코이뮨이 진행하는 임상파이프라인이 대내외적인 변수로 인하여 진행이 지연되거나 자금조달 및 기술이전 성과가 계획과 다르게 진행될 경우, 지속적인 당기순손실이 발생하여 당사의 재무손익에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
|
바. 현금흐름 및 유동성 관련 위험 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있습니다. 투자자께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다. |
당사는 미미한 수준의 매출 발생 및 지속적인 연구개발 활동으로 인해 음(-)의 영업활동현금흐름을 보이고 있으며, 투자활동현금흐름의 경우, 2020년에는 단기금융상품의 취득, 공동기업투자주식의 취득 등으로 인해 음(-)의 현금흐름을 보였으며, 2021년부터 현재까지 단기금융상품의 감소로 양(+)의 현금흐름을 보였습니다. 당사는 음(-)의 영업활동현금흐름을 2020년 기업공개로 인한 재무활동현금흐름을 통하여 충당하고 있는 상황이며, 2023년 1분기말 기준 당사는 4,169백만 원의 현금 및 현금성자산을 보유하고 있습니다. 당사의 최근 3년 및 당분기까지 요약 현금흐름 추이는 다음과 같습니다.
| [주요 현금흐름 추이] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2023년 1분기 | 2022년 1분기 | 2022년 | 2021년 | 2020년 |
|---|---|---|---|---|---|
| 영업활동현금흐름 | (3,340) | (3,046) | (11,172) | (13,404) | (10,890) |
| 당기순이익(손실) | (5,601) | (5,702) | (22,930) | (22,519) | (9,633) |
| 현금유출입이없는수익비용의조정 | 2,377 | 2,343 | 12,074 | 9,513 | (1,005) |
| 감가상각비 | 201 | 262 | 953 | 1,056 | 1,157 |
| 무형자산상각비 | 23 | 21 | 87 | 80 | 74 |
| 금융수익 | (41) | (60) | (1,575) | (214) | (9,244) |
| 금융비용 | 118 | 60 | 267 | 572 | 11,930 |
| 주식기준보상비용 | (77) | 113 | 665 | (1,974) | 4,297 |
| 리스해지손실 | - | - | - | (7) | (35) |
| 잡이익 | - | - | - | (0) | (1) |
| 잡손실 | - | - | - | 1 | - |
| 유형자산폐기손실 | - | - | - | - | 1 |
| 지분법손실 | 2,153 | 1,947 | 11,650 | 9,999 | (9,186) |
| 기타비용 | - | - | 27 | - | - |
| 영업활동으로인한자산ㆍ부채의변동 | (79) | 279 | (379) | (420) | (340) |
| 외상매출의 감소(증가) | (7) | 1 | 11 | 2 | (4) |
| 미수금의 감소(증가) | (2) | (17) | 12 | (1) | (10) |
| 선급금의 감소(증가) | - | (10) | (43) | 286 | (301) |
| 선급비용의 감소(증가) | 48 | 1 | (60) | 30 | (6) |
| 선급세금의 감소(증가) | (64) | 25 | 55 | 59 | (107) |
| 재고자산의 감소(증가) | (49) | 86 | 177 | (244) | 274 |
| 미지급금의 증가(감소) | 72 | 374 | (17) | (337) | 74 |
| 예수금의 증가(감소) | (9) | 20 | 13 | (11) | 13 |
| 선수금의 증가(감소) | - | - | (0) | (4) | - |
| 미지급비용의 증가(감소) | (8) | (135) | (154) | (14) | 31 |
| 환불부채의 증가(감소) | (0) | (5) | (9) | 4 | 3 |
| 계약부채의 증가(감소) | (60) | (60) | (242) | (242) | (215) |
| 장기미지급금의 증가(감소) | - | - | (134) | 51 | - |
| 충당부채의 증가(감소) | - | (0) | (0) | - | (91) |
| 보증금의 증가(감소) | - | - | 12 | - | - |
| 이자수취(영업) | 59 | 78 | 274 | 147 | 231 |
| 이자지급(영업) | (87) | (44) | (204) | (170) | (217) |
| 법인세의 환급(납부) | (9) | - | (7) | 46 | 75 |
| 투자활동현금흐름 | 486 | 6,837 | 14,986 | 15,791 | (23,657) |
| 투자활동으로 인한 현금유입액 | 572 | 16,000 | 31,054 | 44,124 | 19,392 |
| 단기금융상품의 처분 | 572 | 16,000 | 31,000 | 44,104 | 18,192 |
| 보증금의 회수 | - | - | 54 | 20 | 39 |
| 단기금융상품관련 선수금 수령 | - | - | - | - | 1,199 |
| 투자활동으로 인한 현금유출액 | (86) | (9,163) | (16,068) | (28,333) | (43,087) |
| 단기금융상품의 취득 | - | (9,000) | (15,000) | (26,000) | (34,044) |
| 장기금융상품의 취득 | - | - | - | (1,147) | - |
| 종속기업, 조인트벤처와 관계기업에 대한 투자자산의 취득 | - | - | - | - | (7,555) |
| 유형자산의 취득 | (82) | (142) | (505) | (676) | (1,480) |
| 무형자산의 취득 | (2) | - | - | - | (8) |
| 보증금의 증가 | (2) | (21) | (563) | (509) | (0) |
| 재무활동현금흐름 | 107 | (118) | 212 | 425 | 30,189 |
| 재무활동으로 인한 현금유입액 | 144 | - | 6,304 | 908 | 32,302 |
| 주식의 발행 | - | - | - | - | 31,518 |
| 주식선택권행사 | 144 | - | 674 | 908 | 745 |
| 단기차입금의 차입 | - | - | 2,000 | - | - |
| 장기차입금의 차입 | - | - | 3,630 | - | - |
| 재무활동으로 인한 현금유출액 | (37) | (118) | (6,093) | (482) | (2,113) |
| 정부보조금의 수취 | - | - | - | - | 38 |
| 리스부채의 지급 | (37) | (88) | (271) | (355) | (392) |
| 유동성장기차입금의 상환 | - | (30) | (5,820) | (120) | (120) |
| 신주발행비 지급 | (1) | - | (2) | (8) | (1,601) |
| 현금및현금성자산의순증가(감소) | (2,747) | 3,674 | 4,026 | 2,813 | (4,358) |
| 기초현금및현금성자산 | 6,916 | 2,890 | 2,890 | 77 | 4,435 |
| 기말현금및현금성자산 | 4,169 | 6,564 | 6,916 | 2,890 | 77 |
| 출처) 당사 정기보고서 및 당사 제시 |
당사의 줄기세포치료제 파이프라인으로는 만성 이식편대숙주질환(SCM-CGH), 중등증-중증 급성 췌장염(SCM-AGH), 중등증-중증 아토피 피부염(SCM-AGH)이 있습니다. 이에 대한 임상시험을 진행하면서 2020년 8,846백만 원, 2021년 10,015백만 원, 2022년 9,311백만 원, 2023년 1분기 2,452백만 원의 정부보조금을 제외한 경상연구개발비용이 지출되었습니다. 향후 파이프라인별 임상 단계 진전 및 신규 파이프라인 개발에 따라 더 많은 연구개발비가 투입될 예정이며 이에 따라 영업비용 또한 확대될 것으로 예상됩니다.
| [연구개발비용 내역] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2023년도 1분기 | 2022년 | 2021년 | 2020년 | |
|---|---|---|---|---|---|
| 비용의 성격별 분류 |
시약재료비 | 484 | 1,519 | 1,847 | 1,514 |
| 인건비(주식보상비용 제외) | 799 | 2,646 | 2,167 | 2,027 | |
| 주식보상비용 | (42) | 345 | 318 | 405 | |
| 감가상각비 | 18 | 791 | 734 | 1,537 | |
| 외주용역비 | 980 | 3,351 | 4,659 | 2,799 | |
| 기타 | 214 | 660 | 748 | 1,224 | |
| 연구개발비용 합계 | 2,452 | 9,311 | 10,473 | 9,505 | |
| (정부보조금) | - | - | (458) | (659) | |
| 보조금 차감후 금액 | 2,452 | 9,311 | 10,015 | 8,846 | |
| 회계처리 내역 |
경상연구개발비 | 2,452 | 9,311 | 10,015 | 8,846 |
| 개발비(무형자산) | - | - | - | - | |
| 회계처리금액 계 | 2,452 | 9,311 | 10,015 | 8,846 | |
| 매출액 | 98 | 396 | 439 | 320 | |
| 연구개발비용 / 매출액 비율 (연구개발비용 합계÷당기매출액×100) |
2514.47% | 2351.48% | 2279.91% | 2970.20% | |
| 출처) 당사 정기보고서 및 당사 제시 |
| 주1) 당사의 연구개발비는 전액 비용 처리하고 있습니다. |
| 주2) 당사의 연구소, 제조소 및 임상개발부에서 발생하는 비용은 전액 경상연구개발비로 처리하였습니다. |
당사는 2020년 현금성자산 77백만 원 및 단기금융상품 35,219백만 원 2021년 현금성 자산 2,890백만 원 및 단기금융상품 16,754백만 원, 2022년 현금성자산 6,916백만 원 및 단기금융상품 2,053백만 원, 2023년 1분기 현금성자산 4,169백만 원을 보유하고 있습니다. 당사는 매년 매출이 미미한 수준으로 발생하여 영업비용을 충당이 불가능하고, 연구개발비용 등 대규모 순 현금 소요가 발생하고 있어 이를 외부자금 조달 및 금융자산의 처분 등을 통해 충당하고 있습니다. 금번 유상증자를 통해 유입된 자금을 임상개발비와 연구개발비 등 운영자금 및 채무상환자금에 사용할 예정입니다.
당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 당사는 상장 이후 지속적인 임상개발과 연구개발활동으로 인해 유동성 지표가 악화되어 왔으며, 향후에도 유의미한 수준의 매출이 발생하지 않아 음(-)의 영업활동현금흐름이 계속 발생할 경우 유동성 리스크가 부각될 위험이 있습니다. 따라서 보유 파이프라인의 라이선스 아웃 및 영업활동 전반에 대한 모니터링이 필요하다고 판단되며, 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있습니다. 투자자께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다.
|
사. 재고자산 및 매출채권 관련 위험 당사는 기술이전 계약에 따른 계약금 및 라이선스 수수료 외에 코스메슈티컬 브랜드 '이로로 디어스칼프' 를 개발 및 판매한 이후 관리할 재고자산도 증가하는 추세에 있습니다. |
당사는 기술이전 계약에 따른 계약금 및 라이선스 수수료 외에 코스메슈티컬 브랜드 '이로로 디어스칼프' 를 개발 및 판매를 개시한 이후 재고자산도 증가하는 추세에 있습니다. 당사의 매출은 2020년 320백만 원, 2021년 439백만 원, 2022년 396백만 원, 2023년 1분기 98백만 원으로 매출이 소량 발생하고 있으며, 이에 따라 재고자산은 2020년 36백만 원, 2021년 280백만 원, 2022년 103백만 원, 2023년 1분기 152백만 원으로 증가했습니다. 2021년 재고자산의 경우, 아직 제품화되지 않은 미완성품을 재공품(138백만 원)으로 분류하며 280백만 원을 기록했습니다.
한편, 당사의 재고자산회전율은 2020년에 0.3회로, 업종 평균인 5.0회에 비해 크게 하회하고 있으며, 2021년, 2022년 매출액의 증가에도 불구하고 재고자산회전율이 각각 0.6회, 0.3회를 기록하여 업종평균 대비 매우 하회하고 있습니다. 이와 같이, 당사의 재고자산 회전율이 업종평균을 하회하는 주된 원인은 계획했던 연구개발 및 임상시험의 지연으로 인한 기술이전 매출 지연과 코스메슈티컬 제품 판매 부진 때문입니다. 당사의 재고자산 현황은 다음과 같습니다.
| [재고자산 현황] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구 분 | 2023년 1분기 | 2022년 | 2021년 | 2020년 | 업종평균 |
|---|---|---|---|---|---|
| 매출액 | 98 | 396 | 439 | 320 | - |
| 매출원가 | 26 | 220 | 91 | 43 | - |
| 재고자산 | 152 | 103 | 280 | 36 | - |
| 총자산 대비 재고자산 구성비율 | 0.57% | 0.31% | 0.52% | 0.05% | - |
| 재고자산회전율 | 0.8회 | 0.3회 | 0.6회 | 0.3회 | 5.0회 |
| 출처) | 당사 정기보고서 및 당사 제시 |
| 주1) | 재고자산 회전율 = 매출원가/(기초재고+기말재고/2) |
| 주2) | 업종평균금액은 한국은행 기업경영분석 통계표 "의료용 물질 및 의약품(C21)" 2021년 자료를 근거로 작성하였습니다 |
당사는 기존의 코스메슈티컬 제품인 탈모 완화 기능성 화장품 제품군 외에 스킨케어 제품군을 신규로 출시할 계획이며, 최근에는 비대면 채널을 통한 매출이 증가함에 따라 더불어 관리해야 할 재고자산도 증가할 것으로 예상됩니다. 다만, 향후 실제 판매량이 예상 판매량을 하회한다면 재고자산회전율이 감소하게 되며, 이를 적절하게 관리하지 못할 시 평가손실 발생 등 당사 손익 및 영업활동에 부정적인 영향을 줄 수 있습니다. 투자자께서는 이 점 유의하시어 투자해주시기 바랍니다.
한편, 당사의 매출채권은 2019년 (주)한독과의 중등증-중증 아토피 피부염 줄기세포치료제 국내 기술이전 계약 체결 이후부터 발생하고 있습니다.
당사의 매출채권 총액 및 장부가액은 2020년 19백만 원, 2021년 17백만 원, 2022년 6백만 원, 2023년 1분기 12백만 원입니다. 자산총계 대비 매출채권의 비중은 2023년 1분기 기준 매우 낮은 비중을 차지하고 있으며 자산에 유의적인 영향을 미치고 있지 않습니다. 그러나 향후 파이프라인의 해외 기술이전 및 코스메슈티컬 제품의 본격적인 동남아 시장 진출 등의 여부에 따른 매출 증대로 인하여 매출채권이 현 수준보다 증가할 수 있습니다.
매출채권 회수율을 측정하는 주요지표인 매출채권 회전율은 2023년 1분기 기준 10.9회로, 업종 평균인 5.0회 대비 상회하고 있습니다. 하지만 매출액 및 매출채권 금액이 소액이기 때문에 높은 회전율이 긍정적인 의미를 가진다고 볼 수 없습니다. 또한 향후 매출 성장 또는 매출처와의 계약에 따라 회전율은 변동할 수 있으며, 추후 매출채권 회수가 지연되어 매출채권회전율이 감소할 경우 당사 유동성 및 손익에 악영향을 미칠 수 있습니다. 당사의 매출채권 현황은 다음과 같습니다.
| [매출채권 현황] | |
| (K-IFRS, 별도) | (단위: 백만원) |
| 구분 | 2023년 1분기 | 2022년 | 2021년 | 2020년 | 업종평균 |
|---|---|---|---|---|---|
| 매출채권 총액 | 12 | 6 | 17 | 19 | - |
| 대손충당금 | - | - | - | - | - |
| 매출채권 장부가액 | 12 | 6 | 17 | 19 | - |
| 자산총계 | 26,459 | 33,020 | 54,045 | 76,292 | - |
| 매출액 | 98 | 396 | 439 | 320 | - |
| 매출채권회전율 | 10.9회 | 34.4회 | 24.4회 | 19.4회 | 5.0회 |
| 출처) | 당사 정기보고서 및 당사 제시 |
| 주1) | 매출채권회전율 = 연환산 매출액÷{(전기매출채권+당기매출채권)÷2}] |
| 주2) | 업종평균금액은 한국은행 기업경영분석 통계표 "의료용 물질 및 의약품(C21)" 2021년 자료를 근거로 작성하였습니다 |
당사는 현재까지 유의적인 규모의 매출채권이 발생하지 않았기 때문에 대손충당금을 설정하지 않고 있으나, 국내 및 해외시장 진출을 통해 기술이전 및 제품 영업을 확대할 예정으로 향후에는 매출채권의 대손설정률이 점차 높아질 것으로 예상됩니다. 그러나 해외시장의 경제적 여건 악화, 거래상대방의 채무불이행 등 예상치 못한 사유로 인하여 매출채권의 회수가 지연되거나 최종적으로 손상되어 상각 처리된다면 당사의 수익성에 부정적 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자해주시기 바랍니다.
| 아. 최대주주 및 특수관계인 지분희석 및 경영권 관련 위험 증권신고서 제출 전일 기준 당사의 최대주주는 송기령으로 2,771,000주(지분율 22.61%) 보유하고 있으며, 특수관계인을 포함할 시 2,872,113주(지분율 23.43%)를 보유 중에 있습니다. 금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.39164363의 배정비율로 신주인수권증서를 교부받게 됩니다. 증권신고서 제출일 현재, 최대주주는 국세청과 상속세 연부연납 특례 적용 및 납부기한등 연장신청에 대한 관련 서류를 함께 제출하였으며, 연부연납 승인시 분할납부에 따른 이자 포함 약 141억원의 상속세를 2023년부터 2032년까지 10년 동안 매년 9월 말에 분할 납부할 예정입니다. 납세담보로 보유 주식 중 1,456,887주(11.88%)를 공탁하였습니다. 이와 동시에 납부기한 연장 승인 시 2023년 예정된 납부세액을 2024년에 납부할 수 있게 됩니다. 최대주주는 상속세 납부 자금 및 청약 참여 자금을 마련하기 위해 기존 보유주식을 금번 공모 유상증자 기간 및 유상증자 종료 이후에도 상속세 납부 시기 및 청약 일정에 맞추어 블록딜(장외대량매매)로 매각할 예정입니다. 금번 유상증자에서 최대주주 송기령은 증서 매각 대금을 포함한 청약률은 최소 약 15% 내외를 예상하고 있으며 최대주주를 제외한 특수관계인의 청약률은 현재 미정입니다. 최대주주의 증서 청약률은 매각 당시 주가 흐름과 시장 상황에 따라 변동될 수 있습니다. 만약 시장 상황 악화로 인하여 당사의 주가가 하락한다면 증서 매각대금 또한 감소하여 청약률이 낮아질 수 있습니다. 이 경우 청약률 하락으로 인해 지분 희석이 심화될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
증권신고서 제출 전일 기준 동사의 최대주주는 송기령으로 2,771,000주(지분율 22.61%) 보유하고 있으며, 특수관계인을 포함할 시 2,872,113주(지분율 23.43%)를 보유 중에 있습니다. 최대주주 및 특수관계인의 지분 현황은 아래와 같습니다.
| [최대주주 등 지분 현황] | |
| (기준일: 증권신고서 제출 전일 현재) | (단위: 주, %) |
| 주주 | 관계 | 주식의 종류 | 주식수 | 지분율 |
| 송기령 | 최대주주 | 보통주 | 2,771,000 | 22.61 |
| 손병관 | 대표이사 | 보통주 | 73,300 | 0.60 |
| 오형남 | 특수관계인 | 보통주 | 18,648 | 0.15 |
| 이종철 | 특수관계인 | 보통주 | 1,165 | 0.01 |
| 정선영 | 특수관계인 | 보통주 | 3,000 | 0.02 |
| 이희성 | 특수관계인 | 보통주 | 5,000 | 0.04 |
| 합 계 | 2,872,113 | 23.43 | ||
| 출처) 동사 정기보고서 및 동사 제시 |
금번 동사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.39164363의 배정비율로 신주인수권증서를 교부받게 됩니다.(신주배정기준일 전 주식매수선택권의 행사, 자기주식 수의 변동 등에 의하여 변동 가능성이 있습니다.) 이에 따라 최대주주인 송기령은 1,085,244주, 특수관계인들은 총 39,589주를 배정받게 됩니다. 금번 유상증자에서 최대주주는 자금 여력에 따라 최대한 참여할 예정으로, 현재는 최대주주인 송기령은 배정분의 약 15% 정도 참여를 계획 중이며, 특수관계인들에 대한 청약 참여 여부는 미정입니다. 만약 최대주주 및 특수관계인이 전액 미참여할 경우 지분율은 현재 23.43%에서 16.85%까지 감소할 수 있으며, 최대주주가 배정분의 15% 참여하고, 특수관계인이 전액 미참여할 경우 최대주주 및 특수관계인의 지분율은 현재 23.43%에서 17.81%까지 감소할 수 있습니다.
| [최대주주 및 특수관계인 청약률에 따른 지분변동 가정] |
| 성명 | 현재 | 증자 후 | |||||
| (최대주주 및 특수관계인 미참여) | (최대주주 15% 참여, 특수관계인 미참여) | ||||||
| 주식수(주) | 지분율(%) | 배정주식수(주) | 주식수(주) | 지분율(%) | 주식수(주) | 지분율(%) | |
| 송기령 | 2,771,000 | 22.61% | 1,085,244 | 2,771,000 | 16.25% | 2,933,786 | 17.20% |
| 손병관 | 73,300 | 0.60% | 28,707 | 73,300 |
0.43% | 73,300 |
0.43% |
| 오형남 | 18,648 | 0.15% | 7,303 | 18,648 |
0.11% | 18,648 |
0.11% |
| 이종철 | 1,165 | 0.01% | 456 | 1,165 |
0.01% | 1,165 |
0.01% |
| 정선영 | 3,000 | 0.02% | 1,174 | 3,000 | 0.02% | 3,000 | 0.02% |
| 이희성 | 5,000 | 0.04% | 1,958 | 5,000 | 0.04% | 5,000 | 0.04% |
| 합계 | 2,872,113 | 23.43% | 1,121,710 | 2,864,113 |
16.85% | 3,026,899 |
17.81% |
| 주1) 최대주주 송기령의 15% 참여에 따른 청약 참여주식수는 총 162,786주입니다. |
| 주2) 증자 전 발행주식 총수 : 12,256,040주 → 증자 후 발행주식 총수 : 17,056,040주 |
| [행사가능한 주식매수선택권 부여현황] | |
| (기준일 : 증권신고서 제출 전일 현재) | (단위 : 원, 주) |
| 부여 받은자 | 관 계 | 부여일 | 부여방법 | 주식의 종류 | 미행사 수량 | 행사기간 | 행사가격 |
|---|---|---|---|---|---|---|---|
| 함동식 | 미등기임원 | 2017.02.28 | 신주교부 | 보통주 | 42,300 | 2020.02.29~2024.02.28 | 6,700 |
| OOO 외 23명 | 직원 | 2017.02.28 | 신주교부 | 보통주 | 20,264 | 2020.02.29~2024.02.28 | 6,700 |
| 이병건 | 퇴직자 | 2018.05.15 | 신주교부 | 보통주 | 250,000 | 2020.05.16~2025.05.15 | 7,000 |
| 오형남 | 등기임원 | 2018.06.15 | 신주교부 | 보통주 | 45,000 | 2021.06.16~2025.06.15 | 7,250 |
| 함동식 | 미등기임원 | 2018.06.15 | 신주교부 | 보통주 | 2,000 | 2021.06.16~2025.06.15 | 7,250 |
| OOO 외 37명 | 직원 | 2018.06.15 | 신주교부 | 보통주 | 91,340 | 2021.06.16~2025.06.15 | 7,250 |
| 오석우 | 퇴직자 | 2019.01.18 | 신주교부 | 보통주 | 20,000 | 2022.01.19~2026.01.18 | 9,000 |
| OOO | 직원 | 2019.01.18 | 신주교부 | 보통주 | 6,000 | 2022.01.19~2026.01.18 | 9,000 |
| 오석우 | 퇴직자 | 2019.03.29 | 신주교부 | 보통주 | 60,000 | 2022.03.30~2026.03.29 | 10,000 |
| 김용보 | 퇴직자 | 2019.03.29 | 신주교부 | 보통주 | 20,000 | 2022.03.30~2026.03.29 | 10,000 |
| OOO 외 12명 | 직원 | 2019.03.29 | 신주교부 | 보통주 | 43,900 | 2022.03.30~2026.03.29 | 10,000 |
| 이병건 | 퇴직자 | 2019.07.17 | 신주교부 | 보통주 | 98,874 | 2021.07.18~2026.07.17 | 11,000 |
| 정선영 | 등기임원 | 2019.09.20 | 신주교부 | 보통주 | 10,000 | 2022.09.21~2026.09.20 | 14,000 |
| 정은경 | 퇴직자 | 2019.09.20 | 신주교부 | 보통주 | 30,000 | 2022.09.21~2026.09.20 | 14,000 |
| OOO 외 7명 | 직원 | 2019.09.20 | 신주교부 | 보통주 | 34,000 | 2022.09.21~2026.09.20 | 14,000 |
| 이희성 | 등기임원 | 2020.06.30 | 신주교부 또는 차액보상형 선택 |
보통주 | 10,000 | 2022.07.01~2027.06.30 | 30,400 |
| 최희주 | 외부전문가 | 2020.06.30 | 신주교부 또는 차액보상형 선택 |
보통주 | 10,000 | 2022.07.01~2027.06.30 | 30,400 |
| 레오나드 아리프 압둘샤타르 |
등기임원 | 2020.06.30 | 신주교부 또는 차액보상형 선택 |
보통주 | 10,000 | 2022.07.01~2027.06.30 | 30,400 |
| 이종철 | 등기임원 | 2021.03.26 | 신주교부 | 보통주 | 25,000 | 2024.03.27~2028.03.26 | 36,260 |
| OOO외 4명 | 직원 | 2021.03.26 | 신주교부 | 보통주 | 15,000 | 2024.03.27~2028.03.26 | 36,260 |
| 이서종 | 미등기임원 | 2021.08.13 | 신주교부 | 보통주 | 15,000 | 2024.08.14~2028.08.13 | 30,400 |
| OOO 외 2명 | 직원 | 2021.08.13 | 신주교부 | 보통주 | 4,000 | 2024.08.14~2028.08.13 | 30,400 |
| OOO외 3명 | 직원 | 2021.11.12 | 신주교부 | 보통주 | 12,000 | 2024.11.13~2028.11.12 | 20,566 |
| OOO외 1명 | 직원 | 2022.02.08 | 신주교부 | 보통주 | 3,000 | 2025.02.08~2029.02.07 | 17,705 |
| OOO 외 7명 | 직원 | 2022.05.13 | 신주교부 | 보통주 | 37,000 | 2025.05.14~2029.05.13 | 11,590 |
| OOO외 5명 | 직원 | 2022.09.30 | 신주교부 | 보통주 | 30,000 | 2025.10.01~2029.09.30 | 7,896 |
| OOO | 직원 | 2022.12.29 | 신주교부 | 보통주 | 5,000 | 2025.12.30~2029.12.29 | 12,575 |
| OOO외 1명 | 직원 | 2023.02.28 | 신주교부 | 보통주 | 10,000 | 2026.03.01~2030.02.28 | 10,810 |
| 손병관 | 등기임원 | 2023.03.29 | 신주교부 | 보통주 | 40,000 | 2025.03.30~2029.03.29 | 9,883 |
| 문종호 | 등기임원 | 2023.03.29 | 신주교부 | 보통주 | 15,000 | 2025.03.30~2029.03.29 | 9,883 |
| 합계 | 1,014,678 | - | - | ||||
| 출처) 동사 정기 보고서 및 동사 제시 |
| 주1) 주식매수선택권의 경우 행사 시 손익은 발생하지 않으며, 부여 이후 행사가능기간 전까지 주식보상비용이 발생합니다. |
동사의 특수관계인들은 증권신고서 제출 전일 현재 신주교부 방식의 주식매수선택권 총 1,014,678주 중 234,300주를 보유하고 있어 신주교부 방식의 주식매수선택권 총 행사를 가정 할 시 지분율은 23.33%(금번 유상증자 4,800,000주 포함 전량 미청약 시 17.14%, 최대주주 배정분의 15% 청약 시 18.04%)까지 변동될 수 있습니다. 그럼에도 불구하고 동사에 대한 적대적 M&A 등의 위험성이 존재하며, 이는 경영진 변동의 위험성으로 이어져 안정적인 경영활동이 어려울 수 있습니다. 투자자분들은 투자 시, 이 점 유의해주시기 바랍니다.
한편, 2022년 03월 10일 기존 최대주주 송순욱의 별세로 인하여, 최대주주가 송순욱 외 1명에서 배우자 송기령으로 변경되었으며, 2022년 09월 20일 상속지분에 대한 상속절차 완료를 완료하였습니다.
증권신고서 제출일 현재, 최대주주는 국세청과 상속세 연부연납 특례 적용 및 납부기한등 연장신청에 대한 관련 서류를 함께 제출하였으며, 연부연납 승인시 분할납부에 따른 이자 포함 약 141억원의 상속세를 2023년부터 2032년까지 10년 동안 매년 9월 말에 분할 납부할 예정입니다. 납세담보로 보유 주식 중 1,456,887주(11.88%)를 공탁하였습니다. 이와 동시에 납부기한 연장 승인 시 2023년 예정된 납부세액을 2024년에 납부할 수 있게 됩니다.
이에 따라, 상속세 납부 자금 및 청약 참여 자금을 마련하기 위해 기존 보유주식을 금번 공모 유상증자 기간 및 유상증자 종료 이후에도 상속세 납부 시기 및 청약 일정에 맞추어 블록딜(장외대량매매)로 매각할 예정입니다. 최대주주 송기령은 신주인수권증서가 상장되기 전에 당시의 시장상황을 고려하여 적정 수준의 할인율을 적용하여 매매할 예정입니다. 매매일정을 신주인수권증서 상장 전으로 계획한 이유는 동 내용을 청약에 참여하는 투자자들이 해당거래를 충분히 인지한 후 신주인수권증서를 거래하게끔 하기 위함입니다. 투자자께서는 유상증자 기간 및 종료 이후에도 최대주주의 블록딜이 예정되어 있음을 유의하시기 바랍니다.
금번 유상증자에서 최대주주 송기령은 증서 매각 대금을 포함한 청약률은 최소 약 15% 내외를 예상하고 있으며 최대주주를 제외한 특수관계인의 청약률은 현재 미정입니다. 최대주주의 증서 청약률은 매각 당시 주가 흐름과 시장 상황에 따라 변동될 수 있습니다. 만약 시장 상황 악화로 인하여 당사의 주가가 하락한다면 증서 매각대금 또한 감소하여 청약률이 낮아질 수 있습니다. 이 경우 청약률 하락으로 인해 지분 희석이 심화될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
3. 기타위험
| 가. 유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다. 당사가 진행하는 금번 유상증자가 예기치 못한 사유로 인해 철회될 경우 당사는 자본 확충을 위하여 무상감자 등 주주에게 손실을 끼치는 방안 등을 진행할 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있습니다. 2023년 1분기 기준 감가상각비 등을 제외한 당사의 월평균 고정비는 1,091백만원으로 보유 현금및현금성자산 4,169백만원 고려했을 시 약 4개월 정도 고정비를 충당할 수 있습니다. 또한, 총 차입금 5,630백만원까지 고려했을 시 금번 유상증자가 실패하거나 주가 하락 등으로 인해 유상증자 자금 규모가 대폭 감소할 경우 유동성 리스크에 직면할 수 있습니다. 이로 인해 기타 운영자금 부족 및 차입금 미상환으로 인한 담보제공자산(토지, 건물)의 담보권 실행을 초래할 수 있습니다. 특히 경상연구개발비 조달이 원활히 되지 않아 진행 예정 중인 임상 및 연구개발이 중단될 수 있으니 이 점 유의하시기 바랍니다. |
금번 주주배정 후 실권주 일반공모 유상증자는 대표주관회사의 잔액인수 방식으로 진행됩니다. 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다.
유상증자 납입 전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가 하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다.
또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있습니다. 2023년 1분기 기준 감가상각비 등을 제외한 당사의 월평균 고정비는 1,091백만원으로 보유 현금및현금성자산 4,169백만원 고려했을 시 약 4개월 정도 고정비를 충당할 수 있습니다. 또한, 총 차입금 5,630백만원까지 고려했을 시 금번 유상증자가 실패하거나 주가 하락 등으로 인해 유상증자 자금 규모가 대폭 감소할 경우 유동성 리스크에 직면할 수 있습니다.
이로 인해 기타 운영자금 부족 및 차입금 미상환으로 인한 담보제공자산(토지, 건물)의 담보권 실행을 초래할 수 있습니다. 특히 경상연구개발비 조달이 원활히 되지 않아 진행 예정 중인 임상 및 연구개발이 중단될 수 있으니 이 점 유의하시기 바랍니다.
| 나. 주가희석화 및 인수인의 실권주 인수분 물량 출회에 따른 주가하락 위험 신주 상장예정일은 유관기관과의 협의에 따라 변경될 수 있으며, 금번 유상증자에 따른 4,800,000주의 유상신주가 코스닥시장에 추가 상장됩니다. 또한, 구주주 청약주식 및 실권주 일반공모 청약시 기관 및 일반 투자자들의 청약으로 추가 발행되는 주식은 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 또한, 대표주관회사가 잔액인수한 물량은 수익을 확정하기 위해 신주상장일 2영업일 전부터 장내에서 대량 매도할 수 있습니다. 이 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 인수한 실권주를 일정 기간 보유하더라도 동 인수물량이 잠재매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사가 최종 실권주를 인수하게 되면 실권주 인수금액의 15%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관회사의 실권주 매입단가는 일반청약자들보다 15% 낮은 것과 같은 결과가 초래되어 대표주관회사의 실권주 매도단가가 신주의 발행가액보다 낮게 될 가능성이 존재합니다. 투자자께서는 이 점을 반드시 유의하여 주시기 바랍니다. |
| [당사 잠재주식수 비율] |
| 구분 | 주식수 |
|---|---|
| 총발행주식수 (A) | 12,256,040주 |
| 주식매수선택권 (B) | 1,014,678주 |
| 총발행주식수 대비 잠재주식수 (B) / (A) | 8.28% |
| 금번 유상증자 발행예정 주식 수 (C) | 4,800,000주 |
| 총발행주식수 및 발행예정 주식 수 대비 잠재주식수 (B) / (A+C) | 5.95% |
| 출처) 당사 제시 |
금번 유상증자에 따른 모집가액은 「증권의 발행 및 공시 등에 관한 규정」 제5-18조에 의거 주주배정 증자 시 가격 산정절차 폐지 및 가격 산정의 자율화에 따라 발행가액을 자유롭게 산정할 수 있으나, (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 적용하여 산정합니다(Ⅰ. 모집 또는 매출에 관한 일반사항, 3. 공모가격 결정방법 참조). 그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 증자에 따른 모집가격 산정시 결정된 1주당 모집가액보다 향후 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 있습니다.
신주 상장예정일은 유관기관과의 협의에 따라 변경될 수 있으며, 금번 유상증자에 따른 4,800,000주의 유상신주가 코스닥시장에 추가 상장됩니다.
한편, 구주주 청약주식 및 실권주 일반공모 청약시 기관 및 일반 투자자들의 청약으로 추가 발행되는 주식은 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다.
또한, 대표주관회사가 잔액인수한 물량은 수익을 확정하기 위해 신주상장일 2영업일 전부터 장내에서 대량 매도할 수 있습니다. 이 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 인수한 실권주를 일정 기간 보유하더라도 동 인수물량이 잠재매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 높습니다. 대표주관회사가 최종 실권주를 인수하게 되면 실권주 인수금액의 15%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관회사의 실권주 매입단가는 일반청약자들보다 15% 낮은 것과 같은 결과가 초래되어 대표주관회사의 실권주 매도단가가 신주의 발행가액보다 낮게 될 가능성이 존재합니다. 투자자께서는 이 점을 반드시 유의하여 주시기 바랍니다.
| 다. 경영환경변화 등에 따른 위험 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 증권신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분이 독자적으로 결정해야 함을 유의하시기 바랍니다. |
당사의 주가는 국내외 주식시장 환경 변화와 같은 외부적 요인에 영향을 받아 변동할 가능성이 존재하며, 당사의 외부적인 경영환경 변화에 따라 당사 실적이 악화될 가능성이 높아질 경우 당사의 주가에 부정적인 영향을 미칠 수 있습니다.
본 건 공모 주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 하며, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소 및 본 신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해서 투자하셔야 합니다.
만일 상기 투자위험요소에 기재한 내용 중 부정적인 요소가 현실화될 경우 당사 및 종속회사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액에 손실이 발생할 수도 있음을 유의하시기 바랍니다.
| 라. 청약 후 추가상장일까지 환금성 제약 및 주가의 급격한 변동에 따른 손실위험 당사의 금번 유상증자로 인한 발행신주는 주금 납입일 이후 코스닥시장에 추가 상장일까지 유동성이 제한될 수 있으며, 추가상장 시점에서 신주발행가액보다 시장의 수준이 낮은 경우 환금성 위험 및 원금 손실의 위험이 있습니다. 본 유상증자 기간동안 주가의 변동이 있을 수 있다는 점, 투자자께서는 유의하여 주시기 바랍니다. |
당사는 코스닥시장 상장법인으로써, 이번 유상증자로 발행되는 신주는 코스닥시장에 상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다. 그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다.
그리고 금번 유상증자로 인해 발행되는 신주가 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장전체의 환경 변화 등에 의한 급격한 주가 하락이 발생할 경우, 투자원금에 대한 손실이 발생할수 있습니다.
| 마. 유상증자 일정 변경 가능성에 따른 위험 본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. |
「자본시장과 금융투자업에 관한 법률」제120조3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
| ※「자본시장과 금융투자업에관한 법률」제120조(신고의 효력발생시기 등) |
|---|
| ① 제119조제1항 및 제2항에 따른 증권의 신고(이하 "증권신고"라 한다)는 그 증권신고서가 금융위원회에 제출되어 수리된 날부터 증권의 종류 또는 거래의 특성 등을 고려하여 총리령으로 정하는 기간이 경과한 날에 그 효력이 발생한다. ② 금융위원회는 증권신고서의 형식을 제대로 갖추지 아니한 경우 또는 그 증권신고서 중 중요사항에 관하여 거짓의 기재 또는 표시가 있거나 중요사항이 기재 또는 표시되지 아니한 경우를 제외하고는 그 수리를 거부하여서는 아니 된다. ③ 제1항의 효력의 발생은 그 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 정부에서 그 증권의 가치를 보증 또는 승인하는 효력을 가지지 아니한다. ④ 증권의 발행인은 증권신고를 철회하고자 하는 경우에는 그 증권신고서에 기재된 증권의 취득 또는 매수의 청약일 전일까지 철회신고서를 금융위원회에 제출하여야 한다 |
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행과정에서 일정이 변경될 수도 있으므로 투자자들께서는 투자 시 이러한 점을 감안하시기 바랍니다.
| 바. 당사의 잘못된 정보 제공 등으로 손해 끼칠 가능성 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있음을 유의하시기 바랍니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
| 「증권관련 집단소송법」제12조(소송허가 요건) |
|---|
| ① 증권관련 집단소송 사건은 다음 각 호의 요건을 갖추어야 한다. 1. 구성원이 50인 이상이고, 청구의 원인이 된 행위 당시를 기준으로 그 구성원이 보유하고 있는 증권의 합계가 피고 회사의 발행 증권 총수의 1만분의 1 이상일 것 2. 제3조제1항 각 호의 손해배상청구로서 법률상 또는 사실상의 중요한 쟁점이 모든 구성원에게 공통될 것 3. 증권관련집단소송이 총원의 권리 실현이나 이익 보호에 적합하고 효율적인 수단일 것 4. 제9조에 따른 소송허가신청서의 기재사항 및 첨부서류에 흠이 없을 것 ② 증권관련집단소송의 소가 제기된 후 제1항제1호의 요건을 충족하지 못하게 된 경우에도 제소(提訴)의 효력에는 영향이 없다. |
당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있습니다. 본 증권신고서 및 투자설명서에 서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의 대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있습니다.
| 사. 유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. |
금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분께서는 이 점 유의하시기 바랍니다.
이 증권신고서의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있으며, 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점 유의하여 투자에 임하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
| 아. 관리감독기준 위반에 따른 위험 최근 상장 기업에 대한 관리감독기준이 강화되는 추세이며, 향후 당사가 상장기업 관리감독기준을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. |
최근 상장 기업에 대한 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다.
특히, 「코스닥시장 상장규정」 제53조(관리종목), 「코스닥시장 상장규정」 제54조(형식적 상장폐지) 및 「코스닥시장 상장규정」 제56조(상장적격성 실질심사에 다른 상장폐지)"에 유의하시기 바랍니다.
자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융감독법규정보시스템(http://law.fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| [코스닥시장 관리종목 지정요건 및 상장폐지요건 & 해당여부 검토] |
| 구 분 | 관리종목 지정(「코스닥시장 상장규정」 제53조) | 상장폐지(「코스닥시장 상장규정」 제54조, 제56조) | 회사현황 | 관리종목 해당여부 | 항목별 지정유예 종료시점 |
||
|---|---|---|---|---|---|---|---|
| 사업연도 | 금액(백만원)/ 비율(%) /내용 |
지정요건 | 지정유예 | ||||
| 1) 매출액 미달(별도) |
최근 사업연도 30억 원 미만 (지주회사는 연결기준) |
2년 연속 매출액 30억 원 미만 [실질심사] 이익미실현기업 관련 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
2022년 | 396 | 해당 | 해당 | 2024.12.31 |
| 2) 법인세비용차감전 계속사업손실(연결) | 최근 3사업연도중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 - 기술성장기업은 상장후 3년간 미적용 |
관리종목 지정후 자기자본50% 이상(&10억 원 이상)의 법인세비용차감전계속사업손실 발생 [실질심사] 이익미실현기업 관련, 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억 원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
2022년 2021년 2020년 |
-22,930 / 93.5% -22,519 / 50.4% -9,633 / 15.2% |
해당 | 해당 | 2022.12.31 |
| 3) 자본잠식 등 | 다음의 어느 하나에 해당하는 경우 A) 최근 사업연도말을 기준으로 자본잠식률 50%이상 B) 최근 사업연도말을 기준으로 자기자본 10억 원 미만 |
가)최근 사업연도말 현재 완전자본잠식의 경우 나)(A) 관리종목 지정후 도래하는 사업연도말 자본잠식률이 50%이상인 경우 다)(B) 관리종목 지정후 도래하는 사업연도말 자기자본이 10억 원 미만인 경우 [실질심사] 사업보고서 또는 반기보고서의 법정제출 기한까지 당해 상장폐지 기준 해당사실을 해소하였음을 입증하는 재무제표 및 이에 대한 감사인(정기재무제표에 대한 감사인과 동일한 감사인에 한함)의 감사보고서를 제출하는 경우 가~다목까지의 규정을 적용하지 않음. |
2022년 | 자본잠식상태가 아님 자기자본 24,511 (비지배지분 제외) |
미해당 | 미해당 | - |
| 5) 시가총액 미달 | 보통주 시가총액 40억 원 미만 30일간 지속 -천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
관리종목 지정후 90일 기간 경과하는 동안 i) 시가총액 40억 이상으로 10일 이상 계속 ii) 시가총액 40억 이상인 일수가 30일 이상 둘중 하나라도 충족하지 못하면 상장폐지 |
증권신고서 제출 전일 기준 |
해당사항 없음 | 미해당 | 미해당 | - |
| 6) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않거나, 정기주총에서 재무제표 미승인 or 정기주총 미개최할 경우 | 관리종목 지정법인이 다음 회차에 다음 어느 하나에 해당하는 경우 가)분기, 반기, 사업보고서를 법정제출기한내에 미제출 나)사업보고서의 법정제출기한까지 정기주주총회를 미개최하거나 정기주주총회에서 재무제표 미승인 다)최근 2년간 3회 이상 분기, 반기, 사업보고서 법정제출기한까지 제출하지 아니한 경우 라)법정제출기한까지 사업보고서를 제출하지 아니한 후 법정제출기한의 다음날부터 10일 이내 사업보고서 미제출 |
2023년 1분기 | 분기보고서 제출일 2023년 05월 15일 |
미해당 | 미해당 | - |
| 7) 불성실공시 | - | [실질심사]1년간 불성실공시 벌점 15점 이상 | 증권신고서 제출 전일 기준 |
해당사항 없음 | 미해당 | 미해당 | - |
| 8) 지배구조 미달 | 최근 사업연도 사업보고서상 A)사외이사의 수가 법에서 정하는 수에 미달 B)법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 |
관리종목 지정법인이 다음 사업연도에 동일한 상태에 해당하는 경우 | 2022년 | 해당사항 없음 | 미해당 | 미해당 | - |
| 9) 거래량 미달 |
분기 월 평균거래량이 유동주식수의 1%에 미달 |
관리종목 지정법인이 다음 분기에도 연속하여 동 규정에 의한 거래량 미달상태가 계속되는 경우 | 2023년 1분기 | 319,423주 / 2.6% | 미해당 | 미해당 | - |
| 10) 주식분산 미달 |
소액주주 200인 미만 or 소액주주지분 20% 미만 |
관리종목 지정법인이 1년 이내에 동 규정에 의한 주식분산기준미달을 해소하지 아니하는 경우 | 2023년 1분기 | 소액주주수 21,603인 소액주주지분 73.31% |
미해당 | 미해당 | - |
| 11) 회생절차 개시신청 | "채무자 회생 및 파산에 관한 법률" 제34조에 의한 회생 절차개시 신청이 있는 경우 | [실질심사] 관리종목 지정법인이 다음의 어느 하나에 해당하는 경우 코스닥시장 상장폐지실질심사위원회의 심사를 거쳐 상장폐지 가)법원의 회생절차개시신청 기각, 회생절차개시결정 취소, 회생계획 불인가 또는 회생절차폐지의 결정 등이 있은 때 나) 실질심사 제출서류 상 투자자 보호를 위하여 중요한 사항이 누락되거나 거짓 기재된 경우 |
증권신고서 제출 전일 기준 |
해당사항 없음 | 미해당 | 미해당 | - |
| 12) 파산신청 | 코스닥시장 상장법인에 대하여 「채무자 회생 및 파산에 관한 법률」 제294조에 의한 파산신청이 있는 경우 | 증권신고서 제출 전일 기준 |
해당사항 없음 | 미해당 | 미해당 | - | |
| 13) 기타 |
- 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 |
- 감사보고서 부적정·의견거절·범위제한한정 - 해산사유(피흡수합병, 파산선고) - 정관 등에 주식양도제한 두는 경우 - 유가증권시장 상장의 경우 - 우회상장시 우회상장관련 규정 위반시(심사종료전 기업결합완료 및 보호예수 위반 등) |
증권신고서 제출 전일 기준 |
해당사항 없음 | 미해당 | 미해당 | - |
| 출처) 한국거래소 |
| 자. 차입공매도 유상증자 참여 제한 관련 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률 시행령」일부개정에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우에만 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 투자자께서는 이 점 유의하시기 바랍니다. |
주권상장법인이 유상증자 계획을 공시한 이후 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우 증자참여를 허용하고 있습니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 이와 관련 유상증자 참여가 제한되는 공매도 시점과 증자참여가 허용되는 예외사유를 시행령에서 정하도록 위임하고 있습니다.
시행령에 따르면, 유상증자 계획이 공시된 다음 날부터, 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지 공매도 한 경우 증자참여가 제한됩니다. (「자본시장과 금융투자업에 관한 법률 시행령」제208조의4제1항)
다만, 다음의 경우 공매도를 통해 발행가격에 부당한 영향을 미쳤다고 보지 않아 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률 시행령」제208조의4제2항).
ⅰ) 마지막 공매도 이후 발행가격 산정 기산일까지 공매도 주문 수량 이상을 증권시장 정규거래시간에 매수(체결일 기준)
ⅱ) 금융위원회가 정하는 기준을 충족한 독립된 거래단위를 운영하는 법인 내에서 공매도를 하지 않은 거래단위가 증자참여
ⅲ) 시장조성 또는 유동성공급을 위한 거래과정에서 공매도
상기 공매도제도 개선 관련 자본시장법 시행령 개정안에 따라, 당사의 주식을 해당 기간 동안 공매도하는 투자자께서는 금번 유상증자 참여가 제한될 수 있음을 유의하시기 바랍니다. 해당 법령과 관련된 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| 차. 재무제표 작성 기준일 이후 재무상황 변동에 따른 위험 본 공시서류 상 재무제표에 관한 사항은 2023년 1분기 재무제표 (K-IFRS 기준) 작성기준일 이후의 변동을 반영하지 않았습니다. 당사는 금번 유상증자를 진행하는 과정에서 투자 의사결정에 중대한 영향을 미칠 것으로 판단되는 변동사항을 향후에도 상세하게 반영하여 공시할 예정입니다. 그럼에도 불구하고, 당사가 중요하지 않다고 판단하여 기재 및 서술을 생략한 사항 중 당사의 기업가치에 영향을 미칠 만한 사건이 없다고 단정할 수는 없어 주기적이고 면밀한 검토가 필요합니다. |
본 공시서류에 기재된 재무제표에 관한 사항과 감사인의 의견에 관한 사항은 2023년 1분기 재무제표 작성기준일 이후의 변동을 반영하지 않았으므로 투자에 유의하시기 바랍니다.
다만, 본 공시서류에 기재된 재무제표의 작성기준일 이후 본 공시서류 제출일 사이에 발생한 것으로 증권신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익사항에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다.
당사는 금번 유상증자를 진행하는 과정에서 투자 의사결정에 중대한 영향을 미칠 것으로 판단되는 변동사항을 향후에도 상세하게 반영하여 공시할 예정입니다. 그럼에도 불구하고, 당사가 중요하지 않다고 판단하여 기재 및 서술을 생략한 사항 중 당사의 기업가치에 영향을 미칠 만한 사건이 없다고 단정할 수는 없어 주기적이고 면밀한 검토가 필요합니다. 투자자께서는 이 점 유의하시기 바랍니다.
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 「금융투자회사의 기업실사 모범규준」에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 한양증권(주)입니다. 발행회사인 에스씨엠생명과학(주)는 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 금융투자업자(분석기관) | |
|---|---|---|
| 회 사 명 | 고 유 번 호 | |
| 대표주관회사 | 한양증권(주) | 00162416 |
2. 분석의 개요
대표주관회사인 한양증권(주)는 「자본시장과 금융투자업에 관한 법률」 제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한 「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 지분증권, 채무증권 증권신고서를 대상으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사가 기업실사 과정을 통해 발행회사부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
| 「금융투자회사의 기업실사 모범규준」 |
|---|
| 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 '리스크관리위원회 등')의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요 내용
| 일자 | 실사내용 |
|---|---|
| 2023-05-16 | 초도방문 - 상견례 인사 - 유상증자 의사 및 자금조달 관련 논의 - 유상증자 필요성 검토 및 주요일정 협의 - 공시 및 뉴스 내용 등을 통한 발행회사 및 소속산업 사전 조사 - 사업내용 청취 및 주요제품 열람 - 실사 사전 요청자료 송부 |
| 2023-05~17 2023-05-26 |
실사자료 요청 - 실사 요청자료 송부 회사 일반사항 관련 검토 - 정관검토 및 이사회 등 상법 절차 확인 - 경영진 평판 리스크 검토 - 회사의 사업 및 영업구조 관련 면담 |
| 2023-05-27~ 2023-06-02 |
회사방문 - 실무진 상견례 회사 기본사항 검토 - 정관 등 기본자료 수령 - 자금 사용 목적 등에 관한 의견 청취 - 발행 방식 및 조건 등에 관한 협의 - 금융당국으로부터의 제재조치 여부 확인 - 근로기준법 위반행위, 소송진행 여부 확인 산업에 관한 사항 검토 - 산업 경쟁상황, 시장규모, 성장주기 등 확인 - 법률 및 정부규제에 관한 사항 검토 - 시장 내 중대한 환경, 제도 변화요인 검토 회사 지배구조에 관한 사항 검토 - 경영진의 변동내역 및 근무경력 검토 - 계열회사에 관한 사항 검토 - 최대주주의 지분율 및 경영권 안정성 검토 - 사내규정 및 내부통제시스템 확인 - 공시시스템 검토 및 담당자 면담 |
| 2023-06-02 ~ 2023-06-05 |
영업에 관한 사항 검토 - 제품별 매출 현황, 부문별 수익성추이 확인 - 외주업체 관한 사항 - 향후 투자계획에 관한 사항 - 향후 수익성 개선, 원가절감 계획에 관한 사항 재무에 관한 사항 검토 - 매출채권, 재고자산 현황 및 연령분석 - 기타채권 현황 및 회수 내역 분석 - 유형자산 취득/처분 현황 분석 - 수익성/성장성/안정성 지표 분석 - 차입금의 적정성 여부 분석 - 차입금 연장 가능성 및 협의, 상환일정 등 - 지급보증 등의 우발채무현실화에 따른 동사의 유동성 분석 - 현금흐름 구조 기타 사항 검토 - 발행시장 상황 검토 - 최대주주 및 특관자 참여여부 검토 - 자금 조달금액, 공모가액의 적정성 검토 |
| 2023-06-07 ~ 2023-06-09 |
- 실사 추가 자료 요청 - 증권신고서 작성에 대한 조언 - 이사회의사록 검토/인수계약서 작성 및 검토 - 실사이행보고서 작성 및 증권신고서 검토 |
4. 기업실사 참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 한양증권(주) | 기업금융부 | 유문성 | 이사 | 증자업무 총괄 | 2023년 05월 16일 ~ 2023년 06월 09일 | 기업금융업무 19년 |
| 한양증권(주) | 기업금융부 | 정경훈 | 차장 | 실사책임 및 검토 | 2023년 05월 16일 ~ 2023년 06월 09일 | 기업금융업무 11년 |
| 한양증권(주) | 기업금융부 | 장창환 | 대리 | 기업실사 및 서류작성 등 | 2023년 05월 16일 ~ 2023년 06월 09일 | 기업금융업무 5년 |
| 한양증권(주) | 기업금융부 | 윤상호 | 주임 | 기업실사 및 서류작성 등 | 2023년 05월 16일 ~ 2023년 06월 09일 | 기업금융업무 2년 |
[ 발행회사 ]
| 소속 | 부서 | 성명 | 직급 | 담당업무 |
|---|---|---|---|---|
| 에스씨엠생명과학 | - | 손병관 | 대표이사 | 경영총괄 |
| 에스씨엠생명과학 | - | 오형남 | 전무 | IR/PR총괄 |
| 에스씨엠생명과학 | ESG경영본부 | 이종철 | 전무 | ESG 재무총괄 |
| 에스씨엠생명과학 | 첨단바이오의약품본부 | 함동식 | 상무 | 제조임상총괄 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 한양증권(주)는 에스씨엠생명과학(주)가 2023년 06월 09일 이사회에서 결의한 기명식 보통주 4,800,000주에 대한 주주배정 후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 | ▶ 동사의 만성 이식편대숙주질환 줄기세포치료제 SCM-CGH 및 중등증-중증 급성 췌장염 줄기세포치료제 SCM-AGH는 개발단계 희귀의약품으로 지정되어, 임상 2상 종료 후 유효성이 입증되면 조건부 품목허가가 가능합니다. ▶ 중등증-중증 아토피 피부염 줄기세포치료제 SCM-AGH는 2023년 5월 임상 1/2상 결과를 발표하였으며, 국내에서 (주)한독이 임상 3상을 담당하고 해외에서는 글로벌 제약회사와 공동 개발이나 기술이전을 추진할 계획입니다. |
| 부정적 요인 |
▶ 동사의 노력에도 불구하고 사업환경이 급격히 악화되어 해당 요건별 유예기간이 경과한 시점에도 동사의 매출이 저조하여 재무성과를 나타내지 못할 경우 관리종목으로 지정 또는 상장폐지 요건에 해당할 수 있습니다. ▶ 동사의 이자보상배율은 지속적으로 1배 미만을 기록하여 영업을 통해 손실이 지속적으로 발생하고 있어 이자비용을 충당하지 못하는 상황입니다. 이는 동사의 채무상환능력이 취약하다는 것을 나타내며, 미미한 매출 수준으로 인해 영업 적자가 심화되고 있음에 기인합니다.
|
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 채무상환자금, 운영자금(임상시험비용, 연구개발비용) 등으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
다. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다. 또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2023년 06월 09일 |
| 대표주관회사 : 한양증권 주식회사 |
| 대표이사 임 재 택 |
V. 자금의 사용목적
가. 자금조달금액
|
(단위 : 원) |
|
구 분 |
금 액 |
|---|---|
|
모집 또는 매출총액(1) |
21,120,000,000 |
|
발행제비용(2) |
450,000,000 |
|
순 수 입 금 [ (1)-(2) ] |
20,670,000,000 |
|
주1) 상기 금액은 1차 발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. |
나. 발행제비용의 내역
|
(단위 : 원) |
|
구 분 |
금 액 |
계산근거 |
|---|---|---|
|
발행분담금 |
3,801,600 |
모집총액의 0.018% (10원 미만 절사) |
|
인수수수료 |
380,160,000 |
납입금액의 1.8% |
|
상장수수료 |
4,380,000 | 430만원 + 300억원 초과금액의 10억원당 8만원 |
|
등록세 |
9,600,000 |
증자 자본금의 0.4% |
|
교육세 |
1,920,000 |
등록세의 20% |
|
기타비용 |
50,138,400 |
구주주 청약서, 투자설명서 인쇄 및 발송비 등 |
|
합 계 |
450,000,000 |
- |
| 주1) 상기 금액은 1차 발행가액을 기준으로 산정한 금액입니다. |
| 주2) 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가, 유관기관 정책 등에 따라 변동될 수 있습니다. |
| 주3) 기타비용은 예상금액으로 변동될 수 있습니다. |
| 주4) 발행제비용은 공모금액에서 지급될 예정입니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사는 금번 유상증자를 통해 조달한 자금을 다음과 같이 사용할 예정입니다.
| (기준일 : | 2023년 07월 07일 | ) | (단위 : 원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 15,040,000,000 | 5,630,000,000 | - | 450,000,000 | 21,120,000,000 |
나. 공모자금 세부 사용목적
당사는 금번 유상증자로 조달한 자금에 대해여 다음과 같이 채무상환자금, 임상비용, 연구개발비용 등의 운영자금으로 사용할 예정입니다. 만약 금번 유상증자의 공모금액이 당초 계획한 금액에 미달할 경우 당사는 아래에 표기한 자금사용계획 우선순위에 따라 집행 시기를 고려하여 세부적으로 조정할 예정이며, 부족분 및 차입금 이자는 당사의 자체자금으로 충당할 계획입니다. 금번 유상증자를 통한 공모자금의 세부 사용 내역은 아래와 같습니다.
|
[유상증자 자금사용의 우선순위] |
|
(단위 : 백만원) |
| 우선순위 | 자금용도 | 세부 내용 | 금액 |
|---|---|---|---|
| 1 | 채무상환자금 | 장/단기 차입금 상환 | 5,630 |
| 2 | 운영자금 | 만성이식편대숙주질환 임상 2상 정산비용과 임상시험용 및 조건부 시판용 의약품 제조비용 | 2,940 |
| 3 | 운영자금 | 중등증-중증 급성 췌장염 임상2b 비용과 임상시험용 의약품 제조비용 | 7,360 |
| 4 | 운영자금 | 중등증-중증 아토피피부염 임상1/2상 정산비용 | 920 |
| 5 | 운영자금 | 인하대병원 등 병원 전용 연구비용 | 2,040 |
| 6 | 운영자금 | 질환특이적 고순도/고효능 줄기세포치료제의 작용기전/치료 효능 성과기반 확립 | 1,780 |
| - | 기타자금 | 발행제비용 | 450 |
| 합계 | 21,120 | ||
| 출처) 당사 제시 |
1. 채무상환자금
|
[차입금 상세 내역] |
|
(단위 : 백만원) |
| 구분 | 차입처 | 내역 | 이자율(%) | 당기말 |
|---|---|---|---|---|
| 단기차입금 | 기업은행 | 중소기업자금대출 | 6.36% | 1,000 |
| 중소기업자금대출 | 6.60% | 1,000 | ||
| 장기차입금 | 기업은행 | 중소기업시설자금대출 | 5.90% | 3,630 |
| 합계 | 5,630 | |||
| 출처) 당사 제시 |
당사는 현재 기업은행으로부터 총 5,630백만원의 장/단기 차입금을 사용하고 있고 토지와 건물에 6,756백만원의 담보가 제공되어 있습니다. 이번 유상증자 자금조달로 장/단기 차입금을 일시에 상환함으로써 이자비용을 절감하고 재무구조 건전성을 확보하고자 합니다.
2. 운영자금
1) 임상비용
가. 만성 이식편대숙주질환(Graft-Versus-Host Disease, GvHD) 줄기세포 치료제(SCM-CGH)
|
[만성 이식편대숙주질환(Graft-Versus-Host Disease, GvHD) 줄기세포 치료제(SCM-CGH) 임상비용 사용 계획] |
|
(단위 : 백만원) |
| 구분 | 2023년 상반기 | 2023년 하반기 | 2024년 상반기 | 2024년 하반기 | 소요예산 |
|---|---|---|---|---|---|
| 실시기관 임상시험 위탁비용 정산비용(11개 기관) | - | 1,300 | 1,300 | - | 2,600 |
| 실시기관_LTFU_임상시험 위탁비용(11개 기관) | 10 | 20 | 20 | 50 | 100 |
| 임상시험 Audit 비용 | - | 20 | - | - | 20 |
| SCL 헬스케어 검체분석 및 검체운송 비용 | - | 50 | 50 | - | 100 |
| CRO 임상시험 업무 위탁비용_PTC | - | 50 | 50 | - | 100 |
| NDA 업무 위탁비용_RA | - | - | - | 20 | 20 |
| 품목허가 신청 비용(수수료 등) | - | - | - | - | 2,940 |
| 임상시험용 및 조건부 시판용 의약품 제조비용 | - | - | - | - | |
| 합계 | 10 | 1,440 | 1,420 | 70 |
| 출처) 당사 제시 |
이식편대숙주질환(Graft-Versus-Host Disease, GvHD)은 동종 조혈모세포 이식이나 수혈을 받은 경우에 환자에게 이식된 세포(또는 골수)가 환자의 세포를 자기 몸의 것이 아닌 것으로 인식하여 표적 기관을 공격함으로써 나타나는 질환입니다. 1차 치료로 스테로이드 요법이 주로 사용되나, 장기간 스테로이드 사용으로 인한 다양한 부작용과 스테로이드에 불응하는 환자들이 증가하고 있어 현재까지 전문 치료제는 존재하지 않습니다.
최근 혈연관계가 없는 사람들간의 조혈모줄기세포 이식 수요증가로 만성 이식편대숙주질환 환자 수가 지속적으로 증가하고 있어 치료제 개발의 수요가 매우 높습니다. 'Allied Market Research' 2022년 보고서에 따르면 글로벌 이식편대숙주질환 시장은 연평균 13.5% 성장률로 2021년 약 30억 달러에서 2031년 약 104억 달러에 이를 것으로 평가되고 있습니다.
반면, 당사의 만성 이식편대숙주질환 줄기세포치료제 SCM-CGH는 현재 84명의 임상 대상자를 모두 확보했으며, 모집된 대상자의 데이터 수집을 2024년 02월까지 완료하고 이후 결과 분석을 진행할 계획입니다. SCM-CGH는 2019년 「약사법」에 따른 개발단계 희귀의약품으로 지정되어, 임상 2상 종료 후 유효성이 입증되면 조건부 품목허가가 가능합니다.
나. 중등증-중증 급성 췌장염 줄기세포 치료제(SCM-AGH)
|
[중등증-중증 급성 췌장염 줄기세포 치료제(SCM-AGH) 임상비용 사용 계획] |
|
(단위 : 백만원) |
| 구분 | 2023년 상반기 | 2023년 하반기 | 2024년 상반기 | 2024년 하반기 | 소요예산 |
|---|---|---|---|---|---|
| 1/2a상 임상시험 CRO 비용 정산 | 150 | 180 | 330 | ||
| 1/2a상-장기추적 CRO 비용 | 20 | 20 | 20 | 20 | 80 |
| 1/2a상-장기추적 실시기관 비용 | 2 | 2 | 2 | 3 | 9 |
| 2b상 임상시험 CRO 비용 | 100 | 240 | 200 | 200 | 740 |
| 2b상 임상시험 실시기관 환자모집 및 투여 비용 | - | 500 | 550 | 750 | 1800 |
| 2b상 임상시험 Central lab 계약비용 | - | 70 | 70 | 70 | 210 |
| 2b상 임상시험 보험비용 | - | 30 | 40 | 40 | 110 |
| 2b상 임상시험 IP 운송 vendor 계약비용 | - | 35 | 55 | 60 | 150 |
| 2b상 연구자 미팅, 식약처 민원신청 등 임상행정처리 비용 | 2 | 3 | 5 | 5 | 15 |
| 2b상-장기추적 CRO 비용 | - | 50 | 100 | 100 | 250 |
| 2b상-장기추적 실시기관 환자 follow-up 비용 | - | 20 | 20 | 20 | 160 |
| 2b상-장기추적 보험비용 | - | 2 | 2 | 2 | 6 |
| 조건부품목허가 업무 위탁비용 | - | - | |||
| 임상시험용 의약품 제조비용 | - | 1,200 | 1,200 | 1,200 | 3,600 |
| 합계 | 274 | 2,352 | 2,264 | 2,470 | 7,360 |
| 출처) 당사 제시 |
급성 췌장염은 담석이나 과음 등의 원인에 의해 췌장의 자가 소화로 염증이 발생하는 질환으로, 현재까지 급성 췌장염의 치료는 통증 조절을 목적으로 하는 진통제 투여, 수액 및 영양 공급 등의 보존적 치료가 주 치료법이며, 단백분해효소 억제제, 췌장분비억제제 등이 연구되고 있으나, 확실한 효능을 나타내는 약물은 개발되지 않았습니다.
'Market Research Future' 2019년 보고서에 따르면, 급성 췌장염의 글로벌 시장 규모는 연평균 성장률 5.90%로 2022년 55억달러에서 2030년 82억 달러로 평가되며, 알코올 소비 증가로 발병률이 해마다 늘고 있는 추세입니다. 경쟁제품으로 단백분해효소 억제제인 Futhan inj.가 국내에서 허가되어 처방되고 있으나, 직접 치료제가 아닌 증상 개선제로 사용하고 있어, 현재까지 전문 치료제는 개발되지 않은 상황입니다.
당사는 중등증 이상의 급성 췌장염 환자를 대상으로 한 제1/2a상 임상시험을 진행하여 줄기세포치료제 SCM-AGH의 안전성을 확인하였으며, 제2a상 임상시험을 통해 급성 췌장염 환자의 초기 염증 조절 효과를 확인하였습니다. 해당 2a상 결과는 국제 학술지 소화기학(Gastroenterology)에 논문이 게재되었습니다.(Volume 164, Issue7, P1317-1320.E2, JUNE 2023)
해당 결과를 바탕으로 당사는 중등 중증 이상의 급성 췌장염 환자를 대상으로 한 제2b상 임상시험을 계획하고 있으며, 2023년 내 식품의약품안전처의 임상시험계획(IND) 승인을 목표로 하고 있습니다. 또한 SCM-AGH는 2020년 10월 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」에 의거하여 개발단계 희귀의약품으로 지정을 받아, 제2b상 임상시험을 통해 유효성을 입증한다면 향후 조건부 품목허가가 가능합니다.
다. 중등증-중증 아토피 피부염 줄기세포치료제(SCM-AGH)
|
[중등증-중증 아토피 피부염 줄기세포 치료제(SCM-AGH) 임상비용 사용 계획] |
|
(단위 : 백만원) |
| 구분 | 2023년 하반기 | 2024년 상반기 | 2024년 하반기 | 소요예산 |
|---|---|---|---|---|
| 1/2상 임상시험 CRO 비용 정산 | 800 | - | - | 800 |
| 정기추적관찰조사 임상시험 CRO 비용 | 40 | 40 | 40 | 120 |
| 합계 | 840 | 40 | 40 | 920 |
| 출처) 당사 제시 |
아토피 피부염은 복합적인 원인의 면역체계 이상으로 발생하는 만성적인 피부질환으로, 일상생활이 불가한 심한 가려움증으로 고통스러운 질환입니다. 지속적으로 환자 수는 증가하지만, 환자 유형에 따라 치료방법도 달라 치료에 어려움이 있으며, 국소요법 조절의 한계로 전신요법의 완치개념 치료제가 필요한 현실입니다.
'Grand View Research' 2022년 보고서에 따르면, 글로벌 아토피성 피부염 치료제 시장 규모는 2022년부터 2030년까지 연평균 9.0% 성장하여, 2030년 약 277억 달러에 달할 것으로 평가되고 있습니다. 경쟁제품으로 국소치료제로 증상이 조절되지 않거나 기존 약물 사용이 어려운 환자의 치료제로 승인받은 단일클론항체 치료제인 사노피아벤티스의 '듀피젠트'와 자가면역질환 치료에 사용되어 온 야누스 인산화효소(JAK) 저해제 계열인 '올루미언트'와 '린버크'가 있습니다.
2023년 05월 당사의 중등증-중증 아토피 피부염 줄기세포 치료제의 제1/2상 임상시험이 완료됨에 따라 해당 결과보고서 작성을 위해 해당 CRO 업체의 잔여 비용을 정산하고자 합니다.
2) 연구비용
가. 인하대병원 등 병원 전용 연구비용
|
[병원 전용 연구비용 사용 계획] |
|
(단위 : 백만원) |
| 구분 | 2023년 하반기 | 2024년 상반기 | 소요예산 |
|---|---|---|---|
| 인하대병원 전용 연구비 | 400 | 400 | 800 |
| 순천향대병원 전용 연구비 | 400 | 400 | 800 |
| 비임상실험 연구/검토비용 | 400 | 240 | 440 |
| 합계 | 1,200 | 1,040 | 2,040 |
| 출처) 당사 제시 |
해외에서 임상이 진행된 프로젝트를 라이선스 인(In licensing)하여 국내에서 임상을 진행하는 것이 사실 상 실패 확률이 높다는 사실과 궁극적으로 병원에서 쓰지 않는 치료제 개발은 회사에 오랜 시간의 낭비와 막대한 재무적 손실을 미친다는 사실을 보게 되면서, 당사는 2022년 10월 인하대학교 및 인하대학교 의과대학 부속병원과 전략적 기술사업화 추진에 대한 공동 업무협약을 체결하였습니다.
본 계약의 주된 목적은 병원 현장에서 발생하는 환자와 의사의 Unmet needs를 파악하여 케미컬의약품의 한계영역인 희귀질환에 대한 줄기세포 치료제를 연구개발하여 사업화를 추진하는데 있습니다.
미국 병원에서는 Partners Innovation Fund, Mayo Clinic Ventures, Cleveland Clinic Ventures 등과 같이 병원 자체 벤처캐피탈을 설립하여 기술사업화를 직접 추진하는 것처럼, 에스씨엠생명과학㈜이 인하대/인하대병원에서 그 역할을 담당하게 되고 다른 병원까지 점진적으로 확대해 나갈 예정입니다.
에스씨엠생명과학㈜은 병원 전용 연구비를 통하여, 무의미한 연구비/시간을 선제적으로 절감하고 의료현장에서 꼭 필요한 치료제 개발에 집중할 수 있는 노하우와 역량을 확보하게 되었습니다. 2023년 하반기부터 병원 내부의 기술사업화 추진 조직과 구체적인 업무 진행을 통하여 병원 현장에서 필요한 치료제 후보 분야를 조기에 파악하고 고순도/고효능 줄기세포 적용여부를 적시에 검토하여 잠재적 파이프라인 연구 후보군을 확보하고자 합니다.
나. 질환특이적 고순도/고효능 줄기세포치료제의 작용기전/치료 효능 성과기반 확립
|
[중등증-중증 아토피 피부염 줄기세포 치료제(SCM-AGH) 임상비용 사용 계획] |
|
(단위 : 백만원) |
| 구분 | 2023년 하반기 | 2024년 상반기 | 2024년 하반기 | 소요예산 |
|---|---|---|---|---|
| 세포뱅킹기술 - 자동화 | 100 | 80 | 50 | 230 |
| 세포분리기술 - 자동화 | 100 | 80 | 50 | 230 |
| 세포배양기술 - 자동화, Xeno-Free | 100 | 70 | 50 | 220 |
| 대량생산공정 - 자동화 | 100 | 70 | 50 | 220 |
| 효능평가기술 - 질환 맞춤형 세포주 스크리닝 플랫폼 | 100 | 70 | 50 | 220 |
| 중등증-중증 급성췌장염 치료기전 후속연구 | 100 | 70 | 50 | 220 |
| 중등증-중증 아토피피부염 치료기전 후속연구 | 100 | 70 | 50 | 220 |
| 만성이식편대숙주질환 치료기전 후속연구 | 100 | 70 | 50 | 220 |
| 합계 | 800 | 580 | 400 | 1,780 |
| 출처) 당사 제시 |
2023년 범부처재생의료기술개발사업단에게 제시한 '국내 재생의료 중장기 로드맵 2035'에서, 줄기세포 치료제는 재생의료 분야에서 중추적 역할을 담당하고 있습니다.
이에 따라 당사는 세포뱅킹기술, 세포분리기술, 세포배양기술, 효능평가기술 부분에서 자동화, 대량화, 동물/사람 유래성분을 포함하지 않는(Xeno-Free) 공정설계에 대해서 집중적으로 연구/개발하여 생산품질관리기술의 자동화/표준화를 조기에 구축하여 완료하려고 합니다.
이러한 성과로, 당사는 임상 2상 결과가 발표됨에 따라 규명된 작용기전을 토대로 임상데이터 후속연구를 진행하여 임상 3개 파이프라인의 다양한 치료기전을 파악하고 이를 논문화하여 글로벌 기술이전에 필요한 임상/연구 데이터를 지속적으로 확보하려고 합니다. 또한 병원 전용 연구비 투자에서 발굴된 후보 임상 파이프라인에 대한 비임상실험도 진행하여 연구데이터를 지속적으로 확보해 나가고자 합니다.
3. 자금의 운용계획
당사가 금번 유상증자를 통해 조달한 자금 중 일부 자금은 조달시기와 사용시기가 다소 차이가 있을 수 있습니다. 이에 조달로부터 사용시까지 미사용 자금에 대해서는 자금 사용시점 및 금리에 따라 적격 금융기관의 수시입출금 예금, 정기예금 등 금융상품으로 운용할 예정입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
해당사항 없습니다.
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
당사는 원천기술인 층분리배양법 기반의 차세대 고순도 고효능 줄기세포치료제와 조직공학치료제를 개발하는 줄기세포치료제 전문 기업입니다. 줄기세포치료제 개발을 위해 현재 만성 이식편대숙주질환, 중등증-중증 급성 췌장염, 중등증-중증 아토피 피부염 2상 임상들을 국내에서 완료 또는 진행 중이며, 조직공학치료제로는 미국 유타대학교와 공동연구로 Cell Sheet를 이용한 섬유화증 치료제를 개발 중입니다. 또한 2022년 10월 31일, 인하대병원 및 인하대학교와 기술사업화 추진에 대한 공동업무협약이 체결되어, 인천 송도 바이오클러스터 차원에서 산학연병의 연구성과가 사업화 성과로 창출하는데 당사의 ESG 경영 역량이 기여할 수 있게 되었습니다.
가. 연결대상 종속회사 개황
가-1. 연결대상 종속회사 현황(요약) : 해당사항 없음
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | - | - | - | - | - |
| 합계 | - | - | - | - | - |
※상세 현황은 '상세표-1. 연결대상 종속회사 현황(상세)' 참조
가-2. 연결대상회사의 변동내용 : 해당사항 없음
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
나. 회사의 법적ㆍ상업적 명칭
당사의 명칭은 "에스씨엠생명과학 주식회사"이며, 영문으로는 "SCM Lifescience, Inc."로 표기합니다.
다. 설립일자
당사는 2014년 07월 02일에 설립되었습니다.
라. 본사의 주소, 전화번호, 홈페이지 주소
| 구 분 | 내 용 |
|---|---|
| 주소 | 인천광역시 연수구 갯벌로 145번길 7-7 (송도동) |
| 전화번호 | 032-881-3600 |
| 홈페이지 주소 | http:// www.scmlifescience.com |
마. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
바. 대한민국에 대리인이 있는 경우에는 이름(대표자), 주소 및 연락처
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
사. 주요 사업의 내용 및 향후 추진하려는 신규사업
당사는 현재 독자적인 줄기세포분리기술인 '층분리배양법'을 기반으로 줄기세포치료제를 연구개발하고 있으며, 2022년 10월 인하대학교, 인하대병원과의 전략적 기술사업화 추진 공동 업무 협약 체결을 기반으로 에스씨엠생명과학의 고순도, 고효율 줄기세포를 연계한 다분야 연구를 추진 중에 있습니다. 기타 자세한 사항은 『Ⅱ. 사업의 내용』 부분을 참고하시기 바랍니다.
당사의 정관에 기재된 목적 사업은 아래와 같습니다.
| 목 적 사 업 | 비 고 |
|---|---|
| 1. 의약품, 원료의약품, 의약품 제조, 소분 및 판매 2. 생물학적제제 등의 제조 및 판매 8. 기술이전 및 지적재산권 사업 9. 줄기세포추출, 배양, 보관 및 판매 10. 화장품 제조 및 판매 11. 화장품 원료 제조 및 판매 13. 전자상거래 및 통신판매 15. 위 각 호와 관련되거나 필요하거나 부수되는 일체의 사업 |
영위하고 있는 사업 |
| 3. 임상시험, 분석, 통계, 자문, 교육 및 대행 서비스업 4. 각종 질병 예방을 위한 백신의 연구개발 및 생산제조 5. 동물용 의약품 등 제조 및 판매 6. 건강보조식품 제조, 소분 및 판매 7. 연구개발 용역을 포함한 제반 서비스 및 컨설팅 12. 엑셀러레이팅(투자, 인큐베이팅), 투자업무 14. 위 각 호의 사업 관련 수출입, 무역 및 무역대리 |
영위하고 있지 않는 사업 |
아. 신용평가에 관한 사항
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
자. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)여부 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 등 여부 |
특례상장 등 적용법규 |
|---|---|---|---|
| 코스닥 시장 | 2020년 06월 17일 | 기술성장기업의 코스닥시장 상장 | 코스닥시장 상장규정 제2조 제1항 제39호에서 정하는 기술성장기업으로서, 동 규정 제30조 기술성장기업에 대한 특례 적용 |
2. 회사의 연혁
가. 회사의 본점소재지 및 그 변경
| 연 월 | 소재지 | 비고 |
|---|---|---|
| 2014,07 | 인천광역시 중구 서해대로 366, 310호(신흥동3가, 정석빌딩) | 설립 |
| 2020.06 | 인천광역시 연수구 갯벌로 145번길 7-7 (송도동) | 이전 |
나. 경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2019년 01월 18일 | 임시주총 | 사내이사 오석우, 사외이사 윤건수, 기타비상무이사 레오나드아리프 압둘샤타르 |
- | 사내이사 오형남, 사내이사 정승우, 기타비상무이사 김연준, 기타비상무이사 길준일 |
| 2019년 03월 29일 | 정기주총 | - | - | 감사 조학래 |
| 2019년 06월 14일 | 임시주총 | 감사 정선영 | - | - |
| 2019년 10월 22일 | 임시주총 | 사외이사 이희성 | - | 사외이사 윤건수 |
| 2020년 03월 31일 | 정기주총 | 사외이사 최희주 | - | - |
| 2020년 07월 02일 | - | - | 사내이사 송순욱 | - |
| 2021년 03월 26일 | 정기주총 | - | 대표이사 이병건 | - |
| 2021년 11월 12일 | - | 대표이사 송순욱 | - | 대표이사 이병건 (사임) |
| 2022년 03월 28일 | 정기주총 | 사내이사 오형남, 사내이사 이종철, 사외이사 문종호, 기타비상무이사 송기령 |
감사 정선영, 기타비상무이사 레오나드아리프 압둘샤타르 |
사외이사 최희주 (사임) |
| 2022년 07월 22일 | 임시주총 | 사내이사 손병관 | - | - |
| 2022년 07월 22일 | - | 대표이사 손병관 | - | - |
| 2022년 10월 22일 | - | - | - | 사외이사 이희성 |
| 2023년 03월 29일 | 정기주총 | - | 사외이사 이희성 | - |
주1) 주총종류 항목에서 -은 이사회 결의사항입니다.
다. 최대주주의 변동
| (기준일 : | 2023년 3월 31일 | ) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| 2022년 09월 20일 | 송기령 | 2,771,000 | 22.83 | 상속절차 완료 | 주1) |
| 주1) | 당사는 기존 최대주주 송순욱의 별세(2022년 03월 10일)로 인한 상속절차가 2022년 09월 20일 완료됨에 따라 최대주주가 송기령으로 변경되었습니다. |
라. 상호의 변경
당사는 2022년 3월 28일 영문 사명을 SCM Lifescience Inc.에서 SCM Lifescience, Inc.로 변경하였습니다. 자세한 사항은 해당일 공시를 참조 바랍니다.
마. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행 중인 경우 그 내용과 결과
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
바. 회사가 합병등을 한 경우 그 내용
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
사. 회사의 업종 또는 주된 사업의 변화
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
아. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
| 연 월 | 내 용 |
|---|---|
| 2014.07 | 에스씨엠생명과학 주식회사 설립 |
| 고순도 성체줄기세포 분리기술 특허 등록 (EU 01917348) | |
| 2014.08 | 신선형 및 동결형 줄기세포 제조 방법 특허 등록 (미국 08796020) |
| 2014.10 | 에스씨엠생명과학 주식회사 부설연구소 설립 (제2014115434호) |
| 2014.11 | 인하대학교 산학협력단과 특허 전용실시권 계약 체결 |
| 2015.03 | 1차 투자 유치 (한국투자파트너스 외 2개 기관, 70억원) |
| 2016.02 | 2차 투자 유치 (한국투자파트너스 외 4개 기관, 100억원) |
| 2016.03 | SCM-CGH 만성 이식편대숙주질환 2상 임상시험 계획 승인 |
| 2016.09 | 클로날 중간엽줄기세포를 포함하는 아토피성 피부염 예방 또는 치료용 약학적 조성물 특허 등록 (대한민국 10-1655780) |
| 2017.01 | ISO 9001 인증 취득 |
| 2017.05 | 고순도 줄기세포 분리를 위한 층분리배양법, 보건신기술인증(NET) 획득 (제129호) |
| 2018.03 | SCM-AGH 중증 급성 췌장염 1/2a상 임상시험 계획 승인 |
| 2018.08 | 이병건 대표이사 취임 |
| 보건산업유공자 포상 보건복지부 장관상 수상 | |
| 2018.10 | 미국 유타대학교 CSTEC과 세포시트를 이용한 줄기세포치료제 공동연구 협약 체결 |
| 말레이시아 국영 제약사 Duopharma Biotech Berhad로부터 해외투자 유치 (55억원) 및 기술이전 계약 체결 | |
| 2019.02 | 미국 면역 항암 백신 세포치료제 기업 Argos Therapeutics를 제넥신과 컨소시움으로 공동 인수 |
| 미국 조인트벤처 코이뮨(Colmmune, Inc.) 설립 | |
| 미국 Allele Biotechnology and Pharmaceuticals와 유도만능줄기세포 유래 췌장세포 활용한 당뇨치료제 공동개발 계약 체결 | |
| 2019.05 | 한독과 아토피 피부염 줄기세포치료제에 대한 기술이전 계약 체결 |
| 개량특허 "줄기세포의 층분리 배양 및 증식 방법" 등록 (대한민국 제1984227호) | |
| 2019.06 | 상장 전 투자 유치 (한독 40억원, 산업은행 20억원) |
| 미국 PBS Biotech과 3D 바이오리액터 공정개발 계약 체결 | |
| 송도 신사옥 및 GMP 제조시설 부지 매매계약 체결 | |
| 2019.08 | 송도 신사옥 및 GMP 제조시설 부지 취득 |
| 코스닥시장 기술 특례상장을 위한 기술평가 신청 | |
| 2019.09 | 기술평가 통과 |
| 2019.11 | 연구산업 유공자 과학기술부 장관 표창 |
| 코스닥시장 상장을 위한 상장예비심사 청구 | |
| 2020.01 | 코스닥시장 상장을 위한 상장예비심사 승인 |
| 2020.02 | SCM-AGH 중등증-중증 아토피 피부염 1/2상 임상시험 계획 승인 |
| 2020.06 | 코스닥시장 상장 |
| 본점소재지 변경 (송도) | |
| 2020.07 | 미국 PBS Biotech와 줄기세포 대량생산 공정개발 및 최적화에 대한 계약 체결 |
| 2020.08 | 미국 Tera Immune과 자가면역질환 세포치료제 공동 연구개발을 위한 양해각서(MOU)를 체결 |
| 2020.10 | 대만 Steminent Biotherapeutics와 척수소뇌성 실조증 국내 판권 및 기술이전 계약 체결 |
| 2020.11 | 줄기세포의 층분리 배양 및 증식 방법에 대한 특허 등록 (일본 6786554) |
| 2021.04 | 클로날 줄기세포를 포함하는 췌장염 치료용 약학적 조성물 (한국 10-2247136) |
| 2021.05 | 클로날 줄기세포를 포함하는 이식편대숙주질환 치료용 약학적 조성물 (한국 10-2258890) |
| CXCL1(chemokine (C-X-C motif) ligand 1) 단백질을 유효성분으로 포함하는 탈모 예방 또는 치료용 약학적 조성물 (중국 107693780) | |
| 2021.06 | 줄기세포의 기능강화용 조성물 특허 등록 (한국 10-2268242) |
| 미국 Vita Theraeputics에 유도만능줄기세포 파이프라인 확장을 위한 지분 투자 | |
| 미국 Allele Biotechnology and Pharmaceuticals와 당뇨병 치료제 국내 판권 및 기술이전 계약 체결 | |
| 2021.08 | 조절T세포 매개성 질환의 예방 또는 치료용 약학적 조성물 (미국 11096967) |
| 2021.11 | 이병건 대표이사 사임 |
| 송순욱 대표이사 취임 | |
| hPL 함유 배지에서 배양된 중간엽 줄기세포의 배양액을 포함하는 화장품 조성물에 대한 특허 등록 (한국 10-2323056) | |
| 2021.12 | 단일 클로날 줄기세포를 이용한 아토피 피부염 치료 방법에 대한 특허 등록 (한국 10-2341080) |
| 2022.02 | 줄기세포의 층분리 배양 및 증식 방법 특허 등록 (미국 11248210) |
| 이로로 문양 iroro 상표권 등록 (일본 6520049) | |
| 2022.04 | 종합건축사무소예건사와 CMP 제조소 신축공사 설계용역 계약체결 |
| 2022.05 | NUTREATMENT 문자 상표권 등록 (일본 6559513) |
| 2022.06 | NUTREATMENT 문자 상표권 등록 (중국 60939563) |
| 2022.07 | 손병관 대표이사 취임 |
| 2022.08 | Iroro Nutreatment 상표권 등록 (말레이시아 TM2021026990) |
| SCM Specialized Cell Medicine 상표권 등록 (한국 40-1898236) | |
| 클로날 줄기세포를 포함하는 아토피 치료용 약학적 조성물에 대한 특허 등록 (미국 11413313) | |
| 줄기세포의 층분리 배양 및 증식 방법에 대한 특허 등록 (말레이시아 MY-192390-A) | |
| 2022.09 | 줄기세포의 층분리 배양 및 증식 방법에 대한 특허 등록 (베트남 33654) |
| 듀오파마와 이로로 제품 유통 관련 할랄 개발 계약 체결 | |
| 2022.10 | 인하대학교, 인하대병원, 에스씨엠생명과학 주식회사 전략적 기술사업화 추진 공동 업무 협약 체결 |
| 줄기세포의 층분리 배양 및 증식 방법 특허 등록 (싱가포르 10201805163Y) | |
| 2022.11 | 에스씨엠생명과학(주)-유타대학교 공동연구팀 NIMS 어위드 2022 수상 |
| 2022.12 | 에스씨엠생명과학(주)-유타대학교 공동연구팀 원천기술 중간엽 줄기세포 활용 조직공학 논문 국제 학술지 게재 |
| 국제소화기학술대회(KDDW2022) 중등증-중증 급성 췌장염 줄기세포치료제 임상 결과 발표 및 최우수 초록 수상 | |
| 2023.01 | 염증 자극된 중간엽 줄기세포를 포함하는 면역질환 또는 염증 질환의 예방 또는 치료용 약학적 조성물에 대한 특허 등록 (일본 7212371) |
| 줄기세포 프라이밍 조성물 및 프라이밍된 줄기세포에 대한 특허 등록 (한국 10-2492888) | |
| 2023.03 | 클로날 줄기세포를 포함하는 췌장염 치료용 약학적 조성물에 대한 특허 등록 (대만 I796536) |
3. 자본금 변동사항
가. 자본금 변동추이
| (단위 : 원, 주) |
| 종류 | 구분 | 10기 (1분기말) |
9기 (2022년말) |
8기 (2021년말) |
7기 (2020년말) |
6기 (2019년말) |
|---|---|---|---|---|---|---|
| 보통주 | 발행주식총수 | 12,138,690 | 12,120,570 | 12,021,854 | 11,874,615 | 9,175,646 |
| 액면금액 | 500 | 500 | 500 | 500 | 500 | |
| 자본금 | 6,069,345,000 | 6,060,285,000 | 6,010,927,000 | 5,937,307,500 | 4,586,323,000 | |
| 우선주 | 발행주식총수 | - | - | - | - | 714,828 |
| 액면금액 | - | - | - | - | 500 | |
| 자본금 | - | - | - | - | 357,414,000 | |
| 기타 | 발행주식총수 | - | - | - | - | - |
| 액면금액 | - | - | - | - | - | |
| 자본금 | - | - | - | - | - | |
| 합계 | 자본금 | 6,069,345,000 | 6,060,285,000 | 6,010,927,000 | 5,937,307,500 | 4,943,737,000 |
| 주1) | 2019년도 6월중 보통주 81,711주를 발행하여 40,855,500원의 자본금이 증가하였으며, 우선주130,524주를 발행하여 65,262,000원의 자본금이 증가했습니다. |
| 주2) | 2019년도 9월중 우선주 2,694,403주가 보통주 2,694,403주로 전환되었습니다. |
| 주3) | 2019년도 10월중 무상증자로 보통주 4,586,323주를 발행하여 2,293,161,500원의 자본금이 증가하였으며, 우선주 357,414주를 발행하여 178,707,000원의 자본금이 증가하였습니다. |
| 주4) | 2020년도중 보통주 1,987,141주를 발행하여 993,570,500원의 자본금이 증가하였으며, 우선주 714,828주가 보통주 714,828주로 전환되었습니다. |
| 주5) | 2021년도중 보통주 147,239주를 발행하여 73,619,500원의 자본금이 증가하였습니다. |
| 주6) | 2022년도중 보통주 98,716주를 발행하여 49,358,000원의 자본금이 증가하였습니다. |
| 주7) | 2023년도중 보통주 18,120주를 발행하여 9,060,000원의 자본금이 증가하였습니다. |
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 70,000,000 | 30,000,000 | 100,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 12,138,690 | 3,409,231 | 15,547,921 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | 3,409,231 | 3,409,231 | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | 3,409,231 | 3,409,231 | 보통주 전환 | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 12,138,690 | - | 12,138,690 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 12,138,690 | - | 12,138,690 | - | |
나. 자기주식 취득 및 처분 현황
당사는 해당사항 없음
다. 자기주식 직접 취득/처분 이행현황
당사는 해당사항 없음
라. 자기주식 신탁계약 체결/해지 이행현황
당사는 해당사항 없음
마. 종류주식(명칭) 발행현황
당사는 해당사항 없음
5. 정관에 관한 사항
가. 정관의 최근 개정일
정관의 최근 개정일은 제9기 정기주주총회일인 2023년 3월 29일입니다.
나. 정관변경이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2021년 03월 26일 | 제7기 정기주주총회 |
제1조(상호) 제2조(목적) 제8조의2(주식등의 전자등록) 제12조(주식매수선택권) 제13조(신주의 동등배당) 제17조(주주명부의 폐쇄 및 기준일) 제18조(전환사채의 발행) 제19조(신주인수권부사채의 발행) 제21조(소집시기) 제46조(감사의 선임·해임) 제52조(재무제표 등의 작성 등) 제54조(이익배당) |
- 영문사명에 주식회사로 명확히 표기 - 목적사항 추가 - 비상장 사채 등 의무등록 대상이 아닌 주식등에 대해서는 전자등록을 하지 않을 수 있도록 함. - 이사회 결의로 주식매수선택권 부여 가능 - 동등배당 원칙을 명시 배당기준일 설정 후 신주발행에 의한 주주간 이해관계 상충을 방지 - 삭제 - 자금조달을 위한 전환사채 발행한도 증액 - 전환사채를 주식으로 전환하는 경우 이자의 지급에 관한 내용을 삭제 - 자금조달을 위한 신주인수권부사채 발행한도 증액 - 삭제 - 감사선임에 관한 조문정비 - 전자투표 도입 시 감사선임의 주주총회 결의요건 완화에 관한 내용을 반영 - 감사해임에 관한 조문정비 - 감사 선임 또는 해임 시 의결권 제한에 관한 내용을 반영 - 정기주주총회 개최시기의 유연성을 확보하기 위하여 조문을 정비 - 배당기준일을 이사회 결의로 정하는 날로 설정할 수 있도록 함 |
| 2022년 03월 28일 | 제8기 정기주주총회 |
제1조(상호) 제8조(주권의 발행과 종류) 제13조(신주의 동등배당) 제15조(명의개서대리인) 제16조(주주 등의 주소, 성명 및 인감 또는 서명 등 신고) 제16조의2(주주명부) 제20조(사채발행에 관한 준용규정) 제23조(소집통지) 제30조(의결권의 대리행사) 제33조(이사의 수) 제35조(이사의 임기) |
- 단순문구수정 - 단순문구수정 - 신주의 동등배당과 관련되지 않은 규정조항 삭제 - 단순문구수정 - 단순문구수정, 전자등록계좌부에 주식 등을 전자등록하는 경우 비관련 규정 삭제 - 주주명부의 작성 및 비치에 관한 조항 신설 - 단순문구수정 - 단순문구수정, 서면에 의한 의결권을 인정하지 않음에 따른 관련규정 삭제, 주주총회 소집통지 효율화를 위한 조항 신설 - 서면에 의한 의결권을 인정하지 않음에 따른 관련규정 삭제 - 이사의 수에 대한 이사회운영규정과 일치하는 조항 신설 - 이사의 보선에 대한 내용 보완 조항 신설 |
| 2023년 03월 29일 | 제9기 정기주주총회 |
제4조(공고방법) 제8조(주권의 발행과 종류) 제9조(주식의 종류, 수 및 내용) 제12조(주식매수선택권) 제14조(주식의 소각) 제15조(명의개서대리인) 제16조의2(주주명부의 작성·비치) 제17조(주주명부의 폐쇄 및 기준일) 제21조(소집시기) 제23조(소집통지) 제54조(이익배당) |
- 코스닥상장법인 표준정관에 맞춰 문구 수정 - 코스닥상장법인 표준정관에 맞춰 조항 삭제 - 코스닥상장법인 표준정관에 맞춰 문구 수정 - 코스닥상장법인 표준정관에 맞춰 문구 수정 - 코스닥상장법인 표준정관에 맞춰 문구 수정 - 코스닥상장법인 표준정관에 맞춰 문구 수정 - 코스닥상장법인 표준정관에 맞춰 문구 수정 - 정관에 기준일을 특정하지 않고 정기주주총회 개최시마다 이사회 의결로 기준일을 정하도록 기준일 특정 문안을 삭제하였으나, 코스닥상장법인 표준정관에 맞춰 문구 추가 - 코스닥상장법인 표준정관에 맞춰 조항 신설 - 코스닥상장법인 표준정관에 맞춰 문구 수정 - 코스닥상장법인 표준정관개정(2023.2.15)으로 인한 조항 신설, 금융위원회 배당절차 개반 방안(2023.1.31 자)에 따른 배당기준일을 주주총회 의결권행사 기준일과 다른 날로 정할 수 있도록 이사회에서 배당시마다 결정하고 이를 공고하도록 함 |
II. 사업의 내용
1. 사업의 개요
당사는 기존 농도구배원심분리법의 취약점인 균일하지 않은 순도의 치료제 양산을 해결하고자 2002년부터 새로운 분리기술(층분리배양법) 개발을 시작하였고, 2005년에 완성하여 국내외 특허를 출원하게 되었습니다. 이후 층분리배양법에 기반한 줄기세포치료제 제조기술 및 질환 치료 관련 특허들을 출원ㆍ등록하여 지식재산권을 포트폴리오화 하기 시작했습니다. 이 새로운 플랫폼 특허기술을 바탕으로 줄기세포치료제의 효능을 높이고, 각 질환에 가장 적합한 질환 특이적인 치료제를 개발하여 치료비용도 줄일 수 있는 줄기세포치료제를 개발하는 것이 당사 연구개발의 목표입니다.
당사의 주요 사업 분야는 줄기세포치료제와 코스메슈티컬입니다. 첫 번째, 당사의 주요 줄기세포치료제 파이프라인으로는 만성 이식편대숙주질환, 중등증-중증 급성 췌장염, 중등증-중증 아토피 피부염이 있습니다. 만성 이식편대숙주질환은 2상 임상시험대상자 등록 및 투약을 완료하여 임상시험 결과를 확인 중이며, 중등증-중증 급성 췌장염은 1/2a상 임상시험을 완료하였습니다. 중등증-중증 아토피 피부염은 2상 임상시험을 완료하여 결과 발표를 앞두고 있습니다. 두 번째, 탈모완화 기능성 코스메슈티컬 제품인 '이로로 디어스칼프' 제품을 개발하였습니다. 당사는 단일 세포유래 중간엽줄기세포주를 이용하여 줄기세포가 분비하는 단백질 중발모효능을 나타내는 2가지 유효 단백질 물질(CXCL1, TYMP)을 발굴하였고, 현재 CXCL1을 활용한 코스메슈티컬 브랜드 '이로로 디어스칼프'를 출시하여 판매하고 있습니다.
당사는 원천기술은 층분리배양법을 기반으로 생산된 고순도ㆍ고효능 중간엽줄기세포치료제를 각각의 질환별로 개발하여 제품을 생산 및 판매하는 제약회사의 사업구조와 당사가 보유하고 있는 플랫폼 원천기술을 이용하여 개발한 제품을 질환별, 국가별로 기술을 수출하는 바이오텍의 사업구조를 동시에 가지고 있습니다. 현재, 임상시험 단계에 있는 파이프라인들은 신약 개발의 일환으로 당사가 후보물질 발굴, 비임상시험 등을 모두 자체적으로 개발하여 보유한 자산으로서 제3자에게 국내외 권리국가에서의 전용실시권 부여 및 사용권리를 부여할 수 있습니다. 말레이시아 최대 국영 제약사인 Duopharma Biotech Berhad에 동남아 4개국 말레이시아, 싱가포르, 부르나이, 필리핀에 대한 임상 허가 및 독점적 판매권리를 부여하는 계약을 체결하였습니다. 국내 대형 제약사인 한독과는 2019년 5월 중등증-중증 아토피 피부염에 대한 국내 개발 및 판매 권리 기술이전 계약을 체결하였습니다. 따라서 개발 중인 줄기세포치료제의 국내외 기술이전을 통해 선수금 및 경상개발비 명목으로 제품 판매 전에 기술료 수익이 발생할 수 있으며, 제품 개발 후에는 안정적인 제품 매출 및 로열티 수익을 창출할 것으로 기대하고 있습니다.
2. 주요 제품 및 서비스
가. 제품 설명
당사의 주요 사업영역으로 줄기세포치료제 및 줄기세포를 응용한 재생의료 제품을 선정하여 후보물질 선정부터 비임상 및 임상시험을 통한 치료제 생산까지 전주기적 의약품 개발을 하고 있습니다. 또한 현금흐름 유동성 확보 및 수익 실현을 위해 당사가 개발한 발모 효능 단백질을 활용한 탈모완화 기능성 코스메슈티컬 제품을 개발하여 출시한 바 있습니다.
현재, 당사가 영위하고 있는 주요 사업 범위는 아래와 같습니다.
| [에스씨엠생명과학㈜ 주요 사업 범위] |
| 구 분 | 제 품 |
|---|---|
| 줄기세포치료제 | 1. SCM-CGH, 만성 이식편대숙주질환 치료제 2. SCM-AGH, 중등증-중증 급성 췌장염 치료제 3. SCM-AGH, 중등증-중증 아토피 피부염 치료제 |
| 코스메슈티컬 | 이로로 디어스칼프, 탈모완화 기능성 코스메슈티컬 |
| [주요 파이프라인 현황] |
 |
|
에스씨엠생명과학㈜ 파이프라인 |
가-1. 줄기세포치료제
당사는 2024년 조건부 품목허가가 목표인 만성 이식편대숙주질환을 비롯해 중등증-중증 급성 췌장염, 중등증-중증 아토피 피부염 총 3개의 줄기세포치료제를 주력으로 개발하고 있습니다. 당사는 만성 이식편대숙주질환, 중등증-중증 급성 췌장염과 같은 희귀질환을 대상으로 줄기세포치료제의 조건부 허가를 득하여 시장에 진입하고, 중등증-중증의 아토피 피부염 같이 기존 치료제로는 장기적인 효능을 볼 수 없거나 근원적인 치료가 힘들었던 질환을 대상으로 시장을 확대할 계획을 가지고 있습니다.
현재, 면역관련 질환을 대상으로 제품개발을 진행하고 있으며 유사한 기전에 따라 적응증 확대를 통하여 적용제품의 시장을 확대할 예정입니다.
① 만성 이식편대숙주질환 줄기세포치료제
| 구 분 | 내 용 | ||||
|---|---|---|---|---|---|
|
적응증 및 적응증 확대 |
1. 적응증 - 만성 이식편대숙주질환 2. 적응증 확대 - 급성 이식편대숙주질환 |
||||
|
치료제의 제형 및 주요 기능 |
1. 제형 신선형 제형의 줄기세포치료제는 층분리배양법으로 분리 및 배양된 고순도 줄기세포를 가지고 마스터 세포은행과 제조용 세포은행을 구축한 다음, 환자의 투여일정이 확정되면 제조용 세포은행의 줄기세포를 해동하여 10-12일 간의 배양 과정을 통해 완제품을 제조하여 주사기에 충전된 형태로 공급하는 제형입니다. 2. 주요 기능 골수이식을 통해 활성화된 공여자의 T-세포 억제 및 면역조절 |
||||
|
치료제 현황 및 개발 필요성 |
1. 중간엽줄기세포(MSC)의 기능 면역활성 환경에서 고순도 중간엽줄기세포는 T-세포의 증식 억제와 면역세포 표면에 존재하는 아세틸콜린 수용체를 통하여 면역세포의 활성과 증식을 억제합니다.
2. 비임상시험 결과 동종 splenocyte-유도 이식편대숙주질환 동물모델에서 신선형 줄기세포치료제 SCM-CGH를 정맥투여하여 질환동물의 생존율이 높아지고, 임상 증상이 개선되었습니다.
3. 치료제 현황 현재 국내에서는 스테로이드 외 적절한 치료제가 없어 시장규모를 예측하기 어렵습니다. 4. 개발 필요성 - 한국과학기술정보연구원의 National Digital Science Library 보고서에 의하면 만성 이식편대숙주질환은 조혈모줄기세포 이식 후 생존하는 환자의 60-80%에서 발생하며 장기 생존 환자의 가장 중요한 사망원인으로 꼽히고 있습니다. - 최근 조혈모줄기세포 이식은 나이 많은 사람과 혈연관계가 없는 사람간의 이식이 증가하면서 만성 이식편대숙주질환 환자수가 급증하고 있으나 효과적인 치료법이나 병리학적인 기전은 잘 알려져 있지 않은 상태입니다. - 이식편대숙주질환 치료에 있어 골수 및 제대혈유래 줄기세포치료제의 효과가 보고되고 있어 치료제 개발의 요구가 매우 높습니다. 5. 경쟁 현황 - 현재까지 국내에서 만성 이식편대숙주질환을 근본적으로 치료할 수 있는 치료제는 아직 출시되지 않았으며, 표준 치료법으로 corticosteroid, calcineurin inhibitors(cyclosporine, tacrolimus), thalidomide, 체외 광화학요법(extracorporeal photochemotherapy, ECT) 또는 mycophenolate mofetil(MMF), methotrexate 같은 면역억제제가 있습니다. - Janssen의 BTK 저해제인 임브루비카(Imbruvica)가 2017년 만성 이식편대숙주질환에 대한 적응증 추가로 미국 FDA 허가를 받았습니다. 한국 등 글로벌 시장에서는 3상 임상시험을 진행 중이며, 일부 환자에서 증상의 개선이 확인되었고, 개선된 증상이 5개월 이상 지속되었습니다. 그러나 동반된 부작용으로는 피로, 타박상, 설사, 혈소판 감소, 근육 경련, 메스꺼움, 폐렴 등이 있습니다. - Novartis의JAK 신호체계를 선택적으로 억제하는 경구용 소분자 표적 치료제인 자카비(Jakavi)가 한국 등 글로벌만성 이식편대숙주질환 환자를 대상으로 3상 임상시험을 완료하고 2021년9월22일 만성 이식편대숙주질환에 대한 적응증 추가로 미국FDA 허가를 받았습니다. 자카비와 기존 치료(BAT, Best available therapy)를 비교한 3상 임상시험에서 연구 1차 평가변수인 24주차 전체 반응률(ORR)은 자카비 치료군이 49.7%, BAT군이 25.6%로 나타났다. 그러나 자카비 투여 후 가장 일반적인 혈액학적 이상반응은 빈혈, 혈소판 감소증이며, 가장 일반적인 비혈액학적 이상반응은 감염, 바이러스 감염이 있습니다.
- 상기 경쟁약물 대비 만성 이식편대숙주질환 줄기세포치료제 SCM-CGH는 1상 임상시험 단계에서 다수의 장기 반응을 호전시키는 것으로 확인되었으며, 시험약과의 연관성이 있는 중대한 이상반응이 관찰되지 않았고, 임상적으로 유의한 비정상 수치나 결과가 발생되지 않았습니다. - 2상 임상시험에서 유효성이 확인되면 개발단계 희귀의약품으로 지정 받았기 때문에 조건부 품목허가를 받아 빠르게 시장에 진출할 것으로 예상되어 만성 이식편대숙주질환 치료에 대한 미충족 의료수요 해소 및 시장을 선도할 수 있을 것으로 판단됩니다. |
||||
|
임상개발현황 및 개발일정 |
1. 개발 현황 [1상 임상시험] - SCM-CGH를 정맥으로 단회 투여한 11명의 시험대상자 중 10명을 대상으로 유효성 평가를 실시하였습니다. - 10명의 시험대상자 중 급성 이식편대숙주질환인 시험대상자가 1명, 만성 이식편대숙주질환인 시험대상자가 9명이었습니다. - 9명의 만성 이식편대숙주질환 시험대상자를 대상으로 안전성을 평가하였고, 1명의 시험대상자에게서 약물 이상반응 근육통 1건이 발생하였으나 투여 후 3일 내 증상이 사라졌습니다. 시험약과의 연관성이 있는 중대한 이상반응이 관찰되지 않았고, 임상적으로 유의한 비정상 수치나 결과가 발생되지 않았습니다. - 만성 이식편대숙주질환으로 진단된 9명의 시험대상자에서 부분반응 이상의 증상 호전을 통한 치료 효과를 확인하였고, 안전성에도 문제가 없음을 확인하였습니다.
2. 개발일정 - 2018년 2상 임상시험 시작 - 2019년 식약처 개발단계 희귀의약품 지정 (2019.04) - 2024년 조건부품목허가 예정 - 2025년 제품 출시 예정 |
② 중등증-중증 급성 췌장염 줄기세포치료제
| 구 분 | 내 용 | ||||||
|---|---|---|---|---|---|---|---|
| 적응증 및 적응증 확대 |
1. 적응증 - 중등증 이상의 급성 췌장염 2. 적응증 확대 - 염증성 장질환, 위염, 류마티스 관절염, 패혈증 |
||||||
| 치료제의 제형 및 주요 기능 |
1. 제형 동결형 제형의 줄기세포치료제는 제조공정이 완료된 최종 완제품에서의 무균성을 확인한 후 질소 탱크에 저장하여 보관하고 있다가 급성 환자들처럼 빠른 시간 안에 투여가 필요할 경우 완제품을 바로 해동하여 투여할 수 있는 형태의 제형입니다. 2. 주요 기능 조절 T-세포 활성화를 통한 항염증 작용 |
||||||
| 치료제 현황 및 개발 필요성 |
1. 중간엽줄기세포(MSC)의 기능
|
||||||
| 임상개발현황 및 개발일정 |
1. 개발 현황 - 2a상 임상시험 완료(결과보고 완료) 2. 개발일정 - 2018년 국내 임상시험 계획 승인 - 2019년 1/2a상 임상시험 시작 - 2020년 식약처 개발단계 희귀의약품 지정(2020.10) (대상질환 : CTSI 7~10에 해당하거나 장기부전을 동반하는 중 증 급성 췌장염) - 2023년 내 2b상 임상시험 진입 예정 (중등증 이상 포함 개발단계 희귀의약품 대상환자 확대 계획, 2a상 임상시험 참여기관 포함 임상시험 실시기관 수 확대) - 2026년 조건부 품목허가 신청 예정 |
③ 중등증-중증 아토피 피부염 줄기세포치료제
| 구 분 | 내 용 | ||||||
|---|---|---|---|---|---|---|---|
| 적응증 및 적응증 확대 |
1. 적응증 - 중등증-중증 아토피 피부염 2. 적응증 확대 - 건선 |
||||||
| 치료제의 제형 및 주요 기능 |
1. 제형 동결형 제형의 줄기세포치료제는 제조공정이 완료된 최종 완제품에서의 무균성을 확인한 후 질소 탱크에 저장하여 보관하고 있다가 급성 환자들처럼 빠른 시간 안에 투여가 필요할 경우 완제품을 바로 해동하여 투여할 수 있는 형태의 제형입니다. 2. 주요 기능 IL-4 및 IL-17 신호전달체계 억제와 IgE 생성 저해를 통한 면역시스템 조절 |
||||||
| 치료제 현황 및 개발 필요성 |
1. 중간엽줄기세포(MSC)의 기능
|
||||||
| 임상개발현황 및 개발일정 |
1. 개발 현황 - 2상 임상시험대상자 등록 및 투약 완료 - 임상시험 결과 확인 중 2. 개발일정 - 2020년 1상 임상시험 완료 - 2023년 1/2상 임상시험 결과보고 완료 - 2023년 하반기 3상 임상시험 IND 신청 예정 - 2025년 품목 허가 신청 예정 - 2026년 품목 허가 및 제품 출시 예정 |
가-2. 코스메슈티컬
당사는 단일 세포유래 중간엽줄기세포주를 이용하여 줄기세포가 분비하는 단백질 중발모효능을 나타내는 유효 단백질 물질 2가지 단백질(CXCL1, TYMP)을 발굴하였습니다.
해당 단백질들은 CXCL1(Chemokine (C-X-C motif) ligand 1, 7.9 kDa) 케모카인, TYMP(thymidine phosphorylase, endothelial cell growth factor 1(platelet-derived), hPD-ECGF1, 55kDa) 으로 탈모방지, 발모 시장에 큰 도움이 될 것으로 판단하였습니다. 두가지 단백질 중 CXCL1이 분자량이 더 작고, 유효성이 높아 관련 제품 개발에 더 유리하다고 판단되어 핵심 성분으로 설정하였습니다.
![이미지: [발모효능 단백질의 발굴]](27p_%EB%B0%9C%EB%AA%A8%ED%9A%A8%EB%8A%A5%20%EB%8B%A8%EB%B0%B1%EC%A7%88%EC%9D%98%20%EB%B0%9C%EA%B5%B4.jpg) |
|
[발모효능 단백질의 발굴] |
GCM-MSC와 비교하여 cMSC에서 많은 양으로 생산되는 단백질 중 CXCL1, TYMP는 발모에 효능이 있는 유효 물질임을 확인하였습니다.
이를 화장품에 활영하기 위해 CXCL1을 ICID(국제 화장품 원료 사전집)에 등재하였고, 현재 CXCL1을 활용한 코스메슈티컬 브랜드 '이로로 디어스칼프'를 개발하여 판매하고 있습니다.
| [이로로 디어스칼프 제품 라인업] |
|
|
|
|
① 샴푸 (남성용/여성용)
| 구 분 | 내 용 | ||||||
|---|---|---|---|---|---|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 샴푸 - 용량 : 300mL - Type : Wash-off - 탈모완화 기능성 화장품 |
||||||
| 제품 특징 |
- 無실리콘, 無파라벤, 無합성색소
|
② 트리트먼트
| 구 분 | 내 용 |
|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 트리트먼트 - 용량 : 200mL - Type : Wash-off - 탈모완화 기능성 화장품 |
| 제품 특징 |
- 無실리콘, 無파라벤, 無합성색소, 약산성 - 1차 자극 테스트 완료 - 주성분 : 징크피리치온, 살리실산, 덱스판테놀 - 16가지 자연 성분 함유 |
③ 세럼
| 구 분 | 내 용 |
|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 세럼 - 용량 : 100mL - Type : Leave-on - 탈모완화 기능성 화장품 |
| 제품 특징 |
- 無실리콘, 無파라벤, 無합성색소, 약산성 - 1차 자극 테스트 완료 - 주성분 : L-멘톨, 살리실산, 덱스판테놀 - 13가지 자연 성분 함유 |
④ 토닉
| 구 분 | 내 용 |
|---|---|
| 제품 사양 |
- 제품명 : 이로로 디어스칼프 인핸시브 안티헤어로스 토닉 - 용량 : 120mL - Type : Leave-on - 탈모완화 기능성 화장품 |
| 제품 특징 |
- 1차 자극 테스트 완료 - 주성분 : L-멘톨, 살리실산, 덱스판테놀 - 9가지 자연 성분 함유 |
나. 주요 제품 등의 현황
당사가 주력으로 영위하고자 하는 사업은 줄기세포치료제의 연구, 개발 및 판매 사업이며, 코스메슈티컬 사업은 부가가치 창출 사업으로서 당사가 현재 진행하고 있는 주요 사업이 아님을 참고해 주시기 바랍니다.
| (단위 : 천원) |
| 구분 | 2023년도 1분기 (비율) |
2022년도 (비율) |
2021년도 (비율) |
|||
|---|---|---|---|---|---|---|
| 금액 | 비중 | 금액 | 비중 | 금액 | 비중 | |
| 제품 | 37,948 | 39% | 149,966 | 37.9% | 197,701 | 45.0% |
| 위탁연구수입 등 | - | - | 4,454 | 1.1% | - | - |
| 라이선스 수수료 | 59,563 | 61% | 241,562 | 61.0% | 241,562 | 55.0% |
| 합 계 | 97,511 | 100% | 395,982 | 100.0% | 439,263 | 100.0% |
주1) 제품 매출은 당사가 2019년에 출시한 코스메슈티컬 제품 매출입니다.
주2) 라이선스 수수료 수익은 한독 기술이전 계약금(upfront)에 대하여 기간에 걸쳐 수행 의무가 이행되는 것으로 수익을 인식하고 있습니다.
다. 주요 외주처 현황
이로로 디어스칼프는 국내 유수의 업체들과 협력하여 OEM(Original Equipment Manufacturer) 방식으로 제품을 생산하고 있습니다. 당사가 개발한 특허물질 CXCL1과 용기를 포함한 부자재를 한국콜마에 공급하고, 한국콜마는 CXCL1이 포함된 화장품 제형을 생산하여 공급받은 부자재에 충진 및 포장을 합니다. 청진, 연우 등은 화장품 용기를 공급하며, 태경은 단상자를 포함한 인쇄물을 공급합니다.
현재까지 누적 생산량은 2021년에 5만개, 2022년 1만 1천 6백개를 생산하였습니다.
| (단위 : 천원) |
| [화장품 외주처 현황] |
| 사업 연도 | 외주처 | 외주 금액 | 외주 비중 | 외주 내용 |
|---|---|---|---|---|
| 2021년도 (제8기) |
한국콜마 | 175,103 | 56.74% | 물품공급계약 (OEM 생산, 포장, 품질 검사) |
| 연우 | 35,250 | 11.43% | 물품공급계약 (세럼 용기 생산) |
|
| 청진 | 47,070 | 15.25% | 물품공급계약 (샴푸/토닉 용기 생산) |
|
| 태경인쇄 | 41,687 | 13.51% | 물품공급계약 (단상자, 카톤박스, 리플렛, 봉인라벨 등 인쇄물) |
|
| 지에프씨생명과학 | 9,485 | 3.07% | 물품공급계약 (CXCL Complex 생산) |
|
| 합 계 | 308,595 | 100.00% | - | |
| 2022년도 (제9기) |
한국콜마 | 45,782 | 58.50% | 물품공급계약 (OEM 생산, 포장, 품질 검사) |
| 청진 | 27,200 | 34.76% | 물품공급계약 (샴푸 용기 생산) |
|
| 태경인쇄 | 3,875 | 4.95% | 물품공급계약 (단상자, 카톤박스, 리플렛, 쇼핑백 등 인쇄물) |
|
| 지에프씨생명과학 | 1,400 | 1.79% | 물품공급계약 (CXCL Complex 생산) |
|
| 합 계 | 78,257 | 100.00% | - | |
| 2023년도 1분기 (제10기 1분기) |
지에프씨생명과학 | 8,050 | 100% | 물품공급계약 (CXCL Complex 생산) |
| 합계 | 8,050 | 100% |
라. 주요 제품 등의 가격변동 추이
2019년도에 판매를 개시한 화장품의 경우 최근 2021년 1분기 말 기준 세럼 및 트린트먼트의 가격 인하를 진행하였고, 2021년 3분기에 신제품 토닉을 출시하였습니다.
| (단위 : 천원) |
| 품목 | 2023년도 1분기 (제10기 1분기) |
2022년도 (제9기) |
2021년도 (제8기) |
|
|---|---|---|---|---|
| 샴푸 남성용 | 내 수 | 28 | 28 | 28 |
| 수 출 | - | - | - | |
| 샴푸 여성용 | 내 수 | 28 | 28 | 28 |
| 수 출 | - | - | - | |
| 트리트먼트 | 내 수 | 19 | 19 | 19 |
| 수 출 | - | - | - | |
| 세럼 | 내 수 | 35 | 35 | 35 |
| 수 출 | - | - | - | |
| 토닉 | 내 수 | 17 | 17 | 17 |
| 수 출 | - | - | - | |
마. 주요 제품 등 관련 각종 산업표준
코스메슈티컬 제품은 OEM 방식의 외주 생산으로 특이적 산업표준에는 해당하지 않습니다.
줄기세포치료제 개발 기술과 제품은 약사법 및 식약처 고시 세포치료제 가이드라인 등의 국내 규정과 의약품실사상호협력기구(PIC/S) 및 국제조화규정(ICH) 가이드라인 등의 국제조화기준에 의한 규정에 따라 허가됩니다. 당사의 줄기세포치료제는 이러한 규정에서 정하는 GMP 표준에 적합하게 제조되고 있습니다. 2017년 ISO9001에 대한 최초 인증을 받은 이래 2020년에 재인증을 받았습니다.
바. 주요 제품 등 관련 소비자 불만사항 등
보고서 기준일 현재까지 당사 및 판매사를 통해 접수된 주요 제품 등 관련 소비자 불만사항 등의 발생 및 처리 내역은 없습니다.
3. 원재료 및 생산설비
가. 주요 원재료
(1) 매입 현황
| (단위 : 원) |
| 품목 | 구 분 | 2023년도 1분기 (제10기 1분기) |
2022년도 (제9기) |
2021년도 (제8기) |
|---|---|---|---|---|
| 원재료 | 국 내 | 133,726,344 | 217,577,314 | 473,605,329 |
| 수 입 | - | - | - | |
| 합 계 | 133,726,344 | 217,577,314 | 473,605,329 | |
| 부재료 | 국 내 | 410,017,494 | 1,301,008,489 | 674,721,136 |
| 수 입 | - | - | - | |
| 합 계 | 410,017,494 | 1,301,008,489 | 674,721,136 | |
| 외주가공비 | 국 내 | 452,257,542 | 537,654,215 | 398,103,387 |
| 수 입 | - | - | - | |
| 합 계 | 452,257,542 | 537,654,215 | 398,103,387 | |
| 총 합 계 | 국 내 | 996,001,380 | 2,056,240,018 | 1,546,429,852 |
| 수 입 | - | - | - | |
| 합 계 | 996,001,380 | 2,056,240,018 | 1,546,429,852 |
(2) 원재료 가격변동 추이
| (단위 : 원[VAT별도]) |
| 품목 | 구 분 | 2023년도 1분기 (제10기 1분기) |
2022년도 (제9기) |
2021년도 (제8기) |
|---|---|---|---|---|
| FBS | 국 내 | 1,032,300 | 750,000 | 536,000 |
| 수 입 | - | - | - | |
| DMEM | 국 내 | - | 25,700 | 24,390 |
| 수 입 | - | - | - | |
| MEM | 국 내 | 396,300 | 36,500 | 35,200 |
| 수 입 | - | - | - |
(3) 주요 매입처에 관한 사항
당사와 특수 관계에 있는 매입처는 없습니다. 또한 해당 매입처와는 공시대상기간 동안 지속적으로 거래를 해오며, 현재까지 공급가와 관련된 문제가 발생한 사례가 없습니다.
나. 생산 및 설비
(1) 생산 능력 및 생산 실적
당사와 생산 능력 및 생산 실적은 현재 가동 중인 GMP 시설에서 생산한 임상시험용 의약품(SCM-CGH, SCM-AGH)을 기준으로 기재하였습니다.
SCM-CGH는 진행 중인 임상시험의 환자가 등록됨과 동시에 환자의 투여 및 공급 일정이 확정되어 생산을 시작합니다. 2019년부터 2023년 1분기말까지 등록된 환자의 투여를 위해 생산된 배치의 수량을 아래의 표에 기재하였습니다. SCM-CGH 1배치의 경우 제조용 세포은행 해동 후 증식 배양을 거쳐 생산되는 1회 생산 규모이며, 환자 체중에 따라 결정된 투여 세포량 만큼 맞춤 생산 규모입니다.
SCM-AGH 1배치는 마스터 세포은행 1바이알 해동 후 증식 배양을 거쳐 생산되는 완제품 1회 생산 규모입니다.
| (단위 : 배치) |
| 제품 품목명 | 구 분 | 2023년 1분기 (제10기 1분기) |
2022년도 (제9기) |
2021년도 (제8기) |
|||
|---|---|---|---|---|---|---|---|
| 수량 | 금액 | 수량 | 금액 | 수량 | 금액 | ||
| 줄기세포치료제 (SCM-CGH) |
생산 능력 주) |
72 | - | 72 | - | 144 | - |
| 생산 실적 | - | - | 59 | - | 58 | - | |
| 가동률 | 0% | 82% | 40% | ||||
| 줄기세포치료제 (SCM-AGH) |
생산 능력 | 96 | - | 96 | - | 96 | - |
| 생산 실적 | - | - | 13 | - | 15 | - | |
| 가동륙 | 0% | 14% | 16% | ||||
주) SCM-CGH의 생산 능력 산출 근거는 월간 임상 예상등록환자 수 2명을 고려하여, 환
자 1명 당 3배치, 월간 6배치, 연간 72배치로 산정하였습니다.
(2) 생산 설비에 관한 사항
① 설비 현황
| (단위 : 원[VAT별도]) |
| 구 분 | 토지 | 건물 | 구축물 | 기계장치 | 공구와 기구 | 비품 | 시설장치 | 건설중인 자산 | 사용권 자산 | 합 계 |
|---|---|---|---|---|---|---|---|---|---|---|
| 기초 순장부금액 | 6,967,498,403 | 1,872,082,263 | 14,594,667 | 650,655,991 | 160,507,945 | 132,005,750 | 141,763,880 | 577,314,319 | 133,426,659 | 10,649,849,877 |
| 취득 | - | - | - | 50,272,727 | - | 16,200,000 | - | 16,284,018 | 84,928,519 | 167,685,264 |
| 대체 | - | - | - | - | - | - | - | (1,216,657) | - | (1,216,657) |
| 감소 | - | - | - | - | - | - | - | - | - | - |
| 감가상각비 | - | (17,862,420) | (136,003) | (96,473,741) | (17,765,792) | (13,330,729) | (18,468,453) | - | (37,202,639) | (201,239,777) |
| 기말 순장부금액 | 6,967,498,403 | 1,854,219,843 | 14,458,664 | 604,454,977 | 142,742,153 | 134,875,021 | 123,295,427 | 592,381,680 | 181,152,539 | 10,615,078,707 |
② 설비의 신설ㆍ매입 계획
당사는 인천 송도 부지 내 시판용 줄기세포치료제 생산용 GMP 제조시설 신축을 위해 바이오서포트(주)와 21년 12월 개념 설계 계약을 체결하고, 클린룸 개념 설계를 시작하였습니다. 22년 상반기에 예건사와 건축 설계 계약을 체결한 후 현재까지 기본 설계가 진행 중에 있습니다. 신규 GMP 제조시설은 PIC/S에 부합하는 시설로서, 연간 20,000 doses 생산이 가능하도록 주요 장비 및 제조 지원 설비를 구축할 예정입니다.
4. 매출 및 수주상황
가. 매출 실적
| (단위 : 천원) |
| 사업 부문 |
매출 유형 |
품 목 | 2023년도 1분기 (제10기 1분기) |
2022년도 (제9기) |
2021년도 (제8기) |
|
|---|---|---|---|---|---|---|
| 줄기세포 사업부문 |
제품 | 코스메슈티컬 등 | 수출 | - | - | - |
| 내수 | 37,948 | 149,966 | 197,701 | |||
| 합계 | 37,948 | 149,966 | 197,701 | |||
| 위탁 연구개발 |
세포추출 품질시험 등 |
수출 | - | - | - | |
| 내수 | - | 4,454 | - | |||
| 합계 | - | 4,454 | - | |||
| 라이선스 수수료 |
기술이전수익 주) |
수출 | - | - | - | |
| 내수 | 59,563 | 241,562 | 241,562 | |||
| 합계 | 59,563 | 241,562 | 241,562 | |||
| 합 계 | 97,511 | 395,982 | 439,263 | |||
주) 당사는 2019년도에 한독과 아토피 피부염 줄기세포치료제 기술이전계약을 체결하면
서 환불되지 않는 계약금(Upfront Fee) 10억원을 수령하였습니다. 당사는 한국채택국
제회계기준에 따라 동 기술이전 계약에 따른 계약금은 임상시험 기간에 걸쳐 수행의무
가 이행되는 것으로 보아 진행률에 따른 수익을 인식하고 있습니다.
나. 판매 경로
(1) 줄기세포치료제
품목허가 완료 후, 당사의 GMP 제조시설에서 완제 의약품을 제조하고 유통 및 공급은 ㈜한독과 도매상을 활용하여 진행할 예정입니다. 국내 판매경로의 경우 에스씨엠생명과학㈜에서 제조하여 판매사(㈜한독)를 통해 최종 수요처인 병원에 공급되는 방식입니다. 다만, 세포치료제의 안정성 확보를 위한 콜드체인 규정에 따라 당사가 최종 수요처까지의 배송을 담당하여 공급할 예정입니다.
(2) 코스메슈티컬
당사 코스메슈티컬 사업 부문은 2019년 1월 런칭 후 매출 발생을 시작으로 한국콜마 OEM 생산 후 공급을 받아 자사 영업 전담 부서에서 판매를 진행합니다. 판매 경로는 오프라인 B2B 채널(직거래, 대리점)과 온라인 전자상거래 B2C 채널을 활용하고 있었으며, 최근 비대면채널 마케팅을 활성화하여, 자사몰 온라인 판매를 통한 매출 증진이 이루어지고 있습니다. 또한 해외 매출을 위한 Duopharma Biotech Berhad와의 계약을 통해 말레이시아 및 계약 국가에서의 유통이 예정되어 있습니다.
다. 판매 전략
(1) 줄기세포치료제
줄기세포치료제는 당사 GMP 제조시설에서 생산 예정이며, 국내 유통 및 영업은 ㈜한독이 진행하는 구조입니다. 해외의 경우 파트너사의 판로를 일차적으로 활용할 계획이며, 추가적으로 컨퍼런스 및 비즈니스 미팅 등에서의 발표를 통해 신규 파트너를 확보하여 개발 단계에서 라이선스-아웃하는 기술 이전 모델을 추진하고 있습니다. 말레이시아 및 계약 국가들에서의 유통 및 영업은 Duopharma Biotech Berhad가 전담하여 추진하게 됩니다.
당사는 기술 이전 대상 탐색을 위하여 아래의 활동을 하고 있습니다.
■ 전시회 및 비즈니스 파트너링 행사 참여
■ 국/내외 제약사 접촉
■ 초기단계 연구과제 탐색을 위한 국,내외 공공연구기관 및 대학기관과의 접촉
해외 라이선스 추진을 위해 아래와 같이 매년 다양한 학회 및 컨퍼런스에서 회사 소개(IR) 및 임상 결과 발표 등을 통해 미국ㆍ유럽 바이오 및 제약 회사와의 파트너링에 적극적으로 참여하고 있습니다.
(2) 코스메슈티컬 및 배양액
당사에서 판매 중인 코스메슈티컬 제품(이로로 디어스칼프 4종)은 직접 또는 대리점을 주된 판매 경로로 하고 있었으나, 디지털 마케팅 전략을 수립하여 비대면 채널을 통한 효율적이면서 효과적인 판매 전략을 추진하고 있습니다. 또한 Duopharma Biotech Berhad을 통한 해외 판매 전략으로 할랄인증 확보 등 미국, 유럽 수출을 위한 인증확보를 위해서 업무를 진행하고 있습니다.
줄기세포배양액 판매 전략은 배양액을 통해 구축 가능한 제품 포트폴리오를 파악하고 해당 제품 포트폴리오별 전략적 파트너십을 구축하여 당사 브랜드 일원화를 원칙으로 기술사업화 전략을 이행해 나갈 예정입니다.
| [코스메슈티컬 및 배양액 판매ㆍ홍보 전략] |
| 브랜딩 전략 | 판매/홍보 전략 |
|---|---|
| <물질 기술사업화 전략> 특허물질(CXCL1) 함유 제품의 전문성을 부각시킨 코스메슈티컬 및 더마코스메틱 브랜드 이미지 구축 |
코스메슈티컬 관련 학회 및 박람회를 참가하여 CXCL1 등 보유 원료 소구 및 판로 개척 |
| 국내외 SNS 인플루언서를 활용한 지속 광고를 통해 판매 확대 기반 마련 | |
| 전문 상품 이미지 구축 후 매스 시장, 홈쇼핑 시장에 진입하여 매출 확대 모색 | |
| 해외 Agent 협업을 통한 글로벌 시장 진출 |
라. 주요 매출처
| (기준일 : 2023년 03월 31일) | (단위 : 천원) |
| 매출 유형 | 품목 | 거래처 | 매출 금액 | 매출 비중 |
|---|---|---|---|---|
| 라이선스 수수료 |
기술이전 수익 | ㈜한독 | 59,563 | 61.08% |
| 제품 | 코스메슈티컬 등 | 네이버파이낸셜 주식회사 | 11,858 | 12.16% |
마. 수주 상황
당사는 보고서 작성기준일 현재 해당 사항이 없습니다.
5. 위험관리 및 파생거래
당사는 여러 활동으로 인하여 시장위험(환위험, 공정가치 이자율 위험, 현금흐름 이자율 위험 및 가격위험), 신용위험 및 유동성위험과 같은 다양한 금융위험에 노출되어 있습니다. 회사의 전반적인 위험관리정책은 금융시장의 예측불가능성에 초점을 맞추고 있으며 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화하는데 중점을 두고 있습니다.
위험관리는 이사회에서 승인한 정책에 따라 당사 재무팀에 의해 이루어지고 있습니다. 당사 재무팀은 당사의 현업 부서들과 긴밀히 협력하여 재무위험을 식별, 평가 및 회피하고 있습니다. 이사회는 외환위험, 이자율위험, 신용위험 및 유동성을 초과하는투자와 같은 특정 분야에 관한 문서화된 정책 뿐 아니라, 전반적인 위험관리에 대한 문서화된 정책을 제공합니다.
가. 시장위험
(1) 외환위험
당사는 외화로 표시된 거래를 수행하고 있지 않으므로 외화와 관련된 환율변동위험에 노출되어 있지 않습니다.
(2) 이자율위험
이자율 위험은 시장이자율의 변동으로 인하여 금융상품에서 발생하는 이자수익 및 이자비용이 변동할 위험을 의미합니다. 변동이자율로 발행된 차입금으로 인하여 당사는 이자율변동에 따른 현금흐름변동위험에 노출되어 있습니다. 당분기말 및 전기말 현재 이자율변동위험에 노출된 부채의 장부금액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 차입금 | - | - |
당사는 내부적으로 이자율 변동으로 인한 이자율위험을 정기적으로 측정하고 있습니다. 보고기간 종료일 현재 각 자산 및 부채에 대한 이자율이 1% 포인트 변동시 이자율 변동이 당분기말 및 전기말 손익에 미치는 영향(법인세효과 제외)은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 1% 상승시 | 1% 하락시 | 1% 상승시 | 1% 하락시 | |
| 손익효과 | - | - | - | - |
(3) 가격위험
가격위험은 이자율위험이나 환위험 이외의 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험을 의미합니다. 한편, 당분기 및 전기 각각 당기손익-공정가치금융자산 및 당기손익인식금융자산 범주로 분류된 집합투자증권 및 주가연계상품 등은 보유하고 있지 않습니다. 또한, 당분기 및 전기 전환상환우선주부채 및 전환우선주부채의 내재파생상품으로서 분리되어 인식되는 파생상품부채는 공정가치 측정시 사용되는 다양한 투입변수로 인하여 가격위험에 노출되어 있습니다.
나. 신용위험
신용위험은 보유하고 있는 수취채권 및 확정계약을 포함한 도소매 거래처에 대한 신용위험뿐 아니라 현금및현금성자산, 은행 등의 금융기관 예치금으로부터 발생하고 있습니다. 은행 및 금융기관의 경우, 독립적인 신용평가기관으로부터의 신용등급이 최소 A이상인 경우에 한하여 거래를 하고 있습니다. 당분기 중 신용위험에 중요한 영향을 미치는 사항은 발견되지 않았으며, 경영진은 거래상대방의 의무불이행으로 인한 손실을 예상하고 있지 아니합니다.
다. 유동성위험
회사는 차입금한도를 적정수준으로 유지하고 영업 자금 수요를 충족시킬 수 있도록 유동성에 대한 예측을 항시 모니터링하여 차입금 한도나 약정을 위반하는 일이 없도록 하고 있습니다. 유동성에 대한 예측 시에는 회사의 자금조달 계획, 약정 준수, 회사 내부의 목표재무비율 및 통화에 대한 제한과 같은 외부 법규나 법률 요구사항이 있는 경우 그러한 요구사항을 고려하고 있습니다.
회사는 상기에서 언급한 예측을 통해 결정된 대로 유동성이 확보될 수 있도록 적절한만기나 충분한 유동성을 제공해주는 정기예금, 수시입출금식 예금 등의 금융상품을 선택하여 잉여자금을 투자하고 있습니다.
당분기말과 전기말 현재 당사의 유동성 위험 분석내역은 다음과 같습니다.
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 3개월 미만 | 3개월~1년 이하 | 1년~ 2년 이하 | 2년~ 5년 이하 | 합 계 |
| 기타금융부채 | 529,699,627 | - | - | 70,000,000 | 599,699,627 |
| 차입금 | 86,700,356 | 214,655,801 | 214,344,240 | 143,874,901 | 659,575,299 |
| 리스부채 | 39,287,226 | 91,944,897 | 33,433,596 | 33,533,165 | 198,198,884 |
| 합 계 | 655,687,209 | 306,600,698 | 247,777,836 | 247,408,066 | 1,457,473,810 |
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 3개월 미만 | 3개월~1년 이하 | 1년~ 2년 이하 | 2년~ 5년 이하 | 합 계 |
| 기타금융부채 | 456,776,650 | - | - | 70,000,000 | 526,776,650 |
| 차입금 | 85,624,333 | 2,250,341,660 | 214,344,240 | 3,816,743,749 | 6,367,053,982 |
| 리스부채 | 17,608,626 | 50,000,424 | 41,983,596 | 41,179,064 | 150,771,710 |
| 합 계 | 560,009,609 | 2,300,342,084 | 256,327,836 | 3,927,922,813 | 7,044,602,342 |
당사는 상기에서 언급한 예측을 통해 결정된 대로 유동성이 확보될 수 있도록 적절한만기나 충분한 유동성을 제공해주는 정기예금, 수시입출금식 예금 등의 금융상품을 선택하여 잉여자금을 투자하고 있습니다.
라. 자본위험관리
당사의 자본관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본비용을 절감하기 위해 최적 자본구조를 유지하는 것입니다.
당분기말과 전기말 현재의 자본조달비율은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
|
구 분 |
당분기말 | 전기말 |
|
총차입금(*) |
5,817,247,361 | 5,769,109,399 |
|
차감: 현금및현금성자산 |
4,169,287,283 | 6,916,335,193 |
|
순부채 |
1,647,960,078 | (1,147,225,794) |
|
자본총계 |
19,450,142,409 | 24,510,961,512 |
| 총자본 | 21,098,102,487 | 23,363,735,718 |
|
자본조달비율 |
7.81% | -4.91% |
(*) 당분기말 및 전기말 총차입금에는 리스부채가 포함되어 있습니다.
마. 금융상품 공정가치
(1) 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산 | ||||
| 현금및현금성자산 | 4,169,287,283 | 4,169,287,283 | 6,916,335,193 | 6,916,335,193 |
| 단기금융상품 | - | - | 2,053,463,850 | 2,053,463,850 |
| 매출채권 | 12,205,849 | 12,205,849 | 5,630,496 | 5,630,496 |
| 기타채권 | 1,161,553,334 | 1,161,553,334 | 1,175,657,943 | 1,175,657,943 |
| 장기금융상품 | 1,147,100,000 | 1,147,100,000 | 1,147,100,000 | 1,147,100,000 |
| 합 계 | 6,490,146,466 | 6,490,146,466 | 11,298,187,482 | 11,298,187,482 |
| 금융부채 | ||||
| 차입금 | 5,630,000,000 | 5,630,000,000 | 5,630,000,000 | 5,630,000,000 |
| 기타금융부채 | 729,505,990 | 729,505,990 | 634,077,775 | 634,077,775 |
| 합 계 | 6,359,505,990 | 6,359,505,990 | 6,264,077,775 | 6,264,077,775 |
(2) 공정가치 서열체계
공정가치로 측정되는 금융상품은 공정가치 서열체계에 따라 구분되며 정의된 수준들은 다음과 같습니다.
| - 측정일에 동일한 자산이나 부채에 대해 접근할 수 있는 활성시장의(조정하지 않은) 공시가격 (수준 1) |
| - 수준 1의 공시가격 외에 자산이나 부채에 대해 직접적으로나 간접적으로 관측할 수 있는 투입변수 (수준 2) |
| - 자산이나 부채에 대한 관측할 수 없는 투입변수 (수준 3) |
공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
<당분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 |
수준 1 |
수준 2 |
수준 3 |
합 계 |
|
반복적인 공정가치 측정치 |
||||
| 당기손익-공정가치 금융자산 | ||||
| 장기금융상품 | - | - | 1,147,100,000 | 1,147,100,000 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 |
수준 1 |
수준 2 |
수준 3 |
합 계 |
|
반복적인 공정가치 측정치 |
||||
| 당기손익-공정가치 금융자산 | ||||
| 단기금융상품 | - | - | 2,053,463,850 | 2,053,463,850 |
| 장기금융상품 | - | - | 1,147,100,000 | 1,147,100,000 |
| 합계 | - | - | 3,200,563,850 | 3,200,563,850 |
(3) 반복적인 공정가치 측정치의 서열체계 수준 간 이동
당기와 전기 중 수준 1과 수준 2간의 유의적인 이동은 없습니다.
(4) 가치평가기법 및 투입변수
당사는 공정가치 서열체계에서 수준3으로 분류되는 공정가치에 대하여 다음의 가치평가기법과 투입변수를 사용하고 있습니다.
| (단위 : 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 평가기법 | 관측가능하지 않은 투입변수 |
|
| 당분기말 | 전기말 | |||
| 단기금융상품 | - | 2,053,463,850 | 회계법인실사금액 | ㆍ- |
| 장기금융상품 | 1,147,100,000 | 1,147,100,000 | 원가법 | ㆍ기초자산가격 |
바. 파생상품 및 풋백옵션 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
6. 주요계약 및 연구개발활동
가. 경영상의 주요 계약
| (단위 : 백만원) |
| 계약 상대방 | 계약 체결일 |
계약 종료일 |
주요 내용 | 계약 금액 |
|---|---|---|---|---|
| 인하대학교 산학협력단 |
2018.08.09 | - | 특허권 양도계약 - 계약금 : 1억원 - 중도금 : 1.5억원 - 개발성공금 : 2억원 - 경상기술료 : 순매출액의 3% (제품 최초 매출 발생일로부터 6년간) |
450 |
| Duopharma Biotech Berhad |
2018.10.25 | - | Share Subscription Agreement | 5,500 |
| - | Exclusive Marketing and Commercialization Agreement - Compensation 1 : 6억원 (질환 선정 시) - Compensation 2 : 6억원 (첫 환자 등록 시) |
1,200 | ||
| ㈜제넥신 | 2018.12.28 | 2019.06.27 | Binding Argos Joint Bidding Agreement | - |
| 2018.04.11 | - | Shareholder's Agreement | - | |
| 2019.10.31 | - | Common Stock Purchase Agreement | 17,184 | |
| Allele Biotechnology and Pharmaceuticals, Inc. | 2019.02.20 | 옵션기간 | Research Collaboration Option Agreement (iPSC 유래 췌장 베타세포 당뇨병 치료제) |
600 |
| ㈜한독 | 2019.05.24 | - | 기술이전 계약 - Upfront : 10억원 (계약 시) - Milestone : 10억원 (품목허가 시) - 판매 단가 : 제조 원가의 110% - 로열티 : 순매출액의 10% - 중등증-중증 아토피 피부염 임상 3상 주관 |
2,000 |
| Steminent Biotherapeuics |
2019.07.02 | 품목허가 후 5년 |
공동개발 및 상업화(크로스 라이선스) 양해각서 - 척수소뇌성 실조증 치료제 국내 도입 - 현재 사업구조 협의 중 |
- |
| Steminent Biotherapeutics |
2020.10.13 | 2030.10.12 | 척수소뇌성 실조증 국내 판권 및 기술이전 계약 체결 | 4,510 |
| 차바이오텍㈜ | 2021.02.26 | - | 골수유래 세포치료제 완제품의 위탁생산 | 1,106 |
| Vita Therapeutics, Inc. | 2021.06.30 | - | 우선주 계약 | 1,147 |
| Allele Biotechnology and Pharmaceuticals, Inc. | 2021.06.30 | - | iPSC 유래 췌장 베타세포 당뇨병 치료제 개발의 개발, 허가, 생산 및 판매에 대한 국내 독점 권한 계약 | 3,389 |
| (주)바이오서포트 | 2022.12.20 | - | 송도 GMP 제조소 개념설계 | 63 |
| 종합건축사사무소 예건사 |
2022.04.25 | - | 송도 GMP 제조소 신축 공사 설계용역 계약 건 | 309 |
| Duopharma Biotech Berhad |
2022.09.26 | 2027.09.25 | 이로로 제품 유통 관련 할랄 개발 계약 체결 | - |
| IBK 기업은행 | 2022.11.14 | 2025.11.14 | 대출 약정 - 대출 금액 : 36.3억원 - 이자율 : 5.9% - 만기 : 3년 |
3,630 |
| IBK 기업은행 | 2022.11.14 | 2023.11.14 | 대출 약정 - 대출 금액 : 10억원 - 이자율 : 6.36% - 만기 : 1년 |
1,000 |
| IBK 기업은행 | 2022.11.23 | 2023.11.23 | 대출 약정 - 대출 금액 : 10억원 - 이자율 : 6.6% - 만기 : 1년 |
1,000 |
나. 라이선스아웃(License-out) 계약
| [라이선스아웃 계약 총괄표] |
| (단위 : 백만원) |
| 품목 | 계약 상대방 | 대상 지역 | 계약 체결일 | 계약 종료일 | 총 계약 금액 | 수취 금액 | 진행 단계 |
|---|---|---|---|---|---|---|---|
| 줄기세포치료제 | Duopharma Biotech Berhad |
아세안 4개국 (말레이시아, 싱가포르, 필리핀, 브루나이) |
2018.10.25 | - | 1,200 | - | - |
| 중등증-중증 아토피 피부염 줄기세포치료제 |
㈜한독 | 한국 | 2019.05.24 | 제품발매일로부터 20년 |
2,000 | 1,000 | 임상 2상 완료 |
(1) 품목 : 줄기세포치료제
| ① 계약 상대방 | Duopharma Biotech Berhad (말레이시아) |
| ② 계약 내용 | 당사가 개발 완료/개발 중인 줄기세포치료제의 대상 지역에서 독점 개발 및 판매권 |
| ③ 대상 지역 | 아세안 4개국 : 말레이시아, 싱가포르, 필리핀, 브루나이 - 상기 아시아 4개국을 제외한 아세안 국가에 대해서는 The first right of refusal 옵션 부여 |
| ④ 계약 기간 | 적용 특허권 만료 기간까지 |
| ⑤ 총 계약 금액 | 선택 파이프라인별로 약 12억원(USD 1,000,000), 로열티 별도 - 지분 투자 : 55억원 |
| ⑥ 수취 금액 | 지분 투자 55억원 (2018.11.23 납입) |
| ⑦ 계약 조건 | ▲ 지분 투자 : 55억원 (2018.11.23 납입) ▲ 마일스톤(Milestone) - 1차 마일스톤 : USD 500,000 (말레이시아에서 인정하는 국가에서 선택한 파이프라인에 대한 IRB 승인을 받을 때) - 2차 마일스톤 : USD 500,000 (첫 번째 임상시험 환자 등록 시) ▲ 로열티(Royalty) : 치료제 판매이익의 50% |
| ⑧ 회계 처리 방법 | - |
| ⑨ 대상 기술 | 층분리배양법을 적용한 줄기세포치료제 |
| ⑩ 개발 진행 경과 | 거래 상대방이 아직 치료제 품목을 선택하지 않았으며, 당사는 만성 이식편대숙주질환 2상 임상 시험 환자 등록 및 투여 완료, 중등증-중증 아토피 피부염 2상 임상시험 결과 보고 완료 및 중등증-중증 급성 췌장염 1/2a상 임상시험 결과 보고 완료 |
| ⑪ 기타 사항 | - |
(2) 품목 : 중등증-중증 아토피 피부염 줄기세포치료제
| ① 계약 상대방 | 주식회사 한독 (대한민국) |
| ② 계약 내용 | - 중등중-중증 아토피 피부염 치료를 위한 줄기세포치료제의 국 내 개발 및 판매권 - 임상 3상 및 품목허가는 한독이 담당 |
| ③ 대상 지역 | 대한민국 |
| ④ 계약 기간 | 2019년 5월 24일 ~ 제품 발매일로부터 20년 |
| ⑤ 총 계약 금액 | 20억원 |
| ⑥ 수취 금액 | 지분 투자 40억원 (2019.06.05 납입) |
| ⑦ 계약 조건 | ▲ 지분 투자 : 40억원 (2019.06.05 납입) ▲ 계약금(Upfront) : 10억원 - 수취조건 : 계약 체결 시 ▲ 마일스톤(Milestone) - 수취조건 : 제품 품목허가 취득 시 ▲ 로열티(Royalty) : 순매출액의 10% - 수취조건 : 매년 1회 정산 ▲ 제품 판매 : 제조원가에 10% 이익 가산 - 수취조건 : 제품 공급 시 |
| ⑧ 회계 처리 방법 | 수령한 계약금은 당사의 임상 1/2상 의무에 대해 지급한 것으로 임상 1/2상 실질적 예상 수행기간에 따라 안분하여 수익인식 |
| ⑨ 대상 기술 | 층분리배양법 기술을 이용하여 개발하고 있는 중등증-중증 아토피 피부염 치료를 위한 줄기세포치료제 |
| ⑩ 개발 진행 경과 | 2020년 2월 식약처로부터 1/2상 임상시험 계획 승인 후 2023년 5월 1/2상 임상시험 결과보고 완료 |
| ⑪ 기타 사항 | - |
다. 라이선스인(License-in) 계약
| [라이선스인 계약 총괄표] |
| (단위 : 백만원) |
| 품목 | 계약 상대방 | 대상 지역 | 계약 체결일 | 계약 종료일 | 총 계약 금액 | 지급 금액 | 진행 단계 |
|---|---|---|---|---|---|---|---|
| 척수소뇌성실조증 줄기세포치료제 (Stemchymal) |
Steminent Biotherapeutics, Inc. (대만) |
한국 | 2020.10.13 | 2030.10.12 | 4,510 | 507 | 자진철회 추가 검토중 |
| 제1형 및 제3형 당뇨병 치료제 |
Allele Biotechnology and Pharmaceuticals Inc. |
한국 | 2021.06.30 | - | 3,389 | 1,761 | 비임상 |
(1) 품목 : 척수소뇌성 실조증 줄기세포치료제(Stemchymal)
| ① 계약 상대방 | Steminent Biotherapeutics Inc. (대만) |
| ② 계약 내용 | 스템키말(Stemchymal)의 개발, 허가, 생산 및 판매에 대한 국내 독점 권한 |
| ③ 대상 지역 | 대한민국 |
| ④ 계약 기간 | 2020년 10월 13일 ~ 2030년 10월 12일 (계약일로부터 10년, 이후 계약해지 의사 없을 시 매 2년 마다 자동 갱신) |
| ⑤ 총 계약 금액 | $3,932,585 (약 45.1억원), 로열티 별도 |
| ⑥ 지급 금액 | $561,798 (약 5억원) |
| ⑦ 계약 조건 | ▲ 총액 - $3,932,585 (약 45.1억원) ▲ 선급기술료(계약금) - $561,798 (약 5억원) ▲ 마일스톤 지급조건 - 임상 2상 임상시험계획서(IND) 승인 시 : $561,798 (약 5억원) - 조건부 품목허가 취득 시 : $842,697 (약 9.8억원) - 정규 품목허가 취득 시 : $1,685,393 (약 19.3억원) - 의약품 보험등재 완료 시 : $280,899 (약 3.2억원) ▲ 판매 로열티 : 순매출액의 10% |
| ⑧ 회계 처리 방법 | 지급 시 경상연구개발비로 비용 처리 |
| ⑨ 대상 기술 | 스템키말(Stemchymal)은 지방유래 중간엽줄기세포를 활용하는 세포치료제임. 특정 신경세포종인 푸르킨예세포(Purkinje Cell)와 ATAXIN-3 단백질 등의 응집을 감소시킴으로써 퇴행성 뇌신경계 질환인 척수소뇌성 실조증을 치료 |
| ⑩ 개발 진행 경과 | - 대만 임상 2상 환자 투여 완료 - 일본 임상 2상 진행 중 (라이선스 파트너 : 일본 리프로셀 (Repr ocell Inc.) - 미국 임상 2상 임상시험계획서 승인 - 미국 FDA 및 일본 PMDA로부터 희귀의약품 지정 완료 - 제 2상 임상시험 계획(IND) 자진 취하 결정 |
| ⑪ 기타 사항 | - |
(2) 품목 : 제1형 및 제3형 당뇨병 치료제
| ① 계약 상대방 | Allele Biotechnology and Pharmaceuticals, Inc. |
| ② 계약 내용 | iPSC 유래 췌장 베타세포 당뇨병 치료제의 개발, 허가, 생산 및 판매에 대한 국내 독점 권한 |
| ③ 대상 지역 | 대한민국 |
| ④ 계약 기간 | 2021년 6월 30일 ~ 모든 이익분배의무가 만료될 때까지 |
| ⑤ 총 계약 금액 | $3,000,000 (약 33.89억원), 로열티 별도 |
| ⑥ 지급 금액 | $1,500,000 (약 17.6억원) |
| ⑦ 계약 조건 | ▲ 총액 - $3,000,000 (약 33.89억원) ▲ 선급기술료(계약금) - $750,000 (약 8.8억원) ▲ 마일스톤 지급조건 - 개발비 분담금 : $750,000 (약 8.8억원) - 임상시험계획서(IND) 승인 시 : $500,000 (약 5.65억원) - 판매승인신청서(MAA) 승인 시 : $1,000,000 (약 11.30억원) ▲ 판매 로열티 : 영업이익의 35% |
| ⑧ 회계 처리 방법 | 지급 시 경상연구개발비로 비용 처리 |
| ⑨ 대상 기술 | mRNA 원천기술을 적용하여 유도만능줄기세포를 구축하고, 조직 특이적 세포 분화기술을 이용하여 유도만능줄기세포 유래 췌장 베타세포를 만들어 제1형 및 제3형 당뇨병 치료제로 개발하는 기술 |
| ⑩ 개발 진행 경과 | - 미국 유도만능줄기세포 유래 췌장 베타세포 생산 완료 - 미국 비임상 유효성 시험 진행 중 - 한국 비임상 체내 분포, 독성, 종양원성 시험 준비 중 |
| ⑪ 기타 사항 | - |
라. 특허양수도 계약
| (단위 : 백만원) |
| 계약 상대방 | 계약 체결일 |
계약 종료일 |
주요 내용 | 계약 금액 |
|---|---|---|---|---|
| 인하대학교 산학협력단 |
2018.08.09 | - | ▲ 선급기술료(Initial Payment) - 계약금 : 1억원 - 중도금 : 1.5억원 (중도금 상당의 특허권양도 대금체권을 현물 출자) ▲ 개발성공금(Milestone Payment) - 2억원 (해당기술기반 제품 국내외 구분없이 최 초 제품 출시에 한해 1회 지급) ▲ 경상기술료 - 순매출액의 3% (계약기술을 통해 생산되는 제 품 최초 매출 발생일로부터 6년간) |
450 |
마. 공동연구개발 계약
| (단위 : 백만원) |
| 계약 상대방 | 계약 체결일 |
계약 종료일 |
주요 내용 | 계약 금액 |
|---|---|---|---|---|
| University of Utah | 2018.10.10 | 2019.12.31 | 공동연구계약(세포시트를 이용한 신장 및 자궁벽섬유화 치료제 개발) | 1,200 |
| Allele Biotechnology and Pharmaceuticals, Inc. | 2019.02.20 | 옵션기간 | Research Collaboration Option Agreement (iPSC 유래 췌장 베타세포 당뇨병 치료제) |
600 |
| PBS Biotech, Inc. | 2019.05.24 | 2019.11.22 | 3D Bioreactor Process Development Service Agreement (바이오리액터 공정 개발) |
320 |
| ㈜티앤알바이팹 | 2019.07.01 | 2021.06.30 | 공동연구개발 양해각서 (바이오프린팅 응용 재생의료치료제 개발) |
- |
| Steminent Biotherapeuics |
2019.07.02 | 품목허가 후 5년 |
공동개발 및 상업화(크로스 라이선스) 양해각서 - 척수소뇌성 실조증 치료제 국내 도입 및 SCM-AGH(아토피 피부염) 기술 수출 - 현재 사업구조 협의 중 |
- |
| ㈜미토이뮨 테라퓨틱스 |
2019.07.10 | 2021.07.09 | 공동연구개발 양해각서 (미토콘드리아 응용 줄기세포 효능개선 연구) |
- |
| 가톨릭대학교 산학협력단 |
2020.01.01 | 2023.06.30 | 혈액암 환자의 항암 치료 반응 및 내성과 관련한 MSC 유래의 exosome의 역할 연구 | 300 |
| PBS Biotech, Inc. | 2020.07.27 | 2021.07.31 | 2nd phase process development service agreement | 1,263 |
| ㈜테라이뮨 | 2021.07.01 | 2022.06.30 | Clonal MSC와 polyclonal Treg를 활용한 병용세포치료제 연구 및 개발 | - |
바. 유형자산 취득 계약
| (단위 : 백만원) |
| 계약 상대방 | 계약 체결일 |
계약 종료일 |
주요 내용 | 계약 금액 |
|---|---|---|---|---|
| 코바이오텍㈜ | 2019.06.07 | 2019.08.19 | 부동산 매매계약 - 매매가액 : 76억원 |
7,600 |
| ㈜제이오 | 2019.06.01 | 2019.07.20 | GMP 공조설비 개선공사 | 286 |
| 이움도시건축 | 2019.12.06 | 2020.05.31 | 리모델링 설계 및 허가 | 47 |
| 2020.02.10 | 2020.05.31 | 증축 및 리모델링 공사 감리용역 | 27 | |
| ㈜세부종합건설 | 2020.02.18 | 2020.05.31 | 송도 사옥 증축 공사 | 242 |
| ㈜앤츠컴 | 2020.03.09 | 2020.05.31 | 송도 사옥 인테리어 공사 | 638 |
| ㈜신창이엔지 | 2021.03.01 | 2021.04.30 | 송도 사옥 비상 발전기 | 48 |
사. 합작투자 계약
| (단위 : 백만원) |
| 계약 상대방 | 계약 체결일 |
계약 종료일 |
주요 내용 | 계약 금액 |
|---|---|---|---|---|
| ㈜제넥신 | 2018.12.28 | 2019.06.27 | Binding Argos Joint Bidding Agreement | - |
| 2018.04.11 | - | Shareholder's Agreement | - | |
| 2019.10.31 | - | Common Stock Purchase Agreement | 17,184 |
아. 연구개발활동
(1) 연구개발활동의 개요
당사는 국내외 타 중간엽줄기세포치료제 회사들과는 차별화된 줄기세포 분리 및 배양 방법을 사용하여 고순도ㆍ고효능 줄기세포치료제를 개발하고 있습니다. 이를 위하여 세포를 분리하는 플랫폼 기술인 층분리배양법을 개발하여 글로벌 특허를 확보하였고, 최근에는 개선된 층분리배양법을 개발하여 2037년까지 특허권을 확보하였습니다.
당사는 세포치료제 사업의 글로벌 시장 확보를 위하여 가장 중요한 대량생산 최적화 작업들을 지속적으로 전개하여 고밀도 세포배양을 이용하는 1세대 대량생산 제조공정에 이어 저밀도 세포배양과 항산화제를 이용한 2세대 대량생산 제조공정을 확립하였습니다. 현재는 상업화를 고려하여 3D 바이오리액터를 활용한 3세대 대량생산 제조공정 작업을 수행하고 있습니다.
또한, 당사는 질환 특이적 줄기세포치료제를 개발하기 위하여 3단계의 질환 특이적 줄기세포 선별 과정을 수립하여 연구개발을 하고 있습니다.
![이미지: [연구개발 보유기술의 구조]](99-%EC%97%B0%EA%B5%AC%EA%B0%9C%EB%B0%9C%20%EB%B3%B4%EC%9C%A0%EA%B8%B0%EC%88%A0%EC%9D%98%20%EA%B5%AC%EC%A1%B0.jpg) |
|
[연구개발 보유기술의 구조] |
당사는 자체 개발한 원천기술을 이용하여 제조 및 치료 비용이 저렴하고 질환 특이적인 줄기세포치료제 개발과 고순도 줄기세포 유래 분비체를 활용한 제품 개발을 수행하고 있습니다.
(2) 연구개발 담당조직
당사는 본부제 편성 후 연구사업혁신개발본부(연구개발부)와 첨단바이오의약품본부(세포치료제 제조소, 임상개발부)의 긴밀한 협력으로 부서 간 빠른 소통과 의사결정, 활발한 협업을 가능하게 하고 있습니다. 연구개발부에서 수행되는 치료제 특성 규명 연구, 대량생산 공정시험, 차세대 치료제 개발시험은 제조소로 신속하게 이관되어 치료제 생산 시스템에 적용되고 있으며, 비임상 독성과 효력시험, 바이오마커 발굴 관련 연구도 임상시험의 결과와 함께 면밀히 상호 분석하여 치료제를 개발하고 있습니다.
① 연구개발부
| 조 직 | 역 할 |
|---|---|
| 연구소장 | 연구개발 관련 업무 총괄 |
| 비임상약리팀 | 줄기세포치료제 효력/약리, 기전, 독성평가 |
| 세포공정팀 | 대량배양 시스템 개발 |
| 효능검증팀 | 질환특이적 치료제 발굴 및 라이브러리 구축, 치료기전 규명, 질환특이적 치료제 특성 규명 |
② 세포치료제 제조소
| 조 직 | 역 할 |
|---|---|
| 제조소장 | 세포치료제 제조 관련 업무 총괄 |
| 제조관리팀 | 세포은행구축, 임상시험용 세포치료제 제조, 위수탁사업, 배양액 생산 |
| 품질관리팀 | 치료제 품질 관리 및 신규 시험법 개발 |
| 품질보증팀 | GMP 문서 시스템 관리, 교정, 적격성 평가, 출하 승인 |
③ 임상개발부
| 조 직 | 역 할 |
|---|---|
| 첨단바이오의약품 본부장 | 임상시험 관련 업무 총괄 |
| 임상시험 관리자1 | 만성 이식편대숙주질환 임상시험 관리 |
| 임상시험 관리자2 | 중등증-중증 급성 췌장염 임상시험 관리 |
| 임상시험 관리자3 | 중등증-중증 아토피 피부염 임상시험 관리 |
(3) 연구개발현황
당사는 보고서 작성 기준일 현재 박사 5명, 석사 16명 등 총 48명의 연구개발인력을 보유하고 있으며, 그 현황은 아래와 같습니다.
| 구 분 | 박사 | 석사 | 학사 | 전문학사 | 합 계 |
|---|---|---|---|---|---|
| 인원수(명) | 5 | 16 | 27 | - | 48 |
또한, 당사는 아래와 같이 다양한 분야의 외부 자문위원을 활용하고 있습니다. Mudi Sheves 박사는 이스라엘 와이즈만 연구소 교수(부총장)을 역임하고, 와이즈만 연구소의 기술지주회사 예다의 이사회 의장을 맡아 글로벌 기술사업화의 전문가로서 당사의 기술이전 및 사업화 관련 자문을 수행하고 있습니다.
| [에스씨엠생명과학㈜ 자문위원 현황] |
| 직 위 | 성 명 | 주 요 경 력 |
|---|---|---|
| 자문위원 | Mudi Sheves | Chairman Of Boards, Yeda R&D Co., Ltd. Professor(Vice president), Weizmann Institute of Science |
(4) 연구개발비용
당사는 보고서 작성 기준일 현재 연구 및 임상개발 등에 소요되는 모든 비용을 아래와 같이 당기비용으로 회계처리하고 있습니다.
| (단위 : 천원) |
| 구 분 | 2023년도 1분기 (제10기 1분기) |
2022년도 (제9기) |
2021년도 (제8기) |
|
|---|---|---|---|---|
| 비용의 성격별 분류 |
시약재료비 | 483,744 | 1,518,586 | 1,846,722 |
| 인건비(주식보상비용 제외) | 799,048 | 2,646,112 | 2,167,115 | |
| 주식보상비용 | (42,171) | 344,717 | 317,991 | |
| 감가상각비 | 18,026 | 790,650 | 734,243 | |
| 외주용역비 | 979,546 | 3,351,157 | 4,658,793 | |
| 기타 | 213,705 | 660,086 | 748,081 | |
| 연구개발비용 합계 | 2,451,897 | 9,311,308 | 10,472,945 | |
| (정부보조금) | - | - | (458,153) | |
| 보조금 차감후 금액 | 2,451,897 | 9,311,308 | 10,014,792 | |
| 회계처리 내역 |
경상연구개발비 | 2,451,897 | 9,311,308 | 10,014,792 |
| 개발비(무형자산) | - | - | - | |
| 회계처리금액 계 | 2,451,897 | 9,311,308 | 10,014,792 | |
| 매출액 | 97,511 | 395,982 | 439,263 | |
| 연구개발비용 / 매출액 비율 (연구개발비용 합계÷당기매출액×100) |
2514.47% | 2,351.48% | 2,279.91% | |
주1) 당사의 연구개발비는 전액 비용 처리하고 있습니다.
주2) 연구소, 제조소 및 임상개발부에서 발생하는 비용은 전액 경상연구개발비로 처리하
였습니다.
(5) 연구개발실적
① 진행 경과 및 향후 계획
| 구 분 | 품 목 | 적응증 | 연구시작일 | 현재 진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 계획 승인일 |
시험 대상자 수 |
|||||
| 줄기세포 치료제 |
SCM-CGH | 만성 이식편대숙주질환 |
2008년 | 임상 2상 (한국) |
2016년 | 84명 | - |
| SCM-AGH | 중등증-중증 급성 췌장염 |
2010년 | 임상 2a상 (한국) |
2018년 | 2a상 : 36명 | - | |
| SCM-AGH | 중등증-중증 아토피 피부염 |
2013년 | 임상 2상 (한국) |
2020년 | 2상 : 72명 | - | |
(a) 품목 : 만성 이식편대숙주질환 줄기세포치료제 (SCM-CGH)
| ① 구분 | 줄기세포치료제(바이오 신약) |
| ② 적응증 | 만성 이식편대숙주질환 |
| ③ 작용기전 | 면역활성 환경에서 고순도 중간엽줄기세포는 T-세포의 증식 억제와 면역세포 표면에 존재하는 아세틸콜린 수용체를 통하여 면역세포의 활성과 증식을 억제 |
| ④ 제품의 특성 | 신선형 제형의 줄기세포치료제는 층분리배양법으로 분리 및 배양된 고순도 줄기세포로 마스터 세포은행과 제조용 세포은행을 구축한 다음, 환자의 투여 일정이 확정되면 제조용 세포은행의 줄기세포를 해동하여 10~12일 간의 배양 과정을 통해 완제품을 제조하여 주사기에 충전된 형태로 공급하는 제형임 |
| ⑤ 진행 경과 | [세포 확보 및 공정 확립] - 제조공정과 표준작업지침서 완성 (2006) - 치료목적사용 임상시험 2건 실시 (2007.01~2008.12) - 논문 게재 (SCI 1편, 2010) - 세포치료제 제조소 구축 (2009) [비임상시험] - 동물모델 유효성 시험 (2008~2010) → 논문 게재 (SCI 1편, 2010) - 비임상 독성시험 수행 (2008~2010) [임상시험] - 한국 1상 임상시험 실시 (2010~2011) - 한국 2상 임상시험 계획 승인 (2016.04) 및 임상시험 실시 (2018~ 진행 중) - 식약처 개발단계 희귀의약품 지정 (2019.04) - SCM-CGH에 대한 식약처 이식편대숙주질환 줄기세포치료제 치료 목적 사용 허가 (2022.09) - 2상 임상시험대상자 등록 및 투약 완료 (2023.03) |
| ⑥ 향후 계획 | [국내] 2025년 조건부 품목허가 후 2025년 제품 판매 예정 [글로벌] 국내 임상시험 종료 후 글로벌 임상 추진 예정 |
| ⑦ 경쟁 제품 | ▲ 현재까지는 국내에서 만성 이식편대숙주질환을 근본적으로 치료할 수 있는 치료제는 출시되지 않았으며, 표준 치료법으로 corticosteroid, calcineurininhibitors(cyclosporine, tacrolimus), thalidomide, 체이 광화학요법(extracorporeal photochemotherapy, ECT) 또는 mycophenolatemofetil(MMF), methotrexate 같은 면역억제제가 있음. ▲ Janssen의 BTK 저해제인 임브루비카(Imbruvica)가 2017년 만성 이식편대숙주질환에 대한 적응증 추가로 미국 FDA 허가를 받음. 한국 등 글로벌 시장에서는 3상 임상시험을 진행중이며, 일부 환자에서 증상의 개선이 확인되었고, 개선된 증상이 5개월 이상 지속됨. 그러나 동반된 부작용으로는 피로, 타박상, 설사, 혈소판 감소, 근육 경련, 메스꺼움, 폐렴 등이 발생함. ▲ Novartis의 JAK 신호체계를 선택적으로 억제하는 경구용 소분자 표적 치료제인 자카비(Jakavi)가 한국 등 글로벌 만성 이식편대숙주질환 환자를 대상으로 3상 임상시험을 완료하고 2021년 09월 22일 만성 이식편대숙주질환에 대한 적응증 추가로 미국 FDA 허가를 받았음. 자카비와 기존 치료(BAT, Best available therapy)를 비교한 3상 임상시허에서 연구 1차 평가변수인 24주차 전체 반응률(ORR)은 자카비 치료군이 49.7%, BAT군이 25.6%로 나타남. 그러나 자카비 투여 후 가장 일반적인 혈액학적 이상 반응은 감염, 바이러스 감염이 있음. |
| ⑧ 관련 논문 등 | Yi TG et al. (IJSC 2019 Vol. 12(2) 315) |
| ⑨ 시장 규모 | 2018년 기준 4,600억원 규모에서 연 평균 6.22% 성장하여, 2023년에는 6,260억원 규모에 이를 것으로 전망 (출처 : GlobalData, GVHD Epidemiology and Market Size Database (2019)) |
| ⑩ 기타사항 | - |
(b) 품목 : 중등증-중증 급성 췌장염 줄기세포치료제 (SCM-AGH)
| ① 구분 | 줄기세포치료제(바이오 신약) |
| ② 적응증 | 중등증-중증 급성 췌장염 |
| ③ 작용기전 | 고순도 중간엽줄기세포는 면역관문 조절 물질 ICOSL-ICOS와 상호작용을 통해 조절 T-세포의 활성과 항염증성 사이토카인 IL-10의 생성을 유도하고, 이는 조직 괴사가 동반되는 염증성 환경에서 면역반응을 직접적으로 억제 |
| ④ 제품의 특성 | ▲ 제형 : 동결형 제형의 줄기세포치료제는 제조공정이 완료된 최종 완제품에서의 무균성을 확인한 후 질소 탱크에 저장하여 보관하고 있다가 급성 환자들처럼 빠른 시간 안에 투여가 필요할 경우 완제품을 바로 해동하여 투여할 수 있는 형태의 제형임. ▲ 중증등-중증 급성 췌장염에 대한 줄기세포치료제 SCM-AGH는 2022년 08월 31일 제 1/2a상 임상시험에 대한 결과 보고를 완료하였음. ▲ 2020년 10월 개발단계 희귀의약품 지정을 받았으며, 이를 통해 2b상 임상시험 이후 조건부 품목허가를 받아 빠르게 시장에 진출할 것으로 예상되어 급성 췌장염 치료에 대한 미충족 의료 수요 해소 및 시장을 선도할 수 있을 것으로 판단함. |
| ⑤ 진행 경과 | [비임상시험] - 동물모델 유효성 시험 (2010~2011) → 논문 게재 (SCI 1편, 2011) - 비임상 독성시험 수행 (2014~2016) [임상시험] - 한국 1/2a상 임상시험 계획 승인 (2018) - 한국 1/2a상 임상시험 모집 완료 (2019~2021) - 한국 1/2a상 임상시험 및 결과발표 완료 (2022) - KDDW2022 임상결과 발표, 최우수 초록 수상(2022) |
| ⑥ 향후 계획 | [국내] 2026년 조건부 품목허가 후 제품 판매 예정 |
| ⑦ 경쟁 제품 | ▲ 현재 시장에서 출시되어 췌장염 치료에 사용되고 있는 약물인 Futhan과 Miraclid는 단백질 분해효소를 타겟으로 염증 반응을 억제하는 기전을 나타내는 치료제임. 다만, 상기 두 치료제들은 급성 췌장염을 적응증으로 하는 치료제가 아닌 증상 개선을 위한 대중요법으로 허가 받음. ▲ 가장 유력한 경쟁약물은 융합 단백질인 TAK-671(SB-26 또는 울리나시타틴Fc)으로 Takeda Pharmaceutical 및 상성바이오에피스가 협력 개발 중인 약물로서 미국에서 1상 임상시험을 완료하였음. ▲ 다른 경쟁 약물로는 CRAC 채널 억제제인 Auxora(CM4620)으로 CalciMedica, Inc.에서 개발 중인 약물로서 미국에서 SIRS(전신염증반응증후군)을 동반한 급성 췌장염 환자 대상으로 2상 임상시험을 진행 중이나, 당사의 임상시험의 대상자(중등증 이상의 급성 췌장염) 모집 기준의 차이점이 있음. |
| ⑧ 관련 논문 등 | Jung et al. (Gastroenterology. 2011, 140(3):998) |
| ⑨ 시장 규모 | 글로벌 시장 규모는 2025년 73억 7,201만 달러(USD)로 추정하고 있으며, 당사가 목표로 하는 급성 췌장염 환자 비율은 전체 췌장염 환자 중 약 20%의 시장 규모로 약 2조원에 육박함. (출처 : Market Research Future, Global Acute Pancreatitis Market research Report (2019)) |
| ⑩ 기타사항 | - |
(c) 품목 : 중등증-중증 아토피 피부염 줄기세포치료제 (SCM-AGH)
| ① 구분 | 줄기세포치료제(바이오 신약) |
| ② 적응증 | 중등증-중증 아토피 피부염 |
| ③ 작용기전 | IL-4 및 IL-17 신호전달체계 역제와 IgE 생성 저해를 통핸 면역 시스템조절 |
| ④ 제품의 특성 | ▲ 제형 : 동결형 제형의 줄기세포치료제는 제조공정이 완료된 최종 완제품에서의 무균성을 확인한 후 질소 탱크에 저장하여 보관하고 있다가 급성 환자들처럼 빠른 시간 안에 투여가 필요할 경우 완제품을 바로 해동하여 투여할 수 있는 형태의 제형임. ▲ Ovalbumin/Alum-유도 아토피 피부염 동물모델에서 동결형 줄기세포치료제 SCM-AGH를 정맥 투여하여 피부 병변의 임상적 증상을 개선하고 혈중 IgE를 낮추는 치료 효능을 확임함. |
| ⑤ 진행 경과 | [비임상시험] - 동물모델 유효성 시험 (2013~2014) → 논문 게재 (SCI 1편, 2014) [임상시험] - 치료목적사용 임상시험 5명 (2017.06~진행 중) - 한국 1/2상 임상시험 IND 신청 (2019.11) - 한국 1/2상 임상시험 계획 승인 (2020.02) - 한국 1/2상 임상시험 결과보고 완료 (2023.05) |
| ⑥ 향후 계획 | [국내] 2025년 3상 임상시험 완료 후 2026년 제품 판매 예정 [글로벌] 2025년 Accelerated Approval [가속허가] 제도를 통한 조건부 허가 및 2026년 제품 출시 예정 |
| ⑦ 경쟁 제품 | 지난 10여년 동안 시장을 독점하고 있는 치료제들로 FDA 승인을 받은 엘리델과 프로토픽이 존재하였으며, 첫 바이오의약품으로 인터루킨-4/인터루킨-13 수용체 억제제(anti IL-4/IL-13 receptor)인 듀피젠트가 2017년 3월 미국 FDA로부터 중등증-중증 단계의 성인 아토피 피부염 환자에 대한 사용 승인을 받고, 2019년 3월 소아 아토피 피부염에 대하여 추가 승인을 받음. 2022년에는 경구약이며 JAK1 inhibitor인 린버크와 시빈코가 각각 MFDS에 승인되어 추후 간접적인 경쟁 상품이 될 수 있음. |
| ⑧ 관련 논문 등 | Na et al. (Cell Death & Disease. 2014, e1345) |
| ⑨ 시장 규모 | 글로벌 시장 규모는 2019년 6.1조원 규모에서 2024년 8.5조원 수준으로 증가할 것으로 전망되며, 이 중 중등증-중증 비율은 약 40%로 약 3.4조원 시장이 될 것으로 예상됨. (출처 : 보건산업진흥원, 보건의료 기술가치평가 보고서(2018, GlobalData 자료 재가공)) |
| ⑩ 기타사항 | - |
(6) 연구개발 완료 실적
(a) 품목 : 층분리배양법(원천기술)
| ① 구분 | 고순도 중간엽줄기세포 분리방법(층분리배양법) |
| ② 개발 기간 | ▲ 층분리배양법 : 2002.03~2006.02 ▲ 개선된 층분리배양법 : 2014.02~2017.06 |
| ③ 개발 과정 | - 고순도 중간엽줄기세포 분리방법인 층분리배양법 개발(2006.02) - 층분리배양법 국내외 특허 등록 : 한국(2008.01), 미국(2010.08), 일본(2012.12), 중국(2013.01), EU(2014.07) - 저밀도 세포배양과 항산화제를 사용하는 개선된 층분리배양법 개 발(2017.06) - 개선된 층분리배양법 국내 특허 등록(2019.05) → 2026년에서 2037 년으로 특허 기간 연장, 국외 특허 출원(미국 외 9개국, 2018.06~2 018.10) |
| ④ 관련 논문 등 | - Stem Cells and Development. 17(3):451-461(2008) - World Journal of Stem Cells. 3(8):70-82(2011) - Journal Expert Opinion on Biological Therapy Volume 14, 2014-Issu e11 - Tissue Eng Part C Methods. 2015 Dec;21(12):1251-1262 - Tissue Eng Part C Methods. 2015 May;21(5):447-57 |
(b) 품목 : 고순도 줄기세포 유래 발모 효능 단백질이 함유된 화장품
자. 오픈이노베이션을 통한 신규 후보물질 및 기술력 확보
현재, 공동 연구개발을 진행 중인 기관은 미국 유타대학교와 국내 병원 및 대학교 3곳 그리고 미국 Tera Immune 社를 비롯한 3개의 국내외 바이오 벤처기업들로 총 8개이며, 다음과 같은 10가지 목표를 가지고 협력 연구가 진행되고 있습니다.
| [공동연구 프로젝트별 목표] |
| 프로젝트별 목표 | 협력 기관 | |
|---|---|---|
| 1 | 차세대 줄기세포치료제 제형 개발 | - 미국 유타대학교 |
| 2 | 줄기세포 유래 엑소좀 기능 연구 및 개발 | - 가톨릭대학교 서울성모병원 |
| 3 | 미토콘드리아로 인한 줄기세포치료제 효능 개선 연구 및 개발 | - 미토이뮨테라퓨틱스 |
| 4 | 질환 특이적 바이오마커 연구 : 아토피 피부염 | - 인하대병원 |
| 5 | 대량생산 공정 개선 : 3D 바이오리액터 | - 미국 PBS Biotech |
| 6 | 줄기세포와 CAR-Treg를 이용한 자가면역질환 세포치료제 연구개발 | - 미국 Tera Immune |
| 7 | iPSC 유래 췌장 베타세포 당뇨병 치료제 개발 | - 미국 Allele |
| 8 |
췌장염 치료를 위한 최적의 MSC 선별 방법 개발 |
- 인하대학교 |
| 9 |
프라이밍 MSC가 T 세포 활성에 미치는 영향 연구 |
- 인하대병원 |
| 10 |
줄기세포 아토피피부염 치료기전 비교 |
- 인하대학교 |
(1) 차세대 줄기세포치료제 제형 개발
시트(Sheet) 형태의 줄기세포치료제 개발은 기존의 주사형 제형이 전신을 순환하다 생착에 성공한 일부 세포로부터 발현되는 것과는 달리, 목표 부위에 직접 부착하기 때문에 줄기세포의 효능을 극대화할 수 있는 방법입니다.
목표 부위에 직접 부착하여 줄기세포의 효능을 나타낼 수 있는 시트를 개발하기 위해 공동으로 연구를 진행하고 있는 기술로는 유타대학교의 세포시트 기술, 한양대학교의 스페로이드 기술 및 티앤알바이오팹의 3D 바이오프린팅 기술이 있습니다.
① 유타대학교 : 2018년 8월 MOU를 체결한 미국 유타대학교 세포시트 조직 공학 센터(CSTEC)와는 SCM-cMSC를 여러 층의 세포시트 형태로 개발하여 손상된 조직에 이식 후 효능 평가를 하는 공동 연구를 진행 중이며, 본 연구를 통해 자궁벽 및 신장 섬유화증에 적용할 수 있는 제품을 개발하고자 합니다.
(2) 줄기세포 유래 엑소좀 기능 연구 및 개발
엑소좀은 세포가 분비하는 세포 간 신호전달 물질로 최근 세포 재생 및 대사, 진단 연구 분야에서 주목을 받고 있는 나노물질입니다. 그 중 줄기세포가 분비하는 엑소좀의 경우, 면역거부 반응이 낮고 높은 재생 및 치료 효과가 기대되고 있어 SCM-cMSC를 활용한 연구를 진행 중에 있습니다. 가톨릭대 김유진 교수팀과는 2020년 1월 공동 연구계약을 맺고 혈액암 환자의 항암치료 반응 및 내성과 관련한 MSC 유래 엑소좀의 역할에 대한 연구를 진행 중입니다.
(3) 미토콘드리아로 인한 줄기세포 효능 개선 연구 및 개발
미토이뮨테라퓨틱스의 MIT 컴파운드(indole-based privileged chemical scaffold)는 미토콘드리아 기능에 영향을 주어 세포의 괴사를 막고 생존율을 증가시키며, 세포배양이 불가능한 심장근육세포(cardiomyocyte) 및 간세포(hepatocyte) 등의 일차세포배양(primary cell culture)을 가능하게 합니다. 당사는 MIT 컴파운드가 항산화 및 저산소 효과를 통하여 SCM-cMSC의 줄기세포능을 개선시켜 줄 것으로 기대하여, 병행 또는 병렬 투여로 염증성 질환모델에서 유효성 평가와 세포 증식률 증가 분야에서 공동 연구개발을 진행 중입니다.
(4) 질환 특이적 바이오마커 연구 : 아토피 피부염
인하대병원 의생명연구원과 협력을 통해 아토피 피부염 치료에 관여하는 중간엽 줄기세포주의 바이오마커 발굴을 위한 연구를 진행하여, 아토피 피부염에 특이적으로 적용할 수 있는 세포주를 선정하는 효능 지표로 활용하고 있습니다.
(5) 대량생산 공정 개선 : 3D 바이오리액터
PBS Biotech과의 공정개발 과정을 통해 2021년 3D 배양공정을 적용하여 3리터 배양기에서의 최적화를 거쳐 15리터 규모의 초대량 배양 프로세스의 최적화 공정개발 작업을 완료하였습니다.
(6) 줄기세포와 Treg 또는 CAR-Treg를 이용한 자가면역질환 세포치료제
CAR-Treg는 최근 항암제 분야에서 각광받고 있는 CAR-T와 유사한 개념의 치료제입니다. 기존에 면역항암제에서 주로 사용되던 세포독성 T세포 (cytotoxic T cells) 대신 조절 T세포 (regulatory T cells)를 사용함으로써 자가면역질환에 적용할 수 있다는 큰 차이점을 가지고 있습니다. 세포독성 T세포의 경우, 그동안 면역계가 과도하게 반응을 보여 체내에 스스로 해를 끼치는 이른 바 사이토카인 폭풍 등 부작용이 발현되는 현상이 자주 관찰되곤 하나, 조절 T세포를 사용하는 경우 이런 부작용이 최소화됩니다. 고순도 줄기세포와 세포특이적으로 반응하는 면역억제세포인 Treg 또는 CAR-Treg는 다양한 형태의 자가면역질환에 적용할 수 있습니다.
(7) iPSC 유래 췌장 베타세포 당뇨병 치료제 개발
Allele은 2009년부터 유도만능줄기세포에 mRNA 원천기술을 적용해 조직 특이적 세포를 생산하고 있으며, Allele의 당뇨병 치료제의 개발, 허가, 생산 및 판매에 대한 한국 독점권한을 확보했습니다. 유도만능줄기세포는 환자의 세포를 이용해 만들어진 줄기세포이기 때문에 맞춤형 세포 치료 시대의 가능성을 제시하고, 환자 고유의 유전체적 특성을 모두 가지고 있으며, 불치병과 희귀질환 분야의 연구와 치료에 무한한 잠재력을 가지고 있는 도구로 평가받고 있습니다.
(8) 췌장염 치료를 위한 최적의 MSC 선별 방법 개발
인하대학교 연구실과 협력을 통해 췌장염 치료를 위한 최적의 MSC 선별 방법 개발을 위한 연구를 2023년 3월부터 진행하고 있습니다. 본 연구를 통해 발굴되는 in vitro & in vivo 실험들은 추후 췌장염 치료제 선정을 위한 최적의 줄기세포주를 선별하는 방법으로 적용하고자 합니다.
(9) 프라이밍 MSC가 T 세포 활성에 미치는 영향 연구
인하대병원 의생명연구원과 협력을 통해 프라이밍 MSC가 T 세포 활성에 미치는 영향 연구를 2023년 3월부터 진행하고 있습니다. 본 연구를 통해 각각의 프라이밍 인자 및 프라이밍에 기능 강화된 MSC가 T 세포 활성 및 분화에 미치는 영향을 분석하여 아토피 피부염 치료기전을 밝히고 최종적으로 도출된 결과물을 논문을 통하여 발표하고자 합니다.
(10) 줄기세포 라인의 아토피 피부염 치료기전 비교
인하대학교와 협력을 통해 한 공여자에서 분리된 3가지 MSC line의 아토피 피부염 치료기전 비교 연구를 2023년 3월부터 진행하고 있습니다. 본 연구를 통해 한 공여자로부터 분리된 골수 유래 MSC의 서로 다른 아토피 피부염의 치료 효능 비교 및 기전 연구를 통해 아토피 피부염의 치료기전을 밝히고 최종적으로 도출된 결과물을 논문을 통하여 발표하고자 합니다.
7. 기타 참고사항
가. 지적 재산
당사는 보고서 작성일 기준 현재 국내외 총 92건(등록 47건, 출원 42건, PCT 3건)의 특허 및 20건의 상표권(등록 13건, 출원 7건) 등 지식재산권을 주요 국가 및 전략적 파트너 관할 국가에서 보유하고 있으며, 아래는 주요 특허에 대한 요약과 세부 목록입니다.
(1) 보유기술 관련 특허 현황 요약
| 기술 구분 | 국내 | 해외 | PCT | |||
|---|---|---|---|---|---|---|
| 출원 | 등록 | 출원 | 등록 | 출원 | ||
| 줄기세포 분리, 제조기술 |
층분리 배양 및 증식 기술 | - | 3 | 2 | 12 | - |
| 신성형, 동결형 제조 기술 | - | - | - | 1 | - | |
| 지방 유래 줄기세포 분리기술 | - | 1 | - | - | - | |
| 줄기세포치료제 개발 기술 |
이식편대숙주병, 급성췌장염, 아토피 면역질환, 염증관련질환, 발기부전 | 1 | 6 | 25 | 12 | - |
| 줄기세포 기능 강화 개발 기술 |
줄기세포 기능강화 기술 | 3 | 3 | 11 | - | 3 |
| 기타 기술(탈모 완화) | - | 3 | - | 6 | - | |
| 합 계 | 4 | 16 | 38 | 31 | 3 | |
※상세 현황은 '상세표-4. 지적재산권 세부목록' 참조
나. 바이오의약품 및 세포치료제 산업의 특성
(1) 제약 선업의 변화 : 바이오의약품의 도약
바이오의약품의 정의 : 바이오의약품은 우리나라 약사법령 중 식품의약품안전처 고시의「생물학적제제 등의 품목허가ㆍ심사 규정」(식품의약품안전처고시 제2019-77호)에 따라 생물의약품으로 규정하고 있습니다. 이는 사람이나 다른 생물체에서 유래된 것을 원료로 또는 재료로 하여 제조한 의약품으로서 보건위생 상 특별한 주의가 필요한 의약품을 의미하며, 생물학적제제, 유전자재조합의약품, 세포배양의약품, 세포치료제, 유전자치료제, 기타 식품의약품 안전처장이 인정하는 제제를 포함합니다.
| [바이오의약품의 분류별 정의] |
| 분 류 | 정 의 |
|---|---|
| 생물학적제제 | - 생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 물질을 함유한 의약품으로서 물리적ㆍ화학적 시험만으로는 그 역가와 안전성을 평가할 수 없는 제제 - 백신, 혈장분획제제, 독소ㆍ항독소 등을 포함함 |
| 유전자재조합 의약품 | - 유전자조작기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품 - 항체의약품, 펩타이드 또는 단백질의약품, 세포배양의약품 등을 포함함 |
| 세포치료제 | - 살아있는 자가, 동종, 이종 세포를 체외에서 배양ㆍ증식하거나 선별하는 등 물리적, 화학적, 생물학적 방법으로 조작하여 제조하는 의약품 |
| 유전자 치료제 | - 유전물질 발현에 영향을 주기 위하여 투여하는 유전물질 또는 유전물질이 변형되거나 도입된 세포 중 어느 하나를 함유한 의약품 |
| 동등생물의약품 (바이오시밀러) |
- 이미 제조판매 또는 수입품목 허가를 받은 품목과 품질 및 비임상, 임상적 비교 동등성이 입증된 의약품 |
| 개량생물의약품 (바이오베터) |
- 이미 허가된 생물의약품에 비해 안전성ㆍ유효성 또는 유용성(복약 순응도, 편리성 등)이 개선되었거나 의약 기술에 있어 진보성이 있다고 식품의약품안전처장이 인정한 의약품 - 유효성분의 종류 또는 배합 비율 ㆍ 투여 경로 ㆍ 제제학적 개선을 통한 제형, 함량 또는 용법, 용량 ㆍ 명백하게 다른 효능 효과를 추가 |
자료 : 식품의약품안전처고시 제2019-77호, 생물학적제제 등의 품목허가ㆍ심사 규정(201
9.09.09 시행)
백신과 인슐린 등 단백질 치료제는 1세대 바이오의약품으로 분류되며, 가장 활발한 개발이 이루어지고 있는 항체치료제는 세포배양의약품으로서 2세대 바이오의약품입니다. 그리고 마지막으로 당사가 영위하고 있는 사업 분야인 세포치료제와 유전자치료제가 3세대 바이오의약품으로 주목을 받고 있는 분야입니다.
![이미지: [바이오의약품(생물의약품) 시대별 변천사]](6p_%EB%B0%94%EC%9D%B4%EC%98%A4%EC%9D%98%EC%95%BD%ED%92%88%EC%8B%9C%EB%8C%80%EB%B3%84%EB%B3%80%EC%B2%9C%EC%82%AC.jpg) |
|
[바이오의약품(생물의약품) 시대별 변천사] |
바이오의약품 시장은 바이오시밀러를 포함한 항체의약품들의 포화상태로 진입장벽이 높지만 성체줄기세포의 경우 국내 개발사들이 상업화를 선도하고 있을 뿐만 아니라, 산업 자체가 빠르게 성장하고 있으며 아직 선점할 가치가 있는 블루오션으로 판단됩니다.
의약품 시장에서의 바이오 웨이브 : 글로벌 제약 산업은 화학합성의약품 시대를 지나 바이오의약품으로 세대 교체 시점이 도래하였습니다. 바이오의약품이 차지하는 매출 비중이 지속적으로 증가하며, 바이오의약품의 수요가 증가하고 있습니다. 제약시장에서의 이러한 변화는 바이오의약품의 블록버스터 잠재력으로부터 증명되고 있습니다. 전 세계 매출 상위 100대 의약품 중 바이오의약품이 차지하는 비중은 2010년 32%에서 급증하여 2017년 49%에 도달하였습니다. 상위 10대 의약품 중 8개가 바이오의약품일 정도로 파급력이 높은 상황입니다.
![이미지: [글로벌 10대 의약품]](6p_%EA%B8%80%EB%A1%9C%EB%B2%8C10%EB%8C%80%EC%9D%98%EC%95%BD%ED%92%88.jpg) |
|
[글로벌 10대 의약품] |
| 주) | 음영 표시: 바이오의약품 |
| 자료: Nature Reviews Drug Discovery vol. 17, 232 (2018) | |
바이오의약품의 경우 아직까지는 합성의약품에 비해 가격 경쟁력에서 열위하지만, 지속적인 연구개발 및 제조공정 개선 등을 통하여 가격 경쟁력을 갖추게 된다면 보다 큰 부가가치를 창출할 수 있을 것으로 판단됩니다.
우리나라는 이미 바이오시밀러 분야에서 세계 최고의 경쟁력을 가지고 있으며, 세포치료제 분야에서도 큰 영향력을 가지고 있습니다. 현재까지 허가 받은 7개의 성체줄기세포치료제 중 4품목이 한국 제품입니다. 대한민국의 3대 미래전략 산업분야의 하나로 지정된 바이오헬스 산업에서 세포치료제는 향후 보다 큰 부가가치를 창출할 것으로 예상됩니다.
(2) 재생의료의 시대 : 세포치료제
① 고령 사회 집입과 세포치료제의 필요성
3년 전, 우리나라는 최초로 65세 이상의 노인 비중이 0~14세의 유소년 비중을 넘어서 고령사회로 진입하였습니다. 노인 인구 비중이 14%를 넘었으며, 만성 및 난치성 질환에 대한 관심이 급증함으로 인해 차세대 치료제를 통한 재생의료 분야가 각광받고 있습니다. 세포치료제로 기존 합성의약품 또는 1~2세대 바이오의약품으로 치료가 되지 않는 미충족 수요를 해결할 수 있다는 다양한 연구 결과가 제시되었기 때문입니다. 특히 세포치료제는 첨단재생의료 행위에 포함되며 다수의 장기기능 개선효과 사례 또한 보고되면서 임상영역에서 활발한 개발이 이루어지고 있는 분야입니다.
인체의 다양한 세포를 활용하는 세포치료제의 경우 다양한 유형이 존재하며, 당사는 현재 성체줄기세포치료제(중간엽줄기세포), 유도만능줄기세포를 이용한 치료제를 직접 개발하고 있으며, 관계사인 CoImmune에서는 수지상세포 그리고 CAR-CIK세포를 통해 치료제 개발을 진행 중입니다.
| [세포치료제의 유형] |
| 구 분 | 종 류 | 세부 유형 예시 | 당사 사업 영역 |
|---|---|---|---|
| 줄기세포 | 성체줄기세포 | 중간엽줄기세포, 조혈모줄기세포 |
● |
| 유도만능줄기세포 | - |
● |
|
| 배아줄기세포 | - |
- |
|
| 면역세포 | T세포 | 종양 침윤 T세포(TIL) CAR-T세포 TCR-T세포 CAR-CIK세포 |
● |
| 자연살해세포 | CAR-NK세포 |
- |
|
| 수지상세포 | 유전자 조작 수지상세포 |
● |
|
| 체세포 | 피부세포 | 표피, 진피 세포 | - |
| 연골세포 | - | - |
이 중 다양한 질병 치료를 위해 성체줄기세포를 기반으로 하는 치료제에 대한 수요가 증가하는 추세입니다. 당사가 주력 제품으로 개발 중인 성체줄기세포는 낮은 면역원성과 높은 면역 조절 기능이 있으며, 최소 침습적 절차를 통해 쉽게 확보가 가능하다는 장점을 보유하고 있습니다.
고성장ㆍ고부가가치 산업 : 줄기세포치료제가 차세대 의약품으로 인식되면서 향후 잠재성과 파급 효과에 대한 기대감으로 산업 전체가 국내외로 커지고 있습니다. 또한, 줄기세포 관련 원천기술 확보와 시장 선점을 위해 각 국가별로 줄기세포 관련 법안을 완화하고 투자를 확대하고 있습니다.
그 결과, 줄기세포치료제 임상시험이 증가하고 줄기세포 기반의 신약개발 활성화가 속도를 붙여가고 있는 추세입니다. 생명공학정책연구센터가 발간한 2018년 첨단바이오의약품 산업백서에 의하면 글로벌 줄기세포 시장은 연 평균 25.8%의 성장률로 급속하게 성장하여 2017년 72조원 규모의 줄기세포 시장은 2025년 454조원 규모로 성장할 전망입니다. 줄기세포에 대한 지속적인 연구개발, 임상시험을 통한 효능 입증 및 글로벌 제약사의 투자 확대로 줄기세포치료제 시장은 빠르게 커질 것으로 전망됩니다.
![이미지: [글로벌 줄기세포치료제 시장 현황 및 전망 (2016~2025년)]](%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EC%A4%84%EA%B8%B0%EC%84%B8%ED%8F%AC%EC%B9%98%EB%A3%8C%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%20%ED%98%84%ED%99%A9%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D%20%282016%7E2025%EB%85%84%29.jpg) |
|
[글로벌 줄기세포치료제 시장 현황 및 전망 (2016~2025년)] |
| 자료: Inkwood Research, Global Stem Cell Market Forecast (2017) |
특히 다양한 질병 치료에 활용되는 성체줄기세포치료제에 대한 수요가 가장 빠르게 증가하고 있습니다. 성체줄기세포는 다른 줄기세포에 비해 안전성이 확보되었고, 쉽게 확보가 가능하다는 장점이 있어 초기 시장 형성에 도움이 될 것으로 판단됩니다.
② 상대적으로 낮은 개발 리스크
현재, 병원에서 치료하고 있는 여러 다양한 질환들 중에서 아직도 효과적인 치료제가 없어서 제대로 치료할 수 없는 난치성 질환들이 많습니다. 이러한 난치성 질환들을 근원적으로 치료할 수 있는 새로운 치료제들의 개발이 절실히 필요한 상황입니다. 줄기세포치료제가 이러한 난치성 질환들을 치료할 수 있는 새로운 대안이 될 수 있다는 임상시험 결과가 국내외에서 도출되고 있습니다. 당사를 포함하여 세포치료제 개발 기업이 목표로 하는 적응증은 시장에서 다른 치료제와의 경쟁이 없거나 상대적으로 적은 질환입니다.
또한, 일반적인 신약 개발 과정이 평균 10~15년이 소요되며 전임상 이후 단계의 성공률이 낮은 반면, 줄기세포치료제는 개발 기간이 상대적으로 짧고 성공률이 높아 개발 리스크가 낮습니다. 그럼에도 불구하고 세포치료제에 걸맞는 산업 인프라(GMP, 제조시설 및 공정 등)를 구축하고 있는 기업은 매우 적습니다. 당사는 부설연구소와 세포치료제 제조소를 보유하여 위탁 생산 대신 자체 생산의 사업 구조를 가지고 성공적인 치료제 개발을 위한 인프라를 구축하는데 전력을 다하고 있습니다.
다. 시장의 특성
(1) 줄기세포치료제 시장
① 성체줄기세포의 시장 선점
줄기세포는 마땅한 의학적 수단이 없는 난치성 질환의 치료에서 획기적인 대안을 제시한다는 점에서 등장 초기부터 연구자들에게 혁신적인 치료제로 여겨지며 의료계에서 큰 관심을 끌고 있습니다. 특히 임상영역에서 장기 기능 개선 효과 등을 보여주고 있는 세포는 성체줄기세포를 중심으로 이루어지고 있습니다. 여러 세포들 중 성체줄기세포가 임상적용에 활발히 이용될 수 있는 과학적 이유로는 증식력 조절(controlled proliferation)인데 체내에서 지나친 증식을 하지 않고 생리적 조건에 따라 조절되어, 기형종 발생이 문제가 되는 배아줄기세포와 다르게 안전성에 우려가 적습니다. 두 번째 이유는 타 세포 대비 면역조절인자들을 분비하여 염증 반응을 억제하고 사이토카인 및 성장인자들로 인하여 치료 효능을 나타낼 수 있다는 점입니다. 이러한 장점들은 성체줄기세포치료제가 세포치료제 시장의 선두주자로 주목되고 있습니다.
여러가지 줄기세포들 중 성체줄기세포치료제 시장이 2016년 43조원(375억 달러)으로 가장 큰 규모를 차지하였으며, 2025년 전체 줄기세포치료제 시장 중 성체줄기세포가 약 69%로 314조(2,732억 달러)규모로 성장이 예상되며, 유도만능줄기세포(14%) 및 배아줄기세포(13%) 시장 규모보다 각각 5배 이상 큰 시장을 형성할 것으로 예상되고 있습니다.
![이미지: [글로벌 줄기세포 유래별 시장 현황 및 전망]](40p_%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EC%A4%84%EA%B8%B0%EC%84%B8%ED%8F%AC%20%EC%9C%A0%EB%9E%98%EB%B3%84%20%EC%8B%9C%EC%9E%A5%20%ED%98%84%ED%99%A9%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D.jpg) |
|
[글로벌 줄기세포 유래별 시장 현황 및 전망] |
| 자료: 생명공학정책연구센터, 바이오인더스트리 보고서 (2017) |
② 줄기세포치료제 품목허가 현황
성체줄기세포 기반의 안전성 및 유효성은 기존 품목허가를 받은 줄기세포치료제 및 10여년간의 연구개발을 근거로 입증되고 있습니다. 국외의 경우 현재까지 미국 FDA의 판매 승인을 받은 줄기세포치료제는 전무한 상황이나 뉴질랜드 및 캐나다에서 오시리스의 프로키말, 이탈리아 키에시에서 개발한 홀로큘라, 일본 JCR의 템셀-HS주까지 해외 제품 3개가 존재합니다. 반면, 국내는 세계 최초의 줄기세포치료제를 비롯하여 총 4개 상장사인 파미셀, 메디포스트, 안트로젠, 코아스템이 품목허가를 받으며 해당 분야에서의 글로벌 경쟁력을 제고하였습니다.
2011년 파미셀의 심근경색 치료제 '하티셀그램-AMI'가 세계 첫 줄기세포치료제로 국내 품목허가 승인을 받은 이후 2012년 메디포스트의 퇴행성무릎연골 치료제 '카티스템'과 안트로젠의 크론성 누공 치료제 '큐피스템'이 품목허가를 받았으며, 2014년에는 코아스템의 루게릭병 치료제 '뉴로나타-알'이 국내 4호 치료제로 품목허가 승인을 받았습니다.
| [국내 중간엽줄기세포치료제 품목허가 현황] |
| 회사 명 | 상장 시기 | 의약품 명 | 품목허가 | 유래 | 주기 | 대상 질환 |
|---|---|---|---|---|---|---|
| 파미셀 | 1988.05.20 | 셀그램-AMI | 2011 | 자가, 골수 | 단회 | 급성 심근경색 |
| 메디포스트 | 2005.07.29 | 카티스템 | 2012 | 동종, 제대혈 | 단회 | 무릎연골결손 |
| 안트로젠 | 2016.02.15 | 큐피스템 | 2012 | 자가, 지방 | 단회 | 크론성 누공 |
| 코아스템 | 2015.06.26 | 뉴로나타-알 | 2014 | 자가, 골수 | 2회 | 루게릭병 |
 |
|
국내 중간엽줄기세포치료제 품목허가 의약품 |
| 자료 : 약학정보원 2022 |
③ 높은 성장 가능성
줄기세포치료제 시장은 개발 및 상업화를 위한 규제 미비, 윤리적인 문제, 불명확한 치료기전 등 논란의 여지에도 불구하고 아래와 같은 성장요인들에 의하여 사업성 및 성장 가능성이 매우 높은 시장입니다.
| [줄기세포치료제 시장 성장 요인] |
| 성장 요인 | 상 세 내 용 |
|---|---|
| 효과적인 줄기세포치료제 치료 효능 |
- 줄기세포치료제는 질병 관리 뿐만 아니라 암, 림프구 관련 질환, 혈관 질환과 같은 질병에서 효과적인 효능을 보여 최근 재생의료 분야에서 주목받고 있음 - 줄기세포의 치료 효능 관련하여 긍정적인 인식이 확대되어 전 세계적으로 6,768건의 줄기세포 기반 임상시험이 진행 중임(NIH 등록 기준) - 임상시험 건수 증가는 시장에서 줄기세포치료제에 대한 선호도가 높다는 것을 증명하며 지속적인 줄기세포치료제 시장의 성장이 촉진될 것으로 예상함 |
| 세포 분석기술 개발 |
- 생명과학, 생명공학 및 유전체학 분야의 연구가 증가함에 따라 PCR, DNA Sequencing, 유동세포계측법 및 크로마토그래피와 같은 진보된 세포 분석 도구 및 기술이 개발됨 - 세포 분석 기술은 유도된 유도만능줄기세포와 같은 표적 줄기세포주의 정확한 유전자 변형을 분석하여 줄기세포치료제의 초기 개발에 큰 도움이 됨 - 이러한 세포 분석 기술의 진보는 줄기세포치료제 시장 성장에 긍정적인 영향을 미칠 것으로 예상됨 |
| 정부 및 민간 투자 확대 |
- 질병 관리에서 줄기세포의 치료 효능에 대한 인식이 높아지면서 전 세계의 다양한 공공 및 민간 단체가 줄기세포치료제 개발에 투자를 늘리고 있음 - R&D에 대한 공공 및 민간 투자의 가용성이 증가함에 따라 줄기세포치료제 시장 수요는 점차 증가할 것으로 예상됨 |
| 줄기세포 관련 인프라 개발 |
- 2004년에 영국에서 처음으로 줄기세포은행이 설립되었으며, 2005년에는 미국에서 National Stem Cell Bank를 설립하여 20개의 인간 배아줄기세포주를 보유하고 있음 - 줄기세포은행은 높은 품질과 표준화된 연구가 용이하도록 관리되고 있으며, 이는 주요 국가에서 인프라를 개발할 경우, 줄기세포치료제 연구에 대한 수요가 증가할 것으로 예상됨 |
(2) 희귀의약품 시장
① 틈새시장의 전략
제약 산업 내 다국적 제약사 및 바이오 기업을 포함하여 희귀의약품은 고부가 가치의 치료제 영역으로 파이프라인 할성화를 시키기 위한 전략으로 사용되고 있습니다. 틈새시장으로 간주되는 희귀의약품 시장이 매력적인 이유는 종래의 1차 진료에 의한 블록버스터 모델이 더이상 통하지 않기 때문입니다. 본 시장에서의 모델이 다국적 제약사에게는 새로운 사업전략으로 거듭나고 있습니다.
| [다국적 제약사의 희귀의약품 시장 진입 모델 사례] |
| 다국적 제약사 | 모 델 |
|---|---|
| Pfizer | 기업 전략에 맞는 희귀 질병에 특화된 기업과 점진적 계약 체결 |
| Sanofi | 전제임 등 큰 규모의 인수합병을 통하여 피인수 기업이 보유한 희귀의약품 포트폴리오 확보 |
② 희귀의약품 시장 및 규제 현황
시장성 또한 뒷받침 되어 글로벌 희귀의약품 시장은 2018년 1,380억 달러에서 2024년 2,620억 달러 규모로 2배 넘게 성장하며 전체 처방의약품 시장의 22%를 차지할 것으로 전망되고 있습니다.
| [글로벌 희귀의약품 매출 전망] |
| (단위 : 십억 달러) |
| 구 분 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | 2024 |
|---|---|---|---|---|---|---|---|---|
| 희귀의약품 매출 | 125 | 138 | 151 | 169 | 192 | 216 | 240 | 262 |
| 연 성장률 | 11.3% | 9.9% | 9.6% | 11.9% | 13.4% | 12.9% | 10.8% | 9.2% |
| 희귀의약품 처방 비율 | 15.9% | 16.6% | 17.3% | 18.3% | 19.2% | 20.2% | 21.1% | 21.7% |
자료 : EvaluatePharma(2018)
희귀의약품은 규제적으로 허가에 유리하기 때문에 우선 희귀의약품으로 지정된 후 비희귀적응증으로 확장하여 출시할 수 있습니다. 이러한 장점들이 시장에서 작용하여 국내외 희귀의약품 시장은 전체 제약 산업의 성장률보다 휠씬 큰 폭으로 성장하고 있으며, 항암 분야와 당사의 세포치료제와 같은 바이오의약품 연구가 활발히 진행되는 상황입니다. 당사의 만성 이식편대숙주질환 줄기세포치료제 또한 이 제도를 활용하여 개발단계 희귀의약품 지정을 받아, 2상 완료 후 조건부 승인을 받아 조기 시판을 추진하고 있습니다.
과거 희귀의약품 시장은 임상 대상이 소규모인 데다 신약 개발 확실성과 수익성도 보장되지 않아 성장이 더딘 곳으로 평가되었으나, 최근 각국 정부가 허가 기간 단축과 신약에 대한 독점권 보장 등 혜택을 내놓으면서 성장 가능성이 증가하였습니다. 미국 식품의약국(FDA)은 희귀의약품 지정을 받은 신약에 대해 신속허가 제도를 적용하고, 판매 허가 이후 7년의 독점권을 부여하고 중국의 경우 의약품 허가 기간이 상대적으로 길지만 희귀질환치료제는 우선 심사 대상으로 지정해 기간이 단축되었습니다. 국내에서 환자 수가 2만명 미만인 질병을 희귀질환으로 정의하고, 조건부 허가제도를 통해 임상 2상을 마치면 우선 판매 허가를 내주고 희귀의약품 신약에는 4년의 독점권이 주어집니다.
③ 희귀의약품 시장의 특성
희귀의약품은 바이오벤처에 의한 초기 개발 또는 임상단계에 진입해 있으며 이들의 글로벌 진출이 주목되고 있는 상황입니다. NIH에 따르면 전 세계적으로 7,000여가지의 희귀질환이 등록되어 있으며, 본 시장의 특성은 크게 세가지가 있습니다. (1) 희소성, (2) 질환의 심각성, (3) 대체 치료제의 부재입니다.
| [희귀의약품 시장의 특성] |
|
희소성 |
희귀라는 특성의 명목으로 연구개발 투자비가 높아 환자 당 높은 치료비용 산정이 필요함 |
|
질환의 심각성 |
희귀질환의 상당수는 심한 신체적 손상을 가져오고, 환자의 삶의 질을 떨어뜨릴 뿐 아니라 수명을 단축시키는 경우가 많음 |
|
대체 치료제의 부재 |
희귀질환 치료제는 대체 치료제가 없는 경우가 대다수이며, 실제로 유럽에서 허가된 희귀질환 치료제의 40%가 대체 치료제가 없는 품목인 것으로 나타남 |
④ 개발단계 희귀의약품 지정
당사의 만성 이식편대숙주질환 줄기세포치료제인 SCM-CGH는 2019년 4월 23번째로 개발단계 희귀의약품으로 지정되었으며, 2023년 2상 임상시험 종료 후 2024년 조건부 품목허가를 신청할 계획입니다. 식약처로부터 조건부 품목허가를 받는 경우 3상 임상시험을 진행하면서 치료제를 판매할 수 있어 조기 R&D 투자비 회수 및 제품 상용화 경쟁력을 확보가 가능합니다.
또한, 2a상 임상시험 완료한 급성 췌장염 치료제(SCM-AGH)에 대해서도 2020년 10월 식약처로부터 개발단계 희귀의약품 지정을 받아 해당 파이프라인에 대해서도 경쟁력을 확보하였습니다.
(3) 규제환경
① 첨단재생의료 및 바이오법으로 인한 규제 완화
2020년 9월 12일에 시행된 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률안(이하 "첨단재생바이오법")은 세포치료, 유전자치료, 조직공학치료 등 첨단재생의료 임상연구를 신속하게 실시할 수 있는 근거를 마련하고, 첨단바이오의약품에 대한 안전관리체계 확립을 위한 법안입니다.
재생의료에 관한 임상연구 진행 시 일정 요건이 충족되면 심사기준을 완화해 맞춤형 심사, 우선심사, 조건부 허가 등을 가능하도록 하는 법이며 기존 약사법ㆍ생명윤리법ㆍ혈액관리법 등으로 분류된 기존 바이오의약품 규제를 일원화시켜, 재생의료에 관련된 임상연구를 활성화하고 바이오의약품을 신속히 허가하기 위한 취지로 발의되었습니다.
첨단재생바이오법은 구체적으로 ▷ 치료 수단이 없는 질환에 투약하는 혁신 바이오의약품을 다른 의약품보다 먼저 심사하는 '우선 심사' ▷ 개발자 일정에 맞춰 허가 자료를 미리 제출 받아 단계별로 사전 심사하는 '맞춤형 심사' ▷ 3상 임상시험을 수행하는 조건으로 2상 임상만으로도 일단 의약품 시판을 허가해 주는 '조건부 허가' 등을 주요 내용으로 하고 있으며, 당사가 개발 중에 있는 만성 이식편대숙주질환 그리고 급성 췌장염 줄기세포치료제의 경우 해당 법률에 해당하게 되었습니다. 희귀질환으로 대체치료제가 없고 생명을 위협하는 질환에 해당되어 제36조에 의거하여 신속처리 대상에 지정될 수 있어 허가절차 기간을 단축할 수 있을 것으로 판단되며, 2상 임상시험 이후 조건부 품목허가의 가능성이 높습니다.
② 세포치료제 필요성에 인한 국외 규제환경의 변화
국내뿐 아니라 해외에서도 규제환경에 변화가 잇따르고 있습니다. 미국의 경우 2016년 12월 '21세기 치유법(The 21st Century Cures Act, H.R. 6)' 제정으로 첨단재생치료법의 환자 적용을 신속화하기 시작하였습니다. 21세기 치유법에 따라 재생의약 첨단치료제(RMAT) 지정 시, FDA의 신속 승인에 대한 운영에 대한 내용도 2019년 2월 발표한 바 있습니다. 유럽의 경우 2016년 3월 첨단바이오의약품의 신속한 개발 지원을 위해 규제기관이 지원하는 'PRIME' 제도를 적용하여 규제기관과의 상호작용이 강화되고 승인과정을 가속화한 바 있습니다.
라. 시장규모 및 전망
당사의 주요 목표시장을 만성 이식편대숙주질환 치료제, 중등증-중증 급성 췌장염 치료제, 중등증-중증 아토피 피부염 치료제 시장으로 정의하고 시장규모를 추정하여 아래와 같이 제시하였습니다.
(1) 만성 이식편대숙주질환 치료제 시장
① 글로벌 시장
글로벌 이식편대숙주질환 시장은 현재 스테로이드 요법 외 적절한 치료제가 없어 시장규모를 예측하기 어렵습니다. 미국 시장조사 전문기관인 RESEARCH AND MARKETS의 2022년 3월 보고서에 따르면, 전 세계 이식편대숙주질환의 시장규모는 2021년 15억 5728만 달러, 2022년 17억 9580만 달러, 2027년까지 10.03%의 연평균 성장률(GAGR)로 성장하여 27억 6409만 달러에 이를 것으로 전망하고 있습니다.
![이미지: [2021년~2027년 글로벌 이식편대숙주 질환 예상 시장 규모]](%EA%B7%B8%EB%A6%BC1.jpg) |
|
[2021년~2027년 글로벌 이식편대숙주 질환 예상 시장 규모] |
| 자료: RESEARCH AND MARKETS, Graft Versus Host Disease Treatment Market Research Report by Disease Type, Product, Region - Global Forecast to 2027 - Cumulative Impact of COVID-19 (2022.04) |
한국과학기술정보연구원의 National Digital Science Library 보고서에 의하면 만성 이식편대숙주질환은 조혈모줄기세포 이식 후 생존하는 환자의 60~80%에서 발생하며 장기 생존 환자의 가장 중요한 사망원인으로 꼽히고 있습니다. 최근 조혈모줄기세포 이식은 나이 많은 사람과 혈연관계가 없는 사람간의 이식이 증가하면서 만성 이식편대숙주질환 환자수가 급증하고 있으나 효과적인 치료법이나 병리학적인 기전은 잘 알려져 있지 않은 상태입니다. 관여 인자로는 HLA 불일치, 이식 후 100일까지도 스테로이드 사용, T-세포 제거 유무, 여성 공여자의 남성 환자, 환자 나이 및 기증자의 일치성 등이 중요하다고 알려져 있습니다.
이식편대숙주질환 치료에 있어 골수 및 제대혈유래 줄기세포치료제가 효과를 보고 있다고 보고되고 있으며, 당사의 SCM-CGH는 현재까지 다수의 치료목적사용과 1상임상시험을 통하여 이식편대숙주질환 줄기세포치료제로서의 가능성을 확인하여 지속적으로 개발을 하고 있는 PoC(Proof of Concept)을 위한 핵심 파이프라인입니다.
② 국내 시장
건강보험심사평가원 보건의료빅데이터에 의하면 국내 이식편대숙주질환 환자는 2021년 기준 548명으로, 지난 5년간 연평균 7.46%의 높은 성장률로 매년 환자수가 증가하고 있으며앞으로도 높은 성장률로 시장규모가 확대될 것으로 예상됩니다. 또한 한국과학기술정보연구원 통계에 의하면, 이식편대숙주질환 전체 환자 중 약 70%는 만성이며 나머지 30%는 급성 환자인 것으로 추정됨에 따라 당사의 만성 이식편대숙주질환 치료제 대상 환자 규모는 2018년 기준 약 340명으로 추정할 수 있었습니다.
| [최근 5년 골수이식거부(T860)질환에 대한 환자수, 요양급여비용, 보험자부담금 추이] |
|
구 분 |
2017 |
2018 |
2019 |
2020 |
2021 |
5개년 성장률 |
|---|---|---|---|---|---|---|
|
환자수(명) |
422 |
484 |
510 |
511 |
548 |
6.8% |
|
요양급여비용총액 |
1,080,708 |
1,045,717 |
1,616,130 |
1,302,280 |
1,283,770 |
4.4% |
|
보험자부담금 |
964,206 |
932,467 |
1,473,814 |
1,164,402 |
1,152,641 |
4.6% |
| 자료: 건강보험심사평가원 보건의료빅데이터개방시스템 |
(2) 중등증-중증 급성 췌장염 치료제 시장
① 글로벌 시장
Market Research Future에 의하면 급성 췌장염의 글로벌 시장규모는 연평균 성장률5.91%로 성장하여 2025년 73억 7,201만달러로 추정되고 있습니다.
발병 빈도는 미국의 경우 10만명당 24.2명, 영국은 5.4명 그리고 한국은 20명 정도이며 주로 40-50대 남성이 발병률이 가장 높으며 주요 원인은 남성의 경우 술, 여성의 경우 담석질환과 상관관계가 있는 것으로 예상됩니다. 2017년 기준 전 세계 발병환자의 수는 235만명으로 추정되며, 알코올 소비 증가와 진단기술 발달로 급성 췌장염 발병은 해마다 늘고 있는 추세이며 앞으로도 췌장염 발병률이 증가함에 따라 시장규모 또한 증가할 것으로 예상됩니다.
![이미지: [2013~2023년 글로벌 급성 췌장염 예상 시장 규모]](46p_2013%7E23%EB%85%84%20%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EA%B8%89%EC%84%B1%20%EC%B7%8C%EC%9E%A5%EC%97%BC%20%EC%98%88%EC%83%81%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8.jpg) |
|
[2013~2023년 글로벌 급성 췌장염 예상 시장 규모] |
| 자료: Market Research Future, Global Acute Pancreatitis Market Research Report (2017) |
경증 및 중등도 급성 췌장염에서는 수액치료를 통한 합병증 없는 완치율이 99%를 차지함에 따라 당사는 수액 치료보다 효과적인 치료를 필요로 하는 중등증-중증의 급성 췌장염 환자를 타겟으로 하고 있습니다. 췌장염 시장에서 급성 췌장염은 80%의 비율을 차지하고 그중 중증 췌장염 환자는 전체 환자의 20%를 차지합니다. 이를 기준으로 중증 급성 췌장염 시장의 규모는 2025년 약 2조원으로 예측하고 있습니다.
② 국내 시장
글로벌 급성 췌장염 환자수 증가율과 비교하여 국내 급성 췌장염 환자수는 빠른 비율로 증가하는 추세를 보이고 있습니다. 건강보험심사평가원에 따르면 국내 급성 췌장염 환자는 2021년 기준 38,494명으로 집계되며, 5개년 평균 성장률은 1.4%입니다.
| [최근 5년 급성 췌장염(k85)질환에 대한 환자수, 요양급여비용, 보험자부담금 추이] |
|
구 분 |
2017 |
2018 |
2019 |
2020 |
2021 |
5개년 평균 성장률 |
|---|---|---|---|---|---|---|
|
환자수(명) |
36,354 |
39,078 |
40,656 |
39,804 |
38,494 |
1.4% |
|
요양급여비용 |
52,823,198 |
63,672,447 |
69,856,128 |
73,647,405 |
73,844,594 | 8.7% |
|
보험자부담금 |
38,848,104 |
46,976,887 |
51,549,592 |
54,258,227 |
54,106,897 |
8.6% |
| 자료: 건강보험심사평가원 보건의료빅데이터개방시스템 |
(3) 중등증-중증 아토피 피부염 치료제 시장
① 글로벌 시장
GlobalData에 따르면 글로벌 아토피 피부염 시장 규모는 2019년 6.1조원에서 연평균 성장률 6.8% 증가하여 2024년에 8.5조원에 이를 것으로 보고되었습니다.
![이미지: [글로벌 아토피 피부염 예상 시장 규모]](47p_%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EC%95%84%ED%86%A0%ED%94%BC%ED%94%BC%EB%B6%80%EC%97%BC%20%EC%98%88%EC%83%81%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8.jpg) |
|
[글로벌 아토피 피부염 예상 시장 규모] |
| 자료: 보건산업진흥원, 기술가치평가 보고서 (2018, GlobalData 자료 재가공) |
■ 증가하는 아토피 피부염 환자수
아토피 피부염 환자수는 2022년 1억 3,100만명까지 증가할 것으로 예측되고 있습니다. 아시아 시장은 일본 외에 중국, 인도의 저소득 아토피 피부염 환자가 전체 환자수의 60%에 이르며 신흥시장으로 지속적인 성장이 예상되며 중국에서만 4,700만명의 환자가 발생할 것으로 예측합니다. 중국의 경우 가장 많은 환자가 발생할 것으로 보이나, 출산율 감소로 인하여 환자수는 감소할 것으로 예상됩니다(연간 증가율: -0.36%). 반면 미국은 2012년 1,560만명에서 2022년 1,600만명으로 가장 많은 환자가 증가할 것으로 예측되고 있습니다(연간 증가율: 0.71%).
당사가 타겟하고 있는 중등증 이상의 아토피 피부염 환자 비율은 전체 아토피 피부염 환자 중 약 30~40%입니다. 예상하는 증가율에 따라, 2022년에는 약 1억 3,100만명의 환자가 발생할 것으로 예상되며, 이 중 증증도 이상의 아토피 피부염 환자수는 약 5,240만명으로 추산할 수 있습니다.
현재 시장을 주도하기 시작한 의약품으로는 바이오의약품인 듀피젠트가 존재하며 당사의 SCM-AGH의 경우 듀피젠트와 유사한 환자군인 중등증-중증 아토피 피부염을 치료대상으로 합니다.
듀피젠트는 특정인자만을 타겟팅하는 항체로서 부작용의 문제점을 안고 있고 효능의 미비라는 문제점도 발견되고 있으며, 300mg/2ml 주사제 형태로서 환자가 매 2주 간격으로 투여 받아야 합니다. 반면, SCM-AGH의 경우 1 cycle 당 3회 투여로 약 6개월부터 최대 1년 이상까지의 치료효과가 유지됨을 치료목적사용을 통하여 확인한 바 있습니다. 줄기세포의 특성상 부작용 발생 가능성이 현저히 낮고 중등증-중증 아토피 피부염 치료에 대안이 될 것으로 예상되며, 매 6개월 투여 제형으로 개발하여 다른 경쟁사 치료제 대비 환자의 투여 횟수에 대한 부담이 감소할 것으로 예상됩니다.
② 국내 시장
국내 시장만 보았을 때도 아토피 피부염은 큰 규모를 나타내고 있습니다. 건강보험심사평가원에 따르면 우리나라 전체 인구대비 아토피 피부염 진료실 인원 비중과 절대수치를 보았을 때, 줄어드는 경향은 보이지만 그 수는 꾸준하게 약 90만명대를 유지하고 있습니다.
진료실 인원 비중과 상반되게 치료비 규모는 2014년 357억원 규모에서 2018년 435억원 규모로 증가하였습니다. 이처럼 아토피 피부염 시장은 성장하지만, 효과적인 치료제에 대한 해법은 아직 없는 상황입니다. 해당 질환은 삶의 질을 급격히 저하시키는 질환으로 전 세계적으로 환자가 꾸준히 발생하고 있는 만큼 당사가 개발에 성공한다면 막대한 시장가치 창출을 할 수 있을 것으로 사료됩니다.
| [최근 5년 아토피성 피부염(L20)질환에 대한 환자수, 요양급여비용, 보험자부담금 추이] |
|
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
5개년 성장률 |
|---|---|---|---|---|---|---|
|
환자수(명) |
942,927 | 930,245 | 960,193 | 983,913 | 1,001,127 |
1.5% |
|
요양급여비용총액 |
41,413,154 | 43,562,688 | 45,837,611 | 51,847,661 | 86,472,525 |
22.5% |
|
보험자부담금(천원) |
28,005,387 | 29,883,227 | 32,174,334 | 36,342,869 | 68,183,904 |
28.7% |
| 자료: 건강보험심사평가원 보건의료빅데이터개방시스템 |
■ 소아환자에 대한 미충족 의료수요 존재
상기의 진료환자수를 세분화해서 분석해보면, 19세 이하 진료 환자수는 점차 감소하고 있으나 여전히 전체 환자 중 53%의 높은 비중을 차지하고 있어 소아 환자에 대한 미충족 의료수요는 높은 것으로 추정됩니다.
| [최근 5년 아토피성 피부염(L20) 소아 및 성인 환자수 추이] |
|
구 분 |
2017 |
2018 |
2019 |
2020 |
2021 |
비중 |
|---|---|---|---|---|---|---|
|
소아(19세이하, 명) |
539,989 |
511,743 | 503,073 | 493,868 | 477,287 |
53% |
|
성인(20세이상, 명) |
402,938 | 397,502 | 457,120 | 490,045 | 523,840 |
47% |
| 자료: 건강보험심사평가원 보건의료빅데이터개방시스템 |
특히, 아토피 피부염 환자 중 만성 질환자의 약 70%가 유ㆍ소아이므로 안전성 입증 문제가 중요하며, 질병의 특성과 환자 등이 고려된 개발전략이 필요한 상태입니다. 유소아의 경우 면역력이 약하여 외부자극에 쉽게 반응하기에 팔과 다리, 팔꿈치 안쪽 등에 주로 아토피 피부염 증상이 나타나며 기관지 천식이나 비염 등이 동반되기도 합니다. 유소아가 성장하며 자연적 면역능력이 생기며 대부분 증세는 사라지게 되나, 스트레스나 환경 문제로 인하여 성인 아토피 피부염으로 이어지는 경우도 많습니다. 따라서, 특정 시장을 제한하기 보다 두 시장을 모두 타겟으로 삼아 치료제를 개발하고자 하며 성인 아토피 피부염 치료제 개발을 완료한 후, 소아환자로 적응증을 확장하고자 합니다.
마. 경쟁 현황
(1) 당사 현황
줄기세포치료제 개발기업을 중심으로 고려하였을 때, 국내에서 4개의 기업이 당사와의 경쟁 대상이 될 수 있습니다. 국내에서의 줄기세포치료제 분야에 대한 투자는 2005년 메디포스트와 차바이오텍의 코스닥시장 상장 이후 지속적인 정부 지원정책과 바이오 시장의 활황에 힘입어 성장하고 있습니다. 이어 2015년에는 코아스템과 강스템바이오텍, 2016년 안트로젠이 잇따라 상장하였으며, 당사 또한 이러한 기업들과 같이 상장을 통하여 상업화에 대한 기반 마련을 준비하고자 합니다.
당사가 개발 중인 치료제 상용화의 개발속도는 늦었지만, 차별성 있는 분리기술을 이용하여 단일세포유래 고순도 중간엽줄기세포의 상대적 우수성을 검증해 왔으며 해당기술에 대한 지식재산권을 확보하여 경쟁력 있는 줄기세포치료제로 국내외 시장을 확실히 장악할 수 있는 잠재력을 보유하고 있습니다. 현재 당사는 임상단계에 진입 3가지 줄기세포치료제를 파이프라인으로 보유하고 있습니다.
■ 만성 이식편대숙주질환 치료제는 2상 임상시험 환자등록 및 투약을 완료했으며, 국내 23번째로 개발단계 희귀의약품 지정을 받아 2024년 조건부 품목허가 후 2025년 시장 출시 예정에 있습니다.
■ 중등증-중증 급성 췌장염 치료제는 2022년 1/2a상 임상시험을 완료하였으며, 2023년 내에 2b 임상시험을 시작하여 2026년 조건부 품목허가를 신청하여 시장 출시 예정입니다.
■ 중등증-중증 아토피 피부염 치료제는 1상 임상시험을 완료 후 국내 11개 병원에서 4개 병원을 추가하여 총15개 병원에서 2상 임상시험을 진행하였으며, 2022년 6월 시험 대상자 등록 및 투약을 완료하였습니다. 2023년 5월 1/2상 임상시험 결과보고를 완료하였습니다. 또한, 2023년 3상 임상시험을 시작하여, 완료 후 시장출시 예정입니다.
최근 줄기세포 산업에서 당사와 더불어 아토피 피부염에 대한 임상을 진행하고 있는 회사로는 강스템바이오텍이 있습니다. 양사는 중등증-중증 아토피 피부염 질환을 대상으로 현재 치료제를 개발하고 있습니다. 강스템바이오텍이 개발 중에 있는 퓨어스템-AD의 경우 2020년 10월에 3상 임상시험 신청하여 2021년 5월 7일 식약처로부터승인을 받아 임상을 시작하였으나, 단회 피하투여로 12주간 관찰하는 임상시험에서 시험군은 31.82%, 위약군은 27.16%로 큰 차이가 없는 결과를 도출하여 1차 평가변수에 대한 통계적 유의성을 확보하지 못하였습니다. 이로 인하여 강스템바이오텍은 최적의 활성을 가진 세포를 환자에게 투여할 수 있도록 동결제형 도입 등 임상시험 설계를 보완하여 2021년 임상 3상을 재개하여 2022년까지 308명을 대상으로 17개 기관에서 임상시험을 진행하고 있습니다. 피하투여에 대한 경로의 문제, 임상설계 및증상인자 반응 등에서 당사와 다소 차이가 존재합니다.
당사는 분리기술부터 차별화된 고순도ㆍ고효능 세포주를 활용하여 임상시험을 추진 중에 있으며, 바이오마커 분석을 진행하여 질환에 적합한 세포주를 사용하여 치료효과에 대한 변수를 줄였습니다. 아토피 피부염의 경우, 질환 특이적인 마커 발현이 되어도 인종 및 나이 등에 따라 다양한 표현형의 차이가 존재하고 있어 치료법이 상이할 수 있습니다. 한가지 좋은 접근방법의 예로, 아시아계인종의 경우IL-17으로 유도되는Th17 활성과 건선이 동반되는 내재형이 우세하기에 당사는 이를 타겟팅하는 것이 중요하다고 판단하였습니다.
이러한 문헌적 근거를 보완하고자 치료목적사용 임상에서 IL-17이 발현되어 Th17이활성이 동반되었던 환자에게는 당사의 줄기세포치료제가 IL-17을 감소시키는 것을 확인하였고, 치료 결과는 의미있는 시사점을 제공하여 본 임상시험에 반영하였습니다. 질환 특이적 세포주와 투여경로, 투여횟수 및 간격, 바이오마커 등의 변수들은 다수의 비임상 및 임상경험을 통하여 타당성을 입증하였습니다.
(2) 경쟁업체 현황
당사가 개발하고 있는 줄기세포치료제의 경우 희귀ㆍ난치성 질환이거나 미충족 의료수요가 높은 질환으로서 경쟁사가 없거나 소수의 경쟁사만이 존재합니다. 아래 서술된 경쟁업체 현황에는 질환별 치료제의 표준 의약품과 아직 품목허가를 받지 못한 개발단계 제품들을 고려하여 작성하였습니다.
① SCM-CGH(만성 이식편대숙주질환 치료제)의 주요 경쟁업체 현황
(a) 기존 치료법에 대한 배경
현재까지 국내에서 만성 이식편대숙주질환을 근본적으로 치료할 수 있는 치료제는 2020년에 적응증이 추가된 얀센의 임부르비카(Imbruvica)가 유일합니다. 일반 치료법으로 corticosteroid, calcineurin inhibitors(cyclosporine, tacrolimus), thalidomide, 체외 광화학요법(extracorporeal photochemotherapy, ECT) 또는 mycophenolate mofetil(MMF), methotrexate 같은 면역억제제가 있습니다. 상기 치료법으로 증상이 호전되지 않는 경우에는 기존 사용하던 면역억제제의 용량 증가 또는 sirolimus, rituximab, hydroxychloroquine, pentostatin 같은 새로운 약물로 대체 또는 추가하는 병용요법을 시행하고 있습니다. 다만, 오랜기간 사용시 복용에 따른 합병증인 골다공증, 당뇨, 고혈압 등의 부작용이 발병할 수 있으며 긍정적인 효과가 발생하는 경우는 약 20~30%에 불과하여 대부분 사망에 이릅니다.
| [이식편대숙주질환 국내/외 치료제 현황] |
|
구 분 |
노바티스 자카비 |
얀센 임부르비카 |
일본 JCR 파마 템셀 |
오시리스 프로키말 |
|---|---|---|---|---|
|
종 류 |
JAK Inhibitor |
BTK저해제 |
줄기세포 |
줄기세포 |
|
적응증 |
만성/급성 |
만성 |
만성 |
만성 |
|
허 가 |
2021년 9월 FDA |
2020년 3월 |
2019년 5월 일본 승인 |
2012년 5,6월 |
(b) 주요 경쟁업체 현황
주요 경쟁제품인 Janssen의 BTK 저해제인 임브루비카(Imbruvica)가 2017년에 만성이식편대숙주질환에 대한 추가 적응증에 대해 미국 FDA에서 허가를 받았습니다. 소아, 노인 환자 및 예후가 좋지 않은 유전형 환자에게서도 반응을 이끌었고, 일부 적응증에 대해서는 희귀의약품으로 지정 받았기 때문에 조건부 품목허가를 받아 빠르게 시장에서 확대될 것으로 예상됩니다. 그 외에 상업화를 앞두고 있는 의약품은 Novartis의 자카비(Jakavi)가 있습니다.
줄기세포 제품으로는 일본 JCR파마의 템셀과 오시리스의 프로키말이 있으나, 국내에 허가를 받지 못한 상황이고 각각 일본과 캐나다/뉴질랜드에서만 허가를 받은 상황입니다.
| [이식편대숙주질환 개발단계 치료제 현황] |
| 의약품명 |
개발사 |
적응증 |
임상단계 |
|
|---|---|---|---|---|
|
1 |
임부르비카(Imbruvica) |
Janssen |
만성 GvHD |
품목허가 (미국) 임상 3상 (유럽, 일본, 호주) |
|
2 |
자카비(Jakavi) |
Novartis |
만성 GvHD |
임상 3상 (글로벌), 품목허가 (미국) |
|
급성 GvHD |
품목허가 (미국) 임상 3상 (유럽, 일본, 호주) |
|||
| 자료: GlobalData, Pharma Intelligence Center (5개 국가 이상에서 추진 시 글로벌 표기) |
■ 임부르비카 (Janssen)
임부르비카는 키나제 억제제로 기존 혈액암 치료제이나 만성 이식편대숙주질환 적응증 추가 승인 받았습니다. 임상시험에서 환자 42명을 대상으로, 67% 환자에서 증상 개선효과를 보았으며 이들 중48%는 호전된 상태가 5개월 이상 지속되는 효과를 보았습니다. 흔한 부작용으로는 피로, 멍, 설사, 혈소판감소증, 근육경련, 구내염, 오심, 출혈, 빈혈, 폐렴등이 있었으며, 심각한 부작용으로는 출혈, 혈구감소증, 심방세동, 고혈압, 이차 원발성 악성종양, 종양용해증후군 등이 있었습니다.
■ 자카비 (Novartis)
자카비는 JAK 신호체계를 선택적으로 억제하는 경구용 소분자 표적 치료제로, 골수섬유화증 및 진성적혈구증가증의 치료에 사용되고 있습니다. FDA는 스테로이드 불응성 급성 이식편대숙주질환에 대하여 자카비에 우선심사, 혁신적치료제(Breakthrough Therapy) 지정을 하였으며, 2021년 9월 허가했습니다. 상기 경쟁약물 대비 당사의 줄기세포치료제SCM-CGH는 만성 이식편대숙주질환 임상단계에서 다수의 장기 반응을 호전시키는 것으로 확인되어, 2상 임상시험에서 유효성을 확인하면 만성 이식편대숙주질환 치료에 대한 미충족 의료수요가 해소되어 시장을 선도할 수 있을 것으로 판단됩니다.
② SCM-AGH(중등증-중증 급성 췌장염 치료제)의 주요 경쟁업체 현황
(a) 효과적인 치료제의 부재
급성 췌장염 치료제는 현재 다양하게 개발되고 있으며, 특히 염증 반응 단계에서 반응을 억제시키는 약물이 다수 개발되고 있습니다만, 현재까지 확실한 임상적 효능을 나타내는 약물이 개발되지 않은 상황입니다. 이에 따라 지금까지 출시된 치료제는 급성 췌장염 치료에 있어 보조적인 역할로만 사용되며, 주된 치료법으로는 수액 치료 밖에 없으며 중증도가 높을 경우 신장에 발생하는 합병증을 줄이기 위해 투석을 함께 진행하곤 합니다.
(b) 주요 경쟁업체 현황
약물치료법으로는 단백분해효소 억제제(protease inhibitor) 또는 췌장분비 억제제(anti-secretory agent), 항산화제 혹은 항염증제(anti-oxidative, anti-inflammatory agent)등이 연구되고 있습니다.
현재 시장에 출시되어 급성 췌장염 치료에 사용되고 있는 약물인 Futhan과 Miraclid는 단백질 분해효소를 타겟으로 염증반응을 억제하는 기전을 나타내는 치료제입니다. 다만, 상기 두 치료제들은 급성 췌장염을 적응증으로 하는 치료제가 아닌 증상개선을 위한 대중요법으로 허가 받았습니다.
가장 유력한 경쟁약물은 융합 단백질인 TAK-671(SB-26 또는 울리나시타틴Fc)으로 Takeda Pharmaceutical 및 삼성바이오에피스가 협력 개발 중인 약물로서 미국에서 2020년 1상 임상시험 완료하였습니다.
| [급성 췌장염 경쟁약물 현황] |
|
구 분 |
제품명 |
회사명 |
효능,효과 |
현 상황 |
|---|---|---|---|---|
|
단백분해 |
주사용후탄 (Futhan Inj.) |
- Japan Tobacco. - Torii Pharmaceutical - SK케미칼 |
췌염의 급성증상의 개선 |
국내 출시 |
|
Miraclid |
- Mochida Pharmaceutical - JCR Pharmaceutical |
췌장염의 증상 개선 |
일본, 중국, 인도 등에 |
|
|
TAK-671 |
Takeda Pharmaceutical/ 삼성바이오에피스 |
췌장염의 증상 개선 |
임상 1상 완료 |
(c) 세계 최초의 중등증-중증 급성 췌장염 치료제로의 등극
당사의 SCM-AGH는 세계 최초의 중등증-중증 급성 췌장염 줄기세포치료제로서 연구개발의 의의가 있습니다.
③ SCM-AGH(중등증-중증 아토피 피부염 치료제)의 주요 경쟁업체 현황
당사의 줄기세포치료제인 SCM-AGH는 중등증 이상의 아토피 피부염을 표적으로 하고 있습니다. 면역조절능력이 있는 중간엽줄기세포의 경우 질환의 중증도가 심할수록 효과적이라는 비임상적 결과가 있어 초기 아토피 피부염에 사용되는 면역억제제 및 스테로이드 크림과는 차별화됩니다. 따라서 현재 듀피젠트를 시판하고 있는 Sanofi가 주된 경쟁업체라고 간주됩니다.
추가적으로 줄기세포치료제 분야에서는 강스템바이오텍이 중등도 이상의 만성 아토피 피부염 환자를 대상으로 퓨어스템-에이디주(FURESTEM-AD)의 유효성 및 안전성 평가를 위한 Two-Stage, 다기관, 무작위 배정, 이중 눈가림, 위약 대조 등의 내용이 포함된 제 3상 임상시험을 2021년 5월 7일 식약처로부터 승인 받아, 국내 약 15개 기관에서 아토피 환자 308명을 대상으로 진행되고 있습니다. 당사의 SCM-AGH의 경우 1/2상 임상시험을 통하여 안전성 및 유효성을 2023년에 입증하고, 글로벌 시장을 타겟으로 개발을 추진하고 있습니다.
주요 경쟁업체를 제외한 그 밖의 국내 기술 동향을 보았을 때, 아래와 같은 제품들이 개발단계에 있습니다.
| [국내 개발단계 경쟁제품 현황] |
|
개발사 |
제품 설명 (요약) |
|---|---|
|
JW중외제약 |
- JW중외제약은 C&C신약연구소와 아토피 피부염 치료제인 FR-1345의 상업화를 위한 라이선스 계약을 체결하고 임상 1상 시험을 추진하고 있음 - FR-1345는 히스타민 H4 수용체에 선택적으로 작용해 아토피 피부염을 유발하는 면역세포의 활성과 이동을 차단하고, 가려움증을 일으키는 히스타민의 신호전달을 억제하는 작용기전을 가진 후보물질임 |
|
휴온스 |
- 휴온스는 와이디생명과학과 기술이전 계약을 맺고 천연물신약을 통한 크림형 제형의 치료제인 YD-109를 개발하고 있음 - 기존 스테로이드성 약물이 가지고 있는 피부가 얇아지거나 혈관이 확장되어 2차 감염이 우려되는 부작용 등을 감소하는데 중점을 두고 있음. |
| [해외 개발단계 경쟁제품 현황] |
|
개발사 |
제품 설명 (요약) |
|---|---|
|
Sanofi |
인터루킨 저해제 단일클론항체인 듀피젠트를 승인받아 치료제로 판매 중. |
|
Pfizer |
PDE4 저해제인 유크리사를 아토피 피부염 치료제로 판매 중에 있으며, 비스테로이드 국소도포제로서 스테로이드 약물에 따른 부작용이 없다고 알려져 있음 |
|
AstraZeneca |
항인터루킨-13 단일클론항체인 트랄로키누맙을 개발하여 2022년 상반기 FDA 승인 완료. 2주(또는 4주)에 1회 피하주사로 투약하며, TCS와 병행 투여 가능한 특징을 가지고 있음. |
|
Abbvie |
JAK 억제제인 어파다시티닙을 개발하여, MFDS 승인 완료되었으며, 2022년 5월부터 급여 적용됨. |
|
Eli Lily |
JAK 억제제인 바리시티닙를 개발하여, MFDS 승인 완료되었으며, 2022년 5월부터 급여 적용됨. |
 |
|
해외개발단계경쟁제품_IR자료 |
듀피젠트는 아토피 피부염 치료제로는 처음 개발된 표적 생물학적제제입니다. 다양한적응증 추가 승인으로 성장세를 보이고 있으며, 제약바이오전문 매체 '드럭 디스코버리 앤 디벨럽먼트'에 따르면 2021년 기준 글로벌시장에서 한화 약 7조 9730억원 (62억 956만 달러)의 매출을 달성한 바 있습니다. 시장조사 전문기관인 EvaluatePharma의 World Preview 2018, Outlook to 2024 보고서에 의하면, 듀피젠트는 2024년까지 약 9조 2,000억원(80억 달러) 규모로 성장하여 글로벌 10대 블럭버스터 의약품 중 하나로 거듭날 것으로 예측하고 있습니다.
![이미지: [2024년 글로벌 블록버스터 의약품 매출 예상표]](54p_2024%EB%85%84%20%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EB%B8%94%EB%A1%9D%EB%B2%84%EC%8A%A4%ED%84%B0%20%EC%9D%98%EC%95%BD%ED%92%88%20%EB%A7%A4%EC%B6%9C%20%EC%98%88%EC%83%81%ED%91%9C.jpg) |
|
[2024년 글로벌 블록버스터 의약품 매출 예상표] |
듀피젠트의 시장성 증가는 당사 줄기세포치료제를 알리는 것에 긍정적인 작용할 것으로 판단됩니다. 아토피 피부염으로 잠재적 임상적 효능을 치료목적사용으로 확인하였으며, 줄기세포치료제는 듀피젠트와는 다르게 이상반응이나 부작용이 적고 효과가 장기적으로 지속된다는 사례를 보았을 때, 차세대 바이오의약품으로서 듀피젠트의 시장을 대체할 수 있을 것으로 판단하고 있습니다. 또한 희귀의약품이나 난치성 질환에 대한 개발은 유사기전을 통한 적응증 확대가 가능하여 더욱 부가가치를 창출할 수 있을 것으로 생각됩니다.
(3) 비교우위 사항
① SCM-CGH(만성 이식편대숙주질환 치료제)
만성 이식편대숙주질환의 경우 경쟁제품인 임부르비카와 비교하여 아래와 같은 주요장점이 있습니다.
■ 용량/용법의 차이
임부르비카의 경우 140mg 캡슐 3정을 하루에 한번씩 증상이 호전될 때까지 복용을 해야 하지만, 당사 줄기세포치료제의 경우 2주 간격 3회 치료 이후 추가 투여 없이 장기적인 효능을 유지할 수 있음을 이전 임상시험을 통해 확인하였습니다.
■ 안전성의 차이
임부르비카의 경우, 임부르비카 임상시험에 참여했던 20%이상의 환자에서 피로감, 멍듦, 설사, 혈소판 감소증, 구내염, 근육연축, 메스꺼움, 출혈, 빈혈, 폐렴이 확인되었으며, 1명의 환자에서 3등급(Grade 3)의 심방 세동이 확인되었습니다. 또한 임상시험에 참여했던 환자 중 24%가 약물이상반응으로 치료를 중단하였습니다.
■ 당사 줄기세포치료제의 경우, 1상 임상시험과 2상 임상시험의 Part 1을 통해 확인된 약물 관련 이상반응은 경증 수준의 근육통, 감기, 콧물, 인후염이 전부였습니다.
② SCM-AGH(중등증-중증 급성 췌장염 치료제)
중등증-중증 급성 췌장염의 경우 아직까지 개발된 치료제가 없어 당사의 줄기세포치료제가 최초의 중등증-중증 급성 췌장염 줄기세포치료제가 될 것입니다.
③ SCM-AGH(중등증-중증 아토피 피부염 치료제)
중등증-중증 아토피 피부염의 경우 경쟁제품인 듀피젠트와 비교하여 아래와 같은 주요 장점이 있습니다.
■ 용량/용법의 차이
듀피젠트의 경우 첫 투여(600mg)이후 2주 간격으로 300mg을 지속적으로 투여해야 하지만, 당사의 줄기세포치료제는 2주 간격 3회 투여로 추가 투여 없이 장기적인 효능을 유지할 수 있음을 이전 치료목적 사용 임상시험을 통해 확인하였습니다. 또한 치료목적 사용에 참여했던 환자들이 3회 투여 이후 경구용 스테로이드나 경구용 면역억제제의 사용 없이 국소적 치료만으로 개선된 상태를 유지하고 있음을 확인하였습니다.
■ 안전성의 차이
듀피젠트의 경우 듀피젠트 임상시험에 참여했던 환자 중 주사부위 반응과 결막염이상이 있었던 환자가 각각 10%였으며, 눈꺼풀염, 구강 헤르페스, 각막염, 눈가려움증 등의 이상반응이 확인되었습니다.
■ 당사 줄기세포치료제의 경우 치료목적 사용 임상시험에 참여한 환자들에서는 지금까지 보고된 약물관련 이상반응이 없습니다.
바. 신규사업
신규 사업으로는 치료제에 대한 후속 파이프라인과 당사의 층분리배양법으로 분리된줄기세포를 응용하는 오픈이노베이션 기술사업으로 구분하였습니다.
| [신규 사업 요약] |
| 구 분 |
상 세 |
전략적 추진 사유 |
|---|---|---|
| 후속 파이프라인 개발 |
1. 척수소뇌성 실조증 치료제 |
미국, 일본, 대만의 2상 임상시험 기반 지속적인 국내 임상시험 진입 가능성 검토 중 |
|
2. 제1형 및 제3형 당뇨 치료제 |
iPSC-유래 세포치료제로 사업영역 확장 (상용화에 적합한 안정적인 세포주 공급 가능) |
|
|
3. 노쇠/노화 치료제 |
노쇠/노화에 관련된 근감소증 질환 도입 검토 중 |
|
| 오픈이노베이션 기술사업화 |
공동연구개발 8건 |
초기 개발단계 후보물질 확보(미토콘드리아, 엑소좀 치료제 등), 제형 변경(세포시트 등), 상용화 준비(3D 바이오리액터) |
(1) 후속 파이프라인 개발 추진 계획
현재 진행되고 있는 3개의 임상시험 이외에 후속 파이프라인 확보를 위해 기술이전 검토 또는 공동연구개발을 진행 중에 있으며, 척수소뇌성 실조증 치료제와 제1형 및 제3형 당뇨 치료제 라이선스인을 추진하였습니다.
| [후속 파이프라인 개발 진행과정 및 일정 요약] |
| 구 분 | 개발 진행과정 및 일정 | |
|---|---|---|
|
1 |
동종 지방유래 중간엽줄기세포치료제 (척수소뇌성 실조증) |
- 2020년 10월 대만 Steminent와 라이선스인 계약 체결 |
|
2 |
iPSC-유래 췌장 베타세포치료제 |
- 2019년 미국 Allele과 공동연구개발 협약 - 2019년 질환 동물모델 유효성 평가 |
① 척수소뇌성 실조증 줄기세포치료제: Steminent는 대만 줄기세포치료제 바이오 벤처이며, 현재 동종 지방유래 중간엽줄기세포치료제인 Stemchymal로 퇴행성 신경계 질환인 척수소뇌성 실조증(Spinocerebellar Ataxia, 이하 "SCA")에 대한 2상 임상시험 계획을 대만, 미국, 일본에서 승인 받아 진행 중입니다.
2015년 미국 FDA로부터 SCA 치료를 위한 희귀의약품 지정을 받았으며, 2016년 일본 세포치료제 기업인 Reprocell에게 일본 시장에 대한 라이선스 아웃을 하였습니다. 당사는 Steminent의 Stemchymal을 License-in 하여 2상 임상시험 단계의 파이프라인을 확대하고자 합니다. SCA는 40가지 이상의 아형이 있으며 대만과 한국의 경우 SCA 2형과 3형 환자가 다수입니다. 국내 환자수 약 4,000명인 희귀질환으로, First-in-Class 의약품으로 시장진입이 가능할 것으로 예상됩니다.
2019년 7월 본격적인 사업 추진을 위하여 MOU를 체결하였으며, 2020년 10월에 라이선스 계약(Advanced Development and Commercialization License Agreement)을 체결하였으며, 2021년 3월에 국내 식약처에 임상시험계획서를 신청하였습니다.
식약처 세포유전자치료제과의 검토의견 결과, 비임상시험(반복투여 독성 및 분포 시험)이 다시 진행되어야 하고, 이 시험의 경우 소요 기간은 약 10개월임이 확인되었습니다. 식약처가 허용하고 있는 통상적인 보완 연장 기간 내에 상기 비임상시험 결과 확보가 어려운 점을 감안하여 임상시험계획승인 신청을 자진 취하하였습니다. 그러나 Steminent와 계약에 대한 지속적인 논의 중에 있습니다.
| [대만 Steminent 社와의 라이선스 계약 추진 진행상황] |
| 구 분 | 내 용 |
|---|---|
|
2019.07 |
전략적 제휴를 위한 MOU 체결 - Joint Development and Commercialization Agreement(JDCA)를 통한 특정 권리지역에 대한 지식재산권 및 제품개발에 대한 사항 공유 - 치료제 수요에 따라 각 대만 및 한국 GMP 생산시설을 활용한 생산위탁계약 모델 검토 |
|
2019.08 |
연세대학교 의과대학 세브란스병원 신경과 이필휴 교수 사전 미팅 - 국내 수요 및 환자 현황 확인 - 임상적 자문 및 연구자 참여의향 확인 SCA 국내 임상시험 관련하여 식약처 주무관 문의 |
|
2019.09 |
Steminent 1차 실사 및 F2F 미팅 (에스씨엠생명과학㈜ 본사) - 임상 진행사항 업데이트 |
|
2019.10 |
Ryan Chang (CEO) 및 William Milligan (VP, Business Development)과의 F2F 미팅 (미국 캘리포니아) - 대만 내 아토피 피부염 및 급성 췌장염 시장적 접근 논의 - 한국 및 대만 식약처 제출 자료 비교 |
|
2019.11 |
대표 F2F 미팅 (대만) - 계약내용 1차 협의 |
| 2019.12 | 기술료 협의 완료 |
| 2020.01 | 1차 기술실사 및 Advanced Development and Commercialization License Agreement 초안 검토 |
|
2020.02 |
임상개발 및 제조파트 실무진 현장실사 (대만) |
| 2020.04 | 계약 내용 2차 협의 완료 |
| 2020.10 | 라이선스 계약 체결 |
| 2021.03 | 척수소뇌성 실조증 치료에 대한 Stemchymal (동종 지방유래 중간엽줄기세포) 투여의 안전성 및 유효성을 평가하기 위한 공개, 다기관, 단일군, 제2상 임상시험 계획승인(IND) 신청 |
| 2021.09 | 척수소뇌성 실조증 치료에 대한 Stemchymal (동종 지방유래 중간엽줄기세포) 투여의 안전성 및 유효성을 평가하기 위한 공개, 다기관, 단일군, 제 2상 임상시험 계획승인(IND) 신청 자진 취하 |
② 당뇨 췌장 베타세포치료제: 2019년 1월 미국 San Diego 소재 Allele Biotechnology & Pharmaceuticals와 유도만능줄기세포(iPSC) 기반 제1형 당뇨 치료제 공동 개발협약을 체결하였습니다. Allele Biotech는 미국 내 cGMP 생산시설에서 mRNA 원천기술을 적용하여 유도만능줄기세포 구축 및 조직 특이적 세포 분화기술을 보유하고 있습니다. 당사는 Allele Biotech와 유도만능줄기세포 유래 췌장세포를 활용한 1형 및 제3형 당뇨병 치료제 개발을 위한 전임상 연구를 통해 신약개발 가능성을 타진하고, 향후 당뇨병 치료제 시장에 진출하고자 합니다. 2021년 6월에 라이선스 계약(License and Collaboration Agreement)을 체결하였습니다.
사. 미국 관계사 코이뮨
|
주요 사업 |
세포치료제 개발 | 투자금 |
17,597백만원 |
|
설립일 |
2019.02.07 |
종업원수 |
49명 |
|
대표자 |
Charles Nicolette |
기업형태 |
벤처기업, 비상장 중소기업 |
|
주요 주주 |
에스씨엠생명과학: 23.88% 제넥신: 22.94% |
면적 |
1,800㎡ (임차) |
|
주소지 |
4233 Technology Drive, Durham, North Carolina, United States 27704 |
||
당사는 2019년 2월 미국 Argos Therapeutics의 기술력과 글로벌 최고 수준의 세포치료제 제조시설(cGMP) 및 품질관리 시스템을 확보하기 위하여 ㈜제넥신과 공동으로 인력, 특허, cGMP 제조시설 등 일체를 125억원에 인수하여, 미국 합작법인 CoImmune, Inc.(이하 "코이뮨")을 설립하여, 설립 시 당사가 51% 및 ㈜제넥신이 49% 지분을 보유하였습니다.
코이뮨의 100% 자회사인 CoImmune CAR-CIK Inc.가 2020년 4월 30일 차세대 CAR-T 치료제 개발사인 이탈리아 Formula Phamaceuticals Inc.와 합병을 완료하면서 코이뮨은 이탈리아 Formula의 기존 주주에게 CoImmune 주식 8,961,039주를 합병대가로 지급하였습니다.
코이뮨은 국내 및 이탈리아 기관투자자로부터 총 45백만 달러(한화 약 510억원) 규모의 자금조달 유치하였습니다. 당사는 2020년도에 7,555백만원을 추가 납입하여 총 누적 투자액은 17,597백만원입니다.
(1) 개발 파이프라인
 |
|
코이뮨 파이프라인 |
■ 원천기술인 수지상세포를 이용한 면역 항암 백신 세포치료제 개발 사업은 미국에서 전이성 신장암 환자를 대상으로 2b상 임상시험 진입을 위해 2020년 2월 임상시험계획서를 미국 FDA로부터 승인 받았으며, 2020년 4월에 CAR-CIK 치료제 개발 회사인 이탈리아 바이오 기업인 포뮬라를 인수합병으로 면역항암제 파이프라인을 추가하여 높은 수익을 창출할 수 있는 사업모델을 개발 중입니다.
■ 세포치료제 분야는 국내외 전문 인력과 체계적인 생산시스템이 절대적으로 부족한 상황입니다. 진입장벽이 높은 cGMP 생산, 콜드체인 시스템 및 품질관리, 컴퓨터 Validation 및 문서화 작업 등 많은 경험을 이용한 컨설팅 사업 및 cGMP 시스템을 활용한 CDMO(Contract Development & Manufacturing Organization, 의약품 위탁개발생산) 사업 모델로 높은 성장이 예상되는 신규사업을 추진하고 있습니다.
■ 미국 관계회사 코이뮨은 미국의 3대 암 센터인 메모리얼 슬로안 케터링(MemorialSloan Kettering, MSK) 암센터와 코이뮨의 동종CAR-CIK(사이토카인 유도살해 세포) 기술을 이용한 고형암 치료제 개발에 관한 협약을 체결했습니다.
아. 용어 설명
| [용어 설명표] |
|
용 어 |
설 명 |
|---|---|
|
(개발단계)희귀의약품 지정 |
국내에서 임상시험 단계에 있는 의약품일 경우, (개발단계) 희귀의약품 지정을 위한 다음의 지정기준을 만족해야 함 |
|
조건부 품목허가 |
생명을 위협하거나 중대한 질병 치료제로서, 기존 치료법이 없거나 기존 치료에 비해 의미 있는 장점이 있는 의약품을 대상으로 하며, 식약처는 의약품 중 항암제와 희귀의약품 및 세포치료제를 대상으로 조건부 허가 제도를 운영하고 있음 |
|
조혈모줄기세포 |
(Hematopoietic stem cell) 조혈모줄기세포는 정상인의 혈액 중 약 1%정도에 해당되며 모든 혈액세포를 만들어내는 능력을 가진 원조가 되는 줄기세포를 말함 |
|
콜로니 |
(Colony) 단일 세포에서 분열을 통해 성장한 세포들이 이룬 군체를 말하며, 당사에서 확립하는 줄기세포주는 모두 단일 콜로니로부터 분리하여 배양함 |
|
Amylase |
아밀라아제 녹말(당)을 분해하는 소화효소로 침샘과 췌장에서 생산되어 소화작용을 도와주지만, 췌장 괴사가 동반되는 췌장염 발생 시 혈중으로 유리되는 양이 증가하여 췌장염 임상증상 지표물질로 사용함 |
|
CFU-F |
(Colony Forming Unit-Fibroblast) 줄기세포능을 측정하는 방법으로, 하나의 중간엽줄기세포로부터 증식된 세포들이 콜로니를 이룰 수 있는 능력을 평가하는 시험법. CFU-F 형성능이 높은 세포는 자기복제능이 우수한 중간엽줄기세포 특성을 지니는 세포라는 것을 의미함 |
|
CXCL1 |
(Chemokine (C-X-C motif) ligand 1) 호중성 과립구의 케모카인으로 작용하며 다양한 면역반응을 유도하지만, 당사에서 최초로 발모효능을 입증한 발모단백질 |
|
DMN |
(Dimethylnitrosamine) 대사되어 아세트알데하이드를 형성하고, 핵산 및 단백질을 methylation시키는 물질을 형성하여 간세포 (hepatocyte)의 괴사를 유발하여 간섬유화 및 간경변을 유도함 |
|
ELISA |
(Enzyme-linked immunosorbent assay) 항체나 항원에 효소를 표지하여 효소의 활성을 측정하여 항원-항체 반응의 강도와 그 양을 정량적으로 측정하는 방법 |
|
FBS-CM |
(FBS-conditioned medium) 동물유래 성분인 Fetal Bovine Serum (FBS)를 포함한 배지로 중간엽줄기세포를 배양한 배지 |
|
GCM |
(Density Gradient Centrifugation Method) 농도구배원심분리법으로 중간엽줄기세포를 분리하는 대표적인 분리 기술 |
|
hPL |
(Human platelet lysate) 효과적인 FBS 대체제로 인체 유래 혈소판 용해물 |
|
hPL-CM |
Xeno-free hPL을 포함한 배지로 중간엽줄기세포를 배양한 배지 |
|
ICID |
(International Cosmetic Ingredient Dictionary) 미국화장품협회에서 발행하는 화장품원료사전으로 명명법에 의한 원료명, 상품명, 기능 등이 등재되어 있음 |
|
ICOSL |
(Inducible T Cell Costimulator Ligand) 면역관문 조절 물질로 ICOS와 결합하여 T-세포의 활성과 사이토카인의 분비를 유도 |
|
ICOS |
(Inducible T Cell Costimulator) 면역관문 조절 물질로 ICOSL와 결합하여 T세포의 활성과 사이토카인의 분비를 유도 |
|
IDO |
(Indoleamine 2,3-dioxygenase) T-세포의 기능과 면역활성을 조절하는 효소 |
|
IFN-γ |
(Interferon-γ) 면역세포에서 생산하는 외부 침입자들에 대응하는 단백질로 자연살해세포와 대식세포 등의 선천면역 세포들을 활성화시키는 역할을 담당 |
|
IgE |
(Immunoglobulin E) 면역글로불린 E는 알레르기 질환의 발생에 관여하는 면역글로불린의 한 종류로, 알레르기 질환을 진단하는 가장 우선적인 방법의 하나로 혈청 내 총 IgE를 측정함 |
|
IL-4 |
(Interleukin-4) 보조 Th2 T-세포로의 분화를 유도하는 인터루킨. IL-4에 의해 활성화된 Th2 세포들은 추가적인 IL-4를 생산함 |
|
IL-6 |
(Interleukin-6) 염증성 사이토카인 및 항 염증성 미오카인 두가지 양성적 기능을 갖는 인터루킨 |
|
IL-1β |
(Interleukin-1β) 염증이 발생한 환경에서 면역세포로부터 많이 분비되는 사이토카인 |
|
IL-10 |
(Interleukin-10) 사이토카인 합성 억제 인자로 항염증성 기능을 갖는 인터루킨 |
|
IL-17 |
(Interleukin-17A) 전 염증성 (pro-inflammatory) 사이토카인으로 IL-23의 자극에 반응하여 보조 Th17 T-세포에서 생성되고 염증과 자가면역 병인에 직접적인 역할을 함 |
|
IND |
(Investigational New Drug Application) 임상시험계획승인신청은 인체를 대상으로 한 안전성·유효성자료 수집을 목적으로 해당 의약품을 사용하여 임상시험을 실시하고자 하는 자가 식품의약품안전처장의 승인을 신청하는 과정을 말합니다. |
|
In vitro |
생명체 내부가 아니라 시험관이나 페트리 디쉬와 같이 제어가 가능한 환경에서 수행되는 실험 과정을 의미함 |
|
In vivo |
살아 있는 세포 안에서 직접 생화학, 생물학 실험 등을 하는 것을 의미함 |
|
Lipase |
리파아제는 췌장에서 생산되어 지방을 분해하는 효소 중 하나로 췌장염과 같이 췌장이 손상되거나 췌장관이 막히는 경우 췌장관으로 리파아제가 배출되지 못해 증가된 리파아제가 혈액 내로 유입되어 혈중농도를 증가시킴. 췌장염 임상증상 지표물질로 사용함 |
|
LPS |
(Lipopolysaccharide) 그람 음성 박테리아의 외막 구성 성분인 당지질로 면역활성을 유도하는 물질 |
|
MLR |
(Mixed Lymphocyte Reaction) 서로 다른 두 공여자의 말초혈액 단핵세포의 혼합 림프구 반응을 말하며 면역활성을 유도하는 시험법 |
|
MPO |
(Myeloperoxidase) 선천면역의 대표 세포인 호중성 과립구 (neutrophil granulocyte)와 같은 백혈구에 많이 발현되어 있는 항균작용 (antimicrobial activity)을 하는 효소 |
|
MSC |
(Mesenchymal Stem Cell) 중간엽줄기세포로 골수, 지방, 탯줄 조직 등으로부터 추출하기 쉬운 성체줄기세포로, 연골, 뼈, 관절을 재생하는 특징이 있고, 손상을 입거나 염증이 생긴 조직으로 이동하여 면역조절기능을 통한 재생과 질환 치료 효능이 규명된 세포 |
|
NGS |
(Next-generation sequencing) DNA 또는 RNA 시료에서 염기쌍의 신속한 서열분석(sequencing)을 가능하게 하는 차세대 염기서열 분석방법으로 유전체를 무수히 많은 조각으로 나눠서 읽은 후, 얻어진 염기서열 조각을 조립하여 전체 유전체의 서열을 분석함 |
|
Ovalbumin/Alum |
아토피 피부염 유도를 위해 사용하는 달걀 흰자 유래 알부민(Ovalbumin) 및 알루미늄 하이드록사이드 (Alum, aluminum hydroxide)로 함께 혼화하여 복강주사를 통해 감작시킴 |
|
PBMC |
(Peripheral Blood Mononuclear Cell) 말초혈액 단핵세포를 말하며 전혈로부터 피콜(Ficoll)과 원심분리를 이용해 분리함 |
|
Pre-IND 미팅 |
(Pre-Investigational New Drug, Pre-IND) IND 사전상담 미팅은 IND 신청서를 제출하기 전 의뢰자가 FDA 심의 담당관과 IND에 대해 사전상담할 수 있는 절차임. Pre-IND 미팅은 동물연구 결과에 대한 합의 시 결정적인 역할을 수행하며, 이 과정이 끝나야 사람을 대상으로 하는 임상시험을 개시할 수 있음. 또한 이 미팅을 통해 진행할 임상시험의 레이아웃도 제공할 수 있음. |
|
qPCR |
(Quantitative real time polymerase chain reaction) 각 유전자의 정확한 정량을 위해 형광으로 분석하는 시험법 |
|
SCM |
(Subfractionation Culturing Method) 층분리배양법으로 불리는 당사가 자체 개발한 고순도 중간엽줄기세포 분리 및 배양 기술 |
|
Splenocyte |
비장세포로 비장에 위치하거나 비장 조직으로부터 분리되는 다양한 면역 기능을 갖는 T 및 B-림프구, 수지상 세포 및 대식세포와 같은 면역세포 집단 |
|
TCA |
(Taurocholic acid, sodium taurocholate) 콜린산과 타우린의 접합체로 지방의 유화에 관여하는 담즙산으로, 3% TCA (1 mL/kg)를 주입하여 급성 췌장염 질환동물모델을 유도시킬 수 있는 물질 |
|
TGF-β1 |
(Transforming growth factor β1) 세포 성장, 세포 증식, 세포 분화 및 세포 사멸을 포함하여 많은 세포 기능을 수행하는 분비 단백질로 염증반응을 제어하는 면역억제 기능을 담당하기도 함 |
|
TNF-α |
(Tumor necrosis factor-α) 활성화된 대식세포, 보조 T-세포, 자연살해세포 등의 다양한 세포에서 분비되는 대표적인 염증성 사이토카인 |
|
TNFR-1 |
(Tumor necrosis factor receptor 1) 강력한 염증매개 단백질 (종양괴사인자) TNF-α 의 수용체로 중간엽줄기세포에서 발현되는 sTNFR-1(soluble TNFR-1)는 TNF-α 와 결합하여 TNF-α 의 기능을 무력화시키는 방식으로 면역억제 효과를 유도함 |
|
Toluidine blue |
톨루이딘 블루는 산성 조직 성분에 대한 친 화성이 높은 염기성 염료로 비만세포 (mast cell) 특이적 염색 시약으로 사용함 |
|
TYMP |
(Thymidine Phosphorylase) 내피세포의 성장으로 혈관을 신생하는 기능을 포함한 다양한 기능을 보유한 성장인자 |
|
Xeno-free |
동물유래 성분이 전혀 포함되지 않는 세포 배양이나 제조 방법을 총칭할 때 쓰는 용어 |
III. 재무에 관한 사항
1. 요약재무정보
아래 요약재무정보는 한국채택국제회계기준(K-IFRS)에 따라 작성하였습니다.
| (단위: 원) |
|
구 분 |
2023년 1분기 (제10기 1분기) |
2022년 (제9기) |
2021년 (제8기) |
|---|---|---|---|
| Ⅰ.유동자산 | 5,305,637,096 | 10,039,817,126 | 20,311,708,346 |
| Ⅱ.비유동자산 | 21,153,819,967 | 22,980,138,172 | 33,733,038,770 |
| 자산총계 | 26,459,457,063 | 33,019,955,298 | 54,044,747,116 |
| Ⅰ.유동부채 | 3,231,106,065 | 4,562,237,132 | 8,709,277,610 |
| Ⅱ.비유동부채 | 3,778,233,103 | 3,946,756,654 | 722,921,313 |
| 부채총계 | 7,009,339,168 | 8,508,993,786 | 9,432,198,923 |
| Ⅰ.자본금 | 6,069,345,000 | 6,060,285,000 | 6,010,927,000 |
| Ⅱ.자본잉여금 | 163,248,700,796 | 163,098,228,434 | 161,783,738,375 |
| Ⅲ.기타포괄손익누계액 | 2,758,395,617 | 2,378,113,419 | 913,544,926 |
| Ⅳ.결손금 | (152,626,323,518) | (147,025,665,341) | (124,095,662,108) |
| 자본총계 | 19,450,117,895 | 24,510,961,512 | 44,612,548,193 |
| 부채 및 자본총계 | 26,459,457,063 | 33,019,955,298 | 54,044,747,116 |
| 구 분 | (2023.01.01 ~ 2023.03.31) |
(2022.01.01 ~ 2022.12.31) |
(2021.01.01 ~ 2021.12.31) |
| 매출액 | 97,511,422 | 395,982,302 | 439,262,616 |
| 매출원가 | 26,006,792 | 220,230,172 | 91,353,698 |
| 매출총이익 | 71,504,630 | 175,752,130 | 347,908,918 |
| 판매비와관리비 | 3,445,180,878 | 12,754,679,395 | 12,503,078,528 |
| 영업이익(손실) | (3,373,676,248) | (12,578,927,265) | (12,155,169,610) |
| 영업외이익(손실) | (2,226,981,929) | (10,351,075,968) | (10,363,513,308) |
| 법인세비용차감전순이익(손실) | (5,600,658,177) | (22,930,003,233) | (22,518,682,918) |
| 당기순이익(손실) | (5,600,658,177) | (22,930,003,233) | (22,518,682,918) |
| 기타포괄이익(손실) | 380,282,198 | 1,464,568,493 | 2,338,104,142 |
| 총포괄이익(손실) | (5,220,375,979) | (21,465,434,740) | (20,180,578,776) |
| 기본주당이익(손실) | (461) | (1,897) | (1,882) |
| 희석주당이익(손실) | (461) | (1,897) | (1,882) |
2. 연결재무제표
당사는 증권신고서 제출일 현재 해당사항이 없습니다.
3. 연결재무제표 주석
당사는 증권신고서 제출일 현재 해당사항이 없습니다.
4. 재무제표
|
재무상태표 |
|
제 10 기 1분기말 2023.03.31 현재 |
|
제 9 기말 2022.12.31 현재 |
|
(단위 : 원) |
|
제 10 기 1분기말 |
제 9 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
5,305,637,096 |
10,039,817,126 |
|
현금및현금성자산 |
4,169,287,283 |
6,916,335,193 |
|
단기금융상품 |
2,053,463,850 |
|
|
매출채권 |
12,205,849 |
5,630,496 |
|
미수수익 |
18,739,726 |
|
|
미수금 |
3,452,590 |
965,070 |
|
재고자산 |
151,909,469 |
102,711,504 |
|
유동성보증금 |
598,995,540 |
596,847,943 |
|
선급금 |
75,044,947 |
75,044,947 |
|
선급비용 |
49,729,888 |
98,008,979 |
|
선급부가세 |
193,641,330 |
129,810,548 |
|
당기법인세자산 |
51,370,200 |
42,258,870 |
|
비유동자산 |
21,153,819,967 |
22,980,138,172 |
|
지분법적용투자주식 |
8,548,679,798 |
10,321,348,902 |
|
장기투자자산 |
1,147,100,000 |
1,147,100,000 |
|
유형자산 |
10,615,078,707 |
10,649,849,877 |
|
무형자산 |
283,856,258 |
302,734,189 |
|
보증금 |
559,105,204 |
559,105,204 |
|
자산총계 |
26,459,457,063 |
33,019,955,298 |
|
부채 |
||
|
유동부채 |
3,231,106,065 |
4,562,237,132 |
|
미지급금 |
529,699,627 |
456,776,650 |
|
미지급비용 |
129,806,363 |
107,301,125 |
|
예수금 |
47,074,620 |
56,199,753 |
|
선수금 |
28,000 |
1,481,269,376 |
|
단기차입금 |
2,000,000,000 |
2,000,000,000 |
|
유동성계약부채 |
242,236,875 |
241,673,922 |
|
유동성장기차입금 |
||
|
유동성리스부채 |
124,805,408 |
61,561,134 |
|
유동성충당부채 |
157,455,172 |
157,455,172 |
|
비유동부채 |
3,778,233,103 |
3,946,756,654 |
|
장기차입금 |
3,630,000,000 |
3,630,000,000 |
|
장기미지급금 |
70,000,000 |
70,000,000 |
|
계약부채 |
60,225,016 |
|
|
리스부채 |
62,441,953 |
77,548,265 |
|
충당부채 |
||
|
장기미지급비용 |
15,791,150 |
108,983,373 |
|
부채총계 |
7,009,339,168 |
8,508,993,786 |
|
자본 |
||
|
자본금 |
6,069,345,000 |
6,060,285,000 |
|
자본잉여금 |
163,248,700,796 |
163,098,228,434 |
|
기타포괄손익누계액 |
2,758,395,617 |
2,378,113,419 |
|
이익잉여금(결손금) |
(152,626,323,518) |
(147,025,665,341) |
|
자본총계 |
19,450,117,895 |
24,510,961,512 |
|
자본과부채총계 |
26,459,457,063 |
33,019,955,298 |
|
포괄손익계산서 |
|
제 10 기 1분기 2023.01.01 부터 2023.03.31 까지 |
|
제 9 기 1분기 2022.01.01 부터 2022.03.31 까지 |
|
(단위 : 원) |
|
제 10 기 1분기 |
제 9 기 1분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출 |
97,511,422 |
97,511,422 |
113,633,087 |
113,633,087 |
|
매출원가 |
26,006,792 |
26,006,792 |
30,427,409 |
30,427,409 |
|
매출총이익 |
71,504,630 |
71,504,630 |
83,205,678 |
83,205,678 |
|
판매비와관리비 |
3,445,180,878 |
3,445,180,878 |
3,840,638,922 |
3,840,638,922 |
|
영업이익(손실) |
(3,373,676,248) |
(3,373,676,248) |
(3,757,433,244) |
(3,757,433,244) |
|
영업외이익(손실) |
(2,226,981,929) |
(2,226,981,929) |
(1,944,986,845) |
(1,944,986,845) |
|
금융수익 |
40,826,082 |
40,826,082 |
60,161,227 |
60,161,227 |
|
금융비용 |
118,071,369 |
118,071,369 |
59,705,287 |
59,705,287 |
|
기타수익 |
8,213,631 |
8,213,631 |
4,514,108 |
4,514,108 |
|
기타비용 |
4,998,971 |
4,998,971 |
3,161,910 |
3,161,910 |
|
지분법투자관련이익(손실) |
(2,152,951,302) |
(2,152,951,302) |
(1,946,794,983) |
(1,946,794,983) |
|
법인세비용차감전순이익(손실) |
(5,600,658,177) |
(5,600,658,177) |
(5,702,420,089) |
(5,702,420,089) |
|
당기순이익(손실) |
(5,600,658,177) |
(5,600,658,177) |
(5,702,420,089) |
(5,702,420,089) |
|
기타포괄손익 |
380,282,198 |
380,282,198 |
319,141,449 |
319,141,449 |
|
지분법자본변동 |
380,282,198 |
380,282,198 |
319,141,449 |
319,141,449 |
|
총포괄손익(손실) |
(5,220,375,979) |
(5,220,375,979) |
(5,383,278,640) |
(5,383,278,640) |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(461) |
(461) |
(474) |
(474) |
|
희석주당이익(손실) (단위 : 원) |
(461) |
(461) |
(474) |
(474) |
|
자본변동표 |
|
제 10 기 1분기 2023.01.01 부터 2023.03.31 까지 |
|
제 9 기 1분기 2022.01.01 부터 2022.03.31 까지 |
|
(단위 : 원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
자본조정 |
기타포괄손익누계액 |
이익잉여금(결손금) |
자본 합계 |
|
|
2022.01.01 (기초자본) |
6,010,927,000 |
161,783,738,375 |
913,544,926 |
(124,095,662,108) |
44,612,548,193 |
|
|
당기순이익(손실) |
(5,702,420,089) |
(5,702,420,089) |
||||
|
지분법자본변동 |
319,141,449 |
319,141,449 |
||||
|
주식매수선택권행사 |
||||||
|
주식보상비용 |
174,128,862 |
174,128,862 |
||||
|
2022.03.31 (기말자본) |
6,010,927,000 |
161,957,867,237 |
1,232,686,375 |
(129,798,082,197) |
39,403,398,415 |
|
|
2023.01.01 (기초자본) |
6,060,285,000 |
163,098,228,434 |
2,378,113,419 |
(147,025,665,341) |
24,510,961,512 |
|
|
당기순이익(손실) |
(5,600,658,177) |
(5,600,658,177) |
||||
|
지분법자본변동 |
380,282,198 |
380,282,198 |
||||
|
주식매수선택권행사 |
9,060,000 |
134,464,000 |
143,524,000 |
|||
|
주식보상비용 |
16,008,362 |
16,008,362 |
||||
|
2023.03.31 (기말자본) |
6,069,345,000 |
163,248,700,796 |
2,758,395,617 |
(152,626,323,518) |
19,450,117,895 |
|
|
현금흐름표 |
|
제 10 기 1분기 2023.01.01 부터 2023.03.31 까지 |
|
제 9 기 1분기 2022.01.01 부터 2022.03.31 까지 |
|
(단위 : 원) |
|
제 10 기 1분기 |
제 9 기 1분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(3,339,963,730) |
(3,045,813,812) |
|
당기순이익(손실) |
(5,600,658,177) |
(5,702,420,089) |
|
현금유출입이없는수익비용의조정 |
2,376,934,333 |
2,342,728,299 |
|
감가상각비 |
201,239,777 |
262,336,245 |
|
무형자산상각비 |
22,681,828 |
20,912,801 |
|
금융수익 |
(40,826,082) |
(60,161,227) |
|
금융비용 |
118,071,369 |
59,705,287 |
|
주식기준보상비용 |
(77,183,861) |
113,140,210 |
|
지분법손실 |
2,152,951,302 |
1,946,794,983 |
|
영업활동으로인한자산ㆍ부채의변동 |
(79,234,536) |
279,144,386 |
|
외상매출의 감소(증가) |
(6,575,353) |
1,057,229 |
|
미수금의 감소(증가) |
(2,487,520) |
(17,381,523) |
|
선급금의 감소(증가) |
(10,073,116) |
|
|
선급비용의 감소(증가) |
48,279,091 |
1,190,836 |
|
선급세금의 감소(증가) |
(63,830,782) |
24,668,113 |
|
재고자산의 감소(증가) |
(49,197,965) |
85,955,745 |
|
미지급금의 증가(감소) |
71,591,089 |
374,165,460 |
|
예수금의 증가(감소) |
(9,125,133) |
19,679,412 |
|
선수금의 증가(감소) |
28,000 |
39,920 |
|
미지급비용의 증가(감소) |
(8,253,900) |
(135,499,230) |
|
환불부채의 증가(감소) |
(98,860) |
(4,873,637) |
|
계약부채의 증가(감소) |
(59,563,203) |
(59,563,203) |
|
충당부채의 증가(감소) |
(221,620) |
|
|
이자수취(영업) |
59,418,211 |
78,476,292 |
|
이자지급(영업) |
(87,312,231) |
(43,742,700) |
|
법인세의 환급(납부) |
(9,111,330) |
|
|
투자활동현금흐름 |
486,182,377 |
6,837,286,222 |
|
투자활동으로 인한 현금유입액 |
572,194,474 |
16,000,000,000 |
|
단기금융상품의 처분 |
572,194,474 |
16,000,000,000 |
|
보증금의 회수 |
||
|
단기금융상품관련 선수금 수령 |
||
|
투자활동으로 인한 현금유출액 |
(86,012,097) |
(9,162,713,778) |
|
단기금융상품의 취득 |
(9,000,000,000) |
|
|
장기금융상품의 취득 |
||
|
종속기업, 조인트벤처와 관계기업에 대한 투자자산의 취득 |
||
|
유형자산의 취득 |
(82,245,097) |
(142,003,614) |
|
무형자산의 취득 |
(1,767,000) |
|
|
보증금의 증가 |
(2,000,000) |
(20,710,164) |
|
재무활동현금흐름 |
106,733,443 |
(117,606,512) |
|
재무활동으로 인한 현금유입액 |
144,097,000 |
|
|
주식의 발행 |
||
|
주식선택권행사 |
144,097,000 |
|
|
단기차입금의 차입 |
||
|
장기차입금의 차입 |
||
|
재무활동으로 인한 현금유출액 |
(37,363,557) |
(117,606,512) |
|
정부보조금의 수취 |
||
|
리스부채의 지급 |
(36,790,557) |
(87,606,512) |
|
유동성장기차입금의 상환 |
(30,000,000) |
|
|
신주발행비 지급 |
(573,000) |
|
|
현금및현금성자산의순증가(감소) |
(2,747,047,910) |
3,673,865,898 |
|
기초현금및현금성자산 |
6,916,335,193 |
2,890,275,427 |
|
기말현금및현금성자산 |
4,169,287,283 |
6,564,141,325 |
5. 재무제표 주석
| 제 10 기 1분기 2023년 03월 31일 현재 |
| 제 09 기 1분기 2022년 03월 31일 현재 |
| 에스씨엠생명과학 주식회사 |
1. 일반 사항
에스씨엠생명과학 주식회사(이하 '당사')는 2014년 7월 2일에 설립되었으며, 층분리배양법 기술을 이용한 난치성 질환 줄기세포치료제의 개발 및 공급을 목적으로 하고 있습니다. 당사는 인천광역시 연수구에 본사를 두고 있으며, 2020년 6월 17일자로 코스닥시장에 상장하였습니다.
당사는 수차례의 유상증자 및 무상증자를 통하여 당분기말 현재 당사의 자본금은 6,069백만원이며, 최대주주(송기령) 및 특수관계자의 지분율은 23.59%입니다.
2. 재무제표의 작성기준과 유의적인 회계정책
당사의 작성되는 분기재무제표는 한국채택국제회계기준에 따라 작성되는 중간재무제표입니다. 동 재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석은 직전 연차보고기간말 후 발생한 당사의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다.
아래에 기술한 사항을 제외하면, 이번 분기재무제표에 적용된 회계정책은 직전 연차재무제표에 적용한 회계정책과 동일합니다.
2.1 회사가 채택한 제ㆍ개정기준서및해석서
(1) 기업회계기준서 제1001호 '재무제표 표시' - '회계정책'의 공시
중요한 회계정책 정보를 정의하고 이를 공시하도록 하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(2) 기업회계기준서 제1008호 '회계정책, 회계추정의 변경 및 오류' - '회계추정'의 정의
회계추정을 정의하고, 회계정책의 변경과 구별하는 방법을 명확히 하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(3) 기업회계기준서 제1012호 '법인세' - 단일거래에서 생기는 자산과 부채에 대한 이연법인세
자산 또는 부채가 최초로 인식되는 거래의 최초 인식 예외 요건에 거래시점 동일한 가산할 일시적차이와 차감할 일시적차이를 발생시키지 않는 거래라는 요건을 추가하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
(4) 기업회계기준서 제1117호 '보험계약' 제정
기업회계기준서 제1117호 '보험계약'은 기업회계기준서 제1104호 '보험계약'을 대체합니다. 보험계약에 따른 모든 현금흐름을 추정하고 보고시점의 가정과 위험을 반영한 할인율을 사용하여 보험부채를 측정하고, 매 회계연도별로 계약자에게 제공한 서비스(보험보장)를 반영하여 수익을 발생주의로 인식하도록 합니다. 또한, 보험사건과 관계없이 보험계약자에게 지급하는 투자요소(해약/만기환급금)는 보험수익에서 제외하며, 보험손익과 투자손익을 구분 표시하여 정보이용자가 손익의 원천을 확인할 수 있도록 하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
기준서의 개정으로 기업회계기준서 제1117호를 최초로 적용하는 기업은 비교기간에대해 선택적 분류 조정('overlay')를 적용할 수 있습니다. 이러한 분류 조정은 기업회계기준서 제1117호의 적용범위에 포함되는 계약과 연관성이 없는 금융자산을 포함한 모든 금융자산에 적용할 수 있습니다. 금융자산에 분류 조정을 적용하는 기업은 기업회계기준서 제1109호의 분류와 측정 요구사항을 해당 금융자산에 적용해왔던 것처럼 비교정보를 표시하며며, 이러한 분류 조정은 상품별로 적용할 수 있습니다.
(5) 기업회계기준서 제1001호 ' 재무제표 표시 ' - 행사가격 조정 조건이 있는 금융부채 평가손익 공시
발행자의 주가 변동에 따라 행사가격이 조정되는 조건이 있는 금융상품의 전부나 일부가 금융부채로 분류되는 경우 그 금융부채의 장부금액과 관련 손익을 공시하도록 하였습니다. 해당 기준서의 개정이 재무제표에 미치는 중요한 영향은 없습니다.
2.2 미적용 제ㆍ개정 기준서
제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
(1) 기업회계기준서 제1001호 '재무제표 표시' 개정 - 부채의 유동/비유동 분류
보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된경우는 제외됩니다. 동 개정사항은 2024년 1월 1일 이후 시작하는 회계연도부터 적용될 예정이며, 조기적용이 허용됩니다. 회사는 동 개정으로 인한 재무제표의 영향을검토 중에 있습니다.
3. 중요한 판단과 추정 불확실성의 주요 원천
당사는 미래에 대하여 추정 및 가정을 하고 있습니다. 추정 및 가정은 지속적으로 평
가되며, 과거 경험과 현재의 상황에서 합리적으로 예측가능한 미래의 사건과 같은 다
른 요소들을 고려하여 이루어집니다. 이러한 회계추정은 실제 결과와 다를 수도 있습
니다.
분기재무제표에서 사용된 당사의 회계정책의 적용과 추정금액에 대한 경영진의 판단
은 법인세비용을 결정하는데 사용된 추정의 방법을 제외하고는 2022년 12월 31일로 종료되는 회계연도의 연차재무제표와 동일한 회계정책과 추정의 근거를 사용하였습니다.
4. 부문정보
(1) 당사의 경영진은 부문에 자원을 배분하고 부문의 성과를 평가하기 위하여 당사의 최고영업의사결정자에게 보고되는 정보에 기초하여 영업부문을 결정하고 있으며, 당사는 줄기세포사업부 보고부문을 가지고 있습니다.
| 사업부문 | 주요 재화 및 용역 |
|---|---|
| 줄기세포 사업부문 | 위탁연구개발, 화장품 제조 및 판매 |
(2) 당사의 당분기 및 전분기 부문별 수익은 아래와 같으며, 모두 국내에서 발생하였습니다.
| (단위 : 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 줄기세포 사업부문 | 97,511,422 | 113,633,087 |
5. 재고자산
당분기말과 전기말 현재 재고자산의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 제품 | 35,599,145 | 51,861,812 |
| 원재료 | 93,800,000 | 50,800,000 |
| 재공품 | 22,500,000 | - |
| 반환제품회수권 | 10,324 | 49,692 |
| 합 계 | 151,909,469 | 102,711,504 |
6. 지분법적용투자주식
(1) 당분기말 현재 관계기업에 대한 지분율 현황 및 출자금액은 다음과 같습니다.
| (단위: 원) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 투자기업명 | 주요 영업활동 | 소재지 | 결산월 | 당분기말 | 전기말 | ||||
| 지분율 (%) |
취득금액 | 장부금액 | 지분율 (%) |
취득금액 | 장부금액 | ||||
| CoImmune, Inc. | 세포치료제 연구개발 | 미국 | 12월 | 23.88% | 26,339,623,660 | 8,548,679,798 | 23.88% | 26,339,623,660 | 10,321,348,902 |
(2) 당분기말 및 전기말 현재 관계기업의 요약 재무상태는 다음과 같습니다.
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 투자기업명 | 유동자산 | 비유동자산 | 유동부채 | 비유동부채 | 자본 |
| CoImmune, Inc. | 16,887,460,660 | 8,926,481,511 | 1,907,824,268 | 1,292,258,306 | 22,613,859,597 |
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 투자기업명 | 유동자산 | 비유동자산 | 유동부채 | 비유동부채 | 자본 |
| CoImmune, Inc. | 21,805,127,872 | 10,995,888,180 | 1,534,144,956 | 1,357,562,555 | 29,909,308,541 |
(3) 당분기 및 전분기 중 관계기업의 요약 경영성과는 다음과 같습니다.
<당분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 투자기업명 | 매출액 | 영업손익 | 당기순손익 | 기타포괄손익 | 총포괄손익 |
| CoImmune, Inc. | - | (8,847,116,726) | (8,719,174,397) | 684,862,521 | (8,034,311,876) |
<전분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 투자기업명 | 매출액 | 영업손익 | 당기순손익 | 기타포괄손익 | 총포괄손익 |
| CoImmune, Inc. | 306,316,568 | (7,852,899,475) | (7,871,975,550) | 319,141,449 | (7,552,834,100) |
(4) 당분기말 및 전기말 현재 관계기업의 재무정보를 투자기업에 대한 지분의 장부금액으로 조정한 내역은 다음과 같습니다.
<당분기말>
| (단위: 원) | |||
|---|---|---|---|
| 투자기업명 | 순자산지분액 | 투자차액 | 장부금액 |
| CoImmune, Inc. | 3,611,847,384 | 4,936,832,414 | 8,548,679,798 |
<전기말>
| (단위: 원) | |||
|---|---|---|---|
| 투자기업명 | 순자산지분액 | 투자차액 | 장부금액 |
| CoImmune, Inc. | 5,579,352,735 | 4,741,996,167 | 10,321,348,902 |
(5) 당분기 및 전분기 중 관계기업의 종목별 지분법평가내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 투자기업명 | 기초 | 지분법손실 | 지분법자본변동 | 기말 |
| CoImmune, Inc. | 10,321,348,902 | (2,152,951,302) | 380,282,198 | 8,548,679,798 |
<전분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 투자기업명 | 기초 | 지분법손실 | 지분법자본변동 | 기말 |
| CoImmune, Inc. | 20,506,445,708 | (1,946,794,983) | 319,141,449 | 18,878,792,173 |
7. 유형자산
(1) 당분기말과 전기말 유형자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
|
구 분 |
당분기말 |
전기말 |
||||
|
취득원가 |
상각누계액(*2) |
장부금액 |
취득원가 |
상각누계액(*2) |
장부금액 |
|
| 토지(*1) | 6,967,498,403 | - | 6,967,498,403 | 6,967,498,403 | - | 6,967,498,403 |
| 건물(*1) | 2,101,460,939 | (247,241,096) | 1,854,219,843 | 2,101,460,939 | (229,378,676) | 1,872,082,263 |
| 구축물 | 16,000,000 | (1,541,336) | 14,458,664 | 16,000,000 | (1,405,333) | 14,594,667 |
| 기계장치 | 2,795,254,837 | (2,190,799,860) | 604,454,977 | 2,744,982,110 | (2,094,326,119) | 650,655,991 |
| 공구와기구 | 387,259,091 | (244,516,938) | 142,742,153 | 387,259,091 | (226,751,146) | 160,507,945 |
| 비품 | 356,361,075 | (221,486,054) | 134,875,021 | 340,161,075 | (208,155,325) | 132,005,750 |
| 시설장치 | 555,658,244 | (432,362,817) | 123,295,427 | 555,658,244 | (413,894,364) | 141,763,880 |
| 건설중인자산 | 592,381,680 | - | 592,381,680 | 577,314,319 | - | 577,314,319 |
| 사용권자산 | 1,583,132,821 | (1,401,980,282) | 181,152,539 | 1,498,204,302 | (1,364,777,643) | 133,426,659 |
| 합 계 | 15,355,007,090 | (4,739,928,383) | 10,615,078,707 | 15,188,538,483 | (4,538,688,606) | 10,649,849,877 |
(*1) 당사 소유의 토지 및 건물은 기업은행 차입금과 관련하여 담보로 제공되어 있습니다(주석 10 참조).
(*2) 정부보조금을 합산한 금액입니다.
(2) 당분기 및 전분기의 유형자산 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 토지 | 건물 | 구축물 | 기계장치 | 공구와기구 | 비품 | 시설장치 | 건설중인자산 | 사용권자산 | 합 계 |
|
기초 순장부금액 |
6,967,498,403 | 1,872,082,263 | 14,594,667 | 650,655,991 | 160,507,945 | 132,005,750 | 141,763,880 | 577,314,319 | 133,426,659 | 10,649,849,877 |
|
취득 |
- | - | - | 50,272,727 | - | 16,200,000 | - | 16,284,018 | 84,928,519 | 167,685,264 |
|
대체 |
- | - | - | - | - | - | - | (1,216,657) | - | (1,216,657) |
|
감가상각비 |
- | (17,862,420) | (136,003) | (96,473,741) | (17,765,792) | (13,330,729) | (18,468,453) | - | (37,202,639) | (201,239,777) |
|
분기말 순장부금액 |
6,967,498,403 | 1,854,219,843 | 14,458,664 | 604,454,977 | 142,742,153 | 134,875,021 | 123,295,427 | 592,381,680 | 181,152,539 | 10,615,078,707 |
<전분기>
| (단위: 원) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 토지 | 건물 | 구축물 | 기계장치 | 공구와기구 | 비품 | 시설장치 | 건설중인자산 | 사용권자산 | 합 계 |
|
기초 순장부금액 |
6,967,498,403 | 1,943,531,934 | 15,138,667 | 963,619,912 | 198,238,960 | 129,755,849 | 221,774,267 | 304,921,178 | 372,674,768 | 11,117,153,938 |
|
취득 |
- | - | - | 14,800,000 | - | 14,730,000 | - | 112,473,614 | - | 142,003,614 |
|
대체 |
- | - | - | - | - | - | - | (16,350,912) | - | (16,350,912) |
|
감가상각비 |
- | (17,862,420) | (136,003) | (94,602,795) | (17,463,024) | (12,601,501) | (20,802,825) | - | (98,867,677) | (262,336,245) |
|
분기말 순장부금액 |
6,967,498,403 | 1,925,669,514 | 15,002,664 | 883,817,117 | 180,775,936 | 131,884,348 | 200,971,442 | 401,043,880 | 273,807,091 | 10,980,470,395 |
(3) 당분기와 전분기 중 발생한 감가상각비의 배부내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 판매관리비 | 182,636,717 | 100,189,838 |
| 경상연구개발비 | 18,025,587 | 162,146,407 |
| 매출원가 | 577,473 | - |
| 합 계 | 201,239,777 | 262,336,245 |
(4) 당분기 및 전분기의 사용권자산 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 건물 | 시설장치 | 차량운반구 | 합 계 |
| 기초 장부금액 | 340,917 | 29,108,280 | 103,977,462 | 133,426,659 |
| 취득 | 84,928,519 | - | - | 84,928,519 |
| 감가상각비 | (21,232,130) | (2,728,905) | (13,241,604) | (37,202,639) |
| 분기말 장부금액 | 64,037,306 | 26,379,375 | 90,735,858 | 181,152,539 |
<전분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 건물 | 시설장치 | 차량운반구 | 합 계 |
| 기초 장부금액 | 225,179,084 | 40,023,900 | 107,471,784 | 372,674,768 |
| 감가상각비 | (82,360,644) | (2,728,905) | (16,017,873) | (101,107,422) |
| 분기말 장부금액 | 142,818,440 | 37,294,995 | 91,453,911 | 271,567,346 |
(5) 당분기와 전분기 중 리스계약과 관련하여 손익으로 인식된 금액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 사용권자산 감가상각비 | 37,202,639 | 98,867,677 |
| 리스부채 이자비용 | 2,496,669 | 3,550,125 |
| 복구충당부채 이자비용 | - | 1,523,548 |
| 단기리스 관련 비용 | 15,048,600 | 15,048,600 |
| 소액자산리스 관련 비용 | 1,798,950 | 6,190,050 |
당기 중 리스의 총 현금유출은 119,593,256원입니다.
(6) 연장선택권
일부 부동산 리스는 회사가 계약의 해지불능기간 종료 전에 리스기간을 1년 연장할 수 있는 선택권을 포함합니다. 회사는 운영의 효율성을 위하여 가능하면 새로운 리스계약에 연장선택권을 포함하려고 노력합니다. 연장선택권은 회사만 행사할 수 있고, 리스제공자는 행사할 수 없습니다. 회사는 리스개시일에 연장선택권을 행사할 것이 상당히 확실한지 평가합니다. 회사는 통제 가능한 범위에 있는 유의적인 사건이 일어나거나 상황에 유의적인 변화가 있을 때 연장선택권을 행사할 것이 상당히 확실한지 다시 평가합니다.
8. 무형자산
(1) 당분기말과 전기말 무형자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
|
구 분 |
당분기말 |
전기말 |
||||
|
취득원가 |
상각누계액(*) |
장부금액 |
취득원가 |
상각누계액(*) |
장부금액 |
|
| 소프트웨어 | 61,734,000 | (44,555,674) | 17,178,326 | 61,734,000 | (42,980,665) | 18,753,335 |
| 특허권 | 569,436,416 | (314,350,613) | 255,085,803 | 567,365,416 | (294,207,164) | 273,158,252 |
| 상표권 | 20,422,064 | (8,829,935) | 11,592,129 | 18,689,167 | (7,866,565) | 10,822,602 |
| 합 계 | 651,592,480 | (367,736,222) | 283,856,258 | 647,788,583 | (345,054,394) | 302,734,189 |
(*) 손상차손누계액을 합산한 금액입니다.
(2) 당분기 및 전분기의 무형자산 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 소프트웨어 | 특허권 | 상표권 |
합 계 |
| 기초 | 18,753,335 | 273,158,252 | 10,822,602 | 302,734,189 |
| 취득 | - | 1,767,000 | 820,240 | 2,587,240 |
| 대체 | - | 304,000 | 912,657 | 1,216,657 |
| 상각비 | (1,575,009) | (20,143,449) | (963,370) | (22,681,828) |
| 당기말 | 17,178,326 | 255,085,803 | 11,592,129 | 283,856,258 |
<전분기>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 소프트웨어 | 특허권 | 상표권 | 합 계 |
| 기초 | 25,053,335 | 305,716,331 | 4,555,194 | 335,324,860 |
| 취득 | - | - | - | - |
| 대체 | - | 16,350,912 | - | 16,350,912 |
| 상각비 | (1,575,009) | (18,870,794) | (466,998) | (20,912,801) |
| 당기말 | 23,478,326 | 303,196,449 | 4,088,196 | 330,762,971 |
당분기 및 전분기 중 비용으로 인식한 경상연구개발비 금액은 각각 2,451,897,232원, 2,947,790,218원이며, 자산화된 연구개발비는 없습니다.
9. 고객과의 계약에서 생기는 수익 및 관련 계약부채
(1) 당분기와 전분기 중 매출액의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 제품매출 | 37,948,219 | 54,069,884 |
| 라이선스매출 | 59,563,203 | 59,563,203 |
| 합 계 | 97,511,422 | 113,633,087 |
당사의 제품매출은 모두 한 시점에 수행의무가 이행되는 것으로 보아 수익을 인식하고 있고, 라이선스매출은 기간에 걸쳐 수행의무가 이행되는 것으로 수익을 인식하고 있습니다.
(2) 당분기 및 전분기 중 단일 외부고객으로부터의 매출액이 전체 매출액의 10%를 상회하는 고객으로부터 발생한 매출액은 59,563,203원(전분기 : 92,552,295원)입니다.
(3) 당분기말과 전기말 현재 고객과의 계약에서 생기는 수취채권과 계약부채는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 수취채권: | ||
| 매출채권 | 12,205,849 | 5,630,496 |
| 계약부채: | ||
| 계약부채 | 242,223,693 | 301,786,896 |
| 환불부채 | 13,182 | 112,042 |
| 소 계 | 242,236,875 | 301,898,938 |
10. 차입금
당분기말과 전기말 현재 당사의 차입금의 내역은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구분 | 차입처 | 내역 | 당기말 연이자율(%) | 당분기말 | 전기말 |
| 단기차입금 | 기업은행 | 중소기업자금대출 | 6.36% | 1,000,000,000 | 1,000,000,000 |
| 중소기업자금대출 | 6.60% | 1,000,000,000 | 1,000,000,000 | ||
| 장기차입금 | 기업은행 | 중소기업시설자금대출 | 5.90% | 3,630,000,000 | 3,630,000,000 |
당사는 당분기말 현재 동 차입금과 관련하여 당사의 유형자산을 담보로 제공하고 있습니다(주석 26 참조).
11. 충당부채
당분기 및 전분기 중 충당부채 변동내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||||
| 포인트충당부채 | 복구충당부채 | 합계 | 포인트충당부채 | 복구충당부채 | 합계 | |
| 기초 | - | 157,455,172 | 157,455,172 | 221,620 | 151,268,296 | 151,489,916 |
| 전입 | - | - | - | - | 1,523,548 | 1,523,548 |
| 소멸 | - | - | - | (221,620) | - | (221,620) |
| 분기말금액 | - | 157,455,172 | 157,455,172 | - | 152,791,844 | 152,791,844 |
| 유동부채 | - | 157,455,172 | 157,455,172 | - | 151,268,296 | 151,268,296 |
| 비유동부채 | - | - | - | - | 1,523,548 | 1,523,548 |
12. 자본금 및 자본잉여금
(1) 당분기말과 전기말 현재 당사의 자본금의 내역은 다음과 같습니다.
| (단위: 원,주) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 발행할 주식의 총수 | 100,000,000 | 100,000,000 |
| 1주당 액면가액 | 500 | 500 |
| 보통주 발행주식수 | 12,138,690 | 12,120,570 |
| 자본금 | 6,069,345,000 | 6,060,285,000 |
(2) 당분기와 전분기 보통주식수 및 보통주 자본금의 변동내역은 다음과 같습니다.
| (단위: 원, 주) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 보통주식수 | 보통주자본금 | 보통주식수 | 보통주자본금 | |
| 기초 | 12,120,570 | 6,060,285,000 | 12,021,854 | 6,010,927,000 |
| 주식선택권 행사 | 18,120 | 9,060,000 | - | - |
| 기말 | 12,138,690 | 6,069,345,000 | 12,021,854 | 6,010,927,000 |
(3) 당분기말과 전기말 현재 자본잉여금의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 주식발행초과금 | 159,057,576,528 | 158,846,045,576 |
| 기타자본잉여금 | 4,191,124,268 | 4,252,182,858 |
| 합 계 | 163,248,700,796 | 163,098,228,434 |
(4) 당분기 및 전분기 중 자본잉여금의 변동내역은 다음과 같습니다.
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||||||
| 주식발행초과금 | 주식선택권 | 기타자본잉여금 | 합 계 | 주식발행초과금 | 주식선택권 | 기타자본잉여금 | 합 계 | |
| 기초 | 158,846,045,576 | 4,755,748,181 | (503,565,323) | 163,098,228,434 | 158,135,246,950 | 4,152,056,748 | (503,565,323) | 161,783,738,375 |
| 주식선택권 행사 | 211,530,952 | (77,066,952) | - | 134,464,000 | - | - | - | - |
| 주식보상비용 | - | 16,008,362 | - | 16,008,362 | - | 174,128,862 | - | 174,128,862 |
| 기말 | 159,057,576,528 | 4,694,689,591 | (503,565,323) | 163,248,700,796 | 158,135,246,950 | 4,326,185,610 | (503,565,323) | 161,957,867,237 |
13. 기타포괄손익누계액
(1) 당분기말과 전기말 현재 기타포괄손익누계액의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 지분법자본변동 | 2,758,395,617 | 2,378,113,419 |
(2) 당분기 및 전분기의 기타포괄손익누계액의 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 기초 | 지분법자본변동 | 기말 |
| 기타포괄손익누계액 | 2,378,113,419 | 380,282,198 | 2,758,395,617 |
<전분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 기초 | 지분법자본변동 | 기말 |
| 기타포괄손익누계액 | 913,544,926 | 319,141,449 | 1,232,686,375 |
14. 퇴직급여
당분기 중 확정기여제도와 관련해 비용으로 인식한 퇴직급여 중 21,866,498원(전기: 45,919,308원)은 판매비와관리비에 41,385,707원(전기: 41,350,855원)은 경상연구개발비에 포함되어 있습니다.
15. 주식기준보상
(1) 당사의 주주총회 결의에 의거하여 당사의 임직원에게 부여하고 있는 주식선택권의 세부내역은 다음과 같습니다.
| 구 분 | 1 차 | 2 차 | 3차 | 4차 |
|---|---|---|---|---|
| 주식의 종류 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 |
| 부여방법 | 보통주 신주발행 | 보통주 신주발행 | 보통주 신주발행 | 보통주 신주발행 |
| 가득조건 및 행사가능시점 |
부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 40%, 4년 경과 시점에서 70%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 40%, 4년 경과 시점에서 70%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임원으로 재직한 자에 한해 행사가 가능하며 2년 경과시점에서 7년 이내 최초 부여주식의 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 40%, 4년 경과 시점에서 70%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 |
| 부여일 | 2016-02-17 | 2017-02-28 | 2018-05-15 | 2018-06-15 |
| 행사가격 | 2,750원 | 6,700원 | 7,000원 | 7,250원 |
| 최초 부여수량 | 155,700주 | 384,706주 | 250,000주 | 278,000주 |
| 구 분 | 5 차 | 6 차 | 7차 | 8차 |
|---|---|---|---|---|
| 주식의 종류 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 |
| 부여방법 | 보통주 신주발행 | 보통주 신주발행 | 보통주 신주발행 | 보통주 신주발행 |
| 가득조건 및 행사가능시점 |
부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 40%, 4년 경과 시점에서 70%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 40%, 4년 경과 시점에서 70%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임원으로 재직한 자에 한해 행사가 가능하며 2년 경과시점에서 7년 이내 최초 부여주식의 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 40%, 4년 경과 시점에서 70%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 |
| 부여일 | 2019-01-18 | 2019-03-29 | 2019-07-17 | 2019-09-20 |
| 행사가격 | 9,000원 | 10,000원 | 11,000원 | 14,000원 |
| 최초 부여수량 | 26,000주 | 160,000주 | 98,874주 | 80,000주 |
| 구 분 | 9 차 | 10 차 | 11 차 | 12 차 |
|---|---|---|---|---|
| 주식의 종류 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 |
| 부여방법 | 보통주 신주발행 또는 현금차액보상 |
보통주 신주발행 | 보통주 신주발행 | 보통주 신주발행 |
| 가득조건 및 행사가능시점 |
부여일 이후 2년 이상 회사의 임원으로 재직한 자에 한해 행사가 가능하며 2년 경과시점에서 7년이내 최초 부여주식의 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 |
| 부여일 | 2020-06-30 | 2021-03-26 | 2021-08-13 | 2021-11-12 |
| 행사가격 | 30,400원 | 36,260원 | 30,409원 | 20,566원 |
| 최초 부여수량 | 383,701주 | 66,000주 | 49,000주 | 12,000주 |
| 구 분 | 13 차 | 14 차 | 15 차 | 16 차 |
|---|---|---|---|---|
| 주식의 종류 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 | 기명식 보통주식 |
| 부여방법 | 보통주 신주발행 | 보통주 신주발행 | 보통주 신주발행 | 보통주 신주발행 |
| 가득조건 및 행사가능시점 |
부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 |
| 부여일 | 2022-02-08 | 2022-05-13 | 2022-09-30 | 2022-12-29 |
| 행사가격 | 17,705원 | 10,900원 | 7,896원 | 12,575원 |
| 최초 부여수량 | 9,000주 | 41,000주 | 30,000주 | 12,000주 |
| 구 분 | 17 차 | 18 차 |
|---|---|---|
| 주식의 종류 | 기명식 보통주식 | 기명식 보통주식 |
| 부여방법 | 보통주 신주발행 | 보통주 신주발행 |
| 가득조건 및 행사가능시점 |
부여일 이후 2년 이상 회사의 임직원으로 재직한 자에 한해 행사가능하며, 3년 경과 시점에서 최초부여주식의 50%, 4년 경과 시점에서 80%, 5년 경과 시점에서 7년 이내 100%를 행사할 수 있음 | 부여일 이후 2년 이상 회사의 임직원으로 2년 경과 시점에서 최초부여주식의 50%, 3년 경과 시점에서 80%, 4년 경과 시점에서 6년 이내 100%를 행사할 수 있음 |
| 부여일 | 2023-02-28 | 2023-03-29 |
| 행사가격 | 10,810원 | 9,883원 |
| 최초 부여수량 | 10,000주 | 55,000주 |
(2) 당사의 주식선택권의 수량의 변동은 다음과 같습니다.
| (단위:원, 주) | ||||
|---|---|---|---|---|
|
구 분 |
당분기 | 전분기 | ||
| 주식선택권 수량 | 가중평균행사가격 | 주식선택권 수량 | 가중평균행사가격 | |
| 기초 | 999,798 | 11,736 | 1,026,514 | 10,810 |
| 부여 | 65,000 | 10,026 | 50,000 | 18,220 |
| 행사 | (18,120) | 7,952 | - | - |
| 소멸 | (23,000) | 28,083 | - | - |
| 기말 | 1,023,678 | 11,327 | 1,026,514 | 14,310 |
| 행사가능 수량 | 803,678 | 9,557 | 705,994 | 7,772 |
당분기말 현재 미행사된 주식선택권의 행사가격은 6,700원부터 36,260원 사이에 있으며, 가중평균 잔여만기는 3.31년 입니다. 당분기 중 행사된 주식선택권의 행사일 현재 주식가격의 가중편균은 10,547원입니다.
(3) 당사는 주식선택권의 보상원가를 이항모형을 이용한 공정가치접근법을 적용하여 산정했으며, 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| 구 분 | 1 차 | 2 차 | 3차 | 4차 | 5차 | 6차 | 7차 | 8차 | 9차 |
|---|---|---|---|---|---|---|---|---|---|
|
주식선택권의 가중평균 공정가치 |
2,529 | 566 | 4,316 | 4,142 | 6,074 | 5,547 | 6,415 | 5,667 | 526 |
|
부여일의 가중평균 주가(*1) |
4,286 | 3,432 | 8,520 | 8,520 | 11,949 | 12,096 | 15,323 | 15,323 | 9,700 |
|
주가변동성(*2) |
42.00% | 31.00% | 38.00% | 37.00% | 37.00% | 35.00% | 23.00% | 29.00% | 37.53% |
|
배당수익률 |
- | - | - | - | - | - | - | - | - |
|
무위험수익률 |
1.70% | 1.90% | 2.60% | 2.50% | 1.90% | 1.71% | 1.45% | 1.40% | 3.10% |
| 구 분 | 10차 | 11차 | 12차 | 13차 | 14차 | 15차 | 16차 | 17차 | 18차 |
|---|---|---|---|---|---|---|---|---|---|
|
주식선택권의 가중평균 공정가치 |
16,933 | 10,815 | 7,025 | 6,946 | 4,739 | 3,276 | 9,129 | 4,029 | 3,463 |
|
부여일의 가중평균 주가(*1) |
35,900 | 29,200 | 17,700 | 15,350 | 10,900 | 6,330 | 15,150 | 9,350 | 9,610 |
|
주가변동성(*2) |
43.00% | 34.00% | 39.00% | 45.00% | 39.00% | 51.00% | 50.00% | 48.05% | 40.27% |
|
배당수익률 |
- | - | - | - | - | - | - | - | - |
|
무위험수익률 |
1.74% | 1.63% | 2.04% | 2.30% | 2.93% | 3.92% | 3.32% | 3.26% | 3.04% |
(*1) 9차 주식선택권은 차액보상형 주식선택권으로 보고기간말 현재 공정가치가액입니다.
(*2) 1~8차, 10차~18차 주가변동성은 이동평균방법을 적용한 의약품 업종변동성을 적용하였으며, 9차는 유사 동종 업종변동성을 적용하였습니다.
(4) 당사의 주식기준보상비용은 전액 주식결제형 및 차액결제형 주식기준보상과 관련된 비용이며 당분기 및 전분기 중 비용으로 인식한 주식기준보상 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 판매비와관리비 | (35,012,443) | 27,507,134 |
| 경상연구개발비 | (42,171,418) | 85,633,076 |
| 합계 | (77,183,861) | 113,140,210 |
16. 판매비와관리비
당분기 및 전분기 중 판매비와관리비의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 급여 | 309,397,985 | 322,648,805 |
| 퇴직급여 | 21,866,498 | (45,919,308) |
| 복리후생비 | 69,079,082 | 57,792,579 |
| 여비교통비 | 16,805,940 | 10,837,450 |
| 접대비 | 13,103,331 | 12,621,420 |
| 통신비 | 2,612,135 | 24,958,267 |
| 전력비 | 9,395,281 | 7,416,690 |
| 세금과공과금 | 5,041,930 | 4,479,180 |
| 감가상각비 | 182,636,717 | 100,189,838 |
| 지급임차료 | 39,763,448 | 3,272,603 |
| 수선비 | 3,169,850 | 2,100,000 |
| 보험료 | 4,131,558 | 2,526,554 |
| 차량유지비 | 3,776,628 | 3,983,958 |
| 경상연구개발비 | 2,451,897,232 | 2,947,790,218 |
| 운반비 | 778,717 | 3,312,576 |
| 교육훈련비 | 930,000 | 670,000 |
| 도서인쇄비 | 2,990,953 | 15,516,400 |
| 회의비 | - | 272,729 |
| 사무용품비 | 4,639,201 | 4,071,840 |
| 소모품비 | 9,415,913 | 5,555,272 |
| 지급수수료 | 255,807,978 | 217,967,549 |
| 광고선전비 | 49,763,876 | 40,909,089 |
| 판매촉진비 | - | 68,432,341 |
| 무형자산상각비 | 22,681,828 | 1,396,998 |
| 주식보상비용 | (35,012,443) | 27,507,134 |
| 기타 | 507,240 | 328,740 |
| 합계 | 3,445,180,878 | 3,840,638,922 |
17. 성격별비용
당분기와 전분기 중 비용의 성격별 분류의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기(*) | 전분기(*) |
| 종업원급여 | 1,035,582,539 | 1,019,559,921 |
| 감가상각비 및 무형자산상각비 | 223,921,605 | 283,249,046 |
| 지급수수료 | 1,196,682,361 | 1,615,692,370 |
| 소모품비 | 504,556,671 | 527,283,469 |
| 여비교통비 | 31,126,513 | 11,950,757 |
| 지급임차료 | 58,457,353 | 4,318,403 |
| 기타 | 420,860,628 | 409,012,365 |
| 합 계 | 3,471,187,670 | 3,871,066,331 |
(*) 포괄손익계산서상의 매출원가와 판매비와관리비를 합산한 금액입니다.
18. 금융수익과 금융비용
(1) 당분기와 전분기의 금융수익 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 이자수익 | 40,826,082 | 60,161,227 |
(2) 당분기와 전분기의 금융비용 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 이자비용 | 118,071,369 | 51,251,363 |
| 단기투자자산평가손실 | - | 8,453,924 |
| 합 계 | 118,071,369 | 59,705,287 |
19. 기타수익과 기타비용
(1) 당분기와 전분기의 기타수익 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 외환차익 | 2,548,714 | 4,499,306 |
| 잡이익 | 5,664,917 | 14,802 |
| 합 계 | 8,213,631 | 4,514,108 |
(2) 당분기와 전분기의 기타비용 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 외환차손 | 1,940,939 | 29,597 |
| 기부금 | 3,000,000 | 3,000,000 |
| 잡손실 | 58,032 | 132,313 |
| 합 계 | 4,998,971 | 3,161,910 |
20. 법인세비용
(1) 법인세비용은 전체 회계연도에 대해서 예상되는 가중평균법인세율의 추정에 기초하여 인식하였으며, 당분기 및 전분기 중 인식한 법인세비용은 없습니다.
21. 주당손익
(1) 기본주당손익
당분기과 전분기의 보통주 기본주당손익은 다음과 같습니다.
| (단위: 원, 주) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 보통주 당기순이익(손실) | (5,600,658,177) | (5,702,420,089) |
| 가중평균 유통보통주식수(*) | 12,138,287 | 12,021,854 |
| 기본주당순손실 | (461) | (474) |
(*) 당분기 및 전분기 중 가중평균유통보통주식수의 산정내역은 다음과 같습니다.
| (단위: 주) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 기초발행주식수 | 12,120,570 | 12,021,854 |
| 주식선택권 행사 | 17,717 | - |
| 가중평균 유통보통주식수 | 12,138,287 | 12,021,854 |
(2) 희석주당이익
회사는 주식선택권을 발행하고 있으나 동 희석성잠재적보통주로 인하여 희석화 효과가 발생하지 않으므로 희석주당손익은 기본주당손익과 동일합니다.
22. 현금흐름표
(1) 당분기와 전분기 중 유동성 대체를 제외한 중요한 현금의 유입ㆍ유출이 없는 거래는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 건설중인자산의 대체 | 1,216,657 | 16,350,912 |
| 주식매수선택권 행사 | 77,066,952 | - |
(2) 당분기 및 전분기 중 재무활동에서 생기는 부채의 조정내용은 다음과 같습니다.
<당분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 현금흐름 | 비현금변동 | 기말 | |
| 리스부채 증가 | 상각(이자비용) | ||||
| 리스부채 | 139,109,399 | (39,287,226) | 84,928,519 | 2,496,669 | 187,247,361 |
| 단기차입금 | 2,000,000,000 | - | - | - | 2,000,000,000 |
| 장기차입금 | 3,630,000,000 | - | - | - | 3,630,000,000 |
| 재무활동으로부터의 총부채 | 5,769,109,399 | (39,287,226) | 84,928,519 | 2,496,669 | 5,817,247,361 |
<전분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기초 | 현금흐름 | 비현금변동 | 기말 | |
| 리스부채 증가 | 상각(이자비용) | ||||
| 리스부채 | 350,805,935 | (280,650,475) | 59,084,804 | 9,869,135 | 139,109,399 |
| 단기차입금 | - | 2,000,000,000 | - | - | 2,000,000,000 |
| 유동성장기차입금 | 5,820,000,000 | (5,820,000,000) | - | - | - |
| 장기차입금 | - | 3,630,000,000 | - | - | 3,630,000,000 |
| 재무활동으로부터의 총부채 | 6,170,805,935 | (470,650,475) | 59,084,804 | 9,869,135 | 5,769,109,399 |
23. 특수관계자 거래
(1) 당분기말과 전기말 현재 당사의 특수관계자 현황은 다음과 같습니다.
| 구분 | 당분기말 | 전기말 |
|---|---|---|
| 유의적인 영향력을 행사하는 기업(*) | Duopharma Biotech Berhad | Duopharma Biotech Berhad |
| 지분법적용투자기업 | CoImmune, Inc. | CoImmune, Inc. |
(*) 별도 약정서에 의거해 당사의 이사를 선임할 수 있는 권한이 있습니다.
(2) 당분기와 전분기의 당사와 특수관계자간의 거래내역은 다음과 같습니다.
당분기와 전분기의 특수관계자와의 거래는 없습니다.
(3) 당분기와 전분기 현재 특수관계자에 대한 채무 금액은 없습니다.
당분기와 전분기의 특수관계자와의 채무는 없습니다.
(4) 당사는 등기이사 및 기업활동의 계획, 운영 및 통제에 대한 중요한 권한과 책임을가진 등기 임원을 주요 경영진으로 판단하고 있으며, 당분기 및 전분기의 주요 경영진에 대한 보상금액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 급여 | 192,000,000 | 38,709,678 |
| 퇴직급여 | 6,250,000 | 9,677,421 |
| 주식보상비용 | 49,493,959 | - |
| 합 계 | 247,743,959 | 48,387,099 |
24. 범주별 금융상품
당분기말과 전기말 현재 당사의 범주별 금융상품 내역은 다음과 같습니다.
(1) 금융자산
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
|
구 분 |
당분기말 |
전기말 |
||||
| 상각후원가 | 당기손익- 공정가치 |
합 계 | 상각후원가 | 당기손익- 공정가치 |
합 계 | |
| 현금 및 현금성자산 | 4,169,287,283 | - | 4,169,287,283 | 6,916,335,193 | - | 6,916,335,193 |
| 매출채권 | 12,205,849 | - | 12,205,849 | 5,630,496 | - | 5,630,496 |
| 기타채권 | 1,161,553,334 | - | 1,161,553,334 | 1,175,657,943 | - | 1,175,657,943 |
| 단기금융상품 | - | - | - | - | 2,053,463,850 | 2,053,463,850 |
| 장기금융상품 | - | 1,147,100,000 | 1,147,100,000 | - | 1,147,100,000 | 1,147,100,000 |
| 합 계 | 5,343,046,466 | 1,147,100,000 | 6,490,146,466 | 8,097,623,632 | 3,200,563,850 | 11,298,187,482 |
(2) 금융부채
| (단위: 원) | ||
|---|---|---|
|
구 분 |
당분기말 |
전기말 |
| 상각후원가 | 상각후원가 | |
| 차입금 | 5,630,000,000 | 5,630,000,000 |
| 기타금융부채 | 729,505,990 | 634,077,775 |
|
합 계 |
6,359,505,990 | 6,264,077,775 |
(3) 금융상품의 범주별 순손익
| (단위: 원) | ||
|---|---|---|
|
구 분 |
당분기 |
전분기 |
| 당기손익-공정가치 금융자산 | ||
| 이자수익 | 14,170,974 | 10,612,385 |
| 평가손익 | - | (8,453,924) |
| 상각후원가 금융자산 | ||
| 이자수익 | 26,655,108 | 49,548,842 |
| 상각후원가 금융부채 | ||
| 이자비용 | 118,071,369 | 51,251,363 |
25. 재무위험관리
(1) 재무위험관리요소
당사는 여러 활동으로 인하여 시장위험(환위험, 공정가치 이자율 위험, 현금흐름 이자율 위험 및 가격위험), 신용위험 및 유동성위험과 같은 다양한 금융위험에 노출되어 있습니다. 회사의 전반적인 위험관리정책은 금융시장의 예측불가능성에 초점을 맞추고 있으며 재무성과에 잠재적으로 불리할 수 있는 효과를 최소화하는데 중점을 두고 있습니다.
위험관리는 이사회에서 승인한 정책에 따라 당사 재무팀에 의해 이루어지고 있습니다. 당사 재무팀은 당사의 현업 부서들과 긴밀히 협력하여 재무위험을 식별, 평가 및 회피하고 있습니다. 이사회는 외환위험, 이자율위험, 신용위험 및 유동성을 초과하는투자와 같은 특정 분야에 관한 문서화된 정책 뿐 아니라, 전반적인 위험관리에 대한 문서화된 정책을 제공합니다.
가. 시장위험
(1) 외환위험
당사는 외화로 표시된 거래를 수행하고 있지 않으므로 외화와 관련된 환율변동위험에 노출되어 있지 않습니다.
(2) 이자율위험
이자율 위험은 시장이자율의 변동으로 인하여 금융상품에서 발생하는 이자수익 및 이자비용이 변동할 위험을 의미합니다. 당분기말 및 전기말 현재 변동이자율로 발행된 차입금은 없습니다.
(3) 가격위험
가격위험은 이자율위험이나 환위험 이외의 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험을 의미합니다. 한편, 당분기 및 전기 각각 당기손익-공정가치금융자산 및 당기손익인식금융자산 범주로 분류된 집합투자증권 및 주가연계상품 등은 보유하고 있지 않습니다.
나. 신용위험
신용위험은 보유하고 있는 수취채권 및 확정계약을 포함한 도소매 거래처에 대한 신용위험뿐 아니라 현금및현금성자산, 은행 등의 금융기관 예치금으로부터 발생하고 있습니다. 은행 및 금융기관의 경우, 독립적인 신용평가기관으로부터의 신용등급이 최소 A이상인 경우에 한하여 거래를 하고 있습니다. 당분기 중 신용위험에 중요한 영향을 미치는 사항은 발견되지 않았으며, 경영진은 거래상대방의 의무불이행으로 인한 손실을 예상하고 있지 아니합니다.
다. 유동성위험
회사는 차입금한도를 적정수준으로 유지하고 영업 자금 수요를 충족시킬 수 있도록 유동성에 대한 예측을 항시 모니터링하여 차입금 한도나 약정을 위반하는 일이 없도록 하고 있습니다. 유동성에 대한 예측 시에는 회사의 자금조달 계획, 약정 준수, 회사 내부의 목표재무비율 및 통화에 대한 제한과 같은 외부 법규나 법률 요구사항이 있는 경우 그러한 요구사항을 고려하고 있습니다.
회사는 상기에서 언급한 예측을 통해 결정된 대로 유동성이 확보될 수 있도록 적절한만기나 충분한 유동성을 제공해주는 정기예금, 수시입출금식 예금 등의 금융상품을 선택하여 잉여자금을 투자하고 있습니다.
당분기말과 전기말 현재 당사의 유동성 위험 분석내역은 다음과 같습니다.
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 3개월 미만 | 3개월~1년 이하 | 1년~ 2년 이하 | 2년~ 5년 이하 | 합 계 |
| 기타금융부채 | 529,699,627 | - | - | 70,000,000 | 599,699,627 |
| 차입금 | 86,700,356 | 2,214,655,801 | 214,344,240 | 3,773,874,901 | 6,289,575,299 |
| 리스부채 | 39,287,226 | 91,944,897 | 33,433,596 | 33,533,165 | 198,198,884 |
| 합 계 | 655,687,209 | 2,306,600,698 | 247,777,836 | 3,877,408,066 | 7,087,473,810 |
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 3개월 미만 | 3개월~1년 이하 | 1년~ 2년 이하 | 2년~ 5년 이하 | 합 계 |
| 기타금융부채 | 456,776,650 | - | - | 70,000,000 | 526,776,650 |
| 차입금 | 85,624,333 | 2,250,341,660 | 214,344,240 | 3,816,743,749 | 6,367,053,982 |
| 리스부채 | 17,608,626 | 50,000,424 | 41,983,596 | 41,179,064 | 150,771,710 |
| 합 계 | 560,009,609 | 2,300,342,084 | 256,327,836 | 3,927,922,813 | 7,044,602,342 |
당사는 상기에서 언급한 예측을 통해 결정된 대로 유동성이 확보될 수 있도록 적절한만기나 충분한 유동성을 제공해주는 정기예금, 수시입출금식 예금 등의 금융상품을 선택하여 잉여자금을 투자하고 있습니다.
라. 자본위험관리
당사의 자본관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본비용을 절감하기 위해 최적 자본구조를 유지하는 것입니다.
당분기말과 전기말 현재의 자본조달비율은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
|
구 분 |
당분기말 | 전기말 |
|
총차입금(*) |
5,817,247,361 | 5,769,109,399 |
|
차감: 현금및현금성자산 |
4,169,287,283 | 6,916,335,193 |
|
순부채 |
1,647,960,078 | (1,147,225,794) |
|
자본총계 |
19,450,117,895 | 24,510,961,512 |
| 총자본 | 21,098,077,973 | 23,363,735,718 |
|
자본조달비율 |
7.81% | -4.91% |
(*) 당분기말 및 전기말 총차입금에는 리스부채가 포함되어 있습니다.
마. 금융상품 공정가치
(1) 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산 | ||||
| 현금및현금성자산 | 4,169,287,283 | 4,169,287,283 | 6,916,335,193 | 6,916,335,193 |
| 단기금융상품 | - | - | 2,053,463,850 | 2,053,463,850 |
| 매출채권 | 12,205,849 | 12,205,849 | 5,630,496 | 5,630,496 |
| 기타채권 | 1,161,553,334 | 1,161,553,334 | 1,175,657,943 | 1,175,657,943 |
| 장기금융상품 | 1,147,100,000 | 1,147,100,000 | 1,147,100,000 | 1,147,100,000 |
| 합 계 | 6,490,146,466 | 6,490,146,466 | 11,298,187,482 | 11,298,187,482 |
| 금융부채 | ||||
| 차입금 | 5,630,000,000 | 5,630,000,000 | 5,630,000,000 | 5,630,000,000 |
| 기타금융부채 | 729,505,990 | 729,505,990 | 634,077,775 | 634,077,775 |
| 합 계 | 6,359,505,990 | 6,359,505,990 | 6,264,077,775 | 6,264,077,775 |
(2) 공정가치 서열체계
공정가치로 측정되는 금융상품은 공정가치 서열체계에 따라 구분되며 정의된 수준들은 다음과 같습니다.
| - 측정일에 동일한 자산이나 부채에 대해 접근할 수 있는 활성시장의(조정하지 않은) 공시가격 (수준 1) |
| - 수준 1의 공시가격 외에 자산이나 부채에 대해 직접적으로나 간접적으로 관측할 수 있는 투입변수 (수준 2) |
| - 자산이나 부채에 대한 관측할 수 없는 투입변수 (수준 3) |
공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
<당분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 |
수준 1 |
수준 2 |
수준 3 |
합 계 |
|
반복적인 공정가치 측정치 |
||||
| 당기손익-공정가치 금융자산 | ||||
| 장기금융상품 | - | - | 1,147,100,000 | 1,147,100,000 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 |
수준 1 |
수준 2 |
수준 3 |
합 계 |
|
반복적인 공정가치 측정치 |
||||
| 당기손익-공정가치 금융자산 | ||||
| 단기금융상품 | - | - | 2,053,463,850 | 2,053,463,850 |
| 장기금융상품 | - | - | 1,147,100,000 | 1,147,100,000 |
| 합계 | - | - | 3,200,563,850 | 3,200,563,850 |
(3) 반복적인 공정가치 측정치의 서열체계 수준 간 이동
당기와 전기 중 수준 1과 수준 2간의 유의적인 이동은 없습니다.
(4) 가치평가기법 및 투입변수
당사는 공정가치 서열체계에서 수준3으로 분류되는 공정가치에 대하여 다음의 가치평가기법과 투입변수를 사용하고 있습니다.
| (단위 : 원) | ||||
|---|---|---|---|---|
| 구분 | 공정가치 | 평가기법 | 관측가능하지 않은 투입변수 |
|
| 당분기말 | 전기말 | |||
| 단기금융상품 | - | 2,053,463,850 | 회계법인실사금액 | ㆍ- |
| 장기금융상품 | 1,147,100,000 | 1,147,100,000 | 원가법 | ㆍ기초자산가격 |
26. 우발부채 및 약정사항
(1) 당사는 당분기말 현재 신용카드 등 전자결제 대행계약에 따른 손해배상 및 지원사업 협약에 따른 의무상환금과 관련하여 서울보증보험의 이행지급보증보험(부보금액:10,000,000원)에 가입하고 있습니다.
(2) 당분기말 현재 담보제공자산 등의 현황은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 장부금액 | 담보설정액 | 비 고 |
| 토지 | 6,967,498,403 | 6,756,000,000 | 기업은행 차입금 관련 |
| 건물 | 1,854,219,843 | ||
(3) 당사는 Allele Biotechnology and Pharmaceuticals, Inc.와의 라이센스계약에 따라 US$500,000은 주요단계인 IND(임상시험용신약) 승인 시, US$1,000,000은 MAA(시판허가신청) 승인 시 지급할 예정입니다.
6. 배당에 관한 사항
가. 배당에 대한 전반적인 사항
당사의 정관에 기재된 배당에 관한 사항은 아래와 같습니다.
[배당에 관한 사항]
| 제13조(신주의 동등배당) ① 회사가 정한 배당기준일 전에 유상증자, 무상증자 및 주식배당에 의하여 발행한 주식에 대하여는 동등배당한다. |
|
제53조(이익금의 처분) 1. 이익준비금 2. 기타의 법정준비금 3. 배당금 4. 임의적립금 5. 기타의 이익잉여금처분액 |
|
제54조(이익배당) ① 이익의 배당은 금전 또는 금전 외의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다. ③ 회사는 제1항의 배당을 위하여 이사회결의로 배당을 받을 주주를 확정하기 위한 기준일을 정하여야 하며, 그 경우 기준일의 2주 전에 이를 공고하여야 한다. ④ 이익배당은 주주총회의 결의로 정한다. |
나. 주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제10기(1분기) | 제9기 | 제8기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | - | - | - | |
| (별도)당기순이익(백만원) | -5,600 | -22,930 | -22,519 | |
| (연결)주당순이익(원) | -461 | -1,897 | -1,873 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
| 주1) | 당사는 보고서 작성기준일 현재 연결대상 회사가 없으며 상기 (연결)당기순이익 및 (연결)주당순이익은 별도기준으로 작성하였습니다. |
다. 과거 배당이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
| 주1) | 당사는 최근 5년간 배당금을 지급한 사실이 없습니다. |
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 증자(감자)현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2019년 06월 04일 | 주식매수선택권행사 | 보통주 | 16,450 | 500 | 5,500 | - |
| 2019년 06월 05일 | 유상증자(제3자배정) | 보통주 | 65,261 | 500 | 30,646 | - |
| 2019년 06월 05일 | 유상증자(제3자배정) | 우선주 | 130,524 | 500 | 30,646 | - |
| 2019년 09월 18일 | 전환권행사 | 보통주 | 2,656,314 | 500 | - | - |
| 2019년 09월 18일 | 전환권행사 | 우선주 | 2,656,314 | 500 | - | - |
| 2019년 09월 19일 | 전환권행사 | 보통주 | 38,089 | 500 | - | - |
| 2019년 09월 19일 | 전환권행사 | 우선주 | 38,089 | 500 | - | - |
| 2019년 10월 07일 | 무상증자 | 보통주 | 4,586,323 | 500 | 500 | 주1) |
| 2019년 10월 07일 | 무상증자 | 우선주 | 357,414 | 500 | 500 | 주1) |
| 2020년 06월 12일 | 유상증자(일반공모) | 보통주 | 1,854,000 | 500 | 17,000 | 주2) |
| 2020년 06월 17일 | 전환권행사 | 보통주 | 649,566 | 500 | 2,750 | - |
| 2020년 06월 17일 | 전환권행사 | 우선주 | 649,566 | 500 | 6,700 | - |
| 2020년 06월 23일 | 주식매수선택권행사 | 보통주 | 11,676 | 500 | 2,750 | - |
| 2020년 06월 23일 | 주식매수선택권행사 | 보통주 | 36,886 | 500 | 6,700 | - |
| 2020년 07월 09일 | 주식매수선택권행사 | 보통주 | 10,035 | 500 | 2,750 | - |
| 2020년 07월 09일 | 주식매수선택권행사 | 보통주 | 16,542 | 500 | 6,700 | - |
| 2020년 07월 23일 | 주식매수선택권행사 | 보통주 | 6,690 | 500 | 2,750 | - |
| 2020년 07월 23일 | 주식매수선택권행사 | 보통주 | 16,272 | 500 | 6,700 | - |
| 2020년 08월 06일 | 주식매수선택권행사 | 보통주 | 3,345 | 500 | 2,750 | - |
| 2020년 08월 06일 | 주식매수선택권행사 | 보통주 | 2,240 | 500 | 6,700 | - |
| 2020년 08월 20일 | 주식매수선택권행사 | 보통주 | 3,845 | 500 | 2,750 | - |
| 2020년 08월 20일 | 주식매수선택권행사 | 보통주 | 9,111 | 500 | 6,700 | - |
| 2020년 09월 09일 | 전환권행사 | 우선주 | 65,262 | 500 | - | - |
| 2020년 09월 09일 | 전환권행사 | 보통주 | 65,262 | 500 | - | - |
| 2020년 09월 24일 | 주식매수선택권행사 | 보통주 | 1,572 | 500 | 2,750 | - |
| 2020년 09월 24일 | 주식매수선택권행사 | 보통주 | 6,920 | 500 | 6,700 | - |
| 2020년 10월 15일 | 주식매수선택권행사 | 보통주 | 1,500 | 500 | 6,700 | - |
| 2020년 11월 12일 | 주식매수선택권행사 | 보통주 | 51 | 500 | 6,700 | - |
| 2020년 11월 25일 | 주식매수선택권행사 | 보통주 | 5,260 | 500 | 6,700 | - |
| 2020년 12월 09일 | 주식매수선택권행사 | 보통주 | 1,196 | 500 | 6,700 | - |
| 2021년 01월 08일 | 주식매수선택권행사 | 보통주 | 1,000 | 500 | 6,700 | - |
| 2021년 01월 22일 | 주식매수선택권행사 | 보통주 | 240 | 500 | 6,700 | - |
| 2021년 02월 05일 | 주식매수선택권행사 | 보통주 | 2,500 | 500 | 6,700 | - |
| 2021년 02월 19일 | 주식매수선택권행사 | 보통주 | 3,337 | 500 | 2,750 | - |
| 2021년 03월 05일 | 주식매수선택권행사 | 보통주 | 9,842 | 500 | 2,750 | - |
| 2021년 03월 05일 | 주식매수선택권행사 | 보통주 | 18,952 | 500 | 6,700 | - |
| 2021년 04월 09일 | 주식매수선택권행사 | 보통주 | 5,004 | 500 | 2,750 | - |
| 2021년 04월 09일 | 주식매수선택권행사 | 보통주 | 552 | 500 | 6,700 | - |
| 2021년 04월 23일 | 주식매수선택권행사 | 보통주 | 8,511 | 500 | 2,750 | - |
| 2021년 04월 23일 | 주식매수선택권행사 | 보통주 | 17,564 | 500 | 6,700 | - |
| 2021년 07월 01일 | 주식매수선택권행사 | 보통주 | 3,337 | 500 | 2,750 | - |
| 2021년 07월 01일 | 주식매수선택권행사 | 보통주 | 4,000 | 500 | 6,700 | - |
| 2021년 07월 01일 | 주식매수선택권행사 | 보통주 | 72,400 | 500 | 7,250 | - |
| 2022년 04월 29일 | 주식매수선택권행사 | 보통주 | 91,116 | 500 | 6,700 | - |
| 2022년 04월 29일 | 주식매수선택권행사 | 보통주 | 4,400 | 500 | 7,250 | - |
| 2022년 04월 29일 | 주식매수선택권행사 | 보통주 | 3,200 | 500 | 10,000 | - |
| 2022년 12월 30일 | 주식매수선택권행사 | 보통주 | 1,360 | 500 | 6,700 | - |
| 2022년 12월 30일 | 주식매수선택권행사 | 보통주 | 11,860 | 500 | 7,250 | - |
| 2022년 12월 30일 | 주식매수선택권행사 | 보통주 | 4,900 | 500 | 10,000 | - |
| 주1) | 100% 무상증자 (1주당 1주, 재원: 주식발행초과금) |
| 주2) | 코스닥시장 상장 공모(주관사 의무인수분 포함) |
나. 미상환 전환사채
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
다. 미상환 신주인수권부사채
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
라. 미상환 전환형 조건부자본증권 발행현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
| [채무증권의 발행 등과 관련된 사항] |
마. 채무증권 발행현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - |
| 주1) | 당사는 보고서 작성기준일 현재 해당사항이 없습니다. |
바. 기업어음증권 미상환 잔액
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
| 주1) | 당사는 보고서 작성기준일 현재 해당사항이 없습니다. |
사. 단기사채 미상환 잔액
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
| 주1) | 당사는 보고서 작성기준일 현재 해당사항이 없습니다. |
아. 회사채 미상환 잔액
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
| 주1) | 당사는 보고서 작성기준일 현재 해당사항이 없습니다. |
자. 신종자본증권 미상환 잔액
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
| 주1) | 당사는 보고서 작성기준일 현재 해당사항이 없습니다. |
카. 조건부자본증권 미상환 잔액
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
| 주1) | 당사는 보고서 작성기준일 현재 해당사항이 없습니다. |
타. 사채관리계약 주요내용 및 충족여부 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 코스닥시장 상장공모 |
1 | 2020.06.11 | 운영자금 (연구개발비) |
18,959 | 운영자금 (연구개발비) |
18,285 | 23년까지 집행 예정 |
| 코스닥시장 상장공모 |
1 | 2020.06.11 | 운영자금 (일반) |
7,256 | 운영자금 (일반) |
6,824 | 23년까지 집행 예정 |
| 코스닥시장 상장공모 |
1 | 2020.06.11 | 타법인증권 취득자금 |
2,555 | 타법인증권 취득자금 |
- | 추가집행 시기 미정 |
| 코스닥시장 상장공모 |
1 | 2020.06.11 | 시설자금 (공장건설) |
1,118 | 시설자금 (공장건설) |
610 | 추가집행 시기 미정 |
| 주1) | 당사는 2020년 06월 17 일 코스닥시장에 상장하였으며, 31,518백만원(주관사 의무인수분 포함)에서 발행제비용1,630백만원을 제외한 29,888백만원이 조달되었습니다. |
나. 사모자금의 사용내역
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| - | - | - | - | - | - | - | - |
| 주1) | 당사는 보고서 작성기준일 현재 해당사항이 없습니다. |
다. 미사용자금의 운용내역
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 백만원) |
| 종류 | 금융상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 수시RP | 1,622 | - | 주1) |
| 예ㆍ적금 | 보통예금 | 2,547 | - | - |
| 계 | 4,169 | - | ||
| 주1) | 해당 상품은 수시입출금이 가능함에 따라 계약기간 및 실투자기간은 존재하지 않으며, 당사 자금 운용 사정에 따라 안정적인 금융상품에 예치할 예정입니다. |
8. 기타 재무에 관한 사항
가. 재무제표 재작성 등 유의사항
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 대손충당금 설정현황
(1) 계정과목별 대손충당금 설정내용
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
(2) 대손충당금 변동현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
(3) 매출채권관련 대손충당금 설정방침
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
(4) 당해 사업연도말 현재 경과기간별 매출채권 잔액 현황
|
(단위: 천원) |
| 구분 | 경과기간 | 6월이하 | 6월초과~1년이하 | 1년초과~3년이하 | 3년초과 | 계 |
|---|---|---|---|---|---|---|
| 금액 | 일반 | 12,206 | - | - | - | 12,206 |
| 특수관계자 | - | - | - | - | - | |
| 계 | 12,206 | - | - | - | 12,206 | |
| 구성비율 | 100.0% | - | - | - | 100.0% | |
다. 재고자산 현황 등
(1) 재고자산의 사업부문별 보유현황
|
(단위: 천원) |
|
계정과목 |
2023년 (제10기 1분기) |
2022년도 (제9기) |
2021년도 (제8기) |
|---|---|---|---|
| 제품 | 35,599 | 51,862 | 82,197 |
| 원재료 | 93,800 | 50,800 | 55,960 |
| 재공품 | 22,500 | - | 138,067 |
| 반환제품회수권 | 10 | 50 | 3,458 |
| 합계 | 151,909 | 102,712 | 279,682 |
| 총자산 대비 재고자산 구성비율(%) [재고자산합계÷기말자산총계×100] |
0.57% | 0.31% | 0.52% |
| 재고자산 회전율(회수) [연환산 매출원가÷{(기초재고+기말재고)÷2}] |
0.8회 | 0.3회 | 0.6회 |
(2) 재고자산의 실사내용
2021년 기말 재고자산의 경우 지정감사인 삼일회계법인의 입회 하에 재고조사를 실시하였습니다. 2022년 기말 재고자산의 경우 자체조사를 실시하였습니다.
| 2022년 기말 재고자산실사 (자체실사) |
실사(입회)시기 |
2022.12.09 |
1일 |
| 실사(입회)장소 | 인천 본사/위킵 물류창고 | ||
| 실사(입회)대상 | 제품 | ||
| 2021년 재고자산실사 (자체실사) |
실사(입회)시기 |
2021.12.29 |
1일 |
| 실사(입회)장소 | 인천 본사/위킵 물류창고 | ||
| 실사(입회)대상 | 제품 | ||
라. 수주계약 현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
마. 공정가치평가 내역
관련내용은 III. 재무에 관한 사항 → 5.재무제표 주석→ 주석25 마.금융상품 공정가치를 참조해주십시오.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
- 당 분기에 변동사항 없으며 관련 내용은 2023. 3. 21.에 제출된 2022년도 사업보고
서를 참고하시기 바랍니다.
2. 내부통제에 관한 사항
- 당 분기에 변동사항 없으며 관련 내용은 2023. 3. 21.에 제출된 2022년도 사업보고
서를 참고하시기 바랍니다.
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사회 구성 개요
보고서 작성기준일 현재(2023년 3월 31일) 당사의 이사회는 사내이사 3명(손병관,오형남, 이종철), 사외이사 2명(이희성, 문종호), 기타비상무이사 2명(레오나드아리프압둘샤타르, 송기령) 총 7명으로 구성되어 있습니다.
이사회 의장은 손병관 대표이사로, 제약 바이오 산업 패러다임의 급격한 변화 등 악화된 경영환경에 효율적이고 신속하게 대응하고, 책임경영을 실천하기 위하여 이사회 의장으로 선임되었습니다.
이사회는 회사의 최고 의사결정기구로서 주주와 이해관계자들의 이익을 대변하는 동시에 회사의 지속적인 성장을 목표로 법령과 정관에서 정한 사항, 회사 운영의 기본방침 및 업무진행에 관한 중요한 사항을 결의하고, 이사 및 경영진의 직무집행을 감독하고 있습니다.
이사회는 매 분기 개최되는 정기이사회 뿐만 아니라 이사회의 의결이 필요한 사항 발생 시 수시로 개최되며, 이사회 의장 또는 이사회에서 달리 정한 이사가 소집합니다. 이사회 소집 시에는 이사회 규정에 따라 회의일 1일 전까지 각 이사에게 개최시기, 장소 및 안건을 통지하고 있으며, 결의는 관계 법령에서 달리 정하는 경우를 제외하고 이사 과반수의 출석과 출석이사 과반수의 찬성으로 하고 있습니다.
(1)사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 7 | 2 | 1 | - | - |
| 주1) | 2023년 03월 29일 개최된 정기주주총회에서 이희성 사외이사가 재선임되었습니다. |
(2) 사외이사 현황
| 성 명 | 주 요 경 력 | 최대주주 등과의 이해관계 |
결격 요건 | |
|---|---|---|---|---|
| 이희성 | 1980~1991 1991~1996 1996~1999 1999~2004 2004~2009 2009~2010 2010~2011 2011~2013 2013~2015 2015~현재 |
- 보건복지부 약정국, 감사관실 (주무관) - 보건복지부 약정국, 마약관리과 (사무관) - 보건복지부 약정국 약무진흥과(서기관) - 식품의약품안전청 의약품 안정국 (서기관) - 식품의약품안전청 (부이사관, 이사관) - 서울지방식품안전청 청장 - 식품의약품안전청 차장 - 제11대 식품의약품안전청 청장 - 성균관대학교 약학대학원 교수 - 성균관대학교 약학대학 겸임교수 - 법무법인(유) 화우 고문 |
해당사항 없음 | 부 |
| 문종호 |
85.03~89.02 |
- 순천향대학교의과대학 의학과 의학사 - 순천향대학교부속병원 수련의 - 순천향대학교부속병원 내과 전공의 - 순천향대학교대학원 의학과 의학석사 - 순천향대학교대학원 의학과 의학박사 - 대한민국공군 비행군의관, 내과군의관 - 순천향대학교부속병원 소화기내과 전임의 - 순천향대학교부속병원 소화기내과 전임강사 - 순천향대학교부속병원 소화기내과 조교수 - Visiting assistant professor, Division of Gastroenterology, Department of Medicine, University of Washington School of Medicine, Seattle, USA - 순천향대학교의과대학 소화기내과 부교수 - 순천향대학교부천병원 내과계진료부장,종합검진센터소장 - 순천향대학교부천병원 내과과장 - 순천향대학교부천병원 소화기내과과장 - 순천향대학교부천병원 소화기병센터소장 - 순천향대학교의과대학 소화기내과교수 |
해당사항 없음 | 부 |
나. 중요의결사항 등
보고서 작성 대상 기간 중 개최된 이사회의 중요 의결사항 및 보고사항은 다음과 같습니다.
| 구분 | 일 시 | 의 안 내 용 | 가결 여부 |
사내이사 | 사외이사 | 기타비상무이사 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 손병관 (출석률: 100%) |
오형남 (출석률: 100%) |
이종철 (출석률: 100%) |
이희성 (출석률: 0%) (주1) |
문종호 (출석률 : 0%) |
레오나드 아리프 압둘샤타르 (출석률: 50%) |
송기령 (출석률 : 100%) |
||||
| 임시 | 2023.02.03 | 제 1호 의안 : 외부감사 전 2022 결산 재무제표에 대한 승인 의 건 |
가결 | 찬성 | 찬성 | 찬성 | - | 불참 | 불참 | 찬성 |
| 정기 | 2023.02.28 | 제 1호 의안 : 제9기 결산 재무제표 및 영업보고서 승인의 건 제 2호 의안 : 주식매수선택권 부여의 건 제 3호 의안 : 주주총회 안건 상정의 건 제 4호 의안 : 정기주주총회 소집의 건 |
가결 | 찬성 | 찬성 | 찬성 | - | 불참 | 참석 | 찬성 |
| 주1) | 이희성 사외이사는 2022년 10월 22일 임기가 만료 되었으며, 2023년 3월 29일 제9기 정기주주총회에 사외이사 재선임되었습니다. |
다. 이사회내 위원회
당사는 보고서 작성 기준일 현재 이사회 내 위원회를 구성하고 있지 않습니다.
라. 이사의 독립성
보고서 작성기준일 현재, 이사회 구성원은 주주총회에서 선임하며, 주주총회에서 선임할 이사 후보자는 이사회에서 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다. 이사의 선임과 관련하여 관련 법규에 의거한 주주제안이 있는 경우, 이사회는 적법한 범위 내에서 이를 주주총회에 의안으로 제출하고 있습니다. 상기와 같은 절차에 따라 선임된 당사의 이사는 최대주주 또는 주요주주와의 관계에 있어서 독립적입니다.
| 구분 | 임기 | 연임 여부 |
연임 횟수 |
선임배경 | 추천인 | 이사로서의 활동분야 |
회사와의 거래 |
최대주주 또는 관계 등 |
|---|---|---|---|---|---|---|---|---|
| 손병관 | 2025.07.22 | - | - | 인하대병원 소아과 교수(과장) 인하대병원 임상의학연구소장 인하중앙의료원 기획조정실장 인하대병원 진료부원장 환경부지정 환경보건센터장(인하대병원) 및 연합회 회장 인하대학교 의과대학장, 의학전문대학원 원장 대한소아과학회 이사 대한 소아알레르기 호흡기학회 회장 및 이사장 청주의료원 원장 |
이사회 | 대표이사 | - | 등기임원 |
| 레오나드 아리프 압둘샤타르 |
2025.03.28 | 해당 | 1회 |
Usaha Pharma Sdn. Bhd., Managing ICI Paints Malaysia Sdn. Bhd., Managing Director CCM Duopharma Biotech Berhad, CEO CCM Chemicals Sdn. Bhd. Director Chemical Company of Malaysia Berhad Duopharma Biotech Berhad. Group |
이사회 | - | - | 등기임원 |
| 오형남 | 2025.03.28 | 미해당 | - |
인하대학교 경영학 석사 에스씨엠생명과학㈜ 사내이사 인하대병원 미래전략팀 부장 현, 에스씨엠생명과학㈜ 전무이사 |
이사회 | - | - | 등기임원 |
| 이종철 | 2025.03.28 | 미해당 | - | 연세대 경제학 학사 성균관대학교 기술경영학 석사 공인회계사 삼일회계법인 |
이사회 | - | - | 등기임원 |
| 송기령 | 2025.03.28 | 미해당 | - | 서울대학교 음악대학 작곡과 학사 | 이사회 | - | - | 최대주주 본인 |
| 이희성 주1) |
2026.03.29 | 해당 | 1회 | 서울지방식품안전청 청장 식품의약품안전청 차장 제11대 식품의약품안전청 청장 성균관대학교 약학대학원 교수 성균관대학교 약학대학 겸임교수 법무법인(유) 화우 고문 |
이사회 | - | - | 등기임원 |
| 문종호 | 2025.03.28 | 미해당 | - |
순천향대학교 의과대학 의학석사 순천향대학교 의과대학 의학박사 순천향대학교 의과대학 소화기내과 교수 순천향대학교부천병원 소화기병센터소장 순천향대학교부천병원 소화기내과과장 |
이사회 | - | - | 등기임원 |
| 주1) | 이희성 사외이사는 2022년 10월 22일 임기가 만료 되었으며, 2023년 3월 29일 제9기 정기주주총회에 사외이사 재선임되었습니다. |
마. 사외이사의 전문성
(1) 사외이사의 직무수행을 보조
당사의 ESG경영본부는 사외이사가 이사회에서 전문적인 직무수행이 가능하도록 보조하고 있습니다. 또한 이사회 전에 해당 안건 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고, 기타 사내 주요 현안에 대해서도 수시로 정보를 제공하고 있습니다.
(2) 사외이사 교육실시 현황
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | 하반기 교육 예정 |
2. 감사제도에 관한 사항
가. 감사위원회 설치 여부
당사는 보고서 작성기준일 현재 감사위원회를 별도로 설치하고 있지 않으며, 주주총회 결의에 의하여 선임된 비상근 감사 1명이 감사업무를 수행하고 있습니다.
나. 감사의 인적사항
| 성명 | 사외이사 여부 |
경력 | 회계ㆍ재무전문가 관련 | ||
|---|---|---|---|---|---|
| 해당 여부 | 전문가 유형 | 관련 경력 | |||
| 정선영 | - | 85.02 중앙대 경영학 학사 06.07 Univ. of Denver, MBA 87.08 ~ 19.03 한국거래소 19.03 ~ 현재 ㈜위니아딤채 사외이사 19.03 ~ 현재 법무법인 신원 고문 |
예 | 금융기관· 정부· 증권유관기관 등 경력자 (4호 유형) |
87.08 ~ 19.03 한국거래소 |
다. 감사의 독립성
당사의 감사는 상법 상 감사로서의 자격요견을 충족하며, 이사회 및 타 부서와 독립적인 위치에서 업무를 수행하고 있습니다. 또한 당사는 감사의 감사업무에 필요한 경영정보 접근을 위하여 정관에 아래와 같은 조항을 두고 있습니다.
|
제48조(감사의 직무와 의무) ② 감사는 회의의 목적사항과 소집의 이유를 기재한 서면을 이사회에 제출하여 임시주주총회의 소집을 청구할 수 있다. ③ 감사는 그 직무를 수행하기 위하여 필요한 때에는 자회사에 대하여 영업의 보고를 요구할 수 있다. 이 경우 자회사가 지체없이 보고를 하지 아니할 때 또는 그 보고의 내용을 확인할 필요가 있는 때에는 자회사의 업무와 재산상태를 조사할 수 있다. ④ 감사에 대해서는 제37조 제3항의 규정을 준용한다. ⑤ 감사는 회사의 비용으로 전문가의 도움을 구할 수 있다. ⑥ 감사는 필요하면 회의의 목적사항과 소집이유를 적은 서면을 이사(소집권자가 있는 경우에는 소집권자)에게 제출하여 이사회 소집을 청구할 수 있다. ⑦ 제6항의 청구를 하였는데도 이사가 지체 없이 이사회를 소집하지 아니하면 그 청구한 감사가 이사회를 소집할 수 있다. |
라. 감사의 주요 활동내용
당분기까지 총 2회의 이사회가 소집되었고 정선영 감사는 총 2회 참석(출석률 50%)하였습니다.
| 구 분 | 일 시 | 의 안 내 용 | 가결 여부 |
참석여부 |
|---|---|---|---|---|
| 임시 | 2023.02.03 | 제 1호 의안 : 외부감사 전 2022 결산 재무제표에 대한 승인 의 건 |
가결 | O |
| 정기 | 2023.02.28 | 제 1호 의안 : 제9기 결산 재무제표 및 영업보고서 승인의 건 제 2호 의안 : 주식매수선택권 부여의 건 제 3호 의안 : 주주총회 안건 상정의 건 제 4호 의안 : 정기주주총회 소집의 건 |
가결 | x |
마. 교육 실시 계획
당사는 감사의 원할한 감사활동을 지원하기 위하여 회계제도, 내부회계관리제도, 내
부통제 운영 상 발생하는 이슈사항을 중심으로 연 2회 교육을 실시하였습니다.
바. 감사 교육실시 현황
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | 하반기 교육 예정 |
사. 감사 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 준법경영실 | 2 | 전무(25년) | - 회사 경영활동에 대한 감사 업무 지원 - 주주총회, 이사회 등 경영전반에 관한 감사업무 지원 |
아. 준법지원인 등 현황
당사는 보고서 작성 기준일 현재 해당사항 없습니다.
3. 주주총회 등에 관한 사항
가. 투표제도 현황
| (기준일 : | 2023년 03월 31일 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 미도입 | 도입 |
| 실시여부 | - | - | 제9기(2022년도) 정기주총 |
나. 소수주주권
당사는 보고서 작성 대상 기간 중 소수주주권이 행사되지 않았습니다.
다. 경영권 경쟁
당사는 보고서 작성 대상 기간 중 경영권 경쟁이 발생하지 않았습니다.
라. 의결권 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 12,138,690 | - |
| 우선주 | - | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 12,138,690 | - |
| 우선주 | - | - |
마. 주식사무
|
구 분 |
내 용 |
||
|
정관상 |
제10조(신주인수권) ② 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 외의 자에게 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 50을 초과하지 않는 범위 내에서「자본시장과 금융투자업에 관한 법률」제165조의 6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2.「상법」제542조의 3에 따른 주식매수선택권의 행사에 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4.「근로복지기본법」제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 6. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산·판매·자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 자본시장과 금융투자업에 관한 법률 제9조에서 정한 “유가증권시장 또는 코스닥시장(코넥스시장 포함)”에 주권을 신규상장하기 위하여 신주를 모집하거나 인수인에게 인수하는 경우 ③ 제2항 각 호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. ④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. |
||
|
결 산 일 |
12월 31일 |
정기주주총회 |
매 사업년도 종료 후 3개월 이내 |
|
주주명부폐쇄기준일 |
「주식ㆍ사채 등의 전자등록에 관한 법률」에 따라 당사의 주식은 전자등록되어 있어, 주주명부 폐쇄기간의 설정이 불필요함으로 폐쇄기간을 정관상 별도로 규정하고 있지 않음 |
||
|
주주명부폐쇄시기 |
「주식ㆍ사채 등의 전자등록에 관한 법률」에 따라 당사의 주식은 전자등록되어 있어, 주주명부 폐쇄기간의 설정이 불필요함으로 폐쇄기간을 정관상 별도로 규정하고 있지 않음 |
||
| 주권의 종류 | 「주식ㆍ사채 등의 전자등록에 관한 법률」에 따라 주권 및 신주인수권증서에 표시되어야 할 권리가 의무적으로 전자등록됨에 따라 '주권의 종류'를 기재하지 않음. | ||
|
명의개서대리인 |
국민은행 증권대행부 |
||
|
주주의 특전 |
없음 |
||
| 공고방법 | 회사의 공고는 회사의 인터넷 홈페이지(www.scmlifescience.com)에 한다. 다만, 전산장애 그 밖의 부득이한 사유로 회사의 홈페이지에 공고를 할 수 없을 때에는 전국에 발행되는 일간 한국경제신문에 게재한다. | ||
바. 주주총회 의사록 요약
| 일 자 | 의 안 내 용 | 가결 여부 |
| 제7기 정기총회 2021.03.26 |
제1호 의안 : 제7기(2020.01.01~2020.12.31) 재무제표 승인의 건 제2호 의안 : 이사 선임의 건 제3호 의안 : 정관일부 변경의 건 제4호 의안 : 주식매수선택권 부여의 건 제5호 의안 : 이사 보수한도 승인의 건 제6호 의안 : 감사 보수한도 승인의 건 |
가결 |
| 제8기 정기총회 2022.03.28 |
제1호 의안 : 제8기(2021.01.01~2021.12.31) 재무제표 승인의 건 제2호 의안 : 주식매수선택권 부여의 건 제3호 의안 : 이사 선임의 건 제4호 의안 : 사외이사 문종호 선임의 건 제5호 의안 : 감사 정선영 중임의 건 제6호 의안 : 정관 일부 변경의 건 |
가결 |
| 임시총회 2022.07.22 |
제1호 의안 : 사내이사 손병관 선임의 건 제2호 의안 : 주식매수선택권 부여의 건 |
가결 |
| 제9기 정기총회 2023.03.29 |
제1호 의안 : 제9기(2022.01.01~2022.12.31) 재무제표 승인의 건 제2호 의안 : 주식매수선택권 부여 승인의 건 제3호 의안 : 주식매수선택권 부여의 건 제4호 의안 : 사외이사 이희성 선임(중임)의 건 제5호 의안 : 정관 일부 변경의 건 제6호 의안 : 이사 보수한도 승인의 건 제7호 의안 : 감사 보수한도 승인의 건 |
가결 |
VI. 주주에 관한 사항
가. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| SONG KEE RYOUNG (송기령) |
본인 | 보통주 | 2,771,000 | 22.86 | 2,771,000 | 22.83 | - |
| 손병관 | 등기임원 | 보통주 | 73,000 | 0.60 | 73,000 | 0.60 | - |
| 오형남 | 등기임원 | 보통주 | 17,648 | 0.15 | 17,648 | 0.15 | - |
| 이종철 | 등기임원 | 보통주 | 815 | 0.01 | 815 | 0.01 | - |
| 계 | 보통주 | 2,862,463 | 23.62 | 2,862,463 | 23.59 | - | |
| 우선주 | - | - | - | - | - | ||
나. 최대주주의 주요경력 및 개요
| 성 명 (생년월일) |
직 책 | 주 요 경 력 | 비 고 |
|---|---|---|---|
| 송기령 (64.12.02) |
기타비상무이사 | 서울대학교 음악대학 작곡과 | - |
다. 최대주주의 최대주주(법인 또는 단체)의 개요
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
라. 최대주주의 변동 내역
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| 2022년 09월 20일 | 송기령 | 2,771,000 | 22.83 | 상속절차 완료 | 주1) |
| 주1) | 당사는 기존 최대주주 송순욱의 별세(2022년 03월 10일)로 인한 상속절차가 2022년 09월 20일 완료됨에 따라 최대주주가 송기령으로 변경되었습니다. |
마. 주식 소유현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 송기령 (SONG KEE RYOUNG) |
2,771,000 | 22.83 | 최대주주 |
| - | - | - | - | |
| 우리사주조합 | - | - | - | |
바. 소액주주현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 21,603 | 21,606 | 99.99 | 8,898,610 | 12,138,690 | 73.31 | - |
사. 주가 및 거래 실적
| (기준일 : 2023년 03월 31일) | (단위 : 원, 주) |
| 종 류 | 구 분 | 2022년 10월 | 2022년 11월 | 2022년12월 | 2023년 1월 | 2023년 2월 | 2023년 3월 | |
|---|---|---|---|---|---|---|---|---|
| 보통주 | 주가(주1) | 최고 | 6,600 | 5,950 | 15,150 | 14,550 | 10,630 | 10,400 |
| 최저 | 5,500 | 5,180 | 5,390 | 10,050 | 9,160 | 9,230 | ||
| 평균 | 5,919 | 5,528 | 11,109 | 12,214 | 9,811 | 9,700 | ||
| 거래량 | 최고(일) | 57,003 | 78,018 | 7,345,752 | 2,266,688 | 2,961,088 | 557,589 | |
| 최저(일) | 14,391 | 11,495 | - | 111,421 | 46,523 | 46,897 | ||
| 월간 | 577,008 | 559,353 | 35,841,766 | 10,482,933 | 5,832,943 | 3,055,450 | ||
| 주1) | 주가는 해당 일자의 종가입니다. |
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 손병관 | 남 | 1949.04 | 대표이사 | 사내이사 | 상근 | 경영총괄 | 인하대병원 소아과 교수(과장) 인하대병원 임상의학연구소장 인하중앙의료원 기획조정실장 인하대병원 진료부원장 환경부지정 환경보건센터장(인하대병원) 및 연합회 회장 인하대학교 의과대학장, 의학전문대학원 원장 대한소아과학회 이사 대한 소아알레르기 호흡기학회 회장 및 이사장 청주의료원 원장 |
73,000 | - | 등기임원 | 9개월 | 2025.07.22 |
| 오형남 | 남 | 1960.01 | 전무이사 | 사내이사 | 상근 | IR/PR총괄 준법경영 |
인하대학교 경영학 석사 에스씨엠생명과학㈜ 사내이사 인하대병원 미래전략팀 부장 현, 에스씨엠생명과학㈜ 전무이사 |
17,648 | - | 등기임원 | 1년 5개월 | 2025.03.28 |
| 이종철 | 남 | 1973.10 | 전무이사 | 사내이사 | 상근 | ESG 재무총괄 |
연세대 경제학 학사 성균관대학교 기술경영학 석사 공인회계사 삼일회계법인 현, 에스씨엠생명과학㈜ 전무이사 |
815 | - | 등기임원 | 2년 2개월 | 2025.03.28 |
| 전명신 | 여 | 1966.01 | 전무이사 | 미등기 | 상근 | 최고기술책임 | Heinrich-Heine University Dusseldorf 박사 La Jolla Institute for Immunology 박사후 연구원 서울성모병원 연구교수 현, 인하대학교 의과대학 교수 현, 에스씨엠생명과학㈜ 전무이사 |
- | - | - | 3개월 | - |
| 함동식 | 남 | 1976.07 | 상무이사 | 미등기 | 상근 | 제조임상총괄 |
가톨릭대 세포생물학 박사 가톨릭대 의과대학 연구교수 현, 에스씨엠생명과학㈜ 제조소장 |
7,500 | - | - | 6년 7개월 | - |
| 이서종 | 남 | 1975.02 | 이사 | 미등기 | 상근 | 사업개발 | ㈜대웅제약 영업부서 팀장 한국노바티스 Sales&Marketing팀 팀장 한국노바티스 BD&L팀 부장 |
300 | - | - | 1년 8개월 | - |
| 이희성 | 남 | 1953.12 | 사외이사 | 사외이사 | 비상근 | 경영자문 | 보건복지부 약정국, 감사관실 (주무관) 보건복지부 약정국, 마약관리과 (사무관) 보건복지부 약정국 약무진흥과(서기관) 식품의약품안전청 의약품 안정국 (서기관) 식품의약품안전청 (부이사관, 이사관) 서울지방식품안전청 청장 식품의약품안전청 차장 제11대 식품의약품안전청 청장 성균관대학교 약학대학원 교수 성균관대학교 약학대학 겸임교수 법무법인(유) 화우 고문 |
- | - | 등기임원 | 3년 1개월 | 2026.03.29 |
| 문종호 | 남 | 1964.07 | 사외이사 | 사외이사 | 비상근 | 경영자문 | 순천향대학교의과대학 의학과 의학사 순천향대학교대학원 의학과 의학석사 순천향대학교대학원 의학과 의학박사 순천향대학교부속병원 수련의 순천향대학교부속병원 내과 전공의 대한민국공군 비행군의관, 내과군의관 순천향대학교부속병원 소화기내과 전임의 순천향대학교부속병원 소화기내과 전임강사 순천향대학교부속병원 소화기내과 조교수 Visiting assistant professor, Division of Gastroenterology, Department of Medicine, University of Washington School of Medicine, Seattle, USA 순천향대학교의과대학 소화기내과 부교수 순천향대학교부천병원 내과계진료부장, 종합검진센터소장 순천향대학교부천병원 내과과장 순천향대학교부천병원 소화기내과과장 순천향대학교부천병원 소화기병센터소장 순천향대학교의과대학 소화기내과교수 |
- | - | 등기임원 | 1년 1개월 | 2025.03.28 |
| 레오나드 아리프 압둘샤타르 |
남 | 1964.12 | 기타 비상무 이사 |
기타비상무이사 | 비상근 | 경영자문 |
Usaha Pharma Sdn. Bhd., Managing Director ICI Paints Malaysia Sdn. Bhd., Managing Director CCM Duopharma Biotech Berhad, CEO CCM Chemicals Sdn. Bhd. Director Chemical Company of Malaysia Berhad Duopharma Biotech Berhad. Group Managing Director |
- | - | 등기임원 | 4년 3개월 | 2025.03.28 |
| 송기령 | 여 | 1964.12 | 기타 비상무 이사 |
기타비상무이사 | 비상근 | 경영자문 | 서울대학교 음악대학 작곡과 | 2,771,000 | - | 최대주주 본인 |
1년 1개월 | 2025.03.28 |
| 정선영 | 남 | 1962.08 | 감사 | 감사 | 비상근 | 감사 |
중앙대 경영학 학사 Univ. of Denver, MBA 한국거래소 위니아딤채 사외이사 |
- | - | 등기임원 | 4년 1개월 | 2025.03.28 |
| 주1) | 김석조 상무는 2023년 4월 1일자로 퇴직하였습니다. |
나. 임원 겸직 현황
| 성 명 | 직 위 | 겸직 현황 | |||
|---|---|---|---|---|---|
| 회사명 | 직 위 | 담당업무 | 선임연월 | ||
| 전명신 | 전무이사 |
인하대학교 의과대학 |
교수 | 교수 | 2012.03 |
|
레오나드아리프압둘샤타르 |
기타비상무이사 |
Duopharma Biotech Berhad |
Group Managing Director |
경영총괄 | 2017.12 |
| 이희성 | 사외이사 | 법무법인(유) 화우 | 고문 | 고문 | 2015.03 |
| 문종호 | 사외이사 | 순천향대학교부천병원 소화기내과 |
과장 | 과장 | 2010.02 |
| 순천향대학교부천병원 소화기병센터 |
소장 | 소장 | 2010.02 | ||
| 순천향대학교의과대학 소화기내과 |
교수 | 교수 | 2010.09 | ||
|
정선영 |
감사 | 법무법인 신원 |
고문 |
투자자문 |
2019.06 |
다. 직원 등 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 천원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 줄기세포사업부문 | 남 | 22 | - | - | - | 22 | 1.97 | 377,897 | 16,904 | - | - | - | - |
| 줄기세포사업부문 | 여 | 32 | - | - | - | 32 | 4.53 | 384,324 | 11,948 | - | |||
| 합 계 | 54 | - | - | - | 54 | 3.46 | 756,221 | 14,268 | - | ||||
| 주1) | 직원수는 상기 기준일 재직자를 기준으로 작성하였으며 등기임원은 제외하였습니다. |
| 주2) | 연간급여 총액은 2023년 1월 1일부터 상기 기준일까지의 누계 금액으로서, 「소득세법」제20조에 따라 관할 세무서에 제출하는 근로소득지급명세서의 근로소득 기준(근로소득공제 반영전)입니다. |
| 주3) | 1인 평균급여액은 평균 재직자 54명(남 22명, 여 32명) 기준으로 산출하였습니다. |
마. 미등기임원 보수 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 3 | 119 | 39 | - |
| 주1) | 인원수는 상기 기준일 재직자를 기준으로 작성하였으며 등기임원은 제외하였습니다. |
| 주2) | 연간급여 총액은 2023년 1월 1일부터 상기 기준일까지의 누계 금액으로서, 고정급, 성과급 및 급여성 복리후생비 금액 등을 포함하였습니다. |
| 주3) | 1인 평균 급여액은 급여 총액을 보고서 작성기준일 현재 인원수로 나누어 산출하였습니다. |
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
가. 주주총회 승인금액
| (단위 : 천원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 7 | 2,000,000 | - |
| 감사 | 1 | 100,000 | - |
나. 보수지급금액
(1) 이사ㆍ감사 전체
| (단위 : 천원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 8 | 192,000 | 24,000 | - |
| 주1) | 인원수는 보고서 작성기준일 현재 재임중인 임원 기준입니다. |
| 주2) | 보수총액은 2023년 1월 1일부터 보고서 작성기준일까지 등기임원 자격으로 지급받은 누계 금액으로서, 고정급, 성과급 및 급여성 복리후생비 금액 등은 포함하고 퇴직급여 등 충당성 금액은 제외하였습니다. |
| 주3) | 1인당 평균보수액은 보수총액을 보고서 작성기준일 현재 인원수로 나누어 산출하였습니다. |
(2) 유형별
| (단위 : 천원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
5 | 165,000 | 33,000 | 주4) |
| 사외이사 (감사위원회 위원 제외) |
2 | 18,000 | 9,000 | 주5) |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 9,000 | 9,000 | - |
| 주1) | 인원수는 보고서 작성기준일 현재 기준입니다. |
| 주2) | 보수총액은 2023년 1월 1일부터 보고서 작성기준일까지 등기임원 자격으로 지급받은 누계 금액으로서, 고정급, 성과급 및 급여성 복리후생비 금액 등은 포함하고 퇴직급여 등 충당성 금액은 제외하였습니다. |
| 주3) | 1인당 평균보수액은 보수총액을 보고서 작성기준일 현재 인원수로 나누어 산출하였습니다. |
| 주4) | 기타비상무이사 2인은 등기이사에 포함하였습니다. |
다. 이사ㆍ감사의 개인별 보수현황
(1) 보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황
당분기말 현재 개인별 보수지급금액이 5억원 이상인 이사ㆍ감사가 없습니다.
(2) 보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황
당분기말 현재 개인별 보수지급금액이 5억원 이상인 임직원이 없습니다.
마. 주식매수선택권의 부여 및 행사현황
<표1>
| (단위 : 천원) |
| 구 분 | 부여받은 인원수 |
주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
5 | 677,656 | - |
| 사외이사 (감사위원회 위원 제외) |
2 | 5,476 | - |
| 감사위원회 위원 또는 감사 | 1 | 56,668 | - |
| 업무집행지시자 등 | 2 | 168,922 | - |
| 계 | 10 | 908,722 | - |
|
주1) |
기타비상무이사 2인은 등기이사에 포함하였습니다. |
| 주2) | 미등기이사 2인은 업무집행지시자 등에 포함하였습니다. |
| 주3) | 당사는 이항모형에 의한 공정가치접근법을 적용하여 보상원가를 산정합니다. |
| 주4) | 금융감독원 작성지침에 따르면, 당해 사업연도(분ㆍ반기) 손익계산서(포괄손익계산서)에 주식매수선택권과 관련하여 비용으로 기재하라고 되어있습니다. 금융감독원에 질의하여, 작성항목이 공정가치 총액이므로 기간 별 발생비용이 아닌 해당 기간의 공정가치 총액을 기재하였습니다. |
<표2>
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
의무 보유 여부 |
의무 보유 기간 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 김동균 | 퇴직자 | 2016.02.19 | 신주교부 | 보통주 | 11,122 | - | - | - | 11,122 | - | 2019.02.20~2023.02.19 | 2,750 | X | - |
| 박신영 | 퇴직자 | 2016.02.19 | 신주교부 | 보통주 | 11,122 | - | - | - | 11,122 | - | 2019.02.20~2023.02.19 | 2,750 | X | - |
| OOO외 15명 | 직원 | 2016.02.19 | 신주교부 | 보통주 | 133,456 | - | - | 100,094 | 33,362 | - | 2019.02.20~2023.02.19 | 2,750 | X | - |
| 정승우 | 퇴직자 | 2017.02.28 | 신주교부 | 보통주 | 99,800 | - | - | 99,800 | - | - | 2020.02.29~2024.02.28 | 6,700 | X | - |
| 유영동 | 퇴직자 | 2017.02.28 | 신주교부 | 보통주 | 49,800 | - | - | - | 49,800 | - | 2020.02.29~2024.02.28 | 6,700 | X | - |
| 함동식 | 미등기임원 | 2017.02.28 | 신주교부 | 보통주 | 49,800 | - | - | 7,500 | - | 42,300 | 2020.02.29~2024.02.28 | 6,700 | X | - |
| OOO 외 23명 | 직원 | 2017.02.28 | 신주교부 | 보통주 | 185,306 | 1,360 | - | 125,962 | 39,080 | 20,264 | 2020.02.29~2024.02.28 | 6,700 | X | - |
| 이병건 | 퇴직자 | 2018.05.15 | 신주교부 | 보통주 | 250,000 | - | - | - | - | 250,000 | 2020.05.16~2025.05.15 | 7,000 | X | - |
| 오형남 | 등기임원 | 2018.06.15 | 신주교부 | 보통주 | 60,000 | - | - | 15,000 | - | 45,000 | 2021.06.16~2025.06.15 | 7,250 | X | - |
| 함동식 | 미등기임원 | 2018.06.15 | 신주교부 | 보통주 | 2,000 | - | - | - | - | 2,000 | 2021.06.16~2025.06.15 | 7,250 | X | - |
| OOO 외 37명 | 직원 | 2018.06.15 | 신주교부 | 보통주 | 216,000 | 11,860 | - | 73,660 | 51,000 | 91,340 | 2021.06.16~2025.06.15 | 7,250 | X | - |
| 오석우 | 퇴직자 | 2019.01.18 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 20,000 | 2022.01.19~2026.01.18 | 9,000 | X | - |
| OOO | 직원 | 2019.01.18 | 신주교부 | 보통주 | 6,000 | - | - | - | - | 6,000 | 2022.01.19~2026.01.18 | 9,000 | X | - |
| 오석우 | 퇴직자 | 2019.03.29 | 신주교부 | 보통주 | 60,000 | - | - | - | - | 60,000 | 2022.03.30~2026.03.29 | 10,000 | X | - |
| 김용보 | 퇴직자 | 2019.03.29 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 20,000 | 2022.03.30~2026.03.29 | 10,000 | X | - |
| 박의선 | 퇴직자 | 2019.03.29 | 신주교부 | 보통주 | 20,000 | - | - | - | 20,000 | - | 2022.03.30~2026.03.29 | 10,000 | X | - |
| OOO 외 12명 | 직원 | 2019.03.29 | 신주교부 | 보통주 | 60,000 | 4,900 | - | 8,100 | 8,000 | 43,900 | 2022.03.30~2026.03.29 | 10,000 | X | - |
| 이병건 | 퇴직자 | 2019.07.17 | 신주교부 | 보통주 | 98,874 | - | - | - | - | 98,874 | 2021.07.18~2026.07.17 | 11,000 | X | - |
| 정선영 | 등기임원 | 2019.09.20 | 신주교부 | 보통주 | 10,000 | - | - | - | - | 10,000 | 2022.09.21~2026.09.20 | 14,000 | X | - |
| 정은경 | 퇴직자 | 2019.09.20 | 신주교부 | 보통주 | 30,000 | - | - | - | - | 30,000 | 2022.09.21~2026.09.20 | 14,000 | X | - |
| OOO 외 7명 | 직원 | 2019.09.20 | 신주교부 | 보통주 | 40,000 | - | - | - | 6,000 | 34,000 | 2022.09.21~2026.09.20 | 14,000 | X | - |
| 이병건 | 퇴직자 | 2020.06.30 | 신주교부 또는 차액보상형 선택 |
보통주 | 353,701 | - | - | - | 353,701 | - | 2022.07.01~2027.06.30 | 30,400 | X | - |
| 이희성 | 등기임원 | 2020.06.30 | 신주교부 또는 차액보상형 선택 |
보통주 | 10,000 | - | - | - | - | 10,000 | 2022.07.01~2027.06.30 | 30,400 | X | - |
| 최희주 | 외부전문가 | 2020.06.30 | 신주교부 또는 차액보상형 선택 |
보통주 | 10,000 | - | - | - | - | 10,000 | 2022.07.01~2027.06.30 | 30,400 | X | - |
| 레오나드 아리프 압둘샤타르 |
등기임원 | 2020.06.30 | 신주교부 또는 차액보상형 선택 |
보통주 | 10,000 | - | - | - | - | 10,000 | 2022.07.01~2027.06.30 | 30,400 | X | - |
| 이종철 | 등기임원 | 2021.03.26 | 신주교부 | 보통주 | 25,000 | - | - | - | - | 25,000 | 2024.03.27~2028.03.26 | 36,260 | X | - |
| OOO외 5명 | 직원 | 2021.03.26 | 신주교부 | 보통주 | 41,000 | - | - | - | 21,000 | 20,000 | 2024.03.27~2028.03.26 | 36,260 | X | - |
| 김석조 | 퇴직자 | 2021.08.13 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 20,000 | 2024.08.14~2028.08.13 | 30,400 | X | - |
| 이서종 | 미등기임원 | 2021.08.13 | 신주교부 | 보통주 | 15,000 | - | - | - | - | 15,000 | 2024.08.14~2028.08.13 | 30,400 | X | - |
| OOO 외 2명 | 직원 | 2021.08.13 | 신주교부 | 보통주 | 19,000 | - | - | - | 15,000 | 4,000 | 2024.08.14~2028.08.13 | 30,400 | X | - |
| OOO외 3명 | 직원 | 2021.11.12 | 신주교부 | 보통주 | 12,000 | - | - | - | - | 12,000 | 2024.11.13~2028.11.12 | 20,566 | X | - |
| OOO외 1명 | 직원 | 2022.02.08 | 신주교부 | 보통주 | 9,000 | - | - | - | 6,000 | 3,000 | 2025.02.08~2029.02.07 | 17,705 | X | - |
| OOO 외 7명 | 직원 | 2022.05.13 | 신주교부 | 보통주 | 41,000 | - | - | - | 4,000 | 37,000 | 2025.05.14~2029.05.13 | 11,590 | X | - |
| OOO외 5명 | 직원 | 2022.09.30 | 신주교부 | 보통주 | 30,000 | - | - | - | - | 30,000 | 2025.10.01~2029.09.30 | 7,896 | X | - |
| OOO외 2명 | 직원 | 2022.12.29 | 신주교부 | 보통주 | 12,000 | - | - | - | - | 12,000 | 2025.12.30~2029.12.29 | 12,575 | X | - |
| OOO외 1명 | 직원 | 2023.02.28 | 신주교부 | 보통주 | 10,000 | - | - | - | - | 10,000 | 2026.03.01~2030.02.28 | 10,810 | X | - |
| 손병관 | 등기임원 | 2023.03.29 | 신주교부 | 보통주 | 40,000 | - | - | - | - | 40,000 | 2025.03.30~2029.03.29 | 9,883 | X | - |
| 문종호 | 등기임원 | 2023.03.29 | 신주교부 | 보통주 | 15,000 | - | - | - | - | 15,000 | 2025.03.30~2029.03.29 | 9,883 | X | - |
※ 공시서류작성기준일(2023년03월31일) 현재 종가: 9,700원
VIII. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| - | - | - | - |
※상세 현황은 '상세표-2. 계열회사 현황(상세)' 참조
2. 타법인출자 현황(요약)
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 백만원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | 1 | 1 | 10,321 | - | -1,773 | 8,548 |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | 1 | 1 | 1,147 | - | - | 1,147 |
| 계 | - | 2 | 2 | 11,468 | - | -1,773 | 9,695 |
※상세 현황은 '상세표-3. 타법인출자 현황(상세)' 참조
IX. 대주주 등과의 거래내용
가. 대주주등에 관한 신용공여등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 대주주와의 자산양수도 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
다. 대주주와의 영업거래
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
라. 대주주 이외의 이해관계자와의 거래
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
당사는 보고서 작성기준일 현재 해당사항이 없습니다
2. 우발부채 등에 관한 사항
가. 중요한 소송사건
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 견질 또는 담보용 어음ㆍ수표 현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
다. 채무보증 현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
라. 채무인수약정 현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
마. 그 밖에 우발채무 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
3. 제재 등과 관련된 사항
가. 제재현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 한국거래소 등으로부터 받은 제재
| 조치일 | 조치기관 | 조치대상자 | 조치내용 | 사유 및 근거규정 | 조치에 대한 이행현황 | 재발방지를 위한 대책 |
|---|---|---|---|---|---|---|
| 2021.10.08 | 코스닥 시장본부 | 에스씨엠생명과학 주식회사 | 공시불이행 부과벌점 0.0 공시위반제재금 8,000,000원 |
코스닥시장공시규정 제27조, 제32조 및 제34조, 투자판단 관련 주요경영사항 지연공시 |
확정 | - 내부통제제도 강화 및 회계투명성 제고 - 공시체계 정비 - 내부회계관리제도 및 사내규정보완 |
자세한 사항은 2021년 11월 3일 불성실공지법인지정 공시를 참조 바랍니다.
다. 단기매매차익 발생 및 반환에 관한 사항
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
(1) 주식매수선택권 행사
보고서 작성기준일 이후인 2023.04.28 주식매수선택권 행사로 보통주 117,350주가 발행 되었으며 2023.05.12 추가 상장 되었습니다. 자세한 내용은 한국거래소의 2023.05.09 추가상장(주식매수선택권행사) 안내공시 참조 바랍니다.
나. 중소기업기준 검토표
 |
|
에스씨엠생명과학(주)_중소기업등기준검토표 |
다. 외국지주회사의 자회사 현황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
라. 합병 등의 사후정보
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
마. 보호예수 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 |
|---|---|---|---|---|---|---|
| 보통주 | 2,771,000 | 2020년 01월 09일 | 2023년 06월 17일 | 상장일로부터 3년 | 한국거래소 상장규정에 따른 보호예수 (최대주주) |
12,138,690 |
바. 특례상장기업의 재무사항 비교표
| (상장일 : | 2020년 06월 17일 | , 인수인 : | 한국투자증권 | ) | (단위 : 백만원) |
| 추정대상 | 계정과목 | 예측치 | 실적치 | 괴리율 |
|---|---|---|---|---|
| 2021년 | 매출액 | 12,879 | 439 | 97 |
| 영업이익 | -3,415 | -12,155 | -256 | |
| 당기순이익 | -6,516 | -22,519 | -246 | |
| 2022년 | 매출액 | 21,285 | 396 | 98 |
| 영업이익 | 4,106 | -12,579 | 406 | |
| 당기순이익 | 5,065 | -22,930 | 553 | |
| 2023년 | 매출액 | 37,782 | - | - |
| 영업이익 | 15,593 | - | - | |
| 당기순이익 | 19,035 | - | - |
(1) 매출액 분석
당사는 한국채택국제회계기준에 따라 기술이전 계약에 따라 반환불가 조건의 선수수
수료(Upfront Fee 등)를 받는 경우, 미래 제공할 추가적인 수행의무와 관련이 있는
것이라면 해당 의무를 수행하는 시기에 수익을 인식하고, 미래 제공할 추가적인 수행
의무가 없다면 받았을 때 수익을 인식하고 있습니다. 그리고, 수행의무를 이행하지
않아 수익으로 인식하지 않은 금액은 재무상태표에 계약부채로 인식한 후 수행의무
의 기간에 걸쳐 수익으로 인식하고 있습니다.
한편, 증권신고서 상 영업실적을 추정할 때에는 미래에 체결될 계약 내용을 정확히
알 수 없으므로, 수행의무에 따른 기간 인식을 고려하지 않았으며, 이러한 내용 역시
증권신고서 상 적절히 기재하였습니다.
또한 라이선스 수수료 외 화장품(제품) 판매수익도 당사 매출을 구성하고 있습니다.
당사는 2022년도 매출로 화장품(제품) 매출 150백만원 및 한독에 중등증-중증 아토피 피부염 치료제 기술이전에 따른 기술료 수익 242백만원 등 총 396백만원을 인식하였습니다.
매출액의 2022년도 예측치는 21,285백만원, 실적은 396백만원으로 차액 20,889백
만원, 괴리율은 98%입니다. 당사 제품매출은 코로나 19로 인한 소비 위축 및 홈
쇼핑 판매 사업계획 수정 등의 영향으로 예측치를 하회하였습니다. 지금 현재 추진
중인 임상시험 파이프라인의 국내 및 글로벌 기술이전을 추진함과 동시에 줄기세포
화장품 및 줄기세포배양액 판매 사업도 계속적으로 확장할 계획입니다.
(2) 영업이익(손실) 분석
영업이익의 2022년도 예측치는 4,106백만원, 실적은 손실 12,579백만원으로 차액 16,685백만원, 괴리율은 406%입니다. 이는 진행중인 만성 이식편대숙주질환(임상2상), 중등증-중증 급성 췌장염(임상2a상) 및 중등증-중증 아토피 피부염(임상 1/2상)의 임상시험이 빠르게 진행되어 시약재료비 및 임상연구비 등에 경상연구개발비와 지급수수료와 관련 임직원에 대한 주식보상비용이 증가하였기 때문입니다.
(3) 당기순이익(손실) 분석
당기순이익의 2022년도 예측치는 5,065백만원, 실적은 손실 22,930백만원으로
차액 27,995백만원, 괴리율은 553%입니다. 이는 미국 조인트벤처 코이뮨의 합병
및 투자 유치 등의 순자산 변화에 따른 회계적으로 인식되는 지분법투자관련손익 변
동 때문입니다.
사. 특례상장기업 관리종목 지정유예 현황
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 백만원, %) |
| 관리종목 지정요건 | 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|---|
| 항목 | 사업연도 | 금액/비율 | 해당 여부 |
종료 시점 |
||
| 최근 사업연도말 매출액 30억원 미만 |
최근 사업연도말 매출액(별도) | 2022 | 396 | 해당 | 해당 | 2024.12.31 |
| 최근 4사업연도 연속 영업손실 발생 | 최근 4사업연도 각 영업손익 (별도) |
2022 | -12,579 | 해당 | 해당 | - |
| 2021 | -12,155 | |||||
| 2020 | -16,089 | |||||
| 2019 | -12,202 | |||||
| 자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생 | 최근 3사업연도 각 자기자본 대비 법인세차감전 계속사업손익 비율(연결) |
2022 | -93.55 | 해당 | 해당 | 2022.12.31 |
| 2021 | -50.5 | |||||
| 2020 | -15.3 | |||||
| 주1) | 당사는 코스닥시장상장규정 제2조 제31항에서 정하는 기술성장기업으로서, 동 규정 제7조 제2항의 신규상장심사요건 특례 요건을 적용하여 2020년6월17일 코스닥시장에 상장하였습니다. |
| 주2) | 매출액 요건의 경우, 기술성장기업은 신규상장일이 속하는 사업연도를 포함하는 연속하는 5개 사업연도(상장일로부터 상장일이 속한 사업연도의 말일까지 기간이 3월미만인 경우에는 그 다음 사업연도)까지 지정 유예되며, 2025년 부터 대상이 됩니다. |
| 주3) | 기술성장기업에만 적용 또는 유예되는 관리종목 요건에는 최근 4사업연도 영업손실 발생 관련 관리종목 요건은 기한 제한이 없습니다. |
| 주4) | 기술성장기업에 대한 신규상장일이 속하는 사업연도(2020년) 포함하여, 2022년까지 법인세비용차감전계속사업손실 발생연도에서 제외되고, 실질적으로 2023년까지(적용기준:최근 3년간 2회이상) 관리종목 지정유예 중이므로, 2022년말 이후 2개 사업연도가 추가 경과된 2024년부터 관리종목 지정이 가능합니다. |
XI. 상세표
1. 연결대상 종속회사 현황(상세)
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
| (단위 : 원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - |
| - | - | - | - | - | - | - |
| - | - | - | - | - | - | - |
2. 계열회사 현황(상세)
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | - | - | - |
| - | - |
3. 타법인출자 현황(상세)
| (기준일 : | 2023년 03월 31일 | ) | (단위 : 백만원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| CoImmune, Inc. | 비상장 | 2019년 02월 17일 | 공동기업 | 6,520 | 15,300,000 | 23.88 | 10,321 | - | - | -1,773 | 15,300,000 | 23.88 | 8,548 | 25,814 | -8,719 |
| VITA THERAPEUTICS, INC. | 비상장 | 2021년 06월 09일 | 단순투자 | 1,147 | 717,231 | 1.15 | 1,147 | - | - | - | 717,231 | 1.15 | 1,147 | 34,094 | -15,582 |
| 합 계 | 16,017,231 | - | 11,468 | - | - | -1,773 | 16,017,231 | - | 9,695 | 59,908 | -24,301 | ||||
4. 지적재산권 세부 목록
| 구분 | 종류 | 내용 | 소유자 | 출원국 | 출원일 | 등록일 | 적용제품 |
|---|---|---|---|---|---|---|---|
| 1 | 특허 | 층분리배양법을 이용한 골수에서의 중갑엽줄기세포 분리방법 | 에스씨엠생명과학주식회사 | 한국 | 06.08.10 | 08.01.31 | SCM-CGH |
| 2 | 미국 | 06.06.19 | 10.08.24 | ||||
| 3 | 유럽 | 06.06.19 | 14.07.30 | ||||
| 4 | 중국 | 06.06.19 | 13.01.09 | ||||
| 5 | 일본 | 06.06.19 | 12.12.14 | ||||
| 6 | 특허 | 층분리배양법을 이용한 지방-유래 줄기세포의 분리 및 이의 이용 | 에스씨엠생명과학주식회사 | 한국 | 15.07.29 | 17.08.11 | SCM-AGH |
| 7 | 특허 | 새로운 동결 줄기세포의 제조방법 (Manufacturing process for fresh and frozen stem cells) | 에스씨엠생명과학주식회사 | 미국 | 11.12.30 | 14.08.05 | SCM-AGH |
| 8 | 특허 | 줄기세포의 층분리 배양 및 증식 방법 (Method for isolation of stem cells from bone marrow using subfractionation culturing method and proliferation thereof) | 에스씨엠생명과학주식회사 | 한국 | 17.11.06 | 19.05.24 | SCM-AGH |
| 9 | 한국 | 19.05.24 | 20.01.08 | ||||
| 10 | 미국 | 18.07.03 | 22.02.15 | ||||
| 11 | 유럽 | 18.06.22 | - | ||||
| 12 | 일본 | 18.06.21 | 20.10.30 | ||||
| 13 | 중국 | 18.10.10 | - | ||||
| 14 | 호주 | 18.06.19 | 21.01.21 | ||||
| 15 | 러시아 | 18.07.04 | 19.12.12 | ||||
| 16 | 인도네시아 | 18.07.04 | - | ||||
| 17 | 말레이시아 | 18.07.17 | 22.08.18 | ||||
| 18 | 싱가포르 | 18.06.18 | - | ||||
| 19 | 베트남 | 18.07.10 | 22.09.12 | ||||
| 20 | 특허 | 이식편대숙주병의 치료 (Treatment of graft-versus-host disease) | 에스씨엠생명과학주식회사 | 미국 | 08.05.27 | 16.09.13 | SCM-CGH |
| 21 | 유럽 | 08.05.27 | 17.03.15 | ||||
| 22 | 일본 | 08.05.27 | 15.01.23 | ||||
| 23 | 특허 | 클로날 줄기세포를 포함하는 이식편대 숙주질환 치료용 약학적 조성물 | 에스씨엠생명과학주식회사 | 한국 | 19.12.04 | 21.05.26 | SCM-CGH |
| 24 | 미국 | 21.06.16 | - | ||||
| 25 | 유럽 | 21.06.25 | - | ||||
| 26 | 중국 | 21.06.17 | - | ||||
| 27 | 일본 | 21.06.16 | - | ||||
| 28 | 홍콩 | 22.03.07 | - | ||||
| 29 | 특허 | 클로날 줄기세포를 초함하는 췌장염 치료용 약학적 조성물 | 에스씨엠생명과학주식회사 | 한국 | 19.12.04 | 21.04.27 | SCM-AGH |
| 30 | 대만 | 19.12.13 | 23.03.21 | ||||
| 31 | 미국 | 21.06.14 | - | ||||
| 32 | 유럽 | 21.06.17 | - | ||||
| 33 | 중국 | 21.06.11 | - | ||||
| 34 | 일본 | 21.06.14 | - | ||||
| 35 | 홍콩 | 22.03.07 | - | ||||
| 36 | 특허 | 클로날 중간엽 줄기세포를 포함하는, 아토피성 피부염 예방 또는 치료용 약학적 조성물 | 에스씨엠생명과학주식회사 | 한국 | 14.12.01 | 16.09.02 | SCM-AGH |
| 37 | 미국 | 20.08.13 | 22.08.16 | ||||
| 38 | 대만 | 20.01.14 | |||||
| 39 | 한국 | 21.06.11 | |||||
| 40 | 유럽 | 21.06.22 | |||||
| 41 | 중국 | 21.06.25 | |||||
| 42 | 일본 | 21.07.09 | - | ||||
| 43 | 홍콩 | 22.03.07 | - | ||||
| 44 | 특허 | 단일 클로날 줄기세포를 이용한 아토피피부염치료방법 | 에스씨엠생명과학주식회사 | 한국 | 20.03.18 | 21.12.15 | SCM-AGH |
| 45 | 미국 | 21.09.17 | |||||
| 46 | 중국 | 21.09.18 | |||||
| 47 | 일본 | 21.09.17 | |||||
| 48 | 유럽 | 21.10.06 | |||||
| 49 | 특허 | 조절 T세포 매개성 질환의 예방 또는 치료용 약학적 조성물 | 에스씨엠생명과학주식회사 | 한국 | 17.02.24 | 19.09.19 | SCM-AGH |
| 50 | 미국 | 18.07.11 | 21.08.24 | ||||
| 51 | 유럽 | 18.07.09 | |||||
| 52 | 중국 | 18.08.02 | 19.12.10 | ||||
| 53 | 일본 | 18.07.04 | 19.09.06 | ||||
| 54 | 호주 | 18.07.05 | 21.01.21 | ||||
| 55 | 러시아 | 18.07.05 | 20.07.24 | ||||
| 56 | 인도네시아 | 18.07.09 | 21.05.20 | ||||
| 57 | 말레이시아 | 18.07.16 | |||||
| 58 | 싱가포르 | 19.12.12 | |||||
| 59 | 베트남 | 18.07.24 | |||||
| 60 | 특허 | hPL 함유 배지에서 배양된 중간엽 줄기세포의 배양액을 포함하는 화장료 조성물 | 에스씨엠생명과학주식회사 | 한국 | 19.05.02 | 21.11.02 | 줄기세포 배양액 |
| 61 | 유럽 | 21.10.15 | |||||
| 62 | 중국 | 21.10.25 | |||||
| 63 | 미국 | 21.10.29 | |||||
| 64 | 일본 | 21.11.01 | |||||
| 65 | 특허 | 줄기세포 프라이밍 조성물 및 프라이밍된 줄기세포 | 에스씨엠생명과학주식회사 | 한국 | 20.12.23 | 23.01.25 | 줄기세포 기능강화 |
| 66 | PCT | 21.12.21 | |||||
| 67 | 특허 | 염증 자극된 중간엽 줄기세포를 포함하는 면역질환 또는 염증 질환의 예방 또는 치료용 약학적 조성물 (Pharmaceutical composition for prevention or treatment of immune diseases and inflammatory diseases comprising immunogenic stimulated mesenchymal stem cells) | 에스씨엠생명과학주식회사 | 한국 | 16.09.07 | 18.01.02 | SCM-AGH |
| 68 | 미국 | 19.03.07 | - | ||||
| 69 | 일본 | 19.03.07 | 23.01.17 | ||||
| 70 | 유럽 | 19.04.04 | - | ||||
| 71 | 특허 | CXCL1(chemokine (CXC motif) ligand 1) 단백질을 유효성분으로 포함하는 탈모 예방 또는 치료용 약학적 조성물 (Pharmaceutical composition for preventing or treating hair loss comprising CXCL1 protein) | 에스씨엠생명과학주식회사 | 한국 | 16.08.08 | 16.09.07 | IRORO 모발 제품 (샴푸, 트리트먼트, 세럼) |
| 72 | 러시아 | 18.05.17 | 20.01.16 | ||||
| 73 | 특허 | CXCL1단백질 및 미녹시딜을 유효성분으로 포함하는 탈모 예방 또는 치료용 약학적 조성물 (Pharmaceutical composition for preventing or treating hair loss comprising CXCL1 protein) | 에스씨엠생명과학주식회사 | 한국 | 17.08.08 | 19.07.09 | IRORO 모발 제품 (샴푸, 트리트먼트, 세럼) |
| 74 | 일본 | 17.08.08 | 18.05.25 | ||||
| 75 | 미국 | 18.06.21 | 19.12.24 | ||||
| 76 | 중국 | 17.08.08 | 21.05.28 | ||||
| 77 | 유럽 | 17.08.08 | 19.07.24 | ||||
| 78 | 러시아 | 18.07.04 | 19.12.17 | ||||
| 79 | 특허 | TYMP(thymidine phosphorylase) 단백질을 유효성분으로 포함하는 탈모 예방 또는 치료용 약학적 조성물 ( PHARMACEUTICAL COMPOSITION COMPRISING THYMIDINE PHOSPHORYLASE (TYMP) PROTEIN AS EFFECTIVE INGREDIENT FOR PREVENTION OR TREATMENT OF HAIR LOSS) | 에스씨엠생명과학주식회사 | 한국 | 16.08.08 | 16.10.26 | IRORO 모발 제품 (샴푸, 트리트먼트, 세럼) |
| 80 | 특허 | 줄기세포의 기능강화용조성물 | 에스씨엠생명과학주식회사 | 한국 | 20.01.06 | 21.06.17 | 줄기세포 기능강화 |
| 81 | 미국 | 22.07.06 | - | ||||
| 82 | 일본 | 22.07.06 | - | ||||
| 83 | 유럽 | 22.08.05 | - | ||||
| 84 | 호주 | 22.08.05 | - | ||||
| 85 | 중국 | 22.09.02 | - | ||||
| 86 | 특허 | 기능강화 줄기세포를 포함하는 아토피 피부염 예방 또는 치료용 조성물 | 에스씨엠생명과학주식회사 | 한국 | 21.05.18 | - | 줄기세포 기능강화 |
| 87 | PCT | 22.05.18 | - | ||||
| 88 | 특허 | 기능강화 줄기세포 및 조절 T세포를 포함하는 아토피 피부염 예방 또는 치료용 병용투여 조성물 | 에스씨엠생명과학주식회사 | 한국 | 21.06.01 | - | 줄기세포 기능강화 |
| 89 | PCT | 22.05.30 | - | ||||
| 90 | 특허 | 기능강화 줄기세포를 포함하는 관절염 예방 또는 치료용 조성물 | 에스씨엠생명과학주식회사 | 한국 | 22.06.15 | - | 줄기세포 기능강화 |
| 91 | 상표 | SCM | 에스씨엠생명과학주식회사 | 한국 | 18.07.13 | 19.10.29 | - |
| 92 | 상표 | SCM Subfractionation Culturing Method |
에스씨엠생명과학주식회사 | 한국 | 18.07.13 | 19.10.29 | - |
| 93 | 상표 | SCM Stem Cell Medicine |
에스씨엠생명과학주식회사 | 한국 | 18.07.13 | 19.10.29 | - |
| 94 | 상표 | SCM Specialized Cell Medicine |
에스씨엠생명과학주식회사 | 한국 | 21.01.05 | 22.08.10 | - |
| 95 | 상표 | 이로로 문양 | 에스씨엠생명과학주식회사 | 한국 | 18.06.27 | 19.04.01 | - |
| 96 | 상표 | 이로로 문양 | 에스씨엠생명과학주식회사 | 일본 | 21.08.31 | 22.02.28 | - |
| 97 | 상표 | 이로로 문자 | 에스씨엠생명과학주식회사 | 한국 | 18.07.04 | 19.04.25 | - |
| 98 | 상표 | 이로로 문자 | 에스씨엠생명과학주식회사 | 말레이시아 | 22.04.13 | ||
| 99 | 상표 | Iroro Nutreatment | 에스씨엠생명과학주식회사 | 한국 | 21.09.17 | - | - |
| 100 | 상표 | Iroro Nutreatment | 에스씨엠생명과학주식회사 | 말레이시아 | 21.09.30 | 22.08.03 | |
| 101 | 상표 | 엔세리아 문자 | 에스씨엠생명과학주식회사 | 한국 | 18.05.08 | 18.12.11 | - |
| 102 | 상표 | 베라셀 문자 | 에스씨엠생명과학주식회사 | 한국 | 18.05.08 | 18.12.11 | - |
| 103 | 상표 | 베라움 문자 | 에스씨엠생명과학주식회사 | 한국 | 18.05.08 | 18.12.11 | - |
| 104 | 상표 | Nutreatment 문자 | 에스씨엠생명과학주식회사 | 일본 | 21.12.03 | 22.05.20 | - |
| 105 | 상표 | Nutreatment 문자 | 에스씨엠생명과학주식회사 | 중국 | 21.11.26 | 22.06.07 | - |
| 106 | 상표 | Nutreatment 문자 | 에스씨엠생명과학주식회사 | 말레이시아 | 21.11.09 | - | - |
| 107 | 상표 | Nutreatment 문자 | 에스씨엠생명과학주식회사 | 한국 | 21.11.15 | - | - |
| 108 | 상표 | iroro Nuvon 문자 | 에스씨엠생명과학주식회사 | 한국 | 22.11.11 | - | - |
| 109 | 상표 | iroro Nuvon 문자 | 에스씨엠생명과학주식회사 | 말레이시아 | 22.11.16 | - | - |
| 110 | 상표 | iroro Nuvon 문자 | 에스씨엠생명과학주식회사 | 일본 | 22.11.18 | - | - |
【 전문가의 확인 】
1. 전문가의 확인
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
2. 전문가와의 이해관계
당사는 보고서 작성기준일 현재 해당사항이 없습니다.