![이미지: [글로벌 면역항암제 시장규모 현황 및 전망 (2021_2027)]](%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EB%A9%B4%EC%97%AD%ED%95%AD%EC%95%94%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%EA%B7%9C%EB%AA%A8%20%ED%98%84%ED%99%A9%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D%20%282021_2027%29.jpg) |
|
[글로벌 면역항암제 시장규모 현황 및 전망 (2021_2027)] |
주주총회소집공고
| 2023 년 5 월 24 일 | ||
| 회 사 명 : | 주식회사 지아이이노베이션 | |
| 대 표 이 사 : | 이병건, 홍준호 | |
| 본 점 소 재 지 : | 서울특별시 송파구 송파대로 167 에이동 1116호(문정동, 문정역테라타워) | |
| (전 화) 02-404-2003 | ||
| (홈페이지)http://www.gi-innovation.com | ||
| 작 성 책 임 자 : | (직 책) 신고업무담당이사 | (성 명) 장홍국 |
| (전 화) 02-404-2003 | ||
주주총회 소집공고
| (제7기 임시) |
| 주주님의 건승과 댁내의 평안을 기원합니다. 우리 회사는 정관 제24조에 의하여 제7기 임시주주총회를 아래와 같이 소집하오니 참석하여 주시기 바랍니다. |
| - 아래 - |
|
1. 일 시 : 2023년 6월 13일 (화) 오전 9시 - 직접행사 : 신분증 - 간접행사 : 위임장(주주와 대리인 인적사항 기재, 인감날인), 인감증명서, 대리인 신분증 |
| 2023년 5월 24일 주식회사 지아이이노베이션 대표이사 이병건, 홍준호 (직인생략) 명의개서대리인 한국예탁결제원 사장 이순호 |
I. 사외이사 등의 활동내역과 보수에 관한 사항
1. 사외이사 등의 활동내역
가. 이사회 출석률 및 이사회 의안에 대한 찬반여부
| 회차 | 개최일자 | 의안내용 | 사외이사 등의 성명 | ||||
|---|---|---|---|---|---|---|---|
| 김현철 (출석률 100%) |
유규창 (출석률 100%) |
안근용 (출석률 100%) |
김병철 (출석률 80%) |
류양지 (출석률 80%) |
|||
| 찬 반 여 부 | |||||||
| 1차 |
2023.01.27 | 코스닥상장을 위한 신주발행의 건 | 찬성 | 찬성 | 찬성 |
찬성 |
찬성 |
| 2차 |
2023.02.09 | 1. 2022년(제6기) 재무제표 및 영업보고서 승인의 건 2. 주식매수선택권 부여 취소의 건 |
찬성 찬성 |
찬성 찬성 |
찬성 찬성 |
불참 |
찬성 찬성 |
| 3차 |
2023.02.28 | 2022 회계연도 제6기 정기주주총회 소집 결정의 건 | 찬성 | 찬성 | 찬성 |
찬성 |
불참 |
| 4차 |
2023.04.06 | 1. 투명경영위원회 위원 선임의 건 2. 보상위원회 위원 선임의 건 3. 주식매수선택권 부여 취소의 건 4. 주식매수선택권 행사가격 조정의 건 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
찬성 찬성 찬성 찬성 |
| 5차 |
2023.04.26 | 1. 임시주주총회 소집결정의 건 2. 임시주주총회 회의 목적사항 결정의 건 3. 임시주주총회를 위한 주주명부 기준일 설정의 건 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
찬성 찬성 찬성 |
나. 이사회내 위원회에서의 사외이사 등의 활동내역
| 위원회명 | 구성원 | 활 동 내 역 | ||
|---|---|---|---|---|
| 개최일자 | 의안내용 | 가결여부 | ||
| 감사위원회 | 유규창,안근용,김현철 | 2023.02.08 | 1. 외부감사인 선임의 건 2. 2022회계연도 재무제표 및 영업보고서 보고의 건 3. 2022회계연도 내부회계관리제도 운영실태 보고의 건 4. 2022회계연도 내부회계관리제도 운영실태 평가의 건 |
가결 |
| 감사위원회 | 유규창,안근용,김현철 | 2023.02.28 | 1. 2022회계연도(제6기) 정기주주총회 회의 목적사항 심의의 건 2. 2022회계연도(제6기) 내부감시장치 가동현황 보고의 건 |
가결 |
| 감사위원회 | 유규창,안근용,김현철 | 2023.03.31 | 1. 감사위원장 선임의 건 | 가결 |
| 감사위원회 | 유규창,안근용,김현철 | 2023.04.25 | 1. 2023년(제7기) 임시주주총회 회의 목적사항 심의의 건 | 가결 |
| 감사위원회 | 유규창,안근용,김현철 | 2023.05.03 | 1. 2023년(제7기) 1분기 재무제표 검토 및 보고의 건 | 가결 |
| 위원회명 | 구성원 | 활 동 내 역 | ||
|---|---|---|---|---|
| 개최일자 | 의안내용 | 가결여부 | ||
| 투명경영위원회 | 김현철, 김병철, 안근용 | 2023.01.27 | 1. 관계사와의 거래 승인의 건 | 가결 |
| 투명경영위원회 | 김현철, 김병철, 안근용 | 2023.02.28 | 1. 관계사와의 거래 승인의 건 | 가결 |
| 투명경영위원회 | 김현철, 김병철, 안근용 | 2023.03.28 | 1. 관계사와의 거래 승인의 건 2. 임원 대여금 기간 연장의 건 |
가결 가결 |
| 투명경영위원회 | 김현철, 김병철, 안근용 | 2023.04.26 | 1. 관계사와의 거래 승인의 건 | 가결 |
| 투명경영위원회 | 김현철, 김병철, 안근용 | 2023.05.15 | 1. 관계사와의 거래 승인의 건 | 가결 |
| 위원회명 | 구성원 | 활 동 내 역 | ||
|---|---|---|---|---|
| 개최일자 | 의안내용 | 가결여부 | ||
| 보상위원회 | 김병철, 김현철, 안근용 | 2023.02.28 | 1. 임원의 보수한도 검토 및 승인의 건 | 가결 |
| 보상위원회 | 김병철, 김현철, 류양지 | 2023.04.06 | 1. 보상위원장 선임의 건 2. 임원 인센티브 지급의 건 |
가결 |
2. 사외이사 등의 보수현황
| (단위 : 천원) |
| 구 분 | 인원수 | 주총승인금액 | 지급총액 | 1인당 평균 지급액 |
비 고 |
|---|---|---|---|---|---|
| 사외이사 | 5 | 2,000,000 (주2) |
30,000 | 6,000 | - |
(주1) 최근분기말(2023년 1분기말) 기준
(주2) 사내이사 4명, 사외이사 5명을 포함한 총 9명의 보수한도 승인금액
II. 최대주주등과의 거래내역에 관한 사항
1. 단일 거래규모가 일정규모이상인 거래
| (단위 : 억원) |
| 거래종류 | 거래상대방 (회사와의 관계) |
거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| 기타비용 | 주식회사 지아이바이옴 (관계기업) |
2023.01.17 | 0.4 | 1.26 |
(주) 최근분기말(2023년 1분기말) 기준
2. 해당 사업연도중에 특정인과 해당 거래를 포함한 거래총액이 일정규모이상인 거래
| (단위 : 억원) |
| 거래상대방 (회사와의 관계) |
거래종류 | 거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
(주) 최근분기말(2023년 1분기말) 기준
III. 경영참고사항
1. 사업의 개요
가. 업계의 현황
당사는 융합 단백질을 기반으로 차세대 면역치료제를 연구 개발하는 생명공학회사로, 핵심 신약파이프라인 i) GI-101 면역항암제, ii) GI-301 알레르기 치료제를 비롯한 다양한 면역치료제 신약 파이프라인을 보유하고 있습니다. 당사는 의약/바이오 분야 기초 과학자, 공정개발 전문가, 임상 개발 및 기술이전 전문가 등 바이오 신약 연구 개발 및 기술사업화 분야 전문가들로 구성되어 있으며, 이를 바탕으로 융합 단백질 신약 발굴을 위한 플랫폼 기술과 고유의 공정개발 기술, 목표 시장의 미충족 의료 수요에 기반한 임상 개발 역량을 확보하고 있습니다. 당사의 주요 사업모델은 조기 기술이전을 통한 사업화로 자체적인 기술 역량을 기반으로 글로벌 수준의 선도기업 및 연구자들과의 적극적인 협력을 통해 전임상 등 초기 개발 단계에서의 기술이전 실적을 확보해 나아가고 있습니다.
(1) 산업의 특성
(가) 면역항암제
신체를 구성하고 있는 가장 작은 단위인 세포(cell)는 끊임없이 분열하고, 성장하며 죽어 사라지는 과정을 거칩니다. 정상적인 세포는 세포 내 조절 기능에 의해 이 과정을 통제하여 세포수의 균형을 유지합니다. 그러나, 여러가지 이유로 인해 이러한 일련의 과정이 조절되지 않는 경우가 발생할 시, 비정상적인 세포들이 통제되지 못하고 과다하게 증식하게 됩니다. 이로 인해 생성된 종괴는 주위 조직과 장기에 압박을 가하고 혈관을 통한 영양분과 산소의 흐름을 차단하여 정상 조직의 파괴를 초래하게 되는데, 이러한 상태를 암(cancer)이라 정의할 수 있습니다.
항암제는 이러한 암을 치료하는 목적으로 개발된 의약품으로, 2000년대 초부터 암 치료에 대한 여러 방법과 치료제가 개발되었습니다. 그러나 많은 부작용과 제한된 치료 효과로 인해 대안에 대한 수요가 지속되어 왔으며, 다양한 방법을 찾는 끊임없는 연구가 수행되었습니다. 따라서 최근에는 우리 몸의 면역체계를 이용한 면역항암제가 기존 항암제의 대안으로 급부상하였습니다.
면역항암제는 우리 몸의 면역체계를 활성화시켜 암을 제거하는 암 치료법으로, 환자의 몸 속 면역체계를 활용하기 때문에 부작용이 비교적 적은 것으로 알려져 있습니다. 또한 환자의 면역 기능을 복원시켜 암을 이겨내는 형태로, 각각의 암에 적합한 타깃을 찾아내 직접적으로 공격하는 기존의 표적치료제와 비교하여 다양한 암에 적용이 가능하므로 혜택을 받을 수 있는 환자도 많게 됩니다. 이러한 신개념 항암제의 등장으로 최근 암 치료는 기존 화학 및 표적항암제에서 면역항암제로 이른바 '패러다임 전환(paradigm shift)'이 이루어지고 있으며, MSD, BMS, 로슈(Roche), 아스트라제네카(AstraZeneca) 등의 글로벌 제약사들이 신약개발에 성공하여 키트루다® , 옵디보® , 티센트릭® 및 임핀지® 등의 면역관문억제제를 출시해 시장을 주도하고 있습니다. 시장조사기관 GlobalData(2022.05)의 분석에 따르면 면역항암제 시장은 2021년 450억 달러의 시장규모를 이루었으며, 연평균 21.2 %의 지속적인 고속성장으로 2027년에는 1,400억달러 이상에 이를 것으로 전망되고 있습니다(출처: GlobalData, 2022.05).
| [글로벌 면역항암제 시장규모 현황 및 전망(2021-2027)] |
![이미지: [글로벌 면역항암제 시장규모 현황 및 전망 (2021_2027)]](%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EB%A9%B4%EC%97%AD%ED%95%AD%EC%95%94%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%EA%B7%9C%EB%AA%A8%20%ED%98%84%ED%99%A9%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D%20%282021_2027%29.jpg) |
|
[글로벌 면역항암제 시장규모 현황 및 전망 (2021_2027)] |
| 출처: Thematic Research Immuno-Oncology, GlobalData 2022.05 |
이처럼 면역관문억제제를 포함한 글로벌 면역항암제 시장은 매우 성장성이 높은 시장이며, 기존 제제들의 적응증 확대, 병용요법 및 수술 전/후 보조요법으로 적용 방식 확대, 신규 면역항암제의 출시 등으로 인해 지속적으로 고성장할 것으로 전망되며,경쟁력 있는 제품이 출시될 경우 높은 수익 기대가 가능합니다.
(나) 알레르기 질환 치료제
알레르기란 우리 몸의 면역 체계가 일반적으로 인체에 해롭지 않은 특정 물질에 대해 불필요한 면역반응을 일으켜 나타나는 질환입니다. 예를 들어 꽃가루나 집먼지 진드기와 같은 외부 원인 물질에 과민반응을 보이게 되며, 반응하는 신체 기관과 원인 물질에 따라 그 종류는 매우 다양합니다. 알레르기 질환은 산업화, 서구화된 현대사회에서 증가하고 유병률이 높은 만성 염증성 질환으로 사회 경제적인 비용과 질병 부담이 높은 질환입니다. 비교적 가벼운 증상인 피부 두드러기부터 땅콩 알레르기와 같이 음식에 반응하여 호흡을 곤란하게 하는 것과 같이 생명을 위협할 정도의 심각한 증상을 야기하기도 합니다.
알레르기 질환 치료제로써 스테로이드, 항히스타민제 등 증상을 완화하거나 중간산물을 차단할 수 있는 약물이 많이 사용되고 있으나, 최근에는 보다 근본적인 치료가가능한 면역치료제 또한 각광받고 있습니다.
주요 알레르기 질환 중 하나로서 천식, 만성 폐쇄성 폐질환 등 호흡기관에 영향을 미치는 만성 알레르기성 질환은 세계보건기구(WHO)에서 분류한 4대 주요 만성 질환에 포함될 만큼 질병 부담이 큰 질환으로 GlobalData 분석에 따르면 글로벌 주요 7개국의 천식 치료제 시장규모는 2019년 98억 달러에서, 2029년 112억 달러에 이를 것으로 전망됩니다. 글로벌 천식 시장에서 70% 이상을 차지하고 있는 미국의 2019년 천식 치료제 시장의 규모는 2019년 70억 달러(71% 점유)이며, 2029년에는 81억 달러 규모(72% 점유)로 확대될 것으로 예상됩니다(출처: GlobalData 2020.12).
| [주요 7개국 천식 치료제 시장규모 현황 및 전망] |
![이미지: [글로벌 주요 7개국 천식치료제 시장규모 현황 및 전망]](%5B%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EC%A3%BC%EC%9A%94%207%EA%B0%9C%EA%B5%AD%20%EC%B2%9C%EC%8B%9D%EC%B9%98%EB%A3%8C%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%EA%B7%9C%EB%AA%A8%20%ED%98%84%ED%99%A9%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D%5D.jpg) |
|
[글로벌 주요 7개국 천식치료제 시장규모 현황 및 전망] |
| 출처: Asthma - Global Drug Forecast and Market Analysis to 2029, GlobalData 2020.12 |
다른 일례로 아토피 피부염은 심한 가려움증과 염증을 동반하는 민성피부질환으로 유병률이 어린이가 10~20%, 어른은 1~3%으로 높은 편이며 (출처: Silverberg J., Dermatologic Clinics 2017, 35(3): 283-289), 복잡한 발생 원인으로 인해 환자의 유형 구분에 따라 각 기 다른 치료방법이 필요합니다. 이에 따라 현재 시판약물에 치료 반응을 보이지 않는 심각한 난치성 아토피 환자에 대한 미충족 수요로 인해 새로운 시장 창출의 기회가 큰 분야입니다. GlobalData(2022.10) 보고에 따르면, 글로벌 주요 7개국 아토피 피부염 치료제 시장 규모는 2020년 약 64억 달러를 기록했으며, 2030년에는 175억 달러 규모로 연간 10.6%의 성장률을 보이며 지속적으로 성장할 것으로 예상됩니다(출처: GlobalData 2022.10).
| [주요 7개국 아토피 피부염 치료제 시장규모 현황 및 전망] |
![이미지: [글로벌 주요 7개국 아토피 피부염 치료제 시장규모 현황 및 전망]](gii_%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EC%A3%BC%EC%9A%94%207%EA%B0%9C%EA%B5%AD%20ad%EC%B9%98%EB%A3%8C%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%EA%B7%9C%EB%AA%A8%20%ED%98%84%ED%99%A9%20%EB%B0%8F%20%EC%A0%84%EB%A7%9D.jpg) |
|
[글로벌 주요 7개국 아토피 피부염 치료제 시장규모 현황 및 전망] |
| 출처: Atopic Dermatitis: Seven-Market Drug Forecast and Market Analysis Update, GlobalData, 2022.10 |
(2) 산업의 성장성
당사는 두 개의 유효성분을 독자적 노하우로 결합한 이중단백질 의약품 및 이중항체치료제를 개발하고 있으며, 핵심 파이프라인으로서 면역항암제인 GI-101을 보유하고 있습니다. 면역항암제를 포함한 항암제 시장의 성장과 함께, 최근 병용요법의 개발이 본격적으로 진행되고 있는 개발 트랜드는 당사에게 큰 기회 요인으로 작용합니다.
병용투여 요법은 각기 다른 항암효과를 가진 치료 타깃에 대한 치료제들의 효능을 극대화할 수 있어 항암 효능의 상승효과(synergic effect)를 기대할 수 있으며, 최근의 면역항암제 연구개발 트렌드의 초점인 어떤 환자가 면역관문억제제에 반응하는지, 반응하는 환자 수를 어떻게 향상시킬 지에 대한 대안으로서, 다양한 방식으로 병용요법이 진행 중입니다. 기존의 이 중에서도 PD-1에 대한 항체인 키트루다® 및 옵디보® 를 중심으로 병용 요법에 대한 임상이 가장 활발하게 진행 중이며(출처: Jeffrey Weber et al.,The New England Journal of Medicine, 2017), 이들 항 PD-1 항체의 단독 투여로 부족한 항암 효과에 대해 자체 개발한 항체와 병용할 수 있는 적합한 파트너를 물색하는 방향으로 진행되고 있습니다. PD-1/PD-L1을 타깃으로 하는 면역관문억제제의 경우 총 4,400건의 단독 또는 병용 임상시험(2020년 9월)이 진행되고 있고, 이 중 병용임상시험은 총 3,498건에 이릅니다. 키트루다® 의 임상시험의 경우 단일요법이 2017년과 2020년에 각각 160건과 262건인 반면, 병용요법은 2017년과 2020년에 각각 397건과 937건으로 단일요법 대비 각 2.5배와 3.6배로 크게 증가했습니다(출처: Upadhaya, S. et al. Nature Reviews Drug Discovery, 2021).
| [항암제 병용투여 현황] |
![이미지: [면역항암제 중심 병용투여 조합 대상 현황]](%5B%EB%A9%B4%EC%97%AD%ED%95%AD%EC%95%94%EC%A0%9C%20%EC%A4%91%EC%8B%AC%20%EB%B3%91%EC%9A%A9%ED%88%AC%EC%97%AC%20%EC%A1%B0%ED%95%A9%20%EB%8C%80%EC%83%81%20%ED%98%84%ED%99%A9%5D.jpg) |
|
[면역항암제 중심 병용투여 조합 대상 현황] |
| 출처: Upadhaya, S. et al. Nature Reviews Drug Discovery (2021) 20:168-169) |
실제 당사의 주력 제품인 GI-101은 글로벌 제약사인 MSD(Merck & Co., Inc.)의 키트루다® 및 또 다른 글로벌 제약사인 아스트라제네카(Astrazeneca)의 임핀지® 와 병용요법을 공동으로 개발하고 있습니다.
또한 당사의 또 다른 주요 파이프라인 GI-301은 알레르기 질환에서 IgE를 포획하는 기능을 유지하면서 기존의 항체 의약품의 효능과 부작용을 보완할 수 있는 신규 물질로, 발병률이 증가하며 시장 규모가 확대되고 있는 알레르기 질환 시장에서 충분한 경쟁력을 확보할 수 있습니다.
나. 회사의 현황
(1) 영업개황 및 사업부문의 구분
(가) 영업개황
① 회사의 경쟁력
당사는 다양한 단백질 및 항체를 이용하여 최적의 안정성과 활성을 가지는 신규 이중융합단백질을 발굴하고 생산하는 고효율 스크리닝 시스템(high throughput screening system)인 GI-SMART™ 플랫폼 기술을 보유하고 있습니다. 해당 기술은 i) 이중융합단백질 구성요소인 Fc 도메인(crystallized fragment domain; Fc domain), 힌지(hinge), 링커(linker)의 24,190개 아미노산 서열 라이브러리 조합을 통해 이중융합단백질 구조 안정화를 수립하는 SMART-Selex™ 기술과 ii) 다양한 종류의 발현벡터 및 이중융합단백질 생산을 저비용 고효율로 할 수 있게 하는 SMART-cLego™ 기술 두 가지로 구성되어 있습니다. 당사는 이를 통해 타깃부터 선도물질 최적화까지 생산성과 구조적 안정성이 뛰어난 신규 이중융합단백질의 원스톱(one-stop) 조기 발굴이 가능합니다.
| [GI-SMART™ 플랫폼] |
![이미지: [GI-SMART™ 플랫폼]](gii_gi-smart%20%ED%94%8C%EB%9E%AB%ED%8F%BC.jpg) |
|
[GI-SMART™ 플랫폼] |
당사의 주요 두 파이프라인 모두 한국 또는 미국 식품의약품안전처의 허가 아래, GI-101은 임상 1/2상을, GI-301은 임상 1상을 진행하고 있습니다. 특히, 면역항암제 GI-101은 과학기술정보통신부의 '2020 국가연구개발 우수성과 100선'에 선정됨으로써 그 기술력을 인정 받은 바 있으며, 국가신약개발재단(KDDF)으로부터도 총 70억원 규모의 임상과제에 선정되어 임상시험 수행에 지원을 받고 있습니다. 이외에도 당사 플랫폼 기술로 추가 발굴한 신규 대사면역항암제인 GI-108은 KDDF으로부터 총 20억원 규모의 전임상과제에 선정됨으로써 당사의 신약 발굴 능력을 인정받은 바 있습니다.
또한, 당사는 면역치료제 후보군 발굴부터 임상 수행 까지의 역량을 보유한 바이오벤처사로 2건의 글로벌 기술이전을 통해 상업화 역량도 입증하였습니다. 전임상 단계의 면역항암제 GI-101을 중국 심시어(Simcere Pharmaceutical)에 7억9천만달러 규모로 기술이전하였고, 알레르기 치료제 GI-301 역시 전임상 단계에서 유한양행에 1조 4,090억원 규모로 기술이전하는 성과를 거두었습니다.
당사는 자체적인 후보물질 발굴 및 연구개발 외에도, MSD 및 아스트라제네카와 같은 글로벌 선도기업들과 공동임상 계약을 체결하는 등 다양하고 적극적인 협력을 추진하며 글로벌 경쟁력을 확보하고 있습니다. 이러한 개방형 혁신(open innovation)을 통해 글로벌 혁신 신약(first-in-class) 및 최고 신약(best-in-class) 파이프라인을 지속적으로 창출 및 확보하며, 기술이전 및 최종 개발 성공을 통해 글로벌 혁신 제약사로 발돋움하고자 합니다.
가) 면역항암제 GI-101
GI-SMART™ 플랫폼에서 발굴한 이중융합단백질로써 CD80의 세포외도메인과 IL-2 변이체를 결합하여 제작하였으며, 현재 한국과 미국에서 임상 1/2상을 진행 중에 있습니다. 또한, 2019년 11월 중국 제약사 심시어(Simcere Pharmaceutical)와 7억9천만 달러 규모의 기술이전 계약을 체결하였습니다.
하나의 약물에 CD80과 IL-2 변이체 2 개의 활성물질을 가지고 있어, i) CTLA-4의 저해와 ii) T 세포 활성을 위한 IL-2 수용체 자극의 2가지 면역활성 효과를 동시에 나타낼 수 있는 세계 최초의 first-in-class 신약입니다.
| [GI-101 개요] |
![이미지: [GI-101 개요]](gii_gi-101%20%EA%B0%9C%EC%9A%94.jpg) |
|
[GI-101 개요] |
당사는 암-면역 주기의 특성, 면역항암제의 미충족 의료 수요에 기반한 목표제품특성(target product profile; TPP)를 수립하였고, 전임상 단계에서 i) 면역항암제(면역관문억제제) 병용요법, ii) 표적항암제(혈관신생 억제제)와의 병용요법, iii) 방사선치료법과의 병용요법에서의 항암 상승 효능을 이미 확인하였습니다.
이를 바탕으로 GI-101은 현재 고형암을 대상으로 다양한 항암제와의 병용요법을 통해 임상적 효용성을 극대화시키는 데 우선순위를 두고 임상개발을 진행하고 있습니다.
따라서 당사는 i) 치료 경험이 없는 환자에서 GI-101과 면역항암제의 이제 병용요법, ii) 면역항암제 또는 표준치료에 실패한 환자에서의 2차 이상 치료제로서 GI-101과 면역항암제 이제 병용요법, iii) 면역항암제 또는 표준치료에 실패한 환자에서의 2차 이상 치료제로서 GI-101과 혈관신생 억제제 이제 병용요법, 또는 iv) 면역항암제 또는 표준치료에 실패한 환자에서의 2차 이상 치료제로서 GI-101과 방사선과의 이제 병용 요법 등의 임상개발을 수행 또는 수행 준비 중에 있습니다. 당사는 GI-101의 다양한 적응증을 대상으로한 임상 2상의 결과가 본격적으로 도출되는 2024년 글로벌 판권의 기술이전을 계획하고 있습니다.
나) 알레르기질환 치료제 GI-301
FcεRIα의 세포외도메인을 Fc 영역과 융합한 형태의 재조합 단백질로써, 현재 한국에서 임상 1상을 진행 중에 있습니다. 또한, 2020년 7월 ㈜유한양행과 1조 4,090억원 규모의 기술이전 계약을 체결하였습니다.
GI-301은 생체 내에 내에 존재하는 고 친화력 IgE 수용체인 FcεRI α 사슬의 서열 일부를 잘라 만든 것으로, 알레르기 원인물질인 IgE를 효과적으로 포획하는 IgE 트랩(trap)으로 작용하여 알레르기 반응을 억제할 수 있습니다. 또한 IgE에 결합할 수 있는 부위를 탐색하여 새롭게 만들어 낸 외부 물질인 기존의 항 IgE 항체들과 비교하여, 생체 내에서 불필요하게 약물에 대한 면역을 유발할 가능성 즉, 면역원성이 낮으며, 안전성이 높습니다. 뿐만 아니라, 항 IgE 항체와 달리, 비만세포를 활성화시키는 자가항체인 항 FcεRI 항체와도 결합해 그 작용을 억제함으로써, 만성 특발성 두드러기 발병을 억제할 수 있습니다.
또한 GI-301의 modified Fc(IgD/IgG4) 부위는 높은 유연성을 갖고 있을 뿐만 아니라 Fc 영역에 의한 세포독성인 항체의존성 세포매개 세포독성(antibody-dependent cellular cytotoxicity; ADCC)과 보체의존성 세포독성(complement-dependent cytotoxicity; CDC) 작용이 없습니다. 그리고 기존의 항 IgE 항체와 달리 IgG-의존적 아나필락시스 발생에 관여하는 FcγRII과 FcγRIII에 대한 결합력이 없어, 아나필락시스 부작용의 발생 가능성이 희박합니다.
| [GI-301 개요] |
![이미지: [GI-301 개요]](gii_gi-301%20%EA%B0%9C%EC%9A%94.jpg) |
|
[GI-301 개요] |
당사는 기존 항 IgE 항체 알레르기 치료제의 미충족 의료 수요에 기반한 목표제품특성(target product profile; TPP)를 수립하였고, 전임상 단계에서 다양한 알레르기 질환 모델 및 환자의 혈청을 이용한 실험에서 기존 치료제 대비 우수성을 이미 확인하였습니다.
이를 바탕으로 GI-301은 현재 임상 1상 단계임에도 불구하고 약물의 안전성 입증 뿐만 아니라, 기존 항 IgE 항체인 졸레어®(Xolair, 성분명: 오말리주맙(omalizumab)) 대비 GI-301의 효능 우위를 증명하는 데에도 중점을 두고 임상개발을 진행하고 있습니다. 최근 공개된 아토피가 있는 건강인 또는 경증의 알레르기 질환을 가지고 있는 대상자에서 GI-301(유한양행 코드명: YH35324)의 단일투여, 단계적 증량 임상 1a상결과, GI-301은 모든 용량군에서 졸레어® 대비 지속적이고 강력한 free IgE 억제 효과를 보였습니다. 당사는 아토피가 있는 건강인 또는 경증의 알레르기 질환을 가지고 있는 대상자에서 반복 투여, 단계적 증량 임상 1b상을 수행 중에 있으며, 추후 임상 1상 결과를 바탕으로, 만성 특발성 두드러기, 아토피 피부염, 음식 알레르기, 천식 등 다양한 IgE 매개 알레르기 질환으로 적응증을 확장할 예정에 있습니다.
또한 당사는 현재 진행하고 있는 임상 1상 결과를 바탕으로 일본 지역 기술이전을 위한 다양한 사업개발 활동을 진행하고 있습니다. 이와 더불엉 제3자 기술이전(sub-license) 조항에 따라, ㈜유한양행이 GI-301의 글로벌 사업권을 제3자에 이전시 수익금의 50%를 당사가 수령하게 되어 있어 이를 통한 추가 수익도 기대되고 있습니다.
② 경쟁 현황
가) 면역항암제 GI-101
당사가 면역항암제로 선두 파이프라인으로 개발 중인 GI-101은 CD80(CTLA-4를 타깃)과 IL-2 변이체(IL-2 수용체를 타깃)를 포함하는 이중융합 단백질로서, 기전적으로 면역관문 단백질인 CTLA-4 및 인터류킨 단백질 IL-2와 관련되어 있습니다. 현존하는 약물 중 당사의 GI-101과 같이 CTLA-4 및 IL-2 수용체를 동시에 타깃하는 단일 약물은 전무하지만, CTLA-4 또는 IL-2 수용체 각각을 타깃하여 임상 개발 중인 약물들은 아래와 같이 존재합니다(출처: 비엠에스, 아스트라제네카, 앨커미스, 로슈, 사노피 홈페이지, 보도자료).
| [CTLA-4 및 IL-2(2세대) 제제 개발 현황] |
|
타깃 |
제품명(또는 성분명) |
개발사 |
요법 및 허가 |
개발 현황 |
|
CTLA-4 |
여보이® /항 CTLA-4 항체 |
비엠에스 (BMS) |
단독 및 병용 요법/고형암 |
2011년 승인 및 출시 |
|
트레멜리무맙 /항 CTLA-4 항체 |
아스트라제네카 (AstraZeneca) |
단독 및 병용 요법/간암 |
2022년 허가 및 출시 |
|
|
IL-2 |
넴발류킨 알파 /IL-2 융합단백질 |
앨커미스 (Alkermes) |
Nemvaleukin alfa |
임상3상 |
|
RG7461 (simlukafusp alfa) /항 FAP-IL2 변이체 |
로슈 (Roche) |
RG7461 |
임상2상 |
|
|
RG7461 |
임상1b상 |
|||
|
RG6279 |
로슈 (Roche) |
단독 및 티센트릭®병용 요법 /고형암 |
임상1/2상 진행 중 |
|
|
SAR444245 /페길화 IL-2 |
사노피 (Sanofi) |
SAR444245 /소화기계암 |
임상2상 |
출처: 각 사 홈페이지, 보도자료
먼저, CTLA-4를 타깃하는 기전의 치료제로는 항 CTLA-4 항체인 BMS사의 여보이®(Yevoy, 성분명: 이필리무맙(ipilimumab))와 아스트라제네카(AstraZeneca)의 트레멜리무맙(tremelimumab)이 있습니다.
이중 여보이®는 2011년 FDA로부터 흑색종 치료제로 허가 받은 후 전이암, 신장암 그리고 대장암까지 치료제 용법을 확장하였습니다. 또한 신세포암에서는 여보이®와 옵디보®(Opdivo, 성분명: 니볼루맙(nivolumab))의 병용요법으로 허가를 받아 사용하고 있습니다. 하지만, 여보이®는 T 세포 활성화 및 증식으로 인하여 중증 및 사망을 초래하는 이상사례들이 보고된 바 있습니다. 뿐만 아니라 면역매개 반응들로 인해 소장대장염, 간염, 피부염(독성표피괴사를 포함), 신경병증 및 내분비병증 등과 같은 중증반응이 나타날 수 있다는 우려사항이 있는 약물입니다(출처: Leslie A Fecher et al., Oncologist, 2013).
한편, IL-2 수용체를 타깃하는 치료제와 관련하여, IL-2는 이미 항암치료제로 상용화 되어 있는 유일한 사이토카인(cytokine)으로서 프로류킨®(Proleukin, 성분명: 알데스류킨(aldesleukin))이라는 상표명으로 1992년 FDA로부터 전이성 피부암 및 신장암 치료에 대해 승인을 받아 사용되어 왔습니다(출처: Seyed Hamidreza Mahmoudpour et al., Scientific Reports, 2019). 프로류킨®은 항암 면역 반응에 중요한 T 세포 및 자연살해세포의 활성을 증가시키지만, 짧은 체내 반감기와 항암 면역반응을 억제하는 조절 T 세포의 증가를 유도하는 단점을 가지고 있습니다. 이에 따라 최근 프로류킨®의 단점들을 보완하는 전략으로 IL-2α 수용체에 대한 결합력을 감소시킨 2세대 IL-2 변이체들이 개발 중에 있습니다(출처: Rosmely Hernandez et al., Nature Reviews Immunology, 2022).
그 중 임상개발 단계의 경쟁 파이프라인으로는 앨커미스(Alkermes)의 넴발류킨 알파(nemvaleukin alfa), 사노피(Sanofi)의 SAR444245, 로슈(Roche)의 RG6279가 있으며, 이들 IL-2 변이체들은 기존 IL-2 제제의 미충족 수요를 해결하는 시장 내 기대감으로 인해 임상개발 단계에서의 공동 연구 및 인수합병이 활발히 진행되고 있습니다.
특히, 다국적 제약사인 사노피는 면역항암제 파이프라인 강화 목적으로, THOR-707(SAR444245) 파이프라인을 보유하고 있는 신톡스(Synthorx) 사를 2019년 25 억 달러에 인수했습니다. SAR444245는 차세대 페길화 IL-2로서 현재 임상2상 용량을 새롭게 설정하는 신규 임상1/2상을 준비 중에 있습니다(출처: 사노피사 홈페이지).
이처럼 IL-2 변이체 파이프라인의 공동 임상개발 및 인수합병 사례들을 살펴볼 때, 선택적인 효과 T 세포의 활성화가 가능한 IL-2 변이체의 면역항암제로의 효용 가능성에 대해 기술 및 시장 측면에서의 기대가 매우 큰 것으로 판단되며, 당사 파이프라인 가치에도 긍정적인 영향을 미칠 것으로 예상합니다.
특히, 현재 진행 중인 GI-101의 임상 1상 중간 결과, GI-101 단독요법만으로도 면역항암제 불응 환자에서 부분관해(partial response; PR) 및 표준치료 실패 환자에서 완전관해(complete response; CR)가 관찰되었을 뿐만 아니라, 키트루다®(Keytruda, 성분명: 펨브롤리주맙(pembrolizumab)) 병용요법에서 역시 면역항암제 불응 환자를 대상으로 부분관해(PR)가 관찰되었습니다. 이를 통해 GI-101은 기존 항암제의 의학적 미충족 수요를 충족시킬 수 있는 치료제가 될 것으로 기대됩니다.
나) 알레르기질환 치료제 GI-301
알레르기 치료에는 주로 약물치료제와 면역치료제가 사용되고 있습니다. 약물치료제는 알레르기 증상을 완화시키는 것을 목적으로 하며, 알레르기의 주요 체내 매개체인 히스타민의 작용을 억제하는 항 히스타민제(지르텍, 알레그라, 세티리진 등)와 면역억제 및 항염증 효과가 있어 천식 등 다양한 질환에 사용되고 있는 스테로이드제가 있습니다. 그러나 일부 환자는 이러한 치료로 증상이 조절되지 않아 전신 스테로이드를 반복적으로 사용하게 되며, 그에 따른 스테로이드 부작용이 치료의 부담으로 작용하고 있습니다.
한편, 면역치료제의 원리는 몸에 미량의 알레르기 항원을 장기간에 걸쳐 조금씩 투여해서 면역 체계가 더 이상 특정 알레르기 항원에 과민 반응하지 않게 만들어주는 것입니다. 증상의 완화는 물론 완치의 효과를 볼 수 있으나, 치료 기간이 2-3년 이상 걸리고 비용이 고가이며 한달에 2-4회 주사를 맞아야 하는 등의 어려움이 있습니다. 특히, 올해 11월 네슬레가 탈감작 요법을 이용한 땅콩 알레르기약인 팔포지아의 실패를 공식적으로 인정함으로써 해당 요법의 낮은 성공 가능성을 대변해 주었습니다.
최근 이에 대한 대안으로서 특정 생체표지자(biomarker)를 타깃하는 다양한 생물학적 제제가 개발되고 임상에 적용됨에 따라 생물학적 제제에 대한 관심이 증가하고 있습니다. 대표적으로 현재 시판 중인 항알레르기 생물학적 치료제로는 졸레어®이외에도, 듀피젠트®(Dupixent, 성분명: 두필루맙(dupilumab)), 싱케어®(Cinqair, 성분명: 레슬리주맙(reslizumab)) 등이 있습니다. 또한 임상 개발 중인 치료제로서 리겔리주맙(ligelizumab, QGE031)을 이용한 식품알레르기에 대한 임상 3상이 진행되고 있으며, 그 외 아토피 치료제인 일라이 릴리(Eli Lilly) 사의 레브리키주맙(lebrikizumab)과 천식 치료제인 암젠(Amgen)/아스트라제네카의 테제페루맙(tezepelumab) 등이 후기 임상 진행 중입니다(출처: 사노피, 테바, 노바티스, 일라이 릴리, 암젠, 아스트라제네카 홈페이지, 보도자료).
| [항알레르기 생물학적 제제 승인 및 개발 현황] |
|
타깃 |
제품명(또는 성분명) |
업체명 |
적응증 |
개발 현황 |
|
IgE |
졸레어® /항 IgE 항체 |
로슈/ 노바티스 |
만12세 이상 |
2003년 승인 및 출시 |
|
리겔리주맙 /항 IgE 항체 |
노바티스 |
만성 특발성 |
임상 3상 완료 후, 1차 평가변수 입증 실패 |
|
|
IL-4Rα |
듀피젠트® /항 IL-4Rα항체 (IL-4/IL-13 억제) |
사노피/ 리제네론 |
만 12세 이상 |
2017년 승인 및 출시 |
|
IL-5 |
싱케어® /항 IL-5 항체 |
테바 |
만18세 이상 중증 천식 환자 |
2017년 승인 및 출시 |
|
IL-5 |
누칼라®(메폴리주맙) |
글락소스미스클라인 |
중증 호산구성 |
2016년 승인 및 출시 |
|
IL-5 |
파센라®(벤랄리주맙) |
아스트라제네카 |
12세 이상의 중증 호산구 천식 환자 |
2017년 승인 및 출시 |
|
IL-13 |
레브리키주맙 /항 IL-13 항체 |
릴리 |
12세이상 중등증 내지 중증 아토피 피부염 환자 |
허가 당국 심사 중 |
|
TSLP |
테제펠루맙 /항 TSLP 항체 |
암젠/아스트라제네카 |
중증 천식치료 |
2021년 승인 및 출시 |
출처: 각 사 홈페이지, 보도자료
이 중, 로슈(Roche)와 노바티스(Novartis)가 공동개발한 졸레어®는 항 IgE 항체로써, 알레르기에서 기전적으로 중요한 IgE를 감소시킴으로써 증상을 완화시키는 약물로 2003년 FDA으로부터 첫 승인을 받았습니다. 초기에 알레르기성 천식 치료 용도로 쓰였으나, 항히스타민제와 스테로이드로도 낫지 않는 중증 만성 두드러기 치료제로 사용 영역이 확대되어 글로벌 치료제시장의 18%를 차지하고 있으며, 연매출은 32억 달러(2020년 기준)입니다. 그러나 졸레어®는 혈중 IgE 수치가 높은 환자에게서 충분한 치료 효과를 발휘하지 못하는 한계를 가지고 있으며 6세 이하의 소아에게는 사용이 불가능합니다(출처: 졸레어® 미국 FDA 의약품 라벨). 또한 물질특허가 2017년에 만료되어 많은 제약사가 바이오시밀러 개발을 진행하고 있으며 국내기업으로는 셀트리온이 2024년 시판을 목표로 졸레어® 바이오시밀러 개발을 진행 중에 있습니다.
또한 사노피(Sanofi)와 리제네론(Regeneron)이 공동 개발한 천식 및 아토피 피부염 치료제 두필루맙(두피센트®)은 중증 아토피 환자에게 효과가 클 것으로 기대되는 신약이며, 인터류킨 4 수용체(IL-4Rα) 차단을 통해 아토피 및 알레르기 질환에 관여하는 인터류킨 4(IL-4)와 인터류킨 13(IL-13)의 신호전달을 조절함으로써 알레르기 증상을 완화시킵니다(출처: Jennifer D Hamilton et al., ImmunoTherapy, 2015). 두필루맙은 아토피 피부염 환자들 뿐만 아니라 조절이 안되는 지속적인 소아 천식환자들에게서 효과, 호산구성 식도염, 식품ㆍ환경 알레르기, 만성 폐쇄성 폐질환(COPD) 및 기타 각종 피부질환 등 2형 염증에 의해 촉발되는 다른 질환들에도 적응증이 확장되고 있습니다. 두필루맙의 연간 치료제 가격은 3만 7,000달러로 알려져 있으며 2020년 매출은 34억 달러입니다. 약물의 우수성과 광범위한 적응증에 효과적이어서 글로벌 알레르기시장에서 급속한 신장세를 올리고 있으며 높은 점유율을 차지하지만, 상대적으로 타제품에 비해 높은 비용이 들며 복잡한 발병원인에 따른 미충족 수요가 여전히 존재하며, 특히 약물의 부작용으로 결막염을 유발하고 있습니다(출처: Alison D Treister et al., JAMA Dermatol, 2018).
당사는 이러한 기존 IgE 및 사이토카인류를 타깃으로 하는 제품 대비 기전적 차별성을 기반으로 생체 내 IgE를 강력하고 효과적으로 제거함으로써 다양한 IgE 매개 알레르기 질환에 적용 가능한 치료제를 개발하는 것을 목표로 하고 있습니다.
(나) 공시대상 사업부문의 구분
당사는 신약후보물질을 개발하는 연구개발 전문기업으로, 신약 후보물질을 초기 임상(임상 1상, 2a상) 이전에 기술이전하는 단일 사업부문을 영위하고 있습니다.
(2) 시장점유율
당사는 신약후보물질을 개발하는 연구개발 전문기업으로, 신약 후보물질을 초기 임상(임상 1상, 2a상) 이전에 기술이전하는 단일 사업부문을 영위하고 있습니다. 따라서 완제품(시판 신약)을 생산하고 있지 않아 시장점유율을 산출할 수 없습니다.
(3) 시장의 특성
상세한 내용은 [III. 경영참고사항 - 1. 사업의 개요 - 가. 업계의 현황] 부분을 참고하시기 바랍니다.
(4) 신규사업 등의 내용 및 전망
당사는 신약후보 물질 연구개발 회사로, 이외에 추진 중인 신규사업 등은 없습니다.
(5) 조직도
2023년 3월 31일 기준 당사 연구개발 조직으로는 장명호 사장 총괄의 디스커버리 부문, 중개전략부문, 임상 부문과 조영규 부사장 총괄의 SMART 플랫폼 부문 및 R&D 부문으로 구성되어 있습니다. 디스커버리, SMART 플랫폼, R&D 부문과 중개전략 및 임상 부문이 유기적으로 협력해 효율적인 연구개발 전략을 수립하고 신속한 기술이전 진행을 가능케 하고 있습니다. 당사의 연구개발조직은 2018년 5월 한국산업기술진흥협회로부터 기업부설연구소로 인증 받아 운영 중에 있습니다.
보고서 작성기준일 당사는 박사급 20명, 석사급 31명 등 총 63명의 연구개발 인력을 보유하고 있으며, 그 현황은 아래와 같습니다.
|
(기준일 : 2023년 3월 31일) |
|
대분류 |
세부 파트 |
주요 업무 내용 |
| 연구개발 총괄 (CTO) (1명) |
플랫폼 및 R&D 연구 총괄 | |
|
SMART 부문 |
SMART1팀 |
신규의약품 후보물질 Screening 및 초기공정확립 |
|
SMART2팀 |
유력 후보물질 구조 최적화 & 제형개발을 통한 안정성 확립 & 고생산 세포주 CHO 제작 |
|
|
R&D 부문 |
비임상팀 |
알레르기 치료제 비임상 연구개발/독성평가 수행 |
|
품질평가팀 |
단백질 의약품의 품질 규격 분석/분석법 연구 |
|
|
공정개발팀 |
단백질 의약품 공정개발 수행/임상시험용 의약품 생산관리 |
|
|
QA팀 |
R&D품질 및 특허 관리 |
|
| 신약개발 임상전략 총괄 (CSO) (1명) |
디스커버리, 중개전략, 임상 총괄 | |
| 디스커버리 부문 (1명) |
디스커버리1팀 |
대사질환 치료제 신규 타깃 발굴, 스크리닝, 비임상 효능평가 |
|
디스커버리2팀 |
항암제 신규 타깃 발굴, 스크리닝, 비임상 효능 평가 |
|
|
임상 부문 |
임상개발1팀 |
중개연구를 통해 독성 및 효능이 검증된 파이프라인의 임상 개발 전략 수립/ 임상연구, 개발, 운영 |
|
임상개발2팀 |
임상시험 디자인 수립, 글로벌 임상연구 운영, 임상시험 관련 대관업무 지원 |
|
|
임상학술팀 |
경쟁사 동향분석 및 임상 데이터 분석 |
|
|
임상PV팀 |
임상시험용 의약품 부작용 모니터링, 안전성 관련자료 작성등을 포함한 약물 감시업무 |
|
|
RA팀 |
IND 승인을 위한 문서작성, 검토, 제출 등 인허가 업무, 신약 개발을 위한 식약처 및 해외 보건 당국 대관업무 |
|
|
임상분석팀 |
임상시험 생체시료 분석법 (PK, immunogenicity, PD) 개발 및 검증, 임상시험 생체시료 분석 CRO (Bioanalytical lab) 관리 |
|
| 임상기획팀 (1명) |
임상부문장 직속의 임상기획 업무 | |
|
중개전략 부문 |
중개연구1팀 |
비임상 단계 개발 후보물질의 약효 평가, 효력 검증 및 약리 기전 연구 진행(GI-102) |
|
중개연구2팀 |
비임상 단계 개발 후보물질의 약효 평가, 효력 검증 및 약리 기전 연구 진행(GI-108) |
|
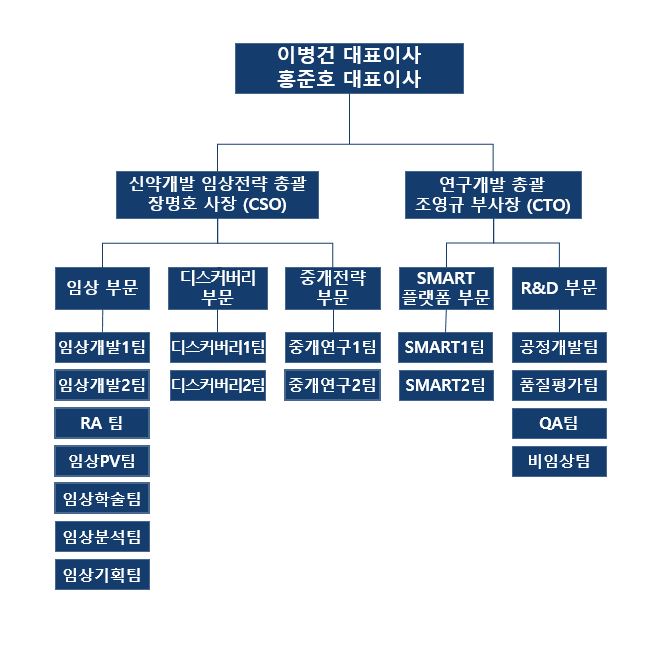 |
|
연구개발 부문 조직도 |
2. 주주총회 목적사항별 기재사항
□ 주식매수선택권의 부여
가. 주식매수선택권을 부여하여야 할 필요성의 요지
기존 우수한 인력의 장기근속을 유도하고 외부의 우수 인력 충원을 통해 핵심 경쟁력을 확보하고자 주식매수선택권을 부여하고자 합니다.
나. 주식매수선택권을 부여받을 자의 성명
| 성명 | 직위 | 직책 | 교부할 주식 | |
|---|---|---|---|---|
| 주식의종류 | 주식수 | |||
| 이병건 | 회장 | 대표이사 | 보통주 | 150,000 |
| 이우형 | 이사 | 팀장 | 보통주 | 20,000 |
| 김수현 | 이사 | 팀장 | 보통주 | 10,000 |
| 노은희 | 이사 | 팀장 | 보통주 | 6,000 |
| ㅇㅇㅇ외 11명 | 직원 | 직원 | 보통주 | 68,000 |
| 총 16 명 | - | - | - | 총 254,000 주 |
다. 주식매수선택권의 부여방법, 그 행사에 따라 교부할 주식의 종류 및 수, 그 행사가격, 행사기간 및 기타 조건의 개요
| 구 분 | 내 용 | 비 고 |
|---|---|---|
| 부여방법 | 신주교부, 자기주식교부, 차액보상 | - |
| 교부할 주식의 종류 및 수 | 보통주식 254,000주 | - |
| 행사가격 및 행사기간 | 1. 행사가격 - 주식매수선택권의 부여일을 기준으로 자본시장과 금융투자업에 관한 법률 시행령 제176조의7 제3항의 규정을 준용함 (주주총회 결의일 전일부터 과거2개월, 과거1개월, 과거1주간의 종가를 거래량으로 가중산술한 평균값을 산술평균하여 결정) 2. 행사기간 - 부여일로부터 2년이 경과한 날로부터 3년 이내 : 191,600주 - 부여일로부터 4년이 경과한 날로부터 3년 이내 : 62,400주 |
- |
| 기타 조건의 개요 | 기타 세부사항은 주식매수선택권과 관련된 제반 법규, 당사 정관, 계약서 등에 정하는 바에 따름 | - |
라. 최근일 현재 잔여주식매수선택권의 내역 및 최근년도 주식매수선택권의 부여, 행사 및 실효내역의 요약
- 최근일 현재 잔여주식매수선택권의 내역
| 총발행 주식수 |
부여가능 주식의 범위 |
부여가능 주식의 종류 |
부여가능 주식수 |
잔여 주식수 |
|---|---|---|---|---|
| 22,048,600 | 발행주식 총수의 15% | 보통주 | 3,307,290 | 1,471,416 |
- 최근 2사업연도와 해당사업연도의 주식매수선택권의 부여, 행사 및 실효내역
| 사업년도 | 부여일 | 부여인원 | 주식의 종류 |
부여 주식수 |
행사 주식수 |
실효 주식수 |
잔여 주식수 |
|---|---|---|---|---|---|---|---|
| 2023년 | - | - | - | - | - | - | - |
| 2022년 | 2022.3.3 | 27 | 보통주 | 488,000 | - | 14,000 | 474,000 |
| 2021년 | 2021.6.16 | 10 | 보통주 | 188,000 | - | 7,000 | 181,000 |
| 2021.3.26 | 8 | 보통주 | 201,000 | - | 25,000 | 176,000 | |
| 계 | - | 총( 45 )명 | 총( 877,000 )주 | 총( 0 )주 | 총( 46,000 )주 | 총( 831,000 )주 |
※ 기타 참고사항
해당사항 없음
IV. 사업보고서 및 감사보고서 첨부
가. 제출 개요
| 제출(예정)일 | 사업보고서 등 통지 등 방식 |
|---|---|
| - | - |
나. 사업보고서 및 감사보고서 첨부
해당사항 없음
※ 참고사항
| 해당사항 없음 |