 |
|
대표이사등의 확인 |
정 정 신 고 (보고)
| 2022년 12월 08일 |
1. 정정대상 공시서류 : 투자설명서
2. 정정대상 공시서류의 최초제출일 : 2022년 11월 07일
3. 정정사유 : 일정변경에 따른 기재정정
| 투자설명서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2022년 11월 07일 | 투자설명서 | 최초제출 |
| 2022년 11월 08일 | [기재정정]투자설명서 | 기재정정(초록색) |
| 2022년 11월 15일 | [기재정정]투자설명서 | 3분기 분기보고서 제출에 따른 기재정정(빨간색) |
| 2022년 12월 05일 | [기재정정]투자설명서 | 단순오기 기재정정(보라색) |
| 2022년 12월 08일 | [기재정정]투자설명서 | 일정 변경에 따른 기재정정(주황색) |
4. 정정사항
| 항 목 | 정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|
| - 단순 오타 및 표현 수정 등은 별도의 색깔표시 없이 정정하였습니다. | |||
| 공통정정 사항 |
|||
| 신주인수권증서 상장 및 거래기간 | 일정 변경에 따른 기재정정 | 2022년 12월 16일 ~ 2022년 12월 22일 |
2022년 12월 15일 ~ 2022년 12월 21일 |
| 신주인수권증서 상장폐지 | 2022년 12월 23일 | 2022년 12월 22일 | |
투 자 설 명 서
| 2022년 11월 07일 |
|
| ( 발 행 회 사 명 ) 주식회사 제넥신 |
|
| ( 증권의 종목과 발행증권수 ) 보통주 5,797,102주 |
|
| ( 모 집 또는 매 출 총 액 ) 89,855,081,000원 |
|
| 1. 증권신고의 효력발생일 : |
2022년 11월 05일 |
| 2. 모집가액 : |
15,500원 |
| 3. 청약기간 : |
구주주 청약일: 2023년 01월 02일 ~ 03일 일반공모 청약일: 2023년 01월 05일 ~ 06일 |
| 4. 납입기일 : |
2023년 01월 10일 |
| 5. 증권신고서 및 투자설명서의 열람장소 |
|
| 가. 증권신고서 : |
전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 일괄신고 추가서류 : |
- |
| 다. 투자설명서 : | 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : (주)제넥신 - 서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크 한국투자증권(주) - 서울특별시 영등포구 의사당대로 88 |
|
| 6. 안정조작 또는 시장조성에 관한 사항 | |
| 해당사항 없음 | |
| 이 투자설명서에 대한 증권신고의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 증권의 가치를 보증 또는 승인한 것이 아니며, 이 투자설명서의 기재사항은 청약일 전에 정정될 수 있음을 유의하시기 바랍니다. |
| ( 대 표 주 관 회 사 명 ) 한국투자증권(주) |
【 대표이사 등의 확인 】
 |
|
대표이사등의 확인 |
【 본 문 】
요약정보
1. 핵심투자위험
| 하단의 핵심투자위험은 증권신고서 본문에 기재된 투자위험요소 중 중요한 항목만을 투자자의 이해도 제고를 위하여 간단ㆍ명료하게 요약한 것입니다. 자세한 투자위험요소는 "본문-제1부 모집 또는 매출에 관한 사항-Ⅲ. 투자위험요소"에 기재되어 있으니 참고하시기 바랍니다. |
| 구 분 | 내 용 |
| 사업위험 | 가. COVID-19 유행, 러시아-우크라이나 전쟁 및 대내외 불확실성이 미치는 위험 세계 각국은 백신 개발과 코로나-19 확산 방지에 총력을 다하고 있습니다. 2021년 백신 접종을 시작으로, 세계 각국은 일정 수준 이상의 백신 접종률 달성을 위해 총력을 기울이고 있습니다. 그러나 코로나-19는 여전히 종식되지 않았으며, 각종 변이 코로나-19가 확산되는 등 장기화될 가능성이 존재합니다. IMF는 고물가, 고환율, 위험요인 장기화 등으로 높은 경기 하방위험이 있음을 전망하였으며, 2022년 경제성장률은 직전 전망치(2022년 07월) 3.2%와 동일한 3.2%를 전망하였고, 2023년 경제성장률은 직전 전망치(2022년 07월) 2.9% 대비 0.2%p 하향한 2.7%를 전망하였습니다. 국내 경기의 경우 최근 국내외 여건변화 등을 감안할때 경제성장률은 2022년 2.6%, 2023년 2.0% 수준을 나타낼 것이라고 전망하였습니다. 한국은행에 따르면 국내경제는 중국 봉쇄조치, 우크라이나 사태 등 대외여건 악화가 하방요인으로 작용하겠으나, 방역조치 완화 등에 힘입어 회복세를 지속할 것으로 예상하고 있습니다. 그러나, 향후 코로나19 바이러스의 변이에 의한 재확산, 실업률 증가, 금융 여건 악화 등 팬데믹 관련 위험 뿐만 아니라 우크라이나 사태, 주요국의 통화정책 긴축 움직임 등이 세계 경제에 부정적인 영향을 끼칠 수 있으며 특히 코로나19 확산세가 지속될 경우 경기 회복세가 더뎌질 수 있습니다. 국내 경기 또한 글로벌 COVID-19 팬데믹의 장기화 및 추후 재발 가능성과 더불어 소비 및 금융 시장 심리 악화, 러시아-우크라이나 전쟁의 장기화, 원자재 가격의 급격한 상승, 높은 인플레이션으로 인한 고강도 통화정책 실시 등 부정적인 요인들은 향후에도 경기 회복세가 둔화될 수 있는 가능성이 존재합니다. 나아가, COVID-19 이외에도 2022년 02월 24일 러시아가 우크라이나를 침공함으로써 러시아-우크라이나 전쟁이 발발하였습니다. 본 공시서류 제출일 현재 러시아-우크라이나 전쟁이 당사에 직접적으로 영향을 미칠지 여부는 미지수입니다. 따라서 투자자께서는 러시아-우크라이나 전쟁이 당사 및 당사가 영위하는 사업에 미칠 미칠 영향에 대해 면밀히 검토하시기 바랍니다. 나. 신약개발 특성에 따른 위험 신약 개발 과정은 후보물질의 유효성과 안전성을 평가하고 이에 대한 근거를 마련하기 위한 중요한 과정으로 관련 규정과 절차를 반드시 준수해야합니다. 먼저, 타겟 질환에 대해 약리적인 효과가 있을 것으로 예상되는 후보물질 탐색 및 발굴을 시작으로, 동물을 대상으로 하는 전임상 연구(preclinical study)와 사람을 대상으로 하는 임상 연구(clinical study)를 통해 후보물질의 안전성과 유효성에 대한 자료를 분석하여, 최종적으로는 규제 당국으로부터 자료의 적합성 심사를 통해 의약품 품목 허가를 받아야 합니다. 또한, 제품이 안전하고 일정한 품질 수준을 유지한 채 생산되어야 하기에 공정개발 및 검증이 동시에 성공적으로 진행되어야 합니다. 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 또한, 신약허가신청(BLA) 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 관리 규정을 따라야 합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공확률이 매우 낮은, 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 당사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실을 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있으므로 투자자 여러분께서는 이 점 유의하여 주시기 바랍니다. 다. 새로운 치료 요법 등장에 따른 시장 환경 변화 위험 면역항암제는 암세포가 획득한 면역억제 또는 면역회피 기전을 극복하기 위하여 면역체계의 종양 인지 능력 또는 파괴 능력을 회복 또는 강화시키는 기전의 약제로, 면역체계의 특이성, 기억력, 적응력을 증강시킴으로써 항암효과를 나타냅니다. 면역항암제는 면역관문억제제를 필두로 한 다수의 면역항암제에 관한 임상연구 및 시판 후 증례를 통해, 1세대 화학항암제, 2세대 표적항암제와 달리, 장기간 효과 지속, 장기 생존가능, 폭넓은 항암효과 및 낮은 부작용 등의 특성을 보여주고 있어, 기존 항암치료의 패러다임을 바꾸며, 암 표준치료 중의 하나로 자리매김하고 있습니다. 최근에는 암세포 또한 기본 대사과정인 성장, 노화, 사멸을 거친는 점을 고려하여, 암의 대사과정이 일어나지 않도록 대사물질을 차단하는 4세대 치료제인 대사항암제가 개발되고 있습니다. 암세포는 계속적으로 증식하는 특성으로 일반 세포에 비해 많은 에너지원을 사용하는 것으로 알려져있습니다. 암세포는 일반세포와 대비하여 100배 이상 많은 ATP를 생성하여 에너지를 생산하며, 때문에 이러한 암세포의 대사 기관인 미토콘드리아의 기능을 저해하거나 조절하는 등의 기전으로 새로운 치료의 방법이 개발되고 있습니다. 당사는 독자적인 지속형 항체 융합 단백질 기술인 hy-fc 플랫폼을 기반으로 T세포의 수를 증가시키는 인터루킨-7을 이용현 면역항암제를 연구개발하고 있는 바이오 회사로, 이 같은 글로벌 항암제 개발 트렌드에 부합하는 연구개발을 수행하고 있습니다. 또한 현재 개발중인 파이프라인은 다양한 암종을 대상으로 적응증 확대가 가능하며, 기존 항암제 및 당사 면역항암제 간의 병용요법을 통한 치료효과 개선이 가능합니다. 기존의 암 치료법을 개선하고, 효과를 증폭시켜 새로운 암 치료 시대를 열 수 있는 잠재력이 높은 기술로 기대되고 있습니다. 이외에도 hyFc 플랫폼 기술을 활용하여 지속형 빈혈치료제, 지속형 성장호르몬 등의 개발도 파트너사와의 협력으로 진행중입니다. 그러나, 이러한 당사의 기술 수준에도 불구하고, 새로운 치료법의 등장, 시장 환경의 변화, 신규 면역항암제 개발 등으로 글로벌 경쟁력 및 기준에 부합하지 않게 되는 경우, 당사의 사업계획 및 수익창출 등에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하여 주시기 바랍니다. 라. 경쟁 면역항암제 개발에 따른 경쟁 심화 위험 과거에는 암 치료를 위해 한가지 항암제만 처방하던 단일요법(Monotherapy)이 주류였으나 현재는 두 가지 또는 그 이상의 항암제를 동시에 혹은 순차적으로 처방하여 암을 치료하는 병용 요법(Combination Therapy)으로 패러다임이 변화하였습니다. 상호 보완적인 작용기전을 가지는 항암제를 동시에 혹은 순차적으로 처방할 경우 시너지 효과가 극대화되어 더욱 우수한 치료 효과를 나타내기 때문입니다. 이에 따라 다수의 바이오 제약사들은 면역항암제와 기존 항암제 혹은 면역항암제들 사이의 최적 조합의 병용요법 개발을 위하여 수많은 연구 및 개발을 진행하고 있습니다. 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황입니다. 항암제 시장의 높은 시장성을 보고 다수의 제약사들이 임상을 확대하여 속도를 내고 있다는 점은 당사 사업에 위협 요인으로 작용할 수 있습니다. 마. 충분한 제품화 사례가 없는 DNA백신 치료제의 불확실성 당사가 연구개발 중인 DNA백신은 현재 대부분 임상 또는 비임상 단계에 있어 가시적인 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. 2021년 8월 21일 인도 제약사 자이더스 캐딜라(Zydus Cadila)의 자이코브-디(ZyCov-D)가 세계 첫 DNA 기반 코로나19 백신이 긴급사용 승인받은 바 있지만 당사가 개발 중인 DNA백신 기반 바이오의약품 역시 임상 시험을 계획대로 진행하여 신약으로서 허가를 받아 제품화 된다고 하더라도, 시장 경쟁력 결여 등의 이유로 수익 창출에 실패할 가능성도 있습니다. 또한, 시판 과정에서 예상치 못한 부작용의 발견, 경쟁 제품 대비 약효 저하 등으로 인해 시판 후에라도 당사가 고려하고 있는 정도의 수익 창출에 실패할 가능성도 상존하고 있습니다. 바. 핵심연구인력 유출 위험 제약 및 바이오사업은 신규 의약품 개발 여부가 중요하며, 연구개발하는 과정에서 핵심 인력의 능력에 의존하고 있습니다. 당사는 바이오연구소와 임상개발실 두 곳으로 나누어 연구개발을 진행하고 있으며, 풍부한 경험과 연구개발 능력을 갖추는 것이 핵심 경쟁력임을 충분히 인지하고 있습니다. 이에 해당 핵심 연구인력 및 조직을 유지하기 위해 보상책을 제공하고 있으나, 그럼에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히 경쟁심화에 따른 당사 우수 인력 스카우트 등은 핵심기술 노하우 유출 등으로 이어질 수 있으며 이는 당사의 경쟁력을 약화시키며 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자분들께서는 이 점 참고하시기 바랍니다. 사. 지적재산권 침해에 따른 위험 당사가 영위하고 있는 제약 및 바이오 사업은 개발회사가 보유한 특화된 기술 및 제품화 능력에 의하여 성패가 결정되는 기술지향형 산업이며, 이를 영위하기 위해서는 기술보호가 필수적입니다. 당사 역시 신약 연구개발 기업으로서 기술 노하우 및 지적재산권의 보호를 사업을 영위하는데 있어 큰 비중을 차지하고 있는 핵심 사안으로 고려하고 있습니다. 이에 당사는 당사 핵심 기술 및 제품에 대한 권리를 보호할 수 있도록 국내뿐만 아니라 해외 에서도 특허 출원 및 등록을 진행하여 지식재산의 권리화에 힘쓰고 있습니다. 본 공시서류 제출일 현재 당사가 권리자인 특허에 대한 침해, 무효 주장에 관한 소송은 존재하지 아니하나 향후 제 3 자에 의하여 당사가 보유하고 있는 특허에 대한 침해, 무효 소송 또는 기타 분쟁이 발생할 가능성을 배제할 수 없고 당사가 해당 지식재산권을 효과적으로 관리하지 못하여 당사 특허가 무효 또는 소멸될 수 있으며, 이 경우 당사의 기술 및 사업경쟁력은 약화되어 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다. 아. 기술이전 지연 및 실패 위험 일반적으로 의약품의 개발은 각 국가의 규제 당국이 제시하는 단계에 따라 비임상 독성 시험, 임상 시험 (1, 2, 3상), 생산 공정개발 및 확립, 시판 승인 절차를 거쳐 최종적으로 상용화되기까지는 오랜 시간과 많은 비용이 소요되며, 많은 시간과 비용을 투자하였더라도 최종 제품으로 개발이 되는 확률은 매우 낮습니다. 이러한 신약개발의 특성상 당사를 포함한 많은 바이오기업들은 파이프라인 기술이전을 주요 사업모델로 하고 있습니다. 당사 또한 GX-I7, GX-188, GX-E4 등 여러 파이프라인 관련 기술이전 계약 및 계약금을 수취한 경험이 있고, 계약에 따라 마일스톤 및 로열티를 기대하고 있습니다. 기술이전 사업전략이 당사의 주요 사업화 전략임에 따라 현재도 지속적으로 파트너사와 관련 논의가 진행 중에 있습니다. 단, 당사의 계획과 달리 파트너사와의 협의가 원활히 이루어지지 않아 기술이전 계약이 취소되거나 규모가 축소될 경우, 파트너사의 임상개발 진행 및 규제당국의 승인 여부, 그리고 파트너사의 자금 상황으로 인해 대금 수취에 어려움이 생길 경우 사업에 부정적인 영향이 생길수 있으니 투자자분들께서는 이점 유의하시기 바랍니다. 자. 정부 정책 및 규제 변화에 따른 위험 당사는 바이오 의약품 연구개발을 수행함에 따라, 각 산업에 대한 안전성 관련 규제에 영향을 받을 수 있습니다. 특히 당사의 유전자 치료백신 연구개발의 경우, 동물 독성시험에서 안전성을 확인하였지만 임상시험에서 예상하지 못한 부작용이 발생할 수 있으며, 정부의 안정성에 대한 규제와 유전자치료제의 품질, 비임상, 임상시험의 규정 및 가이드라인의 규정 및 가이드라인을 준수하여야 합니다.또한,바이오 의약품 연구개발에 대한 정부의 정책 변화로 정부 지원이 축소 또는 변경되거나 임상 단계에서 적용되는 규정 등의 변화가 일어나는 경우, 사업에 부정적인 영향을 미칠 수 있으니 투자자분들께서는 이점 유의하시기 바랍니다. |
| 회사위험 |
가. 성장성 및 수익성 감소에 따른 위험 자. 정부 연구개발 과제 수행 관련 위험 당사는 설립 이래 총 71건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하였으며, 현재 진행중인 정부 과제에 대해서도 특이사항 없이 진행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔으며, 기술실시 권리를 가진 기술소유권자로서 해당 기술의 사업화를 위해 노력해왔습니다. 따라서 당사는 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
|
| 기타 투자위험 | 가. 신주의 환금성 제약 및 주가 변동에 따른 손실위험 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. 나. 증자방식, 청약절차에 대한 주의 및 주가하락 위험 당사의 금번 유상증자로 인하여 기발행주식 총수 25,144,982주의 23.05%에 해당하는 5,797,102주가 추가로 발행될 예정입니다. 본 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행됨에 따라 일반공모를 거쳐 배정 후에도 미 청약된 잔여주식에 대하여는 대표주관회사가 자기계산으로 잔액인수하게 됩니다. 만약 본 유상증자 청약에서 대량 실권이 발생하여 대표주관회사가 실권주를 인수하게 될 경우 주가에 어떠한 영향을 미칠지는 예상하기 어렵습니다. 다만, 대표주관회사가 당사 주식 인수 후 수익을 확정하기 위해 빠른 시일 내에 인수한 주식을 장내에서 매각하게 된다면 단기적으로 당사 주가에 악영향을 미칠 수 있으며, 대표주관회사가 인수한 주식을 일정 기간 보유하더라도 동 인수 물량이 잠재 매각 물량으로 존재하여 주가 상승에 부담으로 작용할 가능성이 있습니다. 대표주관회사가 최종 실권주를 인수할 경우, 당사는 실권주 인수금액의 9.0%를 추가수수료로 지급하게 됩니다. 이를 고려할 때, 대표주관회사의 실권주 매입단가는 일반청약자들 보다 9.0% 낮은 것과 같은 결과가 초래되어 인수 물량을 단기간에 처분하게 될 소지가 높을 것으로 예상되며 일시적으로 대규모 물량이 출회하여 주가가 하락할 가능성이 있습니다. 실질적으로 유상증자 청약자 및 대표주관회사는 신주상장 2영업일 전부터 입고예정 주식의 매도가 가능합니다. 투자자 여러분께서는 이 점에 유의하시어 투자에 임하시기 바랍니다. 다. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 크게 하락할 경우 당사가 계획했던 자금조달 계획 등에 차질이 발생할 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있으니 이 점 유의하시기 바랍니다. 라. 공시서류 정정에 따른 일정 변경 위험 본 공시서류는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다. 마. 분석정보의 한계 및 투자판단 관련 위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있습니다. 본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단하시기 바랍니다. 바. 집단 소송 제기 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있으니 이 점 유의하시기 바랍니다. 사. 유상증자 철회에 따른 위험 유상증자 진행 과정에서 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입 전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 아. 금융감독기관의 규제 강화에 따른 위험 최근 상장기업에 대한 관리감독기준이 강화되는 추세이며, 향후 당사가 상장기업 관리 감독기준을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지 실질심사, 상장폐지, 불성실법인 지정에 따른 벌금 및 벌점 부과 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있으니, 투자자께서는 이점 유의하시기 바랍니다. 자. 차입공매도 유상증자 참여 제한 관련 위험 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률과 시행령」이 개정되어 2021년 4월 6일부터 시행됨에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막 날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자 참여를 제한하되, 예외적인 경우에만 증자 참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 상기 사항을 위반 시 과징금 등의 제재 조치를 받을 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다. 차. 개인종합자산관리계좌(ISA) 납입한도에 따른 청약제한 위험 개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다. 카. 기타 투자자 유의사항 당사의 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우, 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 공시서류에 기재된 정보에만 의존하여 투자 판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 유의하시어 투자에 임하시기 바랍니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 5,797,102 | 500 | 15,500 | 89,855,081,000 | 주주배정후 실권주 일반공모 |
| 인수(주선) 여부 | 지분증권 등 상장을 위한 공모여부 | ||
|---|---|---|---|
| 인수 | 아니오 | 해당없음 | 해당없음 |
| 인수(주선)인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 한국투자증권 | 보통주 | 5,797,102 | 89,855,081,000 | - 인수수수료: 모집총액의 0.4% - 실권수수료: 잔액인수금액의 9.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2023년 01월 02일 ~ 2023년 01월 03일 | 2023년 01월 10일 | 2023년 01월 04일 | 2023년 01월 10일 | 2022년 11월 10일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2022년 09월 27일 | 2022년 12월 27일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 운영자금 | 89,855,081,000 |
| 발행제비용 | 483,573,774 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | 주요사항보고서(유무상증자결정)-2022.12.05 |
| 【기 타】 | 1) 금번 (주)제넥신의 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 한국투자증권(주)입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것입니다. 대표주관회사는 주주배정후 실권주 일반공모 후 최종실권주를 잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 모집 또는 매출에 관한 사항 - Ⅰ. 모집 또는 매출에 관한 일반사항 - 5. 인수 등에 관한 사항'을 참고하여 주시기 바랍니다. 3) 상기 모집가액 및 발행제비용은 예정가액으로 산정된 것으로 향후 변경될 수 있습니다. 확정가액은 구주주 청약 초일 전 제3거래일에 결정될 예정입니다. 4) 상기 청약기일은 구주주의 청약기일이며, 일반공모의 청약기일은 2023년 01월 05일 ~ 2023년 01월 06일(2영업일간)입니다. 일반공모 청약 공고는 2023년 01월 04일에 당사, 대표주관회사의 인터넷 홈페이지를 통해 게시될 예정입니다. 5) 일반공모 청약은 대표주관회사인 한국투자증권(주)의 본ㆍ지점, 홈페이지 및 HTS에서 가능합니다. 단, 구주주 청약 결과 발생한 실권주 및 단수주가 총 50,000주(액면가 500원 기준) 이하 이거나 배정하여야 할 주식의 공모금액이 1억원 이하일 경우에는 일반공모 청약을 하지 아니하고, 대표주관회사가 자기계산으로 인수할 수 있습니다. 6) 「자본시장과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 의거, 2022년 09월 27일부터 2022년 12월 27일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. 7) 금융감독원에서 본 증권신고서를 심사하는 과정에서 정정명령 조치를 취할 수 있으며, 정정 명령 등에 따라 본 신고서에 기재된 일정이 변경될 수 있습니다. 8) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 최초 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」 제165조의6 2항 1호에 의거 한국투자증권(주)와 주주배정후 실권주 일반공모에 대한 잔액인수 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 보통주 5,797,102주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 :원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 보통주 | 5,797,102 | 500 | 15,500 | 89,855,081,000 | 주주배정후 실권주 일반공모 |
| 주1) 최초이사회 결의일 : 2022년 09월 26일, 정정이사회 결의일 : 2022년 10월 20일 주2) 1주의 모집가액 및 모집총액은 1차 발행가액 기준으로 한 예정금액이며, 확정되지 않은 금액입니다. |
발행가액은 「증권의 발행 및 공시 등에 관한 규정」 제5-18조에 의거 주주배정 증자시가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (舊) 「유가증권의 발행 및 공시등에 관한 규정」 제57조의 방식을 일부 준용하여 'Ⅰ. 모집 또는 매출에 관한 일반사항의 3. 공모가격 결정방법'에 기재된 바와 같이 산정할 예정입니다.
■ 1차 발행가액의 산출근거
본 증권신고서의 1차 발행가액은 신주배정기준일 전 3거래일(2022년 11월 07일)을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용, 아래의 산식에 의하여 산정된 발행가액으로 합니다. 단, 할인율 적용에 따른 모집가액이 액면가액 이하일 경우에는 액면가액을 발행가액으로 합니다. (단, 호가단위 미만은 절상함)
※ 1차 발행가액 = [기준주가 * (1- 할인율) ] / [ 1 + ( 증자비율 * 할인율 ) ]
상기 방법에 따라 산정된 1차 발행가액은 참고용이며, 청약일전 3거래일에 확정발행가액을 공시할 예정입니다.
| [1차 발행가액 산정표] |
| 기산일 : 2022년 11월 07일 |
(단위: 원, 주) |
| 일자 | 가중산술평균주가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2022/11/07 | 21,718 | 66,288 | 1,439,611,050 |
| 2022/11/04 | 21,280 | 66,266 | 1,410,162,450 |
| 2022/11/03 | 21,827 | 66,398 | 1,449,248,600 |
| 2022/11/02 | 22,445 | 87,778 | 1,970,164,750 |
| 2022/11/01 | 22,240 | 38,514 | 856,533,850 |
| 2022/10/31 | 22,281 | 40,041 | 892,141,200 |
| 2022/10/28 | 22,452 | 51,377 | 1,153,538,950 |
| 2022/10/27 | 22,947 | 79,927 | 1,834,064,400 |
| 2022/10/26 | 22,644 | 67,824 | 1,535,830,850 |
| 2022/10/25 | 22,465 | 38,036 | 854,465,850 |
| 2022/10/24 | 22,573 | 66,854 | 1,509,116,300 |
| 2022/10/21 | 23,698 | 63,766 | 1,511,157,900 |
| 2022/10/20 | 22,035 | 81,188 | 1,788,980,150 |
| 2022/10/19 | 23,104 | 97,508 | 2,252,851,000 |
| 2022/10/18 | 22,886 | 97,509 | 2,231,604,150 |
| 2022/10/17 | 21,718 | 57,671 | 1,252,484,300 |
| 2022/10/14 | 21,723 | 138,204 | 3,002,179,300 |
| 2022/10/13 | 20,990 | 85,725 | 1,799,407,500 |
| 2022/10/12 | 21,676 | 87,456 | 1,895,687,000 |
| 2022/10/11 | 21,488 | 111,834 | 2,403,080,850 |
| 1개월 거래량 가중산술평균주가 (A) | 22,174 | - | |
| 1주일 거래량 가중산술평균주가 (B) | 21,909 | - | |
| 기산일 종가(C) | 21,850 | - | |
| (A),(B),(C)의 산술 평균 (D) | 21,977 | (A+B+C)/3 | |
| 기준주가 (E) | 21,850 | (C와 D중 낮은가액) | |
| 할인율 (F) | 25% | - | |
| 증자비율 (G) | 23.05% | - | |
| 1차 발행가액 (호가단위 미만은 호가단위로 절상, 액면가액 이하일 경우 액면가액을 발행가액으로 함) |
15,500 | 기준주가 × (1-할인율) / (1+유상증자비율 × 할인율 ) |
|
■ 공모일정 등에 관한 사항
당사는 2022년 09월 26일 최초 이사회를 통해 유무상증자 결의를 하였으며, 세부 일정은 다음과 같습니다
| [주요일정] |
| 날짜 | 업 무 내 용 | 비고 |
|---|---|---|
| 2022년 09월 26일 | 최초 이사회 결의 | 주요사항보고서 제출 |
| 2022년 09월 27일 | 증권신고서(예비투자설명서) 제출 | - |
| 2022년 09월 28일 | 신주발행공고 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.genexine.com) |
| 2022년 10월 20일 | 정정 이사회 결의 | 주요사항보고서 제출 |
| 2022년 11월 07일 | 1차 발행가액 확정 | 신주배정기준일 전 제3거래일 |
| 2022년 11월 09일 | 권리락 | 신주배정기준일 전 제1거래일 |
| 2022년 11월 10일 | 유상증자 신주배정기준일(주주확정) | - |
| 2022년 11월 22일 | 신주배정 통지 | - |
| 2022년 12월 15일 ~ 2022년 12월 21일 |
신주인수권증서 상장 및 거래 기간 | 5거래일 이상 동안 거래 |
| 2022년 12월 22일 | 신주인수권증서 상장폐지 | 구주주 청약초일 5거래일 전 폐지 |
| 2022년 12월 27일 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 전 |
| 2022년 12월 28일 | 확정 발행가액 확정 공고 | 당사 인터넷 홈페이지 (http://www.genexine.com) |
| 2023년 01월 02일 ~ 2023년 01월 03일 |
구주주 청약 | - |
| 2023년 01월 04일 | 일반공모청약 공고 | 당사 인터넷 홈페이지 (http://www.genexine.com) 한국투자증권 홈페이지 (http://www.truefriend.com) |
| 2023년 01월 05일 ~ 2023년 01월 06일 |
일반공모청약 | - |
| 2023년 01월 10일 | 주금납입/환불/배정공고 | - |
| 2023년 01월 12일 | 무상증자 신주배정기준일(주주확정) | - |
| 2023년 01월 26일 | 유상증자 신주상장 예정일 | - |
| 2023년 02월 02일 | 무상증자 신주상장 예정일 | - |
|
주1) 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
■ 무상증자 관한 사항
당사는 2022년 09월 26일 개최된 최초 이사회에서 무상증자를 결의하였으며, 2023년 01월 12일을 무상증자 신주배정기준일로 하여 유상증자 후 주주명부에 기재된 주주(자기주식 제외)에 대하여 소유주식 1주당 0.3주의 비율로 신주를 무상으로 배정(단수주 절사)하는 증자를 시행할 예정입니다. 금번 유상증자로 인해 발행되는 신주의 경우에도 자동적으로 무상증자에 참여하여 신주를 받을 수 있는 권리가 발생하게 됩니다.
[무상증자 개요]
| 구분 | 내용 |
|---|---|
| 무상증자 신주배정 기준일 | 2023년 01월 12일 |
| 무상증자 신주의 주당 발행가액 | 500원 |
| 무상증자 신주의 종류와 수 | 보통주 9,282,625주 |
| 1주당 신주배정 수 | 보통주 0.2999999936주 |
| 무상증자 신주의 재원 | 주식발행초과금 |
| 무상증자 신주권 유통 예정일 | 2023년 02월 02일 |
| 무상증자 신주상장 예정일 | 2023년 02월 02일 |
| 주1) 무상증자 신주의 수는 현재까지 발행한 주식의 총수에서 자기주식을 제외한 유통주식수에 금번 유무상증자 이사회 결의시 결의한 유상증자 주식수를 더한 주식수에 0.3을 곱한 주식수 입니다.(단수주 절사) |
2. 공모방법
| [공모방법 : 주주배정후 실권주 일반공모] |
| 모 집 대 상 | 주식수 | 비 고 |
|---|---|---|
| 구주주 청약 (신주인수권증서 보유자 청약) |
5,797,102주 (100.00%) |
- 구주 1주당 신주 배정비율 : 1주당 0.2305470729주 - 신주배정 기준일 : 2022년 11월 10일 - 구주주 청약일 : 2023년 01월 02일 ~ 2023년 01월 03일 (2일간) - 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권 증서가 배정됨) |
| 초과 청약 | - | - 「자본시장과 금융투자업에 관한 법률」 제165조의6 제2항제2호에 의거 초과청약 - 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2 - 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 |
| 일반모집 청약 (고위험고수익투자신탁, 벤처기업투자신탁 청약 포함) |
- | - 구주주 청약 후 발생하는 단수주 및 실권주에 대해 배정됨 |
| 합 계 | 5,797,102주 (100.00%) |
- |
|
주1) 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
▶ 구주주 1주당 배정비율 산출근거
| A. 보통주식 | 25,144,982 |
| B. 우선주식 | - |
| C. 발행주식총수 (A + B) | 25,144,982 |
| D. 자기주식 + 자기주식신탁 | - |
| E. 자기주식을 제외한 발행주식총수 (C - D) | 25,144,982 |
| F. 유상증자 주식수 | 5,797,102 |
| G. 증자비율 (F / C) | 23.05% |
| H. 구주주 1주당 배정비율 (F/ E) | 0.2305470729 |
| 주) 신주배정기준일 전 신주 발행, 주식관련사채의 권리행사, 주식매수선택권의 행사, 자기주식 및 자기주식신탁 등의 자기주식 변동 등의 과정에서 발생하는 단수주의 영향으로 인하여 1주당 배정주식수 및 증자비율이 변동될 수 있습니다. |
3. 공모가격 결정방법
■ 확정 발행가액 산정
「증권의발행및공시등에관한규정」 제5-18조 (유상증자의 발행가액 결정)에 의거, 주주배정 및 주주우선공모증자시 할인율 등이 자율화 되어 발행가는 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (舊)「유가증권발행및공시등에관한 규정」 제 57조의 방식을 일부 준용하여 발행가액을 산정합니다.
① 1차 발행가액 산정 : 신주배정기준일전 제 3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액을 기준주가로 하여 할인율 25%를 적용,다음의 산식에 의하여 산정된 발행가액을 1차 발행가액으로 합니다. 단, 호가단위 미만은 절상하며, 1주당 발행가액이 액면가 미만일 경우에는 액면가로 합니다.
| 기준주가 ×【 1 - 할인율(25%)】 | ||
| ▶ 1차 발행가액 | = | ------------------------------------- |
| 1 + 【증자비율 × 할인율(25%)】 |
② 2차 발행가액 산정 : 2차발행가액은 구주주 청약일전 제 3거래일을 기산일로 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 종가를 산술평균하여 산정한 가액과 기산일 종가 중 낮은 금액에 동일한 할인율(25%)을 적용하여 다음의 산식에 의하여 산정한 발행가액으로 합니다.
단, 호가단위 미만은 절상하며, 1주당 발행가액이 액면가 미만일 경우에는 액면가로 합니다.
▶ 2차 발행가액 = 기준주가 ×【1 - 할인율(25%)】
③ 확정 발행가액 산정 : 확정발행가액은 ① 의 1차발행가액과 ② 의 2차발행가액 중 낮은 가액으로 합니다. 단, 「자본시장과 금융투자업에관한법률」 제165조의6 및 「증권의 발행 및 공시에 관한 규정」제5-15조의2의 산출근거에 의거, 청약일 전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가를 기준주가로 할인율 40%를 적용하여 산정한 가액이 ① 의 1차발행가액과 ② 의 2차발행가액 중 낮은 가액을 초과하는 경우 동 금액을 확정 발행가액으로 합니다. (단, 호가단위 미만은 절상함)
▶ 확정 발행가액 = Max{Min[1차 발행가액, 2차 발행가액], 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가의 60%}
④ 모집가액 확정공시에 관한 사항 : 1차 발행가액은 신주배정기준일전 제3거래일(2022년 11월 07일)에 결정되어 2022년 11월 08일에 금융감독원 전자공시시스템에 공시될 예정이며, 확정 발행가액은 구주주청약일전 제3거래일(2022년 12월 27일)에 결정되어 2022년 12월 28일에 금융감독원 전자공시시스템에 공시될 예정이며, 정관에서 정한 당사 인터넷 홈페이지(http://www.genexine.com)에 공고하여 개별통지에 갈음할 예정입니다. 확정 발행가액 결정에 따라 정정 신고서(증권발행조건확정)가 금융감독원 전자공시시스템에 공시 됩니다.
※ 일반공모 발행가액은 구주주 청약시에 적용된 확정 발행가액을 동일하게 적용합니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 5,797,102 | ||||||||||||||||||||||||||||||||||||||
| 주당 모집가액 또는 매출가액 |
예정가액 | 15,500 | |||||||||||||||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||||||||||||||
| 모집총액 또는 매출총액 |
예정가액 | 89,855,081,000 | |||||||||||||||||||||||||||||||||||||
| 확정가액 | - | ||||||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
(1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수로 합니다. 다만, 신주배정기준일 현재 신주배정비율은 자기주식 변동으로 인하여 변경될 수 있습니다(단, 1주 미만은 절사한다).
|
||||||||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 (신주인수권증서 보유자) |
개시일 | 2023년 01월 02일 | ||||||||||||||||||||||||||||||||||||
| 종료일 | 2023년 01월 03일 | ||||||||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 개시일 | 2023년 01일 05일 | |||||||||||||||||||||||||||||||||||||
| 종료일 | 2023년 01월 06일 | ||||||||||||||||||||||||||||||||||||||
| 청약 증거금 |
구주주(신주인수권증서 보유자) | 청약금액의 100% | |||||||||||||||||||||||||||||||||||||
| 초 과 청 약 | 청약금액의 100% | ||||||||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | ||||||||||||||||||||||||||||||||||||||
| 납 입 기 일 | 2023년 01월 10일 | ||||||||||||||||||||||||||||||||||||||
| 배당기산일(결산일) | 2023년 01월 01일 | ||||||||||||||||||||||||||||||||||||||
| 주1) 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정 요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. 주2) 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
(1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
|---|---|---|
| 신주발행공고 및 배정기준일(주주확정일) 공고 |
2022년 09월 27일 | 당사 인터넷 홈페이지 (http://www.genexine.com) |
| 모집가액 확정의 공고 | 2022년 12월 28일 | 당사 인터넷 홈페이지 (http://www.genexine.com) |
| 실권주 일반공모 청약공고 | 2023년 01월 04일 | 당사 인터넷 홈페이지 (http://www.genexine.com) 한국투자증권(주) 홈페이지 (http://www.truefriend.com) |
| 실권주 일반공모 배정공고 | 2023년 01월 10일 | 한국투자증권(주) 홈페이지 (http://www.truefriend.com) |
| 주1) 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 홈페이지에 게시함으로써 개별통지에 갈음합니다. 주2) 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지(http://www.genexine.com)에 공고를 할 수 없는 때에는 서울시에서 발행되는 매일경제신문에 한다. |
(2) 청약방법
① 구주주 청약(신주인수권증서 보유자 청약) : 구주주 중 주권을 증권회사에 예탁한 주주(기존 "실질주주". 이하 "일반주주"라 합니다.)는 주권을 예탁한 증권회사의 본·지점 및 대표주관회사의 본ㆍ지점에서 청약할 수 있습니다. 다만, 구주주 중 명의개서대행기관 특별계좌에 주식을 가지고 있는 주주(기존 "명부주주". 이하 "특별계좌 보유자"라 합니다.)는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 대표주관회사의 본ㆍ지점에서 청약할 수 있습니다. 청약 시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출하여야 합니다.
| 2019년 09월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 한국투자증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
|
「주식ㆍ사채 등의 전자등록에 관한 법률」 |
② 초과청약 : 신주인수권증서 청약을 한자에 한하여 신주인수권증서 청약 한도 주식수의 20%를 추가로 청약할 수 있습니다. 이때, 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
a. 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수
b. 신주인수권증서청약 한도주식수 = 보유한 신주인수권 증서의 수량
c. 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 * 초과청약 비율(20%)
③ 일반공모 청약: 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자는「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약합니다. 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자의 청약 시, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구를 제외한 청약자의 한 개 청약처에 대한 복수청약은 불가능합니다. 또한 고위험고수익투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제18호에 따른 요건을 충족하고, 제9조제4항에 해당하지 않음을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다. 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제20호에 따른 요건을 충족하고, 제9조제10항에 따른 확약서 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
④ 청약은 청약주식의 단위에 따라 할 수 있으며 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 하고, 청약사무취급처는 그 차액을 납입일에 당해 청약자에게 반환하며, 이때 받은 날부터의 이자는 지급하지 않습니다.
⑤ 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」 제9조 제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 따라 투자설명서의 교부가 면제되는자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다.
⑥ 청약한도
a. 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.2305470729주를 곱하여 산정된 신주인수권증서(단, 1주 미만은 절사)와 초과청약가능 주식수(보유하고 있는 신주인수권증서 1주당 0.2주를 곱하여 산정된 수, 단 1주 미만은 절사)를 합한 주식수로 하되, 자기주식, 자사주신탁, 주식관련사채의 권리행사 등의 변동으로 인하여 구주주의 1주당 배정 비율은 변동될 수 있습니다.
b. 일반공모 청약자의 청약한도는 일반공모 총 공모주식 100% 범위 내로 하며, 청약한도를 초과하는 부분에 대해서는 청약이 없는 것으로 간주합니다.
⑦ 기타
a. 일반공모 배정을 함에 있어 이중청약이 있는 경우에는 그 청약자의 청약 전부를 청약하지 아니한 것으로 봅니다. 단, 구주주가 신주배정비율에 따라 배정받은 주식을 청약한 후 일반공모에 참여하는 경우에는 금지되는 이중청약이 있는 경우로 보지 않습니다. 단, 동일한 집합투자기구라도 운용주체(집합투자업자)가 다른 경우는 예외로 합니다.
b. 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 합니다.
c. 청약자는 '금융실명거래 및 비밀보장에 관한 법률'에 의거 실지 명의에 의해 청약해야 합니다.
d. 「자본시장과 금융투자업에 관한 법률」 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2022년 09월 27일부터 2022년 12월 27일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 「금융투자업규정」 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위(*)가 모집(매출)에 따른 주식을 취득하는 경우 (*) 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 |
(3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
한국투자증권(주)의 본ㆍ지점 | 2023년 01월 02일 ~ 2023년 01월 03일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 주식회사 제넥신의 주식을 예탁하고 있는 당해 증권회사 본ㆍ지점 2) 한국투자증권(주)의 본ㆍ지점 |
||
| 일반공모청약 (고위험고수익투자신탁 및 벤처기업투자신탁청약 포함) |
한국투자증권(주)의 본ㆍ지점 | 2023년 01월 05일 ~ 2023년 01월 06일 |
|
(4) 청약결과 배정방법
① 구주주(신주인수권증서 보유자) 청약 : '신주배정기준일' 18:00 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 본 주식을 1주당 0.2305470729주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 행사, 자기주식수의 변동 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
② 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주가 있는 경우, 실권주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율 : 배정 신주 1주당 0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다. (단, 초과청약 주식수가 실권주에 미달한 경우 100% 배정)
(i) 청약한도 주식수 = 신주인수권증서청약 한도주식수 + 초과청약한도 주식수
(ii) 신주인수권증서청약 한도주식수 = 보유한 신주인수권 증서의 수량
(iii) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 x 초과청약 비율(20%)
③ 일반공모 청약 : 상기 구주주 청약 및 초과청약 결과 발생한 실권주 및 단수주(이하 "일반공모 배정분"이라 한다)는 "대표주관회사"가 다음 각호와 같이 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」 제9조 제2항 제3호에 따라 고위험고수익투자신탁에 공모주식의 5%를 배정하고, 「증권 인수업무 등에 관한 규정」 제9조 제2항 제4호에 따라 벤처기업투자신탁에 공모주식의 30%를 배정한다. 나머지 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자 포함)에게 구분 없이 배정한다. 고위험고수익투자신탁에 대한 공모주식 5%와 벤처기업투자신탁에 공모주식의 30%와 개인투자자 및 기관투자자에 대한 공모주식 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정한다. 다만, 어떤 그룹에 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정한다.
(i) 일반공모에 관한 배정수량 계산시에는 "대표주관회사"의 "청약물량"("대표주관회사"의 청약처에서 일반공모 방식으로 접수를 받은 청약주식수를 의미한다)을 "일반공모 배정분" 주식수로 나눈 청약경쟁률에 따라 "대표주관회사"의 각 청약자에 배정하는 방식으로 한다.
(ii) 일반공모에 관한 배정시 "대표주관회사"의 "청약물량"이 "일반공모 배정분" 주식수를 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 한다. 다만, 고위험고수익투자신탁에 대한 공모주식 5%와 벤처기업투자신탁에 공모주식의 30%와 개인투자자 및 기관투자자(집합투자업자포함)에 대한 공모주식 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정한다. 다만, 어떤 그룹에 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정한다. 이후 최종 잔여주식은 최고청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사"가 합리적으로 판단하여 배정한다.
(iii) 일반공모 청약결과 "대표주관회사"의 "청약물량"이 "일반공모 배정분" 주식수에 미달하는 경우에는 청약주식수대로 배정한다. 배정결과 발생하는 잔여주식은 "대표주관회사"가 인수한다.
(iv) 단, "대표주관회사"는 「증권 인수업무 등에 관한 규정」 제9조 제2항에 의거 고위험고수익투자신탁, 벤처기업투자신탁, 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 이를 청약자에게 배정하지 아니하고 자기 계산으로 인수할 수 있다.
(5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」 제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 (주)제넥신, 대표주관회사인 한국투자증권(주)가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- 금번 유상증자에 청약하고자 하는 투자자께서는 (「자본시장과 금융투자업에 관한 법률」 제9조 제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제132조에 따라 투자설명서의 교부가 면제되는 자 제외) 청약하시기 전 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
- 투자설명서 수령거부 의사 표시는 서면, 전화ㆍ전신ㆍFAX, 전자우편 및 이와 비슷한 전자통신으로만 하여야 합니다.
① 투자설명서 교부 방법 및 일시
| 구분 | 교부방법 | 교부일시 |
|---|---|---|
|
구주주 청약자 |
1),2),3)을 병행 1) 등기우편 송부 2) "대표주관회사"의 본ㆍ지점 교부 3) "대표주관회사"의 홈페이지나 HTS, MTS에서 교부 |
1) 우편송부시 : 구주주청약초일인 2022년 12월 05일 전 수취 가능 2) "대표주관회사"의 본ㆍ지점 : 청약종료일 (2023년 01월 03일)까지 3) "대표주관회사”의 홈페이지 또는 HTS, MTS 교부 |
|
일반 청약자 |
1), 2)를 병행 1) "대표주관회사"의 본ㆍ지점에서 교부 2) "대표주관회사"의 홈페이지나 HTS, MTS 에서 교부 |
1) "대표주관회사"의 본ㆍ지점 2) "대표주관회사"의 홈페이지 또는 HTS, MTS 교부 |
| ※ 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다. |
② 확인절차
a. 우편을 통한 투자설명서 수령시
- 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
- HTS 또는 MTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
- 주주배정 유상증자 경우 유선청약이 가능합니다. 유선상으로 신분확인을 하신 후, 투자설명서 교부 확인을 해주시고 청약을 진행하여 주시기 바랍니다.
b. 지점 방문을 통한 투자설명서 수령시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
c. 홈페이지, HTS 또는 MTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
③ 기타
a. 금번 유상증자의 경우, 본 증권신고서의 효력발생 이후 주주명부상 주주에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는, 한국투자증권(주)의 본ㆍ지점 방문을 통해 인쇄물을 받으실 수 있으며, 또한 동일한 내용의 투자설명서를 전자문서의 형태로 한국투자증권(주)의 홈페이지에서 다운로드 받으실 수 있습니다. 한편, 일반공모 청약시 투자자께서는 대표주관회사에 방문하여 투자설명서 인쇄물을 수령하시거나 대표주관회사의 홈페이지에서 동일한 내용의 투자설명서를 전자문서의 형태로 다운로드 받으시는 2가지 방법으로 투자설명서를 교부받으실 수 있습니다. 다만, 전자문서의 형태로 교부 받으실 경우, 「자본시장과 금융투자업에 관한 법률」 제124조 제1항 각호의 요건을 모두 충족해야만 청약이 가능합니다.
b. 구주주 청약시 대표주관회사 이외의 증권회사를 이용한 청약 방법
- 해당 증권회사의 청약방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
|
※ 관련법규 「자본시장과 금융투자업에 관한 법률」 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자
1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 "전자문서수신자"라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 ② 누구든지 증권신고의 대상이 되는 증권의 모집 또는 매출, 그 밖의 거래를 위하여 청약의 권유 등을 하고자 하는 경우에는 다음 각 호의 어느 하나에 해당하는 방법에 따라야 한다. 1. 제120조제1항에 따라 증권신고의 효력이 발생한 후 투자설명서를 사용하는 방법 2. 제120조제1항에 따라 증권신고서가 수리된 후 신고의 효력이 발생하기 전에 발행인이 대통령령으로 정하는 방법에 따라 작성한 예비투자설명서(신고의 효력이 발생되지 아니한 사실을 덧붙여 적은 투자설명서를 말한다. 이하 같다)를 사용하는 방법 3. 제120조제1항에 따라 증권신고서가 수리된 후 신문ㆍ방송ㆍ잡지 등을 이용한 광고, 안내문ㆍ홍보전단 또는 전자전달매체를 통하여 발행인이 대통령령으로 정하는 방법에 따라 작성한 간이투자설명서(투자설명서에 기재하여야 할 사항 중 그 일부를 생략하거나 중요한 사항만을 발췌하여 기재 또는 표시한 문서, 전자문서, 그 밖에 이에 준하는 기재 또는 표시를 말한다. 이하 같다)를 사용하는 방법 ③ 집합투자증권의 경우 제2항에도 불구하고 간이투자설명서를 사용할 수 있다. 다만, 투자자가 제123조에 따른 투자설명서의 사용을 별도로 요청하는 경우에는 그러하지 아니하다. <신설 2013. 5. 28.> ④ 제1항 및 제3항에 따라 집합투자증권의 간이투자설명서를 교부하거나 사용하는 경우에는 투자자에게 제123조에 따른 투자설명서를 별도로 요청할 수 있음을 알려야 한다. <신설 2013. 5. 28.>
1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 전문투자자 나. 삭제 <2016. 6. 28.> 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사ㆍ감정인ㆍ변호사ㆍ변리사ㆍ세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주[「금융회사의 지배구조에 관한 법률」 제2조제6호가목에 따른 최대주주를 말한다. 이 경우 "금융회사"는 "법인"으로 보고, "발행주식(출자지분을 포함한다. 이하 같다)"은 "발행주식"으로 본다. 이하 같다]와 발행주식 총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는 그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자 제132조(투자설명서의 교부가 면제되는 자) 1. 제11조제1항제1호다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화ㆍ전신ㆍ팩스, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. |
(6) 주권 유통에 관한 사항
- 주권유통개시(예정)일: 2023년 01월 26일(유상증자 신주) (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
(7) 청약증거금의 대체 및 반환 등에 관한 사항
- 청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다. 일반공모 총 청약주식수(기관투자자 포함)가 일반공모주식수를 초과하여 청약증거금이 발생한 경우, 그 초과 청약증거금은 2023년 01월 10일부터 해당 청약사무 취급처에서 환불합니다.
(8) 주금납입장소 : 우리은행 서울성모병원
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2022년 11월 10일 | 한국투자증권(주) | 00160144 |
(1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」 제165의 6조 3항 및 「증권의발행및공시등에관한규정」 제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
(2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 09월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
(3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 한국투자증권(주)로 합니다.
(4) 신주인수권증서 매매 등
① 금번 유상증자시 신주인수권증서는 전자증권제도 시행 이후에 발행되고 상장될 예정으로 실물은 발행 되지 않고 전자증권으로 등록발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
② 신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자 계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일 내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(5) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 한국투자증권(주)의 본ㆍ지점을 통해 해당 신주인수권증서에 기재되어 있는 수량(초과청약이 있는 경우 초과청약 가능수량이 합산된 수량)만큼 청약할 수 있으며 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
(6) 신주인수권증서의 상장
당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2022년 12월 15일부터 2022년 12월 21일까지 5거래일간으로 예정하고 있으며, 동 기간중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2022년 12월 22일에 상장폐지될 예정입니다. 「코스닥시장 상장규정」 제83조(신주인수권증권 및 신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제85조(신주인수권증권 및 신주인수권증서의 상장폐지)에 따라 신주청약 개시일 5거래일전에 상장폐지되어야 함)
|
※ 관련법령 제165조의6(주식의 발행 및 배정 등에 관한 특례) ③ 주권상장법인은 제1항제1호의 방식으로 신주를 배정하는 경우 「상법」 제416조제5호 및 제6호에도 불구하고 주주에게 신주인수권증서를 발행하여야 한다. 이 경우 주주 등의 이익 보호, 공정한 시장질서 유지의 필요성 등을 고려하여 대통령령으로 정하는 방법에 따라 신주인수권증서가 유통될 수 있도록 하여야 한다. 제176조의8(주식의 발행 및 배정에 관한 방법 등) ④ 법 제165조의6제3항 후단에서 "대통령령으로 정하는 방법"이란 다음 각 호의 어느 하나에 해당하는 방법을 말한다. 1. 증권시장에 상장하는 방법 2. 둘 이상의 금융투자업자(주권상장법인과 계열회사의 관계에 있지 아니한 투자매매업자 또는 투자중개업자를 말한다)를 통하여 신주인수권증서의 매매 또는 그 중개ㆍ주선이나 대리업무가 이루어지도록 하는 방법. 이 경우 매매 또는 그 중개ㆍ주선이나 대리업무에 관하여 필요한 세부사항은 금융위원회가 정하여 고시한다.
제83조(신주인수권증권 및 신주인수권증서의 신규상장) ② 신주인수권증권을 신규상장하려면 다음 각 호의 심사요건을 모두 충족하여야 한다. 1. 신주인수권증권의 발행회사의 주식(외국주식예탁증권을 포함한다. 이하 이 장에서 같다)이 코스닥시장에 상장되어 있을 것 2. 신주인수권증권의 발행회사의 상장 주식이 상장신청일 현재 이 규정에 따른 관리종목으로 지정되지 않고, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유에 해당되지 않을 것 3. 신주인수권증권의 발행총수가 1만 증권 이상일 것. 이 경우 해당 증권의 목적인 신주가 액면주식인 경우에는 액면가액 5,000원을 기준으로 한다. 4. 신주인수권증권의 잔존 권리행사기간이 상장신청일 현재 1년 이상일 것 5. 신주인수권부사채권이 모집 또는 매출로 발행되었을 것. 다만, 주주에게 해당 사채권의 인수권이 주어진 경우에는 그러하지 아니하다. ③ 신주인수권증서를 신규상장하려면 다음 각 호의 심사요건을 모두 충족하여야 한다. 1. 신주인수권증서의 발행회사의 주식이 코스닥시장에 상장되어 있을 것 2. 신주인수권증서의 발행회사의 상장 주식이 상장신청일 현재 이 규정에 따른 관리종목으로 지정되지 않고, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유에 해당되지 않을 것 3. 신주인수권의 양도를 허용하고, 신주인수권을 갖는 모든 주주에게 신주인수권증서를 발행하였을 것 4. 신주인수권증서의 발행총수가 1만 증서 이상일 것. 이 경우 해당 증서의 목적인 신주가 액면주식인 경우에는 액면가액 5,000원을 기준으로 한다. 5. 신주인수권증서의 거래 가능 기간이 5일(매매거래일을 기준으로 한다) 이상일 것 제85조(신주인수권증권 및 신주인수권증서의 상장폐지) 1. 신주인수권증권의 목적인 주식이 관리종목으로 지정되거나, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 2. 신주인수권증권의 목적인 주식에 대한 상장폐지 신청으로 해당 주식이 상장폐지되는 경우 3. 신주인수권 행사기간이 만료되거나 행사가 완료된 경우 4. 그 밖에 공익 실현과 투자자 보호를 위하여 거래소가 신주인수권증권의 상장폐지가 필요하다고 인정하는 경우 ② 거래소는 신주인수권증서가 다음 각 호의 어느 하나에 해당하는 경우 해당 신주인수권증서의 상장을 폐지한다. 1. 신주인수권증서의 목적인 주식이 관리종목으로 지정되거나, 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 2. 신주인수권증서의 목적인 주식에 대한 상장폐지 신청으로 해당 주식이 상장폐지되는 경우 3. 신주 청약 개시일의 5일(매매거래일을 기준으로 한다) 전이 된 경우. 다만, 신주인수권증서의 유통상황을 고려하여 세칙으로 정하는 경우에는 그 기간 전으로 한다. 4. 그 밖에 공익 실현과 투자자 보호를 위하여 거래소가 신주인수권증서의 상장폐지가 필요하다고 인정하는 경우 |
(7) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과 협의된 신주인수권증서 상장시의 제반 거래관련 사항은 다음과 같습니다.
① 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
② 일반주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 기존 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2022년 12월 15일부터 2022년 12월 21일까지(5거래일간) 거래 | 신주배정통지일(2022년 11월 22일(예정))부터 신주인수권증서의 상장거래 마지막 날 이후 제2영업일(2022년 12월 23일)까지 거래 |
| 주1) | 상장거래 : 2022년 12월 15일부터 2022년 12월 21일까지(5영업일간) 거래 가능합니다. |
| 주2) | 계좌대체거래 : 신주배정통지일인 2022년 11월 22일(예정)부터 2022년 12월 23일까지 거래 가능합니다. -> 신주인수권증서 상장거래의 결제일인 2022년 12월 23일까지 계좌대체(장외거래) 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다. |
| 주3) | 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다. |
③ 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
a. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여 또는 신주인수권증서의 매매가 가능합니다.
b. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
(1) 본 증권신고서는 공시심사 과정에서 일부 내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자 시 이러한 점을 감안하시기 바랍니다.
(2) 「자본시장과 금융투자업에 관한 법률」 제120조 3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
(3) 본 증권신고서에 기재된 내용은 신고서 제출일 현재까지 발생된 것으로 본 신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익상황에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다. 따라서, 주주 및 투자자가 투자의사를 결정함에 있어 유의하여야 할 사항이 본 증권신고서상에 누락되어 있지 않습니다.
(4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
(5) 본 증권신고서의 예정 모집가액은 확정되어 있는 것은 아니며, 청약일 3거래일 전에 확정 발행가액을 산정함으로써 확정될 예정입니다. 또한, 본 증권신고서의 발행예정금액은 추후 주당 발행가액이 확정되는 내용에 따라 변경될 수 있음을 유의하여 주시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
|---|---|---|---|
| 대표주관회사 | 한국투자증권(주) | 인수주식의 종류: 보통주 인수주식의 수: 인수한도 의무주식수 X 인수비율(100%) |
- 인수수수료: 모집총액의 0.4% - 추가수수료: 잔액인수금액의 9.0% |
| 주1) 잔여주식총수: 구주주청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 주2) 모집총액 : 최종 발행가액 X 총 발행주식수 주3) 상기 일반공모를 거친 후에도 미청약된 잔여주식에 대하여는 대표주관회사가 인수계약서 상 인수의무주식수를 한도로 하여 인수의무주식수만큼 자기 책임 하에 인수하기로 합니다. |
II. 증권의 주요 권리내용
1. 액면금액 : 보통주 1주당 500원
|
※ 당사의 정관 (이하 동일) 주식 1 주의 금액은 500 원으로 한다. |
2. 주식에 관한 사항
|
제5조(발행예정주식총수) 제7조(1주의 금액) 주식 1 주의 금액은 500 원으로 한다. 제 8 조(주식 및 주권의 종류) 회사는 주식, 사채 등의 전자등록에 관한 법률. 제2조 제1호에 따른 주식등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식등을 전자등록하여야 한다. |
3. 의결권에 관한 사항
|
제30조(주주의 의결권) 주주의 의결권은 1주마다 1개로 한다. 제31조(상호주에 대한 의결권 제한) 회사, 회사와 회사의 자회사 또는 회사의 자회사가 다른 회사의 발행주식총수의 10 분의 1 을 초과하는 주식을 가지고 있는 경우, 그 다른 회사가 가지고 있는 이 회사의 주식은 의결권이 없다. 제32조(의결권의 불통일행사) ① 2 이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3 일전에 회사에 대하여 서면으로 그 뜻과 이유를 통지하여야 한다. 제33조(의결권의 대리행사) ① 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있다. |
4. 신주인수권에 관한 사항
| 제 12 조(신주인수권) ① 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다. ② 회사는 제 1 항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 이외의 자에게 신주를 배정할 수 있다. 1. 발행주식총수의 100 분의 30 을 초과하지 않는 범위 내에서 .자본시장과 금융투자업에 관한 법률. 제 165 조의 6 에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 상법 제 542 조의 3 에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100 분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4. .근로자복지기본법. 제 39 조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 발행주식총수의 100 분의 50 을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 6. 발행주식총수의 100 분의 50 을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산·판매·자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 주권을 유가증권시장 또는 코스닥시장에 신규 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 ③ 제 2 항 각호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. ④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. |
5. 배당에 관한 사항
|
제 14 조(신주의 배당기산일) 제 8 조(주식 및 주권의 종류) 제 9 조 (1 종 종류주식의 수와 내용) 제9조의 3(의결권배제주식) ① 본 회사는 이사회 결의로 발행주식총수의 2분의1 범위 내에서 관련 법령상 허용되는 한도까지 의결권이 배제되는 주식을 발행할 수 있다. ② 본 회사가 유상증자, 무상증자 또는 주식배당을 실시하는 경우 의결권배제주식에 대한 신주의 배정은 유상증자 및 주식배당의 경우에는 이사회 결의에 따라 그와 같은 종류의 주식 또는 그와 다른 종류의 주식으로 할 수 있으며 무상증자의 경우에는 그와 같은 종류의 주식으로 한다. ③ 이익배당우선주식을 제1항의 의결권이 배제되는 주식으로 발행하는 경우, 이사회는 동 이익배당우선주식에 대하여 소정의 배당을 하지 아니한다는 결의가 있는 경우 그 결의가 있는 총회의 다음 총회부터 그 우선적 배당을 한다는 결의가 있는 총회의 종료 시까지 의결권이 있는 것으로 정할 수 있다. 제 58 조(이익배당) |
III. 투자위험요소
| 【투자자 유의사항】 |
|---|
| ■ 금번 유상증자를 청약하고자 하는 투자자들은 투자결정을 하기전에 증권신고서의 다른 기재 부분 뿐만 아니라 특히 아래 기재된 투자위험요소를 주의깊게 검토한 후 이를 고려하여 최종적인 투자판단을 하시기 바랍니다. ■ 당사는 본 증권신고서를 통하여 청약 전에 투자자께서 숙지하셔야 하는 부분에 대하여 성실히 기재하고자 노력하고 있습니다. 다만, 당사가 현재 알고 있지 못하거나 중요 하지 않다고 판단하여 아래 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수 없으므로, 투자자는 아래 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 자신의 독자적이고도 세밀한 판단에 의해야 합니다. 따라서 증권신고서에 기재된 사항은 투자 판단 시 참고 자료로 활용하실 것을 권고드리며, 투자자의 투자 판단에 대한 결과는 투자자 본인에게 귀속됨을 다시 한번 알려드립니다. ■ 만일, 아래 기재한 투자위험요소가 실제로 발생하는 경우, 당사의 사업, 재무상태, 기타 영업활동에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있음을 유의하시기 바랍니다. ■ 2009년 2월 4일 부로 시행된 『자본시장과 금융투자업에 관한 법률』제124조에 의거 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자 (전문투자자, 그밖에 대통령령으로 정하는 자를 제외함) 에게 적합한 투자설명서를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 안됩니다. 다만, 『자본시장과 금융투자업에 관한 법률 시행령』제132조에 의거하여 투자설명서를 받기를 거부한다는 의사를 서면으로 표시한 자는 투자설명서의 교부없이 청약이 가능합니다. ■ 본 공시서류의 기재사항은 투자 결정을 위한 참고사항일 뿐이며, 투자에 대한 모든 손익 및 투자책임은 투자자 본인에게 귀속됨을 다시 한 번 말씀드립니다. |
1. 사업위험
| [안내 사항] |
| ■ 하기 위험 항목에 기재된 내용 관련 용어 해설은 본 공시서류 내 '제2부 발행인에 관한 사항 - II. 사업의 내용 - 1. 사업의 개요'를 참고해주시기 바랍니다. |
| 가. COVID-19 유행, 러시아-우크라이나 전쟁 및 대내외 불확실성이 미치는 위험 세계 각국은 백신 개발과 코로나-19 확산 방지에 총력을 다하고 있습니다. 2021년 백신 접종을 시작으로, 세계 각국은 일정 수준 이상의 백신 접종률 달성을 위해 총력을 기울이고 있습니다. 그러나 코로나-19는 여전히 종식되지 않았으며, 각종 변이 코로나-19가 확산되는 등 장기화될 가능성이 존재합니다. IMF는 고물가, 고환율, 위험요인 장기화 등으로 높은 경기 하방위험이 있음을 전망하였으며, 2022년 경제성장률은 직전 전망치(2022년 07월) 3.2%와 동일한 3.2%를 전망하였고, 2023년 경제성장률은 직전 전망치(2022년 07월) 2.9% 대비 0.2%p 하향한 2.7%를 전망하였습니다. 국내 경기의 경우 최근 국내외 여건변화 등을 감안할때 경제성장률은 2022년 2.6%, 2023년 2.0% 수준을 나타낼 것이라고 전망하였습니다. 한국은행에 따르면 국내경제는 중국 봉쇄조치, 우크라이나 사태 등 대외여건 악화가 하방요인으로 작용하겠으나, 방역조치 완화 등에 힘입어 회복세를 지속할 것으로 예상하고 있습니다. 그러나, 향후 코로나19 바이러스의 변이에 의한 재확산, 실업률 증가, 금융 여건 악화 등 팬데믹 관련 위험 뿐만 아니라 우크라이나 사태, 주요국의 통화정책 긴축 움직임 등이 세계 경제에 부정적인 영향을 끼칠 수 있으며 특히 코로나19 확산세가 지속될 경우 경기 회복세가 더뎌질 수 있습니다. 국내 경기 또한 글로벌 COVID-19 팬데믹의 장기화 및 추후 재발 가능성과 더불어 소비 및 금융 시장 심리 악화, 러시아-우크라이나 전쟁의 장기화, 원자재 가격의 급격한 상승, 높은 인플레이션으로 인한 고강도 통화정책 실시 등 부정적인 요인들은 향후에도 경기 회복세가 둔화될 수 있는 가능성이 존재합니다. 나아가, COVID-19 이외에도 2022년 02월 24일 러시아가 우크라이나를 침공함으로써 러시아-우크라이나 전쟁이 발발하였습니다. 본 공시서류 제출일 현재 러시아-우크라이나 전쟁이 당사에 직접적으로 영향을 미칠지 여부는 미지수입니다. 따라서 투자자께서는 러시아-우크라이나 전쟁이 당사 및 당사가 영위하는 사업에 미칠 미칠 영향에 대해 면밀히 검토하시기 바랍니다. |
신종 코로나 바이러스 감염증(이하 '코로나-19')은 중국 후베이성 우한시에서 2019년 12월 01일 처음 발생 후 확산 중인 급성 호흡기 질환입니다. 감염 확산세가 전세계로 이어지면서 2020년 03월 11일, 세계보건기구(WHO)는 감염병 경보를 기존 5단계에서 최고 단계인 6단계로 상향 조정하여 '세계적 대유행(Pandemic)'으로 선포하였습니다.
세계 각국은 백신 개발과 코로나-19 확산 방지에 총력을 다하고 있습니다. 2021년 백신 접종을 시작으로, 세계 각국은 일정 수준 이상의 백신 접종률 달성을 위해 총력을 기울이고 있습니다. 그러나 코로나-19는 여전히 종식되지 않았으며, 각종 변이 코로나-19가 확산되는 등 장기화될 가능성이 존재합니다. 2020년 10월 인도에서 처음 발견된 코로나-19 변이 바이러스인 델타 변이 바이러스는 기존 코로나-19 백신으로 방어가 가능한 것으로 알려져 있지만, 다른 변이 바이러스보다 전파 속도가 빠른 데다 더 심각한 증상을 유발하는 것으로 알려져 있습니다.
또한, 최근 유행한 오미크론 변이는 남아공 과학자들이 스파이크 단백질에 32가지 유전자 변이를 일으킨 새로운 변이, 'B.1.1.529'가 발견됐다고 보고하면서 알려졌습니다. 처음 발견된 것은 아프리카 보츠와나이고 남아공에서 확산되었으며, 세계보건기구(WHO)는 이날 전문가 회의를 열어 이 변이종에 오미크론이라는 이름을 붙이고 '우려 변이종'으로 분류했습니다. 그리고 이는 델타 변이와 같은 가장 높은 수준의 분류 단계입니다. 2021년 하반기 들어 백신 접종과 방역 체계가 강화되면서 위드 코로나 정책이 유지될 것으로 예상되었지만, 변이 바이러스인 오미크론의 등장과 확진자 수 급증으로 국내 방역조치는 재차 강화되었습니다.
이후 세계 각국의 노력에도 불구하고 코로나19는 여전히 종식되지 않은 상태이며 델타 변이 바이러스에 이은 오미크론 변이 바이러스로 인한 확진자 수 급증으로 국내의 경우 방역조치가 재차 강화되었던 바 있습니다. 본 공시서류 제출일 현재 기준 국내 방역조치는 완화되어 사회적 거리두기 의무화 조치가 해제되었고, 질병관리청은 코로나19를 종전 제1급 감염병에서2급으로 재분류한 상태이나 BA.5 및 켄타우로스 변이 바이러스의 등장으로 코로나 확산의 경계를 낮추지 못하고 있는 상황입니다.
2022년 3월 WHO는 코로나19 비상사태 종료를 조건 검토 중에 있다고 밝혔고 세계 및 국내 소비 경제가 지속적으로 회복되는 흐름을 보이고 있음에도 불구하고, 향후 새로운 강력한 변이 바이러스의 출현으로 인한 팬데믹 재확산 및 코로나19 초장기화의 가능성은 언제나 존재합니다. 이 경우 경기 회복세가 다시 꺾여 경기 둔화가 가속화될 수 있으며 실물 경기 전체에 악영향을 미쳤던 2020년과 같은 사태가 되풀이될 가능성을 배제할 수 없습니다.
2022년 10월 IMF(국제통화기금)가 발표한 세계경제전망에 따르면 2020년 세계 경제성장률은 -3.1%, 2021년에는 6.1%를 기록하였으며, 2022년에는 3.2%, 2023년에는 2.7%의 성장률을 기록할 것으로 전망되고 있습니다. IMF는 러시아-우크라이나 전쟁, 긴축적 통화ㆍ재정정책, 중국의 성장 둔화, 코로나19 영향 등의 영향으로 세계 경제 회복세가 대폭 둔화될 것으로 전망하며, 2022년 경제성장률은 직전 전망치(2022년 07월) 3.2% 와 동일한 3.2%를 전망하였고, 2023년 경제성장률은 직전 전망치(2022년 07월) 2.9% 대비 0.2%p 하향한 2.7%를 전망하였습니다.
IMF(국제통화기금)은 선진국의 경우 미국의 경제성장률은 2분기 연속 마이너스 성장에 따라 대폭 하향, 유럽의 경제성장률은 관광 및 제조업 회복으로 '22년 일부 상향되었으나 러시아 가스공급 중단, 통화 긴축 등으로 '23년 대폭 하향을 전망하였습니다. 이에 따라 2022년 선진국 경제성장률을 직전 전망치(2022년 07월) 2.5% 대비 0.1%p 하향한 2.4%로 전망하였으며 신흥국의 경우 중국의 경제성장률은 제로코로나 정책, 부동산 경기 침체 등으로 대폭 하향되고, 인도의 경제성장률은 예상보다 낮은 2분기 GDP 및 대외수요 감소로 대폭 하향하였습니다. 단, 2022년 신흥국 경제성장률은 직전 전망치(2022년 07월) 3.6% 대비 0.1%p 상향된 3.7%로 전망하였습니다.
이와 더불어, IMF는 1) 상반된 지표에 따른 과잉ㆍ과소 통화정책 위험, 2) 상이한 정책 여건으로 인한 강달러 지속과 국가간 긴장 증가, 3) 식품ㆍ에너지 추가 충격 등으로 인한 인플레 장기화, 4) 신흥국 부채 취약성, 5) 러시아산 가스 유럽공급 중단, 6) 코로나 변이, 원숭이두창 등 전염병 재확산, 7) 중국 부동산 문제 악화, 8) 세계경제 분절화 및 국제협력 약화 등을 위험 요인으로 언급하였습니다.
| [IMF 주요국의 경제성장률 전망치] |
| (단위: %, %p) |
| 경제성장률 | 2020년 | 2021년 | 2022년 | 2023년 | ||||
|---|---|---|---|---|---|---|---|---|
| 전망 ('22.7월 기준) |
전망 ('22.10월 기준) |
조정폭 ('22.4월 대비) |
전망 ('22.7월 기준) |
전망 ('22.10월 기준) |
조정폭 ('22.4월 대비) |
|||
| 세계 | -3.1 | 6.1 | 3.2 | 3.2 | 0 | 2.9 | 2.7 | -0.2 |
| 선진국 | -4.5 | 5.2 | 2.5 | 2.4 | -0.1 | 1.4 | 1.1 | -0.3 |
| 미국 | -3.4 | 5.7 | 2.3 | 1.6 | -0.7 | 1 | 1 | 0 |
| 유로존 | -6.3 | 5.4 | 2.6 | 3.1 | 0.5 | 1.2 | 0.5 | -0.7 |
| 일본 | -4.5 | 1.7 | 1.7 | 1.7 | 0 | 1.7 | 1.6 | -0.1 |
| 신흥개도국 | -2.0 | 6.8 | 3.6 | 3.7 | 0.1 | 3.9 | 3.7 | -0.2 |
| 중국 | 2.2 | 8.1 | 3.3 | 3.2 | -0.1 | 4.6 | 4.4 | -0.2 |
| 인도 | -6.6 | 8.7 | 7.4 | 6.8 | -0.6 | 6.1 | 6.1 | 0 |
| 한국 | -0.7 | 4.1 | 2.3 | 2.6 | 0.3 | 2.1 | 2 | -0.1 |
| 출처) IMF World Economic Outlook (2022.10) |
한편, 국내 경기의 경우 2022년 08월 한국은행이 발표한 경제전망보고서에 따르면 최근 국내외 여건변화 등을 감안할때 경제성장률은 2022년 2.6%, 2023년 2.1% 수준을 나타낼 것이라고 전망하였습니다. 한국은행에 따르면 국내경제는 중국 봉쇄조치, 우크라이나 사태 등 대외여건 악화가 하방요인으로 작용하겠으나, 방역조치 완화 등에 힘입어 회복세를 지속할 것으로 예상하고 있습니다. 그러나, 향후 코로나19 바이러스의 변이에 의한 재확산, 실업률 증가, 금융 여건 악화 등 팬데믹 관련 위험뿐만 아니라 우크라이나 사태, 주요국의 통화정책 긴축 움직임 등이 세계 경제에 부정적인 영향을 끼칠 수 있으며 특히 코로나19 확산세가 지속될 경우 경기 회복세가 더뎌질 수 있습니다.
| [ 국내 주요 거시경제지표 전망 ] |
| (단위: 전년동기 대비 %) |
| 경제성장률 | 2021 | 2022(E) | 2023(E) | ||||
|---|---|---|---|---|---|---|---|
| 연간 | 상반 | 하반 | 연간 | 상반 | 하반 | 연간 | |
| GDP | 4.1 | 2.9 | 2.4 | 2.6 | 1.7 | 2.4 | 2.1 |
| 민간소비 | 3.7 | 4.2 | 3.8 | 4.0 | 3.1 | 2.1 | 2.6 |
| 설비투자 | 9.0 | -7.1 | -0.2 | -3.8 | 3.1 | -1.4 | 0.9 |
| 지식재산생산물 투자 | 4.4 | 4.5 | 3.6 | 4.0 | 3.2 | 3.7 | 3.5 |
| 건설투자 | -1.6 | -4.3 | 1.0 | -1.5 | 3.3 | 1.3 | 2.2 |
| 상품수출 | 10.5 | 5.9 | 0.8 | 3.2 | -1.5 | 4.6 | 1.6 |
| 상품수입 | 12.8 | 5.2 | 0.6 | 2.9 | 0.9 | 3.2 | 2.1 |
| 출처) 한국은행 경제전망보고서(2022.08) |
정부는 악화된 실물 및 금융 경제를 부양하기 위하여 다양한 통화정책 및 재정정책을 실시하면서 경제 안정화를 위해 지속적으로 노력하고 있습니다. 하지만 글로벌 COVID-19 팬데믹의 장기화 및 추후 재발 가능성과 더불어 소비 및 금융 시장 심리 악화, 러시아-우크라이나 전쟁의 장기화, 원자재 가격의 급격한 상승, 높은 인플레이션으로 인한 고강도 통화정책 실시 등 부정적인 요인들은 향후에도 경기 회복세가 둔화될 수 있는 가능성이 존재합니다.
COVID-19 이외에도 2022년 02월 24일 러시아가 우크라이나를 침공함으로써 러시아-우크라이나 전쟁이 발발하였습니다. 러시아는 2022년 02월 21일 동부 우크라이나의 돈바스 지역에 군대를 진주시켰으며, 삼일 뒤인 2022년 02월 24일, 전면적인 침공을 개시했습니다. 러시아는 우크라이나의 수도 키예프를 비롯한 우크라이나 전역에 미사일을 발사했으며, 우크라이나 전역으로 지상군이 투입되었습니다. 바이든 대통령은 러시아의 기습 공격을 "정당한 이유 없는 공격", "계획된 전쟁"으로 규정하고 동맹과 함께 제재를 추가로 부과할 것이라고 예고했습니다. 러시아와 우크라이나는 세계 4대 곡물수출국인 데다 러시아가 유럽으로 향하는 천연가스 대부분을 공급한다는 점에서 양측의 군사충돌이 전 세계적으로 에너지, 곡물 등 원자재 가격의 가파른 상승을 일으킬 것이라는 전망이 높습니다. 본 공시서류 제출 전일 현재 해당 이벤트가 당사에 직접적으로 영향을 미칠지 여부는 미지수입니다. 따라서 투자자께서는 상기 이벤트가 당사 및 당사가 영위하는 사업에 미칠 영향에 대해 면밀히 검토하시기 바랍니다.
| 나. 신약개발 특성에 따른 위험 신약 개발 과정은 후보물질의 유효성과 안전성을 평가하고 이에 대한 근거를 마련하기 위한 중요한 과정으로 관련 규정과 절차를 반드시 준수해야합니다. 먼저, 타겟 질환에 대해 약리적인 효과가 있을 것으로 예상되는 후보물질 탐색 및 발굴을 시작으로, 동물을 대상으로 하는 전임상 연구(preclinical study)와 사람을 대상으로 하는 임상 연구(clinical study)를 통해 후보물질의 안전성과 유효성에 대한 자료를 분석하여, 최종적으로는 규제 당국으로부터 자료의 적합성 심사를 통해 의약품 품목 허가를 받아야 합니다. 또한, 제품이 안전하고 일정한 품질 수준을 유지한 채 생산되어야 하기에 공정개발 및 검증이 동시에 성공적으로 진행되어야 합니다. 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 또한, 신약허가신청(BLA) 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 관리 규정을 따라야 합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공확률이 매우 낮은, 대표적인 High Risk, High Return, Long Term Investment 사업입니다. 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 당사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실을 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있으므로 투자자 여러분께서는 이 점 유의하여 주시기 바랍니다. |
신약개발 사업은 사업화에 성공 시 통상적으로 특허권에 의해 일정기간 동안 독점권으로 보호받게 되며, 시판 승인 후 일정기간 동안 독점 판매기간을 인정받을 수도 있습니다. 대부분의 국가에서 특허 존속기간은 출원 후 20년이며, 특허의 존속기간과 관계없이 신약의 경우, 미국은 시판 승인 후 5년 이상의 시장독점권, EU는 10년의 시장독점권, 국내은 6년의 시장독점권을 보장받을 수 있습니다. 이처럼 특허권 및 독점판매권(시장독점권)을 통해 일정기간 배타적 수익을 보장받을 수 있기 때문에 글로벌 블록버스터급 신약 개발에 성공 시 막대한 수익을 창출할 수 있는 고부가가치 사업입니다.
그러나, 신약 개발 과정은 후보물질의 유효성과 안전성을 평가하고 이에 대한 근거를 마련하기 위한 중요한 과정으로 관련 규정과 절차를 반드시 준수해야합니다. 먼저, 타겟 질환에 대해 약리적인 효과가 있을 것으로 예상되는 후보물질 탐색 및 발굴을 시작으로, 동물을 대상으로 하는 전임상 연구(preclinical study)와 사람을 대상으로 하는 임상 연구(clinical study)를 통해 후보물질의 안전성과 유효성에 대한 자료를 분석하여, 최종적으로는 규제 당국으로부터 자료의 적합성 심사를 통해 의약품 품목 허가를 받아야 합니다. 또한, 제품이 안전하고 일정한 품질 수준을 유지한 채 생산되어야 하기에 공정개발 및 검증이 동시에 성공적으로 진행되어야 합니다.
특히, 일반인 또는 환자를 대상으로 하는 임상시험을 진행하고자 할 때에는 효능과 안전성에 대한 각 국가의 정부규제가 엄격하여, 임상시험 이전 단계부터 엄격한 규제에 의해 축적된 다양한 데이터를 각 국가의 규제 당국에 제출하여야 합니다. 기본적으로 임상 1상(임상약리시험) 및 임상 2상(치료적 탐색시험) 및 임상 3상(치료적 확증시험)의 연구를 진행하게 되며, 임상시험계획승인(IND)을 득하여 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 규제 당국에 의해 임상시험이 중단되거나 철회될 수 있습니다. 또한, 신약허가신청(BLA) 심사를 통과하여 시판 허가를 받아 신약을 생산 및 판매하는 과정에서도 규제 당국의 엄격한 관리 규정을 따라야 합니다. 이처럼 신약개발 사업은 고수익을 창출할 수 있지만, 오랜 시간과 막대한 비용을 투자하더라도 최종 상용화된 제품으로의 성공확률이 매우 낮은, 대표적인 High Risk, High Return, Long Term Investment 사업입니다.
| [신약 개발 과정] |
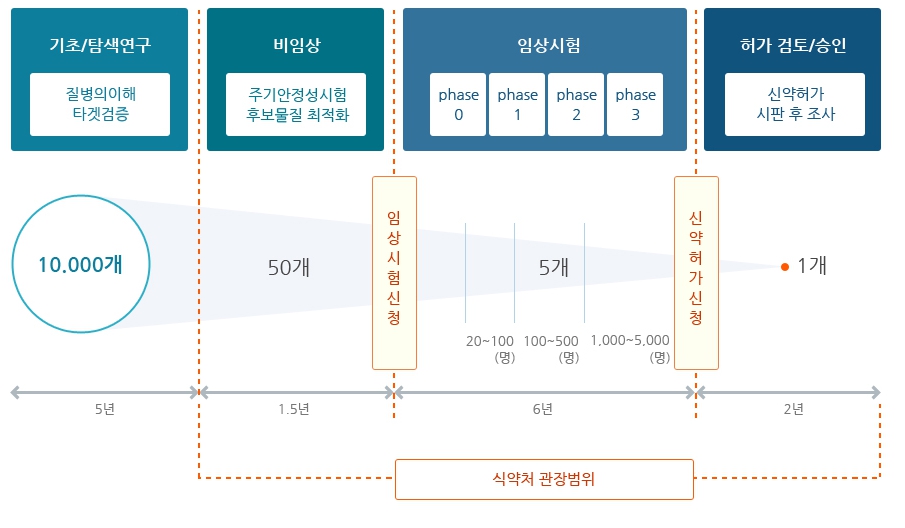 |
|
신약 개발 과정 |
| 출처: 의약품안전나라 의약품통합정보시스템 |
신약개발 과정에 소요되는 기간 및 비용 분석에 관하여 분석기관마다 편차는 있으나, 일반적으로 신약후보물질이 초기 연구 및 임상시험을 거쳐 출시되기까지 보통 10~15년 정도가 소요되는 것으로 알려져 있습니다. 또한 Evaluate Pharma World Preview 2021에 따르면 전 세계 제약 R&D 비용은 2012년 1,370억달러에서 꾸준히 상승하여 2021년 2,120억달러, 2026년에는 2,540억달러가 소요될 것으로 예상하였습니다.
| [전 세계 제약 R&D 비용 추이] |
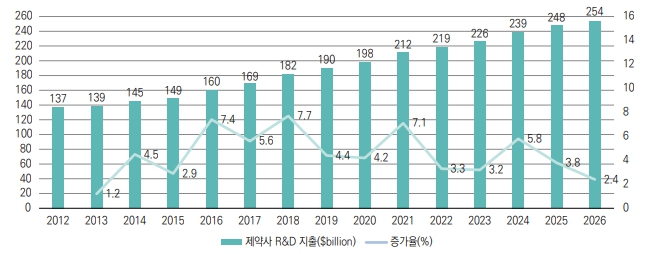 |
|
글로벌 R&D비용 추이 |
| 출처: 2021 제약바이오산업 Databook |
이러한 시간적, 재정적 막대한 투자에도 불구하고, 신약개발의 최종 성공률은 다소 낮은 수준입니다. IQVIA Institute(2022) 보고서에 따르면, 2010년부터 2021년까지 FDA 임상 파이프라인을 대상으로 조사된 임상의 성공률은 평균 13.1%로 나타났습니다.
| [연도별 임상 단계별 이행성공률 및 임상 성공률 추이(2010~2021, FDA)] |
|
| 출처: Global Trends in R&D 2022, IQVIA Institute, 2022.02 |
본 공시서류 제출일 현재, 당사 파이프라인의 연구개발 정도 관련 세부 내용은 본 공시서류 '제2부 발행인에 관한 사항-II. 사업의 내용-1. 사업의 개요/2. 주요 제품 및 서비스'를 참고해주시기 바랍니다.
당사는 코스닥시장 상장 제약사로서 제한된 연구개발비 내에서 실질적인 수익 창출 기여도를 높이기 위한 의약품 개발에 집중하고 있습니다. 당사의 임상단계를 거치고 있는 파이프라인은 추가적인 연구개발이 필요하며 이에 따라, 향후 연구개발활동이 확대될 것으로 예상됩니다. 하지만, 현재까지 연구개발에 대한 성과가 큰 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다.
| [당사의 연구개발비용] |
| (단위: 천원) |
| 구 분 | 2022년 3분기말 (당분기) |
2021년 (전기) | 2020년 (전전기) | 2019년 (전전전기) | |
|---|---|---|---|---|---|
| 비용의 성격별 분류 | 원재료비 | 2,383,553 | 5,971,522 | 6,917,701 | 3,915,071 |
| 인건비 | 4,337,475 | 7,250,850 | 9,802,206 | 9,885,914 | |
| 감가상각비 | 1,788,472 | 1,047,065 | 23,063,949 | 1,047,017 | |
| 위탁용역비 | 8,469,759 | 21,728,793 | 2,593,326 | 24,789,635 | |
| 기타경비 | 1,363,129 | 2,715,913 | 1,132,177 | 2,856,464 | |
| 연구개발비용 계 | 18,342,388 | 38,714,144 | 43,509,359 | 42,494,100 | |
| 정부보조금 | (629,998) | (6,373,365) | (4,513,496) | -2,044,637 | |
| 보조금 차감 후 금액 | 17,712,390 | 32,340,779 | 38,995,862 | 40,449,463 | |
| 회계처리내역 | 판매비와 관리비 | 17,712,390 | 32,340,779 | 38,995,862 | 40,449,463 |
| 제조경비 | - | - | - | - | |
| 개발비 (무형자산) | - | - | - | - | |
| 회계처리금액 계 | 17,712,390 | 32,340,779 | 38,995,862 | 40,449,463 | |
| 연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액×100] |
128% | 84% | 210% | 358% | |
| 출처 : 당사 정기보고서, 별도 기준 |
이와 같이 신약 연구개발을 통하여 가시적인 결과가 나오는 제품의 상용화 단계까지는 많은 비용과 시간이 요구되며, 연구개발 과정에서 수많은 변수가 발생할 수 있습니다. 또한, 당사가 변수들을 미리 찾아내어 극복하지 못한 경우에 지출했던 연구개발 비용 및 시간 등의 큰 손실을 발생할 수 있으므로 투자자 여러분들께서는 이 점 유의하시기 바랍니다. 당사가 영위하고 있는 사업 부문의 공시서류 및 회사 IR자료 등 관련 자료를 참고하더라도 합리적인 투자의사 결정하기에는 고도의 전문적 식견이 필요하며, 관련 산업 및 기술을 정확히 이해하기에는 한계가 있으므로 투자자 여러분께서는 이 점 유의하여 주시기 바랍니다.
|
다. 새로운 치료 요법 등장에 따른 시장 환경 변화 위험 |
암의 치료 요법으로는 외과적 수술, 방사선 치료, 약물 치료 등이 시행되고 있습니다. 약물 치료 중 1세대 항암제는 화학항암제로, 이는 세포독성 화학물질을 처리하여 정상 세포에 비해 세포분화 및 증식 속도가 빠른 암세포를 사멸시키는 기전의 치료제 입니다. 그러나 암세포 뿐만 아니라 정상세포까지도 공격해 심각한 부작용을 유발하는 단점이 있습니다. 2000년대 들어 사용된 2세대 표적 항암제는 암세포에 나타나는 특정 단백질이나 특정 유전자 변화에 작용하여 암의 성장과 분화에 관여하는 신호전달을 차단하는 기전의 항암제로, 화학항암제 대비 치료율이 향상되고 부작용이 개선되었습니다. 그러나 표적 대상이 제한적이어서 같은 암종이라도 표적 인자가 발현되지 않으면 사용이 제한적이며, 표적 유전자가 밝혀지지 않은 암종에 대한 적용의 어려움, 암세포의 돌연변이로 인한 약제 내성 등으로 한계가 있는 상황입니다.
이 같은 문제를 극복하기 위하여 2010년대 들어서는 면역항암제가 본격적으로 개발 적용되기 시작하였습니다. 면역항암제는 암세포가 획득한 면역억제 또는 면역회피 기전을 극복하기 위하여 면역체계의 종양 인지 능력 또는 파괴 능력을 회복 또는 강화시키는 기전의 약제로, 면역체계의 특이성, 기억력, 적응력을 증강시킴으로써 항암효과를 나타냅니다. 면역항암제는 면역관문억제제를 필두로 한 다수의 면역항암제에 관한 임상연구 및 시판 후 증례를 통해, 1세대 화학항암제, 2세대 표적항암제와 달리, 장기간 효과 지속, 장기 생존가능, 폭넓은 항암효과 및 낮은 부작용 등의 특성을 보여주고 있어, 기존 항암치료의 패러다임을 바꾸며, 암 표준치료 중의 하나로 자리매김하고 있습니다.
| [세대별 항암제 종류 및 특징] |
|
구분 |
특징 |
|
|
1세대 (1950년대~) |
화학항암제 |
- 약물을 이용하여 암세포를 죽이는 전신치료 방법 |
|
2세대 (2000년대~) |
표적항암제 |
- 암세포나 암조직에만 많이 발현되는 특정 단백질이나 유전자 변화를 표적으로 삼아 암의 성장과 암의 발생에 관여하는 활동을 방해하는 치료방법 - 암세포만을 식별해 공격하는 장점이 있지만, 유전자 변이를 가진 환자에만 사용할 수 있어 다양한 암치료가 불가능 |
|
3세대 (2010년대~) |
면역항암제 |
- 인체 면역세포를 활성화시켜 암세포를 사멸시키는 방법 |
| 출처: 약학정보원 및 업계자료 취합 |
| [각 세대별 항암제의 원리] |
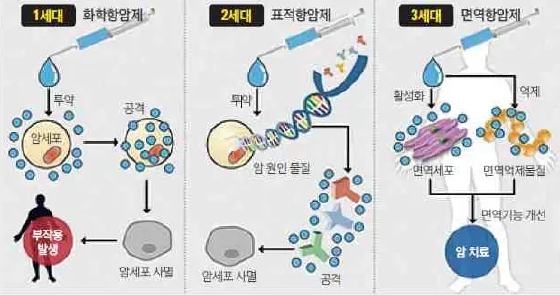 |
|
각 세대별 항암제의 원리 |
| 출처: 표적치료에대한 이해(2016.10), 삼성서울병원 |
다만, 면역항암제 역시 일부 면역관문조절과 같은 특정 바이오마커의 발현율에 따라 치료의 반응률이 차이가 나는 한계점이 있어, 단독요법 외에도 다양한 항암기전을 가지는 치료제들과의 병용요법이 시도되고 있으며, 장기 생존(혹은 완치)을 가능하게 하는 우수한 병용 임상연구 및 시판 후 증례를 통해 현재 다수의 면역항암제 병용요법이 1차 치료제로 승인되어 적용되고 있습니다.
| [항암제 종류별 생존곡선 비교] |
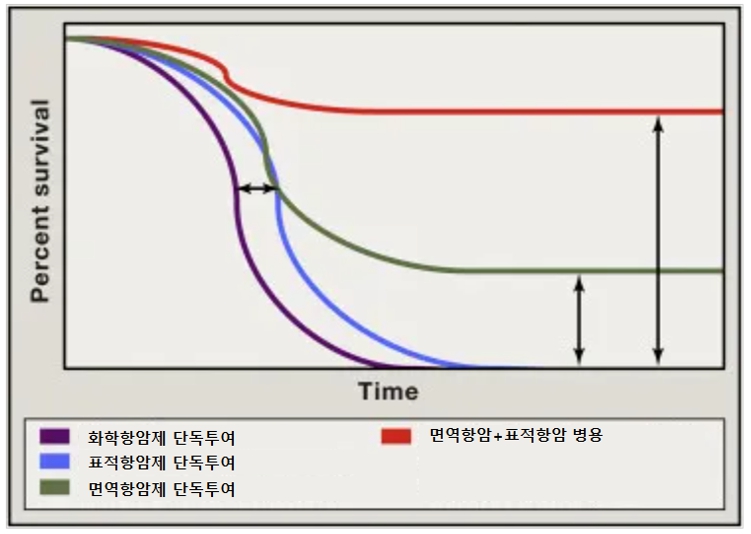 |
|
항암제 종류별 생존곡선 비교 |
| 출처: P. Sharma, J.P. Allison, Cell, 2015, 161, 205-214, 당사 재구성 |
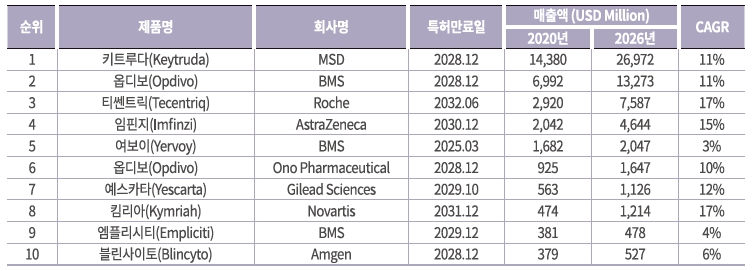
2011년 면역관문억제제인 BMS사의 여보이(Yervoy, 성분명: Ipilimumab)의 승인을 시작으로 면역항암제의 연구 및 임상 적용이 본격적으로 진행되었으며, 현재 면역관문억제제(여보이, 키트루다, 옵디보, 티센트릭, 임핀지, 바벤시오 등)를 중심으로, 면역세포치료제(예스카타, 킴리아 등)와 항암바이러스치료제(임리직 등) 등이 다수 허가돼 판매되고 있습니다. 이 중 키트루다, 옵디보, 티센트릭, 임핀지, 여보이 등 주요 10개 면역항암제 제품의 2020년 글로벌 총 매출은 307억달러 규모로 조사되었습니다. 특히, MSD의 '키트루다'는 암의 종류에 상관없는 바이오마커를 기반으로 한 치료제로, 흑색종을 대상으로 최초 승인을 획득한 이래 비소세포페암, 두경부암, 호지킨 림프종, 방광암 등 다양한 암 적응증에 대부분 1차 치료제로 승인되면서, 2019년 처음으로 단일품목 매출 100억달러를 넘었으며, 항암제를 넘어서 글로벌 의약품 매출 1위 품목이 되었습니다. EvaluatePharma 자료에 따르면, 키트루다는 2026년 270억달러의 매출로 여전히 글로벌 매출1위 품목에 이름을 올릴 것으로 예상되고 있습니다.
| [주요 10개 글로벌 면역항암제의 2020년 매출 실적 및 2026년 예상 매출] |
 |
|
주요 글로벌 면역항암제의 매출 실적 및 예상 매출 |
| 출처: KPBMA 한국제약바이오협회, EvaluatePharma |
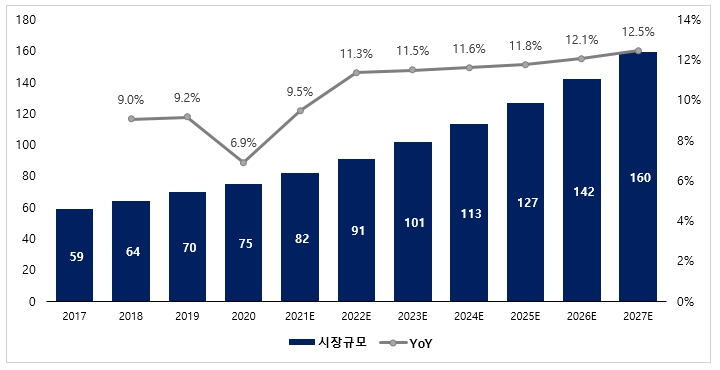
이처럼 글로벌 면역항암제 시장은 키트루다, 옵디보, 티센트릭, 임핀지 등 면역관문억제제들의 적응증 확대, 킴리아, 예스카타 등 CAR-T 치료제의 출시, 병용요법 및 수술 전ㆍ후 보조요법으로 적용 방식 확대, 신규 면역항암제의 출시 등으로 인해 지속적으로 고성장할 것으로 전망됩니다. FutureWise Market Research 자료에 따르면 글로벌 면역항암제 시장 규모는 인구 증가와 고령화에 따른 질병 유병률 증가, 기존 치료법의 한계를 개선하는 치료방식, 이에 따른 해당 시장에 대한 관심 및 R&D 활동의 증가로 2020년 746억달러에서 연 평균 11.8% 성장(2021-2027)하여 2027년에는 1,595억달러에 이를 것으로 전망됩니다.
| [글로벌 면역항암제 시장 현황 및 전망(단위: 십억달러)] |
 |
|
글로벌 면역항암제 시장 현황 및 전망 |
| 출처: FutureWise Market Research, 2021 |
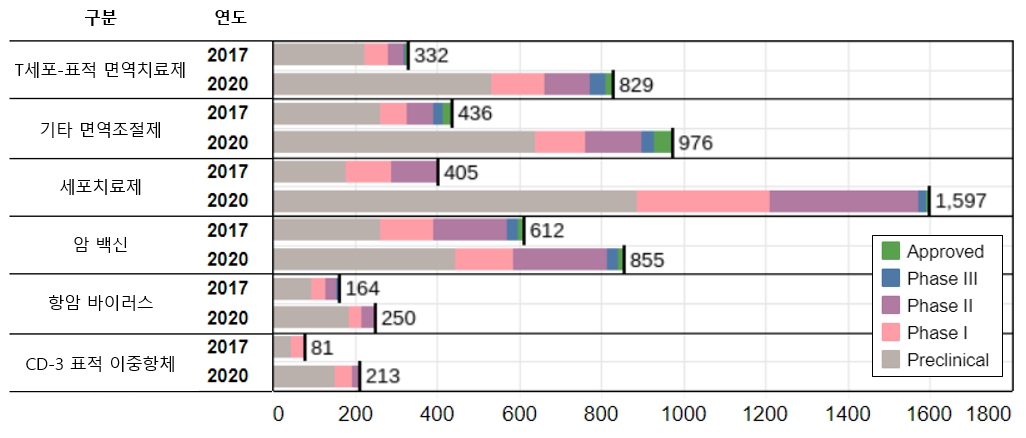
이러한 면역항암제의 본격적인 시장 확대는 그 간의 지속적인 면역항암제 연구개발 노력에 따른 것으로 해석할 수 있으며, 동시에 최근의 면역항암제 연구개발 동향을 파악함으로서 향후의 시장 동향도 전망할 수 있습니다. Nature Reviews Drug Discovery 논문에 따르면, 글로벌 면역항암제의 전임상 및 임상(승인 포함) 파이프라인은 2017년 2,030개에서 2020년 4,720개로 3년새 233% 증가하였습니다. 특히 면역항암제 중에서도 연구개발 파이프라인의 가장 두드러진 성장을 보인 계열은 세포치료제 부문으로, 2017년 이래 1,192개의 파이프라인이 증가하여, 2019년 1,597개의 면역세포치료제 파이프라인이 연구개발 단계에 있는 것으로 조사되었습니다.
| [글로벌 면역항암제 종류별 파이프라인 현황] |
 |
|
글로벌 면역항암제 종류별 파이프라인 현황 |
| 출처: J. Tang et al., Nature Reviews Drug Discovery, 2019, 18, 899-900. (당사 재구성) |
이처럼 항암 치료제 분야는 면역항암제로 패러다임 전환이 이뤄지고 있습니다. 그 중에서도 현재는 면역관문억제제가 면역항암제 시장을 견인하고 있는 상황이며, 2017년 CAR-T세포 치료제의 승인 및 본격적인 적용을 시작으로 다양한 세포 치료제에 대한 연구개발 또한 활발히 진행되고 있습니다. 그럼에도 불구하고 면역항암제의 가장 큰 단점은 약의 효능이 작용하는 반응률이 통상적으로 20~30%에 그친다는 점이며, 치료 효과를 극대화하기 위해서는 다른 면역항암제와 병용 투여를 해야 하는 등의 한계를 가지고 있습니다. 나아가, 모든 암종에 적용하기 어렵다는 범위의 한계가 있습니다.
이러한 이유로, 최근에는 암세포 또한 기본 대사과정인 성장, 노화, 사멸을 거친다는 점을 고려하여, 암의 대사과정이 일어나지 않도록 대사물질을 차단하는 4세대 치료제인 대사항암제가 개발되고 있습니다. 암세포는 계속적으로 증식하는 특성으로 일반 세포에 비해 많은 에너지원을 사용하는 것으로 알려져있습니다. 암세포는 일반세포와 대비하여 100배 이상 많은 ATP를 생성하여 에너지를 생산하며, 때문에 이러한 암세포의 대사 기관인 미토콘드리아의 기능을 저해하거나 조절하는 등의 기전으로 새로운 치료의 방법이 개발되고 있습니다.
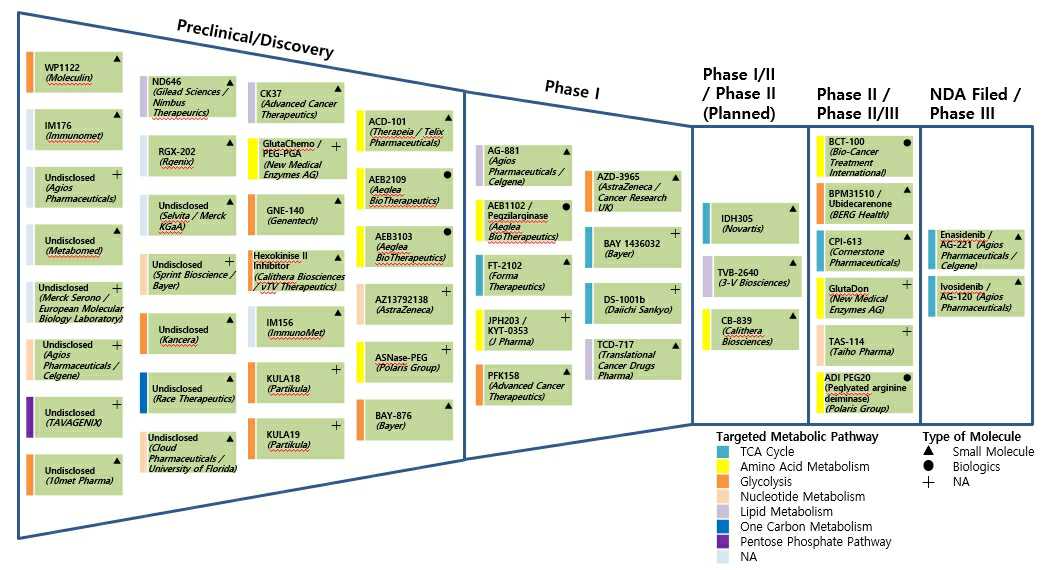
현재 FDA로부터 승인 받은 약물은 Agios社에서 개발한 혈액암 치료제 IDHIFA('17년 승인)와 Tibsovo('18년 승인) 2 건이 있습니다. 그럼에도 불구하고 현재 시장이 큰 폭으로 성장하지 못한 이유는 해당 약물들이 특정 암에서 발견되는 돌연변이 효소(iDH)만만을 타겟하고 있기 때문에, 암 확장성이 제한적인 특성을 갖고 있습니다. 이에 따라, 최근 임상 중인 대사항암제는 암세포에서만 공통적으로 나타나는 대사 과정을 억제하거나 정상세포의 대사과정을 촉진하는 기전으로 개발되는 방향을 띄고 있기도 하며, 향후 적응증 확장성 및 기존 항암제와 병용 가능성으로 주목받고 있습니다. 현재 신규 대사항암제의 개발 현황은 다음과 같습니다.
| [신규 대사항암제 개발 현황] |
 |
|
신규 대사항암제 개발 현황 |
| 자료 : Root Analysis2020 |
당사는 독자적인 지속형 항체 융합 단백질 기술인 hyFc 플랫폼을 기반으로 T세포의 수를 증가시키는 인터루킨-7을 이용한 면역항암제를 연구개발하고 있는 바이오 회사로, 이 같은 글로벌 항암제 개발 트렌드에 부합하는 연구개발을 수행하고 있습니다.
또한 현재 개발중인 파이프라인은 다양한 암종을 대상으로 적응증 확대가 가능하며, 기존 항암제 및 당사 면역항암제 간의 병용요법을 통한 치료효과 개선이 가능합니다. 기존의 암 치료법을 개선하고, 효과를 증폭시켜 새로운 암 치료 시대를 열 수 있는 잠재력이 높은 기술로 기대되고 있습니다. 이외에도 hyFc 플랫폼 기술을 활용하여 지속형 빈혈치료제, 지속형 성장호르몬 등의 개발도 파트너사와의 협력으로 진행중입니다.
그러나, 이러한 당사의 기술 수준에도 불구하고, 새로운 치료법의 등장, 시장 환경의 변화, 신규 면역항암제 개발 등으로 글로벌 경쟁력 및 기준에 부합하지 않게 되는 경우, 당사의 사업계획 및 수익창출 등에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하여 주시기 바랍니다.
| 라. 경쟁 면역항암제 개발에 따른 경쟁 심화 위험 과거에는 암 치료를 위해 한가지 항암제만 처방하던 단일요법(Monotherapy)이 주류였으나 현재는 두 가지 또는 그 이상의 항암제를 동시에 혹은 순차적으로 처방하여 암을 치료하는 병용 요법(Combination Therapy)으로 패러다임이 변화하였습니다. 상호 보완적인 작용기전을 가지는 항암제를 동시에 혹은 순차적으로 처방할 경우 시너지 효과가 극대화되어 더욱 우수한 치료 효과를 나타내기 때문입니다. 이에 따라 다수의 바이오 제약사들은 면역항암제와 기존 항암제 혹은 면역항암제들 사이의 최적 조합의 병용요법 개발을 위하여 수많은 연구 및 개발을 진행하고 있습니다. 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황입니다. 항암제 시장의 높은 시장성을 보고 다수의 제약사들이 임상을 확대하여 속도를 내고 있다는 점은 당사 사업에 위협 요인으로 작용할 수 있습니다. |
현재 항암제 신약 개발의 주요 트렌드는 암 종에 무관한 바이오마커(생체지표) 기반의 항암제 개발 및 병용 요법입니다. 과거에도 특정 암에서 효능이 있는 환자군을 세밀하게 나누는 바이오마커를 기반으로 하는 항암제들은 있었으나, 최근에는 암의 종류에 상관없는 바이오마커 기반의 항암제가 승인 및 개발되고 있습니다. 대표적인 예가 PD-1이라는 면역관문 억제기전을 가진 면역항암제인 '키트루다'로, 2017년 현미부수체불안정성(microsatellite instability-high, MSI-H) 또는 DNA복제실수교정결핍(mismatch repair deficient, dMMR)라는 바이오마커를 가진 고형 종양에 대해 허가를 받으면서, 종양 유형에 무관한 바이오마커 기반 최초의 암 치료제로서, 현재 다수의 암종에 1차 치료제로 적용되고 있습니다. 이 같은 암종에 구분 없는 항암제 개발에 따라, 경쟁 관계에 있어서 동일 질환 내 경쟁관계 보다는 동일 작용기전 내 경쟁관계가 중요한 요소가 되었습니다.
또한 과거에는 암 치료를 위해 한가지 항암제만 처방하던 단일요법(Monotherapy)이 주류였으나 현재는 두 가지 또는 그 이상의 항암제를 동시에 혹은 순차적으로 처방하여 암을 치료하는 병용 요법(Combination Therapy)으로 패러다임이 변화하였습니다. 상호 보완적인 작용기전을 가지는 항암제를 동시에 혹은 순차적으로 처방할 경우 시너지 효과가 극대화되어 더욱 우수한 치료 효과를 나타내기 때문입니다. 이에 따라 다수의 바이오 제약사들은 면역항암제와 기존 항암제 혹은 면역항암제들 사이의 최적 조합의 병용요법 개발을 위하여 수많은 연구 및 개발을 진행하고 있습니다.
Nature Reviews Drug Discovery(2020) 논문 분석에 따르면, 2019년 기준 활성화 상태인 면역관문억제제의 임상시험은 2975개로 확인되었습니다. 제품별로는 키트루다(펨브롤리주맙)와 옵디보(니볼루맙)의 임상연구가 전체 임상시험의 56%를 차지했으며, 유형별로는 단일요법 보다는 병용요법 연구가 전체 임상시험의 76%를 차지했습니다. 병용요법 연구로는 서로 다른 기전의 면역관문억제제간 병용연구를 비롯하여, 항암화학요법, 표적항암요법, 방사선요법 등과의 병용연구가 진행되고 있습니다.
| [주요 면역항암제(면역관문억제제) 임상연구 동향] |
|
| * 출처: J. Tang et al., Nature Reviews Drug Discovery 2020, 19, 163-164 |
이처럼 현재 면역항암제 분야의 글로벌 제약회사들은 면역관문억제제를 중심으로 다양한 암종에 대한 대규모 임상 실험과 병용 처방을 통해 빠르게 시장을 선점해가고 있는 상황입니다. 나아가, 면역세포치료제 또한 상용화가 가속화되면서 시장이 빠르게 확대되고 있습니다. 재생의료연합에 따르면 2020년 세포기반면역항암제의 임상시험 건수는 총 1,220건으로 확인되었으며,임상 3상 개수는 25개에 이르면서 점차 면역세포치료제 시장 또한 경쟁이 심화될 예정입니다. 미국 FDA에서 허가를 받은 CAR-T 치료제는 Novartis 社의 킴리아(Kymriah), Gilead 社의 예스카타(Yescarta)와 테카투스(Tecartus), BMS 社의 브레얀지(Breyanzi)와 아베크마(Abecma)가 이미 존재하고 있으며, 전 세계적으로는 9개의 치료제가 존재하고 있습니다.
위와 같이, 면역항암치료제 시장의 높은 시장성을 보고 다수의 제약사들이 임상을 확대하여 속도를 내고 있다는 점은 당사 사업에 위협 요인으로 작용할 수 있습니다. 해당 경쟁 파이프라인이 당사 제품의 임상속도보다 앞서 임상에 성공하여 시장에 진입할 경우, 당사 면역항암치료제 파이프라인의 시장 경쟁력이 약화될 수 있으며, 이는 제품 판매 및 기술 이전에 부정적인 영향을 미칠 수 있습니다. 이 경우, 당사의 수익성 및 재무상태에 부정적인 영향을 미칠 수 있으므로 투자자께서는 유의하여 주시기 바랍니다.
당사 면역항암치료제인 GX-I7과 경쟁 의약품 간 비교에 세부적인 사항은 본 공시서류 '제2부 발행인에 관한 사항-II. 사업의 내용-1. 사업의 개요'를 참고하여 주시기 바랍니다.
| 마. 충분한 제품화 사례가 없는 DNA백신 치료제의 불확실성 당사가 연구개발 중인 DNA백신은 현재 대부분 임상 또는 비임상 단계에 있어 가시적인 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. 2021년 8월 21일 인도 제약사 자이더스 캐딜라(Zydus Cadila)의 자이코브-디(ZyCov-D)가 세계 첫 DNA 기반 코로나19 백신이 긴급사용 승인받은 바 있지만 당사가 개발 중인 DNA백신 기반 바이오의약품 역시 임상 시험을 계획대로 진행하여 신약으로서 허가를 받아 제품화 된다고 하더라도, 시장 경쟁력 결여 등의 이유로 수익 창출에 실패할 가능성도 있습니다. 또한, 시판 과정에서 예상치 못한 부작용의 발견, 경쟁 제품 대비 약효 저하 등으로 인해 시판 후에라도 당사가 고려하고 있는 정도의 수익 창출에 실패할 가능성도 상존하고 있습니다. |
당사가 연구개발 중인 DNA백신 시장은 'DNA Vaccines: Technologies and Global Markets (2021년 09월, BCC Research사 발행)'에 의하면, DNA백신이 기존 백신들 대비 효과적이고 부작용이 적은 특성으로 말미암아, 2021년 기준 31억달러의 시장을 형성하였으며, 2026년까지 115억달러 규모의 시장과 2021년부터 2026년까지 연평균 성장률(CAGR) 30.2%를 전망하였습니다.
핵산기반 치료제 시장은 주로 유전질환과 유전적 장애를 대상으로 하는 치료제로 개발이 되고 있으며, 기존 치료제들이 치료효능이 거의 없거나 크지 않기 때문에 혁신의약품으로 평가를 받고 있습니다. 'Global Nucleic Acid Therapeutics Market 2020-2024 (2020년 10월, Research And Markets사 발행)' 보고서에 의하면, 2024년말까지 전세계 핵산기반 치료제의 시장은 72억달러 규모의 시장과 2020년부터 2022년까지의 연평균 성장률(CAGR) 33.3%를 전망하였습니다.
하지만, 연구개발 중인 DNA백신은 현재 대부분 임상 또는 비임상 단계에 있어 가시적인 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. 2021년 8월 21일 인도 제약사 자이더스 캐딜라(Zydus Cadila)의 자이코브-디(ZyCov-D)가 세계 첫 DNA 기반 코로나19 백신이 긴급사용 승인받은 바 있지만 당사가 개발 중인 DNA 백신 기반 바이오의약품 역시 임상 시험을 계획대로 진행하여 신약으로서 허가를 받아 제품화 된다고 하더라도 시장 경쟁력 결여 등의 이유로 수익 창출에 실패할 가능성도 있습니다.
당사가 연구개발 중인 GX-188E 백신 치료제는 위와 같이 DNA 기술을 활용한 First-in-Class의 자궁경부암 치료제로, 자궁경부암을 가장 많이 유발하는 인유두종바이러스(HPV) 항원 유전자를 통해, 면역을 통한 치료효과를 극대화하는 기전을 가지고 있습니다. 현재 국내 임상 1b/2상을 완료하여 9월 ESMO에서 65명 환자 대상으로 개관적 반응률(ORR) 31.7%, 완전관해 비율 10%, 부분관해비율 21.7%, OS 17.2개월의 결과를 보인 바 있습니다. 현재 면역관문억제제로 알려진 키트루다 단독 투여시 mOS가 9개월이나, GX-188E와 병용투여 시 이가 17개월로 약 2배 가량 증가하는 등의 효과를 보였습니다. 이와 같은 결과에도 불구하고, 시판 과정에서 예상치 못한 부작용의 발견, 경쟁 제품 대비 약효 저하 등으로 인해 시판 후에라도 당사가 고려하고 있는 정도의 수익 창출에 실패할 가능성도 상존하고 있습니다.
이처럼 DNA백신 시장은 단계적으로 성장하고 있으며, 2021년 08월 21일 인도 제약사 자이더스 캐딜라(Zydus Cadila)의 자이코브-디(ZyCov-D)가 세계 첫 DNA 기반 코로나19 백신이 긴급사용 승인받은 바 외엔 아직까지 제품화 사례가 충분히 없어 향후 성공가능성은 매우 불확실합니다. 이에 계속적인 비용과 시간이 소모될 것으로 예상되며 DNA백신의 효능이 인정되지 못하면 당사에 치명적인 타격이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 바. 핵심연구인력 유출 위험 제약 및 바이오사업은 신규 의약품 개발 여부가 중요하며, 연구개발하는 과정에서 핵심 인력의 능력에 의존하고 있습니다. 당사는 바이오연구소와 임상개발실 두 곳으로 나누어 연구개발을 진행하고 있으며, 풍부한 경험과 연구개발 능력을 갖추는 것이 핵심 경쟁력임을 충분히 인지하고 있습니다. 이에 해당 핵심 연구인력 및 조직을 유지하기 위해 보상책을 제공하고 있으나, 그럼에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히 경쟁심화에 따른 당사 우수 인력 스카우트 등은 핵심기술 노하우 유출 등으로 이어질 수 있으며 이는 당사의 경쟁력을 약화시키며 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자분들께서는 이 점 참고하시기 바랍니다. |
연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 중요한 요소입니다. 이는 제약 및 바이오사업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 또한, 주요 연구 인력의 유출이 있을 경우 해당 연구 개발과제가 지연되거나 개발전략을 수정해야 할 가능성이 존재하며, 개발비 부담 등으로 당사의 경쟁력 및 성장 가능성이 악화될 수 있습니다.
당사의 연구개발 조직은 바이오연구소, 임상개발실로 구성되어 있습니다. 바이오연구소는 세포배양, 비임상, 정제, 분석팀, QA팀으로 구성되어 있습니다. 임상개발실은 임상운영팀 등으로 구성되어 있으며 현황과 담당하는 업무는 아래와 같습니다.
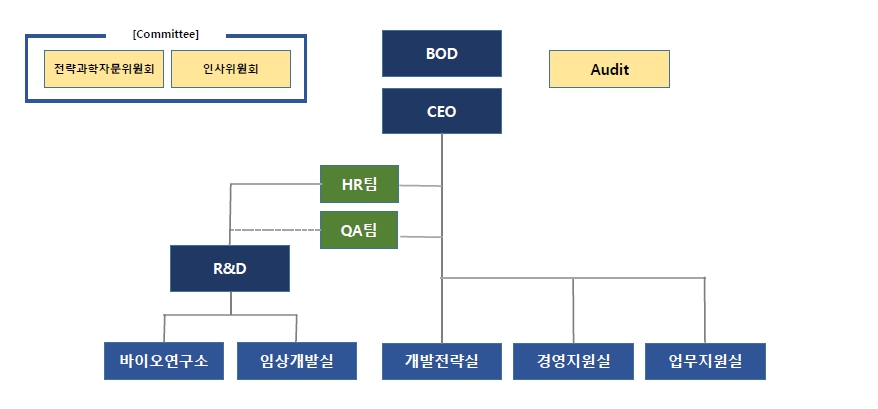 |
|
조직도 |
| (2022.09.30. 기준) |
| [당사의 연구개발 조직 구성] |
| 구분 | 팀명 | 인원 | 담당업무 |
|---|---|---|---|
| 바이오연구소 | - 비임상팀 - 생물품질분석팀 - 세포배양1팀 - 세포배양2팀 - 정제1팀 - 정제2팀 - 분석1팀 - 분석2팀 - 분석3팀 - QA팀 |
59 | - 단백질치료제 개발, 유전자백신개발, 세포주 제조,배양, 정제, CMC, 분석 및 비임상시험 |
| 임상개발실 | - 임상과학팀 - 임상운영1팀 - 임상운영2팀 - CMO |
12 | - 임상 개발 전략 수립 - 임상 시험 기획 - 임상 개발 운영 - 임상 시험 결과 해석 |
| (2022.09.30. 기준) |
| [연구개발인력 현황] |
| 구분 | 인 원 | |||
| 박사 | 석사 | 기타 | 합계 | |
| 바이오연구소, 임상개발실 등 |
9 | 35 | 25 | 71 |
| 출처: 당사 정기보고서 |
2022년 3분기말 기준 현재 당사의 임직원 수는 114명이며, 그 중 바이오연구소 59명, 임상개발실 12명을 합한 71명이 당사의 연구개발인력입니다. 당사의 핵심 연구인력은 전략과학자문위원회 의장인 성영철 고문, R&D 총괄 우정원 사장, 바이오연구소 김기용 전무, 바이오연구소 이성희 수석전문위원, 임상개발실 허민규 상무 등 입니다.
| [당사의 핵심 연구개발인력 현황] |
| 직위 | 성명 | 부서 | 주요 경력 | 주요 연구실적(논문, 학회발표) |
| 자문 | 성영철 | 전략과학자문위원회 의장 | -現 ㈜제넥신 전략과학자문위원회 의장 -前 ㈜제넥신 대표이사 -現 포스텍 융합생명공학부 교수 -前 대한면역학회 회장 |
<논문> - HIF-1α activation in myeloid cells accelerates dextran sodium sulfate-induced colitis progression in mice.(2018년, Dis Model Mech) - Erratum: Plasmacytoid Dendritic Cells Contribute to the Protective Immunity Induced by Intranasal Treatment with Fc-fused Interleukin-7 against Lethal Influenza Virus Infection. (2017년, Immune Netw) - PD-1 deficiency protects experimental colitis via alteration of gut microbiota.(2017년, BMB Rep) - Intravaginal Administration of Fc-Fused IL7 Suppresses the Cervicovaginal Tumor by Recruiting HPV DNA Vaccine-Induced CD8 T Cells. (2016년, Clin Cancer Res) - (p40)2-Fc reduces immune-inflammatory response through the activation of T cells in collagen induced arthritis mice.(2016년, Immunol Lett.) - Safety and immunogenicity of therapeutic DNA vaccine with antiviral drug in chronic HBV patients and its immunogenicity in mice.(2015년, LIVER INTERNATIONAL) - Protective effects of Fc-fused PD-L1 on two different animal models of colitis.(2015년, GUT) - Oral immunization of haemaggulutinin H5 expressed in plant endoplasmic reticulum with adjuvant saponin protects mice against highly pathogenic avian influenza A virus infection.(2015년, Plant Biotechnol J.) - Clearance of persistent HPV infection and cervical lesion by therapeutic DNA vaccine in CIN3 patients.(2014년, Nature communications) - Enhancement of antigen-specific CD8 T cell responses by co-delivery of Fc-fused CXCL11.(2014년, VACCINE) - onlytic Fc-fused IL-7 synergizes with Mtb32 DNA vaccine to enhance antigen-specific T cell responses in a therapeutic model of tuberculosis.(2013년, VACCINE) - IL-7/anti-IL-7 mAb complexes augment cytokine potency in mice through association with IgG-Fc and by competition with IL-7R(2013년, Blood) - Interleukin-27 suppresses osteoclastogenesis via induction of interferon-γ. (2012년, CLINICAL IMMUNOLOGY) - Natural form of noncytolytic flexible human Fc as a long-acting carrier of agonistic ligand, erythropoietin.(2011년, PLOS ONE) - Complete protection against a H5N2 avian influenza virus by a DNA vaccine expressing a fusion protein of H1N1 HA and M2e.(2011년, VACCINE) - Pembrolizumab plus GX-188E therapeutic DNA vaccine in patients with HPV-16-positive or HPV-18-positive advanced cervical cancer: interim results of a single-arm, phase 2 trial (2020년, Lancet Oncology) <학회발표> A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Twice-Monthly Administration in Both Adult and Pediatric Growth Hormone Deficiencies (2017년, ENDO) A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Weekly and Twice-Monthly Administration in Children with Growth Hormone Deficiency (2017년, IMPE) A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Semi-Monthly Administration LBFri-28 in Clinical Studies (2016년, ENDO) / ICE-CSE 2016 / ESPE 2016 |
| 사장 | 우정원 | R&D | -現 (주)제넥신 대표이사 -前 서울성모병원 연구원 -Cornell University 미생물학 박사 |
<논문> - Clearance of persistent HPV infection and cervical lesion by therapeutic DNA vaccine in CIN3 patients.(2014년, Nature communications) - Red ginseng extract ameliorates autoimmune arthritis via regulation of STAT3 pathway, Th17/Treg balance, and osteoclastogenesis in mice and human.(2014년, Mediators of inflammation) - MRP8 promotes Th17 differentiation via upregulation of IL-6 production by fibroblast-like synoviocytes in rheumatoid arthritis.(2013년, Exp Mol Med) - S100A8/A9 as a biomarker for synovial inflammation and joint damage in patients with rheumatoid arthritis.(2014년 Korean J Intern Med.) <학회발표> - A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Twice-Monthly Administration in Both Adult and Pediatric Growth Hormone Deficiencies (2017년, ENDO) - A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Weekly and Twice-Monthly Administration in Children with Growth Hormone Deficiency (2017년, IMPE) - A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for SemiMonthly Administration LBFri-28 in Clinical Studies (2016년, ENDO) - 2016년, ENDO / ICE-CSE / ESPE 발표 |
| 전무 | 김기용 | 바이오연구소 | -녹십자 부장 -㈜두비엘(現 차백신연구소) 연구개발이사 -목암생명공학연구소 책임연구원 |
<논문> - A new manufacturing process to remove thrombogenic factors (II, V(2017년, Biologicals) - Accepted. Multicenter, single-arm, phase IV study to evaluate the efficacy and safety of the combined therapy of aspirin and high-dose "IVIG-SN" for pediatric patients with Kawasaki disease.(2016년, Korean Circulation J) - The role of the alternative complement pathway in early graft loss after intraportal porcine islet xenotransplantation.(2014년, Transplantation) - Intravitreal human complement factor H in a rat model of laser-induced choroidal neovascularization.(2013년, Br. J. Ophthalmol.) - Reconstituted high-density lipoprotein attenuates atherogenesis partly by regulating HSP27 in hyperlipidemic apoE?/? mice(2012년, Int J Cardiol) - Manufacturing and Shelf Stability of Reconstituted High-density Lipoprotein for Infusion Therapy(2011년, Biotech.) - Fructated apolipoprotein A-I showed severe structural modification and loss of beneficial functions in lipid-free and lipid-bound state with acceleration of atherosclerosis and senescence(2010년, Biochem. Biophys.) - Systemic and specific delivery of small interfering RNAs to the liver mediated by apolipoprotein A-I.(2007년, Mol. Ther.) - Mixed lineage kinase 3-activated p38 MAP kinase mediates TGF-β1-induced apoptosis in hepatoma cells(2004년, J. Biol. Chem.) - Purification and molecular cloning of a novel serine protease from the centipede, Scolopendra subspinipes mutilans.(2004년, Insect Biochem.) - The influence of glycosylation on secretion, stability, and immunogenicity of recombinant HBV pre-S antigen synthesized in Saccharomyces cerevisiae.(2003년, Biochem. Biophys.) - N-acetylcysteine induces cell cycle arrest in hepatic stellate cells through its reducing activity.(2001년, J. Biol. Chem.) - Inhibition of fat-storing cell proliferation by a monomeric arginase derived from perfused rat liver.(2000년, J. Biochem.) - Purification and characterization of a novel inhibitor of the proliferation of hepatic stellate cells.(2000년, J. Biochem) - An integrated process for the separation and purification of biologically active proteins from human urine.(1993년, Kor. J. Biotechnol. Bioeng) - The urokinase concentration and the plasmin concentration in the plasma.(1992년, Kor. J. Int. Medicine) - A pharmacokinetic study on the loading dose and maintenance dose for urokinase during intravenous administration.(1992년, Kor. J. Int. Medicine) |
| 수석전문위원 | 이성희 | 바이오연구소 | -동아제약 바이오텍연구소 연구소장 | <논문> - Biochemical characterization of a new recombinant TNF receptor-hyFc fusion protein expressed in CHO cells (2013년 Protein Expression and Purification) - The pharmacology study of a new recombinant TNF receptor-hyFc fusion protein (2013년 Biologicals) - Long-acting Recombinant Human Granulocyte Colony Stimulating Factor(rhG-CSF) with a Trimer-Structured Polyethylene Glycol(2010년 Journal of Pharmaceutical Investigation) - Correlation of antiviral T-cell responses with suppression of viral rebound in chronic hepatitis B carriers: aproof-of concept study (2006년 Gene Therapy) - Long-acting interferon-α 2a modified with atrimer-structured polyethylene glycol: Preparation, in vitro bioactivity, in vivo stability and pharmacokinetics (2006년 International Journal of Pharmaceutics) - Engineering N-glycosylation mutations in IL-12 enhances sustained cytotoxic T lymphocyte responses for DNA immunization (2002년 Nature Biotechnology) - Effect of Recombinant Human FSH on Ovulation, Pregnancy and In Vitro Fertilization in Androgen-sterilized Mice (2002년, Arch. Pharm) - DA-3285(recombinant human erythropoietin)의 국소자극성에 관한 연구 (1998년 J. Toxicol) - Efficacy of Recombinant Human Erythropoietin(rhu-EPO) (1998년 응용약물학회지) - Recombinant Human Erythropoietin (DA-3285)의 실험동물에서의 약동력학 및 조직분포 (1996년 응용약물학회지) - Recombinant Human Erythropoietin(DA-3285)의 효력 및 일반약리작용 (1996년 응용약물학회지) Biotechnology) <학회발표> - Effect of Recombinant Human FSH on Ovulation, Pregnancy and In Vitro Fertilization in Androgen-sterilized Mice (2002년 Proceedings Of The Spring Convention Of The Pharmaceutical Society Of Korea) - Capillary Electrophoresis SDS Nongel Sieving Analysis of PEGylated Interferon Alpha (2001년 AAPS 2001 Annual Meeting & Exposition) - Capillary Electrophoretic Analysis of PEGylated Interferon Alpha (2001년 Proceedings Of International Convention Of The Pharmaceutical Society Of Korea) - Sustained Release of Recombinant Human Growth Hormon From Biodegradable Polymer Matrices (2001년 Proceedings Of International Convention Of The Pharmaceutical Society Of Korea) - Preparation and properties of mono-PEG modified interferon-a having different molecular weight of the PEG portion (2001년 Proceedings Of International Convention Of The Pharmaceutical Society Of Korea) - Development of HIV-1 ELISA Using Highly Reactive HIV-1 Antigens (1997년 제 16차 대한수혈학회 학술대회 초록집) |
| 상무 | 허민규 | 임상개발실 | -前 HBI PM 연구원 -前 중외CreaGene 차장 |
<주요논문> - hIL-7-hyFc, A Long-Acting IL-7, Increased Absolute Lymphocyte Count in Healthy Subjects (2020년, Clinical and Translational Science) - Long-acting FC-fusion rhGH (GX-H9) shows potential for up to twice-monthly administration in GH-deficient adults (2018년, European Journal of Endocrinology) - Adjuvant immunotherapy with autologous dendritic cells for hepatocellular carcinoma, randomized phase II study (2017년, Oncoimmunology) - The changes of estrogen receptorβ variants expression in breast carcinogenesis: Decrease of estrogen receptorβ2 expression is the key event in breast cancer development (2006년, Journal of Surgical oncology) - FBI-1 Enhances Transcription of the Nuclear Factor-κB (NF-κB)-responsive E-selectin Gene by Nuclear Localization of the p65 Subunit of NF-κB (2005년, The Journal of Biological Chemistry) - Expression of estrogen receptor-beta in normal mammary and tumor tissues: is it protective in breast carcinogenesis? (2003년, Breast Cancer Research and Treatment) <학회발표> - Phase 1b/2 Study of GX-I7 plus pembrolizumab in patients with refractory or recurrent (R/R) metastatic triple negative breast cancer (mTNBC): The KEYNOTE-899 Study. (2022년, ASCO) - Pharmacokinetic and Pharmacodynamic Modeling and Simulation of GX-H9 in the Adult Patients with Growth Hormone Deficiency (2020년, KSCPT) - Preliminary safety and efficacy of GX-I7, a long-acting interleukin-7, in combination with pembrolizumab in patients with refractory or recurrent metastatic triple negative breast cancer (mTNBC) (KEYNOTE-899) (2020년, KSMO) - Preliminary safety and efficacy of GX-I7, a long-acting interleukin-7, in combination with pembrolizumab in patients with refractory or recurrent metastatic triple negative breast cancer (mTNBC): Dose escalation period of Phase 1b/2 study (KEYNOTE-899) (2020년, ASCO) - 24-Month Efficacy and Safety of Once Weekly and Every Other Week Administration of GX-H9, Hybrid Fc-Fused Long-Acting Human Growth Hormone: a Phase 2 Study in Children with Growth Hormone Deficiency (2020년, ENDO) - Efficacy and safety of GX-I7 plus pembrolizumab for heavily pretreated patients with metastatic triple negative breast cancer: The Phase 1b/2 KEYNOTE-899 Study (2020년, SITC) - Phase 1b study of GX-I7, a long-acting interleukin-7, evaluating the safety, pharmacokinetics and pharmacodynamics profiles in patients with advanced solid cancers (2019년, SITC) - Hyleukin-7, a long-acting interleukin-7, increased absolute lymphocyte counts after subcutaneous and intramuscular administration in healthy subjects (2019년, AACR) - A Pharmacokinetic-Pharmacodynamic (PK/PD) Analysis of GX-H9, a Long-acting Hybrid Fc-fused rhGH, in Children with GH Deficiency (GHD) (2018, ENDO) - GX-E2 versus CERA for Anemia in Patients Receiving Maintenance Peritoneal Dialysis: A Phase 2, Randomized, Multi-center, Active-comparator, Dose-finding, Safety and Efficacy Study. (2017년, ASN) |
당사는 설립 초기부터 함께 한 우수인력을 보유하고 있으며 동 인력의 유지와 안정적인 연구개발지원을 위하여 다양한 복리후생정책 및 주식매수선택권 부여, 우리사주조합 설립 등의 체계적인 보상을 통해 전문 인력을 유지하고 있습니다. 하지만 업계 특성 상 연구개발 인력들의 개인적인 학업 증진을 위한 해외유학 등의 사유로 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히 타경쟁사의 당사 우수인력의 스카우트는 당사가 사업을 영위함에 있어 큰 문제가 될 수 있습니다.또한, 핵심인력 이탈과 함께 당사의 주요 기술이 유출될 경우, 당사의 경쟁력이 악화될 수 있으며, 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자분들께서는 이 점 유의하시기 바랍니다.
| 사. 지적재산권 침해에 따른 위험 당사가 영위하고 있는 제약 및 바이오 사업은 개발회사가 보유한 특화된 기술 및 제품화 능력에 의하여 성패가 결정되는 기술지향형 산업이며, 이를 영위하기 위해서는 기술보호가 필수적입니다. 당사 역시 신약 연구개발 기업으로서 기술 노하우 및 지적재산권의 보호를 사업을 영위하는데 있어 큰 비중을 차지하고 있는 핵심 사안으로 고려하고 있습니다. 이에 당사는 당사 핵심 기술 및 제품에 대한 권리를 보호할 수 있도록 국내뿐만 아니라 해외 에서도 특허 출원 및 등록을 진행하여 지식재산의 권리화에 힘쓰고 있습니다. 본 공시서류 제출일 현재 당사가 권리자인 특허에 대한 침해, 무효 주장에 관한 소송은 존재하지 아니하나 향후 제 3 자에 의하여 당사가 보유하고 있는 특허에 대한 침해, 무효 소송 또는 기타 분쟁이 발생할 가능성을 배제할 수 없고 당사가 해당 지식재산권을 효과적으로 관리하지 못하여 당사 특허가 무효 또는 소멸될 수 있으며, 이 경우 당사의 기술 및 사업경쟁력은 약화되어 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다. |
당사와 같은 연구개발 기업은 특허의 출원 및 등록과 관련제도를 통한 지적재산권의 관리가 중요하며 핵심 기술 및 제품에 대한 권리를 보호할 수 있는 장치를 마련하는 것이 필요합니다. 특허는 산업상 유용한 발명을 한 자가 자신이 이룬 발명의 내용을 공개하는 대가로 일정한 기간 동안 독점적, 배타적 권리를 부여받는 공적 계약의 일종입니다. 제약산업 분야는 지식재산권 중 특허권의 비중이 타 산업에 비해 높은 편입니다. 이에 따라 제품화 성공 시 높은 경제적 효익의 확보가 가능하나 개발 성공까지 막대한 비용과 많은 시간이 소요되고 성공률이 낮다는 신약개발산업 특징에 기인한 부분입니다. 한편 신약개발에 성공하더라도 개발된 신약이 매우 우수하여 높은 상업적 성공가능성을 보이면 잠재 경쟁업체들이 이에 대한 제네릭 의약품(Generic, 복제의약품)을 개발하여 그 경쟁력을 위협할 수 있는데, 견고한 특허장벽은 이러한 제네릭 의약품의 시장진입에 대한 효과적인 대비책이 될 수 있습니다.
본 공시서류 제출일 현재 당사는 국내외 총 32건의 특허를 보유하고 있으며, 국내외 주요국에 특허를 출원하여 권리 확보에 성공하였습니다.
당사가 보유한 지적재산권 세부 내역 현황은 '제2부 발행인에 관한 사항-II.사업의 내용-7. 기타 참고사항'을 참고하여주시기 바랍니다.
본 공시서류 제출일 현재 당사의 핵심기술 및 활용기술과 관련한 소송이나 분쟁은 발생한 내역이 없으며 기술보호를 위해 국내뿐만 아니라 해외에서도 특허 등록을 진행하고 있습니다. 또한, 전문 컨설팅 기관으로부터 특허의 침해 여부 및 전략에 관하여 정기적으로 컨설팅을 받고 있습니다. 그럼에도 불구하고 향후 당사가 보유한 지적재산권을 적절히 보호하지 못하거나 당사가 사용하는 기술과 관련한 지적재산권 관련 분쟁이 발생하는 경우 당사의 경쟁력은 약화될 수 있으며 이는 당사의 영업 및 손익에 부정적인 영향을 미칠 수 있습니다. 이점 유의하여 투자해 주시기 바랍니다.
| 아. 기술이전 지연 및 실패 위험 일반적으로 의약품의 개발은 각 국가의 규제 당국이 제시하는 단계에 따라 비임상 독성 시험, 임상 시험 (1, 2, 3상), 생산 공정개발 및 확립, 시판 승인 절차를 거쳐 최종적으로 상용화되기까지는 오랜 시간과 많은 비용이 소요되며, 많은 시간과 비용을 투자하였더라도 최종 제품으로 개발이 되는 확률은 매우 낮습니다. 이러한 신약개발의 특성상 당사를 포함한 많은 바이오기업들은 파이프라인 기술이전을 주요 사업모델로 하고 있습니다. 당사 또한 GX-I7, GX-188, GX-E4 등 여러 파이프라인 관련 기술이전 계약 및 계약금을 수취한 경험이 있고, 계약에 따라 마일스톤 및 로열티를 기대하고 있습니다. 기술이전 사업전략이 당사의 주요 사업화 전략임에 따라 현재도 지속적으로 파트너사와 관련 논의가 진행 중에 있습니다. 단, 당사의 계획과 달리 파트너사와의 협의가 원활히 이루어지지 않아 기술이전 계약이 취소되거나 규모가 축소될 경우, 파트너사의 임상개발 진행 및 규제당국의 승인 여부, 그리고 파트너사의 자금 상황으로 인해 대금 수취에 어려움이 생길 경우 사업에 부정적인 영향이 생길수 있으니 투자자분들께서는 이점 유의하시기 바랍니다. |
당사와 같은 바이오 벤처기업은 신약 개발사업이 태생적으로 부담하고 있는 낮은 임상성공률, 대규모 개발비용, 오랜 개발기간에 따른 리스크를 국내외 대형 제약사와 분산하기 위하여 자체제조 및 판매와 더불어 글로벌 제약사로의 기술이전(L/O)함으로써 조기에 수익을 시현하는 것을 기본적 수익모델로 삼고 있습니다. 국내외 대형 제약사 또한 대규모 개발비용을 감수하고 성공확률이 높은 약제로의 선택과 집중을 통해 최상의 결과를 얻고자 사내 연구개발에만 의존하지 않고 외부에서 신약 개발의 기회를 찾는 오픈 이노베이션(open innovation) 전략을 적극적으로 추진하는 추세에 있습니다.
| [2021 국내 제약바이오기업 기술수출 현황] |
| 순번 | 개발사 | 계약상대(국가) | 제품/적응증/기술 | 계약규모 |
|---|---|---|---|---|
| 1 | 알테오젠 | 인타스 파마슈티컬스(인도) | 인간 히알루로니다제(ALT-B4) | 1,250억원 |
| 2 | GC녹십자랩셀-아티바 | MSD(미국) | 고형암에 쓰는 CAR-NK 세포체료제 3종(공동개발) | 2조 900억원 |
| 3 | 제넥신 | KG바이오(인도네시아) | GX-17 (코로나19 치료제와 면역항암제로 개발 중) | 1조 2,000억원 |
| 4 | 대웅제약 | 상해하이니(중국) | 위식도역류질환 치료 신약 '펙수프라잔' | 3,800억원 |
| 5 | 이뮨온시아 | 3D메디슨(중국) | CD47 항체 항암신약후보 물질 'IMC-002' | 5,400억원 |
| 6 | 펩트론 | 치루제약(중국) | 표적항암 항체치료제 'Pab001-ADC' | 6,340억원 |
| 7 | LG화학 | 트랜스테라 바이오사이언스(중국) | 자가면역질환 치료 후보물질 'LC510255' | 비공개 |
| 8 | 한독 CMG제약 | AUM바이오사이언스(싱가포르) | 표적항암제 후보물질 CHC2014 | 1,934억원 |
| 9 | 대웅제약 | 뉴로가스트릭스(미국) | 펙수프라잔' 위식도역류질환 치료제 | 4,800억원 |
| 10 | 팬젠 | VEM(터키) | 빈혈치료제 바이오시밀러 생산기술 | 33억원 |
| 11 | 레고캠바이오 | 익수다테라퓨틱스(영국) | 항체약물접합체 플랫폼기술 | 4,237억원 |
| 12 | 대웅제약 | 펙수프라잔(중남미 4개국) | 위식도역류질환 치료제 '펙수프라잔' | 340억원 |
| 13 | HK이노엔 | 뤄신(중국) | 케이캡' 위식도 역류질환 치료주사 | 비공개 |
| 14 | 툴젠 | 카세릭스(호주) | CAR-T 치료제 | 1,500억원 |
| 15 | 와이바이오로직스 | 피에르파브르(프랑스) | 고형암 치료를 위한 신규 항체 후보물질 | 1,164억원 |
| 16 | 동아에스티 | 인타스(다국적제약사) | 스텔라라 바이오시밀러 'DMB-3115'의 글로벌 라이선스 아웃 계약 | 1,200억원 |
| 17 | 동아에스티 | 양쯔강약업그룹(중국) | DA-7310(요로감염증) | 비공개 |
| 18 | 바이오팜솔루션즈 | 경신제약(중국) | 소아연축/뇌전증 치료물질 계약 | 468억원 |
| 19 | 보로노이 | 브리켈바이오텍(미국) | 자가면역질환 치료제 프로그램 | 3,800억원 |
| 20 | 디앤디파마텍 | 산전 살루브리스 제약(중국) | 대사성질환 치료제 DD01 | 비공개 |
| 21 | 올릭스 | 한소제약(중국) | GalNAc-asiRNA 기반 기술 관련 | 5,368억원 |
| 22 | 에이프릴바이오 | 룬드벡(덴마크) | 자가면역 질환 치료 후보물질 APB-A1 | 5,370억원 |
| 23 | 대웅제약 | 아그라스(아랍에미리트) 등 중동 6개국 | 위식도역류질환 치료 신약 '펙수프라잔' | 991억원 |
| 24 | 큐라클 | 테아오픈이노베이션(프랑스) | 당뇨병성 황반부종 및 습성 황변변성 치료제 'CU06-RE' | 1,907억원 |
| 25 | 고바이오랩 | 상해의약그룹 자회사 신이(중국) | 면역질환 치료 소재 KBL697와 KBL693 | 1,200억원 |
| 26 | 한미약품 | 앱토즈 바이오사이언스(캐나다) | 급성골수성 백혈병(AML) 치료 신약 'HM43239' | 4,961억원 |
| 27 | SK바이오팜 | 이그니스테라퓨틱스(중국) | 세노바메이트 등 6개 CNS 신약 | 2,180억원 |
| 28 | 보로노이 | 피라미드바이오사이언스(미국) | MPS1 타겟 고형암치료제(VRN08) | 1조원 |
| 29 | 레고켐바이오 | 소티오바이오텍(체코) | 항체약물접합체(ADC) 플랫폼 기술 | 1조 2,127억원 |
| 30 | SK바이오팜 | 엔도그룹(아일랜드) | 세노바메이트 | 433억원 |
| 31 | HK이노엔 | 브레인트리 래보라토리스(미국) | 케이캡(테고프라잔) | 6,400억원 |
| 32 | 레고켐바이오사이언스 | 익수다테라퓨틱스(영국) | 표적유방암치료제 LCB14(HER2-ADC) | 1조 1,864억원 |
| 33 | 한미약품 | 에퍼메드 테라퓨틱스(중국) | 안과분야 신약 루미네이트(리수테가닙) | 1,719억원 |
| 출처: KPBMA 한국제약바이오협회, 언론보도 종합 |
당사 역시 주요 사업 개발 전략은 바이오 의약품 치료제의 기술이전이며, 임상2상 시점 또는 임상3상 승인 후에 글로벌 바이오회사에 기술이전하는 것을 주요 사업모델로 하고 있습니다. 당사는 바이오의약품 치료제가 임상에 진입하기 시작한 2012년부터 본격적인 기술이전을 진행하였으며, 주요 기술이전은 2016년 중국 CWB사에 GX-E4의 중국권리 이전($44.5M), 2017년 중국 I-Mab 사에 GX-I7의 중국권리 이전($560M), 2021년 인도네시아 KG-Bio사에 GX-I7의 아세안 등 지역 권리 이전($1,100M)이 있습니다.
해당 파트너사로부터의 기술이전 대금수취조건은 통상적으로 Upfront와 개발진척에 따른 Milestone, 판매진척에 따른 Milestone, 판매에 따른 Running Royalty로 구성됩니다. 따라서 기술이전에 대한 전체 대금을 수취하기 위해서는 기술이전 대상회사에 대한 파트너십과 후속 연구개발단계 진척관리가 필요합니다. 따라서 다양한 연구개발 협력 프로그램(Joint Development Committee, 기술세미나, Tech Transfer 지원 등)을 운영하면서 연구현황을 관리 및 추적하고 있습니다. 이러한 파트너사와의 협력은 당사 파이프라인의 신약개발 성공 및 글로벌 시장에 진출함에 있어 매우 중요합니다.
하지만 당사의 이러한 노력에도 불구하고 파트너사의 사정에 따른 당사의 신약 파이프라인 개발계획 지연, 글로벌 기술이전 거래 건수 및 규모의 감소, 제약/바이오 시장의 수요 감소, 글로벌 제약사들의 사업전략 변동 등의 이유로 인해 기술이전이 예상보다 지연되거나 실패하는 경우 이로 인하여 당사의 재무상태 및 영업실적에 부정적인 영향이 있을 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
당사 파이프라인의 기술이전 계약 현황 관련 세부사항은 본 공시서류 '제2부 발행인에 관한 사항-II. 사업의 내용-6. 주요계약 및 연구개발활동'을 참고해주시기 바랍니다.
| 자. 정부 정책 및 규제 변화에 따른 위험 당사는 바이오 의약품 연구개발을 수행함에 따라, 각 산업에 대한 안전성 관련 규제에 영향을 받을 수 있습니다. 특히 당사의 유전자 치료백신 연구개발의 경우, 동물 독성시험에서 안전성을 확인하였지만 임상시험에서 예상하지 못한 부작용이 발생할 수 있으며, 정부의 안정성에 대한 규제와 유전자치료제의 품질, 비임상, 임상시험의 규정 및 가이드라인의 규정 및 가이드라인을 준수하여야 합니다.또한,바이오 의약품 연구개발에 대한 정부의 정책 변화로 정부 지원이 축소 또는 변경되거나 임상 단계에서 적용되는 규정 등의 변화가 일어나는 경우, 사업에 부정적인 영향을 미칠 수 있으니 투자자분들께서는 이점 유의하시기 바랍니다. |
제약 산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업으로, 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 제약 및 신약개발 사업과 관련된 국내 법률 중 당사의 사업과 밀접하게 연관된 법률로는 식품의약품안전처 및 보건복지부 소관의 '약사법'이 대표적이며, 그 외 보건복지부 소관의 '국민건강보험법', '생명윤리 및 안전에 관한 법률', '제약산업 육성 및 지원에 관한 특별법', '희귀질환관리법', '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률'과 식품의약품안전처 소관의 '실험동물에 관한 법률' 등이 있습니다.
특히, 당사는 DNA 유전자치료백신 연구 개발을 수행함에 따라, 유전자치료제 안전성 관련 규제에 영향을 받을 수 있습니다. 특히 당사의 유전자 치료백신 연구개발의 경우, 동물 독성시험에서 안전성을 확인하였지만 임상시험에서 예상하지 못한 부작용이 발생할 수 있으며, 정부의 안정성에 대한 규제와 유전자치료제의 품질, 비임상, 임상시험의 규정 및 가이드라인의 규정 및 가이드라인을 준수하여야 합니다.
유전자치료제 개발 시장은, 2012년 전 세계적으로 인정을 받은 최초의 유전자치료제 글리베라 (Glybera, rAAV1-LPL, UniQure) 이후 글로벌 신약으로의 가능성을 인정받아 지대한 관심과 함께 활발한 연구개발이 이루어지고 있으므로, 성공적인 제품화 단계로의 준비를 위해 안전성 검증을 위한 품질 평가 기술 개발 및 안전관리 체제의 확립이 필수적으로 요구되며, 이는 유전자치료제 분야에 있어 선제적인 안전 관리 및 효율적인 제품화 진행을 위한 기반을 확립 하는데 매우 중요하게 적용되는 만큼, 과학적인 측면의 연구가 지속적으로 뒷받침되어야 합니다. 관련 하여 유전자치료제의 품질 관리, 안전성 및 유효성에 대한 정부 정책과 규제 변화에 따른 위험이 발생할 수 있습니다.
| [유전자 치료 연구 관련 법률] |
| 생명윤리 및 안전에 관한 법률 |
| 제47조 (유전자치료) ① 인체 내에서 유전적 변이를 일으키는 일련의 행위에 해당하는 유전자 치료에 관한 연구는 다음 각호의 모두에 해당하는 경우에만 할 수 있다. 1. 유전질환, 암, 후천성면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러일으키는 질병의 치료를 위한 연구 2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료를 위한 연구 ② 유전물질 또는 유전물질이 도입된 세포를 인체로 전달하는 일련의 행위에 해당하는 유전자치료에 관한 연구는제1항제1호 또는 제2호 중 어느 하나에 해당하는 경우에만 할 수 있다. ③ 유전자치료는 배아, 난자, 정자 및 태아에 대하여 시행하여서는 아니 된다. |
당사는 내부에 담당 인력과 외부 전문가들을 통하여 국내 및 해외 제약 산업 정책 및 규제 환경을 지속적으로 모니터링하고 있으며, 각국의 규제 당국과의 소통을 통해 정책 및 규제 환경의 변화에 효과적으로 대비하기 위해 최선의 노력을 다하고 있습니다. 그럼에도 불구하고 국내를 포함한 주요 국가에서의 제약 산업 관련 정책이 비우호적 분위기로 전환되거나 규제가 강화되는 경우, 당사의 사업에 부정적인 영향을 미칠 수 있습니다.
2. 회사위험
| [투자자 주의사항] |
| ■ 본 증권신고서는 당사의 영업활동 및 재무에 대해 보다 정확하고 실체적인 정보 전달을 위하여 연결재무제표를 기준으로 작성하였으나, 자세한 설명을 위하여 일부 별도 재무제표를 기준으로 작성한 부분은 본문에 별도 기준이라고 기재하였습니다. 투자자분들께서는 이점 유의하시기 바랍니다. ■ 회사위험에는 당사의 주요 재무적 위험요소들이 기재되어 있습니다. 투자자분들의 이해 편의를 위하여, 당사의 최근 3개년간 주요 재무사항 총괄표를 요약 기재하였으니, 투자 판단에 참고하여 주시기 바랍니다. ■ 본 공시서류에 포함된 2022년 3분기말(제 24기 3분기말) 재무정보는 외부감사인의 검토 또는 감사를 받지 아니한 재무제표를 사용하였습니다. |
| [연결 기준 주요 재무상황 총괄표] |
| (단위: 백만원, 배, %) |
| 구분 | 2022년 3분기 (제24기) |
2021년 (제23기) |
2020년 (제22기) |
2019년 (제21기) |
비 고 |
|---|---|---|---|---|---|
| 외부감사인 | 대성삼경회계법인 | 대성삼경회계법인 | 대성삼경회계법인 | 대성삼경회계법인 | - |
| 감사의견 | 검토 | 적정 | 적정 | 적정 | - |
| 자산총계 | 444,670 | 636,865 | 596,908 | 358,177 | - |
| 유동자산 | 57,994 | 57,274 | 20,646 | 95,817 | - |
| 비유동자산 | 386,676 | 579,591 | 576,262 | 262,360 | - |
| 부채총계 | 106,859 | 113,592 | 60,375 | 61,267 | - |
| 유동부채 | 40,114 | 59,154 | 40,217 | 22,638 | - |
| 비유동부채 | 66,745 | 54,438 | 20,157 | 38,630 | - |
| 자본총계 | 337,810 | 523,273 | 536,533 | 296,909 | - |
| 자본금 | 12,572 | 12,515 | 12,349 | 11,881 | - |
| 매출 | 13,831 | 36,828 | 18,543 | 11,303 | |
| 매출원가 | 3,001 | 5,022 | 6,867 | 3,850 | - |
| 영업이익 | (20,291) | (19,373) | (39,160) | (44,536) | - |
| EBITDA | (17,033) | (16,075) | (36,240) | (42,033) | - |
| 당기순이익 | (18,125) | (48,561) | 27,536 | (16,509) | - |
| 영업현금흐름 | (31,288) | (12,745) | (22,691) | (41,572) | - |
| 투자현금흐름 | 1,342 | (7,704) | (64,394) | 1,637 | - |
| 재무현금흐름 | 26,097 | 43,087 | 73,358 | 3,328 | - |
| 기초현금 | 27,796 | 5,212 | 19,092 | 55,680 | - |
| 기말현금 | 25,057 | 27,796 | 5,212 | 19,052 | - |
| 영업이익률 | -146.71% | -52.6% | -211.2% | -394.0% | 영업이익 ÷ 매출액 |
| EBITDA이익률 | -123.15% | -43.6% | -195.4% | -371.9% | EBITDA ÷ 매출액 |
| 당기순이익률 | -131.05% | -131.9% | 148.5% | -146.1% | 당기순이익 ÷ 매출액 |
| ROA | -5.43% | -7.6% | 4.6% | -4.6% | 당기순이익 ÷ 자산총계 |
| ROE | -7.15% | -9.3% | 5.1% | -5.6% | 당기순이익 ÷ 자본총계 |
| 매출액 성장률 | -49.93% | 98.6% | 64.1% | -12.3% | - |
| 영업이익 성장률 | n/a | n/a | n/a | n/a | - |
| 당기순이익 성장률 | n/a | n/a | n/a | n/a | - |
| 자산총계 성장률 | -30.18% | 6.7% | 66.7% | -4.4% | - |
| 이자보상비율 | -8.8 | -39.3 | -13.4 | -9.7 | 영업이익 ÷ 이자비용 |
| EBITDA 이자보상비율 | -7.4 | -32.6 | -12.4 | -9.2 | EBITDA ÷ 이자비용 |
| 부채비율 | 31.63% | 21.7% | 11.3% | 20.6% | 부채총계 ÷ 자본총계 |
| 유동비율 | 144.57% | 96.8% | 51.3% | 423.3% | 유동자산 ÷ 유동부채 |
| 총차입금 | 77,786 | 52,219 | 27,155 | 39,377 | - |
| 총차입금 의존도 | 17.49% | 8.2% | 4.5% | 11.0% | 총차입금 ÷ 자산총계 |
| 주1) 2022년 3분기 ROA, ROE는 단순 연환산수치를 사용하였으며, 2022년 3분기 매출액 성장률은 2022년 3분기 매출액을 단순 연환산 하여 비교하였고, 2022년 3분기 자산총계성장률은 2021년과 비교하였습니다. |
| 가. 성장성 및 수익성 감소에 따른 위험 당사는 기술이전 및 연구용역/서비스 관련 매출이 주를 이루고 있는 매출구조상, 기술이전 계약 여부에 따라 매출액이 크게 변동하는 특성을 갖고 있습니다. 당사의 최근 직전 3개년 매출액은 기술이전 관련 매출 증가에 따라 2019년 11,303백만원, 2020년 18,543백만원, 2021년 36,828백만원을 기록하며 점진적으로 증가하는 추이를 보였으며, 2022년 3분기에는 13,831백만원의 매출액을 기록하였습니다. 당사는 기술이전, 기술재산권(로열티), 연구용역/서비스 관련 매출이 지속적으로 발생하고 있으나, 신약 개발을 위한 연구개발비 지출로 최근 직전 3개년간 지속적인 영업손실을 기록하는 모습을 보이고 있습니다. 당사의 영업손실은 2019년 44,536백만원, 2020년 39,160백만원, 2021년 19,373백만원, 2022년 3분기 20,291백만원을 기록하였으며, 판매비와 관리비는 최근 직전 3개년간 50,000백만원 수준을 유지해 결과적으로 매출액 규모에 따라 영업이익률이 변동되는 모습을 보입니다. 2021년의 경우 당사의 주요 파트너사인 KG-Bio과의 GX-I7(면역항암제) 기술이전 계약체결에 따라 29,908백만원 매출액이 발생하며 영업이익률이 전년대비 158.6%p. 개선되었으나, 2022년 3분기의 경우 판매비와 관리비는 31,121백만원인데 반해 매출액은 13,831백만원에 그치며 -86.1%의 영업이익률을 기록했습니다. 이와 같이, 지속적인 신약개발에 따라 판매비와 관리비 규모가 유지되는 가운데 향후 기술이전 및 연구용역/서비스 관련 매출 부재로 매출액이 감소할 경우 당사 수익성에 부정적으로 작용할 수 있으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다. 당사는 2022년 3분기 기준 6개의 관계기업과 4개의 공동기업에 대해 투자를 완료한 상태로 이에 따라 지분법손익에 따른 당기순이익 변동이 큰 특징이 있으며, 그 외에도 기발행 전환사채에 기인한 파생상품평가손익이 당기순이익에 영향을 미치는 모습을 보이고 있습니다. 당사의 당기순이익은 2019년 -16,509백만원, 2020년 27,536백만원, 2021년 -48,561백만원, 2022년 3분기 -18,125백만원을 기록하였습니다. 2020년에 전년대비 당기순이익이 크게 개선된 것은 제넨바이오에 대한 유의적 영향력 상실에 따라 해당 투자주식을 관계기업투자주식에서 기타포괄손익금융자산으로 재분류하였고, 이에 따라 발생한 일회성 관계기업투자주식 처분수익 36,972백만원이 지분법이익으로 반영된 것이 주요하게 작용했습니다. 당사는 기술이전 및 연구용역/서비스 관련 매출이 주를 이루고 있는 매출구조상, 기술이전 계약 여부에 따라 매출액이 크게 변동하는 특성을 갖고 있으며, 관계기업 및 공동기업 투자에 따른 지분법손익 등 영업외손익에 따라 수익성이 결정됩니다. 이에 따라, 향후 파이프라인의 제품화 실패 혹은 라이센스 아웃 등이 어려움을 겪어, 영업손실이 지속되고, 지분법손실 및 파생상품평가 손실 등 영업외손실이 발생할 경우 수익성 악화로 재무구조는 악화될 가능성이 존재하니, 투자자께서는 투자판단시 이 점 유의하시기 바랍니다. |
당사는 독자적인 원천기술을 바탕으로 hyFc 플랫폼(항체융합 단백질 플랫폼) 및 고생산 세포주 제조, 공정개발 기술과 DNA 백신 치료제 기술을 보유한 R&D 중심 바이오텍으로서, 주요 파이프라인인 GX-I7, GX-E4, GX-H9, GX-P1, GX-188E 등에 대해서 오픈이노베이션 전략을 통해 국내외 다양한 파트너사와 임상시험을 진행함으로써 치료제 개발 및 제품의 상업화 달성에 주력하고 있습니다.
차세대 단백질 신약의 경우 당사의 고유 기반기술(hybrid Fc; hyFc)과 노하우 기술 (고생산 세포주 제조 및 공정개발 기술) 을 바탕으로 기존의 단백질 치료제에 비해 체내의 반감기 및 효능을 현저히 향상시킨 차세대 의약품 개발에 집중하고 있으며, 제품의 목표시장은 전 세계를 대상으로 하고 있습니다.
당사가 개발하고 있는 단백질 치료제는 주로 암, 내분기계 질환, 면역계통 질환 등의만성질환을 대상으로 한 치료제입니다. 대표적 파이프라인으로 항암 면역치료제 (GX-I7)를 보유하고 있으며, 차세대 단백질 신약으로 지속형 인간성장호르몬 (GX-H9), 빈혈 치료제 (GX-E4) 등을 개발하고 있습니다.
사업화의 핵심은 파이프라인별 파트너쉽과 기술이전에 있습니다. 항체융합단백질 치료제 파이프라인은 대부분 국내 및 해외 제약사와 공동개발 및 임상시험으로 진행되며 해당 제품의 상용화 또는 임상단계에서 글로벌 대형 기업으로의 기술이전을 목표하고 있습니다. 실제로 당사는 미국, 유럽, 중국, 아세안 지역을 대상으로 기술수출계약을 체결함에 따라 차세대 단백질 신약 기술이전 관련 매출액이 2019년 43억원에서 2021년 305억원으로 증가하였습니다.
다음은 당사의 주요 기술이전 계약 관련 세부 내용입니다.
| [투자판단 관련 주요경영사항(2021.02.18] |
| 1. 제목 | GX-I7 (면역항암제) 기술이전 계약체결 | |
| 2. 주요내용 | *투자유의사항 본 계약을 통한 수익 인식은 개발 및 임상시험과 품목허가 등의 성공 여부에 따라 달라질 수 있습니다. 계약 조건에 따라, 규제기관에 의한 연구-개발의 중단, 품목허가 실패 등 발생시 계약이 해지될 수 있습니다. 1.계약상대방 : KG-Bio (인도네시아) 2.계약의 주요내용 (단위 : US Dollar) 1) 계약기술 및 적응증 : 면역항암제 GX-I7 적용 모든 적응증(종양 및 감염증) 2) 계약금액 - 계약금 (Upfront) : $ 27,000,000 (원화 29,907,900,000원,19년도말 자기자본 대비 10.07%) - 마일스톤 (Milestone) : $ 1,073,000,000 (원화 1,188,562,100,000원) 임상단계, 허가, 상업화 등 단계별 일정 계획에 따라 수령 예정 => 총 계약금액 : $ 1,100,000,000 (원화 1,218,470,000,000원) - 경상기술료 (Royalty) : 별도수령 (해당 지역 상업화 제품 연간 순매출액의 10%) 3) 계약지역 : ASEAN 국가, MENA 국가, 호주, 뉴질랜드, 남아시아 (인도 포함) 및 기타 아프리카 4) 계약체결일 : 2021년 02월 18일 5) 계약기간 : 계약일로부터 양방 당사자 서면 종료 합의시까지 |
|
| 3. 사실발생(확인)일 | 2021-02-18 | |
| 4. 결정일 | 2021-02-18 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| (1) 상기 사실발생(확인)일은 계약 체결일입니다. (2) 총 계약금액은 사실발생일의 매매기준율 1,107.07/USD를 적용한 금액입니다. (3) 향후 계약내용 변경 및 공시의무 발생시 즉시 공시 할 예정입니다. |
||
| ※ 관련공시 | - | |
| 출처: 당사 투자판단 관련 주요경영사항 공시 |
| [투자판단 관련 주요경영사항(2022.05.23] |
| 1. 제목 | GX-E4(지속형 빈혈 치료제)기술이전 계약체결 | |
| 2. 주요내용 | * 투자유의사항 본 계약은 조건부 계약으로, 본 계약을 통한 수익 인식은 임상시험과 품목허가 등의 성공여부에 따라 달라질 수 있습니다. 계약 조건에 따라, 규제기관에 의한 연구ㆍ개발의 중단, 품목허가 실패 등 발생시 계약이 해지될 수 있습니다. 1. 계약상대방 : KG-Bio - 국적 : 인도네시아 - 설립일자 : 2015년 12월 28일 - 최근 매출액 : 0원 2.계약의 주요내용 (단위 : US Dollar) - 계약기술 및 적응증 : 투석 및 비투석에 대한 만성신장질환으로 인한 빈혈증 3. 계약금액 - 계약금 (Upfront) : $ 8,000,000 (원화 9,771,200,000원) → 2022년 12월 이내 수령 - 마일스톤 (Milestone) : $ 5,000,000 (원화 6,107,000,000원) → 유럽국가의 투석을 위한 BLA 제출시 수령예정 => 총 계약금액 : $13,000,000 (원화 15,878,200,000원) - 경상기술료 (Royalty) : 순매출액에 따라 합의된 비율로 수령 4. 최근 사업연도 매출액 또는 자기자본 대비 총 계약금액 비율 - 최근 사업연도 매출액(18,543,494,616원)대비85.63% - 최근 사업연도 자기자본(536,533,108,490원)대비 2.96% 5. 계약지역 : ASEAN 국가(인도네시아, 말레이시아, 싱가포르, 필리핀, 태국, 브루나이, 베트남, 미얀마, 캄보디아, 라오스), 나이지리아, 대만, 호주, 뉴질랜드, MENA 국가(알제리, 바레인, 이집트, 이라크, 이스라엘), 요르단, 쿠웨이트, 레바논, 예멘, 아랍에미리트, 리비아, 모로코, 오만, 팔레스타인, 카타르, 사우디아라비아, 튀니지), 남아시아(인도, 파키스탄, 방글라데시 및 스리랑카), 유럽(서부 및 동부유럽, CIS국가 포함)및 기타 아프리카 국가 6. 계약기간 : 계약 체결일로부터 합작법인 계약이 종료될 때까지 7. 계약체결일 : 2022년 03월 24일 |
|
| 3. 사실발생(확인)일 | 2022-03-23 | |
| 4. 결정일 | 2022-03-23 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 1) 상기 사실발생(확인)일은 계약서 수령일 입니다. 2) 당사는 PT Kalbe Farma Tbk와 2015.12.29. 합작법인을 설립하였으며 상기계약의 계약상대방인 KG-Bio는 당사와 PT Kalbe Farma Tbk의 합작법인입니다. 3) 상기 계약은 2015년12월 29일 KG-Bio와 체결한 기술이전계약의 변경계약서 입니다. 4) 상기 계약의 계약금은 2022년 12월 이내 지급받기로 별도 합의하였습니다. 5) 상기 계약의 마일스톤은 유럽국가의 투석을 위한 BLA(생물의약품허가신청) 제출시 수령하는 금액입니다. 6) 상기 2.주요내용의 4. 최근 사업연도 매출액 및 자기자본은 2020년 말 연결재무제표 기준입니다. 7) 총 계약금액은 사실발생일의 매매기준율 1,221.40/USD를 적용한 금액입니다. 8) 향후 계약내용 변경 및 공시의무 발생시 즉시 공시 할 예정입니다. |
||
| ※ 관련공시 | - | |
| 【계약상 특이사항 등 투자위험요소】 |
| 1) 본 계약은 다음 중 하나에 해당하는 경우 종료될 수 있습니다. - 해지하는 당사자의 서면합의 - 상대방이 본 계약의 중요한 조항을 위반하여 상대방이 해당 위반을 시정하기 위한 통지를 받은 날로부터 30일 이내에 시정되지 않은 경우, 위반하지 않는 당사자가 상대방에게 서면으로 통지한 경우 - 불가항력 사건이 발생하여 30일 이상 중단되지 않고 계속되었을 경우 - 상대방이 파산, 파산, 파산, 청산, 사법관리 또는 기타 유사한 절차에 부쳐지거나 업무를 정지하거나 지불을 할 수 없게 된 경우 2) 본 기술이전 계약의 수익인식은 임상시험, 허가, 상업화 이후 누적 매출액 등의 조건 달성 여부에 따르며, 미실현가능성도 있습니다 |
| 출처: 당사 투자판단 관련 주요경영사항 공시 |
또한 당사는 혁신적인 DNA 벡터기술과 플랫폼 기술을 통해 GX-188E (HPV16/18 유래 질환 치료 DNA 백신)을 개발하고 있습니다.
치료 DNA백신의 경우, 최근 글로벌 선진 제약사들이 면역치료 요법에 관심을 가지면서 각광을 받고 있는 분야이고, 제넥신이 보유한 파이프라인이 해당 분야 세계 최초의 유전자 치료 백신을 지향하고 있으므로 그 부가가치가 매우 큽니다. 특히, HPV(인간 유두종 바이러스)의 경우, 자궁경부암의 주요 발병 원인으로 약 70%가 HPV 16 및 18 타입에 의해 유발되며, 최근 HPV 양성 두경부암의 발생율도 증가되는 추세이므로, HPV로 인해 유발되는 암종을 타겟으로 한 치료백신 개발에 대한 수요가 매우 높습니다. 당사가 개발하고 있는 DNA백신 신약은 plasmid DNA 기반 항암 치료 백신으로서 자궁경부암에서 먼저 신약으로서 효능을 입증한 후, HPV양성 두경부암에 대해서도 임상을 통해 치료 효능을 검증할 계획입니다.
GX-188E의 경우 2014년 Nanjing BioSciKin(BSK)로의 기술이전을 통해 매출액이 약 10억원 발행한 이후 기술이전 관련 매출이 부재한 상태입니다. 다만, 2022년 6월 GX-188E에 대한 임삼 1b/2상이 종료된 상태로, 같은 해 9월 9일 프랑스 파리 유럽종양학회 연례학술회의(ESMO 2022)를 통해 1b/2상 결과를 발표하였으며, 2022년 말 신속처리대상지정 및 조건부허가 신청을 위한 절차를 식품의약품안전처(MFDS)와 논의중인 당사는 GX-188E 상업화를 통한 수익화를 위해 최선을 다하고 있습니다. 신속처리대상지정 및 조건부허가 신청관련 세부적인 사항은 본 공시서류 '제1부 모집 또는 매출에 관한 일반사항-V. 자금의 사용목적'을 참고해 주시길 바랍니다.
당사와 Nanjing BioSciKin(BSK) 간 기술이전 계약 당시 관련 공시는 하기와 같습니다.
| [기술도입ㆍ이전 계약 체결] |
| 1. 구분 | 기술이전계약 | |||
| 2. 계약상대방 | Nanjing BioSciKin Co, Ltd.(BSK) | |||
| -회사와의 관계 | 중국지역 파트너 | |||
| 3. 기술의 주요내용 | 도입ㆍ이전 대상 | 자궁경부전암 치료백신(GX-188E) | ||
| 도입ㆍ이전 방법 | 정액기술료 지급을 통한 기술이전 | |||
| 4. 계약의 주요내용 | 계약조건 | 1. 계약의 대상 : 자궁경부전암 치료백신(GX-188E) 관련 특허기술을 이용한 중국내 개발권, 사업권(50%)등 2. 계약시 초기 정액기술료 : $1,000,00 USD (약 1,013,100,000원) 3. 계약의 총 규모 : $5,000,000 USD 4. 이전기술의 사용지역 : 중국지역(대만, 홍콩 포함) 5. 기술료 지급기준 - 기술이전 계약시 - 공동개발 관련 합작회사 설립계약시 - 합작회사 설립시 |
||
| 계약금액 | 계약금액(원) | 5,065,500,000 | ||
| 자기자본(원) | 49,837,818,075 | |||
| 자기자본대비(%) | 10.16 | |||
| 계약기간 | 시작일 | 2014-06-30 | ||
| 종료일 | - | |||
| 5. 계약체결일 | 2014-06-30 | |||
| 6. 이사회결의일(결정일) | - | |||
| -사외이사 참석여부 | 참석(명) | - | ||
| 불참(명) | - | |||
| -감사(사외이사가 아닌 감사위원) 참석여부 | - | |||
| 7. 공정거래위원회 신고대상 여부 | 미해당 | |||
| 8. 공시유보 관련내용 | 유보사유 | - | ||
| 유보기한 | - | |||
| 9. 기타 투자판단에 참고할 사항 | - '4. 계약의 주요내용'에서 계약조건의 정액기술료와 계약금액은 계약체결일 당일의 매매기준 환율(1,013.10원)을 적용한 금액 입니다. - 상기 계약조건의 지급 금액은 기급기준 달성을 전제로 한 수익 입니다. - 금번 기술이전 대상인 자궁경부전암 치료백신(GX-188E)는 현재 국내에서 임상2상시험을 진행중 입니다. - 상기 자기자본은 직전 사업연도말(2013) 재무제표를 기준으로 2014년 1분기 까지의 자본금과 자본잉여금의 증감액을 합산한 금액 입니다. |
|||
| ※관련공시 | 2014-03-11 임상시험단계 진입 ㆍ 종료(자율공시) 2014-01-29 사업계획의 진척상황 등(기술성장기업) |
|||
| 출처: 당사 자율공시 |
당사는 기술이전 및 연구용역/서비스 관련 매출이 주를 이루고 있는 매출구조상, 기술이전 계약 여부에 따라 매출액이 크게 변동하는 특성을 갖고 있습니다. 당사의 최근 직전 3개년 매출액은 기술이전 관련 매출 증가에 따라 2019년 11,303백만원, 2020년 18,543백만원, 2021년 36,828백만원을 기록하며 점진적으로 증가하는 추이를 보였으며, 2022년 3분기에는 13,831백만원의 매출액을 기록하였습니다.
| [손익계산서 주요계정 및 수익성 추이] |
| (단위 : 백만원) |
| 구 분 | 2022년 3분기 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 매출 | 13,831 | 36,828 | 18,543 | 11,303 |
| 매출원가 | 3,001 | 5,022 | 6,867 | 3,850 |
| 매출총이익 | 10,830 | 31,806 | 11,677 | 7,453 |
| 판매비와관리비 | 31,121 | 51,180 | 50,836 | 51,989 |
| 영업이익(손실) | (11,913) | (19,373) | (39,160) | (44,536) |
| 영업이익률(%) | -86.1 | -52.6 | -211.2 | -394.0 |
| 기타수익 | 37,471 | 3,635 | 17,256 | 51,782 |
| 기타비용 | 1,744 | 7,043 | 4,129 | 4,545 |
| 금융수익 | 264 | 321 | 18,798 | 2,923 |
| 금융비용 | 3,872 | 4,628 | 9,501 | 5,995 |
| 지분법이익 | 1,271 | 28,634 | 61,758 | 927 |
| 지분법손실 | 31,225 | 50,107 | 17,487 | 17,064 |
| 법인세비용차감전순이익(손실) | (18,125) | (48,561) | 27,536 | (16,509) |
| 법인세비용 | 0 | 0 | 0 | 0 |
| 당기순이익(손실) | (18,125) | (48,561) | 27,536 | (16,509) |
| 출처: 당사 정기보고서 |
당사의 최근 3개년 매출실적 세부내역은 다음과 같습니다.
| [매출실적 상세내역] |
| (단위 : 백만원) |
| 사업부문 | 매출유형 | 품 목 | 파트너 | 2022년 3분기 |
2021년 | 2020년 | 2019년 |
|---|---|---|---|---|---|---|---|
| 신약개발 | 기술이전 | GX-G3(호중구감소증치료제) | I-Mab | - | - | - | 713 |
| GX-E4(빈혈치료제) | KG-Bio | 9,702 | - | - | 1,949 | ||
| GX-I7 | KG-Bio | - | 29,908 | - | - | ||
| GX-P1/GX-P10 | 제넨바이오, Turret | - | - | 7,930 | - | ||
| hyFc 플랫폼 | 유한양행 | - | 528 | 651 | 1,478 | ||
| 기타기술이전 | 기타 | - | 47 | 276 | 120 | ||
| 소계 | 9,702 | 30,483 | 8,857 | 4,260 | |||
| 기술재산권 (로열티) | FSH(난포자극호르몬) | 동아ST | - | 180 | 104 | 134 | |
| 소계 | - | 180 | 104 | 134 | |||
| 연구용역/서비스 | 세포주구축외 | I-Mab 외 | 2,529 | 523 | 295 | ||
| 프로젝트개발용역 | 한독, NeoImmuneTech, I-Mab 외 | 1,485 | 5,939 | 8,181 | 4,433 | ||
| 비임상분석/동물실험 | 프로젠 외 | 103 | 37 | 440 | 1,671 | ||
| 정부기관 연구용역 | 정부기관 | - | 109 | 217 | 204 | ||
| 기타용역 | 기타 | 12 | 80 | 222 | 306 | ||
| 소계 | 4,129 | 6,165 | 9,060 | 6,614 | |||
| 부문 계 | 13,831 | 36,828 | 18,543 | 11,303 | |||
| 출처: 당사 정기보고서 |
당사는 상기 기술한 바와 같이 기술이전, 기술재산권(로열티), 연구용역/서비스 관련 매출이 지속적으로 발생하고 있으나, 신약 개발을 위한 연구개발비 지출로 최근 직전 3개년간 지속적인 영업손실을 기록하는 모습을 보이고 있습니다. 당사의 영업손실은 2019년 44,536백만원, 2020년 39,160백만원, 2021년 19,373백만원, 2022년 3분기 20,291백만원을 기록하였으며, 판매비와 관리비는 최근 직전 3개년간 50,000백만원 수준을 유지해 결과적으로 매출액 규모에 따라 영업이익률이 변동되는 모습을 보입니다. 2021년의 경우 당사의 주요 파트너사인 KG-Bio과의 GX-I7(면역항암제) 기술이전 계약체결에 따라 29,908백만원 매출액이 발생하며 영업이익률이 전년대비 158.6%p. 개선되었으나, 2022년 3분기의 경우 판매비와 관리비는 31,121백만원인데 반해 매출액은 13,831백만원에 그치며 -86.1%의 영업이익률을 기록했습니다. 이와 같이, 지속적인 신약개발에 따라 판매비와 관리비 규모가 유지되는 가운데 향후 기술이전 및 연구용역/서비스 관련 매출 부재로 매출액이 감소할 경우 당사 수익성에 부정적으로 작용할 수 있으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다.
당사의 연도별 영업비용의 성격별 분류는 아래와 같습니다.
| [판매비와관리비 세부 내역] |
| (단위: 백만원) |
| 구 분 | 2022년 3분기 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 급여 | 4,031 | 4,396 | 2,822 | 3,324 |
| 퇴직급여 | 417 | 473 | 324 | 319 |
| 복리후생비 | 830 | 986 | 551 | 770 |
| 여비교통비 | 168 | 22 | 31 | 345 |
| 세금과공과 | 1,861 | 5,031 | 706 | 809 |
| 접대비 | 108 | 192 | 189 | 230 |
| 임차료 | 2 | 34 | 9 | 21 |
| 대손상각비(환입) | 37 | 285 | (11) | (2) |
| 감가상각비 | 1,077 | 1,301 | 720 | 589 |
| 경상연구개발비 | 17,712 | 33,118 | 39,206 | 40,449 |
| 차량유지비 | 61 | 76 | 90 | 81 |
| 지급수수료 | 1,529 | 1,724 | 1,745 | 1,601 |
| 자문료 | - | 3 | 15 | 54 |
| 기술료 | - | 987 | 1,828 | 673 |
| 보험료 | 76 | 66 | 41 | 32 |
| 주식보상비용 | 1,414 | 1,267 | 1,274 | 1,319 |
| 무형자산상각비 | 160 | 250 | 280 | 274 |
| 기타판매비와관리비 | 1,638 | 967 | 1,017 | 1,100 |
| 합 계 | 31,121 | 51,180 | 50,836 | 51,989 |
| 출처: 당사 정기보고서 |
당사의 판매비와 관리비는 무형자산 인식요건을 충족하지 못한 경상연구개발비 규모가 가장 큰 비중을 차지하고 있으며, 판매비와 관리비 중 경상연구개발비가 차지하고 있는 비중은 2019년 77.8%, 2020년 77.1%, 2021년 64.7%을 기록했고, 2022년 3분기 기준으로는 56.9%를 기록했습니다. 연구개발비용의 성격별 분류 내역은 다음과 같습니다.
| [연구개발비용의 성격별 분류내역] |
| (단위: 백만원) |
| 구 분 | 2022년 3분기 |
2021년 3분기 |
2021년 | 2020년 | 2019년 | |
|---|---|---|---|---|---|---|
| 비용의 성격별 분류 | 원재료비 | 2,384 | 4,900 | 6,251 | 6,936 | 3,915 |
| 인건비 | 4,337 | 5,821 | 7,629 | 9,984 | 9,886 | |
| 감가상각비 | 1,788 | 772 | 1,124 | 1,134 | 1,047 | |
| 위탁용역비 | 8,470 | 16,639 | 21,730 | 23,064 | 24,790 | |
| 기타경비 | 1,363 | 2,070 | 2,758 | 2,601 | 2,856 | |
| 연구개발비용 계 | 18,342 | 30,201 | 39,491 | 43,720 | 42,494 | |
| 정부보조금 | (630) | (6,105) | (6,373) | (4,513) | (2,045) | |
| 보조금 차감 후 금액 | 17,712 | 24,097 | 33,118 | 39,206 | 40,449 | |
| 회계처리내역 | 판매비와 관리비 | 17,712 | 24,097 | 33,118 | 39,206 | 40,449 |
| 제조경비 | - | - | - | - | - | |
| 개발비 (무형자산) | - | - | - | - | - | |
| 회계처리금액 계 | 17,712 | 24,097 | 33,118 | 39,206 | 40,449 | |
| 연구개발비 / 매출액 비율 | 128% | 68% | 90% | 211% | 358% | |
| [연구개발비용계÷당기매출액×100] | ||||||
| 출처: 당사 정기보고서 |
먼저 상기 비용 중 가장 큰 비중을 차지하는 비용은 CRO 업체에 대한 임상 위탁시 발생하는 위탁용역비로 2022년 3분기 기준 전체 연구개발비용에서 46.2%를 차지하였으며, 2021년 55.0%, 2020년 52.8%, 2019년 58.3%를 기록하였습니다. 또한, 연구개발비용 중 인건비 규모는 2019년 9,886백만원, 2020년 9,984백만원, 2021년 7,629백만원을 기록해 점진적으로 감소하는 추이를 보이고 있으며, 2022년 3분기 또한 4,337백만원을 기록해 전년동기 5,821백만원 대비 낮은 수준을 보였습니다. 이는 2019년부터 2022년 3분기까지 당사 직원이 161명에서 114명으로 감소한 것이 주효했습니다.
| [당사 직원 현황] |
| (단위: 백만원) |
| 사업부문 | 2022년 3분기 |
2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 연구소 | 57 |
59 | 88 | 110 |
| 임상/사업 | 24 | 28 | 20 | 23 |
| 경영지원 등 | 33 |
31 | 48 | 28 |
| 합계 | 114 |
118 | 156 | 161 |
| 출처: 당사 정기보고서 |
당사는 2022년 3분기 기준 6개의 관계기업과 4개의 공동기업에 대해 투자를 완료한 상태로 이에 따라 지분법손익에 따른 당기순이익 변동이 큰 특징이 있으며, 그 외에도 기발행 전환사채에 기인한 파생상품평가손익이 당기순이익에 영향을 미치는 모습을 보이고 있습니다. 당사의 당기순이익은 2019년 -16,509백만원, 2020년 27,536백만원, 2021년 -48,561백만원, 2022년 3분기 -18,125백만원을 기록하였습니다. 2020년에 전년대비 당기순이익이 크게 개선된 것은 제넨바이오에 대한 유의적 영향력 상실에 따라 해당 투자주식을 관계기업투자주식에서 기타포괄손익금융자산으로 재분류하였고, 이에 따라 발생한 일회성 관계기업투자주식 처분수익 36,972백만원이 지분법이익으로 반영된 것이 주요하게 작용했습니다.
| [당사 영업외손익 내역] |
| (단위 : 백만원) |
| 구 분 | 2022년 3분기 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 기타수익 | 37,471 | 3,635 | 17,256 | 51,782 |
| 기타비용 | 1,744 | 7,043 | 4,129 | 4,545 |
| 금융수익 | 264 | 321 | 18,798 | 2,923 |
| 금융비용 | 3,872 | 4,628 | 9,501 | 5,995 |
| 지분법이익 (A) | 1,271 | 28,634 | 61,758 | 927 |
| 지분법손실 (B) | 31,225 | 50,107 | 17,487 | 17,064 |
| 지분법손익 (C=A-B) | (29,953) | (21,474) | 44,271 | (16,138) |
| 당기순이익(손실) | (18,125) | (48,561) | 27,536 | (16,509) |
| 출처: 당사 정기보고서 |
다음은 당사의 관계기업 및 공동기업 투자 상세 현황입니다.
| [관계기업 및 공동기업 투자 내역] |
| (단위 : 천원) |
| 구 분 | 회 사 명 | 소재지 | 주요 영업활동 | 지분율(%) | 취득원가 | 장부금액 |
|---|---|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 대한민국 | 생물학적 제제 제조업 | 25.00 | 8,925,000 | 10,834,690 |
| 관계기업 | NIT(NeoImmuneTech,Inc.) | 미국 | 면역학을 이용한 바이오의약품 연구/개발 및 판매 | 21.18 | 45,246,777 | 40,120,875 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 중국 | 중국, 글로벌 임상개발 및 사업화 | 49.00 | 1,102,598 | 883,737 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 인도네시아 | 아세안, 글로벌 임상개발 및 사업화 | 20.32 | 38,694,175 | 46,008,217 |
| 관계기업 | (주)툴젠 | 대한민국 | 유전자교정 연구개발 및 유전자교정 기술 기반 치료제 개발 및 품종개량 |
14.24 | 79,480,998 | 70,870,789 |
| 관계기업 | (주)큐로젠 | 대한민국 | 유전자 및 단백질을 이용한 치료제 개발 | 6.16 | 3,000,180 | 2,809,449 |
| 공동기업 | Rezolute, Inc | 미국 | 글로벌 임상개발 및 사업화 | 4.96 | 25,827,875 | 7,178,723 |
| 공동기업 | CoImmune, Inc | 미국 | 글로벌 임상개발 및 사업화 | 22.94 | 25,374,549 | 19,963,367 |
| 공동기업 | ILKOGEN | 터키 | 글로벌 임상개발 및 사업화 | 50.00 | 9,500,093 | 345,498 |
| 공동기업 | KinGen Biotech, Inc | 태국 | CDMO 서비스 및 사업화 | 50.00 | 2,291,519 | - |
| 합 계 | 239,443,764 | 196,713,024 | ||||
| 주1) 2022년 3분기 기준 |
| 주2) 지분율이 20% 미만이나 투자약정에 의거 피투자회사에 대한 임원 선임권 등이 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업및공동기업으로 분류하였습니다. |
| 주3) 당사 임원이 피투자회사의 사외이사를 겸직하고 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업으로 분류하였습니다. |
| 출처: 당사 정기보고서 |
다음은 관계기업 및 공동기업의 2022년 3분기 요약 재무정보입니다.
| [관계기업 및 공동기업 요약 재무정보] |
| (단위 : 천원) |
| 구 분 | 회 사 명 | 자 산 | 부 채 | 매 출 | 분기순손익 | 총포괄손익 | ||
|---|---|---|---|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |||||
| 관계기업 | 아지노모도제넥신(주) | 21,865,113 | 25,060,308 | 3,586,658 | - | 24,283,488 | 4,801,519 | 4,801,519 |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | 150,199,521 | 24,154,616 | 36,864,565 | 4,203,400 | - | (58,988,799) | (60,046,794) |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 1,504,462 | 308,397 | 9,314 | - | - | 69,967 | 69,967 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 128,450,487 | 155,267,172 | 4,062,871 | 42,930,035 | 12,798,336 | (11,744,296) | (11,142,764) |
| 관계기업 | (주)툴젠 | 62,345,683 | 15,654,092 | 3,146,316 | 1,441,296 | 566,520 | (5,551,306) | (5,529,862) |
| 관계기업 | (주)큐로젠 | 9,591,334 | 3,141,724 | 511,432 | 95,811 | 59,250 | (1,450,263) | (1,450,263) |
| 공동기업 | Rezolute, Inc | 218,237,579 | 453,397 | 3,532,478 | 699 | - | (52,082,557) | (52,082,557) |
| 공동기업 | CoImmune, Inc | 30,752,770 | 15,010,087 | 2,290,028 | 1,648,379 | 322,097 | (25,199,415) | (25,199,415) |
| 공동기업 | ILKOGEN | 625,321 | 4,079,300 | 737,630 | - | - | (7,597) | (7,597) |
| 공동기업 | KinGen Biotech, Inc | 1,461,178 | 299,142 | 4,619,507 | - | 1,406,593 | (2,656,960) | (2,656,960) |
| 출처: 당사 정기보고서 |
상기 기술한 바와 같이, 당사는 기술이전 및 연구용역/서비스 관련 매출이 주를 이루고 있는 매출구조상, 기술이전 계약 여부에 따라 매출액이 크게 변동하는 특성을 갖고 있으며, 관계기업 및 공동기업 투자에 따른 지분법손익 등 영업외손익에 따라 수익성이 결정됩니다. 이에 따라, 향후 파이프라인의 제품화 실패 혹은 라이센스 아웃 등이 어려움을 겪어, 영업손실이 지속되고, 지분법손실 및 파생상품평가 손실 등 영업외손실이 발생할 경우 수익성 악화로 재무구조는 악화될 가능성이 존재하니, 투자자께서는 투자판단시 이 점 유의하시기 바랍니다.
| 나. 재무안정성 관련 위험 당사는 신약을 연구개발하는 바이오의약품 기업으로서 후보물질발굴부터 임상 진행, 품목허가까지 대규모의 자금이 소요되는 사업을 영위합니다. 당사는 원활한 연구개발의 진행을 위해 설립 초기부터 여러 차례 증자나 주식연계채권 발행을 통해 자금을 조달하였으며 이를 통해 재무안정성을 개선하고자 노력하였습니다. 당사는 2022년 3분기 말 총차입금의존도 17.5%, 부채비율 31.6%, 유동비율 144.6%, 2021년 말 총차입금의존도 8.2%, 부채비율 21.7%, 유동비율 96.8%을 기록하였으며, 2022년 3분기 말과 2020년에는 차입 증대 등으로 총차입금을 유동자산 이상으로 보유하고 있는 약화된 재무상태를 보였습니다. 향후에도 당사 사업부문 영업 환경이 지속적으로 악화되거나, 연구개발의 지속적인 투자로 인한 자금 소요 등의 예상치 못한 환경의 변화에 따라 외부자금 조달 수요가 발생할 경우 회사의 재무안정성 약화로 이어질 위험이 존재하오니 투자자분들께서는 이점 유의하시기 바랍니다. 또한, 금번 주주배정 후 실권주 일반공모 유상증자가 진행되어 전환가액이 유상증자 확정발행가액으로 조정된 이후, '제넥신 6CB' 및 '제넥신 7CB'가 내가격(ITM,In The Money) 상태가 되면 투자자의 전환권 행사 유인이 높아지고, 전환사채 풋옵션 행사로 인한 현금 유출 위험이 낮아질 것이라고 판단됩니다. 단, 전환가액이 확정발행가격으로 재조정되어도 주가가 조정된 전환가액을 하회할 경우 투자자가 풋옵션을 행사해 당사의 현금이 유출될 수 있으며, 당사가 자기사채로 취득한 135억원 규모의 '제넥신 6CB'를 재매각 할 경우 해당 물량 또한 풋옵션 행사 위험분이 될 수 있습니다. 투자자께서는 이 점 유의하여 주시기 바랍니다. |
당사는 신약을 연구개발하는 바이오의약품 기업으로서 후보물질발굴부터 임상 진행, 품목허가까지 대규모의 자금이 소요되는 사업을 영위합니다. 당사는 원활한 연구개발의 진행을 위해 설립 초기부터 여러 차례 증자나 주식연계채권 발행을 통해 자금을 조달하였으며 이를 통해 재무안정성을 개선하고자 노력하였습니다. 당사의 최근 3년 및 2022년 3분기말까지의 재무안정성 지표 추이는 다음과 같습니다.
| [당사의 재무안정성 지표 추이] |
| (단위: 백만원, %, 배) |
| 항목 | 2022년 3분기 | 2021년 | 2020년 | 2019년 | 업종평균 |
|---|---|---|---|---|---|
| 자산총계 | 444,670 | 636,865 | 596,908 | 358,177 | - |
| 유동자산 | 57,994 | 57,274 | 20,646 | 95,817 | - |
| 비유동자산 | 386,676 | 579,591 | 576,262 | 262,360 | - |
| 부채총계 | 106,859 | 113,592 | 60,375 | 61,267 | - |
| 유동부채 | 40,114 | 59,154 | 40,217 | 22,638 | - |
| 비유동부채 | 66,745 | 54,438 | 20,157 | 38,630 | - |
| 자본총계 | 337,810 | 523,273 | 536,533 | 296,909 | - |
| 부채비율 | 31.63 | 21.7% | 11.3% | 20.6% | 70.86% |
| 유동비율 | 144.57 | 96.8% | 51.3% | 423.3% | 178.71% |
| 총차입금 | 77,786 | 52,219 | 27,155 | 39,377 | - |
| 총차입금 의존도 | 17.49 | 8.2% | 4.5% | 11.0% | 20.53% |
| 이자보상배율 | -8.8 | -39.3 | -13.4 | -9.7 | 7.0 |
| 주) 업종평균은 한국은행이 발간한 2020년 기업경영분석 C21(의료용 물질 및 의약품 중 중소기업) 기준 출처: 당사 정기보고서 |
당사는 2019년 이후 영업이익이 금융비용(이자비용)의 지급여력을 설명하는 이자보상비율이 (-)를 연속으로 기록하고 있습니다. 이는 당사의 영업이익이 연구개발비 등의 증가로 인해 지속해서 적자를 기록하고 있기 때문입니다. 향후 당사의 금융비용(이자비용)이 영업이익 대비 큰폭으로 증가하거나, 영업손실의 규모가 과도해 질 경우 당사의 재무 안정성에 부정적인 영향을 미칠 수 있음을 투자자께서는 유의하시기 바랍니다.
당사는 2022년 3분기 말 총차입금의존도 17.5%, 부채비율 31.6%, 유동비율 144.6%, 2021년 말 총차입금의존도 8.2%, 부채비율 21.7%, 유동비율 96.8%을 기록하였으며, 2022년 3분기 말과 2020년에는 차입 증대 등으로 총차입금을 유동자산 이상으로 보유하고 있는 약화된 재무상태를 보였습니다. 향후에도 당사 사업부문 영업 환경이 지속적으로 악화되거나, 연구개발의 지속적인 투자로 인한 자금 소요 등의 예상치 못한 환경의 변화에 따라 외부자금 조달 수요가 발생할 경우 회사의 재무안정성 약화로 이어질 위험이 존재하오니 투자자분들께서는 이점 유의하시기 바랍니다.
2022년 3분기 말 기준 당사의 연결기준 금융기관 차입금 내역은 다음과 같습니다.
| [당사의 연결기준 금융기관 차입금 내역] |
| (단위 : 천원) |
| 금융기관 | 차입약정내용 | 2022년 3분기 말 | 2021년 | ||
|---|---|---|---|---|---|
| 약정한도액 | 실행액 | 약정한도액 | 실행액 | ||
| 기업은행 | 시설자금대출 | 10,000,000 | 10,000,000 | 10,000,000 | 10,000,000 |
| 시설자금대출 | 20,000,000 | 20,000,000 | 20,000,000 | 20,000,000 | |
| 시설자금대출 | 20,000,000 | 17,900,000 | 20,000,000 | 8,600,000 | |
| 운전자금대출 | 10,000,000 | 10,000,000 | - | - | |
| 하나은행 | 운전자금대출 | 10,000,000 | 5,000,000 | - | - |
| 합 계 | 70,000,000 | 62,900,000 | 50,000,000 | 38,600,000 | |
| 출처: 당사 정기보고서 |
당사는 상기 차입금과 관련하여 마곡 토지 및 건물(설정금액: 72,000백만원)을 담보로 제공하고 있습니다. 담보제공자산 내역은 아래와 같습니다.
| [2022년 3분기 말 당사의 담보제공자산 내역] |
| (단위 : 천원) |
| 담보제공자산 | 장부금액 | 담보설정금액 | 관련 채무 | 채무금액 | 담보권자 |
|---|---|---|---|---|---|
| 마곡 토지 | 22,136,915 | 60,000,000 | 단기차입금 | 10,000,000 | 기업은행 |
| 마곡 사옥 | 63,833,827 |
장기차입금 | 20,000,000 | 기업은행 | |
| 장기차입금 | 17,900,000 | 기업은행 | |||
| 단기차입금 | 10,000,000 | 기업은행 | |||
| 12,000,000 | 단기차입금 | 5,000,000 | 하나은행 | ||
| I-Mab 주식(주1) | 1,726,064 | 1,726,064 | - | - | 한미약품 |
| 주1) 당사는 한미약품과 체결한 GX-19N의 제조위수탁계약과 관련하여 발생하는 채무를 담보하기 위하여 I-Mab 주식 30만 ADR을 담보로 제공하였습니다. 출처: 당사 정기보고서 |
한편, 당사의 사업이 본 궤도에 진입하기 전까지 영업활동으로 인한 현금흐름이 지속적으로 적자를 기록할 것으로 예상되며, 파트너쉽과 기술이전이 예상보다 지연되거나 연구개발비가 증가하게 될 경우 재무안정성 및 유동성이 악화될 수 있습니다. 당사의 연구개발비 현황은 다음과 같습니다.
| [당사 연구개발비 현황] |
| (단위: 백만원) |
| 구 분 | 2022년 3분기 | 2021년 | 2020년 | |
|---|---|---|---|---|
| 비용의 성격별 분류 | 원재료비 | 2,384 | 6,251 | 6,936 |
| 인건비 | 4,337 | 7,629 | 9,984 | |
| 감가상각비 | 1,788 | 1,124 | 1,134 | |
| 위탁용역비 | 8,470 | 21,730 | 23,064 | |
| 기타경비 | 1,363 | 2,758 | 2,601 | |
| 연구개발비용 계 | 18,342 | 39,491 | 43,720 | |
| 정부보조금 | (630) | (6,373) | (4,513) | |
| 보조금 차감 후 금액 | 17,712 | 33,118 | 39,206 | |
| 회계처리내역 | 판매비와 관리비 | 17,712 | 33,118 | 39,206 |
| 제조경비 | - | - | - | |
| 개발비 (무형자산) | - | - | - | |
| 회계처리금액 계 | 17,712 | 33,118 | 39,206 | |
| 연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액×100] |
128% | 90% | 211% | |
| 출처: 당사 정기보고서 |
상기 표와 같이 당사는 연구개발비를 전액 비용으로 처리하고 있으며, 수령한 보조금은 전액 연구개발비용의 차감으로 회계처리하고 있습니다. 2022년 3분기 17,712백만원을 비용으로 처리하였으며, 2021년 33,118백만원, 2020년 39,206백만원을 차례로 비용으로 처리하였습니다. 매출액 대비 연구개발비용은 2022년 3분기 128%, 2021년 90%, 2020년 221%로 높은 비율을 보이고 있습니다. 당사는 모든 연구개발비를 비용처리하고 있어 추후 임상 지연 및 실패가 발생하더라도 추가적인 손상차손 인식 가능성이 없으나, 연구개발비의 지속적인 증가는 당사의 재무 안전성에 악영향을 미칠 것으로 판단되오니, 투자자께서는 이 점을 유의하시기 바랍니다.
또한, 동 보고서 <Ⅲ. 투자위험요소 - 2. 회사위험 - 마. 최대주주 및 특수관계인 지분희석 및 경영권 관련 위험>에 기재된 바와 같이 당사는 현재 2건 350억원 규모의 전환사채 발행잔액이 존재합니다(종속회사 '제2회 에스엘포젠 기명식 무보증 사모전환사채' 제외). 해당 2건의 전환사채는 계약서 내 문구에 따라 본 주주배정후 실권주 일반공모 유상증자 확정발행가액 결정 이후 기존 전환가액이 확정발행가액으로 조정될 가능성이 존재합니다. 기발행 전환사채 세부 내역은 다음과 같습니다.
| [기발행 전환사채 세부 내역] |
| 종류 | 발행잔액 | 전환가액 | 전환권 행사기간 | 풋옵션 행사기간 |
|---|---|---|---|---|
| 제6회 제넥신 기명식 무보증 사모전환사채 | 15,000백만원 | 87,278원 | 2019년 5월 15일 ~ 2023년 5월 17일 | 2021년 5월 18일 ~ 2023년 2월 18일 |
| 제7회 제넥신 기명식 무보증 사모전환사채 | 20,000백만원 | 119,807원 | 2021년 12월 17일 ~ 2025년 12월 16일 | 2023년 12월 17일 ~ 2025년 9월 17일 |
| 주1) 전환가액의 경우 본 공시서류 제출일 전일 기준 주2) 제6회차 전환사채는 20년 07월 30일 35억원, 20년 08월 05일 315억원 총 350억원이 전환되었으며, 콜옵션 행사로 인해 20년 12월 18일 135억원을 자기사채로 취득하였습니다. 자료: 당사 제시 |
'제6회 제넥신 기명식 무보증 사모전환사채'(이하 '제넥신 6CB')의 경우 2020년 7월 30일 35억원, 2020년 8월 5일 315억원 총 350억원이 전환되었으며, 2020년 12월 18일에는 당사의 콜옵션 행사로 135억원을 자기사채로 취득하였습니다. 이후 보통주 주가 하락으로 인해 전환가액이 주가를 높은 수준으로 상회함에 따라, '제넥신 6CB'외 '제7회 제넥신 기명식 무보증 사모전환사채'(이하 제넥신 7CB)의 풋옵션 행사가 예상되었으며, 특히 '제넥신 7CB'는 최초 풋옵션 행사기간이 도래하는 2023년 12월 17일 조기상환 청구 가능성이 높은 상황이었습니다. 하지만, 금번 주주배정 후 실권주 일반공모 유상증자가 진행되어 전환가액이 유상증자 확정 발행가액으로 조정된 이후, '제넥신 6CB' 및 '제넥신 7CB'가 내가격(ITM,In The Money) 상태가 되면 투자자의 전환권 행사 유인이 높아지고, 전환사채 풋옵션 행사로 인한 현금 유출 위험이 낮아질 것이라고 판단됩니다.
단, 전환가액이 확정발행가격으로 재조정되어도 주가가 조정된 전환가액을 하회할 경우 투자자가 풋옵션을 행사해 당사의 현금이 유출될 수 있으며, 당사가 자기사채로 취득한 135억원 규모의 '제넥신 6CB'를 재매각 할 경우 해당 물량 또한 풋옵션 행사 위험분이 될 수 있습니다. 투자자께서는 이 점 유의하여 주시기 바랍니다.
| 다. 영업현금흐름 및 유동성 관련 위험 당사는 연결기준 최근 3년 및 2022년 3분기까지 지속적으로 음(-)의 영업활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름은 대체적으로 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나 영업 실적이 개선되지 않아 음(-)의 영업활동현금흐름이 계속 발생할 경우 유동성 리스크가 부각될 위험이 있습니다. 때문에 보유 파이프라인의 라이센스 아웃 및 영업활동 전반에 대한 모니터링이 필요하다고 판단되며, 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있습니다. 투자자께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다. |
당사는 연결기준 최근 3년 및 2022년 3분기까지 지속적으로 음(-)의 영업활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름은 대체적으로 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 2022년 3분기 연결기준 당사는 25,057백만원의 현금및현금성자산을 보유하고 있습니다. 당사의 최근 3년 요약 연결 현금흐름 추이는 다음과 같습니다.
| [최근 3개년 요약 연결 현금흐름 추이] |
| (단위: 백만원) |
| 구 분 | 2022년 3분기 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 영업활동현금흐름 | (31,287.6) | (12,745.4) | (22,691.0) | (41,571.7) |
| 영업활동으로 창출된 현금흐름 | (30,721.7) | (12,609.0) | (23,971.9) | (42,720.4) |
| 당기순이익 | (18,124.7) | (48,561.1) | 27,535.9 | (16,509.2) |
| 수익/비용의 조정 | 1,984.2 | 37,288.2 | (59,335.5) | (19,909.8) |
| 영업활동으로 인한 자산부채의 변동 | (14,581.2) | (1,336.1) | 7,827.7 | (6,301.4) |
| 이자수취 | 256.5 | 182.9 | 1,078.8 | 1,152.1 |
| 이자지급 | (871.6) | (485.5) | (153.8) | (250.1) |
| 법인세납부(환급) | 49.3 | 166.1 | 356.0 | 246.8 |
| 투자활동현금흐름 | 1,341.6 | (7,704.5) | (64,393.9) | 1,636.9 |
| 투자활동으로 인한 현금유입액 | 76,546.2 | 103,175.9 | 80,130.6 | 129,997.9 |
| 투자활동으로 인한 현금유출액 | (75,204.6) | (110,880.3) | (144,524.5) | (128,361.0) |
| 재무활동현금흐름 | 26,096.6 | 43,086.8 | 73,358.2 | 3,328.1 |
| 재무활동으로 인한 현금유입액 | 26,281.2 | 43,348.3 | 97,959.1 | 3,496.5 |
| 재무활동으로 인한 현금유출액 | 24,300.0 | (261.5) | (24,600.9) | (168.4) |
| 현금및현금성자산의순증가(감소) | (3,849.3) | 22,637.0 | (13,726.7) | (36,606.7) |
| 기초현금및현금성자산 | 27,795.6 | 5,211.9 | 19,092.5 | 55,679.6 |
| 현금및현금성자산에 대한 환율변동효과 | 1,110.6 | (53.3) | (153.8) | (20.5) |
| 기말현금및현금성자산 | 25,056.9 | 27,795.6 | 5,211.9 | 19,052.4 |
| 출처: 당사 정기보고서 |
2019년 당사는 연결기준으로 16,509백만원의 당기순손실(-)이 발생하였으며, 감가상각비 및 관계기업처분이익의 조정, 이자 관련 수취 및 지급 등으로 최종적으로 41,572백만원의 음(-)의 영업활동현금흐름이 발생하였습니다. 투자활동현금흐름의 경우 단기금융상품의 감소와 당기손익금융자산의 처분 등으로 1,637백만원의 양(+)의 현금흐름이 있었으며, 재무활동현금흐름의 경우 주식매수선택권의 행사 등으로 3,328백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 2019년말 연결기준 현금및현금성자산은 기초 55,680백만원 대비 36,627백만원 감소한(환율변동효과 고려) 19,052백만원을 보유하게 되었습니다.
2020년 당사는 연결기준으로 27,536백만원의 당기순이익(+)이 발생하였으며, 감가상각비 및 관계기업처분이익의 조정, 이자 관련 수취 및 지급 등으로 최종적으로 22,691백만원의 음(-)의 영업활동현금흐름을 기록하였습니다. 27,536백만원 상당의 큰 당기순이익(+)이 발생했음에도 불구하고, 최종적으로 22,691백만원의 음(-)의 영업활동현금흐름이 발생한 이유는 관계기업처분이익이 현금의 유입이 없는 수입의 차감 항목으로 59,132백만원 상당이 가감조정 되었기 때문입니다. 투자활동현금흐름의 경우 관계/공동기업투자의 증가 등으로 64,394백만원의 음(-)의 현금흐름이 발생하였으며, 재무활동현금흐름의 경우 당사가 발행한 200억원 규모의 전환사채(7CB)와 585억원 규모의 제3자배정 유상증자 등에 따라 73,358백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 2020년말 연결기준 현금및현금성자산은 기초 19,093백만원 대비 13,881백만원 감소한(환율변동효과 고려) 5,212백만원을 보유하게 되었습니다.
2021년 당사는 연결기준으로 48,561백만원의 당기순손실(-)이 발생하였으며, 감가상각비 및 관계기업처분이익의 조정, 이자 관련 수취 및 지급 등으로 최종적으로 12,745백만원의 음(-)의 영업활동현금흐름을 기록하였습니다. 48,561백만원의 당기순손실(-)이 발생했음에도 최종적으로 12,745백만원의 음(-)의 영업활동현금흐름만 발생한 이유는 파생상품평가손실 및 지분법손실 등이 현금의 유출이 없는 비용의 가산 항목으로 가감조정되었기 때문입니다. 투자활동현금흐름의 경우 유형자산의 취득 등으로 7,705백만원의 음(-)의 현금흐름이 발생하였으며, 재무활동현금흐름은 234억원 규모의 차입금 증대, 75억원 규모의 주식매수선택권 행사 등으로 43,087백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 2021년말 연결기준 현금및현금성자산은 기초 5,212백만원 대비 22,584백만원 증가한(환율변동효과 고려) 27,796백만원을 보유하게 되었습니다.
2022년 3분기말 당사는 연결기준으로 18,125백만원의 분기순손실(-)이 발생하였으며 감가상각비 및 유형자산처분이익의 조정, 이자 관련 수취 및 지급 등으로 최종적으로 30,722백만원의 음(-)의 영업활동현금흐름을 기록하였습니다. 투자활동현금흐름은 1,342백만원의 양(+)의 현금흐름이 있었으며, 재무활동현금흐름은 243억원의 차입금 증대 등으로 26,097백만원의 양(+)의 현금흐름이 발생하였습니다. 이에 2022년 3분기말 연결기준 현금및현금성자산은 기초 27,796백만원 대비 2,739백만원 감소한(환율변동효과 고려) 25,057백만원을 보유하게 되었습니다.
한편, 당사의 유동비율은 연결 기준으로 2019년 423.3%에서, 2020년 6회차 사모 전환사채의 조기상환권 행사의 따른 사채 취득과 미지급금 증가로 유동비율이 51.3%로 감소하였습니다. 2021년에는 판교사옥 매각으로 토지/건물이 유형자산에서 매각예정비유동자산으로 분리되는 등 유동자산이 증가하여 유동비율이 96.8%로 증가하였으며, 2022년 3분기에는 144.6%를 기록하며 유동비율이 개선되는 추세를 보이고 있습니다.
| [최근 3년 연결기준 당사 유동비율] |
| (단위: 백만원, %) |
| 항목 | 2022년 3분기말 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 유동자산 | 57,994 | 57,274 | 20,646 | 95,817 |
| 유동부채 | 40,114 | 59,154 | 40,217 | 22,638 |
| 유동비율 | 144.6% | 96.8% | 51.3% | 423.3% |
| 출처: 당사 정기보고서 |
당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나, 최근 3년간 지속적으로 음(-)의 영업활동현금흐름을 보이고 있으며, 영업 실적이 개선되지 않아 음(-)의 영업활동현금흐름이 계속 발생할 경우 유동성 리스크가 부각될 위험이 있습니다. 때문에 보유 파이프라인의 라이센스 아웃 및 영업활동 전반에 대한 모니터링이 필요하다고 판단되며, 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있습니다. 투자자께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다.
| 라. 특수관계자 거래 위험 당사는 최근 3개년 관계기업, 공동기업, 기타특수관계자와 매출, 매입, 채권채무 거래 내역이 존재하며, 특수관계자와의 매출 거래 금액은 2022년 3분기말 11,021백만원, 2021년 31,398백만원, 2020년 6,994백만원, 2019년 4,444백만원으로 매출액 대비 특수관계자 매출은 2022년 3분기말 79.7%, 2021년 85.3%, 2020년 37,7%, 2019년 39.3%로 높은 수준입니다. 당사의 특수관계자 매출거래 비중이 높은 이유는 현지 바이오의약품 개발 및 상용화와 관련된 사업전략에 기인합니다. 각 지역별, 국가별로 바이오의약품 개발 및 출시규제가 상이하기 때문에, 현지 제약/바이오 회사와 제휴하여 해외 합작회사를 설립 후, 해당 회사에 기술 수출하는 전략으로 초기 해외사업화를 추진하였습니다. 당사의 글로벌 파트너쉽 확보 및 임상/사업개발 역량 향상에 따라 관계회사 등에 대한 매출의존도는 추후 감소할 것으로 예상합니다. 하지만, 관계회사 등에 대한 매출은 당사가 보유한 지분율에 따라 지분법손익으로 차감되기 때문에 기술이전 기술료의 수익성이 낮아지게 되므로 투자자께서는 이점 유의하시기 바랍니다. |
당사는 최근 3개년 관계기업, 공동기업, 기타특수관계자와 매출, 매입, 채권채무 거래 내역이 존재하며, 특수관계자와의 매출 거래 금액은 2022년 3분기11,021백만원, 2021년 31,398백만원, 2020년 6,994백만원, 2019년 4,444백만원으로 매출액 대비 특수관계자 매출은 2022년 3분기 79.7%, 2021년 85.3%, 2020년 37,7%, 2019년 39.3%로 높은 수준입니다. 이 중 대부분은 해외 합작회사 (Joint Venture)의 기술이전, 연구용역 제공 수입으로 관계기업 및 공동기업인 NIT(NeoImmuneTech, Inc.), KG-Bio, ㈜에스엘메타젠, (주)한독, KinGen Biotech 에서 발생하였습니다. 특수관계자 매출 내역은 다음과 같습니다.
| [최근 3년 연결기준 특수관계자 매출 내역] |
| (단위: 백만원, %) |
| 연도 | 특수관계자 구분 | 특수관계자명 | 특수관계자 매출 | 연결기준 매출액 | 매출액 대비 | 매출 내용 |
|---|---|---|---|---|---|---|
| 2022년 3분기 |
관계기업 | NIT | 1,320 | 13,831 | 79.7% | 시료생산 판매, 위탁개발 |
| 관계기업 | KG-Bio | 9,702 | GX-E4 기술이전 매출 | |||
| 소계 | 11,021 | |||||
| 2021년 | 관계기업 | NIT | 1,487 | 36,828 | 85.3% | 시료생산 판매, 위탁개발 |
| 관계기업 | KG-Bio | 29,911 | GX-I7 기술이전 매출 | |||
| 소계 | 31,398 | |||||
| 2020년 | 관계기업 | NIT | 5,922 | 18,543 | 37.7% | 시료생산 판매, 위탁개발 |
| 관계기업 | KG-Bio | 319 | 연구용역/서비스 | |||
| 관계기업 | ㈜에스엘메타젠 | 122 | 연구용역/서비스 | |||
| 공동기업 | KinGen Biotech | 280 | GX-216A 기술이전 | |||
| 기타특수관계자 | ㈜한독 | 350 | 연구용역/서비스 | |||
| 소계 | 6,994 | |||||
| 2019년 | 관계기업 | NIT | 288 | 11,303 | 39.3% | 시료생산 판매 |
| 관계기업 | KG-Bio | 2,255 | GX-E4 기술이전 milestone 및 연구용역 | |||
| 관계기업 | ㈜에스엘메타젠 | 298 | MG12 기술이전 및 연구용역 | |||
| 기타특수관계자 | ㈜한독 | 1,450 | 연구용역/서비스 | |||
| 기타특수관계자 | ㈜에스엘바이젠 | 153 | pGX27 기술이전 및 연구용역 | |||
| 소계 | 4,444 | |||||
| 출처: 당사 제공 |
당사의 특수관계자 매출거래 비중이 높은 이유는 현지 바이오의약품 개발 및 상용화와 관련된 사업전략에 기인합니다. 각 지역별, 국가별로 바이오의약품 개발 및 출시규제가 상이하기 때문에, 현지 제약/바이오 회사와 제휴하여 해외 합작회사를 설립 후, 해당 회사에 기술 수출하는 전략으로 초기 해외사업화를 추진하였습니다. 당사의 글로벌 파트너쉽 확보 및 임상/사업개발 역량 향상에 따라 관계회사 등에 대한 매출의존도는 추후 감소할 것으로 예상합니다. 하지만, 관계회사 등에 대한 매출은 당사가 보유한 지분율에 따라 지분법손익으로 차감되기 때문에 기술이전 기술료의 수익성이 낮아지게 되므로 투자자께서는 이점 유의하시기 바랍니다.
| 마. 최대주주 및 특수관계인 지분희석 및 경영권 관련 위험 당사의 최대주주는 (주)한독으로 2022년 3분기 기준 3,781,017주(지분율 15.04%)를 보유하고 있으며, 5% 이상 주주로는 당사 고문인 성영철이 1,487,064주(지분율 5.91%)를 보유하고 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 5,797,102주이며, 당사 최대주주인 (주)한독은 871,702주를 배정 받을 예정입니다. (주)한독은 배정주식수의 약 75% 수준에 대해 청약할 예정입니다. 이에 따라 금번 증자 후 당사의 최대주주 지분율은 14.33%로 하락할 것으로 예상됩니다. 당사 최대주주인 (주)한독은 약 75% 수준으로 청약에 참여할 예정이며, 약 75% 참여 가정 시 청약 주식수는 653,777주입니다, 이에 따라 최대주주 예상 필요 청약 자금은 약 101억원으로 해당 금액 수준으로 참여할 예정입니다. 최대주주는 보유자금을 통해 청약에 참여할 예정입니다. 단, 증자 진행 과정에서 주가 상승으로 인항 확정발행가액 변동으로 모집금액 변동 시 최대주주의 청약자금 부담 증가로 인하여 청약 주식수와 금액에 일부 변동이 발생할 수 있으며, 예상치 못한 상황으로 인한 청약 실패 가능성도 배제할 수 없으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다. 당사의 미상환 전환사채는 본 공시서류 제출일 전일 기준 현재 전환가격 대비 전환대상 주식의 시가가 낮은 외가격(OTM,Out The Money) 상태로 당장 투자자의 전환권 청구에 따른 신주발행 가능성이 낮은 상태입니다. 그러나 '제넥신 6CB' 및 '제넥신 7CB'의 계약 당시 전환가액 조정 관련 사항에 따라 본 주주배정후 실권주 일반공모 유상증자 확정발행가액 결정 이후 기존 전환가액이 확정발행가액으로 조정될 가능성이 존재합니다. 최종발행가액이 하락할 경우, 최대주주의 지분율 희석은 제한적일 것으로 판단되나, 최종발행가액이 상승할 경우, 최대주주의 청약 및 납입 부담이 증가하여 참여 수량이 축소할 가능성이 있으며, 이 경우 지분율 희석 효과는 커질 것으로 판단됩니다. 이처럼, 향후 발행가액 최종 결정에 따라 최대주주의 지분율 희석 정도가 변동 가능한점 투자자께서는 유의하시기 바랍니다. 상기와 같이 당사는 금번 유상증자에 따라 현 최대주주의 지분율 하락, 경영권과 관련한 위험이 잠재되어 있으며, 그밖에 예상치 못한 경영권 혼란 가중 가능성도 있을 수 있으니, 투자자께서는 이점 유의하시기 바랍니다. |
당사의 최대주주는 (주)한독으로 2022년 3분기 기준 3,781,017주(지분율 15.04%)를 보유하고 있으며, 5% 이상 주주로는 당사 고문인 성영철이 1,487,064주(지분율 5.91%)를 보유하고 있습니다. 금번 유상증자를 통해 발행 예정인 주식수는 5,797,102주이며, 당사 최대주주인 (주)한독은 871,702주를 배정 받을 예정입니다. (주)한독은 배정주식수의 약 75% 수준에 대해 청약할 예정입니다. 이에 따라 금번 증자 후 당사의 최대주주 지분율은 14.33%로 하락할 것으로 예상됩니다.
|
[최대주주 지분율 변동 시뮬레이션] |
|
| (기준일 : 2022년 10월 20일) |
(단위: 주, %) |
| 성 명 | 주식의 종류 |
유상증자 전 | 배정 주식수 (예정) |
청약 참여 주식수(예정) |
유상증자 후(예정) | ||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| (주)한독 | 의결권 있는 주식 | 3,781,017 | 15.04 | 871,702 | 653,777 | 4,434,794 | 14.33 |
| 주) 최대주주 청약 참여 주식수는 배정주식수의 75%이며, 1주 미만 단수주 절상 |
| 출처: 당사 정기보고서 |
당사 최대주주인 (주)한독은 상기 기술한 바와 같이 약 75% 수준으로 청약에 참여할 예정이며, 약 75% 참여 가정 시 청약 주식수는 653,777주입니다, 이에 따라 최대주주 예상 필요 청약 자금은 약 101억원으로 해당 금액 수준으로 참여할 예정입니다. 최대주주는 보유자금을 통해 청약에 참여할 예정입니다. 단, 증자 진행 과정에서 주가 상승으로 인항 확정발행가액 변동으로 모집금액 변동 시 최대주주의 청약자금 부담 증가로 인하여 청약 주식수와 금액에 일부 변동이 발생할 수 있으며, 예상치 못한 상황으로 인한 청약 실패 가능성도 배제할 수 없으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다.
| [당사 미상환 전환사채 내역] | |||
| (기준일 : | 2022.09.30 | ) | (단위 : 백만원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 (원) |
권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 제6회 제넥신 기명식 무보증 사모전환사채 | 6 | 2018.05.18 | 2023.05.18 | 50,000 | 보통주 | 2019.05.18 ~ 2023.05.17 | 70 | 87,278 | 15,000 | 171,864 | 2018.08.19 시가하락에 따른 가격조정 (최초 전환가 : 102,680, 조정후 전환가 87,278원) |
| 제7회 제넥신 기명식 무보증 사모전환사채 | 7 | 2020.12.17 | 2025.12.17 | 20,000 | 보통주 | 2021.12.17 ~ 2025.12.16 | 100 | 119,807 | 20,000 | 166,935 | 2021.03.17 시가하락에 따른 가격조정 (최초 전환가 : 140,950원, 조정 후 전환가 119,807원) |
| 제2회 에스엘포젠 기명식 무보증 사모전환사채 | 2 | 2020.03.12 | 2035.03.12 | 900 | 보통주 | 2020.09.12 ~ 2035.03.11 | 100 | 5,000 | 900 | 180,000 | - |
| 합 계 | - | - | - | 70,900 | - | - | - | - | 35,900 | 518,799 | - |
|
주) 보고서 기준일 현재, 제6회차 전환사채는 20년 07월 30일 35억원, 20년 08월 05일 315억원 총 350억원이 전환되었으며, 콜옵션 행사로 인해 20년 12월 18일 135억원을 자기사채로 취득하였습니다. |
| 자료: 당사 정기보고서 |
또한, 당사는 본 공시서류 제출일 전일 현재 연결기준으로 총 3건의 미상환 전환사채를 보유하고 있습니다. 이 중 '제넥신 6CB' 및 '제넥신 7CB'의 경우 각각의 만기 시점까지 투자자의 전환청구에 따라 당사 보통주식이 추가로 발행될 옵션이 부여된 주식연계채권입니다.
다음은 당사 미상환 전환사채 중 당사 보통주식이 추가 발행될 옵션이 부여된 주식연계채권에 대한 상세 내역입니다.
| [전환사채권 발행결정(2018.05.18)] |
| 1. 사채의 종류 | 회차 | 6 | 종류 | 기명식 무보증 사모 전환사채 | ||||
| 2. 사채의 권면총액 (원) | 50,000,000,000 | |||||||
| 2-1 (해외발행) | 권면총액 (통화단위) | - | - | |||||
| 기준환율등 | - | |||||||
| 발행지역 | - | |||||||
| 해외상장시 시장의 명칭 | - | |||||||
| 3. 자금조달의 목적 |
시설자금 (원) | - | ||||||
| 운영자금 (원) | 50,000,000,000 | |||||||
| 타법인 증권 취득자금 (원) | - | |||||||
| 기타자금 (원) | - | |||||||
| 4. 사채의 이율 | 표면이자율 (%) | 0 | ||||||
| 만기이자율 (%) | 0 | |||||||
| 5. 사채만기일 | 2023.05.18 | |||||||
| 6. 이자지급방법 | 표면이자 및 만기보장이자는 없으며 이에 지급하지 않기로 한다. | |||||||
| 7. 원금상환방법 | 전환권을 행사하지 않은 사채의 권면금액을 그 사채의 만기일에 일시 상환한다. | |||||||
| 8. 사채발행방법 | 사모 | |||||||
| 9. 전환에 관한 사항 |
전환비율 (%) | 100 | ||||||
| 전환가액 (원/주) | 102,680 | |||||||
| 전환가액 결정방법 |
사채의 전환가격은 「증권발행 및 공시 등에 관한 규정」 제5-22조에 따라 본 사채의 발행을 위한 이사회 결의일 전일을 기산일로 하여 소급하여 산정한 다음 각목의 가격 중 가장 높은 가액에 해당하는 금액으로 하되 원단위 절상한다. 가. 당사 보통주의1개월 가중산술평균주가, 1주일 가중산술평균주가 및 최근일 나. 당사 보통주의 최근일 가중산술평균 주가 다. 당사 보통주의 전환사채 청약일전 제3거래일 가중산술평균주가 |
|||||||
| 전환에 따라 발행할 주식 |
종류 | 주식회사 제넥신 기명식 보통주 | ||||||
| 주식수 | 486,948 | |||||||
| 주식총수대비 비율(%) |
2.4 | |||||||
| 전환청구기간 | 시작일 | 2019.05.18 | ||||||
| 종료일 | 2023.05.17 | |||||||
| 전환가액 조정에 관한 사항 |
1. 채권자가 전환청구를 하기 전 발행사가 본 사채의 발행 이후 사채의 전환가격 이하 가액으로 발행가액을 결정하여 유상증자를 하거나 전환사채의 전환가액 또는 신주인수권부사채의 신주인수권의 행사가액을 정하여 사채를 발행하는 경우 전환가격도 동일하게 하향 조정되는 것으로 한다. (단, 이미 발행된 주식매수선택권의 행사가격은 그러하지 않는다.) 2. 무상증자 또는 주식배당에 의하여 주식수가 증가하는 경우 전환가격은 (기발행주식수 × 조정전 전환가격) / (기발행주식수 + 신발행주식수)의 산식에 의하여 조정된다. 3. 공개시장에 등록한 법인이 전환청구 전에 시가를 하회하는 발행가액, 전환가격 또는 행사가격으로 유상신주 또는 주식연계사채를 발행하는 경우(당해 유상신주 또는 주식연계사채 발행 후 사후적으로 전환가격 또는 행사가격이 채권자의 주당 행사가격 보다 하향 조정되는 경우 포함)에는 다음과 같이 전환가격을 조정한다. 본 호의 계산방법에 의한 조정 후 전환가격과 상기 제1호의 계산 방법에 의한 조정 후 전환가격을 비교하여 낮은 가격을 조정 후 전환가격으로 한다. 다만 아래의 산식에서 시가는 유가증권의 발행 및 공시 등에 관한 규정에서 정하는 당해 발행가액 산정의 기준이 되는 기준 주가 또는 이론권리락주가(유상증자 이외의 경우에는 조정 사유 발생 전일을 기산일로 하여 계산한 기준주가)를 의미하며 '인수인'의 소정 계산방법에 따라 정한다. 조정후 전환가격 = [조정전 전환가격 × {기발행주식수 + (신발행주식수 × 1주당 발행가액 / 시가)}] / (기발행주식수+신발행주식수) 위의 산식에 의한 조정 후 행사가액의 원단위 미만은 절상한다. 4. 전환사채 발행일 3개월 후 당일, 이후3개월이 되는 날(이하 '전환가격 조정일') 마다 전환가격 조정일 전일을 기산일로 하여 산정한 [(1개월 가중산술평균주가 + 1주일가중산술평균주가 + 최근일 가중산술평균주가) /3]가격 및 최근일 가중산술평균주가 중 높은 가액이 본건 전환사채의 전환가격보다 낮은 경우에는 그 가격을 전환가격으로 조정한다. 다만, 조정 후 전환가격은 제3호에 따른 최초전환가격의 85%를 하회하지 못한다. 5. 제1호 및 제2호를 적용하여 전환가격을 조정함에 있어서 유ㆍ무상 증자를 병행실시하는 경우, 유상 증자 1주당 가액이 조정전 전환가격을 상회하는 때에는 유상증자에 의한 신발행주식수는 전환가격 조정에 적용하지 아니하고 무상증자에 의한 신발행 주식수만을 적용한다. |
|||||||
| 9-1. 옵션에 관한 사항 | 본 전환사채는 만기 전 사채권자로부터 본사채를 매수할 수 있는 권리(Call option)가 발행회사 및 발행회사가가 지정하는 제 3자에게 부여된 사채이며 이와 동시에 채권자가 조기상환을 청구할 수 있는 권리(Put option)가 부여된 사채 입니다. [매도청구권(Call Option)에 관한 사항] 발행회사는 본 사채의 발행일로부터 2년이 되는 날인 2020년 월 18일부터 만기일 3개월 전인 2023년 2월 18일 까지 매 3개월이 되는 날마다 채권자가 보유하고 있는 본 사채 권면총액 30%에 해당하는 금액의 한도 내에서 발행회사 에게 상환하거나, 발행회사가 지정하는 제3자에게 매도하여 줄 것을 청구할 수 있으며, 채권자는 이 청구에 따라 보유하고 있는 본 사채를 지정된 제3자에게 30일 이내에 매도하여야 한다. 이 경우 발행회사는 행사하는 권면총액의 연 복리 3%에 해당하는 금액을 가산하여 인수회사에 지급될 수 있도록 한다. [조기상환청구권(Put Option)에 관한 사항] 채권자는 사채 발행일 이후 3년이 되는 날인 2021년 5월 18일부터 만기일 3개월 전인 2023년 2월 18일 까지 매 3개월이 되는 날마다 발행회사에게 본 사채의 원금에 해당하는 금액의 전부에 대해 만기 전 조기상환을 청구할 수 있다. 조기상환 청구시 본 사채권을 소유한 자는 조기상환 지급일 60일 전부터 30일 전 까지 발행회사에 조기상환을 청구하여야 하며, 발행회사는 사채원본을 반환 받음과 동시에 본 사채의 권면총액(사채원금)을 제공하여야 한다. |
|||||||
| 10. 합병 관련 사항 | - | |||||||
| 11. 청약일 | 2018.03.22 | |||||||
| 12. 납입일 | 2018.05.18 | |||||||
| 13. 대표주관회사 | - | |||||||
| 14. 보증기관 | - | |||||||
| 15. 이사회결의일(결정일) | 2018.03.20 | |||||||
| - 사외이사 참석여부 | 참석 (명) | 2 | ||||||
| 불참 (명) | 0 | |||||||
| - 감사(감사위원) 참석여부 | 참석 | |||||||
| 16. 증권신고서 제출대상 여부 | 아니오 | |||||||
| 17. 제출을 면제받은 경우 그 사유 | 면제(사모 발행에 의한 1년간 행사 및 분할 금지) | |||||||
| 18. 당해 사채의 해외발행과 연계된 대차거래 내역 - 목적, 주식수, 대여자 및 차입자 인적사항, 예정처분시기, 대차조건(기간, 상환조건, 이율),상환방식, 당해 전환사채 발행과의 연계성, 수수료 등 |
해당사항 없음 | |||||||
| 19. 공정거래위원회 신고대상 여부 | 미해당 | |||||||
| 자료: 당사 주요사항보고서 |
| [전환사채권 발행결정(2020.12.14)] |
| 1. 사채의 종류 | 회차 | 7 | 종류 | 기명식 무보증 사모 전환사채 | ||||
| 2. 사채의 권면(전자등록)총액 (원) | 20,000,000,000 | |||||||
| 2-1. 정관상 잔여 발행한도 (원) | 206,359,700,000 | |||||||
| 2-2. (해외발행) | 권면(전자등록)총액(통화단위) | - | - | |||||
| 기준환율등 | - | |||||||
| 발행지역 | - | |||||||
| 해외상장시 시장의 명칭 | - | |||||||
| 3. 자금조달의 목적 |
시설자금 (원) | - | ||||||
| 영업양수자금 (원) | - | |||||||
| 운영자금 (원) | - | |||||||
| 채무상환자금 (원) | - | |||||||
| 타법인 증권 취득자금 (원) | 20,000,000,000 | |||||||
| 기타자금 (원) | - | |||||||
| 4. 사채의 이율 | 표면이자율 (%) | 0 | ||||||
| 만기이자율 (%) | 0 | |||||||
| 5. 사채만기일 | 2025년 12월 17일 | |||||||
| 6. 이자지급방법 | 표면이자 및 만기보장이자는 없으며 이에 지급하지 않기로 한다. | |||||||
| 7. 원금상환방법 | 전환권을 행사하지 않은 사채의 권면금액을 그 사채의 만기일에 일시 상환한다. | |||||||
| 8. 사채발행방법 | 사모 | |||||||
| 9. 전환에 관한 사항 |
전환비율 (%) | 100 | ||||||
| 전환가액 (원/주) | 140,950 | |||||||
| 전환가액 결정방법 |
사채의 전환가격은 「증권발행 및 공시 등에 관한 규정」 제5-22조에 따라 본 사채의 발행을 위한 이사회 결의일 전일을 기산일로 하여 소급하여 산정한 다음 각목의 가격 중 가장 높은 가액에 해당하는 금액으로 하되 원단위 절상한다. 가. 당사 보통주의1개월 가중산술평균주가, 1주일 가중산술평균주가 및 최근일 나. 당사 보통주의 최근일 가중산술평균 주가 다. 당사 보통주의 전환사채 청약일전 제3거래일 가중산술평균주가 |
|||||||
| 전환에 따라 발행할 주식 |
종류 | 주식회사 제넥신 기명식 보통주 | ||||||
| 주식수 | 141,894 | |||||||
| 주식총수 대비 비율(%) |
0.58 | |||||||
| 전환청구기간 | 시작일 | 2021년 12월 17일 | ||||||
| 종료일 | 2025년 12월 16일 | |||||||
| 전환가액 조정에 관한 사항 |
전환가액 조정에 관한 사항 (1) 인수회사가 전환청구를 하기 전에 피인수회사가 본 사채의 발행 이후 본 사채의 전환가격 이하의 가액으로 발행가액을 결정하여 유상증자를 하거나 전환사채의 전환가액 또는 신주인수권부사채의 신주인수권의 행사가액을 정하여 사채를 발행하는 경우 전환가격도 동일하게 하향 조정되는 것으로 한다. (다만, 이미 발행된 주식매수선택권의 행사가격은 그러하지 아니하다.) (2) 무상증자 또는 주식배당에 의하여 주식수가 증가하는 경우 전환가격은 (기발행주식수 × 조정전 전환가격) / (기발행주식수 + 신발행주식수)의 산식에 의하여 조정된다. (3) 공개시장에 등록한 법인이 전환청구 전에 시가를 하회하는 발행가액, 전환가격 또는 행사가격으로 유상신주 또는 주식연계사채를 발행하는 경우(당해 유상신주 또는 주식연계사채 발행 후 사후적으로 전환가격 또는 행사가격이 '인수인'의 주당 행사가격 보다 하향 조정되는 경우 포함)에는 다음과 같이 전환가격을 조정한다. 본 호의 계산방법에 의한 조정 후 전환가격과 상기 제1호의 계산 방법에 의한 조정 후 전환가격을 비교하여 낮은 가격을 조정 후 전환가격으로 한다. 다만 아래의 산식에서 시가는 유가증권의 발행 및 공시 등에 관한 규정에서 정하는 당해 발행가액 산정의 기준이 되는 기준 주가 또는 이론권리락주가(유상증자 이외의 경우에는 조정 사유 발생 전일을 기산일로 하여 계산한 기준주가)를 의미하며 '인수인'의 소정 계산방법에 따라 정한다. 조정후 전환가격 = [조정전 전환가격 × {기발행주식수 + (신발행주식수 × 1주당 발행가액 / 시가)}] / (기발행주식수+신발행주식수) 위의 산식에 의한 조정 후 행사가액의 원단위 미만은 절상한다. (4) 전환사채 발행일 3개월 후 당일, 이후3개월이 되는 날(이하 '전환가격 조정일') 마다 전환가격 조정일 전일을 기산일로 하여 산정한 [(1개월 가중산술평균주가 + 1주일가중산술평균주가 + 최근일 가중산술평균주가) /3]가격 및 최근일 가중산술평균주가 중 높은 가액이 본건 전환사채의 전환가격보다 낮은 경우에는 그 가격을 전환가격으로 조정한다. 다만, 조정 후 전환가격은 제3호에 따른 최초전환가격의 85%를 하회하지 못한다. (5) 제1호 및 제2호를 적용하여 전환가격을 조정함에 있어서 유ㆍ무상 증자를 병행실시하는 경우, 유상 증자 1주당 가액이 조정전 전환가격을 상회하는 때에는 유상증자에 의한 신발행주식수는 전환가격 조정에 적용하지 아니하고 무상증자에 의한 신발행 주식수만을 적용한다. (6) 감자, 주식병합 등 주식가치 상승사유가 발생하는 경우 감자, 주식병합 등으로 인한 조정비율만큼 상향하여 반영한 가액을 전환가액으로 한다. 다만, 감자, 주식병합 등을 위한 주주총회 결의일 전일을 기산일로 하여 1개월 가중산술평균주가, 1주일 가중산술평균주가와 최근일 가중산술평균주가를 산술평균한 가액과 최근일(기산일) 가중산술평균주가 중 높은 가액이 액면가액 미만이면서 기산일 전에 전환가액을 액면가액으로 이미 조정한 경우에는 감자 및 주식병합 등으로 인한 조정 후 전환가액은 산정가액(가중산술 평균가액 중 높은 가액)을 기준으로 감자, 주식병합 등으로 인한 조정비율만큼 상향 조정한 가액 이상으로 할 수 있다. |
|||||||
| 시가하락에 따른 전환가액 조정 |
최저 조정가액 (원) | 119,807 | ||||||
| 최저 조정가액 근거 | 「증권의 발행 및 공시 등에 관한 규정」 제5-23조(전환가액의 하향조정)에 따른 발행당시 전환가액의 70% 이상 | |||||||
| 발행당시 전환가액의 70% 미만으로 조정가능한 잔여 발행한도 (원) |
- | |||||||
| 9-1. 옵션에 관한 사항 | 본 전환사채는 만기 전 사채권자로부터 본사채를 매수할 수 있는 권리(Call option)가 발행회사 및 발행회사가가 지정하는 제 3자에게 부여된 사채이며 이와 동시에 채권자가 조기상환을 청구할 수 있는 권리(Put option)가 부여된 사채 입니다. [매도청구권(Call Option)에 관한 사항] 발행회사는 본 사채의 발행일로부터 2년이 되는 날인 2022년 12월 17일부터 만기일 3개월 전인 2025년 9월 17일 까지 매 [3]개월이 되는 날마다 인수회사가 보유하고 있는 본 사채 전자등록총액 30%에 해당하는 금액의 한도 내에서 발행회사에게 전자등록기관을 통하여 상환하거나, 발행회사가 지정하는 제3자에게 매도하여 줄 것을 청구할 수 있으며, 인수회사는 이 청구에 따라 보유하고 있는 본 사채를 30일 이내에 발행회사에게 상환하거나, 지정된 제3자에게 매도하여야 한다. 이 경우 발행회사는 행사하는 전자등록총액의 연 복리 2%에 해당하는 금액을 가산하여 인수회사에 지급될 수 있도록 한다. [조기상환청구권(Put Option)에 관한 사항] 인수회사는 사채 발행일 이후3년이 되는 날인2023년12월 17일부터 만기일3개월 전인 2025년9월 17일 까지 매[3]개월이 되는 날마다 발행회사에게 본 사채의 원금에 해당하는 금액의 전부에 대해 만기 전 조기상환을 청구할 수 있다. 조기상환 청구 시 본 사채권을 소유한 자는 조기상환 지급일60일 전부터30일 전 까지 발행회사에 전자등록기관을 통하여 조기상환을 청구하여야 한다. |
|||||||
| 10. 합병 관련 사항 | - | |||||||
| 11. 청약일 | 2020년 12월 11일 | |||||||
| 12. 납입일 | 2020년 12월 17일 | |||||||
| 13. 대표주관회사 | - | |||||||
| 14. 보증기관 | - | |||||||
| 15. 이사회결의일(결정일) | 2020년 12월 11일 | |||||||
| - 사외이사 참석여부 | 참석 (명) | 0 | ||||||
| 불참 (명) | 2 | |||||||
| - 감사(감사위원) 참석여부 | 참석 | |||||||
| 16. 증권신고서 제출대상 여부 | 아니오 | |||||||
| 17. 제출을 면제받은 경우 그 사유 | 면제(사모 발행에 의한 1년간 행사 및 분할 금지) | |||||||
| 18. 당해 사채의 해외발행과 연계된 대차거래 내역 - 목적, 주식수, 대여자 및 차입자 인적사항, 예정처분시기, 대차조건(기간, 상환조건, 이율),상환방식, 당해 전환사채 발행과의 연계성, 수수료 등 |
해당없음 | |||||||
| 19. 공정거래위원회 신고대상 여부 | 미해당 | |||||||
| 자료: 당사 주요사항보고서 |
'제넥신 6CB'의 경우 최초 발행금액 50,000백만원은 2020년 07월 30일과 2020년 08월 08일에 각각 3,500백만원, 31,500백만원이 전환되었으며, 2020년 12월 18일 당사의 콜옵션 행사에 따라 13,500백만원을 자기사채로 취득한 상태입니다. '제넥신 7CB'의 경우 최초 발행금액 20,000백만원 중 전환청구 및 상환된 금액은 없습니다. 상기 두개의 미상환 전환사채는 본 공시서류 제출일 전일 기준 현재 전환가격 대비 전환대상 주식의 시가가 낮은 외가격(OTM,Out The Money) 상태로 당장 투자자의 전환권 청구에 따른 신주발행 가능성이 낮은 상태입니다. 그러나 '제넥신 6CB' 및 '제넥신 7CB'의 계약 당시 전환가액 조정 관련 사항 중 하기 문구에 따라 본 주주배정후 실권주 일반공모 유상증자 확정발행가액 결정 이후 기존 전환가액이 확정발행가액으로 조정될 가능성이 존재합니다.
|
'제넥신 6CB' 전환가액 조정에 관한 사항 일부 1. 채권자가 전환청구를 하기 전 발행사가 본 사채의 발행 이후 사채의 전환가격 이하 가액으로 발행가액을 결정하여 유상증자를 하거나 전환사채의 전환가액 또는 신주인수권부사채의 신주인수권의 행사가액을 정하여 사채를 발행하는 경우 전환가격도 동일하게 하향 조정되는 것으로 한다. (단, 이미 발행된 주식매수선택권의 행사가격은 그러하지 않는다.) 2. 무상증자 또는 주식배당에 의하여 주식수가 증가하는 경우 전환가격은 (기발행주식수 × 조정전 전환가격) / (기발행주식수 + 신발행주식수)의 산식에 의하여 조정된다. |
|
'제넥신 7CB' 전환가액 조정에 관한 사항 일부 (1) 인수회사가 전환청구를 하기 전에 피인수회사가 본 사채의 발행 이후 본 사채의 전환가격 이하의 가액으로 발행가액을 결정하여 유상증자를 하거나 전환사채의 전환가액 또는 신주인수권부사채의 신주인수권의 행사가액을 정하여 사채를 발행하는 경우 전환가격도 동일하게 하향 조정되는 것으로 한다. (다만, 이미 발행된 주식매수선택권의 행사가격은 그러하지 아니하다.) |
금번 주주배정후 실권주 일반공모 유상증자의 1차 발행가액은 15,500원입니다. '제넥신 6CB'와 '제넥신 7CB'의 전환가액이 1차 발행가액으로 조정된다고 가정할 경우 미상환전환사채에 대한 전환가능주식 수는 다음과 같습니다.
| [유상증자 이후 예상 전환가능주식수] |
| (단위 : 백만원, 주) |
| 구분 | 회차 | 미상환 전환사채 권면(전자등록) 총액 | 전환가액(원) | 전환가능주식수 | |||
|---|---|---|---|---|---|---|---|
| 본 공시서류 제출일 전일 현재 |
유상증자 이후 (주1) | 무상증자 이후 | 본 공시서류 제출일 전일 현재 |
유ㆍ무상증자 이후 | |||
| 제넥신 6CB | 6 | 15,000 | 87,278 | 15,500 | 11,924 | 171,864 | 1,257,967 |
| 제넥신 7CB | 7 | 20,000 | 119,807 | 166,935 | 1,677,289 | ||
| 합 계 | 35,000 | - | - | 338,799 | 2,935,256 | ||
| 주1) 1차 발행가액 기준. 최종적으로 실제 조정 전환가액은 확정발행가액으로 결정될 예정 |
| 주2) 무상증자 이후 조정 전환가액은 원단위 미만 절상 |
| 자료 : 당사 제시 |
금번 주주배정후 실권주 일반공모 유상증자 및 무상증자에 따라 전환가액이 조정된 이후, '제넥신 6CB' 및 7CB가 내가격(ITM,In The Money) 상태가 되어 전환가능주식수 전량이 전환 청구되고, 최대주주가 배정물량의 75%를 청약할 경우 당사 최대주주 (주)한독의 지분율은 13.36%로 예상되어, 본 공시서류 제출일 전일 현재 최대주주 지분율 대비 1.68% 하락할 예정입니다.
|
[최대주주 지분율 변동 시뮬레이션(유상증자 이후 전환사채 전환권 청구 가정)] |
|
| (기준일 : 2022년 11월 07일) |
(단위: 주, %) |
| 성 명 | 주식의 종류 |
증자 전 | 배정 주식수 (예정) |
청약 참여 주식수(예정) |
전환사채 전환청구 주식수(예정) (주1) |
유ㆍ무증자 후(예정) | ||
|---|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | |||||
| (주)한독 | 의결권 있는 주식 | 3,781,017 | 15.04 | 871,702 | 653,777 | 2,935,256 | 5,765,232 | 13.36 |
| 주1) 1차 발행가액 기준. 최종적으로 실제 조정 전환가액은 확정발행가액으로 결정될 예정 |
| 출처: 당사 정기보고서 |
상기 최대주주의 지분율 변화 시뮬레이션은 증권신고서 제출일 현재 1차 발행가액 15,500원을 기준으로 산출하였으며, 향후 최종 발행가액이 확정됨에 따라서 최대주주 지분율 희석 정도가 변동될 수 있습니다. 최종발행가액이 하락할 경우, 최대주주의 지분율 희석은 제한적일 것으로 판단되나, 최종발행가액이 상승할 경우, 최대주주의 청약 및 납입 부담이 증가하여 참여 수량이 축소할 가능성이 있으며, 이 경우 지분율 희석 효과는 커질 것으로 판단됩니다. 이처럼, 향후 발행가액 최종 결정에 따라 최대주주의 지분율 희석 정도가 변동 가능한점 투자자께서는 유의하시기 바랍니다. 상기와 같이 당사는 금번 유상증자에 따라 현 최대주주의 지분율 하락, 경영권과 관련한 위험이 잠재되어 있으며, 그밖에 예상치 못한 경영권 혼란 가중 가능성도 있을 수 있으니, 투자자께서는 이점 유의하시기 바랍니다.
한편, 당사가 임직원에게 부여한 주식매수선택권 중 미행사수량은 717,732주로, 해당 미행사 주식매수선택권은 보고서 제출일 전일 현재 발행주식총수의 2.85% 해당하는 수준입니다. 당사가 부여한 주식매수선택권은 계약서 상 '행사가격 및 부여 주식수의 주의 조정' 관련 조항 내 하기 산식에 의해 행사가격 및 행사 수량이 변경될 예정입니다.
| 1) 행사가격보다 낮은 발행가격으로 유상증자를 하는 경우 조정후의 행사가격 = {(유상증자 직전 발행주식 총수 x 조정전 행사가격) + (유상증자 발행주식수 x 유상증자 주당 발행가액)} / (유상증자 직전 발행주식총수 + 유상증자 발행주식수) 2) 준비금의 자본전입(무상증자)의 경우 조정후 행사가격 = (조정전 행사가액 x 무상증자 직전 발행주식 총수) / (무상증자 직전 발행주식총수 + 무상증자 발행주식수) 조정후 행사수량 = {조정전 행사수량 x (무상증자 직전 발행주식 총수 + 무상증자 발행주식 수)} / 무상증자 직전 발행주식 총수 |
상기 산식에 따라 주식매수선택권 중 미행사수량은 933,052주로 증가할 예정이며, 이는 당사의 유ㆍ무상증자가 완료된 이후 예상 발행주식 총수인 40,224,709주의 2.32%에 해당하는 수준입니다. 향후 주식매수선택권 행사에 따른 주식 희석에 따라 최대주주 지분율이 소폭 하락할 수 있으니 투자자께서는 투자 판단시 이점 유의하시기 바랍니다.
|
[보고서 제출일 전일 기준 미행사 주식매수선택권현황] |
|
|
(기준일 : 2022년 11월 14일) |
(단위: 원) |
| 구 분 | 부여일 | 보유수량 | 행사가능기간 | 행사가격 | 가득조건 | 조정 후 행사가격 (유상증자) |
조정 후 행사가격 (무상증자) |
조정 후 행사수량 (무상증자) |
|---|---|---|---|---|---|---|---|---|
| 11-3차 | 2013.03.15 | 70,800 | 2021.03.15~2023.03.14 | 9,350 | 용역제공 8년 | 9,350 | 7,192 | 92,040 |
| 12-3차 | 2014.03.21 | 86,150 | 2022.03.21~2024.03.20 | 17,600 | 용역제공 8년 | 17,216 | 13,488 | 111,995 |
| 25-1차 | 2018.02.06 | 16,010 | 2021.02.06~2023.02.05 | 78,950 | 용역제공 3년 | 67,072 | 51,839 | 20,813 |
| 25-2차 | 2018.02.06 | 66,932 | 2021.02.06~2024.02.05 | 78,950 | 용역제공 3년 | 67,072 | 51,839 | 87,012 |
| 26차 | 2018.08.08 | 21,500 | 2021.08.08~2023.08.07 | 85,900 | 용역제공 3년 | 72,720 | 56,183 | 27,950 |
| 27차 | 2018.10.12 | 29,000 | 2021.10.12~2023.10.11 | 93,700 | 용역제공 3년 | 79,058 | 61,059 | 37,700 |
| 28차 | 2019.05.22 | 3,190 | 2022.05.22~2024.05.21 | 72,600 | 용역제공 3년 | 61,911 | 47,869 | 4,147 |
| 29차 | 2019.11.28 | 4,500 | 2022.11.28~2024.11.27 | 56,200 | 용역제공 3년 | 48,584 | 37,617 | 5,850 |
| 30차 | 2019.12.27 | 850 | 2022.12.27~2024.12.26 | 56,900 | 용역제공 3년 | 49,153 | 38,055 | 1,105 |
| 31차 | 2020.03.04 | 5,000 | 2023.03.04~2025.03.03 | 58,800 | 용역제공 3년 | 50,697 | 39,243 | 6,500 |
| 32차 | 2020.07.15 | 61,500 | 2023.07.15~2025.07.14 | 96,500 | 용역제공 3년 | 81,334 | 62,809 | 79,950 |
| 33차 | 2021.02.18 | 23,100 | 2024.02.18~2026.02.17 | 104,100 | 용역제공 3년 | 87,510 | 67,560 | 30,030 |
| 34차 | 2021.03.29 | 3,000 | 2024.03.29~2026.03.28 | 100,100 | 용역제공 3년 | 84,259 | 65,060 | 3,900 |
| 35차 | 2021.08.13 | 29,000 | 2024.08.13~2026.08.12 | 90,100 | 용역제공 3년 | 76,133 | 58,809 | 37,700 |
| 36차 | 2022.03.07 | 102,200 | 2025.03.07~2027.03.06 | 47,600 | 용역제공 3년 | 41,595 | 32,241 | 132,860 |
| 37차 | 2022.03.29 | 195,000 | 2025.03.29~2027.03.28 | 45,300 | 용역제공 3년 | 39,726 | 30,804 | 253,500 |
| 합계 | 717,732 | - | 933,052 | |||||
| 출처: 당사 정기보고서 |
상기와 같이 당사는 금번 유상증자, 미상환전환사채에 대한 전환권 행사, 주식매수선택권 행사로 인해 희석이 발생하여 최대주주의 지분율이 하락할 수 있습니다. 이로 인해 적대적 M&A 등의 경영권 분쟁이 발생할 수 있으니 투자자께서는 이점 유의하시기 바랍니다.
| 바. 관리종목 지정 및 상장폐지 위험 당사는 2011년 매출액 26.6억원을 기록하였으며, 코스닥시장상장규정에 따른 매출액 30억원 이상 요건을 충족시키지 못하여 2012년 03월 21일 관리종목에 지정된 바 있습니다. 다만 2012년 기술이전 및 용역수입 증가로 매출액 63.4억원을 기록하여 2013년 03월 08일 관리종목 지정이 다시 해제되었습니다. 당사는 해당년도 이후 연간 매출이 지속적으로 30억원을 상회하였으며, 본 공시서류 제출일 전일기준 현재까지 매출액 요건 이외에 다른 사유로 인해 관리종목이 지정된 사례는 없습니다. 관리종목으로 지정될 경우 중요 사유 발생시마다 한국거래소는 일정기간 매매거래정지 명령을 발동할 수 있습니다. 이외에도 주식의 미수나 신용거래가 금지되며, 미수나 신용거래의 증거금이 되는 대용유가증권으로도 사용할 수 없습니다. 투자자께서는 관리종목 지정에 따른 위험을 인지하시고 투자에 임하시기 바랍니다. 또한, 이러한 관리종목 지정사유 확인 당일 코스닥시장에서의 거래는 정지됩니다. 이를 기한 내에 해결하지 못한다면 코스닥시장 상장폐지 사유에 해당하여, 당사 주식은 향후 장내에서 거래가 이루어지지 못할 수 있습니다. 투자자 여러분들께서는 당사의 주식이 상장폐지될 경우, 투자금액을 회수하지 못하게 될 수도 있는 점을 반드시 유의하여 주시기 바랍니다. |
당사는 2008년 12월 기술보증기금과 생명공학연구원으로 기술평가를 받아 2009년 09월 코스닥시장에 상장하였습니다. 당사는 국내외 주요 파트너로의 기술이전과 연구용역을 통하여 매출을 시현하고 있으나, 글로벌 임상시험 인원확충에 따른 인건비 증가, 연구개발비용 발생 등으로 설립 이후 현재까지 지속적으로 영업손실을 기록하고 있습니다.
당사는 2011년 매출액 26.6억원을 기록하였으며, 코스닥시장상장규정에 따른 매출액 30억원 이상 요건을 충족시키지 못하여 2012년 03월 21일 관리종목에 지정된 바 있습니다. 다만 2012년 기술이전 및 용역수입 증가로 매출액 63.4억원을 기록하여 2013년 03월 08일 관리종목 지정이 다시 해제되었습니다. 당사는 해당년도 이후 연간 매출이 지속적으로 30억원을 상회하였으며, 본 공시서류 제출일 전일 현재까지 매출액 요건 이외에 다른 사유로 인해 관리종목이 지정된 사례는 없습니다.
코스닥 관리종목 지정요건과 당사의 해당 여부는 다음과 같습니다
| [코스닥시장 관리종목 지정요건 및 해당여부 검토] |
| 구 분 | 관리종목 지정(코스닥 상장규정 제53조) | 회사현황 | 관리종목지정요건 해당여부 |
관리종목지정유예 | ||
|---|---|---|---|---|---|---|
| 사업연도 | 금액(백만원) / 비율(%) / 내용 |
해당여부 | 종료시점 | |||
| 1) 매출액 미달(별도) | 최근 사업연도 30억원 미만 (지주회사는 연결기준) - 이익미실현기업 또는 기술성장기업은 상장후 5년간 미적용 - 기술성장기업 중 A), B), C) 중 어느 하나에 해당하는 제약·바이오기업은 최근 사업연도 미적용 A) 최근 사업연도 말「제약산업 육성 및 지원에 관한 특별법」에 따른 혁신제약기업이 세칙으로 정한 요건을 충족하는 경우 B) 최근 사업연도의 일평균 시가총액 4,000억 이상이며, 그 금액이 현재의 자본금을 초과하는 기업이 세칙으로 정하는 요건을 충족하는 경우 C) 최근 3사엽언도의 매출액 합계 90억 이상이며, 최근 사업연도의 직전 사업연도의 매출액이 30억 이상인 경우 |
2021년(별도) | 38,320 | 미해당 | 미해당 | 종료 |
| 2) 법인세비용차감전 계속사업손실(연결) |
최근 3사업연도중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근사업연도에 법인세비용차감전계속사업손실이 있는 경우 - 이익미실현 기업은 상장 후 5년간 미적용 - 기술성장기업은 상장후 3년간 미적용 |
2021년(연결) | -48,561 / -9.28% | 미해당 | 미해당 | 종료 |
| 2020년(연결) | 27,536 / 5.13% | |||||
| 2019년(연결) | -16,509 / -5.56% | |||||
| 3) 영업손실(별도) | 최근 4사업연도 영업손실(지주회사는 연결기준) - 기술성장기업은 미적용 |
2021년(별도) | -16,359 | 해당가능 | 미해당 | 지속 적용 |
| 2020년(별도) | -38,729 | |||||
| 2019년(별도) | -44,536 | |||||
| 2018년(별도) | -38,083 | |||||
| 4) 자본잠식 등(연결) | 반기말 또는 사업연도 말을 기준으로 다음의 어느 하나에 해당하는 경우 A) 최근 반기말 또는 사업연도말을 기준으로 자본잠식률 50%이상 B) 최근 반기말 또는 사업연도말을 기준으로 자기자본 10억원 미만 C) 감사보고서 감사(검토)의견이 부적정 또는 의견 거절이거나 감사범위제한으로 인한 한정인 경우 D) 반기보고서 법정제출기한 다음날부터 10일 이내에 반기검토(감사)보고서를 제출하지 아니한 경우 |
2022년 반기말 (연결) |
A) 자본잠식상태가 아님 B) 자기자본: 375,687 C) 감사의견 적정 D) 2022.08.16. 제출 |
미해당 | - | - |
| 5) 시가총액 미달 | 보통주 시가총액 40억원미만 30일간 지속 -천재지변, 시장상황의 급격한 변동 등으로 거래소가 시장 관리를 위하여 필요하다고 인정될 경우 적용배제 가능 |
현재 기준 | 시가총액 요건 충족 | 미해당 | - | - |
| 6) 정기보고서 미제출 | 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 | 2022년 | 사업보고서 제출일 2022년 03월 17일 분기보고서 제출일 2022년 05월 16일 반기보고서 제출일 2022년 08월 16일 분기보고서 제출일 2022년 11월 14일 |
미해당 | - | - |
| 7) 지배구조 미달 | 최근 사업연도 사업보고서상 A)사외이사의 수가 법에서 정하는 수에 미달 B)법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 *「상법」 제542조의8에 의거 자산총액 1,000억원 미만의 코스닥 상장 벤처기업은 사외이사 선임 의무 면제 **「상법」 제542조의11에 의거 자산총액 2조원 미만의 상장회사는 감사위원회 설치 의무 면제 |
2021년 | 사외이사 요건 충족 (이사의 수: 7인 / 사외이사 수: 2인) |
미해당 | - | - |
| 8) 거래량 미달 | 분기월평균거래량이 유동주식수의 1%에 미달 - 신규상장법인(신규상장일이 속하는 분기에 한정), 월평균거래량 1만주 이상(액면가액 5,000원 기준), 법에 따른 유동성공급계약 체결, 소액주주 300인이상이 20%이상 지분 보유 등은 적용배제 |
2022년 반기말 | 소액주주 지분율 77.67% 소액주주수 100,028명 | 미해당 | - | - |
| 9) 주식분산 미달 | 소액주주200인미만 or 소액주주지분 20%미만 - 300인이상의 소액주주가 유동주식수의 10%이상으로서 100만주이상을 소유, 해외증권시장에 상장된 경우는 적용배제 |
2022년 반기말 | 소액주주 지분율 77.67% 소액주주수 100,028명 | 미해당 | - | - |
| 10) 회생절차 개시신청 | "채무자 회생 및 파산에 관한 법률" 제34조에 의한 회생 절차개시 신청이 있는 경우 | 본 공시서류 제출일 전일 기준 |
해당사항 없음 | 미해당 | - | - |
| 11) 파산신청 | 코스닥시장 상장법인에 대하여 "채무자 회생 및 파산에 관한 법률" 제294조에 의한 파산신청이 있는 경우 | 본 공시서류 제출일 전일 기준 |
해당사항 없음 | 미해당 | - | - |
| 12) 기타 | - 형식적 상장폐지 사유 또는 상장적격성 실질심사에 따른 상장폐지 사유가 발생한 경우 - 변경·추가상장이 유예된 기간 중에「증권의 발행 및 공시 등에 관한 규정」에 따른 재무관리기준을 위반한 경우 |
본 공시서류 제출일 전일 기준 |
해당사항 없음 | 미해당 | - | - |
| 출처: 당사 정기보고서 |
(1) 매출액 미달 여부 검토
| [매출액 미달 여부 검토] | |
| (K-IFRS, 별도) | (단위 : 백만원) |
| 구분 | 2018년 | 2019년 | 2020년 | 2021년 |
|---|---|---|---|---|
| 매출액 | 12,882 | 11,303 | 18,543 | 38,320 |
| 출처: 당사 정기보고서 |
코스닥시장 상장규정 제53조 1항 1호에 따라 최근 사업연도의 매출액이 30억 미만일 경우 관리종목으로 지정되게 됩니다. 당사는 2009년 상장 이후 2011년까지 매출액 요건 30억원에 미달하였으나, 이후 기술이전 등으로 매출이 증가하여 2012년부터 최근사업년도까지 지속적으로 매출액이 30억원을 상회하고 있습니다. 최근 4개년 매출액은 2018년 129억원, 2019년 113억원, 2020년 185억원, 2021년 383억원입니다.
또한 당사는「제약산업 육성 및 지원에 관한 특별법」 제2조제3호에 따른 혁신형제약기업에 선정되어 「코스닥시장 상장규정」 제1항1호나목에 따라 유효기간이 만료되는 2023년 11월 27일까지 최근사업연도의 매출액 미달 요건으로 인한 관리종목 지정이 유예되며, 재인증 심사가 승인될 경우 이 기간은 연장될 수 있습니다. 하지만 라이선스 아웃 실패 등의 사유로 당사의 매출이 감소하여 관리종목 지정 요건에 미달하고, 혁신형제약기업 재인증에 실패할 경우 관리종목 지정 가능성이 있음을 투자자분들께서는 유의하여 주시기 바랍니다.
(2) 법인세차감전계속사업손실 발생 여부 검토
| [법인세차감전계속사업손실 발생 여부 검토] | |
| (K-IFRS, 연결) | (단위 : 백만원) |
| 구분 | 2021년 | 2020년 | 2019년 |
| 법인세비용차감전순이익 | (48,561) | 27,536 | (16,509) |
| 자기자본 | 523,273 | 536,533 | 296,909 |
| 법인세비용차감전순이익/자기자본 | -9.28% | 5.13% | -5.56% |
| 출처: 당사 정기보고서 |
코스닥시장 상장규정 제53조 1항 2호에 따라 최근 3사업연도 중 2사업연도에 각각 당해 사업연도말 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 있고 최근 사업연도에 법인세비용차감전계속사업손실이 있는 경우 관리종목으로 지정되게 됩니다.
당사는 최근 3사업연도(2019년~2021년) 중 자기자본의 50%를 초과하는 법인세비용차감전계속사업손실이 발생한 적이 없으며(2019년 -5.56%, 2020년 5.13%, 2021년 -9.28%), 금번 유상증자 자금 조달 시 자기자본 규모 확대로 법인세차감전계속사업손실 요건으로 인한 관리종목 지정 리스크는 낮을 것으로 판단됩니다.
(3) 영업손실 발생 여부 검토
| [영업손실 발생 여부 검토] | |
| (K-IFRS, 별도) | (단위 : 백만원) |
| 구분 | 2018년 | 2019년 | 2020년 | 2021년 |
|---|---|---|---|---|
| 영업손익(별도) | (38,083) | (44,536) | (38,729) | (16,359) |
| 출처: 당사 정기보고서 |
코스닥시장 상장규정 제53조 1항 3호에 따라 최근 4사업연도 영업손실이 발생하는 경우 관리종목으로 지정되게 됩니다.
당사는 최근 4사업연도 지속적으로 영업손실이 발생하여 관리종목 지정요건에 해당합니다. 다만, 당사는 기술성장특례 적용 기업으로서 코스닥시장 상장규정 제53조 1항 3호 후단에 따라 이 호를 적용받지 않습니다.
(4) 자본잠식 여부 검토
| [자본잠식 여부 검토] | |
| (K-IFRS, 연결) | (단위 : 백만원) |
| 구분 | 2019년 | 2020년 | 2021년 | 2022년 반기말 |
|---|---|---|---|---|
| 자기자본 | 296,909 | 536,533 | 523,273 | 375,687 |
| 자본금 | 11,881 | 12,349 | 12,515 | 12,569 |
| 자본잠식여부 | 미해당 | 미해당 | 미해당 | 미해당 |
| 감사의견 | 적정 | 적정 | 적정 | 검토 |
| 출처: 당사 정기보고서 |
코스닥시장 상장규정 제53조 1항 4호에 따라 반기말 또는 사업연도 말을 기준으로 다음의 어느 하나에 해당하는 경우 A) 최근 반기말 또는 사업연도말을 기준으로 자본잠식률 50%이상 / B) 최근 반기말 또는 사업연도말을 기준으로 자기자본 10억원 미만 / C) 반기보고서 감사(검토)의견이 부적정 또는 의견 거절이거나 감사범위제한으로 인한 한정인 경우 / D) 반기보고서 법정제출기한 다음날부터 10일 이내에 반기검토(감사)보고서를 제출하지 아니한 경우 관리종목으로 지정됩니다.
당사는 A) 최근 반기말(2022년 반기말) 자본잠식상태가 아니고, B) 최근 반기말(2022년 반기말) 자기자본이 약 3,757억원으로 10억원 이상이며, C) 최근 반기보고서(2022년 반기) 검토의견이 부적정 또는 의견 거절이거나 감사범위제한으로 인한 한정에 해당되지 않으며, D) 최근 반기보고서(2022년 반기) 제출일이 2022년 08월 16일로 법정제출기한 내에 제출하였습니다. 이에 따라 당사는 자본잠식 요건에 의한 관리종목 지정요건에 해당하지 않습니다.
(5) 시가총액 미달여부 검토
| [시가총액 미달여부 검토] |
| (단위: 백만원) |
| 구분 | 시가총액(최고) | 시가총액(최저) | 시가총액(평균) |
|---|---|---|---|
| 2022년 3분기 | 869,809 | 520,501 | 759,343 |
| 출처: KRX 정보데이터시스템 |
코스닥시장 상장규정 제53조 1항 5호에 따라 보통주 시가총액 40억원미만 30일간 지속되는 경우 관리종목으로 지정됩니다.
당사의 2022년 3분기 시가총액은 최고 8,698억원, 최저 5,205억원, 평균 7,593억원으로 시가총액 40억원 미만을 기록한 바가 없어 관리종목 지정요건에 해당하지 않습니다.
(6) 정기보고서 미제출 여부 검토
코스닥시장 상장규정 제53조 1항 6호에 따라 사업보고서, 반기보고서 또는 분기보고서를 법정제출기한 내에 제출하지 않은 경우 관리종목으로 지정됩니다.
당사는 2022년 11월 14일 분기보고서를, 2022년 08월 16일 반기보고서를, 2022년 05월 16일에 분기보고서를, 2022년 03월 17일에 사업보고서를 제출함에 따라 법정제출기한 내에 제출한 바, 관리종목 지정요건에 해당하지 않습니다.
(7) 지배구조 미달 여부 검토
코스닥시장 상장규정 제53조 1항 7호에 따라 최근 사업연도 사업보고서상 A)사외이사의 수가 법에서 정하는 수에 미달 B) 법에서 정하는 감사위원회를 구성하지 않거나 구성요건을 충족하지 아니하는 경우 관리종목으로 지정됩니다.
당사는 본 공시서류 제출일 전일 현재 이사의 수 7명, 사외이사 수 2명으로 「상법 시행령」제34조1항1호에 따라 이사 총수의 4 분의 1 명 이상을 사외이사로 하는 요건에 충족하며, 「상법」 제542조의 11에 의거 자산총액이 2조원 미만이므로 감사위원회 설치 의무가 면제됩니다. 따라서 당사는 지배구조 미달 요건에 의한 관리종목 지정요건에 해당하지 않습니다.
(8) 거래량 미달 여부 검토
코스닥시장 상장규정 제53조 1항 8호에 따라 분기월평균거래량이 유동주식수의 1%에 미달하는 경우 관리종목으로 지정됩니다. 다만, 다음 어느 하나에 해당하는 경우에는 이 호에 적용 받지 않습니다. 가) 신규 신규상장법인의 경우. 다만, 신규상장일이 속하는 분기에 한정하는 경우, 나) 분기의 월평균거래량이 1만주 이상인 경우. 이 경우 보통주식 상장법인이 액면주식을 발행한 때에는 액면가액 5,000원을 기준, 다) 세칙으로 정하는 소액주주가 소유한 보통주식의 총수가 유동주식수의 100분의 20 이상이고, 해당 소액주주의 수가 300명 이상인 경우. 이 경우 소액주주가 소유한 주식 수와 소액주주의 수는 최근 사업연도 말을 기준으로 하되, 최근 사업연도 말 이후 주주명부를 폐쇄한 경우에는 그 폐쇄시점 현재를 기준으로 거래소에 제출한 주주명부 및 「주식·사채 등의 전자등록에 관한 법률」에 따른 소유자명세를 기준으로 하는 경우입니다.
당사는 2022년 반기말 기준 소액주주 지분율 77.67%, 소액주주 수 100,028명임에 따라 상기 다) 항목에 해당되어 거래량 미달에 따른 관리종목 지정 요건에 해당되지 않습니다.
(9) 주식분산 미달 여부 검토
코스닥시장 상장규정 제53조 1항 9호에 따라 최근 사업연도말 소액주주가 200인 미만이거나 소액주주지분이 20% 미만일 경우 관리종목으로 지정됩니다.
당사는 2022년 반기말 기준 소액주주 지분율 77.67%, 소액주주 수 100,028명임에 따라 주식분산 미달에 따른 관리종목 지정 요건에 해당되지 않습니다.
(10) 기타사항
코스닥시장 상장규정 제53조 1항 10호에서 13호까지에 따라 회생절차개시신청, 파산신청, 상장폐지사유발생, 재무관리기준 위반 요건에 해당하는 경우 관리종목으로 지정됩니다.
당사는 본 공시서류 제출일 전일 현재 동 관리종목지정요건에 해당하지 않습니다.
관리종목으로 지정될 경우 중요 사유 발생시마다 한국거래소는 일정기간 매매거래정지 명령을 발동할 수 있습니다. 이외에도 주식의 미수나 신용거래가 금지되며, 미수나 신용거래의 증거금이 되는 대용유가증권으로도 사용할 수 없습니다. 투자자께서는 관리종목 지정에 따른 위험을 인지하시고 투자에 임하시기 바랍니다.
또한, 이러한 관리종목 지정사유 확인 당일 코스닥시장에서의 거래는 정지됩니다. 이를 기한 내에 해결하지 못한다면 코스닥시장 상장폐지 사유에 해당하여, 당사 주식은 향후 장내에서 거래가 이루어지지 못할 수 있습니다. 투자자 여러분들께서는 당사의 주식이 상장폐지될 경우, 투자금액을 회수하지 못하게 될 수도 있는 점을 반드시 유의하여 주시기 바랍니다.
|
사. 잦은 자금조달 관련 위험 |
당사는 금번 유상증자를 제외하고 상장 이후 2011년 10월 05일 유상증자 50억원(제3자배정 보통주, 기타자금), 2012년 10월 26일 유상증자 163억원(제3자배정 보통주, 운영자금), 제3회 사모전환사채(CB) 167억원(시설자금 10억원, 운영자금 10억원, 타법인증권취득자금 40억원, 기타자금 107억원), 2014년 04월 15일 제4회 사모전환사채(CB) 70억원(운영자금), 2014년 08월 25일 유상증자 30억원(제3자배정 전환우선주, 운영자금), 2014년 10월 30일 유상증자 500억원(제3자배정 전환우선주, 운영자금), 2015년 12월 03일 유상증자 200억원(제3자배정 전환우선주, 운영자금), 2016년 07월 15일 유상증자 600억원(제3자배정 전환우선주, 운영자금), 2016년 07월 08일 제5회 사모전환사채(CB) 200억원(운영자금), 2018년 05월 18일 유상증자 2,000억원(제3자배정 전환우선주, 운영자금 1,400억원, 타법인증권취득자금 600억원), 제6회 사모전환사채(CB) 500억원(운영자금), 2020년 12월 17일 제7회 사모전환사채(CB) 200억원(타법인증권취득자금), 2020년 12월 21일 유상증자 585억원(제3자배정 보통주, 타법인증권취득자금)을 조달한 이력이 있습니다. 당사가 상장이후 조달한 자금 현황은 다음과 같습니다.
| [상장이후 조달한 자금 현황] |
| (단위: 백만원) |
| 납입일 | 종류 | 사용용도 | 금액 |
|---|---|---|---|
| 2011-10-05 | 유상증자(제3자배정 보통주) | 기타자금 | 5,000 |
| 2012-10-26 | 유상증자(제3자배정 보통주) | 운영자금 | 16,326 |
| 2012-10-26 | 제 3회 사모전환사채 | 시설자금 | 1,000 |
| 운영자금 | 1,000 | ||
| 타법인증권취득자금 | 4,000 | ||
| 기타자금 | 10,650 | ||
| 2014-04-15 | 제 4회 사모전환사채 | 운영자금 | 7,000 |
| 2014-08-25 | 유상증자(제3자배정 전환우선주) | 운영자금 | 3,031 |
| 2014-10-30 | 유상증자(제3자배정 전환우선주) | 운영자금 | 50,001 |
| 2015-12-03 | 유상증자(제3자배정 전환우선주) | 운영자금 | 20,000 |
| 2016-07-15 | 유상증자(제3자배정 전환우선주) | 운영자금 | 59,999 |
| 2016-07-08 | 제 5회 사모전환사채 | 운영자금 | 19,990 |
| 2018-05-18 | 유상증자(제3자배정 전환우선주) | 운영자금 | 139,999 |
| 타법인증권취득자금 | 60,000 | ||
| 2018-05-18 | 제 6회 사모전환사채 | 운영자금 | 50,000 |
| 2020-12-17 | 제 7회 사모전환사채 | 타법인증권취득자금 | 20,000 |
| 2020-12-21 | 유상증자(제3자배정 보통주) | 타법인증권취득자금 | 58,524 |
| 합계 | 526,521 | ||
당사는 상장 이후 조달한 자금은 계획했던 자금사용목적에 맞게 자금을 집행하였으며 금번 공시서류 제출일 전일 현재 조달한 자금은 전액 사용되었습니다. 하지만, 당사의 경우 바이오기업 특성상 향후 추가적인 자금조달 가능성을 배제할 수 없습니다. 금번 유상증자 후에 추가 조달의 필요성이 지속될 경우 당사 자금 유동성이 크게 악화될 수 있고 추가적인 자금조달을 진행 할 수 있으며, 반복적인 주식관련사채 발행 및 유상증자로 인하여 주주가치가 심각하게 훼손될 수 있으니 투자자께서는 투자에 임하실 때 이 점 각별히 유의하시기 바랍니다.
당사는 금번 유상증자 납입자금은 자금 사용목적의 용도로만 사용할 계획이나 당사가 직면한 신약개발일정 변동 등 및 예상치 못한 자금 수요에 따라 변동될 가능성이 있으므로 이 점 유의해 주시기 바랍니다. 금번 공모 자금사용에 대한 구체적인 내용은 본 증권신고서 "제1부 - V. 자금의 사용 목적"을 를 참고하여 주시기 바랍니다
| 아. 임상결과에 따른 기업가치 급등락 위험 업종 특성상 당사의 기업가치는 통상적으로 개발중인 파이프라인의 사업가치에 따라 결정됩니다. 이에 따라 제약/바이오 기업들의 주가는 통상적으로 개발중인 파이프라인의 임상실험 진행 및 결과 발표에 따라 영향을 받고 있습니다. 당사는 2022년 03월 11일 당사의 COVID-19 예방 DNA 백신 GX-19N 임상시험 중 1. 엔데믹 시대로 전환됨에 따라 새로운 백신개발에 대한 긴급성이 떨어진 점 2. 새로운 백신 개발에 대한 시장의 니즈가 낮아졌다는 점 3. 방어효능을 보기 위한 임상 3상 진행 시 위약을 접종 받아야 하는 임상 참여군에 대한 윤리성 문제가 있다는 점을 들어 GX-19N의 사업성이 낮다고 판단하였습니다. 따라서, 2021년 승인받은 인도네시아 2/3상 시험철회를 신청하였으며, 아르헨티나 허가 당국에 신청한 부스터 백신 임상시험 또한 신청을 철회하기로 결정하였습니다. 해당 공시는 2022년 03월 11일 장마감 이후 공시되었으며, 해당 공시 다음날 주가는 전일 종가 대비 11.52% 하락하는 등 주가는 2022년 03월 11일을 고점으로 이전 수준의 값을 회복하지 못하고 있습니다. 이와같이, 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준에 불과합니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. 특히 임상의 진행 중 경과가 당사 기업가치와 주가에 중요한 영향을 끼치고 있기에 투자자께서는 이점 유의하시기 바랍니다. |
업종 특성상 당사의 기업가치는 통상적으로 개발중인 파이프라인의 사업가치에 따라 결정됩니다. 이에 따라 제약/바이오 기업들의 주가는 통상적으로 개발중인 파이프라인의 임상실험 진행 및 결과 발표에 따라 영향을 받고 있습니다.
당사는 2022년 03월 11일 당사의 COVID-19 예방 DNA 백신 GX-19N 임상시험 중 1. 엔데믹 시대로 전환됨에 따라 새로운 백신개발에 대한 긴급성이 떨어진 점 2. 새로운 백신 개발에 대한 시장의 니즈가 낮아졌다는 점 3. 방어효능을 보기 위한 임상 3상 진행 시 위약을 접종 받아야 하는 임상 참여군에 대한 윤리성 문제가 있다는 점을 들어 GX-19N의 사업성이 낮다고 판단하였습니다. 따라서, 2021년 승인받은 인도네시아 2/3상 시험철회를 신청하였으며, 아르헨티나 허가 당국에 신청한 부스터 백신 임상시험 또한 신청을 철회하기로 결정하였습니다. 해당 품목의 임상 철회 공시 상세 내역은 아래와 같습니다.
| [당사의 투자판단 관련 주요 경영사항 공시(2022.03.11)] |
| 1. 제목 | COVID-19 예방 DNA 백신 GX-19N의 2/3상 임상시험 자진 철회 결정 | |
| 2. 주요내용 | ※ 투자유의사항 - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험, 품목허가 과정에서 기대에 상응하지 못하는 결과가 발생할 수 있으며, 상업화 계획을 변경하거나 포기할 수 있는 가능성이 상존합니다. - 투자자는 위 사항과 사업보고서를 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. 1. 임상시험 제목 - 건강한 성인을 대상으로 COVID-19 예방 DNA 백신 GX-19N의 유효성, 안정성 및 면역원성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약대조, 제2/3상 임상시험 2. 임상시험 단계 - 제 2/3상 3. 대상질환(정응증) - 코로나바이러스감염증-19(COVID-19)의 예방 4. 임상 철회 결정 사유 - 인도네시아의 1차백신 및 부스터 접종이 전 국민 대상으로 빠르게 확산됨에 따라 임상시험의 환경이 변화됨. 즉 부스터샷까지 정부지원으로 신속히 맞을 수 있도록 수급상황이 호전됨. - 이에 위약군을 포함하는 임상시험 대상자 모집과 운영이 어렵고 윤리적 이슈가 제기될 수 있어 기 승인받은 미 접종자 대상 임상계획 승인 및 기접종자 대상 부스터 임상계획 변경신청 모두 자진 철회. |
|
| 3. 사실발생(확인)일 | 2022-03-11 | |
| 4. 결정일 | 2022-03-11 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 상기 '3. 사실발생(확인)일은 인도네시아 공동개발사(PT Kalbe Farma)에 제넥신의 철회계획을 통지한 날입니다. | ||
| ※ 관련공시 | 2021-07-07 투자판단 관련 주요경영사항(COVID-19 예방 DNA 백신 GX-19N 의 2/3상 임상시험 계획 인도네시아 식약처 승인) 2021-08-30 투자판단 관련 주요경영사항(COVID-19 예방 DNA 백신 GX-19N 의 2/3상 임상시험 계획 변경 신청) |
|
| 출처: 당사 공시내역, 투자판단 주요 경영사항(2022.03.11) |
GX-19N 품목의 구체적인 연구 중단 현황은 다음과 같습니다.
| [GX-19N 품목 중단 현황] |
| 구 분 | 품 목 | 적응증 | 연구 시작일 |
최종 진행단계 | 연구 중단일 |
중단 사유 | 재개 계획 | ||
|---|---|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||||
| 바이오 | 신약 | GX-19N | COVID-19 | 2020년 | 임상1/2a상(한국) | 2020년 | 2022.03 | 개발환경의 변화* | 없음 |
| 2021년 | 임상2/3상(인도네시아) | 2021년 | |||||||
| 출처: 당사 정기보고서 |
상기 공시는 2022년 03월 11일 장마감 이후 공시되었으며, 해당 공시 다음날 주가는 전일 종가 대비 11.52% 하락하는 등 주가는 2022년 03월 11일을 고점으로 이전 수준의 값을 회복하지 못하고 있습니다. GX-19N 중단 공시 이후 최초 증권신고서 제출일 전일 현재까지 당사의 주가 추이는 다음과 같습니다.
| [GX-19N 중단 공시 이후 당사 주가 추이] |
 |
|
GX-19N 중단 공시 이후 당사 주가 추이 |
| 출처: KRX 정보데이터시스템 |
이와같이, 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준에 불과합니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다.
특히 임상의 진행 중 경과가 당사 기업가치와 주가에 중요한 영향을 끼치고 있기에 투자자께서는 이점 유의하시기 바랍니다.
|
자. 정부 연구개발 과제 수행 관련 위험 당사는 설립 이래 총 71건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하였으며, 현재 진행중인 정부 과제에 대해서도 특이사항 없이 진행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔으며, 기술실시 권리를 가진 기술소유권자로서 해당 기술의 사업화를 위해 노력해왔습니다. 따라서 당사는 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
|
당사는 설립 이래 총 71건의 정부과제를 주관기관 또는 참여기업으로서 성공적으로 수행하여 총 670억원의 정부보조금을 수령하였으며, 현재 진행중인 정부 과제에 대해서도 특이사항 없이 진행 중에 있습니다. 당사는 이와 같은 정부과제의 성공적인 수행 및 진행을 통해 당사 연구개발에 필요한 자금 중 상당 부분을 충당하여 왔습니다. 또한, 지속적이고 책임감있는 연구개발을 위해 협약된 사업의 종료 후 정부납부기술료를 납부해 기술실시 권리를 온전히 확보하고 있으며, 기술소유권자로서 해당 기술의 사업화를 위해 적극적으로 노력해왔습니다. 현재 진행중인 정부과제 또한, 협약 종료 후 제품화 및 기술이전 등 관련 매출의 발생 시 일정금액의 정부납부기술료를 제외한 금액이 당사의 매출로 연결되는 만큼 향후에도 사업과 관련된 정부 출연 연구개발 과제에 적극적으로 지원할 예정입니다.
| [설립 이후 당사가 수행한 정부 연구개발과제 현황] |
| (단위: 천원) |
| 순번 | 계약상대방 | 계약일 | 계약명칭 | 계약기간 | 정부보조금 | 성과 |
|---|---|---|---|---|---|---|
| 1 | 과학기술정보통신부 | 2002.07.01 | EU AIDS 백신들과 국내 개발 AIDS 백신의 효능비교 | 2002.07.01-2004.06.30 | - | 참여기업 |
| 2 | 과학기술정보통신부 | 2003.06.23 | 효과적인 AIDS 후보백신 개발 | 2003.06.23-2005.03.31 | - | 참여기업 |
| 3 | 보건복지부 | 2004.05.01 | B형 간염 치료백신의 면역원성 및 면역치료 메커니즘 규명 | 2004.05.01-2009.03.31 | - | 참여기업 |
| 4 | 과학기술정보통신부 | 2005.07.31 | 자궁경부암에 대한 재조합 아데노바이러스 항암치료제 개발 | 2005.07.31-2006.07.30 | 25,000 | |
| 5 | 산업통상자원부 | 2005.12.01 | 항암 치료 백신 GX-123의 최적화 기술 개발 | 2005.12.01-2007.11.30 | 303,080 | |
| 6 | 과학기술정보통신부 | 2006.04.01 | 성체줄기세포 특이적인 Biomarker 발굴 | 2006.04.01-2008.03.31 | 280,000 | |
| 7 | 산업통상자원부 | 2006.04.01 | 수지상 세포를 이용한AIDS 면역치료제의 개발 | 2006.04.01-2008.03.31 | 800,000 | |
| 8 | 보건복지부 | 2006.04.01 | HIV-1 치료 DNA 백신(GX-12)의 제1상 임상평가 | 2006.04.01-2008.03.31 | 100,000 | |
| 9 | 과학기술정보통신부 | 2006.07.01 | 면역세포특이적인 발현단백질 | 2006.07.01-2009.06.30 | - | 참여기업 |
| 10 | 산업통상자원부 | 2006.11.01 | IL-23 길항제를 이용한 자가면역 질환치료 융합단백질 개발 | 2006.11.01-2012.04.30 | 994,100 | 성실수행 |
| 11 | 중소기업청 | 2007.05.01 | 피부암 면역 치료제 GX-51 개발을 위한 전임상 연구 | 2007.05.01-2009.04.30 | 278,000 | |
| 12 | 바이오벤처협회 | 2008.01.01 | B형간염 치료 DNA 백신 GX-110E의 반복독성 연구 | 2008.01.01-2008.11.30 | 70,000 | |
| 13 | 식품의약품안전처 | 2008.03.13 | 소동물 및 영장류에서 수지상세포를 이용한 ex vivo 유전자치료제의 유효성 및 안전성 평가에 관한 연구 | 2008.03.13-2009.11.30 | 240,000 | |
| 14 | 과학기술정보통신부 | 2008.04.01 | 에이즈 및 결핵유전자치료기술 개발 | 2008.04.01-2014.03.31 | 441,000 | |
| 15 | 보건복지부 | 2008.05.01 | EPO-hFc의 생산세포주 및 단백질 특성 분석 연구 | 2008.05.01-2010.12.31 | 287,500 | |
| 16 | 산업통상자원부 | 2008.12.01 | 단백질공학기술기반 약효지속성 단백질신약 개발 | 2008.12.01-2014.03.31 | 1,168,000 | |
| 17 | 보건복지부 | 2009.05.01 | 지속형 만성 감염증 단백질 치료제 연구 | 2009.05.01-2012.03.31 | 336,000 | 성실실패 |
| 18 | 과학기술정보통신부 | 2009.05.01 | 지속형 항체융합단백질 치료제 개발을 위한 기반기술 구축 및 관련 인력 양성 | 2009.05.01-2012.04.30 | 97,500 | |
| 19 | 보건복지부 | 2009.05.01 | GX-051의 임상시험 및 제품화 사업 | 2009.05.01-2015.03.31 | 2,040,976 | |
| 20 | 중소기업청 | 2009.06.01 | 신규 hybrid Fc단백질 특성 분석 및 시험 공정의 표준화 | 2009.06.01-2011.05.31 | 238,000 | |
| 21 | 산업통상자원부 | 2009.07.01 | Super-biosimilar 제품개발 | 2009.07.01-2010.06.30 | 500,000 | |
| 22 | 과학기술정보통신부 | 2009.07.10 | 단백질/펩타이드 치료제 맞춤형 hybrid Fc 기술개발 | 2009.07.10-2012.06.30 | 1,320,000 | |
| 23 | 과학기술정보통신부 | 2009.07.31 | 자궁경부암 치료 DNA 백신 개발 | 2009.07.31-2012.07.30 | 1,093,000 | |
| 24 | 보건복지부 | 2009.12.01 | 면역질환 융합 연구 사업단 (IDO조절을 이용한 골수이식 후 면역관용 유도법 개발) | 2009.12.01-2011.11.30 | - | 참여기업 |
| 25 | 보건복지부 | 2009.12.01 | 면역질환 융합 연구 사업단 (항체융합 인터페론-베타를 이용한 다발성경화증 치료제 개발) | 2009.12.01-2015.11.30 | 365,000 | |
| 26 | 산업통상자원부 | 2010.04.01 | 면역치료내성 극복형 항암 핵산치료제 개발 | 2010.04.01-2015.03.31 | 1,148,000 | |
| 27 | 보건복지부 | 2010.12.01 | 면역질환 융합 연구 사업단 (점막 면역 조절을 통한 염증성 장질환(IBD) 치료제 개발) | 2010.12.01-2014.11.30 | 460,000 | |
| 28 | 범부처신약개발사업단 | 2010.12.15 | 글로벌 개량생물의약품(bio-better) 개발을 위한 기획 | 2010.12.15-2011.07.14 | 70,000 | |
| 29 | 범부처신약개발사업단 | 2012.02.01 | 차세대 인성장호르몬의 글로벌 비임상 완료 및 1상 승인 | 2012.02.01-2013.09.30 | 2,078,666 | |
| 30 | 농림수산검역본부 | 2012.04.02 | 감별 마커백신 적용 가능한 단백질 검색 및 감별진단법 확립 | 2012.04.02-2013.11.30 | 119,000 | |
| 31 | 과학기술정보통신부 | 2012.10.01 | 유전자 변형 중간엽줄기세포 치료제 개발 | 2012.10.01-2017.09.30 | 624,000 | |
| 32 | 보건복지부 | 2012.12.01 | 자궁경부전암 DNA 치료백신 GX-188E의 임상1상 완료 및 임상2상 승인 | 2012.12.01-2014.10.31 | 786,000 | |
| 33 | 보건복지부 | 2012.12.01 | 하이루킨07의 국외 임상 승인 | 2012.12.01-2015.08.31 | 916,000 | |
| 34 | 보건복지부 | 2012.12.26 | 엔지니어링 줄기세포 기반 재발암 치료제의 허가용 비임상 연구 | 2012.12.26-2015.11.25 | 958,000 | |
| 35 | 식품의약품안전처 | 2013.02.01 | 유전자치료제 순도 분석 시험법 확립에 관한 연구 | 2013.02.01-2014.11.30 | 160,000 | |
| 36 | 보건복지부 | 2013.06.01 | hyJapan | 2013.06.01-2013.11.30 | 35,000 | |
| 37 | 과학기술정보통신부 | 2013.06.01 | 점막 면역 유도에 관한 IL-7-Fc의 역할 | 2013.06.01-2016.05.31 | 122,850 | |
| 38 | 보건복지부 | 2013.06.24 | (비임상) 지속형 혈우병 치료제 개발 | 2013.06.24-2016.06.23 | 1,046,000 | 불성실 |
| 39 | 범부처신약개발사업단 | 2013.11.01 | 차세대 인성장 호르몬 제제의 글로벌 임상 1상 수행 및 종료 | 2013.11.01-2014.08.31 | 842,105 | |
| 40 | 생명공학연구원 | 2013.11.15 | 해독제용 다중발현벡터 연구 | 2013.11.15-2018.12.15 | 211,772 | |
| 41 | 보건복지부 | 2014.06.01 | (비임상) 차세대 당뇨병 치료제의 글로벌 비임상 완료 및 1상 승인 | 2014.06.01-2016.05.31 | 1,385,000 | |
| 42 | 보건복지부 | 2014.06.01 | (임상2상) 지속형 빈혈치료제 GX-E2(EPO-hyFc)의 임상 2상 연구 | 2014.06.01-2018.05.31 | 2,800,000 | |
| 43 | 과학기술정보통신부 | 2014.09.01 | 펩타이드 호르몬을 표적으로 하는 염증성 장질환 치료제 바이오신약 후보물질 개발 | 2014.09.01-2017.03.31 | 680,000 | |
| 44 | 보건복지부 | 2014.10.01 | 글로벌 의료수요 해결을 위한 전략적 기술통합의 개방형 연구 비즈니스 플랫폼 구축 (GX-147E) | 2014.10.01-2017.01.31 | 30,000 | |
| 45 | 농촌진흥청 | 2015.01.15 | 인진쑥 추출물과 재조합 올리고 펩타이드 혼합제형의 미백향상과 주름 개선용 화장품 개발 | 2015.01.15-2017.12.31 | 227,000 | |
| 46 | 산업통상자원부 | 2015.06.01 | 단백질을 이용한 난치성 건선 치료제 개발 | 2015.06.01-2021.04.30 | 2,480,000 | |
| 47 | 범부처신약개발사업단 | 2015.07.01 | 차세대 인성장호르몬 제제(GX-H9)의 성인(AGHD)과 소아(PGHD) 성장 호르몬 결핍 환자 대상 글로벌 임상 2상 승인 | 2015.07.01-2017.06.30 | 1,201,735 | |
| 48 | 보건복지부, 과학기술정보통신부 공동 | 2015.11.01 | 바이러스 감염 질환에 대한 DNA 기반 유전자치료제의 글로벌 임상시험 및 후속 파이프라인 구축 | 2015.11.01-2018.07.31 | 6,545,000 | |
| 49 | 보건복지부 | 2015.12.10 | (위탁) 전임상 연구를 위한 sPD-L1 Fc 단백질 생산 및 특성 분석 | 2015.12.10-2020.11.30 | 170,000 | 위탁 |
| 50 | 범부처신약개발사업단 | 2015.12.16 | 차세대 인성장호르몬 제제 (GX-H9)의 소아 성장호르몬 결핍 환자 (PGHD) 대상 글로벌 임상 2상 승인 및 수행, 글로벌 라이센스 아웃 | 2015.12.16-2018.12.15 | 3,522,544 | |
| 51 | 보건복지부 | 2016.04.01 | 3세대 지속형 G-CSF-hyFc에 대한 중국 임상 1상 승인 | 2016.04.01-2018.12.31 | 837,000 | |
| 52 | 보건복지부 | 2016.04.01 | (비임상) 펩타이드 호르몬을 표적으로 하는 차세대 단장증후군 치료제의 비임상 시험 완료 및 글로벌 1상 IND 승인 | 2016.04.01-2018.12.31 | 1,225,000 | |
| 53 | 보건복지부 | 2016.09.07 | (임상1상)신규 바이오의약품 (IL-7-hyFc)의 국내 1상 개발 | 2016.09.07-2018.05.31 | 1,225,000 | |
| 54 | 산업통상자원부 | 2016.10.01 | 만성 HPV 감염에 대한 신규 점막 면역 치료제, IL-7-hyFc의 개발 | 2016.10.01-2018.07.31 | 650,000 | 성실수행 |
| 55 | 산업통상자원부 | 2016.10.01 | 면역항암제 치료반응 유전체-임상정보 통합 DB기반 사업화 모델 개발 | 2016.10.01-2021.02.28 | 274,000 | |
| 56 | 과학기술정보통신부 | 2017.04.01 | 항암면역치료를 위한 Bispecific HyFc 융합단백질 개발 | 2017.04.01-2022.03.31 | 963,040 | |
| 57 | 보건복지부 | 2017.04.10 | (임상1상) 차세대 월2회 당뇨병 치료제의 임상 1상 완료(독일) 및 임상 2상 승인 | 2017.04.10-2019.12.31 | 2,090,000 | |
| 58 | 보건복지부 | 2017.04.10 | 대사성 간질환 치료 후보물질군 생산, 특성분석 및 최적화 | 2017.04.10-2019.12.31 | 247,500 | |
| 59 | 보건복지부 | 2017.05.31 | 차세대 독감 점막 면역백신 개발 | 2017.05.31-2018.12.31 | 860,000 | |
| 60 | 보건복지부 | 2017.12.01 | 간이식 장기 생존율 향상을 위한 PD-L1 기반 면역억제제의 전임상연구 | 2017.12.01-2020.11.30 | - | 참여기업 |
| 61 | 질병관리본부 | 2018.02.20 | 결핵 예방을 위한 DNA 백신후보주 발굴 | 2018.02.20-2020.12.31 | 600,000 | |
| 62 | 과학기술정보통신부 | 2018.04.01 | 중증 건선의 고위험 분자표적 선택적 피라졸리넌 옥심계 화합물의 치료효능 검증 | 2018.04.01-2019.12.31 | - | 참여기업 |
| 63 | 보건복지부 | 2018.04.30 | 다중물질 표적 기반기술을 이용한 차세대 바이오 항암면역치료제 후보물질 도출 | 2018.04.30-2019.12.31 | 833,000 | |
| 64 | 국가항암신약개발사업단 | 2018.06.29 | GX-188E(HPV의 E6/E7 항원특이적 살상세포 유도성 면역치료 DNA백신) 공동개발 | 2018.06.29-2022.12.31 | 6,324,500 | |
| 65 | 범부처신약개발사업단 | 2018.07.01 | T세포의 증식 및 활성 유도 신약후보와 Pembrolizumab의 병용투여 임상 연구 | 2018.07.01-2020.06.30 | 2,000,000 | |
| 66 | 보건복지부 | 2019.04.19 | 개인 맞춤형 DNA 백신 생산 시스템 구축 | 2019.04.19-2021.12.31 | 150,000 | |
| 67 | 범부처신약개발사업단 | 2020.09.15 | 코로나19 DNA 백신 GX-19N의 임상 1/2a상 개발 및 임상 2b/3상 승인 | 2020.09.15-2021.09.14 | 7,335,797 | |
| 68 | 식품의약품안전처 | 2020.09.20 | 코로나19 바이러스 백신의 품질관리를 위한 표준품의 개발 및 확립 연구 | 2020.09.20-2021.09.19 | 120,000 | |
| 69 | 과학기술정보통신부 | 2021.01.01 | 코로나바이러스감염증-19 치료용 항체의약품의 공정개발 및 비임상 시료생산 | 2021.01.01-2021.12-31 | 345,000 | |
| 70 | 보건복지부 | 2021.01.21 | 차세대 신규 다항원성 결핵 DNA 백신의 유효성 평가 및 비임상 연구 | 2021.01.21-2022.12.31 | 1,120,700 | |
| 71 | 과학기술정보통신부 | 2021.03.01 | 국제협력연구를 통한 코로나 19 치료제·백신 개발 | 2021.03.01-2021.12.31 | 200,000 |
|
주1) 과제 최종평가 결과 정의: 성실수행: 과제최종 평가결과 성실하게 수행하였으나 계획된 최종 개발 목표를 약간 미달성한 경우나 수행결과의 사업화 가능성이 약간 낮은경우 성실실패: 과제최종 평가결과 성실하게 수행하였으나 계획된 최종 개발 목표를 미달성한 경우나 수행결과의 사업화 가능성이 낮은경우 불성실수행: 과제최종 평가결과 최종 개발 목표 달성 정도가 매우 낮은경우, 수행결과의 사업화 가능성이 매우 낮은 경우 (신규과제 선정시 감점등의 제재가 있음) |
당사는 정부 차원에서 신약 연구개발의 중요성을 감안하여, 다양한 정부과제를 통해 연구개발비 지원을 지속적으로 확대하고 있으므로, 당사는 이에 적극적으로 참여함으로써 향후 신규 사업의 추진에 있어서 객관적인 평가와 공신력을 획득하고 정부의 연구개발 진도 관리에 따라 과제의 성공가능성을 높일 계획입니다.
하지만 향후 당사의 신약개발 파이프라인에 대한 국책과제 추가 선정의 불확실성, 현재 진행중인 과제의 실패에 따른 과제 참여의 제한, 정부의 정책 변화에 따른 국고보조금의 감소 등은 지속적으로 자금이 투입되어야 하는 당사의 연구개발활동에 부정적인 영향을 미칠 수 있습니다. 특히, 현행 제도 상 정부 출연 연구개발 과제는 최종 목표달성에 실패하더라도 성실 수행을 입증할 수 있는 경우에는 제제 조치를 면제 받을 수 있으나, 불성실 수행으로 연구개발의 결과가 극히 불량하여 최종 평가 시 실패 과제로 결정된 경우에는 정부로부터 받은 지원금의 전부 혹은 일부의 환수 또는 향후 정부출연과제 참여 제한의 제제 조치가 가해질 수 있음을 투자판단에 참고하시기 바랍니다.
| 차. 분쟁에 따른 우발채무 등에 관한 위험 당사는 본 공시서류 제출일 전일 현재 2건의 소송을 진행중에 있습니다. 먼저, 당사는 마곡산업단지 토지 취득과 관련하여 서울주택도시공사로부터 1,451,653천원의 기부채납 이행 요청을 받았으나 이에 불복하여 2022년 08월 26일 행정소송을 제기하였습니다. 또한, 기발행 전환사채 50억원에 대한 담보로 채무자 (주)코스온으로부터 근저당 설정을 받은 (주)코스아띠끄 건물에 대해 (주)코스아띠끄의 채권자로부터 사해행위 취소 청구 소송이 제기되어 법무법인을 수임하여 소송 대응하고 있습니다. 추가적인 소송이나 분쟁, 예상치 못한 법률적 리스크가 발생할 경우 당사의 영업 및 재무구조에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하시고 투자에 임하시길 바랍니다. |
당사는 본 공시서류 제출일 전일 현재 2건의 소송을 진행중에 있습니다. 먼저, 당사는 마곡산업단지 토지 취득과 관련하여 서울주택도시공사로부터 1,451,653천원의 기부채납 이행 요청을 받았으나 이에 불복하여 2022년 08월 26일 행정소송을 제기하였습니다. 또한, 기발행 전환사채 50억원에 대한 담보로 채무자 (주)코스온으로부터 근저당 설정을 받은 (주)코스아띠끄 건물에 대해 (주)코스아띠끄의 채권자로부터 사해행위 취소 청구 소송이 제기되어 법무법인을 수임하여 소송 대응하고 있습니다.
법률 분쟁은 통상적으로 장기간에 걸쳐 진행되며, 사안에 따라 매우 큰 규모의 분쟁이 될 경우 큰 규모의 소송비용이 발생할 수 있습니다. 당사는 법률위반으로 인한 리스크를 회피하고자 지속적으로 회사의 영업활동에 관련된 법률검토 및 법률자문을 받고 있으며 담당 임직원에 대한 법률적 내부통제에 힘쓰고 있습니다. 다만, 추가적인 소송이나 분쟁, 예상치 못한 법률적 리스크가 발생할 경우 당사의 영업 및 재무구조에 부정적인 영향을 미칠 수 있으므로 투자자께서는 이 점 유의하시고 투자에 임하시길 바랍니다.
| 카. 매출채권미회수 및 기타유동자산 손상 관련 위험 당사 평균 매출채권회전율은 2019년 5.37회, 2020년 7.04회로 평균 6.00회 수준으로 유지되었으며, 2021년의 경우 매출액이 직전년도 말 대비 약 98.6% 증가한 반면 매출채권 잔액은 같은 기간 약 62.3% 감소하며 매출채권회전율이 19.53%로 상승한 모습을 보였습니다. 2022년 3분기의 경우 KG-Bio에 대한 GX-E4 라이센스 아웃 매출이 전액 매출채권으로 잡히면서 매출채권회전율이 3.40회로 하락하였습니다. 당사는 매출채권 부실 방지를 위해 지속적인 추심 절차를 지속하고 있으며, 현재 주요 매출채권에 대해 특별한 부실 징후가 없는 상황이나, 향후 당사 매출채권 관련 충당금 정책에 따라 보유 중인 주요 매출채권의 연령이 1년을 초과할 경우 대손충당금 적립으로 인해 당사 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 이점 유의하시기 바랍니다. 당사의 연구자재 세부 내역을 살펴보면, 2022년 3분기 기준 전체 연구자재 14,348백만원 중 GX-19N(코로나-19 예방 DNA 백신)을 위해 구매한 연구자재가 8,425백만원 규모로 58.72% 비중을 차지하고 있습니다. 당사의 파이프라인이였던 GX-19N의 경우 2022년 03월 11일 ' COVID-19 예방 DNA 백신 GX-19N의 2/3상 임상시험 자진 철회 결정' 공시를 통해 현재 임상시험을 중단한 상태이며, 추후 해당 파이프라인 관련 재개 계획은 없는 상태입니다. 하지만 연구자재에 범용성이 있어 당사 내부 과제의 연구목적. CMO 등 협력회사의 생산품 제조 등에도 사용 가능하므로 자재별로 자체 사용 계획을 수립하고 있으며 연구자재가 필요한 동종업계에 재매각 등을 통해서도 GX-19N(코로나-19 예방 DNA 백신)을 위해 구매한 연구자재를 소진하고 있습니다.다만, 해당 연구자재에 대한 재매각 절차 과정 중에 과도하게 할인된 수준에서 재매각이 발생하거나, 자체 사용 및 재매각 계획 지연에 따른 진부화로 해당 연구자재에 대한 손상이 발생할 경우 당사 손익에 부정적으로 작용할 수 있으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다. |
[매출채권 미회수 관련 위험]
당사는 매출채권에 대해서 연령이 1년을 초과할 경우 해당 연체 매출채권 전액을 충당금으로 설정하고 있습니다. 당사의 최근 3개년 및 2022년 3분기 매출채권 내역을 살펴보면, 자산 총계 대비 1% 내외의 비중을 유지하고 있습니다. 연결기준 매출채권은 2019년 2,526백만원, 2020년 2,739백만원, 2021년 1,032백만원, 2022년 3분기9,810백만원을 기록했습니다. 2019년과 2020년은 20억원대의 유사한 수준의 매출채권 잔액을 기록하였으나, 2021년의 경우 연령 1년 초과 매출채권에 대한 대손충당금 적립으로 매출채권 잔액이 10억대로 감소하였습니다. 2022년 3분기의 경우 2022년 3월 KG-Bio에 GX-E4 라이센스 아웃을 완료한 것에 대한 Upfront 수수료 매출발생으로 외화외상매출금이 증가함에 따라 6개월 이하 매출채권이 전년말대비 약 88억원 증가하였습니다.
당사 평균 매출채권회전율은 2019년 5.37회, 2020년 7.04회로 평균 6.00회 수준으로 유지되었으며, 2021년의 경우 매출액이 직전년도 말 대비 약 98.6% 증가한 반면 매출채권 잔액은 같은 기간 약 62.3% 감소하며 매출채권회전율이 19.53%로 상승한 모습을 보였습니다. 2022년 3분기의 경우 KG-Bio에 대한 GX-E4 라이센스 아웃 매출이 전액 매출채권으로 잡히면서 매출채권회전율이 3.40회로 하락하였습니다. 당사는 매출채권 부실 방지를 위해 지속적인 추심 절차를 지속하고 있으며, 현재 주요 매출채권에 대해 특별한 부실 징후가 없는 상황이나, 향후 당사 매출채권 관련 충당금 정책에 따라 보유 중인 주요 매출채권의 연령이 1년을 초과할 경우 대손충당금 적립으로 인해 당사 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 이점 유의하시기 바랍니다.
| [당사 연결기준 매출채권 연령분석 및 추이] |
| (단위 : 천원) |
| 구분 | 2022년 3분기 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 정상채권 | 31,923 | 1,032,108 | 2,739,286 | 2,526,881 |
| 0~3개월 | - | - | - | - |
| 3~6개월 | 9,759,676 | - | - | - |
| 6개월 초과 | 1,134,429 | 1,079,800 | 794,525 | 805,525 |
| 1년 초과 매출채권에 대한 대손충당금 | (1,116,125) | (1,079,800) | (794,525) | (805,525) |
| 매출채권 계 | 9,809,903 | 1,032,108 | 2,739,286 | 2,526,881 |
| 자산총계 | 444,669,903 | 636,864,823 | 596,907,821 | 358,176,683 |
| 자산총계 대비 매출채권(장부금액) 비중 | 2.21% | 0.16% | 0.46% | 0.71% |
| 매출액 | 13,830,899 | 36,828,455 | 18,543,495 | 11,303,045 |
| 평균 매출채권회전율(회) | 3.40 | 19.53 | 7.04 | 5.37 |
| 주1) 매출채권회전율 = 연환산 매출액÷{(전기매출채권+당기매출채권)÷2}] |
| 주2)2022년 3분기 평균 매출채권회전율(회)는 매출액을 단순 연환산하여 산정하였습니다. |
| 출처: 당사 정기보고서 |
| [KG-Bio 관련 외화외상매출금 상세] |
| (단위 : 원) |
| 세부계정 | 거래처 | 금액 | 비고 |
|---|---|---|---|
| 외화외상매출금 | KG-Bio | 8,791,720,000 | GX-E4 L/O Upfront |
| 출처: 당사 제공 |
[기타유동자산 손상 관련 위험]
당사의 최근 3개년간 기타유동자산은 2019년 8,829만원, 2020년 4,800만원, 2021년 13,419만원 규모이며, 2022년 3분기 기준으로는 19,858만원을 기록하였습니다. 2021년과 2022년 3분기 기타유동자산 규모가 2020년 및 2019년 대비 크게 증가한 이유는 2020년까지 매입시점에 연구개발비로 비용처리 했던 원재료 매입비용을 실제 원재료 사용시점에 비용처리하는 방식으로 회계처리를 변경함에 따라 미사용 원재료를 기타유동자산 내 연구자재 항목으로 분류하였기 때문입니다. 당사 기타유동자산 중 연구자재가 차지하는 비중은 2021년 53.41%, 2022년 3분기 72.25% 수준입니다.
다음은 당사 기타유동자산 세부내역입니다.
| [당사 기타유동자산 내역] |
| (단위 : 백만원) |
| 구 분 | 2022년 3분기 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|
| 선급금 | 2,025 | 3,248 | 2,658 | 720 |
| 선급비용 | 92 | 109 | 13 | 10 |
| 선급용역원가 | 2,178 | 591 | 715 | 7,162 |
| 미청구공사 | 500 | 3 | - | - |
| 부가세대급금 | 715 | 2,301 | 1,414 | 936 |
| 연구자재(A) | 14,348 | 7,167 | - | - |
| 합 계(B) | 19,858 | 13,419 | 4,800 | 8,829 |
| 연구자재 비중(C=A/B) (%) | 72.25 | 53.41% | - | - |
| 출처: 당사 정기보고서 |
당사의 연구자재 세부 내역을 살펴보면, 2022년 3분기 기준 전체 연구자재 14,348백만원 중 GX-19N(코로나-19 예방 DNA 백신)을 위해 구매한 연구자재가 8,425백만원 규모로 58.72% 비중을 차지하고 있습니다. 당사의 파이프라인이였던 GX-19N의 경우 2022년 03월 11일 ' COVID-19 예방 DNA 백신 GX-19N의 2/3상 임상시험 자진 철회 결정' 공시를 통해 현재 임상시험을 중단한 상태이며, 추후 해당 파이프라인 관련 재개 계획은 없는 상태입니다. 하지만 연구자재에 범용성이 있어 당사 내부 과제의 연구목적. CMO 등 협력회사의 생산품 제조 등에도 사용 가능하므로 자재별로 자체 사용 계획을 수립하고 있으며 연구자재가 필요한 동종업계에 재매각 등을 통해서도 GX-19N(코로나-19 예방 DNA 백신)을 위해 구매한 연구자재를 소진하고 있습니다. 다만, 해당 연구자재에 대한 재매각 절차 과정 중에 과도하게 할인된 수준에서 재매각이 발생하거나, 자체 사용 및 재매각 계획 지연에 따른 진부화로 해당 연구자재에 대한 손상이 발생할 경우 당사 손익에 부정적으로 작용할 수 있으니 투자자께서는 투자판단시 이점 유의하시기 바랍니다.
다음은 당사 연구자재 관련 2022년 3분기 기준 세부내역 및 GX-19N 연구개발 중단관련 공시내용 입니다.
| [연구자재 관련 세부 내역 |
| (단위 : 백만원) |
| 세부계정 | 관리항목 | 금액 |
|---|---|---|
| 연구자재 | GX-19N 목적 구매 연구자재 | 8,425 |
| 기타 | 5,923 | |
| 합계 | 14,348 | |
| 출처: 당사 제공 |
| [연구개발활동 및 판매중단 현황] |
| 구 분 | 품 목 | 적응증 | 연구 시작일 |
최종 진행단계 | 연구 중단일 |
중단 사유 | 재개 계획 | ||
|---|---|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||||
| 바이오 | 신약 | GX-19N | COVID-19 | 2020년 | 임상1/2a상(한국) | 2020년 | 2022.03 | 개발환경의 변화* | 없음 |
| 2021년 | 임상2/3상(인도네시아) | 2021년 | |||||||
| 주) 세계 백신시장 수급상황에 비추어 사업성이 낮고, 위약군에 대한 윤리적인 문제로 임상연구 중단 |
| 출처: 당사 정기공시 |
|
[투자판단 관련 주요경영사항(2022.03.11)] |
| 1. 제목 | COVID-19 예방 DNA 백신 GX-19N의 2/3상 임상시험 자진 철회 결정 | |
| 2. 주요내용 | ※ 투자유의사항 - 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험, 품목허가 과정에서 기대에 상응하지 못하는 결과가 발생할 수 있으며, 상업화 계획을 변경하거나 포기할 수 있는 가능성이 상존합니다. - 투자자는 위 사항과 사업보고서를 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. 1. 임상시험 제목 - 건강한 성인을 대상으로 COVID-19 예방 DNA 백신 GX-19N의 유효성, 안정성 및 면역원성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약대조, 제2/3상 임상시험 2. 임상시험 단계 - 제 2/3상 3. 대상질환(정응증) - 코로나바이러스감염증-19(COVID-19)의 예방 4. 임상 철회 결정 사유 - 인도네시아의 1차백신 및 부스터 접종이 전 국민 대상으로 빠르게 확산됨에 따라 임상시험의 환경이 변화됨. 즉 부스터샷까지 정부지원으로 신속히 맞을 수 있도록 수급상황이 호전됨. - 이에 위약군을 포함하는 임상시험 대상자 모집과 운영이 어렵고 윤리적 이슈가 제기될 수 있어 기 승인받은 미 접종자 대상 임상계획 승인 및 기접종자 대상 부스터 임상계획 변경신청 모두 자진 철회. |
|
| 3. 사실발생(확인)일 | 2022-03-11 | |
| 4. 결정일 | 2022-03-11 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 상기 '3. 사실발생(확인)일은 인도네시아 공동개발사(PT Kalbe Farma)에 제넥신의 철회계획을 통지한 날입니다. | ||
| ※ 관련공시 | 2021-07-07 투자판단 관련 주요경영사항(COVID-19 예방 DNA 백신 GX-19N 의 2/3상 임상시험 계획 인도네시아 식약처 승인) 2021-08-30 투자판단 관련 주요경영사항(COVID-19 예방 DNA 백신 GX-19N 의 2/3상 임상시험 계획 변경 신청) |
|
| 출처: 당사 투자판단 관련 주요경영사항 공시 |
| 타. 환율 변동에 따른 위험 당사는 바이오의약품 치료제의 글로벌 사업화 및 임상개발 과정에서 외화거래를 하고 있습니다. 해외 바이오/제약사로의 기술이전, 용역수행으로 외화매출거래가 발생하며, 해외 CRO (Contract Research Organization)에게 해외 독성시험, 임상시험 위탁, CMO (Contract Manufacturing Organization)에게 Cell Banking, 임상시료생산을 위탁함으로써 외화매입거래가 발생합니다. 당사는 외화거래에 있어 별도의 환헷지를 실행하고 있지 않아 환율의 변동이 당사의 손익에 영향을 미치는 환위험에 노출되어 있습니다. 당사는 수출에 의한 외화유입액이 원부재료의 수입 등에 의한 외화유출액보다 많으며, 외화포지션상 외화자산이 외화부채보다 많아 환율의 하락에 따른 평가손이 발생할수 있습니다. 당사는 지속적으로 환율변동을 모니터링하고 있으며, 환리스크를 최소화하기 위하여 외화거래 및 외화자산과 부채의 관리에 만전을 기하고 있습니다. 그러나 만약 예기치 못한 외환시장의 변동으로 인하여 환율이 급격히 하락할 경우 당사의 손익 및 재무구조에 악영향을 미칠 수 있으니 이 점 유의하시기 바랍니다. |
당사는 바이오의약품 치료제의 글로벌 사업화 및 임상개발 과정에서 외화거래를 하고 있습니다. 해외 바이오/제약사로의 기술이전, 용역수행으로 외화매출거래가 발생하며, 해외 CRO (Contract Research Organization)에게 해외 독성시험, 임상시험 위탁, CMO (Contract Manufacturing Organization)에게 Cell Banking, 임상시료생산을 위탁함으로써 외화매입거래가 발생합니다.
2022년 3분기말 연결기준 당사가 보유한 외화자산은 약 16,011,795천원으로 수출로 발생한 매출채권 약 9,780,203천원과 현금및현금성자산 약 5,251,960천원으로 구성되어 있으며, 외화부채는 약 186,183천원으로 전액 미지급금으로 구성되어 있습니다. 당사는 외화거래에 있어 별도의 환헷지를 실행하고 있지 않아 환율의 변동이 당사의 손익에 영향을 미치는 환위험에 노출되어 있습니다. 당사는 수출에 의한 외화유입액이 원부재료의 수입 등에 의한 외화유출액보다 많으며, 외화포지션상 외화자산이 외화부채보다 많아 환율의 하락에 따른 평가손이 발생할수 있습니다.
| [당사 연결기준 환위험에 대한 노출] |
| (외화단위: 달러, 원화 단위 : 천원) |
| 구 분 | 2022년 3분기말 | 전기말 | ||
|---|---|---|---|---|
| 외화 | 원화환산액 | 외화 | 원화환산액 | |
| 현금및현금성자산 | ||||
| USD | 3,660,412.71 | 5,251,960 | 5,563,012.37 | 6,594,951 |
| 매출채권 | ||||
| USD | 6,816,422.57 | 9,780,203 | 644,185.15 | 763,681 |
| 미수금 | ||||
| USD | 682,765.45 | 979,632 | 445,840.49 | 528,544 |
| 외화자산합계 | 16,011,795 | 7,887,176 | ||
| 미지급금 | ||||
| USD | 99,183.97 | 142,309 | 292,354.14 | 346,586 |
| EUR | 6,500.00 | 9,157 | 1,500.00 | 2,014 |
| GBP | 21,720.41 | 34,717 | 13,035.52 | 20,860 |
| 외화부채합계 | 186,183 | 369,460 | ||
당사의 환포지션을 고려할 때 환율변동이 당사의 손익에 미치는 영향은 아래와 같습니다. 각 외화에 대한 원화의 환율이 10% 상승할 경우 2022년 3분기 기준으로 약 1,582,561천원, 2021년 기준으로 약 751,771천원의 이익이 발생할 수 있습니다.
| [당사 연결기준 환율변동에 따른 손익 영향] |
| (원화단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 10% 상승시 | 10% 하락시 | 10% 상승시 | 10% 하락시 | |
| 현금및현금성자산 | 525,196 | (525,196) | 659,495 | (659,495) |
| 매출채권 | 978,020 | (978,020) | 76,368 | (76,368) |
| 미수금 | 97,963 | (97,963) | 52,854 | (52,854) |
| 미지급금 | (18,618) | 18,618 | (36,946) | 36,946 |
| 합 계 | 1,582,561 | (1,582,561) | 751,771 | (751,771) |
당사는 지속적으로 환율변동을 모니터링하고 있으며, 환리스크를 최소화하기 위하여 외화거래 및 외화자산과 부채의 관리에 만전을 기하고 있습니다. 그러나 만약 예기치 못한 외환시장의 변동으로 인하여 환율이 급격히 하락할 경우 당사의 손익 및 재무구조에 악영향을 미칠 수 있으니 이 점 유의하시기 바랍니다.
| 파. 내부회계관리제도 및 내부통제 관련 위험 당사는 코스닥 상장법인으로「주식회사 등의 외부감사에 관한 법률」(이하 '외감법')에 따라 신뢰할 수 있는 회계정보의 작성과 공시를 위해 내부회계관리규정 및 내부회계관리제도를 갖추고 있어야 합니다. 또한, 외부감사인은 당사의 내부회계관리제도 운영실태를 검토 및 감사를 진행하여야 하며, 해당 결과는 감사보고서에 표명하도록 되어 있습니다. |
당사는 코스닥 상장법인으로「주식회사 등의 외부감사에 관한 법률」(이하 '외감법')에 따라 신뢰할 수 있는 회계정보의 작성과 공시를 위해 내부회계관리규정 및 내부회계관리제도를 갖추고 있어야 합니다. 또한, 외부감사인은 당사의 내부회계관리제도 운영실태를 검토 및 감사를 진행하여야 하며, 해당 결과는 감사보고서에 표명하도록 되어 있습니다. 최근 사업연도 기준 당사 외부감사인의 내부회계관리제도 검토 의견은 아래와 같습니다.
| 내부회계관리제도 검토의견 |
| 사업연도 | 감사인 | 감사의견 및 검토 의견 | 지적사항 |
|---|---|---|---|
| 제23기 (2021년) |
대성삼경회계법인 | [감사의견] 회사의 내부회계관리제도는 2021년 12월 31일 현재 「내부회계관리제도 설계 및 운영 개념체계」에 따라 중요성의 관점에서 효과적으로 설계 및 운영되고 있습니다. | 해당사항 없음 |
| 제22기 (2020년) |
대성삼경회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 "중소기업에 대한 적용"의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제21기 (2019년) |
대성삼경회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의 운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 "중소기업에 대한 적용"의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 출처: 당사 정기보고서 |
당사는 내부회계관리 제도 구축을 완료해 2021년 02월 18일 이사회 보고를 완료하였으며, 감사위원회 지원조직 내 내부회계관리 파트장 1인이 재무활동 건전성 및 타당성 검토 지원과 내부회계관리제도 운영실태 검토지원을 진행중입니다. 당사는 현 내부회계관리제도를 철저히 운영하여 외부 감사인의 내부회계관리제도에 대한 검토의견을 받을 계획입니다.
다만, 내부회계관리를 철저히 운영함에도 불구하고 회계처리 위반, 혹은 관련 임직원의 배임 및 횡령 등 발생으로 내부회계관리가 적절하게 운영되지 않을 경우 과태료 등의 법적 제재가 부과될 수 있습니다. 과태료 부과 시 법정최고금액에 과태료 예정금액 산정표에 따른 비율을 적용하여 예정금액을 산정하고, 가증, 감경하여 최종 과태료부과금액을 결정하고 있습니다.
| [과태료 부과기준(외감규정 별표9 참조)] |
 |
|
과태료 부과기준 |
| 출처: 금융감독원 보도자료 |
특히, 이사 등 내부회계관리제도 운영 관련자가 회계정보를 내부회계관리제도에 의하지 아니하고 위조, 변조, 훼손 또는 파기한 사실이 확인되는 경우, 5년 이하의 징역 또는 5천만원 이하의 벌금이 부과될 수 있습니다.
또한, 코스닥시장 상장규정에 따라 내부회계관리제도 비적정 시 투자주의환기종목에 지정될 수 있으며(「코스닥시장 상장규정」제52조), 2년 연속 내부회계관리제도 비적정 의견을 받는 경우 상장적격성 실질심사에 따른 상장폐지 요건에 해당할 수 있습니다(「코스닥시장 상장규정」제56조).
종합적으로 당사는 내부통제를 위한 규정 및 조직을 구축하고 있으며, 우발상황 등이 발생하지 않도록 상시 모니터링을 통해 내부통제 강화를 위하여 상당한 노력을 기울이며 대비하고 있습니다. 그럼에도 불구하고, 내부회계관리조직이 적절하게 운영되지 않거나 혹은 외부감사인의 내부회계관리 운영실태를 감사한 결과 중요한 취약점이 발견될 시 각종 제재사항에 해당할 수 있습니다. 투자자 여러분께서는 공시된 당사의 내부회계관리 운영실태를 충분히 확인하시고 투자에 임해주시기 바랍니다.
| 하. 종속회사 및 계열회사 관련 위험 당사는 본 공시서류 제출일 전일 현재 1개의 종속회사((주)에스엘포젠)을 보유하고 있습니다. 종속회사의 재무상태와 손익은 당사의 연결기준 재무제표에 모두 반영되고 있으므로, 종속회사의 경영실적은 당사의 경영활동 및 연결 실적에 직접적인 영향을 미치고 있습니다. (주)에스엘포젠은 당사 연결대상 종속기업에 포함된 2020년 이후 지속적인 적자를 기록하여 당사 연결 실적에 부정적인 영향을 끼치고 있습니다. 향후 종속회사의 자산규모가 확대되고 영업실적이 본격적으로 발생할 경우, 당사 경영환경에도 더욱 중대한 영향을 미칠 수 있으며, 연결 기준 재무제표가 더 큰 폭으로 변동될 수 있습니다. 또한, 당사는 10개의 관계기업 및 공동기업 투자주식을 보유하고 있습니다.(아지노모도제넥신(주), NIT, Simnogen, KG-Bio, (주)툴젠, (주)큐로젠, Rezolute, Inc, Colmmune, Inc, ILKOGEN, KinGen Biotech, Inc.) 관계기업 및 공동기업 투자주식의 경우 지분법 회계처리를 적용받으며, 지분법이 적용되는 투자자산의 경우 해당 관계기업의 손익 및 자본변동은 당사가 보유한 지분에 비례하는 만큼 법인세비용차감전이익 및 기타포괄손익에 반영됩니다. 뿐만 아니라 투자회사의 사업악화 등에 따라 지분증권의 공정가치가 크게 하락할 경우 손상 및 감액손실이 발생할 수도 있습니다. 당사의 종속기업 및 관계기업/공동기업이 당사의 연결기준 안정성 및 수익성을 더욱 악화시키고 있으며, 향후 종속기업 및 관계기업/공동기업의 사업환경이 악화되어 경영실적이 더욱 부진해질 경우 당사의 경영실적에도 부정적인 영향을 끼칠 수 있습니다. 또한, 종속기업 및 관계기업의 경영 환경이 지속적으로 악화될 경우 당사는 해당 기업에 자금을 대여하거나 신용공여, 담보 제공 및 연대 보증 등의 방법으로 지원할 수 있으며, 해당 기업들의 안정성 및 유동성 위험이 당사에도 전이될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
2022년 3분기 기준, 당사의 종속회사 및 관계기업/공동기업은 다음과 같습니다.
| [2022년 3분기 기준 당사의 종속회사 및 관계기업/공동기업 개요] |
| 구분 | 회사명 | 상세 내용 |
|---|---|---|
| 종속기업 | ㈜에스엘포젠 | 2016년 12월 포스텍과 합작 설립한 회사이며, DNA 백신 생산에 대한 CDMO를 주요사업으로 하여 다품좀 소량생산을 통한 환자의 맞춤형 DNA 백신 생산을 위하여 설립되었으며, 21년 매출 30억원이 발생했습니다. 주요주주로는 제넥신, PT KALBE(인도네시아), POSTECH 이며, 제넥신은 현재까지 누적 106.4억를 투자하여 63.6% 지분율을 보유하여 종속기업으로 분류되어 있습니다. |
| 관계기업 | 아지노모도제넥신㈜ | 2012년 11월 일본 아지노모도社 와 합작 설립한 회사이며 제약 및 바이오 산업의 주요 원자재에 대한 제조 판매를 주요 사업으로 수행하고 있습니다. 89.3억원을 투자하여 25.0%의 지분을 보유하고 있습니다. 사업활동을 통한 매출이 2020년기말 94억원, 2021년 280억원으로 증가하였으며 당기순익 발생함에 따라 22년 배당 시행하였습니다. |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | 2014년 4월 미국내 면역학을 이용한 바이오의약품 연구/개발 및 판매를 위해 10.5억원(지분율 50.0%)의 투자를 시작으로 현재까지 누적 452.5억원(지분율 21.2%, 최대주주)의 투자를 진행하고 있습니다. GX-I7 의 임상연구 개발을 위한 다수의 투자자 유치를 통해 적극적인 임상연구개발 활동을 진행중임에 따라, 2020년 306억원, 2021년 495억원의 당기순손실 증가 추세를 보이고 있습니다. 향후 운영자금 현황에 따라 추가적인 투자가 발생할 수 있습니다. |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 2017년 5월 중국내 바이오의약품 개발 및 사업화를 위하여 총 11.0억원(지분율 49.0%)를 투자하여, Nanjing Bioscikin(51.0%)와 합작하여 설립한 회사입니다. 양사간의 시너지를 위한 다각도 논의가 진행되고 있으며, 회사의 당기순손실 금액은 2020년, 2021년1.3억원으로 아직 미미합니다. |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 2016년 3월 지속형 빈혈치료제 GX-E4의 개발 및 조기 상업화를 위해 인도네시아 제약기업 Kalbe Farma와 공동으로 바이오의약품 합작법인을 설립하고 지분 40.0%(13,200주)를 12.2억원에 취득하였습니다. 지속적인 연구개발 사업활동을 위해 추가적인 투자가 이루어졌으며 현재 총 투자금액은 386.9억원(지분 20.3%) 입니다. 2020년 5억원, 2021년 18억원의 당기순이익이 발생하였으며, 향후 자금 현황에 따라 추가적인 투자가 발생할 수 있습니다. |
| 관계기업 | (주)툴젠 | 툴젠은 1999년 설립하여 리서치용 유전자교정 제품 및 서비스를 주된 사업으로 영위하였고 지속적인 연구개발을 통해 ZFN 유전자가위, TALEN 유전자가위 개발에 이어 2012년 CRISPR 유전자가위 개발에 성공하면서 현재의 사업기반을 마련하였습니다. 현재 툴젠은 CRISPR 유전자교정 원천특허를 기반으로 특허수익화 사업 및 유전자교정 기술을 적용한 치료제, 종자 및 동물 관련 제품에 대한 연구개발을 진행하고 있습니다. 제넥신은 현재까지 현물출자와 현금납입을 통해 누적 794.8억원을 투자하여 14.2% 지분을 보유한 최대주주입니다. |
| 관계기업 | (주)큐로젠 | 큐로젠은 자가면역질환, B세포 림프종, 비알코올성 지방간염, 기능성 치료 세포주 치료제 소재 및 치료 기술 개발회사로 설립되었습니다.제넥신은 현재까지 누적 30억원을 투자하여 6.2%의 지분율을 보유하였으며, 제넥신 임원이 이사회 인원으로 기재되어 활동하고 있는 관계기업입니다. |
| 공동기업 | Rezolute, Inc | 2019년 1월 글로벌 신약개발 전략지역 미국의 교두보 확보를 위해, 미국 장외주식시장(OQCOB) 상장사인 Rezolute, Inc의 지분 27.0%(제넥신 27.0%, 한독 27.0% 공동투자)를 139.9억원에 취득하였습니다. 피투자 회사가 가진 기술력에 대한 시너지 효과와 우수한 인적자원 확보를 통해 GX-H9 등 다양한 임상연구개발에 가속화를 기대하고 있습니다. 제넥신은 현재까지 258.3억원을 투자하여 5.4% 지분율을 보유하고 있습니다. 주요제품 임상 진행에 따라 2020년 42억, 2021년 90억의 당기순손실 증가 추세를 보이고 있습니다. |
| 공동기업 | CoImmune, Inc. | 2019년 2월, 미국내 cGMP 시설을 확보하여 MCB/WCB Banking 및 R&D Pipeline 개발을 목적으로 SCM생명과학과 합작회사를 설립하였습니다. 합작회사에서 운영할 cGMP 시설의 투자를 위해 2018년 11월 파산신청을 진행한 Argos Therapeutics Inc. (Durham, NC 소재, Dendritic Cell Vaccine 연구개발 회사(462명): Dendritic Cell Vaccine 임상 3상 실패)의 설비자산을 미국 델라웨어 법원 경매를 통해 cGMP 시설 및 관련 IP를 USD 11,324,330에 취득하였으며 운영자금 USD 1,500,000 을 지분 SCM생명과학 51.0%, 제넥신 49.0%에 따라 배분 투자하였습니다. 제넥신의 현재까지 누적투자금액은 170.0억원이며 22.9% 지분율을 보유하고 있습니다. |
| 공동기업 | ILKOGEN | 2013년 12월 호중구감소증치료제 임상개발 및 사업화를 위해 터키 ILKOGEN(ILKOGEN Ilac Sanayi ve Ticaret A.S.)의 지분 50.0%를 2.6억원에 취득하였습니다. 현재까지 총 95.0억원(지분 50.0%)를 투자하고 있습니다. 2020년 0.3억원, 2021년 0.06억의 당기순손실이 발생하고 있습니다. |
| 공동기업 | KinGen Biotech, Inc | CDMO사업 목적으로 2019년 11월 설립하였으며, 태국 유일의 biologic drugs(i.e. vaccines, blood components, pDNA, viral vectors, and recombinant proteins) 생산이 가능한 설비 갖추고 있습니다. 사업이 본격화되지 않았고 설비 운영자금이 많이 소요되는 산업특성상 2020년 39억, 2021년 27억 당기순손실이 발생하고 있습니다. 제넥신의 현재까지 누적 투자금액은 23.0억원이며 약 50%의 지분율을 보유하고 있습니다. |
| 출처: 당사 제공 |
당사는 국내외에 총 1개의 종속회사(주식회사 에스엘포젠)를 보유하고 있습니다. 해당 종속회사의 재무상태와 손익은 당사의 연결기준 재무제표에 모두 반영되고 있으므로, 종속회사의 경영실적은 당사의 경영활동 및 연결 실적에 직접적인 영향을 미치고 있습니다. 당사 종속회사의 세부 현황은 다음과 같습니다.
| [2022년 3분기 기준 당사의 연결대상 종속기업 세부 현황] |
| (단위: 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 지분율(%) | 최근사업연도말 자산총액 |
지배관계 근거 |
|---|---|---|---|---|---|---|
| 주식회사 에스엘포젠 |
2016년 12월 15일 | 인천광역시 연구수 송도과학로 85, 3층 (송도동, 에스엘바이젠 산학협력관) |
CDMO 서비스 및 사업화 |
63.65 | 16,233 | 지분율 50% 초과보유 |
| 출처: 당사 정기보고서 |
주식회사 에스엘포젠은 지난 2016년 12월 15일 당사와 포스텍(포항공과대학교)가 합작해 설립하였으며, 플라스미드 DNA 기반 CDMO 사업을 영위하고 있습니다. 당사는 당사 내 단백질생산바이오연구소의 연구인력 일부 및 자산을 종속회사인 (주)에스엘포젠으로 이전하였으며, 생산업무 또한 CDMO 사업 목적의 (주)에스엘포젠으로 이전하였습니다.
2022년 3분기 기준 연결대상 종속기업의 요약 재무정보는 다음과 같습니다.
| [2022년 3분기 기준 당사의 연결대상 종속기업의 요약 재무정보] |
| (단위: 천원) |
| 기업명 | 자산 | 부채 | 매출액 | 당기순손익 | 총포괄손익 |
|---|---|---|---|---|---|
| ㈜에스엘포젠 | 16,062,962 | 3,523,585 | 3,778,755 | (1,426,066) | (1,426,066) |
| 출처: 당사 정기보고서 |
(주)에스엘포젠의 매출액은 2022년 3분기 기준 약 38억원, 당기순손실은 약 14억원을 기록하였습니다. (주)에스엘포젠은 당사 연결대상 종속기업에 포함된 2020년 이후 지속적인 적자를 기록하여 당사 연결 실적에 부정적인 영향을 끼치고 있습니다. 향후 종속회사의 자산규모가 확대되고 영업실적이 본격적으로 발생할 경우, 당사 경영환경에도 더욱 중대한 영향을 미칠 수 있으며, 연결 기준 재무제표가 더 큰 폭으로 변동될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
한편, 당사는 상기한 연결대상 종속회사 외에도 경영참여나 단순투자를 목적으로 지분을 취득하여 지분법을 적용하고 있는 기업이 존재합니다. 당사가 지분법을 적용하고 있는 관계기업 및 공동기업은 10개사로, 2022년 3분기 기준 세부 내용은 다음과 같습니다.
| [2022년 3분기말 기준 당사 관계기업 및 공동기업 현황] |
| (단위: %) |
| 구분 | 회사명 | 지분율(%) | 소재지 | 주요 영업활동 |
|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 25.00% | 대한민국 | 생물학적 제제 제조업 |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | 21.20% | 미국 | 면역학을 이용한 바이오의약품 연구/개발 및 판매 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 49.00% | 중국 | 중국, 글로벌 임상개발 및 사업화 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 20.32% | 인도네시아 | 아세안, 글로벌 임상개발 및 사업화 |
| 관계기업 | (주)툴젠(주1) | 14.24% | 대한민국 | 유전자교정 연구개발 및 유전자교정 기술 기반 치료제 개발 및 품종개량 |
| 관계기업 | (주)큐로젠(주2) | 6.16% | 대한민국 | 유전자 및 단백질을 이용한 치료제 개발 |
| 공동기업 | Rezolute, Inc(주1) | 4.96% | 미국 | 글로벌 임상개발 및 사업화 |
| 공동기업 | CoImmune, Inc. | 22.94% | 미국 | 글로벌 임상개발 및 사업화 |
| 공동기업 | ILKOGEN | 50.00% | 터키 | 글로벌 임상개발 및 사업화 |
| 공동기업 | KinGen Biotech, Inc | 50.00% | 태국 | CDMO 서비스 및 사업화 |
| 주1) 지분율이 20% 미만이나 투자약정에 의거 피투자회사에 대한 임원 선임권 등이 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업및공동기업으로 분류하였습니다. 주2) 당사 임원이 피투자회사의 사외이사를 겸직하고 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업으로 분류하였습니다. 주3) 당분기말 현재 (주)툴젠 985,721주와 NeoImmuneTech, Inc. 20,936,000주는 보호예수로 인해 매각이 제한되어 있습니다. 출처: 당사 정기보고서 |
당사의 2022년 3분기 중 관계기업투자 변동 내역은 다음과 같습니다.
| [2022년 3분기 중 관계기업투자 변동내역] |
| (단위: 천원) |
| 구분 | 회사명 | 기초 | 취득 | 처분및배당 | 지분법손익 | 지분법 자본변동등 |
처분손익 (주1) |
손상차손 | 기말 |
|---|---|---|---|---|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 10,068,062 | - | (433,751) | (1,200,379) | - | - | - | 10,834,690 |
| 관계기업 | NIT(NeoImmuneTech,Inc.) | 45,457,149 | - | - | (13,113,499) | 7,740,528 | 36,697 | - | 40,120,875 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 791,134 | - | - | 34,284 | 58,319 | - | - | 883,737 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 42,370,109 | - | - | (2,252,516) | 5,890,624 | - | - | 46,008,217 |
| 관계기업 | (주)툴젠 | 73,813,115 | - | - | (2,946,880) | 4,554 | - | - | 70,870,789 |
| 관계기업 | (주)큐로젠 | 2,963,420 | - | - | (153,971) | - | - | - | 2,809,449 |
| 공동기업 | Rezolute, Inc | 10,347,484 | - | - | (4,512,312) | 3,897,263 | (11,185) | (2,542,527) | 7,178,723 |
| 공동기업 | CoImmune, Inc | 20,093,975 | - | - | (5,687,862) | 5,557,254 | - | - | 19,963,367 |
| 공동기업 | ILKOGEN | 663,019 | - | - | (3,798) | (313,723) | - | - | 345,498 |
| 공동기업 | KinGen Biotech, Inc | - | - | - | - | - | - | - | - |
| 합 계 | 206,567,467 | - | (433,751) | (27,436,175) | 22,834,820 | 25,512 | (2,542,527) | 199,015,345 | |
| 주1) 불균등 유상증자 등으로 인한 지분율 감소 시 처분손익으로 인식한 금액입니다. |
2022년 3분기 기준 당사의 관계기업 및 공동기업 투자주식은 아지노모도제넥신(주), NIT, Simnogen, KG-Bio, (주)툴젠, (주)큐로젠, Rezolute, Inc, Colmmune, Inc, ILKOGEN, KinGen Biotech, Inc. 등 10개사 입니다.
관계기업 및 공동기업 투자주식의 경우 지분법 회계처리를 적용받으며, 지분법이 적용되는 투자자산의 경우 해당 관계기업의 손익 및 자본변동은 당사가 보유한 지분에 비례하는 만큼 법인세비용차감전이익 및 기타포괄손익에 반영됩니다. 뿐만 아니라 투자회사의 사업악화 등에 따라 지분증권의 공정가치가 크게 하락할 경우 손상 및 감액손실이 발생할 수도 있습니다.
당사는 관계기업 및 공동기업의 R&D 지속 등으로 2022년 3분기까지 약 312억원의 지분법손실을 기록하였으며, 대표적으로 NIT 131억원, Rezolute,Inc 45억원, Colmmune 57억원 등에서 지분법손실이 크게 발생하였습니다. 특히 당사의 관계회사들이 주로 영위하는 바이오의약품 개발 관련 산업은 불확실성이 높은 산업으로 바이오 시장 및 산업의 상황이 불리하게 변화하거나, 개발중인 파이프라인이 계획대로 진행되지 않을 경우 당사 지분법 손익에 반영되어 당사 재무 안정성에 부정적인 영향을 미칠 가능성이 있습니다.
상기한 바와 같이, 당사는 사업 다각화를 통해 성장을 도모하고자 당사 본원 사업과는 다른 사업을 영위하고 있는 다양한 기업의 지분 취득 또는 신규 설립 등의 방법으로 투자하고 있습니다. 그러나 당사의 종속기업 및 관계기업/공동기업이 당사의 연결기준 안정성 및 수익성을 더욱 악화시키고 있으며, 향후 종속기업 및 관계기업/공동기업의 사업환경이 악화되어 경영실적이 더욱 부진해질 경우 당사의 경영실적에도 부정적인 영향을 끼칠 수 있습니다. 또한, 종속기업 및 관계기업의 경영 환경이 지속적으로 악화될 경우 당사는 해당 기업에 자금을 대여하거나 신용공여, 담보 제공 및 연대 보증 등의 방법으로 지원할 수 있으며, 해당 기업들의 안정성 및 유동성 위험이 당사에도 전이될 수 있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
3. 기타위험
| 가. 신주의 환금성 제약 및 주가 변동에 따른 손실위험 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 존재하오니, 투자자께서는 이 점 유의하시기 바랍니다.
당사는 코스닥시장 상장법인으로서 이번 유상증자로 발행되는 신주는 코스닥시장에 상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다. 그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다.
본 유상증자의 자세한 일정은 본 신고서의 "제1부 모집 또는 매출에 관한 사항 - I. 모집 또는 매출에 관한 일반사항" 중 '1. 공모의 개요'를 참고하시기 바랍니다.
또한 코스닥시장에 추가 상장될 때까지 유상증자로 발행되는 신주의 발행가액 수준의 주가가 유지되지 않을 수 있으며, 당사의 내적인 환경변화 또는 시장전체의 환경 변화 등에 의한 급격한 주가하락이 발생할 경우, 투자원금에 대한 손실이 발생할 수 있습니다.
|
나. 증자방식, 청약절차에 대한 주의 및 주가하락 위험 |
당사의 금번 유상증자로 인하여 기발행주식 총수 25,144,982주의 23.05%에 해당하는 5,797,102주가 추가로 발행될 예정입니다.
| [당사 주가 및 유상증자에 따른 발행주식수 및 가격] |
| 모집예정 주식 종류 | 보통주 | 비 고 |
|---|---|---|
| 모집예정주식수 | 5,797,102주 | - |
| 현재 발행주식총수 | 25,144,982주 | - |
| 1차 발행가액 | 15,500원 | 증자비율 및 할인율 고려 |
| 기산일 종가 | 21,850원 | 2022.11.07 종가 |
금번 유상증자에 따른 모집가액은 (舊)「유가증권의 발행 및 공시등에 대한 규정」 제57조를 일부 준용하여 산출됩니다. 그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 증자에 따른 모집가격 산정시 결정된 1주당 모집가액보다 향후 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실이 발생할 가능성이 있습니다.
당사는 본 유상증자의 원활한 신주인수권증서 매매를 위하여 5거래일간 신주인수권증서를 상장하여 신주인수권증서를 통한 구주주 청약률을 제고할 계획입니다. 하지만 신주인수권증서의 원활한 매매 및 청약참여를 위한 노력에도 불구하고 신주인수권증서를 통한 청약이 부진하여 대규모 실권이 발생할 경우, 투자심리에 악영향을 끼쳐 일반공모청약에 부정적 영향을 끼칠 수도 있으며 향후 주가하락 가능성도 배제할 수 없습니다.
또한 금번 유상증자로 인해 추가 발행되는 주식은 보호예수되지 않는 관계로, 일시적인 물량 출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 주권의 상장일은 2023년 01월 26일로 예정되어 있습니다. 금번 유상증자에 따른 모집예정주식 5,797,102주가 향후 유가증권시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가희석화 위험이 발생할 수 있습니다.
한편, 본 유상증자는 주주배정 후 실권주 일반공모 방식으로 진행됨에 따라 일반공모를 거쳐 배정 후에도 미 청약된 잔여주식에 대하여는 대표주관회사가 자기계산으로 잔액인수하게 됩니다. 만약 본 유상증자 청약에서 대량 실권이 발생하여 대표주관회사가 실권주를 인수하게 될 경우 주가에 어떠한 영향을 미칠지는 예상하기 어렵습니다. 다만, 대표주관회사가 당사 주식 인수 후 수익을 확정하기 위해 빠른 시일 내에 인수한 주식을 장내에서 매각하게 된다면 단기적으로 당사 주가에 악영향을 미칠 수 있으며, 대표주관회사가 인수한 주식을 일정 기간 보유하더라도 동 인수 물량이 잠재 매각 물량으로 존재하여 주가 상승에 부담으로 작용할 가능성이 있습니다.
대표주관회사가 최종 실권주를 인수할 경우, 당사는 실권주 인수금액의 9.0%를 추가수수료로 지급하게 됩니다. 이를 고려할 때, 대표주관회사의 실권주 매입단가는 일반청약자들 보다 9.0% 낮은 것과 같은 결과가 초래되어 인수 물량을 단기간에 처분하게 될 소지가 높을 것으로 예상되며 일시적으로 대규모 물량이 출회하여 주가가 하락할 가능성이 있습니다. 실질적으로 유상증자 청약자 및 대표주관회사는 신주상장 2영업일 전부터 입고예정 주식의 매도가 가능합니다. 투자자 여러분께서는 이 점에 유의하시어 투자에 임하시기 바랍니다.
| 다. 주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 크게 하락할 경우 당사가 계획했던 자금조달 계획 등에 차질이 발생할 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있으니 이 점 유의하시기 바랍니다. |
금번 유상증자의 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 결정됩니다. 다만 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 25% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 25% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. (단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
일반공모 후 미청약분에 대해서는 그 전부를 대표주관회사가 인수하므로 청약 미달에 따른 위험은 없으나, 주가 하락으로 발행가액이 낮아져 당사가 목표로 하는 규모의 자금을 조달하지 못할 수도 있습니다. 이 경우, 당사의 재무안정성이 부정적인 영향을 받을 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
| 라. 공시서류 정정에 따른 일정 변경 위험 본 공시서류는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다. |
「자본시장과 금융투자업에 관한 법률」 제120조 3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 참본 공시서류 조하시기 바랍니다.
본 공시서류는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행과정에서 일정이 변경될 수도 있으므로 투자자들께서는 투자시 이러한 점을 감안하시기 바랍니다.
| 마. 분석정보의 한계 및 투자판단 관련 위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있습니다. 본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단하시기 바랍니다. |
상기 서술한 바와 같이, 당사의 주식가치는 금번 유상증자 실시에 따른 전 과정에서 다양한 영향을 받아 하락할 수 있습니다.
본 공시서류의 효력발생은 정부가 공시서류의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있습니다. 본 주식을 청약하고자 하는 투자자께서는 투자결정을 하기 전에 본 공시서류의 상기 투자위험요소 뿐만 아니라 다른 부분 또한 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없습니다. 따라서 투자자께서는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안 되며, 다양한 방면에서 신중한 검토를 병행하여 독자적으로 판단할 필요가 있습니다.
당사는 상기에 기술된 투자위험요소 외에도 불안정한 경제상황 등에 의하여 직·간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 실제 결과는 현재시점에서의 평가와는 상당히 다를 수 있는 점을 유의하시기 바랍니다.
만일 상기 투자위험요소가 실제로 발생할 경우, 당사의 사업환경과 재무상태, 기타 운영결과에 부정적인 영향을 미칠 수 있습니다. 이에 따른 주가 하락으로 투자자께서는 금번 공모 과정에서 취득하게 되는 주식의 투자금액의 일부 또는 전부를 잃을 수 있습니다.
또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 최초에 예측했던 것과 다를 수 있는 점을 유의하시기 바랍니다.
| 바. 집단 소송 제기 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있으니 이 점 유의하시기 바랍니다. |
「증권관련 집단소송법」 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
공시서류에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있음을 유의하시기 바랍니다.
| 사. 유상증자 철회에 따른 위험 유상증자 진행 과정에서 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입 전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. |
금번 주주배정 후 실권주 일반공모 유상증자 진행 과정에서 모집 절차의 진행에 중대한 영향을 미칠 만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다.
유상증자 납입 전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회 시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다.
| 아. 금융감독기관의 규제 강화에 따른 위험 최근 상장기업에 대한 관리감독기준이 강화되는 추세이며, 향후 당사가 상장기업 관리 감독기준을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지 실질심사, 상장폐지, 불성실법인 지정에 따른 벌금 및 벌점 부과 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있으니, 투자자께서는 이점 유의하시기 바랍니다. |
최근 금융감독기관 등의 상장기업에 대한 관리감독기준은 투자자보호 차원에서 엄격해지고 있는 상황이며, 회사가 관련 규정을 위반할 경우 회사 및 회사가 발행한 주식에 대해 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다.
당사는 현재 주권매매정지, 상장폐지, 관리종목 등의 사유에는 해당하지 않지만, 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및 유동성(환금성) 제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있으니 투자자들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다.
코스닥시장 관리종목 지정 및 상장폐지 주요요건은 아래 표와 같습니다.
| [코스닥시장 관리종목 지정 및 상장폐지 주요 요건] |
| 구분 | 관리종목 지정(코스닥시장 상장규정 제53조) | 상장폐지 기준(코스닥시장 상장규정 제54조) |
|---|---|---|
| 매출액 |
최근년 30억원 미만 (지주회사 또는 종속회사가 있는 외국기업은 연결기준) - 기술성장기업, 이익미실현기업은 각각 상장후 5년간 미적용 |
관리종목으로 지정 후 최근 사업연도에도 매출액이 30억원 미만인 경우 [실질심사] 이익미실현기업 관련, 관리종목지정 면제기간 중 상당한 규모의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 법인세비용차감전계속사업손실 |
자기자본 50%이상(&10억원이상)의 법인세비용차감전계속사업손실이 최근3년간 2회 이상(&최근연도계속사업손실) (지주회사, 종속회사가 있는 법인은 연결기준) - 기술성장기업 상장후 3년간 미적용, 이익미실현 기업 상장후 5년 미적용 |
관리종목 지정후 자기자본50%이상(&10억원이상)의 법인세비용차감전계속사업손실 발생 [실질심사] 이익미실현기업 관련, 관리종목지정 면제기간 중 상당한 규모의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 장기영업손실 |
최근 4사업연도 영업손실(지주회사는 연결기준) - 기술성장기업(기술성장기업부)은 미적용 |
[실질심사] 관리종목 지정 후 최근 사업연도 영업손실 |
| 자본잠식/자기자본 |
(A)사업연도(반기)말 자본잠식률 50%이상 (B)사업연도(반기)말 자기자본 10억원미만 (C)반기보고서 제출기한 경과후 10일내 반기검토(감사)보고서 미제출 or 검토(감사)의견 부적정·의견거절·감사범위제한한정 |
최근 사업연도년말 완전자본잠식 A or C 후 사업연도(반기)말 자본잠식률 50%이상 B or C 후 사업연도(반기)말 자기자본 10억원미만 A or B or C 후 반기말 반기보고서 기한 경과후 10일내 미제출 or 감사의견 부적정·의견거절·범위제한한정 [실질심사] 사업보고서 또는 반기보고서의 법정제출 기한까지 당해 상장폐지 기준 해당사실을 해소하였음을 입증하는 재무제표 및 이에 대한 감사인(정기재무제표에 대한 감사인과 동일한 감사인에 한함)의 감사보고서를 제출하는 경우(감사의견 적정에 한정함) |
| 감사의견 | - | 감사보고서 부적정·의견거절·감사범위제한한정 |
| 시가총액 | 보통주 시가총액 40억원미만 30일간 지속 | 관리종목 지정후 90일간 "연속10일 & 누적30일간 40억원이상"의 조건을 미충족 |
| 거래량 |
분기 월평균거래량이 유동주식수의 1%에 미달 - 신규상장법인의 신규상장일이 속하는 분기, 분기 월간거래량 1만주 이상, 소액주주 300인이상이 20%이상 지분 보유 등은 적용배제 |
2분기 연속 |
| 지분분산 |
소액주주의 수가 200인 미만인 경우 |
2년 연속 |
| 불성실공시 | - | [실질심사] 1년간 불성실공시 벌점 15점 이상 |
| 공시서류 |
(A)분기,반기,사업보고서 미제출 |
2년간 3회 분기,반기,사업보고서 미제출 사업보고서 제출기한후 10일내 미제출 |
| 사외이사 등 | 사외이사/감사위원회 요건 미충족 | 2년 연속 |
| 회생절차/파산신청 | 회생절차 개시 신청 또는 파산신청 | [실질심사] 개시신청기각,결정취소,회생계획 불인가등 |
| 기타 | 기타 상장폐지 사유 발생 |
최종부도 또는 은행거래정지 해산사유(피흡수합병, 파산선고) 정관 등에 주식양도제한 두는 경우 유가증권시장 상장의 경우 우회상장시 우회상장관련 규정 위반시 (심사종료전 기업결합완료 및 보호예수 위반 등) |
| (출처: 한국거래소) |
특히 코스닥시장상장규정 제53조(관리종목), 코스닥시장상장규정 제54조(형식적 상장폐지) 및 제56조(상장적격성 실질심사에 따른 상장폐지) 등의 규정사항에 해당되어 관리종목 지정 및 상장폐지 등이 발생할 위험에 유의하시기 바랍니다.
자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| 자. 차입공매도 유상증자 참여 제한 관련 위험 금융위원회의 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률과 시행령」이 개정되어 2021년 4월 6일부터 시행됨에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막 날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자 참여를 제한하되, 예외적인 경우에만 증자 참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 상기 사항을 위반 시 과징금 등의 제재 조치를 받을 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다. |
주권상장법인이 유상증자 계획을 공시한 이후 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우 증자참여를 허용하고 있습니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 이와 관련 유상증자 참여가 제한되는 공매도 시점과 증자참여가 허용되는 예외사유를 시행령에서 정하도록 위임하고 있습니다.
시행령에 따르면, 유상증자 계획이 공시된 다음 날부터, 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지 공매도 한 경우 증자참여가 제한됩니다 (「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제1항)
다만, 다음의 경우 공매도를 통해 발행가격에 부당한 영향을 미쳤다고 보지 않아 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률 시행령」제208조의4 제2항「금융투자업규정」제6-34조)
ⅰ) 마지막 공매도 이후 발행가격 산정 기산일까지 공매도 주문 수량 이상을 증권시장 정규거래시간에 매수(체결일 기준)
ⅱ) 금융위원회가 정하는 기준을 충족한 독립된 거래단위를 운영하는 법인 내에서 공매도를 하지 않은 거래단위가 증자참여
ⅲ) 시장조성 또는 유동성공급을 위한 거래과정에서 공매도
상기 공매도제도 개선 관련 자본시장법 시행령 시행에 따라, 당사의 주식을 해당 기간 동안 공매도하는 투자자께서는 금번 유상증자 참여가 제한될 수 있음을 유의하시기 바랍니다. 해당 법령과 관련된 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
| 차. 개인종합자산관리계좌(ISA) 납입한도에 따른 청약제한 위험 개인종합자산관리계좌(이하 ISA 계좌)는 연간 납입가능한도 제한(연간납입한도 2,000만원, 5년간 최대 1억원까지 납입가능하며 납입한도 이월가능)이 있는 계좌입니다. ISA계좌를 통한 신주인수권증서 보유자 청약시, 투자자별 유상증자 배정주수에 해당하는 청약증거금 납입금액이 ISA계좌 잔여납입한도를 초과할 경우 유상청약이 제한될 수 있으니, 투자자께서는 이 점 유의하시기바랍니다. |
| 카. 기타 투자자 유의사항 당사의 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우, 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 공시서류에 기재된 정보에만 의존하여 투자 판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 유의하시어 투자에 임하시기 바랍니다. |
(1) 금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분들께서는 이 점을 유의하여 주시기 바랍니다.
(2)「자본시장과 금융투자업에 관한 법률」제120조 제3항에 의거하여 본 공시서류의 효력의 발생은 공시서류의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
(3) 본 공시서류의 공시심사 과정에서 기재사항은 청약일 이전에 변경될 수 있고, 일부 내용은 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 공시서류상의 일정에 차질을 가져올 수 있습니다. 또한 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다.
(4) 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 공시서류의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다. 다만, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해야 합니다.
(5) 당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나, 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점을 유의하여 투자에 임하시기 바랍니다.
(6) 만일 상기 투자위험요소가 실제로 발생하는 경우 당사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액의 일부 또는 전부를 잃게 될 수도 있습니다.
(7) 본건 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
(8) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있으니 투자의사를 결정하시는 데 참조하시기 바랍니다.
이와 같이, 본 건 유상증자를 통해 취득한 당사의 주식 가치는 하락할 수 있으며, 본본 공시서류에서 제시된 투자위험요소 및 기타 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분의 독자적인 판단에 의해야 함을 다시 한번 유의하여 주시기 바랍니다.
| ※ 상기 제반사항을 고려하시어 투자자 제위의 현명한 판단을 바랍니다. 투자자는 본건 공모주식에의 투자 여부를 결정함에 있어서 필요한 경우 스스로 별도의 독립된 자문을 받아야 하며, 이에 따른 투자의 결과에 대하여는 투자자가 책임을 부담합니다. |
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 '금융투자회사의 기업실사 모범규준'에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 한국투자증권(주)이며, 발행회사인 (주)제넥신는 "동사"로 기재였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 증 권 회 사 | |
|---|---|---|
| 회 사 명 | 고 유 번 호 | |
| 대표주관회사 | 한국투자증권(주) | 00160144 |
2. 분석의 개요
대표주관회사인 한국투자증권(주)(이하 "대표주관회사"라 합니다.)는『자본시장과금융투자업에관한법률』제71조 및 동법시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한「금융투자회사의 기업실사(Due Diligence) 모범규준」(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 2012년 02월 01일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
다만, '모범규준' 제3조 제②항에 따라 발행회사의 재무 및 영업현황, 사업 환경, 투자위험, 인수 형태, 신용평가등급 등을 감안하여 강화하거나, 완화할 수 있으며, 동조 제⑤항에 따르면 금융투자회사의 이사회나 리스크관리위원회의 의사결정을 거쳐 '모범규준'의 내용(실사수준)을 생략하거나 강화 또는 완화 적용할 수 있도록 허용하였는 바, 주관회사는 지분증권의 인수 또는 모집·매출의 주선업무를 수행함에 있어서 지분증권의 특성 및 발행회사의 일정요건 충족여부 등에 따라 기업실사 수준을 완화하여 적용할 수 있도록 규정하고 있습니다.
본 지분증권은 대표주관회사인 한국투자증권(주)의 내부 규정상 기업실사 기준을 적용하여 기업실사 업무를 수행하였습니다.
| 「금융투자회사의 기업실사 모범규준」 제3조(적용범위 등) ①이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ②이 규준은 주간회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 ‘리스크관리위원회 등’)의 의사결정을 거쳐야 한다. |
3. 기업실사 일정 및 주요 내용
| 일자 | 실사 내용 |
|---|---|
| 2022.09.05 | * 발행회사 초도 방문 - 발행회사의 유상증자 의사 확인 - 자금조달 희망금액 등 발행회사 의견 청취 |
| 2022.09.06 ~ 2022.09.09 |
* 발행회사의 유상증자 방식결정 협의 * 유상증자 일정 협의 및 확정 * 유상증자를 위한 사전 준비사항 및 진행절차 설명 - 발행가 산정 및 세부일정 설명 * 세부 증자관련 논의 - 유상증자 방식 결정 및 대주주 증자 참여 논의 * 유상증자 진행에 대한 질의/응답 * 실사 사전요청자료 송부 |
| 2022.09.12 ~ 2022.09.16 |
* 증자리스크 검토 - 발행시장 상황, 자금조달규모 적정성, 공모가액 희망 할인율 * 발행사와의 협의 - 발행가액 산정방식, 발행일정, 발행규모, 인수수수료 협의 * 기업실사 진행 및 추가자료 요청 - 기업실사 관련 자료요청 및 절차에 대한 설명 - 기업실사 관련 Q&A * 이사회 등 상법 절차 및 정관 등 검토 * 투자위험요소 실사 1) 사업위험관련 실사 - 기존사업 및 신규사업에 대한 세부사항 등 체크 2) 회사위험관련 실사 - 재무관련 위험 및 우발채무 등의 위험요소 등 체크 3) 기타위험관련 실사 - 주가 희석화관련 위험 등 체크 * 담당자 인터뷰 - 회사개요, 사업의 내용, 주요 재무적 이슈 확인 - 자금사용 계획 파악 - 향후 사업추진계획 및 발행회사의 비전 검토 |
| 2022.09.19 ~ 2022.09.27. |
* 증권신고서 작성 및 조언 * 이사회의사록 등 검토 * 인수계약서 체결 * 증권신고서 인수인의 의견 완료 * 첨부서류 등 검토 * 증권신고서 업데이트 |
| 2022.10.13 ~ 2022.10.21 |
*(정정) 금융감독원의 정정요구제출에 따른 증권신고서 작성 가이드 및 추가자료 작성 |
| 2022.10.22 ~ 2022.11.08 |
*(정정) 기재정정사항에 따른 증권신고서 작성 가이드 및 추가자료 작성 |
| 2022.11.10 ~ 2022.11.15 |
*(정정) 기재정정사항에 따른 증권신고서 작성 가이드 및 추가자료 작성 |
4. 기업실사 참여자
| [발행회사] |
| 소속기관 | 부서 | 성명 | 직위 | 실사업무분장 |
|---|---|---|---|---|
| (주)제넥신 | 경영지원실 | 홍성준 | 부사장 | 발행업무 총괄 |
| 경영지원실 | 신승준 | 과장 | 발행업무 기획 및 실무 |
| [대표주관회사] |
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요 경력 |
|---|---|---|---|---|---|---|
| 한국투자증권(주) | IB2본부 | 이현규 | 본부장 | 기업실사 총괄 | 2022년 09월 05일 ~ 2022년 11월 15일 |
기업금융업무 등 31년 |
| 한국투자증권(주) | ECM부 | 채승용 | 이사 | 기업실사 책임 | 2022년 09월 05일 ~ 2022년 11월 15일 |
기업금융업무 등 20년 |
| 한국투자증권(주) | ECM부 | 박상욱 | 팀장 | 기업실사 책임 | 2022년 09월 05일 ~ 2022년 11월 15일 |
기업금융업무 등 12년 |
| 한국투자증권(주) | ECM부 | 송윤태 | 과장 | 기업실사 실무 | 2022년 09월 05일 ~ 2022년 11월 15일 |
기업금융업무 등 8년 |
| 한국투자증권(주) | ECM부 | 정인묵 | 대리 | 기업실사 실무 | 2022년 09월 05일 ~ 2022년 11월 15일 |
기업금융업무 등 5년 |
| 한국투자증권(주) | ECM부 | 김하늘 | 대리 | 기업실사 실무 | 2022년 09월 05일 ~ 2022년 11월 15일 |
기업금융업무 등 3년 |
| 한국투자증권(주) | ECM부 | 박주혁 | 주임 | 기업실사 실무 | 2022년 09월 05일 ~ 2022년 11월 15일 |
기업금융업무 등 2년 |
5. 기업실사 세부항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합의견
가. 대표주관회사인 한국투자증권(주)는 (주)제넥신이 2022년 09월 26일 이사회에서 결의한 보통주식 5,797,102주에 대한 주주배정 후 실권주 일반공모 증자를 잔액인수함에 있어 (주)제넥신에 대하여 다음과 같이 평가합니다.
| 긍정적요인 | ▶ 동사는 독자적인 지속형 항체 융합 단백질 기술인 hyFc 플랫폼을 기반으로 T세포의 수를 증가시키는 인터루킨-7을 이용한 면역항암제를 연구개발하고 있는 바이오 회사로, 이 같은 글로벌 항암제 개발 트렌드에 부합하는 연구개발을 수행하고 있습니다. 또한 현재 개발중인 파이프라인은 다양한 암종을 대상으로 적응증 확대가 가능하며, 기존 항암제 및 당사 면역항암제 간의 병용요법을 통한 치료효과 개선이 가능합니다. 기존의 암 치료법을 개선하고, 효과를 증폭시켜 새로운 암 치료 시대를 열 수 있는 잠재력이 높은 기술로 기대되고 있습니다. 이외에도 hyFc 플랫폼 기술을 활용하여 지속형 빈혈치료제, 지속형 성장호르몬 등의 개발도 파트너사와의 협력으로 진행중입니다. ▶ 동사가 개발하는 GX-I7은 지속형 인터루킨-7(Interleukin-7, IL-7)으로 각종 화학항함제나 방사선치료요법으로 급격히 줄어든 T 세포의 양을 증가시켜 보다 근본적으로 면역력 증진에 도움을 주는 T cell Amplifier(T 세포 증폭제) 이며, 이미 전세계적으로 유일한 First-Class 치료제입니다. 동사의 GX-I7은 I-7을 기반으로한 First-Class 치료제라는 점에서 차별성을 가지고 있으며, 유의미한 임상 결과를 바탕으로 성공적인 시장진입 시 경쟁력을 갖출 수 있을 것으로 기대됩니다. ▶ 동사의 파이프라인은 단독 요법 보다는 기존 화학항암제, 표적항암제와의 병용요법, 다른 타겟의 면역항암제와의 상호보완적인 기전을 통해 항암효과 및 전체 생존율의 증대 등의 시너지 효과를 기대하고 있습니다. 따라서 기존의 시장 내 주력제품들은 당사의 제품과 경쟁관계가 아닌 협력관계에 있으며, 병용 처방을 통해 상호보완적인 시너지 효과를 발휘할 것으로 기대하고 있습니다. |
| 부정적요인 | ▶ 동사는 기술이전, 기술재산권(로열티), 연구용역/서비스 관련 매출이 지속적으로 발생하고 있으나, 신약 개발을 위한 연구개발비 지출로 최근 직전 3개년간 지속적인 영업손실을 기록하는 모습을 보이고 있습니다. ▶동사는 2022년 3분기 말 총차입금의존도 17.5%, 부채비율 31.6%, 유동비율 144.6%, 2021년 말 총차입금의존도 8.2%, 부채비율 21.7%, 유동비율 96.8%을 기록하였으며, 2022년 3분기 말과 2020년에는 차입 증대 등으로 총차입금을 유동자산 이상으로 보유하고 있는 약화된 재무상태를 보였습니다. 향후에도 당사 사업부문 영업 환경이 지속적으로 악화되거나, 연구개발의 지속적인 투자로 인한 자금 소요 등의 예상치 못한 환경의 변화에 따라 외부자금 조달 수요가 발생할 경우 회사의 재무안정성 약화로 이어질 위험이 존재합니다. ▶동사는 연결기준 최근 3년 및 2022년 3분기까지 지속적으로 음(-)의 영업활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름은 대체적으로 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 동사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으나 영업 실적이 개선되지 않아 음(-)의 영업활동현금흐름이 계속 발생할 경우 유동성 리스크가 부각될 위험이 있습니다. ▶동사의 경우 바이오기업 특성상 향후 추가적인 자금조달 가능성을 배제할 수 없으며 금번 유상증자 후에 추가 조달의 필요성이 지속될 경우 자금 유동성이 크게 악화될 수 있고 추가적인 자금조달을 진행 할 수 있으며, 반복적인 주식관련사채 발행 및 유상증자로 인하여 주주가치가 심각하게 훼손될 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 임상자금 및 운영자금으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 (주)제넥신이 제출한 자료와 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 실사를 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수 변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 대표주관회사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2022년 11월 15일 |
| 대표주관회사 : 한국투자증권 주식회사 |
| 대표이사 정 일 문 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
|
(단위: 원) |
|
구 분 |
금 액 |
|---|---|
|
모집 또는 매출총액(1) |
89,855,081,000 |
|
발행제비용(2) |
483,573,774 |
|
순 수 입 금 [ (1)-(2) ] |
89,371,507,226 |
| 주1) | 상기 금액은 1차 발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) | 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) | 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. |
나. 발행제비용의 내역
|
(단위: 원) |
|
구 분 |
금 액 |
지급일자 |
계산근거 |
|---|---|---|---|
|
발행분담금 |
16,173,910 |
신고서제출일 |
모집총액의 0.018%(10원 미만 절사) |
|
인수수수료 |
359,420,324 |
납입일익일 |
인수수수료 0.4% |
| 신주인수권증서 표준코드발급수수료 | 10,000 | 표준코드발급 신청일 | 정액 |
|
추가상장수수료 |
10,450,000 |
신주상장일 |
910만원+1,000억원 초과금액의 10억원당 5만원(코스닥시장상장규정 시행세칙 별표 14) |
| 발행등록수수료 | 1,000,000 | - | 1,000주당 300원(주식 및 신주인수권증서 각각 별도 징수, 수수료 건당 상한 50만원 및 하한 4천원) (주식·사채 등의 전자등록업무규정 시행세칙 별표 |
|
등록세 |
11,594,200 |
등기일 |
증자 자본금의 0.4% |
|
교육세 |
2,318,840 |
등기일 |
등록세의 20% |
|
기타비용 |
82,606,500 |
- |
투자설명서 인쇄 및 발송비 등 |
|
합 계 |
483,573,774 |
- |
- |
| 주1) | 상기 금액은 1차 발행가액 및 기산일 종가를 기준으로 산정한 금액입니다. |
| 주2) | 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가, 유관기관 정책 등에 따라 변동될 수 있습니다. |
| 주3) | 기타비용은 예상금액으로 변동될 수 있습니다. |
2. 자금의 사용목적
가. 자금의 사용목적
당사가 금번 보통주 유상증자를 통해 조달 예정인 자금 89,855,081,000원은 운영자금(임상자금 및 기타 운영자금 등)으로 사용할 계획입니다.
| (기준일 : | 2022년 11월 07일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| - | - | 89,855 | - | - | - | 89,855 |
나. 자금의 세부 사용내역
당사는 금번 유상증자로 조달된 자금을 현재 개발 중인 파이프라인 중 GX-188E(자궁경부암 치료백신, HPV16/18 유래암치료 DNA 백신)의 다국가 임상3상 수행을 위한 R&D비용 및 GX-I7(항암 면역치료제)의 향후 상업화를 위한 임상개발 및 PPQ(공정성능적격성 평가)배치 생산/분석 등에 투자할 계획이며, 그 외에도 당사의 주요 파이프라인인 GX-E4, GX-H9 등의 연구개발비용으로 사용할 계획입니다. 만약 금번 유상증자의 공모 금액이 당초 계획한 금액에 미달할 경우, 당사는 아래에 표기한 자금사용계획 우선순위에 따라 집행 시기를 고려하여 세부적으로 조정할 예정이며, 부족분 및 발행제비용은 당사의 자체자금으로 충당할 계획입니다. 금번 유상증자를 통한 공모 자금의 세부 사용 내역은 아래와 같습니다.
| [자금사용 우선순위] |
| (단위: 백만원) |
| 구 분 | 사용(예정)시기 | 금액 | 우선순위 | ||
|---|---|---|---|---|---|
| (R&D비용) | CMC (생산 및 품질) |
GX-188E | 2023년~2025년 | 5,588 | 4순위 |
| GX-E4 | 2023년~2025년 | 3,330 | 6순위 | ||
| GX-H9 | 2023년~2025년 | 2,257 | 7순위 | ||
| GX-I7 | 2023년~2025년 | 10,925 | 5순위 | ||
| 임상 | GX-188E | 2023년~2025년 | 34,714 | 1순위 | |
| GX-E4 | 2023년~2025년 | 18,000 | 2순위 | ||
| GX-I7 | 2023년~2025년 | 9,479 | 3순위 | ||
| 연구재료비 | 2023년~2025년 | 5,561 | 8순위 | ||
| 총합계 | 89,855 | - | |||
| 출처: 당사 제시 |
[주요용어]
|
구분 |
내용 |
| PPQ: Process Performance Qualification | 공정성능적격성평가(공정을 3회 반복해서 동일한 결과물을 검증하는 과정 |
| E/L Study: Extractables and Leachables Study | 용출및첨출물실험 (공정과정의 불순물, 용기등에서 나올수 있는 불순물을 검증하는과정 |
상기 각 파이프라인별 자금사용 세부사항은 다음과 같습니다.
(1) GX-188E
GX-188E(자궁경부암 치료백신, HPV16/18 유래암치료 DNA 백신)은 국내에서 진행성/재발성 자궁경부암 환자를 대상으로 임상2상을 진행하고 있으며, 현재 65 명의 환자를 대상으로 투약을 완료하여 올해 12월까지 최종보고서(CSR)을 작성할 예정에 있습니다. 신속처리대상지정 및 조건부허가 신청을 위한 절차를 식품의약품안전처(MFDS)와 논의하고 있으며, 이와 병행하여 다국가 임상3상을 위한 임상시험계획승인(IND) 신청을 논의하고 있습니다. 다국가 임상3상을 수행하기 위한 선제적 제반비용이 필요하며, EDC(전자데이터수집)시스템, CRO 인력구성 등 임상시험계획승인(IND) 신청 약 3~4개월 이전에 외부업체와의 계약금 및 비용이 소요됩니다. 또한, 현재 논의 중인 임상시험계획승인(IND)이 빠르게 승인되어 환자모집이 진행되면 초기 사용 비용은 증가할 수 있습니다. 이에 따라 향후 다국가 임상3상 개발비용 약 347억원과 CMC비용 56억원이 소요될 것으로 예상하고 있습니다.
신속처리대상지정 및 조건부허가 제도는 대체치료제가 없는 중대한 질환, 희귀질환관리법에 따른 희귀질환, 대유행 감염병의 예방·치료를 목적으로 하는 첨단바이오의약품으로 지정된 의약품이 초기 임상시험 결과 또는 임상시험 과정에서 안전성·유효성이 확보됨을 확인할 수 있는 자료를 제시하는 경우 추후 임상시험(임상3상) 자료를 제출하는 것을 조건으로 허가하는 제도입니다. 이는 대체치료제가 없고 생명을 위헙하는 암 등 중대한 질환의 치료목적으로 하는 경우에 지정될 수 있으나, 대상질환 및 해당 질환에 대한 표준 치료법의 빠른 변화로 신청 당시 임상 현장 상황에 따라 달리 해석될 수 있으므로, 신속처리대상 지정신청이 신속처리대상지정을 받았다는 것을 의미하는 것은 아닙니다. 그러므로 신속처리대상 지정을 받지 못할 경우 조건부 허가 대상이 되지 못할 가능성이 있으며, 따라서 회사는 이와는 별도로 임상3상을 위한 준비를 병행하여 진행할 예정입니다. 임상 3상을 위한 준비 비용은 금번 유상증자를 통해 조달한 자금으로 충당할 예정입니다.
당사가 계획중인 진행성/재발성 자궁경부암 환자를 대상으로 하는 다국가 임상3상 개발 계획 및 일정, 임상시험비용 세부내역 및 임상시험 개요는 아래와 같습니다.
[GX-188E DNA 치료백신의 향후 개발 계획 및 일정]
|
분류 |
세부 |
2022년 |
2023년 |
2024년 |
2025년 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
||
|
임상개발 |
임상2상 |
● |
● |
● |
● |
● |
|
|
|
|
|
|
|
|
|
조건부허가 |
● |
● |
● |
● |
● |
|
|
|
|
|
|
|
|
|
|
임상3상 |
|
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
|
|
전기천공기 |
해외등록 |
|
● |
● |
● |
● |
● |
● |
|
|
|
|
|
|
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
[진행성/재발성 자궁경부암 환자의 2차 치료제로서 다국가 임상3상 개요]
|
구분 |
내용 |
|---|---|
|
임상시험 대상국가 |
한국, 남미 및 동남아시아 (예상) |
|
임상시험의 목적 |
임상시험의 주요 목표는 진행성 및/또는 재발성 자궁경부암 환자를 대상으로 대조군 대비 GX-188E과 펨브롤리주맙(또는 다른 면역관문억제제) 병용투여의 유효성 확증을 목적으로 한다. |
|
임상시험 수행방법 |
시험 대상자 수: 약 400명 시험방법: 공개(Open), 무작위(Randomized), 활성대조군(Active-controlled), 다국가(Multi-national) 임상3상 디자인으로 대조군 대비 전체생존기간(Overall Survival)과 객관적 반응률 및 무진행생존기간(Progression Free Survival), 질병진행률(Disease Control Rate) 등을 평가하고자 한다. 임상연구기간: 약 4년(환자 모집 상황 및 투여 기간 등에 따라 일정은 변동될 수 있습니다.) |
|
기대효과 |
자궁경부암 발병의 주요 원인인 인유두종바이러스(HPV) 16형과 18형에서 생성되는 암 유발 단백질에 대한 면역반응을 유도하는 치료용 DNA 백신 후보물질로서 GX-188E는 Pembrolizumab과의 병용투여 시 기대할 수 있는 항암면역반응의 시너지가 임상적으로 확증되면, HPV로 인해 유발되는 자궁경부암뿐 아니라 두경부암 및 생식기암으로 다양한 적응증으로 확대할 수 있는 또 다른 시장 개척 가능성을 가지고 있다. 또한, 당사가 개발하고 있는 plasmid DNA 기반 항암 치료 백신으로서 다양한 암과 연계된 항원을 타겟으로 하는 항암 치료용 DNA 백신 개발을 위한 초석이 될 것으로 기대한다. |
|
임상비용 산정근거 |
기 허가된 항암화학요법에서 전체생존기간의 중앙값 9개월 대비 GX-188E 병용용법의 생존기간의 중앙값 14개월을 기반으로 필요한 시험대상자 수를 산출하였으며(약 388명), 국내에서 수행된 임상1b/2상 사용된 환자 1인당 한화 약 9천만원을 기준으로 임상시험연구비 약 347억원이 산정되었습니다. |
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
| [진행성/재발성 자궁경부암 환자의 2차 치료제로서 글로벌 임상3상 상세 임상 개발비용] |
| (단위 : 백만원) |
|
프로젝트 |
항목 |
2023년 |
2024년 |
2025년 |
총액 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
|||
|
임상3상 진행 및/또는 |
임상비용 |
- |
- |
1,784 |
2,676 |
2,800 |
4,200 |
4,200 |
2,800 |
2,700 |
4,050 |
4,050 |
2,700 |
31,960 |
|
임상약 관리 |
85 |
56 |
85 |
127 |
85 |
127 |
127 |
85 |
85 |
127 |
127 |
85 |
1,200 |
|
|
분석비용 |
20 |
30 |
44 |
66 |
39 |
59 |
89 |
133 |
70 |
105 |
158 |
237 |
1,050 |
|
|
기타 |
25 |
37 |
55 |
83 |
25 |
37 |
55 |
83 |
13 |
19 |
29 |
43 |
504 |
|
|
합계 |
129 |
123 |
1,968 |
2,953 |
2,949 |
4,423 |
4,471 |
3,101 |
2,868 |
4,301 |
4,364 |
3,065 |
34,714 |
|
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
CMC 비용은 ㈜바이넥스(위탁생산 및 개발 서비스업, CDMO)를 통해 PPQ 배치 생산 및 분석 32억원, 안정성시험 12억원, E/L Study 외 11.9억원으로, 총 55.9억원을 사용할 계획입니다. 각 비용에 대한 세부내역은 하기와 같으며, 해당 연구에 필요한 견적을 근거로 하여 비용을 추산하였습니다.
[GX-188E 관련 CMC 비용 세부 내역]
| (단위 : 백만원) |
|
분류 |
세부 |
2023년 |
2024년 |
2025년 |
총액 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
|||
|
GX-188E |
PPQ 생산 (DS,DP) |
800 |
800 |
800 |
800 |
- |
- |
- |
- |
- |
- |
- |
- |
3,200 |
|
안정성 시험 |
- |
- |
- |
400 |
- |
- |
- |
400 |
- |
- |
- |
400 |
1,200 |
|
|
E/L study 외 |
- |
- |
- |
39 |
- |
200 |
- |
363 |
- |
200 |
- |
386 |
1,188 |
|
|
합계 |
800 |
800 |
800 |
1,239 |
- |
200 |
- |
763 |
- |
200 |
- |
786 |
5,588 |
|
| 출처: 당사 제공 |
(2) GX-I7
불응성 또는 재발성 삼중음성유방암에 대한 GX-I7(면역항암제)의 임상2상에 대한 중간결과를 올해 6월 ASCO(미국임상종양학회)에서 발표한 바 있습니다. 향후 상업화를 위해 PPQ 배치 생산 및 분석에 대한 투자를 계획하고 있으며CMC 비용으로 약 127억원,임상비용으로 약 95억원을 사용할 계획입니다.
당사는 불응성 또는 재발성 삼중음성유방암 환자를 대상으로 임상1b/2상을 통해 PD-L1 양성(CPS≥10) 환자에서의 긍정적인 결과를 바탕으로 금번 유상증자 자금의 일부를 활용하여 불응성 또는 재발성 삼중음성유방암 환자를 대상으로 하는 다국가 임상2상을 계획하고 있습니다. 임상2상의 향후 개발 계획 및 일정, 임상시험비용 세부내역 및 임상시험 개요는 아래와 같습니다.
[GX-I7 면역항암제의 향후 개발 계획 및 일정]
|
분류 |
세부 |
2022년 |
2023년 |
2024년 |
2025년 |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
|
삼중음성 유방암 |
임상1b/2상 (국내) |
● |
● |
● |
|
|
|
|
|
|
|
|
|
|
|||
|
임상2상 (다국가) |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
|||||
|
재발성 교모세포종 |
임상2상 |
|
● |
● |
● |
● |
|
|
|
|
|
|
|
|
|||
|
임상2/3상 |
|
|
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
||||
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
[불응성 또는 재발성 삼중음성유방암 다국가 임상 2상 상세 임상 개발 비용]
| (단위 : 백만원) |
|
프로젝트 |
항목 |
2023년 |
2024년 |
2025년 |
총액 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
|||
|
임상2상 불응성 또는 재발성 |
임상비용 |
1,246 |
351 |
351 |
351 |
1,279 |
351 |
970 |
351 |
351 |
351 |
770 |
1,070 |
7,794 |
|
임상약 관리 |
185 |
41 |
41 |
41 |
41 |
41 |
185 |
41 |
41 |
185 |
41 |
41 |
926 |
|
|
분석비용 |
123 |
27 |
27 |
27 |
27 |
27 |
123 |
27 |
27 |
123 |
27 |
27 |
617 |
|
|
기타 |
28 |
9 |
9 |
9 |
9 |
9 |
9 |
9 |
9 |
9 |
9 |
28 |
142 |
|
|
합계 |
1,583 |
428 |
428 |
428 |
1,357 |
428 |
1,287 |
428 |
428 |
668 |
847 |
1,167 |
9,479 |
|
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
| [삼중음성유방암 환자 대상 다국가 임상 2상 개요] |
|
구분 |
내용 |
|---|---|
|
임상시험 대상국가 |
한국, 중국 및 동남아시아 (예상) |
|
임상시험의 목적 |
임상시험의 주요 목표는 진행성 및/또는 재발성 삼중음성유방암 환자를 대상으로 대조군 대비 GX-I7과 펨브롤리주맙(또는 다른 면역관문억제제) 병용투여의 안전성과 유효성 확인을 목적으로 한다. |
|
임상시험 수행방법 |
시험 대상자 수: 약 114명 공개(Open), 무작위(Randomized), 활성대조군(Active-controlled), 다국가(Multi-national) 임상2/3상 디자인으로 대조군 대비 객관적 반응률(ORR) 및 무진행생존기간(Progression Free Survival), 전체생존기간(Overall Survival), 질병진행률(Disease Control Rate) 등을 평가하고자 한다. 임상연구기간: 약 4년(환자 모집 상황 및 투여 기간 등에 따라 일정은 변동될 수 있다.) |
|
기대효과 |
단독 투여 시 림프구감소증을 개선시키는 효과와 더불어 암환자에서 종양 침윤림프구(TIL)의 수를 증가시키고, Pembrolizumab과 병용 투여 시 PD-1 차단을 유의하게 강화시켜 높은 항암 효과를 기대할 수 있습니다. 항암화학치료제와 비교하여 독성이 적은 장점도 있어 다양한 면역항암제와의 병용요법에서도 매우 안전하게 투여할 수 있습니다. 따라서 GX-I7은 다양한 면역항암제와의 병용요법으로 항암면역에 중요한 역할을 하는 림프구 수를 증가시켜 항암효과를 증가시키는 약제로서 최초의 신약이 될 것으로 기대합니다. |
|
임상비용 산정근거 |
기 허가된 항암화학요법에서 객관적반응율 약 11% 대비 GX-I7 및 Pembrolizumab 병용요법의 객관적반응율 40% 이상을 추정할 때, 필요한 시험대상자 수를 산출하였으며(약 114명), 국내에서 수행된 임상1b/2상 사용된 환자 1인당 한화 약 8.3천만원을 기준으로 임상시험연구비 약 95억원이 산정되었습니다. |
| 주) 상기 내용은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
CMC 비용은 글로벌 CDMO (삼성바이오로직스 및 Patheon)을 이용한 PPQ 배치 생산 및 분석비용 69억원, E/ L study 40억원으로 총109.3억원이 사용할 계획입니다. 각 비용에 대한 세부내역은 하기와 같으며, 해당 연구에 필요한 견적을 근거로 하여 비용을 추산하였습니다.
| [GX-I7 관련 CMC 비용 세부 내역] | |
| (단위 : 백만원) | |
|
프로젝트 |
항목 |
2023년 |
2024년 |
2025년 |
총액 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
|||
|
GX-I7 |
PPQ 생산 (DS,DP) |
- |
1,300 |
1,300 |
1,300 |
- |
1,000 |
1,000 |
1,000 |
- |
- |
- |
- |
6,900 |
|
E/L study 외 |
- |
- |
- |
- |
- |
- |
419 |
- |
1,000 |
1,000 |
1,000 |
606 |
4,025 |
|
|
합계 |
- |
1,300 |
1,300 |
1,300 |
- |
1,000 |
1,419 |
1,000 |
1,000 |
1,000 |
1,000 |
606 |
10,925 |
|
| 주) 상기 비용은 환율변동 등으로 일부 변경될 수 있습니다. |
| 출처: 당사 제공 |
(3) GX-H9
GX-H9은 한독과 공동 개발중인 지속형 성장호르몬 입니다. 중국 파트너사인 I-MAB 에서는 중국에서 임상3상을 진행하고 있으며, 당사와 한독은 중국 I-MAB과 협업하여 현재 다국가 임상3상시험을 준비중에 있습니다. 이에 향후 CMC 비용으로 약 39억원의 비용이 사용될 것으로 예상하고 있습니다.
CMC 비용은 중국 파트너사인 아이맵(I-MAB)과의 협업으로 제형 및 공정개발 9.0억원, 디바이스 개발 13.6억원, 총 22.6억원이 사용할 계획입니다. 각 비용에 대한 세부내역은 하기와 같으며, 해당 연구에 필요한 견적을 근거로 하여 비용을 추정하였습니다.
| [GX-H9 관련 CMC 비용 세부 내역] |
| (단위 : 백만원) |
|
프로젝트 |
항목 |
2023년 |
2024년 |
2025년 |
총액 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
|||
|
GX-H9 |
제형 및 공정 개발 |
300 |
300 |
300 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
900 |
|
디바이스 개발 |
- |
- |
- |
357 |
- |
500 |
- |
500 |
- |
- |
- |
- |
1,357 |
|
|
합계 |
300 |
300 |
300 |
357 |
- |
500 |
- |
500 |
- |
- |
- |
- | 2,257 | |
| 출처: 당사 제공 |
(4) GX-E4
당사에서 개발한 GX-E4(지속형 빈혈치료제)는 지속형 빈혈치료제로 합자회사인 인도네시아 KGBio와 함께 비투석 신장질환 환자를 대상으로 아세안, 호주, 한국을 포함한 다국가 임상3상을 진행하고 있으며, 2022년 7월 환자 모집이 완료되었습니다.이후, 약 1년 동안의 2주 또는 4주 간격으로 반복 투여하면서 장기 안전성과 유효성에 대해 추적관찰하고 있습니다. 유럽으로의 진출을 위해 당사가 계획한 투석 환자를 대상으로 하는 임상3상 계획을 유럽 규제기관(EMA)와의 사전상담(Scientific Advisory Meeting)을 준비하고 있으며, 2023년 임상3상을 착수할 계획입니다. 향후 투석 환자를 대상으로 한 다국가 임상3상을 위해 약 180억원과 CMC 비용으로 약 33억원을 사용할 계획입니다.
임상3상의 향후 개발 계획 및 일정, 임상시험비용 세부내역 및 임상시험 개요는 아래와 같습니다.
| [GX-E4 향후 개발 계획 및 일정] |
|
분류 |
세부 |
2022년 |
2023년 |
2024년 |
2025년 |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | 1Q | 2Q | 3Q | 4Q | ||
|
임상개발 |
임상3상 (비투석) |
● |
● |
● |
● |
|
|
|
|
|
|
|
|
|
|||
|
국내허가 (비투석) |
|
|
|
|
● |
● |
● |
● |
|
|
|
|
|
||||
|
임상3상 (투석) |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
● |
|||||
|
국내허가 (투석) |
|
|
|
|
|
|
|
|
|
|
|
|
● |
||||
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
| [투석 환자 대상 빈혈치료제로서 다국가 임상3상 개요] |
|
구분 |
내용 |
|---|---|
|
임상시험 대상국가 |
한국, 아세안, 호주 및 유럽을 포함한 약 15개 국가 (예상) |
|
임상시험의 목적 |
임상시험의 주요 목표는 투석을 받는 신장질환 환자를 대상으로 대조군 (네스프 또는 아라네스프) 대비 GX-E4의 유효성(헤모글로빈 수치 개선)을 확증하고 장기 안전성을 확인하기 위한 목적으로 한다. |
|
임상시험 수행방법 |
시험 대상자 수: 약 230명 공개(Open), 무작위(Randomized), 활성대조군(Active-controlled), 다국가(Multi-national) 임상3상 디자인으로 대조군 대비 기저치 대비 헤모글로빈의 변화가 대조군과 비요하여 비열등한지를 평가하고자 한다. 임상연구기간: 약 3년(환자 모집 상황 및 투여 기간 등에 따라 일정은 변동될 수 있습니다.) |
|
기대효과 |
당사의 hyFc 기술 기반의 첫 번째 다국가 임상3 상 제품으로, 상용화된 경쟁 제품 대비 동등 수준 이상 의 효과뿐 아니라, 가격 경쟁력을 갖추고 있어 상업화 이후 빠르게 시장 점유율을 높일 것으로 기대합니다. |
|
임상비용 산정근거 |
비투석 환자를 대상으로 진행한 임상3상에서의 비용을 근거로 1인당 약 8천만원을 추정였고, 임상시험대행업체(CRO)인 OPIS로부터 수령한 임상시험 견적서를 근거로 임상시험 연구비 약 180억원이 산정되었습니다. |
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
| [다국가 임상3상 상세 임상 개발 비용] |
| (단위 : 백만원) |
|
프로젝트 |
항목 |
2023년 |
2024년 |
2025년 |
총액 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
|||
|
임상3상 투석중인 신장질환 환자 |
임상비용 |
719 |
1,078 |
1,078 |
719 |
698 |
1,047 |
1,047 |
698 |
738 |
1,107 |
1,107 |
738 |
10,774 |
|
임상약 관리 |
353 |
529 |
529 |
353 |
200 |
300 |
300 |
200 |
200 |
300 |
300 |
200 |
3,764 |
|
|
분석비용 |
170 |
170 |
170 |
170 |
125 |
125 |
125 |
125 |
125 |
125 |
125 |
125 |
1,681 |
|
|
기타 |
195 |
195 |
195 |
195 |
125 |
125 |
125 |
125 |
125 |
125 |
125 |
125 |
1,781 |
|
|
합계 |
1,437 |
1,973 |
1,973 |
1,437 |
1,148 |
1,597 |
1,597 |
1,148 |
1,188 |
1,657 |
1,657 |
1,188 |
18,000 |
|
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
CMC 비용은 KGM (KALBE GLOBAL MEDIKA)과의 협업으로 공정개발 5억원, 시료 생산 28.3억원으로, 총 33.3억원을 사용할 계획입니다. 각 비용에 대한 세부내역은 하기와 같으며, 인도네시아 합자 회사인 KGBio와 협업하여 진행할 계획입니다.
| [GX-E4 관련 CMC 비용 세부 내역] |
| (단위 : 백만원) |
|
프로젝트 |
항목 |
2023년 |
2024년 |
2025년 |
총액 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
1Q |
2Q |
3Q |
4Q |
|||
|
GX-E4 |
공정개발 |
250 |
250 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
500 |
|
시료 생산 |
- |
- |
- |
- |
- |
- |
1,016 |
- |
907 |
- |
907 |
- |
2,830 |
|
|
합계 |
250 |
250 |
- | - | - |
- |
1,016 |
- |
907 |
- |
907 |
- |
3,330 | |
| 주) 상기 일정은 임상개발 전략의 변경, 규제기관의 정책변화, 시장 환경 변화에 따라 일부 또는 전체가 변경될 수 있습니다. |
| 출처: 당사 제공 |
2) 자금의 운용계획
당사가 금번 유상증자를 통해 조달한 자금 중 일부 자금은 조달시기와 사용시기가 다소 차이가 있을 수 있습니다. 이에 조달로부터 사용시까지 미사용 자금에 대해서는 자금 사용시점 및 금리에 따라 적격금융기관의 수시입출금 예금, 정기예금 등 금융상품 또는 AA등급대(A1등급대)이상의 단기금융상품으로 운용할 예정입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
본 건의 경우 시장조성 또는 안정조작에 관한 사항은 해당사항 없습니다.
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 개황
1. 연결대상 종속회사 개황(연결재무제표를 작성하는 주권상장법인이 사업보고서, 분기ㆍ반기보고서를 제출하는 경우에 한함)
연결대상 종속회사 현황(요약)
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | 1 | - | - | 1 | 1 |
| 합계 | 1 | - | - | 1 | 1 |
1-1. 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
- | - |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
나.회사의 법적, 상업적 명칭
당사의 명칭은 주식회사 제넥신이며, 영문으로는 Genexine, Inc. 라 표기합니다. 단, 약식으로 표기할 경우에는 (주)제넥신 (Genexine)이라고 표기합니다.
다. 설립일자 및 존속기간
당사는 1999년 6월 설립되어 독자적 원천기술인 항체융합단백질 제조기술 및 유전자치료백신 제조기술을 바탕으로 2009년 9월 15일 코스닥시장에 상장되었습니다.
라. 본사의 주소, 전화번호, 홈페이지 주소
1) 주소 : 서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크
2) 전화번호 : 02-6098-2600
3) 홈페이지 주소 : http://www.genexine.com
마. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
(1) 중소기업 해당 여부
당사는 「중소기업기본법」제2조에 의거 중소기업에 해당합니다.
(2) 벤처기업 해당 여부
당사는 「벤처기업육성에 관한 특별조치법」 제25조의 규정에 의거 벤처기업에 해당합니다.
바. 주요 사업의 내용 및 향후 추진하려는 신규사업
당사는 독자적인 기반기술을 바탕으로 바이오 신약을 개발하고 있으며, 주요 신약 개발 제품라인으로는 항암면역치료제와 지속형 항체융합단백질 치료제 제품군, 유전자 치료백신 제품군으로 분류하고 있습니다. 사업에 대한 자세한 사항은 'Ⅱ. 사업의 내용'을 참조하시기 바랍니다.
사.신용평가에 관한 사항
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
아. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)여부 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 등 여부 |
특례상장 등 적용법규 |
|---|---|---|---|
| 코스닥 상장 | 2009.09.15 | 기술성장기업의 코스닥시장 상장 |
코스닥시장 상장규정 제6조(신규상장 심사요건) 및 제7조 (신규상장심사요건의 특례) |
2. 회사의 연혁
가. 회사의 연혁
| 2017년 | 1월 | GX-G6(지속형 당뇨병치료제) 유럽 임상1상 승인 |
| 3월 | 인도네시아 KDNA사에 자궁경부암 진단키트 공급계약 체결 | |
| 5월 | GX-30(갑상선자극호르몬) 국내 임상1상 승인 | |
| 6월 | GX-188E, Keytruda 자궁경부암 병용투여요법 국내 임상 1b, 2상 시험 승인 | |
| 9월 | GX-E2(빈혈치료제) 과학기술정보통신부 국가연구개발 우수성과 과제 선정 | |
| 10월 | (주)코스온과 성장호르몬 단백질을 원료로 하는 글로벌 기능성화장품 연구개발 업무협약 체결 | |
| 11월 | 보건복지부 혁신형 제약기업 재인증 | |
| 12월 | GX-I7(항암면역치료제) 중국 I-Mab Pharma에 기술이전계약 체결 | |
| GX-I7(항암면역치료제) 고형암 환자 대상 국내 임상1상 승인 | ||
| 우리사주대상 고용노동부장관상 수상 | ||
| 2018년 | 7월 | GX-I7(항암면역치료제), 범부처신약개발사업단의 'T세포의 증식 및 활성유도 신약후보와 Pembrolizumab(키트루다)의 병용투여 임상연구' 과제 선정 |
| 8월 | GX-188E(자궁경부암 면역치료백신), 국가항암신약개발사업단의 '면역관문억제제 병용임상 연구' 지원 과제로 선정 | |
| 9월 | GX-I7(항암면역치료제), 고형암환자 대상 화학항암제(Cyclophosphamide) 전처리 후 투여 한국임상 1b/2a 진입 | |
| 12월 | GX-I7(항암면역치료제), 삼중음성유방암 환자 대상 면역관문억제제 병용투여 한국임상 1b/2a 승인 | |
| 2019년 | 4월 | GX-I7(항암면역치료제), 특발성 림프구감소증 대상 미국 희귀의약품 지정 |
| 5월 | GX-188E(자궁경부암 면역치료백신), 자궁경부암 환자 대상 조기 임상2상 2단계 진입 | |
| 10월 | 마곡 신사옥 및 R&D센터 기공식 개최 | |
| 11월 | SITC 2019 학회에서 암환자 대상 GX-I7 후기 1상 결과 발표 | |
| 12월 | GX-188E(자궁경부암 면역치료백신), 자궁경부암 환자 대상 임상2상 3단계 확장 및 진입 | |
| 2020년 | 1월 | 제넨바이오에 GX-P1, GX-P10(장기이식 면역거부반응 적응증 관련 질환 치료제) 기술이전 |
| 3월 | 신종코로나 바이러스 (COVID-19) 예방 DNA 백신(GX-19) 개발을 위한 산학연 컨소시엄 구성 | |
| 6월 | GX-19 한국 임상 1/2a상 시험 승인 | |
| 7월 | GX-188E 식품의약품안전처 바이오 챌린저 선정 | |
| 9월 | 범부처신약개발사업단의 코로나19 백신 임상지원' 사업 과제 선정 | |
| 12월 | GX-19N 한국 임상 1/2a상 시험 승인 | |
| GX-P1(면역억제제) Turret Capital 라이선스 아웃 | ||
| 2021년 | 2월 | GX-I7 (면역항암제) KG-Bio 라이선스 아웃 |
| 7월 | GX-19N 인도네시아 2/3상 시험 계획 승인 | |
| 11월 | 제넥신 마곡 신사옥 (제넥신 프로젠 바이오이노베이션 파크) 준공 및 사용승인 완료 | |
| 2022년 | 3월 | GX-E4 (지속형 빈혈치료제) KG-Bio 라이선스 아웃 |
| 본점 소재지 변경(성남시 분당구->강서구 마곡동) | ||
| 대표이사 변동(단독 대표이사 우정원-> 각자 대표이사 우정원, Neil Warma) |
나. 경영진의 중요한 변동
당사는 2021년 9월 1일 성영철, 우정원 각자 대표이사 체제에서 우정원 대표이사 단독체제로 전환하였고, 2022년 3월 29일 정기이사회에서 Neil Warma 대표이사의 취임으로 우정원, Neil Warma 각자 대표이사 체제로 변경하였습니다.
경영진 및 감사의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2021.03.29 | 정기주총 | 사외이사 신의철 기타비상무이사 이혁종 |
사내이사 서유석 | 사내이사 지희정 사외이사 안미정 |
| 2021.03.29 | 정기주총 | 사내이사 우정원 사내이사 홍성준 사외이사 Neil Warma |
사내이사 성영철 기타비상무이사 김영진 |
사내이사 서유석 사외이사 이태용 |
| 2021.09.01 | - | - | - | 대표이사 성영철 사임 |
| 2022.03.29 | 정기주총 | 사내이사 Neil Warma 사외이사 Peter Laivins 사외이사 배진건 감사 전현철 |
- | 사외이사 Neil Warma 사외이사 신의철 감사 백성기 |
다. 최대주주의 변동
| 변동일 | 최대주주명 |
|---|---|
| 2014.03.24 | (주)한독 |
라. 상호의 변경
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
마. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행중인 경우 그 내용과 결과
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
바. 회사가 합병등을 한 경우 그 내용
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
사. 회사의 업종 또는 주된 사업의 변화
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
아. 그밖에 경영활동과 관련된 중요한 사항의 발생 내용
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
3. 자본금 변동사항
[자본금 변동추이]
| (기준일: 2022년 11월 14일) | (단위 : 원, 주) |
| 종류 | 구분 | 본 공시서류 제출일 전일 |
23기 (2021년말) |
22기 (2020년말) |
|---|---|---|---|---|
| 보통주 | 발행주식총수 | 25,144,982 | 25,029,132 | 24,697,774 |
| 액면금액 | 500 | 500 | 500 | |
| 자본금 | 12,572,491,000 | 12,514,566,000 | 12,348,887,000 | |
| 우선주 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 기타 | 발행주식총수 | - | - | - |
| 액면금액 | - | - | - | |
| 자본금 | - | - | - | |
| 합계 | 자본금 | 12,572,491,000 | 12,514,566,000 | 12,348,887,000 |
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 2022년 11월 14일 |
) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 300,000,000 | - | 300,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 25,365,148 | 5,448,021 | 30,813,169 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | 220,166 | 5,448,021 | 5,668,187 | - | |
| 1. 감자 | 220,166 | - | 220,166 | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | 62,500 | 62,500 | - | |
| 4. 기타 | - | 5,385,521 | 5,385,521 | 우선주의 보통주 전환 | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 25,144,982 | - | 25,144,982 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 25,144,982 | - | 25,144,982 | - | |
나. 자기주식 취득 및 처분 현황
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
다. 자기주식 직접 취득·처분 이행현황
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
라. 자기주식 신탁계약 체결ㆍ해지 이행현황
당사는 본 공시서류 작성기준일 현재 해당사항이 없습니다.
마. 종류주식 발행현황
당사는 설립 이후 5종의 종류주식을 발행하였으며, 2019년까지 모든 종류주식이 보통주로 전환됨에 따라 본 공시서류 작성기준일 현재 발행된 종류주식이 없습니다.
5. 정관에 관한 사항
정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2022.03.29 | 제23기 정기주주총회 | - 본점의 소재지 이전 - 감사선임에 관한 조문 정비 |
- 회사 현황에 부합하도록 정관 정비 |
| 2019.03.22 | 제20기 정기주주총회 | - 사채발행한도 변경 - 상근감사로의 전환에 따른 감사위원회 관련 조항 삭제 |
- 회사 현황에 부합하도록 정관 정비 |
| 2018.03.29 | 제19기 정기주주총회 | - 감사위원회 구성에 따른 관련 조항 신설 | - 회사 현황에 부합하도록 정관 정비 |
II. 사업의 내용
1. 사업의 개요
[주요용어]
|
구분 |
내용 |
| 림프구 |
림프구는 무과립성 백혈구의 일종으로 면역 기능에 관여한다. 림프구에는 자연 살해 세포, T세포, B세포가 포함된다. |
|
B 림프구 (B 세포) |
면역 반응에서 외부로부터 침입하는 항원에 대항하여 항체를 만들어내는 림프구의 하나이다. |
| T 림프구 (T 세포) |
항원 특이적인 적응 면역을 주관하는 림프구의 하나이다. |
| effector T 세포 | 인간이 바이러스에 감염되거나 암에 걸리면 항원 특이적 미접촉 T 세포(naive T cell)가 세포분열 및 분화를 시작하여 대량의 이펙터 T 세포(effector T cell)가 생성됨 |
| IgD | 면역글로불린 D 혹은 IgD 는 항체 개별형 중 하나이다. 성숙 B 세포에서 또 다른 항체인 IgM 과 함께 공동발현 됨. IgD 는 혈액에 존재하는 면역글로불린 중 0.25%를 차지하며, 분자량은 약 185 kDa 이고 반감기는 2.8 일임 |
| IgG4 | IgG 의 subtype 중 하나로서 면역글로불린 G(IgG)는 항체 개별형 중 하나임. 동일한 중쇄 두 개와 경쇄 두 개로 된 단량체이고, 일반적인 항체의 형태인 Y 형으로 배열되어 있음. 각 IgG 에는 항원결합자리가 두 개 있음 |
| memory T 세포 (기억 T 세포) |
기억 T 세포는 항원을 인지한 T 세포가 분화 및 선별 과정을 거친 뒤 장기간 생존하고 있다가 나중에 항원이 재차 침입하였을 때 빠르게 활성화되어 효과 T 세포의 기능을 할 수 있는 잠재적 능력을 가진 세포를 말함 |
| Naive T Cell (미경험 T 세포) |
미접촉 T 세포는 분화와 성숙을 거쳤지만 아직 말초에서 항원을 만나지 못한 T 세포임 |
| ORR (Overall Response Rate) |
객관적 반응률(ORR)은 사전에 정의된 최소한의 기간 동안,사전에 정해놓은 양 이상의 종양 감소를 보인 환자의 비율을 말함. |
| OS (Overall Surival) |
치료 시작후 부터 사망에 이르는 기간환자별 편차가 크기 때문에 평균(average)가 아닌 중간값(median)을 기준으로 삼으며, 치료 또는 임상 시험 중 사망하지 않은 환자는 확인된 가장 긴 시간으로 산정 |
| 도움 T 세포 (CD4 T cell) | 도움 T 세포(Helper T cell, 또는 Th cell)는 효과 T 세포 중 다른 백혈구들의 분화 및 활성화를 조절함으로써 체액성 면역 및 세포성 면역을 촉진하는 세포를 말함. 세포 표면에 CD4 단백질을 가지고 있다는 특징 때문에 CD4 T 세포라고도 함. 보조 T 세포는 세부 기능에 따라 다시 Th1, Th2, Th17, Treg 등으로 분류됨 |
| 면역항암세포치료 | 자신 또는 타인의 혈액에서 직접 면역세포를 채취하여, 체외에서 활성 또는 배양을 한 후 환자의 체내로 넣어 주어 암세포 만을 선택적으로 살해하여 부작용 없이 종양을 제거하는 암 치료법 |
| CAR-T 세포치료제 | 키메라항원수용체를 보유한 T 세포치료제 |
|
자연살해세포 |
선천면역을 담당하는 세포의 일종. 바이러스 감염이나 악성 종양의 발생에서 중요한 1차 방어를 형성하는 역할을 함. 암세포치료제 개발 시 주요 표적 면역세포 중의 하나. |
|
수지상세포 |
항원제시세포 중 가장 전문적인 역할을 하는 세포. 선천면역과 적응면역의 가교 역할을 하여 감염이나 종양 등에대하여 항원특이적 면역반응의 개시를 매개하는 세포 |
|
사이토카인 |
신체 내의 세포, 특히 면역세포 사이에서 신호전달을 위하여 생성하고 분비하는 일련의 과정을 매개하는 단백질.각 사이토카인은 특정 세포군에 의해 생산되며, 작동하는 표적세포도 특화되어 있음. |
|
인터루킨 |
사이토카인의 일종. 주로 수지상세포나 혈액단구(monocyte), 상피세포(epithelial cell) 등에서 생산되어 분비됨. 주요 표적세포는 항암 면역능에 중요한 역할을 하는 자연살해세포나 세포독성 T세포 등임. 면역반응이 일어나는 여러 단계에 작용하여 그 반응을 조절함으로써 인체의 방어작용에 중요한 역할을 하며, 하나의 세포가 다양한 인터루킨을 생산하기도 하고 각각의 인터루킨은 중복되는 역할도 하지만 독특한 고유의 기능을 가지기도 함. |
|
인터루킨-2 |
직접적으로 T 세포에 작용하여 면역 관용과 활성을 조절하는 작용을 하며, 인터루킨 2는 주로 활성화된 CD4+ T 세포, CD8+ 세포, 자연살해세포(Natural Killer Cell, NK)에서 만들어짐. 인터루킨 2와는 다르게 면역을 억제하는 regulatory T cell (Treg)을 건드리지 않기 때문에 면역 효과가 좋을 수 있다고 알려짐. |
|
인터루킨-7 |
조혈세포의 성장인자로 작용하여 주로 골수나 흉수의 기질세포(stromal cell)에서 분비되며, 면역 세포인 T 세포와 B 세포의 증식, 생존 등을 유도해 면역세포의 활성을 도움. |
| 면역관문억제제 |
면역 T 세포가 과다하게 활성화되어 그 기능이 저하되는 것을 억제하는 치료제 |
| 관해 (Response Remission) |
어떤 심각한 질환이 경과하는 중에 자각, 타각증상과 검사성적이 일시적으로 호전되거나 대부분 소실되는 상 태, 완치와 다른 점은 재발 가능성이 있음 |
| 부분관해 (PR: Partial Remission) |
항암제 사용으로 인해 종양의 부피가 어느 정도 감소되는 경우 |
| 플라스미드 DNA (Plasmid DNA) |
세포내에 염색체와 별도로 존재하면서 독자적으로 복제/증식할 수 있는 염색체 이외의 원형 DNA |
| 출처: 당사 제공 |
가. 사업 영역
당사는 독자적인 원천기술인 hyFc 융합 단백질 및 DNA 백신 제조기술을 보유하고 있으며 이를 바탕으로 차세대 혁신 신약을 연구개발하는 바이오의약품 기업으로서 크게 두 가지 제품군의 치료제를 개발하여 사업화 하고 있습니다.
1) 차세대 유전자재조합 단백질 신약 : 당사의 고유 기반기술(hybrid Fc; hyFc)과 노하우 기술 (고생산 세포주 제조 및 공정개발 기술) 을 바탕으로 기존의 단백질 치료제에 비해 체내의 반감기 및 효능을 현저히 향상시킨 차세대 의약품 개발에 집중하고 있으며, 제품의 목표시장은 전 세계를 대상으로 사업 확장을 하고 있습니다.
즉, 당사의 hyFc 플랫폼은 FcRn과의 결합을 통해 약물이 자연스럽게 생체 내에서 재활용 될 수 있다는 점과 증가된 반감기에 따른 지속력을 최적화한 융합 단백질 플랫폼입니다. 기존에 약효 자체는 뛰어나지만 지속성이 짧은 약물들에 비해, 투여 주기를 늘려 편의성을 제고한 것이 가장 대표적인 사례입니다. 상기 기술은 기존 약물의 효능을 제고하였다 하여 '바이오베터(biobetter)’라고 통칭하기도 합니다.
hyFc는 'hybrid Fc' 의 약어로 말 그대로 항체의 일부 구조인 Fc를 혼합한 플랫폼 기술입니다. 기존 항체의 Fc 단편을 분리하여 융합시켜 개발한 기술로서 약효 자체는 뛰어나지만 지속성이 짧은 단백질 약물의 효능을 지속시키는 기전입니다. 당사는 인체에서 유래한 IgD, IgG4 항체로 플랫폼 구조를 구성하여, 자가면역반응과 같은 부작용을 최소화 하고 기존 효능을 극대화하는 플랫폼을 설계하였습니다. 이와 같은 고유의 플랫품 기술을 활용하여 기존 단백질 치료제를 개선한 바이오베터(biobetter) 뿐만이 아닌, 새로운 단백질을 적용한 신약 또한 개발하고 있습니다.
당사가 개발하고 있는 유전자재조합 단백질 치료제는 주로 암, 내분기계 질환, 면역계통 질환 등의 만성질환을 대상으로 합니다. 대표적 파이프라인으로 면역 세포를 증폭시켜주는 사이토카인인 인터루킨-7(Interleukin-7, IL-7)과 hyFc를 융합한 항암 면역치료제 (GX-I7)를 보유하고 있으며, 기존 단백질 치료제의 효능의 지속성과 투여 주기를 개선한 바이오베터인 지속형 인간성장호르몬 (GX-H9)과 빈혈 치료제 (GX-E4) 등을 개발하고 있습니다.
사업화의 핵심은 파이프라인별 파트너쉽과 기술이전에 있습니다. 항체융합단백질 치료제 파이프라인은 대부분 국내 및 해외 제약사와 공동개발 및 임상시험으로 진행되며 해당 제품의 상용화 또는 임상단계에서 글로벌 대형 기업으로의 기술이전을 목표하고 있습니다.
2) 유전자치료제 신약 : 당사는 혁신적인 DNA 벡터기술(유전체 운반 기술)을 기반으로 GX-188E (HPV16/18 유래 질환 치료 DNA 백신)을 개발하고 있습니다.
해당 기술은 면역반응을 유도하는 항원을 코딩하는 유전자를 plasmid DNA 내에 삽입하여 전기천공법으로 생체 내 주입하고, 체내에서 DNA 전사 및 번역 과정을 거쳐 단백질 및 펩타이드 형태로 발현된 항원이 면역반응을 유도하도록 만든 것입니다. 즉 당사의 GX-188E는 인유두종바이러스(HPV)의 HPV 16 및 HPV 18 type의 E6, E7 항원 특이적 T 세포 면역반응을 유도하는 DNA를 주입하는 기전이라고 할 수 있습니다.
치료 DNA백신의 경우, 최근 글로벌 선진 제약사들이 면역치료 요법에 관심을 가지면서 각광을 받고 있는 분야이고, 당사가 보유한 파이프라인이 해당 분야 세계 최초의 유전자 치료 백신을 지향하고 있으므로 그 부가가치가 매우 큽니다. 특히, HPV의 경우, 자궁경부암의 주요 발병 원인으로 약 70%가 HPV 16 및 18 타입에 의해 유발되며, 최근 HPV 양성 두경부암의 발생율도 증가되는 추세이므로, HPV로 인해 유발되는 암종을 타겟으로 한 치료백신 개발에 대한 수요가 매우 높습니다. 당사가 개발하고 있는 DNA백신 신약은 plasmid DNA 기반 항암 치료 백신으로서 자궁경부암에서 먼저 신약으로서 효능을 입증한 후, HPV양성 두경부암에 대해서도 임상시험을 통해 치료 효능을 검증할 계획입니다.
당사의 유전자치료제 신약은 후보물질의 신속한 개발, 간단한 공정을 통한 빠른 생산이 가능하고 안정적으로 면역반응을 유도할 뿐만 아니라 매우 안전하기 때문에 여러 감염증에 대한 예방백신으로 적응증 확대가 용이합니다. 당사는 지금까지 개발 경험을 바탕으로 엔데믹 및 미래 또 다른 바이러스의 팬데믹을 대비한 백신으로 차세대 백신 기술개발을 이어갈 것입니다. 또한, 당사는 개발위험을 최소화하기 위하여 정부과제를 최선을 다해 활용하고 기반기술 자체에 대한 사용 허여 등 각 포트폴리오별, 제품별로 가장 적합한 사업화 계획을 수립하고 이를 추진하고 있습니다.
나. 회사의 영업 및 생산
당사는 신약 연구개발 기업으로, 원천기술을 바탕으로 다수의 제약사에 기술을 이전함으로써 매출을 실현하고 있습니다. 기술이전된 제품의 개발이 성공적으로 완료되는 경우, 당사로부터 기술이전을 받은 국내·외 제약사가 해당 지역의 영업 및 생산을 담당할 예정입니다.
당사가 추진하고 있는 기술이전계약은 단순히 기술이전 만으로 종료되는 일반적인 형태가 아니라 아래의 사업화 전략에서 설명하듯이 대부분 기술이전 후 협업을 통한 공동개발의 형태로 진행되고 있습니다.
1) 사업화 전략
사업화의 핵심은 파이프라인별 파트너쉽 및 상용화와 기술이전에 있습니다. 대부분 국내 및 해외 제약사와 공동개발을 통한 임상시험으로 진행되며 해당 제품의 상용화 또는 임상단계에서 글로벌 대형 기업으로의 기술이전을 목표하고 있습니다.
단기 수익의 창출은 국내 및 해외 제약사로의 조기 기술이전을 통한 기술료로 발생되며, 중장기적인 수익은 임상2상 이후 해외 글로벌 제약사로의 기술이전을 통한 기술료 및 로열티로 발생되며 또한 상용화에 따른 기술료, 로열티 수취로 수익창출이 이루어집니다.
사업화를 위한 제품의 개발 전략은 크게 세가지로 분류하고 있습니다.
가) 차세대 유전자재조합 단백질 신약
[GX-I7, 혁신 항암면역 치료제]
면역관문억제제로 대표되는 항암면역치료제는 3세대 항암제로 각광받고 있는 치료제로 1세대인 세포독성항암제와 2세대인 표적항암제를 거쳐 새로운 암 치료 패러다임으로 자리잡고 있습니다. 항암면역치료제를 통해 환자 고유의 면역시스템을 자극하여 암을 치료할 수 있다는 점에서 기존 치료법과 구분되며, 강한 암세포 특이적인 면역 반응을 유도하여 재발암과 치료제에 내성이 생긴 암에 대해서도 항암 효과를 입증하고 있어 미래 치료제로서 부각되고 있습니다.
전 세계 바이오의약품 업계에서는 체내에 존재하는 다양한 면역 구성 요소를 활용한 면역항암제가 활발히 개발 중에 있으며, 상기 면역관문억제제 및 면역세포치료제의 대다수는 T세포를 기반한 치료법 입니다.
| [2018 ~ 2020년 타깃 세포 유형에 따른 후보 물질 개수] |
 |
|
2018 - 2020년 타깃 세포 유형에 따른 후보물질 |
| 자료 : 한국제약바이오협회, 면역항암제 개발 동향 |
이렇듯 대다수의 면역관문억제제는 T세포를 억제하는 단백질의 활성을 차단하는 기전을 가지고 있으며, 면역세포치료제는 체내의 T세포를 확보하여 암세포 표면에 있는 특이 항원을 선택적으로 잘 인지해 공격할 수 있도록 유전공학적으로 변형시켜 체내에 다시 넣어주는 과정을 통해 환자의 몸에서 암세포만 선택적으로 제기하도록 유도하는 치료방법의 하나입니다. 이와 같이 항암면역치료에서 T세포가 중요한 역할을 하고 있으며, 림프구의 약 70%를 차지하는 T세포의 수는 암환자의 생존율과도 유의미한 상관관계를 보이고 있습니다. 따라서, 항암치료에 앞서 림프구의 수를 증가시켜 암환자의 예후를 향상시키는 것이 중요하다는 것을 알 수 있으며, 특히 림프구의 70%를 차지하고 암세포 살상에 핵심 역할을 하는 T세포의 수를 증가시키는 것은 항암면역치료 분야의 핵심사항이라고 볼 수 있습니다.
| [혈중 림프구 수와 생존율과 상관관계] |
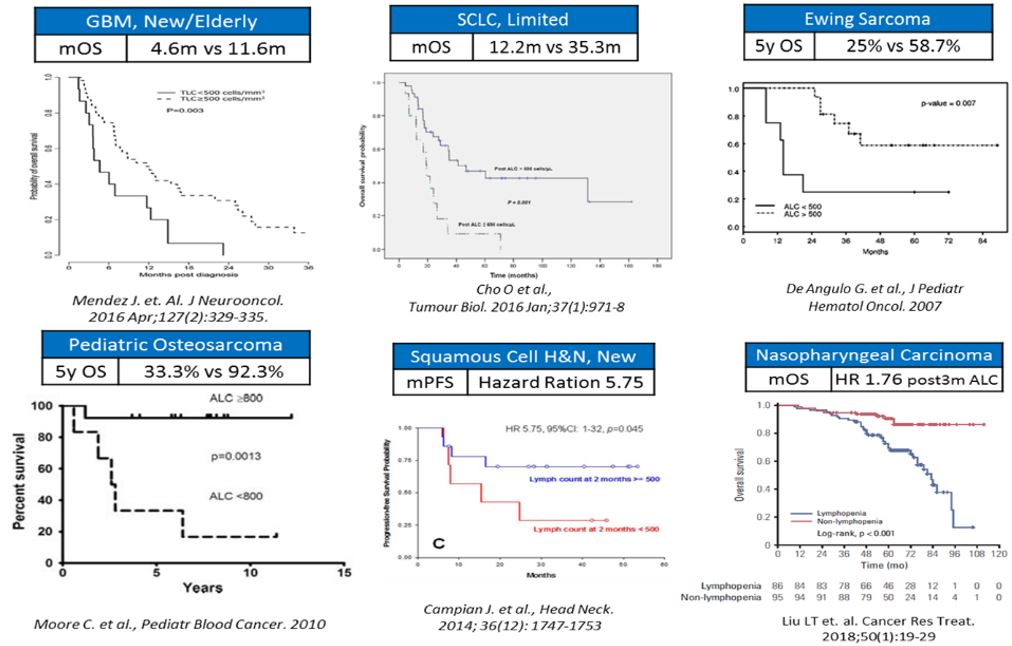 |
|
혈중 림프구 수와 생존율과 상관관계 |
| 출처 : 당사 제공 |
이처럼 항암 면역반응을 극대화하기 위해서는 기존의 면역관문억제제 등의 약물이 관여하는 T세포의 기능(Quality) 향상뿐만 아니라 세포 수(Quantity)의 증가 또한 필수적입니다. 당사가 개발하는 GX-I7은 지속형 인터루킨-7(Interleukin-7, IL-7)으로 각종 화학항암제나 방사선치료요법으로 급격히 줄어든 T세포의 수를 증가시켜 보다 근본적으로 면역력 증진에 도움을 주는 T cell Amplifier(T 세포 증폭제) 이며, 전 세계적으로도 유일한 First-in-Class 제품입니다. IL-7은 T세포 증식에 필수불가결한 사이토카인이며, 현재 항암 면역치료제로 개발되고 있는 대표적 사이토카인으로 IL-7 이외에 IL-2, IL-15 그리고 IL-10이 있습니다. 현재까지 알려진 인터루킨은 약 35가지에 달하며 각기 다른 기능을 가지고 있으나, 연구개발 진행중인 사이토카인의 대부분은 T cell Activator(T세포 활성제)로 해당 기전을 중심으로 연구 개발이 집중되어 오고 있으나 naive(미접촉) 및 memory(기억) T세포의 증식을 일으키는 주요 인터루킨은 IL-7입니다.
당사는 hyFc 플랫폼을 활용하여 자연적 구조로는 매우 불안정한 인터루킨 7을 융합시키고 추가 엔지니어링으로 안정화시켜 생산에 성공함으로써 유일한 T세포 증폭제로의 독자적인 면역치료제 파이프라인 개발을 전략적으로 계획하였습니다. 그리고 당사의 파이프라인 역시 단독요법 보다는 기존 화학항암제, 표적항암제와의 병용요법, 다른 타겟의 면역항암제와의 상호 보완적인 기전을 통해 항암효과 및 전체 생존율의 증대 등의 시너지 효과를 기대하고 있습니다. 따라서 기존 의약품 시장에서의 주력 제품들은 당사의 제품과 경쟁 관계가 아닌 협력관계에 있으며, 병용 처방을 통해 상호 보완적인 시너지 효과를 발휘할 것으로 기대하고 있습니다.
당사가 진행하고 있는 적응증별로의 한국 시장을 살펴보면, 2021년 기준 삼중음성유방암은 1,689억원, 폐암은 9,288억원, 현미부수체안정형 대장암은 4,0 00억원, 췌장선암은 2,608억원, 교모세포종은 32억원, 두경부암 8억원 등 총 1조 7,626억원에 달하고 있습니다. GX-I7은 T 세포의 증폭을 돕는다는 점 에서 면역항암제와 보완적 관계에 있지만, 보수적으로 GX -I7이 면역관문억제제와 병용투여 되는 것이 아닌 T 림프구감소증을 회복시키는 2차 치료제로 사용됨을 가정했을 때, GX-I7의 잠재적 시장 규모는 3,264억원으로 추정하고 있습니다.
당사의 GX-I7은 IL-7을 기반으로 한 First-in-Class 제품이라는 점에서 차별성을 가지고 있으며, 유의미한 임상시험 결과를 바탕으로 성공적인 시장진입 시 경쟁력을 갖출 수 있을 것으로 기대됩니다. 자세한 임상시험 결과 사항은 '제2부 발행인에 관한 사항 내용의 II. 사업의 내용 - 6. 주요계약 및 연구개발활동' 을 참고해주시길 바랍니다.
[GX-H9, 지속형 인간성장 호르몬 결핍증 치료제]
글로벌 의약품 조사기관 IQVIA에 따르면 2021년 기준 전세계 GH(Growth Hormone, 성장호르몬) 시장의 규모는 50억달러로 규모가 큰 시장입니다. 현재 사용되는 1세대 성장호르몬 결핍증 치료제는 Norditropin®, Genotropin®, Omnitrope®가 있습니 다. Norditropin®의 글로벌 점유율은 44% 글로벌 매출액은 약 22.5억달러, 유럽 매출액은 약 4.3억달러로 추정됩니다. 나아가, Genotropin®의 글로벌 점유율은 11%, 글로벌 매출액은 5.7억달러, 유럽에서의 매출액은 약 1.1억원으로 추산되고 있습니다. Omnitope®의 글로벌 점유율은 9%이며 글로벌 매출액 은 4.6억달러, 유럽에서의 매출액은 0.9억달러로 추산되고 있습니다.
위의 1세대 호르몬 치료제는 매일 투여을 해야 하는 등 투여 편의성이 좋지 않 아, 최근 한국을 포함한 글로벌 회사들이 다양한 기술을 이용하여 투여 횟수를 줄일 수 있는 지속형 성장호르몬 제품을 개발하고 있습니다. 글로벌 리서치 기관인 Global Data에 따르면 2세대 지속형 치료제는 2030년까지 시장의 약 90% 이상을 점유할 것으로 전망하였습니다. 지금까지 성장호르몬 시장에서 지속형 2세대 제품으로 선두에서 개발하고 있는 회사는 Ascendis社, Opko社, NovoNordisk社 등 제한적인 상황입니다. 현재 성공적으로 출시된 지속형 2세대 제품으로는 주 1회 투여하는 Ascendis社의 소아성장호르몬 결핍 환자를 대상으로 하는 Skytofa 그리고 Novo Nordisk社의 성인성장호르몬 결핍 환자를 대상으로 하는 Sogroya가 있습니다.
당사의 GX-H9은 임상2상에서 1세대 성장호르몬 대비 동등 이상의 키성장 속도와 우수한 안전성 프로파일을 보여주었습니다. 따라서, GX-H9은 우수한 효능 및 월2회 제형 개발가능성으로 상용화된 제품 또는 현재개발중인 지속형 제형들과의 차별성을바탕으로, 제품개발을 가속화한다면 글로벌 제약사들과 함께 지속적으로 성장하는 성장호르몬시장을 선도할 수 있을것으로 예상됩니다. 현재 경쟁약물 개발현황은 다음과 같습니다.
| [GX-H9 경쟁약물 개발현황] |
 |
|
GX-H9 경쟁약물 개발현황 |
| 자료 : 당사 제공 |
선제적으로 유럽 시장을 타겟으로 임상시험을 진행한 이유는, 글로벌 hGH 시장의 19%의 큰 부분을 차지하고 있기 때문이며, 향후 임상 3상을 미국, 유럽 등의 선진국에서 진행을 계획하고, 코카시안 데이터를 확보하기 위함이었습니다. 향후 다국가 임상 3상을 수행할 계획이며, 자세한 임상결과 사항은 '제2부 발행인에 관한 사항 내용의 II. 사업의 내용 - 6. 주요계약 및 연구개발활동'을 참고 해주시길 바랍니다.
현재 당사의 GX-H9은 중국 I-MAB社와 함께 오픈 이노베이션을 통한 임상 3상을 수행하고 있으며, 임상3상 결과를 통하여 진출 가능한 국가에 먼저 기술이전하여 수익을 창출할 계획입니다.
[GX-E4, 지속형 빈혈치료제]
만성신부전증에 의한 빈혈은 erythropoietin(EPO) 생성 부족에 의하여 발생하며, ESA(Erythropoiesis stimulating agent) 중 EPO가 주요한 치료제입니다. 1세대 치료제인 속효성(Short-acting) EPO 제품으로는 Amgen社가 출시한 Epogen을 선두로 다양한 바이오시밀러 들이 출시된 상황이며, 2세대 지속형(Long-acting) EPO 제품으로는 Amgen/Kyowa Kirin社가 출시한 Aranesp®/Nesp®, 그리고 Roche社가 출시한 Mircera®가 전 세계적으로 상용화되어 보급되고 있습니다.
글로벌 리서치 기관인 글로벌데이터에 따르면 주요 8개국 시장의 만성신장질환으로 인한 빈혈 환자 수는 2019년 400만명에서 2029년 450만명으로 늘어날 것으로 예측됩니다. (출처: GlobalData, Chronic Kidney Disease-Anemia: Epidemiology Forecast to 2029).
또한, 글로벌 의약품 조사기관 IQVIA에 따르면 2021년 전세계 EPO 시장의 매출액은 69 억달러 수준으로 그 중 2세대 치료제인 지속형 EPO의 점유율은 약 39%입니다. 전세계 EPO 제품의 판매량은 꾸준히 상승하는 추세로 2018년 기준 1.7 억 개에서 2021년 기준 2.0 억 개로 증가하였습니다. 그 중 지속형 EPO의 판매량은 2018년 기준 3천 1백만개에서 2021년 기준 3천 3백만개로 증가하였습니다.
글로벌 리서치 기관인 Evaluate Pharma에서 제공하는 EPO 제품의 예상 매출액 자료에 따르면 지속형 EPO의 점유율은 지속적으로 증가하여 2028년에는 62.8%까지 상승할 것으로 분석되었습니다.
당사의 GX-E4는 생체 내 존재하는 IgG4 와 IgD의 부위 중 세포 독성 기능이 없는 서열을 사용한 기반기술을 바탕으로 개발되어 세포독성이 없으며, 타 제품(Aranesp®) 대비 약동학적 프로파일의 변동폭이 낮아 ESA의 장기 투여에 따른 부작용 수준이 낮을 것으로 예상됩니다.
만성신장질환에 의한 빈혈 환자들에게는 10~12g/dL에 이르는 적정 수준의 헤 모글로빈 수치 유지가 매우 중요하며, 임상 3상에서 GX-E4는 경쟁 약물인 Mircera® 대비헤모글로빈반응율(기저치 대비 헤모글로빈 수치를 1.0g/dL 이상 상승하면서 수혈없이 10~12g/dL를 유지하는 환자의 비율)에서 유사한 결과를 보여주고 있습니다.
자세한 임상시험 결과 사항은 '제2부 발행인에 관한 사항 내용의 II. 사업의 내용 - 6. 주요계약 및 연구개발활동' 을 참고해주시길 바랍니다.
GX-E4는 Aranesp® 및/또는 Nesp®와 Mircera® 대비대체가능한유효성과안전성을 보일 것으로 예상되고 있으며, 지속형 EPO 시장에서가격경쟁력을 바탕으로최대 점유율은 30% 이상이 될 것으로 기대하고 있습니다.전세계 지속형 EPO 시장에서 점유율 30%을 달성할 경우, GX-E4의 최대 연간매출 규모는 약 8 억달러 이상이 될 것으로 전망하고 있습니다.
당사의 GX-E4는 한국, 중국, 인도네시아등 아시아 시장을 1차 타겟 시장으로 계획하고 있으며, 해당 시장에서 효능과 시장 점유율을 확인하면서 동시에 파트너사와 함께유럽을 포함한 다국가 임상을 통해 진출 시장을 확장할 계획에 있습니다.
나) 유전자치료제 신약
[GX -188E, HPV16/18 유래 암 치료 DNA 백신]
당사는 혁신적인 DNA 벡터기술과 플랫폼 기술을 통해 HPV (인간유두종바이러스) 16/18 유래 질환 치료 DNA 백신인 GX-188E를 개발하고 있습니다. DNA백신은 기존의 약품으로는 예방/치료하기 어려운 질환에 적용할 수 있으며, 바이오 산업분야에서는 차세대 신기술에 속합니다.
당사는 해당 원천기술을 이용한 혁신적인 바이오 신약 개발을 통해 시장형성 초기단계에서 신속한 시장 장악이 가능한 사업화를 준비하고 있습니다. 자궁경부암(cervical cancer)은자궁의 입구인 자궁경부에 발생하는 여성 생식기 암으로 전세계적으로 여성암사망률 2위를 기록하고, 20대 이하에서의 발생률이 지속적으로 증가하고 있는 것으로 알려져 있습니다. 국내 여성 암 중 유방암, 위암, 대장암, 갑상선암에 이어 발생 빈도가 5위를 차지하며, 2014~2018년 기준 자궁경부암의 국내 5년 생존율은 80.5%로 알려져 있습니다 (ASTI market insight 2022-082). 하지만 말기의 경우 5년 생존율은 원격 전이를 동반한 Stage IV의 경우 18%로 집계되고 있습니다. (출처: https://www.cancer.org)
WHO 산하기관인 IARC(International Agency for Research on Cancer) 조사 결과에 따르면 2020년 기준 전세계의 자궁경부암 발병자수는 약 60만명에서 2040년 85만명으로 증가할 것으로 예상되고 있습니다. 2020년 기준 5년 유병자수는 약 150만명이며, 국내의 경우 발병자수는 약 3천명 그리고 5년 유병자수는 약 1만명입니다. 또한 American Cancer Society는 2022년에 미국 내에서만, 약 14,100건의 새로운 침습성 자궁경부암이 진단되고, 4,000명 이상의 여성이 사망할 것으로 추정하고 있습니다.
글로벌 리서치 기관인 글로벌데이터에 따르면 8MM(8개 주요 국가: 미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본, 중국)의 자궁경부암 치료제 시장 규모는 2020년 6억달러에서 2030년 48억달러까지 연평균 23.0% 성장할 것으로 전망하고 있습니다. 비록 지난 40년 동안, 파파니콜로 검사(Papanicolaou test)의 사용 증가, 효과적인 선별, 그리고 예방적 HPV 백신의 개발 (예, Gardasil, Gardasil 9, Cervarix)로 인하여 독일, 이탈리아, 스페인, 일본, 한국 등의 특정 국가에서는 자궁경부암의 발생률이 감소하는 추세지만 그 폭이 매우 적고, IARC 조사 결과와 같이 아프리카와 중국을 포함한 아시아에서의 발생률과 시장 규모가 지속적으로 증가할 것으로 예상되어 특정 국가의 자궁경부암 발생률 감소는 시장에 미치는 영향이 미미한 것으로 분석되었습니다. 이러한 자궁경부암의 지속적인 시장 규모 성장의 요인들은 고령화와 자유로운 성문화, 흡연과 면역 결핍 등이 있으며(American Cancer Society, 2021 & Mayo Clinic, 2021), 자궁경부암으로 인한 심장병, 간질환, 고혈압, 위장질환 등의 합병증 위험성도 제기되어 왔습니다(Shin et al., 2008).
그리고 글로벌데이터에 따르면 고가의 치료제가 주로 사용되는 Immunotherapy의 시장 점유율이 2020년 14%에서 2030년 59%로 증가할 것으로 예상되고 있습니다. 이와 같이 자궁경부암 환자수와 자궁경부암 시장 규모 모두 증가할 것으로 예상되며 특히 GX-188E가 포함된 Immunotherapy의 점유율이 크게 증가할 것으로 예상되고 있습니다.
현재 자궁경부암을 예방하기 위한 백신은 널리 알려진 미국 Merck社의 '가다실' 과 '가다실9' 제품 2종 그리고 영국 GSK社의 '서바릭스' 가 있으나, 자궁경부암 치료 백신은 없습니다.
현재 국내에서 진행중인 GX-188E와 키트루다를 병용 투여한 임상 1b/2상의 결과는 키트루다를 단독 투여한 KEYNOTE-158 연구 및 2021년 미국 FDA에서 2차 치료제로 승인된 ADC약물인 티소투맙보다 증가된 효과와 안전성을 보여주어, 자궁경부암 2차 치료제 시장에서 최대 점유율은 15% 이상이 될 것으로 기대하고 있습니다. 이러한 경우 GX-188E의 최대 연간매출 규모는 약 1.7억 달러가 될 것으로 전망하고 있습니다.
WHO 산하 기관인 IARC(International Agency for Research on Cancer) 조사 결과에 따르면 2020년 기준 전세계의 두경부암 발병자수는 약 90만명 그리고 5년 유병자수는 약 240만명이며, 국내의 경우 발병자수는 약 5천명 그리고 5년 유병자수는 약 1만 6천명입니다.
글로벌 의약품 조사기관인 글로벌데이터에 따르면 8MM(8개 주요 국 가: 미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본, 중국)의 두경부암 관련 시장 규모는 2020년 20억달러에서 2030년 50억달러까지 연평균 9.8% 성장할 것으로 전망하고 있습니다. 두경부암 면역치료제의 시장 점유율은 2020년 기준 약 50% 수준이며, 이중 81%가 2차 치료제를 사용한다는 것을 고려하였을 때 DNA 치료제는 두경부암 시장의 41%를 타겟하고 있으며, 면역항암제 시장이 급격히 확대되고 있음을 감안했을 때, 그 시장은 점차 확대된다고 예측하고 있습니다.
당사와 유사한 DNA 백신 플랫폼을 기반으로 HPV 16/18 유래 암치료백신을 개발 중인 회사는 대표적으로 미국 Inovio社의 VGX-3112 및 Nykode社의 VB10.16이 있고, 유사한 환자군을 대상으로 임상2상을 진행 중입니다. HPV 유래 암을 타겟으로 한 암치료백신의 약물 개발현황은 다음과 같습니다.
| [GX-188E 경쟁약물 개발현황] |
 |
|
경쟁약물 개발현황 |
| 출처 : 당사 제공 |
국외에서는 전이성/재발성 자궁경부암에 대한 면역치료요법으로서 면역관문억제제, 항체-약물 복합체(ADC), 항 TGF-β 치료제, 치료백신, 종양 침윤 T세포 주입법 등 다양한 치료제가 단독 또는 병용요법으로 임상 진행 중 입니다. 이 중 ADC 기술을 활용한 품목 (Tivdak)이 24%의 객관적 반응률로 지난 2021년 자궁경부암의 2차 치료제로서 FDA에서 신속 허가된 사례가 있습니다. 그 외 키트루다는 2018년 PD-L1 양성 종양 환자의 2차 치료제로 승인되면서 자궁경부암 치료제로 FDA 승인을 받은 최초의 체크포인트 억제제로, 현재 미국에서 약 50%의 2차 환자에게 키트루다가 처방되고 있습니다.
또한, 키트루다는 2021년 미국 FDA에서 자궁경부암 1차 치료로 허가 받았으며 글로벌데이터에 따르면, 연평균 약 25.5% 증가하여 2030년 전체 자궁경부암 시장의 약 20% 정도를 점유할 것으로 추정됩니다.
2022 ESMO 학회에서 발표된 GX-188E와 키트루다®의 병용투여 임상1b/2상 결과, 유효성 평가군 60명 환자에 대한 객관적 반응률(ORR: Objective Response Rate)이 31.7%로 나타났으며, 이 중 완전관해 비율은 10%입니다. 키트루다 단독요법에서 PD-L1 음성 종양 환자의 객관적 반응률은 0%에 비해, GX-188E와 키트루다 병용요법에서는 25%의 객관적 반응률을 보였습니다. 반응지속기간의 중앙값(median DOR: Duration Of Response)은 12.3개월, 전체생존기간의 중앙값(median OS: Overall survival)은 17.2개월로 치료 반응과 생존기간 연장을 입증했습니다. 안전성 평가군에서도 병용요법임에도 키트루다 단독요법과 유사한 수준의 안전성과 내약성을 나타냈습니다. 병용요법임에도 부작용이 크게 증가하지 않았고, 무엇보다 PD-L1 발현과 관계없이 치료 반응 및 생존기간 연장을 확인할 수 있었습니다.
GX-188E는 기존 면역치료제의 제한된 효능으로 고통받고 있는 환자들에게 PD-L1 발현 여부와 상관없이 치료를 제공할 수 있기 때문에, 향후 면역치료제 시장이 점차 확대되는 것으로 예측되어 그 시장성은 매우 우수하다고 할 수 있습니다.
자궁경부암 예방백신의 보급 및 국가 암 검진사업이 진행되고 있지만, 국내 자궁경부암 환자의 발생율은 지난 10년간 큰 변화를 보이지 않고 있으며(2019년 보건복지부 암 통계), 여전히 매년 3,000명 이상이 새로운 자궁경부암으로 진단받고, 약 900명이 사망하고 있습니다. 또한 자궁경부암의 경우 자궁경부전암의 징조가 있더라도 암이 서서히 진행되며 초기에는 증세가 심각하지 않기에 심각성을 인지하는데 시간이 걸리며, 정기검진을 통해 진단이 되어도, 일단 HPV 바이러스가 침투하여 인체 세포에 안착하면 바이러스를 제거할 수 있는 치료제가 없습니다. 즉, 기존 예방백신으로는 이미 암 세포로 변형하고 있는 세포를 공격하여 퇴치할 수 없기에, 자궁경부암 치료제 개발에 대한 의학적 미충족 수요는 여전히 높다고 판단하고 있습니다.
또한 치료 DNA백신의 경우, 최근 글로벌 선진 제약사들이 면역치료 요법에 관심을 가지면서 각광을 받고 있는 분야이고, 제넥신이 보유한 파이프라인이 해당 분야 세계 최초의 유전자 치료 백신을 지향하고 있으므로 그 부가가치가 매우 큽니다. 특히, HPV(인간 유두종 바이러스)의 경우, 자궁경부암의 주요 발병 원인으로 약 70%가 HPV 16 및 18 타입에 의해 유발되며, 최근 HPV 양성 두경부암의 발생율도 증가되는 추세이므로, HPV로 인해 유발되는 암종을 타겟으로 하는 치료백신 개발에 대한 의학적 미충족 수요가 매우 높습니다.
당사가 개발하고 있는 물질은 plasmid DNA 기반 항암 치료 백신으로서 자궁경부암에서 먼저 신약으로서 효능을 입증한 후, 다른 암과 연계된 항원을 타겟으로 또 다른 항암 치료용 DNA 백신 개발을 위한 초석이 될 것으로 기대하고 있습니다.
자세한 임상결과사항은'제2부 발행인에 관한 사항 내용의 II. 사업의내용- 6. 주요계약 및 연구개발활동' 을 참고해주시길 바랍니다.
2) 생산 현황
당사는 현재 신약을 연구개발하는 기업의 특성상 제품의 판매를 위한 생산활동을 하고 있지 않습니다. 다만, 임상시험 수행과 상용화 준비를 위한 생산 활동을 지속적으로 CDMO를 통하여 수행하고 있습니다.
다. 신규 사업 등의 내용 및 전망
당사가 진행 중인 제품들은 모두 당사가 보유하고 있는 고유 원천기술을 기반으로 개발되고 있습니다. hybrid Fc 원천기술은 호르몬, 펩타이드, 사이토카 인 등 경쟁력 있는 다양한 지속형 단백질 제품개발에 적용이 가능한 기반기술이며, 현재 개발중인 제품 포함, 다양한 유전자재조합 단백질 신약에 폭넓게 적용되어 위의 주요 사업화 대상 파이프라인 외에도 연구개발 및 임상시험을 진행하고 있습니다.
아울러 정부 차원에서 신약 연구개발의 중요성을 감안하여 다양한 정부과제를 통해 연구개발비 지원을 지속적으로 확대하고 있으므로, 당사는 이에 적극적으로 참여함으로써 향후 신규 사업의 추진에 있어서 객관적인 평가와 공신력을 획득하고 정부의 연구개발 진도 관리에 따라 과제의 성공가능성을 높일 계획입니다.
[GX -G3, 호중성 백혈구 감소증 치료제]
GX-G3는 호중성 백혈구 감소증 치료제로써 G-CSF(Granulocyte-Colony S timulating Factor) 에 hyFc 기술을 융합시킨 물질이며, 골수에 작용하여 과립성 백혈구와 줄기세포의 생산을 촉진하는 지속형 G-CSF 입니다. 임상 1상 시 험을 통해 안전성 및 내약성에 문제 없음을 확인하였고, 한국 및 유럽 포함 다국가 임상 2상을 진행하여 비교군인 뉴라스타와 유사한 효능을 확인하였습니 다. 향후 다국가 임상 3상은 터키의 일코젠(ILKOGEN) 주도로 진행될 계획입니다. 글로벌 호중구 감소증 치료제 시장은 약 8조원대로 추정되며, 높은 성장 가능성이 예상되는 시장입니다.
[GX -G6, 당뇨병/ 비만 치료제]
GX-G6는 제2형 당뇨병 치료제와 비만 치료제로써 GLP-1(Glucagon-like p eptide-1) 에 hyFc 기술을 융합시켜 GLP-1 리셉터에 대한 작용제(agonist) 로 역할하는 지속형 GLP-1입니다. GX-G6는 GLP-1 수용체의 활성화를 통해 식사 후 인슐린 분비를 자극하는 역할을 할 뿐만 아니라 췌장 외 작용으로 포만 감을 촉진하고 위 배출을 지연시켜 체중을 줄이는 데 도움이 됩니다. 현재 임상 1상시험을 완료하여 안전성 및 내약성에 문제 없음을 확인하였으며 경쟁 약물이자 표준치료제인 Trulicity 대비 심장에 미치는 부작용이 적음을 원숭이 실험을 통해서 확인했습니다. 현재 치료제로써 효능을 입증하기 위해 중국 소재 파트너사로 기술이전 되어 제2형 당뇨와 비만 각 적응증에 대해 중국에서 임상2상을 진행 중에 있습니다. GLP-1 리셉터에 대한 작용제 시장 규모는 2020년 기준 150억달러 수준이며 매년 8% 가량 성장할 것으로 예상하고 있습니다.
2. 주요 제품 및 서비스
공시 일 현재 당사가 개발하고 있는 주요 개발제품 등의 진척상황은 다음과 같습니다
| [면역항암제] |
| PRE-CLINICAL : ◆ | PHASE 1 : ■□□ | PHASE 2 : ■■□ | PHASE 3 : ■■■ |
| 파이프라인 | 주요 차별점 | 적응증 | 임상 시험유형 | 임상단계 |
|---|---|---|---|---|
| GX-I7 |
종양 ■ 림프구감소증의 개선 ■ T 세포 면역 강화를 통한 항암 효과 향상 |
대장암, 유방암, 난소암,자궁경부암, 소장암, 항문암 |
단독 |
■ □ □ Phase 1b |
|
직장암, 담도암, 대장암, 위암, 십이지 장암 |
병용 (싸이클로포스파마이드) |
■ □ □ Phase 1b |
||
|
교모세포종 |
단독 |
■ □ □ Phase 1b |
||
|
삼중음성유방암 |
병용 (Keytruda®) |
■ ■ □ Phase 1b/2 |
||
|
교모세포종 (재발성) |
병용 (Avastin®) |
■ ■ □ Phase 2a |
||
|
교모세포종 (신환) |
병용 (Temodal®) |
■ ■ □ Phase2 (I-MAB 공동임상) |
||
|
교모세포종 |
단독 |
■ □ □ Phase 1 (NIT 공동임상) |
||
|
교모세포종 |
병용 (Temodal®) |
■ ■ □ Phase 1/2 (NIT 공동임상) |
||
|
고위험 피부암 |
병용 (Tecentriq®) |
■ ■ □ Phase 1b/2a (NIT 공동임상) |
||
|
삼중음성유방암, 췌장암, 비소세포폐암, 소세포암, 대장암 |
병용 (Keytruda®) |
■ ■ □ Phase 1b/2a |
||
|
전이성 위암, 식도선암, 위-식도 접합 부암 |
병용 (Opdivo®) |
■ ■ □ Phase 2 (NIT 및 Bristol Myers Squibb 공동임상) |
||
|
미만성거대B세포림프종 |
병용 (Kymriah®) |
■ □ □ Phase 1b (NIT 공동임상) |
||
|
감염성질환 ■ 림프구감소증의 개선 ■ 백신으로 인한 세포성 면역반응의 강화 |
특발성 CD4 T 림프구감소증 |
단독 |
□ □ □ In preperation (NIT 공동임상) |
|
|
예방백신 (고연령 암생존자) |
병용 (백신) |
■ □ □ Phase 1/1b (NIT 공동임상) |
||
|
COVID-19 |
단독 (표준치료법) |
■ □ □ Phase 1 |
||
| GX-188E |
■ 인유두종 바이러스(HPV) 16 또는 18형에 감염 되어 발병하는 자궁경부암을 치료하는 면역치료 DNA 백신 ■ GX-188E DNA 백신과 면역 관문 억제제 의 병용 투여를 통해, 더 이상 효과적인 치료 수단이 없는 말기 자궁경부암 환자에게 향 상된 치료효능을 제공 |
진행성/재발성 자궁경부암 |
병용 (Keytruda®) |
■ ■ □ Phase 1b/2 |
| [희귀질환치료제] |
| PRE-CLINICAL : ◆ | PHASE 1 : ■□□ | PHASE 2 : ■■□ | PHASE 3 : ■■■ |
|
파이프라인 |
주요 차별점 |
적응증 |
임상 시험유형 |
|---|---|---|---|
|
GX-H9 |
■ 주1회 또는 월2회 투여 ■ 매일 주사의 부담감 해소 ■ 일일 제형 대비 향상된 치료 효과 |
성인 성장호르몬 결핍증 |
■ ■ □ Phase 2 |
|
소아 성장호르몬 결핍증 |
■ ■ ■ Phase 3 |
||
|
GX-G8 |
■ 주 1회 지속형 GLP-2 ■ 상용화된 일일 제형 대비 향상된 장의 기능과 성장 유도 |
단장 증후군 |
■ □ □ Phase 1 |
| [기타] |
| PRE-CLINICAL : ◆ | PHASE 1 : ■□□ | PHASE 2 : ■■□ | PHASE 3 : ■■■ |
|
파이프라인 |
주요 차별점 |
적음증 |
임상 시험유형 |
|---|---|---|---|
|
GX-E4 |
■ 월 1회 또는 월 2회 투여 |
만성 신장 질환 관련 빈혈 |
■ ■ ■ Phase 3 |
|
GX-G3 |
■ PEGylated G-CSF 대비 긴 반감기 ■ PEGylated G-CSF 대비 향상된 효력과 안전성 |
호중구감소증,골수억제 항암제를 복용하는 비골수성 기형증 |
■ ■ □ Phase 2 |
|
GX-G6 |
■ 주 1회 또는 월 2회 투여 지속형 GLP-1 ■ 안전성 증가를 위한 수용체 결합력 최적화 |
제 2형 당뇨병 |
■ ■ □ Phase 2 |
|
GX-P1 |
■ T 세포 면역관용유도를 기반으로 하는 혁신적 기전 |
자가면역질환 |
■ □ □ Phase 1 |
3. 원재료 및 생산설비
가. 원재료
1) 매입 현황
| (단위 : 천원) |
| 매입유형 | 품 목 | 구 분 | 2022년 (제24기 3분기) |
2021년 (제23기) |
2020년 (제22기) |
| 연구 개발비 | 시약재료비 | 국 내 | 2,181,607 | 5,231,426 | 5,864,248 |
| 수 입 | - | - | - | ||
| 소 계 | 2,181,607 | 5,231,426 | 5,864,248 | ||
| 기기 | 국 내 | 645,949 | 1,665,211 | 1,210,226 | |
| 수 입 | - | - | 303,008 | ||
| 소 계 | 645,949 | 1,665,211 | 1,513,234 | ||
| 용역 | 재료비 | 국 내 | 1,043,880 | 1,506,285 | 531,354 |
| 수 입 | - | - | - | ||
| 소 계 | 1,043,880 | 1,506,285 | 531,354 | ||
| 총 합 계 | 국 내 | 3,871,436 | 8,402,922 | 7,605,828 | |
| 수 입 | - | - | 303,008 | ||
| 합 계 | 3,871,436 | 8,402,922 | 7,908,836 | ||
☞ 수입된 기기 및 시약재료의 경우 국내의 대리점을 통하여 원화로 매입하고 있어 별도로 외화금액을 표기하지 않습니다.
☞ 연구단계별로 다양한 시약재료 및 기기가 사용되며, 소모용품을 포함한 유형별 매입액을 합산하여 기재하였습니다.
2) 주요 원재료 가격변동 추이
| (단위 : 원) |
| 품 목 | 용 도 | 단위 | 2022년 (제24기 3분기) |
2021년 (제23기) |
2020년 (제22기) |
| Ammonium sulfate | DNA백신의 생산 | 99%, 25kg | 1,420,000 | 1,420,000 | 1,152,700 |
| 1L storage bottle | buffer 보관 용기 | 24/cs | 105,600 | 87,690 | 74,880 |
| E.coli Host cell protein Elisa kit | 숙주단백질 측정 | box | 1,220,000 | 980,000 | 950,000 |
| DMEM media | 500ml, cell culture용 | bottle | 22,000 | 18,000 | 18,000 |
| FBS | cell culture용 | bottle | 750,000 | 700,000 | 700,000 |
| T75 flask | cell culture용 | box | 95,000 | 78,950 | 79,800 |
☞상기의 원재료 가격변동 추이는 당사의 연구와 관련된 시약재료 중 구매 비중이 높은 재료 위주 최근 구매된 원재료 가격을 기준으로 기재되었습니다.
나. 생산 및 설비에 관한 사항
1) 생산능력 및 생산실적 당사는 시판제품의 판매를 위한 생산 설비를 가지고 있지 않습니다. 다만 현재 단계의 연구개발에 필요한 일부 생산 능력을 200L 규모의 Pilot 시설을 포함하여 보유하고 있습니다. 아래 표에서는 각 제품별 생산능력을 표시하였습니다.
| 분류 | 제품 포트폴리오 | 생산 규모 | 생산 실적 |
| 유전자재조합 단백질 |
항체융합 단백질 바이오베터 |
200 리터 규모 파일럿 시설 |
- 초기 효능 및 독성 시험용 : GCSF-hyFc, hGH-hyFc, EPO-hyFc 개발제품의 초기 효능, 독성시험용 등 - 연구용 : GLP1-hyFc, PDL1-hyFc, 항체바이오베터 등 다수 |
| 유전자 치료제 |
DNA 백신, 아데노바이러스 기반 백신 |
5 g /월 (DNA 백신) 1 x 10^12 pfu/월 (아데노바이러스) |
- 효능 및 독성시험용 : DNA 백신의 시험용 생산 |
2) 생산설비(연구설비)에 관한사항
가) 현황
[주요사업장 현황]
| 명칭 | 중요사업내용 | 소재지 |
|---|---|---|
| 바이오이노베이션파크 | R&D | 서울 강서구 마곡중앙로 172 |
당사의 시설 및 설비는 토지, 건물, 기계장치, 비품, 시설장치 및 건설중인자산이 있으며, 2022년 3분기말 현재 금액은 아래와 같습니다.
| <2022년 3분기말> | (단위 : 천원) |
| 구 분 | 기초 | 취득 및 자본적지출 |
처분 | 대체 | 감가상각 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | 21,696,652 | 2,144,695 | (461,751) | (1,242,681) | - | 22,136,915 |
| 건물 | 66,759,780 | 217,749 | (73,684) | (1,844,988) | (1,225,030) | 63,833,827 |
| 기계장치 | 3,103,993 | 489,489 | (207) | 25,959 | (744,632) | 2,874,602 |
| 비품 | 445,795 | 179,242 | (2,549) | 257,691 | (181,331) | 698,848 |
| 시설장치 | 3,596,600 | 140,988 | (13,413) | - | (580,497) | 3,143,678 |
| 사용권자산 | 3,840,068 | 63,307 | (10,934) | - | (277,457) | 3,614,984 |
| 건설중인자산 | 7,895,596 | 7,165,121 | (283,650) | - | 14,777,067 | |
| 합 계 | 107,338,484 | 10,400,591 | (562,538) | (3,087,669) | (3,008,947) | 111,079,921 |
☞ 상기 시설 및 설비현황은 별도기준입니다.
☞ 주요 유형자산의 시가는 객관적인 판단이 어려워 기재를 생략합니다.
나) 당기투자실적
당사는 시설투자를 통해 연구환경을 개선하고 연구개발에 필요한 설비를 보완, 확충하였습니다.
| (단위 : 백만원) |
|
구분 |
투자기간 |
투자대상자산 |
투자효과 |
투자액 |
비고 |
|---|---|---|---|---|---|
|
연구소투자 및 기타 |
22. 01~22.09 |
R&D센터 R&D기자재 등 |
연구설비 확충 및 효율성개선 등 |
10,401 |
- |
다) 설비의 신설ㆍ매입계획
당사는 판교소재지의 기업연구소와 사무공간의 이용을 개선하여 효율적으로 몰입할 수 있는 연구환경을 조성하고 효율적인 의사소통이 가능한 인프라를 구축하기 위해 서울 마곡지구에 건축규모 약 8,900평 규모의 통합 R&D센터(바이오이노베이션파크)를 설립하여 연구소와 본점을 이전하였습니다. 또한 향후 성장과 연구개발의 확장에 대비하여 마곡지구에 2025년 완공 목표로 약 3,500평 규모의 2차 R&D 센터 설립을 추진중에 있습니다
3) 외주생산에 관한 사항
당사는 현재 연구용 제품, 전임상 시료 생산이 가능한 설비를 구축하고 있습니다. 다만, 연구개발 전문 기업이라는 회사의 특성상 현재 상업용 대량 생산 및 대량 임상시료 생산 설비는 갖추고 있지 않은 관계로 위탁생산시설을 이용합니다.
4. 매출 및 수주상황
| 가. 매출실적 |
(단위 : 백만원) |
| 사업부문 | 매출유형 | 품 목 | 파트너 | 2022년 연간 | 2021년 연간 | 2020 연간 |
| 신약개발 | 기술이전 | GX-E4(빈혈치료제) | KG-Bio | 9,702 | - | - |
| GX-I7 | KG-Bio | - | 29,908 | - | ||
| GX-P1/GX-P10 | 제넨바이오, Turret | - | - | 7,930 | ||
| hyFc 플랫폼 | 유한양행 | - | 528 | 651 | ||
| 기타기술이전 | 기타 | - | 47 | 276 | ||
| 기술재산권 (로열티) | FSH(난포자극호르몬) | 동아ST | - | 180 | 104 | |
| 연구용역 /서비스 |
세포주구축외 | I-Mab 외 | - | 523 | ||
| 프로젝트개발용역 | 한독, NeoImmuneTech, I-Mab 외 |
1,629 | 5,939 | 8,181 | ||
| 비임상분석/동물실험 | 프로젠 외 | 103 | 37 | 440 | ||
| 정부기관 연구용역 | 정부기관 | - | 109 | 217 | ||
| 기타용역 | 기타 | 5 | 80 | 222 | ||
| 부문 계 | 11,438 | 36,828 | 18,543 | |||
나. 주요 매출처 등 현황
당사 기업특성상 주요 매출은 기술이전에 의해 발생되며 당사의 제품과 관련된 최근 주요매출처는 다음과 같습니다.
| 제품명 | 매출처 | 내용 |
| GX-I7 (면역항암제) | KG-Bio | 기술이전 마일스톤 |
| GX-E4 (빈혈치료제) | KG-Bio | 기술이전 마일스톤 |
| GX-P1/GX-P10(장기이식 면역거부반응 적응증 치료제) | 제넨바이오, Turret | 기술이전 마일스톤 |
| 세포주 구축, 시료생산 등 연구용역 | I-Mab, NeoImmuneTech 외 | 연구용역 매출 |
다. 판매조직 및 활동
당사는 기술이전 및 개발 업무를 위해 개발실을 두고 각종 바이오컨퍼런스 및 학회, 파트너링 행사, 세미나 등에 적극적으로 참여하여 당사의 기술을 소개하고 이를 통하여 기술이전 협의를 추진하고 있습니다.
<판매경로>
| 매출유형 | 담당 | 구 분 | 판매경로 |
| 기술이전 | 제넥신 사업개발실 | 국내외 | 당사 → 제약회사 및 바이오 기업 |
5. 위험관리 및 파생거래
본문III. 재무에 관한 사항 - 5. 재무제표 주석 - 4. 위험관리부문 - (2) 재무위험관리를 참조하시길 바랍니다.
본문III. 재무에 관한 사항 - 5. 재무제표 주석 - 4. 위험관리부문 - (3) 금융상품의 공정가치를 참조하시길 바랍니다.
6. 주요계약 및 연구개발활동
당사는 기술이전 계약, 정부과제 계약 등의 주요 경영상의 계약들이 있으며 주요 계약현황은 다음과 같습니다.
가. 기술이전 계약
| 1) 총괄표 |
(단위 : $ or \ (천원)) |
| 품목 | 계약상대방 | 대상지역 | 계약체결일 | 계약종료일 | 총 계약금액 | 수취금액 | 진행단계 |
| GX-188 | BSK | 중국 | 2014.07 | 2030.08 | $5,000,000 | $3,000,000 | 중국 임상준비 |
| GX-I7 | NeoImmuneTech | 유럽/미국 | 2015.06 | 특허만료일 | $12,500,000 | $7,500,000 | 미국 임상 2상 진행 |
| hyFc적용 3종단백질치료제 외 (GX-H9, GX-G6,GX-G3) |
I-Mab(Tasgen) | 중국 | 2015.10 | 특허만료일 | $100,000,000 | $20,000,000 | GX-H9 중국 3상 환자모집 완료 |
| GX-E4 | CWB* | 중국 | 2016.02 | 별도계약해지시 | $44,500,000 | $3,750,000 | 중국 임상1상 진행 |
| GX-E4 | KG-Bio | 아세안지역 / MENA |
2015.12 | 별도계약해지시 | $3,000,000 | $3,000,000 | 호주, 인도네시아 등 아세안 다국가 임상3상 진행 |
| GX-I7 | I-Mab | 중국 | 2017.12 | 특허만료 또는 상업판패 이후 15년 | $560,000,000 | $12,000,000 | 중국 임상2상 진행 |
| GX-P1, GX-P10(장기이식 면 역거부반응 적응증 치료제) |
제넨바이오 | 전세계 | 2020.01 | 계약체결일 후 20년 | \191,000,000 | \7,000,000 | 한국 임상계획 |
| GX-P1 면역억제 기전을 활용한 뇌졸증, 자궁내막증, 조산증 치료제) | Turret Capital Management |
전세계 | 2020.12 | 계약체결일 후 10년 | Egret 주식 1백만주 + $200,000,000 | Egret 주식 1백만주 |
미국 임상 1상 준비 |
| GX-I7 | KG-Bio | 아세안지역/ MENA/ 호주, 뉴질랜드/ 기타 아프리카 | 2021.02 | 별도계약해지시 | $1,100,000,000 | $27,000,000 | 인도네시아 임상2상 진행중 |
| GX-E4 | KG-Bio | 아세안지역, MENA, 남아시아, 유럽 및 기타 아프리카 국가 | 2022.03 | 별도계약해지시 | $13,000,000 | - | 호주, 인도네시아 등 아세안 다국가 임상3상 진행 |
CWB* : Shanghai ChemoWanbang Biopharma(중국)
2) 주요 계약상대방에 대한 내용
가) I-Mab
I-Mab은 중국 상하이에 본점을 두고 있으며 2014년 11월에 설립되었고 2020년 1월 Nasdaq에 상장 되었습니다. 보고서 작성 기준일 현재 영위하고 있는 주요 사업은 의약품, 제약원료 등의 연구개발과 제조 판매업 등 입니다.
(1) 법인의 기본정보
| 명 칭 | 주요주주 | ||
|---|---|---|---|
| 성명 | 지분(%) | 비고 | |
| I-Mab | C-Bridge entities | 16.49 | 아시아 바이오-제약 투자회사 |
| Hillhouse | 8.99 | 글로벌 사모펀드 회사 | |
| Genexine | 4.62 | ||
| Others | 69.9 | ||
(2) 법인의 재무현황
(기준일 2021.12.31) (단위:백만원)
| 법인 또는 단체의 명칭 | I-Mab |
|---|---|
| 자산총계 | 1,041,994 |
| 부채총계 | 193,775 |
| 자본총계 | 848,219 |
| 매출액 | 7,204 |
| 영업이익 | (371,975) |
| 당기순이익 | (418,709) |
(3) 사업현황 등 회사 경영 안정성에 영향을 미칠 수 있는 주요 내용
법인의 사업부문
| 사업부문 | 사업내용 | 세부내용 |
|---|---|---|
| 의약품 연구개발업 | 연구개발업 | - 혈액암: Felzartamab (TJ202/MOR202), Lemzoparlimab (TJC4) 으로 다발성골수종, 골수형성이상증후군, 급성골수성백혈병 및 비호지킨림트종을 치료하기 위한 임상2상, 임상3상 진행중 - 고형암 1) Lemzoparlimab (TJC4): 흑색종, 위암, 두경부암, 비소세포폐암, 난소상피암을 치료하기 위한 임상2상 진행중 2) Uliledlimab (TJD5): 비소세포폐암, 고형암을 치료하기 위한 임상2상 진행중 3) Efineptakin Alfa (TJ107): 교모세포종, 삼중음성유방암, 두경부암을 치료하기 위한 임상2상 진행중 4) Bi-specific antibody (TJ-CD4B, TJ-L14B): 위암, 췌장암, 고형암을 치료하기 위한 임상1상 진행중 - 기타 1) Eftansomatropin Alfa (TJ101): 소아 성장호르몬결핍증을 치료하기 위한 임상3상 진행중 2) Plonmarlimab (TJM2): COVID-19/Cytokine Release Syndorme 치료 위한 임상2상 진행중 - 개발 플랫폼: Diferentiated Monoclonal antibody (long-acting 등), Novel Bi-specific antibody, Suprer Antibody (Masking Technology, mRNA Technology, Alphabody Technology, Artificial Intelligence Technology 활용) |
| 비즈니스 파트너쉽 | - AbbVie와 파트너쉽을 통해 lemzoparlimab의 19억 4천만 달러 L/O 거래 달성 | |
| 상업화 | - 향후 3건의 NDA 제출 또는 제품출시를 달성하여 부가수익 창출 |
| [I-Mab 연구개발활동] |
|
출처: I-Mab 홈페이지 (https://www.i-mabbiopharma.com/)
나) KG-Bio
KG-Bio는 인도네시아 자카르타에 소재하고 있으며 2016년 3월에 당사와 인도네시아 제약기업 Kalbe Farma가 공동으로 바이오의약품 합작법인을 설립하였습니다. 보고서 작성 기준일 현재 영위하고 있는 주요사업은 종양학 및 고도의 전문 치료 영역에서 신규 바이오의약품 및 선별 바이오시밀러를 L/I하여, 임상 개발을 마친 후 타겟 지역에서 L/O를 하는 것을 목표로 합니다.
(1) 법인의 기본정보
| 명 칭 | 주요주주 | ||
|---|---|---|---|
| 성명 | 지분(%) | 비고 | |
| KG-Bio | PT. Kalbe Farma, Tbk (주1) | 55.46 | 동남아 최대 제약회사 |
| Genexine | 20.32 | ||
| General Atlantic (주2) | 23.83 | 미국 투자회사 | |
| Others | 0.39 | ||
(주1) PT Kalbe Farma, Tbk는 시가총액 약8.8조원에 연매출총액 약2.4조원로서 동남아시아 최대규모의 바이오제약회사입니다.
(주2) General Atlantic은 자산관리규모 90조원에 이르는 미국소재 글로벌투자관리회사입니다.
(2) 법인의 재무현황
(기준일 2022.09.30) (단위:백만원)
| 법인 또는 단체의 명칭 | KG-Bio |
|---|---|
| 자산총계 | 283,718 |
| 부채총계 | 46,993 |
| 자본총계 | 236,725 |
| 매출액 | 12,798 |
| 영업이익 | (6,425) |
| 당기순이익 | (11,744) |
계약상대방인 KG-Bio의 2022년 9월 30일기준 현금보유액은 약 1,000억원이며, 최근결산일기준(2021년) 매출액은 약 107억, 2022년 09월까지 매출액은 약 129억원입니다. 또한, 당사와 KG-Bio의 기술이전매출계약으로 맺은 총계약규모는 GX-I7 약1.2조원, GX-E4 약158억원 규모 (로열티 별도) 이며, 비록 총계약규모대비 KG-Bio의 현금보유액은 적지만, 매출 발생시 지급되는 마일스톤기반의 계약구조를 바탕으로 당사의 마일스톤 매출을 충당할 예정입니다.
(3) 사업현황 등 회사 경영 안정성에 영향을 미칠 수 있는 주요 내용
법인의 사업부문
| 사업부문 | 사업내용 | 세부내용 |
|---|---|---|
| 의약품 연구개발업 |
신약 연구개발업 | - Nimotuzumab: 두경부 편평세포암, 신경아교종, 비인두암 및 췌장암 치료를 목적으로 임상 완료 후 현재 상업화단계임. - KG-001: MSI-H 고형암 허가, 편평상피세포폐암 및 간암 치료 위해 임상3상 진행중 - KG-002: 삼중음성유방암 임상2상 진행 중, Covid-19 치료제 임상1/2상 진행중 |
| Biosimilar 및 Biobetter 연구개발업 | - Rituximab biosimilar: 비호지킨림트종 치료 목적으로 개발되어 현재 상업화단계임 - Trastzumab biosimilar: 유방암, 위암 및 위식도접합부암 치료 목적으로 개발되어 현재 상업화단계임 - Bevacizumab biosimilar: 전이성대장암, 유방암 및 폐암 치료 목적으로 개발되어 현재 상업화단계임 - KG-003: 만성신장질환으로 인한 빈혈을 가진 비투석환자 대상 임상 3상 완료 후 인도네시아 품목허가 자료 제출 |
|
| 제조업 | 전문 및 일반의약품 제조판매 | 제조기반 시설 확보를 통해 APAC(중국제외) 지역중점의 제조계약체결을 통한 제조판매 |
| [KG-Bio 연구개발활동] |
 |
|
KG-Bio연구개발 |
출처: KG-Bio 홈페이지 (https://www.kg-biologics.com/)
3) 세부내역
| 1) 품목 : GX-188E | |
|---|---|
| 계약상대방 | Nanjing BioSciKin Co, Ltd.(BSK, 중국) |
| 계약내용 | 치료백신(GX-188) 관련 특허기술을 이용한 중국내 개발권, 사업권등의 이전 |
| 대상지역 | 중국지역(대만, 홍콩, 마카오 포함) |
| 계약기간 | 2015년 - 2030년 |
| 계약총 금액 | 미화 5,000,000 달러 ($5,000,000) |
| 계약조건 | 1)Upfront : $1,000,000 (반환조항 없음) 2)마일스톤: - Completion of document transfer: $2,000,000 - Completion of tech transfer: $1,000,000 - Completion of IND filing in the territory: $1,000,000 3) Royalty: 시판 최소 6개월 전에 재계약 예정 |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | HPV 항원 특이적 T 세포 면역반응을 유도하는 치료 DNA 백신 |
| 개발진행경과 | - 계약상대방의 임상 경과 : 중국 허가용 공정개발 및 임상준비 - 회사의 임상 경과 : 자궁경부암 한국 임상 1b/2 진행중 |
| 기타사항 | 1. GX-188E 물질 특허 (치료 DNA 백신 기술) (1) 특허번호 : 중국 CN 103180343 B (2) 출원일 : 2010.08.13 (3) 발명의 명칭 : 사람 파필로마바이러스 변형체 및 면역 증강제를 포함하는 자궁경부암 예방 또는 치료용 조성물 2. GX-188E 단독 용법용량 특허 (치료 DNA 백신 기술 -단독 치료 임상) (1) 특허번호 : 중국 CN 107073070 A (2) 출원일 : 2015.08.14 (3) 발명의 명칭 : 자궁경부암의 치료 방법 |
| 2) 품목 : GX-I7 | |
|---|---|
| 계약상대방 | NeoImmuneTech, Inc.(NIT, 미국) |
| 계약내용 | 항암면역치료제(GX-I7)의 전용실시권 |
| 대상지역 | 북미, 남미, 중미, 유럽 |
| 계약기간 | 2015년 ~ 특허만료일 |
| 계약총 금액 | 미화 12,500,000 달러( $12,500,000) |
| 계약조건 |
1)Upfront : $4,500,000 (반환조항 없음) 2)마일스톤: - IND approval of 1st clinical trial: $1,000,000 - Completion of 1st clinical trial: $2,000,000 - IND approval of 2nd clinical trial: $2,000,000 - Completion of 2nd clinical trial: $3,000,000 3)Royalty: - 35% all revenue from sublicensing |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 인터루킨-7 |
| 개발진행경과 | - 계약상대방의 임상 경과: 뇌암(교모세포종), 피부암(흑색종) 대상 임상 1b/2 진행중(2018.03 ~), 비소세포폐암 (1L) 및 위암/위식도접합부암/식도암 대상 임상2상 포함 총 13개 진행중 - 회사의 임상 경과 :삼중음성유방암 대상 임상 1b/2 진행중( 2017.12 ~), 재발성 교모세포종 대상 임상 2상 진행중 (2022~) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 미국 US 7867491 B2 / 미국 US 8586038 B2 / 미국(DIV) US 108441104 B2 / 캐나다 CA 2687377 C / 유럽 EP 2662449 B1/ 브라질 BRPI0811637?7 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-I7 물질 특허 (1) 특허번호 : 미국 US 10208099 B2 / 미국(CA) US 11041007 B2 / 캐나다 CA 2986388 A1 / 유럽 EP 3307766 A1 / 브라질 BR 1120170266415 (2) 출원일 : 2016.06.10 (3) 발명의 명칭 : 변형된 인터루킨-7 단백질 및 이의 용도 3. GX-I7 HPV 용도 특허 (1) 특허번호 : 미국 US 2018-0319858 A1 (2) 출원일 : 2016.12.02 (3) 발명의 명칭 : 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 사람 파필로마바이러스 유래 질환의 예방 또는 치료용 약학적 조성물 4. GX-I7 Flu 용도 특허 (1) 특허번호 : 미국 US 11357827 B2 (2) 출원일 : 2016.11.30 (3) 발명의 명칭 : 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 인플루엔자 바이러스 감염의 예방 또는 치료용 약학적 조성물 5. GX-I7 제형 특허 (1) 특허번호 : 미국 US 2018-0327472 A1 (2) 출원일 : 2016.11.02 (3) 발명의 명칭 : 변형된 인터루킨-7 융합 단백질의 제형 |
| 3) 품목: 5종단백질치료제GX-H9 (human growth hormone), GX-G6 (GLP-1), GX-G3 (G-CSF), GX-G8(GLP-2), GX-P2(PD-L1) | |
|---|---|
| 계약상대방 | I-Mab Biopharma (I-Mab, 중국) |
| 계약내용 | 중국내 GX-G3, GX-H9, GX-G8, GX-P2의 전용실시권 및 GX-G6의 중국 권리 양도 |
| 대상지역 | 중국지역 |
| 계약기간 | 2015년 ~ 2045년 |
| 계약총 금액 | 미화 100,000,000 달러 ($100,000,000) |
| 계약조건 |
1) Upfront: 2) 전용실시권 (G3, H9, G8, P2): $13,000,000 3) 양도 (G6): $7,000,000 GX-G3 마일스톤: - Net Sales Exceeding $50M: $5,000,000 - Net Sales Exceeding $100M: $10,000,000 GX-H9 마일스톤: - Net Sales Exceeding $150M: $15,000,000 - Net Sales Exceeding $250M: $25,000,000 GX-G8 마일스톤: - Initate Ph3 trial: $1,000,000 - Approval of NDA: $1,000,000 GX-P2 (Rheumatoid Arthritis) 마일스톤: - Initate Ph3 trial: $6,000,000 - Approval of NDA: $10,000,000 GX-P2 (Lupus) 마일스톤: - Initate Ph3 trial: $3,000,000 - Approval of NDA: $4,000,000 GX-G6 마일스톤: - Net Sales Exceeding $100M: $10,000,000 - Net Sales Exceeding $150M: $15,000,000 Royalty (G8, P2) - Net Sales $0-50M: 6.5% - Net Sales $50-100M: 7.5% |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 성장호르몬결핍증 치료제, 당뇨병치료제, 호중구 감소증치료제 |
| 개발진행경과 | -계약상대방의 임상 경과: 소아 성장호르몬 임상 3상 모집 완료 (2022.05) , 당뇨병치료제 GX-G6 임상 1b 진행 중 (CSPC) -회사의 임상 경과 : GX-H9 유럽 성인 임상 2상 완료 및 소아 임상 2상 CSR 완료 |
| 기타사항 |
1. hyFc 물질 특허 (1) 특허번호 : 중국 CN 107207618 B (2) 출원일 : 2015.12.31 (3) 발명의 명칭 : GLP 및 면역글로불린 하이브리드 Fc 융합 폴리펩타이드 및 이의 용도
8. GX-P1 물질 특허 (1) 특허번호 : 중국 CN 115103685 A (2) 출원일 : 2021.01.06 (3) 발명의명칭: PD-L1 단백질이포함된융합단백질및이의용도 |
| 4) 품목 : GX-E4 | |
|---|---|
| 계약상대방 | SHANGHAI CHEMOWANBANG BIOPHARMA CO., LTD.(CWB, 중국) |
| 계약내용 | 지속형 빈혈치료제 GX-E4의 중국내 개발권 및 사업권 |
| 대상지역 | 중국전역(홍콩, 마카오, 대만 제외) |
| 계약기간 | 2016년 ~ 별도의 계약 해지시 |
| 계약총 금액 | 미화 44,500,000 달러 ($ 44,500,000) |
| 계약조건 |
1)Upfront: $2,000,000 2)마일스톤: - Completion of tech transfer: $1,000,000 - CKD anemia - CFDA Ph1 approval: $750,000 - CKD anemia - CFDA Ph2 approval: $1,000,000 - CKD anemia - CFDA Ph3 approval: $2,750,000 - CKD anemia - CFDA NDA approval: $6,000,000 - Chemo-induced anemia - CFDA Ph1 approval: $3,000,000 - Chemo-induced anemia - CFDA NDA approval: $5,000,000 - Net sales exceeding $100M: $8,000,000 - Net sales exceeding $150M: $15,000,000 3)Royalty: 7% of Net Sales |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 erythropoietin |
| 개발진행경과 | - 계약상대방의 임상 경과: 중국 임상1b상 진행 - 회사의 임상 경과 : 한국 임상3상 승인(진행) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-E4 물질 특허 (1) 특허번호 : 중국 CN 105175553 B (2) 출원일 : 2012.06.11 (3) 발명의 명칭 : 면역글로불린 융합 단백질 3. GX-E4 용법용량 특허 (1) 특허번호 : 중국 CN 114159552 A (2) 출원일 : 2016.01.08 (3) 발명의 명칭 : 지속형 EPO 제제를 이용한 빈혈 치료 방법 4. GX-E4 제형/제법 특허 (고순도조성물) (1) 특허번호 : 중국 CN 108137665 A (2) 출원일 : 2016.10.06 (3) 발명의 명칭 : 지속형 에리트로포이에틴 함유 조성물 |
| 5) 품목 : GX-E4 | |
|---|---|
| 계약상대방 | PT KALBE-GENEXINE BIOLOGICS (KG-Bio, 인도네시아) |
| 계약내용 | 지속형 빈혈치료제 GX-E4의 대상지역내 개발권 및 사업권 |
| 대상지역 | 아세안 지역 (인도네시아, 말레이시아, 싱가폴, 필리핀, 태국, 브루나이, 베트남, 미얀마, 캄보디아, 라 오스) 및 MENA, 스리랑카, 나이지리아, 타이완, 호주, 뉴질랜드 |
| 계약기간 | 2015년 ~ JVA 종료일 까지 |
| 계약총 금액 | 미화 3,000,000 달러 ($3,000,000) |
| 계약조건 |
1)Upfront: $1,500,000 2)마일스톤: - Completion of tech transfer: $1,500,000 3) Royalty: 7.5% of Net Sales (시판후10년간) |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 erythropoietin |
| 개발진행경과 | -계약상대방의 임상 경과: ASEAN (호주, 뉴질랜드 포함) 임상 3상 승인 및 진행 중 -회사의 임상 경과 : 한국 임상 3상 승인(진행) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 싱가포르 SG 156826 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-E4 용법용량 특허 (1) 특허번호 : 인도네시아 PID201705182 (2) 출원일 : 2016.01.08 (3) 발명의 명칭 : 지속형 EPO 제제를 이용한 빈혈 치료 방법 3. GX-E4 제형/제법 특허 (고순도조성물) (1) 특허번호 : 인도네시아 IDP000063622 / 인도네시아(DIV) P-00201908699 / 호주 AU 2016334954 B2 (2) 출원일 : 2016.10.06 (3) 발명의 명칭 : 지속형 에리트로포이에틴 함유 조성물 |
| 6) 품목 : GX-I7 | |
|---|---|
| 계약상대방 | I-Mab Biopharma (I-Mab, 중국) |
| 계약내용 | 항암면역치료제(GX-I7)의 전용실시권 |
| 대상지역 | 중국 전역(대만, 홍콩, 마카오 포함) |
| 계약기간 | 2017년 ~ 관련특허 만료일 또는 첫 상업생산 15년 후 까지 |
| 계약총 금액 | 미화 560,000,000 달러 ($560,000,000) |
| 계약조건 |
1) Upfront: $12,000,000 2) 마일스톤: - Completion of first Ph2 clinical trial: $5,000,000 - Completion of first Ph3 clinical trial: $8,000,000 - First NDA or BLA approval: $10,000,000 - Net Sales exceeds $100M USD: $5,000,000 - Net Sales exceeds $200M USD: $20,000,000 - Net Sales exceeds $500M USD: $50,0000,000 - Net Sales exceeds $1,000M USD: $150,000,000 - Net Sales exceeds $2,000M USD: $300,000,000 3) Royalty: 3% of Net Sales |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 인터루킨-7 |
| 개발진행경과 | - 계약상대방의 임상 경과: 고형암, 뇌암(교모세포종) 중국 임상2상 진행 - 회사의 임상 경과 : 삼중음성유방암 대상 임상 1b/2 진행중( 2017.12 ~), 재발성 교모세포종 대상 임상 2상 진행중 (2022~) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B / 홍콩 HK 1141303 / 홍콩(DIV1) HK 1191959 / 홍콩(DIV2) HK 1191347 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-I7 물질 특허 (1) 특허번호 : 중국 CN 114853873 A / 홍콩 HK 1256149 A1 (2) 출원일 : 2016.06.10 (3) 발명의 명칭 : 변형된 인터루킨-7 단백질 및 이의 용도 3. GX-I7 HPV 용도 특허 (1) 특허번호 : 중국 CN 108697765 A / 대만 TW I774651 B / 홍콩 HK 19122600 (2) 출원일 : 2016.12.02 (3) 발명의 명칭 : 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 사람 파필로마바이러스 유래 질환의 예방 또는 치료용 약학적 조성물 4. GX-I7 Flu 용도 특허 (1) 특허번호 : 중국 CN 108697764 A / 대만 TW I775733 B / 홍콩 HK 19122601.8 (2) 출원일 : 2016.11.30 (3) 발명의 명칭 : 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 인플루엔자 바이러스 감염의 예방 또는 치료용 약학적 조성물 5. GX-I7 제형 특허 (1) 특허번호 : 중국 CN 108778337 A / 대만 TW I720051 B / 홍콩 HK 19122944.2 (2) 출원일 : 2016.11.02 (3) 발명의 명칭 : 변형된 인터루킨-7 융합 단백질의 제형 6. GX-I7+CPI 병용 투여 (1) 특허번호 : 중국 CN 113365650 A / 홍콩 HK 40056403 A (2) 출원일 : 2019.11.15 (3) 발명의 명칭 : IL-7 단백질 및 면역 관문 저해제의 조합으로 종양을 치료하는 방법 7. GX-I7 용법용량 특허 (1) 특허번호 : 중국 CN 114746106 A (2) 출원일 : 2020.09.04 (3) 발명의 명칭 : 종양에서 IL-7 융합 단백질을 이용하여 림프구 수를 증가시키는 방법 |
| 7) 품목 : GX-P1, GX-P10 | |
|---|---|
| 계약상대방 | 주식회사 제넨바이오 |
| 계약내용 | PD-L1 면역글로불린 hyFc 융합단백질 (GX-P1, GX-P10) 전용실시권 (장기이식 면역거부반응 적응증에 한정) |
| 대상지역 | 전세계 |
| 계약기간 | 2020년 ~ 계약일로부터 20년간 |
| 계약총 금액 | 원화 191,000,000,000 |
| 계약조건 |
1) Upfront: \7,000,000,000 2) 마일스톤: - 임상 3상 CSR 최종화: \10,000,000,000 - 누적 순매출액 1,000억원 달성: \4,000,000,000 - 누적 순매출액 2,500억원 달성: \10,000,000,000 - 누적 순매출액 5,000억원 달성: \20,000,000,000 - 누적 순매출액 10,000억원 달성: \40,000,000,000 - 누적 순매출액 20,000억원 달성: \100,000,000,000 3) Royalty: 순매출액3% |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 수익 인식 포함된 용역대가는 수행의무 완료시점에 수익인식 |
| 대상기술 | PD-L1 면역글로불린 hyFc 융합단백질의 완제의약품 |
| 개발진행경과 | -계약상대방의 임상 경과: 한국 임상1상 계획 -회사의 임상 경과 : 한국 임상 1상 종료 (GX-P1) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 미국 US 7867491 B2 / 미국 US 8586038 B2 / 미국(DIV) US 108441104 B2 / 캐나다 CA 2687377 C / 유럽 EP 2662449 B1/ 브라질 BRPI0811637-7 / 러시아 RU 2530168 C2/중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B / 홍콩 HK 1141303 / 홍콩(DIV1) HK 1191959 / 홍콩(DIV2) HK 1191347 / 한국 KR 10-0897938 B1 / 한국(DIV1) KR 1380732 B1 / 한국(DIV2) KR 1380729 B1 / 일본 JP 5577243 B2 / 싱가포르 SG 156826 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-P1 물질 특허 (1) 특허번호 : 대만 TW 202130359 A / 미국 US 17/794832 / 유럽 EP 21744724.2 / 일본 JP 2022-544089 / 중국 CN 115103685 A / 2021210773 A1 / 캐나다 CA 3164910 / 한국 KR 2021-0095561 A / 호주 AU (2) 출원일 : 2021.01.06 (3) 발명의 명칭 : PD-L1 단백질이 포함된 융합 단백질 및 이의 용도 3. GX-P10 물질 특허 (1) 특허번호 : 한국 KR 2021-0141311 A / 대만 TW 202142567 A / PCT WO2021/230460 A1 (2) 출원일 : 2021.01.06 (3) 발명의 명칭 : PD-L1 단백질 및 단량체성 IL-10 변이체가 포함된 융합 단백질 및 이의 용도 |
| 8) 품목 : GX-P1 | |
|---|---|
| 계약상대방 | Turret Capital Management |
| 계약내용 | 면역억제 기전을 활용한 뇌졸증, 자궁내막증, 조산증 치료제의 기술이전계약 |
| 대상지역 | 전세계 |
| 계약기간 | 2020년 ~ 특허만료일 |
| 계약총 금액 | Egret 주식 1백만주 + 미화200,000,000 달러 |
| 계약조건 |
1) Upfront: Egret Therapeutics 주식 1백만주 2) 마일스톤: - 누적 매출액 $250M: $25,000,000 - 누적 매출액 $500M: $25,000,000 - 누적 매출액 $750M: $25,000,000 - 누적 매출액 $1B: $25,000,000 - 누적매출액$2B: $100,000,000 |
| 회계처리방법 | - 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 - Egret주식 1주당 $1.0292로 가치평가 (2020.12.31기준) |
| 대상기술 | GX-P1 면역억제 기전을 활용한 뇌졸증, 자궁내막증, 조산증 치료제) |
| 개발진행경과 | - 계약상대방의 임상경과: FDA pre-IND meeting 준비 중 |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 미국 US 7867491 B2 / 미국 US 8586038 B2 / 미국(DIV) US 108441104 B2 / 캐나다 CA 2687377 C / 유럽 EP 2662449 B1/ 브라질 BRPI0811637?7 / 러시아 RU 2530168 C2 / 중국 CN 101687933 B / 중국(DIV1) CN 103626875 B / 중국(DIV2) CN 103641919 B / 홍콩 HK 1141303 / 홍콩(DIV1) HK 1191959 / 홍콩(DIV2) HK 1191347 / 한국 KR 10-0897938 B1 / 한국(DIV1) KR 1380732 B1 / 한국(DIV2) KR 1380729 B1 / 일본 JP 5577243 B2 / 싱가포르 SG 156826 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-P1 물질 특허 (1) 특허번호 : 대만 TW 202130359 A / 미국 US 17/794832 / 유럽 EP 21744724.2 / 일본 JP 2022-544089 / 중국 CN 115103685 A / 2021210773 A1 / 캐나다 CA 3164910 / 한국 KR 2021-0095561 A / 호주 AU (2) 출원일 : 2021.01.06 (3) 발명의 명칭 : PD-L1 단백질이 포함된 융합 단백질 및 이의 용도 |
| 9) 품목 : GX-I7 | |
|---|---|
| 계약상대방 | PT KALBE-GENEXINE BIOLOGICS (KG-Bio, 인도네시아) |
| 계약내용 | 항암면역치료제(GX-I7)의 전용실시권 |
| 대상지역 | ASEAN 국가, MENA 국가, 호주, 뉴질랜드, 남아시아 (인도 포함) 및 기타 아프리카 |
| 계약기간 | 2021년 ~ 별도계약해지시 |
| 계약총 금액 | 미화 1,100,000,000 달러($1,100,000,000) |
| 계약조건 |
1) Upfront: $27,000,000 2) 마일스톤: - BLA submission: $13,000,000 - BLA approval: $10,000,000 - 누적매출액 $500M: $50,000,000 - 누적매출액 $1B: $100,000,000 - 누적매출액 $2B: $200,000,000 - 누적매출액 $3B: $300,000,000 - 누적매출액 $5B: $400,000,000 3) Royalty: 10% of Net Sales |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 일시에 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 인터루킨-7 |
| 개발진행경과 | - 계약상대방의 임상경과: 임상2상 진행 중 - 회사의 임상 경과 : 삼중음성유방암 대상 임상 1b/2 (2017.12 ~), 재발성 교모세포종 대상 임상 2상 진행중 (2022~) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 싱가포르 SG 156826 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-I7 물질 특허 (1) 특허번호 : 인도 IN 201717040190 A / 인도네시아 ID P000074097 (2) 출원일 : 2016.06.10 (3) 발명의 명칭 : 변형된 인터루킨-7 단백질 및 이의 용도 3. GX-I7+CPI 병용 투여 (1) 특허번호 : 뉴질랜드 NZ 775946 / 인도 IN 202117026652 / 인도네시아 ID P00202104485 / 호주 AU 2019379325 A1 (2) 출원일 : 2019.11.15 (3) 발명의 명칭 : IL-7 단백질 및 면역 관문 저해제의 조합으로 종양을 치료하는 방법 4. GX-I7 용법용량 특허 (1) 특허번호 : 남아프리카 ZA 2022/03778 / 뉴질랜드 NZ 784775 /사우디아라비아 SA 522431834 / 싱가포르 11202201344V / 아랍에미리트 AE P6000377/2022 이스라엘 IL 291084 / 인도 IN 202247018416 / 인도네시아 ID P00202203594 / 태국 TH 2201001343 / 호주 AU 2020343018 A1 (2) 출원일 : 2020.09.04 (3) 발명의 명칭 : 종양에서 IL-7 융합 단백질을 이용하여 림프구 수를 증가시키는 방법 |
| 10) 품목 : GX-E4 | |
|---|---|
| 계약상대방 | PT KALBE-GENEXINE BIOLOGICS (KG-Bio, 인도네시아) |
| 계약내용 | 지속형 빈혈치료제 GX-E4의 대상지역내 개발권 및 사업권 |
| 대상지역 | 아세안지역, MENA, 남아시아, 유럽 및 기타 아프리카 국가 |
| 계약기간 | 2022년 ~ JVA 종료일 까지 |
| 계약총 금액 | 미화 13,000,000 달러 ($13,000,000) |
| 계약조건 |
1) Upfront: $8,000,000 2) 마일스톤: - BLA submission for Dialysis in Europe: $5,000,000 3) Royalty: 7.5% of Net Sales (시판후10년간) |
| 회계처리방법 | 계약금, 마일스톤 수취액은 매출계약 조건에 따라 수익 인식 |
| 대상기술 | 지속형 항체융합기술 hyFc을 적용한 erythropoietin |
| 개발진행경과 | -계약상대방의 임상 경과: ASEAN (호주, 뉴질랜드 포함) 임상3상 승인 및 진행 중 -회사의 임상 경과 : 한국 임상3상 승인(진행) |
| 기타사항 | 1. hyFc 물질 특허 (1) 특허번호 : 싱가포르 SG 156826 / 유럽 EP 2662449 B1 / 이스라엘 IL 202128 / 호주 AU 2008257923 B2 (2) 출원일 : 2008.05.30 (3) 발명의 명칭 : 면역글로불린 융합 단백질 2. GX-E4 물질 특허 (1) 특허번호 : 유럽 EP 3176264 B1 (2) 출원일 : 2012.06.11 (3) 발명의 명칭 : 면역글로불린 융합 단백질 3. GX-E4 용법용량 특허 (1) 특허번호 : 유럽 EP 3243525 A1 (2) 출원일 : 2016.01.08 (3) 발명의 명칭 : 지속형 EPO 제제를 이용한 빈혈 치료 방법 4. GX-E4 제형/제법 특허 (고순도조성물) (1) 특허번호 : 호주 AU 2016334954 B2 (2) 출원일 : 2016.10.06 (3) 발명의 명칭 : 지속형 에리트로포이에틴 함유 조성물 |
나. 정부과제 계약
| 종류 | 계약상대방 | 계약일 | 계약명칭 | 계약기간 |
| 정부 과제 계약 |
국가항암신약개발센터 | 2021.01 | GX-188E, NOIU1702 | 6차년도 (2022.01.01~2022.12.31) |
| 보건복지부 | 2022.01 | 차세대 신규 다항원성 결핵 DNA 백신의 유효성 평가 및 비임상 연구 |
3차년도 (2022.01.01~2022.12.31) |
| 주) 상기 정부과제 계약은 공시서류 작성 기준일 현재 유효한 계약만을 기재 하였습니다. |
다. 연구개발활동
1) 연구개발활동의 개요
바이오신약 개발에 있어서 플랫폼 기술이란 신약개발 과정에 적용해 다양한 후보물질을 찾아낼 수 있는 기반으로, 기존에 없는 치료제의 개발에 활용될 수 있으며 기존치료제보다 효능을 높이거나 지속성을 증가시켜 환자의 투여 편의성을 개선하는 등 기술적인 진화를 이루어 높은 부가가치를 만들 수 있는 원천기술을 의미합니다.
당사의 플랫폼 기술인 하이브리드 Fc 융합기술(hyFc)은 우리몸에 존재하는 단백질을 융합하여 생물학적 활성과 체내 지속력을 극대화한 기술이며 이를 이용하여 암, 내분비계질환, 면역계통 질환 등 다양한 만성질환을 대상으로 바이오 의약품을 개발하고 있으며, DNA백신은 세포성 면역반응을 유도하여 항원 특이적인 살상세포 반응을 일으키는 기전이며 혁신적인 DNA벡터기술과 플랫폼 기술을 활용하여 자궁경부암 치료백신 등을 개발하고 있습니다.
2) 연구개발 담당조직
가) 연구개발 조직 개요
당사의 연구개발 조직은 바이오연구소, 임상개발실로 구성되어 있습니다. 바이오연구소는 세포배양, 비임상, 정제, 분석팀, QA팀으로 구성되어 있습니다. 임상개발실은 임상운영팀 등으로 구성되어 있으며 현황과 담당하는 업무는 아래와 같습니다.
| (2022.09.30.) |
| 구분 | 팀명 | 인원 | 담당업무 |
|---|---|---|---|
| 바이오연구소 (주1) |
- 비임상팀 - 생물품질분석팀 - 세포배양1팀 - 세포배양2팀 - 정제1팀 - 정제2팀 - 분석1팀 - 분석2팀 - 분석3팀 - QA팀 |
59 | - 단백질치료제 개발, 유전자백신개발, 세포주 제조,배양, 정제, CMC, 분석 및 비임상시험 |
| 임상개발실 | - 임상과학팀 - 임상운영1팀 - 임상운영2팀 - CMO |
12 | - 임상 개발 전략 수립 - 임상 시험 기획 - 임상 개발 운영 - 임상 시험 결과 해석 |
| 주) 단백질생산바이오연구소의 연구인력 일부 및 자산을 종속회사인 에스엘포젠으로 이전함에 따라, 단백질생산바이오연구소와 유전자생산바이오연구소를 바이오연구소로 통합하였습니다. 유전자백신 개발 업무는 바이오연구소에서 승계하였으며 생산업무는 CDMO사업목적의 에스엘포젠으로 이전하였습니다. |
나) 연구관련 전문인력 현황
2022년 3분기말 기준 현재 당사는 박사급 9명, 석사급 35명 등 총 71명의 연구인력을 보유하고 있으며 그 현황은 아래와 같습니다.
| 구 분 | 인 원 | |||
|---|---|---|---|---|
| 박사 | 석사 | 기타 | 합계 | |
| 바이오연구소, 임상개발실 등 |
9 | 35 | 25 | 71 |
3) 핵심 연구인력
당사의 핵심 연구인력은 전략과학자문위원회 의장인 성영철 고문, R&D 총괄 우정원 사장, 바이오연구소 김기용 전무, 바이오연구소 이성희 수석전문위원, 임상개발실 허민규 상무 등 입니다.
| 직위 | 성명 | 부서 | 주요 경력 | 주요 연구실적(논문, 학회발표) |
|---|---|---|---|---|
| 자문 | 성영철 | 전략과학자문위원회 의장 |
-現 ㈜제넥신 전략과학자문위원회 의장 -前 ㈜제넥신 대표이사 -現 포스텍 융합생명공학부 교수 -前 대한면역학회 회장 |
<논문> - HIF-1α activation in myeloid cells accelerates dextran sodium sulfate-induced colitis progression in mice.(2018년, Dis Model Mech) - Erratum: Plasmacytoid Dendritic Cells Contribute to the Protective Immunity Induced by Intranasal Treatment with Fc-fused Interleukin-7 against Lethal Influenza Virus Infection. (2017년, Immune Netw) - PD-1 deficiency protects experimental colitis via alteration of gut microbiota.(2017년, BMB Rep) - Intravaginal Administration of Fc-Fused IL7 Suppresses the Cervicovaginal Tumor by Recruiting HPV DNA Vaccine-Induced CD8 T Cells. (2016년, Clin Cancer Res) - (p40)2-Fc reduces immune-inflammatory response through the activation of T cells in collagen induced arthritis mice.(2016년, Immunol Lett.) - Safety and immunogenicity of therapeutic DNA vaccine with antiviral drug in chronic HBV patients and its immunogenicity in mice.(2015년, LIVER INTERNATIONAL) - Protective effects of Fc-fused PD-L1 on two different animal models of colitis.(2015년, GUT) - Oral immunization of haemaggulutinin H5 expressed in plant endoplasmic reticulum with adjuvant saponin protects mice against highly pathogenic avian influenza A virus infection.(2015년, Plant Biotechnol J.) - Clearance of persistent HPV infection and cervical lesion by therapeutic DNA vaccine in CIN3 patients.(2014년, Nature communications) - Enhancement of antigen-specific CD8 T cell responses by co-delivery of Fc-fused CXCL11.(2014년, VACCINE) - onlytic Fc-fused IL-7 synergizes with Mtb32 DNA vaccine to enhance antigen-specific T cell responses in a therapeutic model of tuberculosis.(2013년, VACCINE) - IL-7/anti-IL-7 mAb complexes augment cytokine potency in mice through association with IgG-Fc and by competition with IL-7R(2013년, Blood) - Interleukin-27 suppresses osteoclastogenesis via induction of interferon-γ. (2012년, CLINICAL IMMUNOLOGY) - Natural form of noncytolytic flexible human Fc as a long-acting carrier of agonistic ligand, erythropoietin.(2011년, PLOS ONE) - Complete protection against a H5N2 avian influenza virus by a DNA vaccine expressing a fusion protein of H1N1 HA and M2e.(2011년, VACCINE) - Pembrolizumab plus GX-188E therapeutic DNA vaccine in patients with HPV-16-positive or HPV-18-positive advanced cervical cancer: interim results of a single-arm, phase 2 trial (2020년, Lancet Oncology) <학회발표> A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Twice-Monthly Administration in Both Adult and Pediatric Growth Hormone Deficiencies (2017년, ENDO) A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Weekly and Twice-Monthly Administration in Children with Growth Hormone Deficiency (2017년, IMPE) A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Semi-Monthly Administration LBFri-28 in Clinical Studies (2016년, ENDO) / ICE-CSE 2016 / ESPE 2016 |
| 사장 | 우정원 | R&D | -現 (주)제넥신 대표이사 -前 서울성모병원 연구원 -Cornell University 미생물학 박사 |
<논문> - Clearance of persistent HPV infection and cervical lesion by therapeutic DNA vaccine in CIN3 patients.(2014년, Nature communications) - Red ginseng extract ameliorates autoimmune arthritis via regulation of STAT3 pathway, Th17/Treg balance, and osteoclastogenesis in mice and human.(2014년, Mediators of inflammation) - MRP8 promotes Th17 differentiation via upregulation of IL-6 production by fibroblast-like synoviocytes in rheumatoid arthritis.(2013년, Exp Mol Med) - S100A8/A9 as a biomarker for synovial inflammation and joint damage in patients with rheumatoid arthritis.(2014년 Korean J Intern Med.) <학회발표> - A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Twice-Monthly Administration in Both Adult and Pediatric Growth Hormone Deficiencies (2017년, ENDO) - A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for Weekly and Twice-Monthly Administration in Children with Growth Hormone Deficiency (2017년, IMPE) - A Hybrid Fc-Fused Human Growth Hormone, GX-H9, Shows a Potential for SemiMonthly Administration LBFri-28 in Clinical Studies (2016년, ENDO) - 2016년, ENDO / ICE-CSE / ESPE 발표 |
| 전무 | 김기용 | 바이오연구소 | -녹십자 부장 -㈜두비엘(現 차백신연구소) 연구개발이사 -목암생명공학연구소 책임연구원 |
<논문> - A new manufacturing process to remove thrombogenic factors (II, V(2017년, Biologicals) - Accepted. Multicenter, single-arm, phase IV study to evaluate the efficacy and safety of the combined therapy of aspirin and high-dose "IVIG-SN" for pediatric patients with Kawasaki disease.(2016년, Korean Circulation J) - The role of the alternative complement pathway in early graft loss after intraportal porcine islet xenotransplantation.(2014년, Transplantation) - Intravitreal human complement factor H in a rat model of laser-induced choroidal neovascularization.(2013년, Br. J. Ophthalmol.) - Reconstituted high-density lipoprotein attenuates atherogenesis partly by regulating HSP27 in hyperlipidemic apoE?/? mice(2012년, Int J Cardiol) - Manufacturing and Shelf Stability of Reconstituted High-density Lipoprotein for Infusion Therapy(2011년, Biotech.) - Fructated apolipoprotein A-I showed severe structural modification and loss of beneficial functions in lipid-free and lipid-bound state with acceleration of atherosclerosis and senescence(2010년, Biochem. Biophys.) - Systemic and specific delivery of small interfering RNAs to the liver mediated by apolipoprotein A-I.(2007년, Mol. Ther.) - Mixed lineage kinase 3-activated p38 MAP kinase mediates TGF-β1-induced apoptosis in hepatoma cells(2004년, J. Biol. Chem.) - Purification and molecular cloning of a novel serine protease from the centipede, Scolopendra subspinipes mutilans.(2004년, Insect Biochem.) - The influence of glycosylation on secretion, stability, and immunogenicity of recombinant HBV pre-S antigen synthesized in Saccharomyces cerevisiae.(2003년, Biochem. Biophys.) - N-acetylcysteine induces cell cycle arrest in hepatic stellate cells through its reducing activity.(2001년, J. Biol. Chem.) - Inhibition of fat-storing cell proliferation by a monomeric arginase derived from perfused rat liver.(2000년, J. Biochem.) - Purification and characterization of a novel inhibitor of the proliferation of hepatic stellate cells.(2000년, J. Biochem) - An integrated process for the separation and purification of biologically active proteins from human urine.(1993년, Kor. J. Biotechnol. Bioeng) - The urokinase concentration and the plasmin concentration in the plasma.(1992년, Kor. J. Int. Medicine) - A pharmacokinetic study on the loading dose and maintenance dose for urokinase during intravenous administration.(1992년, Kor. J. Int. Medicine) |
| 수석전문위원 | 이성희 | 바이오연구소 |
-동아제약 바이오텍연구소 연구소장 | <논문> - Biochemical characterization of a new recombinant TNF receptor-hyFc fusion protein expressed in CHO cells (2013년 Protein Expression and Purification) - The pharmacology study of a new recombinant TNF receptor-hyFc fusion protein (2013년 Biologicals) - Long-acting Recombinant Human Granulocyte Colony Stimulating Factor(rhG-CSF) with a Trimer-Structured Polyethylene Glycol(2010년 Journal of Pharmaceutical Investigation) - Correlation of antiviral T-cell responses with suppression of viral rebound in chronic hepatitis B carriers: aproof-of concept study (2006년 Gene Therapy) - Long-acting interferon-α 2a modified with atrimer-structured polyethylene glycol: Preparation, in vitro bioactivity, in vivo stability and pharmacokinetics (2006년 International Journal of Pharmaceutics) - Engineering N-glycosylation mutations in IL-12 enhances sustained cytotoxic T lymphocyte responses for DNA immunization (2002년 Nature Biotechnology) - Effect of Recombinant Human FSH on Ovulation, Pregnancy and In Vitro Fertilization in Androgen-sterilized Mice (2002년, Arch. Pharm) - DA-3285(recombinant human erythropoietin)의 국소자극성에 관한 연구 (1998년 J. Toxicol) - Efficacy of Recombinant Human Erythropoietin(rhu-EPO) (1998년 응용약물학회지) - Recombinant Human Erythropoietin (DA-3285)의 실험동물에서의 약동력학 및 조직분포 (1996년 응용약물학회지) - Recombinant Human Erythropoietin(DA-3285)의 효력 및 일반약리작용 (1996년 응용약물학회지) Biotechnology) <학회발표> - Effect of Recombinant Human FSH on Ovulation, Pregnancy and In Vitro Fertilization in Androgen-sterilized Mice (2002년 Proceedings Of The Spring Convention Of The Pharmaceutical Society Of Korea) - Capillary Electrophoresis SDS Nongel Sieving Analysis of PEGylated Interferon Alpha (2001년 AAPS 2001 Annual Meeting & Exposition) - Capillary Electrophoretic Analysis of PEGylated Interferon Alpha (2001년 Proceedings Of International Convention Of The Pharmaceutical Society Of Korea) - Sustained Release of Recombinant Human Growth Hormon From Biodegradable Polymer Matrices (2001년 Proceedings Of International Convention Of The Pharmaceutical Society Of Korea) - Preparation and properties of mono-PEG modified interferon-a having different molecular weight of the PEG portion (2001년 Proceedings Of International Convention Of The Pharmaceutical Society Of Korea) - Development of HIV-1 ELISA Using Highly Reactive HIV-1 Antigens (1997년 제 16차 대한수혈학회 학술대회 초록집) |
| 상무 | 허민규 | 임상개발실 | -前 HBI PM 연구원 -前 중외CreaGene 차장 |
<주요논문> - hIL-7-hyFc, A Long-Acting IL-7, Increased Absolute Lymphocyte Count in Healthy Subjects (2020년, Clinical and Translational Science) - Long-acting FC-fusion rhGH (GX-H9) shows potential for up to twice-monthly administration in GH-deficient adults (2018년, European Journal of Endocrinology) - Adjuvant immunotherapy with autologous dendritic cells for hepatocellular carcinoma, randomized phase II study (2017년, Oncoimmunology) - The changes of estrogen receptorβ variants expression in breast carcinogenesis: Decrease of estrogen receptorβ2 expression is the key event in breast cancer development (2006년, Journal of Surgical oncology) - FBI-1 Enhances Transcription of the Nuclear Factor-κB (NF-κB)-responsive E-selectin Gene by Nuclear Localization of the p65 Subunit of NF-κB (2005년, The Journal of Biological Chemistry) - Expression of estrogen receptor-beta in normal mammary and tumor tissues: is it protective in breast carcinogenesis? (2003년, Breast Cancer Research and Treatment) <학회발표> - Phase 1b/2 Study of GX-I7 plus pembrolizumab in patients with refractory or recurrent (R/R) metastatic triple negative breast cancer (mTNBC): The KEYNOTE-899 Study. (2022년, ASCO) - Pharmacokinetic and Pharmacodynamic Modeling and Simulation of GX-H9 in the Adult Patients with Growth Hormone Deficiency (2020년, KSCPT) - Preliminary safety and efficacy of GX-I7, a long-acting interleukin-7, in combination with pembrolizumab in patients with refractory or recurrent metastatic triple negative breast cancer (mTNBC) (KEYNOTE-899) (2020년, KSMO) - Preliminary safety and efficacy of GX-I7, a long-acting interleukin-7, in combination with pembrolizumab in patients with refractory or recurrent metastatic triple negative breast cancer (mTNBC): Dose escalation period of Phase 1b/2 study (KEYNOTE-899) (2020년, ASCO) - 24-Month Efficacy and Safety of Once Weekly and Every Other Week Administration of GX-H9, Hybrid Fc-Fused Long-Acting Human Growth Hormone: a Phase 2 Study in Children with Growth Hormone Deficiency (2020년, ENDO) - Efficacy and safety of GX-I7 plus pembrolizumab for heavily pretreated patients with metastatic triple negative breast cancer: The Phase 1b/2 KEYNOTE-899 Study (2020년, SITC) - Phase 1b study of GX-I7, a long-acting interleukin-7, evaluating the safety, pharmacokinetics and pharmacodynamics profiles in patients with advanced solid cancers (2019년, SITC) - Hyleukin-7, a long-acting interleukin-7, increased absolute lymphocyte counts after subcutaneous and intramuscular administration in healthy subjects (2019년, AACR) - A Pharmacokinetic-Pharmacodynamic (PK/PD) Analysis of GX-H9, a Long-acting Hybrid Fc-fused rhGH, in Children with GH Deficiency (GHD) (2018, ENDO) - GX-E2 versus CERA for Anemia in Patients Receiving Maintenance Peritoneal Dialysis: A Phase 2, Randomized, Multi-center, Active-comparator, Dose-finding, Safety and Efficacy Study. (2017년, ASN) |
4) 조직도
 |
|
조직도 |
5) 연구개발 비용
| 가) 연구개발 비용( 연결재무제표 기준) | (단위 : 천원) |
| 구 분 | 2022년 (2022년 3분기) |
2021년 (전기) | 2020년 (전전기) | |
| 비용의 성격별 분류 | 원재료비 | 2,383,553 | 6,250,786 | 6,936,125 |
| 인건비 | 4,337,475 | 7,628,771 | 9,984,228 | |
| 감가상각비 | 1,788,472 | 1,123,771 | 1,134,085 | |
| 위탁용역비 | 8,469,759 | 21,730,433 | 23,063,949 | |
| 기타경비 | 1,363,129 | 2,757,531 | 2,601,383 | |
| 연구개발비용 계 | 18,342,388 | 39,491,292 | 43,719,769 | |
| 정부보조금 | (629,998) | (6,373,365) | (4,513,496) | |
| 보조금 차감 후 금액 | 17,712,390 | 33,117,928 | 39,206,273 | |
| 회계처리내역 | 판매비와 관리비 | 17,712,390 | 33,117,928 | 39,206,273 |
| 제조경비 | - | - | - | |
| 개발비 (무형자산) | - | - | - | |
| 회계처리금액 계 | 17,712,390 | 33,117,928 | 39,206,273 | |
| 연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액×100] |
128% | 90% | 211% | |
| 나) 연구개발 비용( 별도재무제표 기준) | (단위 : 천원) |
| 구 분 | 2022년 (2022년 3분기) |
2021년 (전기) | 2020년 (전전기) | |
| 비용의 성격별 분류 | 원재료비 | 2,319,784 | 5,971,522 | 6,917,701 |
| 인건비 | 4,061,072 | 7,250,850 | 9,802,206 | |
| 감가상각비 | 1,726,399 | 1,047,065 | 23,063,949 | |
| 위탁용역비 | 10,145,281 | 21,728,793 | 2,593,326 | |
| 기타경비 | 1,265,179 | 2,715,913 | 1,132,177 | |
| 연구개발비용 계 | 19,517,715 | 38,714,144 | 43,509,359 | |
| 정부보조금 | (629,998) | (6,373,365) | (4,513,496) | |
| 보조금 차감 후 금액 | 18,887,717 | 32,340,779 | 38,995,862 | |
| 회계처리내역 | 판매비와 관리비 | 18,887,717 | 32,340,779 | 38,995,862 |
| 제조경비 | - | - | - | |
| 개발비 (무형자산) | - | - | - | |
| 회계처리금액 계 | 18,887,717 |
32,340,779 | 38,995,862 | |
| 연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액×100] |
139% | 84% | 210% | |
6) 연구개발 실적
당사의 제품별 연구개발 실적은 아래와 같습니다.
가) 전임상 연구 현황
- 세부내역은 "2. 주요제품 및 서비스" 항목을 참고하여 주시기 바랍니다.
나) 주요 제품 임상연구 현황
| (2022년 09월 30일) |
| 구분 | 품목 | 적응증 | 현재 진행단계 | 연구시작일 (임상진입일) |
비고 | |
| 진행국가, 단계 | 승인(종료)일 | |||||
| 유전자치료제 | GX-188E, 자궁경부전암 DNA백신 | 자궁경부전암 | 한국 임상 2상 종료 | (2016-02) | 2014-05 | - |
| 유럽 임상 2상 종료 | (2019-09) | 2015-08 | 글로벌첨단바이오지원사업지원 | |||
| GX-188E, 자궁경부암 DNA백신(CPI병용) | 자궁경부암(CPI**병용) | 한국 임상 1b/2 승인(진행) | 2018-05 | 2018-06 | 국가항암신약개발사업단(NOV_2기) 지원 종료 후 3기 사업단 NOIU( National Cancer Center Onco-Innovation Unit) 후속 과제 지원 (2021.05 ~2022.12) | |
| GX-19, 코로나19 DNA 백신 | 코로나19 예방 | 한국 임상 1/2a 조기종료 | (2020-12) | 2020-06 | 산학연 컨소시엄 공동개발 범부처신약개발사업단(KDDF) 지원 |
|
| GX-19N, 코로나19 DNA 백신 | 코로나19 예방 | 한국 임상 1/2a상 종료 | (2022-05) | 2020-12 | ||
| GX-19N, 코로나19 DNA 백신 (고령자 대상) | 코로나19 예방 (고령자) | 한국 임상 1상 종료 | (2022-04) | 2021-02 | ||
| GX-19N, 코로나19 DNA 백신 | 코로나19 예방 | 인도네시아 2/3상 승인 (자진철회***) | 2021-07 | - | 임상개시 전 IND 자진 철회 (2022.03) | |
| 유전자재조합 단백질 |
GX-I7, 항암면역치료제 및 감염성질환 | 고형암(Monotherapy) | 한국 임상 1b 종료 | (2020-03) | 2018-03 | - |
| 뇌암-교모세포종 | 한국 임상 1b 종료 | (2020-09) | 2018-06 | - | ||
| 뇌암-재발성 교모세포종 (Bevacizumab 병용) | 한국 임상 2상 승인 | 2021-11 | 2021-12 | |||
| 고형암(CPA* Pre-conditioning) | 한국 임상 2b 종료 | (2020-04) | 2018-10 | - | ||
| 삼중음성유방암(CPI**병용) | 한국 임상 1b/2 승인(진행) | 2018-11 | 2019-03 | 범부처신약개발사업단(KDDF) 지원 | ||
| 코로나19(w/ 최적지지요법) | 한국 임상 1b상 조기종료 | (2022-07) | 2021-02 | - | ||
| 코로나19(w/ 최적지지요법) | 인도네시아 임상 2상 승인(진행) | 2020-12 | 2021-02 | 의뢰자: KG-Bio | ||
| GX-H9, 성장호르몬 결핍증 치료제 | 소아 성장호르몬 결핍증 | 유럽 임상 2상(연장시험)종료 | (2019-05) | 2016-01 | 공동개발(한독, 한국/유럽), 범부처신약개발사업단(KDDF) 지원 |
|
| 성인 성장호르몬 결핍증 | 유럽 임상 2상 종료 | (2017-05) | 2015-01 | 공동개발(한독, 한국/유럽), 범부처신약개발사업단(KDDF) 지원 |
||
| GX-E4, 만성신부전증에 의한 빈혈 치료제 | 빈혈 | 한국 임상 2상 종료 | (2017.04) | 2014-08 | - | |
| 비투석신장질환 환자 빈혈치료 |
동남아시아 임상 3상 승인(진행) 한국 임상 3상 승인(진행) |
2020-04 2021-03 |
2020-08 2021-08 |
의뢰자: KG-Bio 국내 IND holder: GX |
||
| GX-P1 면역억제제 | 면역억제제 | 한국 임상 1상 종료 | (2021-07) | 2020-08 | 산자부과제(5차년도) 지원 | |
| CPA* - Cyclophosphamide CPI** - Checkpoint Inhibitor 자진철회*** : 급변하는 전세계 코로나 19 시장을 고려하여 자진철회 하기로 결정하였으며 이와 같은 결정을 하게 된 사유는 아래와 같습니다. (가) 엔데믹 시대로 전환됨에 따라 새로운 백신개발에 대한 긴급성이 떨어진 점, (나) 새로운 백신 개발에 대한 시장의 니즈가 낮아졌다는 점 (다) 방어효능을 보기위한 임상3상 진행 시 위약을 접종 받아야 하는 임상 참여군에 대한 윤리성 문제가 있다는 점 |
| 주1) 그 외 관계사 및 협력사에서 GX-I7 뇌암-교모세포종 중국 임상 1/2 IND 승인 (I-Mab), 고형암(CPI**병용) 중국 임상 2상 승인 (I-Mab) 뇌암 교모세포종 미국 임상 1b/2a 승인 (NIT), 피부암(CPI**병용) 미국 임상 1b/2a 승인 (NIT), 코로나19(w/최적지지요법) 미국 임상1상 승인 (NIT), GX-H9 중국 임상 3상 승인 (I-Mab), GX-G3 호중구감소증 치료제 유럽 3상 준비 (ILKOGEN) 등의 단계로 개발을 진행하고 있습니다. |
| 주2) HPV16/18 양성인 두경부암 환자를 대상으로 1) 수술 전 선행요법으로 GX-188E, GX-I7과 Pembrolizumab 삼중 병용 연구자 주도 임상 2상 및 2) 재발성/전이성 두경부암 환자를 대상으로 GX-188E, GX-I7과 Nivolumab 삼중 병용 연구자 주도 임상 2상을 승인받아 시험대상자 모집 진행 중입니다. |
다) 주요 연구개발 세부 현황
[GX-I7, 항암면역치료제/감염치료제]
| 구 분 | 바이오신약 |
|---|---|
| 적응증 |
고형암에서 방사선 및 화학항암제 치료 관련 림프구감소증 감염 관련 림프구감소증 |
| 작용기전 | IL-7 수용체에 작용하여, CD4 및 CD8 T 세포(Naive & memory subtype) 증가 |
| 제품의 특성 | IgG4 와 IgD 로 구성된 hyFc platform 에 engineered IL-7 을 결합함으로써, 내인성 IL-7을 융합하여 내인성 IL-7 보다 안정하고 반 감기가 긴 것이 특징이며, 화학요법 또는 방사선 요법으로 유발되는 암환자의 T 세포 감소증을 개선할 수 있으며, 동시에 T 세포 면역 강화를 통한 항암 효과 향상을 기대할 수 있다. |
| 진행경과 |
1) 고형암:임상1b상 종료(단독투여, 한국) 임상1b상 종료(단독투여, 중국) 2) 뇌암: 임상1b상 종료(단독투여, 한국) 임상2상 진행 중(Bevacizumab 병용투여, 한국) 임상2상 진행 중(TMZ 병용투여, 중국) 3) 삼중음성유방암: 임상1b/2상 진행 중(Pembrolizumab 병용투여, 한국) 4) COVID-19 임상1b상(국내): 조기종료 5) COVID-19(인도네시아): 임상2상 진행 중(PART 1 모집완료, Part 2[투여경로변경] 환자 모집 중) |
| 향후계획 |
1) 국내 삼중음성유방암 임상2상 종료 추가 유효성 확증을 위한 임상시험 진행 예정 2) COVID-19 (인도네시아): 임상2상 Part2[투여경로변경] 환자모집 완료(2022년 4Q) |
| 경쟁제품 |
1) Nektar Therapeutics: Modified IL-2 임상시험 진행 중 2) Revimmune: CYT107, 재조합 IL-7 으로 고형암, 요로상피세포암 대상 임상2상 진행 중 3) BioNTech: BNT-152, IL-7 코딩 mRNA 로 고형암 대상 임상1상 진행 중 4) Gilead: Trodelvy,Trop-2 표적 항체약물접합체로 절제불가능한 국소진행성 또는 전이성 삼중음성 유방암 치료제로 승인. 키트루다 병용 임상 3상 진행 중 |
| 관련논문 등 | 1) Crucial Roles of Interleukin-7 in the Development of T Follicular Helper Cells and in the Induction of Humoral Immunity. ( J Virol. 2014) 2) 2019 AACR Poster 발표 3) 2020 ASCO Poster 발표 (2020-05) 4) 2020 SITC Poster 발표 (2020-11) 5) Compassionate Use of the human recombinant IL-7 for restoring lymphopenia as a salvage treatment in patients with recurrent glioblastoma (KAI International Meeting 2020 포스터 발표) 6) Recombinant human IL-7-hyFc for Recurrent GBM (2022.01, MedRxiv 발표) 7) 2022 ASCO Poster 발표 (2022-06) |
| 시장규모 | Global cancer immunotherapy 시장은 2020년 $85.6Bn 에서 2030년 $309.7Bn 까지 성장할 것으로 예측 (CAGR 14.1%, 2021 ~ 2030) [Ref]Cancer Immunothrapy Market, 2021-2030 (https://www.alliedmarketresearch.com/cancer-immunotherapy-market) |
| 기타사항 | 삼중음성유방암 (KDDF 지원, NIT 공동개발, Merck - Pembrolizumab 지원) 재발성교모세포종 (Roche-Bevacizumab 지원) |
[GX-188E + 면역관문억제제 병용, HPV 16/18 유래 질환 치료 DNA 백신]
| 구 분 | 바이오신약 |
|---|---|
| 적응증 | HPV16/18 유래 암 (자궁경부암, 두경부암 등) |
| 작용기전 | HPV 16형과 18형의 E6, E7 항원을 발현하는 DNA 플라스미드를 전기천공법으로 근육 세포 내 투여, HPV 16형과 18형 바이러스 특이적 항원에 대한 T 세포 면역반응을 선택적으로 유도, CD8+T세포에 의해 HPV 바이러스에 감염된 암 세포 제거 |
| 제품의 특성 | 1) 자궁경부암의 경우, 암 또는 병변조직의 세포 표면 MHC에는 HPV의 E6, E7 항원이 표지되어 있기 때문에, 본 항원을 이용한 치료백신을 개발하면 자궁경부암 세포를 특이적으로 제거할 수 있음. 즉, 바이러스가 최초로 몸에 들어오는 상황이 아니라, 증세는 전혀 없지만 이미 몸 안에 들어와서 HPV에 감염된 세포가 존재하는 환자에서 E6, E7 항원 특이적으로 바이러스를 품고 있는 세포를 인지하여 사멸시킴. 2) 자궁경부암을 치료하는 메커니즘은 세포성 면역반응을 필요로 하기에, 치료제로서 DNA 백신은 암 조직에 의해 형성된 면역억제환경을 극복할 수 있는 대안이 될 수 있으며, 면역관문억제제와의 병용요법을 통해 종양의 내재적 저항성(종양 미세환경에 의해 개발된 면역억제 효과로 T세포의 기능저하)을 극복함으로써 HPV 감염 및 자궁 경부암 환자에서 기존 치료제 대비 효과적인 치료법을 제시할 수 있음 3) GX-188E가 immune checkpoint inhibitor 등의 기존 치료법과 combination therapy로서 HPV 유래에 암환자에게 적용하여 효과를 발휘할 경우, 장기 생존율이 낮은 자궁경부암 및 두경부암의 치료율 및 생존율을 높이는데 크게 기여할 것임 4) GX-188E는 DNA 구성 및 제조 측면에서 자체발현 고발현 벡터를 사용, genetic adjuvant로 Flt3L를 사용하여, 발현 단백질을 수지상세포(DC)로 targeting하고, DC의 proliferation 활성을 증가시켜 더 높은 면역반응을 유도할 것으로 기대. |
| 진행경과 | 기존 계획서에서 목표한 1차 유효성 평가지표 확인 (Part B 완료), 2021년 4Q 전체 대상자 60명(유효성평가군) 등록 완료 및 임상 진행 중 (2018년 2Q~2023년 4Q) 2022년 4Q 신속처리대상지정(Fast Track Designation, FTD)주) 신청 |
| 향후계획 | 2022년 4Q final CSR 확보 및 종료 2022년 4Q~2023년 4Q 조건부허가(Conditional approval) 신청 및 승인(주1) 다양한 기술이전 후보사를 스크리닝하여 글로벌 사업개발 활성화 계획 (주1)신속처리대상지정 및 조건부허가 제도는 대체치료제가 없는 중대한 질환, 희귀질환관리법에 따른 희귀질환, 대유행 감염병의 예방·치료를 목적으로 하는 첨단바이오의약품으로 지정된 의약품이 초기 임상시험 결과 또는 임상시험 과정에서 안전성·유효성이 확보됨을 확인할 수 있는 자료를 제시하는 경우 추후 임상시험(임상3상) 자료를 제출하는 것을 조건으로 허가하는 제도임. 이는 대체치료제가 없고 생명을 위헙하는 암 등 중대한 질환의 치료목적으로 하는 경우에 지정될 수 있으나, 대상질환 및 해당 질환에 대한 표준 치료법의 빠른 변화로 신청 당시 임상 현장 상황에 따라 달리 해석될 수 있으므로, 신속처리대상 지정신청이 신속처리대상지정을 받았다는 것을 의미하는 것은 아님. 그러므로 신속처리대상 지정을 받지 못할 경우 조건부 허가 대상이 되지 못할 가능성이 있으며, 따라서 회사는 이와는 별도로 임상3상을 위한 준비를 병행하여 진행할 예정임. |
| 경쟁제품 | MSD Keytruda(Pembrolizumab) PD-1 inhibitor, Immunotherapy로, 전이성 또는 재발성 자궁경부암 환자 대상 FDA 허가 (2018) |
| 관련논문 등 | 1) Clearance of persistent HPV infection and cervical lesion by therapeutic DNA vaccine in CIN3 patients. -(Nature communications, 2014) 2) 2020 AACR Oral presentation (2020-04) 3) Pembrolizumab plus GX-188E therapeutic DNA vaccine in patients with HPV-16-positive or HPV-18-positive advanced cervical cancer: interim results of a single-arm, phase 2 trial (Tne Lancet Onncology, 2020-12-01) 4) 2021 ASCO Oral Presentation (2021.06) 5) 2022 ESMO Oral Presentation (2022.09) |
| 시장규모 | - 전 세계적으로 2021년 616,600건의 자궁경부암 사례 발생 추정, 2029년까지 665,600건으로 증가 예상 (Cervical cancer market spotlight, Data monitor, 2022). - 자궁경부암 8개 주요 국가 (미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본, 중국) 에서의 시장 규모는 2020년 $ 6.7Bn 이며, 2030년 $ 48Bn 까지 성장할 것으로 예상 (CAGR 23.0% 2020 ~ 2030) (Cervical Cancer Global Drug Forecast and Market Analysis to 2030, Global data, 2022) |
| 기타사항 | 국가항암신약개발사업단과 공동개발, 식약처 바이오챌린저 프로그램 1호 품목 선정 (2020-07) 연세암병원에서 GX-188E + GX-I7 + CPI 삼중 병용 연구자 주도 임상2상 개시 |
GX-188E는 2013년 5월 식약처로부터 자궁경부 상피내종양 3(CIN3, 자궁경부전암 단계) 환자를 대상으로 GX-188E 단독요법의 안전성을 평가하기 위한 최초 임상시험 (Protocol No. GX-188E-SN)이 승인되었고, 이후 자궁경부전암 환자를 대상으로 한 국내 임상2상 및 유럽 임상2상을 수행하여 GX-188E 단독요법으로 자궁경부전암에 대한 치료효과 및 안전성을 확인하였습니다. 다만, 자궁경부전암의 경우 비교적 간단한 수술로도 치료 효과가 높은 편이라 임상적 미충족 수요가 낮았고, 이에 자궁경부전암에서의 긍정적 임상 결과를 바탕으로 효과적인 치료제에 대한 미충족 수요가 높은 자궁경부암으로 개발전략을 변경 하였습니다.
2017년 6월 식약처로부터 진행성 자궁경부암 환자를 대상으로 GX-188E와 펨브롤리주맙 병용요법의 안전성 및 유효성을 평가하기 위한 임상1b/ 2상 (Protocol No. GX-188E-005) IND 승인을 득한 후, 2021년 12월까지 시험대상자 65명이 모집이 완료되었고, 2022년 10월 현재 5명이 진행 중입니다. 유효성 평가군 60 명 기준 24 주 이내 평가 결과까지 확보 후 통계분석하여 2022년 1 2 월경 최종 결과보고서를 작성할 계획입니다. 이에 당사에서는 자궁경부암 환 자를 대상으로 한 2상 임상 결과를 바탕으로, 국내 조건부 허가 신청을 계획하 고 있습니다.
1) 한국 임상 2상 개요 및 주요 결과
| [자궁경부전암 환자 대상 한국 임상 2상 개요 (2016년 2월 종료)] |
|
구 분 |
바이오신약 |
|---|---|
|
적응증 |
HPV16/18 유래 자궁경부전암 |
|
작용기전 |
HPV 16형과 18형의 E6, E7 항원을 발현하는 DNA 플라스미드를 전기천공법으로 근육 세포 내 투 여, HPV 16형과 18형 바이러스 특이적 항원에 대한 T 세포 면역반응을 선택적으로 유도, CD8+ T 세포에 의해 HPV 바이러스에 감염된 암 세포 제거 |
|
제품의 특성 |
임상 1상 연구 결과를 통해 안전성과 효능의 탁월함이 확인된 새로운 자궁경부전암 면역 유전자치료제 GX-188E은 면역학적 과학 지식과 실험적인 근거를 바탕으로 합리적으로 디자인된 DNA 치료 백신임 GX-188E의 임상1상을 통하여, 사람에서 뛰어난 면역반응을 유도하는 gene therapy module (tPA-Flt3L-antigen)을 발굴함. 이 gene therapy module은 antigen의 secretion과 수지상세포 (DC)로 타겟팅을 증가시켜 면역반응의 T세포 면역반응의 증가를 유도함. 또한, broad immunity를 유도하기 위해 multiple 항원을 사용하였고 야생형 항원이 가진 intact epitope을 모두 보존할 수 있도록 디자인 함. 또, 자체 제작한 고발현 벡터 (pGX27)를 사용하여 항원발현을 증가시킴 |
|
진행경과 |
국내 임상 2상 완료 및 임상결과보고서 도출 (2016년 2월) 1) GX-188E 1mg 및 4mg 용량에서 안전성과 내약성을 확인함. 2) 약물투여 36주차에 67% (35/52)의 환자가 3기에서 1기 수준으로 치료되는 효과를 확인함. 3) HPV clearance 측면에서, 치료 효과를 보인 환자 중 77%가 완치 (HPV clearance)됨. 특허권을 보유한 plasmid DNA에 대해서 중국 BSK사 (치료유전자를 세포치료제에 적용한 경우만 해당) 및 미국 NIT사 (플라스미드 DNA에 대한 non-exclusive 계약)에 일부 권리를 라이센싱 아웃함. |
|
향후계획 |
글로벌 임상 2상 수행을 통해 치료 효능 및 안전성 검증 생산공정 최적화하여 3상 및 상용화를 위한 공정 확립 |
|
경쟁제품 |
미국 Inovio사의 DNA 치료백신 VGX-3100의 자궁경부전암 환자 대상으로 임상2상 결과를 발표하였으며 위약군 대비 통계적으로 유의미한 치료효과를 보였음. 박테리아를 전달체로 사용하여 유전자를 투여하는 Bioleaders사의 치료백신 BLS-ILB-E710c는 경구투여를 함으로써 편의성이 돋보이나 아직 효능 입증 단계임. |
|
관련논문 등 |
Clearance of persistent HPV infection and cervical lesion by therapeutic DNA vaccine in CIN3 patients. (Nature communications, 2014) |
|
시장규모 |
원추 절제술의 1인당 치료비용 80-100만원을 적용할 경우, 자궁경부전암 시장규모는 2012년 연간 1조 2천억원 이상에 달하는 거대 시장임. 또한 전 세계 3억여 명이나 되는 HPV 만성 감염 환자 base와 연간 약 0.3%의 자궁경부암 환자 증가율(Datamonitor, 2010)을 고려 시, 글로벌 CIN2, 3 시장도 꾸준히 유지 또는 점진적 증가가 예상되며, 치료 백신 개발 시 특히 젊은 가임 여성을 타깃으로 한 자궁경부전암 치료제 시장이 초기 급격히 성장하여 큰 규모로 유지될 것으로 예상됨. |
|
기타사항 |
보건복지부 글로벌 첨단바이오의약품 기술개발사업 지원 정부과제 (2015-2018) |
2) 유럽 임상 2상 개요 및 주요 결과
| 자궁경부전암 환자 대상 한국 임상 2상 개요 (2019년 9월 종료) |
|
구 분 |
바이오신약 |
|---|---|
|
적응증 |
HPV16/18 유래 자궁경부전암 |
|
작용기전 |
HPV 16형과 18형의 E6, E7 항원을 발현하는 DNA 플라스미드를 전기천공법으로 근육 세포 내 투 여, HPV 16형과 18형 바이러스 특이적 항원에 대한 T 세포 면역반응을 선택적으로 유도, CD8+ T세포에 의해 HPV 바이러스에 감염된 암 세포 제거 |
|
제품의 특성 |
임상1상과 임상2상 연구 결과를 통해 안전성과 효능의 탁월함이 확인된 새로운 자궁경부전암 면역 유전자치료제 GX-188E은 면역학적 과학 지식과 실험적인 근거를 바탕으로 합리적으로 디자인된 DNA 치료백신임 GX-188E의 임상1상을 통하여, 사람에서 뛰어난 면역반응을 유도하는 gene therapy module (tPA-Flt3L-antigen)을 발굴함. 이 gene therapy module은 antigen의 secretion과 수지상세포 (DC)로 타겟팅을 증가시켜 면역반응의 T세포 면역반응의 증가를 유도함. 또한, broad immunity를 유도하기 위해 multiple 항원을 사용하였고 야생형 항원이 가진 intact epitope을 모두 보존할 수 있도록 디자인 함. 또, 자체 제작한 고발현 벡터 (pGX27)를 사용하여 항원 발현을 증가시킴 |
|
진행경과 |
글로벌 임상 2상 완료 및 임상결과보고서 도출 (2019년 9월) 1) GX-188E 투여 후 HPV 항원 특이적 T 세포 면역반응이 효과적으로 유도됨을 확인함. 2) 약 50% 의 환자가 3기에서 1기 수준으로 병변이 치료되는 효과를 보였으나, GX-188E 투여군과 위약군 간의 통계적으로 유의한 차이를 보이지 않았음. |
|
향후계획 |
자궁경부전암 임상 결과를 토대로 긍정적 임상결과를 바탕으로 효과적인 치료제에 대한 미충족 수요가 높은 자궁경부암으로 임상 개발전략을 변경 |
|
경쟁제품 |
미국 Inovio사의 DNA 치료백신 VGX-3100의 자궁경부전암 환자 대상으로 임상2상 결과를 발표하였으며 위약군 대비 통계적으로 유의미한 치료효과를 보였음. 박테리아를 전달체로 사용하여 유전자를 투여하는 Bioleaders사의 치료백신 BLS-ILB-E710c는 경구투여를 함으로써 편의성이 돋보이나 아직 효능입증 단계임. |
|
관련논문 등 |
A phase 2, prospective, randomized, multicenter, open-label study of the HPV DNA vaccine (GX-188E) in patients with cervical intraepithelial neoplasia 3. (Clinical Cancer Research, 2020) |
|
시장규모 |
원추 절제술의 1인당 치료비용 80-100만원을 적용할 경우, 자궁경부전암 시장규모는 2012년 연간 1조 2천억원 이상에 달하는 거대 시장임. 또한, 전 세계 3억여 명이나 되는 HPV 만성 감염 환자 base와 연간 약 0.3%의 자궁경부암 환자 증가율(Datamonitor, 2010)을 고려 시, 글로벌 CIN2, 3 시장도 꾸준히 유지 또는 점진적 증가가 예상되며, 치료 백신 개발 시 특히 젊은 가임 여성을 타깃으로 한 자궁경부전암 치료제 시장이 초기 급격히 성장하여 큰 규모로 유지될 것으로 예상됨. |
|
기타사항 |
보건복지부 글로벌 첨단바이오의약품 기술개발사업 지원 정부과제(2015-2018) |
[GX-H9, 성장호르몬 결핍증 치료제]
| 구 분 | 바이오신약 |
|---|---|
| 적응증 | 성인, 소아 성장호르몬 결핍증 |
| 작용기전 | 뇌하수체 전구에서 분비되는 호르몬으로서 수용체와 결합하여 IGF-1을 발현시킴으로서 세포의 성장/재생에 관여함. |
| 제품의 특성 |
GX-H9은 Long-acting hGH 제품 중 하나로써 hyFc fusion protein 기술을 사용해 체내 반감기를 늘린 제품임. 매주 한번 투여하는 방식이므로 기존의 매일 투여하는 방식의 short-acting hGH에 비해 환자의 편의성이 증대될 것으로 기대 생체 내 존재하는 IgG4 와 IgD의 부위 중 세포 독성 유발 능력이 없는 서열을 사용하여 non-cytolytic 특성을 가지며, 현재까지 임상에서 주입 부위의 지방 이상증 또는 결절 등의 부작용이 발생하 지 않아 높은 안전성을 보임 |
| 진행경과 | 성인 임상 2상 완료 (2016) & 소아 임상 2상 완료 (2019) US FDA ODD 지정(2016) & EU EMA ODD 지정(2021) Ph3를 위한 DS 생산 및 device 개발 계획 진행 중임. FDA TypeB meeting minutes (2022.03) |
| 향후계획 | 글로벌 L/O 및 I-Mab과 글로벌 임상 3상을 위한 시료생산, Device 개발에 대한 collaboration 논의 |
| 경쟁제품 | Short-acting hGH 개발 제품으로는 Pfizer의 Genotropin, Novo Nordisk의 Norditropin 등 현재 10개 이상의 제품이 사용화되어 있음. 지속형 성장호르몬 (long-acting hGH) 개발 제품으로는 현재 3개의 제품이 상용화되어 있음. Ascendis Pharma의 지속형 제품 Skytrofa 는 PGHD 환자 대상으로 현재 FDA/EMA approved & AGHD 환자 대상으로 ph3 진행 중 Novo Nordisk의 지속형 제품 Sogroya 는 AGHD 환자 대상으로 FDA/EMA approved & PGHD 환자 대상으로 Ph3 진행 중 OPKO/Pfizer의 지속형 제품 Ngenla 는 PGHD 환자 대상으로 현재 FDA approval fail (2022), EMA approved (2022) |
| 관련논문 등 | 2016 ENDO, 2016 ESPE, 2017 ENDO, 2018 ENDO, 2018 ESPE 발표, Long-acting FC-fusion rhGH (GX-H9) shows potential for up to twice-monthly administration in GH-deficient adults( Eur J Endocrinol. 2018), 2020 ENDO |
| 시장규모 | IQVIA에 따르면 2021년 글로벌 성장호르몬 시장의 규모는 $ 5.1B (약 7조원) 임. Global data 보고서에 따르면 Long-acting hGH 제품의 판매량은 2030년까지 전체 hGH 시장의 92.6%를 점유할 것으로 예측 |
| 기타사항 | 공동개발(한독, 한국/유럽), 범부처신약개발사업단(KDDF) 과제 종료. 중국 I-Mab ph3 소아임상 진행 중. |
[GX-E4, 만성신부전증에 의한 빈혈 치료제]
| 구 분 | 바이오신약 |
|---|---|
| 적응증 | 만성신장질환으로 인한 빈혈 |
| 작용기전 | 골수의 전구세포의 에리스로포이에틴 수용체와 상호작용하여 적혈구 생성작용을 촉진 |
| 제품의 특성 | GX-E4는 Long-acting ESA(Erythropoesis simulating agent) 제품 중 하나로, glycosylation (ARANESP®) 또는 PEGylation (MIRCERA®) 기술을 사용해 체내 반감기를 늘린 다른 제품들과 다르게 hyFc fusion protein 기술을 사용해 체내 반감기를 늘린 제품으로 생체 내 존재하는 IgG4 와 IgD의 부위 중 세포 독성 유발 능력이 없는 서열을 사용하여 non-cytolytic 특성을 가지며, 타 제품(ARANESP®) 대비 약동·약력학적 프로파일의 변동 수준이 낮아 EPO 의약품의 장기 투여에 따른 부작용 수준이 낮을 것으로 예상됨 |
| 진행경과 | 1. 임상2상 종료 2. 파트너사 KG-Bio 비투석 임상3상 환자 모집 완료 (2022.07) |
| 향후계획 | 1. 투석 환자 대상 EU포함 다국가 임상 3상 신청 계획 2. 파트너 발굴 및 L/O 추진 |
| 경쟁제품 |
Short-acting EPO 제품으로는 Amgen이 출시한 Epogen을 선두로 현재는 다양한 biosimilar 들이 출시되어 있음. Long-acting EPO 제품으로는 Amgen/Kyowa Kirin 이 출시한 Aranesp®/Nesp® (Darbepoetin Alfa) 와 Roche 가 출시한 Mircera®(Methoxy polyethylene glycol-Epoetin Beta) 가 전세계적으로 상용화 되었으며, 현재는 Aranesp®/Nesp® 의 biosimilar 들이 출시되고 있음. |
| 관련논문 등 | 2017 ASN 포스터발표, 2018년 대한신장학회 구연발표 |
| 시장규모 | IQVIA에 따르면, 2021년 Global ESA 시장의 규모는 $ 6.9B 이며, 여기서 Long-acting ESA 시장 규모는$ 2.7B으로 전체 ESA 시장 중 39%를 차지 |
| 기타사항 | KG-Bio와 공동개발 중국 ChemoWangbang 투석 임상 1b 진행 중 |
[GX-P1, 자가면역질환]
| 구 분 | 바이오신약 |
|---|---|
| 적응증 | 자가면역질환 |
| 작용기전 | T세포에 발현하는 PD-1과 결합하여 T세포의 증식을 억제하고 cytokine 발현을 감소시키는 등 T 세포의 기능을 억제하는 등 자가면역질환 발병에 중추적인 역할을 하는 T 세포의 과활성을 기능을 억제함 |
| 제품의 특성 | 현재까지 PD-1/PD-L1 신호작용을 이용한 치료제는 저해제(antagonist)로서 면역관용을 저해하여 T세포 활성을 증가시키는 방향으로 개발되어 왔음 GX-P1은 soluble PD-L1에 hyFc 기술을 융합시켜 체내 지속력을 강화시킨 PD-1/PD-L1 활성제(agonist)로 T세포 면역관용 유도 기반 면역치료제임 T세포 관용의 유도는 다른 T세포의 활성능은 그대로 유지하면서, 항원특이적으로 자가면역 T세포를 억제할 수 있음. |
| 진행경과 | 2021.07 임상 1상 종료 |
| 향후계획 | 차단계 개발 진행을 위한 파트너사 검토 |
| 경쟁제품 |
현재 상용화된 경쟁 제품 중 PD-1/PD-L1 agonist를 이용한 T-세포 활성 억제제는 없으며, 개발 중인 경쟁 제품으로는 Eli Lily 의 Peresolimab 이 류마티스 관절염을 적응증으로 임상2상 단계에 있고, Anaptys Bio 에서 개발 중인 Rosnilimab 이 원형탈모증을 적응증으로 임상2상 단계에 있음. 자가면역질환 치료제로는 AbbiVie 가 출시한 Humira 가 류마티스 관절염 및 건선 치료를 위해, Janseen 이 출시한 Stelara 가 건선 치료를 위해 전세계적으로 사용되고 있음. |
| 관련논문 등 | 해당 사항 없음 |
| 시장규모 | 글로벌 시장조사기관 Research and Markets 에서는 전세계 자가면역질환 치료제 시장이 2025년 $153 Bn 에 이를 것으로 예측 |
| 기타사항 | 2020. 1Q 제넨바이오로 장기이식 면역거부반응 적응증으로 L/O 및 2020. 4Q 미국 터렛 캐피털에 뇌졸증, 자궁내막증, 조산증 3개 적응증 L/O하였고 현재는 터렛 캐피털의 포트폴리오 회사인 이그렛에서 FDA pre-IND을 하고 IND submission 준비 중임. 산업자원부 지원과제임(5차년도 지원과제이며 2021.04. 만료) |
[GX-19N, 코로나19 백신]
| 구 분 | 바이오신약 |
|---|---|
| 적응증 | 코로나바이러스감염증(COVID-19) 예방 |
| 작용기전 | SARS-CoV-2 바이러스를 무력화시키는 항체 및 T세포 반응이 유도될 수 있도록 특정 유전자를 인체에 투입, 면역반응을 유도하는 기전 |
| 제품의 특성 | 신종코로나바이러스 (SARS-CoV-2)의 단백질을 발현하는 유전자 서열을 포함하는 DNA 예방 백신으로 S 및 NP 항원에 대한 면역반응을 유도하여 SARS-CoV-2 감염이 유도하는 COVID-19질환을 예방 |
| 진행경과 | 1. 국내 건강성인 1/2a상 종료 2. 국내 고령자 1상 종료 3. 인도네시아 2/3상 IND 승인 이후, 사업성 및 위약군에 대한 윤리적인 문제로 개발중단 및 IND 자진철회 |
| 향후계획 | 코로나19 엔데믹 및 새로운 펜데믹에 대한 백신플랫폼 연구개발은 컨소시움을 통해 지속 |
| 경쟁제품 | Moderna(mRNA), Pfizer(mRNA), AstraZeneca/Oxford(Virus vector), Inovio(DNA), Novavax(Subunit), etc |
| 관련논문 등 | Vaccines (Basel). 2021 Mar 24;9(4):307. Safety and immunogenicity of a recombinant DNA COVID-19 vaccine containing~ ('21.06.02, MedRxiv 발표) |
| 시장규모 | COVID-19 예방 백신 시장은 2021년 $81.7 Bn 에서 2028년 $25.4 Bn 까지 하락할 것으로 예측 (CAGR -15.4%, 2021 ~ 2028) Ref: Evaluate_COVID-19 prophylaxis |
| 기타사항 | 산학연 컨소시엄 공동개발 중 (제넥신, 국제백신연구소, 에스엘백시젠, 바이넥스, 제넨바이오, 카이스트, 포스텍) 범부처신약개발사업단(KDDF) 과제 선정 (2020.09) |
7) 향후 계획
당사는 지속형 항체융합단백질을 제조할 수 있는 고유의 항체융합기술인 hybrid Fc 기술과 유전자 치료백신 분야의 원천기술을 보유하고 있으며, 이를 이용하여 오리지널 단백질치료제 및 바이오시밀러 대비 진보된 바이오베터 제품과 차세대 바이오 신약을 개발하고 있습니다. 특히 면역 시스템의 핵심세포인 T세포를 만들어내는 가장 중요한 단백질인 인터루킨-7(interleukin-7)을 이용하여 면역기반 치료제를 개발 중이며, 다양한 암종에 대하여 단독 또는 다른 면역항암제와 병용투여 연구를 계획하고 있으며, 이를 통해 안전성과 치료효과를 확보할 계획입니다.
8) 연구개발활동 및 판매중단 현황
| 구 분 | 품 목 | 적응증 | 연구 시작일 |
최종 진행단계 | 연구 중단일 |
중단 사유 | 재개 계획 | ||
|---|---|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||||
| 바이오 | 신약 | GX-19N | COVID-19 | 2020년 | 임상1/2a상(한국) | 2020년 | 2022.03 | 개발환경의 변화* | 없음 |
| 2021년 | 임상2/3상(인도네시아) | 2021년 | |||||||
* 세계 백신시장 수급상황에 비추어 사업성이 낮고, 위약군에 대한 윤리적인 문제로 임상연구 중단
7. 기타 참고사항
가. 주요 특허보유 현황(지적재산권)
| 번호 | 내용 | 권리자 | 출원일 | 등록일 | 적용 제품 |
비고 |
|---|---|---|---|---|---|---|
| 1 | IL-12 활성을 증가시키는 IL-12p40 소단위체의 유전자 및 이를 DNA백신 면역증강제로 이용하는 용도 |
제넥신 | 01.03.13(한국) 01.03.15 (미국,일본, 유럽, 호주, 캐나다, 중국) 01.09.20(PCT) |
03.09.17(한국) 06.01.05(호주) 06.09.27(유럽) 06.10.25(중국) 06.10.25(중국) 07.08.07(미국) 08.09.05(일본) 11.03.02(미국) 12.11.11(캐나다) |
GX-188E GX-110E GX-051 |
IL12M기술 |
| 2 | Immunoglobulin fusion protein |
제넥신 / POSTECH | 08.05.30(한국) 08.05.30(미국외 14개국) 08.05.30(PCT) 09.11.15(이스라엘) 09.11.06(중국) 09.11.06(인도) 10.08.12(홍콩) 18.12.04(마카오) |
09.05.08(한국) 11.01.11(미국) 11.09.15(싱가폴) 12.09.17(이스라엘) 13.02.27(유럽9개국) 13.05.14(캐나다) 13.07.18(호주) 14.07.11(일본) 14.10.10 (러시아) 15.11.25(중국) 16.09.09(홍콩) 19.03.11(마카오) 20.11.24(브라질) 21.01.29(홍콩) |
항체융합 단백질 치료제 | hyFc기술 |
| 3 | HPV변형체 및 면역증강제를 포함하는 자궁경부암 |
제넥신 | 09.07.02(한국) 10.08.13(PCT) 10.08.13(미국, 유럽, 중국, 일본) 16.05.03(홍콩) |
12.07.11(한국) 15.04.07(미국) 15.05.01(일본) 16.01.20(중국) 18.02.28(유럽) 21.06.01(중국) 21.10.15(홍콩) |
GX-188E | DNA 치료백신 기술 |
| 4 | 자궁경부암의 치료방법 | 제넥신 | 15.08.14(PCT) 17.02.01(캐나다) 17.02.13(브라질) 17.02.14(일본) 17.02.14(미국) 17.02.15(맥시코) 17.03.15(한국) 17.03.15(유럽) 17.03.30(중국) 18.01.19(홍콩) |
21.03.11(호주) | GX-188E | DNA 치료백신 기술 (단독치료 임상) |
| 5 | 변형된 인터루킨-7 단백질 및 이의 용도 |
제넥신 | 16.06.10(한국) 16.06.10(PCT) 16.09.15(미국) 17.11.10(인도) 17.12.11(중국) 17.12.08(일본) 17.11.17(캐나다) 17.12.11(브라질) 18.01.03(유럽) 18.01.08(인도네시아) 18.01.10(러시아) 18.11.28(홍콩) 22.04.13(중국-DIV1) 22.06.08(일본-DIV2) |
18.06.26(한국) 19.02.19(미국) 19.12.04(러시아) 21.02.22(인도네시아, 등록결정) 22.06.10(일본) |
GX-I7 | 물질특허 |
| 6 | GLP 및 면역글로불린 하이브리드 Fc 융합 폴리펩타이드 및 이의 용도 | 제넥신 | 15.12.30(한국) 15.12.31 (PCT) 15.12.31(대만) 17.07.10(유럽) 17.06.22(미국) 17.06.29(일본) 17.06.29(중국) 18.05.07(홍콩) |
18.01.29(한국) 18.08.03(일본) 19.09.04(유럽) 20.01.21(미국) 20.02.21(대만) 20.10.09(홍콩) 20.10.30(중국) |
GX-G6/G8 | 물질특허 |
| 7-1 | hGH 융합단백질을 포함하는 성장호르몬 결핍을 치료하기 위한 약학 조성물(성인) |
제넥신/한독 | 17.02.16(PCT) 17.02.16(한국) 17.02.16(요르단) 17.02.17(베네수엘라) 17.02.17(대만) 18.08.09(캐나다) 18.08.10(미국) 18.08.16(브라질) 18.08.16(일본) 18.09.11(유럽) 18.09.14(인도네시아) 18.09.14(러시아) 18.09.18(중국) 18.12.13(한국) 19.06.14(홍콩) |
20.09.11(러시아) 21.06.11(일본) 21.10.07(한국) 21.12.11(대만) 22.03.16(요르단) 22.06.06(중국 등록결정) 22.07.07(유럽 20개국) |
GX-H9 (성인) |
- |
| 7-2 | hGH 융합단백질을 포함하는 성장호르몬 결핍을 치료하기 위한 약학 조성물(소아) |
제넥신/한독 | 17.08.30(PCT) 17.08.30(베네수엘라) 17.08.30(대만) 17.08.30(한국) 18.12.13(한국) 19.02.12(요르단) 19.02.15(캐나다) 19.02.27(일본) 19.02.28(미국) 19.02.28(브라질) 19.03.25(인도) 19.03.26(유럽) 19.03.28(인도네시아) 19.03.29(러시아) 19.04.28(중국) 19.12.18(홍콩) |
20.12.29(대만) 21.07.01(대만) 21.09.30(한국) |
GX-H9 (소아) |
- |
| 8 | 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 사람 파필로마바이러스 유래 질환의 예방 또는 치료용 약학적 조성물 |
제넥신 | 16.12.02(PCT) 16.12.02(한국) 16.12.02(대만) 18.03.14(한국) 18.05.10(미국) 18.06.01(중국) 19.04.18(홍콩) |
20.07.08(한국) 22.04.16(대만 등록결정) |
GX-I7 | HPV 용도 |
| 9 | 면역글로불린 Fc가 융합된 인터루킨-7 융합 단백질을 포함하는 인플루엔자 바이러스 감염의 예방 또는 치료용 약학적 조성물 |
제넥신 | 16.11.30(한국) 16.11.30(PCT) 16.12.02(대만) 18.05.18(미국) 18.06.01(중국) 19.04.18(홍콩) |
22.05.13(대만 등록결정) | GX-I7 | Flu 용도 |
| 10 | 변형된 인터루킨-7 융합 단백질의 제형 |
제넥신 | 15.11.06(한국) 16.11.02(PCT) 16.11.04(대만) 18.05.03(미국) 18.06.12(중국) 19.04.25(홍콩) |
20.11.18(대만) 21.03.01(대만) 22.04.11(한국) |
GX-I7 | 제형 |
| 11 | GLP-1-hyFc 용량용법 | 제넥신 | 20.03.09(미국) 20.03.09(PCT) |
- | GX-G6 | 임상 |
| 12 | PD-L1 단백질이 포함된 융합 단백질 및 이의 용도 | 제넥신 | 21.01.06(PCT) 21.01.06(한국) 21.01.07(대만) |
- | GX-P1 | 물질 |
| 13 | PD-L1 단백질 및 단량체성 IL-10 변이체가 포함된 융합 단백질 및 그의 용도 | 제넥신 | 21.01.06(PCT) 21.01.06(한국) 21.01.07(대만) |
- | GX-P10 | 물질 |
| 14 | 신규 IL-10 변이체 단백질 및 그의 용도 | 제넥신 / 프로젠 | 20.07.07(PCT) 20.07.07(한국) 20.07.08(대만) 22.02.07(유럽) 22.01.07(일본) 22.01.10(미국) 22.03.08(중국) |
- | GX-P10 | |
| 15 | 종양에서 IL-7 융합 단백질을 이용하여 림프구 수를 증가시키는 방법 | 제넥신 / NIT | 20.09.04(PCT) 22.01.31(뉴질랜드) 22.02.03(캐나다) 22.02.11(싱가포르) 22.02.21(호주) 22.02.22(브라질) 22.02.23(멕시코) 22.02.25(미국) 22.03.02(중국) 22.03.03(일본, 사우디아라비아,아랍에미리트, 태국, 이스라엘, 유럽) 22.03.24(인도네시아) 22.03.28(베트남) 22.03.29(인도) 22.03.30(러시아) 22.03.31(한국) 22.04.01(남아프리카공화국) |
- | GX-I7 | 용법용량 |
| 16 | IL-7 단백질 및 면역체크억제제 조합으로 종양을 치료하는 방법 | 제넥신 / NIT | 19.11.15(PCT) 19.11.15 (호주, 중국, 인도네시아, 인도, 일본, 한국, 뉴질랜드, 홍콩) |
- | GX-I7 | 병용투여 |
| 17 | 변형된 인터루킨-7 단백질 및 이의 용도 | 제넥신 / NIT | 20.04.16(한국) 21.04.16(미국) |
- | modified GX-I7 | MGM 보완 |
| 18 | 변형된 인터루킨-7 및 TGF 베타 수용체 II를 포함하는 융합단백질 및 이의 용도 | 제넥신 / POSTECH | 20.11.13(PCT) 20.11.13(한국) 22.04.07(호주) |
22.05.23(한국) | GX-72 | |
| 19 | 신규 코로나바이러스 예방 및 치료용 백신 조성물 | 제넥신 / 벡시젠 | 20.12.16(한국) 21.12.16(한국) 21.12.16(PCT) |
- | GX-19N | 코로나백신 |
| 20 | 자궁경부암의 치료방법 | 제넥신 | 20.04.24(미국) 21.04.26(PCT) 21.04.26(미국) 22.06.30(한국) |
- | GX-188E | PD-1 항체 병용 |
| 21 | 항-TAA 항체, 항-PD-L1 항체 및 IL-2를 포함하는 융합단백질 및 이의 용도 | 제넥신 | 20.01.31(한국) 21.01.27(PCT) 22.06.30(호주) |
22.05.18(한국) | tri-specific | 면역항암제 |
| 22 | 지속형 에리트로포이에틴 함유 조성물 | 제넥신 / 녹십자 | 15.10.07(한국) 16.10.06(PCT) 16.10.05(인도네시아) 16.10.06(중국) 16.10.07(대만) 18.05.03(호주) |
18.04.03(한국) 19.10.16(인도네시아) 19.04.01(대만) 20.06.11(호주) |
GX-E4 | 고순도조성물 |
| 23 | 지속형 EPO 제제를 이용한 빈혈 치료 방법 | 제넥신 / 녹십자 | 16.01.08(한국) 16.01.08(유럽) 16.01.08(중국) 16.01.08(브라질) 16.01.08(러시아) 16.01.08(일본) 16.01.08(미국) 16.01.08(대만) 17.08.08(인도네시아) 21.12.09(중국) |
18.06.21(대만) 18.11.28(러시아) 19.07.26(일본) |
GX-E4 | 치료방법(용법용량) |
| 24 | COVID-19 mRNA 백신 전달시스템 | 제넥신 / 화이바이오메드/포항공대 | 21.07.09(한국-priority) 21.07.12(한국-priority) 22.07.06(한국) 22.07.07(PCT) |
- | mRNA백신 제형 | HA 제형 |
| 25 | Method of Inducing Stem Cell Mobilization | NIT / 제넥신 / 포항공대 | 20.10.26(미국) 21.10.25(PCT) |
- | GX-I7 | 줄기세포 Mobilization |
| 26 | 결핵의 예방 또는 치료용 약학적 조성물 | 제넥신, 질병관리청 | 20.12.04(한국) 21.12.03(PCT) |
- | 결핵 | 결핵 DNA 백신 |
| 27 | 코로나바이러스 백신 조성물 및 이의 사용 방법 | 제넥신 / 에스엘벡시젠 | 21.09.24(한국) 21.11.03(한국) |
- | GX-19N | 부스터 용량용법 |
| 28 | PD-L1 및 IL-10의 융합단백질을 유효성분으로 하는 이식거부반응 치료용 약학적 조성물 | 제넥신 / 제넨바이오 | 21.11.08(PCT) | - | GX-P10 | 용도 |
| 29 | 코로나바이러스 감염 질환의 치료 또는 예방을 위한 인터루킨-7 융합 단백질의 투여 요법 | 제넥신 | 21.11.12(한국) | - | GX-I7 | 코로나 치료제 |
| 30 | hGH 융합단백질의 고농도 투여 제형 | 제넥신 / 한독 | 21.11.26(한국) | - | GX-H9 | 제형 |
| 31 | 변형된 인터루킨-7 및 VEGF 길항제를 포함하는 암 치료용 조성물 및 이를 이용한 암 치료방법 | 제넥신 | 22.01.03(한국) | - | GX-I7 | 병용투여 |
| 32 | HPV-특이적 DNA 백신, IL-7 단백질 및 면역관문억제제 조합의 종양 치료방법 | 제넥신 / 연세대학교 산학협력단 | 22.03.10(한국) | - | Triple Combo | 병용투여 |
나. 산업의 현황
1) 산업의 특성
바이오의약품 산업의 특성을 구체적으로 살펴보면 다음과 같습니다.
가) 고부가가치를 창출하는 대표적인 지식산업
의약품을 개발한다는 측면에서 넓게는 제약산업의 범주에 속하며, 무형가치의 투입으로 고부가가치를 창출하는 대표적인 지식산업입니다.
나) 고도 성장산업
한국바이오의약품 협회에서 2021년 12월에 발간한 바이오의약품 산업동향 보고서에 따르면 글로벌 바이오의약품 시장은 최근 5년간(2016년~2020년)간 연평균 12% 성장하였으며, 전체 의약품 시장에서 바이오의약품 매출비중은 2012년 20%에서 2019년 29%로 증가했으며, 2026년 35%로 크게 증가할 것으로 예상됩니다.
전 세계 바이오의약품 시장 규모는 2020년 기준 3,793억달러로 2016년 2,408억달러에서 2016년 ~ 2020년 간 연평균 12% 성장하였습니다.
Evaluate Pharma(2021) 보고서에 따르면 글로벌 매출 상위 100대 의약품 중 바이오의약품 매출비중은 2020년 52%로 절반 이상을 차지하는 것으로 추정하였고,2026년에는 100대 의약품 매출액의 57% 차지할 것으로 전망하였습니다.
또한 국내 바이오의약품 시장규모은 2020년 3조 3,029억원으로 2019년 2조 6,002억원 대비 27% 증가하였습니다. 국내 바이오의약품 생산액은 2020년 3조 9,300억 원으로 2019년 2조 5,377억원 대비 54.9% 증가하였고, 의약품 전체 생산액 상승률보다 크게 늘어 의약품 분야 중 가장 활발하게 성장하고 있습니다.
다) 장기투자가 필요한 산업
생명공학기술은 실용화되기까지 엄격한 규제가 적용되는 인허가 단계를 포함한 다단계의 개발 과정이 필요하며, 이를 위해 각 단계별로 대규모 연구개발비 투자가 소요되고, 최종적인 기술의 실용화까지 장기간이 소요되는 특성을 가지고 있습니다.
2) 산업의 성장성
바이오의약품 산업은 생명공학기술이 산업 차원의 발전단계에 진입하면서 이미 보건의료분야에서 산업화가 진전되어 왔습니다. 이러한 추세는 앞으로도 당분간 지속될 것으로 보이며, 최근에는 연구개발을 위한 주요한 장비(Tool)의 개발, 서비스 및 바이오칩 등 융합기술영역에서도 새로운 시장이 대규모로, 그리고 본격적으로 형성되고 있습니다.
현재 바이오 의약품시장은 기존 오리지널 바이오의약품의 특허 만료의 진행, 환자 및 시장으로부터의 요구, 각국 정부의 규제정책의 변화 등을 반영하여 바이오베터(Bio better) 및 항암 바이오신약 개발에 우호적인 시장환경으로 재편되고 있으며, 최근들어 DNA를 이용한 백신과 인체 면역체계를 이용한 면역항암제 개발이 활발히 진행되고 있습니다. 이에 따라 향후 바이오 의약품 시장은 급격히 확대, 재편될 것입니다.
3) 경기변동의 특성
바이오의약품 산업은 경기변동성이 가장 낮은 산업중의 하나입니다. 이는 바이오의약품 산업이 인간의 생명 및 건강을 바탕으로 하는 산업분야이기 때문입니다.
III. 재무에 관한 사항
1. 요약재무정보
(1) 요약 연결재무제표
| (단위: 원) |
| 제 24기 3분기 | 제 23 기 | 제 22 기 | |
| 자산 | |||
| 유동자산 | 57,993,637,827 | 57,274,162,731 | 20,646,264,727 |
| 현금및현금성자산 | 25,056,919,322 | 27,795,646,029 | 5,211,943,321 |
| 당기손익금융자산 | 0 | 0 | 1,501,611,941 |
| 매출채권 및 기타유동채권 | 13,032,840,967 | 2,387,369,167 | 8,179,064,983 |
| 파생상품자산 | 899,999 | 184,899,999 | 787,044,000 |
| 기타유동자산 | 19,858,030,570 | 13,419,075,898 | 4,800,477,923 |
| 당기법인세자산 | 44,946,969 | 50,030,640 | 166,122,559 |
| 매각예정비유동자산 | 0 | 13,437,140,998 | 0 |
| 비유동자산 | 386,676,265,198 | 579,590,659,908 | 576,261,556,036 |
| 당기손익금융자산 | 12,426,791,600 | 13,024,576,122 | 25,144,426,411 |
| 기타포괄손익금융자산 | 48,270,263,721 | 241,771,747,741 | 278,506,627,911 |
| 관계기업및공동기업투자 | 199,015,345,338 | 206,567,467,208 | 193,990,633,595 |
| 파생상품자산 | 0 | 0 | 1,706,563,412 |
| 투자부동산 | 3,040,762,768 | 0 | 0 |
| 유형자산 | 120,037,435,139 | 111,968,681,117 | 71,855,549,812 |
| 무형자산 | 2,836,843,641 | 3,279,528,404 | 4,065,363,283 |
| 기타장기채권 | 127,425,795 | 2,245,198,197 | 269,559,052 |
| 기타비유동자산 | 921,397,196 | 733,461,119 | 722,832,560 |
| 자산총계 | 444,669,903,025 | 636,864,822,639 | 596,907,820,763 |
| 부채 | |||
| 유동부채 | 40,113,991,184 | 59,153,810,542 | 40,217,269,707 |
| 매입채무 및 기타유동채무 | 12,056,541,206 | 23,660,043,429 | 27,939,384,517 |
| 단기차입금 | 25,588,220,000 | 10,000,000,000 | 10,000,000,000 |
| 전환사채 | 1,354,595,736 | 1,200,188,396 | 1,020,884,290 |
| 파생상품부채 | 334,751,676 | 393,100,260 | 279,646,500 |
| 리스부채 | 141,983,045 | 229,673,725 | 169,661,161 |
| 기타유동부채 | 637,899,521 | 23,670,804,732 | 807,693,239 |
| 비유동부채 | 66,745,423,309 | 54,437,739,768 | 20,157,442,566 |
| 장기차입금 | 37,311,780,000 | 28,600,000,000 | 5,200,000,000 |
| 전환사채 | 13,285,324,674 | 12,049,568,686 | 10,575,238,787 |
| 파생상품부채 | 5,743,517,473 | 4,405,277,473 | 2,773,932,016 |
| 리스부채 | 104,243,632 | 138,906,069 | 188,928,933 |
| 종업원급여부채 | 1,623,371,699 | 554,144,793 | 899,271,907 |
| 기타장기채무 | 8,378,631,907 | 8,295,849,454 | 520,070,923 |
| 기타비유동부채 | 298,553,924 | 393,993,293 | 0 |
| 부채총계 | 106,859,414,493 | 113,591,550,310 | 60,374,712,273 |
| 자본 | |||
| 지배기업의 소유주에게 귀속되는 자본 |
332,766,557,524 | 517,741,736,397 | 535,604,990,886 |
| 납입자본 | 578,426,262,932 | 575,230,046,162 | 563,476,933,947 |
| 보통주자본금 | 12,572,491,000 | 12,514,566,000 | 12,348,887,000 |
| 자본잉여금 | 565,853,771,932 | 562,715,480,162 | 551,128,046,947 |
| 기타자본구성요소 | (61,829,435,919) | 106,778,944,424 | 126,088,338,937 |
| 이익잉여금(결손금) | (183,830,269,489) | (164,267,254,189) | (153,960,281,998) |
| 비지배지분 | 5,043,931,008 | 5,531,535,932 | 928,117,604 |
| 자본총계 | 337,810,488,532 | 523,273,272,329 | 536,533,108,490 |
| 자본과부채총계 | 444,669,903,025 | 636,864,822,639 | 596,907,820,763 |
| 2022.1.1~ 2022.9.30 |
2021.1.1~ 2021.12.31 |
2020.1.1~ 2020.12.31 |
|
| 매출 | 13,830,898,698 | 36,828,454,645 | 18,543,494,616 |
| 매출원가 | 3,000,630,188 | 5,021,961,340 | 6,866,700,951 |
| 판매비와관리비 | 31,120,945,443 | 51,179,684,336 | 50,836,337,123 |
| 영업이익(손실) | (20,290,676,933) | (19,373,191,031) | (39,159,543,458) |
| 법인세비용차감전순이익(손실) | (18,124,738,835) | (48,561,062,658) | 27,535,895,606 |
| 법인세비용 | 0 | 0 | 0 |
| 당기순이익(손실) | (18,124,738,835) | (48,561,062,658) | 27,535,895,606 |
| 지배기업 소유주지분 | (17,609,193,350) | (47,726,585,050) | 27,569,725,330 |
| 비지배지분 | (515,545,485) | (834,477,608) | (33,829,724) |
| 총포괄손익 | (189,796,780,394) | (29,578,507,633) | 142,609,831,653 |
| 지배기업의 소유주에게 귀속되는 지분 | (189,281,234,909) | (28,688,020,805) | 142,643,661,377 |
| 비지배지분 | (515,545,485) | (890,486,828) | (33,829,724) |
| 기본주당이익(손실) | (702) | (1,915) | 1,149 |
| 희석주당이익(손실) | (702) | (1,915) | 873 |
| 연결에 도합된 회사 수 | 1 | 1 | 1 |
(2) 요약 재무제표
| (단위: 원) |
| 제 24 기3분기 | 제 23 기 | 제 22 기 | |
| 자산 | |||
| 유동자산 | 53,405,300,858 | 50,362,747,239 | 19,101,745,273 |
| 현금및현금성자산 | 22,634,095,184 | 21,376,196,622 | 5,186,966,852 |
| 매출채권 및 기타유동채권 | 11,020,263,286 | 2,345,684,535 | 8,178,191,363 |
| 파생상품자산 | 899,999 | 184,899,999 | 787,044,000 |
| 기타유동자산 | 19,705,282,780 | 12,974,835,275 | 4,783,652,939 |
| 당기법인세자산 | 44,759,609 | 43,989,810 | 165,890,119 |
| 매각예정비유동자산 | 0 | 13,437,140,998 | 0 |
| 비유동자산 | 395,045,617,222 | 585,947,907,085 | 595,352,956,837 |
| 당기손익금융자산 | 12,426,791,600 | 13,024,576,122 | 25,144,426,411 |
| 기타포괄손익금융자산 | 48,270,263,721 | 241,771,747,741 | 278,506,627,911 |
| 관계기업및공동기업투자 | 205,711,980,705 | 208,880,740,865 | 212,119,828,048 |
| 종속기업투자 | 10,642,000,000 | 10,642,000,000 | 5,100,000,000 |
| 파생상품자산 | 0 | 0 | 1,706,563,412 |
| 투자부동산 | 3,040,762,768 | 0 | 0 |
| 유형자산 | 111,079,920,554 | 107,338,484,284 | 67,717,756,160 |
| 무형자산 | 2,825,074,883 | 3,270,505,902 | 4,065,363,283 |
| 기타장기채권 | 127,425,795 | 286,391,052 | 269,559,052 |
| 기타비유동자산 | 921,397,196 | 733,461,119 | 722,832,560 |
| 자산총계 | 448,450,918,080 | 636,310,654,324 | 614,454,702,110 |
| 부채 | |||
| 유동부채 | 40,758,486,682 | 59,344,873,222 | 40,108,087,492 |
| 매입채무 및 기타유동채무 | 13,031,799,543 | 23,924,872,188 | 27,833,249,932 |
| 단기차입금 | 25,588,220,000 | 10,000,000,000 | 10,000,000,000 |
| 전환사채 | 1,354,595,736 | 1,200,188,396 | 1,020,884,290 |
| 파생상품부채 | 334,751,676 | 393,100,260 | 279,646,500 |
| 리스부채 | 113,774,554 | 168,086,016 | 169,661,161 |
| 기타유동부채 | 335,345,173 | 23,658,626,362 | 804,645,609 |
| 비유동부채 | 66,343,520,366 | 54,214,363,758 | 20,057,552,092 |
| 장기차입금 | 37,311,780,000 | 28,600,000,000 | 5,200,000,000 |
| 전환사채 | 13,166,354,958 | 11,945,624,929 | 10,488,462,793 |
| 파생상품부채 | 5,743,517,473 | 4,405,277,473 | 2,773,932,016 |
| 리스부채 | 104,243,632 | 131,719,090 | 188,928,933 |
| 종업원급여부채 | 1,340,438,472 | 441,899,519 | 886,157,427 |
| 기타장기채무 | 8,378,631,907 | 8,295,849,454 | 520,070,923 |
| 기타비유동부채 | 298,553,924 | 393,993,293 | 0 |
| 부채총계 | 107,102,007,048 | 113,559,236,980 | 60,165,639,584 |
| 자본 | |||
| 납입자본 | 578,061,825,809 | 574,865,609,039 | 563,542,105,287 |
| 보통주자본금 | 12,572,491,000 | 12,514,566,000 | 12,348,887,000 |
| 자본잉여금 | 565,489,334,809 | 562,351,043,039 | 551,193,218,287 |
| 기타자본구성요소 | (85,104,279,117) | 106,331,366,251 | 135,542,815,738 |
| 이익잉여금(결손금) | (151,608,635,660) | (158,445,557,946) | (144,795,858,499) |
| 자본총계 | 341,348,911,032 | 522,751,417,344 | 554,289,062,526 |
| 자본과부채총계 | 448,450,918,080 | 636,310,654,324 | 614,454,702,110 |
| 종속/관계/공동기업투자주식의 평가방법 |
원가법 | 원가법 | 원가법 |
| 2022.1.1~ 2022.9.30 |
2021.1.1~ 2021.12.31 |
2020.1.1~ 2020.12.31 |
|
| 매출 | 13,584,466,362 | 38,320,454,645 | 18,543,494,616 |
| 매출원가 | 2,802,648,554 | 5,021,961,340 | 6,866,700,951 |
| 판매비와관리비 | 31,374,173,547 | 49,657,229,133 | 50,405,959,580 |
| 영업이익(손실) | (20,592,355,739) | (16,358,735,828) | (38,729,165,915) |
| 법인세비용차감전순이익(손실) | 8,798,298,095 | (51,142,245,063) | 18,241,823,487 |
| 법인세비용 | 0 | 0 | 0 |
| 당기순이익(손실) | 8,798,298,095 | (51,142,245,063) | 18,241,823,487 |
| 기타포괄손익 | (194,506,860,443) | 9,209,442,028 | 120,582,287,227 |
| 총포괄손익 | (185,708,562,348) | (41,932,803,035) | 138,824,110,714 |
| 기본주당이익(손실) | 351 | (2,052) | 760 |
| 희석주당이익(손실) | 351 | (2,052) | 491 |
2. 연결재무제표
|
연결 재무상태표 |
|
제 24 기 3분기말 2022.09.30 현재 |
|
제 23 기말 2021.12.31 현재 |
|
(단위 : 원) |
|
제 24 기 3분기말 |
제 23 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
57,993,637,827 |
57,274,162,731 |
|
현금및현금성자산 |
25,056,919,322 |
27,795,646,029 |
|
매출채권 및 기타채권 |
13,032,840,967 |
2,387,369,167 |
|
파생상품자산 |
899,999 |
184,899,999 |
|
기타유동자산 |
19,858,030,570 |
13,419,075,898 |
|
당기법인세자산 |
44,946,969 |
50,030,640 |
|
매각예정비유동자산 |
0 |
13,437,140,998 |
|
비유동자산 |
386,676,265,198 |
579,590,659,908 |
|
당기손익금융자산 |
12,426,791,600 |
13,024,576,122 |
|
기타포괄손익금융자산 |
48,270,263,721 |
241,771,747,741 |
|
관계기업및공동기업투자 |
199,015,345,338 |
206,567,467,208 |
|
투자부동산 |
3,040,762,768 |
0 |
|
유형자산 |
120,037,435,139 |
111,968,681,117 |
|
무형자산 |
2,836,843,641 |
3,279,528,404 |
|
기타장기채권 |
127,425,795 |
2,245,198,197 |
|
기타비유동자산 |
921,397,196 |
733,461,119 |
|
자산총계 |
444,669,903,025 |
636,864,822,639 |
|
부채 |
||
|
유동부채 |
40,113,991,184 |
59,153,810,542 |
|
매입채무 및 기타채무 |
12,056,541,206 |
23,660,043,429 |
|
단기차입금 |
25,588,220,000 |
10,000,000,000 |
|
전환사채 |
1,354,595,736 |
1,200,188,396 |
|
파생상품부채 |
334,751,676 |
393,100,260 |
|
리스부채 |
141,983,045 |
229,673,725 |
|
기타유동부채 |
637,899,521 |
23,670,804,732 |
|
비유동부채 |
66,745,423,309 |
54,437,739,768 |
|
장기차입금 |
37,311,780,000 |
28,600,000,000 |
|
전환사채 |
13,285,324,674 |
12,049,568,686 |
|
파생상품부채 |
5,743,517,473 |
4,405,277,473 |
|
리스부채 |
104,243,632 |
138,906,069 |
|
종업원급여부채 |
1,623,371,699 |
554,144,793 |
|
기타장기채무 |
8,378,631,907 |
8,295,849,454 |
|
기타비유동부채 |
298,553,924 |
393,993,293 |
|
부채총계 |
106,859,414,493 |
113,591,550,310 |
|
자본 |
||
|
지배기업의 소유주에게 귀속되는 자본 |
332,766,557,524 |
517,741,736,397 |
|
납입자본 |
578,426,262,932 |
575,230,046,162 |
|
보통주자본금 |
12,572,491,000 |
12,514,566,000 |
|
자본잉여금 |
565,853,771,932 |
562,715,480,162 |
|
기타자본구성요소 |
(61,829,435,919) |
106,778,944,424 |
|
이익잉여금(결손금) |
(183,830,269,489) |
(164,267,254,189) |
|
비지배지분 |
5,043,931,008 |
5,531,535,932 |
|
자본총계 |
337,810,488,532 |
523,273,272,329 |
|
자본과부채총계 |
444,669,903,025 |
636,864,822,639 |
|
연결 포괄손익계산서 |
|
제 24 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
(단위 : 원) |
|
제 24 기 3분기 |
제 23 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출 |
2,392,430,353 |
13,830,898,698 |
247,206,634 |
34,852,013,622 |
|
매출원가 |
1,913,565,713 |
3,000,630,188 |
285,485,886 |
3,822,104,028 |
|
매출총이익 |
478,864,640 |
10,830,268,510 |
(38,279,252) |
31,029,909,594 |
|
판매비와관리비 |
8,856,690,584 |
31,120,945,443 |
8,079,915,196 |
36,399,921,169 |
|
영업이익(손실) |
(8,377,825,944) |
(20,290,676,933) |
(8,118,194,448) |
(5,370,011,575) |
|
기타수익 |
2,119,354,198 |
37,470,841,177 |
1,516,545,990 |
3,344,299,853 |
|
기타비용 |
552,809,104 |
1,743,685,921 |
824,643,865 |
5,524,532,915 |
|
금융수익 |
104,728,862 |
263,912,065 |
192,121,279 |
252,669,392 |
|
금융비용 |
1,231,458,012 |
3,871,939,175 |
866,573,243 |
2,216,853,446 |
|
지분법이익 |
461,886,705 |
1,271,360,348 |
718,879,458 |
22,719,006,228 |
|
지분법손실 |
11,402,654,422 |
31,224,550,396 |
9,337,211,518 |
28,717,660,782 |
|
법인세비용차감전순이익(손실) |
(18,878,777,717) |
(18,124,738,835) |
(16,719,076,347) |
(15,513,083,245) |
|
법인세비용 |
0 |
0 |
0 |
0 |
|
당기순이익(손실) |
(18,878,777,717) |
(18,124,738,835) |
(16,719,076,347) |
(15,513,083,245) |
|
지배기업 소유주지분 |
(18,788,557,397) |
(17,609,193,350) |
(16,304,207,962) |
(15,092,944,994) |
|
비지배지분 |
(90,220,320) |
(515,545,485) |
(414,868,385) |
(420,138,251) |
|
기타포괄손익 |
(19,888,064,707) |
(171,672,041,559) |
(32,700,688,350) |
135,620,160,685 |
|
후속적으로 당기손익으로 재분류되지 않는 항목 |
||||
|
기타포괄손익금융자산평가손익 |
(33,564,905,077) |
(194,506,860,443) |
(38,089,873,341) |
127,905,381,602 |
|
확정급여제도의 재측정요소 |
0 |
0 |
0 |
0 |
|
관계기업의 재측정요소에 대한 지분 |
4,277,489 |
7,553,859 |
0 |
0 |
|
후속적으로 당기손익으로 재분류될 수 있는 항목 |
||||
|
지분법자본변동 |
13,672,562,881 |
22,827,265,025 |
5,389,184,991 |
7,714,779,083 |
|
총포괄손익 |
(38,766,842,424) |
(189,796,780,394) |
(49,419,764,697) |
120,107,077,440 |
|
총 포괄손익의 귀속 |
||||
|
지배기업의 소유주에게 귀속되는 지분 |
(38,676,622,104) |
(189,281,234,909) |
(49,004,896,312) |
120,527,215,691 |
|
비지배지분 |
(90,220,320) |
(515,545,485) |
(414,868,385) |
(420,138,251) |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(747) |
(702) |
(652) |
(606) |
|
희석주당이익(손실) (단위 : 원) |
(747) |
(702) |
(652) |
(606) |
|
연결 자본변동표 |
|
제 24 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
(단위 : 원) |
|
자본 |
|||||||
|---|---|---|---|---|---|---|---|
|
지배기업의 소유주에게 귀속되는 자본 |
비지배지분 |
자본 합계 |
|||||
|
자본금 |
자본잉여금 |
기타자본항목 |
미처분이익잉여금(미처리결손금) |
지배기업의 소유주에게 귀속되는 자본 합계 |
|||
|
2021.01.01 (기초자본) |
12,348,887,000 |
551,128,046,947 |
126,088,338,937 |
(153,960,281,998) |
535,604,990,886 |
928,117,604 |
536,533,108,490 |
|
당기순이익(손실) |
0 |
0 |
0 |
(15,092,944,994) |
(15,092,944,994) |
(420,138,251) |
(15,513,083,245) |
|
기타포괄손익금융자산평가손익 |
0 |
0 |
127,905,381,602 |
0 |
127,905,381,602 |
0 |
127,905,381,602 |
|
기타포괄손익금융자산처분손익 |
0 |
0 |
(37,453,653,493) |
37,453,653,493 |
0 |
0 |
0 |
|
지분법자본변동 |
0 |
0 |
7,714,779,083 |
0 |
7,714,779,083 |
0 |
7,714,779,083 |
|
관계기업의 재측정요소에 대한 지분 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
주식선택권 발행 및 행사 |
165,379,000 |
11,140,674,027 |
(1,477,447,544) |
0 |
9,828,605,483 |
0 |
9,828,605,483 |
|
연결범위의 변동 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
종속기업의 지분율 변동 |
0 |
351,503,759 |
0 |
744,344 |
352,248,103 |
5,564,576,317 |
5,916,824,420 |
|
2021.09.30 (기말자본) |
12,514,266,000 |
562,620,224,733 |
222,777,398,585 |
(131,598,829,155) |
666,313,060,163 |
6,072,555,670 |
672,385,615,833 |
|
2022.01.01 (기초자본) |
12,514,566,000 |
562,715,480,162 |
106,778,944,424 |
(164,267,254,189) |
517,741,736,397 |
5,531,535,932 |
523,273,272,329 |
|
당기순이익(손실) |
0 |
0 |
0 |
(17,609,193,350) |
(17,609,193,350) |
(515,545,485) |
(18,124,738,835) |
|
기타포괄손익금융자산평가손익 |
0 |
0 |
(194,506,860,443) |
0 |
(194,506,860,443) |
0 |
(194,506,860,443) |
|
기타포괄손익금융자산처분손익 |
0 |
0 |
1,961,375,809 |
(1,961,375,809) |
0 |
0 |
0 |
|
지분법자본변동 |
0 |
0 |
22,827,265,025 |
0 |
22,827,265,025 |
0 |
22,827,265,025 |
|
관계기업의 재측정요소에 대한 지분 |
0 |
0 |
0 |
7,553,859 |
7,553,859 |
0 |
7,553,859 |
|
주식선택권 발행 및 행사 |
57,925,000 |
3,138,291,770 |
1,109,839,266 |
0 |
4,306,056,036 |
27,940,561 |
4,333,996,597 |
|
연결범위의 변동 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
종속기업의 지분율 변동 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2022.09.30 (기말자본) |
12,572,491,000 |
565,853,771,932 |
(61,829,435,919) |
(183,830,269,489) |
332,766,557,524 |
5,043,931,008 |
337,810,488,532 |
|
연결 현금흐름표 |
|
제 24 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
(단위 : 원) |
|
제 24 기 3분기 |
제 23 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(31,287,558,511) |
(18,736,037,335) |
|
영업활동으로 창출된 현금흐름 |
(30,721,725,168) |
(18,644,018,779) |
|
이자수취 |
256,513,097 |
43,330,469 |
|
이자지급 |
(871,620,190) |
(301,471,584) |
|
법인세납부(환급) |
49,273,750 |
166,122,559 |
|
투자활동현금흐름 |
1,341,604,180 |
2,601,751,155 |
|
투자활동으로 인한 현금유입액 |
76,546,224,090 |
86,267,327,000 |
|
당기손익금융자산의 처분 |
51,464,815,387 |
13,499,882,622 |
|
기타포괄손익금융자산의 처분 |
317,553,285 |
55,372,111,202 |
|
관계,공동기업투자의 감소 |
433,750,706 |
0 |
|
유형자산의 처분 |
24,063,280,455 |
13,022,175,000 |
|
대여금의 감소 |
0 |
4,362,046,576 |
|
보증금의 감소 |
66,824,257 |
11,111,600 |
|
시설이용권의 처분 |
200,000,000 |
0 |
|
투자활동으로 인한 현금유출액 |
(75,204,619,910) |
(83,665,575,845) |
|
당기손익금융자산의 취득 |
51,000,000,000 |
7,103,704,393 |
|
기타포괄손익금융자산의 취득 |
1,322,167,606 |
12,166,608,580 |
|
관계/공동기업투자의 증가 |
0 |
32,080,230,148 |
|
유형자산의 취득 |
22,444,663,690 |
29,534,150,492 |
|
무형자산의 취득 |
32,068,264 |
573,816,916 |
|
보증금의 증가 |
405,720,350 |
2,207,065,316 |
|
재무활동현금흐름 |
26,096,645,233 |
37,573,909,301 |
|
재무활동으로 인한 현금유입액 |
26,281,210,000 |
37,740,443,720 |
|
주식선택권의 행사 |
1,981,210,000 |
7,494,494,100 |
|
유상증자 |
0 |
5,945,949,620 |
|
차입금의 증가 |
24,300,000,000 |
17,800,000,000 |
|
임대보증금의 증가 |
0 |
6,500,000,000 |
|
재무활동으로 인한 현금유출액 |
(184,564,767) |
(166,534,419) |
|
리스부채의 상환 |
184,564,767 |
137,409,219 |
|
주식발행비용 |
0 |
29,125,200 |
|
현금및현금성자산의순증가(감소) |
(3,849,309,098) |
21,439,623,121 |
|
기초현금및현금성자산 |
27,795,646,029 |
5,211,943,321 |
|
현금및현금성자산에 대한 환율변동효 (1) |
1,110,582,391 |
(45,965,131) |
|
기말현금및현금성자산 |
25,056,919,322 |
26,605,601,311 |
3. 연결재무제표 주석
| 제 24(당) 기 분기 2022년 09월 30일 현재 |
| 제 23(전) 기 2021년 12월 31일 현재 |
| 주식회사 제넥신과 그 종속기업 |
1. 일반적 사항
(1) 당사의 개요
주식회사 제넥신(이하 "당사")은 1999년 7월 1일 설립되었습니다. 당사 및 종속기업(이하 주식회사 제넥신과 그 종속기업을 일괄하여 "연결회사")은 유전공학방식을 이용한 신약 연구개발과 관련 신기술의 사용권 양도 및 대여 등을 주요사업으로 영위하고있습니다. 당사는 서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크에 본사와 기술개발을 위한 연구시설을 두고 있습니다. 한편 당사의 보통주식은 2009년 9월 15일자로 한국거래소 코스닥시장에 상장되었습니다.
당분기말 현재 당사의 자본금은 보통주 12,572,491천원이며, 주요 주주현황은 다음과같습니다.
| 주 주 명 | 소유주식수(주) | 지 분 율(%) |
|---|---|---|
| ㈜한독 | 3,781,017 | 15.04 |
| 성영철 외 특수관계자 | 1,763,981 | 7.02 |
| 기타 | 19,599,984 | 77.94 |
| 합 계 | 25,144,982 | 100.00 |
(2) 종속기업의 현황
가. 당분기말 현재 연결대상 종속기업은 다음과 같습니다.
| 기업명 | 소재지 | 지분율(%) | 업종 | 결산월 |
|---|---|---|---|---|
| ㈜에스엘포젠 | 대한민국 | 63.65% | 신약 연구개발 | 12월 |
나. 당분기말 현재 연결대상 종속기업의 요약재무정보는 다음과 같습니다.
| (단위 : 천원) |
| 기업명 | 자산 | 부채 | 매출액 | 당기순손익 | 총포괄손익 |
|---|---|---|---|---|---|
| ㈜에스엘포젠 | 16,062,962 | 3,523,585 | 3,778,755 | (1,426,066) | (1,426,066) |
2. 재무제표 작성기준 및 중요한 회계정책
가. 회계기준의 적용
연결회사의 분기연결재무제표는 한국채택국제회계기준에 따라 작성되는 중간재무제표입니다. 동 연결재무제표는 기업회계기준서 제1034호(중간재무보고)에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석은 직전 연차보고기간말 후 발생한 연결회사의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다.
이 분기연결재무제표는 보고기간말인 2022년 9월 30일 현재 유효한 한국채택국제회계기준에 따라 작성되었습니다. 따라서 2022년 12월 31일 한국채택국제회계기준에 따른 연결재무제표를 작성하는 시점에 유효한 한국채택국제회계기준 및 선택사항 적용여부에 따라 변경될 수 있습니다.
중간재무제표의 작성에 적용된 중요한 회계정책은 2021년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다. 한편, 당분기가 속하는 회계연도부터 새로 도입된 기준서 및 해석서와 그로 인한 회계정책 변경의 내용은 다음과 같으며, 이로 인하여 연결재무제표에 미치는 유의적인 영향은 없습니다.
(1) 연결회사가 채택한 제ㆍ개정 기준서 및 해석서
연결회사는 2022년 1월 1일로 개시하는 회계기간부터 다음의 제ㆍ개정 기준서 및 해석서를 신규로 적용하였습니다.
① 기업회계기준서 제1103호 '사업결합’개정 - 개념체계의 인용
인식할 자산과 부채의 정의를 개정된 재무보고를 위한 개념체계를 참조하도록 개정되었으나, 기업회계기준서 제1037호 ‘충당부채, 우발부채 및 우발자산’ 및 해석서 제2121호 ‘부담금’의 적용범위에 포함되는 부채 및 우발부채에 대해서는 해당 기준서를 적용하도록 예외를 추가하고, 우발자산이 취득일에 인식되지 않는다는 점을 명확히 하였습니다. 동 개정사항은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 연결재무제표에 미치는 중요한 영향은 없습니다.
② 기업회계기준서 제1016호 '유형자산’개정 - 의도한 사용 전의 매각금액
기업이 자산을 의도한 방식으로 사용하기 전에 생산된 품목의 판매에서 발생하는 수익을 생산원가와 함께 당기손익으로 인식하도록 요구하며, 유형자산의 취득원가에서차감하는 것을 금지하고 있습니다. 동 개정사항은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 연결재무제표에 미치는 중요한 영향은 없습니다.
③ 기업회계기준서 제1037호 '충당부채, 우발부채 및 우발자산’개정 - 손실부담계약: 계약이행원가
손실부담계약을 식별할 때 계약이행원가의 범위를 계약 이행을 위한 증분원가와 계약 이행에 직접 관련되는 다른 원가의 배분이라는 점을 명확히 하였습니다. 동 개정사항은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 연결재무제표에 미치는 중요한 영향은 없습니다.
④ 기업회계기준서 제 1116호 '리스' 개정 - 2021년 6월 30일 후에도 제공되는 코로나19 관련 임차료 할인 등
코로나19의 직접적인 결과로 발생한 임차료 할인 등(rent concession)이 리스변경에해당하는지 평가하지 않을 수 있도록 하는 실무적 간편법의 적용대상이 2022년 6월 30일 이전에 지급하여야 할 리스료에 영향을 미치는 리스료 감면으로 확대되었습니다. 리스이용자는 비슷한 상황에서 특성이 비슷한 계약에 실무적 간편법을 일관되게 적용해야 합니다. 동 개정사항은 2021년 4월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 연결재무제표에 미치는 중요한 영향은 없습니다.
⑤ 한국채택국제회계기준 연차개선 2018-2020
한국채택국제회계기준 연차개선 2018-2020은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 연결재무제표에 미치는 중요한 영향은 없습니다.
·기업회계기준서 제1101호 '한국채택국제회계기준의 최초 채택’: 최초채택기업인 종속기업
·기업회계기준서 제1109호 '금융상품’: 금융부채 제거 목적의 10% 테스트 관련 수수료
·기업회계기준서 제1116호 '리스’: 리스 인센티브
·기업회계기준서 제1041호 '농립어업’: 공정가치 측정
(2) 연결회사가 적용하지 않은 제ㆍ개정 기준서 및 해석서
제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
① 기업회계기준서 제1001호 ‘재무제표 표시’개정 - 부채의 유동/비유동 분류
보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된경우는 제외됩니다. 동개정사항은 2023년 1월 1일 이후 시작하는 회계연도부터 적용하며, 조기적용이 허용됩니다. 당사는 동 개정으로 인한 연결재무제표의 영향을 검토중에 있습니다.
② 기업회계기준서 제1001호 ‘재무제표 표시’ - '회계정책'의 공시
중요한 회계정책을 정의하고 공시하도록 하며, 중요성 개념을 적용하는 방법에 대한 지침을 제공하기 위하여 국제회계기준 실무서 2 '회계정책 공시'를 개정하였습니다.
동 개정 사항은 2023년 1월 1일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다. 당사는 동 개정으로 인한 연결재무제표의 영향을 검토 중에 있습니다.
③ 기업회계기준서 제1008호 '회계정책, 회계추정의 변경 및 오류' - '회계추정'의 정의
회계추정을 정의하고, 회계정책의 변경과 구별하는 방법을 명확히 하였습니다. 동 개정 사항은 2023년 1월 1일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다. 당사는 동 개정으로 인해 연결재무제표에 중요한 영향은 없을 것으로 예상하고 있습니다.
④ 기업회계기준서 제1012호 '법인세' - 단일거래에서 생기는 자산과 부채에 대한 이연법인세
자산 또는 부채가 최초로 인식되는 거래의 최초 인식 예외 요건에 거래시점 동일한 가산할 일시적차이와 차감할 일시적차이를 발생시키지 않는 거래라는 요건을 추가하였습니다. 동 개정사항은 2023년 1월 1일 이후 시작하는 회계연도부터 적용하며, 조기적용이 허용됩니다. 당사는 동 개정으로 인해 연결재무제표에 중요한 영향은 없을 것으로 예상하고 있습니다.
나. 연결
연결회사는 기준서 제1110호(연결재무제표)에 따라 연결재무제표를 작성하고 있습니다.
(1) 종속기업
종속기업은 연결회사가 지배하고 있는 모든 기업(특수목적기업 포함)입니다. 연결회사가 피투자자에 대한 관여로 변동이익에 노출되거나 변동이익에 대한 권리가 있고, 피투자자에 대하여 자신의 힘으로 그러한 이익에 영향을 미칠 능력이 있는 경우, 해당 피투자자를 지배합니다. 종속기업은 연결회사가 지배하게 되는 시점부터 연결에 포함되며, 지배력을 상실하는 시점부터 연결에서 제외됩니다.
연결회사의 사업결합은 취득법으로 회계처리 됩니다. 이전대가는 취득일의 공정가치로 측정하고, 사업결합으로 취득한 식별가능한 자산ㆍ부채 및 우발부채는 취득일의 공정가치로 최초 측정하고 있습니다. 연결회사는 청산 시 순자산의 비례적 몫을 제공하는 비지배지분을 사업결합 건별로 판단하여 피취득자의 순자산 중 비례적 지분으로 측정합니다. 취득관련 원가는 발생 시 당기비용으로 인식됩니다.
이전대가, 피취득자에 대한 비지배지분의 금액과 취득자가 이전에 보유하고 있던 피취득자에 대한 지분의 취득일의 공정가치 합계액이 취득한 식별가능한 순자산을 초과하는 금액은 영업권으로 인식합니다. 또한, 이전대가 등이 취득한 종속기업 순자산의 공정가액보다 작다면, 그 차액은 당기이익으로 인식됩니다.
연결회사 내의 기업간에 발생하는 거래로 인한 채권과 채무의 잔액, 수익과 비용 및 미실현이익 등은 제거됩니다. 또한 종속기업의 회계정책은 연결회사에서 채택한 회계정책을 일관성있게 적용하기 위해 차이가 나는 경우 수정됩니다.
(2) 지배력의 변동이 없는 종속기업에 대한 소유지분의 변동
지배력의 상실을 발생시키지 않는 비지배지분과의 거래는 자본거래, 즉 소유주로서의 자격을 행사하는 소유주와의 거래로 회계처리하고 있습니다. 지불한 대가의 공정가치와 종속기업의 순자산의 장부금액 중 취득한 지분 해당액과의 차이는 자본에 계상됩니다. 비지배지분의 처분에서 발생하는 손익 또한 자본에 반영됩니다.
(3) 종속기업의 처분
연결회사가 지배력을 상실하는 경우 해당기업에 대해 계속 보유하게 되는 지분은 동시점에 공정가치로 재측정되며, 관련 차액은 당기손익으로 인식됩니다. 이러한 공정가치는 해당 지분이 후속적으로 관계기업, 공동지배기업 또는 금융자산으로 인식되는 경우의 최초 인식 시 장부가액이 됩니다. 또한, 해당 기업에 대하여 이전에 계상하고 있던 기타포괄손익의 금액은 연결회사가 관련 자산과 부채를 직접 처분하였을 경우와 동일하게 회계처리하고 있습니다. 따라서 과거에 인식되었던 기타포괄손익 항목은 손익 또는 자본으로 재분류됩니다.
(4) 비지배지분
당기순손익과 기타포괄손익의 각 구성요소는 지배기업의 소유주와 비지배지분에 귀속되며, 비지배지분이 부(-)의 잔액이 되더라도 총포괄손익은 지배기업의 소유주와 비지배지분에 귀속시키고 있습니다.
3. 중요한 회계추정 및 가정
분기연결재무제표를 작성함에 있어, 연결회사의 경영진은 회계정책의 적용과 자산ㆍ부채 및 수익ㆍ비용에 영향을 미치는 판단, 추정 및 가정을 해야 합니다. 실제 결과는이러한 추정치와 다를 수 있습니다.
분기연결재무제표의 작성을 위해 회계정책의 적용과 추정 불확실성의 주요원천에 대해 연결회사의 경영진이 내린 중요한 판단은 2021년 12월 31일로 종료하는 회계연도에 대한 연차재무제표와 동일합니다.
다만 2022년 COVID-19의 확산으로 연결회사의 추정 및 가정에 영향이 발생할 수 있으나, 당분기말 현재 그 영향을 합리적으로 추정할 수 없습니다.
4. 위험관리
(1) 자본위험관리
연결회사는 부채와 자본의 최적화를 통하여 주주이익을 극대화시키는 동시에 계속기업으로서 지속될 수 있도록 자본을 관리하고 있습니다. 연결회사의 전반적인 전략은 전기와 변동이 없습니다.
연결회사는 자본관리지표로 부채비율을 이용하고 있으며 이 비율은 총부채를 총자본으로 나누어 산출하고 있으며 총부채 및 총자본은 연결재무제표의 금액을 기준으로 계산합니다.
연결회사는 외부적으로 강제된 자기자본규제의 대상은 아니며, 당분기말과 전기말 현재 부채비율은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 부채 | 106,859,414 | 113,591,550 |
| 자본 | 337,810,489 | 523,273,272 |
| 부채비율 | 31.63% | 21.70% |
(2) 재무위험관리
연결회사의 재무부문은 영업을 관리하고, 국내외 금융시장의 접근을 조직하며, 각 위험의 범위와 규모를 분석한 내부위험보고서를 통하여 연결회사의 영업과 관련한 금융위험을 감시하고 관리하는 역할을 하고 있습니다.
이러한 위험들은 시장위험(외환위험, 이자율위험 등), 신용위험, 유동성위험을 포함하고 있습니다. 연결회사는 투기적 목적으로 파생금융상품을 포함한 금융상품계약을체결하거나 거래하지 않습니다.
가. 시장위험
1) 외환위험
연결회사는 영업활동에 있어 외환위험, 특히 주로 달러화, 유로화 및 파운드화와 관련된 환율변동위험에 노출되어 있습니다. 외환위험은 미래예상거래, 인식된 자산 및 부채와 관련하여 발생하고 있습니다.
연결회사의 경영진은 기능통화에 대한 외환위험을 관리하도록 하는 정책을 수립하고있습니다. 외환위험은 미래예상거래 및 인식된 자산, 부채가 기능통화 외의 통화로 표시될 때 발생하고 있습니다.
당분기말과 전기말 현재 기능통화 이외의 외화로 표시된 화폐성자산ㆍ부채의 장부금액은 다음과 같습니다.
| (원화단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 외화 | 원화환산액 | 외화 | 원화환산액 | |
| 현금및현금성자산 | ||||
| USD | 3,660,412.71 | 5,251,960 | 5,563,012.37 | 6,594,951 |
| 매출채권 | ||||
| USD | 6,816,422.57 | 9,780,203 | 644,185.15 | 763,681 |
| 미수금 | ||||
| USD | 682,765.45 | 979,632 | 445,840.49 | 528,544 |
| 외화자산합계 | 16,011,795 | 7,887,176 | ||
| 미지급금 | ||||
| USD | 99,183.97 | 142,309 | 292,354.14 | 346,586 |
| EUR | 6,500.00 | 9,157 | 1,500.00 | 2,014 |
| GBP | 21,720.41 | 34,717 | 13,035.52 | 20,860 |
| 외화부채합계 | 186,183 | 369,460 | ||
당분기말과 전기말 현재 다른 모든 변수가 일정하고 각 외화에 대한 원화 환율의 10% 변동시 환율변동이 연결회사의 손익에 미치는 영향은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 10% 상승시 | 10% 하락시 | 10% 상승시 | 10% 하락시 | |
| 현금및현금성자산 | 525,196 | (525,196) | 659,495 | (659,495) |
| 매출채권 | 978,020 | (978,020) | 76,368 | (76,368) |
| 미수금 | 97,963 | (97,963) | 52,854 | (52,854) |
| 미지급금 | (18,618) | 18,618 | (36,946) | 36,946 |
| 합 계 | 1,582,561 | (1,582,561) | 751,771 | (751,771) |
2) 이자율위험
연결회사는 고정이자율과 변동이자율로 자금을 차입하고 있으며, 이로 인하여 이자율위험에 노출되어 있습니다. 연결회사는 이자율 위험을 관리하기 위하여 고정이자율 차입금과 변동이자율 차입금의 적절한 균형을 유지하고 있으며, 이자율 주기를 통하여 이자비용의 변동을 막음으로써, 최적의 위험회피전략을 적용할 계획입니다.
한편, 당분기말 현재 연결회사가 보유한 차입금의 이자율이 100베이시스포인트 변동할 때, 이러한 이자율변동이 손익에 미치는 영향은 최대629,000천원 증가 또는 629,000천원 감소합니다.
나. 신용위험
신용위험은 보유하고 있는 수취채권 및 확정계약을 포함한 거래처에 대한 신용위험 뿐만 아니라 현금및현금성자산, 은행등 금융기관예치금으로부터 발생하고 있습니다.연결회사는 금융기관에 현금및현금성자산 및 예적금 등을 예치하고 있으며, 신용등급이 우수한 금융기관과 거래하고 있으므로 금융기관으로부터의 신용위험은 제한적입니다.
일반거래처의 경우 고객의 재무상태, 과거 경험 등 기타 요소들을 고려하여 신용을 평가하게 됩니다. 연결회사는 회수가 지연되는 금융자산에 대하여는 분기 단위로 회수 지연 현황 및 회수대책이 보고되고 있으며 지연사유에 따라 적절한 조치를 취하고있습니다.
보고기간종료일 현재 연결회사 금융자산의 신용위험 최대 노출 금액은 장부금액과 동일합니다.
다. 유동성 위험
연결회사는 충분한 적립금과 차입한도를 유지하고 예측현금흐름과 실제현금흐름을 계속하여 관찰하고 금융자산과 금융부채의 만기구조를 대응시키면서 유동성위험을 관리하고 있습니다.
당분기말과 전기말 현재 금융부채의 잔존계약만기에 따른 만기분석은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월 이하 | 3개월 ~ 1년 | 1년 ~ 5년 | 5년 초과 |
|---|---|---|---|---|---|---|
| 매입채무및기타채무 | 12,056,541 | 12,056,541 | 11,961,291 | 95,250 | - | - |
| 차입금 | 62,900,000 | 66,915,266 | 5,442,292 | 21,214,080 | 40,258,894 | - |
| 전환사채 | 14,639,920 | 22,625,209 | 1,500,000 | - | 20,000,000 | 1,125,209 |
| 리스부채 | 246,227 | 252,243 | 57,484 | 88,007 | 106,752 | - |
| 기타장기채무 | 8,378,632 | 8,811,727 | 63,865 | 190,443 | 8,557,420 | - |
| 합 계 | 98,221,320 | 110,660,986 | 19,024,932 | 21,587,780 | 68,923,066 | 1,125,209 |
| <전기말> | (단위 : 천원) |
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월 이하 | 3개월 ~ 1년 | 1년 ~ 5년 | 5년 초과 |
|---|---|---|---|---|---|---|
| 매입채무및기타채무 | 23,660,043 | 23,660,043 | 23,130,138 | 529,905 | - | - |
| 차입금 | 38,600,000 | 40,975,894 | 216,862 | 10,569,928 | 30,189,104 | - |
| 전환사채 | 13,249,757 | 22,625,209 | 1,500,000 | - | 20,000,000 | 1,125,209 |
| 리스부채 | 368,580 | 377,106 | 59,144 | 176,090 | 141,872 | - |
| 기타장기채무 | 8,295,849 | 8,822,096 | 62,021 | 190,434 | 8,569,641 | - |
| 합 계 | 84,174,229 | 96,460,348 | 24,968,165 | 11,466,357 | 58,900,617 | 1,125,209 |
상기 분석은 할인하지 않은 현금흐름을 기초로 연결회사가 지급하여야 하는 가장 빠른 만기일에 근거하여 작성되었습니다.
(3) 금융상품의 공정가치
연결회사의 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산 | ||||
| 현금및현금성자산(*) | 25,056,919 | 25,056,919 | 27,795,646 | 27,795,646 |
| 매출채권및기타채권(*) | 13,032,841 | 13,032,841 | 2,387,369 | 2,387,369 |
| 당기손익금융자산 | 12,426,792 | 12,426,792 | 13,024,576 | 13,024,576 |
| 기타포괄손익금융자산 | 48,270,264 | 48,270,264 | 241,771,748 | 241,771,748 |
| 파생상품자산 | 900 | 900 | 184,900 | 184,900 |
| 기타장기채권(*) | 127,426 | 127,426 | 2,245,198 | 2,245,198 |
| 합 계 | 98,915,142 | 98,915,142 | 287,409,437 | 287,409,437 |
| 금융부채 | ||||
| 매입채무및기타채무(*) | 12,056,541 | 12,056,541 | 23,660,043 | 23,660,043 |
| 차입금(*) | 62,900,000 | 62,900,000 | 38,600,000 | 38,600,000 |
| 전환사채(*) | 14,639,920 | 14,639,920 | 13,249,757 | 13,249,757 |
| 파생상품부채 | 6,078,269 | 6,078,269 | 4,798,378 | 4,798,378 |
| 리스부채(*) | 246,227 | 246,227 | 368,580 | 368,580 |
| 기타장기채무(*) | 8,378,632 | 8,378,632 | 8,295,849 | 8,295,849 |
| 합 계 | 104,299,589 | 104,299,589 | 88,972,607 | 88,972,607 |
(*) 연결회사의 경영진은 재무제표상 상각후원가로 측정된 금융자산과 금융부채의 장부금액은 공정가치와 근사하다고 판단하고 있습니다.
연결회사는 금융자산과 금융부채의 공정가치를 다음과 같이 결정하였습니다.
| - | 표준거래조건과 정상거래시장이 존재하는 금융자산과 금융부채의 공정가치는 시장가격을 이용하여 결정하였습니다. |
| - | 기타 금융자산과 금융부채의 공정가치는 관측가능한 현행시장거래로부터의 가격과유사한 상품에 대한 딜러의 호가를 이용하여 할인한 현금흐름 분석에 기초하여 일반적으로 인정된 가격결정모형에 따라 결정되었습니다. |
연결회사는 공정가치로 측정되는 금융상품을 공정가치 측정에 사용된 투입변수에 따라 다음과 같은 공정가치 서열체계로 분류하였습니다.
| 수준1 : | 동일한 자산이나 부채에 대한 활성시장에서 공시된 가격(조정되지 않은)을 사용하여 도출되는 공정가치 |
| 수준2 : | 자산이나 부채에 대하여 직접적으로(예:가격) 또는 간접적으로(예:가격에서 도출되어)관측가능한 투입변수를 사용하여 도출되는 공정가치 단, 수준1 에 해당되는 공시가격은 제외 |
| 수준3 : | 자산이나 부채에 대하여 관측가능한 시장정보에 근거하지 않은 투입변수(관측불가능한 변수)를 사용하는 평가기법으로부터 도출되는 공정가치 |
당분기말과 전기말 현재 공정가치로 측정된 금융상품의 서열체계 각 수준에 따른 공정가치 측정치는 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익금융자산 | - | 4,870,070 | 7,556,722 | 12,426,792 |
| 기타포괄손익금융자산 | 25,372,588 | - | 22,897,675 | 48,270,263 |
| 파생상품자산 | - | 900 | - | 900 |
| 합 계 | 25,372,588 | 4,870,970 | 30,454,397 | 60,697,955 |
| 금융부채 | ||||
| 파생상품부채 | - | 5,792,937 | 285,332 | 6,078,269 |
| 합 계 | - | 5,792,937 | 285,332 | 6,078,269 |
| <전기말> | (단위 : 천원) |
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익인식금융자산 | - | 5,206,695 | 7,817,881 | 13,024,576 |
| 기타포괄손익금융자산 | 219,780,304 | - | 21,991,444 | 241,771,748 |
| 파생상품자산 | - | 184,900 | - | 184,900 |
| 합 계 | 219,780,304 | 5,391,595 | 29,809,325 | 254,981,224 |
| 금융부채 | ||||
| 파생상품부채 | - | 4,554,211 | 244,167 | 4,798,378 |
| 합 계 | - | 4,554,211 | 244,167 | 4,798,378 |
연결회사는 공정가치 서열체계에서 수준2로 분류되는 금융상품에 대하여 다음의 가치평가기법과 투입변수를 사용하고 있습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 투입변수 |
|---|---|---|---|---|
| 당기손익금융자산 | ||||
| 투자전환사채 | 4,870,070 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품자산 | ||||
| 전환사채 콜옵션 | 900 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품부채 | ||||
| 전환사채 풋옵션 | 5,792,937 | 2 | 이항모형 | 할인율, 변동성 |
| <전기말> |
(단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 투입변수 |
|---|---|---|---|---|
| 당기손익인식금융자산 | ||||
| 투자전환사채 | 5,206,695 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품자산 | ||||
| 전환사채 콜옵션 | 184,900 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품부채 | ||||
| 전환사채 풋옵션 | 4,554,211 | 2 | 이항모형 | 할인율, 변동성 |
연결회사는 공정가치 서열체계에서 수준3으로 분류되는 금융상품에 대하여 다음의 가치평가기법과 투입변수를 사용하고 있습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 유의적이지만 관측가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수 범위 |
|---|---|---|---|---|---|
| 당기손익금융자산 | |||||
| 출자금 | 1,823,992 | 3 | 자산접근법 | 순자산가액 | - |
| 전환사채 | 5,000,000 | 3 | 원가측정 | - | - |
| 전환사채 | 732,729 | 3 | 시장접근법 | PBR, PSR | - |
| 이항모형 | 할인율 | 19.49% | |||
| 변동성 | 28.60% | ||||
| 기타포괄손익금융자산 | |||||
| 보통주 | 12,696,109 | 3 | 원가측정 | - | - |
| 2,618,759 | 3 | 시장접근법 | PBR | - | |
| 우선주 | 7,582,808 | 3 | 원가측정 | - | - |
| 파생상품부채 | |||||
| 보통주 콜옵션 | 236,914 | 3 | 원가측정 | - | - |
| 보통주 풋옵션 | 48,417 | 3 | 시장접근법 | PBR | - |
| 이항모형 | 할인율 | 14.37% | |||
| 변동성 | 24.60% | ||||
| <전기말> | (단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 유의적이지만 관측가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수 범위 |
|---|---|---|---|---|---|
| 당기손익금융자산 | |||||
| 출자금 | 2,065,791 | 3 | 자산접근법 | 순자산가액 | - |
| 전환사채 | 5,000,000 | 3 | 원가측정 | - | - |
| 전환사채 | 752,090 | 3 | 시장접근법 | PBR, PSR | - |
| 이항모형 | 할인율 | 18.21% | |||
| 변동성 | 24.60% | ||||
| 기타포괄손익금융자산 | |||||
| 보통주 | 12,439,529 | 3 | 원가측정 | - | - |
| 2,618,759 | 3 | 시장접근법 | PBR | - | |
| 451,635 | 3 | 자산접근법 | 순자산가액 | - | |
| 우선주 | 6,481,521 | 3 | 원가측정 | - | - |
| 파생상품부채 | |||||
| 보통주 콜옵션 | 195,750 | 3 | 원가측정 | - | - |
| 보통주 풋옵션 | 48,417 | 3 | 시장접근법 | PBR | - |
| 이항모형 | 할인율 | 14.37% | |||
| 변동성 | 24.60% | ||||
5. 범주별 금융상품
(1) 연결회사의 금융자산과 금융부채의 범주별 분류내역은 다음과 같습니다.
가. 당분기말과 전기말 현재 금융자산의 범주별 분류내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당 분 기 말 | 전 기 말 | ||||||
|---|---|---|---|---|---|---|---|---|
| 상각후원가 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익-공정가치측정 금융자산 |
합 계 | 상각후원가 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익-공정가치측정 금융자산 |
합 계 | |
| 현금및현금성자산 | 25,056,919 | - | - | 25,056,919 | 27,795,646 | - | - | 27,795,646 |
| 매출채권및기타채권 | 13,032,841 | - | - | 13,032,841 | 2,387,369 | - | - | 2,387,369 |
| 당기손익금융자산 | - | 12,426,792 | - | 12,426,792 | - | 13,024,576 | - | 13,024,576 |
| 기타포괄손익금융자산 | - | - | 48,270,264 | 48,270,264 | - | - | 241,771,748 | 241,771,748 |
| 파생상품자산 | - | 900 | - | 900 | - | 184,900 | - | 184,900 |
| 기타장기채권 | 127,426 | - | - | 127,426 | 2,245,198 | - | - | 2,245,198 |
| 합 계 | 38,217,186 | 12,427,692 | 48,270,264 | 98,915,142 | 32,428,213 | 13,209,476 | 241,771,748 | 287,409,437 |
나. 당분기말과 전기말 현재 금융부채의 범주별 분류내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당 분 기 말 | 전 기 말 | ||||
|---|---|---|---|---|---|---|
| 상각후원가로 측정 하는 금융부채 |
공정가치로 측정하는 금융부채 |
합 계 | 상각후원가로 측정 하는 금융부채 |
공정가치로 측정하는 금융부채 |
합 계 | |
| 매입채무및기타채무 | 12,056,541 | - | 12,056,541 | 23,660,043 | - | 23,660,043 |
| 차입금 | 62,900,000 | - | 62,900,000 | 38,600,000 | - | 38,600,000 |
| 전환사채 | 14,639,920 | - | 14,639,920 | 13,249,757 | - | 13,249,757 |
| 파생상품부채 | - | 6,078,269 | 6,078,269 | - | 4,798,378 | 4,798,378 |
| 리스부채 | 246,227 | - | 246,227 | 368,580 | - | 368,580 |
| 기타장기채무 | 8,378,632 | - | 8,378,632 | 8,295,849 | - | 8,295,849 |
| 합 계 | 98,221,320 | 6,078,269 | 104,299,589 | 84,174,229 | 4,798,378 | 88,972,607 |
(2) 당분기 및 전분기 중 발생한 금융상품 범주별 순손익은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 당기손익금융자산 | ||
| 평가손익 | (510,529) | (1,643,329) |
| 처분손익 | 377,560 | (1,985,312) |
| 기타포괄손익금융자산 | ||
| 평가손익(기타포괄손익) | (194,506,860) | 127,905,382 |
| 파생상품자산 | ||
| 평가손익 | (184,000) | (1,782,066) |
| 상각후원가측정 금융자산 | ||
| 이자수익 | 153,167 | 178,100 |
| 외환차손익 | (201,468) | 444,170 |
| 외화환산손익 | 2,686,590 | (23,298) |
| 상각후원가로 측정하는 금융부채 | ||
| 이자비용 | (2,303,894) | (78,109) |
| 파생상품부채 | ||
| 평가손익 | (1,279,891) | (287,791) |
6. 현금및현금성자산
보고기간종료일 현재 현금및현금성자산의 세부내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 보통예금 | 19,804,959 | 21,200,695 |
| 외화예금 | 5,251,960 | 6,594,951 |
| 합 계 | 25,056,919 | 27,795,646 |
7. 매출채권 및 기타채권
(1) 보고기간종료일 현재 매출채권 및 기타채권의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 매출채권 | 10,926,028 | - | 2,111,908 | - |
| 차감:손실충당금 | (1,116,125) | - | (1,079,800) | - |
| 미수금 | 1,187,439 | - | 1,314,555 | - |
| 차감:손실충당금 | (47,300) | - | (46,581) | - |
| 미수수익 | 577 | - | 87,287 | - |
| 보증금 | 2,082,221 | 127,426 | - | 2,245,198 |
| 합 계 | 13,032,840 | 127,426 | 2,387,369 | 2,245,198 |
(2) 당분기와 전분기 중 매출채권에 대한 손실충당금의 변동내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 기초 | 대손상각 | 환입 | 기말 |
|---|---|---|---|---|
| 당분기 | 1,079,800 | 62,325 | (26,000) | 1,116,125 |
| 전분기 | 794,525 | - | (10,100) | 784,425 |
(3) 보고기간종료일 현재 매출채권의 연령 및 각 연령별로 손상된 채권금액은 다음과같습니다.
| (단위 : 천원) |
| 구 분(*) | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | |
| 정상채권 | 9,791,599 | - | 9,791,599 | 1,032,108 | - | 1,032,108 |
| 3개월 이하 | - | - | - | - | - | - |
| 3개월 초과 6개월 이하 | - | - | - | - | - | - |
| 6개월 초과 | 1,134,429 | (1,116,125) | 18,304 | 1,079,800 | (1,079,800) | - |
| 합 계 | 10,926,028 | (1,116,125) | 9,809,903 | 2,111,908 | (1,079,800) | 1,032,108 |
(*) 매출채권의 기간구분은 연체일을 기준으로 구분하였습니다.
8. 기타자산
보고기간종료일 현재 기타자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기타유동자산 | ||
| 선급금 | 2,025,382 | 3,248,168 |
| 선급비용 | 92,180 | 108,651 |
| 선급용역원가 | 2,178,053 | 591,174 |
| 미청구공사 | 499,758 | 2,892 |
| 부가세대급금 | 714,568 | 2,300,877 |
| 연구자재 | 14,348,090 | 7,167,313 |
| 합 계 | 19,858,031 | 13,419,075 |
| 기타비유동자산 | ||
| 장기선급금 | 921,397 | 733,461 |
| 합 계 | 921,397 | 733,461 |
9. 당기손익금융자산
보고기간종료일 현재 당기손익금융자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 발행회사명 | 당분기말 | 전기말 |
|---|---|---|---|
| 투자전환사채 | ㈜코스온 | 5,000,000 | 5,000,000 |
| 투자전환사채 | ㈜바이넥스 | 4,870,070 | 5,206,695 |
| 투자전환사채 | ㈜화이바이오메드 | 732,729 | 752,090 |
| 출자금 | 미래에셋청년창업투자조합3호 | 1,823,992 | 2,065,791 |
| 보통주 | ㈜프로젠 | - | - |
| 합 계 | 12,426,791 | 13,024,576 | |
10. 기타포괄손익금융자산
(1) 보고기간종료일 현재 기타포괄손익금융자산 내역은 다음과 같습니다.
| (단위 : 주, 천원) |
| 구 분 | 보유주식수 | 지분율 | 당분기말 | 전기말 | ||
|---|---|---|---|---|---|---|
| 취득가액 | 장부가액 | 취득가액 | 장부가액 | |||
| 시장성있는 지분증권 | ||||||
| (주)제넨바이오(주1,2) | 3,019,913 | 6.93% | 50,966,020 | 4,137,281 | 52,922,047 | 12,426,942 |
| I-Mab | 8,488,885 | 4.45% | 71,767,447 | 21,235,308 | 71,767,447 | 207,353,362 |
| 소 계 | 122,733,467 | 25,372,589 | 124,689,494 | 219,780,304 | ||
| 시장성없는 지분증권 | ||||||
| (주)코스온(주3) | 216,488 | 0.90% | 4,242,064 | - | 4,242,064 | 451,635 |
| PharmaJet | 297,128 | 1.14% | 895,866 | 582,778 | 895,866 | 481,519 |
| 와이바이오로직스 | 176,991 | 1.44% | 2,999,997 | 2,618,759 | 2,999,997 | 2,618,759 |
| 에스엘백시젠 | 250,000 | 13.51% | 10,219,400 | 10,219,400 | 10,219,400 | 10,219,400 |
| 이노퓨틱스 | 381,680 | 6.97% | 1,000,002 | 1,000,002 | 1,000,002 | 1,000,002 |
| 칼로스메디칼 | 8,147 | 1.59% | 1,000,028 | 1,000,028 | - | - |
| (주)지아이이노베이션(주2) | 151,515 | 0.76% | 4,999,995 | 4,999,995 | 4,999,995 | 4,999,995 |
| 진메디신 | 48,182 | 0.59% | 1,000,017 | 1,000,017 | 1,000,017 | 1,000,017 |
| Egret | 1,000,000 | 5.56% | 1,166,598 | 1,476,696 | 1,166,598 | 1,220,117 |
| 소 계 | 27,523,967 | 22,897,675 | 26,523,939 | 21,991,444 | ||
| 합 계 | 150,257,434 | 48,270,264 | 151,213,433 | 241,771,748 | ||
| (주1) 당분기 중 주식이 5:1로 액면병합되었습니다. (주2) 당분기말 현재 (주)제넨바이오와 (주)지아이이노베이션 주식은 보호예수로 인해 매각이 제한되어 있습니다. (주3) 코스닥시장내의 거래정지로 인해 시장성없는 지분증권으로 분류하였습니다. |
(2) 당분기 및 전분기 중 기타포괄손익금융자산의 변동내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | 241,771,748 | 278,506,628 |
| 취득 | 1,322,168 | 12,166,609 |
| 처분 | (534,950) | (58,072,039) |
| 대체 | - | - |
| 평가손익 | (194,288,702) | 127,905,382 |
| 기말 | 48,270,264 | 360,506,580 |
11. 관계기업 및 공동기업 투자
(1) 당분기말 현재 관계기업 및 공동기업 투자에 대한 현황은 다음과 같습니다.
| 구분 | 회사명 | 소재지 | 주요 영업활동 |
|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 대한민국 | 생물학적 제제 제조업 |
| 관계기업 | NIT (NeoImmuneTech, Inc.)(주3) | 미국 | 면역학을 이용한 바이오의약품 연구/개발 및 판매 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 중국 | 중국, 글로벌 임상개발 및 사업화 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 인도네시아 | 아세안, 글로벌 임상개발 및 사업화 |
| 관계기업 | (주)툴젠(주1,주3) | 대한민국 | 유전자교정 연구개발 및 유전자교정 기술 기반 치료제 개발 및 품종개량 |
| 관계기업 | (주)큐로젠(주2) | 대한민국 | 유전자 및 단백질을 이용한 치료제 개발 |
| 공동기업 | Rezolute, Inc(주1) | 미국 | 글로벌 임상개발 및 사업화 |
| 공동기업 | CoImmune, Inc. | 미국 | 글로벌 임상개발 및 사업화 |
| 공동기업 | ILKOGEN | 터키 | 글로벌 임상개발 및 사업화 |
| 공동기업 | KinGen Biotech, Inc | 태국 | CDMO 서비스 및 사업화 |
| (주1) 지분율이 20% 미만이나 투자약정에 의거 피투자회사에 대한 임원 선임권 등이 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업및공동기업으로 분류하였습니다. (주2) 당사 임원이 피투자회사의 사외이사를 겸직하고 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업으로 분류하였습니다. (주3) 당분기말 현재 (주)툴젠 985,721주와 NeoImmuneTech, Inc. 20,936,000주는 보호예수로 인해 매각이 제한되어 있습니다. |
(2) 보고기간종료일 현재 관계기업 및 공동기업 투자의 내역은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 회 사 명 | 지분율(%) | 취득금액 | 장부금액 |
|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 25.00% | 8,925,000 | 10,834,690 |
| 관계기업 | NIT(NeoImmuneTech,Inc.) | 21.18% | 45,246,777 | 40,120,875 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 49.00% | 1,102,598 | 883,737 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 20.32% | 38,694,175 | 46,008,217 |
| 관계기업 | (주)툴젠 | 14.24% | 79,480,998 | 70,870,789 |
| 관계기업 | (주)큐로젠 | 6.16% | 3,000,180 | 2,809,449 |
| 공동기업 | Rezolute, Inc | 4.96% | 25,827,875 | 7,178,723 |
| 공동기업 | CoImmune, Inc | 22.94% | 25,374,549 | 19,963,367 |
| 공동기업 | ILKOGEN | 50.00% | 9,500,093 | 345,498 |
| 공동기업 | KinGen Biotech, Inc | 50.00% | 2,291,519 | - |
| 합 계 | 239,443,764 | 199,015,345 | ||
| <전기말> | (단위 : 천원) |
| 구 분 | 회 사 명 | 지분율(%) | 취득금액 | 장부금액 |
|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 25.00% | 8,925,000 | 10,068,062 |
| 관계기업 | NIT(NeoImmuneTech,Inc.) | 21.24% | 45,246,777 | 45,457,149 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 49.00% | 1,102,598 | 791,134 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 20.32% | 38,694,175 | 42,370,109 |
| 관계기업 | (주)툴젠 | 14.24% | 79,480,998 | 73,813,115 |
| 관계기업 | (주)큐로젠 | 6.16% | 3,000,180 | 2,963,420 |
| 공동기업 | Rezolute, Inc | 11.74% | 25,827,875 | 10,347,484 |
| 공동기업 | CoImmune, Inc | 22.94% | 25,374,549 | 20,093,975 |
| 공동기업 | ILKOGEN | 50.00% | 9,500,093 | 663,019 |
| 공동기업 | KinGen Biotech, Inc | 50.00% | 2,291,519 | - |
| 합 계 | 239,443,764 | 206,567,467 | ||
(3) 보고기간종료일 현재 관계기업 및 공동기업의 요약 재무정보는 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 회 사 명 | 자 산 | 부 채 | 매 출 | 분기순손익 | 총포괄손익 | ||
|---|---|---|---|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |||||
| 관계기업 | 아지노모도제넥신(주) | 21,865,113 | 25,060,308 | 3,586,658 | - | 24,283,488 | 4,801,519 | 4,801,519 |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | 150,199,521 | 24,154,616 | 36,864,565 | 4,203,400 | - | (58,988,799) | (60,046,794) |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 1,504,462 | 308,397 | 9,314 | - | - | 69,967 | 69,967 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 128,450,487 | 155,267,172 | 4,062,871 | 42,930,035 | 12,798,336 | (11,744,296) | (11,142,764) |
| 관계기업 | (주)툴젠 | 62,345,683 | 15,654,092 | 3,146,316 | 1,441,296 | 566,520 | (13,580,781) | (13,559,650) |
| 관계기업 | (주)큐로젠 | 9,591,334 | 3,141,724 | 511,432 | 95,811 | 59,250 | (2,498,885) | (2,498,885) |
| 공동기업 | Rezolute, Inc | 218,237,579 | 453,397 | 3,532,478 | 699 | - | (42,142,983) | (42,142,983) |
| 공동기업 | CoImmune, Inc | 30,752,770 | 15,010,087 | 2,290,028 | 1,648,379 | 322,097 | (25,199,415) | (25,199,415) |
| 공동기업 | ILKOGEN | 625,321 | 4,079,300 | 737,630 | - | - | (7,597) | (7,597) |
| 공동기업 | KinGen Biotech, Inc | 1,461,178 | 299,142 | 4,619,507 | - | 1,406,593 | (2,656,960) | (2,656,960) |
| <전기말> | (단위 : 천원) |
| 구 분 | 회 사 명 | 자 산 | 부 채 | 매 출 | 당기순손익 | 총포괄손익 | ||
|---|---|---|---|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |||||
| 관계기업 | 아지노모도제넥신(주) | 17,773,704 | 27,044,793 | 4,509,786 | 36,464 | 27,987,231 | 9,201,184 | 9,201,184 |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | 167,894,593 | 21,153,664 | 19,369,816 | 4,834,778 | - | (49,549,360) | (49,914,505) |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 1,309,655 | 412,361 | 1,300,965 | - | - | (136,828) | (136,828) |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 89,321,684 | 128,975,159 | 587,889 | 209,011 | - | 1,831,251 | 1,831,251 |
| 관계기업 | (주)툴젠 | 75,489,100 | 12,228,854 | 2,044,654 | 1,024,814 | 1,597,275 | (22,015,282) | (21,827,798) |
| 관계기업 | (주)큐로젠 | 11,956,368 | 2,720,901 | 52,568 | - | 9,250 | (2,309,476) | (2,309,476) |
| 공동기업 | Rezolute, Inc | 45,457,041 | 491,983 | 3,079,929 | 17,311,857 | - | (8,965,873) | (8,965,873) |
| 공동기업 | CoImmune, Inc | 41,664,250 | 18,878,862 | 3,102,666 | 1,631,396 | 360,420 | (37,692,407) | (37,692,407) |
| 공동기업 | ILKOGEN | 700,609 | 4,419,222 | 517,796 | - | - | (6,505) | (6,505) |
| 공동기업 | KinGen Biotech, Inc | 1,429,181 | 27,786,262 | 32,349,742 | - | - | (2,728,977) | (2,728,977) |
(4) 보고기간종료일 현재 관계기업 및 공동기업의 재무정보를 관계기업 및 공동기업에 대한 지분의 장부금액으로 조정한 내역은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구분 | 회사명 | 순자산 | 지분율 | 순자산지분액 | 투자차액 | 내부미실현손익 | 손상차손 | 장부금액 |
|---|---|---|---|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 43,338,763 | 25.00% | 10,834,690 | - | - | - | 10,834,690 |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | 112,321,943 | 21.18% | 23,794,723 | 17,174,913 | (848,761) | - | 40,120,875 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 1,803,545 | 49.00% | 883,737 | - | - | - | 883,737 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 232,661,809 | 20.32% | 47,265,787 | 3,661,476 | (4,919,046) | - | 46,008,217 |
| 관계기업 | (주)툴젠 | 57,878,043 | 14.24% | 8,243,023 | 62,627,766 | - | - | 70,870,789 |
| 관계기업 | (주)큐로젠 | 12,125,815 | 6.16% | 747,146 | 2,062,303 | - | - | 2,809,449 |
| 공동기업 | Rezolute, Inc | 217,750,185 | 4.96% | 10,796,692 | 2,130,331 | - | (5,748,300) | 7,178,723 |
| 공동기업 | CoImmune, Inc | 36,329,740 | 22.94% | 8,334,042 | 20,472,403 | - | (8,843,078) | 19,963,367 |
| 공동기업 | ILKOGEN | 3,966,991 | 50.00% | 1,983,496 | - | (1,637,998) | - | 345,498 |
| 공동기업 | KinGen Biotech, Inc | (4,769,018) | 50.00% | (2,384,505) | - | - | - | - |
| 합 계 | 713,407,816 | 110,498,831 | 108,129,193 | (7,405,805) | (14,591,379) | 199,015,345 | ||
| <전기말> | (단위 : 천원) |
| 구분 | 회사명 | 순자산 | 지분율 | 순자산지분액 | 투자차액 | 내부미실현손익 | 손상차손 | 장부금액 |
|---|---|---|---|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 40,272,247 | 25.00% | 10,068,062 | - | - | - | 10,068,062 |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | 151,276,119 | 21.24% | 32,126,721 | 14,226,063 | (895,635) | - | 45,457,149 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 1,614,559 | 49.00% | 791,134 | - | - | - | 791,134 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 217,499,942 | 20.32% | 44,185,618 | 3,236,901 | (5,052,410) | - | 42,370,109 |
| 관계기업 | (주)툴젠 | 71,422,797 | 14.24% | 10,172,074 | 63,641,041 | - | - | 73,813,115 |
| 관계기업 | (주)큐로젠 | 14,624,700 | 6.16% | 901,117 | 2,062,303 | - | - | 2,963,420 |
| 공동기업 | Rezolute, Inc | 79,965,369 | 11.74% | 9,386,308 | 4,166,949 | - | (3,205,773) | 10,347,484 |
| 공동기업 | CoImmune, Inc | 52,405,318 | 22.94% | 12,021,780 | 16,915,273 | - | (8,843,078) | 20,093,975 |
| 공동기업 | ILKOGEN | 4,602,035 | 50.00% | 2,301,017 | - | (1,637,998) | - | 663,019 |
| 공동기업 | KinGen Biotech, Inc | (3,134,299) | 50.00% | - | - | - | - | - |
| 합 계 | 630,548,787 | 121,953,831 | 104,248,530 | (7,586,043) | (12,048,851) | 206,567,467 | ||
(5) 당분기 및 전분기 중 관계기업 및 공동기업의 종목별 지분법평가내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구분 | 회사명 | 기초 | 취득 | 처분및배당 | 지분법손익 | 지분법 자본변동등 |
처분손익 (주1) |
손상차손 | 기말 |
|---|---|---|---|---|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 10,068,062 | - | (433,751) | 1,200,379 | - | - | - | 10,834,690 |
| 관계기업 | NIT(NeoImmuneTech,Inc.) | 45,457,149 | - | - | (13,113,499) | 7,740,528 | 36,697 | - | 40,120,875 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 791,134 | - | - | 34,284 | 58,319 | - | - | 883,737 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 42,370,109 | - | - | (2,252,516) | 5,890,624 | - | - | 46,008,217 |
| 관계기업 | (주)툴젠 | 73,813,115 | - | - | (2,946,880) | 4,554 | - | - | 70,870,789 |
| 관계기업 | (주)큐로젠 | 2,963,420 | - | - | (153,971) | - | - | - | 2,809,449 |
| 공동기업 | Rezolute, Inc | 10,347,484 | - | - | (4,512,312) | 3,897,263 | (11,185) | (2,542,527) | 7,178,723 |
| 공동기업 | CoImmune, Inc | 20,093,975 | - | - | (5,687,862) | 5,557,254 | - | - | 19,963,367 |
| 공동기업 | ILKOGEN | 663,019 | - | - | (3,798) | (313,723) | - | - | 345,498 |
| 공동기업 | KinGen Biotech, Inc | - | - | - | - | - | - | - | - |
| 합 계 | 206,567,467 | - | (433,751) | (27,436,175) | 22,834,820 | 25,512 | (2,542,527) | 199,015,345 | |
| (주1) 불균등 유상증자 등으로 인한 지분율 감소 시 처분손익으로 인식한 금액입니다. |
| <전분기> | (단위 : 천원) |
| 구 분 | 회 사 명 | 기초 | 취득 | 처분및배당 | 지분법손익 |
지분법 자본변동등 |
처분손익 (주1) |
기말 |
|---|---|---|---|---|---|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 7,767,766 | - | - | 1,915,346 | - | - | 9,683,111 |
| 관계기업 | NIT(NeoImmuneTech,Inc.) | 35,279,967 | - | - | (7,897,152) | 3,136,568 | 16,683,521 | 47,202,904 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 752,539 | - | - | (28,685) | 71,073 | - | 794,927 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 16,038,372 | 20,025,000 | - | (6,194,927) | 3,328,854 | 4,120,139 | 37,317,438 |
| 관계기업 | (주)툴젠 | 79,480,998 | - | - | (2,530,651) | 27,944 | (498,986) | 76,479,305 |
| 관계기업 | (주)큐로젠 | - | 3,000,180 | - | - | - | - | 3,000,180 |
| 공동기업 | Rezolute, Inc | 16,106,948 | - | - | (5,343,198) | (191,118) | (328,573) | 10,244,058 |
| 공동기업 | CoImmune, Inc | 36,423,416 | - | - | (4,795,172) | 1,715,008 | - | 33,343,251 |
| 공동기업 | ILKOGEN | 2,140,628 | - | - | (2,163) | (373,549) | - | 1,764,916 |
| 공동기업 | KinGen Biotech, Inc | - | 1,098,153 | - | (1,098,153) | - | - | - |
| 합 계 | 193,990,634 | 24,123,333 | - | (25,974,756) | 7,714,779 | 19,976,101 | 219,830,091 | |
| (주1) 불균등 유상증자 등으로 인한 지분율 감소 시 처분손익으로 인식한 금액입니다. |
12. 파생상품자산
보고기간종료일 현재 파생상품자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 전환사채 콜옵션(주1) | 900 | - | 184,900 | - |
| (주1) 당사는 2018년 5월과 2020년 12월에 제6회 및 제7회 전환사채를 발행하였으며, 당사가 보유한 콜옵션을 이항모형에 따라 평가하였습니다. |
13. 투자부동산
(1) 보고기간종료일 현재 투자부동산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | |
| 토지 | 1,242,681 | - | 1,242,681 | - | - | - |
| 건물 | 2,505,653 | (707,571) | 1,798,082 | - | - | - |
| 합 계 | 3,748,334 | (707,571) | 3,040,763 | - | - | - |
(2) 당분기 중 투자부동산 장부금액의 변동내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 기초 | 취득 및 자본적지출 |
처분 | 대체(주1) | 감가상각 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | - | - | - | 1,242,681 | - | 1,242,681 |
| 건물 | - | - | - | 1,844,988 | (46,906) | 1,798,082 |
| 합 계 | - | - | - | 3,087,669 | (46,906) | 3,040,763 |
| (주1) 당분기 중 마곡 신사옥으로 본점 및 연구소가 이전함에 따라 임대 중인 판교 사옥을 유형자산에서 투자부동산으로 대체하였습니다. |
(3) 당분기 중 투자부동산에서 발생한 임대수익은 95,439천원이며, 투자부동산 매각과 관련하여 인식한 처분손익은 없습니다.
(4) 투자부동산은 원가모형으로 평가하고 있으며, 공정가치는 공인된 전문자격을 갖춘 독립된 평가인에 의해 평가되지 아니하였습니다. 다만, 공시가격에 따른 보고기간종료일 현재 투자부동산의 가치는 3,730,947천원 입니다.
14. 유형자산
(1) 보고기간종료일 현재 유형자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 계 정 과 목 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | |
| 토지 | 30,528,341 | - | 30,528,341 | 21,696,652 | - | 21,696,652 |
| 건물 | 65,325,278 | (1,491,451) | 63,833,827 | 67,704,339 | (944,559) | 66,759,780 |
| 기계장치 | 12,589,808 | (9,345,305) | 3,244,503 | 12,001,844 | (8,545,457) | 3,456,387 |
| 차량운반구 | - | - | - | 48,724 | (48,724) | - |
| 비품 | 2,355,950 | (1,617,930) | 738,020 | 1,915,295 | (1,431,502) | 483,793 |
| 시설장치 | 4,150,201 | (798,188) | 3,352,013 | 6,179,244 | (2,349,286) | 3,829,958 |
| 사용권자산(주1) | 4,150,251 | (700,179) | 3,450,072 | 4,258,036 | (509,709) | 3,748,327 |
| 건설중인자산 | 14,890,659 | - | 14,890,659 | 11,993,784 | - | 11,993,784 |
| 합 계 | 133,990,488 | (13,953,053) | 120,037,435 | 125,797,918 | (13,829,237) | 111,968,681 |
(2) 당분기 및 전분기 중 유형자산 장부금액의 변동내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 계 정 과 목 | 기초 | 취득 및 자본적지출 |
처분 | 대체(주2) | 감가상각 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | 21,696,652 | 2,144,695 | (461,751) | 7,148,745 | - | 30,528,341 |
| 건물 | 66,759,780 | 217,748 | (73,684) | (1,844,988) | (1,225,029) | 63,833,827 |
| 기계장치 | 3,456,387 | 619,989 | (207) | 25,959 | (857,625) | 3,244,503 |
| 비품 | 483,793 | 184,277 | (2,549) | 257,690 | (185,191) | 738,020 |
| 시설장치 | 3,829,958 | 140,988 | (13,413) | - | (605,521) | 3,352,012 |
| 사용권자산(주1) | 3,748,327 | 132,967 | (72,146) | - | (359,076) | 3,450,072 |
| 건설중인자산 | 11,993,784 | 11,571,951 | - | (8,675,075) | - | 14,890,660 |
| 합 계 | 111,968,681 | 15,012,615 | (623,750) | (3,087,669) | (3,232,442) | 120,037,435 |
| (주1) 당분기말 현재 사용권자산은 차량운반구 214,096천원, 시설이용권 3,235,976천원으로 구성되어 있습니다. (주2) 당분기 중 마곡 신사옥으로 본점 및 연구소가 이전함에 따라 임대 중인 판교 사옥의 토지와 건물 3,087,669천원을 유형자산에서 투자부동산으로 대체하였습니다. |
| <전분기> | (단위 : 천원) |
| 구 분 | 기초 | 취득 및 자본적지출 |
처분 | 대체 | 감가상각 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | 6,838,569 | - | - | - | - | 6,838,569 |
| 건물 | 10,558,490 | - | - | - | (252,469) | 10,306,021 |
| 기계장치 | 2,929,396 | 1,280,331 | (1,860) | 230,600 | (791,150) | 3,647,317 |
| 비품 | 631,306 | 73,349 | (17,079) | - | (158,076) | 529,500 |
| 시설장치 | 514,107 | 673,813 | (425,180) | - | (128,329) | 634,411 |
| 사용권자산(주1) | 3,896,454 | 3,796,378 | (3,555,268) | - | (337,578) | 3,799,986 |
| 건설중인자산 | 46,487,227 | 24,936,427 | - | (230,600) | - | 71,193,054 |
| 합 계 | 71,855,549 | 30,760,298 | (3,999,387) | - | (1,667,603) | 96,948,857 |
| (주1) 전분기말 현재 사용권자산은 차량운반구 273,576천원, 시설이용권 3,526,410천원으로 구성되어 있습니다. |
(3) 당분기 및 전분기의 감가상각비의 계상내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 판매비와관리비 | 1,029,826 | 694,187 |
| 경상연구개발비 | 1,788,472 | 833,599 |
| 용역원가 | 409,874 | 137,116 |
| 공동개발 프로젝트 | 4,270 | 2,700 |
| 합 계 | 3,232,442 | 1,667,602 |
(4) 유형자산 중 토지와 건물은 연결회사의 차입금과 관련하여 담보로 제공되어 있습니다(주석37 참조).
(5) 차입원가자본화
보고기간종료일 현재 차입원가를 자본화하여 건설중인자산으로 계상한 금액과 차입원가를 산정하기 위하여 사용된 일반목적차입금 자본화이자율은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 차입원가 자본화 금액 | 28,110 | 1,788,557 |
| 자본화이자율 | 5.04%~12.35% | 8.8~9.3% |
15 무형자산
(1) 당분기 및 전분기 중 발생한 무형자산 장부금액의 변동내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구분 | 기초 | 취득 | 처분 | 상각 | 기말 |
|---|---|---|---|---|---|
| 산업재산권 | 720,956 | 78,464 | - | (127,926) | 671,494 |
| 시설이용권 | 349,165 | - | (200,000) | - | 149,165 |
| 기타의무형자산 | 2,209,408 | 32,068 | - | (225,291) | 2,016,185 |
| 합계 | 3,279,529 | 110,532 | (200,000) | (353,217) | 2,836,844 |
| <전분기> | (단위 : 천원) |
| 구분 | 기초 | 취득 | 처분 | 상각 | 기말 |
|---|---|---|---|---|---|
| 산업재산권 | 716,770 | 89,630 | - | (121,061) | 685,339 |
| 시설이용권 | 356,040 | - | - | - | 356,040 |
| 기타의무형자산 | 2,992,553 | 577,274 | - | (398,882) | 3,170,945 |
| 합계 | 4,065,363 | 666,904 | - | (519,943) | 4,212,324 |
(2) 당분기 및 전분기에 비용으로 인식한 연구개발 관련 지출액(경상개발비)은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 원재료비 | 2,383,553 | 5,038,701 |
| 인건비 | 4,337,475 | 6,097,030 |
| 위탁용역비 | 8,469,759 | 14,728,013 |
| 기타비용 | 3,151,601 | 3,027,473 |
| 정부보조금 | (629,998) | (6,104,724) |
| 합 계 | 17,712,390 | 22,786,493 |
16. 정부보조금
(1) 개요
연결회사는 신약개발과 관련하여 국가항암신약개발센터, 보건복지부, 과학기술정보통신부 등과 과제수행 주관사로서 다수의 협약을 체결하고 정부과제를 수행하고 있으며, 이러한 협약에 의해 정부보조금을 수령하고 있습니다.
(2) 당분기 및 전분기 중 정부보조금의 증감내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구 분 | 현금및현금성자산 | 투자부동산 | 건물 | 기계장치 | 비품 | 기타의무형자산 |
|---|---|---|---|---|---|---|
| 기초 | - | - | 2,931 | 44,916 | 2,685 | 9,062 |
| 수령 | 604,950 | - | - | - | - | - |
| 자산대체 | - | 2,931 | (2,931) | - | - | - |
| 비용상계 | (604,950) | (75) | - | (7,703) | (1,078) | (3,707) |
| 반납 | - | - | - | - | - | - |
| 기말 | - | 2,856 | - | 37,213 | 1,607 | 5,355 |
| <전분기> | (단위 : 천원) |
| 구 분 | 현금및현금성자산 | 건물 | 기계장치 | 비품 | 기타의무형자산 |
|---|---|---|---|---|---|
| 기초 | - | 12,275 | 11,924 | 4,305 | 14,005 |
| 수령 | 6,270,673 | - | - | - | - |
| 자산취득 | (51,351) | - | 51,351 | - | - |
| 자산처분 | - | - | (8,076) | (104) | - |
| 비용상계 | (6,219,322) | (302) | (7,716) | (1,156) | (3,707) |
| 반납 | - | - | - | - | - |
| 기말 | - | 11,973 | 47,483 | 3,045 | 10,298 |
17. 매각예정비유동자산
보고기간종료일 현재 부동산매매계약을 체결한 토지와 건물을 유형자산에서 매각예정비유동자산으로 재분류하였으며, 그 내역은 다음과 같습니다.
| <전기말> | (단위 : 천원) |
| 구 분 | 내 역 | 재분류전 장부금액 | 손상차손 | 장부금액 |
|---|---|---|---|---|
| 토지 | 판교 사옥 | 5,134,137 | - | 5,134,137 |
| 건물 | 판교 사옥 | 8,303,004 | - | 8,303,004 |
| 합 계 | 13,437,141 | - | 13,437,141 | |
한편, 상기 매각예정비유동자산은 당분기 중 매각이 완료되었습니다.
18. 매입채무 및 기타채무
보고기간종료일 현재 매입채무 및 기타채무의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 계 정 과 목 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 미지급금 | 4,524,857 | 1,961,540 | 21,779,171 | 1,971,908 |
| 미지급비용 | 7,436,435 | 47,062 | 1,688,652 | 47,062 |
| 임대보증금 | 95,250 | 6,370,030 | 192,220 | 6,276,879 |
| 합 계 | 12,056,542 | 8,378,632 | 23,660,043 | 8,295,849 |
19. 기타부채
보고기간종료일 현재 기타유동부채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 계 정 과 목 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 예수금 | 270,358 | - | 233,997 | - |
| 선수금 | 239,940 | - | 23,309,206 | - |
| 선수수익 | 127,602 | 298,554 | 127,602 | 393,993 |
| 합 계 | 637,900 | 298,554 | 23,670,805 | 393,993 |
20. 차입금
(1) 보고기간종료일 현재 장기차입금의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 차입처 | 내 역 | 이자율(%) | 당분기말 | 전기말 |
|---|---|---|---|---|
| 기업은행 | 시설자금대출 | 4.18 | 10,000,000 | 10,000,000 |
| 시설자금대출 | 1.87 | 20,000,000 | 20,000,000 | |
| 시설자금대출 | 2.68 | 17,900,000 | 8,600,000 | |
| 운전자금대출 | 4.75 | 10,000,000 | - | |
| 하나은행 | 운전자금대출 | 3.96 | 5,000,000 | - |
| 합 계 | 62,900,000 | 38,600,000 | ||
상기 차입금과 관련하여 연결회사의 유형자산 중 토지와 건물을 담보로 제공하고 있습니다(주석37 참조).
(2) 보고기간종료일 현재 차입금의 유동성분류 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 금융기관차입금 | 25,588,220 | 37,311,780 | 10,000,000 | 28,600,000 |
21. 전환사채
(1) 보고기간종료일 현재 전환사채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 전환사채 | 1,500,000 | 20,900,000 | 1,500,000 | 20,900,000 |
| 사채상환할증금 | - | 225,209 | - | 225,209 |
| 전환권조정 | (145,404) | (7,839,884) | (299,812) | (9,075,640) |
| 합 계 | 1,354,596 | 13,285,325 | 1,200,188 | 12,049,569 |
(2) 당분기말 현재 연결회사가 발행한 전환사채의 내역은 아래와 같습니다.
| 발행회사 | ㈜제넥신 | ㈜제넥신 | ㈜에스엘포젠 |
|---|---|---|---|
| 사채의 종류 | 제6회 기명식 무보증 사모 전환사채 | 제7회 기명식 무보증 사모 전환사채 | 제2회 기명식 사모 전환사채 |
| 액면가액 | 50,000,000천원 | 20,000,000천원 | 900,000천원 |
| 발행가액 | 50,000,000천원 | 20,000,000천원 | 900,000천원 |
| 발행잔액(주1) | 1,500,000천원 | 20,000,000천원 | 900,000천원 |
| 발행일 | 2018년 05월 18일 | 2020년 12월 17일 | 2020년 03월 12일 |
| 만기일 | 2023년 05월 18일 | 2025년 12월 17일 | 2035년 03월 12일 |
| 이자지급조건 | 없음 | 없음 | 없음 |
| 만기보장수익률 | 0% | 0% | 1.50% |
| 전환조건(주2) | 2019년 5월 18일에서 2023년 5월 17일까지 주당 87,278원으로 전환 가능(총17,186주) | 2020년 12월 17일에서 2025년 12월 16일까지 주당 119,807원으로 전환 가능(총166,935주) | 2020년 09월 12일부터 2035년 03월 11일까지 주당 5,000원으로 전환 가능(총180,000주) |
| 풋옵션 | 채권자는 사채발행후 3년이 되는 날인 2021년 5월 18일부터 만기일 3개월 전인 2023년 2월 18일까지 매 3개월이 되는 날마다 본 사채의 원금에 대해 만기 전 조기상환을 청구할 수 있음 | 채권자는 사채발행후 3년이 되는 날인 2023년 12월 17일부터 만기일 3개월 전인 2025년 9월 17일까지 매 3개월이 되는 날마다 본 사채의 원금에 대해 만기 전 조기상환을 청구할 수 있음 | 없음 |
| 콜옵션 | 발행회사는 사채발행후 2년이 되는 날인 2020년 5월 18일부터 만기일 3개월 전인 2023년 2월 18일까지 매 3개월이 되는 날마다 본 사채 권면총액 30%에 해당하는 금액의 한도 내에서 발행회사에게 상환하거나, 발행회사가 지정하는 제3자에게 매도하여 줄 것을 청구할 수 있음 | 발행회사는 사채발행후 2년이 되는 날인 2022년 12월 17일부터 만기일 3개월 전인 2025년 9월 17일까지 매 3개월이 되는 날마다 본 사채 권면총액 30%에 해당하는 금액의 한도 내에서 발행회사에게 상환하거나, 발행회사가 지정하는 제3자에게 매도하여 줄 것을 청구할 수 있음 | 없음 |
| (주1) 당사가 2018년 5월 18일 발행한 제6회 전환사채는 2020년 07월 30일 3,500,000천원, 2020년 08월 05일 31,500,000천원이 전환되었으며, 2020년 12월 18일 13,500,000천원이 상환되어 잔여액면금액은 1,500,000천원 입니다. |
22. 파생상품부채
보고기간종료일 현재 파생상품부채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 보통주 콜옵션(주1) | 236,914 | - | 195,750 | - |
| 보통주 풋옵션(주2) | - | 48,417 | - | 48,417 |
| 전환사채 풋옵션(주3) | 97,838 | 5,695,100 | 197,351 | 4,356,860 |
| 합 계 | 334,752 | 5,743,517 | 393,101 | 4,405,277 |
| (주1) 당사는 미국 Turret과 2020년 12월에 GX-P1 기술을 이전하고 Egret 보통주를 취득하는 계약을 체결하였으며, 2년 이후 Egret의 주식을 당사로부터 매수할 수 있는 콜옵션을 부여하고 있습니다. 당사는 상기 콜옵션의 공정가치를 최초 취득시 이항모형에 따라 평가하였습니다. (주2) 당사는 인도네시아 Kalbe와 풋옵션이 포함된 주주간 계약을 체결하였으며, 당사의 종속기업인 (주)에스엘포젠의 보통주를 매도할 권리를 부여하였습니다. 당사는 상기 옵션의 공정가치를 이항모형에 따라 평가하였습니다. (주3) 당사는 2018년 5월과 2020년 12월에 전환사채를 발행하였으며, 투자자가 보유한 풋옵션을 이항모형에 따라 평가하였습니다. |
23. 리스부채
(1) 보고기간종료일 현재 리스부채에 대한 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 최소리스료 | 최소리스료의 현재가치 |
최소리스료 | 최소리스료의 현재가치 |
|
| 1년 이내 | 145,491 | 141,983 | 235,234 | 229,674 |
| 1년 초과 5년 이내 | 106,752 | 104,244 | 141,872 | 138,906 |
| 합 계 | 252,243 | 246,227 | 377,106 | 368,580 |
(2) 보고기간종료일 현재 리스부채의 유동성분류 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 리스부채 | 141,983 | 104,244 | 229,674 | 138,906 |
(3) 리스와 관련해서 포괄손익계산서에 인식된 비용은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 사용권자산 감가상각비 | 359,076 | 337,578 |
| 리스부채 이자비용 | 5,495 | 6,694 |
| 단기 및 소액리스 관련비용 | 38,482 | 4,068 |
| 합 계 | 403,053 | 348,340 |
한편, 당분기와 전분기 중 리스부채로 인한 총 현금유출 금액은 각각 184,565천원과 137,409천원입니다.
24. 종업원급여부채
(1) 보고기간종료일 현재 종업원급여부채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 순확정급여부채 | 1,523,479 | 440,792 |
| 기타장기종업원급여부채 | 99,893 | 113,353 |
| 합 계 | 1,623,372 | 554,145 |
(2) 보고기간종료일 현재 순확정급여부채의 구성항목은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 확정급여채무의 현재가치 | 3,236,595 | 4,536,218 |
| 사외적립자산의 공정가치 | (1,713,116) | (4,095,426) |
| 순확정급여부채 | 1,523,479 | 440,792 |
25. 자본금
(1) 당분기말 현재 당사가 발행할 주식의 총수는 300,000,000주, 발행한 주식의 수는 보통주 25,144,982주이며, 1주당 금액은 500원입니다.
(2) 당분기와 전분기 중 보통주식수 및 보통주자본금의 변동내역은 다음과 같습니다.
| (단위 : 주, 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 주식수 | 자본금 | 주식수 | 자본금 | |
| 기초 | 25,138,982 | 12,569,491 | 24,697,774 | 12,348,887 |
| 주식선택권 행사 | 6,000 | 3,000 | 330,758 | 165,379 |
| 기말 | 25,144,982 | 12,572,491 | 25,028,532 | 12,514,266 |
26. 자본잉여금
보고기간종료일 현재 자본잉여금의 구성내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 주식발행초과금 | 555,158,194 | 552,019,902 |
| 감자차익 | 1,100,820 | 1,100,820 |
| 전환권대가(주1) | 9,230,321 | 9,230,321 |
| 기타자본잉여금 | 364,437 | 364,437 |
| 합 계 | 565,853,772 | 562,715,480 |
| (주2) 당사는 금융감독원 질의회신 "회제이-00094" 에 의거 전환권대가를 자본잉여금으로 분류하였습니다. |
27. 기타자본구성요소
보고기간종료일 현재 기타자본구성요소의 구성내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 주식매수선택권 | 10,444,705 | 10,171,855 |
| 기타포괄손익금융자산평가손익 | (101,987,170) | 90,558,314 |
| 지분법자본변동 | 23,274,843 | 447,578 |
| 기타자본항목 | 6,438,186 | 5,601,197 |
| 합 계 | (61,829,436) | 106,778,944 |
28. 주식기준보상
(1) 당분기말 현재 당사가 보유하고 있는 주식기준 보상약정은 다음과 같습니다.
| 구 분 | 부여일 | 보유수량 | 행사가능기간 | 가득조건 |
|---|---|---|---|---|
| 11-3차 | 2013.03.15 | 70,800 | 2021.03.15~2023.03.14 | 용역제공 8년 |
| 12-3차 | 2014.03.21 | 86,150 | 2022.03.21~2024.03.20 | 용역제공 8년 |
| 25-1차 | 2018.02.06 | 16,010 | 2021.02.06~2023.02.05 | 용역제공 3년 |
| 25-2차 | 2018.02.06 | 66,932 | 2021.02.06~2024.02.05 | 용역제공 3년 |
| 26차 | 2018.08.08 | 21,500 | 2021.08.08~2023.08.07 | 용역제공 3년 |
| 27차 | 2018.10.12 | 29,000 | 2021.10.12~2023.10.11 | 용역제공 3년 |
| 28차 | 2019.05.22 | 3,190 | 2022.05.22~2024.05.21 | 용역제공 3년 |
| 29차 | 2019.11.28 | 4,500 | 2022.11.28~2024.11.27 | 용역제공 3년 |
| 30차 | 2019.12.27 | 850 | 2022.12.27~2024.12.26 | 용역제공 3년 |
| 31차 | 2020.03.04 | 5,000 | 2023.03.04~2025.03.03 | 용역제공 3년 |
| 32차 | 2020.07.15 | 56,500 | 2023.07.15~2025.07.14 | 용역제공 3년 |
| 33차 | 2021.02.18 | 21,750 | 2024.02.18~2026.02.17 | 용역제공 3년 |
| 34차 | 2021.03.29 | 3,000 | 2024.03.29~2026.03.28 | 용역제공 3년 |
| 35차 | 2021.08.13 | 26,300 | 2024.08.13~2026.08.12 | 용역제공 3년 |
| 36차 | 2022.03.07 | 95,000 | 2025.03.07~2027.03.06 | 용역제공 3년 |
| 37차 | 2022.03.29 | 195,000 | 2025.03.29~2027.03.28 | 용역제공 3년 |
한편, 당사가 임직원 등에게 부여한 주식기준 보상약정은 주식결제형과 현금결제형을 당사가 선택할 수 있으며, 당분기말 현재 현금을 지급해야 하는 의무가 없어 주식결제형을 선택하여 회계처리하고 있습니다.
(2) 당사가 임직원 등에게 부여한 주식선택권의 부여일 현재 추정 공정가치는 다음과같으며, 동 공정가치는 블랙ㆍ숄즈모형에 따라 산정한 것입니다.
| (단위 : 원) |
| 구 분 | 추정공정가치 | 주가 | 행사가격 | 기대주가변동성 | 기대배당금 | 무위험이자율 | 만기 |
|---|---|---|---|---|---|---|---|
| 11-3차 | 11,832 | 18,450 | 9,350 | 55.09% | - | 2.93% | 2023년 03월 14일 |
| 12-2차 | 17,975 | 33,750 | 17,600 | 54.02% | - | 3.40% | 2022년 03월 20일 |
| 12-3차 | 21,563 | 33,750 | 17,600 | 54.02% | - | 3.56% | 2024년 03월 20일 |
| 22차 | 17,791 | 38,250 | 39,950 | 60.84% | - | 1.83% | 2022년 02월 07일 |
| 23차 | 18,401 | 39,600 | 41,300 | 60.59% | - | 1.90% | 2022년 05월 16일 |
| 25-1차 | 34,512 | 74,500 | 78,950 | 60.01% | - | 2.52% | 2023년 02월 05일 |
| 25-2차 | 34,512 | 74,500 | 78,950 | 60.01% | - | 2.52% | 2024년 02월 05일 |
| 26차 | 39,082 | 81,000 | 85,900 | 63.35% | - | 2.32% | 2023년 08월 07일 |
| 27차 | 42,164 | 87,500 | 93,700 | 63.79% | - | 2.23% | 2023년 10월 11일 |
| 28차 | 33,766 | 69,600 | 72,600 | 64.06% | - | 1.72% | 2024년 05월 21일 |
| 29차 | 25,675 | 54,700 | 56,200 | 61.31% | - | 1.53% | 2024년 11월 27일 |
| 30차 | 30,276 | 61,200 | 56,900 | 61.15% | - | 1.47% | 2024년 12월 26일 |
| 31차 | 26,423 | 62,700 | 58,800 | 50.53% | - | 1.21% | 2025년 03월 03일 |
| 32차 | 41,489 | 96,700 | 96,500 | 54.85% | - | 1.01% | 2025년 07월 14일 |
| 33차 | 49,951 | 107,300 | 104,100 | 58.92% | - | 1.15% | 2026년 02월 17일 |
| 34차 | 43,705 | 96,400 | 100,100 | 59.51% | - | 1.41% | 2026년 03월 28일 |
| 35차 | 40,838 | 88,300 | 90,100 | 59.94% | - | 1.54% | 2026년 08월 12일 |
| 36차 | 19,683 | 44,700 | 47,600 | 57.06% | 2.33% | 2027년 03월 06일 | |
| 37차 | 20,416 | 44,500 | 45,300 | 56.82% | 2.96% | 2027년 03월 28일 |
(3) 당분기 및 전분기 중 당사가 부여하고 있는 주식선택권의 변동내역은 다음과 같습니다.
| (단위 : 원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 수량 | 가중평균행사가격 | 수량 | 가중평균행사가격 | |
| 기초 | 587,232 | 53,898 | 869,480 | 32,498 |
| 부여 | 303,100 | 46,120 | 87,700 | 97,514 |
| 행사 | 115,850 | 17,102 | 330,758 | 23,240 |
| 취소 또는 중도청산 | 73,000 | 71,588 | 23,840 | 96,887 |
| 기말 | 701,482 | 88,510 | 602,582 | 53,898 |
(4) 당분기 및 전분기 중 발생한 보상원가의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 비용으로 인식한 보상원가 | 2,352,787 | 2,334,111 |
| 판매비와관리비 | 1,414,120 | 959,668 |
| 경상연구개발비 | 929,251 | 1,374,443 |
| 용역매출원가 | 9,416 | - |
| 당분기와 전분기 이후 비용으로 인식할 보상원가 | 6,789,517 | 5,356,461 |
29. 결손금
보고기간종료일 현재 결손금의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 과 목 | 당분기말 | 전기말 |
|---|---|---|
| 미처리결손금 | 183,830,269 | 164,267,254 |
30. 수익
당분기 및 전분기 중 포괄손익계산서에 표시된 매출액의 구성 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 기술이전으로 인한 수익 | - | 9,701,600 | - | 29,954,729 |
| 용역의 제공으로 인한 수익 | 2,392,430 | 4,124,579 | 246,967 | 4,761,757 |
| 기타 수익 | - | 4,720 | 240 | 135,528 |
| 합 계 | 2,392,430 | 13,830,899 | 247,207 | 34,852,014 |
31. 비용의 성격별 분류
당분기 및 전분기 중 발생한 비용의 성격별 분류는 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 종업원급여 | 7,952,102 | 8,421,391 |
| 감가상각비 및 무형자산상각비 | 3,537,573 | 2,174,920 |
| 주식보상비용 | 2,352,787 | 2,334,111 |
| 세금과공과 | 1,884,216 | 4,839,180 |
| 연구재료 및 용역비 | 13,628,274 | 18,796,636 |
| 지급수수료 | 2,305,170 | 2,036,448 |
| 기타 | 2,461,454 | 1,619,339 |
| 매출원가 및 판매비와관리비의 합계 | 34,121,576 | 40,222,025 |
32. 판매비와관리비
당분기 및 전분기 중 판매비와관리비의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 1,349,911 | 4,030,665 | 1,088,007 | 3,107,439 |
| 퇴직급여 | 138,995 | 416,984 | 118,823 | 344,274 |
| 복리후생비 | 308,957 | 830,123 | 289,178 | 771,254 |
| 여비교통비 | 76,455 | 167,785 | 1,262 | 10,902 |
| 세금과공과 | 350,680 | 1,861,051 | 221,459 | 4,799,437 |
| 접대비 | 27,209 | 107,959 | 79,437 | 138,636 |
| 임차료 | - | 1,855 | 7,006 | 28,578 |
| 대손상각비(환입) | 16,475 | 37,044 | (4,000) | (10,100) |
| 감가상각비 | 359,303 | 1,076,732 | 231,805 | 694,187 |
| 경상연구개발비 | 4,642,419 | 17,712,390 | 5,014,908 | 22,786,494 |
| 차량유지비 | 22,875 | 60,743 | 16,405 | 49,580 |
| 지급수수료 | 486,384 | 1,529,113 | 421,344 | 1,209,024 |
| 자문료 | - | - | - | 3,000 |
| 기술료 | - | - | - | 541,638 |
| 보험료 | 25,630 | 76,249 | 18,468 | 44,362 |
| 주식보상비용 | 544,656 | 1,414,120 | 313,741 | 959,668 |
| 무형자산상각비 | 51,969 | 160,377 | 56,062 | 192,225 |
| 기타판매비와관리비 | 454,773 | 1,637,755 | 206,011 | 729,323 |
| 합 계 | 8,856,691 | 31,120,945 | 8,079,916 | 36,399,921 |
33. 기타수익과 기타비용
(1) 당분기 및 전분기 중 기타수익의 구성 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 수입임대료 | 103,475 | 313,823 | 144,108 | 423,432 |
| 외환차익 | 214,460 | 278,636 | 20,236 | 691,915 |
| 외화환산이익 | 1,532,804 | 2,689,818 | 375,579 | 511,240 |
| 당기손익금융자산처분이익 | 92,626 | 377,560 | - | 498 |
| 당기손익금융자산평가이익 | - | - | 20,639 | 345,280 |
| 유형자산처분이익 | 15,060 | 33,167,321 | - | 1,740 |
| 기타의대손상각비환입 | - | - | 108,912 | 273,912 |
| 잡이익 | 160,929 | 643,683 | 847,072 | 1,096,283 |
| 합 계 | 2,119,354 | 37,470,841 | 1,516,546 | 3,344,300 |
(2) 당분기 및 전분기 중 기타비용의 구성 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차손 | 434,013 | 480,105 | 57,588 | 247,746 |
| 외화환산손실 | 2,461 | 3,228 | (148,754) | 534,538 |
| 당기손익금융자산처분손실 | - | - | 1,420,663 | 1,985,810 |
| 당기손익금융자산평가손실 | 42,231 | 510,529 | (504,853) | 1,988,608 |
| 유형자산처분손실 | - | 26,896 | - | 7,314 |
| 기부금 | 50,000 | 550,000 | - | 621,100 |
| 잡손실 | 24,104 | 172,928 | - | 139,417 |
| 합 계 | 552,809 | 1,743,686 | 824,644 | 5,524,533 |
34. 금융수익 및 금융비용
당분기 및 전분기 중 금융수익 및 금융비용의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 금융수익 | ||||
| 이자수익 | 53,714 | 153,167 | 153,024 | 178,100 |
| 파생상품평가이익 | 51,015 | 99,513 | 39,098 | 68,888 |
| 리스부채상환이익 | - | 11,232 | - | 5,682 |
| 금융수익 합계 | 104,729 | 263,912 | 192,122 | 252,670 |
| 금융비용 | ||||
| 이자비용 | 864,047 | 2,303,894 | 15,642 | 78,109 |
| 파생상품평가손실 | 367,411 | 1,563,404 | 850,932 | 2,138,744 |
| 리스부채상환손실 | - | 4,641 | - | - |
| 금융비용 합계 | 1,231,458 | 3,871,939 | 866,574 | 2,216,853 |
35. 법인세비용
연결회사는 최근 사업연도까지 지속적 적자 발생 및 결손금 누적으로 법인세 부담액이 없으며, 또한 가까운 장래에 이연법인세자산이 실현될 만큼 충분한 과세소득이 발생할 것으로 기대하지 아니하여 이연법인세자산을 인식하지 않고 있습니다.
36. 주당손익
(1) 당분기와 전분기 중 기본주당손익의 계산내역은 다음과 같습니다.
| (단위 : 원,주) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 지배회사지분 분기순이익(손실) | (18,788,557,397) | (17,609,193,350) | (16,304,207,962) | (15,092,944,994) |
| 가중평균 유통보통주식수 | 25,142,960 | 25,095,186 | 25,009,595 | 24,892,453 |
| 기본주당이익(손실) | (747) | (702) | (652) | (606) |
(2) 당분기 및 전분기 중 희석주당손익의 계산내역은 다음과 같습니다.
연결회사가 보유하고 있는 희석성 잠재적보통주는 전환사채, 주식매입선택권이 있으며, 희석주당손익은 모든 희석성 잠재적보통주가 보통주로 전환된다고 가정하여 조정한 가중평균 유통보통주식수를 적용하여 산정하고 있습니다.
| (단위 : 원,주) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 지배회사지분 분기순이익(손실) | (18,788,557,397) | (17,609,193,350) | (16,304,207,962) | (15,092,944,994) |
| 조정사항(주1) | - | - | - | - |
| 희석효과반영 보통주분기순이익(손실) | (18,788,557,397) | (17,609,193,350) | (16,304,207,962) | (15,092,944,994) |
| 희석효과반영 가중평균 유통보통주식수 | 25,142,960 | 25,095,186 | 25,009,595 | 24,892,453 |
| 희석주당이익(손실) | (747) | (702) | (652) | (606) |
| (주1) 당분기와 전분기 중 희석성 잠재적보통주에 의한 희석효과가 없어 반영하지 아니하였습니다. |
37. 담보제공 및 약정사항 등
(1) 보고기간종료일 현재 연결회사의 금융거래 약정사항은 다음과 같습니다.
| (단위 : 천원) |
| 금융기관 | 차입약정내용 | 당분기말 | 전기말 | ||
|---|---|---|---|---|---|
| 약정한도액 | 실행액 | 약정한도액 | 실행액 | ||
| 기업은행 | 시설자금대출 | 10,000,000 | 10,000,000 | 10,000,000 | 10,000,000 |
| 시설자금대출 | 20,000,000 | 20,000,000 | 20,000,000 | 20,000,000 | |
| 시설자금대출 | 20,000,000 | 17,900,000 | 20,000,000 | 8,600,000 | |
| 운전자금대출 | 10,000,000 | 10,000,000 | - | - | |
| 하나은행 | 운전자금대출 | 10,000,000 | 5,000,000 | - | - |
| 합 계 | 70,000,000 | 62,900,000 | 50,000,000 | 38,600,000 | |
(2) 보고기간종료일 현재 연결회사의 채무를 위하여 담보로 제공되어 있는 자산의내역은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 담보제공자산 | 장부금액 | 담보설정금액 | 관련 채무 | 채무금액 | 담보권자 |
|---|---|---|---|---|---|
| 마곡 토지 | 22,136,915 | 60,000,000 | 단기차입금 | 10,000,000 | 기업은행 |
| 마곡 사옥 | 63,833,827 | 장기차입금 | 20,000,000 | 기업은행 | |
| 장기차입금 | 17,900,000 | 기업은행 | |||
| 단기차입금 | 10,000,000 | 기업은행 | |||
| 12,000,000 | 단기차입금 | 5,000,000 | 하나은행 | ||
| I-Mab 주식(주1) | 1,726,064 | 1,726,064 | - | - | 한미약품 |
| (주1) 연결회사는 한미약품과 체결한 GX-19N의 제조위수탁계약과 관련하여 발생하는 채무를 담보하기 위하여 I-Mab 주식 30만 ADR을 담보로 제공하였습니다. |
| <전기말> | (단위 : 천원) |
| 담보제공자산 | 장부금액 | 담보설정금액 | 관련 채무 | 채무금액 | 담보권자 |
|---|---|---|---|---|---|
| 분양 토지(토지) | 19,418,470 | 13,000,000 | 단기차입금 | 10,000,000 | 기업은행 |
| 판교 사옥 | 16,591,685 | 60,000,000 | 장기차입금 | 20,000,000 | 기업은행 |
| 장기차입금 | 8,600,000 | 기업은행 | |||
| I-Mab 주식(주1) | 16,854,254 | 16,854,254 | - | - | 한미약품 |
| (주1) 연결회사는 한미약품과 체결한 GX-19N의 제조위수탁계약과 관련하여 발생하는 채무를 담보하기 위하여 I-Mab 주식 30만 ADR을 담보로 제공하였습니다. |
(3) 보고기간종료일 현재 연결회사가 타인으로부터 제공받은 지급보증의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 지급보증제공자 | 보증내용 | 보증한도 | |
|---|---|---|---|
| 당분기말 | 전기말 | ||
| 서울보증보험 | 이행보증 | 927,119 | 927,119 |
(4) 보고기간종료일 현재 연결회사가 가입한 보험내역은 다음과 같습니다.
| (단위 : 천원) |
| 보험종류 | 보험사 | 부보금액 | 부보내역 | |
|---|---|---|---|---|
| 당분기말 | 전기말 | |||
| 재산종합보험 | 롯데손해보험 | 12,030,000 | 12,030,000 | 본사사옥 재물위험담보_시설, 기계, 차량, 집기비품 등 |
| 환경책임보험 | DB손해보험 | 5,000,000 | 5,000,000 | 본사사옥 환경오염 배상책임_수질오염 |
| 재산종합보험 | 흥국화재해상보험 | 96,143,423 | 96,143,423 | 마곡사옥 재물위험담보_시설, 기계, 집기비품 등 |
연결회사는 상기 보험 이외에 업무용자동차보험, 임상시험배상책임보험, 임직원단체상해보험, 임원배상책임보험 등에 가입하고 있습니다.
(5) 마곡산업단지 토지 취득과 관련하여 서울주택도시공사로부터 1,451,653천원의 기부채납 이행 요청을 받았으나 연결회사는 이에 불복하여 소송 진행 중에 있으며, 또한 코스온 투자전환사채 5,000,000천원 관련하여 연결회사가 담보 목적으로 설정한 근저당권에 대한 취소 소송이 제기되어 있습니다. 당분기말 현재 상기 소송사건의결과는 예측할 수 없습니다.
38. 특수관계자 거래
(1) 당분기 및 전분기 중 특수관계자 현황은 다음과 같습니다.
| 특수관계구분 | 당분기 | 전분기 |
|---|---|---|
| 관계기업 | 아지노모도제넥신(주) | 아지노모도제넥신(주) |
| 관계기업 | (주)툴젠 | (주)툴젠 |
| 관계기업 | (주)큐로젠 | - |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | NIT (NeoImmuneTech, Inc.) |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | Simnogen (Simnogen Biotech Co. Ltd) |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | KG-Bio (PT Kalbe-Genexine Biologics) |
| 공동기업 | ILKOGEN | ILKOGEN |
| 공동기업 | Rezolute, Inc. | Rezolute, Inc. |
| 공동기업 | CoImmune, Inc. | CoImmune, Inc. |
| 공동기업 | KinGen Biotech | KinGen Biotech |
| 기타특수관계자 | ㈜한독 | ㈜한독 |
| 기타특수관계자 | ㈜에스엘바이젠 | ㈜에스엘바이젠 |
(2) 당분기 및 전분기 중 특수관계자 거래 내역은 다음과 같습니다.
| (단위 : 천원) |
| 특수관계자 구분 | 특수관계자명 | 당분기 | 전분기 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 매출 | 기타수익 | 자산매입 | 기타비용 | 매출 | 기타수익 | 자산매입 | 기타비용 | ||
| 관계기업 | NIT | 1,319,820 | 104,002 | - | 136,121 | 967,643 | 44,617 | - | - |
| 관계기업 | KG-Bio | 9,701,600 | - | - | - | 29,911,246 | - | - | - |
| 공동기업 | KinGen Biotech | - | - | 185,965 | - | - | - | 743,013 | |
| 기타특수관계자 | ㈜한독 | - | - | - | 1,598 | - | 121,861 | - | 68,845 |
| 기타특수관계자 | ㈜에스엘바이젠 | - | - | - | - | - | - | 100,000 | - |
(3) 당분기 및 전분기 중 특수관계자와의 자금거래 내역은 다음과 같습니다.
| (단위 : 천원) |
| 특수관계자 구분 | 특수관계자명 | 당분기 | 전분기 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 자금대여 | 자금차입 | 현금출자 | 출자회수 | 자금대여 | 자금차입 | 현금출자 | 출자회수 | ||
| 관계기업 | 아지노모도제넥신(주) | - | - | - | 433,751 | - | - | - | - |
| 관계기업 | KG-Bio | - | - | - | - | - | - | 20,025,000 | - |
| 공동기업 | KinGen Biotech | - | - | - | - | - | - | 1,098,153 | - |
(4) 보고기간종료일 현재 특수관계자에 대한 채권ㆍ채무잔액은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 특수관계구분 | 특수관계자명 | 채권 | 채무 | ||||
|---|---|---|---|---|---|---|---|
| 매출채권 | 미수금 | 선급금 | 미지급금 | 예수금 | 임대보증금 | ||
| 관계기업 | 툴젠 | - | 22,966 | - | - | - | - |
| 관계기업 | 큐로젠 | - | 1,041 | - | - | - | - |
| 관계기업 | NIT | 23,563 | 678,591 | 658,037 | 1,608 | - | - |
| 관계기업 | KG-Bio | 9,756,640 | 51,097 | 282,015 | - | - | - |
| 공동기업 | KinGen Biotech | 358,700 | - | - | - | - | - |
| 기타특수관계자 | ㈜한독 | - | 3,382 | 52,292 | 344 | - | - |
| <전기말> | (단위 : 천원) |
| 특수관계구분 | 특수관계자명 | 채권 | 채무 | ||||
|---|---|---|---|---|---|---|---|
| 매출채권 | 미수금 | 선급금 | 미지급금 | 예수금 | 임대보증금 | ||
| 관계기업 | NIT | 163,031 | 212,475 | 364,238 | - | - | - |
| 관계기업 | KG-Bio | - | 306,661 | 425,370 | - | - | - |
| 공동기업 | KinGen Biotech | 296,375 | - | - | - | - | - |
| 기타특수관계자 | ㈜한독 | - | 59,090 | 80,800 | - | 130,686 | 105,420 |
(5) 당분기 및 전분기 중 주요 경영진에 대한 보상내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급여 | 846,243 | 709,092 |
| 퇴직급여 | 138,368 | 129,930 |
| 주식보상비용 | 722,192 | 43,546 |
| 합 계 | 1,706,803 | 882,568 |
주요 경영진은 연결회사의 활동의 계획ㆍ운영ㆍ통제에 대한 중요한 권한과 책임을 가진 이사(비상임포함) 및 감사가 포함되어 있습니다.
39. 현금흐름표
(1) 당분기 및 전분기 중 영업으로부터 창출된 현금흐름의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 분기순이익(손실) | (18,124,739) | (15,513,083) |
| 수익/비용의 조정 | 1,984,174 | 14,255,576 |
| 이자비용 | 2,303,894 | 78,109 |
| 감가상각비 | 2,904,592 | 1,658,754 |
| 무형자산상각비 | 353,106 | 516,416 |
| 투자부동산상각비 | 46,906 | - |
| 퇴직급여등 | 615,336 | 811,932 |
| 주식보상비용 | 2,352,787 | 2,334,111 |
| 외화환산손실 | 3,229 | 534,538 |
| 당기손익금융자산평가손실 | 510,529 | 1,988,608 |
| 당기손익금융자산처분손실 | - | 1,985,810 |
| 파생상품평가손실 | 1,563,404 | 2,138,744 |
| 관계기업투자주식처분손실 | 11,184 | 827,559 |
| 관계기업투자주식손상차손 | 2,542,527 | - |
| 지분법손실 | 28,670,839 | 27,890,102 |
| 유형자산처분손실 | 26,896 | 7,314 |
| 리스부채상환손실 | 4,641 | - |
| 대손상각비 | 37,044 | - |
| 기타손실 | 246,634 | (1,980,544) |
| 이자수익 | (153,167) | (178,100) |
| 외화환산이익 | (2,689,818) | (511,240) |
| 당기손익금융자산평가이익 | - | (345,280) |
| 당기손익금융자산처분이익 | (377,560) | (498) |
| 파생상품평가이익 | (99,513) | (68,887) |
| 관계기업투자주식처분이익 | (36,697) | (20,803,660) |
| 지분법이익 | (1,234,663) | (1,915,346) |
| 유형자산처분이익 | (33,167,322) | (1,740) |
| 대손상각비환입 | - | (284,012) |
| 기타이익 | (2,450,634) | (427,114) |
| 영업활동으로 인한 자산부채의 변동 | (14,581,160) | (17,386,512) |
| 매출채권의 감소(증가) | (6,474,554) | (844,314) |
| 기타채권의 감소(증가) | 145,334 | 1,442,757 |
| 당기법인세자산의 감소(증가) | (44,190) | (35,407) |
| 기타유동자산의 감소(증가) | (5,383,010) | (11,438,899) |
| 기타비유동자산의 감소(증가) | 323,842 | 534,853 |
| 기타채무의 증가(감소) | (4,734,196) | (9,763,718) |
| 기타유동부채의 증가(감소) | 1,442,044 | 1,739,038 |
| 순확정급여부채의 증가(감소) | 153,938 | 102,407 |
| 기타비유동부채의 증가(감소) | (10,368) | 876,771 |
| 영업으로부터 창출된 현금 | (30,721,725) | (18,644,019) |
(2) 당분기와 전분기 중 연결회사의 재무활동에서 생기는 부채의 변동은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구 분 | 기초 | 재무활동현금흐름 | 대체 | 기말 |
|---|---|---|---|---|
| 전환사채 | 13,249,757 | - | 1,390,163 | 14,639,920 |
| 차입금 | 38,600,000 | 24,300,000 | - | 62,900,000 |
| 리스부채 | 368,580 | (184,565) | 62,212 | 246,227 |
| 임대보증금 | 6,500,000 | - | (129,971) | 6,370,029 |
| 합 계 | 58,718,337 | 24,115,435 | 1,322,404 | 84,156,176 |
| <전분기> | (단위 : 천원) |
| 구 분 | 기초 | 재무활동현금흐름 | 대체 | 기말 |
|---|---|---|---|---|
| 전환사채 | 11,596,123 | - | 1,215,706 | 12,811,829 |
| 차입금 | 15,200,000 | 17,800,000 | - | 33,000,000 |
| 리스부채 | 358,590 | (137,409) | 140,060 | 361,241 |
| 임대보증금 | - | 6,803,125 | - | 6,803,125 |
| 합 계 | 27,154,713 | 24,465,716 | 1,355,766 | 52,976,195 |
(3) 당분기와 전분기 중 현금의 유ㆍ출입이 없는 중요한 거래는 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 토지와 건물의 투자부동산 대체 | 3,087,669 | - |
| 장기차입금의 유동성 대체 | 588,220 | - |
| 기타포괄손익금융자산의 관계기업투자 대체 | - | 3,000,180 |
40. 영업부문 정보
(1) 연결회사의 보고부문은 단일의 영업부문으로 구성되어 있으며, 영업부문은 최고영업의사결정자에게 보고되는 내부 보고자료와 동일한 방법으로 보고되고 있습니다.
(2) 당분기 및 전분기 중 지역별 매출액은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 국 내 | 950,961 | 1,454,621 |
| 아시아 | 9,701,600 | 29,917,155 |
| 미 주 | 3,178,338 | 3,480,238 |
| 합 계 | 13,830,899 | 34,852,014 |
(3) 당분기 및 전분기 중 연결회사의 매출액의 10%이상을 차지하는 주요 고객 및 당해 고객으로부터의 매출액은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| A사 | 9,701,600 | 29,911,246 |
| 합 계 | 9,701,600 | 29,911,246 |
4. 재무제표
|
재무상태표 |
|
제 24 기 3분기말 2022.09.30 현재 |
|
제 23 기말 2021.12.31 현재 |
|
(단위 : 원) |
|
제 24 기 3분기말 |
제 23 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
53,405,300,858 |
50,362,747,239 |
|
현금및현금성자산 |
22,634,095,184 |
21,376,196,622 |
|
매출채권 및 기타채권 |
11,020,263,286 |
2,345,684,535 |
|
파생상품자산 |
899,999 |
184,899,999 |
|
기타유동자산 |
19,705,282,780 |
12,974,835,275 |
|
당기법인세자산 |
44,759,609 |
43,989,810 |
|
매각예정비유동자산 |
0 |
13,437,140,998 |
|
비유동자산 |
395,045,617,222 |
585,947,907,085 |
|
당기손익금융자산 |
12,426,791,600 |
13,024,576,122 |
|
기타포괄손익금융자산 |
48,270,263,721 |
241,771,747,741 |
|
관계기업및공동기업투자 |
205,711,980,705 |
208,880,740,865 |
|
종속기업투자 |
10,642,000,000 |
10,642,000,000 |
|
투자부동산 |
3,040,762,768 |
0 |
|
유형자산 |
111,079,920,554 |
107,338,484,284 |
|
무형자산 |
2,825,074,883 |
3,270,505,902 |
|
기타장기채권 |
127,425,795 |
286,391,052 |
|
기타비유동자산 |
921,397,196 |
733,461,119 |
|
자산총계 |
448,450,918,080 |
636,310,654,324 |
|
부채 |
||
|
유동부채 |
40,758,486,682 |
59,344,873,222 |
|
매입채무 및 기타채무 |
13,031,799,543 |
23,924,872,188 |
|
단기차입금 |
25,588,220,000 |
10,000,000,000 |
|
전환사채 |
1,354,595,736 |
1,200,188,396 |
|
파생상품부채 |
334,751,676 |
393,100,260 |
|
리스부채 |
113,774,554 |
168,086,016 |
|
기타유동부채 |
335,345,173 |
23,658,626,362 |
|
비유동부채 |
66,343,520,366 |
54,214,363,758 |
|
장기차입금 |
37,311,780,000 |
28,600,000,000 |
|
전환사채 |
13,166,354,958 |
11,945,624,929 |
|
파생상품부채 |
5,743,517,473 |
4,405,277,473 |
|
리스부채 |
104,243,632 |
131,719,090 |
|
종업원급여부채 |
1,340,438,472 |
441,899,519 |
|
기타장기채무 |
8,378,631,907 |
8,295,849,454 |
|
기타비유동부채 |
298,553,924 |
393,993,293 |
|
부채총계 |
107,102,007,048 |
113,559,236,980 |
|
자본 |
||
|
납입자본 |
578,061,825,809 |
574,865,609,039 |
|
보통주자본금 |
12,572,491,000 |
12,514,566,000 |
|
자본잉여금 |
565,489,334,809 |
562,351,043,039 |
|
기타자본구성요소 |
(85,104,279,117) |
106,331,366,251 |
|
이익잉여금(결손금) |
(151,608,635,660) |
(158,445,557,946) |
|
자본총계 |
341,348,911,032 |
522,751,417,344 |
|
자본과부채총계 |
448,450,918,080 |
636,310,654,324 |
|
포괄손익계산서 |
|
제 24 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
(단위 : 원) |
|
제 24 기 3분기 |
제 23 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출 |
2,373,713,064 |
13,584,466,362 |
993,206,634 |
35,598,013,622 |
|
매출원가 |
1,900,910,153 |
2,802,648,554 |
47,994,818 |
3,584,612,960 |
|
매출총이익 |
472,802,911 |
10,781,817,808 |
945,211,816 |
32,013,400,662 |
|
판매비와관리비 |
10,724,268,193 |
31,374,173,547 |
9,560,733,920 |
37,157,206,254 |
|
영업이익(손실) |
(10,251,465,282) |
(20,592,355,739) |
(8,615,522,104) |
(5,143,805,592) |
|
기타수익 |
2,128,007,376 |
37,934,940,592 |
(178,675,253) |
3,689,754,420 |
|
기타비용 |
998,961,988 |
4,911,744,723 |
9,581,359,240 |
14,281,248,290 |
|
금융수익 |
95,213,559 |
234,755,963 |
181,578,998 |
224,799,823 |
|
금융비용 |
1,231,458,012 |
3,867,297,998 |
861,725,018 |
2,203,302,898 |
|
법인세비용차감전순이익(손실) |
(10,258,664,347) |
8,798,298,095 |
(19,055,702,617) |
(17,713,802,537) |
|
법인세비용 |
0 |
0 |
0 |
0 |
|
당기순이익(손실) |
(10,258,664,347) |
8,798,298,095 |
(19,055,702,617) |
(17,713,802,537) |
|
기타포괄손익 |
(33,564,905,077) |
(194,506,860,443) |
(38,089,873,341) |
127,905,381,602 |
|
후속적으로 당기손익으로 재분류되지 않는 항목 |
||||
|
기타포괄손익금융자산평가손익 |
(33,564,905,077) |
(194,506,860,443) |
(38,089,873,341) |
127,905,381,602 |
|
확정급여제도의 재측정요소 |
0 |
0 |
0 |
0 |
|
총포괄손익 |
(43,823,569,424) |
(185,708,562,348) |
(57,145,575,958) |
110,191,579,065 |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(408) |
351 |
(762) |
(712) |
|
희석주당이익(손실) (단위 : 원) |
(408) |
351 |
(762) |
(712) |
|
자본변동표 |
|
제 24 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
(단위 : 원) |
|
자본 |
|||||
|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본항목 |
미처분이익잉여금(미처리결손금) |
자본 합계 |
|
|
2021.01.01 (기초자본) |
12,348,887,000 |
551,193,218,287 |
135,542,815,738 |
(144,795,858,499) |
554,289,062,526 |
|
당기순이익(손실) |
0 |
0 |
0 |
(17,713,802,537) |
(17,713,802,537) |
|
기타포괄손익금융자산평가손익 |
0 |
0 |
127,905,381,602 |
0 |
127,905,381,602 |
|
기타포괄손익금융자산처분손익 |
0 |
0 |
(37,453,653,493) |
37,453,653,493 |
0 |
|
주식선택권 발행 및 행사 |
165,379,000 |
11,140,674,027 |
(1,477,447,544) |
9,828,605,483 |
|
|
2021.09.30 (기말자본) |
12,514,266,000 |
562,333,892,314 |
224,517,096,303 |
(125,056,007,543) |
674,309,247,074 |
|
2022.01.01 (기초자본) |
12,514,566,000 |
562,351,043,039 |
106,331,366,251 |
(158,445,557,946) |
522,751,417,344 |
|
당기순이익(손실) |
0 |
0 |
0 |
8,798,298,095 |
8,798,298,095 |
|
기타포괄손익금융자산평가손익 |
0 |
0 |
(194,506,860,443) |
0 |
(194,506,860,443) |
|
기타포괄손익금융자산처분손익 |
0 |
0 |
1,961,375,809 |
(1,961,375,809) |
0 |
|
주식선택권 발행 및 행사 |
57,925,000 |
3,138,291,770 |
1,109,839,266 |
0 |
4,306,056,036 |
|
2022.09.30 (기말자본) |
12,572,491,000 |
565,489,334,809 |
(85,104,279,117) |
(151,608,635,660) |
341,348,911,032 |
|
현금흐름표 |
|
제 24 기 3분기 2022.01.01 부터 2022.09.30 까지 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
(단위 : 원) |
|
제 24 기 3분기 |
제 23 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(31,434,729,342) |
(17,589,978,311) |
|
영업활동으로 창출된 현금흐름 |
(31,295,519,169) |
(17,493,128,769) |
|
이자수취 |
254,689,931 |
38,731,923 |
|
배당금수취 |
433,750,706 |
0 |
|
이자지급 |
(871,620,190) |
(301,471,584) |
|
법인세납부(환급) |
43,969,380 |
165,890,119 |
|
투자활동현금흐름 |
5,439,320,280 |
1,883,590,164 |
|
투자활동으로 인한 현금유입액 |
76,112,473,384 |
81,875,858,189 |
|
당기손익금융자산의 처분 |
51,464,815,387 |
13,499,882,622 |
|
기타포괄손익금융자산의 처분 |
317,553,285 |
55,071,858,655 |
|
유형자산의 처분 |
24,063,280,455 |
13,022,175,000 |
|
대여금의 감소 |
0 |
273,911,912 |
|
보증금의 감소 |
66,824,257 |
8,030,000 |
|
시설이용권의 처분 |
200,000,000 |
0 |
|
투자활동으로 인한 현금유출액 |
(70,673,153,104) |
(79,992,268,025) |
|
당기손익금융자산의 취득 |
51,000,000,000 |
1,600,800,000 |
|
기타포괄손익금융자산의 취득 |
1,322,167,606 |
12,166,608,580 |
|
관계/공동/종속기업투자의 증가 |
0 |
37,622,230,148 |
|
유형자산의 취득 |
17,918,196,884 |
27,832,022,065 |
|
무형자산의 취득 |
27,068,264 |
563,541,916 |
|
보증금의 증가 |
405,720,350 |
207,065,316 |
|
재무활동현금흐름 |
26,142,725,233 |
31,657,084,881 |
|
재무활동으로 인한 현금유입액 |
26,281,210,000 |
31,794,494,100 |
|
주식선택권의 행사 |
1,981,210,000 |
7,494,494,100 |
|
차입금의 증가 |
24,300,000,000 |
17,800,000,000 |
|
임대보증금의 증가 |
0 |
6,500,000,000 |
|
재무활동으로 인한 현금유출액 |
(138,484,767) |
(137,409,219) |
|
리스부채의 상환 |
138,484,767 |
137,409,219 |
|
현금및현금성자산의순증가(감소) |
147,316,171 |
15,950,696,734 |
|
기초현금및현금성자산 |
21,376,196,622 |
5,186,966,852 |
|
현금및현금성자산에 대한 환율변동효과(1) |
1,110,582,391 |
(45,965,131) |
|
기말현금및현금성자산 |
22,634,095,184 |
21,091,698,455 |
5. 재무제표 주석
| 제 24(당) 기 분기 2022년 9월 30일 현재 |
| 제 23(전) 기 2021년 12월 31일 현재 |
| 주식회사 제넥신 |
1. 당사의 개요
주식회사 제넥신(이하 "당사")은 1999년 7월 1일 설립되어, 유전공학방식을 이용한 신약 연구개발과 관련 신기술의 사용권 양도 및 대여 등을 주요사업으로 영위하고 있습니다. 당사는 서울특별시 강서구 마곡중앙로 172 바이오이노베이션파크에 본사와 기술개발을 위한 연구시설을 두고 있습니다. 한편 당사의 보통주식은 2009년 9월 15일자로 한국거래소 코스닥시장에 상장되었습니다.
당분기말 현재 당사의 자본금은 보통주 12,572,491천원이며, 주요 주주현황은 다음과같습니다.
| 주 주 명 | 소유주식수(주) | 지 분 율(%) |
|---|---|---|
| ㈜한독 | 3,781,017 | 15.04 |
| 성영철 외 특수관계자 | 1,763,981 | 7.02 |
| 기타 | 19,599,984 | 77.94 |
| 합 계 | 25,144,982 | 100.00 |
2. 재무제표 작성기준 및 중요한 회계정책
가. 회계기준의 적용
당사의 분기재무제표는 한국채택국제회계기준에 따라 작성되는 중간재무제표입니다. 동 재무제표는 기업회계기준서 제1034호(중간재무보고)에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석은 직전 연차보고기간말 후 발생한 당사의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다.
이 분기재무제표는 보고기간말인 2022년 9월 30일 현재 유효한 한국채택국제회계기준에 따라 작성되었습니다. 따라서 2022년 12월 31일 한국채택국제회계기준에 따른 재무제표를 작성하는 시점에 유효한 한국채택국제회계기준 및 선택사항 적용여부에 따라 변경될 수 있습니다.
중간재무제표의 작성에 적용된 중요한 회계정책은 2021년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다. 한편, 당분기가 속하는 회계연도부터 새로 도입된 기준서 및 해석서와 그로 인한 회계정책 변경의 내용은 다음과 같으며, 이로 인하여 재무제표에 미치는 유의적인 영향은 없습니다.
(1) 당사가 채택한 제ㆍ개정 기준서
당사는 2022년 1월 1일로 개시하는 회계기간부터 다음의 개정 기준서를 신규로 적용하였습니다.
① 기업회계기준서 제1103호 '사업결합’개정 - 개념체계의 인용
인식할 자산과 부채의 정의를 개정된 재무보고를 위한 개념체계를 참조하도록 개정되었으나, 기업회계기준서 제1037호 ‘충당부채, 우발부채 및 우발자산’ 및 해석서 제2121호 ‘부담금’의 적용범위에 포함되는 부채 및 우발부채에 대해서는 해당 기준서를 적용하도록 예외를 추가하고, 우발자산이 취득일에 인식되지 않는다는 점을 명확히 하였습니다. 동 개정사항은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 재무제표에 미치는 중요한 영향은 없습니다.
② 기업회계기준서 제1016호 '유형자산’개정 - 의도한 사용 전의 매각금액
기업이 자산을 의도한 방식으로 사용하기 전에 생산된 품목의 판매에서 발생하는 수익을 생산원가와 함께 당기손익으로 인식하도록 요구하며, 유형자산의 취득원가에서차감하는 것을 금지하고 있습니다. 동 개정사항은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 재무제표에 미치는 중요한 영향은 없습니다.
③ 기업회계기준서 제1037호 '충당부채, 우발부채 및 우발자산’개정 - 손실부담계약: 계약이행원가
손실부담계약을 식별할 때 계약이행원가의 범위를 계약 이행을 위한 증분원가와 계약 이행에 직접 관련되는 다른 원가의 배분이라는 점을 명확히 하였습니다. 동 개정사항은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 재무제표에 미치는 중요한 영향은 없습니다.
④ 기업회계기준서 제 1116호 '리스' 개정 - 2021년 6월 30일 후에도 제공되는 코로나19 관련 임차료 할인 등
코로나19의 직접적인 결과로 발생한 임차료 할인 등(rent concession)이 리스변경에해당하는지 평가하지 않을 수 있도록 하는 실무적 간편법의 적용대상이 2022년 6월 30일 이전에 지급하여야 할 리스료에 영향을 미치는 리스료 감면으로 확대되었습니다. 리스이용자는 비슷한 상황에서 특성이 비슷한 계약에 실무적 간편법을 일관되게 적용해야 합니다. 동 개정사항은 2021년 4월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 재무제표에 미치는 중요한 영향은 없습니다.
⑤ 한국채택국제회계기준 연차개선 2018-2020
한국채택국제회계기준 연차개선 2018-2020은 2022년 1월 1일 이후 시작하는 회계연도부터 적용되며, 동 개정으로 인해 재무제표에 미치는 중요한 영향은 없습니다.
·기업회계기준서 제1101호 '한국채택국제회계기준의 최초 채택’: 최초채택기업인 종속기업
·기업회계기준서 제1109호 '금융상품’: 금융부채 제거 목적의 10% 테스트 관련 수수료
·기업회계기준서 제1116호 '리스’: 리스 인센티브
·기업회계기준서 제1041호 '농립어업’: 공정가치 측정
(2) 회사가 적용하지 않은 제ㆍ개정 기준서 및 해석서
제정 또는 공표되었으나 시행일이 도래하지 않아 적용하지 아니한 제ㆍ개정 기준서 및 해석서는 다음과 같습니다.
① 기업회계기준서 제1001호 ‘재무제표 표시’개정 - 부채의 유동/비유동 분류
보고기간말 현재 존재하는 실질적인 권리에 따라 유동 또는 비유동으로 분류되며, 부채의 결제를 연기할 수 있는 권리의 행사가능성이나 경영진의 기대는 고려하지 않습니다. 또한, 부채의 결제에 자기지분상품의 이전도 포함되나, 복합금융상품에서 자기지분상품으로 결제하는 옵션이 지분상품의 정의를 충족하여 부채와 분리하여 인식된경우는 제외됩니다. 동개정사항은 2023년 1월 1일 이후 시작하는 회계연도부터 적용하며, 조기적용이 허용됩니다. 당사는 동 개정으로 인한 재무제표의 영향을 검토 중에 있습니다.
② 기업회계기준서 제1001호 ‘재무제표 표시’ - '회계정책'의 공시
중요한 회계정책을 정의하고 공시하도록 하며, 중요성 개념을 적용하는 방법에 대한 지침을 제공하기 위하여 국제회계기준 실무서 2 '회계정책 공시'를 개정하였습니다.
동 개정 사항은 2023년 1월 1일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다. 당사는 동 개정으로 인한 재무제표의 영향을 검토 중에 있습니다.
③ 기업회계기준서 제1008호 '회계정책, 회계추정의 변경 및 오류' - '회계추정'의 정의
회계추정을 정의하고, 회계정책의 변경과 구별하는 방법을 명확히 하였습니다. 동 개정 사항은 2023년 1월 1일 이후 최초로 시작하는 회계연도부터 적용되며 조기적용이 허용됩니다. 당사는 동 개정으로 인해 재무제표에 중요한 영향은 없을 것으로 예상하고 있습니다.
④ 기업회계기준서 제1012호 '법인세' - 단일거래에서 생기는 자산과 부채에 대한 이연법인세
자산 또는 부채가 최초로 인식되는 거래의 최초 인식 예외 요건에 거래시점 동일한 가산할 일시적차이와 차감할 일시적차이를 발생시키지 않는 거래라는 요건을 추가하였습니다. 동 개정사항은 2023년 1월 1일 이후 시작하는 회계연도부터 적용하며, 조기적용이 허용됩니다. 당사는 동 개정으로 인해 재무제표에 중요한 영향은 없을 것으로 예상하고 있습니다.
나. 종속기업, 관계기업 및 공동기업
당사는 별도재무제표에서 종속기업, 관계기업 및 공동기업에 대한 투자를 기준서 제1027호(별도재무제표)에 따라 원가법으로 처리하고 있습니다.
또한 종속기업, 관계기업 및 공동기업 투자에 대한 객관적인 손상의 징후가 있는 경우 종속기업, 관계기업 및 공동기업 투자의 회수가능액과 장부금액과의 차이는 손상차손으로 인식됩니다.
3. 중요한 회계추정 및 가정
분기재무제표를 작성함에 있어, 경영진은 회계정책 적용과 자산ㆍ부채 및 수익ㆍ비용에 영향을 미치는 판단, 추정 및 가정을 해야 합니다. 실제 결과는 이러한 추정치와다를 수 있습니다.
분기재무제표의 작성을 위해 회계정책의 적용과 추정 불확실성의 주요원천에 대해 경영진이 내린 중요한 판단은 2021년 12월 31일로 종료하는 회계연도에 대한 연차재무제표와 동일합니다.
다만 2022년 COVID-19의 확산으로 당사의 추정 및 가정에 영향이 발생할 수 있으나, 당분기말 현재 그 영향을 합리적으로 추정할 수 없습니다.
4. 위험관리
(1) 자본위험관리
당사는 부채와 자본의 최적화를 통하여 주주이익을 극대화시키는 동시에 계속기업으로서 지속될 수 있도록 자본을 관리하고 있습니다. 당사의 전반적인 전략은 2021년과변동이 없습니다.
당사는 자본관리지표로 부채비율을 이용하고 있으며 이 비율은 총부채를 총자본으로나누어 산출하고 있으며 총부채 및 총자본은 재무제표의 금액을 기준으로 계산합니다.
당사는 외부적으로 강제된 자기자본규제의 대상은 아니며, 보고기간종료일 현재 부채비율은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 부채 | 107,102,007 | 113,559,237 |
| 자본 | 341,348,911 | 522,751,417 |
| 부채비율 | 31.38% | 21.72% |
(2) 재무위험관리
당사의 재무부문은 영업을 관리하고, 국내외 금융시장의 접근을 조직하며, 각 위험의범위와 규모를 분석한 내부위험보고서를 통하여 당사의 영업과 관련한 금융위험을 감시하고 관리하는 역할을 하고 있습니다.
이러한 위험들은 시장위험(외환위험, 이자율위험 등), 신용위험, 유동성위험을 포함하고 있습니다. 당사는 투기적 목적으로 파생금융상품을 포함한 금융상품계약을 체결하거나 거래하지 않습니다.
가. 시장위험
1) 외환위험
당사는 영업활동에 있어 외환위험, 특히 주로 달러화, 유로화 및 파운드화와 관련된 환율변동위험에 노출되어 있습니다. 외환위험은 미래예상거래, 인식된 자산 및 부채와 관련하여 발생하고 있습니다.
당사의 경영진은 기능통화에 대한 외환위험을 관리하도록 하는 정책을 수립하고 있습니다. 외환위험은 미래예상거래 및 인식된 자산, 부채가 기능통화 외의 통화로 표시될 때 발생하고 있습니다.
보고기간종료일 현재 기능통화 이외의 외화로 표시된 화폐성자산ㆍ부채의 장부금액은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 외화 | 원화환산액 | 외화 | 원화환산액 | |
| 현금및현금성자산 | ||||
| USD | 3,660,412.71 | 5,251,960 | 5,563,012.37 | 6,594,951 |
| 매출채권 | ||||
| USD | 6,816,422.57 | 9,780,203 | 644,185.15 | 763,681 |
| 미수금 | ||||
| USD | 682,765.45 | 979,632 | 445,840.49 | 528,544 |
| 외화자산합계 | 16,011,795 | 7,887,176 | ||
| 미지급금 | ||||
| USD | 99,183.97 | 142,309 | 292,354.14 | 346,586 |
| EUR | 6,500.00 | 9,157 | 1,500.00 | 2,014 |
| GBP | 21,720.41 | 34,717 | 13,035.52 | 20,860 |
| 외화부채합계 | 186,183 | 369,460 | ||
보고기간종료일 현재 다른 모든 변수가 일정하고 각 외화에 대한 원화 환율의 10% 변동시 환율변동이 당사의 손익에 미치는 영향은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 10% 상승시 | 10% 하락시 | 10% 상승시 | 10% 하락시 | |
| 현금및현금성자산 | 525,196 | (525,196) | 659,495 | (659,495) |
| 매출채권 | 978,020 | (978,020) | 76,368 | (76,368) |
| 미수금 | 97,963 | (97,963) | 52,854 | (52,854) |
| 미지급금 | (18,618) | 18,618 | (36,946) | 36,946 |
| 합 계 | 1,582,561 | (1,582,561) | 751,771 | (751,771) |
2) 이자율위험
당사는 고정이자율과 변동이자율로 자금을 차입하고 있으며, 이로 인하여 이자율위험에 노출되어 있습니다. 당사는 이자율 위험을 관리하기 위하여 고정이자율 차입금과 변동이자율 차입금의 적절한 균형을 유지하고 있으며, 이자율 주기를 통하여 이자비용의 변동을 막음으로써, 최적의 위험회피전략을 적용할 계획입니다.
한편, 당분기말 현재 당사가 보유한 차입금의 이자율이 100베이시스포인트 변동할 때, 이러한 이자율 변동이 손익에 미치는 영향은 최대629,000천원 증가 또는 629,000천원 감소합니다.
나. 신용위험
신용위험은 보유하고 있는 수취채권 및 확정계약을 포함한 거래처에 대한 신용위험 뿐만 아니라 현금및현금성자산, 은행등 금융기관예치금으로부터 발생하고 있습니다.당사는 금융기관에 현금및현금성자산 및 예적금 등을 예치하고 있으며, 신용등급이우수한 금융기관과 거래하고 있으므로 금융기관으로부터의 신용위험은 제한적입니다.
일반거래처의 경우 고객의 재무상태, 과거 경험 등 기타 요소들을 고려하여 신용을 평가하게 됩니다. 당사는 회수가 지연되는 금융자산에 대하여는 분기 단위로 회수 지연 현황 및 회수대책이 보고되고 있으며 지연사유에 따라 적절한 조치를 취하고 있습니다.
보고기간종료일 현재 당사 금융자산의 신용위험 최대 노출 금액은 장부금액과 동일합니다.
다. 유동성 위험
당사는 충분한 적립금과 차입한도를 유지하고 예측현금흐름과 실제현금흐름을 계속하여 관찰하고 금융자산과 금융부채의 만기구조를 대응시키면서 유동성위험을 관리하고 있습니다.
보고기간종료일 현재 금융부채의 잔존계약만기에 따른 만기분석은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월 이하 | 3개월 ~ 1년 | 1년 ~ 5년 |
|---|---|---|---|---|---|
| 매입채무및기타채무 | 13,031,800 | 13,031,800 | 12,936,550 | 95,250 | - |
| 차입금 | 62,900,000 | 66,915,266 | 5,442,292 | 21,214,080 | 40,258,894 |
| 전환사채 | 14,520,951 | 21,500,000 | 1,500,000 | - | 20,000,000 |
| 리스부채 | 218,018 | 223,863 | 42,004 | 75,107 | 106,752 |
| 기타장기채무 | 8,378,632 | 8,811,728 | 63,865 | 190,443 | 8,557,420 |
| 합 계 | 99,049,401 | 110,482,657 | 19,984,711 | 21,574,880 | 68,923,066 |
| <전기말> | (단위 : 천원) |
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월 이하 | 3개월 ~ 1년 | 1년 ~ 5년 |
|---|---|---|---|---|---|
| 매입채무및기타채무 | 23,924,872 | 23,924,872 | 23,394,967 | 529,905 | - |
| 차입금 | 38,600,000 | 40,975,894 | 216,862 | 10,569,928 | 30,189,104 |
| 전환사채 | 13,145,813 | 21,500,000 | 1,500,000 | - | 20,000,000 |
| 리스부채 | 299,805 | 307,506 | 44,744 | 128,090 | 134,672 |
| 기타장기채무 | 8,295,849 | 8,822,096 | 62,021 | 190,434 | 8,569,641 |
| 합 계 | 84,266,339 | 95,530,368 | 25,218,594 | 11,418,357 | 58,893,417 |
상기 분석은 할인하지 않은 현금흐름을 기초로 당사가 지급하여야 하는 가장 빠른 만기일에 근거하여 작성되었습니다.
(3) 금융상품의 공정가치
당사의 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산 | ||||
| 현금및현금성자산(*) | 22,634,095 | 22,634,095 | 21,376,197 | 21,376,197 |
| 매출채권및기타채권(*) | 11,020,263 | 11,020,263 | 2,345,685 | 2,345,685 |
| 당기손익금융자산 | 12,426,792 | 12,426,792 | 13,024,576 | 13,024,576 |
| 기타포괄손익금융자산 | 48,270,264 | 48,270,264 | 241,771,748 | 241,771,748 |
| 파생상품자산 | 900 | 900 | 184,900 | 184,900 |
| 기타장기채권(*) | 127,426 | 127,426 | 286,391 | 286,391 |
| 합 계 | 94,479,740 | 94,479,740 | 278,989,497 | 278,989,497 |
| 금융부채 | ||||
| 매입채무및기타채무(*) | 13,031,800 | 13,031,800 | 23,924,872 | 23,924,872 |
| 차입금(*) | 62,900,000 | 62,900,000 | 38,600,000 | 38,600,000 |
| 전환사채(*) | 14,520,951 | 14,520,951 | 13,145,813 | 13,145,813 |
| 파생상품부채 | 6,078,269 | 6,078,269 | 4,798,378 | 4,798,378 |
| 리스부채(*) | 218,018 | 218,018 | 299,805 | 299,805 |
| 기타장기채무(*) | 8,378,632 | 8,378,632 | 8,295,849 | 8,295,849 |
| 합 계 | 105,127,670 | 105,127,670 | 89,064,717 | 89,064,717 |
(*) 당사의 경영진은 재무제표상 상각후원가로 측정된 금융자산과 금융부채의 장부금액은 공정가치와 근사하다고 판단하고 있습니다.
당사는 금융자산과 금융부채의 공정가치를 다음과 같이 결정하였습니다.
| - | 표준거래조건과 정상거래시장이 존재하는 금융자산과 금융부채의 공정가치는 시장가격을 이용하여 결정하였습니다. |
| - | 기타 금융자산과 금융부채의 공정가치는 관측가능한 현행시장거래로부터의 가격과유사한 상품에 대한 딜러의 호가를 이용하여 할인한 현금흐름 분석에 기초하여 일반적으로 인정된 가격결정모형에 따라 결정되었습니다. |
당사는 공정가치로 측정되는 금융상품을 공정가치 측정에 사용된 투입변수에 따라 다음과 같은 공정가치 서열체계로 분류하였습니다.
| 수준1 : | 동일한 자산이나 부채에 대한 활성시장에서 공시된 가격(조정되지 않은)을 사용하여 도출되는 공정가치 |
| 수준2 : | 자산이나 부채에 대하여 직접적으로(예:가격) 또는 간접적으로(예:가격에서 도출되어)관측가능한 투입변수를 사용하여 도출되는 공정가치 단, 수준1 에 해당되는 공시가격은 제외 |
| 수준3 : | 자산이나 부채에 대하여 관측가능한 시장정보에 근거하지 않은 투입변수(관측불가능한 변수)를 사용하는 평가기법으로부터 도출되는 공정가치 |
보고기간종료일 현재 공정가치로 측정된 금융상품의 서열체계 각 수준에 따른 공정가치 측정치는 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익금융자산 | - | 4,870,070 | 7,556,722 | 12,426,792 |
| 기타포괄손익금융자산 | 25,372,588 | - | 22,897,675 | 48,270,263 |
| 파생상품자산 | - | 900 | - | 900 |
| 합 계 | 25,372,588 | 4,870,970 | 30,454,397 | 60,697,955 |
| 금융부채 | ||||
| 파생상품부채 | - | 5,792,937 | 285,332 | 6,078,269 |
| 합 계 | - | 5,792,937 | 285,332 | 6,078,269 |
| <전기말> | (단위 : 천원) |
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
|---|---|---|---|---|
| 금융자산 | ||||
| 당기손익인식금융자산 | - | 5,206,695 | 7,817,881 | 13,024,576 |
| 기타포괄손익금융자산 | 219,780,304 | - | 21,991,444 | 241,771,748 |
| 파생상품자산 | - | 184,900 | - | 184,900 |
| 합 계 | 219,780,304 | 5,391,595 | 29,809,325 | 254,981,224 |
| 금융부채 | ||||
| 파생상품부채 | - | 4,554,211 | 244,167 | 4,798,378 |
| 합 계 | - | 4,554,211 | 244,167 | 4,798,378 |
당사는 공정가치 서열체계에서 수준2로 분류되는 금융상품에 대하여 다음의 가치평가기법과 투입변수를 사용하고 있습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 투입변수 |
|---|---|---|---|---|
| 당기손익금융자산 | ||||
| 투자전환사채 | 4,870,070 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품자산 | ||||
| 전환사채 콜옵션 | 900 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품부채 | ||||
| 전환사채 풋옵션 | 5,792,937 | 2 | 이항모형 | 할인율, 변동성 |
| <전기말> |
(단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 투입변수 |
|---|---|---|---|---|
| 당기손익인식금융자산 | ||||
| 투자전환사채 | 5,206,695 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품자산 | ||||
| 전환사채 콜옵션 | 184,900 | 2 | 이항모형 | 할인율, 변동성 |
| 파생상품부채 | ||||
| 전환사채 풋옵션 | 4,554,211 | 2 | 이항모형 | 할인율, 변동성 |
당사는 공정가치 서열체계에서 수준3으로 분류되는 금융상품에 대하여 다음의 가치평가기법과 투입변수를 사용하고 있습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 유의적이지만 관측가능하지 않은 투입변수 | 유의적이지만 관측가능 하지 않은 투입변수 범위 |
|---|---|---|---|---|---|
| 당기손익금융자산 | |||||
| 출자금 | 1,823,992 | 3 | 자산접근법 | 순자산가액 | - |
| 전환사채 | 5,000,000 | 3 | 원가측정 | - | - |
| 전환사채 | 732,729 | 3 | 시장접근법 | PBR, PSR | - |
| 이항모형 | 할인율 | 19.49% | |||
| 변동성 | 28.60% | ||||
| 기타포괄손익금융자산 | |||||
| 보통주 | 12,696,109 | 3 | 원가측정 | - | - |
| 2,618,759 | 3 | 시장접근법 | PBR | - | |
| 우선주 | 7,582,808 | 3 | 원가측정 | - | - |
| 파생상품부채 | |||||
| 보통주 콜옵션 | 236,914 | 3 | 원가측정 | - | - |
| 보통주 풋옵션 | 48,417 | 3 | 시장접근법 | PBR | - |
| 이항모형 | 할인율 | 14.37% | |||
| 변동성 | 24.60% | ||||
| <전기말> | (단위 : 천원) |
| 구 분 | 공정가치 | 수준 | 가치평가기법 | 유의적이지만 관측가능하지 않은 투입변수 | 유의적이지만 관측가능하지 않은 투입변수 범위 |
|---|---|---|---|---|---|
| 당기손익금융자산 | |||||
| 출자금 | 2,065,791 | 3 | 자산접근법 | 순자산가액 | - |
| 전환사채 | 5,000,000 | 3 | 원가측정 | - | - |
| 전환사채 | 752,090 | 3 | 시장접근법 | PBR, PSR | - |
| 이항모형 | 할인율 | 18.21% | |||
| 변동성 | 24.60% | ||||
| 기타포괄손익금융자산 | |||||
| 보통주 | 12,439,529 | 3 | 원가측정 | - | - |
| 2,618,759 | 3 | 시장접근법 | PBR | - | |
| 451,635 | 3 | 자산접근법 | 순자산가액 | - | |
| 우선주 | 6,481,521 | 3 | 원가측정 | - | - |
| 파생상품부채 | |||||
| 보통주 콜옵션 | 195,750 | 3 | 원가측정 | - | - |
| 보통주 풋옵션 | 48,417 | 3 | 시장접근법 | PBR | - |
| 이항모형 | 할인율 | 14.37% | |||
| 변동성 | 24.60% | ||||
5. 범주별 금융상품
(1) 당사의 금융자산과 금융부채의 범주별 분류내역은 다음과 같습니다.
가. 보고기간종료일 현재 금융자산의 범주별 분류내역은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 상각후원가 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익-공정가치측정 금융자산 |
합 계 |
|---|---|---|---|---|
| 현금및현금성자산 | 22,634,095 | - | - | 22,634,095 |
| 매출채권및기타채권 | 11,020,263 | - | - | 11,020,263 |
| 당기손익금융자산 | - | 12,426,792 | - | 12,426,792 |
| 기타포괄손익금융자산 | - | - | 48,270,264 | 48,270,264 |
| 파생상품자산 | - | 900 | - | 900 |
| 기타장기채권 | 127,426 | - | - | 127,426 |
| 합 계 | 33,781,784 | 12,427,692 | 48,270,264 | 94,479,740 |
| <전기말> | (단위 : 천원) |
| 구 분 | 상각후원가 금융자산 |
당기손익- 공정가치측정 금융자산 |
기타포괄손익-공정가치측정 금융자산 |
합 계 |
|---|---|---|---|---|
| 현금및현금성자산 | 21,376,197 | - | - | 21,376,197 |
| 매출채권및기타채권 | 2,345,685 | - | - | 2,345,685 |
| 당기손익금융자산 | - | 13,024,576 | - | 13,024,576 |
| 기타포괄손익금융자산 | - | - | 241,771,748 | 241,771,748 |
| 파생상품자산 | - | 184,900 | - | 184,900 |
| 기타장기채권 | 286,391 | - | - | 286,391 |
| 합 계 | 24,008,273 | 13,209,476 | 241,771,748 | 278,989,497 |
나. 보고기간종료일 현재 금융부채의 범주별 분류내역은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 구 분 | 상각후원가로 측정 하는 금융부채 |
공정가치로 측정하는 금융부채 |
합 계 |
|---|---|---|---|
| 매입채무및기타채무 | 13,031,800 | - | 13,031,800 |
| 차입금 | 62,900,000 | - | 62,900,000 |
| 전환사채 | 14,520,951 | - | 14,520,951 |
| 파생상품부채 | - | 6,078,269 | 6,078,269 |
| 리스부채 | 218,018 | - | 218,018 |
| 기타장기채무 | 8,378,632 | - | 8,378,632 |
| 합 계 | 99,049,401 | 6,078,269 | 105,127,670 |
| <전기말> | (단위 : 천원) |
| 구 분 | 상각후원가로 측정 하는 금융부채 |
공정가치로 측정하는 금융부채 |
합 계 |
|---|---|---|---|
| 매입채무및기타채무 | 23,924,872 | - | 23,924,872 |
| 차입금 | 38,600,000 | - | 38,600,000 |
| 전환사채 | 13,145,813 | - | 13,145,813 |
| 파생상품부채 | - | 4,798,378 | 4,798,378 |
| 리스부채 | 299,805 | - | 299,805 |
| 기타장기채무 | 8,295,849 | - | 8,295,849 |
| 합 계 | 84,266,339 | 4,798,378 | 89,064,717 |
(2) 당분기 및 전분기 중 발생한 금융상품 범주별 순손익은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 당기손익금융자산 | ||
| 평가손익 | (510,529) | (1,657,991) |
| 처분손익 | 377,560 | (1,985,810) |
| 기타포괄손익금융자산 | ||
| 평가/처분손익(기타포괄손익) | (194,506,860) | 127,905,382 |
| 파생상품자산 | ||
| 평가손익 | (184,000) | (1,782,066) |
| 상각후원가측정 금융자산 | ||
| 이자수익 | 124,011 | 150,230 |
| 외환차손익 | (200,867) | 444,170 |
| 외화환산손익 | 2,686,590 | (23,298) |
| 상각후원가로 측정하는 금융부채 | ||
| 이자비용 | (2,303,894) | (64,558) |
| 파생상품부채 | ||
| 평가손익 | (1,279,891) | (287,791) |
6. 현금및현금성자산
보고기간종료일 현재 현금및현금성자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 보통예금 | 17,382,135 | 14,781,246 |
| 외화예금 | 5,251,960 | 6,594,951 |
| 합 계 | 22,634,095 | 21,376,197 |
7. 매출채권 및 기타채권
(1) 보고기간종료일 현재 매출채권 및 기타채권의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 매출채권 | 10,917,668 | - | 2,111,908 | - |
| 차감:손실충당금 | (1,116,125) | - | (1,079,800) | - |
| 미수금 | 1,169,712 | - | 1,272,871 | - |
| 차감:손실충당금 | (47,300) | - | (46,581) | - |
| 미수수익 | 577 | - | 87,287 | - |
| 보증금 | 95,731 | 127,426 | - | 286,391 |
| 합 계 | 11,020,263 | 127,426 | 2,345,685 | 286,391 |
(2) 당분기와 전분기 중 매출채권에 대한 손실충당금의 변동내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 기초 | 대손상각 | 환입 | 기말 |
|---|---|---|---|---|
| 당분기 | 1,079,800 | 62,325 | (26,000) | 1,116,125 |
| 전분기 | 794,525 | - | (10,100) | 784,425 |
(3) 보고기간종료일 현재 매출채권의 연령 및 각 연령별로 손상된 채권금액은 다음과같습니다.
| (단위 : 천원) |
| 구 분(*) | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 채권액 | 손실충당금 | 장부금액 | 채권액 | 손실충당금 | 장부금액 | |
| 정상채권 | 9,783,239 | - | 9,783,239 | 1,032,108 | - | 1,032,108 |
| 3개월 이하 | - | - | - | - | - | - |
| 3개월 초과 6개월 이하 | - | - | - | - | - | - |
| 6개월 초과 | 1,134,429 | (1,116,125) | 18,304 | 1,079,800 | (1,079,800) | - |
| 합 계 | 10,917,668 | (1,116,125) | 9,801,543 | 2,111,908 | (1,079,800) | 1,032,108 |
(*) 매출채권의 기간구분은 연체일을 기준으로 구분하였습니다.
8. 기타자산
보고기간종료일 현재 기타자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 기타유동자산 | ||
| 선급금 | 2,015,922 | 3,269,683 |
| 선급비용 | 76,823 | 102,908 |
| 선급용역원가 | 2,063,156 | 321,431 |
| 미청구공사 | 486,724 | 2,892 |
| 부가세대급금 | 714,568 | 2,110,608 |
| 연구자재 | 14,348,090 | 7,167,313 |
| 합 계 | 19,705,283 | 12,974,835 |
| 기타비유동자산 | ||
| 장기선급금 | 921,397 | 733,461 |
| 합 계 | 921,397 | 733,461 |
9. 당기손익금융자산
보고기간종료일 현재 당기손익금융자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 발행회사명 | 당분기말 | 전기말 |
|---|---|---|---|
| 투자전환사채 | ㈜코스온 | 5,000,000 | 5,000,000 |
| 투자전환사채 | ㈜바이넥스 | 4,870,070 | 5,206,695 |
| 투자전환사채 | ㈜화이바이오메드 | 732,729 | 752,090 |
| 출자금 | 미래에셋청년창업투자조합3호 | 1,823,992 | 2,065,791 |
| 보통주 | ㈜프로젠 | - | - |
| 합 계 | 12,426,791 | 13,024,576 |
10. 기타포괄손익금융자산
(1) 보고기간종료일 현재 기타포괄손익금융자산의 내역은 다음과 같습니다.
| (단위 : 주, 천원) |
| 구 분 | 보유주식수 | 지분율 | 당분기말 | 전기말 | ||
|---|---|---|---|---|---|---|
| 취득금액 | 장부금액 | 취득금액 | 장부금액 | |||
| 시장성있는 지분증권 | ||||||
| (주)제넨바이오(주1,2) | 3,019,913 | 6.93% | 50,966,020 | 4,137,281 | 52,922,047 | 12,426,942 |
| I-Mab | 8,488,885 | 4.45% | 71,767,447 | 21,235,308 | 71,767,447 | 207,353,362 |
| 소 계 | 122,733,467 | 25,372,589 | 124,689,494 | 219,780,304 | ||
| 시장성없는 지분증권 | ||||||
| (주)코스온(주3) | 216,488 | 0.90% | 4,242,064 | - | 4,242,064 | 451,635 |
| PharmaJet | 297,128 | 1.14% | 895,866 | 582,778 | 895,866 | 481,519 |
| 와이바이오로직스 | 176,991 | 1.44% | 2,999,997 | 2,618,759 | 2,999,997 | 2,618,759 |
| 에스엘백시젠 | 250,000 | 13.51% | 10,219,400 | 10,219,400 | 10,219,400 | 10,219,400 |
| 이노퓨틱스 | 381,680 | 6.97% | 1,000,002 | 1,000,002 | 1,000,002 | 1,000,002 |
| 칼로스메디칼 | 8,147 | 1.59% | 1,000,028 | 1,000,028 | - | - |
| (주)지아이이노베이션(주2) | 151,515 | 0.76% | 4,999,995 | 4,999,995 | 4,999,995 | 4,999,995 |
| 진메디신 | 48,182 | 0.59% | 1,000,017 | 1,000,017 | 1,000,017 | 1,000,017 |
| Egret | 1,000,000 | 5.56% | 1,166,598 | 1,476,696 | 1,166,598 | 1,220,117 |
| 소 계 | 27,523,967 | 22,897,675 | 26,523,939 | 21,991,444 | ||
| 합 계 | 150,257,434 | 48,270,264 | 151,213,433 | 241,771,748 | ||
| (주1) 당분기 중 주식이 5:1로 액면병합되었습니다. (주2) 당분기말 현재 (주)제넨바이오와 (주)지아이이노베이션 주식은 보호예수로 인해 매각이 제한되어 있습니다. (주3) 코스닥시장내의 거래정지로 인해 시장성없는 지분증권으로 분류하였습니다. |
(2) 당분기 및 전분기 중 기타포괄손익금융자산의 변동내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | 241,771,748 | 278,506,628 |
| 취득 | 1,322,168 | 12,166,609 |
| 처분 | (534,950) | (58,072,039) |
| 대체 | - | - |
| 평가손익 | (194,288,702) | 127,905,382 |
| 기말 | 48,270,264 | 360,506,580 |
11. 관계기업, 공동기업 및 종속기업 투자
(1) 보고기간종료일 현재의 관계기업, 공동기업 및 종속기업 투자의 현황과 장부가액은 다음과 같습니다.
| (단위 : 천원) |
| 구분 | 회사명 | 소재지 | 주요 영업활동 | 지분율 | 당분기말 | 전기말 | ||
|---|---|---|---|---|---|---|---|---|
| 취득금액 | 장부금액 | 취득금액 | 장부금액 | |||||
| 관계기업 | 아지노모도제넥신(주) | 대한민국 | 생물학적 제제 제조업 | 25.00% | 8,925,000 | 8,925,000 | 8,925,000 | 8,925,000 |
| 관계기업 | NIT (NeoImmuneTech, Inc.)(주3) | 미국 | 면역학을 이용한 바이오의약품 연구/개발 및 판매 | 21.18% | 45,246,777 | 45,246,777 | 45,246,777 | 45,246,777 |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | 중국 | 중국, 글로벌 임상개발 및 사업화 | 49.00% | 1,102,598 | 791,134 | 1,102,598 | 791,134 |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | 인도네시아 | 아세안, 글로벌 임상개발 및 사업화 | 20.32% | 38,694,175 | 38,694,175 | 38,694,175 | 38,694,175 |
| 관계기업 | (주)툴젠(주1,3) | 대한민국 | 유전자교정 연구개발 및 유전자교정 기술 기반 치료제 개발 및 품종개량 | 14.24% | 79,480,998 | 79,480,998 | 79,480,998 | 79,480,998 |
| 관계기업 | (주)큐로젠(주2) | 대한민국 | 유전자 및 단백질을 이용한 치료제 개발 | 6.16% | 3,000,180 | 3,000,180 | 3,000,180 | 3,000,180 |
| 공동기업 | Rezolute, Inc(주1) | 미국 | 글로벌 임상개발 및 사업화 | 4.96% | 25,827,875 | 7,178,724 | 25,827,875 | 10,347,484 |
| 공동기업 | CoImmune, Inc. | 미국 | 글로벌 임상개발 및 사업화 | 22.94% | 25,374,549 | 20,093,975 | 25,374,549 | 20,093,975 |
| 공동기업 | ILKOGEN | 터키 | 글로벌 임상개발 및 사업화 | 50.00% | 9,500,093 | 2,301,017 | 9,500,093 | 2,301,017 |
| 공동기업 | KinGen Biotech, Inc | 태국 | CDMO 서비스 및 사업화 | 50.00% | 2,291,519 | - | 2,291,519 | - |
| 종속기업 | ㈜에스엘포젠 | 대한민국 | CDMO 서비스 및 사업화 | 63.65% | 10,642,000 | 10,642,000 | 10,642,000 | 10,642,000 |
| 합 계 | 250,085,764 | 216,353,980 | 250,085,764 | 219,522,740 | ||||
| (주1) 지분율이 20% 미만이나 투자약정에 의거 피투자회사에 대한 임원 선임권 등이 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업및공동기업으로 분류하였습니다. (주2) 당사 임원이 피투자회사의 사외이사를 겸직하고 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업으로 분류하였습니다. (주3) 당분기말 현재 (주)툴젠 985,721주와 NeoImmuneTech, Inc. 20,936,000주는 보호예수로 인해 매각이 제한되어 있습니다. |
(2) 당분기 및 전분기 중 관계기업, 공동기업 및 종속기업 투자의 변동내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 기초 | 219,522,740 | 217,219,827 |
| 취득 | - | 29,665,333 |
| 처분 | - | - |
| 환입(손상) | (3,168,760) | (8,734,688) |
| 기말 | 216,353,980 | 238,150,472 |
12. 파생상품자산
보고기간종료일 현재 파생상품자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 전환사채 콜옵션(주1) | 900 | - | 184,900 | - |
| (주1) 당사는 2018년 5월과 2020년 12월에 제6회 및 제7회 전환사채를 발행하였으며, 당사가 보유한 콜옵션을 이항모형에 따라 평가하였습니다. |
13. 투자부동산
(1) 보고기간종료일 현재 투자부동산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | |
| 토지 | 1,242,681 | - | 1,242,681 | - | - | - |
| 건물 | 2,505,653 | (707,571) | 1,798,082 | - | - | - |
| 합 계 | 3,748,334 | (707,571) | 3,040,763 | - | - | - |
(2) 당분기 중 투자부동산 장부금액의 변동내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 기초 | 취득 및 자본적지출 |
처분 | 대체(주1) | 감가상각 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | - | - | - | 1,242,681 | - | 1,242,681 |
| 건물 | - | - | - | 1,844,988 | (46,906) | 1,798,082 |
| 합 계 | - | = | - | 3,087,669 | (46,906) | 3,040,763 |
| (주1) 당분기 중 마곡 신사옥으로 본점 및 연구소가 이전함에 따라 임대 중인 판교 사옥을 유형자산에서 투자부동산으로 대체하였습니다. |
(3) 당분기 중 투자부동산에서 발생한 임대수익은 95,439천원이며, 투자부동산 매각과 관련하여 인식한 처분손익은 없습니다.
(4) 투자부동산은 원가모형으로 평가하고 있으며, 공정가치는 공인된 전문자격을 갖춘 독립된 평가인에 의해 평가되지 아니하였습니다. 다만, 공시가격에 따른 보고기간종료일 현재 투자부동산의 가치는 3,730,947천원 입니다.
14. 유형자산
(1) 보고기간종료일 현재 유형자산의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 계 정 과 목 | 당분기말 | 전기말 | ||||
|---|---|---|---|---|---|---|
| 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | 취득금액 | 감가상각누계액 및 정부보조금 | 장부금액 | |
| 토지 | 22,136,915 | - | 22,136,915 | 21,696,652 | - | 21,696,652 |
| 건물 | 65,325,278 | (1,491,451) | 63,833,827 | 67,704,339 | (944,559) | 66,759,780 |
| 기계장치 | 12,037,350 | (9,162,748) | 2,874,602 | 11,624,802 | (8,520,809) | 3,103,993 |
| 차량운반구 | - | - | - | 48,724 | (48,724) | - |
| 비품 | 2,308,779 | (1,609,931) | 698,848 | 1,875,843 | (1,430,048) | 445,795 |
| 시설장치 | 3,881,756 | (738,078) | 3,143,678 | 5,910,800 | (2,314,200) | 3,596,600 |
| 사용권자산 | 4,194,494 | (579,510) | 3,614,984 | 4,258,932 | (418,864) | 3,840,068 |
| 건설중인자산 | 14,777,067 | - | 14,777,067 | 7,895,596 | - | 7,895,596 |
| 합 계 | 124,661,639 | (13,581,718) | 111,079,921 | 121,015,688 | (13,677,204) | 107,338,484 |
(2) 당분기 및 전분기 중 유형자산 장부금액의 변동내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구 분 | 기초 | 취득 및 자본적지출 |
처분 | 대체(주2) | 감가상각 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | 21,696,652 | 2,144,695 | (461,751) | (1,242,681) | - | 22,136,915 |
| 건물 | 66,759,780 | 217,749 | (73,684) | (1,844,988) | (1,225,030) | 63,833,827 |
| 기계장치 | 3,103,993 | 489,489 | (207) | 25,959 | (744,632) | 2,874,602 |
| 비품 | 445,795 | 179,242 | (2,549) | 257,691 | (181,331) | 698,848 |
| 시설장치 | 3,596,600 | 140,988 | (13,413) | - | (580,497) | 3,143,678 |
| 사용권자산(주1) | 3,840,068 | 63,307 | (10,934) | - | (277,457) | 3,614,984 |
| 건설중인자산 | 7,895,596 | 7,165,121 | - | (283,650) | - | 14,777,067 |
| 합 계 | 107,338,484 | 10,400,591 | (562,538) | (3,087,669) | (3,008,947) | 111,079,921 |
| (주1) 당분기말 현재 사용권자산은 차량운반구 214,096천원, 시설이용권 3,400,888천원으로 구성되어 있습니다. (주2) 당분기 중 마곡 신사옥으로 본점 및 연구소가 이전함에 따라 임대 중인 판교 사옥의 토지와 건물 3,087,669천원을 유형자산에서 투자부동산으로 대체하였습니다. |
| <전분기> | (단위 : 천원) |
| 구 분 | 기초 | 취득 및 자본적지출 |
처분 | 대체 | 감가상각 | 기말 |
|---|---|---|---|---|---|---|
| 토지 | 6,838,569 | - | - | - | - | 6,838,569 |
| 건물 | 10,558,490 | - | - | - | (252,469) | 10,306,021 |
| 기계장치 | 2,816,814 | 1,257,669 | (259,120) | 230,600 | (743,321) | 3,302,642 |
| 비품 | 617,003 | 52,891 | (25,778) | - | (151,984) | 492,132 |
| 시설장치 | 48,653 | 418,908 | (2,823) | - | (58,338) | 406,400 |
| 사용권자산(주1) | 351,000 | 3,797,274 | (85,571) | - | (196,640) | 3,866,063 |
| 건설중인자산 | 46,487,227 | 24,041,069 | - | (230,600) | - | 70,297,696 |
| 합 계 | 67,717,756 | 29,567,811 | (373,292) | - | (1,402,752) | 95,509,523 |
| (주1) 전분기말 현재 사용권자산은 차량운반구 273,576천원, 시설이용권 3,592,487천원으로 구성되어 있습니다. |
(3) 당분기 및 전분기의 감가상각비의 계상내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 판매비와관리비 | 962,549 | 515,432 |
| 경상연구개발비 | 1,718,548 | 772,117 |
| 용역원가 | 323,580 | 112,503 |
| 공동개발 등 정산 | 4,270 | 2,700 |
| 합 계 | 3,008,947 | 1,402,752 |
(4) 유형자산 중 토지와 건물은 당사의 차입금과 관련하여 담보로 제공되어 있습니다(주석37 참조).
(5) 차입원가자본화
보고기간종료일 현재 차입원가를 자본화하여 건설중인자산으로 계상한 금액과 차입원가를 산정하기 위하여 사용된 일반목적차입금 자본화이자율은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 차입원가 자본화 금액 | 13,519 | 1,770,022 |
| 자본화이자율 | 5.04% | 8.8% |
15. 무형자산
(1) 당분기 및 전분기 중 발생한 무형자산 장부금액의 변동내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구분 | 기초 | 취득 | 처분 | 상각 | 기말 |
|---|---|---|---|---|---|
| 산업재산권 | 720,956 | 78,464 | - | (127,926) | 671,494 |
| 시설이용권 | 349,165 | - | (200,000) | - | 149,165 |
| 기타의무형자산 | 2,200,385 | 27,068 | - | (223,037) | 2,004,416 |
| 합계 | 3,270,506 | 105,532 | (200,000) | (350,963) | 2,825,075 |
| <전분기> | (단위 : 천원) |
| 구분 | 기초 | 취득 | 처분 | 상각 | 기말 |
|---|---|---|---|---|---|
| 산업재산권 | 716,770 | 89,630 | - | (121,061) | 685,339 |
| 시설이용권 | 356,040 | - | - | - | 356,040 |
| 기타의무형자산 | 2,992,553 | 567,249 | - | (398,381) | 3,161,421 |
| 합계 | 4,065,363 | 656,879 | - | (519,442) | 4,202,800 |
(2) 당분기 및 전분기에 비용으로 인식한 연구개발 관련 지출액(경상개발비)은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 연구재료비 | 2,319,784 | 4,899,977 |
| 인건비 | 4,061,072 | 5,821,005 |
| 위탁용역비 | 10,145,281 | 16,638,708 |
| 기타비용 | 2,991,578 | 2,841,765 |
| 정부보조금 | (629,998) | (6,104,724) |
| 합 계 | 18,887,717 | 24,096,731 |
16. 정부보조금
(1) 개요
당사는 신약개발과 관련하여 국가항암신약개발센터, 보건복지부, 과학기술정보통신부 등과 과제수행 주관사로서 다수의 협약을 체결하고 정부과제를 수행하고 있으며, 이러한 협약에 의해 정부보조금을 수령하고 있습니다.
(2) 당분기 및 전분기 중 정부보조금의 증감내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구 분 | 현금및현금성자산 | 투자부동산 | 건물 | 기계장치 | 비품 | 기타의무형자산 |
|---|---|---|---|---|---|---|
| 기초 | - | - | 2,931 | 44,916 | 2,685 | 9,062 |
| 수령 | 604,950 | - | - | - | - | - |
| 자산대체 | - | 2,931 | (2,931) | - | - | - |
| 비용상계 | (604,950) | (75) | - | (7,703) | (1,078) | (3,707) |
| 반납 | - | - | - | - | - | - |
| 기말 | - | 2,856 | - | 37,213 | 1,607 | 5,355 |
| <전분기> | (단위 : 천원) |
| 구 분 | 현금및현금성자산 | 건물 | 기계장치 | 비품 | 기타의무형자산 |
|---|---|---|---|---|---|
| 기초 | - | 12,275 | 11,924 | 4,305 | 14,005 |
| 수령 | 6,469,666 | - | - | - | - |
| 자산취득 | (51,351) | - | 51,351 | - | - |
| 자산처분 | - | - | (8,076) | (104) | - |
| 비용상계 | (6,418,315) | (302) | (7,716) | (1,156) | (3,707) |
| 반납 | - | - | - | - | - |
| 기말 | - | 11,973 | 47,483 | 3,045 | 10,298 |
17. 매각예정비유동자산
보고기간종료일 현재 부동산매매계약을 체결한 토지와 건물을 유형자산에서 매각예정비유동자산으로 재분류하였으며, 그 내역은 다음과 같습니다.
| <전기말> | (단위 : 천원) |
| 구 분 | 내 역 | 재분류전 장부금액 | 손상차손 | 장부금액 |
|---|---|---|---|---|
| 토지 | 판교 사옥 | 5,134,137 | - | 5,134,137 |
| 건물 | 판교 사옥 | 8,303,004 | - | 8,303,004 |
| 합 계 | 13,437,141 | - | 13,437,141 | |
한편, 상기 매각예정비유동자산은 당분기 중 매각이 완료되었습니다.
18. 매입채무 및 기타채무
보고기간종료일 현재 매입채무 및 기타채무의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 계 정 과 목 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 미지급금 | 5,547,090 | 1,961,540 | 22,130,600 | 1,971,908 |
| 미지급비용 | 7,389,460 | 47,062 | 1,602,052 | 47,062 |
| 임대보증금 | 95,250 | 6,370,030 | 192,220 | 6,276,879 |
| 합 계 | 13,031,800 | 8,378,632 | 23,924,872 | 8,295,849 |
19. 기타부채
보고기간종료일 현재 기타부채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 계 정 과 목 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 예수금 | (14,228) | - | 221,818 | - |
| 선수금 | 221,971 | - | 23,309,206 | - |
| 선수수익 | 127,602 | 298,554 | 127,602 | 393,993 |
| 합 계 | 335,345 | 298,554 | 23,658,626 | 393,993 |
20. 차입금
(1) 보고기간종료일 현재 차입금의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 차입처 | 내 역 | 이자율(%) | 당분기말 | 전기말 |
|---|---|---|---|---|
| 기업은행 | 시설자금대출 | 4.18 | 10,000,000 | 10,000,000 |
| 시설자금대출 | 1.87 | 20,000,000 | 20,000,000 | |
| 시설자금대출 | 2.68 | 17,900,000 | 8,600,000 | |
| 운전자금대출 | 4.75 | 10,000,000 | - | |
| 하나은행 | 운전자금대출 | 3.96 | 5,000,000 | - |
| 합 계 | 62,900,000 | 38,600,000 | ||
상기 차입금과 관련하여 당사의 유형자산 중 토지와 건물을 담보로 제공하고 있습니다(주석37 참조).
(2) 보고기간종료일 현재 차입금의 유동성분류 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 금융기관차입금 | 25,588,220 | 37,311,780 | 10,000,000 | 28,600,000 |
21. 전환사채
(1) 보고기간종료일 현재 전환사채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 전환사채 | 1,500,000 | 20,000,000 | 1,500,000 | 20,000,000 |
| 전환권조정 | (145,404) | (6,833,645) | (299,812) | (8,054,375) |
| 합 계 | 1,354,596 | 13,166,355 | 1,200,188 | 11,945,625 |
(2) 당분기말 현재 당사가 발행한 전환사채의 발행조건은 아래와 같습니다.
| 사채의 종류 | 제6회 기명식 무보증 사모 전환사채 | 제7회 기명식 무보증 사모 전환사채 |
|---|---|---|
| 액면가액 | 50,000,000천원 | 20,000,000천원 |
| 발행가액 | 50,000,000천원 | 20,000,000천원 |
| 발행잔액(주1) | 1,500,000천원 | 20,000,000천원 |
| 발행일 | 2018년 05월 18일 | 2020년 12월 17일 |
| 만기일 | 2023년 05월 18일 | 2025년 12월 17일 |
| 이자지급조건 | 없음 | 없음 |
| 만기보장수익률 | 0% | 0% |
| 전환조건(주2) | 2019년 5월 18일에서 2023년 5월 17일까지 주당 87,278원으로 전환 가능(총 17,186주) | 2020년 12월 17일에서 2025년 12월 16일까지 주당 119,807원으로 전환 가능(총 166,935주) |
| 풋옵션 | 채권자는 사채발행후 3년이 되는 날인 2021년 5월 18일부터 만기일 3개월 전인 2023년 2월 18일까지 매 3개월이 되는 날마다 본 사채의 원금에 대해 만기 전 조기상환을 청구할 수 있음 | 채권자는 사채발행후 3년이 되는 날인 2023년 12월 17일부터 만기일 3개월 전인 2025년 9월 17일까지 매 3개월이 되는 날마다 본 사채의 원금에 대해 만기 전 조기상환을 청구할 수 있음 |
| 콜옵션 | 발행회사는 사채발행후 2년이 되는 날인 2020년 5월 18일부터 만기일 3개월 전인 2023년 2월 18일까지 매 3개월이 되는 날마다 본 사채 권면총액 30%에 해당하는 금액의 한도 내에서 발행회사에게 상환하거나, 발행회사가 지정하는 제3자에게 매도하여 줄 것을 청구할 수 있음 | 발행회사는 사채발행후 2년이 되는 날인 2022년 12월 17일부터 만기일 3개월 전인 2025년 9월 17일까지 매 3개월이 되는 날마다 본 사채 권면총액 30%에 해당하는 금액의 한도 내에서 발행회사에게 상환하거나, 발행회사가 지정하는 제3자에게 매도하여 줄 것을 청구할 수 있음 |
| (주1) 당사가 2018년 5월 18일 발행한 제6회 전환사채는 2020년 07월 30일 3,500,000천원, 2020년 08월 05일 31,500,000천원이 전환되었으며, 2020년 12월 18일 13,500,000천원이 상환되어 잔여액면금액은 1,500,000천원 입니다. |
22. 파생상품부채
보고기간종료일 현재 파생상품부채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 보통주 콜옵션(주1) | 236,914 | - | 195,750 | - |
| 보통주 풋옵션(주2) | - | 48,417 | - | 48,417 |
| 전환사채 풋옵션(주3) | 97,838 | 5,695,100 | 197,351 | 4,356,860 |
| 합 계 | 334,752 | 5,743,517 | 393,101 | 4,405,277 |
| (주1) 당사는 미국 Turret과 2020년 12월에 GX-P1 기술을 이전하고 Egret 보통주를 취득하는 계약을 체결하였으며, 2년 이후 Egret의 주식을 당사로부터 매수할 수 있는 콜옵션을 부여하고 있습니다. 당사는 상기 콜옵션의 공정가치를 최초 취득시 이항모형에 따라 평가하였습니다. (주2) 당사는 인도네시아 Kalbe와 풋옵션이 포함된 주주간 계약을 체결하였으며, 당사의 종속기업인 (주)에스엘포젠의 보통주를 매도할 권리를 부여하였습니다. 당사는 상기 옵션의 공정가치를 이항모형에 따라 평가하였습니다. (주3) 당사는 2018년 5월과 2020년 12월에 전환사채를 발행하였으며, 투자자가 보유한 풋옵션을 이항모형에 따라 평가하였습니다. |
23. 리스부채
(1) 보고기간종료일 현재 리스부채에 대한 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 최소리스료 | 최소리스료의 현재가치 |
최소리스료 | 최소리스료의 현재가치 |
|
| 1년 이내 | 117,111 | 113,774 | 172,834 | 168,086 |
| 1년 초과 5년 이내 | 106,752 | 104,244 | 134,672 | 131,719 |
| 합 계 | 223,863 | 218,018 | 307,506 | 299,805 |
(2) 보고기간종료일 현재 리스부채의 유동성분류 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 리스부채 | 113,774 | 104,244 | 168,086 | 131,719 |
(3) 리스와 관련해서 포괄손익계산서에 인식된 비용은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 사용권자산 감가상각비 | 277,457 | 196,640 |
| 리스부채 이자비용 | 4,623 | 5,688 |
| 단기 및 소액리스 관련비용 | 26,219 | 3,452 |
| 합 계 | 308,299 | 205,780 |
한편, 당분기와 전분기 중 리스부채로 인한 총현금유출 금액은 각각 138,485천원 및 137,409천원입니다.
24. 종업원급여부채
(1) 보고기간종료일 현재 종업원급여부채의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 순확정급여부채 | 1,240,546 | 339,988 |
| 기타장기종업원급여부채 | 99,893 | 101,911 |
| 종업원급여부채 | 1,340,439 | 441,899 |
(2) 보고기간종료일 현재 순확정급여부채의 구성항목은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 확정급여채무의 현재가치 | 2,669,656 | 4,091,805 |
| 사외적립자산의 공정가치 | (1,429,110) | (3,751,817) |
| 순확정급여부채 | 1,240,546 | 339,988 |
25. 자본금
(1) 당분기말 현재 당사가 발행할 주식의 총수는 300,000,000주, 발행한 주식의 수는 보통주 25,144,982주이며, 1주당 금액은 500원입니다.
(2) 당분기와 전분기 중 보통주식수 및 보통주자본금의 변동내역은 다음과 같습니다.
| (단위 : 주, 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 주식수 | 자본금 | 주식수 | 자본금 | |
| 기초 | 25,138,982 | 12,569,491 | 24,697,774 | 12,348,887 |
| 주식선택권 행사 | 6,000 | 3,000 | 330,758 | 165,379 |
| 기말 | 25,144,982 | 12,572,491 | 25,028,532 | 12,514,266 |
26. 자본잉여금
보고기간종료일 현재 자본잉여금의 구성내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 주식발행초과금 | 555,158,194 | 552,019,902 |
| 감자차익 | 1,100,820 | 1,100,820 |
| 전환권대가(주1) | 9,230,321 | 9,230,321 |
| 합 계 | 565,489,335 | 562,351,043 |
| (주2) 당사는 금융감독원 질의회신 "회제이-00094" 에 의거 전환권대가를 자본잉여금으로 분류하였습니다. |
27. 기타자본구성요소
보고기간종료일 현재 기타자본구성요소의 구성내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기말 | 전기말 |
|---|---|---|
| 주식매수선택권 | 10,444,705 | 10,171,855 |
| 기타포괄손익금융자산평가손익 | (101,987,170) | 90,558,314 |
| 기타자본항목 | 6,438,186 | 5,601,197 |
| 합 계 | (85,104,279) | 106,331,366 |
28. 주식기준보상
(1) 당분기말 현재 당사가 보유하고 있는 주식기준 보상약정은 다음과 같습니다.
| 구 분 | 부여일 | 보유수량 | 행사가능기간 | 가득조건 |
|---|---|---|---|---|
| 11-3차 | 2013.03.15 | 70,800 | 2021.03.15~2023.03.14 | 용역제공 8년 |
| 12-3차 | 2014.03.21 | 86,150 | 2022.03.21~2024.03.20 | 용역제공 8년 |
| 25-1차 | 2018.02.06 | 16,010 | 2021.02.06~2023.02.05 | 용역제공 3년 |
| 25-2차 | 2018.02.06 | 66,932 | 2021.02.06~2024.02.05 | 용역제공 3년 |
| 26차 | 2018.08.08 | 21,500 | 2021.08.08~2023.08.07 | 용역제공 3년 |
| 27차 | 2018.10.12 | 29,000 | 2021.10.12~2023.10.11 | 용역제공 3년 |
| 28차 | 2019.05.22 | 3,190 | 2022.05.22~2024.05.21 | 용역제공 3년 |
| 29차 | 2019.11.28 | 4,500 | 2022.11.28~2024.11.27 | 용역제공 3년 |
| 30차 | 2019.12.27 | 850 | 2022.12.27~2024.12.26 | 용역제공 3년 |
| 31차 | 2020.03.04 | 5,000 | 2023.03.04~2025.03.03 | 용역제공 3년 |
| 32차 | 2020.07.15 | 56,500 | 2023.07.15~2025.07.14 | 용역제공 3년 |
| 33차 | 2021.02.18 | 21,750 | 2024.02.18~2026.02.17 | 용역제공 3년 |
| 34차 | 2021.03.29 | 3,000 | 2024.03.29~2026.03.28 | 용역제공 3년 |
| 35차 | 2021.08.13 | 26,300 | 2024.08.13~2026.08.12 | 용역제공 3년 |
| 36차 | 2022.03.07 | 95,000 | 2025.03.07~2027.03.06 | 용역제공 3년 |
| 37차 | 2022.03.29 | 195,000 | 2025.03.29~2027.03.28 | 용역제공 3년 |
한편, 당사가 임직원 등에게 부여한 주식기준 보상약정은 주식결제형과 현금결제형을 당사가 선택할 수 있으며, 당분기말 현재 현금을 지급해야 하는 의무가 없어 주식결제형을 선택하여 회계처리하고 있습니다.
(2) 당사가 임직원 등에게 부여한 주식선택권의 부여일 현재 추정 공정가치는 다음과같으며, 동 공정가치는 블랙ㆍ숄즈모형에 따라 산정한 것입니다.
| (단위 : 원) |
| 구 분 | 추정 공정가치 | 주가 | 행사가격 | 기대주가변동성 | 기대배당금 | 무위험이자율 | 만기 |
|---|---|---|---|---|---|---|---|
| 11-3차 | 11,832 | 18,450 | 9,350 | 55.09% | - | 2.93% | 2023년 03월 14일 |
| 12-2차 | 17,975 | 33,750 | 17,600 | 54.02% | - | 3.40% | 2022년 03월 20일 |
| 12-3차 | 21,563 | 33,750 | 17,600 | 54.02% | - | 3.56% | 2024년 03월 20일 |
| 22차 | 17,791 | 38,250 | 39,950 | 60.84% | - | 1.83% | 2022년 02월 07일 |
| 23차 | 18,401 | 39,600 | 41,300 | 60.59% | - | 1.90% | 2022년 05월 16일 |
| 25-1차 | 34,512 | 74,500 | 78,950 | 60.01% | - | 2.52% | 2023년 02월 05일 |
| 25-2차 | 34,512 | 74,500 | 78,950 | 60.01% | - | 2.52% | 2024년 02월 05일 |
| 26차 | 39,082 | 81,000 | 85,900 | 63.35% | - | 2.32% | 2023년 08월 07일 |
| 27차 | 42,164 | 87,500 | 93,700 | 63.79% | - | 2.23% | 2023년 10월 11일 |
| 28차 | 33,766 | 69,600 | 72,600 | 64.06% | - | 1.72% | 2024년 05월 21일 |
| 29차 | 25,675 | 54,700 | 56,200 | 61.31% | - | 1.53% | 2024년 11월 27일 |
| 30차 | 30,276 | 61,200 | 56,900 | 61.15% | - | 1.47% | 2024년 12월 26일 |
| 31차 | 26,423 | 62,700 | 58,800 | 50.53% | - | 1.21% | 2025년 03월 03일 |
| 32차 | 41,489 | 96,700 | 96,500 | 54.85% | - | 1.01% | 2025년 07월 14일 |
| 33차 | 49,951 | 107,300 | 104,100 | 58.92% | - | 1.15% | 2026년 02월 17일 |
| 34차 | 43,705 | 96,400 | 100,100 | 59.51% | - | 1.41% | 2026년 03월 28일 |
| 35차 | 40,838 | 88,300 | 90,100 | 59.94% | - | 1.54% | 2026년 08월 12일 |
| 36차 | 19,683 | 44,700 | 47,600 | 57.06% | - | 2.33% | 2027년 03월 06일 |
| 37차 | 20,416 | 44,500 | 45,300 | 56.82% | - | 2.96% | 2027년 03월 28일 |
(3) 당분기 및 전분기 중 당사가 부여하고 있는 주식선택권의 변동내역은 다음과 같습니다.
| (단위 : 원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 수량 | 가중평균행사가격 | 수량 | 가중평균행사가격 | |
| 기초 | 587,232 | 53,898 | 869,480 | 32,498 |
| 부여 | 303,100 | 46,120 | 87,700 | 97,514 |
| 행사 | 115,850 | 17,102 | 330,758 | 23,240 |
| 취소 또는 중도청산 | 73,000 | 71,588 | 23,840 | 96,887 |
| 기말 | 701,482 | 88,510 | 602,582 | 53,898 |
(4) 당분기 및 전분기 중 발생한 보상원가의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 비용으로 인식한 보상원가 | 2,324,846 | 2,334,111 |
| 판매비와관리비 | 1,395,595 | 959,668 |
| 경상연구개발비 | 929,251 | 1,374,443 |
| 당분기와 전분기 이후 비용으로 인식할 보상원가 | 6,696,277 | 5,356,461 |
29. 결손금
보고기간종료일 현재 결손금의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 과 목 | 당분기말 | 전기말 |
|---|---|---|
| 미처리결손금 | 151,608,636 | 158,445,558 |
30. 수익
당분기 및 전분기 중 포괄손익계산서에 표시된 매출액의 구성 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 기술이전으로 인한 수익 | - | 9,701,600 | - | 29,954,729 |
| 용역의 제공으로 인한 수익 | 2,373,713 | 3,878,146 | 246,967 | 4,761,757 |
| 기타 수익 | - | 4,720 | 746,240 | 881,528 |
| 합 계 | 2,373,713 | 13,584,466 | 993,207 | 35,598,014 |
31. 비용의 성격별 분류
당분기 및 전분기 중 발생한 비용의 성격별 분류는 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 종업원급여 | 7,315,576 | 7,718,759 |
| 감가상각비 및 무형자산상각비 | 3,402,435 | 1,915,717 |
| 주식보상비용 | 2,324,846 | 2,334,111 |
| 세금과공과 | 1,806,111 | 4,838,393 |
| 연구재료 및 용역비 | 15,550,966 | 20,252,905 |
| 지급수수료 | 2,056,405 | 1,816,496 |
| 기타 | 1,720,483 | 1,865,438 |
| 매출원가 및 판매비와관리비의 합계 | 34,176,822 | 40,741,819 |
32. 판매비와관리비
당분기 및 전분기 중 판매비와관리비의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 1,195,248 | 3,560,368 | 1,020,574 | 2,955,629 |
| 퇴직급여 | 117,471 | 352,412 | 116,700 | 337,908 |
| 복리후생비 | 288,562 | 768,667 | 271,351 | 744,744 |
| 여비교통비 | 75,491 | 166,654 | 945 | 10,231 |
| 세금과공과 | 275,536 | 1,782,947 | 220,673 | 4,798,651 |
| 접대비 | 27,209 | 107,959 | 79,239 | 138,438 |
| 임차료 | - | 1,855 | 6,390 | 27,962 |
| 대손상각비(환입) | 16,475 | 37,044 | (4,000) | (10,100) |
| 감가상각비 | 321,011 | 962,549 | 211,056 | 515,432 |
| 경상연구개발비 | 6,864,873 | 18,887,717 | 6,649,626 | 24,096,732 |
| 차량유지비 | 22,875 | 60,743 | 16,405 | 49,579 |
| 지급수수료 | 465,160 | 1,436,028 | 403,618 | 1,123,231 |
| 자문료 | - | - | - | 3,000 |
| 기술료 | - | - | - | 541,638 |
| 보험료 | 21,025 | 65,505 | 18,468 | 44,362 |
| 주식보상비용 | 538,414 | 1,395,595 | 313,741 | 959,668 |
| 무형자산상각비 | 51,719 | 159,627 | 56,062 | 192,225 |
| 기타판매비와관리비 | 443,199 | 1,628,504 | 179,886 | 627,876 |
| 합 계 | 10,724,268 | 31,374,174 | 9,560,734 | 37,157,206 |
33. 기타수익과 기타비용
(1) 당분기 및 전분기 중 기타수익의 구성 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 수입배당금 | - | 433,751 | - | - |
| 수입임대료 | 103,475 | 313,823 | 144,108 | 374,746 |
| 외환차익 | 214,460 | 278,636 | 20,236 | 691,915 |
| 외화환산이익 | 1,532,804 | 2,689,818 | 375,579 | 511,240 |
| 당기손익금융자산처분이익 | 92,626 | 377,560 | - | - |
| 당기손익금융자산평가이익 | - | - | 9,512 | 330,617 |
| 관계기업손상차손환입 | - | - | (2,007,238) | - |
| 유형자산처분이익 | 15,060 | 33,158,873 | 275,171 | 276,911 |
| 기타의대손상각비환입 | - | - | 108,912 | 273,912 |
| 잡이익 | 169,582 | 682,480 | 895,045 | 1,230,412 |
| 합 계 | 2,128,007 | 37,934,941 | (178,675) | 3,689,753 |
(2) 당분기 및 전분기 중 기타비용의 구성 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차손 | 433,411 | 479,503 | 57,588 | 247,745 |
| 외화환산손실 | 2,461 | 3,229 | (148,754) | 534,538 |
| 당기손익금융자산처분손실 | - | - | 1,045,957 | 1,611,104 |
| 당기손익금융자산평가손실 | 42,231 | 510,529 | (130,147) | 2,363,315 |
| 관계기업손상차손 | 446,854 | 3,168,760 | 8,734,688 | 8,734,688 |
| 유형자산처분손실 | - | 26,896 | - | 7,314 |
| 유형자산손상차손 | - | - | 22,027 | 22,027 |
| 기부금 | 50,000 | 550,000 | - | 621,100 |
| 잡손실 | 24,004 | 172,828 | - | 139,417 |
| 합 계 | 998,961 | 4,911,745 | 9,581,359 | 14,281,248 |
34. 금융수익 및 금융비용
당분기 및 전분기 중 금융수익 및 금융비용의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 금융수익 | ||||
| 이자수익 | 44,199 | 124,011 | 142,481 | 150,230 |
| 파생상품평가이익 | 51,015 | 99,513 | 39,098 | 68,888 |
| 리스부채상환이익 | - | 11,232 | - | 5,682 |
| 합 계 | 95,214 | 234,756 | 181,579 | 224,800 |
| 금융비용 | ||||
| 이자비용 | 864,047 | 2,303,894 | 10,794 | 64,558 |
| 파생상품평가손실 | 367,411 | 1,563,404 | 850,932 | 2,138,745 |
| 합 계 | 1,231,458 | 3,867,298 | 861,726 | 2,203,303 |
35. 법인세비용
당사는 최근 사업연도까지 지속적 적자 발생 및 결손금 누적으로 법인세 부담액이 없으며, 또한 가까운 장래에 이연법인세자산이 실현될 만큼 충분한 과세소득이 발생할 것으로 기대하지 아니하여 이연법인세자산을 인식하지 않고 있습니다.
36. 주당손익
(1) 당분기 및 전분기의 기본주당손익의 계산내역은 다음과 같습니다.
| (단위 : 원,주) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 보통주분기순이익(손실) | (10,258,664,347) | 8,798,298,095 | (19,055,702,617) | (17,713,802,537) |
| 가중평균 유통보통주식수 | 25,142,960 | 25,095,186 | 25,009,595 | 24,892,453 |
| 기본주당이익(손실) | (408) | 351 | (762) | (712) |
(2) 당분기 및 전분기의 희석주당손익의 계산내역은 다음과 같습니다.
당사가 보유하고 있는 희석성 잠재적보통주는 전환사채, 주식매입선택권이 있으며, 희석주당손익은 모든 희석성 잠재적보통주가 보통주로 전환된다고 가정하여 조정한 가중평균 유통보통주식수를 적용하여 산정하고 있습니다.
| (단위 : 원,주) |
| 구 분 | 당분기 | 전분기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 보통주분기순이익(손실) | (10,258,664,347) | 8,798,298,095 | (19,055,702,617) | (17,713,802,537) |
| 조정사항(주1) | - | - | - | - |
| 희석효과반영 보통주분기순이익(손실) | (10,258,664,347) | 8,798,298,095 | (19,055,702,617) | (17,713,802,537) |
| 희석효과반영 가중평균 유통보통주식수 | 25,142,960 | 25,095,186 | 25,009,595 | 24,892,453 |
| 희석주당이익(손실) | (408) | 351 | (762) | (712) |
| (주1) 당분기와 전분기 중 희석성 잠재적보통주에 의한 희석효과가 없어 반영하지 아니하였습니다. |
37. 담보제공 및 약정사항 등
(1) 보고기간종료일 현재 금융기관과의 금융거래 약정사항은 다음과 같습니다.
| (단위 : 천원) |
| 금융기관 | 차입약정내용 | 당분기말 | 전기말 | ||
|---|---|---|---|---|---|
| 약정한도액 | 실행액 | 약정한도액 | 실행액 | ||
| 기업은행 | 시설자금대출 | 10,000,000 | 10,000,000 | 10,000,000 | 10,000,000 |
| 시설자금대출 | 20,000,000 | 20,000,000 | 20,000,000 | 20,000,000 | |
| 시설자금대출 | 20,000,000 | 17,900,000 | 20,000,000 | 8,600,000 | |
| 운전자금대출 | 10,000,000 | 10,000,000 | - | - | |
| 하나은행 | 운전자금대출 | 10,000,000 | 5,000,000 | - | - |
| 합 계 | 70,000,000 | 62,900,000 | 50,000,000 | 38,600,000 | |
(2) 보고기간종료일 현재 당사의 채무를 위하여 담보로 제공되어 있는 자산의 내역은다음과 같습니다.
| <당분기말> |
(단위 : 천원) |
| 담보제공자산 | 장부금액 | 담보설정금액 | 관련 채무 | 채무금액 | 담보권자 |
|---|---|---|---|---|---|
| 마곡 토지 | 22,136,915 | 60,000,000 | 단기차입금 | 10,000,000 | 기업은행 |
| 마곡 사옥 | 63,833,827 | 장기차입금 | 20,000,000 | 기업은행 | |
| 장기차입금 | 17,900,000 | 기업은행 | |||
| 단기차입금 | 10,000,000 | 기업은행 | |||
| 12,000,000 | 단기차입금 | 5,000,000 | 하나은행 | ||
| I-Mab 주식(주1) | 1,726,064 | 1,726,064 | - | - | 한미약품 |
| (주1) 당사는 한미약품과 체결한 GX-19N의 제조위수탁계약과 관련하여 발생하는 채무를 담보하기 위하여 I-Mab 주식 30만 ADR을 담보로 제공하였습니다. |
| <전기말> | (단위 : 천원) |
| 담보제공자산 | 장부금액 | 담보설정금액 | 관련 채무 | 채무금액 | 담보권자 |
|---|---|---|---|---|---|
| 분양 토지 | 19,418,470 | 13,000,000 | 단기차입금 | 10,000,000 | 기업은행 |
| 판교 사옥 | 16,591,685 | 60,000,000 | 장기차입금 | 20,000,000 | 기업은행 |
| 장기차입금 | 8,600,000 | 기업은행 | |||
| I-Mab 주식(주1) | 16,854,254 | 16,854,254 | - | - | 한미약품 |
| (주1) 당사는 한미약품과 체결한 GX-19N의 제조위수탁계약과 관련하여 발생하는 채무를 담보하기 위하여 I-Mab 주식 30만 ADR을 담보로 제공하였습니다. |
(3) 보고기간종료일 현재 당사가 타인으로부터 제공받은 지급보증의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 지급보증제공자 | 보증내용 | 보증한도 | |
|---|---|---|---|
| 당분기말 | 전기말 | ||
| 서울보증보험 | 이행보증 | 927,119 | 927,119 |
(4) 보고기간종료일 현재 회사가 가입한 보험내역은 다음과 같습니다.
| (단위 : 천원) |
| 지급보증제공자 | 보증내용 | 부보금액 | 부보내역 | |
|---|---|---|---|---|
| 당분기말 | 전기말 | |||
| 재산종합보험 | 롯데손해보험 | 12,030,000 | 12,030,000 | 본사사옥 재물위험담보_시설, 기계, 차량, 집기비품 등 |
| 환경책임보험 | DB손해보험 | 5,000,000 | 5,000,000 | 본사사옥 환경오염 배상책임_수질오염 |
| 재산종합보험 | 흥국화재해상보험 | 96,143,423 | 96,143,423 | 마곡사옥 재물위험담보_시설, 기계, 집기비품 등 |
당사는 상기 보험 이외에 업무용자동차보험, 임상시험배상책임보험, 임직원단체상해보험, 임원배상책임보험 등에 가입하고 있습니다.
(5) 마곡산업단지 토지 취득과 관련하여 서울주택도시공사로부터 1,451,653천원의 기부채납 이행 요청을 받았으나 당사는 이에 불복하여 소송 진행 중에 있으며, 또한 코스온 투자전환사채 5,000,000천원 관련하여 당사가 담보 목적으로 설정한 근저당권에 대한 취소 소송이 제기되어 있습니다. 당분기말 현재 상기 소송사건의 결과는 예측할 수 없습니다.
38. 특수관계자 거래
(1) 당분기 및 전분기 중 특수관계자 현황은 다음과 같습니다.
| 특수관계구분 | 당분기 | 전분기 |
|---|---|---|
| 관계기업 | 아지노모도제넥신㈜ | 아지노모도제넥신㈜ |
| 관계기업 | ㈜툴젠 | ㈜툴젠 |
| 관계기업 | ㈜큐로젠 | ㈜큐로젠 |
| 관계기업 | NIT (NeoImmuneTech, Inc.) | NIT (NeoImmuneTech, Inc.) |
| 관계기업 | Simnogen (Simnogen Biotech Co. Ltd) | Simnogen (Simnogen Biotech Co. Ltd) |
| 관계기업 | KG-Bio (PT Kalbe-Genexine Biologics) | KG-Bio (PT Kalbe-Genexine Biologics) |
| 공동기업 | ILKOGEN | ILKOGEN |
| 공동기업 | Rezolute, Inc. | Rezolute, Inc. |
| 공동기업 | CoImmune, Inc. | CoImmune, Inc. |
| 공동기업 | KinGen Biotech | KinGen Biotech |
| 종속기업 | ㈜에스엘포젠 | ㈜에스엘포젠 |
| 기타특수관계자 | ㈜한독 | ㈜한독 |
| 기타특수관계자 | ㈜에스엘바이젠 | ㈜에스엘바이젠 |
(2) 당분기 및 전분기 중 특수관계자 거래 내역은 다음과 같습니다.
| (단위 : 천원) |
| 특수관계자 구분 | 특수관계자명 | 당분기 | 전분기 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 매출 | 기타수익 | 자산매입 | 기타비용 | 매출 | 기타수익 | 자산매입 | 기타비용 | ||
| 관계기업 | 아지노모도제넥신㈜ | - | 433,751 | - | - | - | - | - | - |
| 관계기업 | NIT | 1,319,820 | 104,002 | - | 136,121 | 967,643 | 44,617 | - | - |
| 관계기업 | KG-Bio | 9,701,600 | - | - | - | 29,911,246 | - | - | - |
| 공동기업 | KinGen Biotech | - | - | - | 185,965 | - | - | - | 743,013 |
| 종속기업 | ㈜에스엘포젠 | - | - | - | 5,235,014 | 746,000 | 135,594 | 4,088,135 | 1,930,977 |
| 기타특수관계자 | ㈜한독 | - | - | - | 1,598 | - | 121,861 | - | 68,845 |
| 기타특수관계자 | ㈜에스엘바이젠 | - | - | - | - | - | - | 100,000 | - |
(3) 당분기 및 전분기 중 특수관계자와의 자금거래 내역은 다음과 같습니다.
| (단위 : 천원) |
| 특수관계자 구분 | 특수관계자명 | 당분기 | 전분기 | ||||
|---|---|---|---|---|---|---|---|
| 자금대여 | 자금차입 | 현금출자 | 자금대여 | 자금차입 | 현금출자 | ||
| 관계기업 | KG-Bio | - | - | - | - | - | 20,025,000 |
| 공동기업 | KinGen Biotech | - | - | - | - | - | 1,098,153 |
| 종속기업 | ㈜에스엘포젠 | - | - | - | - | - | 5,542,000 |
(4) 보고기간종료일 현재 특수관계자에 대한 채권ㆍ채무잔액은 다음과 같습니다.
| <당분기말> | (단위 : 천원) |
| 특수관계구분 | 특수관계자명 | 채 권 | 채 무 | ||||
|---|---|---|---|---|---|---|---|
| 매출채권 | 미수금 | 선급금 | 미지급금 | 예수금 | 임대보증금 | ||
| 관계기업 | 툴젠 | - | 22,966 | - | - | - | - |
| 관계기업 | 큐로젠 | - | 1,041 | - | - | - | - |
| 관계기업 | NIT | 23,563 | 678,591 | 658,037 | 1,608 | - | - |
| 관계기업 | KG-Bio | 9,756,640 | 51,097 | 282,015 | - | - | - |
| 공동기업 | KinGen Biotech | 358,700 | - | - | - | - | - |
| 종속기업 | ㈜에스엘포젠 | - | 5,379 | - | 1,138,071 | - | - |
| 기타특수관계자 | ㈜한독 | - | 3,382 | 52,292 | 344 | - | - |
| <전기말> | (단위 : 천원) |
| 특수관계구분 | 특수관계자명 | 채 권 | 채 무 | ||||
|---|---|---|---|---|---|---|---|
| 매출채권 | 미수금 | 선급금 | 미지급금 | 예수금 | 임대보증금 | ||
| 관계기업 | NIT | 163,031 | 212,475 | 364,238 | - | - | - |
| 관계기업 | KG-Bio | - | 306,661 | 425,370 | - | - | - |
| 공동기업 | KinGen Biotech | 296,375 | - | - | - | - | - |
| 종속기업 | ㈜에스엘포젠 | - | 4,871 | 22,192 | 773,544 | - | - |
| 기타특수관계자 | ㈜한독 | - | 59,090 | 80,800 | - | 130,686 | 105,420 |
(5) 당분기 및 전분기 중 주요 경영진에 대한 보상내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 급여 | 1,078,294 | 663,992 |
| 퇴직급여 | 102,692 | 129,930 |
| 주식보상비용 | 707,070 | 43,546 |
| 합 계 | 1,888,056 | 837,468 |
주요 경영진은 당사의 활동의 계획ㆍ운영ㆍ통제에 대한 중요한 권한과 책임을 가진 이사(비상임포함) 및 감사가 포함되어 있습니다.
39. 현금흐름표
(1) 당분기 및 전분기 중 영업으로부터 창출된 현금흐름의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 분기순이익(손실) | 8,798,298 | (17,713,803) |
| 수익/비용의 조정 | (23,744,149) | 18,084,096 |
| 이자비용 | 2,303,894 | 64,558 |
| 감가상각비 | 2,681,097 | 1,400,052 |
| 무형자산상각비 | 350,852 | 515,665 |
| 투자부동산상각비 | 46,906 | - |
| 퇴직급여등 | 615,336 | 782,722 |
| 주식보상비용 | 2,324,846 | 2,334,111 |
| 외화환산손실 | 3,229 | 534,538 |
| 당기손익금융자산평가손실 | 510,529 | 1,988,608 |
| 당기손익금융자산처분손실 | - | 1,985,810 |
| 파생상품평가손실 | 1,563,404 | 2,138,744 |
| 관계종속기업주식손상차손 | 3,168,760 | 8,734,688 |
| 유형자산처분손실 | 26,896 | 7,314 |
| 유형자산손상차손 | - | 22,027 |
| 대손상각비 | 37,044 | - |
| 기타손실 | 246,634 | 80,394 |
| 이자수익 | (124,011) | (150,230) |
| 배당금수익 | (433,751) | - |
| 외화환산이익 | (2,689,818) | (511,240) |
| 당기손익금융자산평가이익 | - | (330,617) |
| 당기손익금융자산처분이익 | (377,560) | - |
| 파생상품평가이익 | (99,513) | (68,888) |
| 유형자산처분이익 | (33,158,873) | (276,911) |
| 대손상각비환입 | - | (284,012) |
| 기타이익 | (740,050) | (883,237) |
| 영업활동으로 인한 자산부채의 변동 | (16,349,668) | (17,863,422) |
| 매출채권의 감소(증가) | (7,233,155) | 1,259,255 |
| 기타채권의 감소(증가) | 109,924 | (654,498) |
| 당기법인세자산의 감소(증가) | (44,739) | (35,407) |
| 기타유동자산의 감소(증가) | (6,246,616) | (10,757,842) |
| 기타비유동자산의 감소(증가) | 323,842 | 534,853 |
| 기타채무의 증가(감소) | (3,231,806) | (9,368,019) |
| 기타유동부채의 증가(감소) | - | 147,858 |
| 순확정급여부채의 증가(감소) | (16,750) | 102,407 |
| 기타비유동부채의 증가(감소) | (10,368) | 907,971 |
| 영업으로부터 창출된 현금 | (31,295,519) | (17,493,129) |
(2) 당분기와 전분기 중 재무활동에서 생기는 부채의 변동내역은 다음과 같습니다.
| <당분기> | (단위 : 천원) |
| 구 분 | 기초 | 재무활동현금흐름 | 대체 | 기말 |
|---|---|---|---|---|
| 전환사채 | 13,145,813 | - | 1,375,138 | 14,520,951 |
| 차입금 | 38,600,000 | 24,300,000 | - | 62,900,000 |
| 리스부채 | 299,805 | (138,485) | 56,698 | 218,018 |
| 임대보증금(장기) | 6,500,000 | - | (129,971) | 6,370,029 |
| 합 계 | 58,545,618 | 24,161,515 | 1,301,865 | 84,008,998 |
| <전분기> | (단위 : 천원) |
| 구 분 | 기초 | 재무활동현금흐름 | 대체 | 기말 |
|---|---|---|---|---|
| 전환사채 | 11,509,347 | - | 1,203,161 | 12,712,508 |
| 차입금 | 15,200,000 | 17,800,000 | - | 33,000,000 |
| 리스부채 | 358,590 | (137,409) | 57,246 | 278,427 |
| 임대보증금 | - | 6,500,000 | - | 6,500,000 |
| 합 계 | 27,067,937 | 24,162,591 | 1,260,407 | 52,490,935 |
(3) 당분기와 전분기 중 현금의 유ㆍ출입이 없는 중요한 거래는 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 유형자산 토지와 건물의 투자부동산 대체 | 3,087,669 | - |
| 장기차입금의 유동성 대체 | 588,220 | - |
| 기타포괄손익금융자산의 관계기업투자 대체 | - | 3,000,180 |
40. 영업부문 정보
(1) 당사의 보고부문은 단일의 영업부문으로 구성되어 있으며, 영업부문은 최고영업의사결정자에게 보고되는 내부 보고자료와 동일한 방법으로 보고되고 있습니다.
(2) 당분기 및 전분기 중 지역별 매출액은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| 국 내 | 704,528 | 2,200,621 |
| 아시아 | 9,701,600 | 29,917,155 |
| 미 주 | 3,178,338 | 3,480,238 |
| 합 계 | 13,584,466 | 35,598,014 |
(3) 당분기 및 전분기 중 매출액의 10%이상을 차지하는 주요 고객 및 당해 고객으로부터의 매출액은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당분기 | 전분기 |
|---|---|---|
| A사 | 9,701,600 | 29,911,246 |
| 합 계 | 9,701,600 | 29,911,246 |
6. 배당에 관한 사항
당사는 정관 제 58조에 이익배당에 관해 규정하고 있습니다.
가. 배당에 관한 사항
| 제14조(신주의 배당기산일) 회사가 유상증자, 무상증자 및 주식배당에 의하여 발행한 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전 영업연도 말에 발행된 것으로 본다. 제57조(이익금의 처분) 회사는 매사업년도의 처분 전 이익잉여금을 다음과 같이 처분한다. 1. 이익준비금 2. 기타의 법정준비금 3. 배당금 4. 임의적립금 5. 기타의 이익잉여금처분액 제58조(이익배당) ① 이익의 배당은 금전, 주식 및 기타의 재산으로 할 수 있다. ② 이익의 배당을 주식으로 하는 경우 회사가 수종의 주식을 발행한 때에는 주주총회의 결의에 따라 그와 다른 종류의 주식으로도 할 수 있다. ③ 제1항의 배당은 매결산기 말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④ 이익배당은 주주총회의 결의로 정한다. 다만 제55조 제4항에 따라 이사회가 재무제표를 승인하는 경우 이사회의 결의로 이익배당을 정한다. 제59조(배당금 지급청구권의 소멸시효) ① 배당금의 지급청구권은 5년간 이를 행사하지 아니하면 소멸시효가 완성된다. ② 제1호의 시효의 완성으로 인한 배당금은 이 회사에 귀속된다. 제60조(분기배당) ① 회사는 이사회의 결의로 사업연도 개시일부터 3월· 6월 및 9월의 말일(이하 “분기배당 기준일”이라한다)의 주주에게 자본시장과 금융투자업에 관한 법률 제 165조의12에 따라 분기배당을 할 수 있다. ② 제1항의 이사회 결의는 분기배당 기준일 이후 45일 내에 하여야 한다. ③ 분기배당은 직전결산기의 대차대조표상의 순자산액에서 다음 각호의 금액을 공제한 액을 한도로 한다. 1. 직전결산기의 자본금의 액 2. 직전결산기까지 적립된 자본준비금과 이익준비금의 합계액 3. 직전결산기의 정기주주총회에서 이익배당하기로 정한 금액 4. 직전결산기까지 정관의 규정 또는 주주총회의 결의에 의하여 특정목적을 위해 적립한 임의준비금 5. 상법 시행령 제19조에서 정한 미실현이익 6. 분기배당에 따라 당해 결산기에 적립하여야 할 이익준비금의 합계액 ④ 사업연도 개시일 이후 분기배당 기준일 이전에 신주를 발행한 경우(준비금의 자본전입, 주식배당, 전화사채의 전환청구, 신주인수권부사채의 신주인수권 행사에 의한 경우를 포함한다)에는 분기배당에 관해서는 당해 신주는 직전사업연도 말에 발행된 것으로 본다. 다만, 분기배당 기준일 후에 발행된 신주에 대하여는 최근 분기배당 기준일 직후에 발행된 것으로 본다. ⑤ 제9조의 우선주식에 대한 분기배당은 보통주식과 동일한 배당률을 적용한다. |
주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제24기 3분기 | 제23기 | 제22기 | ||
| 주당액면가액(원) | 500 |
500 | 500 | |
| (연결)당기순이익(백만원) | (18,125) | -48,561 | 27,536 | |
| (별도)당기순이익(백만원) | 8,798 | -51,142 | 18,242 | |
| (연결)주당순이익(원) | (702) | -1,915 | 1,149 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
과거 배당 이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
※ 최근 5년간 당사는 배당을 지급한 이력이 없습니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| (기준일 : | 2022년 9월 30일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2018.01.23 | 주식매수선택권행사 | 보통주 | 21,850 | 500 | 25,775 | 행사가 2종(17,600원, 25,775원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2018.02.02 | 주식매수선택권행사 | 보통주 | 17,600 | 500 | 27,500 | - |
| 2018.02.09 | 주식매수선택권행사 | 보통주 | 16,700 | 500 | 25,775 | 행사가 3종(7,500원, 9,350원 25,775원)의 주식매수선택권 행사 청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2018.03.12 | 주식매수선택권행사 | 보통주 | 37,100 | 500 | 27,500 | 행사가 2종(17,600원, 25,775원, 27,500원)의 주식매수선택권 행사 청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2018.03.19 | 주식매수선택권행사 | 보통주 | 43,000 | 500 | 9,350 | - |
| 2018.04.13 | 주식매수선택권행사 | 보통주 | 191,700 | 500 | 31,000 | 행사가 4종(9,350원, 25,775원, 27,500원, 31,000원)의 주식매수 선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2018.05.19 | 유상증자(제3자배정) | 우선주 | 2,219,749 | 500 | 90,100 | - |
| 2018.06.11 | 주식매수선택권행사 | 보통주 | 14,700 | 500 | 31,000 | 행사가 3종(9,350원, 17,600원, 31,000원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2018.07.13 | 주식매수선택권행사 | 보통주 | 7,000 | 500 | 31,000 | 행사가 3종(9,350원, 17,600원, 31,000원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2018.08.10 | 주식매수선택권행사 | 보통주 | 2,100 | 500 | 31,000 | 행사가 2종(9,350원, 31,000원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2018.09.07 | 주식매수선택권행사 | 보통주 | 11,100 | 500 | 62,400 | 행사가 4종(9,350원, 27,500원, 31,000원, 62,400원)의 주식매수 선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2019.01.11 | 주식매수선택권행사 | 보통주 | 9,000 | 500 | 31,000 | 행사가 3종(9,350원, 27,500원, 31,000원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2019.01.30 | 주식매수선택권행사 | 보통주 | 2,000 | 500 | 9,350 | - |
| 2019.02.22 | 주식매수선택권행사 | 보통주 | 6,750 | 500 | 31,000 | 행사가 3종(9,350원, 27,500원, 31,000원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2019.04.04 | 주식매수선택권행사 | 보통주 | 90,000 | 500 | 46,300 | 행사가 3종(17,600원, 31,000원, 46,300원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2019.05.10 | 주식매수선택권행사 | 보통주 | 17,000 | 500 | 46,300 | 행사가 4종(17,600원, 25,775원, 31,000원, 46,300원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2019.06.11 | 주식매수선택권행사 | 보통주 | 12,000 | 500 | 17,600 | - |
| 2019.08.09 | 주식매수선택권행사 | 보통주 | 8,000 | 500 | 46,800 | - |
| 2019.08.21 | 전환권행사 | 보통주 | 348,812 | 500 | 63,070 | 전환우선주의 보통주 전환청구 |
| 2019.09.10 | 주식매수선택권행사 | 보통주 | 5,700 | 500 | 53,000 | - |
| 2019.09.18 | 전환권행사 | 보통주 | 443,950 | 500 | 63,070 | 전환우선주의 보통주 전환청구 |
| 2019.09.24 | 전환권행사 | 보통주 | 1,426,985 | 500 | 63,070 | 전환우선주의 보통주 전환청구 |
| 2019.10.10 | 전환권행사 | 보통주 | 475,655 | 500 | 63,070 | 전환우선주의 보통주 전환청구 |
| 2019.11.08 | 주식매수선택권행사 | 보통주 | 12,600 | 500 | 41,750 | 행사가 4종(17,600원, 47,750원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2019.11.27 | 전환권행사 | 보통주 | 475,661 | 500 | 63,070 | 전환우선주의 보통주 전환청구 |
| 2020.02.03 | 주식매수선택권행사 | 보통주 | 15,100 | 500 | 46,300 | 행사가 5종(9,350원, 17,600원, 31,000원, 41,750원, 46,300원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2020.02.14 | 주식매수선택권행사 | 보통주 | 8,050 | 500 | 39,950 | - |
| 2020.04.01 | 주식매수선택권행사 | 보통주 | 1,750 | 500 | 39,950 | - |
| 2020.05.04 | 주식매수선택권행사 | 보통주 | 11,000 | 500 | 41,750 | 행사가 4종(9,350원, 17,600원, 39,950원, 41,750원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2020.05.19 | 주식매수선택권행사 | 보통주 | 17,000 | 500 | 41,300 | - |
| 2020.06.03 | 주식매수선택권행사 | 보통주 | 5,300 | 500 | 46,300 | 행사가 2종(46,300원, 41,750원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2020.07.01 | 주식매수선택권행사 | 보통주 | 15,900 | 500 | 9,350 | 행사가 4종(9,350원, 41,750원, 39,950원, 41,300원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2020.07.30 | 전환권행사 | 보통주 | 40,101 | 500 | 87,278 | 전환사채의 전환청구권 행사 |
| 2020.08.05 | 전환권행사 | 보통주 | 360,915 | 500 | 87,278 | 전환사채의 전환청구권 행사 |
| 2020.08.10 | 주식매수선택권행사 | 보통주 | 14,600 | 500 | 17,600 | 행사가 4종(17,600원, 46,300원, 41,750원, 39,950원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2020.09.09 | 주식매수선택권행사 | 보통주 | 9,400 | 500 | 9,350 | 행사가 2종(9,350원, 41,750원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2020.10.08 | 주식매수선택권행사 | 보통주 | 300 | 500 | 41,750 | - |
| 2020.11.10 | 주식매수선택권행사 | 보통주 | 8,000 | 500 | 9,350 | - |
| 2020.12.22 | 유상증자(제3자배정) | 보통주 | 429,061 | 500 | 136,400 | - |
| 2021.01.13 | 주식매수선택권행사 | 보통주 | 20,000 | 500 | 9,350 | 행사가 2종(9,350원, 46,300원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2021.02.04 | 주식매수선택권행사 | 보통주 | 4,600 | 500 | 41,750 | - |
| 2021.02.10 | 주식매수선택권행사 | 보통주 | 29,190 | 500 | 78,950 | - |
| 2021.03.08 | 주식매수선택권행사 | 보통주 | 20,000 | 500 | 57,400 | - |
| 2021.03.17 | 주식매수선택권행사 | 보통주 | 100,100 | 500 | 97,100 | - |
| 2021.04.07 | 주식매수선택권행사 | 보통주 | 17,667 | 500 | 9,350 | 행사가 3종(9,350원, 41,750원, 78,950원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2021.05.03 | 주식매수선택권행사 | 보통주 | 46,267 | 500 | 9,350 | 행사가 3종(9,350원, 41,750원, 78,950원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2021.06.07 | 주식매수선택권행사 | 보통주 | 30,400 | 500 | 9,350 | 행사가 2종(9,350원, 41,750원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2021.07.02 | 주식매수선택권행사 | 보통주 | 43,434 | 500 | 9,350 | 행사가 4종(9,350원, 39,950, 41,750, 78,950원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2021.08.13 | 주식매수선택권행사 | 보통주 | 3,300 | 500 | 9,350 | 행사가 3종(9,350원, 41,750, 85,900원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2021.09.02 | 주식매수선택권행사 | 보통주 | 15,800 | 500 | 9,350 | 행사가 2종(9,350원, 41,750원)의 주식매수선택권 행사청구로 인해 행사가중 1종을 주당발행가액으로 표기함 |
| 2021.10.15 | 주식매수선택권행사 | 보통주 | 600 | 500 | 41,750 | - |
| 2022.04.07 | 주식매수선택권행사 | 보통주 | 82,850 | 500 | 17,600 | - |
| 2022.05.06 | 주식매수선택권행사 | 보통주 | 26,000 | 500 | 17,600 | - |
| 2022.06.08 | 주식매수선택권행사 | 보통주 | 1,000 | 500 | 9,350 | - |
| 2022.07.04 | 주식매수선택권행사 | 보통주 | 3,000 | 500 | 9,350 | - |
| 2022.08.02 | 주식매수선택권행사 | 보통주 | 3,000 | 500 | 9,350 | - |
☞ 당사는 공정가액 접근법(옵션가격결정모형 중 Black& Scholes Model 적용)을 활용하여 행사가능 기간에 따라 행사 가능수량을 가중평균하여 산정합니다.
미상환 전환사채 발행현황
| (기준일 : | 2022.09.30 | ) | (단위 : 백만원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 제6회 제넥신 기명식 무보증 사모전환사채 | 6 | 2018.05.18 | 2023.05.18 | 50,000 | 보통주 | 2019.05.18 ~ 2023.05.17 | 70 | 87,278 | 15,000 | 171,864 | 2018.08.19 시가하락에 따른 가격조정 (최초 전환가 : 102,680, 조정후 전환가 87,278원) |
| 제7회 제넥신 기명식 무보증 사모전환사채 | 7 | 2020.12.17 | 2025.12.17 | 20,000 | 보통주 | 2021.12.17 ~ 2025.12.16 | 100 | 119,807 | 20,000 | 166,935 | 2021.03.17 시가하락에 따른 가격조정 (최초 전환가 : 140,950원, 조정 후 전환가 119,807원) |
| 제2회 에스엘포젠 기명식 무보증 사모전환사채 | 2 | 2020.03.12 | 2035.03.12 | 900 | 보통주 | 2020.09.12 ~ 2035.03.11 | 100 | 5,000 | 900 | 180,000 | - |
| 합 계 | - | - | - | 70,900 | - | - | - | - | 35,900 | 518,799 | - |
☞ 상기 전환가액의 금액 단위는 '원' 입니다.
☞ 보고서 기준일 현재, 제6회차 전환사채는 20년 07월 30일 35억원, 20년 08월 05일 315억원 총 350억원이 전환되었으며, 콜옵션 행사로 인해 20년 12월 18일 135억원을 자기사채로 취득하였습니다.
| [채무증권의 발행 등과 관련된 사항] |
| (기준일 : | 2022.09.30 | ) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| (주)제넥신 | 회사채 | 사모 | 2018.05.18 | 15,000 | 0 | - | 2023.05.18 | 미상환 | - |
| (주)제넥신 | 회사채 | 사모 | 2020.12.17 | 20,000 | 0 | - | 2025.12.17 | 미상환 | - |
| 주식회사 에스엘포젠 | 회사채 | 사모 | 2020.03.12 | 900 | 0 | - | 2035.03.12 | 미상환 | - |
| 합 계 | - | - | - | 35,900 | - | - | - | - | - |
☞ 보고서 기준일 현재, 제6회차 전환사채는 20년 07월 30일 35억원, 20년 08월 05일 315억원 총 350억원이 전환되었으며, 콜옵션 행사로 인해 20년 12월 18일 135억원을 자기사채로 취득하였습니다.
기업어음증권 미상환 잔액
| (기준일 : | 2022.09.30 |
) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
☞ 해당사항 없습니다.
단기사채 미상환 잔액
| (기준일 : | 2022.09.30 |
) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
☞ 해당사항 없습니다.
회사채 미상환 잔액
| (기준일 : | 2022.09.30 |
) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | 15,000 | - | - | 20,000 | - | - | 900 | 35,900 | |
| 합계 | 15,000 | - | - | 20,000 | - | - | 900 | 35,900 | |
신종자본증권 미상환 잔액
| (기준일 : | 2022.09.30 |
) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
☞ 해당사항 없습니다.
조건부자본증권 미상환 잔액
| (기준일 : | 2022.09.30 |
) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
☞ 해당사항 없습니다.
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
사모자금의 사용내역
| (기준일 : | 2022.09.30 |
) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 전환사채 | 6 | 2018.05.18 | 운영자금 | 50,000 | 운영자금 | 50,000 | - |
| 전환사채 | 7 | 2020.12.18 | 타법인 투자 | 20,000 | 타법인 투자 | 20,000 | - |
8. 기타 재무에 관한 사항
대손충당금 변동현황
(단위 : 천원)
| 구 분 | 제24기 | 제23기 | 제22기 |
| 기초 대손충당금 잔액 | 1,126,382 | 1,115,018 | 1,134,195 |
| 2. 순대손처리액(1)-(2)±(3) | (26,000) | 285,012 | 19,176 |
| (1)대손처리액(상각채권액) | - | - | - |
| (2)상각채권회수액 | 26,000 | (285,012) | (19,176) |
| (3)기타증감액 | - | - | - |
| 3. 대손상각비 계상(환입)액 | 63,044 | 296,375 | - |
| 4. 기말 대손충당금 잔액합계 | 1,163,425 | 1,126,382 | 1,115,018 |
대손충당금 설정기준
- 당사는 당분기말 현재 매출채권 등의 회수가능성에 대한 개별분석 및 과거의 대손경험율을 토대로 하여 예상되는 대손추정액을 대손충당금으로 설정하고 있습니다.
재고자산 보유현황
| 계정과목 | 제24기 | 제23기 | 제22기 |
| 제 품 | - | - | - |
| 재 공 품 | - | - | - |
| 상 품 | - | - | - |
| 원 재 료 | - | - | - |
| 부 재 료 | - | - | - |
| 소 계 | - | - | - |
| 총자산대비 재고자산 구성비율(%) [재고자산합계÷기말자산총계×100] |
- | - | - |
| 재고자산회전율(회수) [연환산 매출원가÷{(기초재고+기말재고)÷2}] |
- | - | - |
☞ 공시서류 작성기준일 현재 보유중인 재고자산은 없습니다.
재고자산 실사내용
☞ 해당사항 없습니다.
금융상품의 공정가치
본문III. 재무에 관한 사항 - 5. 연결재무제표 주석 - 4. 위험관리부문 - (2) 재무위험관리를 참조하시길 바랍니다.
본문III. 재무에 관한 사항 - 5. 연결재무제표 주석 - 4. 위험관리부문 - (3) 금융상품의 공정가치를 참조하시길 바랍니다.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
1. 회계감사인의 명칭 및 감사의견
| 사업연도 | 감사인 | 감사의견 | 강조사항 등 | 핵심감사사항 |
|---|---|---|---|---|
| 2022년 제24기 (당기) | 대성삼경회계법인 | 검토 | - | - |
| 2021년 제23기 (전기) | 대성삼경회계법인 | 적정 | - | 관계기업투자의 손상검사 |
| 2020년 제22기 (전전기) | 대성삼경회계법인 | 적정 | - | 금융상품의 공정가치 평가 |
2. 감사용역 체결현황
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제24기(당기) | 대성삼경회계법인 | 분반기 검토 기말 감사 | 165,000 | 2,000 | 80,000 | 703 |
| 제23기(전기) | 대성삼경회계법인 | 분반기 검토 기말 감사 | 165,000 | 2,016 | 165,000 | 2,020 |
| 제22기(전전기) | 대성삼경회계법인 | 반기 검토 기말 감사 | 110,000 | 1,247 | 110,000 | 1,248 |
3. 회계감사인과의 비감사용역 계약체결 현황
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제24기(당기) | - | - | - | - | - |
| 제23기(전기) | - | - | - | - | - |
| 제22기(전전기) | 2020.10 | 세무조정 | 2주 | 6,000 | - |
4. 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 내부감사기구가 회계감사인과 논의한 결과
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2021.12.09 | 회사측: 감사외 2인 감사인측: 업무수행이사외 1인 |
대면회의 | 감사계획 및 중간감사 경과보고 |
| 2 | 2022.03.10 |
회사측: 감사외 2인 감사인측: 업무수행이사외 1인 |
서면회의 | 주요 감사중점사항 및 연간감사 경과보고 |
| 3 | 2022.04.27 |
회사측: 감사외 2인 감사인측: 업무수행이사외 1인 |
대면회의 | 1분기 검토 결과, 22년 외부감사 수행 일정 등 |
| 4 | 2022.07.22 |
회사측: 감사외 2인 감사인측: 업무수행이사외 1인 |
대면회의 | 반기 검토 결과, 핵심감사사항 선정 협의 등 |
5. 조정협의내용 및 재무제표 불일치정보
- 해당사항 없음
2. 내부통제에 관한 사항
[회계감사인의 내부회계관리제도 감사의견 및 검토 의견]
| 사업연도 | 감사인 | 감사의견 및 검토 의견 | 지적사항 |
| 제23기 | 대성삼경회계법인 | [감사의견] 회사의 내부회계관리제도는 2021년 12월 31일 현재 「내부회계관리제도 설계 및 운영 개념체계」에 따라 중요성의 관점에서 효과적으로 설계 및 운영되고 있습니다. | 해당사항 없음 |
| 제22기 | 대성삼경회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 "중소기업에 대한 적용"의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
| 제21기 | 대성삼경회계법인 | 경영진의 내부회계관리제도 운영실태보고서에 대한 우리의 검토결과, 상기 경영진의 운영실태보고 내용이 중요성의 관점에서 내부회계관리제도 모범규준 제5장 "중소기업에 대한 적용"의 규정에 따라 작성되지 않았다고 판단하게 하는 점이 발견되지 아니하였습니다. | 해당사항 없음 |
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사회의 구성 개요
보고서 작성기준일 현재 당사의 이사회는 사내이사 3명(우정원, Neil Warma, 홍성준),사외이사 2명(Peter Laivins, 배진건), 기타비상무이사 2명(김영진, 이혁종), 상근감사 1명(전현철), 총 8명의 등기임원으로 구성되어 있으며, 당사는 우정원 대표이사 체제에서 Neil Warma 대표이사의 신규취임을 통해 우정원 대표이사와 Neil Warma 대표이사의 각자대표 체제로 변경하였습니다. 각 이사의 주요 이력 및 업무분장은 'Ⅷ. 임원 및 직원 등에 관한 사항 - 1. 임원 및 직원의 현황'을 참조하시기 바랍니다.
사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 7 | 2 | 2 | - | 2 |
☞ 본 보고서 제출일 전일 현재 당사의 이사는 총 7명이며, 이 중 사외이사는 2명입니다.
☞ 2022년03월29일 신의철 사외이사가 일신상의 사유로 중도 퇴임하였고, Neil Warma 사외이사는 사내이사로 변경 선임 후 대표이사로 신규 선임되었습니다
☞ 2022년 03월 29일 정기주주총회에서 Peter Laivins 사외이사, 배진건 사외이사가 신규 선임되었습니다.
나. 이사회내 위원회
당사는 현재 기준 별도의 위원회를 설치하지 않았습니다.
다. 이사의 독립성
이사회에서는 제품개발, 기술이전, 연구개발 및 경영전반에 관한 토의가 이루어지며 중요한 경영상의 의사결정의 경우 이사회의 의견을 기반으로 결정하고 있습니다. 이사회 구성원 중 사외이사와 기타비상무이사는 모두 4명이며 비상근 이사비율이 57%로 이사회의 독립성은 유지되고 있다고 판단됩니다.
라. 중요 의결 사항 및 사외이사 활동내역 (2022.01.01.~ 2022.09.30)
| 회차 | 개최일자 | 의안내용 | 가결 여부 | 사내이사 | 기타 비상무이사 | 사외이사 | ||||||||
| 성영철 (출석율 100%) |
우정원 (출석율 100%) |
Neil Warma (출석율 100%) |
홍성준 (출석율 100%) |
김영진 (출석율 100%) |
이혁종 (출석율 80%) |
신의철 (출석율 100%) |
Neil warma (출석율 100%) |
Peter Laivins (출석율 100%) |
배진건 (출석율 100%) |
|||||
| 찬 반 여 부 | ||||||||||||||
| 1 | 2022.02.18 | 결의 | - 2021년 재무제표 승인의 건(감사 전 재무제표) | 가결 | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | - | 찬성 | 찬성 | - | - |
| 2 | 2022.03.07 | 결의 | - 사내이사 선임의 건 - 감사 선임의 건 - 주주총회 전자투표제 도입의 건 - 정관 변경의 건 - 주식매수선택권 부여의 건(이사 외 임직원) - 주식매수선택권 부여의 건(등기이사) - 주식매수선택권 취소의 건 - 한도대출 승인의 건 - 이사 보수 한도 승인의 건 - 감사 보수 한도 승인의 건 - 주주총회 소집 결의의 건 |
가결 | 찬성 | 찬성 | - | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | - | - |
| 3 | 2022.03.14 | 결의 | - 사외이사 선임의 건 - 주식매수선택권 부여의 건(등기 이사 및 상근 감사) - 제23기 정기 주주총회 세부안건 확정 및 정정의 건 |
가결 | 찬성 | 찬성 | - | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | - | - |
| 4 | 2022.03.17 | 결의 | - 2021년 재무제표 승인의 건(감사 후 재무제표) - PPQ 비용 승인의 건 - 한도 대출 변경 승인의 건 |
가결 | 찬성 | 찬성 | - | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | - | - |
| 보고 | - 내부회계관리제도 운영실태 보고의 건 - 감사의 내부회계관리제도 운영실태 평가보고의 건 |
보고 | - | - | - | - | - | - | - | - | - | - | ||
| 5 | 2022.03.29 | 결의 | - 이사회 의장 선임의 건 - 각자 대표이사 선임의 건 - 마곡 R&D Center Ⅱ 건축 승인의 건 - 평가보상위원회 설치 및 운영의 건 - 본점이전 및 마곡지점 폐쇄의 건 - 한도 대출 변경 승인의 건 |
가결 | - | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | - | 찬성 | 찬성 | 찬성 |
| 6 | 2022.05.13 | 보고 | - 신임 대표이사 업무 보고의 건 - 자금현황 보고의 건 - 투자자산 현황 보고의 건 - 1분기 손익 보고의 건 |
보고 | - | - | - | - | - | - | - | - | - | - |
| 7 | 2022.07.14 | 결의 | - 한도대출 승인의 건 - 미국지사 폐쇄의 건 |
가결 | - | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | - | 찬성 | 찬성 | 찬성 |
| 보고 | - 비용 절감 계획 보고의 건 - 투자자산현황 보고의 건 - 마곡 Ⅱ 건설 보고의 건 |
보고 | - | - | - | - | - | - | - | - | - | - | ||
| 8 | 2022.09.26 | 결의 | - 유상증자 신주 발행의 건 | 가결 | - | 찬성 | 찬성 | 찬성 | 찬성 | 찬성 | - | 찬성 | 찬성 | 찬성 |
| 보고 | - 2분기 재무제표 보고의 건 - 마곡 Ⅱ 건설 현황 보고의 건 |
보고 | - | - | - | - | - | - | - | - | - | - | ||
☞ 사내이사 Neil Warma는 당사 2022년 03월 29일 정기주주총회에서 신규선임되었습니다
☞ 사외이사 Peter Laivins와 사외이사 배진건은 당사 2022년 03월29일 정기주주총회에서 신규 선임되었습니다.
☞ 사내이사 성영철은 2022년 03월 29일 일신상의 사유로 사임하였습니다.
☞ 사외이사 신의철은 2022년 03월 29일 일신상의 사유로 사임하였습니다.
사외이사 교육 미실시 내역
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | 당사는 이사회 개최전 안건 내용을 충분히 검토할수 있도록 사전에 자료를 제공하고 있습니다. 향후 사외이사의 전문성 강화를 위하여 교육이 필요할 경우 교육을 실시할 예정입니다. |
2. 감사제도에 관한 사항
가. 감사의 인적사항
| 성 명 | 주요 경력 | 결격요건 여부 | 비고 |
| 전현철 | 강원랜드㈜ 감사위원 한화큐셀 감사위원 애경산업 감사위원 새시대회계법인 Managing partner(現) |
해당사항 없음 | 상근 (2022.03.29 선임) |
나. 감사의 독립성
감사는 회사의 회계와 업무를 감사하며 이사회 및 타 부서로부터 독립된 위치에서 업무를 수행하고 있습니다. 그 직무를 수행하기 위해서 제반 업무와 관련하여 관련 장부 및 관계서류를 해당부서에 제출을 요구할 수 있습니다. 또한 필요시 회사로부터 영업에 관한 사항을 보고 받을 수 있으며, 적절한 방법으로 경영정보에 접근할 수 있습니다.
다. 감사의 주요 활동 내용
| 회차 | 개최일자 | 의안내용 | 전현철 | 백성기 | |
| 1 | 2022.02.18 | 결의 | - 2021년 재무제표 승인의 건(감사 전 재무제표) | - | 출석 |
| 2 | 2022.03.07 | 결의 | - 사내이사 선임의 건 - 감사 선임의 건 - 주주총회 전자투표제 도입의 건 - 정관 변경의 건 - 주식매수선택권 부여의 건(이사 외 임직원) - 주식매수선택권 부여의 건(등기이사) - 주식매수선택권 취소의 건 - 한도대출 승인의 건 - 이사 보수 한도 승인의 건 - 감사 보수 한도 승인의 건 - 주주총회 소집 결의의 건 |
- | 출석 |
| 3 | 2022.03.14 | 결의 | - 사외이사 선임의 건 - 주식매수선택권 부여의 건(등기 이사 및 상근 감사) - 제23기 정기 주주총회 세부안건 확정 및 정정의 건 |
- | 출석 |
| 4 | 2022.03.17 | 결의 | - 2021년 재무제표 승인의 건(감사 후 재무제표) - PPQ 비용 승인의 건 - 한도 대출 변경 승인의 건 |
- | 출석 |
| 보고 | - 내부회계관리제도 운영실태 보고의 건 - 감사의 내부회계관리제도 운영실태 평가보고의 건 |
- | 출석 | ||
| 5 | 2022.03.29 | 결의 | - 이사회 의장 선임의 건 - 각자 대표이사 선임의 건 - 마곡 R&D Center Ⅱ 건축 승인의 건 - 평가보상위원회 설치 및 운영의 건 - 본점이전 및 마곡지점 폐쇄의 건 - 한도 대출 변경 승인의 건 |
출석 | - |
| 6 | 2022.05.13 | 보고 | - 신임 대표이사 업무 보고의 건 - 자금조달계획 보고의 건 - 투자자산 현황 보고의 건 - 1분기 손익 보고의 건 |
출석 | |
| 7 | 2022.07.14 | 결의 | - 한도대출 승인의 건 - 미국지사 폐쇄의 건 |
출석 | |
| 보고 | - 비용 절감 계획 보고의 건 - 투자자산현황 보고의 건 - 마곡 Ⅱ 건설 보고의 건 |
출석 | |||
| 8 | 2022.09.26 | 결의 | - 유상증자 신주 발행의 건 | 출석 | |
| 보고 | - 2분기 재무제표 보고의 건 - 마곡 Ⅱ 건설 현황 보고의 건 |
출석 | |||
☞ 감사 백성기는 임기 만료의 사유로 2022년 3월 29일부 퇴임 하였습니다.
라. 감사 교육실시 현황
| 교육일자 | 교육실시주체 | 주요 교육내용 |
|---|---|---|
| 2022.05.31 | (사)한국감사인연합회 | 공시정보의 신뢰성 제고방안 |
마. 감사 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 내부회계관리Part | 1 | 파트장 1명 (11년 3개월) |
- 재무활동 건전성 및 타당성 검토지원 - 내부회계관리제도 운영실태 검토지원 |
| 법무팀 | 1 | 변호사 1명 (1년 6개월) |
- 준법감사 및 일상감사 관련 자료검토 - 감사록 및 회의록 작성, 유지 |
바. 준법지원인지원조직 현황
보고서 작성 기준일 현재 선임된 내역이 없습니다.
3. 주주총회 등에 관한 사항
가. 투표제도
당사는 정관상 서면투표제와 전자투표제를 채택하고 있으며, 집중투표제는 채택하고 있지 않습니다.
투표제도 현황
| (기준일 : | 2022.09.30 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 도입 | 도입 |
| 실시여부 | - | - | 실시 (2022.03.29) |
☞ 당사는 제 23기 정기주주총회에서 전자위임장 및 전자투표제를 채택하였습니다.
나. 소수주주권
당사는 공시대상 기간 중 소수주주권이 행사된 사실이 없습니다.
다. 경영권 경쟁
당사는 공시대상 기간 중 경영지배권에 대하여 경쟁사실이 없었습니다.
라. 의결권 현황
| (기준일 : | 본공시서류 제출일 전일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 25,144,982 | - |
| 우선주 | - | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 25,144,982 | - |
| 우선주 | - | - |
마. 주식사무
| 정관상 신주인수권의 내용 | 정관 제12조 (신주인수권) ① 주주는 그가 소유한 주식의 수에 비례하여 신주의 배정을 받을 권리를 갖는다. ② 회사는 제1항의 규정에도 불구하고 다음 각 호의 어느 하나에 해당하는 경우 이사회의 결의로 주주 이외의 자에게 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우 2. 상법 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선배정하는 경우 4. 근로자복지기본법 제32조의2의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우 5. 발행주식총수의 100분의 50을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 6. 발행주식총수의 100분의 50을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산·판매·자본제휴를 위하여 그 상대방에게 신주를 발행하는 경우 7. 주권을 유가증권시장 또는 코스닥시장에 신규 상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 ③ 제2항 각호 중 어느 하나의 규정에 의해 신주를 발행할 경우 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다. ④ 신주인수권의 포기 또는 상실에 따른 주식과 신주배정에서 발생한 단주에 대한 처리방법은 이사회의 결의로 정한다. |
||
| 결 산 일 | 12월 31일 | 정기주주총회 | 매사업연도 종료후 3월이내 |
| 주주명부폐쇄시기 | 매년 01월 01일 부터 01월 07일 까지 | ||
| 주식등의 전자등록 | 회사는「주식ㆍ사채 등의 전자등록에 관한 법률」제2조 제1호에 따른 주식등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식등을 전자등록하여야 한다. | ||
| 명의개서대리인 | 국민은행 증권대행부 | ||
| 주주의 특전 | 신주인수권 | 공고게재신문 | 매일경제신문 |
바. 주주총회 의사록 요약
| 주총일자 | 안건 | 결의내용 |
| 제 23기 정기주주총회 | 제 1호 의안 : 제23기(2021.01.01~2021.12.31) 재무제표(결손금처리계산서(안)포함) 및 연결재무제표 승인의 건 | 보고사항으로 변경 |
| 제 2호 의안 : 정관 일부 변경의 건 | 가결 | |
| 제 3호 의안 : 이사 신규선임의 건 | 가결 | |
| - 3-1호 안건 : 사내이사 Neil Warma 신규선임의 건 | ||
| - 3-2호 안건 : 사외이사 Peter Laivins 신규 선임의 건 | ||
| - 3-3호 안건 : 사외이사 배진건 신규 선임의 건 | ||
| 제 4호 의안 : 감사 전현철 신규 선임의 건 | 가결 | |
| 제 5호 의안 : 이사 보수한도 승인의 건 | 가결 | |
| 제 6호 의안 : 감사 보수한도 승인의 건 | 가결 | |
| 제 7호 의안 : 주식매수선택권 부여 승인의 건 (이사회 부여분) | 가결 | |
| 제 8호 의안 : 주식매수선택권 부여 승인의 건 (등기임원 및 감사) | 가결 | |
| 제 22기 정기주주총회 | 제 1 호 의안 : 제22기(2020.01.01~2020.12.31) 재무제표(결손금처리계산서(안)포함) 및 연결재무제표 승인의 건 | 보고사항으로 변경 |
| 제 2호 의안 : 이사 (재)선임의 건 | 가결 | |
| - 2-1호 안건 : 사내이사 성영철 재선임의 건 | ||
| - 2-2호 안건 : 사내이사 우정원 신규 선임의 건 | ||
| - 2-3호 안건 : 사내이사 홍성준 신규 선임의 건 | ||
| - 2-4호 안건 : 사외이사 Mr. Neil Warma 신규 선임의 건 | ||
| - 2-5호 안건 : 기타비상무이사 김영진 재선임의 건 | ||
| 제 3호 의안 : 이사 보수한도 승인의 건 | 가결 | |
| 제 4호 의안 : 감사 보수한도 승인의 건 | 가결 | |
| 제 5호 의안 : 주식매수선택권 부여 승인의 건 (이사회 부여분) | 가결 | |
| 제 6호 의안 : 주식매수선택권 부여 승인의 건 (신임 사외이사) | 가결 | |
| 제 7호 의안 : 임원퇴직금 지급규정 변경안 승인의 건 | 가결 | |
| 제 21기 정기주주총회 | 제 1 호 의안 : 제21기(2019.01.01.~2019.12.31.) 재무제표 및 결손금처리계산서(안) 승인의 건 |
보고사항으로 변경 |
| 제 2 호 의안 : 이사 (재)선임의 건 | 가결 | |
| - 제 2-1 호 : 사외이사 신의철 신규 선임의 건 | ||
| - 제 2-2 호 : 기타비상무이사 이혁종 신규 선임의 건 | ||
| - 제 2-3 호 : 사내이사 서유석 재선임의 건 | ||
| 제 3 호 의안 : 주식매수선택권 승인의 건 | 가결 | |
| 제 4 호 의안 : 이사 보수한도 승인의 건 | 가결 | |
| 제 5 호 의안 : 감사 보수한도 승인의 건 | 가결 |
VI. 주주에 관한 사항
1. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2022년 11월 14일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| (주)한독 | 최대주주 | 보통주 | 3,781,017 | 15.11 | 3,781,017 | 15.04 | - |
| 계 | 보통주 | 3,781,017 | 15.11 | 3,781,017 | 15.04 | - | |
| - | - | - | - | - | - | ||
2. 최대주주의 주요경력 및 개요
당사 최대주주인 (주)한독은 1954년 4월27일 설립되었으며 1976년 6월 30일 유가증권시장에 상장 되었습니다. 보고서 작성 기준일 현재 영위하고 있는 주요 사업은 의약품, 제약원료 등의 연구개발과 제조 판매업 등 입니다.
(1) 최대주주(법인 또는 단체)의 기본정보
| 명 칭 | 출자자수 (명) |
대표이사 (대표조합원) |
업무집행자 (업무집행조합원) |
최대주주 (최대출자자) |
|||
|---|---|---|---|---|---|---|---|
| 성명 | 지분(%) | 성명 | 지분(%) | 성명 | 지분(%) | ||
| (주)한독 | - | 김영진 | 13.65 | - | - | 김영진 외 | 43.38 |
| 백진기 | 0.01 | - | - | - | - | ||
(2) 최대주주(법인 또는 단체)의 최근 결산기 재무현황
| (단위 : 백만원) |
| 구 분 | |
|---|---|
| 법인 또는 단체의 명칭 | (주)한독 |
| 자산총계 | 841,562 |
| 부채총계 | 457,565 |
| 자본총계 | 383,996 |
| 매출액 | 517,641 |
| 영업이익 | 28,006 |
| 당기순이익 | 3,289 |
(3) 사업현황 등 회사 경영 안정성에 영향을 미칠 수 있는 주요 내용
최대주주 법인의 사업부문
| 사업부문 | 주요사업영역 | 주요제품 |
| 의약품 | 전문 및 일반 의약품 제조 및 판매 | 당뇨병치료제 아마릴, 테넬리아, 관절염 치료제 케토톱, 소화제 훼스탈, 폐동맥 고혈압치료제 트라클리어, 옵서미트, 업트라비, 골다공증 치료제 비비안트, 본비바/본비바플러스, 희귀질환 PNH치료제 솔리리스, 불면증 치료제 스틸녹스 등 |
| 의료기기 | 의료기기, 연구기자재 판매 | 면역 검사용 장비 아텔리카, 센토, 임상화학검사용 장비 아텔리카, 비스타, 검사실 자동화 장비 아텔리카 솔루션 외 잠복결핵검사 시약 , QuantiFERON, Life science research 시약 및 장비, 혈당측정기 바로잰, 혈압측정기 바로잰, 콜레스테롤분석기 바로잰, 연속혈당측정기 등 |
| 건강기능식품 등 | 식품, 건강기능식품, 의료용식품의 제조 및 판매업 | 건강지향 브랜드 레디큐/레디큐 츄, 테라큐민, 프로바이오틱스 컬처렐, 건강기능식품 네이처셋, 특수의료용도등식품 네오케이트, 엘리멘탈, 인파트리니 등 |
| 부동산 임대업 | 사옥 등 일부 임대 | 본사 사옥 일부 임대 등 |
3. 최대주주의 최대주주(법인 또는 단체)의 개요
최대주주 변동내역
-해당사항 없음
4. 주식 소유현황
| (기준일 : | 2022.09.30 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 성영철 | 1,487,064 | 5.91 | - |
| - | - | - | - | |
| 우리사주조합 | 3,830 | 0.02 | - | |
5. 소액주주현황
| (기준일 : | 2022.06.30 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 100,028 | 100,032 | 99.9 | 19,525,413 | 25,138,982 | 77.67 | - |
| 주) 상기 주주 및 소유주식수, 지분율은 2022년 6월 30일 기준으로 수령한 주주 명부를 기준으로 작성되었습니다. |
6. 최근 주가 및 주식거래실적
| (단위: 원, 주) |
| 종 류 | 2022년 09월 | 2022년 08월 | 2022년 07월 | 2022년 06월 | 2022년 05월 | 2022년 04월 | |
| 보통주 | 최 고 | 29,450 | 33,850 | 34,600 | 37,800 | 39,400 | 44,900 |
| 최 저 | 20,700 | 29,300 | 29,400 | 28,600 | 32,850 | 37,950 | |
| 월간거래량 | 3,675,297 | 2,453,954 | 2,095,849 | 2,025,571 | 2,162,933 | 2,118,914 | |
| 주) 주가의 경우 해당 일자의 종가 기준 |
| 출처: 한국거래소 |
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
임원 현황
| (기준일 : | 2022.11.14 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 성영철 | 남 | 1956.05 | 고문 | 미등기 | 비상근 | 전략과학자문위원회 의장 |
University of Minesota 대학원 졸업 (1988.01) 현. ㈜제넥신 전략과학자문위원회 의장 전. ㈜제넥신 대표이사(2019.01.~2021.12.) 전. 대한면역학회 회장(2006.01~2007.12) 전. ㈜제넥신 대표이사(2005.01~2015.12) |
1,487,064 | - | - | 7개월 | - |
| 우정원 | 여 | 1960.01 | 대표이사 (각자) |
사내이사 | 상근 | R&D 총괄 | 코넬대학교 미생물학과(박사) 졸업(1992.12) 현. ㈜제넥신 대표이사(각자) 전. 서울성모병원 연구계약교원(2011.10~2013.04) 전. 삼성생명과학연구소 선임연구원(1995.01~1997.05) |
3,000 | - | - | 9년 6개월 |
2024.03.29 |
| Neil Warma |
남 | 1963.01 | 대표이사 (각자) |
사내이사 | 상근 | CEO | Finance and Marketing, York University MBA(1992) 현. ㈜제넥신 대표이사(각자) 전. I-Mab Biopharma U.S General Manager(2019.09~2022.05) 전. Opexa Therapeutics, Inc. CEO(2008~2018) |
- | - | - | 7개월 | 2025.03.29 |
| 홍성준 | 남 | 1965.07 | 부사장 | 사내이사 | 상근 | 경영지원실 실장 | Vanderbilt Law School 법학과(석사) 졸업(2004.05) 연세대학교 경영학과(석사) 졸업(1993.02) 현. ㈜제넥신 부사장(CFO) 전. 로킷헬스케어 총괄사장(2019.09~2020.07) 전. 한독 전무(CFO) (2017.03~2019.09) 전. 슈나이더일렉트릭코리아 부사장(CFO) (2011.11~2016.06) |
2,000 |
- | - | 2년 2개월 |
2024.03.19 |
| 배진건 | 남 | 1951.12 | 사외이사 | 사외이사 | 비상근 | 사외이사 | University of Wisconsin-Madison (1982.08) 현. ㈜제넥신 사외이사 현. 이노큐어 테라퓨틱스 SVP 전. 한독 상임고문 (2011.11~2016.10) 전. C&C신약연구소 대표이사 (2008.11~2010.12) 전. JW중외제약 연구소장 (2008.11~2010.12) |
- | - | - | - | 2025.03.29 |
| Peter Laivins |
남 | 1958.11 | 사외이사 | 사외이사 | 비상근 | 사외이사 | McGill University MBA(1983.05) 현. ㈜제넥신 사외이사 현. NeuroCognitive Insights., Independent Consultant 전. Alzheon, Inc. Chief Commercial Officer(2019.01~2021.01) 전. TESARO, Inc. Senior Vice President(2017.01~2018.08) |
- | - | - | - | 2025.03.29 |
| 김영진 | 남 | 1956.11 | 기타비상무이사 | 기타비상무이사 | 비상근 | 공동개발 대외협력 |
Indiana University Kelley School of Business MBA (1984) 현. 한독 대표이사 회장 |
- | - | 임원 | - | 2024.03.29 |
| 이혁종 | 남 | 1969.11 | 기타비상무이사 | 기타비상무이사 | 비상근 | 공동개발 대외협력 |
University of California, Berkeley, Haas School of Business, MBA (1999.06) 현. ㈜바이넥스 대표이사 전. ㈜에이비엘바이오 비상임이사(2017.02~2019.03) 전. ㈜제넥신 대표이사(2005.01~2011.04) |
- | - | - | - | 2023.03.20 |
| 전현철 | 남 | 1958.06 | 감사 | 감사 | 상근 | 감사 | 연세대학교 경영학과 대학원 졸업(1985.08) 현. ㈜제넥신 상근감사 현. 회계법인새시대 파트너 전. 안진회계법인 부대표이사(1994.04~2014.03) |
- | - | - | 7개월 | 2025.03.29 |
| 이장희 | 남 | 1961.09 | 부사장 | 미등기 | 상근 | 업무지원실 실장 |
광운대학교 전기공학과 졸업(1986.03) 현. ㈜제넥신 업무지원실 부사장 전. 태화이엔지(2003.08~2016.04) 전. ㈜제넥신(2001.04~2003.08) 전. ㈜삼환기업(1986.04~2001.04) |
1,400 | - | - | 4년 9개월 |
- |
| 박현진 | 여 | 1977.12 | 부사장 | 미등기 | 상근 | 사업개발실 실장 |
Aalto University, MBA(2019.02) 현. ㈜제넥신 사업개발실 부사장 전. 대웅제약 본부장(2005.01~2022.02) 전. GSK Korea Product Manager(2000.01~2003.12) |
- | - | - | 8개월 | - |
| 김기용 | 남 | 1960.01 | 전무 | 미등기 | 상근 | 바이오연구소 부소장 |
연세대학교 생화학과 대학원(박사) 졸업(2000.08) 현. (주)제넥신 바이오연구소 전무 전. 녹십자 부장(2005.07~2018.11) 전. NIH PostDoc(2003.04~2005.06) 전. 두비엘 이사(2000.10~2003.03) 전. 목암연구소 부장(1989.07~2000.10) 전. 현대중공업 사원(1986.01~1989.07) |
300 | - | - | 3년 11개월 |
- |
| 허민규 | 남 | 1974.11 | 상무 | 미등기 | 상근 | 임상개발실 실장 |
연세대학교 종양색물학 대학원(석사) 졸업(2004.02) 현. ㈜제넥신 임상개발실 상무 전. 중외 Creagene 임상팀 차장(2006.02~2014.08) 전 HBI PM(2005.01~2005.12) |
1,000 | - | - | 8년 1개월 | - |
| 김기완 | 남 | 1968.01 | 상무 | 미등기 | 상근 | 연구개발운영팀 팀장 |
서강대학교 미생물학과 대학원(석사) 졸업(1996.02) 현. ㈜제넥신 연구개발운영팀 상무 전. 엠디뮨㈜ 이사(2018.03~2019.01) 전. 바이로메드㈜ 부장(2017.06~2018.01) 전. CJ헬스케어 부장(1996.01~2017.05) |
- | - | - | 3년 4개월 | - |
| 최은호 | 남 | 1971.01 | 이사 | 미등기 | 상근 | 총무팀 팀장 |
고려대학교 경영학과 대학원(석사) 졸업(1997.02) 현. ㈜제넥신 총무팀 이사 전. SK네트웍스 팀장(2006.04~2013.12) 전. SK텔레텍 과장(2003.11~2006.04) 전. LG전자 과장(1997.01~2003.11) |
33 | - | - | 9년 1개월 | - |
| 신동민 | 남 | 1974.08 | 이사 | 미등기 | 상근 | IR/PR팀 팀장 | 홍콩과학기술대학교 MBA(2015.07) 현. ㈜제넥신 IR/PR팀 이사 전. 나노젠 JSC 이사(2018.04~2022.07) 전. 대우증권 부장(1999.08~2018.03) |
300 | - | - | 3개월 | - |
| 출처: 당사 제공 주1) 배성윤 이사는 2022년 07월 01월부로 퇴사하였으며, 신동민 이사는 2022년 07월 25일 신규 입사하였습니다. 주2) Neil Warma 대표이사(각자)는 격월로 한국과 미국에서 근무하며, 회사의 일상적인 업무를 총괄하고 있습니다. |
직원 등 현황
| (기준일 : | 2022.09.30 | ) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 연구소 | 남 | 23 | 0 | 0 | 0 | 23 | 2년11개월 | 1,067 | 46 | - | - | - | - |
| 연구소 | 여 | 39 | 0 | 0 | 0 | 39 | 4년1개월 | 1,916 | 49 | - | |||
| 임상/사업 | 남 | 8 | 0 | 0 | 0 | 8 | 1년11개월 | 385 | 48 | - | |||
| 임상/사업 | 여 | 14 | 0 | 0 | 0 | 14 | 4년 2개월 | 990 | 71 | - | |||
| 경영지원 등 | 남 | 16 | 0 | 1 | 0 | 17 | 4년10개월 | 895 | 53 | - | |||
| 경영지원 등 | 여 | 9 | 0 | 0 | 0 | 9 | 2년2개월 | 364 | 40 | - | |||
| 합 계 | 109 | 0 | 1 | 0 | 110 | 3년8개월 | 5,616 | 51 | - | ||||
☞ 급여총액(연간합계)은 스톡옵션 행사이익 등을 포함한 모든 근로소득을 합산한 금액이며, 1인평균 급여액은 급여총액을 직원수로 나눈 단순 평균 입니다.
미등기임원 보수 현황
| (기준일 : | 2022.09.30 | ) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 7 | 624 | 89 | - |
☞ 급여총액(연간합계)은 스톡옵션 행사이익 등을 포함한 모든 근로소득을 합산한 금액이며, 1인평균 급여액은 급여총액을 직원수로 나눈 단순 평균 입니다.
2. 임원의 보수 등
1. 주주총회 승인금액
| (단위 : 백만원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 7 | 1,500 | - |
| 감사 | 1 | 100 | - |
2. 보수지급금액
2-1. 이사ㆍ감사 전체
| (단위 : 백만원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 11 | 968 | 88 | - |
☞ 이사회의 구성원은 주주총회에서 승인받은 이사 7인 및 감사 1인이나, 퇴임 및 신규 선임으로 인한 인원변동으로 2022년 중 보수를 지급받은 이사 및 감사의 수는 11명입니다.
2-2. 유형별
| (단위 : 백만원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
6 | 883 | 147 | - |
| 사외이사 (감사위원회 위원 제외) |
3 | 45 | 15 | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 2 | 40 | 20 | - |
☞ 상기 보수총액은 주주총회 승인금액에 포함되지 않는 보수인 이사의 주식매입선택권 행사이익을 합산한 금액입니다.
☞ 1인당 평균보수액은 현재 재직 중인 인원수로 나눈 단순 평균값입니다.
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
☞ 상기 보수총액은 주주총회 승인금액에 포함되지 않는 보수인 이사의 주식매입선택권 행사이익을 합산한 금액입니다.
☞ 1인당 평균보수액은 현재 재직 중인 인원수로 나눈 단순 평균값입니다.
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
1. 개인별 보수지급금액
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
☞ 해당사항 없습니다.
<주식매수선택권의 부여 및 행사현황>
<표1>
| (단위 : 백만원) |
| 구 분 | 인원수 | 주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 | 4 | 662 | 2022년 3분기 주식보상비용 (우정원, Neil Warma, 홍성준, 이혁종) |
| 사외이사 | 2 | 35 | 2022년 3분기 주식보상비용 (Peter Laivins, 배진건) |
| 감사위원회 위원 또는 감사 | 1 | 17 | 2022년 3분기 주식보상비용 (전현철) |
| 업무집행지시자 | 7 | 332 | 2022년 3분기 주식보상비용 (미등기임원) |
| 계 | 14 | 1,046 | - |
<표2>
| (기준일 : | 2022.09.30 | ) | (단위 : 원, 주) |
| 부여 받은자 | 관 계 | 부여일 | 부여방법 | 주식의 종류 | 최초 부여수량 | 당기변동수량 | 총변동수량 | 기말 미행사수량 | 행사기간 | 행사가격 | 의무보유 여부 | 의무보유 기간 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||||
| 서유석 | 미등기임원 | 2013-03-15 | 신주교부 | 보통주 | 60,000 | - | - | 30,000 | - | 30,000 | 2021.03.15~2023.03.14 | 9,350 | X | X |
| OOO외 22인 | 직원 | 2013-03-15 | 신주교부 | 보통주 | 667,500 | 7,000 | - | 462,500 | 164,200 | 40,800 | 2021.03.15~2023.03.14 | 9,350 | X | X |
| OOO외 15인 | 직원 | 2014-03-21 | 신주교부 | 보통주 | 470,000 | 68,850 | 15,000 | 299,850 | 84,000 | 86,150 | 2022.03.21~2024.03.20 | 17,600 | X | X |
| 이성희 | 미등기임원 | 2018-02-06 | 신주교부 | 보통주 | 25,000 | - | - | - | - | 25,000 | 2021.02.06~2023.02.05 | 78,950 | X | X |
| OOO외 23인 | 직원 | 2018-02-06 | 신주교부 | 보통주 | 108,500 | - | - | 39,158 | 11,400 | 57,942 | 2021.02.06~2023.02.05 | 78,950 | X | X |
| OOO외 15인 | 직원 | 2018-08-08 | 신주교부 | 보통주 | 27,500 | - | - | 1,000 | 5,000 | 21,500 | 2021.08.08~2023.08.07 | 85,900 | X | X |
| 김광호 | 미등기임원 | 2018-10-12 | 신주교부 | 보통주 | 29,000 | - | - | - | - | 29,000 | 2021.10.12~2023.10.11 | 93,700 | X | X |
| OOO외 13인 | 직원 | 2019-05-22 | 신주교부 | 보통주 | 8,210 | - | - | - | 5,020 | 3,190 | 2022.05.22~2024.05.21 | 72,600 | X | X |
| 김기완 | 미등기임원 | 2019-11-28 | 신주교부 | 보통주 | 1,000 | - | - | - | - | 1,000 | 2022.11.28~2024.11.27 | 56,200 | X | X |
| OOO외 10인 | 직원 | 2019-11-28 | 신주교부 | 보통주 | 9,500 | - | 1,000 | - | 6,000 | 3,500 | 2022.11.28~2024.11.27 | 56,200 | X | X |
| OOO외 2인 | 직원 | 2019-11-28 | 신주교부 | 보통주 | 1,350 | - | - | - | 500 | 850 | 2022.12.27~2024.12.26 | 56,900 | X | X |
| 박종섭 | 미등기임원 | 2020-03-04 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2023.03.04~2025.03.03 | 58,800 | X | X |
| 허민규 | 미등기임원 | 2020-07-15 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2023.07.15~2025.07.14 | 96,500 | X | X |
| OOO외 30인 | 직원 | 2020-07-15 | 신주교부 | 보통주 | 97,500 | - | 20,000 | - | 46,000 | 51,500 | 2023.07.15~2025.07.14 | 96,500 | X | X |
| 김기완 | 미등기임원 | 2021-02-18 | 신주교부 | 보통주 | 1,500 | - | - | - | - | 1,500 | 2024.02.18~2026.02.17 | 104,100 | X | X |
| 이장희 | 미등기임원 | 2021-02-18 | 신주교부 | 보통주 | 1,800 | - | - | - | - | 1,800 | 2024.02.18~2026.02.17 | 104,100 | X | X |
| OOO외 28인 | 직원 | 2021-02-18 | 신주교부 | 보통주 | 39,900 | - | 13,100 | - | 21,450 | 18,450 | 2024.02.18~2026.02.17 | 104,100 | X | X |
| Neil warma | 등기임원 | 2021-03-29 | 신주교부 | 보통주 | 3,000 | - | - | - | - | 3,000 | 2024.03.29~2026.03.28 | 100,100 | X | X |
| OOO외 21인 | 직원 | 2021-08-13 | 신주교부 | 보통주 | 40,400 | - | 9,700 | - | 14,100 | 26,300 | 2024.08.13~2026.08.12 | 90,100 | X | X |
| 박현진 | 미등기임원 | 2022-03-07 | 신주교부 | 보통주 | 30,000 | - | - | - | - | 30,000 | 2025.03.07~2027.03.06 | 47,600 | X | X |
| 이장희 | 미등기임원 | 2022-03-07 | 신주교부 | 보통주 | 8,000 | - | - | - | - | 8,000 | 2025.03.07~2027.03.06 | 47,600 | X | X |
| 김기용 | 미등기임원 | 2022-03-07 | 신주교부 | 보통주 | 6,000 | - | - | - | - | 6,000 | 2025.03.07~2027.03.06 | 47,600 | X | X |
| 김기완 | 미등기임원 | 2022-03-07 | 신주교부 | 보통주 | 2,400 | - | - | - | - | 2,400 | 2025.03.07~2027.03.06 | 47,600 | X | X |
| 허민규 | 미등기임원 | 2022-03-07 | 신주교부 | 보통주 | 4,800 | - | - | - | - | 4,800 | 2025.03.07~2027.03.06 | 47,600 | X | X |
| 최은호 | 미등기임원 | 2022-03-07 | 신주교부 | 보통주 | 2,000 | - | - | - | - | 2,000 | 2025.03.07~2027.03.06 | 47,600 | X | X |
| OOO외 15인 | 직원 | 2022-03-07 | 신주교부 | 보통주 | 51,900 | - | 10,100 | - | 10,100 | 41,800 | 2025.03.07~2027.03.06 | 47,600 | X | X |
| Neil warma | 등기임원 | 2022-03-29 | 신주교부 | 보통주 | 100,000 | - | - | - | - | 100,000 | 2025.03.29~2027.03.28 | 45,300 | X | X |
| 우정원 | 등기임원 | 2022-03-29 | 신주교부 | 보통주 | 40,000 | - | - | - | - | 40,000 | 2025.03.29~2027.03.28 | 45,300 | X | X |
| 홍성준 | 등기임원 | 2022-03-29 | 신주교부 | 보통주 | 35,000 | - | - | - | - | 35,000 | 2025.03.29~2027.03.28 | 45,300 | X | X |
| 이혁종 | 등기임원 | 2022-03-29 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2025.03.29~2027.03.28 | 45,300 | X | X |
| Peter Laivins | 등기임원 | 2022-03-29 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2025.03.29~2027.03.28 | 45,300 | X | X |
| 배진건 | 등기임원 | 2022-03-29 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2025.03.29~2027.03.28 | 45,300 | X | X |
| 전현철 | 등기임원 | 2022-03-29 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2025.03.29~2027.03.28 | 45,300 | X | X |
| 합계 | 1,901,760 | 75,850 | 68,900 | 832,508 | 367,770 | 701,482 | ||||||||
☞ 당사는 공정가액 접근법(옵션가격결정모형 중 Black& Scholes Model 적용)을
활용하여 행사가능 기간에 따라 행사 가능수량을 가중평균하여 산정합니다.
VIII. 계열회사 등에 관한 사항
1. 계열회사 현황(요약)
| (기준일 : | 2022.09.30 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| 관계공동기업 | 4 | 11 | 15 |
2. 타법인출자 현황(요약)
| (기준일 : | 2022.09.30 | ) | (단위 : 백만원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | 2 | 6 | 8 | 196,003 | - | (5,243) | 190,760 |
| 일반투자 | 1 | 2 | 3 | 21,207 | - | (2,310) | 18,897 |
| 단순투자 | 3 | 10 | 13 | 243,838 | 618 | (194,361) | 50,094 |
| 계 | 6 | 18 | 24 | 461,047 | 618 | (201,914) | 259,751 |
3. 계통도
| 투자 / 피투자회사 | Unins(H.K.) In'l | (주)한독 테바 | (주)제넥신 (*) | (주)칼로스메디칼 | (주)엔비포스텍 | Theravalues Corporation |
Rezolute, Inc. |
|---|---|---|---|---|---|---|---|
| (주)한독 | 100.00% | 49.00% | 15.04% | 49.96% | 34.99% | 100% | 16.14% |
| (주)제넥신 | - | - | - | 1.59% | - | - | 4.96% |
| (주)툴젠 | - | - | - | - | - | - | - |
(*) 소유지분율은 20%미만이나 피투자회사의 이사회에 참여함에 따라 유의적인 영향력을 보유하는 것으로 판단됩니다
| 투자 / 피투자회사 | (주)이노큐브 | 툴젠(*) | 에스엘포젠 | ILKOGEN | KinGen Biotech |
젠스톰바이오과기유한공사 | TOOLGENKYRGYZ LLC |
|---|---|---|---|---|---|---|---|
| (주)한독 | 72.97% | - | - | - | - | - | - |
| (주)제넥신 | - | 14.24% | 63.65% | 50.00% | 50.00% | - | - |
| (주)툴젠 | - | - | - | - | - | 50.00% | 100.00% |
(*) 소유지분율은 20%미만이나 피투자회사의 이사회에 참여함에 따라 유의적인 영향력을 보유하는 것으로 판단됩니다.
4. 임원의 계열회사 겸직 현황
'XI. 상세표'를 참고하시기 바랍니다.
IX. 대주주 등과의 거래내용
1. 대주주등에 대한 신용공여
당사는 보고서 제출일 현재 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
당사는 보고서 제출일 현재 해당사항이 없습니다.
| 3. 대주주와의 영업거래 | (단위 : 천원) |
| 법인명 | 매출 | 기타수익 | 매입 | 기타비용 등 |
|---|---|---|---|---|
| ㈜한독 | - | - | - | 1,598 |
4. 대주주 이외의 이해관계자와의 거래
최근 3개년간 대주주를 제외한 5%이상 주식을 소유한 주주는 아래와 같으며, 해당 주주와의 거래내역은 보고서 제출일 현재 해당사항이 없습니다.
| (단위: 천원, %) |
| 성명 | 2021년 | 2020년 | 2019년 | |||
|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | 주식수 | 지분율 | |
| 성영철 | 1,476,891 | 5.90 | 1,476,891 | 5.98 | 1,779,891 | 7.49 |
| 지엑스신한인터베스트 제1호 사모투자합자회사 | - | - | - | - | 1,426,985 | 6.01 |
5. 특수관계자와의 거래
(1) 보고기간종료일 현재 회사의 특수관계자 내역은 다음과 같습니다.
| 회사와의 관계 | 당분기말 | 전기말 |
|---|---|---|
| 공동기업 | Rezolute, Inc(주1) | Rezolute, Inc(주1) |
| CoImmune, Inc. | CoImmune, Inc. | |
| ILKOGEN | ILKOGEN | |
| KinGen Biotech, Inc | KinGen Biotech, Inc | |
| 관계기업 | 아지노모도제넥신(주) | 아지노모도제넥신(주) |
| NIT(NeoImmuneTech, Inc.) | NIT(NeoImmuneTech, Inc.) | |
| Simnogen(Simnogen Biotech Co. Ltd) | Simnogen(Simnogen Biotech Co. Ltd) | |
| KG-Bio(PT Kalbe-Genexine Biologics) | KG-Bio(PT Kalbe-Genexine Biologics) | |
| (주)툴젠(주1) | (주)툴젠(주1) | |
| (주)큐로젠(주2) | (주)큐로젠(주2) | |
| 기타특수관계자 | 한독 | 한독 |
| (주)에스엘바이젠 | (주)에스엘바이젠 |
|
| 연결대상 종속기업 | (주)에스엘포젠 | (주)에스엘포젠 |
| (주1) 지분율이 20% 미만이나 투자약정에 의거 피투자회사에 대한 임원 선임권 등이 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업및공동기업으로 분류하였습니다. (주2) 당사 임원이 피투자회사의 사외이사를 겸직하고 있어 유의적인 영향력이 있는 것으로 판단하여 관계기업으로 분류하였습니다. (주3) 당분기말 현재 (주)툴젠 985,721주와 NeoImmuneTech, Inc. 20,936,000주는 보호예수로 인해 매각이 제한되어 있습니다. |
(2) 당분기 중 특수관계자간 거래내역은 다음과 같습니다.
| (단위 : 천원) |
| 특수관계자 구분 | 특수관계자명 | 당분기 | ||
|---|---|---|---|---|
| 매출(주) | 기타수익 | 기타비용 | ||
| 관계기업 | NIT | 1,319,820 | 104,002 | 136,121 |
| 관계기업 | KG-Bio | 9,701,600 | - | - |
| 공동기업 | KinGen Biotech | - | 185,965 | |
| 연결대상 종속기업 | ㈜에스엘포젠 | - | - | 5,235,014 |
| 기타특수관계자 | ㈜한독 | - | - | 1,598 |
(3) 당분기 중 특수관계자간 자금거래내역은 다음과 같습니다.
| (단위 : 천원) |
| 특수관계자명 | 대여 | 출자 | 배당금 수익 | 배당금 지급 |
|---|---|---|---|---|
| 아지노모도제넥신 | - | - | 433,751 | - |
| 출처: 당사 정기보고서 |
(4) 보고기간종료일 현재 특수관계자와의 거래에서 발생한 주요 채권, 채무의 내역은 다음과 같습니다.
| 특수관계구분 | 특수관계자명 | 채 권 | 채 무 | ||||
|---|---|---|---|---|---|---|---|
| 매출채권 | 미수금 | 선급금 | 미지급금 | 예수금 | 임대보증금 | ||
| 관계기업 | 툴젠 | - | 22,966 | - | - | - | - |
| 관계기업 | 큐로젠 | - | 1,041 | - | - | - | - |
| 관계기업 | NIT | 23,563 | 678,591 | 658,037 | 1,608 | - | - |
| 관계기업 | KG-Bio | 9,756,640 | 51,097 | 282,015 | - | - | - |
| 공동기업 | KinGen Biotech | 358,700 | - | - | - | - | - |
| 연결대상 종속기업 | ㈜에스엘포젠 | - | 5,379 | - | 1,138,071 | - | - |
| 기타특수관계자 | ㈜한독 | - | 3,382 | 52,292 | 344 | - | - |
| 주) 외화로 발생한 채권, 채무에 적용된 환율은 1434.80입니다. |
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
해당사항 없음
2. 우발부채 등에 관한 사항
가. 중요한 소송사건
마곡산업단지 토지 취득과 관련하여 서울주택도시공사로부터 1,451,653천원의 기부채납 이행 요청을 받았으나 당사는 이에 불복하여 소송 진행 중에 있으며, 또한 코스온 투자전환사채 5,000,000천원 관련하여 당사가 담보 목적으로 설정한 근저당권에 대한 취소 소송이 제기되어 있습니다. 당분기말 현재 상기 소송사건의 결과는 예측할 수 없습니다.
나. 채무 보증 현황
본문III. 재무에 관한 사항 - 5. 연결재무제표 주석 -37. 담보제공 및 약정사항 등
을 참조하시길 바랍니다.
다. 채무 인수약정 현황
해당사항 없음
라. 견질 또는 담보용 어음ㆍ수표 현황
견질 또는 담보용 어음ㆍ수표 현황
| (기준일 : 2022.09.30 ) | (단위 : 매, 백만원) |
| 제 출 처 | 매 수 | 금 액 | 비 고 |
|---|---|---|---|
| 은 행 | - | - | - |
| 금융기관(은행제외) | - | - | - |
| 법 인 | - | - | - |
| 기타(개인) | - | - | - |
- 해당사항 없습니다.
3. 제재 등과 관련된 사항
가. 한국거래소 등으로부터 받은 제재
당사는 공시대상기간 중 한국거래소로부터 제재사항을 통보 받은 바 없습니다.
나. 단기매매차익 발생 및 환수 현황
당사는 공시대상기간 중 단기매매차익 발생사실을 증권선물위원회로부터 통보 받은 바 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 작성기준일 이후 발생한 주요사항
| 신고일자 | 제목 | 신고내용 | 신고사항의 진행상황 |
| - | - | - | - |
나. 인증현황
| 인증정보 | 인증기관 | 인증일자 | 유효기간 | 관련법령 | |
| 시작일 | 종료일 | ||||
| 벤처기업인증 | 벤처기업확인기관 | 2022.03.23 | 2022.01.26 | 2025.01.25 | 벤처기업육성에 관한 특별조치법 |
| 이노비즈인증(AA) | 중소벤처기업부 | 2022.03.31 | 2022.04.25 | 2025.04.24 | 중소기업기술혁신촉진법 |
| 혁신형제약기업 | 보건복지부 | 2020.11.30 | 2020.11.28 | 2023.11.27 | 제약산업육성 및 지원에 관한 특별법 |
| 기업부설연구소 | 한국산업기술진흥협회 | 2005.01.21 | 유지중 | 기초연구진흥 및 기술개발지원에 관한 법률 | |
다. 중소기업기준 검토표
 |
|
중소기업등기준검토표_1 |
 |
|
중소기업등기준검토표_2 |
라. 보호예수 현황
| (기준일 : | 2022.09.30 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 |
|---|---|---|---|---|---|---|
| 해당사항 없음 | - | - | - | - | - | - |
마. 특례상장기업 관리종목 지정유예 현황
| (기준일 : | 2022.09.30 | ) | (단위 : 천원, %) |
| 관리종목 지정요건 | 요건별 회사 현황 | 관리종목 지정요건 해당여부 |
관리종목지정유예 | |||
|---|---|---|---|---|---|---|
| 항목 | 사업연도 | 금액/비율 | 해당 여부 |
종료 시점 |
||
| 최근 사업연도말 매출액 30억원 미만 |
최근 사업연도말 매출액(별도) | 2021년 | 38,320,455 | 미해당 | 미해당 | - |
| 최근 4사업연도 연속 영업손실 발생 | 최근 4사업연도 각 영업손익 (별도) |
2021년 | -16,358,736 | 미해당 | 해당 | - |
| 2020년 | -38,729,166 | |||||
| 2019년 | -44,536,068 | |||||
| 2018년 | -38,083,104 | |||||
| 자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생 | 최근 3사업연도 각 자기자본 대비 법인세차감전 계속사업손익 비율(연결) |
2021년 | -9.3 | 미해당 | 미해당 | - |
| 2020년 | 5.1 | |||||
| 2019년 | -5.6 | |||||
☞ 당사는 코스닥 상장규정 제 2조 제31항에서 정하는 기술성장기업으로써, 2009년 09월 15일 코스닥시장에 상장되었습니다.
☞ 기술성장기업의 경우 '최근 4사업연도 연속 영업손실 발생'에 대한 관리종목 지정 요건을 적용받지 않습니다. <코스닥시장 상장규정 제28조 제1항 제3호의2>
☞ 당사의 2021년 법인세차감전계속사업손실은 48,561,062,658원이며, 2019년 법인세차감전 계속사업손실은 16,509,197,492원 입니다.
XI. 상세표
1. 연결대상 종속회사 현황(상세)
| (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| 주식회사 에스엘포젠 |
2016년 12월 15일 | 인천광역시 연구수 송도과학로 85, 3층 (송도동, 에스엘바이젠 산학협력관) |
CDMO 서비스 및 사업화 |
16,233 | 지분율 50% 초과보유 |
- |
2. 계열회사 현황(상세)
| (기준일 : | 2022.09.30 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | 4 | (주)제넥신 | 171711-0036705 |
| (주)한독 | 110111-0037005 | ||
| (주)툴젠 | 110111-1785827 | ||
| Rezolute, Inc. | 27-3440894 | ||
| 비상장 | 11 | ㈜에스엘포젠 | 171711-0129443 |
| IILKOGEN | 17-1100130 | ||
| KinGen Biotech | 17-0101371 | ||
| (주)칼로스메디칼 | 110111-5849893 | ||
| (주)한독테바 | 110111-5072733 | ||
| (주)엔비포스텍 | 110111-3837311 | ||
| (주)이노큐브 | 110111-8021125 | ||
| Theravalues Corporation | 5010001111641 | ||
| Unins(HK) International Limited |
538470 | ||
| 젠스톰바이오과기유한공사 | 91120000MA06FBAE26 | ||
| TOOLGENKYRGYZ LLC | 204554-3300-OOO |
| 주1) Rezolute, Inc. 법인등록번호의 경우 현지 Tax ID 입니다. |
| 주2) Unins(HK) International Limited 법인등록번호의 경우 현지 사업자 번호 입니다. |
| 주3) IILKOGEN 법인등록번호의 경우 Tax ID입니다. |
| 주4) KinGen Biotech 법인등록번호의 경우 Tax ID입니다. |
| 주5) 젠스톰바이오과기유한공사 법인등록번호의 경우 통합 사회 신용코드 번호 입니다. |
3. 타법인출자 현황(상세)
| (기준일 : | 2022.09.30 | ) | (단위 : 백만원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| 프로젠 | 비상장 | 2011.12.13 | 단순투자 | 782 | 23,000 | 0.36 | - | - | - | - | 23,000 | 0.34% | - | 60,954 | (6,488) |
| 아지노모도제넥신㈜ | 비상장 | 2012.11.14 | 일반투자 | 8,925 | 1,785,000 | 25.00 | 10,068 | - | - | 767 | 1,785,000 | 25.00% | 10,835 | 43,725 | 5,073 |
| ILKOGEN | 비상장 | 2013.12.24 | 경영참여 | 254 | 2,550,000 | 50.00 | 663 | - | - | (318) | 2,550,000 | 50.00% | 345 | 5,120 | (4) |
| NIT(NeoImmuneTech,Inc.) | 상장 | 2014.04.15 | 경영참여 | 1,045 | 4,187,200 | 21.24 | 45,457 | - | - | (4,563) | 4,187,200 | 21.18% | 40,121 | 187,027 | (54,366) |
| ㈜코스온 | 상장 | 2015.07.10 | 단순투자 | 2,060 | 216,488 | 0.90 | 452 | - | - | (452) | 216,488 | 0.90% | - | 132,474 | (74,205) |
| KG-Bio (PT Kalbe-Genexine Biologics) |
비상장 | 2016.03.03 | 경영참여 | 1,217 | 320,783 | 20.32 | 42,370 | - | - | 3,638 | 320,783 | 20.32% | 46,008 | 253,144 | (8,773) |
| 에스엘포젠 | 비상장 | 2016.12.09 | 경영참여 | 100 | 2,128,400 | 63.65 | 10,642 | - | - | - | 2,128,400 | 63.65% | 10,642 | 16,233 | (2,847) |
| Simnogen (Simnogen Biotech Co. Ltd) |
비상장 | 2017.04.27 | 일반투자 | 1,103 | 6,758,080 | 49.00 | 791 | - | - | 93 | 6,758,080 | 49.00% | 884 | 1,623 | (99) |
| I-Mab | 상장 | 2017.11.17 | 단순투자 | 24,271 | 8,488,885 | 4.62 | 207,353 | - | - | (186,118) | 8,488,885 | 4.45% | 21,235 | 1,041,994 | (418,709) |
| Pharmajet | 비상장 | 2018.04.12 | 단순투자 | 896 | 297,128 | 1.14 | 482 | - | - | 101 | 297,128 | 1.14% | 583 | 24,309 | (1,847) |
| 미래에셋청년창업투자조합3호 | 비상장 | 2018.07.28 | 단순투자 | 495 | 1,980 | 9.90 | 2,066 | (84) | (382) | 141 | 1,896 | 9.90% | 1,824 | 21,001 | 1,925 |
| Rezolute, Inc. | 상장 | 2019.01.28 | 일반투자 | 13,998 | 1,826,019 | 11.74 | 10,347 | - | - | (3,169) | 1,826,019 | 4.96% | 7,179 | 197,064 | (53,086) |
| CoImmune, Inc. | 비상장 | 2019.02.17 | 경영참여 | 6,298 | 14,700,000 | 22.94 | 20,094 | - | - | (131) | 14,700,000 | 22.94% | 19,963 | 60,543 | (39,053) |
| KinGen Biotech | 비상장 | 2019.12.06 | 경영참여 | 20 | 614,999 | 50.00 | - | - | - | - | 614,999 | 50.00% | - | 29,215 | (260) |
| 주식회사 제넨바이오 (주1) | 상장 | 2020.01.13 | 단순투자 | 13,818 | 3,019,913 | 7.22 | 12,427 | - | - | (8,290) | 3,019,913 | 6.93% | 4,137 | 141,446 | (34,650) |
| 와이바이오로직스 | 비상장 | 2020.09.16 | 단순투자 | 3,000 | 176,991 | 1.44 | 2,619 | - | - | - | 176,991 | 1.44% | 2,619 | 38,245 | (17,071) |
| 이노퓨틱스 | 비상장 | 2020.10.06 | 단순투자 | 1,000 | 381,680 | 6.97 | 1,000 | - | - | - | 381,680 | 6.97% | 1,000 | 4,462 | (1,289) |
| 에스엘백시젠 | 비상장 | 2020.10.12 | 단순투자 | 3,000 | 250,000 | 13.51 | 10,219 | - | - | - | 250,000 | 13.51% | 10,219 | 11,543 | (6,444) |
| 큐로젠 | 비상장 | 2020.11.13 | 경영참여 | 3,000 | 24,195 | 6.16 | 2,963 | - | - | (154) | 24,195 | 6.16% | 2,809 | 14,677 | (2,309) |
| (주)툴젠 | 상장 | 2020.12.22 | 경영참여 | 3,000 | 1,118,347 | 14.24 | 73,813 | - | - | (2,942) | 1,118,347 | 14.24% | 70,871 | 87,673 | (20,692) |
| 지아이이노베이션 | 비상장 | 2021.06.08 | 단순투자 | 5,000 | 151,515 | 0.76 | 5,000 | - | - | - | 151,515 | 0.76% | 5,000 | 179,868 | (150,742) |
| 진메디신 | 비상장 | 2021.07.29 | 단순투자 | 1,000 | 48,182 | 0.59 | 1,000 | - | - | - | 48,182 | 0.59% | 1,000 | 50,185 | (20,874) |
| Egret Therapeutics Inc. | 비상장 | 2021.07.31 | 단순투자 | 1,167 | 1,000,000 | 5.88 | 1,220 | - | - | 257 | 1,000,000 | 5.56% | 1,477 | 87 | (32) |
| 칼로스메디칼 | 비상장 | 2022.01.04 | 단순투자 | 1,000 | - | 0.00 | - | 8,147 | 1,000 | - | 8,147 | 1.59% | 1,000 | 3,018 | (7,334) |
| 합 계 | 50,068,785 | - | 461,047 | 8,063 | 618 | (201,140) | 50,076,848 | - | 259,751 | - | |||||
| 주1) 제넨바이오는 2022년 01월 20일 1:5의 액면병합이 진행되었으며, 기초잔액 수량인 15,099,565주는 액면병합 수량인 3,019,913주로 표시하였습니다. |
4. 기업집단 지분도
당사의 최대주주는 (주)한독이며, 최대주주 및 당사의 관계회사 간 지분관계는 다음과 같습니다.
| [한독 및 당사 관계회사 지분도] |
| (기준일: 2022.09.30) |
|
| 주1) 주황색으로 표기된 회사는 비상장사, 남색으로 표기된 회사는 상장사 |
5. 임원의 겸직 현황
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 | 상근 여부 | 담당업무 | 겸직여부 | 겸직회사 등기여부 | 겸직회사명 | 겸직회사 직위 |
|---|---|---|---|---|---|---|---|---|---|---|
| 성영철 | 남 | 1956.05 | 고문 | 미등기 | 비상근 | 전략과학자문위원회 의장 | O | X | 포스텍 | 교수 |
| 우정원 | 여 | 1960.01 | 대표이사 (각자) |
사내이사 | 상근 | R&D총괄 | O | O | NeoImmuneTech (미국) | 기타비상무이사 |
| O | CoImmune (미국) | 사외이사 | ||||||||
| Neil Warma | 남 | 1963.01 | 대표이사 (각자) |
사내이사 | 상근 | CEO | O | O | ProMIS Neuroscience | 사외이사 |
| O | Ridgeline Therapeutics | 사외이사 | ||||||||
| O | GenRAb | 사외이사 | ||||||||
| 홍성준 | 남 | 1965.07 | 부사장 | 사내이사 | 상근 | 경영지원실 실장 | O | O | ㈜툴젠 | 기타비상무이사 |
| O | ㈜ 큐로젠 | 기타비상무이사 | ||||||||
| O | KinGen Biotech Co. Ltd. (태국) | 사외이사 | ||||||||
| 배진건 | 남 | 1951.12 | 사외이사 | 사외이사 | 비상근 | 사외이사 | O | O | 이노큐어 테라퓨틱스 | 사내이사 |
| Peter Laivins | 남 | 1958.11 | 사외이사 | 사외이사 | 비상근 | 사외이사 | X | - | ||
| 김영진 | 남 | 1956.11 | 기타비상무이사 | 기타비상무이사 | 비상근 | 공동개발 대외협력 |
O | O | 주식회사 한독 | 회장 |
| O | 주식회사 한독테바 | 기타비상무이사 | ||||||||
| O | pH Pharma | 기타비상무이사 | ||||||||
| O | 에펜도르프 코리아 주식회사 | 사내이사 | ||||||||
| O | (주)와이앤에스인터내셔날 | 사내이사/대표이사 | ||||||||
| O | 공신진흥(주) | 사내이사 | ||||||||
| O | Theravalues Corporation | 사내이사 | ||||||||
| O | 재단법인 한독제석재단 | 이사장 | ||||||||
| O | Rezolute, Inc. | 이사 | ||||||||
| O | 한국국제교류재단 | 비상임이사 | ||||||||
| O | 청소년희망재단 | 이사 | ||||||||
| 이혁종 | 남 | 1969.11 | 기타비상무이사 | 기타비상무이사 | 비상근 | 공동개발 대외협력 |
O | O | ㈜바이넥스 | 대표이사 |
| O | ㈜바이넥스홀딩스 | 이사 | ||||||||
| X | ㈜광동제약 | 이사 | ||||||||
| 전현철 | 남 | 1958.06 | 감사 | 감사 | 상근 | 감사 | O | O | 회계법인 새시대 | 이사 |
| 이장희 | 남 | 1961.09 | 부사장 | 미등기 | 상근 | 업무지원실 실장 | O | X | ㈜프로젠 | 부사장 |
| 박현진 | 여 | 1977.12 | 부사장 | 미등기 | 상근 | 사업개발실 실장 | O | O | ㈜툴젠 | 기타비상무이사 |
| 김기용 | 남 | 1960.1 | 전무 | 미등기 | 상근 | 바이오연구소 부소장 | X | - | ||
| 허민규 | 남 | 1974.11 | 상무 | 미등기 | 상근 | 임상개발실 실장 | X | - | ||
| 김기완 | 남 | 1968.01 | 상무 | 미등기 | 상근 | 연구개발운영팀 팀장 | X | - | ||
| 최은호 | 남 | 1971.01 | 이사 | 미등기 | 상근 | 총무팀 팀장 | X | - | ||
| 신동민 | 남 | 1974.08 | 이사 | 미등기 | 상근 | IR/PR 팀장 | X | - | ||
| 출처: 당사 제공 |
【 전문가의 확인 】
1. 전문가의 확인
해당사항 없습니다.
2. 전문가와의 이해관계
해당사항 없습니다.