 |
|
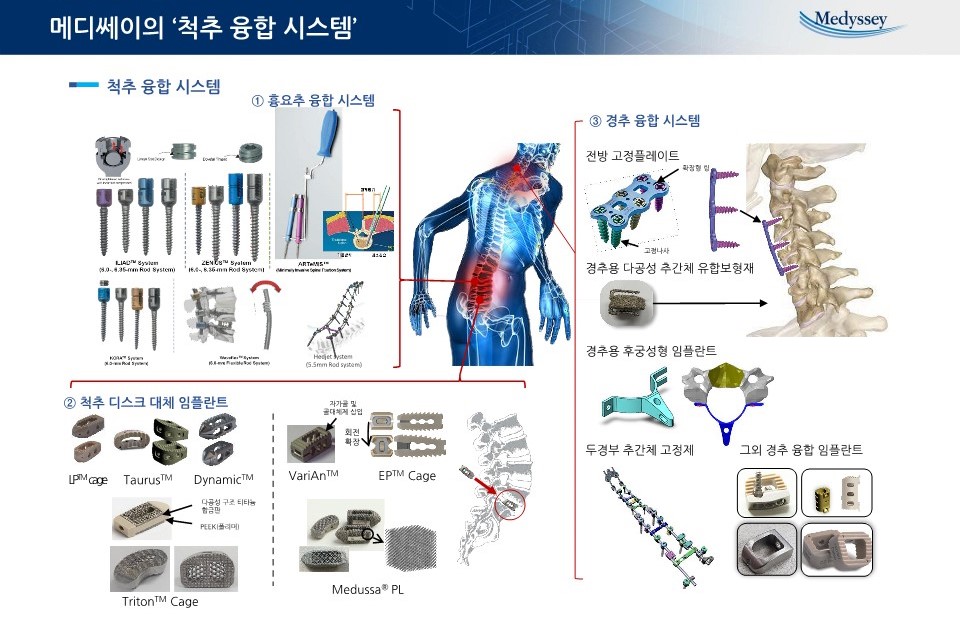
제품_척추융합시스템 |
주주총회소집공고
| 2022년 08월 05일 | ||
| 회 사 명 : | 주식회사 메디쎄이 | |
| 대 표 이 사 : | 한종현 | |
| 본 점 소 재 지 : | 충청북도 제천시 한방엑스포로 129 (제천시 왕암동 1389) | |
| (전 화) 043-716-1014 | ||
| (홈페이지) http://www.medyssey.co.kr | ||
| 작 성 책 임 자 : | (직 책) 이사 | (성 명) 하재성 |
| (전 화) 043-716-1014 | ||
주주총회 소집공고
| (주주총회) |
|
주주님의 건승과 댁내의 평안을 기원합니다. 당사는 상법 제363조와 정관 제 21 조에 의거 2022년 임시주주총회를 아래와 같이 개최 하오니 참석하여 주시기 바랍니다. - 아 래 - 1. 일 시 : 2022년 08월 24일(수요일) 오전 10시 00분 2. 장 소 : 충청북도 제천시 한방엑스포로 129 / 본사2층 대회의실 3. 회의 목적 사항 - 부의안건 : 정관 일부 변경의 건 4. 경영참고사항 비치 상법 제542조의4에 의한 경영참고사항은 당사 인터넷 홈페이지에 게재하고 본점과 명의개서대행회사(국민은행 증권대행사업부)에 비치하였으며, 금융위원회 및 한국거래소에 전자공시하여 조회가 가능하오니 참고하시기 바랍니다. 5. 실질주주의 의결권 행사에 관한 사항 우리 회사의 이번 주주총회에서는 한국예탁결제원이 주주님들의 의결권을 행사할 수 없습니다. 따라서 주주님들께서는 한국예탁결제원에 의결권행사에 관한 의사표시를 하실 필요가 없으며, 종전과 같이 주주총회에 참석하여 의결권을 직접행사하시거나 또는 위임장에 의거 의결권을 간접행사할 수 있습니다. 6. 주총 참석시 : 참석장, 신분증 (대리인 : 참석장, 위임장, 주주 인감증명서, 대리인 신분증) ※ 참고사항 : 코로나바이러스 감염증-19(COVID-19)의 감염 및 전파를 예방하기 위하여 주주총회에 참석시 주주님들의 체온을 측정할 수 있으며, 측정결과에 따라 발열이 의심 되는 경우, 부득이하게 총회장 출입이 제한될 수 있음을 알려드립니다. 또한, 반드시 마스크 착용을 부탁드립니다. 마스크 미착용시 주주총회 개최장소의 출입이 제한될 수 있습니다. 만약, 주주총회 개최 전 코로나바이러스 확산에 따른 불가피한 장소 변경이 있는 경우, 지체없이 재공시 하여 안내 드릴 예정입니다. 2022년 08월 05일 |
I. 사외이사 등의 활동내역과 보수에 관한 사항
1. 사외이사 등의 활동내역
가. 이사회 출석률 및 이사회 의안에 대한 찬반여부
| 회차 | 개최일자 | 의안내용 | 사외이사 등의 성명 | |||
|---|---|---|---|---|---|---|
| A (출석률: %) |
B (출석률: %) |
C (출석률: %) |
D (출석률: %) |
|||
| 찬 반 여 부 | ||||||
| - | - | - | - | - | - | - |
나. 이사회내 위원회에서의 사외이사 등의 활동내역
| 위원회명 | 구성원 | 활 동 내 역 | ||
|---|---|---|---|---|
| 개최일자 | 의안내용 | 가결여부 | ||
| - | - | - | - | - |
2. 사외이사 등의 보수현황
| (단위 : 원) |
| 구 분 | 인원수 | 주총승인금액 | 지급총액 | 1인당 평균 지급액 |
비 고 |
|---|---|---|---|---|---|
| 사외이사 | - | - | - | - | - |
| 비상임이사 | 7 | - | 261,048,250 | 37,292,607 | (주) |
주) 상기 지급총액은 2022년01월01일부터 2022년06월30일까지 지급한 보수총액입니다.
II. 최대주주등과의 거래내역에 관한 사항
1. 단일 거래규모가 일정규모이상인 거래
| (단위 : 억원) |
| 거래종류 | 거래상대방 (회사와의 관계) |
거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
2. 해당 사업연도중에 특정인과 해당 거래를 포함한 거래총액이 일정규모이상인 거래
| (단위 : 억원) |
| 거래상대방 (회사와의 관계) |
거래종류 | 거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
III. 경영참고사항
1. 사업의 개요
가. 업계의 현황
(1) 산업의 정의
당사가 영위하고 있는 의료기기산업의 '의료기기’란 의료기기법 제2조에서는 의료기기를 다음과 같이 정의하고 있습니다. '의료기기’란 의료기기법 제2조 법률 13698호에 의거하여 사람 또는 동물에게 단독 또는 조합하여 사용되는 기구·기계·장치·재료 또는 이와 유사한 제품으로서 질병의 진단, 치료 또는 예방의 목적으로 사용되거나, 구조 또는 기능의 검사, 대체 또는 변형을 목적으로 사용되는 제품 등으로 정의하고 있습니다.
|
1. 질병을 진단·치료·경감·처치 또는 예방할 목적으로 사용되는 제품 2. 상해 또는 장애를 진단·치료·경감 또는 보정할 목적으로 사용되는 제품 3. 구조 또는 기능을 검사·대체 또는 변형할 목적으로 사용되는 제품 4. 임신을 조절할 목적으로 사용되는 제품 |
국가간 의료기기 규제를 조절하고 제정하는 의료기기국제조화회의(GHTF : Global Harmonization Task Force)에서 정의하는 의료기기는 기계·기기·기구·기계장치·이식·진단시약 또는 눈금측정기, 소프트웨어, 재료 또는 기타 유사 또는 관련 물품이 단독 또는 조합으로 사용되며, 다음의 목적을 위해 인간에게 사용하도록 제조자가 의도한 것으로 정의하고 있습니다.
|
1. 질병의 진단, 예방, 감시, 치료 또는 완화 2. 부상에 대한 진단, 감시, 치료, 완화 또는 보상 3, 해부 또는 생리적 과정의 조사, 대체 또는 변경 4. 생명 지원 또는 유지 5. 수태조절(피임) 6. 의료기기의 소독 7. 인체로부터 추출된 표본의 시험과 의료목적을 위한 정보 제공 |
'의료기기산업'이란 의료기기 제품의 설계 및 제조에 관련된 다 학제간(Interdisciplinary : 임상의학과 전기, 전자, 기계 재료, 광학 등 공학) 융합되는 응용기술을 활용하여 의료기기 분야 제품/서비스 제공의 경제활동을 하는 생산단위의 집합 또는 조직으로 정의하며, 궁극적으로 의료기기를 통한 인간 삶의질 향상을 목표로 하는 보건의료의 한 분야로 정의하고 있습니다.
의료기기 분류는 일반분류와 산업 및 시장 분류체계로 나눌 수 있으며, 일반분류는 ① 식약처 의료기기 분류 ② 과학기술 표준분류 ③ 산업통상자원부 산업기술 분류로 나뉠 수 있으며, 산업 및 시장 관련 분류체계는 ① 한국표준산업분류의 의료기기사업 관련 분야 ② 한국보건산업진흥원의 의료기기 유형군 분류로 구성된다. 한국보건산업진흥원에서는 의료기기시장 관점에서 방사선 영상진단기기, 생체계측기기, 마취 및 호흡기기, 치과용 기기, 기계, 체외 진단용 시약 등 총 16개 유형군으로 분류하고 있다. 의료기기 산업은 생산 및 수입 제품을 시장에 유통할 때 정부기관의 인허가를 받아야 한다. 국내의 경우 식품의약품안전처(MFDS)의 의료기기 등급 및 분류기준에 따라, 공중보건에 미치는 잠재적 위해성 정도를 기준으로 개인위해도(Individual Risk, IR)와 공중위해도(Public Risk, PR), 잠재적 위해성의 판단 기준에 근거해 위험도가 높은 4등급에서부터 위험도가 낮은 1등급으로 분류하고 있습니다.
식품의약품안전처의 [의료기기법 시행규칙] 제2조 및 의료기기의 등급분류 및 지정에 관한 기준과 절차, 등급의 지정절차에 따라 의료기기 품목의 대분류(4개)는 ⓐ기구·기계(Medical Instruments), ⓑ의료용품(Medical Supplies), ⓒ치과 재료(Dental Materials), ⓓ체외진단용 시약(IVD Reagents) 4가지 유형으로 구분하며, 중분류는 대분류군을 원자재, 제조공정 및 품질관리체계가 비슷한 품목군으로 분류되며, 소분류의 경우 중분류군을 기능이 독립적으로 발휘되는 품목별로 분류하고 있습니다. 또한, 각 품목은 해당 의료기기가 인체에 미치는 잠재적 위해성을 바탕으로 4개 등급으로 분류되며, 잠재적 위해성에 대한 판단기준은 다음과 같습니다.
|
1) 인체와 접촉하고 있는 기간 2) 침습의 정도 3) 약품이나 에너지를 환자에게 전달하는지 여부 4) 환자에게 생물학적 영향을 미치는지 여부 |
<식품의약품안전처의 의료기기 등급 분류기준>
|
등급 |
등급 기준 |
주요해당 제품 |
|---|---|---|
|
1 등 급 |
·인체에 직접 접촉되지 않는 제품
·잠재적 위해성이 거의 없는 의료기기 |
청진기, 체온계, 의료용 원심 분리기, 의료용 칼, 가위, 영상 저장/조회용 소프트웨어 등 |
|
2 등 급 |
·인체에 직접 접촉되는 제품 중 기능장애 및 잠재적 위해성이 낮은 의료기기 |
콘돔, 심전계, 뇌파계, 전동식침대, 영상전송/출력용 소프트웨어 등 |
|
3 등 급 |
·인체내에 일정기간 삽입되는 제품
·삽입 후 중증도의 잠재적 위험성이 높은 의료기기 |
초음파골밀도측정기, 인공신장기, 엑스선촬영장치, CT, MRI, 정형외과, 척추용 임플란트 등 |
|
당사의 제품군에 해당됨 |
||
|
4 등 급 |
·고도의 위해성을 가진 의료기기
·안전성 검증이 필요한 원자재를 사용한 의료기기
·임상적 검증이 필요한 의료기기 |
인공 혈관, 인공 유방, 심장박동기, 특수재질 임플란트 등 |
주) 식품의약품안전처의 의료기기 등급 기준에 따른 제품의 인허가 과정에 따라 허가를 진행해야 합니다.
1 등급 의료기기
-위해성이 거의 없는 1등급에 해당하는 의료기기는 신고대상으로 ‘의료기기 전자민원시스템’에 등록 후 사용가능합니다.
2 등급 의료기기
-위해성이 낮은 2등급에 해당하는 의료기기로 기술문서 심사 및 허가대상으로 관할지방식약청 품목 허가 취득 및 한국의료기기안전정보원 등록 후 사용 가능합니다.
3 등급 의료기기
-잠재적 위해성이 높은 의료기기로 소재 및 의료기기의 안정성 시험 완료 후 이에 수반되는 기술문서를 기반으로 식약처 품목허가 취득 후 사용 가능합니다.
4 등급 의료기기
-잠재적 위해성이 아주 높은 고도의 위험성을 가진 의료기기로 소재 및 의료기기의 안정성 시험 완료 및 해당 의료기기의 임상시험 완료 후 식약처 품목허가 취득 후 사용 가능합니다.
당사의 제품인 척추 임플란트(흉요추 및 경추 임플란트 & 환자 맞춤형 임플란트)는 식품의약품안전처의 의료기기 등급 3등급 이상의 인체 삽입용 임플란트에 해당됨에 따라 생체적합성이 통과된 원자재를 활용하여 성능평가 시험 후 구조적인 안정성이 확보된 제품을 증명한 후 사용가능합니다. 당사의 제품인 인체삽입용 임플란트 의료기기는 연구 및 시제품 개발 이후 생물학적 안전성 검증 완료, 허가, 보험등재의 단계를 거쳐 시장에 출시되며, 당사의 3등급 의료기기의 경우 시장 진입까지 행정적으로 품목허가 80일, 요양급여 결정신청에 150일의 시간이 소모되며, 신청 의료기기의 비용적인 혜택을 받을 수 있는 신의료기술평가를 추가로 진행하면 270일의 기간이 소모됨에 따라 최소 1년이상의 기간이 소요되는 제품입니다.
※ 용어정리
|
추간체 고정재 (Pedicle screw) |
척추 후방 부위로 삽입하는 임플란트로서 티타늄 소재로 제작된 스크류와 긴 봉, 잠금장치로 구성되어 있는 제품 |
|
추간체 유합 보형재 (Interbody Fusion cage) |
척추 디스크를 대체하는 임플란트로서 금속 및 고분자 소재를 활용하여 척추 디스크 부위 전방, 측방, 후방 등의 다양한 수술접근법으로 삽입되는 제품 |
|
척추 극돌기간 삽입체 (Interspinous process) |
척추 극돌기간내에 삽입하는 임플란트로서, 흉요추 극돌기간 사이에 삽입하여 운동을 제어하는 형태와 고정돌기로 고정하는 등 시술목적에 따라 다양한 제품이 있음 |
|
환자 맞춤형 (Custom-made) |
환자의 해부학적 데이터를 기반으로 3D 프린팅 장비를 활용하여 환자의 골결손부위에 딱맞게 제작하는 제품 |
|
외상 고정 임플란트(Trauma) |
외상 및 골절 등으로 팔,다리에 수술적 고정이 필요한 경우 사용되는 제품으로 금속판과 스크류로 구성되어 있음 |
|
두개골 성형술 (Craniolplasty) |
두개골의 결손된 부위에 3D 프린팅으로 제작된 맞춤형 임플란트를 수술하는 방법 |
|
ASTM (American Society for Testing and Materials) |
미국시험재료학회에서 금속, 소비자용품, 의료용기기 및 기구 등 130개가 넘는 전문분야 에서 표준시험방법, 사양, 제품실습, 지침, 제품의 분류 및 용어 등에 관한 규격 |
|
ISO (International Organization for Standardization) |
국제표준화기구, 여러나라의 표준 제정 단체들의 대표들로 이루어진 국제적인 표준화 기구 |
|
In-Vitro |
생체외를 일컬음 |
|
In-Vivo |
생체내를 일컬음 |
|
MFDS (Ministry of Food And Drug Safety) |
한국식품의약품안전처 |
|
PEEK (Poly Ether Ether Ketone) |
열가소성 비분해성 폴리머로서 내마모성과 기계적 특성이 비교적 우수하며, 생체소재로 널리 활용됨 |
|
Ti-6Al-4V ELI (Titanium - 6% Aluminium - 4% Vanadium extra low interstitial) |
알루미늄 6%, 바나듐 4% 잔부를 Ti로 구성된 합금으로서 특별히 불순물이 제어된 합금 |
|
Ti-6Al-4V ELI (Titanium - 6% Aluminium - 4% Vanadium extra low interstitial) |
알루미늄 6%, 바나듐 4% 잔부를 Ti로 구성된 합금으로서 특별히 불순물이 제어된 합금 |
|
적층제조 (Additive Manufacturing) |
한번에 한층씩 겹겹이 쌓아서 고체 구조물을 제조하는 방식 |
|
DfAM (design for additive manufacturing) |
3D 프린팅 적층제조를 목적으로 한 설계방식 |
|
생체적합성 (Biocompatibility) |
세포와 생체적으로 적합하고 면역반응, 세포독성 등의 이상반응이 없는 것 |
|
골 고정 (Bone Fixation) |
뼈의 고정을 말함 |
|
골절 (Bone Fracture) |
뼈의 부러짐을 말함 |
|
골 융합 (Bone Fusion) |
뼈와 임플란트의 유합을 말함 |
|
만능재료시험기 (UTM: Universal Test Machine) |
일정한 속도로 가하는 힘에 대한 재료 또는 시료의 저항성, 기계적 강도 등을 측정하는 장비 |
|
압축강도 (Compressive Strength) |
시료에 길이방향으로 누르는 힘을 가했을 때 파괴되지 않고 견딜수 있는 최대의 압축응력 |
|
인장강도 (Tensile Strength) |
시료에 길이방향으로 당기는 힘을 가했을 때 파괴되지 않고 견딜수 있는 최대의 인장응력 |
|
비틀림강도 (Torstional Strength) |
시료에 길이방향으로 회전시키는 힘이 작용할 때 파괴에 대한 저항 |
|
피로도 (Fatigue strength) |
시료에 반복적인 하중을 가했을 때 시료가 파괴되지 않는 정도 |
나. 회사의 현황
(1) 영업개황 및 사업부문의 구분
(가) 영업개황
당사는 정형외과와 신경외과에서 주로 사용되는 척추 임플란트, 척추 수술용 기구를 제조, 판매하는 의료기기 전문 기업입니다. 그 중에서 척추의 퇴행, 협착, 외부충격, 또는 종양으로 인한 척추 불안정성을 치료하기 위한 수술과 선천적, 후천적 척추 기형 및 측만증의 척추질환 치료를 목적으로 한 척추 유합술에 사용되는 척추 임플란트제품을 주요 제품으로 제조, 판매 및 수출하고 있습니다.
척추 임플란트 이외에도 흉부외과 오목가슴 치료용 고정장치, 정형외과 휜다리 교정용 임플란트, 각종 체내고정장치 등을 제조, 판매하고 있습니다. 현재는 경추, 흉요추에 사용되는 약 20여개의 척추 임플란트, 상지 및 하지용 Trauma 제품군을 포함한 정형외과 제품군을 구성하여 국내외 시장에 판매하고 있습니다.
2011년 국내 최초 금속 3D프린팅 장비를 도입하였으며, 약 4년간의 연구개발을 통하여 국내최초로 금속 3D 프린팅 기술 기반의 환자 맞춤형 임플란트(Cranioplasty)의 식약처 인허가를 획득하였습니다. 뿐만 아니라, 2012년 중소기업청 창업성장과제를 시작으로 약 10건 이상 3D 프린팅 기술 기반의 제품에 관한 정부 지원을 발판으로 다양한 3D 프린팅 관련 연구 및 제품 개발 완료, 임상적용 등의 성과도 도출하였습니다. 또한, 광대뼈, 안와연, 사지(四肢) 및 장골부위에 해당하는 환자 맞춤형 임플란트를 국내 최초로 개발하여 제품군을 확대하였으며, 매년 3~4개의 특허출원 및 다양한 품목군의 기술개발에 매진하고 있습니다.
당사 의료기기사업의 매출은 대리점 및 병원 납품을 통하여 이루어지고 있습니다. 해외매출은 2006년 말 터키로부터 시작하여 매년 계속적으로 수출국 수를 늘려온 당사는 2022년 현재는 28개 국으로 수출을 하고 있으며 수출 비중은 전체 매출의 약 50% 이상을 유지하는 수출 주도형 회사라고 할 수 있습니다.
세계적으로 큰 시장에 대한 공격적인 영업 및 마케팅과 연계된 매출 증대를 위하여 세계 정형외과용 의료기기 전체 시장 매출 중 가장 큰 비중을 형성하고 있는 북미/남미 지역중 미국(MEDYSSEY USA INC), 멕시코(MEDYSSEY S.A. de C.V), 칠레 (MEDYSSEY S.A. (SPA)), 브라질(MEDYSSEY DO BRASIL COMERCIO)에 당사가 100% 지분을 소유한 해외현지법인을 설립하여 당사의 정형외과용 임플란트 유통을 주사업으로 영위하고 있으며 독자적인 영업 및 자사 브랜드 이미지 구축 중에 있으며 주변 남미 국가들로의 영향력 확대를 통해 해외시장 개척에 따른 매출 확대에 기여하고 있습니다. 또한, 미국 시장 다음으로 미래 중요한 거대 시장으로 떠오를 중국은 현지 생산을 통한 적극적인 영업 및 마케팅 망 확대를 위하여 중국 충칭에 당사가 50% 지분을 소유한 합자법인(MEDYSSEY MEDICAL DEVICE CO.,LTD)을 설립하고, 해외시장에 진출 및 수출을 가속화하며 2018년에는 1,000만불 수출탑을 수상 하였습니다. 지속적인 국내 및 해외 시장에서의 성장 가도를 위해 노력하고 있습니다.
① 회사의 성장과정
|
구분 |
생산 및 판매활동 개요 |
영업상 주요전략 |
|---|---|---|
|
설립기 (2003~2004) |
생산 공장 설립 의료기기 제조업 인허가 |
사업의 시작 단계 제품의 연구개발 단계 |
|
성장기 (2005~2014) |
국내 판매 증대 및 수출 주력 생산시설확대 및 제품군 확대 (Titanium 3D Printer 구입) 한국 내 기업부설연구소 설립 및 미국 내 연구소 설립 미국 FDA승인 및 품질심사, CE 인증, 브라질 ANVISA 품질 심사, GMP인증, ISO 13485 등 국내 및 해외 국가별 제품 인증 및 허가 획득 미국 해외현지법인 설립 및 판매 주력 해외 제품 인증 수출국 30개국 |
판매망 확대 제품의 다양성 확보 신제품연구 및 국책 연구과제 수행을 통한 제품개발 제품 인증을 통한 품질의 우수성 확보 미국시장 판매망 확대 해외시장 판매망 확대 |
|
상장신청기 (2015~현재) |
신규사업영역 확대 (Trauma, 인공관절 등) 충북 제천시 본사 및 공장 확장 이전 해외현지법인 : 칠레, 멕시코, 브라질 해외 신규 3개국 제품인증 진행중 |
환자맞춤형 제품생산 등 판매제품의 다양화 영업망 확대 해외 수출시장의 확대 |
② 주요 제품
 |
|
제품_척추융합시스템 |
 |
|
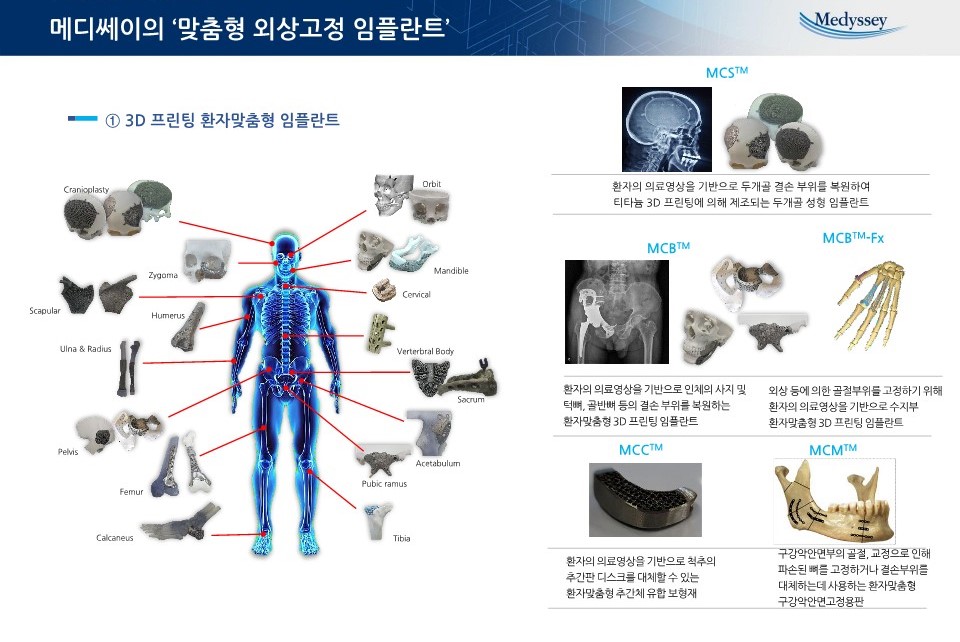
제품_맞춤형 외상고정 임플란트-1 |
 |
|
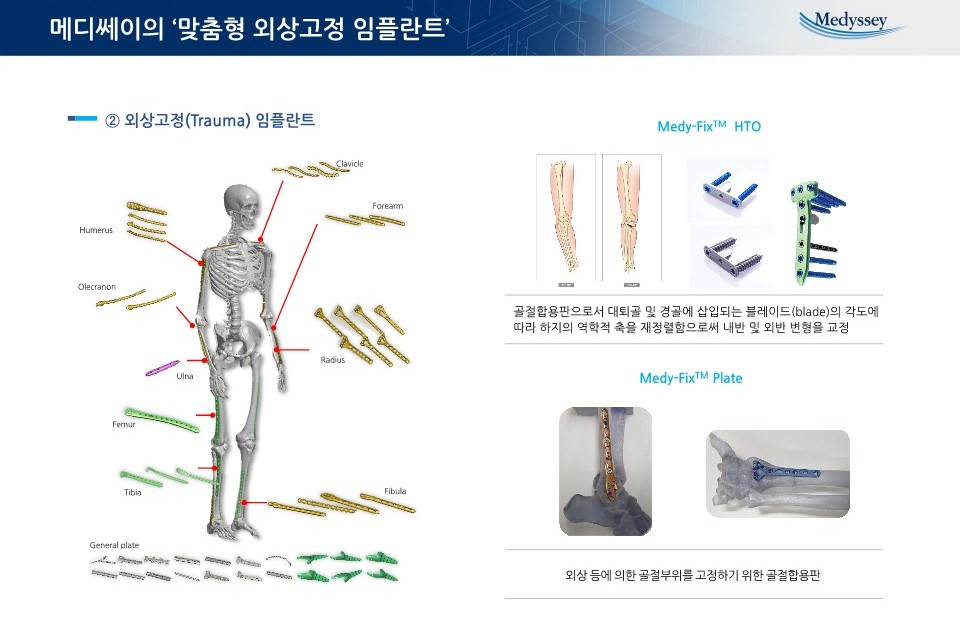
제품_맞춤형 외상고정 임플란트-2 |
(나) 공시대상 사업부문의 구분
당사는 척추 임플란트를 전문적으로 판매하고 있는 의료기기 업체로서 2003년 설립되었으며 최근 5년 간 수출비중이 매출액 대비 53% 이상인 수출주도형 기업입니다. 설립초기부터 대표이사를 중심으로 연구 개발에 전념하였으며 많은 의료진과 퇴행성 디스크 질환 및 척추 병변을 치료하는 추간체 고정재와 확장형 추간체 유합 보형재 개발 시작으로 회사가 성장하였습니다. 이러한 개발품들은 특허 등록까지 완료하여 경쟁업체에 비해 우월한 기술력을 인정받았습니다. 뿐만 아니라, 추가적인 기술개발을 통해 다양한 형태의 추간체 유합 보형재, 추간체 고정재 제품군을 보유하고 있습니다.
2011년 국내 최초 금속 3D프린팅 장비를 도입하였으며, 약 4년간의 연구개발을 통하여 국내최초로 금속 3D 프린팅 기술 기반의 환자 맞춤형 임플란트(Cranioplasty)의 식약처 인허가를 획득하였습니다. 뿐만 아니라, 2012년 중소기업청 창업성장과제를 시작으로 약 10건 이상 3D 프린팅 기술 기반의 제품에 관한 정부 지원을 발판으로 다양한 3D 프린팅 관련 연구 및 제품 개발 완료, 임상적용 등의 성과도 도출하였습니다.
또한, 광대뼈, 안와연, 사지(四肢) 및 장골부위에 해당하는 환자 맞춤형 임플란트를 국내 최초로 개발하여 제품군을 확대하였으며, 매년 3~4개의 특허출원 및 다양한 품목군의 기술개발에 매진하고 있습니다. 현재는 경추, 흉요추에 사용되는 약 20여개의 척추 임플란트, 상지 및 하지용 Trauma 제품군을 포함한 정형외과 제품군을 구성하여 국내외 시장에 판매하고 있습니다.
·흉, 요추(Thoracolumbar) 임플란트
- 추간체 고정재 : Pedicle screw system
흉, 요추 부위에 사용되는 추간체 고정재는 척추간 협착증과 흉, 요추부 통증을 격고 있는 환자들의 수술적 치료에 사용되는 가장 널리 알려진 척추 임플란트입니다. ‘흉, 요추용 추간체 고정재’는 척추체 후방에서 척추경을 관통하여 위 또는 아래 척추에 삽입하고 긴 봉과 함께 고정나사로 고정해 주는 방식으로 최초의 척추 임플란트로 현재까지 가장 보편적으로 사용되고 있는 수술용 임플란트입니다.
당사의 해당제품으로는 척추고정에 사용되는 고정나사의 풀림과 체결시 발생되는 엇갈림의 문제를 역사다리꼴 나사모양과 선형의 슬롯을 추가하여 정확하고 단단하게 고정하는 기술이 접목된 Iliad & Zenius 제품이 있으며, Buttress 나사산 적용으로 보다 안정적으로 사용가능한 Kora 제품이 있습니다.
하지만, 2000년대 이후 척추 수술후 발생하는 인접 부위의 퇴행을 감소하기 위해 운동성을 접목시킨 Rod 형태의 제품이 각광받기 시작하였으며, 이러한 개념을 접목시킨 Wave 형태의 Rod로 구성되어 있는 당사의 WaveFlex system을 개발하여 인접부위의 퇴행을 방지하는 목적의 제품을 판매하고 있습니다.
2010년대 이후 시술 부위를 최소한으로 절개를 하여 흉터를 최소화 할 수 있는 최소침습형 (MIS: Minimal Invasive surgery) 추간체 고정재가 보편화되기 시작하였으며, 이에 당사도 최소칩습형 개념의 추간체 고정재와 특수한 기능의 수술용 기구 시스템을 구축한 ArteMIS 제품으로 환자 및 임상의에게 만족도가 높은 제품을 제공하고 있습니다.
- 추간체 유합 보형재 : Interbody Fusion cage
흉요추용 추간체 고정재와 더불어 사용되는 흉,요추용 추간체 유합보형재는 수핵 탈출증(Disc Herniation), 디스크 퇴행 (Disc Degeneration Disease) 등의 질병에 사용 되며, 추간판 디스크 제거 후 척추체 사이에 삽입되어 척추의 전만 각도 및 디스크 높이를 유지하는 목적으로 하는 제품입니다. 최초의 추간체 유합보형재는 보편적으로 검증이 완료된 티타늄합금 소재를 이용한 직육면체형태의 제품이 보편적으로 사용되어졌습니다. 이에 당사도 티타늄 소재를 활용한 직육면체형태의 Dynamic cage 제품을 2004년도에 국내 식약처 허가를 획득하여 꾸준하게 임상적으로 사용되어지고 있습니다.
하지만, 2000년대 이후 인체의 뼈와 유사한 탄성계수와 특성을 가지고 있는 PEEK(Polyether Ether Ketone) 소재의 개발로 금속재질의 추간체 유합 보형재를 대체하여 사용되어졌습니다. 당사의 경우 Bullet 형상 디자인으로 쉽게 삽입이 가능한 구조의 LP cage 제품을 개발 완료하여 침강현상을 줄이는 장점의 제품으로 판매되고 있습니다. 뿐만 아니라, 추간체 유합 보형재의 경우 수술접근 방법에 따라 후방, 전방, 측방, 측후방 접근법에 따라 다양한 형태의 제품이 임상적으로 요구됨에 따라 Taurus-TL, AL, DL cage를 개발 완료하여 다양한 수술적 방법에 사용되어지고 있습니다.
척추의 경우 하중 분산 및 운동성 유지를 위해 ‘S’ 형태의 만곡을 가지고 있습니다. 이러한 척추 전만각도를 유지하기 위한 형태의 추간체 유합보형재의 필요성이 제기되어 최소한의 절개 및 제품 삽입 후 앞쪽부분을 확장하여 척추의 전만각도를 만들어주는 확장형 추간체 유합보형재가 대세를 이루고 있습니다. 이에 당사도 티타늄 소재의 VariAn & 티타늄과 PEEK 재질의 EP cage를 개발하여 국내외 다양한 국가에서 사용되어지고 있습니다.
최근 3D 프린팅 기술을 활용하여 골유합율을 극대화시킨 다공성 구조의 추간체 유합보형재가 대세를 이루고 있습니다. 이에 당사의 경우 2013년 정부 국책과제를 통해 Medussa cage를 개발하여 골다공증 환자에 특화된 미세 다공성구조의 추간체 유합보형재를 국내 최초 개발 및 식약처 인허가 획득하여 국내 최대 임상사례를 보유하고 있으며, 나아가 FDA 인허가까지 완료하여 국내외 임상에 사용되어 지고 있습니다. 또한 이러한 기술력을 바탕으로 기존 PEEK 재질의 소재와 3D 프린팅 기술을 접목한 Triton cage도 제품화하여 사용되어지고 있습니다.
- 척추 극돌기간 삽입체 : Interspinous process device
척추의 후방부위로 접근하여 흉요추의 척추 극돌기간에 삽입되는 제품으로 척추 디스크의 높이 회복 및 안정화를 도모하는 제품의 OMEGA 과 spike 형태의 고정장치를 이용하여 척추 극돌기간에 고정시켜 척추의 운동성을 제한하는 제품의 SOL을 개발하여 꾸준하게 시장에서 사용되어지고 있습니다.
·경추(cervical) 임플란트
- Cervical screw system (경추용 추간체 고정재)
당사는 경추 임플란트에 대한 거의 모든 라인업을 갖추고 있어 환자의 증상에 따라 척추체 전, 후 모든 방향에서 수술적 접근이 가능합니다. 특히 경추 추간체 고정재의 경우 척추관 협착증(Stenosis), 척추 변형(Deformity), 척추 전방 전위증(Spondylolisthesis) 등의 질병에 사용되는 제품으로 경추 수술 초기부터 꾸준됩니다. 당사의 Poseidon 제품의 경우 보통의 경추에만 사용되는 타사의 제품과 달리 후두부 고정 판과 흉추 고정용 하우징을 포함하여 다양한 환자에게 적용이 가능합니다.
- Cervical Interbody Fusion cage (경추용 추간체 유합 보형재)
경추용 추간체 유합보형재는 수핵 탈출증(Disc Herniation), 디스크 퇴행 (Disc Degeneration Disease) 등의 질병에 사용 되며, 추간판 디스크 제거 후 척추체 사이에 삽입되어 경추의 전만 각도 및 디스크 높이를 유지하는 목적으로 하는 제품입니다. 최초의 경추용 추간체 유합보형재는 인체의 뼈와 유사한 탄성계수와 특성을 가지고 있는 PEEK(Polyether Ether Ketone) 소재를 활용한 제품으로 당사의 제품으로는 C7 cage 있습니다.
또한, 최근 3D 프린팅 기술의 추세에 따라 경추부위에도 골유합율을 극대화시킨 다공성 구조의 추간체 유합보형재가 임상에서 보편적으로 사용되고 있으며, 당사의 제품으로는 Medussa-C가 임상에서 사용되어지고 있습니다.
하지만, 최근 임상적인 보고에 의하면 박스형태의 제품의 경우 시술 후 불안정한 고정력으로 인해 침강 및 이탈현상이 발생됨에 따라 나사를 이용한 기능성 추간체 유합보형재의 필요성이 제기되어 티타늄 나사를 결합시켜 고정력을 증대시킨 Unicorn-CS, Unicorn-CC 제품이 개발하여 시장에서 사용되어지고 있습니다.
- Cervical Plate system (경추 전방 금속판)
경추용 추간체 고정재와 수술적 접근법이 다른 전방 금속판 제품으로 경추의 앞부분으로 시술되어 척추관 협착증(Stenosis), 척추변형(Deformity), 척추 전방 전위증(Spondylolisthesis) 등의 질병에 사용 됩니다. 당사의 Athena 제품이 사용되어지고 있으며, 경추의 전방 부위에 삽입되는 금속 판 과 나사로 구성되어 있는 제품으로 수술후 환자의 이물감을 줄이기 위해 최소 두께(2mm)로 설계 되었으며, screw의 이탈 현상을 방지하기 위한 확장형 링 메커니즘을 포함하고 있습니다.
·환자 맞춤형 임플란트 (Custom-made)
당사의 금속 3D프린터를 활용한 환자 맞춤형 임플란트의 가장 큰 장점은 환자의 해부학적 형상에 맞게 제작하는 것입니다. 당사의 임플란트는 단순고정을 넘어 기능적, 심미적 회복까지 가능합니다. 또한 골절, 선, 후천적 골기형과 골결손에 대한 치료범위의 제한이 없으며, 임플란트 디자인 과정에서 수술계획까지 예측하여 불필요한 주변조직 제거 없이 수술시간 단축과 출혈과 감염 등의 합병증을 혁신적으로 단축하게 합니다. 또한 표면조절을 통해 다공성 구조를 생성하여 높은 안전성과 골생성 촉진을 통해 환자의 빠른 회복을 가능하게 합니다.
·고강도 외상고정(Trauma) 임플란트
외상 고정 임플란트는 인체 형상에 맞춰 해부학적인 데이터를 기반으로 제작이 필요 합니다. 따라서 기존의 일반적인 기계 가공으로 제조가 어렵고 프레스등의 장비로 제조를 하게 됩니다. 그러나 국내외 대부분의 회사들은 기술력의 한계로 인해 구조적인 강도가 낮으면 가공이 쉬운 순수 티타늄으로 제품을 생산하고 있습니다. 그러나 당사는 외상고정 임플란트 제작에 있어 고강도의 티타늄 합금(Ti6Al4V-ELI)을 사용하여 당사만의 노하우로 고온, 고압을 적용하여 제품을 생산해 내는 기술을 개발하였습니다. 고강도 소재와 생산기술 적용으로 임플란트의 두께를 줄일 수 있어 환자의 이물감을 최소화 할 수 있습니다.
(2) 시장점유율
(가) 척추 임플란트 시장
세계 의료기기 시장은 2018년 현재 약 4,979억 달러 규모이며 연평균 6.4%의 성장률 지속적인 증가가 예상됩니다. 지역별 시장 규모는 당사의 시장이 포함된 아시아의 경우 약 5.1%의 연평균 성장률로 2018년 103억 달러의 시장 규모로 파악되고 있습니다.
![이미지: [세계 의료기기 시장 규모]](%5B%EC%84%B8%EA%B3%84%20%EC%9D%98%EB%A3%8C%EA%B8%B0%EA%B8%B0%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%5D.jpg) |
|
[세계 의료기기 시장 규모] |
세계 의료기기 시장 중 척추 임플란트 시장의 규모는 2019년 약 87억 달러에서 2024년 약 101억 달러까지 지속적인 성장률을 보일 것으로 예상되며, 당사의 제품군이 포함된 제품시장은 2016년 71억 달러에서 2021년 82억 달러로 약 3.15%의 성장률로 시장 규모가 확대될 것으로 전망되고 있습니다. (출처 : BMI Espicom(2015), Worldwide Medical Devices Market Forecasts to 2020)
당사의 제품군의 대다수가 포함된 척추 임플란트의 시장(Spinal decompression, Spinal fusion, 82%) 제품의 규모가 매년 확대됨에 따라 매출액 대비 수출액의 비중이 높은 당사의 해외 매출액의 성장 가능성이 높을 것으로 판단됩니다. (출처 : Global Spinal surgery device market, Mordor Intelligence, 2019)
![이미지: [세계 척추 임플란트 시장 규모 및 임플란트 마켓 비율]](%5B%EC%84%B8%EA%B3%84%20%EC%B2%99%EC%B6%94%20%EC%9E%84%ED%94%8C%EB%9E%80%ED%8A%B8%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%20%EB%B0%8F%20%EC%9E%84%ED%94%8C%EB%9E%80%ED%8A%B8%20%EB%A7%88%EC%BC%93%20%EB%B9%84%EC%9C%A8%5D.jpg) |
|
[세계 척추 임플란트 시장 규모 및 임플란트 마켓 비율] |
세계 척추 임플란트 시장은 상위 3개의 글로벌 기업이 50%에 육박하는 시장을 점유하고 있는 과점시장이며, 약 35%의 점유율을 차지하고 있는 기타 기업의 경우 당사가 포함된 아시아 국가의 중소기업으로 예상되며, 점차 점유율을 확대하고 있는 시장 추세에 따라 당사의 해외 시장 점유율도 증가할 것으로 사료되며, 매출액 신장도 기대하고 있습니다.
다국적 기업이 세계시장의 대다수를 차지하는 이유는 제품의 모든 line-up을 갖추고 있기 때문입니다. 다국적 기업이 차지하는 약 65% 시장을 바로 확보할 수는 없지만, 이들과 경쟁하기 위해 당사도 15년간 모든 척추임플란트 제품을 개발 및 검증을 완료하였으며 기반시설 구축 완료에 따른 원가절감으로 시장진입이 가속화 될 것으로 예상됩니다. 또한, 당사는 척추 임플란트 제품군과 더불어 기존 제품에 3D 프린팅 기술을 접목한 다양한 형태의 척추 임플란트를 판매, 개발하고 있어 추후 척추 임플란트의 시장 점유율을 확보하는데 큰 시너지 효과를 기대할 것으로 예상하고 있습니다.
당사의 매출액의 90%이상 차지하는 흉요추용 척추 임플란트는 글로벌 대기업과 견줄만한 제품 Line-up를 갖추고 있으며, 해당 제품이 포함된 시장은 2016년 약 27억 달러에서 연평균 2.91%의 성장률로 2024년 약 36억 규모의 시장으로 성장할 것으로 예상하고 있다. (출처 : Global Spinal surgery device market, Mordor Intelligence, 2019)
(나) 3D 프린팅 기술 기반 임플란트 시장
세계 3D 프린팅 기술 기반 산업의 시장 규모는 2016년 61억달러로 연평균 27.6%씩 증가되어 2022년 262억 달러의 고성장이 예상되는 시장입니다. 당사의 제품군이 포함된 의료/치과 분야의 전체 시장의 약 11%로 2016년 6.7억달러의 규모에서 2022년 28.8억 달러의 성장이 예상되고 있습니다.
뿐만 아니라, 미국, 유럽, 중국 등 주요국은 3D 프린터의 기능(제작 속도, 정밀도 향상 등)개선, 티타늄 등의 다양한 신소재 개발, 바이오와의 결합 등의 활용되는 적용영역이 확대됨에 따라 3D 프린팅 기술의 의료기기 수요는 더욱 더 성장할 것으로 예상됩니다.
![이미지: [세계 3D 프린팅 시장 규모]](%5B%EC%84%B8%EA%B3%84%203d%20%ED%94%84%EB%A6%B0%ED%8C%85%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%5D.jpg) |
|
[세계 3D 프린팅 시장 규모] |
국내 3D 프린팅 시장 규모의 경우 2016년 3천억원 규모에서 2022년 1조원 규모로 연평균 24%의 고성장률을 보일 것으로 예상되고 있으며, 당사의 3D 프린팅 기반 환자 맞춤형 임플란트가 포함된 의료분야는 전체시장의 약 6% 정도로 약 204억 규모로 추산되고 있습니다. (출처 : 2018년 신개발 의료기기 전망분석보고서, 식품의약품안전처)
현재 국내에서는 일부 병원에서 3D 프린터를 이용한 보청기 제작 및 얼굴뼈 이식, 머리뼈, 관절 수술 등에 제한적으로 사용되고 있지만, 최근 국가차원의 연구개발 집중 투자 등으로 보철, 임플란트, 치과보형물 등 다양한 분야로도 확대되고 있어 시장의 큰 성장이 예상됩니다.
![이미지: [국내 3D 프린팅 시장 규모]](%5B%EA%B5%AD%EB%82%B4%203d%20%ED%94%84%EB%A6%B0%ED%8C%85%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%5D.jpg) |
|
[국내 3D 프린팅 시장 규모] |
국내 3D 프린팅 관련 국내 허가 현황의 경우 총 25개의 품목이 식약처 허가를 획득한 것으로 보고되고 있으며, 이러한 품목 중 33%가 당사의 제품군으로 보고되고 있습니다. 당사는 3D 프린팅 시장 초기에 제품군 Line-up을 확보하여 판매 및 시장점유율을 확보하고 있으며, 추가적인 연구, 개발을 바탕으로 국내 및 해외 시장까지 점유율을 확대해 나가고 있습니다. 뿐만 아니라, 최근 정부는 3차원 프린팅산업 진흥법(2016.12.23.)에 의거하여 수립한 3D프린팅산업 진흥 기본계획(2017~2019)을 의결(2016.12.27., 정보통신전략위원회)하고, 기본계획의 4대 전략 12대 중점과제를 구체화하여 2017년 3D프린팅산업 진흥 시행계획 심의·확정(2017.3.31., 관계부처 합동)을 통해 3D 프린팅 기술에 관한 정책적인 지원 범위를 확대하여 다양한 부처에서 3D 프린팅 관련 R&D 연구 및 실증사업을 독려하고 있습니다. 최근 당사는 산업통상자원부의 지원아래 3D 프린팅 환자 맞춤형 실증사업을 5개의 대학병원과 공동으로 진행하고 있습니다. 이러한 정부의 지원을 통한 신뢰성 강화 및 신개념의료기기 및 신 의료기술로써 가능성 검증, 의료기기품목코드 확보 및 의료수가 등재 등 신산업으로 육성 강화를 통해 3D 프린팅 환자 맞춤형 임플란트의 전국 병원으로의 활용 촉진 및 지원이 가능할것으로 예상되고 있습니다. 또한, 당사는 국가공인시험기관(KTL, KTR, KCL 등)과 공동의 3D 프린팅 임플란트 관련 KGMP 가이드라인 제정 및 수립도 진행하고 있으며, 수립이후 3D 프린팅 임플란트 관련 다양한 신사업 육성 및 의료기기 시장진출 기간 단축등의 다양한 효과가 발생할것으로 예상하고 있습니다.
(3) 시장의 특성
(가) 의료산업 및 의료기기 산업 특성
의료산업은 크게 의료서비스(75%), 의약품(15%), 의료기기(5%), 의료소모품(5%) 등으로 구성되어 있습니다. 전체 의료시장에서 4분의 3을 차지하는 의료서비스 시장은 주로 자국민진료를 위한 공공재 성격이 강한 폐쇄성을 보이고 있으며, 이에 따라 시장 확대를 통한 성장이 매우 제한적입니다. 일부 의료 선진국은 외국인 환자 유치(의료관광)를 통해 별도의 수익을 창출하기 위해 노력하고 있지만, 이 역시 성장에 한계가 있다고 볼 수 있습니다.
결국 의료산업 성패는 의약품과 의료기기에 달려 있습니다. 시장조사 전문기관인 플런켓 리서치에 따르면 세계 의료시장(산업)은 6조 1,500억달러(2013년 기준)로 전 세계 국내총생산(GDP)에서 8.2%를 차지하는 것으로 나타나고 있습니다. 우리나라 의료시장 규모는 의료서비스, 의약품, 의료기기 등을 포함해900억달러(약 100조원)로 세계 의료시장에서 차지하는 비중은 약 1.5%에 불과한 것이 현실입니다.
세계 의료기기 시장은 2008년 글로벌 금융위기 직후인 2009년에는 4.2% 감소하였지만, 2010년과 2011년에는 두 자리수의 성장을 실현하였고, 2014년 이후에는 5% 이상의 성장이 이어질 것으로 분석되고 있습니다. 매우 익숙해진 용어지만 고령화, 웰빙 및 건강에 대한 관심 고조 등은 성장 요인으로 여전히 유효하다고 볼수 있으며 또한 중국, 인도, 브라질 등 신흥국의 경제 성장 및 소득 증가와 이에 따른 의료서비스 수요 증가 등도 의료기기 시장의 전망을 긍정적으로 이끄는 요인이 되고 있습니다.
GlobalData의 전망에 의하면, 2015년 세계 의료기기 시장 규모는 4,158억 달러로 2014년 대비 5.7% 성장할 것으로 추정되며, 매년 꾸준히 시장 규모가 성장하여 2020년까지 연평균 6.4%, 시장은 5,679억 달러 규모에 이를 것으로 전망되고 있습니다.
(출처 : Medical Equipment Market, Global(2013-2020), GlobalData)
2013년 국가별 의료기기 시장 규모는 전체 3,402억 달러이며, 미국, 일본, 독일 등 주요 선진국이 대부분의 의료기기 시장을 점유하고 있습니다. 미국의 시장 규모는 1,338억 달러로 세계시장의 약 39.3% 차지하는 것으로 나타났으며, 상위 20개 국가가 전체의 88.8%를 차지하는 것으로 나타났습니다. 일본은 310억 달러(9.1%)로 의료기기 시장규모가 세계에서 두 번째로 큰 국가로 유지하고 있으며, 독일 268억 달러(7.9%)과 중국 187억 달러(5.5%), 프랑스 150억 달러(4.4%) 등 순서로 나타나고 있습니다. 우리나라의 경우 2014년 의료기기 시장 규모는 전세계 11위로 2013년에 이어 2년 연속 11위를 기록하며 50억 달러(1.5%)를 차지하고 있습니다. 특히 중국의 경우 신의약 위생체제 개혁 및 의료기기 세대교체 수요 등으로 인해 2014년 시장규모의 성장율은 20%를 상회할 것으로 전망되고 있습니다.
(출처 : The World Medical Markets Fact Book 2014, MBI & (재)원주의료기기테크노벨리 의료기기시장 기술정보지)
당사의 지사가 있는 미국, 멕시코 칠레, 브라질, 그리고 중국으로 구성된 아프리카, 아시아 시장은 전체 시장의 약 69%로 우수한 성과를 낼 수 있을것으로 사료됩니다.
(나) 규제환경 등
의료기기산업은 정부의 의료정책 및 관리제도와 밀접한 관련성이 있습니다. 의료기기산업은 인간의 생명과 보건에 관련된 제품을 생산하는 산업으로 국민의 건강증진 및 건강권 확보 등에 직간접적 영향을 받기 때문에 정부의 인허가 등 규제가 필요합니다. 따라서 정부는 의료기기 생산 및 제조, 임상시험 등 안전규제, 유통 및 판매 등 안전성, 유효성 확보, 지적재산권 보장 등에 대하여 규제하고 있습니다.
대한민국 의료기기 관련 규제 현황
|
단계 |
관련 법규 |
관련 기관 |
|---|---|---|
|
제조업 허가 |
의료기기법 및 동 시행령 |
식약처 |
|
품목 허가 |
의료기기 허가 등에 관한 규정 의료기기 등급분류 및 지정 등에 관한 규정 |
|
|
품질적합심사 (KGMP) |
의료기기 기술문서 등 심사에 관한 규정 |
품질관리 심사기관 |
|
제품생산 및 판매 |
의료기기 제조/수입 품질관리 기준 |
- |
|
국가명 |
규제기관 |
관련법규 |
품질시스템 |
|---|---|---|---|
|
유럽 |
National Competent |
MDD 93/42/EEC as amended by MDD |
ISO 13485 |
|
미국 |
FDA |
FD&C Act (Federal food, drug & cosmetic Act) |
QSR |
|
멕시코 |
COFEPRIS |
Ley General de Salud Reglamento de Insumos para la Salud (보건용 제품, 소재에 관한규칙) |
ISO 13485 |
|
브라질 |
ANVISA |
Law No.6360,decree No. 79,094/972.RDC-185 |
ISO 13485 |
|
중국 |
CFDA |
의료기기 감독 관리 조례 중국 국령 |
ISO 13485 |
|
일본 |
PMDA |
Pharmaceutical and Medica Device Law (PMDL) |
ISO 13485 |
특허를 통해 독점성이 보장되는 제약산업과 달리, 의료기기산업은 후발기업이 혁신기술을 개발하는 경우 선발기업보다 그 수혜를 더 누릴 수 있는 가능성이 매우 높습니다. 따라서, 선발기업은 빠른 시일 내에 인허가, 의료기술평가, 보험급여라는 모든 규제장벽을 넘어서야만 개발에 대한 대가를 누릴 수 있게 됩니다.. 국내 및 해외 각국가별 다양한 제품을 등록하기 위해 성능평가 및 생물학적 안전성, 멸균시험 등에 대해 국제표준규격에 의거한 시험 리포트를 구비해야 하며 이렇게 축적된 데이터를 바탕으로 신규개발 제품의 인허가 및 보헙급여 획득에 관한 규정 및 절차를 준수해야 합니다. 당사는 기업부설연구소 설립 이후 국제 표준 규격(ISO, ASTM)에 따라 기술개발제품의 선행 연구, 다양한 성능평가시험을 완료하여 국내외 허가(MFDS, FDA, CE, CFDA, ANVISA) 허가를 완료 하였습니다. 뿐만 아니라, 당사가 보유한 성능평가시험 장비를 바탕으로 척추 및 정형외과, 환자 맞춤형 임플란트에 관한 모든 성능평가시험 진행이 가능하며, 약 300건이상의 시험 성적서도 보유하고 있어 국내 및 해외 각국가별 다양한 제품의 등록이 가능한 역량을 보유하고 있습니다.
(4) 신규사업 등의 내용 및 전망
(가) 사업계획의 내용
당사는 정형외과와 신경외과에서 주로 사용되는 척추임플란트, 척추 수술용 기구를 제조 판매하는 의료기기 전문 기업입니다. 당사의 제품은 인간의 몸속에서 시술되는 제품으로 인간의 생명 및 국민보건증진에 중점을 두고 개발된 제품입니다. 제품의 품질 안전성 확보 측면에서 당사가 판매하고 있는 제품들의 대부분 미국 FDA 승인 및 , ISO 13485, GMP 인증을 완료 하였습니다. 당사의 품질 시스템이 미국US FDA의 품질 Audit, 브라질 ANVISA의 품질 Audit에서 이미 증명을 받았다는 것은 품질 및 생산에 있어 신뢰성이 있다는 보증이며 경쟁사들과 차별화 되는 점이라고 판단됩니다. 이러한 차별화를 통해 전체 매출액의 50% 이상이 수출이며 주요 정형외과 글로벌 시장인 북미, 남미에 지사를 설립하여 매출 확대 중에 있습니다.
(나) 투자계획
현재 당사는 주력제품인 척추임플란트 이외에 충북 제천시에 제 2공장 설립을 검토 중에 있습니다. 제 2공장에서는 3D 메탈 프린팅 제품, 인공관절, 인공디스크, 인공뼈, 골접합용판 등의 신규 생산라인을 구축하여 사업 다각화를 통한 경쟁력 강화 목적입니다.
(다) 주요 수출실적 예측 및 전망
① 향후 2사업연도 내수, 수출계획
당사는 2021년 코로나의 영향에도 적극적인 영업활동을 통한 국내외 매출 증가로 2020년 대비 2021년 10.9%의 매출 증가율을 기록하였습니다. 매출액 성장률은 지난 2017년부터 2021년까지 연평균 6.5%로 성장하고 있습니다. 미국, 멕시코, 칠레, 브라질의 해외현지법인을 통한 2021년 매출액은 46억을 달성하였습니다. 또한, 17년말부터 중국합자법인의 현지공장(충칭소재)에서 제품생산에 따라 거대 시장인 중국 시장에 본격적으로 진출하는 계기가 되었습니다. 척추임플란트 시장의 최대 시장인 북미, 남미 그리고 의료기기 거대시장으로 부각하고 있는 중국시장에 대한 진입을 토대로 매년 10% 이상의 매출 신장을 기록할 것으로 전망하고 있습니다.
② 예측 전망에 관한 근거.
[세계 척추수술 관련기기 시장규모(2007~2014)]
(단위: 백만달러, %)
|
구분 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
CAGR (07~14) |
|---|---|---|---|---|---|---|---|---|---|
|
Fusion |
4,576.2 |
4,762.7 |
4,956.9 |
5,159.2 |
5,370.0 |
5,590.0 |
5,819.5 |
6,060 |
4.1 |
|
Non-Fusion |
441.2 |
480.1 |
510.7 |
545.0 |
582.4 |
624.3 |
667.0 |
712 |
7.1 |
|
Vertebral compression fracture repair devices |
677.0 |
711.8 |
748.4 |
813.6 |
855.0 |
898.4 |
944.8 |
994 |
5.6 |
|
Vertebral body replacement system |
272.4 |
286.2 |
300.7 |
316.0 |
332.1 |
349.0 |
366.8 |
386 |
5.1 |
|
Minimal invasive spinal devices |
276.0 |
294.6 |
314.6 |
336.0 |
358.8 |
383.3 |
409.5 |
434 |
6.7 |
|
Total |
6,242.7 |
6,535.4 |
6,831.2 |
7,169.7 |
7,498.3 |
7,845.0 |
8,207.6 |
8,585 |
4.7 |
주) 출처: Medical eTrack, Global Data (2015)
2014년 통계청의 발표에 따르면 국내 척추질환 수술환자에 비해 수술 건수가 약6%가량 많습니다. 이 자료의 의미는 환자수에 비해 수술 건수가 많다는 것이며, 그로인한 척추 임플란트 수요 역시 증가한다는 의미이며 국내에만 국한된 것이 아니라 전세계적인 추세로 당사는 판단하고 있습니다. 또한, 척추수술 환자는 연평균 9.7%, 척추수술 건수는 연평균 10.1% 증가하였습니다.
 |
|
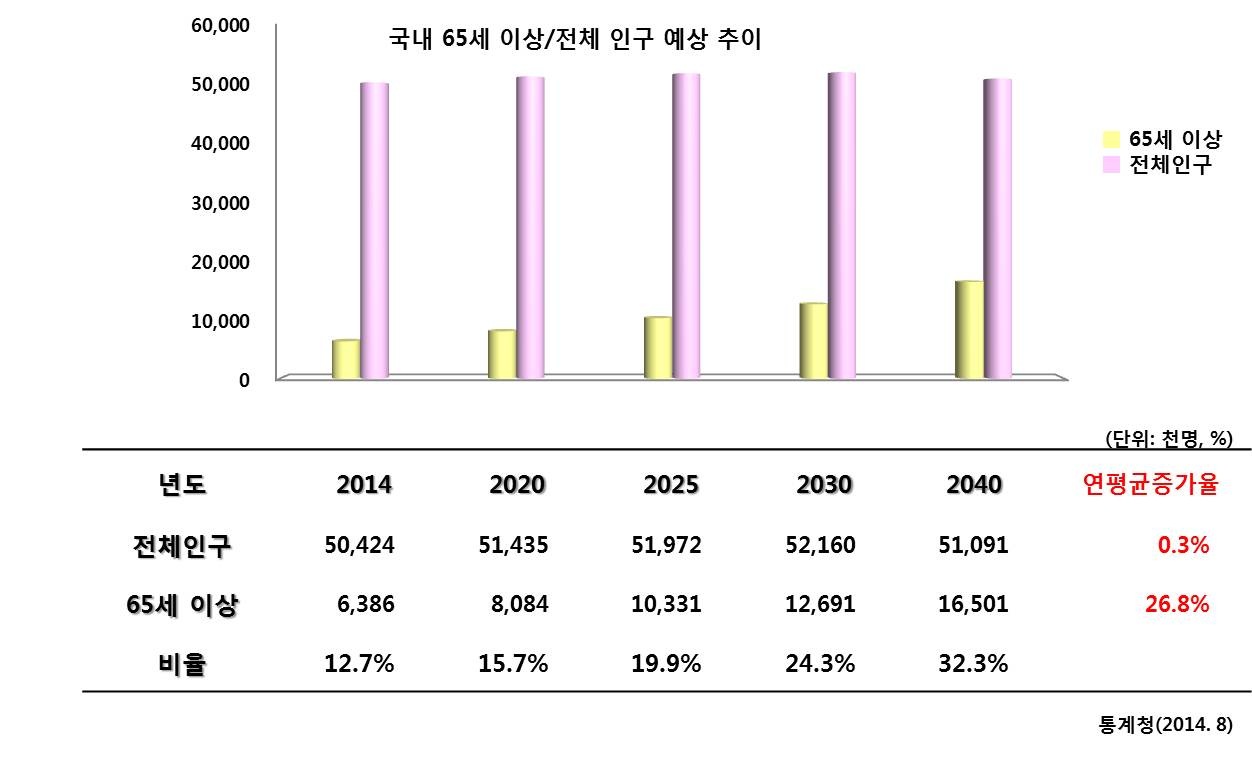
국내 65세 이상 전체인구 예상추이 |
또한 위 표와같이 국내 전체 인구는 연평균 0.3% 증가에 그치는 반면 65세 이상 증가 비율이 26.8% 씩 증가할 것으로 통계청은 발표하였습니다.
고령화의 추세는 국내 문제 뿐 아니라 전 세계적인 흐름입니다. 인구고령화로 인한 척추질환 환자 역시 증가할 것이라는 것이 당사의 예측입니다.
위와 같은 통계 발표를 종합적으로 고려하여 실적을 예측하였습니다. 그럼에도 불구하고 위 기재 또는 표시된 정보는 통계청의 통계 발표를 근거로 한 예측 정보로 투자판단의 참고자료로만 활용하시길 바랍니다. 위 예측치는 시장 상황의 급변으로 인해실제 결과치와 달라질 수 있다는 점을 투자자께서는 유의하시길 바랍니다.
(5) 조직도
(가) 한국법인
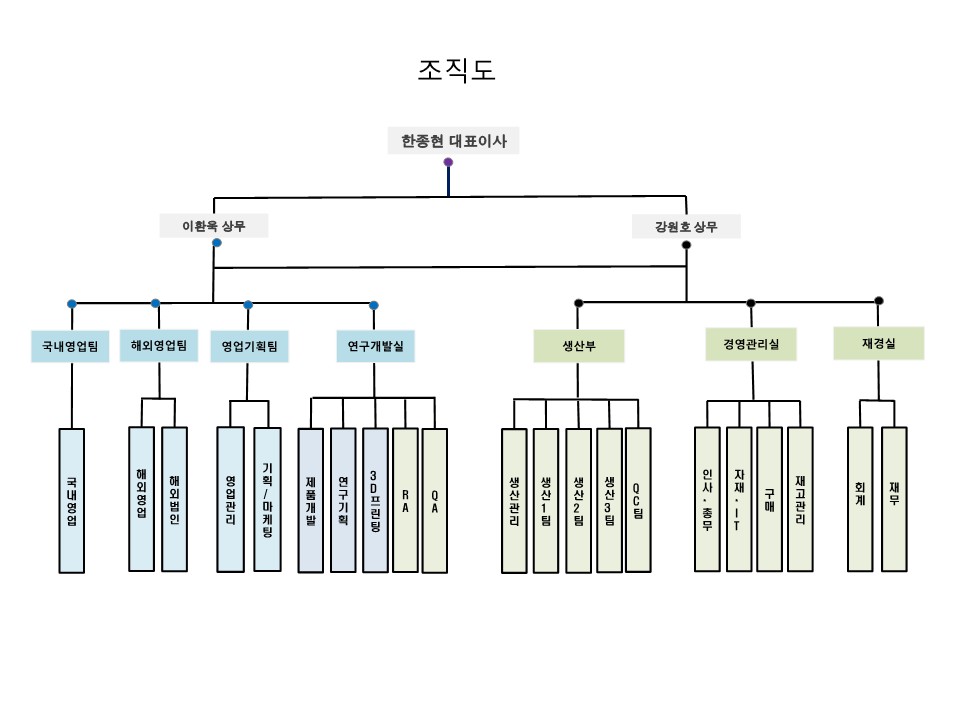 |
|
조직도_메디쎄이 |
(나) 해외법인
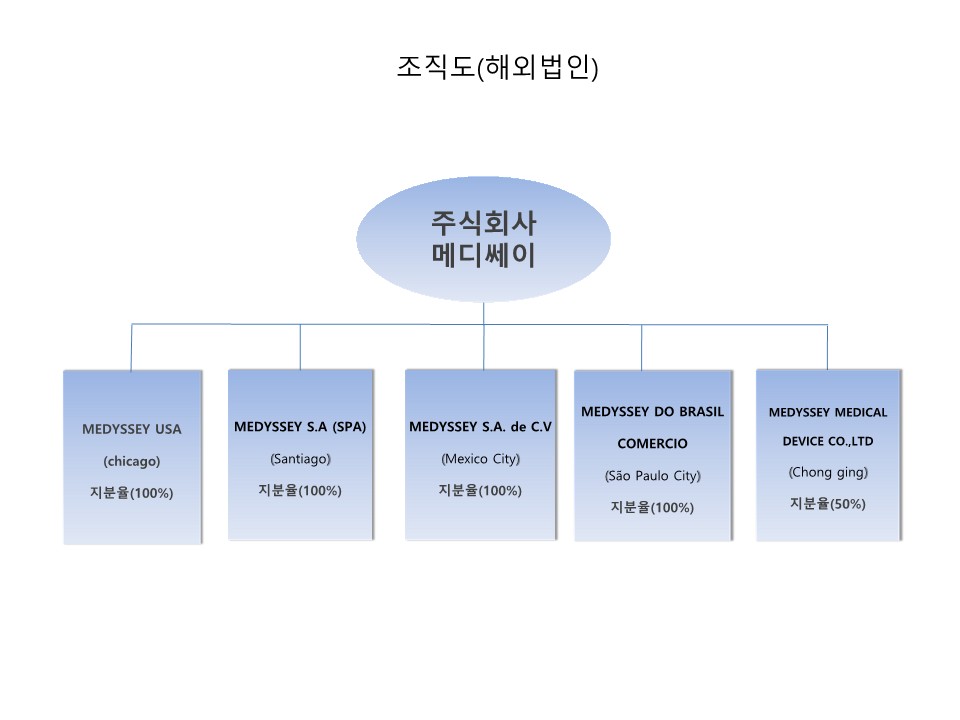 |
|
조직도_해외법인 |
2. 주주총회 목적사항별 기재사항
□ 정관의 변경
가. 집중투표 배제를 위한 정관의 변경 또는 그 배제된 정관의 변경
| 변경전 내용 | 변경후 내용 | 변경의 목적 |
|---|---|---|
| - | - | - |
나. 그 외의 정관변경에 관한 건
| 변경전 내용 | 변경후 내용 | 변경의 목적 |
|---|---|---|
|
제2조(목적) 1. 의료기기 제조 및 도. 소매업 2. 기타 조립금속제품 제조업 3. 전기, 전자기기 제조, 판매업(도, 소매) 4. 의료기기 임대업 5. 기술연구개발 및 기술용역업 6. 외국업체 대리점업 7. 무역업 8. 물품매도확약서 발행업 9. 인터넷 및 전자상거래 관련사업 10. 벤처관련 지분출자 및 투자 11. 부동산 임대업 12. 기타 위 사항에 부대하는 사업일체 |
제2조(목적) 1. 의료기기 제조 및 도. 소매업 2. 기타 조립금속제품 제조업 3. 전기, 전자기기 제조, 판매업(도, 소매) 4. 의료기기 임대업 5. 기술연구개발 및 기술용역업 6. 외국업체 대리점업 7. 무역업 8. 물품매도확약서 발행업 9. 인터넷 및 전자상거래 관련사업 10. 벤처관련 지분출자 및 투자 11. 부동산 임대업 12. 의약품, 원료의약품, 의약외품, 화장품, 의료용구 및 위생용품의 제조, 소분 및 매매 13. 농약, 동물용약품의 소분 및 매매 14. 약초재 재배 및 매매 15. 화공약품 및 독극물의 매매 16. 식료품 및 청량음료의 매매 17. 건강기능식품, 건강식품, 식품첨가물 제조 및 매매 18. 인삼제품 제조 및 매매 19. 세제, 세정제, 플라스틱 제품, 기타 생활용품의 매매 20. 정보통신 관련 사업 21. 유통업 및 물류관련 사업 22. 부동산 개발 및 공급업 23. 기타 위 사항에 부대하는 사업일체 |
사업의 목적 추가 |
※ 기타 참고사항
- 해당사항 없습니다.
IV. 사업보고서 및 감사보고서 첨부
가. 제출 개요
| 제출(예정)일 | 사업보고서 등 통지 등 방식 |
|---|---|
| - | - |
나. 사업보고서 및 감사보고서 첨부
- 해당사항 없습니다.
※ 참고사항
|
코로나바이러스 감염증-19(COVID-19)의 감염 및 전파를 예방하기 위하여 주주총회에 참석시 주주님들의 체온을 측정할 수 있으며, 측정결과에 따라 발열이 의심 되는 경우, 부득이하게 총회장 출입이 제한될 수 있음을 알려드립니다. 또한, 반드시 마스크 착용을 부탁드립니다. 마스크 미착용시 주주총회 개최장소의 출입이 제한될 수 있습니다. 만약, 주주총회 개최 전 코로나바이러스 확산에 따른 불가피한 장소 변경이 있는 경우, 지체없이 재공시 하여 안내 드릴 예정입니다. |