 |
|
제 8기 정기주주총회 소집통지서 |
주주총회소집공고
| 2022 년 03 월 11 일 | ||
| 회 사 명 : | 주식회사 셀리버리 | |
| 대 표 이 사 : | 조대웅 | |
| 본 점 소 재 지 : | 서울시 마포구 상암동 189 중소기업 DMC타워 9층 | |
| (전 화) 02-3151-8900 | ||
| (홈페이지)http://www.cellivery.com | ||
| 작 성 책 임 자 : | (직 책) 대표이사 | (성 명) 조대웅 |
| (전 화) 02-3151-8900 | ||
주주총회 소집공고
| ( 제08기 정기 ) |
 |
|
제 8기 정기주주총회 소집통지서 |
 |
|
감사 후보자 상세사항 |
I. 사외이사 등의 활동내역과 보수에 관한 사항
1. 사외이사 등의 활동내역
가. 이사회 출석률 및 이사회 의안에 대한 찬반여부
| 회차 | 개최일자 | 의안내용 | 사외이사 | |
|---|---|---|---|---|
| 김형준 (출석률: 100 %) |
||||
| 찬 반 여 부 | 결 과 | |||
| 1 | 2021.01.18 | 1. 신주발행에 따른 무상증자의 건 | 찬성 | 가결 |
| 2 | 2021.02.26 | 1. 제7기 재무제표 승인의 건, 정기주주총회 소집의 건 | 찬성 | 가결 |
| 3 | 2021.09.23 | 1. 신주 발행의 건 (제3자 배정 전환우선주) 2. 제2회차 무기명 무보증 사모 전환사채 발행의 건 |
찬성 | 가결 |
| 4 | 2021.09.30 | 1. 신주 발행의 건 (제3자 배정 전환우선주) 2. 제3회차 무기명 무보증 사모 전환사채 발행의 건 |
찬성 | 가결 |
| 5 | 2021.11.16 | 1. 타법인 주식 및 출자증권 양수의 건 | 찬성 | 가결 |
| 6 | 2021.12.23 | 1. 타법인 주식 및 출자증권 취득 결정의 건 | 찬성 | 가결 |
나. 이사회내 위원회에서의 사외이사 등의 활동내역
| 위원회명 | ||
|---|---|---|
| 개최일자 | 의안내용 | 가결여부 |
| - | - | - |
해당사항 없음
2. 사외이사 등의 보수현황
| (단위 : 백만원) |
| 구 분 | 인원수 | 주총승인금액 | 지급총액 | 1인당 평균 지급액 |
비 고 |
|---|---|---|---|---|---|
| 사외이사 | 1 | 15 | 14 | 14 | 지급 총액은 급여 보수임 |
※ 상기의 주총 승인금액은 등기이사 1명에 대한 보수총액 한도액입니다.
II. 최대주주등과의 거래내역에 관한 사항
1. 단일 거래규모가 일정규모이상인 거래
| (단위 : 억원) |
| 거래종류 | 거래상대방 (회사와의 관계) |
거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
- 해당사항 없습니다.
2. 해당 사업연도중에 특정인과 해당 거래를 포함한 거래총액이 일정규모이상인 거래
| (단위 : 억원) |
| 거래상대방 (회사와의 관계) |
거래종류 | 거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
- 해당사항 없습니다.
III. 경영참고사항
1. 사업의 개요
가. 업계의 현황
(1) 사업 환경
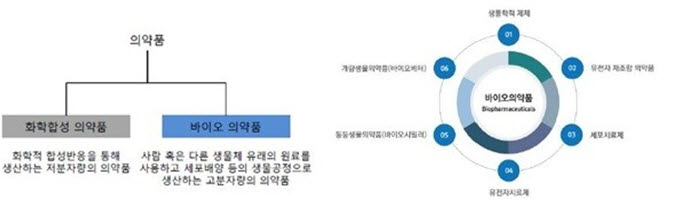
1) 바이오의약품의 정의
바이오의약품은 사람이나 다른 생물체에서 유래하는 세포, 단백질, 유전자 등의 생물유래 물질을 원료로 하여 제조한 의약품으로 성분에 따라 다양하게 구분됩니다. 대표적인 바이오의약품으로는 항체의약품, 백신, 세포치료제, 유전자재조합의약품 등이 있습니다.
바이오의약품은 생물유래물질을 원료로 하기에 화학합성의약품보다 고유 독성이 낮고 작용 기전이 명확합니다. 그로 인해 기존 치료법에 대한 미충족 수요가 높은 퇴행성/난치성 질환 치료제, 혹은 환자 맞춤형 표적 치료제로의 가능성을 바탕으로 바이오의약품의 의약품시장에서의 영향력은 점차 커지고 있습니다.
[의약품 분류] [바이오의약품 분류]
 |
|
보고서 자료 |
2) 바이오산업의 특성
의약품 산업은 국민의 건강관리 및 질병의 예방, 치료, 처치, 진단을 위한 약품을 개발ㆍ제조ㆍ판매하는 산업으로서 전 세계적으로 빠르게 진행되고 있는 인구 고령화, 경제성장으로 인한 평균 수명 증가, 코로나19의 등장과 그로 인한 팬데믹으로 위생과 건강의 관심이 증대 되어 급속한 성장이 예상되는 분야입니다.
의약품 산업은 크게 화학적 합성 의약품이 중심이 되는 저분자 의약품과 바이오 기술의 접목을 통해 단백질 및 백신 등이 중심이 되는 고분자 의약품으로 구분됩니다. 최근에는 생명공학을 바탕으로 생물체의 기능 및 정보를 활용하여 만들어진 고분자 (바이오) 의약품이 전통적인 합성물 의약품 시장보다 빠르게 성장하고 있는데, 이런 바이오의약품은 항체치료제, 세포치료제, 유전자치료제, 줄기세포 치료제, 백신 등을 포함하고 있습니다.
바이오의약품의 특성은 일반적으로 합성의약품에 비해 크기가 크고, 복잡한 구조를 가지고 있으며, 생물체를 이용하여 복잡한 제조공정을 거쳐야 되므로 변화에 민감합니다. 특히 합성의약품은 오염 및 불순물 관리에 유의해야 하는 반면 바이오의약품은 생물유래 물질로 고유의 독성이 낮고 작용기전이 명확하여 난치성 및 만성 질환에 뛰어난 효과를 가지고 있습니다.
바이오의약품은 백신과 혈액제제 등으로 일컫는 1세대 바이오의약품을 시작으로 유전자조작 및 세포 배양기술을 도입한 재조합의약품과 세포배양의약품 그리고 최근에는 세포융합기술 및 정보기술 등을 접목한 항체의약품, 유전자치료제, 세포치료제, DNA 백신 등과 같은 첨단 바이오의약품으로 발전되고 있습니다.
① 철저한 규제 의존성
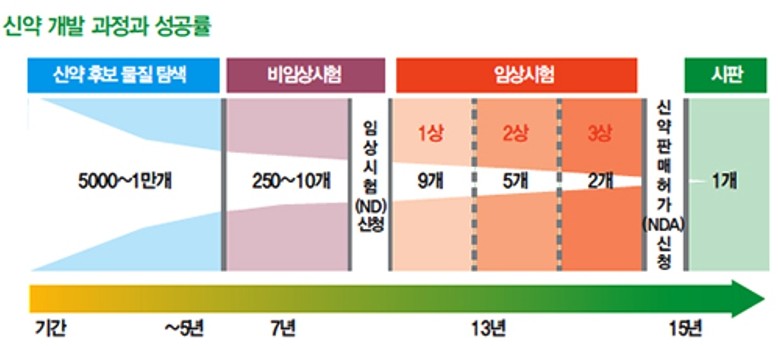
새로운 의약품이 환자에게 판매되기 위해서는 신약후보물질의 발굴에서부터 동물을 대상으로 하는 전임상시험, 인체를 대상으로 하는 임상시험, 시판승인이라는 각 단계를 모두 거쳐야 하며, 모든 단계에서 각 국가의 규제당국이 제시하는 규정을 모두 준수해야 합니다.
특히 인체를 그 시험대상으로 하는 임상시험을 진행하고자 할 때에는 효능과 안전성에 대한 각 국가의 정부규제가 엄격하여, 인체에 대한 임상시험 이전단계부터 엄격한 규제에 의해 축적된 다양한 데이터를 각 국가의 규제당국에 제출하여야 합니다. 또한, 임상개시를 허용받고 임상시험을 진행중인 경우에도 심각한 부작용 등이 보고되는 경우에는 진행 중인 임상이 규제당국에 의해 중단되거나 철회 될 수 있으며, 마찬가지로 임상시험을 성공적으로 마치고 시판승인을 받은 신약을 생산 및 판매하는 과정에서도 규제당국이 제시하는 엄격한 규정을 따라야 합니다.
 |
|
출처: 식품의약품안전처 |
다만, 개발중인 신약의 안정성이 일정수준 이상 확인되고 그 의학적 효능이 기존 치료제 대비 월등하거나, 희귀질환을 치료할수 있는 경우에는 전체 규정된 임상단계가 완료되지 않은 단계에서도 조건부 혹은 전면 조기시판승인이 허용되기도 합니다.
코로나19로 인한 전 세계적 팬데믹 상황에 따라 각 국가별 방역 상황 및 코로나 관련 의약품 긴급사용승인이 늘어나, 코로나19 팬데믹 상황 종결 되기까지 각 국가별 정부 규제 상황은 변동될 예정입니다.
② 높은 진입장벽
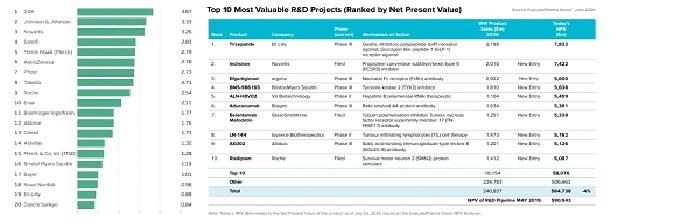
신약후보물질이 초기 연구 및 임상시험을 거쳐 시판승인을 이루기까지는 짧게는 수년에서 길게는 15년 이상의 기간이 소요되며, 그 과정에서 많은 개발비용이 발생하게 됩니다. 즉, 제약 및 신약 개발 산업은 높은 개발비용에 따른 진입 장벽이 존재합니다.
조사결과에 따르면 신약개발 과정에서 발생하는 개발비용은 지속적으로 증가하는 추세를 보이고 있습니다. 2010년 1,300억불에서 2020년에는 1,720억불, 2022년에는 1,820억불에 달할 것으로 예상 되고 있습니다. 이는 신약의 성공확률이 과거대비 하락하고 있어 시판에 성공하는 신약 당 연구개발 비용의 증가세가 두드러지는 것으로 이해되며, 결과적으로 신약개발에 따른 진입장벽이 갈수록 높아지고 있는 추세를 보이고 있는 것으로 파악됩니다.
 |
|
보고서 자료 2 |
자료: 다국적 기업의 R&D 비용 및 순위, Access to Medicine Foundation, 2021
자료: 다국적 기업의 R&D 프로젝트 비용 및 순위, Source EvaluatePharma Vision, 2020
한편, 오랜 기간에 걸쳐 개발된 신약은 통상적으로 특허권에 의해 일정기간 동안 그 권리를 보호받게 되며, 희귀질환 치료제의 경우 신약개발의 인센티브를 부여하기 위하여 규제당국으로부터 시판승인 후 일정기간 동안 독점판매기간을 허용 받을 수도 있습니다. 또한, 한번 시판된 신약에 대해서는 그 사업성을 보장해주기 위해, 타 신약 후보군의 비열등성이 입증되고, 이미 시판된 신약과 비슷한 기전과 효능 및 부작용을 가질 경우에는 시판승인을 불허하고 있는 추세입니다.
대부분의 국가에서 특허 존속기간은 출원 후 20년이고, 해당 신약이 희귀의약품 (Orphan drug)으로 지정되는 경우에는 특허 존속기간과 관계없이 미국은 시판 승인후 7년, 유럽은 10년간 독점판매권을 보장받기 때문에 해당기간 동안 유사한 효능을 가지는 신약이나 복제약이 시장진입을 하기 힘든 구조입니다.
[주요국의 특허 존속기간 및 의약품 독점 판매 기간]
|
구분 |
특허 존속기간 |
희귀의약품 지정시 독점 판매기간 |
|---|---|---|
|
미국 |
출원 후 20년 |
신약 시판승인 후 7년 |
|
유럽 |
출원 후 20년 |
신약 시판승인 후 10년 |
|
한국 |
출원 후 20년 |
- |
자료: 각 국 특허청 및 식약청
주) 한국은 희귀의약품에 대한 독점 판매기간 부여제도를 운영하고 있지 아니합니다.
각 국가의 규제당국은 신약에 대한 시판 승인 이전이라 하더라도 기존에 진행 중인 임상시험과 동일 하거나 유사한 개념의 신규 임상시험 신청에 대해서는 승인을 불허하여 선행 임상진행 신약후보군에 대한 보호조치를 시행합니다. 오랜 신약개발 과정 동안 발생하는 높은 개발비, 특허권 또는 독점판매기간으로 보장되는 권리 등으로 인하여 제약 및 신약개발산업은 여타 산업 대비 강력한 진입장벽을 가집니다.
③ 고위험, 고부가가치 (High risk, High return)
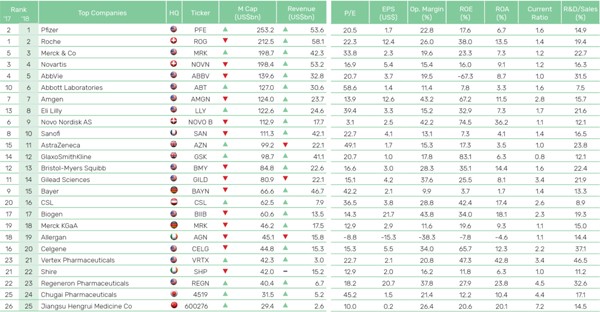
전술한 바와 같이 제약 및 신약개발 산업은 철저한 규제의존성 및 높은 진입장벽이라는 위험이 존재 합니다. 그렇기에 시판 승인 시 특허권을 통한 자체적 권리보호조치를 통해 허용된 독점판매기간 동안 판매할 신약에 대한 가격결정력의 행사가 가능하게 되며 이를 통해 높은 부가가치를 창출할 수 있습니다. 즉, 신약을 개발하기 위해 많은 비용이 투입되지만, 시판 이후에는 생산 및 마케팅 비용 대비 약가가 높은 수준에 형성이 되어 높은 수준의 수익성 시현이 가능합니다.
[글로벌 제약사의 2018년 영업이익률]
 |
|
자료: 글로벌데이터 |
실제로 위 자료와 같이 2018년 상위 25개 제약사들의 평균 영업이익률은 21.6%로 이는 일반 제조업 등에 비해 매우 수익성이 높습니다.
④ 연구 집약적
신약개발을 위해서는 기초연구부터 허가과정까지 의학, 약학, 화학, 생물학 등 제반 기능이 유기적으로 결합되어야하며 10여 년의 개발과정을 거쳐야 하므로 그 어떤 산업보다 연구개발 비중이 높습니다. 2015년 기준 제약산업의 1인 평균 R&D 비용은 산업 중 가장 많은 13만달러이며 이는 반도체 산업 의 약 3배에 달하는 수치입니다. (2015 Profile Biopharmaceutical Research Industry_PhRMA)
⑤ 지적 재산권 확보가 경쟁력의 핵심
제약 산업은 물질특허의 확보가 사업의 핵심 성공 요인으로, 이 물질 특허를 얻지 못하면 원천적으로 사업이 불가능하거나 물질특허 소유자로부터 기술이전을 받아야 합니다. 임상2상a 이상을 수행하기 어려운 중소규모 제약사나 벤처는 임상2상a 단계 이전에 글로벌제약사에 기술이전을 함으로써 수익을 창출할 수 있습니다. 특허가 가장 중요한 경쟁요소이기 때문에 대부분의 국가에서는 특허기간을 최대한 보호하기 위한 다양한 전략 및 정책을 도입하고 있습니다.
3) 바이오산업의 성장성
세계 전문의약품 시장은 매년 지속적으로 성장하고 있습니다. 글로벌 제약시장 조사기관인 Evaluate Pharma에 따르면 세계 전문의약품 시장규모는 매년 성장 추세를 보이고 있습니다. 이는 세계적인 인구 고령화 추세에 따라 노인성, 만성질환에 대한 치료수요가 증가하고 코로나19로 인한 팬데믹의 특수 상황으로 의료 분야의 시장성이 확대되고 있기 때문입니다.
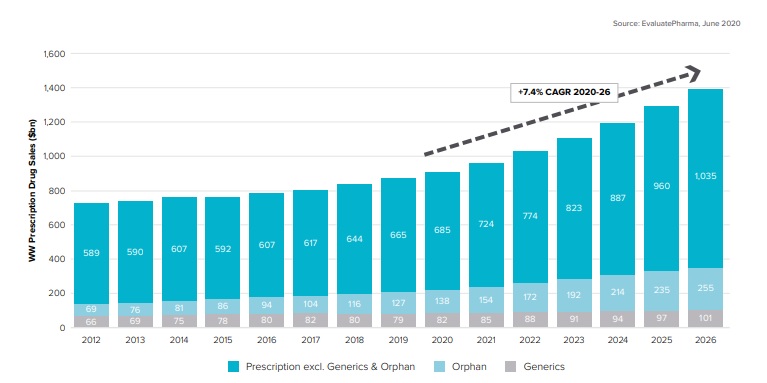 |
|
자료: 글로벌 의약품 시장 규모 (EvaluatePharma, World Preview 2020 Outlook to 2026) |
또한 글로벌 의약품 시장에서 바이오의약품이 차지하는 비중은 매년 증가 추세이며, 글로벌 의약품 전체 시장에서 바이오의약품 비중은 2017년 25%에서 2024년 31%로 증가할 전망입니다. 또한, 글로벌 매출 상위 100대 제품에서 바이오의약품 비중은 2017년 49%에서 2024년 52%로 증가할 전망입니다.
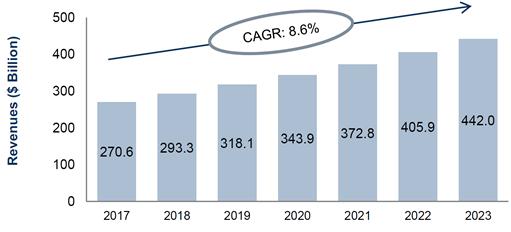 |
|
자료: 생명공학정책연구센터, Strategic Insights into Biopharmaceuticals Industry (Frost & Sullivan 분석), 2019.3 |
당사에서 개발 완료한 가장 진보된 Hydrophobic CPP인 aMTD-융합 재조합단백질 기반 바이오신약/바이오베터 및 연구용시약은 바이오 의약품 분야의 독보적인 기술입니다. 기전특이적인 효능 (Mechanism-specific activity)을 가지고 있는 약리물질은 특정 질병 또는 특정 기전에만 작용할 수 있기 때문에, 이를 세포 내로 전송 한다면 다른 약품에 비해 부작용이 낮아 매우 안전합니다. 또한, 강력한 생체 내 세포 간 연속전송능 (Cell-to-cell systemic delivery)을 통해 우수한 약효를 가진 바이오의약품 개발이 가능할 것입니다. 독보적인 기술 확보 및 limitation이 없는 제품개발, 그리고 바이오의약품 시장의 큰 폭의 성장으로 당사의 "약리물질 생체 내 전송기술" 을 이용한 바이오의약품 연구 및 개발도 지속적으로 성장해 나갈 것이며, 당사의 기술수명주기는 매우 길 것으로 판단됩니다.
4) 목표시장의구성-바이오의약품 (Biotherapeutics)
(가) 바이오의약품 현황
글로벌 의약품 시장의 추세는 점진적으로 합성의약품에서 바이오의약품으로 이동하고 있습니다. 2019년 기준 글로벌 제약시장은 약 9,100억달러 (약 1,018조 2,900억 원) 규모이며, 이 중 바이오의약품 시장은 약 29%인 2,660억달러 (약 297조 6,806억 원)로 나타났습니다. 글로벌 바이오의약품 시장은 최근 8년 (2010년~2018년) 간 연평균 8.2%수준으로 성장했습니다. 이러한 추세는 앞으로도 지속되어 2026년에는 5,050억달러 (565조 4,990억원)로 시장이 커질 것으로 전망됩니다.
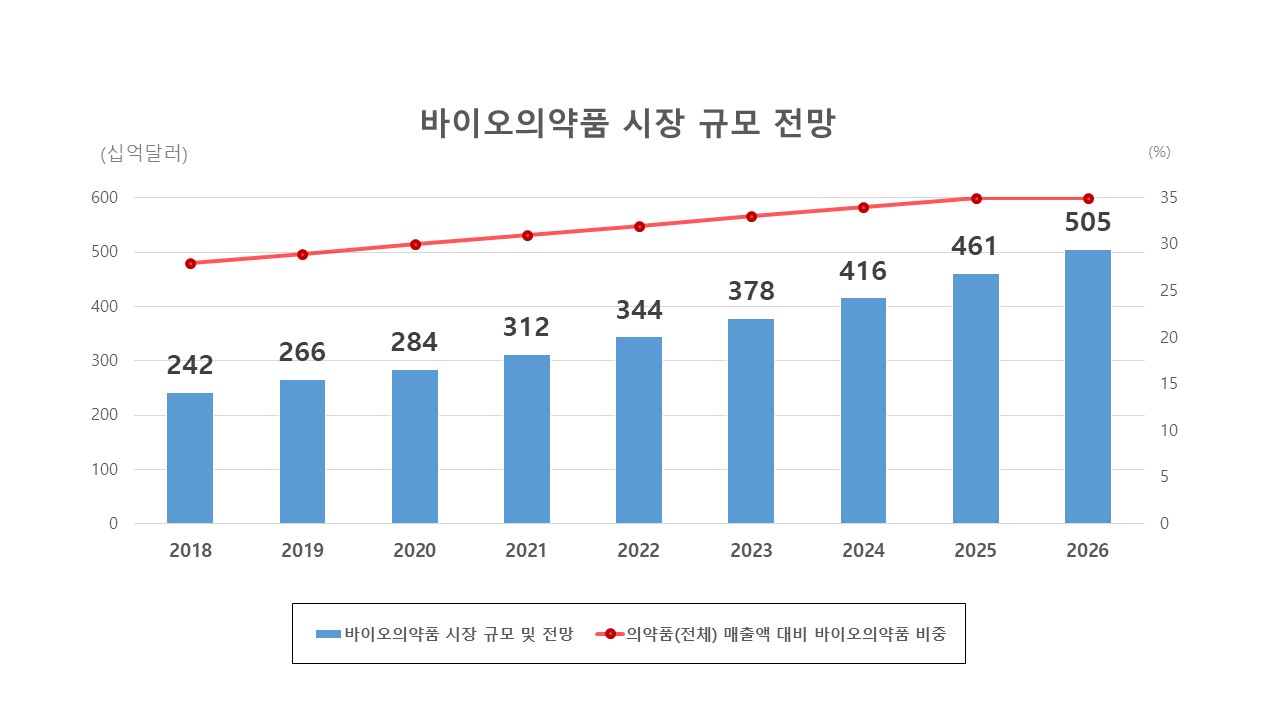 |
|
자료: 한국바이오의약품협회 (2020), 한국보건산업진흥원 <바이오의약품 산업 분석 및 정책 연구> |
(나) 바이오의약품의 분류
바이오의약품은 유효성분에 따라 유전자재조합단백질 (Recombinant protein), 세포치료제 (Cell therapy products), 유전자치료제 (Gene therapy products), 혈액제제 (Blood medicine), 백신 (Vaccine) 등으로 구분할 수 있습니다. 생산조건 및 환경에 민감한 생물체를 이용하여 생산하고 있고 그 제조공정이 복잡하여, 생산시설 구축과 생산기술 확보 등의 진입장벽이 매우 높습니다. 한편, 당사의 주력 기술 제품은 유전자재조합단백질 바이오 의약품에 해당합니다.
[바이오의약품의 종류]
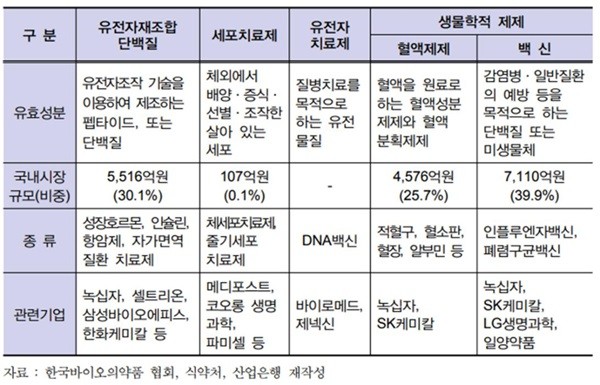 |
|
자료: 바이오의약품의 종류 (한국 바이오의약품 협회, 식약처, 산업은행) |
(다) 유전자재조합단백질 (Recombinant protein)
(다)-1 유전자재조합단백질의 분류
유전자재조합단백질은 유전자재조합 (Gene recombinant), 세포배양 (Cell culture), 단백질공학 (Protein engineering) 기술 등을 기반으로 합니다. 유전자재조합단백질은 미생물, 동물세포를 이용하여 대량생산이 가능하며 인체 천연 단백질과 유사한 구조로 체내 부족한 단백질을 보충해주는 치료용단백질 (Therapeutic protein), 항체의약품 (Therapeutic antibody), 바이오시밀러 (Bio-simillar), 바이오베터 (Bio-better) 등으로 나눌수 있습니다. 당사의 기술개발제품은 치료용 세포투과성 재조합단백질 (Cell-permeable therapeutic recombinant protein), 세포투과성바이오베터가있습니다.
|
구분 |
치료용단백질 |
항체의약품 |
바이오시밀러 |
바이오베터 |
|---|---|---|---|---|
|
개요 |
- 인체 천연 단백질과 유 사한 구조와 기능을 보유 - 체내 부족한 유용 단백질 보충 |
- 안정한 구조를 가진 항체 - 발병기전에 작용하는 인자가 표적 |
- 특허가 만료된 의 약품과의 비교 동등 선이 입증된 복제약 |
- 기존 의약용 단백 질의 효능, 안전성, 환자편의성 등을 개 선한 신약 |
자료: 유전자재조합단백질의 분류 (산업은행, 바이오의약품 기술 및 산업 동향)
(다)-2 유전자재조합단백질 시장 및 임상추진 현황
세계 단백질제제 시장의 5년간 (2019년~2024년) 평균 성장률은 2.5%로 2024년에는 약 130조원 에 달할 것으로 예상됩니다.
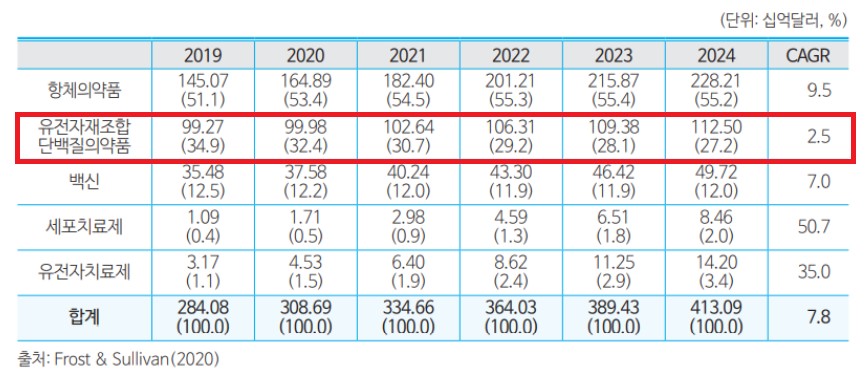 |
|
자료: Frost & Sullivan(Growth strategy consulting & Research Firm 2020) |
국내 바이오의약품 시장의 파이프라인도 글로벌트렌드와 유사한 증가세를 보이고 있습니다. 국내 바이오의약품 중 유전자 재조합단백질 의약품 임상개발이 가장 활발하며, 2020년 국내 전체 의약품 종류별 임상 승인 비중은 유전자 재조합이 26.3%, 생물학적 제재 4.9%, 유전자치료제가 1.4%를 차지합니다.
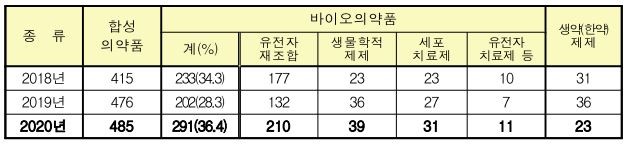 |
|
자료: 바이오의약품 |
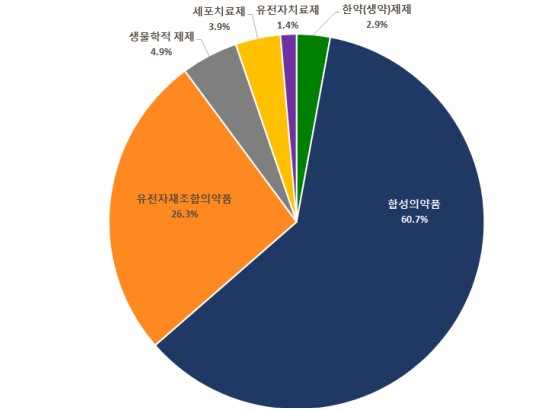 |
|
자료: 식약처, 2020년 임상시험 승인현황 결과 발표 |
시장 내 보고서에 따르면, 통계적으로 유전자재조합단백질의 임상 성공률은 상대적으로 높은 편이며, 당사의 안전하고 기전특이적인 단백질소재 바이오신약 개발제품의 성공률 또한 마찬가지로 매우 높을 것입니다.
(라) 비임상 단계에서의 라이센싱 사례
2016년도 비임상 단계에서 대규모의 기술이전 사례는 11건이 있었으며, 그 중 특히 파킨슨병 치료제와 같은 퇴행성뇌질환 분야는 1건으로 Allergan과 Heptares간의 기술이전으로서 Upfront fee (계약금)만 125백만 달러 (1,500억 원) 규모로 성사되었습니다. Heptares 에서 개발된 의약품은 알츠하이머 및 다른 뇌질환에 적용 가능한 치료제로서 가능성을 보여 총 33억 달러 (한화 4조 원)의 계약규모로 기술이전 되어 파킨슨병 및 알츠하이머병 치료제로서 사용 가능한 당사 iCP-Parkin (파킨슨병 치료제) 기술이전 거래의 좋은 사례일 것으로 판단됩니다.
|
No. |
Licensor/Licensee |
Disease Area (질병분야) |
Phase (단계) |
Upfront (계약금) |
BioBucks (총 계약규모) |
|---|---|---|---|---|---|
|
1 |
Allergan/Heptares |
Neurology (신경학) |
Preclinical (비임상) |
$125M |
$3.3B |
|
2 |
Celgene/Jounce |
Immuno-oncology (면역항암제) |
Preclinical (비임상) |
$261M |
$2.5B |
|
3 |
Novartis/Xencor |
Immuno-oncology (면역항암제) |
Preclinical (비임상) |
$150M |
$2.5B |
|
4 |
Sanofi/DiCE Molecules |
Multiple (질병분야 미정) |
Preclinical (비임상) |
$50M |
$2.3B |
|
5 |
Baxalta/Symphogen |
Immuno-oncology (면역항암제) |
Preclinical (비임상) |
$175M |
$1.8B |
|
6 |
Regeneron/Intellia |
CRISPR/Cas9 (유전자가위) |
Preclinical (비임상) |
$125M |
$1.7B |
|
7 |
Baxalta/Precision |
Immuno-oncology (면역항암제) |
Preclinical (비임상) |
$105M |
$1.7B |
|
8 |
Celgene/Agios |
mmuno-oncology (면역항암제) |
Preclinical (비임상) |
$200M |
$1.2B |
|
9 |
Novartis/Cerulean |
Nanotech Drugs (질병분야 미정) |
Preclinical (비임상) |
$5M |
$1.2B |
|
10 |
Bluebird/Medigene |
mmuno-oncology (면역항암제) |
Preclinical (비임상) |
$15M |
$1.0B |
|
11 |
Roche/Blueprint |
mmuno-oncology (면역항암제) |
Preclinical (비임상) |
$45M |
$1.0B |
|
12 |
유한양행/Boehringer |
NASH(비알코올성지방간염) 치료제 |
Preclinical (비임상) |
$40M |
$0.9B |
|
13 |
JW중외제약/Leo Pharma |
아토피 피부염 치료제 |
Preclinical (비임상) |
$17M |
$0.4B |
자료: 비임상(Preclinicaltrial) 단계의 후보물질 라이센싱 Dealsize(2016) (Source: BioIndustry Analysis, November 2016)
당사는 기술기반 기업으로 최종 의약품 생산 및 판매를 목적으로 하고 있지 않으며, 전임상 단계에서의 기술이전을 목표로 하고 있습니다.
(2) 정부정책 및 법규 등 규제환경
1) 사회/문화적 환경
세계 전문의약품 시장은 매년 지속적으로 성장하고 있습니다. 이러한 급격한 성장 배경은 최근 산업 환경변화에 따른 영향으로 세계적인 인구 고령화 추세에 따라 노인성, 만성질환에 대한 치료수요가 빠르게 증가하고 있고, 삶의 질 향상으로 건강증진 및 유지를 위한 의료분야의 지출이 확대되고 있기 때문입니다. 이에 따라 국가의 의료복지에 비용이 증가하고 있습니다. 그리고 약물의 안전성과 유효성, 효율적인 치료법에 관심이 집중되면서, 보다 안전성이 확보된 바이오의약품에 대한 요구가 증가 되고 있습니다.
2) 정치/제도적 환경
주요선진국들을 중심으로 바이오의약품을 미래 성장 동력으로 확보하고 기술 선점을 위한 정부 차원의 육성 전략 수립을 추진하고 있습니다. 미국, EU, 일본 등 주요국가들이 바이오 산업을 전략적으로 육성하여 중점 투자하는 것은 차세대 핵심 산업으로 성장 가능성이 뚜렷하기 때문입니다. 신 정부는 출범 시 제약/바이오산업의 육성을 위해 아래와 같이 3가지 공약을 제시하였습니다.
- 국제적 규제기준에 부합하는 합리적 기준마련, 정책의 예측가능성을 높이도록 중장기 종합계획 설정
- 국내 개발 신약 글로벌 진출 활성화를 위한 보험 약가 결정구조 개선
- 산학연 연계 신약개발 협력시스템 구축으로 신약개발 생태계 조성
정부는 대통령 직속의 4차 산업혁명위원회에 제약, 의료기기, 바이오 분과 설치를 추진하였고, 치매 국가책임제에 따라 향후에 정부의 지속적인 육성 지원을 약속하였습니다. 또한 보건복지부는 제2차 제약산업 육성지원 종합계획을 공개하였고, 특히 첨단 바이오의약품 R&D 지원 확대를 약속하였습니다. 세제 혜택 확대 방안으로는 신약 후보물질 발굴, 임상시험 수행 등 R&D에 대한 세액공제를 추가적으로 확대하며, 바이오의약품이 경제성 평가를 통해 비용효과성을 입증하기 어려운 점을 감안해 보다 합리적인 약가 결정제도를 마련하기로 하였습니다.
3) 법적 환경
식품의약품안전처는 최근 바이오의약품 예비심사제도 도입 등 현 제도의 운영상 나타난 일부 미비점을 보완 개정하기 위해 "생물학적제제 등의 품목허가 심사규정”을 일부 개정 고시하였습니다. 예비심사 (Pre-review)란 품목허가 신청에 대해 정식 심사 개시 전 미리 해당 제출자료 요건에 따른 자료 구비 여부를 신속히 확인해 필요할경우 자료를 요청하고 심사하여 바이오의약품의 신속한 허가 심사와 이를 통한 제품화 등을 지원하기 위함 입니다. 이처럼 정부는 합리적인 절차 진행을 통해 제품화와 글로벌 제약시장 진출에 도움을 줄 목적으로 법적 제도적 환경을 개정하고 있습니다.
당사는 기술 제품의 개발 및 사업화 전략은 최종 의약품 생산 및 판매를 목적으로 하고 있지 않으며, 전임상 또는 임상 단계에서 기술이전을 목표로 하고 있기 때문에 이에 대한 법적 제약 요인은 없습니다.
나. 회사의 현황
(1) 영업개황 및 사업부문의 구분
(가) 영업개황
당사는 약리물질 생체 내 전송기술 TSDT 플랫폼을 이용하여 5종의 단백질 소재 세포/조직투과성 바이오신약 후보물질인 iCP-Parkin (파킨슨병 치료제), CP-FXN (프리드리히 운동실조증 치료제), iCP-SOCS3 (췌장암 치료제), CP-BMP2 (골형성 촉진제), CP-SD (고도비만/당뇨 치료제) 와 1종의 펩타이드 소재 세포/조직투과성 바이오신약 후보 물질인 iCP-NI (코로나 19 치료제/자가면역질환) 및 3종의 단백질 소재 세포투과성 연구용 시약인 iCP-Cre(유전체 조절효소), iCP-RFs (역분화 유도인자군 6종), CP-Cas9 (유전자 가위)을 개발하고 있습니다.
|
핵심기술 |
주변기술 |
|---|---|
|
- 약리물질 생체 내 전송기술 (TSDT) : 높은 세포/조직투과성 (cell-/tissue-permeability), 용해도 (solubility)와 생산수율 (manufacturing yield)을 갖는 융합 재조합단백질을 만들기 위한 플랫폼 기술 |
- 유전자 조작 기술 - 재조합단백질 정제 기술 - 재조합단백질에 활성 검증 기술 - 재조합단백질의 세포/조직투과성 검증 기술 |
[당사 제품 개요]
|
구분 |
후보물질 |
적응증 |
개요 |
|---|---|---|---|
|
신약 후보물질 |
iCP-Parkin |
파킨슨병 (Neurodegenerative Disease-Parkinson’s Disease) |
혈뇌장벽 (blood brain barrier: BBB)을 투과하여 파킨슨병의 근본 원인인 ‘도파민생성 뇌신경 세포 (dopaminergic neurons)의 손상’을 막고 정상화 시켜 증상을 치료하는 First-In-Class 기전특이적 바이오 신약 후보물질 (mechanism-specific biotherapeutic agent) 임. |
| CP-FXN |
프리드리히 운동실조증 (Friedreichs Ataxia) |
Frataxin (FXN) 유전자의 돌연변이로 인해 유발되는 프리드리히 운동실조증 (FRDA) 치료를 위한 First-In-Class 단백질 대체치료 바이오 신약 후보물질 (protein replacement biotherapeutic agent)임. | |
|
iCP-SOCS3 |
췌장암 및 고형암 (Pancreatic Cancer & Other Solid Tumors) |
암 특이적 신호전달체계 JAK/STAT signaling을 억제하는 기전특이적 표적치료제 (mechanism-specific targeted biotherapeutic agent) 임. |
|
|
CP-BMP2 |
골절 (fracture) 및 골다공증 (osteoporosis) 등의 골 질환 |
외과적 수술과 전달체 (carrier)가 동반해야 하는 기존 BMP2를 세포 조직투과성 주사제로 개발하여, 적용방법과 골 재생 및 골 관련 치료 효능을 개선시킨 바이오베터 (bio-better) 임. |
|
|
CP-SD |
고도비만 및 2형 당뇨병 (Obesity & Type II Diabetes Mellitus) |
고도비만 환자들의 렙틴 저항성 (leptin-resistance)을 극복한 식욕억제 기전의 비만 치료제이며, 인슐린 저항성 (insulin-resistance)을 갖는 2형 당뇨병에도 효능이 있음. |
|
| iCP-NI |
코로나바이러스감염증-19 (Covid-19), |
싸이토카인 및 케모카인의 합성에 필요한 전사인자의 핵 내 이동을 차단하여 다양한 염증성 싸이토카인의 생성을 근본적으로 차단하는 펩타이드 억제제임. 코로나바이러스 감염 등으로 유발된 싸이토카인 폭풍을 억제하여 환자의 중증도 및 사망률 개선에 대응 가능함. |
|
|
연구용 시약 |
iCP-Cre |
유전체 조절효소 (DNA Recombinase) |
개체 전체 (whole-body recombination) 및 특정 장기특이적 (organ-specific recombination) 형질전환 동물모델 제작을 동물 개체 간 교배가 아닌 간단하고 단기간 투여만으로도 가능하게 개발된 조직투과성 유전체 조절효소 (cell-/tissue-permeable genome engineering enzyme) 임. |
|
iCP-RFs 6종 (NANOG, CMYC, LIN28, SOX2, OCT4 & KLF4 ) |
역분화 유도인자 (Reprogramming Factors: RFs) |
유도만능줄기세포 (induced-pluripotent stem cell: iPSC)를 유도하는데 있어서, 역분화 유도인자 (RFs)의 세포 내 발현 시 안전성 (safety) 문제를 해결하여 임상적용 (clinical application)이 가능한 iPSC를 제조할 수 있게 하는 세포투과성 역분화 유도인자군 임. |
|
|
CP-Cas9 |
유전체 조절효소 (DNA Nuclease) |
CRISPR/Cas9 시스템의 단점인 세포의 물리적 자극 (physical stress) 없이 유전자 교정 (gene editing)을 가능케 하는 세포투과성 유전체 조절효소 (genome engineering enzyme) 임. |
(나) 공시대상 사업부문의 구분
당사는 한국표준산업분류의 소분류에 따른 의학 및 약학 연구개발업을 영위하고 있으며 주요 제품 및 상품은 "약리물질 생체 내 전송기술 (Therapeuticmolecule Systemic Delivery Technology: TSDT)"플랫폼을 기술 기반우로 하여 신약을 개발하는 단일 사업부문을 영위하고 있습니다
(2) 시장점유율
당사는 현재 "약리물질 생체 내 전송기술 (Therapeuticmolecule Systemic Delivery Technology: TSDT)" 플랫폼 기술 기반 신약 개발중인 회사이므로 제품이나 상품의 판매에 의한 매출은 존재하지 아니하여, 시장점유율에 대한 정보가 존재하지 아니합니다.
(3) 시장의 특성
'가. 업계의 현황' 내용을 참조하시기 바랍니다.
(4) 신규사업 등의 내용 및 전망
당사는 현재 '"약리물질 생체 내 전송기술(Therapeuticmolecule Systemic Delivery Technology: TSDT)" 플랫폼 기술 기반 신약 개발하고 있으며, 보고서 제출일 현재 신약물질 개발 이외에 추진 중인 신규 사업은 없습니다.
(5) 연구소 조직도
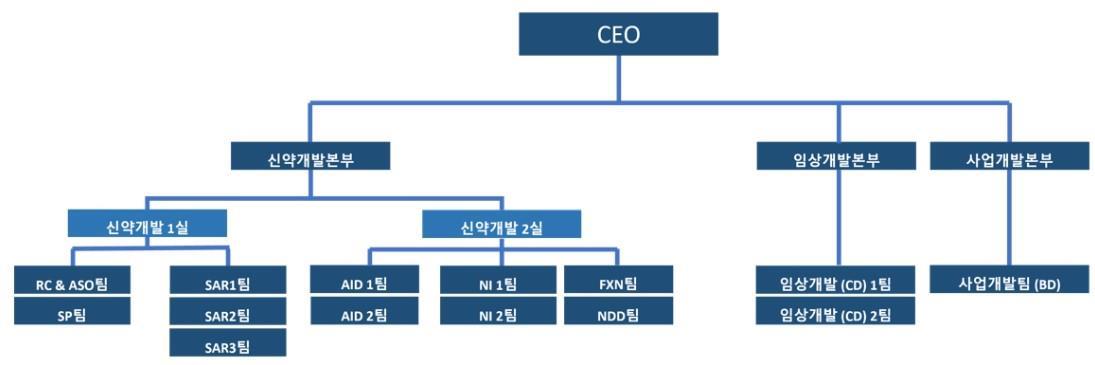 |
|
연구소 조직도 |
나. 사업 세부내용
(1) 주력제품 1: iCP-Parkin (Improved Cell-Permeable Parkin)
(퇴행성뇌질환 파킨슨병 치료제)
(가) 제품의 주요 사용범위
1) 주요 사용범위/적용증
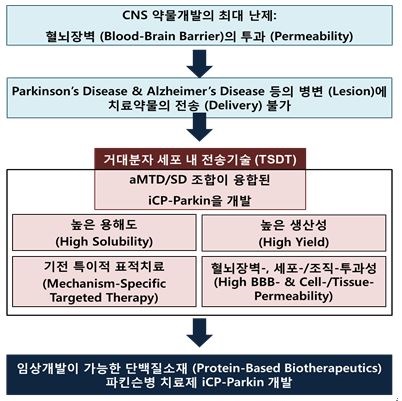
iCP-Parkin은 약리물질 생체 내 전송기술 (TSDT)을 적용한 세포/조직투과성 aMTD-융합 Parkin 재조합단백질로, 운동성을 조절하는 뇌의 흑질 부위 도파민성 신경세포가 퇴행적으로 소실되어 유발되는 운동성 장애를 동반한 퇴행성뇌질환인 파킨슨병 치료를 위한 바이오의약품 후보물질 입니다.
2) 적용증: 파킨슨병
파킨슨병은 다양한 요인에 의해 α-Synuclein 이라는 독소물질이 분비되고 이것이 도파민성 신경세포를 소실시키면서 발생되는 퇴행성 뇌질환 입니다. α-Synuclein은 체내의 파킨 (Parkin) 단백질이 제거할 수 있는데 이 Parkin 단백질의 부족으로 α-Synuclein이 과발현 되면서 병을 유발합니다. 당사의 후보물질인 iCP-Parkin은 이러한 Parkin 단백질을 세포투과성으로 제작하여 세포 내부에서 작용할 수 있게 한 물질로서 파킨슨병의 원인물질인 α-Synuclein을 제거하는 작용기전을 가지고 있습니다.
(나) 파킨슨병 치료제 시장 및 현황
1) 글로벌 주요 8개국 파킨슨병 유병환자는 2019년 1,000만명이었으며, 10년 간 2.9%의 성장률로 증가하여 2030년 까지 1,290만명으로 증가할 것으로 전망하고 있습니다. 또한, 파킨슨병 치료제 시장 규모는 2018년 45억 달러에서 연평균 8.1%로 성장하여 2026년 84억 달러 규모에 이를 것으로 전망하고 있습니다 (Parkinson's Foundation, 2020 / Fortune Business Insights, 2019).
2) 전통적인 파킨슨병 치료법은 상실된 도파민을 보충하는 것으로, 혈뇌장벽 (blood-brain barrier: BBB)을 통과할 수 있는 도파민의 전구물질인 L-dopa를 투여하면 뇌의 신경세포가 이를 도파민으로 전환시켜 상실된 운동기능을 회복하게 만듭니다. 그러나, L-dopa는 증세를 완화시키기는 하지만, 병의 근본원인을 치료하지 못하기 때문에 파킨슨병 진행을 늦추지는 못하고 시간이 지남에 따라 병이 악화되며 다양한 부작용이 나타납니다.
(다) 기존 치료제의 한계점
1) 기존 파킨슨병 치료는 근본적인 병증개선은 불가능하고 오히려 심각한 부작용을 야기한다는 점에서 환자의 안전성 및 약효를 만족시키지 못하고 있습니다. 이러한 시장 요구에 따라 파킨슨병의 진행을 근원적으로 억제할 수 있는 질병조절치료제 (disease-modifying therapy) 개발이 더욱 중요한 추세입니다.
2) 파킨슨병에 대한 치료방식에 있어서 가장 중요하면서 어려운 점은 약물이 혈뇌장벽 (BBB)을 통과해야 한다는 것이며, 당사의 플랫폼 기술인「약리물질 생체 내 전송기술 TSDT」는 혈뇌장벽 투과능을 가지고 있기 때문에 뇌질환 관련 바이오 신약 연구개발에 매우 적합한 기술입니다.
 |
|
파킨슨병 치료제 개발과정 |
(라) 당사 제품의 특징
1) 파킨슨병 치료제 특징
- Parkin 단백질은 파킨슨병의 가장 근본적인 병인인 α-Synuclein 제거와 산화스트레스에 의해 손상된 미토콘드리아 제거를 유도할 수 있는 단백질입니다.
- 당사는 파킨슨병에서 치료효능을 가지는 Parkin 단백질에 「약리물질 생체 내 전송기술 TSDT」을 접목하여 혈뇌장벽 (BBB)을 투과할 수 있는 세포/조직 투과성 aMTD-융합 Parkin 재조합단백질인 improved cell-permeable Parkin (iCP-Parkin)을 개발하였습니다.
- iCP-Parkin은 뇌의 도파민성 신경세포 내로 Parkin 단백질을 보충 (replacement) 하여 손상된 미토콘드리아 자가포식 (mitophagy system)을 활성화시켜 도파민성 신경세포의 감소를 막고 응집된 (aggregated) α-Synuclein 단백질을 감소시킴으로써 도파민 신경세포의 사멸을 억제하고 이를 통해 도파민 생성 능력을 개선할 수 있습니다. 따라서, iCP-Parkin은 PD의 근본적 치료가 가능한 first-in-class 파킨슨병 바이오신약 후보물질로 성공화 가능성이 매우 높습니다.
2) 파킨슨병 치료제 효능
- 당사는 다양한 파킨슨병 동물모델에서 iCP-Parkin 치료효능을 검증하였습니다. 다양한 종류의 파킨슨병 유도물질에 의한 질환동물모델에서 iCP-Parkin은 모두 정상 수준의 운동성 개선 및 신경세포 회복효과를 나타냈습니다.
(2) 주력제품 (후보물질) 2: CP-FXN (Cell-Permeable Frataxin)
(프리드리히 운동실조증 치료제)
(가) 제품의 주요 사용범위
1) 주요 사용범위/적응증
CP-FXN은 약리물질 생체 내 전송기술 (TSDT)을 적용한 세포/조직투과성 aMTD-융합 Frataxin 재조합단백질로, frataxin (FXN) 유전자의 돌연변이로 인해 유발되는 프리드리히 운동실조증 (Friedreich’s ataxia: FRDA) 치료를 위한 바이오의약품 후보물질입니다.
2) 적응증: 프리드리히 운동실조증
FRDA는 진행성 신경계 손상으로 인해 운동장애가 발생하는 선천적 유전질환 (inherited genetic disease) 입니다. 9번 염색체에 위치한 frataxin (FXN) 유전자의 돌연변이로 인해 유발되며, 주요 증상은 척수 신경조직의 퇴화 (degeneration of spinal cord nervous system)와 소뇌 기능 이상 (cerebellar dysfunction) 으로 인한 보행/운동 실조증 (gait & limb ataxia), 감각 소실 (sensory loss), 척추 측만증 (scoliosis) 이 나타나게 됩니다. FRDA 환자 50% 이상에서 심장근육병증 (hypertrophic cardiomyopathy)을 보이며, 이로 인한 심장 부정맥 (arrhythmia) 이나 심부전 (heart failure) 으로 사망에 이르게 되는 질병입니다.
(나) 프리드리히 운동실조증 치료제 시장 및 현황
FRDA의 알려진 발병기전에 (pathogenesis)에 초점을 맞춰, 각 단계를 표적화 하는 치료제들이 개발단계에 있지만 아직까지 개발을 마치고 시판 중인 치료제, 치료법은 없습니다.
(다) 기존 치료제의 한계점
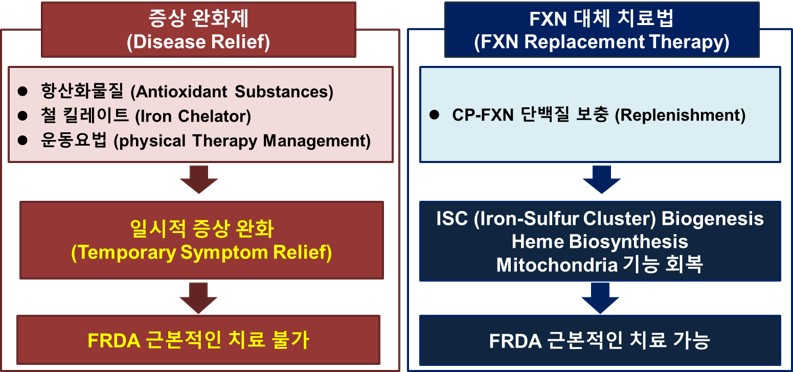
현재 FRDA 환자에게 항산화물질 (antioxidant substances), 외과수술 (surgery), 저혈당 식이요법 (lower blood sugar diet)등 일시적으로 증상을 완화시키는 치료법만 존재하며, 근복적인 치료법은 없습니다. CP-FXN은 환자에게는 부족한 FXN 단백질을 세포 내로 직접 보충 (intracellular direct replenishment) 할 수 있는 근본적 치료법입니다.
 |
|
프리드리히 운동실조증 치료제 과정 |
(라) 당사 제품의 특징
1) FRDA 치료제 특징
FRDA 환자의 경우 FXN 단백질이 결핍 (deficiency)이 되면 및 mitochondria 내 철 (iron) 이온의 불균형을 유발합니다. Mitochondria 내 iron-sulfur cluster (ISC)와 heme 생합성 억제, 철 축적 (iron accumulation) 으로 인해 ATP 생산억제 (inhibition of ATP production)와 활성산소 (reactive oxygen species: ROS) 증가로, mitochondria 기능이 손상됩니다. 이로 인해 세포의 기능 저하와 세포 사멸을 야기하여, 결국 mitochondria 의존적인 신경세포가 손상되어서 말초신경 및 척수신경 섬유의 퇴행 변화가 나타납니다. 당사는 frataxin 유전자의 돌연변이에 의해 유발되는 FRDA를 치료하기 위하여 Frataxin 단백질에「약리물질 생체 내 전송기술 TSDT」를 접목하여 세포/조직 투과성 aMTD-융합 Frataxin 재조합단백질인 cell-permeable Frataxin (CP-FXN)을 개발하였습니다. CP-FXN은 FXN 결핍 심근세포에서 철이온 축적 (iron accumulation)을 억제하고, 철이온 대사를 조절하는 효소 활성도를 회복시켰습니다. 따라서, CP-FXN 은 FRDA의 근본적 치료가 가능한 first-in-class 바이오신약 후보물질로 성공할 가능성이 매우 높습니다.
2) FRDA 치료제 효능
당사는 FXN KO 동물모델에서 CP-FXN 치료 효능을 검증하였습니다. CP-FXN을 FXN KO 동물에 투여하였을 경우 심장조직에서 정상 수준으로 철 (iron) 이온 대사 조절 효소 활성도가 회복되었습니다. 또한, 심근세포 섬유화 (fibrosis) 및 DNA 손상을 막음으로써 심장기능을 회복시켜주었습니다.
(3) 주력제품 (후보물질) 3: iCP-SOCS3 (Improved Cell-Permeable SOCS3)
(기전특이적 표적 췌장암 치료제)
(가) 제품의 주요 사용범위
1) 주요 사용범위/적용증
iCP-SOCS3는 약리물질 생체 내 전송기술 (TSDT)을 적용한 세포/조직투과성 aMTD-융합 SOCS3 재조합단백질로, 암 발현을 유도하는 JAK/STAT signaling이 비정상적으로 활성화된 암세포에 대한 기전특이적 표적 췌장암 치료제 입니다.
2) 적용증: 췌장암
췌장은 길이 약 15 cm, 무게 70 g 정도로 십이지장에 둘러싸여 있고 비장과 가깝게 인접해 있으며, 각종 소화효소와 호르몬을 분비하여 장내 음식물을 분해하고, 혈당조절을 담당합니다.
3) 췌장에 발생하는 종양은 호르몬을 분비하는 내분비 세포에서 발생하는 종양 (5-10%)과 소화효소 분비와 관련된 외분비 세포에서 기원하는 종양 (90% 이상)으로 구분됩니다. 췌장암의 위험인자로는 흡연, 만성 췌장염, 남성, 고령, 방사선, 화학물질, 만성 당뇨병 등이 있습니다.
4) 췌장암은 세계적으로 발병률 9위의 암이며, 2014년 발생한 전체 암의 3%를 차지하고 있습니다 (American Cancer Society, 2019). 췌장암은 초기 증상이 없기 때문에 조기 발견율이 10% 이하로 매우 낮으며, 진행된 췌장암 환자의 대부분에서 복통과 체중감소, 황달, 체중감소, 소화장애, 당뇨병 등이 나타납니다. 췌장암의 수술적 치료는 전체 환자의 10-20% 정도에서만 가능하며, 병기가 진행될수록 수술이 쉽지 않고 초기 합병증이 30% 발생하는 등의 이유로 발병시 4개월~8개월 밖에 살지 못하는 경우가 대부분으로 최악의 사망률과 5 년 생존률 12% 이하를 보이고 있습니다.
(나) 췌장암 치료제 시장 및 현황
1) 췌장암 치료제는 진행성 췌장암이나 수술 후 췌장암의 치료에 주로 이용합니다. 췌장암에서 거의 유일하게 사용되던 대표적인 항암제는 플루러유라실 (5-fluorouracil)로 대부분 소화기암의 일차 항암제로 흔히 사용되었으며, 현재는 젬사이타빈 (gemcitabine)이 췌장암의 가장 기본적인 항암제로 인정받고 있습니다.
2) GBI Research 사의 '주요 선진국 췌장암 치료제 시장 전망' 보고서에 따르면, 췌장암 치료제 시장은 2021년 29억 달러로 확대 될 전망입니다. 그러나 효과적인 치료제와 조기 진단법의 부재로 인해 사망률이 높은 난치암으로 분류되며, 미충족 의료 수요 (unmet medical need)가 큽니다.
(다) 기존 치료제의 한계점
1) 대부분의 췌장암 치료제는 세포독성에 의해 암세포뿐 아니라 정상 세포까지 파괴하고 약물 저항성이 나타남으로 인해 결국 항암 효능이 저하됩니다. 또한, 현재의 항 췌장암 제제는 치료제의 개념보다는 증상 완화 (relief) 및 생존 기간 연장 (prolongation)에 초점이 맞추어져 있는 상태이기 때문에, 기존 항암제의 한계를 극복할 수 있는 치료제 개발이 필요합니다.
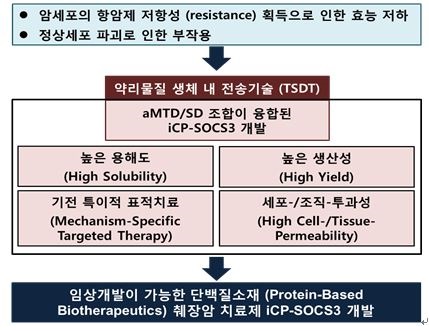
2) 당사는 약리물질 생체 내 전송기술 (TSDT)을 이용하여 단백질과 같은 약리활성물질 (therapeuticmolecule)을 세포 내로 전송할 수 있는 기술을 확보하고 있습니다. 단백질 치료법은 기전특이성이 있고 off-target effect가 낮아 기존 치료제에 비해 부작용이 없거나 적은 새로운 개념의 기전특이적 표적 항암제 (target therapy) 로서 이상적인 항암 치료가 될 수 있습니다.
 |
|
췌장암 치료제 개발과정 |
(라) 당사 제품의 특징 _ 췌장암 치료제 특징
1) Suppressor of cytokine signaling 3 (SOCS3)는 췌장암 유발 주요 신호전달체계 JAK/STAT signaling의 억제인자 입니다. 또한, SOCS3는 췌장암 환자에서 불활성화되었으며, 췌장암 세포 성장 및 염증 반응을 통해 췌장암을 촉진합니다.
2) 당사는 췌장암에서 치료효능을 가지는 SOCS3 단백질에 약리물질 생체 내 전송기술 (TSDT)을 접목하여 세포/조직투과성 재조합단백질을 개발하였습니다. iCP-SOCS3는 JAK/STAT signaling을 억제시켜 췌장암 진행을 늦추고, 염증 매개 암 형성 역시 억제합니다. 따라서, 세포 내부에 존재하는 잠재적 항암단백질인 SOCS3를 보충 (replenishing) 함으로써, 새로운 파라다임의 단백질 치료제로서 다양한 암에서 효과적인 항암제 역할을 할 것입니다.
(4) 주력제품 (후보물질) 4: CP-BMP2 (Cell-Permeable BMP2)
(골형성 촉진제)
(가) 제품의 주요 사용범위
1) 주요 사용범위/적용증
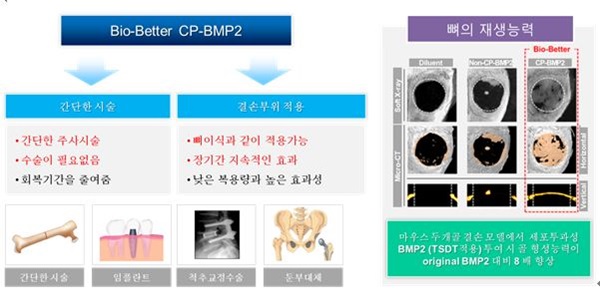
CP-BMP2는 약리물질 생체 내 전송기술 (TSDT)을 적용한 세포/조직투과성 aMTD-융합 BMP2 재조합단백질로, 골 재생 치료를 위한 바이오베터 (bio-better) 의약품 입니다.
 |
|
골형성 촉진제 소개 |
2) 적용증 : 골 질환
골은 형성과 흡수가 반복적으로 일어나는 역동적인 기관이나, 연령이 증가할수록 기능이 저하되고 골절 및 골다공증 같은 골 질환에 의해 integrity가 손상될 수 있습니다. 2013년 골절이 생긴 환자는 15만 4856명임 (건강보험심사 평가원 질병 통계) 으로 2009년 11만 명 대비 5년 만에 약 40% 증가하였습니다.
(나) 골 질환 치료제 시장 및 현황
1) 골 질환 치료제제로서 판매되고 있는 bone morphogenic protein 2 (BMP2)는 1988년부터 제작되기 시작된 인간 유래 BMP2를 이용한 인간 BMP2 (recombinant human BMP2: rhBMP2) 재조합 단백질로써, 미국과 유럽 FDA 허가를 받아서 현재 임상에서 골유합을 통한 손상된 뼈나 치조골 복원 등 근골격계 결손부위에 적용하고 있습니다.
2) 골형성단백질 시장은 전 세계 약 1조 5000억 원 규모로 추산되며, 국내 시장은 1000억 원 정도입니다. 또한, 정형외과용 융합바이오소재 (골이식제)는 대부분 BMP류를 포함하는 골재생의 효과를 높인 제품군으로 전 세계 시장은 2015년 50억달러에서 매년 성장률 7.5%에 달할 것으로 예상하고 있습니다.
(다) 기존 치료제의 한계점
기존 rhBMP2는 고비용 (high cost) 및 사용 시 낮은 편의성 (low convenience) 때문에 골 형성 촉진제의 개발 및 상용화가 매우 제한적입니다.
(라) 당사 제품의 특징
당사는 골 형성능을 가지는 BMP2 단백질에 약리물질 생체 내 전송기술 (TSDT)을 접목하여 운반체 및 이차적 외과 수술 없이 적용가능한 세포/조직투과성 재조합단백질 cell-permeable BMP2 (CP-BMP2)를 개발하였습니다. CP-BMP2는 기존 rhBMP2에 비해 편의성이 획기적으로 개선되었으므로 바이오베터 후보물질로 성공화 가능성이 매우 높습니다.
(5) 주력제품 (후보물질) 5: CP-SD (Cell-Permeable SOCS3 69-96 Peptide)
(고도비만 치료제)
(가) 제품의 주요 사용범위
1) 주요 사용범위/적용증 : 고도비만
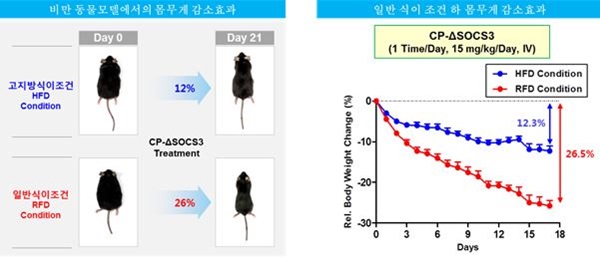
CP-SP는 「약리물질 생체 내 전송기술 (TSDT)」을 적용한 세포/조직투과성 aMTD-융합 truncated SOCS3 재조합단백질로, 랩틴 저항성 (leptin resistance)으로 촉발된 고도비만치료 [mechanism (leptin-resistance)-specific anti-obesity agent]를 위한 바이오의약품 후보물질 입니다.
 |
|
고도비만 치료제 소개 |
- 식이 유도 비만 쥐 모델에서 일반 식이 조건 하 3 주 간 투여 시 26% 몸무게 감소 효과
- 식이 유도 비만 쥐 모델에서 고지방 식이 조건 하 3 주 간 투여 시 지속적인 고지방 섭취에도 불구하고 12%의 몸무게 감소 효과
- 지방간 감소 (90%), 혈 중 콜레스테롤 감소 (31%) 및 혈당감소 (23%) 효과
(나) 고도비만 치료제 시장 및 현황
비만치료약물은 크게 식욕억제제와 지방흡수억제제 두 가지로 나뉘는데, 현재 비만치료제 시장에서는 식욕억제제가 지방흡수 억제제보다 월등히 우세합니다. 전 세계 비만 치료제시장 규모가 2017년 1,760억 달러였으며, 2022년에는 2,455억 달러로 성장할 것이라는 분석이 나오고 있습니다 (MarketsandMarkets, 2017).
(다) 기존 치료제의 한계점
최근까지 허가 받거나 개발 중인 비만 치료제들은 대부분이 중추신경계에 작용하여 식욕을 억제시키는 화학 조성물 (small molecule)이며, 이들은 경구 투여의 이점이 있음에도 1) 미미한 체중 감소효과 (2.0~8.9 Kg의 감량/년) 및 2) 요요현상, 그리고 3)비생체물질로 인한 안전성에 대한 우려, 4) 낮은 기전 특이성으로 인한 심각한 부작용 등의 단점이 있습니다. 이로 인하여 극히 일부분의 비만 환자들 만이 단기간만 사용하여 시장이 확대되지 못하고 있습니다.
또한, 기존 단백질 제제 기반 바이오 신약은 환자 친화적 투여법 개발에 실패하였습니다. 재조합 펩타이드나 단백질 제재 기반의 바이오 신약은 현재 주사 투여를 하고 있으며, 환자들이 선호하는 경구 투여가 가능한 단백질 의약품은 개발 단계에서 대부분 실패하였습니다. 위와 장 등의 소화기를 통과하면서 pH, 효소의 분해 등의 생체 내 요소로 단백질이 분해되기 때문입니다. 이런 이유로 단백질 제재의 비만 치료 신약 개발은 미비하였습니다.
(라) 당사 제품의 특징
당사는 고도비만에서 leptin resistance를 극복할 수 있는 truncated SOCS3 (ΔSOCS3) 단백질에 「약리물질 생체 내 전송기술 (TSDT)」을 접목하여 혈뇌장벽을 투과할 수 있는 세포/조직투과성 재조합단백질을 개발하였습니다. CP-ΔSOCS3는 뇌의 시상하부 내 신경세포에서 leptin receptor 와 결합하고, 이를 통해 세포 내 leptin receptor와 SOCS3 와의 결합을 억제시켜 leptin resistance를 극복할 수 있는 고도비만치료제 입니다.
(6) 주력제품 (후보물질) 6: iCP-NI (Improved Cell-Permeable Neuclear Import Inhibitor)
(내재면역제어 항바이러스/항염증 면역치료제)
(가) 제품의 주요 사용범위
iCP-NI는 정상수준을 벗어난, 조절되지 않는 과도한 급성 염증 상황 즉, ‘싸이토카인폭풍’으로 인한 중증 염증 및 패혈증으로 인한 사망에 대응할 수 있는 기전 특이적 항염증 치료 후보 물질입니다. 일상에서 빈번한 세균감염부터 전세계적으로 유행할 수 있는 바이러스성 판데믹 전염병, 유전 및 환경에 의한 염증성 자가면역질환에 까지 적용가능한 항염증제입니다.
(나) 치료제 시장 및 현황
미국의 경우 매년 700,000 명 이상의 패혈증 환자가 발생하고 그 중 225,000 명 정도가 사망합니다. 패혈증은 각종 감염 및 부상에 의해 발생하는 중증 염증성 질환으로, 현재는 패혈증 치료제가 없어 항생제 등 대증요법에 따라 치료되고 있으며, 2020년 까지 매년 1.5-2.0%의 패혈증 환자가 증가할 것으로 예측됩니다. 패혈증을 발생시키는 원인 중 가장 주목되는 것은 바이러스성 감염병에 의한 호흡기질환이며, 스페인독감, SARS, MERS부터 2019년 코로나19 발생까지, 전세계에서 주기적으로 감염성 판데믹질환이 발생하고 있습니다. 그러나, 백신, 항바이러스제 등의 개발이 감염병의 발생과 전파속도를 따라가지 못하는 한계가 있습니다. iCP-NI는 감염원의 종류와 관계없이 강력한 항염증 효능을 나타낼 수 있는 물질로, 개발시, 코로나19는 물론, 이후 발생가능한 신종, 변종 바이러스성 전염병에도 선제적으로 대응할 수 있으므로, 향후 전세계적으로 수요가 있을 것입니다.
(다) 기존 치료제의 한계점
기존 항염증성 치료제는 스테로이드계열과 항체치료제 등으로 나눌 수 있습니다. 스테로이드성 항염증제는 부작용 등으로 인해 환자에 대한 사용에 있어 매우 각별한 주의를 요하며, 차세대 항염증제로 시판되고 있는 항체치료제는 다종의 염증성 싸이토카인이 아닌 한 두가지의 싸이토카인을 특이적으로 중화하는 방식이 주류를 이루었습니다. 그러나, 이러한 방식은 특정 질병에 특화된 방식이며, 동시에 항염증 효능도 낮은 수준입니다. 경도의 염증성질환에는 널리 사용되고 있으나, 수십종의 싸이토카인의 무분별한 발생으로 인한 싸이토카인폭풍을 동반하는 중증 염증성 질환에는 효능이 없습니다.
(라) 당사 제품의 특징
펩타이드 의약품으로써, NF-κB, AP-1, NFAT, STAT1과 같은 stress related transcription factor (SRTF)의 활성을 억제하는 기전 특이적 항염증 치료 후보 물질입니다. 특정 싸이토카인에만 작용가능한 항체치료제와 달리, 염증성 싸이토카인을 발생시키는 전사인자들의 활동을 원천적으로 차단함으로써, 기존치료제보다 강력한 항염증 효능을 낼 수 있으며. 또한, 감염원 및 원인물질과 관계없이 항염증효능을 나타내므로, 다양한 염증성질환에 적용 가능합니다.
(7) 주력제품 7: 연구용 시약
(가) 유전체 조절효소: iCP-Cre (Improved Cell-Permeable Cre)
(형질전환 동물모델 제작용 세포/조직투과성 유전체 조절효소)
1) 주요 사용범위 : iCP-Cre는 간단한 주사만으로 형질전환 마우스모델(genetically engeneered mouse model: GEM) 제작이 가능한 세포/조직투과성 유전체 조절효소 (genome engineering enzymes: GEEs) 입니다. 기존 시스템의 한계를 극복하여 더 정밀하고 정교하게 의생명과학 연구를 할 수 있는 시스템 「세포/조직투과성 Cre (iCP-Cre)」 입니다. iCP-Cre는 aMTD와 SD를 융합한 차세대 유전체 조절효소로서 기존의 GEEs를 이용한 방법에 비해 높은 효율뿐만 아니라, 시간과 비용 또한 절감할수 있는 연구용 시약 (research reagent) 입니다.
2) 적용 분야 : (1) 유전체 조절기술 (genome engineering technology)은 인위적인 유전체 조절효소를 이용하여 유기체 (organism) 내에 존재하지 않는 새로운 특성을 추가하기 위한 새로운 DNA를 삽입 (insertion) 하거나, 대체 (replacement) 하거나, 기존의 알려진 특성을 제거 (deletion) 하기 위해 유기체 내의 염색체 (chromatin)를 engineering/editing 해주는 기술입니다
신약 개발에 있어 유전체 조절 기술을 이용한 형질전환 마우스모델은 질병의 다양한 원인과 발병과정 및 진단에 대한 연구용 재료를 제공해주고, 질환모델 동물의 연구를 통해 질병에 관련된 유전자들을 알아내고, 개발된 신약후보물질의 실제 효능 및 독성 검사를 통해 실용화 가능성의 여부를 판단하는 기초 자료를 얻을 수 있기 때문에 신약 개발에 필수적으로 필요합니다
[ 질환모델 동물의 활용 가능 분야 (Applications of GEM) ]
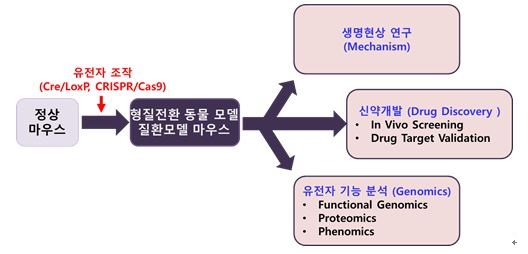 |
|
질환기술의 활용가능 분야 |
(나) 세포분화조절 유도인자군: iCP-RFs _iCP-OCT4, iCP-SOX2, iCP-KLF4, iCP-CMYC, iCP-NANOG, iCP-LIN28 (Improved Cell-Permeable Reprogramming Factors) (유도만능줄기세포 제작용 세포투과성 역분화 유도인자 6종)
1) 주요 사용범위 : iCP-RFs는 virus를 이용하지 않고도 안전하고 높은 효율로 역분화 유도만능 줄기세포 (induced pluripotent stem cells: iPSCs) 제작이 가능한 세포/조직투과성 6종 역분화 유도 인자 (iCP-OCT4, iCP-SOX2, iCP-KLF4, iCP-CMYC, iCP-NANOG, iCP-LIN28) 입니다.
2) 적용 분야 : Virus를 사용하지 않아 돌연변이 문제도 없어 향후 임상적용에도 가능한 iPSC를 개발할 수 있습니다
(다) 유전체 조절효소: CP-Cas9 (Cell-Permeable Cas9)
(유전자 교정용 세포/조직투과성 유전체 효소)
1) 주요 사용범위 : CP-Cas9는 기존의 clustered regularly interspaced short palindromic repeats/Cas9 (CRISPR/Cas9) 시스템의 단점인 세포에 대한 물리적 자극 없이 유전자 교정 (gene editing)이 가능한 세포/조직투과성 유전체 교정시약 입니다.
2) 적용 분야 : CRISPR/Cas9은 특정 염기서열을 인식하여 DNA를 자르고 교정하는 기술을 말합니다. 이는, 다양한 연구 및 산업적 활용이 가능하여 농작물이나 가축의 개량 모델을 제작이나 난치성 질환의 근본적 치료방법을 제시 할 수 있습니다.
2. 주주총회 목적사항별 기재사항
□ 재무제표의 승인
가. 해당 사업연도의 영업상황의 개요
Ⅲ 경영참고사항 中 사업의 개요를 참고하시기 바랍니다.
1) 연결 재무제표
- 연결재무상태표
| 연 결 재 무 상 태 표 | |
| 제 8(당) 기 2021년 12월 31일 현재 | |
| 제 7(전) 기 2020년 12월 31일 현재 |
|
| 주식회사 셀리버리와 그 종속기업 | (단위 : 원) |
| 과 목 | 제 8(당) 기말 | 제 7(당) 기말 | ||
|---|---|---|---|---|
|
자 산 |
|
|
|
|
|
I. 유동자산 |
98,385,169,604 |
|
54,658,189,075 |
|
|
현금및현금성자산 |
69,325,495,466 |
28,678,534,996 |
|
|
|
당기손익-공정가치측정금융자산 |
3,230,481,351 |
3,525,474,122 |
|
|
|
상각후원가측정금융자산 |
12,513,279,456 |
21,609,649,323 |
|
|
|
매출채권 |
4,695,312,131 |
- |
|
|
|
단기수취채권 |
786,361,217 |
222,751,670 |
|
|
|
기타유동자산 |
3,858,004,855 |
543,449,334 |
|
|
|
당기법인세자산 |
56,485,140 |
78,329,630 |
|
|
|
재고자산 |
3,919,749,988 |
- |
|
|
|
Ⅱ. 비유동자산 |
31,456,087,060 |
|
5,857,868,851 |
|
|
비유동상각후원가측정금융자산 |
1,971,861,842 |
1,969,861,842 |
|
|
|
비유동당기손익-공정가치측정금융자산 |
1,152,080,660 |
- |
|
|
|
유형자산 |
22,002,870,800 |
1,895,806,450 |
|
|
|
무형자산 |
2,930,746,619 |
545,176,907 |
|
|
|
사용권자산 |
2,126,733,277 |
|
808,778,555 |
|
|
장기수취채권 |
883,439,824 |
|
281,503,685 |
|
|
기타비유동자산 |
285,950,343 |
|
356,741,412 |
|
|
이연법인세자산 |
102,403,695 |
|
|
|
|
자 산 총 계 |
|
129,841,256,664 |
|
60,516,057,926 |
|
부 채 |
|
|
|
|
|
Ⅰ. 유동부채 |
26,146,658,666 |
|
1,261,466,731 |
|
|
매입채무 |
2,208,616,686 |
- |
|
|
|
단기차입금 |
9,113,869,250 |
- |
|
|
|
유동성기타채무 |
2,622,028,929 |
656,216,320 |
|
|
|
유동성리스부채 |
1,160,270,579 |
362,423,638 |
|
|
|
유동성전환사채 |
10,672,796,011 |
- |
|
|
|
기타유동부채 |
369,077,211 |
242,826,773 |
|
|
|
Ⅱ. 비유동부채 |
|
28,687,529,531 |
|
20,861,341,946 |
|
비유동성기타채무 |
155,526,979 |
|
140,556,526 |
|
|
비유동성리스부채 |
1,006,486,754 |
|
469,016,415 |
|
|
비유동성전환사채 |
22,632,509,780 |
|
20,251,769,005 |
|
|
파생금융부채 |
4,238,510,000 |
|
- |
|
|
순확정급여부채 |
654,496,018 |
|
- |
|
|
부 채 총 계 |
|
54,834,188,197 |
|
22,122,808,677 |
|
자 본 |
|
|
|
|
|
Ⅰ. 지배주주지분 |
|
75,007,068,467 |
|
38,393,249,249 |
|
자본금 |
9,025,761,000 |
|
4,206,307,000 |
|
|
자본잉여금 |
172,025,834,235 |
|
117,664,925,733 |
|
|
기타자본구성요소 |
9,401,627,429 |
|
4,032,816,486 |
|
|
이익잉여금(결손금) |
(115,446,154,197) |
|
(87,510,799,970) |
|
|
Ⅱ. 비지배주주지분 |
|
- |
|
- |
|
자 본 총 계 |
|
75,007,068,467 |
|
38,393,249,249 |
|
부 채 및 자 본 총 계 |
|
129,841,256,664 |
|
60,516,057,926 |
- 연결포괄손익계산서
| 연 결 포 괄 손 익 계 산 서 | |
| 제 8(당) 기 2021년 1월 1일부터 2021년 12월 31일까지 | |
| 제 7(전) 기 2020년 1월 1일부터 2020년 12월 31일까지 |
|
| 주식회사 셀리버리와 그 종속기업 | (단위 : 원) |
| 과 목 | 제 8(당) 기 | 제 7(전) 기 | ||
|---|---|---|---|---|
|
Ⅰ. 매출액 |
|
3,872,401,610 |
|
761,573,447 |
|
Ⅱ. 매출원가 |
|
3,801,774,758 |
|
1,485,047,603 |
|
Ⅲ. 매출총이익(손실) |
|
70,626,852 |
|
(723,474,156) |
|
Ⅳ. 판매비와관리비 |
|
28,120,583,889 |
|
16,888,175,019 |
|
Ⅴ. 영업손실 |
|
(28,049,957,037) |
|
(17,611,649,175) |
|
Ⅵ. 영업외손익 |
|
(1,631,569,833) |
|
(324,916,390) |
|
기타수익 |
181,498,746 |
|
31,615,814 |
|
|
기타비용 |
(48,177,534) |
|
(31,852,787) |
|
|
금융수익 |
1,112,191,214 |
|
485,760,240 |
|
|
금융비용 |
(2,877,082,259) |
|
(810,439,657) |
|
|
Ⅶ. 법인세비용차감전순손실 |
|
(29,681,526,870) |
|
(17,936,565,565) |
|
Ⅷ. 법인세비용 |
|
(1,612,998,732) |
|
(688,223,439) |
|
IX. 당기순이익(손실) |
|
(28,068,528,138) |
|
(17,248,342,126) |
|
X. 기타포괄손익 |
|
133,173,911 |
|
- |
|
확정급여제도의 재측정요소 |
||||
|
XI. 총포괄손익 |
|
(27,935,354,227) |
|
(17,248,342,126) |
|
XII. 주당손익 |
|
|
|
|
|
기본주당이익(손실) |
|
(1,668) |
|
(1,070) |
- 연결자본변동표
| 연 결 자 본 변 동 표 | |
| 제 8(당) 기 2021년 1월 1일부터 2021년 12월 31일까지 | |
| 제 7(전) 기 2020년 1월 1일부터 2020년 12월 31일까지 | |
| 주식회사 셀리버리와 그 종속기업 |
(단위 : 원) |
| 과 목 |
자본금 |
자본잉여금 |
기타타자본구성요소 |
이익잉여금(결손금) |
총 계 (지배주주지분) |
|---|---|---|---|---|---|
|
2020.01.01 (전기초) |
3,910,053,500 |
90,218,760,330 |
3,417,066,578 |
(70,262,457,844) |
27,283,422,564 |
|
당기순손실 |
- |
- |
- |
(17,248,342,126) |
(17,248,342,126) |
|
전환우선주 발행 |
113,753,500 |
20,641,519,553 |
- |
- |
20,755,273,053 |
|
전환권대가 변동 |
- |
2,440,064,919 |
- |
- |
2,440,064,919 |
|
주식매수선택권 행사 |
182,500,000 |
4,364,580,931 |
(2,221,671,951) |
- |
2,325,408,980 |
|
주식기준보상 |
- |
- |
2,837,421,859 |
- |
2,837,421,859 |
|
2020.12.31 (전기말) |
4,206,307,000 |
117,664,925,733 |
4,032,816,486 |
(87,510,799,970) |
38,393,249,249 |
|
2021.01.01 (당기초) |
4,206,307,000 |
117,664,925,733 |
4,032,816,486 |
(87,510,799,970) |
38,393,249,249 |
|
당기순손실 |
- |
- |
- |
(28,068,528,138) | (28,068,528,138) |
|
확정급여제도의 재측정요소 |
- | - | - | 133,173,911 | 133,173,911 |
|
무상증자 |
4,206,307,000 | (4,267,102,260) | - | - | (60,795,260) |
|
전환우선주 발행 |
334,485,500 | 33,952,366,735 | - | - | 34,286,852,235 |
|
전환사채 전환 |
114,661,500 | 11,165,005,536 | - | - | 11,279,667,036 |
|
전환권대가 변동 |
- | 6,196,983,061 | - | - | 6,196,983,061 |
|
주식매수선택권 행사 |
164,000,000 | 7,313,655,430 | (2,173,886,480) | - | 5,303,768,950 |
|
주식기준보상 |
- | - | 7,542,697,423 | - | 7,542,697,423 |
|
2021.12.31 (당기말) |
9,025,761,000 | 172,025,834,235 | 9,401,627,429 | (115,446,154,197) | 75,007,068,467 |
- 연결현금흐름표
| 연 결 현 금 흐 름 표 | |
| 제 8(당) 기 2021년 1월 1일부터 2021년 12월 31일까지 | |
| 제 7(전) 기 2020년 1월 1일부터 2020년 12월 31일까지 |
|
| 주식회사 셀리버리와 그 종속기업 | (단위 : 원) |
| 과 목 | 제 8(당) 기 | 제 7(전) 기 | ||
|---|---|---|---|---|
|
Ⅰ. 영업활동으로 인한 현금흐름 |
(22,744,264,389) |
|
(16,096,635,495) |
|
|
1. 영업활동에서 창출된 현금 |
(22,784,197,427) |
(16,589,053,581) |
|
|
|
(1) 당기순손실 |
(28,068,528,138) |
(17,248,342,126) |
|
|
|
(2) 조정 |
9,043,457,612 |
3,964,264,992 |
|
|
|
(3) 영업활동으로 인한 자산부채의 변동 |
(3,759,126,901) |
(3,304,976,447) |
|
|
|
2. 이자의 수취 |
253,370,466 |
507,791,903 |
|
|
|
3. 이자의 지급 |
(235,363,388) |
(57,972,602) |
|
|
|
4. 배당금의 수취 |
- |
12,577,495 |
|
|
|
5. 법인세의 환급(납부) |
21,925,960 |
30,021,290 |
|
|
|
Ⅱ. 투자활동으로 인한 현금흐름 |
(8,548,615,940) |
|
(1,904,544,632) |
|
|
1. 투자활동으로 인한 현금유입액 |
148,376,299,640 |
93,403,589,095 |
|
|
|
당기손익-공정가치 측정 금융자산 처분 |
67,118,322,729 |
23,102,748,590 |
|
|
|
상각후원가 측정 금융자산 처분 |
81,204,785,093 |
70,117,370,505 |
|
|
|
유형자산의 처분 |
48,181,818 |
182,470,000 |
|
|
|
기타보증금의 감소 |
- |
1,000,000 |
|
|
|
임차보증금의 감소 |
5,010,000 |
- |
|
|
|
2. 투자활동으로 인한 현금유출액 |
(156,924,915,580) |
|
(95,308,133,727) |
|
|
당기손익-공정가치 측정 금융자산 취득 |
67,000,000,000 |
|
26,001,104,007 |
|
|
상각후원가 측정 금융자산 취득 |
72,108,415,226 |
|
68,064,772,667 |
|
|
유형자산의 취득 |
4,589,550,774 |
|
1,208,007,053 |
|
|
무형자산의 취득 |
24,056,000 |
|
33,250,000 |
|
|
종속기업의 취득 |
12,865,305,580 |
|
- |
|
|
기타보증금의 증가 |
200,000 |
|
1,000,000 |
|
|
임차보증금의 증가 |
337,388,000 |
|
- |
|
|
Ⅲ. 재무활동으로 인한 현금흐름 |
71,940,813,351 |
|
45,441,604,790 |
|
|
1. 재무활동으로 인한 현금유입액 |
75,312,495,700 |
46,326,396,100 |
|
|
|
단기차입금의 차입 |
1,000,000 |
- |
|
|
|
전환사채의 발행 |
35,000,000,000 |
23,000,000,000 |
|
|
|
전환우선주 발행 |
34,999,495,700 |
20,998,896,100 |
|
|
|
주식매수선택권 행사 |
5,312,000,000 |
2,327,500,000 |
|
|
|
2. 재무활동으로 인한 현금유출액 |
(3,371,682,349) |
(884,791,310) |
|
|
|
단기차입금의 차입 |
1,432,080,000 |
- |
|
|
|
주식발행비용 등 |
1,486,244,300 |
516,308,270 |
|
|
|
리스부채의 상환 |
453,358,049 |
368,483,040 |
|
|
|
Ⅳ. 외화표시 현금및현금성자산의 환율변동효과 |
|
(972,552) |
|
(7,007,856) |
|
Ⅴ. 현금의 증가(감소) (Ⅰ+Ⅱ+Ⅲ+Ⅳ) |
|
40,646,960,470 |
|
27,433,416,807 |
|
Ⅵ. 기초의 현금 |
|
28,678,534,996 |
|
1,245,118,189 |
|
Ⅶ. 기말의 현금 |
|
69,325,495,466 |
|
28,678,534,996 |
2) 별도재무제표
- 재무상태표
| 재 무 상 태 표 | |
| 제 8(당) 기 2021년 1월 1일부터 2021년 12월 31일까지 | |
| 제 7(전) 기 2020년 1월 1일부터 2020년 12월 31일까지 |
|
| 주식회사 셀리버리 | (단위 : 원) |
| 과 목 | 제 8(당) 기 | 제 7(전) 기 | ||
|---|---|---|---|---|
|
자 산 |
|
|
|
|
|
I. 유동자산 |
77,665,377,745 |
|
54,658,189,075 |
|
|
현금및현금성자산 |
56,799,519,870 |
28,678,534,996 |
|
|
|
당기손익-공정가치측정금융자산 |
2,524,067,533 |
3,525,474,122 |
|
|
|
상각후원가측정금융자산 |
12,513,279,456 |
21,609,649,323 |
|
|
|
매출채권 |
1,051,737,535 |
- |
|
|
|
단기수취채권 |
1,498,362,961 |
222,751,670 |
|
|
|
유동성리스채권 |
329,332,277 |
- |
|
|
|
기타유동자산 |
2,892,757,333 |
543,449,334 |
|
|
|
당기법인세자산 |
56,320,780 |
78,329,630 |
|
|
|
Ⅱ. 비유동자산 |
38,785,760,166 |
|
5,857,868,851 |
|
|
종속기업투자주식 |
28,900,066,510 |
1,969,861,842 |
|
|
|
비유동상각후원가측정금융자산 |
1,152,080,660 |
- |
|
|
|
비유동당기손익-공정가치측정금융자산 |
1,969,861,842 |
- |
|
|
|
유형자산 |
3,659,469,551 |
1,895,806,450 |
|
|
|
무형자산 |
621,551,738 |
545,176,907 |
|
|
|
투자부동산 |
371,344,090 |
- |
|
|
|
사용권자산 |
584,948,685 |
808,778,555 |
|
|
|
장기수취채권 |
632,809,161 |
281,503,685 |
|
|
|
비유동성리스채권 |
607,677,586 |
- |
|
|
|
기타비유동자산 |
285,950,343 |
356,741,412 |
|
|
|
자 산 총 계 |
116,451,137,911 |
|
60,516,057,926 |
|
|
부 채 |
|
|
|
|
|
Ⅰ. 유동부채 |
13,407,389,204 |
|
1,261,466,731 |
|
|
유동성기타채무 |
1,719,435,607 |
656,216,320 |
|
|
|
유동성리스부채 |
764,094,374 |
362,423,638 |
|
|
|
유동성전환사채 |
10,672,796,011 |
- |
|
|
|
기타유동부채 |
251,063,212 |
242,826,773 |
|
|
|
Ⅱ. 비유동부채 |
27,927,731,681 |
|
20,861,341,946 |
|
|
비유동성기타채무 |
290,967,229 |
140,556,526 |
|
|
|
비유동성리스부채 |
765,744,672 |
469,016,415 |
|
|
|
비유동성전환사채 |
22,632,509,780 |
20,251,769,005 |
|
|
|
파생금융부채 |
4,238,510,000 |
- |
|
|
|
부 채 총 계 |
41,335,120,885 |
|
22,122,808,677 |
|
|
자 본 |
|
|
|
|
|
Ⅰ. 자본금 |
9,025,761,000 |
|
4,206,307,000 |
|
|
Ⅱ. 자본잉여금 |
172,025,834,235 |
|
117,664,925,733 |
|
|
Ⅲ. 기타자본구성요소 |
9,401,627,429 |
|
4,032,816,486 |
|
|
Ⅳ. 결손금 |
(115,337,205,638) |
|
(87,510,799,970) |
|
|
자 본 총 계 |
|
75,116,017,026 |
|
38,393,249,249 |
|
부 채 및 자 본 총 계 |
|
116,451,137,911 |
|
60,516,057,926 |
- 포괄손익계산서
| 포 괄 손 익 계 산 서 | |
| 제 8(당) 기 2021년 1월 1일부터 2021년 12월 31일까지 | |
| 제 7(전) 기 2020년 1월 1일부터 2020년 12월 31일까지 |
|
| 주식회사 셀리버리 | (단위 : 원) |
| 과 목 | 제 8(당) 기 | 제 7(전) 기 | ||
|---|---|---|---|---|
|
Ⅰ. 매출액 |
1,138,432,544 |
|
761,573,447 |
|
|
Ⅱ. 매출원가 |
1,390,365,235 |
|
1,485,047,603 |
|
|
Ⅲ. 매출총이익(손실) |
(251,932,691) |
|
(723,474,156) |
|
|
Ⅳ. 판매비와관리비 |
27,391,215,209 |
|
16,888,175,019 |
|
|
Ⅴ. 영업손실 |
(27,643,147,900) |
|
(17,611,649,175) |
|
|
Ⅵ. 영업외손익 |
(1,769,948,977) |
|
(324,916,390) |
|
|
기타수익 |
22,781,805 |
31,615,814 |
|
|
|
기타비용 |
(20,986,950) |
(31,852,787) |
|
|
|
금융수익 |
971,918,300 |
485,760,240 |
|
|
|
금융비용 |
(2,743,662,132) |
(810,439,657) |
|
|
|
Ⅶ. 법인세비용차감전순손실 |
(29,413,096,877) |
|
(17,936,565,565) |
|
|
Ⅷ. 법인세비용 |
(1,586,691,209) |
|
(688,223,439) |
|
|
IX. 당기순이익(손실) |
(27,826,405,668) |
|
(17,248,342,126) |
|
|
X. 기타포괄손익 |
- |
|
- |
|
|
XI. 총포괄손익 |
(27,826,405,668) |
|
(17,248,342,126) |
|
|
XII. 주당손익 |
|
|
||
|
기본주당이익(손실) |
(1,653) |
|
(2,141) | |
- 자본변동표
| 자 본 변 동 표 | |
| 제 8(당) 기 2021년 1월 1일부터 2021년 12월 31일까지 | |
| 제 7(전) 기 2020년 1월 1일부터 2020년 12월 31일까지 |
|
| 주식회사 셀리버리 | (단위 : 원) |
|
과 목 |
자본금 |
자본잉여금 | 기타타자본구성요서 | 결손금 |
총 계 |
|---|---|---|---|---|---|
|
2020.01.01 (전기초) |
3,910,053,500 | 90,218,760,330 | 3,417,066,578 | (70,262,457,844) | 27,283,422,564 |
|
당기순손실 |
- | - | - | (17,248,342,126) | (17,248,342,126) |
|
전환우선주 발행 |
113,753,500 | 20,641,519,553 | - | - | 20,755,273,053 |
|
전환권대가 변동 |
- | 2,440,064,919 | - | - | 2,440,064,919 |
|
주식매수선택권 행사 |
182,500,000 | 4,364,580,931 | (2,221,671,951) | - | 2,325,408,980 |
|
주식기준보상 |
- | - | 2,837,421,859 | - | 2,837,421,859 |
|
2020.12.31 (전기말) |
4,206,307,000 | 117,664,925,733 | 4,032,816,486 | (87,510,799,970) | 38,393,249,249 |
|
2021.01.01 (당기초) |
4,206,307,000 | 117,664,925,733 | 4,032,816,486 | (87,510,799,970) | 38,393,249,249 |
|
당기순손실 |
- | - | - | (27,826,405,668) | (27,826,405,668) |
|
무상증자 |
4,206,307,000 | (4,267,102,260) | - | - | (60,795,260) |
|
전환우선주 발행 |
334,485,500 | 33,952,366,735 | - | - | 34,286,852,235 |
|
전환사채 전환 |
114,661,500 | 11,165,005,536 | - | - | 11,279,667,036 |
|
전환권대가 변동 |
- | 6,196,983,061 | - | - | 6,196,983,061 |
|
주식매수선택권 행사 |
164,000,000 | 7,313,655,430 | (2,173,886,480) | - | 5,303,768,950 |
|
주식기준보상 |
- | - | 7,542,697,423 | - | 7,542,697,423 |
|
2021.12.31 (당기말) |
9,025,761,000 | 172,025,834,235 | 9,401,627,429 | (115,337,205,638) | 75,116,017,026 |
- 현금흐름표
| 현 금 흐 름 표 |
|
| 제 8(당) 기 2021년 1월 1일부터 2021년 12월 31일까지 | |
| 제 7(전) 기 2020년 1월 1일부터 2020년 12월 31일까지 | |
| 주식회사 셀리버리 | (단위 : 원) |
| 과 목 | 제 8(당) 기 | 제 7(전) 기 | ||
|---|---|---|---|---|
| Ⅰ. 영업활동으로 인한 현금흐름 | (22,059,951,621) | (16,096,635,495) | ||
| 1. 영업활동에서 창출된 현금(주31) | (22,134,847,387) | (16,589,053,581) | ||
| (1) 당기순손실 | (27,826,405,668) | (17,248,342,126) | ||
| (2) 조정 | 8,895,333,807 | 3,964,264,992 | ||
| (3) 영업활동으로 인한 자산부채의 변동 | (3,203,775,526) | (3,304,976,447) | ||
| 2. 이자의 수취 | 252,829,376 | 507,791,903 | ||
| 3. 이자의 지급 | (199,942,460) | (57,972,602) | ||
| 4. 배당금의 수취 | - | 12,577,495 | ||
| 5. 법인세의 환급 | 22,008,850 | 30,021,290 | ||
| Ⅱ. 투자활동으로 인한 현금흐름 | (23,223,578,743) | (1,904,544,632) | ||
| 1. 투자활동으로 인한 현금유입액 | 148,371,289,640 | 93,403,589,095 | ||
| 당기손익-공정가치 측정 금융자산 처분 | 67,118,322,729 | 23,102,748,590 | ||
| 상각후원가 측정 금융자산 처분 | 81,204,785,093 | 70,117,370,505 | ||
| 유형자산의 처분 | 48,181,818 | 182,470,000 | ||
| 기타보증금의 감소 |
- | 1,000,000 | ||
| 2. 투자활동으로 인한 현금유출액 |
(171,594,868,383) | (95,308,133,727) | ||
| 당기손익-공정가치 측정 금융자산 취득 | 67,000,000,000 | 26,001,104,007 | ||
| 상각후원가 측정 금융자산 취득 | 72,108,415,226 | 68,064,772,667 | ||
| 종속기업투자의 취득 | 28,900,066,510 | - | ||
| 유형자산의 취득 | 2,860,250,947 | 1,208,007,053 | ||
| 무형자산의 취득 | 16,598,000 | 33,250,000 | ||
| 투자부동산의 취득 | 371,949,700 | - | ||
| 기타보증금의 증가 |
200,000 | 1,000,000 | ||
| 임차보증금의 증가 | 337,388,000 | - | ||
| Ⅲ. 재무활동으로 인한 현금흐름 | 73,398,518,333 | 45,441,604,790 | ||
| 1. 재무활동으로 인한 현금유입액 | 75,311,495,700 | 46,326,396,100 | ||
| 전환사채 발행 | 35,000,000,000 | 23,000,000,000 | ||
| 전환우선주 발행 |
34,999,495,700 | 20,998,896,100 | ||
| 주식선택권 행사 | 5,312,000,000 | 2,327,500,000 | ||
| 2. 재무활동으로 인한 현금유출액 | (1,912,977,367) | (884,791,310) | ||
| 주식발행비용 등 | 1,486,244,300 | 516,308,270 | ||
| 리스부채의 상환 |
426,733,067 | 368,483,040 | ||
| Ⅳ. 외화표시 현금및현금성자산의 환율변동효과 | 5,996,905 | (7,007,856) | ||
| Ⅴ. 현금및현금성자산의 증가(Ⅰ+Ⅱ+Ⅲ+Ⅳ) | 28,120,984,874 | 27,433,416,807 | ||
| Ⅵ. 기초의 현금및현금성자산 | 28,678,534,996 | 1,245,118,189 | ||
| Ⅶ. 기말의 현금및현금성자산 | 56,799,519,870 | 28,678,534,996 | ||
※ 당사 재무제표는 한국채택국제회계기준(K-IFRS)으로 작성되었으며, 외부감사인의 회계감사결과 및 정기주주총회 승인과정에서 변경될 수 있습니다.
- 최근 2사업연도의 배당에 관한 사항
당사는 최근 2사업연도에 배당이 없습니다.
□ 정관의 변경
가. 집중투표 배제를 위한 정관의 변경 또는 그 배제된 정관의 변경
| 변경전 내용 | 변경후 내용 | 변경의 목적 |
|---|---|---|
| - | - | - |
나. 그 외의 정관변경에 관한 건
| 변경전 내용 | 변경후 내용 | 변경의 목적 |
|---|---|---|
|
제 2 조 【 목 적 】 본 회사는 다음 사업을 경영함을 목적으로 한다. 1. 의학 및 약학 연구 개발업 1. 물질 성분 검사 및 분석업 1. 의료용품 및 기타 의약관련 제품 제조업 1. 물질 검사, 측정 및 분석 기구 제조업 1. 기타 의료용 기기 제조업 1. 생물학적제제 제조업 1. 의약품 제조업 1. 과학기자재, 시약제조업 1. 과학기자재, 시약 도소매업 1. 의약품 도소매업 1. 환경 및 건강관련 제조 및 판매사업 1. 부동산 임대 및 관리업 1. 위 각호의 컨설팅 업 1. 위 각 호에 관련된 제품 무역업 1.위각호에 부대되는 관련사업일체 |
제 2 조 【 목 적 】 본 회사는 다음 사업을 경영함을 목적으로 한다. 1. 의학 및 약학 연구 개발업 1. 물질 성분 검사 및 분석업 1. 의료용품 및 기타 의약관련 제품 제조업 1. 물질 검사, 측정 및 분석 기구 제조업 1. 기타 의료용 기기 제조업 1. 생물학적제제 제조업 1. 의약품 제조업 1. 과학기자재, 시약제조업 1. 과학기자재, 시약 도소매업 1. 의약품 도소매업 1. 환경 및 건강관련 제조 및 판매사업 1. 화장품 제조업 및 서비스업 1. 위생용품 제조업 및 서비스업 1. 전자상거래 및 통신판매업 1. 부동산 임대 및 관리업 1. 위 각 호의 컨설팅업 1. 위 각 호에 관련된 제품 무역업 및 도소매업 1. 위 각 호에 부대되는 관련사업일체 |
사업다각화로 인한 목적 추가 |
|
제5조 【 회사가 발행할 주식의 총수 】 본 회사가 발행할 주식의 총수는 20,000,000주로 한다 |
제5조 【 회사가 발행할 주식의 총수 】 본 회사가 발행할 주식의 총수는 200,000,000주로 한다 |
발행주식 총수 변경 |
|
제8조의3 (이익배당에 관한 종류주식) 1. 회사가 발행하는 이익배당에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)은 회사의 이익의 배당에 있어 보통주식보다 우선적 권리를 가지며, 그 발행주식의 한도는 10,000,000주 이내로 한다. 2. 종류주식에 대한 배당률은 액면금액을 기준으로 연 2% 이상 6% 이내에서 발행시에 이사회의 결의로 우선배당률을 정하여 그 비율에 따른 금액을 현금으로 우선배당한다. 단, 우선배당률을 조정할 수 있는 종류주식을 발행하는 경우에는 발행시에 이사회가 우선배당률을 조정할 수 있다 는 내용, 조정사유, 조정의 기준일 및 조정방법을 정하여야 한다. 3. 보통주식의 배당율이 종류주식의 배당율을 초과할 경우에는 그 초과분에 대하여 보통주식과 동일한 비율로 참가시켜 배당한다. 4. 종류주식에 대하여 어느 사업연도에 소정의 배당을 하지 못한 경우에는 누적된 미배당분을 다음 사업연도의 배당시에 우선하여 배당한다. 제8조의4 (전환에 관한 종류주식) 1. 회사가 발행하는 전환에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)의 전환으로 인 하여 발행하는 주식은 보통주식으로 하고, 그 발행주식의 한도는 10,000,000주 이내로 한다. 2. 종류주식의 전환으로 인하여 발행하는 주식의 총발행가액은 전환 전의 종류주식의 총발행가액으로 한다. 3. 종류주식의 주주가 전환을 청구할 수 있는 기간은 발행일로부터 10년의 범위에서 이사회의 결의로 정한다. 4. 주주의 전환청구가 있는 경우 회사는 종류주식 1주당 보통주식 1주를 교부한다. 단, 회사 는 전환비율을 조정할 수 있는 내용으로 전환주식을 발행할 수 있다. 전환비율 조정사유, 전환 비율을 조정하는 기준이 되는 날 및 조정 방법 등은 이사회의 결의로 정한다. 5. 전환으로 인하여 발행하는 주식에 대한 이익의 배당에 관하여는 제9조2의 규정을 준용한다 |
제8조의3 (이익배당에 관한 종류주식) 1. 회사가 발행하는 이익배당에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)은 회사의 이익의 배당에 있어 보통주식보다 우선적 권리를 가지며, 그 발행주식의 한도는 100,000,000주 이내로 한다. 2. 종류주식에 대한 배당률은 액면금액을 기준으로 연 2% 이상 6% 이내에서 발행시에 이사회의 결의로 우선배당률을 정하여 그 비율에 따른 금액을 현금으로 우선배당한다. 단, 우선배당률을 조정할 수 있는 종류주식을 발행하는 경우에는 발행시에 이사회가 우선배당률을 조정할 수 있다 는 내용, 조정사유, 조정의 기준일 및 조정방법을 정하여야 한다. 3. 보통주식의 배당율이 종류주식의 배당율을 초과할 경우에는 그 초과분에 대하여 보통주식과 동일한 비율로 참가시켜 배당한다. 4. 종류주식에 대하여 어느 사업연도에 소정의 배당을 하지 못한 경우에는 누적된 미배당분을 다음 사업연도의 배당시에 우선하여 배당한다. 제8조의4 (전환에 관한 종류주식) 1. 회사가 발행하는 전환에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)의 전환으로 인 하여 발행하는 주식은 보통주식으로 하고, 그 발행주식의 한도는 100,000,000주 이내로 한다. 2. 종류주식의 전환으로 인하여 발행하는 주식의총발행가액은 전환 전의 종류주식의 총발행가액으로 한다. 3. 종류주식의 주주가 전환을 청구할 수 있는 기간은 발행일로부터 10년의 범위에서 이사회의 결의로 정한다. 4. 주주의 전환청구가 있는 경우 회사는 종류주식 1주당 보통주식 1주를 교부한다. 단, 회사 는 전환비율을 조정할 수 있는 내용으로 전환주식을 발행할 수 있다. 전환비율 조정사유, 전환 비율을 조정하는 기준이 되는 날 및 조정 방법 등은 이사회의 결의로 정한다. 5. 전환으로 인하여 발행하는 주식에 대한 이익의 배당에 관하여는 제9조2의 규정을 준용한다 |
발행주식 총수 변경으로 인한 변경 |
|
제8조의5 (상환에 관한 종류주식) 1. 회사가 발행하는 상환에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)의 발행주식의 수는 10,000,000주 이내로 한다. 2. 종류주식의 상환가액은 발행가액 및 이에 가산금액을 더한 금액으로 하며, 가산금액은 발행가액 과 배당률, 시장상황 등 제반 사정을 고려하여 발행시에 이사회의 결의로 정한다. 다만, 상환가액을 조정할 수 있는 것으로 하려는 경우 이사회에서 상환가액을 조정할 수 있다는 뜻, 조정사유, 조정의 기준일 및 조정방법을 정하여야 한다. 3. 종류주식의 상환권행사기간 및 상환기간은 발행일로부터 10년의 범위에서 이사회의 결의로 정한다. 단, 다음 각호의 1에 해당하는 사유가 발생하는 경우에는 그 사유가 해소될 때까지 상환기간은 연장된다. ① 종류주식이 제8조의3에 의한 누적적 이익배당에 관한 우선권이 있는 종류주식과 혼합하여 발 행된 경우 종류주식에 대하여 우선적 배당이 완료되지 아니한 경우 ② 회사의 배당가능이익이 부족하여 상환기간 내에 상환하지 못하는 경우 4. 종류주식의 주주는 자신의 선택으로써 종류주식 전부 또는 일부를 일시에 또는 분할하여 상환해 줄 것을 청구할 수 있다. 이 경우 당해 주주는 상환할 뜻 및 상환 대상 주식을2주 이상의 기간을 정하여 회사에 통지하여야 한다. 단, 회사는 배당가능이익으로 상환대상 주식 전부를 일시에 상환하기 충분하지 않을 경우 이를 이사회에서 정한 방법으로 분할상환할 수 있고, 이 경우 발생하는 단주는 상환하지 아니한다. |
제8조의5 (상환에 관한 종류주식) 1. 회사가 발행하는 상환에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)의 발행주식의 수는 100,000,000주 이내로 한다. 2. 종류주식의 상환가액은 발행가액 및 이에 가산금액을 더한 금액으로 하며, 가산금액은 발행가액 과 배당률, 시장상황 등 제반 사정을 고려하여 발행시에 이사회의 결의로 정한다. 다만, 상환가액을 조정할 수 있는 것으로 하려는 경우 이사회에서 상환가액을 조정할 수 있다는 뜻, 조정사유, 조정의 기준일 및 조정방법을 정하여야 한다. 3. 종류주식의 상환권행사기간 및 상환기간은 발행일로부터 10년의 범위에서 이사회의 결의로 정한다. 단, 다음 각호의 1에 해당하는 사유가 발생하는 경우에는 그 사유가 해소될 때까지 상환기간은 연장된다. ① 종류주식이 제8조의3에 의한 누적적 이익배당에 관한 우선권이 있는 종류주식과 혼합하여 발 행된 경우 종류주식에 대하여 우선적 배당이 완료되지 아니한 경우 ② 회사의 배당가능이익이 부족하여 상환기간 내에 상환하지 못하는 경우 4. 종류주식의 주주는 자신의 선택으로써 종류주식 전부 또는 일부를 일시에 또는 분할하여 상환해 줄 것을 청구할 수 있다. 이 경우 당해 주주는 상환할 뜻 및 상환 대상 주식을2주 이상의 기간을 정하여 회사에 통지하여야 한다. 단, 회사는 배당가능이익으로 상환대상 주식 전부를 일시에 상환하기 충분하지 않을 경우 이를 이사회에서 정한 방법으로 분할상환할 수 있고, 이 경우 발생하는 단주는 상환하지 아니한다. |
발행주식 총수 변경으로 인한 변경 |
|
제8조의6 (잔여재산 분배에 관한 종류주식) 1. 회사가 발행하는 잔여재산 분배에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)의 발 행한도는 10,000,000주 이내로 한다. 2. 종류주식에 대하여는 회사가 청산될 경우 잔여재산 분배에 있어 발행시에 이사회에서 정한 금액 을 한도로 보통주식을 보유한 주주에 우선하여 잔여재산을 분배한다. 3. 보통주식에 대한 잔여재산 분배율이 제2항에 따른 종류주식에 대한 잔여재산 분배율을 초과하는 경우 종류주식은 그 초과분에 대하여 보통주와 동일한 분배율로 참가하여 분배를 받는다. |
제8조의6 (잔여재산 분배에 관한 종류주식) 1. 회사가 발행하는 잔여재산 분배에 관한 종류주식(이하 이 조에서 “종류주식”이라 한다)의 발 행한도는 100,000,000주 이내로 한다. 2. 종류주식에 대하여는 회사가 청산될 경우 잔여재산 분배에 있어 발행시에 이사회에서 정한 금액 을 한도로 보통주식을 보유한 주주에 우선하여 잔여재산을 분배한다. 3. 보통주식에 대한 잔여재산 분배율이 제2항에 따른 종류주식에 대한 잔여재산 분배율을 초과하는 경우 종류주식은 그 초과분에 대하여 보통주와 동일한 분배율로 참가하여 분배를 받는다. |
발행주식 총수 변경으로 인한 변경 |
|
제14조【 사채의 발행 】 본 회사는 사채의 액면총액이 1,000억원을 초과하지 않는 범위내에서 이사회의 결의로 주주 및 주주 외의 자에게 사채, 전환사채, 신주인수권부사채 및 교환사채를 발행할 수 있다. |
제14조【 사채의 발행 】 본 회사는 사채의 액면총액이 10,000억원을 초과하지 않는 범위내에서 이사회의 결의로 주주 및 주주 외의 자에게 사채, 전환사채, 신주인수권부사채 및 교환사채를 발행할 수 있다. |
사채의 액면총액 변경 |
|
제28조【 감사의 선임 】 1. 감사는 주주총회에서 선임한다. 2. 감사의 선임을 위한 의안은 이사의 선임을 위한 의안과는 별도로 상정하여 의결하여야 한다. 3. 감사의 선임은 출석한 주주의 의결권의 과반수로 하되 발행주식총수의 4분의 1이상의 수로 하여 야 한다. 그러나 의결권 있는 발행주식총수의 100분의 3을 초과하는 수익 주식을 가진 주주는 그 초과하는 주식에 관하여 감사의 선임에는 의결권을 행사하지 못한다. 다만, 소유주식수의 산 정에 있어 최대주주와 그 특수관계인, 최대주주, 또는 그 특수관계인의 계산으로 주식을 보유하 는 자, 최대주주 또는 그 특수관계인에게 의결권을 위임한 자가 소유하는 의결권 있는 주식의 수는 합산한다. |
제28조【 감사의 선임 】 1. 감사는 주주총회에서 선임한다. 2. 감사의 선임을 위한 의안은 이사의 선임을 위한 의안과는 별도로 상정하여 의결하여야 한다. 3. 감사의 선임은 출석한 주주의 의결권의 과반수로 하되 발행주식총수의 4분의 1이상의 수로 하여야 한다. 다만, 상법 제368조의4제1항에 따라 전자적 방법으로 의결권을 행사할 수 있도록 한 경우에는 출석한 주주의 의결권의 과반수로써 감사의 선임을 결의할 수 있다. 4. 감사의 해임은 출석한 주주의 의결권의 3분의 2 이상의 수로 하되, 발행주식총수의 3분의 1 이상의 수로 하여야 한다. 5. 제3항·제4항의 감사의 선임 또는 해임에는 의결권 있는 발행주식총수의100분의3을 초과하는 수의 주식을 가진 주주(최대주주인 경우에는 그의 특수관계인, 최대주주 또는 그 특수관계인의 계산으로 주식을 보유하는 자, 최대주주 또는 그 특수관계인에게 의결권을 위임한 자가 소유하는 의결권 있는 주식의 수를 합산한다)는 그 초과하는 주식에 관하여 의결권을 행사하지 못한다. |
전자적 방법으로 의결권행사. (2021.1.7) 반영 |
※ 기타 참고사항
□ 감사의 선임
<감사후보자가 예정되어 있는 경우>
가. 후보자의 성명ㆍ생년월일ㆍ추천인ㆍ최대주주와의 관계
| 후보자성명 | 생년월일 | 최대주주와의 관계 | 추천인 |
|---|---|---|---|
| 이병화 | 1964. 09. 26 | 없음 | 이사회 |
| 총 ( 1 ) 명 | |||
나. 후보자의 주된직업ㆍ세부경력ㆍ해당법인과의 최근3년간 거래내역
| 후보자성명 | 주된직업 | 세부경력(내용) | 해당법인과의 최근3년간 거래내역 |
|---|---|---|---|
| 이병화 | 변호사 | - 서울대학교 법과대학 | 없음 |
| - 서울대학교 법과대학원 | |||
| - 사법시험합격 | |||
| - 사법연수원 수료 | |||
| - (前)김.장.리 법률사무소(Kim, Chang &Lee) | |||
| - (前)㈜한국쓰리엠 법무지원본부 본부장(상무) | |||
| - (前)사법연수원 운영위원 | |||
| - (現)법무법인(유한) 광장(Lee &Ko) |
다. 후보자의 체납사실 여부ㆍ부실기업 경영진 여부ㆍ법령상 결격 사유 유무
| 후보자성명 | 체납사실 여부 | 부실기업 경영진 여부 | 법령상 결격 사유 유무 |
|---|---|---|---|
| 이병화 | 없음 | 없음 | 없음 |
라. 후보자에 대한 이사회의 추천 사유
| 감사 후보자는 법률전문가로서 이사회 및 회사 경영의 감사을 위한 충분한 경험을 보유하고 있으며 관련법령에서 정한 자격 기준에 부합하고 있어, 법률 전문가로서 독립적인 관점에서 내부통제 및 준법경영의 강화에 기여할 것으로 판단되어 셀리버리의 감사로 추천합니다. |
확인서
 |
|
감사 확인서 |
□ 이사의 보수한도 승인
가. 이사의 수ㆍ보수총액 내지 최고 한도액
(당 기)
| 이사의 수 (사외이사수) | 3( 1 ) |
| 보수총액 또는 최고한도액 | 18억원 |
(전 기)
| 이사의 수 (사외이사수) | 3( 1 ) |
| 실제 지급된 보수총액 | 13억원 |
| 최고한도액 | 18억원 |
※ 기타 참고사항
해당사항이 없습니다.
□ 감사의 보수한도 승인
가. 감사의 수ㆍ보수총액 내지 최고 한도액
(당 기)
| 감사의 수 | 1 |
| 보수총액 또는 최고한도액 | 6천만원 |
(전 기)
| 감사의 수 | 1 |
| 실제 지급된 보수총액 | 2천만원 |
| 최고한도액 | 6천만원 |
※ 기타 참고사항
해당사항이 없습니다.
IV. 사업보고서 및 감사보고서 첨부
가. 제출 개요
| 제출(예정)일 | 사업보고서 등 통지 등 방식 |
|---|---|
| 2022년 03월 23일 | 1주전 회사 홈페이지 게재 |
나. 사업보고서 및 감사보고서 첨부
1) 상법시행령 제31조(주주총회의 소집공고)제4항제4호에 의거하여 사업보고서 및
감사보고서는 주주총회 개최 1주 전까지 전자공시 및 당사 홈페이지 (홈페이지 -> PR -> Notice)에 링크될 예정입니다.
※ 홈페이지 주소 : www.cellivery.com
2) 당사는 2022년 3월 30일로 정기주주총회가 예정되어 있으며, 향후 정기주주총회에서 안건이 부결되거나 수정이 발생한 경우 정정보고서를 통해 그 내용 및 사유 등을 반영할 예정이오니 정기주주총회 이후 전자공시시스템 및 당사 홈페이지에 게재된 사업보고서를 확인해 주시기 바랍니다.
※ 참고사항
|
□ 주주총회 집중일 개최사유 : |