 |
|
사업위험 사. 전 세계 원료의약품(api) 시장 규모 |
정 정 신 고 (보고)
| 2021년 11월 16일 |
1. 정정대상 공시서류 : 증권신고서
2. 정정대상 공시서류의 최초제출일 : 2021년 09월 17일
3. 정정사항
| 항 목 | 정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|
| 금번 정정신고서는 3분기보고서 제출에 따른 정정으로써, 정정사항은 편의를 위해 '굵은 보라색'으로 기재하였습니다. | |||
| 요약정보 | |||
| ※ '요약정보'는 본문의 정정사항을 반영하였으며, 정오표를 별도로 기재하지 않았습니다. ※ '요약정보'이외 정정사항은 아래 본문 정정내용을 참고하시기 바랍니다. |
|||
| 제1부 모집 또는 매출에 관한 사항 | |||
| Ⅲ. 투자위험요소 | |||
| 1. 사업위험 | |||
| 다. 임상시험 실패 및 지연에 따른 위험 | 3분기보고서 제출에 따른 정정 | (주1) 정정 전 | (주1) 정정 후 |
| 마. 코로나 19 pDNA백신 관련 신규사업 추진에 따른 위험 |
(주2) 정정 전 | (주2) 정정 후 |
|
| 사. 원료의약품(API) 시장에 따른 위험 |
(주3) 정정 전 | (주3) 정정 후 | |
| 차. 핵심연구인력 유출 | (주4) 정정 전 | (주4) 정정 후 |
|
| 2. 회사위험 | |||
| 가. 지속적인 영업적자로 인한 재무구조 악화 위험 |
3분기보고서 제출에 따른 정정 | (주5) 정정 전 | (주5) 정정 후 |
| 나. 재무안정성 악화 위험 | (주6) 정정 전 | (주6) 정정 후 | |
| 다. 매출채권 회수 지연 가능성에 따른 위험 | (주7) 정정 전 | (주7) 정정 후 | |
| 라. 재고자산 진부화 위험 | (주8) 정정 전 | (주8) 정정 후 | |
| 마. 회사의 유동성 관련 위험 | (주9) 정정 전 | (주9) 정정 후 | |
| 바. 최대주주의 지분율 희석화에 따른 위험 |
(주10) 정정 전 | (주10) 정정 후 | |
| 사. 잦은 자금조달로 인한 주주가치 희석화 |
(주11) 정정 전 | (주11) 정정 후 | |
| 3. 기타위험 |
|||
| 카. 주가 희석화 및 주주배정 후 실권주 일반공모 대량물량 출회 예정에 따른 위험 |
3분기보고서제출에 따른 정정 | (주12) 정정 전 | (주12) 정정 후 |
| Ⅳ. 인수인의 의견(분석기관의 평가의견) | 3분기보고서제출에 따른 정정 | (주13) 정정 전 | (주13) 정정 후 |
| Ⅴ. 자금의 사용목적 |
기재정정 | (주14) 정정 전 | (주14) 정정 후 |
| 제2부 발행인에 관한 사항 | |||
| ※제2부 발행인에 관한 사항은 2021년 3분기 보고서 제출에 따라 일괄 정정되었으며, 정오표에는 별도로 기재하지 아니하였습니다. | |||
(주1) 정정 전
| [연구개발 진행 총괄표] |
| 구분 | 품목 | 적응증 | 연구시작일 | 현재진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||
| 화학합성 | 신약 |
EC-18 |
호중구감소증 |
2013년 |
글로벌 임상2상 part 1 완료 / |
2017년/ |
- |
| 신약 |
EC-18 |
구강점막염 |
2013년 |
임상2상 Database Lock(DBL) |
2017년 |
신속심사지정 |
|
| 신약 |
EC-18 |
급성방사선증후군 |
2013년 |
미국 임상2상 상응 비임상 |
2019년 |
희귀의약품지정 |
|
| 신약 | EC-18 | COVID-19 | 2020년 | -국내 임상2상 종료 - 글로벌 임상2상 진행 중 |
2020년 | - | |
| 신약 |
EC-18 |
류마티스관절염 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
건선 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
패혈증 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
천식 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
아토피 피부염 |
2013년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
비알코올성지방간염 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
당뇨 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
면역항암제 병용 |
2019년 |
임상1상 종료 | - | - | |
| (출처: 당사 정기보고서) |
(중략)
| [구강점막염 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
구강점막염 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전 |
|
④제품의특성 |
1) 경구투여 2) 항암치료 중 발생하는 호중구감소증에도 효과 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막염을 예방 및 치료 4) 호중구감소증, 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 5) 암의 진행을 촉진하는 인자인 STAT3를 억제함 6) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2017년 7월 28일 미국 FDA임상 2상 승인 - 2019년 5월 Stage 1 종료 - 2019년 7월 Stage 2 개시 - 2021년 4월 임상2상 환자 모집 완료 - 2021년 6월 최종 피험자 종료 (LPO) |
|
⑥향후계획 |
구강점막염에 대해서 본 보고서 작성기준일 기준 현재 2상 Stage 2 단계를 진행중 이며, 2021년 3분기에 임상 2상 종료 예정과 동시에 Topline 결과를 바탕으로 미국 FDA에 혁신 신약(BTD) 신청 예정 임상 2상 결과를 활용하여 적극적인 기술 라이선스를 추진할 계획임. |
|
⑦경쟁제품 |
Galera Therapeutics의 GC4419는 방사선치료에 의해 발생되는 구강점막염 치료제로 임상3상을 준비하고 있으나, 항암치료에 필수인 ROS를 억제하는 작용기전을 가지고 있어, 항암치료를 억제하는 가능성을 꾸준히 의심받고 있으며, 정맥주사를 3주~7주 동안 월요일에서 금요일까지 계속해서 맞아야 하므로, 투약이 매우 불편함. |
|
⑧관련논문등 |
Frontiers in Oncology 2016, Orall Disease 2019 |
|
⑨시장규모 |
구강점막염 세계 최고 권위자인Dr. Sonis에 따르면 구강점막염 치료제 시장 규모는 2016년 전체30억달러로 추정되고 있음. |
|
⑩기타사항 |
2018년 2월 FDA 신속심사 지정 |
| (출처: 당사 정기보고서) |
(중략)
| [신종코로나바이러스 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
신종코로나바이러스 (COVID-19) |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 작용기전으로 코로나바이러스에 의해 야기된 폐렴의 중증으로의 진행예방 및 급성폐손상, 급성호흡부전증후군에 효능 |
|
④제품의특성 |
1) 경구투여 |
|
⑤진행경과 |
- 2020년 5월 12일 한국 식품의약품안전처 임상 2상 시험 승인 - 2021년 1월 21일 국내 임상2상 환자모집 완료 - 2021년3월23일 국내 임상2상Database Lock (DBL) |
|
⑥향후계획 |
- 2021년 3분기 한국 임상 2상 종료 예정 - 미국 임상 2상 진행 중 |
|
⑦경쟁제품 |
항바이러스 약물인 길리어드사의 Remdesivir, 부광약품의 Levovir가 있으며, 현재 임상을 진행중임, 항바이러스 약물의 특성 상 내성 및 부작용 우려가 상존 함. |
|
⑧관련논문등 |
J. Trauma 2010, Front Immunol. 2019, J. Immunology 2017 |
| (출처: 당사 정기보고서) |
(중략)
향후 당사는 코로나19 치료제와 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 당사가 진행중인 파이프라인에 대해서, 상기 언급한 것처럼 코로나 19에 따라 임상계획 당시 예상하지 못하였던 변수로 인하여 임상시험 개시 승인이 지연되거나, 코로나 19로 인한 외부 활동 위축으로 임상 시험에 필요한 환자등록이 원활하지 않을 문제가 발생할 수 있습니다. 이 경우 당사의 신약개발이 예정보다 지연될 가능성이 존재하며, 당사가 계획했던 임상시험 비용이 예산을 초과하여 발생하거나, 판매승인 지연으로 인하여 신약매출 발생이 늦어질 수 있습니다.
(주1) 정정 후
| [연구개발 진행 총괄표] |
| 구분 | 품목 | 적응증 | 연구시작일 | 현재진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||
| 화학합성 | 신약 |
EC-18 |
호중구감소증 |
2013년 |
글로벌 임상2상 part 1 완료 / |
2017년/ |
- |
| 신약 |
EC-18 |
구강점막염 |
2013년 |
임상2상 Stage1, Stage2 완료 임상2상(미국) 결과 공시 2021년 11월 혁신신약지정(BTD) 신청완료 |
2017년 |
신속심사지정 |
|
| 신약 |
EC-18 |
급성방사선증후군 |
2013년 |
미국 임상2상 상응 비임상 |
2019년 |
희귀의약품지정 |
|
| 신약 | EC-18 | COVID-19 | 2020년 | 국내 임상 2상 결과 공시 / 미국 임상 2상 진행 중 |
2020년 | - | |
| 신약 |
EC-18 |
류마티스관절염 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
건선 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
패혈증 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
천식 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
아토피 피부염 |
2013년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
비알코올성지방간염 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
당뇨 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
면역항암제 병용 |
2019년 |
임상1상 종료 | - | - | |
| (출처: 당사 정기보고서) |
(중략)
| [구강점막염 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
구강점막염 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전 |
|
④제품의특성 |
1) 경구투여 2) 항암치료 중 발생하는 호중구감소증에도 효과 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막염을 예방 및 치료 4) 호중구감소증, 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 5) 암의 진행을 촉진하는 인자인 STAT3를 억제함 6) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2017년 7월 28일 미국 FDA임상 2상 승인 - 2019년 5월 Stage 1 종료 - 2019년 7월 Stage 2 개시 - 2021년 4월 임상2상 환자 모집 완료 - 2021년 6월 최종 피험자 종료 (LPO) - 2021년 10월 임상2상(미국) 결과 공시 - 2021년 11월 혁신신약지정(BTD) 신청완료 |
|
⑥향후계획 |
본 보고서 작성기준일 기준 현재 2상 Stage 2 단계를 완료하여 결과공시를 제출하였으며, 분석된 결과를 바탕으로 2021년 11월 미국 FDA에 혁신신약지정(BTD) 신청완료. 또한 임상 2상 결과를 활용하여 글로벌 라이선스 아웃을 추진 중. |
|
⑦경쟁제품 |
Galera Therapeutics의 GC4419는 방사선치료에 의해 발생되는 구강점막염 치료제로 임상3상을 준비하고 있으나, 항암치료에 필수인 ROS를 억제하는 작용기전을 가지고 있어, 항암치료를 억제하는 가능성을 꾸준히 의심받고 있으며, 정맥주사를 3주~7주 동안 월요일에서 금요일까지 계속해서 맞아야 하므로, 투약이 매우 불편함. |
|
⑧관련논문등 |
Frontiers in Oncology 2016, Orall Disease 2019 |
|
⑨시장규모 |
구강점막염 세계 최고 권위자인Dr. Sonis에 따르면 구강점막염 치료제 시장 규모는 2016년 전체30억달러로 추정되고 있음. |
|
⑩기타사항 |
2018년 2월 FDA 신속심사 지정 |
| (출처: 당사 정기보고서, 전자공시) |
(중략)
| [신종코로나바이러스 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
신종코로나바이러스 (COVID-19) |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 작용기전으로 코로나바이러스에 의해 야기된 폐렴의 중증으로의 진행예방 및 급성폐손상, 급성호흡부전증후군에 효능 |
|
④제품의특성 |
1) 경구투여 |
|
⑤진행경과 |
- 2020년 5월 12일 한국 식품의약품안전처 임상 2상 시험 승인 - 2021년 1월 21일 국내 임상2상 환자모집 완료 - 2021년3월23일 국내 임상2상Database Lock (DBL) |
|
⑥향후계획 |
- 미국 임상 2상 진행 중 |
|
⑦경쟁제품 |
항바이러스 약물인 길리어드사의 Remdesivir, 부광약품의 Levovir가 있으며, 현재 임상을 진행중임, 항바이러스 약물의 특성 상 내성 및 부작용 우려가 상존 함. |
|
⑧관련논문등 |
J. Trauma 2010, Front Immunol. 2019, J. Immunology 2017 |
| (출처: 당사 정기보고서) |
(중략)
또한 당사는 2021년 10월 19일 당사의 주요 파이프라인인 구강점막염에 대해서 미국 FDA 임상 2상 시험결과를 수령하였으며, 상세한 사항은 아래와 같습니다.
| [2021.11.02 [정정] 투자판단관련주요경영사항] |
| 1. 제목 | 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자에게 유발되는 구강점막염에 대한 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위배정, 이중 눈가림, 위약대조 임상2상 시험 결과 | |
| 2. 주요내용 | ※ 투자유의사항 임상시험 약물이 의약품으로 최종 허가 받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다 1. 임상시험 제목 : 영문: Phase2, multi-center, randomized, double-blind, placebo-controlled study to evaluate the safety and efficacy of EC-18 in altering the severity and course of oral mucositis in patients being treated with concomitant chemoiradiation for cancers of the mouth, oropharynx, hypopharynx and nasopharynx. 국문: 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자에게 유발되는 구강점막염에 대한 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위배정, 이중 눈가림, 위약대조 임상2상 시험 2. 임상시험 단계/지역: 임상2상 / 미국 3. 대상환자 : 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자 4. 대상질환명 : 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자에게 유발되는 구강점막염 5. 임상시험 신청(승인)일 및 승인(시험)기관 - 신청일: 2017년 06월 20일 - 승인일: 2017년 07월 27일 - 임상승인기관: 미국 식품의약국 (FDA) - 임상시험기관: 미국 21개 병원 6. 임상시험 등록번호: NCT03200340 7. 임상시험 결과: 당사는 EC-18의 임상2상 시험을 통해 아래와 같은 임상 결과를 확인하였습니다. < 아 래 > 1) 시험대상자 수: 105명 2) 유효성 : * 1차 평가변수: 중증 구강점막염 지속기간(SOM Duration) 관찰결과 위약군 대비 100% 감소한 것을 확인 -EC-18 투약군 : 0일 -위약군 : 13.5일 * 2차 평가변수: 중증 구강점막염 발생률(SOM Incidence) 관찰결과 위약군 대비 35.0% 감소한 것을 확인 - EC-18 투약군 : 45.5% - 위약군 : 70% 3) 안전성: 임상시험용 의약품 투약군에서 이상반응은 발견되지 않았음 * 10월 19일에 발표한 임상결과 값과 차이가 발생하지 않았음 * TFL Part2 수령하여 제출함 8. 향후 계획: 당사는 본 임상 결과를 토대로 혁신신약지정(BTD) 신청 예정입니다. |
|
| 3. 사실발생(확인)일 | 2021-10-19 | |
| 4. 결정일 | 2021-10-19 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 1) 상기 사실발생(확인)일 및 결정일은 CRO ICON(PRA)로부터 TFL Part1 data를 받은 날(한국시간 기준) 입니다. 2) 2021년 10월 30일(한국시간 기준)에 TFL Part2 수령하여 제출합니다. 3) 본 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정입니다. |
||
| (출처: 당사 전자공시) |
당사는 시험대상자 수 105명을 대상으로 유효성을 평가하였으며, 1차 평가변수에서는 중증 구강점막염 지속기간(SOM Duration) 관찰결과 위약군 대비 100% 감소한 것을 확인하였으며, 2차 평가변수에서는 중증 구강점막염 발생률(SOM Incidence) 관찰결과 위약군 대비 35.0% 감소한 것을 확인하였습니다. 당사는 본 임상 결과를 토대로 미국 FDA 혁신신약지정(BTD) 신청을 2021년 11월 완료하였습니다.
향후 당사는 코로나19 치료제, 구강점막염 치료제와 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 당사가 진행중인 파이프라인에 대해서, 상기 언급한 것처럼 코로나 19에 따라 임상계획 당시 예상하지 못하였던 변수로 인하여 임상시험 개시 승인이 지연되거나, 코로나 19로 인한 외부 활동 위축으로 임상 시험에 필요한 환자등록이 원활하지 않을 문제가 발생할 수 있습니다. 이 경우 당사의 신약개발이 예정보다 지연될 가능성이 존재하며, 당사가 계획했던 임상시험 비용이 예산을 초과하여 발생하거나, 판매승인 지연으로 인하여 신약매출 발생이 늦어질 수 있습니다.
(주2) 정정 전
상기 내용에 따라, 당사는 2021년 10월 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 백신의 본격적인 생산 및 Zydus Cadila에 판매(Zydus Cadlia에 위탁생산 물량 전량 납품)를 진행할 것으로 계획하고 있습니다. 당사의 본 유상증자 대금은 본 LOI 체결에 따른 운전자금 등으로 사용될 예정으로, 소요자금의 상세 내역은 'V. 자금의 사용목적'을 참고해 주시기 바랍니다.
(주2) 정정 후
상기 내용에 따라, 당사는 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 백신의 본격적인 생산 및 Zydus Cadila에 판매(Zydus Cadlia에 위탁생산 물량 전량 납품)를 진행할 것으로 계획하였습니다. 그러나 현재까지 위탁생산(CMO) 본 계약 내 세부조항 및 사전절차를 구체적으로 협의하고 있으나 계약 여부는 확정되지 않은 상황입니다.
| [2021.11.09 풍문또는보도에대한해명(미확정)] |
| 1. 풍문 또는 보도의 내용 | 엔지켐생명과학 자이더스 캐딜라(Zydus Cadila)와의 COVID-19 백신 생산 공급 |
| 2. 풍문 또는 보도의 매체 | 파이낸셜뉴스 등 |
| 3. 풍문 또는 보도의 발생일자 | 2021-09-09 |
| 4. 풍문 또는 보도에 대한 해명내용 | |
| - 본 공시는 2021년 09월 09일자 파이낸셜 뉴스에서 보도된 "세계 최초 DNA 코로나 백신 인도서 사용승인, 국내 DNA 백신은..." 기사 중 엔지켐생명과학과 자이더스 캐딜라 (Zydus Cadila)와의 COVID-19 백신 생산 공급에 대한 풍문 또는 보도에 대한 해명 공시(미확정)의 재공시 입니다. - 당사는 자이더스 캐딜라(Zydus Cadila)와 COVID-19 ZyCoV-D 백신의 글로벌 백신공급의향서를 체결한바 있습니다. 현재 위탁생산(CMO) 및 라이선스 계약의 세부조항인 계약금액, 가격조건, 생산일정, 생산기술 이전 및 상호방문 일정, 배송비용 등과 계약 실행에 대한 사전절차를 구체적으로 진행하고 있으나, 계약 여부는 확정되지 않았습니다. - 상기 내용과 관련하여 확정되는 시점 또는 1개월 이내에 재공시 하겠습니다. - 공시책임자: 경영본부장 김혜경 |
|
| 5. 재공시예정일 | 2021-12-09 |
| (출처: 당사 전자공시) |
추후 계약체결 확정 시 전자공시 등을 통해 공지할 예정이나, 최초 증권신고서 제출 이후 현재까지 본 계약이 체결되지 않았다는 점을 투자자 여러분께서는 반드시 유의해 주시기 바랍니다. 당사의 본 유상증자 대금은 본 LOI 체결에 따른 운전자금 등으로 사용될 예정으로, 소요자금의 상세 내역은 'V. 자금의 사용목적'을 참고해 주시기 바랍니다.
(주3) 정정 전
| [당사 품목별 매출 추이] |
| (단위: 백만원) |
| 구분 | 품목 | 2021년 반기 | 2020년 | 2019년 | 2018년 | 작용기전 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | |||
| 세파계 API |
항생제1 | 644 | 5.89% | 1,108 | 4.29% | 1,421 | 4.52% | 1,705 | 5.49% | 패혈증, 폐렴 |
| 항생제2 | 14 | 0.13% | 211 | 0.82% | 138 | 0.44% | 781 | 2.52% | 폐렴, 자궁내감염등 | |
| 기타 | 78 | 0.71% | 107 | 0.41% | 893 | 2.84% | 872 | 2.81% | - | |
| 소계 | 736 | 6.73% | 1,426 | 5.52% | 2,452 | 7.80% | 3,358 | 10.82% | - | |
| 일반계 API |
항결핵제 | 220 | 2.02% | 324 | 1.25% | 2,524 | 8.02% | 5,143 | 16.57% | - |
| 진해 거담제 | 356 | 3.25% | 4,277 | 16.57% | 4,841 | 15.39% | 6,040 | 19.46% | - | |
| 소염 진통제 | 602 | 5.51% | 2,472 | 9.57% | 2,417 | 7.68% | 1,922 | 6.19% | - | |
| 항응고제 | 2,645 | 24.20% | 5,149 | 19.94% | 5,150 | 16.36% | 4,226 | 13.62% | - | |
| 위궤양치료제 | 1,008 | 9.22% | 1,755 | 6.80% | 2,162 | 6.87% | 1,553 | 5.00% | - | |
| 기타 | 3,994 | 36.53% | 8,807 | 34.12% | 10,182 | 32.35% | 5,736 | 18.49% | - | |
| 소계 | 8,825 | 80.73% | 22,784 | 88.25% | 27,276 | 86.67% | 24,620 | 79.33% | - | |
| 기타 | 1,371 | 12.54% | 1,608 | 6.23% | 1,741 | 5.53% | 3,056 | 9.85% | 상품, 임가공 등 | |
| 합계 | 10,932 | 100.00% | 25,818 | 100.00% | 31,469 | 100.00% | 31,034 | 100.00% | - | |
| (출처: 당사 정기보고서) |
원료의약품(API)은 혁신신약 분야에 속하는 기술로, 의약품 제조에 사용되는 물질 또는 물질의 혼합물로써 정의하며, 이러한 물질은 질병의 진단, 치료, 완화, 예방에 약리학적 활성 또는 다른 직접적인 효과를 제공하거나 신체의 구조 및 기능에 영향을 주기 위한 것입니다. 당사는 연구개발 중심의 벤처기업임에 따라 신약을 개발함과 동시에 원료의약품 사업을 통해 매출을 창출하고 있으며, 당사의 원료의약품 기술은 세파항생제 합성기술, 비세파 원료합성기술과 MRI & CT조영제 합성기술로 구분할 수 있으며, 이와 관련한 제품은 약 40여종이 있습니다.
원료의약품(API) 시장은 주로 의약품 연구개발(R&D) 증가, 만성질환 발생률 증가, 제네릭 원료의약품의 중요성 증대, 바이오의약품의 활용도 증가 등에 의존하고 있습니다. 한편, 여러 국가의 불합리한 약품 가격 통제 정책과 높은 제조 비용이원료의약품(API) 시장의 성장을 억제할 것으로 예상되고 있습니다.
| [글로벌 원료의약품 시장의 원동력] |
| 구분 | 주요 내용 |
|---|---|
| 성장 촉진요인 | ·만성질환 발생률 증가 ·원료의약품 제조기술 ·제네릭 원료의약품의 중요성 증대 ·바이오의약품의 활용도 증가 ·신약 개발을 위한 인공지능(AI) 기반 툴의 채택 증가 ·신약 개발에서 장기 칩(organ-on-chip) 모델 채택 ·정밀의학 중점 ·제약사 실증 투자 |
| 성장 억제요인 | ·불합리한 약품 가격 통제 정책 ·높은 제조 비용 |
| 시장 기회 | ·신흥 바이오시밀러 시장 ·효력이 높은 활성 의약품 성분 ·신흥시장 ·신흥 기술 |
| 해결해야 할 과제 | ·허위 약품의 보급률 증가 |
| (출처: MarketsandMarkets, Active Pharmaceutical Ingredient (API) Market, 2020) |
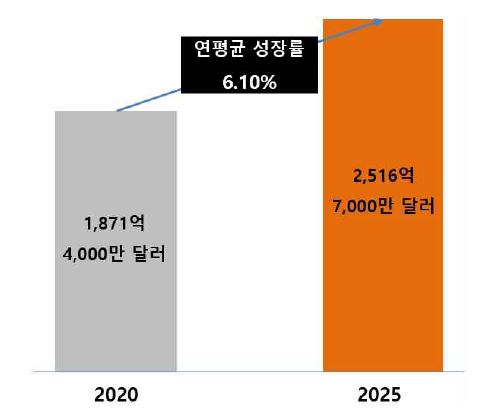
현재 전 세계 원료의약품(API) 시장은 2020년 1,871억 4,000만 달러에서 연평균 성장률 6.10%로 증가하여, 2025년에는 2,516억 7,000만 달러에 이를 것으로 전망하고 있습니다.
| [글로벌 원료의약품(API) 시장 규모 및 전망] |
 |
|
사업위험 사. 전 세계 원료의약품(api) 시장 규모 |
| (출처 : TechNavio, Global Active Pharmaceutical Ingredients Market, 2021) |
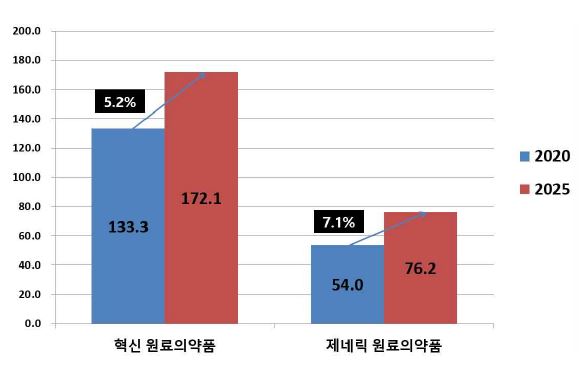
또한, 전 세계 원료의약품(API) 시장은 유형에 따라 혁신 원료의약품, 제네릭 원료의약품으로 분류되고 있습니다. 혁신 원료의약품은 2020년 1,333억 달러에서 연평균 성장률 5.2%로 증가하여 2025년에는 1,721억 달러에 이를 것으로 전망하고 있으며, 제네릭 원료의약품은 2020년 540억 달러에서 연평균 성장률 7.1%로 증가하여 2025년에는 762억 달러에 이를 것으로 전망하고 있습니다.
| [글로벌 원료의약품(API) 시장의 유형별 시장 규모 및 전망] |
 |
|
사업위험. 사. 원료의약품(api) 시장의 유형별 시장 규모 및 전망 |
| (출처 : MarketsandMarkets, Active Pharmaceutical Ingredient (API) Market, 2020) |
국내의 경우, 식품의약품안전처에 따르면 2019년 원료의약품 생산 업체는 총 263개사로 원료의약품 시장은 시장규모 대비 과다한 업체의 시장 참여로 공급 과잉 상태 및 높은 경쟁 강도가 지속되고 있습니다. 이는 국내 제약 산업이 일정 수준의 수익성 확보가 가능한 가운데 설비투자 부담이 타 산업에 비해 크지 않으며, 제네릭 의약품의 경우 연구개발비 부담도 크지 않아 진입장벽이 높지 않은 데 기인하는 것으로 판단됩니다.
| [원료 의약품 생산 규모별 업체수 및 생산액] |
| (단위: 개소, 백만원) |
|
생산규모별 |
2019년 | 2018년 | 2017년 | 2016년 | 2015년 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 업체수 | 생산액 | 업체수 | 생산액 | 업체수 | 생산액 | 업체수 | 생산액 | 업체수 | 생산액 | |
|
1억 미만 |
37 | 1,130 | 25 | 360 | 78 | 1,286 | 23 | 798 | 26 | 955 |
|
1~5억 |
50 | 13,119 | 46 | 2,151 | 33 | 11,909 | 42 | 11,055 | 45 | 11,659 |
|
5~10억 |
33 | 25,434 | 45 | 6,674 | 13 | 24,016 | 44 | 34,708 | 39 | 30,900 |
|
10~50억 |
76 | 182,927 | 63 | 73,457 | 46 | 174,880 | 67 | 159,481 | 69 | 185,668 |
|
50~100억 |
21 | 148,750 | 21 | 105,699 | 13 | 98,807 | 30 | 211,579 | 18 | 119,718 |
|
100~500억 |
35 | 889,443 | 33 | 808,824 | 40 | 921,642 | 29 | 702,550 | 37 | 884,587 |
|
500~1000억 |
8 | 590,893 | 5 | 344,973 | 2 | 132,943 | 6 | 398,467 | 3 | 229,810 |
|
1000억 이상 |
3 | 618,951 | 4 | 1,219,501 | 6 | 1,441,526 | 5 | 955,088 | 4 | 650,294 |
|
합 계 |
263 | 2,470,647 | 242 | 2,561,639 | 231 | 2,807,009 | 246 | 2,473,726 | 241 | 2,113,591 |
| (출처 : 국가통계포털, 식품의약품안전처(원료 의약품 생산 규모별 업체수 및 생산액)) |
원료의약품은 정밀화학 산업분야 중 비중이 큰 분야로서 기술집약형 고부가가치 산업입니다. 국내 제약사들의 원료합성에 대한 새로운 공정 및 기술 개발이 활성화되면서 원료의약품의 국산화에 상당한 노력을 기울이고 있으며, 원료의약품 GMP도입은 품질의 향상을 통한 해외시장 진출에 긍정적 요소로 평가되고 있습니다. 그러나 여전히 국내 제약업계는 주요 생산원료의 조달을 주로 외국의 제약회사와 기술 도입선에 의존하고 있어 원료 자급도가 매우 낮은 편입니다.
| [원료의약품 국내 자급도 현황] |
| (단위: 백만원) |
| 항목 | 2019년 | 2018년 | 2017년 | 2016년 | 2015년 |
|---|---|---|---|---|---|
| 생산액 | 2,470,647 | 2,561,639 | 2,807,010 | 2,473,726 | 2,113,591 |
| 수출액 | 1,981,471 | 1,746,824 | 1,666,629 | 1,635,101 | 1,449,925 |
| 수입액 | 2,530,142 | 2,267,225 | 2,081,393 | 2,195,686 | 2,040,126 |
| 국내자급도 (%) | 16.2 | 26.4 | 35.4 | 27.6 | 24.5 |
| 자료 : 국가통계포털, 식품의약품안전처 원료의약품 국내 자급도 현황 |
| 주) 자급도 = (생산-수출)/(생산-수출+수입) |
원료의약품의 국내 자급도는 2015년 24.5%에서 2017년까지 35.4%까지 상승하였으나, 2018년 26.4%, 2019년 16.2%를 기록하며 하락하는 추세를 보이고 있습니다. 원료의약품 자급도는 2019년에는 20%에도 못 미치는 등 여전히 수입의존도가 높은 편으로 나타났습니다. 원료자급도가 낮은 이유는 국내 원료 생산이 품질측면에서는 유럽산에 비해 경쟁력이 부족하고, 가격 측면에서는 인도나 중국산에 비해 경쟁력이 취약한 것에 기인합니다.
그럼에도 불구하고 당사의 경우, 당사의 원료의약품 주요 매출처는 대부분 국내업체로, 2021년 상반기 매출액 기준 국내 매출이 총 매출액의 99.3%를 차지하고 있습니다. 이는 현재 국내 원료의약품의 경쟁력이 하락 추세인 상황을 감안한다면 당사의 원료의약품 사업에 악영향을 끼칠 수 있습니다.
| [당사의 국가별 매출 실적 추이] |
| (단위: 백만원) |
| 매출유형 | 부 문 | 2021년 상반기 | 2020년 | 2019년 | 2018년 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | |||
| 제품 | 원료 의약품 |
수출 | -55 | -0.5% | 1,921 | 7.4% | 3,050 | 9.7% | 5,497 | 17.7% |
| 내수 | 10,681 | 97.7% | 23,179 | 89.8% | 27,124 | 86.2% | 23,085 | 74.4% | ||
| 소계 | 10,626 | 97.2% | 25,099 | 97.2% | 30,174 | 95.9% | 28,582 | 92.1% | ||
| 상품 | 원료 의약품 외 |
수출 | 131 | 1.2% | 168 | 0.6% | 27 | 0.1% | - | |
| 내수 | 163 | 1.5% | 243 | 0.9% | 1,239 | 3.9% | 1,849 | 6.0% | ||
| 소계 | 294 | 2.7% | 411 | 1.6% | 1,267 | 4.0% | 1,849 | 6.0% | ||
| 기타 | 임가공 외 | 수출 | 6 | 0.1% | 8 | 0.0% | 21 | 0.1% | 3 | 0.0% |
| 내수 | 6 | 0.1% | 300 | 1.2% | 7 | 0.0% | 600 | 1.9% | ||
| 소계 | 13 | 0.1% | 308 | 1.2% | 28 | 0.1% | 603 | 1.9% | ||
| 합계 | 수출 | 82 | 0.7% | 2,096 | 8.1% | 3,098 | 9.8% | 5,500 | 17.7% | |
| 내수 | 10,850 | 99.3% | 23,722 | 91.9% | 28,370 | 90.2% | 25,534 | 82.3% | ||
| 합계 | 10,932 | 100.0% | 25,818 | 100.0% | 31,469 | 100.0% | 31,034 | 100.0% | ||
| (출처: 당사 제시) 주1) 상기 비중은 총 매출액 기준임. |
또한, 국내에서는 2012년 부터 시행하고 있는 보험약가 인하정책에 따라 현재까지 완제 제약회사들은 제조원가 비용을 낮추기 위해 해외 저가 원료를 선택하는 추세입니다. 이에 따라 국내 원료의약품 업체들은 실적 부진에 따른 R&D 투자 여력 부진으로 점차 원가경쟁력을 상실하게 되는 악순환이 발생되고 있습니다.
| [원료의약품(API) 제조 전문업체 매출원가율 추이(2018~2021년 반기)] |
| (단위: 백만원, %) |
| 구분 | 당사 | 하이텍팜 | KPX생명과학 | 화일약품 | |
|---|---|---|---|---|---|
| 2021년 반기 | 매출액 | 10,932 | 46,330 | 10,992 | 49,832 |
| 매출원가 | 10,643 | 43,345 | 11,825 | 44,566 | |
| 매출원가율 | 97.4% | 93.6% | 107.6% | 89.4% | |
| 매출원가율 평균 | 97.0% | ||||
| 2020년 | 매출액 | 25,818 | 74,462 | 24,561 | 123,613 |
| 매출원가 | 23,999 | 73,148 | 24,635 | 108,579 | |
| 매출원가율 | 93.0% | 98.2% | 100.3% | 87.8% | |
| 매출원가율 평균 |
94.8% | ||||
| 2019년 | 매출액 | 31,469 | 63,068 | 37,618 | 108,745 |
| 매출원가 | 28,804 | 65,184 | 34,586 | 94,265 | |
| 매출원가율 | 91.5% | 103.4% | 91.9% | 86.7% | |
| 매출원가율 평균 |
93.4% | ||||
| 2018년 | 매출액 | 31,034 | 66,388 | 32,754 | 102,073 |
| 매출원가 | 26,769 | 61,677 | 32,683 | 86,874 | |
| 매출원가율 | 86.3% | 92.9% | 99.8% | 85.1% | |
| 매출원가율 평균 |
91.0% | ||||
| (출처: 당사 제시) 주1) 당사의 경우, 상기 매출액 및 매출원가에 기타 매출이 포함되어 있음. 주2) 상기 비교 업체는 원료의약품(API) 제조 전문 업체 위주로 선정하였음. |
당사를 비롯하여 주요 원료의약품 전문 업체들의 원가율이 높아지고 있는 상황으로, 2018년 원료의약품(API) 전문업체 매출원가율 평균 91.0%에서 2021년 반기 기준 평균 97.0%까지 증가하는 등 지속적으로 업황이 악화되는 모습을 보이고 있습니다. 이는 향후에 당사가 원가경쟁력 확보전략이 부재하거나, 공급량이 확대되지 않아 매출액이 증가하지 않는다면 지속적으로 사업이 개선되지 못할 가능성이 높은 상황입니다.
(주3) 정정 후
| [당사 품목별 매출 추이] |
| (단위: 백만원) |
| 구분 | 품목 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 작용기전 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | |||
| 세파계 API |
항생제1 | 644 | 3.91% | 1,108 | 4.29% | 1,421 | 4.52% | 1,705 | 5.49% | 패혈증, 폐렴 |
| 항생제2 | 29 | 0.18% | 211 | 0.82% | 138 | 0.44% | 781 | 2.52% | 폐렴, 자궁내감염등 | |
| 기타 | 125 | 0.76% | 107 | 0.41% | 893 | 2.84% | 872 | 2.81% | - | |
| 소계 | 798 | 4.85% | 1,426 | 5.52% | 2,452 | 7.80% | 3,358 | 10.82% | - | |
| 일반계 API |
항결핵제 | 245 | 1.49% | 324 | 1.25% | 2,524 | 8.02% | 5,143 | 16.57% | - |
| 진해 거담제 | 774 | 4.70% | 4,277 | 16.57% | 4,841 | 15.39% | 6,040 | 19.46% | - | |
| 소염 진통제 | 1,441 | 8.74% | 2,472 | 9.57% | 2,417 | 7.68% | 1,922 | 6.19% | - | |
| 항응고제 | 4,009 | 24.32% | 5,149 | 19.94% | 5,150 | 16.36% | 4,226 | 13.62% | - | |
| 위궤양치료제 | 1,495 | 9.07% | 1,755 | 6.80% | 2,162 | 6.87% | 1,553 | 5.00% | - | |
| 기타 | 5,960 | 36.15% | 8,807 | 34.12% | 10,182 | 32.35% | 5,736 | 18.49% | - | |
| 소계 | 13,924 | 84.47% | 22,784 | 88.25% | 27,276 | 86.67% | 24,620 | 79.33% | - | |
| 기타 | 1,763 | 10.68% | 1,608 | 6.23% | 1,741 | 5.53% | 3,056 | 9.85% | 상품, 임가공 등 | |
| 합계 | 16,485 | 100.00% | 25,818 | 100.00% | 31,469 | 100.00% | 31,034 | 100.00% | - | |
| (출처: 당사 정기보고서) |
(중략)
그럼에도 불구하고 당사의 경우, 당사의 원료의약품 주요 매출처는 대부분 국내업체로, 2021년 3분기 매출액 기준 국내 매출이 총 매출액의 98.98%를 차지하고 있습니다. 이는 현재 국내 원료의약품의 경쟁력이 하락 추세인 상황을 감안한다면 당사의 원료의약품 사업에 악영향을 끼칠 수 있습니다.
| [당사의 국가별 매출 실적 추이] |
| (단위: 백만원) |
| 매출유형 | 부 문 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | |||
| 제품 | 원료 의약품 |
수출 | 35 | 0.21% | 1,921 | 7.4% | 3,050 | 9.7% | 5,497 | 17.7% |
| 내수 | 16,150 | 97.97% | 23,179 | 89.8% | 27,124 | 86.2% | 23,085 | 74.4% | ||
| 소계 | 16,185 | 98.18% | 25,099 | 97.2% | 30,174 | 95.9% | 28,582 | 92.1% | ||
| 상품 | 원료 의약품 외 |
수출 | 131 | 0.80% | 168 | 0.6% | 27 | 0.1% | - | |
| 내수 | 168 | 1.02% | 243 | 0.9% | 1,239 | 3.9% | 1,849 | 6.0% | ||
| 소계 | 299 | 1.81% | 411 | 1.6% | 1,267 | 4.0% | 1,849 | 6.0% | ||
| 기타 | 임가공 외 | 수출 | 3 | 0.02% | 8 | 0.0% | 21 | 0.1% | 3 | 0.0% |
| 내수 | (2) | -0.01% | 300 | 1.2% | 7 | 0.0% | 600 | 1.9% | ||
| 소계 | 1 | 0.01% | 308 | 1.2% | 28 | 0.1% | 603 | 1.9% | ||
| 합계 | 수출 | 169 | 1.02% | 2,096 | 8.1% | 3,098 | 9.8% | 5,500 | 17.7% | |
| 내수 | 16,316 | 98.98% | 23,722 | 91.9% | 28,370 | 90.2% | 25,534 | 82.3% | ||
| 합계 | 16,485 | 100.00% | 25,818 | 100.0% | 31,469 | 100.0% | 31,034 | 100.0% | ||
| (출처: 당사 제시) 주1) 상기 비중은 총 매출액 기준임. |
또한, 국내에서는 2012년 부터 시행하고 있는 보험약가 인하정책에 따라 현재까지 완제 제약회사들은 제조원가 비용을 낮추기 위해 해외 저가 원료를 선택하는 추세입니다. 이에 따라 국내 원료의약품 업체들은 실적 부진에 따른 R&D 투자 여력 부진으로 점차 원가경쟁력을 상실하게 되는 악순환이 발생되고 있습니다.
| [원료의약품(API) 제조 전문업체 매출원가율 추이(2018~2021년 3분기)] |
| (단위: 백만원, %) |
| 구분 | 당사 | 하이텍팜 | KPX생명과학 | 화일약품 | |
|---|---|---|---|---|---|
| 2021년 3분기 | 매출액 |
16,485 |
61,644 | 17,424 | 76,010 |
| 매출원가 |
16,216 |
57,824 | 18,734 | 68,438 | |
| 매출원가율 | 98.4% | 93.8% | 107.5% | 90.0% | |
| 매출원가율 평균 | 97.4% | ||||
| 2020년 | 매출액 | 25,818 | 74,462 | 24,561 | 123,613 |
| 매출원가 | 23,999 | 73,148 | 24,635 | 108,579 | |
| 매출원가율 | 93.0% | 98.2% | 100.3% | 87.8% | |
| 매출원가율 평균 |
94.8% | ||||
| 2019년 | 매출액 | 31,469 | 63,068 | 37,618 | 108,745 |
| 매출원가 | 28,804 | 65,184 | 34,586 | 94,265 | |
| 매출원가율 | 91.5% | 103.4% | 91.9% | 86.7% | |
| 매출원가율 평균 |
93.4% | ||||
| 2018년 | 매출액 | 31,034 | 66,388 | 32,754 | 102,073 |
| 매출원가 | 26,769 | 61,677 | 32,683 | 86,874 | |
| 매출원가율 | 86.3% | 92.9% | 99.8% | 85.1% | |
| 매출원가율 평균 |
91.0% | ||||
| (출처: 당사 제시) 주1) 당사의 경우, 상기 매출액 및 매출원가에 기타 매출이 포함되어 있음. 주2) 상기 비교 업체는 원료의약품(API) 제조 전문 업체 위주로 선정하였음. |
당사를 비롯하여 주요 원료의약품 전문 업체들의 원가율이 높아지고 있는 상황으로, 2018년 원료의약품(API) 전문업체 매출원가율 평균 91.0%에서 2021년 3분기 기준 평균 97.4%까지 증가하는 등 지속적으로 업황이 악화되는 모습을 보이고 있습니다. 이는 향후에 당사가 원가경쟁력 확보전략이 부재하거나, 공급량이 확대되지 않아 매출액이 증가하지 않는다면 지속적으로 사업이 개선되지 못할 가능성이 높은 상황입니다.
(주4) 정정 전
| [R&D 조직도 현황] |
 |
|
사업위험 차. r&d 조직도 |
| (출처: 당사 정기보고서) |
(중략)
| [당사 연구개발인력 현황] |
| 구분 | 학위별 | |||||
|---|---|---|---|---|---|---|
| 박사 | 석사 | 기타 | 합계 | |||
| 글로벌신약 R&D연구소 |
바이오연구소 | 4 | 4 | - | 8 | |
| 광교연구소 | 2 | - | 2 | 4 | ||
| 임상R&D부 | 임상개발부 | 1 | - | - | 1 | |
| 임상팀 | - | 1 | 3 | 4 | ||
| 사업개발부 | 2 | 1 | - | 3 | ||
| 첨단소재 연구소 |
첨단소재연구소 | 1 | - | - | 1 | |
| 신약팀 | - | 1 | 1 | 2 | ||
|
신소재팀 |
- | 1 | 2 | 3 | ||
| API팀 | - | 1 | 1 | 2 | ||
| RA팀 | - | - | 4 | 4 | ||
| CMC팀 | - | - | 1 | 1 | ||
| 합 계 | 10 | 9 | 14 | 33 | ||
| (출처: 당사 정기보고서) |
당사의 핵심 연구인력의 현황은 다음과 같습니다.
|
직 위 |
성 명 |
담당업무 |
주요 경력 |
주요 연구실적* |
|---|---|---|---|---|
|
CEO |
손기영 |
EC-18 |
* 1986년 ~ 1989년 고려대 경영대학원 경영학석사 * 1984년 ~ 1998년 삼일회계법인 이사 (CPA), * 1986년 ~ 1993년 국제통상자문 (현대전자 메모리 반도체 외) * 1996년 ~ 2000년 전경련 국제경영원 교수 * 2003년 ~ 현재 브리짓라이프사이언스 회장 * 2012년 ~ 현재 ㈜엔지켐생명과학 대표이사 |
[논문] 1. PLAG alleviates chemotherapy-induced thrombocytopenia via promotion of megakaryocyte/erythrocyte progenitor differentiation in mice. (2018년, Thrombosis Research 161:84-90) 공동저자 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry 119(2):1392-1405) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget 8(57):96636-96648) 공동저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology 6:206) 공동 저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters 377:25-31) 공동저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One 11(3):e0151758) 공동저자 7. Protective effect of EC-18, a synthetic monoacetylglyceride on lung inflammation in a murine model induced by cigarette smoke and lipopolysaccharide. (2016년 International Immunopharmacology 30:62-68) 공동저자 8. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. (2015년 Immune Network 15(3):150-160) 공동저자 9. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network 15(2):100-109) 공동저자 10. EC-18, a synthetic monoacetyldiglyceride (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol), attenuates the asthmatic response in an aluminum hydroxide/ovalbumin-induced medel of asthma. (2014년 International Immunopharmacology 18(1):116-123) 공동저자 [학회] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling. Journal of Immunology May 1, 2018, 200 (1 Supplement) 42.3 (2018년, AAI 미국면역학회) 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. Cancer Research 2018;78(13 Supplement): Abstract nr 4154. (2018년, AACR 미국암학회) 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. Cancer Research 2018;78(13 Supplement): Abstract nr 2446 (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. Journal of Immunology May 1, 2017; 198(1 Supplement) 204.11 (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. Journal of Immunology May 1, 2017; 198(1 supplement) 222.12 (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. Cancer Research 2017;77(13 Supplement): Abstract nr 5664. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. Journal of Immunology 2016, 196(1 Supplement) 50.2. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. . Journal of Immunology 2016, 196 (1 Supplement) 50.3. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. Journal of Immunology 2016, 196 (1 Supplement) 191.2. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. Blood 2015 126:2207 (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. Blood 2015 126:2210 (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. Blood 2015 126:2212 (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. Blood 2015 126:4757 (2015년, ASH 미국혈액학회) |
| 부사장 | 김희수 | 글로벌 신약 R&D, 임상 총괄 |
* 1983년 ~ 1989년 연세대학교의과대학 졸업 * 1992년 ~ 1995년 연세대학교대학원 의학석사 * 1997년 ~ 2000년 연세대학교 대학원 의학박사 * 1990년 ~ 1994년 세브란스병원 소아과 수련, 전문의 * 1994년 ~ 2008년 소아과 진료 * 2009년 ~ 2020년 4월 Sanofi Pasteur : Medical Director, Marketing Director, Regulatory Director, Head of Medical Korea & North Asia 역임 |
[논문] 1. Hee Soo Kim, Yongho Oh, Joanna Korejwo, Valerie Bosch Castells, Kuhyun Yang. Post-Marketing Surveillance of Adverse Events Following Vaccination with the Live-Attenuated Japanese Encephalitis Chimeric Virus Vaccine (Imojev®) in South Korea, 2015-2019. Infectious Diseases and Therapy 2020 (in press) 2. Hee Soo Kim, Yongho Oh, Yael Thollot, Catherine Bravo. Post-Marketing Surveillance of Hepatitis A Virus Vaccine (Avaxim 160U) in South Korea from 2011 to 2015. Infectious Diseases and Therapy 2019 https://doi.org/10.6084/m9.figshare.7564994 3. Won Suk Choi, Ji Yoon Noh, Jacob Lee, Jun Yong Choi, Jin-Soo Lee, Moo Soo Kim, Hee Soo Kim, Joon Bang, Nathalie Lavis, Woo Joo Kim. Immunogenicity and safety of a split-virion quadrivalent influenza vaccine in adults 18?60 years of age in the Republic of Korea. Human Vaccines and Immunotherapeutics 2018;14: 587-592 https://doi.org/10.1080/21645515.2017.1381808 4. Young June Choe, Anne-Frieda Taurel, Joshua Nealon, Han Seok Seo, Hee Soo Kim*. Systematic review of seroepidemiological studies on Japanese encephalitis in the Republic of Korea. International Journal of Infectious Diseases 2018; 67: 14?19 https://doi.org/10.1016/j.ijid.2017.11.023 5. Yun-Kyung Kim, Emmanuel Vidor, Hwang Min Kim, Son Moon Shin, Kyung-Yil Lee, Sung-Ho Cha, Sang Hyuk Ma, Dong Ho Kim, Jin Lee, Su Eun Park, Hyunju Lee, Jong-Duk Kim, Ki Hwan Kim, Kyung-Hyo Kim, Jong-Hyun Kim, A3L31 Study Group: Yae-Jean Kim, Dae Sun Jo, Hyun Hee Kim, Jin Han Kang, Hee Soo Kim, Joon Bang, Yongho Oh. Immunogenicity and safety of a fully liquid DTaP-IPV-HB-PRP~T hexavalent vaccine compared with the standard of care in infants in the Republic of Korea. Vaccine 2017; 35, 4022-4028, http://dx.doi.org/10.1016/j.vaccine.2017.05.062 6. Jin Han Kang, Hoan Jong Lee, Kyung-Hyo Kim, Sung Hee Oh, Sung-Ho Cha, Jin Lee, Nam Hee Kim, Byung Wook Eun, Chang-Hwi Kim, Young Jin Hong, Hyun Hee Kim, Kyung-Yil Lee, Yae-Jean Kim, Eun Young Cho, Hee Soo Kim, Fabrice Guitton, Esteban Ortiz. The Immunogenecity and safety of a combined DTaP-IPV//Hib vaccine compared with individual DTaP-IPV and Hib (PRP~T) vaccines: a randomized clinical trial in Korean infants. Journal of Korean Medical Science 2016 Sep;31(9):1383-1391 http://dx.doi.org/10.3346/jkms.2016.31.9.1383 7. Dong Soo Kim, Min Ja Kim, Sung-Ho Cha, Hwang Min Kim, Jong-Hyun Kim, Kwang Nam Kim, Jin-Soo Lee, Jun Yong Choi, Valelerie Bosch Castells, Hee Soo Kim, Joon Bang, Philipp Oster. Safety and immunogenicity of a single dose of a quadrivalent meningococcal conjugate vaccine (MenACYW?D) : a multicenter, blind-observer, randomized, phase III clinical trial in the Republic of Korea, International Journal of Infectious Diseases 2016; 45:59?64 http://dx.doi.org/10.1016/j.ijid.2016.02.010 8. Dong Soo Kim, Guy Houillon, Gwang Cheon Jang, Sung-Ho Cha, Soo-Han Choi, Jin Lee, Hwang Min Kim, Ji Hong Kim, Jin Han Kang, Jong-Hyun Kim, Ki Hwan Kim, Hee Soo Kim, Joon Bang, Zulaikha Naimi, Valerie Bosch-Castells, Mark Boaz & Alain Bouckenooghe. A randomized study of the immunogenicity and safety of Japanese Encephalitis Chimeric Virus Vaccine (JE-CV) in comparison with SA14-14-2 Vaccine in children in the Republic of Korea, Human Vaccines & Immunotherapeutics, 2014; 10:9, 2656-2663, https://doi.org/10.4161/hv.29743 9. Hee Soo Kim, Geun Woong Noh, Dong Soo Kim, Ki Young Lee, Hee Sun Lee, Hong Kyu Lee, Soon Il Lee. Decreased CD5+B cells during the Acute Phase of Kawasaki Disease. Yonsei Medical Journal 1996; 37(1): 52-58 10. Hee Soo Kim, Ki Sup Chung. Clinical Studies of Chronic Diarrhea of Infancy. Korea Journal of Pediatric Society 1994;37(2):212-220 11. Soo Young Lee, Byung Joo Jeoung, Hee Soo Kim, Dong Soo Kim, Kyu Earn Kim, Ki Young Lee. Chronic Cough in Children: Positive Rates and Provocated Symptoms of Methacholine Bronchial Provocation Test. Allergy 1993;13(2):175-183 12. Hee Soo Kim, Kook In Park, Chul Lee. A Case of Congenital Afibrinogenemia. Korea Journal of Perinatology 1992:99-103 |
| 전무 | 박갑주 | 사업개발 |
* 1992년~1997년 Ph.D. Department of Chemistry, Brown University, RI, USA (Organic/Bio Chemistry) * 1988년-1990년 M.S. Department of Chemistry, POSTECH, Pohang, S. Korea (Polymer Chemistry) * 1983년-1987년 B.S. Department of Chemistry, Seoul National University, Seoul, S. Korea * 2020년~현재 EnzyChem Life Sciences, Director, Business * 2017년~2019년 Institut Pasteur Korea, Director, Medicinal Chemistry * 2016년~2017년 Hankuk University of Foreign Studies, * 2010년~2015년 Yuhan Corp., S. Korea, Director, * 2001년~2010년 Wyeth/Pfizer, Inc. USA Sr. Research Investigator * 1998년~2001년 Duke University, Research Scientist, USA * 1997년~1998년 Texas A&M University, Post-doc, USA |
[논문] 1. Compound 19e, a novel glucokinase activator, protects against cytokine-?induced beta-?cell apoptosis in INS-?1 Cells Oh, Y. S.; Seo, E.; Park, K. Jun, H.-S., Frontiers in Pharmacology,, 2017, 8, 169/1-169/10 2. Design and Synthesis of Acetylenyl Benzamide Derivatives as Novel Glucokinase Activators for the Treatment of T2DM, Park, K*.; Lee, B. M.; Hyun, K. H.; Han, T.; Lee, D. H.; Choi, H. H.ACS Med. Chem. Lett. 2015, 6, 296-301. 3. Discovery of 3-(4-methanesulfonylphenoxy)-N-[1-(2-methoxy-ethoxymethyl)-1H-pyrazol-3-yl]-5-(3-methylpyridin-2-yl)-benzamide as a novel glucokinase activator (GKA) for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B. M.; Hyun, K. H.; Lee, D. H.; Choi, H. H; Kim, H,; Chong, W.; Kim, K. B.; Nam, S. Y. Bioorg. Med. Chem. 2014, 22, 2280-2293. 4. Treatment with glucokinase activator, YH-GKA, increases cell proliferation and decreases glucotoxic apoptosis in INS-1 cells, Oh, Y. S.; Lee, Y.-J; Park, K.; Choi, H. H.; Yoo, S.; Jun, H.-S. Eur. J. Pharma. Sci. 2014, 51, 137-145. 5. Discovery of a novel phenylethyl benzamide glucokinase activator for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B.M.; Kim, Y.H.; Han, T.; Yi, W.; Lee, D.H.; Choi, H.H.; Chong, W.; Lee, C.H. Bioorg. Med. Chem. Lett. 2013, 23, 537-542. [학회] 1. Structure-activity relationship and structure-property relationships of TTCA derivatives as novel anti-tubercular agents. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do, Korea Oct 14-15, 2019. 2. Introduction of novel anti-tubercular agent developed for the treatment of MDR/XDR TB. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do,, Korea Oct 14-15, 2019. 3. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. American Chemical Society (ACS) Spring 2019 National Meeting & Exposition in Orlando, Florida, USA March 31- April 4, 2019 4. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. 2018 Fall Korean Pharmaceutical Conference. Jeju, South Korea. October 17-19, 2018 5. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. General Meeting of the Korean Chemical Society. Daegu, South Korea. October 17-19, 2018 6. In Quest of A Novel Scaffold To Combat MDR/XDR Tuberculosis. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 7. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 8. Genome wide profiling of Mycobacterium Tuberculosis exposed to novel anti-tuberculosis agent, thienothiazolecarboxamide (TTCA) derivatives. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 |
| 상무 | 신동균 | 합성연구소 연구소장 |
* 1990년~1997년 한일약품 과장 (병역특례연구원) |
1. 베타락탐 항생제 개발 : 세포탁심, 세포트리악손, 세픽심, 세포독심 2. 카바페넴 항생제 개발 : 이미페넴, 메로페넴 3. 일반 원료 의약품 개발 : 클라리스로마이신 , 실로도신, 랄록시펜, * 논문 및 특허 1. Synthetic Communications (2005), 35(6), 845-855 2. Tetrahedron Letters (2005), 46(12), 1985-1987. 3. Bulletin of the Korean Chemical Society (1992), 13(2), 176-9. 4. Bulletin of the Korean Chemical Society (1992), 13(1), 98-9. 5. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 6. Bulletin of the Korean Chemical Society (1990), 11(4), 307-9. 7. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 8. KR 2008-87141 9. KR 2008-30366 10. KR 2008-30369 11. KR 2006-38105 12. US 20020016457 13. WO 2001070749 14. WO 2001066532 15. KR 1020140115255 16. KR 1020140115259 17. KR 1020160018457 18. KR 1020160095328 19. KR 1020170054491 20. KR 1020170000770 21. KR 1020170152263 |
| 이사 | 윤선영 |
바이오연구소 (비임상 효능 및 적응증 개발) |
*1991년 ~ 1993년 성균관대학교 생물학과 석사 *1999년 ~ 2005년 한국과학기술원(KAIST) 생명과학과 박사 *1994년 ~ 2003년 한국생명공학연구원 세포생물학실 연구원 *2003년 ~ 2005년 한국생명공학연구원 인간유전체사업단 *2005년 ~ 2006년 Roswell Park Cancer Institute (RPCI), *2006년 ~ 2013년 숙명여자대학교 생명과학과 면역학실 * 2013년 ~ 2014년 코아스템㈜ R&D 그룹 R&D 그룹장 |
[논문] 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget) 교신저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology) 교신저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters) 교신저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One) 공동저자 7. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. Immune Netw. 2015 Jun;15(3):150-60. (2015년 Immune Network) 공동저자 8. Palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network) 주저자 외 48편 주저자 및 공동저자로 논문 게재함 [학회발표] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling (2018년, AAI 미국면역학회) 2. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. (2018년, AACR 미국암학회) 3. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. . (2015년, ASH 미국혈액학회) |
| 이사 | 김지완 | 광교연구소 연구소장 |
* 1994-1998. 충남대학교 미생물학과 석사 * 1997-2000. ㈜중앙백신연구소 선임연구원 * 2000-2003. ㈜대웅제약 생명과학연구소 선임연구원 * 2003-2007. ㈜녹십자웰빙 수석연구원 * 2005-2009. 건국대학교 의과대학 박사 * 2008-2010. 건국대학교 의과대학 연구교수 * 2010-2015. 미국 국립보건원 노화연구소 (NIA/NIH) postdoc (visiting fellow) * 2015-2016. 차의과학대학교 의생명과학과 연구교수 * 2016-2018. ㈜단디 바이오사이언스 연구개발본부장(상무) * 2018-2019. ㈜ ACS Diagnostics 대표이사 * 2019-2020. ㈜ 엘베이스 연구개발본부장(상무) * 2020-2020. ㈜ 프롬바이오 연구소장(이사) * 2020-현재. ㈜ 엔지켐생명과학 광교연구소장 |
[제품] 1. ㈜ 중앙백신. SuiShot® Allres. 연구개발, 허가, 발매 (1997-2000) 2. ㈜대웅, Daewoong Easyef (EGF), ETC available. Daewoong Caretropin (Human Growth Hormone), ETC available. 연구개발 및 기술이전 3. ㈜녹십자웰빙, BST204(유럽2상 완료) 비임상연구 및 IND 승인. 신바로캡슐 비임상연구 및 IND 승인. [논문] 1. Changes in blood lymphocyte numbers with age in vivo and their association with the levels of cytokines/cytokine receptors. Immunity & Aging. 2016;13:24. 제1저자 2. The Src Family Kinase Fgr Is Critical for Activation of Mast Cells and IgE-Mediated Anaphylaxis in Mice. J. Immunol. 2011; 187: 1807-1815. 제1공동저자 3. Morin inhibits Fyn kinase in mast cells and IgE-mediated type I hypersensitivity response in vivo. Biochemical Pharmacology. 2009;77:1506?1512. 제1저자 4. ELK3-GATA3 axis modulates MDA-MB-231 metastasis by regulating cell-cell adhesion-related genes. Biochem Biophys Res Commun. 2018.498(3):509-515. 공동저자 5. The ELK3-GATA3 axis orchestrates invasion and metastasis of breast cancer cells in vitro and in vivo. Oncotarget. 2016 Oct 4;7(40):65137-65146. 공동저자 6. The Anti-apoptotic Effect of Ghrelin on Restraint Stress-Induced Thymus Atrophy in Mice. Immune Netw. 2016. Aug;16(4):242-8. 공동저자 7. MicroRNA-125b modulates inflammatory chemokine CCL4 expression in immune cells and its reduction causes CCL4 increase with age. Aging Cell. 2015. 1?9. 공동저자 8. Ell3 stabilizes p53 following CDDP treatment via its effects on ubiquitin-dependent and -independent proteasomal degradation pathways in breast cancer cells. Oncotarget. 2015; 6(42):44523-37. 공동저자 9. Tellurium Compound AS101 Ameliorates Experimental Autoimmune Encephalomyelitis by VLA-4 Inhibition and Suppression of Monocyte and T Cell Infiltration into the CNS. Neuromol Med. 2014; 16: 292-307. 공동저자 10. Ghrelin augments murine T-cell proliferation by activation of the phosphatidylinositol-3-kinase, extracellular signal-regulated kinase and protein kinase C signaling pathways. FEBS Lett. 2014. Epub 2014 Nov.18. 공동저자 11. The GHS-R Blocker D-[Lys3] GHRP-6 Serves as CCR5 Chemokine Receptor Antagonist. Int. J. Med. Sci. 2012; 9(1): 51-58. 공동저자 12. Identification of Ghrelin Receptor Blocker, D-[Lys3] GHRP-6 as a CXCR4 Receptor Antagonist. Int. J. Biol. Sciences. 2012; 8(1): 108-117. 공동저자. 13. Arctigenin suppresses receptor activator of nuclear factor κB ligand (RANKL)-mediated osteoclast differentiation in bone marrow-derived macrophages. Eur. J. Pharm. 2012; 682: 29-36. 공동저자 14. A Novel Imidazo[1,5-b]isoquinolinone Derivative, U63A05, Inhibits Syk Activation in Mast Cells to Suppress IgE-Mediated Anaphylaxis in Mice. J Pharmacol Sci. 2011;115: 500 ? 508. 공동저자. 15. Interleukin-32α production is regulated by MyD88-dependent and independent pathways in IL-1β-stimulated human alveolar epithelial cells. Immunobiology. 2011;216:32?40. 공동저자. 16. Interleukin-33 stimulates formation of functional osteoclasts from human CD14+monocytes.Cell Mol Life Sci. 2010;67:3883?3892. 공동저자. 17. Tumor necrosis factor alpha-induced interleukin-32 is positively regulated via the Syk/protein kinase C delta/JNK pathway in rheumatoid synovial fibroblasts. Arthritis Rheum. 2009 Mar;60(3):678-85. 공동저자 18. Oral Administration of Curcumin Suppresses Production of Matrix Metalloproteinase (MMP)-1 and MMP-3 to Ameliorate Collagen-Induced Arthritis: Inhibition of the PKCδ/JNK/c-Jun Pathway. Journal of pharmacological sciences. 2009;111:13-21. 공동저자 19. Mast Cell-Mediated Allergic Response Is Suppressed by Sophorae Flos: Inhibition of Src-Family Kinase. Experimentalbiologyandmedicine.2008;233(10):1271-1279. 공동저자 20. Camellia japonica suppresses immunoglobulin E-mediated allergic response by the inhibition of Syk kinase activation in mast cells. Clinical and Experimental Allergy. 2008;38:794?804. 공동저자 21. Curcumin, a constituent of curry, suppresses IgE-mediated allergic response and mast cell activation at the level of Syk. The Journal of allergy and clinical immunology. 2008;121(5):1225-1231. 공동저자 22. Meliae Cortex Extract Exhibits Anti-allergic Activity through the Inhibition of Syk Kinase in Mast Cells. Toxicol Appl Pharmacol. 2007;220:227?234. 공동저자 23. Polygoni Cuspidati Radix Inhibits the Activation of Syk Kinase in Mast Cells for Antiallergic Activity. Experimental biology and medicine. 2007;232(11):1425-1431. 공동저자 24. Role of Src-family kinase isoforms, Lyn, Fyn, Fgr, and c-Src on degranulation in RBL-2H3 mast cells. J Life science. 2007;17:350-355. 공동저자 25. Phospholipase D2 acts as an essential adaptor protein in the activation of Syk in antigen-stimulated mast cells. Blood. 2006 Mar 30;108(3):956-64. 공동저자 26. Inhibitory effects of a fermented ginseng extract, BST204, on the expression of inducible nitric oxide synthase and nitric oxide production in lipopolysaccharide-activated murine macrophages. J Pharm Pharmacol. 2005 Jul;57(7):911-18. 공동저자 27. Effect of a fermented ginseng extract, BST204, on the expression of cyclooxygenase-2 in murine macrophages. Int Immunopharmacol. 2005 May;5(5):929-36. 공동저자 28. High Cell Density Culture of Yarrowia lipolytica Using a One-Step Feeding Process. Biotechnol. Prog. 2000;16:657-660. 제1저자 [특허] 1. Kim JW, Kim JD, Chi WS, Kim YM (2012). A Composition For Preventing And Treating Of Allergic Diseases Comprising Extract Of Morus bombycis (Korean Patent Acquired. Registration No. 1011701580000) 2. Kim JW, Kim JY, You YH (2008), Composition for hangover containing leaf of capsicum annuum. (Korean Patent Acquired. Registration No. 10-0853939-0000) 3. Kim JW, Lee GM, You YH, Kim JY (2008), Composition for treating hangover comprising extracts of persimmon leaves as a main component. (Korean Patent Acquired. Registration No. 10-0877507-0000) 4. Kim JW, You SH, Kim JD, Kim JY (2008), Anti-obesity constituents made by fermented tangle, salty pasture, laver, soybean. (Korean Patent Acquired. Registration No. 10-0853940-0000) |
|
책임 연구원 |
김원우 |
비임상 실무 |
* 2004 ~ 2005 연세대학교 의과학과 종양생물학, 방사선종양학과 석사 * 2006 ~ 2010 연세대학교 의과학과 종양생물학, 방사선종양학과 박사 * 2010 IAEA Fellowship training, The Gray Institute, 옥스포드 대학교, 박사 후 연구원 * 2011.9 연세대학교, 방사선종양학과. 박사 후 연구원 * 2011.10 ~ 2017.12 한국원자력의학원, 방사선치료연구부, 비임상센터. 위촉 연구원 * 2018.2 ~ 2018.10 한양대학교 자연과학연구소. |
[논문] 1. Anticancer and radiosensitizing effects of the cyclin-dependent kinase inhibitors, AT7519 and SNS 032, on cervical cancer. 2018년, Int J Oncol. 2. Rifaximin improves survival and reduces intestinal injury in mice administered whole abdominal irradiation. 2018년, Bioscience Research. 3. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2018년,International Journal of Hyperthermia. 4. Metformin Inhibits Growth and Metastasis With Enhancement of Radiation Response in Hepatocellulcar Carcinoma Xenograft Model. 2017년, International Journal of Radiation OncologyBiologyPhysics 5. XIAP-associating factor 1, a transcriptional target of BRD7, contributes to endothelial cell senescence. 2016년, Oncotarget. 6. Lanatoside C suppressed colorectal cancer cell growth by inducing mitochondrial dysfunction and increased radiation sensitivity by impairing DNA damage repair. 2016년, Oncotarget. 7. Radiobiological mechanisms of stereotactic body radiation therapy and stereotactic radiation surgery. 2015년, Radiat Oncol J. 8. Suppressor of cytokine signaling (SOCS) genes are silenced by DNA hypermethylation and histone deacetylation and regulate response to radiotherapy in cervical cancer cells. 2015년, PLoS One. 9. Altered Biological Potential and Radioresponse of Murine Tumors in Different Microenvironments. 2015년, Cancer Res Treat. 10. Inhibition of IL-17A suppresses enhanced-tumor growth in low dose pre-irradiated tumor beds. 2014년, PLoS One. 11. Sorafenib acts synergistically in combination with radiotherapy without causing intestinal damage in colorectal cancer. 2013년, Tumori. 12. Tumor-infiltrating regulatory T cells delineated by upregulation of PD-1 and inhibitory receptors. 2012년, Cell Immunol. 13. Combination of radiotherapy and adenovirus-mediated p53 gene therapy for MDM2-overexpressing hepatocellular carcinoma. 2012년, J Radiat Res. 14. A novel combination treatment of armed oncolytic adenovirus expressing IL-12 and GM-CSF with radiotherapy in murine hepatocarcinoma. 2011년, J Radiat Res. 15. Identification of proteins indicating radiation-induced hepatic toxicity in cirrhotic rats. 2010년, J Radiat Res. 16. Recombinant Human Epidermal Growth Factor (rhEGF) Protects Radiation-Induced Intestine Injury in Murine System. 2010년, J Radiat Res 17. Identification of proteins that regulate radiation-induced apoptosis in murine tumors with wild type p53. 2007년, J Radiat Res 18. Enhancement of tumor radioresponse by wortmannin in C3H/HeJ hepatocarcinoma. 2007년, J Radiat Res 19. Protein expression profiles in a rat cirrhotic model induced by thioacetamide. 2006년, Korean J Hepatol. [학회발표] 1. Enhancement of radioresponse by PI3K inhibitor in radioresistant murine hepatocarcinoma. 2004년. 16th EORTC-NCI-AACR Symposium. 2. Enhancement of radiosensitivity by wortmannin in murine HCa-I. 2005년. The 1st Symposium Novel targeting drugs and radiotherapy. 3. Cooperative effects of armed oncolytic adenovirus with radiotherapy in C3H/HeJ hepatocarcinoma. 2007년. 13th ICRR. 4. A Novel Combination Treatment of Armed Oncolytic Adenovirus Expressing IL-12 and GM-CSF with Radiotherapy in Murine Hepatocarcinoma. 2009년. ACRR 5. Radioprotective Effects of Recombinant Human Epidermal Growth Factor 6. Overexpression SOCS-1 may inhibit invasion and metastasis of cervical cancer. 2014년, AACR 7. Study on the heating characteristics of Oncothermia heating devices. 8. Combination of Oncothermia with SBRT and Metformin in vivo. 2016년, 9. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2017년, STM 2017. |
| (출처: 당사 정기보고서) |
(주4) 정정 후
| [R&D 조직도 현황] |
 |
|
엔지켐생명과학_임상,연구,사업개발부 조직도 |
| (출처: 당사 2021년 3분기보고서) |
(중략)
| [당사 연구개발인력 현황] |
| 구분 | 학위별 | |||||
| 박사 | 석사 | 기타 | 합계 | |||
| 글로벌신약 R&D연구소 |
바이오연구소 | 4 | 3 | - | 7 | |
| 광교연구소 | - | 1 | 1 | 2 | ||
| 임상R&D부 | 임상개발부 | - | - | - | - | |
| 임상팀 | - | 1 | 3 | 4 | ||
| 사업개발부 | 2 | 1 | - | 3 | ||
| 첨단소재 연구소 |
첨단소재연구소 | 1 | - | - | 1 | |
| 신약팀 | - | 1 | - | 1 | ||
|
신소재팀 |
- | 1 | 2 | 3 | ||
| API팀 | - | 1 | 1 | 2 | ||
| RA팀 | - | - | 4 | 4 | ||
| CMC팀 | - | - | 2 | 2 | ||
| 글로벌 백신생산 본부 | - | 1 | - | 1 | ||
| 합 계 | 7 | 10 | 13 | 30 | ||
| (출처: 당사 제시) |
당사의 핵심 연구인력의 현황은 다음과 같습니다.
|
직 위 |
성 명 |
담당업무 |
주요 경력 |
주요 연구실적* |
|---|---|---|---|---|
|
CEO |
손기영 |
EC-18 |
* 1986년 ~ 1989년 고려대 경영대학원 경영학석사 * 1984년 ~ 1998년 삼일회계법인 이사 (CPA), * 1986년 ~ 1993년 국제통상자문 (현대전자 메모리 반도체 외) * 1996년 ~ 2000년 전경련 국제경영원 교수 * 2003년 ~ 현재 브리짓라이프사이언스 회장 * 2012년 ~ 현재 ㈜엔지켐생명과학 대표이사 |
[논문] 1. PLAG alleviates chemotherapy-induced thrombocytopenia via promotion of megakaryocyte/erythrocyte progenitor differentiation in mice. (2018년, Thrombosis Research 161:84-90) 공동저자 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry 119(2):1392-1405) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget 8(57):96636-96648) 공동저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology 6:206) 공동 저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters 377:25-31) 공동저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One 11(3):e0151758) 공동저자 7. Protective effect of EC-18, a synthetic monoacetylglyceride on lung inflammation in a murine model induced by cigarette smoke and lipopolysaccharide. (2016년 International Immunopharmacology 30:62-68) 공동저자 8. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. (2015년 Immune Network 15(3):150-160) 공동저자 9. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network 15(2):100-109) 공동저자 10. EC-18, a synthetic monoacetyldiglyceride (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol), attenuates the asthmatic response in an aluminum hydroxide/ovalbumin-induced medel of asthma. (2014년 International Immunopharmacology 18(1):116-123) 공동저자 [학회] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling. Journal of Immunology May 1, 2018, 200 (1 Supplement) 42.3 (2018년, AAI 미국면역학회) 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. Cancer Research 2018;78(13 Supplement): Abstract nr 4154. (2018년, AACR 미국암학회) 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. Cancer Research 2018;78(13 Supplement): Abstract nr 2446 (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. Journal of Immunology May 1, 2017; 198(1 Supplement) 204.11 (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. Journal of Immunology May 1, 2017; 198(1 supplement) 222.12 (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. Cancer Research 2017;77(13 Supplement): Abstract nr 5664. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. Journal of Immunology 2016, 196(1 Supplement) 50.2. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. . Journal of Immunology 2016, 196 (1 Supplement) 50.3. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. Journal of Immunology 2016, 196 (1 Supplement) 191.2. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. Blood 2015 126:2207 (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. Blood 2015 126:2210 (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. Blood 2015 126:2212 (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. Blood 2015 126:4757 (2015년, ASH 미국혈액학회) |
| 부사장 | 이홍균 | 글로벌 백신생산 총괄 |
* 1996년~2002년 Sogang University (Seoul), Graduate School of Life Sciences Ph.D. (Major - Microbiology) * 1986년-1991년 Sogang University Graduate School (Seoul), Graduate School of Life Sciences Master's Degree (Major - Biochemistry) * 1982년-1986년 Sogang University (Seoul), Bachelor's Degree in Life Science, Minor - Chemistry * 1991년~2006년 LG Life Sciences Co., Ltd. (currently LG Chem) / Senior Researcher (Director), Institute of Technology *2006년~2010년 LG Life Sciences Co., Ltd. (currently LG Chem)/ Head of Production Team 4 at Iksan Plant *2010년~2012년 SK Chemicals Co., Ltd. *2013년~2017년 SK Chemicals Andong Vaccine Plant (L House), Plant General Manager (Executive Director) *2018년~2019년 SK Bioscience Co., Ltd. Head of Engineering TF (Executive Director) *2019년-2021년 Chong Kun Dang Co., Ltd., Managing Director, Bio Production Division *2021년01월~ Seegene Head of production(COVID diagnostics) |
[Details of work history] 1991~2006 LG Life Sciences Co., Ltd. (currently LG Chem) / Senior Researcher at the Institute of Technology (Bioprocessing team leader, general manager) Main tasks: Gene Cloning/ Cell bank prep./ Cell bank characterization Bioprocess Research- Fermentation/Refining/Formulation Process Development/ Development report, CMC document creation Protein characterization studies Process scale-up (Pilot Scale Study)/ Manufacturing and supply of clinical batch Factory Construction and Qualification (Concept & Basic Design, IQ/ OQ/ PQ/ Engineering Run/ Scale-up/CV/PV) Technology transfer 1) 1991~2000: R & D for Recombinant Bovine Somatotropin / Product Name- Boostin 2) 1993~1994: Process Development of Recombinant Human Somatotropin / Product Name- Utropin 3) 1996: Recombinant Human Alfa Interferon, G-CSF cloning 4) 1991~1997: Recombinant Porcine Somatotropin development research 5) 1998: Process development for Recombinant helicase for diagnosis of human hepatitis C virus 6) 1997~2005: R&D for therapeutic vaccine using Staphylococcus aureus superantigen mutant protein / Product name-Masta Vac 7) 2001~2004: Microbial expression study of useful antibiotics using metabolic engineering 8) 2003~2005: Development of mass production of Coenzyme Q10/Lycopene with E coli using gene evolution technique. 9) 2004~2006: Development of human G-CSF using E. coli 10) 18 patents related to R&D 2006~2010 LG Life Sciences Co., Ltd. (currently LG Chem)/ Head of Production Team 4 at Iksan Plant (Director) Production team leader; Boostin (Recombinant Bovine Somatotropin sustained-release injection) Factive (antibiotics, original agent; Gemifloxacin) Inspection from Korea/ US FDA/ EMEA/ South America and other countries Yield improvement/ cost reduction 2010~2012 SK Chemicals Co., Ltd. Bio 4 Team Leader (Manager) Construction of SK Chemicals Andong Vaccine Factory 1) Concept/ Basic/ Detail Design 2) Oversee General construction work 3) Acquired production building use approval 4) Perform Facility Validation 2013~2017 SK Chemicals Andong Vaccine Plant (L House) Plant, General Manager Establishment of production system for new factory Qualification/Engineering Run, Scale-up/ Clinical batch manufacturing & supply/CV (Cleaning) Validation)/ PV (Process Validation) Acquired manufacturing license (March 2013) Acquired GMP approval for product pipelines - December 2014: Influenza vaccine Skycellflu trivalent - December 2015: Influenza Vaccine Skycellflu Quadrivalent - July 2016: Pneumococcal conjugate vaccine Skypneumo - September 2017: Shingles vaccine Skyzoster Commercial production of licensed products: Final bulk and F/F packaging WHO PQ certification for existing products - Obtained export license for Sky Cell Flu trivalent single dose and multi-dose vial formulation (March/September 2017) Collaboration with overseas partners: Joint development and joint development with a partner company (Sanofi Pasteur) for pneumococcal conjugate vaccine to enter the United States - Supply of clinical batches - Responsible for CAPEX - Acted as a member of JSC (Joint Steering Committee) and participated in major decisions Collaborating with overseas organizations and companies for CDMO business (supply of clinical batches / license approval /commercial production in progress) - PAHO project (recombinant rotavirus vaccine development / commercial production) - IVI (International Vaccine Research Institute) project (typhoid vaccine development/commercial production) - Takeda Pharmaceutical Project (Development of Dengue Vaccine / Commercial Production) Construction related work for the relocation of SK Chemicals Osan blood product factory to Andong - Concept/Basic Design (currently SK Plasma Andong Factory) 2018~2019 Head of SK Bioscience Engineering TF (Executive Director) Expansion and qualification evaluation to increase production capacity of existing factories - Extension work in progress to increase production of Sky Cellflu: Concept/ Basic/ Detail Design Construction in progress - Design of extension construction for pneumococcal conjugate vaccine to enter the United States is in progress (in collaboration with Sanofi Pasteur engineering part and overseas business part) Concept design in progress Global Business Communication Ability: LGLAP grade 4- Advanced Low (Good at business communication) Educational experience: LG/SK group executive education/ Hunet MBA/ leadership education, etc. |
| 전무 | 박갑주 | 사업개발 |
* 1992년~1997년 Ph.D. Department of Chemistry, Brown University, RI, USA (Organic/Bio Chemistry) * 1988년-1990년 M.S. Department of Chemistry, POSTECH, Pohang, S. Korea (Polymer Chemistry) * 1983년-1987년 B.S. Department of Chemistry, Seoul National University, Seoul, S. Korea * 2020년~현재 EnzyChem Life Sciences, Director, Business * 2017년~2019년 Institut Pasteur Korea, Director, Medicinal Chemistry * 2016년~2017년 Hankuk University of Foreign Studies, * 2010년~2015년 Yuhan Corp., S. Korea, Director, * 2001년~2010년 Wyeth/Pfizer, Inc. USA Sr. Research Investigator * 1998년~2001년 Duke University, Research Scientist, USA * 1997년~1998년 Texas A&M University, Post-doc, USA |
[논문] 1. Compound 19e, a novel glucokinase activator, protects against cytokine-?induced beta-?cell apoptosis in INS-?1 Cells Oh, Y. S.; Seo, E.; Park, K. Jun, H.-S., Frontiers in Pharmacology,, 2017, 8, 169/1-169/10 2. Design and Synthesis of Acetylenyl Benzamide Derivatives as Novel Glucokinase Activators for the Treatment of T2DM, Park, K*.; Lee, B. M.; Hyun, K. H.; Han, T.; Lee, D. H.; Choi, H. H.ACS Med. Chem. Lett. 2015, 6, 296-301. 3. Discovery of 3-(4-methanesulfonylphenoxy)-N-[1-(2-methoxy-ethoxymethyl)-1H-pyrazol-3-yl]-5-(3-methylpyridin-2-yl)-benzamide as a novel glucokinase activator (GKA) for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B. M.; Hyun, K. H.; Lee, D. H.; Choi, H. H; Kim, H,; Chong, W.; Kim, K. B.; Nam, S. Y. Bioorg. Med. Chem. 2014, 22, 2280-2293. 4. Treatment with glucokinase activator, YH-GKA, increases cell proliferation and decreases glucotoxic apoptosis in INS-1 cells, Oh, Y. S.; Lee, Y.-J; Park, K.; Choi, H. H.; Yoo, S.; Jun, H.-S. Eur. J. Pharma. Sci. 2014, 51, 137-145. 5. Discovery of a novel phenylethyl benzamide glucokinase activator for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B.M.; Kim, Y.H.; Han, T.; Yi, W.; Lee, D.H.; Choi, H.H.; Chong, W.; Lee, C.H. Bioorg. Med. Chem. Lett. 2013, 23, 537-542. [학회] 1. Structure-activity relationship and structure-property relationships of TTCA derivatives as novel anti-tubercular agents. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do, Korea Oct 14-15, 2019. 2. Introduction of novel anti-tubercular agent developed for the treatment of MDR/XDR TB. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do,, Korea Oct 14-15, 2019. 3. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. American Chemical Society (ACS) Spring 2019 National Meeting & Exposition in Orlando, Florida, USA March 31- April 4, 2019 4. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. 2018 Fall Korean Pharmaceutical Conference. Jeju, South Korea. October 17-19, 2018 5. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. General Meeting of the Korean Chemical Society. Daegu, South Korea. October 17-19, 2018 6. In Quest of A Novel Scaffold To Combat MDR/XDR Tuberculosis. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 7. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 8. Genome wide profiling of Mycobacterium Tuberculosis exposed to novel anti-tuberculosis agent, thienothiazolecarboxamide (TTCA) derivatives. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 |
| 상무 | 신동균 | 합성연구소 연구소장 |
* 1990년~1997년 한일약품 과장 (병역특례연구원) |
1. 베타락탐 항생제 개발 : 세포탁심, 세포트리악손, 세픽심, 세포독심 2. 카바페넴 항생제 개발 : 이미페넴, 메로페넴 3. 일반 원료 의약품 개발 : 클라리스로마이신 , 실로도신, 랄록시펜, * 논문 및 특허 1. Synthetic Communications (2005), 35(6), 845-855 2. Tetrahedron Letters (2005), 46(12), 1985-1987. 3. Bulletin of the Korean Chemical Society (1992), 13(2), 176-9. 4. Bulletin of the Korean Chemical Society (1992), 13(1), 98-9. 5. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 6. Bulletin of the Korean Chemical Society (1990), 11(4), 307-9. 7. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 8. KR 2008-87141 9. KR 2008-30366 10. KR 2008-30369 11. KR 2006-38105 12. US 20020016457 13. WO 2001070749 14. WO 2001066532 15. KR 1020140115255 16. KR 1020140115259 17. KR 1020160018457 18. KR 1020160095328 19. KR 1020170054491 20. KR 1020170000770 21. KR 1020170152263 |
| 이사 | 윤선영 |
바이오연구소 (비임상 효능 및 적응증 개발) |
*1991년 ~ 1993년 성균관대학교 생물학과 석사 *1999년 ~ 2005년 한국과학기술원(KAIST) 생명과학과 박사 *1994년 ~ 2003년 한국생명공학연구원 세포생물학실 연구원 *2003년 ~ 2005년 한국생명공학연구원 인간유전체사업단 *2005년 ~ 2006년 Roswell Park Cancer Institute (RPCI), *2006년 ~ 2013년 숙명여자대학교 생명과학과 면역학실 * 2013년 ~ 2014년 코아스템㈜ R&D 그룹 R&D 그룹장 |
[논문] 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget) 교신저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology) 교신저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters) 교신저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One) 공동저자 7. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. Immune Netw. 2015 Jun;15(3):150-60. (2015년 Immune Network) 공동저자 8. Palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network) 주저자 외 48편 주저자 및 공동저자로 논문 게재함 [학회발표] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling (2018년, AAI 미국면역학회) 2. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. (2018년, AACR 미국암학회) 3. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. . (2015년, ASH 미국혈액학회) |
|
책임 연구원 |
김원우 |
비임상 실무 |
* 2004 ~ 2005 연세대학교 의과학과 종양생물학, 방사선종양학과 석사 * 2006 ~ 2010 연세대학교 의과학과 종양생물학, 방사선종양학과 박사 * 2010 IAEA Fellowship training, The Gray Institute, 옥스포드 대학교, 박사 후 연구원 * 2011.9 연세대학교, 방사선종양학과. 박사 후 연구원 * 2011.10 ~ 2017.12 한국원자력의학원, 방사선치료연구부, 비임상센터. 위촉 연구원 * 2018.2 ~ 2018.10 한양대학교 자연과학연구소. |
[논문] 1. Anticancer and radiosensitizing effects of the cyclin-dependent kinase inhibitors, AT7519 and SNS 032, on cervical cancer. 2018년, Int J Oncol. 2. Rifaximin improves survival and reduces intestinal injury in mice administered whole abdominal irradiation. 2018년, Bioscience Research. 3. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2018년,International Journal of Hyperthermia. 4. Metformin Inhibits Growth and Metastasis With Enhancement of Radiation Response in Hepatocellulcar Carcinoma Xenograft Model. 2017년, International Journal of Radiation OncologyBiologyPhysics 5. XIAP-associating factor 1, a transcriptional target of BRD7, contributes to endothelial cell senescence. 2016년, Oncotarget. 6. Lanatoside C suppressed colorectal cancer cell growth by inducing mitochondrial dysfunction and increased radiation sensitivity by impairing DNA damage repair. 2016년, Oncotarget. 7. Radiobiological mechanisms of stereotactic body radiation therapy and stereotactic radiation surgery. 2015년, Radiat Oncol J. 8. Suppressor of cytokine signaling (SOCS) genes are silenced by DNA hypermethylation and histone deacetylation and regulate response to radiotherapy in cervical cancer cells. 2015년, PLoS One. 9. Altered Biological Potential and Radioresponse of Murine Tumors in Different Microenvironments. 2015년, Cancer Res Treat. 10. Inhibition of IL-17A suppresses enhanced-tumor growth in low dose pre-irradiated tumor beds. 2014년, PLoS One. 11. Sorafenib acts synergistically in combination with radiotherapy without causing intestinal damage in colorectal cancer. 2013년, Tumori. 12. Tumor-infiltrating regulatory T cells delineated by upregulation of PD-1 and inhibitory receptors. 2012년, Cell Immunol. 13. Combination of radiotherapy and adenovirus-mediated p53 gene therapy for MDM2-overexpressing hepatocellular carcinoma. 2012년, J Radiat Res. 14. A novel combination treatment of armed oncolytic adenovirus expressing IL-12 and GM-CSF with radiotherapy in murine hepatocarcinoma. 2011년, J Radiat Res. 15. Identification of proteins indicating radiation-induced hepatic toxicity in cirrhotic rats. 2010년, J Radiat Res. 16. Recombinant Human Epidermal Growth Factor (rhEGF) Protects Radiation-Induced Intestine Injury in Murine System. 2010년, J Radiat Res 17. Identification of proteins that regulate radiation-induced apoptosis in murine tumors with wild type p53. 2007년, J Radiat Res 18. Enhancement of tumor radioresponse by wortmannin in C3H/HeJ hepatocarcinoma. 2007년, J Radiat Res 19. Protein expression profiles in a rat cirrhotic model induced by thioacetamide. 2006년, Korean J Hepatol. [학회발표] 1. Enhancement of radioresponse by PI3K inhibitor in radioresistant murine hepatocarcinoma. 2004년. 16th EORTC-NCI-AACR Symposium. 2. Enhancement of radiosensitivity by wortmannin in murine HCa-I. 2005년. The 1st Symposium Novel targeting drugs and radiotherapy. 3. Cooperative effects of armed oncolytic adenovirus with radiotherapy in C3H/HeJ hepatocarcinoma. 2007년. 13th ICRR. 4. A Novel Combination Treatment of Armed Oncolytic Adenovirus Expressing IL-12 and GM-CSF with Radiotherapy in Murine Hepatocarcinoma. 2009년. ACRR 5. Radioprotective Effects of Recombinant Human Epidermal Growth Factor 6. Overexpression SOCS-1 may inhibit invasion and metastasis of cervical cancer. 2014년, AACR 7. Study on the heating characteristics of Oncothermia heating devices. 8. Combination of Oncothermia with SBRT and Metformin in vivo. 2016년, 9. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2017년, STM 2017. |
| (출처: 당사 정기보고서) |
(주5) 정정 전
당사의 영업손실은 2018년 14,329백만원(영업이익률 : -46.2%), 2019년 16,402백만원(영업이익률 : -52.1%), 2020년 19,107백만원(영업이익률 : -74.0%), 2021년 반기 10,359백만원(영업이익률 : -94.8%)로, 매년 영업손실이 발생하고 있는 상황이며, 영업손익이 악화되는 추세를 보이고 있습니다. 이로 인하여 매년 당기순손실이 지속되고 있으며, 당기순손익도 악화되는 추세를 보이고 있는 상황입니다. 당사의 손익계산서상 주요 계정 및 수익성 추이는 다음과 같습니다.
| [손익계산서 주요계정 및 수익성 추이] |
| (단위 : 백만원) |
|
구 분 |
2021년 반기 | 2020년 반기 | 2020년 |
2019년 |
2018년 |
|---|---|---|---|---|---|
|
매출액 |
10,932 | 17,458 | 25,818 | 31,469 | 31,034 |
|
매출원가 |
10,643 | 16,218 | 23,999 | 28,804 | 26,769 |
|
매출총이익 |
289 | 1,240 | 1,820 | 2,664 | 4,265 |
|
판매비와관리비 |
10,648 | 8,382 | 20,927 | 19,067 | 18,594 |
|
영업손익 |
(10,359) | (7,143) | (19,107) | (16,402) | (14,329) |
|
기타수익 |
39 | 284 | 2,147 | 817 | 146 |
|
기타손실 |
76 | 1,265 | 1,136 | 1,749 | 358 |
|
금융수익 |
487 | 298 | 558 | 714 | 371 |
|
금융원가 |
4,463 | 36 | 1,694 | 55 | 110 |
| 법인세비용차감전순이익 | (14,371) | (7,862) | (19,232) | (16,676) | (14,281) |
| 법인세비용 | (806) | - | (1,725) | 204 | 139 |
| 당기순이익 | (13,566) | (7,862) | (17,507) | (16,879) | (14,420) |
|
매출총이익률 |
2.6% | 7.1% | 7.0% | 8.5% | 13.7% |
|
판매비와관리비율 |
97.4% | 48.0% | 81.1% | 60.6% | 59.9% |
|
영업이익률 |
-94.8% | -40.9% | -74.0% | -52.1% | -46.2% |
|
당기순이익률 |
-124.1% | -45.0% | -67.8% | -53.6% | -46.5% |
| (출처: 당사 제시) |
[성장성]
당사의 연결기준 매출액은 2018년 31,034백만원이 발생하였으며, 2017년 대비 일반계API인 품목(진해 거담제, 항응고제, 위궤양치료제)의 매출 증가로 2017년 매출액인 26,133백만원 대비 18.8% 증가하였습니다. 2019년에도 세파계 API의 매출이 감소한 것에 반하여 일반계API 매출이 증가하면서 매출이 31,469백만원 발생하였고, 2018년 대비 1.4% 성장할 수 있었습니다.
그러나 2020년부터 코로나19 확산에 의하여 마스크 착용이 일반화되면서 호흡기질환 환자가 급감하였으며, 당사의 주요 매출품목이었던 일반API인 진해거담제의 매출이 크게 감소하였고, 코로나19 사태로 항결핵제 수출 수요국가들의 의료재정이 코로나19로 집중되면서 관련 품목들의 수출이 감소하였습니다. 또한 당사 내부적으로도 사업다각화 및 경영합리화 목적으로 저부가가치 품목에 대한 구조조정을 진행하면서 2020년 매출액이 25,818백만원으로 2019년 대비 18.0% 감소하였으며, 이러한 기조가 2021년까지도 이어지고 있어 2021년 반기까지 매출액이 10,932백만원 발생하였고, 이는 전년동기 대비 37.4% 감소한 수치입니다.
| [품목별 매출액 추이] |
| (단위 : 백만원) |
|
품목 |
2021년 반기 |
2020년 |
2019년 |
2018년 |
||||
|---|---|---|---|---|---|---|---|---|
|
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
|
| 세파계 API | 736 | 6.7% | 1,426 | 5.5% | 2,452 | 7.8% | 3,358 | 10.8% |
| 일반계 API | 8,825 | 80.7% | 22,784 | 88.2% | 27,276 | 86.7% | 24,620 | 79.3% |
| 기 타 | 1,371 | 12.5% | 1,608 | 6.2% | 1,741 | 5.5% | 3,056 | 9.8% |
|
합 계 |
10,932 | 100.0% | 25,818 | 100.0% | 31,469 | 100.0% | 31,034 | 100.0% |
| 매출성장률 | -37.4% | -18.0% | 1.4% | 18.8% | ||||
| (출처: 당사 제시) 주1) 2021년 반기 매출성장률은 전년동기대비 매출성장률입니다. |
[수익성]
(중략)
2020년에는 매출액이 감소하면서 원가율도 93.0%로 높아지게 되었으며, 이로 인하여 1,820백만원의 매출총이익이 발생하였습니다. 연구개발비도 12,865백만원으로 증가하면서 2020년 판매비와관리비는 20,927백만원으로 증가하면서 19,107백만원의 영업손실이 발생하였습니다. 추가로 2019년에 기타충당부채로 전입하였던 금액들이 일부 환입되면서 기타수익이 2,147백만원 발생하였고, 2020년 당기순손실은 17,507백만원 발생하였습니다.
2021년 반기까지도 매출액이 전년동기 대비 크게 감소하면서 원가율이 97.4%까지 증가하면서 289백만원의 매출총이익이 발생하였습니다. 연구개발비 5,134백만원 등에 의하여 10,648백만원의 판매비와관리비가 발생하였으며, 이로 인하여 10,359백만원의 영업손실이 발생하게 되었습니다. 또한, 영업외적으로 2020년 11월에 발행한 제2회 사모 전환사채의 유효이자율 상각으로 인하여 총 4,272백만원의 이자를 인식하면서 13,566백만원의 당기순손실이 발생하게 되었습니다.
당사의 최근 3개년 및 2021년 반기 연결기준 판매비와 관리비 내역은 다음과 같습니다.
| [연결기준 판매비와 관리비 내역] |
| (단위 : 백만원) |
|
구 분 |
2021년 반기 | 2020년 | 2019년 |
2018년 |
|---|---|---|---|---|
| 급여 | 3,140 | 4,095 | 2,946 | 2,527 |
| 퇴직급여 | 208 | 152 | 243 | 155 |
| 지급수수료 | 1,028 | 1,755 | 1,782 | 3,858 |
| 감가상각비 | 214 | 292 | 309 | 52 |
| 대손상각비 | (343) | (131) | 149 | 130 |
| 광고선전비 | 211 | 280 | 419 | 341 |
| 무형자산상각비 | 115 | 204 | 232 | 362 |
| 경상개발비 | 5,134 | 12,865 | 11,443 | 9,526 |
| 기타 | 941 | 1,415 | 1,543 | 1,643 |
| 합 계 | 10,648 | 20,927 | 19,067 | 18,594 |
| (출처: 당사 제시) |
상기와 같은 매출과 수익성에 의하여 영업이익률은 2018년 46.2%에서 2019년 52.1%, 2020년 74.0%, 2021년 반기 94.8%로 악화되고 있는 상황이며, 당기순이익율도 2018년 46.5%에서 2019년 53.6%, 2020년 67.8%, 2021년 반기 124.1%로 악화되고 있는 상황입니다.
(중략)
| [구강점막염 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
구강점막염 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전 |
|
④제품의특성 |
1) 경구투여 2) 항암치료 중 발생하는 호중구감소증에도 효과 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막염을 예방 및 치료 4) 호중구감소증, 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 5) 암의 진행을 촉진하는 인자인 STAT3를 억제함 6) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2017년 7월 28일 미국 FDA임상 2상 승인 - 2019년 5월 Stage 1 종료 - 2019년 7월 Stage 2 개시 - 2021년 4월 임상2상 환자 모집 완료 - 2021년 6월 최종 피험자 종료 (LPO) |
|
⑥향후계획 |
구강점막염에 대해서 본 보고서 작성기준일 기준 현재 2상 Stage 2 단계를 진행중 이며, 2021년 3분기에 임상 2상 종료 예정과 동시에 Topline 결과를 바탕으로 미국 FDA에 혁신 신약(BTD) 신청 예정 임상 2상 결과를 활용하여 적극적인 기술 라이선스를 추진할 계획임. |
|
⑦경쟁제품 |
Galera Therapeutics의 GC4419는 방사선치료에 의해 발생되는 구강점막염 치료제로 임상3상을 준비하고 있으나, 항암치료에 필수인 ROS를 억제하는 작용기전을 가지고 있어, 항암치료를 억제하는 가능성을 꾸준히 의심받고 있으며, 정맥주사를 3주~7주 동안 월요일에서 금요일까지 계속해서 맞아야 하므로, 투약이 매우 불편함. |
|
⑧관련논문등 |
Frontiers in Oncology 2016, Orall Disease 2019 |
|
⑨시장규모 |
구강점막염 세계 최고 권위자인Dr. Sonis에 따르면 구강점막염 치료제 시장 규모는 2016년 전체30억달러로 추정되고 있음. |
|
⑩기타사항 |
2018년 2월 FDA 신속심사 지정 |
| (출처: 당사 정기보고서) |
(주5) 정정 후
당사의 영업손실은 2018년 14,329백만원(영업이익률 : -46.2%), 2019년 16,402백만원(영업이익률 : -52.1%), 2020년 19,107백만원(영업이익률 : -74.0%), 2021년 3분기 15,545백만원(영업이익률 : -94.3%)로, 매년 영업손실이 발생하고 있는 상황이며, 영업손익이 악화되는 추세를 보이고 있습니다. 이로 인하여 매년 당기순손실이 지속되고 있으며, 당기순손익도 악화되는 추세를 보이고 있는 상황입니다. 당사의 손익계산서상 주요 계정 및 수익성 추이는 다음과 같습니다.
| [손익계산서 주요계정 및 수익성 추이] |
| (단위 : 백만원) |
|
구 분 |
2021년 3분기 | 2020년 3분기 | 2020년 |
2019년 |
2018년 |
|---|---|---|---|---|---|
|
매출액 |
16,485 | 21,866 | 25,818 | 31,469 | 31,034 |
|
매출원가 |
16,216 | 20,126 | 23,999 | 28,804 | 26,769 |
|
매출총이익 |
269 | 1,741 | 1,820 | 2,664 | 4,265 |
|
판매비와관리비 |
15,815 | 14,196 | 20,927 | 19,067 | 18,594 |
|
영업손익 |
(15,545) | (12,455) | (19,107) | (16,402) | (14,329) |
|
기타수익 |
39 | 795 | 2,147 | 817 | 146 |
|
기타손실 |
147 | 1,741 | 1,136 | 1,749 | 358 |
|
금융수익 |
684 | 472 | 558 | 714 | 371 |
|
금융원가 |
6,909 | 126 | 1,694 | 55 | 110 |
| 법인세비용차감전순이익 | (21,878) | (13,107) | (19,232) | (16,676) | (14,281) |
| 법인세비용 | (1,328) | 7 | (1,725) | 204 | 139 |
| 당기순이익 | (20,550) | (13,113) | (17,507) | (16,879) | (14,420) |
|
매출총이익률 |
1.63% | 7.96% | 7.0% | 8.5% | 13.7% |
|
판매비와관리비율 |
95.93% | 64.92% | 81.1% | 60.6% | 59.9% |
|
영업이익률 |
-94.30% | -56.96% | -74.0% | -52.1% | -46.2% |
|
당기순이익률 |
-124.66% | -59.97% | -67.8% | -53.6% | -46.5% |
| (출처: 당사 제시) |
[성장성]
당사의 연결기준 매출액은 2018년 31,034백만원이 발생하였으며, 2017년 대비 일반계API인 품목(진해 거담제, 항응고제, 위궤양치료제)의 매출 증가로 2017년 매출액인 26,133백만원 대비 18.8% 증가하였습니다. 2019년에도 세파계 API의 매출이 감소한 것에 반하여 일반계API 매출이 증가하면서 매출이 31,469백만원 발생하였고, 2018년 대비 1.4% 성장할 수 있었습니다.
그러나 2020년부터 코로나19 확산에 의하여 마스크 착용이 일반화되면서 호흡기질환 환자가 급감하였으며, 당사의 주요 매출품목이었던 일반API인 진해거담제의 매출이 크게 감소하였고, 코로나19 사태로 항결핵제 수출 수요국가들의 의료재정이 코로나19로 집중되면서 관련 품목들의 수출이 감소하였습니다. 또한 당사 내부적으로도 사업다각화 및 경영합리화 목적으로 저부가가치 품목에 대한 구조조정을 진행하면서 2020년 매출액이 25,818백만원으로 2019년 대비 18.0% 감소하였으며, 이러한 기조가 2021년까지도 이어지고 있어 2021년 3분기까지 매출액이 16,485백만원 발생하였고, 이는 전년동기 대비 24.6% 감소한 수치입니다.
| [품목별 매출액 추이] |
| (단위 : 백만원) |
|
품목 |
2021년 3분기 |
2020년 |
2019년 |
2018년 |
||||
|---|---|---|---|---|---|---|---|---|
|
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
|
| 세파계 API | 798 | 4.85% | 1,426 | 5.5% | 2,452 | 7.8% | 3,358 | 10.8% |
| 일반계 API | 13,924 | 84.47% | 22,784 | 88.2% | 27,276 | 86.7% | 24,620 | 79.3% |
| 기 타 | 1,763 | 10.68% | 1,608 | 6.2% | 1,741 | 5.5% | 3,056 | 9.8% |
|
합 계 |
16,485 | 100.00% | 25,818 | 100.0% | 31,469 | 100.0% | 31,034 | 100.0% |
| 매출성장률 | -24.6% | -18.0% | 1.4% | 18.8% | ||||
| (출처: 당사 제시) 주1) 2021년 3분기 매출성장률은 전년동기대비 매출성장률입니다. |
[수익성]
당사의 최근 3년 및 2021년 3분기까지의 매출은 감소하는 추세에 있으며, 매출액이 매출원가 및 각종 판매비와관리비용을 커버하지 못하고 있고, 특히, 매출액의 32.74~51.03%를 연구개발비용으로 사용하고 있어 영업손실 및 당기순손실이 지속되고 있는 상황입니다. 최근 3년 및 2021년 3분기까지의 연결기준 평균 원가율은 92.2%를 보였으며, 평균 판매비와관리비율은 72.5%, 평균 영업이익률은 -64.7%, 평균 당기순이익률은 -70.5%를 보였습니다.
(중략)
2021년 3분기까지도 매출액이 전년동기 대비 크게 감소하면서 원가율이 98.4%까지 증가하면서 269백만원의 매출총이익이 발생하였습니다. 연구개발비 7,734백만원 등에 의하여 15,815백만원의 판매비와관리비가 발생하였으며, 이로 인하여 15,545백만원의 영업손실이 발생하게 되었습니다. 또한, 영업외적으로 2020년 11월에 발행한 제2회 사모 전환사채의 유효이자율 상각으로 인하여 총 6,622백만원의 이자를 인식하면서 20,550백만원의 당기순손실이 발생하게 되었습니다.
당사의 최근 3개년 및 2021년 3분기 연결기준 판매비와 관리비 내역은 다음과 같습니다.
| [연결기준 판매비와 관리비 내역] |
| (단위 : 백만원) |
|
구 분 |
2021년 3분기 | 2020년 | 2019년 |
2018년 |
|---|---|---|---|---|
| 급여 | 4,169 | 4,095 | 2,946 | 2,527 |
| 퇴직급여 | 308 | 152 | 243 | 155 |
| 지급수수료 | 1,595 | 1,755 | 1,782 | 3,858 |
| 감가상각비 | 322 | 292 | 309 | 52 |
| 대손상각비 | (343) | (131) | 149 | 130 |
| 광고선전비 | 320 | 280 | 419 | 341 |
| 무형자산상각비 | 172 | 204 | 232 | 362 |
| 경상개발비 | 7,734 | 12,865 | 11,443 | 9,526 |
| 기타 | 1,538 | 1,415 | 1,543 | 1,643 |
| 합 계 | 15,815 | 20,927 | 19,067 | 18,594 |
| (출처: 당사 제시) |
상기와 같은 매출과 수익성에 의하여 영업이익률은 2018년 -46.2%에서 2019년 -52.1%, 2020년 -74.0%, 2021년 3분기 -94.3%로 악화되고 있는 상황이며, 당기순이익율도 2018년 -46.5%에서 2019년 -53.6%, 2020년 -67.8%, 2021년 3분기 124.7%로 악화되고 있는 상황입니다.
(중략)
| [구강점막염 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
구강점막염 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전 |
|
④제품의특성 |
1) 경구투여 2) 항암치료 중 발생하는 호중구감소증에도 효과 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막염을 예방 및 치료 4) 호중구감소증, 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 5) 암의 진행을 촉진하는 인자인 STAT3를 억제함 6) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2017년 7월 28일 미국 FDA임상 2상 승인 - 2019년 5월 Stage 1 종료 - 2019년 7월 Stage 2 개시 - 2021년 4월 임상2상 환자 모집 완료 - 2021년 6월 최종 피험자 종료 (LPO) - 2021년 10월 임상2상(미국) 결과 공시 - 2021년 11월 혁신신약지정(BTD) 신청완료 |
|
⑥향후계획 |
본 보고서 작성기준일 기준 현재 2상 Stage 2 단계를 완료하여 결과공시를 제출하였으며, 분석된 결과를 바탕으로 2021년 11월 미국 FDA에 혁신신약지정(BTD) 신청완료. 또한 임상 2상 결과를 활용하여 글로벌 라이선스 아웃을 추진 중. |
|
⑦경쟁제품 |
Galera Therapeutics의 GC4419는 방사선치료에 의해 발생되는 구강점막염 치료제로 임상3상을 준비하고 있으나, 항암치료에 필수인 ROS를 억제하는 작용기전을 가지고 있어, 항암치료를 억제하는 가능성을 꾸준히 의심받고 있으며, 정맥주사를 3주~7주 동안 월요일에서 금요일까지 계속해서 맞아야 하므로, 투약이 매우 불편함. |
|
⑧관련논문등 |
Frontiers in Oncology 2016, Orall Disease 2019 |
|
⑨시장규모 |
구강점막염 세계 최고 권위자인Dr. Sonis에 따르면 구강점막염 치료제 시장 규모는 2016년 전체30억달러로 추정되고 있음. |
|
⑩기타사항 |
2018년 2월 FDA 신속심사 지정 |
| (출처: 당사 정기보고서, 전자공시) |
(주6) 정정 전
당사는 2021년 반기말 연결기준 55,650백만원의 부채가 있으며, 부채비율은 62.5%, 차입금의존도는 33.3%입니다. 당사는 지속적인 영업손실과 당기순손실 발생, 적자를 충당하기 위한 시장에서의 자금조달로 인해 최근 3년동안 연결기준으로 부채비율이 2018년말 14.0%에서 2020년말 70.8%, 차입금의존도가 2018년말 5.8%에서 2020년말 34.8%로 재무지표가 악화되었으나, 2021년 02월 약 300억원의 전환우선주를 발행하면서 2021년 반기말 연결기준으로 부채비율 62.5%, 차입금의존도 33.3%로 재무지표가 소폭 개선되었습니다. 당사의 최근 3년 및 2021년 반기까지의 재무안정성 지표 추이는 다음과 같습니다.
| [연결기준 재무안정성 지표 추이] |
| (단위 : 백만원) |
| 구분 | 2021년 반기 | 2020년 | 2019년 | 2018년 |
|---|---|---|---|---|
| 자산총계(A) | 144,711 | 123,802 | 84,991 | 67,045 |
| 유동자산 | 125,420 | 104,999 | 63,236 | 50,224 |
| 비유동자산 | 19,291 | 18,803 | 21,755 | 16,822 |
| 부채총계(B) | 55,650 | 51,320 | 10,951 | 8,229 |
| 유동부채 | 12,130 | 9,784 | 7,499 | 6,441 |
| 비유동부채 | 43,520 | 41,536 | 3,452 | 1,788 |
| - 총차입금(C) | 48,170 | 43,067 | 3,090 | 3,870 |
| - 단기차입금(유동성장기부채 포함) | 7,592 | 5,438 | 2,614 | 3,570 |
| - 장기차입금 | 4,608 | 6,041 | - | 300 |
| - 전환사채 | 35,350 | 31,078 | - | - |
| 자본총계(D) | 89,060 | 72,483 | 74,041 | 58,817 |
| 부채비율(B/D) | 62.5% | 70.8% | 14.8% | 14.0% |
| 총차입금 의존도(C/A) | 33.3% | 34.8% | 3.6% | 5.8% |
| (출처: 당사 제시) |
당사의 부채 중 가장 큰 비중을 차지하고 있는 차입금은 2021년 반기말 연결기준 48,170백만원으로 당사의 차입금의존도는 33.3%를 보이고 있습니다. 2021년 반기말 연결기준 차입금에 대한 분류를 해보면, 단기차입금(유동성장기부채 포함) 7,592백만원, 장기차입금 4,608백만원, 전환사채 35,350백만원, 장단기리스부채 620백만원으로 구성되어 있습니다.
장단기차입금 중 담보설정된 차입금은 당사의 제천공장이 담보로 제공되어 있는 기업은행의 차입금 4,500백만원(담보설정금액 : 12,415백만원, 장부가액 7,347백만원) 및 오송의 토지 및 단기금융상품(담보설정금액 : 9,240백만원, 장부금액 7,323백만원)이 담보로 제공되어 있는 산업은행의 차입금 7,700백만원이 있습니다.
| [2021년 반기말 연결기준 차입금 상세내역] |
|
| (단위: 백만원) | |
| 차입금 구분 | 차입처 | 내역 | 이자율(%) | 2021년 반기말 | 담보제공자산 |
|---|---|---|---|---|---|
| 단기차입금 | 산업은행 | 운영자금 | 2.06 | 1,600 | 단기금융상품 |
| 운영자금 | 3.46 | 2,000 | 토지(오송) | ||
| 기업은행 | 운영자금 | 2.63 | 1,500 | 토지(제천), 건물, 구축물, 기계장치, 화재보험부보금액 | |
| 소 계 | 5,100 | - | |||
| 장기차입금 | 산업은행 | 시설자금 | 2.36 | 4,100 | 토지(오송) |
| 기업은행 | 시설자금 | 3.44 | 3,000 | 토지(제천), 건물, 구축물, 기계장치, 화재보험부보금액 | |
| 소 계 | 7,100 | - | |||
| (유동성장기부채) | (2,492) | - | |||
| 합 계 | 12,200 | - | |||
| (출처: 당사 제시) |
상기 차입금에 관하여 당사의 상환계획은 아래와 같습니다.
| [주요 차입금 상환계획] |
| (단위: 백만원) |
| 차입금 구분 | 차입처 | 내역 | 이자율(%) | 2021년 반기말 | 주요 상환일정 | ||
|---|---|---|---|---|---|---|---|
| 2021년 3분기 | 2021년 4분기 | 2022년 | |||||
| 단기차입금 | 산업은행 | 운영자금 | 2.06 | 1,600 | - | - | 1,600 |
| 운영자금 | 3.46 | 2,000 | - | - | 2,000 | ||
| 기업은행 | 운영자금 | 2.63 | 1,500 | - | 1,500 | - | |
| 소 계 | 5,100 | - | 1,500 | 3,600 | |||
| 장기차입금 | 산업은행 | 시설자금 | 2.36 | 4,100 | 342 | 342 | 3,417 |
| 기업은행 | 시설자금 | 3.44 | 3,000 | - | 375 | 2,625 | |
| 소 계 | 7,100 | 342 | 717 | 6,042 | |||
| 합 계 | 12,200 | 342 | 2,217 | 9,042 | |||
| (출처: 당사 제시) |
(중략)
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 89,082원 | 50,000 | 561,280 |
| 소 계 | 50,000 | 561,280 | ||||||||
| (출처: 당사 제시) 주1) 전환가액은 시가 하락에 따라 조정된 전환가액입니다. |
한편, 당사는 인도의 다국적 바이오제약사인 Zydus Cadila의 세계 최초 pDNA 코로나19 백신인 ZyCoV-D에 대한 공급계약 관련 LOI를 체결하였으며, 2022년 02월 생산을 목표로 약 3개월분의 CMO생산비용(원/부자재, 세포주, 배양액 등)이 선제적으로 필요하여 KB증권으로부터 1,500억원의 브릿지론을 Zydus Cadila 간 본 계약 체결 이후에 단기 차입할 계획입니다. 이후 브릿지론은 금번 주주배정 후 실권주 일반공모를 통한 자금이 유입될 시 납입일로부터 3영업일 이내에 상환할 계획에 있습니다. 이에 따라 당사의 차입금이 일시적으로 크게 증가하게 될 예정입니다. 차입 진행 시 본 증권신고서를 통해 추가적으로 안내드릴 예정입니다.
| [ 단기자금대출의 주요 금융조건 ] |
| 구분 | 내용 |
|---|---|
| 대주 | KB증권 |
| 대출금액 | 금 150,000백만원(\ 150,000,000,000) |
| 만기 | 차입일로부터 6개월 |
| 차입예정일 | 2021년 10월 |
| 대출금리 | 고정 (연) 3.90% |
| 자금사용 목적 | 코로나19 백신인 ZyCoV-D CMO 생산비용 |
| 의무 상환 | 유상증자 대금납입 후 3영업일 이내 조기상환 |
당사의 2021년 반기말 연결기준 부채비율은 62.5%, 차입금의존도는 33.3%이며, 최근 3년 및 2021년 반기까지 지속적인 영업손실 및 당기순손실의 발생으로 인하여 재무안정성 지표가 악화되어 왔습니다. 당사는 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금을 통하여 매출 및 수익성을 개선하여 재무구조 개선을 위한 노력을 지속할 예정입니다. 그럼에도 불구하고 부정적인 경기 및 산업 동향으로 인한 손실 발생과 신규 사업에 대한 자금 투입 대비 실적 부진, 유동자금 부족 등에 의하여 금융기관 등으로부터 차입금 만기 연장 거부 등에 따른 차입금 상환 부담이 일시적으로 가중될 수 있습니다. 투자자 여러분께서는 이 점 유의하여 투자해 주시기 바랍니다.
(주6) 정정 후
당사는 2021년 3분기 말 연결기준 57,679백만원의 부채가 있으며, 부채비율은 70.0%, 차입금의존도는 35.7%입니다. 당사는 지속적인 영업손실과 당기순손실 발생, 적자를 충당하기 위한 시장에서의 자금조달로 인해 최근 3년동안 연결기준으로 부채비율이 2018년말 14.0%에서 2020년말 70.8%, 차입금의존도가 2018년말 5.8%에서 2020년말 34.8%로 재무지표가 악화되었으나, 2021년 02월 약 300억원의 전환우선주를 발행하면서 2021년 3분기 말 연결기준으로 부채비율 70.0%, 차입금의존도 35.7%로 부채비율이 소폭 개선되는 모습을 보이고 있습니다. 당사의 최근 3년 및 2021년 3분기까지의 재무안정성 지표 추이는 다음과 같습니다.
| [연결기준 재무안정성 지표 추이] |
| (단위 : 백만원) |
| 구분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 |
|---|---|---|---|---|
| 자산총계(A) | 140,034 | 123,802 | 84,991 | 67,045 |
| 유동자산 | 120,451 | 104,999 | 63,236 | 50,224 |
| 비유동자산 | 19,583 | 18,803 | 21,755 | 16,822 |
| 부채총계(B) | 57,679 | 51,320 | 10,951 | 8,229 |
| 유동부채 | 13,117 | 9,784 | 7,499 | 6,441 |
| 비유동부채 | 44,562 | 41,536 | 3,452 | 1,788 |
| - 총차입금(C) | 50,037 |
43,067 | 3,090 | 3,870 |
| - 단기차입금(유동성장기부채 포함) | 7,967 | 5,438 | 2,614 | 3,570 |
| - 장기차입금 | 3,892 | 6,041 | - | 300 |
| - 전환사채 | 37,701 | 31,078 | - | - |
| 자본총계(D) | 82,354 |
72,483 | 74,041 | 58,817 |
| 부채비율(B/D) | 70.0% | 70.8% | 14.8% | 14.0% |
| 총차입금 의존도(C/A) | 35.7% | 34.8% | 3.6% | 5.8% |
| (출처: 당사 제시) |
당사의 부채 중 가장 큰 비중을 차지하고 있는 차입금은 2021년 3분기 말 연결기준 50,037백만원으로 당사의 차입금의존도는 35.7%를 보이고 있습니다. 2021년 3분기 말 연결기준 차입금에 대한 분류를 해보면, 단기차입금(유동성장기부채 포함) 7,967백만원, 장기차입금 3,892백만원, 전환사채 37,701백만원, 장단기리스부채 478백만원으로 구성되어 있습니다.
장단기차입금 중 담보설정된 차입금은 당사의 제천공장이 담보로 제공되어 있는 기업은행의 차입금 4,500백만원(담보설정금액 : 12,415백만원, 장부가액 7,347백만원) 및 오송의 토지 및 단기금융상품(담보설정금액 : 9,240백만원, 장부금액 7,323백만원)이 담보로 제공되어 있는 산업은행의 차입금 7,358백만원이 있습니다.
| [2021년 3분기 말 연결기준 차입금 상세내역] |
|
| (단위: 백만원) | |
| 차입금 구분 | 차입처 | 내역 | 이자율(%) | 2021년 3분기 | 담보제공자산 |
|---|---|---|---|---|---|
| 단기차입금 | 산업은행 | 운영자금 | 2.06 | 1,600 | 단기금융상품 |
| 운영자금 | 3.46 | 2,000 | 토지(오송) | ||
| 기업은행 | 운영자금 | 2.84 |
1,500 | 토지(제천), 건물, 구축물, 기계장치, 화재보험부보금액 | |
| 소 계 | 5,100 | - | |||
| 장기차입금 | 산업은행 | 시설자금 | 2.36 | 3,758 | 토지(오송) |
| 기업은행 | 시설자금 | 3.44 | 3,000 | 토지(제천), 건물, 구축물, 기계장치, 화재보험부보금액 | |
| 소 계 | 6,758 | - | |||
| (유동성장기부채) | (2,867) | - | |||
| 합 계 | 11,858 | - | |||
| (출처: 당사 제시) |
상기 차입금에 관하여 당사의 상환계획은 아래와 같습니다.
| [주요 차입금 상환계획] |
| (단위: 백만원) |
| 차입금 구분 | 차입처 | 내역 | 이자율(%) | 2021년 3분기 | 주요 상환일정 | |
|---|---|---|---|---|---|---|
| 2021년 4분기 | 2022년 | |||||
| 단기차입금 | 산업은행 | 운영자금 | 2.06 | 1,600 | - | 1,600 |
| 운영자금 | 3.46 | 2,000 | - | 2,000 | ||
| 기업은행 | 운영자금 | 2.63 | 1,500 | 1,500 | - | |
| 소 계 | 5,100 | 1,500 | 3,600 | |||
| 장기차입금 | 산업은행 | 시설자금 | 2.36 | 3,758 | 342 | 3,417 |
| 기업은행 | 시설자금 | 3.44 | 3,000 | 375 | 2,625 | |
| 소 계 | 6,758 |
717 | 6,042 | |||
| 합 계 | 11,858 |
2,217 | 9,042 | |||
| (출처: 당사 제시) |
(중략)
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 71,081원 | 50,000 | 703,422 |
| 소 계 | 50,000 | 703,422 | ||||||||
| (출처: 당사 제시) 주1) 전환가액은 시가 하락에 따라 조정된 전환가액입니다. |
한편, 당사는 인도의 다국적 바이오제약사인 Zydus Cadila의 세계 최초 pDNA 코로나19 백신인 ZyCoV-D에 대한 공급계약 관련 LOI를 체결하였으며, 2022년 02월 생산을 목표로 약 4개월분의 CMO생산비용(원/부자재, 세포주, 배양액 등)이 선제적으로 필요하여 KB증권으로부터 1,500억원의 브릿지론을 Zydus Cadila 간 본 계약 체결 이후에 단기 차입할 계획입니다. 이후 브릿지론은 금번 주주배정 후 실권주 일반공모를 통한 자금이 유입될 시 납입일로부터 3영업일 이내에 상환할 계획에 있습니다. 이에 따라 당사의 차입금이 일시적으로 크게 증가하게 될 예정입니다. 차입 진행 시 본 증권신고서를 통해 추가적으로 안내드릴 예정입니다.
다만, 당사의 본계약 체결일 및 단기자금대출일을 2021년 10월 중으로 최초 예상하였으나, 현재 본계약 체결일정이 지연되고 있어 현재까지 단기자금대출이 진행되지 않은 상황입니다. 단기자금대출은 본 계약 체결 이후 진행될 예정이나, 현재까지 본 계약 체결일이 확정되지 않아 단기자금대출일 또한 미정인 상황입니다.
| [ 단기자금대출의 주요 금융조건 ] |
| 구분 | 내용 |
|---|---|
| 대주 | KB증권 |
| 대출금액 | 금 150,000백만원(\ 150,000,000,000) |
| 만기 | 차입일로부터 6개월 |
| 차입예정일 | 본 계약 체결 이후(미정) |
| 대출금리 | 고정 (연) 3.90% |
| 자금사용 목적 | 코로나19 백신인 ZyCoV-D CMO 생산비용 |
| 의무 상환 | 유상증자 대금납입 후 3영업일 이내 조기상환 |
당사의 2021년 3분기 말 연결기준 부채비율은 70.0%, 차입금의존도는 35.7%이며, 최근 3년 및 2021년 3분기까지 지속적인 영업손실 및 당기순손실의 발생으로 인하여 재무안정성 지표가 악화되어 왔습니다. 당사는 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금을 통하여 매출 및 수익성을 개선하여 재무구조 개선을 위한 노력을 지속할 예정입니다. 그럼에도 불구하고 부정적인 경기 및 산업 동향으로 인한 손실 발생과 신규 사업에 대한 자금 투입 대비 실적 부진, 유동자금 부족 등에 의하여 금융기관 등으로부터 차입금 만기 연장 거부 등에 따른 차입금 상환 부담이 일시적으로 가중될 수 있습니다. 투자자 여러분께서는 이 점 유의하여 투자해 주시기 바랍니다.
(주7) 정정 전
당사의 최근 3년 및 2021년 반기동안 매출채권 내역을 살펴보면, 대부분은 6개월 이하의 매출채권인 상황이며, 2021년 반기를 제외하고 는 매출액에 연동하여 변동하고 있는 상황입니다. 2018년에는 8,433백만원의 매출채권 총액이 있었으며, 대손충당금 863백만원(대손충당금설정률 10.2%)로 매출채권 순액은 7,570백만원이 있었습니다. 2019년에는 매출액이 소폭 증가하면서 매출채권 총액 또한 9,681백만원으로 증가하였으나, 대손충당금도 1,012백만원(대손충당금설정률 10.5%)로 증가하면서 매출채권 순액은 8,669백만원이 되었습니다. 2020년에는 매출액이 크게 감소하면서 매출채권 총액도 5,067백만원으로 감소하였으며, 대손충당금 장부가액은 881백만원으로 크게 변동하지 않으면서 대손충당금설정률이 17.4%로 크게 증가하였으며, 매출채권 순액은 4,186백만원이 되었습니다. 2021년 반기까지에는 매출액이 크게 감소한 것에 반하여 매출채권은 총액은 6,342백만원으로 증가하였으며, 대손충당금은 538백만원으로 크게 변동하지 않아 대손충당금설정률은 8.5%로 감소하였으며, 매출채권 순액은 5,804백만원이 되었습니다.
매출채권 회전율의 경우 최근 3년 및 2021년 반기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 3.92회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 93.9일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다.
| [당사 연결기준 매출채권 현황] | |
| (K-IFRS 연결기준) | (단위: 백만원) |
| 구 분 | 2021년 반기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 매출채권 총액 | 6,342 | 5,067 | 9,681 | 8,433 | |
| - 6개월 이하 | 5,382 | 4,169 | 8,539 | 7,315 | |
| - 6개월 초과 1년 이하 | 419 | - | 117 | 186 | |
| - 1년 초과 | 541 | 898 | 1,024 | 932 | |
| 대손충당금 | 538 | 881 | 1,012 | 863 | |
| 대손충당금 설정률 | 8.5% | 17.4% | 10.5% | 10.2% | 대손충당금 / 매출채권 총액 |
| 매출채권 순액 | 5,804 | 4,186 | 8,669 | 7,570 | |
| 매출액 | 10,932 | 25,818 | 31,469 | 31,034 | |
| 매출채권 회전율 | 4.37회 | 4.02회 | 3.88회 | 3.40회 | 매출액 / {(전기매출채권 장부가액+당기매출채권 장부가액)/2} |
| 매출채권 회전일수 | 83.3일 | 90.9일 | 94.2일 | 107.3일 | 365/매출채권회전율 |
| (출처: 당사 제시) 주1) 2021년 반기 매출채권회전율 및 매출채권회전일수의 경우 2021년 반기 누적 매출액을 단순 연환산하여 산출하였습니다. |
미수금의 경우 2021년 반기말 연결기준으로 814백만원 중 대손충당금 500백만원을 설정하여 314백만원의 장부가액이 남아있는 상황입니다. 대손충당금 500백만원의 경우 대부분 대상처의 부도로 인하여 쌓아두고 있는 상황이며, 향후 충당금을 상각할 계획을 가지고 있습니다. 나머지 금액의 경우 임직원 복지를 위한 금액 등으로 인하여 회수가 가능할 것으로 판단되고 있습니다.
| [당사 연결기준 미수금 현황] | |
| (K-IFRS 연결기준) | (단위: 백만원) |
| 구 분 | 2021년 반기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 미수금 총액 | 814 | 585 | 589 | 574 | |
| 대손충당금 | (500) | (500) | (500) | (500) | |
| 대손충당금 설정률 | 61.4% | 85.4% | 84.8% | 87.1% | 대손충당금 / 미수금 총액 |
| 미수금 순액 | 314 | 85 | 89 | 74 |
| (출처: 당사 제시) |
매출채권의 연령분석을 해보았을 때, 대부분의 매출채권은 6개월 이하이며, 이에 따라 대손충당금설정률은 2021년 반기말 연결기준 8.5%로 크지 않은 상황이며, 자산총계 대비 매출채권 장부가액은 약 4.0%로 매출채권 미회수에 따라 당사 재무구조에 유의적으로 부정적인 영향을 미칠 가능성은 낮은 것으로 판단되고 있습니다. 그러나, 매출채권 및 미수금 부실 방지에 대한 적극적인 노력이 미진할 경우 당사의 자금수지 및 재무상태에 악영향을 줄 수 있으며, 충당금 설정율이 높아질 경우 손익에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자해 주시기 바랍니다.
(주7) 정정 후
당사의 최근 3년 및 2021년 3분기동안 매출채권 내역을 살펴보면, 대부분은 6개월 이하의 매출채권인 상황이며, 2021년 3분기를 제외하고는 매출액에 연동하여 변동하고 있는 상황입니다. 2018년에는 8,433백만원의 매출채권 총액이 있었으며, 대손충당금 863백만원(대손충당금설정률 10.2%)로 매출채권 순액은 7,570백만원이 있었습니다. 2019년에는 매출액이 소폭 증가하면서 매출채권 총액 또한 9,681백만원으로 증가하였으나, 대손충당금도 1,012백만원(대손충당금설정률 10.5%)로 증가하면서 매출채권 순액은 8,669백만원이 되었습니다. 2020년에는 매출액이 크게 감소하면서 매출채권 총액도 5,067백만원으로 감소하였으며, 대손충당금 장부가액은 881백만원으로 크게 변동하지 않으면서 대손충당금설정률이 17.4%로 크게 증가하였으며, 매출채권 순액은 4,186백만원이 되었습니다. 2021년 3분기까지는 매출액이 크게 감소한 것에 반하여 매출채권은 총액은 5,044백만원으로 증가하였으며, 대손충당금은 538백만원으로 크게 변동하지 않아 대손충당금설정률은 10.7%로 감소하였으며, 매출채권 순액은 4,506백만원이 되었습니다.
매출채권 회전율의 경우 최근 3년 및 2021년 3분기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 4.09회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 91.1일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다.
| [당사 연결기준 매출채권 현황] | |
| (K-IFRS 연결기준) | (단위: 백만원) |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 매출채권 총액 | 5,044 | 5,067 | 9,681 | 8,433 | |
| - 6개월 이하 | 4,503 | 4,169 | 8,539 | 7,315 | |
| - 6개월 초과 1년 이하 | - | - | 117 | 186 | |
| - 1년 초과 | 541 | 898 | 1,024 | 932 | |
| 대손충당금 | 538 | 881 | 1,012 | 863 | |
| 대손충당금 설정률 | 10.70% | 17.4% | 10.5% | 10.2% | 대손충당금 / 매출채권 총액 |
| 매출채권 순액 | 4,506 | 4,186 | 8,669 | 7,570 | |
| 매출액 | 16,485 | 25,818 | 31,469 | 31,034 | |
| 매출채권 회전율 | 5.06회 | 4.02회 | 3.88회 | 3.40회 | 매출액 / {(전기매출채권 장부가액+당기매출채권 장부가액)/2} |
| 매출채권 회전일수 | 72.2일 | 90.9일 | 94.2일 | 107.3일 | 365/매출채권회전율 |
| (출처: 당사 제시) 주1) 2021년 3분기 매출채권회전율 및 매출채권회전일수의 경우 2021년 3분기 누적 매출액을 단순 연환산하여 산출하였습니다. |
미수금의 경우 2021년 3분기말 연결기준으로 707백만원 중 대손충당금 500백만원을 설정하여 207백만원의 장부가액이 남아있는 상황입니다. 대손충당금 500백만원의 경우 대부분 대상처의 부도로 인하여 쌓아두고 있는 상황이며, 향후 충당금을 상각할 계획을 가지고 있습니다. 나머지 금액의 경우 임직원 복지를 위한 금액 등으로 인하여 회수가 가능할 것으로 판단되고 있습니다.
| [당사 연결기준 미수금 현황] | |
| (K-IFRS 연결기준) | (단위: 백만원) |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 미수금 총액 | 707 | 585 | 589 | 574 | |
| 대손충당금 | (500) | (500) | (500) | (500) | |
| 대손충당금 설정률 | 70.7% | 85.4% | 84.8% | 87.1% | 대손충당금 / 미수금 총액 |
| 미수금 순액 | 207 | 85 | 89 | 74 |
| (출처: 당사 제시) |
매출채권의 연령분석을 해보았을 때, 대부분의 매출채권은 6개월 이하이며, 이에 따라 대손충당금설정률은 2021년 3분기 말 연결기준 10.7%로 크지 않은 상황이며, 자산총계 대비 매출채권 장부가액은 약 3.2%로 매출채권 미회수에 따라 당사 재무구조에 유의적으로 부정적인 영향을 미칠 가능성은 낮은 것으로 판단되고 있습니다. 그러나, 매출채권 및 미수금 부실 방지에 대한 적극적인 노력이 미진할 경우 당사의 자금수지 및 재무상태에 악영향을 줄 수 있으며, 충당금 설정율이 높아질 경우 손익에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자해 주시기 바랍니다.
(주8) 정정 전
당사는 재고자산은 원가와 순실현가능가치 중 작은 금액으로 표시되고, 재고자산의 원가는 총평균법(단, 미착품은 개별법)에 따라 결정하며, 매 회계연도의 결산기에 회사 및 감사인의 입회에 따라 실지 재고조사를 실시하여 그 기록을 조정하고 있고, 분반기에는 회사 자체적으로 실지 재고조사를 실시하고 있습니다. 당사의 최근 3년 및 2021년 반기기준 재고자산 현황은 다음과 같습니다.
| [당사 연결기준 재고자산 현황] |
| (단위 : 백만원) |
|
구 분 |
2021년 반기 | 2020년 | 2019년 | 2018년 | |
|---|---|---|---|---|---|
| 제 품 | 취득원가 | 7,525 | 8,162 | 5,700 | 5,084 |
| 평가충당금 | (2,445) | (1,772) | (1,341) | (839) | |
| 장부가액 | 5,079 | 6,390 | 4,358 | 4,245 | |
|
상품 |
취득원가 | 364 | 589 | 294 | 310 |
| 평가충당금 | (73) | (3) | (1) | - | |
| 장부가액 | 291 | 587 | 293 | 310 | |
|
재공품 |
취득원가 | 249 | 158 | 226 | 223 |
| 평가충당금 | (31) | (78) | (58) | (19) | |
| 장부가액 | 218 | 81 | 168 | 204 | |
|
원재료 |
취득원가 | 3,404 | 3,082 | 3,579 | 2,811 |
| 평가충당금 | (994) | (962) | (736) | (448) | |
| 장부가액 | 2,410 | 2,120 | 2,843 | 2,364 | |
| 저장품 | 장부금액 | - | - | - | 5 |
| 미착품 | 장부금액 | - | - | 184 | - |
|
합 계 |
취득원가 | 11,542 | 11,992 | 9,983 | 8,434 |
| 평가충당금 | (3,544) | (2,814) | (2,137) | (1,306) | |
| 장부가액 | 7,998 | 9,178 | 7,847 | 7,128 | |
|
총자산대비 재고자산 구성비율(%) |
5.5% | 7.4% | 9.2% | 10.6% | |
|
재고자산회전율(회) |
2.5회 | 2.8회 | 3.8회 | 3.8회 | |
|
(출처: 당사 제시) 주1) 총자산대비 재고자산 구성비율(%) = [재고자산÷기말자산총계×100] 주2) 재고자산회전율 = [연환산 매출원가÷{(기초재고+기말재고)÷2}] |
당사는 K-IFRS 회계기준서에 의거 연령별 재고잔액 기준을 설정하고 있으며, 1년 이상 재고에 대해서는 50%, 2년 이상 재고에 대해서는 80%, 3년 이상 재고에 대해서는 100% 평가충당금을 설정하고 있습니다. 당사의 재고자산의 경우 평균 유효사용기한이 약 3년이며, 대부분의 재고자산들은 유효기간 이내에 모두 매출로 이어지고 있는 상황이나, 회계기준에 맞추어 매년 연령평가 충당금을 설정하고 있는 상황입니다.
특히 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 당사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 반기말 연결기준 30.7%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 반기에는 약 2.5회로 감소하고 있는 상황입니다.
당사는 향후 매출단가가 하락추세를 보이고 있는 저부가가치 품목을 2020년부터 정리하고 있으며, 조영제 및 첨단소재같은 신규 고부가가치 제품과 기존 사이크로세린, 사포그릴레이트 등 고부가가치제품의 영업망을 넓혀 재고자산의 회전율 상승 및 평가충당금 설정의 최소화를 위하여 노력할 예정입니다. 추가로, 2021년 반기말 연결기준으로 당사의 총 자산 대비 재고자산의 구성비율은 5.5%이기 때문에 재고자산의 추가적인 평가충당이 당사 재무구조에 유의적으로 부정적인 영향이 있을 가능성은 적을 것으로 판단하고 있습니다.
(주8) 정정 후
당사는 재고자산은 원가와 순실현가능가치 중 작은 금액으로 표시되고, 재고자산의 원가는 총평균법(단, 미착품은 개별법)에 따라 결정하며, 매 회계연도의 결산기에 회사 및 감사인의 입회에 따라 실지 재고조사를 실시하여 그 기록을 조정하고 있고, 분반기에는 회사 자체적으로 실지 재고조사를 실시하고 있습니다. 당사의 최근 3년 및 2021년 3분기 기준 재고자산 현황은 다음과 같습니다.
| [당사 연결기준 재고자산 현황] |
| (단위 : 백만원) |
|
구 분 |
2021년 3분기 | 2020년 | 2019년 | 2018년 | |
|---|---|---|---|---|---|
| 제 품 | 취득원가 | 6,278 | 8,162 | 5,700 | 5,084 |
| 평가충당금 | (2,462) | (1,772) | (1,341) | (839) | |
| 장부가액 | 3,816 | 6,390 | 4,358 | 4,245 | |
|
상품 |
취득원가 | 357 | 589 | 294 | 310 |
| 평가충당금 | (171) | (3) | (1) | - | |
| 장부가액 | 186 | 587 | 293 | 310 | |
|
재공품 |
취득원가 | 406 | 158 | 226 | 223 |
| 평가충당금 | (31) | (78) | (58) | (19) | |
| 장부가액 | 375 | 81 | 168 | 204 | |
|
원재료 |
취득원가 | 3,908 | 3,082 | 3,579 | 2,811 |
| 평가충당금 | (1,033) | (962) | (736) | (448) | |
| 장부가액 | 2,876 | 2,120 | 2,843 | 2,364 | |
| 저장품 | 장부금액 | - | - | - | 5 |
| 미착품 | 취득원가 | 320 | - | 184 | - |
| 평가충당금 | - | - | - | - | |
| 장부가액 | 320 | - | 184 | - | |
|
합 계 |
취득원가 | 11,269 | 11,992 | 9,983 | 8,434 |
| 평가충당금 | (3,697) | (2,814) | (2,137) | (1,306) | |
| 장부가액 | 7,572 | 9,178 | 7,847 | 7,128 | |
|
총자산대비 재고자산 구성비율(%) |
5.4% | 7.4% | 9.2% | 10.6% | |
|
재고자산회전율(회) |
2.6회 | 2.8회 | 3.8회 | 3.8회 | |
|
(출처: 당사 제시) 주1) 총자산대비 재고자산 구성비율(%) = [재고자산÷기말자산총계×100] 주2) 재고자산회전율 = [연환산 매출원가÷{(기초재고+기말재고)÷2}] |
당사는 K-IFRS 회계기준서에 의거 연령별 재고잔액 기준을 설정하고 있으며, 1년 이상 재고에 대해서는 50%, 2년 이상 재고에 대해서는 80%, 3년 이상 재고에 대해서는 100% 평가충당금을 설정하고 있습니다. 당사의 재고자산의 경우 평균 유효사용기한이 약 3년이며, 대부분의 재고자산들은 유효기간 이내에 모두 매출로 이어지고 있는 상황이나, 회계기준에 맞추어 매년 연령평가 충당금을 설정하고 있는 상황입니다.
특히 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 당사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 3분기 말 연결기준 32.8%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 3분기에는 약 2.6회로 감소하고 있는 상황입니다.
당사는 향후 매출단가가 하락추세를 보이고 있는 저부가가치 품목을 2020년부터 정리하고 있으며, 조영제 및 첨단소재같은 신규 고부가가치 제품과 기존 사이크로세린, 사포그릴레이트 등 고부가가치제품의 영업망을 넓혀 재고자산의 회전율 상승 및 평가충당금 설정의 최소화를 위하여 노력할 예정입니다. 추가로, 2021년 3분기 말 연결기준으로 당사의 총 자산 대비 재고자산의 구성비율은 5.4%이기 때문에 재고자산의 추가적인 평가충당이 당사 재무구조에 유의적으로 부정적인 영향이 있을 가능성은 적을 것으로 판단하고 있습니다.
(주9) 정정 전
당사는 연결기준 최근 3년 및 2020년 반기까지 지속적으로 음(-)의 영업활동현금흐름과 투자활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름과 투자활동현금흐름을 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 2021년 반기말 연결기준 당사는 11,047백만원의 현금 및 현금성자산을 보유하고 있습니다. 당사의 최근 3년간 및 2021년 반기까지의 요약 연결 현금흐름 추이는 다음과 같습니다.
| [당사 연결기준 현금흐름 추이] |
| (단위: 백만원) |
| 구 분 | 2021년 반기 | 2020년 | 2019년 | 2018년 |
|---|---|---|---|---|
|
영업활동현금흐름 |
(9,694) | (14,021) | (15,095) | (13,525) |
| - 당기순이익 | (13,566) | (17,507) | (16,879) | (14,420) |
| - 현금의 유출이 없는 비용등의 가감 | 4,380 | 913 | 2,233 | 1,478 |
| - 영업활동으로인한자산ㆍ부채의변동 | (645) | 2,144 | (592) | (465) |
| - 이자수취 | 253 | 702 | 355 | 138 |
| - 이자지급 | (187) | (231) | (164) | (242) |
| - 법인세 납부(환급) | 71 | (41) | (47) | (12) |
|
투자활동현금흐름 |
(11,722) | (45,242) | (18,057) | (36,038) |
| - 단기금융상품의 처분 | 34,602 | 63,916 | 18,783 | 13,750 |
| - 단기금융상품의 취득 | (45,008) | (109,416) | (30,468) | (44,417) |
|
재무활동현금흐름 |
30,596 | 58,827 | 30,904 | 47,236 |
| - 단기차입금의 증감 | 720 | 1,766 | (1,256) | (1,716) |
| - 장기차입금의 증감 | - | 7,100 | - | - |
| - 보통주 증자 | 101 | 225 | 6,314 | 48,949 |
| - 전환우선주 발행 | 30,001 | - | 26,497 | - |
| - 전환사채의 증가 | - | 49,996 | - | - |
|
기초현금및현금성자산 |
1,858 | 2,306 | 4,541 | 6,863 |
|
기말현금및현금성자산 |
11,047 | 1,858 | 2,306 | 4,541 |
| (출처: 당사 제시) |
영업활동현금흐름의 경우 2018년 당기순손실 14,420백만원이 발생하였으며, 감가상각비 1,171백만원 등 현금의 유출이 없는 비용등의 가감 1,478백만원이 있었으나,-13,525백만원 영업활동현금흐름이 발생하였습니다. 2019년에도 당기순손실 16,879백만원이 발생하였으며, 감가상각비 1,714백만원, 퇴직급여 515백만원 등 현금의 유출이 없는 비용등의 가감 2,233백만원이 있었으나, -15,095백만원의 영업활동현금흐름이 발생하였습니다. 2020년의 경우에도 17,507백만원의 당기순손실이 발생하였으며, 감가상각비 1,832백만원, 이자비용 1,430백만원 등 913백만원의 현금의 유출이 없는 비용등의 가감이 있었고, 매출채권 감소 4,572백만원 등으로 2,144백만원의 영업활동으로인한자산ㆍ부채의변동이 있었으나, -14,021백만원의 영업활동현금흐름이 발생하였습니다. 2021년 반기까지도 13,566백만원의 당기순손실이 발생하였고, 2회차 사모 전환사채의 유효이자율 상각액 등으로 인한 이자비용 4,463백만원과 866백만원의 감가상각비 등으로 4,380백만원의 현금의 유출이 없는 비용등의 가감이 있었으나 -9,694백만원의 영업활동현금흐름이 발생하였습니다.
투자활동현금흐름의 경우 당사는 유휴 유동성 현금 및 현금성자산에 대하여 단기금융상품에 투자하여 이자수익을 발생시키고 있으며, 운영자금을 위하여 단기금융상품을 처분하여 유동성을 확보하고 있어 매년 대규모의 단기금융상품 처분 및 취득이 발생하고 있는 상황입니다. 이에 따라 2018년에는 단기금융상품의 취득 44,417백만원과 처분 13,750백만원 등으로 -36,038백만원의 투자활동현금흐름이 발생하였고, 2019년에는 단기금융상품의 취득 30,468백만원과 처분 18,783백만원 등으로 - 18,057백만원의 투자활동현금흐름이 발생하였습니다. 2020년에도 단기금융상품의 취득 109,416백만원과 63,916백만원의 처분 등으로 -45,242백만원의 투자활동현금흐름이 발생하였으며, 2021년 반기까지도 단기금융상품의 취득 45,008백만원과 처분 34,602백만원으로 -11,722백만원의 투자활동현금흐름이 발생하게 되었습니다.
재무활동현금흐름의 경우 상기 음(-)의 영업활동현금흐름과 투자활동현금흐름을 충당하기 위하여 현금이 유입되고 있는 상황입니다. 2018년에는 IPO에 따라 회사에 48,949백만원의 자금이 유입되었으며, 단기차입금이 1,716백만원 감소 등으로 47,236백만원의 재무활동현금흐름이 유입되었으며, 2019년에는 전환우선주 발행 26,497백만원과 보통주 유상증자 6,314백만원, 단기차입금 감소 1,256백만원 등으로 30,904백만원의 재무활동현금흐름이 발생하였습니다. 2020년에는 단기차입금 1,766백만원의 증가와 장기차입금 7,100백만원의 증가 등으로 인하여 58,827백만원의 재무활동현금흐름이 유입되었으며, 2021년 반기에는 전환우선주 발행 30,001백만원, 단기차입금 720백만원의 증가 등으로 30,596백만원의 재무활동현금흐름이 발생하였습니다.
한편, 당사의 최근 3년 및 2021년 반기동안 유동비율은 2018년 779.8%에서 2021년 반기 1,034.0%, 당좌비율은 669.1%에서 2021년 반기 968.0%로 증가하는 추세에 있습니다. 지속적인 영업손실과 당기순손실에도 유동성이 개선되고 있는 사유는 전환우선주 발행에 따른 유동자산 증가와 전환사채 발행에 따른 비유동부채 계상 및 유동자산 증가가 주된 원인입니다.
| [최근 3년 및 2021년 반기 연결기준 당사 유동성 관련 비율] |
| 구 분 | 2021년 반기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 유동비율 | 1,034.0% | 1,073.2% | 843.3% | 779.8% | 유동자산 / 유동부채 |
| 당좌비율 | 968.0% | 979.4% | 738.6% | 669.1% | 당좌자산 / 유동부채 |
| (출처: 당사 제시) |
당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으며, 2021년 반기말 기준 연결기준으로 유동비율 1,034.0%, 당좌비율 968.0%로 안정적인 유동성 지표를 보이고 있어 단기적인 유동성 이슈가 발생할 가능성은 적을 것으로 판단하고 있습니다. 그러나 대내외적 환경이 급격하게 침체되거나 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있으며, 향후 제2회차 사모 전환사채 500억원의 조기상환청구권 행사 등에 의하여 유동성 위기가 발생할 수 있습니다. 투자자들께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다
(주9) 정정 후
당사는 연결기준 최근 3년 및 2021년 3분기까지 지속적으로 음(-)의 영업활동현금흐름과 투자활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름과 투자활동현금흐름을 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 2021년 3분기 말 연결기준 당사는 8,471백만원의 현금 및 현금성자산을 보유하고 있습니다. 당사의 최근 3년간 및 2021년 3분기까지의 요약 연결 현금흐름 추이는 다음과 같습니다.
| [당사 연결기준 현금흐름 추이] |
| (단위: 백만원) |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 |
|---|---|---|---|---|
|
영업활동현금흐름 |
(11,344) | (14,021) | (15,095) | (13,525) |
| - 당기순이익 | (20,550) | (17,507) | (16,879) | (14,420) |
| - 현금의 유출이 없는 비용등의 가감 | 7,049 | 913 | 2,233 | 1,478 |
| - 영업활동으로인한자산ㆍ부채의변동 | 1,944 | 2,144 | (592) | (465) |
| - 이자수취 | 451 | 702 | 355 | 138 |
| - 이자지급 | (279) | (231) | (164) | (242) |
| - 법인세 납부(환급) | 40 | (41) | (47) | (12) |
|
투자활동현금흐름 |
(12,188) | (45,242) | (18,057) | (36,038) |
| - 단기금융상품의 처분 | 70,512 | 63,916 | 18,783 | 13,750 |
| - 단기금융상품의 취득 | (80,667) | (109,416) | (30,468) | (44,417) |
|
재무활동현금흐름 |
30,119 | 58,827 | 30,904 | 47,236 |
| - 단기차입금의 증감 | 720 | 1,766 | (1,256) | (1,716) |
| - 장기차입금의 증감 | (342) | 7,100 | - | - |
| - 보통주 증자 | 101 | 225 | 6,314 | 48,949 |
| - 전환우선주 발행 | 30,001 | - | 26,497 | - |
| - 전환사채의 증가 | - | 49,996 | - | - |
|
기초현금및현금성자산 |
1,858 | 2,306 | 4,541 | 6,863 |
|
기말현금및현금성자산 |
8,471 | 1,858 | 2,306 | 4,541 |
| (출처: 당사 제시) |
영업활동현금흐름의 경우 2018년 당기순손실 14,420백만원이 발생하였으며, 감가상각비 1,171백만원 등 현금의 유출이 없는 비용등의 가감 1,478백만원이 있었으나,-13,525백만원 영업활동현금흐름이 발생하였습니다. 2019년에도 당기순손실 16,879백만원이 발생하였으며, 감가상각비 1,714백만원, 퇴직급여 515백만원 등 현금의 유출이 없는 비용등의 가감 2,233백만원이 있었으나, -15,095백만원의 영업활동현금흐름이 발생하였습니다. 2020년의 경우에도 17,507백만원의 당기순손실이 발생하였으며, 감가상각비 1,832백만원, 이자비용 1,430백만원 등 913백만원의 현금의 유출이 없는 비용등의 가감이 있었고, 매출채권 감소 4,572백만원 등으로 2,144백만원의 영업활동으로인한자산ㆍ부채의변동이 있었으나, -14,021백만원의 영업활동현금흐름이 발생하였습니다. 2021년 3분기까지도 20,550백만원의 당기순손실이 발생하였고, 2회차 사모 전환사채의 유효이자율 상각액 등으로 인한 이자비용 6,909백만원과 1,364백만원의 감가상각비 등으로 7,049백만원의 현금의 유출이 없는 비용등의 가감이 있었으나 -11,344백만원의 영업활동현금흐름이 발생하였습니다.
투자활동현금흐름의 경우 당사는 유휴 유동성 현금 및 현금성자산에 대하여 단기금융상품에 투자하여 이자수익을 발생시키고 있으며, 운영자금을 위하여 단기금융상품을 처분하여 유동성을 확보하고 있어 매년 대규모의 단기금융상품 처분 및 취득이 발생하고 있는 상황입니다. 이에 따라 2018년에는 단기금융상품의 취득 44,417백만원과 처분 13,750백만원 등으로 -36,038백만원의 투자활동현금흐름이 발생하였고, 2019년에는 단기금융상품의 취득 30,468백만원과 처분 18,783백만원 등으로 - 18,057백만원의 투자활동현금흐름이 발생하였습니다. 2020년에도 단기금융상품의 취득 109,416백만원과 63,916백만원의 처분 등으로 -45,242백만원의 투자활동현금흐름이 발생하였으며, 2021년 3분기까지도 단기금융상품의 취득 80,667백만원과 처분 70,512백만원으로 -12,188백만원의 투자활동현금흐름이 발생하게 되었습니다.
재무활동현금흐름의 경우 상기 음(-)의 영업활동현금흐름과 투자활동현금흐름을 충당하기 위하여 현금이 유입되고 있는 상황입니다. 2018년에는 IPO에 따라 회사에 48,949백만원의 자금이 유입되었으며, 단기차입금이 1,716백만원 감소 등으로 47,236백만원의 재무활동현금흐름이 유입되었으며, 2019년에는 전환우선주 발행 26,497백만원과 보통주 유상증자 6,314백만원, 단기차입금 감소 1,256백만원 등으로 30,904백만원의 재무활동현금흐름이 발생하였습니다. 2020년에는 단기차입금 1,766백만원의 증가와 장기차입금 7,100백만원의 증가 등으로 인하여 58,827백만원의 재무활동현금흐름이 유입되었으며, 2021년 3분기에는 전환우선주 발행 30,001백만원, 단기차입금 720백만원의 증가 등으로 30,119백만원의 재무활동현금흐름이 발생하였습니다.
한편, 당사의 최근 3년 및 2021년 3분기동안 유동비율은 2018년 779.8%에서 2021년 3분기 818.4%, 당좌비율은 2018년 669.1%에서 2021년 3분기 860.5%로 변동하고 있습니다. 이는 2020년까지 증가하는 추세였으나, 2021년 3분기 기준으로 유동비율 및 당좌비율이 전년대비 감소하고 있습니다. 다만, 지속적인 영업손실과 당기순손실에도 유동성이 안정적인 사유는 전환우선주 발행에 따른 유동자산 증가와 전환사채 발행에 따른 비유동부채 계상 및 유동자산 증가가 주된 원인입니다.
| [최근 3년 및 2021년 3분기 연결기준 당사 유동성 관련 비율] |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 유동비율 | 818.4% | 1,073.2% | 843.3% | 779.8% | 유동자산 / 유동부채 |
| 당좌비율 | 860.5% | 979.4% | 738.6% | 669.1% | 당좌자산 / 유동부채 |
| (출처: 당사 제시) |
당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으며, 2021년 3분기 말 기준 연결기준으로 유동비율 818.4%, 당좌비율 860.5%로 안정적인 유동성 지표를 보이고 있어 단기적인 유동성 이슈가 발생할 가능성은 적을 것으로 판단하고 있습니다. 그러나 대내외적 환경이 급격하게 침체되거나 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있으며, 향후 제2회차 사모 전환사채 500억원의 조기상환청구권 행사 등에 의하여 유동성 위기가 발생할 수 있습니다. 투자자들께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다
(주10) 정정 전
| [최대주주 및 특수관계인 청약율에 따른 지분변동 가정] |
| (단위 : 주) |
| 성 명 | 현재 소유주식 수 | 유상증자 배정 물량 |
유상증자 후 | 유상증자 후 (잠재주식수 모두 전환 시) |
|||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | 주식수 | 지분율 | ||
| 브리짓라이프사이언스 | 961,780 | 11.5% | 585,206 | 1,020,301 | 7.5% | 1,020,301 | 7.0% |
| 손기영 | 578,361 | 6.9% | 351,910 | 613,552 | 4.5% | 613,552 | 4.2% |
| 기타 특수관계인 | 21,600 | 0.3% | 13,142 | 21,600 | 0.2% | 21,600 | 0.1% |
| 합계 | 1,561,741 | 18.7% | 950,258 | 1,655,453 | 12.1% | 1,655,453 | 11.3% |
| 발행주식총수 | 8,331,345 | 100.0% | 5,300,000 | 13,631,345 | 100.0% | 14,626,762 | 100.0% |
| 주1) 유상증자 전 발행주식 총수 : 8,331,345주(우선주 379,137주 제외) → 유상증자 후 발행주식 총수 : 13,631,345주 |
| 주2) 최대주주인(주)브릿지라이프사이언스 및 손기영이 배정물량의 10%를 참여함을 가정하여 산정하였습니다. |
| 주3) 잠재주식수(미상환전환사채, 미전환 우선주, 주식매수청구권)은 증권신고서 제출 전일 기준으로 995,417주 기준입니다. 주4) 상기 지분변동은 전환우선주, 주식관련사채의 전환권 행사, 주식매수청구권의 행사, 자기주식수의 변동 등으로 변경될 수 있습니다. |
한편, 당사가 발행한 제2회 무보증 사모 전환사채는 2021년 11월 06일부터 전환청구가능하며, 전환가능주수는 561,280주, 전환가액은 89,082원(시가 하락에 의한 최저 Re-fixing 고려 시 전환가능주식수 712,880주, 전환가액 70,138원)입니다. 또한 당사는 잠재주식수로 미전환 우선주 379,137주가 남아있는 상황이며, 시가하락에 의한 최저 Re-fixing 고려 시 505,386주가 전환가능합니다. 또한, 당사가 임직원에게 부여한 주식매수청구권의 미행사수량은 55,000주입니다. 이에 따라 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 995,417주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다.
유상증자 후 잠재주식 수가 모두 행사되었음을 고려 시 최대주주 등 지분율은 11.3%까지 감소될 수 있으며, 이는 각기 행사가액이 시가하락에 의한 전환가액 조정시 추가적으로 하락할 수 있습니다.
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 89,082원 | 50,000 | 561,280 |
| 소 계 | 50,000 | 561,280 | ||||||||
| 주1) 발행 당시 전환가액은 100,196원이었으며, 시가하락에 의한 최저 Re-fixing 가격은 70,138원입니다. |
(주10) 정정 후
| [최대주주 및 특수관계인 청약율에 따른 지분변동 가정] |
| (단위 : 주) |
| 성 명 | 현재 소유주식 수 | 유상증자 배정 물량 |
유상증자 후 | 유상증자 후 (잠재주식수 모두 전환 시) |
|||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | 주식수 | 지분율 | ||
| 브리짓라이프사이언스 | 961,780 | 11.5% | 585,206 | 1,020,301 | 7.5% | 1,020,301 | 6.9% |
| 손기영 | 578,361 | 6.9% | 351,910 | 613,552 | 4.5% | 613,552 | 4.2% |
| 기타 특수관계인 | 21,600 | 0.3% | 13,142 | 21,600 | 0.2% | 21,600 | 0.1% |
| 합계 | 1,561,741 | 18.7% | 950,258 | 1,655,453 | 12.1% | 1,655,453 | 11.2% |
| 발행주식총수 | 8,331,345 | 100.0% | 5,300,000 | 13,631,345 | 100.0% | 14,768,904 |
100.0% |
| 주1) 유상증자 전 발행주식 총수 : 8,331,345주(우선주 379,137주 제외) → 유상증자 후 발행주식 총수 : 13,631,345주 |
| 주2) 최대주주인(주)브릿지라이프사이언스 및 손기영이 배정물량의 10%를 참여함을 가정하여 산정하였습니다. |
| 주3) 잠재주식수(미상환전환사채, 미전환 우선주, 주식매수청구권)은 증권신고서 제출 전일 기준으로 1,137,559주 기준입니다. 주4) 상기 지분변동은 전환우선주, 주식관련사채의 전환권 행사, 주식매수청구권의 행사, 자기주식수의 변동 등으로 변경될 수 있습니다. |
한편, 당사가 발행한 제2회 무보증 사모 전환사채는 2021년 11월 06일부터 전환청구가능하며, 전환가능주수는 703,422주, 전환가액은 71,081원(시가 하락에 의한 최저 Re-fixing 고려 시 전환가능주식수 712,880주, 전환가액 70,138원)입니다. 또한 당사는 잠재주식수로 미전환 우선주 379,137주가 남아있는 상황이며, 시가하락에 의한 최저 Re-fixing 고려 시 505,386주가 전환가능합니다. 또한, 당사가 임직원에게 부여한 주식매수청구권의 미행사수량은 55,000주입니다. 이에 따라 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 1,137,559주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다.
유상증자 후 잠재주식 수가 모두 행사되었음을 고려 시 최대주주 등 지분율은 11.2%까지 감소될 수 있으며, 이는 각기 행사가액이 시가하락에 의한 전환가액 조정시 추가적으로 하락할 수 있습니다.
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 71,081원 | 50,000 | 703,422 |
| 소 계 | 50,000 | 703,422 | ||||||||
| 주1) 발행 당시 전환가액은 100,196원이었으며, 시가하락에 의한 최저 Re-fixing 가격은 70,138원입니다. |
(주11) 정정 전
| [최근 3년 및 2021년 반기 연결기준 세부 연구개발 비용] |
| (단위 : 백만원) |
|
구분 |
2021년 반기 | 2020년 | 2019년 | 2018년 | |
|---|---|---|---|---|---|
|
자산 |
원재료비 |
- | - | - | - |
|
인건비 |
- | - | - | - | |
|
소 계 |
- | - | - | - | |
|
비용 처리 |
제조원가 |
- | - | - | - |
|
판관비 |
5,173 | 13,175 | 12,282 | 10,161 | |
| 소 계 | 5,173 | 13,175 | 12,282 | 10,161 | |
| 연구개발비용 합계 | 5,173 | 13,175 | 12,282 | 10,161 | |
| (정부보조금) | (38) | (309) | (839) | (635) | |
|
연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액 ×100] |
47.32% | 51.03% | 39.03% | 32.74% | |
| (출처: 당사 제시) |
| 주1) 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다. |
| 주2) 당사는 개발중인 원료의약품 및 신약 개발 프로젝트 별로 연구인력의 인건비, 실험 시약 및 재료비, 외주용역비 등을 집계하여 연구개발비를 관리하고 있으며, 국책과제 지원 대상 연구과제에 대해서는 국고보조금을 차감한 후 잔액을 손익계산서상의 경상연구개발비(판매비 및 관리비)로 처리하고 있습니다. |
당사는 경상연구개발비로 2020년 연결기준 13,175백만원, 2021년 반기 연결기준 5,173백만원 사용하였으며, 이는 매출액 대비 각각 51.0%, 47.3% 수준이며, 최근 3개년 및 2021년 반기 평균 매출액 대비 연구개발비의 비중은 42.6%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다.
(주11) 정정 후
| [최근 3년 및 2021년 3분기 연결기준 세부 연구개발 비용] |
| (단위 : 백만원) |
|
구분 |
2021년 3분기 | 2020년 | 2019년 | 2018년 | |
|---|---|---|---|---|---|
|
자산 |
원재료비 |
- | - | - | - |
|
인건비 |
- | - | - | - | |
|
소 계 |
- | - | - | - | |
|
비용 처리 |
제조원가 |
- | - | - | - |
|
판관비 |
7,776 | 13,175 | 12,282 | 10,161 | |
| 소 계 | 7,776 | 13,175 | 12,282 | 10,161 | |
| 연구개발비용 합계 | 7,776 | 13,175 | 12,282 | 10,161 | |
| (정부보조금) | (41) | (309) | (839) | (635) | |
|
연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액 ×100] |
47.17% | 51.03% | 39.03% | 32.74% | |
| (출처: 당사 제시) |
| 주1) 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다. |
| 주2) 당사는 개발중인 원료의약품 및 신약 개발 프로젝트 별로 연구인력의 인건비, 실험 시약 및 재료비, 외주용역비 등을 집계하여 연구개발비를 관리하고 있으며, 국책과제 지원 대상 연구과제에 대해서는 국고보조금을 차감한 후 잔액을 손익계산서상의 경상연구개발비(판매비 및 관리비)로 처리하고 있습니다. |
당사는 경상연구개발비로 2020년 연결기준 13,175백만원, 2021년 3분기 연결기준 7,776백만원 사용하였으며, 이는 매출액 대비 각각 51.03%, 47.17% 수준이며, 최근 3개년 및 2021년 3분기 평균 매출액 대비 연구개발비의 비중은 42.5%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다.
(주12) 정정 전
또한 증권신고서 제출일 현재 당사는 기발행한 사모 전환사채와 전환우선주, 주식매수청구권이 존재하며, 전환 또는 행사 시 신주로 전환되기 때문에 주가희석이 발생할 수 있습니다. 당사가 발행한 제2회 무보증 사모 전환사채는 2021년 11월 06일부터 전환청구가능하며, 전환가능주수는 561,280주, 전환가액은 89,082원(시가 하락에 의한 최저 Re-fixing 고려 시 전환가능주식수 712,880주, 전환가액 70,138원)입니다. 또한 당사는 잠재주식수로 미전환 우선주 379,137주가 남아있는 상황이며, 시가하락에 의한 최저 Re-fixing 고려 시 505,386주가 전환가능합니다. 또한, 당사가 임직원에게 부여한 주식매수청구권의 미행사수량은 55,000주입니다. 이에 따라 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 995,417주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다.
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 89,082원 | 50,000 | 561,280 |
| 소 계 | 50,000 | 561,280 | ||||||||
| 주1) 발행 당시 전환가액은 100,196원이었으며, 시가하락에 의한 최저 Re-fixing 가격은 70,138원입니다. |
(주12) 정정 후
또한 증권신고서 제출일 현재 당사는 기발행한 사모 전환사채와 전환우선주, 주식매수청구권이 존재하며, 전환 또는 행사 시 신주로 전환되기 때문에 주가희석이 발생할 수 있습니다. 당사가 발행한 제2회 무보증 사모 전환사채는 2021년 11월 06일부터 전환청구가능하며, 전환가능주수는 703,422주, 전환가액은 71,081원(시가 하락에 의한 최저 Re-fixing 고려 시 전환가능주식수 712,880주, 전환가액 70,138원)입니다. 또한 당사는 잠재주식수로 미전환 우선주 379,137주가 남아있는 상황이며, 시가하락에 의한 최저 Re-fixing 고려 시 505,386주가 전환가능합니다. 또한, 당사가 임직원에게 부여한 주식매수청구권의 미행사수량은 55,000주입니다. 이에 따라 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 1,137,559주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다.
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 71,081원 | 50,000 | 703,422 |
| 소 계 | 50,000 | 703,422 |
||||||||
| 주1) 발행 당시 전환가액은 100,196원이었으며, 시가하락에 의한 최저 Re-fixing 가격은 70,138원입니다. |
(주13) 정정 전
3. 기업실사 일정 및 주요내용
| 일자 | 기업 실사 내용 |
|---|---|
| 2021년 08월 18일 | 가) 발행회사방문 - 유상증자 의사 및 자금조달 관련 논의 - 유상증자 필요성 검토 및 주요일정 협의 나) 회사 기본사항 점검 - 경영진 면담(경영철학, 회사연혁 등) - 사업내용 청취 및 주요제품 열람 |
| 2021년 08월 23일 ~ 08월 25일 |
가) 발행회사방문 - 실사 요청자료 송부 - 본사 방문 나) 회사 일반사항 관련 검토 - 정관검토 및 이사회 등 상법 절차 확인 - 경영진 평판 리스크 검토 - 회사의 사업 및 영업구조 관련 면담 |
| 2021년 08월 30일 ~ 09월 01일 |
가) 회사 기본사항 검토 - 정관 등 기본자료 수령 - 대략적인 자금 사용 목적 등에 관한 청취 - 발행 방식 및 조건 등에 관한 협의 - 금융당국으로부터 제재조치 여부 확인 - 근로기준법 위반행위, 소송진행 여부 확인 나) 산업에 관한 사항 검토 - 산업에 대한 이해 - 산업 경쟁상황, 시장규모, 성장주기 등 확인 - 법률 및 정부규제에 관한 사항 검토 - 시장 내 중대한 환경, 제도 변화요인 검토 다) 회사 지배구조에 관한 사항 검토 - 경영진의 변동내역 및 근무경력 검토 - 종속회사에 관한 사항 검토 - 최대주주의 지분율 및 경영권 안정성 검토 - 사내규정 및 내부통제시스템 확인 - 공시시스템 검토 및 담당자 면담 |
| 2021년 09월 06일 ~ 09월 09일 |
가) 영업에 관한 사항 검토 - 제품별 매출 현황, 부문별 수익성추이 확인 - 주요 공급처, 매입처에 관한 사항 - 향후 투자계획에 관한 사항 - 향후 수익성 개선 계획에 관한 사항 나) 재무에 관한 사항 검토 - 매출채권, 재고자산 현황 및 연령분석 - 기타채권 현황 및 회수 내역 분석 - 수익성/성장성/안정성 지표 분석 - 차입금 만기구조 분석 - 현금흐름 구조, 유동성 분석 - 향후 유동성 개선 계획에 관한 사항 - 주식연계채권 내역 확인 - 환위험 관리 현황 분석 다) 기타 사항 검토 - 발행시장 상황 검토 - 자금 조달금액, 공모가액의 적정성 검토 - 이사회의사록, 인수계약서 등 주요 서류 확인 - 최대주주 및 특수관계인 등 청약 여부 체크 |
| 2020년 09월 13일 ~ 09월 16일 |
- 실사보고서 작성 - 증권신고서 작성 가이드 및 추가자료 작성 |
| 2020년 09월 17일 ~ 10월 06일 |
- (정정) 증권신고서 추가자료 작성 |
4. 실사참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 케이비증권 | SME금융부 | 연대호 | 상무 | 증자업무 총괄 | 2021년 08월 18일 ~ 2021년 10월 06일 |
기업금융업무 등 23년 |
| 케이비증권 | SME금융부 | 김태헌 | 대리 | 기업실사 실무 | 2021년 08월 18일 ~ 2021년 10월 06일 |
기업금융업무 등 6년 |
| 케이비증권 | SME금융부 | 엄태호 | 대리 | 기업실사 실무 | 2021년 08월 18일 ~ 2021년 10월 06일 |
기업금융업무 등 6년 |
(중략)
| 긍정적 요인 | ▶ 동사는 동사의 신약 후보물질인 EC-18(PLAG) 작용기전을 통해 동사는 구강점막염(CRIOM), 신종코로나바이러스(COVID-19), 급성방사선증후군(ARS) 등 다양한 신약개발 파이프라인을 구성하고 있습니다. 특히, 동사의 구강점막염의 미국 FDA 임상 2상을 진행하고 있으며, 동사는 올해 임상 2상의 Topline(투약 후 안정성 결과) 결과 도출 및 이후 FDA의 혁신신약(BTD) 신청을 계획하고 있습니다. 이후 동사는 임상 3상 IND(임상시험계획승인) 신청 및 라이선스 아웃(기술이전)을 계획하고 있어, 동사가 보유하고 있는 파이프라인 중 구강점막염의 기술이전 가능성이 높을 것으로 판단하고 있습니다. ▶ 동사는 Zydus Cadila 간 LOI(Letter Of Intent) 체결을 통해 Zydus Cadila가 생산하는 pDNA 백신의 위탁생산(CMO)에 대해서 독점적 권리(exclusive right)를 우선 협의한 상황입니다. 본 내용에 따라, 동사는 2021년 10월 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 본격적인 백신 생산 및 Zydus Cadila사로부터 판매를 진행할 것으로 계획하고 있습니다. 동사는 LOI내용에 따라 2022년 부터 약 1억 5천만 dose(약의 1회분)의 백신을 생산할 예정이며, 향후 최대 7억 dose까지 생산할 수 있다는 내용이 포함되어 있습니다. 동사는 Zydus Cadila의 pDNA 백신의 위탁생산과 더불어, 라이선스 매입 또한 진행하고 있습니다. 동사는 라이선스 매입을 통해 ZyCoV-D의 인도 외 지역 허가 시 당사가 직접 공급하기 위함입니다. 종합적으로, 동사는 추후Zydus Cadila의 pDNA백신 위탁생산 및 라이선스 매입의 본 계약 체결 시 당사의 수익성은 개선될 것으로 판단하고 있습니다. ▶ 동사는 2021년 반기말 연결기준 55,650백만원의 부채가 있으며, 부채비율은 62.5%, 차입금의존도는 33.3%입니다. 동사는 지속적인 영업손실과 당기순손실 발생, 적자를 충당하기 위한 시장에서의 자금조달로 인해 최근 3년동안 연결기준으로 부채비율이 2018년말 14.0%에서 2020년말 70.8%, 차입금의존도가 2018년말 5.8%에서 2020년말 34.8%로 재무지표가 악화되었으나, 2021년 02월 약 300억원의 전환우선주를 발행하면서 2021년 반기말 연결기준으로 부채비율 62.5%, 차입금의존도 33.3%로 재무지표가 소폭 개선되었습니다. ▶ 동사의 매출채권 회전율의 경우 최근 3년 및 2021년 반기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 3.92회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 93.9일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다. |
| 부정적 요인 | ▶ 동사의 후보물질은 EC-18은 저분자 합성신약으로 동사의 주요 신약개발은 화학합성 의약품 위주로 진행되고 있습니다. 그러나, 전 세계 의약품 시장에서 바이오의약품이 차지하는 매출 비중은 지속적으로 증가하는 추세로 2018년 28%에서 2026년 바이오의약품은 의약품산업 내 비중이 35%까지 증가할 것 전망하며, 매출 상위 100대 제품 내 비중이 55%를 차지할 것을 전망하고 있습니다. 이는 의약품 시장의 중심이 합성의약품에서 바이오의약품으로 이동하는 추세임에 따라, 동사의 주요 신약 개발영역인 합성신약부문의 개발 등 악영향을 끼칠 수 있습니다. 또한, 전체 제약산업의 환경이 악화되거나 새로운 방식의 의약품 산업이 발전하게 될 경우 동사가 속해있는 합성 의약품 산업의 전망이 악화될 수 있으며, 이는 동사의 사업에 부정적인 영향을 미칠 수 있습니다. ▶ 동사의 코로나 19 치료제의 국내 임상 2상에서는 탐색적 임상시험의 제한된 소수의 대상자 참여와 증상 악화 같은 이상반응 발생 시 투약을 즉시 중단하도록 설계된 임상 디자인의 한계로, 총 14일 동안 1일 1회 경구 투약을 통해 확인하고자 했던 1차 평가변수인 경증 폐렴 환자에서 14일 이내에 산소 치료가 필요한 중증 폐렴 또는 급성호흡곤란증후군(ARDS)으로 이행되는 확률(%)은 투약군 간 통계적 유의성을 확인하지 못했습니다. 동사는 향후 코로나 19 환자 대상 임상 시험을 지속적으로 진행할 예정이나, 임상시험에 따른 지속적인 개발비 지출에도 불구하고 유의미한 임상 결과를 도출하지 못할 가능성도 존재합니다. 동사는 코로나19 치료제와 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 동사 제품의 임상 시험에서의 개발 실패의 가능성을 배제할 수 없으며, 개발 실패시 임상실험 진행에 투입된 비용과 시간에 비례하여 당사의 재무적 안정성에 급격한 훼손이 발생할 수 있습니다. ▶ 동사는 현재 진행중인 신약 파이프라인에 대해서, 임상 결과에 따라 국내외 제약사 및 바이오 기업에 기술이전함으로써 수익을 창출하는 사업모델을 구축하고 있으나, 과거 라이선스 아웃을 진행한 이력은 없는 상황입니다. 또한 추후 라이선스 아웃과 관련된 구체적인 계약 체결 등 계획도 부재한 상황입니다. 이는 지속적인 개발비 발생으로 당사 손익에 악영향을 끼칠 수 있습니다. ▶ 동사가 위탁생산하고자 하는 ZyCoV-D의 경우 백신의 효능이 ZyCoV-D의 경우 돌파감염율이 높은 델타변이가 유행한 시점에 대한 임상결과임을 감안해야 하나, 접종자의 66.6%에서 증상성 질환을 예방할 수 있다는 결과로 여타 코로나19 백신보다는 비교적 효능이 낮은 수치입니다. 또한, 한달 간격으로 3회 접종을 해야되는 등 여타 코로나 백신에 비해 상대적으로 부각될 수 있는 단점들이 존재하는 상황입니다. 이는 향후 당사의 LOI체결에 따른 주요 위탁생산 및 라이선스 매입 대상인 ZyCoV-D에 대해서 향후 백신의 시장성에 대해서 불확실성이 상존하는 주요 요인입니다. 특히, 현재 인도 내 긴급사용만 승인된 상태로, 현재 인도 외 백신사용이 불가한 상황임으로, 당사의 위탁생산 사업은 인도 내 코로나19 접종현황에 따라 크게 영향받으며, 현재 인도 내 코로나 19 백신 개발 현황에 유의할 필요가 있습니다. ▶ 동사는 신약물질 EC-18의 작용기전을 활용한 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 임상시험 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 2015년부터 지속적인 당기순손실이 발생하고 있습니다. 동사의 영업손실은 2018년 14,329백만원(영업이익률 : -46.2%), 2019년 16,402백만원(영업이익률 : -52.1%), 2020년 19,107백만원(영업이익률 : -74.0%), 2021년 반기 10,359백만원(영업이익률 : -94.8%)로, 매년 영업손실이 발생하고 있는 상황이며, 영업손익이 악화되는 추세를 보이고 있습니다. 이로 인하여 매년 당기순손실이 지속되고 있으며, 당기순손익도 악화되는 추세를 보이고 있는 상황입니다. ▶ 동사는 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 동사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 반기말 연결기준 30.7%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 반기에는 약 2.5회로 감소하고 있는 상황입니다. ▶ 동사의 최대주주인 (주)브릿지라이프사이언스가 배정물량의 약 10% 참여 시 유상증자 후 최대주주의 지분율은 현재 11.5%에서 7.5%까지 감소할 수 있으며, 특수관계인 중 2대주주인 손기영이 배정물량의 약 10% 참여 및 기타 특수관계인들은 미참여를 가정할 시 최대주주 및 특수관계인이 보유하고 있는 지분율은 증권신고서 제출일 전일 기준 18.7%에서 유상증자 후 12.1%까지 감소할 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 채무상환, 운영자금(원재료 구매 등), 시설자금 등으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
(주13) 정정 후
3. 기업실사 일정 및 주요내용
| 일자 | 기업 실사 내용 |
|---|---|
| 2021년 08월 18일 | 가) 발행회사방문 - 유상증자 의사 및 자금조달 관련 논의 - 유상증자 필요성 검토 및 주요일정 협의 나) 회사 기본사항 점검 - 경영진 면담(경영철학, 회사연혁 등) - 사업내용 청취 및 주요제품 열람 |
| 2021년 08월 23일 ~ 08월 25일 |
가) 발행회사방문 - 실사 요청자료 송부 - 본사 방문 나) 회사 일반사항 관련 검토 - 정관검토 및 이사회 등 상법 절차 확인 - 경영진 평판 리스크 검토 - 회사의 사업 및 영업구조 관련 면담 |
| 2021년 08월 30일 ~ 09월 01일 |
가) 회사 기본사항 검토 - 정관 등 기본자료 수령 - 대략적인 자금 사용 목적 등에 관한 청취 - 발행 방식 및 조건 등에 관한 협의 - 금융당국으로부터 제재조치 여부 확인 - 근로기준법 위반행위, 소송진행 여부 확인 나) 산업에 관한 사항 검토 - 산업에 대한 이해 - 산업 경쟁상황, 시장규모, 성장주기 등 확인 - 법률 및 정부규제에 관한 사항 검토 - 시장 내 중대한 환경, 제도 변화요인 검토 다) 회사 지배구조에 관한 사항 검토 - 경영진의 변동내역 및 근무경력 검토 - 종속회사에 관한 사항 검토 - 최대주주의 지분율 및 경영권 안정성 검토 - 사내규정 및 내부통제시스템 확인 - 공시시스템 검토 및 담당자 면담 |
| 2021년 09월 06일 ~ 09월 09일 |
가) 영업에 관한 사항 검토 - 제품별 매출 현황, 부문별 수익성추이 확인 - 주요 공급처, 매입처에 관한 사항 - 향후 투자계획에 관한 사항 - 향후 수익성 개선 계획에 관한 사항 나) 재무에 관한 사항 검토 - 매출채권, 재고자산 현황 및 연령분석 - 기타채권 현황 및 회수 내역 분석 - 수익성/성장성/안정성 지표 분석 - 차입금 만기구조 분석 - 현금흐름 구조, 유동성 분석 - 향후 유동성 개선 계획에 관한 사항 - 주식연계채권 내역 확인 - 환위험 관리 현황 분석 다) 기타 사항 검토 - 발행시장 상황 검토 - 자금 조달금액, 공모가액의 적정성 검토 - 이사회의사록, 인수계약서 등 주요 서류 확인 - 최대주주 및 특수관계인 등 청약 여부 체크 |
| 2021년 09월 13일 ~ 09월 16일 |
- 실사보고서 작성 - 증권신고서 작성 가이드 및 추가자료 작성 |
| 2021년 09월 17일 ~ 10월 06일 |
- (정정) 증권신고서 추가자료 작성 |
| 2021년 10월 07일 ~ 11월 16일 |
- 3분기 보고서 작성 현황 점검 및 주요 변동사항 파악 - Zydus Cadila CMO 및 라이선스 계약 현황 파악 - (정정) 증권신고서 추가자료 작성 |
4. 실사참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 케이비증권 | SME금융부 | 연대호 | 상무 | 증자업무 총괄 | 2021년 08월 18일 ~ 2021년 11월 16일 |
기업금융업무 등 23년 |
| 케이비증권 | SME금융부 | 김태헌 | 대리 | 기업실사 실무 | 2021년 08월 18일 ~ 2021년 11월 16일 |
기업금융업무 등 6년 |
| 케이비증권 | SME금융부 | 엄태호 | 대리 | 기업실사 실무 | 2021년 08월 18일 ~ 2021년 11월 16일 |
기업금융업무 등 6년 |
(중략)
| 긍정적 요인 | ▶ 동사는 동사의 신약 후보물질인 EC-18(PLAG) 작용기전을 통해 동사는 구강점막염(CRIOM), 신종코로나바이러스(COVID-19), 급성방사선증후군(ARS) 등 다양한 신약개발 파이프라인을 구성하고 있습니다. 특히, 동사의 구강점막염의 미국 FDA 임상 2상을 진행하고 있으며, 동사는 올해 임상 2상의 Topline(투약 후 안정성 결과) 결과 도출 및 이후 FDA의 혁신신약(BTD) 신청을 계획하고 있습니다. 이후 동사는 임상 3상 IND(임상시험계획승인) 신청 및 라이선스 아웃(기술이전)을 계획하고 있어, 동사가 보유하고 있는 파이프라인 중 구강점막염의 기술이전 가능성이 높을 것으로 판단하고 있습니다. ▶ 동사는 Zydus Cadila 간 LOI(Letter Of Intent) 체결을 통해 Zydus Cadila가 생산하는 pDNA 백신의 위탁생산(CMO)에 대해서 독점적 권리(exclusive right)를 우선 협의한 상황입니다. 본 내용에 따라, 동사는 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 본격적인 백신 생산 및 Zydus Cadila사로부터 판매를 진행할 것으로 계획하였습니다. 그러나 현재까지 위탁생산(CMO) 본 계약 내 세부조항 및 사전절차를 구체적으로 협의하고 있으나 계약 여부는 확정되지 않은 상황입니다. 다만, 동사는 LOI내용에 따라 2022년 부터 약 1억 5천만 dose(약의 1회분)의 백신을 생산할 예정이며, 향후 최대 7억 dose까지 생산할 수 있다는 내용이 포함되어 있습니다. 동사는 Zydus Cadila의 pDNA 백신의 위탁생산과 더불어, 라이선스 매입 또한 진행하고 있습니다. 동사는 라이선스 매입을 통해 ZyCoV-D의 인도 외 지역 허가 시 당사가 직접 공급하기 위함입니다. 종합적으로, 동사는 추후Zydus Cadila의 pDNA백신 위탁생산 및 라이선스 매입의 본 계약 체결 시 당사의 수익성은 개선될 것으로 판단하고 있습니다. ▶ 동사는 2021년 3분기 말 연결기준 57,679백만원의 부채가 있으며, 부채비율은 70.0%, 차입금의존도는 35.7%입니다. 동사는 지속적인 영업손실과 당기순손실 발생, 적자를 충당하기 위한 시장에서의 자금조달로 인해 최근 3년동안 연결기준으로 부채비율이 2018년말 14.0%에서 2020년말 70.8%, 차입금의존도가 2018년말 5.8%에서 2020년말 34.8%로 재무지표가 악화되었으나, 2021년 02월 약 300억원의 전환우선주를 발행하면서 2021년 3분기 말 연결기준으로 부채비율 70.0%로 부채비율이 소폭 개선되는 모습을 보이고 있습니다. ▶ 동사의 매출채권 회전율의 경우 최근 3년 및 2021년 3분기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 4.09회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 72.2일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다. |
| 부정적 요인 | ▶ 동사의 후보물질은 EC-18은 저분자 합성신약으로 동사의 주요 신약개발은 화학합성 의약품 위주로 진행되고 있습니다. 그러나, 전 세계 의약품 시장에서 바이오의약품이 차지하는 매출 비중은 지속적으로 증가하는 추세로 2018년 28%에서 2026년 바이오의약품은 의약품산업 내 비중이 35%까지 증가할 것 전망하며, 매출 상위 100대 제품 내 비중이 55%를 차지할 것을 전망하고 있습니다. 이는 의약품 시장의 중심이 합성의약품에서 바이오의약품으로 이동하는 추세임에 따라, 동사의 주요 신약 개발영역인 합성신약부문의 개발 등 악영향을 끼칠 수 있습니다. 또한, 전체 제약산업의 환경이 악화되거나 새로운 방식의 의약품 산업이 발전하게 될 경우 동사가 속해있는 합성 의약품 산업의 전망이 악화될 수 있으며, 이는 동사의 사업에 부정적인 영향을 미칠 수 있습니다. ▶ 동사의 코로나 19 치료제의 국내 임상 2상에서는 탐색적 임상시험의 제한된 소수의 대상자 참여와 증상 악화 같은 이상반응 발생 시 투약을 즉시 중단하도록 설계된 임상 디자인의 한계로, 총 14일 동안 1일 1회 경구 투약을 통해 확인하고자 했던 1차 평가변수인 경증 폐렴 환자에서 14일 이내에 산소 치료가 필요한 중증 폐렴 또는 급성호흡곤란증후군(ARDS)으로 이행되는 확률(%)은 투약군 간 통계적 유의성을 확인하지 못했습니다. 동사는 향후 코로나 19 환자 대상 임상 시험을 지속적으로 진행할 예정이나, 임상시험에 따른 지속적인 개발비 지출에도 불구하고 유의미한 임상 결과를 도출하지 못할 가능성도 존재합니다. 동사는 코로나19 치료제와 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 동사 제품의 임상 시험에서의 개발 실패의 가능성을 배제할 수 없으며, 개발 실패시 임상실험 진행에 투입된 비용과 시간에 비례하여 당사의 재무적 안정성에 급격한 훼손이 발생할 수 있습니다. ▶ 동사는 현재 진행중인 신약 파이프라인에 대해서, 임상 결과에 따라 국내외 제약사 및 바이오 기업에 기술이전함으로써 수익을 창출하는 사업모델을 구축하고 있으나, 과거 라이선스 아웃을 진행한 이력은 없는 상황입니다. 또한 추후 라이선스 아웃과 관련된 구체적인 계약 체결 등 계획도 부재한 상황입니다. 이는 지속적인 개발비 발생으로 당사 손익에 악영향을 끼칠 수 있습니다. ▶ 동사가 위탁생산하고자 하는 ZyCoV-D의 경우 백신의 효능이 ZyCoV-D의 경우 돌파감염율이 높은 델타변이가 유행한 시점에 대한 임상결과임을 감안해야 하나, 접종자의 66.6%에서 증상성 질환을 예방할 수 있다는 결과로 여타 코로나19 백신보다는 비교적 효능이 낮은 수치입니다. 또한, 한달 간격으로 3회 접종을 해야되는 등 여타 코로나 백신에 비해 상대적으로 부각될 수 있는 단점들이 존재하는 상황입니다. 이는 향후 당사의 LOI체결에 따른 주요 위탁생산 및 라이선스 매입 대상인 ZyCoV-D에 대해서 향후 백신의 시장성에 대해서 불확실성이 상존하는 주요 요인입니다. 특히, 현재 인도 내 긴급사용만 승인된 상태로, 현재 인도 외 백신사용이 불가한 상황임으로, 당사의 위탁생산 사업은 인도 내 코로나19 접종현황에 따라 크게 영향받으며, 현재 인도 내 코로나 19 백신 개발 현황에 유의할 필요가 있습니다. ▶ 동사는 신약물질 EC-18의 작용기전을 활용한 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 임상시험 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 2015년부터 지속적인 당기순손실이 발생하고 있습니다. 동사의 영업손실은 2018년 14,329백만원(영업이익률 : -46.2%), 2019년 16,402백만원(영업이익률 : -52.1%), 2020년 19,107백만원(영업이익률 : -74.0%), 2021년 3분기 15,545백만원(영업이익률 : -94.3%)로, 매년 영업손실이 발생하고 있는 상황이며, 영업손익이 악화되는 추세를 보이고 있습니다. 이로 인하여 매년 당기순손실이 지속되고 있으며, 당기순손익도 악화되는 추세를 보이고 있는 상황입니다. ▶ 동사는 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 동사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 3분기 말 연결기준 32.8%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 3분기에는 약 2.6회로 감소하고 있는 상황입니다. ▶ 동사의 최대주주인 (주)브릿지라이프사이언스가 배정물량의 약 10% 참여 시 유상증자 후 최대주주의 지분율은 현재 11.5%에서 7.5%까지 감소할 수 있으며, 특수관계인 중 2대주주인 손기영이 배정물량의 약 10% 참여 및 기타 특수관계인들은 미참여를 가정할 시 최대주주 및 특수관계인이 보유하고 있는 지분율은 증권신고서 제출일 전일 기준 18.7%에서 유상증자 후 12.1%까지 감소할 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 채무상환, 운영자금(원재료 구매 등), 시설자금 등으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
(주14) 정정 전
1) 채무상환자금
당사는 해외 인도법인인 Zydus Cadila사가 세계 최초로 개발한 pDNA 백신(ZyCoV-D)의 위탁생산(CMO)과 관련하여 생산 공급 의향서(LOI, Letter of Intent)를 체결한 상태로, 당사는 2021년 10월 중 위탁생산(CMO) 본 계약 및 라이선스 계약을 체결할 것으로 예상하고 있습니다. 10월 계약 시 당사는 약 4개월 기준 위탁생산(CMO)에 필요한 운전자금(원/부자재 등)으로 약 2,280억원으로 예상하고 있습니다. 이를 충당하기 위해 당사는 본 건 유상증자의 납입 전 대표주관사인 KB증권을 통해 유상증자 납입 후 3영입일 내 상환을 조건으로 1,500억원의 자금을 단기 차입할 예정입니다.
| [단기차입금의 주요 금융조건] |
| 구분 | 내용 |
|---|---|
| 대주 | KB증권(주) |
| 대출금액 | 금 일천오백억원(\ 150,000,000,000) |
| 차입예정일 | 2021년 10월 중 |
| 만기 | 차입일로부터 6개월 |
| 대출금리 | 고정 (연) 3.90% |
| 자금사용 목적 | Zydus Cadila사 pDNA 백신 위탁생산(CMO)에 따른 원/부자재 구매 |
| 의무 상환 | 유상증자 대금납입 후 3영업일 이내 조기상환 |
| (출처: 당사 제시) |
상기 차입은 당사와 Zydus Cadila 간 본 계약 체결 이후인 10월 중으로 예상하고 있으며, 대표주관사인 KB증권을 통해 단기 차입할 예정입니다. 단기 차입진행 완료 시 본 증권신고서를 통해 추가 안내 예정입니다.
이와 관련하여, 당사가 추진중인 Zydus Cadila 사와 관련된 세부내용은 '사업위험 마.', '사업위험 바.'를 참고해주시기 바라며, 본 단기차입을 통해 사용하고자 하는 구체적 내용은 하기 운영자금 사용용도를 참고해 주시기 바랍니다.
(중략)
■ 자금 사용의 필요성
당사가 매입하고자 하는 라이선스의 주요 백신은 ZyCoV-D로, 현재 임상 3상의 중간 결과에 따라 인도 DCGI에서 긴급사용승인이 된 상태입니다. 현재 이 외에는 사용이 허가된 국가는 없으나, 2021년 10월 세계보건기구(WHO)에 긴급사용신청을 진행할 예정입니다. 만일, 세계보건기구(WHO)의 긴급사용승인이 될 경우 COVAX Facility(코백스 퍼실리티)를 통해서 개발도상국 등 백신 제공이 가능합니다.
코백스 퍼실리티는 세계에 코로나19 백신을 평등하게 공급하기 위해 설립된 세계 백신 공동 분배 프로젝트로, 세계백신면역연합, 유니세프, 세계보건기구등이 주도하고 있으며 코로나19 백신이 세계 모든 나라에 공평하게 공급되는 것을 목표로 하고 있습니다. 이에 따라 당사는 향후 WHO의 긴급사용승인 시 독점적 권리를 통해 인도 외 타 국가의 시장선점이 가능하고 수익성 또한 제고할 수 있을 것으로 판단하고 있습니다. 다만, WHO의 긴급사용승인은 신청 예정 단계로, 현재 WHO 긴급사용승인과 관련하여 확정된 사항은 없다는 점을 유의해 주시기 바랍니다.
■ 자금 사용의 세부 내역
당사는 상기 목적에 따라, Zydus Cadila사와 체결한 LOI 내용을 토대로 2021년 10월 상기 위탁생산(CMO) 계약과 더불어 Zydus Cadila사의 DNA 백신의 독점 라이선스 계약을 체결할 예정입니다. 당사는 라이선스 본계약 체결 전으로, 현재까지 구체적으로 정해진 사항은 양사가 체결한 LOI 상 Zydus Cadila사가 개발한 코로나 DNA백신에 대해서 독점적 권리(exclusive right) 부여 외 로열티 및 마일스톤 지급 등 대한 구체적인 사항은 미확정인 상태이나, 현재 당사가 예상하는 라이선스 계약의 주요 내용은 아래와 같습니다. LOI와 관련된 사항은 '사업위험 마.'를 참고해 주시기 바랍니다.
(주14) 정정 후
1) 채무상환자금
당사는 해외 인도법인인 Zydus Cadila사가 세계 최초로 개발한 pDNA 백신(ZyCoV-D)의 위탁생산(CMO)과 관련하여 생산 공급 의향서(LOI, Letter of Intent)를 체결한 상태로, 당사는 위탁생산(CMO) 본 계약 및 라이선스 계약을 체결할 것으로 예상하고 있습니다. 본 계약 시 당사는 약 4개월 기준 위탁생산(CMO)에 필요한 운전자금(원/부자재 등)으로 약 2,280억원으로 예상하고 있습니다. 이를 충당하기 위해 당사는 본 건 유상증자의 납입 전 대표주관사인 KB증권을 통해 유상증자 납입 후 3영입일 내 상환을 조건으로 1,500억원의 자금을 단기 차입할 예정입니다.
다만, 최초 증권신고서 제출 시 본 단기자금대출일은 위탁생산(CMO) 본계약 체결예정일인 2021년 10월 이후로 예상하였으나, 현재 위탁생산(CMO) 본계약 체결일정이 지연되고 있어 현재까지 단기자금대출이 진행되지 않은 상황입니다. 단기자금대출은 위탁생산(CMO)의 본 계약 체결 이후 진행될 예정이나, 현재까지 본 계약 체결일이 확정되지 않아 단기자금대출일 또한 미정인 상황입니다.
| [단기차입금의 주요 금융조건] |
| 구분 | 내용 |
|---|---|
| 대주 | KB증권(주) |
| 대출금액 | 금 일천오백억원(\ 150,000,000,000) |
| 차입예정일 | 본 계약 체결 이후(미정) |
| 만기 | 차입일로부터 6개월 |
| 대출금리 | 고정 (연) 3.90% |
| 자금사용 목적 | Zydus Cadila사 pDNA 백신 위탁생산(CMO)에 따른 원/부자재 구매 |
| 의무 상환 | 유상증자 대금납입 후 3영업일 이내 조기상환 |
| (출처: 당사 제시) |
상기 차입은 당사와 Zydus Cadila 간 본 계약 체결 이후로 예상하고 있으며, 대표주관사인 KB증권을 통해 단기 차입할 예정입니다. 단기 차입진행 완료 시 본 증권신고서를 통해 추가 안내 예정입니다.
이와 관련하여, 당사가 추진중인 Zydus Cadila 사와 관련된 세부내용은 '사업위험 마.', '사업위험 바.'를 참고해주시기 바라며, 본 단기차입을 통해 사용하고자 하는 구체적 내용은 하기 운영자금 사용용도를 참고해 주시기 바랍니다.
(중략)
■ 자금 사용의 필요성
당사가 매입하고자 하는 라이선스의 주요 백신은 ZyCoV-D로, 현재 임상 3상의 중간 결과에 따라 인도 DCGI에서 긴급사용승인이 된 상태입니다. 현재 이 외에는 사용이 허가된 국가는 없으나, 향후 세계보건기구(WHO)에 긴급사용신청을 진행할 예정입니다. 만일, 세계보건기구(WHO)의 긴급사용승인이 될 경우 COVAX Facility(코백스 퍼실리티)를 통해서 개발도상국 등 백신 제공이 가능합니다.
코백스 퍼실리티는 세계에 코로나19 백신을 평등하게 공급하기 위해 설립된 세계 백신 공동 분배 프로젝트로, 세계백신면역연합, 유니세프, 세계보건기구등이 주도하고 있으며 코로나19 백신이 세계 모든 나라에 공평하게 공급되는 것을 목표로 하고 있습니다. 이에 따라 당사는 향후 WHO의 긴급사용승인 시 독점적 권리를 통해 인도 외 타 국가의 시장선점이 가능하고 수익성 또한 제고할 수 있을 것으로 판단하고 있습니다. 다만, WHO의 긴급사용승인은 신청 예정 단계로, 현재 WHO 긴급사용승인과 관련하여 확정된 사항은 없다는 점을 유의해 주시기 바랍니다.
■ 자금 사용의 세부 내역
당사는 상기 목적에 따라, Zydus Cadila사와 체결한 LOI 내용을 토대로 상기 위탁생산(CMO) 계약과 더불어 Zydus Cadila사의 DNA 백신의 독점 라이선스 계약을 체결할 예정입니다. 다만, 최초 증권신고서 제출 시 2021년 10월 중으로로 예상했던 계약체결이 지연되고 있는 상황으로, 현재 당사는 라이선스 본계약 체결 전인 상황입니다. 이에 따라 현재까지 구체적으로 정해진 사항은 양사가 체결한 LOI 상 Zydus Cadila사가 개발한 코로나 DNA백신에 대해서 독점적 권리(exclusive right) 부여 외 로열티 및 마일스톤 지급 등 대한 구체적인 사항은 미확정인 상태이나, 현재 당사가 예상하는 라이선스 계약의 주요 내용은 아래와 같습니다. LOI와 관련된 사항은 '사업위험 마.'를 참고해 주시기 바랍니다.
【 대표이사 등의 확인 】
 |
|
(enzychem) 대표이사 확인서명_21.11.16 |
증 권 신 고 서
| ( 지 분 증 권 ) |
| [증권신고서 제출 및 정정 연혁] |
| 제출일자 | 문서명 | 비고 |
|---|---|---|
| 2021년 09월 17일 | 증권신고서(지분증권) | 최초 제출 |
| 2021년 10월 06일 | [기재정정] 증권신고서 | 기재 정정(파란색) |
| 2021년 10월 22일 | [기재정정] 증권신고서 | 1차 발행가액 확정(초록색) |
| 2021년 11월 16일 | [기재정정] 증권신고서 | 3분기보고서 제출에 따른 정정(보라색) |
| 금융위원회 귀중 | 2021년 09월 17일 |
| 회 사 명 : |
(주)엔지켐생명과학 |
| 대 표 이 사 : |
손기영 |
| 본 점 소 재 지 : |
충청북도 제천시 바이오밸리로 59 (왕암동) |
| (전 화) 043-652-2845 | |
| (홈페이지) www.enzychem.co.kr | |
| 작 성 책 임 자 : | (직 책) 부회장 (성 명) 김혜경 |
| (전 화) 043-652-2845 | |
| 모집 또는 매출 증권의 종류 및 수 : | 기명식 보통주 5,300,000주 | |
| 모집 또는 매출총액 : | 301,570,000,000 | 원 |
| 증권신고서 및 투자설명서 열람장소 |
| 가. 증권신고서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 나. 투자설명서 |
| 전자문서 : 금융위(금감원) 전자공시시스템 → http://dart.fss.or.kr |
| 서면문서 : (주)엔지켐생명과학 → 충청북도 제천시 바이오밸리로 59 (왕암동) 케이비증권(주) → 서울특별시 영등포구 여의나루로 50 |
【 대표이사 등의 확인 】
![이미지: [enzychem] 대표이사등의 확인-0001](%5Benzychem%5D%20%EB%8C%80%ED%91%9C%EC%9D%B4%EC%82%AC%EB%93%B1%EC%9D%98%20%ED%99%95%EC%9D%B8-0001.jpg) |
|
[enzychem] 대표이사등의 확인-0001 |
요약정보
1. 핵심투자위험
| 구 분 | 내 용 |
| 사업위험 | 가.코로나 19로 인한 경기 침체 및 불확실성 세계 각국은 백신개발과 코로나19 확산 방지에 총력을 다하고 있습니다. 그러나 코로나19는 여전히 종식되지 않았으며 각종 변이 코로나19가 확산되는 등 장기화될 가능성이 존재합니다. 이에 정책 당국은 강도 높은 경기 부양책 및 자본시장 안정화 대책 등으로 실물 시장과 금융 시장에 전례 없는 지원을 하고 있습니다. 다만, 코로나19로 인한 경제활동 둔화가 장기화될 경우, 소비 위축 및 투자 이연 등에 따른 경기 침체 가능성이 높아질 수 있습니다. 정부의 지속적인 경기 부양 정책에도 불구하고 경기가 악화될 가능성은 존재합니다. 이처럼 경기회복에 대한 불확실성이 높은 경우에는 투자 감소로 인하여 신약 개발의 진행 속도가 더뎌져 당사 수주 감소로 이어질 수 있습니다. 투자자 여러분들께서는 코로나19의 장기화로 인한 거시경제에 부정적인 흐름이 발현될 경우 당사의 매출과 수익성이 부정적인 영향을 받을 수 있음을 유의하여 주시기 바랍니다. 나.의약품 사업 성장성과 관련된 위험 당사는 자체 개발한 신약 후보물질인 EC-18을 기반으로 다양한 신약 개발 파이프라인을 보유하고 있으며, 신약으로 개발중인 주요 적응증은 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia) 등이 있습니다. 당사의 후보물질은 EC-18은 저분자 합성신약으로 당사의 주요 신약개발은 화학합성 의약품 위주로 진행되고 있습니다. 2020년 의약품 시장은 코로나 19 팬데믹의 영향으로 만성질환과 코로나19 치료제 수요가 증가했으나, 신약개발 지연과 글로벌 공급망의 변화는 시장 성장폭을 제한하고 있는 상황입니다. 특히, 코로나19 영향에 따른 글로벌 공급망의 취약성, 바이오의약품 시장의 일시적 침체 등이 시장에 부정적인 영향을 미치게 되었습니다. 전 세계 의약품 시장에서 바이오의약품이 차지하는 매출 비중은 지속적으로 증가하는 추세로 2018년 28%에서 2026년 바이오의약품은 의약품산업 내 비중이 35%까지 증가할 것 전망하며, 매출 상위 100대 제품 내 비중이 55%를 차지할 것을 전망하고 있습니다. 의약품 시장의 중심이 합성의약품에서 바이오의약품으로 이동하는 추세임에 따라, 당사의 주요 신약 개발영역인 합성신약부문의 개발 등 악영향을 끼칠 수 있습니다. 또한, 전체 제약산업의 환경이 악화되거나 새로운 방식의 의약품 산업이 발전하게 될 경우 당사가 속해있는 합성 의약품 산업의 전망이 악화될 수 있으며, 이는 당사의 사업에 부정적인 영향을 미칠 수 있습니다. 다. 임상시험 실패 및 지연에 따른 위험 다. 한국 임상의 경우, 2018년 3월 발표된 생명공학정책연구센터의 보고서에 따르면 임상 1상에서부터 신약승인까지의 성공률은 바이오의약품의 경우 11.5%로 확인되었습니다. 단계별로 비임상 약 8년, 임상 6.5년, 허가 검토에 약 0.5년 정도의 시간이 필요합니다. 한국바이오경제연구센터에서는 임상1부터 승인까지 대략 7년의 시간이 소요된다는 결과를 나타냈습니다. 임상 1상 단계에 있는 신약 파이프라인 10개 중 1개 정도만이 최종적으로 품목허가를 받아 시장에 출시되는 것입니다. 또한 전임상 단계에서 안전성 및 효능이 검증되었음에도 불구하고 각 임상 단계에서 부작용 등 예상치 못한 결과로 인하여 의약품 개발에 실패할 위험이 상존합니다. FDA의 경우, 모든 임상들에 대해 임상 1상에서 신약승인까지의 신약 승인 성공률은 평균 9.6%입니다. 임상 1상 통과 가능성은 63.2%이고, 임상 2상은 각 임상 단계별로 가장 낮은 30.7%입니다. 임상 3상은 58.1%이고, 신약 승인 단계 인 NDA/BLA는 가장 높은 85.3%로 나타나고 있습니다. 또한, 상기의 신약개발은 코로나 19에 따른 전 세계적 팬데믹으로 악영향을 받는 것으로 파악되고 있으며, 특히 임상시험 건수의 감소 등에 따라 신약개발이 지연되는 상황이 발생하고 있습니다. 메디데이터에 따르면, 2019년 10월을 COVID-19 이전 베이스라인으로 볼 때, 전 세계적으로 2020년 6월 말 기준 신규 임상시험 참여 시험대상자 수가 약 30% 감소하였으며, 2020년 4월 기준으로는 전 세계적으로 약 70%의 감소가 나타나고 있습니다. 이는 최근일자인 2021년 2월 기준으로도, 데이터 및 분석업체인인 글로벌데이터에 따르면 전세계적으로 1,200건이 넘는 임상시험이 코로나19로 인해 지장을 받고 있으며, 특히 항암제 등 종양 관련 임상시험에 큰 영향을 받고 있어 COVID-19가 임상시험의 지연 등 악영향을 지속적으로 끼치고 있는 상황입니다. 당사는 당사의 신약 후보물질인 EC-18(PLAG)을 기반으로 다양한 신약개발 파이프라인을 구성하고 있습니다. 당사는 코로나19 치료제, 구강점막염 치료제 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 당사가 진행중인 파이프라인에 대해서, 상기 언급한 것처럼 코로나 19에 따라 임상계획 당시 예상하지 못하였던 변수로 인하여 임상시험 개시 승인이 지연되거나, 코로나 19로 인한 외부 활동 위축으로 임상 시험에 필요한 환자등록이 원활하지 않을 문제가 발생할 수 있습니다. 또한, 당사 제품의 임상 시험에서의 개발 실패의 가능성을 배제할 수 없으며, 개발 실패시 임상실험 진행에 투입된 비용과 시간에 비례하여 당사의 재무적 안정성에 급격한 훼손이 발생할 수 있습니다. 따라서 당사에서 진행 중인 신약개발 역시 큰 실패위험 속에 진행되고 있으며, 신약개발에 성공하지 못할 경우 이는 당사의 미래 수익성과 주가에 부정적인 영향을 미칠 수 있음을 알려드립니다. 라. 기술이전 계약(license-out) 체결 실패 위험 글로벌 신약 개발 시 평균 1조~2조 원 상당의 개발 비용과 평균 10~15년 정도의 장기간의 개발기간 소요됩니다. 신약개발은 크게 후보물질 탐색, 前임상, 임상시험 단계로 구분되는데, 임상 단계는 6~7년이 걸리고, 전문역량과 고비용이 요구되는 단계로 전체 신약개발 비용의 약 70% 소요됩니다. 당사는 현재 진행중인 신약 파이프라인에 대해서, 임상 결과에 따라 국내외 제약사 및 바이오 기업에 기술이전함으로써 수익을 창출하는 사업모델을 구축하고 있으나, 과거 라이선스 아웃을 진행한 이력은 없는 상황입니다. 또한 추후 라이선스 아웃과 관련된 구체적인 계약 체결 등 계획도 부재한 상황이나, 당사의 파이프라인 중 구강점막염(CRIOM) 및 코로나19 치료제 등을 향후 잠재적인 라이선스 아웃 후보로 판단하고 있습니다. 당사는 기술이전계약을 통해 제품이 출시되기 이전에 회사의 재무안정성을 확보함과 동시에 지속적인 성장 발판을 마련하고자 하나, 높은 비용과 임상실패율, 오랜시간이 소요되는 신약개발 사업의 특성상 기술이전계약을 체결한다해도 그 자체로 매출의 인식으로 연결되는 것은 아니며, 기 체결된 기술이전계약이 임상시험 실패에 의하여 불가피하게 중도 계약해지 될 수도 있습니다. 또한, 기술이전을 통해 신약개발을 진행하던 기업이 추가개발에 실패하거나 원활한 진행이 되지 않는 경우, 반환의무가 있는 계약금이나 마일스톤 등은 기술이전을 완료했더라도 지급의무가 발생할 수 있습니다. 기술이전한 파트너사는 당사가 통제할 수 없는 부분이기 때문에 파트너사의 임상수행 능력, 파트너사 내부적인 이벤트 등의 변수로 임상진행을 중단할 가능성도 존재합니다. 이로 인해 기술이전 이후 당사가 예상하는 수준의 매출액 및 수익이 발생하지 않을 수 있습니다. 또한, 최종적으로 기술이전에 실패할 확률도 배제할 수 없습니다. 투자자께서는 이점 유의하시기 바랍니다. 마.코로나 19 pDNA백신 관련 신규사업 추진에 따른 위험 당사는 Zydus Cadila 간 LOI(Letter Of Intent) 체결을 통해 Zydus Cadila가 생산하는 pDNA 백신의 위탁생산(CMO)에 대해서 독점적 권리(exclusive right)를 우선 협의한 상황입니다. 이에 당사는 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 백신의 본격적인 생산 및 Zydus Cadila사에 판매를 진행할 것으로 계획하고 있으나, 2021년 10월 중 예상했던 계약 체결이 현재까지 진행되지 않은 상황입니다. 이에 따라, 본 백신 물량은 본 계약 체결 전으로 요청하는 백신 생산 물량이 변동할 수 있으며, 판매단가, 시점 등 구체적으로 정해진 사항은 현재까지 없는 상황입니다. 따라서 LOI 체결이 향후 백신의 위탁생산(CMO) 생산의 구체적 내용을 담보하는 것이 아니며, 본 계약 체결 시 주요사항의 변경 가능성이 상존하고 있습니다. 또한 본 계약 체결이 지속적으로 지연될 경우, 본 유상증자 대금의 자금집행일정 또한 지연될 가능성 또한 존재합니다. 당사는 위탁생산(CMO) 계약과 더불어 Zydus Cadila사의 DNA 백신의 독점 라이선스 계약을 체결할 예정입니다. 현재 당사는 라이선스 본 계약 체결 전으로 현재까지 구체적으로 정해진 사항은 양사가 체결한 LOI 상 Zydus Cadila사가 개발한 코로나 DNA백신에 대해서 독점적 권리(exclusive right) 부여 외 로열티 및 마일스톤 지급 등 대한 구체적인 사항은 미정인 상황입니다. 또한, 당사의 주요사업은 신약개발사업 및 원료의약품(API) 사업으로 의약품의 위탁생산(CMO) 경험이 없는 상황으로 향후 위탁생산 등 진행에 있어도 여러가지 변수가 상존하는 상황입니다. 다만, 당사는 Zydus Cadila사의 긴급승인에 따른 생산 필요물량을 수임하기 위해, 대규모 cGMP 바이오플랜트 및 제조원액의 Fill and Finish가 가능한 "엔지켐 컨소시엄"을 구성하여 시설 및 인력 등을 독점적으로 사용할 수 있는 위탁 생산 설비 등에 대해 사전 약정을 체결한 상황입니다. 당사는 컨소시엄 내에서 Zydus Cadila의 백신 위탁생산을 총괄할 예정으로, 당사는 Zydus Cadila의 Order 접수 및 원료 수급, 최종 완제품 공급 등을 담당하며, 백신 원액(DS) 생산은 엔지켐 컨소시엄 내 A사가, 백신 포장(Fill/Finish)은 B, C사가 담당할 예정입니다. 구체적으로, 당사는 Zydus Cadila와의 위탁생산(CMO)을 위하여 구성한 '엔지켐 컨소시엄'을 총괄하며, 모든 계약 체결의 당사자는 엔지켐생명과학입니다. 현재 Zydus Cadila로부터 대량의 생산 물량 주문이 예상됨에 따라 당사는 위탁생산(CMO) 본 계약이 체결되면 '엔지켐 컨소시엄' 내의 생산 담당 파트와 다시 재위탁 계약을 체결할 것입니다. 또한, 당사는 원액 벌크(DS) 및 완제 fill-finish(DP) 생산을 위한 원부자재(원재료)는 Zydus Cadila와 협력하여 매입·조달할 예정입니다. 원부자재 매입·조달, 원액 벌크(DS) 및 완제 fill-finish(DP) 진행 후 품질보증(QA), 출하 승인, 매출까지 모든 프로세스에 대해 당사가 총괄하여 실행할 계획입니다. 상기에 따라, LOI에 기반한 Zydus Cadila 간 위탁생산(CMO)의 본 계약 체결과 동시에, 위탁생산에 필요한 시설 및 인력 등 독점적 사용에 대한 구체적 계약을 컨소시엄 구성원들과 체결할 예정입니다. 현재로써는 사전 약정에 따라 당사와 컨소시엄 구성원들과 본 계약 체결 가능성이 높을 것으로 보이나, 이 또한 확정적인 사항이 아니기 때문에 계약 조건 및 일정 등 변동이 발생할 수 있습니다. 당사는 또한, 현재 오송지역 내 바이오플랜트 신축을 계획하고 있으며, 당사는 오송신축 설비 완공 시 컨소시엄 내 생산 담당 파트와 같이 본 Zydus Cadila의 백신 위탁생산을 병행할 예정입니다. 당사는 Zydus Cadila 간 LOI 체결로, 추후 Zydus Cadila의 pDNA백신 위탁생산 및 라이선스 매입의 본 계약 체결 시 당사의 수익성은 개선될 것으로 판단하고 있습니다. 그러나 현재 본 계약이 체결된 상황이 아니기 때문에,투자자 여러분께서는 Zydus Cadila 및 컨소시엄 간 본 계약 체결현황을 반드시 확인하시어 투자에 임해주시기 바랍니다. 바.pDNA 백신의 불확실성에 따른 위험 Zydus Cadila가 개발한 ZyCoV-D는 세계 최초의 DNA 기반 코로나 19 백신으로, 긴급사용이 승인된 주요 배경으로는 인도 자국 내 임상 3상 중간 결과가 발표되었기 때문입니다. Zydus Cadila 측에서는 본 임상 3상 결과 중에서 ZyCoV-D가 변이 바이러스, 특히 전염성이 높은 델타 변종에 대한 효능이 있는 것으로 판단하고 있습니다. 다만, ZyCoV-D의 경우 백신의 효능이 ZyCoV-D의 경우 돌파감염율이 높은 델타변이가 유행한 시점에 대한 임상결과임을 감안해야 하나, 접종자의 66.6%에서 증상성 질환을 예방할 수 있다는 결과로 여타 코로나19 백신보다는 비교적 효능이 낮은 수치입니다. 또한, 한달 간격으로 3회 접종을 해야되는 등 여타 코로나 백신에 비해 상대적으로 부각될 수 있는 단점들이 존재하는 상황입니다. 이는 향후 당사의 LOI체결에 따른 주요 위탁생산 및 라이선스 매입 대상인 ZyCoV-D에 대해서 향후 백신의 시장성에 대해서 불확실성이 상존하는 주요 요인입니다. ZyCoV-D는 현재 인도 내 긴급사용만 승인된 상태로, 현재 인도 외 백신사용이 불가한 상황임으로, 당사의 위탁생산 사업은 인도 내 코로나19 접종현황에 따라 크게 영향 받을 것으로 판단됩니다. 인도 내 코로나 확진자 수는 2021년 3월 중순 이후 코로나19 신규 감염자 수가 폭발적으로 증가하면서, 인도는 2차 대유행에 진입하였습니다. 그러나 인도 정부의 확산방지 정책 등에 힘입어 2021년 5월 이후 인도 내 일일 확진자 수 및 사망자수는 감소하고 있는 것으로 파악되고 있어, 현재 인도는 코로나19의 2차 대유행 정점을 지나 안정화 추세로 진입한 것으로 판단됩니다. 현재 인도 정부의 적극적인 코로나19 백신 접종 진행으로 2021년 9월 말 기준 총 접종 횟수는 8.8억 회, 최종 접종 완료된 횟수는 2.34억 회, 접종완료 인구 비율은 17.0%로 추산하고 있습니다. 현재 인도 정부는 접종완료 인구 비율을 확대하기 위해 백신 확보에 총력을 다하고 있는 상황으로, 본 배경에 따른 인도 내 적극적인 백신 개발 추세는 ZyCoV-D의 인도 내 경쟁력은 향후 인도 내 코로나 19 백신의 지속적인 개발에 기술력이 우수한 백신이 추가로 개발될 가능성도 존재한다는 것을 의미합니다. 이에 따라 인도시장 내 제품경쟁력이 저하될 가능성도 존재합니다. 글로벌 DNA백신 시장의 경우, DNA백신은 현재 대부분 임상 또는 비임상 단계에 있어 전 세계 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. 종합적으로, 당사가 위탁생산하고자 하는 자이더스 카딜라(Zydus Cadila)의 자이코브-디(ZyCoV-D)가 세계 첫 DNA 기반 코로나19 백신이 긴급사용 승인받은 바 외엔 아직까지 제품화 사례가 충분히 없어 향후 성공가능성은 매우 불확실합니다. 이에 계속적인 비용과 시간이 소모될 것으로 예상되며 이는 당사에 치명적인 타격이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. 사.원료의약품(API) 시장에 따른 위험 전 세계 원료의약품(API) 시장은 2020년 1,871억 4,000만 달러에서 연평균 성장률 6.10%로 증가하여, 2025년에는 2,516억 7,000만 달러에 이를 것으로 전망하고 있습니다.국내의 경우, 식품의약품안전처에 따르면 2019년 원료의약품 생산 업체는 총 263개사로 원료의약품 시장은 시장규모 대비 과다한 업체의 시장 참여로 공급 과잉 상태 및 높은 경쟁 강도가 지속되고 있습니다. 원료의약품의 국내 자급도는 2015년 24.5%에서 2017년까지 35.4%까지 상승하였으나, 2018년 26.4%, 2019년 16.2%를 기록하며 하락하는 추세를 보이고 있습니다. 원료의약품 자급도는 2019년에는 20%에도 못 미치는 등 여전히 수입의존도가 높은 편으로 나타났습니다. 원료자급도가 낮은 이유는 국내 원료 생산이 품질측면에서는 유럽산에 비해 경쟁력이 부족하고, 가격 측면에서는 인도나 중국산에 비해 경쟁력이 취약한 것에 기인합니다. 그럼에도 불구하고 당사의 경우, 당사의 원료의약품 주요 매출처는 대부분 국내업체로, 2021년 3분기 매출액 기준 국내 매출이 총 매출액의 98.9%를 차지하고 있습니다. 또한, 국내에서는 2012년 부터 시행하고 있는 보험약가 인하정책에 따라 현재까지 완제 제약회사들은 제조원가 비용을 낮추기 위해 해외 저가 원료를 선택하는 추세입니다. 이에 따라 국내 원료의약품 업체들은 실적 부진에 따른 R&D 투자 여력 부진으로 점차 원가경쟁력을 상실하게 되는 악순환이 발생되고 있습니다. 이는 현재 국내 원료의약품의 경쟁력이 하락 추세인 상황을 감안한다면 당사의 원료의약품 사업에 악영향을 끼칠 수 있습니다. 아.CMO 사업 부문과 관련된 위험 당사는 '사업위험 마'에서 언급하였듯이, 현재 당사는 ZyCoV-D의 위탁 생산을 진행할 가능성이 높은 상황입니다. 또한 당사는 ZyCoV-D의 백신 원천 기술을 이전 받아, 제품을 생산하거나 또는 추가 공정을 개발해 전세계에 백신을 공급하는 역할을 할 예정입니다. 다만 당사가 예상하지 못한 외부 변수에 의하여 동 계약에 대한 조건의 변경, 추가 연장 계약의 실패 및 극단적으로 동 계약의 불이행 또는 파기가 이루어지는 경우에는 당사의 예상 실적에 부정적인 영향이 발생할 수 있습니다. 또한 CMO 사업의 특성상 당사의 제품 생산량은 고객사의 제품 판매량에 영향을 받습니다. 고객 제품에 대한 안전성이나 유효성 문제 발생, 판매 부진 등의 경우 당사의 실적은 예상치를 하회할 가능성이 있습니다. CMO 사업의 특성 및 계약의 조건 상 계약 체결 시 계약의 중도 해지에 대한 가능성은 제한적이지만, 고객사 및 당사의 대내/대외 변수로 인한 계약해지 가능성을 배제할 수 없으며, 이 경우 당사 매출 및 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하여 주시기 바랍니다 자.제약산업 규제에 따른 위험 제약산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업으로, 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 당사의 바이오 사업은 주로 국내 당국의 규제 및 미국 당국의 규제를 받을 것으로 예상되고 있습니다. 당사는 특히 구강점막염 치료제의 경우 2018년 03월 14일 미국 FDA 신속심사(Fast Track)에 지정되었습니다. 당사는 구강점막염 치료제의 임상 2상 결과에 따라 혁신신약지정(BTD, Breakthrough Therapy Designation)을 예상하고 있으며, 혁신신약지정 시 당사의 신약 개발 사업에 긍정적인 요인으로 작용할 것으로 기대됩니다. 그러나 제약산업 내 규제를 심화될 경우, 당사에 부정적인 영향을 끼칠 수 있을것으로 예상됩니다. 비록 우호적인 정책이 현재까지는 긍정적인 요인으로 작용할 것으로 기대된다고 하더라도 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 또한 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않을 경우, 규제 완화의 범위가 축소될 수 있습니다. 이러한 정부의 우호적인 정책 및 규제 완화의 변동 가능성은 당사의 사업에 부정적인 영향을 끼칠 수 있습니다. 이 점 유의하여 투자해 주시기 바랍니다. 차.핵심연구인력유출 위험 연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 가장 중요한 요소입니다. 이는 제약 산업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 이는 각종 보상책에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히타경쟁사의 당사 우수인력의 스카우트는 당사가 사업을 영위함에 있어 큰 문제가 될 수 있습니다. 또한, 핵심인력 이탈과 함께 당사의 주요 기술이 유출될 경우, 당사의 경쟁력이 악화될 수 있으며, 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자분들께서는 이 점 유의하시기 바랍니다. 카.아웃소싱(CMO, CRO)과 관련된 위험 당사는 신약으로 개발 중인 EC-18과 관련하여 공정성 및 객관성이 확보될 수 있는데이터의 확보를 위하여 국제적으로 인증 받은 CRO에 의뢰하여 물리화학적, 생물학적 실험을 수행하여 비임상 데이터를 확보하고 있고, 비임상 및 임상시료의 제조는 GMP인증을 받은 CMO에 위탁하고 있습니다. 위와 같이 당사는 의약품을 연구개발함에 있어 IND와 NDA 시 요구되는 기준을 충족하는 공인된 CRO 및 CMO를 이용하고 있습니다. 다만, CRO 또는 CMO는 당사의 위탁으로 실험결과 분석 또는 시료 생산 업무만을 수행하고 당사는 이에 대한 용역 수수료를 지급하고 있습니다. 따라서 예상치 못한 CRO 또는 CMO의 내부 사정으로 인하여 당사가 위탁한 용역업무에 차질이 생길 가능성이 존재하며, 이 경우 당사의 신약개발 일정이 지연될 수 있습니다. |
| 회사위험 | 가.지속적인 영업적자로 인한 재무구조 악화 위험 당사는 신약물질 EC-18의 작용기전을 활용한 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 임상시험 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 2015년부터 지속적인 당기순손실이 발생하고 있습니다.지속적인 영업손실 및 당기순손실로 인해 당사의 재무구조는 악화되어 왔으며, 추후에도 당사 파이프라인의 라이센스 아웃 및 코로나19 백신 공급 등으로 영업흑자로 전환되지 못한다면 재무구조는 계속해서 악화될 것으로 예상됩니다. 당사는 금번 주주배정 후 실권주 일반공모로 유입되는 자금을 사용하여 인도의 다국적 바이오제약사인 Zydus Cadila의 ZyCoV-D 관련 CMO사업의 매출 증가와 EC-18의 구강점막염 라이센스 아웃, 기존 API 매출 강화를 통하여 매출 및 수익성을 향상시킬 계획을 가지고 있으나, 관련 규제기관들의 기준 강화에 따른 생산 및 공급 차질, 라이센스 아웃의 실패 등 차질이 발생할 경우 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 또한, 당사 예상보다 적은 매출이 발생하여 당사가 사용하고 있는 연구개발비를 포함한 판매비관리비와 각종 비용 등을 커버하지 못할 경우 수익성이 악화될 위험도 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. 나.재무안정성 악화 위험 당사는 2021년 3분기 말 연결기준 57,679백만원의 부채가 있으며, 부채비율은 70.0%, 차입금의존도는 35.7%입니다. 한편, 당사는 인도의 다국적 바이오제약사인 Zydus Cadila의 세계 최초 pDNA 코로나19 백신인 ZyCoV-D에 대한 공급계약 관련 LOI를 체결하였으며, 2022년 02월 생산을 목표로 약 4개월분의 CMO생산비용(원/부자재, 세포주, 배양액 등)이 선제적으로 필요하여 KB증권으로부터 1,500억원의 브릿지론을 Zydus Cadila 간 본 계약 체결 이후에 단기 차입할 계획입니다. 다만, 당사의 본계약 체결일 및 단기자금대출일을 2021년 10월 중으로 최초 예상하였으나, 현재 본계약 체결일정이 지연되고 있어 현재까지 단기자금대출이 진행되지 않은 상황입니다. 단기자금대출은 본 계약 체결 이후 진행될 예정이나, 현재까지 본 계약 체결일이 확정되지 않아 단기자금대출일 또한 미정인 상황입니다. 이후 브릿지론은 금번 주주배정 후 실권주 일반공모를 통한 자금이 유입될 시 납입일로부터 3영업일 이내에 상환할 계획에 있습니다. 이에 따라 당사의 차입금이 일시적으로 크게 증가하게 될 예정입니다. 당사의 2021년 3분기 말 연결기준 부채비율은 70.0%, 차입금의존도는 35.7%이며, 최근 3년 및 2021년 3분기까지 지속적인 영업손실 및 당기순손실의 발생으로 인하여 재무안정성 지표가 악화되어 왔습니다. 당사는 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금을 통하여 매출 및 수익성을 개선하여 재무구조 개선을 위한 노력을 지속할 예정입니다. 그럼에도 불구하고 부정적인 경기 및 산업 동향으로 인한 손실 발생과 신규 사업에 대한 자금 투입 대비 실적 부진, 유동자금 부족 등에 의하여 금융기관 등으로부터 차입금 만기 연장 거부 등에 따른 차입금 상환 부담이 일시적으로 가중될 수 있습니다. 다. 매출채권 회수 지연 가능성에 따른 위험 당사의 최근 3년 및 2021년 3분기 동안 매출채권 내역을 살펴보면, 대부분은 6개월 이하의 매출채권인 상황이며, 2021년 3분기를 제외하고는 매출액에 연동하여 변동하고 있는 상황입니다. 매출채권 회전율의 경우 최근 3년 및 2021년 3분기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 4.09회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 72.2일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다. 매출채권의 연령분석을 해보았을 때, 대부분의 매출채권은 6개월 이하이며, 이에 따라 대손충당금설정률은 2021년 3분기 말 연결기준 10.7%로 크지 않은 상황이며, 자산총계 대비 매출채권 장부가액은 약 3.2%로 매출채권 미회수에 따라 당사 재무구조에 유의적으로 부정적인 영향을 미칠 가능성은 낮은 것으로 판단되고 있습니다. 그러나, 매출채권 및 미수금 부실 방지에 대한 적극적인 노력이 미진할 경우 당사의 자금수지 및 재무상태에 악영향을 줄 수 있으며, 충당금 설정율이 높아질 경우 손익에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자해 주시기 바랍니다. 라.재고자산 진부화 위험 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 당사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 3분기말 연결기준 32.8%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 3분기에는 약 2.6회로 감소하고 있는 상황입니다. 코로나19의 지속적인 영향으로, 당사의 제품이 경쟁업체들과의 경쟁심화로 매출단가가 하락하고, 원재료 가격 상승에 의하여 생산단가가 증가할 경우, 회사 입장에서는 재고 보관비용의 증가, 재고자산의 노후화 위험을 동시에 부담할 가능성이 높아질 수 있으며, 재고자산회전율의 감소 및 평가충당금 설정의 위험이 있습니다. 또한, 신규로 시작할 코로나 백신 관련 매출에 있어서 유관기관들의 부정적인 정책 시행이나, 생산에 차질이 있을 경우 매입한 원재료들의 지분화 가능성 또한 있을 수 있습니다. 마.회사의 유동성 관련 위험 당사는 연결기준 최근 3년 및 2021년 3분기까지 지속적으로 음(-)의 영업활동현금흐름과 투자활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름과 투자활동현금흐름을 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 당사의 최근 3년 및 2021년 3분기동안 유동비율은 2018년 779.8%에서 2021년 3분기 818.4%, 당좌비율은 669.1%에서 2021년 3분기 860.5%로변동하고 있습니다. 이는 2020년까지 증가하는 추세였으나, 2021년 3분기 기준으로 유동비율 및 당좌비율이 전년대비 감소하고 있습니다. 지속적인 영업손실과 당기순손실에도 유동성이 개선되고 있는 사유는 전환우선주 발행에 따른 유동자산 증가와 전환사채 발행에 따른 비유동부채 계상 및 유동자산 증가가 주된 원인입니다. 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으며, 2021년 3분기 말 기준 연결기준으로 유동비율 818.4%, 당좌비율 860.5%로 안정적인 유동성 지표를 보이고 있어 단기적인 유동성 이슈가 발생할 가능성은 적을 것으로 판단하고 있습니다. 그러나 대내외적 환경이 급격하게 침체되거나 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있으며, 향후 제2회차 사모 전환사채 500억원의 조기상환청구권 행사 등에 의하여 유동성 위기가 발생할 수 있습니다. 투자자들께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다 바. 최대주주의 지분율 희석화에 따른 위험 증권신고서 제출일 전일 기준, 당사의 최대주주인 (주)브리짓라이프사이언스는 당사의 기명식 보통주 961,780주(지분율 11.5%)를 보유하고 있으며, 2대주주인 손기영은 당사의 기명식 보통주는 578,361주(지분율 6.9%)를 보유하고 있습니다. 최대주주및 특수관계인 4인을 포함 시 당사의 최대주주 및 특수관계인들이 보유하고 있는 주식은 1,561,741주로 지분율은 18.7%입니다. 최대주주인 (주)브리짓라이프사이언스 및 손기영은 금번 주주배정 후 실권주 일반공모 유상증자에서 배정된 물량의 약 10%이상 참여할 계획입니다. 만약 최대주주인 (주)브릿지라이프사이언스가 배정물량의 약 10% 참여 시 유상증자 후 최대주주의 지분율은 현재 11.5%에서 7.5%까지 감소할 수 있으며, 특수관계인 중 2대주주인 손기영이 배정물량의 약 10% 참여 및 기타 특수관계인들은 미참여를 가정할 시 최대주주 및 특수관계인이 보유하고 있는 지분율은 증권신고서 제출일 전일 기준 18.7%에서 유상증자 후 12.1%까지 감소할 수 있습니다. 유상증자 후 잠재주식 수가 모두 행사되었음을 고려 시 최대주주 등 지분율은 11.2%까지 감소될 수 있으며, 이는 각기 행사가액이 시가하락에 의한 전환가액 조정시 추가적으로 하락할 수 있습니다. 최대주주 및 특수관계인의 낮은 지분율은 적대적 M&A등의 위험성을 내포할 수 있으며, 이러한 점은 경영진 변동의 위험성으로 이어져 안정적인 경영활동이 어려울 수 있습니다. 유상증자 후 잠재주식 수 모두 전환을 고려할 시 추가적으로 하락할 가능성이 있어 경영권 안정성에 대해서는 안심할 수 없는 상황입니다. 투자자분들은 투자 시, 이 점 유의해주시기 바랍니다. 사. 잦은 자금조달로 인한 주주가치 희석화 당사는 바이오 사업의 특성상 지속적인 영업손실 및 당기순손실 발생으로 인하여, 지속적으로 자본시장을 통한 자금조달을 진행하고 있으며, 2018년도부터 공모 형태로 IPO 1회 43,120백만원, 사모 형태로 총 4회에 걸쳐 106,500백만원의 자금을 조달하였습니다. 금번에도 주주배정 후 실권주 일반공모 유상증자를 통하여 301,570백만원(1차 발행가액 기준)의 자금을 조달하려고 하고 있으며, 조달 완료 시 2018년부터 총 466,030백만원의 자금을 조달하게 됩니다. 당사는 바이오사업을 영위하고 연구개발중인 파이프라인의 라이센스 아웃 또는 제품화를 위하여 잦은 자금조달이 필요한 상황입니다. 당사는 경상연구개발비로 2020년 연결기준 13,175백만원, 2021년 3분기 연결기준 7,776백만원 사용하였으며, 이는 매출액 대비 각각 51.0%, 47.2% 수준이며, 최근 3개년 및 2021년 3분기 평균 매출액 대비 연구개발비의 비중은 42.5%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다.이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다. 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 신약물질 EC-18의 연구개발이 라이센스 아웃 또는 제품화에 실패하거나 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원할하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다. 아.지속적인 연구개발비용에 따른 손익 악화 위험 당사는 신약물질인 EC-18과 관련하여 구강점막염, 급성방사선증후군, 호중구감소증, 코로나19 바이러스에 대한 연구개발을 지속적으로 수행하고 있으며, 매출이 발생중인 API에서도 연구개발을 수행 중에 있습니다. 이처럼 당사의 바이오 사업부문은 EC-18, CRIOM P3, Zydus pDNA 백신, Providence mRNA 백신 등 파이프라인에 대한 연구개발 및 임상시험을 지속적으로 진행할 계획이며, 이를 위하여 연구개발비를 사용할 예정입니다. 그러나, 임상시험을 진행한다고 하더라도 시험결과 효능(기능)이 부족하거나 안전성 평가에 적합하지 못한 결과가 나올 경우 해당 신약(제품)의 연구개발은 중단될 수 밖에 없습니다. 즉, 임상시험 결과가 가시화되지 않아 라이선스 아웃 또는 제품화가 불가능해질 경우 당사는 투자한 금액 전액은 매출로 이어지거나 자산화가 되지 않고 비용처리만 될 수 있으며, 당사의 비용 및 시간 투자에도 불구하고 엄청난 손실을 야기할 수 밖에 없습니다. 이 점 유의하여 투자해 주시기 바랍니다. |
| 기타 투자위험 | 가.코스닥시장 관리종목 및 상장폐지 요건에 따른 위험 당사는 2018년 02월 기술특례로 코스닥시장에 상장하였습니다. 이에 따라 장기영업손실(4년 연속영업손실 발생)로 인한 관리종목 지정에 대해서는 유예되고, 법인세비용차감전계속사업손실로 인한 관리종목 지정에 대해서도 상장 후 3년간 해당 사유에 대해서는 유예되어 신고서제출일 현재 현재 관리종목 지정 사유에 해당되지 않습니다. 다만, 코스닥시장 규정 등에 따라 당사의 주권은 관리종목으로 지정되거나 상장폐지 될수 있으니 투자자분들께서는 이 점 유의하시기 바랍니다. 나.환금 제한 및 원금 손실 가능성 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있습니다. 투자자분들은 투자시 이점 유의하시기 바랍니다. 다.주가하락에 따른 발행금액 감소 위험 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 하락할 경우 당사가 계획했던 자금운용계획 등에 차질이 빚어질 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있습니다. 라.금융감독기관의 규제 강화에 따른 위험 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및유동성(환금성) 제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있으니 투자자들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다. 마. 경영환경변화 등에 따른 위험 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 증권신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분이 독자적으로 결정해야 함을 유의하시기 바랍니다. 바.증권신고서 정정에 따른 일정 변경 가능성 본 증권신고서는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다. 사.집단 소송이 제기될 위험 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있음을 유의하시기 바랍니다. 아.유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. 자.유상증자 철회에 따른 위험 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다. 차.차입공매도 유상증자 참여 제한 관련 위험 「자본시장과 금융투자업에 관한 법률 시행령」일부개정령에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우에만 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 투자자께서는 이 점 유의하시기 바랍니다. 카.주가 희석화 및 주주배정 후 실권주 일반공모 대량물량 출회 예정에 따른 위험 당사의 금번 유상증자로 인하여 기발행주식 총수 8,331,345주의 60.85%에 해당하는 5,300,000주가 추가로 상장됩니다. 금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 주권의 상장일은 2022년 01월 10일로 예정되어 있습니다. 금번 유상증자에 따른 모집예정주식 5,300,000주가 향후 코스닥 시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다. 또한, 일반공모 청약을 완료한 주식 수의 합계가 모집하여야 할 주식수에 미달하는 경우 미달된 잔여주식은 대표주관사가 자기계산으로 실권주식 전량을 인수하게 됩니다. 대표주관사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 10.0%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관사의 실권주 매입단가는 일반청약자들 보다 10.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 가능성이 존재합니다. 따라서 실권주를 인수한 대표주관사가 인수한 물량을 조기에 장내에서 대량매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재합니다. 또한 증권신고서 제출일 현재 당사는 기발행한 사모 전환사채와 전환우선주, 주식매수청구권이 존재하며, 전환 또는 행사 시 신주로 전환되기 때문에 주가희석이 발생할 수 있습니다. 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 1,137,559주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다. 당사는 전환가능주식수가 모두 행사되어 코스닥 시장에 추가 상장될 경우 주가 희석화 위험이 발생할 수 있습니다. 투자자들께서는 이점 유의하여 투자해 주시기 바랍니다. |
2. 모집 또는 매출에 관한 일반사항
| (단위 : 원, 주) |
| 증권의 종류 |
증권수량 | 액면가액 | 모집(매출) 가액 |
모집(매출) 총액 |
모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 5,300,000 | 500 | 56,900 | 301,570,000,000 | 주주배정후 실권주 일반공모 |
| 인수인 | 증권의 종류 |
인수수량 | 인수금액 | 인수대가 | 인수방법 | |
|---|---|---|---|---|---|---|
| 대표 | 케이비증권 | 기명식보통주 | 5,300,000 | 301,570,000,000 | 인수수수료: 모집총액의 1.5% 실권수수료: 잔액인수금액의 10.0% |
잔액인수 |
| 청약기일 | 납입기일 | 청약공고일 | 배정공고일 | 배정기준일 |
|---|---|---|---|---|
| 2021년 12월 16일 ~ 2021년 12월 17일 | 2021년 12월 24일 | 2021년 12월 20일 | 2021년 12월 23일 | 2021년 10월 26일 |
| 청약이 금지되는 공매도 거래 기간 | |
|---|---|
| 시작일 | 종료일 |
| 2021년 09월 23일 | 2021년 12월 13일 |
| 자금의 사용목적 | |
|---|---|
| 구 분 | 금 액 |
| 채무상환자금 | 150,000,000,000 |
| 운영자금 | 124,400,000,000 |
| 시설자금 | 27,170,000,000 |
| 발행제비용 | 4,666,031,100 |
| 신주인수권에 관한 사항 | ||
|---|---|---|
| 행사대상증권 | 행사가격 | 행사기간 |
| - | - | - |
| 매출인에 관한 사항 | ||||
|---|---|---|---|---|
| 보유자 | 회사와의 관계 |
매출전 보유증권수 |
매출증권수 | 매출후 보유증권수 |
| - | - | - | - | - |
| 일반청약자 환매청구권 | ||||
|---|---|---|---|---|
| 부여사유 | 행사가능 투자자 | 부여수량 | 행사기간 | 행사가격 |
| - | - | - | - | - |
| 【주요사항보고서】 | [정정] 주요사항보고서(유상증자결정)-2021.09.17 |
| 【기 타】 | 1) 금번 ㈜엔지켐생명과학의 주주배정후 실권주 일반공모 유상증자의 대표주관회사는 케이비증권㈜입니다. 2) 금번 유상증자는 잔액인수방식에 의한 것입니다. 대표주관회사는 주주배정후 실권주 일반공모 후 최종실권주를 잔액인수하게 되며, 인수방법 및 인수대가에 대한 자세한 내용은 '제1부 -Ⅰ. - 5. 인수 등에 관한 사항'을 참고하여 주시기 바랍니다. 3) 상기 모집가액 및 발행제비용은 예정가액으로 산정된 것으로 향후 변경될 수 있습니다. 확정가액은 청약일 전 제3거래일에 결정될 예정입니다. 4) 상기 청약기일은 구주주 청약 일정이며, 일반공모 청약은 2021년 12월 21일과 2021년 12월 22일 2일간입니다. 5) 일반공모 청약은 대표주관회사인 KB증권㈜의 본ㆍ지점, 홈페이지 및 HTS, MTS에서 가능합니다. 단, 구주주 청약 결과 발생한 실권주 및 단수주가 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하일 경우 일반에게 공모하지 않고, 대표주관회사가 자기 계산으로 인수할 수 있습니다. 6) 금융감독원에서 본 증권신고서를 심사하는 과정에서 주요사항의 변동으로 인한 기재 내용의 정정 등으로 동 신고서에 기재된 일정이 변경될 수 있습니다. 7) 증권신고서의 효력의 발생은 본 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. |
제1부 모집 또는 매출에 관한 사항
I. 모집 또는 매출에 관한 일반사항
1. 공모개요
당사는 이사회 결의를 통하여 「자본시장과 금융투자업에 관한 법률」제165조의6 제2항 제1호에 의거 케이비증권(주)와 주주배정 후 실권주를 인수하는 계약을 체결하고 사전에 그 실권주를 일반에 공모하기로 하여 기명식 보통주 5,300,000주를 주주배정후 실권주 일반공모 방식으로 발행하기로 결정하였으며, 동 증권의 개요는 다음과 같습니다.
| (단위 : 원, 주) |
| 증권의 종류 | 증권수량 | 액면가액 | 모집(매출)가액 | 모집(매출)총액 | 모집(매출) 방법 |
|---|---|---|---|---|---|
| 기명식보통주 | 5,300,000 | 500 | 56,900 | 301,570,000,000 | 주주배정후실권주일반공모 |
| 주1) 최초 이사회 결의일 : 2021년 09월 17일 주2) 1주의 모집가액 및 모집총액은 1차 발행가액 기준으로 한 예정금액이며, 확정되지 않은 금액입니다. |
발행가액은 「증권의 발행 및 공시 등에 관한 규정」 제5-18조 (유상증자의 발행가액 결정)에 의거, 주주배정증자시 할인율 등이 자율화 되어 자유롭게 산정할 수 있으나, 시장혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 산정할 예정입니다.
■ 1차 발행가액의 산출근거
1차 발행가액은 신주배정기준일(2021년 10월 26일) 전 3거래일(2021년 10월 21일)을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 20%를 적용합니다.(단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하인 경우 액면가액으로 합니다.)
| 기준주가 X 【 1 - 할인율(20%) 】 | ||
| ▶ 모집예정가액 | = | ---------------------------------------- |
| 1 + 【유상증자비율 X 할인율(20%)】 |
상기 방법에 따라 산정된 1차 발행가액은 참고용이며, 구주주 청약일전 3거래일에 확정발행가액이 결정될 예정입니다.
| [1차 발행가액 산정표] |
|
| 기산일 : 2021년 10월 21일 |
(단위 : 원, 주) |
| 일자 | 종 가 | 거래량 | 거래대금 |
|---|---|---|---|
| 2021/10/21 | 78,900 | 229,921 | 18,334,060,200 |
| 2021/10/20 | 78,100 | 484,676 | 39,726,380,400 |
| 2021/10/19 | 86,700 | 203,826 | 17,433,936,600 |
| 2021/10/18 | 82,700 | 205,361 | 16,961,630,600 |
| 2021/10/15 | 80,100 | 180,299 | 14,173,439,700 |
| 2021/10/14 | 75,400 | 88,305 | 6,556,737,200 |
| 2021/10/13 | 70,800 | 48,776 | 3,442,896,300 |
| 2021/10/12 | 70,400 | 68,647 | 4,913,207,400 |
| 2021/10/08 | 73,700 | 109,953 | 8,127,159,400 |
| 2021/10/07 | 71,700 | 89,664 | 6,500,641,900 |
| 2021/10/06 | 70,500 | 220,429 | 15,252,769,300 |
| 2021/10/05 | 66,700 | 161,391 | 11,127,950,800 |
| 2021/10/01 | 70,900 | 77,202 | 5,486,055,000 |
| 2021/09/30 | 72,700 | 48,615 | 3,549,347,900 |
| 2021/09/29 | 73,000 | 81,289 | 5,903,174,000 |
| 2021/09/28 | 74,000 | 123,129 | 9,331,808,000 |
| 2021/09/27 | 79,100 | 62,595 | 5,000,961,700 |
| 2021/09/24 | 80,600 | 93,361 | 7,451,964,900 |
| 2021/09/23 | 82,400 | 355,308 | 27,861,692,700 |
| 1개월 가중산술평균주가 (A) | 77,448 | ||
| 1주일 가중산술평균주가 (B) | 81,766 | ||
| 기산일 가중산술평균주가 (C) | 79,741 | ||
| A,B,C의 산술평균 (D) | 79,652 | (A+B+C)/3 | |
| 기준주가 (E) | 79,652 | (C와 D중 낮은가액) | |
| 할인율 (F) | 20% | - | |
| 증자비율 (G) | 60.85% | - | |
| 1차 발행가액 | 56,900 | 기준주가 × (1-할인율) / 1 + (유상증자비율 × 할인율 ) |
|
■ 공모일정 등에 관한 사항
당사는 2021년 09월 17일 최초 이사회를 통해 유상증자를 결의하였으며, 세부 일정은 다음과 같습니다.
| [주요일정] |
| 날짜 | 업 무 내 용 | 비고 |
|---|---|---|
| 2021-09-17 | 이사회결의 | - |
| 2021-09-17 | 신주발행 및 기준일 공고 | 당사 인터넷 홈페이지 (http://www.enzychem.co.kr) |
| 2021-09-17 | 증권신고서 제출 | - |
| 2021-10-21 | 1차 발행가액 확정 | 신주배정기준일 3거래일 전 |
| 2021-10-25 | 권리락 | - |
| 2021-10-26 | 신주배정 기준일(주주확정) | - |
| 2021-11-24 | 신주배정 통지 | - |
| 2021-12-01 ~ 2021-12-07 |
신주인수권증서 상장 거래기간 | 5거래일 이상 거래 |
| 2021-12-08 | 신주인수권증서 상장 폐지 | 구주주 청약초일 5거래일 전 폐지 |
| 2021-12-13 | 확정 발행가액 산정 | 구주주 청약초일 3거래일 |
| 2021-12-14 | 확정 발행가액 공고 | 당사 인터넷 홈페이지 (http://www.enzychem.co.kr) 및 Dart전자공시시스템(http://dart.fss.or.kr) |
| 2021-12-16 ~ 2021-12-17 | 구주주 청약 및 초과청약 | - |
| 2021-12-20 | 일반공모 청약 공고 | 당사 인터넷 홈페이지 (http://www.enzychem.co.kr) 케이비증권(주) 홈페이지 (www.kbsec.com) |
| 2021-12-21 ~ 2021-12-22 | 일반공모 청약 | - |
| 2021-12-23 | 환불 및 배정 공고 | 케이비증권(주) 홈페이지 (www.kbsec.com) |
| 2021-12-24 | 주금 납입 | - |
| 2022-01-10 | 신주유통 개시일 | - |
| 2022-01-10 | 신주상장 예정일 | - |
| 주1) 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. 주2) 2019년 9월 16일부터 전자증권제도가 시행됨에 따라 금번 유상증자 시 발행되는 신주인수권증서 및 신주가 전자증권으로 발행될 예정이며, 신주상장과 동시에 신주가 유통될 예정입니다. 주3) 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
2. 공모방법
[공모방법 : 주주배정후 실권주 일반공모]
| 모집대상 | 주식수 | 비 고 |
|---|---|---|
| 구주주 (신주인수권증서 보유자 청약) |
5,300,000주 (100.0%) | ▶ 구주 1주당 신주 배정비율 : 1주당 0.6084623101주 ▶ 신주배정 기준일 : 2021년 10월 26일 ▶ 보유한 신주인수권증서의 수량 한도로 청약가능(구주주에게는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율을 곱한 수량만큼의 신주인수권 증서가 배정됨) |
| 초과 청약 | - | ▶ 「자본시장과 금융투자업에 관한 법률」 제165조의6의 제2항 제2호에 의거 초과청약 ▶ 초과청약비율 : 배정신주(신주인수권증서) 1주당 0.2주 ▶ 신주인수권증서 거래를 통해서 신주인수권증서를 매매시 보유자 기준으로 초과청약 가능 |
| 일반모집 청약 (고위험고수익투자신탁, 벤처기업투자신탁 청약 포함) |
- | ▶ 구주주 및 초과청약 후 발생하는 단수주 및 실권주에 대해 배정됨 |
| 합 계 | 5,300,000주(100.00%) | - |
| 주1) | 본 건 유상증자는 주주배정후 실권주 일반공모 방식으로 진행되며, 구주주 청약결과 발생하는 실권주 및 단수주는 우선적으로 초과청약자에게 배정되며, 이후 실권이 발생할 경우에 대해서는 일반에게 공모합니다. |
| 주2) | 구주주의 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식 1주당 신주배정비율인 0.6084623101주를 곱하여 산정된 배정주식수로 하되, 1주 미만은 절사합니다. 단, 신주배정기준일 전 주식관련사채의 권리행사, 자기주식수의 변동으로 인하여 1주당 배정주식수가 변동될 수 있습니다. |
| 주3) |
신주인수권증서 보유자는 보유한 신주인수권증서 수량의 한도로 증서청약을 할 수 있고, 동 주식수에 초과청약비율(20%)를 곱한 수량을 한도로 초과청약 할 수 있습니다. 단, 1주 미만은 절사합니다. (ii) 신주인수권증서청약 한도주식수 = 보유한 신주인수권 증서의 수량 (iii) 초과청약 한도주식수 = 신주인수권증서청약 한도주식수 X 초과청약 비율(20%) |
| 주4) | "고위험고수익투자신탁" 이란 「조세특례제한법」제91조의15제1항에 따른 투자신탁 등을 말합니다. 다만, 해당 투자신탁 등의 최초 설정일·설립일로부터 수요예측 참여일까지의 기간이 6개월 미만인 경우에는 같은 법 시행령 제93조제3항제1호 및 같은 조 제7항에도 불구하고 수요예측 참여일 직전 영업일의 비우량채권과 코넥스 상장주식을 합한 보유비율이 100분의 45 이상이고 이를 포함한 국내 채권의 보유비율이 100분의 60 이상이어야 합니다. |
| 주5) | "벤처기업투자신탁"이란 「조세특례제한법」 제16조제1항제2호의 벤처기업투자신탁(대통령령 제28636호 「조세특례제한법 시행령 일부개정령」 시행 이후 설정된 벤처기업투자신탁에 한한다. 이하 같다)을 말합니다. 다만 해당 벤처기업투자신탁의 최초 설정일로부터 수요예측 참여일까지의 기간이 1년 미만인 경우에는 같은 법 시행령 제14조제1항제3호에도 불구하고 수요예측 참여일 직전영업일의 벤처기업투자신탁 재산총액에서 같은 호 각 목에 따른 비율의 합계가 100분의 35 이상이어야 합니다. |
| 주6) | 본 건 유상증자는 주권상장법인의 유상증자에 해당되므로, 「증권 인수업무 등에 관한 규정」 제9조제2항제3호에 의거하여, 고위험고수익투자신탁 총 배정분은 전체 일반공모주식수의 5% 이상을 배정하고, 「증권 인수업무 등에 관한 규정」 제9조제2항제4호에 의거하여, 벤처기업투자신탁 총 배정분은 전체 일반공모주식수의 30% 이상을 배정하기로 합니다. 이외 일반청약자 총 배정분은 전체 일반공모주식수의 65%를 배정합니다. ① 1단계: 총 청약물량이 일반공모 배정분 주식수를 초과하는 경우, 각 청약자에 5사6입을 원칙으로 안분 배정하여 잔여주식이 최소화되도록 합니다. 다만, 고위험고수익투자신탁에 대한 공모주식 5%와 벤처기업투자신탁에 대한 공모주식 30%, 개인투자자 및 기관투자자(집합투자업자포함)에 대한 공모주식 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 다만, 어느 한 그룹에서 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다. ② 2단계: 1단계 배정 후 최종 잔여주식은 최대청약자부터 순차적으로 1주씩 우선배정하되, 동순위 최대청약자가 최종 잔여주식보다 많은 경우에는 대표주관회사가 합리적으로 판단하여 배정합니다. |
| 주7) | 일반공모를 거쳐 배정 후에도 미 청약된 잔여주식에 대하여는 대표주관회사가 자기계산으로 잔액인수하기로 합니다. |
| 주8) | 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항에 의거 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주 이하(액면가 500원 기준)이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 일반 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자에게 배정하지 아니하고 대표주관회사가 자기계산으로 인수할 수 있습니다. |
| 주9) |
자본시장법 제180조의4 및 같은 법 시행령 제208조의4제1항에 따라 2021년 09월 23일부터 2021년 12월 13일까지 공매도를 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 같은 법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 같은 법 시행령 제208조의4제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다. ※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우 (매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
▶ 구주주 1주당 배정비율 산출 근거
| A. 보통주식 | 8,331,345 |
| B. 우선주식 | 379,137 |
| C. 발행주식총수(A+B) | 8,710,482 |
| D. 자기주식 + 자기주식신탁 | - |
| E. 자기주식을 제외한 발행주식총수 (C-D) | 8,710,482 |
| F. 유상증자 주식수 | 5,300,000 |
| G. 증자비율 (F/C) | 60.85% |
| H. 우리사주조합 배정 | - |
| H. 구주주배정 (F-H) | 5,300,000 |
| I. 구주주 1주당 배정비율 (I/E) | 0.6084623101 |
| 주1) 금번 유상증자는 신주배정기준일 기준 우선주 보유 주주들에게도 구주주 배정비율에 따라 발행하는 보통주를 동일하게 배정합니다. |
3. 공모가격 결정방법
「증권의 발행 및 공시 등에 관한 규정」 제5-18조에 의거 주주배정 증자시 가격산정 절차 폐지 및 가격산정의 자율화에 따라 발행가격을 자유롭게 산정할 수 있으나, 시장 혼란 우려 및 기존 관행 등으로 (구)「유가증권의 발행 및 공시 등에 관한 규정」 제57조를 일부 준용하여 아래와 같이 발행가액을 산정합니다.
가. 1차 발행가액: 신주배정기준일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1개월 가중산술평균주가와 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 20%를 적용합니다.(단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하인 경우 액면가액으로 합니다.)
▶ 1차 발행가액 = 기준주가 × (1-할인율) / [1 + (증자비율 × 할인율)]
나. 2차 발행가액: 구주주 청약 초일 전 제3거래일을 기산일로 하여 코스닥시장에서 성립된 거래대금을 거래량으로 가중산술평균한 1주일 가중산술평균주가 및 기산일 가중산술평균주가를 산술평균하여 산정한 가액과 기산일 가중산술평균주가 중 낮은 금액을 기준주가로 하여, 아래의 산식에 따라 결정하며 할인율은 20%를 적용합니다.(단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하인 경우 액면가액으로 합니다.).
▶ 2차 발행가액 = 기준주가 × (1-할인율)
다. 확정 발행가액: 1차 발행가액과 2차 발행가액 중 낮은 가액을 확정 발행가액으로 합니다. 다만, 「자본시장과 금융투자업에 관한 법률」 제165조의6 및 「증권의 발행 및 공시 등에 관한 규정」 제5-15조의2규정에 의거하여 1차 발행가액과 2차 발행가액 중 낮은 가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일로부터 제5거래일까지의 가중산술평균주가에서 할인율 40%를 적용하여 산정한 가격을 확정발행가액으로 합니다.(단, 호가단위 미만은 호가단위로 절상하며, 그 가액이 액면가액 이하인 경우 액면가액으로 합니다.)
▶ 확정 발행가액 = MAX【MIN(1차 발행가액, 2차 발행가액), 기준주가의 60%】
라. 최종 발행가액은 구주주청약일 초일 전 제3거래일에 결정되어 금융감독원 전자공시시스템에 2021년 12월 14일에 공시될 예정이며, 회사의 인터넷 홈페이지http://www.enzychem.co.kr에 공고하여 개별통지에 갈음할 예정입니다.
4. 모집 또는 매출절차 등에 관한 사항
가. 모집 또는 매출조건
| (단위 : 주, 원) |
| 항 목 | 내 용 | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 모집 또는 매출주식의 수 | 5,300,000 | |||||||||||||||||||||||||||||||||||
| 주당 모집가액 | 예정가액 | 56,900 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 모집총액 | 예정가액 | 301,570,000,000 | ||||||||||||||||||||||||||||||||||
| 확정가액 | - | |||||||||||||||||||||||||||||||||||
| 청 약 단 위 |
(1) "구주주"의 청약단위는 1주로 하며, 개인별 청약한도는 신주배정기준일 현재 주주명부에 기재된 소유주식수에 신주배정비율("주주 배정분"에 해당하는 주식수를 자기주식을 제외한 발행주식 총수로 나눈 비율을 말하며, 자기주식과 발행주식총수는 신주배정기준일 현재의 주식수를 말한다)을 곱하여 산정된 배정주식수(1주 미만은 절사)와 초과청약가능 주식수(보유하고 있는 신주인수권증서 1주당 0.2주를 곱하여 산정된 수, 단 1주 미만은 절사)로 한다. 다만, 신주배정기준일 현재 신주배정비율은 주식관련사채의 행사, 자기주식 변동 등으로 인하여 변경될 수 있다.
|
|||||||||||||||||||||||||||||||||||
| 청약기일 | 구주주 | 개시일 | 2021년 12월 16일 | |||||||||||||||||||||||||||||||||
| 종료일 | 2021년 12월 17일 | |||||||||||||||||||||||||||||||||||
| 실권주 일반공모 | 개시일 | 2021년 12월 21일 | ||||||||||||||||||||||||||||||||||
| 종료일 | 2021년 12월 22일 | |||||||||||||||||||||||||||||||||||
| 청약 증거금 |
구주주 | 청약금액의 100% | ||||||||||||||||||||||||||||||||||
| 초 과 청 약 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 일반모집 또는 매출 | 청약금액의 100% | |||||||||||||||||||||||||||||||||||
| 납 입 기 일 | 2021년 12월 24일 | |||||||||||||||||||||||||||||||||||
| 배당기산일(결산일) | 2021년 01월 01일 | |||||||||||||||||||||||||||||||||||
| 주1) 본 증권신고서는 금융감독원에서 심사하는 과정에서 정정요구 등 조치를 취할 수 있으며, 정정 요구 등에 따라 동 신고서에 기재된 일정이 변경될 수 있습니다. 본 증권신고서의 효력 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 유가증권의 가치를 보증 또는 승인한 것이 아니므로 본 유가증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다. 주2) 상기 일정은 유관기관과의 협의 과정에 의하여 변경될 수 있습니다. |
나. 모집 또는 매출의 절차
1) 공고의 일자 및 방법
| 구 분 | 공고일자 | 공고방법 |
|---|---|---|
| 신주 발행 및 신주배정기준일(주주확정일) 공고 |
2021년 09월 17일 | 회사 인터넷 홈페이지 (http://www.enzychem.co.kr) |
| 모집 또는 매출가액 확정의 공고 | 2021년 12월 14일 | 전자공시시스템(http://dart.fss.or.kr) 회사 인터넷 홈페이지 (http://www.enzychem.co.kr) |
| 실권주 일반공모 청약공고 | 2021년 12월 20일 | 회사 인터넷 홈페이지 (http://www.enzychem.co.kr) 케이비증권㈜ 홈페이지 (http://www.kbsec.co.kr) |
| 실권주 일반공모 배정공고 | 2021년 12월 23일 | 케이비증권㈜ 홈페이지 (http://www.kbsec.co.kr) |
주) 청약결과 초과청약금 환불에 대한 통지는 대표주관회사 홈페이지에 게시함으로써 개별통지에 갈음합니다.
2) 청약방법
가) 구주주 청약: 구주주 중 주권을 증권회사에 예탁한 주주(기존 "실질주주")는 주권을 예탁한 증권회사의 본/지점 및 대표주관회사의 본/지점에서 청약할 수 있습니다. 다만, 구주주 중 증권회사에 예탁하지 않고 자기명의의 주권을 직접 보유하고 있는 명부상 주주는 신주배정통지서를 첨부하여 실명확인증표를 제시한 후 대표주관회사의 본/지점에서 청약할 수 있습니다. 청약시에는 소정의 청약서 2통에 필요한 사항을 기입하여 청약증거금과 함께 제출해야 합니다.
| 2019년 9월 16일 전자증권제도가 시행되며, 주권 상장법인의 상장주식은 전자증권 의무전환대상으로 전자증권제도 시행일에 전자증권으로 일괄전환됩니다. 전자증권제도 시행전까지 증권회사에 예탁하고 있는 실질주주 주식은 해당 증권회사 계좌에 전자증권으로 일괄 전환되며, 기존 명부주주가 보유한 주식은 명의개서대행기관이 개설하는 특별계좌에 발행되어 소유자별로 관리됩니다. 금번 유상증자시 신주인수권증서는 전자증권제도 시행일 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다. '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다. '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사인 케이비증권(주)의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다. |
|
「주식ㆍ사채 등의 전자등록에 관한 법률」 |
나) 초과 청약: 신주인수권증서 청약을 한 자에 한하여 신주인수권증서 청약 한도 주식수의 20%를 추가로 청약할 수 있습니다. 이때, 신주인수권증서 청약 한도주식수의 20%에 해당하는 주식 중 소수점 이하인 주식은 청약할 수 없습니다.
다) 일반공모 청약: 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자는「금융실명거래 및 비밀보장에 관한 법률」의 규정에 의한 실명자이어야 하며, 청약사무 취급처에 실명확인증표를 제시하고 청약합니다. 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자의 청약 시, 한 개의 청약처에서 이중청약은 불가능하며, 집합투자기구 중 운용주체가 다른 집합투자기구만 청약자의 한 개 청약처에 대한 복수청약이 가능합니다. 또한 고위험고수익투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」 제2조제18호에 따른 요건을 충족하고, 제9조제4항에 해당하지 않음을 확약하는 서류 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다. 벤처기업투자신탁은 청약 시, 청약사무 취급처에 「증권 인수업무 등에 관한 규정」제2조제20호에 따른 요건을 충족하고, 제9조제10항에 따른 확약서 및 자산총액이 기재되어 있는 서류를 함께 제출하여야 합니다.
라) 일반청약자의 청약은 청약주식의 단위에 따라 될 수 있으며 1인당 청약한도를 초과하는 청약부분에 대하여는 청약이 없는 것으로 하고 청약사무 취급처는 그 차액을 납입일까지 당해 청약자에게 반환하며, 이때 받은 날부터의 이자는 지급하지 않습니다.
마) 기타
일반공모 배정을 함에 있어 이중청약이 있는 경우에는 그 청약자의 청약 전부를 청약하지 아니한 것으로 봅니다. 단, 구주주가 신주배정비율에 따라 배정받은 주식을 청약한 후 일반공모에 참여하는 경우에는 금지되는 이중청약이 있는 경우로 보지 않습니다.
바) 본 유상증자에 청약하고자 하는 투자자(「자본시장과 금융투자업에 관한 법률」 제9조제5항에 규정된 전문투자자 및 「자본시장과 금융투자업에 관한 법률 시행령」 제 132조에 따라 투자설명서의 교부가 면제되는자 제외)는 청약 전 반드시 투자설명서를 교부 받아야 하고, 이를 확인하는 서류에 서명 또는 기명날인하여야 합니다.
사) 「자본시장법과 금융투자업에 관한 법률」 제180조의4 및 동법 시행령 제208조의4제1항에 의거, 2021년 09월 23일부터 2021년 12월 13일까지 당사의 주식을 공매도 하거나 공매도 주문을 위탁한 자는 금번 모집(매출)에 청약할 수 없으며, 이를 위반하여 주식을 취득할 경우 동법 제429조의3제2항에 따라 과징금이 부과될 수 있습니다. 다만, 모집(매출)가액의 공정한 가격형성을 저해하지 않는 경우로서 동법 시행령 제208조의4제2항 및 금융투자업규정 제6-34조에 해당할 경우에는 예외적으로 주식 취득이 허용됩니다.
|
※ 예외적으로 모집(매출)에 따른 주식 취득이 허용되는 경우 ① 모집(매출)에 따른 주식 취득이 금지되는 공매도 거래 기간 중에 전체 공매도 주문수량보다 많은 수량의 주식을 가격경쟁에 의한 거래 방식으로 매수한 경우(매매계약 체결일 기준으로 정규시장의 매매거래시간에 매수한 경우로 한정) ② 한국거래소의 증권시장업무규정 또는 파생상품시장업무규정에서 정한 유동성 공급 및 시장조성 목적을 위해 해당 주식을 공매도하거나 공매도 주문을 위탁한 경우 ③ 동일한 법인 내에서 모집(매출)에 따른 주식 취득 참여가 금지되는 공매도 거래 기간 중 공매도를 하지 않거나 공매도 주문을 위탁하지 않은 독립거래단위*가 모집(매출)에 따른 주식을 취득하는 경우 * 금융투자업규정 제6-30조 제5항에 따라 의사결정이 독립적이고 상이한 증권계좌를 사용하는 등의 요건을 갖춘 거래단위 |
3) 청약취급처
| 청약대상자 | 청약취급처 | 청약일 | |
|---|---|---|---|
| 구주주 (신주인수권증서 보유자) |
특별계좌 보유자 (기존 '명부주주') |
케이비증권(주) 본ㆍ지점 | 2021년 12월 16일~ 2021년 12월 17일 |
| 일반주주 (기존 '실질주주') |
1) 주주확정일 현재 (주)엔지켐생명과학의 주식을 예탁하고 있는 당해 증권회사 본ㆍ지점 2) 케이비증권(주) 본ㆍ지점, 홈페이지ㆍHTS ㆍMTS |
||
| 일반공모청약 (고위험고수익투자신탁, 벤처기업투자신탁 청약 포함) |
케이비증권(주) 본ㆍ지점, 홈페이지ㆍHTS ㆍMTS | 2021년 12월 21일~ 2021년 12월 22일 |
|
4) 청약결과 배정방법
가) 구주주 청약 : 신주배정기준일(2021년 10월 26일 예정) 18:00 현재 주주명부에 등재된 주주(이하 "구주주"라 한다)에게 본 주식을 1주당 0.6084623101주를 곱하여 산정된 배정주식수(단, 1주 미만은 절사함)로 하고, 배정범위 내에서 청약한 수량만큼 배정합니다. 단, 신주배정기준일 전 주식관련사채의 행사, 자기주식수의 변동 등으로 인하여 1주당 배정주식수가 변동될 수 있습니다.
나) 초과청약 : 구주주(신주인수권증서 보유자) 청약 이후 발생한 실권주가 있는 경우, 실권주를 구주주(신주인수권증서 보유자)가 초과청약(초과청약비율: 배정 신주1주당0.2주)한 주식수에 비례하여 배정하며, 1주 미만의 주식은 절사하여 배정하지 않습니다(단, 초과청약 주식수가 실권주에 미달한 경우100% 배정).
다) 일반공모 청약:
(1) 상기 구주주청약 및 초과청약 결과 발생한 실권주 및 단수주(이하 "일반공모 배정분"이라 한다)는 대표주관회사가 일반에게 공모하되, 「증권 인수업무 등에 관한 규정」 제9조 제2항 제3호에 따라 고위험고수익투자신탁에 공모주식의 5% 이상을 배정하기로 합니다. 또한, 「증권 인수업무 등에 관한 규정」제9조제2항제4호, 제6호에 따라 벤처기업투자신탁에 일반공모 배정분의 30% 이상을 배정하되, 벤처기업투자신탁에 배정하는 금액은 「증권 인수업무 등에 관한 규정」 제9조 제8항에 따라 해당 벤처기업투자신탁의 자산총액의 100분의 10 이내가 되도록 합니다. 이 경우, 자산총액은 고위험고수익투자신탁, 벤처기업투자신탁을 운용하는 기관투자자가 제출한 자료를 기준으로 산정합니다. 나머지 일반공모 배정분의 65%에 해당하는 주식은 개인청약자 및 기관투자자(집합투자업자 포함)에게 구분 없이 배정합니다. 고위험고수익투자신탁에 대한 일반공모 배정분의 5%와 벤처기업투자신탁에 대한 일반공모 배정분의 30%와 개인투자자 및 기관투자자에 대한 일반공모 배정분의 65%에 대한 청약경쟁률과 배정에 있어서는, 별도로 산출 및 배정합니다. 다만, 「증권인수업무 등에 관한 규정」 제9조제3항에 따라 어느 한 그룹에서 청약미달이 발생할 경우, 청약미달에 해당하는 주식은 청약초과 그룹에 배정합니다.
(2) 일반공모 청약결과 일반공모 총 청약자의 청약주식수가 공모주식수를 초과하는 경우에는 청약경쟁률에 따라 5사6입을 원칙으로 안분 배정하며 잔여주식이 최소화되도록 합니다. 다만, 고위험고수익투자신탁에 대한 공모주식 5%와 벤처기업투자신탁에 공모주식의 30%와 개인투자자 및 기관투자자에 대한 공모주식 65%에 대한 청약경쟁률과 배정은 별도로 산출 및 배정합니다. 어떤 그룹에 청약미달이 발생할 경우, 청약 미달에 해당하는 주식은 청약초과그룹에 배정합니다. 이후 최종 잔여주식은 최고청약자부터 순차적으로 우선 배정하되, 동순위 최고청약자가 최종 잔여 주식보다 많은 경우에는 "대표주관회사"가 합리적으로 판단하여 배정합니다.
(3) 일반공모 청약결과 일반공모 총 청약주식수가 일반공모 주식수에 미달하는 경우에는 청약주식수대로 배정하며, 배정결과 발생하는 잔여주식은 "대표주관회사"가 자기의 계산으로 인수합니다.
라) 단, 대표주관회사는 「증권 인수업무 등에 관한 규정」 제9조제2항 7호에 의거 일반 고위험고수익투자신탁, 벤처기업투자신탁 및 일반청약자에 대하여 배정하여야 할 주식이 50,000주(액면가 500원 기준) 이하 이거나, 배정할 주식의 공모금액이 1억원 이하인 경우에는 일반청약자에게 배정하지 아니하고 자기의 계산으로 인수할 수 있습니다.
5) 투자설명서 교부에 관한 사항
- 「자본시장과 금융투자업에 관한 법률」 제124조에 의거, 본 주식의 청약에 대한 투자설명서 교부 의무는 당사 및 대표주관회사가 부담하며, 금번 유상증자의 청약에 참여하시는 투자자께서는 투자설명서를 의무적으로 교부받으셔야 합니다.
- 금번 유상증자에 청약하고자 하는 투자자께서는 (동법 제9조제5항에 규정된 전문투자자 및 동법 시행령 제132조에 따라 투자설명서의 교부가 면제되는 자 제외) 청약하시기 전 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
- 투자설명서 수령거부의사표시는 서면, 전화, 전신, 모사전송, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 가능합니다.
-전자문서의 방법으로 투자설명서를 교부받고자 하는 투자자는 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각호의 요건을 모두 충족하여야 합니다.
가) 투자설명서 교부 방법 및 일시
| 구분 | 교부방법 | 교부일시 |
|---|---|---|
| 구주주 청약자 |
1),2),3)을 병행 1) 우편 송부 2) 대표주관회사의 본,지점 3) 대표주관회사의 홈페이지나 HTS, MTS에서 교부 |
1) 우편송부시 : 구주주 청약초일인 2021년 12월 16일 전 수취 가능 2) 대표주관회사의 본,지점, 홈페이지 또는 HTS, MTS 교부 : 청약종료일(2021년 12월 17일)까지 |
| 일반 청약자 |
1),2)를 병행 1) 대표주관회사의 본,지점 2) 대표주관회사의 홈페이지나 HTS, MTS에서 교부 |
대표주관회사의 본, 지점, 홈페이지 또는 HTS, MTS 교부 : 청약종료일(2021년 12월 22일)까지 |
※ 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
나) 확인절차
(1) 우편을 통한 투자설명서 수령 시
(가) 청약하시기 위해 지점을 방문하셨을 경우, 직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
(나) HTS를 통한 청약을 원하시는 경우, 청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
(다) 주주배정 유상증자 경우 유선청약이 가능합니다. 유선 상으로 신분확인을 하신 후, 투자설명서 교부 확인을 해주시고 청약을 진행하여 주시기 바랍니다.
(2) 지점 방문을 통한 투자설명서 수령 시
직접 투자설명서 교부확인서를 작성하시고 청약을 진행하시기 바랍니다.
(3) 홈페이지 또는 HTS를 통한 교부
청약화면에 추가된 투자설명서 다운로드 및 투자설명서 교부 확인에 체크가 선행되어야 청약업무 진행이 가능합니다.
다) 기타
(1) 금번 유상증자에서 당사는 본 증권신고서의 효력발생 이후 주주명부상 주주분들에게 투자설명서를 우편으로 발송할 예정입니다. 우편의 반송 등에 의한 사유로 교부를 받지 못하신 투자자께서는 지점 방문을 통해 인쇄물을 받으실 수 있으며, 또한 동일한 내용의 투자설명서를 전자문서의 형태로 대표주관회사의 홈페이지에서다운로드 받으실 수 있습니다. 다만, 전자문서의 형태로 교부 받으실 경우, 「자본시장과 금융투자업에 관한 법률」 제124조제1항 각 호의 요건을 모두 충족해야만 청약이 가능합니다.
(2) 구주주 청약 시 대표주관회사 이외의 증권회사를 이용한 청약 방법
해당 증권회사의 청약 방법 및 규정에 의해 청약을 진행하시기 바랍니다. 이 경우에도, 본 투자설명서의 교부에 대한 확인 등의 절차를 수행하지 아니하면, 금번 유상증자의 청약에 참여하실 수 없음에 유의하시기 바랍니다.
※ 투자설명서 교부를 받지 않거나, 수령거부의사를 서면 등의 방법으로 표시하지 않을 경우, 본 유상증자의 청약에 참여할 수 없습니다.
| ※ 관련법규 「자본시장과 금융투자업에 관한 법률」 제9조 (그 밖의 용어의 정의) ⑤ 이 법에서 "전문투자자"란 금융투자상품에 관한 전문성 구비 여부, 소유자산규모 등에 비추어 투자에 따른 위험감수능력이 있는 투자자로서 다음 각 호의 어느 하나에 해당하는 자를 말한다. 다만, 전문투자자 중 대통령령으로 정하는 자가 일반투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우 금융투자업자는 정당한 사유가 있는 경우를 제외하고는 이에 동의하여야 하며, 금융투자업자가 동의한 경우에는 해당 투자자는 일반투자자로 본다. <개정 2009.2.3> 1. 국가 2. 한국은행 3. 대통령령으로 정하는 금융기관 4. 주권상장법인. 다만, 금융투자업자와 장외파생상품 거래를 하는 경우에는 전문투자자와 같은 대우를 받겠다는 의사를 금융투자업자에게 서면으로 통지하는 경우에 한한다. 5. 그 밖에 대통령령으로 정하는 자 제124조 (정당한 투자설명서의 사용) ① 누구든지 증권신고의 효력이 발생한 증권을 취득하고자 하는 자(전문투자자, 그 밖에 대통령령으로 정하는 자를 제외한다)에게 제123조에 적합한 투자설명서(집합투자증권의 경우 투자자가 제123조에 따른 투자설명서의 교부를 별도로 요청하지 아니하는 경우에는 제2항제3호에 따른 간이투자설명서를 말한다. 이하 이 항 및 제132조에서 같다)를 미리 교부하지 아니하면 그 증권을 취득하게 하거나 매도하여서는 아니 된다. 이 경우 투자설명서가 제436조에 따른 전자문서의 방법에 따르는 때에는 다음 각 호의 요건을 모두 충족하는 때에 이를 교부한 것으로 본다.<개정 2013.5.28> 1. 전자문서에 의하여 투자설명서를 받는 것을 전자문서를 받을 자(이하 "전자문서수신자"라 한다)가 동의할 것 2. 전자문서수신자가 전자문서를 받을 전자전달매체의 종류와 장소를 지정할 것 3. 전자문서수신자가 그 전자문서를 받은 사실이 확인될 것 4. 전자문서의 내용이 서면에 의한 투자설명서의 내용과 동일할 것 「자본시장과 금융투자업에 관한 법률 시행령」 제11조(증권의 모집ㆍ매출) ① 법 제9조제7항 및 제9항에 따라 50인을 산출하는 경우에는 청약의 권유를 하는 날 이전 6개월 이내에 해당 증권과 같은 종류의 증권에 대하여 모집이나 매출에 의하지 아니하고 청약의 권유를 받은 자를 합산한다. 다만, 다음 각 호의 어느 하나에 해당하는 자는 합산 대상자에서 제외한다. <개정 2009. 10. 1., 2010. 12. 7., 2013. 6. 21., 2013. 8. 27., 2016. 6. 28., 2016. 7. 28.> 1. 다음 각 목의 어느 하나에 해당하는 전문가 가. 전문투자자 나. 삭제<2016. 6. 28.> 다. 「공인회계사법」에 따른 회계법인 라. 신용평가회사(법 제335조의3에 따라 신용평가업인가를 받은 자를 말한다. 이하 같다) 마. 발행인에게 회계, 자문 등의 용역을 제공하고 있는 공인회계사ㆍ감정인ㆍ변호사ㆍ변리사ㆍ세무사 등 공인된 자격증을 가지고 있는 자 바. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 전문가로서 금융위원회가 정하여 고시하는 자 2. 다음 각 목의 어느 하나에 해당하는 연고자 가. 발행인의 최대주주[「금융회사의 지배구조에 관한 법률」 제2조제6호가목에 따른 최대주주를 말한다. 이 경 우 "금융회사"는 "법인"으로 보고, "발행주식(출자지분을 포함한다. 이하 같다)"은 "발행주식"으로 본다. 이하 같다]와 발행주식 총수의 100분의 5 이상을 소유한 주주 나. 발행인의 임원(「상법」 제401조의2제1항 각 호의 자를 포함한다. 이하 이 호에서 같다) 및 「근로복지기본 법」에 따른 우리사주조합원 다. 발행인의 계열회사와 그 임원 라. 발행인이 주권비상장법인(주권을 모집하거나 매출한 실적이 있는 법인은 제외한다)인 경우에는 그 주주 마. 외국 법령에 따라 설립된 외국 기업인 발행인이 종업원의 복지증진을 위한 주식매수제도 등에 따라 국내 계열 회사의 임직원에게 해당 외국 기업의 주식을 매각하는 경우에는 그 국내 계열회사의 임직원 바. 발행인이 설립 중인 회사인 경우에는 그 발기인 사. 그 밖에 발행인의 재무상황이나 사업내용 등을 잘 알 수 있는 연고자로서 금융위원회가 정하여 고시하는 자 제132조 (투자설명서의 교부가 면제되는 자) 법 제124조제1항 각 호 외의 부분 전단에서 "대통령령으로 정하는 자"란 다음 각 호의 어느 하나에 해당하는 자를 말한다. <개정 2009.7.1, 2013.6.21> 1. 제11조 제1항 제1호 다목부터 바목까지 및 같은 항 제2호 각 목의 어느 하나에 해당하는 자 1의2. 제11조제2항제2호 및 제3호에 해당하는 자 2. 투자설명서를 받기를 거부한다는 의사를 서면, 전화·전신·모사전송, 전자우편 및 이와 비슷한 전자통신, 그 밖에 금융위원회가 정하여 고시하는 방법으로 표시한 자 3. 이미 취득한 것과 같은 집합투자증권을 계속하여 추가로 취득하려는 자. 다만, 해당 집합투자증권의 투자설명서의 내용이 직전에 교부한 투자설명서의 내용과 같은 경우만 해당한다. |
6) 주권교부에 관한 사항
주권유통개시일: 2022년 01월 10일 (2019년 9월 16일 전자증권제도가 시행됨에 따라 실물 주권의 교부 없이 각 주주의 보유 증권계좌로 상장일에 주식이 등록발행되어 입고되며, 상장일부터 유통이 가능합니다. 단, 유관기관과의 업무 협의 과정에서 상기 일정은 변경될 수 있음을 유의하시기 바랍니다.)
7) 청약증거금의 대체 및 반환 등에 관한 사항
청약증거금은 청약금액의 100%로 하고, 주금납입기일에 주금납입금으로 대체하며, 청약증거금에 대해서는 무이자로 합니다.
8) 주금납입장소 : 중소기업은행 양재동지점
다. 신주인수권증서에 관한 사항
| 신주배정기준일 | 신주인수권증서의 매매 금융투자업자 | |
|---|---|---|
| 회사명 | 회사고유번호 | |
| 2021년 10월 26일 |
케이비증권(주) | 00164876 |
1) 금번과 같이 주주배정방식의 유상증자를 실시할 때, 주주가 소유하고 있는 주식수 비율대로 신주를 인수할 권리인 신주인수권에 대하여 당사는 「자본시장과 금융투자업에 관한 법률」 제165의6조3항 및 「증권의 발행 및 공시 등에 관한 규정」 제5-19조에 의거하여 주주에게 신주인수권증서를 발행합니다.
2) 금번 유상증자시 신주인수권증서는 전자증권제도 시행일(2019년 9월 16일) 이후에 발행되고 상장될 예정으로 전자증권으로 발행됩니다. 주주가 증권사 계좌에 보유하고 있는 주식(기존 '실질주주' 보유주식)에 대하여 배정되는 신주인수권증서는 해당 증권사 계좌에 발행되어 입고되며, 명의개서대행기관 특별계좌에 관리되는 주식(기존 '명부주주' 보유주식)에 대하여 배정되는 신주인수권증서는 명의개서대행기관 내 특별계좌에 소유자별로 발행 처리됩니다.
3) 신주인수권증서 매매의 중개를 할 증권회사는 대표주관회사인 케이비증권(주)로 합니다.
4) 신주인수권증서 매매 등
신주인수권증서를 매매하고자 하는 주주는 신주인수권증서를 예탁하고 있는 증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
5) 신주인수권증서를 양수한 투자자의 청약방법
신주인수권증서를 증권회사에 예탁하고 있는 양수인은 당해 증권회사 점포 및 케이비증권(주)의 본점 및 지점을 통해 해당 신주인수권증서에 기재되어 있는 수량만큼 청약할 수 있으며 청약 기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다.
6) 당사는 금번 주주배정후 실권주 일반공모 유상증자 관련 신주인수권증서의 상장을 한국거래소에 신청할 예정입니다. 동 신주인수권증서가 상장될 경우 상장기간은 2021년 12월 01일부터 2021년 12월 07일까지 5거래일간으로 예정하고 있으며, 동 기간 중 상장된 신주인수권증서를 한국거래소에서 매매할 수 있습니다. 동 신주인수권증서는 2021년 12월 08일에 상장폐지될 예정입니다. 「코스닥시장 상장규정」 제16조 3(신주인수권증서의 신규상장)에 따라 5거래일 이상 상장되어야 하며, 동 규정 제44조의3 "신주인수권증서의 상장폐지기준"에 따라 신주청약 개시일 5거래일전에 상장폐지되어야 함)
7) 신주인수권증서의 거래 관련 추가사항
당사는 금번 유상증자의 신주인수권증서를 상장신청할 예정인 바, 현재까지 관계기관과의 협의를 통해 확인된 신주인수권증서 상장시의 제반 거래관련 사항은 다음과 같습니다.
가) 상장방식 : 전자등록발행된 신주인수권증서 전부를 상장합니다.
나) 주주의 신주인수권증서 거래
| 구분 | 상장거래방식 | 계좌대체 거래방식 |
|---|---|---|
| 방법 | 주주의 신주인수권증서를 전자등록발행하여 상장합니다. 상장된 신주인수권증서를 장내거래를 통하여 매수하여 증권사 계좌에 보유한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. 주주의 신주인수권증서는 전자등록발행되므로 실물 증서는 발행되지 않습니다. | 신주인수권증서를 매매하고자 하는 실질주주는 위탁증권회사에 신주인수권증서의 매매를 증명할 수 있는 서류를 첨부하여 거래상대방 명의의 위탁자 계좌로 신주인수권증서의 계좌대체를 청구합니다. 위탁자계좌를 통하여 신주인수권증서를 매수한 자는 그 수량만큼 청약할 수 있으며, 청약기일내에 청약하지 아니하면 그 권리와 효력은 상실됩니다. |
| 기간 | 2021년 12월 01일부터 2021년 12월 07일까지(5거래일간) 거래 |
2021년 11월 24일부터 2021년 12월 09일까지거래 |
(1) 상장거래 : 2021년 12월 01일부터 2021년 12월 07일까지(5영업일간) 거래 가능합니다.
(2) 계좌대체거래 : 신주배정통지일인 2021년 11월 24일(예정)부터 2021년 12월 09일까지 거래 가능 합니다.
* 신주인수권증서의 계좌대체(장외거래)는 신주인수권증서 상장거래의 결제일인 2021년 12월 09일까지 가능하며, 동일 이후부터는 신주인수권증서의 청약권리 명세를 확정하므로 신주인수권증서의 계좌대체(장외거래)가 제한됩니다.
(3) 신주인수권증서는 전자등록발행되므로 실물은 발행되지 않습니다.
다) 특별계좌 소유주(기존 '명부주주')의 신주인수권증서 거래
(1) '특별계좌 보유자(기존 '명부주주')'는 명의개서대행기관에 '특별계좌'에서 '일반전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후 금번 유상증자 청약 참여또는 신주인수권증서의 매매가 가능합니다.
(2) '특별계좌 보유자(기존 '명부주주')'는 신주인수권증서의 '일반 전자등록계좌(증권회사 계좌)'로 이전 없이 대표주관회사의 본ㆍ지점에서 직접 청약하는 방법으로도 금번 유상증자에 청약이 가능합니다. 다만 신주인수권증서의 매매는 명의개서대행기관에 '특별계좌'에서 '일반 전자등록계좌(증권회사 계좌)'로 신주인수권증서를 이전 신청한 후에만 가능하므로 이 점 유의하시기 바랍니다.
라. 기타 모집 또는 매출에 관한 사항
1) 본 증권신고서는 공시심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요 내용의 변경시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있으므로 투자자 여러분께서는 투자시 이러한 점을 감안하시기 바랍니다.
2) 「자본시장과 금융투자업에 관한 법률」 제120조3항에 의거 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 주주 및 투자자에게 귀속됩니다.
3) 본 증권신고서에 기재된 내용은 신고서 제출일 현재까지 발생된 것으로 본 신고서에 기재된 사항 이외에 자산, 부채, 현금흐름 또는 손익상황에 중대한 변동을 가져오거나 중요한 영향을 미치는 사항은 없습니다. 따라서, 주주 및 투자자가 투자의사를 결정함에 있어 유의하여야 할 사항이 본 증권신고서상에 누락되어 있지 않습니다.
4) 금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서, 반기보고서, 분기보고서 및 감사보고서 등 기타 정기공시사항과 수시공시사항 등이 전자공시되어 있사오니 투자의사를 결정하시는 데 참조하시기 바랍니다.
5. 인수 등에 관한 사항
| [인수방법: 잔액인수] |
| 인수인 | 인수주식 종류 및 수 | 인수대가 | |
|---|---|---|---|
| 대표주관회사 | 케이비증권(주) | 인수주식의 종류: 기명식 보통주식 인수주식의 수: 최종 실권주 X 인수비율(100%) |
인수수수료 : 모집총액의 1.5% 실권수수료 : 잔액인수금액의 10.0% |
| 주1) 최종 실권주 : 구주주청약 및 일반공모 후 발생한 배정잔여주 또는 청약미달주식 주2) 모집총액 : 최종 발행가액 X 총 발행주식수 |
II. 증권의 주요 권리내용
당사가 금번 주주배정후 실권주 일반공모 유상증자를 통하여 발행할 증권은 기명식 보통주이며, 동 증권의 주요 권리내용은 다음과 같습니다. 동 증권의 주요 권리는 당사 정관에 의거합니다.
1. 액면금액
제6조(1주의 금액) 회사가 발행하는 주식 1주의 금액은 500원으로 한다.
2. 주식의 발행 및 배정에 관한 사항
제5조(발행예정주식의 총수) 회사가 발행할 주식의 총수는 100,000,000주로 한다.
제8조(주식 및 주권의 종류) ①회사가 발행할 주식은 보통주식과 종류주식으로 한다.
②회사가 발행할 종류주식은 이익배당 또는 잔여재산분배에 관한 우선주식, 의결권 배제에 관한 주식, 상환주식, 전환주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다.
③제8조의3 내지 제8조의6에 따라 발행되는 종류주식의 총수는 회사의 발행주식총수의 4분의 1을 초과할 수 없다.
제8조의2(이익배당에 관한 종류주식) ①회사는 이익배당에 관하여 우선권이 있으면서 의결권이 있는 주식(이하 “배당우선주식”)을 발행할 수 있으며, 제5조의 발행예정주식총수 중 배당우선주식의 발행한도는 25,000,000주로 한다.
②배당우선주식에 대한 우선배당은 1주의 금액을 기준으로 연 1% 이상의 범위에서 발행 시에 이사회가 정한 배당률에 따라 현금으로 지급한다.
③배당우선주식에 대하여 제2항에 따른 배당을 하고 보통주식에 대하여 상환주식의 배당률과 동률의 배당을 한 후, 잔여배당가능이익이 있으면 보통주식과 상환주식에 대하여 동등한 비율로 배당한다.
④배당우선주식에 대하여 제2항에 따른 배당을 하지 못한 사업연도가 있는 경우에는 미배당분을 누적하여 다음 사업연도의 배당 시에 우선하여 배당한다.
⑤배당우선주식의 존속기간은 발행일로부터 10년의 범위 내에서 발행 시 이사회 결의로 정하며, 이 기간 만료와 동시에 보통주식으로 전환된다. 그러나 위 기간 중 소정의 배당을 하지 못한 경우에는 소정의 배당을 완료할 때까지 그 기간을 연장한다. 이 경우 전환으로 인하여 발행하는 주식에 대한 이익의 배당에 관하여는 제12조의 규정을 준용한다.
제8조의3(이익배당, 의결권 배제 및 주식의 상환에 관한 종류주식) ①회사는 이익배당, 의결권 배제 및 주식의 상환에 관한 종류주식(이하 “상환주식”)을 발행할 수 있다.
②제5조의 발행예정주식총수 중 상환주식의 발행한도는 6,250,000주로 한다.
③상환주식에 대하여는 우선 배당한다. 상환주식에 대한 우선배당은 1주의 금액을 기준으로 연 1% 이상의 범위에서 발행 시에 이사회가 정한 배당률에 따라 현금으로 지급한다.
④상환주식에 대하여 제3항에 따른 배당을 하고 보통주식에 대하여 상환주식의 배당률과 동률의 배당을 한 후, 잔여배당가능이익이 있으면 보통주식과 상환주식에 대하여 동등한 비율로 배당한다.
⑤상환주식에 대하여 제3항에 따른 배당을 하지 못한 사업연도가 있는 경우에는 미배당분을 누적하여 다음 사업연도의 배당 시에 우선하여 배당한다.
⑥상환주식의 주주에게는 상환주식에 대하여 제3항에 따른 배당을 하지 아니한다는 결의가 있는 총회의 다음 총회부터 그 우선적 배당을 한다는 결의가 있는 총회의 종료 시까지 의결권이 있다.
⑦회사는 이사회 결의로 상환주식을 상환할 수 있다.
⑧주주는 회사에 대하여 상환주식의 상환을 청구할 수 있으며, 그 세부적인 조건은 발행 시에 이사회 결의로 정한다.
⑨상환가액은 발행가액에 발행가액의 연 10%를 넘지 않는 범위 내에서 발행 시 이사회에서 정한 금액을 더한 가액으로 한다. 다만, 상환가액을 조정하려는 경우 이사회에서 조정할 수 있다는 뜻, 조정사유, 조정방법 등을 정하여야 한다.
⑩상환기간(또는 상환청구 기간)은 상환주식의 발행 후 3년이 경과한 날로부터 10년이 되는 날의 범위 내에서 발행 시 이사회 결의로 정한다.
⑪회사는 주식의 취득의 대가로 현금이외의 유가증권이나(다른 종류의 주식은 제외한다) 그 밖의 자산을 교부할 수 있다.
제8조의4(이익배당, 의결권 배제 및 주식의 전환에 관한 종류주식) ①회사는 이익배당, 의결권 배제 및 주식의 전환에 관한 종류주식(이하 “전환주식”)을 발행할 수 있다.
②제5조의 발행예정주식총수 중 전환주식의 발행한도는 6,250,000주로 한다.
③전환주식에 대하여는 우선 배당한다. 전환주식에 대한 우선배당은 1주의 금액 기준 연 1% 이상으로 발행 시에 이사회가 정한 배당률에 따라 현금으로 지급한다.
④전환주식에 대하여 제3항에 따른 배당을 하고 보통주식에 대하여 전환주식의 배당률과 동률의 배당을 한 후, 잔여배당가능이익이 있으면 보통주식과 전환주식에 대하여 동등한 비율로 배당한다.
⑤전환주식에 대하여 제3항에 따른 배당을 하지 못한 사업연도가 있는 경우에는 미배당분을 누적하여 다음 사업연도의 배당 시에 우선하여 배당한다.
⑥전환주식의 주주에게는 전환주식에 대하여 제3항에 따른 배당을 하지 아니한다는 결의가 있는 총회의 다음 총회부터 그 우선적 배당을 한다는 결의가 있는 총회의 종료 시까지 의결권이 있다.
⑦전환으로 인하여 발행할 주식은 보통주식으로 하고, 전환을 청구할 수 있는 기간은 발행 시 이사회 결의로 정한 존속기간 이내로 하며, 주주는 전환기간 내에 전환주식의 전부 또는 일부의 보통주식 전환을 청구할 권리가 있다. 전환 청구가 없는 경우 전환주식은 위 존속기간 만료 시에 자동으로 보통주식으로 전환된다.
⑧제7항의 전환비율은 전환주식 1주당 전환으로 인하여 발행하는 보통주식 1주로 한다. 전환가액의 조정 사유 및 방법 등 전환에 대한 사항은 발행 시에 이사회 결의로 정한다.
⑨제7항에 따라 발행되는 신주에 대한 이익의 배당에 관하여는 제12조를 준용한다.
제8조의5(이익배당, 의결권 배제에 관한 종류주식) ①회사는 이익배당, 의결권 배제에 관한 종류주식(이하 “무의결권 배당우선 주식”)을 발행할 수 있다.
②제5조의 발행예정주식총수 중 무의결권 배당우선 주식의 발행한도는 6,250,000주로 한다.
③무의결권 배당우선 주식의 발행에 관하여는 제8조의2 제2항 내지 제5항을 준용한다.
④무의결권 배당우선 주식의 주주에게는 무의결권 배당우선 주식에 대하여 제3항에 의하여 준용되는 제8조의2 제2항에 따른 배당을 하지 아니한다는 결의가 있는 총회의 다음 총회부터 그 우선적 배당을 한다는 결의가 있는 총회의 종료 시까지 의결권이 있다.
제8조의6(이익배당, 의결권 배제 및 주식의 상환 및 전환에 관한 종류주식) ①회사는 제8조의3에 따른 상환주식 및 제8조의4에 따른 전환주식의 성격을 동시에 지닌 이익배당, 의결권 배제 및 주식의 상환 및 전환에 관한 종류주식(이하 “상환전환주식”)을 발행할 수 있다.
②제5조의 발행예정주식총수 중 상환전환주식의 발행한도는 6,250,000주로 한다.
③상환전환주식의 발행과 관련하여 위 제8조의3 내지 제8조의4를 준용한다.
제8조의7(주식 등의 전자등록) 회사는 「주식·사채 등의 전자등록에 관한 법률」 제2조 제1호에 따른 주식 등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식 등을 전자등록하여야 한다.
제9조(신주인수권) ①회사의 주주는 상법 제418조의 규정에 의하여 그가 소유한 주식수에 비례하여 신주의 배정을 받을 권리를 가진다.
②제1항의 규정에 불구하고 다음 각 호의 어느 하나에 해당하는 경우에는 주주 외의 자에게 이사회 결의로 신주를 배정할 수 있다.
1. 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 자본시장과 금융투자업에 관한 법률 제165조의6에 따라 일반공모증자 방식으로 신주를 발행하는 경우.
2. 상법 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우
3. 발행하는 주식총수의 100분의 20 범위 내에서 우리사주조합원에게 주식을 우선 배정하는 경우
4. 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권의 행사로 인하여 신주를 발행하는 경우
5. 발행주식의 100분의 30을 초과하지 않는 범위 내에서 사업상 중요한 기술도입, 연구개발, 생산·판매·자본제휴 등 회사의 경영상의 목표를 달성하기 위하여 필요한 경우
6. (삭제 2019. 3. 26.)
7. 발행주식수의 100분의 30을 초과하지 않는 범위 내에서 긴급한 자금조달을 위하여 국내외 금융기관, 기관투자자 또는 일반투자자 등에게 신주를 발행하는 경우
8. 회사가 경영상 필요로 외국인투자촉진법에 의한 외국인투자를 위하여 신주를 발행하는 경우
9. 주식예탁증서(DR) 발행에 따라 신주를 발행하는 경우
10. 회사의 자금조달 또는 경영상의 목적으로 임원, 종업원, 기술도입선, 거래선, 기타 회사의 경영 및 영업상 관련이 있는 자에게 신주를 발행하는 경우
③제2항 각 호의 어느 하나의 방식에 의해 신주를 발행할 경우에는 발행할 주식의 종류와 수 및 발행가격 등은 이사회의 결의로 정한다.
④주주가 신주인수권을 포기 또는 상실하거나 신주배정에서 단주가 발생하는 경우에 그 처리방법은 이사회의 결의로 정한다.
제10조(주식매수선택권) ①회사는 주주총회의 특별결의로 발행주식총수의 100분의 15 범위 내에서 주식매수선택권을 부여할 수 있다. 다만, 상법 제542조의3 제3항의 규정에 따라 발행주식총수의 100분의 3 범위 내에서 이사회의 결의로 주식매수선택권을 부여할 수 있다. 이 경우 주식매수선택권은 경영성과 또는 주가지수 등에 연동하는 성과연동형으로 부여할 수 있다.
②제1항 단서의 규정에 따라 이사회 결의로 주식매수선택권을 부여한 경우에는 그 부여 후 처음으로 소집되는 주주총회의 승인을 얻어야 한다.
③제1항의 규정에 의한 주식매수선택권 부여대상자는 회사의 설립·경영과 기술혁신 등에 기여하거나 기여할 수 있는 회사의 이사·감사 또는 피용자 및 상법 시행령 제30조 제1항이 정하는 관계회사의 이사·감사 또는 피용자로 한다. 다만, 회사의 이사에 대하여는 이사회의 결의로 주식매수선택권을 부여할 수 없다.
④제3항의 규정에 불구하고 상법 제542조의8 제2항 제5호의 최대주주(이하 “최대주주”라 함)와 주요주주 및 그 특수관계인에게는 주식매수선택권을 부여할 수 없다. 다만, 회사 또는 제3항의 관계회사의 임원이 됨으로써 특수관계인에 해당하게 된 자(그 임원이 계열회사의 상무에 종사하지 아니하는 이사·감사인 경우를 포함한다)에게는 주식매수선택권을 부여할 수 있다.
⑤임원 또는 직원 1인에 대하여 부여하는 주식매수선택권은 발행주식총수의 100분의 3을 초과할 수 없다.
⑥다음 각 호의 어느 하나에 해당하는 경우에는 이사회의 결의로 주식매수선택권의 부여를 취소할 수 있다.
1. 주식매수선택권을 부여받은 자가 본인의 의사에 따라 사임 또는 사직한 경우
2. 주식매수선택권을 부여받은 자가 고의 또는 과실로 회사에 중대한 손해를 입힌 경우
3. 회사의 파산 등으로 주식매수선택권의 행사에 응할 수 없는 경우
4. 기타 주식매수선택권 부여계약에서 정한 취소사유가 발생한 경우
⑦회사는 주식매수선택권을 다음 각 호의 1에서 정한 방법으로 부여한다.
1. 주식매수선택권의 행사가격으로 새로이 보통주식(또는 종류주식)을 발행하여 교부하는 방법
2. 주식매수선택권의 행사가격으로 보통주식(또는 종류주식)의 자기주식을 교부하는 방법
3. 주식매수선택권의 행사가격과 시가와의 차액을 현금 또는 자기주식으로 교부하는 방법
⑧주식매수선택권을 부여받은 자는 제1항의 결의일부터 2년 이상 재임 또는 재직하여야 주식매수선택권을 행사할 수 있으며, 주식매수선택권을 행사할 수 있는 날로부터 1년 내에 이를 행사하여야 한다. 다만, 제1항의 결의일로부터 2년 내에 사망하거나 그 밖에 본인의 책임이 아닌 사유로 퇴임 또는 퇴직한 자는 그 행사기간 동안 주식매수선택권을 행사할 수 있다.
⑨주식매수선택권의 행사로 인하여 발행한 신주에 대한 이익의 배당에 관하여는 제12조의 규정을 준용한다.
제11조(우리사주매수선택권)
①회사는 주주총회의 특별결의로 우리사주조합원에게 발행주식총수의 100분의 20범위 내에서 근로복지기본법 제39조의 규정에 의한 우리사주매수선택권을 부여할 수 있다. 다만, 발행주식총수의 100분의 10 범위 내에서는 이사회의 결의로 우리사주매수선택권을 부여할 수 있다.
②우리사주매수선택권의 행사로 발행하거나 양도할 주식은 보통주식으로 한다.
③우리사주매수선택권은 타인에게 양도할 수 없다. 다만, 우리사주매수선택권을 부여 받은 자가 사망한 때에는 그 상속인이 이를 부여받은 것으로 한다.
④우리사주매수선택권을 부여받은 자는 제1항의 결의일부터 6월 이상 2년 이하의 기간 이내에 권리를 행사할 수 있다. 다만, 제1항의 결의로 그 기간 중 또는 그 기간 종료 후 일정한 행사기간을 정하여 권리를 행사하게 할 수 있다.
⑤우리사주매수선택권의 행사가격은 근로복지기본법 시행규칙 제14조의 규정이 정하는 평가가격의 100분의 70 이상으로 한다. 다만, 주식을 발행하여 교부하는 경우로서 행사가격이 당해 주식의 권면액보다 낮은 때에는 그 권면액을 행사가격으로 한다.
⑥다음 각 호의 어느 하나에 해당하는 경우에는 이사회의 결의로 우리사주매수선택권의 부여를 취소할 수 있다.
1. 우리사주매수선택권을 부여받은 우리사주조합원이 고의 또는 과실로 회사에 중대한 손해를 끼친 경우
2. 회사의 파산 또는 해산 등으로 우리사주매수선택권의 행사에 응할 수 없는 경우
3. 기타 우리사주매수선택권 부여계약에서 정한 취소사유가 발생한 경우
⑦우리사주매수선택권의 행사로 인하여 발행한 신주에 대한 이익의 배당에 관 하여는 제12조의 규정을 준용한다.
3. 배당에 관한 사항
제12조(신주의 배당기산일) 회사가 유상증자, 무상증자 및 주식배당에 의하여 신주를 발행하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전영업연도말에 발행된 것으로 본다.
제53조(이익금의 처분) 회사는 매사업연도의 처분전이익잉여금을 다음과 같이 처분한다.
1. 이익준비금
2. 기타의 법정적립금
3. 배당금
4. 임의적립금
5. 기타의 이익잉여금처분액
제54조(이익배당) ①이익의 배당은 금전과 주식으로 할 수 있다.
②이익의 배당을 주식으로 하는 경우 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로 할 수 있다.
③제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다.
④이익배당은 주주총회의 결의로 정한다. 다만, 제51조 제2항에 따라 재무제표를 이사회가 승인하는 경우에는 이사회의 결의로 정한다.
4. 의결권에 관한 사항
제25조(주주의 의결권) 주주의 의결권은 1주마다 1개로 한다.
제26조(상호주에 대한 의결권 제한) 회사, 회사와 회사의 자회사 또는 회사의 자회사가 다른 회사의 발행주식총수의 10분의 1을 초과하는 주식을 가지고 있는 경우 그 다른 회사가 가지고 있는 이 회사의 주식은 의결권이 없다.
제27조(의결권의 불통일행사) ①2이상의 의결권을 가지고 있는 주주가 의결권의 불통일행사를 하고자 할 때에는 회일의 3일 전에 회사에 대하여 서면 또는 전자문서로 그 뜻과 이유를 통지하여야 한다.
②회사는 주주의 의결권의 불통일행사를 거부할 수 있다. 그러나 주주가 주식의 신탁을 인수하였거나 기타 타인을 위하여 주식을 가지고 있는 경우에는 그러하지 아니하다.
제28조(의결권의 대리행사) ①주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있다.
②제1항의 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다.
III. 투자위험요소
1. 사업위험
| [주요 용어] |
|
용어 |
설명 |
|---|---|
|
호중구 |
주로 골수에서 만들어지는 과립백혈구의 일종으로 단핵구와 같은 계열의 세포. 사람의 혈액에서 백혈구의 50~70%, 과립구의 약 90%를 점유하고 있는 세포로, 주요 역할은 체내에 침입한 세균 등 이물을 식작용으로 흡수하여 과산화수소나 리소좀 중의 소화효소로 분해하여 인체를 보호함. |
|
구강점막염(CRIOM) |
구강 점액막에 통증과 염증이 오는 상태로, 화학요법과 방사선치료의 흔한 부작용임. 화학요법 시행 후 5-10일 후부터 시작되고, 방사선 요법이 시작되면 2주 후부터 증상이 시작됨. 궤양으로 발전하게 될 경우, 음식섭취가 힘들어져, 환자의 체력저하를 유발하게 되고, 더 나아가 암의 치료에도 영향을 끼침. |
|
G-CSF |
과립구 집락자극인자. 염증이나 내독소(endotoxin)에 자극을 받아서 대식세포, 섬유모세포, 내피세포 등이 생산하는 시토카인(cytokine)으로, 골수에서 호중구의 생산을 촉진함. |
|
혁신신약지정 |
2012년 7월 9일 미국식품 의약청 안전 및 혁신법 (Food and Drug Administration and Innovation Act) 제 902 항에 의거하여 의회가 창안 한 약물 개발을 촉진법에 의해 미국 FDA가 지정하는 제도임. FDA의 "혁신신약"지정은 예비 임상 시험에서, 심각한 또는 생명을 위협하는 질병을 앓고 있는 환자에게 기존 치료법에 비해 상당한 치료 이점을 제공 할 가능성을 제시할 경우, 약물 후보자에게 우선 심사권을 부여하는 제도. |
|
신속심사지정 |
신속심사지정은 심각하거나 생명을 위협하는 상태의 환자를 치료하고 미충족 의학적 수요를 채우는 약물 개발을 촉진하기 위해, 임상시험용 의약품에 대해 신속한 검토프로세스를 진행할 수 있도록 미국 FDA가 지정하는 제도임. |
|
희귀의약품지정 |
희귀의약품 지정은 소수의 환자들이 앓는 희귀질환 치료제로서 시장의 규모가 작아 제약기업의 개발동기를 높이기 위해 제도적으로 만든 개발 촉진책으로, 개발과정의 특혜와 일정기간 시장 독점권을 제공함. |
|
병행투여/병용투여 (Combination therapy |
두 가지 이상의 의약품을 동시에 혹은 연속적으로 투여하는 치료 방법. |
|
자가면역질환 (Autoimmune disease) |
생체 내 단백질에 대한 항체가 생성되어 공격함으로써 발생되는 질환. 항체는 외부의 물질로부터 신체를 보호하기 위해 생성되는 단백질이기 때문에 정상적인 상황에서는 생체 내 물질에 대해서는 항체가 만들어지지 않지만 경우에 따라서 항체가 만들어지기도 하는데, 이들 항체가 생체 내 세포 혹은 조직을 공격하기 때문에 생기는 질환. 대표적인 질환으로 류마티스 관절염, 당뇨 등이 있음. 생체 내 면역 반응이 비정상적으로 향상되어 나타나는 질환을 포함하는 경우도 있음. |
|
작용기전 (Mode of Action; MoA) |
의약품이 효능을 나타내는 화학적 작용의 과정과 원리. 항체의약품이 치료효능을 나타내는 기전. 타겟 단백질의 생체 내 기능 및 질병에서의 역할을 어떤 방식으로 억제하는지를 분석함. |
|
CCL2 |
단핵구 화학 유인 물질 1 (MCP1) 및 유도성 사이토카인 A2라고도 불리는 작은 사이토카인. 단핵구, T 세포, 호중구 및 수지상 세포 등의 면역세포들을 감염 또는 염증조직에 모으는 역할을 함. |
|
CXCL2 |
작은 사이토카인으로 대식세포 염증 단백질 2-alpha (MIP2-alpha), 성장 조절 단백질 beta (Gro-beta) 및 Gro oncogene- 2 (Gro-2)라고도 불림. 단핵구와 대식세포에 의해 분비되고 과립 백혈구와 조혈 간세포를 조직으로 끌어들이는 역할을 함. |
|
CXCL8 |
인터루킨 8 (IL-8)이라고도 불리는 사이토카인으로, 대식세포 및 상피 세포, 기도 평활근 세포 및 내피 세포와 같은 다른 세포 유형에 의해 생성. 호중구를 조직으로 끌어들이는 인자로 잘 알려진 IL-8은 두 가지 주요 기능을 가지고 있음. 1) 주로 호중구 뿐만 아니라 다른 과립구들을 감염 부위로 이동하게 하는 역할을 하며, 외부물질의 식균 작용을 유도함. 2) 혈관 신생의 강력한 촉진제로 알려져 있음. |
|
IL-4 |
미성숙 T 세포 (Th0 세포)를 염증성 사이토카인 분비 T세포인 Th2 세포로 분화시키는 사이토카인. 활성화 된 B 세포 및 T 세포 증식의 자극 및 B 세포의 항체생산 세포로의 분화를 비롯한 많은 생물학적 역할을 함. 또한, IL-4는 B 세포의 IgE 로의 전환을 유도하고 T세포의 염증성 사이토카인 생산을 촉진하므로, IL-4의 과다 생산은 알레르기와 직접적 관련이 있음. |
|
IL-6 |
생체 내 면역 반응에 관여하는 사이토카인의 일종. 양이 증가하는 경우 류마티스 관절염을 포함한 다양한 자가면역 질환을 유발하는 것으로 알려져 있음. |
|
항체 (Antibody) |
면역계에 있어 항원 (박테리아 등)의 자극에 의하여 생체 내에서 생성되는 항원과 특이적으로 결합하는 단백질. 항원의 자극에 의해 생체에서 만들어져서 질병을 일으키는 세균, 바이러스, 종양세포 등의 항원과 특이적으로 결합하여 항원의 작용을 방해하거나 이를 제거하도록 면역반응을 통해 만들어지는 단백질임. 항체의 구조는 Y자형이며, Y자의 위 두가지에 항원과 결합할 수 있는 가변 반응영역이 있음. 항체의 항원을 인지, 제거하는 능력은 다양한 분야에 활용되고 있으며, 진단 및 치료분야가 대표적임. 항체는 결합하는 에피토프에 따라 상이한 효능, 효력, 작용기전을 갖는 특징을 갖고 있음. |
|
IND (Investigational |
새로운 의약품의 마케팅 신청이 승인되기 전에 제약 회사에게 임상시험을 수행하기 위해 실험용 의약품의 사용을 승인해 주는 단계임. 의약품 담당기관 (FDA 또는 식약처)은 개발 중인 의약품에 의해 연구 대상이 부당한 위험에 처하지 않도록 안전을 위해 IND 신청서를 검토함. IND 신청서가 승인되면, 후보 약물은 임상 시험에 진입할 수 있음. |
|
NDA |
신약 후보물질이 IND에서 제3상까지의 임상시험이 완료되고 나면, 신약 허가를 받기 위해 ‘신약 허가 심사(New Drug Application, NDA)’를 준비하여 의약품 담당기관 (FDA 또는 식약처)에 제출함. 이는 전임상시험부터 제3상까지 수집한 자료가 전문가의 분석을 거쳐 긍정적인결과를 얻었을 경우 신청이 가능함. |
|
CRO |
신약개발을 하는 과정에서 제약기업의 임상시험 관리를 대행해 주는 기관을 총칭함. CRO는 단순한 데이터 관리 및 통계분석 서비스에서 최근 약물 발굴·신약개발·제조·운송·상품화까지 제약 산업 전 단계에 걸쳐 서비스를 제공하는 영역에까지 확대하고 있음. |
|
CMO |
제약업계에서 많이 사용되는 용어로 의약품을 대행 생산하도록 아웃소싱을 맡기는 것을 뜻함. 전자업계 OEM이나 반도체 파운드리와 유사한 개념임. |
|
GMP |
의약품제조업자가 우수 의약품의 제조 및 품질관리를 위하여 준수해야 할 사항임. 미국 및 유럽의 경우, 의약품이 안전(safety), 확인(identity), 효능(strength), 품질(quality), 순도(purity)라는 특성별로 기준에 적합하게 생산되고 있음을 보증하기 위하여 생산, 공정, 포장, 및 보관 등과 같은 제조, 관리에 사용되는 방법에 대한 법적 요건을 GMP라고 정의함. 한국은 원자재의 구입으로부터 제조, 포장, 출하에 이르기까지의 생산공정 전반에 걸쳐 충분한 조직적 관리하에 의약품을 생산하는 체제를 확립하기 위하여 필요요건을 규정한 것이 GMP라고 정의하고 있다. |
| cGMP (Current Good Manufacturing Practice) |
cGMP는 인체에 투여할 의약품을 생산 및 품질평가를 하는 기준으로, 미국FDA (Food and Drug Adminstration)가 인정하는 기준으로 국내에서는 선진GMP라고도 부름. 미국 등 선진국 의약품 규제기관들은cGMP 규정을 엄격히 적용하고 있고 의약품의 허가 및 수입허가시 본 규정에 따른 생산 및 관리를 필수 적으로 요구하고 있음. |
|
GLP |
GLP는 의약품, 화학품 등의 비임상 평가를 위하여 실시하는 각종 시험의 신뢰성을 보증하기 위하여 연구인력, 시험시설, 장비, 시험방법 등 시험의 전과정에 관련되는 모든 사항을 조직적, 체계적으로 관리 하는 규정을 뜻함. 식품의약품안전청에서 말하는 GLP는 의약품 등의 안전성 유효성 심사에 관한 규정에 의하여 의약품등의 제조 및 수입 허가 신청 등을 위한 비임상 시험의 계획, 실시, 점검, 기록, 보고 및 보관을 위한 시험기관에서의 절차 및 조건 등을 정한 비임상시험관리기준임. |
| DNA 백신 | 현재 사용하고 있는 백신과는 달리 병원균이나 바이러스 등의 특정 항원에 해당하는 유전자를 인공적으로 복제하여 합성한 후 인체의 근육이나 피부에 주사하면, 각 조직 내 세포에서 생성된 항원이 면역반응을 유도하여 항체를 형성하고, 활성화된 살상T세포를 통해 치료와 예방이 가능한 백신입니다. |
| DNA기반 유전자의약품 | DNA 기반 유전자의약품은 플라스미드에 삽입된 암호화된 유전자 서열의 종류에 따라, DNA 기반 단백질의약품과 DNA기반 단클론 항체의약품으로 구분할 수 있습니다. 기존 단백질 의약품과 단클론 항체의약품은 바이오의약품 생산공정을 통해 단백질과 단클론항체로 제품을 생산한 후 환자에 투여하여 질병을 치료를 하게 됩니다, 하지만, DNA 기반 유전자의약품은 해당 치료용 단백질과 치료용 단클론항체를 암호화하는 유전자서열을 플라스미드에 삽입한 후, 이 플라스미드를 환자의 체내에 투여하면, 체내에서 단백질과 단클론항체가 직접 생성되어 질병을 치료하게 됩니다. |
| 핵산 | 핵산(Nucleic acids)은 뉴클레오티드(nucleotides)라는 단위체로 구성된 중합체입니다. 핵산에는 DNA와 RNA라는 두 가지 유형이 있으며, 유전정보의 저장과 전달, 그리고 발현을 돕는 기능을 담당한다. 단백질의 형태를 결정하는 데 중요한 폴리펩티드(polypeptides)의 일차 구조인 아미노산 서열은 유전자에 의해 설계되어 있습니다. 이런 유전자는 바로 DNA라는 핵산에 의해 구성됩니다. |
| 플라스미드 | 유전자 치료는 치료에 필요한 유전자를 원하는 체내 세포로 전달하여 유전적 결함을 치료하거나 새로운 단백질이 발현되도록 합니다. 이를 위해서 대상 세포로 치료 유전자를 전달하는 방법이 가장 중요한데, 여기서 쓰이는 치료 유전자 전달체 역할을 하는 것이 플라스미드입니다. 플라스미드 기반의 DNA백신은 바이러스를 직접 죽이거나 약화시켜 만든 기존 백신과는 달리 바이러스의 유전정보를 바탕으로 치료에 적합한 DNA만을 추출하여 플라스미드에 주입하게 됩니다. 이 플라스미드를 사람 몸에 접종하면 세포속에 들어가 바이러스의 세포 표면에 있는 것과 흡사한 단백질(항원)이 만들어지는데, 이 단백질(항원)이 면역반응을 유도하여 바이러스에 대한 면역력을 형성하게 됩니다. |
[코로나 19로 인한 경기 침체 및 불확실성]
| 가. 세계 각국은 백신개발과 코로나19 확산 방지에 총력을 다하고 있습니다. 그러나 코로나19는 여전히 종식되지 않았으며 각종 변이 코로나19가 확산되는 등 장기화될 가능성이 존재합니다. 이에 정책 당국은 강도 높은 경기 부양책 및 자본시장 안정화 대책 등으로 실물 시장과 금융 시장에 전례 없는 지원을 하고 있습니다. 다만, 코로나19로 인한 경제활동 둔화가 장기화될 경우, 소비 위축 및 투자 이연 등에 따른 경기 침체 가능성이 높아질 수 있습니다. 정부의 지속적인 경기 부양 정책에도 불구하고 경기가 악화될 가능성은 존재합니다. 이처럼 경기회복에 대한 불확실성이 높은 경우에는 투자 감소로 인하여 신약 개발의 진행 속도가 더뎌져 당사 수주 감소로 이어질 수 있습니다. 투자자 여러분들께서는 코로나19의 장기화로 인한 거시경제에 부정적인 흐름이 발현될 경우 당사의 매출과 수익성이 부정적인 영향을 받을 수 있음을 유의하여 주시기 바랍니다. |
신종 코로나 바이러스 감염증(이하 '코로나19')은 중국 후베이성 우한시에서 2019년 12월 1일 처음 발생 후 확산 중인 급성 호흡기 질환으로, 감염 확산세가 전세계로 이어지면서 2020년 03월 11일, 세계보건기구(WHO)는 감염병 경보를 기존 5단계에서 최고 단계인 6단계로 상향 조정하여 '세계적 대유행(Pandemic)'으로 선포하였습니다.
세계 각국은 백신개발과 코로나19 확산 방지에 총력을 다하고 있습니다. 그러나 코로나19는 여전히 종식되지 않았으며 각종 변이 코로나19가 확산되는 등 장기화될 가능성이 존재합니다. 이에 정책 당국은 강도 높은 경기 부양책 및 자본시장 안정화 대책 등으로 실물 시장과 금융 시장에 전례 없는 지원을 하고 있습니다. 다만, 코로나19로 인한 경제활동 둔화가 장기화될 경우, 소비 위축 및 투자 이연 등에 따른 경기 침체 가능성이 높아질 수 있습니다.
| [IMF 주요국의 경제성장률 전망치] |
| (단위 : %) |
| 구분 | 2020 | 2021 ('21.04) |
2021 ('21.07) |
2022(E) |
|---|---|---|---|---|
| 세계 | -3.2 | 6.0 | 6.0 | 4.9 |
| 선진국 | -4.6 | 5.1 | 5.6 | 4.4 |
| 미국 | -3.5 | 6.4 | 7.0 | 4.9 |
| 유럽 | -6.5 | 4.4 | 4.6 | 4.3 |
| 일본 | -4.7 | 3.3 | 2.8 | 3.0 |
| 신흥국 | -2.1 | 6.7 | 6.3 | 5.2 |
| 중국 | 2.3 | 8.4 | 8.1. | 5.7 |
| 인도 | -7.3 | 12.5 | 9.5 | 8.5 |
| 한국 | -0.9 | 3.6 | 4.3 | 3.4 |
| 출처) IMF World Economic Outlook Update(2021.07) |
IMF가 2021년 07월 발표한 World Economic Outlook에 따르면, 2021년 세계경제성장률 전망치는 2021년 04월 예상한 바와 같이 6.0%, 2022년 세계경제 성장률 전망치는 4.9%를 전망하였습니다. 이는 선진국들을 중심으로 진행된 재정 확대 정책과 백신 보급의 가속화로 인한 것으로 추정됩니다. 2021년 하반기 이후부터는 경제 회복 모멘텀이 소폭 강화될 것으로 예상되지만, 여전히 코로나19 이전 성장경로를 하회할 전망입니다.
국가별 전망을 살펴보면, 선진국의 2021년 경제성장률 전망은 2021년 04월 전망치 대비 0.5%p 증가한 5.6%, 신흥국의 2021년 경제성장률 전망은 2021년 04월 전망치 대비 0.4%p 감소한 6.3%로 조정되었습니다. 선진국의 경우 미국과 유럽의 경기 부양책 효과 등이 반영되었고 신흥개도국의 국가ㆍ지역별 회복 양상은 상이하나, 코로나19 확산으로 인해 인도 성장률 하향 등이 반영된 것에 기인합니다.
이처럼 세계 경제성장률은 백신 생산ㆍ보급 가속화, 추가 재정확대 및 백신 생산·배분 가속화를 위한 국제 공조 강화 등의 결과로 증가할 것으로 전망되나 여전히 팬데믹 전개로 인한 불확실성이 높은 상황입니다. 팬데믹 재확산, 금융여건 위축, 사회 불안 확대, 지정학적ㆍ무역 갈등 및 코로나19에 따른 부정적 요인이 상존하고 있습니다. 한국은행이 현재 추정하는 국내 경제 성장률은 다음과 같습니다.
| [ 국내 경제 주요지표 추정치 ] |
| (단위: %) |
| 구분 | 2020년 | 2021년(E) | 2022년(E) | ||||
|---|---|---|---|---|---|---|---|
| 연간 | 상반기 | 하반기 | 연간 | 상반기 | 하반기 | 연간 | |
| GDP | -1.0 | 3.7 | 4.2 | 4.0 | 3.2 | 2.8 | 3.0 |
| 민간소비 | -4.9 | 1.0 | 4.0 | 2.5 | 4.7 | 2.3 | 3.5 |
| 설비투자 | 6.8 | 10.7 | 4.3 | 7.5 | 2.8 | 4.2 | 3.5 |
| 지식재산 생산물투자 | 3.6 | 3.6 | 5.0 | 4.3 | 4.3 | 3.4 | 3.8 |
| 건설투자 | -0.1 | -1.0 | 3.4 | 1.3 | 2.3 | 2.7 | 2.5 |
| 상품수출 | -0.5 | 14.8 | 4.0 | 9.0 | 1.9 | 3.1 | 2.5 |
| 상품수입 | -0.1 | 11.0 | 5.9 | 8.3 | 3.0 | 4.0 | 3.5 |
| 출처) 한국은행 경제전망보고서(2021.05) |
| 주) 전년동기 대비 |
한국은행이 2021년 05월 발표한 경제전망보고서에 따르면 국내 경제성장률은 2021년 4.0%, 2022년 3.0% 수준을 기록할 전망입니다. 국내 경기는 글로벌 경기개선 등에 힘입어 수출과 설비투자를 중심으로 회복세를 이어가겠으나, 민간소비 개선 지연으로 회복속도는 완만할 것으로 예상됩니다. 하지만 향후 코로나19 전개 양상 및 백신 보급상황 등에 따라 성장경로의 불확실성이 높은 상황입니다.
| [국내 경제성장률 추이] |
| (단위 : %) |
| 구분 | 2017년 | 2018년 | 2019년 | 2020년 | 2021년(E) | 2022년(E) |
|---|---|---|---|---|---|---|
| 국내 경제성장률 | 3.2 | 2.9 | 2.0 | -1.0 | 4.0 | 3.0 |
| 출처: 한국은행 경제전망보고서(2021.05) |
정부는 악화된 실물 및 금융 경제를 부양하기 위하여 다양한 통화정책 및 재정정책을 내면서, 경제가 안정화되도록 지속적으로 노력하고 있습니다. 하지만 정부의 지속적인 경기 부양 정책에도 불구하고 경기가 악화될 가능성은 존재합니다. 이처럼 경기회복에 대한 불확실성이 높은 경우에는 투자 감소로 인하여 신약 개발의 진행 속도가 더뎌져 당사 수주 감소로 이어질 수 있습니다. 투자자 여러분들께서는 코로나19의 장기화로 인한 거시경제에 부정적인 흐름이 발현될 경우 당사의 매출과 수익성이 부정적인 영향을 받을 수 있음을 유의하여 주시기 바랍니다.
[의약품 사업 성장성과 관련된 위험]
| 나. 당사는 자체 개발한 신약 후보물질인 EC-18을 기반으로 다양한 신약 개발 파이프라인을 보유하고 있으며, 신약으로 개발중인 주요 적응증은 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia) 등이 있습니다. 당사의 후보물질은 EC-18은 저분자 합성신약으로 당사의 주요 신약개발은 화학합성 의약품 위주로 진행되고 있습니다. 2020년 의약품 시장은 코로나 19 팬데믹의 영향으로 만성질환과 코로나19 치료제 수요가 증가했으나, 신약개발 지연과 글로벌 공급망의 변화는 시장 성장폭을 제한하고 있는 상황입니다. 특히, 코로나19 영향에 따른 글로벌 공급망의 취약성, 바이오의약품 시장의 일시적 침체 등이 시장에 부정적인 영향을 미치게 되었습니다. 전 세계 의약품 시장에서 바이오의약품이 차지하는 매출 비중은 지속적으로 증가하는 추세로 2018년 28%에서 2026년 바이오의약품은 의약품산업 내 비중이 35%까지 증가할 것 전망하며, 매출 상위 100대 제품 내 비중이 55%를 차지할 것을 전망하고 있습니다. 의약품 시장의 중심이 합성의약품에서 바이오의약품으로 이동하는 추세임에 따라, 당사의 주요 신약 개발영역인 합성신약부문의 개발 등 악영향을 끼칠 수 있습니다. 또한, 전체 제약산업의 환경이 악화되거나 새로운 방식의 의약품 산업이 발전하게 될 경우 당사가 속해있는 합성 의약품 산업의 전망이 악화될 수 있으며, 이는 당사의 사업에 부정적인 영향을 미칠 수 있습니다. |
당사는 자체 개발한 신약 후보물질인 EC-18을 기반으로 다양한 신약 개발 파이프라인을 보유하고 있으며, 신약으로 개발중인 주요 적응증은 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia) 등이 있습니다. 당사의 후보물질은 EC-18은 저분자 합성신약으로 당사의 주요 신약개발은 화학합성 의약품 위주로 진행되고 있습니다.
의약품은 일반적으로 화학합성의약품(저분자의약품이라고도 함)과 바이오의약품으로 나눌 수 있으며, 합성의약품은 화학합성에 의해 제조하는 의약품으로서 일반적으로 복용하는 고혈압약, 진통제 등이 대부분 합성의약품에 속하고 있습니다. 바이오의약품은 생물공학기술을 이용하여 사람이나 다른 생물체에서 유래된 것(단백질)을 원료 및 재료로 해서 만든 의약품으로서 백신, 인슐린, 항체 의약품 등이 있습니다.
| [주요 의약품 분류] |
|
구분 |
화학합성 의약품 (Small Molecule Drug) | 바이오 의약품(Bio Drug) |
|---|---|---|
|
정의 |
- 화학적 방법으로 약효 성분을 추출하여 만들어낸 의약품 |
- 사람이나 생물체에서 유래된 것을 원료 또는 재료로 하여 제조한 의약품 |
|
특징 |
- 분자량이 매우 작음(500 Dalton 이하) - 화학적 구조가 잘 밝혀져 있음 - 화학물질의 화학반응을 통해 비교적 간단한 화학 생산공정 |
- 분자량이 매우 크고 복잡한 3차원 복잡한 구조를 가짐 (단백질의약품은 20,000~25,000, 항체의약품은 150,000) - 살아있는 세포를 통해 매우 복잡한 생물학적 공정 - 주로 유전자재조합을 통해 형질도입된 숙주세포를 배양하고 필요한 물질을 추출하는 복잡한 생산공정 |
|
투약법 |
- 경구 투약(먹는 약) |
- 정맥/피하 주사 |
|
가격 |
- 상대적으로 저가/낮음 |
- 고가/높음 |
|
부작용 |
- 부작용 높음 (인체의 전 부분에 작용, 예상불가능 부작용) |
- 부작용 경미함 (특정부위 부작용, 작용기전에 의한 국소 부작용) |
| 신약 (오리지널 약품) |
- 합성 의약품 또는 합성 신약 | - 바이오의약품 또는 바이오신약 |
| 복제 약품 | - 제네릭: 오리지널, 합성의약품과 주성분, 제형, 함량, 효능, 효과 및 용량이 모두 동일 | - 바이오시밀러(Biosimilar): 오리지널 바이오의약품과 주성분, 제형, 함량, 효능, 효과 및 용량이 유사 |
| 신약 개선 | - 개량신약: 기존 허가된 오리지널 의약품을 물리화학적 특성, 제제 처방화 및 효능을 개선하여 새롭게 허가등록한 의약품 | - 바이오베터(Biobetter) |
| (출처: 보건산업진흥원) |
2020년 의약품 시장은 코로나 19 팬데믹의 영향으로 만성질환과 코로나19 치료제 수요가 증가했으나, 신약개발 지연과 글로벌 공급망의 변화는 시장 성장폭을 제한하고 있는 상황입니다. 특히, 코로나19 영향에 따른 글로벌 공급망의 취약성, 바이오의약품 시장의 일시적 침체 등이 시장에 부정적인 영향을 미치게 되었습니다. 바이오의약품의 경우, 병원에서 처방.치료가 필요한 처방의약품으로서 코로나19로 인한 병원방문 감소에 따라 수요가 위축되었던 반면, 합성의약품은 만성질환 치료제를 중심으로 한 수요가 지속 되었습니다.
2020년 글로벌 의약품 시장규모는 합성의약품의 수요 지속 등에 힘입어 전년대비 4%대로 성장하여 약 1조 3,250억 달러로 추정하고 있습니다. 제약사들은 코로나19로 인한 글로벌 공급망 변화와 임상시험 중단 등의 난관을 극복하기 위해 다각적인 대응책 모색하고 있으며, 미국, 인도 등은 글로벌 공급체인 문제 해결을 위한 리쇼어링 정책 추진 중에 있습니다. 한편 제약사들은 가격경쟁력, 유연성, 투명성을 강화한 공급망 디지털화와 AI를 통한 코로나19 치료제 및 플랫폼 개발에 주력하고 있습니다.
| [2020년 의약품 시장 규모] |
 |
|
사업위험 나. 2020년 의약품 시장 규모 |
| (출처: 프로스트앤설리번, Post-pandemic Global Healthcare Market Outlook 2020(2020.7) |
처방의약품의 경우, 글로벌 의약품 시장조사기관 이밸류에이트파마(EvaluatePharma)에 따르면 글로벌 처방의약품 매출액은 2012년부터 2019년까지 매출액 연평균 성장률 2.7%였으나, 희귀의약품 시장의 급성장과 혁신적 의약품 승인에 힘입어 2020년 9,040억 달러에서 연평균 7.4% 성장하여 2026년 1조 3,903억 달러가 될 것으로 전망하고 있습니다.특히, 코로나19 유행으로 헬스케어 전반에 단기적인 이슈가 있었으나, 혁신적이고 효과적인 치료법에 대한 산업 전반의 수요가 있어 산업의 성장을 견인할 것으로 전망하고 있습니다.
| [글로벌 처방의약품 매출액 전망] |
 |
|
사업위험 나. 글로벌 처방의약품 매출액 추이 |
| (출처: EvaluatePharma, World Preview 2020. Outlook 2026) |
또한, 전 세계 의약품 시장에서 바이오의약품이 차지하는 매출 비중은 지속적으로 증가하는 추세로 2018년 28%에서 2026년 바이오의약품은 의약품산업 내 비중이 35%까지 증가할 것 전망하며, 매출 상위 100대 제품 내 비중이 55%를 차지할 것을 전망하고 있습니다.
| [의약품 종류별 시장점유율 추이와 전망(2019~2026] |
 |
|
사업위험 나. 의약품 종류별 시장점유율 추이와 전망 |
| (출처: EvaluatePharma, World Preview 2020, Outlook to 2026(2020.6)) |
바이오의약품은 합성의약품에 비해 독성이 낮아 부작용이 적고, 표적 장기에 직접적 효능을 발휘하여 효과가 뛰어나며, 합성신약의 성공빈도가 점차 낮아져 R&D 투자 효율성이 낮아지는 반면 바이오의약품은 생물공학기술 발전 등으로 성공확률이 높아 바이오의약품 사업에 대한 제약사들의 관심 증가하고 있습니다.
이는 의약품 시장의 중심이 합성의약품에서 바이오의약품으로 이동하는 추세임에 따라, 당사의 주요 신약 개발영역인 합성신약부문의 개발 등 악영향을 끼칠 수 있습니다. 또한, 전체 제약산업의 환경이 악화되거나 새로운 방식의 의약품 산업이 발전하게 될 경우 당사가 속해있는 합성 의약품 산업의 전망이 악화될 수 있으며, 이는 당사의 사업에 부정적인 영향을 미칠 수 있습니다. 투자자 여러분께서는 의약품 산업의 전반적인 동향과 전망 등 당사 사업과 관련된 위험요인을 숙지하시고 투자에 임해주시기 바랍니다.
[임상시험 실패 및 지연에 따른 위험]
| 다. 한국 임상의 경우, 2018년 3월 발표된 생명공학정책연구센터의 보고서에 따르면 임상 1상에서부터 신약승인까지의 성공률은 바이오의약품의 경우 11.5%로 확인되었습니다. 단계별로 비임상 약 8년, 임상 6.5년, 허가 검토에 약 0.5년 정도의 시간이 필요합니다. 한국바이오경제연구센터에서는 임상1부터 승인까지 대략 7년의 시간이 소요된다는 결과를 나타냈습니다. 임상 1상 단계에 있는 신약 파이프라인 10개 중 1개 정도만이 최종적으로 품목허가를 받아 시장에 출시되는 것입니다. 또한 전임상 단계에서 안전성 및 효능이 검증되었음에도 불구하고 각 임상 단계에서 부작용 등 예상치 못한 결과로 인하여 의약품 개발에 실패할 위험이 상존합니다. FDA의 경우, 모든 임상들에 대해 임상 1상에서 신약승인까지의 신약 승인 성공률은 평균 9.6%입니다. 임상 1상 통과 가능성은 63.2%이고, 임상 2상은 각 임상 단계별로 가장 낮은 30.7%입니다. 임상 3상은 58.1%이고, 신약 승인 단계 인 NDA/BLA는 가장 높은 85.3%로 나타나고 있습니다. 또한, 상기의 신약개발은 코로나 19에 따른 전 세계적 팬데믹으로 악영향을 받는 것으로 파악되고 있으며, 특히 임상시험 건수의 감소 등에 따라 신약개발이 지연되는 상황이 발생하고 있습니다. 메디데이터에 따르면, 2019년 10월을 COVID-19 이전 베이스라인으로 볼 때, 전 세계적으로 2020년 6월 말 기준 신규 임상시험 참여 시험대상자 수가 약 30% 감소하였으며, 2020년 4월 기준으로는 전 세계적으로 약 70%의 감소가 나타나고 있습니다. 이는 최근일자인 2021년 2월 기준으로도, 데이터 및 분석업체인인 글로벌데이터에 따르면 전세계적으로 1,200건이 넘는 임상시험이 코로나19로 인해 지장을 받고 있으며, 특히 항암제 등 종양 관련 임상시험에 큰 영향을 받고 있어 COVID-19가 임상시험의 지연 등 악영향을 지속적으로 끼치고 있는 상황입니다. 당사는 당사의 신약 후보물질인 EC-18(PLAG)을 기반으로 다양한 신약개발 파이프라인을 구성하고 있습니다. 당사는 코로나19 치료제, 구강점막염 치료제와 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 당사가 진행중인 파이프라인에 대해서, 상기 언급한 것처럼 코로나 19에 따라 임상계획 당시 예상하지 못하였던 변수로 인하여 임상시험 개시 승인이 지연되거나, 코로나 19로 인한 외부 활동 위축으로 임상 시험에 필요한 환자등록이 원활하지 않을 문제가 발생할 수 있습니다. 또한, 당사 제품의 임상 시험에서의 개발 실패의 가능성을 배제할 수 없으며, 개발 실패시 임상실험 진행에 투입된 비용과 시간에 비례하여 당사의 재무적 안정성에 급격한 훼손이 발생할 수 있습니다. 따라서 당사에서 진행 중인 신약개발 역시 큰 실패위험 속에 진행되고 있으며, 신약개발에 성공하지 못할 경우 이는 당사의 미래 수익성과 주가에 부정적인 영향을 미칠 수 있음을 알려드립니다. |
신약(New Drug)은 기존 약물에 모방이나 개량 합성에 의한 것이 아닌, 기존약물의 부작용과 현저한 기능 개선이 포함되어야 하며, 화학합성, 미생물·배양조직세포로부터 유전자재조합을 이용한 생산, 천연물 추출 등의 신물질 탐색 작업, 비임상시험, 임상시험 등을 거쳐 제조 승인을 받은 의약품 입니다. 신약개발 시 한국(식품의약안전처) 및 미국(FDA)의 주요 과정 및 위험요인은 아래와 같습니다.
1. 한국(식품의약안전처)
| [신약개발 R&D과정] |
 |
|
사업위험 다. 신약개발 r&d 과정 |
| (출처: 식품의약품안전처 의약품통합정보시스템) |
신약개발의 과정은 발견단계(Discovery)와 개발단계(Development)로 구분하고 있습니다. 일반적으로 발견단계는 질병타겟을 정하고, 동물시험 등을 거쳐 신약후보물질을 도출하는 단계이며, 개발단계에서 사람에서의 안전성과 유효성을 확인하는 임상시험을 실시하는 단계입니다.
발견단계는 치료가능성이 있는 질병원인과 타겟을 규명 선택한 후, 이에 작용하여 기대하는 치료효과를 발휘할 수 있는 새로운 물질(molecule)을 만들거나 기존에 만들거나 수집된 분자 중에 선택하고 구조변경 등 최적화(optimization)하여 신약후보물질(newdrug candidate)을 선정하는 단계입니다. 이 후보물질은 광범위한 동물이나 실험적으로 안전성과 유효성을 시험하여 사람에게 임상시험을 실시해도 안전하며 유효한지를 결정합니다..
개발단계에서 실시되는 임상시험은 사람에게 사용되는 만큼 안전성과 윤리성이 보장되어야 하기 때문에 임상시험을 실시하기전에 식약처로부터 임상시험계획에 대한 승인을 받아야합니다. 임상시험에 대한 구분은 약사법 시행규칙에서 정의하고 있으며, "임상시험"이라 함은 의약품의 안정성과 유효성을 증명하기 위하여 사람을 대상으로 해당 약물의 약동ㆍ약력ㆍ약리ㆍ임상적 효과를 확인하고 이상반응을 조사하는 시험을 말합니다. 임상시험은 시판 허가 전의 3단계(1상, 2상, 3상)와 시판 후 임상시험(PMS)을 포함하여 총 4단계로 구분합니다. 각 임상 단계별 주요 내용은 아래와 같습니다.
| [임상시험 구분] |
| 구분 | 목적 | 내용 |
|---|---|---|
| Phase 1 (1상) |
ㆍ안전성 검토 ㆍ내약성 평가 ㆍPK/PD 정의/서술 ㆍ치료효과 추정 |
ㆍ용량-내약성 임상시험 ㆍ안전용량 범위와 부작용 확인 ㆍ체내 약물 동태 검토 ㆍ1a: SAD, 1b: MAD |
| Phase 2 (2상) |
ㆍ단기 유효성/안전성 검토 ㆍ목표 적응증에 대한 탐구 ㆍ후속 시험을 위한 용량 추정 ㆍ치료확증 시험을 위한 시험설계, 평가항목, 평가방법에 대한 근거 제공 |
ㆍ용량-반응 탐색 임상시험 ㆍ소수의 환자에서의 비교적 단기간에 걸친 초기 임상시험 ㆍ2a: 약효확인, 유효용량 검토 ㆍ2b: 약효입증, 유효용량 확인, 유효성 및 안전성의 균형 검토 |
| Phase 3 (3상) |
ㆍ안전성, 유효성 재확인 ㆍ임상적용을 위한 Risk/Benefit의 상대평가 근거제공 ㆍ용량과 반응에 대한 관계 확립 ㆍ효과에 대한 검증 |
ㆍ무작위 배정에 의한 용량-반응 임상시험 ㆍ유효성 확립을 위한 적절하고 잘 통제된 임상시험 ㆍ이환율/사망률을 위한 임상시험 ㆍ충분한 환자에서 유효성 및 안전성 확립 ㆍ대조군을 이용한 비교 임상시험 ㆍ대규모 임상시험 |
| Phase 4 (4상, PMS) |
ㆍ시판 후 안전성 조사 및 추가 임상시험 ㆍ일반 또는 특정 대상군/환경에서 Risk/Benefit에 대한 이해 ㆍ흔하지 않은 이상반응 확인 ㆍ추천되는 용량을 확인 ㆍ모든 시험 디자인이 가능 |
ㆍ장기투여시 부작용 검토 ㆍ안전성 재확립 ㆍ새로운 적응증 등 탐색 연구 ㆍ대조군을 이용한 유효성 임상시험 ㆍ이환율/사망률에 대한 임상시험 ㆍ부가적인 평가 항목에 대한 임상시험 ㆍ약물경제학적 측면의 임상시험 |
| 주1) 약물의 농도-반응 관계를 PK/PD라고 합니다. PK(Pharmacokinetics 약동학)는 약물의 흡수, 분포, 생체 내 변화 및 배설을 연구합니다. PD(Pharmacodynamics 약력학)는 생체에 대한 약물의 생리학적 및 생화학적 작용과 그 작용 기전, 즉 약물이 일으키는 생체의 반응을 주로 연구함 주2) SAD(단회용량상승, single ascending dose) : 단회용량을 투여한 후 안전성과 내약성을 확인함 주3) MAD(다중용량 상승, multiple ascending dose) : 반복 투여를 통해 더 높은 용량으로 증량해가면서 최대 내약 용량을 확인함 |
(가) 제1상
임상시험은 소규모(약 20명에서 100명)의 건강한 지원자를 대상으로 시험하는 단계로서 의약품이 사람에게서 안전한지 여부를 확인하는 것을 목적으로 실시합니다.
(나) 제2상
임상시험은 임상시험용 의약품이 기대된 작용기전(mechanism)에 따라 작용되는지 검토하고, 의약품을 사용에 있어서 최적 용량(dose strength)과 투약방법(schedules)을 분석합니다.
(다) 제3상
제3상 임상시험은 대규모 환자를 대상으로 하는 시험으로 연구자는 후보의약품의 안전성과 유효성 및 전체적인 benefit-risk 관계에 대한 통계학적으로 유의한 데이터(significant data)를 만들기 위해서 약 1,000명에서 5,000명의 환자를 대상으로 연구가 실시됩니다. 이 단계는 의약품으로서 안전성과 유효성 여부결정의 핵심단계로서 적정한 의약품 사용을 보증하기 위한 다른 의약품과 상호작용 정보 등 표시사항의 기초가 되며, 임상시험동안 실생산 규모의 생산계획, 식약청에 품목허가를 받기 위해 필요하고 복잡한 서류준비 등을 위한 품질등에 관한 중요한 연구가 많이 수행됩니다. 유효물질 수준에서 5,000개에서 10,000개의 화합물이 연구개발(R&D)의 파이프라인으로 들어가지만 전임상단계에서 약 250개의 연구를 거쳐 결국 1개의 승인을 받게 됩니다. 이러한 신약개발 과정을 거쳐 환자가 이용할 수 있을 때까지 소요되는 기간과 비용은 약 10년~15년의 연구개발기간과 비용은 800백만달러에서 13억달러($1.3 billion)이상으로 추정하고 있습니다(식품의약품안전처 의약품통합정보시스템).
개발사들은 앞 단계의 연구에서 위험(독성) 대비 이익(유효성)이 충분하다고 판단될 때 다음 단계 임상시험의 진입을 결정하게 되며, 약사법에 따라 적합한 임상시험계획승인(IND) 신청 자료를 마련하여 규제기관의 심사를 받게 됩니다. 규제기관은 위험 대비 이익이 허용 가능하다고 판단되면 임상시험계획(IND) 승인을 해주며, 개발사는 승인된 계획서와 의약품임상시험관리규정을 준수하여 임상시험을 실시하게 됩니다.
임상시험계획서에서 설정한 목표를 임상시험을 통해 입증했을 때 임상시험이 성공한 것이며, 다음 단계 연구로 나아갈 수 있고, 목표를 입증하지 못하면 임상시험에 실패하게 됩니다. 임상시험의 목표는 단계별 목적과 질환별 치료목적에 따라 설정하며, 통계적 유의성 입증을 위한 대상자 수와 평가방법을 계획서에 명시해야 하며, 시험 진행 도중에 이러한 사항을 변경하기는 어렵습니다. 회사는 임상시험을 위해 자금과 시간을 투자해야 하기 때문에 다음 단계 임상시험로 진입여부를 결정할 때 성공 가능성에 대한 면밀한 검토를 하지만, 임상의 단계가 올라갈수록 대상자 조건이 다양해지고 관찰기간이 길어지기 때문에 앞단계에서 확인하지 못했던 결과가 나타날 수 있습니다.
1~3상 임상시험은 시험기관윤리위원회 심의 시 임상시험배상책임보험에 의무적으로 가입하도록 되어 있으며, 해당 보험을 통하여 시험 중 개발중인 약으로 인한 부작용 발생 시 대상자에게 적절한 배상을 하게 됩니다.
| [의약품 분류별 단계별 임상통과 확률 및 소요기간] |
|
구분 |
임상1상에서 |
임상2상에서 |
임상3상에서 |
승인신청서 |
임상1부터 |
|---|---|---|---|---|---|
|
합성의약품 |
61% |
26% |
49% |
78% |
6.2% |
|
바이오의약품 |
66% |
34% |
57% |
88% |
11.5% |
|
개량신약 |
70% |
48% |
74% |
90% |
22.6% |
|
소요기간 |
1.5년 |
2년 |
3년 |
0.5년 |
7년 |
| 출처 : 생명공학정책연구센터 "의약품 유형별(합성, 바이오) 개발 특성", 한국바이오경제연구센터 "글로벌 제약시장 임상 파이프라인 분석" |
2018년 3월 발표된 생명공학정책연구센터의 보고서에 따르면 임상 1상에서부터 신약승인까지의 성공률은 바이오의약품의 경우 11.5%로 확인되었습니다. 단계별로 비임상 약 8년, 임상 6.5년, 허가 검토에 약 0.5년 정도의 시간이 필요합니다. 한국바이오경제연구센터에서는 임상1부터 승인까지 대략 7년의 시간이 소요된다는 결과를 나타냈습니다. 임상 1상 단계에 있는 신약 파이프라인 10개 중 1개 정도만이 최종적으로 품목허가를 받아 시장에 출시되는 것입니다. 또한 전임상 단계에서 안전성 및 효능이 검증되었음에도 불구하고 각 임상 단계에서 부작용 등 예상치 못한 결과로 인하여 의약품 개발에 실패할 위험이 상존합니다.
2. 미국(FDA)
FDA(Food and Drug Administration)는 미국의 식품의약국으로 미국에서 생산 및 유통, 판매되는 모든 종류의 의약품에서부터 의료기기, 화장품, 식품 등의 품목에 대 해 통제, 관리, 승인을 하는 기관입니다. FDA는 의약품 등에 대해 전세계에서 가장 엄격하고 신중하게 관리 및 승인하는 기관으로 FDA 에서 승인된 신약은 매우 안전 하고 뛰어난 약효를 가진 신약으로 인정을 받기 때문에 사실상 전세계 어디에서나 특별한 절차 없이 출시가 가능하게 됩니다.
FDA에서의 임상 단계별 성공 가능성을 추정하기 위해서, 2006년부터 2015년까지 과거 10년간 FDA에서 임상을 수행했거나 진행중인 자료를 조사해보면 여러 특징적인 사실들이 보여집니다. 모든 임상들에 대해 임상 1상에서 신약승인까지의 신약 승인 성공률은 평균 9.6%입니다. 임상 1상 통과 가능성은 63.2%이고, 임상 2상은 각 임상 단계별로 가장 낮은 30.7%입니다. 임상 3상은 58.1%이고, 신약 승인 단계 인 NDA/BLA는 가장 높은 85.3%로 나타나고 있습니다.
| [FDA 임상 시 각 단계별 성공 가능성] |
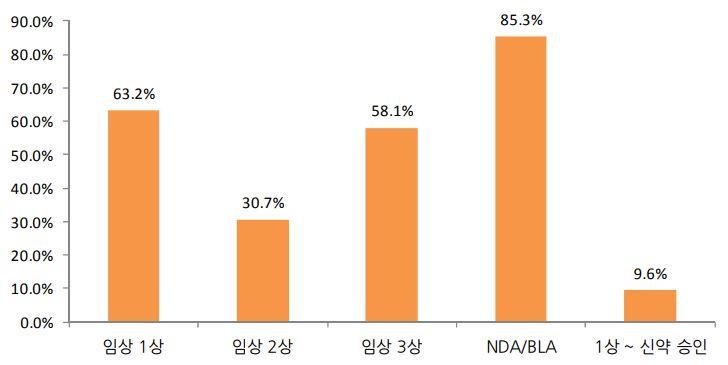 |
|
사업위험 다. fda 임상 시 각 단계별 성공 가능성 |
| (출처: FDA, Amplion, Biomedtracker, Biotechnology Innovation Organization, SK증권) 주1) NDA - New Drug Application , 합성 의약품의 신약승인 단계 주2) BLA- Biologic License Application, 바이오 의약품의 신약승인 단계 |
3. 임상시험 지연 현황
상기의 신약개발은 코로나 19에 따른 전 세계적 팬데믹으로 악영향을 받는 것으로 파악되고 있으며, 특히 임상시험 건수의 감소 등에 따라 신약개발이 지연되는 상황이 발생하고 있습니다. 메디데이터에 따르면, 2019년 10월을 COVID-19 이전 베이스라인으로 볼 때, 전 세계적으로 2020년 6월 말 기준 신규 임상시험 참여 시험대상자 수가 약 30% 감소하였으며, 2020년 4월 기준으로는 전 세계적으로 약 70%의 감소가 나타나고 있습니다.
| [시험기관 신규 참여 시험대상자 현황: 전 세계 vs 미국 vs 중국] |
 |
|
사업위험 다. 시험기관 신규 참여 시험대상자 |
| (출처: medidata, '메디데이터가 바라보는 COVID-19와 임상시험(2020.07.13)') |
상기 영향에 따라, 일부 대형 제약회사(Pfizer, Bristol Myers Squibb 및 Eli Lilly) 와 소규모 생명공학 회사(Moderna Therapeutics , Iveric Bio , Aslan , Provention Bio 및 Addex )들은 자사의 R&D 계획을 수정하고 있다고 공개 발표했습니다. R&D 계획 수정에는 시험기관 활성화 및/또는 시험대상자 등록을 일시적으로 연기하는 것 등이 포함됩니다. 실제로, Aveo Pharmaceuticals Inc.가 급성 골수성 백혈병 대상자 대상 ficlatuzumab 시험 실패의 이유를 COVID-19로 언급했듯이, COVID-19가 임상시험의 성공에 미치는 영향은 이미 중요한 이슈가 되었습니다. COVID-19 팬데믹으로 인한 영향 및 비용 부담을 줄이기 위해 바이오 제약사들이 임상시험을 연기 또는 중단하는 사례는 점차 증가하고 있습니다.
시험기관에 대한 팬데믹의 영향은 2020년 4월 말 메디데이터가 1,000곳이 넘는 시험기관의 담당자를 대상으로 실시한 설문조사에서도 확인되고 있습니다. 대부분의 시험기관이 현재 및 향후 임상시험, 특히 시험대상자의 등록 및 모집 지연과 관련해 팬데믹의 부정적인 영향을 느끼고 있는 것이 분명하게 나타났으며, 시험기관들은 또한 임상시험 지연 및 취소에 의한 재정적인 문제도 우려하고 있습니다. 응답자의 2/3 이상이 현재 진행 중인 임상시험의 대상자 모집을 중단했거나 곧 중단할 것이라고 했으며, 1/3은 무작위배정을 중단하고 있다고 했습니다. 응답자의 약 절반 가량은 현재 시험이 지연되고 있거나 지연될 것이라고 답했습니다.
최근일자인 2021년 2월 기준으로도, 데이터 및 분석업체인인 글로벌데이터에 따르면 전세계적으로 1,200건이 넘는 임상시험이 코로나19로 인해 지장을 받고 있으며, 특히 항암제 등 종양 관련 임상시험에 큰 영향을 받고 있어 COVID-19가 임상시험의 지연 등 끼치는 악영향이 지속되고 있는 상황입니다.
국내의 경우, 대한의학회지에 실린 논문(전주연, 김혜경, 유경상, 2020. The Impact of COVID-19 on the Conduct of Clinical Trials for Medical Products in Korea, 대한의학회지)에 따르면 국내 상위25개 제약사 중 절반 이상인 13개 제약사가 코로나19로 인해 임상시험 수행에 어려움을 겪는다고 답한 바 있으며, 특히 코로나19로 인해 임상 site를 확보하기 어려운 점, 임상 환자가 내원하여 임상을 진행하기 어려운 점 등을 주요 요인으로 꼽았습니다.
종합적으로, COVID-19의 확산세가 지속될 경우 임상시험의 연기 혹은 중단 등 임상시험 지연에 따라 부정적인 영향이 발생하고 있으며, 이는 상기 한국 및 미국의 신약개발 단계에 악영향을 끼칠 수 있습니다. 또한 COVID-19 외, 여타 예상하지 못한 변수가 발생할 시 임상시험을 지연시키는 추가적인 요인으로 작용할 수 있습니다.
4. 당사의 신약개발 현황
당사는 당사의 신약 후보물질인 EC-18(PLAG)을 기반으로 다양한 신약개발 파이프라인을 구성하고 있습니다. 우선, EC-18(PLAG)은 당사가 독자적으로 개발한 면역조절제로, 녹용에 0.002% 들어있는 'PLAG'라는 유효성분을 화학적으로 합성한 지질(lipid)계열의 합성의약품입니다. EC-18은 염증유발 신호물질인 DAMP(손상연관분자유형, damage-associated molecular pattern) 제거를 촉진시키는데, 이는 염증반응을 억제시키는 것이 아닌 염증유발 물질의 처리능력을 활성화를 유발하여 염증신호의 지속시간이나 강도를 약화시킬 수 있습니다.
| [EC-18(PLAG) 주요 처리과정] |
 |
|
사업위험 다. ec-18 주요 처리과정 |
| (출처: 당사 제시) |
염증반응이 과도해지면 손상을 유발할 수 있어 염증반응과 상처치료 및 조직재생과정, 면역과정 등은 필요한 시간 동안만 활성화되는 것이 중요며, DAMP가 면역세포들을 불러일으키고 이들이 염증반응 등을 유발시키기 때문에 DAMP가 너무 많이 발생하거나 오랫동안 제거되지 않을 경우, 과도한 양의 면역세포들이 몰려들어 조직손상이 발생할 수 있습니다. 최근 코로나 19 중증 환자에게 나타나는 과잉 염증반응인 사이토카인 폭풍(cytokine storm)을 대표적인 예로 볼 수 있습니다. 당사는 EC-18을 통해 손상지역의 DAMP 및 세균처리능력을 강화시켜 이들의 처리가 빨리 이뤄질 수 있게 해줌으로써 과도한 염증반응으로 인한 문제들의 해결 가능성이 높을 것으로 보고 있으며, EC-18의 작용기전을 통해 당사는 구강점막염(CRIOM), 신종코로나바이러스(COVID-19), 급성방사선증후군(ARS) 등 다양한 신약개발 파이프라인을 구성하고 있습니다.
| [당사가 개발중인 주요 신약 파이프라인] |
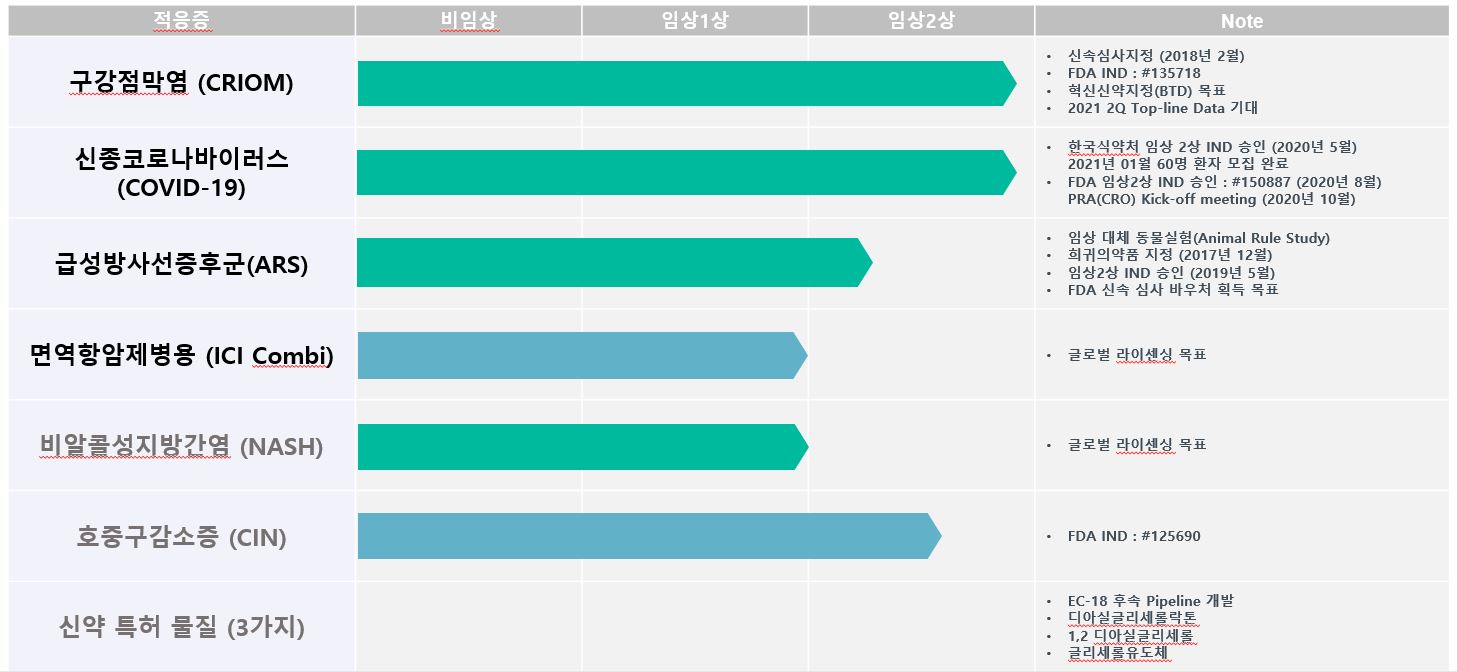 |
|
사업위험 다. 신약개발 파이프라인 |
| (출처: 당사 제시) |
| [연구개발 진행 총괄표] |
| 구분 | 품목 | 적응증 | 연구시작일 | 현재진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||
| 화학합성 | 신약 |
EC-18 |
호중구감소증 |
2013년 |
글로벌 임상2상 part 1 완료 / |
2017년/ |
- |
| 신약 |
EC-18 |
구강점막염 |
2013년 |
임상2상 Stage1, Stage2 완료 임상2상(미국) 결과 공시 2021년 11월 혁신신약지정(BTD) 신청완료 |
2017년 |
신속심사지정 |
|
| 신약 |
EC-18 |
급성방사선증후군 |
2013년 |
미국 임상2상 상응 비임상 |
2019년 |
희귀의약품지정 |
|
| 신약 | EC-18 | COVID-19 | 2020년 | 국내 임상 2상 결과 공시 / 미국 임상 2상 진행 중 |
2020년 | - | |
| 신약 |
EC-18 |
류마티스관절염 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
건선 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
패혈증 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
천식 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
아토피 피부염 |
2013년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
비알코올성지방간염 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
당뇨 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
면역항암제 병용 |
2019년 |
임상1상 종료 | - | - | |
| (출처: 당사 정기보고서) |
| [호중구감소증 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
호중구감소증 |
|
③작용기전 |
혈중 호중구의 유출을 조절 |
|
④제품의특성 |
1) 경구 투여가 가능함 (G-CSF는 주사제임) 2) 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 3) 항암치료로 인한 점막염증에도 효과가 있음 4) 암의 진행을 촉진하는 인자인 STAT3를 억제함 5) 방사선요법을 병행하는 암 치료에도 사용가능 6) 제조원가가 낮음 |
|
⑤진행경과 |
- 2015년 2월 5일 한국 MFDS임상 1상 시험승인 - 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2016년 7월 16일 글로벌 임상 2상 승인 - 2019년 5월 Part 1 대상자 투약 완료 - 2019년 10월 AACR-NCI-EORTC(보스턴, 미국) 학회에서 결과 발표 - 2020년 4월3일 한국 MFDS임상2상 Part 2 승인 |
|
⑥향후계획 |
호중구감소증에 대해서 글로벌 임상 2상 시험은 보고서 작성기준일 현재 Part 1 환자 투약이 완료되었으며, Part 1 결과 및 최종 결과를 활용하여 적극적인 기술 라이선스를 추진할 계획임. |
|
⑦경쟁제품 |
현재의 호중구감소증 치료제 시장은G-CSF 제품으로 형성되어 있지만, 발암성의 증가와 같은 치명적인 부작용, 환자의50%에게만 효능을 나타내는 제한된 약효, 혈액암 환자와 항암화학 방사선 요법 환자에게의 사용 제한, 높은 약가로 인한 비열성 호중구감소증 환자에게의 사용 제한 등으로 인해 새로운 치료제의 도입이 매우 시급한 상황입니다. |
|
⑧관련논문등 |
World J Oncol 2015, Cancer Letters 2016, Thrombosis Research 2018, Cell & Bioscience 2019 |
|
⑨시장규모 |
2017년10월에 보고된Credence Research 자료에 따르면, 화학요법에 따른 호중구감소증 치료제 시장 규모는2016년 전체77억달러에 이르고 있으며, 약5.6%의 연간시장성장률(CAGR)을 보여2025년에는 약125.6억달러 규모로 성장할 것으로 예측하고 있습니다. |
|
⑩기타사항 |
- |
| (출처: 당사 정기보고서) |
| [구강점막염 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
구강점막염 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전 |
|
④제품의특성 |
1) 경구투여 2) 항암치료 중 발생하는 호중구감소증에도 효과 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막염을 예방 및 치료 4) 호중구감소증, 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 5) 암의 진행을 촉진하는 인자인 STAT3를 억제함 6) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2017년 7월 28일 미국 FDA임상 2상 승인 - 2019년 5월 Stage 1 종료 - 2019년 7월 Stage 2 개시 - 2021년 4월 임상2상 환자 모집 완료 - 2021년 6월 최종 피험자 종료 (LPO) - 2021년 10월 임상2상(미국) 결과 공시 - 2021년 11월 혁신신약지정(BTD) 신청완료 |
|
⑥향후계획 |
본 보고서 작성기준일 기준 현재 2상 Stage 2 단계를 완료하여 결과공시를 제출하였으며, 분석된 결과를 바탕으로 2021년 11월 미국 FDA에 혁신신약지정(BTD) 신청완료. 또한 임상 2상 결과를 활용하여 글로벌 라이선스 아웃을 추진 중. |
|
⑦경쟁제품 |
Galera Therapeutics의 GC4419는 방사선치료에 의해 발생되는 구강점막염 치료제로 임상3상을 준비하고 있으나, 항암치료에 필수인 ROS를 억제하는 작용기전을 가지고 있어, 항암치료를 억제하는 가능성을 꾸준히 의심받고 있으며, 정맥주사를 3주~7주 동안 월요일에서 금요일까지 계속해서 맞아야 하므로, 투약이 매우 불편함. |
|
⑧관련논문등 |
Frontiers in Oncology 2016, Orall Disease 2019 |
|
⑨시장규모 |
구강점막염 세계 최고 권위자인Dr. Sonis에 따르면 구강점막염 치료제 시장 규모는 2016년 전체30억달러로 추정되고 있음. |
|
⑩기타사항 |
2018년 2월 FDA 신속심사 지정 |
| (출처: 당사 정기보고서, 전자공시) |
| [급성방사선증후군 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
급성방사선증후군 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전으로 급성방사선에 의해 야기된 호중구감소증, 혈소판감소증, 점막염, 폐렴, 급성 폐손상에 효능 |
|
④제품의특성 |
1) 경구투여, 실온보관으로 현장사용(field use)에 적합 2) 급성방사선에 의해 야기된 호중구감소증, 혈소판감소증, 점막염, 폐렴, 급성 폐손상에 효능 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 급성방사선증후군으로 인한 생존률을 높임 4) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험 승인 |
|
⑥향후계획 |
급성방사선증후군에 대해서 본 보고서 작성기준일 현재 미국에서 임상 2상에 상응하는 비임상 효능 시험을 진행하고 있으며, 2021년 시험을 완료하고 이후 판매 허가 신청을 진행할 예정입니다. |
|
⑦경쟁제품 |
호중구감소증 치료제인 G-CSF와 GM-CSF가 급성방사선 치료제로 FDA로 부터 허가를 획득하였지만, 호중구감소증에만 적용되어 한계점을 가지고 있음. 또한 이들 약물은 저온보관 해야하는 주사제이므로, 현장사용(field use)에 적합하지 않음. |
|
⑧관련논문등 |
J. Trauma 2010, Immune Network 2015, World J Oncol 2015, Cancer Letters 2016, Frontiers in Oncology 2016, Thrombosis Research 2018, Radiation Research 2019 |
|
⑨시장규모 |
2017년10월 발간된Ameri Risearch 연구조사 자료에 따르면, 2018년 전 세계 방사선증후군 치료제 시장규모는 약52억달러 규모이며,연평균6.6% 성장하여2024년에는 약83억달러로 성장할 것으로 예상하고 있습니다. 특히, 이 리포트에서2018년 급성방사선증후군 치료제 시장(골수질환 약3.4억 달러, 점막염질환 약9.5억달러, 심혈관계 질환 약5.4억달러, 신경계질환 약6.7억달러)은 약25억달러로 추정하고 있습니다. |
|
⑩기타사항 |
2017년 12월 FDA 희귀의약품 지정 |
| (출처: 당사 정기보고서) |
| [신종코로나바이러스 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
신종코로나바이러스 (COVID-19) |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 작용기전으로 코로나바이러스에 의해 야기된 폐렴의 중증으로의 진행예방 및 급성폐손상, 급성호흡부전증후군에 효능 |
|
④제품의특성 |
1) 경구투여 |
|
⑤진행경과 |
- 2020년 5월 12일 한국 식품의약품안전처 임상 2상 시험 승인 - 2021년 1월 21일 국내 임상2상 환자모집 완료 - 2021년3월23일 국내 임상2상Database Lock (DBL) |
|
⑥향후계획 |
- 미국 임상 2상 진행 중 |
|
⑦경쟁제품 |
항바이러스 약물인 길리어드사의 Remdesivir, 부광약품의 Levovir가 있으며, 현재 임상을 진행중임, 항바이러스 약물의 특성 상 내성 및 부작용 우려가 상존 함. |
|
⑧관련논문등 |
J. Trauma 2010, Front Immunol. 2019, J. Immunology 2017 |
| (출처: 당사 정기보고서) |
특히, 당사는 2021년 08월 27일, 당사가 개발중인 코로나19 치료제에 대한 임상시험결과보고서를 수령하였으며, 임상결과 중 일부 유의미한 결과를 도출하지 못한 사실이 있습니다. 자세한 사항은 아래와 같습니다.
| [2021.08.27 투자판단관련주요경영사항] |
| 1. 제목 | 신종 코로나바이러스 환자를 대상으로 폐렴에서 중증폐렴 또는 급성호흡곤란증후군으로의 이행을 예방하는 EC-18의 안전성과 유효성을 평가하는 국내 임상2상 시험 결과 [임상시험결과보고서(Clinical Study Report, CSR) 수령] |
| 2. 주요내용 | ※ 투자유의사항 임상시험 약물이 의약품으로 최종 허가 받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다 1. 임상시험 제목 : 신종 코로나바이러스로 인한 폐렴환자에서 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위배정, 이중 눈가림 임상 2상시험 2. 임상시험 단계 : 임상 2상 3. 대상환자 : 신종 코로나바이러스 감염이 확진되고, 흉부 엑스선 혹은 CT 스캔을 통해 폐 침범이 확진된 자 4. 대상질환명 : 신종 코로나바이러스로 인한 감염성 폐렴 5. 임상시험 신청(승인)일 및 승인(시험)기관 - 신청일 : 2020년 04월 20일 - 승인일 : 2020년 05월 12일 - 임상승인기관 : 식품의약품안전처(MFDS) - 임상시험기관 : 국내 5개 병원 6. 임상시험 등록번호 : 2020082418 7. 임상시험 결과 : 당사는 EC-18의 임상 2상 시험을 통해 아래와 같은 임상 결과를 확인할 수 있었음. < 아 래 > 1) 시험대상자 수 : 63명 2) 유효성 : - 1차 평가변수 : 임상시험용의약품을 1회 이상 투여한 경증 폐렴 환자에서 14일 이내에 산소 치료가 필요한 중증 폐렴 또는 급성호흡곤란증후군(ARDS)으로 이행되는 확률(%)은, 투약군 간 통계적 유의성을 확인하지 못했음. 이는 탐색적 임상시험의 특성에 따라 제한된 작은 수의 대상자가 참여한 것과 증상 악화와 같은 이상반응 발생 시 투약을 즉시 중단하도록 설계된 디자인의 한계로 인해 임상시험용의약품의 유효성을 제대로 평가할 수 없었을 것으로 분석할 수 있음. 또한, 총 14일 동안 1일 1회 경구 투약하며 임상시험용의약품의 유효성을 평가하려 했으나 증상 악화 또는 이상반응으로 중도 탈락 및 투약 중단 (평균 투약 일수 : 3.6일)되어 유효성을 평가하는데 제약이 있었음. - 2차 평가변수 : 코로나19 폐렴의 병태심리에 핵심 역할을 하는 염증성 사이토카인 IL-8과 IL-6에서 통계적으로 유의한 감소를 발견할 수 있었음. IL-8의 경우 시험 1일차에 비해 시험 14일차에서 통계적으로 유의한 감소(p=0.0032)를 나타내었으며, IL-6 또한 50~64세 연령군에서 시험 1일차에 비해 시험 14일차에서 통계적으로 유의한 감소(p=0.0021)가 확인됨. 대상자 증상의 호전을 보여주는 지표인 영국 조기경고 점수(NEWS)의 경우, 50~64세 대상자의 D8,D11,D12,D14에서 투약군 간 유의한 차이를 보였고, Baseline 대비 각 검사 시점의 차이에 대하여 비교하였을 때, D8-D1, D9-D1, D10-D1, D11-D1, D12-D1, D13-D1, D14-D1에서 EC-18군이 Placebo군보다 통계적으로 유의하게 평균값이 감소된 것을 확인하였음. 3) 안전성 : 임상시험용의약품 투약 후 위약군과 비교하였을 때, 이상반응은 대부분 경증이었으며, 이상반응 발생빈도에서 시험군과 대조군에서 통계적 차이가 관찰되지 않았으며, 활력징후, 심전도 등에서 임상적으로 유의한 소견이 관찰되지 않았음. 이와 같은 결과를 토대로 본 임상시험용의약품은 내약성과 안전성이 우수한 것을 확인하였음. 8. 향후 계획 : 당사의 임상시험 결과를 통하여 신종 코로나바이러스로 인한 경증 폐렴 환자에서 EC-18의 투약 안전성 및 내약성을 확인하였고, 유효성 평가에서는 IL-6,IL-8등 Cytokine 염증 지표의 평균값이 감소되고, 대상자 증상의 호전 정도를 나타내는 영국 조기경고 점수 (NEWS, 총 0~21점, 총점이 높을수록 '중증도'도 높음)의 평균값이 감소된 것을 고려하였을 때, 추후 연구를 통한 임상적인 활용 가능성을 확인할 수 있었음. |
| 3. 사실발생(확인)일 | 2021-08-27 |
| 4. 결정일 | 2021-08-27 |
| (출처: 당사 전자공시) |
당사의 코로나 19 치료제의 국내 임상 2상에서는 탐색적 임상시험의 제한된 소수의 대상자 참여와 증상 악화 같은 이상반응 발생 시 투약을 즉시 중단하도록 설계된 임상 디자인의 한계로, 총 14일 동안 1일 1회 경구 투약을 통해 확인하고자 했던 1차 평가변수인 경증 폐렴 환자에서 14일 이내에 산소 치료가 필요한 중증 폐렴 또는 급성호흡곤란증후군(ARDS)으로 이행되는 확률(%)은 투약군 간 통계적 유의성을 확인하지 못했습니다. 다만, 염증성 사이토카인 IL-8과 IL-6에서 시험 1일 차에 비해 시험 14일에서 통계적으로 유의미한 감소(p=0.0032)를 나타냈으며, IL-6 또한 50~64세 연령군에서 시험 1일 차에 비해 시험 14일 차에서 통계적으로 유의미한 감소(p=0.0021)를 확인하였습니다. 당사는 향후 코로나 19 환자 대상 임상 시험을 지속적으로 진행할 예정이나, 임상시험에 따른 지속적인 개발비 지출에도 불구하고 유의미한 임상 결과를 도출하지 못할 가능성도 존재합니다.
또한 당사는 2021년 10월 19일 당사의 주요 파이프라인인 구강점막염에 대해서 미국 FDA 임상 2상 시험결과를 수령하였으며, 상세한 사항은 아래와 같습니다.
| [2021.11.02 [정정] 투자판단관련주요경영사항] |
| 1. 제목 | 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자에게 유발되는 구강점막염에 대한 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위배정, 이중 눈가림, 위약대조 임상2상 시험 결과 | |
| 2. 주요내용 | ※ 투자유의사항 임상시험 약물이 의약품으로 최종 허가 받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다 1. 임상시험 제목 : 영문: Phase2, multi-center, randomized, double-blind, placebo-controlled study to evaluate the safety and efficacy of EC-18 in altering the severity and course of oral mucositis in patients being treated with concomitant chemoiradiation for cancers of the mouth, oropharynx, hypopharynx and nasopharynx. 국문: 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자에게 유발되는 구강점막염에 대한 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위배정, 이중 눈가림, 위약대조 임상2상 시험 2. 임상시험 단계/지역: 임상2상 / 미국 3. 대상환자 : 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자 4. 대상질환명 : 항암화학방사선요법 치료를 받는 구강, 구인두, 하인두, 비인두 환자에게 유발되는 구강점막염 5. 임상시험 신청(승인)일 및 승인(시험)기관 - 신청일: 2017년 06월 20일 - 승인일: 2017년 07월 27일 - 임상승인기관: 미국 식품의약국 (FDA) - 임상시험기관: 미국 21개 병원 6. 임상시험 등록번호: NCT03200340 7. 임상시험 결과: 당사는 EC-18의 임상2상 시험을 통해 아래와 같은 임상 결과를 확인하였습니다. < 아 래 > 1) 시험대상자 수: 105명 2) 유효성 : * 1차 평가변수: 중증 구강점막염 지속기간(SOM Duration) 관찰결과 위약군 대비 100% 감소한 것을 확인 -EC-18 투약군 : 0일 -위약군 : 13.5일 * 2차 평가변수: 중증 구강점막염 발생률(SOM Incidence) 관찰결과 위약군 대비 35.0% 감소한 것을 확인 - EC-18 투약군 : 45.5% - 위약군 : 70% 3) 안전성: 임상시험용 의약품 투약군에서 이상반응은 발견되지 않았음 * 10월 19일에 발표한 임상결과 값과 차이가 발생하지 않았음 * TFL Part2 수령하여 제출함 8. 향후 계획: 당사는 본 임상 결과를 토대로 혁신신약지정(BTD) 신청 예정입니다. |
|
| 3. 사실발생(확인)일 | 2021-10-19 | |
| 4. 결정일 | 2021-10-19 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 1) 상기 사실발생(확인)일 및 결정일은 CRO ICON(PRA)로부터 TFL Part1 data를 받은 날(한국시간 기준) 입니다. 2) 2021년 10월 30일(한국시간 기준)에 TFL Part2 수령하여 제출합니다. 3) 본 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정입니다. |
||
| (출처: 당사 전자공시) |
당사는 시험대상자 수 105명을 대상으로 유효성을 평가하였으며, 1차 평가변수에서는 중증 구강점막염 지속기간(SOM Duration) 관찰결과 위약군 대비 100% 감소한 것을 확인하였으며, 2차 평가변수에서는 중증 구강점막염 발생률(SOM Incidence) 관찰결과 위약군 대비 35.0% 감소한 것을 확인하였습니다. 당사는 본 임상 결과를 토대로 미국 FDA 혁신신약지정(BTD) 신청을 2021년 11월 완료하였습니다.
향후 당사는 코로나19 치료제, 구강점막염 치료제와 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 당사가 진행중인 파이프라인에 대해서, 상기 언급한 것처럼 코로나 19에 따라 임상계획 당시 예상하지 못하였던 변수로 인하여 임상시험 개시 승인이 지연되거나, 코로나 19로 인한 외부 활동 위축으로 임상 시험에 필요한 환자등록이 원활하지 않을 문제가 발생할 수 있습니다. 이 경우 당사의 신약개발이 예정보다 지연될 가능성이 존재하며, 당사가 계획했던 임상시험 비용이 예산을 초과하여 발생하거나, 판매승인 지연으로 인하여 신약매출 발생이 늦어질 수 있습니다.
또한, 최종적으로 당사 제품의 임상 시험에서의 개발 실패의 가능성을 배제할 수 없으며, 개발 실패시 임상실험 진행에 투입된 비용과 시간에 비례하여 당사의 재무적 안정성에 급격한 훼손이 발생할 수 있습니다.
종합적으로, 신약개발은 시간과 노력에 비해 성공확률이 낮기 때문에 높은 위험 부담이 있음에도 불구하고, 성공 시 창출되는 높은 경제적 가치를 고려했을 때 매력적인 산업일 수 있습니다. 하지만 새로운 의약품이 개발되어 소비자에게 전달되기까지는 많은 비용과 노력이 필요하며, 시판으로 이어질 확률은 10,000분의 1 정도로 낮은 편입니다. 따라서 당사에서 진행 중인 신약개발 역시 큰 실패위험 속에 진행되고 있으며, 신약개발에 성공하지 못할 경우 이는 당사의 미래 수익성과 주가에 부정적인 영향을 미칠 수 있음을 알려드립니다.
[기술이전 계약(license-out) 체결 실패 위험]
| 라. 글로벌 신약 개발 시 평균 1조~2조 원 상당의 개발 비용과 평균 10~15년 정도의 장기간의 개발기간 소요됩니다. 신약개발은 크게 후보물질 탐색, 前임상, 임상시험 단계로 구분되는데, 임상 단계는 6~7년이 걸리고, 전문역량과 고비용이 요구되는 단계로 전체 신약개발 비용의 약 70% 소요됩니다. 당사는 현재 진행중인 신약 파이프라인에 대해서, 임상 결과에 따라 국내외 제약사 및 바이오 기업에 기술이전함으로써 수익을 창출하는 사업모델을 구축하고 있으나, 과거 라이선스 아웃을 진행한 이력은 없는 상황입니다. 또한 추후 라이선스 아웃과 관련된 구체적인 계약 체결 등 계획도 부재한 상황이나, 당사의 파이프라인 중 구강점막염(CRIOM) 및 코로나19 치료제 등을 향후 잠재적인 라이선스 아웃 후보로 판단하고 있습니다. 당사는 기술이전계약을 통해 제품이 출시되기 이전에 회사의 재무안정성을 확보함과 동시에 지속적인 성장 발판을 마련하고자 하나, 높은 비용과 임상실패율, 오랜시간이 소요되는 신약개발 사업의 특성상 기술이전계약을 체결한다해도 그 자체로 매출의 인식으로 연결되는 것은 아니며, 기 체결된 기술이전계약이 임상시험 실패에 의하여 불가피하게 중도 계약해지 될 수도 있습니다. 또한, 기술이전을 통해 신약개발을 진행하던 기업이 추가개발에 실패하거나 원활한 진행이 되지 않는 경우, 반환의무가 있는 계약금이나 마일스톤 등은 기술이전을 완료했더라도 지급의무가 발생할 수 있습니다. 기술이전한 파트너사는 당사가 통제할 수 없는 부분이기 때문에 파트너사의 임상수행 능력, 파트너사 내부적인 이벤트 등의 변수로 임상진행을 중단할 가능성도 존재합니다. 이로 인해 기술이전 이후 당사가 예상하는 수준의 매출액 및 수익이 발생하지 않을 수 있습니다. 또한, 최종적으로 기술이전에 실패할 확률도 배제할 수 없습니다. 투자자께서는 이점 유의하시기 바랍니다. |
글로벌 신약 개발 시 평균 1조~2조 원 상당의 개발 비용과 평균 10~15년 정도의 장기간의 개발기간 소요됩니다. 신약개발은 크게 후보물질 탐색, 前임상, 임상시험 단계로 구분되는데, 임상 단계는 6~7년이 걸리고, 전문역량과 고비용이 요구되는 단계로 전체 신약개발 비용의 약 70% 소요됩니다. 이에 높은 비용과 임상실패율, 오랜시간이 소요되는 신약개발 사업의 특성상 많은 바이오 벤처기업들이 기술이전을 사업모델로 하고 있습니다.
기술이전이란 개발된 기술을 계약 파트너에게 이전하여 해당기술의 독점실시권을 허락하는 것으로, 일반적으로 기술을 이전할 때는 계약 파트너가 해당 기술을 활용하여제품을 개발하고 판매할 수 있는 권리도 이전하게 됩니다. 이 과정에서 기술을 이전한 바이오 벤처기업은 계약 조건에 따라 계약체결 직후 선수금, 향후 일정 개발 단계의 달성 시점에 따라 중도금 및 완제 의약품의 시장 출시 후 판매대금의 일정비율을 지급받는 로열티를 지급받고, 이러한 기술료 수입이 바이오 벤처 기업들의 주요 수익원이라 할 수 있습니다. 따라서 기술이전 계약 시점 이후에 이루어지는 임상 개발, 품목 허가 및 판매 등의 업무는 기술이전 대상 회사의 역량에 따라 좌우된다고 볼 수 있습니다. 특히나 대규모 비용이 요구되는 임상 3상 단계부터는 글로벌 제약사와의 파트너쉽 또는 기술 이전을 통하여 자금을 확보하는 것이 필요합니다.
라이센스 거래는 제약기업간 전략적 제휴의 대표적인 형태 중 하나로 최근 건수가 감소하고 있으나 거래규모는 확대되고 있습니다. 양질의 기술을 보유했으나 자금력과 경험 부족 등으로 높은 임상비용을 감당하기 어려운 소규모 업체는 라이센싱 아웃(기술이전)을 통해 각종 기술료를 받음으로써 회사 재무구조 개선에 활용하고 있습니다. 라이센싱 아웃은 Upfront fee(초기계약금), Milestone(개발단계별 기술료), Running Royalty(매출의 일정 비중을 로열티로 지급) 등의 기술료 수익이 발생하게 됩니다. 반대로 라이센싱 인을 하는 기업은 오랜 기간이 소요되는 연구 단계를 거치지 않고 양질의 기술을 신속하게 확보함으로써 신약개발의 효율성 제고가 가능합니다. 라이센스 거래는 다양한 파이프라인을 보유 목적 외에 파이프라인 독점 수단으로도 활용되고 있습니다.
질환영역별로는 종양, 감염질환, 중추신경계 질환 순으로 거래가 이루어지고 있으며, 2012~2016년까지 있었던 종양질환 라이센스 거래 규모는 약 280억 달러 수준에 이르고 있습니다. 임상단계별로 글로벌 라이센스 거래를 살펴본결과 2012~2016년간 전임상 단계에서의 거래건수와 규모가 모두 높게 나타나고 있습니다.
| [글로벌 임상단계별 라이센스 거래건수 및 거래규모] |
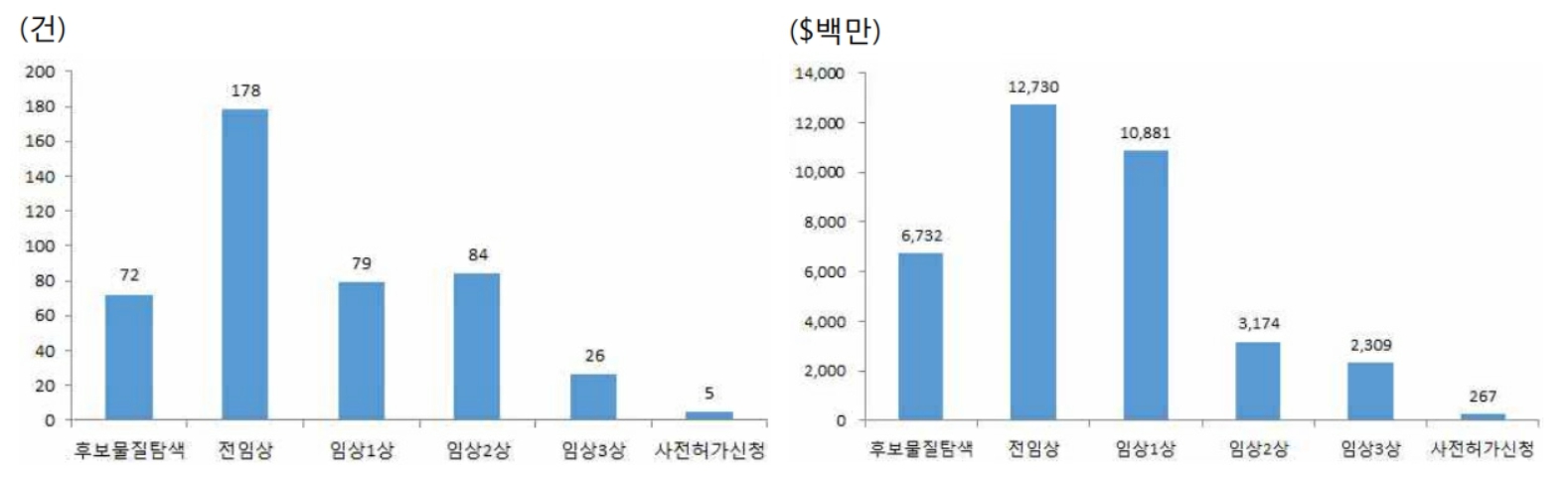 |
|
사업위험 라. 글로벌 임상단곌별 라이센스 거래건수 및 거래규모 |
| (출처 : 한국수출입은행, 세계 바이오의약품 산업 동향 및 전망(2019.7.22), 글로벌 제약시장 임상 파이프라인 분석(2017), 과학기술일자리진흥원 재인용(2018)) |
일반적으로 기술이전이 이루어지게 되면, 추가개발은 라이선스인을 한 기업에서 진행하며 계약에 따라 별도로 추가개발을 진행할 수도 있습니다. 라이선스인한 기업에서는 추가개발 상황 및 임상시험 결과에 따라 마일스톤 및 로열티를 지급하게 되는데 이러한 수익구조는 다음과 같이 정리할 수 있습니다.
| [라이센스 계약 수익구조] |
| 구분 | 내용 | |
|---|---|---|
| 총계약금액 | 계약금 | 계약 체결 직후 또는 일정기간 내에 받게 되는 금액 |
| 마일스톤 | 전임상, 임상, 허가신청, 허가완료 등 개발 단계별로 성공시 받게 되는 금액 | |
| 로열티 | 기술 이전으로 생산된 제품의 매출에 따라 받게 되는 금액 (통상 매출액 대비 비율로 책정) |
|
| (출처 : 금융감독원 보도자료 "제약·바이오 기업의 공시실태 및 투자자 보호방안) |
계약금은 계약 직후 수령하게 되는데, 계약조건에 따라 반환의무가 있을 수 있습니다. 마일스톤의 경우 추가개발 진행상황에 따라 수취하게 되는 금액이며, 로열티는 최종 허가 이후 해당 제품이 매출을 발생시킬 경우 받게 되는 수수료입니다.
당사는 현재 진행중인 신약 파이프라인에 대해서, 임상 결과에 따라 국내외 제약사 및 바이오 기업에 기술이전함으로써 수익을 창출하는 사업모델을 구축하고 있으나, 과거 라이선스 아웃을 진행한 이력은 없는 상황입니다. 또한 추후 라이선스 아웃과 관련된 구체적인 계약 체결 등 계획도 부재한 상황이나, 당사의 파이프라인 중 구강점막염(CRIOM) 및 코로나19 치료제 등을 향후 잠재적인 라이선스 아웃 후보로 판단하고 있습니다. 당사의 주요 파이프라인의 시장규모 및 경쟁상황은 아래와 같습니다.
| [당사 파이프라인의 시장규모 예측] |
| 구분 | 시장규모 | 출처 | 경쟁상황 |
|---|---|---|---|
| 호중구감소증 | 화학요법에 따른 호중구감소증 치료제 시장 규모는 2019년 전체 12.6억 달러에 이르고 있으며, 2010년부터 2027년까지 약 5.4%의 연간시장성장률 (CAGR)을 보여 2027년에는 약 186억원 달러 규모로 성장할 것으로 예측하고 있습니다. | Allied Market Research, 2020.05 |
Amgen社 Filgrastim (G-CSF 제품) |
| 구강점막염 | 전 세계 구강점막염 시장규모는 2020년 15억 달러 (1.7조원)에서 2026년 내 CAGR 4.0%로 18억 달러 (2조원)에 이를 것으로 예상됩니다. | MarketWatch, 2020.12 | Galera GC-4419 (3상) |
| 급성방사선증후군 | 전세계 방사선 독성 치료 시장은 2029년 예상 기간까지 미화 55억 달러의 가치를 넘어 설 것으로 보고되고 있습니다. | Pharmiweb.com, 2021.01 | - |
| COVID-19 |
신종코로나바이러스 감염증 (COVID-19) 치료제 시장 크기는 -57.8%의 연간 시장 성장률 (CAGR)로 2020년 23억원 달러 (2.5조원)에서 2025년 14억달러 (1.5조원)에 도달할 것으로 예상됩니다. |
MarketsandMarkets, 2020.05 |
Merck (MSD) (3상) Pfizer (3상) (경구용 치료제) |
| (출처; 당사 제시) |
특히, 당사의 구강점막염의 미국 FDA 임상 2상을 진행하고 있으며, 당사는 올해 임상 2상의 Topline(투약 후 안정성 결과) 결과 도출 및 이후 FDA의 혁신신약(BTD) 신청을 계획하고 있습니다. 이후 당사는 임상 3상 IND(임상시험계획승인) 신청 및 라이선스 아웃(기술이전)을 계획하고 있어, 당사가 보유하고 있는 파이프라인 중 구강점막염의 기술이전 가능성이 높을 것으로 판단하고 있습니다. 그럼에도 불구하고, 임상 2상의 결과가 좋지 않을 경우, 라이선싱 아웃이 시기가 지연될 수 있으며 당사 손익에 악영향을 끼칠 수 있습니다.
당사는 기술이전계약을 통해 제품이 출시되기 이전에 회사의 재무안정성을 확보함과 동시에 지속적인 성장 발판을 마련하고자 하나, 높은 비용과 임상실패율, 오랜시간이 소요되는 신약개발 사업의 특성상 기술이전계약을 체결한다해도 그 자체로 매출의 인식으로 연결되는 것은 아니며, 기 체결된 기술이전계약이 임상시험 실패에 의하여 불가피하게 중도 계약해지 될 수도 있습니다.
또한, 기술이전을 통해 신약개발을 진행하던 기업이 추가개발에 실패하거나 원활한 진행이 되지 않는 경우, 반환의무가 있는 계약금이나 마일스톤 등은 기술이전을 완료했더라도 지급의무가 발생할 수 있습니다. 기술이전한 파트너사는 당사가 통제할 수 없는 부분이기 때문에 파트너사의 임상수행 능력, 파트너사 내부적인 이벤트 등의 변수로 임상진행을 중단할 가능성도 존재합니다. 이로 인해 기술이전 이후 당사가 예상하는 수준의 매출액 및 수익이 발생하지 않을 수 있습니다. 또한, 최종적으로 기술이전에 실패할 확률도 배제할 수 없습니다. 투자자께서는 이점 유의하시기 바랍니다.
[코로나 19 pDNA백신 관련 신규사업 추진에 따른 위험]
| 마. 당사는 Zydus Cadila 간 LOI(Letter Of Intent) 체결을 통해 Zydus Cadila가 생산하는 pDNA 백신의 위탁생산(CMO)에 대해서 독점적 권리(exclusive right)를 우선 협의한 상황입니다. 이에 당사는 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 백신의 본격적인 생산 및 Zydus Cadila사에 판매를 진행할 것으로 계획하고 있으나, 2021년 10월 중 예상했던 계약 체결이 현재까지 진행되지 않은 상황입니다. 이에 따라, 본 백신 물량은 본 계약 체결 전으로 요청하는 백신 생산 물량이 변동할 수 있으며, 판매단가, 시점 등 구체적으로 정해진 사항은 현재까지 없는 상황입니다. 따라서 LOI 체결이 향후 백신의 위탁생산(CMO) 생산의 구체적 내용을 담보하는 것이 아니며, 본 계약 체결 시 주요사항의 변경 가능성이 상존하고 있습니다. 또한 본 계약 체결이 지속적으로 지연될 경우, 본 유상증자 대금의 자금집행일정 또한 지연될 가능성 또한 존재합니다. 당사는 위탁생산(CMO) 계약과 더불어 Zydus Cadila사의 DNA 백신의 독점 라이선스 계약을 체결할 예정입니다. 현재 당사는 라이선스 본 계약 체결 전으로 현재까지 구체적으로 정해진 사항은 양사가 체결한 LOI 상 Zydus Cadila사가 개발한 코로나 DNA백신에 대해서 독점적 권리(exclusive right) 부여 외 로열티 및 마일스톤 지급 등 대한 구체적인 사항은 미정인 상황입니다. 또한, 당사의 주요사업은 신약개발사업 및 원료의약품(API) 사업으로 의약품의 위탁생산(CMO) 경험이 없는 상황으로 향후 위탁생산 등 진행에 있어도 여러가지 변수가 상존하는 상황입니다. 다만, 당사는 Zydus Cadila사의 긴급승인에 따른 생산 필요물량을 수임하기 위해, 대규모 cGMP 바이오플랜트 및 제조원액의 Fill and Finish가 가능한 "엔지켐 컨소시엄"을 구성하여 시설 및 인력 등을 독점적으로 사용할 수 있는 위탁 생산 설비 등에 대해 사전 약정을 체결한 상황입니다. 당사는 컨소시엄 내에서 Zydus Cadila의 백신 위탁생산을 총괄할 예정으로, 당사는 Zydus Cadila의 Order 접수 및 원료 수급, 최종 완제품 공급 등을 담당하며, 백신 원액(DS) 생산은 엔지켐 컨소시엄 내 A사가, 백신 포장(Fill/Finish)은 B, C사가 담당할 예정입니다. 구체적으로, 당사는 Zydus Cadila와의 위탁생산(CMO)을 위하여 구성한 '엔지켐 컨소시엄'을 총괄하며, 모든 계약 체결의 당사자는 엔지켐생명과학입니다. 현재 Zydus Cadila로부터 대량의 생산 물량 주문이 예상됨에 따라 당사는 위탁생산(CMO) 본 계약이 체결되면 '엔지켐 컨소시엄' 내의 생산 담당 파트와 다시 재위탁 계약을 체결할 것입니다. 또한, 당사는 원액 벌크(DS) 및 완제 fill-finish(DP) 생산을 위한 원부자재(원재료)는 Zydus Cadila와 협력하여 매입·조달할 예정입니다. 원부자재 매입·조달, 원액 벌크(DS) 및 완제 fill-finish(DP) 진행 후 품질보증(QA), 출하 승인, 매출까지 모든 프로세스에 대해 당사가 총괄하여 실행할 계획입니다. 상기에 따라, LOI에 기반한 Zydus Cadila 간 위탁생산(CMO)의 본 계약 체결과 동시에, 위탁생산에 필요한 시설 및 인력 등 독점적 사용에 대한 구체적 계약을 컨소시엄 구성원들과 체결할 예정입니다. 현재로써는 사전 약정에 따라 당사와 컨소시엄 구성원들과 본 계약 체결 가능성이 높을 것으로 보이나, 이 또한 확정적인 사항이 아니기 때문에 계약 조건 및 일정 등 변동이 발생할 수 있습니다. 당사는 또한, 현재 오송지역 내 바이오플랜트 신축을 계획하고 있으며, 당사는 오송신축 설비 완공 시 컨소시엄 내 생산 담당 파트와 같이 본 Zydus Cadila의 백신 위탁생산을 병행할 예정입니다. 당사는 Zydus Cadila 간 LOI 체결로, 추후 Zydus Cadila의 pDNA백신 위탁생산 및 라이선스 매입의 본 계약 체결 시 당사의 수익성은 개선될 것으로 판단하고 있습니다. 그러나 현재 본 계약이 체결된 상황이 아니기 때문에,투자자 여러분께서는 Zydus Cadila 및 컨소시엄 간 본 계약 체결현황을 반드시 확인하시어 투자에 임해주시기 바랍니다. |
당사는 인도의 글로벌 바이오제약사인 자이더스 카딜라(Zydus Cadila)가 개발중인 pDNA 기반 코로나 19 백신인 ZyCoV-D에 대해서, 임상 3상 중간 결과에 따라 인도의약품관리국(DCGI)에서 2021년 08월 20일 긴급사용 승인(EUA)이 허가되었으며, 이는 세계 첫 DNA 기반 코로나 19 백신이 허가된 사례입니다. 인도 내 긴급사용 승인에 따라 Zydus Cadila는 9월 중 ZyCoV-D의 인도 내 백신 접종을 개시할 것으로 예상하고 있으며, 이에 따라 Zydus Cadila는 ZyCoV-D의 대량 생산이 필요한 상황이었습니다. 상기 배경에 따라 Zydus Cadila의 위탁 생산(CMO)처가 필요한 상황이었으며, 당사와 Zydus Cadila 간 LOI(Letter Of Intent) 체결을 통해 Zydus Cadila가 생산하는 pDNA 백신의 위탁생산(CMO)에 대해서 독점적 권리(exclusive right)를 우선 협의한 상황입니다.
| [2021.09.09 풍문또는보도에대한해명(미확정)] |
| 1. 풍문 또는 보도의 내용 | 엔지켐생명과학과 자이더스 캐딜라(Zydus Cadila)와의 COVID-19 백신 생산 공급 |
| 2. 풍문 또는 보도의 매체 | 파이낸셜 뉴스 등 |
| 3. 풍문 또는 보도의 발생일자 | 2021-09-09 |
| 4. 풍문 또는 보도에 대한 해명내용 | |
| - 본 공시는 2021년 09월 09일자 파이낸셜 뉴스에서 보도된 "세계 최초 DNA 코로나 백신 인도서 사용승인, 국내 DNA 백신은..." 기사 중 엔지켐생명과학과 자이더스 캐딜라(Zydus Cadila)와의 COVID-19 백신 생산 공급에 대한 풍문 또는 보도에 대한 해명 공시(미확정) 입니다. - 당사는 자이더스 캐딜라(Zydus Cadila)와 COVID-19 ZyCoV-D 백신의 글로벌 생산 공급 의향서를 체결하였고, 라이센스 및 위탁생산 논의가 구체적으로 진행되고 있으나 현재까지 확정된 바 없습니다. - 상기 내용과 관련하여 확정되는 시점 또는 1개월 이내에 재공시 하겠습니다. - 공시책임자 : 경영본부장 김혜경 |
|
| (출처: 당사 전자공시) |
| [LOI 체결 주요내용(2021.08.20)] |
| 주요 목적(Purpose) - Zydus Cadila와 엔지켐생명과학 간 플라스미드 디옥시리보핵산(pDNA) 항바이러스 백신을 위한 잠재적인 파트너쉽 체결 (중략) 제안사항(Proposal) - 엔지켐생명과학은 pDNA 백신 7억 dose까지 생산에 필요한 생산품목을 공급하는 협약을 체결하며, 2021-2022년 간 매년 1억 5천 dose 생산을 시작하기로 함 - 엔지켐생명과학이 생산하여야 하는 pDNA 백신의 구체적인 시기, 제품의 설계 및 가격 등은 계약서에서 정하기로 함 - 로열티 및 마일스톤 기반 라이선스는 엔지켐생명과학에게 대한민국 내 Zydus Cadila의 Covid-19 DNA백신의 독점적 생산 및 판매 권한을 부여함 |
| (출처: 당사 제시) 주1) 상기 내용은 요약본으로, 의역에 따라 일부 차이가 발생할 수 있음. |
상기 LOI의 협약 대상인 Zydus Cadila는 인도 구자라트 아메 다 바드에 본사를 두고 있는 인도의 자국적 제약 회사로, 주로 제네릭 의약품 제조에 종사하고 있습니다. Zydus Cadila의 개요는 아래와 같습니다.
| [자이더스 카딜라(Zydus Cadila) 주요 개요] |
|
일자 |
내용 |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
상호 |
Cadila healthcare Limited |
|||||||||||
|
주소 |
Ahmedabad, Gujarat, India |
|||||||||||
|
설립연도 |
1952년(직원수: 25,000명(연구인력 1,400명) |
|||||||||||
|
주주 현황 (2021.03 기준) |
발행주식: 1,023,742,600주 주요주주 - Zydus Fmily Trust(766,381,434주 / 74.86%) - Life Insurance Corporation of India(32,078,893주 / 3.13%) - Kotak Standard Multicap Fund(12,500,000주 / 1.22%) 시가총액: 약 9.7조원(2021.7월 기준) |
|||||||||||
|
주요사업 |
- Formulations(제약): 인도 제약산업에서 4위를 기록하고 있음(종양, 류마티스, 단일클론항체, 항체-약물 접합체(antibody drug conjugates) 백신) - Active Pharaceutical Ingredients(API), Animal healthcare products: 항박테리아(anti-bacterial)
주1)Zydus Cadila는 3월 결산법인임. |
| (출처: 당사 제시) |
상기 내용에 따라, 당사는 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 백신의 본격적인 생산 및 Zydus Cadila에 판매(Zydus Cadlia에 위탁생산 물량 전량 납품)를 진행할 것으로 계획하였습니다. 그러나 현재까지 위탁생산(CMO) 본 계약 내 세부조항 및 사전절차를 구체적으로 협의하고 있으나 계약 여부는 확정되지 않은 상황입니다.
| [2021.11.09 풍문또는보도에대한해명(미확정)] |
| 1. 풍문 또는 보도의 내용 | 엔지켐생명과학 자이더스 캐딜라(Zydus Cadila)와의 COVID-19 백신 생산 공급 |
| 2. 풍문 또는 보도의 매체 | 파이낸셜뉴스 등 |
| 3. 풍문 또는 보도의 발생일자 | 2021-09-09 |
| 4. 풍문 또는 보도에 대한 해명내용 | |
| - 본 공시는 2021년 09월 09일자 파이낸셜 뉴스에서 보도된 "세계 최초 DNA 코로나 백신 인도서 사용승인, 국내 DNA 백신은..." 기사 중 엔지켐생명과학과 자이더스 캐딜라 (Zydus Cadila)와의 COVID-19 백신 생산 공급에 대한 풍문 또는 보도에 대한 해명 공시(미확정)의 재공시 입니다. - 당사는 자이더스 캐딜라(Zydus Cadila)와 COVID-19 ZyCoV-D 백신의 글로벌 백신공급의향서를 체결한바 있습니다. 현재 위탁생산(CMO) 및 라이선스 계약의 세부조항인 계약금액, 가격조건, 생산일정, 생산기술 이전 및 상호방문 일정, 배송비용 등과 계약 실행에 대한 사전절차를 구체적으로 진행하고 있으나, 계약 여부는 확정되지 않았습니다. - 상기 내용과 관련하여 확정되는 시점 또는 1개월 이내에 재공시 하겠습니다. - 공시책임자: 경영본부장 김혜경 |
|
| 5. 재공시예정일 | 2021-12-09 |
| (출처: 당사 전자공시) |
추후 계약체결 확정 시 전자공시 등을 통해 공지할 예정이나, 최초 증권신고서 제출 이후 현재까지 본 계약이 체결되지 않았다는 점을 투자자 여러분께서는 반드시 유의해 주시기 바랍니다. 당사의 본 유상증자 대금은 본 LOI 체결에 따른 운전자금 등으로 사용될 예정으로, 소요자금의 상세 내역은 'V. 자금의 사용목적'을 참고해 주시기 바랍니다.
당사는 LOI내용에 따라 2022년 부터 약 1억 5천만 dose(약의 1회분)의 백신을 생산할 예정이며, 향후 최대 7억 dose까지 생산할 수 있다는 내용이 포함되어 있습니다. 다만, 본 백신 물량은 본 계약 체결 전으로 요청하는 백신 생산 물량이 변동할 수 있으며, 판매단가, 시점 등 구체적으로 정해진 사항은 현재까지 없는 상황입니다. 따라서 LOI 체결이 향후 백신의 위탁생산(CMO) 생산의 구체적 내용을 담보하는 것이 아니며, 본 계약 체결 시 주요사항의 변경 가능성이 상존하고 있습니다.
또한 본 계약 체결이 지속적으로 지연될 경우, 본 유상증자 대금의 자금집행일정 또한 지연될 가능성 또한 존재합니다. 추가로, 당사가 생산하는 시세품의 품질에 따라 위탁생산 계약에 영향을 끼칠 수 있으며, 종합적으로 확정된 사항이 현재까지 제한적임에 따라 위탁생산에 끼치는 변수가 큰 상황입니다. 투자자 여러분들께서는 본 LOI가 Zydus Cadila 간 위탁생산(CMO)이 확정된 것이 아님을 반드시 명심해주시기 바라며, 주의하여 투자에 임해주시기 바랍니다. 당사는 향후 확정되는 사항에 대해서 본 증권신고서 및 추가 공시 등 통하여 정확한 내용을 전달할 계획입니다.
당사는 Zydus Cadila의 pDNA 백신의 위탁생산과 더불어, 라이선스 매입 또한 진행하고 있습니다. 이에 따라 본 유상증자 대금 중 일부는 라이선스 매입 및 마일스톤에 따른 수수료 등이 지급될 예정입니다. 당사는 라이선스 매입을 통해 ZyCoV-D의 인도 외 지역 허가 시 당사가 직접 공급하기 위함입니다.
당사는 상기 목적에 따라, Zydus Cadila사와 체결한 LOI 내용을 토대로 상기 위탁생산(CMO) 계약과 더불어 Zydus Cadila사의 DNA 백신의 독점 라이선스 계약을 체결할 예정입니다. 현재 당사는 라이선스 본 계약 체결 전으로 현재까지 구체적으로 정해진 사항은 양사가 체결한 LOI 상 Zydus Cadila사가 개발한 코로나 DNA백신에 대해서 독점적 권리(exclusive right) 부여 외 로열티 및 마일스톤 지급 등 대한 구체적인 사항은 미정인 상황입니다. 다만, 당사 및 Zydus Cadila사는 Licensing 및 CMO에 관련된 계약 내용을 현재 구체적으로 검토중이며, 양사 간 구체적인 Due Diligence 절차가 진행중에 있습니다. 이 또한 명확한 계약 내용 및 권리관계를 구체적으로 확정할 예정이며, 향후 확인되는 대로 본 증권신고서 및 추가 공시를 통하여 정확한 내용을 전달할 계획입니다. 권리관계에 따른 구체적 비용 등에 관한 사항은 'V. 자금의사용목적'을 참고해 주시기 바랍니다.
당사는 Zydus Cadila 간 위탁생산 LOI를 체결하였다고 하나, 당사의 주요사업은 신약개발사업 및 원료의약품(API) 사업으로 의약품의 위탁생산(CMO) 경험이 없는 상황으로 향후 위탁생산 등 진행에 있어도 여러가지 변수가 상존하는 상황입니다. 다만, 당사는 Zydus Cadila사의 긴급승인에 따른 생산 필요물량을 수임하기 위해, 대규모 cGMP 바이오플랜트 및 제조원액의 Fill and Finish가 가능한 "엔지켐 컨소시엄"을 구성하여 시설 및 인력 등을 독점적으로 사용할 수 있는 위탁 생산 설비 등에 대해 사전 약정을 체결한 상황입니다. 당사는 컨소시엄을 통해 Zydus Cadila에게 백신의 위탁생산을 진행할 예정으로, 당사는 컨소시엄 내에서 Zydus Cadila의 백신 위탁생산을 총괄할 예정입니다. 컨소시엄 내 당사는 Zydus Cadila의 Order 접수 및 원료 수급, 최종 완제품 공급 등을 담당하며, 백신 원액(DS) 생산은 엔지켐 컨소시엄 내 A사가, 백신 포장(Fill/Finish)은 B, C사가 담당할 예정입니다.
| [LOI 체결 주요내용(2021.08.20)_위탁생산능력] |
| 엔지켐 컨소시엄 자산(Enzychem Consortium's assets) - 40,000m2 cGMP 생산시설 - 500명 이상의 전문인력: 연구개발(R&D) 부서 및 충전 및 포장(Fill&Finish and Packing), 품질관리(QC/QA) 전문인력 - 5억 dose의 충전 및 포장능력 |
| (출처: 당사 제시) 주1) 상기 내용은 요약본으로, 의역에 따라 일부 차이가 발생할 수 있음. |
| [엔지켐 컨소시엄 위탁생산 주요시설현황] |
|
구분 |
내용 |
|---|---|
|
생산 대상 품목 |
ZyCoV-D |
|
생산 능력 |
12,500L X 2 미생물 배양시설 |
|
바이오플랜트 cGMP시설 현황 |
1~4층 16,732㎡ |
| 연구인력 | 500명 이상의 전문인력: 연구개발(R&D) 부서 및 충전 및 포장(Fill&Finish and Packing), 품질관리(QC/QA) 전문인력 |
|
대한민국 정부 지원 |
컨소시엄 파트너들은 대한민국 정부가 출범시킨 Covid 백신 글로벌 허브 TF 핵심 맴버들로, 임상 개발 및 규제 승인을 가속화하고 중요한 공급품 및 원자재의 수입과 제품 수출을 촉진 등 지원 |
| (출처: 당사 제시) 주1) 상기 위탁생산 주요시설은 컨소시엄 내 원액(DS) 생산 및 Fill/Finish를 담당하는 업체의 주요시설입니다. |
| [엔지켐 컨소시엄의 위탁생산(CMO) 시 주요 역할] |
| 구분 | 역할 | 내용 |
|---|---|---|
| 엔지켐생명과학 | 위탁생산 총괄 | 백신 생산 총괄, Zydus Cadila 위탁생산 Order 접수, 원료 수급, 백신 생산 후 최종 완제품의 Zydus Cadila 공급 |
| A사 | 백신 원액(DS) 생산 | A사 보유 생산시설을 통한 원액(DS) 위탁생산 전담 |
| B, C사 | 백신 포장(Fill/Finish) | 백신 원액의 충전, 마감 및 포장 전담 |
| (출처: 당사 제시) |
엔지켐 컨소시엄을 통한 위탁생산(CMO)의 주요 사항은 아래와 같습니다.
1. 계약 진행
당사는 Zydus Cadila의 생산 주문에 대응하기 위하여 원부자재 매입·조달, 생산 방식(원액 벌크(DS), 완제 fill-finish(DP)), 공급 가격, 제품 공급, 대금 결제 및 수령 등이 포함된 위탁생산(CMO) 본 계약에 대해 Zydus Cadila와 구체적으로 협의 진행중입니다. 당사는 Zydus Cadila와의 위탁생산(CMO)을 위하여 구성한 '엔지켐 컨소시엄'을 총괄하며, 모든 계약 체결의 당사자는 엔지켐생명과학입니다. 당사는 '엔지켐 컨소시엄'의 총괄사로서 신고서 제출일 현재 위탁생산(CMO) 관련 LOI 체결, 위탁생산(CMO) 세부 조건의 구체적 협의, 위탁생산(CMO) 본 계약 체결, 필요시 원액 벌크(DS) 생산 및 완제 fill-finish(DP)의 재위탁 계약 체결 등 Zydus Cadila와의 위탁생산에 관한 전체 프로세스를 주관하여 실행하고 있습니다. 현재 Zydus Cadila로부터 대량의 생산 물량 주문이 예상됨에 따라 당사는 위탁생산(CMO) 본 계약이 체결되면 '엔지켐 컨소시엄' 내의 생산 담당 파트와 다시 재위탁 계약을 체결할 것입니다.
2. 당사의 역할
당사는 원액 벌크(DS) 및 완제 fill-finish(DP) 생산을 위한 원부자재(원재료)는 Zydus Cadila와 협력하여 매입·조달할 예정입니다. 원부자재 매입·조달, 원액 벌크(DS) 및 완제 fill-finish(DP) 진행 후 품질보증(QA), 출하 승인, 매출까지 모든 프로세스에 대해 당사가 총괄하여 실행할 계획입니다.
3. 위탁생산(CMO) 프로세스
상기 계약 진행 후 당사는 1. 당사가 Zydus Cadila에게 CMO 본 계약에 따른 백신생산 order 접수, 2. 백신 생산에 필요한 원부자재를 Zydus Cadila로 부터 수급하여(Zydus Cadila 요청에 따라 수급처 변경 가능) 백신 원액(DS)를 생산하는 A사에게 전달, 3. A사의 원액 생산 후 B, C사에서 원액의 Fill/Finish(마감 및 포장)를 진행, 4. 당사는 완성된 백신을 Zydus Cadila가 지정한 운송사에 최종 완제품을 인계하고, 완제품 접수 시 대금 결제를 완료하는 것으로 위탁생산 프로세스가 진행될 것으로 예상하고 있습니다.
상기에 따라, LOI에 기반한 Zydus Cadila 간 위탁생산(CMO)의 본 계약 체결과 동시에, 위탁생산에 필요한 시설 및 인력 등 독점적 사용에 대한 구체적 계약을 컨소시엄 구성원들과 체결할 예정입니다. 현재로써는 각 컨소시엄 구성원들과의 사전 약정을 통해 당사를 Zydus Cadila의 위탁생산의 단일 창구로 진행하는 사항만 협의한 상태이며, 여타 위탁생산과 관련된 구체적인 사항은 각 컨소시엄 구성원들과 추가적으로 계약을 진행해야 하는 상황입니다. 당사와 컨소시엄 구성원들과 본 계약 체결 가능성이 높을 것으로 보이나, 이 또한 확정적인 사항이 아니기 때문에 계약 조건 및 일정 등 변동이 발생할 수 있습니다.
현재 당사의 주요 생산시설은 제천1공장, 제천2공장으로 현재는 주로 원료의약품(API)만 생산하고 있습니다.
| [당사 유형자산 생산능력] |
| 구분 | 생산능력 산출품목 |
Batch Size (Kg) |
연간 최대 Batch 수 | 연간 생산능력(톤) |
|---|---|---|---|---|
| 제천공장 | 항결핵제 | 105.00 | 93 | 9.73 |
| 진해 거담제 | 540.00 | 39 | 21.09 | |
| 염증치료제 | 205.00 | 59 | 12.02 | |
| 위궤양치료제 | 200.00 | 181 | 36.12 | |
| 항응고제 | 525.03 | 88 | 46.3 |
| (출처: 당사 정기보고서) 주1) 연간생산능력은 생산공정에 투입될 수 있는 Batch 수와 품목별 최대 Batch size에 따라 결정됨. 주2) Batch수는 Batch Term에 따라 결정되며 Batch Term은 첫번째 Batch(일반 제조업의 경우 생산 LOT의 개념) 이후 두번째 Batch가 투입되는데 필요한 일수를 의미함. 주3) Batch size는 해당 공장의 반응기 크기에 따라 결정되며, 다만 각 품목별로 반응에 필요한 용매, 촉매 등의 필요 수량이 다르기 때문에 같은 반응기에서 생산을 할 경우에도 품목별로 Batch size는 다를 수 있음. |
다만, 당사는 현재 오송신축 설비투자를 진행중에 있으며, 금번 유상증자 대금 중 일부는 시설투자에 사용될 예정입니다. 자세한 사항은 'V. 자금의 사용목적'을 참고 부탁드리겠습니다. 현재 오송신축 설비투자의 세부 계획은 아래와 같습니다. 추후 오송신축 설비 완공 시 당사가 추후 진행하고자 하는 위탁생산 등 추가적인 능력이 확대될 수 있으며, 당사는 오송신축 설비 완공 시 컨소시엄 내 생산 담당 파트와 같이 본 Zydus Cadila의 백신 위탁생산을 병행할 예정입니다.
| [향후 시설자금 사용계획(2022년~2024년) |
| (단위 : 억원) |
| 구분 | 2022년 상반기 |
2022년 하반기 |
2023년 상반기 |
2023년 하반기 |
2024년 상반기 |
Total | |
|---|---|---|---|---|---|---|---|
| 백신 완제(DP) 생산 시설 신축 |
생산시설 건축 |
95 | 95 | 47 | 47 | 284 | |
|
시설 장비 구매 |
93 | - | 93 | - | 186 | ||
|
시스템, 전산 구비 |
- | - | - | 70 | 70 | ||
|
설계 비용 |
10 | - | - | - | - | 10 | |
|
소 계 |
198 | 95 | 140 | 47 | 70 | 550 | |
| 백신 원료(DS) 생산 시설 신축 |
생산시설 건축 |
250 | 250 | 500 | 500 | 500 | 2,000 |
|
시설 장비 구매 |
- | - | 1,000 | - | 735 | 1,735 | |
|
설계 비용 |
30 | - | - | - | - | 30 | |
|
소 계 |
280 | 250 | 1,500 | 500 | 1,235 | 3,765 | |
| 합 계 | 478 | 345 | 1,640 | 547 | 1,305 | 4,315 | |
| 주1) 현재 설계 및 그에 따른 시공계가 완료되기 전 단계로 상기 시설공사비 및 장비구입비용, 설비 비용등은 추정한 금액이므로 실제 건설단계에서 일부 변경될 수 있습니다. |
라이선스 매입을 통해 추후 ZyCoV-D 의 국가별 허가 현황에 따라 당사가 판매할 수 있는 지역이 확대될 것으로 기대하고 있으나, 상기 언급하였듯이 현재 본 계약 체결 전으로 아직 어느것도 확정된 사항이 없는 상황입니다. 또한 라이선스 매입에 성공하더라도, ZyCoV-D가 현재 코로나19 백신시장에서 시장 경쟁력을 보유하고 있는 점에 대해서도 미지수인 상황입니다. ZyCoV-D의 불확실성에 관해서는 '사업위험 바.'를 참고해 주시기 바랍니다. 이는 최악의 경우에는 라이선스 매입에 따른 수익이 비용을 상회하지 못할 수도 있으며, 오히려 라이선스 매입으로 인해 당사의 손익에 악영향을 끼칠 수 있습니다.
종합적으로, 당사는 Zydus Cadila 간 LOI 체결로, 추후 Zydus Cadila의 pDNA백신 위탁생산 및 라이선스 매입의 본 계약 체결 시 당사의 수익성은 개선될 것으로 판단하고 있습니다. 그러나 현재 본 계약이 체결된 상황이 아니기 때문에,투자자 여러분께서는 Zydus Cadila 및 컨소시엄 간 본 계약 체결현황을 반드시 확인하시어 투자에 임해주시기 바랍니다.
[pDNA 백신의 불확실성에 따른 위험]
| 바. Zydus Cadila가 개발한 ZyCoV-D는 세계 최초의 DNA 기반 코로나 19 백신으로, 긴급사용이 승인된 주요 배경으로는 인도 자국 내 임상 3상 중간 결과가 발표되었기 때문입니다. Zydus Cadila 측에서는 본 임상 3상 결과 중에서 ZyCoV-D가 변이 바이러스, 특히 전염성이 높은 델타 변종에 대한 효능이 있는 것으로 판단하고 있습니다. 다만, ZyCoV-D의 경우 백신의 효능이 ZyCoV-D의 경우 돌파감염율이 높은 델타변이가 유행한 시점에 대한 임상결과임을 감안해야 하나, 접종자의 66.6%에서 증상성 질환을 예방할 수 있다는 결과로 여타 코로나19 백신보다는 비교적 효능이 낮은 수치입니다. 또한, 한달 간격으로 3회 접종을 해야되는 등 여타 코로나 백신에 비해 상대적으로 부각될 수 있는 단점들이 존재하는 상황입니다. 이는 향후 당사의 LOI체결에 따른 주요 위탁생산 및 라이선스 매입 대상인 ZyCoV-D에 대해서 향후 백신의 시장성에 대해서 불확실성이 상존하는 주요 요인입니다. ZyCoV-D는 현재 인도 내 긴급사용만 승인된 상태로, 현재 인도 외 백신사용이 불가한 상황임으로, 당사의 위탁생산 사업은 인도 내 코로나19 접종현황에 따라 크게 영향 받을 것으로 판단됩니다. 인도 내 코로나 확진자 수는 2021년 3월 중순 이후 코로나19 신규 감염자 수가 폭발적으로 증가하면서, 인도는 2차 대유행에 진입하였습니다. 그러나 인도 정부의 확산방지 정책 등에 힘입어 2021년 5월 이후 인도 내 일일 확진자 수 및 사망자수는 감소하고 있는 것으로 파악되고 있어, 현재 인도는 코로나19의 2차 대유행 정점을 지나 안정화 추세로 진입한 것으로 판단됩니다. 현재 인도 정부의 적극적인 코로나19 백신 접종 진행으로 2021년 9월 말 기준 총 접종 횟수는 8.8억 회, 최종 접종 완료된 횟수는 2.34억 회, 접종완료 인구 비율은 17.0%로 추산하고 있습니다. 현재 인도 정부는 접종완료 인구 비율을 확대하기 위해 백신 확보에 총력을 다하고 있는 상황으로, 본 배경에 따른 인도 내 적극적인 백신 개발 추세는 ZyCoV-D의 인도 내 경쟁력은 향후 인도 내 코로나 19 백신의 지속적인 개발에 기술력이 우수한 백신이 추가로 개발될 가능성도 존재한다는 것을 의미합니다. 이에 따라 인도시장 내 제품경쟁력이 저하될 가능성도 존재합니다. 글로벌 DNA백신 시장의 경우, DNA백신은 현재 대부분 임상 또는 비임상 단계에 있어 전 세계 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. 종합적으로, 당사가 위탁생산하고자 하는 자이더스 카딜라(Zydus Cadila)의 자이코브-디(ZyCoV-D)가 세계 첫 DNA 기반 코로나19 백신이 긴급사용 승인받은 바 외엔 아직까지 제품화 사례가 충분히 없어 향후 성공가능성은 매우 불확실합니다. 이에 계속적인 비용과 시간이 소모될 것으로 예상되며 이는 당사에 치명적인 타격이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다. |
Zydus Cadila가 개발한 ZyCoV-D는 세계 최초의 DNA 기반 코로나 19 백신으로, 긴급사용이 승인된 주요 배경으로는 인도 자국 내 임상 3상 중간 결과가 발표되었기 때문입니다. Zydus Cadila 측에서는 본 임상 3상 결과 중에서 ZyCoV-D가 변이 바이러스, 특히 전염성이 높은 델타 변종에 대한 효능이 있는 것으로 판단하고 있습니다.
| [ZyCoV-D의 임상 3상 중간결과] |
| - 약 2만 8천명(12세~18세 1,000명 포함) 대상 50개 이상의 병원에서 임상 진행 - 피내 접종(intradermal), 4주 간격 3회 접종 스케줄 - 3회 접종 후 모든 유증상 감염에 대하여 예방 효능 66.6% |
| (출처: Zydus Cadila) |
미국의 화이자와 모더나 백신이 바이러스의 유전정보가 담긴 '메신저 리보핵산(mRNA)'를 활용한 백신이라면, ZyCoV-D는 '플라스미드-DNA(pDNA)'를 활용한 백신입니다. 특히, RNA백신은 세포질에 도달하면 되는 반면, DNA백신의 경우 세포핵까지 도달하여야 하는 어려움으로 인해 강력한 면역반응 유도에 어려움이 있는 반면, 기존 백신들에 비해 효과적이고 부작용이 적다는 장점이 있습니다.
세포핵까지 도달하는 어려움을 해결하기 위해 ZyCoV-D는 체내 주입 시 주사바늘이 아닌 고속분사 주사시스템을 일회용 인젝터를 통해 피부 속으로 투여되는 특징이 있습니다. 이 외, ZyCoV-D의 주요 특징은 아래와 같습니다.
| [자이코브-디(ZycoV-D)의 주요 특징] |
| - LNP제형(mRNA가 안정화되고 캡슐화되어 세포 내로의 흡수를 촉진하고 세포 외 분해를 방지하기 위해 다양한 지질 성분으로 구성된 전달 제형으로서 보조제 활성을 가질 수 있음)이 필요하지 않음. - 4℃ 보관조건, 25℃에서도 3개월 보관 가능 - 간단하고 빠른 제조공정 - 12세 이상 18세 미만 청소년에게도 접종 가능 |
| [주요 코로나19 백신 개발현황] |
| 백신 | 타입 | 효능 | 용량 | dose | 보관조건 | WHO PQ | 등록국가 수 | 접종연령 |
|---|---|---|---|---|---|---|---|---|
| 화이자/바이오엔테크 | mRNA | 95% | 0.3ml | 2 | -25℃ ~ -15℃ | O | 83 | 12세 이상 |
| 모더나 | mRNA | 94% | 0.5ml | 2 | -25℃ ~ -15℃ | O | 46 | 16세 이상 |
| 아스트라제네카 | Viral | 76% | 0.5ml | 2 | 2℃ ~ 8℃ | O | 92 | 18세 이상 |
| 얀센 | Viral | 70% | 0.5ml | 1 | 2℃ ~ 8℃ | O | 41 | 18세 이상 |
| 스푸트니크 V | Viral | 91% | 0.5ml | 2 | 2℃ ~ 8℃ | X | 63 | 18세 이상 |
| 시노벡 | Inactivated | 50% | 0.5ml | 2 | 2℃ ~ 8℃ | O | 22 | 18세 이상 |
| 시노팜 | Inactivated | 78% | 0.5ml | 2 | 2℃ ~ 8℃ | O | 35 | 18세 이상 |
| 자이코브-디 | pDNA | 67% | 0.2ml | 3 | 2℃ ~ 8℃ | X | 1 | 12세 이상 |
| (출처: 당사 제시) 주1) Viral: 바이러스 벡터 백신 주2) Inactivated: 비활성화 백신(사백신; 死vaccine, killed vaccine) 주3) WHO PQ(Pre-qualification): WHO 품질인증. 개발도상국에 백신 등 의약품을 공급하기 위해 안전성·유효성 등을 평가하는 제도 |
다만, ZyCoV-D의 경우 백신의 효능이 ZyCoV-D의 경우 돌파감염율이 높은 델타변이가 유행한 시점에 대한 임상결과임을 감안해야 하나, 접종자의 66.6%에서 증상성 질환을 예방할 수 있다는 결과로 여타 코로나19 백신보다는 비교적 효능이 낮은 수치입니다. 또한, 한달 간격으로 3회 접종을 해야되는 등 여타 코로나 백신에 비해 상대적으로 부각될 수 있는 단점들이 존재하는 상황입니다. 이는 향후 당사의 LOI체결에 따른 주요 위탁생산 및 라이선스 매입 대상인 ZyCoV-D에 대해서 향후 백신의 시장성에 대해서 불확실성이 상존하는 주요 요인입니다.
특히, 현재 인도 내 긴급사용만 승인된 상태로, 현재 인도 외 백신사용이 불가한 상황임으로, 당사의 위탁생산 사업은 인도 내 코로나19 접종현황에 따라 크게 영향을 받을 것으로 판단됩니다.
인도 내 코로나 확진자 수는 2021년 3월 중순 이후 코로나19 신규 감염자 수가 폭발적으로 증가하면서, 인도는 2차 대유행에 진입하였습니다. 인도는 대유행 진입 이후 2021년 09월 30일까지 최대 일일 신규확진자 수는 약 478,506명과 일일 사망자 수는 4,699명을 기록하였습니다.
| [인도 내 코로나 확진자 현황(2021.09.30, 일별기준)] |
 |
|
사업위험 바. 인도 코로나 확진자 현황(일별기준) |
| (출처: coronaboard) |
| [인도 내 코로나 사망자 현황(2021.09.30, 일별기준)] |
 |
|
사업위험 바. 인도 코로나 사망자 현황(일별기준) |
| (출처: coronaboard) |
인도 현지 연구자들은 최근 급속한 코로나19 확산의 원인으로 이중변이 바이러스를 지목하고 있으며, 2020년 말 처음 학회에 보고된 인도발 변이 바이러스(델타 변이) 'B.1.617'은 기존 바이러스 대비 약 20% 높은 전파력을 가지고 있으며, 항체 효능을 50% 이상 감소시키는 것으로 밝히고 있습니다. 이는 특히 젊은 층에서 이중변이 바이러스가 빠르게 전파되고 있는데, 4월까지 45세 이하는 백신을 맞을 수 없었기 때문에 젊은 층의 감염 위험이 더 커졌다는 주장이 제기되고 있는 상황입니다.
인도의 중앙정부와 지방의 주정부는 2차 대유행에 진입함에 따라, 각각 긴급명령 및 봉쇄조치 등을 시행하는 한편, 지속적인 백신 접종을 통해 코로나19 재확산에 대응하고 있으며, 중앙정부는 백신과 치료제의 국외 반출을 제한하고, 의료용 산소를 비롯한 관련 장비의 확보를 위해 긴급 명령을 내리는 등의 조치를 시행하였습니다. 이러한 정책 등에 따라 2021년 5월 이후 인도 내 일일 확진자 수 및 사망자수는 감소하고 있는 것으로 파악되고 있으며, 2021년 09월 30일 누적기준으로는 확진자 수가 약 3,376만명, 사망자 수는 약 45만명을 기록하고 있습니다.
| [인도 내 코로나 확진자 현황(2021.09.30, 누적기준)] |
 |
|
사업위험 바. 인도 코로나 확진자 현황(누적기준) |
| (출처: coronaboard) |
| [인도 내 코로나 사망자 현황(2021.09.30, 누적기준)] |
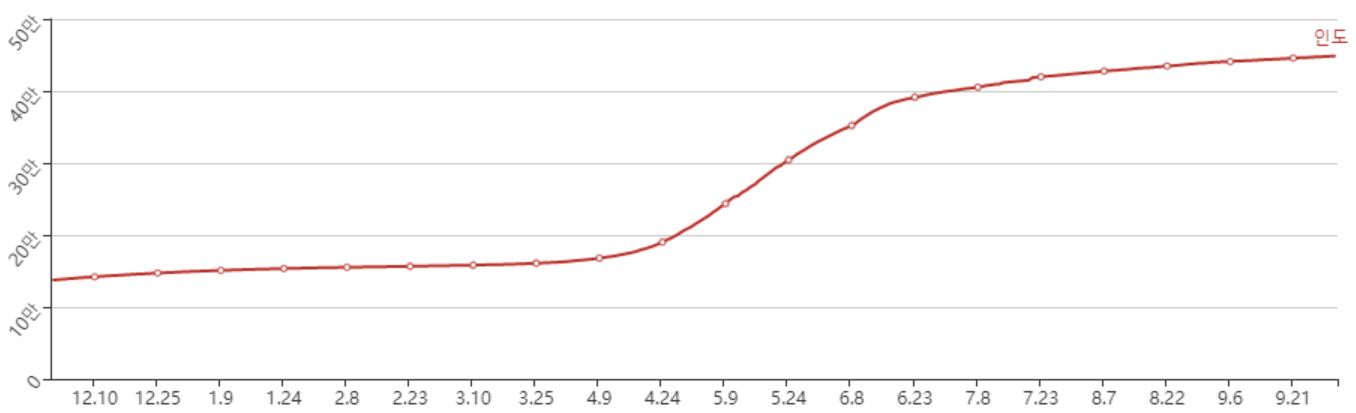 |
|
사업위험 바. 인도 코로나 사망자 현황(누적기준) |
| (출처: coronaboard) |
현재 인도는 코로나19의 2차 대유행 정점을 지나 안정화 추세로 진입한 것으로 판단됩니다. 현재 인도 정부의 적극적인 코로나19 백신 접종 진행으로 2021년 9월 말 기준 총 접종 횟수는 8.8억 회, 최종 접종 완료된 횟수는 2.34억 회, 접종완료 인구 비율은 17.0%로 추산하고 있습니다(출처: Our World in Data). 이에 인도 정부는 접종완료 인구 비율을 확대하기 위해 백신 확보에 총력을 다하고 있는 상황입니다.
상기와 같은 상황에 따라, 세계에서 가장 큰 백신 제조 능력을 보유하고 있어 '세계의 약국'으로 불리는 인도는 주요 코로나19백신 개발 제약사들과 협력하여 코로나19 백신 생산에 집중하고 있습니다. 전 세계 복제약 생산의 약 20%, 그리고 전 세계 백신의 62%를 생산하고 있는 인도에서는 현재 총 30여 개의 코로나19 백신이 개발 및 제조되고 있으며, 각 백신별로 다른 임상시험 단계에 있는 상황입니다.
코로나19 사태가 터지자 세계 최대 백신 제조사인 인도 세럼연구소(Serum Institute of India, 이하 SII)는 영국의 아스트라제네카 및 옥스퍼드대학(Oxford University)과 백신 위탁생산 계약을 맺고, 2020년 4월부터 코로나19 백신 대량생산 준비를 시작하고 있는 상황입니다. 이는 백신 개발 및 승인이 끝나기도 전에 4억 5,000만 달러를 투자하여 백신 생산기간을 대폭 줄이려 한 SII의 선제적 결정입니다. 인도 의학연구협의회(Indian Council of Medical Research, 이하 ICMR)는 코비실드 백신 개발 과정에 공동으로 참여해 백신에 대한 2상·3상 임상시험을 인도의 15개 센터에서 진행하였습니다.
한편 인도 제약업체인 바라트 바이오테크(Bharat Biotech)도 인도의 첫 자체개발 백신인 코백신(Covaxin) 개발에 성공하였습니다. 인도정부는 1월 2일 SII의 코비실드와 바라트 바이오테크의 코백신에 대한 긴급 사용승인을 함.코백신은 아직 3상 임상시험이 완료된 것은 아니나, 현재 변이 바이러스 유행 등의 심각한 상황을 고려해 인도정부는 백신의 긴급 사용을 승인함과 동시에 3상 시험도 계속하기로 하였습니다.그러나 코백신의 3상 임상시험이 진행 중인 데다, 예방효과마저 공개되지 않아 인도 당국이 졸속 승인했다는 지적이 제기되고 있습니다. 긴급 사용이 승인된 두 백신 이외에도 임상시험 단계에 있는 여러 백신이 있어 향후 인도는 백신 강국으로 성장할 가능성이 클 것으로 판단하고 있습니다.
자이더스 카딜라(Zydus Cadila)의 경우, ZyCoV-D는 DNA 백신으로 세 차례의 접종을 완료해야 하며, Zydus Cadila는 1억 2,000만 도스의 물량을제조하기 위해 공장 건설을 계획하고 있는 것으로 확인되고 있습니다.
또한 바라트 바이오테크가 비강 내에 투여할 수 있는 백신 개발에 성공한다면, 기존의 다른 백신들보다 운송이 쉽고 접종 접근성이 높아진다는 장점이 존재하는 상황입니다. 현재 인도 내 대표 백신의 제조 현황은 하기와 같습니다.
| [인도의 대표 백신 제조 현황] |
| 백신 개발사 | 인도 제조사 | 백신명 | 타입 | 개발 단계 | 접종 횟수(간격) |
|---|---|---|---|---|---|
| Oxford University-AstraZeneca(UK) | SII | Covishield | Viral Vector | 긴급사용승인 | 2번(0일, 28일) |
| Bharat Biotech | Bharat Biotech | Covaxin | RNA | 긴급사용승인 | 2번(0일, 28일) |
| Zydus Cadila | Zydus Cadila | ZyCov-D | DNA | 긴급사용승인 | 3번(0일, 28일, 56일) |
| Bharat Biotech | Bharat Biotech | BBV154 | Intranasal | 1상 | 2번 |
| Gamaleya National Center(Russia) | Dr Reddy's Lab | Sputnik V | DNA | 3상 | 2번 |
| Dynavax .Baylor College of Medicine(US) | Biological E | - | Protein Subunit | 2상 | 2번 |
| Novavax(US) | SII | NVX.CoV2373 | Protein Subunit | 2상 | 2번 |
| HDT Biotech(US) | Gennova | HGCO19 | mRNA | 1상 | 2번 |
| SpyBiotech(UK) | SII | - | VLP | 1상 | 2번 |
| (출처: KIEP 세계경제 포커스(21.03.08)) 주1) 상기 현황은 세계경제 포커스 자료 중 당사가 Zydus Cadila 현황에 맞춰 일부 가공한 것으로, 각 백신 개발사별로 일부 현황 변동이 발생할 수 있습니다. |
ZyCoV-D의 인도 내 경쟁력은 향후 인도 내 코로나 19 백신의 지속적인 개발에 기술력이 우수한 백신이 추가로 개발될 가능성도 존재하며, 이에 따라 인도시장 내 제품경쟁력이 저하될 가능성도 존재합니다. 투자자여러분께서는 인도 내 코로나19 백신 개발 현황을 반드시 파악하여 주시기 바랍니다.
또한, 글로벌 DNA백신 시장의 경우, DNA백신은 현재 대부분 임상 또는 비임상 단계에 있어 전 세계 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. Markets (2021년 09월, BCC Research사 발행)'에 의하면, DNA백신이 기존 백신들 대비 효과적이고 부작용이 적은 특성으로 말미암아, 2021년 기준 31억달러의 시장을 형성하였으며, 2026년까지 115억달러 규모의 시장과 2021년부터 2026년까지 연평균 성장률(CAGR) 30.2%를 전망하였습니다.
핵산기반 치료제 시장은 주로 유전질환과 유전적 장애를 대상으로 하는 치료제로 개발이 되고 있으며, 기존 치료제들이 치료효능이 거의 없거나 크지 않기 때문에 혁신의약품으로 평가를 받고 있습니다. 'Global Nucleic Acid Therapeutics Market 2020-2024 (2020년 10월, Research And Markets사 발행)' 보고서에 의하면, 2024년말까지 전세계 핵산기반 치료제의 시장은 72억달러 규모의 시장과 2020년부터 2022년까지의 연평균 성장률(CAGR) 33.3%를 전망하고 있습니다.
하지만, 연구개발 중인 DNA백신은 현재 대부분 임상 또는 비임상 단계에 있어 가시적인 시장의 규모와 적정한 경쟁력의 정도를 합리적으로 측정하는 것이 어려운 산업이라는 문제점을 포함하고 있습니다. 특히, 상기 ZyCoV-D는 긴급사용승인에 따라 제품화에 성공하였음에도 불구하고, 시장 경쟁력 결여 등의 이유로 수익 창출에 실패할 가능성도 있습니다. 또한, 시판 과정에서 예상치 못한 부작용의 발견, 경쟁 제품 대비 약효 저하 등으로 인해 시판 후에라도 수익 창출에 실패할 가능성도 상존하고 있습니다.
종합적으로, 당사가 위탁생산하고자 하는 자이더스 카딜라(Zydus Cadila)의 자이코브-디(ZyCoV-D)가 세계 첫 DNA 기반 코로나19 백신이 긴급사용 승인받은 바 외엔 아직까지 제품화 사례가 충분히 없어 향후 성공가능성은 매우 불확실합니다. 이에 계속적인 비용과 시간이 소모될 것으로 예상되며 이는 당사에 치명적인 타격이 발생할 수 있으니 투자자께서는 이 점 유의하시기 바랍니다.
[원료의약품(API) 시장에 따른 위험]
| 사. 전 세계 원료의약품(API) 시장은 2020년 1,871억 4,000만 달러에서 연평균 성장률 6.10%로 증가하여, 2025년에는 2,516억 7,000만 달러에 이를 것으로 전망하고 있습니다.국내의 경우, 식품의약품안전처에 따르면 2019년 원료의약품 생산 업체는 총 263개사로 원료의약품 시장은 시장규모 대비 과다한 업체의 시장 참여로 공급 과잉 상태 및 높은 경쟁 강도가 지속되고 있습니다. 원료의약품의 국내 자급도는 2015년 24.5%에서 2017년까지 35.4%까지 상승하였으나, 2018년 26.4%, 2019년 16.2%를 기록하며 하락하는 추세를 보이고 있습니다. 원료의약품 자급도는 2019년에는 20%에도 못 미치는 등 여전히 수입의존도가 높은 편으로 나타났습니다. 원료자급도가 낮은 이유는 국내 원료 생산이 품질측면에서는 유럽산에 비해 경쟁력이 부족하고, 가격 측면에서는 인도나 중국산에 비해 경쟁력이 취약한 것에 기인합니다. 그럼에도 불구하고 당사의 경우, 당사의 원료의약품 주요 매출처는 대부분 국내업체로, 2021년 3분기 매출액 기준 국내 매출이 총 매출액의 98.9%를 차지하고 있습니다. 또한, 국내에서는 2012년 부터 시행하고 있는 보험약가 인하정책에 따라 현재까지 완제 제약회사들은 제조원가 비용을 낮추기 위해 해외 저가 원료를 선택하는 추세입니다. 이에 따라 국내 원료의약품 업체들은 실적 부진에 따른 R&D 투자 여력 부진으로 점차 원가경쟁력을 상실하게 되는 악순환이 발생되고 있습니다. 이는 현재 국내 원료의약품의 경쟁력이 하락 추세인 상황을 감안한다면 당사의 원료의약품 사업에 악영향을 끼칠 수 있습니다. |
| [당사 품목별 매출 추이] |
| (단위: 백만원) |
| 구분 | 품목 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 작용기전 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | |||
| 세파계 API |
항생제1 | 644 | 3.91% | 1,108 | 4.29% | 1,421 | 4.52% | 1,705 | 5.49% | 패혈증, 폐렴 |
| 항생제2 | 29 | 0.18% | 211 | 0.82% | 138 | 0.44% | 781 | 2.52% | 폐렴, 자궁내감염등 | |
| 기타 | 125 | 0.76% | 107 | 0.41% | 893 | 2.84% | 872 | 2.81% | - | |
| 소계 | 798 | 4.85% | 1,426 | 5.52% | 2,452 | 7.80% | 3,358 | 10.82% | - | |
| 일반계 API |
항결핵제 | 245 | 1.49% | 324 | 1.25% | 2,524 | 8.02% | 5,143 | 16.57% | - |
| 진해 거담제 | 774 | 4.70% | 4,277 | 16.57% | 4,841 | 15.39% | 6,040 | 19.46% | - | |
| 소염 진통제 | 1,441 | 8.74% | 2,472 | 9.57% | 2,417 | 7.68% | 1,922 | 6.19% | - | |
| 항응고제 | 4,009 | 24.32% | 5,149 | 19.94% | 5,150 | 16.36% | 4,226 | 13.62% | - | |
| 위궤양치료제 | 1,495 | 9.07% | 1,755 | 6.80% | 2,162 | 6.87% | 1,553 | 5.00% | - | |
| 기타 | 5,960 | 36.15% | 8,807 | 34.12% | 10,182 | 32.35% | 5,736 | 18.49% | - | |
| 소계 | 13,924 | 84.47% | 22,784 | 88.25% | 27,276 | 86.67% | 24,620 | 79.33% | - | |
| 기타 | 1,763 | 10.68% | 1,608 | 6.23% | 1,741 | 5.53% | 3,056 | 9.85% | 상품, 임가공 등 | |
| 합계 | 16,485 | 100.00% | 25,818 | 100.00% | 31,469 | 100.00% | 31,034 | 100.00% | - | |
| (출처: 당사 정기보고서) |
원료의약품(API)은 혁신신약 분야에 속하는 기술로, 의약품 제조에 사용되는 물질 또는 물질의 혼합물로써 정의하며, 이러한 물질은 질병의 진단, 치료, 완화, 예방에 약리학적 활성 또는 다른 직접적인 효과를 제공하거나 신체의 구조 및 기능에 영향을 주기 위한 것입니다. 당사는 연구개발 중심의 벤처기업임에 따라 신약을 개발함과 동시에 원료의약품 사업을 통해 매출을 창출하고 있으며, 당사의 원료의약품 기술은 세파항생제 합성기술, 비세파 원료합성기술과 MRI & CT조영제 합성기술로 구분할 수 있으며, 이와 관련한 제품은 약 40여종이 있습니다.
원료의약품(API) 시장은 주로 의약품 연구개발(R&D) 증가, 만성질환 발생률 증가, 제네릭 원료의약품의 중요성 증대, 바이오의약품의 활용도 증가 등에 의존하고 있습니다. 한편, 여러 국가의 불합리한 약품 가격 통제 정책과 높은 제조 비용이원료의약품(API) 시장의 성장을 억제할 것으로 예상되고 있습니다.
| [글로벌 원료의약품 시장의 원동력] |
| 구분 | 주요 내용 |
|---|---|
| 성장 촉진요인 | ·만성질환 발생률 증가 ·원료의약품 제조기술 ·제네릭 원료의약품의 중요성 증대 ·바이오의약품의 활용도 증가 ·신약 개발을 위한 인공지능(AI) 기반 툴의 채택 증가 ·신약 개발에서 장기 칩(organ-on-chip) 모델 채택 ·정밀의학 중점 ·제약사 실증 투자 |
| 성장 억제요인 | ·불합리한 약품 가격 통제 정책 ·높은 제조 비용 |
| 시장 기회 | ·신흥 바이오시밀러 시장 ·효력이 높은 활성 의약품 성분 ·신흥시장 ·신흥 기술 |
| 해결해야 할 과제 | ·허위 약품의 보급률 증가 |
| (출처: MarketsandMarkets, Active Pharmaceutical Ingredient (API) Market, 2020) |
현재 전 세계 원료의약품(API) 시장은 2020년 1,871억 4,000만 달러에서 연평균 성장률 6.10%로 증가하여, 2025년에는 2,516억 7,000만 달러에 이를 것으로 전망하고 있습니다.
| [글로벌 원료의약품(API) 시장 규모 및 전망] |
 |
|
사업위험 사. 전 세계 원료의약품(api) 시장 규모 |
| (출처 : TechNavio, Global Active Pharmaceutical Ingredients Market, 2021) |
또한, 전 세계 원료의약품(API) 시장은 유형에 따라 혁신 원료의약품, 제네릭 원료의약품으로 분류되고 있습니다. 혁신 원료의약품은 2020년 1,333억 달러에서 연평균 성장률 5.2%로 증가하여 2025년에는 1,721억 달러에 이를 것으로 전망하고 있으며, 제네릭 원료의약품은 2020년 540억 달러에서 연평균 성장률 7.1%로 증가하여 2025년에는 762억 달러에 이를 것으로 전망하고 있습니다.
| [글로벌 원료의약품(API) 시장의 유형별 시장 규모 및 전망] |
 |
|
사업위험. 사. 원료의약품(api) 시장의 유형별 시장 규모 및 전망 |
| (출처 : MarketsandMarkets, Active Pharmaceutical Ingredient (API) Market, 2020) |
국내의 경우, 식품의약품안전처에 따르면 2019년 원료의약품 생산 업체는 총 263개사로 원료의약품 시장은 시장규모 대비 과다한 업체의 시장 참여로 공급 과잉 상태 및 높은 경쟁 강도가 지속되고 있습니다. 이는 국내 제약 산업이 일정 수준의 수익성 확보가 가능한 가운데 설비투자 부담이 타 산업에 비해 크지 않으며, 제네릭 의약품의 경우 연구개발비 부담도 크지 않아 진입장벽이 높지 않은 데 기인하는 것으로 판단됩니다.
| [원료 의약품 생산 규모별 업체수 및 생산액] |
| (단위: 개소, 백만원) |
|
생산규모별 |
2019년 | 2018년 | 2017년 | 2016년 | 2015년 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 업체수 | 생산액 | 업체수 | 생산액 | 업체수 | 생산액 | 업체수 | 생산액 | 업체수 | 생산액 | |
|
1억 미만 |
37 | 1,130 | 25 | 360 | 78 | 1,286 | 23 | 798 | 26 | 955 |
|
1~5억 |
50 | 13,119 | 46 | 2,151 | 33 | 11,909 | 42 | 11,055 | 45 | 11,659 |
|
5~10억 |
33 | 25,434 | 45 | 6,674 | 13 | 24,016 | 44 | 34,708 | 39 | 30,900 |
|
10~50억 |
76 | 182,927 | 63 | 73,457 | 46 | 174,880 | 67 | 159,481 | 69 | 185,668 |
|
50~100억 |
21 | 148,750 | 21 | 105,699 | 13 | 98,807 | 30 | 211,579 | 18 | 119,718 |
|
100~500억 |
35 | 889,443 | 33 | 808,824 | 40 | 921,642 | 29 | 702,550 | 37 | 884,587 |
|
500~1000억 |
8 | 590,893 | 5 | 344,973 | 2 | 132,943 | 6 | 398,467 | 3 | 229,810 |
|
1000억 이상 |
3 | 618,951 | 4 | 1,219,501 | 6 | 1,441,526 | 5 | 955,088 | 4 | 650,294 |
|
합 계 |
263 | 2,470,647 | 242 | 2,561,639 | 231 | 2,807,009 | 246 | 2,473,726 | 241 | 2,113,591 |
| (출처 : 국가통계포털, 식품의약품안전처(원료 의약품 생산 규모별 업체수 및 생산액)) |
원료의약품은 정밀화학 산업분야 중 비중이 큰 분야로서 기술집약형 고부가가치 산업입니다. 국내 제약사들의 원료합성에 대한 새로운 공정 및 기술 개발이 활성화되면서 원료의약품의 국산화에 상당한 노력을 기울이고 있으며, 원료의약품 GMP도입은 품질의 향상을 통한 해외시장 진출에 긍정적 요소로 평가되고 있습니다. 그러나 여전히 국내 제약업계는 주요 생산원료의 조달을 주로 외국의 제약회사와 기술 도입선에 의존하고 있어 원료 자급도가 매우 낮은 편입니다.
| [원료의약품 국내 자급도 현황] |
| (단위: 백만원) |
| 항목 | 2019년 | 2018년 | 2017년 | 2016년 | 2015년 |
|---|---|---|---|---|---|
| 생산액 | 2,470,647 | 2,561,639 | 2,807,010 | 2,473,726 | 2,113,591 |
| 수출액 | 1,981,471 | 1,746,824 | 1,666,629 | 1,635,101 | 1,449,925 |
| 수입액 | 2,530,142 | 2,267,225 | 2,081,393 | 2,195,686 | 2,040,126 |
| 국내자급도 (%) | 16.2 | 26.4 | 35.4 | 27.6 | 24.5 |
| 자료 : 국가통계포털, 식품의약품안전처 원료의약품 국내 자급도 현황 |
| 주) 자급도 = (생산-수출)/(생산-수출+수입) |
원료의약품의 국내 자급도는 2015년 24.5%에서 2017년까지 35.4%까지 상승하였으나, 2018년 26.4%, 2019년 16.2%를 기록하며 하락하는 추세를 보이고 있습니다. 원료의약품 자급도는 2019년에는 20%에도 못 미치는 등 여전히 수입의존도가 높은 편으로 나타났습니다. 원료자급도가 낮은 이유는 국내 원료 생산이 품질측면에서는 유럽산에 비해 경쟁력이 부족하고, 가격 측면에서는 인도나 중국산에 비해 경쟁력이 취약한 것에 기인합니다.
그럼에도 불구하고 당사의 경우, 당사의 원료의약품 주요 매출처는 대부분 국내업체로, 2021년 3분기 매출액 기준 국내 매출이 총 매출액의 98.98%를 차지하고 있습니다. 이는 현재 국내 원료의약품의 경쟁력이 하락 추세인 상황을 감안한다면 당사의 원료의약품 사업에 악영향을 끼칠 수 있습니다.
| [당사의 국가별 매출 실적 추이] |
| (단위: 백만원) |
| 매출유형 | 부 문 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | 매출액 | 비중 | |||
| 제품 | 원료 의약품 |
수출 | 35 | 0.21% | 1,921 | 7.4% | 3,050 | 9.7% | 5,497 | 17.7% |
| 내수 | 16,150 | 97.97% | 23,179 | 89.8% | 27,124 | 86.2% | 23,085 | 74.4% | ||
| 소계 | 16,185 | 98.18% | 25,099 | 97.2% | 30,174 | 95.9% | 28,582 | 92.1% | ||
| 상품 | 원료 의약품 외 |
수출 | 131 | 0.80% | 168 | 0.6% | 27 | 0.1% | - | |
| 내수 | 168 | 1.02% | 243 | 0.9% | 1,239 | 3.9% | 1,849 | 6.0% | ||
| 소계 | 299 | 1.81% | 411 | 1.6% | 1,267 | 4.0% | 1,849 | 6.0% | ||
| 기타 | 임가공 외 | 수출 | 3 | 0.02% | 8 | 0.0% | 21 | 0.1% | 3 | 0.0% |
| 내수 | (2) | -0.01% | 300 | 1.2% | 7 | 0.0% | 600 | 1.9% | ||
| 소계 | 1 | 0.01% | 308 | 1.2% | 28 | 0.1% | 603 | 1.9% | ||
| 합계 | 수출 | 169 | 1.02% | 2,096 | 8.1% | 3,098 | 9.8% | 5,500 | 17.7% | |
| 내수 | 16,316 | 98.98% | 23,722 | 91.9% | 28,370 | 90.2% | 25,534 | 82.3% | ||
| 합계 | 16,485 | 100.00% | 25,818 | 100.0% | 31,469 | 100.0% | 31,034 | 100.0% | ||
| (출처: 당사 제시) 주1) 상기 비중은 총 매출액 기준임. |
또한, 국내에서는 2012년 부터 시행하고 있는 보험약가 인하정책에 따라 현재까지 완제 제약회사들은 제조원가 비용을 낮추기 위해 해외 저가 원료를 선택하는 추세입니다. 이에 따라 국내 원료의약품 업체들은 실적 부진에 따른 R&D 투자 여력 부진으로 점차 원가경쟁력을 상실하게 되는 악순환이 발생되고 있습니다.
| [원료의약품(API) 제조 전문업체 매출원가율 추이(2018~2021년 3분기)] |
| (단위: 백만원, %) |
| 구분 | 당사 | 하이텍팜 | KPX생명과학 | 화일약품 | |
|---|---|---|---|---|---|
| 2021년 3분기 | 매출액 |
16,485 |
61,644 | 17,424 | 76,010 |
| 매출원가 |
16,216 |
57,824 | 18,734 | 68,438 | |
| 매출원가율 | 98.4% | 93.8% | 107.5% | 90.0% | |
| 매출원가율 평균 | 97.4% | ||||
| 2020년 | 매출액 | 25,818 | 74,462 | 24,561 | 123,613 |
| 매출원가 | 23,999 | 73,148 | 24,635 | 108,579 | |
| 매출원가율 | 93.0% | 98.2% | 100.3% | 87.8% | |
| 매출원가율 평균 |
94.8% | ||||
| 2019년 | 매출액 | 31,469 | 63,068 | 37,618 | 108,745 |
| 매출원가 | 28,804 | 65,184 | 34,586 | 94,265 | |
| 매출원가율 | 91.5% | 103.4% | 91.9% | 86.7% | |
| 매출원가율 평균 |
93.4% | ||||
| 2018년 | 매출액 | 31,034 | 66,388 | 32,754 | 102,073 |
| 매출원가 | 26,769 | 61,677 | 32,683 | 86,874 | |
| 매출원가율 | 86.3% | 92.9% | 99.8% | 85.1% | |
| 매출원가율 평균 |
91.0% | ||||
| (출처: 당사 제시) 주1) 당사의 경우, 상기 매출액 및 매출원가에 기타 매출이 포함되어 있음. 주2) 상기 비교 업체는 원료의약품(API) 제조 전문 업체 위주로 선정하였음. |
당사를 비롯하여 주요 원료의약품 전문 업체들의 원가율이 높아지고 있는 상황으로, 2018년 원료의약품(API) 전문업체 매출원가율 평균 91.0%에서 2021년 3분기 기준 평균 97.4%까지 증가하는 등 지속적으로 업황이 악화되는 모습을 보이고 있습니다. 이는 향후에 당사가 원가경쟁력 확보전략이 부재하거나, 공급량이 확대되지 않아 매출액이 증가하지 않는다면 지속적으로 사업이 개선되지 못할 가능성이 높은 상황입니다.
종합적으로, 당사의 주요 수익은 현재 원료의약품 및 기타 매출에서만 발생하며, 현재까지는 원료의약품의 국내 업체 경쟁력이 해외 업체보다 취약한 상황입니다. 이에 따라 당사의 원료의약품의 경쟁력을 갖추기 위해서는 지속적인 기술 개발 등이 필요하며, 개발에 따른 추가적인 지출에 따라 수익성이 지속적으로 악화될 가능성도 존재합니다. 투자자여러분께서는 원료의약품의 시장현황 및 국내 경쟁현황을 충분히 숙지하시고 투자에 임해주시기 바랍니다.
[CMO 사업 부문과 관련된 위험]
| 아. 당사는 '사업위험 마'에서 언급하였듯이, 현재 당사는 ZyCoV-D의 위탁 생산을 진행할 가능성이 높은 상황입니다. 또한 당사는 ZyCoV-D의 백신 원천 기술을 이전 받아, 제품을 생산하거나 또는 추가 공정을 개발해 전세계에 백신을 공급하는 역할을 할 예정입니다. 다만 당사가 예상하지 못한 외부 변수에 의하여 동 계약에 대한 조건의 변경, 추가 연장 계약의 실패 및 극단적으로 동 계약의 불이행 또는 파기가 이루어지는 경우에는 당사의 예상 실적에 부정적인 영향이 발생할 수 있습니다. 또한 CMO 사업의 특성상 당사의 제품 생산량은 고객사의 제품 판매량에 영향을 받습니다. 고객 제품에 대한 안전성이나 유효성 문제 발생, 판매 부진 등의 경우 당사의 실적은 예상치를 하회할 가능성이 있습니다. CMO 사업의 특성 및 계약의 조건 상 계약 체결 시 계약의 중도 해지에 대한 가능성은 제한적이지만, 고객사 및 당사의 대내/대외 변수로 인한 계약해지 가능성을 배제할 수 없으며, 이 경우 당사 매출 및 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하여 주시기 바랍니다 |
당사는 '사업위험 마'에서 언급하였듯이, 현재 당사는 ZyCoV-D의 위탁 생산을 진행할 가능성이 높은 상황입니다. 또한 당사는 ZyCoV-D의 백신 원천 기술을 이전 받아, 제품을 생산하거나 또는 추가 공정을 개발해 전세계에 백신을 공급하는 역할을 할 예정입니다.
다만 당사가 예상하지 못한 외부 변수에 의하여 동 계약에 대한 조건의 변경, 추가 연장 계약의 실패 및 극단적으로 동 계약의 불이행 또는 파기가 이루어지는 경우에는 당사의 예상 실적에 부정적인 영향이 발생할 수 있습니다.
이와 같이 계약의 상대방에 따른 리스크가 존재하는 상황인 바, 체결예정이거나 혹은 체결된 계약에서 변동이 발생할 수 있는 주요 사유를 정리하자면 다음과 같습니다.
1) 물량 또는 가격의 변동
기 계약된 물량 또는 가격의 변동이 발생할 가능성이 존재하며, 이 경우 양 당사자의 서면 합의가 필요하기 때문에 하향 조정의 시현가능성은 낮은 상황이나 글로벌 수요의 감소 내지는 생산 위탁자의 불가피한 사정으로 인하여 대금을 지불할수 없는 등의 문제로 인하여 동 리스크는 완벽하게 배제할 수 없습니다.
2) 품질에 대한 이슈 발생(제품의 하자)
생산 위탁자와 합의한 사양 내지 품질 등을 만족하지 못할 경우에는 계약 당사자 일방의 귀책사유 또는 과실 여부를 판단하여야 합니다. 당사의 귀책, 고의, 중과실이 존재하는 경우에는 기 반영이 이루어진 실적이 차감(기 수령 대금의 환불)될 가능성이 있으며, 당사의 귀책, 고의, 중과실이 아닌 경우라도 이에 대한 판단이 이루어지기 까지 당사 실적에의 반영 시기가 지연될 가능성이 있습니다.
3) 계약 종료에 따른 위험
COVID-19의 조기 종식, 경쟁사 출현 등의 사유로 인하여 추가 연장 계약이 이루어지지 않을 경우, 당사의 예상 실적이 하향 조정될 가능성이 있으며, 실적의 발생 기간이 축소될 위험도 존재합니다.
4) 기타 사항
생산 위탁자의 허가 없이 하도급 또는 권리를 양도하는 등의 사유가 발생하거나, 비밀유지 의무 등을 위반할 경우에는 계약이 파기될 위험도 존재하며, 이와는 별도로 손해배상의 책임이 발생할 수 있습니다. 그 외에 상기에 언급되지 않은 당사에서 예상하지 못한 사유로 인하여 계약사항의 의무를 불이행하거나 이행하지 못하는 경우에도 회사의 실적에 부정적인 영향을 미칠 수 있습니다.
또한 CMO 사업의 특성상 당사의 제품 생산량은 고객사의 제품 판매량에 영향을 받습니다. 고객 제품에 대한 안전성이나 유효성 문제 발생, 판매 부진 등의 경우 당사의 실적은 예상치를 하회할 가능성이 있습니다. CMO 사업의 특성 및 계약의 조건 상 계약 체결 시 계약의 중도 해지에 대한 가능성은 제한적이지만, 고객사 및 당사의 대내/대외 변수로 인한 계약해지 가능성을 배제할 수 없으며, 이 경우 당사 매출 및 손익에 부정적인 영향을 미칠 수 있으니 투자자께서는 이 점 유의하여 주시기 바랍니다.
[제약산업 규제에 따른 위험]
| 자. 제약산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업으로, 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 당사의 바이오 사업은 주로 국내 당국의 규제 및 미국 당국의 규제를 받을 것으로 예상되고 있습니다. 당사는 특히 구강점막염 치료제의 경우 2018년 03월 14일 미국 FDA 신속심사(Fast Track)에 지정되었습니다. 당사는 구강점막염 치료제의 임상 2상 결과에 따라 혁신신약지정(BTD, Breakthrough Therapy Designation)을 예상하고 있으며, 혁신신약지정 시 당사의 신약 개발 사업에 긍정적인 요인으로 작용할 것으로 기대됩니다. 그러나 제약산업 내 규제를 심화될 경우, 당사에 부정적인 영향을 끼칠 수 있을것으로 예상됩니다. 비록 우호적인 정책이 현재까지는 긍정적인 요인으로 작용할 것으로 기대된다고 하더라도 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 또한 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않을 경우, 규제 완화의 범위가 축소될 수 있습니다. 이러한 정부의 우호적인 정책 및 규제 완화의 변동 가능성은 당사의 사업에 부정적인 영향을 끼칠 수 있습니다. 이 점 유의하여 투자해 주시기 바랍니다. |
제약산업은 인간의 생명 및 건강과 직결되는 의약품을 개발ㆍ제조ㆍ판매하는 산업으로, 제품의 개발 및 제조, 임상시험, 인허가, 유통 및 판매에 이르기까지 전 과정에 걸쳐 각 국가의 규제 당국이 제시하는 엄격한 규정과 절차를 따라야 합니다. 당사의 바이오 사업은 주로 국내 당국의 규제 및 미국 당국의 규제를 받을 것으로 예상되고 있습니다. 이 외 향후 기타 국가들에 대하여 임상시험 또는 라이선스 아웃 진행 시 해당 국가의 규제 당국이 제시하는 규정 및 절차에 따라야 합니다.
[국내 규제 당국 규제 관련]
제약 및 신약개발 사업과 관련된 국내 법률 중 당사의 사업과 밀접하게 연관된 법률로는 식품의약품안전처 및 보건복지부 소관의 '약사법'이 대표적이며, 그 외 보건복지부 소관의 '국민건강보험법', '생명윤리 및 안전에 관한 법률', '제약산업 육성 및 지원에 관한 특별법', '희귀질환관리법', '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(2020. 08. 28. 시행 예정)'과 식품의약품안전처 소관의 '실험동물에 관한 법률' 등이 있습니다.
특히, '약사법' 하위 시행령/시행규칙 중 의약품 등의 안전에 관한 규칙, 의약품 등의 제조업 및 수입자의 시설기준령 시행규칙, 생물학적 제제 등의 제조ㆍ판매관리 규칙, 동물용 의약품등 취급규칙 등과 이의 하위 규정을 준수해야 합니다. 이에 따라, 신약 후보물질의 발굴에서부터 동물을 대상으로 하는 비임상시험, 인체를 대상으로 하는 임상시험, 품목허가에 이르기 까지 임상 승인에 관한 규정, 의약품의 약리 및 독성, 안정성 시험 기준, 임상시험 실시기관 지정에 관한 규정, 품목허가ㆍ심사 등의 규정 등을 반드시 준수하여 진행해야 합니다. 또한 제조 및 판매 단계에서도 제조소 시설 기준, 제조 및 품질관리 규정, 포장 및 공급에 관한 규정, 표시 등에 관한 규정을 준수해야 하며, 사후에도 정기적으로 규제기관으로부터 제품 생산 공정 및 품질관리 전반에 대한 실사 및 관리, 감독을 받게 됩니다. 이러한 규제 및 검증을 통해 제약산업의 선진화 정책을 시현할 수 있지만, 각종 규제 및 절차, 검증 강화로 인한 부담이 높아지는 경우, 당사의 사업에 부정적인 영향을 미칠 수 있습니다.
또한, 국내는 단일보험자(국민건강보험공단)에 의한 전국민 건강보험제도를 운영하고 있는 상황으로, 건강보험의 지속가능성 제고와 적정수준의 국민의료비 유지, 불법 리베이트 차단 등의 목표 하에 약가에 대해 정책적 개입이 이루어지고 있습니다. 국내의 약가 사후관리제도는 대내외 보건의료 환경변화에 의하여 수 차례 변화되어, 현재는 실거래가 조사에 의한 약가 인하, 사용량-약가 연동 협상, 급여범위 확대 시 약가인하, 제네릭의약품 등재 시 오리지널의약품의 약가인하 등의 제도가 운영되고 있습니다. 약가는 산업 정책과 보건의료 정책이 상충하여 변동성이 상재해 있는 상황으로, 현재 제네릭 약가 차등제가 시행 예정되어 있는 상황입니다. 이러한 점진적인 약가 인하 정책은 제약산업에서 간과할 수 없는 중요 요인이며, 당사의 사업에도 부정적인 영향을 미칠 수 있습니다.
| [약가 인하 정책 추이] |
|
시기 |
인하제도 |
내용 |
|---|---|---|
|
2000년 ~ 2009년 |
실거래가약가인하 (표본조사) |
표본조사(전국 80개 요양기관)를 통해 의약품 청구 실태 조사 후 약가인하 |
| 2002년 ~ 2012년 |
약가 재평가 |
최초 상한금액 산정이후 3년마다 7개국 조정 평균가를 |
| 2007년 ~ 2014년 |
기등재 목록정비 |
2007년 선별등재제도로 전환하면서 기존약재의 경우 20% |
| 2012년 |
일괄 약가인하 |
상한금액대비 53.55%수준까지 일괄 약가인하 |
| 2016년 ~ |
실거래가약가인하 (전수조사) |
유통정보센터 유통정보를 근거로 가중평가가격 까지 약가 인하 |
|
현행 |
특허만료 약가인하 |
개별약제 특허만료시 1년간 70%, 1년 후 53.55%로 약가인하 |
|
현행 |
사전 약가인하 |
개별약제 급여기준 확대 이전에 협의를 통하여 약가인하 |
|
현행 |
사용량 약가연동 |
개별약제 약가와 사용량을 연계하여 등재 후 사용량이 일정 % 증가할 때 약가 인하 |
국내의 식품의약품안전처는 희귀의약품이나 항암제, 일부 세포치료제(자가연골세포치료제, 자가피부세포치료제)에 대해 신속한 출시를 허용하는 목적으로 1997년부터 조건부허가제도를 도입하여 식약처 예규로 운영해 왔으며, 2016년부터는 생명을 위협하는 질환 또는 중증의 비가역질환을 대상으로 치료적 탐색(2상) 임상 시험의 허가 요건과 그 결과를 충족하는 세포치료제의 경우에도 조건부 허가를 신청할 수 있도록 세포치료제 조건부 허가 범위를 확대하여 운영하고 있는 상황입니다. 이에 따라 해당 운영 가이드라인 및 요건에 부합하는 세포치료제는 추후 임상 3상(치료적 확증) 시험 자료를 제출하는 조건으로, 임상 2상(치료적 탐색) 시험 자료만으로 우선 허가받아 시판할 수 있게 되었습니다.
이에 더불어, 최근에는 재생의료 임상연구실시 및 첨단바이오의약품 패스트트랙을 골자로 하는 '첨단재생의료법(첨단재생의료 및 첨단바이오의약품의 안전ㆍ지원에 관한 법률)'이 국회 본회의를 통과하여 2020년 8월 28일부터 시행되었습니다. 첨단바이오의약품은 세포치료제, 유전자체료제, 조직공학제제 등 살아있는 세포ㆍ조직 또는 유전자를 원료로 제조한 의약품을 의미합니다. 첨단재생의료법은 첨단재생의료의 안전성 확보 체계 및 기술 혁신ㆍ실용화 방안을 마련하고, 약사법, 생명윤리법 등에 산재한 바이오의약품 관련 규제를 일원화하며, 신속허가제도 도입 및 안전관리체계를 구축하는 것이 핵심입니다. 본 법이 시행되면 재생의료 임상연구가 가능해져 의료기술의 기술경쟁력을 제고하여 희귀ㆍ난치 질환자에게 새로운 치료 기회를 제공할 수 있을 뿐만 아니라, 품목허가 검증 체계를 첨단바이오의약품 특성에 맞게 재편하여 맞춤형 심사, 우선 심사, 조건부 허가 등의 혜택이 가능할 것으로 기대됩니다.
[미국 관련 규제 당국 규제 관련]
미국 식품의약품청(Food and Drug Administration, FDA)은 인체 및 동물용 의약품, 생약 제제, 의료기기, 국가 식량 공급, 화장품, 방사선 제품의 안전성, 유효성 및 안전을 보장함으로써 공중보건을 보호하는 기관입니다. FDA는 식품 및 의약품의 유효성을 확보하고 자국민에게 보다 안전하고 비용부담이 적은 제품의 공급을 추진하며, 국민 건강 유지 및 개선을 위해 의약품과 식품 사용에 필요한 정확하고 과학적 기반을 가진 정보를 얻을 수 있도록 도움으로써 공중보건을 증진시키고 있습니다.
임상시험을 위해서는 임상시험계획승인 신청(Investigational New Drug application, IND)를 통과하여야 하며, 판매용 및 연구용(비판매용) 두가지 범주가 있고, 다음과 같은 세가지 신청 유형이 있습니다.
| [미국 임상시험계획 승인 신청] |
| 구 분 | 내 용 |
|---|---|
| 연구자 임상시험계획 승인신청 | 해당 신청은 임상시험을 개시하고 수행하는 의사가 제출하며, 의사의 직접적인 지시 하에 시험용 의약품이 투여 또는 조제됩니다. 의사는 미허가 의약품 또는 새로운 적응증이나 새로운 환자군에 대한 허가 의약품에 대한 시험을 제안하기 위해 연구용 임상시험계획 승인신청을 제출할 수 있습니다. |
| 응급상황 사용 임상시험계획 승인신청 | 해당 신청은 미국 식품의약품청이 『연방규정집』312.23조 또는 312.34조에 따른 임상시험계획 승인을 위한 시간이 허용되지 않는 상황에서의 시험약의 사용을 허가할 수 있도록 합니다. 또한 기존의 시험 계획 조건을 충족시키기 못하는 환자를 대상으로 또는 허가된 시험 계획서가 존재하지 않을 경우에 사용될 수 있습니다. |
| 치료목적 임상시험계획 승인신청 | 해당 신청은 임상 시험이 수행되고 미국 식품의약품청의 검토가 진행 중일 때, 임상 시험에서 중증 또는 즉각적으로 생명을 위협할 수 있는 증상에 대한 전망을 보이는 시험약을 위해 제출됩니다. 중증질환의 경우 임상 3상 중이거나 또는 모든 임상시험들이 완료된 의약품을 본 항에 따른 치료용 사용이 가능합니다. 즉각적으로 생명을 위협할 수 있는 질환의 경우, 임상 3상 이전이라 하더라도, 통상 임상 2상 이전이 아니라면 해당 의약품을 본 항에 따른 치료용으로 사용 가능할 수 있습니다. |
| 출처 : 식품의약품 안전처(미국 의약품 허가 제도, 2016.06.30) |
이후, 신약 허가신청(New Drug Application, NDA)은 미국 식품의약품청이 미국에서
신약 판매 허가를 승인 받기 위해 의약품 의뢰자가 취하는 공식 단계로, 신약 허가신청은 의약품이 어떻게 체내에서 작용하고 어떻게 제조되는지에 대한 정보를 포함하여 모든 동물 및 인체 데이터와 그 분석을 포함합니다. 신약 허가신청 절차는 아래와 같은 단계를 따릅니다.
| [미국 신약 허가 신청 결과] |
| 구 분 | 내 용 |
|---|---|
| 신약 허가신청 사전회의(Pre-NDA Meeting) | - |
| 신약 허가신청서 제출 및 심사 | - 신약 허가가 신청되면 식품의약품청은 해당 신청이 정식으로 제출되어 심사 받을 수 있도록 할지 결정하는 60일의 기간이 주어집니다. 미국 식품의약품청은 완전하지 않은 신청에 대한 정식 제출을 거절할 수 있습니다. - 신약 허가신청이 정식 제출되면, 식품의약품청 심사팀(의사, 화학자, 통계학자, 미생물학자, 약리학자, 다른 전문가들)은 의뢰자가 제출한 시험이, 제안된 용법에서 해당 의약품이 안전하고 유효성이 있음을 나타내는지 평가합니다. 어떤 의약품도 절대적으로 안전하지 않으며 모든 의약품은 부작용이 있으나, “안전하다”라는 의미는 의약품의 유익성이 알려진 위해성을 상회한다는 뜻입니다. - 심사팀은 시험결과를 검토하고, 시험방법 또는 분석의 취약점과 같은 가능한 문제들에 대해 검토합니다. 심사자들은 의뢰자의 결과 및 결론에 동의할지 여부를 결정하거나, 결정을 내리기 위해 필요한 추가 정보가 필요한지 여부를 결정합니다. - 각 심사자는 신청에 대한 결론과 권고사항을 포함한 서면 평가서를 준비합니다. 이러한 평가는 이후 신청 종류에 따라 팀장, 부서장, 실장의 검토를 거칩니다. |
| 의약품 표시기재사항에 대한 심사 | 식품의약품청은 의약품 표시기재사항에 아래 정보가 포함되었는지 여부를 심사합니다. (1) 적응증, 용량, 투여 경로 및 방법, 투여 횟수 및 기간, 관련 경고문, 위험, 금기사항, 부작용, 주의사항 등 사용법에 대한 적절한 정보로서 의약품을 투여하는 법률상 허가된 의료인이 해당 의약품을 안전하게 사용할 수 있고, 광고되거나 표현된 모든 증상을 포함하여 본래 목적에 따라 사용될 수 있도록 하는 자료 (2) 라벨 및 표시기재사항 또는 의약품이 조제된 포장 내 표시된 의약품의 성분과 관련한 정보 |
| 실태조사 | 시설 등에 대한 실태조사는 식품의약품청이 수행하며, 미국의 의약품 제조 및 품질관리기준(GMP)을 따릅니다. |
| 의약품 허가 | - |
| 출처 : 식품의약품 안전처(미국 의약품 허가 제도, 2016.06.30) |
한편, 미국을 비롯한 유럽 등 글로벌 선진국에서는 제약·바이오 산업을 국민의 건강을 증진하고 일자리와 고부가가치를 창출하는 핵심 기간산업이자 미래 신성장 동력 산업으로 인지하고, 제약ㆍ바이오 산업에 대한 우호적 정책을 펼치고 있는 상황입니다. 또한, 미국, 유럽 등 글로벌 선진국은 제약사들의 신약 R&D 및 인허가에 소요되는 막대한 비용 부담을 줄일 수 있도록 다양한 규제장벽을 완화하는 정책을 적극적으로 펼치고 있습니다. 대표적으로, 의학적 미충족 수요에 부응할 가능성이 있는 제약/바이오 기술들을 위중한 상태에 있는 환자들에게 신속하게 전달할 기회를 제공하기 위해 조건부 신속허가를 제도적으로 정착하려는 노력이 진행되고 있습니다.
특히, 미국은 패스트트랙(Fast Track)과 혁신의약품(Breakthrough Therapy) 프로그램을 통해 심각한 질환(Serious Condition)을 치료하는 의약품의 정확하고 신속한 개발을 지원하고 있습니다. 패스트트랙은 의학적 미충족 수요의 해결 가능성을 입증하는 비임상 및 임상자료를 제출해야 하고, 혁신의약품은 기존치료법 대비 상당한 개선을 보여주는 임상 1, 2상의 데이터를 요구하고 있습니다.
| [패스트트랙(Fast Track) vs 혁신치료제(Breakthrough Therapy) 비교] |
 |
|
사업위험 자. 패스트트랙, 혁신치료제 비교 |
| (출처: FDA, 한화투자증권 리서치센터) |
당사는 특히 구강점막염 치료제의 경우 2018년 03월 14일 미국 FDA 신속심사(Fast Track)에 지정되었습니다. 당사는 구강점막염 치료제의 임상 2상 결과에 따라 혁신신약지정(BTD, Breakthrough Therapy Designation)을 예상하고 있으며, 혁신신약지정 시 당사의 신약 개발 사업에 긍정적인 요인으로 작용할 것으로 기대됩니다.
그러나 제약산업 내 규제를 심화될 경우, 당사에 부정적인 영향을 끼칠 수 있을것으로 예상됩니다. 비록 우호적인 정책이 현재까지는 긍정적인 요인으로 작용할 것으로 기대된다고 하더라도 실제 효율적인 정책 지원이 이루어지지 않거나, 세부과제 추진에 어려움이 생길 수 있으며, 관련 법규의 제정 및 개정 단계, 예산 확보 등에 난항이 발생할 수 있습니다. 또한 해당 정책의 기대효과가 감소되는 경우 정책 기조의 변화로 정부 지원이 축소될 수 있으며, 조건부 허가와 같은 규제 완화에 대한 실효성이 크지 않을 경우, 규제 완화의 범위가 축소될 수 있습니다. 이러한 정부의 우호적인 정책 및 규제 완화의 변동 가능성은 당사의 사업에 부정적인 영향을 끼칠 수 있습니다. 이 점 유의하여 투자해 주시기 바랍니다.
[핵심연구인력유출 위험]
| 차. 연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 가장 중요한 요소입니다. 이는 제약 산업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 이는 각종 보상책에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히타경쟁사의 당사 우수인력의 스카우트는 당사가 사업을 영위함에 있어 큰 문제가 될 수 있습니다. 또한, 핵심인력 이탈과 함께 당사의 주요 기술이 유출될 경우, 당사의 경쟁력이 악화될 수 있으며, 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자분들께서는 이 점 유의하시기 바랍니다. |
연구개발 능력은 당사가 속한 산업의 특성상 매우 중요한 요소이며, 지속적인 연구개발을 위해 우수한 인재를 보유 및 유치하는 것이 회사의 성과를 결정하는 가장 중요한 요소입니다. 이는 제약 산업을 영위하고 있는 업체들에 공통적으로 적용되는 사항으로, 업계 내에서 우수한 인력 유치에 관한 경쟁은 점차 심화되고 있습니다. 또한, 주요 연구 인력의 유출이 있을 경우 해당 연구 개발과제가 지연되거나 개발전략을 수정해야 할 가능성이 존재하며, 개발비 부담 등으로 당사의 경쟁력 및 성장 가능성이 악화될 수 있습니다.
당사의 연구개발조직은 글로벌신약R&D연구소 산하 5개팀, 첨단소재연구소 산하 5개팀 등 총 2개 연구소, 8개 팀으로 구성되어 있으며, 그 현황은 다음과 같습니다.
| [연구개발 조직 구성] |
| 연구소 | 팀 | 주요업무 |
|---|---|---|
| 글로벌신약R&D연구소 | 임상 | 국내 및 해외 임상과제 진행 CRO 관리, 인허가 |
| 임상개발 | 임상개발 Business의 전반적인 임상개발 업무 수행 | |
| 사업개발 | 신약개발 Business의 전반적인 사업개발 업무 수행 | |
| 바이오 연구소 |
In vitro & vivo 약효평가 수행, assay setup | |
| 광교연구소 | In vitro & vivo 약효평가 수행, assay setup | |
| 첨단소재 연구소 |
첨단소재 연구소 |
첨단소재 개발 전반적인 업무 수행 |
| 신약 | 신약 물질 개발 및 전반적인 업무 수행 | |
| 신소재 | 신소재 개발 및 전반적인 업무 수행 | |
| API | 원료의약품 신규합성개발 및 제품에대한 품질 개선 연구 | |
| CMC | 임상시험용 의약품 원료 및 완제관리, 인허가 관리 | |
| RA | 품목 인허가/법률적 검토 등 인허가 사항 일체 |
| (출처: 당사 정기보고서) |
| [R&D 조직도 현황] |
 |
|
엔지켐생명과학_임상,연구,사업개발부 조직도 |
| (출처: 당사 2021년 3분기보고서) |
당사는 EC-18의 글로벌 임상개발과 라이센싱 아웃을 성공적으로 수행하기 위해 글로벌 수준의 내부 전문인력을 기반으로 하고, 추가적으로 외부의 전문인력을 구성하여 전략적으로 활용하고 있으며, 이러한 외부 전문인력은 비임상전문가, 임상개발 전문가, 전문 컨설턴트 그룹 등으로 나뉘어 있고 글로벌 2상 임상시험의 성공적 수행을위해 박차를 가하고 있습니다.
또한, 고순도, 고수율의 EC-18의 원료물질을 생산하기 위해 당사의 원료의약품 연구소에서는 지속적으로 공정연구와 제법연구를 수행하고 있으며, 다양한 생산 프로세스 최적화 연구를 통해 지속적인 수율개선 및 원가절감을 위한 연구에 몰두하고 있습니다.
보고서 작성일 현재 내부핵심인력은 CEO, CMO (Chief Medical Officer), 미국법인장을 포함한 주요 경영진과 실무책임자들로 구성되어 있으며, 기술자문위원단은 Duke 의대 Dr. Jeff Crawford, Harvard medical school의 Dr. Sonis를 포함한 국내외 임상 전문가들로 구성되어 있습니다.
이에 따라 증권신고서 제출일 현재 당사는 박사급 10명, 석사급 9명, 기타 14명 등,총 33명의 연구인력을 보유하고 있으며, 그 현황은 다음과 같습니다.
| [당사 연구개발인력 현황] |
| 구분 | 학위별 | |||||
| 박사 | 석사 | 기타 | 합계 | |||
| 글로벌신약 R&D연구소 |
바이오연구소 | 4 | 3 | - | 7 | |
| 광교연구소 | - | 1 | 1 | 2 | ||
| 임상R&D부 | 임상개발부 | - | - | - | - | |
| 임상팀 | - | 1 | 3 | 4 | ||
| 사업개발부 | 2 | 1 | - | 3 | ||
| 첨단소재 연구소 |
첨단소재연구소 | 1 | - | - | 1 | |
| 신약팀 | - | 1 | - | 1 | ||
|
신소재팀 |
- | 1 | 2 | 3 | ||
| API팀 | - | 1 | 1 | 2 | ||
| RA팀 | - | - | 4 | 4 | ||
| CMC팀 | - | - | 2 | 2 | ||
| 글로벌 백신생산 본부 | - | 1 | - | 1 | ||
| 합 계 | 7 | 10 | 13 | 30 | ||
| (출처: 당사 제시) |
당사의 핵심 연구인력의 현황은 다음과 같습니다.
|
직 위 |
성 명 |
담당업무 |
주요 경력 |
주요 연구실적* |
|---|---|---|---|---|
|
CEO |
손기영 |
EC-18 |
* 1986년 ~ 1989년 고려대 경영대학원 경영학석사 * 1984년 ~ 1998년 삼일회계법인 이사 (CPA), * 1986년 ~ 1993년 국제통상자문 (현대전자 메모리 반도체 외) * 1996년 ~ 2000년 전경련 국제경영원 교수 * 2003년 ~ 현재 브리짓라이프사이언스 회장 * 2012년 ~ 현재 ㈜엔지켐생명과학 대표이사 |
[논문] 1. PLAG alleviates chemotherapy-induced thrombocytopenia via promotion of megakaryocyte/erythrocyte progenitor differentiation in mice. (2018년, Thrombosis Research 161:84-90) 공동저자 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry 119(2):1392-1405) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget 8(57):96636-96648) 공동저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology 6:206) 공동 저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters 377:25-31) 공동저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One 11(3):e0151758) 공동저자 7. Protective effect of EC-18, a synthetic monoacetylglyceride on lung inflammation in a murine model induced by cigarette smoke and lipopolysaccharide. (2016년 International Immunopharmacology 30:62-68) 공동저자 8. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. (2015년 Immune Network 15(3):150-160) 공동저자 9. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network 15(2):100-109) 공동저자 10. EC-18, a synthetic monoacetyldiglyceride (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol), attenuates the asthmatic response in an aluminum hydroxide/ovalbumin-induced medel of asthma. (2014년 International Immunopharmacology 18(1):116-123) 공동저자 [학회] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling. Journal of Immunology May 1, 2018, 200 (1 Supplement) 42.3 (2018년, AAI 미국면역학회) 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. Cancer Research 2018;78(13 Supplement): Abstract nr 4154. (2018년, AACR 미국암학회) 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. Cancer Research 2018;78(13 Supplement): Abstract nr 2446 (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. Journal of Immunology May 1, 2017; 198(1 Supplement) 204.11 (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. Journal of Immunology May 1, 2017; 198(1 supplement) 222.12 (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. Cancer Research 2017;77(13 Supplement): Abstract nr 5664. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. Journal of Immunology 2016, 196(1 Supplement) 50.2. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. . Journal of Immunology 2016, 196 (1 Supplement) 50.3. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. Journal of Immunology 2016, 196 (1 Supplement) 191.2. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. Blood 2015 126:2207 (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. Blood 2015 126:2210 (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. Blood 2015 126:2212 (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. Blood 2015 126:4757 (2015년, ASH 미국혈액학회) |
| 부사장 | 이홍균 | 글로벌 백신생산 총괄 |
* 1996년~2002년 Sogang University (Seoul), Graduate School of Life Sciences Ph.D. (Major - Microbiology) * 1986년-1991년 Sogang University Graduate School (Seoul), Graduate School of Life Sciences Master's Degree (Major - Biochemistry) * 1982년-1986년 Sogang University (Seoul), Bachelor's Degree in Life Science, Minor - Chemistry * 1991년~2006년 LG Life Sciences Co., Ltd. (currently LG Chem) / Senior Researcher (Director), Institute of Technology *2006년~2010년 LG Life Sciences Co., Ltd. (currently LG Chem)/ Head of Production Team 4 at Iksan Plant *2010년~2012년 SK Chemicals Co., Ltd. *2013년~2017년 SK Chemicals Andong Vaccine Plant (L House), Plant General Manager (Executive Director) *2018년~2019년 SK Bioscience Co., Ltd. Head of Engineering TF (Executive Director) *2019년-2021년 Chong Kun Dang Co., Ltd., Managing Director, Bio Production Division *2021년01월~ Seegene Head of production(COVID diagnostics) |
[Details of work history] 1991~2006 LG Life Sciences Co., Ltd. (currently LG Chem) / Senior Researcher at the Institute of Technology (Bioprocessing team leader, general manager) Main tasks: Gene Cloning/ Cell bank prep./ Cell bank characterization Bioprocess Research- Fermentation/Refining/Formulation Process Development/ Development report, CMC document creation Protein characterization studies Process scale-up (Pilot Scale Study)/ Manufacturing and supply of clinical batch Factory Construction and Qualification (Concept & Basic Design, IQ/ OQ/ PQ/ Engineering Run/ Scale-up/CV/PV) Technology transfer 1) 1991~2000: R & D for Recombinant Bovine Somatotropin / Product Name- Boostin 2) 1993~1994: Process Development of Recombinant Human Somatotropin / Product Name- Utropin 3) 1996: Recombinant Human Alfa Interferon, G-CSF cloning 4) 1991~1997: Recombinant Porcine Somatotropin development research 5) 1998: Process development for Recombinant helicase for diagnosis of human hepatitis C virus 6) 1997~2005: R&D for therapeutic vaccine using Staphylococcus aureus superantigen mutant protein / Product name-Masta Vac 7) 2001~2004: Microbial expression study of useful antibiotics using metabolic engineering 8) 2003~2005: Development of mass production of Coenzyme Q10/Lycopene with E coli using gene evolution technique. 9) 2004~2006: Development of human G-CSF using E. coli 10) 18 patents related to R&D 2006~2010 LG Life Sciences Co., Ltd. (currently LG Chem)/ Head of Production Team 4 at Iksan Plant (Director) Production team leader; Boostin (Recombinant Bovine Somatotropin sustained-release injection) Factive (antibiotics, original agent; Gemifloxacin) Inspection from Korea/ US FDA/ EMEA/ South America and other countries Yield improvement/ cost reduction 2010~2012 SK Chemicals Co., Ltd. Bio 4 Team Leader (Manager) Construction of SK Chemicals Andong Vaccine Factory 1) Concept/ Basic/ Detail Design 2) Oversee General construction work 3) Acquired production building use approval 4) Perform Facility Validation 2013~2017 SK Chemicals Andong Vaccine Plant (L House) Plant, General Manager Establishment of production system for new factory Qualification/Engineering Run, Scale-up/ Clinical batch manufacturing & supply/CV (Cleaning) Validation)/ PV (Process Validation) Acquired manufacturing license (March 2013) Acquired GMP approval for product pipelines - December 2014: Influenza vaccine Skycellflu trivalent - December 2015: Influenza Vaccine Skycellflu Quadrivalent - July 2016: Pneumococcal conjugate vaccine Skypneumo - September 2017: Shingles vaccine Skyzoster Commercial production of licensed products: Final bulk and F/F packaging WHO PQ certification for existing products - Obtained export license for Sky Cell Flu trivalent single dose and multi-dose vial formulation (March/September 2017) Collaboration with overseas partners: Joint development and joint development with a partner company (Sanofi Pasteur) for pneumococcal conjugate vaccine to enter the United States - Supply of clinical batches - Responsible for CAPEX - Acted as a member of JSC (Joint Steering Committee) and participated in major decisions Collaborating with overseas organizations and companies for CDMO business (supply of clinical batches / license approval /commercial production in progress) - PAHO project (recombinant rotavirus vaccine development / commercial production) - IVI (International Vaccine Research Institute) project (typhoid vaccine development/commercial production) - Takeda Pharmaceutical Project (Development of Dengue Vaccine / Commercial Production) Construction related work for the relocation of SK Chemicals Osan blood product factory to Andong - Concept/Basic Design (currently SK Plasma Andong Factory) 2018~2019 Head of SK Bioscience Engineering TF (Executive Director) Expansion and qualification evaluation to increase production capacity of existing factories - Extension work in progress to increase production of Sky Cellflu: Concept/ Basic/ Detail Design Construction in progress - Design of extension construction for pneumococcal conjugate vaccine to enter the United States is in progress (in collaboration with Sanofi Pasteur engineering part and overseas business part) Concept design in progress Global Business Communication Ability: LGLAP grade 4- Advanced Low (Good at business communication) Educational experience: LG/SK group executive education/ Hunet MBA/ leadership education, etc. |
| 전무 | 박갑주 | 사업개발 |
* 1992년~1997년 Ph.D. Department of Chemistry, Brown University, RI, USA (Organic/Bio Chemistry) * 1988년-1990년 M.S. Department of Chemistry, POSTECH, Pohang, S. Korea (Polymer Chemistry) * 1983년-1987년 B.S. Department of Chemistry, Seoul National University, Seoul, S. Korea * 2020년~현재 EnzyChem Life Sciences, Director, Business * 2017년~2019년 Institut Pasteur Korea, Director, Medicinal Chemistry * 2016년~2017년 Hankuk University of Foreign Studies, * 2010년~2015년 Yuhan Corp., S. Korea, Director, * 2001년~2010년 Wyeth/Pfizer, Inc. USA Sr. Research Investigator * 1998년~2001년 Duke University, Research Scientist, USA * 1997년~1998년 Texas A&M University, Post-doc, USA |
[논문] 1. Compound 19e, a novel glucokinase activator, protects against cytokine-?induced beta-?cell apoptosis in INS-?1 Cells Oh, Y. S.; Seo, E.; Park, K. Jun, H.-S., Frontiers in Pharmacology,, 2017, 8, 169/1-169/10 2. Design and Synthesis of Acetylenyl Benzamide Derivatives as Novel Glucokinase Activators for the Treatment of T2DM, Park, K*.; Lee, B. M.; Hyun, K. H.; Han, T.; Lee, D. H.; Choi, H. H.ACS Med. Chem. Lett. 2015, 6, 296-301. 3. Discovery of 3-(4-methanesulfonylphenoxy)-N-[1-(2-methoxy-ethoxymethyl)-1H-pyrazol-3-yl]-5-(3-methylpyridin-2-yl)-benzamide as a novel glucokinase activator (GKA) for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B. M.; Hyun, K. H.; Lee, D. H.; Choi, H. H; Kim, H,; Chong, W.; Kim, K. B.; Nam, S. Y. Bioorg. Med. Chem. 2014, 22, 2280-2293. 4. Treatment with glucokinase activator, YH-GKA, increases cell proliferation and decreases glucotoxic apoptosis in INS-1 cells, Oh, Y. S.; Lee, Y.-J; Park, K.; Choi, H. H.; Yoo, S.; Jun, H.-S. Eur. J. Pharma. Sci. 2014, 51, 137-145. 5. Discovery of a novel phenylethyl benzamide glucokinase activator for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B.M.; Kim, Y.H.; Han, T.; Yi, W.; Lee, D.H.; Choi, H.H.; Chong, W.; Lee, C.H. Bioorg. Med. Chem. Lett. 2013, 23, 537-542. [학회] 1. Structure-activity relationship and structure-property relationships of TTCA derivatives as novel anti-tubercular agents. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do, Korea Oct 14-15, 2019. 2. Introduction of novel anti-tubercular agent developed for the treatment of MDR/XDR TB. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do,, Korea Oct 14-15, 2019. 3. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. American Chemical Society (ACS) Spring 2019 National Meeting & Exposition in Orlando, Florida, USA March 31- April 4, 2019 4. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. 2018 Fall Korean Pharmaceutical Conference. Jeju, South Korea. October 17-19, 2018 5. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. General Meeting of the Korean Chemical Society. Daegu, South Korea. October 17-19, 2018 6. In Quest of A Novel Scaffold To Combat MDR/XDR Tuberculosis. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 7. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 8. Genome wide profiling of Mycobacterium Tuberculosis exposed to novel anti-tuberculosis agent, thienothiazolecarboxamide (TTCA) derivatives. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 |
| 상무 | 신동균 | 합성연구소 연구소장 |
* 1990년~1997년 한일약품 과장 (병역특례연구원) |
1. 베타락탐 항생제 개발 : 세포탁심, 세포트리악손, 세픽심, 세포독심 2. 카바페넴 항생제 개발 : 이미페넴, 메로페넴 3. 일반 원료 의약품 개발 : 클라리스로마이신 , 실로도신, 랄록시펜, * 논문 및 특허 1. Synthetic Communications (2005), 35(6), 845-855 2. Tetrahedron Letters (2005), 46(12), 1985-1987. 3. Bulletin of the Korean Chemical Society (1992), 13(2), 176-9. 4. Bulletin of the Korean Chemical Society (1992), 13(1), 98-9. 5. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 6. Bulletin of the Korean Chemical Society (1990), 11(4), 307-9. 7. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 8. KR 2008-87141 9. KR 2008-30366 10. KR 2008-30369 11. KR 2006-38105 12. US 20020016457 13. WO 2001070749 14. WO 2001066532 15. KR 1020140115255 16. KR 1020140115259 17. KR 1020160018457 18. KR 1020160095328 19. KR 1020170054491 20. KR 1020170000770 21. KR 1020170152263 |
| 이사 | 윤선영 |
바이오연구소 (비임상 효능 및 적응증 개발) |
*1991년 ~ 1993년 성균관대학교 생물학과 석사 *1999년 ~ 2005년 한국과학기술원(KAIST) 생명과학과 박사 *1994년 ~ 2003년 한국생명공학연구원 세포생물학실 연구원 *2003년 ~ 2005년 한국생명공학연구원 인간유전체사업단 *2005년 ~ 2006년 Roswell Park Cancer Institute (RPCI), *2006년 ~ 2013년 숙명여자대학교 생명과학과 면역학실 * 2013년 ~ 2014년 코아스템㈜ R&D 그룹 R&D 그룹장 |
[논문] 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget) 교신저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology) 교신저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters) 교신저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One) 공동저자 7. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. Immune Netw. 2015 Jun;15(3):150-60. (2015년 Immune Network) 공동저자 8. Palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network) 주저자 외 48편 주저자 및 공동저자로 논문 게재함 [학회발표] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling (2018년, AAI 미국면역학회) 2. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. (2018년, AACR 미국암학회) 3. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. . (2015년, ASH 미국혈액학회) |
|
책임 연구원 |
김원우 |
비임상 실무 |
* 2004 ~ 2005 연세대학교 의과학과 종양생물학, 방사선종양학과 석사 * 2006 ~ 2010 연세대학교 의과학과 종양생물학, 방사선종양학과 박사 * 2010 IAEA Fellowship training, The Gray Institute, 옥스포드 대학교, 박사 후 연구원 * 2011.9 연세대학교, 방사선종양학과. 박사 후 연구원 * 2011.10 ~ 2017.12 한국원자력의학원, 방사선치료연구부, 비임상센터. 위촉 연구원 * 2018.2 ~ 2018.10 한양대학교 자연과학연구소. |
[논문] 1. Anticancer and radiosensitizing effects of the cyclin-dependent kinase inhibitors, AT7519 and SNS 032, on cervical cancer. 2018년, Int J Oncol. 2. Rifaximin improves survival and reduces intestinal injury in mice administered whole abdominal irradiation. 2018년, Bioscience Research. 3. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2018년,International Journal of Hyperthermia. 4. Metformin Inhibits Growth and Metastasis With Enhancement of Radiation Response in Hepatocellulcar Carcinoma Xenograft Model. 2017년, International Journal of Radiation OncologyBiologyPhysics 5. XIAP-associating factor 1, a transcriptional target of BRD7, contributes to endothelial cell senescence. 2016년, Oncotarget. 6. Lanatoside C suppressed colorectal cancer cell growth by inducing mitochondrial dysfunction and increased radiation sensitivity by impairing DNA damage repair. 2016년, Oncotarget. 7. Radiobiological mechanisms of stereotactic body radiation therapy and stereotactic radiation surgery. 2015년, Radiat Oncol J. 8. Suppressor of cytokine signaling (SOCS) genes are silenced by DNA hypermethylation and histone deacetylation and regulate response to radiotherapy in cervical cancer cells. 2015년, PLoS One. 9. Altered Biological Potential and Radioresponse of Murine Tumors in Different Microenvironments. 2015년, Cancer Res Treat. 10. Inhibition of IL-17A suppresses enhanced-tumor growth in low dose pre-irradiated tumor beds. 2014년, PLoS One. 11. Sorafenib acts synergistically in combination with radiotherapy without causing intestinal damage in colorectal cancer. 2013년, Tumori. 12. Tumor-infiltrating regulatory T cells delineated by upregulation of PD-1 and inhibitory receptors. 2012년, Cell Immunol. 13. Combination of radiotherapy and adenovirus-mediated p53 gene therapy for MDM2-overexpressing hepatocellular carcinoma. 2012년, J Radiat Res. 14. A novel combination treatment of armed oncolytic adenovirus expressing IL-12 and GM-CSF with radiotherapy in murine hepatocarcinoma. 2011년, J Radiat Res. 15. Identification of proteins indicating radiation-induced hepatic toxicity in cirrhotic rats. 2010년, J Radiat Res. 16. Recombinant Human Epidermal Growth Factor (rhEGF) Protects Radiation-Induced Intestine Injury in Murine System. 2010년, J Radiat Res 17. Identification of proteins that regulate radiation-induced apoptosis in murine tumors with wild type p53. 2007년, J Radiat Res 18. Enhancement of tumor radioresponse by wortmannin in C3H/HeJ hepatocarcinoma. 2007년, J Radiat Res 19. Protein expression profiles in a rat cirrhotic model induced by thioacetamide. 2006년, Korean J Hepatol. [학회발표] 1. Enhancement of radioresponse by PI3K inhibitor in radioresistant murine hepatocarcinoma. 2004년. 16th EORTC-NCI-AACR Symposium. 2. Enhancement of radiosensitivity by wortmannin in murine HCa-I. 2005년. The 1st Symposium Novel targeting drugs and radiotherapy. 3. Cooperative effects of armed oncolytic adenovirus with radiotherapy in C3H/HeJ hepatocarcinoma. 2007년. 13th ICRR. 4. A Novel Combination Treatment of Armed Oncolytic Adenovirus Expressing IL-12 and GM-CSF with Radiotherapy in Murine Hepatocarcinoma. 2009년. ACRR 5. Radioprotective Effects of Recombinant Human Epidermal Growth Factor 6. Overexpression SOCS-1 may inhibit invasion and metastasis of cervical cancer. 2014년, AACR 7. Study on the heating characteristics of Oncothermia heating devices. 8. Combination of Oncothermia with SBRT and Metformin in vivo. 2016년, 9. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2017년, STM 2017. |
| (출처: 당사 정기보고서) |
일반적으로 업계 연구 인력들의 특성이 학계나 국가 연구원 등에서 근무하는 것을 선호하고 있으며, 개인적인 학업 증진을 위한 해외유학 등의 사유로 핵심연구 인력의 이탈이 발생할 수 있습니다. 이에 대한 대안으로 당사는 주식매수선택권 부여와 차별화된 대우 및 보상(특별 인센티브), 급여성/비급여성 복리후생 강화, 신약을 포함한 다양한 프로젝트 추진 환경 및 기회 제공 등을 시행 중입니다. 그러나 이와 같은 각종 보상책에도 불구하고 핵심인력의 이탈 가능성을 배제할 수는 없는 상황입니다. 특히타경쟁사의 당사 우수인력의 스카우트는 당사가 사업을 영위함에 있어 큰 문제가 될 수 있습니다. 또한, 핵심인력 이탈과 함께 당사의 주요 기술이 유출될 경우, 당사의 경쟁력이 악화될 수 있으며, 지속적인 성장에 부정적인 영향을 끼칠 수 있습니다. 투자자분들께서는 이 점 유의하시기 바랍니다.
[아웃소싱(CMO, CRO)과 관련된 위험]
| 카. 당사는 신약으로 개발 중인 EC-18과 관련하여 공정성 및 객관성이 확보될 수 있는데이터의 확보를 위하여 국제적으로 인증 받은 CRO에 의뢰하여 물리화학적, 생물학적 실험을 수행하여 비임상 데이터를 확보하고 있고, 비임상 및 임상시료의 제조는 GMP인증을 받은 CMO에 위탁하고 있습니다. 위와 같이 당사는 의약품을 연구개발함에 있어 IND와 NDA 시 요구되는 기준을 충족하는 공인된 CRO 및 CMO를 이용하고 있습니다. 다만, CRO 또는 CMO는 당사의 위탁으로 실험결과 분석 또는 시료 생산 업무만을 수행하고 당사는 이에 대한 용역 수수료를 지급하고 있습니다. 따라서 예상치 못한 CRO 또는 CMO의 내부 사정으로 인하여 당사가 위탁한 용역업무에 차질이 생길 가능성이 존재하며, 이 경우 당사의 신약개발 일정이 지연될 수 있습니다. |
모든 의약품들은 각국 의약품 허가 관련 기관의 IND(Investigational New Drug application, 임상시험승인신청) 승인을 통해 임상시험이 이루어지고, 임상시험 결과에 대한 NDA(New Drug Application, 신약허가신청) 승인 이후에 판매가 이루어집니다.
IND와 NDA 작성을 위한 공정성과 객관성을 갖춘 시험자료 확보 및 제품생산을 위해서는 자체 연구개발 설비와 생산설비에 대해 GLP(Good Laboratory Practice, 비임상시험관리기준), GCP(Good Clinical Practice, 임상시험관리기준), GMP(Good Manufacturing Practice, 우수의약품제조품질관리기준) 인증을 받거나 해당인증을 받은 전문 CRO(Contract Research Organization), CMO(Contract Manufacturing Organization)를 활용하게 됩니다.
CRO(Contract Research Organization, 비임상 또는 임상시험수탁기관)는 임상시험이나 비임상시험과 관련된 의뢰자의 임무나 역할의 일부 또는 전부를 대행하기 위하여 의뢰자로부터 계약에 의해 위임받은 개인이나 기관, CMO(Contract Manufacturing Organization, 생산전문수탁기관)는 제조업체의 의뢰를 받아 제품을 생산해 주는 위탁생산 전문 공장입니다.
당사는 신약으로 개발 중인 EC-18과 관련하여 공정성 및 객관성이 확보될 수 있는데이터의 확보를 위하여 국제적으로 인증 받은 CRO에 의뢰하여 물리화학적, 생물학적 실험을 수행하여 비임상 데이터를 확보하고 있고, 비임상 및 임상시료의 제조는 GMP인증을 받은 CMO에 위탁하고 있습니다. EC-18의 비임상 및 임상 개발과 관련하여 당사가 이용하였거나 이용하고 있는 CRO 및 CMO는 다음과 같습니다.
| [당사 CRO, CMO 사용 현황] |
| 구분 | 기관명 | 이용내역 |
|---|---|---|
| CRO | 바이오톡스텍 | EC-18 비임상 독성 |
| Novotech, Rho | EC-18 임상 1상 | |
|
Honorem |
호중구감소증 치료제 임상 2상 | |
| PRA Health Sciences | 구강점막염 치료제 임상 2상 | |
| CMO | 콜마파마 | EC-18 임상 1상 캡슐화 주) |
| Catalent, Capsugel | 호중구감소증 치료제 임상 2상 캡슐화 주) |
| 주) | 비임상 및 임상 시료의 생산은 GMP 인증을 받은 당사 제2공장에서 하고 있으며, CMO에는 캡슐화만을 위탁하고 있습니다. |
위와 같이 당사는 의약품을 연구개발함에 있어 IND와 NDA 시 요구되는 기준을 충족하는 공인된 CRO 및 CMO를 이용하고 있습니다. 다만, CRO 또는 CMO는 당사의 위탁으로 실험결과 분석 또는 시료 생산 업무만을 수행하고 당사는 이에 대한 용역 수수료를 지급하고 있습니다. 따라서 예상치 못한 CRO 또는 CMO의 내부 사정으로 인하여 당사가 위탁한 용역업무에 차질이 생길 가능성이 존재하며, 이 경우 당사의 신약개발 일정이 지연될 수 있습니다.
2. 회사위험
[지속적인 영업적자로 인한 재무구조 악화 위험]
| 가. 당사는 신약물질 EC-18의 작용기전을 활용한 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 임상시험 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 2015년부터 지속적인 당기순손실이 발생하고 있습니다.지속적인 영업손실 및 당기순손실로 인해 당사의 재무구조는 악화되어 왔으며, 추후에도 당사 파이프라인의 라이센스 아웃 및 코로나19 백신 공급 등으로 영업흑자로 전환되지 못한다면 재무구조는 계속해서 악화될 것으로 예상됩니다. 당사는 금번 주주배정 후 실권주 일반공모로 유입되는 자금을 사용하여 인도의 다국적 바이오제약사인 Zydus Cadila의 ZyCoV-D 관련 CMO사업의 매출 증가와 EC-18의 구강점막염 라이센스 아웃, 기존 API 매출 강화를 통하여 매출 및 수익성을 향상시킬 계획을 가지고 있으나, 관련 규제기관들의 기준 강화에 따른 생산 및 공급 차질, 라이센스 아웃의 실패 등 차질이 발생할 경우 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 또한, 당사 예상보다 적은 매출이 발생하여 당사가 사용하고 있는 연구개발비를 포함한 판매비관리비와 각종 비용 등을 커버하지 못할 경우 수익성이 악화될 위험도 있습니다. 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 신약물질 EC-18의 작용기전을 활용한 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 임상시험 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 2015년부터 지속적인 당기순손실이 발생하고 있습니다.
당사의 영업손실은 2018년 14,329백만원(영업이익률 : -46.2%), 2019년 16,402백만원(영업이익률 : -52.1%), 2020년 19,107백만원(영업이익률 : -74.0%), 2021년 3분기 15,545백만원(영업이익률 : -94.3%)로, 매년 영업손실이 발생하고 있는 상황이며, 영업손익이 악화되는 추세를 보이고 있습니다. 이로 인하여 매년 당기순손실이 지속되고 있으며, 당기순손익도 악화되는 추세를 보이고 있는 상황입니다. 당사의 손익계산서상 주요 계정 및 수익성 추이는 다음과 같습니다.
| [손익계산서 주요계정 및 수익성 추이] |
| (단위 : 백만원) |
|
구 분 |
2021년 3분기 | 2020년 3분기 | 2020년 |
2019년 |
2018년 |
|---|---|---|---|---|---|
|
매출액 |
16,485 | 21,866 | 25,818 | 31,469 | 31,034 |
|
매출원가 |
16,216 | 20,126 | 23,999 | 28,804 | 26,769 |
|
매출총이익 |
269 | 1,741 | 1,820 | 2,664 | 4,265 |
|
판매비와관리비 |
15,815 | 14,196 | 20,927 | 19,067 | 18,594 |
|
영업손익 |
(15,545) | (12,455) | (19,107) | (16,402) | (14,329) |
|
기타수익 |
39 | 795 | 2,147 | 817 | 146 |
|
기타손실 |
147 | 1,741 | 1,136 | 1,749 | 358 |
|
금융수익 |
684 | 472 | 558 | 714 | 371 |
|
금융원가 |
6,909 | 126 | 1,694 | 55 | 110 |
| 법인세비용차감전순이익 | (21,878) | (13,107) | (19,232) | (16,676) | (14,281) |
| 법인세비용 | (1,328) | 7 | (1,725) | 204 | 139 |
| 당기순이익 | (20,550) | (13,113) | (17,507) | (16,879) | (14,420) |
|
매출총이익률 |
1.63% | 7.96% | 7.0% | 8.5% | 13.7% |
|
판매비와관리비율 |
95.93% | 64.92% | 81.1% | 60.6% | 59.9% |
|
영업이익률 |
-94.30% | -56.96% | -74.0% | -52.1% | -46.2% |
|
당기순이익률 |
-124.66% | -59.97% | -67.8% | -53.6% | -46.5% |
| (출처: 당사 제시) |
[성장성]
당사의 연결기준 매출액은 2018년 31,034백만원이 발생하였으며, 2017년 대비 일반계API인 품목(진해 거담제, 항응고제, 위궤양치료제)의 매출 증가로 2017년 매출액인 26,133백만원 대비 18.8% 증가하였습니다. 2019년에도 세파계 API의 매출이 감소한 것에 반하여 일반계API 매출이 증가하면서 매출이 31,469백만원 발생하였고, 2018년 대비 1.4% 성장할 수 있었습니다.
그러나 2020년부터 코로나19 확산에 의하여 마스크 착용이 일반화되면서 호흡기질환 환자가 급감하였으며, 당사의 주요 매출품목이었던 일반API인 진해거담제의 매출이 크게 감소하였고, 코로나19 사태로 항결핵제 수출 수요국가들의 의료재정이 코로나19로 집중되면서 관련 품목들의 수출이 감소하였습니다. 또한 당사 내부적으로도 사업다각화 및 경영합리화 목적으로 저부가가치 품목에 대한 구조조정을 진행하면서 2020년 매출액이 25,818백만원으로 2019년 대비 18.0% 감소하였으며, 이러한 기조가 2021년까지도 이어지고 있어 2021년 3분기까지 매출액이 16,485백만원 발생하였고, 이는 전년동기 대비 24.6% 감소한 수치입니다.
| [품목별 매출액 추이] |
| (단위 : 백만원) |
|
품목 |
2021년 3분기 |
2020년 |
2019년 |
2018년 |
||||
|---|---|---|---|---|---|---|---|---|
|
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
매출액 |
비율 |
|
| 세파계 API | 798 | 4.85% | 1,426 | 5.5% | 2,452 | 7.8% | 3,358 | 10.8% |
| 일반계 API | 13,924 | 84.47% | 22,784 | 88.2% | 27,276 | 86.7% | 24,620 | 79.3% |
| 기 타 | 1,763 | 10.68% | 1,608 | 6.2% | 1,741 | 5.5% | 3,056 | 9.8% |
|
합 계 |
16,485 | 100.00% | 25,818 | 100.0% | 31,469 | 100.0% | 31,034 | 100.0% |
| 매출성장률 | -24.6% | -18.0% | 1.4% | 18.8% | ||||
| (출처: 당사 제시) 주1) 2021년 3분기 매출성장률은 전년동기대비 매출성장률입니다. |
[수익성]
당사의 최근 3년 및 2021년 3분기까지의 매출은 감소하는 추세에 있으며, 매출액이 매출원가 및 각종 판매비와관리비용을 커버하지 못하고 있고, 특히, 매출액의 32.74~51.03%를 연구개발비용으로 사용하고 있어 영업손실 및 당기순손실이 지속되고 있는 상황입니다. 최근 3년 및 2021년 3분기까지의 연결기준 평균 원가율은 92.2%를 보였으며, 평균 판매비와관리비율은 72.5%, 평균 영업이익률은 -64.7%, 평균 당기순이익률은 -70.5%를 보였습니다.
2018년에는 4,265백만원의 매출총이익으로 원가율이 86.3%였으나, 급여 2,527백만원, 지급수수료 3,858백만원, 연구개발비 9,526백만원 등 18,594백만원의 판매비와관리비가 발생하면서 14,329백만원의 영업손실이 발생하였으며, 이로 인하여 14,420백만원의 당기순손실이 발생하였습니다. 2019년에는 매출이 증가하였음에도 원가율이 상대적으로 높은 일반계API의 매출이 증가하였기 때문에 2,664백만원의 매출총이익(원가율 91.5%)이 발생하여 전년도 대비 감소하였으며, 급여 2,946백만원과 연구개발비 11,443백만원이 발생하며 16,402백만원의 영업손실이 발생하였고, 기타충당부채전입 등으로 1,749백만원의 기타비용이 발생하면서 16,879백만원의 당기순손실이 발생하였습니다.
2020년에는 매출액이 감소하면서 원가율도 93.0%로 높아지게 되었으며, 이로 인하여 1,820백만원의 매출총이익이 발생하였습니다. 연구개발비도 12,865백만원으로 증가하면서 2020년 판매비와관리비는 20,927백만원으로 증가하면서 19,107백만원의 영업손실이 발생하였습니다. 추가로 2019년에 기타충당부채로 전입하였던 금액들이 일부 환입되면서 기타수익이 2,147백만원 발생하였고, 2020년 당기순손실은 17,507백만원 발생하였습니다.
2021년 3분기까지도 매출액이 전년동기 대비 크게 감소하면서 원가율이 98.4%까지 증가하면서 269백만원의 매출총이익이 발생하였습니다. 연구개발비 7,734백만원 등에 의하여 15,815백만원의 판매비와관리비가 발생하였으며, 이로 인하여 15,545백만원의 영업손실이 발생하게 되었습니다. 또한, 영업외적으로 2020년 11월에 발행한 제2회 사모 전환사채의 유효이자율 상각으로 인하여 총 6,622백만원의 이자를 인식하면서 20,550백만원의 당기순손실이 발생하게 되었습니다.
당사의 최근 3개년 및 2021년 3분기 연결기준 판매비와 관리비 내역은 다음과 같습니다.
| [연결기준 판매비와 관리비 내역] |
| (단위 : 백만원) |
|
구 분 |
2021년 3분기 | 2020년 | 2019년 |
2018년 |
|---|---|---|---|---|
| 급여 | 4,169 | 4,095 | 2,946 | 2,527 |
| 퇴직급여 | 308 | 152 | 243 | 155 |
| 지급수수료 | 1,595 | 1,755 | 1,782 | 3,858 |
| 감가상각비 | 322 | 292 | 309 | 52 |
| 대손상각비 | (343) | (131) | 149 | 130 |
| 광고선전비 | 320 | 280 | 419 | 341 |
| 무형자산상각비 | 172 | 204 | 232 | 362 |
| 경상개발비 | 7,734 | 12,865 | 11,443 | 9,526 |
| 기타 | 1,538 | 1,415 | 1,543 | 1,643 |
| 합 계 | 15,815 | 20,927 | 19,067 | 18,594 |
| (출처: 당사 제시) |
상기와 같은 매출과 수익성에 의하여 영업이익률은 2018년 -46.2%에서 2019년 -52.1%, 2020년 -74.0%, 2021년 3분기 -94.3%로 악화되고 있는 상황이며, 당기순이익율도 2018년 -46.5%에서 2019년 -53.6%, 2020년 -67.8%, 2021년 3분기 124.7%로 악화되고 있는 상황입니다.
[향후 매출 및 수익성 개선 방안]
1) Zydus Cadila와의 세계 최초 DNA코로나 백신 생산을 통한 공급
당사는 인도 다국적 바이오제약사인 자이더스 카딜라(Zydus Cadila)의 9월 중 생산 예정인 세계 최초 pDNA 코로나 19 백신인 자이코브-디(ZyCoV-D)의 위탁생산(CMO)을 맡아 공급을 할 계획입니다. ZyCoV-D는 세계 최초의 코로나 19 pDNA 백신으로, 2021년 08월 20일 인도의약품관리국(DCGI)의 긴급사용승인으로(임상 3상 중간평가 우수) 9월 중 인도 내 ZyCoV-D 백신 접종 개시 예정이며, ZyCoV-D는 접종대상 연령이 12세 이상으로(아스트라제네카, 얀센, 스푸트니크V 등 대부분의 백신은 18세 이상 접종), 3회 접종이 필요합니다.
현재 인도 내 12세~18세 연령 인구 수는 약 1억 2천만명으로 예상하고 있으며, Zydus Cadila에서 예상하는 필요 접종수량은 총 3억 6천만 dose(3회 접종)로 예상하고 있으며, Zydus Cadila의 인도 내 생산능력(capa)은 연 최대 1억 2천만 dose 수준이며, 당사는 우선적으로 백신을 생산하여 인도부터 시작하여 국내에서의 긴급사용 신청 후 국내뿐만 아니라 글로벌로도 공급할 예정입니다.
※ 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금 중 일부에 대하여 Zydus Cadila와의 세계 최초 COVID-19 DNA코로나 백신 생산을 통한 공급자금으로 사용할 계획입니다. 해당 내용에 대해서는 제1부 모집 또는 매출에 관한 사항 - Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
2) EC-18의 구강점막염 관련 라이센스 아웃을 통한 매출 확대
당사는 신약후보물질 EC-18을 활용하여 구강점막염의 미국 FDA 임상 2상을 진행하고 있으며, 당사는 올해 임상 2상의 Topline(투약 후 안정성 결과) 결과 도출 및 이후 FDA의 혁신신약(BTD) 신청을 계획하고 있습니다. 이후 당사는 임상 3상 IND(임상시험계획승인) 신청 및 라이선스 아웃(기술이전)을 계획하고 있습니다.
| [구강점막염 치료제 개요] |
|
①구 분 |
화학합성 신약 |
|
②적응증 |
구강점막염 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전 |
|
④제품의특성 |
1) 경구투여 2) 항암치료 중 발생하는 호중구감소증에도 효과 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막염을 예방 및 치료 4) 호중구감소증, 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 5) 암의 진행을 촉진하는 인자인 STAT3를 억제함 6) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2017년 7월 28일 미국 FDA임상 2상 승인 - 2019년 5월 Stage 1 종료 - 2019년 7월 Stage 2 개시 - 2021년 4월 임상2상 환자 모집 완료 - 2021년 6월 최종 피험자 종료 (LPO) - 2021년 10월 임상2상(미국) 결과 공시 - 2021년 11월 혁신신약지정(BTD) 신청완료 |
|
⑥향후계획 |
본 보고서 작성기준일 기준 현재 2상 Stage 2 단계를 완료하여 결과공시를 제출하였으며, 분석된 결과를 바탕으로 2021년 11월 미국 FDA에 혁신신약지정(BTD) 신청완료. 또한 임상 2상 결과를 활용하여 글로벌 라이선스 아웃을 추진 중. |
|
⑦경쟁제품 |
Galera Therapeutics의 GC4419는 방사선치료에 의해 발생되는 구강점막염 치료제로 임상3상을 준비하고 있으나, 항암치료에 필수인 ROS를 억제하는 작용기전을 가지고 있어, 항암치료를 억제하는 가능성을 꾸준히 의심받고 있으며, 정맥주사를 3주~7주 동안 월요일에서 금요일까지 계속해서 맞아야 하므로, 투약이 매우 불편함. |
|
⑧관련논문등 |
Frontiers in Oncology 2016, Orall Disease 2019 |
|
⑨시장규모 |
구강점막염 세계 최고 권위자인Dr. Sonis에 따르면 구강점막염 치료제 시장 규모는 2016년 전체30억달러로 추정되고 있음. |
|
⑩기타사항 |
2018년 2월 FDA 신속심사 지정 |
| (출처: 당사 정기보고서, 전자공시) |
다만, 당사의 미국 FDA의 임상 2상 결과에 따라 당사가 예상하는 시점보다 라이선싱 아웃이 지연될 수 있으며, 투자자 여러분께서는 구강점막염의 임상 현황을 잘 숙지해 주시기 바랍니다. 이 외 라이선싱 아웃과 관련된 위험은 '사업위험 라.'를 참고해 주시기 바랍니다.
3) 기존 API 관련 사업의 매출 확대
당사는 기존 API 매출에 있어서도 1) 알츠하이머치료제, 우울증 치료제, 고지혈증 치료제 등의 신제품 마케팅 확대, 2) 조영제, 엘도스테인 등의 수출 확대, 3) 완제사와의 협업을 통한 Pro-drug 개발 및 시장 선점을 통한 매출안정화 진행 등의 노력을 하고 있습니다. 세부 품목별 매출 확대 방안은 다음과 같습니다.
| 품목 명 | 매출 확대 방안 |
|---|---|
| 알츠하이머, 우울증 치료제 | 인구구조 등 사회환경이 변화하고 질병양상이 변화됨에 따른 시장 성장가능 품목 발굴 및 DMF등록 완료, 신규 프로모션 진행 |
| 고지혈증 치료제 | 치료제 트랜드 복합제 시장 확대에 따른 틈새시장 발굴 및 DMF등록 완료, 신규 프로모션 진행 |
| 진해거담제, 항결핵제 | 향후 COVID-19의 백신 공급 확산으로 안정화될 경우 매출 회복 기대 |
| 엘도스테인 | 오리지날대비 우수한 품질과 경쟁력으로 터키/방글라데시에서 안정적으로 런칭하였고, 터키에서 매출이 꾸준히 증가 중임. |
| 조영제 | 중국 1위업체와의 협업 및 인도 고객선 확보로, 경쟁사대비 빠른 해외진출을 추진하고 있으며 추가로 유럽/미국시장 진출을 준비할 예정. |
| (출처: 당사 제시) |
이처럼 지속적인 영업손실 및 당기순손실로 인해 당사의 재무구조는 악화되어 왔으며, 추후에도 당사 파이프라인의 라이센스 아웃 및 코로나19 백신 공급 등으로 영업흑자로 전환되지 못한다면 재무구조는 계속해서 악화될 것으로 예상됩니다. 당사는 금번 주주배정 후 실권주 일반공모로 유입되는 자금을 사용하여 인도의 다국적 바이오제약사인 Zydus Cadila의 ZyCoV-D 관련 CMO사업의 매출 증가와 EC-18의 구강점막염 라이센스 아웃, 기존 API 매출 강화를 통하여 매출 및 수익성을 향상시킬 계획을 가지고 있으나, 관련 규제기관들의 기준 강화에 따른 생산 및 공급 차질, 라이센스 아웃의 실패 등 차질이 발생할 경우 당사 매출 및 수익성에 부정적인 영향이 있을 수 있습니다. 또한, 당사 예상보다 적은 매출이 발생하여 당사가 사용하고 있는 연구개발비를 포함한 판매비관리비와 각종 비용 등을 커버하지 못할 경우 수익성이 악화될 위험도 이있습니다. 투자자께서는 이 점 유의하시기 바랍니다.
[재무안정성 악화 위험]
| 나. 당사는 2021년 3분기 말 연결기준 57,679백만원의 부채가 있으며, 부채비율은 70.0%, 차입금의존도는 35.7%입니다. 한편, 당사는 인도의 다국적 바이오제약사인 Zydus Cadila의 세계 최초 pDNA 코로나19 백신인 ZyCoV-D에 대한 공급계약 관련 LOI를 체결하였으며, 2022년 02월 생산을 목표로 약 4개월분의 CMO생산비용(원/부자재, 세포주, 배양액 등)이 선제적으로 필요하여 KB증권으로부터 1,500억원의 브릿지론을 Zydus Cadila 간 본 계약 체결 이후에 단기 차입할 계획입니다. 다만, 당사의 본계약 체결일 및 단기자금대출일을 2021년 10월 중으로 최초 예상하였으나, 현재 본계약 체결일정이 지연되고 있어 현재까지 단기자금대출이 진행되지 않은 상황입니다. 단기자금대출은 본 계약 체결 이후 진행될 예정이나, 현재까지 본 계약 체결일이 확정되지 않아 단기자금대출일 또한 미정인 상황입니다. 이후 브릿지론은 금번 주주배정 후 실권주 일반공모를 통한 자금이 유입될 시 납입일로부터 3영업일 이내에 상환할 계획에 있습니다. 이에 따라 당사의 차입금이 일시적으로 크게 증가하게 될 예정입니다. 당사의 2021년 3분기 말 연결기준 부채비율은 70.0%, 차입금의존도는 35.7%이며, 최근 3년 및 2021년 3분기까지 지속적인 영업손실 및 당기순손실의 발생으로 인하여 재무안정성 지표가 악화되어 왔습니다. 당사는 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금을 통하여 매출 및 수익성을 개선하여 재무구조 개선을 위한 노력을 지속할 예정입니다. 그럼에도 불구하고 부정적인 경기 및 산업 동향으로 인한 손실 발생과 신규 사업에 대한 자금 투입 대비 실적 부진, 유동자금 부족 등에 의하여 금융기관 등으로부터 차입금 만기 연장 거부 등에 따른 차입금 상환 부담이 일시적으로 가중될 수 있습니다. |
당사는 2021년 3분기 말 연결기준 57,679백만원의 부채가 있으며, 부채비율은 70.0%, 차입금의존도는 35.7%입니다. 당사는 지속적인 영업손실과 당기순손실 발생, 적자를 충당하기 위한 시장에서의 자금조달로 인해 최근 3년동안 연결기준으로 부채비율이 2018년말 14.0%에서 2020년말 70.8%, 차입금의존도가 2018년말 5.8%에서 2020년말 34.8%로 재무지표가 악화되었으나, 2021년 02월 약 300억원의 전환우선주를 발행하면서 2021년 3분기 말 연결기준으로 부채비율 70.0%, 차입금의존도 35.7%로 부채비율이 소폭 개선되는 모습을 보이고 있습니다. 당사의 최근 3년 및 2021년 3분기까지의 재무안정성 지표 추이는 다음과 같습니다.
| [연결기준 재무안정성 지표 추이] |
| (단위 : 백만원) |
| 구분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 |
|---|---|---|---|---|
| 자산총계(A) | 140,034 | 123,802 | 84,991 | 67,045 |
| 유동자산 | 120,451 | 104,999 | 63,236 | 50,224 |
| 비유동자산 | 19,583 | 18,803 | 21,755 | 16,822 |
| 부채총계(B) | 57,679 | 51,320 | 10,951 | 8,229 |
| 유동부채 | 13,117 | 9,784 | 7,499 | 6,441 |
| 비유동부채 | 44,562 | 41,536 | 3,452 | 1,788 |
| - 총차입금(C) | 50,037 |
43,067 | 3,090 | 3,870 |
| - 단기차입금(유동성장기부채 포함) | 7,967 | 5,438 | 2,614 | 3,570 |
| - 장기차입금 | 3,892 | 6,041 | - | 300 |
| - 전환사채 | 37,701 | 31,078 | - | - |
| 자본총계(D) | 82,354 | 72,483 | 74,041 | 58,817 |
| 부채비율(B/D) | 70.0% | 70.8% | 14.8% | 14.0% |
| 총차입금 의존도(C/A) | 35.7% | 34.8% | 3.6% | 5.8% |
| (출처: 당사 제시) |
당사의 부채 중 가장 큰 비중을 차지하고 있는 차입금은 2021년 3분기 말 연결기준 50,037백만원으로 당사의 차입금의존도는 35.7%를 보이고 있습니다. 2021년 3분기 말 연결기준 차입금에 대한 분류를 해보면, 단기차입금(유동성장기부채 포함) 7,967백만원, 장기차입금 3,892백만원, 전환사채 37,701백만원, 장단기리스부채 478백만원으로 구성되어 있습니다.
장단기차입금 중 담보설정된 차입금은 당사의 제천공장이 담보로 제공되어 있는 기업은행의 차입금 4,500백만원(담보설정금액 : 12,415백만원, 장부가액 7,347백만원) 및 오송의 토지 및 단기금융상품(담보설정금액 : 9,240백만원, 장부금액 7,323백만원)이 담보로 제공되어 있는 산업은행의 차입금 7,358백만원이 있습니다.
| [2021년 3분기 말 연결기준 차입금 상세내역] |
|
| (단위: 백만원) | |
| 차입금 구분 | 차입처 | 내역 | 이자율(%) | 2021년 3분기 | 담보제공자산 |
|---|---|---|---|---|---|
| 단기차입금 | 산업은행 | 운영자금 | 2.06 | 1,600 | 단기금융상품 |
| 운영자금 | 3.46 | 2,000 | 토지(오송) | ||
| 기업은행 | 운영자금 | 2.84 | 1,500 | 토지(제천), 건물, 구축물, 기계장치, 화재보험부보금액 | |
| 소 계 | 5,100 | - | |||
| 장기차입금 | 산업은행 | 시설자금 | 2.36 | 3,758 | 토지(오송) |
| 기업은행 | 시설자금 | 3.44 | 3,000 | 토지(제천), 건물, 구축물, 기계장치, 화재보험부보금액 | |
| 소 계 | 6,758 | - | |||
| (유동성장기부채) | (2,867) | - | |||
| 합 계 | 11,858 | - | |||
| (출처: 당사 제시) |
상기 차입금에 관하여 당사의 상환계획은 아래와 같습니다.
| [주요 차입금 상환계획] |
| (단위: 백만원) |
| 차입금 구분 | 차입처 | 내역 | 이자율(%) | 2021년 3분기 | 주요 상환일정 | |
|---|---|---|---|---|---|---|
| 2021년 4분기 | 2022년 | |||||
| 단기차입금 | 산업은행 | 운영자금 | 2.06 | 1,600 | - | 1,600 |
| 운영자금 | 3.46 | 2,000 | - | 2,000 | ||
| 기업은행 | 운영자금 | 2.63 | 1,500 | 1,500 | - | |
| 소 계 | 5,100 | 1,500 | 3,600 | |||
| 장기차입금 | 산업은행 | 시설자금 | 2.36 | 3,758 | 342 | 3,417 |
| 기업은행 | 시설자금 | 3.44 | 3,000 | 375 | 2,625 | |
| 소 계 | 6,758 |
717 | 6,042 | |||
| 합 계 | 11,858 |
2,217 | 9,042 | |||
| (출처: 당사 제시) |
다만, 상기 차입금 상환 계획은 당사의 계획일 뿐, 증권신고서 제출일 현재까지 예상하지 못한 변수가 발생하거나 당사 영업환경이 악화될 시 금융기관으로부터 긴급한 상환 요청이 발생할 수 있습니다. 금융기관의 상환요청에도 불구하고 당사의 자금여력이 부족하여 상환하지 못할 경우 당사의 신용도가 크게 하락할 수 있으며, 이는 당사의 사업에도 부정적인 영향을 미칠 수 있음을 유의해주시기 바랍니다.
또한, 당사는 증권신고서 제출 전일 기준으로 2020년 11월 06일에 발행하였던 2회차 사모 전환사채 50,000백만원이 남아있는 상황이며, 최초 전환청구기간은 발행일로부터 1년 후인 2021년 11월 06일부터이며, 조기상환 청구기간은 발행일로부터 2년 후인 2022년 11월 06일부터로, 최초 전환가액은 100,196원(최저 Re-Fixing 전환가액 : 70,138원)입니다. 향후 조기상환청구일까지 당사의 주가가 전환가액보다 지속적으로 하회할 경우 투자자들로부터 조기상환청구권이 청구될 가능성이 있으며, 이에 따라 당사는 유동성 위기가 올 수 있습니다. 당사의 미상환 전환사채 발행 현황은 다음과 같습니다.
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 71,081원 | 50,000 | 703,422 |
| 소 계 | 50,000 | 703,422 | ||||||||
| (출처: 당사 제시) 주1) 전환가액은 시가 하락에 따라 조정된 전환가액입니다. |
한편, 당사는 인도의 다국적 바이오제약사인 Zydus Cadila의 세계 최초 pDNA 코로나19 백신인 ZyCoV-D에 대한 공급계약 관련 LOI를 체결하였으며, 2022년 02월 생산을 목표로 약 4개월분의 CMO생산비용(원/부자재, 세포주, 배양액 등)이 선제적으로 필요하여 KB증권으로부터 1,500억원의 브릿지론을 Zydus Cadila 간 본 계약 체결 이후에 단기 차입할 계획입니다. 이후 브릿지론은 금번 주주배정 후 실권주 일반공모를 통한 자금이 유입될 시 납입일로부터 3영업일 이내에 상환할 계획에 있습니다. 이에 따라 당사의 차입금이 일시적으로 크게 증가하게 될 예정입니다. 차입 진행 시 본 증권신고서를 통해 추가적으로 안내드릴 예정입니다.
다만, 당사의 본계약 체결일 및 단기자금대출일을 2021년 10월 중으로 최초 예상하였으나, 현재 본계약 체결일정이 지연되고 있어 현재까지 단기자금대출이 진행되지 않은 상황입니다. 단기자금대출은 본 계약 체결 이후 진행될 예정이나, 현재까지 본 계약 체결일이 확정되지 않아 단기자금대출일 또한 미정인 상황입니다.
| [ 단기자금대출의 주요 금융조건 ] |
| 구분 | 내용 |
|---|---|
| 대주 | KB증권 |
| 대출금액 | 금 150,000백만원(\ 150,000,000,000) |
| 만기 | 차입일로부터 6개월 |
| 차입예정일 | 본 계약 체결 이후(미정) |
| 대출금리 | 고정 (연) 3.90% |
| 자금사용 목적 | 코로나19 백신인 ZyCoV-D CMO 생산비용 |
| 의무 상환 | 유상증자 대금납입 후 3영업일 이내 조기상환 |
당사의 2021년 3분기 말 연결기준 부채비율은 70.0%, 차입금의존도는 35.7%이며, 최근 3년 및 2021년 3분기까지 지속적인 영업손실 및 당기순손실의 발생으로 인하여 재무안정성 지표가 악화되어 왔습니다. 당사는 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금을 통하여 매출 및 수익성을 개선하여 재무구조 개선을 위한 노력을 지속할 예정입니다. 그럼에도 불구하고 부정적인 경기 및 산업 동향으로 인한 손실 발생과 신규 사업에 대한 자금 투입 대비 실적 부진, 유동자금 부족 등에 의하여 금융기관 등으로부터 차입금 만기 연장 거부 등에 따른 차입금 상환 부담이 일시적으로 가중될 수 있습니다. 투자자 여러분께서는 이 점 유의하여 투자해 주시기 바랍니다.
[매출채권 회수 지연 가능성에 따른 위험]
| 다. 당사의 최근 3년 및 2021년 3분기 동안 매출채권 내역을 살펴보면, 대부분은 6개월 이하의 매출채권인 상황이며, 2021년 3분기를 제외하고는 매출액에 연동하여 변동하고 있는 상황입니다. 매출채권 회전율의 경우 최근 3년 및 2021년 3분기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 4.09회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 72.2일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다. 매출채권의 연령분석을 해보았을 때, 대부분의 매출채권은 6개월 이하이며, 이에 따라 대손충당금설정률은 2021년 3분기 말 연결기준 10.7%로 크지 않은 상황이며, 자산총계 대비 매출채권 장부가액은 약 3.2%로 매출채권 미회수에 따라 당사 재무구조에 유의적으로 부정적인 영향을 미칠 가능성은 낮은 것으로 판단되고 있습니다. 그러나, 매출채권 및 미수금 부실 방지에 대한 적극적인 노력이 미진할 경우 당사의 자금수지 및 재무상태에 악영향을 줄 수 있으며, 충당금 설정율이 높아질 경우 손익에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자해 주시기 바랍니다. |
당사는 매출채권 등에 대해 발생할 것으로 예상되는 손실에 대해 충당금을 설정하고 있습니다. 이 충당금은 개별적으로 유의적인 항목에 대한 구체적인 손상차손과 유사한 특성을 가진 금융자산 집합에서 발생되었으나 아직 식별되지 않은 손상으로 구성됩니다. 금융자산 집합의 충당금은 유사한 금융자산의 회수에 대한 과거 자료에 근거하여 결정되고 있습니다.
당사의 최근 3년 및 2021년 3분기동안 매출채권 내역을 살펴보면, 대부분은 6개월 이하의 매출채권인 상황이며, 2021년 3분기를 제외하고는 매출액에 연동하여 변동하고 있는 상황입니다. 2018년에는 8,433백만원의 매출채권 총액이 있었으며, 대손충당금 863백만원(대손충당금설정률 10.2%)로 매출채권 순액은 7,570백만원이 있었습니다. 2019년에는 매출액이 소폭 증가하면서 매출채권 총액 또한 9,681백만원으로 증가하였으나, 대손충당금도 1,012백만원(대손충당금설정률 10.5%)로 증가하면서 매출채권 순액은 8,669백만원이 되었습니다. 2020년에는 매출액이 크게 감소하면서 매출채권 총액도 5,067백만원으로 감소하였으며, 대손충당금 장부가액은 881백만원으로 크게 변동하지 않으면서 대손충당금설정률이 17.4%로 크게 증가하였으며, 매출채권 순액은 4,186백만원이 되었습니다. 2021년 3분기까지는 매출액이 크게 감소한 것에 반하여 매출채권은 총액은 5,044백만원으로 증가하였으며, 대손충당금은 538백만원으로 크게 변동하지 않아 대손충당금설정률은 10.7%로 감소하였으며, 매출채권 순액은 4,506백만원이 되었습니다.
매출채권 회전율의 경우 최근 3년 및 2021년 3분기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 4.09회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 91.1일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다.
| [당사 연결기준 매출채권 현황] | |
| (K-IFRS 연결기준) | (단위: 백만원) |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 매출채권 총액 | 5,044 | 5,067 | 9,681 | 8,433 | |
| - 6개월 이하 | 4,503 | 4,169 | 8,539 | 7,315 | |
| - 6개월 초과 1년 이하 | - | - | 117 | 186 | |
| - 1년 초과 | 541 | 898 | 1,024 | 932 | |
| 대손충당금 | 538 | 881 | 1,012 | 863 | |
| 대손충당금 설정률 | 10.7% | 17.4% | 10.5% | 10.2% | 대손충당금 / 매출채권 총액 |
| 매출채권 순액 | 4,506 | 4,186 | 8,669 | 7,570 | |
| 매출액 | 16,485 | 25,818 | 31,469 | 31,034 | |
| 매출채권 회전율 | 5.06회 | 4.02회 | 3.88회 | 3.40회 | 매출액 / {(전기매출채권 장부가액+당기매출채권 장부가액)/2} |
| 매출채권 회전일수 | 72.2일 | 90.9일 | 94.2일 | 107.3일 | 365/매출채권회전율 |
| (출처: 당사 제시) 주1) 2021년 3분기 매출채권회전율 및 매출채권회전일수의 경우 2021년 3분기 누적 매출액을 단순 연환산하여 산출하였습니다. |
미수금의 경우 2021년 3분기말 연결기준으로 707백만원 중 대손충당금 500백만원을 설정하여 207백만원의 장부가액이 남아있는 상황입니다. 대손충당금 500백만원의 경우 대부분 대상처의 부도로 인하여 쌓아두고 있는 상황이며, 향후 충당금을 상각할 계획을 가지고 있습니다. 나머지 금액의 경우 임직원 복지를 위한 금액 등으로 인하여 회수가 가능할 것으로 판단되고 있습니다.
| [당사 연결기준 미수금 현황] | |
| (K-IFRS 연결기준) | (단위: 백만원) |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 미수금 총액 | 707 | 585 | 589 | 574 | |
| 대손충당금 | (500) | (500) | (500) | (500) | |
| 대손충당금 설정률 | 70.7% | 85.4% | 84.8% | 87.1% | 대손충당금 / 미수금 총액 |
| 미수금 순액 | 207 | 85 | 89 | 74 |
| (출처: 당사 제시) |
매출채권의 연령분석을 해보았을 때, 대부분의 매출채권은 6개월 이하이며, 이에 따라 대손충당금설정률은 2021년 3분기 말 연결기준 10.7%로 크지 않은 상황이며, 자산총계 대비 매출채권 장부가액은 약 3.2%로 매출채권 미회수에 따라 당사 재무구조에 유의적으로 부정적인 영향을 미칠 가능성은 낮은 것으로 판단되고 있습니다. 그러나, 매출채권 및 미수금 부실 방지에 대한 적극적인 노력이 미진할 경우 당사의 자금수지 및 재무상태에 악영향을 줄 수 있으며, 충당금 설정율이 높아질 경우 손익에 부정적인 영향을 미칠 수 있습니다. 투자자께서는 이 점 유의하시어 투자해 주시기 바랍니다.
[재고자산 진부화 위험]
| 라. 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 당사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 3분기말 연결기준 32.8%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 3분기에는 약 2.6회로 감소하고 있는 상황입니다. 코로나19의 지속적인 영향으로, 당사의 제품이 경쟁업체들과의 경쟁심화로 매출단가가 하락하고, 원재료 가격 상승에 의하여 생산단가가 증가할 경우, 회사 입장에서는 재고 보관비용의 증가, 재고자산의 노후화 위험을 동시에 부담할 가능성이 높아질 수 있으며, 재고자산회전율의 감소 및 평가충당금 설정의 위험이 있습니다. 또한, 신규로 시작할 코로나 백신 관련 매출에 있어서 유관기관들의 부정적인 정책 시행이나, 생산에 차질이 있을 경우 매입한 원재료들의 지분화 가능성 또한 있을 수 있습니다. |
당사는 재고자산은 원가와 순실현가능가치 중 작은 금액으로 표시되고, 재고자산의 원가는 총평균법(단, 미착품은 개별법)에 따라 결정하며, 매 회계연도의 결산기에 회사 및 감사인의 입회에 따라 실지 재고조사를 실시하여 그 기록을 조정하고 있고, 분반기에는 회사 자체적으로 실지 재고조사를 실시하고 있습니다. 당사의 최근 3년 및 2021년 3분기 기준 재고자산 현황은 다음과 같습니다.
| [당사 연결기준 재고자산 현황] |
| (단위 : 백만원) |
|
구 분 |
2021년 3분기 | 2020년 | 2019년 | 2018년 | |
|---|---|---|---|---|---|
| 제 품 | 취득원가 | 6,278 | 8,162 | 5,700 | 5,084 |
| 평가충당금 | (2,462) | (1,772) | (1,341) | (839) | |
| 장부가액 | 3,816 | 6,390 | 4,358 | 4,245 | |
|
상품 |
취득원가 | 357 | 589 | 294 | 310 |
| 평가충당금 | (171) | (3) | (1) | - | |
| 장부가액 | 186 | 587 | 293 | 310 | |
|
재공품 |
취득원가 | 406 | 158 | 226 | 223 |
| 평가충당금 | (31) | (78) | (58) | (19) | |
| 장부가액 | 375 | 81 | 168 | 204 | |
|
원재료 |
취득원가 | 3,908 | 3,082 | 3,579 | 2,811 |
| 평가충당금 | (1,033) | (962) | (736) | (448) | |
| 장부가액 | 2,876 | 2,120 | 2,843 | 2,364 | |
| 저장품 | 장부금액 | - | - | - | 5 |
| 미착품 | 취득원가 | 320 | - | 184 | - |
| 평가충당금 | - | - | - | - | |
| 장부가액 | 320 | - | 184 | - | |
|
합 계 |
취득원가 | 11,269 | 11,992 | 9,983 | 8,434 |
| 평가충당금 | (3,697) | (2,814) | (2,137) | (1,306) | |
| 장부가액 | 7,572 | 9,178 | 7,847 | 7,128 | |
|
총자산대비 재고자산 구성비율(%) |
5.4% | 7.4% | 9.2% | 10.6% | |
|
재고자산회전율(회) |
2.6회 | 2.8회 | 3.8회 | 3.8회 | |
|
(출처: 당사 제시) 주1) 총자산대비 재고자산 구성비율(%) = [재고자산÷기말자산총계×100] 주2) 재고자산회전율 = [연환산 매출원가÷{(기초재고+기말재고)÷2}] |
당사는 K-IFRS 회계기준서에 의거 연령별 재고잔액 기준을 설정하고 있으며, 1년 이상 재고에 대해서는 50%, 2년 이상 재고에 대해서는 80%, 3년 이상 재고에 대해서는 100% 평가충당금을 설정하고 있습니다. 당사의 재고자산의 경우 평균 유효사용기한이 약 3년이며, 대부분의 재고자산들은 유효기간 이내에 모두 매출로 이어지고 있는 상황이나, 회계기준에 맞추어 매년 연령평가 충당금을 설정하고 있는 상황입니다.
특히 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 당사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 3분기 말 연결기준 32.8%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 3분기에는 약 2.6회로 감소하고 있는 상황입니다.
당사는 향후 매출단가가 하락추세를 보이고 있는 저부가가치 품목을 2020년부터 정리하고 있으며, 조영제 및 첨단소재같은 신규 고부가가치 제품과 기존 사이크로세린, 사포그릴레이트 등 고부가가치제품의 영업망을 넓혀 재고자산의 회전율 상승 및 평가충당금 설정의 최소화를 위하여 노력할 예정입니다. 추가로, 2021년 3분기 말 연결기준으로 당사의 총 자산 대비 재고자산의 구성비율은 5.4%이기 때문에 재고자산의 추가적인 평가충당이 당사 재무구조에 유의적으로 부정적인 영향이 있을 가능성은 적을 것으로 판단하고 있습니다.
그럼에도 불구하고 향후에도 코로나19의 지속적인 영향으로, 당사의 제품이 경쟁업체들과의 경쟁심화로 매출단가가 하락하고, 원재료 가격 상승에 의하여 생산단가가 증가할 경우, 회사 입장에서는 재고 보관비용의 증가, 재고자산의 노후화 위험을 동시에 부담할 가능성이 높아질 수 있으며, 재고자산회전율의 감소 및 평가충당금 설정의 위험이 있습니다. 또한, 신규로 시작할 코로나 백신 관련 매출에 있어서 유관기관들의 부정적인 정책 시행이나, 생산에 차질이 있을 경우 매입한 원재료들의 지분화 가능성 또한 있을 수 있습니다. 투자자 여러분께서는 이 점 유의하여 투자해 주시기 바랍니다.
[회사의 유동성 관련 위험]
| 마. 당사는 연결기준 최근 3년 및 2021년 3분기까지 지속적으로 음(-)의 영업활동현금흐름과 투자활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름과 투자활동현금흐름을 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 당사의 최근 3년 및 2021년 3분기동안 유동비율은 2018년 779.8%에서 2021년 3분기 818.4%, 당좌비율은 669.1%에서 2021년 3분기 860.5%로변동하고 있습니다. 이는 2020년까지 증가하는 추세였으나, 2021년 3분기 기준으로 유동비율 및 당좌비율이 전년대비 감소하고 있습니다. 지속적인 영업손실과 당기순손실에도 유동성이 개선되고 있는 사유는 전환우선주 발행에 따른 유동자산 증가와 전환사채 발행에 따른 비유동부채 계상 및 유동자산 증가가 주된 원인입니다. 당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으며, 2021년 3분기 말 기준 연결기준으로 유동비율 818.4%, 당좌비율 860.5%로 안정적인 유동성 지표를 보이고 있어 단기적인 유동성 이슈가 발생할 가능성은 적을 것으로 판단하고 있습니다. 그러나 대내외적 환경이 급격하게 침체되거나 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있으며, 향후 제2회차 사모 전환사채 500억원의 조기상환청구권 행사 등에 의하여 유동성 위기가 발생할 수 있습니다. 투자자들께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다 |
당사는 연결기준 최근 3년 및 2021년 3분기까지 지속적으로 음(-)의 영업활동현금흐름과 투자활동현금흐름을 보이고 있으며, 이러한 음(-)의 영업활동현금흐름과 투자활동현금흐름을 재무활동현금흐름을 통하여 충당하고 있는 상황입니다. 2021년 3분기 말 연결기준 당사는 8,471백만원의 현금 및 현금성자산을 보유하고 있습니다. 당사의 최근 3년간 및 2021년 3분기까지의 요약 연결 현금흐름 추이는 다음과 같습니다.
| [당사 연결기준 현금흐름 추이] |
| (단위: 백만원) |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 |
|---|---|---|---|---|
|
영업활동현금흐름 |
(11,344) | (14,021) | (15,095) | (13,525) |
| - 당기순이익 | (20,550) | (17,507) | (16,879) | (14,420) |
| - 현금의 유출이 없는 비용등의 가감 | 7,049 | 913 | 2,233 | 1,478 |
| - 영업활동으로인한자산ㆍ부채의변동 | 1,944 | 2,144 | (592) | (465) |
| - 이자수취 | 451 | 702 | 355 | 138 |
| - 이자지급 | (279) | (231) | (164) | (242) |
| - 법인세 납부(환급) | 40 | (41) | (47) | (12) |
|
투자활동현금흐름 |
(12,188) | (45,242) | (18,057) | (36,038) |
| - 단기금융상품의 처분 | 70,512 | 63,916 | 18,783 | 13,750 |
| - 단기금융상품의 취득 | (80,667) | (109,416) | (30,468) | (44,417) |
|
재무활동현금흐름 |
30,119 | 58,827 | 30,904 | 47,236 |
| - 단기차입금의 증감 | 720 | 1,766 | (1,256) | (1,716) |
| - 장기차입금의 증감 | (342) | 7,100 | - | - |
| - 보통주 증자 | 101 | 225 | 6,314 | 48,949 |
| - 전환우선주 발행 | 30,001 | - | 26,497 | - |
| - 전환사채의 증가 | - | 49,996 | - | - |
|
기초현금및현금성자산 |
1,858 | 2,306 | 4,541 | 6,863 |
|
기말현금및현금성자산 |
8,471 | 1,858 | 2,306 | 4,541 |
| (출처: 당사 제시) |
영업활동현금흐름의 경우 2018년 당기순손실 14,420백만원이 발생하였으며, 감가상각비 1,171백만원 등 현금의 유출이 없는 비용등의 가감 1,478백만원이 있었으나,-13,525백만원 영업활동현금흐름이 발생하였습니다. 2019년에도 당기순손실 16,879백만원이 발생하였으며, 감가상각비 1,714백만원, 퇴직급여 515백만원 등 현금의 유출이 없는 비용등의 가감 2,233백만원이 있었으나, -15,095백만원의 영업활동현금흐름이 발생하였습니다. 2020년의 경우에도 17,507백만원의 당기순손실이 발생하였으며, 감가상각비 1,832백만원, 이자비용 1,430백만원 등 913백만원의 현금의 유출이 없는 비용등의 가감이 있었고, 매출채권 감소 4,572백만원 등으로 2,144백만원의 영업활동으로인한자산ㆍ부채의변동이 있었으나, -14,021백만원의 영업활동현금흐름이 발생하였습니다. 2021년 3분기까지도 20,550백만원의 당기순손실이 발생하였고, 2회차 사모 전환사채의 유효이자율 상각액 등으로 인한 이자비용 6,909백만원과 1,364백만원의 감가상각비 등으로 7,049백만원의 현금의 유출이 없는 비용등의 가감이 있었으나 -11,344백만원의 영업활동현금흐름이 발생하였습니다.
투자활동현금흐름의 경우 당사는 유휴 유동성 현금 및 현금성자산에 대하여 단기금융상품에 투자하여 이자수익을 발생시키고 있으며, 운영자금을 위하여 단기금융상품을 처분하여 유동성을 확보하고 있어 매년 대규모의 단기금융상품 처분 및 취득이 발생하고 있는 상황입니다. 이에 따라 2018년에는 단기금융상품의 취득 44,417백만원과 처분 13,750백만원 등으로 -36,038백만원의 투자활동현금흐름이 발생하였고, 2019년에는 단기금융상품의 취득 30,468백만원과 처분 18,783백만원 등으로 - 18,057백만원의 투자활동현금흐름이 발생하였습니다. 2020년에도 단기금융상품의 취득 109,416백만원과 63,916백만원의 처분 등으로 -45,242백만원의 투자활동현금흐름이 발생하였으며, 2021년 3분기까지도 단기금융상품의 취득 80,667백만원과 처분 70,512백만원으로 -12,188백만원의 투자활동현금흐름이 발생하게 되었습니다.
재무활동현금흐름의 경우 상기 음(-)의 영업활동현금흐름과 투자활동현금흐름을 충당하기 위하여 현금이 유입되고 있는 상황입니다. 2018년에는 IPO에 따라 회사에 48,949백만원의 자금이 유입되었으며, 단기차입금이 1,716백만원 감소 등으로 47,236백만원의 재무활동현금흐름이 유입되었으며, 2019년에는 전환우선주 발행 26,497백만원과 보통주 유상증자 6,314백만원, 단기차입금 감소 1,256백만원 등으로 30,904백만원의 재무활동현금흐름이 발생하였습니다. 2020년에는 단기차입금 1,766백만원의 증가와 장기차입금 7,100백만원의 증가 등으로 인하여 58,827백만원의 재무활동현금흐름이 유입되었으며, 2021년 3분기에는 전환우선주 발행 30,001백만원, 단기차입금 720백만원의 증가 등으로 30,119백만원의 재무활동현금흐름이 발생하였습니다.
한편, 당사의 최근 3년 및 2021년 3분기동안 유동비율은 2018년 779.8%에서 2021년 3분기 818.4%, 당좌비율은 2018년 669.1%에서 2021년 3분기 860.5%로 변동하고 있습니다. 이는 2020년까지 증가하는 추세였으나, 2021년 3분기 기준으로 유동비율 및 당좌비율이 전년대비 감소하고 있습니다. 다만, 지속적인 영업손실과 당기순손실에도 유동성이 안정적인 사유는 전환우선주 발행에 따른 유동자산 증가와 전환사채 발행에 따른 비유동부채 계상 및 유동자산 증가가 주된 원인입니다.
| [최근 3년 및 2021년 3분기 연결기준 당사 유동성 관련 비율] |
| 구 분 | 2021년 3분기 | 2020년 | 2019년 | 2018년 | 비 고 |
|---|---|---|---|---|---|
| 유동비율 | 818.4% | 1,073.2% | 843.3% | 779.8% | 유동자산 / 유동부채 |
| 당좌비율 | 860.5% | 979.4% | 738.6% | 669.1% | 당좌자산 / 유동부채 |
| (출처: 당사 제시) |
당사는 현금흐름 및 유동성에 대하여 지속적으로 모니터링하면서 유동성 이슈가 발생하지 않도록 대응하고 있으며, 2021년 3분기 말 기준 연결기준으로 유동비율 818.4%, 당좌비율 860.5%로 안정적인 유동성 지표를 보이고 있어 단기적인 유동성 이슈가 발생할 가능성은 적을 것으로 판단하고 있습니다. 그러나 대내외적 환경이 급격하게 침체되거나 지속적으로 영업 성과에 부정적인 영향으로 음(-)의 영업활동현금흐름이 발생할 경우 장기적으로 회사의 현금흐름에 문제가 발생할 소지가 있으며, 향후 제2회차 사모 전환사채 500억원의 조기상환청구권 행사 등에 의하여 유동성 위기가 발생할 수 있습니다. 투자자들께서는 회사의 현금흐름 및 유동성 관련 위험요인을 면밀히 검토하시고 투자에 임해주시기 바랍니다
[최대주주의 지분율 희석화에 따른 위험]
| 바. 증권신고서 제출일 전일 기준, 당사의 최대주주인 (주)브리짓라이프사이언스는 당사의 기명식 보통주 961,780주(지분율 11.5%)를 보유하고 있으며, 2대주주인 손기영은 당사의 기명식 보통주는 578,361주(지분율 6.9%)를 보유하고 있습니다. 최대주주및 특수관계인 4인을 포함 시 당사의 최대주주 및 특수관계인들이 보유하고 있는 주식은 1,561,741주로 지분율은 18.7%입니다. 최대주주인 (주)브리짓라이프사이언스 및 손기영은 금번 주주배정 후 실권주 일반공모 유상증자에서 배정된 물량의 약 10%이상 참여할 계획입니다. 만약 최대주주인 (주)브릿지라이프사이언스가 배정물량의 약 10% 참여 시 유상증자 후 최대주주의 지분율은 현재 11.5%에서 7.5%까지 감소할 수 있으며, 특수관계인 중 2대주주인 손기영이 배정물량의 약 10% 참여 및 기타 특수관계인들은 미참여를 가정할 시 최대주주 및 특수관계인이 보유하고 있는 지분율은 증권신고서 제출일 전일 기준 18.7%에서 유상증자 후 12.1%까지 감소할 수 있습니다. 유상증자 후 잠재주식 수가 모두 행사되었음을 고려 시 최대주주 등 지분율은 11.2%까지 감소될 수 있으며, 이는 각기 행사가액이 시가하락에 의한 전환가액 조정시 추가적으로 하락할 수 있습니다. 최대주주 및 특수관계인의 낮은 지분율은 적대적 M&A등의 위험성을 내포할 수 있으며, 이러한 점은 경영진 변동의 위험성으로 이어져 안정적인 경영활동이 어려울 수 있습니다. 유상증자 후 잠재주식 수 모두 전환을 고려할 시 추가적으로 하락할 가능성이 있어 경영권 안정성에 대해서는 안심할 수 없는 상황입니다. 투자자분들은 투자 시, 이 점 유의해주시기 바랍니다. |
증권신고서 제출일 전일 기준, 당사의 최대주주인 (주)브리짓라이프사이언스는 당사의 기명식 보통주 961,780주(지분율 11.5%)를 보유하고 있으며, 2대주주인 손기영은 당사의 기명식 보통주는 578,361주(지분율 6.9%)를 보유하고 있습니다. 최대주주및 특수관계인 4인을 포함 시 당사의 최대주주 및 특수관계인들이 보유하고 있는 주식은 1,561,741주로 지분율은 18.7%입니다. 증권신고서 제출 전일 기준 당사의 최대주주 및 특수관계인의 당사 주식 보유 현황은 다음과 같습니다.
| [당사 최대주주 및 특수관계인의 주식 보유 현황] |
| (단위 : 주) |
| 성 명 | 관 계 | 주식의 종류 | 소유주식수 및 지분율 | |
|---|---|---|---|---|
| 주식수 | 지분율 | |||
| 브리짓라이프사이언스 | 최대주주 | 보통주 | 961,780 | 11.5% |
| 손기영 | 특수관계인 | 보통주 | 578,361 | 6.9% |
| 이종수 | 특수관계인 | 보통주 | 17,000 | 0.2% |
| 정재한 | 특수관계인 | 보통주 | 2,000 | 0.0% |
| 김해기 | 특수관계인 | 보통주 | 2,600 | 0.0% |
| 계 | 보통주 | 1,561,741 | 18.7% | |
금번 당사의 주주배정 후 실권주 일반공모 유상증자로 인하여 구주주들은 1주당 0.6084623101주의 배정주식(신주인수권증서)를 교부받게 됩니다.(다만, 신주배정기준일 현재 신주배정비율은 전환우선주, 주식관련사채의 전환권 행사, 주식매수청구권의 행사, 자기주식수의 변동 등으로 변경될 수 있습니다.) 최대주주인 (주)브리짓라이프사이언스 및 손기영은 금번 주주배정 후 실권주 일반공모 유상증자에서 배정된 물량의 약 10%이상 참여할 계획입니다.
만약 최대주주인 (주)브릿지라이프사이언스가 배정물량의 약 10% 참여 시 유상증자 후 최대주주의 지분율은 현재 11.5%에서 7.5%까지 감소할 수 있으며, 특수관계인 중 2대주주인 손기영이 배정물량의 약 10% 참여 및 기타 특수관계인들은 미참여를 가정할 시 최대주주 및 특수관계인이 보유하고 있는 지분율은 증권신고서 제출일 전일 기준 18.7%에서 유상증자 후 12.1%까지 감소할 수 있습니다.
| [최대주주 및 특수관계인 청약율에 따른 지분변동 가정] |
| (단위 : 주) |
| 성 명 | 현재 소유주식 수 | 유상증자 배정 물량 |
유상증자 후 | 유상증자 후 (잠재주식수 모두 전환 시) |
|||
|---|---|---|---|---|---|---|---|
| 주식수 | 지분율 | 주식수 | 지분율 | 주식수 | 지분율 | ||
| 브리짓라이프사이언스 | 961,780 | 11.5% | 585,206 | 1,020,301 | 7.5% | 1,020,301 | 6.9% |
| 손기영 | 578,361 | 6.9% | 351,910 | 613,552 | 4.5% | 613,552 | 4.2% |
| 기타 특수관계인 | 21,600 | 0.3% | 13,142 | 21,600 | 0.2% | 21,600 | 0.1% |
| 합계 | 1,561,741 | 18.7% | 950,258 | 1,655,453 | 12.1% | 1,655,453 | 11.2% |
| 발행주식총수 | 8,331,345 | 100.0% | 5,300,000 | 13,631,345 | 100.0% | 14,768,904 |
100.0% |
| 주1) 유상증자 전 발행주식 총수 : 8,331,345주(우선주 379,137주 제외) → 유상증자 후 발행주식 총수 : 13,631,345주 |
| 주2) 최대주주인(주)브릿지라이프사이언스 및 손기영이 배정물량의 10%를 참여함을 가정하여 산정하였습니다. |
| 주3) 잠재주식수(미상환전환사채, 미전환 우선주, 주식매수청구권)은 증권신고서 제출 전일 기준으로 1,137,559주 기준입니다. 주4) 상기 지분변동은 전환우선주, 주식관련사채의 전환권 행사, 주식매수청구권의 행사, 자기주식수의 변동 등으로 변경될 수 있습니다. |
한편, 당사가 발행한 제2회 무보증 사모 전환사채는 2021년 11월 06일부터 전환청구가능하며, 전환가능주수는 703,422주, 전환가액은 71,081원(시가 하락에 의한 최저 Re-fixing 고려 시 전환가능주식수 712,880주, 전환가액 70,138원)입니다. 또한 당사는 잠재주식수로 미전환 우선주 379,137주가 남아있는 상황이며, 시가하락에 의한 최저 Re-fixing 고려 시 505,386주가 전환가능합니다. 또한, 당사가 임직원에게 부여한 주식매수청구권의 미행사수량은 55,000주입니다. 이에 따라 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 1,137,559주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다.
유상증자 후 잠재주식 수가 모두 행사되었음을 고려 시 최대주주 등 지분율은 11.2%까지 감소될 수 있으며, 이는 각기 행사가액이 시가하락에 의한 전환가액 조정시 추가적으로 하락할 수 있습니다.
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 71,081원 | 50,000 | 703,422 |
| 소 계 | 50,000 | 703,422 | ||||||||
| 주1) 발행 당시 전환가액은 100,196원이었으며, 시가하락에 의한 최저 Re-fixing 가격은 70,138원입니다. |
| [미전환 우선주 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 전자등록 총액 |
이익배당 | 전환청구 가능기간 |
발행가액 | 미전환 우선주 | |
|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
||||||
| 전환우선주 | 21.03.03 | 23,501 | 발행가액의 연 1.0% (누적적, 참가적) |
22.03.03 ~ 26.03.02 | 78,400원 | 23,501 | 299,764 |
| 전환우선주 | 21.03.08 | 6,501 | 발행가액의 연 1.0% (누적적, 참가적) |
22.03.08 ~ 26.03.07 | 81,900원 | 6,501 | 79,373 |
| 소 계 | 30,002 | 379,137 | |||||
| 주1) 21.03.03에 발행한 전환우선주의 시가하락에 의한 최저 Re-fixing 가격은 58,000원이며, 21.03.08에 발행한 전환우선주의 시가하락에 의한 최저 Re-fixing가액은 61,500원입니다. |
| [미행사 주식매수청구권 내역] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
기말 미행사수량 |
행사기간 | 행사 가격 |
|---|---|---|---|---|---|---|---|---|
| 조도현 | 미등기임원 | 2019.10.02 | 신주교부 | 보통주 | 5,000 | 5,000 | 2021.10.02~2022.10.01 | 50,500 |
| 계열회사 직원 3명 | 계열회사 직원 | 2019.10.02 | 신주교부 | 보통주 | 5,000 | 5,000 | 2021.10.02~2022.10.01 | 50,500 |
| 계열회사 직원 1명 | 계열회사 직원 | 2019.11.04 | 신주교부 | 보통주 | 1,000 | 1,000 | 2021.11.04~2022.11.03 | 59,600 |
| 당사 직원 8명 | 직원 | 2021.03.12 | 신주교부 | 보통주 | 27,000 | 27,000 | 2023.03.12~2024.03.11 | 97,100 |
| 계열회사 5명 | 계열회사 직원 | 2021.03.12 | 신주교부 | 보통주 | 14,000 | 14,000 | 2023.03.12~2024.03.11 | 97,100 |
| 오혜영 | 등기임원 | 2021.03.31 | 신주교부 | 보통주 | 3,000 | 3,000 | 2023.03.31~2024.03.30 | 118,400 |
| 합 계 | 55,000 | 55,000 | - | - | ||||
최대주주 및 특수관계인의 낮은 지분율은 적대적 M&A등의 위험성을 내포할 수 있으며, 이러한 점은 경영진 변동의 위험성으로 이어져 안정적인 경영활동이 어려울 수 있습니다. 당사의 최대주주 및 특수관계인들은 증권신고서 제출일 현재 당사 지분 18.7%를 보유하고 있으며, 나머지 주식들은 소액주주들에게 분산되어 있는 상황이나, 최대주주인 (주)브리짓라이프사이언스 및 손기영은 금번 주주배정 후 실권주 일반공모 유상증자에서 배정된 물량의 약 10%이상 참여할 계획입니다. 유상증자 후 잠재주식 수 모두 전환을 고려할 시 추가적으로 하락할 가능성이 있어 경영권 안정성에 대해서는 안심할 수 없는 상황입니다. 투자자분들은 투자 시, 이 점 유의해주시기 바랍니다.
[잦은 자금조달로 인한 주주가치 희석화]
|
사. 당사는 바이오 사업의 특성상 지속적인 영업손실 및 당기순손실 발생으로 인하여, 지속적으로 자본시장을 통한 자금조달을 진행하고 있으며, 2018년도부터 공모 형태로 IPO 1회 43,120백만원, 사모 형태로 총 4회에 걸쳐 106,500백만원의 자금을 조달하였습니다. 금번에도 주주배정 후 실권주 일반공모 유상증자를 통하여 301,570백만원(1차 발행가액 기준)의 자금을 조달하려고 하고 있으며, 조달 완료 시 2018년부터 총 466,030백만원의 자금을 조달하게 됩니다. 당사는 바이오사업을 영위하고 연구개발중인 파이프라인의 라이센스 아웃 또는 제품화를 위하여 잦은 자금조달이 필요한 상황입니다. 당사는 경상연구개발비로 2020년 연결기준 13,175백만원, 2021년 3분기 연결기준 7,776백만원 사용하였으며, 이는 매출액 대비 각각 51.0%, 47.2% 수준이며, 최근 3개년 및 2021년 3분기 평균 매출액 대비 연구개발비의 비중은 42.5%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다.이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다. 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 신약물질 EC-18의 연구개발이 라이센스 아웃 또는 제품화에 실패하거나 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원할하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다. |
당사는 바이오 사업의 특성상 지속적인 영업손실 및 당기순손실 발생으로 인하여, 지속적으로 자본시장을 통한 자금조달을 진행하고 있으며, 2018년도부터 공모 형태로 IPO 1회 43,120백만원, 사모 형태로 총 4회에 걸쳐 106,500백만원의 자금을 조달하였습니다. 금번에도 주주배정 후 실권주 일반공모 유상증자를 통하여 301,570백만원(1차 발행가액 기준)의 자금을 조달하려고 하고 있으며, 조달 완료 시 2018년부터 총 466,030백만원의 자금을 조달하게 됩니다. 2018년부터 현재 자본시장을 통한 자금조달 내역은 다음과 같습니다.
| [2018년~신고서제출일 현재 자본시장을 통한 자금조달 내역] |
| (단위 : 백만원) |
| 구분 | 최초 주요사항보고서 공시일 | 납입일 | 규모 | 발행방식 | 자금의 사용목적 |
|---|---|---|---|---|---|
| 유상증자 | 2017.12.15 | 2018.02.13 | 43,120 | 일반공모(IPO) | 연구개발비 및 시설투자비 |
| 유상증자 (전환우선주) |
2019.04.17 | 2019.04.25 | 26,498 | 사모(제3자배정) | 신약개발 임상비용, 연구개발비, 운영비용 |
| 전환사채 | 2020.11.04 | 2020.11.06 | 50,000 | 사모 | 공장 신축 및 연구 ·생산 설비 구축비용 |
| 유상증자 (전환우선주) |
2021.02.23 | 2021.03.03 | 23,501 | 사모(제3자배정) | 1) 주요 파이프라인 임상비용(한국, 미국) 및 연구개발 2) 사업목표 달성을 위한 공장, 연구소 운용 및 개선 |
| 유상증자 (전환우선주) |
2021.02.26 | 2021.03.08 | 6,501 | 사모(제3자배정) | 1. 2021년 임상진행일정(예 : Next Phase, BTD)을 대비한 운영 및 연구개발 2. 우주의학부문 국내외(한국,미국) 협업과 선도적 시장 진출 목적 달성을 위한 선제적 대응 3. 혁신형 글로벌제약기업 도약을 위한 사업 전략적 토대 마련 |
| 합계 | 149,620 | - | - | ||
당사는 바이오사업을 영위하고 연구개발중인 파이프라인의 라이센스 아웃 또는 제품화를 위하여 잦은 자금조달이 필요한 상황입니다. 당사의 주요사업은 신약물질 EC-18의 작용기전을 활용한 다양한 파이프라인을 발견하고, 한국과 미국에서 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 지속적인 연구개발과 임상시험을 진행하여 라이센스 아웃 또는 제품화하는 것이며, 연구개발을 위한 투자 또한 필연적인 사항입니다. 당사는 기존 파이프라인 외에도 코로나19 백신 관련 신규 CMO사업를 진행할 예정이며, 미래성장동력 확보를 위하여 연구개발 및 임상시험을 지속적으로 진행할 예정입니다.
| [최근 3년 및 2021년 3분기 연결기준 세부 연구개발 비용] |
| (단위 : 백만원) |
|
구분 |
2021년 3분기 | 2020년 | 2019년 | 2018년 | |
|---|---|---|---|---|---|
|
자산 |
원재료비 |
- | - | - | - |
|
인건비 |
- | - | - | - | |
|
소 계 |
- | - | - | - | |
|
비용 처리 |
제조원가 |
- | - | - | - |
|
판관비 |
7,776 | 13,175 | 12,282 | 10,161 | |
| 소 계 | 7,776 | 13,175 | 12,282 | 10,161 | |
| 연구개발비용 합계 | 7,776 | 13,175 | 12,282 | 10,161 | |
| (정부보조금) | (41) | (309) | (839) | (635) | |
|
연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액 ×100] |
47.17% | 51.03% | 39.03% | 32.74% | |
| (출처: 당사 제시) |
| 주1) 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다. |
| 주2) 당사는 개발중인 원료의약품 및 신약 개발 프로젝트 별로 연구인력의 인건비, 실험 시약 및 재료비, 외주용역비 등을 집계하여 연구개발비를 관리하고 있으며, 국책과제 지원 대상 연구과제에 대해서는 국고보조금을 차감한 후 잔액을 손익계산서상의 경상연구개발비(판매비 및 관리비)로 처리하고 있습니다. |
당사는 경상연구개발비로 2020년 연결기준 13,175백만원, 2021년 3분기 연결기준 7,776백만원 사용하였으며, 이는 매출액 대비 각각 51.03%, 47.17% 수준이며, 최근 3개년 및 2021년 3분기 평균 매출액 대비 연구개발비의 비중은 42.5%입니다. 하지만, 현재까지 연구개발에 대한 성과가 수익으로 연결되지 않아 계속적인 영업적자를 기록하고 있습니다. 이에 따라 당사는 자체 사업으로만 운영자금을 확보하지 못해 외부로부터 주식관련사채를 발행하거나 유상증자를 통해 연구개발비를 포함한 운영자금을 조달하고 있습니다.
| [최근 3개년 및 2021년 3분기 자금조달 내역 및 사용 현황] | |
| (단위 : 백만원) | |
| 구 분 | 납입일 | 납입금액 | 자금조달 목적 | 실제 자금사용 현황 | 잔여 자금 사용 계획 |
|---|---|---|---|---|---|
| 유상증자 | 2018.02.13 | 43,120 | 시설자금 및 기타 1. 코스닥시장상장규정 제26조 제6항 제2호에 의해 상장주선인은 모집ㆍ매출하는 주식의 100분의 3에 해당하는 수량을 모집ㆍ매출하는 가격과 동일 가격으로 사모의 방법으로 발행한 주식을 취득하여 보유하여야 합니다. 동 상장주선인의 의무취득분 999,992,000원 은 상기 자금 조달 목적에 제외되어 있으며, 기타자금으로 사용할 예정 2. 기타에는 연구개발비 33,000,000,000원, 발행제비용 1,538,000,000원이 포함 |
34,500 | - 기타 파이프라인 기초 연구비 - ICI, NASH, CIN, RA 임상 시험추진비(예비비) |
| 유상증자 (전환우선주) |
2019.04.25 | 26,498 | 운영자금 1. 신약개블 임상비용, 연구개발비, 운영비용 |
23,395 | |
| 전환사채 | 2020.11.06 | 50,000 | 시설자금 1. 공장 신축 및 연구,생산 설비 구축 |
- | - 제천 제2공장 및 제천 연구소 확장 (공사 완료 시점 대금 지급 예정) - 백신 완제 공장 신축비용 충당 |
| 유상증자 (전환우선주) |
2021.03.03 | 23,501 | 운영자금 1. 주요 파이프라인 임상비용 및 연구개발 2. 사업목표 달성을 위한 공장, 연구소 운용 및 개선 |
- | - cGMP 인증 제반 비용 집행 (컨설팅 수수료, 장비교체, 인증료 등) |
| 유상증자 (전환우선주) |
2021.03.08 | 6,501 | 운영자금 1. 2021년 임상진행일정(예 : Next Phase, BTD)을 대비한 운영 및 연구개발 2. 우주의학부문 국내외(한국,미국) 협업과 선도적 시장 진출 목적 달성을 위한 선제적 대응 3. 혁신형 글로벌제약기업 도약을 위한 사업 전략적 토대 마련 |
- | - 2021년 하반기 CRIOM BTD 신청 - 2021년 COVID-19 치료제 2b/3상 진행 - 우주방사선의약연구소 연구 비용 집행 |
| 소 계 | 149,620 | - | 57,895 | - | |
추가로, 금번 주주배정 후 실권주 일반공모를 통한 자금을 이용하여 301,570백만원을 사용할 예정입니다. 세부 자금사용 계획에 대해서는 제1부 모집 또는 매출에 관한 사항 중 Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
이처럼 당사는 유가증권 시장을 통해 자금조달을 하고 있기 때문에 현재 영위하고 있는 신약물질 EC-18의 연구개발이 라이센스 아웃 또는 제품화에 실패하거나 장기적인 사업계획과 자금운용계획을 적정하게 수립하지 못할 경우 향후에도 추가적인 자금조달을 할 수 있습니다. 또한 시장 상황으로 인해 자금조달이 원할하지 않을시에는 유동성 위험에 직면하여 큰 어려움에 처할 수 있으니, 투자자께서는 이 점 유의하시기 바랍니다.
[지속적인 연구개발비용에 따른 손익 악화 위험]
| 아. 당사는 신약물질인 EC-18과 관련하여 구강점막염, 급성방사선증후군, 호중구감소증, 코로나19 바이러스에 대한 연구개발을 지속적으로 수행하고 있으며, 매출이 발생중인 API에서도 연구개발을 수행 중에 있습니다. 이처럼 당사의 바이오 사업부문은 EC-18, CRIOM P3, Zydus pDNA 백신, Providence mRNA 백신 등 파이프라인에 대한 연구개발 및 임상시험을 지속적으로 진행할 계획이며, 이를 위하여 연구개발비를 사용할 예정입니다. 그러나, 임상시험을 진행한다고 하더라도 시험결과 효능(기능)이 부족하거나 안전성 평가에 적합하지 못한 결과가 나올 경우 해당 신약(제품)의 연구개발은 중단될 수 밖에 없습니다. 즉, 임상시험 결과가 가시화되지 않아 라이선스 아웃 또는 제품화가 불가능해질 경우 당사는 투자한 금액 전액은 매출로 이어지거나 자산화가 되지 않고 비용처리만 될 수 있으며, 당사의 비용 및 시간 투자에도 불구하고 엄청난 손실을 야기할 수 밖에 없습니다. 이 점 유의하여 투자해 주시기 바랍니다. |
당사는 신약물질인 EC-18과 관련하여 구강점막염, 급성방사선증후군, 호중구감소증, 코로나19 바이러스에 대한 연구개발을 지속적으로 수행하고 있으며, 매출이 발생중인 API에서도 연구개발을 수행 중에 있습니다. 이에 최근 3년인 2018년 01월 01일부터 연구개발과 관련하여 투자한 금액은 약 46,112백만원이며, 세부적인 당사의 연구개발 투자내역 및 진행상황은 다음과 같습니다.
| [2018년 01월 01일부터 당사 연구개발 투자 내역] | |
| [증권신고서 제출 전일 기준] | (단위 : 백만원) |
| 프로젝트 명 | 세부 내용 | 투자 내역 | 진행 상황 |
|---|---|---|---|
| EC-18 | EC-18 기초연구 | 23,926 | - |
| CIN | 1,698 | - 2020년 4월 3일 한국 MFDS 임상2상 Part 2 승인 | |
| CRIOM | 9,535 | - 2021년 4월 Phase 2 환자 모집 완료 - 2021년 7월 환자 투약 완료 |
|
| ARS | 354 | - 미국 항공우주국 NASA 주관 우주방사선 손상 예방 및 치료제 연구개발 프로젝트에 선정(미국방성, 미육군 생화학연구소, 미국 국립 알레르기· 전염병 연구소)되어 미국 연구기관과 공동연구 진행 중 |
|
| NASH | 1,034 | - 임상 1상 종료 및 임상 2상 준비중 | |
| COVID-19 | 2,391 | - 2021년 8월 국내 임상2상 결과 발표 완료 - 2b/3상 준비중 |
|
| EC-18 범부처과제 3차 | 2,358 | - | |
| 기타 | 941 | - 류마티스관절염, 건선, 패혈증, 당뇨, 암전이억제 등 임상 1상 종료 | |
| 소 계 | 42,237 | - | |
| API | API 등 | 3,020 | - 신제품 도네페질, 로수바스타틴, 펠루비프로펜 연구 개발. 2022년 상용화 예정 - 도네페질 염산염 2021년 6월 한국식약처 DMF 등록 완료. 2개 제약사 샘플 진행중 - 로수바스타틴 2021년 8월 한국 식약처 DMF 등록 완료 - 펠루비프로펜 합성연구 진행중. 2021년 PV 완료 예정 |
| 조영제 등 | 595 | - 가도부트롤 & 칼코부트롤 두 제품 한국 식약처 2018년 등록 완료. 독일 함부르크 식약처 2019년 EU GMP 등록완료. 2022년 해외 5개국 진출 및 상용화 예정 |
|
| PTBA-MA의 개발 및 사업화 | 131 | - Lafutidine의 원가절감 및 원료수급 문제 해결을 위해 개발 진행. 2022년 상용화 예정 |
|
| 보티옥세틴 | 129 | - 2020년 한국 식약처 DMF 허가 완료. 상용화 완료. A 제약사에서 당사 제품으로 생동 진행 예정 | |
| 소 계 | 3,875 | - | |
| 합계 | 46,112 | - | |
| (출처: 당사 제시) 주1) 국고보조금 미차감 금액 |
추가적으로, 당사는 향후 바이오 사업부문에 있어서 EC-18, CRIOM P3 관련 미국과 한국에서 항암화학방사선요법으로 인한 구강점막염 3상 개발를 진행할 계획이며, 약 120,000백만원이 소요될 것으로 예상하고 있습니다. 또한, Zydus pDNA 백신의 경우 국내 및 아시아에서 COVID-19 변이 및 pDNA medicine 신규 적응증 개발을 진행할 계획이며, 약 60,000백만원이 소요될 것으로 예상하고 있고, Providence mRNA 백신의 경우 국내 및 아시아에서 COVID-19 변이 및 mRNA medicine 신규 적응증 개발을 진행할 계획으로 약 60,000백만원이 소요될 것으로 예상하고 있습니다. 추가로, EC-18 관련 기타 적응증(ARS, ICI Combi, NASH, CIN) 임상 개발을 위하여 미국 및 한국 내에서 약 60,000백만원의 연구개발자금이 소요될 것으로 예상하고 있습니다. 이에 당사가 계획하고 있는 향후 5년간 바이오사업부문의 연구개발 투자는 약 300,000백만원을 예상하고 있으며, 세부 계획은 다음과 같습니다.
| [향후 5년간 바이오사업부문 연구개발 투자 세부 계획] |
| (단위 : 백만원) |
| 프로젝트명 | 연구개발 기간 | 내 용 | 총 개발비용(예정) | 개발비용 근거 |
|---|---|---|---|---|
| EC-18, CRIOM P3 | 2022.1Q ~ 2024.1Q | 항암화학방사선요법으로 인한 구강점막염 3상 개발(미국, 한국) | 120,000 |
- 총 모집 대상자 수: 500명 - 참여기관: 총 100여 기관(미국, 한국) |
| Zydus pDNA 백신 | 2022.3Q ~ 2025.4Q | COVID-19 변이 및 pDNA medicine 신규 적응증 개발 (국내, 아시아) | 60,000 |
- 예상 비용추정 * 총 모집 대상자 수: 100명 * 참여기관: 총 5~10개 기관(한국, 아시아) 1) 연구비(investigator cost): 3,600 백만원 2) CRO cost: 3,600 백만원 3) CRO pass through cost: 1,200 백만원 4) 임상약 생산, 포장, 보관 및 운송: 1,200 백만원 5) Central lab cost: 1,200 백만원 6) 기타비용: 1,200 백만원 3. 3상 임상시험: 42,000 백만원 * 총 모집 대상자 수: 300명 * 참여기관: 총 20~30개 기관(한국, 아시아) 1) 연구비(investigator cost): 12,000 백만원 2) CRO cost: 12,000 백만원 3) CRO pass through cost: 3,600 백만원 4) 임상약 생산, 포장, 보관 및 운송: 6,000 백만원 5) Central lab cost: 6,000 백만원 |
| Providence mRNA 백신 | 2022.3Q ~ 2025.4Q | COVID-19 변이 및 mRNA medicine 신규 적응증 개발 (국내, 아시아) |
60,000 |
- 예상 비용추정 1. 신규 적응증 발굴 및 비임상시험: 6,000 백만원 2. 2상 임상시험: 12,000 백만원 * 총 모집 대상자 수: 100명 * 참여기관: 총 5~10개 기관(한국, 아시아) 1) 연구비(investigator cost): 3,600 백만원 2) CRO cost: 3,600 백만원 3) CRO pass through cost: 1,200 백만원 4) 임상약 생산, 포장, 보관 및 운송: 1,200 백만원 5) Central lab cost: 1,200 백만원 6) 기타비용: 1,200 백만원 3. 3상 임상시험: 42,000 백만원 * 총 모집 대상자 수: 300명 * 참여기관: 총 20~30개 기관(한국, 아시아) 1) 연구비(investigator cost): 12,000 백만원 2) CRO cost: 12,000 백만원 3) CRO pass through cost: 3,600 백만원 4) 임상약 생산, 포장, 보관 및 운송: 6,000 백만원 5) Central lab cost: 6,000 백만원 6) 기타비용: 2,400 백만원 |
| EC-18 다른 적응증 임상 개발 | 2022.3Q ~ 2025.4Q | ARS, ICI Combi, NASH, CIN (미국, 한국) | 60,000 |
- 예상 비용추정 1. ARS: 6,000 백만원 2. ICI combi 임상시험: 18,000 백만원 * 총 모집 대상자 수: 100명 * 참여기관: 15~20개 기관(미국, 한국) 1) 연구비(investigator cost): 6,000 백만원 2) CRO cost: 6,000 백만원 3) CRO pass through cost: 2,400 백만원 4) 임상약 생산, 포장, 보관 및 운송: 1,200 백만원 5) Central lab cost: 1,200 백만원 6) 기타비용: 1,200 백만원 3. NASH 임상시험: 18,000 백만원 * 총 모집 대상자 수: 100명 * 참여기관: 15~20개 기관(미국, 한국) 1) 연구비(investigator cost): 6,000 백만원 2) CRO cost: 6,000 백만원 3) CRO pass through cost: 2,400 백만원 4) 임상약 생산, 포장, 보관 및 운송: 1,200 백만원 5) Central lab cost: 1,200 백만원 6) 기타비용: 1,200 백만원 4. CIN 임상시험: 18,000 백만원 * 총 모집 대상자 수: 100명 * 참여기관: 15~20개 기관(미국, 한국) 1) 연구비(investigator cost): 6,000 백만원 2) CRO cost: 6,000 백만원 3) CRO pass through cost: 2,400 백만원 4) 임상약 생산, 포장, 보관 및 운송: 1,200 백만원 5) Central lab cost: 1,200 백만원 6) 기타비용: 1,200 백만원 |
| 소 계 | 300,000 | |||
※ 금번 주주배정 후 실권주 일반공모를 통하여 유입되는 자금 중 일부에 대하여 바이오 사업부문 연구개발 투자로 사용할 계획입니다. 해당 내용에 대해서는 제1부 모집 또는 매출에 관한 사항 - Ⅴ. 자금의 사용목적을 참고하여 주시기 바랍니다.
이처럼 당사의 바이오 사업부문은 EC-18, CRIOM P3, Zydus pDNA 백신, Providence mRNA 백신 등 파이프라인에 대한 연구개발 및 임상시험을 지속적으로 진행할 계획이며, 이를 위하여 연구개발비를 사용할 예정입니다. 그러나, 임상시험을 진행한다고 하더라도 시험결과 효능(기능)이 부족하거나 안전성 평가에 적합하지 못한 결과가 나올 경우 해당 신약(제품)의 연구개발은 중단될 수 밖에 없습니다. 즉, 임상시험 결과가 가시화되지 않아 라이선스 아웃 또는 제품화가 불가능해질 경우 당사는 투자한 금액 전액은 매출로 이어지거나 자산화가 되지 않고 비용처리만 될 수 있으며, 당사의 비용 및 시간 투자에도 불구하고 엄청난 손실을 야기할 수 밖에 없습니다. 이 점 유의하여 투자해 주시기 바랍니다.
3. 기타위험
[코스닥시장 관리종목 및 상장폐지 요건에 따른 위험]
|
가. 당사는 2018년 02월 기술특례로 코스닥시장에 상장하였습니다. 이에 따라 장기영업손실(4년 연속영업손실 발생)로 인한 관리종목 지정에 대해서는 유예되고, 법인세비용차감전계속사업손실로 인한 관리종목 지정에 대해서도 상장 후 3년간 해당 사유에 대해서는 유예되어 신고서제출일 현재 현재 관리종목 지정 사유에 해당되지 않습니다. 다만, 코스닥시장 규정 등에 따라 당사의 주권은 관리종목으로 지정되거나 상장폐지 될수 있으니 투자자분들께서는 이 점 유의하시기 바랍니다. |
| [ 코스닥시장 관리종목 지정 및 상장폐지 주요 요건 ] |
| 구분 | 관리종목 지정(코스닥시장 상장규정 제28조) | 상장폐지 기준(코스닥시장 상장규정 제38조) |
|---|---|---|
| 매출액 |
최근년 30억원 미만 (지주회사는 연결기준) - 기술성장기업, 이익미실현기업은 각각 상장후 5년간 미적용 |
2년 연속 [실질심사] 이익미실현기업 관련, 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 법인세비용차감전계속사업손실 |
자기자본50%이상 (&10억원이상)의 법인세비용차감전계속사업손실이 최근3년간 2회 이상 (&최근연도계속사업손실) - 기술성장기업 상장후 3년간 미적용, 이익미실현 기업 상장후 5년 미적용 |
관리종목 지정후 자기자본50%이상(&10억원이상)의 법인세비용차감전계속사업손실 발생 [실질심사] 이익미실현기업 관련, 관리종목지정 유예기간 중 최근 3사업연도 연속으로 매출액이 5억원 미만이면서 전년 대비 100분의 50 이상의 매출액 감소가 공시 등을 통해 확인되는 경우 |
| 장기영업손실 |
최근 4사업연도 영업손실(지주회사는 연결기준) - 기술성장기업(기술성장기업부)은 미적용 |
[실질심사] 관리종목 지정 후 최근 사업연도 영업손실 |
| 자본잠식/자기자본 |
(A)사업연도(반기)말 자본잠식률 50%이상 (B)사업연도(반기)말 자기자본 10억원미만 (C)반기보고서 제출기한 경과후 10일내 반기검토(감사)보고서 미제출 or 검토(감사)의견 부적정·의견거절·범위제한한정 |
최근년말 완전자본잠식 A or C 후 사업연도(반기)말 자본잠식률 50%이상 B or C 후 사업연도(반기)말 자기자본 10억원미만 A or B or C 후 반기말 반기보고서 기한 경과후 10일내 미제출 or 감사의견 부적정·의견거절·범위제한한정 [실질심사] 사업보고서 또는 반기보고서의 법정제출 기한까지 당해 상장폐지 기준 해당사실을 해소하였음을 입증하는 재무제표 및 이에 대한 감사인(정기재무제표에 대한 감사인과 동일한 감사인에 한함)의 감사보고서를 제출하는 경우 |
| 감사의견 | - | 감사보고서 부적정·의견거절·범위제한한정 |
| 시가총액 | 보통주 시가총액 40억원미만 30일간 지속 | 관리종목 지정후 90일간 "연속10일 & 누적30일간 40억원이상"의 조건을 미충족 |
| 거래량 |
분기 월평균거래량이 유동주식수의 1%에 미달 - 월간거래량 1만주, 소액주주 300인이상이 20%이상 지분 보유 등은 적용배제 |
2분기 연속 |
| 지분분산 |
소액주주200인미만or소액주주지분20%미만 - 300인이상의 소액주주가 유동주식수의 10%이상으로서 100만주이상을 소유하는 경우는 적용배제 |
2년 연속 |
| 불성실공시 | - | [실질심사] 1년간 불성실공시 벌점 15점 이상 |
| 공시서류 |
(A)분기,반기, 사업보고서 미제출 (B)정기주총에서 재무제표 미승인 or 정기주총 미개최 |
2년간 3회 분기,반기,사업보고서 미제출 사업보고서 제출기한후 10일내 미제출 A(미제출상태유지) or B 후 다음회차에 A or B |
| 사외이사 등 | 사외이사/감사위원회 요건 미충족 | 2년 연속 |
| 회생절차/파산신청 | 회생절차 개시 신청 또는 파산신청 | [실질심사] 개시신청기각,결정취소,회생계획 불인가등 |
| 기타 | - |
최종부도 또는 은행거래정지 해산사유(피흡수합병, 파산선고) 정관 등에 주식양도제한 두는 경우 유가증권시장 상장의 경우 우회상장시 우회상장관련 규정 위반시 (심사종료전 기업결합완료 및 보호예수 위반 등) |
| 출처) 한국거래소 |
당사는 2018년 02월 기술특례로 코스닥시장에 상장하였습니다. 이에 따라 장기영업손실(4년 연속영업손실 발생)로 인한 관리종목 지정에 대해서는 유예되고, 법인세비용차감전계속사업손실로 인한 관리종목 지정에 대해서도 상장 후 3년간 해당 사유에 대해서는 유예되어 신고서제출일 현재 현재 관리종목 지정사유에 해당되지 않습니다. 당사가 기술성장기업으로서 적용받는 관리종목 지정요건 특례는 다음과 같습니다.
1)매출액 30억원 미만 발생으로 인한 관리종목 지정요건
당사는 기술특례로 인해 상장일이 속하는 사업연도를 포함한 연속하는 5개 사업연도, 즉 2018, 2019, 2020, 2021, 2022 사업연도간 해당 요건을 적용받지 않습니다. 따라서 당사는 2023 사업연도부터 최근 사업연도의 매출액이 30억원 미만 발생한다면 관리종목에 지정될 수 있습니다.
2)법인세비용차감전계속사업손실로 인한 관리종목 지정요건
당사는 기술특례로 인해 상장일이 속하는 사업연도를 포함한 연속하는 3개 사업연도, 즉 2018, 2019, 2020 사업연도간 해당 요건을 적용받지 않습니다. 따라서 당사는 연결 재무제표 기준 2021 사업연도를 포함하여 향후 3년간 2회 이상 자기자본의 100분의 50을 초과(10억원 이상)하고, 손실규모가 10억원 이상인 법인세비용차감전계속사업손실이 발생한다면 관리종목에 지정될 수 있습니다.
3)장기영업손실로 인한 관리종목 지정요건
당사는 기술특례상장을 통해 코스닥 시장에 상장했으므로 코스닥 기술성장기업부에 소속되어 있어 해당 요건을 적용받지 않습니다.
다만, 상기의 사유 등에 따라 당사의 주권은 관리종목으로 지정되거나 상장폐지 될수 있으니 투자자분들께서는 이 점 유의하시기 바랍니다.
[환금 제한 및 원금 손실 가능성]
| 나. 금번 유상증자 청약에 참여하여 신주를 배정받을 경우 신주의 추가상장일까지 환금성에 제약이 있으며, 청약 후 추가상장일 사이에 주가가 하락할 경우 원금에 대한 손해가 발생할 가능성이 있습니다. 투자자분들은 투자시 이점 유의하시기 바랍니다. |
당사는 코스닥 시장 상장법인으로서 이번 유상증자로 발행되는 신주는 코스닥 시장에 상장되어 거래될 예정이므로 유동성과 관계된 심각한 환금성 위험은 존재하지 않습니다. 그러나 유상증자 청약에 참여하여 신주를 배정받을 경우, 신주가 상장되어 매매가 가능할 때까지 납입주금에 대한 유동성의 제약이 있습니다.
본 유상증자의 자세한 일정은 본 신고서의 '제1부 모집 또는 매출에 관한 사항 - I. 모집 또는 매출에 관한 일반사항' 중 '1. 공모의 개요'를 참고하시기 바랍니다.
또한 신주가 코스닥 시장에 추가 상장될 때까지 당사의 주가가 유상증자로 발행되는 신주의 발행가액 수준으로 유지되지 않을 수 있으며, 당사의 내적인 요인 또는 시장전체의 환경 변화 등에 의해 주가가 급락할 경우, 투자원금에 대한 손실이 발생할 수 있습니다.
당사의 금번 발행되는 주식에 대해서는 전량 보호예수되지 않으므로 상장 후 즉시 물량 출회가 가능하여 주가 하락에 따른 환금성 위험 및 주가희석화에 노출될 수 있으니, 이점 투자에 유의하시기 바랍니다.
[주가하락에 따른 발행금액 감소 위험]
| 다. 주식시장의 급격한 상황 악화로 인하여 회사의 금번 유상증자 발행가액이 하락할 경우 당사가 계획했던 자금운용계획 등에 차질이 빚어질 수 있으며, 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있습니다. |
금번 유상증자의 확정발행가액은 1차 발행가액과 2차 발행가액 중 낮은 가액으로 결정됩니다. 다만 '자본시장과 금융투자업에 관한 법률' 제165조의6 및 '증권의 발행 및 공시 등에 관한 규정' 제5-15조의2에 의거하여 1차 발행가액과 2차 발행가액 중 낮은가액이 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격보다 낮은 경우 청약일전 과거 제3거래일부터 제5거래일까지의 가중산술평균주가에서 40% 할인율을 적용하여 산정한 가격을 확정발행가액으로 합니다. (단, 발행가액이 액면가보다 낮을 경우 액면가를 발행가액으로 합니다.)
일반공모 후 미청약분에 대해서는 그 전부를 대표주관사인 케이비증권(주)가 자기 계산으로 인수하므로 청약 미달에 따른 위험은 없으나, 주가 하락으로 발행가액이 크게 하락할 경우 회사가 계획했던 자금운용계획에 차질이 빚어질 수 있습니다. 이러할 경우 당사의 재무적 안정성은 부정적인 영향을 받을 수 있으니 투자자 여러분께서는 이 점 유의하시기 바랍니다.
[금융감독기관의 규제 강화에 따른 위험]
| 라. 최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다. 향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및유동성(환금성) 제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있으니 투자자들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다. |
최근 금융감독기관 등의 관리감독기준이 엄격해지고 있는 상황으로 관련 규정을 위반할 경우 주권매매정지, 관리종목지정, 상장폐지실질심사, 상장폐지 등의 조치가 취해질 수 있습니다.
향후 감독기관으로부터 당사가 현재 파악하지 못한 제재가 부과될 경우 주가하락 및유동성(환금성)제약 등으로 인해 투자금에 막대한 손실이 발생할 수 있으니 투자자들께서는 관련 규정을 충분히 검토하신 후 투자에 임해주시기 바랍니다.
특히, "코스닥시장 상장규정 제28조(관리종목), 코스닥시장 상장규정 제38조(상장의 폐지) 및 코스닥시장 상장규정 제38조의2(실질심사위원회의 심사 등)"에 유의하시기 바랍니다. 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
[경영환경변화 등에 따른 위험]
| 마. 대내외적 경영환경 변화에 따라 당사 실적의 급변동이 있을 경우 투자원금에 대한 손실이 발생할 수 있으므로, 상기 투자위험요소 및 본 증권신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 투자자 여러분이 독자적으로 결정해야 함을 유의하시기 바랍니다. |
당사의 주가는 국내외 주식시장 환경 변화와 같은 외부적 요인에 영향을 받아 변동할 가능성이 존재하며, 당사의 외부적인 경영환경 변화에 따라 당사 실적이 악화될 가능성이 높아질 경우 당사의 주가에 부정적인 영향을 미칠 수 있습니다.
본 건 공모 주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 하며, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 상기 투자위험요소에 기재하지 않은 사항이라 하더라도 당사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자는 상기 투자위험요소 및 본 신고서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 자신의 독자적인 판단에 의해서 투자하셔야 합니다.
만일 상기 투자위험요소에 기재한 내용 중 부정적인 요소가 현실화될 경우 당사 및 종속회사의 사업, 재무상태, 기타 운영결과에 중대한 부정적 영향을 미칠 수 있으며, 이에 따라 투자자가 금번 공모 과정에서 취득하게 되는 당사 주식의 시장가격이 하락하여 투자금액에 손실이 발생할 수도 있음을 유의하시기 바랍니다.
[증권신고서 정정에 따른 일정 변경 가능성]
| 바. 본 증권신고서는 공시심사 과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 시에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행 과정에서 일정이 변경될 수도 있습니다. |
"자본시장과 금융투자업에 관한 법률" 제120조 3항에 의거하여 본 증권신고서의 효력의 발생은 증권신고서의 기재사항이 진실 또는 정확하다는 것을 인정하거나, 정부가 이 증권의 가치를 보증 또는 승인한 것이 아니므로 본 증권에 대한 투자는 전적으로 투자자에게 귀속됩니다.
금융감독원 전자공시 홈페이지(http://dart.fss.or.kr)에는 당사의 사업보고서(분기 및 반기보고서 포함) 및 감사보고서 등 기타 정기 공시사항과 수시 공시사항 등이 전자공시되어 있사오니 투자 의사를 결정하시는 데 참조하시기 바랍니다.
본 증권신고서는 공시 심사과정에서 일부내용이 정정될 수 있으며, 투자판단과 밀접하게 연관된 주요내용이 변경될 경우에는 본 신고서상의 일정에 차질을 가져올 수 있습니다. 또한, 관계기관과의 업무진행과정에서 일정이 변경될 수도 있으므로 투자자들께서는 투자시 이러한 점을 감안하시기 바랍니다.
[집단 소송이 제기될 위험]
| 사. 당사가 잘못된 정보를 제공하거나 부실감사 등으로 주주들에게 손해를 끼칠 시 일부 주주들로부터 집단 소송이 제기될 위험이 있음을 유의하시기 바랍니다. |
'증권관련 집단소송법' 제12조(소송허가 요건)에 따라 50명 이상의 개인이 발행주식총수의 0.01% 이상 보유할 경우 한 명 이상의 대표 당사자가 상기 50인 이상의 당사자들을 대리하여 회사가 발행한 증권의 거래과정에서 발생한 피해에 대하여 소송을 제기할 수 있습니다.
증권신고서 및 투자설명서에서 기재된 잘못된 내용, 잘못된 사업보고서의 공시, 내부자거래에 의한 손해배상청구 및 회계부정으로 인한 손해배상 청구 등이 주요한 소송사유에 포함됩니다. 당사는 향후 이와 같은 집단소송의대상이 되지 않는다고 확신할 수 없으며, 만약 당사에 대하여 집단소송이 제기될 경우 상당한 소송비용이 발생할 수 있음을 유의하시기 바랍니다.
[유상증자에 따른 주식가치 하락 및 기재정보 의존에 따른 투자위험]
| 아. 금번 유상증자를 통해 취득한 당사의 주식가치가 하락할 수 있으며, 상기 투자위험요소 및 기타 기재된 정보에만 의존하여, 투자판단을 해서는 안되며 투자자 여러분의 독자적인 판단에 의해야 함을 유의하여 주시기 바랍니다. |
금번 유상증자 실시로 당사의 주식가치가 향후 하락할 수 있으므로 투자자 여러분께서는 이 점 유의하시기 바랍니다.
이 증권신고서의 효력발생은 정부가 증권신고서의 기재사항이 진실 또는 정확하다는것을 인정하거나 이 유가증권의 가치를 보증 또는 승인한 것이 아니며, 기재사항은 청약일 이전에 변경될 수 있으며, 본 건 공모주식을 청약하고자 하는 투자자들은 투자결정을 하기 전에 본 증권신고서의 다른 기재 부분 뿐만 아니라 상기 투자위험요소를 주의 깊게 검토한 후 이를 고려하여 최종적인 투자판단을 해야 합니다.
당사는 상기에 기술된 투자위험요소 외에도 전반적으로 불안정한 경제상황 등에 의하여 직접적으로 또는 간접적으로 영향을 받을 수 있습니다. 당사의 재무제표는 당사의 재무상태에 영향을 미칠 수 있는 경제상황에 대한 경영자의 현재까지의 평가를 반영하고 있으나 그 실제결과는 현재시점에서의 평가와는 상당히 다를 수 있는 만큼, 투자자 여러분께서는 이 점 유의하여 투자에 임하시기 바랍니다.
또한 금번 공모를 위한 분석 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 대내외적으로 여러가지 요소들의 영향에 따라 애초에 예측했던 것과 다를 수 있다는 점에 유의해야 합니다.
[유상증자 철회에 따른 위험]
| 자. 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사 및 인수회사의 판단으로 유상증자가 철회될 수 있습니다. 유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다. 또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하여 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다. |
금번 주주배정후 실권주 일반공모 유상증자는 대표주관회사의 잔액인수 방식으로 진행됩니다. 유상증자 진행 중에 모집 절차의 진행에 중대한 영향을 미칠만한 사유가 발생하여 당사 혹은 대표주관회사의 판단으로 유상증자가 철회될 수 있습니다.
유상증자 납입전에 철회될 경우 청약으로 인한 손실은 발생하지 않으나, 철회시점에 따라 권리락에 따른 주가하락, 신주인수권증서 매매로 인한 손실 등이 발생할 수 있음을 투자자께서는 유의하시기 바랍니다.
또한, 당사가 계획한 자금사용목적의 자금이 조달되지 않기 때문에 당사는 단기간 유동성 위험에 직면하고, 장기적으로 당사의 성장을 위해 수립한 경영계획에 차질이 생길 수 있습니다. 유상증자가 철회될 경우 매우 위험한 상황이 발생할 수 있으니 이점 유의하시기 바랍니다.
[차입공매도 유상증자 참여 제한 관련 위험]
| 차. 「자본시장과 금융투자업에 관한 법률 시행령」일부개정령에 따라, 주권상장법인이 유상증자 계획을 공시한 이후 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지, 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우에만 증자참여가 허용됩니다(「자본시장과 금융투자업에 관한 법률」제180조의4). 투자자께서는 이 점 유의하시기 바랍니다. |
금융위원회는 2021년 01월 13일 공매도 제도개선 관련 「자본시장과 금융투자업에 관한 법률 시행령」일부개정령을 입법예고 하였습니다. 이에 따르면, 주권상장법인이 유상증자 계획을 공시한 이후 해당 기업의 주식을 공매도 한 자는 증자참여를 제한하되, 예외적인 경우 증자참여를 허용하고 있습니다. (「자본시장과 금융투자업에 관한 법률」제180조의4). 이와 관련 유상증자 참여가 제한되는 공매도 시점과, 증자참여가 허용되는 예외사유를 시행령에서 정하도록 위임하고 있습니다.
해당 시행령에 따르면, 유상증자 계획이 공시된 다음 날부터, 발행가격 산정을 위한 대상 거래기간의 마지막날(발행가격 산정 기산일)까지 공매도 한 경우 증자참여가 제한됩니다. (「자본시장과 금융투자업에 관한 법률 시행령」208조의4제1항)
다만, 다음의 경우 공매도를 통해 발행가격에 부당한 영향을 미쳤다고 보지 않아 증자참여가 허용됩니다. (「자본시장과 금융투자업에 관한 법률 시행령」제208조의4제2항)
ⅰ) 마지막 공매도 이후 발행가격 산정 기산일까지 공매도 주문 수량 이상을 증권시장 정규거래시간에 매수(체결일 기준)
ⅱ) 금융위원회가 정하는 기준을 충족한 독립된 거래단위를 운영하는 법인 내에서 공매도를 하지 않은 거래단위가 증자참여
ⅲ) 시장조성 또는 유동성공급을 위한 거래과정에서 공매도
상기 공매도제도 개선 관련 자본시장법 시행령 개정안에 따라, 당사의 주식을 해당 기간 동안 공매도하는 투자자께서는 금번 유상증자 참여가 제한될 수 있음을 유의하시기 바랍니다. 해당 법령과 관련된 자세한 금융관련 법규는 "국가법령정보센터(http://law.go.kr)", "금융감독원 금융법규서비스(http://fss.or.kr)", "KRX법규서비스(http://law.krx.co.kr)" 등을 참고하시기 바랍니다.
[주가 희석화 및 주주배정 후 실권주 일반공모 대량물량 출회 예정에 따른 위험]
| 카. 당사의 금번 유상증자로 인하여 기발행주식 총수 8,331,345주의 60.85%에 해당하는 5,300,000주가 추가로 상장됩니다. 금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 주권의 상장일은 2022년 01월 10일로 예정되어 있습니다. 금번 유상증자에 따른 모집예정주식 5,300,000주가 향후 코스닥 시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다. 또한, 일반공모 청약을 완료한 주식 수의 합계가 모집하여야 할 주식수에 미달하는 경우 미달된 잔여주식은 대표주관사가 자기계산으로 실권주식 전량을 인수하게 됩니다. 대표주관사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 10.0%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관사의 실권주 매입단가는 일반청약자들 보다 10.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 가능성이 존재합니다. 따라서 실권주를 인수한 대표주관사가 인수한 물량을 조기에 장내에서 대량매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재합니다. 또한 증권신고서 제출일 현재 당사는 기발행한 사모 전환사채와 전환우선주, 주식매수청구권이 존재하며, 전환 또는 행사 시 신주로 전환되기 때문에 주가희석이 발생할 수 있습니다. 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 1,137,559주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다. 당사는 전환가능주식수가 모두 행사되어 코스닥 시장에 추가 상장될 경우 주가 희석화 위험이 발생할 수 있습니다. 투자자들께서는 이점 유의하여 투자해 주시기 바랍니다. |
당사의 금번 유상증자로 인하여 기발행주식 총수 8,331,345주의 60.85%에 해당하는 5,300,000주가 추가로 상장됩니다.
| [유상증자 모집예정 내역] |
| 구 분 | 내 용 |
|---|---|
| 모집예정 주식 종류 | 기명식보통주 |
| 모집예정주식수 | 10,000,000주 |
| 현재 발행주식총수 | 5,300,000주 |
| 증자비율 | 60.85% |
금번 유상증자에 따른 모집가액은 '(舊)유가증권의 발행 및 공시등에 대한 규정' 제57조에 의해 산출됩니다. 그러나 주식시장의 특성상 향후 주가에 대한 변동성이 있는 관계로 증자에 따른 모집가격 산정시 결정된 1주당 모집가액보다 향후 추가 상장 후 거래 시점의 주가가 낮아져 투자자에게 금전적 손실을 끼칠 가능성이 있습니다.
당사는 본 유상증자의 원활한 신주인수권증서 매매를 위하여 5거래일간 신주인수권증서를 상장하여 신주인수권증서를 통한 구주주 청약률을 제고할 계획입니다. 하지만 신주인수권증서의 원활한 매매 및 청약 참여를 위한 노력에도 불구하고 신주인수권증서를 통한 청약이 부진하여 대규모 실권이 발생할 경우, 투자심리에 악영향을 끼쳐 일반공모 청약에 부정적 영향을 끼칠 수도 있으며 향후 주가하락 가능성도 배제할 수 없습니다.
금번 증자로 인해 추가 발행되는 신주는 보호예수되지 않으므로 일시적인 물량출회에 따른 주가하락의 가능성이 있습니다. 금번 유상증자에 따른 주권의 상장일은 2022년 01월 10일로 예정되어 있습니다. 금번 유상증자에 따른 모집예정주식 5,300,000주가 향후 코스닥 증권 시장에 추가 상장될 경우 유통주식수의 증가로 인하여 주가 희석화 위험이 발생할 수 있습니다.
또한, 일반공모 청약을 완료한 주식 수의 합계가 모집하여야 할 주식수에 미달하는 경우 미달된 잔여주식은 대표주관사가 자기계산으로 실권주식 전량을 인수하게 됩니다. 대표주관사가 최종 실권주를 인수하게 되면 당사는 실권주 인수금액의 10.0%를 추가수수료로 지급하게 되며, 이를 고려 시 대표주관사의 실권주 매입단가는 일반청약자들 보다 10.0% 낮은 것과 같은 결과가 초래되어 조기에 인수물량을 처분하게 될 가능성이 존재합니다. 따라서 실권주를 인수한 대표주관사가 인수한 물량을 조기에 장내에서 대량매도할 경우 일시적 물량 출회에 따른 주가 하락의 가능성이 존재하며, 인수한 실권주를 일정 기간 보유하더라도 동 인수물량이 잠재매각물량으로 존재하여 주가 상승에는 부담으로 작용할 가능성이 존재합니다.
또한 증권신고서 제출일 현재 당사는 기발행한 사모 전환사채와 전환우선주, 주식매수청구권이 존재하며, 전환 또는 행사 시 신주로 전환되기 때문에 주가희석이 발생할 수 있습니다. 당사가 발행한 제2회 무보증 사모 전환사채는 2021년 11월 06일부터 전환청구가능하며, 전환가능주수는 703,422주, 전환가액은 71,081원(시가 하락에 의한 최저 Re-fixing 고려 시 전환가능주식수 712,880주, 전환가액 70,138원)입니다. 또한 당사는 잠재주식수로 미전환 우선주 379,137주가 남아있는 상황이며, 시가하락에 의한 최저 Re-fixing 고려 시 505,386주가 전환가능합니다. 또한, 당사가 임직원에게 부여한 주식매수청구권의 미행사수량은 55,000주입니다. 이에 따라 당사의 현재 전환가능한 잠재주식수는 증권신고서 제출 전일 기준으로 총 1,137,559주가 남아있는 상황이며, 시가하락에의한 최저 Re-fixing을 고려 시 1,273,266주가 남아있는 상황입니다.
| [미상환 전환사채 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 만기일 | 전자등록 총액 |
표면 이자율 |
만기 이자율 |
전환청구 가능기간 |
조기상환 청구권(Put option) |
전환가액 | 미상환사채 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
|||||||||
| 2회 사모 전환사채 | 20.11.06 | 25.11.06 | 50,000 | 0.0% | 0.0% | 21.11.06~25.10.06 | 22.11.06부터 매3개월마다 | 71,081원 | 50,000 | 703,422 |
| 소 계 | 50,000 | 703,422 |
||||||||
| 주1) 발행 당시 전환가액은 100,196원이었으며, 시가하락에 의한 최저 Re-fixing 가격은 70,138원입니다. |
| [미전환 우선주 발행현황] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 백만원, 주) |
| 종 류 | 발행일 | 전자등록 총액 |
이익배당 | 전환청구 가능기간 |
발행가액 | 미전환 우선주 | |
|---|---|---|---|---|---|---|---|
| 전자등록 총액 |
전환가능 주식수 |
||||||
| 전환우선주 | 21.03.03 | 23,501 | 발행가액의 연 1.0% (누적적, 참가적) |
22.03.03 ~ 26.03.02 | 78,400원 | 23,501 | 299,764 |
| 전환우선주 | 21.03.08 | 6,501 | 발행가액의 연 1.0% (누적적, 참가적) |
22.03.08 ~ 26.03.07 | 81,900원 | 6,501 | 79,373 |
| 소 계 | 30,002 | 379,137 | |||||
| 주1) 21.03.03에 발행한 전환우선주의 시가하락에 의한 최저 Re-fixing 가격은 58,000원이며, 21.03.08에 발행한 전환우선주의 시가하락에 의한 최저 Re-fixing가액은 61,500원입니다. |
| [미행사 주식매수청구권 내역] |
| (기준일 : | 증권신고서 제출일 전일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
기말 미행사수량 |
행사기간 | 행사 가격 |
|---|---|---|---|---|---|---|---|---|
| 조도현 | 미등기임원 | 2019.10.02 | 신주교부 | 보통주 | 5,000 | 5,000 | 2021.10.02~2022.10.01 | 50,500 |
| 계열회사 직원 3명 | 계열회사 직원 | 2019.10.02 | 신주교부 | 보통주 | 5,000 | 5,000 | 2021.10.02~2022.10.01 | 50,500 |
| 계열회사 직원 1명 | 계열회사 직원 | 2019.11.04 | 신주교부 | 보통주 | 1,000 | 1,000 | 2021.11.04~2022.11.03 | 59,600 |
| 당사 직원 8명 | 직원 | 2021.03.12 | 신주교부 | 보통주 | 27,000 | 27,000 | 2023.03.12~2024.03.11 | 97,100 |
| 계열회사 5명 | 계열회사 직원 | 2021.03.12 | 신주교부 | 보통주 | 14,000 | 14,000 | 2023.03.12~2024.03.11 | 97,100 |
| 오혜영 | 등기임원 | 2021.03.31 | 신주교부 | 보통주 | 3,000 | 3,000 | 2023.03.31~2024.03.30 | 118,400 |
| 합 계 | 55,000 | 55,000 | - | - | ||||
전환 또는 행사가능주식수가 모두 행사되어 코스닥 시장에 추가 상장될 경우 주가 희석화 위험이 발생할 수 있습니다. 투자자들께서는 이점 유의하여 투자해 주시기 바랍니다.
IV. 인수인의 의견(분석기관의 평가의견)
| 본 장은 「자본시장과 금융투자업에 관한 법률」 제119조 및 제125조, 금융감독원의 '금융투자회사의 기업실사 모범규준'을 참조하여 작성된 대표주관회사인 케이비증권(주)의 내부규정에 따라 본건 공모 지분증권 인수인이 당해 공모 지분증권에 대한 의견을 기재하고 있는 부분입니다. 따라서 본 장의 작성 주체는 대표주관회사인 케이비증권(주)입니다. 발행회사인 (주)엔지켐생명과학은 "동사"로 기재하였습니다. 본 장에 기재된 분석의견 중에는 예측정보가 포함되어 있습니다. 그러나 예측정보에 대한 실제 결과는 여러가지 요소들의 영향에 따라 예측했던 것과 다를 수 있다는 점을 유의하시기 바랍니다. |
1. 분석기관
| 구 분 | 회 사 명 | 고 유 번 호 |
|---|---|---|
| 대표주관회사 | 케이비증권(주) | 00164876 |
2. 분석의 개요
대표주관회사인 케이비증권(주)는「자본시장과 금융투자업에 관한 법률」제71조 및 동법 시행령 제68조에 의거 공정한 거래질서 확립과 투자자 보호를 위해 다수인을 상대로 한 모집ㆍ매출 등에 관여하는 인수회사로서, 발행인이 제출하는 증권신고서 등에 허위의 기재나 중요한 사항의 누락을 방지하는데 필요한 적절한 주의를 기울였습니다.
대표주관회사는 인수 또는 모집ㆍ매출의 주선업무를 수행함에 있어 적절한 주의의무를 다하기 위해 금융감독원이 제정한 '금융투자회사의 기업실사(Due Diligence) 모범규준'(이하 "모범규준"이라 한다)의 내용을 내부 규정에 반영하여 2012년 2월 1일부터 제출되는 지분증권, 채무증권 증권신고서를 대상(자산유동화증권 등 제외)으로 기업실사를 의무적으로 수행하도록 규정하고 있습니다.
본 장에 기재된 분석의견은 대표주관회사인 케이비증권(주)가 기업실사과정을 통해 발행회사인 (주)엔지켐생명과학으로부터 제공받은 정보 및 자료에 기초한 합리적, 주관적 판단일 뿐이므로, 이로 인해 대표주관회사가 투자자에게 본 건 주주배정후 실권주 일반공모 유상증자의 투자여부에 관한 경영 및 재무상의 조언 또는 자문을 제공하는 것은 아닙니다.
또한 본 평가의견에 기재된 내용 중에는 예측정보가 포함되어 있으며, 예측정보에 대한 실제 결과는 여러 가지 요소들의 영향에 따라 최초 예측치와는 다른 결과를 가져올 수 있다는 점에 유의하시기 바랍니다.
| 「금융투자회사의 기업실사 모범규준」 제3조(적용범위 등) ① 이 규준은 법 제119조제3항의 규정에 의한 증권신고서 및 법 제122조의 규정에 의한 정정신고서를 제출하는 경우에 적용하며, 영업의 실체가 있는 발행회사가 제출하는 지분증권, 채무증권 증권신고서를 대상으로 하고 자산유동화증권 등은 적용대상에서 제외된다. ② 이 규준은 주관회사가 업무수행 중 참고해야 할 기본적인 지침으로 발행회사의 재무 및 영업 현황, 사업 환경, 투자위험, 인수 형태 등을 감안하여 강화하거나 완화하는 등 탄력적으로 운용할 수 있다. ③ 기업공개의 경우 기업공개 실사절차의 특성을 감안하여 이 규준의 내용중 한국거래소의 상장심사지침 등에서 의무사항으로 규정하고 있는 내용과 중복되는 부분에 대해서는 이를 생략하거나 완화할 수 있다. ④ 채무증권의 경우 i)보증유무, 상환조건(만기, 옵션유무), 특약 등 해당 사채의 특성, ii)법 제119조제2항에서 규정하고 있는 일괄신고서에 의한 발행인지 여부, iii)발행회사가 시행령 제121조제6항의 요건을 충족하고 있는지 여부, iv)해당 사채권에 대한 신용평가등급(외부 및 내부) 등을 감안하여 합리적인 기준에 따라 이 규준을 완화할 수 있다. ⑤ 제2항 내지 제4항에 따라 이 규준을 생략하거나 강화 또는 완화하는 경우에는 이사회나 리스크관리위원회(이하 ‘리스크관리위원회 등’)의 의사결정을 거쳐야 한다. |
분석의견의 상세한 내용은 동 증권신고서에 첨부되어 있는 기업실사 부분을 참고하시기 바랍니다.
3. 기업실사 일정 및 주요내용
| 일자 | 기업 실사 내용 |
|---|---|
| 2021년 08월 18일 | 가) 발행회사방문 - 유상증자 의사 및 자금조달 관련 논의 - 유상증자 필요성 검토 및 주요일정 협의 나) 회사 기본사항 점검 - 경영진 면담(경영철학, 회사연혁 등) - 사업내용 청취 및 주요제품 열람 |
| 2021년 08월 23일 ~ 08월 25일 |
가) 발행회사방문 - 실사 요청자료 송부 - 본사 방문 나) 회사 일반사항 관련 검토 - 정관검토 및 이사회 등 상법 절차 확인 - 경영진 평판 리스크 검토 - 회사의 사업 및 영업구조 관련 면담 |
| 2021년 08월 30일 ~ 09월 01일 |
가) 회사 기본사항 검토 - 정관 등 기본자료 수령 - 대략적인 자금 사용 목적 등에 관한 청취 - 발행 방식 및 조건 등에 관한 협의 - 금융당국으로부터 제재조치 여부 확인 - 근로기준법 위반행위, 소송진행 여부 확인 나) 산업에 관한 사항 검토 - 산업에 대한 이해 - 산업 경쟁상황, 시장규모, 성장주기 등 확인 - 법률 및 정부규제에 관한 사항 검토 - 시장 내 중대한 환경, 제도 변화요인 검토 다) 회사 지배구조에 관한 사항 검토 - 경영진의 변동내역 및 근무경력 검토 - 종속회사에 관한 사항 검토 - 최대주주의 지분율 및 경영권 안정성 검토 - 사내규정 및 내부통제시스템 확인 - 공시시스템 검토 및 담당자 면담 |
| 2021년 09월 06일 ~ 09월 09일 |
가) 영업에 관한 사항 검토 - 제품별 매출 현황, 부문별 수익성추이 확인 - 주요 공급처, 매입처에 관한 사항 - 향후 투자계획에 관한 사항 - 향후 수익성 개선 계획에 관한 사항 나) 재무에 관한 사항 검토 - 매출채권, 재고자산 현황 및 연령분석 - 기타채권 현황 및 회수 내역 분석 - 수익성/성장성/안정성 지표 분석 - 차입금 만기구조 분석 - 현금흐름 구조, 유동성 분석 - 향후 유동성 개선 계획에 관한 사항 - 주식연계채권 내역 확인 - 환위험 관리 현황 분석 다) 기타 사항 검토 - 발행시장 상황 검토 - 자금 조달금액, 공모가액의 적정성 검토 - 이사회의사록, 인수계약서 등 주요 서류 확인 - 최대주주 및 특수관계인 등 청약 여부 체크 |
| 2021년 09월 13일 ~ 09월 16일 |
- 실사보고서 작성 - 증권신고서 작성 가이드 및 추가자료 작성 |
| 2021년 09월 17일 ~ 10월 06일 |
- (정정) 증권신고서 추가자료 작성 |
| 2021년 10월 07일 ~ 11월 16일 |
- 3분기 보고서 작성 현황 점검 및 주요 변동사항 파악 - Zydus Cadila CMO 및 라이선스 계약 현황 파악 - (정정) 증권신고서 추가자료 작성 |
4. 실사참여자
[대표주관회사]
| 소속기관 | 부서 | 성명 | 직책 | 실사업무분장 | 참여기간 | 주요경력 |
|---|---|---|---|---|---|---|
| 케이비증권 | SME금융부 | 연대호 | 상무 | 증자업무 총괄 | 2021년 08월 18일 ~ 2021년 11월 16일 |
기업금융업무 등 23년 |
| 케이비증권 | SME금융부 | 김태헌 | 대리 | 기업실사 실무 | 2021년 08월 18일 ~ 2021년 11월 16일 |
기업금융업무 등 6년 |
| 케이비증권 | SME금융부 | 엄태호 | 대리 | 기업실사 실무 | 2021년 08월 18일 ~ 2021년 11월 16일 |
기업금융업무 등 6년 |
[발행회사]
| 소속 | 부서 | 성명 | 직급 | 담당업무 |
|---|---|---|---|---|
| (주)엔지켐생명과학 | 투자전략기획실 | 양석모 | 상무 | 투자자금조달 업무 등 14년 |
| (주)엔지켐생명과학 | 투자전략기획실 |
박성용 | 과장 | 투자전략기획 업무 등 4년 |
| (주)엔지켐생명과학 | 투자전략기획실 |
김성연 | 주임 | 투자전략기획 업무 등 3년 |
5. 기업실사 세부 항목 및 점검 결과
- 동 증권신고서에 첨부되어 있는 기업실사 보고서를 참조해 주시기 바랍니다.
6. 종합 의견
가. 대표주관회사인 케이비증권(주)는 (주)엔지켐생명과학이 2021년 09월 17일 이사회에서 결의한 기명식 보통주 5,300,000주에 대한 주주배정후 실권주 일반공모 방식으로 발행을 결정하고 이에 잔액인수 함에 있어 다음과 같이 의견을 제시합니다.
| 긍정적 요인 | ▶ 동사는 동사의 신약 후보물질인 EC-18(PLAG) 작용기전을 통해 동사는 구강점막염(CRIOM), 신종코로나바이러스(COVID-19), 급성방사선증후군(ARS) 등 다양한 신약개발 파이프라인을 구성하고 있습니다. 특히, 동사의 구강점막염의 미국 FDA 임상 2상을 진행하고 있으며, 동사는 올해 임상 2상의 Topline(투약 후 안정성 결과) 결과 도출 및 이후 FDA의 혁신신약(BTD) 신청을 계획하고 있습니다. 이후 동사는 임상 3상 IND(임상시험계획승인) 신청 및 라이선스 아웃(기술이전)을 계획하고 있어, 동사가 보유하고 있는 파이프라인 중 구강점막염의 기술이전 가능성이 높을 것으로 판단하고 있습니다. ▶ 동사는 Zydus Cadila 간 LOI(Letter Of Intent) 체결을 통해 Zydus Cadila가 생산하는 pDNA 백신의 위탁생산(CMO)에 대해서 독점적 권리(exclusive right)를 우선 협의한 상황입니다. 본 내용에 따라, 동사는 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 본격적인 백신 생산 및 Zydus Cadila사로부터 판매를 진행할 것으로 계획하였습니다. 그러나 현재까지 위탁생산(CMO) 본 계약 내 세부조항 및 사전절차를 구체적으로 협의하고 있으나 계약 여부는 확정되지 않은 상황입니다. 다만, 동사는 LOI내용에 따라 2022년 부터 약 1억 5천만 dose(약의 1회분)의 백신을 생산할 예정이며, 향후 최대 7억 dose까지 생산할 수 있다는 내용이 포함되어 있습니다. 동사는 Zydus Cadila의 pDNA 백신의 위탁생산과 더불어, 라이선스 매입 또한 진행하고 있습니다. 동사는 라이선스 매입을 통해 ZyCoV-D의 인도 외 지역 허가 시 당사가 직접 공급하기 위함입니다. 종합적으로, 동사는 추후Zydus Cadila의 pDNA백신 위탁생산 및 라이선스 매입의 본 계약 체결 시 당사의 수익성은 개선될 것으로 판단하고 있습니다. ▶ 동사는 2021년 3분기 말 연결기준 57,679백만원의 부채가 있으며, 부채비율은 70.0%, 차입금의존도는 35.7%입니다. 동사는 지속적인 영업손실과 당기순손실 발생, 적자를 충당하기 위한 시장에서의 자금조달로 인해 최근 3년동안 연결기준으로 부채비율이 2018년말 14.0%에서 2020년말 70.8%, 차입금의존도가 2018년말 5.8%에서 2020년말 34.8%로 재무지표가 악화되었으나, 2021년 02월 약 300억원의 전환우선주를 발행하면서 2021년 3분기 말 연결기준으로 부채비율 70.0%로 부채비율이 소폭 개선되는 모습을 보이고 있습니다. ▶ 동사의 매출채권 회전율의 경우 최근 3년 및 2021년 3분기 동안 증가하고 있는 추세에 있으나 크게 변동하고 있지는 않으며 평균 4.09회를 보이고 있는 상황이며, 매출채권 회전일수는 평균 72.2일로 약 3개월 전후로 매출채권이 회수되고 있는 모습을 보이고 있는 상황입니다. |
| 부정적 요인 | ▶ 동사의 후보물질은 EC-18은 저분자 합성신약으로 동사의 주요 신약개발은 화학합성 의약품 위주로 진행되고 있습니다. 그러나, 전 세계 의약품 시장에서 바이오의약품이 차지하는 매출 비중은 지속적으로 증가하는 추세로 2018년 28%에서 2026년 바이오의약품은 의약품산업 내 비중이 35%까지 증가할 것 전망하며, 매출 상위 100대 제품 내 비중이 55%를 차지할 것을 전망하고 있습니다. 이는 의약품 시장의 중심이 합성의약품에서 바이오의약품으로 이동하는 추세임에 따라, 동사의 주요 신약 개발영역인 합성신약부문의 개발 등 악영향을 끼칠 수 있습니다. 또한, 전체 제약산업의 환경이 악화되거나 새로운 방식의 의약품 산업이 발전하게 될 경우 동사가 속해있는 합성 의약품 산업의 전망이 악화될 수 있으며, 이는 동사의 사업에 부정적인 영향을 미칠 수 있습니다. ▶ 동사의 코로나 19 치료제의 국내 임상 2상에서는 탐색적 임상시험의 제한된 소수의 대상자 참여와 증상 악화 같은 이상반응 발생 시 투약을 즉시 중단하도록 설계된 임상 디자인의 한계로, 총 14일 동안 1일 1회 경구 투약을 통해 확인하고자 했던 1차 평가변수인 경증 폐렴 환자에서 14일 이내에 산소 치료가 필요한 중증 폐렴 또는 급성호흡곤란증후군(ARDS)으로 이행되는 확률(%)은 투약군 간 통계적 유의성을 확인하지 못했습니다. 동사는 향후 코로나 19 환자 대상 임상 시험을 지속적으로 진행할 예정이나, 임상시험에 따른 지속적인 개발비 지출에도 불구하고 유의미한 임상 결과를 도출하지 못할 가능성도 존재합니다. 동사는 코로나19 치료제와 더불어 주요 파이프라인을 통한 임상시험으로 연구개발을 진행할 계획입니다. 그러나 동사 제품의 임상 시험에서의 개발 실패의 가능성을 배제할 수 없으며, 개발 실패시 임상실험 진행에 투입된 비용과 시간에 비례하여 당사의 재무적 안정성에 급격한 훼손이 발생할 수 있습니다. ▶ 동사는 현재 진행중인 신약 파이프라인에 대해서, 임상 결과에 따라 국내외 제약사 및 바이오 기업에 기술이전함으로써 수익을 창출하는 사업모델을 구축하고 있으나, 과거 라이선스 아웃을 진행한 이력은 없는 상황입니다. 또한 추후 라이선스 아웃과 관련된 구체적인 계약 체결 등 계획도 부재한 상황입니다. 이는 지속적인 개발비 발생으로 당사 손익에 악영향을 끼칠 수 있습니다. ▶ 동사가 위탁생산하고자 하는 ZyCoV-D의 경우 백신의 효능이 ZyCoV-D의 경우 돌파감염율이 높은 델타변이가 유행한 시점에 대한 임상결과임을 감안해야 하나, 접종자의 66.6%에서 증상성 질환을 예방할 수 있다는 결과로 여타 코로나19 백신보다는 비교적 효능이 낮은 수치입니다. 또한, 한달 간격으로 3회 접종을 해야되는 등 여타 코로나 백신에 비해 상대적으로 부각될 수 있는 단점들이 존재하는 상황입니다. 이는 향후 당사의 LOI체결에 따른 주요 위탁생산 및 라이선스 매입 대상인 ZyCoV-D에 대해서 향후 백신의 시장성에 대해서 불확실성이 상존하는 주요 요인입니다. 특히, 현재 인도 내 긴급사용만 승인된 상태로, 현재 인도 외 백신사용이 불가한 상황임으로, 당사의 위탁생산 사업은 인도 내 코로나19 접종현황에 따라 크게 영향받으며, 현재 인도 내 코로나 19 백신 개발 현황에 유의할 필요가 있습니다. ▶ 동사는 신약물질 EC-18의 작용기전을 활용한 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 임상시험 관련 연구개발비가 지속적으로 발생하고 있으며, 이에 관련 투자가 이루어지면서 2015년부터 지속적인 당기순손실이 발생하고 있습니다. 동사의 영업손실은 2018년 14,329백만원(영업이익률 : -46.2%), 2019년 16,402백만원(영업이익률 : -52.1%), 2020년 19,107백만원(영업이익률 : -74.0%), 2021년 3분기 15,545백만원(영업이익률 : -94.3%)로, 매년 영업손실이 발생하고 있는 상황이며, 영업손익이 악화되는 추세를 보이고 있습니다. 이로 인하여 매년 당기순손실이 지속되고 있으며, 당기순손익도 악화되는 추세를 보이고 있는 상황입니다. ▶ 동사는 2020년부터 매출이 감소하였음에도 취득원가가 증가한 사유는 코로나19의 영향으로 API업체들의 과도한 경쟁으로 매출단가는 하락한 것에 반하여 생산단가는 물가상승 및 원재료 상승에 의하여 올라가고 있기 때문입니다. 이에 따라 동사의 재고자산 평가충당금설정률은 2018년말 연결기준 15.5%에서 2021년 3분기 말 연결기준 32.8%까지 상승하였습니다. 또한, 이러한 사항이 반영되어 재고자산회전율도 2019년도에는 약 3.8회였으나, 2020년에는 약 2.8회, 2021년 3분기에는 약 2.6회로 감소하고 있는 상황입니다. ▶ 동사의 최대주주인 (주)브릿지라이프사이언스가 배정물량의 약 10% 참여 시 유상증자 후 최대주주의 지분율은 현재 11.5%에서 7.5%까지 감소할 수 있으며, 특수관계인 중 2대주주인 손기영이 배정물량의 약 10% 참여 및 기타 특수관계인들은 미참여를 가정할 시 최대주주 및 특수관계인이 보유하고 있는 지분율은 증권신고서 제출일 전일 기준 18.7%에서 유상증자 후 12.1%까지 감소할 수 있습니다. |
| 자금조달의 필요성 |
▶ 동사는 금번 유상증자를 통해 조달하는 자금을 채무상환, 운영자금(원재료 구매 등), 시설자금 등으로 활용할 계획입니다. ▶ 금번 유상증자를 통해 조달한 자금의 세부사용 내역은 "Ⅴ. 자금의 사용목적"을 참고하시기 바랍니다. |
나. 대표주관회사는 동사가 제출한 자료와 당사가 객관적으로 정확하고 신뢰할 수 있다고 믿어지는 자료를 중심으로 용역을 수행하였으며, 객관적인 입장에서 공정을 기하기 위하여 최선의 노력을 다 하였습니다.
다. 대표주관회사는 상기 실사를 통해 제공받는 자료들로부터 도출된 결과나 오류, 누락 등에 대하여 당사가 책임지지 않으며, 인간적 또는 기계적, 기타 그 외의 다른 요인에 의한 오류발생 가능성으로 인해 본 평가 내용에 대해 명시적으로 혹은 묵시적으로도 증명이나 서명 또는 보증 및 단언을 할 수 없습니다.
라. 동사의 금번 유상증자는 국내외 거시경제 변수변화로 투자수익에 대한 확실성이 저하될 수 있습니다. 투자자 여러분께서는 상기 검토결과는 물론 동 증권신고서 및 투자설명서에 기재된 동사의 회사 전반에 걸친 현황 및 재무상의 위험과 산업 및 영업상의 위험요인 등을 감안하시어 투자에 유의하시기 바랍니다.
또한, 당사가 현재 알고 있지 못하거나 중요하지 않다고 판단하여 동 증권신고서 및 투자설명서에 기재하지 않은 사항이라 하더라도 동사의 운영에 중대한 부정적 영향을 미칠 수 있다는 가능성을 배제할 수는 없으므로, 투자자께서는 동 증권신고서 및 투자설명서에 기재된 정보에만 의존하여 투자판단을 해서는 안되며, 독자적이고도 세밀한 판단에 의해 투자결정을 하시기 바랍니다.
| 2021년 09월 17일 |
| 대표주관회사 : 케이비증권 주식회사 |
| 대표이사 김 성 현 |
V. 자금의 사용목적
1. 모집 또는 매출에 의한 자금조달 내역
가. 자금조달금액
|
(단위 : 원) |
|
구 분 |
금 액 |
|---|---|
|
모집 또는 매출총액(1) |
301,570,000,000 |
|
발행제비용(2) |
4,666,031,100 |
|
순 수 입 금 [ (1)-(2) ] |
296,903,968,900 |
|
주1) 상기 금액은 1차 발행가액을 기준으로 산정한 금액으로 모집가액 확정시 변경될 수 있습니다. |
| 주2) 상기 모집총액은 우선적으로 하단에 기재된 자금의 사용 목적에 따라 사용할 예정입니다. |
| 주3) 발행제비용은 공모금액 및 실권규모에 따라 변경될 수 있으며, 상기 기재 금액은 청약 초과로 인하여 실권이 발생하지 않은 상황을 가정하여 산정되었습니다. 또한 상장수수료는 상장신청일 직전일 주가에 따라 변동될 수 있습니다. |
나. 발행제비용의 내역
|
(단위 : 원) |
|
구 분 |
금 액 |
지급일자 |
계산근거 |
|---|---|---|---|
|
발행분담금 |
54,282,600 |
신고서제출일 |
모집총액의 0.018% (10원 미만 절사) |
|
인수수수료 |
4,523,550,000 |
납입일익일 |
납입금액의 1.5% |
|
상장수수료 |
22,860,000 |
신주상장일 |
추가상장 금액 기준 2,000억원 초과 5,000억원 이하 (1,410만원 + 2,000억원 초과금액의 10억원당 4억원) |
|
등록세 |
10,600,000 |
등기일 |
증자 자본금의 0.4% |
|
교육세 |
2,120,000 |
등기일 |
등록세의 20% |
|
기타비용 |
52,618,500 |
- |
구주주청약서, 투자설명서 인쇄 및 발송비 등 |
|
합 계 |
4,666,031,100 |
- |
- |
| 주1) 상기 금액은 1차 발행가액을 기준으로 산정한 금액입니다. |
| 주2) 발행제비용은 공모금액 및 상장신청일 직전일 한국거래소에서 거래되는 당사의 보통주식 종가, 유관기관 정책 등에 따라 변동될 수 있습니다. |
| 주3) 기타비용은 예상금액으로 변동될 수 있습니다. |
| 주4) 발행제비용은 공모금액에서 지급될 예정입니다. |
2. 자금의 사용 목적
가. 자금의 사용목적
| (기준일 : | 2021년 09월 17일 | ) | (단위 : 백만원) |
| 시설자금 | 영업양수 자금 |
운영자금 | 채무상환 자금 |
타법인증권 취득자금 |
기타 | 계 |
|---|---|---|---|---|---|---|
| 27,170 | - | 124,400 | 150,000 | - | - | 301,570 |
| 주1) 당사의 채무상환자금 중 150,000백만은 금번 주주배정 후 실권주 일반공모를 통한 유상증자 대금 납입 후 3영업일 내 상환을 조건으로 차입할 예정입니다. 이에 따라 KB증권으로부터 차입한 자금은 자금사용목적상 채무상환자금이나, 실질적으로는 운영자금(Zydus Cadila사 pDNA 백신 위탁생산(CMO)에 따른 원/부자재 및 라이선스 구매)으로 사용될 예정입니다. 주2) 자금의 사용목적 중 외화로 필요한 금액에 대하여는 2021년 09월 03일 서울외국환중개 매매기준율 (1,159.70원/달러)을 사용하여 원화금액을 산출하였으며, 상세 액수는 향후 당사의 주가 및 환율의 변동에 따라 변경될 수 있습니다. |
나. 공모자금 세부 사용목적
당사는 금번 유상증자 공모자금을 아래와 같은 우선순위에 따라 사용할 계획을 가지고 있습니다.
| 우선순위 | 구분 | 세부내역 | 금액 |
|---|---|---|---|
| 1순위 | 채무상환자금 | KB증권 단기차입금 상환(운영자금) | 150,000 |
| 2순위 | 운영자금 | Zydus Cadila사 pDNA 백신(ZyCoV-D) 위탁생산(CMO)에 따른 원/부자재 구매(4개월 분) |
78,000 |
| 3순위 | 운영자금 | pDNA License in Upfont & Milstone Fee | 46,400 |
| 4순위 | 시설자금 | 백신(pDNA 및 mRNA) 생산시설 신축 | 27,170 |
| 합 계 | 301,570 | ||
| 주1) 상기 금액은 1차 발행가액을 기준으로 산정한 금액입니다. 주2) 상기 계획은 현재 시점에서 예상되는 시기, 사용금액, 사용 용도이며, 향후 시장 상황에 따라 변동될 수 있습니다. 주3) 자금의 사용목적 중 외화로 필요한 금액에 대하여는 2021년 09월 03일 서울외국환중개 매매기준율(1,159.70원/달러)을 사용하여 원화금액을 산출하였으며, 상세 액수는 향후 당사의 주가 및 환율의 변동에 따라 변경될 수 있습니다. 주4) 백신 생산 시설에는 DS(원료)와 DP(완제)가 포함되었습니다. |
1) 채무상환자금
당사는 해외 인도법인인 Zydus Cadila사가 세계 최초로 개발한 pDNA 백신(ZyCoV-D)의 위탁생산(CMO)과 관련하여 생산 공급 의향서(LOI, Letter of Intent)를 체결한 상태로, 당사는 위탁생산(CMO) 본 계약 및 라이선스 계약을 체결할 것으로 예상하고 있습니다. 본 계약 시 당사는 약 4개월 기준 위탁생산(CMO)에 필요한 운전자금(원/부자재 등)으로 약 2,280억원으로 예상하고 있습니다. 이를 충당하기 위해 당사는 본 건 유상증자의 납입 전 대표주관사인 KB증권을 통해 유상증자 납입 후 3영입일 내 상환을 조건으로 1,500억원의 자금을 단기 차입할 예정입니다.
다만, 최초 증권신고서 제출 시 본 단기자금대출일은 위탁생산(CMO) 본계약 체결예정일인 2021년 10월 이후로 예상하였으나, 현재 위탁생산(CMO) 본계약 체결일정이 지연되고 있어 현재까지 단기자금대출이 진행되지 않은 상황입니다. 단기자금대출은 위탁생산(CMO)의 본 계약 체결 이후 진행될 예정이나, 현재까지 본 계약 체결일이 확정되지 않아 단기자금대출일 또한 미정인 상황입니다.
| [단기차입금의 주요 금융조건] |
| 구분 | 내용 |
|---|---|
| 대주 | KB증권(주) |
| 대출금액 | 금 일천오백억원(\ 150,000,000,000) |
| 차입예정일 | 본 계약 체결 이후(미정) |
| 만기 | 차입일로부터 6개월 |
| 대출금리 | 고정 (연) 3.90% |
| 자금사용 목적 | Zydus Cadila사 pDNA 백신 위탁생산(CMO)에 따른 원/부자재 구매 |
| 의무 상환 | 유상증자 대금납입 후 3영업일 이내 조기상환 |
| (출처: 당사 제시) |
상기 차입은 당사와 Zydus Cadila 간 본 계약 체결 이후로 예상하고 있으며, 대표주관사인 KB증권을 통해 단기 차입할 예정입니다. 단기 차입진행 완료 시 본 증권신고서를 통해 추가 안내 예정입니다.
이와 관련하여, 당사가 추진중인 Zydus Cadila 사와 관련된 세부내용은 '사업위험 마.', '사업위험 바.'를 참고해주시기 바라며, 본 단기차입을 통해 사용하고자 하는 구체적 내용은 하기 운영자금 사용용도를 참고해 주시기 바랍니다.
2) 운영자금
| ※ 본 운영자금은 상기 자금사용목적 중 1순위인 채무상환자금이 실질적으로는 하기와 운영자금으로 사용되었으며, 투자자 여러분들께서는 운영자금 사용용도를 반드시 확인해 주시기 바랍니다. |
가) Zydus Cadila사 pDNA 백신(ZyCoV_D) 위탁생산(CMO) 관련 생산비용
■ 자금 사용의 필요성
Zydus Cadila사는 인도 제약/백신 기업으로, 2021년 08월 20일 Zydus Cadila사의 pDNA백신인 ZyCoV-D에 대해서 인도의약품관리국(DCGI, Drug Controller General of India)으로부터 긴급사용(EUA, Emergency Use Approval)이 승인되었습니다. 이에 따라 9월중순부터 인도 내 ZyCov-D 백신 접종 개시 예정임에 따라, Zydus Cadila사는 자국 내 백신 접종에 필요한 백신 위탁생산(CMO)기관이 필요한 상태였습니다. 이에 따라 당사는 Zydus Cadila 사와 LOI를 체결하였으며, 본 계약 체결 전 위탁생산에 대비하여 매입자금을 선제적으로 조달하고자 합니다. Zydus Cadila 사와 체결한 LOI와 관련된 사항은 '사업위험 마', '사업위험 바'를 반드시 참고해 주시기 바랍니다. 본 LOI체결에 따른 당사의 향후 추진계획은 아래와 같습니다.
| [당사의 향후 추진계획] |
|
시기 |
향후 추진 사항 |
|---|---|
|
21.08.20 |
Zydus pDNA vaccine ZyCoV-D 인도 DCGI EUA (Emergency Use Approval) 획득 |
|
21.08.27 |
Zydus와 LOI 체결 |
|
21.10~12 |
Zydus Cadila사와 엔지켐생명과학 라이센스 및 CMO 계약 체결 예정 기술이전 (Tech Transfer) 진행 예정 WHO EUA Apply Zydus Cadila, ZyCov-D 제품 인도 현지 생산 개시(연 1.5억 도즈) |
|
2022.02 |
ZyCov-D CMO제품 국내 생산 개시(엔지켐생명과학 컨소시엄) - 생산규모: 연 1.2억dose |
| (출처: 당사 제시) 주1) 상기 계획은 향후 진행상황에 따라 일부 변경될 수 있습니다. |
당사는 2021년 중 위탁생산(CMO)의 본 계약 체결과 동시에 2022년부터 ZyCoV-D 본격적인 백신 생산 및 Zydus Cadila사로부터 백신 위탁생산을 계획하고 있습니다. 이에 따라 당사는 ZyCoV-D 위탁생산에 필요한 약 4개월 치 운전자금(원/부자재, 세포주, 배양액, plasmid vial 등을 구매비용)을 2022년 생산 일정에 맞춰 선제적으로 조달하고자 하며, 약 2,280억원이 필요할 것으로 예상하고 있습니다. 이는 상기 KB증권으로 차입한 단기차입금 1,500억원을 포함하여 건 유상증자 대금 중 약 780억원을 추가로 활용할 예정입니다. 당사는 이후 필요한 운전자금은 Zydus Cadila사의 본격적인 매출 발생에 따라 영업활동현금흐름으로 충당이 가능할 것으로 예상하고 있습니다.
■ 자금 사용의 세부 내역
1. pDNA 제조 비용 추정
당사는 '사업위험 마.'에서 기재한 바와 같이, 컨소시엄 내 업체들이 보유하고 있는 생산설비를 통해 pDNA의 백신 원액 및 완제 Fill/Finish를 진행할 예정입니다. 당사는 최초 비용 산정 시 각 컨소시엄에서 보유한 원액 벌크(DS) 시설 및 Fill&Finish의 배치(batch) 단위 기준으로 생산 비용을 산정하였습니다. 배치(batch)란, 하나의 공정 또는 연속된 공정을 통해 생산 된 출발 물질, 포장 자재 또는 제품의 정해진 수량으로써, 보유 시설 공정라인의 단위로 볼 수 있습니다. 생산시설 능력과 관련한 자세한 사항은 '사업위험 마.'를 참고해 주시기 바랍니다.
이에 따라 원액 벌크는 1배치 당 약 4억 1,568만원, Fill&Finish의 경우 1배치 당 1억 1,320만원의 비용이 발생할 것으로 예상하고 있습니다. 1배치 당 생산수량은 원액 벌크의 경우 약 18.8만 dose(dose: 백신 1회 단위), 완제 Fill/Finish의 경우 약 10만 dose의 생산이 가능할 것으로 판단하고 있습니다.
종합적으로 각 공정별(원액, fill&finis) 1 배치 라인 당 필요한 생산 비용과 생산 물량(dose)을 감안하였을 때, 완제 백신 1 dose 당 생산 비용은 약 5,552원(USD 4.79)으로 예상하며(원액 벌크의 경우 50% 수율을 감안), 본 공모자금으로 필요한 4개월 치 수량인 4천만 dose에 필요한 최종 운전자금은 약 2,280억원(USD 200m)으로 예상하고 있습니다. 본 건 위탁생산과 관련된 세부 내역은 하기와 같습니다.
| [1배치(batch) 기준 원액 벌크 비용] |
| (단위: 만원) |
| 구분 |
세부 항목 |
금액 |
|---|---|---|
|
원액벌크 원부자재 |
발효 |
4,350 |
|
회수 |
1,168 |
|
|
정제 |
22,050 |
|
| 원액벌크 인건비 및 기타 비용 |
인건비 |
6,000 |
|
QC + IPC 비용 |
2,000 |
|
|
수도/가스/전기료 (UT비용) |
2,500 |
|
|
감가상각액 |
3,500 |
|
|
합계(원액 벌크 비용) |
41,568 |
|
| (출처: 당사 제시) 주1) 상기 비용은 당사 추정자료로, 실제 비용과 다소 차이가 발생할 수 있습니다. 주2) QC: Quality Control, IPC: initial Product Check, UT: Utility 주3) 상기 원액 벌크의 1배치 당 백신 원액 생산능력은 약 18.8만 dose로 추정함. |
| [1배치(batch) 기준 완제 fill/finish(DP)] |
| (단위: 만원) |
| 구분 |
세부 항목 |
금액 |
|---|---|---|
|
완제 원부자재 |
완제제조용 Bag X 2, 멸균 Filter, Vial + Stopper + AL cap/Carton + Label + Insert 및 외 포장 Box |
1,900 |
|
완제 인건비 및 기타비용 |
인건비 |
3,750 |
|
QC + IPC 비용 |
2,000 |
|
|
수도/가스/전기료 (UT비용) |
1,500 |
|
|
감가상각액 |
2,170 |
|
|
합계(Fill &Finish 비용) |
11,320 |
|
| (출처: 당사 제시) 주1) 상기 비용은 당사 추정자료로, 실제 비용과 다소 차이가 발생할 수 있습니다. 주2) AL cap: 알루미늄 캡, Vial: 바이얼 주3) 상기 완제 fill/finish의 1배치 당 백신 완제 생산능력은 1만 vial로, 약 10만 dose(1 vial = 10 dose)의 완제 백신 생산이 가능할 것으로 추정함. |
| [Dose 당 단가추정] |
| (단위: 원) |
| 구분 | 기준 |
금액 |
|---|---|---|
| 원액벌크 | 1배치 당 벌크가격(41,568만원) ÷18.8만 dose ÷ 0.5(50% yield) | 4,420 |
| Fill&Finish |
Fill&finish 비용(11,320만원) ÷1만 vial(10만 dose) |
1,132 |
| 최종 단가 |
5,552원(USD 4.79) |
|
| (출처: 당사 제시) 주1) 상기 비용은 당사 추정자료로, 실제 비용과 다소 차이가 발생할 수 있습니다. 주2) 18.8만 dose는 원액 벌크(DS) 1배치기준이며, 1만 vial(약 10만 dose)은 완제 fill&finish(DP) 배치 기준입니다. 주3) 미생물을 활용하는 제조공정의 특성상 Loss 등을 감안 시 수율은 보수적으로 50%로 계산하였습니다. 주4) 본 단가추정은 프로젝트 초기 가정에 의거한 당사 추정자료로, 향후 가격 협상, 생산량, 수율 등 여러 요인으로 변동가능성이 높아 실제 비용과 차이가 발생할 수 있습니다. |
2. 위탁생산(CMO) 계약에 따른 연간 제조비용 추정
| 구분 | 기준 | 금액 |
|---|---|---|
| 연간제조비용 | 최종 제조단가(5$ 가정) * 1.2억 dose | 약 6,960억원(USD 600m) |
| 4개월 운전 자금 | 연 USD 600m | 약 2,280억원(USD 200m) |
| (출처: 당사 제시) 주1) 상기 비용은 당사 추정자료로, 실제 비용과 다소 차이가 발생할 수 있습니다. |
나) Zydus Cadila사 pDNA 백신(ZyCoV_D) 라이선스 매입(License-In)
■ 자금 사용의 필요성
당사가 매입하고자 하는 라이선스의 주요 백신은 ZyCoV-D로, 현재 임상 3상의 중간 결과에 따라 인도 DCGI에서 긴급사용승인이 된 상태입니다. 현재 이 외에는 사용이 허가된 국가는 없으나, 향후 세계보건기구(WHO)에 긴급사용신청을 진행할 예정입니다. 만일, 세계보건기구(WHO)의 긴급사용승인이 될 경우 COVAX Facility(코백스 퍼실리티)를 통해서 개발도상국 등 백신 제공이 가능합니다.
코백스 퍼실리티는 세계에 코로나19 백신을 평등하게 공급하기 위해 설립된 세계 백신 공동 분배 프로젝트로, 세계백신면역연합, 유니세프, 세계보건기구등이 주도하고 있으며 코로나19 백신이 세계 모든 나라에 공평하게 공급되는 것을 목표로 하고 있습니다. 이에 따라 당사는 향후 WHO의 긴급사용승인 시 독점적 권리를 통해 인도 외 타 국가의 시장선점이 가능하고 수익성 또한 제고할 수 있을 것으로 판단하고 있습니다. 다만, WHO의 긴급사용승인은 신청 예정 단계로, 현재 WHO 긴급사용승인과 관련하여 확정된 사항은 없다는 점을 유의해 주시기 바랍니다.
■ 자금 사용의 세부 내역
당사는 상기 목적에 따라, Zydus Cadila사와 체결한 LOI 내용을 토대로 상기 위탁생산(CMO) 계약과 더불어 Zydus Cadila사의 DNA 백신의 독점 라이선스 계약을 체결할 예정입니다. 다만, 최초 증권신고서 제출 시 2021년 10월 중으로로 예상했던 계약체결이 지연되고 있는 상황으로, 현재 당사는 라이선스 본계약 체결 전인 상황입니다. 이에 따라 현재까지 구체적으로 정해진 사항은 양사가 체결한 LOI 상 Zydus Cadila사가 개발한 코로나 DNA백신에 대해서 독점적 권리(exclusive right) 부여 외 로열티 및 마일스톤 지급 등 대한 구체적인 사항은 미확정인 상태이나, 현재 당사가 예상하는 라이선스 계약의 주요 내용은 아래와 같습니다. LOI와 관련된 사항은 '사업위험 마.'를 참고해 주시기 바랍니다.
| [예상 License Agreement 주요 내용(Drafted)] |
| 항목 | 내용 |
|---|---|
| Products | - ZyCoV-D 원액("DS") 및 완제생산("DP") - 차세대 코로나 pDNA 백신("Next Generation Vaccines") - pDNA 기반 의약품("Medication") |
| 계약기간 | - 기본 계약기간 및 5년 및 연장 계약 가능 |
| 주요지역 | - 대한민국("Korea"), 아시아(인도 및 중국 제외), 동유럽을 포함한 저소득국가(low middle income countries, LMIC) |
| 권리 | - Zydus Cadila는 엔지켐생명과학에게 해당 지역에서 제품을 제조 및 유통하기 위해 Zydus Cadila가 소유하거나 관리하는 지적 재산권 및 know-how를 사용, 수입, 판매, 시장 점유율, 연구, 개발, 제조, 생산, 유통, 상용화 또는 그 밖에 방법으로 이용할 수 있는 독점 라이센스를 부여함 |
| 지불금 | - 선급급(Upfront Payment): USD 20m - 마일스톤(Milstone): 대한민국 긴급사용승인(EUA) 시 USD 20m - 경상기술료(Running Royalty) 민간부분시장 판매: 총 금액의 약 5% 공공부문시장 판매: 기술료 없음 |
| 비고 | - Zydus Cadila는 엔지켐생명과학이 해당 지역에서 제품의 운영 제조를 확립하는 데 필요한 모든 기술(노하우 및 지적 재산권 활용 권리 포함)을 엔지켐생명과학에게 이전해야 함 - Zydus Cadila는 합리적으로 합의된 가격, 수량 및 일정으로 Zydus Cadila가 공급하는 Pharmajet Tropis의 주사 바늘을 사용할 수 있는 권한을 엔지켐생명과학에 부여해야 함 |
| (출처: 당사 제시) 주1) 상기 라이선스 계약 초안(상호협의 중)은 추후 본 계약 진행 시 일부 변동될 수 있습니다. |
다만, 당사 및 Zydus Cadila사는 Licensing 및 CMO에 관련된 계약 내용을 현재 구체적으로 검토중이며, 양사 간 구체적인 Due Diligence 절차가 진행중에 있습니다. 당사는 명확한 계약 내용 및 권리관계를 구체적으로 확정할 예정이며, 향후 확인되는 대로 본 증권신고서 및 추가 공시를 통하여 정확한 내용을 전달할 계획입니다.
상기에 따라 당사는 선제적으로 라이선스 매입에 따른 비용을 본 유상증자 대금을 통해 조달하고자 하며, 라이선스 매입 비용은 Upfront Fee 및 Milestone Fee 각 232억원(USD 20m )이 소요될 것으로 예상하고 있습니다. 기술이전에 따른 비용지급시기는 본 계약 체결 후 2022년 내 진행될 예정입니다.
다) 위탁생산 및 라이선스 매입에 따른 효과
| [자이더스 카딜라 간 위탁생산 및 라이선스 매입 본 계약시 추정 손익] |
| 구분 | 2022년 | 2023년 | 2024년 | |
|---|---|---|---|---|
| 예상 매출 | 생산량(억 dose) | 1.2 | 1.5 | 3.0 |
| 총 매출(억 원) | 11,136 | 12,180 | 20,880 | |
| 예상 비용 | 생산 비용(억 원) | 6,960 | 7,830 | 13,920 |
| License in 비용(억 원) | 1,004 | 609 | 1,044 | |
| 원료(DS)시설 증축(억 원) | 530 | 2,000 | 1,235 | |
| 완제(DP)시설 증축(억 원) | 292 | 188 | 70 | |
| 소계 | 8,787 | 10,626 | 16,269 | |
| 예상 수익(억 원) | 2,349 | 1,552 | 4,611 | |
| 주1) 상기 수치는 당사의 추정치로서, 실제 계약에 따른 판매단가 등으로 다를 수 있습니다. 주2) 상기 수치는 기준환율에 따라 변경될 수 있음. 주3) 상기 매출은 2022년 최초 생산 이후 공정 및 수율개선 등 원가 절감 효과 등으로 인한 단가 하락을 감안한 수치임. 주4) License in 비용은 예상 Running Royalty(총 매출액의 약 5% 가정) 까지 포함된 금액임 |
종합적으로, 당사는 본 유상증자 대금으로 2022년 02월 백신 최초 생산을 위한 원부자재 선구매 비용이 상기와 같이 2,280억원(연간 비용의 26.5%), pDNA License in Upfront Fee & Milestone Fee 지급비용 464억원으로 총 2,744억원을 지급할 것으로 예상하고 있습니다. 이 외 당사는 추가적인 지출 예상금액으로 백신(DP+DS) 생산 시설 설계및 건축 비용 약 272억원을 예상하고 있습니다. 생산시설 자금과 관련된 사항은 하기 '3) 시설자금'을 참고해 주시기 바랍니다.
당사는 본 위탁생산 및 라이선스 매입을 통해 2022년 1억 2천만 dose 생산 시 총 매출은 약 1조 1,136억원이 발생할 것으로 예상하며, 본 유상증자 대금을 활용하여 본 사업을 진행하고자 합니다.
3) 시설자금
현재 당사는 오송지역에 백신 관련 시설을 신축중에 있으며, 당사가 설립하고자 하는 오송 바이오플랜트의 건설 개요 및 진행 현황은 아래와 같습니다.
| [오송 바이오플랜트 건설 개요] |
| 1. 사업명: 오송 바이오플랜트(백신 공장) 건설공사 2. 사업내용: 백신(pDNA 등) 생산 공장 건설 3. 공사기간: 2022년~2023년 4. 위치: 충북 청주시 흥덕구 오송읍 정중리 726(오송바이오폴리스 지구 내) 5. 부지면적: 17,500㎡(약 5,300평, 175m*100m) 6. 예상 생산능력: 최대 5억 dose |
| [오송바이오플랜트 site] |
 |
|
자금의사용목적. 오송바이오플랜트 site |
| (출처: 당사 제시) |
현재 당사는 약 1만 7,500㎡(약 5,300평)의 토지 매입이 완료되었으며, 당사는 토지 매입을 위해 총 5,265백만원의 비용을 지출하였습니다. 현재 당사는 글로벌 전문 엔지니어링사와 설계 공정을 협의중(현재 진행율 90%)이며, 2021년 4분기 내에 설계 공정을 최종 완성(2021.12월말 기준, 설계 공정 예정 진행율 100%)하여 2022년 상반기에 착공을 계획하고 있습니다. 당사는 착공 후 2024년 상반기(2024년 6월말 기준, 예정 진행율 100%) 까지 완공 및 가동을 계획하고 있으며, 본 유상증자 대금 중 약 272억원을 활용하여 백신 완제(DP) 생산시설 및 기타시설에 필요한 자금으로 활용하고자 합니다.
| [본 건 시설자금 세부내역] |
| (단위: 백만원) |
| 구분 | 내용 | 금액 |
|---|---|---|
| 백신 완제(DP) 생산시설 |
- Fill Finished Area 600평, - QC/QA 300평, Admin/공무200평 - 창고500평 - UT 500평 총 2,100평 * 평당 1,350만원 |
27,170 |
| (출처: 당사 제시) 주1) 상기 내용에 기재된 총 비용 중 본 건 유상증자 대금을 제외한 잔여금액은 자체자금으로 충당할 예정입니다. |
당사는 시설자금을 하기 사용계획에 맟춰 사용하고자 하며, 본 유상증자 대금 약 272억원은 2023년 하반기까지 소진될 것으로 예상하고 있습니다. 당사의 2024년 상반기까지 계획하는 시설투자자금의 시기는 아래와 같습니다.
| [향후 시설자금 사용계획(2022년~2024년) |
| (단위 : 억원) |
| 구분 | 2022년 상반기 |
2022년 하반기 |
2023년 상반기 |
2023년 하반기 |
2024년 상반기 |
Total | |
|---|---|---|---|---|---|---|---|
| 백신 완제(DP) 생산 시설 신축 |
생산시설 건축 |
95 | 95 | 47 | 47 | - | 284 |
|
시설 장비 구매 |
93 | - | 93 | - | - | 186 | |
|
시스템, 전산 구비 |
- | - | - | 70 | 70 | ||
|
설계 비용 |
10 | - | - | - | - | 10 | |
|
소 계 |
198 | 95 | 140 | 47 | 70 | 550 | |
| 백신 원료(DS) 생산 시설 신축 |
생산시설 건축 |
250 | 250 | 500 | 500 | 500 | 2,000 |
|
시설 장비 구매 |
- | - | 1,000 | - | 735 | 1,735 | |
|
설계 비용 |
30 | - | - | - | - | 30 | |
|
소 계 |
280 | 250 | 1,500 | 500 | 1,235 | 3,765 | |
| 합 계 | 478 | 345 | 1,640 | 547 | 1,305 | 4,315 | |
| 주1) 현재 설계 및 그에 따른 시공계가 완료되기 전 단계로 상기 시설공사비 및 장비구입비용, 설비 비용등은 추정한 금액이므로 실제 건설단계에서 일부 변경될 수 있습니다. 주2) 본 건 유상증자대금은 백신 완제(DP) 생산시설 신축자금으로 대부분 소진될 예정으로, pDNA백신 원료(DS) 생산시설의 경우 당사 자체자금 등을 활용하여 진행할 예정입니다. |
당사는 향후 CMO등 사업을 위해 백신 완제(DP) 생산시설 및 원료(DS) 생산시설을 증축할 계획을 가지고 있습니다. 당사는 유상증자 대금을 활용하여 설계, 백신 완제(DP) 생산시설 건축 및 시설 장비 구매에 사용하고, 부족한 부분은 자체자금 등을 통해 나머지 시설 장비 구축, 시스템, 전산 구비에 사용할 예정입니다. 장기적으로 2024년까지 총 4,315억원의 시설자금이 사용될 것으로 예상하고 있으며, 2022년 및 2023년에 필요한 자금은 약 3,010억원 수준으로 예상하고 있습니다. 다만, CMO 및 라이선스 계약에 따라 진행시점, 완공 시점은 6개월 이상 변동이 있을 수 있습니다.
특히, 백신 완제(DP) 시설의 경우 2023년까지 약 480억원이 소요될 것으로 예상되고 있으며, 이 중 당사는 본 건 유상증자 대금 약 272억원이 활용될 예정입니다. 이외 필요한 자금은 당사 자체자금 등을 활용하여 진행할 예정입니다.
완공 시 당사는 약 5억 dose의 완제 생산시설을 구축할 수 있을 것으로 예상하고 있으며, 향후 Zydus Cadila의 CMO 생산에도 활용할 수 있을 것으로 판단됩니다.
4) 자금의 운용계획
당사가 금번 유상증자를 통해 조달한 자금 중 일부 자금은 조달시기와 사용시기가 다소 차이가 있을 수 있습니다. 이에 조달로부터 사용시까지 미사용 자금에 대해서는 자금 사용시점 및 금리에 따라 적격금융기관의 수시입출금 예금, 정기예금 등 금융상품 또는 AA등급대(A1등급대)이상의 단기금융상품으로 운용할 예정입니다.
VI. 그 밖에 투자자보호를 위해 필요한 사항
해당사항 없습니다.
제2부 발행인에 관한 사항
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 개황
| (단위 : 사) |
| 구분 | 연결대상회사수 | 주요 종속회사수 |
|||
|---|---|---|---|---|---|
| 기초 | 증가 | 감소 | 기말 | ||
| 상장 | - | - | - | - | - |
| 비상장 | 1 | 1 | - | 2 | 2 |
| 합계 | 1 | 1 | - | 2 | 2 |
(1) 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
(주)메쎄나 | 신규사업 추진 목적 |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
나. 계열회사에 관한 사항
| 회사명 | 상장여부 |
|---|---|
| ENZYCHEM LIFESCIENCES USA, INC. | 비상장 |
| (주)메쎄나 | 비상장 |
다. 중소기업 등 해당 여부
| 중소기업 해당 여부 | 해당 | |
| 벤처기업 해당 여부 | 해당 | |
| 중견기업 해당 여부 | 미해당 | |
* 당사는 보고서 작성기준일 현재 중소기업법 제2조 및 중소기업법 시행령 제3조에 의거 중소기업에 해당됩니다. 자세한 사항은 본 보고서의 XI. 그 밖에 투자자 보호를 위하여 필요한 사항 중 '3. 제재현황 등 그밖의 상황, 다. 중소기업검토 기준표'를 참고하시기 바랍니다.
라. 벤처기업해당여부
| 구분 | 당사현황 | 발행번호 | 벤처기업지정 |
|---|---|---|---|
| 연구개발기업 | 확인일자 : 2021.07.07 | 제20210729020060호 | 벤처기업확인기관장 |
| 유효일자 : 2024.07.06 |
마. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)여부 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 등 여부 |
특례상장 등 적용법규 |
|---|---|---|---|
| 코스닥 시장 | 2018년 02월 21일 | 기술성장 기업 | 코스닥시장 상장규정 제2조제31항제1호 세칙에서 정하는 바에 따라 기술력과 성장성이 인정되는 중소기업 |
바. 회사의 법적, 상업적 명칭
당사의 명칭은 '주식회사 엔지켐생명과학'이라고 표기합니다. 영문으로는 'ENZYCHEM LIFESCIENCES CORPORATION'으로 표기하고, 약식으로는 'ENZYCHEM LSC'로 포기합니다.
사. 설립일자 및 존속기간
당사는 1999년 7월 20일에 설립 되었으며, 2013년 9월 25일 한국거래소 코넥스시장에 주식을 상장 하였으며, 2018년 2월 21일 코스닥시장 상장규정에 의한 기술성장 기업으로서 코넥스시장에서 코스닥시장으로 이전 상장 하였습니다.
아. 본사의 주소, 전화번호 및 홈페이지
주 소 : 충청북도 제천시 바이오밸리로 59(왕암동)
전화번호 : 043-652-2845(내선번호 1000)
홈페이지 : www.enzychem.co.kr
자. 주요 사업의 내용 및 향후 진출하려는 신규 사업
당사는 현재 원료의약품 의약화학(Medicinal Chemistry)을 기반으로 합성신약을 연구, 개발하고 기술이전 등을 통해 사업화를 이어가고 있습니다. 기타 자세한 사항은 'Ⅱ.사업의 내용'을 참조하시기 바랍니다.
| [정관에 기재된 목적사업] |
| 목 적 사 업 | 비 고 |
|---|---|
| 1. 의약품의 연구, 개발, 제조 및 판매업 2. 원료의약품의 연구, 개발 제조 및 판매업 3. 의약외품의 연구, 개발 제조 및 판매업 5. 백신, 화합물, 천연물, 기초 의약물질 및 생물학적 제제의 연구, 개발, 제조 및 판매업 6. 건강기능식품, 건강보조식품, 건강식품의 연구, 개발, 제조 및 판매업 8. 동물약품의 연구, 개발, 제조 및 판매업 9. 화학약품, 화공약품, 농예약품, 종자의 연구, 개발, 제조 및 판매업 10. 첨단소재의 연구, 개발, 제조 및 판매업 11. 화장품원료, 화장품, 기능성 화장품의 연구, 개발, 제조 및 판매업 16. 위탁생산(CMO), 위탁개발(CDO), 위탁개발생산(CDMO), 임상시험수탁업(CRO) 18. 국내외 기술거래 및 중개업 20 . 액셀러레이터 활동(창업자 선발, 보육, 투자 등) 및 투자조합 출자 22. 통신판매업, 통신판매중개업, 인터넷 전자상거래업 및 전자금융업 26. 각 호에 관련대 위탁제조업 27. 각 호에 관련된 수입판매업 28. 각 호에 관련된 무역업 및 무역대리업 29. 각 호에 관련된 국내외 투자업, 투자중개업 및 부대사업 일체 |
현재 회사가 |
| 4. 시약, 진단시약, 진단기기의 연구, 개발, 제조, 판매 및 서비스업 7. 식품, 식품첨가물의 연구, 개발, 제조 및 판매업 12. 의료기기, 동물용 의료기기, 의료용구, 위생용품의 연구, 개발 제조 및 판매업 13. 디지털의료기기, IT기기의 연구, 개발, 제조 및 판매업 14. 환경기기, 관련 용품의 연구, 개발, 제조, 판매 및 서비스업 15. 헬스케어 및 디지털헬스케어업 17. AI를 활용한 신약개발 플랫폼업 19. 지주회사 설립 및 지주회사 사업 21. 팁스(TIPS) 운영업 23. 연구, 조사 및 정보 관련 서비스업 24. 컨설팅, 교육, 연수 및 관련 서비스업 25. 건설업, 건축업, 부동산 개발업, 부동산 매매 및 임대업 |
현재 회사가 |
차. 신용평가에 관한 사항
보고서 작성기준일 현재 해당사항이 없습니다.
2. 회사의 연혁
가. 회사의 본점 소재지 변경
당사의 설립 후 본점소재지의 변경내역은 다음과 같습니다.
| 일자 | 주소 | 비고 |
|---|---|---|
| 1999년 12년 27일 | 대전 유성구 화암동 62-1 한국과학기술원 첨단기술사업화센터 4308호 | - |
| 2002년 06년 25일 | 대전 유성구 어은동 53-3 카이스트 신기술창업관 7106호 | 이전 |
| 2010년 07년 22일 | 대전광역시 유성구 문지동 193, 카이스트 아이씨씨 에프 741호(문지동) | 변경 |
| 2017년 07월 07일 | 충청북도 제천시 바이오밸리로 59(왕암동) | 변경 |
나. 경영진의 중요한 변동
| 변동일자 | 주총종류 | 선임 | 임기만료 또는 해임 |
|
|---|---|---|---|---|
| 신규 | 재선임 | |||
| 2017.03.30 | 정기주총 | - | 손기영 대표이사 | - |
| 2017.03.30 | 정기주총 | - | 김혜경 사내이사 | - |
| 2017.03.30 | 정기주총 | - | 이재용 사내이사 | - |
| 2018.03.22 | 정기주총 | - | 강황배 감사 | - |
| 2018.03.22 | - | - | - | 길버트 알렉산더플레밍 기타비상무이사 임기만료 |
| 2018.03.22 | 정기주총 | - | 고상곤 사외이사 | - |
| 2018.03.22 | 정기주총 | - | 김명환 기타비상무이사 |
- |
| 2018.03.22 | 정기주총 | - | 강종구 기타비상무이사 |
- |
| 2019.01.15 | - | - | - | 김상희 기타비상무이사 일신상의 사유로 사임 |
| 2019.01.15 | - | - | - | 강종구 기타비상무이사 일신상의 사유로 사임 |
| 2019.03.26 | 정기주총 | 홍창기 사외이사 | - | - |
| 2019.03.30 | - | - | - | 고상곤 사외이사 일신상의 사유로 사임 |
| 2019.10.21 | - | - | - | 조도현 기타비상무이사 임기만료 |
| 2020.03.30 | 정기주총 | - | 손기영 대표이사 (*) | - |
| 2020.03.30 | 정기주총 | - | 김혜경 사내이사 | - |
| 2020.03.30 | 정기주총 | 오혜영 사외이사 | - | - |
| 2020.03.30 | - | - | - | 이재용 사내이사 임기만료 |
| 2020.05.12 | - | - | - | 김명환 기타비상무이사 일신상의 사유로 사임 |
| 2021.03.31 | 정기주총 | - | 강황배 감사 | - |
* 손기영 대표이사는 2020년 정기주주총회에서 사내이사로 재선임 되었고, 이사회를 통하여 대표이사로 선임되었습니다.
다. 최대주주의 변동
| (기준일 : 보고서 작성 기준일 현재) | (단위 : 주) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 비고 |
|---|---|---|---|---|
| 2010.12.29 | 브리짓라이프사이언스 | 961,780 | 11.54% | 유상증자 (*) |
* 최대주주 변동후 소유주식수 및 지분율은 보고서 작성기준일 현재 의결권 있는 주식수 기준으로 기재하였습니다.
라. 상호의 변경
| 변경일자 | 변경전 상호 | 변경후 상호 | 변경사유 |
|---|---|---|---|
| 2011.02 | 엔지켐 | 엔지켐생명과학 | 글로벌신약 개발기업으로 경영사명 정립 |
마. 회사의 업종 또는 주된 사업의 변화
당사는 2013년 9월 정관상 기존의 제조 및 판매업에서 원료의약품과 건강기능식품 제조 및 판매업종을 추가하였습니다.
바. 회사의 연혁
당사의 설립일 이후 주요연혁은 아래와 같습니다.
|
일 자 |
주요 내용 |
|---|---|
| 2013.09 | 코넥스 (KONEX)시장 주식상장 (주관사:대신증권) |
| 2014.01 | 면역조절 개별인정형 건강기능식품 "록피드" 출시 |
|
2014.06 |
EC-18 혈소판감소증, 백혈구감소증 치료제 특허출원 |
| 2014.06 | EC-18 신약 1상임상(IND)승인 (K-FDA) |
| 2014.07 | "ROCKPID" 상표권 등록 |
| 2014.08 | PTC 특허 출원 (류마티스관절염, 항암,암전이 억제, 천식, COPD, 아토피, 적혈구) |
| 2014.09 | 글로벌신약개발본부 출범 |
| 2015.01 | 식약처팜나비(PharmNavi)신약개발 사업 대상으로 선정 |
| 2015.02 | 식약처 임상 1상 시험 타겟 질환 변경 승인 (항암제로 인한 호중구 감소증 치료제) |
| 2015.02 |
산업통상자원부로부터 첨단 기술 제품 인증 "신개념 Lipid계 호중구 감소증 치료제, EC-18" |
| 2015.02 |
EC-18, 항암제로 유발되는 호중구 감소증 치료제 개발 "범부처신약개발사업단(KDDF)로 부터 글로벌 신약개발 과제 협약체결 |
| 2015.03 | EC-18 국내임상 1상시험 개시 (연세 세브란스 병원) |
| 2015.04 | 제천공장에 대한 일본 식약처 PMDA GMP 규격 승인 |
| 2015.05 |
미국 FDA로부터 IND 승인 (항암제로 인한 호중구 감소증 치료제) |
| 2015.06 | 글로벌 신약개발 및 라이센싱 특별자문위원 선임 (MD Anderson Cancer Center 홍완기교수) |
|
2015.06 |
EC-18 혈소판감소증, 백혈구 감소증 치료제 PCT 특허출원 |
|
2016.02 |
EC-18의 미국 및 한국 임상1상 시험 종료 |
|
2016.07 |
미국 FDA로부터 IND 승인 (항암제로 인한 호중구 감소증 치료제 임상2상) |
|
2016.07 |
록피드 미국 수출 등록 ( US FDA 21 CFR 740.109에 의거) |
| 2016.12 | 식약처 로부터 국내 임상2상 IND승인 (항암제로 인한 호중구 감소증 치료제 임상2상) |
|
2017.06 |
EC-18, 호중구감소증 글로벌 2상 임상시험 개시 |
|
2017.07 |
본점소재지 변경 (대전광역시에서 충청북도 제천시 이전) |
|
2017.12 |
미국FDA EC-18의 급성방사선증후군 치료제 적응증 희귀의약품 지정 획득 |
|
2018.02 |
코스닥 (KOSDAQ) 시장에 이전 상장 |
|
2018.03 |
EC-18 구강점막염 치료제 적응증 미국FDA 신속심사 지정 획득 |
| 2018.04 | ENZYCHEM LIFESCIENCES USA, INC 설립 (100% 출자) |
| 2019.02 | EU GMP 승인 획득 |
| 2019.05 |
급성방사선증후군(ARS) 치료를 위한 EC-18의 임상 2상 상응 시험계획에 대한 미국 FDA 승인 |
| 2019.09 |
AFRRI(Armed Forces Radiobiology Research Institute)의 MTA(Material Transfer Agreement) 선정 (ARS) |
| 2020.03 |
COVID-19 미국 특허 출원(출원번호 : 62/987,324) 발명의 명칭 : 출원번호 : PCT/IB2021/051963 출원일자 : 2021.03.09 * 특허출원 내용 (연구결과 부분 요약) 1) EC-18을 이용한 항바이러스 활성 평가를 통해, SARS-CoV-2 virus를 감염시킨 Vero E6 세포에서 cytopathic effect (CPE, 세포병변효과)를 확인함 2) EC-18 처리 농도가 증가함에 따라 SARS-CoV-2 replication을 억제한다는 효능을 확인함 (EC-18 150 μM에서 효과적으로 억제) 3) EC-18을 처리한 Vero E6 세포에서 SARS-CoV-2 virus의 titer(역가) 감소 및 replication 억제 효능 확인 |
| 2020.05 | 식약처로 부터 국내 임상2상 IND승인 (신종 코로나바이러스로 인한 폐렴환자에서 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위배정, 이중 눈가림 제2상 임상 시험) |
| 2020.08 | 미국 FDA로부터 IND 승인 (신종 코로나바이러스 환자를 대상으로 폐렴에서 급성호흡부전 또는 급성호흡곤란증후군으로의 이행을 예방하는 EC-18의 안전성과 유효성을 평가하는 임상 2상 시험계획 (IND) FDA 승인) |
| 2021.02 | 미국 항공우주국(NASA) 연구과제 최종 선정 (우주방사선 치료를 위한'3D 생체모방 인간조직 모델을 이용한 우주비행 아날로그 배양 살모넬라 감염에 대한 저선량 방사선 및 방사선 대책의 영향 연구(Effects of Low Dose Radiation and Radiation Countermeasures on Infection by Spaceflight Analogue Cultured Salmonella using 3-D Biomimetic Human Tissue Models) |
| 2021.08 | 국내 코로나 임상 2상 결과 발표 (신종 코로나바이러스로 인한 폐렴환자에서 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위배정, 이중 눈가림 제2상 임상 시험) |
3. 자본금 변동사항
가. 자본금 변동추이
| (단위 : 원, 주) |
| 종류 | 구분 | 당분기말 (2021.09.30) |
제22기 (2020년말) |
제21기 (2019년말) |
제20기 (2018년말) |
제19기 (2017년말) |
|---|---|---|---|---|---|---|
| 보통주 | 발행주식총수 | 8,331,345 | 8,247,200 | 7,859,262 | 7,728,732 | 6,835,375 |
| 액면금액 | 500 | 500 | 500 | 500 | 500 | |
| 자본금 | 4,165,672,500 | 4,123,600,000 | 3,929,631,000 | 3,864,366,000 | 3,417,687,500 | |
| 우선주 | 발행주식총수 | 379,137 | 48,113 | 334,575 | - | - |
| 액면금액 | 500 | 500 | 500 | - | - | |
| 자본금 | 189,568,500 | 24,056,500 | 167,287,500 | - | - | |
| 기타 | 발행주식총수 | - | - | - | - | - |
| 액면금액 | - | - | - | - | - | |
| 자본금 | - | - | - | - | - | |
| 합계 | 자본금 | 4,355,241,000 | 4,147,656,500 | 4,096,918,500 | 3,864,366,000 | 3,417,687,500 |
* 당사는 2018년 2월 코넥스 시장에서 코스닥 시장으로 이전 상장 및 주식매수선택권 행사로 인하여 자본금이 446,678,500원 증가하였습니다.
* 당사는 2019년 4월 제3자배정 유상증자 및 주식매수선택권 행사로 인하여 자본금이 232,552,500원 증가하였습니다.
* 당사는 2020년말 전기 대비 자본금이 50,738,000원 증가하였고 주된 사유는 전환우선주의 보통주 전환 및 주식매수선택권 행사입니다.
* 당사는 2021년 3분기말 전기 대비 자본금이 207,584,500원 증가하였고 주된 사유는 전환우선주의 보통주 전환, 제3자배정 유상증자, 주식매수선택권 행사 입니다.
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주 | 우선주 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 75,000,000 | 25,000,000 | 100,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 8,331,345 | 713,712 | 9,045,057 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | 334,575 | 334,575 | 전환우선주의 보통주 전환 | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | 334,575 | 334,575 | 전환우선주의 보통주 전환 | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 8,331,345 | 379,137 | 8,710,482 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 8,331,345 | 379,137 | 8,710,482 | - | |
나. 자기주식 취득 및 처분 현황
보고서 작성 기준일 현재 해당사항 없습니다.
다. 종류주식(명칭) 발행현황
(1) 5우선주 발행현황
| (단위 : 원) |
| 발행일자 | 2021년 03월 03일 | |||
| 주당 발행가액(액면가액) | 78,400 | 500 | ||
| 발행총액(발행주식수) | 23,501,497,600 | 299,764 | ||
| 현재 잔액(현재 주식수) | 23,501,497,600 | 299,764 | ||
| 주식의 내용 |
이익배당에 관한 사항 |
(가) 본건 우선주는 참가적, 누적적 우선주로서 발행가액 기준 매년 최저 연 1.0%의 현금배당을 발행회사가 발행하는 모든 보통주에 우선하여 배당하고, 보통주의 배당률이 본건 우선주의 배당률을 초과할 경우에는 초과하는 부분에 대하여 보통주식과 동일한 배당률로 함께 참가하여 배당한다. (나) 본건 우선주는 누적적 우선주로 인수인은 본건 우선주를 보유하는 동안 어느 해에 우선적 배당을 받지 못한 경우 그 배당 받지 못한 부분을 매 다음 해에 누적적으로 우선 배당 받는다. (다) 발행회사가 현금배당 대신 주식배당을 실시하는 경우에도 본조 제1항 내지 제2항과 같은 방법으로 배당하되, 본건 우선주에 대하여는 동일한 내용의 우선주의 형태로 주식배당을 한다. (라) 배당결의가 있기 전에 본건 우선주를 보통주로 전환청구한 경우에는, 인수인은 발행회사에 미지급배당금의 지급청구를 할 수 없다. |
||
| 잔여재산분배에 관한 사항 | 인수인은 발행회사 청산 시의 잔여재산분배에 대하여 본건 우선주 1주당 발행가액과 미지급된 배당금을 합한 금액의 한도에서 보통주식을 보유한 주주에 우선하여 잔여재산의 분배를 받을 권리를 갖는다. 본건 우선주에 대한 우선분배를 한 후 보통주식에 대한 주당 분배금액이 본건 우선주에 대한 주당 분배금액을 초과하는 경우에 본건 우선주는 초과하는 부분에 대하여 보통주와 동일한 분배율로 함께 참가하여 잔여재산을 분배 받을 권리가 있다. | |||
| 상환에 관한 사항 |
상환조건 | - | ||
| 상환방법 | - | |||
| 상환기간 | - | |||
| 주당 상환가액 | - | |||
| 1년 이내 상환 예정인 경우 |
- | |||
| 전환에 관한 사항 |
전환조건 (전환비율 변동여부 포함) |
(가) 자동 전환: 본건 우선주는 납입일로부터 5년이 되는 날까지 보통주로 전환되지 않은 경우에는 그 다음 날에 자동적으로 보통주로 전환된다(단, 위 기간 중 위 나.목에 따른 소정의 우선배당을 하지 못하는 경우에는 소정의 우선배당을 완료할 때까지 그 기간을 연장한다). (나) 전환청구기간 및 절차: 인수인은 본건 우선주의 납입일 익일로부터 1년이 경과한 날로부터 5년이 되는 날까지 본건 우선주의 전부 또는 일부를 보통주식으로 전환할 것을 청구할 수 있다. (다) 전환의 효력 발생: 보통주식으로의 전환은 그 청구를 한 때에 효력이 생긴다. 단, 이익이나 이자의 배당에 관하여는 그 청구를 한 때가 속하는 영업년도의 직전영업연도말에 전환된 것으로 본다. |
||
| 전환청구기간 | 2022.03.03 ~ 2026.03.02 | |||
| 전환으로 발행할 주식의 종류 |
보통주 | |||
| 전환으로 발행할 주식수 |
299,764 | |||
| 의결권에 관한 사항 | 의결권 없음 | |||
| 기타 투자 판단에 참고할 사항 (주주간 약정 및 재무약정 사항 등) |
- | |||
(2) 6우선주 발행현황
| (단위 : 원) |
| 발행일자 | 2021년 03월 08일 | |||
| 주당 발행가액(액면가액) | 81,900 | 500 | ||
| 발행총액(발행주식수) | 6,500,648,700 | 79,373 | ||
| 현재 잔액(현재 주식수) | 6,500,648,700 | 79,373 | ||
| 주식의 내용 |
이익배당에 관한 사항 |
(가) 본건 우선주는 참가적, 누적적 우선주로서 발행가액 기준 매년 최저 연 1.0%의 현금배당을 발행회사가 발행하는 모든 보통주에 우선하여 배당하고, 보통주의 배당률이 본건 우선주의 배당률을 초과할 경우에는 초과하는 부분에 대하여 보통주식과 동일한 배당률로 함께 참가하여 배당한다. (나) 본건 우선주는 누적적 우선주로 인수인은 본건 우선주를 보유하는 동안 어느 해에 우선적 배당을 받지 못한 경우 그 배당 받지 못한 부분을 매 다음 해에 누적적으로 우선 배당 받는다. (다) 발행회사가 현금배당 대신 주식배당을 실시하는 경우에도 본조 제1항 내지 제2항과 같은 방법으로 배당하되, 본건 우선주에 대하여는 동일한 내용의 우선주의 형태로 주식배당을 한다. (라) 배당결의가 있기 전에 본건 우선주를 보통주로 전환청구한 경우에는, 인수인은 발행회사에 미지급배당금의 지급청구를 할 수 없다. |
||
| 잔여재산분배에 관한 사항 | 인수인은 발행회사 청산 시의 잔여재산분배에 대하여 본건 우선주 1주당 발행가액과 미지급된 배당금을 합한 금액의 한도에서 보통주식을 보유한 주주에 우선하여 잔여재산의 분배를 받을 권리를 갖는다. 본건 우선주에 대한 우선분배를 한 후 보통주식에 대한 주당 분배금액이 본건 우선주에 대한 주당 분배금액을 초과하는 경우에 본건 우선주는 초과하는 부분에 대하여 보통주와 동일한 분배율로 함께 참가하여 잔여재산을 분배 받을 권리가 있다. | |||
| 상환에 관한 사항 |
상환조건 | - | ||
| 상환방법 | - | |||
| 상환기간 | - | |||
| 주당 상환가액 | - | |||
| 1년 이내 상환 예정인 경우 |
- | |||
| 전환에 관한 사항 |
전환조건 (전환비율 변동여부 포함) |
(가) 자동 전환: 본건 우선주는 납입일로부터 5년이 되는 날까지 보통주로 전환되지 않은 경우에는 그 다음 날에 자동적으로 보통주로 전환된다(단, 위 기간 중 위 나.목에 따른 소정의 우선배당을 하지 못하는 경우에는 소정의 우선배당을 완료할 때까지 그 기간을 연장한다). (나) 전환청구기간 및 절차: 인수인은 본건 우선주의 납입일 익일로부터 1년이 경과한 날로부터 5년이 되는 날까지 본건 우선주의 전부 또는 일부를 보통주식으로 전환할 것을 청구할 수 있다. (다) 전환의 효력 발생: 보통주식으로의 전환은 그 청구를 한 때에 효력이 생긴다. 단, 이익이나 이자의 배당에 관하여는 그 청구를 한 때가 속하는 영업년도의 직전영업연도말에 전환된 것으로 본다. |
||
| 전환청구기간 | 2022.03.08 ~ 2026.03.07 | |||
| 전환으로 발행할 주식의 종류 |
보통주 | |||
| 전환으로 발행할 주식수 |
79,373 | |||
| 의결권에 관한 사항 | 의결권 없음 | |||
| 기타 투자 판단에 참고할 사항 (주주간 약정 및 재무약정 사항 등) |
- | |||
5. 정관에 관한 사항
본 보고서에 작성한 정관은 2021년 3월 31일 정기 주주총회 안건으로 통과되어
개정된 정관내용 입니다.
|
개정 조문 |
변경 전 |
변경 예정 |
변경의 목적 |
|---|---|---|---|
|
제2조 (사업목적) |
1. 동물약품 제조 및 판매 2. 화학약품 제조 및 판매 3. 식품, 건강보조식품, 식품첨가물 제조 및 판매업 4. 의약품 제조 및 판매업 5. 의약외품 제조 및 판매업 6. 화장품 제조 및 판매업 7. 각 호에 관련된 무역업 8. 각 호에 관련된 무역대리업 9. 각 호에 관련된 부대사업 일체 10. 부동산임대업 11. 건강기능식품 수입업 12. 원료의약품 제조 및 판매업 13. 건강기능식품 제조 및 판매업 |
1. 의약품의 연구, 개발, 제조 및 판매업 2. 원료의약품의 연구, 개발, 제조 및 판매업 3. 의약외품의 연구, 개발, 제조 및 판매업 4. 시약, 진단시약, 진단기기의 연구, 개발, 제조, 판매 및 서비스업 5. 백신, 화합물, 천연물, 기초의약물질 및 6. 건강기능식품, 건강보조식품, 건강식품의 연구, 개발, 제조 및 판매업 7. 식품, 식품첨가물의 연구, 개발, 제조 및 판매업 8. 동물약품의 연구, 개발, 제조 및 판매업 9. 화학약품, 화공약품, 농예약품, 종자의 연구, 개발, 제조 및 판매업 10. 첨단소재의 연구, 개발, 제조 및 판매업 11. 화장품원료, 화장품, 기능성 화장품의 연구, 개발, 제조 및 판매업 12. 의료기기, 동물용 의료기기, 의료용구, 위생용품의 연구, 개발, 제조 및 판매업 13. 디지털의료기기, IT기기의 연구, 개발, 제조 및 판매업 14. 환경기기, 관련 용품의 연구, 개발, 제조, 판매 및 서비스업 15. 헬스케어 및 디지털헬스케어업 16. 위탁생산(CMO), 위탁개발(CDO), 위탁개발생산(CDMO), 임상시험수탁(CRO)업 17. AI를 활용한 신약개발 플랫폼업 18. 국내외 기술거래 및 중개업 19. 지주회사 설립 및 지주회사 사업 20. 액셀러레이터 활동(창업자 선발, 보육, 투자 등) 및 투자조합 출자 21. 팁스(TIPS)운영업 22. 통신판매업, 통신판매중개업, 인터넷 전자상거래업 및 전자금융업 23. 연구, 조사 및 정보 관련 서비스업 24. 컨설팅, 교육, 연수 및 관련 서비스업 25. 건설업, 건축업, 부동산 개발업, 부동산 매매 및 임대업 26. 각 호에 관련된 위탁제조판매업 27. 각 호에 관련된 수입판매업 28. 각 호에 관련된 무역업 및 무역대리업 29. 각 호에 관련된 국내외 투자업, 투자중개업 및 부대사업 일체 |
1. 혁신형 제약·바이오 기업으로 성장하기 위한 정관 정비 2. 사업목적 다각화를 통한 글로벌 제약·바이오 기업으로 도약 3. 기업가치 제고와 주주가치 실현 4. 혁신 및 글로벌 성장의 기반 구축 5. 사업목적 세분화로 각 부문별 사업계획의 구체화 전략 |
|
제4조 (공고방법) |
회사의 공고는 회사의 인터넷 홈페이지(www.enzychem.com)에 한다. 다만, 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 매일경제신문에 한다. |
회사의 공고는 인터넷 홈페이지(www.enzychem.co.kr)에 한다. 다만, 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 매일경제신문에 한다. |
회사 공고 인터넷 홈페이지 주소 변경 |
|
제8조의3 (이익배당, 의결권 배제 및 주식의 상환에 관한 종류주식) |
② 제5조의 발행예정주식총수 중 상환주식의 발행한도는 6,250,000주로 한다. |
② 제5조의 발행예정주식총수 중 상환주식의 발행한도는 10,000,000주로 한다. |
발행 주식 수 변경 |
|
제8조의4 (이익배당, 의결권 배제 및 주식의 전환에 관한 종류주식) |
② 제5조의 발행예정주식총수 중 전환주식의 발행한도는 6,250,000주로 한다. |
② 제5조의 발행예정주식총수 중 전환주식의 발행한도는 10,000,000주로 한다. |
발행 주식 수 변경 |
|
제8조의5 (이익배당, 의결권 배제에 관한 종류주식) |
② 제5조의 발행예정주식총수 중 무의결권 배당우선 주식의 발행한도는 6,250,000주로 한다. |
② 제5조의 발행예정주식총수 중 무의결권 배당우선주식의 발행한도는 10,000,000주로 한다. |
발행 주식 수 변경 |
|
제8조의6 (이익배당, 의결권 배제 및 주식의 상환 및 전환에 관한 종류주식) |
② 제5조의 발행예정주식총수 중 상환전환주식의 발행한도는 6,250,000주로 한다. |
② 제5조의 발행예정주식총수 중 상환전환주식의 발행한도는 10,000,000주로 한다. |
발행 주식 수 변경 |
|
제8조의7 (주식 등의 전자등록) |
회사는 「주식·사채 등의 전자등록에 관한 법률」 제2조 제1호에 따른 주식 등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식 등을 전자등록하여야 한다. |
회사는 「주식·사채 등의 전자등록에 관한 법률」제2조 제1호에 따른 주식 등을 발행하는 경우에는 전자등록기관의 전자등록계좌부에 주식 등을 전자등록하여야 한다. 다만, 회사가 법령에 따른 등록의무를 부담하지 않는 주식 등의 경우에는 그러하지 아니할 수 있다. |
상법개정에 따른 조문정비 : 비상장 사채 등 의무등록 대상이 아닌 주식등에 대해서는 전자등록을 하지 않을 수 있도록 한다. |
|
제12조 (신주의 배당기산일) |
회사가 유상증자, 무상증자 및 주식배당에 의하여 신주를 발행하는 경우 신주에 대한 이익의 배당에 관하여는 신주를 발행한 때가 속하는 영업연도의 직전영업연도말에 발행된 것으로 본다. |
① 회사는 배당기준일 현재 발행(전환된 경우를 포함한다)된 동종 주식에 대하여 발행일에 관계없이 모두 동등하게 배당한다. ② 제1항의 규정에도 불구하고 배당기준일을 정하는 이사회 결의일로부터 그 배당기준일까지 발행한 신주에 대하여는 배당을 하지 아니한다. |
상법개정에 따른 조문정비 : 동등배당 원칙을 명시함. |
|
제14조 (주주명부의 폐쇄 및 기준일) |
① 회사는 매년 1월 1일부터 1월 31일까지 주주의 권리에 관한 주주명부의 기재변경을 정지한다. ② 회사는 매년 12월 31일 최종의 주주명부에 기재되어 있는 주주를 그 결산기에 관한 정기주주총회에서 권리를 행사할 주주로 한다. ③ 회사는 임시주주총회의 소집 기타 필요한 경우 이사회의 결의로 3개월을 경과하지 아니하는 일정한 기간을 정하여 권리에 관한 주주명부의 기재변경을 정지하거나, 이사회의 결의로 3개월 내로 정한 날에 주주명부에 기재되어 있는 주주를 그 권리를 행사할 주주로 할 수 있다. 이 경우 이사회는 필요하다고 인정하는 때에는 주주명부의 기재변경 정지와 기준일의 지정을 함께 할 수 있으며, 회사는 주주명부 폐쇄기간 또는 기준일의 2주간 전에 이를 공고하여야 한다. |
① 회사는 의결권을 행사하거나 배당을 받을 자 기타 주주 또는 질권자로서 권리를 행사할 자를 정하기 위하여 이사회 결의로 일정한 기간을 정하여 주주명부의 기재변경을 정지하거나 일정한 날에 주주명부에 기재된 주주 또는 질권자를 그 권리를 행사할 주주 또는 질권자로 볼 수 있다. ② 회사가 제1항의 기간 또는 날을 정하는 경우 3개월을 경과하지 아니하는 일정한 기간을 정하여 권리에 관한 주주명부의 기재변경을 정지하거나, 3개월 내로 정한 날에 주주명부에 기재되어 있는 주주를 그 권리를 행사할 주주로 할 수 있다. ③ 회사가 제1항의 기간 또는 날을 정한 때에는 그 기간 또는 날의 2주 전에 이를 공고하여야 한다. |
상법개정에 따른 조문정비 : 정기주주총회 개최시기의 유연성을 확보하기 위하여 조문을 정비함. |
|
제15조 (전환사채의 발행) |
⑤ 전환으로 인하여 발행하는 주식에 대한 이익의 배당과 전환사채에 대한 이자의 지급에 관하여는 제12조의 규정을 준용한다. |
⑤ 전환으로 인하여 발행하는 주식에 대한 이익의 배당에 관하여는 제12조의 규정을 준용한다. |
상법개정에 따른 조문정비 : 전환사채를 주식으로 전환하는 경우 이자의 지급에 관한 내용을 삭제함. |
| 제17조 (교환사채 발행) |
- |
<신설> ① 회사는 이사회 결의로 사채의 액면 총액이 ② 교환사채의 발행에 관한 세부사항은 이사회의 결의로 정한다. |
정관 내 사채발행 관련 재규정 일괄 정비 |
|
제19조 (소집시기) |
① 회사의 주주총회는 정기주주총회와 임시주주총회로 한다. ② 정기주주총회는 매사업연도 종료 후 3개월 이내에, 임시주주총회는 필요에 따라 소집한다. |
회사는 매결산기마다 정기주주총회를 소집하여야 하고, 필요에 따라 임시주주총회를 소집한다. |
상법개정에 따른 조문정비 : 정기주주총회 개최시기의 유연성을 확보하기 위하여 조문을 정비함. |
|
제36조 (이사의 직무와 대표이사의 직무 대행) |
부회장, 사장, 부사장, 전무이사, 상무이사 및 이사는 대표이사를 보좌하고 이사회에서 정하는 바에 따라 회사의 업무를 분장 집행하며 대표이사의 유고 시에는 위 순서로 그 직무를 대행한다. |
① 이사는 대표이사를 보좌하고 이사회에서 정하는 바에 따라 회사의 업무를 분장 집행한다. ② 대표이사의 유고 시에는 부회장, 사장, 부사장, 전무, 상무의 순서로 그 직무를 대행한다. |
등기 임원의 직함을 "이사"로 통일화 |
|
제44조 (감사의 수와 선임·해임) |
②감사는 주주총회에서 선임하며, 감사의 선임을 위한 의안은 이사의 선임을 위한 의안과는 구분하여 상정, 의결하여야 한다. ③감사의 선임은 출석한 주주의 의결권의 과반수로 하되 발행주식총수의 4분의 1이상의 수로 하여야 한다. 그러나 의결권 있는 발행주식총수의 100분의 3을 초과하는 수의 주식을 가진 주주는 그 초과하는 주식에 관하여 제1항의 감사의 선임에 있어서는 의결권을 행사하지 못한다. 다만, 소유주식수의 산정에 있어 최대주주와 그 특수관계인, 최대주주 또는 그 특수관계인의 계산으로 주식을 보유하는 자, 최대주주 또는 그 특수관계인에게 의결권을 위임한 자가 소유하는 의결권있는 주식의 수는 합산한다. |
② 감사는 주주총회에서 선임·해임하며, 감사의 선임·해임을 위한 의안은 이사의 선임 또는 해임을 위한 의안과는 별도로 상정하여 의결하여야 한다. ③ 감사의 선임은 출석한 주주의 의결권의 과반수로 하되 발행주식총수의 4분의 1 이상의 수로 하여야 한다. 다만 상법 제368조의4 제1항에 따라 전자적 방법으로 의결권을 행사할 수 있도록 한 경우에는 출석한 주주의 의결권의 과반수로써 감사의 선임을 결의할 수 있다. ④ 감사의 해임은 출석한 주주의 의결권의 3분의 2 이상의 수로 하되, 발행주식총수의 3분의 1이상의 수로 하여야 한다. ⑤ 제3항과 제4항의 감사의 선임 또는 해임에는 의결권 있는 발행주식총수의 100분의 3을 초과하는 수의 주식을 가진 주주 (최대주주인 경우에는 그의 특수관계인, 최대주주 또는 그 특수관계인의 계산으로 주식을 보유하는 자, 최대주주 또는 그 특수관계인에게 의결권을 위임한 자가 소유하는 의결권 있는 주식의 수를 합산한다)는 그 초과하는 주식에 관하여 의결권을 행사하지 못한다. |
상법개정에 따른 조문정비 : 감사선임에 관한 조문정비 전자투표 도입시 감사선임의 주주총회 결의 요건 완화에 관한 내용을 반영함. |
|
제54조 (이익배당) |
③ 제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. |
③ 제1항의 배당은 이사회 결의로 정하는 배당기준일 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. |
상법개정에 따른 조문정비 : 배당기준일을 이사회 결의로 정하는 날로 설정할 수 있도록 함. |
|
부 칙 제1조 |
|
이 정관은 2021년 3월 31일부터 시행한다. |
부칙 신설 |
|
부칙 제2조 (감사의 선임·해임에 관한 적용례) |
|
① 제44조 제3항, 제5항의 개정규정은 이 정관 시행 이후 선임하는 감사부터 적용한다. ② 제44조 제4항, 제5항의 개정규정은 이 정관 시행 당시 종전 규정에 따라 선임된 감사를 해임하는 경우에도 적용한다. |
부칙 신설 |
가. 정관 변경 이력
| 정관변경일 | 해당주총명 | 주요변경사항 | 변경이유 |
|---|---|---|---|
| 2018년 03월 22일 | 정기주주총회 | 1. (발행예정 주식의 총 수) 회사가 발행할 주식의 총 수는 100,000,000주로 한다. 2. (주식 및 주권의 종류) 회사가 발행할 주식의 종류는 기명식 보통주식과 기명식 종류식으로 하며, 회사가 발행할 종류주식은 이익배당에 관한 우선주식, 상환주식, 전환주식, 무의결권 배당우선 주식 및 이들의 전부 또는 일부를 혼합한 주식으로 한다. |
1. 총발행 가능 주식 수 변경 2. 불명확한 종류주식 발행 및 종류 수정 |
| 2019년 03월 26일 | 정기주주총회 |
1. (이익배당에 관한 종류 주식) ①회사는 이익배당에 관하여 우선권이 있으면서 의결권이 있는 주식(이하 “배당우선주식”)을 발행할 수 있으며, 제5조의 발행예정주식총수 중 배당우선주식의 발행한도는 25,000,000주로 한다. ②배당우선주식에 대한 우선배당은 1주의 금액을 기준으로 연 1% 이상의 범위에서 발행시에 이사회가 정한 배당률에 따라 현금으로 지급한다. ③배당우선주식에 대하여 제2항에 따른 배당을 하고 보통주식에 대하여 상환주식의 배당률과 동률의 배당을 한 후, 잔여배당가능이익이 있으면 보통주식과 상환주식에 대하여 동등한 비율로 배당한다. ④배당우선주식에 대하여 대하여 제2항에 따른 배당을 하지 못한 사업연도가 있는 경우에는 미배당분을 누적하여 다음 사업연도의 배당시에 우선하여 배당한다. ⑤배당우선주식의 존속기간은 발행일로부터 10년의 범위 내에서 발행 시 이사회 결의로 정하며,이 기간 만료와 동시에 보통주식으로 전환된다. 그러나 위 기간중 소정의 배당을 하지 못한 경우에는 소정의 배당을 완료할 때까지 그 기간을 연장한다. 이 경우 전환으로 인하여 발행하는 주식에 대한 이익의 배당에 관하여는 제12조의 규정을 준용한다. ①회사는 매년 1월 1일부터 1월 31일까지 주주의 권리에 관한 주주명부의 기재변경을 정지한다. ③회사는 임시주주총회의 소집 기타 필요한 경우 이사회의 결의로 3개월을경과하지 아니하는 일정한 기간을 정하여 권리에 관한 주주명부의 기재변경을 정지하거나, 이사회의 결의로 3개월내로정한 날에 주주명부에 기재되어 있는 주주를 그 권리를 행사할 주주로 할 수 있다. 이 경우 이사회는 필요하다고 인정하는 때에는 주주명부의 기재변경 정지와 기준일의 지정을 함께 할 수 있으며, 회사는주주명부 폐쇄기간 또는 기준일의 2주간 전에 이를 공고하여야 한다. |
|
II. 사업의 내용
1. 사업의 개요
당사의 사업부문은 글로벌신약개발 사업부문과 원료의약품 사업부문 2가지로 구성되어 있습니다.
글로벌신약개발 사업부문은 신약물질 EC-18의 작용기전을 활용한 다양한 파이프라인을 발견하고, 한국과 미국에서 구강점막염(Chemo Radiation Induced Oral Mucositis), 급성방사선증후군(Acute Radiation Syndrome), 코로나바이러스(COVID-19), 호중구감소증(Chemotherapy-Induced Neutropenia)에 대한 임상2상시험을 진행하고 있습니다.
특히 당사 연구소에서는 미국 법인과의 협업을 통해 △바이러스 감염에 의한 폐렴 유도모델에서 EC-18의 개선효과, △기존 항암제와 다른 차별적인 항암 작용기전 검증, △항암제에 의한 호중구감소증 유도 모델 확립, △방사선 노출에 의한 ARS 유도모델에서 EC-18의 효능 검증 marker선정 및 GI-ARS 개선 효능 연구, △NASH모델에서 EC-18 개선효능 연구, △면확질환 적응증별 trarget K/O condition에서 지질기반 후보물질의 작용기전 규명 등의 다양한 비임상 연구를 지원합니다.
원료의약품 사업부문에는 세파항생제 합성기술, 비세파 원료합성기술과 MRI & CT조영제 합성기술로 현재까지 40여종이 넘는 제품들을 개발했습니다. 향후 3가지 이상의 1st Generic 제품 개발을 목표로, Eu GMP(2019년 인증 취득) 외 진행 중인 cGMP 인증과 신규 원료의약품 등록 및 생산, 판매를 위한 인·허가 절차를 완료할 계획입니다.
「세파항생제」 합성에 관하여 당사는 저온반응에서 건조에 이르기까지의 모든 공정을 담당하고 있으며 '세프부페라존' 과 같은 고난이도 제품의 합성 기술력을 갖추고 있습니다. 「비세파원료의약품」 합성에서도 원가절감률이 높은 공장운영과 대량생산이 동시 가능한 시스템을 구축했으며, 'Gadobutrol' 등과 같은 원료 품질에 대한 각별한 주의가 요구되는 고순도ㆍ고품질 「조영제」 생산역량 또한 확보했습니다.
본 사업의 개요에 요약된 내용의 세부사항 및 포함되지 않은 내용 등은 "II. 사업의 내용"의 "2. 주요 제품 및 서비스" 부터 "7. 기타 참고사항"까지의 항목에 상세히 기재되어 있으며 또는, 상세표-4. 원료의약품 부문과 상세표-5 글로벌 신약개발 부문을 참고하여 주시기 바랍니다.
2. 주요 제품 및 서비스
가. 주요 제품 등의 현황
| (단위 : 백만원) |
| 구분 | 품목 | 매출액 | 총제품매출액비중 | 작용기전 |
|---|---|---|---|---|
| 세파계 API | 항생제1 | 644 | 3.91% | 패혈증, 폐렴 |
| 항생제2 | 29 | 0.18% | 폐렴, 자궁내감염등 | |
| 기타 | 125 | 0.76% | - | |
| 소계 | 798 | 4.85% | - | |
| 일반계 API | 항결핵제 | 245 | 1.49% | 항결핵제 |
| 진해 거담제 | 774 | 4.70% | 진해 거담제 | |
| 소염 진통제 | 1,441 | 8.74% | 소염, 진통제 | |
| 항응고제 | 4,009 | 24.32% | 항응고제 | |
| 위궤양치료제 | 1,495 | 9.07% | 위궤양치료제 | |
| 기타 | 5,960 | 36.15% | - | |
| 소계 | 13,924 | 84.47% | - | |
| 기타 | 1,763 | 10.68% | 상품 및 임가공 등 | |
| 합계 | 16,485 | 100.00% | - | |
* 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다.
* 원료의약품을 제외한 기타 사업부문의 매출의 비중이 낮아 별도 구분하지 않았습니다.
(1) 주요 제품 등의 가격변동 추이
| (단위 : 원) |
| 품 목 | 2021년 (제23기 3분기) |
2020년 (제22기) |
2019년 (제21기) |
| 항생제1 | 2,090,000 | 2,090,000 | 2,090,000 |
| 항생제2 | 720,000 | 720,000 | 720,000 |
| 항결핵제 | 972,656 | 1,015,727 | 765,762 |
| 진해 거담제 | 128,139 | 130,197 | 126,529 |
(2) 산출기준
총매출액 / 총판매량(kg)
(3) 주요 가격변동원인
수입원자재의 가격변동과 환율변동에 주로 영향을 받습니다.
3. 원재료 및 생산설비
가. 매입현황
| (단위 : 천원) |
| 매입 유형 |
품목 | 구분 | 2021년 | 2020년 | 2019년 |
|---|---|---|---|---|---|
| (제23기 3분기) | (제22기) | (제21기) | |||
| 원재료 | 세파계 API |
국내 | 300,305 | 1,193,263 | 1,880,214 |
| 수입 | 408,808 | 558,040 | 951,318 | ||
| 소계 | 709,113 | 1,751,303 | 2,831,532 | ||
| 일반계 API |
국내 | 6,078,548 | 8,424,000 | 11,809,466 | |
| 수입 | 2,687,447 | 6,191,121 | 5,066,058 | ||
| 소계 | 8,765,995 | 14,615,121 | 16,875,524 | ||
| 공용원료 | 국내 | 1,045,785 | 2,204,278 | 2,341,717 | |
| 수입 | - | 102,728 | 51,701 | ||
| 소계 | 1,045,785 | 2,307,006 | 2,393,418 | ||
| 원재료 합계 |
국내 | 7,424,638 | 11,821,541 | 16,031,397 | |
| 수입 | 3,096,255 | 6,851,889 | 6,069,077 | ||
| 소계 | 10,520,893 | 18,673,430 | 22,100,474 | ||
| 상품 | 세파계 API |
국내 | - | 129,871 | 1,125,550 |
| 수입 | - | - | - | ||
| 소계 | - | 129,871 | 1,125,550 | ||
| 일반계 API |
국내 | 118,322 | 573,710 | - | |
| 수입 | - | 46,437 | - | ||
| 소계 | 118,322 | 620,147 | - | ||
| 상품 합계 |
국내 | 118,322 | 703,581 | 1,125,550 | |
| 수입 | - | 46,437 | - | ||
| 소계 | 118,322 | 750,018 | 1,125,550 | ||
| 총합계 | 국내 | 7,542,960 | 12,525,122 | 17,156,947 | |
| 수입 | 3,096,255 | 6,898,326 | 6,069,077 | ||
| 소계 | 10,639,215 | 19,423,448 | 23,226,024 | ||
* 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다.
(1) 원재료 가격변동추이
| (단위 : 원) |
| 사업연도 | 2021년 (제23기 3분기) |
2020년 (제22기) |
2019년 (제21기) |
|
|---|---|---|---|---|
| 구분 | 품목 | |||
| 세파계 | 원재료 A | 334,121 | 340,618 | 329,385 |
| 원재료 B | 101,889 | 104,510 | 102,454 | |
| 일반계 | 원재료 C | 146,073 | 146,073 | 146,398 |
| 원재료 D | - | 63,332 | 60,662 | |
| 원재료 E | 227,370 | 225,415 | 208,830 | |
* 각 품목별 구성이 다양하여 주요 원재료 품목만 산출하여 산정하였습니다.
(2) 산출기준
- 총 평균법에 의한 산출
(3) 주요 가격변동 원인
- 환율의 상승 및 하락
- 원료비의 상승 및 하락
나. 주요 매입처에 관한 사항
| (단위 : 천원) |
| 사업년도 | 매입처 | 소재지 | 매입액 | 비중 |
|---|---|---|---|---|
| 2021년 (제23기 3분기) |
A | 국내 | 1,684,950 | 15.84% |
| B | 국내 | 1,634,900 | 15.37% | |
| C | 중국 | 1,519,204 | 14.28% | |
| 기타 | - | 5,800,161 | 54.51% | |
| 합계 | 10,639,215 | 100.00% | ||
| 2020년 (제22기) |
A | 국내 | 3,342,200 | 17.21% |
| B | 중국 | 2,226,942 | 11.47% | |
| C | 국내 | 2,022,478 | 10.41% | |
| 기타 | - | 11,831,828 | 60.91% | |
| 합계 | 19,423,448 | 100.00% | ||
| 2019년 (제21기) |
A | 국내 | 6,087,293 | 26.21% |
| B | 국내 | 5,247,525 | 22.59% | |
| C | 중국 | 2,058,928 | 8.86% | |
| 기타 | - | 9,832,278 | 42.34% | |
| 합계 | 23,226,024 | 100.00% | ||
* 상기 금액은 원재료 및 상품 매입액 기준입니다.
* 상기 거래처를 제외한 전체 매입액의 10%인 미만인 매입처는 기타로 통합하여 기재하였습니다.
다. 생산능력 및 생산실적, 생산가동율 관련사항
당사의 각 품목별 단가가 상이하여 같은 공장에서 다른 품목을 생산할 경우 금액 기준 생산능력 및 생산실적의 차이가 매우 심하여 객관성을 저해합니다. 또한 각 품목별 공정시간 역시 매우 상이하기 때문에 획일화된 기준에 따라 생산수량을 산출한다 해도 객관성이 떨어집니다.
이러한 특성을 감안하여 생산량(매출) 비중이 가장 높은 대표 품목을 선정하여 연간 생산능력을 산출하고 생산실적은 실제 생산량을 기재하였습니다.
| (단위 : 톤) |
| 생산 시설 |
제품명 |
구분 | 2021년 | 2020년 | 2019년 |
| (제23기 3분기) | (제22기) | (제21기) | |||
| 제천 공장 |
항결핵제 | 생산능력 | 7.30 | 9.73 | 9.53 |
| 생산실적 | 0.42 | 1.05 | 1.74 | ||
| 가동율 | 5.76% | 10.79% | 18.26% | ||
| 진해 거담제 | 생산능력 | 15.82 | 21.09 | 18.13 | |
| 생산실적 | 0.00 | 32.40 | 45.99 | ||
| 가동율 | 0.00% | 153.63% | 253.67% | ||
| 염증치료제 | 생산능력 | 9.02 | 12.02 | 11.58 | |
| 생산실적 | 2.46 | 8.82 | 7.68 | ||
| 가동율 | 27.29% | 73.38% | 66.32% | ||
| 위궤양치료제 | 생산능력 | 27.09 | 36.12 | 34.60 | |
| 생산실적 | 3.20 | 5.80 | 6.80 | ||
| 가동율 | 11.81% | 16.06% | 19.65% | ||
| 항응고제 | 생산능력 | 34.73 | 46.30 | 44.79 | |
| 생산실적 | 12.13 | 17.85 | 15.82 | ||
| 가동율 | 34.93% | 38.55% | 35.32% | ||
| 합계 | 생산능력 | 93.95 | 125.26 | 118.63 | |
| 생산실적 | 18.21 | 65.92 | 78.03 | ||
| 가동율 | 19.38% | 52.63% | 65.78% |
* 당사의 공장은 겸용공장으로 각각의 제품 특성에 따라 생산 작업일수 및 생산량(Size)이 상이하며, 각 공장별 대표품목의 연간 생산능력을 적용하였기 때문에 수량만으로 가동률을 산정하는 경우 왜곡이 있을 수 있습니다.
* 상기 생산능력은 연간 가동일 264일 기준으로 계산된 것으로 가동률이 100%를 초과하는 것은 연간 가동일 수 264일을 초과한 것입니다.
* 일부 품목의 생산능력 변동은 공정개선 및 추가 연구개발에 의한 수율 향상에 따른 변동입니다.
라. 생산능력 산출근거
연간생산능력은 생산공정에 투입될 수 있는 Batch 수와 품목별 최대 Batch size에 따라 결정됩니다. Batch수는 Batch Term에 따라 결정되며 Batch Term은 첫번째 Batch(일반 제조업의 경우 생산 LOT의 개념) 이후 두번째 Batch가 투입되는데 필요한 일수를 의미합니다. Batch size는 해당 공장의 반응기 크기에 따라 결정됩니다.
다만, 각 품목별로 반응에 필요한 용매, 촉매 등의 필요 수량이 다르기 때문에 같은 반응기에서 생산을 할 경우에도 품목별로 Batch size는 다를 수 있습니다.
| 구분 | 생산능력 산출품목 |
Batch Size (Kg) |
연간 최대 Batch 수 | 연간 생산능력(톤) |
| 제천공장 | 항결핵제 |
105.00 | 93 | 9.73 |
| 진해 거담제 |
540.00 | 39 | 21.09 | |
| 염증치료제 |
205.00 | 59 | 12.02 | |
| 위궤양치료제 | 200.00 | 181 | 36.12 | |
| 항응고제 | 525.03 | 88 | 46.3 |
| * 연간 가동일 수 264일 기준으로 계산한 생산능력입니다 |
마. 외주생산에 관한 사항
(1) 외주생산의 이유
당사는 생산의 효율성, 원가절감 등을 위하여 기술함량이 낮은 일부 공정 혹은 시험 생산, 특정 생산설비의 부재 등으로 인해 외주생산을 진행하고 있습니다.
(2) 주요외주처에 관한 사항
| (단위 : 천원) |
| 사업년도 | 외주처 | 외주금액 | 비중 |
|---|---|---|---|
| 2021년 (제23기 3분기) |
A | 109,087 | 96.46% |
| 기타 | 4,000 | 3.54% | |
| 합계 | 113,087 | 100.00% | |
| 2020년 (제22기) |
A | 580,908 | 70.55% |
| B | 163,964 | 19.91% | |
| 기타 | 78,475 | 9.54% | |
| 합계 | 823,347 | 100.00% | |
| 2019년 (제21기) |
A | 844,914 | 86.92% |
| 기타 | 127,142 | 13.08% | |
| 합계 | 972,056 | 100.00% |
| * 상기 거래처를 제외한 외주금액의 10%인 미만인 외주처는 기타로 통합하여 기재하였습니다. |
| * 당사와 주요 외주처간의 특수한 관계는 없습니다. |
바. 생산설비의 현황 등
당사는 충천북도 청주시(토지) 및 제천시에 토지, 건물, 구축물, 기계장치, 차량운반구, 공구와기구, 비품 등의 생산설비를 보유하고 있습니다.
보고서 작성기준일 현재 유형자산 장부금액의 변동 내역은 다음과 같습니다.
| (단위 : 원) |
| 구분 | 기초 | 취득 | 처분 | 대체 | 감가상각 | 외환차이조정 | 당분기말 |
|---|---|---|---|---|---|---|---|
| 토지 | 6,249,229,959 | - | - | - | - | - | 6,249,229,959 |
| 건물 | 4,520,291,471 | - | - | - | (107,914,311) | - | 4,412,377,160 |
| 구축물 | 226,439,195 | - | - | - | (6,303,879) | - | 220,135,316 |
| 기계장치 | 2,322,335,026 | 14,920,000 | (20,770,483) | 815,113,404 | (421,319,305) | - | 2,710,278,642 |
| 차량운반구 | 13,082,167 | - | - | - | (2,737,494) | - | 10,344,673 |
| 공구와기구 | 806,092,040 | 54,964,000 | (1,000) | - | (176,272,838) | - | 684,782,202 |
| 비품 | 444,719,110 | 72,436,302 | (1,000) | 475,738,492 | (148,803,012) | 1,768,467 | 845,858,359 |
| 사용권자산 | 528,005,503 | 469,303,492 | (836,178) | - | (501,064,009) | 11,090,706 | 506,499,514 |
| 건설중인자산 |
559,019,000 | 940,091,546 | - | (1,311,010,546) | - | - | 188,100,000 |
| 합계 | 15,669,213,471 | 1,551,715,340 | (21,608,661) | (20,158,650) | (1,364,414,848) | 12,859,173 | 15,827,605,825 |
사. 설비의 신설 ·매입계획
(1) 오송신축 설비투자 계획(2022년~2024년)
| (단위 : 억원) |
| 구분 | 2022년 상반기 |
2022년 하반기 |
2023년 상반기 |
2023년 하반기 |
2024년 상반기 |
Total | |
| 백신 완제(DP) 생산 시설 신축 |
생산시설 건축 |
95 | 95 | 47 | 47 | - | 284 |
|
시설 장비 구매 |
93 | - | 93 | - | - | 186 | |
|
시스템, 전산 구비 |
- | - | - | - | 70 | 70 | |
|
설계 비용 |
10 | - | - | - | - | 10 | |
|
소 계 |
198 | 95 | 140 | 47 | 70 | 550 | |
| 백신 원료(DS) 생산 시설 신축 |
생산시설 건축 |
250 | 250 | 500 | 500 | 500 | 2,000 |
|
시설 장비 구매 |
- | - | 1,000 | - | 735 | 1,735 | |
|
설계 비용 |
30 | - | - | - | - | 30 | |
|
소 계 |
280 | 250 | 1,500 | 500 | 1,235 | 3,765 | |
| 합 계 | 478 | 345 | 1,640 | 547 | 1,305 | 4,315 | |
| * 상기 금액은 회사의 상황에 따라 변동 될 수 있습니다. |
4. 매출 및 수주상황
가. 매출유형별 실적
(1) 매출 실적
| (단위 : 천원) |
| 매출유형 | 부 문 | 2021년 (제23기 3분기) |
2020년 (제22기) |
2019년 (제21기) |
|
|---|---|---|---|---|---|
| 제품 | 원료 의약품 |
수출 | 34,725 | 1,920,777 | 3,049,980 |
| 내수 | 16,150,413 | 23,178,655 | 27,123,814 | ||
| 소계 | 16,185,138 | 25,099,432 | 30,173,794 | ||
| 상품 | 원료 의약품 외 |
수출 | 131,117 | 167,744 | 27,398 |
| 내수 | 167,809 | 243,236 | 1,239,495 | ||
| 소계 | 298,926 | 410,980 | 1,266,893 | ||
| 기타 | 임가공 외 | 수출 | 3,100 | 7,863 | 20,856 |
| 내수 | (2,235) | 300,158 | 7,180 | ||
| 소계 | 865 | 308,021 | 28,036 | ||
| 합계 | 수출 | 168,942 | 2,096,384 | 3,098,234 | |
| 내수 | 16,315,987 | 23,722,049 | 28,370,489 | ||
| 합계 | 16,484,929 | 25,818,433 | 31,468,723 | ||
* 원료의약품을 제외한 기타 사업부문의 매출의 비중이 낮아 별도 구분하지 않았습니다.
(2) 주요 매출처 등 현황
당사 매출액의 주요 상위 3개 고객사에 대한 매출액은 다음과 같습니다.
| (단위 : 천원,%) |
| 사업년도 | 매출처 | 소재지 | 매출액 | 비중 |
|---|---|---|---|---|
| 2021년 (제23기 3분기) |
A | 국내 | 2,145,705 | 13.02 |
| B | 국내 | 1,879,770 | 11.40 | |
| C | 국내 | 1,495,000 | 9.07 | |
| 기타 | - | 10,964,454 | 66.51 | |
| 합계 | 16,484,929 | 100.00 | ||
| 2020년 (제22기) |
A | 국내 | 3,500,670 | 13.56 |
| B | 국내 |
2,371,601 | 9.19 | |
| C | 국내 |
2,016,720 | 7.81 | |
| 기타 | - | 17,929,442 | 69.44 | |
| 합계 | 25,818,433 | 100.00 | ||
| 2019년 (제21기) |
A | 국내 | 5,773,726 | 18.35 |
| B | 국내 | 3,020,400 | 9.60 | |
| C | 국내 | 2,161,000 | 6.87 | |
| 기타 | - | 20,513,597 | 65.18 | |
| 합계 | 31,468,723 | 100.00 | ||
| * 상기 거래처를 제외한 전체 매출액의 10%인 미만인 매출처는 기타로 통합하여 기재하였습니다. |
| * 당사와 주요 매출처간의 특수한 관계는 없습니다. |
나. 판매경로
(1) 판매조직
(가) 원료의약품 부문
당사의 영업본부의 조직은 국내영업과 해외영업, 신규제품을 개발하는 사업개발로 나뉘어져 운영하고 있습니다.
원료의약품 판매 구조는 2가지 경로로 판매가 이루어지고 있습니다.
직접 완제의약품 제조사에 공급하는 형태와 완제사와의 밀접한 관계로 이루어닞 도매상을 통해 공급되는 판매구조로 되어 있습니다. 영업본부 조직도는 다음과 같습니다.
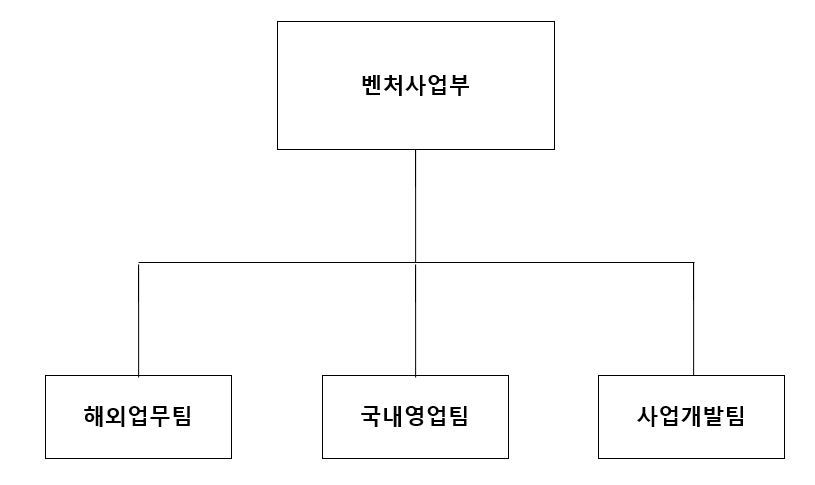 |
|
벤처사업부 조직도 |
(나) 글로벌 신약개발 부문
당사는 빅파마와의 라이센싱 혹은 전략적 제휴를 통해 글로벌 신약을 공동개발하고 개발에 성공할 경우 해당 빅파마가 판매를 담당하게 됩니다.
당사와 라이센싱 계약을 맺을 파트너들은 모두 글로벌 또는 해당 국가에서 의약품 마케팅을 위한 인력, 조직, 영업망 및 노하우 등을 확보하고 있는 제약사들 입니다.
(2) 판매경로
(가) 원료의약품 부문
| (단위 : 천원,%) |
| 매출유형 | 구 분 | 판매경로 | 매출액 | 비중 |
|---|---|---|---|---|
| 직판 | 국내 |
회사-대리점-완제제조사 |
12,336,502 | 74.84 |
|
회사-제약사 |
3,979,485 | 24.14 | ||
| 수출 |
회사-현지대리점-완제제조사 |
118,210 | 0.72 | |
|
회사-제약사 |
50,732 | 0.30 | ||
| 합계 | 16,484,929 | 100.00 | ||
(나) 글로벌 신약개발 부문
글로벌 신약개발 부문의 매출액은 신약개발의 성공시 글로벌제약사로부터 수령하는
Upfront fee, Milestone 과 Running Loyalty로 구성되며 당사가 라이센싱과 전략적 제휴를 위해 글로벌제약사를 접촉하는 방법은 아래와 같습니다.
1) 전시회 혹은 비즈니스 파트너쉽 행사 참여
2) 당사의 전략적 투자가들을 통한 빅파마 접촉
3) 미국 법인을 통한 빅파마와의 지속적인 커뮤니케이션
(3) 판매전략
(가) 원료의약품 부문
1) 수익성 강화
매출액과 수익성 위주로 매출구조를 변화시키는 전략으로 영업력을 집중하고 있습니다.
2) 수출 중심의 시장 확대 전략
당사의 시장확대 전략은 다음과 같습니다.
첫째, 내수 중심에서 수출 위주로 매출구조를 변화
둘째, PMDA (일본 식약처) 실사 통과로 일본 항생제 원료 수출이 시작되면서 세파품목의 안정적인 수출을 확대하고, 일반 품목 수출 기회를 창출하기 위해 일본지역을 최우선으로 해외 마케팅 강화 및 조직재편
3) MRI & CT 조영제 EU GMP 등록 및 수출 품목으로 사업화
조영제 품목의 사업화를 통해 2016년 하반기부터 국내 및 유럽 등록을 위한 샘플 판매 및 완제 등록용 판매를 시작으로 조영제 사업을 본격화 하고 있습니다.
최근 조영제 시장은 Gadolinium 독성 문제로 유럽 및 미국 그리거, 일본까지 가돌리윰 독성 문제가 확대되어 시장의 흐름이 Low Risk군으로 이동하고 있습니다.
Low Risk군에 있는 Gadoterate(DOTA) 그리고 Gadobutrol 제품시장의 확대가 급격히 이루어지고 있으며, 이들 품목의 상용화를 마친 당사는 미국 G사와 유럽의 10여개 조영제 제조사와의 협력을 통해 판매를 준비하고 있습니다.
특히 원료 공급이 원활하지 못한 이들 두 제품에 대해 Generic 발매를 기다리던 조영제 제조회사는 제품등록을 통해 제네릭 발매를 위한 상업화 생산에 속도를 붙이고 있습니다.
당사는 2018년 이들 두 품목 (DOTA, Gadobutrol)에 대해 국내 DMF 등록을 마쳤고, 2019년 2월 유럽 GMP인증을 득했으며, 순차적으로 미국 cGMP를 진행 중에 있으며, DMF 품목등록도 병행해서 진행을 하고 있습니다.
이 두 품목의 유럽 GMP 인증으로 유럽 제약사와 완제등록을 위한 PV(Process Validation)을 진행하고 있으며, 매출 상승에 큰 기대를 하고 있습니다.
당사는 EU GMP 승인을 획득하여 유럽시장 진출에 발판을 확보하고, cGMP 승인을 위한 준비를 진행할 예정입니다.
조영제의 가장 중요한 핵심은 제제기술과 공정 특허로서 당사가 보유한 출원 및 등록된 특허와 제제기술을 토하여 완제사와의 Co-work을 통한 1st Generic 제품 출시와 함께 최적화된 프로세스로 경쟁력 있는 품질과 가격으로 시장을 선점 할 것입니다.
(나) 글로벌 신약개발 부문
당사는 대표이사를 중심으로 EC-18의 글로벌 라이센싱 또는 전략적 제휴를 글로벌 임상시험과 병행하여 진행해오고 있습니다.
당사의 EC-18은 항암제에 의한 호중구감소증 (CIN) 및 항암화학방사선 치료 유발 구강점막염 (CRIOM) 2상 임상시험 종료 후 유효성 및 안전성 결과를 토대로 혁신신약 지정을 목표로 하고 있으며, 특히 항암방사선 치료에 의한 구강점막염 (CRIOM)에 대하여 미국 FDA로 부터 신속심사 지정을 받았기 때문에 혁신신약 지정의 가능성이 높을 것으로 기대하고 있습니다.
따라서 이 두 적응증에 대해서는 2상 임상시험의 중간단계부터 본격적인 협상을 추진할 계획입니다.
한편, EC-18은 급성방사선증후군 (Acute Radiation Syndrome, ARS) 치료제로 2017년말 미국 FDA로부터 희귀질환치료제로 지정을 받았으며, Animal rule study를 통해 2상 임상시험을 종료 후 시판허가 및 Medical countermeasure (MCM) 분야 약물로서 priority review voucher (PRV) 획득을 목표로 하고 있습니다.
범 세계적으로 팬데믹 상황을 초래한 COVID-19에 대해서 2020년 5월 식약처로부터 EC-18의 치료제 2상 임상 시험을 승인 받아 충북대병원, 인천의료원, 인하대병원등에서 진행하여 2021년 8월에 국내 임상2상 결과 발표를 하였고, 미국에서의 임상 2상 시험도 2020년 8월 승인을 받아 임상을 진행하고 있습니다.
동시에 당사는 다른 적응증에 대해서 미국, 유럽, 일본의 다국적 제약사와 계속적으로 라이센싱 혹은 전략적 제휴를 진행해 오고 있으며, 그들의 라이센싱 조건에 대해 계속적인 협의를 하고 있습니다.
당사는 글로벌 빅파마와 CIN, CRIOM의 2상 임상시험이 종료되는 시점에서 건선, 패혈증, 류마티스 관절염, 천식, 아토피 피부염 등의 모든 적응증의 연구성과를 package하여 포괄적인 라이센싱 딜을 진행할 전략을 갖고 있습니다. 동시에 일본, 중국에 한하여 적응증별과 지역별 라이센싱은 계속 추진할 전략을 갖고 있습니다.
다. 수주현황
보고서 작성기준일 현재 해당 사항 없습니다.
5. 위험관리 및 파생거래
가. 재무위험 관리요소
당사는 여러 활동으로 인하여 시장위험(환위험, 공정가치이자율위험, 현금흐름이자율위험 및 가격위험), 신용위험 및 유동성위험과 같은 다양한 재무위험에 노출돼있습니다. 당사의 전반적인 위험관리정책은 금융시장의 변동성에 초점을 맞추고있으며 재무성과에 미치는 부정적 영향을 최소화하는데 중점을 두고 있습니다.
위험관리는 이사회에서 승인한 정책에 따라 이루어지고 있습니다. 이사회는 전반적인 위험관리에 대한 문서화된 정책, 외환위험, 이자율 위험, 신용 위험, 파생금융상품과 비파생금융상품의 이용 및 유동성을 초과하는 투자와 같은 특정 분야에 관한 문서화된 정책을 검토하고 승인합니다.
(1) 시장위험
① 외환위험
외환위험은 환율의 변동으로 인하여 금융상품의 공정가치가 변동할 위험입니다. 당사는 기능통화인 원화 이외의 통화로 표시되는 판매 및 구매에 대해 환위험에 노출되어 있습니다. 당사는 별도의 금융상품을 통한 외화표시 화폐성 자산과 부채의 경제적인 위험회피를 위한 활동을 수행하고 있지 않으며, 지급기일 조정 등을 통하여 환위험을 관리하고 있습니다.
보고서 작성기준일 현재 기능통화 이외의 외화로 표시된 화폐성 자산과 화폐성 부채의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 자 산 | 부 채 | 자 산 | 부 채 | |
| USD | 649,848,061 | 1,452,336,394 | 1,139,542,933 | 1,817,878,825 |
| EUR | - | 41,229,300 | - | 128,638,320 |
| 합 계 | 649,848,061 | 1,493,565,694 | 1,139,542,933 | 1,946,517,145 |
당사는 내부적으로 외화 환율 변동에 따른 환위험을 정기적으로 측정하고 있으며, 보고서 작성기준일 현재 각 외화에 대한 기능통화의 환율변동이 법인세비용차감전순이익에 미치는 영향은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 5% 상승 | 5% 하락 | 5% 상승 | 5% 하락 | |
| USD | (40,124,417) | 40,124,417 | (33,916,795) | 33,916,795 |
| EUR | (2,061,465) | 2,061,465 | (6,431,916) | 6,431,916 |
| 합 계 | (42,185,882) | 42,185,882 | (40,348,711) | 40,348,711 |
② 가격위험
가격위험은 이자율위험이나 환위험 이외의 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험이며, 보고기간종료일 현재 연결회사의 기타포괄손익-공정가치측정 지분상품의 장부금액은 462,568,000원이며, 주가가 1% 변동할 경우 당분기 총 포괄손익의 변동금액은 4,625,680원 입니다.
③ 이자율 위험
이자율 위험은 미래의 시장 이자율 변동에 따라 예금 또는 차입금 등에서 발생하는 이자수익 및 이자비용이 변동될 위험을 뜻하며, 이는 주로 변동금리부 조건의 예금과차입금에서 발생하고 있습니다. 당사의 이자율 위험관리의 목표는 이자율 변동으로 인한 불확실성과 순이자비용의 최소화를 추구함으로써 기업의 가치를 극대화하는데 있습니다.
보고서 작성기준일 현재 당사의 금융상품 중 이자율 위험에 노출되어 있는 금융상품은 존재하지 아니합니다.
(2) 신용위험
신용위험은 거래상대방이 의무를 이행하지 않아 재무손실이 발생할 위험입니다. 당사는 영업활동과 재무활동에서 신용위험에 노출되어 있습니다.
금융자산의 장부금액은 신용위험에 대한 최대 노출정도를 나타냅니다. 보고서 작성기준일 현재 신용위험에 대한 최대 노출정도는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 현금및현금성자산 | 8,426,281,393 | 1,857,599,584 |
| 매출채권및기타채권 | 5,209,856,688 | 4,567,074,209 |
| 단기대여금 | 118,490,000 | 108,800,000 |
| 당기손익-공정가치 측정 금융자산(비유동) | 144,349,685 | 111,909,475 |
| 기타금융자산 | ||
| 금융기관예치금(유동) | 98,802,600,000 | 88,645,952,579 |
| 장기대여금 | 30,450,000 | 82,650,000 |
| 보증금 | 825,141,773 | 625,982,014 |
| 합 계 | 113,557,169,539 | 95,999,967,861 |
당사는 매출채권 등에 대해 발생할 것으로 예상되는 손실에 대해 충당금을 설정하고 있습니다. 이 충당금은 개별적으로 유의적인 항목에 대한 구체적인 손상차손과 유사한 특성을 가진 금융자산 집합에서 발생되었으나 아직 식별되지 않은 손상으로 구성됩니다. 금융자산 집합의 충당금은 유사한 금융자산의 회수에 대한 과거 자료에 근거하여 결정되고 있습니다.
매출채권 및 미수금, 미수수익은 대손충당금이 차감된 순액으로 연결재무상태표에 표시되었는 바, 보고서 작성기준일 현재 대손충당금 차감 전 총액 기준에 의한 매출채권 및 기타채권과 관련한 대손충당금의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 매출채권 | 5,043,988,374 | 5,066,709,475 |
| (대손충당금) | (537,858,027) | (880,995,526) |
| 미수금 | 706,939,021 | 585,408,482 |
| (대손충당금) | (499,532,805) | (499,532,805) |
| 미수수익 | 496,320,125 | 295,484,583 |
| 합 계 | 5,209,856,688 | 4,567,074,209 |
보고서 작성기준일 현재 매출채권 및 기타채권의 연령 및 각 연령별로 손상된 채권금액은다음과 같습니다.
<당분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 매출채권 | 기타채권 | 합 계 | |||
| 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | |
| 6개월이하 | 4,503,143,871 | - | 520,909,341 | - | 5,024,053,212 | - |
| 6개월초과 1년이하 | - | - | 182,817,000 | - | 182,817,000 | - |
| 1년초과 | 540,844,503 | 537,858,027 | 499,532,805 | 499,532,805 | 1,040,377,308 | 1,037,390,832 |
| 합 계 | 5,043,988,374 | 537,858,027 | 1,203,259,146 | 499,532,805 | 6,247,247,520 | 1,037,390,832 |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 매출채권 | 기타채권 | 합 계 | |||
| 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | |
| 6개월이하 | 4,169,091,601 | - | 381,360,260 | - | 4,550,451,861 | - |
| 6개월초과 1년이하 | - | - | - | - | - | - |
| 1년초과 | 897,617,874 | 880,995,526 | 499,532,805 | 499,532,805 | 1,397,150,679 | 1,380,528,331 |
| 합 계 | 5,066,709,475 | 880,995,526 | 880,893,065 | 499,532,805 | 5,947,602,540 | 1,380,528,331 |
(3) 유동성 위험
당사는 미사용 차입금 한도를 적정 수준으로 유지하고, 영업 자금 수요를 충족시키기 위해 차입금 한도나 약정을 위반하는 일이 없도록 유동성에 대한 예측을 항시 모니터링하고 있습니다. 유동성을 예측하는데 있어 당사의 자금조달 계획, 약정 준수, 당사 내부의 목표재무비율 및 통화에 대한 제한과 같은 외부 법규나 법률 요구사항도 고려하고 있습니다.
보고서 작성기준일 현재 금융부채의 잔존 계약만기에 따른 현금유출액은(원금과 이자상당액) 다음과 같습니다.
<당분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월이하 | 3개월초과 ~ 1년이하 |
1년초과 ~ 5년이하 |
5년 초과 |
| 매입채무 | 2,148,734,069 | 2,148,734,069 | 2,148,734,069 | - | - | - |
| 단기차입금 | 5,100,000,000 | 5,164,230,443 | 1,531,777,543 | 3,632,452,900 | - | - |
| 미지급금 | 1,806,351,112 | 1,806,351,112 | 1,484,926,253 | 321,424,859 | - | - |
| 미지급비용 | 15,041,995 | 15,041,995 | 15,041,995 | - | - | - |
| 유동성장기부채 | 2,866,640,000 | 3,012,503,112 | 761,402,698 | 2,251,100,414 | - | - |
| 장기차입금 | 3,891,620,000 | 3,962,073,873 | - | - | 3,962,073,873 | - |
| 전환사채 | 37,701,161,313 | 50,000,000,000 | - | - | 50,000,000,000 | - |
| 유동리스부채 | 284,482,299 | 304,073,566 | 158,247,632 | 145,825,934 | - | - |
| 비유동리스부채 | 193,106,374 | 208,106,625 | - | - | 208,106,625 | - |
| 합 계 | 54,007,137,162 | 66,621,114,795 | 6,100,130,190 | 6,350,804,107 | 54,170,180,498 | - |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월이하 | 3개월초과 ~ 1년이하 |
1년초과 ~ 5년이하 |
5년 초과 |
| 매입채무 | 867,650,649 | 867,650,649 | 867,650,649 | - | - | - |
| 단기차입금 | 4,380,000,000 | 4,425,709,984 | 1,624,770,538 | 2,800,939,446 | - | - |
| 미지급금 | 2,815,303,298 | 2,815,303,298 | 2,524,083,158 | 291,220,140 | - | - |
| 미지급비용 | 15,768,056 | 15,768,056 | 15,768,056 | - | - | - |
| 유동성장기부채 | 1,058,400,000 | 1,249,982,975 | 48,892,345 | 1,201,090,630 | - | - |
| 장기차입금 | 6,041,600,000 | 6,211,343,466 | - | - | 6,211,343,466 | - |
| 전환사채 | 31,078,120,985 | 50,000,000,000 | - | - | 50,000,000,000 | - |
| 유동리스부채 | 191,280,600 | 220,070,633 | 57,723,722 | 162,346,911 | - | - |
| 비유동리스부채 | 317,114,915 | 345,394,076 | - | - | 345,394,076 | - |
| 합 계 | 46,765,238,503 | 66,151,223,137 | 5,138,888,468 | 4,455,597,127 | 56,556,737,542 | - |
나. 자본위험관리
당사의 자본위험관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본비용을 절감하기 위해 최적 자본구조를 유지하는 것입니다.
당사는 최적 자본구조 달성을 위해 부채비율과 순차입금비율 등의 재무비율을 자본위험관리지표로 사용하고 있습니다. 부채비율은 부채총계를 자본총계로 나누어 산출하고 있으며, 순차입금비율은 순차입금을 자본총계로 나누어 산출하고 있습니다.
보고서 작성기준일 현재 부채비율 및 순차입금비율은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 부채비율: | ||
| 부채총계 | 57,679,462,107 | 51,319,665,897 |
| 자본총계 | 82,354,773,562 | 72,482,539,901 |
| 부채비율(%) | 70.04 | 70.80 |
| 순차입금비율: | ||
| 차입금 | 11,858,260,000 | 11,480,000,000 |
| 전환사채 | 37,701,161,313 | 31,078,120,985 |
| (차감)현금및현금성자산 | (8,426,281,393) | (1,857,599,584) |
| (차감)당기손익-공정가치 측정 금융자산(비유동) | (144,349,685) | (111,909,475) |
| (차감)기타포괄손익-공정가치 측정 지분상품 | (462,568,000) | (344,124,000) |
| (차감)기타금융자산 | (99,776,681,773) | (89,463,384,593) |
| 순차입금(A) | (59,250,459,538) | (49,218,896,667) |
| 자본총계(B) | 82,354,773,562 | 72,482,539,901 |
| 순차입금비율(C=A/B)(%) | -(*) | -(*) |
* 부수이므로 산정하지 아니하였습니다.
다. 파생거래
보고서 작성기준일 현재 해당사항 없습니다
6. 주요계약 및 연구개발활동
가. 주요계약
(1) 라이센스아웃(License-out) 계약
보고서 작성기준일 현재 해당사항이 없습니다.
(2) 라이센스인(License-in) 계약
보고서 작성기준일 현재 해당사항이 없습니다.
(3) 기술제휴계약
보고서 작성기준일 현재 해당사항이 없습니다.
(4) 판매계약
보고서 작성기준일 현재 해당사항이 없습니다.
(5) 기타계약
| (단위 : 천원) |
| 계약구분 | 계약 상대방 | 계약체결시기 및 계약기간 |
계약의 목적 및 내용 | 계약금액 | 비고 |
| 기타 경영상 주요계약 |
한국산업단지공단 충북개발공사 |
2016.08.11 (2020.04.24종료) |
공장신축용지 확보 | 5,173,700 |
나. 연구개발 활동
(1) 연구개발활동의 개요
당사는 글로벌 신약 및 원료의약품 개발 및 생산을 전문으로 하는 회사로서, 연구개발 활동을 수행하고 있습니다. 'EC-18 제법 및 생체면역조절 신개념 치료제 기술'
을 기반으로 글로벌 신약 개발 연구활동을 수행 중이며, 세파항생제 합성기술, 일반 원료합성기술과 MRI & CT 조영제 합성기술로 제품 개발 연구 활동을 수행 중에 있습니다.
다. 연구개발 담당조직
(1) 연구개발 조직 개요
당사의 연구개발 조직은 글로벌신약R&D연구소 산하 5개팀, 첨단소재연구소 산하 5개팀 등 총 2개 연구소, 글로벌 백신생산 본부 등 11개 팀으로 구성되어 있으며, 그 현황은 다음과 같습니다.
<연구개발 조직 구성>
| 연구소 | 팀 | 주요업무 |
| 글로벌신약R&D연구소 | 임상 | 국내 및 해외 임상과제 진행 CRO 관리, 인허가 |
| 임상개발 | 임상개발 Business의 전반적인 임상개발 업무 수행 | |
| 사업개발 | 신약개발 Business의 전반적인 사업개발 업무 수행 | |
| 바이오 연구소 |
In vitro & vivo 약효평가 수행, assay setup | |
| 광교연구소 | In vitro & vivo 약효평가 수행, assay setup | |
| 첨단소재 연구소 |
첨단소재 연구소 |
첨단소재 개발 전반적인 업무 수행 |
| 신약 | 신약 물질 개발 및 전반적인 업무 수행 | |
| 신소재 | 신소재 개발 및 전반적인 업무 수행 | |
| API | 원료의약품 신규합성개발 및 제품에대한 품질 개선 연구 | |
| CMC | 임상시험용 의약품 원료 및 완제관리, 인허가 관리 | |
| RA | 품목 인허가/법률적 검토 등 인허가 사항 일체 | |
| 글로벌 백신생산본부 |
글로벌 백신생산본부 |
글로벌 백신 생산 및 글로벌 백신 상업화 전략 업무 수행 |
<조직도>
 |
|
엔지켐생명과학_임상,연구,사업개발부 조직도 |
EC-18의 글로벌 임상개발과 라이센싱 아웃을 성공적으로 수행하기 위해 당사는 글로벌 수준의 내부 전문인력을 기반으로 하고, 추가적으로 외부의 전문인력을 구성하여 전략적으로 활용하고 있으며, 이러한 외부 전문인력은 비임상전문가, 임상개발 전문가, 전문 컨설턴트 그룹 등으로 나뉘어 있고 글로벌 2상 임상시험의 성공적 수행을위해 박차를 가하고 있습니다.
또한, 고순도, 고수율의 EC-18의 원료물질을 생산하기 위해 당사의 원료의약품 연구소에서는 지속적으로 공정연구와 제법연구를 수행하고 있으며, 다양한 생산 프로세스 최적화 연구를 통해 지속적인 수율개선 및 원가절감을 위한 연구에 몰두하고 있습니다.
보고서 작서일 현재 내부핵심인력은 CEO, CMO (Chief Medical Officer), 미국법인장을 포함한 주요 경영진과 실무책임자들로 구성되어 있으며, 기술자문위원단은 Duke 의대 Dr. Jeff Crawford, Harvard medical school의 Dr. Sonis를 포함한 국내외 임상 전문가들로 구성되어 있습니다.
(2) 연구개발인력 현황
보고서 작성기준일 현재 당사의 연구개발인력 현황은 다음과 같습니다.
| 구분 | 학위별 | |||||
| 박사 | 석사 | 기타 | 합계 | |||
| 글로벌신약 R&D연구소 |
바이오연구소 | 4 | 3 | - | 7 | |
| 광교연구소 | - | 1 | 1 | 2 | ||
| 임상R&D부 | 임상개발부 | - | - | - | 0 | |
| 임상팀 | - | 1 | 3 | 4 | ||
| 사업개발부 | 2 | 1 | - | 3 | ||
| 첨단소재 연구소 |
첨단소재연구소 | 1 | - | - | 1 | |
| 신약팀 | - | 1 | - | 1 | ||
|
신소재팀 |
- | 1 | 2 | 3 | ||
| API팀 | - | 1 | 1 | 2 | ||
| RA팀 | - | - | 4 | 4 | ||
| CMC팀 | - | - | 2 | 2 | ||
| 글로벌 백신생산 본부 | - | 1 | - | 1 | ||
| 합 계 | 7 | 10 | 13 | 30 | ||
(3) 핵심 연구인력 현황
| (기준일 : | 신고서제출일 전일) |
|
직 위 |
성 명 |
담당업무 |
주요 경력 |
주요 연구실적* |
|---|---|---|---|---|
|
CEO |
손기영 |
EC-18 |
* 1986년 ~ 1989년 고려대 경영대학원 경영학석사 * 1984년 ~ 1998년 삼일회계법인 이사 (CPA), * 1986년 ~ 1993년 국제통상자문 (현대전자 메모리 반도체 외) * 1996년 ~ 2000년 전경련 국제경영원 교수 * 2003년 ~ 현재 브리짓라이프사이언스 회장 * 2012년 ~ 현재 ㈜엔지켐생명과학 대표이사 |
[논문] 1. PLAG alleviates chemotherapy-induced thrombocytopenia via promotion of megakaryocyte/erythrocyte progenitor differentiation in mice. (2018년, Thrombosis Research 161:84-90) 공동저자 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry 119(2):1392-1405) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget 8(57):96636-96648) 공동저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology 6:206) 공동 저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters 377:25-31) 공동저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One 11(3):e0151758) 공동저자 7. Protective effect of EC-18, a synthetic monoacetylglyceride on lung inflammation in a murine model induced by cigarette smoke and lipopolysaccharide. (2016년 International Immunopharmacology 30:62-68) 공동저자 8. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. (2015년 Immune Network 15(3):150-160) 공동저자 9. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network 15(2):100-109) 공동저자 10. EC-18, a synthetic monoacetyldiglyceride (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol), attenuates the asthmatic response in an aluminum hydroxide/ovalbumin-induced medel of asthma. (2014년 International Immunopharmacology 18(1):116-123) 공동저자 [학회] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling. Journal of Immunology May 1, 2018, 200 (1 Supplement) 42.3 (2018년, AAI 미국면역학회) 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. Cancer Research 2018;78(13 Supplement): Abstract nr 4154. (2018년, AACR 미국암학회) 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. Cancer Research 2018;78(13 Supplement): Abstract nr 2446 (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. Journal of Immunology May 1, 2017; 198(1 Supplement) 204.11 (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. Journal of Immunology May 1, 2017; 198(1 supplement) 222.12 (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. Cancer Research 2017;77(13 Supplement): Abstract nr 5664. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. Journal of Immunology 2016, 196(1 Supplement) 50.2. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. . Journal of Immunology 2016, 196 (1 Supplement) 50.3. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. Journal of Immunology 2016, 196 (1 Supplement) 191.2. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. Blood 2015 126:2207 (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. Blood 2015 126:2210 (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. Blood 2015 126:2212 (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. Blood 2015 126:4757 (2015년, ASH 미국혈액학회) |
| 부사장 | 이홍균 | 글로벌 백신생산 총괄 |
* 1996년~2002년 Sogang University (Seoul), Graduate School of Life Sciences Ph.D. (Major - Microbiology) * 1986년-1991년 Sogang University Graduate School (Seoul), Graduate School of Life Sciences Master's Degree (Major - Biochemistry) * 1982년-1986년 Sogang University (Seoul), Bachelor's Degree in Life Science, Minor - Chemistry * 1991년~2006년 LG Life Sciences Co., Ltd. (currently LG Chem) / Senior Researcher (Director), Institute of Technology *2006년~2010년 LG Life Sciences Co., Ltd. (currently LG Chem)/ Head of Production Team 4 at Iksan Plant *2010년~2012년 SK Chemicals Co., Ltd. *2013년~2017년 SK Chemicals Andong Vaccine Plant (L House), Plant General Manager (Executive Director) *2018년~2019년 SK Bioscience Co., Ltd. Head of Engineering TF (Executive Director) *2019년-2021년 Chong Kun Dang Co., Ltd., Managing Director, Bio Production Division *2021년01월~ Seegene Head of production(COVID diagnostics) |
[Details of work history] 1991~2006 LG Life Sciences Co., Ltd. (currently LG Chem) / Senior Researcher at the Institute of Technology (Bioprocessing team leader, general manager) Main tasks: Gene Cloning/ Cell bank prep./ Cell bank characterization Bioprocess Research- Fermentation/Refining/Formulation Process Development/ Development report, CMC document creation Protein characterization studies Process scale-up (Pilot Scale Study)/ Manufacturing and supply of clinical batch Factory Construction and Qualification (Concept & Basic Design, IQ/ OQ/ PQ/ Engineering Run/ Scale-up/CV/PV) Technology transfer 1) 1991~2000: R & D for Recombinant Bovine Somatotropin / Product Name- Boostin 2) 1993~1994: Process Development of Recombinant Human Somatotropin / Product Name- Utropin 3) 1996: Recombinant Human Alfa Interferon, G-CSF cloning 4) 1991~1997: Recombinant Porcine Somatotropin development research 5) 1998: Process development for Recombinant helicase for diagnosis of human hepatitis C virus 6) 1997~2005: R&D for therapeutic vaccine using Staphylococcus aureus superantigen mutant protein / Product name-Masta Vac 7) 2001~2004: Microbial expression study of useful antibiotics using metabolic engineering 8) 2003~2005: Development of mass production of Coenzyme Q10/Lycopene with E coli using gene evolution technique. 9) 2004~2006: Development of human G-CSF using E. coli 10) 18 patents related to R&D 2006~2010 LG Life Sciences Co., Ltd. (currently LG Chem)/ Head of Production Team 4 at Iksan Plant (Director) Production team leader; Boostin (Recombinant Bovine Somatotropin sustained-release injection) Factive (antibiotics, original agent; Gemifloxacin) Inspection from Korea/ US FDA/ EMEA/ South America and other countries Yield improvement/ cost reduction 2010~2012 SK Chemicals Co., Ltd. Bio 4 Team Leader (Manager) Construction of SK Chemicals Andong Vaccine Factory 1) Concept/ Basic/ Detail Design 2) Oversee General construction work 3) Acquired production building use approval 4) Perform Facility Validation 2013~2017 SK Chemicals Andong Vaccine Plant (L House) Plant, General Manager Establishment of production system for new factory Qualification/Engineering Run, Scale-up/ Clinical batch manufacturing & supply/CV (Cleaning) Validation)/ PV (Process Validation) Acquired manufacturing license (March 2013) Acquired GMP approval for product pipelines - December 2014: Influenza vaccine Skycellflu trivalent - December 2015: Influenza Vaccine Skycellflu Quadrivalent - July 2016: Pneumococcal conjugate vaccine Skypneumo - September 2017: Shingles vaccine Skyzoster Commercial production of licensed products: Final bulk and F/F packaging WHO PQ certification for existing products - Obtained export license for Sky Cell Flu trivalent single dose and multi-dose vial formulation (March/September 2017) Collaboration with overseas partners: Joint development and joint development with a partner company (Sanofi Pasteur) for pneumococcal conjugate vaccine to enter the United States - Supply of clinical batches - Responsible for CAPEX - Acted as a member of JSC (Joint Steering Committee) and participated in major decisions Collaborating with overseas organizations and companies for CDMO business (supply of clinical batches / license approval /commercial production in progress) - PAHO project (recombinant rotavirus vaccine development / commercial production) - IVI (International Vaccine Research Institute) project (typhoid vaccine development/commercial production) - Takeda Pharmaceutical Project (Development of Dengue Vaccine / Commercial Production) Construction related work for the relocation of SK Chemicals Osan blood product factory to Andong - Concept/Basic Design (currently SK Plasma Andong Factory) 2018~2019 Head of SK Bioscience Engineering TF (Executive Director) Expansion and qualification evaluation to increase production capacity of existing factories - Extension work in progress to increase production of Sky Cellflu: Concept/ Basic/ Detail Design Construction in progress - Design of extension construction for pneumococcal conjugate vaccine to enter the United States is in progress (in collaboration with Sanofi Pasteur engineering part and overseas business part) Concept design in progress Global Business Communication Ability: LGLAP grade 4- Advanced Low (Good at business communication) Educational experience: LG/SK group executive education/ Hunet MBA/ leadership education, etc. |
| 전무 | 박갑주 | 사업개발 |
* 1992년~1997년 Ph.D. Department of Chemistry, Brown University, RI, USA (Organic/Bio Chemistry) * 1988년-1990년 M.S. Department of Chemistry, POSTECH, Pohang, S. Korea (Polymer Chemistry) * 1983년-1987년 B.S. Department of Chemistry, Seoul National University, Seoul, S. Korea * 2020년~현재 EnzyChem Life Sciences, Director, Business * 2017년~2019년 Institut Pasteur Korea, Director, Medicinal Chemistry * 2016년~2017년 Hankuk University of Foreign Studies, * 2010년~2015년 Yuhan Corp., S. Korea, Director, * 2001년~2010년 Wyeth/Pfizer, Inc. USA Sr. Research Investigator * 1998년~2001년 Duke University, Research Scientist, USA * 1997년~1998년 Texas A&M University, Post-doc, USA |
[논문] 1. Compound 19e, a novel glucokinase activator, protects against cytokine-?induced beta-?cell apoptosis in INS-?1 Cells Oh, Y. S.; Seo, E.; Park, K. Jun, H.-S., Frontiers in Pharmacology,, 2017, 8, 169/1-169/10 2. Design and Synthesis of Acetylenyl Benzamide Derivatives as Novel Glucokinase Activators for the Treatment of T2DM, Park, K*.; Lee, B. M.; Hyun, K. H.; Han, T.; Lee, D. H.; Choi, H. H.ACS Med. Chem. Lett. 2015, 6, 296-301. 3. Discovery of 3-(4-methanesulfonylphenoxy)-N-[1-(2-methoxy-ethoxymethyl)-1H-pyrazol-3-yl]-5-(3-methylpyridin-2-yl)-benzamide as a novel glucokinase activator (GKA) for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B. M.; Hyun, K. H.; Lee, D. H.; Choi, H. H; Kim, H,; Chong, W.; Kim, K. B.; Nam, S. Y. Bioorg. Med. Chem. 2014, 22, 2280-2293. 4. Treatment with glucokinase activator, YH-GKA, increases cell proliferation and decreases glucotoxic apoptosis in INS-1 cells, Oh, Y. S.; Lee, Y.-J; Park, K.; Choi, H. H.; Yoo, S.; Jun, H.-S. Eur. J. Pharma. Sci. 2014, 51, 137-145. 5. Discovery of a novel phenylethyl benzamide glucokinase activator for the treatment of type 2 diabetes mellitus, Park, K.*; Lee, B.M.; Kim, Y.H.; Han, T.; Yi, W.; Lee, D.H.; Choi, H.H.; Chong, W.; Lee, C.H. Bioorg. Med. Chem. Lett. 2013, 23, 537-542. [학회] 1. Structure-activity relationship and structure-property relationships of TTCA derivatives as novel anti-tubercular agents. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do, Korea Oct 14-15, 2019. 2. Introduction of novel anti-tubercular agent developed for the treatment of MDR/XDR TB. 2019 Fall International Convention of the Pharmaceutical Society of Korea, Yeosu, Jeollanam-do,, Korea Oct 14-15, 2019. 3. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. American Chemical Society (ACS) Spring 2019 National Meeting & Exposition in Orlando, Florida, USA March 31- April 4, 2019 4. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. 2018 Fall Korean Pharmaceutical Conference. Jeju, South Korea. October 17-19, 2018 5. Discovery of novel anti-tubercular agent for the treatment of MDR/XDR TB. General Meeting of the Korean Chemical Society. Daegu, South Korea. October 17-19, 2018 6. In Quest of A Novel Scaffold To Combat MDR/XDR Tuberculosis. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 7. Structure-activity relationships of TTCA series for identification of novel anti-tubercular agents. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 8. Genome wide profiling of Mycobacterium Tuberculosis exposed to novel anti-tuberculosis agent, thienothiazolecarboxamide (TTCA) derivatives. ESCMID/ASM Conference on Drug Development to Meet the Challenge of Antimicrobial Resistance. Lisbon, Portugal. September 4-7, 2018 |
| 상무 | 신동균 | 합성연구소 연구소장 |
* 1990년~1997년 한일약품 과장 (병역특례연구원) |
1. 베타락탐 항생제 개발 : 세포탁심, 세포트리악손, 세픽심, 세포독심 2. 카바페넴 항생제 개발 : 이미페넴, 메로페넴 3. 일반 원료 의약품 개발 : 클라리스로마이신 , 실로도신, 랄록시펜, * 논문 및 특허 1. Synthetic Communications (2005), 35(6), 845-855 2. Tetrahedron Letters (2005), 46(12), 1985-1987. 3. Bulletin of the Korean Chemical Society (1992), 13(2), 176-9. 4. Bulletin of the Korean Chemical Society (1992), 13(1), 98-9. 5. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 6. Bulletin of the Korean Chemical Society (1990), 11(4), 307-9. 7. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio- 8. KR 2008-87141 9. KR 2008-30366 10. KR 2008-30369 11. KR 2006-38105 12. US 20020016457 13. WO 2001070749 14. WO 2001066532 15. KR 1020140115255 16. KR 1020140115259 17. KR 1020160018457 18. KR 1020160095328 19. KR 1020170054491 20. KR 1020170000770 21. KR 1020170152263 |
| 이사 | 윤선영 |
바이오연구소 (비임상 효능 및 적응증 개발) |
*1991년 ~ 1993년 성균관대학교 생물학과 석사 *1999년 ~ 2005년 한국과학기술원(KAIST) 생명과학과 박사 *1994년 ~ 2003년 한국생명공학연구원 세포생물학실 연구원 *2003년 ~ 2005년 한국생명공학연구원 인간유전체사업단 *2005년 ~ 2006년 Roswell Park Cancer Institute (RPCI), *2006년 ~ 2013년 숙명여자대학교 생명과학과 면역학실 * 2013년 ~ 2014년 코아스템㈜ R&D 그룹 R&D 그룹장 |
[논문] 2. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) reduces hepatic injury in concanavaline A-treated mice. (2018년, Journal of Cellular Biochemistry) 공동저자 3. 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol(PLAG) ameliorates arthritic joints through reducing neutrophil infiltration mediated by IL-6/STAT3 and MIP-2 activation. (2017년, Oncotarget) 교신저자 4. The Therapeutic Effect of PLAG against Oral Mucositis in Hamster and Mouse Model. (2016년, Frontiers in Oncology) 교신저자 5. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) augments the therapeutic effect of pegfilgrastim on gemcitabine-induced neutropenia. (2016년 Cancer Letters) 교신저자 6. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells. (2016년 PLoS One) 공동저자 7. Effect of 1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol on immune functions in healthy adults in a randomized controlled trial. Immune Netw. 2015 Jun;15(3):150-60. (2015년 Immune Network) 공동저자 8. Palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (EC-18) modulates Th2 immunity through attenuation of IL-4 expression. (2015년 Immune Network) 주저자 외 48편 주저자 및 공동저자로 논문 게재함 [학회발표] 1. PLAG ameliorates LPS-induced ALI by attenuation of neutrophil infiltration into alveolar via a prompt resolution of TLR4 signaling (2018년, AAI 미국면역학회) 2. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) exhibits the therapeutic effect in chemoradiation-induced oral mucositis mouse model. (2018년, AACR 미국암학회) 3. palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation. (2018년, AACR 미국암학회) 4. Gemcitabine-generated ROS promotes neutrophil chemotactic activity through CXCL8 production via PKCδ/ERK pathway in a murine 4T1 breast cancer model. (2017년 AAI 미국면역학회) 5. PLAG reduces the infection risk via acceleration of bacteria clearance through NF-κB activation in Pseudomonas aeruginosa induced pneumonia model with chemotherapy-induced neutropenia. (2017년 AAI 미국면역학회) 6. PLAG prevents the loss of circulating neutrophils in the chemotherapy induced neutropenia model. (2017년, AACR 미국암학회) 7. Prevention of LPS-induced lung inflammation by PLAG administration via blocking of IL-6-STAT3-MIP-2 pathway. (2016년, AAI 미국면역학회) 8. PLAG (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) regulates IL-6-STAT3 signaling to reduce neutrophil infiltration into the synovium of arthritic joints. (2016년, AAI 미국면역학회) 9. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) modulates eosinophil chemotaxis by regulating CCL26 expression from epithelial cells. (2016년, AAI 미국면역학회) 10. Neutrophil Transmigration into the Joint of RA-Induced Mouse Is Markedly Blocked By EC-18, Via STAT3 Signaling. (2015년, ASH 미국혈액학회) 11. Control of Neutrophil Endothelial transmigration By EC-18 in Chemotherapy Induced Neutropenia. (2015년, ASH 미국혈액학회) 12. Neutrophil Infiltration Is Partially Inhibited By EC-18 in the LPS Induced Acute Lung Injury. (2015년, ASH 미국혈액학회) 13. EC-18 (1-palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol) Exhibits the Immune Regulatory Role through HSC Differentiation of Bone Marrow Cells in Mice. . (2015년, ASH 미국혈액학회) |
|
책임 연구원 |
김원우 |
비임상 실무 |
* 2004 ~ 2005 연세대학교 의과학과 종양생물학, 방사선종양학과 석사 * 2006 ~ 2010 연세대학교 의과학과 종양생물학, 방사선종양학과 박사 * 2010 IAEA Fellowship training, The Gray Institute, 옥스포드 대학교, 박사 후 연구원 * 2011.9 연세대학교, 방사선종양학과. 박사 후 연구원 * 2011.10 ~ 2017.12 한국원자력의학원, 방사선치료연구부, 비임상센터. 위촉 연구원 * 2018.2 ~ 2018.10 한양대학교 자연과학연구소. |
[논문] 1. Anticancer and radiosensitizing effects of the cyclin-dependent kinase inhibitors, AT7519 and SNS 032, on cervical cancer. 2018년, Int J Oncol. 2. Rifaximin improves survival and reduces intestinal injury in mice administered whole abdominal irradiation. 2018년, Bioscience Research. 3. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2018년,International Journal of Hyperthermia. 4. Metformin Inhibits Growth and Metastasis With Enhancement of Radiation Response in Hepatocellulcar Carcinoma Xenograft Model. 2017년, International Journal of Radiation OncologyBiologyPhysics 5. XIAP-associating factor 1, a transcriptional target of BRD7, contributes to endothelial cell senescence. 2016년, Oncotarget. 6. Lanatoside C suppressed colorectal cancer cell growth by inducing mitochondrial dysfunction and increased radiation sensitivity by impairing DNA damage repair. 2016년, Oncotarget. 7. Radiobiological mechanisms of stereotactic body radiation therapy and stereotactic radiation surgery. 2015년, Radiat Oncol J. 8. Suppressor of cytokine signaling (SOCS) genes are silenced by DNA hypermethylation and histone deacetylation and regulate response to radiotherapy in cervical cancer cells. 2015년, PLoS One. 9. Altered Biological Potential and Radioresponse of Murine Tumors in Different Microenvironments. 2015년, Cancer Res Treat. 10. Inhibition of IL-17A suppresses enhanced-tumor growth in low dose pre-irradiated tumor beds. 2014년, PLoS One. 11. Sorafenib acts synergistically in combination with radiotherapy without causing intestinal damage in colorectal cancer. 2013년, Tumori. 12. Tumor-infiltrating regulatory T cells delineated by upregulation of PD-1 and inhibitory receptors. 2012년, Cell Immunol. 13. Combination of radiotherapy and adenovirus-mediated p53 gene therapy for MDM2-overexpressing hepatocellular carcinoma. 2012년, J Radiat Res. 14. A novel combination treatment of armed oncolytic adenovirus expressing IL-12 and GM-CSF with radiotherapy in murine hepatocarcinoma. 2011년, J Radiat Res. 15. Identification of proteins indicating radiation-induced hepatic toxicity in cirrhotic rats. 2010년, J Radiat Res. 16. Recombinant Human Epidermal Growth Factor (rhEGF) Protects Radiation-Induced Intestine Injury in Murine System. 2010년, J Radiat Res 17. Identification of proteins that regulate radiation-induced apoptosis in murine tumors with wild type p53. 2007년, J Radiat Res 18. Enhancement of tumor radioresponse by wortmannin in C3H/HeJ hepatocarcinoma. 2007년, J Radiat Res 19. Protein expression profiles in a rat cirrhotic model induced by thioacetamide. 2006년, Korean J Hepatol. [학회발표] 1. Enhancement of radioresponse by PI3K inhibitor in radioresistant murine hepatocarcinoma. 2004년. 16th EORTC-NCI-AACR Symposium. 2. Enhancement of radiosensitivity by wortmannin in murine HCa-I. 2005년. The 1st Symposium Novel targeting drugs and radiotherapy. 3. Cooperative effects of armed oncolytic adenovirus with radiotherapy in C3H/HeJ hepatocarcinoma. 2007년. 13th ICRR. 4. A Novel Combination Treatment of Armed Oncolytic Adenovirus Expressing IL-12 and GM-CSF with Radiotherapy in Murine Hepatocarcinoma. 2009년. ACRR 5. Radioprotective Effects of Recombinant Human Epidermal Growth Factor 6. Overexpression SOCS-1 may inhibit invasion and metastasis of cervical cancer. 2014년, AACR 7. Study on the heating characteristics of Oncothermia heating devices. 8. Combination of Oncothermia with SBRT and Metformin in vivo. 2016년, 9. Role of HIF-1α in the Response of Tumors to the Combination of Hyperthermia and Radiation in vivo. 2017년, STM 2017. |
| (출처: 당사 정기보고서) |
라. 연구개발비용
| (단위 : 천원) |
|
구분 |
2021년 (제23기 3분기) |
2020년 (제22기) |
2019년 (제21기) |
비고 | |
|---|---|---|---|---|---|
|
자산 |
원재료비 |
- | - | - | - |
|
인건비 |
- | - | - | - | |
|
소 계 |
- | - | - | - | |
|
비용 처리 |
제조원가 |
- | - | - | - |
|
판관비 |
7,775,600 | 13,174,793 | 12,281,724 | - | |
| 소 계 | 7,775,600 | 13,174,793 | 12,281,724 | - | |
| 연구개발비용 합계 | 7,775,600 | 13,174,793 | 12,281,724 | - | |
| (정부보조금) | (41,248) | (309,296) | (838,613) | - | |
|
연구개발비 / 매출액 비율 [연구개발비용계÷당기매출액 |
47.17% | 51.03% | 39.03% | - | |
* 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다
* 당사는 개발중인 원료의약품 및 신약 개발 프로젝트 별로 연구인력의 인건비, 실험 시약 및 재료비, 외주용역비 등을 집계하여 연구개발비를 관리하고 있으며, 국책과제 지원 대상 연구과제에 대해서는 국고보조금을 차감한 후 잔액을 손익계산서상의 경상연구개발비(판매비 및 관리비)로 처리하고 있습니다.
마. 연구개발실적
(1) 연구개발 진행 현황 및 향후계획
보고서 작성기준일 현재 당사가 연구개발 진행 중인 신약 [개량신약, 복제약(시밀러) 등 포함]의 현황은 다음과 같습니다.
<연구개발 진행 총괄표>
| 구분 | 품목 | 적응증 | 연구시작일 | 현재진행단계 | 비고 | ||
|---|---|---|---|---|---|---|---|
| 단계(국가) | 승인일 | ||||||
| 화학합성 | 신약 |
EC-18 |
호중구감소증 |
2013년 |
글로벌 임상2상 part 1 완료 / |
2017년/ |
- |
| 신약 |
EC-18 |
구강점막염 |
2013년 |
임상2상 Stage1, Stage2 완료 임상2상(미국) 결과 공시 2021년 11월 혁신신약지정(BTD) 신청완료 |
2017년 |
신속심사지정 |
|
| 신약 |
EC-18 |
급성방사선증후군 |
2013년 |
미국 임상2상 상응 비임상 |
2019년 |
희귀의약품지정 |
|
| 신약 | EC-18 | COVID-19 | 2020년 | 국내 임상 2상 결과 공시 / 미국 임상 2상 진행 중 |
2020년 | - | |
| 신약 |
EC-18 |
류마티스관절염 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
건선 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
패혈증 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
천식 |
2013년 |
임상1상 종료 |
- | - | |
| 신약 |
EC-18 |
아토피 피부염 |
2013년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
비알코올성지방간염 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
당뇨 |
2017년 |
임상1상 종료 | - | - | |
| 신약 |
EC-18 |
면역항암제 병용 |
2019년 |
임상1상 종료 | - | - | |
(가) 품목 : EC-18
|
①구 분 |
화학합성 신약 |
|
②적응증 |
호중구감소증 |
|
③작용기전 |
혈중 호중구의 유출을 조절 |
|
④제품의특성 |
1) 경구 투여가 가능함 (G-CSF는 주사제임) 2) 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 3) 항암치료로 인한 점막염증에도 효과가 있음 4) 암의 진행을 촉진하는 인자인 STAT3를 억제함 5) 방사선요법을 병행하는 암 치료에도 사용가능 6) 제조원가가 낮음 |
|
⑤진행경과 |
- 2015년 2월 5일 한국 MFDS임상 1상 시험승인 - 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2016년 7월 16일 글로벌 임상 2상 승인 - 2019년 5월 Part 1 대상자 투약 완료 - 2019년 10월 AACR-NCI-EORTC(보스턴, 미국) 학회에서 결과 발표 - 2020년 4월3일 한국 MFDS임상2상 Part 2 승인 |
|
⑥향후계획 |
호중구감소증에 대해서 글로벌 임상 2상 시험은 보고서 작성기준일 현재 Part 1 환자 투약이 완료되었으며, Part 1 결과 및 최종 결과를 활용하여 적극적인 기술 라이선스를 추진할 계획임. |
|
⑦경쟁제품 |
현재의 호중구감소증 치료제 시장은G-CSF 제품으로 형성되어 있지만, 발암성의 증가와 같은 치명적인 부작용, 환자의50%에게만 효능을 나타내는 제한된 약효, 혈액암 환자와 항암화학 방사선 요법 환자에게의 사용 제한, 높은 약가로 인한 비열성 호중구감소증 환자에게의 사용 제한 등으로 인해 새로운 치료제의 도입이 매우 시급한 상황입니다. |
|
⑧관련논문등 |
World J Oncol 2015, Cancer Letters 2016, Thrombosis Research 2018, Cell & Bioscience 2019 |
|
⑨시장규모 |
2017년10월에 보고된Credence Research 자료에 따르면, 화학요법에 따른 호중구감소증 치료제 시장 규모는2016년 전체77억달러에 이르고 있으며, 약5.6%의 연간시장성장률(CAGR)을 보여2025년에는 약125.6억달러 규모로 성장할 것으로 예측하고 있습니다. |
|
⑩기타사항 |
- |
(나) 품목 : EC-18
|
①구 분 |
화학합성 신약 |
|
②적응증 |
구강점막염 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전 |
|
④제품의특성 |
1) 경구투여 2) 항암치료 중 발생하는 호중구감소증에도 효과 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막염을 예방 및 치료 4) 호중구감소증, 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐 5) 암의 진행을 촉진하는 인자인 STAT3를 억제함 6) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험승인 - 2017년 7월 28일 미국 FDA임상 2상 승인 - 2019년 5월 Stage 1 종료 - 2019년 7월 Stage 2 개시 - 2021년 4월 임상2상 환자 모집 완료 - 2021년 6월 최종 피험자 종료 (LPO) - 2021년 10월 임상2상(미국) 결과 공시 - 2021년 11월 혁신신약지정(BTD) 신청완료 |
|
⑥향후계획 |
본 보고서 작성기준일 기준 현재 2상 Stage 2 단계를 완료하여 결과공시를 제출하였으며, 분석된 결과를 바탕으로 2021년 11월 미국 FDA에 혁신신약지정(BTD) 신청완료. 또한 임상 2상 결과를 활용하여 글로벌 라이선스 아웃을 추진 중. |
|
⑦경쟁제품 |
Galera Therapeutics의 GC4419는 방사선치료에 의해 발생되는 구강점막염 치료제로 임상3상을 준비하고 있으나, 항암치료에 필수인 ROS를 억제하는 작용기전을 가지고 있어, 항암치료를 억제하는 가능성을 꾸준히 의심받고 있으며, 정맥주사를 3주~7주 동안 월요일에서 금요일까지 계속해서 맞아야 하므로, 투약이 매우 불편함. |
|
⑧관련논문등 |
Frontiers in Oncology 2016, Orall Disease 2019 |
|
⑨시장규모 |
구강점막염 세계 최고 권위자인Dr. Sonis에 따르면 구강점막염 치료제 시장 규모는 2016년 전체30억달러로 추정되고 있음. |
|
⑩기타사항 |
2018년 2월 FDA 신속심사 지정 |
(다) 품목 : EC-18
|
①구 분 |
화학합성 신약 |
|
②적응증 |
급성방사선증후군 |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용기전으로 급성방사선에 의해 야기된 호중구감소증, 혈소판감소증, 점막염, 폐렴, 급성 폐손상에 효능 |
|
④제품의특성 |
1) 경구투여, 실온보관으로 현장사용(field use)에 적합 2) 급성방사선에 의해 야기된 호중구감소증, 혈소판감소증, 점막염, 폐렴, 급성 폐손상에 효능 3) 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 급성방사선증후군으로 인한 생존률을 높임 4) 제조원가가 낮음. |
|
⑤진행경과 |
- 2015년 5월 29일 미국 FDA임상 1상 시험 승인 |
|
⑥향후계획 |
급성방사선증후군 임사2상 animal ruled study의 실험 조건 확립을 위한 선행 동물 연구 진행 중 |
|
⑦경쟁제품 |
호중구감소증 치료제인 G-CSF와 GM-CSF가 급성방사선 치료제로 FDA로 부터 허가를 획득하였지만, 호중구감소증에만 적용되어 한계점을 가지고 있음. 또한 이들 약물은 저온보관 해야하는 주사제이므로, 현장사용(field use)에 적합하지 않음. |
|
⑧관련논문등 |
J. Trauma 2010, Immune Network 2015, World J Oncol 2015, Cancer Letters 2016, Frontiers in Oncology 2016, Thrombosis Research 2018, Radiation Research 2019 |
|
⑨시장규모 |
2017년10월 발간된Ameri Risearch 연구조사 자료에 따르면, 2018년 전 세계 방사선증후군 치료제 시장규모는 약52억달러 규모이며,연평균6.6% 성장하여2024년에는 약83억달러로 성장할 것으로 예상하고 있습니다. 특히, 이 리포트에서2018년 급성방사선증후군 치료제 시장(골수질환 약3.4억 달러, 점막염질환 약9.5억달러, 심혈관계 질환 약5.4억달러, 신경계질환 약6.7억달러)은 약25억달러로 추정하고 있습니다. |
|
⑩기타사항 |
2017년 12월 FDA 희귀의약품 지정 |
(라) 품목 : EC-18
|
①구 분 |
화학합성 신약 |
|
②적응증 |
신종코로나바이러스 (COVID-19) |
|
③작용기전 |
염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 작용기전으로 코로나바이러스에 의해 야기된 폐렴의 중증으로의 진행예방 및 급성폐손상, 급성호흡부전증후군에 효능 |
|
④제품의특성 |
1) 경구투여 |
|
⑤진행경과 |
- 2020년 5월 12일 한국 식품의약품안전처 임상 2상 시험 승인 - 2021년 1월 21일 국내 임상2상 환자모집 완료 - 2021년3월23일 국내 임상2상Database Lock (DBL) |
|
⑥향후계획 |
- 미국 임상 2상 진행 중 |
|
⑦경쟁제품 |
항바이러스 약물인 길리어드사의 Remdesivir, 부광약품의 Levovir가 있으며, 현재 임상을 진행중임, 항바이러스 약물의 특성 상 내성 및 부작용 우려가 상존 함. |
|
⑧관련논문등 |
J. Trauma 2010, Front Immunol. 2019, J. Immunology 2017 |
* 류마티스관절염, 건선, 패혈증, 천식, 아토피피부염 적응증에 대해서는 비임상 효능, 임상1상시험을 종료하였고, 당사의 전략적 판단에 따라 임상2상에 진입하는 시기를 조율하고 있음.
(2) 연구개발 완료 실적
보고서 작성기준일 현재 해당사항 없습니다.
(3) 기타 연구개발 실적
당사는 하기 치료제 개발과 관련하여 정부 및 유관기관에서 지원하는 연구개발 과제들을 성공적으로 수행하고 있습니다.
(가) 호중구감소증 치료제
가) 범부처전주기 신약개발 사업단
경구용 호중구감소증 치료제의 임상개발에 대해, 국내 최고의 투자기관으로 해외에서도 인정받고 있는 범부처전주기 신약개발 사업단으로부터 지원과제로 선정되었습니다.
1) 과제번호: KDDF-201410-10 (1차)
과제명: 항암화학요법으로 유발되는 호중구감소증 치료를 위한 경구용 신약개발
과제기간: 2015년 3월 ~ 2016년 9월
2) 과제번호: KDDF-201506-03 (2차)
과제명: 항암치료로 유발되는 호중구감소증 치료를 위한 경구용 신약의 글로벌 임상 1상 개발 과제기간: 2015년 10월~ 2016년 5월
3) 과제번호: KDDF-201606-08 (3차)
과제명: 항암치료로 유발되는 호중구감소증 치료를 위한 first-in-class 경구용 신약의 글로벌 임상2상 개발
과제기간: 2016년 11월~ 2019년 10월
나) 한국보건산업진흥원
한국보건산업진흥원이 심사하여 선정하는 제약 산업 컨설팅 지원사업 대상으로 EC-18 글로벌 신약개발 과제가 선정되었습니다.
1) 2015년 해외 인허가 컨설팅 지원 사업
2) 2016년 해외 인허가 컨설팅 지원 사업
3) 2019 년 제약산업 글로벌 현지화 강화 지원 사업
과제명: EC-18 캡슐 수출 현지화 지원 (미국 FDA cGMP 획득)
과제기간: 2019년 5월 ~ 2019년 11월
다) 한국생명공학연구원 한국생명공학연구원에서 주관하는 '민간수탁과제'에 지원하여 본 과제가 선정되었습니다.
1) 1차 지원과제명: 항암화학요법으로 유발되는 호중구감소증에서의 EC-18의 작용기전 연구
(과제기간 : 2015년 2월 ~ 2016년 3월)
2) 2차 지원과제명: 항암화학요법으로 유발된 호중구감소 모델에서 박테리아균 감염시 EC-18에 의한 risk 개선 효과에 관한 연구
(과제기간 : 2016년 3월 ~ 2016년 9월)
3) 3차 지원과제명 : First in class 경구용 지질 신약 후보물질의 작용점(MoA) 규명 및 신규 적응증 개발과 유도체를 활용한 후보물질 연구
(과제기간 : 2017년 1월 ~ 2018년 12월)
4) 4차 지원과제명 : First in class 경구용 지질 신약 후보물질의 호중구 이동 작용점 규명 및 생체 내 흡수기전 연구 (과제기간 : 2017년 8월 ~ 2018년 1월)
5) 5차 지원과제명 : 지질기반 후보물질에 따른 암세포의 비정상적 전이 억제 효과 검증 및 항암제제 적용에 의한 호중구 감소증 증상 완화 효과 확인
(과제기간 : 2019년 3월 ~ 2020년 2월)
라) 충청북도
충청북도에서 주관하는 2015 바이오제품 안전성 시험비용 지원사업에 지원하여 사업 대상에 선정되었습니다. (지원 기간: 2015년 5월 ~ 2016년 4월)
1) 지원과제명: EC-18 (PLAG)의 안전성시험을 통한 글로벌 면역치료제 개발
마) 과학기술연합대학원
한국생명공학연구원과 공동으로 'UST 계약학과 협력지원사업'에 지원하여 대상과제로 선정되었습니다. (지원기간: 2015년 7월 ~ 2017년 11월)
1) 1차 지원과제명: 대량생산된 녹용추출성분(EC-18)의 고부가가치 창출을 위한 효능 보완연구
2) 2차 지원과제명: 암 미세환경 조절물질을 활용한 항암 및 암 전이 억제효과 규명
(나) 구강점막염 치료제
가) 한국생명공학연구원
한국생명공학연구원에서 주관하는 '민간수탁과제'에 지원하여 본 과제가 선정되었습니다.
1) 1차 지원과제명: 항암요법으로 유발된 구강점막염 (Oral Mucositis) 동물 모델에서 EC-18 투여에 의한 개선 기전 연구 (과제기간 : 2016년 3월 ~ 2016년 8월)
2) 2차 지원과제명 : 지질기반 신약 후보물질의 신규 적응증 모델 구축과 질환개선 효과 및 기전 연구 (과제기간 : 2018년 7월 ~ 2019년 6월)
(다) 비알콜성지방간염(NASH) 치료제
가) 한국생명공학연구원 (과제기간 : 2019년 9월 ~ 2020년 8월)
1) 지원과제명 : 지질기반 후보물질에 따른 NAFLD 및 만성 대사질환의 조절 기전 확립
(라) 암전이억제제 [면역관문억제제(Immune checkpoint inhibitor, ICI) 병용처리)]
가) 한국생명공학연구원 (과제기간 : 2020년 3월 ~ 2021년 2월)
1) 지원과제명 : 지질기반 후보물질과 Immune checkpoint inhibitor 병용처리에 의한 항암 시너지 효과 및 작용기전 연구
(마) 바이러스감염 치료제
가) 한국생명공학연구원 (과제기간 : 2020년 10월 ~ 2021년 09월)
1) 지원과제명 : 지질기반 후보물질에 의한 바이러스 유도 pneumonia 또는 ARDS 모델에서 효능 검증 및 작용기전 연구
(바) 당뇨병 치료제
가) 과학기술연합대학원
한국생명공학연구원과 공동으로 ‘UST 계약학과 협력지원사업’에 지원하여 대상과제로 선정되었습니다. (지원기간: 2018년 12월 ~ 2019년 11월)
1) 지원과제명 : 지질 신약 후보물질의 당뇨병성 세포 손상 예방 작용기전 규명
(사) 류마티스관절염 치료제
가) 강남성모 병원 류마티스센터 (지원 기간: 2016년 1월~ 2018년 12월)
당사가 확보한 비임상 데이터를 강남성모병원 류마티스센터가 평가한 후 공동 연구 제안을 받아 T2B 과제로 선정되었습니다.
1) 1차 지원과제명: EC-18 이용한 관절염 효력모델에서의 치료효과
2) 2차 지원과제명: EC-18 이용한 류마티스관절염 병인 T세포 및 관절 활막세포제어 메커니즘 연구
3) 3차 지원과제명: EC-18을 통한 림프구의 migration 및 chemokine 발현 조사 연구 과제
4) 4차 지원과제명: EC-18과 MTX 병용 투여에 의한 류마티스관절염 치료 효력 연구
5) 5차 지원과제명: EC-18을 통한 마우스 병인세포 조절 효과 조사
(아) 패혈증 치료제
가) 한국생명공학연구원 (지원기간: 2016년 8월~ 2017년 7월)
국가과학기술연구회에서 주관하는 ‘상용화 기술개발사업’에 지원하여 본 과제가 선정되었습니다.
1) 지원과제명: 면역조절 기반 급성 폐손상 및 급성호흡곤란 증후군 예방 및 치료제 개발
나) 과학기술연합대학원
한국생명공학연구원과 공동으로 ‘UST 계약학과 협력지원사업’에 지원하여 대상과제로 선정되었습니다. (지원기간: 2017년 10월 ~ 2018년 10월)
1) 지원과제명 : 선천성 면역조절 기반 후보물질의 염증성 폐질환 예방 작용기전 규명 연구
(자) 아토피, 건선, 천식 치료제
가) 한국생명공학연구원 (과제기간 : 2013년 1월 ~ 2014년 6월)
1) 지원과제명 : EC-18의 타겟질환 개발을 위한 면역조절 효능 및 메카니즘 규명 연구
(차) 원료의약품 (팔리페리돈)
가) 중소기업청 (지원기간: 2014년 11월~ 2016년 11월)
중소기업청에서 주관하는 '기술혁신개발사업' 에 지원하여 본 과제가 선정되었습니다.
1) 지원과제명: 중소기업청기술혁신개발사업과제 조현병 치료제 개발
2) 지원과제명: 조현병 치료제인 팔리페리돈 중간체 및 원제 개발
나)중소벤처기업부 (지원기간: 2019년 06월~ 2020년 05월)
1) 지원사업명: 지역기업 혁신성장 지원 사
2) 지원과제명: 보티옥세틴 브롬화 수소산염의 개발 및 사업화
다) 중소벤처기업부 (지원기간: 2020년 05월 ~ 2021년 04월)
1) 지원사업명: 지역 특화 산업 육성 사업
2) 지원과제명: 라프티딘 전구체인 PTBA-MA의 개발 및 사업화
(카) MRI 조영제
가) 중소기업기술정보진흥원 (지원기간: 2018년 05월~ 2020년 4월)
1) 지원사업명: 중소기업 기술개발사업 해외수요처 연계기술개발 사업
2) 지원과제명: MRI 조영제 가도부트롤의 개발
나) 중소기업기술정보진흥원 (지원기간: 2018년 07월~ 2019년 7월)
1) 지원사업명: 중소기업 기술개발사업 공정개선 기술 개발 사업
2) 지원과제명: MRI 조영제인 가도부트롤의 공정개선 기술 개발
다) 충북 테크노파크 (지원기간: 2019년 07월~ 2020년 06월)
1) 지원사업명: 4차 산업혁명 대응 선도기술 개발 사업
2) 지원과제명: 거대고리형 MRI 조영제 가도테리돌의 개발 및 사업화
라) 중소벤처기업부 (지원기간: 2019년 07월~ 2020년 06월)
1) 지원사업명: 지역기업 개방형 혁신 성장 지원 사업
2) 지원과제명: 체지방 감소 효능을 갖는 프로바이오틱스 건강기능 식품 및 가도테릭산을 이용하여 경제성을 극대화한 MRI 조영의약품 개발
(타) 글로벌 현지화 강화 지원 사업
가) 한국보건산업진흥원 (지원기간: 2019년 05월~ 2019년 11월)
한국보건산업진흥원에서 진행하는 '글로벌 현지화 강화 지원 사업'에 지원하여 본
과제가 선정되었습니다.
1) 지원사업명: 글로벌 현지화 강화 지원 사업
2) 지원과제명: 2019년 제약산업 글로벌 현지화 강화 지원 사업
(파) 취업지원
가) 충북대학교 산학협력단 (지원기간: 2019년 09월~ 2019년 12월)
1) 지원과제명: 바이오분야 전문인력 양성 및 취업지원 (Open Lab)
2) 지원과제명: 타우로리딘
나) 충북대학교 산학협력단 (지원기간: 2020년 05월~ 2020년 12월)
1) 지원사업명: 바이오분야 전문인력 양성 및 취업지원 (Open Lab)
2) 지원과제명: 도네페질
(하) 지역 기업혁신 성장 지원사업
가) 중소벤처기업부 (지원기간: 2019년 06월~ 2020년 05월)
중소벤처기업부에서 진행하는 '지역기업혁신 성장 지원사업'에 지원하여 본 과제가 선정되었습니다.
1) 지원과제명: 보티옥세틴 브롬화 수소산염의 개발 및 사업화
나) 충북 테크노파크 (지원기간: 2020년 08월 ~ 2020년 12월)
1) 지원사업명: 스타기업 맞춤형 기업 지원 사업
7. 기타 참고사항
가. 지적재산권 보유현황
당사는 기술가치를 충분히 보장할 수 있는 산업재산권 (특허권 및 상표권) 총 264건을 보유하고 있으며 142건의 특허권, 10건의 상표권은 등록되었고, 108건은 출원 중인 특허권, 4건은 출원중인 상표권입니다. (소멸된 특허권 21건, 양도된 특허권 4건 미포함)
EC-18 글로벌 신약 관련 특허권은 총 213건으로 이 중 128건은 등록되었고 85건은 출원 중에 있습니다.
(1) 산업재산권 현황 요약 (특허권 등록 142건, 특허권 출원 108건)
| [산업재산권 현황 요약] |
|
사업 구분 |
출원/등록 구분 |
건 수 |
|
글로벌신약 |
특허 등록 |
128 |
|
특허 출원 |
85 | |
|
원료의약품 |
특허 등록 |
9 |
|
특허 출원 |
2 | |
|
조영제 |
특허 등록 |
5 |
|
특허 출원 |
21 |
당사의 산업재산권에 대한 자세한 내용은 상세표-6. 지적재산권 보유현황[상세] 부문을 참고하여 주시기 바랍니다.
나. 업계의 현황
(1) 산업의 개요
(가) 원료의약품 부문
원료의약품이란 신약 및 Generic 완제의약품을 제조하기 위한 원료 물질의 총칭으로 사람에게 투여하기 위해 가공, 성형 (제제(製劑)화, formulation)하기 바로 전단계의 의약품을 의미합니다.
원료의약품은 인허가제도, 품질의 균일성 유지, 안전성 검증 등의 이유로 제품의 거래 발생시 특별한 절차가 요구되는 특성이 있으며, 완제의약품 생산은 좋은 원료의약품을 적정 형태로 가공, 포장하는 작업이 대부분이므로 규격에 맞고 품질이 우수하며 신뢰성이 높은 원료의약품을 확보하는 것이 완제의약품 제품의 경쟁력과 직결되게 됩니다.
세계 원료의약품 시장은 전통적으로 고도의 생산기술을 확보하고 있는 이탈리아, 독일 등 유럽 제약업체들 (ACS Dobfar (이탈리아), Sandoz, Merck (독일) 등)이 장악해 왔는데, 2000년 이후 Generic 의약품 시장의 성장으로 의약품 생산 기술력과 함께 원가경쟁력이 완제의약품 생산의 주요소로 부각되면서 점차 인도, 중국 등 아시아권 업체의 성장세가 두드러지고 있는 상황입니다.
우리나라의 상위 완제의약품 제약사들은 계열사 (원료의약품 생산) 로부터 원료를 공급받고 있으며, 중소형 제약사의 경우, 고가 원료는 유럽/미국에서, 저가 원료는 인도/중국으로부터 수입하고 있습니다.
한편 국내 원료의약품 제조사들은 국내외 시장에서 중국 및 인도의 저가 제약사들과 가격면에서 경쟁력이 약하기 때문에 단순한 구조의 Generic 의약품 원료 생산만으로는 경쟁력을 확보할 수 없습니다.
따라서 특허 만료가 임박한 원료의약품의 특성을 파악해 원료 제조에 고도의 생산 기술과 제제/제법 기술 개발을 통한 고부가가치의 원료의약품 생산에 특화하여 선진국시장에 수출을 하고 있습니다.
이러한 선진국 수준의 생산기술을 보유한 국내 원료의약품 제조사들은 가격보다 품질을 우선시 하는 일본 의약품 시장을 주력 시장으로 진출하였습니다.
일본은 특성상 상호신뢰 관계 구축과 의약품 품질에 대한 기준이 까다롭고 원료의약품 신고제도 (DMF)에 따른 등록 없이는 진입이 힘든 시장이기 때문에 유수의 중국 및 인도 원료의약품 제조사들의 저가 공세에도 고가의 원료 시장이 형성되어 있습니다.
게다가 일본 정부 역시 건강보험 재정 부담이 심화됨에 따라 Generic 의약품 촉진정책을 펴고 있으며, 향후 Generic 의약품 시장이 크게 확대될 것으로 예상 됩니다.
국내 원료의약품시장은 1950년대까지는 완제의약품의 수입에 의존하였고, 1960년대부터 완제의약품의 국산화를 통해 본격적으로 제약 산업이 발전하기 시작하여 제제 기술의 개발에 주력 하였고 완제의약품의 수입은 억제하였습니다.
1970년대는 항생제등 원료의약품의 국산화에 박차를 가한 시기였고, 이를 지원하기위해 국산화에 성공한 원료의약품의 국내 수입을 금지하였습니다. 1980년대에는 1970년대까지의 모방적 단계에서 더 나아가 신공정 개발에 기술력을 축적하였고 1980년대 말부터 물질 특허제도의 도입과 함께 신약개발을 시작하였습니다.
1990년대는 신약개발 준비단계로 볼 수 있으며, 1999년 7월에 국내 신약 1호 (SK케미칼의 선플라주)가 탄생되어 본격적인 신약개발 시대가 도래 하였고, 1990년대 들어 중국, 인도를 비롯한 신흥공업국 관련 업체들과의 경쟁 심화로 가격 위주 경쟁체제로 전홤됨에 따라 어려움을 겪었습니다.
(나) 글로벌 신약개발 부문
1990년대 말까지의 글로벌 제약 산업은 사상 최대의 호황을 맞았습니다. 의학 및 분자생물학의 발전에 힘입어 질환의 원인을 분자수준에서 규명하기 시작하였으며, 질병을 일으키는 특정 단백질의 활성을 저해 혹은 증진시키는 약물의 개발을 통해 표적 치료제의 개념이 도입되기 시작하였습니다.
이를 통하여 다양한 질환군에 대해 기존 약물 대비 안전성과 유효성이 현격하게 개선된 치료제가 시장에 출시되기 시작하면서, 1996년에서 1998년 사이 135개의 신약이 미국 FDA 승인을 받을 전도로 표적 치료제 개발을 통한 신약개발 분야의 괄목한 성장이 이루어졌습니다.
대표적으로, 1996년 승인을 받은 화이자(Pfizer)사의 콜레스테롤 합성 저해제 리피토(Lipitor)는 최고 연간매출 15조원에 이르는 초대형 블록버스터 신약이 되었으며, 시장 규모가 큰 고혈압, 고지혈증, 당뇨병 분야의 치료제 개발뿐만 아니라, 환자 수도 적고 치료제 개발도 미진하지만 독점 진입을 통한 수익력의 극대화를 기대할 수 있는 니치마켓 치료제 개발 전략도 표적 항암제 개발을 통해 잘 나타나고 있습니다.
1) 대형품목(블록버스터 약품) 특허만료
화이자, 머크, 존슨앤존슨 등과 같은 빅파마의 블록버스터 의약품 특허가 대거 만료되면서, 시장에서 복제약 (Generic) 경쟁이 치열해지면서 빅파마의 매출과 영업 이익이 급감하였습니다.
이런 추세 때문에 제약사의 연구개발비를 제외한 영업이익은 2010년 48%에서 2020년 43%로 하락할 것으로 시장전망기관은 예측하고 있고, 세계매출 1위였던 화이자의 리피토 특허가 2011년 만료됨에 따라 매출액이 2012년 95억 달러에서 2013년 39억 달러로 급감하였습니다.
2) 연구개발비 생산성 저하
2000년대 초반까지 빅파마들은 신약 타겟의 발굴부터 후기 임상진행까지 연구개발의 모든 역할을 자체적으로 수행해 왔습니다.
이러한 시도는 엄청난 자본 투자로 이루어졌으나, 결국 고부가가치 혁신신약개발에 필수적인 이노베이션을 만들어내는 효율성 측면에서는 실패하였습니다. 이와 같은 비효율성의 악순환을 끊어내기 위해 빅파마들은 2000년대 중반 이후 전례없는 대규모 연구개발 구조조정을 단행하기 시작하였습니다.
구조조정의 핵심은 이노베이션의 주축을 담당하던 초기 연구개발 조직을 대폭 축소하고, 대기업 조직이 효율적으로 움직일 수 있는 후기 임상개발 기능을 강화하는 것이었습니다.
여기서 발생하는 이노베이션의 공백, 즉 혁신적인 초기 연구개발과제는 효율적인 운영이 가능한 바이오벤처를 통해서 도입하는 것으로 방향을 잡았습니다.
2000년대 중반부터 시작된 글로벌 제약엽계의 구조조정의 성과는 신약개발에 소요되는 약 10년간의 시간이 소요된 뒤인 요즘 두드러지고 있습니다. 최근 FDA에 의해서 승인되는 신약은 증가 추세에 있으며, 1990년대 후반에 나타났던 제약시장의 최전성기의 신약 승인 건수를 상회하고 있습니다.
이러한 사실은 이노베이션은 바이오벤처가 맡고 후기 개발 및 마케팅은 빅파마가 맡는 역할 분담의 구조가 효율적이라는 것을 보여주고 있습니다.
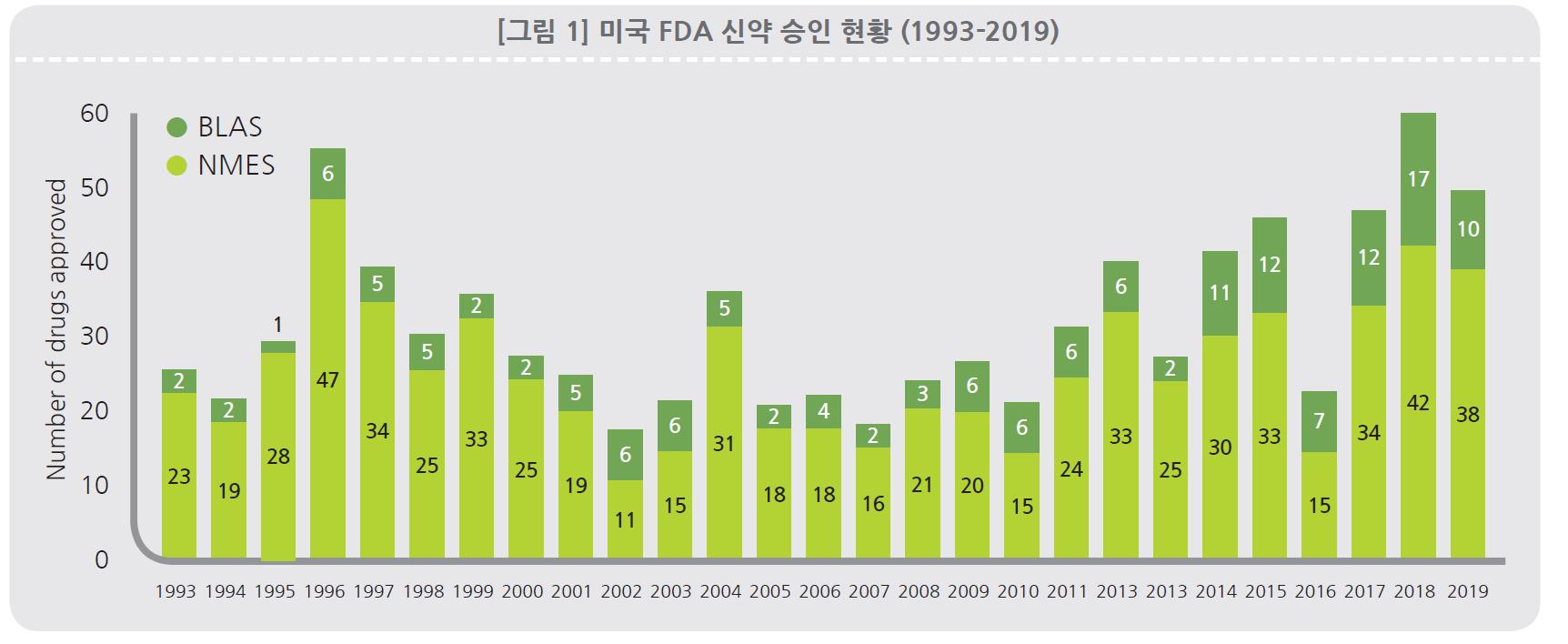 |
|
1993-2019년 미국 FDA 신약 승인 현황; NMES:화학합성신약, BLAs:바이오신약 |
빅파마의 신약개발 프로그램의 성공률은 바이오벤처로부터 기술도입 및 공동연구를 통한 신약 프로그램, 즉 오픈 이노베이션 (Open Innovation, OI)을 통한 프로그램의 임상개발 성공률이 자체적으로 초기 연구 및 개발을 수행하는 프로그램보다 월등히 높은 것을 볼 수 있습니다.
![이미지: [프로그램 소스에 따른 신약개발 성공률 비교 (Deloitte Consulting Report, 2015)]](%5B%ED%94%84%EB%A1%9C%EA%B7%B8%EB%9E%A8%20%EC%86%8C%EC%8A%A4%EC%97%90%20%EB%94%B0%EB%A5%B8%20%EC%8B%A0%EC%95%BD%EA%B0%9C%EB%B0%9C%20%EC%84%B1%EA%B3%B5%EB%A5%A0%20%EB%B9%84%EA%B5%90%20%28deloitte%20consulting%20report%2C%202015%29%5D.jpg) |
|
[프로그램 소스에 따른 신약개발 성공률 비교 (Deloitte Consulting Report, 2015)] |
이러한 결과는 앞으로 글로벌 제약업계가 지속적으로 성장해 나갈 수 있는 방향을 제시 해주는 것으로, 이노베이션을 통해 혁신신약을 개발하는 바이오벤처와 후기 개발 오퍼레이션 및 마케팅에 역량을 집중하는 빅파마간의 상생적 공생관계가 더욱더 확대될 것을 보여주고 있습니다.
3) 각국 정부의 강력한 약가인하정책 등 공공의료비 예산삭감
미국, 일본, 유럽, 중국 등 각국 정부는 재정 악화에 따른 약가인하정책 등으로 의료비에 대한 공공지출 감축을 시행하였으며 앞으로도 지속될 것으로 보입니다. 국내의 경우에도 2014년 4월부터 일괄적으로 약가인하제도가 실시되어, 국내 제약사들의 보험적용을 받는 의약품가격이 22.3% 인하되었습니다.
또한, 합성의약품에 비해 임상1상에서 성공확률이 2.5배 높고, 활성 대사체와 관련된 독성이 없다는 점으로 인해 글로벌제약사들을 중심으로 개발되어 온 고가의 바이오의약품 분야도 이러한 약가인하정책 등으로 인해 바이오시밀러 개발 쪽으로 개발 중심이 이동하고 있습니다.
즉, 박파마들은 약가를 낮출 수 있는 바이오시밀러와 안전성이 확보된 합성 의약품 개발로의 연구개발비 투자를 확대하고, 전략적인 제휴 ((예) 인수와 합병, 라이센싱)를 통해 개발 파이프라인을 확보하는 방향으로 선회하고 있습니다.
(2) 산업의 특성
(가) 원료의약품 사업
산업경기 측면에서 의약산업은 수요탄력성이 낮고 경기의 변동에 크게 영향을 받지 않는 특성을 보입니다. 다만, 전문의약품 (ETC: Ethical drug)과 달리 일반의약품 (OTC : Over The Counter drug) 시장의 경우는 경기변동과 계절적 요인에 의하여 변동이 있을 가능성이 다소 있습니다. 의약산업은 경기변동에 의해 영향을 받지 않는 대표적인 산업으로, 일반적으로 기술의 발달에 따라 10년 주기로 산업 전반에 대한 변화가 있는 것으로 알려져 있습니다. 또한 의약산업은 고령화와 식습관의 변화 등과밀접한 관계를 가지고 있으며, 이와 관련된 질병에 대한 진단제품 및 치료제 개발로 이어지고 있습니다.
그로 인해 높은 진입장벽이 형성되어 있어 신규사업자의 진입이 쉽지 않으며, 의료기술의 발전과 더불어 평균연령 증가로 인해 원료의약품시장의 규모는 지속적으로 성장하고 있습니다.
국내 원료의약품 회사의 원가경쟁력은 중국과 인도에 다소 뒤지지만 선진국 수준의 QA/QC 역량, 고난이도 합성 및 양산 기술 구축, 선진국 수준의 GMP 인증 등을 경쟁력으로 하여 주로 고부가가치 제품 영역에서 경쟁력이 있는 것으로 평가되고 있습니다.
원료의약품산업은 제약 산업의 완제품 판매 절차인 시장조사, 연구, 시제품 생산, 제품 출시와 마케팅의 단계와 긴밀한 연관관계를 나타내므로 개발에서 판매까지의 기간이 길고, 연구개발 분야에서 높은 투자가 요구되는 반면 시장진입 후 제품 주기 상 성장기와 성숙기에 접어들면 매출이 안정적으로 발생하는 특성을 보이고 있습니다.
최근에는 각국의 품질기준 강화와 함께 국내에서도 원료의약품 신고제도 (KDMF: Korea Drug Master File)의 확대실시, 우리나라의 PIC/S (Pharmaceutical InspectionCO-operation Scheme, 의약품 실사 상호협력기구)의 가입 등 원료의약품 품질수준에 대한 규제강화로 품질이 경쟁의 핵심요소로 떠오르고 있어 보다 개선된 생산성향상과 더불어 엄격한 품질관리에 주력하고 있으며, 2018년, 2019년에는 제네릭 발매의 약품에 대한 기준이 더욱 강화되어 시장의 변화가 예상되며, 또한 주요 제약 기업들의 해외 투자 및 해외 진출이 본격화 되고, 해외 파트너들과의 전략적인 투자가 저극적으로 이루어 지고 있습니다.
조영제는 원료의약품군에 속하기보다는 진단 시약에 해당됩니다. 전 세계 조영제 시장(2015년 기준)은 약 82억 달러로 MRI와 CT 조영제를 포함하는 시장이며, 4개의 Major (Bayer Shering, GE Healthcare, Guerbet, Braco 등) 회사가 전체시장의 약90%를 장악하고 있으며, 특허와 기술 장벽이 높아 신규 개발자가 진입하기에는 쉽지 않은 시장구조를 가지고 있는 것이 특징입니다. 특히 MRI시장은 지난 2015년 가돌리움 신장독성으로 인한 사고로 시장 구조를 가돌리움 독성의 따른 Risk별로 구분하고, High Risk군에 속하는 모든 조영제는 미국에서 사용을 금지하는 조치가 이루어 졌습니다. 2016년 말부터 2017년 초에 이르러 Middle Risk군에 있는 조영제의 신장 독성이 추가로 발견됨에 따라 미국을 비롯한 유럽, 일본 등 제약산업의 선두 그룹에 있는 국가에서부터 점차 판매가 중지 되고 있으며, 2017년 12월에는 국내에서도 중지가 되었습니다. 이러한 연유로 급격한 시장 변화가 일어나고 있는 실정이며, 이러한 추세라면 조영제 시장은 Low Risk군에 속한 제품이 시장을 주도 할 것으로 예상되며, 조영제 제품의 제네릭 발매를 위해 준비해 온 제약사들이 제제 기술 개벌에 노력하고 있습니다.
(나) 글로벌 신약개발 부문
글로벌 신약산업의 특성은 아래와 같습니다.
1) 고도의 기술집약적 첨단과학기반
신약개발사업은 대표적인 과학기반 산업 (science-based industry)으로 약학, 화학, 생물학, 수의학, 의학 등 여러 분야의 기초과학연구의 결과가 산업적 성과와 긴밀하게 연계되어 있습니다.
신약개발을 위한 연구에서부터 원료 및 완제의약품의 생산과 판매 등 모든 과정을 포괄하는 첨단산업으로 연구집약도가 높고 신약 개발 여부에 따라 고부가가치를 창출할 수있는 미래 주력 산업입니다.
2) 고위험, 고부가가치 (high risk high return)
신약개발은 막대한 비용과 시간이 필요하며, 이러한 비용과 시간투자에도 불구하고 신약개발의 성공률은 높지 않습니다. 신약개발 전 과정을 거치면 신약 출시까지 보통 12~15년의 기간과 약 1조원의 비용이 소요되지만, 글로벌 Top 10 제약사 기준으로 비임상 이후 단계의 성공률은 평균 11% 수준으로 높지 않습니다.
하지만, 신약 개발이 성공하면 그로부터 천문학적인 수익을 거두는 경우가 많습니다. 전 세계 매출 1위 휴미라의 연간 매출은 2019년 197억원 달러에 달하며 이벨류에이트파마의 '2021 Preview' 보고서에 따르면 COVID-19 관련 의약품을 제외한 올해 상위 10개의 의약품의 총 매출액은 1097억원 달러 규모로 예상하고 있습니다.
![이미지: [2019년 매출액 및 2021년 예상 매출액]](%EA%B8%80%EB%A1%9C%EB%B2%8C%EC%8B%A0%EC%95%BD_%EC%82%AC%EC%A7%842.jpg) |
|
[2019년 매출액 및 2021년 예상 매출액] |
3) 산업의 특징
글로벌 신약산업의 특징은 아래와 같습니다.
① 신규 진입과 퇴출의 희소성
신약개발에 필요한 전문성과 막대한 비용 및 시간이 높은 진입장벽을 형성하여, 시장점유율의 변동은 있어도 진입 및 퇴출되는 기업은 많지 않습니다.
② 세분화된 시장
제약 산업은 약의 종류가 매우 많고 각 질환 마다 다른 전문성을 요하기 때문에 한 회사가 모든 질환에 대한 가장 좋은 약을 개발할 수 없습니다. 따라서 전체 세계시장의 점유율 6%가 넘는 기업이 없을 정도로, 제약사들은 몇몇 질환과 약효군에 대해 전문성을 갖고 시장을 세분화하여 점유하고 있습니다.
![이미지: [글로벌 매출 상위 10대 제약 기업 2019년 매출액 및 2026년 예상 매출액]](%EA%B8%80%EB%A1%9C%EB%B2%8C%EC%8B%A0%EC%95%BD_%EC%82%AC%EC%A7%843.jpg) |
|
[글로벌 매출 상위 10대 제약 기업 2019년 매출액 및 2026년 예상 매출액] |
③ 활발한 전략적 제휴
제품 포트폴리오의 확대, 새로운 지역으로의 진출, 기술적 보완관계를 통한 시너지 창출, 비용구조 개선 및 연구개발 생산성 증대 등을 이유로 전략적 제휴 (인수·합병, 라이센싱)가 매우 활발 합니다.
이러한 전략적 제휴는 특히 개발비용은 증가하지만, 자체신약 개발 성공은 감소하는 경향으로 인하여 더 활성화 되고 있습니다.
특히, 빅파마가 진출하지 않은 첨단제제 영역에서는 기술개발에 성공한 벤처기업이 신흥강자로 나타날 수 있고 기존의 제약기업이 분약 확대를 위한 수단으로써 기술벤처를 인수·합병 혹은 관련 기술을 라이센싱하는 등 전략적 제휴를 활발히 진행하고 있습니다.
4) 엄격한 규제 적용
글로벌신약산업은 엄격한 규제가 적용됩니다.
① 신약허가
제약 산업은 인간 생명과 보건에 관련된 제품을 생산하는 국민의 건강과 직결된 산업으로서 다른 산업과 달리 국가에서 제품의 개발, 임상시험, 인허가 및 제조, 유통, 판매 등 전 과정을 매우 엄격히 규제하고 있습니다.
② 지적재산권 보호
신약은 다른 제품에 비해 개발비용이 막대하게 소요되는 반면 복제는 상대적으로 쉽기 때문에 특허에 의한 보호가 매우 중요합니다. 특허가 가장 중요한 경쟁요소로서 대부분의 국가들은 특허 기간을 최대한 보호하기 위한 다양한 전략 및 정책을 도입하고 있습니다.
제약사들도 상품화 이후 특허 보호기간을 늘리기 위한 전략으로 특허 출원을 늦추거나, 공정 특허, 제법 특허 등을 통해 유사제품 출시를 방지하는 방법 등을 활용하고 있습니다.
(3) 시장현황 및 전망
2019년 세계 의약품 시장은 1조 1,703억 달러 규모로, 2015년에 마이너스 성장(-3.3%)를 기록한 이후 차츰 회복세를 보이며 최근 5년간(2015~2019년) 연평균 2.3%씩 성장하였습니다.
 |
|
세계 의약품 시장 규모 |
국내 제약산업 시장규모(생산-수출+수입)는 24조 3,100억 원으로 2018년(23조 1,175억 원)에 비해 5.2% 증가하였으며 2015~19년 동안 연평균 6.0% 성장하며 시장규모가 확대되고 있습니다.
2019년 지역별 의약품 시장 규모는 북미지역의 시장규모가 3,920억 달러로 전체 시장의 33.5%를 차지하며 여전히 부동의 1위를 기록하고 있으며, 그 뒤로 아시아/퍼시픽 3,488억 달러(29.8%), 유럽 3,448억 달러(29.5%), 라틴아메리카 467억 달러(4.0%) 등 순으로 비중이 높았습니다.
유럽은 지난해 대비 0.2% 성장으로 세계시장에서 차지하는 비중이 점차 축소되는 양상을 보이고 있으며, 아시아/퍼시픽은 지난해 대비 2.5% 성장을 하며 2번째 높은 비중을 보이며 매년 점유율이 확대되고 있습니다.
 |
|
지역별 의약품 시장 규모 |
향후 세계 의약품 시장은 매년 5.3% 성장하여 2024년에 1조 4,822억 달러가 될 것으로 추정되고, 북미 지역이 2024년 4,752억 달러로 가장 큰 시장을 유지할 것으로 보이며, 다음으로 아시아/퍼시픽 4,568억 달러, 유럽 4,525억 달러 순으로 전망됩니다.
(가) 원료의약품 부문
원료의약품산업은 완제의약품산업이 성장함에 따라 동반 성장해 오고 있습니다.
2019년 의약품 생산액은 22조 3,132억 원을 기록해 전년(21조 1,054억 원) 대비 5.7%증가했습니다. 완제의약품은 19조 8,425억 원을 생산하여 '18년(18조 5.438억원)에 비해 약 7.0% 증가하였으며 최근 5년간(2015년~2019년) 연평균 약 7.5% 성장하였습니다. 원료의약품은 2조 4,706억원으로 '18년(2조 5,616억 원) 대비 3.6% 감소하였으며 최근 5년간(2015~2019년) 연평균 4.0% 증가하였습니다. 2015년 이후
2017년까지 증가세를 유지하다 2018년 이후 감소세를 보이고 있으며, 총 생산실적 중 원료의약품의 비중이 11.1%로 나타났습니다.
원료의약품 시장의 지속적인 성장이 기대되는 이유는 아래 표에서 보는 바와 같이 매년 완제의약품 시장이 성장을 지속하고 있기 때문입니다.
 |
|
의약품 분류별 생산 현황 |
1) 다수의 블록버스터 신약들의 특허 만료에 따른 Generic 의약품의 활성화
Generic 의약품 (Generic drug)은 특허가 만료된 오리지널 의약품의 복제약 (copy)을 지칭합니다.
Generic 의약품은 초기의 낮은 연구개발비용과 대량생산을 통한 단위당 생산원가를 낮출 수 있기 때문에 오리지널 의약품 대비 가격이 낮아 각국의 정부에서는 약가 인하 유도와 건강보험재정의 건전성을 확보하기 위해 Generic 의약품의 사용을 장려하고 있습니다.
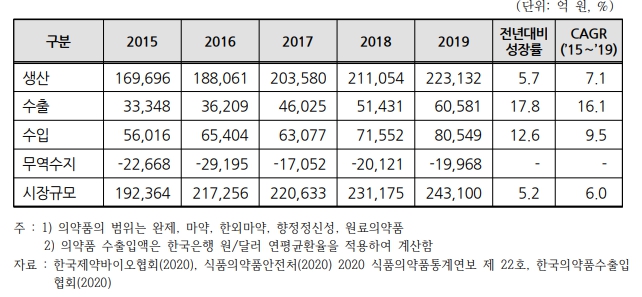 |
|
의약품 수출입액 |
2) 전방산업인 제약산업의 지속적인 성장
4차 산업혁명 시대가 도래하면서, 제약산업은 인구 고령화, 바이오기술의 발전 등으로 세계가 주목하는 신산업 분야로 각광받고 있습니다. 제약산업은 인간의 생명과 보건에 관련된 제품을 생산하는 국민의 건강과 직결된 산업으로 타 업종에 비해 기술 집약도가 높고 고도의 전문성과 지속적인 연구개발 및 투자가 필요하며, 사업의 성공시 막대한 고부가가치 창출이 가능하여 미래의 먹거리 산업으로 분류됩니다.
2019년 제약산업의 총 생산액은 약 22 조 원으로 전년에 비해 5.7% 증가했으며, 최근 5년간 연평균 7.1% 증가하며 성장세를 이어가고 있습니다. 유럽 및 아시아 시장은 정부의 의료비 절감 정책에도 불구하고 시장규모는 계속 증가할 것으로 예상됩니다. 혁신적인 치료법의 도입과 함께 고령화 인구의 높은 의료 수요가 성장의 주요 동력으로 작용할 것으로 보입니다
 |
|
세계 의약품 시장규모 전망(2015~2024) |
또한 진단 시장의 핵심 진단 시약인 MRI와 CT 조영제를 포함한 전 세계 조양제 시장규모는 약 82억 달러이며, 시장은 지속적으로 성장을 거듭하고 있습니다. 특히, 중국, 인도 등 원료시장의 선진화로 평균 10~15% 이상의 성장을 하고 있습니다.
|
(나) 글로벌 신약개발 부문
1) 호중구감소증 치료제
2020년 5월에 보고된 Allied Market Research 자료에 따르면, 화학요법에 따른 호중구감소증 치료제 시장 규모는 2019년 전체 12.6억 달러에 이르고 있으며, 2010년부터 2027년까지 약 5.4%의 연간시장성장률 (CAGR)을 보여 2027년에는 약 186억원 달러 규모로 성장할 것으로 예측하고 있습니다. (근거:https://www.alliedmarketresearch.com/request-sample/6663)
현재의 호중구감소증 치료제 시장은 G-CSF(granulocyte-colony stimulating factor), GM-CSF(granulocyte macrophage-colonystimulating factor) 그리고 CDK4/6 저해제 제품으로 형성되어 있지만, 발암성의 증가와 같은 치명적인 부작용, 환자의 50%에게만 효능을 나타내는 제한된 약효, 높은 약가로 인한 비열성 호중구감소증 환자에게의 사용 제한 등으로 인해 새로운 치료제의 도입이 매우 시급한 상황입니다. 그래서 미국 FDA에서도 EC-18과 같은 차별화된 신규 기전의 치료제에 대해서 혁신신약 지정 (Breakthrough Therapy Designation)을 적극적으로 검토하고 있습니다.
이에 당사가 개발한 EC-18은 항암효능을 가지고 있고, 부작용은 없으며, 방사선 요법 등 환자 사용에 제한이 없고, 비열성 호중구 감소증 환자들에게도 적극적으로 사용할 수 있는 새로운 기전의 치료제로 개발되어 유방암환자를 대상으로 진행된 임상 2상 Part1을 성공적으로 종료하였고, 후속 Part2 임상을 승인 받은 상태이며, 이들 결과를 토대로 호중구감소증 치료제 시장에서 새로운 Game changer가 될 것입니다.
2) 구강점막염 치료제
2020년 12월 MarketWatch 분석에 의하면 전 세계 구강점막염 시장규모는 2020년 15억 달러 (1.7조원)에서 2026년 내 CAGR 4.0%로 18억 달러 (2조원)에 이를 것으로 예상됩니다. (근거: https://www.marketwatch.com/press-release/oral-mucositis-market-2020-top-countries-data-market-size-with-global-demand-analysis-and-business-opportunities-outlook-2026-2020-12-04) 항암화학-방사선요법으로 치료 받은 암환자의 약 40%가 구강점막염에 걸리며, 두경부암 환자의 경우 약 90%까지 상승하게 됩니다.
구강점막염 치료제로는 2020년 미국FDA의 승인을 득한 Palifermin이 유일한 의약품으로서 자가 조혈모세포 이식 골독성 요법을 받는 악성 혈액암 환자에 국한하여 심각한 구강 점막염 발생과 지속 기간을 감소시킬 수 있고 WHO 기준 3급 점막염을 일으킬 것으로 예측되는 환자들의 예방 치료법에 대한 보조적인 치료제로만 쓰이고 있습니다. 개발중인 주요 후보물질에는 임상 3상 시험이 진행중인 Galera Therapeutics사의 GC4419[오전1] (21년10월 종료 예정)과 21년3월 임상 3상 시험이 완료된 Soligenix사의 SGX942가 있습니다. 하지만, 기대를 모았던 SGX942의 topline 결과가 좋지 않아 효과적인 치료제 개발이 시급하게 요구되고 있는 상황입니다. 따라서, 구강점막염 치료제는 항암방사선 치료가 필수적인 두경부암을 포함, 다양한 고형암 환자를 대상으로 개발해야 하는 적응증으로 새로운 시장 창출과 함께 급속한 성장이 이루어 질 것입니다.
3) 급성방사선증후군 치료제
2021년 1월 Pharmiweb.com의 연구조사 자료에 따르면 전세계 방사선 독성 치료 시장은 2029년 예상 기간까지 미화 55억 달러의 가치를 넘어 설 것으로 보고되었습니다. 암 질환 사례에 사용되는 항암방사선치료와 급성방사선증후군을 포함한 방사선 독성 사례가 증가하고 있습니다. 이에 따라 급성방사선증후군 치료제 개발은 시장 성장성에 핵심이 될 것으로 예상됩니다. 아울러 미국 정부는 대량살상무기 대응 차원 및 기존 희귀 의약품 규정에 따라 효과적인 치료제 개발을 적극 장려하고 있습니다.
(근거: https://www.pharmiweb.com/press-release/2021-01-05/radiation-toxicity-treatment-market-witnesses-downturn-during-covid-19-outbreak-as-healthcare-resou)
급성방사선증후군(Acute Radiation Syndrome, ARS)은 핵공격 또는 핵발전소 붕괴 등 치사량의 방사선 노출에 의하여 발생하여 골수질환(호중구감소증, 혈소판감소증), 점막염질환, 심혈관계질환, 신경계질환 감염에 의한 폐렴 및 패혈증 등이 복합적으로 환자의 생명을 위협하는 치명적인 질환입니다. 이와 같이 증상 및 증후에 따라 조혈계(H-ARS), 위장관계(GI-ARS), 심혈관계(CV-ARS), 중추신경계(CNS-ARS)증후군과 같이 4가지로 나누어집니다.
현재 한정적으로 급성방사선증후군의 조혈증후군(H-ARS) 관련하여 FDA 승인된 치료제로는 홍중구감소증 치료제인 뉴포젠/뉴라스타(승인년도 : 2015년 ; G-CSF 일종), 류카인 (2018년 ; 백혈구 성장인자)과 엔플레이트(2021년 ; TPO 유사체 일종인 유전자 재조합 단백질)가 약물 재창출된 경우가 있습니다.
위와 같이 승인된 약물의 투여방식은 주사제로서 경구투여가 가능한 EC-18은 환자의 선호도가 높을 것입니다. 또한, 호중구감소증, 점막염, 패혈증 및 폐렴에 복합적으로 효력이 있는 EC-18은 급성방사선증후군 시장진입에 매우 유리할 것으로 전망됩니다.
4) 비알콜성지방간염 치료제
2020년 4월 iHealthcareAnalyst, INC의 비알콜성지방간염(NASH) 치료제 글로벌 시장 동향 보고서에 따르면 2027년에 200억 달러에 이를 것이며, 최대 34.1%의 연간 성장률(CAGR)이 예상됩니다 . (근거: https://www.ihealthcareanalyst.com/global-nonalcoholic-steatohepatitis-treatment-market/)
급격하게 발병률이 증가하고 있는 비알콜성지방간질환 (Nonalcoholic fatty liver disease, NAFLD)은 비만, 제 2형 당뇨병, 고혈압 등을 동반한 대사증후군과 밀접한 연관성을 보이나 명확한 병리 기전이 규명되지 않았고, 현재 승인된 치료제가 부재한 상황입니다. 대부분은 무증상이기에 장기간에 걸쳐 양성질환의 경과를 나타내며 간암으로 진행될 수 있어 적절한 치료제가 필요한 상황입니다.
![이미지: [비알콜성지방간염(NSAH)의 발병 및 악화 과정]](nash.jpg) |
|
[비알콜성지방간염(NSAH)의 발병 및 악화 과정] |
* 2013년 헬스조선 뉴스: http://m.health.chosun.com/svc/news_view.html?contid=2013101502168
비알콜성지방간질환(NAFLD)을 앓고 있는 대부분의 환자 중 10~20%가 NSAH로 고통받고 있습니다. 전 세계적으로 14억 6천만 명의 성인들이 과체중 및 비만인 것으로추정되는데, 미국인의 약 600만 명이 비알콜성지방간염 발병이 진행되었으며, 이 중 약 60만 명에서 비알콜성지방간염 질환으로 인하여 간경화증으로 악화되는 심각한 상태가 초래됩니다.
비알콜성지방간질환의 원인으로는 인슐린 저항성과 과도한 염증반응이 있는데, 과도한 염증반응을 조절하는 면역조절제 작용기전을 가진 EC-18은 효과적인 NASH 치료제로서 주목 받고 있으며, 현재 진행중인 동물 모델 비임상시험이 완료된 후 임상 2상 시험을 계획할 예정입니다.
5) 면역항암제 병용 치료제
기존 항암제들이 암세포와 함께 정상 세포도 공격하는 기전과는 달리 면역관문억제제는 몸 속의 면역세포가 암세포만을 선택적으로 공격하도록 유도함으로써 부작용은 적고 항암 효과는 우수하면서 지속적입니다. 따라서, 임상 현장에서는 흑색종을 비롯한 주요 암종에서 1차 치료는 물론 2차 이후 치료법으로 사용되고 있고 수많은 임상시험들이 진행중입니다. EvaluatePharma 2020년 보고에 의하면, 면역관문억제제의 시장 규모는 해마다 꾸준히 증가, 2018년부터 연평균 성장률이 19%에 달해 2024년이면 약 480억 달러 규모에 이를 전망입니다.
![이미지: [면역항암제 주요 지역별 시장 규모, 2016-2026 (www.polarismarketresearch.com)]](ici.jpg) |
|
[면역항암제 주요 지역별 시장 규모, 2016-2026 (www.polarismarketresearch.com)] |
면역관문억제제 단독 치료 요법 시 50%를 넘는 반응률이 나오기도 하지만, 암종에 따라 50~95% 내외의 암환자들은 치료에 반응을 보이지 않는다는 단점이 있어 향상된 효능을 보일 수 있는 병용 요법 개발이 절실합니다. 이러한 임상적 요구에 따라, 면역관문억제제와 함께 항암화학 요법 방사선 치료, 또는 기존 면역관문억제제와의 병용 요법에 대한 임상시험이 활발히 진행되고 있습니다. 2020년 미국 암 연구원 (cancer research institute, CRI)의 보고에 따르면, 단일 요법을 제외한 병용요법 임상시험 건수는 2,900건에 이릅니다. (근거: https://www.cancerresearch.org/scientists/immuno-oncology-landscape) 그 중 PD-1, PD-L1 타겟 면역관문억제제와 함께 선택되는 병용 치료요법으로는 다른 면역항암제와의 병용이 가장 많고 그 다음이 표적항암제와의 병용요법이 따르고 있습니다. 다양한 비임상 연구들을 통해 면역관문억제제의 낮은 반응률의 주요 원인은 암세포를 이루는 조직이 면역 관문 외에도 다양한 면역 회피 기전을 갖고 있기 때문이라는 것이 밝혀졌습니다. 이는 면역관문억제제가 막지 못하는 또 다른 면역 회피 기전을 통해 T세포의 활성이 억제되면, 암세포가 살아남을 수 있게 되는 것입니다. 최근 들어, 면역관문억제제 치료를 하고 난 뒤 획득된 면역관문억제제 치료를 하고 난 뒤 획득된 면역관문억제제 치료에 대한 저항을 야기시키는 면역억제성 종양 미세환경 (Tumor MicroEnvironmnent, TME)을 타겟하는 후보 물질과 면역관문억제제와의 병용 치료 가능성에 대한 임상연구가 활발하게 진행되고 있습니다. 특히, 면역억제제 메커니즘 중 세포외 아데노신 (extracellular adenosine, eADO)의 농도가 주요 요인으로 알려지면서 면역관문억재재와 eADO를 타겟한 면역 항암 치료법 개발이 최우선 과제로 부상하게 되었습니다.
당사는 비임상 연구를 통해 EC-18이 면역관문억제제의 항암 작용 기전을 증대시키는 것은 물론 암 생성 및 전이의 주요 인자인 종양미세환경을 조절함으로써 시너지 항암 효과를 보이는 것을 확인하였습니다.
6) 신종코로나바이러스 치료제
2020년 5월, MarketsandMarkets 분석에 따르면, 신종코로나바이러스 감염증 (COVID-19) 치료제 시장 크기는 -57.8%의 연간 시장 성장률 (CAGR)로 2020년 23억원 달러 (2.5조원)에서 2025년 14억달러 (1.5조원)에 도달할 것으로 예상됩니다. (근거 : https://www.marketsandmarkets.com/Market-Reports/covid-19-impact-on-vaccines-market-112248051) 세계보건기구 (WHO)RK 2020년 3월 COVID-19에 대해 세계적인 전염병 대유행인 '팬데믹(pandemic)'을 선언한 이후 비상사태에 대응하기 위한 치료제 개발 전략은 기존의 약물로 새로운 치료제를 개발하는 방식인 신약 재창출 (drug repositioning) 방법을 통해 안전하고 효과적인 COVID-19 치료제를 탐색하는 임상시험 연구와 더불어 새로운 치료제 연구가 활발히 진행되고 있습니다.
현재, 효과적인 치료제가 개발되지 않은 상태에서 Remdesivir, Baricitinib이 FDA에서 치료제로 허가된 유일한 약제들입니다. 하지만 Remdesivir는 SOLIDARITY 임상시험 결과에 따르면, 사망률 및 치료 기간 단축 등 주요한 임상 결과를 개선하지 못했다고 밝혔습니다. 혈장치료는 현재도 치료제로 임상시험이 진행되고 있습니다. 이러한 상황에서 FDA의 긴급 사용 승인을 획득한 항체 치료제로 리제네론의 REGN-COV2와 일라이릴리의 Bamlanivimab이 있습니다. REGN-COV2는 위약보다 49% 정도 환자의 병원 방문율을 단축했고, 안정성 결과는 위약과 유사하였으나, Bamlanivimab은 부작용 문제로 중단된 바 있어 후속 연구 결과에 따라 승인이 취소될 가능성도 남아 있습니다. 국내외 주요 임상시험 현황은 아래 표와 같습니다.
![이미지: [국내 주요 임상시험 현황]](%EA%B5%AD%EB%82%B4%20%EC%A3%BC%EC%9A%94%20%EC%9E%84%EC%83%81%EC%8B%9C%ED%97%98%20%ED%98%84%ED%99%A9.jpg) |
|
[국내 주요 임상시험 현황] |
![이미지: [국외 주요 임상시험 현황 (https://www.uspharmacist.com, 21년 02월 기준]_1](%EA%B5%AD%EC%99%B8%20%EC%A3%BC%EC%9A%94%20%EC%9E%84%EC%83%81%EC%8B%9C%ED%97%98%20%ED%98%84%ED%99%A9_1.jpg) |
|
[국외 주요 임상시험 현황 (https://www.uspharmacist.com, 21년 02월 기준]_1 |
![이미지: [국외 주요 임상시험 현황 (https://www.uspharmacist.com, 21년 02월 기준]_2](%EA%B5%AD%EC%99%B8%20%EC%A3%BC%EC%9A%94%20%EC%9E%84%EC%83%81%EC%8B%9C%ED%97%98%20%ED%98%84%ED%99%A9_2.jpg) |
|
[국외 주요 임상시험 현황 (https://www.uspharmacist.com, 21년 02월 기준]_2 |
![이미지: [국외 주요 임상시험 현황 (https://www.uspharmacist.com, 21년 02월 기준]_3](%EA%B5%AD%EC%99%B8%20%EC%A3%BC%EC%9A%94%20%EC%9E%84%EC%83%81%EC%8B%9C%ED%97%98%20%ED%98%84%ED%99%A9_3.jpg) |
|
[국외 주요 임상시험 현황 (https://www.uspharmacist.com, 21년 02월 기준]_3 |
7) 류마티스관절염 치료제
2017년 2월 보고한 GlobalData 보고서에 따르면, 주요 8개국 (미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본, 호주)의 류마티스관절염 치료제 시장은 2015년 195억달러의 규모에서, 2025년에는 약 3.9%의 연간시장성장률을 보이며 약 285억달러 규모로 성장할 것으로 예상하고 있습니다. (근거 : https://www.globaldata.com/rheumatoid-arthritis-market-will-hit-28-5-billion-2025-says-globaldata/)
현재 류마티스관절염 시장을 장악하고 있는 Enbrel® 및 Humira®등 모든 first-line바이오제품의 바이오시밀러가 2025년까지 주요 8개국에 출시되어 23%정도 점유 할 것으로 예상됩니다.
지금까지의 치료제 시장은 항체중심 주사제로 형성되어 있으나, 고가의 약가와 투약의 불편함 때문에 경구용 치료제 개발에 빅파마의 관심이 집중되고 있습니다. Pfizer에서는 경구용 Janus Kinase (JAK) 표적저해제인 젤잔스 (Xeljanz®)를 2016년부터 출시하고 있으며, Eli Lilly에서는 JAK 표적저해제 바리시티닙 (barictinib)을 개발하고 있지만, JAK1, JAK3를 타겟으로 하는 화합물이기에 감염위험이 높아 안정성이 이슈가 되고 있습니다.
따라서, EC-18과 같은 복용편이성이 높으며, 젤잔스의 효능 또는 안전성 면에서 우월한 경구용 치료제가 개발된다면, 메년 성장하는 류마티스관절염 치료제 시장 진입에 매우 유리할 것 입니다.
8) 건선치료제
미국 캘리포니아州 센프란시스코에 소재한 시장조사·컨설팅기관 그랜드 뷰 리서치社는 2017년 10월 공개한 '2016~2022년 약물계열별, 치료제 유형별 건선 치료제 시장 규모, 전망 및 트렌드 분석' 보고서에서, 건선 치료제 시장 규모는 2016년 전체
114억 9,200만 달러에 이르고 있으며, 연평균 9.3%에 달하는 괄목할만한 성장세를 이어가 2022년에는 약 214억 3,600만 달러 규모로 지금보다 2배 가까이 성장할 것으로 예측하고 있습니다. (근거 : http://www.yakup.com/news/index.html?mode=view&cat=16&nid=211591)
보고서에서는 건선 치료에 대한 급여적용의 확대와 진단기구의 향상, 건서에 대한 인식도의 개선 등에 힘입어 건선 치료제를 사용하는 환자 수가 늘어날 것으로 예상하고 있으며, 건선 유병률의 증가 또한 시장의 몸집을 키우는데 힘을 보탤 것으로 추정 하고 있습니다.
기존 치료제들이 장기간 사용 시 나타나는 부작용으로 인해 만성질환인 건선에 대해 사용이 어려워 표적저해제가 점진적으로 시장을 대체할 것으로 판단됩니다.
TNF 저해제들이 건선치료제로 사용되고 있었으나, 최근 건선에 보다 직접적인 염증 유발 사이토카인인 IL-17, IL-23을 표적으로 하는 단클론 항체 Taltz® (Eli Lilly)가 시장 선두품목으로 진입할 것으로 예상됩니다.
이외에 2017년도에 승인을 받은 IL-4 수용체에 작용하여 IL-23 신호기전을 저해하는 Dupixent® 역시 치료제 시장에 성공적으로 안착할 것으로 전망되고 있습니다.
따라서, 지금까지의 치료제 시장은 항체중심 주사제로 형성되어 있으나, EC-18과 같은 경구용 치료제가 개발될 경우 매년 성장하는 건선 치료제 시장 진입에 매우 유리할 것 입니다.
9) 패혈증 치료제
2017년 보고한 Global Data 보고서에 따르면, 주요 7개국 (미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본)의 패혈증 및 패혈증 쇼크에 대한 시장은 2016년 기준 28억달러 규모에서, 2026년에는 약 7.9%의 연간시장 성장률을 보이며 약 59억달러 규모로 확대될 것으로 예측하고 있습니다. (근거 : http://www.newsmp.com/news/articleView.html?idxno=174510)
아직까지 주요 7개 국가에서 패혈증에 직접 승인된 제품이 없어, 패혈증의 원인인 사이토카인 폭풍을 조절하는 기전을 가진 치료제의 개발이 가장 큰 미충족 수요로 남아있습니다.
따라서, 사이토카인 폭풍을 조절하는 기전을 가진 EC-18과 같은 경구용 약물이 개발된다면 독점적 시장 우위를 점유할 것 입니다.
10) 천식 치료제
2017년 11월에 발표된 Acute Market Reports 자료에 의하면 천식 및 만성 폐쇄성 폐질환의 치료제 시장 규모는 2016년 390억달러에 이르고 있으며, 약 4.2%의 연간시장성장률 (CAGR)로 성장하여 2025년에는 약 565억달러 규모에 이를 것으로 예측하고 있습니다. (근거 : http://www.acutemarketreports.com/report/asthma-and-copd-drug-market-report)
비록 Generic 제품의 시장 진입으로 기존 오리지널 제품의 매출에 영향을 미치겠지만 높은 개발비로 인한 높은 약가 및 천식치료제의 새로운 흡입 devices에 대한 환자의 저항감으로 인해 그 효과는 크지 않으며, 향후 2015년~2024년 사이에 새로운 바이오제품 (Cinquil®;Teva, Nucala®;GSK, benalizumab; AstraZeneca)들이 시장 진입이 예상되고 있어 부작용이 상대적으로 적은 항체 치료제 중심의 주사제 품목의 증가가 예상됩니다.
지금까지의 치료제 시장은 항체중심 주사제로 형성되어 있으나, EC-18과 같은 경구용 치료제가 개발될 경우 매년 성장하는 천식 치료제 시장 진입에 매우 유리할 것입니다.
11) 아토피피부염 치료제
2017년 6월 발간된 Future Market Insights의 마켓 리서치 리포트에 따르면, 아토피피부염 치료제 시장 규모는 2017년에 약 72억달러 규모이며, 연평균 12.8%에 달하는 괄목할만한 성장세를 이어가 2027년에는 약 240억 달러로 성장할 것을 예측하고 있습니다. (근거 : https://www.futuremarketinsights.com/reports/atopic-dermatitis-treatment-market)
아토피피부염 치료제로 승인된 first 바이오 제품인 Dupixent® (duplinumab, Regeneron/Sanofi)은 단일제품으로 30억 달러 이상의 매출을 예상하고 있으며, 지속적인 매출증가가 기대되고 있습니다.
따라서, Dupixent®와 다른 EC-18과 같은 경구용 치료제가 개발될 경우, 매년 성장하는 아토피피부염 치료제 시장 진입에 매우 유리할 것입니다.
(4) 경기변동과의 관계
의약품은 인간의 생명 및 건강과 직접 관련이 있기 때문에 일반적으로 제품의 가격이높더라도 비용을 지불하고 구매하려는 속성으로 인해 가격 비 탄력적 특성을 가지며 경기변동이나 계절적 요인에 의한 경기 민감도가 낮은 산업입니다. 또한 의약품에 대한 정보의 불균형으로 최종 소비자인 환자의 선택의 폭이 좁고 의사 및 약사의 선택에 따르는 경향이 강하여 경기변동에 의한 영향이나 민감도가 낮으며, 그에 따라 안정적인 성장을 하고 있습니다.
(5) 제품의 라이프사이클
인간의 생명 및 건강과 직결된 사업인 만큼 개발에서 판매에 이르기까지는 많은 자본과 시간이 투자되며, 약효와 안정성이 확인된 의약품의 라이프 사이클은 장기적으로 유지됩니다.
국내외적으로 제약, 생물공학, 유전공학, 건강 서비스 등 의료관련 산업은 앞으로 중요한 위치를 차지하는 고부가가치 산업으로 부상할 것입니다.
다. 조직도
 |
|
엔지켐생명과학_전체 조직도 |
III. 재무에 관한 사항
1. 요약재무정보
가. 요약연결재무정보
| (단위 : 원) |
| 구 분 | 제 23 기 | 제 22 기 | 제 21 기 |
|---|---|---|---|
| 2021년 9월말 | 2020년 12월말 | 2019년 12월말 | |
| Ⅰ. 유동자산 | 120,451,354,061 |
104,998,820,775 |
63,236,294,574 |
| 1. 현금및현금성자산 | 8,426,281,393 |
1,857,599,584 |
2,287,757,126 |
| 2. 매출채권및기타채권 | 5,209,856,688 |
4,567,074,209 |
9,253,975,655 |
| 3. 재고자산 | 7,572,488,578 |
9,177,837,067 |
7,846,630,339 |
| 4. 기타유동금융자산 | 98,921,090,000 |
88,754,752,579 |
43,337,181,587 |
| 5. 기타유동자산 | 252,017,512 |
531,676,636 |
442,000,127 |
| 6. 당기법인세자산 | 69,619,890 |
109,880,700 |
68,749,740 |
| Ⅱ. 비유동자산 | 19,582,881,608 | 18,803,385,023 | 21,754,871,898 |
| 1. 유형자산 | 15,827,605,825 |
15,669,213,471 |
14,812,659,246 |
| 2. 무형자산 | 2,292,766,325 |
1,969,506,063 |
1,571,044,930 |
|
3. 비유동 당기손익- |
144,349,685 | 111,909,475 | 36,750,771 |
|
4. 관계기업에 대한 |
- | - | 3,704,699,759 |
|
5. 비유동 기타포괄손익- |
462,568,000 |
344,124,000 |
516,150,000 |
|
6. 기타비유동금융자산 |
855,591,773 |
708,632,014 |
1,113,567,192 |
| 자 산 총 계 | 140,034,235,669 | 123,802,205,798 | 84,991,166,472 |
| Ⅰ. 유동부채 | 13,117,091,414 | 9,783,831,404 | 7,498,916,998 |
| Ⅱ. 비유동부채 | 44,562,370,693 | 41,535,834,493 | 3,451,708,231 |
| 부 채 총 계 | 57,679,462,107 | 51,319,665,897 | 10,950,625,229 |
| Ⅰ. 지배기업의 소유지분 | 82,354,773,562 |
72,482,539,901 |
74,040,541,243 |
| 1. 자본금 | 4,355,241,000 |
4,147,656,500 |
4,096,918,500 |
| 2. 자본잉여금 | 178,449,390,028 |
148,519,602,917 |
148,367,826,818 |
| 3. 기타자본 | 16,347,501,339 | 15,800,031,401 | 27,931,412 |
| 4. 결손금 | (116,403,445,498) | (95,176,353,400) | (77,789,573,491) |
| 5. 기타포괄손익누계액 | (393,913,307) | (808,397,517) | (662,561,996) |
| Ⅱ. 비지배지분 | - | - | - |
| 자 본 총 계 | 82,354,773,562 | 72,482,539,901 | 74,040,541,243 |
| 구 분 | (2021.01.01~ 2021.09.30) |
(2020.01.01~ 2020.12.31) |
(2019.01.01~ 2019.12.31) |
| Ⅰ. 매출액 | 16,484,929,526 | 25,818,432,585 | 31,468,723,444 |
| Ⅱ. 영업이익(손실) | (15,545,138,243) | (19,107,442,964) | (16,402,180,757) |
| Ⅲ. 당기순이익(손실) | (20,549,862,904) | (17,506,927,997) | (16,879,076,540) |
| 1. 지배기업의 소유주지분 | (20,549,862,904) |
(17,506,927,997) |
(16,879,076,540) |
| 2. 비지배지분 | - |
- |
- |
| Ⅳ. 기타포괄손익 | (262,744,984) | (25,687,433) | (704,621,740) |
| Ⅴ. 총포괄이익(손실) | (20,812,607,888) | (17,532,615,430) | (17,583,698,280) |
| 기본주당이익(손실) | (2,400) |
(2,154) |
(2,102) |
| 희석주당이익(손실) | (2,400) |
(2,154) |
(2,102) |
| 연결에 포함된 회사수 | 2 | 1 | 1 |
* 한국채택국제회계기준(K-IFRS)에 따라 작성되었습니다.
나. 요약별도재무정보
| (단위 : 원) |
| 과 목 | 제 23 기 | 제 22 기 | 제 21 기 |
|---|---|---|---|
| 2021년 9월말 | 2020년 12월말 | 2019년 12월말 | |
| Ⅰ. 유동자산 | 118,941,591,333 |
104,687,888,207 |
62,959,714,991 |
| 1. 현금및현금성자산 | 7,046,409,781 |
1,728,376,758 |
2,148,228,344 |
| 2. 매출채권및기타채권 | 5,215,476,688 |
4,564,753,679 |
9,253,975,655 |
| 3. 재고자산 | 7,572,488,578 |
9,177,837,067 |
7,846,630,339 |
| 4. 기타유동금융자산 | 98,802,600,000 |
88,645,952,579 |
43,221,401,587 |
| 5. 기타유동자산 | 235,056,326 |
461,087,424 |
420,729,326 |
| 6. 당기법인세자산 | 69,559,960 |
109,880,700 |
68,749,740 |
| Ⅱ. 비유동자산 | 20,590,322,845 |
18,794,474,763 |
20,925,418,573 |
| 1. 유형자산 | 15,688,127,655 |
15,504,391,786 |
14,582,471,343 |
| 2. 무형자산 | 2,292,766,325 |
1,969,506,063 |
1,571,044,930 |
| 3. 비유동 당기손익- 공정가치 측정 금융자산 |
144,349,685 | 111,909,475 | 36,750,771 |
|
4. 종속기업 및 관계기업에 대한 투자자산 |
1,180,153,565 | 185,119,950 | 3,134,771,912 |
|
5. 비유동 기타포괄손익- 공정가치 측정 지분상품 |
462,568,000 | 344,124,000 | 516,150,000 |
| 6. 기타비유동금융자산 | 822,357,615 | 679,423,489 | 1,084,229,617 |
| 자 산 총 계 | 139,531,914,178 | 123,482,362,970 | 83,885,133,564 |
| Ⅰ. 유동부채 | 12,661,725,351 | 9,580,964,099 | 7,411,088,756 |
| Ⅱ. 비유동부채 | 44,500,830,992 | 41,436,766,305 | 3,290,758,378 |
| 부 채 총 계 | 57,162,556,343 | 51,017,730,404 | 10,701,847,134 |
| 1. 자본금 | 4,355,241,000 |
4,147,656,500 |
4,096,918,500 |
| 2. 자본잉여금 | 178,449,390,028 |
148,519,602,917 |
148,367,826,818 |
| 3. 기타자본 | 16,347,501,339 |
15,800,031,401 |
27,931,412 |
| 4. 결손금 | (116,359,677,572) | (95,184,940,572) | (78,625,852,900) |
| 5. 기타포괄손익누계액 | (423,096,960) | (817,717,680) | (683,537,400) |
| 자 본 총 계 | 82,369,357,835 | 72,464,632,566 | 73,183,286,430 |
| 종속,관계,공동기업 투자주식의 평가방법 | 원가법 | 원가법 | 원가법 |
| 구 분 | (2021.01.01~ 2021.09.30) |
(2020.01.01~ 2020.12.31) |
(2019.01.01~ 2019.12.31) |
| Ⅰ. 매출액 | 16,484,929,526 | 25,818,432,585 | 31,468,723,444 |
| Ⅱ. 영업이익(손실) | (15,558,914,313) | (19,000,494,086) | (16,301,097,386) |
| Ⅲ. 당기순이익(손실) | (20,497,507,806) | (16,679,235,760) | (17,467,415,858) |
| Ⅳ. 기타포괄손익 | (282,608,474) | (14,032,192) | (721,662,915) |
| Ⅴ. 총포괄이익(손실) | (20,780,116,280) | (16,693,267,952) | (18,189,078,773) |
| 기본주당이익(손실) | (2,394) | (2,053) | (2,175) |
| 희석주당이익(손실) | (2,394) | (2,053) | (2,175) |
* 한국채택국제회계기준(K-IFRS)에 따라 작성되었습니다.
2. 연결재무제표
|
연결 재무상태표 |
|
제 23 기 3분기말 2021.09.30 현재 |
|
제 22 기말 2020.12.31 현재 |
|
(단위 : 원) |
|
제 23 기 3분기말 |
제 22 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
120,451,354,061 |
104,998,820,775 |
|
현금및현금성자산 |
8,426,281,393 |
1,857,599,584 |
|
매출채권 및 기타채권 |
5,209,856,688 |
4,567,074,209 |
|
재고자산 |
7,572,488,578 |
9,177,837,067 |
|
기타유동금융자산 |
98,921,090,000 |
88,754,752,579 |
|
기타유동자산 |
252,017,512 |
531,676,636 |
|
당기법인세자산 |
69,619,890 |
109,880,700 |
|
비유동자산 |
19,582,881,608 |
18,803,385,023 |
|
유형자산 |
15,827,605,825 |
15,669,213,471 |
|
무형자산 |
2,292,766,325 |
1,969,506,063 |
|
비유동 당기손익-공정가치 측정 금융자산 |
144,349,685 |
111,909,475 |
|
비유동 기타포괄손익-공정가치 측정 지분상품 |
462,568,000 |
344,124,000 |
|
기타비유동금융자산 |
855,591,773 |
708,632,014 |
|
자산총계 |
140,034,235,669 |
123,802,205,798 |
|
부채 |
||
|
유동부채 |
13,117,091,414 |
9,783,831,404 |
|
단기차입금 |
5,100,000,000 |
4,380,000,000 |
|
유동성장기부채 |
2,866,640,000 |
1,058,400,000 |
|
매입채무 및 기타채무 |
3,970,127,176 |
3,698,722,003 |
|
유동성충당부채 |
281,608,621 |
167,384,219 |
|
유동리스부채 |
284,482,299 |
191,280,600 |
|
기타유동부채 |
614,233,318 |
288,044,582 |
|
비유동부채 |
44,562,370,693 |
41,535,834,493 |
|
장기차입금 |
3,891,620,000 |
6,041,600,000 |
|
전환사채 |
37,701,161,313 |
31,078,120,985 |
|
비유동리스부채 |
193,106,374 |
317,114,915 |
|
이연법인세부채 |
1,227,466,808 |
2,694,856,217 |
|
순확정급여부채 |
1,549,016,198 |
1,404,142,376 |
|
부채총계 |
57,679,462,107 |
51,319,665,897 |
|
자본 |
||
|
지배기업의 소유주에게 귀속되는 자본 |
82,354,773,562 |
72,482,539,901 |
|
자본금 |
4,355,241,000 |
4,147,656,500 |
|
자본잉여금 |
178,449,390,028 |
148,519,602,917 |
|
기타자본 |
16,347,501,339 |
15,800,031,401 |
|
기타포괄손익누계액 |
(393,913,307) |
(808,397,517) |
|
이익잉여금(결손금) |
(116,403,445,498) |
(95,176,353,400) |
|
비지배지분 |
0 |
0 |
|
자본총계 |
82,354,773,562 |
72,482,539,901 |
|
자본과부채총계 |
140,034,235,669 |
123,802,205,798 |
|
연결 포괄손익계산서 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
제 22 기 3분기 2020.01.01 부터 2020.09.30 까지 |
|
(단위 : 원) |
|
제 23 기 3분기 |
제 22 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출액 |
5,552,904,272 |
16,484,929,526 |
4,408,461,877 |
21,866,357,829 |
|
매출원가 |
5,572,655,014 |
16,215,891,381 |
3,907,668,356 |
20,125,783,599 |
|
매출총이익 |
(19,750,742) |
269,038,145 |
500,793,521 |
1,740,574,230 |
|
판매비와관리비 |
5,166,629,966 |
15,814,176,388 |
5,813,323,907 |
14,195,773,974 |
|
영업이익(손실) |
(5,186,380,708) |
(15,545,138,243) |
(5,312,530,386) |
(12,455,199,744) |
|
기타수익 |
31,428 |
39,106,086 |
510,691,268 |
794,685,892 |
|
기타비용 |
71,234,628 |
146,771,125 |
991,201,198 |
1,740,829,839 |
|
지분법손실 |
0 |
0 |
(465,177,948) |
50,662,901 |
|
금융수익 |
197,067,803 |
684,236,784 |
173,093,099 |
471,583,891 |
|
금융원가 |
2,445,856,881 |
6,909,205,901 |
89,783,578 |
126,256,465 |
|
법인세비용차감전순이익(손실) |
(7,506,372,986) |
(21,877,772,399) |
(5,244,552,847) |
(13,106,679,166) |
|
법인세비용 |
(522,032,811) |
(1,327,909,495) |
6,992,884 |
6,569,366 |
|
당기순이익(손실) |
(6,984,340,175) |
(20,549,862,904) |
(5,251,545,731) |
(13,113,248,532) |
|
당기순이익(손실)의 귀속 |
||||
|
지배기업의 소유주지분 |
(6,984,340,175) |
(20,549,862,904) |
(5,251,545,731) |
(13,113,248,532) |
|
비지배지분 |
0 |
0 |
0 |
0 |
|
기타포괄손익 |
9,101,475 |
(262,744,984) |
(23,464,273) |
(13,850,236) |
|
당기손익으로 재분류되지 않는항목(세후기타포괄손익) |
0 |
(282,608,474) |
(15,331,680) |
(16,833,244) |
|
순확정급여부채의 재측정손익 |
0 |
0 |
0 |
(5,699,524) |
|
기타포괄손익-공정가치측정 지분상품평가손익 |
0 |
(282,608,474) |
(15,331,680) |
(11,133,720) |
|
당기손익으로 재분류될 수 있는 항목 |
9,101,475 |
19,863,490 |
(8,132,593) |
2,983,008 |
|
해외사업환산손익 |
9,101,475 |
19,863,490 |
(8,132,593) |
2,983,008 |
|
총포괄손익 |
(6,975,238,700) |
(20,812,607,888) |
(5,275,010,004) |
(13,127,098,768) |
|
총 포괄손익의 귀속 |
||||
|
지배기업의 소유주지분 |
(6,975,238,700) |
(20,812,607,888) |
(5,275,010,004) |
(13,127,098,768) |
|
비지배지분 |
0 |
0 |
0 |
0 |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(836) |
(2,400) |
(646) |
(1,623) |
|
희석주당이익(손실) (단위 : 원) |
(836) |
(2,400) |
(646) |
(1,623) |
|
연결 자본변동표 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
제 22 기 3분기 2020.01.01 부터 2020.09.30 까지 |
|
(단위 : 원) |
|
자본 |
||||||||
|---|---|---|---|---|---|---|---|---|
|
지배기업의 소유주에게 귀속되는 자본 |
비지배지분 |
자본 합계 |
||||||
|
자본금 |
자본잉여금 |
기타자본 |
기타포괄손익누계액 |
이익잉여금 |
지배기업의 소유주에게 귀속되는 자본 합계 |
|||
|
2020.01.01 (기초자본) |
4,096,918,500 |
148,367,826,818 |
27,931,412 |
(662,561,996) |
(77,789,573,491) |
74,040,541,243 |
0 |
74,040,541,243 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(13,113,248,532) |
(13,113,248,532) |
0 |
(13,113,248,532) |
|
확정급여의 재측정요소 |
0 |
0 |
0 |
0 |
(5,699,524) |
(5,699,524) |
0 |
(5,699,524) |
|
기타포괄손익-공정가치측정 지분상품 평가손익 |
0 |
0 |
0 |
(11,133,720) |
0 |
(11,133,720) |
0 |
(11,133,720) |
|
기타포괄손익-공정가치측정 지분상품 처분 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
기타포괄손익(해외사업환산손익) |
0 |
0 |
0 |
2,983,008 |
0 |
2,983,008 |
0 |
2,983,008 |
|
주식매수선택권 |
3,000,000 |
235,884,980 |
24,600,326 |
0 |
0 |
263,485,306 |
0 |
263,485,306 |
|
전환우선주의 발행 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
전환우선주의 보통주 전환 |
46,238,500 |
(46,862,450) |
0 |
0 |
0 |
(623,950) |
0 |
(623,950) |
|
2020.09.30 (기말자본) |
4,146,157,000 |
148,556,849,348 |
52,531,738 |
(670,712,708) |
(90,908,521,547) |
61,176,303,831 |
0 |
61,176,303,831 |
|
2021.01.01 (기초자본) |
4,147,656,500 |
148,519,602,917 |
15,800,031,401 |
(808,397,517) |
(95,176,353,400) |
72,482,539,901 |
0 |
72,482,539,901 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(20,549,862,904) |
(20,549,862,904) |
0 |
(20,549,862,904) |
|
확정급여의 재측정요소 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
기타포괄손익-공정가치측정 지분상품 평가손익 |
0 |
0 |
0 |
(282,608,474) |
0 |
(282,608,474) |
0 |
(282,608,474) |
|
기타포괄손익-공정가치측정 지분상품 처분 |
0 |
0 |
0 |
677,229,194 |
(677,229,194) |
0 |
0 |
0 |
|
기타포괄손익(해외사업환산손익) |
0 |
0 |
0 |
19,863,490 |
0 |
19,863,490 |
0 |
19,863,490 |
|
주식매수선택권 |
10,000,000 |
126,868,691 |
547,469,938 |
0 |
0 |
684,338,629 |
0 |
684,338,629 |
|
전환우선주의 발행 |
189,568,500 |
29,811,493,420 |
0 |
0 |
0 |
30,001,061,920 |
0 |
30,001,061,920 |
|
전환우선주의 보통주 전환 |
8,016,000 |
(8,575,000) |
0 |
0 |
0 |
(559,000) |
0 |
(559,000) |
|
2021.09.30 (기말자본) |
4,355,241,000 |
178,449,390,028 |
16,347,501,339 |
(393,913,307) |
(116,403,445,498) |
82,354,773,562 |
0 |
82,354,773,562 |
|
연결 현금흐름표 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
제 22 기 3분기 2020.01.01 부터 2020.09.30 까지 |
|
(단위 : 원) |
|
제 23 기 3분기 |
제 22 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(11,344,342,900) |
(9,458,530,570) |
|
당기순이익(손실) |
(20,549,862,904) |
(13,113,248,532) |
|
조정 |
7,049,258,135 |
2,578,592,736 |
|
대손상각비 |
(343,137,499) |
(96,854,758) |
|
감가상각비 |
1,364,414,848 |
1,365,101,652 |
|
무형자산상각비 |
172,365,310 |
149,196,887 |
|
경상개발비 |
(42,676,435) |
(219,998,083) |
|
지급임차료 |
3,248,573 |
3,811,575 |
|
지급수수료 |
42,490,132 |
25,126,513 |
|
차량유지비 |
539,648 |
0 |
|
주식보상비용(환입) |
583,075,869 |
37,826,306 |
|
퇴직급여 |
400,366,298 |
381,274,740 |
|
이자비용 |
6,909,205,901 |
126,256,465 |
|
외화환산손실 |
18,485,640 |
14,913,779 |
|
관계기업투자자산 처분손실 |
0 |
654,036,858 |
|
유형자산폐기손실 |
1,000 |
0 |
|
유형자산처분손실 |
14,770,483 |
0 |
|
지분법손실 |
0 |
50,662,901 |
|
기타충당부채전입 |
0 |
786,433,374 |
|
잡손실 |
83,212 |
0 |
|
재해손실 |
0 |
130,766,256 |
|
법인세비용 |
(1,387,679,327) |
4,747,838 |
|
이자수익 |
(680,736,574) |
(414,508,305) |
|
외화환산이익 |
(267,605) |
(24,274,109) |
|
당기손익-공정가치측정 금융자산 평가이익 |
(3,500,210) |
(57,075,586) |
|
관계기업투자자산 처분이익 |
0 |
(326,168,773) |
|
유형자산처분이익 |
(1,499,000) |
0 |
|
잡이익 |
(292,129) |
(12,682,794) |
|
영업활동으로인한자산ㆍ부채의변동 |
1,943,813,963 |
588,302,632 |
|
매출채권 |
22,988,706 |
2,192,904,446 |
|
미수금 |
(7,713,539) |
(357,884,973) |
|
선급금 |
200,745,963 |
(145,699,151) |
|
선급비용 |
8,444,056 |
5,189,270 |
|
반환제품회수권 |
(28,517,667) |
45,337,037 |
|
재고자산 |
1,605,348,489 |
(1,734,468,373) |
|
매입채무 |
1,275,473,270 |
(625,534,432) |
|
미지급금 |
(1,177,260,404) |
1,056,282,106 |
|
예수금 |
(101,446,326) |
35,996,222 |
|
선수금 |
295,269,945 |
214,797,327 |
|
환불부채 |
18,297,511 |
(53,971,566) |
|
정부보조금 |
87,676,435 |
206,690,168 |
|
퇴직금의 지급 |
(255,930,326) |
(288,826,316) |
|
퇴직연금운용자산 |
437,850 |
37,490,867 |
|
이자의 수취 |
451,228,629 |
674,642,704 |
|
이자의 지급 |
(279,041,533) |
(150,198,610) |
|
법인세의 납부(환급) |
40,260,810 |
(36,621,500) |
|
투자활동현금흐름 |
(12,187,635,693) |
(1,356,992,274) |
|
단기금융상품의 처분 |
70,511,754,127 |
56,393,918,216 |
|
단기대여금의 감소 |
0 |
299,000,000 |
|
장기대여금의 감소 |
52,200,000 |
99,100,000 |
|
매도가능금융자산의 처분 |
119,237,444 |
0 |
|
관계기업투자자산의 처분 |
0 |
1,500,000,000 |
|
기계장치의 처분 |
6,000,000 |
0 |
|
비품의 처분 |
1,500,000 |
0 |
|
임차보증금의 감소 |
10,487,140 |
579,203,000 |
|
단기금융상품의 취득 |
(80,667,398,064) |
(56,893,918,216) |
|
단기대여금의 증가 |
0 |
(211,000,000) |
|
당기손익-공정가치 측정 금융자산의 취득 |
(28,940,000) |
(52,092,000) |
|
매도가능금융자산의 취득 |
(600,000,000) |
0 |
|
기계장치의 취득 |
(14,920,000) |
(26,910,000) |
|
공구와기구의 취득 |
(50,180,000) |
(20,814,300) |
|
비품의 취득 |
(67,440,366) |
(24,742,051) |
|
건설중인자산의 증가 |
(1,269,504,784) |
(2,420,021,923) |
|
회원권의 취득 |
(1,029,470) |
(253,000,000) |
|
기타무형자산의 취득 |
0 |
(2,300,000) |
|
임차보증금의 증가 |
(189,401,720) |
(323,415,000) |
|
재무활동현금흐름 |
30,119,129,099 |
9,951,024,633 |
|
단기차입금의 증가 |
4,039,660,000 |
6,642,835,955 |
|
장기차입금의 증가 |
0 |
7,100,000,000 |
|
정부보조금의 수취 |
0 |
5,002,086 |
|
보통주 증자 |
100,703,760 |
225,035,050 |
|
전환우선주 발행 |
30,001,061,920 |
0 |
|
단기차입금의 상환 |
(3,319,660,000) |
(3,547,017,100) |
|
유동성장기부채의 상환 |
(341,740,000) |
(300,000,000) |
|
유동리스부채의 지급 |
(360,896,581) |
(174,831,358) |
|
현금및현금성자산의 순증가 |
6,587,150,506 |
(864,498,211) |
|
기초현금및현금성자산 |
1,857,599,584 |
2,305,902,870 |
|
현금및현금성자산에 대한 환율변동효과 |
26,531,303 |
(349,028) |
|
기말현금및현금성자산 |
8,471,281,393 |
1,441,055,631 |
3. 연결재무제표 주석
| 제 23기 3분기 2021년 01월 01일부터 2021년 09월 30일까지 |
| 제 22기 3분기 2020년 01월 01일부터 2020년 09월 30일까지 |
| 주식회사 엔지켐생명과학과 그 종속기업 |
1. 일반사항
1-1. 지배기업
주식회사 엔지켐생명과학(이하 '당사')은 1999년 7월 20일 설립되어 원료의약품사업및 글로벌 신약개발사업을 주요 사업으로 영위하고 있습니다. 당사는 2011년 2월에 상호를 (주)엔지켐에서 주식회사 엔지켐생명과학으로 변경하였으며, 2018년 2월 21일 코스닥시장 상장규정에 의한 기술성장 기업으로서 코넥스시장 (2013년 9월 25일 상장)에서 코스닥시장으로 이전 상장 하였습니다.
보고기간종료일 현재 납입자본금은 4,355,241,000원이며, 주요 주주 현황은 다음과 같습니다.
| (단위: 주, %) | |||||
|---|---|---|---|---|---|
| 주주명 | 보통주 | 전환우선주 | 합 계 | 지분율(%) | 비 고 |
| (주)브리짓라이프사이언스 | 961,780 | - | 961,780 | 11.04 | 최대주주 |
| 손기영 | 578,361 | - | 578,361 | 6.64 | 대표이사 |
| NORGES BANK | 246,077 | - | 246,077 | 2.83 | |
| 기타 | 6,545,127 | 379,137 | 6,924,264 | 79.49 | |
| 합 계 | 8,331,345 | 379,137 | 8,710,482 | 100.00 | |
1-2. 연결 대상 종속기업
보고기간종료일 현재 종속기업은 다음과 같습니다.
<당분기말>
| 종속기업명 | 주요 영업활동 | 투자주식수(주) | 지분율(%) | 결산일 | 소재지 |
|---|---|---|---|---|---|
| Enzychem Lifesciences USA Inc. | 임상개발/라이선스 | 1,010 | 100.00 | 12월 31일 | 미국 |
| (주)메쎄나(*) | 의약품 위탁생산/신약개발 | 1,800,000 | 100.00 | 12월 31일 | 한국 |
(*) (주)메쎄나는 당분기 중 설립 되었습니다.
<전기말>
| 종속기업명 | 주요 영업활동 | 투자주식수(주) | 지분율(%) | 결산일 | 소재지 |
|---|---|---|---|---|---|
| Enzychem Lifesciences USA Inc. | 임상개발/라이선스 | 1,010 | 100.00 | 12월 31일 | 미국 |
1-3. 연결범위의 변동
보고기간종료일 현재 종속기업의 내역은 다음과 같습니다.
| (단위 : 원, %) | ||||
| 종속기업명 | 당분기말 | 전기말 | ||
| 투자금액 | 지분율(%) | 투자금액 | 지분율(%) | |
| Enzychem Lifesciences USA Inc. | 380,153,565 | 100.00 | 185,119,950 | 100.00 |
| (주)메쎄나 | 900,000,000 | 100.00 | - | - |
1-4. 종속기업의 주요 재무현황
보고기간종료일 현재 종속기업의 주요 재무현황은 다음과 같습니다.
<당분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 종속기업명 | 자산총계 | 부채총계 | 매출액 | 분기순이익(손실) | 분기총포괄손익 |
| Enzychem Lifesciences USA Inc. | 887,854,461 | 516,905,764 | 1,583,414,378 | (46,975,693) | (27,112,203) |
| (주)메쎄나 | 900,240,595 | 5,620,000 | - | (5,379,405) | (5,379,405) |
<전기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 종속기업명 | 자산총계 | 부채총계 | 매출액 | 당기순이익(손실) | 당기총포괄손익 |
| Enzychem Lifesciences USA Inc. | 504,962,778 | 301,935,493 | 1,593,070,482 | (122,992,478) | (134,647,719) |
2. 중요한 회계정책 및 재무제표 작성기준
2-1. 연결재무제표 작성기준
당사와 당사의 종속기업(이하 '연결회사')의 재무제표는 연차재무제표가 속하는 기간의 일부에 대하여 기업회계기준서 제1034호 "중간재무보고"를 적용하여 작성하는 재무제표입니다. 동 중간재무제표에 대한 이해를 위해서는 한국채택국제회계기준에 따라 작성된 2020년 12월 31일자로 종료하는 회계연도에 대한 연차재무제표를 함께 이용하여야 합니다.
중간재무제표 작성에 적용된 중요한 회계정책은 아래 기술되어 있으며, 당분기 재무제표의 작성에 적용된 중요한 회계정책은 아래에서 설명하는 기준서나 해석서의 도입과 관련된 영향을 제외하고는 2020년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다.
2-2. 제ㆍ개정된 기준서의 적용
중간재무제표를 작성하기 위하여 채택한 중요한 회계정책은 다음의 2021년 1월 1일부터 적용되는 기준서를 제외하고는 2020년 12월 31일로 종료되는 회계기간에 대한연차재무제표 작성시 채택한 회계정책과 동일합니다. 연결회사는 공표되었으나 시행되지 않은 기준서, 해석서, 개정사항을 조기적용한 바 없습니다.
여러 개정사항과 해석서가 2021년부터 최초 적용되며, 연결회사의 재무제표에 중요한 영향을 미치지 않습니다.
2-2-1. 기업회계기준서 제1116호 '리스' 개정(코로나 19 관련 임차료 할인 등에 대한 실무적 간편법)
동 개정사항은 코로나19의 직접적인 결과로 발생한 임차료 할인 등을 리스이용자가 회계처리할 때, 리스이용자에게 코로나19 관련 임차료 할인 등이 리스변경에 해당하는지 여부를 평가하지 않는 선택을 할 수 있도록 허용합니다. 이러한 선택을 한 리스이용자는 코로나19 관련 임차료 할인 등으로 인한 리스료 변동을 그러한 변동이 리스변경이 아닐 경우에 리스이용자가 회계처리하는 방식과 일관되게 회계처리합니다.
동 실무적 간편법은 코로나19의 직접적인 결과로 발생한 임차료 할인 등에만 적용되며 아래의 조건을 모두 충족하는 경우에 적용합니다.
- 리스료의 변동으로 수정된 리스대가가 변경 전 리스대가와 실질적으로 동일하거나 그보다 작음
- 리스료 감면이 2021년 6월 30일 이전(2021년 개정사항을 조기 적용하기로 한 경우[2021년 6월 30일]을 [2022년 6월 30일]로 변경하여 기재)에 지급하여야 할 리스료에만 영향을 미침
- 그 밖의 리스기간과 조건은 실질적으로 변경되지 않음
2-2-2. 기업회계기준서 제1109호 '금융상품', 제1039호 '금융상품: 인식과 측정', 제1107호 '금융상품: 공시', 제 1104호 '보험계약' 및 제 1116호 '리스' 개정 - 이자율지표 개혁 2단계 (개정)
이자율지표 개혁과 관련하여 새로운 이자율이 대체 지표 이자율이 되어 불확실성이 해소되는 시점에 적용되는 실무적 간편법을 제공합니다.
- (상각후원가 측정 금융상품) 특정요건 충족 시, 이자율 대체에 따른 금융상품 변경 손익이 인식되지 않도록 함
- (위험회피) 이자율지표 개혁에서 요구된 변경을 반영하기 위해, 관련 위험회피관계에 대한 문서를 수정하더라도 위험회피회계를 유지
- (리스) 리스료 산정기준이 변경될 때 특정요건 충족 시 새 대체 지표 이자율을 고려하여 미래 리스료를 할인
동 개정사항이 재무제표에 미치는 유의적인 영향은 없습니다.
2-3. 제정ㆍ공표되었으나 아직 시행일이 도래하지 않아 적용하지 아니한 한국채택국제회계기준의 내역은 다음과 같습니다.
2-3-1. 기업회계기준서 제1001호 '재무제표 표시'(개정) - 부채의 유동/비유동 분류
동 개정사항은 유동부채와 비유동부채의 분류는 보고기간말에 존재하는 기업의 권리에 근거한다는 점을 명확히 하고 기업이 부채의 결제를 연기할 수 있는 권리를 행사할 지 여부에 대한 기대와는 무관하다는 점을 강조합니다. 그리고 보고기간말에 차입약정을 준수하고 있다면 해당 권리가 존재한다고 설명하고 결제는 현금, 지분상품, 그 밖의 자산 또는 용역을 거래상대방에게 이전하는 것으로 그 정의를 명확히 합니다.
동 개정사항은 2023 년 1 월 1 일 이후 최초로 시작하는 회계연도의 개시일 이후 소급적으로 적용되며 조기적용이 허용됩니다.
2-3-2. 기업회계기준서 제1103호 '사업결합'(개정) - '개념체계'에 대한 참조
인식할 자산과 부채의 정의를 개정된 재무보고를 위한 개념체계를 참조하도록 개정되었으나, 기업회계기준서 제1037호 '충당부채, 우발부채 및 우발자산' 및 해석서 제2121호 '부담금'의 적용범위에 포함되는 부채 및 우발부채에 대해서는 해당 기준서를 적용하도록 예외를 추가하고, 우발자산이 취득일에 인식되지 않는다는 점을 명확히 하였습니다.
동 개정사항은 취득일이 2022년 1월 1일 이후 최초로 시작되는 회계연도의 개시일 이후인 사업결합에 적용합니다. 동 개정사항과 함께 공표된 '한국채택국제회계기준에서 개념체계 참조에 대한 개정'에 따른 모든 개정사항을 동 개정사항보다 먼저 적용하거나 동 개정사항과 동시에 적용하는 경우에만 동 개정사항의 조기 적용이 허용됩니다.
2-3-3. 기업회계기준서 제1016호 '유형자산'(개정) - 의도한 사용 전의 매각금액
동 개정사항은 유형자산이 사용 가능하기 전에 생산된 재화의 매각금액, 즉 경영진이의도하는 방식으로 가동하는 데 필요한 장소와 상태에 이르게 하기 전에 생산된 재화의 매각금액)을 유형자산의 원가에서 차감하는 것을 금지합니다. 따라서 그러한 매각금액과 관련 원가를 당기손익으로 인식하며, 해당 원가는 기업회계기준서 제1002호에 따라 측정합니다.
또한 동 개정사항은 '유형자산이 정상적으로 작동되는지 여부를 시험하는 것'의 의미를 명확히 하여 자산의 기술적, 물리적 성능이 재화나 용역의 생산이나 제공, 타인에 대한 임대 또는 관리활동에 사용할 수 있는 정도인지를 평가하는 것으로 명시합니다.
동 개정사항은 이 개정내용을 처음 적용하는 재무제표에 표시된 가장 이른 기간의 개시일 이후에 경영진이 의도한 방식으로 가동할 수 있는 장소와 상태에 이른 유형자산에 대해서만 소급 적용합니다. 동 개정사항의 최초 적용 누적효과는 표시되는 가장 이른 기간의 시작일에 이익잉여금(또는 적절하다면 자본의 다른 구성요소)의 기초 잔액을 조정하여 인식합니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 적용되며, 조기적용이 허용됩니다.
2-3-4. 기업회계기준서 제1037호 '충당부채, 우발부채 및 우발자산'(개정) - 손실부담계약의 계약이행원가
동 개정사항은 계약이 손실부담계약인지 또는 손실을 발생시키는 계약인지 평가할 때 기업이 포함해야할 원가를 명확하게 하였습니다.
개정 기준서는 "직접 관련된 원가 접근법"을 적용합니다. 재화나 용역을 제공하는 계약에 직접적으로 관련되는 원가는 증분원가와 계약 활동에 직접적으로 관련되는 원가 배분액을 모두 포함합니다. 일반 관리 원가는 계약에 직접적으로 관련되지 않으며계약에 따라 거래상대방에게 명시적으로 부과될 수 없다면 제외됩니다.
동 개정사항은 이 개정사항을 최초로 적용하는 회계연도의 개시일에 모든 의무의 이행이 완료되지는 않은 계약에 적용합니다. 비교재무제표는 재작성 하지 않고, 그 대신 개정 내용을 최초로 적용함에 따른 누적효과를 최초적용일의 기초이익잉여금 또는 적절한 경우 다른 자본요소로 인식합니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 적용되며, 조기적용이 허용됩니다.
2-3-5. 한국채택국제회계기준 2018-2020 연차개선
(1) 기업회계기준서 제 1101호 '한국채택국제회계기준의 최초채택' - 최초채택기업인 종속기업
동 개정사항은 지배기업보다 늦게 최초채택기업이 되는 종속기업의 누적환산차이의 회계처리와 관련하여 추가적인 면제를 제공합니다. 기업회계기준서 제 1101호 문단 D16(1)의 면제규정을 적용하는 종속기업은 지배기업의 한국채택국제회계기준 전환일에 기초하여 지배기업의 연결재무제표에 포함될 장부금액으로 모든 해외사업장의 누적환산차이를 측정하는 것을 선택할 수 있습니다. 다만 지배기업이 종속기업을 취득하는 사업결합의 효과와 연결절차에 따른 조정사항은 제외합니다. 관계기업이나 공동기업이 기업회계기준 제 1101호 문단 D16(1)의 면제규정을 적용하는 경우에도 비슷한 선택을 할 수 있습니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는회계연도부터 적용되며, 조기적용이 허용됩니다.
(2) 기업회계기준서 제1109호 '금융상품' - 금융부채 제거 목적의 10% 테스트 관련 수수료
동 개정사항은 금융부채의 제거 여부를 평가하기 위해 '10%' 테스트를 적용할 때, 기업(차입자)과 대여자 간에 수취하거나 지급하는 수수료만을 포함하며, 여기에는 기업이나 대여자가 다른 당사자를 대신하여 지급하거나 수취하는 수수료를 포함한다는 점을 명확히 하고 있습니다. 동 개정사항은 최초 적용일 이후 발생한 변경 및 교환에 대하여 전진적으로 적용됩니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 시행되며 조기적용이 허용됩니다.
(3) 기업회계기준서 제1116호 '리스' - 리스 인센티브
동 개정사항은 기업회계기준서 제1116호 사례13에서 리스개량 변제액에 대한 내용을 삭제하였습니다. 동 개정사항은 적용사례에만 관련되므로, 시행일은 별도로 규정되지 않았습니다.
(4) 기업회계기준서 제1041호 '농림어업' - 공정가치 측정
동 개정사항은 생물자산의 공정가치를 측정할 때 세금 관련 현금흐름을 제외하는 요구사항을 삭제하였습니다. 이는 기업회계기준서 제1041호의 공정가치 측정과 내부적으로 일관된 현금흐름과 할인율을 사용하도록 하는 기업회계기준서 제1113호의 요구사항을 일치시키며, 기업은 가장 적절한 공정가치 측정을 위해 세전 또는 세후 현금흐름 및 할인율을 사용할지 선택할 수 있습니다.
동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 시행되며 조기적용이 허용됩니다.
2-3-6. 기업회계기준서 제1117호 '보험계약'(제정)
기업회계기준서 제1176호 '보험계약'은 2023년 1월 1일 이후 최초로 시작되는 회계연도부터 적용하되 조기 적용할 수도 있습니다. 이 기준서는 현행 기업회계기준서 제1104호 '보험계약'을 대체할 예정입니다.
보험회사는 보험계약에 따른 모든 현금흐름을 추정하고 보고시점의 가정과 위험을 반영한 할인율을 사용하여 보험부채를 즉정합니다. 보험수익은 발생주의에 따라 매 회계연도별로 보험회사가 계약자에게 제공한 서비스를 반영하여 수익을 인식합니다.또한, 보험사건과 관계없이 보험계약자에게 지급하는 투자요소는 보험수익에서 제외하며, 보험손익과 투자손익을 구분표시합니다.
연결회사는 상기에 열거된 제ㆍ개정사항이 재무제표에 미치는 영향이 중요하지 않을것으로 판단하고 있습니다.
3. 재무위험관리
3-1. 재무위험관리요소
연결회사는 여러 활동으로 인하여 시장위험(환위험, 공정가치이자율위험, 현금흐름이자율위험 및 가격위험), 신용위험 및 유동성위험과 같은 다양한 재무위험에 노출돼있습니다. 연결회사의 전반적인 위험관리정책은 금융시장의 변동성에 초점을 맞추고있으며 재무성과에 미치는 부정적 영향을 최소화하는데 중점을 두고 있습니다.
위험관리는 이사회에서 승인한 정책에 따라 이루어지고 있습니다. 이사회는 전반적인 위험관리에 대한 문서화된 정책, 외환위험, 이자율 위험, 신용 위험, 파생금융상품과 비파생금융상품의 이용 및 유동성을 초과하는 투자와 같은 특정 분야에 관한 문서화된 정책을 검토하고 승인합니다.
3-1-1. 시장위험
(1) 외환위험
외환위험은 환율의 변동으로 인하여 금융상품의 공정가치가 변동할 위험입니다. 연결회사는 기능통화인 원화 이외의 통화로 표시되는 판매 및 구매에 대해 환위험에 노출되어 있습니다. 연결회사는 별도의 금융상품을 통한 외화표시 화폐성 자산과 부채의 경제적인 위험회피를 위한 활동을 수행하고 있지 않으며, 지급기일 조정 등을 통하여 환위험을 관리하고 있습니다.
보고기간종료일 현재 기능통화 이외의 외화로 표시된 화폐성 자산과 화폐성 부채의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 자 산 | 부 채 | 자 산 | 부 채 | |
| USD | 649,848,061 | 1,452,336,394 | 1,139,542,933 | 1,817,878,825 |
| EUR | - | 41,229,300 | - | 128,638,320 |
| 합 계 | 649,848,061 | 1,493,565,694 | 1,139,542,933 | 1,946,517,145 |
연결회사는 내부적으로 외화 환율 변동에 따른 환위험을 정기적으로 측정하고 있으며, 보고기간종료일 현재 각 외화에 대한 기능통화의 환율변동이 법인세비용차감전순이익에 미치는 영향은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 5% 상승 | 5% 하락 | 5% 상승 | 5% 하락 | |
| USD | (40,124,417) | 40,124,417 | (33,916,795) | 33,916,795 |
| EUR | (2,061,465) | 2,061,465 | (6,431,916) | 6,431,916 |
| 합 계 | (42,185,882) | 42,185,882 | (40,348,711) | 40,348,711 |
(2) 가격위험
가격위험은 이자율위험이나 환위험 이외의 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험이며, 보고기간종료일 현재 연결회사의 기타포괄손익-공정가치측정 지분상품의 장부금액은 462,568,000원이며, 주가가 1% 변동할 경우 당분기 총 포괄손익의 변동금액은 4,625,680원 입니다.
(3) 이자율 위험
이자율 위험은 미래의 시장 이자율 변동에 따라 예금 또는 차입금 등에서 발생하는 이자수익 및 이자비용이 변동될 위험을 뜻하며, 이는 주로 변동금리부 조건의 예금과차입금에서 발생하고 있습니다. 연결회사의 이자율 위험관리의 목표는 이자율 변동으로 인한 불확실성과 순이자비용의 최소화를 추구함으로써 기업의 가치를 극대화하는데 있습니다.
보고기간종료일 현재 연결회사의 금융상품 중 이자율 위험에 노출되어 있는 금융상품은 존재하지 아니합니다.
3-1-2. 신용위험
신용위험은 거래상대방이 의무를 이행하지 않아 재무손실이 발생할 위험입니다. 연결회사는 영업활동과 재무활동에서 신용위험에 노출되어 있습니다.
금융자산의 장부금액은 신용위험에 대한 최대 노출정도를 나타냅니다. 보고기간종료일 현재 신용위험에 대한 최대 노출정도는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 현금및현금성자산 | 8,426,281,393 | 1,857,599,584 |
| 매출채권및기타채권 | 5,209,856,688 | 4,567,074,209 |
| 단기대여금 | 118,490,000 | 108,800,000 |
| 당기손익-공정가치 측정 금융자산(비유동) | 144,349,685 | 111,909,475 |
| 기타금융자산 | ||
| 금융기관예치금(유동) | 98,802,600,000 | 88,645,952,579 |
| 장기대여금 | 30,450,000 | 82,650,000 |
| 보증금 | 825,141,773 | 625,982,014 |
| 합 계 | 113,557,169,539 | 95,999,967,861 |
연결회사는 매출채권 등에 대해 발생할 것으로 예상되는 손실에 대해 충당금을 설정하고 있습니다. 이 충당금은 개별적으로 유의적인 항목에 대한 구체적인 손상차손과 유사한 특성을 가진 금융자산 집합에서 발생되었으나 아직 식별되지 않은 손상으로 구성됩니다. 금융자산 집합의 충당금은 유사한 금융자산의 회수에 대한 과거 자료에 근거하여 결정되고 있습니다.
매출채권 및 미수금, 미수수익은 대손충당금이 차감된 순액으로 연결재무상태표에 표시되었는 바, 보고기간종료일 현재 대손충당금 차감 전 총액 기준에 의한 매출채권및기타채권과 관련한 대손충당금의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 매출채권 | 5,043,988,374 | 5,066,709,475 |
| (대손충당금) | (537,858,027) | (880,995,526) |
| 미수금 | 706,939,021 | 585,408,482 |
| (대손충당금) | (499,532,805) | (499,532,805) |
| 미수수익 | 496,320,125 | 295,484,583 |
| 합 계 | 5,209,856,688 | 4,567,074,209 |
보고기간종료일 현재 매출채권및기타채권의 연령 및 각 연령별로 손상된 채권금액은다음과 같습니다.
<당분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 매출채권 | 기타채권 | 합 계 | |||
| 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | |
| 6개월이하 | 4,503,143,871 | - | 520,909,341 | - | 5,024,053,212 | - |
| 6개월초과 1년이하 | - | - | 182,817,000 | - | 182,817,000 | - |
| 1년초과 | 540,844,503 | 537,858,027 | 499,532,805 | 499,532,805 | 1,040,377,308 | 1,037,390,832 |
| 합 계 | 5,043,988,374 | 537,858,027 | 1,203,259,146 | 499,532,805 | 6,247,247,520 | 1,037,390,832 |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 매출채권 | 기타채권 | 합 계 | |||
| 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | |
| 6개월이하 | 4,169,091,601 | - | 381,360,260 | - | 4,550,451,861 | - |
| 6개월초과 1년이하 | - | - | - | - | - | - |
| 1년초과 | 897,617,874 | 880,995,526 | 499,532,805 | 499,532,805 | 1,397,150,679 | 1,380,528,331 |
| 합 계 | 5,066,709,475 | 880,995,526 | 880,893,065 | 499,532,805 | 5,947,602,540 | 1,380,528,331 |
3-1-3. 유동성 위험
연결회사는 미사용 차입금 한도를 적정 수준으로 유지하고, 영업 자금 수요를 충족시키기 위해 차입금 한도나 약정을 위반하는 일이 없도록 유동성에 대한 예측을 항시 모니터링하고 있습니다. 유동성을 예측하는데 있어 연결회사의 자금조달 계획, 약정 준수, 연결회사 내부의 목표재무비율 및 통화에 대한 제한과 같은 외부 법규나 법률 요구사항도 고려하고 있습니다.
보고기간종료일 현재 금융부채의 잔존 계약만기에 따른 현금유출액은(원금과 이자상당액) 다음과 같습니다.
<당분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월이하 | 3개월초과 ~ 1년이하 |
1년초과 ~ 5년이하 |
5년 초과 |
| 매입채무 | 2,148,734,069 | 2,148,734,069 | 2,148,734,069 | - | - | - |
| 단기차입금 | 5,100,000,000 | 5,164,230,443 | 1,531,777,543 | 3,632,452,900 | - | - |
| 미지급금 | 1,806,351,112 | 1,806,351,112 | 1,484,926,253 | 321,424,859 | - | - |
| 미지급비용 | 15,041,995 | 15,041,995 | 15,041,995 | - | - | - |
| 유동성장기부채 | 2,866,640,000 | 3,012,503,112 | 761,402,698 | 2,251,100,414 | - | - |
| 장기차입금 | 3,891,620,000 | 3,962,073,873 | - | - | 3,962,073,873 | - |
| 전환사채 | 37,701,161,313 | 50,000,000,000 | - | - | 50,000,000,000 | - |
| 유동리스부채 | 284,482,299 | 304,073,566 | 158,247,632 | 145,825,934 | - | - |
| 비유동리스부채 | 193,106,374 | 208,106,625 | - | - | 208,106,625 | - |
| 합 계 | 54,007,137,162 | 66,621,114,795 | 6,100,130,190 | 6,350,804,107 | 54,170,180,498 | - |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월이하 | 3개월초과 ~ 1년이하 |
1년초과 ~ 5년이하 |
5년 초과 |
| 매입채무 | 867,650,649 | 867,650,649 | 867,650,649 | - | - | - |
| 단기차입금 | 4,380,000,000 | 4,425,709,984 | 1,624,770,538 | 2,800,939,446 | - | - |
| 미지급금 | 2,815,303,298 | 2,815,303,298 | 2,524,083,158 | 291,220,140 | - | - |
| 미지급비용 | 15,768,056 | 15,768,056 | 15,768,056 | - | - | - |
| 유동성장기부채 | 1,058,400,000 | 1,249,982,975 | 48,892,345 | 1,201,090,630 | - | - |
| 장기차입금 | 6,041,600,000 | 6,211,343,466 | - | - | 6,211,343,466 | - |
| 전환사채 | 31,078,120,985 | 50,000,000,000 | - | - | 50,000,000,000 | - |
| 유동리스부채 | 191,280,600 | 220,070,633 | 57,723,722 | 162,346,911 | - | - |
| 비유동리스부채 | 317,114,915 | 345,394,076 | - | - | 345,394,076 | - |
| 합 계 | 46,765,238,503 | 66,151,223,137 | 5,138,888,468 | 4,455,597,127 | 56,556,737,542 | - |
3-2. 자본위험관리
연결회사의 자본위험관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본비용을 절감하기 위해 최적 자본구조를 유지하는 것입니다.
연결회사는 최적 자본구조 달성을 위해 부채비율과 순차입금비율 등의 재무비율을 자본위험관리지표로 사용하고 있습니다. 부채비율은 부채총계를 자본총계로 나누어 산출하고 있으며, 순차입금비율은 순차입금을 자본총계로 나누어 산출하고 있습니다.
보고기간종료일 현재 부채비율 및 순차입금비율은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 부채비율: | ||
| 부채총계 | 57,679,462,107 | 51,319,665,897 |
| 자본총계 | 82,354,773,562 | 72,482,539,901 |
| 부채비율(%) | 70.04 | 70.80 |
| 순차입금비율: | ||
| 차입금 | 11,858,260,000 | 11,480,000,000 |
| 전환사채 | 37,701,161,313 | 31,078,120,985 |
| (차감)현금및현금성자산 | (8,426,281,393) | (1,857,599,584) |
| (차감)당기손익-공정가치 측정 금융자산(비유동) | (144,349,685) | (111,909,475) |
| (차감)기타포괄손익-공정가치 측정 지분상품 | (462,568,000) | (344,124,000) |
| (차감)기타금융자산 | (99,776,681,773) | (89,463,384,593) |
| 순차입금(A) | (59,250,459,538) | (49,218,896,667) |
| 자본총계(B) | 82,354,773,562 | 72,482,539,901 |
| 순차입금비율(C=A/B)(%) | -(*) | -(*) |
(*) 부수이므로 산정하지 아니하였습니다.
3-3. 사용이 제한된 금융자산
보고기간종료일 현재 사용이 제한된 금융자산의 내역은 다음과 같습니다.
| (단위 : 원) | |||
|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | 사용제한내용 |
| 현금및현금성자산(*) | - | 186,765,360 | 채권압류 |
| 단기금융상품 | 4,302,600,000 | 7,145,952,579 | 담보제공 등 |
| 현금및현금성자산 | 45,000,000 | - | 정부보조금 |
(*) 전기말 해고무효확인 및 주권인도소송과 관련된 채권압류건은 당분기 중 추심 완료되었습니다.
4. 영업부문정보
연결회사의 최고 영업의사 결정자는 부문성과평가와 자원배분 의사결정에 각 부문의매출정보만을 이용하며, 내부보고자료에는 부문당기손익, 부문자산 및 부문부채 등의 정보를 포함하지 않습니다.
4-1. 영업부문에 대한 일반정보
영업부문별 주요사업은 다음과 같습니다.
| 부 문 | 주요사업내용 |
|---|---|
| 원료의약품 부문 | 세파계 항생제 및 비세파계, 조영제 API 제조/판매 |
| 원료의약품이외 부문 | 건강기능성식품 제조/판매, 임가공, 연구R&D 용역 등 |
4-2. 영업부문의 부문별 정보
연결회사의 각 영업부문별 매출 및 손익에 대한 정보는 다음과 같습니다.
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||||||
| 원료의약품부문 | 원료의약품 이외부문 |
조정 및 제거 | 합 계 | 원료의약품부문 | 원료의약품 이외부문 |
조정 및 제거 | 합 계 | |
| 매출액 | 15,172,153,383 | 1,331,073,654 | (18,297,511) | 16,484,929,526 | 20,961,851,869 | 850,534,394 | 53,971,566 | 21,866,357,829 |
| 영업이익(손실) | (14,291,339,582) | (1,253,798,661) | - | (15,545,138,243) | (11,969,531,847) | (485,667,897) | - | (12,455,199,744) |
| 분기순이익(손실) | (18,892,406,393) | (1,657,456,511) | - | (20,549,862,904) | (12,601,921,217) | (511,327,315) | - | (13,113,248,532) |
연결회사의 영업자산 및 영업부채는 전사차원에서 관리되고 있습니다.
4-3. 지역별 부문의 정보
연결회사의 각 지역별로 세분화된 외부고객으로부터의 수익은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 국 내 | 16,315,987,445 | 19,951,689,732 |
| 해 외 | 168,942,081 | 1,914,668,097 |
| 합 계 | 16,484,929,526 | 21,866,357,829 |
4-4. 주요 고객별 정보
당분기와 전분기 중 고객으로부터의 수익이 연결회사 전체 수익의 10(%) 이상을 차지하는 부문의 고객별 수익금액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분(*) | 당분기 | 전분기 |
| A | 1,495,000,000 | 2,312,301,088 |
| B | 2,145,704,704 | 3,352,185,000 |
| 합 계 | 3,640,704,704 | 5,664,486,088 |
(*) 동일 지배력하에 있는 것으로 인지하고 있는 기업들은 단일 고객으로 간주하였습니다.
5. 금융상품 공정가치
5-1. 보고기간종료일 현재 금융상품의 장부금액과 공정가치는 다음과 같습니다.
5-1-1. 금융자산
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 공정가치로 인식된 금융자산 : | ||||
| 당기손익-공정가치측정금융자산(비유동) | 144,349,685 | 144,349,685 | 111,909,475 | 111,909,475 |
| 기타포괄손익-공정가치측정지분상품 | 462,568,000 | 462,568,000 | 344,124,000 | 344,124,000 |
| 소 계 | 606,917,685 | 606,917,685 | 456,033,475 | 456,033,475 |
| 상각후원가로 인식된 금융자산 : | ||||
| 현금및현금성자산 | 8,426,281,393 | 8,426,281,393 | 1,857,599,584 | 1,857,599,584 |
| 매출채권및기타채권 | 5,209,856,688 | 5,209,856,688 | 4,567,074,209 | 4,567,074,209 |
| 기타금융자산(유동) | 98,921,090,000 | 98,921,090,000 | 88,754,752,579 | 88,754,752,579 |
| 기타금융자산(비유동) | 855,591,773 | 855,591,773 | 708,632,014 | 708,632,014 |
| 소 계 | 113,412,819,854 | 113,412,819,854 | 95,888,058,386 | 95,888,058,386 |
| 합 계 | 114,019,737,539 | 114,019,737,539 | 96,344,091,861 | 96,344,091,861 |
5-1-2. 금융부채
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 상각후원가로 인식된 금융부채 : | ||||
| 단기차입금 | 5,100,000,000 | 5,100,000,000 | 4,380,000,000 | 4,380,000,000 |
| 유동성장기부채 | 2,866,640,000 | 2,866,640,000 | 1,058,400,000 | 1,058,400,000 |
| 매입채무및기타채무 | 3,970,127,176 | 3,970,127,176 | 3,698,722,003 | 3,698,722,003 |
| 장기차입금 | 3,891,620,000 | 3,891,620,000 | 6,041,600,000 | 6,041,600,000 |
| 전환사채 | 37,701,161,313 | 37,701,161,313 | 31,078,120,985 | 31,078,120,985 |
| 유동리스부채 | 284,482,299 | 284,482,299 | 191,280,600 | 191,280,600 |
| 비유동리스부채 | 193,106,374 | 193,106,374 | 317,114,915 | 317,114,915 |
| 합 계 | 54,007,137,162 | 54,007,137,162 | 46,765,238,503 | 46,765,238,503 |
5-2. 금융상품 공정가치 서열 체계
공정가치로 측정되거나 공정가치가 공시되는 항목은 공정가치 서열체계에 따라 구분하며, 정의된 수준들은 다음과 같습니다.
| (수준1) | 동일한 자산이나 부채에 대한 활성시장의 (조정되지 않은) 공시가격 |
| (수준2) | 직접적으로(예:가격) 또는 간접적으로(예: 가격에서 도출되어) 관측 가능한 자산이나 부채에 대한 투입 변수를 이용하여 산정한 공정가치. 단 수준 1에 포함된 공시 가격은 제외함. |
| (수준3) | 관측 가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입 변수(관측 가능하지 않은 투입 변수)를 이용하여 산정한 공정가치 |
5-3. 공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
<당분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
| <자산> | ||||
| 비유동 당기손익-공정가치측정금융자산 | - | 144,349,685 | - | 144,349,685 |
| 기타포괄손익-공정가치측정지분상품 | - | - | 462,568,000 | 462,568,000 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
| <자산> | ||||
| 비유동 당기손익-공정가치측정금융자산 | - | 111,909,475 | - | 111,909,475 |
| 기타포괄손익-공정가치측정지분상품 | - | 157,716,000 | 186,408,000 | 344,124,000 |
5-4. 공정가치 서열체계 수준3의 가치평가기법 및 투입변수 설명
연결회사는 수준 3으로 분류된 금융자산에 대해서 독립적인 외부평가기관의 전문가적인 판단에 근거한 합리적인 평가모형과 적절한 추정치를 사용하여 산정한 금액을 공정가치로 보아 평가하고 있습니다.
6. 범주별 금융상품
6-1. 금융상품 범주별 장부금액
보고기간종료일 현재 금융자산 및 금융부채의 범주별 분류내역은 다음과 같습니다.
6-1-1. 금융자산
<당분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 상각후원가 측정 금융자산 |
기타포괄손익-공정 |
당기손익-공정가치 측정 금융자산 |
합 계 |
| 현금및현금성자산 | 8,426,281,393 | - | - | 8,426,281,393 |
| 단기금융상품 | 98,802,600,000 | - | - | 98,802,600,000 |
| 비유동 당기손익-공정가치측정금융자산 | - | - | 144,349,685 | 144,349,685 |
| 매출채권 | 4,506,130,347 | - | - | 4,506,130,347 |
| 미수금 | 207,406,216 | - | - | 207,406,216 |
| 미수수익 | 496,320,125 | - | - | 496,320,125 |
| 단기대여금 | 118,490,000 | - | - | 118,490,000 |
| 매도가능금융자산 | - | 462,568,000 | - | 462,568,000 |
| 장기대여금 | 30,450,000 | - | - | 30,450,000 |
| 보증금 | 825,141,773 | - | - | 825,141,773 |
| 합 계 | 113,412,819,854 | 462,568,000 | 144,349,685 | 114,019,737,539 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 상각후원가 측정 금융자산 |
기타포괄손익-공정 |
당기손익-공정가치 측정 금융자산 |
합 계 |
| 현금및현금성자산 | 1,857,599,584 | - | - | 1,857,599,584 |
| 단기금융상품 | 88,645,952,579 | - | - | 88,645,952,579 |
| 비유동 당기손익-공정가치측정금융자산 | - | - | 111,909,475 | 111,909,475 |
| 매출채권 | 4,185,713,949 | - | - | 4,185,713,949 |
| 미수금 | 85,875,677 | - | - | 85,875,677 |
| 미수수익 | 295,484,583 | - | - | 295,484,583 |
| 단기대여금 | 108,800,000 | - | - | 108,800,000 |
| 매도가능금융자산 | - | 344,124,000 | - | 344,124,000 |
| 장기대여금 | 82,650,000 | - | - | 82,650,000 |
| 보증금 | 625,982,014 | - | - | 625,982,014 |
| 합 계 | 95,888,058,386 | 344,124,000 | 111,909,475 | 96,344,091,861 |
6-1-2. 금융부채
<당분기말>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 매입채무 | 2,148,734,069 | - | 2,148,734,069 |
| 단기차입금 | 5,100,000,000 | - | 5,100,000,000 |
| 미지급금 | 1,806,351,112 | - | 1,806,351,112 |
| 미지급비용 | 15,041,995 | - | 15,041,995 |
| 유동성장기부채 | 2,866,640,000 | - | 2,866,640,000 |
| 장기차입금 | 3,891,620,000 | - | 3,891,620,000 |
| 전환사채 | 37,701,161,313 | - | 37,701,161,313 |
| 유동리스부채 | 284,482,299 | - | 284,482,299 |
| 비유동리스부채 | 193,106,374 | - | 193,106,374 |
| 합 계 | 54,007,137,162 | - | 54,007,137,162 |
<전기말>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 매입채무 | 867,650,649 | - | 867,650,649 |
| 단기차입금 | 4,380,000,000 | - | 4,380,000,000 |
| 미지급금 | 2,815,303,298 | - | 2,815,303,298 |
| 미지급비용 | 15,768,056 | - | 15,768,056 |
| 유동성장기부채 | 1,058,400,000 | - | 1,058,400,000 |
| 장기차입금 | 6,041,600,000 | - | 6,041,600,000 |
| 전환사채 | 31,078,120,985 | - | 31,078,120,985 |
| 유동리스부채 | 191,280,600 | - | 191,280,600 |
| 비유동리스부채 | 317,114,915 | - | 317,114,915 |
| 합 계 | 46,765,238,503 | - | 46,765,238,503 |
6-2. 금융상품 범주별 순손익
금융자산 및 금융부채의 범주별 관련손익은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 |
상각후원가측정 금융자산 |
기타포괄손익-공정 가치측정 금융자산 |
당기손익-공정가치 측정 금융자산 |
상각후원가측정 금융부채 |
합 계 | |||||
| 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | |
| 당기손익 : | ||||||||||
| 이자수익 | 196,180,066 | 680,736,574 | - | - | - | - | - | - | 196,180,066 | 680,736,574 |
| 이자비용 | - | - | - | - | - | - | (2,445,856,881) | (6,909,205,901) | (2,445,856,881) | (6,909,205,901) |
| 당기손익-공정가치 측정 금융자산 평가손익 |
- | - | - | - | 887,737 | 3,500,210 | - | - | 887,737 | 3,500,210 |
| 기타포괄손익 : | ||||||||||
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
- | - | - | (282,608,474) | - | - | - | - | - | (282,608,474) |
| 합 계 | 196,180,066 | 680,736,574 | - | (282,608,474) | 887,737 | 3,500,210 | (2,445,856,881) | (6,909,205,901) | (2,248,789,078) | (6,507,577,591) |
<전분기>
| (단위: 원) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 |
상각후원가측정 금융자산 |
기타포괄손익-공정 가치측정 금융자산 |
당기손익-공정가치 측정 금융자산 |
상각후원가측정 금융부채 |
합 계 | |||||
| 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | |
| 당기손익 : | ||||||||||
| 이자수익 | 118,531,859 | 414,508,305 | - | - | - | - | - | - | 118,531,859 | 414,508,305 |
| 이자비용 | - | - | - | - | - | - | (89,783,578) | (126,256,465) | (89,783,578) | (126,256,465) |
| 당기손익-공정가치 측정 금융자산 평가손익 |
- | - | - | - | 54,561,240 | 57,075,586 | - | - | 54,561,240 | 57,075,586 |
| 기타포괄손익 : | ||||||||||
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
- | - | (15,331,680) | (11,133,720) | - | - | - | - | (15,331,680) | (11,133,720) |
| 합 계 | 118,531,859 | 414,508,305 | (15,331,680) | (11,133,720) | 54,561,240 | 57,075,586 | (89,783,578) | (126,256,465) | 67,977,841 | 334,193,706 |
7. 현금및현금성자산
보고기간종료일 현재 현금및현금성자산 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 보통예금 | 8,471,281,393 | 1,857,599,584 |
| 국고보조금 | (45,000,000) | - |
| 합 계 | 8,426,281,393 | 1,857,599,584 |
8. 당기손익-공정가치 측정 금융자산
8-1. 보고기간종료일 현재 당기손익-공정가치 측정 금융자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 장기금융상품 | - | 144,349,685 | - | 111,909,475 |
8-2. 당분기 및 전기 중 당기손익-공정가치 측정 금융자산의 변동내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전 기 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 기 초 | - | 111,909,475 | - | 36,750,771 |
| 취 득 | - | 28,940,000 | 1,826,168,773 | 69,456,000 |
| 처 분 | - | - | (1,569,000,000) | - |
| 평 가 | - | 3,500,210 | - | 5,702,704 |
| 손 익 | - | - | (257,168,773) | - |
| 기 말 | - | 144,349,685 | - | 111,909,475 |
9. 기타포괄손익-공정가치 측정 지분상품
보고기간종료일 현재 기타포괄손익-공정가치 측정 지분상품의 내역은 다음과 같습니다.
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 회사명 | 주식수(주) | 취득원가 | 공정가치 | 미실현보유 손익누계액 |
장부금액 |
| (주)로보쓰리(*) | 234,000 | 987,480,000 | - | - | - |
| (주)메드푸드 | 67,000 | 1,005,000,000 | 462,568,000 | (542,432,000) | 462,568,000 |
| 합 계 | 1,992,480,000 | 462,568,000 | (542,432,000) | 462,568,000 | |
(*) 당분기 중 소유주식 전량을 매각하였습니다. 매각 된 주식의 공정가치는 119,237,444원이며, 관련하여 세후기타포괄손실로 인식된 677,229,194원은 처분 후 결손금으로 대체되었습니다.
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 회사명 | 주식수(주) | 취득원가 | 공정가치 | 미실현보유 손익누계액 |
장부금액 |
| (주)로보쓰리 | 234,000 | 987,480,000 | 157,716,000 | (829,764,000) | 157,716,000 |
| (주)메드푸드 | 27,000 | 405,000,000 | 186,408,000 | (218,592,000) | 186,408,000 |
| 합 계 | 1,392,480,000 | 344,124,000 | (1,048,356,000) | 344,124,000 | |
10. 기타금융자산
보고기간종료일 현재 기타금융자산 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 단기금융상품 | 98,802,600,000 | - | 88,645,952,579 | - |
| 단기대여금 | 118,490,000 | - | 108,800,000 | - |
| 장기대여금 | - | 30,450,000 | - | 82,650,000 |
| 보증금 | - | 825,141,773 | - | 625,982,014 |
| 합 계 | 98,921,090,000 | 855,591,773 | 88,754,752,579 | 708,632,014 |
11. 매출채권및기타채권
11-1. 보고기간종료일 현재 매출채권및기타채권 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 매출채권 | 5,043,988,374 | 5,066,709,475 |
| (대손충당금) | (537,858,027) | (880,995,526) |
| 미수금 | 706,939,021 | 585,408,482 |
| (대손충당금) | (499,532,805) | (499,532,805) |
| 미수수익 | 496,320,125 | 295,484,583 |
| 합 계 | 5,209,856,688 | 4,567,074,209 |
11-2. 보고기간종료일 현재 매출채권및기타채권 대손충당금 변동내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 매출채권 | 미수금 | 매출채권 | 미수금 | |
| 기초잔액 | 880,995,526 | 499,532,805 | 1,012,078,338 | 499,532,805 |
| 대손상각비(환입) | (343,137,499) | - | (131,082,812) | - |
| 기말잔액 | 537,858,027 | 499,532,805 | 880,995,526 | 499,532,805 |
11-3. 보고기간종료일 현재 매출채권및기타채권 연령분석은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 6개월이하 | 6개월초과 1년이하 |
1년초과 | 합 계 | |
| 당분기말 | 매출채권 | 5,043,988,374 | 4,503,143,871 | - | 540,844,503 | 5,043,988,374 |
| 미수금 | 706,939,021 | 24,589,216 | 182,817,000 | 499,532,805 | 706,939,021 | |
| 미수수익 | 496,320,125 | 496,320,125 | - | - | 496,320,125 | |
| 전기말 | 매출채권 | 5,066,709,475 | 4,169,091,601 | - | 897,617,874 | 5,066,709,475 |
| 미수금 | 585,408,482 | 85,875,677 | - | 499,532,805 | 585,408,482 | |
| 미수수익 | 295,484,583 | 295,484,583 | - | - | 295,484,583 | |
12. 재고자산
보고기간종료일 현재 재고자산 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||||
| 취득원가 | 평가손실충당금 | 장부금액 | 취득원가 | 평가손실충당금 | 장부금액 | |
| 제 품 | 6,278,102,154 | (2,461,892,153) | 3,816,210,001 | 8,161,655,609 | (1,771,799,442) | 6,389,856,167 |
| 상 품 | 356,827,714 | (170,710,250) | 186,117,464 | 589,338,383 | (2,660,000) | 586,678,383 |
| 재공품 | 406,000,272 | (31,498,754) | 374,501,518 | 158,771,645 | (77,893,904) | 80,877,741 |
| 원재료 | 3,908,363,235 | (1,032,834,000) | 2,875,529,235 | 3,082,361,560 | (961,936,784) | 2,120,424,776 |
| 미착품 | 320,130,360 | - | 320,130,360 | - | - | - |
| 합 계 | 11,269,423,735 | (3,696,935,157) | 7,572,488,578 | 11,992,127,197 | (2,814,290,130) | 9,177,837,067 |
13. 기타자산
보고기간종료일 현재 기타자산 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 선급금 | 33,702,143 | - | 286,242,651 | - |
| 선급비용 | 39,533,672 | - | 95,169,955 | - |
| 반환제품회수권(*) | 178,781,697 | - | 150,264,030 | - |
| 합 계 | 252,017,512 | - | 531,676,636 | - |
(*) 반환제품회수권은 고객이 반품권을 행사하면 고객으로부터 제품을 회수할 권리를 나타냅니다.
14. 유형자산
14-1. 보고기간종료일 현재 유형자산의 세부 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기말 |
전기말 |
||||
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 토 지 | 6,249,229,959 | - | 6,249,229,959 | 6,249,229,959 | - | 6,249,229,959 |
| 건 물 | 5,755,432,267 | (1,343,055,107) | 4,412,377,160 | 5,755,432,267 | (1,235,140,796) | 4,520,291,471 |
| 구축물 | 336,209,043 | (116,073,727) | 220,135,316 | 336,209,043 | (109,769,848) | 226,439,195 |
| 기계장치 | 10,400,333,152 | (7,690,054,510) | 2,710,278,642 | 9,658,076,336 | (7,335,741,310) | 2,322,335,026 |
| 차량운반구 | 55,693,811 | (45,349,138) | 10,344,673 | 55,693,811 | (42,611,644) | 13,082,167 |
| 공구와기구 | 2,082,043,952 | (1,397,261,750) | 684,782,202 | 2,033,801,006 | (1,227,708,966) | 806,092,040 |
| 비 품 | 1,586,594,942 | (740,736,583) | 845,858,359 | 1,042,016,591 | (597,297,481) | 444,719,110 |
| 사용권자산 | 1,278,105,817 | (771,606,303) | 506,499,514 | 821,035,209 | (293,029,706) | 528,005,503 |
| 건설중인자산 | 188,100,000 | - | 188,100,000 | 559,019,000 | - | 559,019,000 |
| 합 계 | 27,931,742,943 | (12,104,137,118) | 15,827,605,825 | 26,510,513,222 | (10,841,299,751) | 15,669,213,471 |
14-2. 당분기 및 전기 중 유형자산 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 처 분 | 대 체 | 감가상각 | 외환차이조정 | 기 말 |
| 토 지 | 6,249,229,959 | - | - | - | - | - | 6,249,229,959 |
| 건 물 | 4,520,291,471 | - | - | - | (107,914,311) | - | 4,412,377,160 |
| 구축물 | 226,439,195 | - | - | - | (6,303,879) | - | 220,135,316 |
| 기계장치 | 2,322,335,026 | 14,920,000 | (20,770,483) | 815,113,404 | (421,319,305) | - | 2,710,278,642 |
| 차량운반구 | 13,082,167 | - | - | - | (2,737,494) | - | 10,344,673 |
| 공구와기구 | 806,092,040 | 54,964,000 | (1,000) | - | (176,272,838) | - | 684,782,202 |
| 비 품 | 444,719,110 | 72,436,302 | (1,000) | 475,738,492 | (148,803,012) | 1,768,467 | 845,858,359 |
| 사용권자산 | 528,005,503 | 469,303,492 | (836,178) | - | (501,064,009) | 11,090,706 | 506,499,514 |
| 건설중인자산 | 559,019,000 | 940,091,546 | - | (1,311,010,546) | - | - | 188,100,000 |
| 합 계 | 15,669,213,471 | 1,551,715,340 | (21,608,661) | (20,158,650) | (1,364,414,848) | 12,859,173 | 15,827,605,825 |
<전기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 처 분 | 대 체(*) | 감가상각 | 외환차이조정 | 기 말 |
| 토 지 | 610,907,280 | - | - | 5,638,322,679 | - | - | 6,249,229,959 |
| 건 물 | 4,641,244,449 | - | (107,274,451) | 130,000,000 | (143,678,527) | - | 4,520,291,471 |
| 구축물 | 234,844,415 | - | - | - | (8,405,220) | - | 226,439,195 |
| 기계장치 | 3,122,440,009 | 26,910,000 | (23,491,805) | 170,500,000 | (974,023,178) | - | 2,322,335,026 |
| 차량운반구 | 16,732,167 | - | - | - | (3,650,000) | - | 13,082,167 |
| 공구와기구 | 809,381,141 | 203,998,130 | - | - | (207,287,231) | - | 806,092,040 |
| 비 품 | 468,639,553 | 44,548,356 | - | 82,650,000 | (149,638,483) | (1,480,316) | 444,719,110 |
| 사용권자산 | 484,367,995 | 448,951,519 | (52,208,216) | - | (345,065,144) | (8,040,651) | 528,005,503 |
| 건설중인자산 | 4,424,102,237 | 2,156,389,442 | - | (6,021,472,679) | - | - | 559,019,000 |
| 합 계 | 14,812,659,246 | 2,880,797,447 | (182,974,472) | - | (1,831,747,783) | (9,520,967) | 15,669,213,471 |
(*) 전기 중 오송산업단지와 관련하여 건설중인자산에서 토지 (5,638,322,679원)로 대체되었습니다.
14-3. 보고기간종료일 현재 사용권자산의 현황은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 건물 | 425,252,267 | 392,538,624 |
| 차량운반구 | 68,576,844 | 118,410,569 |
| 비품 | 12,670,403 | 17,056,310 |
| 합 계 | 506,499,514 | 528,005,503 |
14-4. 당분기 및 전기 중 차입원가 자본화 내역은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 계정과목 | 당분기 | 전 기 | 비 고 |
| 건설중인자산 | - | 36,488,759 | 오송산업단지 토지 |
14-5. 보고기간종료일 현재 보유한 토지의 공시지가는 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 소재지 | 면적(㎡) | 당분기말 | 전기말 | ||
| 장부금액 | 공시지가 | 장부금액 | 공시지가 | ||
| 충북 제천시 바이오밸리로 59 | 7,559 | 610,907,280 | 709,790,100 | 610,907,280 | 679,554,100 |
| 충북 청주시 흥덕구 오송읍 정중리 726번지 | 17,499 | 5,638,322,679 | 3,832,281,000 | 5,638,322,679 | 3,587,295,000 |
| 합 계 | 6,249,229,959 | 4,542,071,100 | 6,249,229,959 | 4,266,849,100 | |
14-6. 보고기간종료일 현재 보험가입내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 보험종류 | 보험회사 | 부보대상 | 장부금액 | 부보금액 |
| 화재보험 | MG손해보험 | 건물 | 4,412,377,160 | 9,305,406,623 |
| 구축물 | 220,135,316 | |||
| 기계장치 | 2,710,278,642 | |||
| 합 계 | 7,342,791,118 | 9,305,406,623 | ||
연결회사는 상기 이외 차량운반구와 관련하여 자동차종합보험 및 책임보험에 가입하고 있습니다.
15. 무형자산
15-1. 보고기간종료일 현재 무형자산의 세부 내역은 다음과 같습니다.
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당분기말 |
전기말 |
||||||
| 취득원가 | 상각누계액 | 손상차손누계액 | 장부금액 | 취득원가 | 상각누계액 | 손상차손누계액 | 장부금액 | |
| 산업재산권 | 1,204,782,800 | (460,996,553) | (4,569,832) | 739,216,415 | 1,118,827,506 | (386,611,952) | (4,569,832) | 727,645,722 |
| 개발비 | 2,703,414,008 | (2,678,902,413) | (24,511,595) | - | 2,703,414,008 | (2,677,728,098) | (24,511,595) | 1,174,315 |
| 회원권 | 306,390,015 | - | (58,566,000) | 247,824,015 | 258,566,000 | - | (58,566,000) | 200,000,000 |
| 기타무형자산 | 646,488,237 | (351,602,948) | - | 294,885,289 | 646,488,237 | (254,796,554) | - | 391,691,683 |
| 건설중인자산 | 1,010,840,606 | - | - | 1,010,840,606 | 648,994,343 | - | - | 648,994,343 |
| 합 계 | 5,871,915,666 | (3,491,501,914) | (87,647,427) | 2,292,766,325 | 5,376,290,094 | (3,319,136,604) | (87,647,427) | 1,969,506,063 |
15-2. 당분기 및 전기 중 무형자산 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 상 각 | 손상차손 | 대 체 | 기 말 |
| 산업재산권 | 727,645,722 | - | (74,384,601) | - | 85,955,294 | 739,216,415 |
| 개발비 | 1,174,315 | - | (1,174,315) | - | - | - |
| 회원권 | 200,000,000 | 47,824,015 | - | - | - | 247,824,015 |
| 기타무형자산 | 391,691,683 | - | (96,806,394) | - | - | 294,885,289 |
| 건설중인자산 | 648,994,343 | 464,513,039 | - | - | (102,666,776) | 1,010,840,606 |
| 합 계 | 1,969,506,063 | 512,337,054 | (172,365,310) | - | (16,711,482) | 2,292,766,325 |
<전기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 상 각 | 손상차손 | 대 체 | 기 말 |
| 산업재산권 | 422,126,192 | - | (67,052,440) | (1,523,998) | 374,095,968 | 727,645,722 |
| 개발비 | 9,398,070 | - | (8,223,755) | - | - | 1,174,315 |
| 회원권 | - | 258,566,000 | - | (58,566,000) | - | 200,000,000 |
| 기타무형자산 | 518,266,463 | 2,300,000 | (128,874,780) | - | - | 391,691,683 |
| 건설중인자산 | 621,254,205 | 443,483,295 | - | - | (415,743,157) | 648,994,343 |
| 합 계 | 1,571,044,930 | 704,349,295 | (204,150,975) | (60,089,998) | (41,647,189) | 1,969,506,063 |
15-3. 당분기 및 전분기 중 무형자산상각비 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 판매비와관리비 | 57,503,298 | 172,365,310 | 50,362,878 | 149,196,887 |
15-4. 당분기 및 전분기 중 경상개발비의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 판매비와관리비 | 2,600,082,085 | 7,734,351,477 | 4,219,741,521 | 9,351,700,818 |
15-5. 보고기간종료일 현재 연결회사가 진행 중인 EC-18 임상시험의 내역은 다음과같습니다.
| 임상명 | 임상단계 |
| 호중구감소증(CIN) | 임상2상 Part 1 완료 / 임상2상 Part 2 승인 |
| 구강점막염(CRIOM) | 임상2상 Stage 2 결과 통계분석 |
| 급성방사선증후군(ARS) | 임상2상에 준하는 영장류 시험 진행 |
| 코로나19치료제(COVID-19) | 임상2상 완료(국내) / 임상2상 진행중(미국) |
16. 정부보조금
16-1. 보고기간종료일 현재 진행 중인 정부과제 내역은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 과제명 | 전문기관 | 계약기간 | 총 사업비 | 정부보조금 |
| 1 | 라푸티딘의 전구체인 PTBA-MA의 개발 및 사업화 | 한국산업기술진흥원 | 2020.05.01 ~ 2021.04.30 | 200,000,000 | 160,000,000 |
| 2 | 중견기업 글로벌 지원산업 | 대한무역투자진흥공사 | 2021.02.01 ~ 2022.01.31 | 100,000,000 | 70,000,000 |
| 3 | 글로벌 IP 스타기업 지원사업 | 충북지식재산센터 | 2021.03.30 ~ 2021.12.31 | 70,000,000 | 70,000,000 |
| 4 | 소염진통제인 펠루비프로펜의 연구개발 및 사업화 | 한국산업기술진흥원 | 2021.04.01 ~ 2022.03.31 | 190,000,000 | 150,000,000 |
| 5 | 구직자 참여형 바이오 R&D 지원 사업 | 충북대학교 산학협력단 | 2021.05.26 ~ 2021.12.31 | 16,000,000 | 16,000,000 |
| 6 | 급성방사선증후군 치료제 개발을 위한 전임상연구 | 한국방사선진흥협회 | 2021.06.14 ~ 2022.12.13 | 116,250,000 | 90,000,000 |
16-2. 당분기 및 전기 중 정부보조금 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 과제명 | 관련 계정 | 기 초 | 수령금액 | 반환금액 | 사용금액 | 기 말 | |
| 자산취득 | 비용보전 등 | |||||||
| 1 | PTBA-MA의 개발 및 사업화 | 현금및현금성자산 | - | 39,592,021 | (73,170) | - | (39,518,851) | - |
| 2 | 중견기업 글로벌 지원산업 | 현금및현금성자산 | - | 5,688,410 | - | - | (5,688,410) | - |
| 3 | 글로벌 IP 스타기업 지원사업 | 현금및현금성자산 | - | 56,610,000 | - | - | (56,610,000) | - |
| 4 | 펠루비프로펜 개발 및 사업화 | 현금및현금성자산 | - | 3,084,414 | - | - | (3,084,414) | - |
| 5 | 구직자 참여형 바이오 R&D 지원 사업 | 현금및현금성자산 | - | 13,950,420 | - | - | (13,950,420) | - |
| 6 | 급성방사선증후군 치료제 개발을 위한 전임상연구 | 현금및현금성자산 | - | 45,000,000 | - | - | - | 45,000,000 |
| 합 계 | - | 163,925,265 | (73,170) | - | (118,852,095) | 45,000,000 | ||
<전기>
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 과제명 | 관련 계정 | 기 초 | 수령금액 | 반환금액 | 사용금액 | 기 말 | |
| 자산취득 | 비용보전 등 | |||||||
| - | MRI 조영제 가도부트롤 개발 | 현금및현금성자산 | - | 50,026,438 | (776,662) | (49,249,776) | - | |
| 매입채무및기타채무 | 21,977,055 | - | - | - | (21,977,055) | - | ||
| - | 보티옥세틴 연구개발과 사업화 | 현금및현금성자산 | - | 56,577,547 | (17,350,651) | - | (39,226,896) | - |
| - | 거대고리형 MRI조영제 가도테리돌 개발 | 현금및현금성자산 | 18,145,744 | 40,018,234 | (4,837,825) | - | (53,326,153) | - |
| - | 가도테릭산을 이용한 MRI조영제 의약품 개발 | 현금및현금성자산 | - | 11,457,178 | - | - | (11,457,178) | - |
| 1 | PTBA-MA의 개발 및 사업화 | 현금및현금성자산 | - | 118,059,022 | - | - | (118,059,022) | - |
| - | 신약개발물질 유전독성 평가연구 | 현금및현금성자산 | - | 16,000,000 | - | - | (16,000,000) | - |
| 합 계 | 40,122,799 | 292,138,419 | (22,965,138) | - | (309,296,080) | - | ||
16-3. 미이행조건과 우발상황
보고기간종료일 현재 재무제표에 인식된 정부보조금과 관련하여 미이행조건 및 기타
우발상황은 존재하지 아니합니다.
17. 차입금
17-1. 보고기간종료일 현재 단기차입금 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 차입기관 | 이자율(%) | 당분기말 | 전기말 |
| 운영자금 | KDB산업은행 | 2.06 | 1,600,000,000 | 1,600,000,000 |
| 운영자금 | KDB산업은행 | 3.46 | 2,000,000,000 | 2,000,000,000 |
| 운영자금 | IBK기업은행 | 2.84 | 1,500,000,000 | 780,000,000 |
| 합 계 | 5,100,000,000 | 4,380,000,000 | ||
17-2. 보고기간종료일 현재 장기차입금 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 차입기관 | 이자율(%) | 당분기말 | 전기말 |
| 시설자금 | KDB산업은행 | 2.36 | 3,758,260,000 | 4,100,000,000 |
| 시설자금 | IBK기업은행 | 3.48 | 3,000,000,000 | 3,000,000,000 |
| 소 계 | 6,758,260,000 | 7,100,000,000 | ||
| 차감: 1년 이내 만기도래분(유동성장기부채) | (2,866,640,000) | (1,058,400,000) | ||
| 차감 후 잔액 | 3,891,620,000 | 6,041,600,000 | ||
17-3. 보고기간종료일 현재 장기차입금의 연도별 상환계획은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 차입기관 | 1년 이내 | 1년 초과~2년 이내 | 2년 초과 | 합 계 |
| 시설자금 | KDB산업은행 | 1,366,640,000 | 1,366,640,000 | 1,024,980,000 | 3,758,260,000 |
| 시설자금 | IBK기업은행 | 1,500,000,000 | 1,500,000,000 | - | 3,000,000,000 |
| 합 계 | 2,866,640,000 | 2,866,640,000 | 1,024,980,000 | 6,758,260,000 | |
18.전환사채
18-1. 보고기간종료일 현재 전환사채 내역은 다음과 같습니다.
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 종 류 | 발행일 | 만기일 | 연이자율(%) | 당분기말 | 전기말 |
| 제2회 무기명식 무보증 사모 전환사채 | 2020.11.06 | 2025.11.06 | - | 50,000,000,000 | 50,000,000,000 |
| 사채할인발행차금 | (2,373,005) | (3,650,891) | |||
| 전환권조정 | (12,296,465,682) | (18,918,228,124) | |||
| 소 계 | 37,701,161,313 | 31,078,120,985 | |||
| 차감 : 1년 이내 만기도래분 | - | - | |||
| 합 계 | 37,701,161,313 | 31,078,120,985 | |||
18-2. 당분기 및 전기 중 전환사채의 변동 내역은 다음과 같습니다.
<당분기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 발 행 | 조기상환 | 상각액 | 기 말 |
| 액면금액 | 50,000,000,000 | - | - | - | 50,000,000,000 |
| 사채할인발행차금 | (3,650,891) | - | - | 1,277,886 | (2,373,005) |
| 전환권조정 | (18,918,228,124) | - | - | 6,621,762,442 | (12,296,465,682) |
| 장부금액 | 31,078,120,985 | - | - | 6,623,040,328 | 37,701,161,313 |
<전기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 발 행 | 조기상환 | 상각액 | 기 말 |
| 액면금액 | - | 50,000,000,000 | - | - | 50,000,000,000 |
| 사채할인발행차금 | - | (3,884,240) | - | 233,349 | (3,650,891) |
| 전환권조정 | - | (20,127,400,000) | - | 1,209,171,876 | (18,918,228,124) |
| 장부금액 | - | 29,868,715,760 | - | 1,209,405,225 | 31,078,120,985 |
18-3. 보고기간종료일 현재 전환사채의 발행조건은 다음과 같습니다.
| 구 분 | 내 용 |
|---|---|
| 사채의 명칭 | 제2회 무기명식 이권부 무보증 사모 전환사채 |
| 액면금액 | 50,000,000,000원 |
| 발행가액 | 50,000,000,000원 |
| 발행일자 | 2020.11.06 |
| 만기일자 | 2025.11.06 |
| 이자지급조건 | 0% |
| 보장수익률 | 0% |
| 상환방법 | 만기보유 사채 만기일 일시상환 |
| 전환청구기간 | 2021.11.06 ~ 2025.10.06 |
| 전환가액(*) | 89,082 원 |
| 전환가액 조정 | - 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 사채 발행일 이 후 3개월이 지난 시점부터 매 3개월마다 시가 변동에 따라 전환가격 평가 |
| 조기상환청구권 | 발행일로부터 24개월이 되는 2022년 11월 06일 및 이후 3개월에 해당되는 날 |
(*) 최초 전환가액은 100,196원이었으나, 전환가액 조정으로 89,082원으로 변경되었으며, 전환가액 조정으로 인해 전환가능주식수는 561,280주로 변경 되었습니다.
19. 매입채무및기타채무
보고기간종료일 현재 매입채무및기타채무 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 매입채무 | 2,148,734,069 | - | 867,650,649 | - |
| 미지급금 | 1,806,351,112 | - | 2,815,303,298 | - |
| 미지급비용 | 15,041,995 | - | 15,768,056 | - |
| 합 계 | 3,970,127,176 | - | 3,698,722,003 | - |
20. 리스부채
20-1. 보고기간종료일 현재 리스부채 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 건물 | 217,808,561 | 174,391,624 | 119,917,260 | 249,204,658 |
| 차량운반구 | 60,892,740 | 11,505,478 | 65,842,778 | 56,332,099 |
| 비품 | 5,780,998 | 7,209,272 | 5,520,562 | 11,578,158 |
| 합 계 | 284,482,299 | 193,106,374 | 191,280,600 | 317,114,915 |
20-2. 당분기 및 전기 중 리스부채의 변동내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전 기 |
| 기 초 | 508,395,515 | 475,531,247 |
| 증 가 | 359,305,664 | 394,095,041 |
| 감 소 | (29,215,925) | (123,769,332) |
| 지 급 | (360,896,581) | (237,461,441) |
| 기 말 | 477,588,673 | 508,395,515 |
20-3. 보고기간종료일 현재 리스에 따라 지급할 것으로 예상되는 최소리스료의 현재가치는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 최소리스료 | 현재가치 | 최소리스료 | 현재가치 | |
| 1년 이내 | 301,289,400 | 284,482,299 | 224,485,290 | 191,280,600 |
| 1년 초과 5년 이내 | 205,307,775 | 193,106,374 | 353,775,920 | 317,114,915 |
| 합 계 | 506,597,175 | 477,588,673 | 578,261,210 | 508,395,515 |
20-4. 당분기 및 전분기 중 당기손익으로 인식한 금액은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용(금융원가에 포함) | 8,184,057 | 28,988,057 | 7,413,730 | 25,243,464 |
| 단기리스료(매출원가 및 판매관리비에 포함) | - | - | - | - |
| 소액자산 리스료(매출원가 및 판매관리비에 포함) | 4,106,512 | 14,343,252 | 4,263,671 | 11,913,840 |
| 리스부채 측정치에 포함되지 않은 변동리스료(판매관리비에 포함) | 14,607,949 | 40,062,668 | 30,602,271 | 90,135,584 |
| 리스료 할인(영업외수익에 포함) | 445,119 | (292,129) | (3,437,740) | (10,438,202) |
20-5. 당분기 및 전분기 중 리스로 인한 현금유출액은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 리스 관련 총현금유출액 | 162,063,285 | 443,998,429 | 98,459,524 | 291,686,044 |
21. 기타부채
보고기간종료일 현재 기타부채 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 예수금 | 173,333,010 | - | 160,962,336 | - |
| 선수금 | 440,900,308 | - | 127,082,246 | - |
| 합 계 | 614,233,318 | - | 288,044,582 | - |
22. 충당부채
22-1. 보고기간종료일 현재 충당부채 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 환불부채(*) | 185,681,730 | - | 167,384,219 | - |
| 복구충당부채 | 95,926,891 | - | - | - |
| 합 계 | 281,608,621 | - | 167,384,219 | - |
(*) 환불부채는 반품할 수 있는 고객의 권리와 관련하여 고객이 반품할 것으로 추정되는 금액이며, 동 환불부채에 상응하여 수익인식금액이 조정됩니다.
22-2. 당분기 및 전기 중 충당부채의 변동내역은 다음과 같습니다.
<당분기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 전 입 | 환 입 | 대 체 | 기 말 |
| 환불부채 | 167,384,219 | 18,297,511 | - | - | 185,681,730 |
| 복구충당부채 | - | 95,926,891 | - | - | 95,926,891 |
| 합 계 | 167,384,219 | 114,224,402 | - | - | 281,608,621 |
<전기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 전 입 | 환 입 | 대 체 | 기 말 |
| 환불부채 | 199,221,909 | - | (31,837,690) | - | 167,384,219 |
| 소송충당부채(*) | 1,587,449,738 | - | (1,277,903,597) | (309,546,141) | - |
| 합 계 | 1,786,671,647 | - | (1,309,741,287) | (309,546,141) | 167,384,219 |
(*) 전기 중 진행 중이던 소송에서 연결회사는 최종 패소하였으며, 관련 부채 309,546천원을 미지급금으로 계상하였습니다.
23. 순확정급여부채
23-1. 보고기간종료일 현재 순확정급여부채 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 확정급여채무 | 2,694,914,508 | 2,542,914,701 |
| 사외적립자산 | (1,145,898,310) | (1,138,772,325) |
| 순확정급여부채 | 1,549,016,198 | 1,404,142,376 |
23-2. 당분기 및 전분기 중 순확정급여부채와 관련하여 포괄손익계산서에 반영된 금액 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 당기근무원가 | 407,930,133 | 382,100,225 |
| 이자원가 | - | 16,050,859 |
| 사외적립자산의 기대수익 | (7,563,835) | (16,876,344) |
| 합 계 | 400,366,298 | 381,274,740 |
23-3. 당분기 및 전분기 중 기타포괄손익으로 인식한 각 요소별 금액 내역은 다음과
같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 재측정손익 | - | (7,307,082) |
| 법인세효과 | - | 1,607,558 |
| 합 계 | - | (5,699,524) |
23-4. 보고기간종료일 현재 사외적립자산의 구성내역은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 예치기관 | 구성내역 | 당분기말 | 전기말 |
| 우리은행 | 정기예금 | 326,624,739 | 325,873,958 |
| IBK기업은행 | 정기예금 | 819,273,571 | 600,390,643 |
| 하나은행 | 정기예금 | - | 212,507,724 |
| 합 계 | 1,145,898,310 | 1,138,772,325 | |
24. 자본금 및 자본잉여금
24-1. 보고기간종료일 현재 자본금 내역은 다음과 같습니다.
| (단위: 원, 주) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 발행할 주식의 총수(주) | 100,000,000 | 100,000,000 |
| 1주의 금액(원) | 500 | 500 |
| 발행한 보통주식의 수(주) | 8,331,345 | 8,247,200 |
| 발행한 우선주식의 수(주) | 379,137 | 48,113 |
| 보통주자본금(원) | 4,165,672,500 | 4,123,600,000 |
| 우선주자본금(원) | 189,568,500 | 24,056,500 |
24-2. 당분기 및 전기 중 자본금 변동내역은 다음과 같습니다.
| (단위: 원, 주) | ||||
|---|---|---|---|---|
| 구 분 | 보통주 자본금 | 우선주 자본금 | ||
| 주식수(주) | 금 액 | 주식수(주) | 금 액 | |
| 전기초 | 7,859,262 | 3,929,631,000 | 334,575 | 167,287,500 |
| 주식매수선택권 행사 | 6,000 | 3,000,000 | - | - |
| 전환우선주의 행사 | 381,938 | 190,969,000 | (286,462) | (143,231,000) |
| 전기말 | 8,247,200 | 4,123,600,000 | 48,113 | 24,056,500 |
| 당기초 | 8,247,200 | 4,123,600,000 | 48,113 | 24,056,500 |
| 주식매수선택권 행사 | 20,000 | 10,000,000 | - | - |
| 전환우선주의 발행 | - | - | 379,137 | 189,568,500 |
| 전환우선주의 행사 | 64,145 | 32,072,500 | (48,113) | (24,056,500) |
| 당분기말 | 8,331,345 | 4,165,672,500 | 379,137 | 189,568,500 |
24-3. 보고기간종료일 현재 자본잉여금의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 보통주 | 우선주 | 보통주 | 우선주 | |
| 주식발행초과금 | 148,299,295,512 | 29,811,493,420 | 144,394,678,501 | 3,786,323,320 |
| 기타자본잉여금 | 338,601,096 | - | 338,601,096 | - |
| 합 계 | 148,637,896,608 | 29,811,493,420 | 144,733,279,597 | 3,786,323,320 |
24-4. 보고기간종료일 현재 전환우선주의 내역은 다음과 같습니다.
| 구 분 | 제4차 전환우선주(*) | 제5차 전환우선주 | 제6차 전환우선주 |
|---|---|---|---|
| 발행일 | 2019년 04월 25일 | 2021년 03월 03일 | 2021년 03월 08일 |
| 발행주식수 | 446,085 주 | 299,764 주 | 79,373 주 |
| 1주당 발행가액 | 59,400 원 | 78,400 원 | 81,900 원 |
| 총 발행가액 | 26,498,340,000 원 | 23,501,497,600 원 | 6,500,648,700 원 |
| 전환대상 및 전환비율 | 보통주와 1:1.33로 전환가능 | 보통주와 1:1로 전환가능 | 보통주와 1:1로 전환가능 |
| 전환권 행사기간 | 발행일로부터 1년 경과후 존속기간 내 (존속기간은 발행일로부터 5년) |
발행일로부터 1년 경과후 존속기간 내 (존속기간은 발행일로부터 5년) |
발행일로부터 1년 경과후 존속기간 내 (존속기간은 발행일로부터 5년) |
| 전환가액 조정 | - 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 우선주 발행일 이 후 3개월이 지난 시점부터 매 3개월 마다 시가 변동에 따라 전환가격 평가 |
- 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 우선주 발행일 이 후 3개월이 지난 시점부터 매 3개월 마다 시가 변동에 따라 전환가격 평가 |
- 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 우선주 발행일 이 후 3개월이 지난 시점부터 매 3개월 마다 시가 변동에 따라 전환가격 평가 |
(*) 당분기 중 잔여 우선주 모두 보통주로 전환 되었습니다.
25. 기타자본
25-1. 보고기간종료일 현재 기타자본 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 주식매수선택권 | 648,129,339 | 100,659,401 |
| 전환권대가 | 15,699,372,000 | 15,699,372,000 |
| 합 계 | 16,347,501,339 | 15,800,031,401 |
25-2. 주식선택권
25-2-1. 주식기준보상
연결회사는 주주총회 결의에 의거 지배기업의 임직원 등에게 주식선택권을 부여하였으며, 주요 사항은 다음과 같습니다.
| - | 주식선택권으로 발행할 주식의 종류 : 기명식 보통주식 |
| - | 부여방법 : 기명식 보통주 신주발행교부 |
| - | 가득조건 및 행사가능시점 : 부여일 이후 2년 동안 지배기업에 용역을 제공한 자에 한하여 부여일로부터 2년이 경과한 날로부터 3년 이내에 행사가능 |
25-2-2. 주식선택권 현황
보고기간종료일 현재 유효한 주식선택권 현황은 다음과 같습니다.
| (단위: 원, 주) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 차 수 | 부여일자 | 주당 행사가격 | 최초 부여수량 | 미행사 기초수량 | 당기 부여수량 | 당기 행사수량 | 당기 취소수량 | 미행사 기말수량 |
| 1차 | 2013.12.04 | 3,665 | 120,000 | - | - | - | - | - |
| 2차 (*) | 2014.06.24 | 5,066 | 150,000 | 20,000 | - | 20,000 | - | - |
| 3차 | 2014.12.31 | 25,100 | 44,500 | - | - | - | - | - |
| 4차 | 2015.01.23 | 30,200 | 72,000 | - | - | - | - | - |
| 5차 | 2015.06.26 | 58,700 | 63,000 | - | - | - | - | - |
| 6차 | 2016.10.21 | 51,200 | 197,000 | - | - | - | - | - |
| 7차 | 2017.03.30 | 29,000 | 10,000 | - | - | - | - | - |
| 8차 | 2018.03.22 | 98,000 | 3,000 | - | - | - | - | - |
| 9차 | 2018.06.29 | 81,000 | 5,000 | 1,000 | - | - | 1,000 | - |
| 10차 | 2019.10.02 | 50,500 | 10,000 | 10,000 | - | - | - | 10,000 |
| 11차 | 2019.11.04 | 59,600 | 1,000 | 1,000 | - | - | - | 1,000 |
| 12차 | 2020.06.22 | 93,000 | 1,000 | - | - | - | - | - |
| 13차 | 2021.03.12 | 97,100 | 41,000 | - | 41,000 | - | - | 41,000 |
| 14차 | 2021.03.31 | - | 3,000 | - | 3,000 | - | - | 3,000 |
| 합 계 | 720,500 | 32,000 | 44,000 | 20,000 | 1,000 | 55,000 | ||
(*) 전기 중 소송판결에 의하여 주식매수선택권이 재부여 되었습니다.
25-2-3. 보상원가 산정
연결회사는 부여된 주식선택권의 보상원가를 이항모형을 적용한 공정가액접근법을 적용하여 산정하였으며, 보상원가를 산정하기 위한 제반 가정 및 변수는 다음과 같습니다.
| (단위: 원, %) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 1차 | 2차 | 3차 | 4차 | 5차 | 6차 | 7차 | 8차 | 9차 | 10차 | 11차 | 12차 | 13차 | 14차 |
| 측정시점의 공정가치 | 1,379 | 1,780 | 18,935 | 14,769 | 21,380 | 1,921 | 513 | 13,946 | 10,662 | 6,605 | 13,510 | 19,905 | 46,555 | 50,913 |
| 측정시점의 주가 | 4,800 | 6,500 | 44,500 | 44,500 | 77,100 | 50,000 | 26,450 | 104,000 | 85,000 | 50,100 | 66,100 | 99,500 | 104,100 | 121,500 |
| 주가변동성(*) | 19.45 | 19.26 | 18.10 | 18.10 | 20.12 | 7.10 | 5.20 | 8.30 | 8.90 | 17.00 | 19.00 | 23.10 | 63.10 | 60.60 |
| 무위험수익률 | 2.72 | 2.39 | 1.73 | 1.73 | 1.63 | 1.44 | 1.69 | 2.29 | 2.12 | 1.35 | 1.60 | 0.86 | 1.30 | 1.22 |
| 할인율 | 6.64 | 6.35 | 5.68 | 5.68 | 4.96 | 15.84 | 1.69 | 2.29 | 2.12 | 1.35 | 1.60 | 0.86 | 1.30 | 1.22 |
(*) 주가변동성은 상장종가 1년 영업일 기준 변동성에 기초하여 산출한 주가의 연속복리 투자수익률의 표준편차입니다.
25-2-4. 당분기 및 전분기 중 비용으로 인식한 주식기준보상은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 주식보상비용 | 269,816,880 | 583,075,869 | 12,521,730 | 37,826,306 |
26. 결손금
보고기간종료일 현재 결손금 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 기업합리화적립금 | 6,514,167 | 6,514,167 |
| 미처리결손금 | (116,409,959,665) | (95,182,867,567) |
| 합 계 | (116,403,445,498) | (95,176,353,400) |
27. 기타포괄손익누계액
보고기간종료일 현재 기타포괄손익누계액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 |
(423,096,960) | (817,717,680) |
| 해외사업환산손익 | 29,183,653 | 9,320,163 |
| 합 계 | (393,913,307) | (808,397,517) |
28. 매출액
당분기 및 전분기 중 매출액 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 제품매출 | 5,559,569,234 | 16,185,138,545 | 4,095,119,331 | 21,054,039,527 |
| 상품매출 | 5,000,000 | 298,926,419 | 42,454,546 | 531,647,546 |
| 기타매출 | (11,664,962) | 864,562 | 270,888,000 | 280,670,756 |
| 합 계 | 5,552,904,272 | 16,484,929,526 | 4,408,461,877 | 21,866,357,829 |
29. 판매비와관리비
당분기 및 전분기 중 판매비와관리비 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 1,028,836,194 | 4,168,980,719 | 799,954,921 | 2,195,773,032 |
| 퇴직급여 | 99,262,839 | 307,673,232 | 36,309,609 | 122,632,644 |
| 지급수수료 | 567,399,654 | 1,594,930,846 | 289,670,173 | 1,016,696,581 |
| 감가상각비 | 107,862,433 | 321,508,242 | 70,944,705 | 220,955,663 |
| 대손상각비 | 105,737 | (343,137,499) | (100,307,604) | (96,854,758) |
| 광고선전비 | 108,323,998 | 319,626,385 | 76,693,903 | 206,479,054 |
| 무형자산상각비 | 57,503,298 | 172,365,310 | 50,362,878 | 149,196,887 |
| 경상개발비 | 2,600,082,085 | 7,734,351,477 | 4,219,741,521 | 9,351,700,818 |
| 기타 | 597,253,728 | 1,537,877,676 | 369,953,801 | 1,029,194,053 |
| 합 계 | 5,166,629,966 | 15,814,176,388 | 5,813,323,907 | 14,195,773,974 |
30. 금융수익(원가)
당분기 및 전분기 중 금융수익(원가) 내역은 다음과 같습니다.
30-1. 금융수익
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | 196,180,066 | 680,736,574 | 118,531,859 | 414,508,305 |
| 당기손익-공정가치측정금융자산 평가이익 | 887,737 | 3,500,210 | 54,561,240 | 57,075,586 |
| 합 계 | 197,067,803 | 684,236,784 | 173,093,099 | 471,583,891 |
30-2. 금융원가
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용 | 2,445,856,881 | 6,909,205,901 | 89,783,578 | 126,256,465 |
31. 기타수익(비용)
당분기 및 전분기 중 기타수익(비용) 내역은 다음과 같습니다.
31-1. 기타수익
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차익 | 507,174 | 25,601,740 | 61,464,327 | 157,386,870 |
| 외화환산이익 | (1,311,837) | 267,605 | (25,056,258) | 24,274,109 |
| 유형자산처분이익 | - | 1,499,000 | - | - |
| 보험금수익 | - | - | 137,346,496 | 137,346,496 |
| 관계기업투자자산 처분이익 | - | - | 326,168,773 | 326,168,773 |
| 잡이익 | 836,091 | 11,737,741 | 10,767,930 | 149,509,644 |
| 합 계 | 31,428 | 39,106,086 | 510,691,268 | 794,685,892 |
31-2. 기타비용
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차손 | 40,600,715 | 106,782,409 | 4,793,536 | 146,600,681 |
| 외화환산손실 | 12,215,049 | 18,485,640 | 11,117,584 | 14,913,779 |
| 기부금 | 3,500,000 | 6,500,000 | 789,287 | 8,078,880 |
| 재해손실 | - | - | (15,320,291) | 130,766,256 |
| 유형자산처분손실 | 14,770,483 | 14,770,483 | - | - |
| 유형자산폐기손실 | - | 1,000 | - | - |
| 기타충당부채전입 | - | - | 335,784,218 | 786,433,374 |
| 관계기업투자자산 처분손실 | - | - | 654,036,858 | 654,036,858 |
| 잡손실 | 148,381 | 231,593 | 6 | 11 |
| 합 계 | 71,234,628 | 146,771,125 | 991,201,198 | 1,740,829,839 |
32. 종업원급여
당분기 및 전분기 중 종업원급여 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 2,126,058,790 | 7,635,497,673 | 1,853,889,771 | 5,177,199,461 |
| 퇴직급여 | 129,603,467 | 400,366,298 | 134,817,395 | 381,274,740 |
| 주식보상비용 | 269,816,880 | 583,075,869 | 12,521,730 | 37,826,306 |
| 합 계 | 2,525,479,137 | 8,618,939,840 | 2,001,228,896 | 5,596,300,507 |
33. 비용의 성격별 공시
당분기 및 전분기 중 비용의 성격별 분류 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 재고자산변동 | 1,079,044,634 | 1,584,993,849 | (866,650,946) | (1,872,614,795) |
| 원재료의 사용액 | 3,085,098,068 | 9,774,234,849 | 4,538,582,594 | 16,284,041,791 |
| 상품매입 | (289,508) | 144,039,280 | 60,231,636 | 726,767,669 |
| 급여 | 2,126,058,790 | 7,635,497,673 | 1,853,889,771 | 5,177,199,461 |
| 퇴직급여 | 129,603,467 | 400,366,298 | 134,817,395 | 381,274,740 |
| 전력비 | 77,761,910 | 199,801,061 | 86,677,391 | 233,276,113 |
| 지급수수료 | 641,246,804 | 1,746,307,796 | 345,403,898 | 1,110,771,009 |
| 외주가공비 | 55,052,080 | 113,087,350 | 282,528,490 | 717,245,190 |
| 감가상각비 | 498,863,902 | 1,364,414,848 | 456,596,468 | 1,365,101,652 |
| 무형자산상각비 | 57,503,298 | 172,365,310 | 50,362,878 | 149,196,887 |
| 경상개발비 | 1,742,123,933 | 5,275,961,175 | 3,583,652,398 | 7,596,385,621 |
| 대손상각비 | 105,737 | (343,137,499) | (100,307,604) | (96,854,758) |
| 기타 | 1,247,111,865 | 3,962,135,779 | 843,771,488 | 2,549,766,993 |
| 합 계 | 10,739,284,980 | 32,030,067,769 | 11,269,555,857 | 34,321,557,573 |
34. 법인세
34-1. 당분기 및 전분기 중 법인세비용의 주요 구성내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 법인세부담액 | 59,769,832 | 1,821,528 |
| 일시적차이로 인한 이연법인세 변동액 | (1,467,389,409) | - |
| 자본에 반영된 법인세비용(이익) | 79,710,082 | 4,747,838 |
| 법인세비용(이익) | (1,327,909,495) | 6,569,366 |
34-2. 당분기 및 전분기 법인세비용차감전순이익과 법인세비용간의 관계는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 법인세비용차감전순이익(손실) | (21,877,772,399) | (13,106,679,166) |
| 적용세율에 따른 법인세 | 59,769,832 | 1,821,528 |
| 조정사항 : | ||
| 일시적차이로 인한 이연법인세 변동액 | (1,467,389,409) | - |
| 발생한 일시적차이 중 이연법인세자산(부채) 미인식 효과 | 79,710,082 | 4,747,838 |
| 법인세비용(이익) | (1,327,909,495) | 6,569,366 |
34-3. 당분기 및 전분기 중 기타포괄손익으로 인식한 항목의 법인세효과는 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||||
| 세 전 | 법인세 | 세 후 | 세 전 | 법인세 | 세 후 | |
| 기타포괄손익 : | ||||||
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
(362,318,556) | 79,710,082 | (282,608,474) | (14,274,000) | 3,140,280 | (11,133,720) |
| 확정급여채무에 대한 보험수리적손익 |
- | - | - | (7,307,082) | 1,607,558 | (5,699,524) |
| 기타포괄손익 계 | (362,318,556) | 79,710,082 | (282,608,474) | (21,581,082) | 4,747,838 | (16,833,244) |
| 당기법인세 | - | - | - | - | - | - |
| 이연법인세 | - | 79,710,082 | - | - | 4,747,838 | - |
34-4. 보고기간종료일 현재 자본에 직접 반영된 법인세효과는 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전 기 | ||||
| 반영 전 | 법인세효과 | 반영 후 | 반영 전 | 법인세효과 | 반영 후 | |
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
(542,432,000) | 119,335,040 | (423,096,960) | (1,048,356,000) | 230,638,320 | (817,717,680) |
| 확정급여채무에 대한 보험수리적손익 |
(1,001,579,003) | 220,347,381 | (781,231,622) | (1,001,579,003) | 220,347,381 | (781,231,622) |
| 전환권대가 | 20,127,400,000 | (4,428,028,000) | 15,699,372,000 | 20,127,400,000 | (4,428,028,000) | 15,699,372,000 |
| 합 계 | 18,583,388,997 | (4,088,345,579) | 14,495,043,418 | 18,077,464,997 | (3,977,042,299) | 14,100,422,698 |
34-5. 이연법인세자산 실현가능성 판단
이연법인세자산의 실현가능성은 연결회사의 성과, 전반적인 경제환경과 산업에 대한전망, 향후 예상수익 등 다양한 요소들에 달려 있습니다. 연결회사는 주기적으로 이러한 사항들을 검토하고 있으며, 보고기간종료일 현재 차감할 일시적차이가 소멸될 기간에 과세소득이 충분하지 못할 것으로 예상되어 연결회사가 인식하지 않은 이연법인세자산은 당분기말 및 전기말 현재 각각 29,010,925,663원 및 26,731,126,794원입니다.
35. 주당손익
35-1. 연결회사의 기본주당순이익(손실)은 보통주 1주에 대한 주당순이익(손실)으로당분기 및 전분기의 기본주당순이익(손실) 계산내역은 다음과 같습니다.
| (단위: 원, 주) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 지배기업지분 분기순이익(손실) | (6,984,340,175) | (20,549,862,904) | (5,250,698,695) | (13,113,248,532) |
| 차감 : 우선주소유주 귀속 분기순이익(손실) | (16,797,536) | (607,257,580) | 8,757,963 | (45,395,053) |
| 보통주소유주 귀속 분기순이익(손실) | (6,967,542,639) | (19,942,605,324) | (5,259,456,658) | (13,067,853,479) |
| 가중평균유통보통주식수 | 8,331,345 | 8,310,517 | 8,143,828 | 8,049,866 |
| 기본주당이익(손실) | (836) | (2,400) | (646) | (1,623) |
35-2. 당분기 및 전분기의 가중평균유통보통주식수의 산정내역은 다음과 같습니다.
| (단위: 원, 주) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 기초유통보통주식수 | 8,247,200 | 8,247,200 | 7,859,262 | 7,859,262 |
| 전환우선주의 전환 | 64,145 | 46,614 | 279,205 | 186,476 |
| 주식매수선택권 행사 | 20,000 | 16,703 | 5,361 | 4,128 |
| 가중평균유통보통주식수 | 8,331,345 | 8,310,517 | 8,143,828 | 8,049,866 |
35-3. 당분기 및 전분기 손실발생으로 인하여 희석효과가 없습니다. 따라서 희석주당손익은 기본주당손익과 동일합니다.
35-4. 당분기 중 반희석효과로 인하여 희석주당손익 계산시 고려하지 않았으나 향후 희석효과의 발생가능성이 있는 잠재적 보통주의 내용은 다음과 같습니다.
| (단위 : 주) | ||
|---|---|---|
| 구 분 | 잠재적보통주 | 청구가능기간 |
| 5회차 전환우선주(*1) | 299,764 | 2022.03.03 ~ 2026.03.02 |
| 6회차 전환우선주(*1) | 79,373 | 2022.03.08 ~ 2026.03.07 |
| 2회차 전환사채 전환권(*2) | 561,280 | 2021.11.06 ~ 2025.10.06 |
| 10회차 주식매수선택권 | 10,000 | 2021.10.02 ~ 2022.10.01 |
| 11회차 주식매수선택권 | 1,000 | 2021.11.04 ~ 2022.11.03 |
| 13회차 주식매수선택권 | 41,000 | 2023.03.12 ~ 2024.03.11 |
| 14회차 주식매수선택권 | 3,000 | 2023.03.31 ~ 2024.03.30 |
(*1) 전환우선주의 잠재적보통주 주식수는 당분기말 현재 전환되지 않은 전환우선주를 모두 전환할 경우 발행 될 보통주 주식수입니다.
(*2) 전환사채 전환권의 잠재적보통주 주식수는 전환사채를 모두 전환할 경우 발행 될 보통주 주식수이며, 전환가액 조정으로 인해 변경되었습니다.
36. 특수관계자
36-1. 보고기간종료일 현재 특수관계자 현황은 다음과 같습니다.
| 특수관계 구분 | 특수관계자 | |
|---|---|---|
| 당분기말 | 전기말 | |
| 연결회사에 유의적인 영향력을 행사하는 회사 | (주)브리짓라이프사이언스 | (주)브리짓라이프사이언스 |
| 기타특수관계자 | (주)메드푸드 | (주)메드푸드 |
36-2. 당분기 및 전분기 중 특수관계자와의 중요한 거래내역은 다음과 같습니다.
<당분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 특수관계자명 | 매출 등 | 매입 등 |
| 기타특수관계자 | (주)메드푸드 | 1,330,209,092 | - |
<전분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 특수관계자명 | 매출 등 | 매입 등 |
| 기타특수관계자 | (주)메드푸드 |
569,863,638 | - |
36-3. 보고기간종료일 현재 특수관계자와의 주요 채권ㆍ채무 내역은 다음과 같습니다.
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 채 권 | 채 무 | ||
| 매출채권 | 대여금 | 매입채무 | 미지급금 | ||
| 기타특수관계자 | (주)메드푸드 | 439,000,000 | - | - | - |
| 기타특수관계자 | 임직원 | - | 148,940,000 | - | - |
| 합 계 | 439,000,000 | 148,940,000 | - | - | |
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 채 권 | 채 무 | ||
| 매출채권 | 대여금 | 매입채무 | 미지급금 | ||
| 기타특수관계자 |
임직원 | - | 191,450,000 | - | - |
36-4. 자금대여거래
당분기 및 전기 중 특수관계자와의 자금대여거래는 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 기 초 | 대 여 | 회 수 | 외환차이조정 | 기 말 |
| 단기대여금 | 임직원 | 108,800,000 | 5,000,000 | (5,000,000) | 9,690,000 | 118,490,000 |
| 장기대여금 | 임직원 | 82,650,000 | - | (52,200,000) | - | 30,450,000 |
| 합 계 | 191,450,000 | 5,000,000 | (57,200,000) | 9,690,000 | 148,940,000 | |
<전기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 기 초 | 대 여 | 회 수 | 외환차이조정 | 기 말 |
| 단기대여금 | 임직원 | 203,780,000 | 211,000,000 | (299,000,000) | (6,980,000) | 108,800,000 |
| 장기대여금 | 임직원 |
235,650,000 | - | (153,000,000) | - | 82,650,000 |
| 합 계 | 439,430,000 | 211,000,000 | (452,000,000) | (6,980,000) | 191,450,000 | |
36-5. 자금차입거래
당분기 및 전기 중 특수관계자와의 자금차입거래 내역은 없습니다.
36-6. 지급보증 및 담보제공 내역
보고기간종료일 현재 KDB산업은행 및 IBK기업은행 차입금과 관련하여 대표이사로부터지급보증(지급보증금액: 12,080,880,000원)을 제공받고 있습니다. 한편, 우리사주조합의 우선배정주식 청약증거금과 관련하여 한국증권금융에 지급보증(지급보증금액: 117,600,000원)을 제공하고 있습니다.
36-7. 주요 경영진 보상내역
이사와 주요경영진에 대한 보상은 개인의 실적과 시장동향 등을 고려하여 이사회에서 결정합니다. 연결회사는 모든 이사(업무집행이사 여부를 불문함)를 포함하여 직ㆍ간접적으로 당해 기업활동의 계획ㆍ지휘ㆍ통제에 대한 권한과 책임을 가진 자를 주요 경영진으로 하고 있으며, 당분기 및 전분기 중 주요 경영진에 대한 보상내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 단기급여 | 814,182,186 | 3,571,533,750 | 680,033,370 | 1,723,932,954 |
| 퇴직급여 | 106,962,952 | 320,541,756 | 41,005,186 | 61,114,759 |
| 합 계 | 921,145,138 | 3,892,075,506 | 721,038,556 | 1,785,047,713 |
37. 우발채무와 약정사항
37-1. 계류중인 소송사건
보고기간종료일 현재 계류 중인 소송사건은 없습니다.
37-2. 담보제공된 어음 및 수표
보고기간종료일 현재 담보로 제공된 어음 및 수표는 존재하지 아니합니다.
37-3. 금융기관과의 약정사항
보고기간종료일 현재 금융기관과의 약정사항은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 금융기관 | 약정사항 | 약정한도금액 | 실행금액 |
| 하나은행 | 무역자금 | USD 1,000,000 | USD 111,990 |
| 하나은행 | 상업어음할인 | 500,000,000 | - |
| IBK기업은행 | 무역자금 | USD 1,000,000 | USD 270,000 |
| IBK기업은행 | 상업어음할인 | 1,000,000,000 | - |
| IBK기업은행 | 시설자금 | 3,000,000,000 | 3,000,000,000 |
| IBK기업은행 | 운영자금 | 1,500,000,000 | 1,500,000,000 |
| KDB산업은행 | 운영자금 | 1,600,000,000 | 1,600,000,000 |
| KDB산업은행 | 시설자금 | 4,100,000,000 | 3,758,260,000 |
| KDB산업은행 | 운영자금 | 2,000,000,000 | 2,000,000,000 |
| 서울보증보험 | 이행보증등 | 87,511,600 | 87,511,600 |
| 현대해상화재보험 | 임상실험 보상보험 | 1,000,000,000 | - |
37-4. 보고기간종료일 현재 매출채권 중 타인에게 배서하여 만기가 미도래한 금액은없습니다.
37-5. 담보제공자산
보고기간종료일 현재 장ㆍ단기차입금 등과 관련하여 담보로 제공된 자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 담보권자 | 담보제공자산 | 장부금액 | 담보설정금액 | 관련 차입금 장부금액 |
| IBK기업은행 | 토지(제천) | 610,907,280 | 6,000,000,000 | 4,500,000,000 |
| 건물 | 4,412,377,160 | |||
| 구축물 | 220,135,316 | |||
| 기계장치 | 2,710,278,642 | |||
| 화재보험부보금액 | - | 6,415,000,000 | ||
| KDB산업은행 | 토지(오송) | 5,638,322,679 | 7,320,000,000 | 5,758,260,000 |
| KDB산업은행 | 단기금융상품 | 1,685,000,000 | 1,920,000,000 | 1,600,000,000 |
| 하나은행 | 단기금융상품 | 2,500,000,000 | 2,500,000,000 | - |
| 한국증권금융 | 단기금융상품 | 117,600,000 | 117,600,000 | - |
| 합 계 | 17,894,621,077 | 24,272,600,000 | 11,858,260,000 | |
37-6. 타인으로부터 제공받은 지급보증
보고기간종료일 현재 연결회사는 KDB산업은행 및 IBK기업은행 차입금과 관련하여 대표이사로부터 지급보증(지급보증금액: 12,080,880,000원)을 제공받고 있으며, 또한, 서울보증보험으로부터 이행보증관련 지급보증(지급보증금액: 87,511,600원)을 제공받고 있습니다.
38. 현금흐름표
38-1. 현금흐름표상의 현금은 재무상태표상 현금및현금성자산과 일치합니다(주석7 참조).
38-2. 연결회사의 현금흐름표는 간접법에 의해 작성되었으며, 당분기 및 전분기 현금흐름표상의 현금의 유입과 유출이 없는 중요한 거래의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 장기차입금의 유동성 대체 | 2,149,980,000 | 341,740,000 |
| 건설중인자산의 본계정 대체 | 1,376,807,190 | 6,059,570,535 |
| 타계정대체로 증가된 유/무형자산 | 191,674,282 | 110,421,995 |
| 주식매수선택권의 주식발행초과금 대체 | 35,605,931 | 13,225,980 |
| 사용권자산의 증가 | 469,303,492 | 247,748,570 |
| 리스부채의 유동성 대체 | 130,723,705 | 106,524,817 |
| 전환우선주의 보통주 전환 | 3,810,379,659 | 21,974,377,396 |
| 기타포괄손익공정가치측정 금융자산 평가손익 |
362,318,556 | 14,274,000 |
| 합 계 | 8,526,792,815 | 28,867,883,293 |
38-3. 재무활동에서 생기는 부채의 변동
당분기와 전분기 중 재무활동에서 생기는 부채의 변동은 다음과 같습니다.
<당분기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 재무활동현금흐름 | 환율변동 | 비현금 거래 | 기 말 | ||
| 증 가 | 감 소 | 신 규 | 상각 등 | ||||
| <유동성> | |||||||
| 단기차입금 | 4,380,000,000 | 4,039,660,000 | (3,319,660,000) | - | - | - | 5,100,000,000 |
| 유동성장기부채 | 1,058,400,000 | - | (341,740,000) | - | 2,149,980,000 | - | 2,866,640,000 |
| 유동리스부채 | 191,280,600 | - | (360,896,581) | 5,248,772 | 490,029,369 | (41,179,861) | 284,482,299 |
| 소 계 | 5,629,680,600 | 4,039,660,000 | (4,022,296,581) | 5,248,772 | 2,640,009,369 | (41,179,861) | 8,251,122,299 |
| <비유동성> | |||||||
| 장기차입금 | 6,041,600,000 | - | - | - | (2,149,980,000) | - | 3,891,620,000 |
| 전환사채 | 31,078,120,985 | - | - | - | - | 6,623,040,328 | 37,701,161,313 |
| 비유동리스부채 | 317,114,915 | - | - | 6,715,164 | - | (130,723,705) | 193,106,374 |
| 소 계 | 37,436,835,900 | - | - | 6,715,164 | (2,149,980,000) | 6,492,316,623 | 41,785,887,687 |
| 합 계 | 43,066,516,500 | 4,039,660,000 | (4,022,296,581) | 11,963,936 | 490,029,369 | 6,451,136,762 | 50,037,009,986 |
<전분기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 재무활동현금흐름 | 환율변동 | 비현금 거래 | 기 말 | ||
| 증 가 | 감 소 | 신 규 | 상각 등 | ||||
| <유동성> | |||||||
| 단기차입금 | 2,314,000,000 | 6,642,835,955 | (3,547,017,100) | (687,500) | - | - | 5,409,131,355 |
| 유동성장기부채 | 300,000,000 | - | (300,000,000) | - | 341,740,000 | - | 341,740,000 |
| 유동리스부채 | 177,520,497 | - | (174,831,358) | 587,894 | 146,257,312 | 44,211,590 | 193,745,935 |
| 소 계 | 2,791,520,497 | 6,642,835,955 | (4,021,848,458) | (99,606) | 487,997,312 | 44,211,590 | 5,944,617,290 |
| <비유동성> | |||||||
| 장기차입금 | - | 7,100,000,000 | - | - | (341,740,000) | - | 6,758,260,000 |
| 비유동리스부채 | 298,010,750 | - | - | 3,147,293 | 57,887,746 | (142,999,241) | 216,046,548 |
| 소 계 | 298,010,750 | 7,100,000,000 | - | 3,147,293 | (283,852,254) | (142,999,241) | 6,974,306,548 |
| 합 계 | 3,089,531,247 | 13,742,835,955 | (4,021,848,458) | 3,047,687 | 204,145,058 | (98,787,651) | 12,918,923,838 |
4. 재무제표
|
재무상태표 |
|
제 23 기 3분기말 2021.09.30 현재 |
|
제 22 기말 2020.12.31 현재 |
|
(단위 : 원) |
|
제 23 기 3분기말 |
제 22 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
118,941,591,333 |
104,687,888,207 |
|
현금및현금성자산 |
7,046,409,781 |
1,728,376,758 |
|
매출채권 및 기타채권 |
5,215,476,688 |
4,564,753,679 |
|
재고자산 |
7,572,488,578 |
9,177,837,067 |
|
기타유동금융자산 |
98,802,600,000 |
88,645,952,579 |
|
기타유동자산 |
235,056,326 |
461,087,424 |
|
당기법인세자산 |
69,559,960 |
109,880,700 |
|
비유동자산 |
20,590,322,845 |
18,794,474,763 |
|
유형자산 |
15,688,127,655 |
15,504,391,786 |
|
무형자산 |
2,292,766,325 |
1,969,506,063 |
|
비유동 당기손익-공정가치 측정 금융자산 |
144,349,685 |
111,909,475 |
|
종속기업 및 관계기업에 대한 투자자산 |
1,180,153,565 |
185,119,950 |
|
비유동 기타포괄손익-공정가치 측정 지분상품 |
462,568,000 |
344,124,000 |
|
기타비유동금융자산 |
822,357,615 |
679,423,489 |
|
자산총계 |
139,531,914,178 |
123,482,362,970 |
|
부채 |
||
|
유동부채 |
12,661,725,351 |
9,580,964,099 |
|
단기차입금 |
5,100,000,000 |
4,380,000,000 |
|
유동성장기부채 |
2,866,640,000 |
1,058,400,000 |
|
매입채무 및 기타채무 |
3,882,294,840 |
3,674,985,466 |
|
유동성충당부채 |
281,608,621 |
167,384,219 |
|
유동리스부채 |
214,428,440 |
139,102,078 |
|
기타유동부채 |
316,753,450 |
161,092,336 |
|
비유동부채 |
44,500,830,992 |
41,436,766,305 |
|
장기차입금 |
3,891,620,000 |
6,041,600,000 |
|
전환사채 |
37,701,161,313 |
31,078,120,985 |
|
비유동리스부채 |
131,566,673 |
218,046,727 |
|
이연법인세부채 |
1,227,466,808 |
2,694,856,217 |
|
순확정급여부채 |
1,549,016,198 |
1,404,142,376 |
|
부채총계 |
57,162,556,343 |
51,017,730,404 |
|
자본 |
||
|
자본금 |
4,355,241,000 |
4,147,656,500 |
|
자본잉여금 |
178,449,390,028 |
148,519,602,917 |
|
기타자본 |
16,347,501,339 |
15,800,031,401 |
|
기타포괄손익누계액 |
(423,096,960) |
(817,717,680) |
|
이익잉여금(결손금) |
(116,359,677,572) |
(95,184,940,572) |
|
자본총계 |
82,369,357,835 |
72,464,632,566 |
|
자본과부채총계 |
139,531,914,178 |
123,482,362,970 |
|
포괄손익계산서 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
제 22 기 3분기 2020.01.01 부터 2020.09.30 까지 |
|
(단위 : 원) |
|
제 23 기 3분기 |
제 22 기 3분기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
매출액 |
5,552,904,272 |
16,484,929,526 |
4,408,461,877 |
21,866,357,829 |
|
매출원가 |
5,572,655,014 |
16,215,891,381 |
3,907,668,356 |
20,125,783,599 |
|
매출총이익 |
(19,750,742) |
269,038,145 |
500,793,521 |
1,740,574,230 |
|
판매비와관리비 |
4,977,015,058 |
15,827,952,458 |
5,934,324,671 |
14,209,459,057 |
|
영업이익(손실) |
(4,996,765,800) |
(15,558,914,313) |
(5,433,531,150) |
(12,468,884,827) |
|
기타수익 |
21,428 |
39,096,086 |
510,691,268 |
794,685,892 |
|
기타비용 |
71,234,628 |
146,771,125 |
337,164,340 |
1,086,792,981 |
|
금융수익 |
196,371,202 |
682,470,501 |
172,641,516 |
470,239,058 |
|
금융원가 |
2,443,398,453 |
6,901,068,282 |
86,454,730 |
115,470,183 |
|
법인세비용차감전순이익(손실) |
(7,315,006,251) |
(21,885,187,133) |
(5,173,817,436) |
(12,406,223,041) |
|
법인세비용 |
(577,052,197) |
(1,387,679,327) |
4,324,320 |
4,747,838 |
|
당기순이익(손실) |
(6,737,954,054) |
(20,497,507,806) |
(5,178,141,756) |
(12,410,970,879) |
|
기타포괄손익 |
0 |
(282,608,474) |
(15,331,680) |
(16,833,244) |
|
당기손익으로 재분류되지 않는항목(세후기타포괄손익) |
0 |
(282,608,474) |
(15,331,680) |
(16,833,244) |
|
순확정급여부채의 재측정손익 |
0 |
0 |
0 |
(5,699,524) |
|
기타포괄손익-공정가치측정 지분상품평가손익 |
0 |
(282,608,474) |
(15,331,680) |
(11,133,720) |
|
당기손익으로 재분류될 수 있는 항목 |
0 |
0 |
0 |
0 |
|
총포괄손익 |
(6,737,954,054) |
(20,780,116,280) |
(5,193,473,436) |
(12,427,804,123) |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(808) |
(2,394) |
(637) |
(1,537) |
|
희석주당이익(손실) (단위 : 원) |
(808) |
(2,394) |
(637) |
(1,537) |
|
자본변동표 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
제 22 기 3분기 2020.01.01 부터 2020.09.30 까지 |
|
(단위 : 원) |
|
자본 |
||||||
|---|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본 |
기타포괄손익누계액 |
이익잉여금 |
자본 합계 |
|
|
2020.01.01 (기초자본) |
4,096,918,500 |
148,367,826,818 |
27,931,412 |
(683,537,400) |
(78,625,852,900) |
73,183,286,430 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(12,410,970,879) |
(12,410,970,879) |
|
확정급여의 재측정요소 |
0 |
0 |
0 |
0 |
(5,699,524) |
(5,699,524) |
|
기타포괄손익-공정가치측정 지분상품 평가손익 |
0 |
0 |
0 |
(11,133,720) |
0 |
(11,133,720) |
|
기타포괄손익-공정가치측정 지분상품 처분 |
0 |
0 |
0 |
0 |
0 |
0 |
|
주식매수선택권 |
3,000,000 |
235,884,980 |
24,600,326 |
0 |
0 |
263,485,306 |
|
전환우선주의 발행 |
0 |
0 |
0 |
0 |
0 |
0 |
|
전환우선주의 보통주 전환 |
46,238,500 |
(46,862,450) |
0 |
0 |
0 |
(623,950) |
|
2020.09.30 (기말자본) |
4,146,157,000 |
148,556,849,348 |
52,531,738 |
(694,671,120) |
(91,042,523,303) |
61,018,343,663 |
|
2021.01.01 (기초자본) |
4,147,656,500 |
148,519,602,917 |
15,800,031,401 |
(817,717,680) |
(95,184,940,572) |
72,464,632,566 |
|
당기순이익(손실) |
0 |
0 |
0 |
0 |
(20,497,507,806) |
(20,497,507,806) |
|
확정급여의 재측정요소 |
0 |
0 |
0 |
0 |
0 |
0 |
|
기타포괄손익-공정가치측정 지분상품 평가손익 |
0 |
0 |
0 |
(282,608,474) |
0 |
(282,608,474) |
|
기타포괄손익-공정가치측정 지분상품 처분 |
0 |
0 |
0 |
677,229,194 |
(677,229,194) |
0 |
|
주식매수선택권 |
10,000,000 |
126,868,691 |
547,469,938 |
0 |
0 |
684,338,629 |
|
전환우선주의 발행 |
189,568,500 |
29,811,493,420 |
0 |
0 |
0 |
30,001,061,920 |
|
전환우선주의 보통주 전환 |
8,016,000 |
(8,575,000) |
0 |
0 |
0 |
(559,000) |
|
2021.09.30 (기말자본) |
4,355,241,000 |
178,449,390,028 |
16,347,501,339 |
(423,096,960) |
(116,359,677,572) |
82,369,357,835 |
|
현금흐름표 |
|
제 23 기 3분기 2021.01.01 부터 2021.09.30 까지 |
|
제 22 기 3분기 2020.01.01 부터 2020.09.30 까지 |
|
(단위 : 원) |
|
제 23 기 3분기 |
제 22 기 3분기 |
|
|---|---|---|
|
영업활동현금흐름 |
(11,793,886,297) |
(9,557,764,676) |
|
당기순이익(손실) |
(20,497,507,806) |
(12,410,970,879) |
|
조정 |
6,766,920,900 |
1,774,015,441 |
|
대손상각비 |
(343,137,499) |
(96,854,758) |
|
감가상각비 |
1,292,351,137 |
1,316,303,446 |
|
무형자산상각비 |
172,365,310 |
149,196,887 |
|
경상개발비 |
(42,676,435) |
(219,998,083) |
|
지급수수료 |
36,870,132 |
25,126,513 |
|
차량유지비 |
539,648 |
0 |
|
주식보상비용(환입) |
388,042,254 |
0 |
|
퇴직급여 |
400,366,298 |
381,274,740 |
|
이자비용 |
6,901,068,282 |
115,470,183 |
|
외화환산손실 |
18,485,640 |
14,913,779 |
|
유형자산폐기손실 |
1,000 |
0 |
|
유형자산처분손실 |
14,770,483 |
0 |
|
기타충당부채전입 |
0 |
786,433,374 |
|
잡손실 |
83,212 |
0 |
|
재해손실 |
0 |
130,766,256 |
|
법인세비용 |
(1,387,679,327) |
4,747,838 |
|
이자수익 |
(678,970,291) |
(413,163,472) |
|
외화환산이익 |
(267,605) |
(24,274,109) |
|
당기손익-공정가치측정 금융자산 평가이익 |
(3,500,210) |
(57,075,586) |
|
관계기업투자자산 처분이익 |
0 |
(326,168,773) |
|
유형자산처분이익 |
(1,499,000) |
0 |
|
잡이익 |
(292,129) |
(12,682,794) |
|
영업활동으로인한자산ㆍ부채의변동 |
1,723,915,321 |
580,581,886 |
|
매출채권 |
22,988,706 |
2,192,904,446 |
|
미수금 |
(15,654,069) |
(357,884,973) |
|
선급금 |
200,745,963 |
(29,919,151) |
|
선급비용 |
2,008,257 |
(5,597,012) |
|
반환제품회수권 |
(28,517,667) |
45,337,037 |
|
재고자산 |
1,605,348,489 |
(1,734,468,373) |
|
매입채무 |
1,275,473,270 |
(625,534,432) |
|
미지급금 |
(1,230,803,212) |
1,079,380,912 |
|
예수금 |
(101,446,326) |
35,996,222 |
|
선수금 |
143,290,440 |
78,984,057 |
|
환불부채 |
18,297,511 |
(53,971,566) |
|
정부보조금 |
87,676,435 |
206,690,168 |
|
퇴직금의 지급 |
(255,930,326) |
(288,826,316) |
|
퇴직연금운용자산 |
437,850 |
37,490,867 |
|
이자의 수취 |
450,821,820 |
674,642,704 |
|
이자의 지급 |
(278,357,272) |
(139,412,328) |
|
법인세의 납부(환급) |
40,320,740 |
(36,621,500) |
|
투자활동현금흐름 |
(12,987,007,145) |
(1,356,530,840) |
|
단기금융상품의 처분 |
70,511,754,127 |
56,393,918,216 |
|
단기대여금의 감소 |
0 |
299,000,000 |
|
장기대여금의 감소 |
52,200,000 |
99,100,000 |
|
매도가능금융자산의 처분 |
119,237,444 |
0 |
|
관계기업투자자산의 처분 |
0 |
1,500,000,000 |
|
기계장치의 처분 |
6,000,000 |
0 |
|
비품의 처분 |
1,500,000 |
0 |
|
임차보증금의 감소 |
10,487,140 |
579,203,000 |
|
단기금융상품의 취득 |
(80,667,398,064) |
(56,893,918,216) |
|
단기대여금의 증가 |
0 |
(211,000,000) |
|
당기손익-공정가치 측정 금융자산의 취득 |
(28,940,000) |
(52,092,000) |
|
매도가능금융자산의 취득 |
(600,000,000) |
0 |
|
종속기업투자자산의 취득 |
(800,000,000) |
0 |
|
기계장치의 취득 |
(14,920,000) |
(26,910,000) |
|
공구와기구의 취득 |
(50,180,000) |
(20,814,300) |
|
비품의 취득 |
(66,811,818) |
(24,280,617) |
|
건설중인자산의 증가 |
(1,269,504,784) |
(2,420,021,923) |
|
회원권의 취득 |
(1,029,470) |
(253,000,000) |
|
기타무형자산의 취득 |
0 |
(2,300,000) |
|
임차보증금의 증가 |
(189,401,720) |
(323,415,000) |
|
재무활동현금흐름 |
30,143,926,465 |
9,951,024,633 |
|
단기차입금의 증가 |
4,039,660,000 |
6,642,835,955 |
|
장기차입금의 증가 |
0 |
7,100,000,000 |
|
정부보조금의 수취 |
0 |
5,002,086 |
|
보통주 증자 |
100,703,760 |
225,035,050 |
|
전환우선주 발행 |
30,001,061,920 |
0 |
|
단기차입금의 상환 |
(3,319,660,000) |
(3,547,017,100) |
|
유동성장기부채의 상환 |
(341,740,000) |
(300,000,000) |
|
유동리스부채의 지급 |
(336,099,215) |
(174,831,358) |
|
현금및현금성자산의 순증가 |
5,363,033,023 |
(963,270,883) |
|
기초현금및현금성자산 |
1,728,376,758 |
2,166,374,088 |
|
현금및현금성자산에 대한 환율변동효과 |
0 |
0 |
|
기말현금및현금성자산 |
7,091,409,781 |
1,203,103,205 |
5. 재무제표 주석
| 제 23기 3분기 2021년 01월 01일부터 2021년 09월 30일 까지 |
| 제 22기 3분기 2020년 01월 01일부터 2020년 09월 30일 까지 |
| 주식회사 엔지켐생명과학 |
1. 일반사항
주식회사 엔지켐생명과학(이하 '당사')은 1999년 7월 20일 설립되어 원료의약품사업및 글로벌 신약개발사업을 주요 사업으로 영위하고 있습니다. 당사는 2011년 2월에 상호를 (주)엔지켐에서 주식회사 엔지켐생명과학으로 변경하였으며, 2018년 2월 21일 코스닥시장 상장규정에 의한 기술성장 기업으로서 코넥스시장 (2013년 9월 25일 상장)에서 코스닥시장으로 이전 상장 하였습니다.
보고기간종료일 현재 납입자본금은 4,355,241,000원이며, 주요 주주 현황은 다음과 같습니다.
| (단위: 주, %) | |||||
|---|---|---|---|---|---|
| 주주명 | 보통주 | 전환우선주 | 합 계 | 지분율(%) | 비 고 |
| (주)브리짓라이프사이언스 | 961,780 | - | 961,780 | 11.04 | 최대주주 |
| 손기영 | 578,361 | - | 578,361 | 6.64 | 대표이사 |
| NORGES BANK | 246,077 | - | 246,077 | 2.83 | |
| 기타 | 6,545,127 | 379,137 | 6,924,264 | 79.49 | |
| 합 계 | 8,331,345 | 379,137 | 8,710,482 | 100.00 | |
2. 중요한 회계정책 및 재무제표 작성기준
2-1. 재무제표 작성기준
당사의 재무제표는 연차재무제표가 속하는 기간의 일부에 대하여 기업회계기준서 제1034호 "중간재무보고"를 적용하여 작성하는 재무제표이며, 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표입니다. 동 중간재무제표에 대한 이해를 위해서는 한국채택국제회계기준에 따라 작성된 2020년 12월 31일자로 종료하는 회계연도에 대한 연차재무제표를 함께 이용하여야 합니다.
중간재무제표 작성에 적용된 중요한 회계정책은 아래 기술되어 있으며, 당분기 재무제표의 작성에 적용된 중요한 회계정책은 아래에서 설명하는 기준서나 해석서의 도입과 관련된 영향을 제외하고는 2020년 12월 31일로 종료하는 회계연도에 대한 연차재무제표 작성시 채택한 회계정책과 동일합니다.
2-2. 제ㆍ개정된 기준서의 적용
중간재무제표를 작성하기 위하여 채택한 중요한 회계정책은 다음의 2021년 1월 1일부터 적용되는 기준서를 제외하고는 2020년 12월 31일로 종료되는 회계기간에 대한연차재무제표 작성시 채택한 회계정책과 동일합니다. 당사는 공표되었으나 시행되지않은 기준서, 해석서, 개정사항을 조기적용한 바 없습니다.
여러 개정사항과 해석서가 2021년부터 최초 적용되며, 당사의 재무제표에 중요한 영향을 미치지 않습니다.
2-2-1. 기업회계기준서 제1116호 '리스' 개정(코로나 19 관련 임차료 할인 등에 대한 실무적 간편법)
동 개정사항은 코로나19의 직접적인 결과로 발생한 임차료 할인 등을 리스이용자가 회계처리할 때, 리스이용자에게 코로나19 관련 임차료 할인 등이 리스변경에 해당하는지 여부를 평가하지 않는 선택을 할 수 있도록 허용합니다. 이러한 선택을 한 리스이용자는 코로나19 관련 임차료 할인 등으로 인한 리스료 변동을 그러한 변동이 리스변경이 아닐 경우에 리스이용자가 회계처리하는 방식과 일관되게 회계처리합니다.
동 실무적 간편법은 코로나19의 직접적인 결과로 발생한 임차료 할인 등에만 적용되며 아래의 조건을 모두 충족하는 경우에 적용합니다.
- 리스료의 변동으로 수정된 리스대가가 변경 전 리스대가와 실질적으로 동일하거나 그보다 작음
- 리스료 감면이 2021년 6월 30일 이전(2021년 개정사항을 조기 적용하기로 한 경우[2021년 6월 30일]을 [2022년 6월 30일]로 변경하여 기재)에 지급하여야 할 리스료에만 영향을 미침
- 그 밖의 리스기간과 조건은 실질적으로 변경되지 않음
2-2-2. 기업회계기준서 제1109호 '금융상품', 제1039호 '금융상품: 인식과 측정', 제1107호 '금융상품: 공시', 제 1104호 '보험계약' 및 제 1116호 '리스' 개정 - 이자율지표 개혁 2단계 (개정)
이자율지표 개혁과 관련하여 새로운 이자율이 대체 지표 이자율이 되어 불확실성이 해소되는 시점에 적용되는 실무적 간편법을 제공합니다.
- (상각후원가 측정 금융상품) 특정요건 충족 시, 이자율 대체에 따른 금융상품 변경 손익이 인식되지 않도록 함
- (위험회피) 이자율지표 개혁에서 요구된 변경을 반영하기 위해, 관련 위험회피관계에 대한 문서를 수정하더라도 위험회피회계를 유지
- (리스) 리스료 산정기준이 변경될 때 특정요건 충족 시 새 대체 지표 이자율을 고려하여 미래 리스료를 할인
동 개정사항이 재무제표에 미치는 유의적인 영향은 없습니다.
2-3. 제정ㆍ공표되었으나 아직 시행일이 도래하지 않아 적용하지 아니한 한국채택국제회계기준의 내역은 다음과 같습니다.
2-3-1. 기업회계기준서 제1001호 '재무제표 표시'(개정) - 부채의 유동/비유동 분류
동 개정사항은 유동부채와 비유동부채의 분류는 보고기간말에 존재하는 기업의 권리에 근거한다는 점을 명확히 하고 기업이 부채의 결제를 연기할 수 있는 권리를 행사할 지 여부에 대한 기대와는 무관하다는 점을 강조합니다. 그리고 보고기간말에 차입약정을 준수하고 있다면 해당 권리가 존재한다고 설명하고 결제는 현금, 지분상품, 그 밖의 자산 또는 용역을 거래상대방에게 이전하는 것으로 그 정의를 명확히 합니다.
동 개정사항은 2023 년 1 월 1 일 이후 최초로 시작하는 회계연도의 개시일 이후 소급적으로 적용되며 조기적용이 허용됩니다.
2-3-2. 기업회계기준서 제1103호 '사업결합'(개정) - '개념체계'에 대한 참조
인식할 자산과 부채의 정의를 개정된 재무보고를 위한 개념체계를 참조하도록 개정되었으나, 기업회계기준서 제1037호 '충당부채, 우발부채 및 우발자산' 및 해석서 제2121호 '부담금'의 적용범위에 포함되는 부채 및 우발부채에 대해서는 해당 기준서를 적용하도록 예외를 추가하고, 우발자산이 취득일에 인식되지 않는다는 점을 명확히 하였습니다.
동 개정사항은 취득일이 2022년 1월 1일 이후 최초로 시작되는 회계연도의 개시일 이후인 사업결합에 적용합니다. 동 개정사항과 함께 공표된 '한국채택국제회계기준에서 개념체계 참조에 대한 개정'에 따른 모든 개정사항을 동 개정사항보다 먼저 적용하거나 동 개정사항과 동시에 적용하는 경우에만 동 개정사항의 조기 적용이 허용됩니다.
2-3-3. 기업회계기준서 제1016호 '유형자산'(개정) - 의도한 사용 전의 매각금액
동 개정사항은 유형자산이 사용 가능하기 전에 생산된 재화의 매각금액, 즉 경영진이의도하는 방식으로 가동하는 데 필요한 장소와 상태에 이르게 하기 전에 생산된 재화의 매각금액)을 유형자산의 원가에서 차감하는 것을 금지합니다. 따라서 그러한 매각금액과 관련 원가를 당기손익으로 인식하며, 해당 원가는 기업회계기준서 제1002호에 따라 측정합니다.
또한 동 개정사항은 '유형자산이 정상적으로 작동되는지 여부를 시험하는 것'의 의미를 명확히 하여 자산의 기술적, 물리적 성능이 재화나 용역의 생산이나 제공, 타인에 대한 임대 또는 관리활동에 사용할 수 있는 정도인지를 평가하는 것으로 명시합니다.
동 개정사항은 이 개정내용을 처음 적용하는 재무제표에 표시된 가장 이른 기간의 개시일 이후에 경영진이 의도한 방식으로 가동할 수 있는 장소와 상태에 이른 유형자산에 대해서만 소급 적용합니다. 동 개정사항의 최초 적용 누적효과는 표시되는 가장 이른 기간의 시작일에 이익잉여금(또는 적절하다면 자본의 다른 구성요소)의 기초 잔액을 조정하여 인식합니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 적용되며, 조기적용이 허용됩니다.
2-3-4. 기업회계기준서 제1037호 '충당부채, 우발부채 및 우발자산'(개정) - 손실부담계약의 계약이행원가
동 개정사항은 계약이 손실부담계약인지 또는 손실을 발생시키는 계약인지 평가할 때 기업이 포함해야할 원가를 명확하게 하였습니다.
개정 기준서는 "직접 관련된 원가 접근법"을 적용합니다. 재화나 용역을 제공하는 계약에 직접적으로 관련되는 원가는 증분원가와 계약 활동에 직접적으로 관련되는 원가 배분액을 모두 포함합니다. 일반 관리 원가는 계약에 직접적으로 관련되지 않으며계약에 따라 거래상대방에게 명시적으로 부과될 수 없다면 제외됩니다.
동 개정사항은 이 개정사항을 최초로 적용하는 회계연도의 개시일에 모든 의무의 이행이 완료되지는 않은 계약에 적용합니다. 비교재무제표는 재작성 하지 않고, 그 대신 개정 내용을 최초로 적용함에 따른 누적효과를 최초적용일의 기초이익잉여금 또는 적절한 경우 다른 자본요소로 인식합니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 적용되며, 조기적용이 허용됩니다.
2-3-5. 한국채택국제회계기준 2018-2020 연차개선
(1) 기업회계기준서 제 1101호 '한국채택국제회계기준의 최초채택' - 최초채택기업인 종속기업
동 개정사항은 지배기업보다 늦게 최초채택기업이 되는 종속기업의 누적환산차이의 회계처리와 관련하여 추가적인 면제를 제공합니다. 기업회계기준서 제 1101호 문단 D16(1)의 면제규정을 적용하는 종속기업은 지배기업의 한국채택국제회계기준 전환일에 기초하여 지배기업의 연결재무제표에 포함될 장부금액으로 모든 해외사업장의 누적환산차이를 측정하는 것을 선택할 수 있습니다. 다만 지배기업이 종속기업을 취득하는 사업결합의 효과와 연결절차에 따른 조정사항은 제외합니다. 관계기업이나 공동기업이 기업회계기준 제 1101호 문단 D16(1)의 면제규정을 적용하는 경우에도 비슷한 선택을 할 수 있습니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는회계연도부터 적용되며, 조기적용이 허용됩니다.
(2) 기업회계기준서 제1109호 '금융상품' - 금융부채 제거 목적의 10% 테스트 관련 수수료
동 개정사항은 금융부채의 제거 여부를 평가하기 위해 '10%' 테스트를 적용할 때, 기업(차입자)과 대여자 간에 수취하거나 지급하는 수수료만을 포함하며, 여기에는 기업이나 대여자가 다른 당사자를 대신하여 지급하거나 수취하는 수수료를 포함한다는 점을 명확히 하고 있습니다. 동 개정사항은 최초 적용일 이후 발생한 변경 및 교환에 대하여 전진적으로 적용됩니다. 동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 시행되며 조기적용이 허용됩니다.
(3) 기업회계기준서 제1116호 '리스' - 리스 인센티브
동 개정사항은 기업회계기준서 제1116호 사례13에서 리스개량 변제액에 대한 내용을 삭제하였습니다. 동 개정사항은 적용사례에만 관련되므로, 시행일은 별도로 규정되지 않았습니다.
(4) 기업회계기준서 제1041호 '농림어업' - 공정가치 측정
동 개정사항은 생물자산의 공정가치를 측정할 때 세금 관련 현금흐름을 제외하는 요구사항을 삭제하였습니다. 이는 기업회계기준서 제1041호의 공정가치 측정과 내부적으로 일관된 현금흐름과 할인율을 사용하도록 하는 기업회계기준서 제1113호의 요구사항을 일치시키며, 기업은 가장 적절한 공정가치 측정을 위해 세전 또는 세후 현금흐름 및 할인율을 사용할지 선택할 수 있습니다.
동 개정사항은 2022년 1월 1일 이후 최초로 시작되는 회계연도부터 시행되며 조기적용이 허용됩니다.
2-3-6. 기업회계기준서 제1117호 '보험계약'(제정)
기업회계기준서 제1176호 '보험계약'은 2023년 1월 1일 이후 최초로 시작되는 회계연도부터 적용하되 조기 적용할 수도 있습니다. 이 기준서는 현행 기업회계기준서 제1104호 '보험계약'을 대체할 예정입니다.
보험회사는 보험계약에 따른 모든 현금흐름을 추정하고 보고시점의 가정과 위험을 반영한 할인율을 사용하여 보험부채를 즉정합니다. 보험수익은 발생주의에 따라 매 회계연도별로 보험회사가 계약자에게 제공한 서비스를 반영하여 수익을 인식합니다.또한, 보험사건과 관계없이 보험계약자에게 지급하는 투자요소는 보험수익에서 제외하며, 보험손익과 투자손익을 구분표시합니다.
당사는 상기에 열거된 제ㆍ개정사항이 재무제표에 미치는 영향이 중요하지 않을 것으로 판단하고 있습니다.
3. 재무위험관리
3-1. 재무위험관리요소
당사는 여러 활동으로 인하여 시장위험(환위험, 공정가치이자율위험, 현금흐름이자율위험 및 가격위험), 신용위험 및 유동성위험과 같은 다양한 재무위험에 노출돼 있습니다. 당사의 전반적인 위험관리정책은 금융시장의 변동성에 초점을 맞추고 있으며 재무성과에 미치는 부정적 영향을 최소화하는데 중점을 두고 있습니다.
위험관리는 이사회에서 승인한 정책에 따라 이루어지고 있습니다. 이사회는 전반적인 위험관리에 대한 문서화된 정책, 외환위험, 이자율 위험, 신용 위험, 파생금융상품과 비파생금융상품의 이용 및 유동성을 초과하는 투자와 같은 특정 분야에 관한 문서화된 정책을 검토하고 승인합니다.
3-1-1. 시장위험
(1) 외환위험
외환위험은 환율의 변동으로 인하여 금융상품의 공정가치가 변동할 위험입니다. 당사는 기능통화인 원화 이외의 통화로 표시되는 판매 및 구매에 대해 환위험에 노출되어 있습니다. 당사는 별도의 금융상품을 통한 외화표시 화폐성 자산과 부채의 경제적인 위험회피를 위한 활동을 수행하고 있지 않으며, 지급기일 조정 등을 통하여 환위험을 관리하고 있습니다.
보고기간종료일 현재 기능통화 이외의 외화로 표시된 화폐성 자산과 화폐성 부채의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 자 산 | 부 채 | 자 산 | 부 채 | |
| USD | 14,427,342 | 1,364,504,058 | 899,199,577 | 1,794,142,288 |
| EUR | - | 41,229,300 | - | 128,638,320 |
| 합 계 | 14,427,342 | 1,405,733,358 | 899,199,577 | 1,922,780,608 |
당사는 내부적으로 외화 환율 변동에 따른 환위험을 정기적으로 측정하고 있으며, 보고기간종료일 현재 각 외화에 대한 기능통화의 환율변동이 법인세비용차감전순이익
에 미치는 영향은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 5% 상승 | 5% 하락 | 5% 상승 | 5% 하락 | |
| USD | (67,503,836) | 67,503,836 | (44,747,136) | 44,747,136 |
| EUR | (2,061,465) | 2,061,465 | (6,431,916) | 6,431,916 |
| 합 계 | (69,565,301) | 69,565,301 | (51,179,052) | 51,179,052 |
(2) 가격위험
가격위험은 이자율위험이나 환위험 이외의 시장가격의 변동으로 인하여 금융상품의 공정가치나 미래현금흐름이 변동할 위험이며, 보고기간종료일 현재 당사의 기타포괄손익-공정가치측정 지분상품의 장부금액은 462,568,000원이며, 주가가 1% 변동할 경우 당분기 총 포괄손익의 변동금액은 4,625,680원 입니다.
(3) 이자율 위험
이자율 위험은 미래의 시장 이자율 변동에 따라 예금 또는 차입금 등에서 발생하는 이자수익 및 이자비용이 변동될 위험을 뜻하며, 이는 주로 변동금리부 조건의 예금과차입금에서 발생하고 있습니다. 당사의 이자율 위험관리의 목표는 이자율 변동으로 인한 불확실성과 순이자비용의 최소화를 추구함으로써 기업의 가치를 극대화하는데 있습니다.
보고기간종료일 현재 당사의 금융상품 중 이자율 위험에 노출되어 있는 금융상품은 존재하지 아니합니다.
3-1-2. 신용위험
신용위험은 거래상대방이 의무를 이행하지 않아 재무손실이 발생할 위험입니다. 당사는 영업활동과 재무활동에서 신용위험에 노출되어 있습니다.
금융자산의 장부금액은 신용위험에 대한 최대 노출정도를 나타냅니다. 보고기간종료일 현재 신용위험에 대한 최대 노출정도는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 현금및현금성자산 | 7,046,409,781 | 1,728,376,758 |
| 매출채권및기타채권 | 5,215,476,688 | 4,564,753,679 |
| 당기손익-공정가치 측정 금융자산(비유동) | 144,349,685 | 111,909,475 |
| 기타금융자산 | ||
| 금융기관예치금(유동) | 98,802,600,000 | 88,645,952,579 |
| 장기대여금 | 30,450,000 | 82,650,000 |
| 보증금 | 791,907,615 | 596,773,489 |
| 합 계 | 112,031,193,769 | 95,730,415,980 |
당사는 매출채권 등에 대해 발생할 것으로 예상되는 손실에 대해 충당금을 설정하고 있습니다. 이 충당금은 개별적으로 유의적인 항목에 대한 구체적인 손상차손과 유사한 특성을 가진 금융자산 집합에서 발생되었으나 아직 식별되지 않은 손상으로 구성됩니다. 금융자산 집합의 충당금은 유사한 금융자산의 회수에 대한 과거 자료에 근거하여 결정되고 있습니다.
매출채권 및 미수금, 미수수익은 대손충당금이 차감된 순액으로 재무상태표에 표시되었는 바, 보고기간종료일 현재 대손충당금 차감 전 총액 기준에 의한 매출채권및기타채권과 관련한 대손충당금의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 매출채권 | 5,043,988,374 | 5,066,709,475 |
| (대손충당금) | (537,858,027) | (880,995,526) |
| 미수금 | 712,559,021 | 583,087,952 |
| (대손충당금) | (499,532,805) | (499,532,805) |
| 미수수익 | 496,320,125 | 295,484,583 |
| 합 계 | 5,215,476,688 | 4,564,753,679 |
보고기간종료일 현재 매출채권및기타채권의 연령 및 각 연령별로 손상된 채권금액은다음과 같습니다.
<당분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 매출채권 | 기타채권 | 합 계 | |||
| 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | |
| 6개월이하 | 4,503,143,871 | - | 526,529,341 | - | 5,029,673,212 | - |
| 6개월초과 1년이하 | - | - | 182,817,000 | - | 182,817,000 | - |
| 1년초과 | 540,844,503 | 537,858,027 | 499,532,805 | 499,532,805 | 1,040,377,308 | 1,037,390,832 |
| 합 계 | 5,043,988,374 | 537,858,027 | 1,208,879,146 | 499,532,805 | 6,252,867,520 | 1,037,390,832 |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 매출채권 | 기타채권 | 합 계 | |||
| 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | 채권금액 | 손상된금액 | |
| 6개월이하 | 4,169,091,601 | - | 379,039,730 | - | 4,548,131,331 | - |
| 6개월초과 1년이하 | - | - | - | - | - | - |
| 1년초과 | 897,617,874 | 880,995,526 | 499,532,805 | 499,532,805 | 1,397,150,679 | 1,380,528,331 |
| 합 계 | 5,066,709,475 | 880,995,526 | 878,572,535 | 499,532,805 | 5,945,282,010 | 1,380,528,331 |
3-1-3. 유동성 위험
당사는 미사용 차입금 한도를 적정 수준으로 유지하고, 영업 자금 수요를 충족시키기위해 차입금 한도나 약정을 위반하는 일이 없도록 유동성에 대한 예측을 항시 모니터링하고 있습니다. 유동성을 예측하는데 있어 당사의 자금조달 계획, 약정 준수, 당사 내부의 목표재무비율 및 통화에 대한 제한과 같은 외부 법규나 법률 요구사항도 고려하고 있습니다.
보고기간종료일 현재 금융부채의 잔존 계약만기에 따른 현금유출액은(원금과 이자상당액) 다음과 같습니다.
<당분기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월이하 | 3개월초과 ~ 1년이하 |
1년초과 ~ 5년이하 |
5년 초과 |
| 매입채무 | 2,148,734,069 | 2,148,734,069 | 2,148,734,069 | - | - | - |
| 단기차입금 | 5,100,000,000 | 5,164,230,443 | 1,531,777,543 | 3,632,452,900 | - | - |
| 미지급금 | 1,718,518,776 | 1,718,518,776 | 1,397,093,917 | 321,424,859 | - | - |
| 미지급비용 | 15,041,995 | 15,041,995 | 15,041,995 | - | - | - |
| 유동성장기부채 | 2,866,640,000 | 3,012,503,112 | 761,402,698 | 2,251,100,414 | - | - |
| 장기차입금 | 3,891,620,000 | 3,962,073,873 | - | - | 3,962,073,873 | - |
| 전환사채 | 37,701,161,313 | 50,000,000,000 | - | - | 50,000,000,000 | - |
| 유동리스부채 | 214,428,440 | 227,499,478 | 132,485,997 | 95,013,481 | - | - |
| 비유동리스부채 | 131,566,673 | 144,460,033 | - | - | 144,460,033 | - |
| 합 계 | 53,787,711,266 | 66,393,061,779 | 5,986,536,219 | 6,299,991,654 | 54,106,533,906 | - |
<전기말>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 계약상현금흐름 | 3개월이하 | 3개월초과 ~ 1년이하 |
1년초과 ~ 5년이하 |
5년 초과 |
| 매입채무 | 867,650,649 | 867,650,649 | 867,650,649 | - | - | - |
| 단기차입금 | 4,380,000,000 | 4,425,709,984 | 1,624,770,538 | 2,800,939,446 | - | - |
| 미지급금 | 2,791,566,761 | 2,791,566,761 | 2,500,346,621 | 291,220,140 | - | - |
| 미지급비용 | 15,768,056 | 15,768,056 | 15,768,056 | - | - | - |
| 유동성장기부채 | 1,058,400,000 | 1,249,982,975 | 48,892,345 | 1,201,090,630 | - | - |
| 장기차입금 | 6,041,600,000 | 6,211,343,466 | - | - | 6,211,343,466 | - |
| 전환사채 | 31,078,120,985 | 50,000,000,000 | - | - | 50,000,000,000 | - |
| 유동리스부채 | 139,102,078 | 158,028,054 | 42,311,973 | 115,716,081 | - | - |
| 비유동리스부채 | 218,046,727 | 239,473,514 | - | - | 239,473,514 | - |
| 합 계 | 46,590,255,256 | 65,959,523,459 | 5,099,740,182 | 4,408,966,297 | 56,450,816,980 | - |
3-2. 자본위험관리
당사의 자본위험관리 목적은 계속기업으로서 주주 및 이해당사자들에게 이익을 지속적으로 제공할 수 있는 능력을 보호하고 자본비용을 절감하기 위해 최적 자본구조를 유지하는 것입니다.
당사는 최적 자본구조 달성을 위해 부채비율과 순차입금비율 등의 재무비율을 자본위험관리지표로 사용하고 있습니다. 부채비율은 부채총계를 자본총계로 나누어 산출하고 있으며, 순차입금비율은 순차입금을 자본총계로 나누어 산출하고 있습니다.
보고기간종료일 현재 부채비율 및 순차입금비율은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 부채비율: | ||
| 부채총계 | 57,162,556,343 | 51,017,730,404 |
| 자본총계 | 82,369,357,835 | 72,464,632,566 |
| 부채비율(%) | 69.40 | 70.40 |
| 순차입금비율: | ||
| 차입금 | 11,858,260,000 | 11,480,000,000 |
| 전환사채 | 37,701,161,313 | 31,078,120,985 |
| (차감)현금및현금성자산 | (7,046,409,781) | (1,728,376,758) |
| (차감)당기손익-공정가치 측정 금융자산(비유동) | (144,349,685) | (111,909,475) |
| (차감)기타포괄손익-공정가치 측정 지분상품 | (462,568,000) | (344,124,000) |
| (차감)기타금융자산 | (99,624,957,615) | (89,325,376,068) |
| 순차입금(A) | (57,718,863,768) | (48,951,665,316) |
| 자본총계(B) | 82,369,357,835 | 72,464,632,566 |
| 순차입금비율(C=A/B)(%) | -(*) | -(*) |
(*) 부수이므로 산정하지 아니하였습니다.
3-3. 사용이 제한된 금융자산
보고기간종료일 현재 사용이 제한된 금융자산의 내역은 다음과 같습니다.
| (단위 : 원) | |||
|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | 사용제한내용 |
| 현금및현금성자산(*) | - | 186,765,360 | 채권압류 |
| 단기금융상품 | 4,302,600,000 | 7,145,952,579 | 담보제공 등 |
| 현금및현금성자산 | 45,000,000 | - | 정부보조금 |
(*) 전기말 해고무효확인 및 주권인도소송과 관련된 채권압류건은 당분기 중 추심 완료되었습니다.
4. 영업부문정보
당사의 최고 영업의사결정자는 부문성과평가와 자원배분 의사결정에 각 부문의 매출정보만을 이용하며, 내부보고자료에는 부문당기손익, 부문자산 및 부문부채 등의 정보를 포함하지 않습니다.
4-1. 영업부문에 대한 일반정보
영업부문별 주요사업은 다음과 같습니다.
| 부 문 | 주요사업내용 |
|---|---|
| 원료의약품 부문 | 세파계 항생제 및 비세파계, 조영제 API 제조/판매 |
| 원료의약품이외 부문 | 건강기능성식품 제조/판매, 임가공 등 |
4-2. 영업부문의 부문별 정보
당사의 각 영업부문별 매출 및 손익에 대한 정보는 다음과 같습니다.
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||||||
| 원료의약품부문 | 원료의약품 이외부문 |
조정 및 제거 | 합 계 | 원료의약품부문 | 원료의약품 이외부문 |
조정 및 제거 | 합 계 | |
| 매출액 | 15,172,153,383 | 1,331,073,654 | (18,297,511) | 16,484,929,526 | 20,961,851,869 | 850,534,394 | 53,971,566 | 21,866,357,829 |
| 영업이익(손실) | (14,304,004,538) | (1,254,909,775) | - | (15,558,914,313) | (11,982,683,305) | (486,201,522) | - | (12,468,884,827) |
| 분기순이익(손실) | (18,844,274,014) | (1,653,233,792) | - | (20,497,507,806) | (11,927,027,606) | (483,943,273) | - | (12,410,970,879) |
당사의 영업자산 및 영업부채는 전사차원에서 관리되고 있습니다.
4-3. 지역별 부문의 정보
당사의 각 지역별로 세분화된 외부고객으로부터의 수익은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 국 내 | 16,315,987,445 | 19,951,689,732 |
| 해 외 | 168,942,081 | 1,914,668,097 |
| 합 계 | 16,484,929,526 | 21,866,357,829 |
4-4. 주요 고객별 정보
당분기와 전분기 중 고객으로부터의 수익이 당사 전체 수익의 10(%) 이상을 차지하는 부문의 고객별 수익금액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분(*) | 당분기 | 전분기 |
| A | 1,495,000,000 | 2,312,301,088 |
| B | 2,145,704,704 | 3,352,185,000 |
| 합 계 | 3,640,704,704 | 5,664,486,088 |
(*) 동일 지배하에 있는 것으로 인지하고 있는 기업들은 단일 고객으로 간주하였습니다.
5. 금융상품 공정가치
5-1. 보고기간종료일 현재 금융자산 및 금융부채의 장부금액과 공정가치는 다음과 같습니다.
5-1-1. 금융자산
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 공정가치로 인식된 금융자산 : | ||||
| 당기손익-공정가치측정금융자산(비유동) | 144,349,685 | 144,349,685 | 111,909,475 | 111,909,475 |
| 기타포괄손익-공정가치측정지분상품 | 462,568,000 | 462,568,000 | 344,124,000 | 344,124,000 |
| 소 계 | 606,917,685 | 606,917,685 | 456,033,475 | 456,033,475 |
| 상각후원가로 인식된 금융자산 : | ||||
| 현금및현금성자산 | 7,046,409,781 | 7,046,409,781 | 1,728,376,758 | 1,728,376,758 |
| 매출채권및기타채권 | 5,215,476,688 | 5,215,476,688 | 4,564,753,679 | 4,564,753,679 |
| 기타금융자산(유동) | 98,802,600,000 | 98,802,600,000 | 88,645,952,579 | 88,645,952,579 |
| 기타금융자산(비유동) | 822,357,615 | 822,357,615 | 679,423,489 | 679,423,489 |
| 소 계 | 111,886,844,084 | 111,886,844,084 | 95,618,506,505 | 95,618,506,505 |
| 합 계 | 112,493,761,769 | 112,493,761,769 | 96,074,539,980 | 96,074,539,980 |
5-1-2. 금융부채
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 상각후원가로 인식된 금융부채 : | ||||
| 단기차입금 | 5,100,000,000 | 5,100,000,000 | 4,380,000,000 | 4,380,000,000 |
| 유동성장기부채 | 2,866,640,000 | 2,866,640,000 | 1,058,400,000 | 1,058,400,000 |
| 매입채무및기타채무 | 3,882,294,840 | 3,882,294,840 | 3,674,985,466 | 3,674,985,466 |
| 장기차입금 | 3,891,620,000 | 3,891,620,000 | 6,041,600,000 | 6,041,600,000 |
| 전환사채 | 37,701,161,313 | 37,701,161,313 | 31,078,120,985 | 31,078,120,985 |
| 유동리스부채 |
214,428,440 | 214,428,440 | 139,102,078 | 139,102,078 |
| 비유동리스부채 | 131,566,673 | 131,566,673 | 218,046,727 | 218,046,727 |
| 합 계 | 53,787,711,266 | 53,787,711,266 | 46,590,255,256 | 46,590,255,256 |
5-2. 금융상품 공정가치 서열 체계
공정가치로 측정되거나 공정가치가 공시되는 항목은 공정가치 서열체계에 따라 구분하며, 정의된 수준들은 다음과 같습니다.
| (수준1) | 동일한 자산이나 부채에 대한 활성시장의 (조정되지 않은) 공시가격 |
| (수준2) | 직접적으로(예:가격) 또는 간접적으로(예: 가격에서 도출되어) 관측 가능한 자산이나 부채에 대한 투입 변수를 이용하여 산정한 공정가치. 단 수준 1에 포함된 공시 가격은 제외함. |
| (수준3) | 관측 가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입 변수(관측 가능하지 않은 투입 변수)를 이용하여 산정한 공정가치 |
5-3. 공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
<당분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
| <자산> | ||||
| 비유동 당기손익-공정가치측정금융자산 | - | 144,349,685 | - | 144,349,685 |
| 기타포괄손익-공정가치측정지분상품 | - | - | 462,568,000 | 462,568,000 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 수준1 | 수준2 | 수준3 | 합 계 |
| <자산> | ||||
| 비유동 당기손익-공정가치측정금융자산 | - | 111,909,475 | - | 111,909,475 |
| 기타포괄손익-공정가치측정지분상품 | - | 157,716,000 | 186,408,000 | 344,124,000 |
5-4. 공정가치 서열체계 수준3의 가치평가기법 및 투입변수 설명
당사는 수준 3으로 분류된 금융자산에 대해서 독립적인 외부평가기관의 전문가적인 판단에 근거한 합리적인 평가모형과 적절한 추정치를 사용하여 산정한 금액을 공정가치로 보아 평가하고 있습니다.
6. 범주별 금융상품
6-1. 금융상품 범주별 장부금액
보고기간종료일 현재 금융자산 및 금융부채의 범주별 분류내역은 다음과 같습니다.
6-1-1. 금융자산
<당분기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 상각후원가 측정 금융자산 |
기타포괄손익-공정 |
당기손익-공정가치 측정 금융자산 |
합 계 |
| 현금및현금성자산 | 7,046,409,781 | - | - | 7,046,409,781 |
| 단기금융상품 | 98,802,600,000 | - | - | 98,802,600,000 |
| 비유동 당기손익-공정가치측정금융자산 | - | - | 144,349,685 | 144,349,685 |
| 매출채권 | 4,506,130,347 | - | - | 4,506,130,347 |
| 미수금 | 213,026,216 | - | - | 213,026,216 |
| 미수수익 | 496,320,125 | - | - | 496,320,125 |
| 매도가능금융자산 | - | 462,568,000 | - | 462,568,000 |
| 장기대여금 | 30,450,000 | - | - | 30,450,000 |
| 보증금 | 791,907,615 | - | - | 791,907,615 |
| 합 계 | 111,886,844,084 | 462,568,000 | 144,349,685 | 112,493,761,769 |
<전기말>
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 상각후원가 측정 금융자산 |
기타포괄손익-공정 |
당기손익-공정가치 측정 금융자산 |
합 계 |
| 현금및현금성자산 | 1,728,376,758 | - | - | 1,728,376,758 |
| 단기금융상품 | 88,645,952,579 | - | - | 88,645,952,579 |
| 비유동 당기손익-공정가치측정금융자산 | - | - | 111,909,475 | 111,909,475 |
| 매출채권 | 4,185,713,949 | - | - | 4,185,713,949 |
| 미수금 | 83,555,147 | - | - | 83,555,147 |
| 미수수익 | 295,484,583 | - | - | 295,484,583 |
| 매도가능금융자산 | - | 344,124,000 | - | 344,124,000 |
| 장기대여금 | 82,650,000 | - | - | 82,650,000 |
| 보증금 | 596,773,489 | - | - | 596,773,489 |
| 합 계 | 95,618,506,505 | 344,124,000 | 111,909,475 | 96,074,539,980 |
6-1-2. 금융부채
<당분기말>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 매입채무 | 2,148,734,069 | - | 2,148,734,069 |
| 단기차입금 | 5,100,000,000 | - | 5,100,000,000 |
| 미지급금 | 1,718,518,776 | - | 1,718,518,776 |
| 미지급비용 | 15,041,995 | - | 15,041,995 |
| 유동성장기부채 | 2,866,640,000 | - | 2,866,640,000 |
| 장기차입금 | 3,891,620,000 | - | 3,891,620,000 |
| 전환사채 | 37,701,161,313 | - | 37,701,161,313 |
| 유동리스부채 | 214,428,440 | - | 214,428,440 |
| 비유동리스부채 | 131,566,673 | - | 131,566,673 |
| 합 계 | 53,787,711,266 | - | 53,787,711,266 |
<전기말>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 상각후원가 측정 금융부채 |
당기손익-공정가치 측정 금융부채 |
합 계 |
| 매입채무 | 867,650,649 | - | 867,650,649 |
| 단기차입금 | 4,380,000,000 | - | 4,380,000,000 |
| 미지급금 | 2,791,566,761 | - | 2,791,566,761 |
| 미지급비용 | 15,768,056 | - | 15,768,056 |
| 유동성장기부채 | 1,058,400,000 | - | 1,058,400,000 |
| 장기차입금 | 6,041,600,000 | - | 6,041,600,000 |
| 전환사채 | 31,078,120,985 | - | 31,078,120,985 |
| 유동리스부채 | 139,102,078 | - | 139,102,078 |
| 비유동리스부채 | 218,046,727 | - | 218,046,727 |
| 합 계 | 46,590,255,256 | - | 46,590,255,256 |
6-2. 금융상품 범주별 순손익
금융자산 및 금융부채의 범주별 관련손익은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 |
상각후원가 측정 금융자산 |
기타포괄손익-공정 가치측정 금융자산 |
당기손익-공정가치 측정 금융자산 |
상각후원가 측정 금융부채 |
합 계 | |||||
| 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | |
| 당기손익 : | ||||||||||
| 이자수익 |
195,483,465 | 678,970,291 | - | - | - | - | - | - | 195,483,465 | 678,970,291 |
| 이자비용 |
- | - | - | - | - | - | (2,443,398,453) | (6,901,068,282) | (2,443,398,453) | (6,901,068,282) |
| 당기손익-공정가치 측정 금융자산 평가손익 |
- | - | - | - | 887,737 | 3,500,210 | - | - | 887,737 | 3,500,210 |
| 기타포괄손익 : | ||||||||||
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
- | - | - | (282,608,474) | - | - | - | - | - | (282,608,474) |
| 합 계 | 195,483,465 | 678,970,291 | - | (282,608,474) | 887,737 | 3,500,210 | (2,443,398,453) | (6,901,068,282) | (2,247,027,251) | (6,501,206,255) |
<전분기>
| (단위: 원) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 |
상각후원가 측정 금융자산 |
기타포괄손익-공정 가치측정 금융자산 |
당기손익-공정가치 측정 금융자산 |
상각후원가 측정 금융부채 |
합 계 | |||||
| 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | 3개월 | 누적 | |
| 당기손익 : | ||||||||||
| 이자수익 | 118,080,276 | 413,163,472 | - | - | - | - | - | - | 118,080,276 | 413,163,472 |
| 이자비용 |
- | - | - | - | - | - | (86,454,730) | (115,470,183) | (86,454,730) | (115,470,183) |
| 당기손익-공정가치 측정 금융자산 평가손익 |
- | - | - | - | 54,561,240 | 57,075,586 | - | - | 54,561,240 | 57,075,586 |
| 기타포괄손익 : | ||||||||||
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
- | - | (15,331,680) | (11,133,720) | - | - | - | - | (15,331,680) | (11,133,720) |
| 합 계 | 118,080,276 | 413,163,472 | (15,331,680) | (11,133,720) | 54,561,240 | 57,075,586 | (86,454,730) | (115,470,183) | 70,855,106 | 343,635,155 |
7. 현금및현금성자산
보고기간종료일 현재 현금및현금성자산 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 보통예금 | 7,091,409,781 | 1,728,376,758 |
| 국고보조금 | (45,000,000) | - |
| 합 계 | 7,046,409,781 | 1,728,376,758 |
8. 당기손익-공정가치 측정 금융자산
8-1. 보고기간종료일 현재 당기손익-공정가치 측정 금융자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 장기금융상품 | - | 144,349,685 | - | 111,909,475 |
8-2. 당분기 및 전기 중 당기손익-공정가치 측정 금융자산의 변동내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전 기 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 기 초 | - | 111,909,475 | - | 36,750,771 |
| 취 득 | - | 28,940,000 | 1,826,168,773 | 69,456,000 |
| 처 분 | - | - | (1,569,000,000) | - |
| 평 가 | - | 3,500,210 | - | 5,702,704 |
| 손 익 | - | - | (257,168,773) | - |
| 기 말 | - | 144,349,685 | - | 111,909,475 |
9. 기타포괄손익-공정가치 측정 지분상품
보고기간종료일 현재 기타포괄손익-공정가치 측정 지분상품의 내역은 다음과 같습니다.
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 회사명 | 주식수(주) | 취득원가 | 공정가치 | 미실현보유 손익누계액 |
장부금액 |
| (주)로보쓰리(*) | 234,000 | 987,480,000 | - | - | - |
| (주)메드푸드 | 67,000 | 1,005,000,000 | 462,568,000 | (542,432,000) | 462,568,000 |
| 합 계 | 1,992,480,000 | 462,568,000 | (542,432,000) | 462,568,000 | |
(*) 당분기 중 소유주식 전량을 매각하였습니다. 매각 된 주식의 공정가치는 119,237,444원이며, 관련하여 세후기타포괄손실로 인식된 677,229,194원은 처분 후 결손금으로 대체되었습니다.
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 회사명 | 주식수(주) | 취득원가 | 공정가치 | 미실현보유 손익누계액 |
장부금액 |
| (주)로보쓰리 | 234,000 | 987,480,000 | 157,716,000 | (829,764,000) | 157,716,000 |
| (주)메드푸드 | 27,000 | 405,000,000 | 186,408,000 | (218,592,000) | 186,408,000 |
| 합 계 | 1,392,480,000 | 344,124,000 | (1,048,356,000) | 344,124,000 | |
10. 기타금융자산
보고기간종료일 현재 기타금융자산 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 단기금융상품 | 98,802,600,000 | - | 88,645,952,579 | - |
| 장기대여금 | - | 30,450,000 | - | 82,650,000 |
| 보증금 | - | 791,907,615 | - | 596,773,489 |
| 합 계 | 98,802,600,000 | 822,357,615 | 88,645,952,579 | 679,423,489 |
11. 매출채권및기타채권
11-1. 보고기간종료일 현재 매출채권및기타채권 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 매출채권 | 5,043,988,374 | 5,066,709,475 |
| (대손충당금) | (537,858,027) | (880,995,526) |
| 미수금 | 712,559,021 | 583,087,952 |
| (대손충당금) | (499,532,805) | (499,532,805) |
| 미수수익 | 496,320,125 | 295,484,583 |
| 합 계 | 5,215,476,688 | 4,564,753,679 |
11-2. 보고기간종료일 현재 매출채권및기타채권 대손충당금 변동내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 매출채권 | 미수금 | 매출채권 | 미수금 | |
| 기초잔액 | 880,995,526 | 499,532,805 | 1,012,078,338 | 499,532,805 |
| 대손상각비(환입) | (343,137,499) | - | (131,082,812) | - |
| 기말잔액 | 537,858,027 | 499,532,805 | 880,995,526 | 499,532,805 |
11-3. 보고기간종료일 현재 매출채권및기타채권 연령분석은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 장부금액 | 6개월이하 | 6개월초과 1년이하 |
1년초과 | 합 계 | |
| 당분기말 | 매출채권 | 5,043,988,374 | 4,503,143,871 | - | 540,844,503 | 5,043,988,374 |
| 미수금 | 712,559,021 | 30,209,216 | 182,817,000 | 499,532,805 | 712,559,021 | |
| 미수수익 | 496,320,125 | 496,320,125 | - | - | 496,320,125 | |
| 전기말 | 매출채권 | 5,066,709,475 | 4,169,091,601 | - | 897,617,874 | 5,066,709,475 |
| 미수금 | 583,087,952 | 83,555,147 | - | 499,532,805 | 583,087,952 | |
| 미수수익 | 295,484,583 | 295,484,583 | - | - | 295,484,583 | |
12. 재고자산
보고기간종료일 현재 재고자산 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||||
| 취득원가 | 평가손실충당금 | 장부금액 | 취득원가 | 평가손실충당금 | 장부금액 | |
| 제 품 | 6,278,102,154 | (2,461,892,153) | 3,816,210,001 | 8,161,655,609 | (1,771,799,442) | 6,389,856,167 |
| 상 품 | 356,827,714 | (170,710,250) | 186,117,464 | 589,338,383 | (2,660,000) | 586,678,383 |
| 재공품 | 406,000,272 | (31,498,754) | 374,501,518 | 158,771,645 | (77,893,904) | 80,877,741 |
| 원재료 | 3,908,363,235 | (1,032,834,000) | 2,875,529,235 | 3,082,361,560 | (961,936,784) | 2,120,424,776 |
| 미착품 | 320,130,360 | - | 320,130,360 | - | - | - |
| 합 계 | 11,269,423,735 | (3,696,935,157) | 7,572,488,578 | 11,992,127,197 | (2,814,290,130) | 9,177,837,067 |
13. 기타자산
보고기간종료일 현재 기타자산 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 선급금 | 33,702,143 | - | 286,242,651 | - |
| 선급비용 | 22,572,486 | - | 24,580,743 | - |
| 반환제품회수권(*) | 178,781,697 | - | 150,264,030 | - |
| 합 계 | 235,056,326 | - | 461,087,424 | - |
(*) 반환제품회수권은 고객이 반품권을 행사하면 고객으로부터 제품을 회수할 권리를 나타냅니다.
14. 종속기업투자
14-1. 보고기간종료일 현재 종속기업 내역은 다음과 같습니다.
| 구 분 | 회사명 | 주요영업활동 | 투자주식수(주) | 지분율(%) | 결산일 | 소재지 |
|---|---|---|---|---|---|---|
| 종속기업 | Enzychem Lifesciences USA Inc. | 임상개발/라이선스 | 1,010 | 100.00 | 12월 31일 | 미국 |
| 종속기업 | (주)메쎄나(*) | 의약품 위탁생산/신약개발 | 1,600,000 | 88.89 | 12월 31일 | 한국 |
(*) (주)메쎄나는 당분기 중 설립되었습니다.
14-2. 보고기간종료일 현재 종속기업 투자현황은 다음과 같습니다.
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구 분 | 회사명 | 당분기말 | 전기말 | ||||
| 지분율(%) | 순자산지분해당액 | 장부금액 | 지분율(%) | 순자산지분해당액 | 장부금액 | ||
| 종속기업 | Enzychem Lifesciences USA Inc. | 100.00 | 370,948,697 | 380,153,565 | 100.00 | 203,027,285 | 185,119,950 |
| 종속기업 | (주)메쎄나 | 88.89 | 795,228,247 | 800,000,000 | - | - | - |
| 합 계 | 1,166,176,944 | 1,180,153,565 | 203,027,285 | 185,119,950 | |||
14-3. 당분기 및 전기 중 종속기업의 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 회사명 | 기 초 | 취 득(*) | 처 분 | 기 말 |
| 종속기업 | Enzychem Lifesciences USA Inc. | 185,119,950 | 195,033,615 | - | 380,153,565 |
| 종속기업 | (주)메쎄나 | - | 800,000,000 | - | 800,000,000 |
| 합 계 | 185,119,950 | 995,033,615 | - | 1,180,153,565 | |
(*) Enzychem Lifesciences USA Inc. 당기 취득액은 종속기업 임직원에 대한 주식보상비용 해당액입니다.
<전기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 회사명 | 기 초 | 취 득(*1) | 처 분 | 기 말 |
| 종속기업 | Enzychem Lifesciences USA Inc. | 134,771,912 | 50,348,038 | - | 185,119,950 |
| 관계기업 | 베리타스투자조합(*2) | 3,000,000,000 | - | (3,000,000,000) | - |
| 합 계 | 3,134,771,912 | 50,348,038 | (3,000,000,000) | 185,119,950 | |
(*1) Enzychem Lifesciences USA Inc. 전기 취득액은 종속기업 임직원에 대한 주식보상비용 해당액 입니다.
(*2) 전기 중 당사가 보유중이던 지분을 전량 매각함에 따라 관계기업에서 제외되었습니다.
14-4. 당분기 및 전분기 중 종속기업의 요약 재무상태는 아래와 같습니다.
<당분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 회사명 | 자산총계 | 부채총계 | 매 출 | 분기순이익(손실) | 분기총포괄손익 |
| 종속기업 | Enzychem Lifesciences USA Inc. | 887,854,461 | 516,905,764 | 1,583,414,378 | (46,975,693) | (27,112,203) |
| 종속기업 | (주)메쎄나 | 900,240,595 | 5,620,000 | - | (5,379,405) | (5,379,405) |
| 합 계 | 1,788,095,056 | 522,525,764 | 1,583,414,378 | (52,355,098) | (32,491,608) | |
<전분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 회사명 | 자산총계 | 부채총계 | 매 출 | 분기순이익(손실) | 분기총포괄손익 |
| 종속기업 | Enzychem Lifesciences USA Inc. | 659,506,032 | 328,947,646 | 1,260,781,043 | 2,422,106 | 5,405,114 |
| 관계기업 | 베리타스투자조합(*) | 17,456,216,058 | 2,100,000 | - | (241,999,791) | (241,999,791) |
| 합 계 | 18,115,722,090 | 331,047,646 | 1,260,781,043 | (239,577,685) | (236,594,677) | |
(*) 전기 중 당사가 보유중이던 지분을 전량 매각함에 따라 관계기업에서 제외되었습니다.
15. 유형자산
15-1. 보고기간종료일 현재 유형자산의 세부 내역은 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기말 |
전기말 |
||||
| 취득원가 | 상각누계액 | 장부금액 | 취득원가 | 상각누계액 | 장부금액 | |
| 토 지 | 6,249,229,959 | - | 6,249,229,959 | 6,249,229,959 | - | 6,249,229,959 |
| 건 물 | 5,755,432,267 | (1,343,055,107) | 4,412,377,160 | 5,755,432,267 | (1,235,140,796) | 4,520,291,471 |
| 구축물 | 336,209,043 | (116,073,727) | 220,135,316 | 336,209,043 | (109,769,848) | 226,439,195 |
| 기계장치 | 10,400,333,152 | (7,690,054,510) | 2,710,278,642 | 9,658,076,336 | (7,335,741,310) | 2,322,335,026 |
| 차량운반구 | 55,693,811 | (45,349,138) | 10,344,673 | 55,693,811 | (42,611,644) | 13,082,167 |
| 공구와기구 | 2,082,043,952 | (1,397,261,750) | 684,782,202 | 2,033,801,006 | (1,227,708,966) | 806,092,040 |
| 비 품 | 1,547,740,744 | (721,236,068) | 826,504,676 | 1,006,944,498 | (584,694,861) | 422,249,637 |
| 사용권자산 | 971,978,098 | (585,603,071) | 386,375,027 | 571,911,029 | (186,257,738) | 385,653,291 |
| 건설중인자산 | 188,100,000 | - | 188,100,000 | 559,019,000 | - | 559,019,000 |
| 합 계 | 27,586,761,026 | (11,898,633,371) | 15,688,127,655 | 26,226,316,949 | (10,721,925,163) | 15,504,391,786 |
15-2. 당분기 및 전기 중 유형자산 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 처 분 | 대 체 | 감가상각 | 기 말 |
| 토 지 | 6,249,229,959 | - | - | - | - | 6,249,229,959 |
| 건 물 | 4,520,291,471 | - | - | - | (107,914,311) | 4,412,377,160 |
| 구축물 | 226,439,195 | - | - | - | (6,303,879) | 220,135,316 |
| 기계장치 | 2,322,335,026 | 14,920,000 | (20,770,483) | 815,113,404 | (421,319,305) | 2,710,278,642 |
| 차량운반구 | 13,082,167 | - | - | - | (2,737,494) | 10,344,673 |
| 공구와기구 | 806,092,040 | 54,964,000 | (1,000) | - | (176,272,838) | 684,782,202 |
| 비 품 | 422,249,637 | 71,807,754 | (1,000) | 475,738,492 | (143,290,207) | 826,504,676 |
| 사용권자산 | 385,653,291 | 436,071,017 | (836,178) | - | (434,513,103) | 386,375,027 |
| 건설중인자산 | 559,019,000 | 940,091,546 | - | (1,311,010,546) | - | 188,100,000 |
| 합 계 | 15,504,391,786 | 1,517,854,317 | (21,608,661) | (20,158,650) | (1,292,351,137) | 15,688,127,655 |
<전기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 처 분 | 대 체(*) | 감가상각 | 기 말 |
| 토 지 | 610,907,280 | - | - | 5,638,322,679 | - | 6,249,229,959 |
| 건 물 | 4,641,244,449 | - | (107,274,451) | 130,000,000 | (143,678,527) | 4,520,291,471 |
| 구축물 | 234,844,415 | - | - | - | (8,405,220) | 226,439,195 |
| 기계장치 | 3,122,440,009 | 26,910,000 | (23,491,805) | 170,500,000 | (974,023,178) | 2,322,335,026 |
| 차량운반구 | 16,732,167 | - | - | - | (3,650,000) | 13,082,167 |
| 공구와기구 | 809,381,141 | 203,998,130 | - | - | (207,287,231) | 806,092,040 |
| 비 품 | 446,747,315 | 36,300,617 | - | 82,650,000 | (143,448,295) | 422,249,637 |
| 사용권자산 | 276,072,330 | 448,951,519 | (52,208,216) | - | (287,162,342) | 385,653,291 |
| 건설중인자산 | 4,424,102,237 | 2,156,389,442 | - | (6,021,472,679) | - | 559,019,000 |
| 합 계 | 14,582,471,343 | 2,872,549,708 | (182,974,472) | - | (1,767,654,793) | 15,504,391,786 |
(*) 전기 중 오송산업단지와 관련하여 건설중인자산에서 토지 (5,638,322,679원)로 대체되었습니다.
15-3. 보고기간종료일 현재 사용권자산의 현황은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 건물 | 305,127,780 | 250,186,412 |
| 차량운반구 | 68,576,844 | 118,410,569 |
| 비품 | 12,670,403 | 17,056,310 |
| 합 계 | 386,375,027 | 385,653,291 |
15-4. 당분기 및 전기 중 차입원가 자본화 내역은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 계정과목 | 당분기 | 전 기 | 비 고 |
| 건설중인자산 | - | 36,488,759 | 오송산업단지 토지 |
15-5. 보고기간종료일 현재 보유한 토지의 공시지가는 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 소재지 | 면적(㎡) | 당분기말 | 전기말 | ||
| 장부금액 | 공시지가 | 장부금액 | 공시지가 | ||
| 충북 제천시 바이오밸리로 59 | 7,559 | 610,907,280 | 709,790,100 | 610,907,280 | 679,554,100 |
| 충북 청주시 흥덕구 오송읍 정중리 726번지 | 17,499 | 5,638,322,679 | 3,832,281,000 | 5,638,322,679 | 3,587,295,000 |
| 합 계 | 6,249,229,959 | 4,542,071,100 | 6,249,229,959 | 4,266,849,100 | |
15-6. 보고기간종료일 현재 보험가입내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 보험종류 | 보험회사 | 부보대상 | 장부금액 | 부보금액 |
| 화재보험 | MG손해보험 | 건물 | 4,412,377,160 | 9,305,406,623 |
| 구축물 | 220,135,316 | |||
| 기계장치 | 2,710,278,642 | |||
| 합 계 | 7,342,791,118 | 9,305,406,623 | ||
당사는 상기 이외 차량운반구와 관련하여 자동차종합보험 및 책임보험에 가입하고 있습니다.
16. 무형자산
16-1. 보고기간종료일 현재 무형자산의 세부 내역은 다음과 같습니다.
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 당분기말 |
전기말 |
||||||
| 취득원가 | 상각누계액 | 손상차손누계액 | 장부금액 | 취득원가 | 상각누계액 | 손상차손누계액 | 장부금액 | |
| 산업재산권 | 1,204,782,800 | (460,996,553) | (4,569,832) | 739,216,415 | 1,118,827,506 | (386,611,952) | (4,569,832) | 727,645,722 |
| 개발비 | 2,703,414,008 | (2,678,902,413) | (24,511,595) | - | 2,703,414,008 | (2,677,728,098) | (24,511,595) | 1,174,315 |
| 회원권 | 306,390,015 | - | (58,566,000) | 247,824,015 | 258,566,000 | - | (58,566,000) | 200,000,000 |
| 기타무형자산 | 646,488,237 | (351,602,948) | - | 294,885,289 | 646,488,237 | (254,796,554) | - | 391,691,683 |
| 건설중인자산 | 1,010,840,606 | - | - | 1,010,840,606 | 648,994,343 | - | - | 648,994,343 |
| 합 계 | 5,871,915,666 | (3,491,501,914) | (87,647,427) | 2,292,766,325 | 5,376,290,094 | (3,319,136,604) | (87,647,427) | 1,969,506,063 |
16-2. 당분기 및 전기 중 무형자산 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 상 각 | 손상차손 | 대 체 | 기 말 |
| 산업재산권 | 727,645,722 | - | (74,384,601) | - | 85,955,294 | 739,216,415 |
| 개발비 | 1,174,315 | - | (1,174,315) | - | - | - |
| 회원권 | 200,000,000 | 47,824,015 | - | - | - | 247,824,015 |
| 기타무형자산 | 391,691,683 | - | (96,806,394) | - | - | 294,885,289 |
| 건설중인자산 | 648,994,343 | 464,513,039 | - | - | (102,666,776) | 1,010,840,606 |
| 합 계 | 1,969,506,063 | 512,337,054 | (172,365,310) | - | (16,711,482) | 2,292,766,325 |
<전기>
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 취 득 | 상 각 | 손상차손 | 대 체 | 기 말 |
| 산업재산권 | 422,126,192 | - | (67,052,440) | (1,523,998) | 374,095,968 | 727,645,722 |
| 개발비 | 9,398,070 | - | (8,223,755) | - | - | 1,174,315 |
| 회원권 | - | 258,566,000 | - | (58,566,000) | - | 200,000,000 |
| 기타무형자산 | 518,266,463 | 2,300,000 | (128,874,780) | - | - | 391,691,683 |
| 건설중인자산 | 621,254,205 | 443,483,295 | - | - | (415,743,157) | 648,994,343 |
| 합 계 | 1,571,044,930 | 704,349,295 | (204,150,975) | (60,089,998) | (41,647,189) | 1,969,506,063 |
16-3. 당분기 및 전분기 중 무형자산상각비 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 판매비와관리비 | 57,503,298 | 172,365,310 | 50,362,878 | 149,196,887 |
16-4. 당분기 및 전분기 중 경상개발비의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 판매비와관리비 | 2,953,992,479 | 9,317,765,855 | 4,756,265,491 | 10,612,481,861 |
16-5. 보고기간종료일 현재 당사가 진행 중인 EC-18 임상시험의 내역은 다음과 같습니다.
| 임상명 | 임상단계 |
| 호중구감소증(CIN) | 임상2상 Part 1 완료 / 임상2상 Part 2 승인 |
| 구강점막염(CRIOM) | 임상2상 Stage 2 결과 통계분석 |
| 급성방사선증후군(ARS) | 임상2상에 준하는 영장류 시험 진행 |
| 코로나19치료제(COVID-19) | 임상2상 완료(국내) / 임상2상 진행 중(미국) |
17. 정부보조금
17-1. 보고기간종료일 현재 당사가 진행 중인 정부과제 내역은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 과제명 | 전문기관 | 계약기간 | 총 사업비 | 정부보조금 |
| 1 | 라푸티딘의 전구체인 PTBA-MA의 개발 및 사업화 | 한국산업기술진흥원 | 2020.05.01 ~ 2021.04.30 | 200,000,000 | 160,000,000 |
| 2 | 중견기업 글로벌 지원사업 | 대한무역투자진흥공사 | 2021.02.01 ~ 2022.01.31 | 100,000,000 | 70,000,000 |
| 3 | 글로벌 IP 스타기업 지원사업 | 충북지식재산센터 | 2021.03.30 ~ 2021.12.31 | 70,000,000 | 70,000,000 |
| 4 | 소염진통제인 펠루비프로펜의 연구개발 및 사업화 | 한국산업기술진흥원 | 2021.04.01 ~ 2022.03.31 | 190,000,000 | 150,000,000 |
| 5 | 구직자 참여형 바이오 R&D 지원 사업 | 충북대학교 산학협력단 | 2021.05.26 ~ 2021.12.31 | 16,000,000 | 16,000,000 |
| 6 | 급성방사선증후군 치료제 개발을 위한 전임상연구 | 한국방사선진흥협회 | 2021.06.14 ~ 2022.12.13 | 116,250,000 | 90,000,000 |
17-2. 당분기 및 전기 중 정부보조금 변동내역은 다음과 같습니다.
<당분기>
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 과제명 | 관련 계정 | 기 초 | 수령금액 | 반환금액 | 사용금액 | 기 말 | |
| 자산취득 | 비용보전 등 | |||||||
| 1 | PTBA-MA의 개발 및 사업화 | 현금및현금성자산 | - | 39,592,021 | (73,170) | - | (39,518,851) | - |
| 2 | 중견기업 글로벌 지원산업 | 현금및현금성자산 | - | 5,688,410 | - | - | (5,688,410) | - |
| 3 | 글로벌 IP 스타기업 지원사업 | 현금및현금성자산 | - | 56,610,000 | - | - | (56,610,000) | - |
| 4 | 펠루비프로펜 개발 및 사업화 | 현금및현금성자산 | - | 3,084,414 | - | - | (3,084,414) | - |
| 5 | 구직자 참여형 바이오 R&D 지원 사업 | 현금및현금성자산 | - | 13,950,420 | - | - | (13,950,420) | - |
| 6 | 급성방사선증후군 치료제 개발을 위한 전임상연구 | 현금및현금성자산 | - | 45,000,000 | - | - | - | 45,000,000 |
| 합 계 | - | 163,925,265 | (73,170) | - | (118,852,095) | 45,000,000 | ||
<전기>
| (단위: 원) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 구 분 | 과제명 | 관련 계정 | 기 초 | 수령금액 | 반환금액 | 사용금액 | 기 말 | |
| 자산취득 | 비용보전 등 | |||||||
| - | MRI 조영제 가도부트롤 개발 | 현금및현금성자산 | - | 50,026,438 | (776,662) | - | (49,249,776) | - |
| 매입채무및기타채무 | 21,977,055 | - | - | - | (21,977,055) | - | ||
| - | 보티옥세틴 연구개발과 사업화 | 현금및현금성자산 | - | 56,577,547 | (17,350,651) | - | (39,226,896) | - |
| - | 거대고리형 MRI조영제 가도테리돌 개발 | 현금및현금성자산 | 18,145,744 | 40,018,234 | (4,837,825) | - | (53,326,153) | - |
| - | 가도테릭산을 이용한 MRI조영제 의약품 개발 | 현금및현금성자산 | - | 11,457,178 | - | - | (11,457,178) | - |
| 1 | PTBA-MA의 개발 및 사업화 | 현금및현금성자산 | - | 118,059,022 | - | - | (118,059,022) | - |
| - | 신약개발물질 유전독성 평가연구 | 현금및현금성자산 | - | 16,000,000 | - | - | (16,000,000) | - |
| 합 계 | 40,122,799 | 292,138,419 | (22,965,138) | - | (309,296,080) | - | ||
17-3. 미이행조건과 우발상황
보고기간종료일 현재 재무제표에 인식된 정부보조금과 관련하여 미이행조건 및 기타우발상황은 존재하지 아니합니다.
18. 차입금
18-1. 보고기간종료일 현재 단기차입금 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 차입기관 | 이자율(%) | 당분기말 | 전기말 |
| 운영자금 | KDB산업은행 | 2.06 | 1,600,000,000 | 1,600,000,000 |
| 운영자금 | KDB산업은행 | 3.46 | 2,000,000,000 | 2,000,000,000 |
| 운영자금 | IBK기업은행 | 2.84 | 1,500,000,000 | 780,000,000 |
| 합 계 | 5,100,000,000 | 4,380,000,000 | ||
18-2. 보고기간종료일 현재 장기차입금 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 차입기관 | 이자율(%) | 당분기말 | 전기말 |
| 시설자금 | KDB산업은행 | 2.36 | 3,758,260,000 | 4,100,000,000 |
| 시설자금 | IBK기업은행 | 3.48 | 3,000,000,000 | 3,000,000,000 |
| 소 계 | 6,758,260,000 | 7,100,000,000 | ||
| 차감: 1년 이내 만기도래분(유동성장기부채) | (2,866,640,000) | (1,058,400,000) | ||
| 차감 후 잔액 | 3,891,620,000 | 6,041,600,000 | ||
18-3. 보고기간종료일 현재 장기차입금의 연도별 상환계획은 다음과 같습니다.
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 차입기관 | 1년 이내 | 1년 초과~2년 이내 | 2년 초과 | 합 계 |
| 시설자금 | KDB산업은행 | 1,366,640,000 | 1,366,640,000 | 1,024,980,000 | 3,758,260,000 |
| 시설자금 | IBK기업은행 | 1,500,000,000 | 1,500,000,000 | - | 3,000,000,000 |
| 합 계 | 2,866,640,000 | 2,866,640,000 | 1,024,980,000 | 6,758,260,000 | |
19. 전환사채
19-1. 보고기간종료일 현재 전환사채 내역은 다음과 같습니다.
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 종 류 | 발행일 | 만기일 | 연이자율(%) | 당분기말 | 전기말 |
| 제2회 무기명식 무보증 사모 전환사채 | 2020.11.06 | 2025.11.06 | - | 50,000,000,000 | 50,000,000,000 |
| 사채할인발행차금 | (2,373,005) | (3,650,891) | |||
| 전환권조정 | (12,296,465,682) | (18,918,228,124) | |||
| 소 계 | 37,701,161,313 | 31,078,120,985 | |||
| 차감 : 1년 이내 만기도래분 | - | - | |||
| 합 계 | 37,701,161,313 | 31,078,120,985 | |||
19-2. 당분기 및 전기 중 전환사채의 변동 내역은 다음과 같습니다.
<당분기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 발 행 | 조기상환 | 상각액 | 기 말 |
| 액면금액 | 50,000,000,000 | - | - | - | 50,000,000,000 |
| 사채할인발행차금 | (3,650,891) | - | - | 1,277,886 | (2,373,005) |
| 전환권조정 | (18,918,228,124) | - | - | 6,621,762,442 | (12,296,465,682) |
| 장부금액 | 31,078,120,985 | - | - | 6,623,040,328 | 37,701,161,313 |
<전기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 발 행 | 조기상환 | 상각액 | 기 말 |
| 액면금액 | - | 50,000,000,000 | - | - | 50,000,000,000 |
| 사채할인발행차금 | - | (3,884,240) | - | 233,349 | (3,650,891) |
| 전환권조정 | - | (20,127,400,000) | - | 1,209,171,876 | (18,918,228,124) |
| 장부금액 | - | 29,868,715,760 | - | 1,209,405,225 | 31,078,120,985 |
19-3. 보고기간종료일 현재 전환사채의 발행조건은 다음과 같습니다.
| 구 분 | 내 용 |
|---|---|
| 사채의 명칭 | 제2회 무기명식 이권부 무보증 사모 전환사채 |
| 액면금액 | 50,000,000,000원 |
| 발행가액 | 50,000,000,000원 |
| 발행일자 | 2020.11.06 |
| 만기일자 | 2025.11.06 |
| 이자지급조건 | 0% |
| 보장수익률 | 0% |
| 상환방법 | 만기보유 사채 만기일 일시상환 |
| 전환청구기간 | 2021.11.06 ~ 2025.10.06 |
| 전환가액(*) | 89,082 원 |
| 전환가액 조정 | - 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 사채 발행일 이 후 3개월이 지난 시점부터 매 3개월마다 시가 변동에 따라 전환가격 평가 |
| 조기상환청구권 | 발행일로부터 24개월이 되는 2022년 11월 06일 및 이후 3개월에 해당되는 날 |
(*) 최초 전환가액은 100,196원이었으나, 전환가액 조정으로 89,082원으로 변경되었으며, 전환가액 조정으로 인해 전환가능주식수는 561,280주로 변경 되었습니다.
20. 매입채무및기타채무
보고기간종료일 현재 매입채무및기타채무 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 매입채무 | 2,148,734,069 | - | 867,650,649 | - |
| 미지급금 | 1,718,518,776 | - | 2,791,566,761 | - |
| 미지급비용 | 15,041,995 | - | 15,768,056 | - |
| 합 계 | 3,882,294,840 | - | 3,674,985,466 | - |
21. 리스부채
21-1. 보고기간종료일 현재 리스부채 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 건물 | 147,754,702 | 112,851,923 | 67,738,738 | 150,136,470 |
| 차량운반구 | 60,892,740 | 11,505,478 | 65,842,778 | 56,332,099 |
| 비품 | 5,780,998 | 7,209,272 | 5,520,562 | 11,578,158 |
| 합 계 | 214,428,440 | 131,566,673 | 139,102,078 | 218,046,727 |
21-2. 당분기 및 전기 중 리스부채의 변동내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전 기 |
| 기 초 | 357,148,805 | 264,380,575 |
| 증 가 | 326,073,189 | 394,095,041 |
| 감 소 | (1,127,666) | (63,865,370) |
| 지 급 | (336,099,215) | (237,461,441) |
| 기 말 | 345,995,113 | 357,148,805 |
21-3. 보고기간종료일 현재 리스에 따라 지급할 것으로 예상되는 최소리스료의 현재가치는 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 최소리스료 | 현재가치 | 최소리스료 | 현재가치 | |
| 1년 이내 | 227,499,478 | 214,428,440 | 158,028,054 | 139,102,078 |
| 1년 초과 5년 이내 | 144,460,033 | 131,566,673 | 239,473,514 | 218,046,727 |
| 합 계 | 371,959,511 | 345,995,113 | 397,501,568 | 357,148,805 |
21-4. 당분기 및 전분기 중 당기손익으로 인식한 금액은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용(금융원가에 포함) | 6,002,814 | 20,850,438 | 4,084,882 | 14,457,182 |
| 단기리스료(매출원가 및 판매관리비에 포함) | - | - | - | - |
| 소액자산 리스료(매출원가 및 판매관리비에 포함) | 4,106,512 | 14,343,252 | 4,263,671 | 11,913,840 |
| 리스부채 측정치에 포함되지 않은 변동리스료(판매관리비에 포함) | 13,383,108 | 36,472,451 | 29,345,187 | 86,324,009 |
| 리스료 할인(영업외수익에 포함) | 445,119 | (292,129) | (3,437,740) | (10,438,202) |
21-5. 당분기 및 전분기 중 리스로 인한 현금유출액은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 리스 관련 총현금유출액 | 150,113,855 | 407,473,227 | 93,873,592 | 277,088,187 |
22. 기타부채
보고기간종료일 현재 기타부채 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 예수금 | 173,333,010 | - | 160,962,336 | - |
| 선수금 | 143,420,440 | - | 130,000 | - |
| 합 계 | 316,753,450 | - | 161,092,336 | - |
23. 충당부채
23-1. 보고기간종료일 현재 충당부채 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 유 동 | 비유동 | 유 동 | 비유동 | |
| 환불부채(*) | 185,681,730 | - | 167,384,219 | - |
| 복구충당부채 | 95,926,891 | - | - | - |
| 합 계 | 281,608,621 | - | 167,384,219 | - |
(*) 환불부채는 반품할 수 있는 고객의 권리와 관련하여 고객이 반품할 것으로 추정되는 금액이며, 동 환불부채에 상응하여 수익인식금액이 조정됩니다.
23-2. 당분기 및 전기 중 충당부채의 변동내역은 다음과 같습니다.
<당분기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 전 입 | 환 입 | 대 체 | 기 말 |
| 환불부채 | 167,384,219 | 18,297,511 | - | - | 185,681,730 |
| 복구충당부채 | - | 95,926,891 | - | - | 95,926,891 |
| 합 계 | 167,384,219 | 114,224,402 | - | - | 281,608,621 |
<전기>
| (단위 : 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 기 초 | 전 입 | 환 입 | 대 체 | 기 말 |
| 환불부채 | 199,221,909 | - | (31,837,690) | - | 167,384,219 |
| 소송충당부채(*) | 1,587,449,738 | - | (1,277,903,597) | (309,546,141) | - |
| 합 계 | 1,786,671,647 | - | (1,309,741,287) | (309,546,141) | 167,384,219 |
(*) 전기 중 진행 중이던 소송에서 당사는 최종 패소하였으며, 관련 부채 309,546천원을 미지급금으로 계상하였습니다.
24. 순확정급여부채
24-1. 보고기간종료일 현재 순확정급여부채 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 확정급여채무 | 2,694,914,508 | 2,542,914,701 |
| 사외적립자산 | (1,145,898,310) | (1,138,772,325) |
| 순확정급여부채 | 1,549,016,198 | 1,404,142,376 |
24-2. 당분기 및 전분기 중 순확정급여부채와 관련하여 포괄손익계산서에 반영된 금액 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 당기근무원가 | 407,930,133 | 382,100,225 |
| 이자원가 | - | 16,050,859 |
| 사외적립자산의 기대수익 | (7,563,835) | (16,876,344) |
| 합 계 | 400,366,298 | 381,274,740 |
24-3. 당분기 및 전분기 중 기타포괄손익으로 인식한 각 요소별 금액 내역은 다음과
같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 재측정손익 | - | (7,307,082) |
| 법인세효과 | - | 1,607,558 |
| 합 계 | - | (5,699,524) |
24-4. 보고기간종료일 현재 사외적립자산의 구성내역은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 예치기관 | 구성내역 | 당분기말 | 전기말 |
| 우리은행 | 정기예금 | 326,624,739 | 325,873,958 |
| IBK기업은행 | 정기예금 | 819,273,571 | 600,390,643 |
| 하나은행 | 정기예금 | - | 212,507,724 |
| 합 계 | 1,145,898,310 | 1,138,772,325 | |
25. 자본금 및 자본잉여금
25-1. 보고기간종료일 현재 자본금 내역은 다음과 같습니다.
| (단위: 원, 주) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 발행할 주식의 총수(주) | 100,000,000 | 100,000,000 |
| 1주의 금액(원) | 500 | 500 |
| 발행한 보통주식의 수(주) | 8,331,345 | 8,247,200 |
| 발행한 우선주식의 수(주) | 379,137 | 48,113 |
| 보통주자본금(원) | 4,165,672,500 | 4,123,600,000 |
| 우선주자본금(원) | 189,568,500 | 24,056,500 |
25-2. 당분기 및 전기 중 자본금 변동내역은 다음과 같습니다.
| (단위: 원, 주) | ||||
|---|---|---|---|---|
| 구 분 | 보통주 자본금 | 우선주 자본금 | ||
| 주식수(주) | 금 액 | 주식수(주) | 금 액 | |
| 전기초 | 7,859,262 | 3,929,631,000 | 334,575 | 167,287,500 |
| 주식매수선택권 행사 | 6,000 | 3,000,000 | - | - |
| 전환우선주의 행사 | 381,938 | 190,969,000 | (286,462) | (143,231,000) |
| 전기말 | 8,247,200 | 4,123,600,000 | 48,113 | 24,056,500 |
| 당기초 | 8,247,200 | 4,123,600,000 | 48,113 | 24,056,500 |
| 주식매수선택권 행사 | 20,000 | 10,000,000 | - | - |
| 전환우선주의 발행 | - | - | 379,137 | 189,568,500 |
| 전환우선주의 행사 | 64,145 | 32,072,500 | (48,113) | (24,056,500) |
| 당분기말 | 8,331,345 | 4,165,672,500 | 379,137 | 189,568,500 |
25-3. 보고기간종료일 현재 자본잉여금의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기말 | 전기말 | ||
| 보통주 | 우선주 | 보통주 | 우선주 | |
| 주식발행초과금 | 148,299,295,512 | 29,811,493,420 | 144,394,678,501 | 3,786,323,320 |
| 기타자본잉여금 | 338,601,096 | - | 338,601,096 | - |
| 합 계 | 148,637,896,608 | 29,811,493,420 | 144,733,279,597 | 3,786,323,320 |
25-4. 보고기간종료일 현재 전환우선주의 내역은 다음과 같습니다.
| 구 분 | 제4차 전환우선주(*) | 제5차 전환우선주 | 제6차 전환우선주 |
|---|---|---|---|
| 발행일 | 2019년 04월 25일 | 2021년 03월 03일 | 2021년 03월 08일 |
| 발행주식수 | 446,085 주 | 299,764 주 | 79,373 주 |
| 1주당 발행가액 | 59,400 원 | 78,400 원 | 81,900 원 |
| 총 발행가액 | 26,498,340,000 원 | 23,501,497,600 원 | 6,500,648,700 원 |
| 전환대상 및 전환비율 | 보통주와 1:1.33로 전환가능 | 보통주와 1:1로 전환가능 | 보통주와 1:1로 전환가능 |
| 전환권 행사기간 | 발행일로부터 1년 경과후 존속기간 내 (존속기간은 발행일로부터 5년) |
발행일로부터 1년 경과후 존속기간 내 (존속기간은 발행일로부터 5년) |
발행일로부터 1년 경과후 존속기간 내 (존속기간은 발행일로부터 5년) |
| 전환가액 조정 | - 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 우선주 발행일 이 후 3개월이 지난 시점부터 매 3개월 마다 시가 변동에 따라 전환가격 평가 |
- 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 우선주 발행일 이 후 3개월이 지난 시점부터 매 3개월 마다 시가 변동에 따라 전환가격 평가 |
- 전환가액을 하회하는 발행가액으로 유상증자를 하는 경우 등 - 우선주 발행일 이 후 3개월이 지난 시점부터 매 3개월 마다 시가 변동에 따라 전환가격 평가 |
(*) 당분기 중 잔여 우선주 모두 보통주로 전환되었습니다.
26. 기타자본
26-1. 보고기간종료일 현재 기타자본 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 주식매수선택권 | 648,129,339 | 100,659,401 |
| 전환권대가 | 15,699,372,000 | 15,699,372,000 |
| 합 계 | 16,347,501,339 | 15,800,031,401 |
26-2. 주식선택권
26-2-1. 주식기준보상
당사는 주주총회 결의에 의거 당사의 임직원 등에게 주식선택권을 부여하였으며, 주요 사항은 다음과 같습니다.
| - | 주식선택권으로 발행할 주식의 종류 : 기명식 보통주식 |
| - | 부여방법 : 기명식 보통주 신주발행교부 |
| - | 가득조건 및 행사가능시점 : 부여일 이후 2년 동안 당사에 용역을 제공한 자에 한하여 부여일로부터 2년이 경과한 날로부터 3년 이내에 행사가능 |
26-2-2. 주식선택권 현황
보고기간종료일 현재 유효한 주식선택권 현황은 다음과 같습니다.
| (단위: 원, 주) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 차 수 | 부여일자 | 주당 행사가격 | 최초 부여수량 | 미행사 기초수량 | 당기 부여수량 | 당기 행사수량 | 당기 취소수량 | 미행사 기말수량 |
| 1차 | 2013.12.04 | 3,665 | 120,000 | - | - | - | - | - |
| 2차(*) | 2014.06.24 | 5,066 | 150,000 | 20,000 | - | 20,000 | - | - |
| 3차 | 2014.12.31 | 25,100 | 44,500 | - | - | - | - | - |
| 4차 | 2015.01.23 | 30,200 | 72,000 | - | - | - | - | - |
| 5차 | 2015.06.26 | 58,700 | 63,000 | - | - | - | - | - |
| 6차 | 2016.10.21 | 51,200 | 197,000 | - | - | - | - | - |
| 7차 | 2017.03.30 | 29,000 | 10,000 | - | - | - | - | - |
| 8차 | 2018.03.22 | 98,000 | 3,000 | - | - | - | - | - |
| 9차 | 2018.06.29 | 81,000 | 5,000 | 1,000 | - | - | 1,000 | - |
| 10차 | 2019.10.02 | 50,500 | 10,000 | 10,000 | - | - | - | 10,000 |
| 11차 | 2019.11.04 | 59,600 | 1,000 | 1,000 | - | - | - | 1,000 |
| 12차 | 2020.06.22 | 93,000 | 1,000 | - | - | - | - | - |
| 13차 | 2021.03.12 | 97,100 | 41,000 | - | 41,000 | - | - | 41,000 |
| 14차 | 2021.03.31 | 118,400 | 3,000 | - | 3,000 | - | - | 3,000 |
| 합 계 | 720,500 | 32,000 | 44,000 | 20,000 | 1,000 | 55,000 | ||
(*) 전기 중 소송판결에 의하여 주식매수선택권이 재부여 되었습니다.
26-2-3. 보상원가 산정
당사는 부여된 주식선택권의 보상원가를 이항모형을 적용한 공정가액접근법을 적용하여 산정하였으며, 보상원가를 산정하기 위한 제반가정 및 변수는 다음과 같습니다.
| (단위: 원, %) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 구 분 | 1차 | 2차 | 3차 | 4차 | 5차 | 6차 | 7차 | 8차 | 9차 | 10차 | 11차 | 12차 | 13차 | 14차 |
| 측정시점의 공정가치 | 1,379 | 1,780 | 18,935 | 14,769 | 21,380 | 1,921 | 513 | 13,946 | 10,662 | 6,605 | 13,510 | 19,905 | 46,555 | 50,913 |
| 측정시점의 주가 | 4,800 | 6,500 | 44,500 | 44,500 | 77,100 | 50,000 | 26,450 | 104,000 | 85,000 | 50,100 | 66,100 | 99,500 | 104,100 | 121,500 |
| 주가변동성(*) | 19.45 | 19.26 | 18.10 | 18.10 | 20.12 | 7.10 | 5.20 | 8.30 | 8.90 | 17.00 | 19.00 | 23.10 | 63.10 | 60.60 |
| 무위험수익률 | 2.72 | 2.39 | 1.73 | 1.73 | 1.63 | 1.44 | 1.69 | 2.29 | 2.12 | 1.35 | 1.60 | 0.86 | 1.30 | 1.22 |
| 할인율 | 6.64 | 6.35 | 5.68 | 5.68 | 4.96 | 15.84 | 1.69 | 2.29 | 2.12 | 1.35 | 1.60 | 0.86 | 1.30 | 1.22 |
(*) 주가변동성은 상장종가 1년 영업일 기준 변동성에 기초하여 산출한 주가의 연속복리 투자수익률의 표준편차입니다.
26-2-4. 당분기 및 전분기 중 비용으로 인식한 주식기준보상은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 주식보상비용 | 177,663,160 | 388,042,254 | - | - |
27. 결손금
보고기간종료일 현재 결손금 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 기업합리화적립금 | 6,514,167 | 6,514,167 |
| 미처리결손금 | (116,366,191,739) | (95,191,454,739) |
| 합 계 | (116,359,677,572) | (95,184,940,572) |
28. 기타포괄손익누계액
보고기간종료일 현재 기타포괄손익누계액은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기말 | 전기말 |
| 기타포괄손익-공정가치측정 지분상품 평가손익 |
(423,096,960) | (817,717,680) |
29. 매출액
당분기 및 전분기 중 매출액 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 제품매출 | 5,559,569,234 | 16,185,138,545 | 4,095,119,331 | 21,054,039,527 |
| 상품매출 | 5,000,000 | 298,926,419 | 42,454,546 | 531,647,546 |
| 기타매출 | (11,664,962) | 864,562 | 270,888,000 | 280,670,756 |
| 합 계 | 5,552,904,272 | 16,484,929,526 | 4,408,461,877 | 21,866,357,829 |
30. 판매비와관리비
당분기 및 전분기 중 판매비와관리비 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 788,463,970 | 3,457,019,220 | 572,674,360 | 1,547,543,119 |
| 퇴직급여 | 99,262,839 | 307,673,232 | 36,309,609 | 122,632,644 |
| 지급수수료 | 488,646,470 | 1,295,634,525 | 203,387,142 | 745,481,085 |
| 감가상각비 | 83,267,758 | 249,444,531 | 54,849,893 | 172,157,457 |
| 대손상각비 | 105,737 | (343,137,499) | (100,307,604) | (96,854,758) |
| 광고선전비 | 102,416,306 | 292,453,863 | 76,503,272 | 196,888,773 |
| 무형자산상각비 | 57,503,298 | 172,365,310 | 50,362,878 | 149,196,887 |
| 경상개발비 | 2,953,992,479 | 9,317,765,855 | 4,756,265,491 | 10,612,481,861 |
| 기타 | 403,356,201 | 1,078,733,421 | 284,279,630 | 759,931,989 |
| 합 계 | 4,977,015,058 | 15,827,952,458 | 5,934,324,671 | 14,209,459,057 |
31. 금융수익(원가)
당분기 및 전분기 중 금융수익(원가) 내역은 다음과 같습니다.
31-1. 금융수익
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자수익 | 195,483,465 | 678,970,291 | 118,080,276 | 413,163,472 |
| 당기손익-공정가치측정금융자산 평가이익 | 887,737 | 3,500,210 | 54,561,240 | 57,075,586 |
| 합 계 | 196,371,202 | 682,470,501 | 172,641,516 | 470,239,058 |
31-2. 금융원가
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 이자비용 | 2,443,398,453 | 6,901,068,282 | 86,454,730 | 115,470,183 |
32. 기타수익(비용)
당분기 및 전분기 중 기타수익(비용) 내역은 다음과 같습니다.
32-1. 기타수익
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차익 | 507,174 | 25,601,740 | 61,464,327 | 157,386,870 |
| 외화환산이익 | (1,311,837) | 267,605 | (25,056,258) | 24,274,109 |
| 유형자산처분이익 | - | 1,499,000 | - | - |
| 보험금수익 | - | - | 137,346,496 | 137,346,496 |
| 관계기업투자자산 처분이익 | - | - | 326,168,773 | 326,168,773 |
| 잡이익 | 826,091 | 11,727,741 | 10,767,930 | 149,509,644 |
| 합 계 | 21,428 | 39,096,086 | 510,691,268 | 794,685,892 |
32-2. 기타비용
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 외환차손 | 40,600,715 | 106,782,409 | 4,793,536 | 146,600,681 |
| 외화환산손실 | 12,215,049 | 18,485,640 | 11,117,584 | 14,913,779 |
| 기부금 | 3,500,000 | 6,500,000 | 789,287 | 8,078,880 |
| 재해손실 | - | - | (15,320,291) | 130,766,256 |
| 유형자산처분손실 | 14,770,483 | 14,770,483 | - | - |
| 유형자산폐기손실 | - | 1,000 | - | - |
| 기타충당부채전입 | - | - | 335,784,218 | 786,433,374 |
| 잡손실 | 148,381 | 231,593 | 6 | 11 |
| 합 계 | 71,234,628 | 146,771,125 | 337,164,340 | 1,086,792,981 |
33. 종업원급여
당분기 및 전분기 중 종업원급여 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 1,885,686,566 | 6,923,536,174 | 1,626,609,210 | 4,528,969,548 |
| 퇴직급여 | 129,603,467 | 400,366,298 | 134,817,395 | 381,274,740 |
| 주식보상비용 | 177,663,160 | 388,042,254 | - | - |
| 합 계 | 2,192,953,193 | 7,711,944,726 | 1,761,426,605 | 4,910,244,288 |
34. 비용의 성격별 공시
당분기 및 전분기 중 비용의 성격별 분류 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 재고자산변동 | 1,079,044,634 | 1,584,993,849 | (866,650,946) | (1,872,614,795) |
| 원재료의 사용액 | 3,085,098,068 | 9,774,234,849 | 4,538,582,594 | 16,284,041,791 |
| 상품매입 | (289,508) | 144,039,280 | 60,231,636 | 726,767,669 |
| 급여 | 1,885,686,566 | 6,923,536,174 | 1,626,609,210 | 4,528,969,548 |
| 퇴직급여 | 129,603,467 | 400,366,298 | 134,817,395 | 381,274,740 |
| 전력비 | 77,761,910 | 199,801,061 | 86,677,391 | 233,276,113 |
| 지급수수료 | 562,493,620 | 1,447,011,475 | 259,120,867 | 839,555,513 |
| 외주가공비 | 55,052,080 | 113,087,350 | 282,528,490 | 717,245,190 |
| 감가상각비 | 474,269,227 | 1,292,351,137 | 440,501,656 | 1,316,303,446 |
| 무형자산상각비 | 57,503,298 | 172,365,310 | 50,362,878 | 149,196,887 |
| 경상개발비 | 2,096,034,327 | 6,859,375,553 | 4,120,176,368 | 8,857,166,664 |
| 대손상각비 | 105,737 | (343,137,499) | (100,307,604) | (96,854,758) |
| 기타 | 1,047,306,646 | 3,475,819,002 | 757,906,686 | 2,270,914,648 |
| 합 계 | 10,549,670,072 | 32,043,843,839 | 11,390,556,621 | 34,335,242,656 |
35. 법인세
35-1. 당분기 및 전분기 중 법인세비용의 주요 구성내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 법인세부담액 | - | - |
| 일시적차이로 인한 이연법인세 변동액 | (1,467,389,409) | - |
| 자본에 반영된 법인세비용(이익) | 79,710,082 | 4,747,838 |
| 법인세비용(이익) | (1,387,679,327) | 4,747,838 |
35-2. 당분기 및 전분기 법인세비용차감전순이익과 법인세비용간의 관계는 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 법인세비용차감전순이익(손실) | (21,885,187,133) | (12,406,223,041) |
| 적용세율에 따른 법인세 | - | - |
| 조정사항 : | ||
| 일시적차이로 인한 이연법인세 변동액 | (1,467,389,409) | - |
| 발생한 일시적차이 중 이연법인세자산(부채) 미인식 효과 | 79,710,082 | 4,747,838 |
| 법인세비용(이익) | (1,387,679,327) | 4,747,838 |
35-3. 당분기 및 전분기 중 기타포괄손익으로 인식한 항목의 법인세효과는 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||||
| 세 전 | 법인세 | 세 후 | 세 전 | 법인세 | 세 후 | |
| 기타포괄손익 : | ||||||
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
(362,318,556) | 79,710,082 | (282,608,474) | (14,274,000) | 3,140,280 | (11,133,720) |
| 확정급여채무에 대한 보험수리적손익 |
- | - | - | (7,307,082) | 1,607,558 | (5,699,524) |
| 기타포괄손익 계 | (362,318,556) | 79,710,082 | (282,608,474) | (21,581,082) | 4,747,838 | (16,833,244) |
| 당기법인세 | - | - | - | - | - | - |
| 이연법인세 | - | 79,710,082 | - | - | 4,747,838 | - |
35-4. 보고기간종료일 현재 자본에 직접 반영된 법인세효과는 다음과 같습니다.
| (단위: 원) | ||||||
|---|---|---|---|---|---|---|
| 구 분 | 당분기 | 전 기 | ||||
| 반영 전 | 법인세효과 | 반영 후 | 반영 전 | 법인세효과 | 반영 후 | |
| 기타포괄손익-공정가치 측정 지분상품 평가손익 |
(542,432,000) | 119,335,040 | (423,096,960) | (1,048,356,000) | 230,638,320 | (817,717,680) |
| 확정급여채무에 대한 보험수리적손익 |
(1,001,579,003) | 220,347,381 | (781,231,622) | (1,001,579,003) | 220,347,381 | (781,231,622) |
| 전환권대가 | 20,127,400,000 | (4,428,028,000) | 15,699,372,000 | 20,127,400,000 | (4,428,028,000) | 15,699,372,000 |
| 합 계 | 18,583,388,997 | (4,088,345,579) | 14,495,043,418 | 18,077,464,997 | (3,977,042,299) | 14,100,422,698 |
35-5. 이연법인세자산 실현가능성 판단
이연법인세자산의 실현가능성은 당사의 성과, 전반적인 경제환경과 산업에 대한 전망, 향후 예상수익 등 다양한 요소들에 달려있습니다. 당사는 주기적으로 이러한 사항들을 검토하고 있으며, 보고기간종료일 현재 차감할 일시적차이가 소멸될 기간에 과세소득이 충분하지 못할 것으로 예상되어 당사가 인식하지 않은 이연법인세자산은당분기말 및 전기말 현재 각각 30,709,496,022원 및 26,731,126,794원입니다.
36. 주당손익
36-1. 당사의 기본주당순이익(손실)은 보통주 1주에 대한 주당순이익(손실)으로 당분기 및 전분기의 기본주당순이익(손실) 계산내역은 다음과 같습니다.
| (단위: 원, 주) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 분기순이익(손실) | (6,737,954,054) | (20,497,507,806) | (5,178,141,756) | (12,410,970,879) |
| 차감 : 우선주소유주 귀속 분기순이익(손실) | (6,073,204) | (604,978,745) | 9,257,696 | (40,558,142) |
| 보통주소유주 귀속 분기순이익(손실) | (6,731,880,850) | (19,892,529,061) | (5,187,399,452) | (12,370,412,737) |
| 가중평균유통보통주식수 | 8,331,345 | 8,310,517 | 8,143,828 | 8,049,866 |
| 기본주당이익(손실) | (808) | (2,394) | (637) | (1,537) |
36-2. 당분기 및 전분기의 가중평균유통보통주식수의 산정내역은 다음과 같습니다.
| (단위: 원, 주) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 기초유통보통주식수 | 8,247,200 | 8,247,200 | 7,859,262 | 7,859,262 |
| 전환우선주의 전환 | 64,145 | 46,614 | 279,205 | 186,476 |
| 주식매수선택권 행사 | 20,000 | 16,703 | 5,361 | 4,128 |
| 가중평균유통보통주식수 | 8,331,345 | 8,310,517 | 8,143,828 | 8,049,866 |
36-3. 당분기 및 전분기 손실발생으로 인하여 희석효과가 없습니다. 따라서 희석주당손익은 기본주당손익과 동일합니다.
36-4. 당분기 중 반희석효과로 인하여 희석주당손익 계산시 고려하지 않았으나 향후희석효과의 발생 가능성이 있는 잠재적 보통주의 내용은 다음과 같습니다.
| (단위 : 주) | ||
|---|---|---|
| 구 분 | 잠재적보통주 | 청구가능기간 |
| 5회차 전환우선주(*1) | 299,764 | 2022.03.03 ~ 2026.03.02 |
| 6회차 전환우선주(*1) | 79,373 | 2022.03.08 ~ 2026.03.07 |
| 2회차 전환사채 전환권(*2) | 561,280 | 2021.11.06 ~ 2025.10.06 |
| 10회차 주식매수선택권 | 10,000 | 2021.10.02 ~ 2022.10.01 |
| 11회차 주식매수선택권 | 1,000 | 2021.11.04 ~ 2022.11.03 |
| 13회차 주식매수선택권 | 41,000 | 2023.03.12 ~ 2024.03.11 |
| 14회차 주식매수선택권 | 3,000 | 2023.03.31 ~ 2024.03.30 |
(*1) 전환우선주의 잠재적보통주 주식수는 당분기말 현재 전환되지 않은 전환우선주를 모두 전환할 경우 발행 될 보통주 주식수입니다.
(*2) 전환사채 전환권의 잠재적보통주 주식수는 전환사채를 모두 전환할 경우 발행 될 보통주 주식수이며, 전환가액 조정으로 인해 변경되었습니다.
37. 특수관계자
37-1. 보고기간종료일 현재 지배ㆍ종속기업 등 특수관계자 현황은 다음과 같습니다.
| 특수관계 구분 | 특수관계자 | |
|---|---|---|
| 당분기말 | 전기말 | |
| 당사에 유의적인 영향력을 행사하는 회사 | (주)브리짓라이프사이언스 | (주)브리짓라이프사이언스 |
| 종속기업(*) | Enzychem Lifesciences USA Inc. | Enzychem Lifesciences USA Inc. |
| (주)메쎄나 | - | |
| 기타특수관계자 | (주)메드푸드 | (주)메드푸드 |
(*) (주)메쎄나는 당분기 중 설립되었습니다.
37-2. 당분기 및 전분기 중 특수관계자와의 중요한 거래내역은 다음과 같습니다.
<당분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 특수관계자명 | 매출 등 | 매입 등 |
| 종속기업 | Enzychem Lifesciences USA Inc. | - | 1,583,414,378 |
| (주)메쎄나 | 5,620,000 | - | |
| 기타특수관계자 | (주)메드푸드 | 1,330,209,092 | - |
| 합 계 | 1,335,829,092 | 1,583,414,378 | |
<전분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 특수관계자명 | 매출 등 | 매입 등 |
| 종속기업 | Enzychem Lifesciences USA Inc. | - | 1,260,781,043 |
| 기타특수관계자 | (주)메드푸드 | 569,863,638 | - |
| 합 계 | 569,863,638 | 1,260,781,043 | |
37-3. 보고기간종료일 현재 특수관계자와의 주요 채권ㆍ채무 내역은 다음과 같습니다.
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 채 권 | 채 무 | ||
| 매출채권 | 대여금 | 매입채무 | 미지급금 | ||
| 종속기업 | (주)메쎄나 | 5,620,000 | - | - | - |
| 기타특수관계자 | (주)메드푸드 | 439,000,000 | - | - | - |
| 기타특수관계자 | 임직원 | - | 30,450,000 | - | - |
| 합 계 | 444,620,000 | 30,450,000 | - | - | |
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 채 권 | 채 무 | ||
| 매출채권 | 대여금 | 매입채무 | 미지급금 | ||
| 기타특수관계자 |
임직원 | - | 82,650,000 | - | - |
37-4. 자금대여거래
당분기 및 전기 중 특수관계자와의 자금 대여거래는 다음과 같습니다.
<당분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 기 초 | 대 여 | 회 수 | 기 말 |
| 단기대여금 | 임직원 | - | 5,000,000 | (5,000,000) | - |
| 장기대여금 | 임직원 | 82,650,000 | - | (52,200,000) | 30,450,000 |
| 합 계 | 82,650,000 | 5,000,000 | (57,200,000) | 30,450,000 | |
<전기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 기 초 | 대 여 | 회 수 | 기 말 |
| 단기대여금 | 임직원 | 88,000,000 | 211,000,000 | (299,000,000) | - |
| 장기대여금 | 임직원 | 235,650,000 | - | (153,000,000) | 82,650,000 |
| 합 계 | 323,650,000 | 211,000,000 | (452,000,000) | 82,650,000 | |
37-5. 자금차입거래
당분기 및 전기 중 특수관계자와의 자금차입거래 내역은 없습니다.
37-6. 지급보증 및 담보제공 내역
보고기간종료일 현재 KDB산업은행 및 IBK기업은행 차입금과 관련하여 대표이사로부터지급보증(지급보증금액: 12,080,880,000원)을 제공받고 있습니다. 한편, 우리사주조합의 우선배정주식 청약증거금과 관련하여 한국증권금융에 지급보증(지급보증금액: 117,600,000원)을 제공하고 있습니다.
37-7. 주요 경영진 보상내역
이사와 주요경영진에 대한 보상은 개인의 실적과 시장동향 등을 고려하여 이사회에서 결정합니다. 당사는 모든 이사(업무집행이사 여부를 불문함)를 포함하여 직ㆍ간접적으로 당해 기업활동의 계획ㆍ지휘ㆍ통제에 대한 권한과 책임을 가진 자를 주요 경영진으로 하고 있으며 당분기 및 전분기 중 주요 경영진에 대한 보상내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 구 분 | 당분기 | 전분기 | ||
| 3개월 | 누적 | 3개월 | 누적 | |
| 단기급여 | 814,182,186 | 3,571,533,750 | 680,033,370 | 1,723,932,954 |
| 퇴직급여 | 106,962,952 | 320,541,756 | 41,005,186 | 61,114,759 |
| 합 계 | 921,145,138 | 3,892,075,506 | 721,038,556 | 1,785,047,713 |
38. 우발채무와 약정사항
38-1. 계류중인 소송사건
보고기간종료일 현재 계류 중인 소송사건은 없습니다.
38-2. 담보제공된 어음 및 수표
보고기간종료일 현재 담보로 제공된 어음 및 수표는 존재하지 아니합니다.
38-3. 금융기관과의 약정사항
보고기간종료일 현재 금융기관과의 약정사항은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 금융기관 | 약정사항 | 약정한도금액 | 실행금액 |
| 하나은행 | 무역자금 | USD 1,000,000 | USD 111,990 |
| 하나은행 | 상업어음할인 | 500,000,000 | - |
| IBK기업은행 | 무역자금 | USD 1,000,000 | USD 270,000 |
| IBK기업은행 | 상업어음할인 | 1,000,000,000 | - |
| IBK기업은행 | 시설자금 | 3,000,000,000 | 3,000,000,000 |
| IBK기업은행 | 운영자금 | 1,500,000,000 | 1,500,000,000 |
| KDB산업은행 | 운영자금 | 1,600,000,000 | 1,600,000,000 |
| KDB산업은행 | 시설자금 | 4,100,000,000 | 3,758,260,000 |
| KDB산업은행 | 운영자금 | 2,000,000,000 | 2,000,000,000 |
| 서울보증보험 | 이행보증등 | 87,511,600 | 87,511,600 |
| 현대해상화재보험 | 임상실험 보상보험 | 1,000,000,000 | - |
38-4. 보고기간종료일 현재 매출채권 중 타인에게 배서하여 만기가 미도래한 금액은 없습니다.
38-5. 담보제공자산
보고기간종료일 현재 장ㆍ단기차입금 등과 관련하여 담보로 제공된 자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 담보권자 | 담보제공자산 | 장부금액 | 담보설정금액 | 관련 차입금 장부금액 |
| IBK기업은행 | 토지(제천) | 610,907,280 | 6,000,000,000 | 4,500,000,000 |
| 건물 | 4,412,377,160 | |||
| 구축물 | 220,135,316 | |||
| 기계장치 | 2,710,278,642 | |||
| 화재보험부보금액 | - | 6,415,000,000 | ||
| KDB산업은행 | 토지(오송) | 5,638,322,679 | 7,320,000,000 | 5,758,260,000 |
| KDB산업은행 | 단기금융상품 | 1,685,000,000 | 1,920,000,000 | 1,600,000,000 |
| 하나은행 | 단기금융상품 | 2,500,000,000 | 2,500,000,000 | - |
| 한국증권금융 | 단기금융상품 | 117,600,000 | 117,600,000 | - |
| 합 계 | 17,894,621,077 | 24,272,600,000 | 11,858,260,000 | |
38-6. 타인으로부터 제공받은 지급보증
보고기간종료일 현재 당사는 KDB산업은행 및 IBK기업은행 차입금과 관련하여 대표이사로부터 지급보증(지급보증금액: 12,080,880,000원)을 제공받고 있으며, 또한, 서울보증보험으로부터 이행보증관련 지급보증(지급보증금액: 87,511,600원)을 제공받고 있습니다.
39. 현금흐름표
39-1. 현금흐름표상의 현금은 재무상태표상 현금및현금성자산과 일치합니다(주석7 참조).
39-2. 당사의 현금흐름표는 간접법에 의해 작성되었으며, 당분기 및 전분기 현금흐름표상의 현금의 유입과 유출이 없는 중요한 거래의 내역은 다음과 같습니다.
| (단위: 원) | ||
|---|---|---|
| 구 분 | 당분기 | 전분기 |
| 장기차입금의 유동성 대체 | 2,149,980,000 | 341,740,000 |
| 건설중인자산의 본계정 대체 | 1,376,807,190 | 6,059,570,535 |
| 타계정대체로 증가된 유/무형자산 | 191,674,282 | 110,421,995 |
| 주식매수선택권의 주식발행초과금 대체 | 35,605,931 | 13,225,980 |
| 사용권자산의 증가 |
436,071,017 | 247,748,570 |
| 리스부채의 유동성 대체 | 86,480,054 | 64,003,163 |
| 전환우선주의 보통주 전환 | 3,810,379,659 | 21,974,377,396 |
| 기타포괄손익공정가치측정 금융자산 평가손익 | 362,318,556 | 14,274,000 |
| 관계기업투자자산으로 당기손익 측정 공정가치 금융자산 취득 | - | 1,500,000,000 |
| 합 계 | 8,449,316,689 | 30,325,361,639 |
39-3. 재무활동에서 생기는 부채의 변동
당분기와 전분기 중 재무활동에서 생기는 부채의 변동은 다음과 같습니다.
<당분기>
| (단위: 원) | |||||||
|---|---|---|---|---|---|---|---|
| 구 분 | 기 초 | 재무활동현금흐름 | 환율변동 | 비현금 거래 | 기 말 | ||
| 증 가 | 감 소 | 신 규 | 상각 등 | ||||
| <유동성> | |||||||
| 단기차입금 | 4,380,000,000 | 4,039,660,000 | (3,319,660,000) | - | - | - | 5,100,000,000 |
| 유동성장기부채 | 1,058,400,000 | - | (341,740,000) | - | 2,149,980,000 | - | 2,866,640,000 |
| 유동리스부채 | 139,102,078 | - | (336,099,215) | - | 412,553,243 | (1,127,666) | 214,428,440 |
| 소 계 | 5,577,502,078 | 4,039,660,000 | (3,997,499,215) | - | 2,562,533,243 | (1,127,666) | 8,181,068,440 |
| <비유동성> | |||||||
| 장기차입금 | 6,041,600,000 | - | - | - | (2,149,980,000) | - | 3,891,620,000 |
| 전환사채 | 31,078,120,985 | - | - | - | - | 6,623,040,328 | 37,701,161,313 |
| 비유동리스부채 | 218,046,727 | - | - | - | - | (86,480,054) | 131,566,673 |
| 소 계 | 37,337,767,712 | - | - | - | (2,149,980,000) | 6,536,560,274 | 41,724,347,986 |
| 합 계 | 42,915,269,790 | 4,039,660,000 | (3,997,499,215) | - | 412,553,243 | 6,535,432,608 | 49,905,416,426 |
<전분기>
| (단위: 원) | |||||||
| 구 분 | 기 초 | 재무활동현금흐름 | 환율변동 | 비현금 거래 | 기 말 | ||
| 증 가 | 감 소 | 신 규 | 상각 등 | ||||
| <유동성> | |||||||
| 단기차입금 | 2,314,000,000 | 6,642,835,955 | (3,547,017,100) | (687,500) | - | - | 5,409,131,355 |
| 유동성장기부채 | 300,000,000 | - | (300,000,000) | - | 341,740,000 | - | 341,740,000 |
| 유동리스부채 | 127,319,678 | - | (174,831,358) | - | 146,257,312 | 40,119,827 | 138,865,459 |
| 소 계 | 2,741,319,678 | 6,642,835,955 | (4,021,848,458) | (687,500) | 487,997,312 | 40,119,827 | 5,889,736,814 |
| <비유동성> | |||||||
| 장기차입금 | - | 7,100,000,000 | - | - | (341,740,000) | - | 6,758,260,000 |
| 비유동리스부채 | 137,060,897 | - | - | - | 57,887,746 | (100,477,587) | 94,471,056 |
| 소 계 | 137,060,897 | 7,100,000,000 | - | - | (283,852,254) | (100,477,587) | 6,852,731,056 |
| 합 계 | 2,878,380,575 | 13,742,835,955 | (4,021,848,458) | (687,500) | 204,145,058 | (60,357,760) | 12,742,467,870 |
6. 배당에 관한 사항
가. 배당에 관련한 회사의 정책
당사는 회사 정관 규정에 의거하여 이사회 및 주주총회 결의를 통해 배당을 실시할 수 있으며, 이익규모 및 미래성장을 위한 투자재원 확보, 기업의 재무구조 건전성 유지 등의 요인 등을 종합적으로 고려하여 배당정책을 결정할 예정입니다. 배당에 관한회사의 중요한 정책, 배당의 제한에 관한 사항 등은 아래와 같이 당사 정관에서 규정하고 있습니다. 또한 당사는 현재 자사주와 관련하여 매입 및 소각 등의 구체화된 계획이 없습니다.
나. 배당에 관련한 정관 기재사항
|
제12조(신주의 배당기산일) 이 회사는 매사업년도의 처분전이익잉여금을 다음과 같이 처분한다. 1. 이익준비금 2. 기타의 법정적립금 3. 배당금 4. 임의적립금 5. 기타의 이익잉여금처분액
②회사는 주주총회의 결의에 의하여 이익의 배당을 주식으로써 할 수 있으며, 회사가 종류주식을 발행한 때에는 각각 그와 같은 종류의 주식으로도 할 수 있다. ③제1항의 배당은 매결산기말 현재의 주주명부에 기재된 주주 또는 등록된 질권자에게 지급한다. ④이익배당은 주주총회의 결의로 정한다. 다만, 제51조 제2항에 따라 재무제표를 이사회가 승인하는 경우에는 이사회의 결의로 정한다. |
다. 주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제23기 3분기 | 제22기 | 제21기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | -20,549 | -17,506 | -16,879 | |
| (별도)당기순이익(백만원) | -20,497 | -16,679 | -17,467 | |
| (연결)주당순이익(원) | -2,400 | -2,154 | -2,102 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
라. 과거 배당 이력
| (단위: 회, %) |
| 연속 배당횟수 | 평균 배당수익률 | ||
|---|---|---|---|
| 분기(중간)배당 | 결산배당 | 최근 3년간 | 최근 5년간 |
| - | - | - | - |
※ 당사는 코스닥 기술성장특례 적용 법인으로 (상장일 : 2018년 2월 21일) 상장 한 이후 배당이력이 없습니다. 추후에 배당과 관련된 사항은 회사 정관 규정에 의거하여 이사회 및 주주총회 결의를 통해 배당을 실시할 수 있으며, 이익규모 및 미래성장을 위한 투자재원 확보, 기업의 재무구조 건전성 유지 등의 요인 등을 종합적으로 고려하여 배당정책을 결정할 예정입니다.
7. 증권의 발행을 통한 자금조달에 관한 사항
7-1. 증권의 발행을 통한 자금조달 실적
| [지분증권의 발행 등과 관련된 사항] |
가. 증자(감자)현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2017.02.04 | 유상증자(제3자배정) | 보통주 | 80,160 | 500 | 35,850 | 유상증자 |
| 2017.07.06 | 유상증자(제3자배정) | 보통주 | 7,500 | 500 | 25,100 | 주식매수선택권 행사 |
| 2018.02.14 | 유상증자(일반공모) | 보통주 | 787,857 | 500 | 56,000 | 코스닥시장 상장 |
| 2018.04.26 | 주식매수선택권행사 | 보통주 | 28,000 | 500 | 25,100 | 주식매수선택권 행사 |
| 2018.04.26 | 주식매수선택권행사 | 보통주 | 23,000 | 500 | 58,700 | 주식매수선택권 행사 |
| 2018.06.21 | 주식매수선택권행사 | 보통주 | 500 | 500 | 25,100 | 주식매수선택권 행사 |
| 2018.06.21 | 주식매수선택권행사 | 보통주 | 3,000 | 500 | 58,700 | 주식매수선택권 행사 |
| 2018.12.06 | 주식매수선택권행사 | 보통주 | 1,000 | 500 | 30,200 | 주식매수선택권 행사 |
| 2018.12.06 | 주식매수선택권행사 | 보통주 | 50,000 | 500 | 51,200 | 주식매수선택권 행사 |
| 2019.01.09 | 주식매수선택권행사 | 보통주 | 3,262 | 500 | 51,200 | 주식매수선택권 행사 |
| 2019.02.20 | 주식매수선택권행사 | 보통주 | 2,000 | 500 | 30,200 | 주식매수선택권 행사 |
| 2019.02.20 | 주식매수선택권행사 | 보통주 | 58,884 | 500 | 51,200 | 주식매수선택권 행사 |
| 2019.04.25 | 유상증자(제3자배정) | 우선주 | 334,575 | 500 | 79,200 | 유상증자 |
| 2019.05.03 | 주식매수선택권행사 | 보통주 | 9,000 | 500 | 30,200 | 주식매수선택권 행사 |
| 2019.05.03 | 주식매수선택권행사 | 보통주 | 30,890 | 500 | 51,200 | 주식매수선택권 행사 |
| 2019.05.03 | 주식매수선택권행사 | 보통주 | 5,000 | 500 | 29,000 | 주식매수선택권 행사 |
| 2019.08.30 | 주식매수선택권행사 | 보통주 | 19,540 | 500 | 51,200 | 주식매수선택권 행사 |
| 2019.10.21 | 주식매수선택권행사 | 보통주 | 954 | 500 | 51,200 | 주식매수선택권 행사 |
| 2019.12.10 | 주식매수선택권행사 | 보통주 | 1,000 | 500 | 25,100 | 주식매수선택권 행사 |
| 2020.03.02 | 주식매수선택권행사 | 보통주 | 5,000 | 500 | 29,000 | 주식매수선택권 행사 |
| 2020.05.13 | 전환권행사 | 보통주 | 329,947 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2020.05.13 | 전환권행사 | 우선주 | 247,467 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2020.05.14 | 전환권행사 | 보통주 | 13,465 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2020.05.14 | 전환권행사 | 우선주 | 10,099 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2020.05.18 | 전환권행사 | 보통주 | 16,834 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2020.05.18 | 전환권행사 | 우선주 | 12,626 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2020.07.27 | 주식매수선택권행사 | 보통주 | 1,000 | 500 | 81,000 | 주식매수선택권 행사 |
| 2020.08.21 | 전환권행사 | 보통주 | 9,693 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2020.08.21 | 전환권행사 | 우선주 | 7,270 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2020.12.08 | 전환권행사 | 보통주 | 11,999 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2020.12.08 | 전환권행사 | 우선주 | 9,000 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2021.01.28 | 전환권행사 | 보통주 | 11,151 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2021.01.28 | 전환권행사 | 우선주 | 8,364 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2021.02.15 | 주식매수선택권행사 | 보통주 | 20,000 | 500 | 5,066 | 주식매수선택권 행사 |
| 2021.03.02 | 전환권행사 | 보통주 | 15,709 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2021.03.02 | 전환권행사 | 우선주 | 11,782 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2021.03.03 | 유상증자(제3자배정) | 우선주 | 299,764 | 500 | 78,400 | 유상증자 |
| 2021.03.08 | 유상증자(제3자배정) | 우선주 | 79,373 | 500 | 81,900 | 유상증자 |
| 2021.04.05 | 전환권행사 | 보통주 | 37,996 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2021.04.05 | 전환권행사 | 우선주 | 21,000 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
| 2021.04.06 | 전환권행사 | 보통주 | 9,289 | 500 | 59,400 | 우선주보통주전환에 의한 보통주 증가 |
| 2021.04.06 | 전환권행사 | 우선주 | 6,967 | 500 | -79,200 | 우선주보통주전환에 의한 우선주 감소 |
나. 미상환 전환사채 발행현황
미상환 전환사채 발행현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원, 주) |
| 종류\구분 | 회차 | 발행일 | 만기일 | 권면(전자등록)총액 | 전환대상 주식의 종류 |
전환청구가능기간 | 전환조건 | 미상환사채 | 비고 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 전환비율 (%) |
전환가액 | 권면(전자등록)총액 | 전환가능주식수 | ||||||||
| 무기명식 이권부 무보증 사모 전환사채 |
2회차 | 2020.11.06 | 2025.11.06 | 50,000,000,000 | 보통주 | 2021.11.06~2025.10.06 | 100 | 71,081 | 50,000,000,000 | 703,422 | 보고서 작성일 기준 전환가액은 71,081원이며 전환가능주식 수는 703,422주 입니다. |
| 합 계 | - | - | - | 50,000,000,000 | - | - | 100 | 71,081 | 50,000,000,000 | 703,422 | - |
| [채무증권의 발행 등과 관련된 사항] |
다. 채무증권 발행실적
채무증권 발행실적
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| 엔지켐생명과학 | 회사채 | 사모 | 2020.11.06 | 50,000,000,000 | 0.00% | - | 2025.11.06 | - | - |
| 합 계 | - | - | - | 50,000,000,000 | 0.00% | - | - | - | - |
* 당사는 2020년 11월 06일 오송공장 신축 및 연구 ·생산 설비 구축비용으로
전환사채 500억원을 발행하였습니다.
라. 기업어음증권 미상환 잔액
기업어음증권 미상환 잔액
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
마. 단기사채 미상환 잔액
단기사채 미상환 잔액
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
바. 회사채 미상환 잔액
회사채 미상환 잔액
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
사. 신종자본증권 미상환 잔액
신종자본증권 미상환 잔액
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
아. 조건부자본증권 미상환 잔액
조건부자본증권 미상환 잔액
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
자. 사채관리계약 주요내용 및 충족여부 등
보고서 작성기준일 현재 해당사항 없습니다.
7-2. 증권의 발행을 통해 조달된 자금의 사용실적
가. 공모자금의 사용내역
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 유상증자 | 1 | 2018년 02월 13일 | 시설자금 기타자금 |
44,119 | 시설자금 기타자금 |
34,500 | 자금 사용계획에 따라 집행 예정 |
나. 사모자금의 사용내역
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 주요사항보고서의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 주식매수 선택권 행사 |
1 | 2018년 04월 26일 | 운영자금 | 2,052 | 운영자금 | 2,052 | - |
| 주식매수 선택권 행사 |
2 | 2018년 06월 21일 | 운영자금 | 188 | 운영자금 | 188 | - |
| 주식매수 선택권 행사 |
3 | 2018년 12월 06일 | 운영자금 | 2,590 | 운영자금 | 2,590 | - |
| 주식매수 선택권 행사 |
1 | 2019년 01월 09일 | 운영자금 | 167 | 운영자금 | 167 | - |
| 주식매수 선택권 행사 |
5 | 2019년 02월 20일 | 운영자금 | 3,075 | 운영자금 | 3,075 | - |
| 제3자배정 유상증자 |
4 | 2019년 04월 26일 | 운영자금 | 26,498 | 운영자금 | 23,395 | 조달금액 미사용 |
| 주식매수 선택권 행사 |
6 | 2019년 05월 03일 | 운영자금 | 1,998 | 운영자금 | - | 조달금액 미사용 |
| 주식매수 선택권 행사 |
7 | 2019년 08월 30일 | 운영자금 | 1,000 | 운영자금 | - | 조달금액 미사용 |
| 주식매수 선택권 행사 |
8 | 2019년 10월 21일 | 운영자금 | 49 | 운영자금 | - | 조달금액 미사용 |
| 주식매수 선택권 행사 |
9 | 2019년 12월 10일 | 운영자금 | 25 | 운영자금 | - | 조달금액 미사용 |
| 주식매수 선택권 행사 |
10 | 2020년 03월 02일 | 운영자금 | 145 | 운영자금 | - | 조달금액 미사용 |
| 주식매수 선택권 행사 |
11 | 2020년 07월 27일 | 운영자금 | 81 | 운영자금 | - | 조달금액 미사용 |
| 무기명식 이권부 무보증 사모 전환사채 |
2 | 2020년 11월 06일 | 시설자금 | 50,000 | 시설자금 | - | 조달금액 미사용 |
| 주식매수 선택권 행사 |
12 | 2021년 02월 15일 | 운영자금 | 101 | 운영자금 | - | 조달금액 미사용 |
| 제3자배정 유상증자 |
2 | 2021년 03월 03일 | 운영자금 | 23,501 | 운영자금 | - | 조달금액 미사용 |
| 제3자배정 유상증자 |
3 | 2021년 03월 08일 | 운영자금 | 6,500 | 운영자금 | - | 조달금액 미사용 |
다. 미사용자금의 운용내역
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 백만원) |
| 종류 | 금융상품명 | 운용금액 | 계약기간 | 실투자기간 |
|---|---|---|---|---|
| 예ㆍ적금 | 정기예금 | 20,000 | 2020.11 ~ 2021.11 | 1년 |
| 예ㆍ적금 | 정기예금 | 10,000 | 2021.02 ~ 2022.02 | 1년 |
| 예ㆍ적금 | 정기예금 | 6,000 | 2021.08 ~ 2021.11 | 1년 |
| 예ㆍ적금 | 정기예금 | 3,500 | 2020.10 ~ 2021.10 | 1년 |
| 예ㆍ적금 | 정기예금 | 10,000 | 2021.08 ~ 2022.02 | 6개월 |
| 예ㆍ적금 | 정기예금 | 10,000 | 2020.11 ~ 2021.11 | 1년 |
| 예ㆍ적금 | 정기예금 | 2,000 | 2021.03 ~ 2022.03 | 1년 |
| 예ㆍ적금 | 정기예금 | 10,000 | 2021.02 ~ 2022.02 | 1년 |
| 예ㆍ적금 | 정기예금 | 10,000 | 2020.07 ~ 2021.07 | 1년 |
| 예ㆍ적금 | 정기예금 | 4,000 | 2021.03 ~ 2022.03 | 1년 |
| 예ㆍ적금 | 정기예금 | 7,000 | 2021.08 ~ 2022.08 | 1년 |
| 예ㆍ적금 | 정기예금 | 2,000 | 2020.11 ~ 2021.11 | 1년 |
| 예ㆍ적금 | 보통예금 | 4,890 | - | - |
| 계 | 99,390 | - | ||
8. 기타 재무에 관한 사항
가. 재무제표의 재작성 등 유의사항
(1) 재무제표를 재작성한 경우 재작성사유, 내용 및 재무제표에 미치는 영향
보고서 작성기준일 현재 해당사항 없습니다.
(2) 합병, 분할, 자산양수도, 영업양수도
1) 자산양수도의 배경
당사는 현재 EC-18 국내와 미국에서 임상 2상을 진행하고 또한 조영제의 시판을 준비하고 있어 향후 생산을 위한 공장신축의 필요성이 제기되어 EC-18의 신규 치료제 및 조영제등의 생산능력을 갖추고자 오송바이오폴리스지구(오송2지구) 산업시설용지 BT-10-8 지번(획지)토지를 양수하여 생산공장으로 사용하고자 합니다.
2) 자산양수도 대상 자산
| 양수도대상자산 | 오송바이오폴리스지구(오송2지구) 산업시설용지 BT-10-8 지번(획지)토지 17,500㎡ |
| 양수도가액 | 5,173,700,000 원 |
3) 자산 양수도 당사자
| 구분 | 양도회사 | 양수회사 | ||
| 법인명 | 한국산업단지공단 | 충북개발공사 | ㈜엔지켐생명과학 | |
| 대표이사 | 김정환 | 이상철 | 손기영 | |
| 주소 | 본사 | 대구 광역시 동구 첨단로 39(신서동) |
충청북도 청주시 상당구 상당로 195(문화동) | 충청북도 제천시 바이오밸리로 59(왕암동) |
| 연락처 | 070-8895-7000 | 043-210-9100 | 043-652-2845 | |
| 설립연월일 | 1997년 01월 10일 | 2006년 01월 16일 | 1999년 07월 20일 | |
| 납입 자본금 | - 백만원 | 130,176 백만원 | 4,148 백만원 | |
| 자산총액 | 2,109,182 백만원 | 641,443백만원 | 123,802 백만원 | |
| 결산기 | 12월31일 | 12월31일 | 12월31일 | |
| 종업원수 | 610명 | 89명 | 109명 | |
| 주권상장 또는 코스닥상장일 | - | - | 2018.02(코스닥) | |
| 발행주식의 종류 및 수 | - | 보통주 : 13,017,590 주 | 보통주 : 8,247,200 주 우선주 : 48,113주 |
|
* 2020년 12월 31일 기준입니다.
4) 자산양수ㆍ도의 진행 경과 및 일정
| 구분 | 일자 |
| 자산양수ㆍ도계약일 | 2016년 08월 11일 |
| 이사회결의일 | 2016년 08월 10일 |
| 주요사항보고서(중요한자산양수ㆍ도)제출일 | 2016년 12월 08일 |
| 자산양수도 종료일 (잔금 완료일) | 2020년 04월 24일 |
5) 대금지급방법
| (단위 : 원) |
| 구분 | 일자 | 금액 | 지급방법 |
| 계약금 | 2016.08.11 | 517,370,000 | 현금 |
| 중도금 | 2017.02.11 | 582,041,250 | 현금 |
| 2017.08.11 | 582,041,250 | 현금 | |
| 2018.02.11 | 582,041,250 | 현금 | |
| 2018.08.11 | 582,041,250 | 현금 | |
| 2019.02.11 | 582,041,250 | 현금 | |
| 2019.08.11 | 582,041,250 | 현금 | |
| 2020.02.11 | 582,041,250 | 현금 | |
| 잔 금 | 2020.04.24 | 582,041,250 | 현금 |
| 합계 | 5,173,700,000 | - | |
* 상기 취득금액은 제세공과금, 수수료 등의 부대비용을 제외한 금액입니다.
* 2020년 4월 24일 잔금 납부로 유형자산으로 대체 되었습니다.
6) 회사의 경영, 재무, 영업 등에 미치는 중요 영향 및 효과
현재 자산양수도를 통한 경영권 및 영업활동에 미치는 영향은 없으나, 향후 EC-18 임상 완료 후 제품 상용화가 이루어지면 국내 및 해외 판매 재고 확보에 중요한 영향을 줄 것으로 기대하고 있습니다.
(3) 자산유동화 관련한 자산매각의 회계처리 및 우발채무 등에 관한 사항
보고서 작성기준일 현재 해당사항 없습니다.
(4) 기타 재무제표 이용에 유의하여야 할 사항
보고서 작성기준일 현재 해당사항 없습니다.
나. 대손충당금 설정현황
(1) 계정과목별 대손충당금 설정내역
| (단위 : 원) |
| 구분 | 계정과목 | 채권금액 | 대손충당금 | 대손충당금 설정률 |
| 2021년 (제23기 3분기) |
매출채권 | 3,865,319,558 | 498,750,527 | 12.90% |
| 받을어음 | 1,178,668,816 | 39,107,500 | 3.32% | |
| 미수금 | 706,939,021 | 499,532,805 | 70.66% | |
| 합계 | 5,750,927,395 | 1,037,390,832 | 18.04% | |
| 2020년 (제22기) |
매출채권 | 3,349,301,977 | 841,888,026 | 25.14% |
| 받을어음 | 1,717,407,498 | 39,107,500 | 2.28% | |
| 미수금 | 585,408,482 | 499,532,805 | 85.33% | |
| 합계 | 5,652,117,957 | 1,380,528,331 | 24.42% | |
| 2019년 (제21기) |
매출채권 | 7,284,514,596 | 972,970,838 | 13.36% |
| 받을어음 | 2,396,038,384 | 39,107,500 | 1.63% | |
| 미수금 | 589,002,587 | 499,532,805 | 84.81% | |
| 합계 | 10,269,555,567 | 1,511,611,143 | 14.72% |
* 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다.
(2) 대손충당금 변동현황
| (단위 : 원) |
| 구분 | 2021년 | 2020년 | 2019년 |
| (제23기 3분기) | (제22기) | (제21기) | |
| 1. 기초 대손충당금 잔액합계 | 1,380,528,331 | 1,511,611,143 | 1,362,665,329 |
| 2. 순대손처리액(①-②±③) | - | - | - |
| ① 대손처리액(상각채권액) | - | - | - |
| ② 상각채권회수액 | - | - | - |
| ③ 기타증감액 | - | - | - |
| 3. 대손상각비 계상(환입)액 | (343,137,499) | (131,082,812) | 148,945,814 |
| 4. 기말 대손충당금 잔액합계 | 1,037,390,832 | 1,380,528,331 | 1,511,611,143 |
(3) 대손충당금 설정방침
당사는 매출채권에 대하여 개별분석 및 과거 대손경험율에 의하여 산출된 금액을 대손충당금으로 설정하고 있으며, 미회수가 확정된 매출채권의 경우 100% 대손충당금을 설정하고 있습니다. 당사의 기간별 설정비율은 다음과 같습니다.
| (단위:%) |
| 3개월 이내 | 3개월 초과 6개월이하 |
6개월 초과 9개월이하 |
9개월 초과 1년 이하 |
1년 초과 |
| 0.00 | 0.00 | 0.00 | 24.51 | 96.18 |
(4) 보고서 작성기준일 현재 경과기간별 매출채권 잔액 현황
| (단위 : 천원) |
| 구분 | 3개월 이하 | 3개월 초과 6개월이하 |
6개월 초과 9개월이하 |
9개월 초과 1년 이하 |
1년 초과 | 합계 | |
| 금액 | 일반 | 4,029,823 | 34,320 | - | - | 540,845 | 4,604,988 |
| 특수관계자 | 439,000 | - | - | - | - | 439,000 | |
| 합계 | 4,468,823 | 34,320 | - | - | 540,845 | 5,043,988 | |
| 구성비율 | 88.60% | 0.68% | 0.00% | 0.00% | 10.72% | 100.00% | |
* 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다.
다. 재고자산의 보유 및 실사내역 등
(1) 재고자산의 사업부문별 보유현황
| (단위 : 원) |
| 사업부문 | 계정과목 | 2021년 | 2020년 | 2019년 |
| (제23기 3분기) | (제22기) | (제21기) | ||
| 원료의약품 등 | 원재료 | 2,875,529,235 | 2,120,424,776 | 2,843,125,503 |
| 재공품 | 374,501,518 | 80,877,741 | 168,328,817 | |
| 제품 | 3,816,210,001 | 6,389,856,167 | 4,358,368,000 | |
| 상품 | 186,117,464 | 586,678,383 | 293,293,169 | |
| 저장품 | - | - | - | |
| 미착품 | 320,130,360 | - | 183,514,850 | |
| 합계 | 7,572,488,578 | 9,177,837,067 | 7,846,630,339 | |
| 총자산대비 재고자산 구성비율(%) [재고자산합계÷기말자산총계×100] |
5.4 | 7.4 | 9.2 | |
| 재고자산회전율(회수) [연환산 매출원가÷{(기초재고 +기말재고)÷2}] |
2.6 | 2.8 | 3.8 | |
* 연결기준이며, 한국채택국제회계기준에 따라 작성되었습니다.
(2) 재고자산의 실사내용
가) 실사일자
1) 2019년 기말 재고자산 실사 : 2020년 01월 06일
2) 2020년 기말 재고자산 실사 : 2021년 01월 04일
3) 2021년 3분기말 재고자산 실사 : 2021년 10월 01일
실사일이 보고서 작성기준일과 다른 경우에는 그 사이 변동내역을 반영하여 보고서 작성기준일의 재고자산을 파악하고 있습니다.
나) 재고실사시 전문가의 참여 또는 감사인의 입회여부
1) 2019년 기말 : 대주회계법인
2) 2020년 기말 : 대주회계법인
3) 2021년 3분기말 : 회사자체 수행
다)장기체화재고 등의 현황
재고자산의 시가가 취득원가보다 하락한 경우에는 저가법을 사용하여 재고자산의 재무상태표가액을 결정하고 있으며, 재고자산에 대한 평가내역은 다음과 같습니다.
| (기준일 : 2021년 09월 30일) | (단위 : 원) |
| 계정과목 | 취득원가 | 보유금액 | 당기평가충당금 | 기말잔액 |
| 원재료 | 3,908,363,235 | 3,908,363,235 | (1,032,834,000) | 2,875,529,235 |
| 재공품 | 406,000,272 | 406,000,272 | (31,498,754) | 374,501,518 |
| 제품 | 6,278,102,154 | 6,278,102,154 | (2,461,892,153) | 3,816,210,001 |
| 상품 | 356,827,714 | 356,827,714 | (170,710,250) | 186,117,464 |
| 미착품 | 320,130,360 | 320,130,360 | - | 320,130,360 |
| 합계 | 11,269,423,735 | 11,269,423,735 | (3,696,935,157) | 7,572,488,578 |
라. 공정가치평가 내역 등
(1)금융상품 종류별 공정가치
보고서 작성기준일 현재 금융상품의 장부금액과 공정가치는 다음과 같습니다.
| (단위 :원) |
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| <금융자산> | ||||
| 공정가치로 인식된 금융자산 : | ||||
| 당기손익- 공정가치 측정 금융자산(비유동) | 144,349,685 | 144,349,685 | 111,909,475 | 111,909,475 |
| 기타포괄손익- 공정가치 측정 지분상품 |
462,568,000 | 462,568,000 | 344,124,000 | 344,124,000 |
| 소 계 | 606,917,685 | 606,917,685 | 456,033,475 | 456,033,475 |
| 상각후원가로 인식된 금융자산 : | ||||
| 현금및현금성자산 | 8,426,281,393 | 8,426,281,393 | 1,857,599,584 | 1,857,599,584 |
| 매출채권및기타채권 | 5,209,856,688 | 5,209,856,688 | 4,567,074,209 | 4,567,074,209 |
| 기타금융자산(유동) | 98,921,090,000 | 98,921,090,000 | 88,754,752,579 | 88,754,752,579 |
| 기타금융자산(비유동) | 855,591,773 | 855,591,773 | 708,632,014 | 708,632,014 |
| 소 계 | 113,412,819,854 | 113,412,819,854 | 95,888,058,386 | 95,888,058,386 |
| 금융자산 합계 | 114,019,737,539 | 114,019,737,539 | 96,344,091,861 | 96,344,091,861 |
| (단위 :원) |
| 구 분 | 당분기말 | 전기말 | ||
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| <금융부채> | ||||
| 공정가치로 인식된 금융부채 : | ||||
| 소 계 | - | - | - | - |
| 상각후원가로 인식된 금융부채 : | ||||
| 단기차입금 | 5,100,000,000 | 5,100,000,000 | 4,380,000,000 | 4,380,000,000 |
| 유동성장기부채 | 2,866,640,000 | 2,866,640,000 | 1,058,400,000 | 1,058,400,000 |
| 매입채무및기타채무 | 3,970,127,176 | 3,970,127,176 | 3,698,722,003 | 3,698,722,003 |
| 장기차입금 | 3,891,620,000 | 3,891,620,000 | 6,041,600,000 | 6,041,600,000 |
| 전환사채 | 37,701,161,313 | 37,701,161,313 | 31,078,120,985 | 31,078,120,985 |
|
유동리스부채 |
284,482,299 | 284,482,299 | 191,280,600 | 191,280,600 |
| 비유동리스부채 | 193,106,374 | 193,106,374 | 317,114,915 | 317,114,915 |
| 소 계 | 54,007,137,162 | 54,007,137,162 | 46,765,238,503 | 46,765,238,503 |
| 금융부채 합계 | 54,007,137,162 | 54,007,137,162 | 46,765,238,503 | 46,765,238,503 |
(2) 금융상품 공정가치 서열 체계
공정가치로 측정되거나 공정가치가 공시되는 항목은 공정가치 서열체계에 따라 구분하며, 정의된 수준들은 다음과 같습니다.
| (수준1) | 동일한 자산이나 부채에 대한 활성시장의 (조정되지 않은) 공시가격 |
| (수준2) | 직접적으로(예:가격) 또는 간접적으로(예: 가격에서 도출되어) 관측 가능한 자산이나 부채에 대한 투입 변수를 이용하여 산정한 공정가치. 단 수준 1에 포함된 공시 가격은 제외함. |
| (수준3) | 관측 가능한 시장자료에 기초하지 않은, 자산이나 부채에 대한 투입 변수(관측 가능하지 않은 투입 변수)를 이용하여 산정한 공정가치 |
(3) 공정가치로 측정되는 금융상품의 공정가치 서열체계 구분은 다음과 같습니다.
<당분기말>
| (단위 :원) |
| 구분 | 수준1 | 수준2 | 수준3 | 합계 |
| <자산> | ||||
| 비유동 당기손익 -공정가치 측정금융자산 | - | 144,349,685 | - | 144,349,685 |
| 기타포괄손익-공정가치측정 지분상품 | - | - | 462,568,000 | 462,568,000 |
<전기말>
| (단위 :원) |
| 구분 | 수준1 | 수준2 | 수준3 | 합계 |
| <자산> | ||||
| 비유동 당기손익 -공정가치 측정금융자산 | - | 111,909,475 | - | 111,909,475 |
| 기타포괄손익-공정가치측정 지분상품 | - | 157,716,000 | 186,408,000 | 344,124,000 |
마. 진행률적용 수주계약 현황
보고서 작성기준일 현재 해당사항 없습니다.
IV. 회계감사인의 감사의견 등
1. 외부감사에 관한 사항
가. 회계감사인의 변경
당사는 2018 사업연도(제20기)부터 2020 사업연도(제22기)까지 외부감사인이었던 대주회계법인과의 감사계약 기간이 만료됨에 따라, 2021년 02월 05일 감사인선임위원회 개최 및 결의를 통하여 2021 사업연도(제23기) 부터 2023 사업연도 (제25기)까지 3개 사업연도에 대한 외부감사인으로 대주회계법인을 재선임 하였습니다.
나. 회계감사인의 명칭 및 감사의견
| 사업연도 | 감사인 | 감사의견 | 강조사항 등 | 핵심감사사항 |
|---|---|---|---|---|
| 제23기(당기) | 대주회계법인 | - | 해당사항없음 | - |
| 제22기(전기) | 대주회계법인 | 적정 | 해당사항없음 | 전환사채 발행 회계처리 |
| 제21기(전전기) | 대주회계법인 | 적정 | 해당사항없음 | 해당사항없음 |
다. 감사용역 체결현황
| (단위 : 천원) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제23기(당기) | 대주회계법인 | 별도/ 연결 재무제표 감사, 반기검토, 내부회계관리제도 검토, 재고실사 |
65,000 | 1,094 | 20,000 | - |
| 제22기(전기) | 대주회계법인 | 별도/ 연결 재무제표 감사, 반기검토, 내부회계관리제도 검토, 재고실사 |
55,000 | 860 | 55,000 | 862 |
| 제21기(전전기) | 대주회계법인 | 별도/ 연결 재무제표 감사, 반기검토, 내부회계관리제도 검토, 재고실사 |
50,000 | 860 | 50,000 | 860 |
라. 회계감사인과의 비감사용역 계약체결 현황
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제23기(당기) | - | - | - | - | - |
| 제22기(전기) | - | - | - | - | - |
| 제21기(전전기) | - | - | - | - | - |
* 세무조정, 세무자문 포함
마. 내부감사기구가 회계감사인과 논의한 결과
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2021년 02월 10일 | (주)엔지켐생명과학 : 감사 1명, 재경부 이사 1명 대주회계법인 : 감사인 1명 |
대면 보고 | 전반적인 수행 내역 및 일정 |
| 2 | 2021년 08월 05일 | (주)엔지켐생명과학 : 감사 1명, 재경부 이사 1명 대주회계법인 : 감사인 1명 |
대면 보고 | - 2021년 반기검토 결과 - 2021년 핵심감사 사항 선정 협의 및 검토 |
2. 내부통제에 관한 사항
당사는 「주식회사 외부감사에 관한 법률」제2조의2 및 동법 시행령 제2조의2 내지 제2조의3, 외부감사 및 회계등에 관한 규정에 의거 신뢰할 수 있는 회계정보의 작성 및 공시를 위하여 내부회계관리규정을 제정하여 운영하고 있습니다.
V. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사의 수
본 보고서 작성 기준일 현재 당사의 이사회는 2명의 사내이사(대표이사 포함)와 2명의 사외이사 총 4인으로 구성되어 있습니다. 이사의 주요 이력 및 업무분장은
【Ⅷ. 임원 및 직원의 현황】을 참고하시기 바랍니다.
* 2021년 3분기말 기준입니다.
나. 사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 4 | 2 | - | - | - |
다. 이사회의 권한 내용
| 구분 | 내용 |
| 구성 및 의장 | <정관 제38조 제1항> 이사회는 이사로 구성하며 이 회사 업무의 중요사항을 결의한다. <이사회 운영규정 제5조> 1. 이사회는 이사 전원으로 구성한다. 2. 이사회의 구성원은 3인 이상 11명 이내로 한다. <이사회 운영규정 제6조> 1. 이사회의 의장은 대표이사로 한다. 2. 대표이사가 사고로 인하여 직무를 수행할 수 없을 때에는 부회장, 사장, 부사장, 전무, 상무의 순서로 그 직무를 대행한다. 3. 의장은 이사회의 질서를 유지하고 의사를 정리한다. |
| 소집권자 |
<이사회 운영규정 제10조> 1. 이사회는 대표이사가 소집한다. 그러나 대표이사가 사고로 인하여 2. 각 이사는 대표이사 사장에게 의안을 서면으로 제출하여 이사회의 |
| 소집절차 | <이사회 운영규정 제11조> 1. 이사회를 소집함에는 이사회일자를 정하고 그 7일전에 각 이사 및 감 사에 대하여 통지를 발송하여야 한다. 2. 이사회는 이사 및 감사 전원의 동의가 있을 때에는 제1항의 절차에 상관없이 언제든지 회의를 할 수 있다. |
| 결의방법 | <이사회 운영규정 제12조> 1. 이사회의 결의는 법령에 다른 정함이 있는 경우를 제외하고는 이사 과반수의 출석과 출석이사 과반수로 한다. 2. 이사회는 이사의 전부 또는 일부가 직접 회의에 출석하지 아니하고 모든 이사가 동영상 및 음성을 동시에 송수신하는 통신수단에 의하여 결의에 참가하는 것을 허용할 수 있으며, 이 경우 당해 이사는 이사회 에 직접 출석한 것으로 본다. 3. 이사회의 결의에 관하여 특별한 이해관계가 있는 이사는 의결권을 행사하지 못한다. 4. 제3항의 규정에 의하여 의결권을 행사할 수 없는 이사의 수는 출석한 이사의 수에 산입하지 아니한다. |
| 부의사항 |
<이사회 운영규정 제13조> 이사회는 다음 사항을 심의·의결한다. 1. 상법 및 정관상 결의사항 가. 주주총회의 소집 나. 영업보고서 및 재무제표의 승인 다. 대표이사 등의 선임 라. 신주의 발행사항 결정 마. 준비금의 자본전입 바. 전환사채의 발행 사. 신주인수권부사채의 발행 아. 사채의 발행 자. 지점의 설치, 이전 또는 폐지 차. 자본의 감소 카. 자기주식의 취득 및 소각 타. 주식매수선택권 부여 파. 우리사주매수선택권 부여 하. 영업의 양도, 양수, 임대 등 거. 정관의 변경 너. 회사의 합병 및 분할 더. 주식의 분할 러. 명의개서대리인의 선정 2. 회사경영에 관한 사항 가. 회사경영의 기본방침 결정 및 변경 나. 신규사업의 추진 다. 중요한 규칙의 제정 및 개정 3. 자산에 관한 사항 가. 중요한 계약의 체결 나. 중요한 재산의 취득 또는 처분 다. 결손의 처분 라. 장기 자금의 차입 4. 기타 가. 주요한 소송의 제기와 화해에 관한 사항 나. 이해관계자거래에대한통제규정에 규정된 사항 다. 기타법령 또는 정관에 정한 사항 및 대표이사가 필요하다고 |
| 감사 및 관계자의 출석 |
<이사회 운영규정 제7조> 1. 감사는 이사회에 출석하여 의견을 진술할 수 있다. 2. 감사는 이사가 법령 또는 정관에 위반한 행위를 하거나 그 행위를 할 염려가 있다고 인정한 때에는 이사회에 이를 보고하여야 한다. <이사회 운영규정 제8조> 이사회는 의안을 심의함에 있어 관계 임직원 또는 외부 인사를 출석시켜 의안에 대한 설명이나 의견을 청취할 수 있다. |
| 직무집행 감독 |
<이사회 운영규정 제15조> 1. 이사회는 이사의 청구가 있거나 필요하다고 판단한 경우 해당이사에 대하여 관련 자료의 제출, 조사 및 설명을 요청할 수 있다. 2. 제1항에 의하여 감독권을 행사한 이사회는 그 결과에 대하여 적절한 조치를 취하여야 한다. |
| 의사록 | <이사회 운영규정 제16조> 1. 이사회의 의사에 관하여는 의사록을 작성하여야 한다. 2. 의사록에는 의사의 안건, 경과요령, 그 결과, 반대하는 자와 그 반대 이유를 기재하여 출석한 이사 및 감사가 기명날인 또는 서명한다. 3. 주주는 영업시간 내에 이사회 의사록의 열람 또는 등사를 청구할 수 있다. 4. 회사는 제3항의 청구에 대하여 이유를 붙여 이를 거절할 수 있다. 이 경우 주주는 법원의 허가를 얻어 이사회 의사록을 열람 또는 등사할 수 있다. |
라. 사외이사 현황
당사는 경영의 투명성 확립을 위해 보고서 작성 기준일 현재 2명의 사외이사를 선임하고 있습니다.
| 성명 | 주요경력 | 최대주주와의이해관계 | 결격요건 여부 |
비고 |
| 홍창기 | 서울대학교 대학원 의학박사 과정 (박사) 신시내티대학교 의과대학 내과학교실 교수 (1975~1990 ) 서울아산병원 부원장(1991~1996) 울산대학교병원 병원장(1998~2000) 서울아산병원 병원장(2001~2002 ) 울산대학교 명예교수(내과학) (2002~ 현재) (주)엔지켐생명과학 사외이사 (2019~현재) |
이해관계 없음 |
결격요건 |
비상근 |
| 오혜영 | 성균관대학교 대학원 약학 박사 식품의약품 안전처 식품기준기획관 (2009~2013) 한국식품안전관리 인증원 원장 (2014~2017) 경성대학교 식품응용공학부 초빙교수 (2017~2020) 한국의약품안전관리원 비상임이사 (2019~2021) |
이해관계 없음 |
결격요건 |
비상근 |
마. 이사후보의 인적사항에 과한 주총전 공시여부 및 주주의 추천여부
당사는 상법 제363조 및 당사 정관 제24조의 규정에 따라 주주총회 소집은 일시, 장소 및 회의의 목적사항을 총회의 2주간 전에 주주에게 서면 또는 전자문서로 통지하고 있습니다. 한편, 주주제안권에 의해 이사 선임의안이 제출된 경우는 없었습니다.
바. 이사의 손해배상책임보험 가입여부
당사는 보고서 작성기준일 현재 손해배상책임보험에 가입되어 있지 않습니다.
사. 중요의결사항
(1) 이사회의 주요활동 내역
| 회차 | 개최일자 | 의 안 내 용 | 가결여부 | 비고 |
| 1 | 2021-01-08 | 운영자금 차입의 건 | 가결 | - |
| 2 | 2021-02-15 | 주식매수선택권 행사에 따른 신주권 발행의 건. | 가결 | - |
| 3 | 2021-02-15 | 내부회계관리제도 운영실태보고서 보고의 건 | 가결 | - |
| 4 | 2021-02-15 | 감사의 내부회계관리제도 평가보고서 보고의 건 | 가결 | - |
| 5 | 2021-02-23 | 제3자배정 유상증자(전환주식 발행)의 건 | 가결 | - |
| 6 | 2021-02-26 | 제3자배정 유상증자(전환주식 발행)의 건 | 가결 | - |
| 7 | 2021-03-12 | 주식매수선택권 부여의 건 | 가결 | - |
| 8 | 2021-03-15 | 제1호 의안 : 제22기 정기주주총회 소집결정 및 회의목적사항 결정의 건 제2호 의안 : 전자투표 도입의 건 |
가결 | - |
| 9 | 2021-06-07 | 제 1호 의안 : 운영자금 차입의 건 | 가결 | - |
| 10 | 2021-09-17 | 제 1호 의안 : 유상증자 신주발행의 건 (주주배정 후 실권주 일반공모) |
가결 | - |
(2) 이사의 주요 활동내역
|
회차 |
개최일자 |
의안내용 |
가결여부 | 이사의 성명 | |||
| 손기영 (출석률:100%) |
김혜경 (출석률:100%) |
홍창기 (출석률:60%) |
오혜영 (출석률:100%) |
||||
| 찬반여부 | 찬반여부 | 찬반여부 |
찬반여부 |
||||
| 1 | 2021-01-08 | 운영자금 차입의 건 | 가결 | 찬성 | 찬성 | - | 찬성 |
| 2 | 2021-02-15 | 주식매수선택권 행사에 따른 신주권 발행의 건. | 가결 | 찬성 | 찬성 | - | 찬성 |
| 3 | 2021-02-15 | 내부회계관리제도 운영실태보고서 보고의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 |
| 4 | 2021-02-15 | 감사의 내부회계관리제도 평가보고서 보고의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 |
| 5 | 2021-02-23 | 제3자배정 유상증자(전환주식 발행)의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 |
| 6 | 2021-02-26 | 제3자배정 유상증자(전환주식 발행)의 건 | 가결 | 찬성 | 찬성 | - | 찬성 |
| 7 | 2021-03-12 | 주식매수선택권 부여의 건 | 가결 | 찬성 | 찬성 | 찬성 | 찬성 |
| 8 | 2021-03-15 | 제1호 의안 : 제22기 정기주주총회 소집결정 및 회의목적사항 결정의 건 제2호 의안 : 전자투표 도입의 건 |
가결 | 찬성 | 찬성 | 찬성 | 찬성 |
| 9 | 2021-06-07 | 제 1호 의안 : 운영자금 차입의 건 | 가결 | 찬성 | 찬성 | - | 찬성 |
| 10 | 2021-09-17 | 제 1호 의안 : 유상증자 신주발행의 건 (주주배정 후 실권주 일반공모) | 가결 | 찬성 | 찬성 | 찬성 | 찬성 |
사. 이사의 독립성
이사는 주주총회에서 선임하며, 주주총회에서 선임할 이사 후보자는 이사회가 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다.
이사의 선임 관련하여 관련 법규에 의거한 주주제안이 있는 경우, 이사회는 적법한 범위 내에서 이를 주주총회에 의안으로 제출할 수 있도록 하고 있으며, 상법 제363조및 당사 정관 제32조에 의거 주주총회 목적사항이 이사 선임에 관한 사항인 경우 서면결의에 의한 의결권을 보장하기 위해 이사후보자의 성명, 약력 등을 총회 2주 전에
주주에게 서면을 통해 공고하고 있습니다. 현재 이사회 구성원 중 주주제안권에 의거하여 추천되었던 이사 후보는 없으며, 상기와 같은 절차에 따라 선임된 이사는 다음과 같습니다.
| 직명 | 성명 | 추천인 | 활동분야(담당업무) | 회사와의 거래 | 최대주주 또는 주요주주와의 관계 |
| 사내이사 (대표이사) |
손기영 | 이사회 | 경영총괄 | 해당없음 | 최대주주의 최대주주 |
| 사내이사 | 김혜경 | 이사회 | 경영지원 | 해당없음 | 최대주주의 대표이사 |
| 사외이사 | 홍창기 | 이사회 | 사외이사 | 해당없음 | - |
| 사외이사 | 오혜영 | 이사회 | 사외이사 | 해당없음 | - |
아. 사외이상의 전문성
보고서 작성 기준일 현재 당사의 사외이사는 각각 경영, 재무, 의학, 제약 분야 전문가로서 전문성을 충분히 갖추고 있어 사외이사를 대상으로 교육을 실시하거나 위탁 교육등 외부기관이 제공하는 교육을 이수한 바 없습니다.
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | 보고서 작성 기준일 현재 당사의 사외이사는 각각 경영, 재무, 의학, 제약 분야 전문가로서 전문성을 충분히 갖추고있어 사외이사를 대상으로 교육을 실시하거나 위탁 교육등외부기관이 제공하는 교육을 이수한 바 없습니다. |
2. 감사제도에 관한 사항
가. 감사기구 관련 사항
(1) 감사위원회(감사) 설치여부, 구성방법 등
당사는 보고서 작성기준일 현재 정관 및 감사직무규정을 두어 감사의 권한, 책임, 운영방안 등을 규정하고 있으며, 작성일 현재 자산총액 1천억 원을 초과하여 금번 주주총회에서 상근감사를 선임 하였습니다. 당사 정관 및 감사직무규정에 규정된 주요 내용은 아래와 같습니다.
| 구분 | 내용 |
| 감사의 수 | <정관 제44조> 1. 이 회사의 감사는 1명 이상 2명 이내로 한다. |
| 감사의 선임 | <정관 제44조> 2. 감사는 주주총회에서 선임하며, 감사의 선임을 위한 의안은 이사의 선 임을 위한 의안과는 구분하여 의결하여야 한다. 3. 감사의 선임은 출석한 주주의 의결권의 과반수로 하되 발행주식총수의 4분의 1이상의 수로 하여야 한다. 그러나 의결권 있는 발행주식총수의 100분의 3을 초과하는 수의 주식을 가진 주주는 그 초과하는 주식에 관 하여 제1항의 감사의 선임에 있어서는 의결권을 행사하지 못한다. 다만, 소유주식수의 산정에 있어 최대주주와 그 특수관계인, 최대주주 또는 그 특수관계인의 계산으로 주식을 보유하는 자, 최대주주 또는 그 특수관계인에게 의결권을 위임한 자가 소유하는 의결권 있는 주식의 수는 합산한다. |
| 감사의 임기 | <정관 제45조> 감사의 임기는 취임후 3년 내의 최종의 결산기에 관한 정기주주총회 종결시까지로 한다. |
| 감사의 직무 | <정관 제47조> 1. 감사는 이 회사의 회계와 업무를 감사한다. 2. 감사는 이사회에 출석하여 의견을 진술할 수 있다. 3. 감사는 회의의 목적사항과 소집의 이유를 기재한 서면을 이사회에 제 출하여 임시총회의 소집을 청구할 수 있다. 4. 감사는 그 직무를 수행하기 위하여 필요한 때에는 자회사에 대하여 영 업의 보고를 요구할 수 있다. 이 경우 자회사가 지체없이 보고를 하지 아니할 때 또는 그 보고의 내용을 확인할 필요가 있는 때에는 자회사의 업무와 재산상태를 조사할 수 있다. 5. 감사에 대해서는 제37조 제5항의 규정을 준용한다. 6. 감사는 필요하면 회의의 목적사항과 소집이유를 적은 서면을 이사(소 집권자가 있는 경우에는 소집권자)에게 제출하여 이사회 소집을 청구할 수 있다. 7. 제6항의 청구를 하였는데도 이사가 지체 없이 이사회를 소집하지 아니 하면 그 청구한 감사가 이사회를 소집할 수 있다. |
| 감사의 보수와 퇴직금 | <정관 제49조> 1. 감사의 보수는 주주총회의 결의로 이를 정한다. 감사의 보수결정을 위한 의안은 이사의 보수결정을 위한 의안과는 구분하여 의결하여야 한다. 2. 감사의 퇴직금의 지급은 주주총회 결의를 거친 임원퇴직금지급규정 에 의한다. |
(2) 감사위원회(감사)의 독립성
감사는 이사회에 참석하여 독립적으로 이사의 업무를 감독할 수 있으며, 제반 업무와관련하여 관련 장부 및 관계 서류를 해당 부서에 제출을 요구 할 수 있습니다. 또한 필요시 회사로 부터 영업에 관한 사항을 보고 받을 수 있으며, 감사 업무에 필요한 경영정보접근을 위하여 정관 및 이사회운영규정 상 다음과 같은 조항을 명시하고 있습니다. 또한 감사직무규정에 감사인의 독립성과 권한을 두어 공정하고 엄중한 감사가 될 수 있도록 규정하고 있습니다.
| 구분 | 조항 | 내용 |
| 정관 | 제47조 (감사의 직무) |
1. 감사는 이 회사의 회계와 업무를 감사한다. 2. 감사는 이사회에 출석하여 의견을 진술할 수 있다. 3. 감사는 회의의 목적사항과 소집의 이유를 기재한 서면을 이사회에 제출하여 임시총회의 소집을 청구할 수 있다. 4. 감사는 그 직무를 수행하기 위하여 필요한 때에는 자회 사에 대하여 영업의 보고를 요구할 수 있다. 이 경우 자 회사가 지체없이 보고를 하지 아니할 때 또는 그 보고의 내용을 확인할 필요가 있는 때에는 자회사의 업무와 재 산상태를 조사할 수 있다. 5. 감사에 대해서는 제37조 제5항의 규정을 준용한다. 6. 감사는 필요하면 회의의 목적사항과 소집이유를 적은 서 면을 이사(소집권자가 있는 경우에는 소집권자)에게 제 출하여 이사회 소집을 청구할 수 있다. 7. 제6항의 청구를 하였는데도 이사가 지체 없이 이사회를 소집하지 아니하면 그 청구한 감사가 이사회를 소집할 수 있다. |
| 이사회 운영 규정 |
제7조 (감사의 출석) |
1. 감사는 이사회에 출석하여 의견을 진술할 수 있다. 2. 감사는 이사가 법령 또는 정관에 위반한 행위를 하거나 그 행위를 할 염려가 있다고 인정한 때에는 이사회에 이 를 보고하여야 한다. |
(3) 감사위원회(감사)의 인적사항
당사는 보고서 작성기준일 현재 2015년 3월 30일 선임되고, 2021년 3월 31일 재선임된 강황배 감사가 재직 중입니다. 경영 및 재무에 대한 전문적인 지식을 갖춘 세무사를 감사로 선임하였으며, 상법 제542조의10 제2항의 감사의 자격요건 상 결격요건은 없는것으로 판단됩니다.
| 성명 | 사외이사 여부 |
경력 | 회계ㆍ재무전문가 관련 | ||
|---|---|---|---|---|---|
| 해당 여부 | 전문가 유형 | 관련 경력 | |||
| 강황배 | - | 고려대학교 경영대학 학사 (주)SK증권, 現 세무사 | 예 | 회계사 및 금융기관·정부·증권유관기관 등 경력자 |
- (주)SK 증권 (1993~1998) - 온누리세무회계사무소 세무사 (2009 ~ 현재) |
나. 감사의 주요활동내역
감사의 활동한 내역은 다음과 같습니다.
| 회차 | 개최일자 | 의 안 내 용 | 가결여부 | 비고 |
| 1 | 2021-01-08 | 운영자금 차입의 건 | 가결 | 불참 |
| 2 | 2021-02-15 | 주식매수선택권 행사에 따른 신주권 발행의 건. | 가결 | 불참 |
| 3 | 2021-02-15 | 내부회계관리제도 운영실태보고서 보고의 건 | 가결 | 참석 |
| 4 | 2021-02-15 | 감사의 내부회계관리제도 평가보고서 보고의 건 | 가결 | 참석 |
| 5 | 2021-02-23 | 제3자배정 유상증자(전환주식 발행)의 건 | 가결 | 참석 |
| 6 | 2021-02-26 | 제3자배정 유상증자(전환주식 발행)의 건 | 가결 | 참석 |
| 7 | 2021-03-12 | 주식매수선택권 부여의 건 | 가결 | 참석 |
| 8 | 2021-03-15 | 제1호 의안 : 제22기 정기주주총회 소집결정 및 회의목적사항 결정의 건 제2호 의안 : 전자투표 도입의 건 |
가결 | 참석 |
| 9 | 2021-06-07 | 제 1호 의안 : 운영자금 차입의 건 | 가결 | 불참 |
| 10 | 2021-09-17 | 제1호 의안 : 유상증자 신주발행의 건 (주주배정 후 실권주 일반공모) |
가결 | 참석 |
다. 감사의 독립성
감사는 이사회에 참석하여 독립적으로 이사의 업무를 감독할 수 있으며, 제반업무와 관련하여 해당 부서에 관련 장부 및 관계서류 제출을 요구할 수 있습니다. 또한, 필요시 회사로부터 영업에 관한 상항을 보고 받을 수 있으며, 적절한 방법으로 경영 정보에 접근할 수 있습니다.
라. 감사 교육 미실시 내역
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | 보고서 작성 기준일 현재 당사의 감사는 감사업무를 수행함에 있어 경영, 재무, 세무 분야 전문가로서 전문성을 충분히 갖추고 있어 감사를 대상으로 교육을 실시하거나 위탁 교육등 외부기관이 제공하는 교육을 이수한 바 없습니다. |
마. 감사위원회(감사) 지원조직 현황
보고서 작성기준일 현재 해당사항 없습니다.
바. 준법지원인 지원조직 현황
보고서 작성기준일 현재 해당사항 없습니다.
3. 주주총회 등에 관한 사항
가. 투표제도 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) |
| 투표제도 종류 | 집중투표제 | 서면투표제 | 전자투표제 |
|---|---|---|---|
| 도입여부 | 배제 | 도입 | 도입 |
| 실시여부 | - | 실시 | 실시 |
나. 집중투표제의 채택여부
보고서 작성기준일 현재 집중투표제를 채택하고 있지 않습니다.
다. 서면투표제 또는 전자투표제의 채택여부
- 당사 이사회는 2020년 1월 31일 의결권 행사에 있어 주주의 편의를 제고하기 위하여「상법」제368조의4(전자적 방법에 의한 의결권의 행사)에 따라 전자투표제를 채택하였고, 당사는 2021년 3월 31일에 개최예정인 제22기 정기주주총회부터 전자투표제를 시행하기로 하였습니다.
- 당사는 주주총회 소집공고 시 전자적 방법으로 의결권을 행사할 수 있다는 내용을 공고하고 있으며, 매결산기 최종일에 의결권 있는 주식을 소유한 주주는 주주총회에 직접 참석하지 아니 하고 삼성증권에서 제공하는 전자투표시스템을 통하여 주주총회 10일 전부터 주주총회일 전날까지 의결권을 행사할 수 있습니다.
라. 의결권 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 8,331,345 | - |
| 우선주 | 379,137 | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | 379,137 | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 8,331,345 | - |
| 우선주 | - | - |
마. 소수주주권의 행사여부
보고서 작성기준일 현재 소수주주권 행사 내역이 존재하지 않습니다.
바. 경영권 경쟁
보고서 작성기준일 현재 경영권 경쟁이 발생한 사실이 없습니다.
사. 주주총회 의사록 요약
| 개최일자 | 주주총회 종류 | 의안내용 | 가결여부 |
|---|---|---|---|
| 2017.03.30 | 정기 | 제1호 의안 : 제18기 재무상태표 승인의 건 제2호 의안 : 정관 변경의 건 제3호 의안 : 이사 선임의 건 제4호 의안 : 주식매수선택권 부여의 건 제5호 의안 : 이사 보수액 한도 승인의 건 제6호 의안 : 감사 보수액 한도 승인의 건 |
가결 |
| 2017.07.07 | 임시 | 제1호 의안 : 정관 변경의 건 | 가결 |
| 2018.03.22 | 정기 | 제1호 의안 : 제19기 재무상태표 승인의 건 제2호 의안 : 정관 변경의 건 제3호 의안 : 이사 선임의 건 제4호 의안 : 감사 선임의 건 제5호 의안 : 주식매수선택권 부여의 건 제6호 의안 : 이사 보수액 한도 승인의 건 제7호 의안 : 감사 보수액 한도 승인의 건 |
가결 |
| 2019.03.26 | 정기 | 제1호 의안 : 제20기(2018.01.01~2018.12.31)재무제표 및 연결재무제표(결손금처리계산서(안) 포함) 승인의 건 제2호 의안 : 이사 보수한도 승인의 건 제3호 의안 : 감사 보수한도 승인의 건 제4호 의안 : 사외이사 선임의 건 (사외이사 홍창기 선임의 건) 제5호 의안 : 주식매수선택권 부여 승인의 건 제6호 의안 : 정관 일부 변경의 건 |
가결 |
| 2020.03.24 | 정기 | 제1호 의안 : 제21기(2019.01.01~2019.12.31)재무제표 및 연결재무제표(결손금처리계산서(안) 포함) 승인의 건 제2호 의안 : 이사 선임의 건 제3호 의안 : 이사 보수한도 승인의 건 제4호 의안 : 감사 보수한도 승인의 건 제5호 의안 : 주식매수선택권 부여 승인의 건 |
가결 |
| 2021.03.31 | 정기 | 제1호의안 : 제22기(2020.01.01~2020.12.31) 재무제표 및 연결재무제표(결손금처리계산서(안) 포함)승인의 건 제2호의안 : 정관 일부 변경의 건 제3호의안 : 감사 선임의 건 제4호의안 : 이사 보수한도 승인의 건 제5호의안 : 감사 보수한도 승인의 건 제6호의안 : 주식매수선택권 부여 및 부여 승인의 건 |
가결 |
VI. 주주에 관한 사항
가. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 손기영 | 대표이사 | 보통주 | 578,361 | 7.01 | 578,361 | 6.94 | - |
| 브리짓 라이프 사이언스 |
관계회사 (최대주주) |
보통주 | 961,780 | 11.66 | 961,780 | 11.54 | - |
| 이종수 | 미등기임원 | 보통주 | 17,000 | 0.21 | 17,000 | 0.20 | - |
| 정재한 | 미등기임원 | 보통주 | 2,000 | 0.02 | 2,000 | 0.02 | - |
| 김해기 | 미등기임원 | 보통주 | 2,600 | 0.03 | 2,600 | 0.03 | - |
| 계 | 보통주 | 1,561,741 | 18.93 | 1,561,741 | 18.74 | - | |
| - | - | - | - | - | - | ||
* 주식매수선택권 행사 및 전환우선주 청구로 인한 발행 주식 총 수 의 변경으로 인한 지분율 변동
나. 최대주주의 주요경력 및 개요
(1) 최대주주(법인 또는 단체)의 기본정보
| 명 칭 | 출자자수 (명) |
대표이사 (대표조합원) |
업무집행자 (업무집행조합원) |
최대주주 (최대출자자) |
|||
|---|---|---|---|---|---|---|---|
| 성명 | 지분(%) | 성명 | 지분(%) | 성명 | 지분(%) | ||
| 브리짓 라이프 사이언스 |
7 | 김혜경 | 29.94 | 김혜경 | 29.94 | 손기영 | 38.57 |
| - | - | - | - | - | - | ||
-회사현황
상호: 브리짓라이프사이언스
사업자등록번호 : 217-84-41071
설립일: 2003.08.09
대표자: 김혜경
주소: 서울특별시 서초구 강남대로 27, aT센터 1005호
전화번호: 02-6213-7101
- 연혁
2003년 8월 회사설립
2003년 ~ 2005년 주)나노하이브리드의 무기물 나노 캡슐레이션에 의한 Drug Delivery System 개발
2008년-2010년 메디칼디바이스제품 기술해외 라이센싱 및 해외 마케팅
2010년 12월 (주)엔지켐생명과학 인수
(2) 최대주주(법인 또는 단체)의 최근 결산기 재무현황
| (단위 : 백만원) |
| 구 분 | |
|---|---|
| 법인 또는 단체의 명칭 | 브리짓라이프사이언스 |
| 자산총계 | 1,411 |
| 부채총계 | 560 |
| 자본총계 | 851 |
| 매출액 | - |
| 영업이익 | -2 |
| 당기순이익 | -2 |
(3) 사업현황 등 회사 경영 안정성에 영향을 미칠 수 있는 주요 내용
브리짓라이프사이언스는 2003년에 설립, 한국을 중심으로 개발된 Bio-Medical-Healthcare 제품과 solution을 해외로 수출하고, 자체 개발한 바이오 글로벌 상업화 엑셀러레이터인 BEA(BioBusiness Exit Accelerator)을 갖고 바이오 메디컬 기업을 만들어가고자 하였습니다.
나노 캡슐레이션에 의한 drug delivery system을 이용한 개량신약 개발과 기술 해외 라이센싱, 척추 측만증 치료제품인 Fortis, Laser Toothbrush, 자동소변수집기( Urine Collection System), 광선을 이용한 피부진단 및 치료기 등을 미국과 유럽으로 수출하는 해외 마케팅을 하여 왔습니다.
2010년 12월에 (주)엔지켐생명과학을 인수한 후, 당사의 대표이사 및 이사진은 그간의 글로벌 마케팅, 라이센싱 경험을 바탕으로 현재까지 엔지켐생명과학의 경영에 참여하여 EC-18을 이용한 Global 신약개발을 해오고 있습니다.
다. 최대주주 변동내역
최대주주 변동내역
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주, %) |
| 변동일 | 최대주주명 | 소유주식수 | 지분율 | 변동원인 | 비 고 |
|---|---|---|---|---|---|
| 2010년 12월 29일 | 브리짓라이프사이언스 | 961,780 | 11.54 | 유상증자 | - |
라. 주식 소유현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율(%) | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 손기영 | 578,361 | 6.94 | - |
| 브리짓라이프사이언스 | 961,780 | 11.54 | - | |
| 우리사주조합 | 2,606 | 0.03 | ||
마. 소액주주현황
소액주주현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 35,071 | 35,079 | 99.97 | 5,915,805 | 8,247,200 | 71.73 | - |
* 보고서 작성기준일 현재 전환우선주 청구 및 주식매수선택권 행사로 인하여 주식수 변동이 있으나 소액주주 변동내역 확인을 할 수 없어 2020년 기말 기준으로 작성하였습니다
바. 주식사무
|
정관상 신주인수권의 내용 |
제9조(신주인수권)① 회사의 주주는 상법 제418조의 규정에 의하여 그가 소유한 주식수에 비례하여 신주의 배정을 받을권리를 가진다. |
|
결 산 일 |
12월31일 |
|
정기주주총회의 시기 |
회사는 매결산기마다 정기주주총회를 소집하여야 하고, 필요에 따라 임시주주총회를 소집한다. |
|
주주명부 폐쇄시기 |
① 회사는 의결권을 행사하거나 배당을 받을 자 기타 주주 또는 질권자로서 권리를 행사할 자를 정하기 위하여 이사회 결의로 일정한 기간을 정하여 주주명부의 기재변경을 정지하거나 일정한 날에 주주명부에 기재된 주주 또는 질권자를 그 권리를 행사할 주주 또는 질권자로 볼 수 있다. |
|
주권의 종류 |
기명식 보통주 8종 |
|
명의개서대리인 |
국민은행 증권대행부 |
|
주주의 특전 |
없음 |
|
공고게재신문 |
회사의 인터넷 홈페이지(www.enzychem.co.kr)에 한다. 다만, 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시에서 발행되는 매일경제신문에 한다. |
사. 주가 및 주식거래 실적
보고서 작성기준일로부터 최근 6개월간 주가 및 거래량은 다음과 같습니다.
| (단위 : 원,주) |
| 종 류 | 2021년 4월 | 2021년 5월 | 2021년 6월 | 2021년 7월 | 2021년 8월 | 2021년 9월 | ||
|---|---|---|---|---|---|---|---|---|
| 보통주 | 주가 | 최 고 | 157,800 | 122,600 | 101,000 | 101,400 | 95,800 | 91,100 |
| 최 저 | 114,600 | 97,000 | 94,000 | 85,200 | 78,100 | 72,700 | ||
| 평 균 | 138,123 | 106,205 | 96,573 | 91,841 | 89,224 | 83,489 | ||
| 거래량 | 최고일거래량 | 904,784 | 510,697 | 254,236 | 184,215 | 578,707 | 475,850 | |
| 최저일거래량 | 92,930 | 87,156 | 42,399 | 53,503 | 33,840 | 48,615 | ||
| 월간 총거래량 | 6,012,431 | 4,513,646 | 2,733,880 | 2,289,680 | 2,962,008 | 2,717,420 | ||
VII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
|
손기영 |
남 | 1961.09 |
대표 |
사내이사 | 상근 |
경영 총괄 |
고려대 경영학과 졸업 고려대 경영대학원 경영학과 석사 삼일회계법인 이사(CPA)(1984~1998) 브리짓라이프사이언스 회장(2003~현재) ㈜엔지켐생명과학 대표이사(2011~현재) |
578,361 | - | 최대주주 | 10년 8개월 |
2023.03.30 |
| 김혜경 | 여 | 1958.02 | 사내 이사 |
사내이사 | 상근 | 경영 지원 |
이화여자대학교 외국어교육 불어학과 졸업 A.C. Nielsen Production Manager(1983~1991) 브리짓라이프사이언스 대표이사(2003~현재) ㈜엔지켐생명과학 대표이사(2011~2012) |
- | - | 대표이사 | 10년 8개월 |
2023.03.30 |
| 홍창기 | 남 | 1937.05 | 사외 이사 |
사외이사 | 비상근 | 자문 위원 |
서울대학교 대학원 의학박사 과정 (박사) 신시내티대학교 의과대학 내과학교실 교수(1,975~1,990 ) 서울아사병원 부원장(1,991~1,996) 울산대학교병원 병원장(1,998~2,000) 서울아산병원 병원장(2,001~2,002 ) 울산대학교 명예교수(내과학) (2,002~ 현재) (주)엔지켐생명과학 사외이사 (2,019~현재) |
- | - | - | 2년 6개월 | 2022.03.25 |
| 오혜영 | 여 | 1956.03 | 사외 이사 |
사외이사 | 비상근 | 자문 위원 |
성균관대학교 대학원 약학 박사 식품의약품 안전처 식품기준기획관 (2009~2013) 한국식품안전관리 인증원 원장 (2014~2017) 경성대학교 식품응용공학부 초빙교수 (2017~2020) 한국의약품안전관리원 비상임이사 (2019~2021) |
- | - | - | 1년 6개월 | 2023.03.30 |
| 강황배 | 남 | 1966.08 | 감사 | 감사 | 상근 | 감사 |
고려대학교 경영대학 졸업 (학사) ㈜SK증권 주임 (1993~1998) |
- | - | - | 6년 6개월 | 2024.03.31 |
| 이홍균 | 남 | 1963.07 | 부사장 | 미등기 | 상근 | 글로벌백신생산 총괄 |
* 1996년~2002년 Sogang University (Seoul), Graduate School of Life Sciences Ph.D. (Major - Microbiology) * 1986년-1991년 Sogang University Graduate School (Seoul), Graduate School of Life Sciences Master's Degree (Major - Biochemistry) * 1982년-1986년 Sogang University (Seoul), Bachelor's Degree in Life Science, Minor - Chemistry * 1991년~2006년 LG Life Sciences Co., Ltd. (currently LG Chem) / Senior Researcher (Director), Institute of Technology *2006년~2010년 LG Life Sciences Co., Ltd. (currently LG Chem)/ Head of Production Team 4 at Iksan Plant (Director) *2010년~2012년 SK Chemicals Co., Ltd. Bio 4 Team Leader (Manager) *2013년~2017년 SK Chemicals Andong Vaccine Plant (L House), Plant General Manager (Executive Director) *2018년~2019년 SK Bioscience Co., Ltd. Head of Engineering TF *2019년-2021년 Chong Kun Dang Co., Ltd., Managing Director, 2021년.01월~ Seegene Head of production (COVID diagnostics) |
160 | - | - | 1개월 | - |
| 이종수 | 남 | 1966.04 | 전무 | 미등기 | 상근 | 공장장 |
아주대학교 화학과 졸업 (학사) 아주대학교 대학원 화학과 졸업 (석사) ㈜경보화학 중앙연구소 (1993~1999) ㈜엔지켐생명과학 상무이사 (1999~현재) |
17,000 | - | - | 22년 1개월 |
- |
| 박갑주 | 남 | 1965.01 | 전무 | 미등기 | 상근 | 사업 개발 |
Ph.D. (1992.8-97.5) Department of Chemistry, Brown University, M.S. (1988.3-90.2) Department of Chemistry, POSTECH, Pohang, (1997.6-1998.5) Texas A&M University, Post-doc, USA |
- | - | - | 1년 7개월 |
- |
| 강인수 | 남 | 1962.10 | 전무 | 미등기 | 상근 | 혁신 성장실 |
부산대학교 법학과 졸업 부국증권 지점장 (1987~1997 ) 삼성증권 금융센터장 (1997~2012 ) 금융감독원 금융투자담당 (2012~2020 ) ㈜엔지켐생명과학 전무(2021~ 현재) |
- | - | - | 9개월 | - |
| 최광식 | 남 | 1949.07 | 전무 | 미등기 | 상근 | 품질 관리 |
중앙대학교 약학대학 약학과 졸업 (학사) 원광대학교 약학대학원 졸업 (석사 / 박사) 국립보건안전연구원 안전성연구부 (1976~1998) 국립독성연구소/일반독성과/특수독성 (1998~2006) 한국의약품시험연구소장 (2006~2011) ㈜엔지켐생명과학 전무 (2011 ~ 현재) |
- | - | - | 10년 3개월 |
- |
| 최재호 | 남 | 1969.08 | 상무 | 미등기 | 상근 | 국내 영업 |
건국대학교 경제학과 졸업 (학사) 중외제약 영업대리 (1996~1999) Mathys Korea 영업과장 (1999~2001) 화일약품 영업부장 (2001~2013) 신영바이오텍 영업이사 (2014~2014) ㈜엔지켐생명과학 이사 (2014~현재) |
645 | - | - | 7년 | - |
| 정재한 | 남 | 1969.11 | 상무 | 미등기 | 상근 | 경영 지원 |
중앙대학교 회계학과 졸업 (학사) 보령제약 자금 및 회계 차장 (1994~2010) 케이아이씨 재정 부장 (2010~2012) 무림오피스웨이 관리부장 (2014~2015) ㈜엔지켐생명과학 이사 (2015~현재) |
2,000 | - | - | 6년 6개월 | - |
| 신동균 | 남 | 1967.04 | 상무 | 미등기 | 상근 | 합성 연구소 연구 소장 |
한일약품 과장 (병역특례연구원) (1990.12 ~ 1997.05 ) 한미약품 책임연구원 (1997.06 ~ 1998.12 ) 한미정밀 책임연구원 (1999.01 ~ 2003.05 ) 이매진 수석연구원 ( 2003.06 ~ 2009.03 ) 포켐바이오제닉스 연구소 소장 ( 2009.04 ~ 2013.09) 다산제약 합성연구소 소장 ( 2013.10 ~ 2020.02 ) |
- | - | - | 1년 6개월 | - |
| 윤선영 | 여 | 1968.08 | 이사 | 미등기 | 상근 | 대전 연구소 연구소장 |
성균관대학교 생물학과 석사 (1991~1993) 한국과학기술원(KAIST) 생명과학과 박사 (1999~2005) 한국생명공학연구원 세포생물학실 연구원 (1994~2003) 한국생명공학연구원 인간유전체사업단 연구원 (2003~2005) Roswell Park Cancer Institute (RPCI), Buffalo, 숙명여자대학교 생명과학과 면역학실 연구교수 (2006 ~ 2013) 코아스템㈜ R&D 그룹 R&D 그룹장 (2013~2014) |
- | - | - | 7년 4개월 | - |
| 김해기 | 남 | 1962.01 | 이사 | 미등기 | 상근 | 합성 연구 및 생산 지원 |
단국대학교 화학과 졸업 (학사) JR PHARM 품질관리부 차장 (1989~2001) 한국유니온제약㈜ 부장 (2001~2006) ㈜엔지켐생명과학 이사 (2007~현재) |
2,600 | - | - | 14년 5개월 |
- |
나. 직원 등 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 관리 | 남 | 17 | - | - | - | 17 | 2.8 | 776 | 46 | - | - | - | - |
| 관리 | 여 | 5 | - | - | - | 5 | 2.10 | 146 | 29 | - | |||
| 영업 | 남 | 3 | - | - | - | 3 | 7.0 | 142 | 47 | - | |||
| 영업 | 여 | 1 | - | - | - | 1 | 4.7 | 26 | 26 | - | |||
| 연구 | 남 | 14 | - | - | - | 14 | 2.4 | 891 | 63 | - | |||
| 연구 | 여 | 18 | - | - | - | 18 | 1.12 | 553 | 30 | - | |||
| 생산 | 남 | 32 | - | - | - | 32 | 6.11 | 1,098 | 34 | - | |||
| 생산 | 여 | 14 | - | - | - | 14 | 4.1 | 225 | 16 | - | |||
| 합 계 | 104 | - | - | - | 104 | 3.8 | 3,857 | 37 | - | ||||
다. 미등기임원 보수 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 11 | 1,350 | 104 | - |
2. 임원의 보수 등
가. 주주총회 승인금액
| (단위 : 백만원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 이사 | 4 | 7,000 | - |
| 감사 | 1 | 100 | - |
나. 보수지급금액
2-1. 이사ㆍ감사 전체
| (단위 : 백만원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 5 | 2,216 | 443 | - |
2-2. 유형별
| (단위 : 백만원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
2 | 2,152 | 1,076 | - |
| 사외이사 (감사위원회 위원 제외) |
2 | 45 | 23 | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 19 | 19 | - |
다. 보수지급금액 5억원 이상인 이사 ·감사의 개인별 보수현황
개인별 보수현황은 2016년 3월「자본시장과 금융투자업에 관한 법률」개정으로 연 2회 공시(반기보고서 및 사업보고서)하고 있습니다.
라. 보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황
개인별 보수현황은 2016년 3월「자본시장과 금융투자업에 관한 법률」개정으로 연 2회 공시(반기보고서 및 사업보고서)하고 있습니다.
마. 주식매수선택권의 부여 및 행사현황
<표1>
| (단위 : 원) |
| 구 분 | 인원수 | 주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 | 2 | - | - |
| 사외이사 | 2 | 152,737,860 | - |
| 감사위원회 위원 또는 감사 | 1 | - | - |
| 계 | 5 | - | - |
<표2>
| (기준일 : | 2021년 09월 30일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||
| 강종구 | 등기임원 | 2013.12.04 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2015.12.05~2018.12.04 | 3,665 |
| 김재화 | - | 2013.12.04 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2015.12.05~2018.12.04 | 3,665 |
| 오세량 | - | 2013.12.04 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2015.12.05~2018.12.04 | 3,665 |
| 김명환 | 등기임원 | 2013.12.04 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2015.12.05~2018.12.04 | 3,665 |
| 김상희 | 등기임원 | 2014.07.24 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2016.07.25~2019.07.24 | 5,066 |
| 김명환 | 등기임원 | 2014.07.24 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2016.07.25~2019.07.24 | 5,066 |
| 나성수 | - | 2014.07.24 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2,016.07.25~2,019.07.24 | 5,066 |
| 정세호 | - | 2014.07.24 | 신주교부 | 보통주 | 30,000 | - | - | 20,000 | 10,000 | - | 2016.07.25~2019.07.24 | 5,066 |
| 한용해 | - | 2014.07.24 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2016.07.25~2019.07.24 | 5,066 |
| 최재호 | 미등기임원 | 2014.12.31 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 육진수 | - | 2014.12.31 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 이종수 | 미등기임원 | 2014.12.31 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 신동일 | 미등기임원 | 2014.12.31 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 최광식 | 미등기임원 | 2014.12.31 | 신주교부 | 보통주 | 1,000 | - | - | 1,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 전남득 | - | 2014.12.31 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 강병규 | 미등기임원 | 2014.12.31 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 김해기 | 미등기임원 | 2014.12.31 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.01.01~2019.12.31 | 25,100 |
| 당사직원 25명 | 직원 | 2014.12.31 | 신주교부 | 보통주 | 20,000 | - | - | 17,000 | 3,000 | - | 2017.01.01~2019.12.31 | 25,100 |
| 이철민 외 13명 | - | 2014.12.31 | 신주교부 | 보통주 | 9,500 | - | - | 5,000 | 4,500 | - | 2017.01.01~2019.12.31 | 25,100 |
| 이재용 | 등기임원 | 2015.01.23 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2017.01.24~2020.01.23 | 30,200 |
| 고상곤 | 등기임원 | 2015.01.23 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2017.01.24~2020.01.23 | 30,200 |
| 김흥재 | - | 2015.01.23 | 신주교부 | 보통주 | 12,000 | - | - | 12,000 | - | - | 2017.01.24~2020.01.23 | 30,200 |
| 홍완기 | - | 2015.06.26 | 신주교부 | 보통주 | 30,000 | - | - | - | 30,000 | - | 2017.06.27~2018.06.26 | 58,700 |
| 육진수 | - | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | 3,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 이종수 | 미등기임원 | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | 3,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 김해기 | 미등기임원 | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | 3,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 신동일 | 미등기임원 | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | 3,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 최재호 | 미등기임원 | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | 3,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 정재욱 | - | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | - | 3,000 | - | 2017.06.27~2018.06.26 | 58,700 |
| 이용섭 | - | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | 3,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 전장호 | - | 2015.06.26 | 신주교부 | 보통주 | 3,000 | - | - | - | 3,000 | - | 2017.06.27~2018.06.26 | 58,700 |
| 강병규 | 미등기임원 | 2015.06.26 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 정재한 | 미등기임원 | 2015.06.26 | 신주교부 | 보통주 | 2,000 | - | - | 2,000 | - | - | 2017.06.27~2018.06.26 | 58,700 |
| 당사직원 3명 | 직원 | 2015.06.26 | 신주교부 | 보통주 | 5,000 | - | - | 4,000 | 1,000 | - | 2017.06.27~2018.06.26 | 58,700 |
| 김명환 | 등기임원 | 2016.10.21 | 신주교부 | 보통주 | 60,000 | - | - | 38,530 | 21,470 | - | 2018.10.22~2019.10.21 | 51,200 |
| 강종구 | 등기임원 | 2016.10.21 | 신주교부 | 보통주 | 30,000 | - | - | 30,000 | - | - | 2018.10.22~2019.10.21 | 51,200 |
| 김상희 | 등기임원 | 2016.10.21 | 신주교부 | 보통주 | 30,000 | - | - | 30,000 | - | - | 2018.10.22~2019.10.21 | 51,200 |
| 길버트 알렉산더플레밍 |
- | 2016.10.21 | 신주교부 | 보통주 | 10,000 | - | - | - | 10,000 | - | 2018.10.22~2019.10.21 | 51,200 |
| 조도현 | 등기임원 | 2016.10.21 | 신주교부 | 보통주 | 5,000 | - | - | 5,000 | - | - | 2018.10.22~2019.10.21 | 51,200 |
| 고상곤 | 등기임원 | 2016.10.21 | 신주교부 | 보통주 | 30,000 | - | - | 30,000 | - | - | 2018.10.22~2019.10.21 | 51,200 |
| 당사직원 2명 | 직원 | 2016.10.21 | 신주교부 | 보통주 | 32,000 | - | - | 30,000 | 2,000 | - | 2018.10.22~2019.10.21 | 51,200 |
| 문병곤 | 미등기임원 | 2017.03.30 | 신주교부 | 보통주 | 3,000 | 2,000 | - | 3,000 | - | - | 2019.03.31~2020.03.30 | 29,000 |
| 이도영 | 미등기임원 | 2017.03.30 | 신주교부 | 보통주 | 3,000 | 3,000 | - | 3,000 | - | - | 2019.03.31~2020.03.30 | 29,000 |
| 고상곤 | 등기임원 | 2017.03.30 | 신주교부 | 보통주 | 3,000 | - | - | 3,000 | - | - | 2019.03.31~2020.03.30 | 29,000 |
| 당사직원 1명 | 직원 | 2017.03.30 | 신주교부 | 보통주 | 1,000 | - | - | 1,000 | - | - | 2019.03.31~2020.03.30 | 29,000 |
| 윤도경 | 미등기임원 | 2018.03.22 | 신주교부 | 보통주 | 3,000 | - | - | - | 3,000 | - | 2020.03.23~2021.03.22 | 98,000 |
| 계열회사 직원 2명 | 계열회사 직원 | 2018.06.29 | 신주교부 | 보통주 | 4,000 | - | 1,000 | - | 4,000 | - | 2020.06.29~2021.06.28 | 81,000 |
| 당사직원 | 직원 | 2018.06.29 | 신주교부 | 보통주 | 1,000 | 1,000 | - | 1,000 | - | - | 2020.06.29~2021.06.28 | 81,000 |
| 조도현 | 미등기임원 | 2019.10.02 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2021.10.02~2022.10.01 | 50,500 |
| 계열회사 직원 3명 | 계열회사 직원 | 2019.10.02 | 신주교부 | 보통주 | 5,000 | - | - | - | - | 5,000 | 2021.10.02~2022.10.01 | 50,500 |
| 계열회사 직원 1명 | 계열회사 직원 | 2019.11.04 | 신주교부 | 보통주 | 1,000 | - | - | - | - | 1,000 | 2021.11.04~2022.11.03 | 59,600 |
| 계열회사 직원 1명 | 계열회사 직원 | 2020.06.22 | 신주교부 | 보통주 | 1,000 | - | - | - | 1,000 | - | 2022.06.22~2023.06.23 | 93,000 |
| 당사 직원 8명 | 직원 | 2021.03.12 | 신주교부 | 보통주 | 27,000 | - | - | - | - | 27,000 | 2023.03.12~2024.03.11 | 97,100 |
| 계열회사 5명 | 계열회사 직원 | 2021.03.12 | 신주교부 | 보통주 | 14,000 | - | - | - | - | 14,000 | 2,023.03.12~2,024.03.11 | 97,100 |
| 오혜영 | 등기임원 | 2021.03.31 | 신주교부 | 보통주 | 3,000 | - | - | - | - | 3,000 | 2023.03.31~2024.03.30 | 118,400 |
VIII. 계열회사 등에 관한 사항
가. 계열회사 현황(요약)
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 사) |
| 기업집단의 명칭 | 계열회사의 수 | ||
|---|---|---|---|
| 상장 | 비상장 | 계 | |
| (주)엔지켐생명과학 | - | 2 | 2 |
나. 타법인출자 현황(요약)
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 천원) |
| 출자 목적 |
출자회사수 | 총 출자금액 | |||||
|---|---|---|---|---|---|---|---|
| 상장 | 비상장 | 계 | 기초 장부 가액 |
증가(감소) | 기말 장부 가액 |
||
| 취득 (처분) |
평가 손익 |
||||||
| 경영참여 | - | 2 | 2 | 185,120 | 1,095,034 | - | 1,280,154 |
| 일반투자 | - | - | - | - | - | - | - |
| 단순투자 | - | 1 | 1 | 344,124 | 480,763 | -362,319 | 462,568 |
| 계 | - | 3 | 3 | 529,244 | 1,575,797 | -362,319 | 1,742,722 |
IX. 대주주 등과의 거래내용
1. 대주주등과의 거래내역
가. 대주주(대표이사)로부터 제공받는 지급보증
보고서 작성기준일 현재 KDB산업은행 및 우리은행 차입금과 관련하여 대표이사로부터지급보증(지급보증금액: 12,015,000,000원)을 제공받고 있습니다. 한편, 우리사주조합의 우선배정주식 청약증거금과 관련하여 한국증권금융에 지급보증(지급보증금액: 117,600,000원)을 제공하고 있습니다.
2. 대주주 이외의 이해관계자와의 거래
보고서 작성기준일 현재 해당사항이 없습니다.
3. 기타 거래내역
가. 특수관계자 현황
| 특수관계 구분 | 특수관계자 | |
|---|---|---|
| 당분기말 | 전기말 | |
| 당사에 유의적인 영향력을 행사하는 회사 | (주)브리짓라이프사이언스 | (주)브리짓라이프사이언스 |
| 종속기업(*) | Enzychem Lifesciences USA Inc. | Enzychem Lifesciences USA Inc. |
| (주)메쎄나 | - | |
| 기타특수관계자 | (주)메드푸드 | (주)메드푸드 |
* (주)메쎄나는 당분기 중 설립되었습니다.
나. 특수관계자와의 매출ㆍ매입 등 거래 내역
<당분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 특수관계자명 | 매출 등 | 매입 등 |
| 종속기업 | Enzychem Lifesciences USA inc. | - | 1,583,414,378 |
| (주)메쎄나 | 5,620,000 | - | |
| 기타특수관계자 | (주)메드푸드 | 1,330,209,092 | - |
| 합 계 | 1,335,829,092 | 1,583,414,378 | |
<전분기>
| (단위: 원) | |||
|---|---|---|---|
| 구 분 | 특수관계자명 | 매출 등 | 매입 등 |
| 종속기업 | Enzychem Lifesciences USA inc. | - | 1,260,781,043 |
| 기타특수관계자 | (주)메드푸드 | 569,863,638 | - |
| 합 계 | 569,863,638 | 1,260,781,043 | |
다. 특수관계자와의 채권ㆍ채무 내역
<당분기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 채 권 | 채 무 | ||
| 매출채권 | 대여금 | 매입채무 | 미지급금 | ||
| 종속기업 | (주)메쎄나 | 5,620,000 | - | - | - |
| 기타특수관계자 | (주)메드푸드 | 439,000,000 | - | - | - |
| 기타특수관계자 | 임직원 | - | 30,450,000 | - | - |
| 합 계 | 444,620,000 | 30,450,000 | - | - | |
<전기말>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 채 권 | 채 무 | ||
| 매출채권 | 대여금 | 매입채무 | 미지급금 | ||
| 기타특수관계자 |
임직원 | - | 82,650,000 | - | - |
라. 특수관계자와의 자금 거래 내역
<당분기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 기 초 | 대 여 | 회 수 | 기 말 |
| 단기대여금 | 임직원 |
- |
5,000,000 |
(5,000,000) |
- |
| 장기대여금 | 임직원 |
82,650,000 |
- |
(52,200,000) |
30,450,000 |
| 합 계 |
82,650,000 |
5,000,000 |
(57,200,000) |
30,450,000 |
|
<전기>
| (단위: 원) | |||||
|---|---|---|---|---|---|
| 구 분 | 특수관계자명 | 기 초 | 대 여 | 회 수 | 기 말 |
| 단기대여금 | 임직원 |
88,000,000 |
211,000,000 |
(299,000,000) |
- |
| 장기대여금 | 임직원 |
235,650,000 |
- |
(153,000,000) |
82,650,000 |
| 합 계 |
323,650,000 |
211,000,000 |
(452,000,000) |
82,650,000 |
|
마. 특수관계자와의 자금차입 거래 내역
보고서 작성기준일 현재 특수관계자와의 자금차입거래 내역은 없습니다.
X. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시내용 진행 및 변경사항
보고서 작성기준일 현재 해당사항이 없습니다.
2. 우발부채 등에 관한 사항
가. 견질 또는 담보용 어음ㆍ수표 현황
| (기준일 : 본 공시서류 제출일 현재) | (단위 : 매, 백만원) |
| 제 출 처 | 매 수 | 금 액 | 비 고 |
|---|---|---|---|
| 은 행 | - | - | - |
| 금융기관(은행제외) | - | - | - |
| 법 인 | - | - | - |
| 기타(개인) | - | - | - |
나. 신용보강 제공 현황
보고서 작성기준일 현재 해당사항이 없습니다.
다. 장래매출채권 유동화 현황
보고서 작성기준일 현재 해당사항이 없습니다.
라. 계류중인 소송사건
보고서 작성기준일 현재 계류 중인 소송사건 없습니다.
마. 담보제공된 어음 및 수표
보고서 작성기준일 현재 담보로 제공된 어음 및 수표는 존재하지 아니합니다.
바. 금융기관과의 약정사항
보고서 작성기준일 현재 금융기관과의 약정사항은 다음과 같습니다.
| (단위: 원) | |||
|---|---|---|---|
| 금융기관 | 약정사항 | 약정한도금액 | 실행금액 |
| 하나은행 | 무역자금 | USD 1,000,000 | USD 111,990 |
| 하나은행 | 상업어음할인 | 500,000,000 | - |
| IBK기업은행 | 무역자금 | USD 1,000,000 | - |
| IBK기업은행 | 상업어음할인 | 1,000,000,000 | - |
| IBK기업은행 | 시설자금 | 3,000,000,000 | 3,000,000,000 |
| IBK기업은행 | 운영자금 | 1,500,000,000 | 1,500,000,000 |
| KDB산업은행 | 운영자금 | 1,600,000,000 | 1,600,000,000 |
| KDB산업은행 | 시설자금 | 4,100,000,000 | 4,100,000,000 |
| KDB산업은행 | 운영자금 | 2,000,000,000 | 2,000,000,000 |
| 서울보증보험 | 이행보증등 | 79,890,000 | 79,890,000 |
| 현대해상화재보험 | 임상실험 보상보험 | 1,000,000,000 | - |
사. 배서금액
보고서 작성기준일 현재 매출채권 중 타인에게 배서하여 만기가 미도래한 금액은 없습니다.
아. 담보제공자산
보고서 작성기준일 현재 장ㆍ단기차입금 등과 관련하여 담보로 제공된 자산의 내역은 다음과 같습니다.
| (단위: 원) | ||||
|---|---|---|---|---|
| 담보권자 | 담보제공자산 | 장부금액 | 담보설정금액 | 관련 차입금 장부금액 |
| IBK기업은행 | 토지(제천) | 610,907,280 | 6,000,000,000 | 4,500,000,000 |
| 건물 | 4,412,377,160 | |||
| 구축물 | 220,135,316 | |||
| 기계장치 | 2,710,278,642 | |||
| 화재보험부보금액 | - | 6,415,000,000 | ||
| KDB산업은행 | 토지(오송) | 5,638,322,679 | 7,320,000,000 | 5,758,260,000 |
| KDB산업은행 | 단기금융상품 | 1,685,000,000 | 1,920,000,000 | 1,600,000,000 |
| 하나은행 | 단기금융상품 | 2,500,000,000 | 2,500,000,000 | - |
| 한국증권금융 | 단기금융상품 | 117,600,000 | 117,600,000 | - |
| 합 계 | 17,894,621,077 | 24,272,600,000 | 11,858,260,000 | |
3. 제재 등과 관련된 사항
가. 중소기업기준 검토표
 |
|
중소기업기준검토표_1 |
 |
|
중소기업기준검토표_2 |
나. 단기매매차익 미환수 현황
보고서 작성기준일 현재 단기매매차익 미환수 내용은 없습니다.
4. 작성기준일 이후 발생한 주요사항 등 기타사항
가. 외국지주회사의 자회사 현황
| (기준일 : ) | (단위 : 백만원) |
| 구 분 | A지주회사 | B법인 | 연결조정 | 연결 후 금액 |
|---|---|---|---|---|
| 매출액 | - | - | ( - ) | - |
| 내부 매출액 | ( - ) | ( - ) | - | - |
| 순 매출액 | - | - | - | - |
| 영업손익 | - | - | ( - ) | - |
| 계속사업손익 | - | - | ( - ) | - |
| 당기순손익 | - | - | ( - ) | - |
| 자산총액 | - | - | ( - ) | - |
| 현금및현금성자산 | - | - | - | |
| 유동자산 | - | - | - | - |
| 단기금융상품 | - | - | - | - |
| 부채총액 | - | - | ( - ) | - |
| 자기자본 | - | - | ( - ) | - |
| 자본금 | - | - | ( - ) | - |
| 감사인 | - | - | - | - |
| 감사ㆍ검토 의견 | - | - | - | - |
| 비 고 | - | - | - | - |
나. 합병등 전후의 재무사항 비교표
보고서 작성기준일 현재 해당사항이 없습니다.
다. 보호예수 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 |
|---|---|---|---|---|---|---|
| 우선주 | 299,764 | 2021.03.17 | 2022.03.16 | 12개월 | 모집(전매제한) | 299,764 |
| 우선주 | 79,373 | 2021.03.19 | 2022.03.18 | 12개월 | 모집(전매제한) | 79,373 |
라. 특례상장기업 관리종목 지정유예 현황
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 원) |
| 관리종목 지정요건 | 요건별 회사 현황 | 관리종목 지정유예 여부 |
항목별 지정유예 종료시점 |
|||
|---|---|---|---|---|---|---|
| 항목 | 사업연도 | 금액 | 해당 | 미해당 | ||
| 최근 사업연도말 매출액 30억미만 |
최근 사업연도말 매출액(별도) | 2020년 | 25,818,432,585 | - | ○ | 2022년 12월 31일 |
| 최근 4사업연도 연속 영업손실 발생 | 최근 4사업연도 각 영업손익 (별도) |
2020년 | -19,000,494,086 | - | ○ | - |
| 2019년 | -16,301,097,386 | |||||
| 2018년 | -14,591,277,944 | |||||
| 2017년 | -5,380,429,803 | |||||
| 자기자본 50%이상(10억원 이상에 한함)의 법인세차감전계속사업손실이 최근 3년간 2회 이상 및 최근 사업연도 법인세차감전계속사업손실 발생 | 최근 3사업연도 각 법인세차감전 계속사업손익 (연결) |
2020년 | -19,231,998,028 | - | ○ | 2020년 12월 31일 |
| 2019년 | -16,675,530,590 | |||||
| 2018년 | -14,280,967,611 | |||||
* 당사는 코스닥 기술성장특례 적용 법인으로서 (상장일 : 2018년 2월 21일), 매출액 요건의 경우 신규상장일이 속하는 사업연도 (상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 5개 사업연도, 세전이익 요건의 경우 신규상장일이 속하는 사업연도(상장 후 사업연도말까지 3월 미만인 경우 다음 사업연도)를 포함한 연속하는 3개 사업연도에 대해서는 해당 요건을 적용 받지 않습니다(영업이익 요건은 유예기간 없이 적용 면제)
XI. 상세표
1. 연결대상 종속회사 현황(상세)
| (단위 : 원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| ENZYCHEM LIFESCIENCES USA, INC | 2018.04.03 | 440 Sylvan Ave. Ste. 290, Englewood Cliffs, NJ 07632 |
임상개발/ 라이선스 |
504,962,778 | 기업 의결권의 과반수 소유 (기업회계기준서 1110호) |
부 |
| (주)메쎄나(*) | 2021.04.02 | 충청북도 제천시 바이오밸리로 59 (왕암동) | 의약품 위탁생산/ 신약개발 |
- | 기업 의결권의 과반수 소유 (기업회계기준서 1110호) |
부 |
* (주)메쎄나는 당반기 중 설립 되었습니다.
2. 계열회사 현황(상세)
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 사) |
| 상장여부 | 회사수 | 기업명 | 법인등록번호 |
|---|---|---|---|
| 상장 | - | - | - |
| - | - | ||
| 비상장 | 2 | ENZYCHEM LIFESCIENCES USA, INC | 275-114195 (해외현지기업 고유번호) |
| (주)메쎄나 | 151211-0047491 |
3. 타법인출자 현황(상세)
| (기준일 : | 본 공시서류 제출일 현재 | ) | (단위 : 천원, 주, %) |
| 법인명 | 상장 여부 |
최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
||||||
| 수량 | 금액 | ||||||||||||||
| (주) 로보쓰리(주1) | 비상장 | 2018.04.02 | 단순출자 | 987,480 | 234,000 | 5.00 | 157,716 | -234,000 | -119,237 | -38,479 | - | 0.00 | - | 1,921,241 | -471,741 |
| ENZYCHEM LIFESCIENCES USA, INC.(주2) |
비상장 | 2018.05.02 | 경영참여 | 109,405 | 1,010 | 100.00 | 185,120 | - | 195,034 | - | 1,010 | 100.00 | 380,154 | 504,963 | -122,992 |
| 메드푸드 | 비상장 | 2019.10.10 | 단순출자 | 405,000 | 27,000 | 6.75 | 186,408 | 40,000 | 600,000 | -323,840 | 67,000 | 16.75 | 462,568 | 204,356 | 55,953 |
| (주)메쎄나(주3) | 비상장 | 2021.04.02 | 경영참여 | 900,000 | - | 0.00 | - | 1,800,000 | 900,000 | - | 1,800,000 | 100.00 | 900,000 | - | - |
| 합 계 | 262,010 | - | 529,244 | 1,606,000 | 1,575,797 | -362,319 | 1,868,010 | - | 1,742,722 | 2,630,560 | -538,780 | ||||
주1) 당기 중 소유주식 전량을 매각하였습니다.
주2) 당기 중 증가 금액은 추가 출자금액이 아닌 주식매선택권 부여에 따른 주식보상비용 입니다.
주3) (주)메쎄나는 당반기 중 설립 되었습니다.
4. 원료의약품 부문[상세]
당사의 원료의약품 기술은 세파항생제 합성기술, 비세파 원료합성기술과 MRI & CT조영제 합성기술로 구분할 수 있으며, 이와 관련한 제품은 약 40여종입니다. 이에 대한 기술적인 비교 우위를 분야별 합성기술로 설명하면 다음과 같습니다.
(1) 세파계 항생제 합성기술
당사의 세파 항생제 합성기술은 저온반응에서 건조에 이르기까지 모든 공정을 직접진행하고 있으며, 특히 세프부페라존과 같은 반응이 어려운 제품의 합성법을 개발하였습니다. 당사의 제품은 생산 수율면에서 오리지널보다 평균 5~10% 이상의 고수율을 보이고 있으며, 품질면에서도 오리지널 제품과 동등이상의 품질을 유지하고 있으며, 가격적인면에서도 경쟁력이 있습니다. 또한 세포페라존 등 세파항생제 3개 품목은 2016년 일본 품질인증을 통과하고 수출을 시작하였습니다.
(2) 비세파 원료의약품 합성기술
비세파 원료의약품 합성 기술 측면에서 당사는 최적화된 공정을 통하여 원가 경쟁력이 있는 합성법을 개발하였으며, 이러한 최적화된 공정을 통해 우수한 품질의 제품을 대량으로 생산할 수 있는 시스템을 구축하고 있다는 점에서 경쟁력을 확보하고 있습니다. 또한 수출 주력 품목인 항결핵제는 세계에서 2번째로 제품을 개발하여, 국내 D사에 이어 두 번째의 시장 점유율을 유지하고 있으며, 수출액은 매년 눈에 띄게 성장을 이루어 나가고 있습니다. 이미 품질과 가격 경쟁력을 확보하고 있는 제품인 만큼 진행중인 WHO 품목 등록이 완료되면 전세계 WHO산하의 NGO 단체로의 공급도 기대하고 있습니다. 또한 중국 원료사들의 원료 생산이 환경문제로 인해 이전하거나, 중국 정부로부터 생산 중단하는 기업들이 많아지므로 경쟁사들이 원료 수급에 차질을 빚기도 하지만, 당사는 처음부터 이원화 전략으로 원료를 수급하고, 대량 물량을 발주하면서 완급 조절을 하므로 지금과 같은 수급 조절 방식에 대응이 이루어지고 있다면 상황 변화에 따른 수급문제는 없을 것으로 판단하고 있습니다.
(3) MRI & CT 조영제 합성 기술
조영제는 인체의 질병을 진단하는 진단시약 입니다. 특히 혈관에 직접 투약하기 때문에 품질에 대한 관리가 각별히 요구되는 제품이며, 심지어는 진단 중에 가돌리움 신장 독성으로 인해 사람의 생명도 위험할 수 있는 중요한 원료입니다. 당사는 고순도의 고품질 제품을 생산하는데 필요한 핵심기술을 모두 확보하고 있습니다.
위와 같은 기술의 완성을 통해 당사는 3개 이상의 1st Generic 제품을 개발하고, 전세계 시장에 판매를 위한 EU GMP, 미국 cGMP, 등 품질 시험을 통한 인,허가 및 등록 작업을 진행 중에 있습니다. 당사는 2019년 2월 유럽GMP 인증을 통과하고, Low Risk 군에 속하는 3가지의 제품을 모도 개발하고 상용화 하였습니다. 당사는 해외 글로벌 조영제 전문기업과 독점 공급계약을 체결하고, 미국 등 조영제 발매를 준비하고 있는 글로벌제약사(일본, 유럽, 러시아, 중국등)에 제품의 품질시험을 통과하였습니다.
5. 글로벌 신약개발 부문[상세]
(가) 호중구감소증 치료제
이 분야의 유사제품 또는 경쟁제품은 G-CSF 성분의 주사제이며 항암체료로 인한 호중구감소증 치료의 표준 치료제로(standard of care) 자리 잡고 있습니다.
EC-19과 G-CSF 제제의 비교분석 내용을 정리하면 아래와 같습니다.
| [G-CSF와 EC-18의 차별화점 비교 요약] |
|
구분 |
G-CSF |
EC-18 |
|---|---|---|
|
투여경로 |
주사 |
경구 (저분자) |
|
생산단가 |
높음 |
낮음 |
|
항암화학방사선 치료 적응증 |
사용제한 |
사용가능 |
|
혈액암 (백혈병) 적응증 |
AML 또는 MDS에 사용제한 |
사용가능 |
|
혈소판에 미치는 영향 |
영향없음 |
혈소판 수치 증가 |
|
점막염에 미치는 영향 |
영향없음 |
항점막염 효과 |
|
STAT3에 미치는 영향 |
활성증가 |
활성감소 |
|
종양에 미치는 영향 |
암 진행, 전이 촉진시킴 |
항암, 항전이 효과 |
| * AML: Acute Myeloid Leukemia, MDS: myelodysplastic |
G-CSF는 피하로 주사하는 약물이므로 사용하기 불편하고, 독성의 우려 때문에 항암제가 투여되고 반드시 24시간이 지난 후에야 G-CSF를 투여하는 것도 환자들에게 불편을 초래합니다.
즉, G-CSF 주사를 맞기 위해 퇴원 후 다시 병원을 찾아야 하는 번거로움이 발생하고, Amgen사의 조사에 따르면, 미국의 경우 암환자들이 G-CSF 1회 주사를 위해 병원을 방문하는 데만 평균 103분의 시간을 허비하고 이를 위해 $106의 방문비용이 발생합니다.
그러나 EC-18의 경우 경구로 투여하는 약물이므로 G-CSF에 비해 환자들이 갖는 편익이 매우 큽니다.
G-CSF의 기본적인 부작용은 bone pain (뼈 통증), splenic rupture (비장파열), anaphylaxsis (아나필락시스), 피부발진 등이 보고되고 있으며, Amgen사의 G-CSF제품 (Neulasa®, Neupogen®)의 사용설명서에 경고문구로 표시되어 있습니다.
또한, G-CSF는 사용 가이드라인 상 rescue의 의미를 가지기에 열성 호중구감소증 (febrile neutropenia)에 한정해서 사용하도록 권고 받고 있고 사용설명서에 이를 명시하고 있습니다.
반면, EC-18은 비임상 독성, 1상 임상시험 및 2상 임상시험의 안전성 평가를 통해 위와 같은 심각한 부작용이 없다는 것을 확인할 수 있으며, 작용기전상 혈중 호중구의 유출을 방지하는 역할을 하기에 열성/비열성 호중구감소증에 특별한 제한이 없습니다.
최근 여러 연구결과들로 인해 G-CSF 투여에 의해 암의 성장이 촉진되는 것이 알려지고 있고, 암 치료를 받아야 하는 암환자들이 항암치료 과정에서 성장인자인 G-CSF에 의해 암이 조장된다는 것은 심각한 문제가 되고 있으며, 이는 FDA가 또 다른 성장인자인 erythropoietin을 암환자들에게 사용하지 못하도록 한 것처럼 잠재적인 위험성이 큰 약물입니다.
그러나 EC-18의 경우 종양을 이식한 동물모델에서 종양의 성장을 억제하는 결과를 보였습니다.
G-CSF와 EC-18이 암의 성장에 다르게 작용하는 것은 기전 상으로 STAT3에 대한 두 약물의 작용 양상이 상이하기 때문입니다.
G-CSF는 STAT3의 활성을 통해 호중구의 생산을 촉진하는 역할을 나타내지만, STAT3는 잘 알려진 대로 암의 생성을 촉진하는 인자이며, STAT3 저해제가 항암제로 개발되고 있는 사실은 항암치료를 받는 암환자에겐 매우 불리한 요소라 할 수 있습니다.
반면 EC-18의 주 작용기전은 STAT3의 활성화를 억제하며, 이러한 사실 때문에 EC-18의 비교우위사항을 정리하면 다음과 같습니다.
1) 경구 투여가 가능함 (G-CSF는 주사제임)
2) 혈소판감소증에도 효과가 있음이 연구자 임상에서 밝혀짐
3) 항암치료로 인한 점막염증에도 효과가 있음
4) 암의 진행을 촉진하는 인자인 STAT3를 억제함
5) 방사선요법을 병행하는 암 치료에도 사용가능
6) 제조원가 또는 약가가 상대적으로 낮음
상기 비교우월성을 가진 EC-18은 G-CSF에 반응하지 않는 50% 환자, 방사선 치료환자, 혈액암 환자와 같은 미충족 의학적 수요 부분을 충족시키고, 암억제 효과로 향후 G-CSF 치료제 시장의 상당부분도 대체할 것입니다.
(나) 구강점막염 치료제
구강점막염 치료제로는 2020년 미국 FDA의 승인을 득한 Palifermin이 유일한 의약품으로 자가 조혈모세포 이식 골독성 요법을 받는 악성 혈액암 환자에 국한하여 심각한 구강점막염 발생과 지속 기간을 감소시킬 수 있고 WHO 3급 점막염을 일으킬 것으로 예측되는 환자들의 예방 치료법에 대한 보조적인 치료제로만 쓰이고 있습니다. 따라서, 항암 치료에 수반되는 구강점막염을 치료하기 위하여 다양한 기전의 치료제 연구 개발이 시도되고 있습니다.
EC-18의 우월성은 아래와 같습니다.
1) 항암화학제 및 항암화학-방사선요법으로 인한 구강점막염이 발병한 고형암 환자에 대한 치료제가 없는 상황에서, 비임상연구를 통해 고형암의 치료제 후보 물질로서 검증되었습니다.
2) EC-18이 구강점막염의 발병 원인인 HMGB1(DAMP)의 패턴인식수용인 TLR4의 세포 내 수송을 가속화하여 구강점막염의 치료하는 기전을 밝혔습니다.
3) 고형암에서 많이 사용되는 항암제 5-FU로 유발시킨 구강점막염 동물모델에서 안전성 및 유효성이 검증되었고, 염증유발 사이토카인의 발현 감소 및 염증부위로의 호중구의 이동을 조절하는 이중 작용을 통해 구강점막을 보호하는 작용이 입증되었습니다.
4) EC-18은 다양한 고형암에 적용이 가능하며, 항암화학-방사선 요법 (chemo-radiation therapy)이 1차 치료법인 두경부암 (head and neck cancer)에서 사용 가능하기 때문에 적응증 및 대상 환자면에서 우월성을 가지고 있습니다.
5) 미국 내 25개 병원에서 시행중인 임상1상 시험 안전성 평가를 통해 심각한 부작용이 나타나지 않았음을 확인하였고 임상2상 시험의 Top-Line 결과가 2021년 상반기에 발표될 예정에 있으며 이어서 미국 FDA와의 임상2상 종료 후 혁신신약(BTD, Breakthrough Therapy Designation)으로 제출할 예정에 있습니다.
6) 세균 감염 억제를 목적으로 하는 구강청결제는 환자의 증상에 맞춘 대증요법이고 Palifermin은 예방 치료에 대한 보조적인 치료제인 반면, EC-18은 점막의 염증을 억제하고 호중구의 이동을 감소하여 점막을 유지시키는 기전을 가지고 있어 근본적인 치료가 가능하여 궁극적으로 항암화학-방사선 치료의 효율성을 높일 수 있게 되어 환자의 수명 연장을 기대하는 기술로 평가받고 있습니다.
상기 우월성을 가진 EC-18은 치료제가 없는 고형암의 항암 치료 시 발생하는 구강점막염 치료제 시장에서 독점적 시장 지위를 가지게 될 것입니다.
(다) 급성방사선증후군 치료제
급성방사선증후군은 골수질환, 점막염질환, 심혈관계질환, 신경계질환, 감염에 의한 폐렴 및 패혈증 등이 복합적으로 오는 질환이지만, 현재 급성방사선증후군의 치료제는 조혈 증후군(H-ARS)을 타겟으로 FDA 승인을 받은 치료제들이 있고 호중구감소증, 백혈병과 저혈소판증 치료제로써 약물 재창출된 경우입니다.
급성방사선증후군은 사고에 의해 일어날 가능성이 높다는 질환의 특성상 그 치료제는 현장 사용 (Field use)이 중요합니다.현재 한정적으로 승인된 급성방사선증후군의 조혈 증후군 치료제들은 주사제로서 저온 보관을 해야하므로 현장 사용에 적합하지 않으며, 조혈계 질환에만 국소적인 효력을 가지고 있습니다.
반면, EC-18은 경구 투여가 가능하고 실온에 보관하므로 현장 사용에 적합할 뿐만 아니라, 호중구감소증, 혈소판감소증, 혈액 응고장애, 점막염, 패혈증 및 폐렴등 과량의 방사선 노출에 의한 복합적 질환에 효력을 가지고 있습니다.
그러므로, EC-18은 급성방사선증후군 시장에 우위를 차지할 것 입니다.
또한 미국 유수 연구기관과 공동으로 참여하여 급성방사선증후군 치료제 개발 연구를 진행하고 있습니다. 아울러 최근 미국항공우주국(NASA)의 연구 지원에 선정되어 애리조나주립대학교외 우주비행 환경 내 EC-18의 장 조직 손상 및 염증 방어제 효능을 검증하는 공동연구를 통하여 우주방사선(GCR) 치료제 개발과 같은 적응증 확장을 할 계획입니다.
(라) 비알콜성지방간염 치료제
아직까지 승인된 비알콜성지방간염 치료제는 부재하나 현재 다수의 제약회사가 임상시험 진행 중이며 주요 신약후보물질로는 Intercept 社의 Obeticholic acid(OCA), Madrigal 社의 MGL-3196 및 Viking 社의 VK2809 등이 있으나, 일부 섬유증 완화에 대한 1차 평가변수를 충족시키지 못하며 NASH 신약 개발의 장벽을 넘지 못하는 상황입니다.
| NASH 치료제 임상시험 현황 |
| 개발회사 | 신약후보물질 | 임상단계 | 작용기전 |
|---|---|---|---|
|
Intercept |
OCA |
3상 |
FXR agonist |
|
Madrigal |
MGL-3196 |
3상 |
THRB agonist |
|
Viking |
VK2809 |
2상 |
THRB agonist |
비알콜성지방간질환의 발병 원인은 매우 복잡하며 대표적으로 인슐린 저항성으로 인한 간 내 지방 침착, 과도한 영양섭취 및 유전적 문제 등이 있습니다. 또한, 염증반응이 일어남에 따라 지방의 과산화가 일어나고 이로 인한 산화스트레스가 간 조직 내 섬유화 반응을 촉진시키는데, 이때 염증성 사이토카인인 IL-6와 TNF-α가 증가함으로써 간 조직 내 NFkB의 활성이 증가하여 과도한 염증반응이 일어납니다. 이러한 염증 반응은 간 주변의 과도한 염증반응으로 간의 주변 정상조직까지 손상시키며, 질병이 악화되면서 간경화증으로 진행되며 미리 진단하지 못할 경우 간암으로 악화됩니다. 또한, 간, 지방 조직, 근육, 장 상피 세포 및 순환하는 면역세포에서 발현되는 TLR4가 복합적으로 작용하여 NASH의 발병 및 간의 섬유화를 초래합니다.
이에 따른 EC-18의 작용기전은 NASH 발병에 관여된 간, 지방조직, 근육, 장 상피 세포 및 순환하는 면역 세포를 대상으로 발현된 TLR4의 세포내 재순환을 촉진하여 NASH의 악화 및 간의 섬유화를 개선합니다. 당사가 진행한 High-Fat High-Fructose (HFHF) 동물 모델 비임상시험에서 EC-18은 체내 혈당 수치와 인슐린 수치를 낮춤으로서 인슐린 표적 조직의 인슐린 저항성을 감소시킨 것을 입증했습니다. 따라서
EC-18의 First-in-class 작용기전은 체내 모든 조직에서 염증 면역 반응의 기간을 단축하여 더 이상 간의 조직 손상을 방지하고, 정상 면역 시스템을 유지하는 기능을 가져 당사가 개발한 EC-18이 혁신적인 NASH 치료제가 될 것으로 기대되고 있습니다.
비알콜성지방간염의 발병기전은 매우 복잡하기 때문에, 전략적인 병용 치료제 요법이 개발이 최우선이 될 수 있습니다. EC-18의 작용기전은 NASH 발병기전에 영향을 끼치는 유형인식수용체 (예, TLR4)의 경로를 표적으로 하여 과도한 염증 반응을 해소합니다. 현재 진행중인 임상시험에서 약물 후보자의 표적이 다양한 만큼 NASH의 발병 기전의 복잡함을 뜻합니다. 따라서 단일 치료제 뿐만 아니라 기전적으로 다른 경쟁사와 병용 치료제 요법 개발의 가능성이 높습니다. 우수한 안정성 프로필 및 생체 내 효능이 인정되고 있는 EC-18의 고유한 작용기전은 현재 임상 진행중인 다른 신약후보물질과 함께 사용하여 NASH의 치료 효력을 향상시킬 것입니다.
(마) 면역항암제 병용 치료제
면역항암제 단독 요법으로는 반응률과 무진행 생존율이 항암 화학 요법에 비해 높지 않고 병용요법이 항암 화학 요법보다 독성이 더 강하지 않기 때문에 암 치료제 개발 방향이 면역항암제 단독 요법에서 병용요법 중심으로 변화하고 있습니다. 최근 들어, 면역관문억제제 치료를 하고 난 뒤 획득된 면역관문억제제 치료에 대한 저항을 야기시키는 면역억제성 종양 미세환경 (tumor microenvironment, TME)을 타겟하는 후보 물질과 면역관문억제제와의 병용 치료 가능성에 대한 임상연구가 활발하게 진행되고 있습니다. 특히, 면역억제 메커니즘 중 세포외 아데노신 (extracellular adenosine, eADO)의 농도가 주요 요인으로 알려지면서 면역관문억제제와 eADO를 타겟한 면역 항암 치료법 개발이 주목 받고 있습니다.
방광암과 폐암 마우스 모델을 이용한 PD-L1(방광암)과 PD-1(폐암) 면역항암제와의 병용 치료 관련 전임상 연구 및 암세포주와 면역세포주를 이용한 검증 연구를 통해 확인된 EC-18 효능은 아래와 같습니다.
1) 면역억제성 종양 미세환경을 유발하는 주요 원인인 세포외 아데노신의 제거를 통해 면역관문억제제와의 병용 치료에 대한 시너지 효과를 보입니다.
2) 면역관문억제제와의 병용 치료뿐만아니라 단독 치료만으로 암 성장 억제 효과를 보입니다.
사멸하는 종양세포에서 분비되는 손상 관련 물질 패턴 (Damage-Associated Molecular Patterns, DAMPs)을 신속하게 제거합니다.
3) 종양 조직에서 분비되는 사이토카인/케모카인의 생성을 낮추어 종양면역환경 내 호중구 침윤을 억제합니다.
4) 암 성장에서 암 억제로의 종양 면역환경 밸런스를 유도하여 세포 독성 T 림프구의 항암 활성을 촉진시킵니다.
유방암과 폐암 이종이식(xenograft) 마우스 모델을 이용한 비임상 연구를 통해
EC-18과 세포독성항암제와의 병용 치료에 대한 시너지 항암 효과를 확인하였고 방광암 동종 이식 햄스터 모델을 이용하여 뇌와 장 조직으로의 원발암 전이율이 감소하는 것을 확인하였습니다.
따라서 상기 우월성을 가진 EC-18은 면역항암제와의 병용 치료 효과가 기대됨과 동시에 면역항암제 부작용을 개선할 수 있으며 면역항암제와 세포독성항암제와의 다중 병용 치료에도 효과를 기대할 수 있는 독보적인 가능성을 보유하고 있습니다.
(바) 류마티스관절염 치료제
현재 시판되고 있는 관절염 치료제 매출의 대부분 (약 94%)는 생물할적 제제인 Humira®, Enbrel®, Remicade®, Actemra®, Simponi®, Orencia®, Cimzia® 이 차지하고 있는데, 이들 모두가 주사제로 투여하나, EC-18은 경구투여 약물이라서 환자 편의성이 매우 큽니다.
류마티스관절염 치료제 시장의 주류를 이루고 있는 TNF-α저해제는 주사제라는 불편한 점 외에도 감염의 위험과 결핵, 종양 발생의 우려가 있고, TNF-α저해제는 염증의 원인이 되는 사이토카인을 직접 억제하거나 항염증 작용을 나타내는 사이토카인의 활성을 높이는 역할을 합니다.
JAK 표적저해제는 Janus Kinase라는 단백질에 작용함으로서 염증성 사이토카인을 조절하는 작용기전을 가지는데 TNF-α저해제의 복용상의 불편함과 부작용을 개선하여 시장의 needs를 충족시키고자 개발되었고, 임상시험 결과에서 장점이 많은 것으로 결론이 났으며, 최종적으로 2015년 미국 류마티스 학회에서 JAK 표적자해제인 Xeljanz® (성분명 tofacitinib)을 치료 가이드라인에 포함시켰습니다.
EC-18의 경우는 JAK 표적저해제와의 직접 동물효능비교 시험에서 JAK 표적저해제를 뛰어넘는 효과를 보이고 있습니다. 이는 임상에서 재현될 가능성이 크기에 우월성을 기대하고 있습니다.
EC-18의 경쟁제품대비 우월성은 아래와 같습니다.
1) Actemra®의 경우 주사제이며, 직접적인 IL-6 저해제가 아니라고 IL-6 수용체를 저해하는 기전이기에 혈증 IL-6 level을 떨어뜨리는 EC-18에 비해 선택성이 떨어지고, JAK 표적저해제 중 tofacitinib의 경우, JAK1, JAK3를 타겟으로 하는 화합물이기에 IL-6 저해를 하는데 있어서 선택적이지 않고, baricitinib의 경우 JAK1, JAK2를 타겟으로 하기에 IL-6 선택적이라고 할 수 있으나, 최근 3상 임상시험 종료 후 시판 허가 과정에서 FDA로부터 안전성 자료 미흡에 대한 보완의견을 받아 최종허가까지는 상당한 시일이 소요될 것으로 보고 있습니다.
2) EC-18은 JAK 표적저해제와 유사하게 IL-6를 타겟으로 하면서 JAK 표적저해제 보다 우수한 효력을 비임상에서 나타냈기에 확실한 경쟁 우위 요소를 가집니다.
(사) 건선치료제
초기 건선 치료제인 스테로이드의 경우 항염, 진통, 가려움증의 억제 등 건선에 의해 야기되는 다양한 증상의 개선에 효과적이나, 약물 특유의 부작용으로 인해 장기간 사용하기는 적합하지 못한 약물로 알려져 있습니다.
또한 면역 조절을 목적으로 투여하는 면역억제제 또한 장기 사용 시 전신면역 시스템의 약화로 다양한 감염에 노출되는 위험이 높아 사용하기 어려운 단점을 가지고 있습니다.
염증유발 사이토카인 표적 의약품의 경우 처음 관절염 치료제 표적으로도 잘 알려진 TNF-α표적 단클론 항체인 Humira®, Enbrel®이 주로 사용되다가 최근 IL-17 표적 단클론 항체 Taltz®, IL-4 수용체 표적 Dupixent®가 출시되어 건선의 병리학적 기전에 보다 가까운 표적 중심으로 시장이 확대되고 있습니다.
이들 생물학적 제제는 대부분 단일 표적 중심의 단클론 항체로서 주사제로만 사용이 가능하고, 생산단가가 높아 환자의 편의성 및 경제성 측면에서 불리한 요소로 작용되고 있습니다.
또한 TNF-a 표적 단클론 항체의 경우 신호기전 상 downstream에 위치하여 인체유지에 필요한 필수 면역 신호를 차단할 가능성이 높아 다양한 부작용이 우려되어 사용상 주의가 필요한 약물입니다.
EC-18은 건선 유발 동물모델로부터 건선에 특화된 IL-8, IL-7 및 IL-22의 신호를 효과적으로 제어하며, 또한 건선으로 야기된 염증 부위에 호중구의 과도한 집중을 억제하여 질환의 진행에 따른 염증을 효과적으로 조절할 수 있습니다.
이와 같이 건선치료제로 사용 중인 경쟁약물과는 다르게 이중 작용을 통해 건선을 치료 하는 개념은 EC-18이 최초이며, 따라서 First-in-Class 치료제로 개발 성공 가능성이 매우 높다고 판단하고 있습니다.
EC-18은 1상 임상시험 및 췌장암 환자를 대상으로 진행된 파일럿 임상시험을 통해 안전성과 유효성이 입증된 약물입니다.
또한 경구용 약물로 가격이 저렴하고 환자의 복용편이성이 높아 고가 주사제인 Taltz®등 생물학적 제제의 혜택을 보지 못하는 대다수 환자에 접근이 가능하므로 EC-18은 건선 치료제 분야에 높은 점유율을 가질 것으로 확신하고 있습니다.
염증유발 사이토카인 표적 단클론 항체 대비 우위사항은 아래와 같습니다.
건선 (psoriasis)의 경우 시장에 출시된 상당수의 약물이 초기 스테로이드 (corticosteroid) 혹은 면역억제제 (methotrezate, cyclosporin) 등이 사용되다가 최근 생물학적 제제인 염증유발 사이토카인 표적 단클론 항체가 소개되고 있습니다.
스테로이드 및 면역억제제의 경우 장기간 사용 시 부작용이 심하여 만성 질환인 건선에 대해 효과적인 치료가 어렵게 되고, 생물학적 제제의 경우 고가의 주사제로만 사용가능하며 국내의 경우 3차 이상 대학병원에서만 처방 및 시술이 이루어지고 있어 소수의 환자를 제외하고 대다수의 환자는 혜택을 보기가 어려운 상황입니다.
EC-18은 경구용 약물로 가격이 저렴하고 환자의 복용편이성이 높아 생물학적 제제의 혜택을 보지 못하는 대다수 환자에 대한 접근이 가능하여 대형병원은 물로 로컬의원에서도 적절한 처방 및 치료가 가능합니다. 또한 EC-18은 합성신약으로 생물학적 제제에 비해 가격적인 이점을 가지고 있습니다.
(아) 패혈증 치료제
FDA의 승인을 받은 유일한 치료제인 Xigris®는 FDA로부터 조건부 승인을 받고 실시한 후속 임상시험에서 효력을 입증하는데 실패하였고, 출혈 부작용이 심각하였기에 2011년 시장에서 퇴출되었습니다.
Xigris®의 패혈증 동물실험 모델에서의 생존율은 5일째 40%임에 불과하고, 임상 3상에서 중단된 Takeda의 TAK-242의 경우 생존율이 약 20%인 것에 비해 EC-18의 경우는 10일째까지의 생존율이 85~90%에 달해 EC-18의 효능이 월등하였습니다.
|
현재까지 발표된 어떤 패혈증 치료제도 생존율을 80~90%까지 높인 결과를 보인 적은 없었기에 아래 EC-18의 생존율 data는 (85~90%) 향후 패혈증치료제로의 개발과정에서 매우 긍정적인 영향을 미칠 것입니다.
|
그밖에 현재 패혈증의 마지막 단계인 septic shock을 막기 위해 사용하고 있는 항생제나 항염스테로이드는 질환 유발의 중심인 cytokine storm을 억제하는 기전이 아니며, 스테로이드는 오히려 면역력을 떨어뜨리는 부작용 때문에 치료제로 적합하지 않으나, EC-18은 cytokine storm의 원인이 되는 IL-6 level을 정상수준에 가깝게 감소시기에 septic shock을 막을 수 있습니다.
기존에 개발되었던 치료제 (Xigris®) 및 현재 개발 중인 치료제와 비교했을 때, 동물 모델 실험결과 생존율 측면세서 EC-18이 월등하게 유리하기에 기술격차가 매우 크다고 할 수 있습니다.
EC-18의 경쟁제품 대비 우월성은 다음과 같습니다.
1) 현재까지 타 기관에서 발표된 패혈증 동물모델에서의 생존율은 최고 60% 정도 이고 FDA의 허가를 받은 유일한 치료제인 Xigris®도 5일째 생존율이 40%에 불과했지만 EC-18의 경우 생존율이 10일째 까지의 생존율이 85~90%에 달하였습니다.
이러한 생존율 확인 효능시험은 반복시험을 수행하여 확인된 바가 있고 다른 여러 효력시험 결과와 마찬가지로 논문으로 출간되었습니다.
2) 치료 효력을 나타내는 기전 면에서도 EC-18은 패혈증의 근본적인 원인읻 되는
cytokine storm을 막을 수 있는 근거를 가지고 있고, 염증유발 사이토카인인 IL-6를 투여 후 약 16시간 이후부터는 효과적으로 낮추어 지는 것이 관찰되었습니다.
(자) 천식치료제
현재 개발 중이거나 최근에 승인 받은 치료제들은 대부분 생물학적 제제라서 주사제인 것에 반해 EC-18은 경구용이라 환자들에게 편의성이 큽니다.
천식 치료의 대표적인 병용요법 중 하나는 흡입 스테로이드 제제와 흡입 기관지 확장제 이며, 이때의 흡입 스테로이드 제제는 효과는 우수하나 장기간 사용 시 국소적 부작용 뿐 아니라 전신부작용이 발생할 수 있기에 1일 사용량을 엄격히 제한하고 있으나, 스테로이드 사용 용량이 증가함에 따라 천식증상의 악화가 개선되는 상관성을 보이기에 부작용이 있음에도 사용할 수 밖에 없는 상황입니다.
최근 개발된 IL-5 억제 항체 치료제 Nucala®는 주사제로만 사용이 가능하고, 생산단가가 높아 환자의 편의성 및 경제성 측면에서 불리한 요소로 작용되고 있습니다.
EC-18의 항염증작용은 스테로이드와는 다르게 proinflammatory cytokine인 IL-6를 낮추는 작용기전하에 작동하면서 급성염증을 resolution하는 작용기전을 가지기에 스테로이드의 부작용을 나타내지 않습니다.
천식은 적절한 치료제를 사용하지 않으면 호흡곤란 등으로 사망할 수 있기에, 개발된 치료제가 부작용이 심하다고 하더라도 효용가치가 있으면 허가를 받을 수 있는 상황이나 EC-18은 benefit/risk 평가에서 매우 유리한 위치를 차지하고 있습니다.
1) 흡입스테로이드는 천식의 증상 및 주요 원인인 염증을 감소시키는 질병조절제로서 효과가 있으나 국소 및 전신 부작용이 있으며, EC-18은 항염증 작용은 우수하면서 위의 스테로이드 부작용은 관찰되지 않아서 장기적으로 사용했을 때도 안전성을 확보할 수 있어서 기도부위의 만성적인 염증을 감소시킴으로서 천식의 근본치료를 가능하게 할 가능성이 있습니다.
2) 천식의 원인이 되는 주요 염증세포는 호산구 (eosinophil)로 알려져 있으며, EC-18은 이러한 호산구의 이동에 관여하는 케모카인인 CCL26을 낮추는 것이 기전 상으로 확인되었기에 보다 정교한 질병의 치료가 가능합니다.
3) 흡입스테로이드는 미량을 사용해도 효력이 발생하는 장점이 있지만, 장기적으로 사용했을 때 국소적 부작용과 더불어 전신적인 부작용이 크며, 중증천식에는 효과가 없을 가능성이 큽니다.
반면 EC-18은 천식원인 염증세포인 호산구의 이동을 나타낼수 있는 바이오마커인 CCL26의 level을 조절하기에 이 부분에서 차별성이 부각될 수 있습니다.
(차) 아토피 피부염 치료제
아토피 피부염의 경우 시장에 출시된 상당수의 약물이 초기 스테로이드 (corticosteroid) 혹은 면역억제제 (methotrexate, cyclosporin) 등이 사용되다가, 아토피피부염의 주요 원인 사이토카인인 IL-4 또는 IL-13으로 밝혀져, 최근 생물학적 제제인 IL-4 수용체 표적 단클론 항체 Dupixent®가 소개되고 있습니다.
Dupilumab의 경우 moderate severe한 아토피 피부염 환자를 대상으로 3상 임상시험을 진행하여 가려움증에서의 효력을 확인했으며, EC-18의 경우도 IL-4를 효과적으로 낮추고 아토피 피부염과 직접적 연관이 있는 IgE를 낮추므로 항체와 동등하거나 우수한 효과를 얻을 수 있습니다.
추가적으로 EC-18은 경구투여의 장점을 가지며, 항체와는 달리 비교적 낮은 생산단가로 약물의 공급이 가능하기에 중등도 또는 중증의 아토피 피부염 환자에서 임상시험에 성공할 경우 항체신약보다 더 주목받을 가능성이 큽니다.
또한, 현재 사용되고 있는 국소 스테로이드제제 및 면역억제제와 비교하여 EC-18은 장기사용에도 안정하게 사용 가능하므로, 충분한 경쟁력을 가지고 있습니다.
1) 스테로이드 및 면역억제제의 경우 장기간 사용시 부작용이 심하여 만성 질환인 아토피 피부염에 대해 근본치료가 어렵고, 항체 치료제의 Dupixent®의 경우 고가주사제로 대학병원급 이상만 치료가 가능하여 소수의 환자만 적용 가능합니다.
2) EC-18은 경구제로 가격이 저렴하고 접근성이 높아 생물학적 제제의 혜택을 보지 못하는 대다수 환자에 대한 접근이 가능하여 다양한 의료기관에서 처방 및 치료가 가능합니다. 또한 EC-18은 저분자 합성신약으로 비용면에서 항체치료제 대비하여 높은 점유율을 가질수 있을거라 예상합니다.
(카) COVID-19 치료제
현재, 효과적인 치료제가 개발되지 않은 상태에서 Remdesivir, Baricitinib이 FDA에서 치료제로 허가된 유일한 약제들입니다. 하지만, Remdesivir는 SOLIDARITY 임상시험 결과에 따르면 사망률 및 치료 기간 단축 등 주요한 임상 결과를 개선하지 못했다고 밝혔습니다. 게다가 코로나바이러스의 특성상 잦은 변이종의 출현은 COVID-19의 치료에 큰 걸림돌이 되고 있으며 또다른 신종 바이러스의 출현 또한 향후 큰 문제가 될 것으로 예측되고 있습니다.
비임상연구를 통해 EC-18은 COVID-19 바이럿의 사멸 효과와 더불어 COVID-19 바이러스에 의한 폐 감염을 신속히 해결하여 중증환자에게서 특징적으로 나타나는 면역세포의 과도한 반응 및 염증매개 사이토카인의 과다분비, 즉 '사이토카인 폭풍'을 예방, 제거하는 치료제로서 기전을 규명하였으며 2020년 5월 한국 식품의약품안전처로부터 임상2상 시험을 승인 받아 진행중에 있습니다. 또한 2020년 8월 미국
FDA로부터 임상2상 시험을 승인 받아 활발한 임상시험을 진행하고 있습니다. 한국 임상2상 시험은 2021년 3월에, 미국 임상2상 시험은 2021년 2분기에 완료될 예정이며 각각 긴급사용 승인 (EUA, Emergency Use Authorization) 또는 조건부허가 승인을 제출할 예정에 있으며 한국 임상2상 시험 결과는 3월 말 기준으로 데이터베이스 잠금(Database lock, DBL) 상태입니다.
EC-18의 경쟁제품 대비 우월성은 다음과 같습니다.
1) 치료제로서 EC-18은 바이러스에 의한 폐렴을 신속히 치료 및 종결하는 기전이기 때문에 바이럿의 변이 또는 신종바이러스의 출현과 관계없이 사용 가능한 장점을 가지고 있습니다.
2) 중증 COVID-19의 경우, 심각한 후유증 또는 사망을 초래하며 경제적, 사회적 비용 또한 매우 크기 때문에 EC-18의 적용 대상 환자인 경증 및 중등증 환자가 중증으로 이행되는 것을 예방하는 전략은 환자 개인은 물론 보건 사회적 관점에서도 매우 유리한 측면이 될 것입니다.
6. 지적재산권 보유현황[상세]
(2) 산업재산권 현황 상세
(가) 글로벌 신약 등록 특허
|
No. |
국가 |
특허 권자 (출원인) |
출원번호 (출원일) |
등록번호 등록일 |
발명의 명칭 |
법적 상태 |
|---|---|---|---|---|---|---|
|
1 |
KR |
엔지켐 생명과학 |
10-2005-0023569 2005.03.22 |
0754888 2007.08.28 |
글리세롤 유도체의 위치 선택적인 제조 방법 및 그 중간체 |
등록 |
|
2 |
KR |
엔지켐 생명과학 |
10-2005-0065792 2005.07.20 |
0789323 2007.12.20 |
글리세롤 유도체의 위치 선택적 제조 방법 및 그 중간체 |
등록 |
|
3 |
FR |
06783328.5 2006.07.18 |
1907345 2009.10.21 |
|||
|
4 |
EP |
06783328.5 2008.01.15 |
1 907 345 B1 2009.10.21 |
|||
|
5 |
DE |
06783328.5 2006.07.18 |
1907345 2009.10.21 |
|||
|
6 |
CH |
06783328.5 2006.07.18 |
1907345 2009.10.21 |
|||
|
7 |
GB |
06783328.5 2006.07.18 |
1907345 2009.10.21 |
|||
|
8 |
ES |
06783328.5 2006.07.18 |
1907345 2009.10.21 |
|||
|
9 |
IT |
06783328.5 2006.07.18 |
1907345 2009.10.21 |
|||
|
10 |
RU |
2008106478 2008.02.19 |
2392264 2010.06.20 |
|||
|
11 |
US |
11/989,074 2008.01.18 |
7868196 2011.01.11 |
|||
|
12 |
CA |
2615519 2008.01.15 |
2615519 2011.03.15 |
|||
|
13 |
JP |
2008-522697 2008.01.18 |
4717117 2011.04.08 |
|||
|
14 |
CN |
2680026155.6 2008.01.17 |
ZL200680026155.6 2011.05.25 |
|||
|
15 |
IN |
383/DELNP/2008 2008.01.14 |
251684 2012.03.28 |
|||
|
16 |
CA |
엔지켐 생명과학 |
2849289 2014.03.19 |
2849289 2016.05.10 |
1-팔미토일-3-아세틸글리세롤의 제조방법 및 이를 이용한 1-팔미토일-2-리놀레오일-3-아세틸글리세롤의 제조방법 |
등록 |
|
17 |
KR |
10-2011-0096341 2011.09.23 |
1278874 2013.06.20 |
|||
|
18 |
CN |
201280046277.7 2014.03.21 |
ZL201280046277.7 2015.09.16 |
|||
|
19 |
JP |
2014-531727 2014.03.20 |
5799171 2015.08.28 |
|||
|
20 |
RU |
2014116232 2014.04.22 |
2566826 2015.10.01 |
|||
|
21 |
AU |
2012310342 2014.03.17 |
2012310342 2016.03.10 |
|||
|
22 |
EP |
12 834 214.4 2014.03.27 |
2 759 529 B1 2016.12.21 |
|||
|
23 |
CH |
12 834 214.4 2014.03.27 |
2 759 529 B1 2017.01.20 |
|||
|
24 |
GB |
12 834 214.4 2014.03.27 |
2 759 529 B1 2017.01.04 |
|||
|
25 |
FR |
12 834 214.4 2014.03.27 |
2 759 529 B1 2017.03.06 |
|||
|
26 |
ES |
12 834 214.4 2014.03.27 |
2 759 529 B1 2017.03.17 |
|||
|
27 |
DE |
60 2012 026 948.0 2014.03.27 |
2 759 529 B1 2017.09.21 |
|||
|
28 |
IT |
502017000013791 2014.03.27 |
2 759 529 B1 2017.02.18 |
|||
|
29 |
US |
14/958,734 2015.12.03 |
9,701,613 B2 2017.07.11 |
|||
|
30 |
IN |
2166/DELNP/2014 2014.03.21 |
307644 2019.02.19 |
|||
| 31 | KR | 엔지켐 생명과학 |
10-2006-0102032 2006.10.19 |
0885679 2009.02.19 |
모노아세틸디아실그리세롤류 화합물을 유효성분으로 함유하는 건강식품 | 등록 |
| 32 |
KR |
엔지켐 생명과학 |
10-2005-0033744 2005.04.22 |
0767701 2007.10.10 |
모노아세틸디아실글리세롤류 화합물을 유효성분으로 함유하는 면역조절제 및 항암제 (청구항: 패혈증 포함) |
등록 |
| 33 |
RU |
2006141418 2006.11.23 |
2341257 2008.12.20 |
|||
| 34 |
US |
11/587,377 2006.10.24 |
7662853 2010.02.16 |
|||
| 35 |
CN |
200580012914.9 2006.10.24 |
ZL200580012914.9 2010.12.29 |
|||
| 36 |
CA |
2,562,897 2006.10.17 |
2562897 2011.03.15 |
|||
| 37 |
JP |
2007-59400 2006.10.23 |
4892473 2011.12.22 |
|||
| 38 |
EP |
05764571.3 2006.10.18 |
1740169 2012.09.05 |
|||
| 39 |
CH |
05764571.3 2005.04.22 |
EP 1 740 169 2012.09.05 |
|||
| 40 |
DE |
60 2005 036 008.5 2005.04.22 |
1 740 169 2012.09.05 |
|||
| 41 |
FR |
05764571.3 2012.11.12 |
EP 1 740 169 2012.09.05 |
|||
| 42 |
GB |
05764571.3 2005.04.22 |
1 740 169 2012.09.05 |
|||
| 43 |
KR |
엔지켐 생명과학 |
10-2014-0107714 2014.08.19 |
1621863 2016.05.11 |
모노아세틸디아실글리세롤 화합물을 유효성분으로 함유하는 만성폐쇄성 폐질환의 예방 또는 치료용 조성물 |
등록 |
| 44 |
AU |
2014309569 2016.02.23 |
2014309569 2017.07.13 |
|||
| 45 |
JP |
2016-536024 2016.02.18 |
6151454 2017.06.02 |
|||
| 46 |
CA |
2921849 2016.02.18 |
2921849 2017.10.06 |
|||
| 47 |
RU |
2016109968 2016.03.18 |
2642631 2018.01.25. |
|||
| 48 |
CN |
201480053789.5 2016.03.29 |
ZL201480053789.5 2019.04.09 |
|||
| 49 | GB |
14838604.8 2016.03.09 |
3037093 2020.01.01 |
|||
| 50 | FR |
14838604.8 2016.03.09 |
3037093 2020.01.01 |
|||
| 51 | DE |
60 2014 059 451.4 2016.03.09 |
3037093 2020.01.01 |
|||
| 52 | IT |
14838604.8 2016.03.09 |
3037093 2020.01.01 |
|||
| 53 | ES |
14838604.8 2016.03.09 |
3037093 2020.01.01 |
|||
| 54 | IN |
201617009055 2016.03.15 |
328457 2019.12.30 |
|||
| 55 | US |
15/857,933 2017.12.29 |
10765655 2020.09.08 |
|||
| 56 |
KR |
엔지켐 생명과학 |
10-2014-0107233 2014.08.18 |
1621851 2016.05.11 |
모노아세틸디아실글리세롤 화합물을 유효성분으로 함유하는 혈액암 또는 암전이 억제용 조성물 |
등록 |
| 57 |
AU |
2014309635 2016.02.23 |
2014309635 2017.07.20 |
|||
| 58 |
RU |
2016109986 2016.04.01 |
2632098 2017.10.02 |
|||
| 59 |
JP |
2016-536021 2016.03.02 |
6201054 2017.09.01 |
|||
| 60 |
CA |
2921841 2016.02.18 |
2921841 2018.06.19 |
|||
| 61 |
US |
14/912,916 2016.02.18 |
10058527 2018.08.28 |
|||
| 62 |
CN |
201480055291.2 2016.04.07 |
ZL201480055291.2 2019.06.21 |
|||
| 63 | GB |
14 838 256.7 2016.03.24 |
3037092 2020.01.01 |
|||
| 64 | FR |
14 838 256.7 2016.03.24 |
3037092 2020.01.01 |
|||
| 65 | DE |
60 2014 059 449.2 2016.03.24 |
3037092 2020.01.01 |
|||
| 66 | IT |
14 838 256.7 2016.03.24 |
3037092 2020.01.01 |
|||
| 67 | ES |
14 838 256.7 2016.03.24 |
3037092 2020.01.01 |
|||
| 68 | US CON |
16/045,617 2018.07.24 |
10,857,119 2020.12.08 |
|||
| 69 |
US |
엔지켐 생명과학 |
14/912,920 2016.02.18 |
10098864 2018.10.16 |
모노아세틸디아실글리세롤 화합물을 유효성분으로 함유하는 천식의 예방 또는 치료용 조성물 |
등록 |
| 70 |
JP |
2016-536025 2016.02.19 |
6081025 2017.01.27 |
|||
| 71 |
AU |
2014309570 2016.02.23 |
2014309570 2017.08.03 |
|||
| 72 |
KR |
20140107681 2014.08.19 |
1761285 2017.07.19 |
|||
| 73 |
RU |
2016109969 2016.03.18 |
2636615 2017.11.24 |
|||
| 74 |
CA |
2921764 2016.02.18 |
2921764 2017.12.05 |
|||
| 75 | IN | 201627009227 2016.03.16 |
366981 2021.05.19 |
|||
| 76 |
KR |
엔지켐 생명과학 |
10-2014-0107255 2014.08.18 |
1621856 2016.05.11 |
모노아세틸디아실글리세롤류 화합물을 유효성분으로 함유하는 류마티스관절염의 예방 또는 치료용 조성물 |
등록 |
| 77 |
JP |
2016-536022 2016.02.19 |
6081024 2017.01.27 |
|||
| 78 |
AU |
2014309637 2016.02.23 |
2014309637 2017.08.31 |
|||
| 79 |
US |
15/048,732 2016.02.19 |
9,895,337 2018.02.20 |
|||
| 80 |
CA |
2921845 2016.02.18 |
2921845 2018.01.17 |
|||
| 81 |
RU |
2016109975 2016.03.18 |
2646823 2018.03.07 |
|||
| 82 | GB | 14837360.8 2016.03.17 |
3037090 2019.07.31 |
|||
| 83 | FR | 14837360.8 2016.03.17 |
3037090 2019.07.31 |
|||
| 84 | DE | 60 2014 051 000.0 2016.03.17 |
3037090 2019.07.31 |
|||
| 85 | IT | 14837360.8 2016.03.17 |
3037090 2019.07.31 |
|||
| 86 | ES | 14837360.8 2016.03.17 |
3037090 2019.07.31 |
|||
| 87 | IN | 201627009226 2016.03.16 |
334932 2020.03.17 |
|||
| 88 |
JP |
엔지켐 생명과학 |
2016-540804 2016.03.02 |
6129423 2017.04.21 |
모노아세틸디아실글리세롤류 화합물을 유효성분으로 함유하는 아토피 피부염의 예방 또는 치료용 조성물 |
등록 |
| 89 |
AU |
2014315877 2016.02.23 |
2014315877 2017.07.06 |
|||
| 90 |
US |
14/915.799 2016.03.01 |
9,763,908 B2 2017.09.19 |
|||
| 91 |
RU |
2016112495 2016.04.01 |
2640503 2018.01.09 |
|||
| 92 |
CA |
2922171 2016.02.22 |
2922171 2018.01.10 |
|||
| 93 | GB |
14 841 734.8 2016.03.24 |
3042651 2020.01.01 |
|||
| 94 | FR |
14 841 734.8 2016.03.24 |
3042651 2020.01.01 |
|||
| 95 | DE |
60 2014 059 457.3 2016.03.24 |
3042651 2020.01.01 |
|||
| 96 | IT |
14 841 734.8 2016.03.24 |
3042651 2020.01.01 |
|||
| 97 | ES |
14 841 734.8 2016.03.24 |
3042651 2020.01.01 |
|||
| 98 |
US |
엔지켐 생명과학 |
14/959,750 2015.12.16 |
9,808,438 2017.11.07 |
점막염 치료용 조성물 Method for Treating Mucositis |
등록 |
| 99 |
KR |
10-2017-7014195 2017.05.25 |
1781993 2017.09.20 |
|||
| 100 | AU | 2016353600 2018.04.26 |
2016353600 2020.05.14 |
|||
| 101 | JP | 2018-544013 2018.05.09 |
6824998 2021.01.15 |
|||
| 102 | CA | 3004879 2018.05.09 |
30044879 2021.05.18 |
|||
| 103 |
KR |
엔지켐 생명과학 |
10-2016-0132598 2016.10.13 |
1817552 2018.01.05 |
모노아세틸디아실글리세롤류 화합물을 함유하는 간염의 예방 또는 치료용 조성물 |
등록 |
| 104 | AU | 2017341663 2019.05.03 |
2017341663 2020.12.10 |
|||
| 105 |
KR |
엔지켐 생명과학 |
10-2016-0134296 2016.10.17 |
1836822 2018.03.05 |
모노아세틸디아실글리세롤 화합물을 함유하는 건선의 예방 또는 치료용 조성물 |
등록 |
| 106 | AU | 2017.346183 2019.05.03 |
2017341663 2020.12.10 |
|||
| 107 | KR | 엔지켐 생명과학 |
10-2016-7035244 2016.12.15 |
1826903 2018.02.01 |
백혈구 감소증 및 혈소판 감소증에 대한 치료 방법 |
등록 |
| 108 | US | 14/936,464 2015.11.09 |
10,588,886 2020.03.17 |
|||
| 109 | US | 14/951,353 2015.11.24 |
10,596,141 2020.03.24 |
|||
| 110 | JP | 2017-512879 2016.11.15 |
6321886 2018.05.09 |
|||
| 111 | AU | 2015258840 2016.11.25 |
2015258840 2018.06.28 |
|||
| 112 | CA | 2949096 2016.11.14 |
2949096 2019.04.30 |
|||
| 113 | GB | 15793591.7 2015.05.15 |
3142657 2019.09.11 |
|||
| 114 | FR | 15793591.7 2015.05.15 |
3142657 2019.09.11 |
|||
| 115 | DE | 60 2015 037 891.1 2015.05.15 |
3142657 2019.09.11 |
|||
| 116 | IT | 15793591.7 2015.05.15 |
3142657 2019.09.11 |
|||
| 117 | ES | 15793591.7 2015.05.15 |
3142657 2019.09.11 |
|||
| 118 | CH | 15793591.7 2015.05.15 |
3142657 2019.09.11 |
|||
| 119 | RU | 2016149232 2016.12.14 |
2702122 2019.10.04 |
|||
| 120 |
KR |
엔지켐 생명과학 |
10-2016-0179237 2016.12.26 |
1859200 2018.05.11 |
모노아세틸디아실글리세롤 화합물의 경구 투여용 조성물 및 고형 제제 |
등록 |
| 121 | US | 엔지켐 생명과학 |
15/775,810 2018.05.11 |
10,555,923 2020.02.11 |
Methods for treating proxysmal nocturnal hemoglobinuria (발작성 야간 혈색소뇨증의 치료 방법) |
등록 |
| 122 | US | 엔지켐 생명과학 |
15/775,811 2018.05.11 |
10,653,657 2020.05.19 |
Methods for treating Hemolytic Uremic Syndrome (용혈성 요독 증후군의 치료 방법) |
등록 |
| 123 | KR | 엔지켐 생명과학 |
10-2018-0028871 2018.03.12 |
2038971 2019.10.25 |
디아실글리세롤락톤 화합물, 그 제조방법 및 이를 유효성분으로 함유하는 면역증진제 | 등록 |
| 124 | KR | 엔지켐 생명과학 |
10-2018-0034537 2018.03.26 |
2054401 2019.12.04 |
1,2- 디아실글리세롤 화합물, 그 제조방법 및 이를 유효성분으로 함유하는 면역조절제 |
등록 |
| 125 | KR | 엔지켐 생명과학 |
10-2018-0046890 2018.04.23 |
2062291 2019.12.27 |
글리세롤 유도체, 이의 제조방법 및 이를 유효성분으로 함유하는 면역조절제 |
등록 |
| 126 | KR | 엔지켐 생명과학 |
10-201-0044514 2019.04.16 |
2218540 2021.02.16 |
모노아세틸디아실글리세롤 화합물을 함유하는 당뇨병 치료용 조성물 및 당뇨병의 치료 방법 | 등록 |
| 127 | KR | 엔지켐 생명과학 |
10-201-0044515 2019.04.16 |
2218542 2021.02.16 |
모노아세틸디아실글리세롤 화합물을 함유하는 통풍 치료용 조성물 및 통풍의 치료 방법 | 등록 |
| 128 | KR | 엔지켐 생명과학 |
10-201-0086967 2019.07.18 |
2218545 2021.02.16 |
모노아세틸글리세롤 화합물을 유효성분으로 함유하는 지방간 질환 치료용 조성물 |
등록 |
(나) 원료의약품 등록 특허
|
No. |
국가 |
특허권자 (출원인) |
출원번호 (출원일) |
등록번호 등록일 |
발명의 명칭 |
법적 상태 |
|---|---|---|---|---|---|---|
| 129 |
KR |
엔지켐 생명과학 |
10-2007-0042894 2007.05.03 |
0881890 2009.01.29 |
사포그렐레이트 염산염의 제조방법 |
등록 |
| 130 |
KR |
엔지켐 생명과학 |
10-2007-0051520 2007.05.28 |
0898099 2009.05.11 |
잘토프로펜의 제조방법 |
등록 |
| 131 |
KR |
엔지켐 생명과학 |
10-2007-0090159 2007.09.05 |
0898103 2009.05.11 |
세프부페라존 중간체의 신규한 제조방법 |
등록 |
| 132 |
KR |
엔지켐 생명과학 |
10-2011-0051646 2011.05.30 |
1315751 2013.10.01 |
로페라미드 옥사이드 모노하이드레이트의 신규한 제조방법 |
등록 |
| 133 |
KR |
엔지켐 생명과학 |
10-2012-0134515 2012.11.26 |
1462468 2014.11.11 |
염산 에페리손의 제조방법 |
등록 |
| 134 |
KR |
엔지켐 생명과학 |
10-2014-0003871 2014.01.13 |
1595747 2016.02.15 |
나파모스탯 메실레이트의 제조방법 |
등록 |
| 135 |
KR |
엔지켐 생명과학 |
10-2015-0114980 2015.08.14 |
1788268 2017.10.13 |
L-카르노신 아연 착물의 제조 방법 |
등록 |
| 136 |
KR |
엔지켐 생명과학 |
10-2016-0145412 2016.11.02 |
1867988 2018.06.08 |
팔리페리돈 중간체 및 이를 이용한 팔리페리돈의 제조방법 |
등록 |
| 137 | KR | 엔지켐 생명과학 |
10-201-0008675 2019.01.23 |
2218538 2021.02.16 |
폴마콕시브의 제조 방법 | 등록 |
(다) 조영제 등록 특허
|
No. |
국가 |
특허권자 (출원인) |
출원번호 (출원일) |
등록번호 등록일 |
발명의 명칭 |
법적 상태 |
|---|---|---|---|---|---|---|
| 138 |
KR |
엔지켐 생명과학 |
10-2017-0109677 2017.08.29 |
1971435 2019.04.17 |
가도부트롤 중간체 및 이를 이용한 가도부트롤의 제조 방법 |
등록 |
| 139 | US | 16/642,108 2018.08.29 |
11,091,449 2021.08.17 |
|||
| 140 | RU | 2020111439 2018.08.29 |
2740901 2021.01.21 |
|||
| 141 | KR | 엔지켐 생명과학 |
10-2018-0007310 2018.01.19 |
2033964 2019.10.14 |
가도테리돌 중간체 및 이를 이용한 가도테리돌 제조방법 | 등록 |
| 142 | IN | 엔지켐 생명과학 |
202027030973 2019.01.11 |
370666 2021.06.29 |
칼코부트롤의 제조방법 | 등록 |
(라) 글로벌 신약 출원 특허
|
No. |
국가 |
특허권자 (출원인) |
출원번호 (출원일) |
등록번호 등록일 |
발명의 명칭 |
법적 상태 |
|---|---|---|---|---|---|---|
| 1 |
CN |
엔지켐 생명과학 |
201810420691.9 2018.05.04 |
모노아세틸디아실글리세롤류 화합물을 유효성분으로 함유하는 류마티스관절염의 예방 또는 치료용 조성물 |
출원 |
|
| 2 | IN |
엔지켐 생명과학 |
201617009591 2016.03.29 |
모노아세틸디아실글리세롤 화합물을 유효성분으로 함유하는 혈액암 또는 암전이 억제용 조성물 |
출원 |
|
| 3 | CN |
201910459431.7 2019.05.29 |
||||
| 4 | US |
16/886,280 2020.05.28 |
||||
| 5 |
IN |
엔지켐 생명과학 |
201617010846 2016.03.29 |
|
모노아세틸디아실글리세롤 화합물을 유효성분으로 함유하는 아토피피부염의 예방 또는 치료용 조성물 |
출원 |
| 6 |
US |
엔지켐 생명과학 |
16/127,930 2018.09.11 |
모노아세틸디아실글리세롤 화합물을 유효성분으로 함유하는 천식의 예방 또는 치료용 조성물 | 특허 허여 |
|
| 7 |
EP |
14837475.4 2014.08.19 |
||||
| 8 |
CN |
엔지켐 생명과학 |
201780063760.9 2019.04.16 |
모노아세틸디아실글리세롤 화합물을 함유하는 건선의 예방 또는 치료용 조성물 | 출원 | |
| 9 |
US |
16/342,769 2019.04.17 |
||||
| 10 |
EP |
17862701.4 2019.05.17 |
||||
| 11 |
JP |
2019-542339 2019.04.16 |
||||
| 12 |
JP |
2021-110550 2019.04.16 |
||||
| 13 |
IN |
201927017601 2019.05.02 |
||||
| 14 | IN |
엔지켐 생명과학 |
201627040338 2016.11.25 |
혈소판 감소증에 대한 치료 방법 |
출원 |
|
| 15 | CN | 201580038245.6 2017.01.13 |
||||
| 16 | JP | 2018-073153 2018.04.05 (CIP) |
||||
| 17 | JP | 2020-071167 2020.04.10 |
||||
| 18 | CA DIV |
3037762 2015.05.15 |
||||
| 19 | EP DIV |
19196029.3 2019.09.06 |
||||
| 20 | US | 16/775,820 2020.01.29 |
||||
| 21 | US | 16/775,886 2020.01.29 |
||||
| 22 |
EP |
엔지켐 생명과학 |
16864555.4 2018.06.09 |
Methods for treating mucositis |
출원 |
|
| 23 |
IN |
201817017613 2018.06.09 |
||||
| 24 |
CN |
201680065316.6 2018.05.08 |
||||
| 25 | JP DIV |
2021-002532 2021.01.12 |
||||
| 26 | US DIV2 |
엔지켐 생명과학 |
17/010,806 2020.09.02 |
모노아세틸디아실글리세롤 화합물을 유효성분으로 함유하는 만성폐쇄성 폐질환의 예방 또는 치료용 조성물 |
출원 |
|
| 27 | US |
엔지켐 생명과학 |
16/888,716 2020.05.30 |
1-팔미토일-2-리놀레오일-3-아세틸글리세롤을 포함하는 급성 방사선 증후군의 예방 또는 치료용 조성물 |
출원 |
|
| 28 | US | 17/114,473 2020.12.07 |
||||
| 29 | KR | 10-2020-7018828 2018.11.30 |
||||
| 30 | EP |
18882935.2 2018.11.30 |
||||
| 31 | JP |
2020-529508 2018.11.30 |
||||
| 32 | CN | 201880088084,5 2018.11.30 |
||||
| 33 | RU |
2020121489 2018.11.30 |
||||
| 34 | IL |
274974 2018.11.30 |
||||
| 35 |
CN |
엔지켐 생명과학 |
201780063688.X 2019.04.15 |
모노아세틸디아실글리세롤 화합물을 함유하는 간염의 예방 또는 치료용 조성물 |
출원 |
|
| 36 |
US |
16/341,476 2019.04.12 |
||||
| 37 |
EP |
17860633.1 2019.05.13 |
||||
| 38 |
JP |
2019-520431 2019.04.12 |
||||
| 39 | JP DIV |
2021-078822 2017.12.06 |
||||
| 40 |
IN |
201917017607 2019.05.02 |
||||
| 41 | US |
엔지켐 생명과학 |
16/977,548 2019.03.08 |
디아실글리세롤락톤 화합물, 그 제조방법 및 이를 유효성분으로 함유하는 면역증진제 |
출원 |
|
| 42 | EP |
19768507.6 2019.03.08 |
||||
| 43 | JP |
2020-548721 2019.03.08 |
||||
| 44 | CN |
201980018473.5 2019.03.08 |
||||
| 45 | IN |
202027038302 2019.03.08 |
||||
| 46 | US |
엔지켐 생명과학 |
16/978,873 2019.03.25 |
|
1,2-디아실글리세롤 화합물, 그 제조방법 및 이를 유효성분으로 함유하는 면역조절제 |
출원 |
| 47 | EP |
19 774 283.6 2019.03.25 |
||||
| 48 | JP |
2020-549758 2019.03.25 |
||||
| 49 | CN |
201980022216.9 2019.03.25 |
||||
| 50 | IN |
202027038438 2019.03.25 |
||||
| 51 |
US |
엔지켐 생명과학 |
17/047,123 2019.04.19 |
글리세롤 유도체, 이의 제조방법 및 이를 유효성분으로 함유하는 면역조절제 |
출원 |
|
| 52 | EP | 19792728.8 2019.04.19 |
||||
| 53 | JP | 2020-558931 2019.04.19 |
||||
| 54 | CN | 201980027923.7 2019.04.19 |
||||
| 55 | IN | 202027046356 2019.04.19 |
||||
| 56 | US |
엔지켐 생명과학 |
PCT/US20/12577 2020.01.07 |
|
Composition and Methods for Modulating an Inflammatory Response |
출원 |
|
57 |
KR |
엔지켐 생명과학 |
10-2021-7025519 2019.01.16 |
|
Methods and Compositions for Treatment of Cancer |
출원 |
|
58 |
US |
17/423,343 2019.01.16 |
||||
|
59 |
EP |
19910092.6 2019.01.16 |
||||
|
60 |
CA |
3126887 2019.01.16 |
||||
|
61 |
CN |
출원번호미정 2019.01.16 |
||||
|
62 |
JP |
2021-541567 2019.01.16 |
||||
|
63 |
RU |
2021123836 2019.01.16 |
||||
|
64 |
IN |
202117037055 2019.01.16 |
||||
|
65 |
US |
엔지켐 생명과학 |
17/419,949 2020.03.06 |
Composition Comprising Monoaoetyldiaculglycerol Compound for Treating Fatty Liver Disease | 출원 | |
|
66 |
EP |
20766948.2 2020.03.06 |
||||
|
67 |
AU |
2020231261 2020.03.06 |
||||
|
68 |
JP |
2021-541223 2020.03.06 |
||||
|
69 |
CN |
202080006890.0 2020.03.06 |
||||
|
70 |
RU |
2021116827 2020.03.06 |
||||
|
71 |
IN |
202117032961 2020.03.06 |
||||
|
72 |
US |
엔지켐 생명과학 |
17/423,218 2020.04.16 |
Compositions and Methods for Treating Diabetes | 출원 | |
|
73 |
EP |
20791797.2 2020.04.16 |
||||
|
74 |
CN |
202080010666.9 2020.04.16 |
||||
|
75 |
JP |
2021-541605 2020.04.16 |
||||
| 76 | KR | 엔지켐 생명과학 |
10-2019-0128021 2019.10.15 |
1-팔미토일-2-리놀레오일-3-아세틸 글리세롤의 제조방법 |
출원 | |
| 77 | EP | EP20200615.1 2020.10.07 |
||||
| 78 | US | 17/069,267 2020.10.13 |
||||
| 79 | CA | 3096189 2020.10.14 |
||||
| 80 | JP | 2020-172894 2020.10.14 |
||||
| 81 | IN | 202014044498 2020.11.04 |
||||
| 82 | CN | 2020110991932 2020.10.14 |
||||
| 83 | PCT | 엔지켐 생명과학 |
PCT/IB2020/060104 2020.10.28 |
Methods and Compositions for Treatment of Cancer |
출원 | |
| 84 | PCT | PCT/IB2021/051963 2021.03.09 |
||||
| 85 | US | 엔지켐 생명과학 |
63/080,007 2020.09.17 |
Glycerol Compounds and Methods of Use |
가출원 |
|
(마) 원료의약품 출원 특허
|
No. |
국가 |
특허권자 (출원인) |
출원번호 (출원일) |
등록번호 등록일 |
발명의 명칭 |
법적 상태 |
|---|---|---|---|---|---|---|
| 86 | KR | 엔지켐 생명과학 |
10-2020-0058910 2020.05.18 |
보티옥세틴 브롬화수소산염의 제조방법 | 출원 | |
| 87 | KR | 엔지켐 생명과학 |
10-2021-0039007 2021.03.25 |
|
N-(4(4-(피페리디노메틸)피리딜-2-옥시)-시스-2-부텐)프 탈이미드 말레이트의 제조방법 |
출원 |
(바) 조영제 출원 특허
|
No. |
국가 |
특허권자 (출원인) |
출원번호 (출원일) |
등록번호 등록일 |
발명의 명칭 |
법적 상태 |
|---|---|---|---|---|---|---|
| 88 |
EP |
엔지켐 생명과학 |
18851066.3 2018.08.29 |
가도부트롤 중간체 및 이를 이용한 가도부트롤의 제조 방법 |
출원 |
|
| 89 |
CA |
3074161 2018.08.29 |
||||
| 90 | JP | 2020-512644 2018.08.29 |
||||
| 91 | CN | 201880055972.7 2018.08.29 |
||||
| 92 | IN | 202027010920 2018.08.29 |
||||
| 93 | JP |
엔지켐 생명과학 |
PCT/KR2019/000483 2019.01.11 |
|
가도테리돌 중간체 및 이를 이용한 가도테리돌 제조방법 |
출원 |
| 94 | US | 엔지켐 생명과학 |
16/962,287 2019.01.11 |
칼코부트롤의 제조방법 | 출원 | |
| 95 | EP |
19740840.4 2019.01.11 |
||||
| 96 | JP |
2020-539828 2019.01.11 |
||||
| 97 | CN |
201980008673.2 2019.01.11 |
||||
| 98 | US |
엔지켐 생명과학 |
17/193,592 2021.03.05 |
|
가도부트롤 주사제 제조를 위한 부형제인 칼코부트롤의 제조 방법 |
출원 |
| 99 | EP | 21160054.9 2021.03.01 |
||||
| 100 | CN | 2021102422811 2021.03.04 |
||||
| 101 | JP | 2021-034941 2021.03.05 |
||||
| 102 | IN | 202114008204 2021.02.26 |
||||
| 103 | US |
엔지켐 생명과학 |
17/193,129 2021.03.05 |
|
칼테리돌의 제조방법 |
출원 |
| 104 | EP | 21160976.3 2021.03.05 |
||||
| 105 | CN | 2021102653286 2021.03.11 |
||||
| 106 | JP | 2021-037983 2021.03.10 |
||||
| 107 | IN | 202114008566 2021.03.01 |
||||
| 108 | KR | 엔지켐 생명과학 |
10-2020-0069379 2020.06.09 |
가도테레이트 메글루민 중간체인 가도케릭산의 제조 및 가도테레이트 메글루민 제조 방법 |
출원 |
【 전문가의 확인 】
1. 전문가의 확인
보고서 작성기준일 현재 해당사항이 없습니다.
2. 전문가와의 이해관계
,
보고서 작성기준일 현재 해당사항이 없습니다.