![이미지: [세계 의료기기 시장 규모]](%5B%EC%84%B8%EA%B3%84%20%EC%9D%98%EB%A3%8C%EA%B8%B0%EA%B8%B0%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%5D.jpg) |
|
[세계 의료기기 시장 규모] |
주주총회소집공고
| 2021년 03월 03일 | ||
| 회 사 명 : | 주식회사 메디쎄이 | |
| 대 표 이 사 : | 강원호, 이환욱 | |
| 본 점 소 재 지 : | 충청북도 제천시 한방엑스포로 129 (제천시 왕암동 1389) | |
| (전 화) 043-716-1014 | ||
| (홈페이지) http://www.medyssey.co.kr | ||
| 작 성 책 임 자 : | (직 책) 이사 | (성 명) 하재성 |
| (전 화) 043-716-1014 | ||
주주총회 소집공고
| (주주총회) |
|
주주님의 건승과 댁내의 평안을 기원합니다.
당사는 상법 제363조와 정관 제21조에 의거 제18기 정기주주총회를 아래와 같이 개최 하오니 참석하여 주시기 바랍니다.
- 아 래 - 1. 일 시 : 2021년 03월 23일(화요일) 오전 10시 00분
2. 장 소 : 충청북도 제천시 한방엑스포로 129 / 본사 2층 대회의실
3. 회의 목적 사항 가. 보고사항 : 제18기 감사보고, 영업보고, 내부회계관리제도 운영실태보고 나. 부의 안건 제1호 의안 : 제18기 연결(별도) 재무제표 및 이익잉여금처분계산서 승인의 건 제2호 의안 : 이사 선임 승인의 건 (별첨 참조) 제3호 의안 : 이사 보수한도 승인의 건(보수총액10억원, 전년도와 동일) 제4호 의안 : 감사 보수한도 승인의 건(보수총액1억원, 전년도와 동일)
4. 경영참고사항 비치 상법 제542조의4에 의한 경영참고사항은 당사 인터넷 홈페이지에 게재하고 본점과 명의개서대행 회사(국민은행 증권대행부)에 비치하였으며, 금융위원회 및 한국거래소에 전자 공시하여 조회가 가 능하오니 참고하시기 바랍니다. 5. 실질주주의 의결권 행사에 관한 사항 우리 회사의 이번 주주총회에서는 한국예탁결제원이 주주님들의 의결권을 행사할 수 없습니다. 따라서 주주님들께서는 한국예탁결제원에 의결권행사에 관한 의사표시를 하실 필요가 없으며, 종전과 같이 주주총회에 참석하여 의결권을 직접 행사하시거나 또는 위임장에 의거 의결권을 간접 행사할 수 있습니다.
6. 주총 참석시 준비물 *직접행사 : 주주총회 참석장, 신분증 *대리행사 : 주주총회 참석장, 위임장(주주와 대리인의 인적 사항 기재, 인감 날인), 주주 인감증명 서, 대리인 신분증
※ 참고사항 : 코로나바이러스 감염증-19(COVID-19)의 감염 및 전파를 예방하기 위하여 주주총회에 참석시 주주님들의 체온을 측정할 수 있으며, 측정결과에 따라 발열이 의심 되는 경우, 부득이하게 총회장 출입이 제한될 수 있음을 알려드립니다. 또한, 반드시 마스크 착용을 부탁드립니다. 마스크 미착용시 주주총회 개최장소의 출입이 제한될 수 있습니다. 만약, 주주총회 개최 전 코로나바이러스 확산에 따른 불가피한 장소 변경이 있는 경우, 지체없이 재공시 하여 안내 드릴 예정입니다.
2021년 03월 03일 |
I. 사외이사 등의 활동내역과 보수에 관한 사항
1. 사외이사 등의 활동내역
가. 이사회 출석률 및 이사회 의안에 대한 찬반여부
| 회차 | 개최일자 | 의안내용 | 사외이사 등의 성명 | |||
|---|---|---|---|---|---|---|
| 황용희 (출석률: 100%) |
B (출석률: %) |
C (출석률: %) |
D (출석률: %) |
|||
| 찬 반 여 부 | ||||||
| 100 | 2020.01.28 | 브라질법인 추가 투자의 건 | 찬성 | - | - | - |
| 101 | 2020.02.12 | 우리은행 34억 대출의 건 | 찬성 | - | - | - |
| 102 | 2020.02.28 | 내부회계관리 운영실태 보고 건 | 찬성 | - | - | - |
| 103 | 2020.02.28 | 내부회계관리제도에 관한 감사의 평가보고 건 | 찬성 | - | - | - |
| 104 | 2020.03.05 | 제17기정기주주총회소집및부의안건 승인의 건 | 찬성 | - | - | - |
| 105 | 2020.03.13 | 제17기 연결재무제표(별도) 승인의 건 | 찬성 | - | - | - |
| 106 | 2020.03.31 | 신한은행 차입금(5억)승인에 관한 건 | 찬성 | - | - | - |
| 107 | 2020.04.29 | 임원변경(대표이사 강원호, 이환욱)의 건 | 찬성 | - | - | - |
| 108 | 2020.05.06 | 기채에 관한 건(수출성장자금대출)의 건 | 찬성 | - | - | - |
| 109 | 2020.06.10 | 신한은행 차입금(20억)관련의 건 | 찬성 | - | - | - |
| 110 | 2020.06.10 | 신한은행 차입금관련 대표권 행사시 대표이사 강원호로 정한다 | 찬성 | - | - | - |
| 111 | 2020.07.24 | 신한은행 차입금(25)억관련의 건 | 찬성 | - | - | - |
| 112 | 2020.07.24 | 신한은행 차입금관련 대표권 행사시 대표이사 강원호로 정한다 | 찬성 | - | - | - |
| 113 | 2020.08.06 | 우리은행 차입금(34억) 연장의 건 | 찬성 | - | - | - |
| 114 | 2020.09.14 | 전환상환우선주식의 상환 및 자기주식으로 취득에 관한 건 외 | 찬성 | - | - | - |
| 115 | 2020.10.06 | 임시주주총회 소집에 관한 건(정관일부변경, 사내이사선임) | 찬성 | - | - | - |
주) 사외이사 황용희는 2020년11월20일 일신상의 사유로 사임하였습니다.
나. 이사회내 위원회에서의 사외이사 등의 활동내역
| 위원회명 | 구성원 | 활 동 내 역 | ||
|---|---|---|---|---|
| 개최일자 | 의안내용 | 가결여부 | ||
| - | - | - | - | - |
2. 사외이사 등의 보수현황
| (단위 : 원) |
| 구 분 | 인원수 | 주총승인금액 | 지급총액 | 1인당 평균 지급액 |
비 고 |
|---|---|---|---|---|---|
| 사외이사 | 1 | 보수총액 10억원 | 12,000,000 | 12,000,000 | - |
| 비상임이사 | 4 | - | 254,164,960 | 63,541,240 | - |
주1) 상기 주총승인금액은 제17기 정기주주총회(2020년3월30일)에서 승인받은 사내이사 5인을 포함한 등기이사 6인의 보수한도 총액입니다.
주2) 상기 지급총액은 2020년1월1일부터 2020년12월31일까지 지급한 보수총액입니다.
II. 최대주주등과의 거래내역에 관한 사항
1. 단일 거래규모가 일정규모이상인 거래
| (단위 : 억원) |
| 거래종류 | 거래상대방 (회사와의 관계) |
거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
2. 해당 사업연도중에 특정인과 해당 거래를 포함한 거래총액이 일정규모이상인 거래
| (단위 : 억원) |
| 거래상대방 (회사와의 관계) |
거래종류 | 거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
III. 경영참고사항
1. 사업의 개요
가. 업계의 현황
(1) 산업의 정의
당사가 영위하고 있는 의료기기산업의 '의료기기’란 의료기기법 제2조에서는 의료기기를 다음과 같이 정의하고 있습니다. '의료기기’란 의료기기법 제2조 법률 13698호에 의거하여 사람 또는 동물에게 단독 또는 조합하여 사용되는 기구·기계·장치·재료 또는 이와 유사한 제품으로서 질병의 진단, 치료 또는 예방의 목적으로 사용되거나, 구조 또는 기능의 검사, 대체 또는 변형을 목적으로 사용되는 제품 등으로 정의하고 있습니다.
|
1. 질병을 진단·치료·경감·처치 또는 예방할 목적으로 사용되는 제품 2. 상해 또는 장애를 진단·치료·경감 또는 보정할 목적으로 사용되는 제품 3. 구조 또는 기능을 검사·대체 또는 변형할 목적으로 사용되는 제품 4. 임신을 조절할 목적으로 사용되는 제품 |
국가간 의료기기 규제를 조절하고 제정하는 의료기기국제조화회의(GHTF : Global Harmonization Task Force)에서 정의하는 의료기기는 기계·기기·기구·기계장치·이식·진단시약 또는 눈금측정기, 소프트웨어, 재료 또는 기타 유사 또는 관련 물품이 단독 또는 조합으로 사용되며, 다음의 목적을 위해 인간에게 사용하도록 제조자가 의도한 것으로 정의하고 있습니다.
|
1. 질병의 진단, 예방, 감시, 치료 또는 완화 2. 부상에 대한 진단, 감시, 치료, 완화 또는 보상 3, 해부 또는 생리적 과정의 조사, 대체 또는 변경 4. 생명 지원 또는 유지 5. 수태조절(피임) 6. 의료기기의 소독 7. 인체로부터 추출된 표본의 시험과 의료목적을 위한 정보 제공 |
'의료기기산업'이란 의료기기 제품의 설계 및 제조에 관련된 다 학제간(Interdisciplinary : 임상의학과 전기, 전자, 기계 재료, 광학 등 공학) 융합되는 응용기술을 활용하여 의료기기 분야 제품/서비스 제공의 경제활동을 하는 생산단위의 집합 또는 조직으로 정의하며, 궁극적으로 의료기기를 통한 인간 삶의질 향상을 목표로 하는 보건의료의 한 분야로 정의하고 있습니다.
의료기기 분류는 일반분류와 산업 및 시장 분류체계로 나눌 수 있으며, 일반분류는 ① 식약처 의료기기 분류 ② 과학기술 표준분류 ③ 산업통상자원부 산업기술 분류로 나뉠 수 있으며, 산업 및 시장 관련 분류체계는 ① 한국표준산업분류의 의료기기사업 관련 분야 ② 한국보건산업진흥원의 의료기기 유형군 분류로 구성된다. 한국보건산업진흥원에서는 의료기기시장 관점에서 방사선 영상진단기기, 생체계측기기, 마취 및 호흡기기, 치과용 기기, 기계, 체외 진단용 시약 등 총 16개 유형군으로 분류하고 있다. 의료기기 산업은 생산 및 수입 제품을 시장에 유통할 때 정부기관의 인허가를 받아야 한다. 국내의 경우 식품의약품안전처(MFDS)의 의료기기 등급 및 분류기준에 따라, 공중보건에 미치는 잠재적 위해성 정도를 기준으로 개인위해도(Individual Risk, IR)와 공중위해도(Public Risk, PR), 잠재적 위해성의 판단 기준에 근거해 위험도가 높은 4등급에서부터 위험도가 낮은 1등급으로 분류하고 있습니다.
식품의약품안전처의 [의료기기법 시행규칙] 제2조 및 의료기기의 등급분류 및 지정에 관한 기준과 절차, 등급의 지정절차에 따라 의료기기 품목의 대분류(4개)는 ⓐ기구·기계(Medical Instruments), ⓑ의료용품(Medical Supplies), ⓒ치과 재료(Dental Materials), ⓓ체외진단용 시약(IVD Reagents) 4가지 유형으로 구분하며, 중분류는 대분류군을 원자재, 제조공정 및 품질관리체계가 비슷한 품목군으로 분류되며, 소분류의 경우 중분류군을 기능이 독립적으로 발휘되는 품목별로 분류하고 있습니다. 또한, 각 품목은 해당 의료기기가 인체에 미치는 잠재적 위해성을 바탕으로 4개 등급으로 분류되며, 잠재적 위해성에 대한 판단기준은 다음과 같습니다.
|
1) 인체와 접촉하고 있는 기간 2) 침습의 정도 3) 약품이나 에너지를 환자에게 전달하는지 여부 4) 환자에게 생물학적 영향을 미치는지 여부 |
<식품의약품안전처의 의료기기 등급 분류기준>
|
등급 |
등급 기준 |
주요해당 제품 |
|---|---|---|
|
1 등 급 |
·인체에 직접 접촉되지 않는 제품
·잠재적 위해성이 거의 없는 의료기기 |
청진기, 체온계, 의료용 원심 분리기, 의료용 칼, 가위, 영상 저장/조회용 소프트웨어 등 |
|
2 등 급 |
·인체에 직접 접촉되는 제품 중 기능장애 및 잠재적 위해성이 낮은 의료기기 |
콘돔, 심전계, 뇌파계, 전동식침대, 영상전송/출력용 소프트웨어 등 |
|
3 등 급 |
·인체내에 일정기간 삽입되는 제품
·삽입 후 중증도의 잠재적 위험성이 높은 의료기기 |
초음파골밀도측정기, 인공신장기, 엑스선촬영장치, CT, MRI, 정형외과, 척추용 임플란트 등 |
|
당사의 제품군에 해당됨 |
||
|
4 등 급 |
·고도의 위해성을 가진 의료기기
·안전성 검증이 필요한 원자재를 사용한 의료기기
·임상적 검증이 필요한 의료기기 |
인공 혈관, 인공 유방, 심장박동기, 특수재질 임플란트 등 |
주) 식품의약품안전처의 의료기기 등급 기준에 따른 제품의 인허가 과정에 따라 허가를 진행해야 합니다.
1 등급 의료기기
-위해성이 거의 없는 1등급에 해당하는 의료기기는 신고대상으로 ‘의료기기 전자민원시스템’에 등록 후 사용가능합니다.
2 등급 의료기기
-위해성이 낮은 2등급에 해당하는 의료기기로 기술문서 심사 및 허가대상으로 관할지방식약청 품목 허가 취득 및 한국의료기기안전정보원 등록 후 사용 가능합니다.
3 등급 의료기기
-잠재적 위해성이 높은 의료기기로 소재 및 의료기기의 안정성 시험 완료 후 이에 수반되는 기술문서를 기반으로 식약처 품목허가 취득 후 사용 가능합니다.
4 등급 의료기기
-잠재적 위해성이 아주 높은 고도의 위험성을 가진 의료기기로 소재 및 의료기기의 안정성 시험 완료 및 해당 의료기기의 임상시험 완료 후 식약처 품목허가 취득 후 사용 가능합니다.
당사의 제품인 척추 임플란트(흉요추 및 경추 임플란트 & 환자 맞춤형 임플란트)는 식품의약품안전처의 의료기기 등급 3등급 이상의 인체 삽입용 임플란트에 해당됨에 따라 생체적합성이 통과된 원자재를 활용하여 성능평가 시험 후 구조적인 안정성이 확보된 제품을 증명한 후 사용가능합니다. 당사의 제품인 인체삽입용 임플란트 의료기기는 연구 및 시제품 개발 이후 생물학적 안전성 검증 완료, 허가, 보험등재의 단계를 거쳐 시장에 출시되며, 당사의 3등급 의료기기의 경우 시장 진입까지 행정적으로 품목허가 80일, 요양급여 결정신청에 150일의 시간이 소모되며, 신청 의료기기의 비용적인 혜택을 받을 수 있는 신의료기술평가를 추가로 진행하면 270일의 기간이 소모됨에 따라 최소 1년이상의 기간이 소요되는 제품입니다.
※ 용어정리
|
추간체 고정재 (Pedicle screw) |
척추 후방 부위로 삽입하는 임플란트로서 티타늄 소재로 제작된 스크류와 긴 봉, 잠금장치로 구성되어 있는 제품 |
|
추간체 유합 보형재 (Interbody Fusion cage) |
척추 디스크를 대체하는 임플란트로서 금속 및 고분자 소재를 활용하여 척추 디스크 부위 전방, 측방, 후방 등의 다양한 수술접근법으로 삽입되는 제품 |
|
척추 극돌기간 삽입체 (Interspinous process) |
척추 극돌기간내에 삽입하는 임플란트로서, 흉요추 극돌기간 사이에 삽입하여 운동을 제어하는 형태와 고정돌기로 고정하는 등 시술목적에 따라 다양한 제품이 있음 |
|
환자 맞춤형 (Custom-made) |
환자의 해부학적 데이터를 기반으로 3D 프린팅 장비를 활용하여 환자의 골결손부위에 딱맞게 제작하는 제품 |
|
외상 고정 임플란트(Trauma) |
외상 및 골절 등으로 팔,다리에 수술적 고정이 필요한 경우 사용되는 제품으로 금속판과 스크류로 구성되어 있음 |
|
두개골 성형술 (Craniolplasty) |
두개골의 결손된 부위에 3D 프린팅으로 제작된 맞춤형 임플란트를 수술하는 방법 |
|
ASTM (American Society for Testing and Materials) |
미국시험재료학회에서 금속, 소비자용품, 의료용기기 및 기구 등 130개가 넘는 전문분야 에서 표준시험방법, 사양, 제품실습, 지침, 제품의 분류 및 용어 등에 관한 규격 |
|
ISO (International Organization for Standardization) |
국제표준화기구, 여러나라의 표준 제정 단체들의 대표들로 이루어진 국제적인 표준화 기구 |
|
In-Vitro |
생체외를 일컬음 |
|
In-Vivo |
생체내를 일컬음 |
|
MFDS (Ministry of Food And Drug Safety) |
한국식품의약품안전처 |
|
PEEK (Poly Ether Ether Ketone) |
열가소성 비분해성 폴리머로서 내마모성과 기계적 특성이 비교적 우수하며, 생체소재로 널리 활용됨 |
|
Ti-6Al-4V ELI (Titanium - 6% Aluminium - 4% Vanadium extra low interstitial) |
알루미늄 6%, 바나듐 4% 잔부를 Ti로 구성된 합금으로서 특별히 불순물이 제어된 합금 |
|
Ti-6Al-4V ELI (Titanium - 6% Aluminium - 4% Vanadium extra low interstitial) |
알루미늄 6%, 바나듐 4% 잔부를 Ti로 구성된 합금으로서 특별히 불순물이 제어된 합금 |
|
적층제조 (Additive Manufacturing) |
한번에 한층씩 겹겹이 쌓아서 고체 구조물을 제조하는 방식 |
|
DfAM (design for additive manufacturing) |
3D 프린팅 적층제조를 목적으로 한 설계방식 |
|
생체적합성 (Biocompatibility) |
세포와 생체적으로 적합하고 면역반응, 세포독성 등의 이상반응이 없는 것 |
|
골 고정 (Bone Fixation) |
뼈의 고정을 말함 |
|
골절 (Bone Fracture) |
뼈의 부러짐을 말함 |
|
골 융합 (Bone Fusion) |
뼈와 임플란트의 유합을 말함 |
|
만능재료시험기 (UTM: Universal Test Machine) |
일정한 속도로 가하는 힘에 대한 재료 또는 시료의 저항성, 기계적 강도 등을 측정하는 장비 |
|
압축강도 (Compressive Strength) |
시료에 길이방향으로 누르는 힘을 가했을 때 파괴되지 않고 견딜수 있는 최대의 압축응력 |
|
인장강도 (Tensile Strength) |
시료에 길이방향으로 당기는 힘을 가했을 때 파괴되지 않고 견딜수 있는 최대의 인장응력 |
|
비틀림강도 (Torstional Strength) |
시료에 길이방향으로 회전시키는 힘이 작용할 때 파괴에 대한 저항 |
|
피로도 (Fatigue strength) |
시료에 반복적인 하중을 가했을 때 시료가 파괴되지 않는 정도 |
(2) 의료기기 산업의 특성
의료기기 산업은 다음과 같이 6가지의 특징으로 정의할 수 있습니다.
첫째, 대표적인 자본집약적 및 기술형 산업으로 기술력과 마케팅 능력을 보유한 소수의 다국적 기업이 독과점하는 산업이다. J&J, GE, Simens 등 10대 기업이 세계시장의 60%를 점유하고 있으며, 척추임플란트 시장에서도 Meditronecs, DePuy Synthes, Nuvasive, Styker 등 소수기업이 시장의 60% 이상을 점유하고 있다. 글로벌 대기업은 대규모 R&D 투자, 우수기술을 보유한 전문벤처기업 인수 등을 통해 기술 및 시장지배력을 지속적으로 유지하고 있다. 글로벌 10대 기업 중 일부 기업은 특정 분야에 집중하고 있으나 대부분 진단·계측, 수술·치료, 의료용품·치료재료 등과 같이 다양한 분야에 진출하고 있습니다.
둘째, 의료기기는 기술발전에 따라 점차 복잡해지고 다양화되는 추세이다. 국내의료기기 산업은 4차 산업혁명을 선도하는 핵심기술들과 빠르게 융합하면서 발전하고 있다. ICT 기술과의 융합을 통한 응용 제품과 3D프린팅 기술을 활용한 개인맞춤형 의료기기, 의료용 로봇과 수술기기, 인공지능 기반의 가상현실과 증강현실등 첨단기술을 이용한 다양한 제품군으로 확대되고 있다. 기존의 전통 의료기기와 달리 복잡하고 다양화되면서 의학, 전기전자, 기계, 광학 등 기술이 융합되는 특성을 보이고 있다.
셋째, 의료기기산업은 대표적인 다품종 소량생산 산업이다. 저가 또는 일부 시장에서는 전문 중소기업이 시장을 주도하지만 고가의 첨단 고부가가치 제품은 소수의 대기업이 주도하고 있다.
넷째, 의료기기산업은 정부의 의료정책과 관리제도 등 규제가 상시적으로 이루어지고 있다. 인간의 생명 및 건강과 관련된 제품이므로 세계적으로 정부의 인허가 등 규제가 있다. 생산, 제조, 임상시험 등의 안전규제, 유통 및 판매 등의 안전성 확보, 지식재산권 보호 등으로 규제되고 있다. 각 국가별 인허가제도는 국제교역에서 보이지 않은 무역장벽으로 작용하고 있다. 의료기기의 경우 미국 FDA의 인허가에 소요되는 기간이 평균 7.2개월, 중국은 13개월이지만, 인체에 삽입되는 임플란트의 경우 미국 FDA 1년, 중국 CFDA 3년이상의 시간이 소모되며 이후 시장에 진입하는 소요기간은 더 길다. 일반적으로 의료기기는 제품개발 이후에도 다년간의 임상시험 등 신뢰성 확보 기간이 필요하고 특히 해외시장 진출을 위해서는 해당 국가의 인증을 추가로 받아야 하기 때문에 신뢰성과 안정성 확보에 많은 시간과 비용이 소요된다. 해외시장 진출을 위해서는 FDA(미국), CE(EU), 후생노동성(일본), SFDA(중국) 등 각국 규제기관으로부터 안전성과 유효성을 검증받아야 한다.
다섯째, 의료기기는 수요가 제한적이라는 특징이 있다. 의료기기는 병의원이 주요 수요처이다. 건강 및 보건과 관련되므로 제품의 안전성과 신뢰성을 우선적으로 고려하고 기존 유명제품을 계속 사용하는 보수적인 성향이 강하다. 따라서 상대적으로 시장 진입장벽이 높고 가격탄력성은 낮다. 제품 및 기업에 대한 인지도와 브랜드가 매우 중요한 산업이며, 마케팅 장벽 및 충성도가 높아 경기 민감도는 상대적으로 낮은 편이다.
여섯째, 연구개발에 대한 지속적인 투자가 필요하다. 의료기기산업은 자본 및기술 집약적 산업으로 제품의 개발부터 생산까지 약 3~5년 정도가 소요되어 비용회수기간이 길다. 이에 비해 제품의 시장규모가 작고 수명주기가 짧아 연구개발에 대한 지속적인 투자가 필요한 산업이다. 의료기기 산업은 IT, 통신, 화학, 재료, 기계공학 등 융합화 되는 첨단 융복합 산업으로 제품의 수명주기가 짧아 기술 확보되지 못한 제품은 시장 도태와 진입장벽 상존하며, 생명과의 직접적인 연관성으로 제품의 제조와 판매가 엄격히 규제되고 있어 진입 장벽이 매우 높은 산업이다. 국내 의료기기산업은 성숙기에 접어들었지만 BT 및 IT 등 첨단혁신기술과의 융합을 통해 향후에도 성장성은 높을 것으로 예상된다. 특히 당사의 제품과 같이 최소침습 치료를 가능하게 하는 의료기기를 통해 기존 제품을 대체할 뿐만 아니라 신규 수요를 창출하면서 고부가가치를 창출할 것으로 예상된다.
|
구분 |
척추 임플란트 산업 |
BT 산업 |
IT 산업 |
|---|---|---|---|
|
제품 수명 주기 |
·환자마다 차이가 있으나 최소 10년이상 또는 반영구적인 제품 수명주기의 특성을 가짐 ·지속적인 업그레이드 및 보수가 필요 ·생명과 직결되는 특성으로 시장으로 진입하여 제품으로 확산되는데 시간이 소요 |
·제품 수명주기가 긴 특징 (아스피린은 개발 100여년이 지난 현재도 판매중) ·건강과 직결되어 소비자기호가 반영되기 어려운 특징 |
·제품 수명주기가 짧음(스마트폰: 6~9개월) ·소비자 기호변화가 빠르며, 이에 대한 제품개발 역동적(소비자 기호와 직결) |
|
제품 개발 기간 |
·3등급 의료기기로서 안정성, 유효성, 시험인증, 제품개발 등으로 사업화 기간 소요 |
·제품 개발시간이 긴 특징(신약은 비임상 포함 10년 소요) ·안정성, 생명윤리 등으로 개발 장기화(의약품은 안정성 검증 위해 5년 이상 소요) |
·제품 개발기간이 짧고 소비자에게 전달되는 속도 빠름(스마트폰 개발 기간: 1~2년) |
|
연구 개발 특성 |
·원재료 조달은 비교적 용이 ·생산설비 등 의료기기 제조 허가 필요 ·3D 프린팅 등 IT기술과 접목된 생산 가시화 |
·연구개발에 장기간 소요 ·기초연구(질환규명)에 의존성 높으며, 기초연구 성과가 사업화로 직접연계 가능 |
·단기간의 연구개발 가능 ·응용 및 실용화 중심의 연구성과에 의존성 높음 |
|
산업 진흥법 |
·의료기기 산업육성법을 제정준비 중이나 관련부처의 반대로 향후 전망 불투명 |
·생명공학육성법에서 포괄하고 있으나, 별도의 산업진흥법 부재 |
·정보통신산업진흥법, SW 진흥법등 IT를 포괄하는 산업진흥을 위한 법률 존재 |
|
관련 규제 |
·의료기기법등에 의한 엄격한 규제 |
·생명 윤리법등에 의한 엄격한 규제(인체 유래 연구, 배아, 유전자 취급시 IRP의 승인과 감독하에 규제) |
·개인정보보호법 등에 의하여 규제를 받으나, 제품 생산 자체보다는 활용 측면의 규제 |
|
인프라 |
·의료기기임상시험센터, 시험인증, GMP 등 정부차원의 인프라 투자 필요 |
·임상시험센터, GMP 등 정부차원의 인프라 투자 필요 |
·민간의 인프라 투자 활발 |
(3) 설립배경 및 성장 과정
당사는 척추 임플란트를 전문적으로 판매하고 있는 의료기기 업체로서 2003년 ㈜베리안이라는 법인으로 경기도 양주시에 작은 공장을 인수하고 의료기기 제조업인가를 받으면서 출발하였습니다. 당사 창업자인 대표이사의 작은 아이디어를 시작으로 국내외 특허를 취득하였으며 내수시장 확보, 수출시장 진출을 실현시켰습니다. 이를 기반으로 2007년 기업부설연구소 설립 및 법인명 ㈜메디쎄이로 변경등의 본격적인 척추 임플란트 전문 기업으로 기반을 다지게 되었습니다.
현재 임상에서 사용되는 당사의 척추 임플란트 제품군은 특허권을 기반으로 경쟁업체에 비해 우월한 기술력을 인정받았으며, 2012년 중소기업청 과제를 시작으로 다양한 척추 임플란트 및 3D 프린팅 기술기반의 임플란트 개발 등의 정부 R&D 국책 사업을 통해 다양한 제품 개발을 완료하였습니다. 또한, 추가적인 기술개발을 통해 다양한 형태의 추간체 유합 보형재, 추간체 고정재 제품군을 보유하고 있습니다. 2011년 국내 최초 금속 3D 프린팅 장비를 도입하여 많은 시행 착오끝에 국내 최초로 금속 3D 프린팅 기술 기반의 환자 맞춤형 임플란트(Cranioplasty)의 식약처 인허가를 획득하였습니다. 또한, 광대뼈, 안와연, 사지(四肢) 및 장골부위에 해당하는 환자 맞춤형 임플란트를 국내 최초로 개발하여 제품군을 확대하였으며, 이러한 업적을 인정받아 정부기관으로부터 다수의 표창을 수여하였으며, 2015년 충북 제천으로의 본사 이전과 더불어 코넥스 시장 상장 등의 본격적인 글로벌 기업으로의 도약을 시작하였습니다. 2012년부터 미국을 기점으로 멕시코, 브라질, 칠레 4개의 해외직접투자법인과 1개의 중국 합자법인을 설립하고 해외 시장에 진출 및 수출을 가속화하며 2018년에는 1,000만불 수출탑을 수상 하였습니다. 2020년 현재 당사에는 약 100여명의 임직원이 종사하고 있으며, 국내 척추 임플란트 시장의 1~2위의 점유율 차지하며 지속적인 국내 및 해외 시장에서의 성장 가도를 위해 노력하고 있습니다.
(4) 경기변동과의 관계와 제품의 라이프사이클 등
고령화 사회 진행으로 인한 의료수요의 증가
한국은 2018년 고령사회(Aged Society)에 진입할 전망이다. UN 기준에 따르면, 65세 이상 인구가 전체 인구의 7% 이상이 되면 고령화사회(Aging Society), 14% 이상이 되면 고령사회(aged society), 20% 이상이 되면 초고령사회(Super-aged society)로 구분한다. 65세 이상 노년인구가 증가하면서 인구고령화(Population Aging)가 급격히 진행되고 있다. 2000년 7.2%에 불과하던 65세 이상의 인구 구성비는 2017년 13.8%로 상승하고, 2018년 14.2%, 2065년까지 42.5%에 달할 것으로 예상된다.
한국은 2000년 고령화사회에 진입했고, 2018년 고령사회로 진입할 전망이다. 한국은 고령화사회에서 고령사회에 도달하기까지 18년, 초고령사회로의 진입 기간은 8년으로 다른 선진국 대비 가장 빠르게 고령화가 진행되고 있다. 미국, 일본, 독일은 고령사회로 진입하는데 각각 73년, 24년, 40년 소요된 것으로 분석된다. 한국은 고령화 속도가 다른 선진국보다 빠르게 진행되고 있기 때문에 정부 정책 및 기업전략 등에 있어서 각별한 관심을 가질 필요가 있습니다.
지속적인 노인의 증가는 의료비용의 증가를 의미합니다. 하지만 의료비용의 증가율은 노인인구의 증가율보다 훨씬 높게 나타납니다. 여기에는 여러 가지 이유가 있겠지만 가장 큰 이유 중 하나는 평균수명이 늘어난 만큼 건강하게 살수있는 기간이 늘어나지 못하기 때문입니다. 통계청 자료에 따르면 평균수명은 점차 늘어나고 있지만 건강수명은 오히려 줄어들고 있습니다. 여기서 건강수명이랑 질병 등 신체적 어려움으로 인해 곤란을 겪지 않고 살아갈 수 있는 평균적인 수명을 의미합니다.
노인인구는 지속적으로 증가하여 고령사회에 접어들었지만, 건강하게 살고자 하는 욕구에 의해 의료지출비용 또한 증가하고 있습니다. 고령화의 진행과 웰빙을 위한 욕구는 전체 의료산업, 특히 당사와 관련된 정형/신경외과용 의료기기 분야의 헬스케어 부문, 척추 및 관절치료 등과 관련된 의료기기에 대한 수요가 꾸준히 증가할 것으로 예측됩니다.
경기변동에 따른 영향
의료기기 산업의 특성 상 타 산업에 비해 대부분 경기변동에 따른 민감도가 적은 편입니다. 그러나, 당사의 주력 제품이 속하는 분야인 정형/신경외과의 경우 고가의 치료비를 수반하는 일부 수술 치료는 경기가 위축될 경우 환자들의 부담으로 인해 의료수요가 감소할 수 있으나, 당사의 제품군이 포함된 수술적 치료방법의 경우 보험적용 및 환자의 실비보험 시스템으로 인해 다양한 의료혜택을 적용받음에 따라 경기변동에는 크게 영향이 없는 것으로 보고되고 있습니다.
의료기기 가격 정책에 따른 수요 변동
의료기기산업의 가격은 의료정책 및 가격 관리제도에 밀접한 영향을 받기 때문에 의료기기의 보험급여 적용 여부와 수가 수준에 따라 의료기기의 수요변동에 영향을 미칠 수 있습니다.
계절적인 요인에 의한 수요의 변동
계절적인 요인으로 노인층 인구가 많은 농촌의 경우 지역 특성상 농번기에는 수술에 대한 수요가 줄어들고 농한기인 겨울철에 수요가 많이 몰리는 특성이 있습니다. 도시의 경우에는 염증이 발생하기 쉬운 여름철보다는 겨울철에 수술을 하는 경향이 뚜렷합니다. 최근에는 삶의 질 향상에 따른 익스트림 스포츠, 등산 등 여가활동이 많아지면서 골절 등 사고 사례가 많아지고 있으며, 활동이 많아지는 겨울 외 시즌의 수요도 증가추세에 있습니다.
제품의 라이프 사이클
대부분의 의료기기가 병원 등의 의료기관에서 사용되기 위해서는 관련 법령에 따라 각종 시험 및 인허가를 받아야 하는데 오랜 시간과 비용이 소요되며, 의료기법의 획기적인 발전과 이에 대한 확실한 검증이 없는 한 대체재를 수용하지 아니하는 의료업의 보수성에 따라 타 산업에 비해 월등히 긴 라이프 사이클을 가지고 있습니다. 당사의 주력 제품인 척추 임플란트 역시 티타늄, PEEK 등 인체 적합성과 내구성이 검증된 소재를 기반으로 통상 20년 이상의 반영구적인 수명을 가질 수 있도록 설계, 제작하고 있습니다. 또한, 일부 품목의 경우 멸균제품으로 유효기간이 3~5년으로 설정이 되어 있으나, 멸균 유효기간 이후 재멸균하여 사용가능함에 따라 제품 자체의 유효기간은 영구적으로 정의할수 있습니다.
(5) 사업 구조
(가) 주요 원재료 수급 현황
의료용 원재료는 매우 엄격한 품질관리를 요하며, ISO(International Organization for Standardization), ASTM(American Society for Testing and Materials), FDA Guidance 등 표준기관의 표준을 득한 검증된 재료만 사용하여야 합니다.
당사의 주요 제품 중 척추 임플란트 경우 원재료인 임플란트의 생산에는 의료용 티타늄 합금과 폴리머 소재인 PEEK를 사용합니다. 그리고 수술기구는 ASTM F899 TYPE의 스테인리스강을 사용하여 가공합니다.
척추 임플란트 및 인공관절에 사용되는 원재료는 대부분 미국과 영국 등에서 수입되고 있으므로 국제 원자재 가격 시세에 따라 수입 가격이 변동됩니다. 티타늄 및 스테인리스강 가격의 경우 인상 및 하락을 반복하고 있으나 PEEK의 시세는 매우 안정적입니다. 또한, 산업의 발전과 원소재 제련 기술의 발달 및 당사의 구매량 증대에 따라 향후 추가적인 원가 절감도 가능할 것으로 기대됩니다.
·티타늄 : 제조사의 사정에 따라 주문 후 납기까지의 소요기간이 길게는 5개월, 짧게는2주일 정도 소요되므로 당사는 안정적 공급을 위하여 판매 예측수량을 근거로 한 연간수급계획을 공급사와 공유하여 안정적인 수급을 유지할 수 있도록 관리하고 있습니다.
·스테인리스 스틸 : 발주 후 납기까지의 소요기간이 평균 2주일 정도 소요되어 최소 2~3개월의 사용 예상량을 재고로 운영하여 생산 투입에 차질이 없도록 유지하고 있습니다.
·PEEK(Polyether ether ketone) : 제조사의 사정에 따라 주문 후 납기까지의 소요기간이 길게는 2개월, 짧게는 3주일 정도 소요되므로 당사는 안정적 공급을 위하여 판매 예측수량을 근거로 한 연간수급계획을 공급사와 공유하여 안정적인 수급을 유지할 수 있도록 관리하고 있습니다.
(나). 시장 현황
① 시장의 특성
ⓐ 의료산업 및 의료기기 산업 특성
의료산업은 크게 의료서비스(75%), 의약품(15%), 의료기기(5%), 의료소모품(5%) 등으로 구성되어 있습니다. 전체 의료시장에서 4분의 3을 차지하는 의료서비스 시장은 주로 자국민진료를 위한 공공재 성격이 강한 폐쇄성을 보이고 있으며, 이에 따라 시장 확대를 통한 성장이 매우 제한적입니다. 일부 의료 선진국은 외국인 환자 유치(의료관광)를 통해 별도의 수익을 창출하기 위해 노력하고 있지만, 이 역시 성장에 한계가 있다고 볼 수 있습니다.
결국 의료산업 성패는 의약품과 의료기기에 달려 있습니다. 시장조사 전문기관인 플런켓 리서치에 따르면 세계 의료시장(산업)은 6조 1,500억달러(2013년 기준)로 전 세계 국내총생산(GDP)에서 8.2%를 차지하는 것으로 나타나고 있습니다. 우리나라 의료시장 규모는 의료서비스, 의약품, 의료기기 등을 포함해900억달러(약 100조원)로 세계 의료시장에서 차지하는 비중은 약 1.5%에 불과한 것이 현실입니다.
세계 의료기기 시장은 2008년 글로벌 금융위기 직후인 2009년에는 4.2% 감소하였지만, 2010년과 2011년에는 두 자리수의 성장을 실현하였고, 2014년 이후에는 5% 이상의 성장이 이어질 것으로 분석되고 있습니다. 매우 익숙해진 용어지만 고령화, 웰빙 및 건강에 대한 관심 고조 등은 성장 요인으로 여전히 유효하다고 볼수 있으며 또한 중국, 인도, 브라질 등 신흥국의 경제 성장 및 소득 증가와 이에 따른 의료서비스 수요 증가 등도 의료기기 시장의 전망을 긍정적으로 이끄는 요인이 되고 있습니다.
GlobalData의 전망에 의하면, 2015년 세계 의료기기 시장 규모는 4,158억 달러로 2014년 대비 5.7% 성장할 것으로 추정되며, 매년 꾸준히 시장 규모가 성장하여 2020년까지 연평균 6.4%, 시장은 5,679억 달러 규모에 이를 것으로 전망되고 있습니다.
(출처 : Medical Equipment Market, Global(2013-2020), GlobalData)
2013년 국가별 의료기기 시장 규모는 전체 3,402억 달러이며, 미국, 일본, 독일 등 주요 선진국이 대부분의 의료기기 시장을 점유하고 있습니다. 미국의 시장 규모는 1,338억 달러로 세계시장의 약 39.3% 차지하는 것으로 나타났으며, 상위 20개 국가가 전체의 88.8%를 차지하는 것으로 나타났습니다. 일본은 310억 달러(9.1%)로 의료기기 시장규모가 세계에서 두 번째로 큰 국가로 유지하고 있으며, 독일 268억 달러(7.9%)과 중국 187억 달러(5.5%), 프랑스 150억 달러(4.4%) 등 순서로 나타나고 있습니다. 우리나라의 경우 2014년 의료기기 시장 규모는 전세계 11위로 2013년에 이어 2년 연속 11위를 기록하며 50억 달러(1.5%)를 차지하고 있습니다. 특히 중국의 경우 신의약 위생체제 개혁 및 의료기기 세대교체 수요 등으로 인해 2014년 시장규모의 성장율은 20%를 상회할 것으로 전망되고 있습니다.
(출처 : The World Medical Markets Fact Book 2014, MBI & (재)원주의료기기테크노벨리 의료기기시장 기술정보지)
당사의 지사가 있는 미국, 멕시코 칠레, 브라질, 그리고 중국으로 구성된 아프리카, 아시아 시장은 전체 시장의 약 69%로 우수한 성과를 낼 수 있을것으로 사료됩니다.
ⓑ 규제환경 등
의료기기산업은 정부의 의료정책 및 관리제도와 밀접한 관련성이 있습니다. 의료기기산업은 인간의 생명과 보건에 관련된 제품을 생산하는 산업으로 국민의 건강증진 및 건강권 확보 등에 직간접적 영향을 받기 때문에 정부의 인허가 등 규제가 필요합니다. 따라서 정부는 의료기기 생산 및 제조, 임상시험 등 안전규제, 유통 및 판매 등 안전성, 유효성 확보, 지적재산권 보장 등에 대하여 규제하고 있습니다.
대한민국 의료기기 관련 규제 현황
|
단계 |
관련 법규 |
관련 기관 |
|---|---|---|
|
제조업 허가 |
의료기기법 및 동 시행령 |
식약처 |
|
품목 허가 |
의료기기 허가 등에 관한 규정 의료기기 등급분류 및 지정 등에 관한 규정 |
|
|
품질적합심사 (KGMP) |
의료기기 기술문서 등 심사에 관한 규정 |
품질관리 심사기관 |
|
제품생산 및 판매 |
의료기기 제조/수입 품질관리 기준 |
- |
|
국가명 |
규제기관 |
관련법규 |
품질시스템 |
|---|---|---|---|
|
유럽 |
National Competent |
MDD 93/42/EEC as amended by MDD |
ISO 13485 |
|
미국 |
FDA |
FD&C Act (Federal food, drug & cosmetic Act) |
QSR |
|
멕시코 |
COFEPRIS |
Ley General de Salud Reglamento de Insumos para la Salud (보건용 제품, 소재에 관한규칙) |
ISO 13485 |
|
브라질 |
ANVISA |
Law No.6360,decree No. 79,094/972.RDC-185 |
ISO 13485 |
|
중국 |
CFDA |
의료기기 감독 관리 조례 중국 국령 |
ISO 13485 |
|
일본 |
PMDA |
Pharmaceutical and Medica Device Law (PMDL) |
ISO 13485 |
특허를 통해 독점성이 보장되는 제약산업과 달리, 의료기기산업은 후발기업이 혁신기술을 개발하는 경우 선발기업보다 그 수혜를 더 누릴 수 있는 가능성이 매우 높습니다. 따라서, 선발기업은 빠른 시일 내에 인허가, 의료기술평가, 보험급여라는 모든 규제장벽을 넘어서야만 개발에 대한 대가를 누릴 수 있게 됩니다.. 국내 및 해외 각국가별 다양한 제품을 등록하기 위해 성능평가 및 생물학적 안전성, 멸균시험 등에 대해 국제표준규격에 의거한 시험 리포트를 구비해야 하며 이렇게 축적된 데이터를 바탕으로 신규개발 제품의 인허가 및 보헙급여 획득에 관한 규정 및 절차를 준수해야 합니다. 당사는 기업부설연구소 설립 이후 국제 표준 규격(ISO, ASTM)에 따라 기술개발제품의 선행 연구, 다양한 성능평가시험을 완료하여 국내외 허가(MFDS, FDA, CE, CFDA, ANVISA) 허가를 완료 하였습니다. 뿐만 아니라, 당사가 보유한 성능평가시험 장비를 바탕으로 척추 및 정형외과, 환자 맞춤형 임플란트에 관한 모든 성능평가시험 진행이 가능하며, 약 300건이상의 시험 성적서도 보유하고 있어 국내 및 해외 각국가별 다양한 제품의 등록이 가능한 역량을 보유하고 있습니다.
② 시장 규모 및 전망
ⓐ 척추 임플란트 시장
세계 의료기기 시장은 2018년 현재 약 4,979억 달러 규모이며 연평균 6.4%의 성장률 지속적인 증가가 예상됩니다. 지역별 시장 규모는 당사의 시장이 포함된 아시아의 경우 약 5.1%의 연평균 성장률로 2018년 103억 달러의 시장 규모로 파악되고 있습니다.
![이미지: [세계 의료기기 시장 규모]](%5B%EC%84%B8%EA%B3%84%20%EC%9D%98%EB%A3%8C%EA%B8%B0%EA%B8%B0%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%5D.jpg) |
|
[세계 의료기기 시장 규모] |
세계 의료기기 시장 중 척추 임플란트 시장의 규모는 2019년 약 87억 달러에서 2024년 약 101억 달러까지 지속적인 성장률을 보일 것으로 예상되며, 당사의 제품군이 포함된 제품시장은 2016년 71억 달러에서 2021년 82억 달러로 약 3.15%의 성장률로 시장 규모가 확대될 것으로 전망되고 있습니다. (출처 : BMI Espicom(2015), Worldwide Medical Devices Market Forecasts to 2020)
당사의 제품군의 대다수가 포함된 척추 임플란트의 시장(Spinal decompression, Spinal fusion, 82%) 제품의 규모가 매년 확대됨에 따라 매출액 대비 수출액의 비중이 높은 당사의 해외 매출액의 성장 가능성이 높을 것으로 판단됩니다. (출처 : Global Spinal surgery device market, Mordor Intelligence, 2019)
![이미지: [세계 척추 임플란트 시장 규모 및 임플란트 마켓 비율]](%5B%EC%84%B8%EA%B3%84%20%EC%B2%99%EC%B6%94%20%EC%9E%84%ED%94%8C%EB%9E%80%ED%8A%B8%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%20%EB%B0%8F%20%EC%9E%84%ED%94%8C%EB%9E%80%ED%8A%B8%20%EB%A7%88%EC%BC%93%20%EB%B9%84%EC%9C%A8%5D.jpg) |
|
[세계 척추 임플란트 시장 규모 및 임플란트 마켓 비율] |
세계 척추 임플란트 시장은 상위 3개의 글로벌 기업이 50%에 육박하는 시장을 점유하고 있는 과점시장이며, 약 35%의 점유율을 차지하고 있는 기타 기업의 경우 당사가 포함된 아시아 국가의 중소기업으로 예상되며, 점차 점유율을 확대하고 있는 시장 추세에 따라 당사의 해외 시장 점유율도 증가할 것으로 사료되며, 매출액 신장도 기대하고 있습니다.
다국적 기업이 세계시장의 대다수를 차지하는 이유는 제품의 모든 line-up을 갖추고 있기 때문입니다. 다국적 기업이 차지하는 약 65% 시장을 바로 확보할 수는 없지만, 이들과 경쟁하기 위해 당사도 15년간 모든 척추임플란트 제품을 개발 및 검증을 완료하였으며 기반시설 구축 완료에 따른 원가절감으로 시장진입이 가속화 될 것으로 예상됩니다. 또한, 당사는 척추 임플란트 제품군과 더불어 기존 제품에 3D 프린팅 기술을 접목한 다양한 형태의 척추 임플란트를 판매, 개발하고 있어 추후 척추 임플란트의 시장 점유율을 확보하는데 큰 시너지 효과를 기대할 것으로 예상하고 있습니다.
당사의 매출액의 90%이상 차지하는 흉요추용 척추 임플란트는 글로벌 대기업과 견줄만한 제품 Line-up를 갖추고 있으며, 해당 제품이 포함된 시장은 2016년 약 27억 달러에서 연평균 2.91%의 성장률로 2024년 약 36억 규모의 시장으로 성장할 것으로 예상하고 있다. (출처 : Global Spinal surgery device market, Mordor Intelligence, 2019)
ⓑ 3D 프린팅 기술 기반 임플란트 시장
세계 3D 프린팅 기술 기반 산업의 시장 규모는 2016년 61억달러로 연평균 27.6%씩 증가되어 2022년 262억 달러의 고성장이 예상되는 시장입니다. 당사의 제품군이 포함된 의료/치과 분야의 전체 시장의 약 11%로 2016년 6.7억달러의 규모에서 2022년 28.8억 달러의 성장이 예상되고 있습니다.
뿐만 아니라, 미국, 유럽, 중국 등 주요국은 3D 프린터의 기능(제작 속도, 정밀도 향상 등)개선, 티타늄 등의 다양한 신소재 개발, 바이오와의 결합 등의 활용되는 적용영역이 확대됨에 따라 3D 프린팅 기술의 의료기기 수요는 더욱 더 성장할 것으로 예상됩니다.
![이미지: [세계 3D 프린팅 시장 규모]](%5B%EC%84%B8%EA%B3%84%203d%20%ED%94%84%EB%A6%B0%ED%8C%85%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%5D.jpg) |
|
[세계 3D 프린팅 시장 규모] |
국내 3D 프린팅 시장 규모의 경우 2016년 3천억원 규모에서 2022년 1조원 규모로 연평균 24%의 고성장률을 보일 것으로 예상되고 있으며, 당사의 3D 프린팅 기반 환자 맞춤형 임플란트가 포함된 의료분야는 전체시장의 약 6% 정도로 약 204억 규모로 추산되고 있습니다. (출처 : 2018년 신개발 의료기기 전망분석보고서, 식품의약품안전처)
현재 국내에서는 일부 병원에서 3D 프린터를 이용한 보청기 제작 및 얼굴뼈 이식, 머리뼈, 관절 수술 등에 제한적으로 사용되고 있지만, 최근 국가차원의 연구개발 집중 투자 등으로 보철, 임플란트, 치과보형물 등 다양한 분야로도 확대되고 있어 시장의 큰 성장이 예상됩니다.
![이미지: [국내 3D 프린팅 시장 규모]](%5B%EA%B5%AD%EB%82%B4%203d%20%ED%94%84%EB%A6%B0%ED%8C%85%20%EC%8B%9C%EC%9E%A5%20%EA%B7%9C%EB%AA%A8%5D.jpg) |
|
[국내 3D 프린팅 시장 규모] |
국내 3D 프린팅 관련 국내 허가 현황의 경우 총 25개의 품목이 식약처 허가를 획득한 것으로 보고되고 있으며, 이러한 품목 중 33%가 당사의 제품군으로 보고되고 있습니다. 당사는 3D 프린팅 시장 초기에 제품군 Line-up을 확보하여 판매 및 시장점유율을 확보하고 있으며, 추가적인 연구·개발을 바탕으로 국내 및 해외 시장까지 점유율을 확대해 나가고 있습니다. 뿐만 아니라, 최근 문재인 정부 이후 정부는 3차원 프린팅산업 진흥법(2016.12.23.)에 의거하여 수립한 3D프린팅산업 진흥 기본계획(2017~2019)을 의결(2016.12.27., 정보통신전략위원회)하고, 기본계획의 4대 전략 12대 중점과제를 구체화하여 2017년 3D프린팅산업 진흥 시행계획 심의·확정(2017.3.31., 관계부처 합동)을 통해 3D 프린팅 기술에 관한 정책적인 지원 범위를 확대하여 다양한 부처에서 3D 프린팅 관련 R&D 연구 및 실증사업을 독려하고 있습니다. 최근 당사는 산업통상자원부의 지원아래 3D 프린팅 환자 맞춤형 실증사업을 5개의 대학병원과 공동으로 진행하고 있습니다. 이러한 정부의 지원을 통한 신뢰성 강화 및 신개념의료기기 및 신 의료기술로써 가능성 검증, 의료기기품목코드 확보 및 의료수가 등재 등 신산업으로 육성 강화를 통해 3D 프린팅 환자 맞춤형 임플란트의 전국 병원으로의 활용 촉진 및 지원이 가능할것으로 예상되고 있습니다. 또한, 당사는 국가공인시험기관(KTL, KTR, KCL 등)과 공동의 3D 프린팅 임플란트 관련 KGMP 가이드라인 제정 및 수립도 진행하고 있으며, 수립이후 3D 프린팅 임플란트 관련 다양한 신사업 육성 및 의료기기 시장진출 기간 단축등의 다양한 효과가 발생할것으로 예상하고 있습니다.
나. 회사의 현황
(1) 회사의 성장과정
|
구분 |
생산 및 판매활동 개요 |
영업상 주요전략 |
|---|---|---|
|
설립기 (2003~2004) |
생산 공장 설립 의료기기 제조업 인허가 |
사업의 시작 단계 제품의 연구개발 단계 |
|
성장기 (2005~2014) |
국내 판매 증대 및 수출 주력 생산시설확대 및 제품군 확대 (Titanium 3D Printer 구입) 한국 내 기업부설연구소 설립 및 미국 내 연구소 설립 미국 FDA승인 및 품질심사, CE 인증, 브라질 ANVISA 품질 심사, GMP인증, ISO 13485 등 국내 및 해외 국가별 제품 인증 및 허가 획득 미국 해외현지법인 설립 및 판매 주력 해외 제품 인증 수출국 30개국 |
판매망 확대 제품의 다양성 확보 신제품연구 및 국책 연구과제 수행을 통한 제품개발 제품 인증을 통한 품질의 우수성 확보 미국시장 판매망 확대 해외시장 판매망 확대 |
|
상장신청기 (2015~현재) |
신규사업영역 확대 (Trauma, 인공관절 등) 충북 제천시 본사 및 공장 확장 이전 해외현지법인 : 칠레, 멕시코, 브라질 해외 신규 1개국 제품인증 진행중 |
환자맞춤형 제품생산 등 판매제품의 다양화 영업망 확대 해외 수출시장의 확대 |
(2) 주요 제품
![이미지: [주요 제품 개요]](%5B%EC%A3%BC%EC%9A%94%20%EC%A0%9C%ED%92%88%20%EA%B0%9C%EC%9A%94%5D.jpg) |
|
[주요 제품 개요] |
당사는 척추 임플란트를 전문적으로 판매하고 있는 의료기기 업체로서 2003년 설립되었으며 최근 5년 간 수출비중이 매출액 대비 50% 이상인 수출주도형 기업입니다. 설립초기부터 대표이사를 중심으로 연구 개발에 전념하였으며 많은 의료진과 퇴행성 디스크 질환 및 척추 병변을 치료하는 추간체 고정재와 확장형 추간체 유합 보형재 개발 시작으로 회사가 성장하였습니다. 이러한 개발품들은 특허 등록까지 완료하여 경쟁업체에 비해 우월한 기술력을 인정받았습니다. 뿐만 아니라, 추가적인 기술개발을 통해 다양한 형태의 추간체 유합 보형재, 추간체 고정재 제품군을 보유하고 있습니다.
2011년 국내 최초 금속 3D프린팅 장비를 도입하였으며, 약 4년간의 연구개발을 통하여 국내최초로 금속 3D 프린팅 기술 기반의 환자 맞춤형 임플란트(Cranioplasty)의 식약처 인허가를 획득하였습니다. 뿐만 아니라, 2012년 중소기업청 창업성장과제를 시작으로 약 10건 이상 3D 프린팅 기술 기반의 제품에 관한 정부 지원을 발판으로 다양한 3D 프린팅 관련 연구 및 제품 개발 완료, 임상적용 등의 성과도 도출하였습니다.
또한, 광대뼈, 안와연, 사지(四肢) 및 장골부위에 해당하는 환자 맞춤형 임플란트를 국내 최초로 개발하여 제품군을 확대하였으며, 매년 3~4개의 특허출원 및 다양한 품목군의 기술개발에 매진하고 있습니다. 현재는 경추, 흉요추에 사용되는 약 20여개의 척추 임플란트, 상지 및 하지용 Trauma 제품군을 포함한 정형외과 제품군을 구성하여 국내외 시장에 판매하고 있습니다.
·흉, 요추(Thoracolumbar) 임플란트
- 추간체 고정재 : Pedicle screw system
흉, 요추 부위에 사용되는 추간체 고정재는 척추간 협착증과 흉, 요추부 통증을 격고 있는 환자들의 수술적 치료에 사용되는 가장 널리 알려진 척추 임플란트입니다. ‘흉, 요추용 추간체 고정재’는 척추체 후방에서 척추경을 관통하여 위 또는 아래 척추에 삽입하고 긴 봉과 함께 고정나사로 고정해 주는 방식으로 최초의 척추 임플란트로 현재까지 가장 보편적으로 사용되고 있는 수술용 임플란트입니다.
당사의 해당제품으로는 척추고정에 사용되는 고정나사의 풀림과 체결시 발생되는 엇갈림의 문제를 역사다리꼴 나사모양과 선형의 슬롯을 추가하여 정확하고 단단하게 고정하는 기술이 접목된 Iliad & Zenius 제품이 있으며, Buttress 나사산 적용으로 보다 안정적으로 사용가능한 Kora 제품이 있습니다.
하지만, 2000년대 이후 척추 수술후 발생하는 인접 부위의 퇴행을 감소하기 위해 운동성을 접목시킨 Rod 형태의 제품이 각광받기 시작하였으며, 이러한 개념을 접목시킨 Wave 형태의 Rod로 구성되어 있는 당사의 WaveFlex system을 개발하여 인접부위의 퇴행을 방지하는 목적의 제품을 판매하고 있습니다.
2010년대 이후 시술 부위를 최소한으로 절개를 하여 흉터를 최소화 할 수 있는 최소침습형 (MIS: Minimal Invasive surgery) 추간체 고정재가 보편화되기 시작하였으며, 이에 당사도 최소칩습형 개념의 추간체 고정재와 특수한 기능의 수술용 기구 시스템을 구축한 ArteMIS 제품으로 환자 및 임상의에게 만족도가 높은 제품을 제공하고 있습니다.
- 추간체 유합 보형재 : Interbody Fusion cage
흉요추용 추간체 고정재와 더불어 사용되는 흉,요추용 추간체 유합보형재는 수핵 탈출증(Disc Herniation), 디스크 퇴행 (Disc Degeneration Disease) 등의 질병에 사용 되며, 추간판 디스크 제거 후 척추체 사이에 삽입되어 척추의 전만 각도 및 디스크 높이를 유지하는 목적으로 하는 제품입니다. 최초의 추간체 유합보형재는 보편적으로 검증이 완료된 티타늄합금 소재를 이용한 직육면체형태의 제품이 보편적으로 사용되어졌습니다. 이에 당사도 티타늄 소재를 활용한 직육면체형태의 Dynamic cage 제품을 2004년도에 국내 식약처 허가를 획득하여 꾸준하게 임상적으로 사용되어지고 있습니다.
하지만, 2000년대 이후 인체의 뼈와 유사한 탄성계수와 특성을 가지고 있는 PEEK(Polyether Ether Ketone) 소재의 개발로 금속재질의 추간체 유합 보형재를 대체하여 사용되어졌습니다. 당사의 경우 Bullet 형상 디자인으로 쉽게 삽입이 가능한 구조의 LP cage 제품을 개발 완료하여 침강현상을 줄이는 장점의 제품으로 판매되고 있습니다. 뿐만 아니라, 추간체 유합 보형재의 경우 수술접근 방법에 따라 후방, 전방, 측방, 측후방 접근법에 따라 다양한 형태의 제품이 임상적으로 요구됨에 따라 Taurus-TL, AL, DL cage를 개발 완료하여 다양한 수술적 방법에 사용되어지고 있습니다.
척추의 경우 하중 분산 및 운동성 유지를 위해 ‘S’ 형태의 만곡을 가지고 있습니다. 이러한 척추 전만각도를 유지하기 위한 형태의 추간체 유합보형재의 필요성이 제기되어 최소한의 절개 및 제품 삽입 후 앞쪽부분을 확장하여 척추의 전만각도를 만들어주는 확장형 추간체 유합보형재가 대세를 이루고 있습니다. 이에 당사도 티타늄 소재의 VariAn & 티타늄과 PEEK 재질의 EP cage를 개발하여 국내외 다양한 국가에서 사용되어지고 있습니다.
최근 3D 프린팅 기술을 활용하여 골유합율을 극대화시킨 다공성 구조의 추간체 유합보형재가 대세를 이루고 있습니다. 이에 당사의 경우 2013년 정부 국책과제를 통해 Medussa cage를 개발하여 골다공증 환자에 특화된 미세 다공성구조의 추간체 유합보형재를 국내 최초 개발 및 식약처 인허가 획득하여 국내 최대 임상사례를 보유하고 있으며, 나아가 FDA 인허가까지 완료하여 국내외 임상에 사용되어 지고 있습니다. 또한 이러한 기술력을 바탕으로 기존 PEEK 재질의 소재와 3D 프린팅 기술을 접목한 Triton cage도 제품화하여 사용되어지고 있습니다.
- 척추 극돌기간 삽입체 : Interspinous process device
척추의 후방부위로 접근하여 흉요추의 척추 극돌기간에 삽입되는 제품으로 척추 디스크의 높이 회복 및 안정화를 도모하는 제품의 OMEGA 과 spike 형태의 고정장치를 이용하여 척추 극돌기간에 고정시켜 척추의 운동성을 제한하는 제품의 SOL을 개발하여 꾸준하게 시장에서 사용되어지고 있습니다.
·경추(cervical) 임플란트
- Cervical screw system (경추용 추간체 고정재)
당사는 경추 임플란트에 대한 거의 모든 라인업을 갖추고 있어 환자의 증상에 따라 척추체 전, 후 모든 방향에서 수술적 접근이 가능합니다. 특히 경추 추간체 고정재의 경우 척추관 협착증(Stenosis), 척추 변형(Deformity), 척추 전방 전위증(Spondylolisthesis) 등의 질병에 사용되는 제품으로 경추 수술 초기부터 꾸준됩니다. 당사의 Poseidon 제품의 경우 보통의 경추에만 사용되는 타사의 제품과 달리 후두부 고정 판과 흉추 고정용 하우징을 포함하여 다양한 환자에게 적용이 가능합니다.
- Cervical Interbody Fusion cage (경추용 추간체 유합 보형재)
경추용 추간체 유합보형재는 수핵 탈출증(Disc Herniation), 디스크 퇴행 (Disc Degeneration Disease) 등의 질병에 사용 되며, 추간판 디스크 제거 후 척추체 사이에 삽입되어 경추의 전만 각도 및 디스크 높이를 유지하는 목적으로 하는 제품입니다. 최초의 경추용 추간체 유합보형재는 인체의 뼈와 유사한 탄성계수와 특성을 가지고 있는 PEEK(Polyether Ether Ketone) 소재를 활용한 제품으로 당사의 제품으로는 C7 cage 있습니다.
또한, 최근 3D 프린팅 기술의 추세에 따라 경추부위에도 골유합율을 극대화시킨 다공성 구조의 추간체 유합보형재가 임상에서 보편적으로 사용되고 있으며, 당사의 제품으로는 Medussa-C가 임상에서 사용되어지고 있습니다.
하지만, 최근 임상적인 보고에 의하면 박스형태의 제품의 경우 시술 후 불안정한 고정력으로 인해 침강 및 이탈현상이 발생됨에 따라 나사를 이용한 기능성 추간체 유합보형재의 필요성이 제기되어 티타늄 나사를 결합시켜 고정력을 증대시킨 Unicorn-CS, Unicorn-CC 제품이 개발하여 시장에서 사용되어지고 있습니다.
- Cervical Plate system (경추 전방 금속판)
경추용 추간체 고정재와 수술적 접근법이 다른 전방 금속판 제품으로 경추의 앞부분으로 시술되어 척추관 협착증(Stenosis), 척추변형(Deformity), 척추 전방 전위증(Spondylolisthesis) 등의 질병에 사용 됩니다. 당사의 Athena 제품이 사용되어지고 있으며, 경추의 전방 부위에 삽입되는 금속 판 과 나사로 구성되어 있는 제품으로 수술후 환자의 이물감을 줄이기 위해 최소 두께(2mm)로 설계 되었으며, screw의 이탈 현상을 방지하기 위한 확장형 링 메커니즘을 포함하고 있습니다.
·환자 맞춤형 임플란트 (Custom-made)
당사의 금속 3D프린터를 활용한 환자 맞춤형 임플란트의 가장 큰 장점은 환자의 해부학적 형상에 맞게 제작하는 것입니다. 당사의 임플란트는 단순고정을 넘어 기능적, 심미적 회복까지 가능합니다. 또한 골절, 선, 후천적 골기형과 골결손에 대한 치료범위의 제한이 없으며, 임플란트 디자인 과정에서 수술계획까지 예측하여 불필요한 주변조직 제거 없이 수술시간 단축과 출혈과 감염 등의 합병증을 혁신적으로 단축하게 합니다. 또한 표면조절을 통해 다공성 구조를 생성하여 높은 안전성과 골생성 촉진을 통해 환자의 빠른 회복을 가능하게 합니다.
·고강도 외상고정(Trauma) 임플란트
외상 고정 임플란트는 인체 형상에 맞춰 해부학적인 데이터를 기반으로 제작이 필요 합니다. 따라서 기존의 일반적인 기계 가공으로 제조가 어렵고 프레스등의 장비로 제조를 하게 됩니다. 그러나 국내외 대부분의 회사들은 기술력의 한계로 인해 구조적인 강도가 낮으면 가공이 쉬운 순수 티타늄으로 제품을 생산하고 있습니다. 그러나 당사는 외상고정 임플란트 제작에 있어 고강도의 티타늄 합금(Ti6Al4V-ELI)을 사용하여 당사만의 노하우로 고온, 고압을 적용하여 제품을 생산해 내는 기술을 개발하였습니다. 고강도 소재와 생산기술 적용으로 임플란트의 두께를 줄일 수 있어 환자의 이물감을 최소화 할 수 있습니다.
(3) 영업 현황 및 해외진출 계획
(가) 국내 영업현황
한국보건산업진흥원의 자료에 따르면 우리나라 의료기기시장 규모는 2016년 5조 8,733억원으로 전년 대비 11.5% 증가했고, 2012년부터 2016년까지 연평균 6.3%의 성장성을 보이고 있습니다. 우리나라 의료기기 중 척추 임플란트와 가장 유사한 품목은 추간체고정보형재이며, 추간체고정보형재에는 추간체 고정재, 특수재질추간체고정재, 추간체유합보형재, 특수재질추간체유합보형재, 인공추간판, 특수재질인공추간판 등이 포함되는데 국내 생산규모는 2016년 55,415백만원, 수출액 29,026백만원, 수입액 30,886백만원입니다. 우리나라의 2017년 의료기기 시장규모는 세계 9위로 58억달러이며 세계 의료기기 시장에서 차지하는 비중은 1.6%로 입니다.
이와 같이 하여 동사의 국내영업활동 또한 국내 수술 현황과 시장요구에 맞는 척추 임플란트와 척추 수술기구 등을 개발 제조하여 전국의 대리점을 통해 국내 유수의 대형병원 및 전문병원 납품되어 사용하고 있습니다. 2015년 기준으로 지속적으로 척추시장의 임플란트(Pedicle screw, cage 군) 시장 점유율의 경우 국내 의료기기 제조업체들의 점유율이 확대되는것으로 나타났으며 cage 시장의 경우 국내제조업체가 60% 점유율, pedicle screw 시장의 경우도 약 60% 가까운 시장 점유율이 나타나는것으로 분석됩니다.
(나) 해외 영업현황 및 진출계획
2006년 터키를 첫 수출국으로 시작한 메디쎄이 해외 수출은 국내 시장의 판매 증가에 발맞춰 더 넓은 시장으로의 진출을 위하여 수출국 및 수출량을 꾸준히 증대시켜 왔고, 현재는 세계 33개 국으로 수출을 하고 있으며, 2019년 현재 제품 인증진행 중인 1개 국가들의 인증이 완료된다면 수출국의 수는 약 34개가 될 것입니다.
세계적으로 큰 시장에 대한 공격적인 영업 및 마케팅과 연계된 매출 증대를 위하여 미국에 2010년 1월에 미국지사를 설립하였고, 2012년12월에 미국지사를 폐쇄하고동사가 100% 지분을 소유한 미국현지법인(MEDYSSEY USA INC)을 설립하여 미국에서의 입지를 확대해 나가고 있습니다. 미국 시장은 앞으로도 당사의 차별화된 제품개발 및 국내 및 해외 고객들간의 상호 학술교류의 장으로 큰 역할을 할 중요한 시장으로 역할을 하게 될 것입니다.
더불어, 세계 정형외과용 의료기기 전체 시장 매출 중 가장 큰 비중을 형성하고 있는 북미/남미 지역(1,546억 달러/45.4%) 중 멕시코(Medyssey S.A. de C.V), 칠레 (Medyssey SPA), 브라질(MEDYSSEY DO BRASIL COMERCIO)에도 동사가 100% 지분을 소유한 해외현지법인을 설립하여 동사의 정형외과용 임플란트 유통을 주사업으로 영위하고 있으며 독자적인 영업 및 자사 브랜드 이미지 구축 중에 있으며 주변 남미 국가들로의 영향력 확대를 통해 해외시장 개척에 따른 매출 확대에 기여하고 있습니다.
또한, 미국 시장 다음으로 미래 중요한 거대 시장으로 떠오를 중국은 현지 생산을 통한 적극적인 영업 및 마케팅 망 확대를 위하여 중국 충칭에 동사가 50% 지분을 소유한 합자법인(MEDYSSEY MEDICAL DEVICE CO.,LTD)을 설립하였고 2017년말에는 현지생산공장을 완공하였으며 현지공장에서 생산된 제품으로 인증받고, 판매하여 전체 수출 중 많은 비중을 차지하는 시장으로 부각될 것으로 예측됩니다.
종합해 볼때, 세계적인 의료기기 시장의 성장과 더불어 동사가 영위하고 있는 척추임플란트 시장의 안정적인 성장이 기대되는 가운데 안정적인 영업환경과 비젼을 갖추고 있는 동사는 국내 의료기기 시장과 더불어 정형외과용 의료기기 시장의 산업 전반을 발전시키는 계기가 될 수 있을 것으로 보입니다.
조직도
① 한국법인
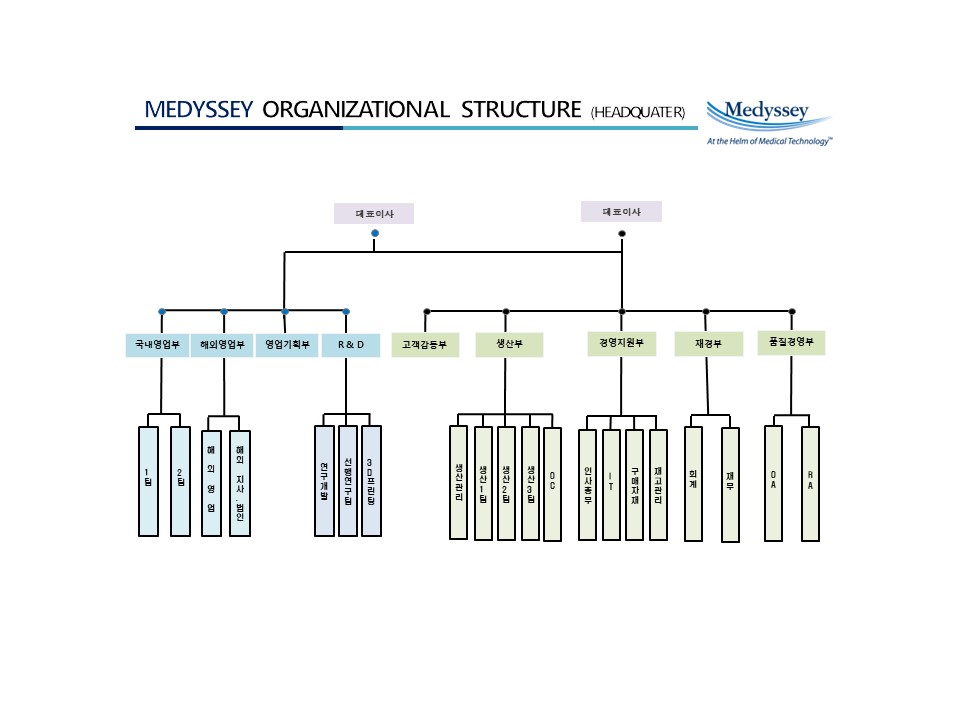 |
|
조직도 |
② 해외법인
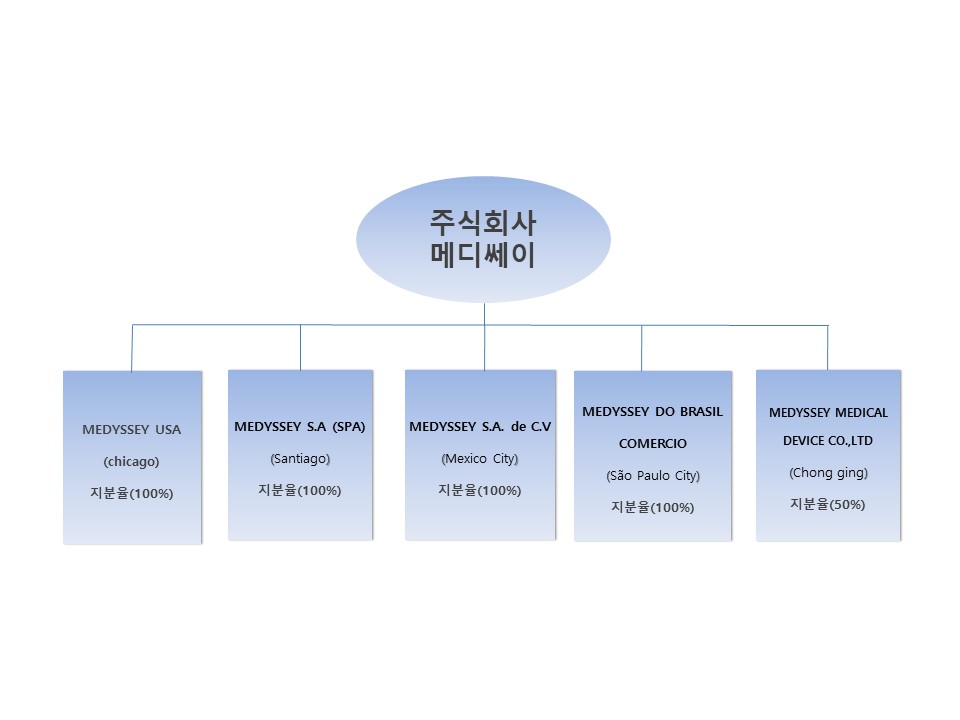 |
|
조직도(해외법인) |
2. 주주총회 목적사항별 기재사항
□ 재무제표의 승인
제1호 의안 : 제18기 연결(별도) 재무제표 및 이익잉여금처분계산서 승인의 건
가. 해당 사업연도의 영업상황의 개요
나. 해당 사업연도의 대차대조표(재무상태표)ㆍ손익계산서(포괄손익계산서)ㆍ이익잉여금처분계산서(안) 또는 결손금처리계산서(안)
| ※ 연결 및 별도재무제표는 외부감사인의 회계감사 및 검토가 완료되지 않았으며, 외부감사인의 감사 및 정기주주총회 승인 결과에 따라 일부 변경될 수 있습니다. |
1) 연결 재무제표
| 연 결 재 무 상 태 표 | |
| 제 18(당) 기말 : 2020년 12월 31일 현재 | |
| 제 17(전) 기말 : 2019년 12월 31일 현재 | |
| 주식회사 메디쎄이와 그 종속기업 | (단위 : 원) |
| 과 목 | 주석 | 제 18(당) 기말 | 제 17(전) 기말 | ||
|---|---|---|---|---|---|
| 자 산 | |||||
| Ⅰ. 유동자산 | 17,936,968,008 | 17,607,108,475 | |||
| 1. 현금및현금성자산 | 4,6,7 | 7,961,635,064 | 4,280,558,150 | ||
| 2. 매출채권및기타채권 | 4,6,8,32 | 5,835,907,803 | 8,203,895,005 | ||
| 3. 기타유동금융자산 | 4,6,10,32 | 2,556,800 | 2,894,500 | ||
| 4. 기타유동자산 | 16 | 119,533,523 | 272,266,024 | ||
| 5. 당기법인세자산 | 179,666,271 | 140,773,034 | |||
| 6. 재고자산 | 9 | 3,837,668,547 | 4,706,721,762 | ||
| Ⅱ. 비유동자산 | 16,493,049,440 | 17,003,106,938 | |||
| 1. 공동기업투자주식 | 11 | 2,501,294,511 | 2,406,667,514 | ||
| 2. 기타비유동금융자산 | 4,6,10,32 | 87,578,691 | 159,821,160 | ||
| 3. 유형자산 | 12 | 9,448,229,015 | 9,778,480,038 | ||
| 4. 사용권자산 | 13 | 220,102,886 | 316,998,874 | ||
| 5. 무형자산 | 14 | 166,253,895 | 216,687,170 | ||
| 6. 투자부동산 | 15 | 3,763,688,407 | 3,690,265,559 | ||
| 7. 이연법인세자산 | 29 | 305,902,035 | 434,186,623 | ||
| 자 산 총 계 | 34,430,017,448 | 34,610,215,413 | |||
| 부 채 | |||||
| Ⅰ. 유동부채 | 17,071,797,699 | 17,137,622,647 | |||
| 1. 매입채무및기타채무 | 4,6,17,32 | 2,585,280,700 | 3,199,055,348 | ||
| 2. 단기차입금 | 4,6,18,30 | 9,800,000,000 | 9,400,000,000 | ||
| 3. 유동성전환상환우선주 | 4,6,18,30 | 2,997,095,939 | 3,689,679,094 | ||
| 4. 기타유동금융부채 | 4,6,19 | 29,500,000 | 29,500,000 | ||
| 5. 미지급법인세 | 61,509,409 | 93,829,022 | |||
| 6. 기타유동부채 | 20 | 301,148,302 | 382,249,733 | ||
| 7. 파생상품부채 | 4,5,6,18 | 1,297,263,349 | 343,309,450 | ||
| Ⅱ. 비유동부채 | 302,049,525 | 618,155,014 | |||
| 1. 장기매입채무및기타채무 | 262,049,525 | 178,155,014 | |||
| 2. 장기차입금 | 4,6,17,32 | - | 400,000,000 | ||
| 3. 기타비유동금융부채 | 4,6,18,30 | 40,000,000 | 40,000,000 | ||
| 부 채 총 계 | 17,373,847,224 | 17,755,777,661 | |||
| 자 본 | |||||
| 지배기업소유주지분 | 17,056,170,224 | 16,854,437,752 | |||
| Ⅰ. 자본금 | 21 | 1,739,079,500 | 1,739,079,500 | ||
| Ⅱ. 자본잉여금 | 22 | 5,409,253,500 | 5,409,253,500 | ||
| Ⅲ. 기타포괄손익누계액 | 22 | 197,857,656 | (137,739,583) | ||
| Ⅳ.이익잉여금 | 23 | 9,709,979,568 | 9,843,844,335 | ||
| 비지배지분 | - | - | |||
| 자 본 총 계 | 17,056,170,224 | 16,854,437,752 | |||
| 부 채 와 자 본 총 계 | 34,430,017,448 | 34,610,215,413 | |||
| 연 결 포 괄 손 익 계 산 서 | |
| 제 18(당) 기 : 2020년 01월 01일부터 2020년 12월 31일까지 | |
| 제 17(전) 기 : 2019년 01월 01일부터 2019년 12월 31일까지 | |
| 주식회사 메디쎄이와 그 종속기업 | (단위 : 원) |
| 과 목 | 주석 | 제 18(당) 기 | 제 17(전) 기 | ||
|---|---|---|---|---|---|
| Ⅰ. 매출액 | 31,32 | 18,758,825,055 | 19,968,062,824 | ||
| Ⅱ. 매출원가 | 24,32 | 6,505,774,912 | 6,974,148,062 | ||
| Ⅲ. 매출총이익 | 12,253,050,143 | 12,993,914,762 | |||
| 판매비와관리비 | 24,25 | 9,430,901,939 | 11,038,728,574 | ||
| 대손상각비 | 4,6 | 429,732,427 | 36,267,265 | ||
| Ⅳ. 영업이익(손실) | 2,392,415,777 | 1,918,918,923 | |||
| 1. 금융수익 | 6,26,32 | 181,460,796 | 367,513,625 | ||
| 2. 금융비용 | 6,26 | 2,399,905,503 | 987,408,716 | ||
| 3. 기타수익 | 6,27,32 | 135,416,463 | 683,531,589 | ||
| 4. 기타비용 | 6,27 | 381,988,212 | 343,160,619 | ||
| 5. 지분법이익 | 11 | 77,841,724 | (30,854,186) | ||
| Ⅴ. 법인세비용차감전순이익(손실) | 5,241,045 | 1,608,540,616 | |||
| 법인세비용(수익) | 29 | 139,105,812 | 160,340,179 | ||
| Ⅵ. 당기순이익(손실) | (133,864,767) | 1,448,200,437 | |||
| 지배주주지분 | (133,864,767) | 1,448,200,437 | |||
| 비지배지분 | - | - | |||
| Ⅶ. 기타포괄손익 | 335,597,239 | 138,098,007 | |||
| 후속적으로 당기손익으로 재분류되는 항목 | 335,597,239 | 138,098,007 | |||
| 지분법자본변동 | 11 | 16,785,273 | 43,334,444 | ||
| 해외사업환산손익 | 318,811,966 | 94,763,563 | |||
| Ⅷ. 당기총포괄손익 | 201,732,472 | 1,586,298,444 | |||
| 지배주주지분 | 201,732,472 | 1,586,298,444 | |||
| 비지배지분 | - | - | |||
| Ⅸ. 주당손익 | |||||
| 1. 기본주당이익(손실) | 28 | (41)원 | 379원 | ||
| 2. 희석주당이익(손실) | 28 | (41)원 | 379원 | ||
| 연 결 자 본 변 동 표 | |
| 제 18(당) 기 : 2020년 01월 01일부터 2020년 12월 31일까지 | |
| 제 17(전) 기 : 2019년 01월 01일부터 2019년 12월 31일까지 | |
| 주식회사 메디쎄이와 그 종속기업 | (단위 : 원) |
| 과 목 | 주석 | 자본금 | 자본잉여금 | 기타포괄손익누계액 | 이익잉여금 | 총계 |
|---|---|---|---|---|---|---|
| 2019.01.01(당기초) | 1,739,079,500 | 5,409,253,500 | (275,837,590) | 8,395,643,898 | 15,268,139,308 | |
| 총포괄손익 | ||||||
| 당기순이익 | - | - | - | 1,448,200,437 | 1,448,200,437 |
|
| 지분법자본변동 | 11,22 | - | - | 43,334,444 | - | 43,334,444 |
| 해외사업환산손익 | 22 | - | - | 94,763,563 | - | 94,763,563 |
| 2019.12.31(당기말) | 1,739,079,500 | 5,409,253,500 | (137,739,583) | 9,843,844,335 | 16,854,437,752 | |
| 2020.01.01(당기초) | 1,739,079,500 | 5,409,253,500 | (137,739,583) | 9,843,844,335 | 16,854,437,752 | |
| 총포괄손익 | ||||||
| 당기순이익 | - | - | - | (133,864,767) | (133,864,767) |
|
| 지분법자본변동 | 11,22 | - | - | 16,785,273 | - | 16,785,273 |
| 해외사업환산손익 | 22 | - | - | 318,811,966 | - | 318,811,966 |
| 2020.12.31(당기말) | 1,739,079,500 | 5,409,253,500 | 197,857,656 | 9,709,979,568 | 17,056,170,224 |
| 연 결 현 금 흐 름 표 | |
| 제 18(당) 기 : 2020년 01월 01일부터 2020년 12월 31일까지 | |
| 제 17(전) 기 : 2019년 01월 01일부터 2019년 12월 31일까지 | |
| 주식회사 메디쎄이와 그 종속기업 | (단위 : 원) |
| 과 목 | 주석 | 제 18(당) 기 | 제 17(전) 기 | ||
|---|---|---|---|---|---|
| Ⅰ. 영업활동으로 인한 현금흐름 | 5,529,360,015 | 4,306,821,062 | |||
| 1. 영업으로부터 창출된 현금 | 30 | 5,951,397,012 | 4,973,084,566 | ||
| 2. 이자의 수취 | 5,229,996 | 1,942,508 | |||
| 3. 이자의 지급 | (330,892,461) | (293,615,062) | |||
| 4. 법인세의 납부 | (96,374,532) | (374,590,950) | |||
| Ⅱ. 투자활동으로 인한 현금흐름 | (764,537,606) | (130,632,021) | |||
| 1. 투자활동으로 인한 현금유입액 | 202,093,445 | 204,799,743 | |||
| 가. 기타유동금융자산의 감소 | 177,008 | 2,156,453 | |||
| 나. 유형자산의 처분 | 8,636,364 | 142,909,091 | |||
| 다. 기타비유동금융자산의 감소 | 91,280,073 | 59,734,199 | |||
| 라. 정부보조금의 수령 | 102,000,000 | - | |||
| 2. 투자활동으로 인한 현금유출액 | (966,631,051) | (335,431,764) | |||
| 가. 기타유동금융자산의 증가 | - | 2,739,278 | |||
| 나. 유형자산의 취득 | 711,696,869 | 265,602,906 | |||
| 다. 투자부동산의 취득 | 112,076,000 | - | |||
| 라. 무형자산의 취득 | 123,137,434 | 29,075,789 | |||
| 마. 기타비유동금융자산의 증가 | 19,720,748 | 38,013,791 | |||
| Ⅲ. 재무활동으로 인한 현금흐름 | (828,765,701) | (2,264,248,359) | |||
| 1. 재무활동으로 인한 현금유입액 | 5,000,000,000 | 2,400,000,000 | |||
| 가. 단기차입금의 차입 | 5,000,000,000 | 2,000,000,000 | |||
| 나. 장기차입금의 차입 | - | 400,000,000 | |||
| 2. 재무활동으로 인한 현금유출액 | (5,828,765,701) | (4,664,248,359) | |||
| 가. 단기차입금의 상환 | 5,000,000,000 | 1,748,018,831 | |||
| 나. 리스사채의 상환 | 136,182,546 | 115,854,199 | |||
| 다. 상환전환우선주의 상환 | 692,583,155 | 2,770,375,329 | |||
| 라. 임대보증금의 감소 | - | 30,000,000 | |||
| Ⅳ. 현금및현금성자산의 증가(감소) | 3,936,056,708 | 1,911,940,682 | |||
| Ⅴ. 기초 현금및현금성자산 | 4,280,558,150 | 2,381,635,679 | |||
| Ⅵ. 현금및현금성자산의 환율변동효과 | (254,979,794) | (13,018,211) | |||
| Ⅶ. 기말 현금및현금성자산 | 7,961,635,064 | 4,280,558,150 | |||
2) 별도 재무제표
| 재 무 상 태 표 | |
| 제 18(당) 기말 : 2020년 12월 31일 현재 | |
| 제 17(전) 기말 : 2019년 12월 31일 현재 | |
| 주식회사 메디쎄이 | (단위 : 원) |
| 과 목 | 주석 | 제 18(당) 기말 | 제 17(전) 기말 | ||
|---|---|---|---|---|---|
| 자 산 | |||||
| I. 유동자산 | 17,324,597,000 | 17,231,555,897 | |||
| 1.현금및현금성자산 | 4,6,7 | 6,490,644,118 | 3,506,989,698 | ||
| 2.매출채권및기타채권 | 4,6,8 | 6,910,332,804 | 8,898,508,449 | ||
| 3.기타유동자산 | 88,062,975 | 121,961,878 | |||
| 4.당기법인세자산 | 16 | 356,140 | - | ||
| 5.재고자산 | 3,835,200,963 | 4,704,095,872 | |||
| II. 비유동자산 | 9 | 16,184,276,194 | 18,850,117,485 | ||
| 1.종속기업및관계기업투자 | 11 | 2,597,340,150 | 3,717,026,150 | ||
| 2.기타비유동금융자산 | 4,6,10 | 67,213,000 | 1,295,302,000 | ||
| 3.유형자산 | 12 | 9,027,172,270 | 9,383,676,220 | ||
| 4.사용권자산 | 13 | 220,102,886 | 282,668,171 | ||
| 5.무형자산 | 14 | 163,620,031 | 214,105,788 | ||
| 6.투자부동산 | 15 | 3,763,688,407 | 3,690,265,559 | ||
| 7.이연법인세자산 | 29 | 345,139,450 | 267,073,597 | ||
| 자 산 총 계 | 33,508,873,194 | 36,081,673,382 | |||
| 부 채 | |||||
| I. 유동부채 | 16,380,845,444 | 16,539,859,992 | |||
| 1.매입채무및기타채무 | 4,6,17,30 | 2,038,771,655 | 2,622,520,955 | ||
| 2.단기차입금 | 4,6,18,30 | 9,800,000,000 | 9,400,000,000 | ||
| 3.유동성전환상환우선주부채 | 4,6,18,30 | 2,997,095,939 | 3,689,679,094 | ||
| 4.기타유동금융부채 | 4,6,19 | 29,500,000 | 29,500,000 | ||
| 5.미지급법인세 | 53,536,028 | 38,415,974 | |||
| 6.기타유동부채 | 20 | 164,678,473 | 416,434,519 | ||
| 7.파생상품부채 | 4,5,6 | 1,297,263,349 | 343,309,450 | ||
| II. 비유동부채 | 302,049,525 | 618,155,014 | |||
| 1.장기차입금 | 4,6,18,30 | - | 400,000,000 | ||
| 2.장기매입채무및기타채무 | 4,6,17,30 | 262,049,525 | 178,155,014 | ||
| 3.기타비유동금융부채 | 4,6,19,30 | 40,000,000 | 40,000,000 | ||
| 부 채 총 계 | 16,682,894,969 | 17,158,015,006 | |||
| 자 본 | |||||
| I.자본금 | 21 | 1,739,079,500 | 1,739,079,500 | ||
| II. 자본잉여금 | 22 | 5,409,253,500 | 5,409,253,500 | ||
| Ⅲ.이익잉여금 | 23 | 9,677,645,225 | 11,775,325,376 | ||
| 자 본 총 계 | 16,825,978,225 | 18,923,658,376 | |||
| 부 채 와 자 본 총 계 | 33,508,873,194 | 36,081,673,382 | |||
| 포 괄 손 익 계 산 서 | |
| 제 18(당) 기 : 2020년 01월 01일부터 2020년 12월 31일까지 | |
| 제 17(전) 기 : 2019년 01월 01일부터 2019년 12월 31일까지 | |
| 주식회사 메디쎄이 | (단위 : 원) |
| 과 목 | 주석 | 제 18(당) 기 | 제 17(전) 기 | ||
|---|---|---|---|---|---|
| Ⅰ. 매출액 | 31,32 | 18,755,027,300 | 19,967,106,466 | ||
| Ⅱ. 매출원가 | 24,32 | 6,848,240,380 | 6,964,134,827 | ||
| Ⅲ. 매출총이익 | 11,906,786,920 | 13,002,971,639 | |||
| 판매비와관리비 | 24,25,32 | 9,297,988,819 | 11,158,514,670 | ||
| 대손상각비 | 4,6 | 424,649,013 | (91,211,180) | ||
| Ⅳ. 영업이익(손실) | 2,184,149,088 | 1,935,668,149 | |||
| 1. 금융수익 | 6,26,32 | 169,637,750 | 318,714,898 | ||
| 2. 금융비용 | 6,26 | 1,999,478,506 | 888,114,115 | ||
| 3. 기타수익 | 6,27 | 106,942,557 | 259,962,274 | ||
| 4. 기타비용 | 6,27 | 2,583,050,968 | 41,093,563 | ||
| Ⅴ.법인세비용차감전순이익(손실) | (2,121,800,079) | 1,585,137,643 | |||
| 법인세비용(수익) |
29 | (24,119,928) | (13,597,344) | ||
| Ⅵ. 당기순이익(손실) | (2,097,680,151) | 1,598,734,987 | |||
| Ⅶ. 기타포괄손익 | - | - | |||
| Ⅷ. 당기총포괄이익(손실) | (2,097,680,151) | 1,598,734,987 | |||
| Ⅸ. 주당손익 | |||||
| 1. 기본주당이익(손실) |
28 | (556) | 418 | ||
| 2. 희석주당이익(손실) |
28 | (556) | 418 | ||
| 자 본 변 동 표 | |
| 제 18(당) 기 : 2020년 01월 01일부터 2020년 12월 31일까지 | |
| 제 17(전) 기 : 2019년 01월 01일부터 2019년 12월 31일까지 | |
| 주식회사 메디쎄이 | (단위 : 원) |
| 과 목 | 주석 | 자본금 | 자본잉여금 | 이익잉여금 | 총계 |
|---|---|---|---|---|---|
| 2019.01.01(전기초) | 1,739,079,500 | 5,409,253,500 | 10,176,590,389 | 17,324,923,389 | |
| 총포괄손익 | |||||
| 당기순이익 | - | - | 1,598,734,987 | 1,598,734,987 | |
| 2019.12.31(전기말) | 1,739,079,500 | 5,409,253,500 | 11,775,325,376 | 18,923,658,376 | |
| 2020.01.01(당기초) | 1,739,079,500 | 5,409,253,500 | 11,775,325,376 | 18,923,658,376 | |
| 총포괄손익 | |||||
| 당기순이익 | - | - | (2,097,680,151) | (2,097,680,151) | |
| 2020.12.31(당기말) | 1,739,079,500 | 5,409,253,500 | 9,677,645,225 | 16,825,978,225 |
| 현 금 흐 름 표 | |
| 제 18(당) 기 : 2020년 01월 01일부터 2020년 12월 31일까지 | |
| 제 17(전) 기 : 2019년 01월 01일부터 2019년 12월 31일까지 | |
| 주식회사 메디쎄이 | (단위 : 원) |
| 과 목 | 주석 | 제 18(당) 기 | 제 17(전) 기 | ||
|---|---|---|---|---|---|
| I.영업활동으로 인한 현금흐름 | 4,840,206,891 | 4,833,549,287 | |||
| 1.영업으로부터 창출된 현금 | 30 | 5,202,854,127 | 5,145,306,080 | ||
| 2.이자 수취 | 4,903,699 | 42,142,503 | |||
| 3.이자 지급 | (328,368,924) | (291,138,044) | |||
| 4.법인세 납부 | (39,182,011) | (62,761,252) | |||
| II.투자활동으로 인한 현금흐름 | (897,191,171) | (847,864,475) | |||
| 1.투자활동으로 인한 현금 유입액 | 181,136,364 | 181,759,091 | |||
| 가.유형자산의 처분 | 8,636,364 | 142,909,091 | |||
| 나.정부보조금의 수령 | 102,000,000 | - | |||
| 다.임차보증금의 감소 | 70,500,000 | 38,850,000 | |||
| 2.투자활동으로 인한 현금 유출액 | 1,078,327,535 | 1,029,623,566 | |||
| 가.장기대여금의 대여 | 291,745,000 | 906,420,000 | |||
| 나.유형자산의 취득 | 551,225,535 | 58,346,566 | |||
| 다.무형자산의 취득 | 123,070,000 | 29,000,000 | |||
| 라.투자부동산의 취득 | 112,076,000 | ||||
| 마.임차보증금의 증가 | 211,000 | 35,857,000 | |||
| III.재무활동으로 인한 현금흐름 | (794,277,076) | (2,230,881,639) | |||
| 1.재무활동으로 인한 현금 유입액 | 5,000,000,000 | 2,400,000,000 | |||
| 가.단기차입금의 차입 | 5,000,000,000 | 2,000,000,000 | |||
| 나.장기차입금의 차입 | - | 400,000,000 | |||
| 2.재무활동으로 인한 현금 유출액 | 5,794,277,076 | 4,630,881,639 | |||
| 가.단기차입금의 상환 | 5,000,000,000 | 1,748,018,831 | |||
| 나.리스부채의 상환 | 101,693,921 | 82,487,479 | |||
| 다.상환전환우선주의 상환 | 692,583,155 | 2,770,375,329 | |||
| 라.임대보증금의 상환 | - | 30,000,000 | |||
| IV.현금및현금성자산의 순증가(감소) | 3,148,738,644 | 1,754,803,173 | |||
| V.기초 현금및현금성자산 | 3,506,989,698 | 1,764,136,995 | |||
| Ⅵ.환율효과 | (165,084,224) | (11,950,470) | |||
| Ⅶ.기말 현금및현금성자산 | 6,490,644,118 | 3,506,989,698 | |||
이익잉여금처분계산서(안) 또는 결손금처리계산서(안)
| 제 18(당)기 | 2020년 01월 01일 | 부터 | 제 17(전)기 | 2019년 01월 01일 | 부터 |
| 2020년 12월 31일 | 까지 | 2019년 12월 31일 | 까지 | ||
| 처분예정일 | 2021년 03월 23일 | 처분확정일 | 2020년 03월 30일 |
| (단위 : 천원) |
| 과 목 | 당기 | 전기 | ||
|---|---|---|---|---|
| Ⅰ. 미처분이익잉여금 | 9,677,645,225 | 11,775,325,376 | ||
| 1. 전기이월미처분이익잉여금 | 11,775,325,376 | 10,176,590,389 | ||
| 2. 당기순이익(손실) | (2,097,680,151) | 1,598,734,987 | ||
| 합 계 | 9,677,645,225 | 11,775,325,376 | ||
| Ⅱ. 이익잉여금처분액 | - | - | ||
| III. 차기이월미처분이익잉여금 | 9,677,645,225 | 11,775,325,376 | ||
- 최근 2사업연도의 배당에 관한 사항
: 해당사항 없습니다.
□ 이사의 선임
제2호 의안 : 이사 선임 승인의 건
가. 후보자의 성명ㆍ생년월일ㆍ추천인ㆍ최대주주와의 관계ㆍ사외이사후보자 등 여부
| 후보자성명 | 생년월일 | 사외이사 후보자여부 |
감사위원회 위원인 이사 분리선출 여부 |
최대주주와의 관계 | 추천인 |
|---|---|---|---|---|---|
| 이인덕 | 1973년12월9일 | 해당사항 없음 | 해당사항 없음 | 임원 | 이사회 |
| 총 ( 1 ) 명 | |||||
나. 후보자의 주된직업ㆍ세부경력ㆍ해당법인과의 최근3년간 거래내역
| 후보자성명 | 주된직업 | 세부경력 | 해당법인과의 최근3년간 거래내역 |
|
|---|---|---|---|---|
| 기간 | 내용 | |||
| 이인덕 | 現) 동화약품 전략기획실 상무 | 2018년06월 ~ 현재 2016년12월 ~ 2018년05월 2008년03월 ~ 2016년01월 |
동화약품 전략기획실 상무 |
해당사항 없음 |
다. 후보자의 체납사실 여부ㆍ부실기업 경영진 여부ㆍ법령상 결격 사유 유무
| 후보자성명 | 체납사실 여부 | 부실기업 경영진 여부 | 법령상 결격 사유 유무 |
|---|---|---|---|
| 이인덕 | 해당사항 없음 | 해당사항 없음 | 해당사항 없음 |
라. 후보자의 직무수행계획(사외이사 선임의 경우에 한함)
| - |
마. 후보자에 대한 이사회의 추천 사유
| 상기 추천자는 현재 최대주주인 동화약품 주식회사에서 해당분야에 대한 폭넓은 경험을 갖춘 전문가로 향후에는 우리회사의 지속적인 발전과 기업가치 제고에 도움이 될 것으로 판단하여 추천합니다. |
확인서
 |
|
확인서-이인덕 |
※ 기타 참고사항
: 해당사항 없습니다.
□ 이사의 보수한도 승인
제3호 의안 : 이사 보수한도 승인의 건(보수총액10억원, 전년도와 동일)
가. 이사의 수ㆍ보수총액 내지 최고 한도액
(당 기)
| 이사의 수 (사외이사수) | 6 ( 1 ) |
| 보수총액 또는 최고한도액 | 10억원 |
(전 기)
| 이사의 수 (사외이사수) | 6 ( 1 ) |
| 실제 지급된 보수총액 | 611백만원 |
| 최고한도액 | 10억원 |
※ 기타 참고사항
: 해당사항 없습니다.
□ 감사의 보수한도 승인
제4호 의안 : 감사 보수한도 승인의 건(보수총액1억원, 전년도와 동일)
가. 감사의 수ㆍ보수총액 내지 최고 한도액
(당 기)
| 감사의 수 | 1 |
| 보수총액 또는 최고한도액 | 1억원 |
(전 기)
| 감사의 수 | 1 |
| 실제 지급된 보수총액 | 12백만원 |
| 최고한도액 | 1억원 |
※ 기타 참고사항
: 해당사항 없습니다.
IV. 사업보고서 및 감사보고서 첨부
가. 제출 개요
| 제출(예정)일 | 사업보고서 등 통지 등 방식 |
|---|---|
| 2021년 03월 15일 | 1주전 회사 홈페이지 게재 |
주) 감사보고서는 2021년03월15일에 회사 홈페이지에 게재할 예정입니다.
나. 사업보고서 및 감사보고서 첨부
당사는 2021년03월15일 감사보고서를 전자공시시스템(http://dart.fss.or.kr)에
공시하고 당사 홈페이지(http://www.medyssey.co.kr→ KOREAN → 공지사항) 에 게재할 예정입니다. 또한, 당사는 2021년03월15일 사업보고서를 전자공시시 스템(http://dart.fss.or.kr)에 공시하고 홈페이지(http://www.medyssey.co.kr→ KOREAN → 공지사항)에 게재할 예정입니다.
한편 이 사업보고서는 향후 주주총회 이후 변경되거나 오기 등이 있는 경우 수정 될 수 있으며, 이 경우 전자공시시스템(http://dart.fss.or.kr)에 정정보고서를 공 시할 예정이므로 이를 참조하시기 바랍니다.
※ 참고사항
| 코로나바이러스 감염증-19(COVID-19)의 감염 및 전파를 예방하기 위하여 주주총회에 참석시 주주님들의 체온을 측정할 수 있으며, 측정결과에 따라 발열이 의심 되는 경우, 부득이하게 총회장 출입이 제한될 수 있음을 알려드립니다. 또한, 반드시 마스크 착용을 부탁드립니다. 마스크 미착용시 주주총회 개최장소의 출입이 제한될 수 있습니다. 만약, 주주총회 개최 전 코로나바이러스 확산에 따른 불가피한 장소 변경이 있는 경우, 지체없이 재공시 하여 안내 드릴 예정입니다. |