 |
|
확인서_202008014 |
반 기 보 고 서
(제 5 기 반기)
| 사업연도 | 2020년 01월 01일 | 부터 |
| 2020년 06월 30일 | 까지 |
| 금융위원회 | |
| 한국거래소 귀중 | 2020년 8 월 14 일 |
| 제출대상법인 유형 : | 주권상장법인 |
| 면제사유발생 : | 해당사항 없음 |
| 회 사 명 : | 주식회사 티움바이오 |
| 대 표 이 사 : | 김 훈 택 |
| 본 점 소 재 지 : | 경기도 성남시 분당구 대왕판교로 644번길 49, 4층(삼평동, 다산타워) |
| (전 화)070-4162-7320 | |
| (홈페이지) http://www.tiumbio.com | |
| 작 성 책 임 자 : | (직 책)상무이사 (성 명)고현실 |
| (전 화)070-4162-7320 | |
【 대표이사 등의 확인 】
 |
|
확인서_202008014 |
I. 회사의 개요
1. 회사의 개요
가. 연결대상 종속회사 개황
| (단위 : 백만원) |
| 상호 | 설립일 | 주소 | 주요사업 | 최근사업연도말 자산총액 |
지배관계 근거 | 주요종속 회사 여부 |
|---|---|---|---|---|---|---|
| TiumBio Australia PTY LTD | 2020년 1월 14일 | Level 54, 111 Eagle St, Brisbane, QLD 4000 Australia | 의학 및 약학 연구개발업 | - | 의결권의 과반수 소유 (K-IFRS 1110호) |
해당사항 없음 |
※ 상기 '최근 사업연도말 자산총액'은 2019년도말 기준이며, 상기 종속기업은 '주요 종속회사'의 기준 요건인 "① 최근 사업연도 개별재무제표상 자산총액이 지배회사 개별재무제표상 자산총액의 10% 이상 ② 자산총액이 750억원 이상 기준에 모두 미달합니다.
(1) 연결대상회사의 변동내용
| 구 분 | 자회사 | 사 유 |
|---|---|---|
| 신규 연결 |
TiumBio Australia PTY LTD | 당기 중 신설 |
| - | - | |
| 연결 제외 |
- | - |
| - | - |
나. 회사의 법적ㆍ상업적 명칭
당사의 명칭은 "주식회사 티움바이오"이며, 영문으로는 "TiumBio Co., Ltd"라고 표기합니다.
다. 설립 일자
당사는 2016년 12월 6일에 설립되었습니다.
라. 본사의 주소, 전화번호, 홈페이지
| 구분 |
내용 |
|---|---|
|
주소 |
경기도 성남시 분당구 대왕판교로 644번길 49, 4층(삼평동, 다산타워) |
|
전화번호 |
070-4162-7320 |
|
홈페이지 |
https://www.tiumbio.com |
마. 중소기업 해당여부
당사는 보고서 작성기준일 현재, 중소기업기본법 제2조에 의한 중소기업에 해당됩니다.
바. 벤처기업 해당 여부
당사는 벤처기업육성에 관한 특별조치법에 따른 벤처기업에 해당합니다.
|
구분 |
기준 |
당사 현황 |
적/부합 |
|
|---|---|---|---|---|
|
벤처기업 |
벤처투자기업 (창투사등이 자본금 10%이상 투자) |
한국벤처캐피탈협회 |
확인일자 : 2019.04.13 |
적합 |
|
유효일자 : 2021.04.12 |
||||
사. 주요 사업의 내용 및 신규사업
당사는 희귀/난치성 질환에 대한 치료제를 연구개발하는 기업으로서, 저분자 합성신약 및 바이오신약 양 분야로 혁신 신약을 발굴할 수 있는 역량을 보유하고 있습니다. 또한, 전임상 또는 초기 임상 단계에서의 기술이전을 통해 기술이전 계약금 및 개발단계 별 마일스톤을 수령하고 향후 제품 판매를 통해 로열티를 수령하는 사업모델을 영위하고 있습니다. 기타 자세한 사항은 "Ⅱ. 사업의 내용"을 참조하시기 바랍니다.
| [정관에 기재된 목적 사업] |
|
목 적 사 업 |
|---|
|
1. 의학 및 약학 연구개발업 2. 생명과학관련제품 도소매업 및 수출입업 3. 위 각호에 관련된 부대사업 일체 |
아. 계열회사의 총수, 주요계열회사의 명칭 및 상장여부
당사는 보고서 기준일 현재 독점규제 및 공정거래에 관한 법률 상의 대규모기업집단에 속하여 있지 않습니다.
| 계열회사의 명칭 | 상장여부 | 주요 사업 | 지분율 | 비 고 |
|---|---|---|---|---|
| TiumBio Australia PTY LTD | 비상장법인 | 의학 및 약학 연구개발업 | 100% | 종속기업 |
자. 신용평가에 관한 사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
차. 회사의 주권상장(또는 등록ㆍ지정)여부 및 특례상장에 관한 사항
| 주권상장 (또는 등록ㆍ지정)여부 |
주권상장 (또는 등록ㆍ지정)일자 |
특례상장 등 여부 |
특례상장 등 적용법규 |
|---|---|---|---|
| 코스닥시장 | 2019년 11월 22일 | 기술성장기업의 코스닥시장 상장 | 코스닥시장 상장규정 제2조 제31항에서 정하는 기술성장기업으로서, 동 규정 제7조 제2항의 신규상장심사요건 특례 요건 적용 |
2. 회사의 연혁
가. 회사의 본점 소재지 및 그 변경
|
변경일자 |
주소 |
|---|---|
|
2017.02.13 |
경기도 성남시 분당구 판교로 310, 5층(삼평동) |
|
2017.07.01 |
경기도 성남시 분당구 대왕판교로 644번길 49, 4층(삼평동, 다산타워) |
나. 경영진의 중요한 변동
|
구분 |
변경 전 |
변경 후 |
비고 |
||||
|---|---|---|---|---|---|---|---|
|
대표이사 |
이사 |
감사 |
대표이사 |
이사 |
감사 |
||
|
2016.12.08 |
- |
장진욱 |
최종규 |
- |
장진욱 |
- |
최종규 감사 사임 |
|
2016.12.27 |
- |
장진욱 |
- |
- |
김훈택 |
- |
김훈택 사내이사 선임 장진욱 사내이사 사임 |
|
2017.05.08 |
- |
김훈택 |
- |
김훈택 |
황만순 |
- |
김훈택 대표이사 선임 황만순 사외이사 선임 |
|
2017.10.30 |
김훈택 |
황만순 |
- |
김훈택 |
고현실 황만순 |
- |
고현실 사내이사 선임 |
|
2018.11.16 |
김훈택 |
고현실 황만순 |
- |
김훈택 |
고현실 송인영 김재상 강동필 황만순 |
이종윤 |
송인영 사내이사 선임 김재상 사외이사 선임 강동필 사외이사 선임 황만순 사외이사 사임 /기타비상무이사 선임 이종윤 감사 선임 |
| 2020.03.30 |
김훈택 |
고현실 송인영 김재상 강동필 황만순 |
이종윤 |
김훈택 |
고현실 송인영 김재상 강동필 황만순 |
이종윤 |
김훈택 대표이사 중임 |
다. 최대주주의 변동
당사의 설립 이후 현재까지 최대주주의 변동은 없습니다.
라. 상호의 변동
당사의 설립 이후 현재까지 상호의 변동은 없습니다.
마. 회사가 화의, 회사정리절차 그 밖에 이에 준하는 절차를 밟은 적이 있거나 현재 진행중인 경우 그 내용과 결과
당사는 보고서 작성기준일 현재 해당사항 없습니다.
바. 회사가 합병 등을 한 경우 그 내용
당사는 보고서 작성기준일 현재 해당사항 없습니다.
사. 회사의 업종 또는 주된 사업의 변화
당사는 보고서 작성기준일 현재 해당사항 없습니다.
아. 그 밖에 경영활동과 관련된 중요한 사항의 발생내용
|
구 분 |
내 용 |
|---|---|
|
2016.12 |
㈜티움바이오 설립 |
|
2017.02 |
NCE401 등 주요 파이프라인 관련 특허권 및 기타 유무형자산 자산양수도 계약 체결 (SK케미칼) 본점이전 (경기도 성남시 분당구 판교로 310, 5층(삼평동)) |
|
2017.03 |
기업부설연구소 인증(한국산업기술진흥협회) |
|
2017.04 |
벤처기업 인증(한국벤처캐피탈협회) |
|
2017.06 |
면역항암제 후보물질(NCE401_TU2218) Evaluation & Option Agreement 체결 |
|
2017.07 |
본점이전 (경기도 성남시 분당구 대왕판교로 644번길 49, 다산타워 4층) |
|
2018.04 |
신규 면역항암 치료제 개발 과제 선정(보건복지부) |
|
2018.05 |
병역지정업체 인증(경인지방병무청) |
|
2018.07 |
자궁내막증 치료제(NCE403_TU2670) 유럽 임상 1b상 CTA 승인(독일) |
|
2018.07 |
면역 항암 치료제 특허 전략 개발 과제 선정(특허청) 신규 항암 치료제 임상 전략 개발 과제 선정(보건복지부) |
|
2018.09 |
신규 혈우병 치료제 개발 과제 선정(중소벤처기업부) |
|
2018.12 |
폐질환 신약 후보물질(NCE401) 기술수출 |
|
2019.02 |
자궁내막증 치료제(NCE403_TU2670) 대원제약 기술이전 |
|
2019.06 |
신규 치료용 항체-약물 결합체 개발 과제 선정(한국특허전략개발원) |
| 2019.10 | 자궁내막증 치료제(NCE403_TU2670) 유럽 임상 1b상 완료 |
| 2019.11 | 코스닥시장 상장 |
| 2020.01 | 호주 자회사 설립(TiumBio Australia PTY LTD) |
| 2020.07 | 미국 자회사 설립(Initium Therapeutics Inc.) |
| 2020.07 | 신규 비알콜성지방간염 치료제 개발 과제 선정(중소벤처기업부) |
| 2020.07 | 자궁내막증 치료제(NCE403_TU2670) 유럽(우크라이나) 임상 2a상 신청 |
| 2020.07 | 자궁내막증 치료제(NCE403_TU2670) 유럽(러시아) 임상 2a상 신청 |
3. 자본금 변동사항
가. 자본금 변동 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 원, 주) |
| 주식발행 (감소)일자 |
발행(감소) 형태 |
발행(감소)한 주식의 내용 | ||||
|---|---|---|---|---|---|---|
| 주식의 종류 | 수량 | 주당 액면가액 |
주당발행 (감소)가액 |
비고 | ||
| 2016.12.06 | 유상증자(주주배정) |
보통주 |
2,000 |
5,000 |
5,000 |
설립자본 |
| 2017.01.10 | 유상증자(주주배정) |
보통주 |
38,000 |
5,000 |
5,000 |
주주배정 |
| 2017.01.19 | 유상증자(제3자배정) |
보통주 |
2,400 |
5,000 |
25,000 |
제3자배정 |
| 2017.02.03 | 유상증자(제3자배정) |
보통주 |
1,050 |
5,000 |
100,000 |
제3자배정 |
| 2017.02.07 | 유상증자(제3자배정) |
보통주 |
1,511 |
5,000 |
180,000 |
제3자배정 |
| 2017.02.14 | 유상증자(제3자배정) |
보통주 |
2,651 |
5,000 |
350,000 |
제3자배정 |
| 2017.02.25 | 유상증자(제3자배정) |
보통주 |
280 |
5,000 |
350,000 |
제3자배정 |
| 2017.03.31 | 유상증자(제3자배정) |
우선주 |
15,396 |
5,000 |
584,600 |
전환상환우선주 |
| 2017.05.11 | 유상증자(제3자배정) |
우선주 |
5,132 |
5,000 |
584,600 |
전환상환우선주 |
| 2017.11.30 | 주식분할 |
우선주 |
184,752 |
500 |
- |
- |
| 2017.11.30 | 주식분할 | 보통주 |
431,028 |
500 |
- |
- |
| 2017.11.30 | 무상증자 |
우선주 |
205,280 |
500 |
- |
주주배정 |
| 2017.11.30 | 무상증자 | 보통주 |
478,920 |
500 |
- |
주주배정 |
| 2018.04.27 | 유상증자(제3자배정) |
우선주 |
200,730 |
500 |
54,800 |
전환상환우선주 |
| 2018.05.22 | 유상증자(제3자배정) |
우선주 |
228,103 |
500 |
54,800 |
전환상환우선주 |
| 2018.12.19 | 전환권행사 |
전환상환우선주 |
839,393 |
500 |
- |
(주1) |
| 2018.12.19 | 전환권행사 | 보통주 |
839,393 |
500 |
- |
(주1) |
| 2019.04.22 | 무상증자 |
보통주 |
16,175,097 |
500 |
- |
주주배정 |
| 2019.05.01 | 유상증자(제3자배정) |
보통주 |
240,000 |
500 |
12,500 |
제3자배정 |
| 2019.05.09 | 유상증자(제3자배정) |
보통주 |
2,402,596 |
500 |
15,400 |
제3자배정 |
| 2019.11.15 | 유상증자(일반공모) | 보통주 | 2,575,000 | 500 | 12,000 | 일반공모 |
| 2019.12.11 | 주식매수선택권행사 | 보통주 | 269,900 | 500 | 2,046 | - |
| 2020.04.01 | 주식매수선택권행사 | 보통주 | 12,000 | 500 | 2,046 | - |
| (주1) | 2018년 12월 19일 전환상환우선주의 보통주 전환으로 전환상환우선주 839,393주가 감소하고 보통주 839,393주가 증가하였습니다. |
나. 전환사채 등 발행 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
4. 주식의 총수 등
가. 주식의 총수 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 비고 | |||
|---|---|---|---|---|---|
| 보통주식 | 종류주식 | 합계 | |||
| Ⅰ. 발행할 주식의 총수 | 100,000,000 | - | 100,000,000 | - | |
| Ⅱ. 현재까지 발행한 주식의 총수 | 23,471,826 | - | 23,471,826 | - | |
| Ⅲ. 현재까지 감소한 주식의 총수 | - | - | - | - | |
| 1. 감자 | - | - | - | - | |
| 2. 이익소각 | - | - | - | - | |
| 3. 상환주식의 상환 | - | - | - | - | |
| 4. 기타 | - | - | - | - | |
| Ⅳ. 발행주식의 총수 (Ⅱ-Ⅲ) | 23,471,826 | - | 23,471,826 | - | |
| Ⅴ. 자기주식수 | - | - | - | - | |
| Ⅵ. 유통주식수 (Ⅳ-Ⅴ) | 23,471,826 | - | 23,471,826 | - | |
5. 의결권 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 주) |
| 구 분 | 주식의 종류 | 주식수 | 비고 |
|---|---|---|---|
| 발행주식총수(A) | 보통주 | 23,471,826 | - |
| 우선주 | - | - | |
| 의결권없는 주식수(B) | 보통주 | - | - |
| 우선주 | - | - | |
| 정관에 의하여 의결권 행사가 배제된 주식수(C) | 보통주 | - | - |
| 우선주 | - | - | |
| 기타 법률에 의하여 의결권 행사가 제한된 주식수(D) |
보통주 | - | - |
| 우선주 | - | - | |
| 의결권이 부활된 주식수(E) | 보통주 | - | - |
| 우선주 | - | - | |
| 의결권을 행사할 수 있는 주식수 (F = A - B - C - D + E) |
보통주 | 23,471,826 | - |
| 우선주 | - | - |
6. 배당에 관한 사항 등
가. 배당에 관한 사항
당사 정관에 기재된 배당에 관한 사항은 다음과 같습니다.
|
제11조(신주의 배당기산일) 제51조(이익금의 처분) 제52조(이익배당) ② 이익의 배당을 주식으로 하는 경우 회사가 수종의 주식을 발행한 때에는 주주총회의 결의로 그와 같은 종류의 주식으로 할 수 있다. ③ 이익배당금은 매 결산기말 현재의 주주명부에 기재된 주주 또는 질권자에게 지급한다. ① 본 회사는 이사회의 결의로 사업연도 개시일부터 3월, 6월 및 9월의 말일(이하 “분기배당 기준일”이라 한다)의 주주에게 자본시장과 금융투자업에 관한 법률 제165조의12에 따라 분기배당을 할 수 있다. 분기배당은 금전으로 한다. ② 제1항의 이사회 결의는 분기배당 기준일 이후 45일 내에 하여야 한다. ③ 분기배당은 직전결산기의 대차대조표상의 순자산액에서 다음 각호의 금액을 공제한 액을 한도로 한다. 1. 직전결산기의 자본금의 액 2. 직전결산기까지 적립된 자본준비금과 이익준비금의 합계액 3. 직전결산기의 정기주주총회에서 이익배당하기로 정한 금액 4. 직전결산기까지 정관의 규정 또는 주주총회의 결의에 의하여 특정목적을 위해 적립한 임의준비금 5. 상법 시행령 제19조에서 정한 미실현이익 6. 분기배당에 따라 당해 결산기에 적립하여야 할 이익준비금의 합계액 ④ 사업연도개시일 이후 분기배당 기준일 이전에 신주를 발행한 경우(준비금의 자본전입, 주식배당, 전환사채의 전환청구, 신주인수권부사채의 신주인수권 행사에 의한 경우를 포함한다)에는 분기배당에 관해서는 당해 신주는 직전사업연도말에 발행된 것으로 본다. 다만, 분기배당 기준일 후에 발행된 신주에 대하여는 최근 분기배당 기준일 직후에 발행된 것으로 본다. ⑤ 제8조2의 종류주식에 대한 분기배당은 보통주식과 동일한 배당률을 적용한다. |
나. 최근 3사업연도 배당에 관한 사항
당사는 최근 3사업연도 중 배당을 실시한 내역이 없습니다.
주요배당지표
| 구 분 | 주식의 종류 | 당기 | 전기 | 전전기 |
|---|---|---|---|---|
| 제5기 반기 | 제4기 | 제3기 | ||
| 주당액면가액(원) | 500 | 500 | 500 | |
| (연결)당기순이익(백만원) | -5,304 | -7,091 | -13,752 | |
| (별도)당기순이익(백만원) | -4,845 | - | - | |
| (연결)주당순이익(원) | -226 | -354 | -1,392 | |
| 현금배당금총액(백만원) | - | - | - | |
| 주식배당금총액(백만원) | - | - | - | |
| (연결)현금배당성향(%) | - | - | - | |
| 현금배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주식배당수익률(%) | - | - | - | - |
| - | - | - | - | |
| 주당 현금배당금(원) | - | - | - | - |
| - | - | - | - | |
| 주당 주식배당(주) | - | - | - | - |
| - | - | - | - | |
II. 사업의 내용
[주요 용어 정리]
|
용어 |
해설 |
|---|---|
|
골밀도 (BMD, Bone Mineral Density) |
뼈 안에 기질이나 무기질 따위가 들어 있는 양이나 정도 |
|
기질 (Substrate) |
효소가 인식/결합하여 효소기작 (화학반응)을 시작할 수 있는 물질 |
|
노력성 폐활량 (FVC: Forced Vital Capacity) |
폐 기능을 확인하는 검사지표로 안정된 상태에서 천천히 최대한 깊이 숨을 들이마신 후 최대한 빠르고 세게 내뱉었을 때의 공기의 양을 의미함. |
|
뇌하수체 전엽 |
간뇌의 시상하부 아래쪽에 매달려 있는 내분비 기관임. 프로락틴, 성장 호르몬, 갑상샘 자극 호르몬, 부신피질 자극 호르몬, 난포 자극 호르몬, 황체 자극 호르몬등을 분비함. |
|
동결건조 |
생물학적 의약품 등을 장기적으로 안정하게 보관하기 위한 보관방법으로, 저온으로 동결을 하고 수분을 제거하여 건조하는 방법임. 최대한 동결이나 건조과정으로 인한 변성을 막기 위해 여러 가지 부형제라고 불리는 첨가물질을 사용함. |
|
면역 억제성 사이토카인 (Immunosuppressive cytokine) |
면역 반응에 작용하는 사이토카인으로 면역 반응을 억제하는 기능을 가짐 |
|
면역관문 억제제 (ICI, Immune Checkpoint Inhibitor) |
암세포와 면역체계간의 특정 신호 경로를 공략하여 항암 면역반응을 일으키는 신규 면역치료제 (항PD-1, 항PD-L1, 항CTLA-4)로 현재 대표적인 시판 약으로는 Merck의 Keytruda 와 BMS의 Yervoy, Opdivo 등이 있으며, 흑색종, 폐암, 신장암 치료제 등으로 사용되고 있음 |
|
면역원성 (Immunogenicity) |
개체의 면역을 유발하는 물질의 특성을 말하며, 면역세포 혹은 혈액이나 림프액내의 거대분자를 매개로 면역반응을 유발할 수 있음 |
|
면역치료제/면역항암제 (Cancer Immunotherapy) |
인체의 면역기능을 활성화시키거나 면역체계간 신호 경로를 공략하여 암세포 등을 포함하는 인체 내 유해한 병원체를 치료하는 의약품 |
|
바이오리엑터 (생물반응기, bioreactor) |
생물반응기는 세포나 미생물을 대용량으로 배양하기 위해 고안된 배양기로 배양배지를 교반하고 세포가 필요로 하는 영양분, 온도, 가스등의 출입을 통제할 수 있도록 고안된 기기 |
|
반감기 (Half-life) |
약물의 초기 농도가 절반으로 줄어드는 데 걸리는 시간 |
|
배란억제 |
호르몬 주기에 따라 난자가 배란되는 것을 차단하는 것 |
|
병용요법 (Combination therapy /treatment) |
두 가지 이상의 의약품을 동시에 투여하여 질병을 치료하는 방법 |
|
부정 출혈 (Spotting or breakthrough bleeding) |
월경과는 관계없이 자궁에서 피가 나오는 병. 출혈이 주기으로 있지 않고 때때로 있으며, 7일 이상 계속됨. |
|
부형제 (Exipient) |
동결건조, 알약, 액상 형태 등 여러 형태의 약을 제조하고자 할 때, 효과를 나타내는 활성물질을 제외한 성분을 총칭하여 부형제라고 함. 제조과정에서 약물의 변성을 막거나, 용해나 흡수를 도와주거나, 장기간 안전하게 보관할 수 있도록 도와주는 기능을 하는 물질의 총칭 |
|
블레오마이신 (Bleomycin) |
방사선균 Streptomyces verticillus 균주에서 분리된 항종양성 항생물질로, 특발성 폐섬유화증 동물모델 유도에 이용되는 물질 |
|
비임상 시험 관리 기준 (GLP, Good Laboratory Practice) |
의약품의 안전성 평가를 위하여 실시하는 각종 독성 시험의 신뢰성을 보증하기 위하여 연구 인력, 실험 시설, 방비, 시험 방법 등을 관리하는 기준 |
|
생체이용률 |
의약품의 유효성분 또는 활성성분이 생체내의 작용부위에 도달하는 속도 및 양 |
|
성호르몬 |
남성과 여성의 생식선에서 분비되는 호르몬으로 생식기관을 발달시키며 생식기능을 유지하는 역할을 함. 남성호르몬은 테스토스테론, 여성호르몬은 에스트라디올과 프로게스테론임. |
|
시상하부 |
다양한 기능을 가진 작은 핵으로 구성된 뇌의 일부분으로 시상하부는 시상의 밑, 뇌줄기의 위쪽에 위치함. 신경계를 뇌하수체를 통해 내분비계와 연결하고 체내 특정 대사과정 및 자율신경계의 활동에 중요한 역할을 함. 체온조절과 배고픔, 갈증, 수면, 일주기 리듬 등을 조절함. |
|
안전역 (Safety margin) |
의약품의 안전도를 최대무독성량과 유효량 (효력을 나타내는 의약품의 량)의 비율로 나타낸 값으로, 수치가 클수록 안전함을 의미함 |
|
약동력학 (PK, Pharmacokinetics) |
생체에 투여한 약물의 움직임과 그 해석방법에 대해 연구하는 분야. 약물이 체내에서 흡수, 분포되어 대사과정을 거쳐 배설되는 정도를 시간에 따라 나타냄. 생체에 약물을 투여한 후에 체내에서 어떠한 움직임을 나타내는지를 측정하는 것이 약물동태학의 목적 중 하나임. 약물의 체내 움직임은 일반적으로 다음의 4 단계로 구성됨. 흡수 (Absorption): 약물이 투여 부위에서 혈액 및 임파액 속으로 이행하는 과정. 분포 (Distribution): 혈중의 약물이 조직과 세포로 이행하는 과정 대사 (Metabolism): 생체내의 효소에 의해 약물이 다른 화학 구조를 가진 화합물로 변환되는 과정. 배설 (Excretion): 약물 혹은 그 대사물이 체외에 배출되는 과정 |
|
완제 (Drug product) |
원제에 다양한 부형제를 첨가하고 시중에 유통될 제형으로 제작된 완제품 |
|
우회인자 (Bypassing agent) |
혈우병 치료제의 하나로, 중화항체가 발생한 인자를 우회 (bypassing)하여 그 하위 단계의 반응을 유도하는 인자 |
|
원제 (Drug substance) |
약의 제조에 사용될 고순도로 정제된 활성물질 |
|
원형, 자연형, 천연형 |
"wild type" 으로 변형되지 않은 자연 그대로의 형태를 지칭함 |
|
유전자 재조합 (Gene recombination) |
유전자를 변형하여 새로운 형태의 유전자를 얻어내는 기술로서, 서로 다른 유전자를 잘라 원하는 부분만 분리 획득한 후에 이들을 다시 재조합 (re-combine)하고 원하는 순서로 이어 붙여 새로운 형태의 유전자를 얻어내는 기술 |
|
융합단백질 (Fusion protein) |
하나의 단백질 형태로 얻기 위해서 단백질과 단백질을 유전적 혹은 화학적인 방법으로 연결/융합시킨 단백질 |
|
임상 |
임상 시험용 의약품의 안전성과 유효성을 증명할 목적으로, 해당 약물의 약동ㆍ약력ㆍ약리ㆍ임상적 효과를 확인하고 이상 반응을 조사하기 위하여 사람을 대상으로 실시하는 시험 또는 연구 |
|
자궁선근증 |
자궁으로 비정상적으로 침투한 자궁내막 조직이 주위의 자궁근층의 성장을 촉진하여 마치 임신 시 자궁처럼 커지게 하는 증상을 자궁선근증이라 하며, 자궁내막증이 자궁 외의 부위에 자궁내막이 존재하는 것인 반면 선근증은 자궁내막이 자궁근층 내에 존재한다는 의미에서 다름. |
| 자연형 FIX (Factor IX) | 응고인자 Factor IX에 어떤 변형도 가하지 않은, 인간 혈액에서 자연적으로 발견되는 응고인자9번(FIX)을 말함 |
|
저분자 화합물 (Small molecule) |
약학 분야에서 저분자 화합물 단백질이나 핵산과 같은 생체고분자에 결합하여 생체 고분자의 기능을 조절하는 분자량이 작은 (<900 달톤) 유기 화합물을 말함 |
|
적응증 (Indication) |
의약품에 의해 치료 효과가 기대되는 병이나 증상 |
|
전임상 시험 (Preclinical study) |
동물을 이용하여 의약품으로 개발하고자 하는 후보 물질의 유효성 및 안전성을 확인하는 시험. |
|
정맥주사 (Intravenous injection) |
정맥(심장으로 흘러가는 피가 이동하는 혈관)에 약물을 주사하는 방법 |
|
조숙증 |
신체적 또는 정신적 특성이 해당 연령보다 더 진행된 상태. 병적으로 남자 아이가 9세에 정소의 증대, 성모의 발생 등이 나타나거나, 여아 7세에 유방 발달, 성모 발생 등의 2차성징이 나타나는 것이 조숙증에 해당함. |
|
중화항체 (Neutralizing antibody) |
어떤 물질에 결합을 하는 항체 중에서 특히 해당 물질의 생물학적 활성을 막는 항체를 말함 |
| 지속형 FIX (Factor IX) | Long-acting Factor IX으로 기존 자연형FIX 대비 반감기가증가된 응고 인자 IX을 뜻함 |
|
최대무독성 용량 (NOAEL, No Observed Adverse Effect Level) |
의약품이 조직에 노출되었을 때 통계적으로 생리학적 또는 독성학적 영향이 관측되지 않는 최고 농도. |
|
크로마토그래피 |
혼합물을 분리하는 실험기술로서, 흐르는 상태의(예를 들어, 용매 속에 녹아있는) 혼합물과 고체상태의 물질 사이의 상호작용 정도의 차이로 인해서, 흐르는 상태의 혼합물들이 서로 다른 속도로 이동을 하고 이를 통해 혼합물을 분리하는 기술 |
|
탈감작 |
사전적 의미로 ‘민감 소실’임. 알레르기성 질환이 있는 환자의 알레르겐에 대한 과민성을 제거ㆍ감약(減弱)시키기 위해 탈감작요법을 사용하며, 이를 면역요법이라고도 함. |
|
트랜스페린 |
혈액에 풍부하게 존재하는 단백질로서, 음식물로 흡수한 철을 흡수하여 세포로 전달하는 기능을 하는 단백질 |
|
폐섬유화증 (IPF, Idiopathic Pulmonary Fibrosis) |
원인 미상으로 폐포벽에 만성염증 세포들이 침투하면서 폐를 딱딱하게 하는 여러 변화가 발생하여 폐 조직의 심한 구조적 변화를 야기하며 점차 폐 기능이 저하되어 사망하게 되는 질환 |
|
표적항암제 |
정상세포와 차이가 나는 암세포의 특정 부분을 표적으로 하여 암세포만을 선택적으로 공격하는 약물 |
|
피하주사 (Subcutaneous injection) |
피부와 근육 사이에 존재하는 피하조직에 약물을 주사하는 방법 |
|
혁신 신약 (First-in-class) |
기존에 치료제가 없는 질병을 고치는 신약 또는 특정 질환에 대한 약의 효능이 기존에 나온 약물과 구별되는 신약을 의미함. |
|
혈우병 (Hemophilia) |
혈액 내 특정 단백질의 결핍이나 불활성으로 인해 출혈이 발생했을 때 지혈이 제대로 이루어 지지 않는 질병 |
|
효소 (Enzyme) |
효소는 단백질의 일종으로 효소를 이루고 있는 아미노산의 잔기를 이용하여 다양한 종류의 화학 반응을 진행시키는 단백질 촉매임. 화학반응을 유도할 뿐 소모되지는 않음 |
|
흡입제 (Inhaler) |
의약품을 적당한 부형제에 녹이거나 분산시켜 증기상, 미세입자상 또는 에어로졸상으로 호흡기에 적용하는 제제로서, 국소 또는 전신 작용하는 제제를 말함. |
|
Add-back therapy |
estradiol 과 norethindrone acetate 소량을 추가하여, 지나치게 낮은 estradiol level을 상향 조정함으로써 골손실 리스크를 줄이는 방법 |
|
ALK5 (Activin A receptor type II-like kinase) |
TGF-ß가 결합하는 막 결합 수용체 단백질로 TGF-ß 결합 시 복합체를 형성하여 TGF-ß 신호를 세포 표면에서 세포 안으로 전달하는 세린/트레오닌 단백질 키나제 |
|
API (Active Pharmaceutical Ingredient) |
생체 반응을 일으키는 약물 내 성분 |
|
Estradiol |
에스트라디올은 난소의 여포에서 주로 생산되는 스테로이드 호르몬. 여성의 생식기관과 성기능에 중요한 역할을 하며, 그 외에 뼈와 같은 다른 기관에도 영향을 미침. 에스트라디올은 에스트론, 에스트리올과 함께 에스트로겐으로 분류됨. |
|
Ex vivo |
"out of organism"의 라틴어로서, 개체로부터 조직이나 세포를 적출하여 개체 밖에서 실험을 수행하는 상태를 의미함. |
|
FSH (Follicle-Stimulating Hormone) |
난포자극호르몬, 뇌하수체전엽에서 나오는 폴리펩타이드 호르몬임. 생식세포의 성숙에 관여하며, 여성에서는 황체형성 호르몬과 함께 월경주기의 조절에 관여함. |
|
GMP(good manufacturing practice) |
우수 의약품 제조 및 품질관리 기준 |
|
GnRH (Gonadotropin Releasing Hormone) |
생식샘자극호르몬. 뇌하수체 전엽에서 분비되며, FSH, LH을 분비하도록 자극하는 호르몬 |
|
GnRH antagonist |
GnRH 수용체를 차단하여 GnRH의 작용을 방해하는 물질 |
|
GnRH agonist |
GnRH 수용체에 작용하여 GnRH와 유사한 기능을 하는 물질 |
|
GnRH receptor |
생식샘자극호르몬의 수용체로 뇌하수체의 생식선 세포 표면 및 림프구, 유방 난소 및 전립선에서 발현됨. |
|
HPLC (High Performance Liquid Chromatograph) |
용액을 고압으로 흘려주고 매우 미세한 고체상의 물질을 흐르게 함으로써 일반 크로마토그래피 대비 월등한 분리능력을 갖는 크래마토그래피를 말하며, 소량의 혼합물을 분석하는 용도로 사용되는 기술임 |
|
In vitro |
라틴어로 'in glass’란 의미로 조직배양에서와 같이 시험관 내에서 조직의 일부 및 유기체를 인공의 조건으로 실험하는 것. 생물학 용어로는 각종 연구목적을 위하여 생체의 일부분이 ‘생체 밖으로’ 적출, 유리되어 있는 상태를 나타냄 |
|
In vivo |
생체 내 반응을 말하며, 통상적으로 동물이나 인체내 반응. 생화학에서는 살아있는 생체 중에서 대상으로 하는 생체 반응을 조사할 때에 생체 외로 나왔을 때의 상태(in vitro)에 대비하여 사용 |
|
IND (Investigational New Drug, 의약품 임상시험계획 승인 제도) |
새로운 의약품의 마케팅 신청이 승인되기 전에 제약 회사에게 임상시험을 수행하기 위해 실험용 의약품의 사용을 승인해 주는 단계임. 의약품 담당기관 (FDA 또는 식약처)은 개발 중인 의약품에 의해 연구 대상이 부당한 위험에 처하지 않도록 안전을 위해 IND 신청서를 검토함. IND 신청서가 승인되면, 후보 약물은 임상 시험에 진입할 수 있음 |
|
LH (Luteinizing hormone) |
황체형성호르몬, 뇌하수체전엽에서 분비되는 호르몬 중 하나임. 여성에게 배란을 일으키고 남성의 라이디히 세포를 자극해서 테스토스테론이 분비되게 함. |
|
Linker (링커) |
단백질 공학에서 단백질과 단백질을 연결(link)하기 위해서 사용되는 펩타이드 (아미노산의 연결체) 물질 |
|
Peptide |
아미노산의 중합체임. 보통 소수의 아미노산이 연결된 형태가 펩타이드이며, 많은 아미노산이 연결되면 단백질임. |
|
Progestin |
프로게스테론 유도체의 총칭. 임신 유지나 경구 피임제로 씀. |
|
Progesterone |
여성의 생식계에서 분비되는 호르몬. 자궁속막이 수정란을 수용·착상·성장할 수 있게 자궁벽을 준비시키며 착상된 수정란을 방해하지 못하도록 자궁의 근육수축을 억제함. |
|
Testosterone |
남성 고환의 라이디히 세포에서 생성되는 스테로이드 호르몬. 남성에서 성기 확대, 체모의 성장, 변성 등의 2차 성징을 자극하며 정자형성을 촉진하고, 근육을 발달시킴. |
|
TGF-ß (Transforming Growth Factor beta) |
조직 섬유화 진행의 핵심 분자로 TGF-ß 수용체에 결합하여 조직의 섬유화를 유도하는 기능과 면역세포에 작용하여 면역활성을 억제하는 물질 |
|
UGT (UDP-glucuronosyltransferase) |
세포질에 있는 대사 효소 중 하나로 UDP-글루쿠론산을 포합 시켜 대사 시킴. 특히 UGT1A1은 빌리루빈 대사에 관여하는 효소로 알려져 있음 |
(1) 사업 개황
![이미지: [사업개황] 3](%5B%EC%82%AC%EC%97%85%EA%B0%9C%ED%99%A9%5D%203.jpg) |
|
[사업개황] 3 |
당사는 SK케미칼(주)에서 오랜 기간 혁신 신약 연구 개발에만 집중하고 그 결과 미국 FDA 및 유럽 EMA의 승인을 득한 바이오신약 혈우병 치료제(앱스틸라, Afstyla)를 연구하여 기술이전에 성공시킨 김훈택 대표이사 및 핵심 연구진들이 설립한 회사입니다.
(가) 당사가 영위하고 있는 사업의 분류
당사는 희귀/난치성 질환에 대한 치료제를 연구개발하는 기업으로서, 목표하고 있는 질환의 치료 목적을 위해 저분자 합성의약품 및 바이오의약품 양 분야로 신물질신약을 발굴할 수 있는 역량을 보유하고 있습니다. 특정 질환을 치료하기 위한 방법으로서 저분자 합성의약품과 바이오의약품은 다음과 같은 특성을 각각 보유하고 있는 바, 질환을 유발하는 원인들에서 치료의 목표가 되는 단백질/효소 등의 타겟(Target)이 세포 외부/내부에 존재하는지, 해당 질환의 병인이 되는 기전을 억제하거나 질환을 치료하기 위한 기전을 활성화하는 방법이 무엇인지 등을 종합적으로 고려하여 가장 유용한 의약품 후보물질을 도출하고 이에 대한 연구개발을 수행하고 있습니다.
| [저분자 합성의약품과 바이오의약품] |
|
구 분 |
저분자 합성의약품 |
바이오의약품 |
|---|---|---|
|
정 의 |
화학적 방법으로 약효 성분을 추출하거나 합성하여 만들어낸 약물의 크기가 질량이 작은 의약품 |
사람이나 생물체에서 유래된 것을 원료 또는 재료로 생물공학기술을 이용하여 생산된 의약품 |
|
생산방법 |
화학물질의 화학반응을 통해 합성되거나 식물이나 다른 원료물질의 추출물로 만들어짐 |
미생물, 식물 혹은 동물세포 등 살아있는 생물체로부터 단백질이나 탄수화물로 구성된 분자량이 큰 물질을 얻어 내거나 배양된 세포자체를 사용하며 매우 복잡한 생물학적 공정을 거쳐 생산됨 |
|
구조적 특징 |
분자량이 매우 작고 화학적 구조가 잘 밝혀져 있음 |
분자량이 매우 크고 복잡한 3차원 구조를 가지고 있어 구조를 밝히거나 특성을 규명하기가 어려움 |
|
투약법 |
경구 투여 및 다양한 투여 경로 가능 |
정맥 /피하 주사로 가능 |
|
가격 |
상대적으로 저가/낮음 |
고가/높음 |
|
부작용 |
질환 발병의 선택적 치료가 부족할 경우 부작용 발생확률 상대적으로 높음 |
부작용 중 독성은 낮을 수 있으나 면역원성 부작용 발생 가능 |
저분자 합성의약품은 전통적인 의약품으로서 일반인들이 손쉽게 접하는 아스피린, 타이레놀 등부터 전문의약품인 Revlimid(레블리미드, 다발성골수종치료제) 같은 정제/캡슐 형태로 많이 복용하는 경구용 제제들로, 2018년 현재 미국 의약품 시장 판매액의 63% 비중을 차지하고 있습니다. 분자량이 낮아 세포 내 목표 단백질에 접근이 가능하고, 경구용으로 제조가능하여 복용이 용이하며, 화학물질의 합성 반응을 통한 대량 생산이 가능하여 가격 경쟁력이 높습니다. 다만, 이러한 저분자 합성의약품은 부작용 발생확률이 상대적으로 높고, 질환에 대한 선택적 치료가 어렵다는 단점이 있습니다. 최근에는 분자모델링 기법의 진화에 따라 저분자 합성의약품 영역이 지속적으로 확장되면서 적은 양, 최소한의 부작용으로 표적 치료가 가능한 저분자 합성의약품의 개발이 활발해지고 있습니다.
한편, 바이오의약품은 인체에 이미 존재하는 물질과 동일하거나 유사한 물질이라는 특성에 의해 체내에서 적은 부작용으로 의도한 효과를 기대할 수 있다는 장점이 있어 유전자재조합 단백질 치료제와 항체 치료제의 신약 허가 건수는 매년 꾸준히 증가하고 있습니다. 다만, 분자량 크기로 인하여 질병의 원인이 되는 조직 부위에 도달하거나, 세포 내 존재하는 단백질을 억제하기 힘들다는 단점으로 인하여 현재 적용되는 대부분의 바이오의약품은 혈관 내 물질이나 세포 외 단백질만을 타겟한다는 한계점이 있고, 장에서 흡수가 어려워 주사제만으로 투여가 가능한 상태입니다.
이렇듯 저분자 합성의약품과 바이오의약품은 각각의 장단점과 가능성을 지니고 있으며, 주목할 만한 점은 합성의약품과 바이오의약품의 병용 시도가 지속적으로 증가하고 있다는 점입니다. 당사는 합성의약품 및 바이오의약품 양 분야의 신약 창출시스템을 보유하고 있어 초기 연구단계에서 치료 Target 범위의 확장 및 TPP(Target Product Profile, 목표제품특성)의 구현 가능성을 높여 치료제로서의 가능성이 높은 물질을 발굴해낼 수 있다는 경쟁력을 확보하고 있습니다.
(나) 당사의 신약 창출 시스템
당사는 당사의 핵심연구진들이 연구개발활동을 통해 내재화시킨 합성 신약 및 바이오 신약창출 시스템을 통해, 질환을 치료할 수 있는 Target의 선정 및 이들 Target을 제어 및 조절할 수 있는 혁신 신약을 연구, 개발 중에 있습니다.
당사가 보유한 합성 신약 및 바이오 신약 창출 시스템은 다음과 같습니다.
1) 저분자 합성 신약 창출 시스템
저분자 합성 신약의 연구 개발 과정은 크게 Discovery(연구)와 Development(개발)의 여러 단계로 구분할 수 있으며, 아래 그림과 같이 요약할 수 있습니다. Discovery 단계에서는 단계별로 요구되는 핵심 지표를 달성함으로써 최적화된 후보 물질을 도출하게 되며 이후 임상에서 약효 및 안전성에 대한 입증을 거쳐 발매에 이르게 됩니다. 합성 신약 개발의 전 과정은 과학적 지식에 기반을 두고 창의적 사고와 통찰력에 바탕을 둔 Ideation과 효율적인 합성 및 스크리닝 시스템으로부터 안전성-약효-물성에대한 최적의 균형을 찾아가는 과정으로 볼 수 있으며 특화된 개발 전략과 결합할 때 성과를 극대화할 수 있습니다.
![이미지: [합성신약 연구 개발 흐름과 단계별 세부 활동 및 티움바이오 후보물질 개발현황] 3](%5B%ED%95%A9%EC%84%B1%EC%8B%A0%EC%95%BD%20%EC%97%B0%EA%B5%AC%20%EA%B0%9C%EB%B0%9C%20%ED%9D%90%EB%A6%84%EA%B3%BC%20%EB%8B%A8%EA%B3%84%EB%B3%84%20%EC%84%B8%EB%B6%80%20%ED%99%9C%EB%8F%99%20%EB%B0%8F%20%ED%8B%B0%EC%9B%80%EB%B0%94%EC%9D%B4%EC%98%A4%20%ED%9B%84%EB%B3%B4%EB%AC%BC%EC%A7%88%20%EA%B0%9C%EB%B0%9C%ED%98%84%ED%99%A9%5D%203.jpg) |
|
[합성신약 연구 개발 흐름과 단계별 세부 활동 및 티움바이오 후보물질 개발현황] 3 |
당사 합성신약 연구진은 면역항암/섬유증 치료제와 자궁내막증/자궁근종 치료제로 대표되는 목표 질환군을 설정하고, 과제 기획에서부터 Discovery 및 Development에 이르기까지 전 과정에서 요구되는 핵심 역량 및 노하우를 습득, 발전시켜 내재화하였습니다. 특히, 물질 디자인/합성, 약효/독성 평가, 제형화, 임상 개발 분야에서 고도의 전문 역량 및 협력을 필요로 하는 합성 신약 개발에서 당사만의 독창성과 속도감을 유지하기 위한 핵심 시스템 및 기술은 다음과 같습니다.
| [저분자 합성신약 창출을 위한 기반 기술] |
|
구 분 |
내 용 |
|---|---|
|
'3D Mapping Assisted Rational Drug Design (MARD)'에 의한 분자모델링을 통한 유효물질 도출 기술 |
당사의 유효물질 도출은 3D Mapping Assisted Rational Drug Design (MARDD)에 기반하며, 3D mapping은 활성이 우수한 선행 화합물군의 active conformer들이 공통으로 점유하는 3차원 공간을 정의하고, 이에 잘 결합할 수 있는 최적의 scaffold를 계산적으로 찾거나 선행하는 core scaffold를 중심으로 최적의 fragments를 배열하여 생리활성과 물리화학적 특성을 동시에 최적화하는 기술입니다. 이 기술에 과학적 지식과 경험에 바탕한 rational design을 접목시켜 독창적이며 druggability를 가지는 유효물질 수준에서 한 단계 더 나아간 선도물질(Lead 화합물) 수준의 신규물질을 빠르게 도출이 가능합니다. |
|
개발물질의 염/결정화 개발 기술 |
개발물질의 다른 염/결정 형태로부터 나타내는 용출속도, 물리화학적 안정성, 흡습성, 겉보기 밀도의 차이는 생산성, 제형성 및 생체이용률에 중대한 영향을 미칩니다. 따라서 개발 물질의 생산성 및 제형화 용이성을 극대화하고 더 나아가 개발물질 특허권에 대한 확장 또는 방어 수단으로 활용하기 위해 개발물질의 다양한 염 및 결정 형태를 스크리닝하고 특성화하는 것은 매우 중요합니다. 따라서, Discovery 단계에서부터 개발물질의 물리화학적 특성에 대해 규명하여 염 및 결정 형태를 탐색/도출해나가야 하며 이는 궁극적으로 가장 안정하고 이상적인 형태의 원료 의약품(API)을 도출하고 효율적인 프로세스 개발에 기여하게 됩니다. 먼저 개발 물질 고유의 물리화학적 특성를 반영하여 약학적으로 허용가능한 염 및 용매 매트릭스군을 설정하고 다양한 결정 형성 조건에서 스크리닝을 통해 유리염기, 염 및 용매화물에 대한 결정성을 확인한 후 결정형 평가, 물리화학적 안정성 평가를 통해 우수한 군을 도출한 후 마지막으로 생체이용률을 평가하여 최종 제형을 결정합니다. |
|
약효 평가 시험법 |
각 파이프라인이 해당 적응증에 약효가 있는지 평가하는 것은 신약 개발의 가장 핵심적인 사항으로, 약효 평가를 위한 다양한 시험법에 대한 지식과 경험이 부족할 경우 비효율적인 후속 연구 개발이 진행될 수 있습니다. 당사는 보유한 파이프라인에 대한 핵심 약효평가 기술들을 내부적으로 확립하였으며, 이를 타 질환에 응용할 수 있는 역량을 보유하고 있습니다. 1) Kinase assay 기술 5) HUVEC migration assay 6) in vivo 종양모델 약효시험법 7) Bleomycin 유도 IPF 모델 약효시험법 8) 일측성 요관폐색(Unilateral Ureteral Obstruction, UUO) 신장 섬유증 모델 약효시험법 9) HPG axis(Hypothalamus-pituitary-Gonad axis, 시상하부-뇌하 수체-성선 축) 기능 평가를 위한 약효시험법 |
2) 바이오신약 창출 시스템
바이오의약품은 식약처에서 다음과 같이 분류하고 있으며, 당사는 '02. 유전자재조합 의약품' 중 단백질 의약품에 대한 신약 창출 시스템을 보유하고 있습니다.
| [바이오의약품의 분류] |
|
분류 |
정의 |
|---|---|
|
01. 생물학적 제제 |
생물체에서 유래된 물질이나 생물체를 이용하여 생성시킨 문질을 함유한 의약품으로서 물리적/화학적 시험만으로는 그 역가와 안전성을 평가할 수 없는 백신/혈장분획제제 및 항독소 등 |
|
02. 유전자재조합 의약품 |
유전자조작기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품 항체의약품, 펩타이드 또는 단백질의약품, 세포배양의약품 등을 포함합니다. (세포배양의약품이란 세포배양기술을 이용하여 제조되는 펩타이드 또는 단백질 등을 유효성분으로 하는 의약품) |
|
03. 세포치료제 |
살아있는 자가/동종/이종세포를 체외에서 배양/증식하거나 선별하는 등 물리적/화학적/생물학적 방법으로 조작하여 제조하는 의약품 다만, 의료기관에서 자가 또는 동종세포를 당해 수술이나 처치과정에서 안정성 문제가 없는 최소한의 조작만을 하는 경우는 제외 (생물학적 특성이 유지되는 범위에서 단순분리, 세척, 냉동, 해동 등) |
|
04. 유전자치료제 |
질병치료 등을 목적으로 인체에 투입하는 유전물질 또는 유전물질을 포함하고 있는 의약품 |
|
05. 동등생물의약품 |
이미 제조판매 또는 수입품목 허가를 받은 품목과 품질 및 비임상, 임상적 비교 동등성이 입증된 의약품 |
|
06. 개량생물의약품 |
이미 허가된 바이오의약품에 비해 안전성, 유효성 또는 유용성이 개선되었거나 의약기술에 있어 진보성이 있는 의약품 |
(출처 : 식품의약품안전처 생물학적제제 등의 품목허가심사 규정 고시)
재조합한 단백질 의약품은 유전자 조작기술을 이용하여 생체에서 충분히 얻기 힘든 치료용 단백질 성분을 세포 배양 등을 통해서 대량 생산한 의약품입니다. 재조합 단백질 의약품은 아래 그림에서 보는 바와 같은 과정으로 생산됩니다. 간단히 설명하면, 치료단백질과 같은 유용유전자 서열을 함유하는 유전자들을 자르고 붙이는 과정을 통해 새롭게 조합하여 재조합된 유전자를 제작하고, 숙주세포에서 해당 유전자를 단백질로 생성(발현이라고 함)될 수 있도록 도와주는 발현벡터와 연결시킵니다. 제작된발현벡터를 숙주세포의 염색체에 삽입시키고(이 과정을 형질전환이라고 칭함), 형질전환된 숙주세포를 배양하면 세포 내에서 유용유전자가 단백질형태로 생성(발현)됩니다. 생성된 단백질은 배양 배지 밖으로 분비가 되고 이를 순수 정제하면 다량의 재조합 단백질 의약품을 얻을 수 있습니다.
![이미지: [재조합 단백질 의약품의 발현 과정]3](%5B%EC%9E%AC%EC%A1%B0%ED%95%A9%20%EB%8B%A8%EB%B0%B1%EC%A7%88%20%EC%9D%98%EC%95%BD%ED%92%88%EC%9D%98%20%EB%B0%9C%ED%98%84%20%EA%B3%BC%EC%A0%95%5D3.jpg) |
|
[재조합 단백질 의약품의 발현 과정]3 |
이러한 방식으로 개발한 최초의 유전자 재조합 단백질 의약품은 인슐린이며, 인슐린은 체내에서 혈당을 조절하는 호르몬으로, 당뇨병 환자들에게 외부에서 생산한 인슐린을 공급해 주는 방법으로 치료를 하고 있습니다. 그 외 성장호르몬, EPO(에리스로포이에틴), 혈우병 치료제 Factor VIII(제8응고인자) 등 다수의 재조합 단백질 의약품이 출시되었으며, 당사의 연구진들이 직전 근무회사에서 개발하였던 A형 혈우병 치료제인 Factor VIII(제8응고인자) 단백질 의약품은 글로벌 바이오텍에 기술수출된 이후 미국 FDA, 유럽 EMA 및 일본 후생성의 허가를 득하여 현재 글로벌 시장에서 판매되고 있습니다.
단백질 의약품을 개발하는 단계는 아래 모식도와 같이 좀 더 복잡한 과정을 거쳐서 이루어지며 당사에서는 지난 이십여 년 동안 해당하는 단계마다 최적의 성과를 달성할 수 있는 역량을 갖추어 왔습니다.
![이미지: [재조합 단백질 개발의 개괄적인 과정 모식도]3](%5B%EC%9E%AC%EC%A1%B0%ED%95%A9%20%EB%8B%A8%EB%B0%B1%EC%A7%88%20%EA%B0%9C%EB%B0%9C%EC%9D%98%20%EA%B0%9C%EA%B4%84%EC%A0%81%EC%9D%B8%20%EA%B3%BC%EC%A0%95%20%EB%AA%A8%EC%8B%9D%EB%8F%84%5D3.jpg) |
|
[재조합 단백질 개발의 개괄적인 과정 모식도]3 |
| [바이오신약 창출을 위한 기반 기술] |
|
구 분 |
내 용 |
||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
단백질 유전자 변형 기술 |
바이오신약의 개발을 위해 문헌 정보와 새로운 아이디어를 바탕으로, 당사가 보유한 유전자 변형(mutagenesis, insertion, deletion 등) 기술을 이용하여 목표 유전자를 새롭게 변형하였습니다. 최적의 변형을 도입하기 위해 다양한 시도를 하고, 이를 기반으로 발현된 변형 단백질의 특성을 분석함으로써 목적했던 특성을 확인하는 작업을 수행하였습니다. 당사 연구진이 수행했던 NBP601 (AFSTYLA® 라는 변형된 혈우병 치료제 제품으로 전세계적으로 상품화됨) 및 현재 보유하고 있는 TU7710 및 다른 재조합 단백질 치료제 파이프라인들도 모두 단백질 변형기술을 통해서 최적화한 유전자들입니다. |
||||||||||||||||||||||
|
반감기 증가 기술 - 트랜스페린 융합기술 |
당사의 platform technology 인 트랜스페린(Tf) 융합기술을 이용하여 혈우병 치료제의 반감기를 증가시키고 활성을 유지하는 기술을 개발하였습니다. 당사는 트랜스페린 수용체(TfR)에 의해 트랜스페린(Tf)이 recycling 된다는 점을 이용해 혈액응고인자 FVIIa 및 FIX에 Tf을 유전적으로 융합시켜 반감기 증가를 구현함과 동시에 이러한 융합 단백질이 작용점에서 링커(linker)가 절단되면서 트랜스페린의 영향을 받지 않고 최대 효소 활성을 지닐 수 있도록 고안하였습니다. |
||||||||||||||||||||||
|
생산 세포주 개발 기술 |
① 목표단백질 최적발현벡터 제작 기술 선별된 최적의 목표단백질을 발현하는 유전자는 숙주세포에서 안정적으로 발현될 수 있도록 필요한 요소들을 포함하는 발현 벡터에 삽입해야 합니다. 숙주를 대장균, 효모, 동물세포 등 어떤 형태를 이용할지에 따라 발현벡터의 필요 요소가 달라집니다. 다양한 번역 후 수식(post-translational modification) 과정을 거쳐야 하는 당단백질의 경우는 생산성이 낮더라도 동물세포주를 이용해야 하며, 동물 세포주에서 목적 단백질을 발현할 때 낮은 생산성을 극복하기 위해서 당사는 자체 최적화된 발현 벡터 시스템을 갖추고 있습니다. ② 목표단백질 고발현 세포주 구축기술 동물세포에서의 발현량은 낮아 경제성을 확보하기 위해서 고발현 세포주의 개발은 필수적입니다. 당사에서는 methotrexate(MTX)라는 엽산(folic acid) 생성저해 약물을 이용한 유전자 증폭기작으로 목적단백질 유전자의 증폭을 꾀할 수 있습니다. |
||||||||||||||||||||||
|
동물세포 배양 기술 |
① 배양 조건의 최적화 기술 당사는 세포배양기술을 확립할 때 배양 온도, 용존산소량(DO), pH 및 교반속도 등의 변수를 실험설계(design of experiment) 기법에 적용하여 재조합 단백질의 품질요소 및 생산성을 최적화하도록 배양 공정 parameter를 설정하고 있습니다. ② 배양 scale-up 소규모 바이오리엑터를 통해서 최적화된 배양조건을 이용하여 5L, 10L, 50L 규모별 배양 scale-up을 진행하면서 생산성과 품질이 유지되는 배양기 종류 및 크기 별 scale-up parameter를 파악할 수 있습니다. 대량 배양 공정을 확립하기 위해 동일 공기주입(Aeration, VVM) 조건에서 교반(agitation) 조건에 따른 세포성장과 사멸도 및 대사물질 분석을 통해 생산공정을 최적화합니다. ③ 대량(50L~200L) 배양 기술 확보 배양 규모를 증가시켜도 원하는 품질 및 생산성을 얻을 수 있는 조건을 확보하는 것이 기술이전 등 사업화를 위해 매우 중요한 요소인 바, 대량 생산 scale-up 연구를 진행하여 200L 배양에서도 50L배양 결과와 동등한 세포성장 및 생산성을 획득하는 기술을 확보하였습니다. |
||||||||||||||||||||||
|
목표 단백질 정제 기술 |
Bioreactor 배양 공정으로부터 얻어진 배양액을 이용하여 정제 과정을 통하여 고순도의 단백질을 획득하여야 최종 의약품으로서의 기능을 하는 단백질이 획득됩니다. 정제 공정은 먼저, 바이러스불활화 과정을 거치고, 불활화 과정을 거친 농축 배양액은 친화성 크로마토 그래피 단계에서 목표 단백질을 제외한 배양액 내의 기타 단백질들을 제거합니다. 이온교환크로마토그래피 등 9단계의 정제 과정을 거쳐 최종 순도가 97% 이상인 단백질을 얻을 수 있으며 정제 효율의 경제성도 확보합니다. |
||||||||||||||||||||||
|
상온 보관 가능한 제형 개발 기술 |
다양한 부형제를 시험하여 온도변화에 따른 제품의 안정성을 테스트하고, 동결건조 공정을 통해 안정된 성형을 가지는 동시에 상온 이하에서 유리전이온도가 관찰되지 않는 제형을 확보하여 특정 단백질에 대하여 상온 보관 가능한 제형을 개발할 수 있습니다. |
||||||||||||||||||||||
|
원제/완제의 분석기술 |
최종 정제산물이 의약품으로서의 규격에 적합한지 기준을 설정하여야 하는데, 당사는 기 확보한 원제 및 완제 분석 기술을 기반으로 아래 표의 시험항목들을 TU7710 완제 및 원제 분석에 적용하여 확립하였습니다. 아래의 자체 보유 기술 이외의 추가적인 분석은 외부 분석기관을 활용하고 있습니다. [원/완제 분석 항목 및 목적]
|
||||||||||||||||||||||
|
생리활성 분석기술 |
1) 응고 기반 활성 분석기술 (coagulation activity assay) 2) In vitro 기질을 이용한 함량 분석기술 3) Ex vivo / In vivo효능 검증기술 4) 동물 모델에서 약동력학 분석기술 |
상기에서 기술한 저분자 합성신약/바이오신약 창출시스템에 따라 당사는 적합한 질환모델을 확보하고, 타겟검증을 수행한 후 당사의 제품 NCE401(TU2218), NCE403(TU2670), NBP604(TU7710) 등을 발굴, 연구 및 개발하고 있으며, 향후에도 지속적으로 파이프라인을 추가, 확장해 나갈 계획입니다.
(2) 제품(신약후보물질) 설명
앞서 서술한 바와 같이 당사는 저분자 합성신약과 유전자 재조합 바이오신약의 연구개발 및 사업화를 목표로 혁신 신약 연구개발을 수행하고 있는 회사로서, 당사의 신약 창출 시스템을 통해 저분자 합성신약으로서 NCE401, NCE403 프로그램과 바이오신약으로서 NBP604 등의 프로그램을 연구 개발 중에 있으며, 각 프로그램의 개요는 다음과 같습니다.
| 구분 |
파이프라인 |
신약후보물질 |
적응증 |
개발단계 |
|---|---|---|---|---|
| TGF-β 저해제 | NCE401 | TU2218 | 특발성 폐섬유증, 면역항암제 | 전임상 |
| GnRH antagonist | NCE403 | TU2670 | 자궁내막증, 자궁근종 | 유럽 임상2a상 준비중 |
| 재조합 단백질 | NBP604 | TU7710 | 혈우병 우회인자 | 전임상 |
| 재조합 단백질 | NBP611 | TU7918 | B형 혈우병 치료제 | Discovery |
주1. 상기 표에서 NCE는 New Chemical Entity, NBP는 New Biological Product의 줄임 표현으로, 치료제 개발 프로그램을 의미합니다. 해당 프로그램의 후보물질군 내에서 당사가 주력하여 개발하는 후보물질을 Tiumbio의 약자인 ‘TU + 물질코드’ 명으로 표시하였습니다.
(가) NCE401프로그램 (TU2218 - TGF-β 저해제)
당사가 핵심 파이프라인으로 개발하고 있는 NCE401 프로그램은 TGF-β 저해제로서, 당사의 합성신약창출시스템에 의하여 도출된 수백개의 유도체 중 TU2218을 후보물질로 선정하여 폐섬유증 치료제와 면역항암제로 연구/개발하고 있습니다.
■ TU2218의 특징
선도물질인 TU2218은 TGF-β 신호전달경로를 차단하는 저분자 kinase inhibitor입니다. TGF-β란 생체 내 존재하는 단백질로서 Transforming Growth Factor-β(전환성장인자) family member 중 하나로 TGF-β 신호전달을 통해 성숙한 세포의 증식, 분화 그리고 세포이동, 세포사멸과 같은 다양한 세포 반응을 조절하는 사이토카인으로 알려져 있습니다. TGF-β는 특히 암세포의 성장과 분화, 전이에 중요한 역할을 하는 인자로 주목받으면서 이를 저해하는 약물이 항암 치료제로서의 가능성을 높게 평가받고 있습니다. TU2218은 TGF-β 신호 전달을 억제하는 기전으로 섬유증 및 암을 타겟(Target)으로 하는 신약후보물질로 개발중이며, 생체 외 실험(In vitro assay) 및 생체 내(in vivo) 평가에서 경쟁 물질들 대비 우수한 활성, 약효 및 선택성을 보여 동일 기전 내에서 'Best in Class' 치료제로 개발될 것으로 기대하고 있습니다.
■ TU2218의 작용 기전
TU2218이 타겟하는 TGF-β type I receptor kinase는 ALK5(Activin receptor-like kinase 5)로 불리며, TGF-β의 신호를 전달하여 세포의 성장과 사멸, 세포 이동과 침투, epithelial-mesenchymal transition(EMT, 상피간엽이행), extracellular matrix(ECM, 세포외기질), 리모델링 등 넓은 범위의 세포 반응에 관여하고 있습니다. TGF-β는 특히, 섬유화, 암, 염증 상태 등에서 과발현되어 관련 질환을 발전시키거나 약물의 침투를 막는 역할을 합니다.
장기 조직에 지속적인 손상이 유도되게 되면 TGF-β 단백질의 발현이 증가되고 해당 단백질은 세포표면에 존재하는 TGF-β 수용체(ALK5)에 결합하게 됩니다. TGF-β가 결합된 수용체는 조직의 섬유화에 관여하는 다양한 유전자들의 발현을 유도하며, 섬유화를 일으키는 섬유조직의 단백질들을 생성하게 만듭니다.( TGF-β 신호 전달 “ON”)
![이미지: [tgf-β 의 작용기전]3](%5Btgf-%CE%B2%20%EC%9D%98%20%EC%9E%91%EC%9A%A9%EA%B8%B0%EC%A0%84%5D3.jpg) |
|
[tgf-β 의 작용기전]3 |
당사의 파이프라인 TU2218은 TGF-β수용체의 기능을 저해하는 작용 기전에 의하여 TGF- β신호 전달을 저해함으로써 장기 조직의 섬유화를 억제하고 암세포의 면역회피/면역억제를 저해함과 동시에 종양세포 주위의 섬유아세포(Cancer Associated Fibroblast, CAF) 발생 및 종양미세환경의 종양 보호촉진기능을 저해하여 종양의 성장 및 전이를 억제합니다. (TGF- β 신호 전달 “OFF”)
![이미지: [tu2218에 의한 tgf-β 신호 전달 억제 기전]3](%5Btu2218%EC%97%90%20%EC%9D%98%ED%95%9C%20tgf-%CE%B2%20%EC%8B%A0%ED%98%B8%20%EC%A0%84%EB%8B%AC%20%EC%96%B5%EC%A0%9C%20%EA%B8%B0%EC%A0%84%5D3.jpg) |
|
[tu2218에 의한 tgf-β 신호 전달 억제 기전]3 |
또한, 종양미세환경의 섬유화 반응(desmoplasia)을 억제하여 약물의 종양 침투를 증가시킴으로써 궁극적으로 항암효능을 높이는데 기여할 것으로 예상됩니다. 최근까지누적된 임상시험 및 관련 연구 결과, 적절한 임상 용량/용법 선정을 통해 TGF-β 저해제의 치료제로서의 개발 가능성이 주목 받고 있으며, 이와 같은 개발 동향 분석에 근거하여 당사 연구진은 TGF-β저해제의 적응증을 의학적 미충족 수요가 높은 특발성 폐섬유증(idiopathic pulmonary fibrosis, IPF) 및 면역항암(immuno-oncology)으로 설정하여 개발을 진행하고 있습니다.
■ TU2218의 개발 적응증
1) 특발성 폐섬유증 (Idiopathic Pulmonary Fibrosis, IPF)
대부분의 장기는 조직손상 후 염증과 치유 과정을 거치게 되는데, 손상이 지속되는 경우 치유과정에서 조직의 섬유화가 발생합니다. 섬유화(fibrosis)는 기본적으로 비정상적인 반흔과정(scarring)이며, 콜라겐, fibronectin, a-SMA 등의 세포외 기질(extracellular matrix, ECM)이 과다하게 생성되어 조직에 축적되는 현상으로, 이로 인해 조직의 정상구조가 파괴되고 기능장애(organ failure)가 초래될 수 있습니다.
특발성 폐섬유증(IPF)은 폐에서 섬유화 과정이 발생하는 대표적인 예로서, 평소 말랑하고 탄력 있던 폐 조직이 반복적인 염증손상에 노출되면서 섬유세포가 과잉 증식하게 되고 폐 조직이 영구적으로 굳어져 호흡장애가 오는 질환입니다. IPF의 발병기전은 명확히 밝혀져 있지 않으나, 흡연, 각종 분진에의 반복적 과도한 노출, 바이러스성감염, 유전적 요인 등이 IPF 발병 가능성을 높인다고 알려져 있습니다. 마른 기침, 짧은 호흡 등의 증상으로 시작하여 폐기능 저하로 이어지며, 폐색전증, 폐렴, 폐 고혈압, 심부전 등의 합병증을 동반할 수 있습니다. 이러한 증상이 심화되어 진단 후 3 ~ 5년 내 환자의 사망률이 70%에 이르는 치명적인 질병입니다.
그러나 Pirfenidone 및 Nintedanib 등 기존의 치료제들은 노력성 폐활량(forced vital capacity, FVC)의 악화를 개선하는 증상개선의 임상적 효능만으로 IPF 적응증에 대해 승인받았으며, 특발성 폐섬유화 환자의 생존율을 높여주지는 못하여 의학적 미충족 수요가 높은 질환입니다.
IPF의 발병 및 진전에 있어 TGF-β 신호전달에 의한 섬유화가 핵심적인 역할을 수행하므로, TU2218은 ALK5 저해를 통해 TGF-β 신호를 직접 차단함으로써 IPF 질환을 보다 근본적으로 치료하여 생존율을 높여 미충족 수요를 만족시키는 First-in-class 약물로 개발 가능할 것으로 기대하고 있습니다.
2) 암 (Cancer)
당사의 TU2218은 작용기전에서 전술한 바와 같이 암 치료제로서도 높은 가능성을 지니고 있으며, 암의 발암기전에 대한 설명을 통해 면역항암제로서의 개발 가능성에 대해 설명하도록 하겠습니다.
인간의 몸을 구성하고 있는 가장 작은 단위를 세포(cell)라고 부릅니다. 정상적으로 세포는 세포 내 조절기능에 의해 분열하며 성장하고 죽어 없어지기도 하며 세포수의 균형을 유지합니다. 그러나 여러가지 이유로 인해 이러한 증식과 억제, 사멸이 조절되지 않는 비정상적인 세포들이 과다하게 증식하여 주위 조직 및 장기에 침입하고 종괴를 형성하며 정상 조직을 파괴하는 상태에 이르는 것을 암(cancer)이라 정의하고 있습니다. 암세포의 경우 세포의 유전자 중 일부에 이상이 발생하여 이들 유전자의 산물인 단백질의 특성이 바뀌게 되고, 그 결과로 세포 성장 조절에 이상이 발생하며, 이러한 세포 성장 조절의 이상은 유전자의 변이를 동반하게 됩니다. 암의 발암기전은 크게 다음의 두 가지 측면에서 연구되고 있습니다.
① 정상 세포의 변화: 정상 세포가 유전자 변이를 일으키는 위험요인에 노출되었을 때 암세포로 변하게 되고 따라서 암이 발생한다고 보는 것입니다. 흔히 실제 암발생의 위험요인으로 알려져 있는 흡연, 발암성 식품 및 화학물질, 발암성 병원체 등에 정상세포가 노출되면 유전자의 변이를 일으키게 됩니다. 또한 암발생에 있어 10~20% 정도는 부모로부터 물려받은 유전자의 이상에 의한 유전적 영향을 받습니다. 세포핵의 구성요소 중에는 DNA라는 물질이 있는데 이 DNA의 구조가 변화하여 암세포가 생성됩니다. 이렇게 변형된 세포는 분열하여도 계속 변형된 DNA를 갖게 되며, 결국 이것들이 계속 분열증식하여 암이 발생한다고 보는 것입니다. 이러한 변화는 일시적으로 이루어지는 것은 아니며 대개 20~30년에 걸쳐 여러 종류의 유전자 변이가 축적되어 암이 발생합니다.
② 면역계의 이상: 인체의 정상적인 면역기능은 신체 내에서 생성되는 종양세포 1,000만개까지는 파괴할 능력을 가지고 있습니다. 그러나 보통 임상적으로 암이 발견될 정도로 암세포의 분열과 증식이 커지는 경우는 최소한 10억 개의 종양 세포를 포함하게 되므로 면역기능에 의하여 파괴될 수 있는 수준을 훨씬 넘어버리게 됩니다. 따라서 암세포가 제거되지 못하고 암이 발생하게 됩니다. 암을 퇴치할 수 있는 효과적 면역반응이 유도되기 위해서는 선천면역계와 적응면역계의 세포들이나 활성분자들이 조화롭게 상호작용을 해야만 하는데, 면역계가 감당할 수없을 정도로 빨리 암세포가 성장하면 살아남는 암세포의 숫자가 증가하고, 이 경우 암세포들은 면역계를 속이거나, 면역세포들에 대하여 암세포를 공격하지 못하도록 길들이면서 계속 증식하게 됩니다. 암덩어리가 발견되는 단계는 거의 대부분의 경우 면역억제 종양미세환경(tumor microenvironment)이 형성되어 면역계가 암을 쉽게 제거하기 어려운 상황에 빠져 있을 때입니다.
이와 같이 암의 진행은 면역계의 이상에 따른 것으로 보아 과거 수십 년 동안 암 치료 전략으로서 면역체계를 유도 내지는 강화시키려는 다양한 노력들이 시도되었습니다. 그러나, 아쉽게도 많은 시도들이 대부분 실패로 돌아가며 종양 면역 치료에 대한 비관 또는 냉소주의가 자라나게 되었는데, 2011년 이필리무맙(CTLA-4 억제제) 치료제의 성공으로 종양 면역 치료의 새로운 지평이 열리게 되었습니다. 이는 면역체계에대한 지식과 이해의 증가, 특히 T-림프구 기능 및 이를 조절하는 면역관문(immune checkpoint)에 대한 이해의 증가에서 비롯된 것으로, 종양세포의 성장 및 전이과정에서 인체의 면역체계를 억제 내지는 회피하는 동적 프로세스를 과학적으로 연구함에 따른 것입니다. 즉, 면역체계에 대한 지식 발전을 통하여 면역기능의 활성화 또는 비활성화에 관여하는 특정 신호전달체계가 존재함을 알게 되었는데, 이러한 면역반응과정의 조절기전-면역관문(immune checkpoint)은 가속기(accelerator) 역할을 하는 동시자극 면역관문 수용체와 제동기(brake) 역할을 하는 동시억제 면역관문수용체 그리고 각각의 수용체와 결합하는 리간드(ligand)의 상호작용을 시공간적으로 매우 정교하게 작동시킴으로써 이루어집니다.
특히, 면역항암제 시장을 형성하고 있는 면역관문억제제로서 PD-1(Programmed cell death-1)과 해당 리간드 PD-L1(Programmed death ligand-1)에 대한 단클론항체들은 종양면역치료에서 괄목할만한 성과를 보이며 다양한 암종의 치료법으로 확대되고 있습니다. 암 표준치료 중의 하나로 자리잡으면서 암 치료의 새로운 패러다임이 되고 있으며, 흥미로운 점은 이러한 면역관문 억제제들과 병용요법을 통하여 치료효과 상승작용을 기대할 수 있는 치료제의 개발이 각광받고 있다는 점입니다.
면역치료가 암치료의 새로운 전기를 마련함에 따라, 면역체계에서의 TGF-β의 역할이 재조명되고 있습니다. 종양의 면역 환경 내에서 TGF-β가 암의 성장 촉진에 중요한 역할을 하는 것으로 알려져 유망한 치료 타겟으로 부상하였으며, 면역항암제와 TGF-β신호전달 저해제의 병용치료가 큰 관심을 받고 있습니다. 작용기전에서 전술한 바와 같이 TGF-β는 면역계의 많은 구성 요소의 기능과 확장을 저해함으로 면역 항상성(homeostasis)과 관용(tolerance)을 결정 짓는 중요한 집행자 역할을 하는 것으로 알려져 있으며, 특히, 종양미세환경에서 면역 억제의 중재자로서 TGF-β가 중요한 역할을 한다는 사실이 많은 연구를 통해 증명되고 있습니다.
당사는 TU2218이 TGF-β 신호 차단제로서 암세포 성장 및 전이를 억제할 수 있는 가능성과 종양미세환경 내의 면역억제 시스템을 무력화하면서 PD-1/PD-L1 억제제와의 병용투여 치료법으로서의 가능성을 높이 평가하여 면역항암제로 개발하고 있습니다.
2019년 2월 GSK와 독일 머크사의 M7824(TGF-β / PD1 이중항체) 공동 개발 계약(약 5조원 규모) 및 2019년 6월 미국 머크의 TGF-β 저해제 개발 회사 인수(0.9조원)는 TGF-β 저해제의 항암 치료제로서의 높은 가능성 및 관심을 증명하고 있는 최근의 사례들입니다.
(나) NCE403프로그램 (TU2670 - GnRH antagonist)
NCE403 프로그램(또는 과제)은 GnRH antagonist (성선자극호르몬 억제제)로서, 당사의 합성신약창출시스템에 의하여 도출된 저분자 화합물 유도체로 구성되어 있으며, 그 중 TU2670을 후보물질로 선정하여 자궁내막증 및 자궁근종 등 여성 성호르몬과 관련된 질환의 치료제로 연구/개발하고 있습니다.
■ TU2670의 특징
TU2670은 경구용 저분자 nonpeptide GnRH antagonist 로, 투여 시 즉각적으로 GnRH 수용체를 억제하므로 성호르몬의 초기 상승을 유발시키지 않고, 기존 주사 치료제와 달리 경구용으로 복용이 편리한 장점이 있습니다. 또한, 질환의 특성에 맞춰 성호르몬 레벨을 형성하도록 투여 용량을 조절할 수 있으므로 보다 용이하게 효과와 부작용 사이에서 균형을 잡을 수 있다는 장점이 있습니다.
TU2670(GnRH antagonist)은 작용기전적으로 GnRH agonist와 유사한 효과를 나타내므로 주요 개발대상 적응증인 자궁내막증과 자궁근종 외에도 기존 GnRH agonist의 적응증들(성조숙증, 불임치료, 자궁선근증 등)로 확대가 가능할 것으로 기대되고 있습니다.
■ TU2670의 작용기전
자궁내막증 치료제로써 TU2670은 인간 내에 시상하부-뇌하수체-난소 축이라는 생식기능 조절시스템에 작용하여 효과를 나타냅니다. 시상하부와 뇌하수체는 뇌에 존재하며, 뇌하수체는 시상하부 바로 밑에 복주머니 형태로 매달려 있습니다.
![이미지: [a. 시상하부-뇌하수체-난소 축, b. 뇌에서 시상하부와 뇌하수체의 위치]3](%5Ba.%20%EC%8B%9C%EC%83%81%ED%95%98%EB%B6%80-%EB%87%8C%ED%95%98%EC%88%98%EC%B2%B4-%EB%82%9C%EC%86%8C%20%EC%B6%95%2C%20b.%20%EB%87%8C%EC%97%90%EC%84%9C%20%EC%8B%9C%EC%83%81%ED%95%98%EB%B6%80%EC%99%80%20%EB%87%8C%ED%95%98%EC%88%98%EC%B2%B4%EC%9D%98%20%EC%9C%84%EC%B9%98%5D3_1.jpg) |
|
[a. 시상하부-뇌하수체-난소 축, b. 뇌에서 시상하부와 뇌하수체의 위치]3 |
![이미지: [tu2670의 작용기전]3](%5Btu2670%EC%9D%98%20%EC%9E%91%EC%9A%A9%EA%B8%B0%EC%A0%84%5D3.jpg) |
|
[tu2670의 작용기전]3 |
(출처: Hypothalamic Pituitary Gonadal axis ; HPG axis)
GnRH(Gonadotropin releasing hormone)는 인간 생식계의 주요 신경내분비 조절자로, 시상하부에서 방출되며, 뇌하수체 전엽에 있는 GnRH receptor에 결합함으로써고나도트로핀[(LH(황체형성 호르몬, Luteinizing hormone)과 FSH(난포자극호르몬, follicle-stimulating hormone)]의 분비를 자극합니다. 이어서, 이들은 남성에서 정자 생성 및 테스토스테론의 합성을, 여성에서 난포 성장 및 에스트라디올/프로게스테론생성을 자극합니다.
자궁내막증의 경우 에스트라디올에 의해 악화되는 질환이므로, 에스트라디올의 분비에 영향을 미치는 LH 및 FSH의 분비를 차단 또는 감소시킴으로써 증상의 개선 또는 악화를 지연시킬 수 있습니다. LH 및 FSH의 분비를 차단 또는 감소시키기 위해 시상하부에서 분비되는 GnRH 수용체에 작용하는 기전으로 GnRH agonist와 GnRH antagonist가 있습니다.
GnRH agonist는 GnRH 수용체에 작용하여 LH/FSH의 분비를 촉진하여 에스트라디올 등 성호르몬의 생성을 급격하게 증가시킵니다. 급격하게 증가된 성호르몬은 반작용 기전으로 GnRH 수용체의 발현을 감소시킴으로써 성호르몬의 생성을 억제하는 기전입니다. 따라서, GnRH agonist는 투여 초기 고나도트로핀과 성호르몬의 급격한 증가(initial flare)를 초래하고, 뇌하수체의 탈감작 (desensitization, 과민성을 제거 또는약하게 함)이 이루어진 후 에스트라디올을 거세 또는 폐경 수준 이하로 억제합니다. 이러한 기전적 이유로, 초기의 성호르몬 상승에 따른 질환 악화의 가능성과 이후 성호르몬의 과다한 억제에 따른 부작용(주요한 부작용으로, 남성에서의 성기능 장애, 근력 약화, 여성의 경우 골밀도 감소 등)의 안전성 이슈가 존재합니다. 현재 GnRH agonist는 전립선암, 유방암, 불임치료시 배란억제, 조숙증, 자궁내막증, 선근증, 자궁근종, 월경과다, 안드로겐과잉증 등의 적응증에 대해서 승인받았습니다.
![이미지: [gnrh agonist 와 antagonist 투여시 sex hormone 억제 정도의 비교]3](%5Bgnrh%20agonist%20%EC%99%80%20antagonist%20%ED%88%AC%EC%97%AC%EC%8B%9C%20sex%20hormone%20%EC%96%B5%EC%A0%9C%20%EC%A0%95%EB%8F%84%EC%9D%98%20%EB%B9%84%EA%B5%90%5D3.jpg) |
|
[gnrh agonist 와 antagonist 투여시 sex hormone 억제 정도의 비교]3 |
TU2670의 작용기전인 GnRH antagonist는 GnRH agonist와 달리 즉각적이고 가역적으로 시상하부에서 분비되는 GnRH의 신호를 차단함으로써, LH/FSH의 분비를 일차적으로 차단하고, 이어 표적기관인 난소에서 에스트라디올 등 성호르몬을 억제하는 기전입니다. 즉, GnRH agonist와는 달리, antagonist는 즉각적으로 수용체를 억제하므로 성호르몬의 초기 상승을 유발하지 않는 장점이 있습니다. 2018년에 Abbvie사의 Elagolix가 최초의 경구용 GnRH antagonist로서 자궁내막증에 대해서 미 FDA로부터 신약 판매허가 승인을 받았으며, 자궁근종, 전립선암 치료제로도 개발 중입니다.
■ TU2670의 개발 적응증
1) 자궁내막증
자궁내막증은 병리학적으로 자궁내막조직이 자궁외 다른부위에 이식되고 그 조직이 난소의 성호르몬 주기에 반응하여 증식하는 것이 특징입니다. 주로, 난소에 발생하며, 그외 복막, 직장질중경, 자궁인대에도 흔히 발생합니다. 유병율은 국가 및 인종에 따라 10~30% 정도로 다양하게 보고되고 있으며, 자궁내막증은 심한 월경통 및 골반통을 유발할 수 있으며, 병변의 발생 위치에 따라 다양한 증상을 야기합니다. 또한, 불임의 흔한 원인으로 불임여성의 30~40%에서 자궁내막증이 관찰됩니다. 진단은 초음파나 MRI 같은 영상검사를 이용할 수 있으나, 확실한 진단은 복강경으로 가능합니다. 치료 방법은 증상 종류와 정도, 임신을 원하는지 여부, 자궁내막증 병변의 정도 및 위치에 따라 선택되며, 내과적으로 진통제, 경구피임제, GnRH agonist, progestin(Visanne), GnRH antagonist(Elagolix) 등이 있고, 외과적으로 수술적 치료 등이 있습니다. 수술 후에도 재발가능성이 높고, 수술 후 5년이내 재발 확률이 40~50%에 이르며, 주변조직과의 심한 유착으로 인해 합병증 위험성이 높습니다.
2) 자궁근종
자궁근종은 자궁에서 발생하는 가장 흔한 양성 종양으로, 가임 연령의 여성에서는 약 25%, 35세 이상의 여성에게서는 무증상 자궁 근종을 포함하여 약 40~50% 발병합니다. 통증, 생리 과다 및 부정 출혈, 요실금 등의 증상이 동반되며, 치료는 약물치료, 비수술적 치료, 수술적 치료가 있으며, 약물 치료제로는 GnRH agonist, progesterone receptor modulator(Esmya) 등이 있습니다. 비수술적 치료에는 자궁동맥 색전술,초음파 시술이 있고, 수술적으로는 근종절제술, 자궁절제술 등이 있으며, 복강경 수술의 재발율은 3년후 36.1%, 5년 후 52.9%로 재발율이 높습니다.
현재 결혼 연령이 높아지고 출산을 늦추는 추세에 따라 가임력을 고려해 자궁이나 난소를 가능한 보존할 수 있는 치료에 대한 관심도가 높습니다. 가임여성에서 주로 발병하는 자궁내막증과 근종은 수술 후 재발율 또한 높아 폐경까지 꾸준히 관리를 요구하는 질환이므로, 장기적으로 사용할 수 있는 안전한 약물 치료에 대한 니즈가 높습니다.
(다) NBP604프로그램 (TU7710 - 혈우병 치료제)
당사는 당사의 핵심연구진이 과거 SK케미칼에서 연구개발하였던 혈우병 치료제인 NBP601 프로그램이 호주 CSL Berhing 사에 기술 이전된 이후 미국 FDA, 유럽 EMA, 일본 후생성에서 허가를 득함에 따라 국내 개발 바이오신약으로서 최초로 허가를 득한 성공 이력을 보유하고 있습니다. 신약 개발의 희박한 성공 확률을 고려시 혈우병 치료제로서 승인을 득한 것은 그만큼 해당 치료제에 대한 전문성과 연구개발 역량이 뛰어나다는 것을 방증하는 것입니다. 당사는 혈우병 치료제 개발에 직접 참여하였던 대표이사 및 핵심 연구인력들이 바이오 신약창출시스템을 통해 혈우병 치료제 포트폴리오를 집중적으로 연구개발하고 있습니다. 이러한 치료제군 중 가장 개발 속도가 빠른 파이프라인은 임상 1상에 진입할 예정인 NBP604 프로그램이며, 신약후보물질명은 TU7710입니다.
■ TU7710의 특징
당사는 트랜스페린 수용체(transferrin receptor, TfR)에 의해 트랜스페린(Tf)이 재활용(recycling) 된다는 점을 이용해 혈액응고인자 7번(FVIIa)에 트랜스페린을 유전자 재조합적으로 융합시켜 반감기 증가를 시킨 혈우병 치료제를 개발하고 있고, 활성화된 응고인자 7번(FVIIa)에 최적화된 linker와 트랜스페린을 융합시킨 후보물질은 TU7710이라는 코드명으로 개발 중입니다. TU7710은 활성화된 응고인자 7번의 지속형 제형으로서, 중화항체 보유 A형 혈우병과 중화항체 보유 B형 혈우병, 그리고 응고인자 7번 결핍 혈우병에 대한 치료제로서의 적응증을 가지고 있습니다. 또한, TU7710은 1세대인 혈장유래제품의 감염 등 안전성 이슈와 NovoSeven 등 2세대 우회인자제품의 짧은 반감기 등 의학적 미충족 수요를 트랜스페린 융합 기술을 통해 극복하는 3세대 우회인자 제품으로 분류될 수 있습니다.
■ TU7710의 작용기전 및 적응증
정상인은 혈관이 파손되면 혈액에 존재하는 응고를 촉진하는 '응고 인자’라는 단백질들이 지혈 유도를 하여 궁극적으로 응고단백질로 이루어진 그물망으로 혈관을 막아 지혈을 할 수 있습니다 (아래그림 (가)). 혈우병은 특정 응고인자(제8인자 혹은 제9인자)가 결핍되어 지혈이 이루어지지 않는 질병이며, 해당 결핍 응고 인자를 주사제 형태로 보충해 주어 치료를 하게 됩니다 (그림 (나)). 그러나, 혈우병 환자의 일부는 치료를 위해 외부에서 보충해 준 응고 인자(제8인자 혹은 제9인자)에 대해서 면역반응을 일으켜 항체를 생성하게 됩니다. 면역반응으로 발생한 항체들 중에는 응고인자의 기능을 없애 버리는 항체들도 존재하게 되는데 이를 중화항체(neutralizing antibody)라고 합니다. 이런 중화항체를 보유한 혈우병 환자의 경우는 투여된 응고인자(제8인자 혹은 제9인자)의 기능이 작동하지 않게 되어 더 이상 지혈이 되지 않게 됩니다(그림 (다), 좌측).
|
● 혈우병 환자중에서 치료제에 대한 중화항체를 보유하는 비중은 A형 혈우병 환자의 경우 약 5~25%가 FVIII에 대한 중화항체를 형성하는 것으로 보고되고 있으며, B형 혈우병 환자의 경우에는 3~6%가 FIX에 대해 중화항체를 형성하는 것으로 알려져 있습니다. ● 중화항체를 보유한 혈우병 환자의 경우에는 기존 FVIII이나 FIX 제품으로는 치료효과가 없으므로, FVIII이나 FIX과는 독립적으로 혈액응고 기전의 하위 단계를 활성화시키는 우회인자(bypassing agent) 제제를 사용합니다. ● 주요 우회인자 치료제는 과량의 활성화형 응고인자 7번(activated factor VII, FVIIa)을 사용하거나 FXa와 FII를 포함하는 혈장제를 사용하고 있습니다(FEIBA) |
![이미지: [혈우병 발병 기전]3](%5B%ED%98%88%EC%9A%B0%EB%B3%91%20%EB%B0%9C%EB%B3%91%20%EA%B8%B0%EC%A0%84%5D3.jpg) |
|
[혈우병 발병 기전]3 |
이런 중화항체를 보유한 혈우병 환자는 '다량의' 활성형 응고 7인자를 보충하여 치료할 수 있습니다. 다량의 활성형 응고7 인자는 응고인자 8번과 9번이 관여하는 단계를'우회' 하여 그 아래 단계인 응고 10 인자 생성을 유도함으로써 충분한 양의 응고단백질 그물망을 형성하여 그림 (다)와 같이 중화항체보유 혈우병환자의 출혈도 멈출 수 있게 됩니다.
혈우병 치료제는 주기적으로 해당 응고인자를 정맥주사 해야 하기 때문에 반감기를 늘려 투여 횟수를 감소시킴으로 환자의 편의성을 늘려 주는 것이 제품개발의 주요한 방향입니다.
TU7710은 활성형 응고 7인자의 지속형 제품으로서, 기존 제품의 단점을 개선한 치료제입니다. 기존 응고 7인자의 경우 인체 내에 투여했을 때, 효과가 2~3시간 만에 50%가 감소하게 되어 1회지혈을 위해서 며칠 동안 2~3시간 마다 약물을 투여해야 합니다. 이렇게 약물의 농도(효과)가 절반으로 감소하는 시간을 반감기라고 하는데, 개발하고 있는 후보물질 TU7710은 기존 응고인자 대비 반감기가 2~3배 증가되어 환자의 편의를 크게 증진시켰습니다.
![이미지: [tu7710 작용 기전]3](%5Btu7710%20%EC%9E%91%EC%9A%A9%20%EA%B8%B0%EC%A0%84%5D3.jpg) |
|
[tu7710 작용 기전]3 |
응고 7인자의 반감기를 개선한 방법은 트랜스페린이라는 혈액 내에 풍부하게 존재하고 있는 단백질의 특성을 이용하여 달성하였습니다. 위의 그림 왼쪽과 같이 보통의 단백질들은 혈액 내에서 순환하는 과정에서 분해 과정을 거쳐 제거가 됩니다. 하지만, 트랜스페린 단백질은 보통의 단백질이 겪는 분해 과정을 빠져 나와 다시 재활용되는 기작이 있습니다. 그런 이유로 혈중에서 긴 반감기를 유지할 수 있게 됩니다. TU7710은 기존 활성형 응고7인자에 트랜스페린을 유전적으로 융합시켜 하나의 분자처럼 행동하게 만들어, 반감기가 긴 트랜스페린의 특성을 응고 7인자에 적용할 수 있었습니다. 결과적으로 TU7710은 기존 응고인자에 비해서 2-3배 길어진 반감기를 가짐을 확인하였습니다.
(라) 경기변동과의 관계 및 계절적 요인
당사가 영위하고 있는 신약 개발 사업은 인간의 건강 및 생명과 밀접하게 관련되어 소비 지출 중 우선적으로 지출되는 경향에 따라 경기변동이나 계절적요인에 영향을 적게 받는 사업입니다. 의약품은 전문의약품과 일반의약품으로 구분이 가능하며, 일반의약품은 상대적으로 경기 변동과 계절성에 민감할 수 있으나 당사가 개발중인 전문의약품 분야는 경기변동과 계절적요인에 거의 영향을 받지 않는다고 할 수 있습니다. 또한, 인구고령화와 경제성장으로 건강에 대한 사회적 관심이 고조되고 이는 삶의 질 향상, 수명 연장에 대한 욕구 증가로 연결되어 의료서비스와 의약품에 대한 수요가 크게 증가하고 있고 이에 따라 전세계 의약품 시장은 지속적, 안정적으로 고성장할 것으로 예상되고 있습니다.
(마) 제품의 라이프사이클
신약의 경우 특허, Initial exclusivities for New Drugs 제도 등을 통하여 일정기간 동안 독점적인 판매권을 보장받을 수 있으며, 이 기간은 제품의 라이프사이클과도 연관을 가지고 있습니다. 특허의 경우 일반적으로 출원으로부터 20년간 제품의 권리가 보호되며, 미국, 유럽, 일본, 한국을 비롯한 여러 국가에서 의약품의 임상시험 및 허가심사에 소요된 기간에 대하여 최고 5년까지 특허존속기간을 연장해 주는 제도를 가지고 있습니다(Waxman-Hatch법, 일본특허법 제67조제2항, Regulation EC 469/200).
Initial exclusivities for New Drugs 제도는 신약의 인허가에 필요한 노력을 보상해 주기 위하여 허가 신청 시 제출된 안전성, 유효성 자료에 대하여 허가일로부터 일정기간 동안 독점권을 부여해 주는 제도로써 신약의 경우 5년(희귀질환 경우 7년), 적응증 추가에 따른 신규 임상추가의 경우 3년 정도의 기간동안 보호받을 수 있습니다. 일반적으로 신약개발에는 후보물질 탐색 등 Discovery 단계에서 전임상, 임상, 허가 후 출시까지 12~15년 정도의 기간이 소요되므로, 출시 후 제네릭 제품 출시까지 평균적으로 10년 이상의 기간 동안 보호받을 수 있습니다. 당사의 TU2218(특발성 폐섬유증) 및 혈우병치료제는 희귀질환(Orphan Drug)으로 인정받을 가능성이 높기 때문에 Initial exclusivities for New Drugs 제도에 따라 보호받는 기간은 연장될 가능성이 높습니다.
(3) 사업 구조
당사는 혁신신약 연구개발 회사로서, 장기간 소요되는 신약 개발의 프로세스 중 Discovery 단계와 Pre-Clinical(전임상) 단계 그리고 Early Clinical(초기 임상) 단계까지 Value Chain 상의 역할을 담당합니다. 해당 단계까지 신약후보물질의 약효 유효성과안전성을 입증하여, 임상 또는 후기 임상단계 및 상업화 단계는 해당 영역에 특화된 다국적 제약사 및 바이오 기업에 기술 이전 (Licensing out, L/O)을 하여 당사의 수익(마일스톤 및 로열티)을 확보하는 사업화 전략을 영위하고 있습니다.
![이미지: [당사의 사업 구조]3](%5B%EB%8B%B9%EC%82%AC%EC%9D%98%20%EC%82%AC%EC%97%85%20%EA%B5%AC%EC%A1%B0%5D3_1.jpg) |
|
[당사의 사업 구조]3 |
결론적으로 당사의 입장에서는 기술이 제품화되어 대량생산을 통해 시장에 공급되는 최종 상업화 시점이 판매 시점이 아니라, 연구개발 과정 중에 신약후보물질의 개발가능성을 더 높일 수 있는 개발 파트너에게 기술이전이 되는 시점이 판매가 이루어지는시점입니다.
이러한 사업 구조를 가능케 하는 배경은 제약 산업 내 혁신 분업 구조의 확대 및 글로벌 혁신 네트워크의 발달입니다. 다국적 대형 제약사들(Big pharma)은 R&D 생산성 저하 문제로 제약 산업 내 R&D 가치사슬 단계에 있어서 글로벌 혁신 네트워크를 활용하여 글로벌 표준에 맞는 연구목표와 방법론에 따라 신약후보물질을 연구개발할 수 있는 역량을 보유한 회사들로부터 후보물질 또는 기술을 도입하는 방식으로 리스크 관리 및 수익창출을 추구하고 있으며 이러한 경향은 지속 증가하고 있습니다. 당사와 같이 글로벌 허가 신약 연구 이력 및 우수한 신약창출 시스템 및 인력을 보유한 기업의 경우, 이러한 글로벌 혁신 네트워크에 참여하여 국내외 대형 제약사에 기술이전을 통한 수익 창출이 가능하며, 설립 이후 지속적으로 기술이전 사업화를 실행하고 있습니다.
(4) 신규 사업
당사는 보고서 작성기준일 현재 신약 연구개발 이외에 추진 중인 신규 사업은 없습니다.
나. 시장 현황
(1) 시장의 특성
(가) 글로벌 의약품 시장의 특성
1) 국민 보건 및 안전성과 관련된 규제 의존성
의약품 시장은 각국별로 국민 보건 및 안전성과 관련하여 새로운 의약품이 환자에게 판매되기 까지의 모든 단계를 엄격하게 규제하는 규제당국의 통제를 받는 시장으로, 해당 시장에 참여하는 주체들이 그러한 규제에 따라 시장 진입 여부, 제품에 대한 가격 결정, 공급 및 판매 방식 등 모든 영역에서 중대한 영향을 받게 됩니다. 각국별로 규제의 수준과 내용이 다양하게 나타나고 있는 바, 시장 규모가 가장 큰 지역인 미국과 유럽의 규제는 약물사고로 인한 의약품의 안전성 측면에 맞춰 입법되어 오다가 1980년대 이후부터는 혁신적 약물 개발로 인한 환자 치료 확대와 공공적 이익을 극대화하는 방향으로 규제의 내용이 점차 바뀌어 가고 있습니다.
2) 일정 기간 독점적 지위와 높은 진입장벽 존재
시장에서 판매되는 하나의 신약이 개발되기까지 초기 후보물질 도출에서 시판 승인을 받는 데에 걸리는 통상적인 기간은 약 10년~15년이며, 그 과정에서 많은 개발비용이 발생하게 됩니다. 이러한 오랜 기간과 높은 개발비용은 그 자체만으로 진입을 어렵게 만들어 여타 다른 산업 대비 높은 시장 진입장벽을 가지고 있습니다. 또한, 해당 신약물질에 대한 특허권을 출원/등록한 이후 약 20년의 기간동안 특허가 존속하는 것에 덧붙여 미국 및 유럽은 특허존속기간과 관계없이 신약에 대한 독점판매기간도 인정해주는 경우가 많이 있습니다. 이러한 사유로 신약 개발에 성공할 경우 높은 개발비, 각 단계별 절대적으로 소요되는 개발 기간, 특허권 및 독점판매권으로 인하여 독점적 지위를 제공받게 되고 이에 따라 대부분의 치료제 시장은 일정 기간 소수의 의약품만 경쟁하는 과점 시장을 형성하게 됩니다.
3) 지식 및 기술집약도가 높은 고부가가치 영역
신규 의약품 개발은 지식 및 기술 집약도가 높은 고부가가치 영역으로서, 신약개발을 위한 연구에서부터 원료 및 완제의약품의 생산과 판매 등 모든 과정에 정밀 화학, 의학, 약학, 생물학 등 여러 분야의 지식과 기술이 복합적으로 투입되어야 하는 종합 예술이라 할 수 있습니다. 전술한 바와 같이 규제당국의 통제와 특허권 및 독점적 지위에 따라 경쟁이 제한되고 지식 및 기술적인 측면에서 각 분야의 전문가들이 협업하여 오랜 기간 동안 연구개발 하여야 하므로, 일단 신약으로 판매 허가를 받고 나면 상당한 규모의 부가가치가 창출됩니다. 약가는 시판 이후의 생산 및 마케팅 비용보다 훨씬 높은 수준에서 형성이 되는 경우가 많으므로 이에 따른 높은 수준의 수익성이 실현된다고 할 수 있습니다.
4) 지속적인 고성장 예상
전세계 의약품 시장은 전인류의 고령화 및 수명연장 욕구에 따라 건강과 직결되는 의약품의 수요는 꾸준히 증가할 것으로 예상되고 있습니다. 그뿐만 아니라 의약품의 보급이 원활하지 않았던 저개발 국가들의 경제 발전이 가속화되고, 개개인별 유전체 분석 기술이 발달함에 따라 맞춤형 의약품 시장이 태동하면서 의약품 시장은 전방위적으로 확대될 것으로 예상하고 있습니다.
5) 가격의 비탄력성 및 경기변동 영향 적음
의약품은 생명 및 건강과 직접 관련이 있어 가격이 높더라도 비용을 지불하고 구매하려는 속성이 있으며, 의약품 가격은 타 제품 대비 비탄력적입니다. 이에 따라 의약품은 타 산업에 비해 경기 변동에 큰 영향을 받지 않으며, 안정적인 성장을 하는 경향이 있습니다.
(나) 희귀질환 치료제 시장의 특성
당사가 목표로 하는 희귀질환 치료제 시장은 다음과 같은 특성을 지니고 있습니다. 희귀 난치성 질환은 질환별 환자 수가 일반 질환에 비해 적고 대부분 적절한 치료제가 개발되어 있지 않은 상황이며, 이로 인해 제약 선진국인 미국, 일본, EU 등은 정부가 직접적으로 개입하여 여러 지원정책을 실시하며 개발을 독려하고 있습니다. 질환별 환자수는 적은 편이나 희귀질환은 지속적으로 증가하여 미국에서 발견된 희귀질환은 약 7,000여개이고 해당 환자는 3,000만명에 육박하고 있어 관련 환자는 지속적으로 증가하고 있습니다.
희귀질환 치료제 개발을 독려하기 위하여 미국 정부는 선도적으로 희귀의약품법안인 'The Orphan Drug Act'을 제정하고 희귀의약품 개발을 장려하기 위하여 다양한 혜택을 제공하고 있습니다. 미국 기준에 의하면 희귀질환은 환자수를 20만명 미만으로 제한하고 있으며 약가가 낮아 의약품 개발비용의 회수가 어려울 것으로 예상되는 경우에는 환자수가 20만명을 초과하여도 희귀의약품으로 지정하고 있으며, 희귀의약품으로 지정되면 연구개발비용 세액공제, 보조금 지원, 승인 신청 수수료 면제, 시판 후 7년간 독점권 부여 등 다양한 혜택을 제공하고 있습니다.
| [미국의 희귀의약품 지원제도] |
|
지원제도 |
내용 |
|---|---|
|
시장독점권 |
승인 희귀의약품 7년간 시장독점권 부여 해당 기간동안 제네릭 시장진입 불가 → 전통적인 IP의 특허보호권 및 물질적인 인센티브보다 우월 |
|
세액공제 |
희귀의약품 세액공제(The Orphan DrugTax Credit, ODTC)를 통해 적응증에 대한 미국내 임상시험비용에 대한 세액공제(적격임상비용의 25%) → 의약품 개발비용 감소 효과 |
|
임상보조금 지원 |
희귀의약품 보조금프로그램(OrphanProduct Grant Program)은 희귀질환의 치료/진단을 위한 새로운 치료법의 임상비용지원 → 의약품 개발비용 감소 효과 |
|
수수료 면제 |
희귀의약품은 FDA가 부과하는 일반적인 신약신청 또는 "사용자" 수수료("User" fees) 면제 → 의약품 개발비용 감소 효과 |
(출처: FDA, Health Law Journal, NORD, 한화투자증권리서치센터)
따라서, 희귀질환 치료제는 심각한 의학적 미충족 수요를 바탕으로 희귀의약품 도입 규제의 완화 및 약가 정책 등 각종 인센티브 지원이 활발해지면서 전세계 제약시장에서 가장 빠르게 성장하고 있는 분야로 향후에도 성장세가 가속화될 것이라는 분석입니다. 실제로, 희귀의약품 판매 성장률은 2011년~2017년 기간 동안 두배 가량 증가하였으며, 2019년 1,360억 달러에서 2024 년 2,420억 달러로 연평균 12% 성장할 전망입니다. 이는 같은 기간 일반의약품 시장이 연평균 6% 성장하는 것과 비교할 때 매우 높은 성장세입니다. 또한, 1인당 연간 평균 치료비의 경우 희귀의약품은 15만달러로 일반의약품 3만달러 대비 4.5배 높습니다.
![이미지: [희귀질환 치료제 시장전망]](%5B%ED%9D%AC%EA%B7%80%EC%A7%88%ED%99%98%20%EC%B9%98%EB%A3%8C%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%EC%A0%84%EB%A7%9D%5D.jpg) |
|
[희귀질환 치료제 시장전망] |
(출처: EvaluatePharma)
(다) 당사 보유 주요 파이프라인의 시장 규모 및 전망
1) TU2218 - 특발성 폐섬유증 (IPF) 시장 현황 및 전망
IPF는 진단 후 5년 내 사망률이 70%에 이르는 매우 치명적인 질환임에도 불구하고 현재까지 생존률을 향상시키는 치료제 개발이 전무한 상황입니다. 2015년 Roche의 Pirfenidone(상품명, Esbriet) 및 Boehringer-Ingelheim의 Nintedanib(상품명, Ofev) 단 2종류의 약제가 최초 허가되어 시판되고 있으나, FVC(forced vital capacity, 노력성 폐활량)의 악화를 개선하는 수준의 약제로 한계점을 지니고 있습니다. 스테로이드를 비롯해 항섬유화제 등 기타 약물을 사용할 수 있지만 모든 증상 및 환자에 적용 가능한 것은 아니며 뚜렷한 효과 역시 입증되지 않았으며, 말기 환자는 폐 이식 외 다른치료 방법이 없는 것으로 여겨지고 있음에 따라 치료제 시장이 견고하게 형성되어 있지 아니합니다.
앞서 언급한 Pirfenidone(Esbriet)와 Nintedanib(Ofev)가 미 FDA와 EU EMA에서 희귀의약품으로 지정되어 경중증도 환자 대상으로 시판되고 있고, 국내에서도 두 제품 모두 희귀의약품으로 지정되었으며, IPF 치료제로 승인된 치료제는 2015년 승인된 두 치료제뿐으로 IPF 치료제 시장을 개척하고 있는 상황입니다. 그러나, 해당 치료제의 부작용으로 설사, 구토, 복통, 간효소 증가, 식욕 및 체중 감소 등 다양한 부작용이 보고되고 있으며, 이들 제품은 FVC(forced vital capacity, 노력성 폐활량)의 악화를 개선하는 수준의 임상적 효능만으로 IPF에 대해 승인을 받았으나, 원천적 치료를 통한 생존율 개선 효과는 없다고 보고됩니다. 또한, 안전역(safety margin)이 매우 낮아 복용 시 대부분의 환자에서 부작용이 발생하여 해당 약제의 용량 증가를 통한 효능 향상이 불가능한 것으로 나타나는 등 의학적 미충족 수요가 높은 상황입니다.
그럼에도 불구하고 적절한 치료제의 부재로 Esbriet과 Ofev의 매출은 2019년 기준 각각 $1.15Bn, $1.75Bn으로 블록버스터 매출을 달성하였습니다.
주요7개국(7MM, 미국, 일본, 프랑스, 독일, 이탈리아, 스페인, 독일) 기준, IPF 치료제 Esbriet 및 Ofev 시장의 규모는 2015년 $1Bn에서 2019년 $2.9Bn의 매출을 달성하였으며, 글로벌 시장조사업체인 Globaldata가 예측한 연도별 성장률 적용 시 2025년 Esbriet 및 Ofev의 매출은 $5.4Bn을 달성할 것으로 예상됩니다. 향후 신규 치료제의 출시가 치료제 시장의 확대를 견인할 것으로 예상합니다.
![이미지: [ipf치료제, esbriet 및 ofev 시장 전망 7mm 기준] 3](%5Bipf%EC%B9%98%EB%A3%8C%EC%A0%9C%2C%20esbriet%20%EB%B0%8F%20ofev%20%EC%8B%9C%EC%9E%A5%20%EC%A0%84%EB%A7%9D%207mm%20%EA%B8%B0%EC%A4%80%5D%203.jpg) |
|
[ipf치료제, esbriet 및 ofev 시장 전망 7mm 기준] 3 |
(출처: 2019년 이전 - 각사 Annual Report, 2020년 이후 - Globaldata 추정 성장률 적용)
2) TU2218 - 면역항암제 시장 현황 및 전망
글로벌 시장조사기관 IQVIA에 따르면 전세계 면역항암제 시장 규모는 2013년 기준 $0.9 Bn(약 1조원)에서 20배 이상 증가하여 2018년 $19.3 Bn(약 21조원)로 성장하였으며, 전체 항암제 시장에서 차지하는 비중도 1% 미만에서 12.9%로 증가하였습니다.
![이미지: [2013년 대비 2018년 면역항암제의 매출 규모 및 비중($bn)]3](%5B2013%EB%85%84%20%EB%8C%80%EB%B9%84%202018%EB%85%84%20%EB%A9%B4%EC%97%AD%ED%95%AD%EC%95%94%EC%A0%9C%EC%9D%98%20%EB%A7%A4%EC%B6%9C%20%EA%B7%9C%EB%AA%A8%20%EB%B0%8F%20%EB%B9%84%EC%A4%91%28%24bn%29%5D3.jpg) |
|
[2013년 대비 2018년 면역항암제의 매출 규모 및 비중($bn)]3 |
BMS와 오노약품공업이 공동 개발한 옵디보와 여보이 2개 면역관문억제제는 전세계시장에서 매년 조 단위의 매출을 올리고 있는 블록버스터 신약으로 포문을 열었고, 글로벌 시장에서 옵디보의 2019년 연간 매출액은 $8Bn를 기록하였습니다. MSD의 키트루다의 글로벌 매출액은 2014년 시장에 나온 이후 계속 성장해 2019년 매출액은 $11Bn를 기록 중이며, 사용범위가 상대적으로 넓은 옵디보가 2014년 출시 이후 초반 면역항암제 시장의 주도권을 쥐었지만, 2017년 이후 키트루다의 매출이 큰 폭으로 증가하고 있습니다.
| [면역관문억제제 매출 현황] |
|
미 FDA 허가 |
제품명 |
성분명 |
작용기전 |
매출 ($ Bn) |
||||
|---|---|---|---|---|---|---|---|---|
|
2015년 |
2016년 |
2017년 |
2018년 |
2019년 | ||||
|
2014 |
옵디보 |
nivolizumab |
PD-1 |
1.14 |
4.73 |
5.78 |
7.57 |
8.06 |
|
2014 |
키트루다 |
pembrolizumab |
PD-1 |
0.57 |
1.40 |
3.81 |
7.17 |
11.08 |
|
2016 |
티센트릭 |
atezolizumab |
PD-L1 |
- |
- |
0.49 |
0.79 |
1.97 |
|
2017 |
임핀지 |
durvalumab |
PD-L1 |
- |
- |
- |
0.63 |
1.46 |
(출처: Datamonitor, Globaldata 옵디보는 오노약품공업의 판매분을 포함)
당사 신약후보물질이 단독 또는 병용투여를 통해 진입할 것으로 예상되는 목표 시장은 면역항암제 시장으로 정의할 수 있으며, 면역항암제 시장은 전망기관에 따라 최소$30Bn에서 최대 $90Bn까지 예측하고 있습니다. Globaldata에 따르면, 현재 면역항암제 시장을 주도하고 있는 면역관문억제제 중 PD-1, PD-L1의 주요 제품(티센트릭,바벤시오, 임핀지, 옵디보, 키트루다 5가지)은 2018년 $13.6Bn에서 2023년 $34.4Bn로 연평균 15% 이상 고성장할 것으로 전망하고 있습니다.
![이미지: [면역관문억제제 글로벌 시장 전망]3](%5B%EB%A9%B4%EC%97%AD%EA%B4%80%EB%AC%B8%EC%96%B5%EC%A0%9C%EC%A0%9C%20%EA%B8%80%EB%A1%9C%EB%B2%8C%20%EC%8B%9C%EC%9E%A5%20%EC%A0%84%EB%A7%9D%5D3.jpg) |
|
[면역관문억제제 글로벌 시장 전망]3 |
(출처: GlobalData 2017)
3) TU2670 - 자궁내막증 및 자궁근종 시장 현황 및 전망
자궁내막증은 만성골반통증, 불임, 월경통, 성교통 등의 증상을 동반하는 에스트로겐의존성 질환으로 가임기 여성의 약 10% ~ 30% 수준으로 발병하는 것으로 보고되고 있으며, 골반통증이 있거나 불임이 있는 여성으로 한정하면 자궁내막증을 앓고 있는 비율은 30~50% 수준으로 유병율이 아주 높은 질환입니다.
자궁근종은 자궁 평활근에서 유래되는 양성종양으로, 여성에서 발생하는 종양 중에서 가장 흔한 종양입니다. 자궁내막증과 유사하게 가임기 여성에서 주로 발견되며, 35세 이상의 여성 중 약 40~50%는 무증상 자궁 근종을 포함하여 자궁근종을 가지고 있는 것으로 알려져 있습니다. 주로 월경이상(월경과다), 통증(골반통, 성교통, 월경통) 및 복부 압박감 등의 증상이 나타나며, 불임과 유산 등에 영향을 미친다고 보고됩니다.
자궁내막증 및 자궁근종 치료제로 사용되는 주요 치료제는 GnRH agonist 계열, Progestin 계열 등이 있으며, 2018년 당사가 개발하고 있는 TU2670과 동일한 기전인 Elagolix가 GnRH antagonist 계열로 미 FDA의 첫 승인을 받았습니다. GnRH agonist 계열의 치료제들은 자궁내막증 뿐 아니라 자궁근종, 전립선암, 성조숙증 등 다양한 적응증에 적용되고 있으며, 기전적으로 유사한 GnRH antagonist 계열의 치료제도 자궁내막증 외 다양한 적응증에 적용이 가능할 것으로 예상되고 있습니다. 실제로 Elagolix는 승인된 자궁내막증 외 자궁근종 임상3상을 진행중이며, Relugolix는 자궁내막증, 자궁근종, 전립선암에 대해 임상3상을 진행하고 있습니다. 따라서, 자궁내막증 및 자궁근종의 치료제로 사용되는 주요 치료제의 시장 규모 현황 및 전망을 당사가 목표로 하는 시장규모로 추정하였습니다.
Datamonitor에 따르면, 자궁내막증 및 자궁근종의 치료제로 사용되는 주요 치료제는 GnRH agonist 계열의 Lupron, Zoladex, Trelstar와 프로게스틴 계열의 Visanne, Oral GnRH antagonist인 Elagolix 등이 있으며, 2017년까지 GnRH agonist 계열의 치료제가 주요 치료제 시장의 대부분을 차지하고 있습니다. 그러나 향후 GnRH antagonist 계열의 Elagolix가 2021년 이후 $1 Bn의 매출을 달성하면서 자궁내막증 및 자궁근종 치료제 시장을 견인할 것으로 예상되고 있습니다.
| [자궁내막증 및 자궁근종 주요 치료제 기준 시장 규모] |
| (단위: M$) |
|
Drug |
Type |
2014년 |
2015년 |
2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
2021년 |
2022년 |
|---|---|---|---|---|---|---|---|---|---|---|
|
Lupron |
GnRH agonist |
1,921 |
1,973 |
1,874 |
1,884 |
1,771 |
1,687 |
1,602 |
1,541 |
675 |
|
Zoladex |
GnRH agonist |
930 |
823 |
821 |
740 |
690 |
660 |
658 |
648 |
628 |
|
Trelstar |
GnRH agonist |
421 |
371 |
376 |
394 |
343 |
342 |
341 |
338 |
344 |
|
Vissane* |
Progestin |
- |
107 |
128 |
73 |
|
|
|
|
|
|
Elagolix |
GnRH antagonist |
- |
- |
- |
- |
130 |
411 |
695 |
1,424 |
1,860 |
|
합계 |
3,272 |
3,274 |
3,199 |
3,091 |
2,934 |
3,100 |
3,296 |
3,951 |
3,507 |
|
(출처: Datamonitor 2017, 2018, 2014~2017 실적, 2018~2022 추정)
*2017년 이후 추정정보 미제공
4) 혈우병 치료제 시장의 현황 및 전망
■ 국가별 혈우병 치료제 시장규모의 전망
Datamonitor에 따르면, 선진 7개국(7MM)의 혈우병 치료제 시장은 2016년 $10.1Bn에서 2025년 $12.4Bn로 연간 2.6%의 성장률을 보이며 완만하게 성장할 것으로 예상됩니다. 국가별로는 2016년 기준 선진 7개국 시장 중 미국이 약 55%의 비중을 차지하며 가장 큰 시장을 형성하고 있으며, 2025년에는 약 59%로 시장에서 차지하는 비중이 점차 증가할 것으로 예상되고 있습니다.
| [국가별 혈우병 치료제 시장규모의 전망] |
| (단위: M$) |
|
국가 |
2016 |
2017 |
2018 |
2019 |
2020 |
중략 |
2024 |
2025 |
|---|---|---|---|---|---|---|---|---|
|
미국 |
5,462 |
5,649 |
5,844 |
6,048 |
6,255 |
··· |
7,146 |
7,368 |
|
일본 |
751 |
763 |
785 |
825 |
879 |
1,125 |
1,170 |
|
|
프랑스 |
1,023 |
939 |
940 |
939 |
936 |
904 |
897 |
|
|
독일 |
617 |
602 |
600 |
599 |
599 |
609 |
614 |
|
|
이탈리아 |
462 |
463 |
465 |
468 |
471 |
479 |
481 |
|
|
스페인 |
254 |
257 |
259 |
262 |
265 |
281 |
284 |
|
|
영국 |
1,446 |
1,464 |
1,491 |
1,519 |
1,545 |
1,611 |
1,617 |
|
|
총합계 |
10,015 |
10,136 |
10,384 |
10,660 |
10,950 |
12,157 |
12,431 |
(출처: Datamonitor 2018, 7MM)
■ 혈우병 우회인자 치료제(Bypassing agent)의 시장규모 전망
TU7710은 중화항체 보유 혈우병 환자 및 선천적으로 Factor VII이 없는 혈우병환자를 대상으로 판매중인 치료제(Bypassing agent) 시장을 주요 타깃으로 하고 있고, 당사는 Datamonitor에서 추정하는 Bypassing agent 시장 전망자료를 기준으로 목표 시장의 규모를 추정하였습니다. Bypassing agent의 경우 7MM 기준 2016년 매출이 $1.5Bn에서 소폭 증가하여 2025년 매출은 약 $1.6Bn 수준일 것으로 예상됩니다.
| [7MM 기준 Bypassing agent의 시장 전망] |
| (단위: M$) |
|
제품 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
2023 |
2024 |
2025 |
|---|---|---|---|---|---|---|---|---|---|---|
|
NovoSeven |
893 |
896 |
906 |
910 |
900 |
881 |
856 |
823 |
787 |
754 |
|
FEIBA |
643 |
645 |
650 |
652 |
645 |
633 |
617 |
597 |
574 |
552 |
|
LR769 |
- |
- |
6 |
24 |
64 |
111 |
165 |
225 |
282 |
325 |
|
합계 |
1,537 |
1,541 |
1,562 |
1,586 |
1,609 |
1,625 |
1,638 |
1,645 |
1,643 |
1,631 |
(출처: Datamonitor 2018, 7MM 기준)
■ B형 혈우병 치료제 시장규모 전망
Datamonitor에 따르면, B형 혈우병치료제의 경우 7MM 기준 2016년 매출이 약 $1.5Bn에서 연평균 약 5%씩 증가하여 2025년 매출은 약 $ 2.3Bn수준으로 증가할 것으로 예상되고 있습니다.
| [7MM 기준 Bypassing agent의 시장 전망] |
| (단위: M$) |
|
제품 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
2023 |
2024 |
2025 |
|---|---|---|---|---|---|---|---|---|---|---|
|
Alprolix |
300 |
342 |
394 |
451 |
503 |
550 |
590 |
622 |
645 |
663 |
|
Idelvion |
29 |
92 |
184 |
287 |
381 |
468 |
540 |
595 |
632 |
658 |
|
Rebinyn |
- |
0.3 |
42 |
77 |
127 |
162 |
187 |
208 |
224 |
237 |
|
Benefix |
480 |
445 |
390 |
334 |
278 |
232 |
196 |
170 |
154 |
146 |
|
기타 |
652 |
631 |
609 |
587 |
570 |
559 |
555 |
556 |
560 |
567 |
|
합계 |
1,460 |
1,509 |
1,618 |
1,736 |
1,859 |
1,971 |
2,068 |
2,150 |
2,217 |
2,271 |
(출처: Datamonitor 2018, 7MM 기준)
다. 경쟁 현황
(1) 특발성 폐섬유증 치료제
① 경쟁 구도
특발성 폐섬유증 치료제으로 허가받은 치료제는 저분자 합성신약인 Roche의 Esbriet, Boehringer Ingelheim사의 Ofev로 단 2개의 치료제만이 존재합니다. Esbriet 및 Ofev가 2015년 출시되면서 특발성 폐섬유증 치료제 시장이 본격적으로 형성되기 시작하였으며, 특발성 폐섬유증 치료제 시장을 양분하고 있습니다. 두 치료제는 생존률에는 영향을 미치지 못하는 증상완화의 효과만을 가지고 있으나 적절한 치료제의 부재로 Esbriet과 Ofev의 매출은 2019년 기준 각각 $1.15Bn, $1.75Bn으로 블록버스터 매출을 달성하였습니다.특발성 폐섬유증 치료제의 최근 매출추이 및 점유율은 다음과 같습니다.
![이미지: [특발성 폐섬유증 치료제 매출추이($m)]3](%5B%ED%8A%B9%EB%B0%9C%EC%84%B1%20%ED%8F%90%EC%84%AC%EC%9C%A0%EC%A6%9D%20%EC%B9%98%EB%A3%8C%EC%A0%9C%20%EB%A7%A4%EC%B6%9C%EC%B6%94%EC%9D%B4%28%24m%29%5D3.jpg) |
|
[특발성 폐섬유증 치료제 매출추이($m)]3 |
(출처: Medtrack, Informa Pharma Intelligence)
② 신규 개발 파이프라인의 동향
특발성 폐섬유증과 관련하여 국내외 대표적으로 개발중인 파이프라인은 다음과 같습니다.
|
Drug |
개발사 |
개발단계 |
비고 |
|---|---|---|---|
|
GLPG-1690 |
Galapagos NV |
Phase III |
저분자 화합물, 경구용, autotaxin inhibitor |
|
FG3019 |
FibroGen Inc |
Phase III |
단일클론항체, CTGF Target |
|
PRM-151 |
Promedior Inc |
Phase II completed |
재조합단백질 |
|
BBT-877 |
브릿지바이오 |
Phase I |
저분자 화합물 autotaxin inhibitor |
Galapagos의 GLPG1690은 임상3상 진행 중이며, Fibrogen의 FG3019, Promedior의 PRM-151는 임상2상을 완료 후 임상3상 진입 대기 중에 있습니다. 당사 물질과 기전은 다르나 small molecule 제제로 개발중인 GLPG1690은 Autotaxin (섬유증, 자가면역질환, 종양 등 다양한 질병에 관여하는 것으로 알려짐) 저해 신약후보물질인자로서 1일1회 경구 복용하는 신약으로 개발 중입니다. FG3019는 CTGF Inhibitor로서 단일클론 항체이고, PRM-151은 재조합 인간 펜트락신2단백질(Recombinant PTX2) 기전의 물질입니다.
국내에서는 브릿지바이오가 국내 레고켐바이오사이언스로부터 도입한 autotaxin 저해 신약 후보 물질 'BBT-877'를 개발 중에 있으며, 2019년 7월 다국적제약사 베링거인겔하임에 총 11억유로 규모의 기술이전계약을 체결한 바 있습니다.
(2) 면역항암제
① 경쟁 구도
항암 치료제 시장의 트렌드는 1세대 화학항암제에서, 2세대 표적항암제로, 3세대 면역항암제로 각각의 의학적 미충족 수요를 충족하면서 발전하고 있습니다.
3세대 면역항암제에 속하는 TU2218은 TGF-β저해제로써 강력한 면역항암 효과뿐아니라, 종양미세환경을 다각도로 타겟하는 Multi-Level의 항암기전을 가지고 있으며, 이러한 기전으로 개발되어 현재 허가를 득한 항암 치료제는 현재 없습니다. 또한,기존의 면역항암제와 병용투여를 통해 기존 면역항암제에 반응하지 않는 환자의 반응성을 높일 수 있기 때문에 기존의 면역항암제가 경쟁치료제라기보다는 상호 보완적인 치료제로 볼 수 있을 것으로 판단되며, 허가될 경우 기존 면역항암제 시장을 잠식하기보다는 새로운 시장을 창출하면서 성장할 것으로 예상됩니다. 다만, 현재 TU2218과 유사한 기전으로 다국적 제약사 일라이 릴리 및 국내 신약개발회사 메드팩토가 개발 중이며, 허가될 경우 잠재적인 경쟁회사가 될 것으로 예상됩니다.
② 신규 개발 파이프라인의 동향
|
Drug |
개발사 |
개발단계 |
비고 |
|---|---|---|---|
|
LY3200882 |
Eli Lily |
Phase II |
고형암 치료를 위해 개발중이며 경구용으로 개발중. 2018년 11월 임상2상에 진입 |
|
TEW-7197 |
Medpacto |
Phase IIa |
벡토서팁 (Vactosertib, 종양미세환경 조절) 개발 중. MSD의 키트루다 및 아스트라제네카의 임핀지와 병용 투여 임상 진행 중 |
(3) 자궁내막증, 자궁근종 치료제
① 경쟁 구도
자궁내막증 치료제는 계열별로 Progestin, GnRH agonist, GnRH antagonist 등이 있으며, 이들 치료제는 계열별로 자궁내막증 외 자궁근종, 전립선암, 성조숙증 등에 사용되고 있습니다. 2018년 기준 자궁내막증으로 사용되는 주요 치료제 중 GnRH agonist 기전의 Lupron, Zoladex, Trelstar가 매출규모가 크며, 해당 치료제들 기준 점유율은 다음과 같습니다.
![이미지: [gnrh agonist 기전 치료제 시장점유율(2018)]3](%5Bgnrh%20agonist%20%EA%B8%B0%EC%A0%84%20%EC%B9%98%EB%A3%8C%EC%A0%9C%20%EC%8B%9C%EC%9E%A5%EC%A0%90%EC%9C%A0%EC%9C%A8%282018%29%5D3.jpg) |
|
[gnrh agonist 기전 치료제 시장점유율(2018)]3 |
(출처: Medtrack, Informa Pharma Intelligence)
2018년 Elagolix(제품명: Orilissa)가 GnRH antagonist 계열 치료제로 처음 출시되었으며, 향후 자궁내막증 시장을 장악하면서 시장의 성장을 견인할 것으로 기대하고 있습니다. TU2670은 GnRH antagonist 기전의 치료제로서 동일한 기전의 Elagolix와 경쟁하게 될 것으로 예상됩니다.
② 신규 개발 파이프라인의 동향
|
Drug |
개발회사 |
개발단계 |
비고 |
|---|---|---|---|
|
Elagolix |
Abbvie |
- 자궁내막증 (Approved) - 자궁근종 (Phase III) |
GnRH antagonist 기전의 First in Class, 자궁내막증으로 2018년 허가됨 |
|
Relugolix |
Myovant |
- 자궁근종 (Phase III) - 전립선암 (Phase III) - 자궁내막증 (Phase III) |
자궁근종, 자궁내막증 외 전립선암으로 임상3상 진행중 |
|
Linzagolix |
Obseva |
- 자궁내막증 (Phase III) - 자궁근종 (Phase III) |
Add Back Therapy없는 75mg 용량 및 Add Back Therapy가 필요한 200mg 용량 2가지로 임상3상 개시(2019년 5월) |
GnRH antagonist 기전으로 개발하고 있는 파이프라인은 상기 표와 같으며, Elagolix의 경우 2018년 자궁내막증에 대해 FDA 승인을 받았습니다. Myovant에서 Relugolix를 전립선암, 자궁내막증, 자궁근종으로 임상 3상을 진행중이며, ObsEva에서 자궁내막증 및 자궁근종을 적응증으로 임상3상을 진행하고 있습니다.
(4) 혈우병 우회인자 치료제
① 경쟁 구도
혈우병 우회인자(Bypassing agent) 치료제는 30년 이상의 개발 역사를 가지고 있으며 1세대 제품을 시작으로 현재는 3세대 제품군들이 개발되고 있으며, TU7710은 그 중 3세대 제품 군에 속합니다. 현재 판매중인 제품으로는 1세대 제품인 혈장정제제품의 FEIBA와 2세대 제품인 유전자재조합단백질 NovoSeven이 있으며, 최근 10년이상 혈우병 우회인자 시장을 양분하고 있었습니다. 그러나 2017년부터 발매된 Roche의 Hemlibra가 긴 반감기와 피하주사 제형으로 인한 편의성을 장점으로 시장을 빠른 속도로 장악하고 있습니다. 다만, Hemlibra의 경우 예방목적으로만 사용이 가능하고, 출혈 또는 수술 시에는 사용이 어렵다는 단점이 있습니다. 2017년 기준 혈우병 Bypassing agent 시장의 점유율은 다음과 같습니다.
![이미지: [혈우병 bypassing agent 시장의 점유율(2017)]3](%5B%ED%98%88%EC%9A%B0%EB%B3%91%20bypassing%20agent%20%EC%8B%9C%EC%9E%A5%EC%9D%98%20%EC%A0%90%EC%9C%A0%EC%9C%A8%282017%29%5D3.jpg) |
|
[혈우병 bypassing agent 시장의 점유율(2017)]3 |
(출처: Datamonitor Healthcare 2018)
② 신규 개발 파이프라인의 동향
|
Drug |
개발사 |
개발단계 |
비고 |
|---|---|---|---|
|
LR769 |
LFB SA/rEVO |
FDA 승인 |
토끼의 유즙에서 생산하여 정제한 제품으로 NovoSeven의 바이오시밀러 |
|
CB-813d |
Catalyst Bioscience |
임상 2상 완료 (피하주사/예방목적) |
FVIIa variant, 아미노산 변형 (N-glycan 첨가) |
|
MOD-5014 |
OPKO biologics |
임상2상 진행 중 |
CTP technology |
LFB SA/rEVO 사의 LR769(제품명: Sevenfact)는 2020년 4월 1일 12세 이상의 중화항체를 보유한 혈우병 환자들의 치료제로 FDA의 승인을 득하였습니다. LR769는 토끼의 유즙에서 생산하여 정제한 제품으로 동물세포를 이용한 제품은 아니며, 짧은 반감기가 단점입니다.
Catalyst Bioscience사에 의해 개발중인 CB-813d는 원형 FVIIa 대비 높은 활성과 반감기가 3배 정도 높습니다. 다만, 임상 1상까지 Pfizer와 공동 개발하였으나, 2015년 Pfizer에서 공동개발 계약을 해지하였고, 현재는 Catalyst Bioscience사에 의해서 임상2상 완료 후 임상3상을 준비 중에 있습니다.
OPKO biologics사에서는 human chorionic gonadotropin(hCG)의 C-terminal peptide(CTP) 일부 서열을 반복해서 제작한 단백질을 FVIIa에 융합하여 MOD-5014라는 이름으로 임상 2상 진행 중입니다.
(5) B형 혈우병 치료제
① 경쟁 구도
B형 혈우병치료제 시장은 자연형 rFIX로 Benefix가 있고, 지속형(long-acting) FIX 기반 치료제로 Alprolix, Idelvion, Rebinyn가 시장을 주도하고 있습니다. Datamonitor에서는 2016년 기준 자연형 rFIX 및 혈장유래 pFIX 기반 치료제의 비중이 약 78%를 차지하고 있으나 점차 기전적으로 우수한 지속형(long-acting) FIX 기반 치료제의 비중이 확대되어 2025년에는 지속형(long-acting) FIX 기반 치료제가 B형 혈우병 치 치료제 시장의 69%를 차지할 것으로 전망하고 있습니다. 그러나, 혈우병 치료제의 특성상 자연형 rFIX 및 혈장유래 pFIX 기반 치료제도 일정 수준을 유지할 것으로 예상됩니다.
![이미지: [b형 혈우병치료제의 시장규모 추이]3](%5Bb%ED%98%95%20%ED%98%88%EC%9A%B0%EB%B3%91%EC%B9%98%EB%A3%8C%EC%A0%9C%EC%9D%98%20%EC%8B%9C%EC%9E%A5%EA%B7%9C%EB%AA%A8%20%EC%B6%94%EC%9D%B4%5D3.jpg) |
|
[b형 혈우병치료제의 시장규모 추이]3 |
(출처: Datamonitor Healthcare 2018)
② 신규 개발 파이프라인의 동향
|
Drug |
개발사 |
개발단계 |
비고 |
|---|---|---|---|
|
ISU304 |
이수앱지스 |
임상 2상 |
- 화이자 베네픽스를 개량해 피하주사 제형 으로 개발하는 제품 |
|
Concizumab |
Novo Nordisk |
임상 3상 |
- 적응증 : A형 혈우병, B형 혈우병 - 예방을 목적으로 하는 TFPI(Tissue Factor Pathway Inhibitor)에 대한 단일항체 - 피하주사제형으로 개발하는 제품 |
|
Fitusiran (ALN-AT3SC) |
Alnylam Pharmaceuticals/ Sanofi Genzyme |
임상 3상 |
- 적응증 : A형 혈우병, B형 혈우병 - RNAi therapy |
현재, B형 혈우병으로 개발하고 있는 파이프라인은 상기와 같으며, 당사의 TU7918와 같이 지속형 FIX로 개발되고 있는 파이프라인은 파악되지 않았습니다.
2. 주요 제품 등에 관한 사항
가. 주요제품 등의 현황
당사는 신약 개발 단계에 따라 국내외 제약사와의 기술이전 등에 대한 License-out 계약을 체결한 뒤 선수수수료 및 연구개발을 진행하면서 단계적으로 기술을 이전해 주는 대가로서 단계별 마일스톤 금액을 수취하는 계약을 맺고 있으며, 제품 출시 이후에는 판매액의 일정 부분을 로열티로 받게 됩니다.
| (단위 : 백만원) |
| 구분 |
프로그램 |
적응증 |
2020년 반기 (비중) |
2019년 (비중) |
2018년 (비중) |
|---|---|---|---|---|---|
| 기술이전수익 |
NCE401 |
특발성폐섬유증 |
- | - | 1,129 (100%) |
|
NCE403 |
자궁내막증 자궁근종 |
- | 1,000 (90%) |
- | |
| 용역매출 | NCE403 (TU2670) |
자궁내막증 자궁근종 |
- | 113 (10%) |
- |
| 합계 | - | 1,113 (100%) |
1,129 (100%) |
||
나. 주요 제품 등의 가격변동추이
당사는 보고서 작성기준일 현재 모든 개발 중인 제품이 임상시험 또는 진입 전 단계이므로, 판매중인 제품이 없어 제품의 가격변동 추이를 기재하지 않았습니다. 또한, 당사의 사업구조 상 기술이전을 기본 전략으로 하고 있고, 신약의 기술이전은 거래구조와 조건에 따라 크게 변동하므로 주요 제품 등의 가격변동추이의 기재는 생략합니다.
3. 매입에 관한 사항
당사는 보고서 작성기준일 현재 신약후보물질을 연구개발 중인 회사로 생산 및 판매중인 제품이나 상품이 없어 원재료 등의 매입 현황이 없습니다. 다만, 당사는 개발중인 파이프라인 등에 대한 비임상 또는 임상 시험의 수행을 위하여 연구용역의 수행, 연구시약 및 연구소모품을 매입하고 있으며, 관련 매입액은 모두 경상연구개발비로 처리하고 있습니다.
| (단위: 백만원) |
|
매입유형 |
구 분 |
2020년 반기 (제5기 반기) |
2019년 (제4기) |
2018년 (제3기) |
|---|---|---|---|---|
|
연구용역 |
국 내 |
453 | 447 | 430 |
|
수 입 |
1,663 | 3,154 | 2,088 | |
|
소 계 |
2,116 | 3,601 | 2,518 | |
|
연구시약 |
국 내 |
340 | 391 | 514 |
|
수 입 |
13 | 3 | 12 | |
|
소 계 |
353 | 394 | 526 | |
|
연구소모품 |
국 내 |
140 | 140 | 80 |
|
수 입 |
- | - | - | |
|
소 계 |
140 | 140 | 80 | |
|
총 합 계 |
국 내 |
933 | 977 | 1,024 |
|
수 입 |
1,676 | 3,157 | 2,100 | |
|
소 계 |
2,609 | 4,134 | 3,124 |
4. 생산 및 생산설비에 관한 사항
당사는 신약개발 관련 디스커버리 단계에서부터 임상 초기단계까지 연구개발을 수행하고 기술이전을 통해 수익을 창출하는 바이오벤처기업으로 최종 제품을 직접 제조하고 판매 및 마케팅을 수행하는 기업은 아닙니다.
따라서, 현재 당사는 제품의 생산과 관련한 시설이나 인프라를 내부에 구축한 상황은아니며, 비임상 및 임상시험에 필요한 원제 및 완제의 생산은 모두 일정기준을 충족하는 CMO(Contract Manufacturing Organization)를 통해서 외주가공 형태로 제조하고 있습니다.
5. 매출에 관한 사항
가. 매출 실적
(단위 : 백만원)
|
매출 유형 |
품 목 |
2020년 반기 (제5기 반기) |
2019년 (제4기) |
2018년 (제3기) |
|
|---|---|---|---|---|---|
|
기술이전 |
NCE401(TU2218_ 특발성폐섬유증) |
내수 |
- |
- |
- |
|
수출 |
- |
- |
1,129 |
||
|
NCE403(TU2670_ 자궁내막증) |
내수 |
- |
1,000 |
- |
|
|
수출 |
- |
- |
- |
||
| 용역매출 |
NCE403(TU2670_ 자궁내막증) |
내수 |
- |
113 | - |
| 수출 |
- |
- | - | ||
|
합 계 |
내수 |
- |
1,113 |
- |
|
|
수출 |
- |
- |
1,129 |
||
|
합계 |
- |
1,113 |
1,129 |
||
주) 당사의 매출실적은 기술이전수익 및 용역매출로 구성되어 있어 수량을 기재하지 않았습니다.
나. 판매경로 등
(1) 판매조직
![이미지: [판매 조직]3](%5B%ED%8C%90%EB%A7%A4%20%EC%A1%B0%EC%A7%81%5D3.jpg) |
|
[판매 조직]3 |
|
구분 |
업무 분장 |
|---|---|
|
CEO(대표이사) |
Business Development 및 Global Alliance 총괄 |
|
CFO(상무) |
파이프라인 별 시장 및 Deal 규모 분석, Risk 사항 검토 |
|
연구과제 책임자(상무) |
기술관련 사항 분석 및 자문 |
|
BD(이사) |
L/O 전반에 관한 제반 업무, Potential Partner사 관리 |
당사의 사업구조는 보고서 작성기준일 현재 비임상 및 임상초기단계에서의 기술이전을 통해 매출을 발생시키는 구조입니다. 따라서, 당사는 기술이전을 위한 전담 조직인 사업개발팀(BD) 외에 대표이사 및 CFO, 연구과제 책임자 등 당사의 핵심인력이 기술사업화 방향성 및 전략을 수립하고 기존 파트너사 및 잠재파트너사와의 지속적인 Communication을 진행하고 있습니다.
(2) 판매경로 및 전략
당사의 매출은 국내외 제약사 및 바이오텍과의 신약후보물질 기술이전을 통해 발생하며, 당사와 고객간 직접 거래 형태로 이루어지고 있습니다.
![이미지: [판매 경로]3](%5B%ED%8C%90%EB%A7%A4%20%EA%B2%BD%EB%A1%9C%5D3.jpg) |
|
[판매 경로]3 |
당사의 판매전략은 R&D, 전임상 또는 초기 임상 단계에서의 기술이전을 성공시켜 기술이전 관련 수익을 최대화하고 이후 계약상대방인 다국적제약사 및 바이오텍회사가 추가 임상 개발 및 제품 허가를 통해 발생하는 개발 단계별 마일스톤 및 제품 판매를 통해 발생하는 로열티 수익을 수령하는 전략입니다.
단기적으로 현재 개발중인 신약후보물질들을 초기 임상(글로벌 임상 2상) 단계까지 진행하고, 이후 임상 개발, 생산 및 상업화 단계는 해외 또는 국내 제약사 및 바이오기업에 기술 수출(Licensing out, L/O)을 통해 진행함으로써 조기에 수익을 확보하여 사업성 위험을 최소화하는 전략입니다.
또한, 조기에 L/O 달성을 위한 전략으로 신약후보물질별 해당 적응증의 치료제 개발및 상업화에 전문성을 가진 다국적 제약사, 주요 지역 및 국가별 (일본, 중국 중심) 대형 제약 회사, 바이오회사들 중심으로 후보사들을 발굴하고 BIO-USA, BIO-EUROPE 및 JPM Healthcare Conference 등의 국제 학회 및 SK케미칼 시절부터 구축한 네트워크 및 우호적 파트너(CSL 등)를 적극 활용하여 글로벌 기술 수출 및 일본, 중국 등 단일 시장으로 큰 규모의 국가들을 대상으로 기술 수출을 병행 진행할 예정입니다.
6. 수주 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
7. 시장위험과 위험관리
당사는 경영활동과 관련하여 시장위험, 신용위험, 유동성위험과 같은 다양한 위험에 노출되어 있습니다.당사의 전반적인 위험관리정책은 금융시장의 변동성에 초점을 맞추고 있으며 재무성과에 미치는 부정적 영향을 최소화하는데 중점을 두고 있습니다.
가. 시장위험
(1) 외환위험
당사는 국제적으로 영업활동을 영위하고 있기 때문에 외환 위험에 노출되어 있습니다. 외환 위험은 미래예상거래, 인식된 자산과 부채와 관련하여 발생하고 있습니다.
당분기말 현재 다른 모든 변수가 일정하고 주요 외화에 대한 원화의 환율 10% 변동시 환율변동이 법인세비용차감전순이익에 미치는 영향은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 10% 상승시 | 10% 하락시 |
|---|---|---|
| USD | (14,651) | 14,651 |
| EUR | (22,382) | 22,382 |
(2) 이자율위험
이자율위험은 시장이자율의 변동으로 인하여 금융상품에서 발생하는 이자수익 및 이자비용이 변동할 위험을 의미합니다. 한편, 보고서 작성기준일 현재 당사의 변동이자율을 적용받는 이자부 부채는 없습니다.
나. 신용위험
신용위험은 재무적 손실의 최소화를 목적으로 당사 차원에서 관리되고 있습니다. 신용위험은 회사의 통상적인 거래 및 투자활동에서 발생하며 거래상대방이 계약조건상의무사항을 지키지 못하여 당사에 재무적 손실을 미칠 위험을 의미합니다. 이러한 신용위험을 관리하기 위하여 회사는 거래시 재무상태와 과거 경험 및 기타 요소들을 포함한 거래상대방의 신용도를 고려하고 있습니다.
신용위험은 보유하고 있는 수취채권에 대한 신용위험뿐 아니라 현금및현금성자산, 은행 및 금융기관 예치금으로부터 발생할 수 있습니다. 이러한 위험을 줄이기 위하여당사는 신용도가 높은 금융기관들과 거래를 하고 있습니다.
보고서 작성기준일 현재 당사가 보유한 금융상품과 관련하여 신용위험 최대노출액은장부금액과 동일합니다.
다. 유동성 위험
유동성위험은 지급능력에는 문제가 없으면서도 유동성 부족으로 인하여 부채의 만기도래시 원리금을 상환할 재무자원이 없는 등 금융부채와 관련된 의무를 충족하는 데 어려움을 겪게 될 위험을 의미합니다. 당사는 중장기 경영계획 및 단기 경영전략을 통해 현금흐름을 모니터링하고 있으며, 일반적인 예상 운영비용을 충당할 수 있는 충분한 현금및현금성자산을 보유하고 있다고 확신하고 있습니다.
당사의 유동성 위험 분석 내역은 다음과 같습니다. 아래 표시된 금액은 현금흐름을 할인하지 아니한 금액이며, 예상 이자비용이 포함된 금액입니다.
| (단위: 천원) |
| 당반기말 | 1년이내 | 1년초과 5년이내 | 5년초과 | 합 계 |
|---|---|---|---|---|
| 매입채무및기타채무 | 1,308,431 | - | - | 1,308,431 |
| 리스부채 | 243,992 | 611,034 | - | 855,026 |
| 합 계 | 1,552,423 | 611,034 | - | 2,163,457 |
8. 파생상품 거래현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
9. 경영상의 주요 계약
가. 라이센스아웃(License-out) 계약
보고서 작성기준일 현재 당사가 체결 중인 라이센스아웃(License-out) 계약의 현황은 다음과 같습니다.
[라이센스아웃 계약 총괄표]
| (단위: USD, 천원) |
|
품 목 |
계약상대방 |
대상지역 |
계약체결일 |
계약종료일 |
총계약금액 |
수취금액 |
진행단계 |
|---|---|---|---|---|---|---|---|
|
NCE401 |
Chiesi |
전세계 |
2018.12.21 |
제품의 매출에 대한 Royalty 지급 의무가 만료되는 때까지 (각 국가별로 각기 달리 적용) |
USD 74,000,000 |
USD 1,000,000 |
전임상 |
| NCE403 (TU2670) |
대원제약 |
한국 |
2019.02.25 |
'대상지역'에서 품목의 판매가 종료되는 날까지 |
4,000,000 |
1,000,000 |
임상2a상 |
(1) 폐섬유증 치료제 후보물질 (NCE401)
|
계약상대방 |
Chiesi Farmaceutici S.p.A.,(이탈리아) |
|
계약내용 |
NCE401프로그램 내 후보물질을 호흡기질환(Respiratory Diseases)에 한정하여 독점적 권리를 갖고 임상시험, 허가, 생산, 상업화 등을 진행 |
|
대상지역 |
전세계 |
|
계약기간 |
계약체결일: 2018.12.21 ~ 제품의 매출에 대한 Royalty 지급 의무가 만료되는 때까지(각 국가별로 각기 달리 적용) |
|
총계약금액 |
USD 74백만, 로열티는 별도 |
|
수취금액 |
<반환의무 없는 금액> 계약금(Upfront Payment): USD 1백만, 2019년 1월 수취 |
|
계약조건 |
계약금(Upfront Payment): USD 1백만 - 수취조건: 계약 체결시 마일스톤(Milestione): USD 73백만 - 수취조건: 각 임상단계 개시, 판매 승인, 적응증 추가, 매출 일정규모 이상 등 로열티(Royalty): 매출액에 따라 차등 비율 적용 |
|
회계처리방법 |
계약금 수취액 1,129백만원(USD 1백만)은 일시에 수익 인식 |
|
대상기술 |
TGF-βType I receptor kinase (=ALK5) 저해제 개발 기술 |
|
개발진행경과 |
개발 진행 중(전임상) |
|
기타사항 |
주1) |
| 주1) 계약 세부 내용의 경우 영업기밀에 해당하므로 이에 세부 내용을 기재하지 않았습니다. |
(2) 자궁내막증/자궁근종 치료제 후보물질(TU2670)
|
계약상대방 |
대원제약(주)(한국) |
|
계약내용 |
NCE403 프로그램 내 TU2670 후보물질에 대한 국내 전용실시권 부여 |
|
대상지역 |
한국 |
|
계약기간 |
계약체결일:2019.2.25 ~ '대상지역'에서 품목의 판매가 종료되는 날 |
|
총계약금액 |
4,000백만원, 로열티는 별도 |
|
수취금액 |
<반환의무 없는 금액> 계약금(Upfront Payment): 1,000백만원, 2019년 3월 수취 |
|
계약조건 |
계약금(Upfront Payment): 1,000백만원 - 수취조건: 계약 체결시 마일스톤(Milestione): 3,000백만원 - 수취조건:각 임상단계 IND 허가, 품목 허가, 매출 일정규모 이상 등 로열티(Royalty): 매출액에 따라 차등 비율 적용 - 수취조건: 매출 발생시 |
|
회계처리방법 |
계약금 수취액 1,000백만원은 일시에 수익 인식 |
|
대상기술 |
GnRH 수용체 antagonist (길항제) 개발 기술 |
|
개발진행경과 |
개발 진행 중(자궁근종 국내 임상2상 준비중) |
|
기타사항 |
주1) |
| 주1) 계약 세부 내용의 경우 영업기밀에 해당하므로 이에 세부 내용을 기재하지 않았습니다. |
나. 자산양수도 계약
|
계약상대방 |
계약시기 |
계약의 목적 및 내용 |
금액 |
|---|---|---|---|
|
SK케미칼(주) |
2017.02.23 |
연구과제, 무형자산, 설비에 대한 소유권 이전계약 1. 연구과제 5건(NCE401, NCE403, NCE406, NBP604, NBP611) 2. 무형자산 - 연구과제 관련 특허권 3. 설비 - Bioreactor 외 179개 유형자산 |
계약금 |
| 주) 계약 세부 내용의 경우 영업기밀에 해당하므로 이에 세부 내용을 기재하지 않았습니다. |
10. 연구개발 활동
가. 연구개발 조직의 개요
 |
|
연구개발 조직 |
당사의 연구개발 조직은 연구개발 총책임자(CTO)인 대표이사와 기업부설연구소 산하 조직으로서 바이오신약 1팀, 바이오신약 2팀이 바이오신약(Biologics) 개발을 담당하고 있으며, 각각의 팀에서 후보물질 탐색, 세포주 제작, 단백질 배양 및 정제, 생산공정 개발 등을 진행하고 있습니다. 또한, 합성신약(Small Molecule)개발을 담당하는 합성신약팀, 타겟 발굴 및 연구, 후보물질의 약효/약리 평가, 기전 연구 등을 진행하는 Discovery팀과 Development팀, 그리고 임상시험, 독성시험, 국책과제를 진행/관리하는 연구기획팀과 사업개발팀으로 구성되어 있습니다.
보고서 작성기준일 현재 R&D 인력은 총 39명이며 이 중 박사급 인력의 수는 14명, 석사급 인력의 수는 22명입니다.
나. 연구개발 인력 현황
보고서 작성기준일 현재 연구개발 인력 현황은 다음과 같습니다.
| 구분 | 총원 | 박사 | 석사 | 학사 |
|---|---|---|---|---|
| 합성신약팀 | 6 |
3 |
3 |
- |
| Discovery팀 | 5 | 5 |
- |
- |
| Development팀 | 4 | 2 | 2 | - |
| 바이오신약 1팀 |
6 |
2 |
4 |
- |
| 바이오신약 2팀 | 12 | 1 | 10 | 1 |
| 연구기획팀 | 5 |
- |
3 | 2 |
| CTO |
1 |
1 |
- |
- |
| 합계 |
39 |
14 |
22 | 3 |
다. 핵심 연구인력
당사 핵심 연구인력의 주요 경력 및 연구 실적은 다음과 같습니다.
|
직위 |
성명 |
담당업무 |
주요경력 |
주요 연구실적 |
|---|---|---|---|---|
|
대표이사 |
김훈택 |
연구개발/ |
1. 주요 경력 '07~'16 SK케미칼㈜ 혁신R&D센터장 '00~'07 ㈜인투젠 연구소 '90~'00 SK케미칼㈜ '10~'11 University of Southern California (MBA) '96~'99 Texas A&M University 분자병태생물학(박) '88~'90 서울대학교 대학원 수의예방(석) '84~'88 서울대학교 수의학(학) |
1. 논문 1) Effect of SKI2670, a novel, orally active, non-peptide GnRH antagonist, on hypothalamic-pituitary-gonadal axis. Kim SM, Yoo T, Lee SY, Kim EJ, Lee SM, Lee MH, Han MY, Jung SH, Choi JH, Ryu KH, Kim HT. Life Sciences 2015, Oct 15, 139, 166 2) Production of recombinant human von Willebrand factor in the milk of transgenic pigs, Lee HG, Lee HC, Kim SW, Lee P, Chung HJ, Lee YK, Han JH, Hwang IS, Yoo JI, Kim YK, Kim HT, Lee HT, Chang WK, Park JK. J Reprod Dev. 2009 3) Recombinant human erythropoietin produced in milk of transgenic pigs, Park JK, Lee YK, Lee P, Chung HJ, Kim S, Lee HG, Seo MK, Han JH, Park CG, Kim HT, Kim YK, Min KS, Kim JH, Lee HT, Chang WK. J Biotechnol. 2006 4) IN-1130, a novel transforming growth factor-beta type I receptor kinase (ALK5) inhibitor, suppresses renal fibrosis in obstructive nephropathy. Moon JA, Kim HT, Cho IS, Sheen YY, Kim DK. Kidney Int. 2006 외 22편 2. 특허 1) ALK5 및/또는 ALK4 저해제로서의 2-피리딜이 치환된 이미다졸 화합물, 등록년도(2019), 등록국가(한국 외 7개국) 2) 인자 IX 활성을 갖는 융합 단백질, 등록번호(10-1853405), 등록년도(2018), 등록국가(한국 외 5개국) 3) FACTOR VIII POLYPEPTIDE, 등록번호(10-0642293), 등록년도(2006), 등록국가(한국 외 4개국) 4) FUSION PROTEIN HAVING FACTOR VII ACTIVITY, 등록번호(10-1331101), 등록국가(한국 외 10개국) 외 26건 |
|
상무 |
송인영 |
바이오1팀 총괄 |
1. 주요 경력 '07~'16 SK케미칼㈜ '00~'07 ㈜인투젠 연구소 '00~'00 SK케미칼㈜ '11~'15 University of Massachusetts 면역학(박, 수료) '97~'99 포항공과대학교 대학원 생명과학(석) '92~'97 포항공과대학교 생명과학(학) |
1. 논문 2. 특허 |
|
연구위원 |
김선미 |
합성신약팀 총괄 |
1. 주요 경력 '06~'16 SK케미칼㈜ '99~'06 C&C 신약연구소
'97~'99 서울대학교 대학원 약학(석) '93~'97 서울대학교 약학(학) |
1. 논문 2) Discovery of an Orally Bioavailable Gonadotropin-Releasing Hormone Receptor Antagonist, Kim SM, Lee M, Lee SY, Park E, Lee SM, Kim EJ, Han MY, Yoo T, Ann J, Yoon S, Lee J, Lee J. Journal of Medicinal Chemistry. 2016, 59, 19, 9150 3) Effects of single oral administration of SKI2670, gonadotropin-releasing hormone(GnRH) antagonist, in healthy pre-menopausal women, Han, K. Lim, S. Cho, J. Kim, S. Choe, J. Jung, J. Ghim, H. Jeong, T. Yoo, S. Kim, H. Lim, J. Shim, K. Bae. Fertility and Sterility, 2016, 106, 3, supp. e273 S. 2) 고나도트로핀 방출 호르몬 수용체 길항제, 이의 제조방법 및 이를 함유하는 약제학적 조성물, 국내출원번호(10-2010-0115345) 등록번호 (1011226060000) |
| 연구위원 | 서정민 | Development팀 총괄 |
1. 주요 경력 '17~현재 ㈜티움바이오 '10~'16 SK케미칼㈜ '07~'10 Wake Forest Univ 의대 Post Doc '05~'07 NYU 의대 Post Doc '04~'05 Texas A&M University Post Doc '98~'04 Texas A&M University 분자영양학(박) '95~'97 서울대학교 대학원 영양학(석) '91~'95 서울대학교 식품영양학(학) |
1. 논문 2) Zhu X., Westcott M.M., Bi X., Liu M., Gowdy K.M., Seo J., Cao Q., Gebre A.K., Fessler M.B., Hiltbold E.M., & Parks J.S. Myeloid cell-specific ABCA1 deletion protects mice from bacterial infection. Cir. Res. 111, 1398-1409 (2012) 3) Mulya A., Seo J., Brown A.L., Gebre A.K., Boudyguina E., Shelness G.S., & Parks J.S. Apolipoprotein M expression increases the size of nascent pre-beta (pre-β) HDL formed by ATP Binding Cassette Transporter A1 (ABCA1). J. Lipid Res. 51, 514-524 (2010) 4) Chapkin R.S., Seo J., McMurray D.N. & Lupton J.R. Mechanisms by which docosahexaenoic acid and related fatty acids reduce colon cancer risk and inflammatory disorders of the intestine. Chem. phys. Lipids 153, 14-23 (2008) 5) Gusarova V., Seo J., Sullivan M.L., Watkins S.C., Brodsky J.L. & Fisher E.A. Golgi-associated maturation of very low density lipoproteins involves conformational changes of apolipoprotein B, but is not dependent on apolipoprotein E. J. Biol. Chem. 282, 19453-19462 (2007) 6) Seo J., Barhoumi R., Johnson A.E., Lupton J.R. & Chapkin R.S. Docosahexaenoic acid selectively inhibits plasma membrane targeting of lipidated proteins. FASEB J. 20, 770-772 (2006) |
| 연구위원 | 최재원 | Discovery팀 총괄 | 1. 주요 경력 '19~현재 ㈜티움바이오 '14~'19 Harvard Medical School / Boston Children's Hospital/ '02~'05 ㈜인투젠 연구소 2. 주요 학력 '07~'13 Mayo Clinic 면역학(박) '99~'01 고려대학교 대학원 생명공학(석) '92~'99 고려대학교 생물학(학) |
1. 논문 1) Severe osteogenesis imperfecta in cyclophilin B-deficient mice. Choi JW, Sutor SL, Lindquist L, Evans GL, Madden BJ, Bergen HR 3rd, Hefferan TE, Yaszemski MJ, Bram RJ. PLoS Genetics. 2009 Dec;5(12) 2) Cyclophilin B supports Myc and mutant p53 dependent survival of glioblastoma multiforme cells. Choi JW, Schroder MA, Sakaria JN, Bram RJ. Cancer Research. 2014 Jan 15;74(2):484-96. 3) Withaferin A is a Natural Leptin Sensitizer and an Anti-Obesity Molecules. Lee JM, Liu J, Feng X, Salazar M, Mucka P, Choi JW, Ozcan U. Nature Medicine. 2016 Sep; 22(9) 4) IL1R1 is required for celastrol’s leptin sensitization and anti-obesity effects. Feng X, Guan D, Auen T, Choi JW, Salazar M, Lee JM, Chun H, Faruk F, Kaplun E, Herbert Z, Copps KD, Ozcan U. Nature Medicine. 2019 Apr;25(4):575-582. 2. 특허 1) 형질전환 동물의 유즙 전처리 방법 및 이를 통한 인체단백질의 정제방법(Methods of preparation of milk from transgenic animals and their use for the purification of human proteins in milk), 등록번호(1005674480000) 등록년도(2005) 등록국가(한국) 2) FACTOR VIII POLYPEPTIDE, 등록번호(10-0642293), 등록년도(2006), 등록국가(한국 외4개국) |
| 연구위원 | 김창환 | 바이오2팀 총괄 |
1. 주요 경력 '19~현재 ㈜티움바이오 '15~'19 ㈜제넥신 '12~'15 삼성바이오에피스 '01~'11 ㈜한미약품 2. 주요 학력 '99~'01 건국대학교 생물공학(석) '92~'99 건국대학교 미생물공학(학) |
1. 주요 기술 및 업적 - 배양 공정 개발, scale-up 및 임상시료 생산 (최대 15,000L scale) - BLA를 위한 Process Characterization 수행 - 국내외 CMO 선정 및 임상시료 생산 수행 (DS 및 DP) - 과제 CMC part에 대한 Project Leader 역할 수행 - 신약 및 바이오시밀러 개발 - CMC 전반에 관한 경험 및 이해 (PoC 증명, 세포주 제작, 분석, 제형, DP) - 국내외 바이오 제품 및 바이오기술 평가 수행 2. 특허 1) A pharmaceutical composition comprising an immunoglobulin fc region as a carrier, EP1682584A4(2013, EU) 2) Method for mass production of Factor VII/VIIa, 10-1380728-0000(2014, 한국) |
라. 연구개발비용
당사는 신약 개발 프로젝트가 임상 3상 개시 승인 단계를 통과한 이후 발행한 지출을 무형자산으로 인식하고, 이전 단계에서 발생한 지출은 당기비용으로 회계처리하고 있습니다.
당사의 최근 3년간 연구개발비용은 다음과 같습니다.
[연구개발비용 현황]
| (단위: 천원, %) |
| 구 분 | 2020년 반기 | 2019년 | 2018년 | 비고 | |
|---|---|---|---|---|---|
| (제5기 반기) | (제4기) | (제3기) | |||
| 비용의 성격별 분류 | 인건비 | 1,216,882 | 1,460,222 | 1,037,841 | - |
| 재료비(시약/소모품) | 493,127 | 533,537 | 605,564 | - | |
| 외주용역비 | 2,581,527 | 3,600,884 | 2,518,412 | - | |
| 감가상각비 | - | - | - | ||
| 기타 | 217,503 | 814,405 | 474,959 | - | |
| 연구개발비용 합계 | 4,509,039 | 6,409,048 | 4,636,776 | - | |
| 회계처리 내역 | 경상연구개발비 | 4,141,075 | 5,858,076 | 4,065,309 | - |
| 개발비(무형자산) | - | - | - | - | |
| 회계처리금액 소계 | 4,141,075 | 5,858,076 | 4,065,309 | - | |
| 정부보조금 | 367,964 | 550,971 | 571,467 | - | |
| 연구개발비용 합계 | 4,509,039 | 6,409,047 | 4,636,776 | - | |
| 매출액 | - | 1,113,000 | 1,128,900 | - | |
| 연구개발비용/매출액 | - | 576% | 411% | - | |
마. 연구개발실적
(1) 연구개발 진행현황 및 향후 계획
보고서 작성기준일 현재 당사가 연구개발 진행 중인 프로젝트별 진행현황 및 추진계획은 다음과 같습니다.
[연구개발 진행 총괄표]
|
구 분 |
품 목 |
적응증 |
연구시작 |
현재 진행단계 |
연구 중단일 |
비 고 |
|
|---|---|---|---|---|---|---|---|
|
단계(국가) |
승인연월 |
||||||
|
합성 신약 |
NCE401 (TU2218) |
폐섬유증 | 2008년 | 비임상 | - | - |
라이센스아웃 |
| 고형암 | 2008년 | 비임상 | - | - | 임상시료생산중 정부과제 진행중 |
||
| NCE403 (TU2670) |
자궁내막증/자궁근종 | 2008년 | 임상2a상 신청 (러시아, 우크라이나) |
- | - |
국내지역 라이선스아웃 |
|
| NCE406 (TU5113) |
섬유증 | 2019년 | 비임상 | - | - | 정부과제선정('20년 7월) | |
|
바이오 신약 |
NBP604 (TU7710) |
혈우병 우회인자 | 2010년 | 임상1상 준비중 (임상시험시료 생산중) |
- | - | 비임상 완료/ 임상시료생산중 |
| NBP611 (TU7918) |
B형 혈우병 | 2010년 | 신약 후보물질연구(Discovery) 단계 |
- | - | 정부과제 진행중 | |
| NBX001 | A형 혈우병 | 2017년 | 신약 후보물질연구(Discovery) 단계 |
- | - | - | |
| NBX002 | 폐질환 |
2017년 |
신약 후보물질연구(Discovery) 단계 |
- |
- |
- |
|
| 주1. 당사 연구진들이 해당 신약연구개발 프로그램 연구를 개시한 실제 년도를 기준으로 작성함. |
① 폐섬유증 치료제로서의 TGF-beta 저해제 (NCE401)
| 구분 | 저분자 합성 신약 |
|
프로젝트 |
TGF-β저해제의 신규 폐섬유증 치료제 개발 |
| 신약후보물질 | TU2218 또는 NCE401 프로그램 내 물질 |
| 적응증 | 특발성 폐섬유증 |
| 작용기전 | TGF-β 수용체의 기능을 저해하는 작용기전에 의하여 폐조직의 섬유화를 억제 |
| 제품의 특성 | TU2218은 약물의 전신 노출에 따른 부작용 위험성 및 약효 감소의 단점을 줄이고, 환자의 편의성을 높이기 위하여 흡입제형으로 개발하고 있으며, 당사와 기술이전 계약을 체결한 Chiesi(키에지, 이탈리아)사는 흡입제형으로 특화된 호흡기질환 전문업체임 |
| 진행경과 | 폐섬유증 치료영역에서의 In vitro 및 In vivo 실험을 통해 TU2218의 선택성 및 약효평가와 약물 동태 확인/ Chiesi Farmaceutici S.P.A (LICENSEE)에 기술이전, Chiesi(키에지)사에서는 기술이전 계약 체결 이후 전임상시험을 진행중에 있음 |
|
추진계획 |
본 프로그램의 경우, 2018년 12월 이탈리아 소재 글로벌 제약회사 Chiesi사에 호흡기 질환 영역에 대하여 기술이전 됨에 따라, Licensee인 Chiesi사에서 향후 비임상, 임상, 허가 및 상업화를 진행할 예정 |
| 경쟁제품 | 발매된 치료제: Esbriet(Roche), Ofev(Boeringer Ingellheim) 개발중인 치료제: GLPG-1690(Galapagos NV, 임상3상) 등 |
| 관련논문 등 | IN-1130, a novel transforming growth factor-beta type I receptor kinase (ALK5) inhibitor, suppresses renal fibrosis in obstructive nephropathy(Kidney International, 2006) |
| 시장규모 | Globaldata에 따르면, 주요 7개국(7MM, 미국, 일본, 프랑스, 독일,이탈리아, 스페인, 독일) 기준 특발성폐섬유증 치료제 시장의 규모는 2015년 9억달러(발매중인 치료제가 허가된 년도)에서 2024년 32억달러로 3.5배 이상 성장할 것으로 예상함 |
|
기대효과 |
TGF-β 신호전달에 의한 섬유화는 특발성 폐섬유증의 발병 및 진전에 있어 핵심적인 역할을 수행하므로, TGF-β 신호의 직접적인 차단을 통한 치료 효과를 비임상, 임상 시험을 통하여 확인할 수 있다면 First-in-class로 치료제 개발 가능할 것으로 기대하고 있음. - TGF-β를 직접 타겟하는 최초의 섬유증 치료 약물 개발 - 약물의 전신 노출에 따른 부작용 위험 및 약효 감소의 단점을 줄이면서 환자의 편이성을 높일 수 있는 흡입제형으로 개발 |
② 면역항암제로서의 TGF-beta 저해제 (NCE401)
| 구분 | 저분자 합성 신약 |
| 프로젝트 |
TGF-β저해제의 면역항암제 개발 |
| 신약후보물질 | TU2218 |
| 적응증 | 고형암 (두경부암/간암 등) |
| 작용기전 | TGF-β 수용체의 기능을 저해하는 작용기전에 의하여 암세포의면역회피/면역억제를 저해함과 동시에 종양세포 주위의 섬유아세포 발생 및 종양미세환경의 종양 보호촉진기능을 저해하여 종양의 성장 및 전이를 억제 |
| 제품의 특성 | 당사의 TU2218은 TGF-β의 종양촉진기능을 차단함으로써, 암세포의 면역회피 및 면역억제력을 저해하고, 종양미세환경의 섬유화 및 경화로 인해 저해된 항암 약물의 종양 내 침투율을 원활하게 하도록 하여 다른 면역항암제와의 병용투여 가능성을 높이고 있음 |
| 진행경과 | 항암치료분야에서의 In vitro 및 In vivo 실험을 통해 TU2218의 약효평가와 GLP 독성평가를 완료하였으며, 현재 임상1상 시료 생산 및 제형 개발을 진행하고 있음 |
|
추진계획 |
본 프로그램의 경우, 2020년 임상 원제 생산완료 및 완제 제형 개발예정이며, 2021년 중 해외 임상 1상 시험 진입 및 환자에서의 안전성과 POC를 입증하여 글로벌 기술이전 추진 예정 |
| 경쟁제품 | TGF-β 저해 기전으로 현재 허가를 득한 항암치료제는 없음 개발중인 치료제: TEW-7197(임상2상, 메드팩토), LY3200882 (임상 2상, Eli Lily) 등 |
| 관련논문 등 | IN-1130, a novel transforming growth factor-beta type I receptor kinase (ALK5) inhibitor, suppresses renal fibrosis in obstructive nephropathy(Kidney International, 2006) |
| 시장규모 | 면역항암제 시장은 전망기관에 따라 최소 300억달러에서 최대 900억달러까지 예측하고 있으며, Globaldata에 따르면, 현재 면역항암제 시장을 주도하고 있는 면역관문억제제 중 PD-1, PD-L1의 주요 제품(티센트릭, 바벤시오, 임핀지, 옵디보, 키트루다 5가지)은 2018년 136억 달러에서 2023년 344억달러로 연평균 15% 이상 고성장할 것으로 전망하고 있음 |
|
기대효과 |
TGF-β는 강력한 면역억제 사이토카인으로서 종양 내 TGF-β 분비 및 활성화는 암세포가 숙주면역체계에 의한 사멸을 회피하는 가장 지배적인 기전임. 이러한 종양미세환경 내에서 암세포의 면역회피/면역억제를 저해하는 기전으로 작동하는지 여부를 비임상, 임상 시험을 통하여 확인함으로써 면역항암제로 개발 가능할 것으로 기대하고 있음 - 대부분의 고형암에 사용 가능한 치료제로의 개발 추진. 특히, 면역관문억제제와의 병용 투여에 따른 반응율 증대를 기대함 - 안전성 이슈를 최소화하는 개발 전략 실행 |
③ 자궁내막증 치료제로서의 GnRH antagonist (NCE403)
| 구분 | 저분자 합성 신약 |
| 프로젝트 |
GnRH antagonist의 자궁내막증 치료제 개발 GnRH antagonist의 자궁근종 치료제 개발 |
| 신약후보물질 | TU2670 |
| 적응증 | 자궁내막증/자궁근종 |
| 작용기전 | GnRH antagonist는 시상하부에서 분비되는 GnRH의 신호를 차단함으로써, LH/FSH의 분비를 일차적으로 차단하고, 표적기관인 난소에서 에스트라디올 등 성호르몬을 억제하는 기전 |
| 제품의 특성 | TU2670은 선두물질인 Abbvie사의 Elagolix와 비교 시, 하루 한번 투여 용량으로 Elagolix의 하루 2회 투여 용량과 유사한 수준의 효과가 예상되어 1일 1회 투여용법으로 복용 편의성 및 안전성 측면에서 개선 가능성이 높음 |
|
진행경과 |
자궁내막증에 대한 유럽 임상 2a 허가신청을 위해 임상프로토콜 최종화 등 필요업무 진행함. 임상 2a를 위한 완제 GMP생산 완료하였고, 설치류 13주시험 진행 중이며 약물상호작용 연구 진행함. 당사가 국내지역을 대상으로 기술이전한 대원제약은 5월에 자궁근종 질환에 대해 국내 임상2상 시험 신청하였음. |
| 추진계획 |
당사는 본 과제의 해외 임상 2a상을 수행하여 환자에서 POC를 입증하고 글로벌 기술이전을 추진하여 글로벌 제품으로 개발하고자 함. 자궁내막증 임상2a상은 유럽에서 2020년 중 신청할 계획임. 대원제약은 하반기 국내 자궁 근종 임상2상이 승인 후 환자에서 POC 입증하여 국내에서 개발하고자 하며, 동시에 자궁내막증 치료제로써 개발을 병행하고자 함. |
| 경쟁제품 | 발매된 치료제: Elagolix(Abbvie) 개발중인 치료제: Relugolix(Myovant, 임상3상), Linzagolix(Obseva, 임상3상) |
| 관련논문 등 | Effect of SKI2670, a novel, orally active, non-peptide GnRH antagonist, on hypothalamic-pituitary-gonadal axis(Life Sciences, 2015) Discovery of an Orally Bioavailable Gonadotropin-Releasing Hormone Receptor Antagonist(Journal of Medicinal Chemistry, 2016) Synthesis and biological evaluation of 3-(2-aminoethyl) uracil derivatives as gonadotropin-releasing hormone (GnRH) receptor antagonists(European journal of medicinal chemistry, 2018) |
| 시장규모 | Globaldata에 따르면, 주요 7개국(7MM, 미국, 일본, 프랑스, 독일,이탈리아, 스페인, 독일) 기준 자궁내막증 치료제 시장의 규모는 2015년 17억달러에서 2022년 20억달러로 완만하게 성장할 것으로 예상함 |
|
기대효과 |
저분자 GnRH antagonist는 경구용 약물로 기존치료제 (GnRH agonist, 주사제형) 대비 복용이 편리하고 용량을 조절함으로써 골감소 부작용을 최소화할 수 있어 기존치료제의 시장을 대체할 뿐만 아니라, 기존치료제(6개월)보다 장기간 사용이 가능함에 따라 시장을 견인해 갈 것으로 기대됨. - 1일 1회 복용 가능한 경구용 자궁내막증 치료제로 경쟁 우위 확보 - 추가 적응증 (성조숙증, 시험관아기시술, 자궁선근증 등) 확대 가능 |
④ 혈우병 우회인자 치료제 (NBP604)
| 구분 | 바이오 신약 (Recombinant Protein) |
| 프로젝트 |
Hemophilia Bypassing Agent의 혈우병 치료제 개발 |
| 신약후보물질 | TU7710 |
| 적응증 | 중화항체 보유 A형, B형 혈우병 환자에 대한 치료제 |
| 작용기전 | 혈중 단백질인 트랜스페린의 재활용기작을 활용하여 혈액응고인자 7번(FVIIa)에 트랜스페린을 유전자재조합적으로 융합하여 반감기를 증가시키는 기전 |
| 제품의 특성 | 천연형 단백질의 융합으로 낮은 면역 원성 및 융합으로 인한 활성저하 문제 해결하였으며, 기존 치료제인 NovoSeven 대비 동물모델에서 약 3배의 반감기증가를 확인함 |
|
진행경과 |
Patheon사와 임상시료생산 계약 체결, 배양 및 정제 development 지속 진행, IND 준비를 위한 국내 컨설팅 진행 및 보완이 필요한 사항 확인하여 해당 시험 진행 중, Tech transfer를 위해 관련 서류 작성 및 Patheon과 공유, 공정 단계별 세부 사항에 대한 논의 진행 중, 대조약물과 유사 효능을 보이는 용량확인을 위해 효능시험 진행 중 |
| 추진계획 | 2020년에 임상 시료 생산을 시작하여 2021년 해외 임상 1상 시험을 진행하고 환자에서의 안전성과 POC를 입증하여 글로벌 기술이전 추진 예정 |
| 경쟁제품 | 발매된 치료제: NovoSeven(Novo Noridsk), FEIBA(Shire), Hemlibra(Roche), LR769(LFB SA/rEVO) 개발중인 치료제: MOD-5014(OPKO biologics, 임상2상) 등 |
| 관련논문 등 | Activated Factor VII fused with transferrin (NBP604) showed prolonged half life with desirable safety profile in animal models(ISTH, 2018, 포스터) |
| 시장규모 | Datamonitor에 따르면, 주요 7개국(7MM, 미국, 일본, 프랑스, 독일,이탈리아, 스페인, 독일) 기준 혈우병 우회인자 치료제 시장의 규모는 2016년 15억달러에서 2025년 16억달러로 소폭 증가할 것으로추정하고 있음 |
|
기대효과 |
중화항체를 보유한 혈우병 환자를 대상으로 사용되는 치료제로서 대표적인 제품인 NovoSeven의 반감기는 2.5시간으로 매우 짧음. 중화항체를 보유한 혈우병 환자가 발치와 같은 작은 수술을 하더라도 수 일 동안 2-3시간 마다 계속 투여를 받아야 하기 때문에 편의성 측면에서 큰 단점이 있음. 당사 파이프라인은 반감기를 2-3배 증가시킨 약물로서 투약 회수를 줄여주게 되어 환자의 편의성을 크게 향상시킬 것으로 기대함. |
⑤ B형 혈우병 치료제 (NBP611)
| 구분 | 바이오 신약 (Recombinant Protein) |
| 프로젝트 |
B형 혈우병 치료제 개발 |
| 신약후보물질 | TU7918 |
| 적응증 | B형 혈우병 |
| 작용기전 | 혈중 단백질인 트랜스페린의 재활용기작을 활용하여 혈액응고인자 9번(FIX)에 트랜스페린을 유전자재조합적으로 융합하여 반감기를 증가시키는 기전 |
| 제품의 특성 | 천연형 단백질의 융합으로 낮은 면역 원성 및 융합으로 인한 활성저하 문제 해결하였으며, 자연형 rFIX 대비 동물모델에서 약 3배의 반감기증가를 확인함 |
|
진행경과 |
발굴된 세포주를 바탕으로, 배양 공정 개발 진행, 세포 안정성 확보와 더불어 기존 경쟁물질 대비 반감기 동등 이상인 후보물질 효과 확인중 |
| 추진계획 | 초기 개발 단계 (Discovery 단계)로서 배양 정제 공정 확립, 물질특성 분석, 독성시험, 임상 시험 등을 통해 글로벌 L/O를 목표로 하고 있음. |
| 경쟁제품 | 발매된 치료제: Alprolix(Sanofi), Idevion(CSL Behring) 등 개발중인 치료제: Fitusiran(Sanofi, 임상3상) 등 |
| 관련논문 등 | 논문 게재 이력없음 |
| 시장규모 | Datamonitor에 따르면, 주요 7개국(7MM, 미국, 일본, 프랑스, 독일,이탈리아, 스페인, 독일) 기준 B형 혈우병 치료제 시장의 규모는 2016년 15억달러에서 2025년 23억달러로 증가할 것으로추정하고 있음 |
|
기대효과 |
FIX의 반감기를 증가하고자 하는 타 원천기술 (알부민 융합, 항체의 Fc 융합 등)을 침해하지 않으면서 경쟁제품을 출시할 수 있으며, 현재 지속형 FIX 제품을 보유하고 있지 못한 대형 제약사에 기술 수출이 가능할 것으로 기대함 |
⑥ 신규 A형 혈우병 치료제 (NBX001)
| 구분 | 바이오 신약 |
| 프로젝트 |
차세대 지속형 A형 혈우병 치료제로의 연구 |
| 적응증 | A형 혈우병 |
| 작용기전 | vWF의 상호작용을 약화시키고 긴 반감기를 달성하는 융합 단백질 형태로 A형 혈우병 치료제를 개발 중에 있음 |
| 제품의 특성 | 신약후보물질이 선정되지 않은 연구개발 초기단계로 제품의 특성을 특정하기 어려움 |
|
진행경과 |
Proof of Concept 확인 단계 |
| 추진계획 | 지속적으로 새로운 개념의 융합 단백질들을 제작하고 있으며, 해당 물질의 POC 확인 및 동물모델에서 반감기 증가를 확인하고자 함 |
| 경쟁제품 | 발매된 치료제: Eloctate(Sanofi), Advate(TAKEDA), Hemribra(Roche) |
| 관련논문 등 | 논문 게재 이력없음 |
| 시장규모 | Datamonitor에 따르면, 주요 7개국(7MM, 미국, 일본, 프랑스, 독일,이탈리아, 스페인, 독일) 기준 A형 혈우병 치료제 시장의 규모는 2016년 68억달러에서 2025년 82억달러로 증가할 것으로 추정하고 있음 |
|
기대효과 |
기존 A형 혈우병 치료제의 반감기 증가를 제한했던 요인에 대한 해결책을 제시함으로써 항체수준의 긴 반감기를 확보할 수 있을 것으로 기대함 |
⑦ 신규 폐질환 치료제 (NBX002)
| 구분 | 바이오 신약 |
| 프로젝트 | A1AT 결핍증치료제로의 연구 |
| 적응증 | 폐질환 |
| 작용기전 | Neutrophil elastase의 활동 억제로 혈중 NE:A1AT 밸런스 정상화 |
| 제품의 특성 | 신약후보물질이 선정되지 않은 연구개발 초기단계로 제품의 특성을 특정하기 어려움 |
|
진행경과 |
개발 개념에 맞는 항체 제작 단계 |
| 추진계획 | 초기 연구 단계로서 단기적으로 예비후보항체를 발현하는 세포주들을 확립 후 최종 후보 항체를 선별할 계획 |
| 경쟁제품 | 개발중인 치료제: Prolastin®-C(Grifols, 허가완료) |
| 관련논문 등 | 논문 게재 이력없음 |
| 시장규모 | Fortune Business Insights에 따르면, 2018년 11억달러에서 2026년 20억달러로 증가할 것으로 예상하고 있음 |
|
기대효과 |
A1AT 대비 반감기도 증가되고, 저분자 약물 대비 선택성이 높은 제품으로 개발 가능할 것으로 기대함 |
⑧ 신규 섬유증 치료제 (NCE406)
| 구분 | 합성 신약 |
| 프로젝트 | 신규 기전의 NASH 치료제 개발 |
| 신약후보물질 | TU5113 |
| 적응증 | 비알콜성 지방간염(NASH) |
| 작용기전 | TU5113은 free fatty acid를 인지하는 GPR40 (FFAR1)의 선택적 agonist인 동시에 GPR84의 antagonist임. GPR40 agonist는 췌장 beta cell의 인슐린 분비를 촉진하고 장 내분비세포의 GLP-1 분비를 증가시켜 혈당을 조절하고 대사 profile을 개선함. GPR84의 antagonist는 면역세포들을 조절하여 염증반응을 낮추는 기전이 있음. GPR40 agonist/GPR84 antagonist는 항섬유화와 항염증 효과를 보임. |
| 제품의 특성 | TU5113은 임상에서 우수한 효능을 보인 TAK-875 (GPR40 agonist) 대비 ~30배 이상 더 낮은 용량에서도 동등 이상의 인슐린 분비능/혈당 조절능을 보임. 특히 장기 반복투여 시험에서 혈중 lipid profile 개선 효과, 식이섭취량 감소 효과, GLP-1 분비 효과에서 양성대조물질 (TAK-875) 대비 우수한 약효를 보임. 또한, TU-5113은 GPR40의 agonist 효능과 함께 GPR84의 antagonist 효능이 있으며 동일기전의 PBI-4050 대비하여 potency가 20배 이상 높아 항섬유화와 항염증 효능면에서 비교 우위가 있음 |
|
진행경과 |
당사는 2형 당뇨 치료제로 개발 중이던 TU5113을 NASH 치료제로 약물 재창출하려고 함. TU5113의 항섬유화 효과를 CCl4로 유도된 랫드 간섬유화 모델에서 평가하고 있음. |
| 추진계획 | CCl4로 유도된 랫드 간섬유화 모델에서 TU5113의 항섬유화 효과를 확인 후, bleomycin으로 유도된 랫드 폐섬유화 모델, 일측요로폐쇄 (UUO) 랫드 모델 등에서도 항섬유화 효과를 확인할 예정임. 2021년에는 NASH 모델 (STAM 모델)을 통해 TU5113의 항섬유화 효과를 확인하고 용량별 약효를 확인할 예정. Non-GLP 독성평가를 완료하여 약효 및 독성 자료를 확보한 후 글로벌 제약사에 라이선스 아웃 또는 공동연구개발을 추진 |
| 경쟁제품 | 현재 NASH치료제로 승인된 치료제는 없음 |
| 관련논문 등 | 논문 게재 이력없음 |
| 시장규모 | 현재 승인된 NASH치료제는 없으나 Datamonitor에서는 2027년 기준 주요 6개국에서 NASH치료제시장이 216억달러 수준에 달할 것으로 추정하고 있음 |
|
기대효과 |
GPR40의 agonist/GPR84의 antagonist인 TU5113은 인슐린과 GLP-1 분비를 통한 항당뇨 효능이 뛰어나고 항염증 및 항섬유화 효과가 우수하기 때문에 특히 2형 당뇨를 가진 NASH 환자 (NASH 환자의 약 40%)의 치료에 큰 효과를 보일 것으로 기대하고 있음. 동일기전을 갖는 PBI-4050은 면역세포들을 조절하여 염증반응을 낮추는 기전으로 특발성 폐섬유증 모델에서 효과를 보였고 임상 2상 진행 중임. PBI-4050 대비하여 TU5113의 potency가 20배 이상 높아 효능면에서 비교 우위가 있음. 이러한 차별점을 바탕으로 비임상실험에서 유효한 결과를 보일 경우 기술이전을 통해 높은 기대 수익이 예상됨. |
(2) 연구개발 완료 실적
당사는 보고서 작성기준일 현재 연구개발이 완료되어 상용화된 제품은 없습니다.
(3) 기타 연구개발 실적
당사가 수행 및 진행하고 있는 정부기관 지원과제 현황은 다음과 같습니다.
| (단위: 천원) |
|
지원부처 |
과제명 |
지원기간 |
정부지원금 |
진행상황 |
|---|---|---|---|---|
|
보건복지부 |
신규 면역 항암 치료제 개발 (NCE401 과제 - TU2218) |
2018.04.30 ~2020.12.31 |
1,166,667 |
진행중 |
|
특허청 |
면역 항암 치료제 특허 전략 개발 (NCE401 과제 - TU2218) |
2018.07.13 ~2018.11.29 |
26,000 |
완료 |
|
보건복지부 |
신규 항암 치료제 임상 전략 개발 (NCE401 과제 - TU2218) |
2018.07.30 ~2018.11.30 |
25,000 |
완료 |
|
중소벤처기업부 |
신규 혈우병 치료제 개발 (NBP611과제 - TU7918) |
2018.09.21 ~2020.09.20 |
500,000 |
진행중 |
|
특허청 |
신규 치료용 항체-약물 결합체 개발 (NCX001 과제 - IP R&D 컨설팅 사업) |
2019.06.14 ~2019.11.01 |
80,000 |
완료 |
11. 그 밖에 투자의사결정에 필요한 사항
제약 산업은 물질특허의 확보가 사업의 핵심 성공 요인으로, 이 물질 특허를 얻지 못하면 원천적으로 사업이 불가능하거나 기술이전/수출이 어려울 수 있습니다. 당사는글로벌 시장을 목표로 후보물질에 대한 글로벌 특허 전략을 수행하고 있으며, 이에 당사 보유 파이프라인들에 대한 미국, 유럽, 일본 등 주요국에서의 특허 등록이 완료된 상태로, 이외 국가들의 지속적인 특허 등록을 추진할 계획입니다. 또한, 염/결정형, 제형/제법, 용량/용법 특허 등의 특허를 출원/등록하여 물질특허 만료기간 후의 지속적인 영업권을 확보하는 특허포트폴리오를 구축할 계획입니다.
보고서 작성기준일 현재 당사의 지적재산권 보유현황은 다음과 같습니다.
가. NCE401(폐섬유증, 면역항암제)
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
국가 |
|
1 |
(TU2218 물질특허) ALK5 및/또는 ALK4 억제제로서의 2-피리딜-치환된 이미다졸 |
티움바이오 |
2012-07-13 |
2019-01-08 |
한국 |
|
2 |
2018-12-18 |
미국 |
|||
|
3 |
2018-04-04 |
유럽(20국) |
|||
|
4 |
2017-02-24 |
일본 |
|||
|
5 |
2017-04-12 |
중국 |
|||
|
6 |
2017-09-14 |
호주 |
|||
|
7 |
2019-02-26 |
캐나다 |
|||
|
8 |
2017-03-13 |
러시아 |
|||
|
9 |
심사중 |
브라질 |
|||
|
10 |
2019-11-13 |
멕시코 |
|||
|
11 |
심사중 |
인도 |
|||
|
12 |
물질특허 ALK5 및/또는 ALK4 억제제로서의 2-피리딜-치환된 이미다졸 |
티움바이오 |
2011-01-05 |
2016-08-31 |
한국 |
|
13 |
2009-06-11 |
2013-04-02 |
미국 |
||
|
14 |
2009-06-11 |
2014-01-22 |
중국 |
나. NCE403(자궁내막증, 자궁근종)
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
국가 |
|
1 |
(TU2670 물질특허) 고나도트로핀 방출 호르몬 수용체 길항체, 이의 제조방법 및 이를 함유하는약제학적 조성물 |
티움바이오 |
2013-02-28 |
2015-02-13 |
한국 |
|
2 |
2016-11-01 |
미국 |
|||
|
3 |
2016-11-30 |
유럽(7개국) |
|||
|
4 |
2017-09-15 |
일본 |
|||
|
5 |
2016-09-28 |
중국 |
|||
|
6 |
2019-02-05 |
중국 |
|||
|
7 |
2017-12-18 |
호주 |
|||
|
8 |
2018-07-26 |
멕시코 |
|||
|
9 |
2020-03-10 |
캐나다 |
|||
|
10 |
심사중 |
브라질 |
|||
|
11 |
심사중 |
인도 |
|||
|
12 |
(물질특허) 고나도트로핀 방출 호르몬 수용체 길항체, 이의 제조방법 및 이를 함유하는 약제학적 조성물 |
티움바이오 |
2010-11-19 |
2012-02-24 |
한국 |
|
13 |
2015-05-19 |
미국 |
|||
|
14 |
2015-08-12 |
유럽(5개국) |
|||
|
15 |
2015-06-12 |
일본 |
|||
|
16 |
(염, 결정형 특허) 퓨로피리미딘 화합물의 염 및 결정형, 및 이를 포함하는 약학적 조성물 |
티움바이오 |
2018-11-30 |
2019-04-22 |
한국 |
다. NBP604(혈우병 우회인자)
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
국가 |
|
1 |
(TU7710 물질특허) 인자 VII활성을 갖는 융합 단백질 |
티움바이오 |
2011-06-07 |
2013-11-13 |
한국 |
|
2 |
2017-05-09 |
미국 |
|||
|
3 |
2020-06-30 |
미국(분할) |
|||
|
4 |
2018-04-25 |
유럽(7개국) |
|||
|
5 |
2017-05-19 |
일본 |
|||
|
6 |
2018-10-26 |
일본(분할) |
|||
|
7 |
2016-05-05 |
호주 |
|||
|
8 |
2017-06-20 |
멕시코 |
|||
|
9 |
2016-05-27 |
러시아 |
|||
|
10 |
2014-03-26 |
남아공 |
|||
|
11 |
2016-04-21 |
터키 |
|||
|
12 |
2019-03-26 |
인도 |
|||
|
13 |
2017-03-01 |
인도네시아 |
|||
|
14 |
2019-12-03 |
캐나다 |
|||
|
15 |
심사중 |
중국 |
|||
|
16 |
심사중 |
브라질 |
|||
|
17 |
(TU7710 조성물 특허) 인자 VII의 융합 단백질을 포함하는 안정성이 개선된 약학적 조성물 |
티움바이오 |
2013-12-16 |
2019-12-18 |
한국 |
|
18 |
2013-12-16 |
2018-06-05 |
미국 |
||
|
19 |
2019-05-08 |
유럽(7개국) |
라. NBP611(B형 혈우병)
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
국가 |
|
1 |
(TU7918 물질특허)인자 IX활성을 갖는 융합 단백질 |
티움바이오 |
2011-10-18 |
2018-04-24 |
한국 |
|
2 |
2011-10-19 |
2017-04-11 |
미국 |
||
|
3 |
2018-05-16 |
유럽(7개국) |
|||
|
4 |
2017-07-21 |
일본 |
|||
|
5 |
2018-07-10 |
캐나다 |
|||
|
6 |
2018-07-24 |
캐나다(분할1) |
|||
|
7 |
2018-07-24 |
캐나다(분할2) |
|||
|
8 |
심사중 |
중국 |
|||
|
9 |
심사중 |
브라질 |
마. NCE406(섬유증)
|
번호 |
내용 |
권리자 |
출원일 |
등록일 |
국가 |
|
1 |
삼환식 화합물 및 이의 용도 |
티움바이오 |
2014-02-28 |
2017-05-08 |
한국 |
|
2 |
2017-05-09 |
미국 |
|||
|
3 |
2018-12-26 |
유럽(7국) |
|||
|
4 |
2018-08-17 |
일본 |
|||
|
5 |
2018-09-14 |
중국 |
|||
|
6 |
심사중 |
중국(분할) |
|||
|
7 |
2018-06-21 |
호주 |
|||
|
8 |
심사중 |
캐나다 |
III. 재무에 관한 사항
1. 요약재무정보
당사의 재무제표는 한국채택국제회계기준(K-IFRS)에 따라 작성되었습니다.
가. 요약연결재무정보
| (단위: 원) |
| 과 목 | 제 5 기 반기 | 제 4 기 | 제 3 기 |
| (2020년 6월말) | (2019년 12월말) | (2018년 12월말) | |
| 유동자산 | 85,769,166,142 | 90,437,602,167 | 25,928,918,485 |
| 현금및현금성자산 | 6,928,920,276 | 2,882,958,603 | 1,860,378,733 |
| 단기금융자산 | 55,000,000,000 | 86,000,000,000 | 22,500,000,000 |
| 당기손익-공정가치측정금융자산 | 23,047,000,000 | - | - |
| 매출채권 | - | - | 1,118,100,000 |
| 기타자산 | 793,245,866 | 1,554,643,564 | 450,439,752 |
| 비유동자산 | 4,269,971,195 | 3,019,072,942 | 3,394,651,093 |
| 유형자산 | 1,688,815,343 | 859,397,957 | 432,554,921 |
| 무형자산 | 1,918,354,217 | 2,071,671,020 | 2,425,948,172 |
| 기타비유동채권 | 589,913,000 | 16,290,000 | 536,148,000 |
| 기타비유동자산 | 72,888,635 | 71,713,965 | - |
| 자산총계 | 90,039,137,337 | 93,456,675,109 | 29,323,569,578 |
| 유동부채 | 1,794,203,461 | 958,275,535 | 574,765,855 |
| 비유동부채 | 611,033,506 | - | - |
| 부채총계 | 2,405,236,967 | 958,275,535 | 574,765,855 |
| 지배기업 소유주지분 | 87,633,900,370 | 92,498,399,574 | 28,748,803,723 |
| 자본금 | 11,735,913,000 | 11,729,913,000 | 898,616,500 |
| 기타불입자본 | 110,863,174,308 | 110,425,560,817 | 50,396,051,158 |
| 기타포괄손익누계액 | (3,724,135) | - | - |
| 결손금 | (34,961,462,803) | (29,657,074,243) | (22,545,863,935) |
| 비지배지분 | - | - | - |
| 자본총계 | 87,633,900,370 | 92,498,399,574 | 28,748,803,723 |
| (2020.01.01~2020.06.30) | (2019.01.01~2019.12.31) | (2018.01.01~2018.12.31) | |
| 영업수익 | - | 1,113,000,000 | 1,128,900,000 |
| 영업손실 | (6,084,488,990) | (8,019,654,430) | (5,240,976,561) |
| 법인세비용차감전순손실 | (6,084,488,990) | (7,091,425,738) | (13,751,614,565) |
| 연결당기순손실 | (5,304,388,560) | (7,091,425,738) | (13,751,614,565) |
| 지배기업 소유주지분 | (5,304,388,560) | (7,091,425,738) | (13,751,614,565) |
| 비지배지분 | - | - | - |
| 기본주당손실 | (226) | (354) | (1,392) |
| 희석주당손실 | (226) | (354) | (1,392) |
| 연결에 포함된 회사수 | 1 | - | - |
나. 요약별도재무정보
| (단위: 원) |
| 과 목 | 제 5 기 반기 | 제 4 기 | 제 3 기 |
| (2020년 6월말) | (2019년 12월말) | (2018년 12월말) | |
| 유동자산 | 85,764,952,255 | 90,437,602,167 | 25,928,918,485 |
| 현금및현금성자산 | 6,925,217,963 | 2,882,958,603 | 1,860,378,733 |
| 단기금융자산 | 55,000,000,000 | 86,000,000,000 | 22,500,000,000 |
| 당기손익-공정가치측정금융자산 | 23,047,000,000 | - | - |
| 매출채권 | - | - | 1,118,100,000 |
| 기타자산 | 792,734,292 | 1,554,643,564 | 450,439,752 |
| 비유동자산 | 4,277,990,365 | 3,019,072,942 | 3,394,651,093 |
| 종속기업투자 | 8,019,170 | - | - |
| 유형자산 | 1,688,815,343 | 859,397,957 | 432,554,921 |
| 무형자산 | 1,918,354,217 | 2,071,671,020 | 2,425,948,172 |
| 기타비유동채권 | 589,913,000 | 16,290,000 | 536,148,000 |
| 기타비유동자산 | 72,888,635 | 71,713,965 | - |
| 자산총계 | 90,042,942,620 | 93,456,675,109 | 29,323,569,578 |
| 유동부채 | 1,334,540,661 | 958,275,535 | 574,765,855 |
| 비유동부채 | 611,033,506 | - | - |
| 부채총계 | 1,945,574,167 | 958,275,535 | 574,765,855 |
| 자본금 | 11,735,913,000 | 11,729,913,000 | 898,616,500 |
| 기타불입자본 | 110,863,174,308 | 110,425,560,817 | 50,396,051,158 |
| 결손금 | (34,501,718,855) | (29,657,074,243) | (22,545,863,935) |
| 자본총계 | 88,097,368,453 | 92,498,399,574 | 28,748,803,723 |
|
종속ㆍ관계ㆍ공동기업 투자주식의 평가방법 |
원가법 | 해당사항 없음 | 해당사항 없음 |
| (2020.01.01~2020.06.30) | (2019.01.01~2019.12.31) | (2018.01.01~2018.12.31) | |
| 영업수익 | - | 1,113,000,000 | 1,128,900,000 |
| 영업손실 | (5,609,369,756) | (8,019,654,430) | (5,240,976,561) |
| 법인세비용차감전순손실 | (5,609,369,756) | (7,091,425,738) | (13,751,614,565) |
| 당기순손실 | (4,844,644,612) | (7,091,425,738) | (13,751,614,565) |
| 기본주당손실 | (206) | (354) | (1,392) |
| 희석주당손실 | (206) | (354) | (1,392) |
2. 연결재무제표
|
연결 재무상태표 |
|
제 5 기 반기말 2020.06.30 현재 |
|
제 4 기말 2019.12.31 현재 |
|
(단위 : 원) |
|
제 5 기 반기말 |
제 4 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
85,769,166,142 |
90,437,602,167 |
|
현금및현금성자산 |
6,928,920,276 |
2,882,958,603 |
|
단기금융자산 |
55,000,000,000 |
86,000,000,000 |
|
당기손익-공정가치측정금융자산 |
23,047,000,000 |
|
|
매출채권및기타채권 |
370,037,959 |
1,207,320,832 |
|
기타유동자산 |
268,658,857 |
252,269,502 |
|
당기법인세자산 |
154,549,050 |
95,053,230 |
|
비유동자산 |
4,269,971,195 |
3,019,072,942 |
|
유형자산 |
1,688,815,343 |
859,397,957 |
|
무형자산 |
1,918,354,217 |
2,071,671,020 |
|
기타비유동채권 |
589,913,000 |
16,290,000 |
|
기타비유동자산 |
72,888,635 |
71,713,965 |
|
자산총계 |
90,039,137,337 |
93,456,675,109 |
|
부채 |
||
|
유동부채 |
1,794,203,461 |
958,275,535 |
|
매입채무및유동채무 |
1,308,430,581 |
317,744,659 |
|
기타유동부채 |
241,780,453 |
523,314,187 |
|
유동리스부채 |
243,992,427 |
117,216,689 |
|
비유동부채 |
611,033,506 |
|
|
비유동리스부채 |
611,033,506 |
|
|
부채총계 |
2,405,236,967 |
958,275,535 |
|
자본 |
||
|
지배기업의 소유주에게 귀속되는 자본 |
87,633,900,370 |
92,498,399,574 |
|
자본금 |
11,735,913,000 |
11,729,913,000 |
|
자본잉여금 |
109,432,086,629 |
109,385,133,493 |
|
기타자본항목 |
1,431,087,679 |
1,040,427,324 |
|
기타포괄손익누계액 |
(3,724,135) |
|
|
이익잉여금(결손금) |
(34,961,462,803) |
(29,657,074,243) |
|
자본총계 |
87,633,900,370 |
92,498,399,574 |
|
자본과부채총계 |
90,039,137,337 |
93,456,675,109 |
|
연결 포괄손익계산서 |
|
제 5 기 반기 2020.01.01 부터 2020.06.30 까지 |
|
제 4 기 반기 2019.01.01 부터 2019.06.30 까지 |
|
(단위 : 원) |
|
제 5 기 반기 |
제 4 기 반기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
영업수익 |
1,000,000,000 |
|||
|
영업비용 |
3,629,449,635 |
6,084,488,990 |
2,243,585,677 |
4,036,048,479 |
|
영업이익(손실) |
(3,629,449,635) |
(6,084,488,990) |
(2,243,585,677) |
(3,036,048,479) |
|
금융수익 |
368,729,164 |
773,431,712 |
222,336,919 |
336,287,122 |
|
금융비용 |
5,869,461 |
7,959,066 |
5,569,709 |
12,740,779 |
|
기타수익 |
27,400,866 |
32,464,278 |
4,449,191 |
12,470,670 |
|
기타비용 |
(3,928,181) |
17,836,494 |
9,847,173 |
10,710,840 |
|
법인세비용차감전순이익(손실) |
(3,235,260,885) |
(5,304,388,560) |
(2,032,216,449) |
(2,710,742,306) |
|
법인세비용 |
||||
|
당기순이익(손실) |
(3,235,260,885) |
(5,304,388,560) |
(2,032,216,449) |
(2,710,742,306) |
|
당기순이익(손실)의 귀속 |
||||
|
지배기업의 소유주에게 귀속되는 당기순이익(손실) |
(3,235,260,885) |
(5,304,388,560) |
(2,032,216,449) |
(2,710,742,306) |
|
비지배지분에 귀속되는 당기순이익(손실) |
||||
|
기타포괄손익 |
(3,512,725) |
(3,724,135) |
||
|
당기손익으로 재분류될수있는 항목 |
||||
|
해외사업환산손실 |
(3,512,725) |
(3,724,135) |
||
|
총포괄손익 |
(3,238,773,610) |
(5,308,112,695) |
(2,032,216,449) |
(2,710,742,306) |
|
총 포괄손익의 귀속 |
||||
|
지배기업 소유주지분 |
(3,238,773,610) |
(5,308,112,695) |
(2,032,216,449) |
(2,710,742,306) |
|
비지배지분 |
||||
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(138) |
(226) |
(104) |
(145) |
|
희석주당이익(손실) (단위 : 원) |
(138) |
(226) |
(104) |
(145) |
|
연결 자본변동표 |
|
제 5 기 반기 2020.01.01 부터 2020.06.30 까지 |
|
제 4 기 반기 2019.01.01 부터 2019.06.30 까지 |
|
(단위 : 원) |
|
자본 |
|||||||
|---|---|---|---|---|---|---|---|
|
지배기업의 소유주에게 귀속되는 자본 |
자본 합계 |
||||||
|
자본금 |
자본잉여금 |
기타자본구성요소 |
기타포괄손익누계액 |
이익잉여금 |
지배기업의 소유주에게 귀속되는 자본 합계 |
||
|
2019.01.01 (기초자본) |
898,616,500 |
49,711,706,561 |
684,344,597 |
(22,545,863,935) |
28,748,803,723 |
28,748,803,723 |
|
|
회계정책변경에 따른 증가(감소) |
(19,795,544) |
(19,795,544) |
(19,795,544) |
||||
|
재분류조정 |
898,616,500 |
49,711,706,561 |
684,344,597 |
(22,565,659,479) |
28,729,008,179 |
28,729,008,179 |
|
|
당기순이익(손실) |
(2,710,742,306) |
(2,710,742,306) |
(2,710,742,306) |
||||
|
해외사업환산이익(손실) |
|||||||
|
유상증자 |
1,321,298,000 |
38,662,716,380 |
39,984,014,380 |
39,984,014,380 |
|||
|
무상증자 |
8,087,548,500 |
(8,130,224,724) |
(42,676,224) |
(42,676,224) |
|||
|
주식보상비용 |
428,395,775 |
428,395,775 |
428,395,775 |
||||
|
주식매수선택권의 행사 |
|||||||
|
2019.06.30 (기말자본) |
10,307,463,000 |
80,244,198,217 |
1,112,740,372 |
(25,276,401,785) |
66,387,999,804 |
66,387,999,804 |
|
|
2020.01.01 (기초자본) |
11,729,913,000 |
109,385,133,493 |
1,040,427,324 |
(29,657,074,243) |
92,498,399,574 |
92,498,399,574 |
|
|
회계정책변경에 따른 증가(감소) |
|||||||
|
재분류조정 |
|||||||
|
당기순이익(손실) |
(5,304,388,560) |
(5,304,388,560) |
(5,304,388,560) |
||||
|
해외사업환산이익(손실) |
(3,724,135) |
(3,724,135) |
(3,724,135) |
||||
|
유상증자 |
|||||||
|
무상증자 |
|||||||
|
주식보상비용 |
420,375,211 |
420,375,211 |
420,375,211 |
||||
|
주식매수선택권의 행사 |
6,000,000 |
46,953,136 |
(29,714,856) |
23,238,280 |
23,238,280 |
||
|
2020.06.30 (기말자본) |
11,735,913,000 |
109,432,086,629 |
1,431,087,679 |
(3,724,135) |
(34,961,462,803) |
87,633,900,370 |
87,633,900,370 |
|
연결 현금흐름표 |
|
제 5 기 반기 2020.01.01 부터 2020.06.30 까지 |
|
제 4 기 반기 2019.01.01 부터 2019.06.30 까지 |
|
(단위 : 원) |
|
제 5 기 반기 |
제 4 기 반기 |
|
|---|---|---|
|
영업활동현금흐름 |
(3,599,413,891) |
(169,005,535) |
|
영업활동으로인한자산ㆍ부채의변동 |
(4,538,978,383) |
(617,912,864) |
|
이자지급(영업) |
1,003,410,878 |
445,750,410 |
|
이자수취(영업) |
(4,350,566) |
(12,067,101) |
|
법인세납부(환급) |
(59,495,820) |
15,224,020 |
|
투자활동현금흐름 |
7,742,592,469 |
(21,701,534,138) |
|
단기금융상품의 처분 |
58,000,000,000 |
22,500,000,000 |
|
단기금융상품의 취득 |
(27,000,000,000) |
(44,000,000,000) |
|
당기손익-공정가치측정금융자산의 취득 |
(23,000,000,000) |
|
|
유형자산의 취득 |
(184,455,000) |
(104,825,454) |
|
무형자산의 취득 |
(58,532,531) |
(66,708,684) |
|
보증금의 증가 |
(30,710,000) |
(30,000,000) |
|
보증금의 감소 |
16,290,000 |
|
|
재무활동현금흐름 |
(89,969,769) |
39,836,342,677 |
|
유상증자 |
39,984,014,380 |
|
|
주식매수선택권 행사 |
24,552,000 |
|
|
신주발행비용 |
(1,313,720) |
(42,676,224) |
|
리스부채의 상환 |
(113,208,049) |
(104,995,479) |
|
현금및현금성자산의순증가(감소) |
4,053,208,809 |
17,965,803,004 |
|
기초현금및현금성자산 |
2,882,958,603 |
1,860,378,733 |
|
현금및현금성자산의 환율변동효과 |
(7,247,136) |
(673,678) |
|
기말현금및현금성자산 |
6,928,920,276 |
19,825,508,059 |
3. 연결재무제표 주석
| 제 5 기 당반기 : 2020년 6월 30일 현재 |
| 제 4 기 전반기 : 2019년 6월 30일 현재 |
| 주식회사 티움바이오와 그 종속기업 |
1. 회사의 개요
주식회사 티움바이오(이하 '지배기업')는 2016년 12월 6일 설립되어 혁신신약 연구개발을 주요 사업으로 영위하고 있으며, 경기도 성남시 분당구 판교테크노밸리에 소재하고 있습니다. 한편, 지배기업은 2019년 11월 22일에 지배기업의 주식을 한국거래소가 개설한 코스닥시장에 상장하였습니다.
수차례의 유상증자 및 무상증자를 통하여 당반기말 현재 총발행주식수는 23,471,826주이고, 자본금은 11,735,913천원이며, 전부 기명식보통주식입니다.
당반기말 현재 지배기업의 최대주주(대표이사 김훈택)의 지분율은 34.19%입니다.
당반기말 및 전기말 현재 지배기업의의 연결대상 종속기업 현황은 다음과 같습니다.
|
종속기업 |
소재지 |
지배지분율 |
연차 |
업종 |
|
|---|---|---|---|---|---|
| 당반기말 | 전기말 | ||||
| TiumBio Australia PTY LTD |
호주 |
100% |
- |
12월 |
의학 및 약학 연구개발업 |
당반기말 현재 지배기업의 종속기업인 TiumBio Australia PTY LTD의 내역은 다음과 같습니다.
| (단위: 천원) |
| 회사명 | 자산총액 | 부채총액 | 자본총액 | 매출액 | 반기순손실 |
|---|---|---|---|---|---|
| TiumBio Australia PTY LTD | 4,213 | 459,663 | (455,450) | - | (459,744) |
2. 재무제표 작성기준
(1) 회계기준의 적용
지배기업과 지배기업의 종속기업(이하 "연결실체")의 반기연결재무제표는 한국채택국제회계기준에 따라 작성되는 요약중간연결재무제표입니다. 동 연결재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차연결재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석은 직전 연차보고기간말 후 발생한 연결실체의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다.
(2) 추정과 판단
① 경영진의 판단 및 가정과 추정의 불확실성
한국채택국제회계기준에서는 중간재무제표를 작성함에 있어서 회계정책의 적용이나, 중간보고기간말 현재 자산, 부채 및 수익, 비용의 보고금액에 영향을 미치는 사항에 대하여 경영진의 최선의 판단을 기준으로 한 추정치와 가정의 사용을 요구하고 있습니다. 중간보고기간말 현재 경영진의 최선의 판단을 기준으로한 추정치와 가정이 실제 환경과 다를 경우 이러한 추정치와 실제 결과는 다를 수 있습니다.
반기연결재무제표에서 사용된 연결실체의 회계정책 적용과 추정금액에 대한 경영진의 판단은 2019년 12월 31일로 종료되는 회계연도의 연차재무제표와 동일한 회계정책과 추정의 근거를 사용하였습니다.
② 공정가치 측정
연결실체는 공정가치평가 정책과 절차를 수립하고 있습니다. 동 정책과 절차에는 공정가치 서열체계에서 수준 3으로 분류되는 공정가치를 포함한 모든 유의적인 공정가치 측정의 검토를 책임지는 평가부서의 운영을 포함하고 있으며, 그 결과는 재무담당임원에게 직접 보고되고 있습니다.
평가부서는 정기적으로 관측가능하지 않은 유의적인 투입변수와 평가 조정을 검토하고 있습니다. 공정가치 측정에서 중개인 가격이나 평가기관과 같은 제 3자 정보를 사용하는 경우, 평가부서에서 제 3자로부터 입수한 정보에 근거한 평가가 공정가치 서열체계 내 수준별 분류를 포함하고 있으며 해당 기준서의 요구사항을 충족한다고 결론을 내릴 수 있는지 여부를 판단하고 있습니다.
연결실체는 유의적인 평가 문제를 감사에 보고하고 있습니다.
자산이나 부채의 공정가치를 측정하는 경우, 연결실체는 최대한 시장에서 관측가능한 투입변수를 사용하고 있습니다. 공정가치는 다음과 같이 가치평가기법에 사용된 투입변수에 기초하여 공정가치 서열체계 내에서 분류됩니다.
·수준 1: 측정일에 동일한 자산이나 부채에 대한 접근 가능한 활성시장의 조정되지 않은 공시가격
·수준 2: 수준 1의 공시가격 이외에 자산이나 부채에 대해 직접적으로 또는 간접적으로 관측가능한 투입변수
·수준 3: 자산이나 부채에 대한 관측가능하지 않은 투입변수
자산이나 부채의 공정가치를 측정하기 위해 사용되는 여러 투입변수가 공정가치 서열체계 내에서 다른 수준으로 분류되는 경우, 연결실체는 측정치 전체에 유의적인 공정가치 서열체계에서 가장 낮은 수준의 투입변수와 동일한 수준으로 공정가치 측정치 전체를 분류하고 있으며, 변동이 발생한 보고기간 말에 공정가치 서열체계의 수준간 이동을 인식하고 있습니다.
공정가치 측정시 사용된 가정의 자세한 정보는 아래 주석에 포함되어 있습니다.
- 주석 5 : 범주별 금융상품
3. 유의적인 회계정책
반기연결재무제표에 적용된 회계정책은 직전 연차재무제표에 적용된 회계정책과 동일합니다. 2020년 1월 1일부터 시행되는 새로운 회계기준 있으나, 그 기준들은 연결실체의 연결재무제표에 중요한 영향을 미치지 않습니다.
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전손익에 적용하여 계산합니다.
4. 영업부문 정보
연결실체는 기업회계기준서 제1108호(영업부문)에 따른 보고부문이 단일부문으로 기업전체 수준에서의 부문별 정보는 다음과 같습니다.
(1) 수익의 세부내역
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기술이전수익 | - | 1,000,000 |
전반기의 기술이전수익은 모두 국내에서 발생하였습니다.
(2) 주요 고객에 대한 정보
당반기와 전반기 중 연결회사 매출액의 10% 이상을 차지하는 외부고객과 관련된 정보는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 매출액 | |
|---|---|---|
| 당반기 | 전반기 | |
| 고객 1 | - | 1,000,000 |
5. 금융상품
(1) 당반기말과 전기말 현재 범주별 금융상품의 장부금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 당기손익-공정가치측정금융자산 | 23,047,000 | - |
| 상각후원가측정금융자산 | 62,888,871 | 90,106,570 |
| 상각후원가측정금융부채 | 2,163,457 | 434,962 |
(2) 당반기말과 전기말 현재 금융상품의 장부금액과 공정가치는 다음과 같습니다.
| (단위: 천원) |
| 과 목 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산: | ||||
| 공정가치로 인식된 금융자산 | ||||
| 당기손익-공정가치측정금융자산 | 23,047,000 | 23,047,000 | - | - |
| 상각후원가로 인식된 금융자산 | ||||
| 현금및현금성자산 | 6,928,920 | 6,928,920 | 2,882,959 | 2,882,959 |
| 단기금융자산 | 55,000,000 | 55,000,000 | 86,000,000 | 86,000,000 |
| 매출채권및기타채권 | 370,038 | 370,038 | 1,207,321 | 1,207,321 |
| 기타비유동채권 | 589,913 | 589,913 | 16,290 | 16,290 |
| 소 계 | 62,888,871 | 62,888,871 | 90,106,570 | 90,106,570 |
| 합 계 | 85,935,871 | 85,935,871 | 90,106,570 | 90,106,570 |
| 금융부채: | ||||
| 상각후원가로 인식된 금융부채 | ||||
| 매입채무및기타채무 | 1,308,431 | 1,308,431 | 317,745 | 317,745 |
| 유동리스부채 | 243,992 | 243,992 | 117,217 | 117,217 |
| 비유동리스부채 | 611,034 | 611,034 | - | - |
| 합 계 | 2,163,457 | 2,163,457 | 434,962 | 434,962 |
(3) 공정가치 서열체계
당반기말과 전기말 현재 공정가치로 측정되는 금융상품의 각 종류별로 공정가치 수준별 측정치는 다음과 같습니다.
수준 1 : 활성시장에서 거래되는 금융상품(예 : 상장 주식 등)
수준 2 : 활성시장에서 거래되지 아니하고, 평가기법을 사용하여 공정가치를 산출한 금융상품. 단, 공정가치 측정에 요구되는 모든 유의적인 투입변수가 관측가능하여야 함.
수준 3 : 하나 이상의 유의적인 투입변수가 관측가능한 시장정보에 기초한 것이 아니라면 해당 상품은 "수준 3"에 포함.
① 당반기말
| (단위: 천원) |
| 구 분 | 수준 1 | 수준 2 | 수준 3 | 합 계 |
|---|---|---|---|---|
| 금융자산: | ||||
| 당기손익-공정가치측정금융자산 | - | 23,047,000 | - | 23,047,000 |
② 전기말
전기말 현재 공정가치로 측정되는 금융상품은 없습니다.
6. 현금및현금성자산
당반기말과 전기말 현재 현금및현금성자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 현금 | 465 | - |
| 보통예금(*1) | 6,445,646 | 2,824,294 |
| 외화예금 | 482,531 | 58,664 |
| 기타제예금 | 278 | - |
| 합 계 | 6,928,920 | 2,882,958 |
(*1) 당반기말 현재 보통예금 중 KB국민은행 426,420천원(전기말 : 585,447천원)은 보건복지부 과제 관련 직접비 용도 및 중소벤처기업부 채용지원 사업에 대한 인건비 용도로 사용이 제한되어 있습니다.
7. 매출채권및기타채권
당반기말과 전기말 현재 매출채권및기타채권의 내역은 다음과 같습니다.
| (단위: 천원) |
|
구 분 |
당반기말 | 전기말 | ||
|---|---|---|---|---|
|
유동 |
비유동 |
유동 |
비유동 | |
| 매출채권 | - | - | - | - |
| 기타채권 | ||||
| 미수금 | 24,960 |
- | 25,975 | - |
| 미수수익 | 305,078 | - | 582,143 | - |
| 보증금 | 40,000 | 589,913 | 599,203 | 16,290 |
| 소 계 | 370,038 | 589,913 | 1,207,321 | 16,290 |
| 합 계 | 370,038 | 589,913 | 1,207,321 | 16,290 |
8. 단기금융자산
당반기말과 전기말 현재 단기금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 정기예금 | 35,000,000 | 72,000,000 |
| 환매조건부채권 | 10,000,000 | 14,000,000 |
| 전자단기사채 | 10,000,000 | - |
| 합 계 | 55,000,000 | 86,000,000 |
9. 당기손익-공정가치측정금융자산
당반기말과 전기말 현재 당기손익-공정가치측정금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 파생결합증권 | 23,047,000 | - |
10. 기타자산
당반기말과 전기말 현재 기타자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 선급금 | 30,875 | 72,889 | 61,686 | 71,714 |
| 선급비용 | 66,586 | - | 52,217 | - |
| 부가세대급금 | 171,198 | - | 138,366 | - |
| 합 계 | 268,659 | 72,889 | 252,269 | 71,714 |
11. 유형자산
(1) 당반기와 전기 중 유형자산의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | ||||||
|---|---|---|---|---|---|---|---|
| 기계장치 | 공구와기구 | 비품 | 시설장치 | 사용권자산 (부동산) |
사용권자산 (차량운반구) |
합 계 | |
| 기초 | 460,227 | 28,243 | 108,235 | 157,120 | 94,142 | 11,431 | 859,398 |
| 취득 | 109,500 | 87,265 | 6,890 | - | 726,197 | 132,440 | 1,062,292 |
| 처분 | (55) | (3) | - | - | - | (7,620) | (7,678) |
| 상각 | (64,589) | (16,963) | (16,234) | (24,994) | (94,142) | (8,275) | (225,197) |
| 기말 | 505,083 | 98,542 | 98,891 | 132,126 | 726,197 | 127,976 | 1,688,815 |
| (단위: 천원) |
| 구 분 | 전기 | ||||||
|---|---|---|---|---|---|---|---|
| 기계장치 | 공구와기구 | 비품 | 시설장치 | 사용권자산 (부동산) |
사용권자산 (차량운반구) |
합 계 | |
| 기초 | 146,045 | 70,505 | 77,730 | 138,275 | - | - | 432,555 |
| 회계정책변동효과 | - | - | - | - | 282,427 | 26,662 | 309,089 |
| 취득 | 384,042 | 11,900 | 55,604 | 59,000 | - | - | 510,546 |
| 처분 | (61) | (73) | - | - | - | - | (134) |
| 상각 | (69,799) | (54,089) | (25,099) | (40,155) | (188,285) | (15,231) | (392,658) |
| 기말 | 460,227 | 28,243 | 108,235 | 157,120 | 94,142 | 11,431 | 859,398 |
(2) 당반기와 전기 감가상각비는 전액 영업비용에 배부되어 있습니다.
12. 무형자산
(1) 당반기와 전기 중 무형자산의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | |||
|---|---|---|---|---|
| 특허권 | 상표권 | 소프트웨어 | 합 계 | |
| 기초 | 2,055,000 | 877 | 15,794 | 2,071,671 |
| 취득 | 47,830 | 25,000 | - | 72,830 |
| 상각 | (221,970) | (1,375) | (2,802) | (226,147) |
| 기말 | 1,880,860 | 24,502 | 12,992 | 1,918,354 |
| (단위: 천원) |
| 구 분 | 전기 | |||
|---|---|---|---|---|
| 특허권 | 상표권 | 소프트웨어 | 합 계 | |
| 기초 | 2,403,423 | 1,127 | 21,398 | 2,425,948 |
| 취득 | 87,371 | - | - | 87,371 |
| 상각 | (435,794) | (250) | (5,604) | (441,648) |
| 기말 | 2,055,000 | 877 | 15,794 | 2,071,671 |
(2) 당반기와 전기 무형자산상각비는 전액 영업비용에 배부되어 있습니다.
13. 매입채무및기타채무
당반기말과 전기말 현재 매입채무및기타채무의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 미지급금 | 133,427 | 9,713 |
| 미지급비용 | 1,175,004 | 308,032 |
| 합 계 | 1,308,431 | 317,745 |
14. 리스부채
당반기말과 전기말 현재 리스부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동리스부채 | 243,992 | 117,217 |
| 비유동리스부채 | 611,034 | - |
| 합 계 | 855,026 | 117,217 |
연결실체는 기업회계기준서 제1116호 '리스'에 따라 리스기간이 12개월을 초과하고기초 자산이 소액이 아닌 모든 리스에 대하여 사용권자산과 리스부채를 인식하였습니다.
15. 기타부채
당반기말과 전기말 현재 기타부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 선수수익(*) | 217,106 | 462,624 |
| 예수금 | 24,674 | 60,690 |
| 합 계 | 241,780 | 523,314 |
(*) 당반기말 현재 선수수익 중 199,835천원은 보건복지부 국책과제와 관련하여 수령한 금액입니다.
16. 종업원급여
당반기 중 확정기여제도와 관련하여 비용으로 인식한 금액은 121,033천원이며, 53,879천원은 퇴직급여에 67,154천원은 경상연구개발비에 포함되어 있습니다.
17. 우발상황 및 약정사항
(1) 연결실체는 당반기말과 전기말 현재 정부 및 지방자치단체 보조금 등의 반환지급보증과 관련하여 서울보증보험으로부터 50백만원의 지급보증을 제공받고 있습니다.
(2) 연결실체는 2017년 2월 SK케미칼 주식회사와 연구과제, 무형자산, 설비 등의 자산을 양수도하는 계약을 체결하였으며, 향후 양수한 각 연구과제별 경상연구개발비, 기타관리비 등의 누적비용을 차감한 연구과제별 순이익 발생 시, 순이익의 10%를 지급하는 약정을 맺고 있습니다.
18. 자본금과 자본잉여금
(1) 연결실체가 발행할 주식의 총수는 100,000,000주이고, 발행한 주식수는 보통주식 23,471,826주(전기말: 23,459,826주)이며 1주당 액면금액은 500원입니다.
(2) 당반기와 전기 중 연결실체가 발행한 주식 및 이에 따른 자본금과 주식발행초과금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 주식수(단위: 주) | 자본금 | 자본잉여금 |
|---|---|---|---|
| 전기초 | 1,797,233 | 898,617 | 49,711,707 |
| 무상증자 | 16,175,097 | 8,087,549 | (8,130,225) |
| 유상증자 | 5,217,596 | 2,608,798 | 66,720,884 |
| 주식선택권행사 | 269,900 | 134,949 | 1,082,767 |
| 전기말 | 23,459,826 | 11,729,913 | 109,385,133 |
| 주식선택권행사 | 12,000 | 6,000 | 46,954 |
| 당반기말 | 23,471,826 | 11,735,913 | 109,432,087 |
19. 기타자본항목
당반기말과 전기말 현재 기타자본항목의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 주식선택권 | 1,431,088 | 1,040,427 |
20. 주식기준보상
(1) 연결실체는 주주총회 결의에 의거해서 연결회사의 임직원에게 주식선택권을 부여했으며, 당반기말 현재 그 주요 내용은 다음과 같습니다.
| 구 분 |
1차 |
2차 |
3차 | 4차 |
|---|---|---|---|---|
| 회사가 발행할 주식의 총수 | 612,000주(잔여 224,100주) | 378,000주(잔여 350,000주) | 95,000주(잔여 45,000주) | 467,500주(잔여 437,500주) |
|
행사가격 |
2,046원 | 3,840원 | 10,400원 | 9,944원 |
|
부여일 |
2017.12.04 | 2018.11.16 | 2019.05.17 | 2020.03.30 |
|
가득조건 |
용역제공기간 : 부여일로부터 2년 또는 3년 또는 4년 | |||
|
약정만기 |
선택권 부여일로부터 7년 이내 기간까지 가득수량에 대해 행사 가능 | |||
|
결제방식(*) |
주식결제 또는 현금차액보상 | |||
|
부여받은자 |
임직원 | |||
(*) 연결실체가 결제방식에 대한 선택권을 보유하고 있으며, 연결실체는 과거에 이러한 주식선택권에 대해 현금결제를 한 경험이 없습니다.
(2) 당반기와 전기 중 주식선택권의 변동은 다음과 같습니다.
| (단위 : 주) |
| 구분 | 당반기 | 전기 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1차 | 2차 | 3차 | 4차 | 합 계 | 1차 | 2차 | 3차 | 합 계 | |
| 기초 잔여주 | 252,100 | 355,000 | 95,000 | - | 702,100 | 552,000 | 378,000 | - | 930,000 |
| 부여 | - | - | - | 467,500 | 467,500 | - | - | 95,000 | 95,000 |
| 행사 | (12,000) | - | - | - | (12,000) | (269,900) | - | - | (269,900) |
| 소멸(*) | (16,000) | (5,000) | (50,000) | (30,000) | (101,000) | (30,000) | (23,000) | - | (53,000) |
| 기말 잔여주 | 224,100 | 350,000 | 45,000 | 437,500 | 1,056,600 | 252,100 | 355,000 | 95,000 | 702,100 |
(*) 당반기 중 퇴사로 인한 소멸입니다.
전기 중 연결실체는 주당 액면금액 500원의 보통주 16,175,097주를 무상증자하였으며, 전기 및 당기초 주식선택권 수량 산정시 무상증자를 반영하여 산정하였습니다.
당반기말 현재 행사 가능한 주식선택권 수량은 31,300주이며, 유효한 주식선택권의 가중평균잔여만기는 5.7년입니다.
(3) 연결실체는 부여된 주식선택권의 보상원가를 이항모형을 이용한 공정가치접근법을 적용하여 산정하였습니다.
(4) 당반기와 전반기 중 비용으로 인식한 주식기준보상은 영업비용에 212,252천원(전반기: 168,545천원)와 경상연구개발비에 208,124천원(전반기: 259,851천원)입니다. 당반기와 전반기의 주식기준보상비용은 전액 주식결제형 주식기준보상과 관련된 비용입니다.
21. 영업비용
당반기와 전반기의 영업비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 226,945 | 435,155 | 147,378 | 289,793 |
| 퇴직급여 | 26,887 | 53,879 | 15,762 | 30,899 |
| 복리후생비 | 129,385 | 228,790 | 56,931 | 111,251 |
| 여비교통비 | 11,420 | 27,983 | 11,217 | 28,367 |
| 감가상각비 | 118,784 | 225,197 | 94,522 | 187,179 |
| 지급임차료 | 26,072 | 54,452 | 3,655 | 4,435 |
| 경상연구개발비 | 2,582,459 | 4,141,075 |
1,446,155 | 2,453,213 |
| 소모품비 | 12,988 | 22,515 | 8,935 | 12,073 |
| 지급수수료 | 155,068 | 258,460 | 144,974 | 250,294 |
| 건물관리비 | 37,376 | 74,726 | 29,771 | 59,165 |
| 무형자산상각비 | 114,028 | 226,147 | 109,649 | 218,289 |
| 주식보상비용 | 139,368 | 212,252 |
83,194 | 168,545 |
| 기타 | 48,670 | 123,858 | 91,443 | 222,545 |
| 합 계 | 3,629,450 | 6,084,489 | 2,243,586 | 4,036,048 |
22. 법인세비용
법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균 연간법인세율의 추정에 기초하여 인식하였습니다. 2020년 12월 31일로 종료하는 회계연도는 이월결손금의 사용으로 납부할 법인세가 없을 것으로 추정하였으며(2020년도 6월 30일로 종료하는 기간에 대한 예상평균연간 법인세율 : 0%), 당반기말 현재 이연법인세 자산의 실현가능성이 높지 않은 것으로 판단되어 이연법인세 자산을 인식하지 않은 이유로 법인세 비용이 발생하지 않았습니다.
23. 주당손실
(1) 분기 주당손실의 계산 내역은 다음과 같습니다.
① 2분기 기본주당손실
| (단위: 주, 원) |
| 구 분 | 당 2분기 | 전 2분기 |
|---|---|---|
| 보통주분기순손실 (지배기업의 소유주지분) |
(3,235,260,885) | (2,032,216,449) |
| 가중평균유통보통주식수(*) | 23,471,694 | 19,532,523 |
| 기본주당손실 | (138) | (104) |
(*) 당반기 및 전반기 가중평균유통보통주식수는 전기 중 실시한 무상증자 비율에 따라 조정되었습니다.
② 가중평균유통보통주식수의 계산 내역
- 당 2분기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2020.04.01~2020.06.30 | 23,459,826 | 2,134,844,166 |
| 주식선택권의 행사 | 2020.04.02~2020.06.30 | 11,868 | 1,080,000 |
| 계 | 23,471,694 | 2,135,924,166 | |
- 전 2분기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2019.04.01~2019.06.30 | 17,972,330 | 1,635,482,030 |
| 유상증자 | 2019.05.01~2019.06.30 | 160,879 | 14,640,000 |
| 유상증자 | 2019.05.09~2019.06.30 | 1,399,314 | 127,337,588 |
| 계 | 19,532,523 | 1,777,459,618 | |
(2) 반기 주당손실의 계산 내역은 다음과 같습니다.
① 반기 기본주당손실
| (단위: 주, 원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 보통주반기순손실 (지배기업의 소유주지분) |
(5,304,388,560) | (2,710,742,306) |
| 가중평균유통보통주식수(*) | 23,465,760 | 18,756,737 |
| 기본주당손실 | (226) | (145) |
(*) 당반기 및 전반기 가중평균유통보통주식수는 전기 중 실시한 무상증자 비율에 따라 조정되었습니다.
② 가중평균유통보통주식수의 계산 내역
- 당반기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2020.01.01~2020.06.30 | 23,459,826 | 4,269,688,332 |
| 주식선택권의 행사 | 2020.04.02~2020.06.30 | 5,934 | 1,080,000 |
| 계 | 23,465,760 | 4,270,768,332 | |
- 전반기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2019.01.01~2019.06.30 | 17,972,330 | 3,252,991,730 |
| 유상증자 | 2019.05.01~2019.06.30 | 80,884 | 14,640,000 |
| 유상증자 | 2019.05.09~2019.06.30 | 703,523 | 127,337,588 |
| 계 | 18,756,737 | 3,394,969,318 | |
(3) 반희석 잠재적보통주
당반기 및 전기 중에는 반희석효과로 희석주당손익을 계산할 때 고려하지 않았지만 향후 희석 효과가 발생할 가능성이 있는 잠재적보통주의 내역은 다음과 같습니다.
| (단위: 주) |
| 구 분 | 당반기 | 전기 |
|---|---|---|
| 주식선택권 | 1,056,600 | 702,100 |
24. 특수관계자
(1) 연결실체는 연결실체의 주식이 2019년 11월 22일 한국거래소가 개설한 코스닥시장에 상장됨에 따라 전기초 현재 유의적인 영향력을 행사하는 자로 분류한 한국투자글로벌제약산업육성사모투자전문회사 외 10개사와의 특수관계가 해소되었습니다.
(2) 당반기 및 전반기 중 특수관계자와의 자금거래내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 회사명 | 당반기 | 전반기 |
|---|---|---|---|
| 유상증자 | 프리미어 글로벌 이노베이션 1호 투자조합 | - | 3,000,000 |
| 키움증권 주식회사 | - | 1,000,000 | |
| 합 계 | - | 4,000,000 | |
(3) 당반기말과 전기말 현재 특수관계자와의 채권 및 채무는 없습니다.
(4) 주요 경영진에 대한 보상
연결실체는 기업 활동의 계획ㆍ운영ㆍ통제에 대하여 중요한 권한과 책임을 가진 대표이사, 등기임원, 비등기임원을 주요 경영진으로 판단하였으며, 당반기 및 전반기 중 주요 경영진에 대한 보상을 위해 지급한 금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 단기종업원 급여 | 675,384 | 355,577 |
| 퇴직급여 | 77,695 | 43,429 |
| 주식보상비용 | 187,212 | 225,649 |
| 합 계 | 940,291 | 624,655 |
25. 영업으로부터 창출된 현금
(1) 당반기와 전반기 중 영업으로부터 창출된 현금의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 반기순손실 | (5,304,389) | (2,710,742) |
| 조정: | ||
| 퇴직급여 | 121,033 | 70,208 |
| 주식보상비용 | 420,375 | 428,396 |
| 이자비용 | 4,350 | 12,067 |
| 감가상각비 | 225,197 | 187,179 |
| 무형자산상각비 | 226,147 | 218,289 |
| 유형자산폐기손실 | 58 | - |
| 이자수익 | (726,346) | (336,287) |
| 외화환산이익 | (17,044) | (212) |
| 외화환산손실 | 4,378 | 1,634 |
| 당기손익-공정가치측정금융자산평가이익 | (47,000) | - |
| 소 계 | 211,148 | 581,274 |
| 영업활동으로 인한 자산ㆍ부채의 변동 | ||
| 매출채권의 감소(증가) | - | 1,118,100 |
| 기타채권의 감소(증가) | 1,015 | (5,694) |
| 기타유동자산의 감소(증가) | (16,389) | 18,058 |
| 기타비유동자산의 감소(증가) | (34,672) | - |
| 기타채무의 증가(감소) | 885,843 | (241,200) |
| 기타유동부채의 증가(감소) | (281,534) | 622,291 |
| 소 계 | 554,263 | 1,511,555 |
| 합 계 | (4,538,978) | (617,913) |
(2) 현금의 유출ㆍ입이 없는 거래 중 중요한 사항
| (단위 : 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 보증금의 비유동성대체 | 559,203 | - |
(3) 재무활동에서 생기는 부채의 조정내용
1) 당반기
| (단위 : 천원) |
| 구 분 | 당기초 | 현금거래 | 비현금거래 | 당반기말 | ||
|---|---|---|---|---|---|---|
| 차입 및 발행 | 상환 | 계정대체 | 기타변동 | |||
| 유동리스부채 | 117,217 | - | (113,208) | 247,604 | (7,620) | 243,993 |
| 비유동리스부채 | - | - | - | (247,604) | 858,638 | 611,034 |
2) 전반기
| (단위 : 천원) |
| 구 분 | 전기초 | 현금거래 | 비현금거래 | 전반기말 | ||
|---|---|---|---|---|---|---|
| 차입 및 발행 | 상환 | 계정대체 | 기타변동 | |||
| 유동리스부채 | 212,195 | - | (104,995) | 110,626 | - | 217,826 |
| 비유동리스부채 | 117,217 | - | - | (110,626) | - | 6,591 |
26. 기술이전계약
(1) 연결실체는 2019년 2월 25일자로 대한민국에 소재한 대원제약(주)와 자궁내막증치료 신약후보물질 TU2670에 대한 기술이전 계약을 체결하였습니다. 연결실체는 반환조건 없는 계약금(Upfront payment) 1,000,000천원을 일시에 수령하였으며, 기업회계기준서 제1115호 '고객과의 계약에서 생기는 수익'의 적용지침에 의거하여 해당 기술이전은 다른 재화 혹은 용역과 구별되며 라이선스를 부여하는 시점에 존재하는 지적재산을 사용할 권리로 판단하여 계약금을 2019년에 수익인식 하였습니다. 또한, 연결실체는 규제당국의 허가 및 상업화에 성공할 경우 최대 3,000,000천원 규모의 마일스톤 금액(Milestone payment) 및 로열티(Royalty)를 수령할 수 있습니다.
(2) 연결실체는 2018년 12월 21일자로 이탈리아에 소재한 CHIESI FARMACEUTICI S.p.A사와 폐섬유증 치료 신약 후보물질 NCE401 물질에 대한 기술이전 계약을 체결하였으며 반환조건 없는 계약금(Upfront payment) USD 1,000,000을 2018년에 수익으로 인식하였습니다. 또한, 연결실체는 향후 규제당국의 허가 및 상업화에 성공할 경우 최대 USD 73,000,000 규모의 마일스톤 금액(Milestone payment) 및 로열티(Royalty)를 수령할 수 있습니다.
(3) 기술이전계약과 관련된 불확실성 및 기타사항
연결실체의 향후 마일스톤 및 로열티 수익은 임상시험, 관계당국의 허가 등 개발의 성공여부에 따라 달라질 수 있으므로 발생가능성에 불확실성이 내포되어 있습니다.
27. 비교표시 재무제표
연결실체는 2020년 중 종속기업을 최초로 취득하여 당기부터 별도재무제표와 연결재무제표를 작성하였습니다. 비교표시목적으로 첨부한 2019년 12월 31일의 요약연결재무상태표와 2019년 6월 30일로 종료되는 요약반기연결포괄손익계산서와 요약반기연결자본변동표 및 요약반기연결현금흐름표는 개별재무제표와 동일합니다.
4. 재무제표
|
재무상태표 |
|
제 5 기 반기말 2020.06.30 현재 |
|
제 4 기말 2019.12.31 현재 |
|
(단위 : 원) |
|
제 5 기 반기말 |
제 4 기말 |
|
|---|---|---|
|
자산 |
||
|
유동자산 |
85,764,952,255 |
90,437,602,167 |
|
현금및현금성자산 |
6,925,217,963 |
2,882,958,603 |
|
단기금융자산 |
55,000,000,000 |
86,000,000,000 |
|
당기손익-공정가치측정금융자산 |
23,047,000,000 |
|
|
매출채권및기타채권 |
370,037,959 |
1,207,320,832 |
|
기타유동자산 |
268,147,283 |
252,269,502 |
|
당기법인세자산 |
154,549,050 |
95,053,230 |
|
비유동자산 |
4,277,990,365 |
3,019,072,942 |
|
종속기업에 대한 투자자산 |
8,019,170 |
|
|
유형자산 |
1,688,815,343 |
859,397,957 |
|
무형자산 |
1,918,354,217 |
2,071,671,020 |
|
기타비유동채권 |
589,913,000 |
16,290,000 |
|
기타비유동자산 |
72,888,635 |
71,713,965 |
|
자산총계 |
90,042,942,620 |
93,456,675,109 |
|
부채 |
||
|
유동부채 |
1,334,540,661 |
958,275,535 |
|
매입채무및유동채무 |
848,767,781 |
317,744,659 |
|
기타유동부채 |
241,780,453 |
523,314,187 |
|
유동리스부채 |
243,992,427 |
117,216,689 |
|
비유동부채 |
611,033,506 |
|
|
비유동리스부채 |
611,033,506 |
|
|
부채총계 |
1,945,574,167 |
958,275,535 |
|
자본 |
||
|
자본금 |
11,735,913,000 |
11,729,913,000 |
|
자본잉여금 |
109,432,086,629 |
109,385,133,493 |
|
기타자본항목 |
1,431,087,679 |
1,040,427,324 |
|
이익잉여금(결손금) |
(34,501,718,855) |
(29,657,074,243) |
|
자본총계 |
88,097,368,453 |
92,498,399,574 |
|
자본과부채총계 |
90,042,942,620 |
93,456,675,109 |
|
포괄손익계산서 |
|
제 5 기 반기 2020.01.01 부터 2020.06.30 까지 |
|
제 4 기 반기 2019.01.01 부터 2019.06.30 까지 |
|
(단위 : 원) |
|
제 5 기 반기 |
제 4 기 반기 |
|||
|---|---|---|---|---|
|
3개월 |
누적 |
3개월 |
누적 |
|
|
영업수익 |
1,000,000,000 |
|||
|
영업비용 |
3,159,099,284 |
5,609,369,756 |
2,243,585,677 |
4,036,048,479 |
|
영업이익(손실) |
(3,159,099,284) |
(5,609,369,756) |
(2,243,585,677) |
(3,036,048,479) |
|
금융수익 |
368,729,164 |
773,431,712 |
222,336,919 |
336,287,122 |
|
금융비용 |
5,869,461 |
7,959,066 |
5,569,709 |
12,740,779 |
|
기타수익 |
11,863,031 |
16,926,443 |
4,449,191 |
12,470,670 |
|
기타비용 |
(4,090,730) |
17,673,945 |
9,847,173 |
10,710,840 |
|
법인세비용차감전순이익(손실) |
(2,780,285,820) |
(4,844,644,612) |
(2,032,216,449) |
(2,710,742,306) |
|
법인세비용 |
||||
|
당기순이익(손실) |
(2,780,285,820) |
(4,844,644,612) |
(2,032,216,449) |
(2,710,742,306) |
|
총포괄손익 |
(2,780,285,820) |
(4,844,644,612) |
(2,032,216,449) |
(2,710,742,306) |
|
주당이익 |
||||
|
기본주당이익(손실) (단위 : 원) |
(118) |
(206) |
(104) |
(145) |
|
희석주당이익(손실) (단위 : 원) |
(118) |
(206) |
(104) |
(145) |
|
자본변동표 |
|
제 5 기 반기 2020.01.01 부터 2020.06.30 까지 |
|
제 4 기 반기 2019.01.01 부터 2019.06.30 까지 |
|
(단위 : 원) |
|
자본 |
|||||
|---|---|---|---|---|---|
|
자본금 |
자본잉여금 |
기타자본구성요소 |
이익잉여금 |
자본 합계 |
|
|
2019.01.01 (기초자본) |
898,616,500 |
49,711,706,561 |
684,344,597 |
(22,545,863,935) |
28,748,803,723 |
|
회계정책변경에 따른 증가(감소) |
(19,795,544) |
19,795,544 |
|||
|
재분류조정 |
898,616,500 |
49,711,706,561 |
684,344,597 |
(22,565,659,479) |
28,729,008,179 |
|
당기순이익(손실) |
(2,710,742,306) |
(2,710,742,306) |
|||
|
유상증자 |
1,321,298,000 |
38,662,716,380 |
39,984,014,380 |
||
|
무상증자 |
8,087,548,500 |
(8,130,224,724) |
(42,676,224) |
||
|
주식보상비용 |
428,395,775 |
428,395,775 |
|||
|
주식매수선택권의 행사 |
|||||
|
2019.06.30 (기말자본) |
10,307,463,000 |
80,244,198,217 |
1,112,740,372 |
(25,276,401,785) |
66,387,999,804 |
|
2020.01.01 (기초자본) |
11,729,913,000 |
109,385,133,493 |
1,040,427,324 |
(29,657,074,243) |
92,498,399,574 |
|
회계정책변경에 따른 증가(감소) |
|||||
|
재분류조정 |
|||||
|
당기순이익(손실) |
(4,844,644,612) |
(4,844,644,612) |
|||
|
유상증자 |
|||||
|
무상증자 |
|||||
|
주식보상비용 |
420,375,211 |
420,375,211 |
|||
|
주식매수선택권의 행사 |
6,000,000 |
46,953,136 |
(29,714,856) |
23,238,280 |
|
|
2020.06.30 (기말자본) |
11,735,913,000 |
109,432,086,629 |
1,431,087,679 |
(34,501,718,855) |
88,097,368,453 |
|
현금흐름표 |
|
제 5 기 반기 2020.01.01 부터 2020.06.30 까지 |
|
제 4 기 반기 2019.01.01 부터 2019.06.30 까지 |
|
(단위 : 원) |
|
제 5 기 반기 |
제 4 기 반기 |
|
|---|---|---|
|
영업활동현금흐름 |
(3,598,821,169) |
(169,005,535) |
|
영업활동으로인한자산ㆍ부채의변동 |
(4,538,385,661) |
(617,912,864) |
|
이자지급(영업) |
1,003,410,878 |
445,750,410 |
|
이자수취(영업) |
(4,350,566) |
(12,067,101) |
|
법인세납부(환급) |
(59,495,820) |
15,224,020 |
|
투자활동현금흐름 |
7,734,573,299 |
(21,701,534,138) |
|
단기금융상품의 처분 |
58,000,000,000 |
22,500,000,000 |
|
단기금융상품의 취득 |
(27,000,000,000) |
(44,000,000,000) |
|
당기손익-공정가치측정금융자산의 취득 |
(23,000,000,000) |
|
|
종속기업의 취득 |
(8,019,170) |
|
|
유형자산의 취득 |
(184,455,000) |
(104,825,454) |
|
무형자산의 취득 |
(58,532,531) |
(66,708,684) |
|
보증금의 증가 |
(30,710,000) |
(30,000,000) |
|
보증금의 감소 |
16,290,000 |
|
|
재무활동현금흐름 |
(89,969,769) |
39,836,342,677 |
|
유상증자 |
39,984,014,380 |
|
|
주식매수선택권 행사 |
24,552,000 |
|
|
신주발행비용 |
(1,313,720) |
(42,676,224) |
|
리스부채의 상환 |
(113,208,049) |
(104,995,479) |
|
현금및현금성자산의순증가(감소) |
4,045,782,361 |
17,965,803,004 |
|
기초현금및현금성자산 |
2,882,958,603 |
1,860,378,733 |
|
현금및현금성자산의 환율변동효과 |
(3,523,001) |
(673,678) |
|
기말현금및현금성자산 |
6,925,217,963 |
19,825,508,059 |
5. 재무제표 주석
| 제 5 기 당반기 : 2020년 6월 30일 현재 |
| 제 4 기 전반기 : 2019년 6월 30일 현재 |
| 주식회사 티움바이오 |
1. 회사의 개요
주식회사 티움바이오(이하 '당사')는 2016년 12월 6일 설립되어 혁신신약 연구개발을 주요 사업으로 영위하고 있으며, 경기도 성남시 분당구 판교테크노밸리에 소재하고 있습니다. 한편, 당사는 2019년 11월 22일에 당사의 주식을 한국거래소가 개설한코스닥시장에 상장하였습니다.
수차례의 유상증자 및 무상증자를 통하여 당반기말 현재 총발행주식수는 23,471,826주이고, 자본금은 11,735,913천원이며, 전부 기명식보통주식입니다.
당반기말 현재 당사의 최대주주(대표이사 김훈택)의 지분율은 34.19%입니다.
2. 재무제표 작성기준
(1) 회계기준의 적용
당사의 반기재무제표는 한국채택국제회계기준에 따라 작성되는 요약중간재무제표입니다. 동 재무제표는 기업회계기준서 제1034호 '중간재무보고'에 따라 작성되었으며, 연차재무제표에서 요구되는 정보에 비하여 적은 정보를 포함하고 있습니다. 선별적 주석은 직전 연차보고기간말 후 발생한 당사의 재무상태와 경영성과의 변동을 이해하는데 유의적인 거래나 사건에 대한 설명을 포함하고 있습니다.
당사의 재무제표는 기업회계기준서 제1027호 '별도재무제표'에 따른 별도재무제표로서 지배기업, 관계기업의 투자자 또는 공통지배기업의 참여자가 투자자산을 피투자자의 보고된 성과와 순자산에 근거하지 않고 직접적인 지분투자에 근거한 회계처리로 표시한 재무제표입니다.
(2) 추정과 판단
① 경영진의 판단 및 가정과 추정의 불확실성
한국채택국제회계기준에서는 중간재무제표를 작성함에 있어서 회계정책의 적용이나, 중간보고기간말 현재 자산, 부채 및 수익, 비용의 보고금액에 영향을 미치는 사항에 대하여 경영진의 최선의 판단을 기준으로 한 추정치와 가정의 사용을 요구하고 있습니다. 중간보고기간말 현재 경영진의 최선의 판단을 기준으로한 추정치와 가정이 실제 환경과 다를 경우 이러한 추정치와 실제 결과는 다를 수 있습니다.
반기재무제표에서 사용된 당사의 회계정책 적용과 추정금액에 대한 경영진의 판단은2019년 12월 31일로 종료되는 회계연도의 연차재무제표와 동일한 회계정책과 추정의 근거를 사용하였습니다.
② 공정가치 측정
당사는 공정가치평가 정책과 절차를 수립하고 있습니다. 동 정책과 절차에는 공정가치 서열체계에서 수준 3으로 분류되는 공정가치를 포함한 모든 유의적인 공정가치 측정의 검토를 책임지는 평가부서의 운영을 포함하고 있으며, 그 결과는 재무담당임원에게 직접 보고되고 있습니다.
평가부서는 정기적으로 관측가능하지 않은 유의적인 투입변수와 평가 조정을 검토하고 있습니다. 공정가치 측정에서 중개인 가격이나 평가기관과 같은 제 3자 정보를 사용하는 경우, 평가부서에서 제 3자로부터 입수한 정보에 근거한 평가가 공정가치 서열체계 내 수준별 분류를 포함하고 있으며 해당 기준서의 요구사항을 충족한다고 결론을 내릴 수 있는지 여부를 판단하고 있습니다.
당사는 유의적인 평가 문제를 감사에 보고하고 있습니다.
자산이나 부채의 공정가치를 측정하는 경우, 당사는 최대한 시장에서 관측가능한 투입변수를 사용하고 있습니다. 공정가치는 다음과 같이 가치평가기법에 사용된 투입변수에 기초하여 공정가치 서열체계 내에서 분류됩니다.
·수준 1: 측정일에 동일한 자산이나 부채에 대한 접근 가능한 활성시장의 조정되지 않은 공시가격
·수준 2: 수준 1의 공시가격 이외에 자산이나 부채에 대해 직접적으로 또는 간접적으로 관측가능한 투입변수
·수준 3: 자산이나 부채에 대한 관측가능하지 않은 투입변수
자산이나 부채의 공정가치를 측정하기 위해 사용되는 여러 투입변수가 공정가치 서열체계 내에서 다른 수준으로 분류되는 경우, 당사는 측정치 전체에 유의적인 공정가치 서열체계에서 가장 낮은 수준의 투입변수와 동일한 수준으로 공정가치 측정치 전체를 분류하고 있으며, 변동이 발생한 보고기간 말에 공정가치 서열체계의 수준간 이동을 인식하고 있습니다.
공정가치 측정시 사용된 가정의 자세한 정보는 아래 주석에 포함되어 있습니다.
- 주석 5 : 범주별 금융상품
3. 유의적인 회계정책
반기재무제표에 적용된 회계정책은 직전 연차재무제표에 적용된 회계정책과 동일합니다. 2020년 1월 1일부터 시행되는 새로운 회계기준 있으나, 그 기준들은 당사의 재무제표에 중요한 영향을 미치지 않습니다.
중간기간의 법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균연간법인세율, 즉 추정평균연간유효법인세율을 중간기간의 세전손익에 적용하여 계산합니다.
4. 영업부문 정보
당사는 기업회계기준서 제1108호(영업부문)에 따른 보고부문이 단일부문으로 기업전체 수준에서의 부문별 정보는 다음과 같습니다.
(1) 수익의 세부내역
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 기술이전수익 | - | 1,000,000 |
전반기의 기술이전수익은 모두 국내에서 발생하였습니다.
(2) 주요 고객에 대한 정보
당반기와 전반기 중 회사 매출액의 10% 이상을 차지하는 외부고객과 관련된 정보는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 매출액 | |
|---|---|---|
| 당반기 | 전반기 | |
| 고객 1 | - | 1,000,000 |
5. 금융상품
(1) 당반기말과 전기말 현재 범주별 금융상품의 장부금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 당기손익-공정가치측정금융자산 | 23,047,000 | - |
| 상각후원가측정금융자산 | 62,885,169 | 90,106,570 |
| 상각후원가측정금융부채 | 1,703,794 | 434,962 |
(2) 당반기말과 전기말 현재 금융상품의 장부금액과 공정가치는 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |
| 금융자산: | ||||
| 공정가치로 인식된 금융자산 | ||||
| 당기손익-공정가치측정금융자산 | 23,047,000 | 23,047,000 | - | - |
| 상각후원가로 인식된 금융자산 | ||||
| 현금및현금성자산 | 6,925,218 | 6,925,218 | 2,882,959 | 2,882,959 |
| 단기금융자산 | 55,000,000 | 55,000,000 | 86,000,000 | 86,000,000 |
| 매출채권및기타채권 | 370,038 |
370,038 |
1,207,321 | 1,207,321 |
| 기타비유동채권 | 589,913 | 589,913 | 16,290 | 16,290 |
| 소 계 | 62,885,169 | 62,885,169 | 90,106,570 | 90,106,570 |
| 합 계 | 85,932,169 | 85,932,169 | 90,106,570 | 90,106,570 |
| 금융부채: | ||||
| 상각후원가로 인식된 금융부채 | ||||
| 매입채무및기타채무 | 848,768 | 848,768 | 317,745 | 317,745 |
| 유동리스부채 | 243,992 | 243,992 | 117,217 | 117,217 |
| 비유동리스부채 | 611,034 | 611,034 | - | - |
| 합 계 | 1,703,794 | 1,703,794 | 434,962 | 434,962 |
(3) 공정가치 서열체계
당반기말과 전기말 현재 공정가치로 측정되는 금융상품의 각 종류별로 공정가치 수준별 측정치는 다음과 같습니다.
수준 1 : 활성시장에서 거래되는 금융상품(예 : 상장 주식 등)
수준 2 : 활성시장에서 거래되지 아니하고, 평가기법을 사용하여 공정가치를 산출한 금융상품. 단, 공정가치 측정에 요구되는 모든 유의적인 투입변수가 관측가능하여야 함.
수준 3 : 하나 이상의 유의적인 투입변수가 관측가능한 시장정보에 기초한 것이 아니라면 해당 상품은 "수준 3"에 포함.
① 당반기말
| (단위: 천원) |
| 구 분 | 수준 1 | 수준 2 | 수준 3 | 합 계 |
|---|---|---|---|---|
| 금융자산: | ||||
| 당기손익-공정가치측정금융자산 | - | 23,047,000 | - | 23,047,000 |
② 전기말
전기말 현재 공정가치로 측정되는 금융상품은 없습니다.
6. 현금및현금성자산
당반기말과 전기말 현재 현금및현금성자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 현금 | 465 | - |
| 보통예금(*1) | 6,441,944 | 2,824,294 |
| 외화예금 | 482,531 | 58,664 |
| 기타제예금 | 278 | - |
| 합 계 | 6,925,218 | 2,882,958 |
(*1) 당반기말 현재 보통예금 중 KB국민은행 426,420천원(전기말 : 585,447천원)은 보건복지부 과제 관련 직접비 용도 및 중소벤처기업부 채용지원 사업에 대한 인건비 용도로 사용이 제한되어 있습니다.
7. 매출채권및기타채권
당반기말과 전기말 현재 매출채권및기타채권의 내역은 다음과 같습니다.
| (단위: 천원) |
|
구 분 |
당반기말 | 전기말 | ||
|---|---|---|---|---|
|
유동 |
비유동 |
유동 |
비유동 | |
| 매출채권 | - | - | - | - |
| 기타채권 | ||||
| 미수금 | 24,960 |
- | 25,975 | - |
| 미수수익 | 305,078 | - | 582,143 | - |
| 보증금 | 40,000 | 589,913 | 599,203 | 16,290 |
| 소 계 | 370,038 |
589,913 | 1,207,321 | 16,290 |
| 합 계 | 370,038 | 589,913 | 1,207,321 | 16,290 |
8. 단기금융자산
당반기말과 전기말 현재 단기금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 정기예금 | 35,000,000 | 72,000,000 |
| 환매조건부채권 | 10,000,000 | 14,000,000 |
| 전자단기사채 | 10,000,000 | - |
| 합 계 | 55,000,000 | 86,000,000 |
9. 당기손익-공정가치측정금융자산
당반기말과 전기말 현재 당기손익-공정가치측정금융자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 파생결합증권 | 23,047,000 | - |
10. 기타자산
당반기말과 전기말 현재 기타자산의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 | ||
|---|---|---|---|---|
| 유동 | 비유동 | 유동 | 비유동 | |
| 선급금 | 30,875 | 72,889 | 61,686 | 71,714 |
| 선급비용 | 66,586 | - | 52,217 | - |
| 부가세대급금 | 170,686 | - | 138,366 | - |
| 합 계 | 268,147 | 72,889 | 252,269 | 71,714 |
11. 유형자산
(1) 당반기와 전기 중 유형자산의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | ||||||
|---|---|---|---|---|---|---|---|
| 기계장치 | 공구와기구 | 비품 | 시설장치 | 사용권자산 (부동산) |
사용권자산 (차량운반구) |
합 계 | |
| 기초 | 460,227 | 28,243 | 108,235 | 157,120 | 94,142 | 11,431 | 859,398 |
| 취득 | 109,500 | 87,265 | 6,890 | - | 726,197 | 132,440 | 1,062,292 |
| 처분 | (55) | (3) | - | - | - | (7,620) | (7,678) |
| 상각 | (64,589) | (16,963) | (16,234) | (24,994) | (94,142) | (8,275) | (225,197) |
| 기말 | 505,083 | 98,542 | 98,891 | 132,126 | 726,197 | 127,976 | 1,688,815 |
| (단위: 천원) |
| 구 분 | 전기 | ||||||
|---|---|---|---|---|---|---|---|
| 기계장치 | 공구와기구 | 비품 | 시설장치 | 사용권자산 (부동산) |
사용권자산 (차량운반구) |
합 계 | |
| 기초 | 146,045 | 70,505 | 77,730 | 138,275 | - | - | 432,555 |
| 회계정책변동효과 | - | - | - | - | 282,427 | 26,662 | 309,089 |
| 취득 | 384,042 | 11,900 | 55,604 | 59,000 | - | - | 510,546 |
| 처분 | (61) | (73) | - | - | - | - | (134) |
| 상각 | (69,799) | (54,089) | (25,099) | (40,155) | (188,285) | (15,231) | (392,658) |
| 기말 | 460,227 | 28,243 | 108,235 | 157,120 | 94,142 | 11,431 | 859,398 |
(2) 당반기와 전기 감가상각비는 전액 영업비용에 배부되어 있습니다.
12. 무형자산
(1) 당반기와 전기 중 무형자산의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | |||
|---|---|---|---|---|
| 특허권 | 상표권 | 소프트웨어 | 합 계 | |
| 기초 | 2,055,000 | 877 | 15,794 | 2,071,671 |
| 취득 | 47,830 | 25,000 | - | 72,830 |
| 상각 | (221,970) | (1,375) | (2,802) | (226,147) |
| 기말 | 1,880,860 | 24,502 | 12,992 | 1,918,354 |
| (단위: 천원) |
| 구 분 | 전기 | |||
|---|---|---|---|---|
| 특허권 | 상표권 | 소프트웨어 | 합 계 | |
| 기초 | 2,403,423 | 1,127 | 21,398 | 2,425,948 |
| 취득 | 87,371 | - | - | 87,371 |
| 상각 | (435,794) | (250) | (5,604) | (441,648) |
| 기말 | 2,055,000 | 877 | 15,794 | 2,071,671 |
(2) 당반기 및 전기 무형자산상각비는 전액 영업비용에 배부되어 있습니다.
13. 종속기업투자
당반기말과 전기말 현재 종속기업투자의 내역은 다음과 같습니다.
| (단위: 천원) |
|
구 분 |
종 목 |
소재국가 |
당반기말 |
전기말 |
||
|---|---|---|---|---|---|---|
|
지분율 |
장부금액 |
지분율 |
장부금액 |
|||
|
종속기업 |
TiumBio Australia PTY LTD |
호주 |
100% |
8,019 |
- |
- |
|
합 계 |
|
8,019 |
- | |||
연결대상 종속기업인 TiumBio Australia PTY LTD는 2020년 1월 당사가 100% 출자하여 설립하였습니다.
14. 매입채무및기타채무
당반기말과 전기말 현재 매입채무및기타채무의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 미지급금 | 133,427 | 9,713 |
| 미지급비용 | 715,341 | 308,032 |
| 합 계 | 848,768 | 317,745 |
15. 리스부채
당반기말과 전기말 현재 리스부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동리스부채 | 243,992 | 117,217 |
| 비유동리스부채 | 611,034 | - |
| 합 계 | 855,026 | 117,217 |
당사는 기업회계기준서 제1116호 '리스'에 따라 리스기간이 12개월을 초과하고 기초자산이 소액이 아닌 모든 리스에 대하여 사용권자산과 리스부채를 인식하였습니다.
16. 기타부채
당반기말과 전기말 현재 기타부채의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기말 | 전기말 |
|---|---|---|
| 유동 | ||
| 선수수익(*) | 217,106 | 462,624 |
| 예수금 | 24,674 | 60,690 |
| 합 계 | 241,780 | 523,314 |
(*) 당반기말 현재 선수수익 중 199,835천원은 보건복지부 국책과제와 관련하여 수령한 금액입니다.
17. 종업원급여
당반기 중 확정기여제도와 관련하여 비용으로 인식한 금액은 121,033천원이며, 53,879천원은 퇴직급여에 67,154천원은 경상연구개발비에 포함되어 있습니다.
18. 우발상황 및 약정사항
(1) 당사는 당반기말과 전기말 현재 정부 및 지방자치단체 보조금 등의 반환지급보증과 관련하여 서울보증보험으로부터 50백만원의 지급보증을 제공받고 있습니다.
(2) 당사는 2017년 2월 SK케미칼 주식회사와 연구과제, 무형자산, 설비 등의 자산을 양수도하는 계약을 체결하였으며, 향후 양수한 각 연구과제별 경상연구개발비, 기타관리비 등의 누적비용을 차감한 연구과제별 순이익 발생 시, 순이익의 10%를 지급하는 약정을 맺고 있습니다.
19. 자본금과 자본잉여금
(1) 당사가 발행할 주식의 총수는 100,000,000주이고, 발행한 주식수는 보통주식 23,471,826주(전기말: 23,459,826주)이며 1주당 액면금액은 500원입니다.
(2) 당반기와 전기 중 회사가 발행한 주식 및 이에 따른 자본금과 주식발행초과금의 변동내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 주식수(단위: 주) | 자본금 | 자본잉여금 |
|---|---|---|---|
| 전기초 | 1,797,233 | 898,617 | 49,711,707 |
| 무상증자 | 16,175,097 | 8,087,549 | (8,130,225) |
| 유상증자 | 5,217,596 | 2,608,798 | 66,720,884 |
| 주식선택권행사 | 269,900 | 134,949 | 1,082,767 |
| 전기말 | 23,459,826 | 11,729,913 | 109,385,133 |
| 주식선택권행사 | 12,000 | 6,000 | 46,954 |
| 당반기말 | 23,471,826 | 11,735,913 | 109,432,087 |
20. 기타자본항목
당반기말과 전기말 현재 기타자본항목의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구분 | 당반기말 | 전기말 |
|---|---|---|
| 주식선택권 | 1,431,088 | 1,040,427 |
21. 주식기준보상
(1) 당사는 주주총회 결의에 의거해서 회사의 임직원에게 주식선택권을 부여했으며, 당반기말 현재 그 주요 내용은 다음과 같습니다.
| 구 분 |
1차 |
2차 |
3차 | 4차 |
|---|---|---|---|---|
| 당사가 발행할 주식의 총수 | 612,000주(잔여 224,100주) | 378,000주(잔여 350,000주) | 95,000주(잔여 45,000주) | 467,500주(잔여 437,500주) |
|
행사가격 |
2,046원 | 3,840원 | 10,400원 | 9,944원 |
|
부여일 |
2017.12.04 | 2018.11.16 | 2019.05.17 | 2020.03.30 |
|
가득조건 |
용역제공기간 : 부여일로부터 2년 또는 3년 또는 4년 | |||
|
약정만기 |
선택권 부여일로부터 7년 이내 기간까지 가득수량에 대해 행사 가능 | |||
|
결제방식(*) |
주식결제 또는 현금차액보상 | |||
|
부여받은자 |
임직원 | |||
(*) 당사가 결제방식에 대한 선택권을 보유하고 있으며, 당사는 과거에 이러한 주식선택권에 대해 현금결제를 한 경험이 없습니다.
(2) 당반기와 전기 중 주식선택권의 변동은 다음과 같습니다.
| (단위 : 주) |
| 구분 | 당반기 | 전기 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1차 | 2차 | 3차 | 4차 | 합 계 | 1차 | 2차 | 3차 | 합 계 | |
| 기초 잔여주 | 252,100 | 355,000 | 95,000 | - | 702,100 | 552,000 | 378,000 | - | 930,000 |
| 부여 | - | - | - | 467,500 | 467,500 | - | - | 95,000 | 95,000 |
| 행사 | (12,000) | - | - | - | (12,000) | (269,900) | - | - | (269,900) |
| 소멸(*) | (16,000) | (5,000) | (50,000) | (30,000) | (101,000) | (30,000) | (23,000) | - | (53,000) |
| 기말 잔여주 | 224,100 | 350,000 | 45,000 | 437,500 | 1,056,600 | 252,100 | 355,000 | 95,000 | 702,100 |
(*) 당반기 중 퇴사로 인한 소멸입니다.
전기 중 당사는 주당 액면금액 500원의 보통주 16,175,097주를 무상증자하였으며, 전기 및 당기초 주식선택권 수량 산정시 무상증자를 반영하여 산정하였습니다.
당반기말 현재 행사 가능한 주식선택권 수량은 31,300주이며, 유효한 주식선택권의 가중평균잔여만기는 5.7년입니다.
(3) 당사는 부여된 주식선택권의 보상원가를 이항모형을 이용한 공정가치접근법을 적용하여 산정하였습니다.
(4) 당반기와 전반기 중 비용으로 인식한 주식기준보상은 영업비용에 212,252천원(전반기: 168,545천원)와 경상연구개발비에 208,124천원(전반기: 259,851천원)입니다. 당반기와 전반기의 주식기준보상비용은 전액 주식결제형 주식기준보상과 관련된 비용입니다.
22. 영업비용
당반기와 전반기의 영업비용의 내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 | ||
|---|---|---|---|---|
| 3개월 | 누적 | 3개월 | 누적 | |
| 급여 | 226,945 | 435,155 | 147,378 | 289,793 |
| 퇴직급여 | 26,887 | 53,879 | 15,762 | 30,899 |
| 복리후생비 | 129,385 | 228,790 | 56,931 | 111,251 |
| 여비교통비 | 11,420 | 27,983 | 11,217 | 28,367 |
| 감가상각비 | 118,784 | 225,197 | 94,522 | 187,179 |
| 지급임차료 | 26,072 | 54,452 | 3,655 | 4,435 |
| 경상연구개발비 | 2,116,857 | 3,675,473 |
1,446,155 | 2,453,213 |
| 소모품비 | 12,988 | 22,515 | 8,935 | 12,073 |
| 지급수수료 | 150,320 | 248,943 | 144,974 | 250,294 |
| 건물관리비 | 37,376 | 74,726 | 29,771 | 59,165 |
| 무형자산상각비 | 114,028 | 226,147 | 109,649 | 218,289 |
| 주식보상비용 | 139,368 | 212,252 | 83,194 | 168,545 |
| 기타 | 48,669 | 123,858 | 91,443 | 222,545 |
| 합 계 | 3,159,099 | 5,609,370 | 2,243,586 | 4,036,048 |
23. 법인세비용
법인세비용은 전체 회계연도에 대해서 예상되는 최선의 가중평균 연간법인세율의 추정에 기초하여 인식하였습니다. 2020년 12월 31일로 종료하는 회계연도는 이월결손금의 사용으로 납부할 법인세가 없을 것으로 추정하였으며(2020년도 6월 30일로 종료하는 기간에 대한 예상평균연간 법인세율 : 0%), 당반기말 현재 이연법인세 자산의 실현가능성이 높지 않은 것으로 판단되어 이연법인세 자산을 인식하지 않은 이유로 법인세 비용이 발생하지 않았습니다.
24. 주당손실
(1) 분기 주당손실의 계산 내역은 다음과 같습니다.
① 2분기 기본주당손실
| (단위: 주, 원) |
| 구 분 | 당 2분기 | 전 2분기 |
|---|---|---|
| 보통주분기순손실 | (2,780,285,820) | (2,032,216,449) |
| 가중평균유통보통주식수(*) | 23,471,694 | 19,532,523 |
| 기본주당손실 | (118) | (104) |
(*) 당분기 및 전분기 가중평균유통보통주식수는 전기 중 실시한 무상증자 비율에 따라 조정되었습니다.
② 가중평균유통보통주식수의 계산 내역
- 당 2분기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2020.04.01~2020.06.30 | 23,459,826 | 2,134,844,166 |
| 주식선택권의 행사 | 2020.04.02~2020.06.30 | 11,868 | 1,080,000 |
| 계 | 23,471,694 | 2,135,924,166 | |
- 전 2분기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2019.04.01~2019.06.30 | 17,972,330 | 1,635,482,030 |
| 유상증자 | 2019.05.01~2019.06.30 | 160,879 | 14,640,000 |
| 유상증자 | 2019.05.09~2019.06.30 | 1,399,314 | 127,337,588 |
| 계 | 19,532,523 | 1,777,459,618 | |
(2) 반기 주당손실의 계산 내역은 다음과 같습니다.
① 반기 기본주당손실
| (단위: 주, 원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 보통주반기순손실 | (4,844,644,612) | (2,710,742,306) |
| 가중평균유통보통주식수(*) | 23,465,760 | 18,756,737 |
| 기본주당손실 | (206) | (145) |
(*) 당반기 및 전반기 가중평균유통보통주식수는 전기 중 실시한 무상증자 비율에 따라 조정되었습니다.
② 가중평균유통보통주식수의 계산 내역
- 당반기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2020.01.01~2020.06.30 | 23,459,826 | 4,269,688,332 |
| 주식선택권의 행사 | 2020.04.02~2020.06.30 | 5,934 | 1,080,000 |
| 계 | 23,465,760 | 4,270,768,332 | |
- 전반기
| (단위: 주) |
| 구 분 | 기 간 | 가중평균 유통보통주식수 |
적 수 |
|---|---|---|---|
| 기초 | 2019.01.01~2019.06.30 | 17,972,330 | 3,252,991,730 |
| 유상증자 | 2019.05.01~2019.06.30 | 80,884 | 14,640,000 |
| 유상증자 | 2019.05.09~2019.06.30 | 703,523 | 127,337,588 |
| 계 | 18,756,737 | 3,394,969,318 | |
(3) 반희석 잠재적보통주
당반기 및 전기 중에는 반희석효과로 희석주당손익을 계산할 때 고려하지 않았지만 향후 희석 효과가 발생할 가능성이 있는 잠재적보통주의 내역은 다음과 같습니다.
| (단위: 주) |
| 구 분 | 당반기 | 전기 |
|---|---|---|
| 주식선택권 | 1,056,600 | 702,100 |
25. 특수관계자
(1) 당반기말과 전기말 현재 회사의 특수관계자 현황은 다음과 같습니다.
| 구 분 | 당반기말(*1) | 전기말(*2) |
|---|---|---|
| 종속기업 | TiumBio Australia PTY LTD | - |
(*1) 연결대상 종속기업인 TiumBio Australia PTY LTD는 2020년 1월 당사가 100% 출자하여 설립하였습니다.
(*2) 당사는 당사의 주식이 2019년 11월 22일 한국거래소가 개설한 코스닥시장에 상장됨에 따라 전기초 현재 유의적인 영향력을 행사하는 자로 분류한 한국투자글로벌제약산업육성사모투자전문회사 외 10개사와의 특수관계가 해소되었습니다.
(2) 당반기 및 전반기 중 특수관계자와의 자금거래내역은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 회사명 | 당반기 | 전반기 |
|---|---|---|---|
| 자본금 출자 | TiumBio Australia PTY LTD | 8,019 | - |
| 유상증자 | 프리미어 글로벌 이노베이션 1호 투자조합 | - | 3,000,000 |
| 키움증권 주식회사 | - | 1,000,000 | |
| 합 계 | 8,019 | 4,000,000 | |
(3) 당반기말과 전기말 현재 특수관계자와의 채권 및 채무는 없습니다.
(4) 주요 경영진에 대한 보상
당사는 기업 활동의 계획ㆍ운영ㆍ통제에 대하여 중요한 권한과 책임을 가진 대표이사, 등기임원, 비등기임원을 주요 경영진으로 판단하였으며, 당반기 및 전반기 중 주요 경영진에 대한 보상을 위해 지급한 금액은 다음과 같습니다.
| (단위: 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 단기종업원 급여 | 675,384 | 355,577 |
| 퇴직급여 | 77,695 | 43,429 |
| 주식보상비용 | 187,212 | 225,649 |
| 합 계 | 940,291 | 624,655 |
26. 영업으로부터 창출된 현금
(1) 당반기와 전반기 중 영업으로부터 창출된 현금의 내역은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 반기순손실 | (4,844,645) | (2,710,742) |
| 조정: | ||
| 퇴직급여 | 121,033 | 70,208 |
| 주식보상비용 | 420,375 | 428,396 |
| 이자비용 | 4,350 | 12,067 |
| 감가상각비 | 225,197 | 187,179 |
| 무형자산상각비 | 226,147 | 218,289 |
| 유형자산폐기손실 | 58 | - |
| 이자수익 | (726,346) | (336,287) |
| 외화환산이익 | (1,507) | (212) |
| 외화환산손실 | 4,215 | 1,634 |
| 당기손익-공정가치측정금융자산평가이익 | (47,000) | - |
| 소 계 | 226,522 | 581,274 |
| 영업활동으로 인한 자산ㆍ부채의 변동 | ||
| 매출채권의 감소(증가) | - | 1,118,100 |
| 기타채권의 감소(증가) | 1,015 | (5,694) |
| 기타유동자산의 감소(증가) | (15,877) | 18,058 |
| 기타비유동자산의 감소(증가) | (34,672) | - |
| 기타채무의 증가(감소) | 410,805 | (241,200) |
| 기타유동부채의 증가(감소) | (281,534) | 622,291 |
| 소 계 | 79,737 | 1,511,555 |
| 합 계 | (4,538,386) | (617,913) |
(2) 당반기와 전반기 중 현금의 유출ㆍ입이 없는 거래 중 중요한 사항은 다음과 같습니다.
| (단위 : 천원) |
| 구 분 | 당반기 | 전반기 |
|---|---|---|
| 보증금의 비유동성대체 | 559,203 | - |
(3) 당반기와 전반기 중 재무활동에서 생기는 부채의 조정내용은 다음과 같습니다.
1) 당반기
| (단위 : 천원) |
| 구 분 | 당기초 | 현금거래 | 비현금거래 | 당반기말 | ||
|---|---|---|---|---|---|---|
| 차입 및 발행 | 상환 | 계정대체 | 기타변동 | |||
| 유동리스부채 | 117,217 | - | (113,208) | 247,604 | (7,620) | 243,993 |
| 비유동리스부채 | - | - | - | (247,604) | 858,638 | 611,034 |
2) 전반기
| (단위 : 천원) |
| 구 분 | 전기초 | 현금거래 | 비현금거래 | 전반기말 | ||
|---|---|---|---|---|---|---|
| 차입 및 발행 | 상환 | 계정대체 | 기타변동 | |||
| 유동리스부채 | 212,195 | - | (104,995) | 110,626 | - | 217,826 |
| 비유동리스부채 | 117,217 | - | - | (110,626) | - | 6,591 |
27. 기술이전계약
(1) 당사는 2019년 2월 25일자로 대한민국에 소재한 대원제약(주)와 자궁내막증 치료 신약후보물질 TU2670에 대한 기술이전 계약을 체결하였습니다. 당사는 반환조건 없는 계약금(Upfront payment) 1,000,000천원을 일시에 수령하였으며, 기업회계기준서 제1115호 '고객과의 계약에서 생기는 수익'의 적용지침에 의거하여 해당 기술이전은 다른 재화 혹은 용역과 구별되며 라이선스를 부여하는 시점에 존재하는 지적재산을 사용할 권리로 판단하여 계약금을 2019년에 수익인식 하였습니다. 또한, 회사는 규제당국의 허가 및 상업화에 성공할 경우 최대 3,000,000천원 규모의 마일스톤 금액(Milestone payment) 및 로열티(Royalty)를 수령할 수 있습니다.
(2) 당사는 2018년 12월 21일자로 이탈리아에 소재한 CHIESI FARMACEUTICI S.p.A사와 폐섬유증 치료 신약 후보물질 NCE401 물질에 대한 기술이전 계약을 체결하였으며 반환조건 없는 계약금(Upfront payment) USD 1,000,000을 2018년에 수익으로 인식하였습니다. 또한, 당사는 향후 규제당국의 허가 및 상업화에 성공할 경우 최대 USD 73,000,000 규모의 마일스톤 금액(Milestone payment) 및 로열티(Royalty)를 수령할 수 있습니다.
(3) 기술이전계약과 관련된 불확실성 및 기타사항
당사의 향후 마일스톤 및 로열티 수익은 임상시험, 관계당국의 허가 등 개발의 성공여부에 따라 달라질 수 있으므로 발생가능성에 불확실성이 내포되어 있습니다.
6. 기타 재무에 관한 사항
가. 대손충당금 설정현황
(1) 최근 3사업연도의 계정과목별 대손충당금 설정내용
당사는 보고서 작성기준일 현재 해당사항 없습니다.
(2) 최근 3사업연도의 대손충당금 변동현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
(3) 매출채권 관련 대손충당금 설정방침
당사는 매출채권에 대해 전체 기간 기대신용손실을 손실충당금으로 인식하는 간편법을 적용하며, 기대신용손실을 측정하기 위해 매출채권은 신용위험 특성과 연체일을 기준으로 구분합니다.
당사는 다음의 징후가 있는 경우 손상의 객관적인 증거가 있는 것으로 간주합니다.
- 지급의무자의 유의적인 재무적 어려움
- 차입자의 파산이나 기타 재무구조조정의 가능성이 높은 상태가 됨
- 이자지급이나 원금상환의 불이행이나 지연
(4) 당해 사업연도말 현재 경과기간별 매출채권 잔액 현황
보고서 작성기준일 현재 당사의 매출채권은 존재하지 아니하며, 공시대상기간 중 손상과 관련하여 대손상각비 등으로 당기손익에 인식된 금액은 없습니다.
나. 재고자산 현황 등
당사는 보고서 작성기준일 현재 해당사항 없습니다.
다. 수주계약 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
라. 공정가치평가 내역
(1) 금융상품 종류별 공정가치
공시대상기간 중 연결기준 금융상품의 종류별 장부금액 및 공정가치는 다음과 같습니다.
| (단위 : 천원) |
| 과 목 | 당반기말(2020년 반기) | 전기말(2019) | 전전기말(2018) | |||
|---|---|---|---|---|---|---|
| 장부금액 | 공정가치 | 장부금액 | 공정가치 | |||
| 공정가치로 측정되는 금융자산: | ||||||
| 당기손익-공정가치 측정 금융자산 | 23,047,000 | 23,047,000 | - | - | - | - |
| 소 계 | 23,047,000 | 23,047,000 | - | - | - | - |
| 공정가치로 측정되지 않는 금융자산: | ||||||
| 현금및현금성자산 | 6,928,920 | 6,928,920 | 2,882,959 | 2,882,959 | 1,860,379 | 1,860,379 |
| 단기금융자산 | 55,000,000 | 55,000,000 | 86,000,000 | 86,000,000 | 22,500,000 | 22,500,000 |
| 매출채권및기타채권 | 370,038 | 370,038 | 1,207,321 | 1,207,321 | 1,365,303 | 1,365,303 |
| 기타비유동채권 | 589,913 | 589,913 | 16,290 | 16,290 | 536,148 | 536,148 |
| 소 계 | 62,888,871 | 62,888,871 | 90,106,570 | 90,106,570 | 26,261,830 | 26,261,830 |
| 합 계 | 85,935,871 | 85,935,871 | 90,106,570 | 90,106,570 | 26,261,830 | 26,261,830 |
| 공정가치로 측정되지 않는 금융부채: | ||||||
| 매입채무및기타채무 | 1,308,431 | 1,308,431 | 317,745 | 317,745 | 526,200 | 526,200 |
| 유동리스부채 | 243,992 | 243,992 | 117,217 | 117,217 | - | - |
| 비유동리스부채 | 611,034 | 611,034 | - | - | - | - |
| 소 계 | 2,163,457 | 2,163,457 | 434,962 | 434,962 | 526,200 | 526,200 |
| 합 계 | 2,163,457 | 2,163,457 | 434,962 | 434,962 | 526,200 | 526,200 |
(2) 공정가치 서열 체계
공정가치로 측정되는 금융상품은 공정가치 서열체계에 따라 구분되며 정의된 수준들은 다음과 같습니다.
| - |
측정일에 동일한 자산이나 부채에 대해 접근할 수 있는 활성시장의 (조정하지 않은) 공시가격 (수준 1) |
| - |
수준 1의 공시가격 외에 자산이나 부채에 대해 직접적으로나 간접적으로 관측할수 있는 투입변수 (수준 2) |
| - |
자산이나 부채에 대한 관측할 수 없는 투입변수 (수준 3) |
(3) 당반기말과 전기말 현재 공정가치로 측정되는 금융상품의 각 종류별로 공정가치 수준별 측정치는 다음과 같습니다.
① 당반기말
| (단위: 천원) |
| 구 분 | 수준 1 | 수준 2 | 수준 3 | 합 계 |
|---|---|---|---|---|
| 금융자산: | ||||
| 당기손익-공정가치측정금융자산 | 23,047,000 | 23,047,000 | ||
② 전기말
전기말 현재 공정가치로 측정되는 금융상품은 없습니다.
마. 채무증권 발행실적 등
당사는 보고서 작성기준일 현재 해당사항 없습니다.
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원, %) |
| 발행회사 | 증권종류 | 발행방법 | 발행일자 | 권면(전자등록)총액 | 이자율 | 평가등급 (평가기관) |
만기일 | 상환 여부 |
주관회사 |
|---|---|---|---|---|---|---|---|---|---|
| - | - | - | - | - | - | - | - | - | - |
| - | - | - | - | - | - | - | - | - | - |
| 합 계 | - | - | - | - | - | - | - | - | - |
바. 기업어음증권 미상환 잔액
당사는 보고서 작성기준일 현재 해당사항 없습니다.
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
1년초과 2년이하 |
2년초과 3년이하 |
3년 초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | |
사. 단기사채 미상환 잔액
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 10일 이하 | 10일초과 30일이하 |
30일초과 90일이하 |
90일초과 180일이하 |
180일초과 1년이하 |
합 계 | 발행 한도 | 잔여 한도 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
아. 회사채 미상환 잔액
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
자. 신종자본증권 미상환 잔액
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 5년이하 |
5년초과 10년이하 |
10년초과 15년이하 |
15년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | |
차. 조건부자본증권 미상환 잔액
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원) |
| 잔여만기 | 1년 이하 | 1년초과 2년이하 |
2년초과 3년이하 |
3년초과 4년이하 |
4년초과 5년이하 |
5년초과 10년이하 |
10년초과 20년이하 |
20년초과 30년이하 |
30년초과 | 합 계 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 미상환 잔액 | 공모 | - | - | - | - | - | - | - | - | - | - |
| 사모 | - | - | - | - | - | - | - | - | - | - | |
| 합계 | - | - | - | - | - | - | - | - | - | - | |
IV. 이사의 경영진단 및 분석의견
기업공시서식 작성기준에 따라 분ㆍ반기 보고서의 경우에는 이 항목을 기재하지 않습니다.
V. 감사인의 감사의견 등
1. 회계감사인의 명칭 및 감사의견(검토의견 포함한다. 이하 이 조에서 같다)을 다음의 표에 따라 기재한다.
| 사업연도 | 감사인 | 감사의견 | 강조사항 등 | 핵심감사사항 |
|---|---|---|---|---|
| 제5기 당반기 | 삼정회계법인 | 해당사항 없음 | 해당사항 없음 | 수익인식 회계처리의 적정성 |
| 제4기(전기) | 삼일회계법인 | 적정 | 해당사항 없음 | - |
| 제3기(전전기) | 삼일회계법인 | 적정 | 해당사항 없음 | - |
2. 감사용역 체결현황은 다음의 표에 따라 기재한다.
| (단위: 천원, 시간) |
| 사업연도 | 감사인 | 내 용 | 감사계약내역 | 실제수행내역 | ||
|---|---|---|---|---|---|---|
| 보수 | 시간 | 보수 | 시간 | |||
| 제5기 당반기 | 삼정회계법인 | 별도 및 연결 반기 재무제표 검토 | 80,000 | 842 | 40,000 | 292 |
| 제4기(전기) | 삼일회계법인 | 반기재무제표 검토 개별재무제표 감사 |
90,000 | - | 90,000 | 120 441 |
| 제3기(전전기) | 삼일회계법인 | 개별재무제표 감사 | 85,000 | - | 85,000 | 506 |
3. 회계감사인과의 비감사용역 계약체결 현황은 다음의 표에 따라 기재한다.
| 사업연도 | 계약체결일 | 용역내용 | 용역수행기간 | 용역보수 | 비고 |
|---|---|---|---|---|---|
| 제5기 당반기 | - | - | - | - | - |
| 제4기(전기) | 2019.09.18 | 증권신고서에 대한 감사인확인서 | 2주 | 20,000 | - |
| 제3기(전전기) | - | - | - | - | - |
4. 재무제표 중 이해관계자의 판단에 상당한 영향을 미칠 수 있는 사항에 대해 내부감사기구가 회계감사인과 논의한 결과를 다음의 표에 따라 기재한다.
| 구분 | 일자 | 참석자 | 방식 | 주요 논의 내용 |
|---|---|---|---|---|
| 1 | 2020.08.10 | 감사 및 이사회 감사인: 업무담당이사 외 2인 재무기획팀장 |
서면회의 | 연간 감사계획 핵심감사사항 선정 |
5. 종속회사 감사의견
당사의 종속회사는 당기 중 설립되어 공시대상기간 중 회계감사를 받은 사실이 없습니다.
6. 회계감사인의 변경
당사는 신규 코스닥상장법인으로 2018년 및 2019년 회계연도에 대해서는 증권선물위원회에서 지정한 삼일회계법인으로부터 감사를 받았습니다. 이후 주식회사 등의 외부감사에 관한 법률 제11조 6항에 따라 감사인을 변경하게 되었으며, 이에 따라 감사인선임위원회를 거쳐 삼정회계법인을 외부감사인으로 선임하였습니다. 삼정회계법인은 2020년을 포함하여 연속하는 3개 회계연도에 대해서 회계감사업무를 수행할 예정입니다.
VI. 이사회 등 회사의 기관에 관한 사항
1. 이사회에 관한 사항
가. 이사회 구성 개요
(1) 이사의 구성현황
당사의 이사회는 2020년 6월 30일 현재 사내이사 3인, 사외이사 2인, 기타비상무이사 1인으로 총 6인의 이사로 구성되어 있습니다. 김훈택 대표이사가 이사회 의장을 맡고 있으며 겸직을 하고 있지 않습니다. 이사회 내에는 보상위원회가 설치되어 운영 중입니다.
(2) 이사회의 권한 내용
당사 이사회규정에 의하면 당사의 이사회는 법령 또는 정관에 정해진 사항, 주주총회로부터 위임받은 사항, 회사 경영의 기본 방침 및 업무 집행에 관한 중요 사항을 의결하고 있습니다.
(3) 이사회 운영 규정의 주요 내용
|
구분 |
세부내용 |
|---|---|
|
제4조 (구성) |
① 이사회는 이사 전원으로 구성한다. ② 이사회의 구성원은 3인 이상 7인 이내로 한다.. ③ 이사회에는 총 이사수의 4분의 1 이상의 사외이사를 둔다. |
|
제5조 (의장) |
① 이사회의 의장은 대표이사로 하되, 제8조 4항 또는 5항에 의하여 이사회에서 따로 정한 이사가 이사회를 소집한 경우에는 해당 이사회의 소집권자로 한다. ② 대표이사가 유고 등으로 그 직무를 수행할 수 없을 때에는 최초 이사 선임일을 기준으로 가장 먼저 선임된 사내이사가 의장의 직무를 대행한다. 단, 선임된 일자가 같은 경우에는 연장자 순으로 한다. |
|
제8조 (이사회의 소집) |
① 이사회는 정기이사회와 임시이사회로 한다. ② 정기이사회는 분기 1회 개최를 원칙으로 한다. ③ 임시이사회는 필요에 따라 수시로 개최한다. ④ 이사회를 소집함에는 대표이사 또는 이사회에서 따로 정한 이사가 있을 때에는 그 이사가 회의 일시를 정하여 회일 3일 전에 각 이사 및 감사에게 문서, 전자문서 또는 구두로써 통지하여 소집한다. 다만, 이사 및 감사 전원의 동의가 있을 때에는 소집절차를 생략할 수 있다. |
|
제9조 (결의방법) |
① 이사회의 결의는 법령이나 정관에 다른 정함이 있는 경우를 제외하고는 이사 과반수의 출석과 출석이사의 과반수로 한다. ② 이사회는 이사의 전부 또는 일부가 직접 회의에 출석하지 아니하고 모든 이사가 음성을 동시에 송/수신하는 통신수단에 의하여 결의에 참가하는 것을 허용할 수 있으며, 이 경우 당해 이사는 이사회에 직접 출석한 것으로 본다. ③ 이사회의 결의에 관하여 특별한 이해관계가 있는 이사는 의결권을 행사하지 못한다. ④ 제3항의 규정에 의하여 의결권을 행사할 수 없는 이사의 수는 출석한 이사의 수에 산입하지 아니한다. |
|
제12조 (이사회 내 위원회) |
① 이사회는 신속하고 효율적인 의사결정을 위하여 정관이 정한 바에 따라 이사회 내에 각종의 위원회를 설치할 수 있다. ② 이사회는 다음 각호의 사항을 제외하고는 그 권한을 위원회에 위임할 수 있다. 1. 주주총회의 승인을 요하는 사항의 제안 2. 대표이사의 선임 및 해임 3. 위원회의 설치와 그 위원의 선임 및 해임 4. 정관에서 정하는 사항 ③ 위원회는 2인 이상의 이사로 구성한다. ④ 위원회는 그 결의로 위원회를 대표할 자를 선정하여야 한다. ⑤ 위원회의 세부운영에 관한 사항은 이사회에서 따로 정한다. |
|
제14조 (의사록) |
① 이사회의 의사에 관하여는 의사록을 작성한다. ② 의사록에는 의사의 안건, 경과요령, 그 결과, 반대하는 자와 그 반대이유를 기재하고 출석한 이사 및 감사가 기명날인 또는 서명한다. ③ 주주는 영업시간 내에 이사회 의사록의 열람 또는 등사를 청구할 수 있다. ④ 회사는 제3항의 청구에 대하여 이유를 붙여 이를 거절할 수 있다. 이 경우 주주는 법원의 허가를 얻어 이사회 의사록을 열람 또는 등사할 수 있다. |
나. 사외이사 현황
(1) 사외이사 및 그 변동현황
| (단위 : 명) |
| 이사의 수 | 사외이사 수 | 사외이사 변동현황 | ||
|---|---|---|---|---|
| 선임 | 해임 | 중도퇴임 | ||
| 6 | 2 | - | - | - |
(2) 사외이사 현황
|
성명 |
주요경력 |
최대주주등과의 이해관계 |
결격요건 여부 |
|
|---|---|---|---|---|
|
김재상 |
2018.11~현재 |
㈜티움바이오 사외이사 |
타인 |
해당사항 없음 |
|
2002.09~현재 |
이화여자대학교 생명과학부 교수 |
|||
|
1996.07~2002.08 |
California Institute of Technology Post doc |
|||
|
1989.09~1996.06 |
MIT Biology(석/박) |
|||
|
1983.09~1987.06 |
Harvard University Chemistry(학) |
|||
|
강동필 |
2018.11~현재 |
㈜티움바이오 사외이사 |
||
|
2000.03~현재 |
법무법인 세인 대표변호사 |
|||
|
1998.03~1998.09 |
서울중앙지방법원 판사 |
|||
|
1993.03~1998.03 |
수원지방법원 판사 |
|||
|
1990.03~1993.03 |
춘천지방법원 판사 |
|||
|
1984.03~1988.02 |
연세대학교 법학(학) |
|||
다. 주요 의결사항
|
개최일자 |
의 안 내 용 |
가결여부 | 사외이사 등의 성명 | ||
|---|---|---|---|---|---|
| 김재상 사외이사 (출석률: 100%) |
강동필 사외이사 (출석률: 60%) |
황만순 기타비상무이사 (출석률: 40%) |
|||
| 찬반여부 | |||||
| 2020-01-10 | 1. TU7710(NBP604) 임상시료 생산의 건 2. 호주현지법인 설립의 건 |
가결 |
찬성 |
찬성 |
- |
| 2020-01-31 | 1. 재무제표승인의 건 | 가결 | 찬성 |
- |
- |
| 2020-02-12 | 1. 2019년도 영업보고서 승인의 건 2. 2019년도 내부회계관리제도 운영실태 보고의 건 |
가결 |
찬성 |
- |
찬성 |
| 2020-03-09 | 1. 정기주주총회 소집 승인의 건 2. 정기주주총회 상정 의안 승인의 건 3. 감사의 내부회계관리제도 운영실태 평가 보고 |
가결 |
찬성 |
찬성 |
찬성 |
| 2020-03-30 | 1. 대표이사 재선임(중임)의 건 2. 주식매수선택권 행사에 따른 신주 발행의 건 |
가결 |
찬성 |
찬성 |
- |
| 2020-06-15 | 1. 미국 현지 법인 설립 및 자본금 출자의 건 2. 사규 일부 개정의 건 |
가결 |
찬성 | - | 찬성 |
라. 이사회 내의 위원회 구성
당사는 투명하고 합리적인 보상정책을 설계하고 운영하여 경영진 보상과 관련된 주주와 경영진간의 대리인 문제를 해소하기 위한 방안으로 이사회 내의 위원회로 보상위원회를 설치하여 운영하고 있습니다.
(1) 보상위원회의 구성
| 위원회명 | 구성 | 소속 이사명 | 권한 및 기능 | 비 고 |
|---|---|---|---|---|
| 보상위원회 | 기타비상무이사 1인 사외이사 1인 사내이사 1인 |
황만순(위원장) 강동필 고현실 |
권한사항 (보상위원회 규정 제 3조) - 성과급 재원 및 지급방식 검토 - 기타 이사회에서 위임한 사항 |
- |
(2)보상위원회의 주요 의결사항
|
개최일자 |
의 안 내 용 |
가결여부 | 이사 등의 성명 | ||
|---|---|---|---|---|---|
| 황만순(위원장) 기타비상무이사 (출석률: 100%) |
강동필 사외이사 (출석률: 100%) |
고현실 사내이사 (출석률: 100%) |
|||
| 찬반여부 | |||||
| 2020-02-25 | 1. 등기이사 보수 한도 결정의 건 2. 등기이사 및 미등기임원 보상체계 심의의 건 3. 임직원 주식매수선택권 부여 심의의 건 |
가결 |
찬성 |
찬성 |
찬성 |
마. 이사의 독립성
(1) 이사회 선임에 관한 사항
당사는 보고서 작성기준일 현재 사외이사후보추천위원회를 구성하고 있지 않습니다. 이사는 주주총회에서 선임하며, 주주총회에서 선임할 이사 후보자는 이사회에서 선정하여 주주총회에 제출할 의안으로 확정하고 있습니다. 이 때, 이사 후보자의 성명, 약력 등 후보자에 관한 사항을 주주에게 서면 통지 등의 방법으로 공고하고 있습니다. 한편, 이사의 선임과 관련하여 관련 법규에 의거한 주주제안이 있는 경우, 이사회는 적법한 범위 내에서 이를 주주총회에 의안으로 제출하고 있습니다.
(2) 이사의 현황
| 직책 | 성명 | 임기 | 연임여부 및 연임횟수 |
추천인 | 활동분야 | 선임배경 | 최대주주와의 관계 |
회사와의 거래 |
|---|---|---|---|---|---|---|---|---|
| 사내이사 (대표이사) |
김훈택 | 3년 | 연임1회 최초선임 (2016.12.27) |
이사회 | 연구 및 경영 총괄 / 이사회의장 |
당사 연구 및 경영 총괄 및 대외 업무 |
본인 | - |
| 사내이사 | 고현실 | 3년 | 최초선임 (2017.10.30) |
이사회 | 경영기획 총괄 | 당사 재무ㆍ기획 등 경영 전반 업무 및 대외 업무 |
등기임원 | - |
| 사내이사 | 송인영 | 3년 | 최초선임 (2018.11.16) |
이사회 | 바이오신약 개발 | 바이오신약 개발 총괄 | 등기임원 | - |
| 사외이사 | 김재상 | 3년 | 최초선임 (2018.11.16) |
이사회 | 사외이사 | 당사 경영의 투명성 제고 | 등기임원 | - |
| 사외이사 | 강동필 | 3년 | 최초선임 (2018.11.16) |
이사회 | 사외이사 | 당사 경영의 투명성 제고 | 등기임원 | - |
| 기타비상무이사 | 황만순 | 3년 | 최초선임 (2018.11.16) |
이사회 | 기타비상무이사 | 당사 경영 전반에 대한 업무 | 등기임원 | - |
바. 사외이사의 전문성
당사는 사외이사가 이사회에서 전문적인 직무수행이 가능하도록 보조하고 있습니다. 또한, 이사회 전에 해당 안건 내용을 충분히 검토할 수 있도록 사전에 자료를 제공하고 기타 사내 주요 현안에 대해서도 수시로 정보를 제공하고 있습니다.
(1) 사외이사 지원조직 현황
| 부서(팀)명 | 직원수 | 직위(근무연수) | 주요활동내역 |
|---|---|---|---|
| 재무기획팀 | 2명 | 팀장 1명(1년 9개월) 매니저 1명(4개월) |
재무제표, 주주총회, 이사회 등 경영 전반에 관한 사외이사 업무 지원 |
| 인사총무팀 | 1명 | 매니저 1명(2년 9개월) |
(2) 사외이사 교육 미실시 내역
| 사외이사 교육 실시여부 | 사외이사 교육 미실시 사유 |
|---|---|
| 미실시 | 현재 사외이사에 대한 교육계획을 수립중이며, 추후 교육을 실시하도록 하겠습니다. |
2. 감사제도에 관한 사항
가. 감사위원회(감사) 설치여부 및 구성방법 등
당사는 보고서 작성기준일 현재 감사위원회를 별도로 설치하고 있지 않으며, 주주총회 결의에 의하여 선임된 비상근 감사 1명이 감사업무를 수행하고 있습니다.
나. 감사의 독립성
감사는 이사회에 참석하여 독립적으로 이사의 업무를 감독할 수 있으며, 제반 업무와관련하여 관련 장부 및 관계 서류의 제출을 해당 부서에 요구할 수 있습니다. 또한, 필요시 당사로부터 영업에 관한 사항을 보고 받을 수 있으며, 적절한 방법으로 경영정보에 접근할 수 있습니다.
다. 감사의 인적사항
|
성 명 |
주요 경력 |
담당 업무 |
결격요건 여부 |
비 고 |
|---|---|---|---|---|
|
이종윤 (1968) |
2011 ~ 현재 가율회계법인 2008 ~ 2010 프로비티코리아 1995 ~ 2008 삼일회계법인 1987 ~ 1995 연세대학교(학) |
Audit / Advisory 내부감사 컨설팅 Audit / Advisory - |
해당사항 없음 |
- |
라. 감사의 주요 활동 내역
|
개최일자 |
의 안 내 용 |
가결 여부 |
|---|---|---|
| 2020-01-31 | 1. 재무제표승인의 건 |
가결 |
| 2020-02-12 | 1. 2019년도 영업보고서 승인의 건 2. 2019년도 내부회계관리제도 운영실태 보고의 건 |
가결 |
| 2020-03-09 | 1. 정기주주총회 소집 승인의 건 2. 정기주주총회 상정 의안 승인의 건 3. 감사의 내부회계관리제도 운영실태 평가 보고 |
가결 |
| 2020-03-30 | 제4기 정기주주총회 의사록 1.제 4기 재무제표 승인의 건 2. 정관 일부 변경의 건 3. 사내이사 김훈택 선임(중임)의 건 4. 이사 보수 한도 승인의 건 5. 감사 보수 한도 승인의 건 6. 주식매수선택권 부여의 건 7. 임원퇴직금 지급규정 개정의 건 |
가결 |
마. 감사 교육 미실시 내역
| 감사 교육 실시여부 | 감사 교육 미실시 사유 |
|---|---|
| 미실시 | 현재 감사에 대한 교육계획을 수립중이며, 추후 교육을 실시하도록 하겠습니다. |
바. 감사 지원조직 현황
| 부서(팀)명 | 직원수(명) | 직위(근속연수) | 주요 활동내역 |
|---|---|---|---|
| 재무기획팀 | 2 | 팀장 1명(1년 9개월) 매니저 1명(4개월) |
재무제표, 내부회계관리제도, 이사회,주주총회 등 경영 전반에 관한 감사 업무 지원 |
| 인사총무팀 | 1 | 2년 9개월 | 이사회,주주총회 등 경영 전반에 관한 감사 업무 지원 |
사. 준법지원인 등
당사는 보고서 작성기준일 현재 준법지원인 지원조직을 별도로 두고 있지 않습니다.
3. 주주의 의결권 행사에 관한 사항
가. 집중투표제의 배제여부
당사는 보고서 작성기준일 현재 집중투표제를 채택하고 있지 않습니다.
나. 서면투표제 또는 전자투표제의 채택여부
당사는 보고서 작성기준일 현재 정관 제28조에 의거, 서면투표제를 채택하고 있습니다.
|
제28조 (의결권의 행사) ① 주주는 총회에 출석하지 아니하고 서면에 의하여 의결권을 행사할 수 있다. ② 서면에 의하여 의결권을 행사하고자 하는 주주는 의결권행사에 관한 서면에 필요한 사항을 기재하여, 회 일의 전일까지 회사에 제출하여야 한다 ③ 주주는 대리인으로 하여금 그 의결권을 행사하게 할 수 있으며, 이 경우 대리인은 주주총회 개시 전에 그 대리권을 증명하는 서면(위임장)을 제출하여야 한다. |
다. 소수주주권의 행사여부
당사는 보고서 작성기준일 현재까지 소수주주권의 행사 사실이 존재하지 않습니다.
라. 경영권 경쟁 여부
당사는 보고서 작성기준일 현재까지 경영권과 관련하여 경쟁이 발생한 사실이 없습니다.
VII. 주주에 관한 사항
가. 최대주주 및 특수관계인의 주식소유 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 주, %) |
| 성 명 | 관 계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
|---|---|---|---|---|---|---|---|
| 기 초 | 기 말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
|
김훈택 |
본인 |
보통주 |
8,000,000 | 34.10 | 8,025,000 | 34.19 | 추가 매입 |
|
고현실 |
등기임원 |
보통주 |
50,000 | 0.21 | 56,000 | 0.24 | 추가 매입 |
|
송인영 |
등기임원 |
보통주 |
110,000 | 0.47 | 110,000 | 0.47 | - |
|
김선미 |
비등기임원 |
보통주 |
110,000 | 0.47 | 110,000 | 0.47 | - |
| 서정민 | 비등기임원 |
보통주 |
110,000 | 0.47 | 110,000 | 0.47 | - |
|
장진욱 |
비등기임원 | 보통주 | 42,000 | 0.18 | 0 | 0 | 사임 |
| 정진우 | 비등기임원 | 보통주 | 0 | 0.00 | 5,000 | 0.02 | 신규 보고 및 추가 매입 |
|
한제희 |
처남 |
보통주 |
100,000 | 0.43 | 100,000 | 0.43 | - |
| 계 |
보통주 |
8,522,000 | 36.33 | 8,516,000 | 36.28 | - | |
|
우선주 |
- |
- |
- |
- |
- | ||
나. 최대주주 주요경력 및 개요
|
성 명 (생년월일) |
직책 |
주요경력 |
비고 |
|---|---|---|---|
|
김훈택 |
대표이사 |
-(주)티움바이오 대표이사 |
- |
다. 최대주주의 변동을 초래할 수 있는 특정 거래 유무
당사는 보고서 작성기준일 현재 해당사항 없습니다.
2. 최대주주 변동현황
당사의 설립 이후 현재까지 최대주주의 변동은 없습니다.
3. 주식의 분포
가. 주식 소유현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 주) |
| 구분 | 주주명 | 소유주식수 | 지분율 | 비고 |
|---|---|---|---|---|
| 5% 이상 주주 | 김훈택 |
8,025,000 |
34.19% |
- |
| 한국투자글로벌제약산업육성사모투자전문회사 |
3,626,650 |
15.45% |
- |
|
| 우리사주조합 | - | - | - | |
나. 소액주주 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 주) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
|---|---|---|---|---|---|---|---|
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 20,747 | 20,754 | 99.9 | 10,029,396 | 23,471,826 | 42.7 | 발행주식총수의 100분의 1에 미달하는 주식을 소유한 주주 |
4. 주식사무
| 구분 | 내용 | ||
|---|---|---|---|
|
정관상 신주인수권의 내용 |
제9조(신주인수권) ① 본 회사의 주주는 신주발행에 있어서 그가 소유한 주식수에 비례하여 신주의 배정을 받을 권리를 가진다. ② 제1항의 규정에 불구하고 다음 각호의 경우에는 주주외의 자에게 이사회 결의로 신주를 배정할 수 있다. 1. 발행주식총수의 100분의 30을 초과하지 않는 범위 내에서 이사회의 결의로 일반공모증자 방식으로 신주를 발행하는 경우 2. 발행하는 주식총수의 100분의 20범위 내에서 우리사주조합원에게 신주를 배정 또는 우선배정 하는 경우 3.「상법」 제542조의3에 따른 주식매수선택권의 행사로 인하여 신주를 발행하는 경우 4. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 주식예탁증서(DR) 발행에 따라 신주를 발행하는 경우 5. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 회사가 경영상 필요로 외국인투자촉진법에 의한 외국인투자를 위하여 신주를 발행하는 경우 6. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 긴급한 자금의 조달을 위하여 국내외 금융기관 또는 기관투자자에게 신주를 발행하는 경우 7. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 기술도입을 필요로 그 제휴회사에게 신주를 발행하는 경우 8. 주권을 신규상장하기 위하여 신주를 모집하거나 인수인에게 인수하게 하는 경우 9. 발행주식총수의 100분의 20을 초과하지 않는 범위 내에서 회사의 경영상 신규영업의 진출 및 사업목적의 확대 등을 위한 자금의 조달을 위하여 국내외의 법인 또는 개인 투자자에게 신주를 발행하는 경우 ③ 본 회사는 제2항에 따라 주주 외의 자에게 신주를 배정하는 경우 회사는 그 납입기일의 2주 전까지 관련 법령에서 정하는 사항을 주주에게 통지하거나 공고하여야 한다. 다만, 한국거래소에 상장 후에는 자본시장과 금융투자업에 관한 법률에 의거하여 처리한다. ④ 회사는 신주를 배정하는 경우 그 기일까지 신주인수의 청약을 하지 아니하거나 그 가액을 납입하지 아니한 주식이 발생하는 경우에 그 처리방법은 발행가액의 적정성등 관련 법령에서 정하는 바에 따라 이사회 결의로 정한다. ⑤ 회사는 신주를 배정하면서 발생하는 단주에 대한 처리방법은 이사회의 결의로 정한다. |
||
|
결산일 |
12월 31일 |
정기주주총회 |
매사업년도 종료후 3월이내에 |
|
주주명부 |
매년 1월 1일부터 1월 15일까지 |
||
|
주권의 종류 |
주식ㆍ사채 등의 전자등록에 관한 법률의 시행으로 해당사항 없음 | ||
|
명의개서대리인 (한국예탁결제원) |
제13조(명의개서대리인) ① 회사는 주식의 명의개서대리인을 둘 수 있다. ② 명의개서대리인 및 그 사무취급장소와 대행업무의 범위는 이사회의 결의로 정한다. ③ 회사의 주주명부 또는 그 복본을 명의개서대리인의 사무취급장소에 비치하고 주식의 전자등록, 주주명부의 관리, 기타 주식에 관한 사무는 명의개서대리인으로 하여금 취급케 한다. ④ 제3항의 사무취급에 관한 절차는 명의개서대리인의 유가증권의 명의개서 대행 등에 관한 규정에 따른다. |
||
|
공고방법 |
제4조(공고방법) 본 회사의 공고는 회사의 인터넷 홈페이지(www.tiumbio.com)에 게재한다. 다만 전산장애 또는 그 밖의 부득이한 사유로 회사의 인터넷 홈페이지에 공고를 할 수 없는 때에는 서울특별시내에서 발행하는 일간 매일경제신문에 게재한다. |
||
5. 주가 및 주식거래실적
당사의 공시서류작성기준일로부터 최근 6개월간의 주가 및 거래량은 다음과 같습니다.
| (단위: 원, 주) |
| 종 류 | 2020년 1월 | 2020년 2월 | 2020년 3월 | 2020년 4월 | 2020년 5월 | 2020년 6월 | ||
|---|---|---|---|---|---|---|---|---|
| 보통주 | 주가 | 최고 | 17,850 | 14,250 | 13,950 | 12,050 | 14,500 | 17,700 |
| 최저 | 12,800 | 11,950 | 6,030 | 9,980 | 11,500 | 13,050 |
||
| 평균 | 16,618 | 13,143 | 9,941 | 10,982 | 13,411 | 15,491 | ||
| 거래량 | 최고(일) | 4,770,494 | 1,452,846 | 2,035,231 | 2,367,273 | 2,556,791 | 10,944,877 | |
| 최저(일) | 424,934 | 240,204 | 283,299 | 295,912 | 240,697 | 253,288 | ||
| 월간 | 31,446,889 | 9,501,105 | 15,041,215 | 13,869,179 | 15,990,207 | 40,661,950 | ||
| (주1) | 상기 주가는 종가 기준입니다. |
VIII. 임원 및 직원 등에 관한 사항
1. 임원 및 직원 등의 현황
가. 임원 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 주) |
| 성명 | 성별 | 출생년월 | 직위 | 등기임원 여부 |
상근 여부 |
담당 업무 |
주요경력 | 소유주식수 | 최대주주와의 관계 |
재직기간 | 임기 만료일 |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 의결권 있는 주식 |
의결권 없는 주식 |
|||||||||||
| 김훈택 | 남 | 1966.06 |
대표이사 |
등기임원 | 상근 | CEO |
'17~현재 ㈜티움바이오 대표이사 '07~'16 SK케미칼㈜ 혁신R&D센터장 '00~'07 ㈜인투젠 연구소 '90~'00 SK케미칼㈜ '96~'99 Texas A&M University 분자병태생물학(박) '88~'90 서울대학교 대학원 수의예방(석) '84~'88 서울대학교 수의학(학) |
8,025,000 |
- |
본인 | 2016.12.27 ~현재 |
2023.03.31 |
| 고현실 | 여 | 1979.07 | 상무 | 등기임원 | 상근 | CFO |
'17~현재 ㈜티움바이오 상무(CFO) '02~'17 삼일회계법인 Deal Advisory 이사 |
56,000 |
- |
등기임원 | 2017.07.01 ~현재 |
2020.10.29 |
| 송인영 | 남 | 1973.11 | 상무 | 등기임원 | 상근 | CRO 바이오신약 |
'17~현재 ㈜티움바이오 상무 '07~'16 SK케미칼㈜ '00~'07 ㈜인투젠 연구소 '00~'00 SK케미칼㈜ '97~'99 포항공과대학교 대학원 생명과학(석) '92~'97 포항공과대학교 생명과학(학) |
110,000 |
- |
등기임원 | 2017.01.01 ~현재 |
2021.11.15 |
| 황만순 | 남 | 1970.09 | 기타비상무이사 | 등기임원 | 비상근 | 경영 자문 |
'18 ~현재 ㈜티움바이오 기타비상무이사 '09~현재 한국투자파트너스㈜ 상무 '07~'08 ㈜켐온 부사장 '06~'07 한국바이오기술투자㈜ 투자심사팀장 '94~'96 서울대학교 대학원 약학(석) '90~'94 서울대학교 제약학(학) |
- |
- |
등기임원 | 2017.05.08 ~현재 |
2021.11.15 |
| 김재상 | 남 | 1964.09 | 사외이사 | 등기임원 | 비상근 | 사외 이사 |
'18~현재 ㈜티움바이오 사외이사 '02~현재 이화여자대학교 생명과학부 교수 '96~'02 California Institute of Technology Post doc '89~'96 MIT Biology(석, 박) '83~'87 Harvard University Chemistry(학) |
- |
- |
등기임원 | 2018.11.16 ~현재 |
2021.11.15 |
| 강동필 | 남 | 1964.10 | 사외이사 | 등기임원 | 비상근 | 사외 이사 |
'18~현재 ㈜티움바이오 사외이사 '00~현재 법무법인 세인 대표변호사 '98~'98 서울중앙지방법원 판사 '93~'98 수원지방법원 판사 '90~'93 춘천지방법원 판사 '84~'88 연세대학교 법학(학) |
- |
- |
등기임원 | 2018.11.16 ~현재 |
2021.11.15 |
| 이종윤 | 남 | 1968.11 | 감사 | 등기임원 | 비상근 | 감사 |
'18~현재 ㈜티움바이오 감사 '11~현재 가율회계법인 Audit / Advisory '08~'10 프로비티코리아 내부감사컨설팅 '95~'08 삼일회계법인 Audit/Advisory '87~'95 연세대학교 경영학(학) |
- |
- |
등기임원 | 2018.11.16 ~현재 |
2021.11.15 |
| 김선미 | 여 | 1976.02 | 연구위원 (상무대우) |
미등기임원 | 상근 | 합성 신약 |
'17~현재 ㈜티움바이오 '06~'16 SK케미칼㈜ '99~'06 C&C 신약연구소 '13~'18 서울대학교 대학원 약학(박) '97~'99 서울대학교 대학원 약학(석) '93~'97 서울대학교 약학(학) |
110,000 |
- |
미등기임원 | 2017.01.01 ~현재 |
- |
| 서정민 | 여 | 1973.09 | 연구위원 (상무대우) |
미등기임원 | 상근 | Development | '17~현재 ㈜티움바이오 '10~'16 SK케미칼㈜ '07~'10 Wake Forest Univ 의대 Post Doc '05~'07 NYU 의대 Post Doc '04~'05 Texas A&M University Post Doc '98~'04 Texas A&M University 분자영양학(박) '95~'97 서울대학교 대학원 영양학(석) '91~'95 서울대학교 식품영양학(학) |
110,000 |
- |
미등기임원 | 2017.01.01 ~현재 |
- |
| 남규현 | 남 | 1973.11 | 이사 | 미등기임원 | 상근 | 사업 개발 |
'18~현재 ㈜티움바이오 이사 '16~'18 ㈜퓨처켐 B/D '15~'16 ㈜메디톡스 B/D '13~'15 삼성바이오에피스㈜ Marketing '11~'13 삼성그룹 전략기획 '08~'11 현대약품㈜ B/D '05~'08 오츠카제약 과제관리 '03~'05 ㈜태평양제약 B/D '00~'04 포항공과대학교 대학원 분자생명과학(박) '98~'00 포항공과대학교 대학원 생명과학(석) '92~'98 포항공과대학교 생명과학(학) |
- | - | 미등기임원 | 2018.07.01 ~현재 |
- |
| 최재원 | 남 | 1973.12 | 연구위원 | 미등기임원 | 상근 | Discovery | '19~현재 ㈜티움바이오 '14~'19 Boston Children's Hospital/Harvard Medical School '02~'05 ㈜인투젠 연구소 '07~'13 Mayo Clinic 면역학(박) '99~'01 고려대학교 대학원 생명공학(석) '92~'99 고려대학교 생물학(학) |
- | - | 미등기임원 | 2019.10.21 ~현재 |
- |
| 김창환 | 남 | 1973.04 | 연구위원 | 미등기임원 | 상근 | 바이오신약 | '19~현재 ㈜티움바이오 '15~'19 ㈜제넥신 '12~'15 삼성바이오에피스 '01~'11 ㈜한미약품 '99~'01 건국대학교 생물공학(석) '92~'99 건국대학교 미생물공학과(학) |
- | - | 미등기임원 | 2019.11.01 ~현재 |
- |
| 강인실 | 여 | 1979.01 | 이사 | 미등기임원 | 상근 | 인사 총무 |
'19~현재 ㈜티움바이오 '14~'20 토요타파이낸셜서비스코리아 인사담당 부장 '07~'08 토요타파이낸셜서비스코리아 인사담당 '03~'04 제이피모건체이스뱅크 인사담당 '01~'03 크레딧스위스퍼스트보스톤 재무담당 '97~'02 연세대학교 경영학(학) |
- |
- |
미등기임원 | 2020.02.05 ~현재 |
- |
| 정진우 | 남 | 1982.02 | 이사 | 미등기임원 | 상근 | 재무 기획 |
'18~현재 ㈜티움바이오 '09~'18 삼일회계법인 Deal Advisory Senior Manager |
5,000 |
- |
미등기임원 | 2018.10.15 ~현재 |
- |
나. 임원 겸직현황
| (기준일 : | 2020.06.30 | ) |
| 겸직 임원 | 겸직 회사 | ||||
|---|---|---|---|---|---|
| 성명 | 직위 | 회사명 | 직위 | 선임연월 | 담당업무 |
| 황만순 | 기타비상무이사 |
한국투자파트너스 |
상무 |
2018.01 |
투자심사 |
| 김재상 | 사외이사 |
이화여자대학교 |
교수 |
2002.09 |
교수 |
| 강동필 | 사외이사 |
세인 법무법인 |
대표변호사 |
2000.03 |
대표변호사 |
| 이종윤 | 감사 |
가율회계법인 |
회계사 |
2011.01 |
Audit Advisory |
다. 직원 등 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원) |
| 직원 | 소속 외 근로자 |
비고 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 사업부문 | 성별 | 직 원 수 | 평 균 근속연수 |
연간급여 총 액 |
1인평균 급여액 |
남 | 여 | 계 | |||||
| 기간의 정함이 없는 근로자 |
기간제 근로자 |
합 계 | |||||||||||
| 전체 | (단시간 근로자) |
전체 | (단시간 근로자) |
||||||||||
| 연구/관리 | 남 | 19 | - | - | - | 19 | 1년6개월 | 559 | 29 | - | - | - | - |
| 연구/관리 | 여 | 27 | - | - | - | 27 | 1년7개월 | 675 | 25 | - | |||
| 합 계 | 46 | - | - | - | 46 | 1년7개월 | 1,235 | 27 | - | ||||
| (주1) | 직원수는 상기 기준일 재직자를 기준으로 작성하였으며 등기임원은 제외하였습니다. |
| (주2) | 연간급여 총액은 2020년 1월 1일부터 상기 기준일까지의 누계 금액으로서, 고정급, 성과급 및 급여성 복리후생비 금액 등을 포함하였습니다. |
| (주3) | 1인 평균 급여액은 급여 총액을 인원수로 나누어 산출하였습니다. |
라. 미등기임원 보수 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원) |
| 구 분 | 인원수 | 연간급여 총액 | 1인평균 급여액 | 비고 |
|---|---|---|---|---|
| 미등기임원 | 7 | 354 | 51 | - |
| (주1) | 연간급여 총액은 2020년 1월 1일부터 상기 기준일까지의 누계 금액으로서, 고정급, 성과급 및 급여성 복리후생비 금액 등을 포함하였습니다. |
| (주2) | 1인 평균 급여액은 급여 총액을 인원수로 나누어 산출하였습니다. |
2. 임원의 보수 등
| <이사ㆍ감사 전체의 보수현황> |
(1) 주주총회 승인금액
| (단위 : 백만원) |
| 구 분 | 인원수 | 주주총회 승인금액 | 비고 |
|---|---|---|---|
| 등기이사 | 6 | 1,500 | - |
| 감사 | 1 | 100 | - |
(2) 보수지급금액
2-1. 이사ㆍ감사 전체
| (단위 : 백만원) |
| 인원수 | 보수총액 | 1인당 평균보수액 | 비고 |
|---|---|---|---|
| 7 | 324 | 46 | - |
2-2. 유형별
| (단위 : 백만원) |
| 구 분 | 인원수 | 보수총액 | 1인당 평균보수액 |
비고 |
|---|---|---|---|---|
| 등기이사 (사외이사, 감사위원회 위원 제외) |
4 | 291 | 73 | - |
| 사외이사 (감사위원회 위원 제외) |
2 | 24 | 12 | - |
| 감사위원회 위원 | - | - | - | - |
| 감사 | 1 | 9 | 9 | - |
(3) 이사ㆍ감사의 보수지급기준
당사는 기타비상무이사 1인, 사외이사 1인, 사내이사 1인으로 하는 보상위원회를 이사회내 위원회로 운영하고 있으며, 보상위원회에서 등기임원의 보상정책 수립 및 보상수준의 결정, 성과급 재원 및 지급방식을 검토하고 있습니다. 등기이사 및 감사의 유형별 보수체계, 지급근거 및 보수결정시 평가항목은 다음과 같습니다.
| 구 분 | 보수체계 | 지급근거 및 보수결정시 평가항목 |
|---|---|---|
| 등기이사(사외이사 제외) | 급여 | 보수규정, 보상위원회에서 직급, 리더십, 전문성, 회사기여도 등을 종합적으로 반영하여 책정 |
| 상여 | ||
| 퇴직소득 | 임원퇴직금 지급규정 | |
| 주식매수선택권 부여 | 정관, 주주총회에서 부여, 보상위원회에서 직급, 리더십, 전문성, 회사기여도 등을 종합적으로 반영하여 책정 | |
| 사외이사 | 급여 | 보상위원회에서 역할, 전문성, 회사기여도 등을 종합적으로 반영하여 책정 |
| 감사 | 급여 |
| <보수지급금액 5억원 이상인 이사ㆍ감사의 개인별 보수현황> |
당사의 이사ㆍ감사 중 개인별 보수 지급액이 5억원 이상에 해당하는 자는 없습니다.
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
| <보수지급금액 5억원 이상 중 상위 5명의 개인별 보수현황> |
당사의 임직원 중 개인별 보수 지급액이 5억원 이상에 해당하는 자는 없습니다.
| (단위 : 백만원) |
| 이름 | 직위 | 보수총액 | 보수총액에 포함되지 않는 보수 |
|---|---|---|---|
| - | - | - | - |
(4) 주식매수선택권의 부여 및 행사현황
<표1>
| (단위 : 백만원) |
| 구 분 | 인원수 | 주식매수선택권의 공정가치 총액 | 비고 |
|---|---|---|---|
| 등기이사 | 4 | 60 | - |
| 사외이사 | 2 | 26 | - |
| 감사위원회 위원 또는 감사 | 1 | - | - |
| 계 | 7 | - | - |
| (주1) | 당사는 주식매수선택권의 공정가치를 이항모형에 의한 공정가치접근법을 적용하여 산정하였으며, 상기 공정가치 총액은 당기 포괄손익계산서에 주식보상비용으로 계상된 금액입니다. |
| (주2) | 상기 등기이사 인원수에는 기타비상무이사가 포함되어 있으며, 보고서 작성기준일 현재 기타비상무이사에게 부여된 주식매수선택권은 없습니다. |
<표2>
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 원, 주) |
| 부여 받은자 |
관 계 | 부여일 | 부여방법 | 주식의 종류 |
최초 부여 수량 |
당기변동수량 | 총변동수량 | 기말 미행사수량 |
행사기간 | 행사 가격 |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 행사 | 취소 | 행사 | 취소 | |||||||||
| 고현실 | 등기임원 | 2017.12.04 | 신주교부 | 보통주 | 100,000 | - | - | 40,000 | - | 60,000 | 2019.12.04~2024.12.04 | 2,046 |
| 송인영 | 등기임원 | 2017.12.04 | 신주교부 | 보통주 | 50,000 | - | - | 30,000 | - | 20,000 | 2019.12.04~2024.12.04 | 2,046 |
| 김선미 | 미등기임원 | 2017.12.04 | 신주교부 | 보통주 | 50,000 | - | - | 30,000 | - | 20,000 | 2019.12.04~2024.12.04 | 2,046 |
| 서정민 | 미등기임원 | 2017.12.04 | 신주교부 | 보통주 | 50,000 | - | - | 30,000 | - | 20,000 | 2019.12.04~2024.12.04 | 2,046 |
| 직원 등 15명 | 직원 | 2017.12.04 | 신주교부 | 보통주 | 362,000 | 12,000 | 16,000 | 151,900 | 106,000 | 104,100 | 2019.12.04~2024.12.04 | 2,046 |
| 고현실 | 등기임원 | 2018.11.16 | 신주교부 | 보통주 | 50,000 | - | - | - | - | 50,000 | 2020.11.16~2025.11.16 | 3,840 |
| 송인영 | 등기임원 | 2018.11.16 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 20,000 | 2020.11.16~2025.11.16 | 3,840 |
| 김선미 | 미등기임원 | 2018.11.16 | 신주교부 | 보통주 | 10,000 | - | - | - | - | 10,000 | 2020.11.16~2025.11.16 | 3,840 |
| 서정민 | 미등기임원 | 2018.11.16 | 신주교부 | 보통주 | 10,000 | - | - | - | - | 10,000 | 2020.11.16~2025.11.16 | 3,840 |
| 남규현 | 미등기임원 | 2018.11.16 | 신주교부 | 보통주 | 75,000 | - | - | - | - | 75,000 | 2020.11.16~2025.11.16 | 3,840 |
| 정진우 | 미등기임원 | 2018.11.16 | 신주교부 | 보통주 | 70,000 | - | - | - | - | 70,000 | 2020.11.16~2025.11.16 | 3,840 |
| 직원 등 18명 | 직원 | 2018.11.16 | 신주교부 | 보통주 | 143,000 | - | 5,000 | - | 28,000 | 115,000 | 2020.11.16~2025.11.16 | 3,840 |
| 직원 등 5명 | 직원 | 2019.05.17 | 신주교부 | 보통주 | 95,000 | - | 50,000 | - | 50,000 | 45,000 | 2021.05.17~2026.05.17 | 10,400 |
| 최재원 | 미등기임원 | 2020.03.30 | 신주교부 | 보통주 | 80,000 | - | - | - | - | 80,000 | 2022.03.30~2027.03.30 | 9,944 |
| 강인실 | 미등기임원 | 2020.03.30 | 신주교부 | 보통주 | 80,000 | - | - | - | - | 80,000 | 2022.03.30~2027.03.30 | 9,944 |
| 김창환 | 미등기임원 | 2020.03.30 | 신주교부 | 보통주 | 70,000 | - | - | - | - | 70,000 | 2022.03.30~2027.03.30 | 9,944 |
| 직원 등 12명 | 직원 | 2020.03.30 | 신주교부 | 보통주 | 197,500 | - | 30,000 | - | 30,000 | 167,500 | 2022.03.30~2027.03.30 | 9,944 |
| 김재상 | 등기임원 | 2020.03.30 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 20,000 | 2022.03.30~2027.03.30 | 9,944 |
| 강동필 | 등기임원 | 2020.03.30 | 신주교부 | 보통주 | 20,000 | - | - | - | - | 20,000 | 2022.03.30~2027.03.30 | 9,944 |
IX. 계열회사 등에 관한 사항
1. 계열회사의 현황
가. 기업집단 소속회사의 명칭
당사 및 당사의 계열회사는 「독점규제 및 공정거래에 관한 법률」에 따른 상호출자 제한 기업집단 등에 해당하지 아니하며, 당사를 포함한 기업집단 소속회사의 명칭은 다음과 같습니다.
| 구분 | 소재지 | 회사명 | 주요영업활동 |
|---|---|---|---|
| 상장사 | 대한민국 | 주식회사 티움바이오 | 의학 및 약학 연구개발업 |
| 비상장사 | 호주 | TiumBio Australia PTY LTD | 의학 및 약학 연구개발업 |
나. 계열회사간 출자현황
본 보고서 작성기준일 현재 당사가 TiumBio Australia PTY LTD의 발행주식 전부(100%)를 보유하고 있습니다.
다. 계열회사간 임원겸직 현황
| (기준일 : | 2020년 06월 30일 | ) |
| 성명 | 회사명 | 직위 | 비고 |
|---|---|---|---|
| 김훈택 | 주식회사 티움바이오 | 대표이사 | 상근 |
| TiumBio Australia PTY LTD | CEO | 비상근 |
2. 타법인출자 현황
| (기준일 : | 2020년 06월 30일 | ) | (단위 : 백만원, 천주, %) |
| 법인명 | 최초취득일자 | 출자 목적 |
최초취득금액 | 기초잔액 | 증가(감소) | 기말잔액 | 최근사업연도 재무현황 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 수량 | 지분율 | 장부 가액 |
취득(처분) | 평가 손익 |
수량 | 지분율 | 장부 가액 |
총자산 | 당기 순손익 |
|||||
| 수량 | 금액 | |||||||||||||
| TiumBio Australia PTY LTD | 2020.01.14 | 임상시료 생산 | 8 | - | - | - | 10 | 8 | - | 10 | 100% | 8 | - | - |
| 합 계 | - | - | - | 10 | 8 | - | 10 | 100% | 8 | - | - | |||
X. 이해관계자와의 거래내용
1. 대주주등에 대한 신용공여 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
2. 대주주와의 자산양수도 등
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
3. 대주주와의 영업거래
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
4. 대주주 이외의 이해관계자와의 거래
가. 특수관계자와의 거래내역
(1) 당반기말 현재 당사의 특수관계자 내역은 다음과 같습니다.
| 구 분 | 회사명 |
|---|---|
| 종속기업 | TiumBio Australia PTY LTD |
| 5%이상 주식을 소유한 주주 | 한국투자글로벌제약산업육성사모투자전문회사 |
(2) 당반기와 전기 중 특수관계자와의 중요한 거래내역은 다음과 같습니다.
① 당반기
| (단위 : 천원) |
| 특수관계 구분 | 특수관계자명 | 매출 | 매입 |
|---|---|---|---|
| 종속기업 | TiumBio Australia PTY LTD |
- | - |
② 전기
| (단위 : 천원) |
| 특수관계 구분 | 특수관계자명 | 매출 | 매입 |
|---|---|---|---|
| - | - | - | - |
(3) 당반기말과 전기말 현재 당사와 특수관계자간 채권 채무잔액은 다음과 같습니다.
① 당반기말
| (단위 : 천원) |
| 특수관계 구분 | 특수관계자명 | 매출채권 | 매입채무 |
|---|---|---|---|
| - | - | - | - |
② 전기말
| (단위 : 천원) |
| 특수관계 구분 | 특수관계자명 | 매출채권 | 매입채무 |
|---|---|---|---|
| - | - | - | - |
XI. 그 밖에 투자자 보호를 위하여 필요한 사항
1. 공시사항의 진행, 변경상황 및 주주총회 현황
가. 공시사항의 진행, 변경상황
당사는 보고서 작성기준일 현재 해당사항이 없습니다.
나. 주주총회 의사록 요약
|
회차 |
개최일자 |
의 안 내 용 |
가결 여부 |
|---|---|---|---|
|
1 |
2016.12.27 | 사내이사 선임의 건 |
가결 |
|
2 |
2017.01.09 | 신주 발행의 건 |
가결 |
|
3 |
2017.01.18 | 신주 발행의 건 |
가결 |
|
4 |
2017.02.02 | 신주 발행의 건 |
가결 |
|
5 |
2017.02.06 | 신주 발행의 건 |
가결 |
|
6 |
2017.02.13 | 신주 발행의 건 정관 변경의 건 |
가결 |
|
7 |
2017.02.15 | 자산 양수도 계약 승인의 건 |
가결 |
|
8 |
2017.02.24 | 신주 발행의 건 |
가결 |
|
9 |
2017.03.28 | 결산보고 승인의 건 이사보수한도 승인의 건 정관 변경의 건 신주 발행의 건 |
가결 |
| 10 | 2017.05.08 | 사외이사 선임의 건 대표이사 선임의 건 신주 발행의 건 |
가결 |
| 11 | 2017.05.22 | Option Agreement 체결의 건 |
가결 |
| 12 | 2017.07.01 | 본점 이전의 건 |
가결 |
| 13 | 2017.10.30 | 주식매수 선택권 부여의 건 주식 액면분할의 건 사내이사 선임의 건 |
가결 |
| 14 | 2017.12.04 | 주식매수 선택권 부여의건 |
가결 |
| 15 | 2018.03.29 | 재무제표 승인의 건 정관 변경의 건 이사 보수한도 승인의 건 |
가결 |
| 16 | 2018.04.16 | 정관 변경의 건 |
가결 |
| 17 | 2018.10.26 | 외부감사인 지정신청 및 변경 승인의 건 |
가결 |
| 18 | 2018.11.16 | 이사 선임 및 사임의 건 감사 선임의 건 감사 보수 한도 승인의 건 임원 퇴직금 지급 규정 승인의 건 주식 매수 선택권 부여의 건 정관 일부 변경의 건 |
가결 |
| 19 | 2019.03.29 | 재무제표 승인의 건 이사 보수 한도 승인의 건 감사 보수 한도 승인의 건 정관 일부 변경의 건 |
가결 |
| 20 | 2019.05.17 | 주식매수선택권 부여의 건 |
가결 |
| 21 | 2020.03.30 | 제 4기 재무제표 승인의 건 정관 일부 변경의 건 사내이사 김훈택 선임(중임)의 건 이사 보수 한도 승인의 건 감사 보수 한도 승인의 건 주식매수선택권 부여의 건 임원퇴직금 지급규정 개정의 건 |
가결 |
2. 우발채무 등
가. 중요한 소송사건
당사는 보고서 작성기준일 현재 해당사항 없습니다.
나. 견질 또는 담보용 어음, 수표현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
다. 채무보증 현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
라. 채무인수약정현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
마. 그 밖의 우발채무 등
(1) 회사는 당반기말 현재 정부 및 지방자치단체 보조금 등의 반환지급보증과 관련하여 서울보증보험으로부터 50백만원(전기말: 50백만원)의 지급보증을 제공받고 있습니다.
(2) 회사는 2017년 2월 SK케미칼(주)와 연구과제, 무형자산, 설비 등의 자산을 양수도하는계약을 체결하였으며, 향후 양수한 각 연구과제별 경상연구개발비, 기타관리비 등의 누적비용을 차감한 연구과제별 순이익 발생 시, 순이익의 10%를 지급하는 약정을 맺고 있습니다.
바. 자본으로 인정되는 채무증권의 발행
당사는 보고서 작성기준일 현재 해당사항 없습니다.
3. 제재현황 등 그 밖의 사항
가. 제재현황
당사는 보고서 작성기준일 현재 해당사항 없습니다.
나. 단기매매차익 환수 현황
당사는 과거 3사업연도 및 이번 사업연도 공시서류작성기준일까지 단기매매차익 발생사실을 증권선물위원회(금융감독원장)로부터 통보받은 바 없습니다.
다. 작성기준일 이후 발생한 주요사항
당사는 보고서 작성기준일 현재 해당사항 없습니다.
라. 중소기업기준 검토표
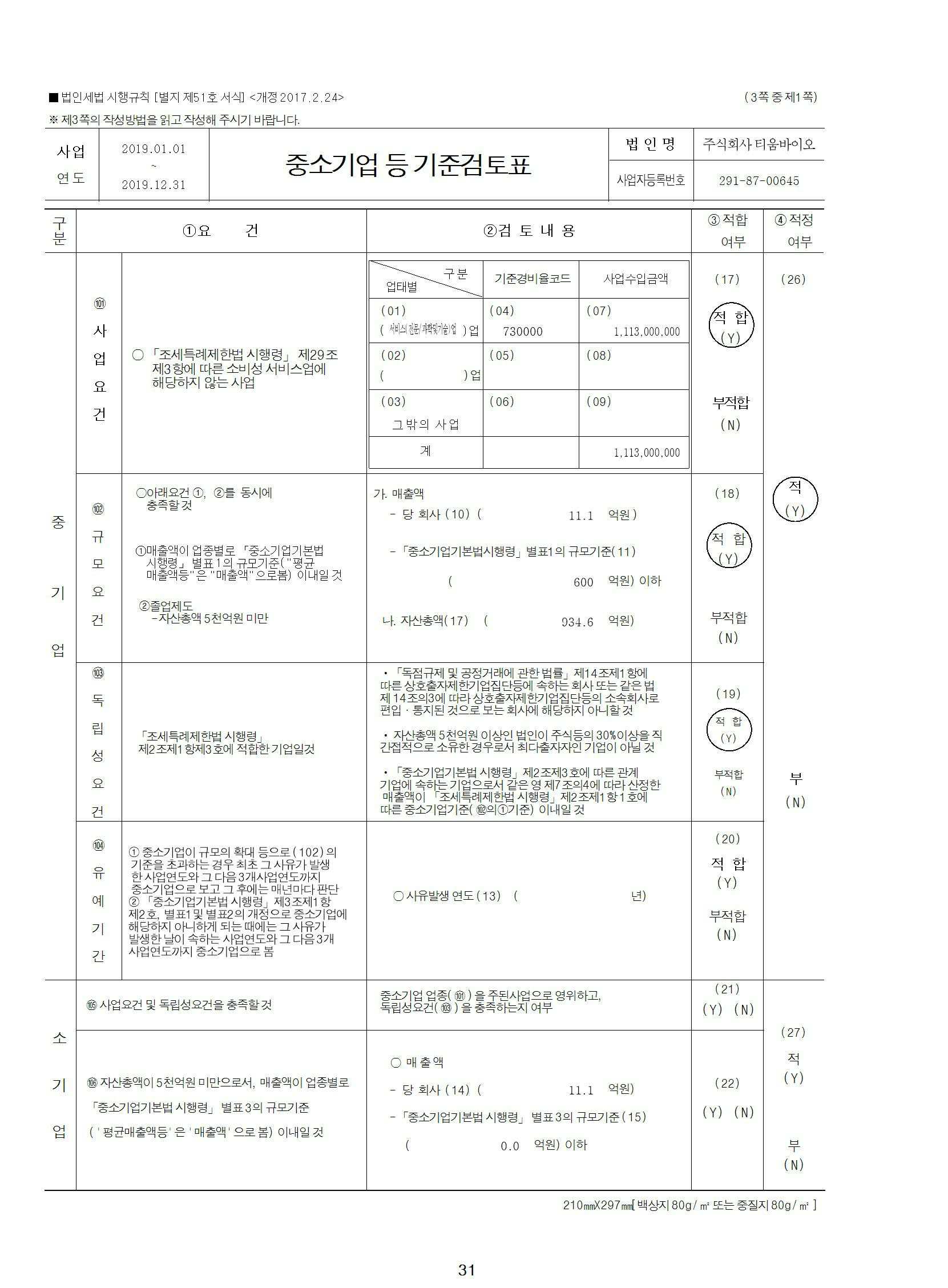 |
|
중소기업 등 기준검토표_1 |
 |
|
중소기업 등 기준검토표_2 |
마. 직접금융 자금의 사용
(1) 공모자금의 사용내역
| (기준일 : | 2020.06.30 | ) | (단위 : 백만원) |
| 구 분 | 회차 | 납입일 | 증권신고서 등의 자금사용 계획 |
실제 자금사용 내역 |
차이발생 사유 등 | ||
|---|---|---|---|---|---|---|---|
| 사용용도 | 조달금액 | 내용 | 금액 | ||||
| 코스닥시장 공모 | 1 | 2019.11.14 | 운영자금 | 28,544 | 운영자금 | 4,697 | (주1) |
| 코스닥시장 공모 | 1 | 2019.11.14 | 시설자금 | 756 | 시설자금 | 293 | (주1) |
| 코스닥시장 공모 | 1 | 2019.11.14 | 발행제비용 | 1,600 | 발행제비용 | 1,541 | 예상 금액과 소액 차이 발생 |
| (주1) | 당사는 2019년 11월 코스닥시장 공모를 통해 동 공모 자금을 조달 하였으며, 보고서 작성기준일 현재 자금 사용 계획 상의 시기 미도래로 인하여 차이가 발생합니다. 미사용 잔액은 은행 예금 등으로 예치되어 있습니다. |
(2) 사모자금의 사용내역
상기 공모자금을 제외한 공시대상기간 중 사모자금 유상증자는 모두 상장 전에 이루어진 것으로서 주요사항보고서를 제출하지 않았으므로, 해당사항이 없어 기재하지 않았습니다.
바. 보호예수 현황
| (기준일 : | 2020.06.30 | ) | (단위 : 주) |
| 주식의 종류 | 예수주식수 | 예수일 | 반환예정일 | 보호예수기간 | 보호예수사유 | 총발행주식수 |
|---|---|---|---|---|---|---|
| 보통주 | 899,220 | 2019.06.24 | 2020.11.22 | 상장일로부터 1년 (2019.11.22 ~2020.11.21) |
한국거래소 상장규정에 따른 보호예수 (제3자배정) |
23,471,826 |
| 보통주 | 190,000 | 2019.06.24 | 2020.11.22 | 상장일로부터 1년 (2019.11.22 ~2020.11.21) |
한국거래소 상장규정에 따른 보호예수 (최대주주 등) |
23,471,826 |
| 보통주 | 250,000 | 2019.06.24 | 2020.11.22 | 상장일로부터 1년 (2019.11.22 ~2020.11.21) |
기타 (주1) |
23,471,826 |
| 보통주 | 190,000 | 2019.06.24 | 2021.11.22 | 상장일로부터 2년 (2019.11.22 ~2021.11.21) |
한국거래소 상장규정에 따른 보호예수 (최대주주 등) |
23,471,826 |
| 보통주 | 120,000 | 2019.06.24 | 2021.11.22 | 상장일로부터 2년 (2019.11.22 ~2021.11.21) |
기타 (주1) |
23,471,826 |
| 보통주 | 8,000,000 | 2019.06.24 | 2022.11.22 | 상장일로부터 3년 (2019.11.22 ~2022.11.21) |
한국거래소 상장규정에 따른 보호예수 (최대주주) |
23,471,826 |
| (주1) | 경영안정성 등을 위한 자발적 보호예수물량입니다. |
사. 특례상장기업의 사후정보
| (단위: 백만원) |
|
계정과목 |
예측 |
실적(연결기준) |
비고 |
||||
|---|---|---|---|---|---|---|---|
| 2019년 (1차년도) |
2020년 (2차년도 반기) |
2019년(1차년도) | 2020년(2차년도 반기) | ||||
|
실적 |
괴리율 |
실적 |
괴리율 |
||||
|
영업수익 |
1,925 |
844 | 1,113 | 42.18% | - | 100.00% | - |
| 영업비용 | 14,467 | 7,103 | 9,133 | 37.65% | 6,084 | 14.35% | - |
|
영업손실 |
(12,721) |
(6,259) |
(8,020) | 36.95% | (6,084) | 2.80% | - |
|
당기순손실 |
(12,669) |
(6,259) | (7,091) | 44.03% | (5,304) | 15.26% | - |
| (주1) | 괴리율은 '(예측치-실적치)/예측치'로 산정된 비율입니다. |
| (주2) | 2020년 반기(2차연도 반기) 예측치는 증권신고서에 기재된 2020년 온기 예측치를 반기 수치로 환산한 금액입니다. |
당사는 한국채택국제회계기준에 따라 기술이전 계약에 따라 반환불가 조건의 선수수수료(Upfront Fee 등)를 받는 경우, 미래 제공할 추가적인 수행의무와 관련이 있는 것이라면 해당 의무를 수행하는 시기에 수익을 인식하고, 미래 제공할 추가적인 수행의무가 없다면 받았을 때 수익을 인식하고 있습니다. 그리고, 수행의무를 이행하지 않아 수익으로 인식하지 않은 금액은 재무상태표에 계약부채로 인식한 후 수행의무의 기간에 걸쳐 수익으로 인식하고 있습니다.
한편, 증권신고서 상 영업실적을 추정할 때에는 미래에 체결될 계약 내용을 정확히 알 수 없으므로, 수행의무에 따른 기간 인식을 고려하지 않았으며, 이러한 내용 역시 증권신고서 상 적절히 기재하였습니다.
(1) 2019년(1차 년도)
1) 영업수익 분석
영업수익의 2019년도 예측치는 1,925백만원, 실적은 1,113백만원으로 차액 812백만원, 괴리율은 42.18%입니다. 이는 2019연도 하반기 TU2218(면역항암제)의 기술이전계약 체결을 목표로 작성된 예측치로 본 보고서 작성일 현재 당사가 계획한 기술이전계약 지연으로 인한 것입니다. 당사는 TU2218(면역항암제)의 기술이전계약을 추진함과 동시에 자체적으로 임상시험 진입을 위한 개발을 계속적으로 진행하고 있습니다.
2) 영업비용 분석
당사의 영업비용 중 경상연구개발비를 제외한 영업비용은 예측금액이 3,356백만원, 실제금액이 3,275백만원으로 유의적인 차이는 있지 않는 것으로 판단됩니다(차액 81백만원, 괴리율 2.41%). 경상연구개발비는 예측금액이 11,291백만원, 실제금액은 5,858백만원으로 차액은 5,433백만원, 차이율은 48.12%입니다. 이는 TU2670 임상시험비용의 지급일정 추정의 차이와 2019년말 체결할 것으로 예상한 TU7710 임상시료생산계약이 2020년 1월로 일부 지연됨에 따른 것으로 2019년 추정 비용 중 일부가 2020년에 지급될 예정으로 총 비용에 영향을 미치지는 않습니다.
3) 영업손실 및 당기순손실 분석
영업손실은 위에서 설명한 '(1) 영업수익 분석' 및 '(2) 영업비용 분석'의 결과로 나타나는 차이이므로, 중복되는 설명은 생략하였습니다.
당기순손실의 2019년도 예측치는 12,669백만원, 실적은 7,091백만원으로 차액 5,578백만원, 괴리율은 44.03%입니다. 이는 전술한 영업손실의 차이 4,701백만원 외 공모로 유입된 자금 등을 금융상품에 가입하여 발생한 이자수익 965백만원 등으로 인한 차이입니다.
(2) 2020년 반기(2차 년도 반기)
1) 영업수익 분석
영업수익의 2020년도 예측치는 1,688백만원이며 반기로 환산할 경우 844백만원입니다. 다만, 2020년 반기의 영업수익은 발생하지 않았으며, 이는 증권신고서 제출 시 추정한 2020년 영업수익은 전액 TU2218(특발성폐섬유증)의 기술이전계약에 따른 마일스톤 수익으로 추정하였으며, 해당 수익은 2020년말에 발생할 것으로 예상됨에 따라 발생하는 차이입니다.
2) 영업비용 분석
당사의 영업비용 중 경상연구개발비를 제외한 영업비용은 2020년 반기 환산 예측금액이 1,740백만원, 실제금액이 1,943백만원으로 유의적인 차이는 있지 않는 것으로 판단됩니다(차액 203백만원, 괴리율 -11.67%). 경상연구개발비는 예측금액이 5,363백만원, 실제금액은 4,141백만원으로 차액은 1,222백만원, 괴리율은 22.79%입니다. 이는 TU2670 임상시험비용의 지급일정 및 TU7710 임상시료생산계약 지급 일정이 일부 지연됨에 따른 것으로 총 비용에 영향을 미치지는 않습니다.
3) 영업손실 및 당기순손실 분석
영업손실은 위에서 설명한 '(1) 영업수익 분석' 및 '(2) 영업비용 분석'의 결과로 나타나는 차이이므로, 중복되는 설명은 생략하였습니다.
2020년도 반기순손실의 환산 예측치는 6,259백만원, 실적은 5,304백만원으로 차액 955백만원, 괴리율은 15.26%입니다. 이는 전술한 영업손실의 차이 175백만원 외 공모로 유입된 자금 등을 금융상품에 가입하여 발생한 금융수익 773백만원 등으로 인한 차이입니다.
【 전문가의 확인 】
1. 전문가의 확인
해당사항 없음
2. 전문가와의 이해관계
해당사항 없음