 |
|
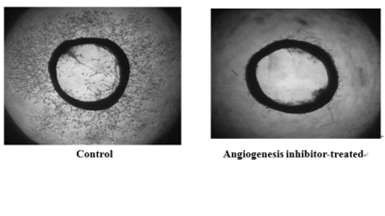
control |
 |
|
angiogenesis inhibitor-treated |
정 정 신 고 (보고)
| 2019년 03월 07일 |
1. 정정대상 공시서류 : 주주총회소집공고
2. 정정대상 공시서류의 최초제출일 : 2019년 03월 07일
3. 정정사항
| 항 목 | 정정사유 | 정 정 전 | 정 정 후 |
|---|---|---|---|
| Ⅲ. 경영참고사항 2. 주주총회 목적별 기재사항 □ 재무제표의 승인 나. 해당 사업연도의 대차대조표(재무상태표)ㆍ손익계산서(포괄손익계산서)ㆍ자본변동표ㆍ이익잉여금처분계산서(안) 또는 결손금처리계산서(안)ㆍ현금흐름표 |
단순 오기 수정 | - 손익계산서(포괄손익계산서) 과목 : Ⅳ. 영업손실 |
- 손익계산서(포괄손익계산서) 과목 : Ⅳ. 영업손익 |
주주총회소집공고
| 2019년 03월 07일 | ||
| 회 사 명 : | 주식회사 안지오랩 | |
| 대 표 이 사 : | 김 민 영 | |
| 본 점 소 재 지 : | 대전광역시 유성구 테크노3로 65, 159호(관평동, 한신에스메카) | |
| (전 화) 042-867-5785 | ||
| (홈페이지)http://www.angiolab.co.kr | ||
| 작 성 책 임 자 : | (직 책) 전무이사 | (성 명) 서 관 식 |
| (전 화) 042-867-5785 | ||
주주총회 소집공고
| 제20기 정기주주총회 소집 통지(공고) |
주주님의 건승과 댁내의 평안을 기원합니다.
당사는 상법 제363조와 정관 제19조에 의하여 제20기 정기주주총회를 아래와 같이 소집하오니 참석하여 주시기 바랍니다.
| - 아 래 - |
1. 일 시 : 2019년 3월 22일(금) 11:00
2. 장 소 : 대전광역시 유성구 테크노3로 65, 한신에스메카 5층 소회의실
3. 회의목적사항
《보고사항》 ▣ 감사보고 ▣ 영업보고 ▣ 외부감사인(지정) 선임보고 ▣ 내부회계관리제도 운영실태보고
《부의안건》
제1호 의안 : 제20기(2018년 1월 1일 ~ 2018년 12월 31일) 재무제표 승인의 건
제2호 의안 : 정관일부 변경의 건(전자증권제도 시행에 따른 개정 등)
제3호 의안 : 이사 선임의 건
제3-1호 의안 : 사내이사 박병영 선임의 건
제3-2호 의안 : 사외이사 이영신 선임의 건
제4호 의안 : 감사 선임의 건
제4-1호 의안 : 감사 김인철 선임의 건
제5호 의안 : 이사 보수한도액 승인의 건(한도액 3억원)
제6호 의안 : 감사 보수한도액 승인의 건(한도액 5천만원)
4. 경영참고사항
상법 제542조의4에 의거 경영참고사항을 당사 인터넷 홈페이지에 게재하고 본점과명의개서대행회사(국민은행증권대행부)에 비치하였으며, 금융위원회 및 한국거래소에 전자공시하여 조회가 가능하오니 참고하시기 바랍니다.
5. 실질주주의 의결권 행사에 관한 사항
금번 당사의 주주총회에는 한국예탁결제원이 주주님들의 의결권을 대리행사 할 수 없습니다. 따라서 주주님이 주주총회에 참석하여 의결권을 직접적으로 행사하시거나, 대리인에 위임하여 의결권을 간접적으로 행사하실 수 있습니다.
6. 주주총회 참석시 준비물
- 직접행사 : 주총참석장, 신분증
- 대리행사 : 주총참석장, 위임장(주주와 대리인의 인적사항 기재, 인감 날인 및 인감증명서 첨부), 대리인의 신분증
※ 당사는 주주총회에서 기념품을 준비하지 않기로 하였습니다. 주주여러분의 깊은 이해를 바랍니다.
| 2019년 3월 07일 |
| 주식회사 안지오랩 |
| 대표이사 김 민 영 |
I. 사외이사 등의 활동내역과 보수에 관한 사항
1. 사외이사 등의 활동내역
가. 이사회 출석률 및 이사회 의안에 대한 찬반여부
| 회차 | 개최일자 | 의안내용 | 사외이사 등의 성명 | |
|---|---|---|---|---|
| 이영신 (출석률: 100%) |
박명옥 (출석률: 100%) |
|||
| 찬 반 여 부 | ||||
| 31 | 2018년 01월 30일 | ◈ 2017년(제19기) 재무제표 승인의 건 | 찬성 | 찬성 |
| 32 | 2018년 01월 30일 | ◈ 2017년 제19기 내부회계관리제도 운영실태보고서 보고의 건 | 찬성 | 찬성 |
| 33 | 2018년 03월 05일 | ◈ 제19기 정기주주총회 소집 및 부의안건 승인의 건 | 찬성 | 찬성 |
나. 이사회내 위원회에서의 사외이사 등의 활동내역
| 위원회명 | 구성원 | 활 동 내 역 | ||
|---|---|---|---|---|
| 개최일자 | 의안내용 | 가결여부 | ||
| - | - | - | - | - |
2. 사외이사 등의 보수현황
| (단위 : 원) |
| 구 분 | 인원수 | 주총승인금액 | 지급총액 | 1인당 평균 지급액 |
비 고 |
|---|---|---|---|---|---|
| 사외이사 | 2 | 300,000,000 | - | - | - |
주1) 주총승인금액은 이사 전체에 대한 승인금액입니다.
주2) 사외이사에 대하여는 보수를 지급하지 않고 있습니다.
II. 최대주주등과의 거래내역에 관한 사항
1. 단일 거래규모가 일정규모이상인 거래
| (단위 : 억원) |
| 거래종류 | 거래상대방 (회사와의 관계) |
거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
2. 해당 사업연도중에 특정인과 해당 거래를 포함한 거래총액이 일정규모이상인 거래
| (단위 : 억원) |
| 거래상대방 (회사와의 관계) |
거래종류 | 거래기간 | 거래금액 | 비율(%) |
|---|---|---|---|---|
| - | - | - | - | - |
III. 경영참고사항
1. 사업의 개요
가. 업계의 현황
(1) 제약산업
1) 제약산업의 개요
제약산업이란 질병의 진단, 치료 경감, 처치, 예방 또는 건강증진을 목적으로 하는 의약품(한약 포함)을 연구하고 제조하는 산업을 말합니다. 제약산업은 국민의 보건과 관련되어 있어 의약품의 제조, 유통 등 전 과정을 국가가 엄격하게 통제하고 있으며, 전 산업 평균 부가가치율 8.8%에 비하여 제약산업의 부가가치율은 36.6% 로서 고부가가치 산업입니다. 또한 기술 및 지식 집약적 산업이며, 고수익사업이면서 동시에 고위험산업의 특성을 지니고 있습니다.
의약품이란 사람이나 동물의 질병을 진단, 치료, 경감, 처치 또는 예방의 목적으로 사용하는 것으로 기계나 기구가 아닌 것을 말합니다. 이러한 의약품에는 일반적으로 화학합성의약품, 바이오의약품 그리고 천연물의약품으로 구분할 수 있습니다.
화학합성의약품은 현재 사용하는 의약품 시장의 70~80%를 차지하고 있으며, 약물 의 크기와 질량이 작은 화합물의약품을 말합니다. 개발기간이 길고 비용이 크며 성공확률이 매우 낮습니다. 주로 천연에 존재하는 생리활성물질을 찾아내고 이 물질보다 효능은 향상시키고 부작용은 적은 화합물을 얻기 위하여 화학반응을 통하여 유도체 를 합성하고 의약품으로 개발하는 방법으로서 일부 천연물로부터 분리, 정제하여 사 용하고 있습니다만 제조비용이 높고 수율이 낮아 완전합성이나 반합성을 통하여 의 약품을 생산하는 것이 일반적입니다. 최근에는 생체내 효소 반응을 촉진, 억제할 수 있는 이상적인 구조의 화합물을 컴퓨터로 선정하고 합성 및 검색을 통하여 의약품을 개발하는 방법도 있습니다.
이에 비해 바이오의약품은 생물공학기술을 이용하여 생산된 의약품을 말하며, 미생 물, 식물 또는 동물세포 등 살아있는 생물체로부터 단백질이나 탄수화물로 구성된 분자량이 큰 물질을 얻어내거나 배양된 세포 그 자체를 사용하고 있습니다. 바이오의약품은 질환별 표적치료제 개발이 가능해 희귀성이나 난치성 질병에 대한 치료 가능성 제시로 향후 성장성이 주목받고 있는 의약품입니다.
천연물의약품은 천연물 성분을 이용하여 연구개발한 의약품으로 조성성분이나 효능 이 새로운 의약품을 말합니다. 여기에서 천연물이란 자연계에서 얻어지는 식물, 동물, 광물 및 미생물과 이들의 대사산물을 말하며, 천연물의약품이란 천연물로부터 절단, 분쇄, 추출 등의 간단한 가공을 통하여 약효성분을 추출하고, 추출물상태로 질병의 치료에 사용하는 의약품으로 개발한 것을 천연물의약품이라고 합니다.
기존의 합성의약품이나 바이오의약품과 달리 한국은 오랫동안 축적된 천연물관련지 식을 기반으로 의약품을 개발하기에 유리한 점에 주목하였고, 이에 보건복지부에서 는 2000년에 천연물과학의 육성 등 천연물신약연구개발의 기반을 조성하고 천연물 을 이용한 신약연구개발과 그 개발기술의 산업화를 촉진하여 국민건강의 증진과 국 가경제의 발전에 기여하고자 "천연물신약연구개발촉진법"을 발표하였으며, 천연물신약이라는 단어는 천연물의약품으로 현재 사용하고 있습니다.
2) 제약산업의 현황
제약산업은 국가경제에 대한 약적인 기여도와 더불어 질병퇴치 및 국민의 건강, 복지증진 등 질적인 국가사회의 발전을 위해 필수적인 산업분야이며, 정부가 현재 중점 적으로 육성하고자하는 유망한 산업분야입니다. 따라서 제품의 생산 및 유통 전반에 걸쳐 약사법 등 관계법령 및 보건복지부, 식품의약품안전처 등 해당정부기관의 규제 를 받는 대표적인 규제산업입니다.
지금까지 국내 제약회사들은 오리지널 의약품의 특허 만료가 될 경우 제네릭 의약품 을 출시해 판매하는 제네릭 비즈니스가 주된 사업이었습니다. 그러나 약가인하 및 제네릭 경쟁심화로 시장에 참여하는 제약사들의 수익성은 점차 떨어지게 되었고, 이에 따라 주요 제약회사들은 ETC(전문의약품) 외에도 OTC(일반의약품), 건강기능식품, 진단/의료기기, 피부성형제품, 화장품 등의 사업으로 영역을 확대해 나가기 시작했 고 종합 헬스케어 비즈니스를 지향하는 사업으로 전략을 다각화하기 시작하였습니다. 또한 제약사들은 내수의존도가 높은 국내산업 중심에서 해외로 눈을 돌려 API(원료의약품) 및 완제의약품의 수출확대를 모색하는 등 내수시장에서의 성장정체를 극복 하기 위한 노력을 지속하고 있습니다.
경제협력개발기구(OECD)는 한국의 잠재성장률을 2015~2020년 3.4%, 2020~202 5년 2.6%로 내다보고 있는데, 이런 저성장 전망에도 국내 제약산업은 꾸준한 성장을이어갈 것으로 예상되고 있습니다. 그 근거로는 인구고령화 와 수출확대 그리고 시 장성 있는 R&D 성과 등이 주요 배경입니다.
2014년 우리나라 제약산업 시장규모(생산-수출+수입)는 19조 2,539억 원으로 전년 대비 1.2% 증가하였으며 2010~2014년 동안 연평균 0.5%로 시장규모가 확대되었 습니다. 이를 조금 더 자세히 살펴보면, 2014년 국내 의약품 시장규모는 2013년과 비슷한 19조 2,539억원 이었습니다. 2014년 의약품 국내 생산실적은 16조 4,194억 원으로 2013년 대비 1.4% 증가하였습니다. 수출액은 2조 5,314억원으로 2013년에 비해 9.2% 증가하였으며, 수입액도 4.1% 증가한 5조 3,659억원으로 확대되었습니 다.
| <우리나라 제약산업 시장규모 및 시장동향> |
| (단위: 억원, %) |
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
전년대비 |
CAGR |
|---|---|---|---|---|---|---|---|
|
생산 |
155,700 |
154,403 |
155,607 |
161,919 |
164,194 |
1.4 |
1.3 |
|
수출 |
17,701 |
19,435 |
23,095 |
23,185 |
25,314 |
9.2 |
9.4 |
|
수입 |
51,089 |
54,471 |
57,289 |
51,558 |
53,659 |
4.1 |
1.2 |
|
무역수지 |
-33,389 |
-35,036 |
-34,193 |
-28,373 |
-28,345 |
- |
- |
|
시장규모 |
189,084 |
189,438 |
188,900 |
190,292 |
192,539 |
1.2 |
0.5 |
주 : 1) 의약품의 범위는 완제, 마약, 한외마약, 향정정신성, 원료의약품
2) 의약품 수출입액은 한국은행 원/달러 연평균환율을 적용하여 계산함
[출처 : 한국제약협회(2015), 한국의약품수출입협회(2015) Facts & Survey Report]
또한 제약산업의 지속적인 발전에 따라 국내 제약기업의 해외투자도 증가하고 있습 니다. 해외직접투자는 2014년 신고금액 기준 1억 5,488만 달러로 전년 대비 201.9%증가하였으며, 송금액 기준은 1억 1,487만 달러로 전년(5,999만 달러) 대비 915% 증가하였으며, 신고액 대비 송금액 비율은 74.2%로 투자가 이루어졌습니다. 나라별로는 미국이 5,288만 달러로 가장 많으며 그 뒤로 홍콩, 캐나다, 일본, 중국 순으로 나타났습니다. 2010년 미국으로 투자하는 비중이 63.7%로 매우 높았으나, 최근 들어 과거에 비해 그 비중이 점차 줄어들어 2014년 현재 기준 총 투자액의 46.0%를 차지하며 여전히 투자 상위국 순위를 기록하고 있습니다.(출처: 2015년 제약산업 분석 보고서- 한국보건산업진흥원, 2015.12)
국내 의약품시장에서 무엇보다도 가장 주목할 점은 시장성 있는 R&D 성과입니다. 국내 제약 및 바이오업체들은 1990년대 초반부터 신약개발을 위한 R&D에 역량을 집중해 왔는데, 이러한 노력의 일환으로 1999년에는 SK케미칼이 국내신약 1호 선플라주(항암제) 개발에 성공했으며 뒤를 이어 JW중외제약의 큐록신(항생제), LG생명과학의 팩티브(호흡기감염증), 동아에스티의 시벡스트로(항생제) 등 현재까지 총26개 의 신약이 개발된 상황입니다. 그런데 이러한 신약개발환경이 최근에 이르러 급속도 로 변화하기 시작하고 있습니다. 기존까지 대부분의 제약회사들은 글로벌 제약사들 이 개발하던 물질을 도입해 임상을 진행하는 경우가 대부분이었으나, 현재는 국내제약 및 바이오업체들이 개발하고 있는 치료제에 대한 기술을 글로벌 제약사로 이전하 는 사례가 늘고 있습니다.
특히 화학합성 신약개발에서 백신, 바이오시밀러, 세포치료제, 유전자치료제 등 바이오신약개발로 그 범주가 넓어지면서 이러한 기술이전 건수와 그 규모도 급속도로 확 대되고 있습니다. 일례로 한미약품이 면역질환치료제 및 표적항암제 등을 각각 글로 벌 제약사인 릴리, 베링거인겔하임 등에 약 8,000억원(총 마일스톤규모)에 이르는 라이선스아웃계약을 체결하였고, 또한 SK케미칼은 사노피아 벤티스와 차세대 폐렴구 균백신의 공동개발계약을 맺기도 하였습니다.
바이오 전문업체로는 바이로메드가 당뇨병에 수반하는 질병(당뇨병성 신경병증, 허 혈성 지체질환 등)을 적응증으로 한 약물에 대해 자체적으로 미국 임상3상에 진입했 으며, 코오롱생명과학도 퇴행성관절염치료제 인보사(티슈진-C)를 한국과 미국에서 각각 품목허가와 임상3상을 진행할 예정입니다.
이렇듯 글로벌 기술이전이 늘어나는 배경에는 글로벌 제약사들이 기존 합성신약의 특허만료에 따른 약가 인하 및 제네릭 경쟁심화로 새로운 성장 동력을 발굴해야만 하는 과제를 안고 있기 때문입니다. 아울러 국내 제약 및 바이오업체들의 경우 글로벌 임상진행에 따른 막대한 규모의 개발비용이 부담으로 작용하기 때문에 글로벌 제약 사와 국내 제약사간의 상호 니즈가 잘 맞아 떨어진 점도 글로벌 B2B 확대 요인으로 볼 수 있을 것입니다. 향후 이러한 신약개발모델은 점차 발전해 나갈 전망입니다. (출처: 제약, 바이오 산업분석, 키움증권, 2015.11)
기존의 합성의약품이 제약산업을 주도하여 왔다면, 현재 바이오 의약품시장의 확대 와 더불어 연구개발이 크게 확대되고 있습니다. 바이오의약품시장은 크게 1세대 단 백질 의약품과 백신, 2세대 항체의약품과 바이오시밀러, 차세대세포치료제, 유전자 치료제 등으로 구분될 수 있습니다. 2000년대 초반까지 바이오의약품의 성장을 견인해온 치료제는 1세대 바이오 의약품이지만 특허 만료로 성장률은 감소하고 있으며, 이에 따라 1세대 바이오 의약품과 관련한 R&D는 치료제 투여기간을 연장시켜 주는 서방형제제, 화학합성의약품 등과 복합해약의 효능을 높여주는 Combination 제제 등 바이오베터(Bio Better)로 개발되고 있습니다.
현재 시장은 2세대 바이오의약품인 항체의약품이 주도하는 실정입니다. 2015년을 기점으로 블록버스터급 항체의약품들의 특허가 선진시장에서 단계적으로 만료가 되면서 바이오시밀러시장이 본격적으로 개화하는 상황이기도 합니다. 최근 개발이 활 발하게 진행되고 있는 세포치료제, 유전자치료제, 면역치료제 등에 대한 시장의 관심도 증가하고 있습니다. 아직까지 차세대 바이오의약품에 대한 시장규모를 추정하거 나, 치료제에 대한 상업성평가가 완벽하게 이루어진 것은 아니지만 기존의약품으로 치료가 불가능한 난치성질환의 치료를 가능하게 하면서 바이오의약품시장의 성장을 이끌 것으로 전망되고 있습니다.
세계 바이오의약품 시장은 최근 4년간 연평균 8.0% 증가해 2013년 기준 시장규모는1,610억 달러로 추정됩니다. 또한 2013년부터 2016년까지 바이오의약품 시장은 연 평균 5.5% 증가해 전체 의약품성장률(2.8%)의 두배 성장되었습니다. 이에 따라 전체의약품 시장에서 바이오의약품 시장 비중은 2002년의 10.3%에서 2016년에 23.0% 로 확대 되었습니다. 치료가 어려운 난치성 질환의 증가, 글로벌 제약사들의 바이오의약품으로의 투자 확대 등을 통해 바이오 의약품 산업은 제약 산업 전체보다 고성장이 예상됩니다.
합성의약품, 바이오의약품과 더불어 의약품의 또 다른 한 축을 차지하고 있는 천연물의약품은 기존 의약품의 한계를 극복할 수 있는 대안으로 떠오르고 있습니다.
당사가 개발하는 의약품 중 파이프라인 상에서 가장 앞서가고 있는 것은 천연물의약품으로서 아래에 별도의 항으로 구분하여 자세하게 설명드리겠습니다.
(2) 천연물의약품
1) 개요
천연물이란 넓은 의미에서 자연계에서 얻어지는 식물, 동물, 광물, 미생물과 이들의 대사산물을 총칭하는데, 이러한 천연물을 이용한 의약품은 이를 사용하는 국가들의 역사적, 문화적 차이에 따라서 생약(Crude drug) 또는 생약제제(Herbal medicinal pr eparation), 식물의약품(Botanical drug) 또는 식물제제(HMP : herbal medicinal product) 등으로 불리고 있습니다.
미국의 경우 천연물의약품에 대한 공식적인 용어로 식물의약품 (Botanical drug)이란
용어를 사용하고 있습니다. Botanical drug 이란 식물성 물질을 원료로 제조된 의약 품을 일컫는 말로서, 넓은 의미에서는 식물성 성분을 함유하는 식품첨가물, 의료기기및 화장품도 포함합니다.
유럽에서는 천연물을 현대 과학적 관점에서 접근하여 추출물 상태로 의약품으로 개 발해 질병 치료에 널리 이용해 왔으며, 이러한 천연물 추출물 의약품을 Herbal medicinal product (HMP)라고 부르고 있습니다.
HMP란 활성물질로 1종 이상의 천연물(Herbal substance)이나 천연물 제제(Herbal p reparation)를 함유하고 있는 의약품을 총칭하는 용어로서 phyto-pharmaceutical 이라는 용어도 동일한 의미로 사용됩니다. (출처: 천연물의약품의 현황과 전망, 성상현,박진호, 서울대학교 약학대학, (주)엘컴사이언스 생명과학연구소, 2006.11)
2) 천연물의약품 산업의 특성
|
특 징 |
내 용 |
|---|---|
|
낮은 민감도 |
천연물의약품은 합성의약품의 대체재로서 경기변동 및 가격에 대 한 민감도가 낮습니다. |
|
장기투자 필요 |
대규모 연구개발비 투자가 소요되고, 최종적인 기술의 실용화까지 장기간이 소요됩니다. |
|
융합산업 |
약학, 화학, 생물학 등 여러 분야의 지식과 기술을 기반으로 막대한 비용과 시간을 투입해야 하는 첨단 융합 산업입니다. |
|
고부가가치산업 |
천연물에서 추출한 약리 활성 물질을 이용하면 화학적으로 합성하 는 방식에 비해 개발기간과 개발비를 줄일 수 있는데다 약효는 뛰 어나고 부작용은 적은 고부가가치 신약개발이 가능합니다. |
|
높은 진입장벽 |
신약개발 개발과정에 따른 안전성, 유효성을 입증하는 임상시험이 완료된 후에도 의약품 허가 및 이의 실용화를 위한 우수 의약품 제조관리 (GMP; Good Manufacturing Practice) 시설 투자 등으로 진입장벽이 높은 특성을 가지고 있습니다. |
[출처: 나이스 TDB시장보고서, 2015]
3) 관련 시장
세계 천연물의약품 시장은 2008년 77억 달러에서 연평균 23.36% 성장하여 2013년
219억 달러로 성장하였습니다. 또한, 2013년 이후 연평균 23.36% 성장하여 2018년 에는 626억 달러에 이를 것으로 전망됩니다. 시장규모는 중국이 가장 크며, 이어서 유럽, 아시아, 북미지역, 일본 등의 순입니다. 천연물의약품은 미국 FDA의 최초 승인이래 지속적인 성장 추세를 보이고 있으며 천연물 관련 의약품의 수와 시장의 규모 또한 지속적인 증가를 보이고 있습니다.
현재 40억 명, 즉 세계 인구의 약 80%가 1차 healthcare를 위해 천연물의약품을 이용하고 있다고 알려져 있습니다. 또한, 전 세계에 판매되고 있는 상위 25개 제품 중 42
%가 생물학 제제, 천연물의약품 또는 천연물유래 단일물질이며, 현재의 약전에 수재된 의약품 중 25%는 식물유래 의약품입니다.
미국, 유럽, 일본 등 전 세계 주요시장에서 1998년 이후 발매된 천연물유래 신약은 20종이 넘고 있는데 그 주요 내용은 아래와 같습니다.
| <1998년 이후 전 세계 주요시장에서 발매된 주요 천연물관련 신약> |
|
년도 |
일반명 ( 상품명) |
주성분 |
유래 |
적응증 |
|---|---|---|---|---|
|
1998 |
Orlistat (Xenical) |
Lipstatin |
반합성 |
항비만 |
|
1998 |
Cefoselis (Wincel) |
Cephalosporin |
천연물 |
항박테리아 |
|
1999 |
Dalfopristin & Quinupristi n (70:30) (Synercid) |
Streptogramin B & Strep togramin A |
반합성 |
항박테리아 |
|
1999 |
Valrubicin (Valstar) |
Doxorubicin 144 |
천연물 |
항종양 |
|
1999 |
Colforsin daropate (Adele , Adehl) |
Forskolin |
반합성 |
강심제 |
|
2000 |
Arteether (Artemotil) |
Artemisinin 40 |
반합성 |
항말라리아 |
|
2001 |
Ertapanem (Invanz) |
Thienamycin |
천연물 |
항박테리아 |
|
2001 |
Caspofungin (Cancidas) |
Pneumocandin B |
반합성 |
항진균제 |
|
2001 |
Telithromycin (ketek) |
Erythromycin 19 |
반합성 |
항박테리아 |
|
2001 |
Pimecrolimus (Elidel) |
asoomycin |
반합성 |
아토피성피부염 |
|
2002 |
Galantamine (Reminyl) |
Galantamine |
천연물 |
알프하이머 |
|
2002 |
Amrubicin hydrochloride ( Calsed) |
Doxorubicin |
천연물 |
항종양제 |
|
2002 |
Micafungin (Funguard) |
FR901379 |
반합성 |
항진균제 |
|
2002 |
Biapenem (Omegacin) |
Thienamycin |
천연물 |
항박테리아 |
|
2002 |
Nitisinone (Orfadin) |
Leptospermone |
천연물 |
anti-tyrosinaemia |
|
2003 |
Miglistat (Zavesca) |
1-Deoxynojirimycin |
반합성 |
type 1 Gaucher |
|
2003 |
Mycophenolate sodium ( Myfortic) |
Mycophenolic acid- |
천연물 |
면역억제제 |
|
2003 |
Rosuvastatin (Crestor) |
Mevastatin |
천연물 |
고지혈증 |
|
2003 |
Pitavastatin (Livalo) |
Mevastatin |
천연물 |
고지혈증 |
|
2003 |
Daptomycin (Cubicin) |
Dapromycin |
천연물 |
항박테리아 |
|
2004 |
Overolimus (Certican) |
Sirolimus 91 |
반합성 |
면역억제제 |
|
2006 |
Sinecatechins(Verezen) |
green tee leaf |
천연물 |
Ointment for |
|
2012 |
Crofelemer(Fulyzaq) |
Croton lechleri plant |
천연물 |
diarrhea in HIV/ |
자료 : Nat. Prod. Rep.(2005), 22(2):162-95
주1 : 천연물 - 임상시험이나 시판을 위하여 합성된 경우 포함
주2 : 천연물 유래 - 천연물을 주형(template)으로 하여 합성
주3 : 반합성(Semi-synthetic) - 천연물을 주형으로 하여 반합성
주4 : 생약혼합물(herbal mixture) 등은 제외
[출처: 바이오제품 시장 및 바이오기술개발 동향 2010.1, 지식경제부, 한국산업기술평가관리원, 바이오협회]
국내 천연물의약품 시장은 2008년 3,698억 원에서 연평균 9.25% 성장하여 2013년 5,755억 원으로 성장하였고 2013년 이후에도 연평균 9.25% 성장하여 2018년에는 8,956억 원에 도달할 것으로 전망됩니다. (출처: 나이스 TBD 시장보고서, 2015)
국내에서 개발에 성공한 신약 중 천연물 의약품은 8개로 약 24%를 차지하는데, 201 1년 3개, 2012년 2개의 천연물 신약이 허가를 받았으며, 이는 2001년 천연물 연구개발 촉진법 이후 꾸준히 진행되었던 천연물 신약 개발의 성과로 볼 수 있습니다.
| <국내 주요 천연물 신약> |
|
기업명 |
제품명 |
적응증 |
주요성분 |
허가년도 |
추정매출 |
비고 |
|---|---|---|---|---|---|---|
|
동아제약 |
스티렌캅셀 |
위염 |
애엽 |
2002 |
7,300억 (누적) |
PG생성촉진, 위점액분비촉진 |
|
SK케미칼 |
조인스정 |
관절염 |
위령선, 괄루근, 하고초 |
2001 |
2,300억 (누적) |
연골파괴억제, 관절분해효소억제 |
|
안국약품 |
푸로스판 |
진해거담 |
아이비잎 |
2000 |
1,000억 (누적) |
|
|
휴온스 |
살사라진 |
관절염 |
당귀, 작약, 천궁, 연교 등 18종 |
2003 /2007 |
- |
동의보감 처방 |
|
구주제약 |
아피톡신 |
관절염 |
봉독 |
1999 /2003 |
- |
|
|
광동제약 |
편자환 |
간염, 안염 |
사향, 우황 등 |
1983 |
- |
중국처방 도입 |
|
유유제약 |
타나민 D |
혈액순환 |
은행잎 |
2008 |
- |
독자개발 |
|
SK케미칼 |
기넥신 |
혈액순환 |
은행잎 |
1991 |
- |
독자개발 |
|
동아제약 |
모티리톤 |
기능성 |
- |
2011 |
214억 |
|
|
녹십자 |
신바로 |
골관절염 |
- |
2011 |
88억 |
|
|
한국피엠지 |
레일라 |
골관절염 |
- |
2012 |
184억 |
|
[출처 : 바이오제품 시장 및 바이오기술개발 동향: 지식경제부, 한국산업기술평가관 리원, 바이오협회, 2010.4, 건강보험심사평가원 등]
(3) 항체의약품
1) 개요
사람은 외부로부터 유해물질이나 병원균(이들을 항원이라 함)이 체내에 유입될 경우 면역반응을 통해 이를 제거합니다. 사람의 면역반응은 크게 두가지 즉 세포성 면역반응과 체액성 면역반응으로 구분됩니다. 세포성 면역반응은 세포독성 T 세포(cytotoxic Tcell), 대식세포(macrophage), 자연 살해 세포 (Natural Killer, NK cell) 등이 활성화 되어 항원을 제거하는 과정이며, 체액성 면역반응은 항원과 특이적으로 결합 할 수 있는 항체를 생산함으로써 항원을 중화(neutralization)하거나 제거하는 과정입니다. 체액성 면역반응의 중요한 특징은 어떠한 항원에 대해서도 특이적으로 결합할 수있는 항체를 생산할 수 있다는 점이며, 수지상세포(dendritic cell), TH cell(T Helper cell), B cell 등이 관여합니다. 이와 같이 체액성 면역계에 의해 생산되는 항체의 특성을 질병치료에 활용한 것이 바로 항체의약품입니다. 이러한 항체의약품은 1985년 Orthoclone OKT3(얀센)이 이식거부반응 치료제로 세계 최초로 판매 승인된 이후 많은 제품들 의 개발이 이어져 현재는 판매액 기준 세계 10위 의약품 중 6개를 차지하고 있을 만 큼 비중이 큰 의약품으로 성장했습니다.
항체를 의약품으로 활용하기 위해서는 원하는 항원 결합능을 지닌 항체 단백질만을 순수하게 대량생산할 수 있는 기술이 필요한데 이와 관련한 최초 기술은 hybridoma 제조기술(hybridoma technology)이며 이는 1970년대에 C. Milstein과 G. Kohler에 의해 개발되었다. hybridoma cell 제조를 위해서는 우선 표적항원을 마우스에 주입하여 마우스 면역계로 하여금 표적항원 특이적인 항체를 생산하는 항체생산세포(B cell
)를 만들도록 하여야 한다. 그리고 비장에 있는 B cell을 myeloma cell과 융합시켜 hybridoma cell을 만듭니다. 각 hybridoma cell들은 무한 증식이 가능하고 특정 항체를 생산할 수 있는 융합세포입니다. 그 후 hybridoma cell들이 생산하는 항체를 분석하여 최 종적으로 원하는 항체를 가장 잘 생산하는 세포를 선별하게 됩니다. 결국 hybridoma 제조기술을 이용하여 생산한 최초의 항체의약품은 마우스 기원의 항체(mouseantibody)였습니다.
마우스 기원 항체의 경우, 표적 항원에 대한 특이적 결합력으로 인해 의약품으로서의가치는 있지만 다른 한편으로 인체에 적용할 경우, 항체단백질 자체가 면역원으로 작용하여 예기치 못한 부작용을 일으킬 수 있습니다. 따라서 많은 제약회사와 연구자들은 최근까지 기술 개발을 통해 항체단백질로부터 마우스 유래 부위를 줄이고 궁극적으로는 온전한 인간 항체를 개발생산 하고자 노력해왔으며, 그 결과로 키메라 항체(chi meric antibody), 인간화 항체(humanized antibody), 인간 항체(human antibody) 등과 같은 유형의 항체의약품들이 등장하게 되었습니다. 그리고 이와 같은 항체의약품 발전과정에는 정교해진 DNA 조작기술의 발전이 크게 기여하였다. 더 나아가 최근에는 항체의약품의 효능 및 안정성을 향상시키는 다양한 항체공학적 기술들이 제품 개발에 적용되고 있습니다. 예를 들어 빠른 흡수를 위해 항원결합 부위만을 사용하는 제품, 하나의 분자에 다양한 항원들에 대한 결합능을 부여한 융합항체, 항체와 독성약물의 장점을 결합시킨 항체-약물 복합체, 그리고 안정성 향상을 위해 당구조를 변화시킨 항체의약품 등이 그것입니다. (출처: 식품의약품안전처-항체의약품 개발기술 동향)
2) 항체의약품의 종류
① 단클론항체(mAb) 의약품
- 마우스 단클론 항체(mouse monoclonal antibody) : 1985년, OKT3 (muromonab) 는 사람에게 사용된 최초의 항체의약품으로 hybridoma cell 제조 기술을 통해 개발 되었다. Hybridoma cell(융합양세포)은 항체 생산 세포인mouse B cell 과 myeloma cell이 융합된 hybrid cell(융합세포)로 표적 항원을 주입하여 면역 반응이 유발된 마우 스의 비장으로부터 얻어진 B 세포를 보통 전기장을 가하는 방법으로 myeloma cell( 골수종세포)과 융합하여 얻었다. 마우스 단클론 항체의 이름에는 중간에 -o-가 들어 있습니다.
키메라 단클론 항체(chimeric monoclonal antibody) : Hybridoma 기술은 마우스 단 클론 항체의 대량 생산을 가능하게 하였습니다. 그러나 마우스 단클론 항체는 Fc 기능(effector function)을 기대할 수 없고, 면역 반응이 유발되어 중화(neutralization)되어 버리는 등의 문제점이 있었습니다. 즉, 인체에 반복적으로 사용할 경우 인체 내 면역반응이 생긴다는 문제점을 발견하게 되면서 이를 해결하기 위해 인간 항체와 유사한 인간화 단클론 항체의 필요성이 제기되었습니다. 이에 따라 DNA 재조합 기술을 도입하여 마우스 항체의 가변 영역과 인간 항체의 불변 영역을 재조합시킨 hybridantibody를 제조하게 되었습니다. 키메라 단클론 항체는 인간 항체가 75%를 차지하고 있으며, 항체 이름에는 중간에 -xi-가 들어 있습니다.
인간화 단클론 항체(humanized monoclonal antibody) : 키메라 단클론 항체의 경우 마우스 항체 부분에 가변 영역이 존재하므로 반복적으로 투여하면 면역반응을 유발 한다는 단점이 여전히 존재하였습니다. 1986년 단백질 공학기술이 개발됨에 따라 마우스단일클론 항체의 CDR을 인간 항체에 이식시키는 CDR-grafting 방법이 개발되었습니다.
즉, 마우스 유래 CDR을 인간 유래 프레임 워크영역(framework region, FR)과 재조 합시켜 인간화 가변 영역을 제조하고 이를 인간 항체의 불변 영역과 재조합시켜 인간
화 단클론 항체를 제조하는 방법입니다. 인간화 단클론 항체는 인간 항체가 90% 또는 83%를 차지하며, 각각 항체 이름 중간에 -zu- 또는 -zizu-가 들어있습니다.
인간 단클론 항체(human monoclonal antibody) : 인간화 단클론 항체의 경우 단순히CDRs 이식만으로는 친화도가 떨어진다는 문제점이 발견되었습니다. 이에 따라 인간항체 라이브러리(library)의 파지 디스플레이(phage display) 기술과 인간 항체 유전자를 포함하는 형질전환 마우스(transgenic mice)를 이용하여 인간 단클론 항체가 제조되게 되었습니다. 인간 단클론 항체는 인간 항체가 100%를 차지하며, 이름 중간에-u-가들어가 있습니다.
② 항체 절편 (antibody fragment) 의약품
항체 절편은 항체에서 항원 결합 부위 Fab(antibody binding fragment)만 두고 Fc 면역기능(effector function)을 나타내는 Fc 부위를 제외한 조각입니다. 즉, 항원 결합 능력만 있고 항체 효능은 없습니다. 항체 절편 의약품은 Fab, single-chain antibody fragment(scFv) 및 3세대 항체 절편(예, single domain, minibody 등) 등이 있습니다.
③ 항체-약물 복합체 (antibody-drug conjugate, ADC) 의약품
항체-약물 복합체(ADC)는 항체의 특이성과 약물의 독성을 조합하여 만든 신개념 치료제의 일종입니다. ADC는 항체가 갖는 특이성을 통해 표적하는 특정 세포에만 약물 효과를 미칠 수 있어 특히 항암치료제로 개발되었습니다.
④ 면역접합체(immunoconjugate) 의약품
면역접합체는 IgG의 Fc 부위에 독소, 약품, 방사성핵종(radionuclides), 또는 다른 인 자들이 결합된 단클론항체로서, 일반적으로 특정 시약을 사용하여, 접합되지 않은 항체와 비항체 인자들을 결합시키는 화학적 과정을 통해 생산되거나 다른 방법으로, 같은 폴리펩타이드 체인 내에 비면역글로불린과 면역글로불린 서열을 포함하는 키메라재조합 단백질의 형태로 얻을 수 있습니다. 이들 약제들은 성분명 어미 부분에 -cept로 되어 있습니다.
3) 관련 시장
세계 의약품 시장의 규모는 약 1조달러(2013년)인 것으로 추정되고 있는데 이중 항 체의약품은 약 750억달러 규모이며 전체 바이오의약품에서 약 50%의 비중을 차지 하고 있습니다. 항체의약품은 규모의 성장뿐 아니라 성장속도 자체도 매우 빨라 최근5년간(2008년-2013년) 약 90%의 성장을 이루었는데, 이는 같은 기간 다른 바이오의약품의 판매액이 약 26% 성장한 것과 비교하면 엄청난 속도라 할 수 있을 것입니다.
항체의약품이 세계 의약품 시장에서 차지하는 비중은 2014년 매출액 상위 10 개 의 약품 중 항체의약품이 6개라는 사실로부터도 가늠할 수 있으며, 매출액으로도 상위 10위 총매출액 826억 달러의 64%(527억 달러)를 차지했습니다. (출처: 식품의약품안전처-항체의약품 개발기술 동향)
따라서 향후 의약품 시장에서 바이오의약품이 차지하는 비중은 궁극적으로는 화학의약품 규모를 추월할 것으로 예상되며 바이오의약품 중 항체의약품의 비중 또한 비약 적으로 증가될 것으로 예상됩니다.
PhRMA(Pharmaceutical Research and Manufacturers of America)의 2013년 조사 자료에 의하면 세계적으로 약 100종류의 질환군에 대하여 907개 정도의 바이오의약 품이 개발 중에 있습니다. 질환군 중에는 암이 338개, 감염성 질환이 176개, 그리고 자가 면역질환이 71개 순으로 바이오의약품 개발이 활발히 이루어지고 있으며 개발 중인 바이오의약품을 종류별로 구분해보면 항체 신약이 338개, 백신이 250개로 가장많은비중을 차지하고 있습니다.
또한 바이오의약품 개발이 가장 활발한 질환군인 암과 감염성 질환에서 개발 중인 바이오의약품 종류를 살펴보면 암에서는 항체신약이 170개(50%)로 주류를 이루고 있 으며, 감염성 질환의 경우에는 백신이 134개(76%)로 대부분을 차지하는 것으로 나타났습니다.
국내 2016년 제약시장 규모는 수출(약 2조원)을 제외하고 생산 및 수입을 합쳐 약 19조원 규모이며, 표2에서 제시된 바와 같이 연평균 약 36%의 성장이 기대되고 있기 때문에 향후 시장규모는 비약적으로 성장할 것으로 예상됩니다. 이러한 전망은 2012년 약 4000억 달러 규모의 미국 의약품 시장에서 항체의약품이 차지하는 비중(515억달러, 13%)으로부터도 충분히 예측이 가능한 것으로 사료됩니다.
더구나 국내 제약업계의 경우, 특허가 만료되는 오리지널 바이오의약품에 대한 항체바이오시밀러 개발에 투자를 강화하고 있습니다. 실제로 이미 5개의 항체 바이오시밀러가 국내 허가를 받은 바 있으며, 곧이어 더 많은 항체 바이오시밀러 제품들이 출시될 것으로 기대되고 있으며, 이는 국내 항체의약품 규모 증가로 이어질 것으로 예상됩니다.
2015년 12월 현재, 국내에 허가 받은 항체의약품은 43개입니다. 43개 제품 중 37개는 수입의약품이며 국내에서 개발된 제품은 6개입니다. 국내개발 의약품 중 5개는 바이오시밀러이고 1개는 희귀의약품으로 허가된 신약입니다. 국내의 항체의약품 생산능력은 세계 수준에 다가가고 있지만 신약개발 역량은 선진국에 비해 매우 비약한 수준으로 평가됩니다. 허가된 항체의약품을 구분해보면 항암치료제가 18종(43%)으로 가장 많고, 면역조절제가 16종(36%), 골다공증치료제 등 기타 적응증 치료제가 9종(21%)인 것으로 나타났습니다. 항체 유형으로 분류해 보면 단클론항체가 대부분(30종, 69%)을 차지하고 있었으며, 그밖에 항체-약물 복합체(3종, 7%) 항원결합부위-Fc 복합체(6종, 14%), Fab(4종, 10%) 등으로 구분할 수 있었습니다.
다른 한편 국내 임상현황을 통해 항체의약품 개발 현황을 분석해보면, 2015년 9월 현재, 임상시험 중인 93건의 항체의약품 중 84건(89%)은 외국개발자에 의한 것이고 9건(11%)만이 국내업체에 의한 것이었습니다. 외국개발자에 의한 임상시험은 임상 2상과 3상이 82%(각각 39%, 43%)이고 1상은 18%였으나 국내개발 중인 항체의약품은 아직 임상1상 중인 것이 대부분(7건, 78%)이었고 2상은 22%(2건)이었으며 임상3상에 이른 것은 없었습니다. 다른 한편 개발 중인 항체의약품은 항암치료 및 면역조절을 위한 것이 각각 47%와 38%로 대부분을 차지하고 있었습니다. 항암치료 목적으로 개발 중인 항체의약품의 표적분자는 c-Met, EGFR, FGFR2(b), HGF(/SF) 등 다양하였으며 PD-1과 PD-L1을 표적으로 하는 제3세대 면역항암제도 개발 중(3건)인 것으로 나타났습니다. 그러나 임상시험 중인 국내 개발 제3세대 면역항암제는 없었습니다. 면역조절 목적으로 개발 중인 항체의약품의 표적분자는 BAFF, IL-5R, IL-6R 등이고 국내개발 중인 면역조절 항체의약품은 IL-1R를 표적으로 한 것이었습니다. (출처: 식품의약품안전처-항체의약품 개발기술 동향)
(4) 건강기능식품
1) 건강기능식품
'건강기능식품'은 기능성원료를 사용하여 제조 가공한 제품으로, 기능성원료는 식품의약품안전처에서 「건강기능식품 공전」에 기준 및 규격을 고시하여 누구나 사용 할 수 있는 고시된 원료와 개별적으로 식품의약품안전처의 심사를 거쳐 인정받은 영업자만이 사용할 수 있는 개별인정 원료로 나눌 수 있습니다.
- 고시된 원료
「건강기능식품 공전」에 등재되어 있는 기능성 원료를 말합니다. 공전에서 정하고 있는 제조기준, 규격, 최종제품의 요건에 적합할 경우 별도의 인정절차가 필요하지 않습니다. 영양소(비타민 및 무기질, 식이섬유 등) 등 약 83여 종의 원료가 등재되어 있습니다.
- 개별인정 원료
「건강기능식품 공전」에 등재되지 않은 원료로, 식품의약품안전처장이 개별적으로 인정한 원료를 말합니다. 이 경우, 영업자가 원료의 안전성, 기능성, 기준 및 규격 등 의 자료를 제출하여 관련 규정에 따른 평가를 통해 기능성 원료로 인정을 받아야 하 며 인정받은 업체만이 동 원료를 제조 또는 판매할 수 있습니다. 현재까지 140 여종 의 기능성원료가 있습니다.
건강기능식품은 기능성원료(고시형 원료 또는 개별인정형 원료)를 사용하고, 기타원 료(식품 또는 식품첨가물 기준 및 규격에 적합한 것, 또는 건강기능식품의 기준 및 규격에 적합한 것) 등을 사용하여 정해진 기준 및 규격에 맞게 제조하여야 합니다.
2) 기능성의 종류
'건강기능식품'의 기능성은 의약품과 같이 질병의 직접적인 치료나 예방을 하는 것 이 아니라 인체의 정상적인 기능을 유지하거나 생리기능 활성화를 통하여 건강을 유 지하고 개선하는 것을 말하는 것으로, '영양소기능', '질병발생 위험감소 기능' 및 '생리활성 기능'이 있습니다.
영양소기능은 인체의 성장ㆍ증진 및 정상적인 기능에 대한 영양소의 생리학적 작용 이고, 생리활성기능은 인체의 정상기능이나 생물학적 활동에 특별한 효과가 있어 건강상의 기여나 기능향상 또는 건강유지ㆍ개선 기능을 말합니다. 또한 '질병발생 위험감소 기능'은 식품의 섭취가 질병의 발생 또는 건강상태의 위험을 감소하는 기능입니다.
기능성 근거자료가 질병발생위험감소를 나타내며 확보된 과학적 근거자료의 수준이 과학적 합의에 이를 정도로 높을 경우 '질병발생위험감소기능'이 인정되며, 인체 의 정상기능이나 생물학적 활동에 특별한 효과가 있어 건강상의 기여나 기능향상 또는 건강유지ㆍ개선을 나타낸 경우 '생리활성기능'이 인정됩니다. (출처: 식품안전처 홈페이지)
3) 전 세계 건강기능식품 시장 현황
한국건강기능식품협회에 따르면, 2012년 전 세계 전체 건강식품 시장 규모는 3,464 억달러(약 350조원)로 추산되며, 2009년부터 2012년까지 연평균 + 6% 성장률로 성장해 왔습니다.
향후 세계건강식품시장은 2013년~2020년 연평균 + 7.9% 성장률로 성장세가 보다강화되면서 2020년에는 6,394억 달러의 시장규모가 형성될 전망이며, 세부 분야별로는 Supplements(비타민, 미네랄, 허브, 식사대용식품, 스포츠및영양강화식품등), Natural&Organic Foods(유기농식품), Natural&Organic Personal Care&HouseholdProduct(천연및유기농헬스&뷰티제품), Functional Food(특정성분을 강화하여 건강을 증진시키는 기능성을 함유한 식품)으로 나누어 볼 수 있으며, 특히 유기농 관련 분야가 상대적으로 더 높은 성장세를 이어 갈 전망입니다.
4) 국내 건강기능식품 시장
고령화 사회 진입과 함께 건강에 대한 의식수준이 높아지면서 전 세계적으로 건강기능 식품시장이 확대되고 있습니다. 건강기능식품은 일반 식품과 같은 보편화된 기능성 식품으로 안정성을 갖춘 동시에 쉽게 섭취할 수 있다는 특성을 가지고 있고, 또한 건강기능식품은 의약품과 같은 효능을 발휘하면서도 의약품 대비 까다로운 임상 절차를 거치지 않아 제품화가 용이하고, 의사의 처방 없이도 다양한 채널로 판매할 수 있다는 점에도 강점이 있습니다.
국내 건기식 시장은 연평균 + 12.9% 성장세를 보이고 있으며, 프로바이오틱스와 개 별인정형이 성장을 주도하고 있습니다.
국내 건강기능식품 시장은 국내외 경기 침체에도 불구하고, 건강에 대한 관심이 높아지며, 새로운 기능성을 찾는 다양한 계층의 소비자 욕구가 반영되면서 2008년~2013년 연평균 + 12.9%의 성장세를 이어가고 있습니다. 특히 최근에는 자체적으로 개발 한 독과점적 핵심 원료를 바탕으로 강력한 브랜드 구축에 성공한 업체들이 폭발적인 성장세를 나타내고 있습니다.
2013년 국내 건강기능식품 총 생산액은 1조 4,829억원으로 전년대비 5.2% 증가하였으며, 총생산액을 출하액과 수출액으로 구분하여 살펴보면, 출하액은 전년대비 4. 1% 증가하였고, 수출액은 전년대비 29.1% 대폭 증가하였다. 2012년 잠시 감소하는 경향을 보였던 수입액은 2013년 3,854억원으로 집계되며, 8.7% 증가한 추세를 보이고 있습니다.
품목별로는 여전히 홍삼이 전체 시장의 39.6%의 비중을 차지하면서 가장 높은 비중 을 차지하고 있으며, 최근에는 밀크씨슬추출 (간기능 개선), 프로바이오틱스 (유산균)
, 개별인정형 순으로 생산이 급증하고 있습니다. 개별인정형 내 원료별 생산액은 백 수오 등 복합추출물이 전년대비 600% 이상 증가하여 헛개나무과병추출분말을 제치 고 1위로 올라섰으며, 건강기능식품 기능성 내용별 시장에서는 면역기능개선이 7,483억원으로 전체 시장의 25.3%의 비중을 점유하는 것으로 추산됩니다.
나. 회사의 현황
(1) 영업개황 및 사업부문의 구분
(가) 영업개황
당사는 혈관신생분야에 특화된 기술을 가지고 있으며, 혈관신생억제제를 이용한 의 약품, 건강기능식품을 개발하고 있습니다. 당사가 보유한 혈관신생 억제 효능을 가진후보물질은 단백질, 단일 화합물, 천연물추출물이 있으며, 이와 관련하여 60여건의 특허를 보유하고 있습니다.
당사는 천연물의약품인 비만치료제, 습성황반변성 치료제, 비알코올성지방간염 치료제, 치주질환 치료제, 삼출성중이염 치료제 및 건선 치료제 개발과 함께 항체치료제 개발에도 주력하고 있으며, 의약품 개발을 하면서 혈관신생 억제 효능을 가진 건강기능식품 Ob-X를 개발하여 내장지방 감소 효능으로 식약처 인증을 받았고, 국내 및 해외에 제품을 판매하고 있습니다.
(나) 보유기술의 개요
당사는 혈관신생 억제 활성검색(Assay) 기술을 보유하고 있어 기존에 사용되고 있는의약품을 대상으로 새로운 효능을 찾고 또한 천연 추출물 라이브러리로부터 혈관신생 억제 효능물질을 검색하여 단백질, 단일 화합물, 천연물 등 다양한 혈관신생 억제 물질을 확보하고 있습니다. 혈관신생 억제 활성을 검색하는 기술은 독성이 없는 농도를 찾고, 독성이 없는 농도 이하에서 여러 가지 assay를 시행하여 혈관신생 억제 효능을 가진 물질을 찾는 기술입니다.
또한, 당사는 신약개발에 관한 핵심기술과 경험을 가지고 있습니다. 특히 천연물 의약품은 화합물과는 다르게 원생약의 산지별, 수확시기 별로 품질이 달라질 수 있으므로 일정한 품질을 유지하기 위하여 CMC 에 대한 까다로운 기준이 요구됩니다. 원생약부터 원료의약품 및 완제품까지 품질관리를 위한 원식물의 확인(Identification), 지표물질을 설정하는 기준 및 시험방법, 분석 방법을 설정하고 분석방법에 대한 method validation을 실시하고 원생약, 원료의약품 및 완제의약품에 대한 기준 및 규격을 설정하고 있습니다. 추가적으로 기준 및 시험방법에 따라 원료의약품과 완제의약품의 안정성 시험을 실시하여 일정기간 동안 안정함을 보여주어야 합니다.
해당 물질을 찾는 기술 이외에 임상시험 승인을 위한 IND 신청을 위하여 임상 프로토콜을 설계하고 임상시험 계획서를 만들어서 CMC 자료와 안정성 시험자료를 가지고 식약처로부터 임상 승인을 받은 경험이 축적되어 있습니다. 비만 치료제 임상 2상과 3상 IND 승인을 받았었고 황반변성 치료제 임상 2상 승인을 받은바 있습니다
● 혈관신생 억제 활성검색(Assay) 기술
안지오랩의 혈관신생 활성 검색(Assay)기술을 요약하면 다음과 같습니다.
In vitro assay
√ HUVEC(Human Umbilical Vein Endothelial Cell) tube formation assay
√ bFGF-induced cell proliferation assay
√ VEGF-induced cell proliferation assay
√ Invasion assay
| <HUVECtubeformationassay> |
|
|
Enzyme assay
√ MMPs (MMP-1,2,3,7,9,13) inhibition : Spectrofluorometric assay
(MMP는 Baculovirus system을 이용하여 곤충세포에서 자체 제조하여 사용)
√ Gelatin zymogram
√ Casein zymogram
Ex vivo assay
√ CAM(chick Chorioallantoic membrane) assay
√ Rat aortic ring angiogenesis assay
√ Rat aortic ring anti-angiogenesis assay
 |
|
rat aortic ring assay |
In vivo assay
√ Mouse Matrigel implant assay
√ Inflammation (ear edema) model
● 신약개발에 관한 보유기술
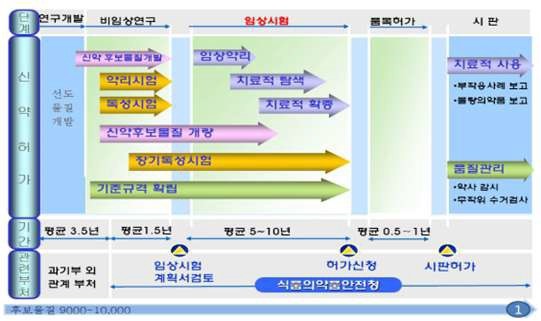
의약품을 개발하려면 후보물질 9,000∼10,000개로부터 시작하여 선도 물질을 검색하고 후보물질을 선별하여 최적화하고 질환동물 모델에서 유효성 시험, GLP기관에서 독성 시험, 안정성 시험과 같은 비임상 연구를 한 후 식품의약품안전처에 임상시험계획서를 제출하고 승인을 받으면 한 개의 후보물질만이 임상 1상, 2상 그리고 3상시험을 거쳐서 시판허가를 받아 제품화되는 것입니다.
 |
|
연구개발 |
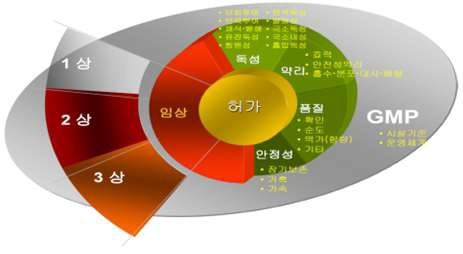
임상 시험을 진행하기 위하여 IND 신청 및 승인을 받아야 하며, 임상시험과 허가에 필요한 자료는 다음과 같습니다.
 |
|
임상시험허가에 필요한 자료 |
천연물을 의약품으로 개발하는 데 있어서 중요한 장점은 약물의 안전성 측면에서 우수하고, 의약품 개발단계에서 임상1상이 면제되는 경우가 많아 화합물 의약품에 비해 상대적으로 개발기간이 짧아 성공가능성이 높은 장점이 있다는 점입니다. 하지만,이러한 상대적인 장점에도 불구하고 천연물의약품 및 원료 생약의 품질확보, 유효성분, 지표성분 규명(활성 성분 규명과 함량기준 제시), 적절한 bioassay 확보 문제, 지적재산권 확보문제, 허가를 위한 임상시험 (설계, 적응증) 등 여러 가지 난제들도 존재하고 있는 것이 사실입니다.
당사는 품질확보(phytoequivalence)를 확보하기 위해 이미 유럽의 특정지역을 원생약의 생산지로 확보하였으며, 원생약의 규격을 유럽약전에 맞추어 공급받고 있으며, 유효성분 및 지표성분을 규명하여 기준 및 규격에 함량기준을 제시하였고, 기 확보된혈관신생 assay를 이용하여 적절한 bioassay 방법을 수립하였으며, 지적재산권도 확보되어 있습니다.
지표성분의 기준 및 시험방법, 분석 방법을 설정하고 분석방법에 대한 method validation을 실시하고 원생약, 원료의약품 및 완제의약품에 대한 품질관리를 시행하고 있습니다.
(다) 제품라인업
현재 ㈜안지오랩이 개발하고 있는 제품은 모두 혈관신생 및 MMP 효소 억제제에 기반을 둔 제품이며, 천연물의약품으로는 비만치료제, 습성황반변성 치료제, 비알코올성지방간염 치료제, 치주질환치료제, 삼출성중이염 치료제, 건선치료제가 있고, 항체의약품은 현재 후보물질을 개발하고 있습니다.
|
분류 |
타겟 질환 (제품) |
|---|---|
|
의약품 |
복부비만 치료제(AL101-AOB) |
|
습성황반변성 치료제(AL101-AMD) |
|
| 비알코올성지방간염 치료제(AL101-NASH) | |
|
치주질환 치료제(AL102-PDT) |
|
|
삼출성중이염 치료제(AL101-OME) |
|
|
건선 치료제(AL101-PSO) |
|
| 항체 치료제(AL201-AB) | |
|
기능성 건강식품 |
내장지방감소 건강기능식품(Ob-X) : 식약처 인증 |
의약품 이외에 체지방 감소(내장지방감소 효능표기)의 기능성 건강식품 Ob-X는 이미 제품개발이 완료되어 식약처 인증을 받고 국내 병의원과 약국 및 홈쇼핑 등에서 판매되고 있으며, 해외에 수출하고 있습니다.
당사 파이프라인에 있는 각 제품별 용도 및 주요 특징은 다음 표에 요약하였습니다.
|
비만치료제 |
용도 |
● 전문 의약품 ● 대사증후군이 있는 복부비만 환자의 내장지방 감소 |
||
|
주요 기능 및 특징 |
● 작용기전: 혈관신생을 억제하여 빨리 커지는 내장지방을 선택적으로 감소 ● 주성분: ALS-L1023. ● 용법ㆍ용량 : 1회 2정, 1일 2회 경구투여. ● 개발현황 : 임상2상 완료, 임상 3상 검토중 |
|||
|
습성 황반변성치료제 |
용도 |
● 전문 의약품 ● 신생혈관성(습성) 연령관련 황반변성의 치료제 |
||
|
주요 기능 및 특징 |
● 작용기전 : 습성 연령관련 황반변성의 주요인자인 VEGF를 억제하며, 산화 스트레스에 의한 망막색소 상피세포 보호 작용 ● 주성분 : ALS-L1023 ● 용법ㆍ용량: 1회 2정, 1일 2회 경구투여 ● 개발현황 : 임상 2상 IND 승인, IRB승인, 임상2상 환자모집 개시(2018.12) |
|||
| 비알코올성지방간염 치료제 |
용도 |
● 전문 의약품 ● 비알코올성지방간염 치료제 |
||
| 주요 기능 및 특징 |
● 작용기전 : 지방축적 억제 및 간섬유화 / 염증을 개선시키는 치료제로서 ● 주성분 : ALS-L1023 ● 용법ㆍ용량 : 1회 1정 또는 2정, 1일 2회 경구투여 ● 개발현황 : 임상 2a상 IND 신청 예정, 2019년 8월경부터 임상2a상 개시 예정 |
|||
|
치주질환 치료제 |
용도 |
● 전문 의약품 ● 치주질환 치료제 |
||
|
주요 기능 및 특징 |
● 작용기전: 치주염으로 인하여 잇몸과 치조골을 분해하는 효소인 MMPs 억제 ● 주성분: ALH-L1005 ● 용법ㆍ용량 : 경구투여 ● 개발현황 : 임상 2a상 IND 신청 준비 |
|||
|
중이염 치료제 |
용도 |
● 전문 의약품 ● 삼출성 중이염 치료제 |
||
|
주요 기능 및 특징 |
● 작용기전 : 삼출성 중이염의 특징인 혈관의 투과성 증가와 혈관내피세포의 증식에 중요한 역할을 하는 VEGF를 억제 ● 주성분 : ALS-L1023 ● 용법ㆍ용량 : 경구투여 ● 개발현황 : 임상2a상 IND 신청 준비 |
|||
|
건선치료제 |
용도 |
● 전문 의약품 ● 건선의 치료제 |
||
|
주요 기능 및 특징 |
● 작용기전 : 혈관신생에 의한 각질세포의 과다 증식 억제 ● 주성분 : ALS-L1023 ● 용법ㆍ용량 : 경구투여 또는 피부도포 ● 개발현황 : 건선 질환동물 모델을 이용한 유효성 실험 중 |
|||
| 항체치료제 | 용도 |
● 전문 의약품 ● 항체치료제 |
||
| 주요기능 및 특징 |
● 작용기전 : VEGF receptor1 및 receptor2의 dual inhibitor ● 개발현황 : 후보물질 발굴 중 |
|||
|
내장지방 (Ob-X) |
용도 |
● 개별인정형 건강기능식품
|
||
|
주요 기능 및 특징 |
● 작용기전: 혈관신생에 의한 내장지방감소 ● 주성분 : Ob-X ● 용법ㆍ용량 : 경구투여 ● 개발현황 : 식약처로부터 개별인정형 건강기능식품으로 허가 받은 후 현재 병의원과 약국, 홈쇼핑에 판매 및 해외에 수출 |
(2) 시장점유율
(가) 경기변동과의 관계
제약 산업은 타 산업 군에 비하여 경기변동성이 매우 낮습니다. 다만 독감치료제 등일시적이고 급격히 발생하는 전염성 질환 치료제와 같이 제품에 따라 계절적 변동이 있을 수 있습니다. 제약산업은 그 특성상 안정적인 수요 성장을 보이고 있으며, 국민 생활수준 향상과 급속한 노령화 현상에 따라 향후 시장 수요가 지속적으로 증가할 것으로 예상됩니다.
건강기능식품 산업은 꾸준한 성장을 이어오고 있습니다(아래의 표 참조). 장기적인 저성장기조의 경제환경에서도 몸매관리 등에 대한 관심이 높아지는 추세로 인하여 계속적인 성장을 이어오고 있습니다.
한국 식품의약품안전처(이하 '식약처')에 따르면, 국내 건강기능식품시장 규모는 2014년 2조 196억원으로 2013년 1조 7,920억원 대비 12.70%의 성장률을 보였습니다. 세부 현황을 보면, 국내 총생산액 1조 6,310억원, 수입액 4,556억원, 수출액 670억원입니다.
| <국내 건강기능식품 시장 규모 추이> |
| (단위:억원) |
|
구분 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
연평균 성장률 |
|---|---|---|---|---|---|---|---|
|
생산액 |
9,598 |
10,671 |
13,682 |
14,091 |
14,820 |
16,310 |
11.19% |
|
수입액 |
2,417 |
2,593 |
3,729 |
3,532 |
3,854 |
4,556 |
13.52% |
|
수출액 |
415 |
460 |
556 |
584 |
754 |
670 |
10.05% |
|
시장규모 |
11,600 |
12,804 |
16,855 |
17,039 |
17,920 |
20,196 |
11.73% |
|
성장률 |
6.2% |
10.4% |
31.6% |
1.1% |
5.2% |
12.70% |
- |
주) 시장규모=생산+수입-수출
*환율적용 1$=1,159원(09년), 1,156원(10년), 1,108원(11년), 1,126원(12년), 1,095원(13년), 1,088원(14년)
[출처: 건강기능식품 생산실적 보도자료(식품의약품안전처, 2015)]
다이어트관련 기능성식품의 생산액시준 시장규모를 보면 2012년 811억원, 2013년 1023억원, 2014년 1173억원으로 꾸준한 성장을 이어오고 있습니다. 그러나 2015년 내츄럴엔도텍의 백수오 사건이 발생한 이후 건강기능식품의 판매가 전체적으로 감소하는 분위기이지만 아직 통계적으로 발표되지는 않은 상태입니다. 하지만 건강기능식품 중에서도 미용과 관련이 있는 체지방감소 기능성제품은 계속적인 수요로 인하 여 타 기능군과는 달리 여전히 인터넷상으로는 활발한 신제품과 판매가 이루어짐을 볼 때 앞으로 계속적인 성장이 기대되고 있습니다.
(나) 계절적인 요인
체지방감소제품은 계절적인 영향이 다른 기능성식품보다는 많이 받습니다. 체형 변 화의 목표시점을 노출의 정도가 가장 큰 여름으로 하는 경향이 많아 봄부터 여름까지의 매출이 가을과 겨울에 비하여 매출비중이 높습니다.
하지만 점차적으로 계절적요인에 의한 소비패턴에는 차이를 보이고 있습니다. 즉, 다이어트나 미용 측면 뿐만아니라 건강적인 측면의 중요성이 인식되면서 연중 큰 변화없이 시장이 형성되어 가고있는 경향입니다. 이는 기능성식품을 생산하는 GMP업체들의 생생한 현장의 소리로도 확인할 수 있습니다. 물론 체지방감소, 다이어트 등의제품이므로 시기나 계절별로 다소 차이는 있습니다만 예전처럼 봄과 여름에 집중된현상과는 달라지는 것은 다이어트에 대한 소비자의 인식의 변화로 기인된 것으로 생각할 수 있습니다. 또한 건강기능식품의 판매추이를 볼 때에도 계절별 큰 변화가 없는 것으로 판단됩니다.
(3) 시장의 특성
제약 분야 제품의 라이프사이클은 타 산업에 비하여 상대적으로 길며 안정적입니다. 일반적으로 물질 특허 출원 후 20년의 독점 기간이 인정되며, 그 밖에도 다양한 에버그린 전략(특허연장)을 통해 독점 기간을 연장하고 있습니다.
저분자화합물(small molecule) 의약품의 경우 일반적으로 특허 만료시점까지 꾸준히 매출이 증가하다가 일단 특허가 만료되면 1∼2년 내에 급격한 매출 축소 현상 (일명 "patent cliff" 현상)이 나타나는데 반해, 약효지속화 기술이 적용된 제품의 경우는 특허뿐 아니라 스케일-업 등 제조 기술 노하우 등에 의한 높은 기술적 진입 장벽이 존재하기 때문에 특허 만료 후에도 수익성이 크게 악화되지 않는 장점이 있습니다.
건강기능식품의 많은 기능성원료들은 라이프 사이클이 길지 않다고 볼 수 있습니다. 체지방감소 기능성원료는 26종에 이르며 이중 대부분의 원료는 외국의 원료를 이용하여 기능성원료로 인정을 받은 후 집중적인 광고를 통하여 판매를 하였으며, 광고한내용과 다름을 인지한 소비자들은 또 다른 원료를 찾는 일련의 과정에서 제품의 라이프 사이클이 짧아지게 된 것입니다.
하지만 가르시니아캄보지아 껍질추출물은 2008년 체지방감소기능성원료로 인정을 받은 원료로서 모든 기능성식품군의 원료매출 6위를 차지하는 장수 제품입니다. 이러한 장수의 이유는 많은 논문자료, 저렴한 가격, 공급의 용이성, 관능적인 면 등으로생각이 됩니다.
Ob-X는 당사가 자체적으로 개발한 원료로서 전 세계적으로 지적재산권을 소유하고 있으며, 당사만이 생산하고 공급할 수 있는 구조입니다. 또한 병의원 및 약국유통을 위주로 판매하여 왔기에 제품의 신뢰도를 충분히 구축하였다고 판단이 됩니다. 또한 아직 널리 알려지지 않은 신선한 소재로서의 성격도 함께 지니고 있습니다. 앞으로 기존의 신뢰성을 바탕으로 소재의 특성과 기능을 계속 확장해 나가면 라이프 사이클이 매우 긴 장수제품으로 자리매김할 수 있을 것으로 생각합니다.
(4) 신규사업 등의 내용 및 전망
당사는 현재 보유하고 있는 파이프라인의 기술이전 계약을 계획하고 있으며, 해당 기술이전 계약이 성공적으로 발생할 경우, 이에 따라 매출액(영업수익)이 증가할 것으로예상되나, 정확한 수치나 수준을 예상하기는 어렵습니다.
(가) 천연물신약의 개발단계 및 기술이전 목표의 내용은 아래와 같습니다.
|
항목 |
현재 개발단계 |
기술이전 목표단계 |
비고 |
|---|---|---|---|
|
비만치료제 |
임상3상 프로토콜 검토 |
임상3상 단계 |
기술료, 로열티 |
|
습성황반변성 |
임상2상 |
국내 : 임상2상 중/후 해외 : 임상2상 중/후 |
기술료, 로열티 |
| 비알코올성지방간염치료제 | 임상2a상 준비 | 국내 : 임상2a상 중/후 해외 : 임상2a상 중/후 |
기술료, 로열티 |
|
치주질환치료제 |
임상2a상 준비 |
국내 : 임상2a상 중/후 |
기술료, 로열티 |
|
중이염치료제 |
임상2a상 준비 |
국내 : 임상2a상 중/후 |
기술료, 로열티 |
| 건선치료제 | 비임상시험 | 국내 : 임상2a상 중/후 | 기술료, 로열티 |
|
항체치료제 |
후보물질 발굴 |
국내 : 후보물질 발굴 이후 |
기술료, 로열티 |
기술이전을 받은 회사가 신약출시에 성공을 한 후 기존의 판매 인프라를 최대한 활용할 수 있는 판매능력이 매출규모와 시장형성에 결정적인 역할을 합니다. 시장규모의 증가와 더불어 시장 확보율 또한 매우 중요하기 때문에 기술이전을 받는 제약회사의 판매능력은 동사의 로열티수입과 직결이 되므로 매우 중요합니다.
(나) 건강기능식품(Ob-X, 체지방감소식품, 내장지방감소)
혈관신생억제 활성물질의 천연물신약 개발을 통하여 얻은 경험과 노하우를 바탕으로자체 개발한 원료를 활용한 체지방감소기능 건강기능식품의 판매를 진행하고 있습니다. 인체적용시험을 통하여 내장지방의 감소를확인하였으며, 2010년 5월에 식약처로부터 건강기능식품 기능성 원료(제2010-24호)로 인정을 받았습니다. 원료명은 "레몬밤추출물혼합분말"이며 Ob-X라는 브랜드를 사용하고 있습니다. 이는 개별인정형원료로서 "체지방감소에 도움을 줄 수 있습니다" 라는 기능을 표기하여 제품을 판매할 수 있습니다.
2011년부터 "RVL오비엑스", "RVL오비엑스플러스" 등의 제품을 모나비코리아에 공급을 시작하였으며, 현재 병의원에서 의사들의 추천으로 판매되는 "실루엣플러스", GS홈쇼핑에 "슈퍼킬 오비엑스 레몬밤 다이어트", CJ오쇼핑에 "쎈킬 오비엑스 레몬밤 다이어트", 롯데홈쇼핑에 "내속에밤 오비엑스 레몬밤 다이어트", 홈앤쇼핑에 "이너컷 오비엑스 레몬밤 다이어트", 현대홈쇼핑에 "올킬 오비엑스 레몬밤 다이어트"등을 생산 공급하고 있습니다.
국내의 경우 지금까지의 외부유통업체에 공급하는 한정적 매출을 극복하기 위하여 자체적인 온라인마케팅을 기획하고 있어 향후 국내 매출규모 증가를 목표로 하고 있습니다.
또한 해외의 경우는 파키스탄에 "Ob-X" 라는 제품을 완제품으로 공급 하였으며, 현재는 대만, 스위스, 스페인과 프랑스에 원료(Ob-X premix)를 공급하고 있습니다. 스페인에서는 "abdogras", 프랑스와 독일에서는 "ABDONORM"이라는 제품으로 판매가 되고 있으며, 최근에는 미국에 원료를 공급하기로 계약을 맺어 수출 확대를 계획하고 있습니다.
향후 국내 및 해외 유통구조의 확대 및 원가절감을 통한 수익증대제고, 다양한 유통채널을 활용한 유효한 마케팅전략, 기술력을 확보한 규모의 제조원 생산을 통한 안정적인 제품의 공급 등이 향후 동사의 건강기능 식품 및 기능성화장품의 매출의 변동에영향을 미칠 것으로 추정됩니다.
(5) 조직도
|
2. 주주총회 목적사항별 기재사항
□ 재무제표의 승인
가. 해당 사업연도의 영업상황의 개요
Ⅲ. 경영참고사항, 1. 사업의 개요, 나. 회사의 현황 참조
나. 해당 사업연도의 대차대조표(재무상태표)ㆍ손익계산서(포괄손익계산서)ㆍ자본변동표ㆍ이익잉여금처분계산서(안) 또는 결손금처리계산서(안)ㆍ현금흐름표
※ 본 재무제표는 외부감사인의 회계감사 및 검토가 완료되기 이전 재무제표이며, 외부감사인의 감사결과 및 주주총회 승인에 따라 일부 변경될 수 있습니다.
- 대차대조표(재무상태표)
| <대 차 대 조 표(재 무 상 태 표)> |
| 제 20기말 2018년 12월 31일 현재 |
| 제 19기말 2017년 12월 31일 현재 |
| 제 19기초 2017년 01월 01일 현재 |
| (단위 : 원) |
| 과 목 | 제20(당)기말 | 제19(전)기말 | 제 19(전)기초 | |||
|---|---|---|---|---|---|---|
| 자 산 | ||||||
| I. 유동자산 | 9,264,213,599 | 9,885,272,763 | 10,606,255,294 | |||
| 현금및현금성자산 | 496,662,826 | 1,335,066,048 | 1,101,802,649 | |||
| 매출채권및기타채권 | 936,507,363 | 720,411,793 | 80,754,621 | |||
| 당기법인세자산 | 15,779,580 | 20,265,380 | 5,340,810 | |||
| 기타금융자산 | 6,891,345,139 | 7,089,945,195 | 8,970,822,726 | |||
| 재고자산 | 776,956,273 | 599,443,356 | 336,778,639 | |||
| 기타유동자산 | 146,962,418 | 120,140,991 | 110,755,849 | |||
| II.비유동자산 | 497,030,329 | 453,754,365 | 421,598,551 | |||
| 기타금융자산 | 213,000,000 | 183,000,000 | 153,000,000 | |||
| 유형자산 | 138,237,937 | 113,649,454 | 79,311,652 | |||
| 무형자산 | 145,792,392 | 157,104,911 | 189,286,899 | |||
| 자 산 총 계 | 9,761,243,928 | 10,339,027,128 | 11,027,853,845 | |||
| 부 채 | ||||||
| I. 유동부채 | 15,436,591,804 | 6,580,891,991 | 5,340,707,023 | |||
| 매입채무 | 460,521,573 | 541,751,164 | 7,392,000 | |||
| 기타금융부채 | 447,083,281 | 381,497,870 | 370,455,780 | |||
| 기타유동부채 | 98,160,000 | 59,123,488 | 53,396,290 | |||
| 전환상환우선주 | 9,151,234,376 | 3,471,066,368 | 3,014,955,278 | |||
| 파생상품부채 | 5,279,592,574 | 2,127,453,101 | 1,894,507,675 | |||
| II.비유동부채 | 8,212,996,825 | 8,335,678,101 | 8,430,256,066 | |||
| 기타비유동금융부채 | 19,432,810 | 544,807,623 | 571,300,000 | |||
| 전환상환우선주 | - | 4,442,755,996 | 3,829,620,015 | |||
| 파생상품부채 | 7,973,938,364 | 2,901,621,727 | 3,570,269,053 | |||
| 순확정급여채무 | 219,625,651 | 446,492,755 | 459,066,998 | |||
| 부 채 총 계 | 23,649,588,629 | 14,916,570,092 | 13,770,963,089 | |||
| 자 본 | ||||||
| I.자본금 | 902,957,000 | 902,957,000 | 902,957,000 | |||
| II.자본잉여금 | 881,539,205 | 881,539,205 | 881,539,205 | |||
| III.결손금 | (15,672,840,906) | (6,362,039,169) | (4,527,605,449) | |||
| 자 본 총 계 | (13,888,344,701) | (4,577,542,964) | (2,743,109,244) | |||
| 부 채 및 자 본 총 계 | 9,761,243,928 | 10,339,027,128 | 11,027,853,845 | |||
- 손익계산서(포괄손익계산서)
| <손 익 계 산 서(포 괄 손 익 계 산 서)> |
| 제 20 기 (2018. 01. 01 부터 2018. 12. 31 까지) |
| 제 19 기 (2017. 01. 01 부터 2017. 12. 31 까지) |
| (단위 : 원) |
| 과 목 | 제 20 기 | 제 19 기 | ||
|---|---|---|---|---|
| Ⅰ.매출액 | 6,104,380,199 | 1,188,858,635 | ||
| Ⅱ.매출원가 | 3,827,606,710 | 689,817,701 | ||
| Ⅲ.매출총이익 | 2,276,773,489 | 499,040,934 | ||
| 판매비와관리비 | 2,249,354,664 | 1,797,545,205 | ||
| Ⅳ.영업손익 | 27,418,825 | (1,298,504,271) | ||
| 기타영업외수익 | 78,666,850 | 8,566,688 | ||
| 기타영업외비용 | (23,396,514) | (54,707,181) | ||
| 금융수익 | 291,708,495 | 1,342,085,727 | ||
| 금융비용 | (9,642,970,438) | (1,840,586,652) | ||
| Ⅴ.법인세비용차감전순이익(손실) | (9,268,572,782) | (1,843,145,689) | ||
| Ⅵ.법인세비용(수익)(주21) | - | - | ||
| Ⅶ.당기순이익(손실) | (9,268,572,782) | (1,843,145,689) | ||
| Ⅷ.기타포괄손익 | (42,228,955) | 8,711,969 | ||
| 후속적으로 당기손익으로 재분류되지 않는 포괄손익 | (42,228,955) | 8,711,969 | ||
| 확정급여제도의 재측정요소 | (42,228,955) | 8,711,969 | ||
| 법인세효과 | - | - | ||
| Ⅸ.총포괄손실 | (9,310,801,737) | (1,834,433,720) | ||
| Ⅹ.주당손익 | ||||
| 기본주당이익(손실)(주24) | (5,132) | (1,021) | ||
| 희석주당이익(손실)(주24) | (5,132) | (1,021) | ||
- 이익잉여금처분계산서(안) 또는 결손금처리계산서(안)
| <이익잉여금처분계산서 / 결손금처리계산서> |
| 제 20 기 (2018. 01. 01 부터 2018. 12. 31 까지) |
| 제 19 기 (2017. 01. 01 부터 2017. 12. 31 까지) |
| (단위 : 원) |
| 과 목 | 제 20 기 | 제 19 기 | ||
|---|---|---|---|---|
| 처리예정일 : 2019년 3월 22일 | 처리확정일 : 2018년 3월 27일 | |||
| Ⅰ. 미처리결손금 | (15,672,840,906) | (6,362,039,169) | ||
| 전기미처리결손금 | (6,362,039,169) | (4,527,605,449) | ||
| 보험수리적손익 | (42,228,955) | 8,711,969 | ||
| 당기순손실 | (9,268,572,782) | (1,843,145,689) | ||
| Ⅱ. 결손금처리액 | - | - | ||
| Ⅲ. 차기이월미처리결손금 | (15,672,840,906) | (6,362,039,169) | ||
- 자본변동표
| <자 본 변 동 표> |
| 제 20 기 (2018. 01. 01 부터 2018. 12. 31 까지) |
| 제 19 기 (2017. 01. 01 부터 2017. 12. 31 까지) |
| (단위 : 원) |
| 과 목 | 자본금 | 자본잉여금 | 이익잉여금 | 총 계 |
|---|---|---|---|---|
| 2017.01.01(전기초) | 902,957,000 | 881,539,205 | (4,527,605,449) | (2,743,109,244) |
| 총포괄손익 | ||||
| 당기순이익 | - | - | (1,843,145,689) | (1,843,145,689) |
| 기타포괄손익 | ||||
| 확정급여채무의 재측정요소 | - | - | 8,711,969 | 8,711,969 |
| 기타포괄손익 합계 | - | - | 8,711,969 | 8,711,969 |
| 총포괄손익 합계 | - | - | (1,834,433,720) | (1,834,433,720) |
| 2017.12.31(전기말) | 902,957,000 | 881,539,205 | (6,362,039,169) | (4,577,542,964) |
| 2018.01.01(당기초) | 902,957,000 | 881,539,205 | (6,362,039,169) | (4,577,542,964) |
| 총포괄손익 | ||||
| 당기순이익 | - | - | (9,268,572,782) | (9,268,572,782) |
| 기타포괄손익 | ||||
| 확정급여채무의 재측정요소 | - | - | (42,228,955) | (42,228,955) |
| 기타포괄손익 합계 | - | - | (42,228,955) | (42,228,955) |
| 총포괄손익 합계 | - | - | (9,310,801,737) | (9,310,801,737) |
| 2018.12.31(당기말) | 902,957,000 | 881,539,205 | (15,672,840,906) | (13,888,344,701) |
- 현금흐름표
| <현 금 흐 름 표> |
| 제 20 기 (2018. 01. 01 부터 2018. 12. 31 까지) |
| 제 19 기 (2017. 01. 01 부터 2017. 12. 31 까지) |
| (단위 : 원) |
| 과 목 | 제 20 기 | 제 19 기 | ||
|---|---|---|---|---|
| I. 영업활동 현금흐름 | (503,374,021) | (1,506,952,190) | ||
| 1. 영업에서 창출된 현금흐름 | (599,115,539) | (1,614,988,070) | ||
| 당기순이익(손실) | (9,277,863,152) | (1,843,145,689) | ||
| 수익비용의조정 | 9,561,119,128 | 823,258,222 | ||
| 영업활동으로 인한 자산 부채의 변동 | (882,371,515) | (595,100,603) | ||
| 2. 이자의 수취 | 91,255,718 | 122,960,450 | ||
| 3. 이자의 지급 | - | - | ||
| 4. 배당금 수령 | - | - | ||
| 5. 법인세의 납부 | 4,485,800 | (14,924,570) | ||
| II. 투자활동 현금흐름 | 121,971,758 | 1,793,124,704 | ||
| 1. 투자활동으로 인한 현금유입액 | 16,516,401,804 | 15,718,901,222 | ||
| 통화선물거래의 정산 | ||||
| 단기금융상품의 감소 | 13,258,075,804 | 15,708,901,222 | ||
| 단기보증금의 감소 | 10,000,000 | - | ||
| 유형자산의 처분 | - | - | ||
| 무형자산의 처분 | - | - | ||
| 보증금의 감소 | - | 10,000,000 | ||
| 종속기업투자주식의 청산 | 3,248,326,000 | - | ||
| 관계기업투자주식의 처분 | - | - | ||
| 2. 투자활동으로 인한 현금유출액 | (16,394,430,046) | (13,925,776,518) | ||
| 단기금융상품의 증가 | 11,979,639,527 | 13,805,597,428 | ||
| 무형자산의 취득 | - | 640,000 | ||
| 장기금융상품의 증가 | 4,298,568,246 | - | ||
| 종속기업투자의 증가 | 1,425,000 | - | ||
| 유형자산의 취득 | 74,797,273 | 79,539,090 | ||
| 보증금의 증가 | 40,000,000 | 40,000,000 | ||
| III. 재무활동 현금흐름 | (472,500,000) | (229,107,672) | ||
| 1. 재무활동으로 인한 현금유입액 | - | - | ||
| 2. 재무활동으로 인한 현금유출액 | (472,500,000) | (229,107,672) | ||
| 국고보조금의 반환 | 472,500,000 | 229,107,672 | ||
| IV. 현금및현금성자산의 증가(감소) | (853,902,263) | 57,064,842 | ||
| V. 기초 현금및현금성자산 | 1,335,066,048 | 1,330,910,321 | ||
| Ⅵ. 외화표시 현금및현금성자산의 환율변동효과 | 15,499,041 | 52,909,115 | ||
| Ⅶ. 기말 현금및현금성자산 | 496,662,826 | 1,335,066,048 | ||
- 최근 2사업연도의 배당에 관한 사항 : 해당사항 없음
□ 정관의 변경
가. 집중투표 배제를 위한 정관의 변경 또는 그 배제된 정관의 변경
| 변경전 내용 | 변경후 내용 | 변경의 목적 |
|---|---|---|
| - | - | 해당사항 없음 |
나. 그 외의 정관변경에 관한 건
| 변경전 내용 | 변경후 내용 | 변경의 목적 |
|---|---|---|
|
제9조(주권의 종류) 이 회사가 발행할 주권의 종류는 일주권, 오주권, 일십주권, 오십주권, 일백주권, 오백주권, 일천주권, 일만주권의 8종으로 한다. |
제9조(주식 및 신주인수권증서에 표시되어야 할 권리의 전자등록) 이 회사는 주권 및 신주인수권증서를 발행하는 대신 전자등록기관의 전자등록계좌부에 주식 및 신주인수권증서에 표시되어야 할 권리를 전자등록한다. |
-상장회사의 경우 발행하는 모든 주식 및 신주인수권증서에 표시되어야 할 권리에 대한 전자등록이 사실상 의무화됨에 따라 주권의 종류 삭제 및 관련 근거를 신설 |
|
제11조(명의개서대리인) ①이 회사는 주식의 명의개서대리인을 둔다. ②명의개서대리인 및 그 사무취급장소와 대행업무의 범위는 이사회의 결의로 정한다. ④제3항의 사무취급에 관한 절차는 명의개서대리인의 증권의 명의개서대행 등에 관한 규정에 따른다. |
제11조(명의개서대리인) ①〈좌 동〉
② 〈좌 동〉
④ 〈좌 동〉 |
-주식등의 전자등록에 따른 주식사무처리 변경내용 반영 |
|
제12조(주주 등의 주소, 성명 및 인감 또는 서명 등 신고) ①주주와 등록질권자는 그 성명, 주소 및 인감 또는 서명 등을 제11조의 명의개서대리인에게 신고하여야 한다. ②외국에 거주하는 주주와 등록질권자는 대한민국내에 통지를 받을 장소와 대리인을 정하여 신고하여야 한다. ③제1항 및 제2항의 변동이 생긴 경우에도 같다. |
제12조 <삭 제〉 |
-주식이 전자등록 될 경우 명의개서대리인에게 주주 등의 제반정보를 신고할 필요가 없으므로 관련 내용 삭제 |
|
제13조(주주명부의 폐쇄 및 기준일) ①이 회사는 매년 1월 1일부터 1월 31일까지 권리에 관한 주주명부의 기재변경을 정지한다. ②이 회사는 매년 12월 31일 최종의 주주명부에 기재되어 있는 주주를 그 결산기에 관한 정기주주총회에서 권리를 행사할 주주로 한다. ③이 회사는 임시주주총회의 소집 기타 필요한 경우 이사회의 결의로 3월을 경과하지 아니하는 일정한 기간을 정하여 권리에 관한 주주명부의 기재변경을 정지하거나 이사회의 결의로 정한 날에 주주명부에 기재되어 있는 주주를 그 권리를 행사할 주주로 할 수 있으며, 이사회가 필요하다고 인정하는 경우에는 주주명부의 기재변경 정지와 기준일의 지정을 함께 할 수 있다. 회사는 이를 2주간전에 공고하여야 한다. |
제13조(주주명부의 폐쇄 및 기준일) ① 〈좌 동〉
② 〈좌 동〉
③이 회사는 임시주주총회의 소집 기타 필요한 경우 이사회의 결의로 3개월을 경과하지 아니하는 일정한 기간을 정하여 권리에 관한 주주명부의 기재변경을 정지하거나 이사회의 결의로 정한 날에 주주명부에 기재되어 있는 주주를 그 권리를 행사할 주주로 할 수 있으며, 이사회가 필요하다고 인정하는 경우에는 주주명부의 기재변경 정지와 기준일의 지정을 함께 할 수 있다. 회사는 이를 2주간전에 공고하여야 한다. |
-기간을 의미하는 경우 개월로 표현을 수정(이하 동일) |
|
<신 설> |
제15조의2(사채 및 신주인수권증권 에 표시되어야 할 권리의 전자등록) 이 회사는 사채권 및 신주인수권증권을 발행하는 대신 전자등록기관의 전자등록계좌부에 사채 및 신주인수권증권에 표시되어야 할 권리를 전자등록한다. |
-상장회사의 경우 발행하는 사채 및 신주인수권증권에 표시되어야 할 권리에 대하여 사실상 전자등록이 의무화됨에 따라 관련 근거 신설 |
|
제16조(사채발행에 관한 준용규정) 제11조, 제12조의 규정은 사채발행의 경우에 준용한다. |
제16조(사채발행에 관한 준용규정) 제11조의 규정은 사채발행의 경우에 준용한다. |
- 제12조 삭제에 따른 문구 정비 |
|
제17조(소집시기) ①이 회사의 주주총회는 정기주주총회와 임시주주총회로 한다. ②정기주주총회는 매사업년도 종료후 3월 이내에, 임시주주총회는 필요에 따라 소집한다. |
제17조(소집시기) ① 〈좌 동〉
② 정기주주총회는 매사업년도 종료후 3개월 이내에, 임시주주총회는 필요에 따라 소집한다. |
-재무제표 확정권이 주주총회 또는 이사회에 있는지 여부에 따라 정기총회의 개최시기를 달리 규정할 수 있도록 선택사항 표시를 신설 |
|
제18조(소집권자) ①주주총회의 소집은 법령에 다른 규정이 있는 경우를 제외하고는 이사회의 결의에 따라 대표이사(사장)이 소집한다. ②대표이사(사장)이 유고시에는 제34조 제2항의 규정을 준용한다. |
제18조(소집권자) ①주주총회의 소집은 법령에 다른 규정이 있는 경우를 제외하고는 이사회의 결의에 따라 대표이사가 소집한다. ②대표이사가 유고시에는 제34조 제2항의 규정을 준용한다. |
-대표이사제도를 탄력적으로 운영할 수 있도록 직위명 예시를 삭제(이하 동일) |
|
제21조(의장) ①주주총회의 의장은 대표이사(사장)으로 한다. |
제21조(의장) ①주주총회의 의장은 대표이사로 한다. |
-대표이사 유고시 주총회 의장에 대해서는 주주총회에서 원칙적으로 정하는 것으로 변경 |
|
제33조(대표이사 등의 선임) 이 회사는 이사회의 결의로 대표이사(사장) ○명, 부사장, 전무 및 상무 약간 명을 선임할 수 있다. |
제33조(대표이사 등의 선임) 이 회사는 이사회의 결의로 대표이사, 부사장, 전무 및 상무 약간 명을 선임할 수 있다. |
|
|
제34조(이사의 직무) ①대표이사(사장)은 회사를 대표하고 업무를 총괄한다. ②부사장, 전무, 상무 및 이사는 사장을 보좌하고 이사회에서 정하는 바에 따라 이 회사의 업무를 분장 집행하며 대표이사(사장)의 유고시에는 위 순서로 그 직무를 대행한다. |
제34조(이사의 직무) ①대표이사는 회사를 대표하고 업무를 총괄한다. ②부사장, 전무, 상무 등은 대표이사를 보좌하고 이사회에서 정하는 바에 따라 이 회사의 업무를 분장 집행하며 대표이사의 유고시에는 이사회에서 정한 순서에 따라 그 직무를 대행한다. |
-대표이사 유고시 직무대행순서를 탄력적으로 운용할 수 있도록 정관에서 정하지 않고 이사회에서 정하도록 하는 규정을 신설 |
|
제35조(이사회의 구성과 소집) ①이사회는 이사로 구성하며 이 회사 업무의 중요사항을 결의한다. ②이사회는 대표이사(사장) 또는 이사회에서 따로 정한 이사가 있을 때에는 그 이사가 회일 ○일전에 각 이사 및 감사에게 통지하여 소집한다. 그러나 이사 및 감사 전원의 동의가 있을 때에는 소집절차를 생략할 수 있다.
|
제35조(이사회의 구성과 소집) ① 〈좌 동〉 ②이사회는 각 이사가 소집한다. 그러나 이사회에서 따로 정한 이사가 있을 때에는 그러하지 아니하다.
|
-상법 390조를 반영하여 소집권자를 특정하기 보다는 법에 따라 유연하게 운용할 수 있도록 수정 |
|
제47조(재무제표와 영업보고서의 작성ㆍ비치 등) ①이 회사의 대표이사(사장)은 정기주주총회 회일의 6주간전에 다음의 서류와 그 부속명세서 및 영업보고서를 작성하여 감사의 감사를 받아야 하며, 다음 각호의 서류와 영업보고서를 정기총회에 제출하여야 한다. 1. 대차대조표 2. 손익계산서 3. 그 밖에 회사의 재무상태와 경영성과를 표시하는 것으로서 상법시행령에서 정하는 서류 ④대표이사(사장)은 제1항의 서류와 감사보고서를 정기주주총회 회일의 1주간 전부터 본사에 5년간, 그 등본을 지점에 3년간 비치하여야 한다. |
제47조(재무제표와 영업보고서의 작성ㆍ비치 등) ①이 회사의 대표이사는 정기주주총회 회일의 6주간전에 다음의 서류와 그 부속명세서 및 영업보고서를 작성하여 감사의 감사를 받아야 하며, 다음 각호의 서류와 영업보고서를 정기총회에 제출하여야 한다. 1. 대차대조표 2. 손익계산서 3. 그 밖에 회사의 재무상태와 경영성과를 표시하는 것으로서 상법시행령에서 정하는 서류 ④대표이사는 제1항의 서류와 감사보고서를 정기주주총회 회일의 1주간 전부터 본사에 5년간, 그 등본을 지점에 3년간 비치하여야 한다. |
|
|
제47조의2(외부감사인의 선임) 회사는 주식회사의 외부감사에 관한 법률의 규정에 의한 감사인선임위원회의 승인을 얻어 외부감사인을 선임하며 그 사실을 선임한 사업년도 중에 소집되는 정기총회에 보고하거나 최근 주주명부폐쇄일의 주주에게 서면이나 전자문서에 의한 통지 또는 회사의 인터넷 홈페이지에 게재한다. |
제47조의2(외부감사인의 선임) 회사는 주식회사 등의 외부감사에 관한 법률의 규정에 의한 감사인선임위원회의 승인을 받아 감사가 선정한 외부감사인을 선임하며 그 사실을 선임한 이후에 소집되는 정기총회에 보고하거나 주식회사 등의 외부감사에 관한 법률 시행령에서 정하는 바에 따라 주주에게 통지 또는 공고하여야 한다. |
-개정 외부감사법 제10조에 따라 외부감사인의 선정권 변경 내용을 반영 -관련법령의 개정에 따라 정관을 수시로 개정할 필요가 없도록 조문 정리 |
|
|
부 칙 이 정관은 제20기 정기 주주총회에서 승인한 날 부터 시행한다. 다만, 제9조, 제11조, 제12조, 제15조의2 및 제16조 개정내용은 「주식ㆍ사채 등의 전자등록에 관한 법률 시행령」이 시행되는 2019년 9월 16일부터 시행한다. |
-전자증권법 시행일이 2019년 9월로 예정됨에 따라 관련 정관규정의 시행시기를 별도로 규정하는 단서 신설 |
□ 이사의 선임
가. 후보자의 성명ㆍ생년월일ㆍ추천인ㆍ최대주주와의 관계ㆍ사외이사후보자 여부
| 후보자성명 | 생년월일 | 사외이사 후보자여부 |
최대주주와의 관계 | 추천인 |
|---|---|---|---|---|
| 이영신 | 58.09.16 | 사외이사(비상근) | 해당사항 없음 | 이사회 |
| 박병영 | 69.03.17 | 사내이사(상근) | 해당사항 없음 | 이사회 |
| 총 ( 2 ) 명 | ||||
나. 후보자의 주된직업ㆍ약력ㆍ해당법인과의 최근3년간 거래내역
| 후보자성명 | 주된직업 | 약력 | 해당법인과의 최근3년간 거래내역 |
|---|---|---|---|
| 이영신 | DIA Asia 대표이사 | - 美 오레곤대학 화학박사 - 1995 바이엘 미국 한국 이사 |
해당사항 없음 |
| 박병영 | (주)안지오랩 상무이사 | - KAIST 생명과학 석ㆍ박사 - 1994 한효과학기술원 연구원 |
해당사항 없음 |
□ 감사의 선임
<권유시 감사후보자가 예정되어 있는 경우>
가. 후보자의 성명ㆍ생년월일ㆍ추천인ㆍ최대주주와의 관계
| 후보자성명 | 생년월일 | 최대주주와의 관계 | 추천인 |
|---|---|---|---|
| 김인철 | 51.04.24 | 없음 | 이사회 |
| 총 ( 1 ) 명 | |||
나. 후보자의 주된직업ㆍ약력ㆍ해당법인과의 최근3년간 거래내역
| 후보자성명 | 주된직업(현재) | 약력 | 해당법인과의 최근3년간 거래내역 |
|---|---|---|---|
| 김인철 | (주)안지오랩 감사 | - 한양대 공대 무기재료 공학 - 1977~2007 한국산업은행 - 전 (주)만도 사외이사 등 |
해당사항 없음 |
□ 이사의 보수한도 승인
가. 이사의 수ㆍ보수총액 내지 최고 한도액
| 구 분 | 전 기 | 당 기 |
|---|---|---|
| 이사의 수(사외이사수) | 4명(2명) | 4명(2명) |
| 보수총액 내지 최고한도액 | 300,000,000원 | 300,000,000원 |
□ 감사의 보수 한도 승인
가. 감사의 수ㆍ보수총액 내지 최고 한도액
| 구 분 | 전 기 | 당 기 |
|---|---|---|
| 감사의 수 | 1명 | 1명 |
| 보수총액 내지 최고한도액 | 50,000,000원 | 50,000,000원 |
※ 참고사항
|
당사 대표이사가 해외세미나(2019 Bio Europe Spring, Vienna,3/25~3/27)에 참석후 3/29(금) 도착예정인 사유와 등기임원들의 참석 가능일정, 외부감사인의 감사보고서 수령일자 등을 고려하여 불가피하게 주주총회 집중일에 개최를 하게 되었습니다. |